Автор: Тареева И.Е.
Теги: заболевания мочеполовой системы урология медицина нефрология
ISBN: 5-225-04195-7
Год: 2000
Текст
РУКОВОДСТВО для ВРАЧЕЙ
Под редакцией
И.Е.Тареевой
РУКОВОДСТВО ДЛЯ ВРАЧЕЙ
НЕФРОЛОГИЯ
Под редакцией
члена-корреспондента РАМН
И.Е.Тареевой
МОСКВА
"МЕДИЦИНА"
2000
УДК 616.61(035)
ББК 56.9
Н58
Федеральная программа книгоиздания России
Нефрология: Руководство для врачей /Под ред. И.Е.Та-
Н58 реевой. — М.: Медицина, 2000. — 2-е изд., перераб. и
доп. — 688 с.: ил. — ISBN 5-225-04195-7
В руководстве изложены современные представления о морфологии
и физиологии почек, механизмах развития и прогрессирования нефро-
патий, методах исследования нефрологических больных. Представлены
ведущие клинические синдромы (нефротический синдром, почечная ги-
пертензия, острая и хроническая почечная недостаточность) и основ-
ные заболевания почек — гломерулонефрит, пиелонефрит, нефроли-
тиаз, амилоидоз, поражение почек при системных, метаболических,
инфекционных заболеваниях и опухолях. Обсуждаются поражения по-
чек в детском и старческом возрасте, а также при беременности. Отра-
жены современные терапевтические подходы к лечению ведущих не-
фропатий.
Для нефрологов, терапевтов, педиатров, врачей общей практики и
специалистов смежных специальностей.
ББК 56.9
ISBN 5-225-04195-7
© М., Медицина, 1995
© Коллектив авторов, Москва, 2000
Все права авторов защищены. Ни одна часть этого издания не может
быть занесена в память компьютера либо воспроизведена любым спосо-
бом без предварительного письменного разрешения издателя.
Авторский коллектив
АЛЯЕВ Юрий Геннадьевич —
д.м.н., профессор, зав. кафедрой урологии ММА
им. И.М.Сеченова.
АМОСОВ Александр Валентинович —
д.м.н., профессор, доцент курса урологии при
кафедре нефрологии и гемодиализа ФППО
ММА им. И.М.Сеченова.
АНДРОСОВА Светлана Олеговна —
к.м.н., доцент кафедры нефрологии и гемоди-
ализа ФППО ММА им. И.М.Сеченова.
БАЛКАРОВ Игорь Михайлович —
к.м.н., доцент кафедры терапии и профболезней
мед.-профилакт. ф-та ММА им. И.М.Сеченова.
БОРИСОВ Владимир Викторович —
д.м.н., зав. курсом урологии при кафедре
нефрологии и гемодиализа ФППО ММА
им. И.М.Сеченова.
БОРИСОВ Игорь Анатольевич —
д.м.н., профессор, зав. курсом нефрологии,
ревматологии, иммунологии Учебно-научного
центра Медицинского Центра УДПРФ.
БОБКОВА Ирина Николаевна —
к.м.н., с.н.с. отдела нефрологии НИЦ ММА
им. И.М.Сеченова.
ВАРШАВСКИЙ Владимир Анатольевич —
д.м.н., профессор кафедры патологической
анатомии ММА им. И.М.Сеченова.
ГАНЗЕН Татьяна Николаевна —
д.м.н., профессор кафедры патологической
анатомии ММА им. И.М.Сеченова.
ГОРДОВСКАЯ Надежда Борисовна —
к.м.н., доцент кафедры нефрологии и гемоди-
ализа ФППО ММА им. И.М.Сеченова.
ГРИГОРЬЕВ Николай Александрович —
к.м.н., ассистент кафедры урологии ММА
им. И.М.Сеченова.
ГУСЕВА Надежда Гавриловна —
д.м.н., профессор, академик РАЕН, зав. лабо-
раторией микроциркуляции и воспаления Ин-
ститута ревматологии РАМН.
ЕРМОЛЕНКО Валентин Михайлович —
д.м.н., профессор, зав. кафедрой нефрологии и
гемодиализа РМАПО.
ЗВЕРЕВ Дмитрий Владимирович —
к.м.н., зав. Московским детским центром гра-
витационной хирургии крови и гемодиализа
МДБ Святого Владимира.
ИВАНОВ Алексей Алексеевич —
д.м.н., зав. лабораторией клеточной и молеку-
лярной патологии НИЦ ММА им. И.М.Сече-
нова.
ИГНАТОВА Майя Сергеевна —
д.м.н., профессор, зав. отделом наследственных
и приобретенных болезней почек Московского
НИИ педиатрии и детской хирургии М3 РФ.
КОЗЛОВСКАЯ Лидия Владимировна —
д.м.н., профессор кафедры терапии и проф-
болезней мед.-проф. фак-та, вед. научн. corp, от-
дела нефрологии НИЦ ММА им. И.М.Сече-
нова.
КОЗЛОВСКАЯ Наталья Львовна —
к.м.н., доцент кафедры нефрологии и гемоди-
ализа ФППО ММА им. И.М.Сеченова.
КРАПИВИН Андрей Александрович —
врач-ординатор клиники урологии ММА
им. И.М.Сеченова.
КРАСНОВА Татьяна Николаевна —
к.м.н., вед. научн. сотр. отдела нефрологии НИЦ
ММА им. И.М.Сеченова.
КРИВОШЕЕВ Олег Геннадьевич —
к.м.н., ассистент кафедры терапии и профбо-
лезней мед.-проф. фак-та ММА им. И.М.Сече-
нова.
3
КУТЫРИНЛ Ирина Михайловна —
д.м.н., профессор кафедры нефрологии и гемо-
диализа ФППО, вед. научн. сотр. отдела нефро-
логии НИЦ ММА им. И.М.Сеченова.
КУХТЕВИЧ Алексей Владимирович —
д.м.н., вед. научн. сотр. отдела нефрологии НИЦ
ММА им. И.М.Сеченова.
МИХАЙЛОВ Алексей Алексеевич —
д.м.н., профессор кафедры внутренних болез-
ней № 4 леч. фак-та ММА им. И.М.Сеченова.
МОЙСЮК Ян Геннадиевич —
д.м.н., зав. отделением пересадки почек и пе-
чени НИИ трансплантологии и искусственных
органов М3 РФ.
МУХИН Николай Алексеевич —
д.м.н, профессор, академик РАМН, зав. кафед-
рой терапии и профболезней мед.-проф. фак-
та ММА им. И.М.Сеченова.
НАТОЧИН Юрий Викторович —
д.м.н., профессор, академик РАН, зав. лабора-
торией физиологии почки Института эволюци-
онной физиологии и биохимии им. И.М.Сече-
нова РАН.
НЕВЕРОВ Никита Игоревич —
д.м.н., вед. научн. сотр. отдела нефрологии НИЦ
ММА им. И.М.Сеченова.
НИКОЛАЕВ Алексей Юрьевич —
д.м.н., профессор кафедры нефрологии и гемо-
диализа ФППО, профессор кафедры нефроло-
гии и гемодиализа РМАПО.
ПЕРОВ Юрий Ливерьевич —
д.м.н., проф., чл.-корр. РАМН, 1-й зам. гене-
рального директора Учебно-научного центра
Медицинского центра УДПРФ
ПОЛЯНЦЕВА Людмила Романовна —
к.м.н., с.н.с. отдела нефрологии НИЦ ММА им.
И.М. Сеченова.
РОГОВ Виталий Аркадьевич —
д.м.н., доцент кафедры нефрологии и гемоди-
ализа ФППО ММА им. И.М.Сеченова.
СЕМЕНКОВА Евгения Николаевна —
д.м.н., профессор кафедры терапии и профболез-
ней мед.-проф. фак-та ММА им. И.М.Сеченова.
СЕРОВ Виктор Викторович —
д.м.н., профессор, академик РАМН, профес-
сор кафедры патологической анатомии ММА
им. И.М.Сеченова.
ГАРЕЕВА Ирина Евгеньевна —
д.м.н., профессор, чл.-корр. РАМН, зав. отделом
нефрологии НИЦ, зав. кафедрой нефрологии и
гемодиализа ФППО ММА им. И.М.Сеченова.
ТОМИЛИНА Наталья Аркадьевна —
д.м.н., зав. отделением нефрологических про-
блем трансплантации почки НИИ трансплан-
тологии и искусственных органов М3 РФ.
ХАСАБОВ Николай Николаевич —
к.м.н., доцент, руководитель курса нефрологии
кафедры общей терапии ФУВ РГМУ.
ЦАЛИКОВА Фатима Даудовна —
к.м.н., с.н.с. отдела наследственных и приобре-
тенных болезней почек Московского НИИ пе-
диатрии и детской хирургии М3 РФ.
ШЕСТАКОВА Марина Владимировна —
д.м.н., главн. научн. сотр., зав. отделением не-
фрологии Эндокринологического научного цен-
тра РАМН.
ШИЛОВ Евгений Михайлович —
д.м.н., профессор кафедры нефрологии и гемо-
диализа ФППО, вед. научн. сотр. отдела нефро-
логии НИЦ ММА им. И.М.Сеченова.
ШУМАКОВ Валерий Иванович —
д.м.н., профессор, академик РАН и РАМН,
директор НИИ трансплантологии и искусствен-
ных органов М3 РФ.
Оглавление
Предисловие ................................ 11
Глава 1. Функциональная морфология почек.
— В. В. Серов.............................. 12
Глава 2. Механизмы моче образования. —
Ю.В.Наточин................................ 24
Глава 3. Почки и водно-электролитный обмен.
— И.М.Кутырина............................. 49
Глава 4. Фосфорно-кальциевый обмен и поч-
ки. — В. М. Ермоленко...................... 62
Глава 5. Методы исследования нефрологи-
ческих больных............................. 76
5.1. Исследование мочи. — Л.В.Коз-
ловская ...................... "Л>
5.2. Оценка функционального сос-
тояния почек. — И.М.Кутырина 88
5.3. Визуализирующие методы ис-
следования. — А.В.Амосов,
В. В. Борисов................... 101
5.4. Биопсия почки. — А.Ю.Ииколаев 126
Глава 6. Иммунопатология болезней почек. —
Е.М. Шилов........................ 132
Глава 7. Протеинурия и нефротический синд-
ром. — И.Е.Тареева, Л.Р.Полянцева 145
Глава 8. Почки и артериальная гипертензия. —
И.М.Кутырина, А.А.Михайлов..... 164
Глава 9. Гломерулонефрита.................. 188
9.1. Общие вопросы. Клиника. —
Е.М. Гареев..................... 188
9.2. Комментарии к разделам, на-
писанным Е.М.Тареевым. —
И А. Мухин...................... 205
9.3. Морфология гломерулонефри-
та. — В.В.Серов, В.А.Варшав-
ский, А.А. Иванов.............. 211
9.4. Механизмы прогрессирования
гломерулонефрита. — И.Е.Та-
реева, И. И. Бобкова, Л. В. Коз-
ловская, И.М.Кутырина, Н.И.Не-
веров, Е.М.Шилов............. 224
9.5. Клинические особенности от-
дельных морфологических
форм гломерулонефрита. —
И.Е.Тареева..................... 239
9.6. Лечение гломерулонефрита. —
И.Е.Тареева, Е.М.Шилов......... 246
9.7. Диуретики. — И.М.Кутырина 268
Глава 10. Почки при системных заболева-
ниях..................................... 280
10.1. Поражение почек при сис-
темной красной волчанке. —
И.Е.Тареева, Т.И.Краснова ... 280
10.2. Поражение почек при узел-
ковом полиартериите. —
Е.Н.Семенкова................... 291
10.3. Поражение почек при грану-
лематозе Вегенера. — Е.Н. Се-
менкова ........................ 294
10.4. Поражение почек при микро-
скопическом полиартериите.
— Е.Н.Семенкова............. 296
10.5. Поражение почек при пурпуре
Шенлейна—Геноха. — А.Ю.Ни-
колаев, О. Г. Кривошеев........ 297
10.6. Поражение почек при сис-
темной склеродермии. —
НЕ Гусева....................... 299
10.7. Поражение почек при сме-
шанной криоглобулинемии.
— НБ.Гордовская, Л. В. Коз-
ловская ........................ 304
10.8. Тромботические микроангио-
патии — тромботическая
тромбоцитопеническая пурпу-
ра и гемолитико-уремический
синдром. — Л. В. Козловская... 308
10.9. Синдром Гудпасчера. —
Н.А.Мухин................... 314
Глава 11. Канальцевые дисфункции. — И.Е.Та-
реева, М.С.Игнатова...................... 320
Глава 12. Тубулоинтерстициальные нефропа-
тии. — И.Е. Тареева...................... 329
5
Глава 13. Наследственные и врожденные неф-
ропатии. — М.С.Игнатова........ 337
Глава 14. Лекарственные поражения почек. —
И. Е. Гареева, А. Ю. Николаев,
С. О.Андросова............................ 372
Глава 15. Пиелонефрит. — И.А.Борисов..... 383
Глава 16. Ксантогранулематозный пиелонеф-
рит. — Ю.Г.Аляев, Т.Н.Ганзен,
Н.А.Григорьев.................... 400
Глава 17. Рефлюкс-нефропатия. — А.В.Кухте-
вич.............................. 407
Глава 18. Почечнокаменная болезнь. — И.Е.Та-
реева, А.В.Кухтевич.............. 413
Глава 19. Подагрическая почка. — Н.А.Мухин,
ИМ. Балкаров..................... 422
Глава 20. Туберкулез почки. — Ю.Г.Аляев,
В. В. Борисов.................... 429
Глава 21. Поликистоз почек. — ИМ.Куты-
рина............................. 437
Глава 22. Нефроптоз. — А.В.Кухтевич...... 444
Глава 23. Диабетическая нефропатия. —
Н.А.Мухин, М.В.Шестакова....... 448
Глава 24. Поражение почек при алкоголиз-
ме. — А. Ю. Николаев...................... 454
Глава 25. Почки и беременность. — В.А.Ро-
гов, Н.Б.Гордовская.............. 464
Глава 26. Особенности патологии почек у де-
тей. — М. С.Игнатова...................... 484
Глава 27. Старческая почка. — И.А.Борисов,
Ю.Л. Перов....................... 509
Глава 28. Опухоли почки. — Ю. Г.Аляев,
А.А.Крапивин................................ 525
Глава 29. Доброкачественная гиперплазия (аде-
нома) предстательной железы. —
В.А.Рогов................................... 534
Глава 30. Паранеопластические нефропатии. —
Н.А.Мухин, Н.НХасабов........... 540
Глава 31. Амилоидоз почек. — Н.А.Мухин,
В. В. Серов, Л. В. Козловская............. 546
Глава 32. Поражение почек при парапротеине-
миях. — И.Е.Тареева, Н.Б.Гордовс-
кая ........................................ 557
Глава 33. Поражение почек при подостром ин-
фекционном эндокардите. — А. Ю. Ни-
колаев ..................................... 563
Глава 34. Поражение почек при синдроме
приобретенного иммунодефицита. —
А.Ю.Николаев................................ 568
Глава 35. Геморрагическая лихорадка с почеч-
ным синдромом. — А. Ю. Николаев.. 572
Глава 36. Поражение почек при малярии. —
А.В.Кухтевич................................ 575
Глава 37. Поражение почек при шистосомато-
зе. — А.В.Кухтевич.......................... 578
Глава 38. Острая почечная недостаточность. —
В.М.Ермоленко............................... 580
Глава 39. Хроническая почечная недостаточ-
ность. — В.М. Ермоленко..................... 596
Глава 40. Трансплантация почки. — В. И.Шу-
маков, Я.Г.Мойсюк, Н.А.Томилина 658
Предметный указатель........................ 683
Список сокращений
АП — ангиотензин II
АДГ — антидиуретический гормон
АДПБВ — аутосомно-доминантная поликис-
тозная болезнь взрослых
АЗА — азатиоприн
АЗС — адинамическое заболевание скелета
АК — антагонисты кальция
АлАТ — аланиновая аминотрансфераза
АН — анальгетическая нефропатия
АНФ — антинуклеарный фактор
АНЦА — антинейтрофильные цитоплазмати-
ческие антитела
АПФ — ангиотензинпревращающий фер-
мент
АР — аутосомно-рецессивный
АРП — активность ренина плазмы
АсАТ — аспарагиновая аминотрансфераза
АУФ — амилоидускоряющий фактор
АФС — антифосфолипидный синдром
БМ — базальная мембрана
БМК — базальная мембрана клубочка
БПВН — быстропрогрессирующий волчаноч-
ный нефрит
БПГН — быстропрогрессирующий гломеру-
лонефрит
ВГПТ — вторичный гиперпаратиреоз
ВКЖ — внеклеточная жидкость
ВН — волчаночный нефрит
ВПР — внутрипочечный рефлюкс
ВТ — веротоксин
ВУР — везикоуретральный рефлюкс
ГМ — гломерулярная мембрана
ГБМ — гломерулярная базальная мембрана
ГВ — гранулематоз Вегенера
ГД — гемодиализ
ГДФ — гемодиафильтрация
ГЗТ — гиперчувствительность замедленного
типа
ГК — глюкокортикоиды
ГКС — глюкокортикостероиды
ГЛПС — геморрагическая лихорадка с почеч-
ным синдромом
ГПД — гипопластическая дисплазия
ГР — гормон роста
ГРС — гепаторенальный синдром
ГСПГ — гепарансульфатпротеогликаны
ГУС — гемолитико-уремический синдром
ГФ — гемофильтрация
ДАПД — дневной амбулаторный перитоне-
альный диализ
ДГПЖ — доброкачественная гиперплазия
предстательной железы
7
ДДАВП — 1-диамино-8-В-аргинин-вазопрес- МКГН — мезангиокапиллярный гломеруло-
син нефрит
дкк — диаминокарбоновая кислота ММ — множественная миелома
дмск — димеркаптосукциновая кислота мн — мембранный нефрит
дн — диабетическая нефропатия МПА — микроскопический полиартериит
дп — D-пеницилламин МПГН — мезангиопролиферативный неф-
дтпк рит
— диэтилентриаминопепта кислота НАГ — Н-ацетил-/3-В-глюкозаминидаза
ДФА иг — дефероксиамин НИПД — ночной интермиттирующий перито-
— иммуноглобулин неальный диализ
иАПФ — ингибиторы ангиотензинпревраща- НН — наследственный нефрит
ИК ющего фермента ННА — ненаркотические анальгетики
— иммунный комплекс НООД — наследственная остеониходисплазия
ИКл
— интерстициальная клетка нппд — ночной приливной перитонеальный
ИЛ-1 — интерлейкин-1 диализ
ими — инфекция мочевых путей НС — нефротический синдром
ипд — интермиттирующий перитонеаль- нет — нефроциты собирательных трубок
ный диализ непп
ипц — индекс почечной циркуляции — нестероидные противовоспалитель-
ные препараты
иптг — иммунореактивный паратиреоид- нтн — нефротоксический нефрит
ный гормон НФ — нефронофтиз Фанкони
ИФР КАМ — инсулиноподобный фактор роста оин — острый интерстициальный нефрит
— клеточные адгезивные молекулы окк — оксалатно-кальциевая кристаллурия
кг ккс — криоглобулинемия окн — острый канальцевый нефроз
— калликреин-кининовая система омн — острая мочекислая нефропатия
КС — карпальный синдром ОМС — органы мочевой системы
КСБ — кальцийсвязывающий белок онс — острый нефритический синдром
Кт — кальцитонин оппс — общее почечное периферическое
КУФ — коэффициент ультрафильтрации сопротивление
мдн — масса действующих нефронов опсс — общее почечное сосудистое сопро-
тивление
МАК — мембраноатакующий комплекс отин — острый тубулоинтерстициальный
МАУ — микроальбуминурия нефрит
МКБ — мочекаменная болезнь оцк — объем циркулирующей крови
8
ПАГ — парааминогиппурат
ПАПД — постоянный амбулаторный перито-
неальный диализ
ПБП — поликистозная болезнь почек
Пг — простагландин
ПГ — почечная гипертензия
ПД — перитонеальный диализ
ПЗТ — почечно-заместительная терапия
ПИЭ — подострый инфекционный эндокар-
дит
ПК — почечный кровоток
ПКА — почечный канальцевый ацидоз
ПКР — почечно-клеточный рак
ПМР — пузырно-мочеточниковый рефлюкс
ПНА — предсердный натрийуретический ат-
риопептид
ПОН — полиорганная недостаточность
ПСА — простатоспецифический антиген
ПТГ — паратгормон
ПФ — плазмаферез
ПЦР — полимеразная цепная реакция
ПШГ — пурпура Шенлейна — Геноха
ПЩЖ — паращитовидная железа
ПЭ — преэклампсия
РААС — ренин-ангиотензин-альдостероновая
система
РАИ — ренально-аортальный индекс
РКИ — ренокортикальный индекс
РКС — рентгеноконтрастные средства
РНП — рефлюксная нефропатия
РОД — ренальная остеодистрофия
РФ — ренотропный фактор
РФП — радиофармпрепарат
РЧГР — рекомбинантный человеческий гор-
мон роста
СА — синдром Альпорта
СВ — сердечный выброс
СКГ — смешанная криоглобулинемия
СКФ — скорость клубочковой фильтрации
СМФ — система мононуклеарных фагоци-
тов
СС — синдром Сениора
ССД — системная склеродермия
ТБН — тубулярная базальная мембрана
ТИК — тубулоинтерстициальный компо-
нент
ТИН — тубулоинтерстициальный нефрит
ТкА2 — тромбоксан
ТП — трансплантация почки
ТПН — терминальная почечная недостаточ-
ность
ТТП — тромботическая тромбоцитопени-
ческая пурпура
ТФР — трансформирующий фактор роста
ТцФР — тромбоцитарный фактор роста
ТЭЛА — тромбоэмболия легочной артерии
УП — узелковый периартериит
ФАТ — фактор активности тромбоцитов
ФВ — функциональная выживаемость
ФНОя — фактор некроза опухолей а
ФСГ — сегментарный гломерулосклероз
ФСГС — фокально-сегментарный гломеру-
лосклероз
ХАГ — хроническая артериальная гиперто-
ния
ХБ — хромосомные болезни
9
хин — хронический интерстициальный нефрит ЭДТА — этилендиаминтетрауксусная кис- лота
хот — хроническое отторжение трансплан-
тированной почки ЭКГН — экстракапиллярный гломерулонеф-
рит
хспг — хондроитинсульфатпротеогликаны ЭМ — электронная микроскопия
хтин — хронический тубулоинтерстициаль-
ный нефрит ЭПП — эффективный почечный плазмо-
ток
пог — циклооксигеназа ЭУВЛ — экстракорпоральная ударно-волно-
ЦП — цирроз печени вая литотрипсия
ЦсА — циклоспорин А ЭРП — эритропоэтин
ЦТ — цитостатики ЭФР — эпидермальный фактор роста
ЦФА — циклофосфамид ЮГА — юкстагломерулярный аппарат
Предисловие
После выхода в свет первого издания (1995)
книга уже исчезла с прилавков магазинов. За
эти годы появились новые данные, касающие-
ся различных проблем нефрологии — этой ин-
тегрирующей специальности внутренней меди-
цины, рассматривающей такие вопросы, как
почечная гипертензия, почечная анемия, ме-
ханизмы прогрессирования клубочковых пора-
жений, поражение почек при сахарном диабе-
те, беременность и почки, трансплантация
почек. В клинической практике нашли приме-
нение новые диагностические методы — луче-
вая визуализации почек, выявление антител к
цитоплазме нейтрофилов для диагностики си-
стемных васкулитов и быстропрогрессирующе-
го гломерулонефрита, микроальбуминурии —
для ранней диагностики диабетической нефро-
патии и др. Стали использоваться новые лечеб-
ные подходы — ингибиция ангиотензинпре-
вращающего фермента для снижения протеин-
урии и торможения прогрессирования клубоч-
ковых заболеваний, пульс-терапия циклофос-
фаном при прогрессирующих формах нефритов.
Циклоспорин А начали применять не только в
трансплантологии, но и в терапевтической не-
фрологии. В России продолжает дальнейшее
развитие перитонеальный диализ, существен-
но расширяющий возможности заместительной
терапии при хронической уремии. В связи с
этим стала необходимой систематизация новых
данных.
Настоящее руководство отличается от пер-
вого издания несколько большим объемом.
Частично изменена его структура. Обновился
и состав авторов. Всем им приносим благодар-
ность за быстрый отклик и понимание редак-
ционных проблем. С грустью вспоминаем ав-
торов первого издания, ушедших за эти годы
из жизни, — Ольгу Михайловну Виноградо-
ву, Владимира Владимировича Суру, Юрия
Антоновича Пытеля, Игоря Израилевича Зо-
лотарева.
Как и в первом издании, мы сочли возмож-
ным включить в книгу некоторые разделы, на-
писанные Евгением Михайловичем Тареевым,
что четко аргументировано его учеником ака-
демиком РАМН Н.А. Мухиным в «Комментари-
ях» к этим разделам.
Член-корреспондент РАМН профессор
И.Е.ТАРЕЕВА
Апрель 1999 г.
Глава 1
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ
ПОЧЕК
В. В. Серов
Функциональная морфология почек изуча-
ется на разных структурных уровнях — от мак-
ромолекулярного и ультраструктур но го до
органного и системного. Ниже рассматривает-
ся своеобразие тонкой структуры нефрона,
строения сосудистой, нервной и гормональной
систем почек, позволяющее понять особенно-
сти функций почек и их нарушения при важ-
нейших почечных заболеваниях.
1.1. Строение и функция
нефрона
Нефрон, состоящий из сосудистого клубочка,
его капсулы и почечных канальцев (рис. 1.1),
имеет высокую структурно-функциональную
специализацию.
Сосудистый клубочек. В каждой почке содер-
жится около 1—1,3 млн клубочков. Сосудистый
клубочек имеет около 50 капиллярных петель,
между которыми найдены анастомозы, что по-
зволяет клубочку функционировать как «диали-
зирующая система». Стенка капилляра представ-
ляет собой клубочковый фильтр, состо-
ящий из эпителия, эндотелия и располагаю-
щейся между ними базальной мембраны (БМ).
Эпителий клубочка, или подо-
цит, состоит из крупного клеточного тела с
ядром в его основе, митохондриями, пластин-
чатым комплексом, эндоплазматической сетью,
фибриллярными структурами и другими вклю-
чениями. Большие отростки подоцита отходят
из перинуклеарной зоны; они напоминают «по-
душки», охватывающие значительную поверх-
ность капилляра. Малые отростки, или педику-
лы, отходят от больших почти перпендикуляр-
но и закрывают собой все свободное от боль-
12
ших отростков пространство капилляра (рис. 1.2
и 1.3). Педикулы тесно прилежат друг к другу,
межпедикулярное пространство составляет 25—
30 нм [Kriz W. et al., 1994].
Подоциты связаны между собой пучковыми
структурами, образующимися из плазмолеммы.
Фибриллярные структуры особенно отчетливо
выражены между малыми отростками подоци-
тов, где они образуют так называемую щеле-
вую диафрагму (см. рис. 1.3), которой отводит-
ся большая роль в гломерулярной фильтрации.
Щелевая диафрагма, имея филаментарное стро-
ение (толщина 6 нм, длина И нм), образует
своеобразную решетку, или систему пор филь-
трации, диаметр которых у человека 5—12 нм.
Снаружи щелевая диафрагма покрыта гликока-
ликсом, т.е. сиалопротеиновым слоем цитолем-
мы подоцита, внутри она граничит с lamina гага
externa БМ капилляра (рис. 1.4).
На поверхности подоцитов найден эпителиаль-
ный антиген почечных канальцев, гликопротеин ще-
точной каймы (gp 330) и подоксалин. Подоцитар-
ный антиген представлен эндогенным гликопроте-
ином, который включен в состав рецепторов, осу-
ществляющих эндоцитоз в подоцитах; gp 330 лока-
лизован в углублениях плазматической мембраны
ножек подоцитов и в структурах синтеза этих кле-
ток — эндоплазматической сети и пластинчатом ком-
плексе Гольджи. Подоксалин — основной сиалопро-
теин клубочка, обеспечивающий отрицательный за-
ряд БМ; локализован в основании ножек подоци-
тов и на поверхности самих клеток, обращенной к
базальной мембране [Keijaschki D. et al., 1986].
Функцию фильтрации осуществляет не толь-
ко щелевая диафрагма, но и миофиламенты
цитоплазмы подоцитов, с помощью которых
происходит их сокращение. Так, «субмикроско-
пические насосы» перекачивают ультрафильт-
рат плазмы в полость капсулы клубочка. Той же
функции транспорта первичной мочи служит и
Рис. 1.1. Строение нефрона.
1 — сосудистый клубочек; 2 — главный (проксимальный)
отдел канальцев; 3 — тонкий сегмент петли Генле; 4 —
дистальный отдел канальцев; 5 — собирательные трубки.
Рис. 1.2. Гломерулярный фильтр. Электронограмма.
1 — базальная мембрана; 2 — педикулы; 3 — эндотелий;
4 — полость капсулы. Стрелками показана щелевая диаф-
рагма. X 88 000 [Rodewald Р., Karnowsky М., 1974].
система микротрубочек подоцитов. С подоцита-
ми связана не только функция фильтрации, но
и, как уже говорилось, продукция вещества БМ.
Кроме того, они экспрессируют антигены, об-
щие с клетками крови [Striker С. Е., Striker L. J.,
1985]. В цистернах гранулярной эндоплазмати-
ческой сети этих клеток находят материал, ана-
логичный веществу базальной мембраны.
Изменения подоцитов чаще всего бывают
вторичными и обычно наблюдаются при про-
теинурии, нефротическом синдроме (НС). Они
выражаются в гиперплазии фибриллярных
структур клетки, исчезновении педикул, ваку-
олизации цитоплазмы и нарушении щелевой
диафрагмы. Эти изменения связаны как с пер-
вичным повреждением базальной мембраны,
так и с самой протеинурией. Инициальные и
типичные изменения подоцитов в виде исчез-
новения их отростков характерны для липоид-
ного нефроза.
Эндотелиальные клетки капилляров
клубочка имеют поры размером до 100—150 нм
и снабжены специальной диафрагмой. Поры за-
нимают около 30 % эндотелиальной выстилки,
покрытой гликокаликсом. Поры рассматривают
как основной путь ультрафильтрации, но до-
пускают и трансэндотелиальный путь, миную-
щий поры; в пользу этого допущения говорит
высокая пиноцитозная активность гломеруляр-
ного эндотелия. Помимо ультрафильтрации,
эндотелий гломерулярных капилляров участву-
ет в образовании вещества БМ.
Изменения эндотелия капилляров клубочка раз-
нообразны: набухание, вакуолизация, некробиоз,
пролиферация и десквамация, однако преобладают
деструктивно-пролиферативные изменения, столь
характерные для гломерулонефрита (ГН).
Важную роль в регуляции кровотока играет
поверхность эндотелиальных клеток. При по-
вреждении этих клеток на их поверхности по-
являются многочисленные выросты (аркадная
формация), создающие турбулентные завихре-
ния кровотока и способствующие адгезии лей-
•коцитов к эндотелию. Кроме того, эндотелиаль-
ные клетки участвуют в регуляции кровотока,
секретируя эндотелины, оказывающие сосудо-
суживающий эффект, и оксид азота (NO), вы-
зывающий вазодилатацию [Cattell V., Cook Н.Т.,
1993].
13
Рис. 1.3. Поверхность капиллярной петли клубочка
покрыта телом подоцита и его отростками (педику-
лами), между которыми видны межпедикулярные
щели. Сканирующая электронная микроскопия,
х 6600.
Рис. 1.4. Элементы гломерулярного фильтра.
Подоциты (1), содержащие миофиламенты (2), окружены
плазматической мембраной (3). Филаменты базальной мем-
браны (4) образуют между малыми отростками подоцитов
щелевую диафрагму (5), покрытую снаружи гликокалик-
сом (6) плазматической мембраны; те же филаменты (4)
связаны с эндотелиальными клетками (7), оставляя сво-
бодными лишь его поры (8).
Базальная мембрана клубочковых ка-
пилляров, в образовании которой участвуют не
только подоциты и эндотелий, но и мезанги-
альные клетки, имеет толщину 250—400 нм и
14
в электронном микроскопе выглядит трехслой-
ной: центральный плотный слой (lamina densa)
окружен более тонкими слоями с наружной
(lamina гага externa) и внутренней (lamina гага
interna) стороны. Собственно БМ служит lamina
densa; наружный и внутренний слои являются
по существу гликокаликсом подоцитов и эндо-
телия. Филаменты lamina densa толщиной 1,2—
2,5 нм входят в «подвижные» соединения с
молекулами окружающих их веществ и образу-
ют тиксотропный гель.
В состав БМ входит несколько специфических
белков, которые объединяются в высокоорганизо-
ванный матрикс. Это прежде всего коллаген IV типа,
ламинин и 2 формы гепарансульфатпротеогликанов
(ГСПГ), которые образуют «рабочую сеть», соеди-
няющуюся с клетками и другими компонентами мат-
рикса, включая коллаген V типа, энтактин, ВМ-40,
нефритогенозид, фибронектин [Dziadek М. et al.,
1985; Abrahamson D.R., 1986]. Суммируя многочис-
ленные данные о распределении структурных ком-
понентов ГБМ [Adler S. et al., 1986; Kerjaschki D. et
al., 1986], можно сказать, что для коллагена IV типа
характерна локализация во всех слоях БМ, но наи-
более высокая концентрация его найдена во внут-
ренней части lamina densa. Ламинин обнаружен во
всех слоях БМ, наиболее высокая концентрация
характерна для lamina densa externa и lamina гага interna;
там же выявлены в высокой концентрации и ГСПГ.
Энтактин, ВМ-40, нефритогенозид найдены в lamina
гага interna, фибронектин и коллаген V типа —
как в lamina densa, так и в окружающих ее пластин-
ках.
Если с коллагеновыми белками связано структу-
рирование БМ, то с неколлагеновыми гликопроте-
инами — ламинином, энтактином и фибронекти-
ном — адгезия клеток с базальной мембраной [Dzia-
dek М. et al., 1985]. С возрастом количество коллаге-
на БМ значительно увеличивается, а гликопротеи-
нов — снижается [Karttunen М. et al., 1986]. Проте-
ингликаны БМ совместно с сиалопротеинами подо-
цитов и в меньшей мере эндотелия обеспечивают от-
рицательный заряд базальной мембраны, который
является основным барьером для анионных и нейт-
ральных макромолекул [Kerjaschki D. et al., 1986;
Melvin T., Michael A. F., 1986].
С присутствием в плотной пластинке колла-
геноподобных филаментов связана гипотеза о
порах фильтрации в базальной мембране. По-
казано, что средний радиус пор мембраны ра-
вен 2,9 нм и определяется расстоянием между
нормально расположенными и неизмененными
филаментами коллагеноподобного белка. При
падении гидростатического давления в капил-
лярах клубочков первоначальная «упаковка»
коллагеноподобных филаментов в БМ изменя-
ется, что ведет к увеличению размера пор филь-
трации [Ryan G., Kamovsky М., 1975]. Предпо-
лагают, что при нормальном кровотоке поры
базальной мембраны гломерулярного фильтра
достаточно велики и могут пропускать молеку-
лы альбумина, IgG, каталазы, но проникнове-
ние этих веществ ограничено высокой скорос-
тью фильтрации. Фильтрация ограничена так-
же дополнительным барьером гликопротеинов
(гликокаликс) между мембраной и эндотели-
ем, причем этот барьер в условиях нарушенной
гломерулярной гемодинамики повреждается.
Для поддержания нормальной клубочковой
фильтрации большое значение имеет отрица-
тельный заряд стенки капилляров клубочков.
Благодаря отрицательному заряду БМ и глико-
каликсовой оболочки, покрывающей подоци-
ты, от стенки капилляра отталкиваются белко-
вые молекулы плазмы, которые при физиоло-
гических значениях pH имеют отрицательный
заряд. Белки плазмы поэтому не проходят даль-
ше субэндотелиального слоя БМ, но для тех
молекул, которые прошли ее, последним ба-
рьером является щелевая диафрагма. Инициаль-
ными моментами в возникновении протеину-
рии служат очаговые дефекты гломерулярной
БМ (микроперфорации, очаговое оголение по-
доцитов). Через такие очаговые дефекты белки
выходят в полость капсулы, что в свою очередь
изменяет первоначальный заряд стенки капил-
ляра, снимает часть отрицательного заряда. Это
приводит к усилению фильтрации белков че-
рез гломерулярный фильтр и появлению про-
теинурии.
Изменения БМ клубочка характеризуются ее
утолщением, гомогенизацией, разрыхлением и
фибриллярностью. Утолщение БМ встречается
при многих заболеваниях с протеинурией. При
этом наблюдаются увеличение промежутков меж-
ду филаментами мембраны и деполимеризация
цементирующего вещества, с чем связывают
повышенную порозность мембраны для белков
плазмы крови. Кроме того, к утолщению БМ
гломерул ведут мембранозная трансформация, в
основе которой лежит избыточная продукция ве-
щества БМ подоцитами, и мезангиальная интер-
позиция, представленная «выселением» отрост-
ков мезангиоцитов на периферию капиллярных
петель, отслаивающих эндотелий от БМ.
При многих заболеваниях с протеинурией,
помимо утолщения мембраны, методом элект-
ронной микроскопии выявляются различные
отложения (депозиты) в мембране или в не-
посредственной близости от нее. При этом каж-
дому отложению той или иной химической
природы (иммунные комплексы, амилоид, ги-
алин) соответствует своя ультраструктура. Наи-
более часто в БМ выявляются депозиты иммун-
ных комплексов, что ведет не только к глубо-
ким изменениям самой мембраны, но и к де-
струкции подоцитов, гиперплазии эндотелиаль-
ных и мезангиальных клеток.
Рис. 1.5. Строение мезангия.
1 — мезангиоциты; 2 — мезангиальный матрикс; 3 — эндо-
телий; 4 — базальная мембрана; 5 — подоцит; 6 — малые
отростки подоцита; 7 — просвет капилляра.
Капиллярные петли связывает друг с другом
и подвешивает наподобие брыжейки к гломе-
рулярному полюсу соединительная ткань клу-
бочка, или мезангий (рис. 1.5), структура ко-
торого подчинена в основном функции фильт-
рации и репарации при повреждении мембра-
ны. В мезангии различают мезангиоциты (мезан-
гиальные клетки) и мезангиальный матрикс.
В мезангиоцитах хорошо выражены плас-
тинчатый комплекс, гранулярная эндоплазматичес-
кая сеть; в них много мелких митохондрий, рибо-
сом, лизосом. Цитоплазма клеток богата основны-
ми и кислыми белками, тирозином, триптофаном,
гистидином, полисахаридами, РНК, гликогеном.
Своеобразие ультраструктуры и богатство пластин-
чатого материала обусловливают высокие секретор-
ные и гиперпластические потенции мезангиальных
клеток. Выделяют 3 типа мезангиоцитов: гладкомы-
шечного типа (они преобладают); костномозгового
происхождения (относятся к системе мононуклеар-
ных фагоцитов); транзиторные типа моноцитов
[Kashgarian М., 1985]. Мезангиоциты гладкомышеч-
ного типа осуществляют синтез всех компонентов
мезангиального матрикса и их утилизацию, костно-
мозговые мезангиоциты заведуют функцией фагоци-
тоза различных макромолекул, в том числе цирку-
лирующих иммунных комплексов, контролируют
синтетическую функцию гладкомышечных мезанги-
15
ильных клеток [Striker G.S., Striker L.J., 1985], вы-
ступают в роли la-положительных (антигенпредстав-
ляющих) клеток [Gumer А.С. et al., 1987].
Основными компонентами мезангиаль-
ного матрикса являются коллагены IV и
V типов — ламинин и фибронектин. В отличие
от БМ матрикс не содержит энтактина и дру-
гих «мелких» гликопротеинов, вместо ГСПГ
присутствует хондроитинсульфатпротеогликаны
(ХСПГ) [Adler S. et al., 1986; Melvin T., Michael
A.F., 1986]. В функциональном отношении ме-
зангиальный матрикс, образуя систему каналов,
выполняет роль «мусоропровода» для анионных
и нейтральных макромолекул, микроорганизмов
и т. д. [Latta Н., Fligiel S., 1985].
Мезангиоциты принимают активное участие
в иммунных реакциях (la-положительные клет-
ки). Они способны реагировать на те или иные
повреждения гломерулярного фильтра продук-
цией вещества БМ, в чем проявляется репара-
тивная реакция в отношении основного ком-
понента гломерулярного фильтра. Гипертрофия
и гиперплазия мезангиальных клеток ведут к
расширению мезангиума, к его интерпозиции
[Arakawa М., Kimmelstiel Р., 1969], когда отро-
стки клеток, окруженные мембраноподобным
веществом, или сами клетки «выселяются» на
периферию клубочка, что вызывает утолщение
и склероз стенки капилляра, а в случае про-
рыва эндотелиальной выстилки — облитерацию
его просвета. С интерпозицией мезангия связа-
но развитие гломерулосклероза при многих гло-
мерулопатиях (ГН, диабетический и печеноч-
ный гломерулосклероз и т.д.). Мезангиоциты
выполняют и фагоцитарную функцию — очи-
щение клубочка, его соединительной ткани.
Мезангиоциты являются основным источни-
ком медиаторов, регулирующих как тонус ка-
пиллярных петель (оксид азота), так и проли-
ферацию клеток почечного клубочка (ИЛ-1,
ФРФ, ТцФР), и синтез ими компонентов вне-
клеточного матрикса (ТФРЬ, металлопротеина-
зы, ингибиторы металлопротеиназ) [Sterzel B.R.
et al., 1993].
Мезангиальные клетки как один из компо-
нентов юкстагломерулярного аппарата (ЮГА)
[Серов В. В., Пальцев М. А., 1984; Rouiller С.,
Orci L., 1971] способны в определенных усло-
виях к инкреции ренина fCantin М. et al., 1977].
Этой функции служат, видимо, взаимоотноше-
ния отростков мезангиоцитов с элементами
гломерулярного фильтра: определенное количе-
ство отростков перфорирует эндотелий клубоч-
ковых капилляров, проникает в их просвет и
имеет непосредственные контакты с кровью.
Считают, что мезангиоциты способны к сокра-
щению, которое подчинено фильтрационной
функции. В цитоплазме мезангиальных клеток
16
найдены фибриллы, обладающие актиновой и
миозиновой активностью.
Получены данные о механизмах взаимодей-
ствия клеток почечного клубочка. Так, подоци-
ты в норме секретируют гепариноподобное ве-
щество, ингибирующее пролиферацию мезан-
гиоцитов [Carpenter С.В., 1986], при деструк-
ции подоцитов образуется МАК —мембрано-
атакующий комплекс, с чем связывают разви-
тие сегментарного гиалиноза клубочков
[Schwartz М.М. et al., 1987]. Мезангиоциты,
подоциты и эндотелиоциты клубочка секрети-
руют метаболиты арахидоновой кислоты (про-
стагландины, лейкотриены, тромбоксаны),
которые регулируют тонус этих клеток, почеч-
ный кровоток и иммунные реакции в клубоч-
ках.
Капсула клубочка представлена БМ и эпи-
телием. Мембрана, продолжающаяся в глав-
ный отдел канальцев, состоит из ретикулярных
волокон. Тонкие коллагеновые волокна закреп-
ляют клубочек в интерстиции. Эпителиаль-
ные клетки фиксированы на БМ с помо-
щью филаментов, содержащих актомиозин. На
этом основании эпителий капсулы рассматри-
вают как разновидность миоэпителия, изменя-
ющего объем капсулы, что способствует филь-
трации. Эпителий имеет кубическую форму, но
в функциональном отношении близок к эпи-
телию главного отдела канальцев; в области по-
люса клубочка эпителий капсулы переходит в
подоциты.
1.2. Почечные канальцы
Канальцевую часть нефрона принято делить на
четыре отдела:
• главный (проксимальный);
• тонкий сегмент петли Генле;
• дистальный;
• собирательные трубки.
Главный (проксимальный) отдел
состоит из извитой и прямой частей. Клетки
извитой части имеют более сложное строение,
чем клетки других отделов нефрона. Это высо-
кие (до 8 мкм) клетки со щеточной каемкой,
внутриклеточными мембранами, большим чис-
лом правильно ориентированных митохондрий,
хорошо развитыми пластинчатым комплексом
и эндоплазматической сетью, лизосомами и
другими ультраструктурами (рис. 1.6 и 1.7). В их
цитоплазме содержится много аминокислот,
основных и кислых белков, полисахаридов и
активных SH-групп, высокоактивных дегидро-
геназ, диафораз, гидролаз [Серов В.В., Уфим-
цева А.Г., 1977; Jakobsen N., Jorgensen F., 1975].
Клетки прямой (нисходящей)
Рис. 1.6. Ультраструктура кле-
ток канальцев различных от-
делов нефрона.
1 — клетка извитой части глав-
ного отдела; 2 — клетка прямой
части главного отдела; 3 — клет-
ка тонкого сегмента петли Ген-
ле; 4 — клетка прямой (восходя-
щей) части дистального отдела;
5 — клетка извитой части дис-
тального отдела; 6 — «темная»
клетка связующего отдела и со-
бирательной трубки; 7 — «свет-
лая» клетка связующего отдела и
собирательной трубки.
части главного отдела в основном име-
ют то же строение, что и клетки извитой час-
ти, но пальцевидные выросты щеточной каем-
ки более грубые и короткие, внутриклеточных
мембран и митохондрий меньше, они не так
строго ориентированы, значительно меньше
цитоплазматических гранул.
Щеточная каемка состоит из много-
численных пальцевидных выростов цитоплаз-
мы, покрытых клеточной мембраной и глико-
каликсом. Их число на поверхности клетки до-
стигает 6500, что увеличивает рабочую площадь
каждой клетки в 40 раз [Bargmann W., 1978].
Эти сведения дают представление о поверхно-
сти, на которой совершается обмен в прокси-
мальном отделе канальцев.
Рис. 1.7. Ультраструктура клетки главного отдела ка-
нальцев (метод замораживания — скалывания).
ЩК — щеточная каемка; В — вакуоли; Я — ядро.
2—2950
17
В щеточной каемке доказана активность щелочной
фосфатазы, АТФазы, 5-нуклеотидазы, аминопепти-
дазы и ряда других ферментов [Wachsmuth Е., Stoye
J., 1976]. Мембрана щеточной каемки содержит на-
трийзависимую транспортную систему. Считают, что
гликокаликс, покрывающий микроворсинки щеточ-
ной каемки, проницаем для малых молекул. Большие
молекулы поступают в каналец с помощью пиноци-
тоза, который осуществляется благодаря кратерооб-
разным углублениям в щеточной каемке.
Внутриклеточные мембраны образованы не
только изгибами БМ клетки, но и латеральны-
ми мембранами соседних клеток, которые как
бы перекрывают друг друга. Внутриклеточные
мембраны являются по существу и межклеточ-
ными, что служит активному транспорту жид-
кости. При этом главное значение в транспор-
те воды придается базальному лабиринту, об-
разованному выпячиваниями БМ внутрь клет-
ки; он рассматривается как «единое диффузи-
онное пространство» [Thoenes W., 1968].
Многочисленные митохондрии расположены в
базальной части между внутриклеточными мембрана-
ми, что и создает впечатление их правильной ориен-
тации. Каждая митохондрия, таким образом, заклю-
чена в камере, образованной складками внутри- и
межклеточных мембран. Это позволяет продуктам фер-
ментативных процессов, развивающихся в митохон-
дриях, легко выходить за пределы клетки. Энергия,
вырабатываемая в митохондриях, служит как транс-
порту вещества, так и секреции, осуществляемой с
помрщью гранулярной эндоплазматической сети и
пластинчатого комплекса, который претерпевает цик-
лические изменения в различные фазы диуреза.
Ультраструктура и ферментохимия клеток
канальцев главного отдела объясняют его слож-
ную и дифференцированную функцию. Щеточ-
ная каемка, как и лабиринт внутриклеточных
мембран, является своеобразным приспособле-
нием для колоссальной по объему функции ре-
абсорбции, выполняемой этими клетками. Фер-
ментная транспортная система щеточной каем-
ки, зависимая от натрия, обеспечивает реабсор-
бцию глюкозы, аминокислот, фосфатов. С внут-
риклеточными мембранами, особенно с базаль-
ным лабиринтом, связывают реабсорбцию воды,
глюкозы, аминокислот, фосфатов и ряда дру-
гих веществ, которую выполняет натрийзависи-
мая транспортная система мембран лабиринта.
Особый интерес представляет вопрос о ка-
нальцевой реабсорбции белка. Считают доказан-
ным, что весь фильтрующийся в клубочках бе-
лок реабсорбируется в проксимальном отделе
канальцев, чем объясняется его отсутствие в
моче здорового человека. Это положение осно-
вывается на многих исследованиях, выполнен-
ных, в частности, с помощью электронного
микроскопа. Так, транспорт белка в клетке про-
ксимального канальца изучен в опытах с мик-
18
роинъекцией меченного 1311 альбумина непосред-
ственно в каналец крысы с последующей элек-
тронно-микроскопической радиографией этого
канальца. Альбумин находят прежде всего в ин-
вагинатах мембраны щеточной каемки, затем в
пиноцитозных пузырьках, которые сливаются в
вакуоли. Белок с вакуолей появляется затем в
лизосомах и пластинчатом комплексе и расщеп-
ляется гидролитическими ферментами. Таким об-
разом, в нефроците существует вакуолярно-ли-
зосомальная система реабсорбции белка.
В связи с этими данными становятся понят-
ными механизмы «повреждения» канальцев
главного отдела. При НС любого генеза, проте-
инурических состояниях изменения эпителия
канальцев проксимального отдела в виде бел-
ковой дистрофии (гиалиново-капельной, гид-
ропической) отражают резорбционную недо-
статочность вакуолярно-лизосомальной системы
и системы базального лабиринта канальцев в
условиях повышенной порозности гломеруляр-
ного фильтра для белка [Плоткин В.Я., 1980;
Серов В.В. и др., 1983]. Однако не всегда мож-
но объяснить изменения канальцев при НС пер-
вично-дистрофическими процессами. В равной
мере нельзя рассматривать и протеинурию как
результат только повышенной порозности гло-
мерулярного фильтра. Протеинурия при НС от-
ражает как первичное повреждение фильтра
почки, так и вторичное истощение (блокаду)
ферментных систем канальцев, осуществляю-
щих реабсорцию белка и воды.
При ряде инфекций и интоксикаций блокада
ферментных систем клеток канальцев главного от-
дела может наступить остро, поскольку эти каналь-
цы первыми подвергаются действию токсинов и ядов
при их элиминации почками. Активация гидролаз ли-
зосомного аппарата клетки завершает в ряде случа-
ев дистрофический процесс развитием некроза клет-
ки (острый нефроз). В свете приведенных данных ста-
новится понятной патология «выпадения» фермен-
тов канальцев почек наследственного порядка (так
называемые наследственные канальцевые ферменто-
патии). Определенная роль в повреждении канальцев
(тубулолизис) отводится антителам, реагирующим с
антигеном тубулярной базальной мембраны и щеточ-
ной каемки.
Клетки тонкого сегмента петли
Генле характеризуются тем, что внутрикле-
точные мембраны и пластинки пересекают тело
клетки на всю ее высоту, образуя в цитоплаз-
ме щели шириной до 7 нм [Bargmann W., 1978].
Создается впечатление, что цитоплазма состо-
ит из отдельных сегментов, причем часть сег-
ментов одной клетки как бы вклинивается меж-
ду сегментами соседней клетки. Ферментохимия
тонкого сегмента отражает функциональную
особенность этого отдела нефрона, который как
дополнительное приспособление уменьшает до
минимума фильтрационный заряд воды и обес-
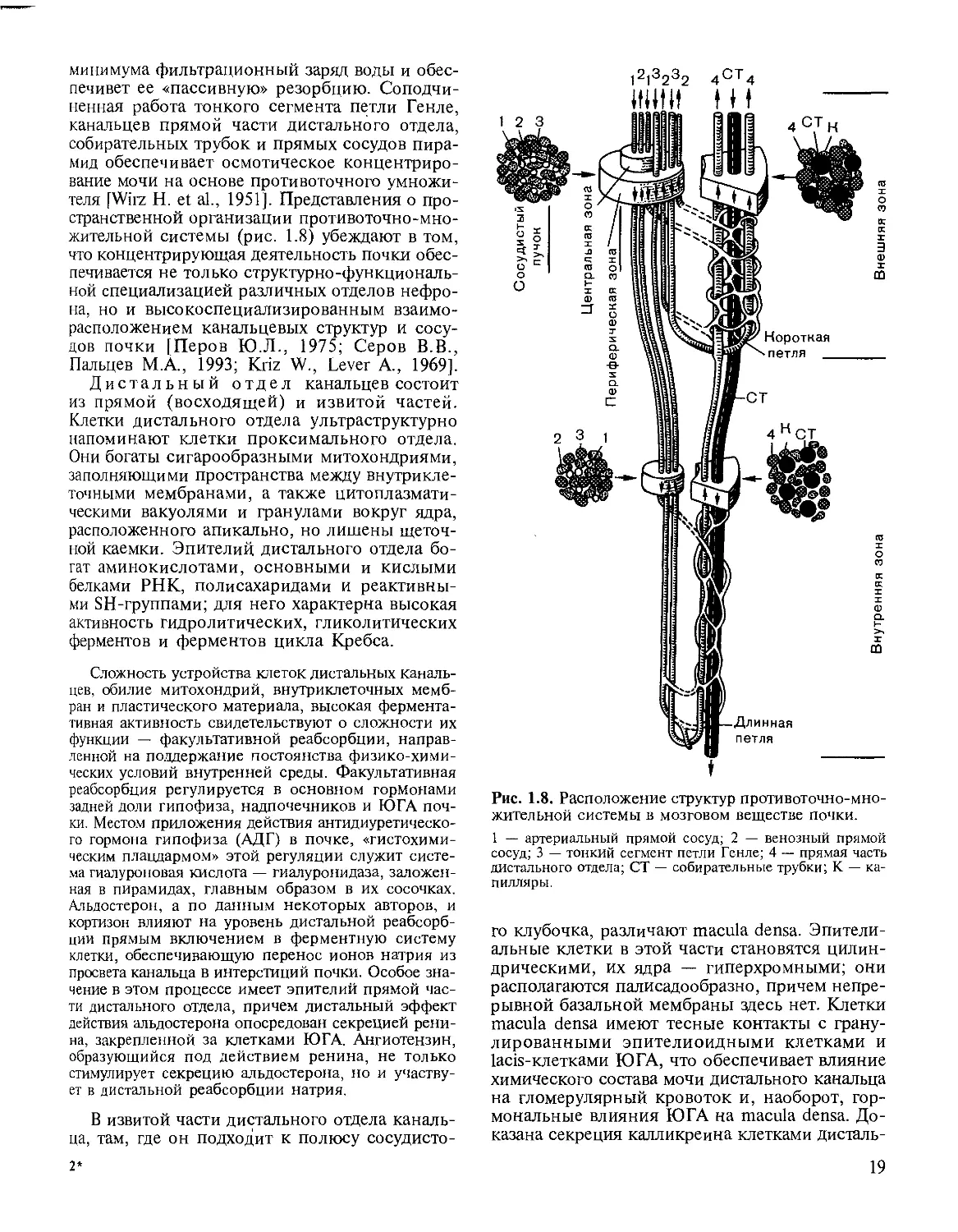
печивет ее «пассивную» резорбцию. Соподчи-
ненная работа тонкого сегмента петли Генле,
канальцев прямой части дистального отдела,
собирательных трубок и прямых сосудов пира-
мид обеспечивает осмотическое концентриро-
вание мочи на основе противоточного умножи-
теля [Wirz Н. et al., 1951]. Представления о про-
странственной организации противоточно-мно-
жительной системы (рис. 1.8) убеждают в том,
что концентрирующая деятельность почки обес-
печивается не только структур но-функциональ-
ной специализацией различных отделов нефро-
на, но и высокоспециализированным взаимо-
расположением канальцевых структур и сосу-
дов почки [Перов Ю.Л., 1975; Серов В.В.,
Пальцев М.А., 1993; Kriz W., Lever А., 1969].
Дистальный отдел канальцев состоит
из прямой (восходящей) и извитой частей.
Клетки дистального отдела ультраструктурно
напоминают клетки проксимального отдела.
Они богаты сигарообразными митохондриями,
заполняющими пространства между внутрикле-
точными мембранами, а также цитоплазмати-
ческими вакуолями и гранулами вокруг ядра,
расположенного апикально, но лишены щеточ-
ной каемки. Эпителий дистального отдела бо-
гат аминокислотами, основными и кислыми
белками РНК, полисахаридами и реактивны-
ми SH-группами; для него характерна высокая
активность гидролитических, гликолитических
ферментов и ферментов цикла Кребса.
Сложность устройства клеток дистальных каналь-
цев, обилие митохондрий, внутриклеточных мемб-
ран и пластического материала, высокая фермента-
тивная активность свидетельствуют о сложности их
функции — факультативной реабсорбции, направ-
ленной на поддержание постоянства физико-хими-
ческих условий внутренней среды. Факультативная
реабсорбция регулируется в основном гормонами
задней доли гипофиза, надпочечников и ЮГА поч-
ки. Местом приложения действия антидиуретическо-
го гормона гипофиза (АДГ) в почке, «гистохими-
ческим плацдармом» этой регуляции служит систе-
ма гиалуроновая кислота — гиалуронидаза, заложен-
ная в пирамидах, главным образом в их сосочках.
Альдостерон, а по данным некоторых авторов, и
кортизон влияют на уровень дистальной реабсорб-
ции прямым включением в ферментную систему
клетки, обеспечивающую перенос ионов натрия из
просвета канальца в интерстиций почки. Особое зна-
чение в этом процессе имеет эпителий прямой час-
ти дистального отдела, причем дистальный эффект
действия альдостерона опосредован секрецией рени-
на, закрепленной за клетками ЮГА. Ангиотензин,
образующийся под действием ренина, не только
стимулирует секрецию альдостерона, но и участву-
ет в дистальной реабсорбции натрия.
В извитой части дистального отдела каналь-
ца, там, где он подходит к полюсу сосудисто-
2*
Рис. 1.8. Расположение структур противоточно-мно-
жительной системы в мозговом веществе почки.
1 — артериальный прямой сосуд; 2 — венозный прямой
сосуд; 3 — тонкий сегмент петли Генле; 4 — прямая часть
дистального отдела; СТ — собирательные трубки; К — ка-
пилляры.
го клубочка, различают macula densa. Эпители-
альные клетки в этой части становятся цилин-
дрическими, их ядра — гиперхроиными; они
располагаются палисадообразно, причем непре-
рывной базальной мембраны здесь нет. Клетки
macula densa имеют тесные контакты с грану-
лированными эпителиоидными клетками и
lacis-клетками ЮГА, что обеспечивает влияние
химического состава мочи дистального канальца
на гломерулярный кровоток и, наоборот, гор-
мональные влияния ЮГА на macula densa. До-
казана секреция калликреина клетками дисталь-
19
ных канальцев, показана топографическая бли-
зость этих клеток к клеткам macula densa.
Со структурно-функциональной особеннос-
тью канальцев дистального отдела, их повышен-
ной чувствительностью к кислородному голода-
нию связано до некоторой степени их избира-
тельное поражение при острых гемодинамичес-
ких повреждениях почек, в патогенезе которых
основную роль играют глубокие нарушения по-
чечного кровообращения с развитием аноксии
тубулярного аппарата. В условиях острой аноксии
клетки дистальных канальцев подвергаются воз-
действию содержащей токсичные продукты кис-
лой мочи, что ведет к их поражению вплоть до
некроза. При хронической аноксии клетки дис-
тального канальца чаще, чем проксимального,
подвергаются атрофии.
Собирательные трубки, выстланные
кубическим, а в дистальных отделах цилиндри-
ческим эпителием (светлые и темные клетки)
с хорошо развитым базальным лабиринтом, вы-
сокопроницаемы для воды. С темными клетка-
ми связывают секрецию ионов водорода, в них
обнаружена высокая активность карбоангидра-
зы. Доказано, что нефроциты собирательных
трубок секретируют простагландины. Пассивный
транспорт воды в собирательных трубках обес-
печивается особенностями функции противо-
точно-множительной системы [Wirz Н., 1953].
Заканчивая описание гистофизиологии не-
фрона, следует остановиться на его структур-
но-функциональном различии в разных отделах
почки. На этом основании выделяют кортикаль-
ные и юкстамедуллярные нефроны, различаю-
щиеся строением клубочков и канальцев, а
также своеобразием функции; различно и кро-
воснабжение этих нефронов (см. Сосудистая
система и строма почек).
1.3. Сосудистая система
и строма почек
Архитектоника кровеносной системы
почки подчинена авторегуляции почечного кро-
вообращения, дифференциации кровотока в
корковом и мозговом веществе. Этим целям
служат два структурно и функцио-
нально разных круга кровообраще-
ния в почках: большой (кортикальный) и
малый (юкстамедуллярный).
Кортикальный круг представлен со-
судами коркового вещества: междольковыми ар-
териями, приносящими сосудами и сетью ос-
новной массы гломерул, выносящими сосуда-
ми и постгломерулярной капиллярной и веноз-
ной сетью коры. Юкстамедуллярный
круг кровообращения почки составляют про-
ксимальные отрезки интерлобулярных артерий,
20
приносящие артериолы юкстамедуллярных клу-
бочков и сосудистая сеть, выносящие артерио-
лы юкстамедуллярных клубочков, артериальные
и венозные компоненты сосудов пирамид, а
также проксимальные отрезки интерлобулярных
вен. Установлено, что элементами юкстамедул-
лярного пути почечного кровотока могут быть
также межканальцевые капилляры кортико-ме-
дуллярной зоны, перигломерулярные сосудистые
сплетения, связывающие афферентные и эффе-
рентные артериолы юкстамедуллярных клубоч-
ков, а также негломерулярные артериовенозные
анастомозы пограничного слоя почки.
Возможность кровообращения в почке по
юкстамедуллярному «укороченному» пути обес-
печивается прежде всего особым строением, а
также своеобразием функции юкстамедулляр-
ных клубочков и сосудов пограничного слоя
почки. Юкстамедуллярные клубочки, составля-
ющие ’/10—'/,5 общего числа гломерул, в отли-
чие от кортикальных имеют выносящие сосу-
ды гораздо большего диаметра, чем принося-
щие. Широкие выносящие сосуды юкстамедул-
лярных клубочков обильно анастомозируют
между собой и с венами, спускаются в пира-
миды, где образуют широкопетлистые артерио-
венозные сплетения, после чего впадают в ос-
новные венозные стволы почки. Кроме того, у
этих клубочков имеются анастомотические свя-
зи между приносящими и выносящими сосуда-
ми. Юкстамедуллярные клубочки рассматривают-
ся, таким образом, не только как аппараты
фильтрации, но и как дренажные системы.
Значение пограничного слоя в регуляции
почечного кровообращения огромно, посколь-
ку в этой зоне происходит перераспределение
крови между корой и пирамидами и устанав-
ливается доля участия кортикального и юкста-
медуллярного путей в почечном кровотоке.
В физиологических условиях перераспределение
крови в почках происходит таким образом, что
85—90 % течет по кортикальному и лишь 10—
15 % — по юкстамедуллярному пути. Однако
при определенных условиях основная масса
крови может циркулировать по укороченному
почечному пути; тогда юкстамедуллярный путь
становится своеобразным шунтом (шунт Труе-
та), по которому кровь сбрасывается в пирами-
ды, минуя корковое вещество, что ведет к из-
бирательной ишемии коры вплоть до развития
кортикальных некрозов почки.
Почечное шунтирование связано с нервно-
рефлекторными механизмами, развитием спаз-
ма артерий коркового вещества почки, а так-
же с гуморальными механизмами. Это позволяет
рассматривать шунтирование как один из вари-
антов авторегуляции почечного кровотока.
Строение лимфатической системы
подчинено функциональной специфике органа
[Жданов Д.А., 1957; Kriz W., Dieterich H., 1970].
Начальные сети лимфатических капилляров
(корни лимфатической системы почки) опле-
тают капсулу клубочков, канальцы, причем
лимфатические капилляры имеют больший ка-
либр, чем кровеносные. В гломерулах лимфати-
ческих капилляров нет.
Лимфатические капилляры, расположенные вок-
руг клубочков и канальцев коркового вещества, пе-
реходят в окружающие междольковые артерии и
вены, в футлярообразные сети лимфатических ка-
пилляров (калибр некоторых из них достигает 25—
30 мкм), причем между этими сетями есть анасто-
мозы капиллярного типа.
Междольковые кровеносные сосуды и оплетаю-
щие их лимфатические капилляры, так же как и ду-
говые, и междолевые кровеносные и лимфатичес-
кие сосуды, находятся в едином соединительноткан-
ном ложе, формируют единый сосудистый пучок.
Таким образом, анатомия лимфатической системы
почки в значительной мере соответствует конструк-
ции ее кровеносной системы, прежде всего опреде-
ляющей функциональную специфику этого органа.
Лимфатическая система почки, как и ее
строма, функционально подчинена главным
образом реабсорбционной работе канальцев и
является вторым звеном почечной реабсорбции.
Сосуды почек находятся в тесной связи с
соединительной тканью органа, при-
чем их функция в значительной степени зави-
сит от строения и состояния соединительной
ткани. В различных слоях почки соединительная
ткань развита неодинаково, да и «качество» ее
различно.
В пограничном слое соединительная ткань,
представленная коллагеновыми и ретикулярны-
ми волокнами, особенно хорошо развита. В кор-
ковом веществе строма в основном ретикуляр-
ная и представлена довольно скудно, клеточ-
ные элементы также немногочисленны. Стро-
мальные фибробласты рассматриваются как
контрактильные клетки, участвующие в функ-
циях канальцев. В мозговом веществе соедини-
тельной ткани немного, она очень рыхлая,
способна легко «набухать» и «спадаться». Боль-
шое значение для полипотентной функции
почек имеют интерстициальные клетки мозго-
вого вещества, которые продуцируют проста-
гландины, влияющие на обмен электролитов и
воды [Постнов Ю.В., Перов Ю.Л., 1972] вклю-
чением в работу противоточного умножителя
почки. Эти клетки способны и к синтезу кис-
лых гликозаминогликанов и коллагена.
Функциональная специфика соединительной
ткани пирамид объясняет избирательную рани-
мость стромы мозгового вещества почки при
различных патологических процессах (склероз,
гиалиноз, амилоидоз); в корковом веществе
слабое развитие соединительной ткани обуслов-
ливает ранимость почечной паренхимы при трав-
ме, отеке, воспалении. Следует указать, что ин-
терстиций почки служит ареной не гуморальных,
а клеточных иммунных реакций [McCluskey К.,
Andres G., 1975].
1.4. Нервная система почек
Нервные волокна образуют в адвентиции и
медии крупных сосудов сплетения, от которых
отходят двигательные окончания к гладкой
мускулатуре, чувствительные — к адвентиции.
От этих же сплетений отходят нервы к моче-
вым канальцам. В иннервации почек участвуют
адренергические и холинергические нервы,
проникающие вплоть до приносящих артериол
[Швалев В.Н., 1965; Sirotakova М. et al., 1975].
Доказана идентичность адренергических и хо-
линергических волокон в почке.
Иннервация нефрона. От сплетения не-
рвных волокон, оплетающих стенку приносящей ар-
териолы, отходят тонкие ветви к мышечной оболоч-
ке сосуда, к капиллярам и капсуле клубочка. Вокруг
выносящих артериол имеются единичные безмякот-
ные волокна. От нервных стволов, расположенных по
ходу артерий, отходят нервные волокна к мочевым
канальцам, образуя окончания под базальной мемб-
раной. Изучение иннервации стенок приносящей и
выносящей артериол с помощью электронного мик-
роскопа показало, что терминали, содержащие гра-
нулярные и агранулярные пузырьки, образуют кон-
такты с гладкомышечными клетками артериол. Рабо-
ты с применением комплекса гистохимических и ав-
торадиографических методов убеждают, что принося-
щая и выносящая артериолы имеют один источник
адренергической и холинергической иннервации. Во-
локна, иннервирующие выносящую артериолу, про-
слежены вплоть до прямых сосудов. Канальцы глав-
ного и дистального отделов иннервируются адренер-
гическими и холинергическими волокнами, отходя-
щими от нервных сплетений в стенках артерий поч-
ки, причем терминали образуют контакты с базаль-
ной мембраной канальцев; показана также иннерва-
ция тонкого сегмента петли Генле (петли нефрона).
Источником иннервации элементов ЮГА являет-
ся аорторенальное сплетение. Описана иннервация
гранулированных эпителиоидных клеток [Dolezel S. et
al., 1976]. Терминали в области плотного пятна закан-
чиваются у БМ. По данным L.Bajaras и J.Muller (1973),
иннервируется около 25 % клеточных элементов ЮГА.
Самую скудную иннервацию получают клетки Гурмаг-
тига и прилегающие к ним мезангиальные клетки.
Механизм нервной регуляции функции по-
чек сложен. Эти функции регулируются а- и В-
адренорецепторами, причем почечная гемоди-
намика контролируется а-рецепторами, а вы-
деление ренина — (J-адренорецепторами. (3-Ад-
реностимуляция вызывает расширение почеч-
ных сосудов, а а-адреноблокада — некоторое
их сужение. ^-Рецепторы локализованы в стен-
21
Рис. 1.9. Строение юкстагломерулярного аппарата.
I — гранулированные эпителиоидные (юкстагломеруляр-
ные) клетки; II — клетки плотного пятна (macula densa);
HI — клетки Гурмагтига (lacis-клетки); IV — мезангиаль-
ные клетки: 1 — приносящая артериола клубочка; 2 — ка-
налец дистального отдела; 3 — выносящая артериола клу-
бочка; 4 — мезангий; 5 — капилляры клубочка; 6 — по-
лость капсулы; 7 — наружный листок капсулы.
ке афферентной артериолы, в юкстагломеру-
лярных клетках и в эпителии собирательных
трубок. Стимуляция а- и [3-адренорецепторов ве-
дет к выбросу вазопрессина. Слабая стимуляция
симпатических нервов почки вызывает сниже-
ние кровотока и увеличение фильтрации мочи,
а сильная стимуляция — снижение и кровото-
ка, и фильтрации мочи (воды и натрия). Пока-
зано участие нервной системы почки в регуля-
ции продукции и выброса эритропоэтина. Дей-
ствие адренергических медиаторов, выделяемых
почечными нервами, тесно связано с проста-
гландинами. Простагландин Е2 независимо от
дозы тормозит выброс норадреналина, насту-
пающий после стимуляции почечного нерва.
1.5. Эндокринные аппараты
почек
К эндокринным аппаратам почек относят:
• ЮГА, выделяющий ренин и эритропоэтин;
• интерстициальне клетки мозгового вещества
и нефроциты собирательных трубок (НСТ),
вырабатывающие простагландины;
• калликреин-кининовую систему;
• клетки APUD-системы, содержащие серото-
нин.
Юкстагломерулярный аппарат.
В этом аппарате выделяют четыре компонента
(рис. 1.9): 1) гранулированные эпителиоидные
клетки в стенке афферентной артериолы (юк-
стагломерулярные клетки); 2) клетки плотно-
го пятна; 3) клетки Гурмагтига (lacis-клетки);
4) мезангиальные клетки клубочка.
Юкстагломерулярные клетки вырабатывают
ренин — катализатор начального этапа образо-
вания ангиотензина. В юкстагломерулярных
клетках ренин сосредоточен в специфических
секреторных гранулах. Помимо этих гранул, в
клетках имеются и неспецифические, например
гранулы липофусцина. Ренин оказывает силь-
ное сосудосуживающее действие и стимулиру-
ет продукцию альдостерона надпочечниками.
Выброс ренина регулируется нервной системой.
Роль своеобразного рецептора играет плотное
пятно, реагирующее на качественный состав со-
держимого дистального канальца. Плотное пят-
но в свою очередь взаимодействует с эпителио-
идными клетками через клетки Гурмагтига, что
имеет морфологические доказательства. То, что
клетки Гурмагтига, негранулированные гладко-
мышечные и мезангиальные клетки при гиперт-
рофии ЮГА могут участвовать в выработке ре-
нина, превращаясь в юкстагломерулярные клет-
ки, получило новые подтверждения [Серов В.В.,
Пальцев М.А., 1993].
Наиболее часты изменения ЮГА, обуслов-
ленные гиперплазией клеток. Они более выра-
жены при реноваскулярной гипертензии: общее
число клеток в ЮГА увеличивается в среднем
в 3 раза, количество гранулированных клеток —
в 8 раз, площадь — в 2 раза. Существенно воз-
растают указанные параметры ЮГА при остром
ГН как с нормальным, так и с повышенным
артериальным давлением, злокачественной
форме артериальной гипертензии, некрозе ка-
нальцев, некрозе коры почек, реакции оттор-
жения пересаженной почки. Выраженность этих
изменений ЮГА имеет определенное прогнос-
тическое значение и может помочь в выборе
тактики лечения. Помимо гиперплазии клеток
ЮГА, находят его атрофию, например, при
первичном гипокалиемическом альдостерониз-
ме, или синдроме Конна.
Описана опухоль из клеток ЮГА. Клиничес-
ки она проявляется высоким артериальным
давлением и высоким содержанием ренина в
плазме крови.
Интерстициальные клетки моз-
гового вещества. Ось интерстициальных
клеток ориентирована перпендикулярно к
длиннику сосочка пирамиды, ИК расположе-
ны параллельно друг другу и лежат между со-
бирательными трубками, сосудами и тонкими
сегментами петель Генле. ИК имеют длинные
цитоплазматические отростки, позволяющие им
контактировать с сосудами, канальцевым аппа-
ратом почки и друг с другом. Клетки содержат
липидные капли, причем концентрация гранул
22
в ИК и самих ИК в мозговом веществе почки
возрастает по направлению к вершине сосочка.
Как свидетельствуют данные электронной мик-
роскопии, в этих клетках хорошо развиты ци-
топлазматическая сеть, главным образом шеро-
ховатого типа, пластинчатый комплекс, много
митохондрий, большое количество осмиофиль-
ных гранул овальной формы, иногда окружен-
ных одноконтурной мембраной. Функция интер-
стициальных клеток заключается в синтезе и
выделении почечных простагландинов, они
участвуют в работе противоточно-множитель-
ной системы.
Калликреин-кининовая система
представлена в почках нефроцитами дистальных
канальцев, в которых с помощью специфичес-
кой иммунной сыворотки была выявлена сек-
реция калликреина. Канальцы, содержащие кал-
ликреиноциты, располагаются вблизи macula
densa [Orstavik Т.В. et al., 1976]. Калликреин, вы-
деляясь в просвет канальцев, взаимодействует
с кининогенами; образующиеся кинины могут
достигать мозгового вещества почки и вызывать
высвобождение простагландинов и интерстици-
альных клеток.
Взаимодействие эндокринных
аппаратов почек. Клеточная гетероген-
ность ЮГА обеспечивает ауторегуляцию его
функций: клетки плотного пятна улавливают
изменения состава мочи (снижение концентра-
ции NaCl в моче, например, ведет к повыше-
нию активности ренина в плазме крови); ме-
зангиальные клетки, обладающие рецепторами
к ангиотензину II, улавливают изменения со-
става плазмы крови, а эпителиоидные и глад-
комышечные клетки ЮГА, имеющие [1-рецеп-
торы, — изменения уровня артериального дав-
ления. В регуляции синтеза ренина ЮГА при-
нимают участие простагландины и кинины:
ПП, (простациклин), выделяемый эндотелием
сосудов почек, оказывает более сильное влия-
ние на ЮГА, ПГЕ2, синтезируемый ИК моз-
гового вещества и НСТ, — менее сильное вли-
яние [Gerber J.G. et al., 1981]. Синтез проста-
гландинов в свою очередь возбуждает кинины
[Grenier F.C. et al., 1981], а кинины — проста-
гландины. Из ЮГА ренин поступает в почеч-
ный интерстиций, где выявлены все компонен-
ты ренин-ангиотензиновой системы.
Итак, в почках осуществляется соподчинен-
ная работа клубочковых и околоклубочковых
структур с канальцами и стромой пирамид. Это
соподчинение идет не только по линии «пря-
мых связей» (клубочек — каналец — строма —
лимфатические сосуды — вены), но и на уровне
нейрогуморальных и эндокринно-почечных
координированных регуляций, имеющих кон-
кретное структурное выражение.
Литература
Вихерт А.М., Соколова Р., Волков В.Н. Ренин-ангио-
тензиновая система в условиях изменения синтеза
простагландинов//Бюлл. экспер. биол. — 1976. —
№ 9. - С. 1034-1036.
Серов В. В. Функциональная морфология почек//Кли-
ническая нефрология/Под ред. Е.М.Тареева. — М.:
Медицина, 1983. — Т.1. — С. 9—33.
Серов В.В., Пальцев М.А. Почки и артериальная ги-
пертензия. — М.: Медицина, 1993.
Серов В.В., Варшавский В.А., Куприянова Л.А. Имму-
нопатология почек. — М.: Медицина, 1983.
Серов В.В., Варшавский В.А., Ковтун Т.И., Куприя-
нова Л.А. Морфогенез дистрофии нефроцитов//Арх.
пат. - 1983. - Выл. 1. - С. 25-33.
Abrahamson D.R. Recent studies on the structure and
pathology of basement membranes//!. Pathol. — 1986. —
Vol. 149, N 4. - P. 257-278.
Adler S., Striker L.J., Striker G.E. et al. Studies of
progressive glomerular sclerosis in the rat//Amer.
J. Pathol. - 1986. - Vol. 123, N 3. - P. 553-562.
Cattell V., Cook H.T. Nitric oxide: role in physiology and
pathology of the glomerulus//Exp. Nephrol. — 1993. —
Vol. 1. - P. 265-272.
Gumer A.S., Smith J., Cattell V. The origin of la-antigen-
expressing cells in the rat kidney //Amer. J. Pathol. —
1987. - Vol. 127, N 2. - P. 342-348.
Kashgarian M. Mesangium and glomerular disease//Lab.
Investig. - 1984. - Vol. 52, N 6. - P. 569-571.
Kerjaschki D., Sawada H., Farquhar M.G. Immunoelect-
ron microscopy in kidney research: some contributions
and limitations//Kidney Int. — 1986. — Vol. 30, N 2. —
P. 229-245.
Kriz W., Hackenthal E., Nobiling R. et al. A role for
podocytes to counteract capillary wall distension//Kidney
Int. - 1994. - Vol. 49. - P. 369-375.
Latta H., Fligiel S. Mesangial fenestrations, sieving,
filtration, and flow//Lab. Investig. — 1985. — Vol. 52,
N 6. - P. 591-598.
Melvin T, Michael A.F. New insights into the pathoge-
nesis of minimal change disease//Clin. Immunol.
Alleigs. - 1986. - Vol. 6, N 2. - P. 331-352.
Serov V.V., Varshavsky V.A., Kupriyanova L.A.,
Proskurneva E.P. Tubulo-interstitielle Nephritis//Zentralbl.
allg. Pathol. Anat. - 1986. - Bd 132, N 5/6. - S. 385-393.
Sterzel B.R., Schulze-Lohoff E., Marx M. Cytokines and
mesangial cells//Kidney Int. — 1993. — Suppl. 39. —
S. 26-31.
Striker C.E., Striker L.J. Glomerular cell culture//Lab.
Investig. - 1985. - Vol. 53, N 2. - P. 122-131.
23
Гпава 2
МЕХАНИЗМЫ МОЧЕОБРАЗОВАНИЯ
Ю.В.Наточин
Роль почек в организме весьма многогран-
на, от них зависит постоянство состава и объе-
ма жидкостей внутренней среды. Описание
функций, выполняемых почками в организме
человека, имеет особое значение для клиници-
стов, поскольку симптомы нарушений работы
почки обусловлены изменением состояния той
или иной ее функции или ряда функций поч-
ки. Почки участвуют в поддержании стабильной
концентрации осмотически активных веществ
в крови и других жидкостях тела (осморегуля-
ция), в регуляции объема крови и внеклеточ-
ных жидкостей (волюморегуляция), от их дея-
тельности зависят во многом постоянство ион-
ного состава крови и кислотно-основное рав-
новесие. Они экскретируют конечные продук-
ты азотистого обмена, чужеродные вещества,
избыток ряда органических веществ — амино-
кислот, глюкозы. Почки играют существенную
роль в метаболизме белков, углеводов и липи-
дов, участвуют в регуляции артериального дав-
ления, эритропоэза, обмена кальция благода-
ря секреции физиологически активных веществ,
таких, как ренин, активные формы витамина
D,, простагландины, эритропоэтин.
Образование мочи в почке обеспечивается
рядом процессов — ультрафильтрацией жидко-
сти в клубочках, реабсорбцией и секрецией ве-
ществ в канальцах, синтезом новых соединений.
В данной главе будут рассмотрены современные
представления о механизмах, лежащих в осно-
ве осуществления каждого из этих процессов,
подробно проанализировано их значение в вы-
делении органических и неорганических ве-
ществ почкой. Вопросы, касающиеся регуляции
деятельности почки, ее метаболической и ин-
креторной функций, излагаются в последующих
главах.
Современный анализ механизмов мочеобра-
зования основан на данных изучения функции
почки в целостном организме, микропункции
почечных канальцев, исследовании ультраструк-
24
туры почки, анализе биофизических и биохими-
ческих показателей клеток клубочков и каналь-
цев. Проникновение в механизмы работы мемб-
ранных систем клетки нефрона, изучение фун-
кции отдельных нефронов и особенностей их ре-
гуляции служат основой воссоздания картины
деятельности почки как органа и особенностей
ее функционирования в организме, позволяет
яснее представить вероятные варианты наруше-
ния работы почки, что важно при проведении
дифференциального диагноза и применении
фармакологических средств в клинике.
2.1. Клубочковая фильтрация
Обе почки человека, масса которых меньше
0,5 % массы тела, получают от 20 до 25 % кро-
ви, выбрасываемой в аорту желудочком серд-
ца в минуту. Почечный кровоток у взрослого че-
ловека составляет более 1200 мл • мин 1 на
1,73 м2 поверхности тела. Из этого количества
по сосудам коры почки протекает 91—93 % кро-
ви, в наружное мозговое вещество поступает от
6 до 8 %, во внутреннее мозговое вещество по-
падает менее 1 %. Кровоснабжение коры почки
велико; достаточно сказать, что кровоток в ней
в 100 раз интенсивнее, чем в покоящейся мыш-
це. Особенностью гемодинамики почки являют-
ся исключительно большой кровоток и разви-
тая система его саморегуляции, обусловливаю-
щая постоянство кровотока и объема клубоч-
ковой фильтрации в широких пределах изме-
нения артериального давления — от 90 до 190
мм рт. ст. Объем, занимаемый кровью в почке,
составляет от 20 до 25 % общей массы органа;
не найдено существенных различий в относи-
тельном объеме крови в коре и мозговом ве-
ществе почки, он существенно не изменяется
при разных физиологических состояниях поч-
ки, при больших колебаниях артериального дав-
ления.
Начальный этап мочеобразования представ-
ляет собой ультрафильтрацию из плазмы кро-
ви воды и низкомолекулярных водорастворимых
компонентов через фильтрующую мембрану
клубочка, она практически непроницаема для
белков. Термин «ультрафильтрация» означает,
что гломерулярный фильтр не пропускает кле-
точных элементов и белков; вода и низкомо-
лекулярные вещества проходят в фильтрат.
В минуту через обе почки человека протекает
около 1200 мл крови (660 мл плазмы крови).
В клубочках из этого количества плазмы обра-
зуется приблизительно 125 мл фильтрата, по-
ступающего в просвет канальца (в сутки около
180 л). У здорового человека доля плазмы, филь-
труемой в клубочках, так называемая фильтра-
ционная фракция, составляет 19 % (125:660 =
0,19x100 = 19 %).
Кровь в клубочек поступает по афферентной
артериоле, которая распадается на петли капил-
ляров, общая поверхность которых в почках
человека достигает 1,6 м2, суммарная поверх-
ность пор, через которые происходит фильтра-
ция, составляет 2—3 % общей поверхности, в
то время как в капиллярах мышц она занимает
0,1 %. Через эти поры проходят 100 % инули-
на, 75 % миоглобина, 22 % яичного альбуми-
на, 3 % гемоглобина и менее 1 % сывороточ-
ного альбумина. Чтобы оценить связь между
проницаемостью и размером молекул, следует
привести молекулярную массу этих веществ:
инулин — 5500, миоглобин — 17 000, яичный
альбумин — 43 500, гемоглобин — 68 000, сы-
вороточный альбумин — 69 000.
Химический анализ ультрафильтрата, полу-
ченного из капсулы клубочка, показывает, что
он не содержит белков, имеет такую же, как и
плазма, концентрацию осмотически активных
веществ, глюкозы, аминокислот, мочевины,
креатинина. В ультрафильтрате концентрация
натрия, калия несколько меньше, чем в плаз-
ме, но на такую же величину выше концент-
рация хлора и бикарбоната. Это обусловлено
эффектом Гиббса — Доннана — наличием в
плазме крови отрицательно заряженных бел-
ков — анионов, не проникающих через фильтр
и удерживающих часть катионов. Однако кон-
центрационные различия, вызванные эффектом
Гиббса — Доннана, малы и практически не
учитываются в расчетах, используемых в кли-
нической физиологии почки. Двухвалентные
катионы существуют в плазме крови в трех
формах — связанной с белком, в виде низко-
молекулярных комплексов и свободных ионов.
В клубочках фильтруются низкомолекулярные
комплексы и свободные ионы. Концентрация
кальция в плазме крови составляет около 2,5
ммоль-л1, из них 46 % связаны с белками,
фильтруются в клубочках 47,5 % в виде ионов
и 6,5 % в виде комплексов кальция с фосфа-
том, цитратом и др. В плазме крови в норме
содержится 0,85 ммоль • л-' магния, 32 % этого
количества связаны с белком, 55 % фильтру-
ются в клубочках в виде ионов и 13 % — в виде
комплексов. Данные, представленные в табл. 2.1,
позволяют оценить количество различных ве-
ществ, фильтруемых в клубочках, реабсорбиру-
емых и экскретируемых почкой.
Уровень клубочковой фильтрации регулиру-
ется как вне-, так и внутрипочечными факто-
рами, обеспечивающими поддержание клубоч-
ково-канальцевого баланса. Неоднократно было
показано, что в широком диапазоне артериаль-
ного давления обнаруживается постоянство
почечного плазмотока и клубочковой фильтра-
ции. Этот эффект саморегуляции проявляется в
денервированной и даже изолированной поч-
ке. Согласно миогенной гипотезе, в основе са-
морегуляции лежит изменение тонуса афферен-
тной артериолы, поскольку оно устранялось
при расслаблении мышц этих сосудов папаве-
рином. Однако эти данные ничего не говорят о
том, каков механизм изменения мышечного
тонуса.
Согласно гипотезе Турау, в почке имеется
система обратной связи, регулирующая скорость
клубочковой фильтрации в каждом нефроне в
зависимости от объема притекающей крови и
скорости реабсорбции хлорида натрия в данном
нефроне. Эта функция выполняется ЮГА, ко-
торый реагирует на степень растяжения аффе-
рентной артериолы притекающей кровью, а
также на уровень реабсорбции хлорида натрия
в нефроне, воспринимая концентрацию ионов
в области macula densa [Thurau К., 1981]. В ко-
нечном счете ЮГА секретирует ренин, изме-
няется локальная концентрация ангиотензина
II, который селективно регулирует степень со-
кращения эфферентной артериолы, не влияя на
афферентную, и меняет тем самым кровоток и
фильтрацию в клубочках.
На пути ультрафильтрата из просвета капил-
ляра в полость капсулы клубочка располагает-
ся 3 слоя — эндотелий, БМ и эпителий висце-
рального листка капсулы. Эндотелий, кроме
области ядра, истончен и пронизан отверстия-
ми шириной от 50 до 100 нм, через которые
не проникают форменные элементы, но могут
свободно проходить вода и растворенные веще-
ства. БМ в клубочках у человека имеет толщи-
ну 3250 нм и состоит из нескольких слоев. При
характеристике свойств БМ и других элемен-
тов клубочкового фильтра раньше обычно оце-
нивали размер пор, через которые происходит
ультрафильтрация. Однако оказалось, что суще-
ственно отличается проникновение через
фильтр молекул полимеров, имеющих одина-
ковый размер, но разный заряд. Сопоставление
25
прохождения через клубочковый фильтр моле-
кул декстрана, имеющих подобно альбумину
радиус молекулы 3,6 нм, показало, что филь-
труются 11 % нейтрального декстрана, 42 %
декстрана в катионной форме — диэтиламин-
этилдекстрана, в то время как отрицательно
заряженные молекулы декстран-сульфата и аль-
бумина практически почти не фильтруются
[Brenner В., Baylis С., 1978]. Эти данные сви-
детельствуют о том, что стенка капилляров клу-
бочка, содержащая большое количество сиало-
вых кислот, отрицательно заряжена. Это замед-
ляет прохождение молекул с отрицательным
зарядом. Тем самым в условиях патологии по-
теря фиксированных зарядов стенкой фильтру-
ющего слоя гломерул может явиться одной из
причин протеинурии при некоторых формах
заболеваний почки. Ряд катионных макромоле-
кул (например, протамин) может вызывать
структурные изменения клубочкового фильтра,
устраняемые введением полианионов, таких как
гепарин.
Важнейшая роль БМ клубочка как фильтра,
задерживающего проникновение белков, допол-
няется функцией щелевых мембран. Со сторо-
ны капсулы к БМ прикрепляются ножки по-
доцитов, между которыми располагаются ще-
левые мембраны. Они закрывают собой про-
странства между ножками подоцитов, имеющие
в поперечном сечении размер около 40х 14 нм.
Внешняя поверхность щелевых мембран и от-
ростки подоцитов покрыты слоем полисахари-
дов толщиной до 12 нм. Щели между ножками
заполнены этим веществом и, вероятно, слу-
жат окончательным барьером на пути белковых
молекул, радиус которых более 3,2 нм. Поры
для этих молекул не видны в электронном мик-
роскопе, что, по-видимому, обусловлено оп-
ределенной конфигурацией макромолекул ба-
зальной и щелевой мембран, а также слоя по-
лисахаридов.
Движущей силой, обеспечивающей фильт-
рацию в клубочках, является транскапиллярная
разность давлений — гидростатического и он-
котического. В прямом опыте на крысах удалось
в отдельных клубочках измерить величину сил,
обеспечивающих процесс ультрафильтрации.
При системном систолическом артериальном
давлении 110—130 мм рт. ст. в гломерулярных
капиллярах давление составляет 45—52 мм рт. ст.
К силам, противодействующим фильтрации,
относится коллоидно-осмотическое (онкотичес-
кое) давление, создаваемое белками плазмы, не
проникающими через фильтр (18—26 мм рт. ст.),
и давление жидкости в капсуле клубочка (8—
15 мм рт. ст.). Благодаря этому эффективное
фильтрационное давление, обеспечивающее
процесс ультрафильтрации в клубочках, состав-
ляет в среднем 48 — 12 — 22 — 14 мм рт. ст. (пре-
26
делы колебаний от 10 до 18). В результате фильт-
рации концентрация белков в плазме растет, он-
котическое давление повышается до 35 мм рт. ст.,
и на эфферентном конце капилляров клубочка
эффективное фильтрационное давление снижа-
ется до нуля.
Приведенные выше данные имеют суще-
ственное значение при анализе некоторых фак-
торов, влияющих на уровень клубочковой филь-
трации. Анурия из-за снижения фильтрации раз-
вивается при падении системного систолическо-
го артериального давления ниже 50 мм рт. ст.
Уменьшение клубочковой фильтрации наблю-
дается при повышении внутрипочечного давле-
ния в результате затруднения оттока мочи и в
случае возрастания венозного давления в поч-
ке.
Среднее фильтрационное давление оказалось
близким по величине в начальных участках гло-
мерулярных и экстраренальных капилляров, в
то время как общий объем ультрафильтрата в
почке составляет 120 мл-мин', во всех экст-
раренальных капиллярах он менее 2 мл • мин1.
Это обусловлено высоким значением коэффи-
циента ультрафильтрации (КУФ) в гломеруляр-
ных капиллярах, вероятно, прежде всего бла-
годаря многочисленным фенестрам в их эндо-
телии. В прямом эксперименте на крысах была
измерена величина КУФ, которая оказалась
равной 0,08 нл/(с-1 • мм рт.ст/1). Такое же зна-
чение КУФ, по расчетным данным, имеется и
в клубочках почки у человека [Arendshorst W.,
Gottschalk С., 1985].
Существенно различается фильтрационное
давление по длиннику капилляров почечно-
го клубочка и экстраренальных капилляров.
Прежде всего вдоль гломерулярных капилля-
ров сохраняется относительно постоянное
гидростатическое давление, в то время как в
кровеносных капиллярах других органов оно
падает. Далее, особенностью капилляра клу-
бочка является нарастание онкотического дав-
ления плазмы крови по длиннику капилляра,
что обусловлено большим объемом жидкости,
фильтруемой через стенку этих капилляров,
в других же органах онкотическое давление
плазмы крови в капиллярах существенно не
меняется.
Принципиально другим стало представление
об образовании первичной мочи как нерегули-
руемом процессе. Клубочек оказался местом
действия ряда гормонов и некоторых физиоло-
гически активных веществ иной природы, ко-
торые изменяют состояние гломерулярного
фильтра. Значительное снижение КУФ в клубоч-
ке наблюдается под влиянием вазопрессина,
ангиотензина II, простагландинов Ер Е2, аце-
тилхолина, брадикинина. При анализе возмож-
ного механизма уменьшения КУФ было выска-
Рис. 2.1. Основные процессы мочеобразования.
1 — ультрафильтрация в полость капсулы клубочка; 2 —
реабсорбция веществ, профильтровавшихся из просвета
канальца в околоканальцевую жидкость и кровь; 3 — сек-
реция вещества, образовавшегося в клетке канальца, в его
просвет или поступление в кровь; 4 — секреция веществ из
крови в просвет канальца; 5 — натриевый канал в люми-
нальной мембране клетки; 6 — натриевый насос; 7 — зона
клеточных контактов (стрелками обозначена диффузия ве-
ществ из межклеточной жидкости в просвет нефрона и в
противоположном направлении).
зано предположение, что многие из перечис-
ленных физиологически активных веществ и
лекарственных препаратов увеличивают образо-
вание или затрудняют разрушение цАМФ, ко-
торый накапливается в клубочке; усиливаются
секреция ренина, образование ангиотензина II,
активирующего сокращение клеток мезангия.
Такое же действие на них оказывает и вазо-
прессин, в результате чего уменьшается повер-
хность гломерулярных капилляров, приводя к
снижению КУФ.
Таким образом, объем клубочковой фильтрации
в почке определяется количеством функциони-
рующих клубочков, скоростью гломерулярного
кровотока, градиентом гидростатического дав-
ления между кровью в просвете капилляров клу-
бочка и жидкостью в боуменовой капсуле (кап-
суле клубочка), величиной коэффициента гломе-
рулярной ультрафильтрации.
Очевидно, что уменьшение объема клубоч-
кового фильтрата может зависеть от измене-
ния каждого из перечисленных факторов, а
состав фильтруемой жидкости, прежде всего
содержание в ней белка, будет определяться
как состоянием каждого из элементов гломе-
рулярного фильтра, так и степенью физиоло-
гической сохранности белковых молекул в
плазме крови.
2.2. Реабсорбция, секреция
и синтез веществ в канальцах
После поступления в просвет канальцев ульт-
рафильтрата начинается обратное всасывание
(реабсорбция) в кровь всех ценных для орга-
низма веществ. При этом следует отметить ряд
важных особенностей работы нормально функ-
ционирующей почки:
• всасывание огромного количества веществ
(табл. 2.1);
• исключительно высокую избирательность си-
стем канальцевого транспорта, обладающих
способностью химически идентифицировать
каждое из жизненно необходимых веществ и
возвращать их в кровь;
• способность к предельно точной регуляции
уровня всасывания веществ, что обеспечива-
ет стабильность основных физико-химичес-
ких характеристик крови.
Изучение физиологии почек позволило по-
нять молекулярную природу процессов, лежа-
щих в основе транспорта веществ в канальцах
и его регуляции. Будут рассмотрены лишь ос-
новные механизмы функции канальцев, кото-
рые обусловливают выделение наиболее важных
в клинической практике органических и неор-
ганических веществ.
После ультрафильтрации всех низкомолеку-
лярных компонентов плазмы крови, а также по-
падания небольших количеств белка в первич-
ную мочу в канальцах происходит реабсорбция
многих веществ. Процессы, происходящие в
канальцах, весьма разнообразны (рис. 2.1). Клет-
ки нефрона и собирательных трубок обладают
системами активного транспорта, системами
котранспорта, обеспечивающими перенос ве-
ществ против градиента концентрации из про-
света канальцев в кровь, часть веществ секре-
27
Таблица 2.1. Концентрация в плазме крови,
фильтрация, реабсорбция и экскреция воды, неор-
ганических и органических веществ почками чело-
века
Исследуемое вещество Концентрация в плазме крови, ММОЛЬ-Л'1 Количество, ммоль-24 ч*’
фильт- руемое реаб- сорби- руемое экскре- тируе- мое
Натрий 143 24 420 24 330 90
Калий 4,5 770 690 80
Кальций 2,5 270 267,5 2,5
Магний 0,85 98,7 93,7 5,0
Хлорид 105 19 850 19 760 90
Бикарбонат 26 4900 4888 2
Фосфат 1,1 208 187 21
Сульфат 0,5 90 62 28
Глюкоза 5,5 990 989,8 0,2
Мочевина 6 1080 580 500
Вода (л) — 169,2 167,7 1,5
тируется из внеклеточной жидкости в первич-
ную мочу. Вслед за активно транспортируемы-
ми ионами по градиенту электрохимического по-
тенциала могут проходить некоторые ионы
противоположного знака. В результате всасыва-
ния большинства компонентов ультрафильтра-
та создается осмотический градиент и через во-
допроницаемую стенку канальцев реабсорбиру-
ется вода, диффундируют некоторые вещества
(мочевина, углекислота). Ряд веществ всасыва-
ется благодаря пиноцитозу, поток воды через
поры может увлекать водорастворимые молеку-
лы (solvent drag). Существенное значение в
транспорте органических и неорганических ве-
ществ имеют облегченная диффузия и неионная
диффузия. В клетках канальцев синтезируется
также ряд соединений, поступающих в кровь
или мочу.
2.3. Выделение неорганических
веществ
Натрий и хлор. Эти ионы преобладают в
молярном отношении среди различных неорга-
нических и органических компонентов плазмы
крови и внеклеточной жидкости, их доля наи-
более высока среди осмотически активных ве-
ществ ультрафильтрата. У взрослого человека
концентрация ионов натрия в плазме крови
составляет около 143 ммоль-л', ионов хло-
ра — 105 ммоль-л1. В суточной моче концент-
рация натрия обычно колеблется от 40 до 220
ммоль • л в отдельных пробах мочи она может
значительно снижаться. Широкий диапазон
колебаний содержания ионов натрия и хлора в
моче характерен для нормально функциониру-
ющей почки. На примере описания всасывания
28
этих ионов в различных отделах нефрона удоб-
но охарактеризовать общие механизмы функци-
онирования отдельных частей почечных каналь-
цев.
В проксимальном сегменте нефрона всасы-
вается около 2/3 профильтровавшейся воды,
натрия, хлора, практически полностью реаб-
сорбируются аминокислоты, глюкоза, витами-
ны, белки и многие другие вещества (рис. 2.2).
Этот сегмент нефрона, особенно его прямой
отдел, имеет важное значение в секреции из
крови в просвет канальца органических кислот
и оснований, в самых дистальных частях нефро-
на и собирательных трубках секретируются
ионы калия. Следует отметить, что термин «сек-
реция» имеет два значения применительно к
функциям почки: перенос веществ в неизме-
ненном виде через клетки канальца из крови в
его просвет и секреция в содержимое каналь-
ца или в кровь вновь синтезированных веществ.
Наиболее часто термин «секреция» в связи с
процессом мочеобразования используют в пер-
вом значении этого слова. К секретируемым в
почке веществам относятся, например, диод-
раст, феноловый красный, пенициллин, калий,
ионы водорода. В отделах почечных канальцев,
следующих за прямым проксимальным сегмен-
том нефрона, всасываются главным образом
вода и ионы.
В проксимальном сегменте нефрона всасы-
вается большая часть натрия, но его концент-
рация в канальцевой жидкости остается такой
же, как в плазме крови. Особенность прокси-
мальной реабсорбции заключается в том, что
натрий и другие реабсорбируемые вещества
всасываются с осмотически эквивалентным
объемом воды и содержимое канальца всегда
остается изоосмотичным плазме крови. Это
обусловлено высокой проницаемостью для воды
стенки проксимального канальца.
В начальных отделах канальца главным ани-
оном, сопровождающим натрий, является би-
карбонат. Стенка этой части нефрона для хло-
ридов малопроницаема. Это приводит к посте-
пенному увеличению концентрации ионов хло-
ра, которая возрастает в 1,4 раза по сравнению
с плазмой крови. В начальных частях прокси-
мального канальца интенсивно реабсорбируют-
ся глюкоза, аминокислоты и некоторые другие
органические компоненты ультрафильтрата.
Таким образом, в конечных частях проксималь-
ного извитого канальца состав изоосмотичес-
кой жидкости существенно изменяется — из
нее всасываются основная масса бикарбоната,
многие органические вещества, но концентра-
ция ионов хлора становится выше. Оказалось,
что в прямой части проксимального канальца
в отличие от извитой части имеется высокая
проницаемость межклеточных контактов для
Глюкоза
Бикарбонат
Натрий
Калий
Магний
Кальций
Фосфат
Сульфат
Аминокислоты
Витамины
Белок
Мочевина
Хлор
Натрий
Вода
Рис. 2.2. Реабсорбция и секреция элек-
тролитов и неэлектролитов в нефроне.
1 - клубочек; 2 — проксимальный изви-
той каналец; 3 — проксимальный прямой
каналец; 4 . тонкое нисходящее колено
петли Генле; 5 — изгиб петли Генле; 6 —
толстое восходящее колено петли Генле;
7 — дистальный извитой каналец; 8 — свя-
зующий отдел; 9 — собирательная трубка
наружного мозгового вещества; 10 — соби-
рательная трубка внутреннего мозгового
вещества почки; 11 — беллиниев проток.
Стрелка, обращенная из просвета каналь-
ца, — реабсорбция вещества, в просвет
канальца —- секреция.
хлоридов. В связи с тем что их концентрация в
просвете выше, чем в околоканальцевой жид-
кости и в крови, они начинают по градиенту
пассивно реабсорбироваться из канальца, увле-
кая за собой натрий и воду. В прямом отделе
проксимального канальца происходит как ак-
тивный транспорт натрия, так и пассивная ре-
абсорбция хлоридов и движение части натрия
вместе с ними по межклеточным промежуткам,
обладающим высокой проницаемостью для хло-
ридов.
Резюмируя сказанное о реабсорбции натрия и
хлоридов в проксимальных канальцах, следует рас-
смотреть механизмы и регуляцию этого процесса.
Проницаемость стенки канальцев для ионов и воды
определяется свойствами не только мембран клеток,
но и зоны плотного соединения, где клетки контак-
тируют друг с другом. Оба этих элемента существенно
различаются в разных отделах нефрона. Через апи-
кальную мембрану клетки натрий входит в цито-
плазму пассивно по градиенту электрохимического
потенциала, так как внутренняя поверхность клет-
ки электроотрицательна по отношению к канальце-
вой жидкости. Далее натрий движется по цитоплаз-
ме к базальной и боковым частям клетки, где нахо-
дятся натриевые насосы. В этих клетках натриевым
насосом служит активируемая ионами Na4 и К+,
зависимая от Mg+ аденозинтрифосфатаза (Na’, К+-
АТФаза). Этот фермент, используя энергию АТФ,
обеспечивает перенос из клетки ионов натрия и по-
ступление в нее ионов калия. Ингибиторами этого
фермента являются сердечные гликозиды (например,
29
Триамтерен,
амилорид
уабаин, строфантин К и др.), полностью прекраща-
ющие активную реабсорбцию натрия клетками про-
ксимального канальца.
Важнейшее значение в осуществлении функ-
циональной способности проксимального каналь-
ца имеет высокопроницаемая для некоторых
ионов и воды зона клеточных контактов. Через
нее происходят пассивная реабсорбция хлоридов
и движение воды по осмотическому градиенту.
Полагают, что регуляция скорости всасывания
жидкости по межклеточным промежуткам про-
исходит под влиянием таких физических сил, как
соотношение между уровнем гидростатического
давления в почечных артериях, венах и мочеточ-
нике, величина онкотического давления в око-
локанальцевых капиллярах. Проницаемость меж-
клеточных промежутков не является строго по-
стоянной величиной, она может меняться при
ряде физиологических состояний.
В тонком нисходящем отделе петли Генле не
происходит сколько-нибудь существенной ре-
абсорбции натрия и хлора. Особенностью это-
го канальца по сравнению с тонким восходя-
щим отделом петли Генле является высокая
проницаемость для воды. Тонкий нисходящий
отдел петли характеризуется низкой проница-
емостью для натрия, а восходящий, напро-
тив, — высокой.
Пройдя по тонкому отделу петли Генле,
Рис. 2.3. Варианты систем ре-
абсорбции натрия в клетках
нефрона. Объяснение в тексте.
жидкость поступает в толстый восходящий от-
дел петли. Стенка этого канальца всегда имеет
низкую проницаемость для воды. Особенность
клеток этого канальца состоит в том, что в них
функционирует иной молекулярный механизм
реабсорбции хлора и натрия из просвета каналь-
ца. В люминальной мембране расположена сис-
тема переноса в клетку ионов Na+, К+ и двух
ионов СГ; эта макромолекула контранспортера
инактивируется при наличии с внешней повер-
хности люминальной мембраны (т.е. в просвете
канальца) таких веществ, как фуросемид, буме-
танид, этакриновая кислота (рис. 2.3). С клини-
ческой точки зрения важно, что эти диуретики
действуют из просвета канальца, они неэффек-
тивны при добавлении к околоканальцевой
жидкости. Диуретики поступают в просвет не-
фрона при фильтрации и секреции в прокси-
мальном канальце, с током мочи достигают
толстого восходящего отдела петли Генле, пре-
кращают реабсорбцию хлора и препятствуют
всасыванию натрия в этом участке канальца.
Толстый восходящий отдел петли Генле
переходит в часть дистального канальца, дос-
тигающую области macula densa, за которой
следует дистальный извитой каналец. Этот от-
дел нефрона также обладает очень низкой про-
ницаемостью для воды. Ведущим механизмом
реабсорбции солей в этом канальце является
натриевый насос, который обеспечивает реаб-
30
сорбцию натрия против высокого электрохими-
ческого градиента. Особенность реабсорбции
натрия в этом отделе состоит в том, что хотя
здесь может всосаться лишь 10 % профильтро-
вавшегося натрия и скорость реабсорбции мень-
ше, чем в проксимальном канальце, однако
создается большой концентрационный гради-
ент; концентрация натрия и хлора в просвете
может снижаться до 30—40 ммоль/л. Реабсорб-
ция хлора происходит вслед за реабсорбцией
натрия и пассивно.
Связующий отдел соединяет дистальный
сегмент нефрона с начальными отделами со-
бирательных трубок, которые являются одни-
ми из важнейших структур почки, тонко и точ-
но реагирующих на действие гормонов и при-
спосабливающих работу почки к потребности
организма. В этих частях канальца основой ре-
абсорбции натрия служит иной молекулярный
механизм, не представленный в предшествую-
щих отделах канальца. В люминальной мембра-
не клеток имеются натриевые каналы, ингиби-
руемые амилоридом и триамтереном.
Эти блокаторы натриевых каналов, являющиеся
диуретиками, действуют из просвета нефрона. Они
связываются с натриевыми каналами апикальной
мембраны, которые обеспечивают вход натрия в
клетку; когда канал блокирован амилоридом, натрий
не может реабсорбироваться и экскретируется с
мочой. В обычных условиях натрий, вошедший в
клетку по натриевому каналу, движется по цитоп-
лазме к базальным плазматическим мембранам и
переносится во внеклеточную жидкость Na+-, К+-
АТФазой. Стенка связующих канальцев и собиратель-
ных трубок может быть не только водонепроницае-
мой, но и высокопроницаемой для воды в присут-
ствии АДГ. Именно в этом отделе канальцев действу-
ет АДГ. Транспорт натрия в этих клетках и дисталь-
ном извитом канальце увеличивается под влиянием
альдостерона. В этих канальцах действует верошпирон,
являющийся конкурентным ингибитором альдостеро-
на. Верошпирон снижает реабсорбцию натрия, пре-
пятствуя связыванию в клетке альдостерона.
Кортикальные отделы собирательных трубок
переходят в собирательные трубки, проходящие
по мозговому веществу почки. Основная особен-
ность их функции состоит в том, что они спо-
собны активно реабсорбировать совсем неболь-
шие количества натрия, но могут создавать
очень высокий концентрационный градиент.
Стенка этих канальцев обладает низкой прони-
цаемостью для солей и регулируемой проница-
емостью для воды.
Раньше полагали, что реабсорбция жидкости в
проксимальном канальце является облигатной, по-
стоянной по величине и нерегулируемой в отличие
от факультативной реабсорбции в дистальном сег-
менте канальцев, которая меняется при разных фун-
кциональных состояниях организма. Оказалось, что
Рис. 2.4. Компенсаторное усиление реабсорбции ве-
ществ в последовательно расположенных отделах ка-
нальцев.
Слева — контроль, справа — компенсаторное усиление
реабсорбции вещества при блокаде его всасывания в вы-
шележащих отделах нефрона.
под влиянием импульсов, передающихся к почечным
канальцам по эфферентным нервам, при действии
ряда физиологически активных веществ меняется
всасывание ионов и жидкости в проксимальном ка-
нальце. Это выявляется при увеличении объема крови
и внеклеточной жидкости, когда уменьшение реаб-
сорбции ионов и воды в проксимальном канальце
способствует усилению их экскреции и нормализа-
ции водно-солевого обмена.
Важное значение в функции нефрона имеет
возможность адаптивного изменения всасыва-
ния веществ в последующих отделах нефрона
при нарушении их реабсорбции в вышележа-
щих частях канальцев. Так, в некоторых случа-
ях при уменьшении реабсорбции натрия в про-
ксимальном сегменте нефрона он всасывается
в восходящем отделе петли Генле (рис. 2.4). Эти
данные имеют большое значение при оценке
причин слабой эффективности фармакотера-
пии, направленной на усиление выведения
определенных ионов почкой, при анализе ме-
ханизма функции нефрона у больных с синд-
ромом Фанкони и действии некоторых токсич-
ных веществ на почку, когда отмечается уси-
ление экскреции одних компонентов ультра-
фильтрата при нормальных остальных значениях
состава мочи.
Для понимания особенностей выделения
ионов натрия и хлора почкой, возможной ре-
31
зистентности отеков к действию диуретиков су-
щественное значение имеют представленные вы-
ше данные об одновременной работе в клетках
разных отделов почечных канальцев нескольких
типов мембранных систем переноса натрия — на-
триевых каналов, чувствительных к амилориду,
сопряженного переноса натрия, калия и хлора,
блокируемого фуросемидом, а также ряда ионо-
обменных систем, в которых натрий меняется на
ионы калия, кальция, протоны. Оказалось, что
и транспорт органических веществ (глюкоза,
аминокислоты) сопряжен с переносом натрия.
Такое большое разнообразие систем транспорта
натрия в нефроне требует учета их роли при
различных патологических состояниях почки. Не
меньшее значение приобретает выявление меха-
низмов регуляции этих систем.
Регуляция выделения натрия почкой зависит
от влияния на почку нескольких одновременно
действующих на нее стимулов, поступающих по
эфферентным нервам (см. главу 3). Наиболее глу-
боко изучен механизм клеточного действия аль-
достерона, описание которого позволит глубже
понять основные способы регуляции транспор-
та неорганических веществ в почке.
Альдостерон, введенный в кровь, увеличивает
реабсорбцию натрия после продолжительного латен-
тного периода, равного 45—120 мин. Этот гормон
через перитубулярную плазматическую мембрану
проникает в клетку и в цитоплазме связывается со
стереоспецифичным для него белком. Этот процесс
занимает 30—45 мин, после чего комплекс альдо-
стерон — рецептор переносится в ядро и взаимодей-
ствует с акцепторными для него участками ядерно-
го хроматина. Это вызывает транскрипцию гена: ак-
тивация участка ДНК способствует синтезу РНК —
посредника, который переходит из ядра в цитоплаз-
му и стимулирует в рибосомах синтез нового белка.
Существует ряд гипотез, объясняющих точку при-
ложения в клетке этого белка и механизм, с помо-
щью которого он увеличивает транспорт натрия.
Согласно одной из гипотез, этот белок является
компонентом натриевого канала, облегчая вход на-
трия в клетку через апикальную мембрану. Другая ги-
потеза основное значение придает синтезу макромо-
лекул Na+-, К+-АТФазы. Высказывается также мысль
о возможности действия этого белка не на один, а
на два компонента системы — вход и активное вы-
ведение натрия из клетки, что автоматически уси-
ливает энерготраты и приводит к возрастанию об-
разования АТФ. Понимание механизма действия
альдостерона имеет существенное значение для кли-
ники: становятся понятными способ действия, при-
чина длительного латентного периода и сущность
влияния диуретиков, являющихся конкурентными
антагонистами альдостерона (верошпирон). Эти ве-
щества угнетают связывание альдостерона с рецеп-
торными белками, находящимися в цитоплазме.
По новым данным, основным местом дей-
ствия альдостерона в нефроне являются самые
32
конечные отделы дистального извитого каналь-
ца и начальные отделы собирательных трубок.
В этих же клетках действуют и спиронолакто-
ны. Описанные выше данные о механизме кле-
точного влияния альдостерона касаются толь-
ко его влияния на реабсорбцию натрия; вызы-
ваемое гормоном усиление секреции калия не
опосредовано генетическим аппаратом клетки.
Калий. Основное количество калия в орга-
низме находится в клетках; во внеклеточной
жидкости, включая плазму крови, содержится
лишь 2 % калия — около 65 ммоль. С пищей
человек потребляет в день 25—150 ммоль калия,
т.е. во всей внеклеточной жидкости содержит-
ся в среднем почти столько калия, сколько
поступает с пищей и выводится почкой. Таким
образом, становится очевидной роль почки в
гомеостазе калия, концентрация которого дол-
жна поддерживаться в особо узких пределах,
поскольку гипер- и гипокалиемия могут выз-
вать тяжелые нарушения в работе клеток раз-
личных органов и систем.
Калий свободно фильтруется в клубочках, в
сутки в просвет канальцев поступает 700—800
ммоль калия, который реабсорбируется клетка-
ми проксимального и дистального сегментов
нефрона. Экскреция калия составляет обычно
около 10 % профильтровавшегося количества,
но механизм выделения калия почкой иной,
чем натрия. Профильтровавшийся калий почти
полностью реабсорбируется в проксимальном
сегменте и петле Генле, а выделение с мочой
зависит от его секреции клетками дистального
извитого канальца и собирательных трубок
[Giebisch G., 1975]. При избыточном поступле-
нии калия в организм его реабсорбция в про-
ксимальных канальцах не снижается, но резко
усиливается секреция в конечных отделах по-
чечных канальцев. Особое значение секреторный
механизм приобретает при уменьшении объе-
ма клубочковой фильтрации; количество сек-
ретируемого калия в ряде случаев может пре-
вышать количество всего калия, поступающе-
го в нефрон при фильтрации в клубочках.
В одной и той же клетке дистального изви-
того канальца и собирательных трубок, по-ви-
димому, сосуществуют системы реабсорбции и
секреции калия. При дефиците калия они обес-
печивают максимальное извлечение калия из
канальцевой жидкости, а при избытке — его
секрецию.
Калий, секретируемый клеткой, транспорти-
руется вначале в цитоплазму из внеклеточной
жидкости Na/K-насосом, находящимся в базаль-
ной плазматической мембране. Этот насос обес-
печивает удаление из клетки натрия и поступ-
ление в нее калия, что создает высокую внут-
риклеточную концентрацию калия. Для секреции
необходимо, чтобы возросла проницаемость
люминальной плазматической мембраны для
калия и градиент потенциала на этой мембране
благоприятствовал его секреции. Увеличение от-
рицательного электрического заряда просвета
дистального канальца при введении сульфата
натрия способствует секреции калия. Альдосте-
рон является одним из факторов, увеличиваю-
щих проницаемость апикальной мембраны для
калия и повышающих его секрецию. Таким об-
разом, секреция калия через мембрану клетки
со стороны просвета канальца является пассив-
ным процессом, происходящим по концентра-
ционному градиенту и зависящим от проница-
емости мембраны для калия и величины элект-
рического потенциала на этой мембране.
Усиление секреции калия под влиянием
альдостерона связано не только с действием
последнего на проницаемость мембраны для
калия, но и с увеличением поступления калия
в клетку вследствие усиления работы Na/K-на-
соса. Другим важным фактором регуляции
транспорта калия в канальцах является инсу-
лин, уменьшающий экскрецию калия и повы-
шающий толерантность организма к введению
его солей. Большое влияние на уровень выде-
ления калия оказывает КОС. Алкалоз сопровож-
дается увеличением выделения калия почкой,
а ацидоз приводит к уменьшению калийуреза.
Кальций. Общее количество кальция в
организме велико — около 2 % массы тела, по-
скольку этот элемент является одним из основ-
ных компонентов скелета. Почки и кость игра-
ют главную роль в поддержании стабильного
уровня кальция в крови, что исключительно важ-
но в связи с ролью кальция в большом числе
физиологических процессов: он участвует в сек-
реции, оплодотворении, мембранной проница-
емости, свертывании крови, мышечном сокра-
щении; ионы кальция оказались внутриклеточ-
ными мессенджерами. В сутки потребление каль-
ция составляет около 1 г; 0,8 г выделяется ки-
шечником, почки экскретируют от 0,1 до 0,3 г
(2,5—7,5 ммоль/сут).
В клубочках фильтруется кальций, ионизи-
рованный и находящийся в виде низкомолеку-
лярных комплексов, что составляет до 11 г/сут.
Более 50 % профильтровавшегося кальция ре-
абсорбируется в проксимальном канальце, зна-
чительная реабсорбция кальция происходит в
толстом восходящем отделе петли Генле (20—
25 %), дистальном извитом канальце (5—10 %)
и собирательных трубках (0,5—1 %). С мочой
экскретируется кальций, «избежавший» реаб-
сорбции; секреции кальция в почке у человека
не происходит.
Механизм реабсорбции кальция представляется
следующим образом. Общее внутриклеточное со-
держание кальция составляет около 0,3 ммоль, т.е.
меньше, чем в плазме крови. Однако в самой ци-
топлазме находится лишь около 0,01 % свободного
кальция (около 10'7 М) от общего количества, в
основном он сосредоточен в эндоплазматической
сети и митохондриях. Если во внеклеточной жидко-
сти и ультрафильтрате, поступающем в каналец,
концентрация кальция составляет около 1,3 ммоль/л,
то в цитоплазме клетки она соответственно в 1000—
10 000 раз меньше. Выделение кальция из клетки при
реабсорбции происходит активно через базальную
плазматическую мембрану с помощью кальциевого
насоса (Са2+-АТФаза). Другим механизмом в этой же
мембране служит Na+/Ca2+-обменник, обеспечива-
ющий удаление ионов Са2+ из клетки в обмен на по-
ступающие в нее ионы натрия. Условием работы
этого молекулярного устройства служит непрерыв-
ное выведение из клетки ионов натрия при участии
находящейся рядом в мембране Na-, К-АТФазы.
В клетке почечного канальца нужно иметь особенно
эффективную систему стабилизации содержания
Са2+, так как он непрерывно поступает через люми-
нальную мембрану, а ослабление транспорта в кровь
не только нарушило бы баланс кальция в организ-
ме, но и повлекло бы патологические изменения в
самой клетке нефрона. В базальной плазматической
мембране имеется также Ca2+/Na2+-обменник; вре-
менное перераспределение кальция внутри клетки
обеспечивают эндоплазматическая сеть и отчасти
митохондрии.
Среди гормонов, регулирующих транспорт
кальция в почке, наибольшее значение имеет
паратгормон. После удаления паращитовидных
желез резко возрастает кальцийурез, несмотря
на уменьшение количества фильтруемого каль-
ция из-за гипокальциемии. Введение паратгор-
мона уменьшает выделение кальция почкой.
В проксимальном канальце паратгормон умень-
шает реабсорбцию кальция, однако при этом
снижается его экскреция почкой вследствие
стимулируемого этим гормоном всасывания
кальция в дистальном сегменте нефрона и со-
бирательных трубках.
В противоположность паратгормону тиро-
кальцитонин вызывает увеличение экскреции
кальция почкой. Активная форма витамина D3
повышает реабсорбцию кальция, по-видимому,
в проксимальном канальце нефрона. Гормон
роста способствует усилению кальцийуреза,
хотя неясно, обусловлено ли это прямым дей-
ствием гормона на клетки нефрона или опос-
редованным, связанным с хроническим увели-
чением объема внеклеточной жидкости. Повы-
шенное выделение кальция с мочой в услови-
ях действия на почку паратгормона позволяет
видеть в этом одну из причин частого появле-
ния мочекаменной болезни у больных акроме-
галией.
Рецепторы паратгормона в почке найдены в
базальной и латеральной мембранах клеток про-
ксимального сегмента нефрона, корковых час-
тях толстого восходящего отдела петли Генле и
3—2950
33
начальных отделах собирательных трубок. Пос-
ле стимуляции рецепторов этим гормоном ак-
тивируется фермент аденилатциклаза, благодаря
чему увеличивается внутриклеточная концент-
рация цАТФ и меняется транспорт кальция и
фосфатов.
Магний. В норме у человека в плазме кро-
ви содержится около 0,8—1 ммоль-л-1 магния,
в просвет нефрона при фильтрации в минуту
поступает около 0,064 ммоль ионизированного
магния и 0,01 ммоль в виде комплексов; осталь-
ной магний остается в плазме, так как он свя-
зан с белками. Выделение с мочой колеблется
от 3 до 5 ммоль/сут. Исследования методом мик-
ропункции выявили значительные различия в
уровне реабсорбции магния в проксимальном
канальце — от 20 до 60 %; большие количества
магния всасываются клетками толстого восходя-
щего отдела петли Генле. Реабсорбция магния
является активным процессом и ограничена ве-
личиной максимального канальцевого транспор-
та (TmMg). Гипермагниемия приводит к усилению
экскреции магния почкой и может сопровож-
даться преходящей гиперкальциурией. При нор-
мальном уровне клубочковой фильтрации поч-
ка быстро и эффективно справляется с повы-
шением уровня магния в крови, предотвращая
гипермагниемию, поэтому клиницисту чаще
приходится встречаться с проявлениями гипо-
магниемии. Повышенный уровень магния в кро-
ви может наблюдаться при резком снижении
скорости клубочковой фильтрации.
До сих пор не установлены специфические
факторы, регулирующие выделение магния
почкой, хотя гомеостаз магния поддерживает-
ся исключительно точно. Обнаружена система
рефлекторной регуляции выделения магния
почкой. Скорость экскреции магния возрастает
при остром увеличении объема внеклеточной
жидкости, при инъекции больших доз тиро-
кальцитонина и вазопрессина; паратгормон
уменьшает выделение магния. Однако гиперпа-
ратиреоидизм у ряда больных сопровождается
гипомагниемией и отрицательным балансом
магния, что, возможно, обусловлено более
выраженным действием гиперкальциемии на
почку, чем прямым влиянием паратгормона. Ги-
перкальциемия вызывает увеличение экскреции
кальция и магния почкой.
Фосфор. Почки играют ключевую роль в
поддержании постоянства концентрации фосфа-
тов в жидкостях внутренней среды. В плазме кро-
ви фосфаты представлены в виде свободных
ионов (около 80 %) и связанных с белками. При
pH 7,4 в плазме крови почти 80 % фосфатов
существует в двухвалентной форме НРО4, 20 %
составляют Н2РО4. При нормальном уровне клу-
бочковой фильтрации 125 мл/мин и концентра-
34
ции фосфатов 1,14 ммоль-л4 в клубочках филь-
труется около 0,132 ммоль • мин4 и экскретиру-
ется в среднем 10 % этого количества, 90 % ре-
абсорбируется в канальцах. Выделение почкой
обычно колеблется в пределах 13 —
42 ммоль/сут. Наиболее интенсивно всасывают-
ся фосфаты в начальных частях проксимально-
го канальца, где реабсорбируется 60—70 % филь-
труемых фосфатов, в петле Генле до дистального
извитого канальца реабсорбируется лишь 5—
10 % фосфатов, в дистальном канальце и соби-
рательных трубках — 10—25 %. Такова картина
обработки фосфатов в нормальных условиях;
если резко снижена проксимальная реабсорбция
фосфатов, то полнее начинает использоваться
большая мощность транспортной системы дис-
тального сегмента нефрона, который может в
этих условиях предотвращать фосфатурию.
Основным фактором регуляции реабсорбции
фосфатов служит паратгормон. При гиперпара-
тиреоидизме резко увеличена экскреция неор-
ганических фосфатов, дефицит паратгормона
проявляется в стимуляции реабсорбции фосфа-
тов. Транспорт фосфатов ограничен Ттро4, вве-
дение паратгормона резко уменьшает величи-
ну Тшро4 в проксимальном и дистальном сег-
ментах нефрона. Роль этого гормона заключа-
ется в регуляции транспорта фосфатов в раз-
личных отделах нефрона. Механизм фосфатури-
ческого действия паратгормона основан на уве-
личении внутри клеток, чувствительных к дей-
ствию этого гормона, цАМФ, который умень-
шает реабсорбцию фосфатов.
В проксимальном канальце 1,25 (OH)2D3 сти-
мулирует реабсорбцию фосфатов. Важно отме-
тить, что одной из функций клеток коры поч-
ки является превращение неактивной формы
циркулирующего в крови витамина D3 в актив-
ные метаболиты. Другим биологически актив-
ным веществом, усиливающим реабсорбцию
фосфатов, является гормон роста. В почечной
ткани найдены химические рецепторы тиро-
кальцитонина, однако его реальное значение в
регуляции транспорта фосфатов пока не уста-
новлено. Фосфатурическое действие характерно
для диуретиков, эффект которых локализован
в проксимальном канальце.
Сульфат. Концентрация сульфата в плаз-
ме крови составляет 0,6±0,2 ммоль/л. Профиль-
тровавшиеся в клубочках сульфаты реабсорби-
руются в канальцах системой с Tmso4, макси-
мальная реабсорбция которой равна 0,04—
0,12 ммоль-мин1. При введении сульфатов в
кровь быстро насыщается система реабсорбции,
и избыток сульфатов экскретируется почкой.
Максимальная способность к реабсорбции суль-
фатов снижается после введения в кровь фос-
фатов, ацетата, тиосульфата. Величина макси-
мальной реабсорбции сульфатов возрастает
после введения гормона роста и глюкокорти-
коидов, но не дезоксикортикостерона. Почти в
2 раза увеличивался Tmso4 у больных акромега-
лией в активном периоде болезни. Возможно,
что действие гормона роста носит не специфи-
ческий характер, а обусловлено возрастанием
клубочковой фильтрации и реабсорбции всех
основных компонентов ультрафильтрата.
2.4. Выделение воды
(осмотическое концентрирование
и разведение мочи)
В зависимости от состояния водного баланса
организма почки могут выделять гипотоничес-
кую, очень разведенную или осмотически кон-
центрированную мочу. В этом процессе участву-
ют все отделы канальцев и сосуды мозгового
вещества почки, функционирующие как про-
Рис. 2.5. Процесс осмотического разведения (а) и
концентрирования мочи (б).
Цифрами в просвете клубочка и у проксимального каналь-
ца показано количество электролитов (Э) и неэлектроли-
тов (НЭ) в процентах от общего количества осмотически
активных веществ, профильтровавшихся со 100 частями
воды клубочкового фильтрата. Цифрами в просвете нефро-
на и между канальцами обозначена величина осмоляльной
концентрации. Сплошные стрелки означают активный
транспорт натрия (Na), прерывистые — пассивное движе-
ние воды (Н2О) и мочевины (М); I — кора почки; II и
III — наружное и внутреннее мозговое вещество; К — клу-
бочек; П — проксимальный каналец; НТ — нисходящий
тонкий отдел петли Генле; ВТ — восходящий тонкий от-
дел петли Генле; ВО — восходящий толстый отдел петли
Генле; ДК — дистальный извитой каналец; С — связующий
отдел; СТ — собирательная трубка; БП — беллиниев про-
ток.
тивоточная поворотная множительная система.
Сущность деятельности этой системы заключа-
ется в следующем. К концу проксимального
канальца в норме реабсорбируется около 65 %
з*
35
ультрафильтрата. Оставшаяся в канальцах жид-
кость не отличается по осмоляльности от плаз-
мы крови, хотя и имеет иной состав вследствие
реабсорбции веществ в проксимальном каналь-
це (рис. 2.5, а). Далее жидкость переходит из
коркового слоя в мозговое вещество почки, в
нисходящие тонкие петли Генле, движется до
вершины почечного сосочка, где каналец по-
добно шпильке изгибается на 180°, и моча пе-
реходит в тонкий восходящий отдел петли, рас-
положенный параллельно ее нисходящему от-
делу, но в нем жидкость течет в направлении
от вершины сосочка к коре почки (рис. 2.5, б).
Функциональное значение различных отделов
петли Генле неодинаково. Жидкость из прокси-
мального канальца поступает в тонкий нисхо-
дящий отдел петли Генле, стенка которого
проницаема для воды, но относительно непро-
ницаема для солей. В толстом восходящем от-
деле петли Генле клетки активно реабсорбиру-
ют ионы натрия, калия, хлора без воды, по-
скольку стенка нефрона в этом отделе не про-
пускает воду. В дистальный извитой каналец при
водном диурезе и антидиурезе поступает гипо-
тоническая жидкость, концентрация осмотичес-
ки активных веществ в которой менее 200 мос-
моль • л1. При избытке воды в организме в кро-
ви практически нет вазопрессина (АДГ), стен-
ка собирательных трубок остается водонепро-
ницаемой, ее клетки всасывают соли натрия.
Почки выделяют большие объемы гипотони-
ческой мочи с низкой концентрацией солей.
Мочеотделение может достигать 15 % от объе-
ма жидкости, профильтровавшейся в клубоч-
ках, т.е. возрастает до 18 мл • мин1 • 1,73 м-2
поверхности тела, а осмоляльность мочи сни-
жается до 70—50 мосмоль • кг1 Н2О.
В условиях дефицита жидкости в организме,
при повышении осмоляльности крови наступает
секреция АДГ, и почка осуществляет осмоти-
ческое концентрирование мочи. Мочеотделение
уменьшается до 0,5 мл • мин_| • 1,73 м-2 поверх-
ности тела, осмоляльность мочи у человека
может возрастать до 1200—1400 мосмоль-кг1
Н2О.
Сущность этого процесса в общих чертах
может быть представлена следующим образом.
После реабсорбции 65 % профильтровавшейся
жидкости в проксимальном канальце в тонкий
нисходящий отдел петли Генле поступает изо-
тоничная плазме крови жидкость. Содержимое
тонкого отдела петли становится более концен-
трированным, так как из его просвета в меж-
клеточное вещество по осмотическому гради-
енту всасывается вода, а осмотически активные
вещества остаются внутри канальца. Чем даль-
ше от коры по продольной оси мозгового ве-
щества находится жидкость в нисходящем ко-
лене петли Генле, тем выше ее осмолярная
36
концентрация. Таким образом, в каждых сосед-
них участках нисходящего отдела петли наблю-
дается лишь небольшое нарастание осмотичес-
кого давления, но по длиннику мозгового слоя
осмотическая концентрация в почке человека
увеличивается, постепенно повышаясь от 300 до
1200—1500 мосмоль • кг1 Н2О.
На вершине петли Генле не только в не-
сколько раз возрастает осмотическая концент-
рация канальцевой жидкости, но и значитель-
но уменьшается ее объем. При дальнейшем дви-
жении жидкость проходит по непроницаемому
для воды восходящему отделу петли Генле и
дистальному канальцу, в которых продолжает-
ся реабсорбция ионов хлора и натрия, вода же
остается в их просвете. В собирательных труб-
ках коры почки под влиянием АДГ возрастает
проницаемость стенки для воды, она начинает
реабсорбироваться по осмотическому градиен-
ту. При протекании мочи по собирательным
трубкам в мозговом веществе продолжается
концентрирование мочи. Поскольку все выше
становится осмолярность окружающего собира-
тельные трубки интерстиция, то из просвета
всасывается вода, в конечном счете образуется
и выделяется гиперосмотическая моча, в кото-
рой осмотическое давление так же велико, как
в интерстициальной жидкости на вершине по-
чечной пирамиды.
В механизме осмотического концентрирова-
ния мочи особую роль играет мочевина. В отли-
чие от наружной зоны мозгового вещества, где
повышение осмолярности обусловлено главным
образом накоплением солей натрия, во внут-
реннем мозговом веществе наряду с солями
натрия важное значение имеет мочевина. В моз-
говом веществе почки функционирует специ-
альная система, обеспечивающая кругооборот
мочевины и ее удержание в почке. Централь-
ную роль в этом процессе играет неодинако-
вая проницаемость различных частей канальцев
для мочевины и особенно способность АДГ уве-
личивать проницаемость для мочевины стенки
тех участков собирательных трубок, которые
расположены во внутреннем мозговом веществе
почки. Вследствие реабсорбции воды в выше-
лежащих отделах собирательных трубок в их
просвете повышается концентрация мочевины,
однако она не может выйти из канальца. Когда
же моча достигает того участка собирательных
трубок, где АДГ увеличивает проницаемость и
для воды, и для мочевины (зона внутреннего
слоя мозгового вещества), большие количества
обоих веществ реабсорбируются в мозговое ве-
щество. Мочевина увеличивает осмолярную кон-
центрацию в интерстиции мозгового вещества,
создавая условия для реабсорбции дополнитель-
ных количеств воды. Войдя в ткань мозгового
вещества, мочевина диффундирует по межкле-
точному веществу, проникает в просвет тонкого
восходящего отдела петли Генле и движется по
канальцу. Общее количество входящей в про-
свет нефрона мочевины настолько значитель-
но, что при антидиурезе в дистальный изви-
той каналец поступает больше мочевины, чем
профильтровалось в клубочках. Мочевина сно-
ва реабсорбируется под влиянием АДГ в соби-
рательных трубках, что и обеспечивает непре-
станный ее кругооборот в почке и объясняет
важную роль мочевины в процессе осмотичес-
кого концентрирования мочи.
Эффективность осмотического концентриро-
вания мочи зависит от многих причин. Важное
значение имеет соотношение между количе-
ством нефронов с длинной и короткой петля-
ми Генле. Юкстамедуллярные нефроны, петли
Генле которых глубоко спускаются в мозговое
вещество почки, обеспечивают его высокую ос-
моляльность и благодаря этому наибольшее
осмотическое концентрирование мочи. Очевид-
но, что степень поражения тех или иных групп
нефронов в условиях патологии определяет и
дефект процесса осмотического концентриро-
вания мочи.
Увеличение скорости движения жидкости по
прямым кровеносным сосудам способствует вымы-
ванию осмотически активных веществ из мозгового
вещества почки, а ускорение потока мочи по соби-
рательным трубкам снижает уровень всасывания
мочевины, что также ухудшает работу концентриру-
ющего механизма. К этому же приводит питание ма-
лобелковой пищей, так как меньше образуется мо-
чевины и не удается достичь высокого осмотичес-
кого градиента в мозговом веществе почки. В этой
же зоне почки образуются простагландины, некото-
рые из них стимулируют движение крови по пря-
мым сосудам мозгового вещества, а также снижают
действие АДГ на проницаемость для воды клеток
собирательных трубок.
Оценка состояния осморегулирующей фун-
кции почки имеет важное значение для кли-
ницистов. Осмотическое концентрирование
мочи требует участия почти всех элементов
почки — сосудистой системы, почечных ка-
нальцев, интерстиция. Поэтому изменение ос-
морегулирующей функции почки может зави-
сеть от многих причин, их выяснение будет спо-
собствовать постановке диагноза. Роль этой
функции почки была известна клиницистам
еще в начале нашего столетия, когда были
предложены тесты на разведение и концентри-
рование мочи; до наших дней сохранили зна-
чение пробы Фольгарда (F.Volhard) и Зимниц-
кого. Нарушение процесса осмотического кон-
центрирования, выделение мочи с низкой от-
носительной плотностью после водной депри-
вации могут быть обусловлены изменением
работы любого элемента, описанного выше. Ве-
роятно, для клинициста целесообразно не толь-
ко рассмотреть данные физиологических иссле-
дований, показывающих значение каждого из
компонентов системы концентрирования мочи,
но и проанализировать особенности работы
почки при таких патологических состояниях,
которые позволяют глубже оценить роль основ-
ных элементов концентрирования мочи и мо-
гут быть полезны при выяснении причин по-
лиурии и нарушения концентрационной спо-
собности почки [Шейман Д.А., 1999; Goldber-
ger Е., 1975]. Изменение способности почки к
осмотическому разведению и концентрирова-
нию мочи может быть обусловлено экстраре-
нальными факторами либо процессами, проис-
ходящими в почке.
Описаны случаи нарушения функции осмо-
рецепторов, когда почки при сухоядении не
концентрировали мочу; это было обусловлено
не нарушением функции пептидергических
нейронов, как при истинном несахарном диа-
бете, а тем, что нейрогипофиз сохранял спо-
собность секретировать АДГ только после инъ-
екции никотина. Полиурия при нормальном со-
стоянии осморецепторов может быть обуслов-
лена повышенной возбудимостью центра жаж-
ды, вызывающей увеличенное потребление
воды при более низкой осмоляльности плазмы
крови, чем у здорового человека. В этих случа-
ях осмоляльность крови ниже, чем в норме (269
мосмоль-кг1 Н2О), в то время как при неса-
харном диабете она выше, чем в норме (280—
295 мосмоль • кг1 ЕГО), и составляет более 295
мосмоль • кг'1 Н2О. Во всех этих случаях сохра-
няется нормальная реакция почки на инъекцию
препаратов гормонов задней доли гипофиза или
синтетического вазопрессина, что свидетель-
ствует о сохранности осморегулирующей фун-
кции почки.
Значительное снижение клубочковой фильтра-
ции и почечного кровотока независимо от вы-
звавшей их причины приводит к уменьшению
концентрационной функции почки из-за недоста-
точной доставки осмотически активных ве-
ществ и нарушения нормального движения жид-
кости.
Большое значение имеет и сохранение дос-
таточного кровоснабжения мозгового вещества
почки. При серповидно-клеточной анемии на-
рушение концентрационной способности поч-
ки связано с тем, что патологически изменен-
ные эритроциты, входящие с током крови в
прямые сосуды мозгового вещества, резко из-
меняют свою форму, соприкасаясь с гиперто-
нической средой. Это уменьшает кровоток в
узких сосудах мозгового слоя; ишемия только
этой зоны снижает в ней накопление натрия,
хлора, мочевины, в конечном счете нарушает-
37
ся функция концентрирования мочи. После
обменного переливания крови концентрацион-
ная способность почки у этих больных времен-
но восстанавливается до нормы. Другим приме-
ром может служить питрессинрезистентный
ноктуральный нефрогенный несахарный диа-
бет, описанный при пароксизмальной гипер-
тензии. Он обусловлен усилением кровотока по
прямым сосудам мозгового вещества; увеличе-
ние кровотока вызывает вымывание осмотичес-
ки активных веществ из мозгового вещества
почки в период пароксизмальной гипертензии,
что сопровождается снижением осмоляльности
мочи.
Процесс осмотического концентрирования
мочи представляет собой совокупную работу
всех составляющих почку элементов. Поэтому
для эффективного концентрирования важное
значение имеют количество функционирующих
нефронов, тесная связь их друг с другом, спо-
собствующая деятельности противоточной си-
стемы, нормальные размеры отдельных сегмен-
тов нефронов. Снижение концентрационной
способности при хронической почечной недо-
статочности (ХПН), в частности, зависит от
резкого уменьшения количества функциониру-
ющих нефронов, увеличения расстояния меж-
ду отдельными нефронами. Любые факторы, на-
рушающие соотношение между структурами
мозгового слоя почки, приводят к снижению
процесса осмотического концентрирования. Это
может наблюдаться, например, при поликис-
тозе или поражении мозгового вещества ами-
лоидом.
Значительное снижение реабсорбции жидкости в
проксимальном канальце вызывает усиление пото-
ка жидкости по петле Генле и вымывание из нее
осмотически активных веществ. Это наблюдается при
врожденном дефекте нефрона — укороченном про-
ксимальном канальце, осмотическом диурезе любой
этиологии (сахарный диабет, ХПН, вливание ман-
нита и других осмотических диуретиков). Активный
транспорт солей клетками толстого восходящего от-
дела петли Генле нарушается при гипокалиемии из-
за ухудшения работы ионных насосов. Гиперкальци-
емия и избыток кальция в клетке снижают накоп-
ление натрия в мозговом веществе, угнетая его ак-
тивный транспорт.
Увеличение проницаемости для воды стен-
ки собирательных трубок инициируется АДГ. Из
русла крови он проникает в межклеточную
жидкость, достигает внешней поверхности
плазматических мембран базальной и латераль-
ной поверхности клетки. В этих мембранах на-
ходятся У2-рецепторы, АДГ взаимодействует с
ними, и при участии G-белков активируется
аденилатциклаза, способствующая преобразова-
нию АТФ в цАМФ. Последний перемещается в
область апикальной части клетки, и вследствие
38
стимуляции протеинкиназы и ряда биохимичес-
ких реакций осуществляется перестройка лю-
минальной плазматической мембраны, увели-
чивается ее проницаемость для воды, в нее
встраиваются водные каналы — аквапорины 2.
Сказанное не отражает известной уже в насто-
ящее время сложности внутриклеточных био-
химических и ультраструктурных преобразова-
ний, наступающих после активации У2-рецеп-
тора, однако позволяет понять возможные при-
чины нарушения осморегулирующей функции
почки при некоторых видах фармакотерапии,
нарушении ионного состава внутренней среды
организма, эндокринопатиях.
Нарушение концентрационной способности поч-
ки наблюдается при гипокортицизме, гипопитуита-
ризме и гипотиреоидизме. Изменение ионного со-
става внутренней среды оказывает влияние на реак-
цию клеток собирательных трубок на АДГ. Взаимо-
действие гормона с клеткой ослабевает при гипер-
кальциемии, дефицит калия в организме сопровож-
дается нарушением хода внутриклеточных процессов,
активируемых АДГ и происходящих после образова-
ния цАМФ. Различные фармакологические средства,
применяемые в клинике, могут вмешиваться в био-
химические процессы, участвующие в осмотическом
концентрировании. Среди них можно упомянуть
анальгетики, некоторые диуретики, винкристин.
Оказалось, что в увеличении проницаемости люми-
нальной мембраны участвует щитоскелет, поэтому
фармакологические средства, влияющие на состоя-
ние цитоскелета, сборку микрофиламентов и мик-
ротрубочек, изменяют реакцию клеток на АДГ.
Существенное значение в механизме дей-
ствия этого гормона имеет его способность ак-
тивировать образование ряда простагландинов
в мозговом веществе почки. Их функциональ-
ное назначение состоит в снижении чувстви-
тельности клеток к АДГ, уменьшении реакции
на АДГ. Казалось бы, складывается парадоксаль-
ная ситуация — один и тот же гормон увели-
чивает проницаемость собирательных трубок
для воды и способствует секреции веществ,
угнетающих собственную реакцию. Этот факт
можно объяснить тем, что АДГ является основ-
ным (а возможно, и единственным) регулято-
ром водного обмена, поэтому была необходи-
мость создать систему снижения реакции на
этот гормон. В этом и заключается двойствен-
ность его эффекта: он увеличивает реабсорбцию
воды и способствует выработке вещества, сни-
жающего чувствительность рецепторов к вазо-
прессину, тем самым противодействующего воз-
растанию осмотической проницаемости. Гормон
быстро разрушается, и пока в кровь поступают
все новые количества АДГ, сохраняется увели-
ченная реабсорбция воды, однако снижение
секреции этого гормона быстро приводит к вос-
становлению водонепроницаемости стенки
Рис. 2.6. Основные реакции, обусловливающие учас-
тие почки в регуляции кислотно-основного состоя-
ния (схема).
КА — карбоангидраза. Остальные объяснения в тексте.
канальца. Влияние на эффект АДГ могут ока-
зывать и лекарственные препараты, влияющие
на синтез и инактивацию простагландинов.
Данные об увеличении АДГ проницаемости
канальцев для мочевины позволяют понять дав-
но известный в клинике факт, что очищение
от мочевины зависит от величины диуреза —
оно меньше при низком диурезе и значитель-
но возрастает при увеличении мочеотделения,
достигая 65 % от одновременно измеряемого
очищения от креатинина или инулина при вод-
ном диурезе. Малый уровень мочеотделения
обычно обусловлен значительной концентраци-
ей в крови АДГ и, следовательно, большей ре-
абсорбцией в канальцах воды и мочевины; об-
ратные процессы наблюдаются при большой
скорости диуреза, когда нет АДГ. Нельзя не
учитывать и рациона, в котором должно быть
достаточное количество не только солей, но и
белка. При потреблении малобелковой пищи
образуется недостаточное количество мочевины
и вследствие этого не создается необходимого
уровня ее накопления в мозговом слое почки.
Все сказанное должно помочь в воссоздании
«целостного образа» процесса осмотического
концентрирования и лечь в основу последую-
щего анализа причин, вызывающих нарушение
одной из основных функций почки, связанных
с ее участием в водно-солевом обмене и важ-
ных в клинике для характеристики функцио-
нального состояния почки.
2.5. Выделение Н+
Почки участвуют в поддержании стабильного
значения pH крови на уровне 7,35—7,43, что
обусловлено их способностью удалять из плаз-
мы крови избыток кислых продуктов или осно-
ваний. В норме при pH 7,4 в плазме крови кон-
центрация бикарбоната составляет около
25 ммоль/л, а парциальное давление СО2 —
40 мм рт. ст. В почечных клубочках в течение суток
фильтруется более 4500 ммоль бикарбоната, а
экскретируется с мочой лишь около
2 ммоль. Основным механизмом, с помощью
которого почка участвует в регуляции кислот-
но-основного равновесия, является секреция Н+
(рис. 2.6). Активный транспорт Н+ осуществля-
ется в канальцевую жидкость через люминаль-
ную мембрану, а ион Na+ поступает в клетку,
обеспечивая баланс электрических зарядов. Сек-
39
реция Н+ отчасти обусловлена прямым обменом
на ионы Na+. В просвете канальца ионы Н+ со-
единяются с НСО3, образуется Н2СО3, которая
под влиянием фермента карбоангидразы, встро-
енного в люминальную мембрану клетки про-
ксимального канальца, дегидратируется, и СО2
диффундирует в клетку. Внутри клетки под вли-
янием такого же фермента активируется реак-
ция гидратации СО, * СО, + Н,О -> Н,СО3 *
* Н1 + НСО3. Через базальную плазматическую
мембрану клетки активно транспортируется Na+
и пассивно по градиенту поступает в кровь
НСО3'. Таким образом, секреция Н+ обеспечи-
вает в конечном счете реабсорбцию бикарбона-
та и эквивалентного количества Na+.
В проксимальном канальце секретируется
наибольшее количество поступающих в просвет
нефрона ионов Н+, здесь же реабсорбируется
до 80—90 % бикарбоната. Главным фактором,
ограничивающим реабсорбцию НСО3 , являет-
ся скорость секреции ионов Н+ и градиент его
концентрации. Реабсорбция бикарбоната не ог-
раничена Тт даже при увеличении его концен-
трации в плазме более чем в 2 раза, до 60
ммоль; всасывание бикарбоната снижается при
увеличении объема внеклеточной жидкости.
Угнетение карбоангидразы после введения ее
ингибитора ацетазоламида приводит к умень-
шению реабсорбции бикарбоната, а вместе с
ним натрия и воды, из крови удаляются осно-
вания, что может привести к ацидозу. Возрас-
тает потеря калия с мочой, что вызывает ги-
покалиемию.
В петле Генле реабсорбируется около 5 %
профильтровавшегося бикарбоната, приблизи-
тельно 5 % достигает дистального извитого ка-
нальца. При увеличении загрузки этих отделов
нефрона бикарбонатом его реабсорбция значи-
тельно возрастает, что указывает на резервную,
не используемую в обычных условиях транспор-
тную мощность этих канальцев. В более дисталь-
ных отделах канальцев в мембране со стороны
просвета действует активный протонный насос,
хотя в этом случае секретируется меньше ионов
Н+, но эти клетки обладают способностью к со-
зданию все более значительного градиента pH.
В конечных отделах канальцев pH жидкости мо-
жет снижаться до 4,4, т.е. градиент концентра-
ции ионов Н+ по сравнению с плазмой крови
достигает 1000.
Скорость реабсорбции НСО3 не является
постоянной величиной. Она тесно связана с ре-
абсорбцией ионов натрия в проксимальном
сегменте нефрона и зависит от тех регулятор-
ных влияний, которые меняют его обратное
всасывание. При увеличении объема внутрисо-
судистой жидкости уменьшается реабсорбция
жидкости в проксимальном канальце, в том
числе и всасывание НСО3‘. При гипервентиля-
40
ции, а также других ситуациях, когда падает
содержание СО2 в артериальной крови, реаб-
сорбция НСО3 уменьшается; при увеличении
Рсо2 она возрастает. Усиление всасывания НСО,
отмечено при повышении содержания в крови
кортикостероидов (например, при синдроме
Иценко — Кушинга).
Выделение почкой кислых продуктов обус-
ловлено главным образом тем, что секретиру-
емые ионы Н+ соединяются с нереабсорбируе-
мыми анионами, преимущественно с НРО42 +
Н+ Н2Ро4_, а также с аммиаком. Фосфат, при-
соединив ионы Н+, экскретируется почкой.
Общее количество секретируемых почкой ионов
Н+ в минуту определяется суммой реабсорбции
НСО3 и экскреции титруемых кислот и аммо-
ния. Общее выделение ионов Н+, связанное с
секрецией аммония и экскрецией титруемых
кислот, составляет у человека 50—70 ммоль в
день; в условиях ацидоза оно может возрастать
до 500. При длительном ацидозе могут терять-
ся значительные количества фосфатов вслед-
ствие растворения кости. В условиях диабетичес-
кого ацидоза 0-оксибутират становится одним
из важных компонентов титруемых кислот,
выделяемых с мочой.
Клетки проксимального и дистального ка-
нальцев нефрона участвуют в секреции аммиа-
ка. При нейтральном, а тем более при кислом
значении pH канальцевой жидкости аммиак,
диффундирующий из клетки в просвет каналь-
ца, превращается в ион аммония (NH + Н+ -»
-> NH4+). в основе образования аммиака лежит
процесс дезаминирования аминокислот; основ-
ным его предшественником служит глутамин, од-
нако отчасти для этого используются также ала-
нин и глицин. Эти аминокислоты в присутствии
оксокетоглутарата под влиянием трансаминазы
превращаются в глутамат, который затем дезами-
нируется. Образование аммиака происходит внут-
ри клеток, аминокислоты поступают в них как
при реабсорбции, так и путем транспорта из
межклеточной жидкости. Дезаминирование глута-
мина может происходить при участии глутами-
назы II либо глутаминазы I и глутаматдегидро-
геназы; в обоих случаях выделяются аммиак и
оксокетоглутарат. Образование в почке и экскре-
ция аммиака усиливаются при хроническом аци-
дозе. Одним из возможных механизмов этого
процесса, по-видимому, является повышение
транспорта глутамина в митохондрии.
2.6. Выделение органических
веществ
Глюкоза. У здорового человека каждую ми-
нуту в просвет нефрона поступает более 100 мг
глюкозы (0,4—0,6 ммоль), с мочой она прак-
тически не экскретируется. В норме в 1 л су-
точной мочи обнаруживается от 10 до 150 мг
глюкозы (0,06—0,83 ммоль •л1). Так как в те-
чение суток фильтруется около 1000 ммоль глю-
козы, а выводятся лишь следы глюкозы, то оче-
видно, что практически вся профильтровавша-
яся глюкоза реабсорбируется. Обратное всасы-
вание глюкозы в кровь происходит в прокси-
мальном сегменте нефрона. Концентрация глю-
козы в просвете канальца снижается вследствие
ее переноса в межклеточную жидкость, т.е.
против концентрационного градиента.
В настоящее время достигнуты значительные
успехи в понимании молекулярных механизмов
реабсорбции глюкозы. Процесс ее транспорта
из просвета канальца в кровь носит название
вторично-активного. Это обусловлено тем, что
реабсорбция глюкозы обеспечивается не актив-
ным переносом ее молекулы, как считалось
раньше, а транспортом глюкозы через мембрану
щеточной каемки с помощью переносчика,
одновременно присоединяющего и ионы Na+,
и глюкозу.
Рассмотрим подробнее механизм реабсорбции
глюкозы. Клеточная энергия для реабсорбции глю-
козы создается при работе натриевого насоса, ло-
кализованного в плазматических мембранах боковых
и базальных частей клетки и удаляющего ионы Na+
из клетки в сторону межклеточной жидкости и кро-
веносных капилляров. Активный транспорт ионов
Na+ из клетки приводит к тому, что в цитоплазме
его концентрация снижается. Это служит движущей
силой для пассивного по градиенту электрохимичес-
кого потенциала входа ионов Na+ в клетку через
мембрану щеточной каемки. На внешней стороне
плазматической мембраны клетки переносчики об-
разуют комплекс с глюкозой и ионами Na+, и тог-
да создаются условия для перемещения этих веществ
в цитоплазму. Необходимость переносчика для транс-
мембранного передвижения глюкозы обусловлена
тем, что глюкоза нерастворима в липидах и не мо-
жет легко проходить через плазматическую мембра-
ну внутрь клетки. Движение этого переносчика уг-
нетается флоридзином. Внутренняя поверхность клет-
ки отрицательно заряжена, в ней ниже концентра-
ция ионов Na+, чем в просвете канальца, и его
поступление по градиенту электрохимического по-
тенциала создает условия для транспорта глюкозы
против концентрационного градиента внутрь клет-
ки. Проникновение глюкозы в клетку через люми-
нальную мембрану является самым медленным эта-
пом при реабсорбции глюкозы. Далее глюкоза дви-
жется по цитоплазме, достигает базолатеральных
плазматических мембран, перенос глюкозы через
которые в межклеточную жидкость происходит так-
же с участием переносчика, чувствительного к фло-
ретину, но уже не требуется присутствия ионов Na+.
Таким образом, активный транспорт ионов Na+ че-
рез базальную мембрану, на который расходуется
энергия клеточного метаболизма, способствует сни-
жению его внутриклеточной концентрации и созда-
ются условия для поступления из просвета через
мембрану глюкозы по механизму вторично активного
транспорта.
При патологии нередко наблюдаются не ге-
нерализованные, а локальные изменения в
почках, патологический процесс может затра-
гивать отдельные участки почечных канальцев.
В этой связи следует обратить внимание на не-
которые отличия молекулярных механизмов
реабсорбции тех же самых соединений, но в
клетках различных частей даже одного отдела
нефрона. Эту проблему можно проанализиро-
вать на примере реабсорбции глюкозы. Чем
дальше от клубочка расположены клетки про-
ксимального отдела канальцев, тем все мень-
ше становится концентрация глюкозы, непре-
рывно реабсорбируемой в расположенных выше
частях нефрона. Оказалось, что по длиннику
проксимального канальца меняются физико-хи-
мические характеристики транспортера глюкозы.
В начальных отделах этого канальца переносчик
глюкозы, находящийся в мембране щеточной
каемки, имеет два центра связывания — один
для ионов Na+ и один для глюкозы. По мере
удаления от клубочка на смену этому перенос-
чику появляется другой, который связывает
1 молекулу глюкозы и 2 иона Na+, что обеспе-
чивает большую движущую силу для реабсорб-
ции глюкозы. Оба процесса транспорта глюко-
зы имеют разные кинетические характеристи-
ки, в частности сродство к глюкозе, от эффек-
тивности их работы зависит полнота всасыва-
ния глюкозы.
В клинике определение способности почки
к реабсорбции глюкозы является одним из важ-
ных показателей функционального состояния
клеток проксимального канальца и общего ко-
личества эффективно работающих канальцев. Из
сказанного выше о сущности процесса реабсор-
бции глюкозы следует, что максимальное ко-
личество реабсорбируемых молекул глюкозы из
канальцевой жидкости в кровь зависит от чис-
ла переносчиков глюкозы и скорости их обо-
рота в мембране. Очевидно, что вся профильт-
ровавшаяся глюкоза реабсорбируется до тех
пор, пока количество переносчиков и скорость
их движения в мембране обеспечивают перенос
всех поступивших в просвет канальца молекул
глюкозы. Экскреция глюкозы с мочой начина-
ется лишь тогда, когда ее концентрация в плаз-
ме возрастает настолько, что количество про-
фильтровавшейся глюкозы превышает реабсор-
бционную способность канальцев. Количество
глюкозы, реабсорбируемой при максимальной
загрузке всех мембранных переносчиков, уча-
ствующих в транспорте глюкозы (TmG), служит
при стандартных условиях исследования важ-
ным показателем функции проксимального
канальца. Максимальный транспорт глюкозы у
41
мужчин равен 375±79,7, а у женщин —
303±55,3 мг/мин при расчете на 1,73 м2 повер-
хности тела.
Исследования с введением глюкозы в кровь
и измерением TmG представляют интерес в
клинике для характеристики баланса между
клубочковой фильтрацией и реабсорбцией в
проксимальном канальце каждого из нефронов.
При вливании гипертонического раствора глю-
козы в кровь гипергликемия не вызывает глю-
козурии, пока в каком-либо из канальцев не
будет достигнут предел его способности реаб-
сорбировать глюкозу. Если во всех нефронах
имеется соответствие между объемом фильтру-
емой жидкости (тем самым и глюкозы) и спо-
собностью к ее реабсорбции, то TmG будет
достигнут одновременно во всех нефронах и при
дальнейшем повышении концентрации глюко-
зы в крови наступит глюкозурия. Если же в двух
нефронах имеется одинаковая фильтрация, но
разное состояние канальцев, разная способ-
ность к реабсорбции глюкозы, то TmG будет
достигнут неодновременно. Чем большие отли-
чия существуют между отдельными нефронами,
чем более гетерогенны популяции нефронов,
чем меньше соответствия между уровнем клу-
бочковой фильтрации глюкозы и ее реабсорб-
цией, тем значительнее расхождение между
нефронами во времени наступления TmG при
постепенном увеличении концентрации глюко-
зы в плазме. В некоторых нефронах TmG дос-
тигается при концентрации глюкозы в плазме
11 ммоль/л, в других же — 20 ммоль/л. Это
явление носит название расщепления кривой
титрования нефронов глюкозой; оно зависит от
степени морфологической и функциональной
гетерогенности популяций нефронов в почке.
Увеличение TmG наблюдается при акромегалии,
после введения тироксина, а его снижение ха-
рактерно для болезни Аддисона, сывороточной
сенсибилизации, при увеличении концентрации
в фильтрате 1-лизина и 1-аланина.
Белок. В течение суток в норме выделение
белка с мочой не превышает 50—80 мг [Шюк О.,
1975]. Профильтровавшаяся в клубочки жид-
кость содержит очень небольшие количества
белков, среди них содержатся измененные бел-
ки, а также полипептиды и осколки белковых
молекул, размер которых меньше диаметра пор
фильтрующей мембраны. У здорового человека
действует ряд эффективных механизмов, пре-
пятствующих поступлению белка из просвета
капилляров в полость капсулы клубочка. В эн-
дотелии капилляров имеются достаточно круп-
ные отверстия (фенестры), но движение белка
через них затруднено тем, что при нормальной
скорости кровотока на поверхности коры об-
разуется слой крупных белковых молекул и
затрудняется прохождением белков с меньшей
42
молекулярной массой. При замедлении крово-
тока нарушается структура этого слоя крупно-
молекулярных белков, облегчается прохождение
белков к базальной мембране клубочка. Она
считается основным барьером на пути белка,
ее поры имеют меньший диаметр, чем у аль-
бумина. Проникновению альбуминов препят-
ствует также наличие отрицательного заряда в
стенке поры (альбумины также имеют отрица-
тельный заряд) и стерическое несоответствие
формы поры и молекулы альбумина. При дезор-
ганизации базальной мембраны меняются заряд
и форма пор, что облегчает фильтрацию белка.
Наконец, следующим препятствием на пути
белка служат щелевые мембраны между ножка-
ми подоцитов и находящиеся на их поверхнос-
ти сиалогликопротеины. Полианионная приро-
да этих веществ также ограничивает прохожде-
ние белков, имеющих отрицательный заряд.
Приведенные данные о роли состояния гло-
мерулярного фильтра для процесса ультрафиль-
трации имеют важное значение для понимания
патогенетических механизмов развития проте-
инурии. В опытах на крысах было показано, что
после введения нефротоксической сыворотки
снижается содержание полианионов в клубоч-
ках и развивается протеинурия. Уменьшение
величины заряда гломерулярного фильтра на-
блюдается после введения азотнокислого ура-
нила, который, взаимодействуя с полианиона-
ми базальной мембраны, изменяет проницае-
мость для альбуминов. Большая часть поступив-
ших в нефрон полипептидов и белков гидро-
лизуется в клетках, и аминокислоты реабсор-
бируются в кровь. В проксимальном канальце
всасывание белка осуществляется посредством
пиноцитоза. Вещества, адсорбированные на
наружной поверхности плазматической мемб-
раны, и капельки находящейся в этом месте
жидкости втягиваются в клетку вследствие впя-
чивания мембраны внутрь между микроворсин-
ками люминальной мембраны и образованием
вакуоли. Пиноцитозные вакуоли отшнуровыва-
ются и движутся в сторону базальной части
клетки, в околоядерной области, где находит-
ся пластинчатый комплекс (аппарат Гольджи),
они могут сливаться с лизосомами, обладаю-
щими высокой активностью ряда гидролитичес-
ких ферментов, в частности кислой фосфата-
зы. Образующиеся аминокислоты выделяются
через базальную плазматическую мембрану в
кровь. В клетках канальцев имеются специфи-
ческие механизмы для раздельной реабсорбции
различных белков — альбумина, гемоглобина.
Выделение значительных количеств белка с
мочой наблюдается при ряде физиологических
и патологических состояний, суточная потеря
белка может достигать 50 г и более [Тареев Е. М.,
1958]. Появление небольших количеств белка в
моче может наблюдаться при ряде физиологи-
ческих состояний, когда нет патологических из-
менении в почке: при охлаждении, введении
катехоламинов, раздражении кожных покровов,
некоторых заболеваниях (феохромоцитома, ги-
пертонический криз, псориаз), эмоциональном
напряжении. Описана протеинурия после тяже-
лой физической нагрузки (маршевая протеину-
рия). Ортостатическая протеинурия наблюдает-
ся у здоровых лиц при длительном стоянии, она
исчезает после перемены положения тела. У
молодых людей с резко выраженным искрив-
лением позвоночника выпуклостью кпереди
при стоянии возрастает выделение белка с
мочой. Протеинурия отмечена при застойной
сердечной недостаточности и лихорадке.
Аминокислоты и пептид ы. В клубоч-
ковом фильтрате концентрация аминокислот
такая же, как и в плазме крови — 2,5 —
3,5 ммоль •л1. В обычных условиях обратному
всасыванию подвергается почти 99 % профиль-
тровавшихся аминокислот, причем этот про-
цесс происходит главным образом в начальных
частях проксимального извитого канальца. Ме-
ханизм реабсорбции аминокислот подобен опи-
санному выше для глюкозы. Аминокислота со-
единяется в люминальной мембране со специ-
фичным для нее участком на переносчике, он
присоединяет Na+, и комплекс перемещается
в мембране, освобождая в цитоплазму амино-
кислоту и Na+. Имеется ограниченное количе-
ство переносчиков, и когда все они соединя-
ются с соответствующими аминокислотами,
избыток последних остается в канальцевой
жидкости и экскретируется с мочой. Предпо-
ложение о существовании одного типа перенос-
чиков для некоторых групп разных аминокис-
лот основано на том, что при увеличении кон-
центрации в плазме крови одной аминокисло-
ты усиливается экскреция всех аминокислот
только данной группы. Описаны переносчики
для основных — диаминокислот (цистин, ли-
зин, аргинин, орнитин), кислых — дикарбок-
сильных аминокислот (глутаминовая кислота,
аспарагиновая кислота), имино кислот и глици-
на (пролин, оксипролин, глицин), нейтраль-
ных аминокислот (валин, лейцин, изолейцин
и др.), /?-аминокислот (/?-аланин, /?-амино-
изомасляная кислота). Поступившие в клетку
аминокислоты перемещаются к латеральным и
базальной плазматической мембранам, где они
через мембрану транспортируются в межклеточ-
ную жидкость. В щеточной каемке на ее люми-
нальной поверхности имеются пептидазы, осу-
ществляющие гидролиз пептидов, а образую-
щиеся аминокислоты всасываются этими же
клетками. Предполагают, что пептидазы в мем-
бране не только расщепляют пептиды, но и
участвуют в реабсорбции аминокислот.
В норме моча содержит следы аминокислот.
При использовании колоночной ионообменной
хроматографии в суточной моче у здорового
человека выявляется до 2 мг £-аланина, от 2
до 12 мг валина, от следов до 34 мг глутами-
новой кислоты, от 2 до 24 мг изолейцина, до
9 мг метионина, не более 7 мг орнитина. Уве-
личение выделения почкой аминокислот на-
блюдается при различных патологических состо-
яниях и может зависеть от нарушения одного
или нескольких физиологических механизмов,
от которых зависит фильтрация и реабсорбция
аминокислот. Аминоацидурия может быть выз-
вана возрастанием концентрации одной или
нескольких аминокислот в плазме крови (и
соответственно в ультрафильтрате) при поступ-
лении в организм избытка этих аминокислот
или нарушении их метаболизма. Так как реаб-
сорбция аминокислот каждой из групп ограни-
чена величиной максимального канальцевого
транспорта, то после загрузки всех переносчи-
ков излишние количества аминокислот данной
группы будут экскретироваться с мочой. Дру-
гой причиной аминоацидурии может быть де-
фект переносчика, обеспечивающего реабсор-
бцию аминокислоты, в этом случае будет про-
исходить ее потеря с мочой и при нормальном
содержании данной аминокислоты в плазме
крови.
У здорового человека люминальная зона
клеточных контактов практически не пропус-
кает аминокислот из внеклеточной жидкости и
цитоплазмы в первичную мочу, что обеспечи-
вает их эффективную реабсорбцию при участии
переносчиков. Однако при дефекте люминаль-
ной мембраны клеток канальцев, когда возра-
стает ее проницаемость для аминокислот, воз-
можен их отток из цитоплазмы в канальцевую
жидкость и последующее выделение с мочой.
Нарушение матаболизма клеток проксимально-
го канальца также может сопровождаться на-
рушением реабсорбции ряда веществ, в том
числе и аминокислот.
Описано несколько вариантов наследствен-
ных нарушений транспорта аминокислот в по-
чечных канальцах. Цистинурия может быть в
двух формах: 1) увеличение экскреции цисти-
на, лизина, аргинина; 2) увеличение экскре-
ции лишь цистина и цистеина (изолированная
цистинурия). За сутки экскретируется до 700 мг
цистеина, клиренс которого может превышать
клиренс инулина. Глицинурия проявляется в
уменьшенной реабсорбции глицина, несмотря
на нормальную его концентрацию в плазме
крови. В сутки почки выделяют до 1 г глицина.
Иминоглицинурия сопровождается увеличени-
ем экскреции пролина, оксипролина и глици-
на, глюкоглицинурия — глицина и глюкозы.
Аномалия транспорта триптофана, аланина,
43
гистидина, изолейцина, лейцина, треонина,
валина, глутамина и аспарагина характерна для
болезни Хартнупа. Более генерализованное по-
ражение систем реабсорбции в проксимальном
канальце наблюдается при болезни де Тони —
Дебре — Фанкони, когда наряду с аминоаци-
дурией наблюдаются глюкозурия, фосфатурия,
метаболический ацидоз, полиурия [Игнато-
ва М.С., Вельтищев Ю.Е., 1989]. Физиологичес-
ки очевиден механизм усиленной экскреции
именно перечисленных веществ, в то время как
экскреция натрия, калия, магния остается нор-
мальной. Из-за дефекта проксимального каналь-
ца большие количества самых различных ве-
ществ, в том числе глюкозы, аминокислот,
ионов и воды, поступают в дистальный сегмент
нефрона. Клетки этих отделов канальца не спо-
собны к реабсорбции органических веществ, но
эффективно всасывают ионы натрия, калия,
магния. Поэтому при болезни де Тони — Деб-
ре — Фанкони увеличена экскреция почкой
аминокислот, глюкозы, фосфатов; полиурия
вызвана необходимостью растворения избыточ-
ных количеств этих веществ в канальцевой
жидкости, чтобы сохранить осмоляльность,
близкую к плазме крови.
Многие пептиды, имеющиеся в крови и
поступающие в фильтрат (вазопрессин, АКТГ,
ангиотензин II, гастрин, брадикинин, инсулин
и др.), метаболизируются и всасываются в
кровь. Со стороны просвета канальца в люми-
нальной мембране обнаружены активные пеп-
тидазы, которые быстро гидролизуют пептиды,
и образовавшиеся аминокислоты реабсорбиру-
ются клетками проксимального канальца. Гид-
ролиз физиологически активных пептидов име-
ет двоякое функциональное значение — в кровь
поступают аминокислоты, используемые для
синтетических процессов в различных органах
и тканях, и организм непрерывно освобожда-
ется от поступивших в кровоток биологически
активных соединений, что улучшает точность
регуляторных влияний. Снижение функциональ-
ной способности почки по удалению этих ве-
ществ приводит к тому, что при почечной не-
достаточности может наступить гипергастрине-
мия, появляется избыток в крови паратгормо-
на (помимо увеличения его секреции) и подоб-
ных ему веществ. Кроме того, из-за замедления
инактивации инсулина в почке у больных диа-
бетом при развитии почечной недостаточнос-
ти может снижаться потребность в инсулине.
Считалось, что всасываются только амино-
кислоты или белки, гидролизуемые в клетках
канальцев. Однако было установлено, что в
люминальной мембране клеток проксимального
отдела нефрона имеется специфическая систе-
ма транспорта дипептидов и трипептидов из
канальцевой жидкости в цитоплазму [Ganapa-
44
thy V., Leibach F., 1986]. Так как в крови кон-
центрация таких олигопептидов крайне низка,
весьма вероятно, что они расщепляются внут-
ри клеток до аминокислот. Источником ди-,
трипептидов во внутриканальцевой жидкости
могут быть полипептиды, поступающие в уль-
трафильтрат из крови и гидролизуемые пепти-
дазами. Мембрана содержит очень высокую ак-
тивность дипептидазы, но в отличие от амино-
пептидаз при ее участии отщепляются от по-
липептидов не аминокислоты, а дипептиды. Вы-
явлен механизм реабсорбции ди- и трипепти-
дов и обнаружено его качественное отличие от
всасывания аминокислот и глюкозы. Перенос
ди- и трипептидов через люминальную мемб-
рану осуществляется при участии ионов не Na+,
а Н+. В этой мембране имеется обменник, ко-
торый удаляет из клетки ион Н+ в обмен на
Na+, поступающий в цитоплазму из просвета
канальца. Благодаря этому создаются условия
для совместного переноса (котранспорта) с
помощью специфического мембранного пере-
носчика дипептида и Н+ по градиенту, связан-
ному с транспортом протона. Эта физиологи-
ческая система имеет важное значение для со-
хранения в организме малых пептидов. Установ-
лено, что аминоцефалоспорины, используемые
в антимикробной терапии, по физико-химичес-
ким показателям имеют ряд черт сходства с ди-
пептидами, благодаря чему эти антибиотики
реабсорбируются почечной системой транспор-
та пептидов.
Органические кислоты и основа-
ния. Выделение некоторых конечных продук-
тов обмена веществ и чужеродных веществ обес-
печивается, помимо фильтрации в клубочках,
с помощью процесса секреции, т.е. переноса
этих соединений клетками проксимального сег-
мента из межклеточной жидкости в просвет
нефрона. К веществам, секретируемым клетка-
ми этого канальца, относятся феноловый крас-
ный, парааминогиппурат (ПАГ), диодраст, пе-
нициллин, сульфаниламиды, салицилаты и др.
Этот процесс обусловлен функционированием
специальных систем транспорта [Ullrich К.,
1997].
Рассмотрим механизм секреции на примере
выделения ПАГ. После введения ПАГ в кровь
возрастает его концентрация в плазме, он
фильтруется в почечных клубочках, а оставший-
ся в крови ПАГ по эфферентной артериоле с
током крови поступает в околоканальцевые
капилляры. В мембране клетки, обращенной к
межклеточной жидкости, имеется переносчик,
обладающий высоким сродством к ПАГ. В при-
сутствии ПАГ образуется комплекс с перенос-
чиком, он перемещается в мембране; на внут-
ренней поверхности мембраны комплекс рас-
падается, освобождая ПАГ в цитоплазму, а
переносчик снова приобретает способность воз-
вращаться к внешней стороне мембраны и со-
единяться с новой молекулой ПАГ.
Секреция ПАГ возрастает пропорционально уве-
личению концентрации ПАГ в крови до тех пор,
пока все молекулы переносчика не насыщаются ПАГ.
В этот момент достигается максимальная скорость
транспорта ПАГ (Тт), т.е. количество ПАГ, секре-
тируемое почкой, способно насытить все молекулы
переносчика с образованием комплекса. Дальнейшее
увеличение концентрации ПАГ в крови уже не уве-
личивает секрецию ПАГ почкой. После распада внут-
ри клетки комплекса ПАГ с переносчиком молеку-
ла ПАГ движется по цитоплазме в сторону апикаль-
ной мембраны клетки, обращенной в просвет ка-
нальца. Концентрация ПАГ внутри клетки резко уве-
личивается, и его выделение в просвет канальца
через мембрану щеточной каемки происходит с уча-
стием системы, облегчающей движение ПАГ через
мембрану.
Получены доказательства адаптивной приро-
ды системы секреции органических веществ в
почечных канальцах. После введения в организм
избытка ряда органических кислот или основа-
ний наблюдалось постепенное увеличение ско-
рости их секреции. Это обусловлено синтезом
белковых веществ, являющихся необходимыми
компонентами системы секреторного транспор-
та. Очевидно клиническое значение такого фи-
зиологического механизма, обеспечивающего
более быструю экскрецию чужеродных веществ
из организма.
Наиболее интенсивно секреция ПАГ проис-
ходит в прямом отделе проксимального сегмен-
та нефрона. Оказалось, что активная секреция
ПАГ в этом канальце может приводить и к
секреции жидкости [Grantham J., 1976]. Поми-
мо ПАГ, секрецию жидкости стимулировали
некоторые производные ариловых кислот, а
также сыворотка крови больных уремией.
Высказывается гипотеза, что при уремии значи-
тельную роль в конечном объеме выделяемой мочи
играет не только жидкость, поступающая при филь-
трации в клубочках, но и образующаяся при секре-
ции в прямом отделе проксимального канальца. В со-
став этой изотоничной плазме крови жидкости вхо-
дят не только секретируемые органические кисло-
ты, концентрация которых достигает 40 ммоль •л1,
но и натрий, хлор и ряд других электролитов, про-
никающих через зону клеточных контактов. Накоп-
ление в крови при уремии производных ариловых
кислот позволяет объяснить такие особенности со-
стояния почки при ХПН, как рефрактерность к фу-
росемиду и уменьшение накопления ПАГ почечной
тканью под влиянием сыворотки крови, полученной
от больных уремией. Это обусловлено тем, что в
крови при уремии появляются органические кисло-
ты, которые могут конкурировать с ПАГ и фуросе-
мидом за переносчик в мембране почечной клетки.
Вследствие этого снижается возможность секреции
этих веществ, а также не создаются условия для ди-
уретического действия фуросемида.
Секреция оксалата наблюдается при различ-
ных функциональных состояниях почки. Введение
ПАГ прекращает секрецию оксалата. Скорость
реабсорбции оксалата в проксимальном каналь-
це значительно меньше, чем мочевой кислоты.
В клетках проксимального сегмента нефрона
наряду с системой секреции органических кис-
лот функционирует и система секреции органи-
ческих оснований (например, холина, толазоли-
на и др.). Обе системы обеспечивают независи-
мый транспорт из крови в просвет канальца
органических кислот и оснований (табл. 2.2). При
угнетении секреции органических кислот после
введения пробенецида секреция оснований не
уменьшается. Секреция органических оснований
характеризуется кинетикой насыщения и имеет
определенную величину Тт.
Выделение с мочой кислот и оснований во
многом зависит от pH внутриканальцевой жид-
кости. При сдвиге pH среды в кислую сторону
равновесие между ионизированными и неиони-
зированными формами кислот смещается к об-
разованию неионизированных веществ, для
которых более проницаемы клеточные мембра-
ны. Благодаря этому из кислой мочи быстрее
всасываются слабые кислоты, а слабые осно-
вания экскретируются в таких условиях с боль-
шой скоростью. У оснований степень иониза-
ции уменьшается в щелочной среде, в которой
хорошо диссоциируют слабые кислоты; напри-
мер, никотин, являющийся слабым основани-
ем, в 3—4 раза быстрее выделяется с кислой
Таблица 2.2. Органические вещества, секретиру- емые клетками проксимального нефрона
Вещества эндогенного происхождения Вещества, введенные в организм
Органическ Желчные кислоты Мочевая кислота Щавелевая кислота цАМФ ие кислоты Диодраст Индометацин Парааминогиппуровая кислота Пенициллин Салициловая кислота Фенолсульфофталеин Фуросемид Этакриновая кислота
Органические основания
Адреналин Амилорид
Ацетилхолин Атропин
Гистамин Морфин
Серотонин Неостигмин
Тиамин Прокаин Хинин
45
мочой при pH 5,0, чем при нейтральном зна-
чении pH около 7,3. Этот процесс зависимости
реабсорбции кислот и оснований от pH каналь-
цевой жидкости получил название «неионной
диффузии». Он оказывает значительное влияние
на скорость выделения почкой аммония, бар-
битуратов, ацетазоламида и др. Очевидно, что
при необходимости ускорить выделение неко-
торых лекарственных веществ почкой можно
повлиять на этот процесс, сдвинув pH мочи в
кислую или щелочную сторону.
2.7. Выделение конечных
продуктов азотистого обмена
Мочевая кислота является одним из наи-
более важных конечных продуктов азотистого
обмена у человека. В норме ее концентрация в
сыворотке крови у мужчин составляет 0,27—
0,48 ммоль-л1, у женщин 0,18—0,38 ммоль • л-1;
суточная экскреция с мочой колеблется от 2,3
до 4,5 ммоль (400—750 мг). У человека экскре-
тируется мочевая кислота, у многих млекопи-
тающих имеется фермент уриказа, которая
окисляет мочевую кислоту до аллантоина. В теле
здорового человека в сутки образование и вы-
деление мочевой кислоты составляет от 500 до
700 мг. Большая часть мочевой кислоты (до
80 %) образуется в результате метаболизма эн-
догенных нуклеиновых кислот, лишь около 20 %
связано с пуринами, поступающими с пищей.
Почки за сутки экскретируют около 500 мг мо-
чевой кислоты, 200 мг удаляются через желу-
дочно-кишечный тракт.
Мочевая кислота свободно фильтруется в
клубочках почки у человека; в почечных каналь-
цах она подвергается как реабсорбции, так и
секреции. В нормальных условиях до 98 % про-
фильтровавшейся мочевой кислоты реабсорби-
руется.
Изучены механизмы канальцевого транспор-
та мочевой кислоты и способы регуляции это-
го процесса. При реабсорбции эта кислота пе-
реносится через мембрану щеточной каемки и
базолатеральную мембрану клетки проксималь-
ного канальца. Не исключена возможность вса-
сывания части мочевой кислоты через зону кле-
точных контактов. Секреция уратов из крови в
просвет проксимального канальца зависит от
наличия в базальной плазматической мембра-
не анионообменного механизма, обеспечиваю-
щего поступление мочевой кислоты в клетку и
ее последующее выведение через мембрану
щеточной каемки в просвет канальца [Kahn А.,
Weinman Е., 1985].
Увеличение клиренса и экскреции мочевой
кислоты наблюдается при увеличении диуреза,
вызванном введением воды, маннитола, физи-
46
ологического раствора. Одной из причин ури-
козурии является увеличение объема внеклеточ-
ной жидкости и снижение проксимальной ре-
абсорбции; уменьшение экскреции мочевой
кислоты описано при усилении реабсорбции
натрия в проксимальном канальце, например
при застойной сердечной недостаточности. Вве-
дение малых доз салицилатов и фенилбутазона
сопровождается снижением экскреции уратов
почкой и развитием гиперурикемии, в больших
дозах оба эти вещества вызывают урикозурию.
Объяснить этот парадоксальный эффект мож-
но тем, что система секреции высокочувстви-
тельна к действию этих веществ и они блоки-
руют ее уже в малых дозах, выделение уратов
снижается; при введении больших количеств
препаратов ингибируется система реабсорбции
мочевой кислоты и наблюдается урикозуричес-
кий эффект. Реабсорбция и секреция мочевой
кислоты угнетаются пробенецидом, секреция —
пиразиноевой кислотой.
Мочевая кислота имеет рКа 5,75, т.е. при pH
мочи ниже этой величины ее растворимость
очень мала, она становится недиссоциирован-
ной. Так как pH мочи в ее конечных отделах
может снижаться до величин, равных 4,4, то
это будет способствовать образованию малора-
створимых форм мочевой кислоты. Образованию
ее кристаллов благоприятствует также всасыва-
ние больших количеств воды в почечных ка-
нальцах и гиперурикемия, способствующая уве-
личению концентрации мочевой кислоты в
моче. Однако в почечных канальцах у здоровых
людей создаются условия, при которых не про-
исходит образования почечных камней. Меха-
низм этого явления неясен.
Циркадный ритм экскреции мочевой кисло-
ты напоминает ритм выделения натрия — в
ночные часы выведение мочевой кислоты по-
чти в 2 раза меньше, чем утром в период с 7
до 10 ч.
При анализе причин повышенной концент-
рации мочевой кислоты в крови (гиперурике-
мия) необходимо проанализировать следующие
возможности: 1) увеличение скорости синтеза
мочевой кислоты, 2) уменьшение клубочковой
фильтрации, 3) увеличение канальцевой реаб-
сорбции, 4) снижение канальцевой секреции.
Следует учитывать, что некоторые фармаколо-
гические средства могут влиять на транспорт
мочевой кислоты в почечных канальцах. Так,
пиразинамид быстро уменьшает экскрецию
мочевой кислоты и вызывает гиперурикемию.
Креатинин. В сыворотке крови у здоровых
мужчин концентрация креатинина составляет
0,6—1,2 мг-100 мл'1 (0,053—0,106 ммоль-л1),
у женщин — 0,5—1,1 мгф 100 мл1 (0,044—0,097
ммоль-л-1). Суточная экскреция креатинина
почками у мужчины (70 кг) составляет 0,98—
1,82 г (8,7—16,1 ммоль), у женщин на 20—25 %
меньше. Креатинин образуется из креатинфос-
фата, являющегося важнейшим компонентом
мышечных клеток. После отщепления фосфата
от креатинфосфорной кислоты образуется кре-
атин, потеря молекулы воды приводит к появ-
лению креатинина.
Количество креатинина, ежедневно образующе-
гося в организме человека, является довольно
постоянной величиной, которая зависит от мы-
шечной массы тела. Поэтому содержание креа-
тинина в крови и его выделение почками опреде-
ляются полом, возрастом, развитием мышечной
массы, интенсивностью обмена. В меньшей сте-
пени оно зависит от рациона, определенную роль
играет содержание мяса в пище.
Креатинин полностью фильтруется в почеч-
ных клубочках. Небольшие его количества сек-
ретируются клетками проксимального каналь-
ца, в некоторых случаях эта величина достига-
ет 28 % по отношению к количеству креати-
нина, поступившего в просвет нефрона при
фильтрации [Smith Н., 1951]. В эксперименте
показано, что секреция креатинина угнетается
при введении гиппурана, диодраста, пробене-
цида. Система секреции креатинина подчине-
на гормональному контролю. При введении
человеку кортизона клиренс креатинина сни-
жается до величины одновременно измеренного
клиренса инулина, что свидетельствует об уг-
нетении секреции креатинина. При низкой ско-
рости мочеотделения (меньше 0,5 мл • мин1)
значительные количества креатинина могут
реабсорбироваться.
Однако следует признать, что в обычной
клинической практике измерение клиренса
эндогенного креатинина служит довольно точ-
ным отражением величины клубочковой филь-
трации. Суточное образование креатинина в
организме меняется мало, поэтому при пора-
жении клубочков уменьшается объем фильтру-
емой жидкости и нарастает концентрация кре-
атинина в плазме крови. В клинической прак-
тике изменение концентрации креатинина в
крови позволяет судить о состоянии процесса
гломерулярной фильтрации в почке.
Мочевина является у человека важней-
шим конечным продуктом азотистого метабо-
лизма. В обычных условиях потребление белка
в сутки составляет около 100 г, в нем содер-
жится до 16 г азота. Почти 90 % азота выделя-
ется с мочой в виде мочевины, что составляет
0,43—0,71 моль мочевины в сутки.
Экскретируемая мочевина необходима для
процесса осмотического концентрирования
мочи. В почечных клубочках мочевина свобод-
но фильтруется и поступает в просвет каналь-
ца в той же концентрации, что и в воде плаз-
мы крови (15—38,5 мг- 100 мл1, или 2,5—6,4
ммоль-л1). Стенка проксимального сегмента
нефрона проницаема для мочевины, и к кон-
цу этого отдела реабсорбируется около полови-
ны профильтровавшейся мочевины. К началу
дистального извитого канальца в жидкости
просвета нефрона количество мочевины превы-
шает поступившее с ультрафильтратом. Это
означает, что в каких-то участках петли Генле
из околоканальцевой жидкости она через стен-
ку нефрона вновь поступает в его просвет. Спе-
циальными исследованиями было показано, что
это не обусловлено активной секрецией моче-
вины, а зависит от ее движения по концент-
рационному градиенту из межклеточного веще-
ства, где высоко содержание мочевины, в ка-
нальцевую жидкость с меньшей ее концентра-
цией. Стенка дистального канальца и началь-
ных отделов собирательных трубок слабопрони-
цаема для мочевины. Собирательные трубки
мозгового вещества почки при водном диурезе
реабсорбируют мало мочевины, но в присут-
ствии вазопрессина проницаемость их стенки
для мочевины резко возрастает, она всасыва-
ется в мозговое вещество почки, а ее экскре-
ция уменьшается. Эти данные позволяют адек-
ватно объяснить известный в клинике факт, что
очищение от мочевины при диурезе меньше
2 мл • мин1 низкое, но быстро возрастает и
приобретает стандартное значение, если во
время водного диуреза (т.е. при малой концен-
трации или отсутствии в крови вазопрессина)
мочеотделение становится выше 2—3 мл • мин1.
Данные об увеличении проницаемости со-
бирательных трубок мозгового вещества почки
для мочевины при воздействии вазопрессина
дают возможность понять причину увеличения
содержания мочевины в дистальном канальце
и само явление рециркуляции мочевины. В со-
бирательных трубках коры почки всасывание
воды через канальцевую стенку, непроницае-
мую для мочевины, приводит к повышению ее
концентрации в канальцевой жидкости. Когда
под влиянием вазопрессина возрастает прони-
цаемость стенки собирательной трубки для
мочевины, она начинает всасываться по кон-
центрационному градиенту в мозговое веще-
ство, где увеличивается ее содержание. Из вне-
клеточной жидкости мочевина проникает в
просвет тонкого нисходящего отдела петли
Генле и, возможно, тонкого восходящего от-
дела петли Генле юкстамедуллярных нефронов,
что приводит к появлению в дистальных ка-
нальцах больших количеств мочевины. Благодаря
этому функционирует система кругооборота,
рециркуляции мочевины, которая в значитель-
ной степени определяет степень осмотическо-
го концентрирования мочи и уровень экскре-
ции мочевины почкой.
47
2.8. Элементы интеграции
деятельности почки
Отдельные процессы, обеспечивающие образо-
вание мочи, следует рассматривать лишь как
фрагменты мозаичного панно деятельности
почки. Для клинической оценки функциональ-
ного состояния почки наибольшее значение
имеет понимание степени дезинтеграции про-
цессов, лежащих в основе мочеобразования и
в норме тесно взаимосвязанных. Именно ана-
лиз степени и формы нарушения состояния
почки составляет одну из наиболее трудных
задач. Это связано с хорошо развитыми компен-
саторными возможностями почки, множествен-
ностью перекрывающих друг друга регулятор-
ных воздействий и разнообразием молекуляр-
ных систем реабсорбции и секреции веществ.
Эффективность деятельности почки определя-
ется интеграцией работы клубочков, канальцев,
интерстиция и сосудистой системы. Важнейшее
значение в выполнении почкой ее гомеостати-
ческой функции имеют взаимодействие различ-
ных отделов нефронов друг с другом, компен-
сация дистальными частями канальцев функции
их более проксимальных канальцев, роль ЮГА
в координации функции гломерулярного аппа-
рата и тубулярной части нефрона. Ведущую роль
в координации функции почки и других сис-
тем организма, в обеспечении почкой ее цен-
тральной роли в поддержании константных
значений внутренней среды организма имеют
многочисленные гормоны и эфферентные не-
рвы, адаптирующие работу клеток разных час-
тей нефрона и собирательных трубок. В нормаль-
ных условиях, особенно при патологических
состояниях и использовании фармакологичес-
ких средств, для коррекции функции почки
большое значение приобретает действие на
клетку веществ, находящихся в просвете ка-
нальцев. В процессе мочеобразования ряд орга-
нических соединений (в том числе и лекар-
ственных препаратов) проникает в просвет
нефрона не только при ультрафильтрации, но
и секреции, а вследствие всасывания воды кон-
центрация нереабсорбируемых веществ может
возрастать в 100 раз и более по сравнению с
плазмой крови. Это может служить важным
фактором воздействия на клетки с внешней
поверхности люминальной мембраны, где име-
ются ионные каналы, химические рецепторы
для ряда веществ.
Процесс интеграции разных клеточных фун-
кций не может быть глубоко проанализирован
без учета роли внутриклеточных мессенджеров
(цАМФ, цГМФ, ИФз, диацилглицерин, ионы
Са2+), действия на клетки модуляторов гормо-
нальных эффектов, вырабатываемых в почке
(простагландины). Выше речь шла и о значении
ионов Na+ в транспорте многих веществ при
участии механизма вторично активного транс-
порта.
Сказанное позволяет наметить лишь конту-
ры системы, обеспечивающей целостную кар-
тину функций почки. В условиях патологии каж-
дый из перечисленных (и многих иных) эле-
ментов может быть угнетен или усилен, обес-
печивая стабильность работы почки как орга-
на. Приведенные в этой главе основные пред-
ставления о функции почки призваны помочь
в оценке степени и места дезинтеграции рабо-
ты почки и компенсации нарушенных функций.
Литература
Наточин Ю.В. Почка: Справочник врача. — СПб.:
Изд-во С.-Петербургского ун-та, 1997.
Физиология почки и водно-солевого обмена/Под ред.
Ю.В.Наточина. — СПб.: Наука, 1993.
Шейман Д.А. Патофизиология почки: Пер. с англ. —
М.: Восточная книжная компания, 1997.
Koushanpour Е., Kriz W. Renal Physiology. — NY:
Springer, 1986.
Schuck О. (Шюк О.). Функциональное исследование
почек. — Прага: Авиценнум, 1975.
The Kidney, physiology and pathophysiology/Seldin
D.W., Giebisch G. (Eds). - NY: Raven Press, 1988.
Vander A. J. Renal Physiology. — NY: McGraw-Hill, 1995.
Гпава 3
ПОЧКИ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ
ОБМЕН
И. М. Кут ырина
Роль почек в организме не ограничивается
только экскрецией конечных продуктов белко-
вого обмена и чужеродных веществ. Крайне
важной является функция почек, обеспечива-
ющая сохранение постоянства объема циркули-
рующей крови и внеклеточной жидкости, под-
держание гомеостаза натрия, калия и других
электролитов. Настоящая глава посвящена роли
почек в регуляции баланса двух важнейших
электролитов — натрия и калия.
3.1. Почечная регуляция объема
жидкости и баланса натрия
В организме человека вода составляет от 45 до
75 % массы тела. Она распределена в двух важ-
нейших водных пространствах — внутриклеточ-
ном и внеклеточном, которые отделены друг от
друга клеточной мембраной. На долю внутри-
клеточной жидкости приходится около 60 %
всего количества воды в организме. Внеклеточ-
ная жидкость распределена в плазме, интерсти-
ции (интерстициальная жидкость и лимфа),
костно-хрящевой ткани и представлена транс-
целлюлярной жидкостью (моча, жидкость же-
лудочно-кишечная, цереброспинальная и
т.д.).Трансцеллюлярная жидкость по объему
составляет примерно половину всего количества
внеклеточной жидкости [Клар С., 1987].
Основным катионом внеклеточной жидкости
является натрий, основными анионами — хлор и
бикарбонаты. Основной катион внутриклеточ-
ной жидкости — калий, основные анионы — не-
органические и органические фосфаты и белки.
В норме концентрация натрия в плазме и
интерстициальной жидкости составляет от 136
до 145 ммоль/л. Увеличение концентрации на-
трия в крови более 145 ммоль/л называется ги-
пернатриемией, при этом концентрация элект-
ролита в крови, близкая 160 ммоль/л, рассмат-
ривается как ургентная. Снижение концентра-
ции натрия в крови менее 135 ммоль/л назы-
вается гипонатриемией, а снижение концентра-
ции натрия ниже 115 ммоль/л представляет
угрозу для жизни.
Во внутриклеточной жидкости содержание
натрия составляет лишь ‘/10 его содержания во
внеклеточной жидкости, концентрация хлори-
дов и бикарбонатов в ней низкая. Осмотическая
концентрация плазмы, жидкости интерстиция и
внутриклеточной жидкости не различается. Ме-
ханизмы регуляции объема внеклеточной жид-
кости и осмоляльности тесно связаны, и они
обеспечены прежде всего работой почек по под-
держанию гомеостаза натрия [Клар С., 1987;
Kokko J., Tanner R., 1990; Shayman J., 1997].
Транспорт натрия в нефроне. Процессы транс-
порта натрия через нефрон включают в себя
клубочковую фильтрацию и реабсорбцию в
канальцах. Около 70 % профильтровавшегося
натрия реабсорбируется в проксимальных ка-
нальцах. Реабсорбция осуществляется с помо-
щью механизмов как котранспорта, так и про-
тивотранспорта. Кроме того, большие количе-
ства натрия и воды реабсорбируются парацел-
люлярно, через проницаемые клеточные кон-
такты. Дальнейшая реабсорбция электролита
происходит в коленах петли Генле (петля не-
фрона), что играет важную роль в создании ос-
мотического градиента почечного интерстиция.
В дистальных канальцах происходит сочетанная
реабсорбция натрия и хлоридов. Энергию для
этого процесса обеспечивает Na, К-АТФаза
[Наточин Ю.В., 1982; Клар С., 1987; Cassock R.J.,
1987; Kokko J., Tannen R., 1990; Shayman J.,
1997].
4—2950
49
3.2. Почечная регуляция
баланса натрия
В норме почка регулирует баланс натрия очень
эффективно. У человека суточное потребление
соли практически равно ее экскреции с мочой.
Средний уровень потребления соли составляет
примерно 160—170 ммоль/сут, из них 165 ммоль
выводятся с мочой и приблизительно 5 ммоль
с калом. При резком увеличении потребления
соли экскреция ее с мочой возрастает. Однако
стабильное состояние устанавливается только
через 3—5 дней. В этот период выявляется по-
ложительный натриевый баланс, который ха-
рактеризуется увеличением объема внеклеточ-
ной жидкости, ее задержкой и увеличением
массы тела. В течение указанного срока в ответ
на увеличение объема внеклеточной жидкости
возрастает экскреция натрия и восстанавлива-
ется натриевый баланс. Когда потребление соли
резко уменьшается, наблюдается противопо-
ложный эффект: приблизительно за 3 дня сни-
жается экскреция натрия, достигая уровня,
равного введению; этот короткий период отри-
цательного натриевого баланса приводит к сни-
жению общего количества воды в организме и
соответственно массы тела [Reineck Н., Stein J.,
1980].
Как следует из представленных данных, в
физиологических условиях в ответ на увеличе-
ние объема внеклеточной жидкости развивает-
ся натрийурез, а при его снижении — задерж-
ка натрия. В условиях патологии связь между
объемом внеклеточной жидкости и экскреци-
ей почками натрия нарушается, что клиничес-
ки проявляется развитием отеков или состоя-
ния дегидратации.
Механизмы, посредством которых почки
регулируют постоянное содержание натрия, а
следовательно, и воды в организме, сложны и
многогранны. Учитывая транспорт натрия в
нефроне, выделение его с мочой определяют
по разнице между величиной профильтровав-
шегося в клубочках натрия и величиной его
реабсорбции:
En = F, - RN ,
Na Na Na’
где ENa — экскреция натрия с мочой; FNa —
количество профильтровавшегося натрия, рав-
ное PNa • СКФ (PNa — концентрация натрия в
крови, СКФ — скорость клубочковой фильтра-
ции); RNa — реабсорбция натрия.
Поскольку концентрация натрия в крови,
как правило, величина мало меняющаяся, ре-
гуляцию почечной экскреции натрия рассмат-
ривают с позиций регуляции скорости клубоч-
ковой фильтрации и регуляции реабсорбции
электролита.
50
Скорость клубочковой фильтрации (СКФ).
СКФ принято определять как первый фактор
контроля экскреции натрия.
С помощью расчетных методов было пока-
зано, что при условии неизменной канальце-
вой реабсорбции электролита увеличение СКФ
на 1 % приведет к двукратному возрастанию
экскреции натрия, а снижение СКФ на 1 %
будет сопровождаться практически полной ре-
абсорбцией электролита из мочи [Reineck Н.,
Stein J., 1983], т.е. представленные данные те-
оретических расчетов свидетельствуют о том,
что даже минимальные колебания СКФ могут
значительно изменять экскрецию натрия с
мочой. Вместе с тем, как следует из клиничес-
ких наблюдений и данных экспериментов, даже
значительные изменения фильтрационной фун-
кции почек (вплоть до состояния хронической
почечной недостаточности), как правило, не
нарушают баланса натрия в организме.
Постоянство водно-электролитного обмена
при выраженных изменениях СКФ можно
объяснить двумя факторами. Во-первых, нали-
чием феномена клубочково-канальцевого ба-
ланса. Суть его заключается в том, что измене-
ние СКФ всегда сопровождается однонаправ-
ленным изменением величины реабсорбции
натрия, т.е. существует тесная прямая связь
между СКФ и реабсорбцией электролита. Точ-
ный механизм феномена клубочково-канальце-
вого баланса пока не установлен. Однако изве-
стно, что он наблюдается во всех сегментах по-
чечного нефрона, но более всего в проксималь-
ных канальцах и в петле Генле [Клар С., 1987;
Kokko J., Tannen R., 1990].
Во-вторых, при длительном и хроническом
снижении СКФ баланс натрия в организме
контролируется в основном за счет первичных,
не связанных с функционированием феноме-
на клубочково-канальцевого баланса, измене-
ний в канальцевой реабсорбции электролита
[Reineck Н., Stein J., 1983; Shayman J., 1997].
Сниженная клубочковая фильтрация как
определяющий фактор водно-электролитных
нарушений выявляется относительно нечасто —
при остром нефритическом синдроме, в оли-
гурическую стадию острой почечной недоста-
точности, в фазе нарастания отеков при нефро-
тическом синдроме; может наблюдаться при
острых расстройствах кровообращения (острая
сердечная недостаточность, кардиогенный
шок), после острой кровопотери.
Мы наблюдали развитие водно-электролитных
расстройств в связи со снижением СКФ у 35 боль-
ных ХГН нефротического типа в фазе нарастания
отеков [Кутырина И. М. и др., 1988]. У больных в этой
фазе заболевания наблюдалась резкая задержка на-
трия в организме (суточная экскреция натрия состав-
ляла 29,3±2,1 ммоль/сут при суточном потреблении
натрия 80—120 ммоль), нарастал отечный синдром
(масса тела больных за 7—10-дневный период уве-
личилась на 4,8±1,1 кг). СКФ в этот период состав-
ляла 42±6 мл/мин, при этом имела место прямая
корреляционная связь между СКФ и экскрецией
натрия с мочой (г = 0,49, р<0,05). В фазе стабили-
зации отечного синдрома, когда у больных восста-
навливался натриевый баланс, но отечный синдром
сохранялся, СКФ была значительно выше (78±5 мл/
мин), а корреляционная зависимость между СКФ и
экскрецией натрия полностью исчезала.
Полученные данные свидетельствуют о том,
что ретенцию натрия у данных больных обус-
ловливало поражение фильтрационной функ-
ции почек. E.Dorhout Mees (1984) и H.Koomans
(1987) констатируют, что значения СКФ в
период ретенции натрия всегда ниже, чем в
период ремиссии нефротического синдрома, а
начало натрийуреза совпадает с возрастанием
СКФ.
М.Shapiro и соавт. (1986) при сравнении двух
групп больных с нефротическим синдромом, не
отличавшихся по активности ренин-ангиотензин-
альдостероновой системы (РААС) и показателям
системной гемодинамики, но имеющих значитель-
ные различия СКФ, отмечали, что при водной на-
грузке натрий задерживался у больных с низкой
величиной клубочковой фильтрации. При погруже-
нии исследуемых больных в сидячую ванну разви-
тие натрийуреза совпадало с возрастанием СКФ.
Связь между увеличением натрийуреза и возраста-
нием СКФ оказалась очень тесной и высокозначи-
мой.
Таким образом, представленные данные
подтверждают, что СКФ является важным фак-
тором регуляции баланса натрия в организме.
Вместе с тем существование феномена клубоч-
ково-канальцевого баланса и широкая возмож-
ность изменений в экскреции натрия при воз-
действии на уровень канальцевой реабсорбции
электролита свидетельствуют о том, что основ-
ным фактором регуляции экскреции натрия яв-
ляется уровень его канальцевой реабсорбции.
Регуляция канальцевой реабсорбции натрия.
Канальцевую реабсорбцию натрия контролиру-
ют альдостерон, предсердный натрийуретичес-
кий атриопептид, физические факторы, дей-
ствующие в области проксимального канальца,
перераспределение внутрипочечного кровотока,
катехоламины, калликреин-кининовая система,
простагландины.
Наибольшее значение из них имеет гормон
коры надпочечников альдостерон, который ха-
рактеризуется как второй фактор контроля эк-
скреции натрия.
Основными физиологическими эффектами
альдостерона являются:
• регуляция объема внеклеточной жидкости;
• регуляция гомеостаза калия.
Объем внеклеточной жидкости регулирует-
ся альдостероном опосредованно через влияние
его на транспорт натрия. Доказано, что основ-
ными местами действия альдостерона являют-
ся корковый отдел собирательных трубок и
отдельные сегменты дистального отдела нефро-
на, где посредством сложных внутриклеточных
преобразований альдостерон усиливает реабсор-
бцию натрия и увеличивает секрецию калия в
просвет почечного канальца. Соотношение кон-
центраций натрия и калия в моче (-!^М, связь
клиренса натрия с концентрацией альдостеро-
на в крови и коэффициент ——^-являются на-
дежными показателями участия альдостерона в
регуляции экскреции натрия и калия с мочой
[Рябов С.И., Наточин Ю.В., 1997; Hene R. et
al., 1984]. Внепочечные эффекты альдостерона
не оказывают существенного воздействия на
баланс натрия в организме.
Эффективность альдостеронового механизма
регуляции объема внеклеточной жидкости и
почечной экскреции натрия чрезвычайно вы-
сока. Представлены теоретические расчеты, сви-
детельствующие о том, что в условиях макси-
мальной секреции альдостерона экскреция на-
трия с мочой может снижаться до нулевых зна-
чений. Вместе с тем при отсутствии гормона она
составит 2 % всего профильтровавшегося ко-
личества натрия, что при условии нормальных
значений СКФ и концентрации натрия в кро-
ви может достигать 500 ммоль/сут, т.е. почти
30 г хлорида натрия [Клар С., 1987].
Клинические наблюдения также подтверж-
дают важную роль альдостерона в регуляции
натриевого гомеостаза. Так, у больных с над-
почечниковой недостаточностью выявляется
выраженный натрийурез; у пациентов с низким
объемом внеклеточной жидкости отмечается
активная стимуляция секреции альдостерона, а
при гиперволемии секреция альдостерона, на-
оборот, снижается [Уильямс Г., 1987].
Мы исследовали роль альдостерона в механизмах
ретенции натрия у 106 больных ХГН с отечным син-
дромом (70 больных с нефротическим нефритом и
36 — со смешанным нефритом). У всех больных оп-
ределяли активность гормональной системы ренин —
ангиотензин — альдостерон, показатели транспорта
натрия в нефроне и изучали корреляционную зави-
симость между ними. Дополнительно у 74 из обсле-
дованных были проведены исследования в период их
лечения гепарином, который является фармаколо-
гическим блокатором синтеза альдостерона, действу-
ющим на фермент синтеза гормона — 18-гидроок-
сидегидрогеназу, тем самым препятствуя превраще-
нию кортикостерона в 18-оксикортикостерон и аль-
достерон [Bailey R., Ford Н., 1969; O’Kelly et al.,
1983].
4*
51
У всех обследованных больных до назначения
лечения был выявлен гиперальдостеронизм (концен-
трация альдостерона 221± 18 пг/мл у больных нефро-
тическим нефритом и 162,2±15,9 пг/мл у больных
смешанным нефритом против нормальных значений
123±11,2 пг/мл).
Существование патогенетической зависимости ги-
перальдостеронемии и ретенции натрия в наших ис-
следованиях подтверждалось выявлением устойчивой,
достоверно отрицательной, хотя и несильной корре-
ляционной связи между концентрацией альдостеро-
на в крови и экскрецией натрия с мочой (г = —0,41,
р<0,05).
В период применения гепарина блокада синтеза
альдостерона подтверждалась снижением концентра-
ции альдостерона в крови до 20 % от исходного
уровня. Одновременно со снижением концентрации
альдостерона в крови отмечены возрастание экскре-
ции натрия с мочой (в 2,5 раза), снижение до нор-
мальных значений его концентрации в крови и уве-
личение диуреза (в 2 раза). Путем анализа показате-
лей транспорта натрия в нефроне было установле-
но, что увеличение экскреции электролита с мочой
в период лечения гепарином явилось следствием
снижения его реабсорбции в канальцах, о чем сви-
детельствует увеличение экскретируемой фракции
натрия с 0,32±0,05 до 0,72±0,10 % у больных с не-
фротическим нефритом и с 0,62±0,09 до 1,07±0,19 %
у больных смешанным нефритом.
В период блокады синтеза альдостерона отмече-
но исчезновение связи между концентрацией альдо-
стерона в крови и экскрецией натрия с мочой и
появление связи между изменением концентрации
альдостерона (4АП) и приростом минутного диуреза
(г = —0,47, р<0,01). Динамика корреляционных свя-
зей подтверждала прекращение регуляции транспорта
натрия альдостероном при нефротическом синдро-
ме.
Таким образом, клинические эффекты гепа-
рина, снижение реабсорбции натрия в каналь-
цах и характер изменения корреляционных свя-
зей (ДАП — экскреция натрия и ДАП — Д —
диурез) при лечении гепарином убедительно
свидетельствуют о важной роли альдостерона в
ретенции натрия и воды при нефротическом
синдроме.
Вместе с тем в клинической практике име-
ется и ряд ситуаций, свидетельствующих о том,
что альдостерон, несмотря на несомненное
участие в регуляции экскреции натрия, не яв-
ляется единственным регулятором его экскре-
ции. В числе доказательств этого положения
приводятся следующие факты.
Во-первых, при надпочечниковой недоста-
точности больные поддерживают баланс на-
трия, получая постоянную невысокую дозу ми-
нералокортикоидов и кортизона, даже несмотря
на отсутствие возможности изменить секрецию
этих гормонов. Равным образом при полном
отсутствии альдостерона, что наблюдается у
больных, кора надпочечников которых разру-
шена, умеренное увеличение содержания на-
52
трия в диете достаточно для того, чтобы ком-
пенсировать потери натрия с мочой, характер-
ные для этого синдрома. Эти данные указыва-
ют, во-первых, на то, что при хронических
заболеваниях выведение натрия почками, ожи-
даемое в результате полного отсутствия альдо-
стерона, компенсируется, по крайней мере
частично, другими механизмами.
Во-вторых, для развития натрийзадержива-
ющего эффекта альдостерона требуется от 30 до
60 мин, что связано с внутрипочечными меха-
низмами действия гормона. Вместе с тем уста-
новлено, что изменения в экскреции натрия
выявляются сразу же в ответ на воздействие
стимулов, приводящих к изменениям натрие-
вого баланса.
И, наконец, в-третьих, при длительном вве-
дении минералокортикоидов задержка натрия
в организме отмечается лишь в первые несколь-
ко дней введения этих препаратов. В последую-
щем, несмотря на продолжающееся введение
минералокортикоидов, спонтанно развиваются
натрийурез и диурез, и баланс натрия восста-
навливается. Приведенный факт известен как
феномен «ускользания от действия альдостеро-
на». Полагают, что он вызывается иными фак-
торами, чем СКФ или альдостерон [Kelly Т.,
Nelson D., 1987].
Таким образом, установлено, что в регуля-
ции экскреции натрия, помимо СКФ и альдо-
стерона — первого и второго факторов регуля-
ции экскреции натрия, играют роль и другие
факторы, объединенные вместе как «третий
фактор» экскреции натрия.
В их число включены факторы гормональные
(натрийуретический атриопептид, катехолами-
ны, почечные простагландины и кинины);
физические, действующие через стенку почеч-
ных канальцев (гидростатическое давление и
онкотическое давление в почечных капилля-
рах), и гемодинамические (усиление медулляр-
ного почечного кровотока, перераспределение
внутрипочечного кровотока).
Предсердный натрийуретический атриопептид
(ПНА). Впервые мнение о существовании в
организме фактора, контролирующего экскре-
цию натрия и отличающегося от клубочковой
фильтрации и альдостерона, было высказано
Н. de Wardener (1977). В настоящее время на-
трийуретический атриопептид выделен в чис-
том виде. Идентифицирована химическая струк-
тура гормона. Доказано, что он представляет
собой полипептид и может существовать в че-
тырех видах, имея в своей структуре от 21 до
35 аминокислот [Inagami Т. et al., 1985].
Осуществлен его химический синтез. Установ-
лено, что он синтезируется в организме пред-
сердиями, в связи с чем получил название пред-
сердный натрийуретический атриопептид. Сти-
мулом для его секреции является растяжение
предсердий, при этом продукция ПНА правым
предсердием в 1,5—3 раза превышает его про-
дукцию левым предсердием [Cantin М. et al.,
1984]. В меньших количествах ПНА продуциру-
ется передней долей гипофиза, хромаффинны-
ми клетками надпочечников и собирательными
трубками почек [Inagami Т. et al., 1985].
В почках под влиянием ПНА резко возрас-
тает диурез, усиливается выделение натрия и
хлора с мочой, возрастает калийурез, снижа-
ется продукция ренина ЮГА [Burnett J. et al.,
1984; Cogan M., 1990].
Механизм натрийуретического действия гор-
мона сложен. Определяющим фактором в раз-
витии натрийуреза считают увеличение клубоч-
ковой фильтрации и фильтрационной фракции.
По данным С. Huang и соавт. (1985), СКФ под
влиянием натрийуретического гормона возрас-
тает на 30—50 % от исходного уровня, при этом
величина почечного кровотока практически не
изменяется.
Наряду с гемодинамическим механизмом в
натрийуретическом эффекте гормона обсужда-
ется прямое воздействие его на почечные ка-
нальцы со снижением реабсорбции натрия пре-
имущественно в области кортикального отдела
собирательных трубок [Inagami Т. et al., 1985;
Hoegler С. et al., 1989].
Одним из механизмов натрийуретического
действия ПНА является ингибиция продукции
альдостерона и ренина [Opgenorth J., Burnett J.,
1985; Kageyava S., Brown J., 1990].
Физические факторы, действующие в облас-
ти проксимального канальца. Транспорт натрия
из просвета проксимальных извитых канальцев
в околоканальцевые капилляры зависит от сил
Старлинга, действующих через капиллярную
стенку, т.е. от разницы между гидростатическим
и онкотическим давлением в просвете каналь-
ца и капиллярах, от скорости перитубулярно-
го капиллярного кровотока и от проницаемос-
ти канальцевой стенки.
Выявлено, что уменьшение онкотического
давления в околоканальцевых капиллярах и/или
увеличение гидростатического давления в них
сопровождаются снижением реабсорбции на-
трия и усилением натрийуреза. И наоборот, при
повышении онкотического давления в капил-
лярах реабсорбция натрия в проксимальном
отделе нефрона возрастает.
Низкое онкотическое давление в эфферент-
ной артериоле выявляется при гипопротеинеми-
ях, в том числе при нефротическом синдроме,
а также при состояниях с высоким объемом
внеклеточной жидкости, что объясняет сниже-
ние проксимальной реабсорбции натрия при них.
Увеличение онкотического давления за счет
перфузии околоканальцевых капилляров раство-
ром с высоким содержанием альбумина приво-
дит к нормализации реабсорбции натрия. Одна-
ко изменения проксимальной канальцевой ре-
абсорбции натрия часто нивелируются соответ-
ствующими изменениями реабсорбции электро-
лита в последующих сегментах нефрона в ответ
на влияние одновременно действующих других
факторов регуляции натрийуреза, так что в ко-
нечном итоге уровень экскреции натрия пред-
ставляется производным от суммы воздействий.
Роль перераспределения внутрипочечного кро-
вотока в механизмах регуляции экскреции на-
трия не решена и требует уточнения. Скорее
всего этот фактор оказывает несущественное
влияние на регуляцию водно-солевого баланса.
Катехоламины. Согласно данным морфологи-
ческих исследований, канальцы почек иннер-
вированы адренергическими волокнами. При
изменении адренергической активности не-
рвной системы выявляются изменения водно-
электролитного баланса, однако механизм их
развития окончательно не установлен.
Возможны 3 пути воздействия катехолами-
нов на почечную экскрецию натрия:
• влияние на силы Старлинга в периферичес-
ких капиллярах;
• изменение центрального объема крови и,
следовательно, перераспределение объемов
внеклеточной жидкости;
• изменение почечной гемодинамики.
Роль катехоламинов в регуляции экскреции
натрия уточняется.
Калликреин-кининовая система. Кинины от-
носят к классу тканевых или местных гормонов.
Калликреин-кининовая система представлена
системой ферментов (калликреинов) и гормо-
нов (кининов).
Кинины обладают выраженными натрийуре-
тическими и диуретическими свойствами. Од-
нако механизм их действия и роль в регуляции
экскреции натрия окончательно не установле-
ны.
Имеются данные, что введение кининов в
почечную артерию приводит к увеличению кро-
вотока, диуреза и натрийуреза без изменения
скорости клубочковой фильтрации [Stein J. et
al., 1972; Zeidel M. et al., 1990]. В этой связи
полагают, что натрийуретический эффект ки-
нинов может быть связан с сосудорасширяю-
щим эффектом препарата, перераспределени-
ем внутрипочечного кровотока и изменением
осмотического градиента в мозговом слое по-
чек.
Имеются данные и о прямом влиянии ки-
нинов на транспорт натрия в дистальных отде-
лах нефрона и в проксимальных канальцах
юкстамедуллярных нефронов [Карретеро О.А.,
Сцикли А.Г., 1987]. Однако эффекты экзоген-
53
ных кининов и кининов, локально образован-
ных в почках, не могут рассматриваться как
однозначные, так как имеется разница в их
концентрации: концентрация экзогенных гор-
монов более чем в 50 раз превышает концент-
рацию эндогенных кининов.
Роль локально-почечных кининов в регуля-
ции экскреции натрия и воды изучалась с по-
мощью внутрипочечно введенных фармаколо-
гических ингибиторов кининазы II, что способ-
ствовало накоплению кининов в просвете не-
фрона за счет торможения их разрушения. После
введения препарата отмечено возрастание кро-
вотока в юкстамедуллярных нефронах, а также
увеличение экскретируемой фракции натрия и
диуреза. И напротив, при внутрипочечном вве-
дении апротинина — ингибитора калликреина
и других протеаз — выявлено снижение крово-
тока в почках, диуреза и натрийуреза.
Таким образом, приведенные выше данные
свидетельствуют об участии калликреин-кини-
новой системы в регуляции транспорта воды и
электролитов.
Простагландины. Простагландины, как и
кинины, также относят к классу тканевых, или
местных, гормонов. Простагландины в организ-
ме синтезируются из полиненасыщенных жир-
ных кислот посредством специальной фермен-
тной системы (простагландин-синтетазы), фик-
сированной в микросомальных мембранах. Об-
щим субстратом для образования простаглан-
динов является арахидоновая кислота.
Различают простагландины классов ПГЕ2,
ПГП2, ПГФ2а, ПГИ2 (простациклин) и ТкА2
(тромбоксан).
В ткани почек имеются основные ферменты,
способствующие синтезу всех классов простаг-
ландинов и их метаболизму. Основным местом
синтеза почечных простагландинов является
мозговое вещество почек. По данным A.Hassid,
M.Dimn (1980), простагландинсинтетическая
активность мозгового вещества почек в 5—20
раз превышает таковую в почечной коре. Ис-
точником синтеза простагландинов в мозговом
веществе почек являются интерстициальные
клетки и эпителий собирательных трубок, в коре
почек — почечные сосуды и клубочки [Terragno
N. et al., 1978; Folkert V., Schlondoiff D., 1979].
Синтезированные в почках простагландины
быстро инактивируются. Период их «полужиз-
ни» составляет около 25 с. Основной путь инак-
тивации почечных простагландинов — их ме-
таболизм, который осуществляется в коре по-
чек посредством ферментных реакций. Часть по-
чечных простагландинов метаболизму не под-
вергается и либо выделяется в мочу в неизме-
ненном виде, либо попадает в почечную вену
и затем метаболизируется в легких [Dunn М.,
Hood V., 1977; Дани М. Дж., 1987]. Исключе-
54
ние составляют ПГИ2, которые не разрушают-
ся в легких и могут действовать как циркули-
рующие гормоны [Ferris Т., 1983].
Выраженным натрийуретическим действием
обладают почечные ПГЕ, натрийуретический
эффект ПГИ2 и ПГФ2я незначителен.
Увеличение с мочой экскреции натрия опос-
редуется через сосудорасширяющий эффект
простагландинов и через прямое влияние гор-
монов на транспорт натрия в области толстого
восходящего колена петли Генле и собиратель-
ных трубок. Простагландины усиливают экск-
рецию натрия также за счет увеличения кро-
вообращения в юкстамедуллярных нефронах и
последующего «вымывания» его из почечного
интерстиция [Higashihara Е. et al., 1979].
Почечные простагландины, особенно ПГЕ2,
играют важную роль в регуляции реабсорбции
воды в почках. Тесная связь гормонов с мета-
болизмом воды во многом обусловлена местом
синтеза почечных простагландинов — мозговым
веществом почек и собирательными трубками,
т.е. почечными структурами, тесно связанными
с действием АДГ, обеспечивающим регуляцию
экскреции почками воды. Доказано, что почеч-
ные простагландины препятствуют действию
вазопрессина на реабсорцию воды. Диуретичес-
кий эффект их опосредуется через аденилатцик-
лазу, которая осуществляет взаимодействие
почечных простагландинов и АДГ [Gross Р. et
al., 1981; Dunn М., 1984]. Почечные простаг-
ландины снижают осмолярность мозгового ве-
щества почки, что также способствует разви-
тию диуретической реакции. Этот эффект свя-
зан с уменьшением реабсорбции мочевины в
собирательных трубках и одновременным сни-
жением реабсорбции хлорида натрия в толстой
части восходящего колена петли Генле и соби-
рательных трубках мозгового слоя. Усиливается
прямой эффект простагландинов также за счет
возрастания кровотока в мозговом веществе
почек [Данн М.Дж., 1987].
Результатом перечисленных воздействий
простагландинов является выделение почками
большого объема мочи с высокой концентра-
цией в ней натрия.
Клиническая практика подтверждает важную
роль почечных простагландинов в регуляции эк-
скреции воды и натрия и в генезе водно-элек-
тролитных нарушений. В частности, при нефро-
тическом синдроме применение индометаци-
на — фармакологического блокатора синтеза
простагландинов — вызывает уменьшение су-
точной экскреции натрия, снижение диуреза и
ухудшение состояния почечных функций.
В наших исследованиях индометацин был приме-
нен у 18 больних с нефротическим нефритом в фазу
стабилизации отечного синдрома.
Назначение индометацина привело к выражен-
ному снижению диуреза (с 0,74±0,06 до 0,53±
0,05 мл/мин) и снижению экскреции натрия с мо-
чой (с 88,7±7,8 до 67,8+6,7 ммоль/с). При отмене ин-
дометацина показатели диуреза и натрийуреза воз-
вращались к исходному уровню.
Анализ результатов обобщенного исследова-
ния показателей транспорта натрия в нефроне,
величины клубочковой фильтрации и активно-
сти РААС привел нас к заключению, что бло-
катор синтеза простагландинов индометацин
при нефротическом синдроме снижает загруз-
ку нефрона профильтрованным натрием и уве-
личивает реабсорбцию натрия и воды в каналь-
цах, даже несмотря на обусловленную индоме-
тацином гипоальдостеронемию.
Полученные данные позволили считать, что
одной из причин задержки натрия и воды в
организме при нефротическом синдроме в фазу
его формирования может быть недостаточная
продукция простагландинов в почках. Это под-
тверждается серией исследований T.Niwa и со-
авт. (1982, 1983, 1985), использовавших внут-
ривенное введение простагландинов при забо-
леваниях почек. При сниженной почечной фун-
кции в ответ на внутривенное введение ПГЕ,
авторы отмечали увеличение диуреза и натрий-
уреза.
Итак, как следует из представленных дан-
ных, водно-натриевый гомеостаз поддержива-
ется почками посредством сложных, друг дру-
га компенсирующих механизмов. Большую роль
в них играет гормональная система почек и
надпочечников. Указанные механизмы обеспе-
чивают высокую эффективность сохранения по-
стоянства натрия и воды в организме. Наруше-
ния водно-электролитного баланса организма
развиваются при срыве в системах его регуля-
ции и могут быть связаны с экстраренальны-
ми причинами и с поражением почек. После-
дние будут рассмотрены в следующих главах.
3.3. Нарушения баланса натрия
3.3.1. Гипонатриемия
Гипонатриемия — состояние, характеризующе-
еся снижением концентрации натрия в крови
до уровня менее 135 ммоль/л.
В норме снижение поступления натрия в
организм не приводит к развитию гипонатрие-
мии, так как одновременно снижается и выде-
ление воды. Гипонатриемия развивается в том
случае, если потери натрия превышают общее
поступление электролита. Эта ситуация может
наблюдаться либо вследствие резких потерь
организмом натрия, либо при уменьшении
выделения воды. Последнее положение выявля-
ется при заболеваниях почек, при синдроме
непропорциональной продукции АДГ, при
отечных состояниях любого генеза, при поли-
дипсии. В этих ситуациях гипонатриемию рас-
сматривают в рамках нарушений скорее водно-
го, чем электролитного, баланса [Клар С., 1987;
Glassock R.J., 1987].
Патологические потери натрия классифици-
руют как экстраренальные и ренальные. Среди
экстраренальных причин ведущее значение име-
ют потери электролита:
• через желудочно-кишечный тракт (при рво-
те, поносе, свищах, заболеваниях желудоч-
но-кишечного тракта — панкреатите, пери-
тоните);
• через кожу (при тепловых воздействиях с
потом, муковисцидозе, при повреждениях
кожи вследствие ожога, воспаления);
• при развитии массивных кровотечений, при
парацентезе, при секвестрации крови вслед-
ствие обширных травм конечностей, расши-
рения периферических сосудов и т.д.
Потери натрия с мочой возможны как при
неизмененных почках, так и при почечной
патологии. Почечные потери натрия при исход-
но неповрежденных почках в основном связа-
ны с использованием диуретиков (главным об-
разом осмотических) и с дефицитом минера-
локортикоидов (гипоалвдосгеронизм).
Заболевания почек, приводящие к потере
натрия [Клар С., 1987]:
• хроническая почечная недостаточность;
• неолигурическая острая почечная недостаточ-
ность; период восстановления после олигу-
рической острой почечной недостаточности;
• сольтеряющая нефропатия: устранение об-
структивной нефропатии, нефрокальциноз/
интерстициальный нефрит, медуллярная ки-
стозная болезнь, синдром Барттера.
Общим для всех этих состояний является
неспособность эпителия почечных канальцев
нормально реабсорбировать натрий даже в ус-
ловиях максимальной гормональной стимуля-
ции его реабсорбции.
Ведущий механизм развития гипонатрие-
мии — потеря натрия или нарушение выделе-
ния воды — определяет гемодинамический ва-
риант гипонатриемии: гиповолемический, ги-
перволемический или изоволемический.
Гиповолемическая гипонатриемия развивает-
ся у больных при потере натрия и воды через
почки или желудочно-кишечный тракт либо
вследствие кровотечения или перераспределе-
ния объема крови (при панкреатитах, ожогах,
травмах). Клинические проявления соответству-
ют гиповолемии — гипотензия, тахикардия,
55
усиливающиеся в положении ортостаза; сни-
женный тургор кожи, жажда, низкое венозное
давление. Гипонатриемия в этой ситуации раз-
вивается исключительно вследствие избыточно-
го восполнения жидкости.
Основным признаком гиперволемической ги-
понатриемии являются отеки. У таких больных
снижен почечный кровоток, уменьшена ско-
рость клубочковой фильтрации, увеличена про-
ксимальная реабсорбция натрия и резко сни-
жена экскреция осмотически свободной воды.
Этот вариант водно-электролитных нарушений
развивается при застойной сердечной недоста-
точности и при тяжелых повреждениях печени.
Он является плохим прогностическим призна-
ком. При нелеченом нефротическом синдроме
гипонатриемия выявляется редко. Как правило,
она развивается вследствие интенсивного лече-
ния диуретиками.
Изоволемическая гипонатриемия развивается
при задержке в организме 3—5 л воды, из ко-
торых 2/3 распределяются в клетки, вследствие
чего отеков не образуется. Этот вариант наблю-
дается при синдроме непропорциональной сек-
реции АДГ и может иметь место при хроничес-
кой и острой почечной недостаточности.
Клинические проявления непос-
редственно определенные гипонатриемией,
связаны с патологией ЦНС. Развивается невро-
логическая симптоматика — от тошноты, го-
ловной боли, потери сознания до комы и ле-
тального исхода. Тяжесть проявлений зависит
как от степени гипонатриемии, так и от тем-
пов ее нарастания. Быстрое снижение содержа-
ния внутриклеточного натрия осложняется пе-
ремещением воды внутрь клетки и может при-
вести к отеку головного мозга. Концентрация
натрия в крови ниже 110—115 ммоль/л пред-
ставляет риск для жизни больного и требует
интенсивного лечения.
3.3.2. Гипернатриемия
Гипернатриемия — состояние, характеризую-
щееся увеличением концентрации натрия в
крови свыше 145 ммоль/л.
В норме при увеличении концентрации на-
трия во внеклеточной жидкости тотчас же
включаются компенсаторные механизмы, на-
правленные на восстановление натриевого го-
меостаза. Среди этих механизмов ведущими яв-
ляются:
• общий ток воды во внеклеточную жидкость;
• жажда;
• секреция АДГ с задержкой воды почками.
Гипернатриемия развивается при неадекват-
ности компенсаторных реакций и свидетель-
56
ствует о нарушениях в системе почечной регу-
ляции натриевого гомеостаза. Гипернатриемия,
развившаяся в условиях обычного поступления
натрия в организм, связана с выходом натрия
из клеток во внеклеточное пространство, след-
ствием чего является развитие гиперосмоляр-
ности этого пространства. По законам сохране-
ния осмотического равновесия из клеток начи-
нает выходить вода и развивается внутриклеточ-
ная дегидратация, которая служит проявлени-
ем всех гипернатриемий, в то время как объем
внеклеточной жидкости может быть различным.
В зависимости от него в клинике выделяют
гиповолемическую, гиперволемическую и изо-
волемическую гипернатриемию. Гемодинами-
ческий вариант гипернатриемии зависит от
распределения натрия во внутрисосудистом и
интерстициальном пространствах [Клар С.,
1987; Shayman J., 1997].
Гиповолемическая гипернатриемия развивает-
ся вследствие потери гипотонической жидко-
сти через почки, желудочно-кишечный и рес-
пираторный тракт или кожу.
В нефрологической практике причиной его
может быть:
• длительное использование осмотических ди-
уретиков;
• острая почечная недостаточность в фазе по-
лиурии;
• хроническая почечная недостаточность в фазе
полиурии;
• постобструктивная нефропатия;
• лечение перитонеальным диализом.
Причиной гиперволемической гипернатрие-
мии чаще всего является ятрогенный фактор —
введение гипертонических растворов, лекар-
ственных препаратов. В патологии этот вариант
электролитных нарушений наблюдается при
избыточной продукции минералокортикоидов
(первичном и вторичном гиперальдостерониз-
ме), эстрогенов, при синдроме Кушинга, мо-
жет иметь место при сахарном диабете.
В нефрологической практике причиной его
могут быть:
• острый нефритический синдром;
• острая почечная недостаточность в фазе оли-
гурии;
• хроническая почечная недостаточность в фазе
олигурии;
• нефротический синдром.
Положительный баланс натрия в этих усло-
виях в значительной степени определен сниже-
нием скорости клубочковой фильтрации.
Основной причиной изоволемической гипер-
натриемии является несахарный диабет. Вслед-
ствие отсутствия продукции АДГ (центральный
несахарный диабет) или нечувствительности
почек к АДГ (почечный несахарный диабет) в
большом количестве выделяется гипотоничная
моча. В ответ на потерю жидкости стимулиру-
ется центр жажды и потеря жидкости практи-
чески восполняется. Гипернатриемия при этих
состояниях, как правило, невысокая.
Клинические проявления непос-
редственно гипернатриемии также связаны с
поражением ЦНС и находятся в прямой зави-
симости от уровня натрия в крови. При умерен-
ной гипернатриемии (концентрация натрия в
крови менее 160 ммоль/л) ранними признака-
ми гипернатриемии являются неврологические
нарушения: раздражительность, сонливость,
слабость. При возрастании уровня натрия в
крови свыше 160 ммоль/л развиваются судоро-
ги, кома. При сохранении этого уровня концен-
трации натрия в течение 48 ч смертность боль-
ных составляет более 60 %. Непосредственной
причиной смерти в этой ситуации является
внутриклеточная дегидратация, приводящая к
необратимым изменениям в системе мозговых
сосудов. В то же время длительно существующая
(хроническая) умеренная гипернатриемия ча-
сто лишена четко очерченной неврологической
симптоматики. Это связано с тем, что в ответ
на дегидратацию в клетках сосудов головного
мозга синтезируются «идиогенные осмоли»,
которые препятствуют потере жидкости клет-
ками головного мозга. Это обстоятельство сле-
дует учитывать при быстрой регидратации боль-
ных, так как она может осложниться отеком
головного мозга.
3.4. Почечная регуляция
баланса калия
Калий является основным катионом внутрикле-
точной жидкости. Его содержание в целостном
организме составляет около 3500 ммоль, т.е.
приблизительно 50 ммоль на 1 кг массы тела,
при этом основное количество калия сосредо-
точено внутри клеток и лишь 65 ммоль калия
распределены во внеклеточном пространстве.
Концентрация калия во внутриклеточной жидко-
сти составляет около 150 ммоль/л, в то время
как во внеклеточной жидкости (в том числе в
сыворотке и плазме крови) она равна 3,5—
5 ммоль/л. Концентрация внеклеточного калия
ниже 3,5 ммоль/л называется гипокалиемией, а
выше 5 ммоль/л — гиперкалиемией.
В суточном рационе европейцев содержится
приблизительно 50—100 ммоль калия. В норме
около 90 % потребляемого калия выделяется
почками, остальное количество выводится че-
рез желудочно-кишечный тракт и небольшое
количество — с потом. При снижении функции
почек выделение калия кишечником возраста-
ет и при почечной недостаточности может до-
стигать 50 % общего количества потребляемо-
го калия [Shayman J., 1997].
Транспорт калия в нефроне. В физиологичес-
ких условиях примерно 10—15 % профильтро-
вавшегося в клубочках калия выводится с мо-
чой. Процесс обработки калия в нефроне сло-
жен: по мере прохождения через нефрон калий
подвергается реабсорбции и последующей сек-
реции в проксимальном канальце, реабсорби-
руется в толстом восходящем колене петли
Генле (петли нефрона), так что в просвете
дистального канальца сохраняется лишь 10 %
профильтровавшегося калия. Это свидетельству-
ет о том, что роль процессов фильтрации в
окончательном выведении электролита невели-
ка. Количество калия, выделяемого с мочой,
зависит от функции дистальных сегментов не-
фрона, где осуществляется как реабсорбция
оставшегося калия, так и секреция электроли-
та. При этом именно баланс процессов реабсор-
бции и секреции калия в дистальном канальце
определяет количество экскретируемого почка-
ми электролита.
Среди факторов регуляции секреции калия
в дистальных канальцах основными являются
следующие:
• pH внеклеточной жидкости (ацидоз-алкалоз);
• альдостерон;
• состояние проницаемости люминальной мем-
браны;
• скорость канальцевого тока жидкости.
Непосредственная роль каждого из перечис-
ленных факторов представлена в специальной
литературе [Клар С., 1987; Glassock R., 1987;
Tannen R., 1990; Shayman J., 1997, и др.].
3.4.1. Гипокалиемия
Гипокалиемия — состояние, при котором кон-
центрация калия в сыворотке или плазме кро-
ви ниже 3,5 ммоль/л. Условно гипокалиемию
разделяют на гипокалиемию, протекающую без
потерь калия, так называемую псевдогипокали-
емию, и гипокалиемию с потерей калия [Sterns
R.H., Narins R.G., 1990].
Гипокалиемия, не связанная с потерями калия,
развивается при перемещении калия из внекле-
точного во внутриклеточное пространство.
Целый ряд факторов могут вызывать этот
процесс. Основными из них являются гормо-
ны — инсулин и адреналин. Показано, что к ги-
покалиемии приводит повышение уровня ин-
сулина, вызванное или гипергликемией, или
введением экзогенного инсулина. Эндогенное
57
выделение катехоламинов при стрессах или ис-
пользование лекарственных препаратов, явля-
ющихся бета-2-агонистами, также сопровожда-
ется снижением концентрации калия в крови.
Перераспределение калия с перемещением его
внутрь клеток наблюдается при наследственном
заболевании — гипокалиемическом периодичес-
ком параличе.
Гипокалиемия, протекающая с потерями калия,
более часто встречается в клинической практике.
Потери калия могут быть обусловлены внепочеч-
ными и почечными факторами. Среди внепочеч-
ных причин развития гипокалиемии наиболее
частыми являются потери калия через желудоч-
но-кишечный тракт вследствие поноса (желудоч-
но-кишечные заболевания, в том числе виллоз-
ная аденома прямой кишки; неадекватный при-
ем слабительных, нейрогенная анорексия с час-
той рвотой). Разграничить почечную и внепочеч-
ную потерю калия при данной ситуации можно
на основании определения концентрации хлори-
дов в моче. При выделении с мочой хлоридов
менее 10 мэкв/л с большой степенью вероятно-
сти следует предполагать потерю электролитов
через желудочно-кишечный тракт.
Почечные потери калия диагностируют в том
случае, когда у больных с гипокалиемией вы-
являют «несоответствующее» состоянию выде-
ление калия с мочой, т.е. калийурию более 20
мэкв/сут (1 г). Такая ситуация может выявляться
при целом ряде патологических состояний. Пос-
ледние принято разделять на 2 группы:
• патологические состояния, протекающие с
нормальным уровнем артериального давления
и преимущественно обусловленные наруше-
ниями кислотно-щелочного равновесия
(группа А);
• патологические состояния, протекающие с
высокой артериальной гипертензией, кото-
рые дополнительно подразделяют в зависимо-
сти от уровня циркулирующего альдостерона
и ренина плазмы (группа Б) [Tannen R.L.,
1992].
Причинами почечной потери калия могут
быть следующие факторы.
А. Нормотензивные состояния:
• метаболический ацидоз;
• метаболический алкалоз;
• злоупотребление тиазидовыми и петлевыми
диуретиками;
• синдром Барттера;
• острая миелоцитная лейкемия;
Б. Гипертензивные состояния.
• 1. Высокий уровень альдостерона и высокий
уровень ренина:
первичный альдостеронизм (аденома, ги-
перплазия).
• 2. Высокий уровень альдостерона и низкий
уровень ренина:
злокачественная артериальная гипертен-
зия, реноваскулярная артериальная ги-
пертензия, опухоль, секретирующая ренин.
• 3. Низкий уровень альдостерона и ренина:
введение минералокортикоидов, глицир-
ризиновой кислоты, карбенонсолона.
• 4. Нормальный уровень альдостерона и ре-
нина: синдром Кушинга.
Среди заболеваний группы А, сопровожда-
ющихся развитием метаболического ацидоза,
наиболее тяжелая гипокалиемия выявляется при
почечном канальцевом ацидозе дистального
типа (тип I) и почечном канальцевом ацидозе
проксимального типа (тип II). Подобную кли-
ническую картину вызывает также и длитель-
ное применение диуретиков — ингибиторов
карбоангидразы (диакарб, диамокс).
Гипокалиемический метаболический алкалоз
чаще всего связан с истощением запаса хлори-
дов. Этот синдром возникает обычно при поте-
ре хлоридов желудочно-кишечным трактом
вследствие рвоты или промывания желудка.
Активная рвота с истощением запаса хлоридов
приводит к интенсивной реабсорбции хлоридов
в почках, что значительно повышает почечную
экскрецию калия.
Тиазидовые и петлевые диуретики — также
частая причина развития гипокалиемии и ал-
калоза. Вызванное диуретиками повышенное
поступление натрия и жидкости в дистальные
канальцы стимулирует повышенную продукцию
альдостерона и потерю калия.
Синдром Барттера — одно из наиболее яр-
ких состояний, протекающих с калиевым из-
нурением. При синдроме Барттера выявляется
гиперплазия юкстамедуллярного аппарата, ко-
торая сопровождается резким повышением про-
дукции ренина и альдостерона. Клинически
синдром Барттера проявляется калиевым изну-
рением, гипокалиемией, метаболическим алка-
лозом и нормальным или сниженным артери-
альным давлением. Генез гипокалиемии при
синдроме Барттера сложен. Помимо повышен-
ной продукции альдостерона, большое значе-
ние в развитии гипокалиемии придают нару-
шенной реабсорбции натрия в проксимальных
канальцах с последующей повышенной загруз-
кой этим электролитом дистальных канальцев,
что приводит к потере ими калия; обсуждается
в генезе гипокалиемии и роль гиперпродукции
простагландинов [Клар С., 1987].
У больных с потерей калия при гипертен-
зивных состояниях основной причиной гипока-
лиемии является чрезмерная выработка мине-
58
ралокортикоидных гормонов и в первую оче-
редь альдостерона. У этих больных обычно раз-
вивается гипохлоремический метаболический
алкалоз.
Сочетание высокой концентрации альдосте-
рона и низкой активности ренина плазмы вы-
являют при первичном альдостеронизме, кото-
рый развивается при аденоме, гиперплазии или
карциноме клубочковой зоны коры надпочеч-
ников.
Гиперальдостеронизм с высоким уровнем
ренина плазмы обычно выявляют при крайне
тяжелой артериальной гипертензии — злокаче-
ственной артериальной гипертензии, реновас-
кулярной гипертензии и ренин-секретирующей
опухоли (см. главу «Почки и артериальная ги-
пертензия»).
Гипокалиемия на фоне артериальной гипер-
тензии с нормальным уровнем альдостерона и
ренина плазмы выявляется при синдроме Ку-
шинга.
Клинические проявления гипока-
лиемии следующие:
• поражение скелетной мускулатуры (слабость,
утомляемость, вялый паралич, рабдомио-
лиз);
• поражение гладкой мускулатуры (уменьше-
ние двигательной активности желудка и тон-
кого кишечника);
• поражение сердечной мышцы (снижение
зубца Т, удлинение интервала QT, появле-
ние выраженного зубца U, расширение ком-
плекса QRS и развитие атриовентрикулярной
блокады);
• поражение периферических нервов (паресте-
зия и ригидность конечностей);
• поражение почек с развитием полиурии,
никтурии (вследствие нарушения концентра-
ционной способности почек) и первичной
полидипсии. Длительное истощение запасов
калия может вызвать интерстициальный не-
фрит и развитие почечной недостаточности,
а в ряде случаев — развитие кист в почках
[Shayman J.A., 1997].
3.4.2. Гиперкалиемия
Гиперкалиемия — состояние, при котором кон-
центрация калия в сыворотке крови превышает
5 ммоль/л. Ее можно наблюдать при ложно за-
вышенных данных лабораторных анализов, при
перераспределении калия из внутриклеточного
пространства во внеклеточное и при задержке
калия в организме, а также при гемолизе.
Ложное повышение калия в сыворотке вы-
являют при гемолизе крови, высоком лейкоци-
тозе (число лейкоцитов выше 20 109/л) и тром-
боцитозе. Гиперкалиемия в этих случаях вызва-
на выходом калия из лейкоцитов и тромбоци-
тов при свертывании крови.
Перераспределение калия из внутриклеточно-
го пространства во внеклеточное может наблю-
даться при развитии ацидоза, при недостаточ-
ности инсулина и введении бета-блокаторов, т.е.
действии тех же факторов, которые вызывают
гипокалиемию, но противоположно направлен-
ных. Быстрый выход калия из клеток с разви-
тием выраженной гиперкалиемии наблюдается
при тяжелых травмах, размозжении тканей
(краш-синдроме). Химиотерапия при лимфомах,
лейкемии, миеломной болезни приводит к по-
вышению уровня калия в крови. Перераспреде-
ление ионов калия может вызвать также алко-
гольная интоксикация и введение лекарствен-
ных препаратов, вызывающих изменение соот-
ношения калия между клеткой и средой. К та-
ким препаратам относятся сердечные гликози-
ды, деполяризующие миорелаксанты (исполь-
зующиеся в анестезиологии), аргинин-НС1.
Может вызвать гиперкалиемию очень тяжелая
острая или длительная физическая нагрузка.
Гиперкалиемия вследствие задержки калия.
Выделение калия почкой зависит от количества
функционирующих нефронов, адекватной до-
ставки натрия и жидкости к дистальным отде-
лам нефрона, нормальной секреции альдосте-
рона и от состояния эпителия дистального ка-
нальца.
Причины почечной гиперкалиемии:
• олигурическая почечная недостаточность:
— острая,
— хроническая;
• минералокортикоидная недостаточность:
— болезнь Аддисона,
— гипоренинемический гипоальдостеро--
низм;
• препараты, нарушающие почечную экскре-
цию калия:
— спиронолактон (верошпирон),
— триамтерен,
— амилорид,
— ингибиторы ангиотензинпревращающего
фермента,
— гепарин;
• канальцевые дефекты почечной экскреции
калия.
Больные с хронической почечной недостаточно-
стью способны поддерживать калиевый гомеос-
таз вплоть до снижения величины скорости клу-
бочковой фильтрации до 15 мл/мин. В этих усло-
виях гомеостаз поддерживается за счет повы-
шенной секреции калия в оставшиеся нефроны.
Быстрое развитие гиперкалиемии при ост-
рой почечной недостаточности объясняется сле-
дующими причинами:
59
• сниженной скоростью клубочковой фильт-
рации;
• сниженным поступлением жидкости в дис-
тальный отдел нефрона;
• прямым повреждением дистальных каналь-
цев при остром канальцевом некрозе;
• поступлением калия во внеклеточную жид-
кость вследствие ускоренного катаболизма.
Минералокортикоидная недостаточность. Аль-
достерон стимулирует секрецию калия в кор-
тикальном отделе собирательных трубок и по-
вышает захват калия клетками. Недостаточность
альдостерона вне зависимости от вызвавшей ее
причины предрасполагает к развитию гиперка-
лиемии.
Гипоальдостеронизм может быть результатом
первичного поражения надпочечников (болезнь
Аддисона) или развиваться вследствие наслед-
ственных дефектов биосинтеза альдостерона (ад-
реногенитальный синдром или недостаточность
С21-гидроксилазы). При болезни Аддисона наряду
с гиперкалиемией часто выявляют солевое исто-
щение и общее снижение тонуса организма.
Гипоальдостеронизм в сочетании с низким
уровнем ренина плазмы известен как гипорени-
немический гипо альдостеронизм. Этот синдром
часто выявляется при хронических тубулоинтер-
стициальных заболеваниях почек, сахарном
диабете, обструктивной нефропатии, серповид-
но-клеточной анемии. Причиной его развития
могут быть и лекарственные препараты. Нами
описано развитие этого синдрома при приме-
нении индометацина у больных ХГН [Kutyri-
na I., Androsova S., Tareyeva I., 1979]. Как пра-
вило, синдром встречается у пациентов пожи-
лого возраста, у половины из них развивается
гиперхлоремический метаболический ацидоз
из-за вызванного гиперкалиемией угнетения об-
разования аммиака в почке и ненормальной
секреции Н-ионов вследствие низкого уровня
альдостерона. Артериальная гипертензия выяв-
ляется в половине случаев, у подавляющего
большинства больных развивается почечная
недостаточность.
Среди препаратов, нарушающих почечную
экскрецию калия, следует выделить калийзадер-
живающие диуретики (спиронолактоны, триам-
терен и амилорид), ингибиторы ангиотензин-
превращающего фермента, гепарин.
Спиронолактоны ингибируют секрецию ка-
лия в кортикальном отделе собирательных тру-
бок. Он действует как антагонист альдостеро-
на, связывая белковые рецепторы минералокор-
тикоидов в клетках-мишенях и образуя комп-
лекс спиронолактон — рецептор, который не
активирует транскрипцию гена. Это приводит к
ингибированию альдостеронзависимой реабсор-
бции натрия в кортикальном отделе собиратель-
ной трубки с соответствующим торможением
дистальной канальцевой секреции калия. Ами-
лорид и триамтерен угнетают секрецию калия
посредством альдостероннезависимого механиз-
ма [Клар С., 1987; Shayman J.A., 1997].
Ингибиторы ангиотензинпревращающего
фермента вызывают повышение сывороточно-
го калия через блокаду ангиотензина II и опос-
редованное этим подавление продукции альдо-
стерона. При этом выраженность гиперкалиемии
особенно резко возрастает на фоне почечной
недостаточности.
Гепарин является прямым ингибитором син-
теза альдостерона, в связи с чем требуется ос-
торожность применения этого препарата при
диабете и при почечной недостаточности.
Канальцевые дефекты почечной секреции ка-
лия обнаруживают у больных с нормальными
или повышенными уровнями ренина и альдо-
стерона в крови. Эти больные не отвечают на
терапию минералокортикоидами. У них не раз-
вивается нормальный калийурез в ответ на вве-
дение сульфата натрия, фуросемида или хло-
рида калия. Эти дефекты выявляют у больных
с серповидно-клеточной анемией, при систем-
ной красной волчанке, обструктивной нефро-
патии и у больных с трансплантированной
почкой.
Клинически гиперкалиемия про-
является нарушениями сердечного ритма:
при увеличении концентрации калия в крови
на электрокардиограмме выявляют повышен-
ный зубец Т, расширение комплекса QRS, уд-
линение интервала PR и в дальнейшем появ-
ление сглаженной двухфазной волны QRS—T.
Кроме того, могут развиться суправентрикуляр-
ная тахикардия, блокада синусного узла, атрио-
вентрикулярная диссоциация, фибрилляция же-
лудочков и/или остановка сердца.
Литература
Данн М. Простагландины почки//Современная не-
фрология: Пер. с англ./Под ред. С.Клар, С.Массри. —
М.: Медицина, 1984. — С. 80—-121.
Клар С. Почки и гомеостаз в норме и при патоло-
гии: Пер. с англ. — М.: Медицина, 1987. — С.38—65.
Кутырина И.М., Клепиков П.В., Тареева И.Е. О роли
ренин-ангиотензиновой системы в патогенезе
нефротического синдрома//Тер.арх. — 1988. - № 6. -
С.32-34.
Наточин Ю.В. Механизмы мочеобразования//Нефро-
логия: Руководство для врачей. — М.: Медицина,
1995. - С. 35-76.
Рябов СИ., Наточин Ю.В. Функциональная нефро-
логия. — М., 1997. — 299 с.
60
Cogan M.G. Renal effects of atrial natriuretic factor//Ann.
Rev. Physiol. — Pabo Alto (Calif.). — 1990. — Vol. 152. —
P. 699-708.
Cuppies W.A., Sonnenberg H. Renal medullary plasma flow
rate and reabsorption of salt and water from inner
medullary collecting duct//Can. H. Physiol, and
Pharmacol. - 1987. - Vol.65, N 12. - P. 2415-2421.
Glassock R.J. Current therapy in nephrology and
hypertension. — 1987. — P. 1—6.
Hoegler C., McIntyre K, Zeballos G. et al. Relationship
between plasma atriopeptin concentration and function
in the conscious primata//J. Pharmacol. Exp. Ther. —
1989. - Vol. 251, N 3. - P. 929-936.
Kageyama S., Brown J. Effect of atrial natriuretic peptide
on renin release in rat isolated glomeruli//Biochem. and
Biophys. Res. Commun. — 1990. — Vol. 168, N 1. —
P. 37-42.
Kelly T.M., Nelson Don H. Sodium excretion and atrial
natriuretic peptide levels during mineralocorticoid
administration. A mechanism for the escape from
hyperaldosteronism//Endocrine Res. — 1987. — Vol. 13,
N 4. - P. 363-383.
Kokko J., Tannen R. Fluids and electrolytes. —
Philadelphia: W.B. Saunders, 1990.
Kutyrina I, Nikishova T., Tareyeva I. Effects of heparin-
induced aldosterone deficiency on renal function in
patients with chronic glomerulonephritis//Nephrology,
Dialysis, Transplantation. — 1987. — Vol.2. — P. 209—
223.
Reineck H.J., Stein J.H. Control of sodium excretion//
Textbook of Nephrology/ S.Massry, R.Glassock. —
Baltimore: Williams a. Wilkins, 1983. — Vol. 1. —
Part. 2.-3.12-3.21.
Shapiro M.D., Nichols K.M., Groves B.M., Schrier R.W.
Role of glomerular filtration rate in the impaired sodium
and water excretion of patients with the nephrotic
syndrome //Amer. J. Kidney Dis. — 1986. — Vol. 8,
N 2. - P. 81-87.
Shayman J.А. Патофизиология почки: Пер. с англ. —
М., 1997. - С. 39-66.
Zeidel М., Jabs К., Kikeri D., Silva Р. Kinins inhibit
conductive Na uptake by rabbit inner medullary collecting
duct cells//Amer. J. Physiol. — 1990. — Vol. 258, N 6. —
Pt. 2. - P. 1584-1591.
Гпава 4
ФОСФОРНО-КАЛЬЦИЕВЫЙ ОБМЕН
И ПОЧКИ
В.М.Ермоленко
Почки играют важную роль в поддержании
гомеостаза кальция и фосфора. Потребление
кальция с пищей составляет в среднем 1000 мг/
сут, из которых в желудочно-кишечном тракте
абсорбируется 200—400 мг. Поскольку элими-
нация кальция из организма осуществляется
главным образом с мочой, у взрослого челове-
ка без дефицита кальция не менее 200 мг эле-
мента должно экскретироваться почками.
В сыворотке кальций представлен тремя фрак-
циями: приблизительно 40 % от общего коли-
чества (10 мг/дл) связано с белком, 10 % — с
цитратом, бикарбонатом и фосфатом, а 50 %
приходится на свободную фракцию (ионизиро-
ванный кальций — Са2+), обладающую наи-
большей биологической активностью.
Кальций, связанный с белком, не проходит
через гломерулярный фильтр, но при величи-
не клубочковой фильтрации, равной 100 мл/
мин (144 л/сут), фильтрационная нагрузка для
ультрафильтруемого кальция (ионизированный
+ комплексированный) достигает 8000 мг/сут
(5,5 мг/длх144) и 95—97,5 % профильтрован-
ного количества реабсорбируется преимуще-
ственно в проксимальных канальцах (70 %) и
восходящем колене петли Генле (20 %). В изви-
тых проксимальных канальцах, как и в эпите-
лии тонкого кишечника, реабсорбция кальция
частично происходит совместно с натрием и
водой в виде раствора (solvent drag) и пассив-
ной диффузией по электрохимическому гради-
енту благодаря разнице между высокой концен-
трацией кальция в люминальном пространстве
и низкой — в интерстиции. В клетку кальций
поступает, по-видимому, через кальциевые ка-
налы, а из клеток удаляется Ca2+-Na+ сопере-
носчиком или Са2+-помпой. Значительное ко-
личество кальция реабсорбируется и парацел-
люлярно. В дистальных канальцах реабсорбция
62
кальция диссоциирована от всасывания натрия
и происходит против концентрационного гра-
диента. Через клетку, не увеличивая внутрикле-
точное содержание Са2+, реабсорбируемый
кальций переносится посредством зависимого
от витамина D Са2+-связывающего белка.
Основным депо фосфата в организме, как
и кальция, является скелет и только 10 % на-
ходится в мягких тканях.
Ежесуточно 60 % из 800—1500 мг потребля-
емого фосфора абсорбируется в кишечнике и
такое же количество должно экскретироваться
почками. Только небольшая часть фосфора сы-
воротки связана с белком, и практически он
почти полностью фильтруется в клубочках и на
80 % реабсорбируется в проксимальных каналь-
цах. 10 % всасывается в дистальных канальцах
и только 10 % профильтрованного количества
экскретируется с мочой. Реабсорбция фосфата
носит насыщаемый характер, пока не исчерпы-
вается мощность транспортной системы, но
уменьшается при повышении его уровня в сы-
воротке. Первое соответствует максимальной ре-
абсорбции фосфата (ТгпР). Излишек профиль-
трованного фосфата, превышающий эту вели-
чину, экскретируется с мочой, а при значени-
ях ниже порогового выведение фосфата снижа-
ется. Отношение TmP/КФ используется в каче-
стве показателя активности тубулярной реабсор-
бции фосфата.
Поступление фосфата в клетку проксималь-
ного канальца осуществляется посредством Na/
Pi-сопереносчиков типа I и II, в значительной
степени совпадающих по строению, основная
функция из которых по реабсорбции фосфата
принадлежит Na/Pi II типа. Последний состо-
ит из 640 аминокислот, разделенных на 8 транс-
мембранных доменов, содержащих приблизи-
тельно по 100 аминокислотных остатков и NH2-
и С-терминальные цитоплазматические фраг-
менты.
Na/Pi-сотранспортер II типа способен пере-
носить через апикальную мембрану канальце-
вых клеток как моно-, так и дивалентные фос-
фаты и при взаимодействии с Н+ утрачивает в
значительной степени аффинитет к натрию.
В физиологических условиях экспрессия
мРНК Na/Pi-сопереносчика наблюдается в
щеточной каемке по всей длине проксималь-
ного канальца, но в большей степени в сегмен-
те S,. Паратгормон и потребление фосфата —
основные регуляторы активности Na/Pi-сопе-
реносчика II типа. Быстрое изменение актив-
ности Na/Pi-сопереносчика в ответ на измене-
ния потребления фосфата предполагает суще-
ствование внутриклеточных структур, быстро
транслоцирующихся на мембрану при дефиците
фосфата. ПТГ ингибирует активность соперенос-
чика, уменьшая число его молекул на апикаль-
ной мембране за счет их перехода в субапикаль-
ное пространство, где они подвергаются фос-
форилированию с участием протеинкиназы А
или С.
С генетическим дефектом этого соперенос-
чика и/или появлением в циркуляции факто-
ра, угнетающего его активность, связывают
развитие сцепленной с Х-хромосомой гипофос-
фатемии у мышей и у человека.
В норме основными регуляторами фосфор-
но-кальциевого обмена являются ПТГ, кальци-
тонин (КТ) и витамин D.
Влияя на почки, скелет и всасывание каль-
ция в кишечнике, ПТГ обеспечивает постоян-
ство концентрации ионизированного кальция
во внеклеточной жидкости (ВКЖ).
Действие ПТГ на почки в основном опос-
редуется связанной с клеточной мембраной
ПТГ-чувствительной аденилатциклазой, лока-
лизованной в различных участках нефрона: в
проксимальных прямых и извитых канальцах,
восходящей порции петли Генле, в дистальных
канальцах и соединительных трубочках. ПТГ
уменьшает реабсорбцию фосфата в проксималь-
ных и дистальных канальцах, вызывая фосфа-
турию и гипофосфатемию, ингибирует секре-
цию ионов водорода в проксимальных каналь-
цах, тормозя Na-H-обмен в мембранах щеточ-
ной каемки, что сопровождается бикарбонату-
рией, а у части больных — развитием метабо-
лического ацидоза, повышает реабсорбцию
кальция в дистальных канальцах, уменьшает
канальцевую реабсорбцию натрия и ряда ами-
нокислот, в частности пролина.
В костной ткани ПТГ увеличивает растворе-
ние гидроксиапатита, в результате чего фосфор,
кальций и бикарбонат высвобождаются во
ВКЖ, однако содержание фосфора и бикарбо-
ната в крови не повышается из-за усиления
потерь этих веществ с мочой, в то время как
содержание кальция увеличивается.
ПТГ непосредственно не влияет на всасыва-
ние кальция в кишечнике, но стимулирует
цАМФ-зависимым способом продукцию метабо-
лита витамина D, — 1,25(OH)2D3 в ткани почек,
усиливающего абсорбцию кальция. Поэтому та-
кие состояния, как гипопаратиреоз и псевдоги-
попаратиреоз, сопровождающиеся, как прави-
ло, гипокальциемией, корригируются не ПТГ,
а экзогенными метаболитами витамина D.
При дефиците кальция в пище ПТГ вместе
с метаболитами витамина D3 усиливает моби-
лизацию кальция из костной ткани. Таким об-
разом, при невозможности задействовать дру-
гие пути коррекции скелет «приносится в жер-
тву» ради поддержания постоянства кальция в
ВКЖ.
В противоположность ПТГ кальцитонин
(КТ), секретируемый в межфолликулярных
клетках щитовидной железы, снижает концен-
трацию кальция в крови и ВКЖ, предотвращая
гиперкальциемию, уменьшает количество и ак-
тивность остеокластов костной ткани и инги-
бирует остеоцитный остеолиз, индуцируемый
ПТГ.
КТ оказывает фосфатурический эффект,
угнетая реабсорбцию фосфатов в проксималь-
ных извитых канальцах независимым от адени-
латциклазы путем и стимулирует реабсорбцию
кальция, активируя КТ-зависимую аденилат-
циклазу.
Помимо этого, КТ стимулирует активность
1 а -гидроксилазы в проксимальных прямых ка-
нальцах, повышая продукцию и содержание в
плазме 1,25(OH)2D3.
В норме витамин D3 (холекальциферол) об-
разуется в коже под действием ультрафиолето-
вого света из своего предшественника — 7-де-
гидрохолестерина или поступает в организм с
пищей, а в циркуляции находится в виде ком-
плекса со специфическим переносчиком (вита-
мин D-связывающий белок).
Еще не обладающий биологической актив-
ностью витамин D3 частично откладывается в
депо — в жировой и мышечной ткани и час-
тично подвергается дальнейшей метаболической
трансформации: в митохондриальной и микро-
сомальных фракциях печеночних клеток холе-
кальциферол гидроксилируется 25-гидроксила-
зой и превращается в 25-гидроксихолекальци-
ферол [25(OH)D3], причем эта реакция, как и
гидроксилирование в почечной ткани, сопро-
вождается редуцированием НАДФ и поглоще-
нием молекулярного О2.
Печень — практически единственное место
в организме, где содержится этот фермент, и
при тяжелых паренхиматозных и холестатичес-
ких заболеваниях печени содержание этого ме-
63
таболита витамина D3 в циркуляции может
снижаться.
Другими причинами дефицита 25(OH)D^
являются недостаточное поступление с пищеи
холекальциферола, длительное парентеральное
питание, потери метаболита с мочой у боль-
ных с нефротическим синдромом, прием про-
тивосудорожных препаратов.
В проксимальных извитых канальцах почек
25(OH)D3 при участии 1 а-гидроксилазы и ми-
тохондриальной цитохром-450-оксидазы пре-
вращается в 1,25-дигидроксихолекальциферол
[ 1,25(OH)jD3] — наиболее активный метаболит
витамина D3, увеличивающий абсорбцию каль-
ция в кишечнике и его мобилизацию из кост-
ной ткани, или относительно менее полярное
соединение 24,25(OH)2D3, способное, как по-
лагают, улучшать минерализацию костной тка-
ни, особенно в сочетании с 1,25(OH)2D3. В эк-
сперименте 24,25(OH)2D3 ускорял новообразо-
вание кости, индуцировал синтез протеоглика-
нов в культуре хондроцитов, а также увеличи-
вал ретенцию кальция у бинефрэктомирован-
ных больных.
В то время как на активность 1а-гидрокси-
лазы влияют ПТГ, гипофосфатемия и ряд дру-
гих факторов, стимуляция и ингибиция продук-
ции 24,25(ОН) D регулируются главным обра-
зом 1,25(ОН)2Е)3, причем первоначально био-
логически инертный 24,25(OH)2D3 становится
активным только после превращения в почеч-
ной ткани в la 24,25(OH)2D3.
Роль других метаболитов витамина D3 в ре-
гуляции фосфорно-кальциевого обмена, число
которых превышает 30, изучена недостаточно,
хотя некоторые из них, например фтородери-
ваты, подвергаются более быстрому 1а-гидро-
оксилированию, чем 1,25(OH)2D3, а 3-гекса-
флуоро-1,25(ОН)2Б3, не уступая в активности
1,25(OH)2D3, имеет более продолжительный
период полужизни в плазме человека и поэто-
му может назначаться не 2, а 1 раз в сутки.
Если у здоровых людей 1,25(ОН) D3 образу-
ется исключительно в почках (при беременно-
сти — в плаценте, при саркоидозе — в лимфо-
цитах, при инфицировании вирусом HTLV-1 —
в макрофагах), то ферментная система для
продукции 24,25(OH)2D имеется и в других
тканях, например в эмбриональных клетках
кишечника.
Синтезированный в почках 1,25(OH)2D3 ви-
тамин D-связывающим белком переносится к
клеткам-мишеням в кишечнике, костной и
других тканях, где реагирует с ядерным рецеп-
тором. Результатом этого взаимодействия явля-
ется фосфорилирование рецепторного комплек-
са, активирующего специфические гены, под
контролем которых, в частности в энтероци-
тах тонкого кишечника, образуются кальцийс-
64
вязывающий белок (КСБ) с молекулярной
массой 90 000, щелочная фосфатаза, Са-АТФа-
за, актин и ряд других белков, в результате чего
увеличивается всасывание кальция и фосфора.
У млекопитающих рецепторы к 1,25(OH)2D3
имеют молекулярную массу 55 000 и обладают
высокой специфичностью; связывание с рецеп-
торами 24,25(OH)2D3, 1а24,25(ОН) D и других
метаболитов гораздо меньше, чем 1,25(OH)2D3.
Важность взаимодействия 1,25(OH),D3 с ре-
цептором иллюстрируется наблюдениями за
больными витамин D-резистентным рахитом II
типа, у части из которых нарушена функция ре-
цепторов, что не позволяет 1,25(OH)2D3, не-
смотря на высокую концентрацию в крови,
усиливать интестинальную абсорбцию кальция.
В костной ткани 1,25(OH)2D3 не стимулиру-
ет активности остеокластов, но, возможно,
способствует их образованию из недифферен-
цированных клеток костного мозга и лимфоци-
тов периферической крови.
По мере созревания эти клетки теряют ре-
цепторы к 1,25(OH)2D3, и деятельность остеок-
ластов начинает регулироваться другими гормо-
нами: ПТГ, простагландинами и т.д.
Рецепторы к 1,25(OH)2D3 обнаружены так-
же в половых железах, желудке, паращитовид-
ной железе, моноцитах и т. д.
Во многих из перечисленных органов, как
и в ряде областей головного мозга, включая
мозжечок, 1,25(OH),D, стимулирует продукцию
КСБ.
In vitro 1,25(OH)2D3 оказался способным
ингибировать пролиферацию фибробластов,
пролиферацию и терминальную дифференци-
ровку кератиноцитов, синтез ПТГ и тиреоидных
гормонов, стимулировать продукцию ИЛ-1 ак-
тивированными моноцитами.
В Т-лимфоцитах периферической крови пос-
ле стимуляции ФГА появляются рецепторы к
1,25(OH)2D3. Взаимодействуя с i,25(OH)2D3,
клетки теряют способность к пролиферации й
продукции ИЛ-1. В В-клетках после контакта с
1,25(OH)2D3 снижается синтез иммуноглобули-
нов. Под влиянием 1,25(OH)2D3 уменьшается
способность к пролиферации злокачественных
клеток, а опухолевые клетки некоторых клонов
трансформируются в зрелые лимфоциты. К сожа-
лению, этот ингибирующий эффект 1,25(OH)2D3
наблюдается только в присутствии метаболита
в культуральной среде, и поэтому оказались
безрезультатными попытки использовать
1,25(OH),D3 для лечения лейкозов и некоторых
других злокачественных новообразований. В на-
стоящее время 1,25(OH)2D3 с успехом приме-
няется для лечения гиперпролиферативных со-
стояний, в частности псориаза.
Таким образом, витамин D и его метаболи-
ты регулируют деятельность многих систем
организма. Однако основные его функции —
предупреждение гипокальциемии, при достаточ-
ной выраженности которой наблюдается тета-
ния, и обеспечение минерализации скелета.
Выполнение этих функций осуществляется
тремя основными механизмами: усилением вса-
сывания кальция в дистальных канальцах по-
чек, мобилизацией кальция из костей (осуще-
ствляется совместно с ПТГ), повышением вса-
сывания кальция в желудочно-кишечном трак-
те, опосредуемое КСБ. ПТГ не оказывает вли-
яния на этот процесс.
При ХПН нарушаются все звенья регуляции
фосфорно-кальциевого обмена.
Уже на ранних стадиях ХПН уменьшается
фильтрационный заряд фосфата, однако бла-
годаря увеличению продукции ПТГ снижается
ТтР и отчетливая гиперфосфатемия развива-
ется только при падении клубочковой фильт-
рации менее 20—25 мл/мин, когда высокий
уровень ПТГ в сыворотке неспособен обеспе-
чить достаточное выведение фосфата.
Гиперфосфатемия реципрокно снижает в
крови концентрацию ионизированного каль-
ция, и совместный эффект гиперфосфатемии
и гипокальциемии стимулирует секрецию ПТГ.
Гипокальциемия даже в отсутствие гипер-
фосфатемии также способна увеличивать эксп-
рессию мРНК ПТГ.
В ткани паращитовидных желез (ПЩЖ)
обнаружены Са-рецепторы, число которых
уменьшается более чем на 50 % при экспери-
ментальной уремии, у больных с ТПН и при
первичном гиперпаратиреозе. Каждый рецептор
содержит большой внеклеточный домен, состо-
ящий из набора аминокислот, способных свя-
зывать кальций. Мутация этого рецептора при-
водит к развитию семейной гипокальциуричес-
кой гиперкальциемии и тяжелому гиперпара-
тиреозу у новорожденных.
В клетках проксимальных канальцев почек,
как упоминалось, присутствует два Na-зависи-
мых транспортера фосфата, активность кото-
рых, в первую очередь Na/Pi II типа, регули-
руемого ПТГ, определяет реабсорбцию фосфата
в почках. В то же время гомеостаз фосфата на
клеточном уровне поддерживается Na/Pi транс-
портерами III типа, выделенными первоначаль-
но в качестве рецепторов вируса лейкемии гиб-
бонов и мышей, а также ретровирусов мышей
и человека.
K.Miyamoto и соавт. (1999) изолировали
кДНК этого транспортера из ПЩЖ крыс и по-
казали, что его активность регулируется потреб-
лением фосфата и 1,25(OH)2D3. У крыс потреб-
ление фосфата увеличивает концентрацию ПТГ
в сыворотке, несмотря на постоянный уровень.
кальция и кальцитриола. Аналогичные резуль-
таты получены и на культуре клеток ПЩЖ.
Таким образом, содержание фосфата в сы-
воротке оказывает непосредственный эффект на
секрецию ПТГ независимо от уровня кальция,
обеспеченности метаболитами витамина D3 и
других факторов, значение которых будет об-
суждаться ниже.
Гиперсекреция ПТГ при уремии реализует-
ся двумя путями: усилением продукции гормона
отдельными клетками, подвергшимися гипер-
трофии, и увеличением на 20—50 % числа сек-
ретируюших клеток (гиперплазия).
В каждой отдельной клетке ПЩЖ 3 факто-
ра ответственны за гиперсекрецию ПТГ: низ-
кий уровень кальцитриола, который стимули-
рует транскрипцию препро-ПТГ, низкий уро-
вень кальция и высокое содержание фосфата в
сыворотке. Оба последних фактора индуцируют
экспрессию генов ПТГ. Снижение кальцитрио-
ла уменьшает также число специфических каль-
цитриоловых рецепторов, активация которых
предупреждает гиперплазию ПЩЖ.
Гиперплазированные клетки ПЩЖ менее
чувствительны к ингибирующему влиянию
кальция на секрецию ПТГ, вследствие чего для
полумаксимальной ингибиции секреции ПТГ
(set-point) у больных уремией требуется более
высокий уровень Са2+ в сыворотке, чем у здо-
ровых.
С учетом приведенных патофизиологических
данных развитие вторичного гиперпаратирео-
за — наиболее частой формы ренальной осте-
одистрофии у больных с хронической почеч-
ной недостаточностью — представляется следу-
ющим образом.
Снижение уровня ионизированного кальция
в сыворотке и повышение концентрации фос-
фата стимулирует гиперплазию ПЩЖ, усили-
вающуюся под влиянием дефицита кальцитри-
ола, перестающего через соответствующие ре-
цепторы на клетках ПЩЖ сдерживать эти про-
цессы. В свою очередь дефицит кальцитриола
развивается не только из-за недостаточной его
продукции клетками проксимальных канальцев
сморщенных почек, но и вследствие снижения
под влиянием гиперфосфатемии активности
1а-гидроксилазы, конверсирующей 25(OH)D3
в 1,25(OH)2D3. Угнетающее влияние на актив-
ность этого фермента оказывает и свойствен-
ный уремии метаболический ацидоз, a set-point
сдвигается вправо. Гиперплазированные ПЩЖ
менее чувствительны к ингибирующему влия-
нию кальциемии. Под влиянием секретируемо-
го в избытке ПТГ в костях образуются полости
резорбции, выполненные неорганизованным
остеоидом, количество которого увеличивает-
ся по мере снижения клубочковой фильтрации
до 40 мл/мин и менее. Увеличение числа остео-
кластов наблюдается даже при незначительном
снижении КФ (< 70 мл/мин) на фоне весьма
5—2950
65
умеренного повышения ПТГ сыворотки, хотя
в целом поверхность остеокластической резор-
бции тесно коррелирует с уровнем ПТГ в сы-
воротке.
В норме (процессы ремоделирования костной
ткани) и при ренальной остеодистрофии резор-
бция костной ткани осуществляется остеокла-
стами, образующимися из гемопоэтических мо-
нонуклеарных клеток костного мозга. Зрелые
остеокласты представляют собой гигантские (до
100 мкм в диаметре) мультиядерные клетки
(10—20), богатые лизосомами и митохондрия-
ми, примыкающими зазубренной поверхностью
к поверхности кости. Генерируемые внутрикле-
точно с участием карбоангидразы II ионы во-
дорода посредством водородной помпы посту-
пают в костную ткань, обеспечивая необходи-
мое окружение для действия лизосомальных
ферментов, протеолизирующих костный мат-
рикс. Первоначально остеокласт образует лаку-
ну и начинает продвигаться по костной повер-
хности. Процесс резорбции обычно начинает-
ся в момент прекращения движения.
ПТГ, как и 1,25(OH)2D3, активируют осте-
окласты, резорбирующие кость поверхностно
(пятнистая резорбция) или в глубине костной
ткани (лакунарная резорбция). Резорбтивные
полости заполняются остеобластами, однако
синтезируемый ими коллаген располагается не
параллельно поверхности трабекул, а повторя-
ет очертания полости (эндостальный фиброз).
Нарушается ламеллярная структура матрикса
кости, что в конечном итоге приводит к обра-
зованию неупорядоченной кости (woven bone)
и неупорядоченного остеоида (woven osteoid).
Последний может избыточно минерализовать-
ся и в отсутствие метаболитов витамина D3, что
объясняет парадоксальный факт обнаружения
у больных с выраженной ренальной остеодис-
трофией нормального содержания общего каль-
ция тела.
Стимулируют активность остеокластов наря-
ду с ПТГ и 1,25(OH)2D3 интерлейкины, лимфо-
токсин, фактор некроза опухоли, остеокласто-
поэтический фактор, витамин А, трансформи-
рующий фактор роста альфа, простагландины,
лейкотриены, в то время как кальцитонин,
у-интерфрон, нейтральные фосфаты, глюкокор-
тикоиды и т.д. обладают противоположным эф-
фектом. Усиление остеокластической резорбции
костной ткани наблюдается у женщин в мено-
паузальном периоде из-за дефицита эстрогенов.
Степень гиперплазии ПЩЖ не только обус-
ловливают методы (хирургические, лекарствен-
ные) коррекции у больных уремией вторично-
го гиперпаратиреоза (ВГПТ), но и предопре-
деляет механизмы туморогенеза, который яв-
ляется прямым показанием к хирургическому
вмешательству.
66
Согласно Y.Tominaga (1999), увеличение
объема ПЩЖ изначально обусловлено диффуз-
ным поликлональным ростом, сменяющимся
нодулярной гиперплазией, трансформирующей-
ся в моноклональную неоплазму. В этой транс-
формации не последнюю роль играет уменьше-
ние продукции кальцитриола, угнетающего
гиперплазию клеток ПЩЖ. Во всяком случае
число рецепторов в участках нодулярной гипер-
плазии существенно меньше, чем в зонах диф-
фузной гиперплазии.
Клинический опыт свидетельствует, что при
увеличении диаметра ПЩЖ более 0,5 см воз-
можности лекарственного подавления активно-
сти ПЩЖ ограничены.
Умеренный и выраженный ВГПТ являются
метаболически активным вариантом (I тип)
ренальной остеодистрофии (РОД).
Катаболический вариант РОД (II тип) пред-
ставлен остеомаляцией и адинамическим забо-
леванием скелета (АЗС). Остеомаляция харак-
теризуется присутствием пластов неминерали-
зованного остеоида и достаточного количества
остеобластов, хотя процессы ремоделирования
костной ткани резко замедлены. При АЗС в
костной ткани отсутствуют остеобласты, осте-
окласты, остеоид, полностью прекращается ре-
моделирование костной ткани. Смешанная фор-
ма РОД (III тип) является сочетанием гипер-
паратиреоза и остеомаляции.
Максимальной выраженности ВГПТ дости-
гает у больных, длительно находящихся на ге-
модиализе, в то время как первые признаки
остеомаляции появляются уже на ранних ста-
диях ХПН и достигают клинической выражен-
ности при прогредиентном ее течении.
Основным проявлением остеомаляции слу-
жит задержка минерализации остеоида. В нор-
ме остеобласты продуцируют в день слой осте-
оида толщиной 1 мкм, который спустя 10 дней
подвергается минерализации. Поэтому обнару-
жение пласта остеоида свыше 10 мкм свидетель-
ствует о задержке минерализации. С практичес-
кой точки зрения важно помнить, что о нали-
чии дефекта минерализации можно судить толь-
ко при сохранении ламеллярной структуры
костной ткани, поскольку в случае неупорядо-
ченного остеоида четкий фронт минерализации
отсутствует. После субтотальной паратиреоидэк-
томии исчезновение кальцифицированного ос-
теоида с неупорядоченной структурой усугуб-
ляет остеомаляцию. Таким образом, картина
преобладания остеомаляции или фиброзного
остеоида по крайней мере частично определя-
ется наличием или отсутствием минерализован-
ного остеоида.
Во время гемодиализа дополнительное не-
благоприятное влияние на скелет оказывает
аккумуляция в организме больных алюминия.
Последний попадает в организм при приеме
содержащих алюминий гелей, назначаемых
больным для контроля гиперфосфатемии, ан-
тацидов, некоторых парентерально применяе-
мых растворов, например альбумина, и при
использовании для приготовления диализиру-
ющего раствора неочищенной от алюминия
водопроводной воды.
Попадание в организм алюминия с водопро-
водной водой — основная причина гипералю-
минемии у больных, находящихся на гемодиа-
лизе, однако нередко тяжелые осложнения,
связанные с накоплением алюминия в тканях
(поражение скелета, энцефалопатия, анемия),
могут быть следствием только пероральной
нагрузки.
Пероральная нагрузка, обусловленная при-
емом содержащих алюминий гелей, — основ-
ной путь поступления алюминия у больных с
предтерминальной ХПН и основная причина
развития у них костной патологии, как и у лиц
с нормальной функцией почек, находящихся
на парентеральном питании. Усиливают всасы-
вание алюминия соединения цитрата путем
повышения растворимости алюминия и пара-
целлюлярного пути абсорбции.
Гистологически у больных с поражением
скелета вследствие интоксикации алюминием
отложения последнего обнаруживаются вдоль
уменьшенного в размерах фронта минерализа-
ции остеоида, препятствуя отложению солей
кальция в остеоид, причем выраженность ос-
теомаляции тесно коррелирует с содержанием
алюминия в костной ткани. В местах отложения
алюминия, образующего структуры величиной
от 20 до 100 нм, практически полностью от-
сутствуют активные остеобласты, а в выстила-
ющих поверхность кости фибробластоподобных
клетках не выявляется эндоплазматический ре-
тикулум. Костная ткань выглядит неактивной и
практически не воспринимает тетрациклиновую
метку, что свидетельствует о резком замедле-
нии процессов ремоделирования (новообразо-
вания) костной ткани. У некоторых больных ос-
теомалятическое поражение костной ткани
носит очаговый характер, однако в большин-
стве случаев эти очаговые «апластические» из-
менения со временем трансформируются в ге-
нерализованную форму остеомаляции и нередко
персистируют без изменений в течение ряда лет.
АЗС может развиваться и в отсутствие накоп-
ления алюминия в костной ткани.
У части больных массивные отложения алю-
миния в трабекулярной кости сочетаются с
признаками фиброзного остеита и с нормаль-
ной или увеличенной скоростью новообразова-
ния костной ткани. Однако и в этих случаях
дальнейшая аккумуляция алюминия приводит
в конечном итоге к развитию остеомаляции.
5*
Механизм, посредством которого алюминий
индуцирует остеомалятические изменения,
окончательно не расшифрован. Однако прове-
денные с культурой костной ткани исследова-
ния показали, что алюминий через гидроксиль-
ную группу формирует с цитратом металлоцит-
ратный комплекс, препятствующий росту кри-
сталлов фосфата кальция и угнетающий мине-
рализацию остеоида. Аналогичными свойствами
обладают железо и бериллий, сочетающие по-
ливалентность с небольшим молекулярным
радиусом.
Алюминий в концентрации 54—135 мкг/л,
которая нередко наблюдается в сыворотке кро-
ви больных, находящихся на гемодиализе, и без
цитрата способен ингибировать рост кристал-
лов фосфата кальция, однако ингибирующая
активность металлоцитратного комплекса, ко-
торый откладывается на поверхности кристал-
лов, во много раз выше.
Основными клиническими симптомами РОД
являются боль в костях и мышечная слабость.
При преобладании остеомаляции недостаточное
обызвествление большой массы остеоида ведет
к размягчению костей, развитию деформаций
и патологических переломов. У лиц молодого
возраста при остеомаляции замедляется рост,
развиваются кифоз, кифосколиоз, деформация
костей таза и конечностей вследствие пере-
стройки метафизарных зон трубчатых костей.
У взрослых деформации костей встречаются
реже, но более выражен болевой синдром.
При рентгенологическом исследовании у
детей и подростков отмечается расширение ме-
таэпифизарной зоны провизорной кальцифика-
ции, наиболее заметное в области интенсивного
роста (дистальный метафиз бедренных костей).
Типичными для остеомаляции являются
зоны Лоозера — симметричные участки про-
светления кости, локализующиеся в местах
максимальной механической нагрузки — в лон-
ных и седалищных костях, медиальном крае
шейки бедра, малом вертеле, ключице. Эти
псевдопереломы наблюдаются также в ребрах и
длинных трубчатых костях. Клинически карти-
на остеомаляции, связанной с интоксикацией
алюминием, не отличается от классической,
однако в противоположность последней прак-
тически никогда не сопровождается признака-
ми гипокальциемии; уровень в крови ПТГ, как
правило, не повышен, активность щелочной
фосфатазы находится в пределах нормы.
Наиболее ранним рентгенологическим при-
знаком ренального гиперпаратиреоза считают
субпериостальные эрозии, обычно развивающи-
еся на лучевой стороне средней фаланги II и
III пальцев правой руки. Первоначально неров-
ности костного края с трудом отличаются от
нормального варианта. В последующем они усу-
67
губляются, появляются на противоположной
(локтевой) стороне фаланги, распространяют-
ся на дистально и проксимально примыкающие
фаланги. В далеко зашедших случаях корковый
слой может полностью исчезнуть, а эрозивный
процесс углубиться на половину толщины фа-
ланги.
Остеоид защищает минерализованную кость
от действия остеокластов, но непостоянно от-
кладывается вдоль периостальной поверхности;
поэтому субпериостальная область — наиболее
часто встречающееся место эрозирования.
Другие типичные места локализации эро-
зии — латеральный конец ключицы, сакрои-
леальное сочленение, лонное сращение, задне-
верхний край ребер, переднемедиальный край
большеберцовой кости, большой и малый вер-
телы бедра.
Субпериостальные эрозии характеризуются
потерей компактности коркового слоя, поля-
ми субкортикальной рарефикации кости и
иногда сочетаются с кистовидной дегенераци-
ей. У больных с фиброзным оститом часто на-
блюдаются переломы ребер, шейки бедра, на-
пример, во время судорожного припадка, ком-
прессия позвонков и т.д.
При остеосклерозе первоначально отмечает-
ся утолщение отдельных трабекул, но в даль-
нейшем границы отдельных трабекул сливают-
ся, образуя рентгенологически плотную одно-
родную поверхность. Участки остеосклероза
встречаются в позвоночнике, костях таза, реб-
рах, скуловых и длинных костях конечностей.
В позвоночнике уплотненные участки верхней
и нижней поверхностей каждого позвонка, че-
редующиеся с разреженными участками в те-
лах позвонков, создают своеобразную картину
«полосатого» позвоночного столба.
Истинный остеопороз у больных уремией,
не получающих лечения гемодиализом, встре-
чается редко. У больных, находящихся на ле-
чении гемодиализом, часто возникают измене-
ния, напоминающие остеопороз: истончение
кортикального слоя, исчезновение трабекул,
юкстаартикулярная рарефикация.
При вторичном гиперпаратиреозе чаще, чем
при остеомаляции, наблюдаются отложения
фосфорно-кислых солей кальция в мягких тка-
нях, в различных органах, стенках сосудов.
Предрасполагают к выпадению солей увеличе-
ние содержания фосфора в сыворотке крови
больных, когда произведение концентраций
СахР в сыворотке крови превышает 70, а так-
же гипермагнезиемия, алкалоз, развивающие-
ся во время гемодиализа, локальное поврежде-
ние тканей.
S.Contiguglia и соавт. (1973) показали, что
кальцификаты мягких тканей и сосудов состо-
ят из кристаллов гидрооксиапатита, тогда как
68
в мышцах, сердце и легких обычно находят
аморфные микрокристаллы кальция, магния и
фосфора. Различный состав кальцификатов,
возможно, обусловлен местными тканевыми
факторами, в частности концентрацией водо-
родных ионов, некоторых электролитов. Выпа-
дение кристаллов гидроксиапатита сопровожда-
ется выраженной фиброзной реакцией, в то
время как аморфные кристаллы кальция, маг-
ния и фосфора не вызывают ее.
В периферических сосудах кальцификаты
обнаруживаются преимущественно в медиаль-
ной оболочке в отличие от атеросклеротичес-
ких изменений, локализующихся в интиме.
Чаще всего кальцификации подвергаются луче-
вая, локтевая артерии, сосуды голени, свода
стопы и кисти.
L.Jacobs и соавт. (1979) наблюдали 63-лет-
него больного, у которого кальцификация до-
стигла такой степени, что сосуды конечностей
было невозможно пережать манжеткой при
измерении АД. Вследствие этого у больного
ошибочно была диагностирована высокая ги-
пертензия (систолическое давление свыше 300
мм рт. ст.), хотя при подключении манометра
непосредственно к фистуле АД не превышало
80 мм рт. ст. Н.Rosen и соавт. (1972) описали
развитие гангрены у больного на фоне кальци-
фикации артерий нижней конечности.
Кальцификация сосудов может создавать
дополнительные трудности при пересадке поч-
ки. Артериальные кальцификаты медленно рас-
сасываются после субтотальной паратиреоидэк-
томии и у больных с хорошо функционирую-
щим трансплантатом.
Кальцификаты в легких или мышце сердца
обычно не выявляются при рентгенологическом
исследовании, но в ряде случаев могут вызы-
вать тяжелые и даже смертельные осложнения.
Так, R. Henderson и соавт. (1971) описали боль-
ного 27 лет с ХПН, умершего от нарушения
ритма сердца, у которого кальцификаты при
вскрытии обнаружены в проводящей системе
миокарда. K.Devacaanthan и соавт. (1976) наблю-
дали массивную кальцификацию легких у 35-
летнего больного, сопровождавшуюся выражен-
ной дыхательной недостаточностью. Два случая
кальцификации легких у больных, находящих-
ся на гемодиализе, описаны Г.П.Кулаковым и
соавт. (1980).
Отложения фосфорно-кальциевых солей в
коже вызывают сильнейший зуд, который ис-
чезает только после паратиреоидэктомии. Депо-
зиты солей кальция в конъюнктиве и рогови-
це на фоне сопутствующего воспаления обус-
ловливают появление картины «красных глаз»,
впервые описанной G.Berlyne (1967).
Отложение солей кальция около суставов
может вызывать ограничение их подвижности
и сопровождаться тендовагинитом. Чаще всего
кальциевые депозиты обнаруживаются вокруг
суставов фаланг, предплечья, в области лопа-
ток, локтя и т.д. Помимо фосфорнокислых со-
лей кальция, в околосуставных тканях могут
откладываться кристаллы мочевой кислоты
(вторичная подагра) и пирофосфата кальция
(псевдоподагра), что сочетается с хондрокаль-
цинозом. Псевдоподагра диагностируется на
основании обнаружения в синовиальных клет-
ках включений пирофосфата и чаще, чем пред-
полагали, встречается при ХПН. М.Eliman и со-
авт. (1979) обнаружили псевдоподагру у 3 из 82
больных, лечившихся гемодиализом, причем
все больные были старше 60 лет.
Выше были приведены данные о неблагоп-
риятном воздействии алюминия на скелет и
другие органы больных с уремией.
Признаками Al-интоксикации считается по-
вышение концентрации алюминия в сыворот-
ке более 68 мкг/л (2,3 мкмоль/л), особенно в
сочетании с клиническими проявлениями по-
ражений скелета (дефект минерализации), ЦНС
(деменция), системы крови (микроцитарная
анемия).
Исследование содержания алюминия в сы-
воротке следует проводить больным не менее
2 раз в год, а при уровне свыше 60 мкг/л —
чаще. Степень выявляемой гипералюминиемии
следует интерпретировать с учетом запасов
железа, которое находится в реципрокном от-
ношении к содержанию алюминия в организ-
ме. При концентрации алюминия в сыворотке
более 60 мкг/л и уровне ферритина более 100
мкг/л для подтверждения перегрузки алюмини-
ем проводят тест с ДФА (5 мкг/кг внутривен-
но в течение 60 мин в последний час проце-
дуры гемодиализа). Тест считается положитель-
ным, если уровень алюминия в сыворотке пе-
ред последующим гемодиализом превысит 150
мкг/л, однако отрицательные результаты теста
не исключают А1-интоксикацию.
При подтверждении избытка алюминия в
организме проводят лечение ДФА в той же дозе
1 раз в неделю в течение 3 мес и после месяч-
ного перерыва тест повторяют. Лечение прекра-
щают, когда содержание алюминия в 2 конт-
рольных пробах не превышает 75 мкг/л. Такая
схема применения ДФА эффективна и безопас-
на у больных с исходным уровнем алюминия
менее 300 мкг/л. При более высоких его значе-
ниях ДФА рекомендуют вводить за 5 ч до на-
чала процедуры гемодиализа, чтобы уменьшить
время экспозиции высокой концентрации алю-
миния [Barato G. et al., 1996].
Проведенные исследования по кинетике
алюминия у больных во время процедур гемо-
диализа показали, что в плазме крови алюми-
ний на 75—80 % связан с белками, в основ-
Рис. 4.1. Результаты ДФА-теста у больных с различ-
ными сроками лечения гемодиализом.
ном с трансферрином и альбумином, и его
перенос из диализирующего раствора в плазму
и в обратном направлении, как и кальция,
обусловлен не различным содержанием алюми-
ния в крови и диализате, а градиентом концен-
трации между несвязанным с белком (ультра-
фильтруемым) алюминием плазмы и алюмини-
ем диализирующего раствора.
Понятно, что в случае использования диа-
лизирующего раствора с повышенным содер-
жанием алюминия его перенос всегда будет
происходить из диализата в плазму. С учетом
этого в ряде стран существует законодатель-
ство, запрещающее использование неочищен-
ной водопроводной воды для приготовления
диализирующего раствора. Наиболее жесткий
стандарт к водопроводной воде существует в
США.
У всех больных следует проводить профилак-
тику Al-интоксикации (очистка воды обратным
осмосом, отказ от использования содержащих
алюминий фосфатных гелей, соков, содержа-
щих цитраты, усиливающих абсорбцию алюми-
ния в желудочно-кишечном тракте, и т.д.).
Профилактика должна быть особенно скрупу-
лезной у детей, у больных диабетом, пациен-
69
тов после паратиреоидэктомии, у реципиентов
почки, вернувшихся после нефрэктомии транс-
плантата на диализ, у больных с дефицитом
железа и получающих рчЭРП. Следует учиты-
вать, что даже минимальная концентрация алю-
миния в диализирующем растворе (5 мкг/л)
приводит к положительному балансу алюминия
и его медленному накоплению в организме
больных, о чем свидетельствуют приведенные
на рис. 4.1 данные. Недавно было установлено,
что кремний уменьшает биодоступность алюми-
ния и при мультицентровом исследовании в
ряде диализных отделений выявлена обратная
зависимость между содержанием в крови алю-
миния и кремния [Рапу R. et al., 1998], однако
вряд ли целесообразно предупреждать А1-инток-
сикацию увеличением кремния в диализирую-
щем растворе.
Помимо общепринятых клинических и рен-
тгенологических методов, диагностика РОД
основана на применении ряда специальных
инструментальных и лабораторных методов, а
также морфологического исследования костной
ткани.
При сцинтиграфии скелета ""'Тс накапли-
вается в участках с высокой метаболической ак-
тивностью, и применение этого метода имеет
решающее значение для выявления костных
метастазов, однако динамика накопления мо-
жет косвенно свидетельствовать об эффектив-
ности супрессии ВГПТ.
Надежным диагностическим критерием
ВГПТ является повышение в сыворотке кон-
центрации ПТГ, интактной его молекулы или
ее средней части, в то время как определение
СООН-терминального фрагмента не имеет
большого значения, поскольку его клиренс у
больных с нарушенной функцией почек сни-
жается. Об усилении метаболизма костной тка-
ни, свойственного ВГПТ, свидетельствует по-
вышение в сыворотке активности щелочной
фосфатазы, особенно ее костного изофермен-
та, продуцируемого остеобластами. Об этом же
свидетельствует повышенный уровень в крови
остеокальцина, формирующего около 1 % орга-
нического матрикса кости и экспрессируемого
остеобластами под контролем l,25(OH)2Dr N-
и С-пропептиды коллагена I типа также повы-
шаются до высоких значений в ситуациях, ког-
да происходит формирование костной ткани,
однако динамика их значений крайне слабо
коррелирует с морфологическими изменения-
ми костной ткани. Более информативным счи-
тается определение карбокситерминального
пропептида проколлагена I типа (PICP).
Маркерами резорбции костной ткани явля-
ются повышение экскреции с мочой гидро-
ксипролина (лучше гликозилированного гидро-
ксилизина), пиридинолинов (пиридолина и де-
70
зоксипиринолина), а также карбокситерминаль-
ного телопептида коллагена I типа (ICTP),
представляющего продукт деградации коллаге-
на. В сыворотке таким показателем является
резистентная к тартрату кислая фосфатаза, де-
фосфорилирующая матричный белок остеопон-
тин.
Ниже представлены современные биохими-
ческие маркеры ремоделирования костной тка-
ни.
Сывороточные маркеры, продуцируемые
остеобластами (ремоделирование):
• пропептиды коллагена I типа:
— С-пропептид (PICP),
— N-пропептид;
• остеокальцин;
• щелочная фосфатаза;
Маркеры, продуцируемые остеокластами
(резорбция):
• моча:
— гидроксипролин,
— гидроксилизин гликозилированный,
— пиридинолины и дезоксипиридиноли-
ны;
• сыворотка:
— тартрат-резистентная щелочная фосфата-
за,
— карбокситерминальный телопептид кол-
лагена I типа (ICTP).
Однако даже тщательное совокупное опре-
деление упомянутых маркеров далеко не всегда
позволяет идентифицировать морфологический
вариант РОД и окончательный диагноз устанав-
ливается только после морфологического иссле-
дования биоптата костной ткани.
Предупреждение и лечение различных форм
поражения скелета при уремии остается дале-
ко не решенной проблемой. Уже на ранних ста-
диях ХПН (КФ от 65 до 55 мл/мин), несмотря
на нормальное содержание общего кальция и
1,25(OH)2D3 в крови, уровень Са2+ снижен, что
стимулирует секрецию ПТГ, усугубляемую ги-
перфосфатемией. Поэтому контроль гиперфос-
фатемии в этих условиях не только тормозит
секрецию ПТГ, но реципрокно увеличивает
кальций сыворотки за счет улучшения его вса-
сывания в желудочно-кишечном тракте. Таким
образом, мониторирование фосфатемии у боль-
ных даже с незначительным снижением КФ
нормализует фосфорно-кальциевый обмен и
предупреждает развитие вторичного гиперпара-
тиреоза. Ограничивать поступление фосфата
необходимо даже в тех случаях, когда его со-
держание в крови не повышено, благодаря чему
удается снизить внутриклеточный уровень фос-
фата.
Богаты фосфором мясо (особенно печень,
сердце), рыба, твердые и плавленые сыры,
яичный белок, сосиски, хлеб грубого помола,
овсяная крупа, дрожжи, выпечка, пищевые
добавки, что необходимо учитывать при состав-
лении диеты.
Помимо ограничения поступления фосфата
с пищей, больным, как правило, назначают
различные гели, связывающие фосфаты в ки-
шечнике, препятствуя их абсорбции. К таким
веществам относятся соли алюминия [А12(СО)3)3,
А1(ОН)3]; соли кальция: алгинат, ацетат, кар-
бонат, цитрат, глюконат, кетоглутарат, кето-
валин; карбонат и гидроокись магния [MgCO
и Mg(OH)2].
Понятно, что применение солей алюминия
из-за возможного их накопления в организме
больных нежелательно. Кальция цитрат спосо-
бен усиливать абсорбцию алюминия в желудоч-
но-кишечном тракте, прием солей магния не-
редко осложняется диареей и гипермагниеми-
ей, угнетающей минерализацию остеоида. Та-
ким образом, для коррекции гиперфосфатемии
чаще всего используются карбонат и ацетат
кальция. В 1 г ацетата кальция содержится 0,25 г
элементарного Са2+, а в 1 г карбоната каль-
ция — 0,4 г Са2+, однако в силу лучшей раство-
римости ацетата снижение содержания фосфа-
та сыворотки на одинаковую величину вызы-
вают 1,5 г ацетата и 3,5 г карбоната кальция,
что позволяет потреблять заметно меньше каль-
ция ацетата без ущерба для окончательного ре-
зультата. Это в свою очередь существенно умень-
шает частоту гиперкальциемии, которая встре-
чается у 61,5 % больных на фоне приема каль-
ция карбоната и только у 15,1 % пациентов,
получающих кальция ацетат.
Поскольку больше всего фосфатов содержит-
ся в мясе и рыбе, легко подсчитать, что при
потреблении 0,8—0,6 и 0,3 г белка на 1 кг мас-
сы тела больные с додиализной ХПН получа-
ют в среднем 800—450 и 250 мг/сут фосфата.
В этих условиях назначение больным 0,5—1 г/сут
кальция карбоната в сочетании с небольшими
дозами кальцитриола (0,25 мкг/сут) может
обеспечить нормальный уровень фосфата и
кальция в крови.
Больным, находящимся на гемодиализе,
обычно рекомендуют повышенное потребление
белка (1,35—1,5 г/сут). Даже если в кишечнике
всасывается только 50—55 % потребленного с
продуктами фосфата, то ежедневно необходи-
мо элиминировать 450—600 мг этого элемента.
Однако при самом оптимальном варианте эли-
минирования расчетное ежесуточное выведение
колеблется от 252 (во время гемодиализа) до
309 мг/сут (при гемофильтрации). Около 300 мг
фосфата в сутки элиминируется у больных на
ПАПД. Таким образом, ни одна из заместитель-
ных процедур фактически не обеспечивает дол-
жной элиминации фосфата. Все это предопре-
деляет необходимость применения фосфатсвя-
зывающих гелей. При стандартной белковой
нагрузке и содержании кальция в диализирую-
щем растворе от 1,625 до 1,7 ммоль/л счита-
лось необходимым назначать больным кальция
карбонат в средней дозе 9—10 г/сут или ком-
бинацию 10 г кальция карбоната и 5 г гидро-
окиси алюминия. В этом случае гидроокись алю-
миния являлась «платой» за предупреждение
гиперкальциемии, особенно у больных, у ко-
торых доза 10 г карбоната кальция оказывалась
недостаточной.
Широкое использование метаболитов вита-
мина D3 для лечения РОД, усиливающих аб-
сорбцию кальция и фосфата, привело к идее
применять у больных, находящихся на гемоди-
ализе и перитонеальном диализе, низкокальци-
евый диализат (1,25 ммоль/л), избегая перегруз-
ки кальцием. При перитонеальном диализе та-
кой подход оказался достаточно удачным, по-
скольку оживлял активность ПТГ у большин-
ства больных, у которых преобладающей фор-
мой РОД было АЗС. В то же время у больных
на гемодиализе индуцированная гипокальцие-
мия в ряде случаев аггравировала ВГПТ.
В настоящее время проходят клинические
испытания не содержащие алюминия и каль-
ция гели, связывающие фосфаты, состоящие из
поли[иллиламин гидрохлорида] — Rena Gel,
неабсорбтивных полимеров хлоралгидрата лан-
тана, циконила хлорида, с помощью которых
уже в скором будущем, как считают, будет
решена проблема контроля гиперфосфатемии
без отрицательного влияния на ПЩЖ и нут-
ритивный статус больных.
Предупреждение и лечение РОД следует
проводить уже на ранних стадиях ХПН. Если на-
значением препаратов кальция и контролем
гиперфосфатемии не удается достичь нормали-
зации фосфорно-кальциевого обмена, уместно
добавление небольших доз 1,25(OH)2D3 (0,25
мкг/сут) в сочетании с 3 г кальция карбоната.
Такая сочетанная терапия, по данным P.Fornier
и соавт. (1986), улучшает состояние скелета, не
вызывая ухудшения функции почек. Ранее ме-
таболиты витамина D, избегали назначать боль-
ным с додиализной ХПН.
При пероральном назначении препаратов
кальция следует учитывать, что они абсорби-
руются в желудочно-кишечном тракте на 25—
45 % от принятого количества, в то время как
натрий, фосфор и калий абсорбируются пол-
ностью. Максимальная скорость абсорбции
кальция наблюдается у человека и животных в
двенадцатиперстной кишке, однако в силу
быстрого пассажа пищи через дуоденум основ-
ная часть кальция всасывается в тонкой кишке.
71
Усиливают абсорбцию кальция лактоза, лизин,
аргинин, триптофан, угнетают глюкокортико-
иды, тормозящие конверсию 25(OH)D3 в
1,25(OH),D3, оксалаты и фитаты, образующие
с кальцием нерастворимые комплексы. Это так-
же важно помнить урологам, пытающимся
профилактировать образование оксалатно-каль-
циевых камней. Ограничение потребления каль-
ция у таких больных усиливает абсорбцию ок-
салата, индуцируя гипероксалурию. По этой же
причине больным оксалатно-кальциевым лити-
азом ограничивают потребление жира, так как
он реагирует с кальцием в кишечнике, препят-
ствуя его взаимодействию с оксалатами.
У больных на гемодиализе с умеренно вы-
раженным ВГПТ используют более высокие
дозы 1,25(ОН)2П3-кальцитриола (0,5—1 мкг/сут),
подавляющие секрецию ПТГ, повышающие
абсорбцию кальция в кишечнике, восстанавли-
вающие мышечную силу. Лечение обычно длит-
ся не менее 4—6 мес. Дополнительно назнача-
ют препараты кальция, чтобы поддержать его
концентрацию в сыворотке на уровне 10—10,5
мг/дл, и фосфатсвязывающие гели.
Вместо монотонного ежедневного приема
препарата практикуют его пероральные пуль-
сы (4 мкг дважды в неделю). Такой подход обес-
печивает равноценную с ежедневным приемом
супрессию продукции ПТГ (в среднем на 50—
60 %), урежая эпизоды гиперкальциемии.
Абсорбция кальция в желудочно-кишечном
тракте под влиянием кальцитриола меньше в
ночное время, чем утром. Поэтому ночной при-
ем препарата почти вдвое уменьшает частоту
гиперкальциемии у получающих кальцитриол
больных. Тяжесть гиперкальциемии меньше при
дневном приеме кальцитриола, чем при утрен-
нем [Schaefer К. et al., 1992].
Внутривенное введение кальцитриола перво-
начально использовалось у больных, плохо пе-
реносивших пероральную терапию, однако в
последующем оказалось, что внутривенное вве-
дение препарата (0,5—4 мкг 3 раза в неделю)
не влияет на всасывание кальция в кишечни-
ке, уменьшая тем самым эпизоды гиперкаль-
циемии, а создаваемый высокий уровень пре-
парата в крови вызывает более выраженное
подавление (на 70 %) секреции ПТГ [Slatopols-
ky Е. et al., 1994]. Меньшие дозы кальцитриола
(1—2,5 мкг 3 раза в неделю) оказывают более
мягкий эффект в плане коррекции кальциемии,
супрессии ВГПТ, стимуляции остеобластов.
Однако уменьшение эпизодов гиперкальциемии
на фоне внутривенного введения кальцитрио-
ла не избавляет от гиперфосфатемии, которая,
по данным M.Gallieni и соавт. (1992), наблюда-
ется у 60 % гемодиализных больных, получав-
ших внутривенно кальцитриол по 0,015 мкг/кг
в течение 4 мес. В целом вводимая доза каль-
цитриола зависит от исходной выраженности
ВГПТ и подлежит коррекции в зависимости от
оказываемого эффекта.
Начинать лечение кальцитриолом необходи-
мо уже на начальных стадиях развития ВГПТ,
когда еще не возникла гиперплазия ткани
ПЩЖ, как правило, плохо поддающаяся об-
ратному развитию. Нодулярно гиперплазирован-
ная ткань ПЩЖ обеднена кальцитриоловыми
рецепторами, и необходим более высокий уро-
вень кальциемии, чтобы подавить секрецию
этой тканью ПТГ. В табл. 4.1 приводятся реко-
мендуемые дозы кальцитриола в зависимости от
тяжести ВГПТ.
Как видно из табл. 4.1, возможна попытка
лечения больных даже с тяжелыми формами
ВГПТ, однако она должна проводиться макси-
мально возможными дозами кальцитриола с
тщательным контролем содержания в сыворотке
Са, Р и особенно произведения СахР, кото-
рое не должно превышать 70 из-за опасности
усиления метастатической кальцификации.
Поскольку у больных, получающих большие
дозы кальцитриола, для контроля гиперфосфа-
темии приходится назначать большие дозы кар-
боната или ацетата кальция, концентрацию
кальция в диализирующем растворе снижают до
2,5 мэкв/л. Чтобы добиться ощутимых резуль-
татов снижения массы ПЩЖ и продукции
ПТГ, лечение нередко приходится проводить в
Таблица 4.1. Дозы кальцитриола при внутривен-
ном введении в зависимости от тяжести ВГПТ (по
К. Norris, 1996)
Степень ВГПТ — концентрация интактного ПТГ в сыворотке Началь- ная доза кальци- триола Увели- чение дозы, мкг Частота мониторирования показателей
Начальные прояв ления; иПТГ 65—200 мг/мл — — иПТГ — ежеквар- тально Сахр — ежеме- сячно Са, Р
Умеренный; иПТГ — 200— 600 мг/мл 1—2 мкг 3 раза в неделю 0,5 иПТГ — ежеквар- тально Сахр — 1 раз в 2 нед Са, Р
Выраженный; иПТГ 600— 1200 пг/мл 2—4 мкг 3 раза в неделю 0,5—1 иПТГ — 1 раз в 6—8 нед Сахр — ежене- дельно Са, Р
Тяжелый; иПТГ > 1200 пг/мл 4 мкг 3 раза в неделю 1 иПТГ — 1 раз в 4—6 нед Сахр — 1—2 раза в нед Са, Р
72
течение многих месяцев [Andress D. et al., 1989;
Canella G. et al., 1994].
В настоящее время проходят клинические
испытания аналоги кальцитриола — 22-окса-
кальцитриол, кальципотриол (Dovonex) и 19-
Nor-1,25(OH)2D3, обладающие менее выражен-
ным кальциемическим эффектом при сохране-
нии антипролиферативного и других механиз-
мов влияния на ВГПТ и поэтому более без-
опасные в клинической практике.
В случае, когда секреция ПТГ остается не-
подавляемой, приходится прибегать к парати-
реоидэктомии. Абсолютными показаниями к
паратиреоидэктомии являются неуспех терапии
кальцитриолом, кожные некрозы из-за кальци-
фикации мелких сосудов кожи, нестерпимый
кожный зуд.
Обычно во время операции удаляли 3 из 4
предварительно визуализированных с помощью
компьютерной томографии, радиоизотопных или
ультразвуковых методов ПЩЖ, а иногда прихо-
дилось удалять и часть оставшейся железы.
В настоящее время обычно прибегают к то-
тальной паратиреоидэктомии, подсаживая уда-
ленную железу или ее часть на предплечье или
в m.sternocleidomastoideus, однако частота ре-
цидивов ВГПТ и в этом случае остается доста-
точно высокой [Hampl Н. et al., 1991; Pothmund
М. et al., 1991].
D. Lieu и соавт. (1998) недавно описали опу-
холевидное образование на шее у молодой жен-
щины, обусловленное ростом клеток ПЩЖ,
подсаженных в грудиноключично-сосцевидную
мышцу.
При выявлении аденомы в одной из ПЩЖ
иногда бывает достаточным введение под УЗ-
контролем этанола или других склерозирующих
веществ в ткань аденомы.
Немедленно после операции у больных рез-
ко снижается содержание в крови ПТГ и каль-
ция, что в ряде случаев сопровождается тета-
нией. Для предупреждения гипокальциемии в
послеоперационном периоде назначают (до 4—
6 г элементарного кальция), 1,25(OH)2D3 (до 2
мкг/сут), проводят гемодиализ; при повышении
содержания кальция (до 2 ммоль/л) стремятся
избегать резких изменений pH крови во время
процедур гемодиализа, поскольку алкалоз спо-
собствует судорожному припадку.
Вскоре после удаления ПЩЖ исчезают кож-
ный зуд, боль в костях, увеличивается мышеч-
ная сила. В крови снижается концентрация фос-
фора, что требует уменьшения дозы фосфатс-
вязывающих препаратов, поскольку сниженное
содержание фосфора замедляет реминерализа-
цию скелета. Позднее падает активность КЩФ,
а через 3—4 мес уменьшаются субпериосталь-
ные эрозии и примерно у 60 % больных каль-
цификаты в мягких тканях. В мелких артериях
интенсивность отложений кальция даже может
увеличиваться.
Уменьшению очагов эктопической кальци-
фикации способствует бифосфонат натрия —
синтетический аналог пирофосфата, который
можно назначать и больным, не подлежащим
паратиреоидэктомии. У части больных после
операции развивается остеомаляция, у некото-
рых, как упоминалось, бывают рецидивы ги-
перпаратиреоза, что требует или повторной
операции для удаления добавочных паращито-
видных желез, или сокращения размера экто-
пически пересаженной ткани. Описаны случаи
инфильтративного роста трансплантированных
на предплечье ПЩЖ.
В первые недели и месяцы после трансплан-
тации почки у 60—70 % реципиентов, несмотря
на хорошую функцию трансплантата, вследствие
недостаточной инволюции паращитовидных же-
лез сохраняются признаки ВГПТ, причем у 20 %
больных отмечается непропорциональная гипер-
секреция ПТГ, хотя в крови нормализуется со-
держание ионизированного кальция.
Обычно у реципиентов почечного транс-
плантата гиперкальциемия редко достигает
высоких значений, однако в редких случаях при
неудовлетворительной коррекции гиперпарати-
реоза во время лечения гемодиализом гипер-
кальциемия становится клинически значимой,
и у больных могут развиваться ишемические
некрозы кожи, для лечения которых необходи-
ма экстренная паратиреоидэктомия.
Постоянная (в течение одного года и более)
гиперкальциемия у реципиентов почечного
трансплантата чаще всего связана с третичным
(автономным) гиперпаратиреозом, требующим
паратиреоидэктомии, а иногда носит паранео-
пластический характер вследствие развития но-
вообразований на фоне иммуносупрессивной
терапии.
При развитии гиперкальциемии независимо
от происхождения необходима ее настойчивая
коррекция из-за отрицательного влияния на
функцию трансплантата.
В России препараты кальцитриола как для
перорального, так и для внутривенного введе-
ния отсутствуют, однако сходный с кальцит-
риолом эффект оказывает отечественный пре-
парат оксидевит (la(OH)D3), имеющий гидро-
ксильную группу в первом положении и не
нуждающийся в гидроксилировании в ткани по-
чек. Превращаясь в печени в la,25(OH)2D3,
оксидевит оказывает при ВГПТ действие, ана-
логичное кальцитриолу. Препарат в дозе от 0,5
до 2 мкг/сут назначают больным на длитель-
ный срок, контролируя те же параметры, что
и при лечении кальцитриолом.
Как свидетельствуют наши данные, на фоне
приема оксидевита в крови увеличивается со-
73
держание кальция и фосфора, а концентрация
иПТГ и активность костного изофермента щелоч-
ной фосфатазы снижаются.
Препарат можно назначать перорально посто-
янно или в виде пульсов (0,5—3 мкг 3 раза в не-
делю) [Koskimies О., Ala-Houhala М., 1996] либо
внутривенно.
Как и другие метаболиты витамина D3, ок-
сидевит может индуцировать гиперкальциемию
и, излечивая ВГПТ, более отчетливо проявлять
остеомалятические изменения.
Альтернативный подход практикуется при
лечении остеомаляции и особенно АЗС, кото-
рое в настоящее время диагностируется у 65 %
больных, находящихся на перитонеальном ди-
ализе.
После устранения избытка алюминия из
организма для лечения уремической остеома-
ляции, как и остеомаляции другого генеза,
рекомендуются препараты кальция, кальцитри-
ол и другие метаболиты витамина D3.
По данным I.Eastwood и соавт. (1976) и Н.
Neelsen и соавт. (1977), у больных с преобла-
данием процессов остеомаляции снижено в
сыворотке содержание 25(OH)D3. Поэтому не-
большие дозы этого препарата рекомендуется
использовать для профилактики данного ослож-
нения. 25(OH)D3 является не только предше-
ственником 1,25(OH)^D3, но может индуциро-
вать экстраренальныи синтез 24,25(OH)2D3 —
метаболита, способствующего поступлению
кальция в скелет, и стимулировать активность
почечной 1а-гидроксилазы. У бинефрэктомиро-
ванных больных избыток 25(OH)2D3 приводит
к повышению 1,25(OH)2D3 в сыворотке, что
свидетельствует о возможности внепочечного
образования этого метаболита [Dusso A. et al.,
1988]. Некоторое повышение 25(OH)2D3 и
1,25(OH)2D. у больных, находящихся на гемо-
диализе, способен вызвать нифедипин [Riegel W.
et al., 1986].
Профилактика АЗС, более свойственного
пожилому контингенту больных, получающих
лечение диализом, основывается на предуп-
реждении у них гиперкальциемии, включая
иммобилизационную, а также за счет соответ-
ствия кальция диализата кальцию, содержаще-
муся в фосфатсвязывающих препаратах, ис-
пользования умеренных доз метаболитов вита-
мина D3. Снижая концентрацию кальция в
диализирующем растворе, пытаются несколь-
ко оживить активность пщж, поддерживая
содержание ПТГ в крови на уровне трех норм,
что, как полагают, ускоряет ремоделирование
костной ткани. Необходимо учитывать, что
хотя АЗС в противоположность Al-остеомаля-
ции не сопровождается выраженным болевым
синдромом, но предрасполагает к патологичес-
ким переломам.
Литература
Andress D., Norris К., Coburu G. et al. Intravenous
calcitriol in the treatment of refractery osteitis fibrosa of
chronic renal failure//N. Engl. J. Med. — 1989. — Vol.
321. - P. 274-279.
Barato G., D’Haese P., Pires C. et al. Low-dose (5 mg/
kg) desferrioxamine treatment in acutely aluminium-
intoxicated haemodialysis patients using two drug
administration schedules//Nephrol. Dial. Transplant. —
1996. - Vol. 11. - P. 125-132.
Cannela G., Bonucci E., Rolla D. et al. Evidence of
healing of secondary hyperarathyroidism in chronically
hemodialysed patients treated with long-term intrave-
nous calcitriol//Kidney int. — 1994. — Vol. 46. — P.
1124-1132.
Dusso A., Lopez-Hilker S., Rapp N., Slatopolsky E.
Extrarenal production of calcitriol in chronic re-
nal failure//Kidney int. - 1988. - Vol. 34. - P. 368-
375.
Fornier P., Moriniere Ph., Sebert G. et al. Calcium
carbonate as aluminium free agent for control of
hyperphosphatemia, hypocalcemia and hyperparathy-
roidism in uremia//Kidney int. — 1986. — Vol. 29. — Suppl.
1. - P. 114-119.
Gallieni M., Broncaccio D., Padovese P. et al. Low-dose
intravenous calcitriol treatment of secondary hyperpara-
thyroidism in hemodialysis patients//Kidney int. —
1992. - Vol. 42. - P. 1191-1198.
Hampl H, Steinmuller T., Stabell U. et al. Reccurent
hyperparathyroidism after total parathyroidectomy and
autotransplantation in patients with long-term
hemodialysis//Miner. Electrolyte Metal. — 1991. — Vol
17. P. 250-260.
Koskimies O., Ala-Houhala M. Alphacalcidiol oral pulses
are effective in secondary hyperparathyroidism prior to
dialysis//Clin. Nephrol. — 1996. — Vol. 46. — P.71—72.
Lien D., Hirschowitz Sh., Skinner K, Zuckerbraun L.
Reccurent secondary hyperparathyroidism after
autotransplantation into the stemoclaidomastoid muscle:
report of case with fine needle aspiration flndings//Acta
Cytol. - 1998. - Vol. 42. - P. 1195-1198.
Miyamoto K, Tatsumi S., Segawa H. et al. Regulation of
PiT-1, a sodium-dependent phosphate co-transporter in
rat parathyroid glands//Nephrol. Dial. Transplant. — 1999.
- Vol. 14. - Suppl. 1. - P. 73-75.
Norris K. Determining the appropriate dosage of calcijex
(calcitriol injection) for hemodialysis patients with
secondary hyperparathyroidism//Nephrol. exchange. —
1996. - Vol. 6. - P. 5-11.
Parry R., Plowman D., Delves H. et al. Silicon and
aluminium interaction in hemodialysis patiehts//Nephrol.
Dial. Transplant. — 1998. — Vol. 60. — P. 349—353.
74
Riegel W., Horl W., Heidland A. Long-term effect of
nifedipine on plasma levels of 25 hydroxyvitamin D and
1,25 dihydroxyvitamin D in hypertensive hemodialysis
patients//Klin. Wschr. — 1986 — Vol. 64. — P. 1291.
Rothmund M., Wagner P., Schark C. Subtotal parathyroi-
dectomy versus total parathyroidectomy and autotrans-
plantation in secondary hyperparathyroidism: a randomized
trial//World. Suig. - 1991. - Vol. 15. - P. 745-750.
Schaefer K, Umlauf E., Herrath D. Reduced risk of
hypercalcemia for hemodialysis patients by admistrering
calcitriol at night//Am. J. Kidney Dis. — 1992. — Vol. 9. —
P. 460-464.
Slatopolsky E., Weerts C., Thielan G. et al. Marked
suppression of secondary hyperparathyroidism by
intravenous administration 1,25 dihydroxycholecalciferol
in uremic patients//! Clin. Invest. — 1984. — Vol. 74. —
P. 2136-2143.
Tominaga Y. Mechanism of parathyroid tumourigenesis
in uraemia//Nephrol. Dial. Transplant. — 1999. — Vol.
14. — Suppl. 1. — P. 63—65.
Гпава 5
МЕТОДЫ ИССЛЕДОВАНИЯ
НЕФРОЛОГИЧЕСКИХ БОЛЬНЫХ
5.1. Исследование мочи*
Анализ мочи — важный этап обследования
нефрологического больного. В сочетании с кли-
ническим наблюдением за больным анализ
мочи способствует выяснению характера пато-
логии почек, патогенеза заболеваний, опреде-
лению активности процесса, оценке прогноза
и часто служит критерием эффективности про-
водимой терапии.
Правила сбора мочи. Общему анализу подвер-
гают среднюю порцию утренней (концентриро-
ванной) мочи, выделенной при свободном
мочеиспускании. Среднюю порцию (при тща-
тельном соблюдении гигиенических условий)
обычно используют и для выявления бактери-
урии, что позволяет избежать нежелательной,
особенно у женщин, катетеризации мочевого
пузыря. С целью предотвращения размножения
бактериальной флоры и разрушения формен-
ных элементов мочи, неизбежных при ее хра-
нении, бактериологическое исследование и
микроскопию мочевого осадка проводят не
позднее 1—2 ч после сбора мочи. Если свеже-
выпущенную мочу нельзя быстро исследовать,
ее следует держать в холодильнике.
Для ряда исследований установлены особые
правила сбора мочи. Так, для количественных
исследований учитывают всю мочу, выделен-
ную за определенный отрезок времени — 24,
12 и 3 ч (определение суточной протеинурии,
глюкозурии, пробы Каковского — Аддиса,
Амбурже), или берут строго определенный
объем мочи из разовой порции (проба Нечи-
поренко). При проведении пробы по Зимниц-
кому мочу собирают через каждые 3 ч в тече-
ние суток; для ортостатической пробы иссле-
Раздел написан Л.В.Козловской.
дуют 2 порции мочи: первую получают утром
в положении пациента лежа, вторую — через
1—2 ч после умеренных физических упражне-
ний или ходьбы. Для 3-стаканной пробы боль-
ной во время мочеиспускания собирает в 3
разных сосуда начальную (первые несколько
миллилитров), среднюю (основную часть) и
конечную (последние 10—20 мл) порции мочи,
которые затем сравнивают по величине лейко-
цитурии и эритроцитурии. Провокационные
пробы для выявления скрытой лейкоцитурии
основаны на сравнении числа лейкоцитов в
моче, выделенной до и после проведения про-
воцирующих лейкоцитурию мероприятий (вве-
дение преднизолона, пирогенала, водной на-
грузки).
При проведении общего анализа мочи на-
ряду с ручными методами исследования все
большее место занимают методы с использо-
ванием реагентных бумажных полосок, пропи-
танных различными химическими реактивами,
и таблеток-реагентов. Реагентные полоски
(Multistix) рассчитаны на определение сразу
нескольких параметров: содержания белка, глю-
козы, кетоновых тел, билирубина, уробилина,
показателя pH; в настоящее время к ним до-
бавлены еще два теста для выявления мочевой
инфекции — нитритный тест на бактериурию
и эстеразный тест на лейкоцитурию [Kiel D.P.,
Moskowitz М.Н., 1987]. Тест-полоски опускают
в мочу, выдерживают заданное время, затем
извлекают и сравнивают со шкалой, прилагае-
мой к тест-набору. Отмечают изменения окрас-
ки цветных индикаторов в участках реагирова-
ния на полосках и таким образом оценивают
реакцию мочи, наличие того или иного ком-
понента и по степени окраски — его количе-
ство. Применение этого метода значительно
упрощает и ускоряет исследование, а по точ-
ности и воспроизводимости результатов он со-
76
поставим с ручными методами, являясь в то же
время более экономичным [Woolhandler S. et al.,
1989; Pels R.J. et al., 1989].
Изменения диуреза, протеинурия, глюкозу-
рия, кетонурия описаны в других главах руко-
водства, поэтому в данном разделе они не рас-
сматриваются.
Общие свойства мочи. Анализ мочи начина-
ют с изучения общих свойств мочи, при этом
оценивают:
• цвет мочи;
• прозрачность;
• запах;
• реакцию;
• относительную плотность мочи.
Цвет мочи. Моча в норме имеет различ-
ные оттенки желтого цвета. Интенсивность ок-
раски зависит от концентрации мочевых пиг-
ментов — урохромов А и В, уророзеина, уро-
эритрина, а также копропорфирина и некото-
рых других веществ, происходящих из пигмен-
тов крови. Разведенная моча бывает бледно-
желтоватого цвета, концентрированная — на-
сыщенно-желтого (желто-коричневого) цвета.
При патологических состояниях отмечаются ко-
личественные и качественные изменения цве-
та мочи. Длительное выделение бледной, часто
почти бесцветной мочи характерно для несахар-
ного и сахарного диабета, хронической почеч-
ной недостаточности; интенсивно окрашенная
моча выделяется при лихорадочных состояни-
ях, гипертиреозе, опухолях. Качественные из-
менения цвета мочи наиболее часто связаны с
присутствием крови, продуктов распада гемо-
глобина, билирубина и его метаболитов. При-
месь свежей крови или свободного гемоглоби-
на окрашивает мочу в розово-красный цвет, ко-
торый затем может изменяться на темно-корич-
невый вследствие превращения гемоглобина
под влиянием кислотности мочи в гематин или
метгемоглобин. Присутствие миоглобина прида-
ет моче также красно-коричневую окраску.
Моча, содержащая билирубин и его дериваты,
имеет шафранно-желтую, бурую, зеленовато-
бурую окраску; при билирубинурии в желтый
цвет окрашена и пена. В ряде случаев необыч-
ная (патологическая) окраска появляется при
стоянии мочи на воздухе. Так, при экскреции
порфобилиногена (острая интермиттирующая
порфирия) моча при стоянии приобретает тем-
но-красную окраску, при выделении гомоген-
тизиновой кислоты (алкаптонурия) или мела-
ногена (меланома) — темно-коричневый, по-
чти черный цвет. Молочно-белый цвет моча
имеет при хилурии (образование фистулы меж-
ду лимфатической и мочевыводящей система-
ми из-за закупорки лимфатических сосудов
паразитами (филяриями) и, реже, вследствие
непаразитарных причин — травмы, опухоли,
туберкулеза, беременности) и липурии. Мно-
гие лекарства вызывают изменение окраски
мочи: например, фенацетин может окрашивать
мочу в буро-зеленый или темный цвет; ами-
триптилин и метиловый голубой — в зеленый
и сине-зеленый; имипенем — в коричневый,
как при гипербилирубинемии; амидопирин,
антипирин — в красный; хлорохин, рибофла-
вин — в ярко-желтый; фурагин, фурадонин,
рифампицин — в оранжевый; ацетилсалицило-
вая кислота, фенилин — в розовый; метилдо-
па, дилантин и психотропные вещества груп-
пы фенотиазина могут вызывать розовую, крас-
ную, красно-коричневую окраску мочи. В мочу
могут переходить растительные пигменты пищи
и некоторые красители (метиленовая синь,
эозин).
Осадок мочи также может быть окрашен в
различные цвета. Так, при большом содержа-
нии мочевой кислоты осадок мочи имеет вид
желтого песка, при большом количестве ура-
тов осадок бывает кирпично-красного цвета,
при наличии триппельфосфатов и аморфных
фосфатов осадок плотный, белый, гноя —
сливкообразный с зеленым оттенком, крови —
красный, слизи — студнеобразный.
Прозрачность мочи. Свежевыпущен-
ная моча здорового человека прозрачная и лишь
слегка пенится. Мутность мочи зависит от при-
сутствия большого количества солей, клеточ-
ных элементов, бактерий, слизи, жира. Мут-
ность, появляющаяся в постоявшей моче,
обычно обусловлена солями и, как правило,
значения не имеет. В то же время выделение
мутной мочи уже из мочевого пузыря является
признаком патологии. Для выяснения причины
помутнения мочи используют механические,
химические методы и микроскопию осадка.
Если помутнение исчезает после нагревания
мочи до 60 °C, то оно вызвано уратами и мо-
чевой кислотой, если мутность удаляется только
после добавления 10 % (или ледяной) уксус-
ной кислоты, то она связана с присутствием в
моче фосфатов. Исчезновение мутности после
внесения в мочу разведенной соляной кисло-
ты указывает на наличие оксалатов. Если моча
становится прозрачной после добавления спир-
та или эфира, то мутность мочи вызвана при-
сутствием жира. При большом содержании фор-
менных элементов и слизи просветление мочи
наступает после фильтрования или центрифу-
гирования. Сохранение мутности после всех
указанных мероприятий свидетельствует о бак-
териурии. От мутности необходимо избавлять-
ся при исследовании мочи на белок и сахар.
Моча, содержащая белок, пенится, причем
пена сохраняется довольно долго.
Запах мочи. В норме моча имеет слабый
77
специфический запах. Ряд пищевых и лекар-
ственных веществ (лук, чеснок, хрен, уксус, ал-
коголь, валериана, ментол) может придавать
моче своеобразный, свойственный этим веще-
ствам запах. При щелочном брожении моча при-
обретает резкий аммиачный запах. Разложение
в моче белка, крови, гноя вызывает гнилост-
ный запах; гнилостный запах может иметь и
свежевыпущенная моча при распадающемся
раке или дивертикуле мочевого пузыря.
Реакция мочи. Моча здорового челове-
ка обычно слабокислая, однако кислотность
мочи может колебаться в широких пределах (pH
от 4,5 до 8,5) в зависимости от характера пи-
тания, приема лекарств и других факторов. Кис-
лотность мочи тесно связана с функцией по-
чек по поддержанию кислотно-основного рав-
новесия — реабсорбцией и регенерацией ионов
бикарбоната и активной секрецией ионов во-
дорода; Н+-ионы, выделяющиеся в составе сла-
бых кислот (фосфорной и органических), ионов
аммония и меньше в свободном виде, подкис-
ляют мочу. Реакцию мочи ориентировочно мож-
но определить с помощью лакмусовых бумажек
или, точнее, универсальной индикаторной бу-
маги, выявляющей диапазон pH от 1,0 до 9,0,
а также тест-полосок. Для этой цели использу-
ют комбинацию бромтимолового голубого и
метилового красного. Однако более полное
представление о метаболической работе почек
получают при раздельном исследовании экс-
креции титруемых кислот и аммония наряду с
определением экскреции бикарбоната.
Щелочная реакция мочи наблюдается отно-
сительно редко: при преобладании в диете
фруктов и овощей и низком содержании бел-
ков, при приеме ощелачивающих лекарств (би-
карбонат натрия и др.), при остром респира-
торном алкалозе, в отдельных случаях метабо-
лического алкалоза, не сопровождающегося
значительной гипокалиемией, например при
большой потере Н+ и СГ с желудочным соком.
Стойкая щелочная реакция мочи (pH 8,0—
9,0) отмечается при почечном канальцевом
ацидозе — ПКА (наследственном и вторичном
при интерстициальном, в том числе лекар-
ственном нефрите, вирусных гепатитах, пер-
вичном билиарном циррозе, СКВ, синдроме
Шегрена и др.). Различают дистальный класси-
ческий ПКА (I тип), обусловленный наруше-
нием процессов подкисления мочи в дисталь-
ном отделе нефрона, и проксимальный ПКА
(II тип), связанный со снижением реабсорбции
бикарбонатов в проксимальном канальце при
сохранной способности к подкислению мочи в
дистальном канальце. Для дифференциальной
диагностики этих типов канальцевой дисфунк-
ции проводят тест с кислотной нагрузкой. Боль-
ному назначают большие дозы хлорида аммо-
78
ния (12 г/сут в течение 3 дней). У здорового
человека кислотная нагрузка приводит к сни-
жению pH до 4,5—5,5, при дистальном ПКА
pH мочи снижается лишь до 6,0—6,5, при про-
ксимальном ПКА возможно снижение pH после
нагрузки ниже 5,5.
Изменение реакции мочи на резко щелоч-
ную происходит под влиянием бактерий, рас-
щепляющих аммоний. Поэтому если свежевы-
пущенная моча имеет щелочную реакцию, не-
обходимо исключать инфекцию мочевых путей.
Резко кислая реакция мочи может отмечать-
ся при употреблении большого количества мяса
(экзогенный источник Н+-ионов), подкисляю-
щих лекарств (хлорид аммония, хлорид каль-
ция, аскорбиновая кислота), сопровождает все
виды ацидоза, кроме почечного канальцевого
ацидоза, наблюдается при подагре, лихорадке,
выраженном дефиците калия в организме.
Реакция мочи имеет значение для образова-
ния мочевых камней: резко кислая реакция
(рН<5,5) предрасполагает к образованию урат-
ных камней, в щелочной моче чаще образуют-
ся оксалатные и фосфатные камни.
Относительная плотность мочи
пропорциональна концентрации растворенных
в ней осмотически активных частиц. Измерение
относительной плотности производят с помо-
щью аэрометра-урометра, который опускают в
сосуд с мочой, чтобы он свободно плавал и не
соприкасался со стенками, и снимают показа-
ния шкалы (современный урометр калиброван
на измерение плотности от 1,000 до 1,050). На
величину относительной плотности влияет не
только количество растворенных в 1 л мочи
частиц, но и их размер и молекулярная масса.
При высокой концентрации в моче таких вы-
сокомолекулярных компонентов, как белки и
особенно глюкоза, рентгеноконтрастные веще-
ства, декстраны, в показания урометра необ-
ходимо вносить поправку. Так, величину отно-
сительной плотности мочи снижают на 0,001
при повышении концентрации белка на каж-
дые 4 г/л и глюкозы — 2,7 г/л [Strasinger S.K.,
1985]. Более точным методом оценки способно-
сти почек к осмотическому концентрированию
и разведению является определение осмоляль-
ности мочи (по точке замерзания), на показа-
тель которой мало влияет экскреция указанных
крупномолекулярных компонентов.
У здорового человека относительная плот-
ность мочи может колебаться в значительных
пределах (1,002—1,030), что зависит от количе-
ства выпитой жидкости, пищевого рациона,
интенсивности потоотделения. Максимальная
величина относительной плотности мочи дает
представление о концентрационной функции
почек. Практически эту функцию можно счи-
тать нормальной, если относительная плотность
утренней наиболее концентрированной мочи
выше 1,018.
Снижение относительной плотности мочи
отмечается при старении, избыточном употреб-
лении жидкости, малосолевой и бедной белком
диете, при применении диуретиков. Депрессия
относительной плотности мочи наблюдается
при гипофизарной недостаточности со сниже-
нием уровня в крови антидиуретического гор-
мона, при почечных канальцевых дисфункци-
ях (калийпеническая почка, синдром Фанкони,
почечный несахарный диабет), при тубулоин-
терстициальном нефрите, поликистозе почек,
гидронефрозе. Длительное выделение мочи низ-
кой относительной плотности (при исключении
вышеперечисленных причин) свидетельствует о
хронической почечной недостаточности (ХПН).
Ввиду простоты и надежности исследование от-
носительной плотности мочи утренней (наибо-
лее концентрированной) порции и на протя-
жении суток (проба Зимницкого) по-прежне-
му включают в функциональные тесты перво-
степенного значения при диагностике ХПН.
Повышение относительной плотности мочи
особенно характерно для сахарного диабета, но
может наблюдаться при больших внепочечных
потерях жидкости (лихорадочные состояния,
поносы).
Имеется связь величины относительной
плотности с интенсивностью окраски мочи
(прямая) и количеством мочи (обратная). Ис-
ключение составляет сахарный диабет, при
котором выделяется большое количество свет-
лой мочи высокой плотности.
Элементы осадка мочи. Элементы мочевого
осадка делятся на 2 группы: органические (кле-
точные элементы, цилиндры) и неорганичес-
кие (различные соли); большее практическое
(диагностическое) значение имеет изучение
элементов органического осадка. Основным
методом исследования осадка мочи является
микроскопическое изучение нативных препара-
тов с оценкой содержания форменных элемен-
тов в поле зрения микроскопа (обычный ори-
ентировочный способ). Кроме того, применя-
ют количественные методы с использованием
счетных камер и некоторые специальные мето-
ды качественного изучения клеточных элемен-
тов мочи.
Для приготовления осадка берут 10 мл мочи,
центрифугируют в течение 5 мин при 1500 об/мин,
надосадочный слой удаляют, осадок суспензи-
руют в небольшом количестве (не более ОД-
ОД мл) оставшейся мочи, каплю суспензии
переносят на предметное стекло, накрывают
покровным и изучают под микроскопом в за-
темненном поле зрения. На результат исследо-
вания при ориентировочном способе влияют
толщина слоя суспензии осадка на стекле, тол-
щина предметного и покровного стекла, сте-
пень увеличения микроскопа. Поэтому для по-
лучения сравнимых результатов необходимо
соблюдать стандартные условия приготовления
осадка мочи и его изучения. Исследование
обычно проводят при среднем увеличении мик-
роскопа (х 200), для подробного рассмотрения
клеток и цилиндров прибегают и к большему
увеличению (х 400).
При проведении качественной дифференци-
ации мочевого осадка важное значение имеет
максимальная сохранность клеточных элемен-
тов. Поскольку клеточные элементы подверга-
ются дегенерации и частично разрушаются при
центрифугировании под влиянием солей и сли-
зи в высококонцентрированной моче, то с це-
лью уменьшения влияния этих факторов иссле-
дуют либо нецентрифугированную свежевыпу-
щенную мочу, либо осадок, приготовленный из
1—2-часовой порции мочи. Чтобы избежать по-
падания клеток из нижних мочевых путей, мож-
но использовать мочу, полученную из мочевого
пузыря путем надлобковой чрескожной аспира-
ции, но к этому способу прибегают редко.
Среди органических элементов осадка мочи
изучают:
• эпителиальные клетки;
• эритроциты;
• лейкоциты;
• цилиндры.
Эпителиальные клетки, встречающиеся в
осадке мочи, бывают главным образом трех
типов. Клетки плоского эпителия
имеют большой размер, полигональную фор-
му, относительно маленькое ядро, происходят
из нижних отделов мочевого тракта (мочевого
пузыря, уретры, у женщин также влагалища и
вульвы). Число клеток плоского эпителия в нор-
ме невелико — 1—2 в поле зрения. Значитель-
ное число этих клеток, расположенных группа-
ми и тесно спаянных между собой, свидетель-
ствует о слущивании эпителиального покрова
мочевыводящих путей (например, при прохож-
дении камня, воспалении, при выведении не-
которых лекарств). При воспалительных процес-
сах в нижних мочевых путях спущенный плос-
кий эпителий нередко структурно изменен,
выглядит набухшим, имеет смазанные конту-
ры ядра и жировые включения в цитоплазме.
Клетки цилиндрического эпителия
меньше размером, имеют продолговатую, гру-
шевидную, хвостатую форму и сдвинутое к
основанию небольшое ядро. Ранее признавали
принадлежность этих клеток почечным лохан-
кам, выявление их в осадке мочи считали важ-
ными в диагностике пиелита. В настоящее вре-
мя доказано, что подобные клетки могут про-
исходить из мочеточника и отделяться от мно-
79
гослойного эпителия нижних мочевых путей.
Клетки почечного канальцевого
эпителия имеют небольшой размер (сред-
ний диаметр 13 мкм), округлую форму, цент-
рально или несколько эксцентрично располо-
женное круглое ядро, зернистость в цитоплаз-
ме. С целью дифференциации почечных тубуляр-
ных клеток от зернистых лейкоцитов к осадку
мочи (в пробирке или прямо на стекле) добав-
ляют каплю 5 % раствора уксусной кислоты или
0,1 Н хлористоводородной кислоты; кислота
просветляет цитоплазму, благодаря чему отчет-
ливее видно ядро и одноядерные эпителиаль-
ные клетки можно отличить от полиморфно-
ядерных лейкоцитов [Miller R.B., 1985]. Клет-
ки почечного эпителия лучше визуализируют-
ся в фазово-контрастном микроскопе, при этом
более четко контурируется светло-серое ядро с
наличием нуклеолы, отсутствуют движения
гранул в цитоплазме (в отличие от гранулоци-
тов, гранулы которых могут активно двигать-
ся). Однако в фазово-контрастном микроскопе
часто невозможно отличить клетки почечного
эпителия от лимфоцитов, моноцитов, плазма-
тических клеток и круглых эпителиальных кле-
ток, происходящих из других отделов мочево-
го тракта. С достоверностью круглые эпители-
альные клетки относят к почечным, когда они
обнаруживаются в составе эпителиальных ци-
линдров или выявляются группами (слепком)
наряду с клеточными и зернистыми цилиндра-
ми. Значительное число клеток почечного эпи-
телия (от 14 до 39 % всех клеточных элемен-
тов) наблюдается в осадке мочи при каналь-
цевом некрозе, эндемической нефропатии,
амилоидозе почек, тубулоинтерстициальном
нефрите, хроническом гломерулонефрите и
волчаночном нефрите, особенно с нефротичес-
ким синдромом. При нефротическом синдроме
эти клетки нередко находятся в состоянии
жирового перерождения; вследствие наполне-
ния липидами и холестерином утрачивают кон-
туры ядра и приобретают овальную форму
жировых телец. Овальные жировые тельца об-
ладают способностью сильно преломлять свет
и хорошо выявляются в поляризованном мик-
роскопе как образования, содержащие отдель-
ные круглые светящиеся включения или как
диффузно-опалесцирующие клетки [Miller R.B.,
1985]. Повышение содержания в осадке мочи де-
генеративно измененных почечных тубулярных
клеток наблюдается в начале криза отторжения
почечного трансплантата [Guder W.G., Heid-
land А., 1986]. Клетки почечного эпителия с
увеличенной и резко вакуолизированной цито-
плазмой, огромными митохондриями, выявля-
емые при электронной микроскопии, характер-
ны для интоксикации циклоспорином [Winkel-
mann М. et al., 1985].
В осадке мочи здоровых лиц могут обнару-
живаться единичные эритроциты (0—1 в
поле зрения микроскопа). Выделение эритроци-
тов с мочой обозначают термином «гематурия».
Гематурия бывает различной как по интенсив-
ности (макро- и микрогематурия), так и по
происхождению (из мочевых путей, почечная,
не связанная с органами мочевой системы, на-
пример гипокоагуляционная).
Макрогематурию определяют при ос-
мотре по изменению цвета мочи. Моча с при-
месью крови мутная (вид мясных помоев) в
отличие от мочи с содержанием кровяных пиг-
ментов (гемоглобин, метгемоглобин) и мио-
глобина, которая без наличия форменных эле-
ментов сохраняет, как правило, прозрачность.
Для разграничения гематурии, гемоглобинурии
и миоглобинурии применяют химические про-
бы на гемоглобинтолуидиновую и бензидино-
вую пробы, основанные на пероксидазной ак-
тивности гемоглобина, пробу с сульфатом ам-
мония на осаждение гемоглобина. Метод с суль-
фатом аммония достаточно прост: к 5 мл мочи
добавляют 2,8 г сульфата аммония, при этом
гемоглобин преципитирует, а миоглобин оста-
ется в растворенном виде. После фильтрации
или центрифугирования преципитаты гемогло-
бина остаются на фильтре или уходят в осадок
и моча светлеет, а в случае миоглобинурии
моча по-прежнему окрашена. Иммуноэлектро-
форез в агаровом геле является точным мето-
дом обнаружения даже малых концентраций ге-
моглобина и миоглобина. В реагентных полос-
ках используется пероксидазная активность ге-
моглобина, при этом интактные эритроциты
мочи гемолизируются на тест-бумаге, освобож-
даемый гемоглобин вызывает окисление орга-
нической перекиси, которой пропитана тест-
бумага, и изменение цвета индикатора. Ложно-
положительная реакция возможна при содер-
жании в моче оксидантов и большого количе-
ства бактерий [Fogazzi G.B., Fenili D., 1998].
Окончательно наличие эритроцитов должно
быть подтверждено при микроскопическом изу-
чении осадка мочи.
Содержание эритроцитов в осадке мочи до
100 в поле зрения микроскопа не отражается
на цвете мочи и называется микрогемату-
рией. Для выявления микрогематурии не все-
гда достаточно только ориентировочного спо-
соба исследования осадка мочи; при умеренной
и особенно минимальной гематурии прибега-
ют к количественным методам с изучением
осадка мочи в динамике. По методу Нечипорен-
ко определяют количество форменных элемен-
тов (эритроцитов, лейкоцитов, цилиндров) в
1 мл мочи, по методу Каковского — Аддиса
число подсчитанных в камере форменных эле-
ментов пересчитывают на объем суточной мочи.
80
У здорового взрослого человека выделяется не
более 1 103 эритроцитов в 1 мл мочи и не
более 1,0—1,5 • 106 эритроцитов за сутки. Для
оценки микрогематурии предпочтительнее ис-
пользовать первый метод, так как при его вы-
полнении исключается потеря клеточных эле-
ментов, связанных с хранением мочи.
Эритроциты, обнаруживаемые в моче, мо-
гут быть неизмененными и измененными. Не-
измененные (свежие) эритроциты представля-
ют собой круглые безъядерные клетки желто-
ватого цвета, обусловленного присутствием ге-
моглобина. Измененные эритроциты в зависи-
мости от реакции и относительной плотности
мочи могут иметь вид бесцветных (из-за утра-
ты гемоглобина) одно- и двухконтурных колец
(тени эритроцитов) или форму неровных с
зазубренными краями дисков. Иногда возника-
ют затруднения при дифференциации эритро-
цитов от спор дрожжевых клеток и круглых
оксалатов. Дрожжевые споры обычно овальной
формы, зеленоватого свечения, собираются
группами. В сомнительных случаях к осадку мочи
добавляют каплю разведенной уксусной кисло-
ты, при этом эритроциты растворяются, дрож-
жевые клетки остаются неизмененными. Окса-
латы круглой формы в отличие от эритроци-
тов резко преломляют свет, при вращении
микровинтом микроскопа в них выявляется
концентрическая исчерченность.
Гематурия — частый симптом заболеваний
почек и мочевыводящих путей, но возникает
иногда и у практически здоровых лиц после
больших физических напряжений, наблюдает-
ся при различных нарушениях тромбоцитарно-
го и коагуляционного гемостаза (тромбоцито-
пении и тромбоцитопатии, гемофилии, ДВС-
синдром, передозировка антикоагулянтов). Важ-
ное значение имеет топическая диагностика
гематурии — выяснение уровня ее возникно-
вения в органах мочевой системы. Для разгра-
ничения гематурии из нижних мочевых путей
и почечной гематурии, помимо инструменталь-
ных методов исследования (цистоскопия, внут-
ривенная урография, эхо- и сцинтиграфия),
применяют трехстаканную пробу. Наличие кро-
ви только в первой порции свежевыпущенной
мочи (так называемая инициальная гематурия)
свидетельствует о поражении начальной части
уретры (травма, язвенно-воспалительные про-
цессы, опухоль). Появление крови в конце мо-
чеиспускания, в третьей порции (терминальная
гематурия), наблюдается при воспалении и опу-
холях простаты и пришеечной части мочевого
пузыря, при ущемлении камня во внутреннем
отверстии уретры. Тотальная (во всех трех пор-
циях) гематурия отмечается при различных за-
болеваниях мочевого пузыря, мочеточников,
почечных лоханок, почек. Тотальная макроге-
6—2950
матурия, обычно наряду с дизурией, наблюда-
ется при геморрагических циститах (в том чис-
ле туберкулезной и паразитарной этиологии),
камнях мочевого пузыря; бессимптомная (без-
болевая) макрогематурия, возникающая вне-
запно, в первую очередь требует исключения
опухоли мочевого пузыря и почки. В зависимо-
сти от интенсивности такая гематурия может
сопровождаться образованием сгустков. Круп-
ные бесформенные сгустки, выделяющиеся при
мочеиспускании с трудом, указывают на кро-
вотечение из мочевого пузыря; длинные чер-
веобразные сгустки, формирующиеся в моче-
точниках, характерны для кровотечения из
почки или почечной лоханки. Иногда червеоб-
разные сгустки выделяются при поликистозной
деформации и камнях почки, в последнем слу-
чае им предшествует почечная колика.
Гематурия, происходящая из почки (почеч-
ная гематурия), требует ориентации во многих
как нефрологических (терапевтических), так и
урологических заболеваниях.
Механизм почечной гематурии может быть
связан с механическим повреждением и дест-
руктивными процессами в почечной ткани, с
почечной венной гипертензией — нарушением
венозного оттока и развитием венозно-лоханоч-
ного рефлюкса, некротизирующим почечным
ангиитом, приобретенным (иммунное воспале-
ние) или наследственным поражением клубоч-
ковой базальной мембраны, почечной внутри-
сосудистой коагуляцией, токсическим или вос-
палительным поражением интерстиция и ка-
нальцевого эпителия.
Почечная гематурия бывает макро- и мик-
роскопической. При урологических заболеваниях
(травмы, опухоли, камни почек, нефроптоз,
аномалия развития почечных сосудов, тромбоз
почечных вен) часто наблюдается макрогема-
турия, при нефропатиях (первичный гломеру-
лонефрит, наследственные нефриты, нефриты
при системных заболеваниях, алкогольная и
подагрическая нефропатия, лекарственные по-
ражения почек) чаще, чем при урологических
заболеваниях, отмечается микрогематурия. Од-
нако при таких нефропатиях, как острый гло-
мерулонефрит, IgA-нефропатия, синдром Гуд-
пасчера, люмбалгически-гематурический синд-
ром, нередка макрогематурия. По клиническим
особенностям гематурия при урологических
заболеваниях бывает, как правило, односторон-
ней, часто изолированной и болевой, гемату-
рия при нефропатиях двусторонняя обычно без-
болевая, сочетается с протеинурией (цилинд-
рурией). В то же время рецидивирующая изоли-
рованная гематурия при гематурическом нефри-
те (болезни Берже) иногда может сопровож-
даться болью.
На практике дифференциальный диагноз
81
почечной гематурии достаточно труден, вклю-
чает разнообразные методы исследования ча-
шечно-лоханочной и сосудистой систем почек
(в том числе ретроградную пиелографию, ком-
пьютерную томографию, ангиографию). Роль
клинического исследования мочи для этой цели
ограничена. При установлении связи гематурии
с нефроптозом и патологически подвижной
почкой определенное значение придают орто-
статической пробе — появлению или усилению
гематурии в порции мочи после физической
нагрузки.
Для разграничения так называемой гломеру-
лярной и негломерулярной гематурии целесо-
образно изучение структуры эритроцитов мочи
в фазово-контрастном микроскопе. Морфологи-
ческие изменения эритроцитов в осадке мочи
определяются и в световом микроскопе, но
фазово-контрастная микроскопия дает возмож-
ность осмотреть большее число эритроцитов и
их фрагментов, лучше детализировать морфо-
логическую картину. Выявление в моче более
80 % структурно измененных (дисморфных)
эритроцитов с неравномерной разорванной, не-
редко ундулирующей мембраной, резко разли-
чающихся по величине, указывает на гломеру-
лярный генез гематурии (гломерулонефриты).
Обнаружение более 80 % неизмененных пра-
вильной формы и одинакового размера (изо-
морфных) эритроцитов свидетельствует о не-
гломерулярном происхождении гематурии (уро-
логические заболевания).
При отсутствии явного преобладания того
или иного вида эритроцитов гематурию обозна-
чают как смешанную. Смешанная популяция
эритроцитов не позволяет определенно выска-
заться относительно источника гематурии. Це-
лесообразность использования метода фазово-
контрастной микроскопии осадка мочи для
уточнения характера гематурии подтверждена
рядом работ.
Однако на практике различить дисморфную
популяцию эритроцитов не всегда легко, ме-
тод недостаточно надежен при выраженной
гематурии, почечной недостаточности, форси-
рованном диурезе [Tomita М. et al., 1992]. Кро-
ме того, остается до конца не ясным, обяза-
тельно ли дисморфизм эритроцитов свидетель-
ствует о гломерулярном источнике кровопоте-
ри. По данным А.А.Щербина и А.Ю.Николае-
ва (1985), преобладание в моче морфологичес-
ки измененных эритроцитов свойственно не
только гломерулонефриту, но наблюдается и
при интерстициальном нефрите.
В слепом исследовании G.V.Raman и соавт.
(1986) также показали, что при интерстициаль-
ном нефрите гематурия характеризуется либо
морфологически измененной, либо смешанной
популяцией эритроцитов. По материалам этих
82
авторов, специфичность метода не столь высо-
ка, более информативным для определения
гематурии, обусловленной почечными паренхи-
матозными заболеваниями (гломеруло- и интер-
стициальные нефриты), оказалось изучение в
фазово-контрастном микроскопе кровяных
(эритроцитарных) цилиндров в нецентрифуги-
рованной моче.
Исследованиями последних лет установлено,
что высокоспецифичным в определении гломе-
рулярной гематурии является обнаружение в
моче акантоцитов (эритроциты с неровной вол-
нистой поверхностью в виде кленового листа).
В количестве не менее 5 % всех эритроцитов
осадка мочи они выявляются только при гло-
мерулонефрите [Kohler Н. et al., 1991; Lettgen В.,
Wohlmuth А., 1995].
У здорового человека в осадке мочи обна-
руживают единичные лейкоциты (0—1 в
поле зрения микроскопа у мужчин и до 5—6 —
у женщин). Выделение лейкоцитов с мочой в
количестве более 5 в поле зрения микроскопа
обозначают термином «лейкоцитурия» (пиурия).
Выраженную лейкоцитурию (пиурию) можно
заподозрить при внешнем осмотре по диффуз-
ному помутнению мочи и наличию комочков
и хлопьев.
При использовании полосок диагностика
лейкоцитурии основывается на эстеразной ак-
тивности гранулоцитов. Реакция специфична
для лейкоцитов, как интактных, так и лизи-
рованных в среде низкой плотности, и при ще-
лочной pH, когда микроскопическое исследова-
ние затруднено. Ложноположительные результа-
ты возможны при содержании в моче кетоно-
вых тел, цефалексина, цефалотина, нитрофура-
нов, тетрациклина, тобромицина [Fogazzi G.B.,
Fenili D., 1998]. Лейкоцитурия должна подтвер-
ждаться при микроскопическом исследовании
осадка мочи.
Лейкоциты в осадке мочи имеют вид круг-
лых серого цвета зернистых клеток со слабокон-
турированным ядром. При выраженной пиурии
они густо покрывают поле зрения микроскопа,
представляют плохо дифференцируемую массу,
содержащую клеточный детрит, и не подлежат
подсчету. Менее значительная лейкоцитурия
может быть оценена количественно. Методы с
использованием счетных камер (по Нечипорен-
ко, Каковскому — Аддису) позволяют более
точно определить наличие, степень лейкоциту-
рии и ее динамику, что особенно ценно при
небольшой и минимальной лейкоцитурии. Факт
лейкоцитурии подтверждается, если выделяет-
ся более чем 4 • 103 лейкоцитов в 1 мл мочи,
более 2 • 106 за сутки. Для выявления скрытой
лейкоцитурии применяют провокационные те-
сты, чаще преднизолоновый: больному внутри-
венно вводят 30 мг преднизолона, после чего
собирают 4 порции мочи (три — каждый час и
одну — спустя сутки). Тест считается положи-
тельным, если хотя бы в одной из 4 порций
мочи число лейкоцитов в 1 мл возрастает в 2
раза по сравнению с исходным. Преднизолоно-
вый тест малоспецифичен, так как может быть
положительным при любой локализации вос-
палительного процесса в мочевом тракте.
После выявления лейкоцитурии выясняют ее
источник (из мочевых путей или почек) и ге-
нез (инфекционная или асептическая). Для диф-
ференциации лейкоцитурии из ниж-
них мочевых путей и почечной лейко-
цитурии применяют трехстаканную пробу, при
необходимости исследуют мочу, взятую раз-
дельно из мочевого пузыря и почечных лоха-
нок (цистоскопия с катетеризацией мочеточни-
ков), используют другие методы исследования
(внутривенная урография, радиоизотопное и
ультразвуковое сканирование). О происхожде-
нии лейкоцитов из почки свидетельствует од-
новременное выявление в осадке мочи лейко-
цитарных и зернистых цилиндров.
Наряду с топической диагностикой лейко-
цитурии важное практическое значение имеет
уточнение характера (генеза) почечной
лейкоцитурии. Трактовка любой лейкоци-
турии как инфекционной может повлечь за
собой ошибки в диагностике и лечении (не-
обоснованное назначение антибиотиков). Мас-
сивная пиурия практически всегда является ин-
фекционной; умеренная лейкоцитурия (до 30—
40 в поле зрения микроскопа, до 30—50 • 103 в
1 мл мочи) может быть и асептической.
Инфекционная лейкоцитурия характерна для
острого и хронического пиелонефрита, однако
вне обострения и при латентном течении хро-
нического пиелонефрита лейкоцитурия может
не обнаруживаться, иногда она отсутствует и
при тяжелом обострении — обструктивном и
апостематозном пиелонефрите (в таких случа-
ях показаны провокационные пробы). Асепти-
ческая лейкоцитурия отмечается при обостре-
нии хронического гломерулонефрита (первич-
ного и волчаночного), при хроническом оттор-
жении почечного трансплантата, в ряде случа-
ев амилоидоза и интерстициального нефрита.
Для разграничения двух видов почечной лей-
коцитурии (септической и асептической) име-
ют значение бактериологическое исследование
мочи, изучение качественных особенностей
лейкоцитов.
Выявление значительной бактериурии (более
1 • 105 в 1 мл мочи) указывает на инфекцион-
ный генез лейкоцитурии. Однако посев мочи не
всегда является надежным дифференциально-
диагностическим критерием при пиелонефри-
те, что связано с интермиттирующим характе-
ром бактериурии, а также с трудностями вы-
явления протопластов и L-форм бактерий, иг-
рающих немаловажную роль в течении заболе-
вания.
Качественная дифференциация лейкоцитов
в осадке мочи возможна с помощью специаль-
ных окрасок и при применении фазово-контра-
стной микроскопии.
На суправитальной окраске осадка мочи раство-
ром сафранина или метиленового синего с добав-
лением дистиллированной воды основан метод оп-
ределения так называемых активных лейкоци-
тов. Метод предложен для диагностики пиелонеф-
рита, в том числе и острого. Однако выявление ак-
тивных (живых) лейкоцитов характерно не только для
пиелонефрита, но и для воспалительных заболеваний
нижних мочевых путей и половых органов. В отличие
от активных лейкоцитов клетки Штернгеймера —
Мальбина (бледно-окрашенные, увеличенные в раз-
мере лейкоциты с водной вакуолью в цитоплазме и
движущимися гранулами вокруг сдвинутого к пери-
ферии ядра) образуются уже в мочевых путях (обыч-
но при относительной плотности мочи ниже 1,018 и
pH выше 5,1), для их обнаружения в осадке мочи
применяется окраска сафранином и генциановым
фиолетовым. Клетки были впервые описаны в моче
больных хроническим пиелонефритом, однако этот
тест также оказался малоспецифичным.
Фазово-контрастная микроскопия позволя-
ет различать нейтрофилы с темным сегменти-
рованным ядром, яркой цитоплазмой и часто
подвижными гранулами и мононуклеарные
клетки с круглым или почкообразным ядром и
светлой гранулярной цитоплазмой, среди ко-
торых можно выделить клетки почечного эпи-
телия. Однако с помощью фазово-контрастно-
го микроскопа не классифицируются частично
дегенерированные клетки, не всегда легко диф-
ференцировать и неизмененные мононуклеар-
ные клетки, например клетки почечного эпи-
телия и лимфоциты; практически не различа-
ются лимфоциты от макрофагов и макрофаги
от круглого почечного эпителия с включения-
ми в цитоплазме.
Нейтрофильные гранулоциты могут быть марки-
рованы цитохимической окраской на миелоперокси-
дазу или хлорацетатэстеразу, не содержащихся в
лимфоцитах и эпителиальных клетках. С помощью
этих окрасок удается четко отграничить нейтрофи-
лы от остальных клеток мочевого осадка и таким
образом оценить истинную величину нейтрофилу-
рии, что имеет значение для дифференциальной ди-
агностики хронического пиелонефрита. Миелоперок-
сидазная реакция, несмотря на высокую специфич-
ность, оказывается отрицательной в пикнотически
измененных гранулоцитах; окраска на эстеразу бо-
лее стабильна, она положительна даже при значи-
тельных колебаниях pH мочи и в клетках с выра-
женными явлениями кариолизиса, это важно, в
частности, для определения гранулоцитов в составе
лейкоцитарных цилиндров. На эстеразной активно-
6*
83
сти нейтрофилов основан тест на выявление лейко-
цитурии в современных реагентных полосках: нейт-
рофильные эстеразы катализируют гидролиз эфира
индоксилкарбоновой кислоты в индоксил на полоске
с появлением красного цвета индикатора [Kiel D.P.,
Moskowitz М.Н., 1987].
Дополнительные возможности для дифференци-
ации отдельных видов лейкоцитов дает морфологи-
ческое исследование мазков из осадка мочи, фик-
сированных метанолом и окрашенных азур-эозином
(по Папенгейму, Нохту). При отсутствии значитель-
ных сдвигов в реакции мочи (резко щелочная или
резко кислая) достаточно хорошо дифференцируют-
ся нейтрофилы (по характерному сегментированно-
му ядру), лимфоциты (по наличию круглого плот-
ного ядра, занимающего большую часть клетки, и
узкого ободка синей цитоплазмы вокруг) и эозино-
филы (по крупной, сохраняющей розовый цвет зер-
нистости), менее четко — моноциты-макрофаги
(большие клетки с округлым ядром и грубой нерав-
номерно расположенной темной зернистостью в
цитоплазме). Но и при этой окраске возникают труд-
ности в разграничении лимфоцитов и круглого по-
чечного эпителия; эпителиальные клетки несколько
крупнее лимфоцитов, имеют более широкую цито-
плазму (часто с неровным краем) и менее плотное
ядро. Несколько облегчает диагностику лимфоцитов
применение специфической окраски метиловым зе-
леным пиронином.
В норме в окрашенных мазках мочи выявля-
ются главным образом нейтрофилы, но абсо-
лютное содержание их низкое, лимфоциты со-
ставляют в среднем около 2 %.
Нейтрофилы (до 90—100 % всех лейкоцитов)
являются преобладающими клеточными эле-
ментами осадка мочи при пиелонефрите (и
инфекционно-воспалительном процессе в дру-
гих отделах мочевого тракта). При этом нейт-
рофилурия обычно абсолютная, так как она
обнаруживается на фоне лейкоцитурии, в ост-
рой фазе болезни нередко весьма значительной.
Такие нейтрофилы хорошо сохранены морфо-
логически (живые «активные» лейкоциты), за
исключением случаев массивной пиурии, когда
цитоморфологическое исследование затруднено.
Усиление выделения лимфоцитов с мочой
(более 20 % всех лейкоцитов) — лимфоци-
турия — отмечается у больных с трансплан-
татом почки, что является предвестником криза
отторжения [Sandoz P.F. et al., 1986].
Увеличение содержания лимфоцитов харак-
терно для асептической лейкоцитурии при обо-
стрении хронического гломерулонефрита и вол-
чаночного нефрита. По нашим данным [Козлов-
ская Л.В., 1987], доля лимфоцитов среди лей-
коцитов осадка мочи у больных с активными
формами хронического гломерулонефрита со-
ставляет в среднем 37 %, волчаночного нефри-
та — 40 %; наиболее высокие показатели (до
65—80 % всех лейкоцитов мочевого осадка) от-
мечены у больных активным волчаночным не-
84
фритом. При ремиссии нефрита содержание
лимфоцитов в моче снижается одновременно с
уменьшением общего числа лейкоцитов. При-
соединение вторичной инфекции сдвигает мо-
чевую лейкоцитарную формулу в пользу нейт-
рофилов, при этом увеличивается и общее ко-
личество лейкоцитов в моче.
Лимфоцитурия обычно наряду с эозино-
фил ур ие й описана также у больных интер-
стициальным нефритом. Эозинофилы в осадке
мочи лучше выявляются при окраске по Райту
и ее модификации [Nolan C.R. et al., 1986]. Зна-
чительная эозинофилурия (более 5 % всех лей-
коцитов мочи) является характерным призна-
ком острого лекарственного интерстициально-
го нефрита, отличающим его от острого тубу-
лонекроза [Lenku A.L. et al., 1980; Gorwin H.L.
et al., 1985]. При индуцированном метицилли-
ном остром интерстициальном нефрите эози-
нофилы в осадке мочи могут составлять 10—
60 %. Единичные эозинофилы обнаруживают в
моче и при гломерулонефрите — быстропрог-
рессирующем, мезангиопролиферативном, в
том числе IgA-нефропатии, остром постинфек-
ционном.
Белковую основу цилиндров составля-
ют уромукоид Тамма —Хорсфолла, секретиру-
емый эпителием восходящего колена петли
Генле, и агрегированные плазменные белки.
Цилиндрообразование происходит в дистальном
отделе нефрона, за исключением цилиндров из
легких пептидных цепей при множественной
миеломе, которые формируются, как показа-
ли гистологические исследования, в прокси-
мальном нефроне. Преципитации белка Там-
ма — Хорсфолла и плазменных белков, ведущей
к цилиндрообразованию, способствует измене-
ние концентрации электролитов, осмолярнос-
ти и pH мочи [Miller R.B., 1985].
Цилиндры бывают белковые (гиалиновые и
восковидные) и содержащие в белковом мат-
риксе различные включения (клетки, клеточ-
ный детрит, соли, жир).
Гиалиновые цилиндры состоят по-
чти исключительно из белка Тамма — Хорсфол-
ла, имеют гомогенную структуру, прозрачные,
нередко с прилипшими к поверхности единич-
ными клеточными элементами и солями. Гиа-
линовые цилиндры являются наиболее частым
видом цилиндров при патологии почек, обна-
руживаются также у здоровых лиц (не более 100
в 1 мл мочи), особенно в утренней концент-
рированной порции, после физической нагруз-
ки, дегидратации, у больных с лихорадкой, ос-
трой сердечной недостаточностью, получающих
фуросемид или этакриновую кислоту. Гиалино-
вые цилиндры необходимо отличать от так на-
зываемых цилиндроидов — узких длинных сли-
зисто-фиброзных нитей.
Восковидные цилиндры из-за более
плотного расположения белка имеют желтова-
тый цвет, резко очерчены, сильнее, чем гиа-
линовые цилиндры, преломляют свет. Услови-
ем образования восковидных цилиндров иссле-
дователи считают длительное пребывание их
(стаз) в канальцах. Есть основание полагать, что
восковидные цилиндры состоят преимуще-
ственно из белков плазменного происхождения,
так как иммунофлюоресцентным методом бел-
ка Тамма — Хорсфолла в них обнаружить не
удалось [Fogazzi G.B., Fenili D., 1998]. Воско-
видные цилиндры обнаруживаются чаще при
хронических нефропатиях, но могут наблюдать-
ся и при остром гломерулонефрите, остром
тубулярном некрозе; в моче здоровых лиц они
отсутствуют.
Клеточные цилиндры возникают вследствие
экссудативных, геморрагических или деструк-
тивных процессов в нефроне, всегда указывая
на почечное происхождение составляющих их
клеток. В связи с этим разграничение отдель-
ных видов клеточных цилиндров имеет важное
практическое (дифференциально-диагностичес-
кое) значение. Эритроцитарные (кро-
вяные) цилиндры распознаются по ха-
рактерному розовому цвету содержащихся в них
интактных эритроцитов. Эритроциты в кровя-
ных цилиндрах легко разрушаются, так что
очертания клеток исчезают, однако розово-ко-
ричневое окрашивание сохраняется вследствие
пропитывания гиалинового матрикса пигмен-
том (гемоглобином). Кровяные цилиндры вы-
являются преимущественно при гематуриях,
связанных с гломерулярными поражениями
(гломерулонефриты, васкулиты), но могут об-
наруживаться и при интерстициальном нефри-
те, при тубулярном некрозе, инфаркте почки.
Частота выявления эритроцитарных цилиндров
при гломерулярных гематуриях повышается при
исследовании в фазово-контрастном микроско-
пе нецентрифугированной мочи [Raman G.V. et
al., 1986]. Лейкоцитарные цилиндры
содержат обычно полиморфно-ядерные грану-
лоциты, но могут включать и другие типы лей-
коцитов (эозинофилы, лимфоциты). Лейкоци-
тарные (нейтрофильные) цилиндры характер-
ны для пиелонефрита (острого и обострения
хронического), редко они выявляются при гло-
мерулонефрите (с включением лимфоцитов).
Эозинофильные цилиндры могут выявляться
при остром лекарственном интерстициальном
нефрите. Лейкоцитарные цилиндры трудно от-
личить от эпителиальных цилиндров не только
в обычном световом микроскопе, но и в фазо-
во-контрастном микроскопе из-за дегенератив-
ных изменений клеток. Для дифференциации
этих двух видов цилиндров применяют цито-
химическую окраску на хлорацетатэстеразу,
специфически выявляющую гранулы нейтро-
фильных лейкоцитов, что позволяет отграни-
чить лейкоцитарные (нейтрофильные) цилин-
дры от эпителиальных цилиндров и других кле-
точных агрегатов (лимфоцитарных, эозино-
фильных, моноцитарных). Эпителиальные ци-
линдры свидетельствуют о десквамации почеч-
ного канальцевого эпителия, выявляются при
остром канальцевом некрозе, вместе с лейко-
цитарными цилиндрами при остром воспале-
нии почечной паренхимы. Кроме клеточных ци-
линдров, состоящих из одного типа клеток, в
моче могут наблюдаться смешанно-клеточные
цилиндры, содержащие почечный канальцевый
эпителий и эритроциты и(или) лейкоциты;
такие смешанно-клеточные цилиндры обнару-
живаются преимущественно при гломерулонеф-
ритах. Среди эпителиальных клеток в цилинд-
рах нередко присутствуют овальные жировые
тельца, иногда жировые тельца разной величи-
ны занимают всю площадь цилиндра. Цилинд-
ры с жировыми включениями легко всплыва-
ют на поверхность мочи, поэтому для их обна-
ружения исследуют не только осадок, но и
верхний слой мочи. Жировые цилиндры
хорошо распознаются при люминесцентной
микроскопии: отмечаются либо отдельные све-
топреломляющие шары, либо общая опалес-
ценция цилиндра. Жировые цилиндры выявля-
ются только при выраженной протеинурии —
при нефротическом синдроме различной эти-
ологии.
Зернистые цилиндры — непрозрач-
ные, грубые, содержат большое количество гра-
нулярных включений. Грануляции в зернистых
цилиндрах считают остатками дегенерирован-
ных клеток, однако с помощью иммунофлюо-
ресцентного метода показано, что многие из
них являются преципитированными сывороточ-
ными протеинами в матриксе белка Тамма —
Хорсфолла [Miller R.B., 1985]; мелкозернистые
цилиндры рассматривают иногда как предста-
дию восковидных цилиндров. Зернистые цилин-
дры, как и восковидные, — всегда признак
органического заболевания почек. Они выявля-
ются при пиелонефрите, гломерулонефрите,
особенно при нефротическом синдроме. Одна-
ко не отмечается прямой зависимости между
выраженностью цилиндрурии и тяжестью по-
чечного поражения; при туберкулезе почки
цилиндры обнаруживаются крайне редко.
В моче могут наблюдаться необычно широ-
кие цилиндры, предположительно образующи-
еся в собирательных трубках при значительном
замедлении тока мочи по ним. Появление ши-
роких цилиндров сопутствует выраженному
снижению почечных функций, в связи с чем
эти цилиндры называют также цилиндрами
«почечной недостаточности».
85
Помимо цилиндров, надежно подтверждающих
почечное происхождение встроенных в их матриксе
клеточных элементов, для дифференциации пораже-
ний верхнего и нижнего отделов мочевого тракта
показана роль выявления в моче свободных клеток,
покрытых белком Тамма — Хорсфолла [Abrass С.К.,
Laird C.W., 1987]. Белок Тамма — Хорсфолла на сво-
ей поверхности может иметь клетки всех типов
(эритроциты, лейкоциты, почечный тубулярный
эпителий), для их определения применяют иммуно-
флюоресцентный метод с антисывороткой к чело-
веческому белку Тамма — Хорсфолла. Относитель-
ное содержание клеток, покрытых белком Тамма —
Хорсфолла, в мочевом осадке при паренхиматозных
заболеваниях почек (хронический гломерулонефрит,
интерстициальный нефрит и др.) составляет 50—
60 %, при заболеваниях нижних мочевых путей — ме-
нее 12 %, у здоровых лиц — от 0 до 8 %.
Неорганический осадок. В моче могут содер-
жаться различные кристаллы; одни из них вы-
являются при кислой, другие — при щелочной
реакции мочи.
Кристаллы мочевой кислоты обнаруживают в
кислой моче. Они имеют форму таблеток, бо-
чонков, часто собранных в пучки, розеток (дру-
зы) янтарно-коричневого цвета, обладают
свойством двойного лучепреломления в поля-
ризованном свете, образуют кирпичного цвета
осадок при стоянии (охлаждении) мочи.
Кристаллы оксалата кальция — моногидра-
та и дигидрата — встречаются в моче любой pH;
первые имеют вид светопреломляющих оваль-
ных частиц, гантелей, двояковогнутых дисков,
вторые — типичную бипирамидальную форму
конвертов, не преломляющих свет. Соли фос-
фата кальция выявляются в щелочной моче в
форме не поляризующих свет пластинок с зер-
нистой поверхностью, кристаллов, имеющих
вид светопреломляющих иголок или розеток.
Трипелъфосфаты (аммонийно-магниевые
фосфаты) — прозрачные двоякопреломляющие
свет призмы (в виде «гробовых крышек») боль-
шого размера, которые обычно легко распоз-
наются.
Аморфные ураты и фосфаты морфологичес-
ки неразличимы, выглядят как гранулярный
материал, нередко склеенный в конгломераты.
Однако ураты обнаруживаются в кислой, а
фосфаты — в щелочной моче, при этом пер-
вые преломляют свет, вторые этим свойством
не обладают.
Кристаллы холестерина имеют вид прозрач-
ных тонких пластинок коричневого цвета с за-
остренными краями и острыми углами, выяв-
ляются в моче пациентов с выраженной про-
теинурией (нефротический синдром). Кристал-
лы цистина (обнаруживаются при цистину-
рии) — неправильной формы гексагональные
двоякопреломляющие свет пластинки, накла-
дывающиеся друг на друга или собранные в
86
пучки, розетки; видны только при очень кис-
лой pH мочи.
Кристаллы тирозина имеют вид тонких иго-
лок, сгруппированных в связки или розетки;
кристаллы лейцина выглядят как масляные ша-
рики с концентрической исчерченностью. Оба
вида кристаллов обнаруживают у больных с
тяжелым поражением печени.
Мочекислая, оксалатная и фосфатная кри-
сталлурия сама по себе не считается патологи-
ческим явлением. Несмотря на то что в свеже-
собранной и исследованной при 37 °C моче лиц
с мочекаменной болезнью содержится больше
кристаллов и их агрегатов, чем в моче здоро-
вых лиц, на основании одной кристаллурии
невозможно судить о наличии камня и его при-
роде. Образование солей и их преципитация в
кристаллы зависят от нарушений солевого об-
мена, но также и от характера пищи, объема
мочи, изменения температуры и pH мочи при
ее стоянии. В некоторых случаях (острая моче-
кислая нефропатия, интоксикация этиленгли-
колем, прием высоких доз сульфаниламидов,
ацикловира) кристаллурия может быть связа-
на с выпадением кристаллов в канальцах по-
чек. К факторам риска острой канальцевой бло-
кады с развитием ОПН относятся массивная и/
или атипичная кристаллурия и выявление со-
держащих соли цилиндров [Fogazzi G.B., 1998].
Появление в моче цистина, тирозина, лейци-
на, холестерина — всегда признак патологии.
Кроме того, в осадке мочи могут выявлять-
ся:
• бактерии;
• грибы;
• простейшие;
• паразиты.
Бактерии. В осадке мочи обнаруживают кок-
ковую и палочковую флору часто вследствие
попадания из воздуха при стоянии (хранении)
мочи. Присутствие лейкоцитов в моче повышает
вероятность связи бактериурии с мочеполовой
инфекцией. Для исключения загрязнения мочи
бактериями и лейкоцитами из половых органов,
особенно у женщин, важное значение имеет со-
блюдение правил сбора мочи с использовани-
ем стерильной посуды. О почечном происхож-
дении бактериурии и лейкоцитурии (пиелонеф-
рит) свидетельствует обнаружение зернистых и
лейкоцитарных цилиндров; при остром пиело-
нефрите описаны и бактериальные цилиндры.
Грибы. Наиболее часто в моче находят грибы
рода Candida, которые имеют вид светящихся
зеленоватых клеток вытянутой овоидной и сфе-
рической формы, имеющих ядро и хорошо кон-
турированную стенку; характерный морфологи-
ческий признак — наличие отпочкований. Та-
кие грибы могут попадать в мочу из половых
органов, но могут происходить и из мочевых
путей.
Размножение грибов рода Candida в мочевом
тракте наблюдается у пациентов, страдающих
сахарным диабетом и структурными аномали-
ями, с постоянными катетерами, при длитель-
ной терапии антибиотиками или иммуносупрес-
сорами.
Простейшие. Trichomonas vaginalis могут при-
сутствовать в моче как мужчин, так и женщин,
обычно поступая из отделяемого половых ор-
ганов. Они имеют 4 жгутика, круглую или гру-
шевидную форму и размер несколько больший,
чем у нейтрофила. Живые трихомонады иден-
тифицируют по быстрому беспорядочному дви-
жению тела и подвижным жгутикам.
Паразиты. В моче могут обнаруживаться яйца
Schistosoma haemotobium, что служит основани-
ем для диагностики этого вида шистосомоза.
У детей с энтеробиозом в мочу могут попадать
(из ануса или половых органов) яйца Enterobins
vermicularis, что нужно учитывать при исследо-
вании осадка мочи.
Значение исследования мочи для оценки ак-
тивности нефрита. Оценка активности нефрита
основывается на анализе клинических особен-
ностей заболевания и изучении морфологичес-
кой картины. Среди клинических признаков
активности почечного процесса исследование
мочи имеет немаловажное практическое значе-
ние.
Об активности нефрита в первую очередь
свидетельствует нарастание протеинурии, осо-
бенно формирование нефротического синдро-
ма (НС) и усиление гематурии, лейкоцитурии
(«богатый» мочевой осадок). Возникновение НС
практически всегда рассматривают как клини-
ческий эквивалент активности нефрита, одна-
ко необходимо учитывать существование форм
нефротического нефрита, длительно (годами)
персистирующего без тенденции к прогресси-
рованию, и возможную связь НС с развитием
осложнений (тромбоз почечных вен, инфекция,
аллергические реакции). Только по величине
гематурии не всегда можно судить об активно-
сти нефрита: выраженная гематурия характер-
на для IgA-нефропатии часто доброкачествен-
ного течения, наблюдается при наследственном
нефрите, интерстициальном нефрите с гипер-
оксалурией, люмбалгически-гематурическом
синдроме, где роль иммуновоспалительных и
других механизмов активности не столь очевид-
на, может быть обусловлена лекарственными
(сульфаниламиды, аминогликозиды, анальгети-
ки) и токсическими (алкоголь, соли лития)
воздействиями, гемокоагуляционными ослож-
нениями (ДВС-синдром, передозировка анти-
коагулянтов).
Дополнительным тестом при определении
активности нефрита является цитоморфологи-
ческое изучение осадка мочи. Как указывалось
выше, у больных с обострением гломерулонеф-
рита независимо от его этиологии (первичный
или волчаночный) закономерно выявляется
лимфоцитурия (более 20 %), обычно на фоне
увеличенного содержания лейкоцитов в 1 мл
мочи.
Стойкое повышение содержания лимфоци-
тов в моче свидетельствует о сохраняющейся
активности заболевания и имеет неблагоприят-
ное прогностическое значение. Однако необхо-
димо иметь в виду, что определение содержа-
ния лимфоцитов в моче целесообразно прово-
дить только при наличии лейкоцитурии (более
3000 в 1 мл мочи).
Из других «мочевых» тестов для оценки ак-
тивности нефрита имеет значение исследование
ферментурии, прежде всего содержания тех
ферментов, которые у здоровых лиц или отсут-
ствуют, или выявляются в минимальных коли-
чествах. Среди органоспецифических ферментов
ценно исследование трансаминидазы, уровень
которой в моче прямо коррелирует со степе-
нью активности нефрита.
Е.М.Тареев и соавт. (1985) показали, что при
добавлении мочи больных волчаночным нефритом,
ХГН к лейкоцитарной взвеси из крови здоровых лиц
воспроизводятся клеточные феномены, подобные
тем, которые обнаруживаются в крови больных СКВ:
LE-клетки, внеклеточный ядерный материал — так
называемые круглые гомогенные гематоксилиновые
тельца (КГГТ), фагоцитоз целых клеток — эритро-
цитов, тромбоцитов, лейкоцитов (эритроцитофагия).
Все указанные клеточные феномены индуцируются
наиболее часто при внесении мочи больных с быс-
тропрогрессирующими формами нефрита.
С помощью метода непрямой иммунофлюорес-
ценции в моче этих больных выявляются антинук-
леарные факторы (АНФ); АНФ в крови определя-
ются только у больных СКВ.
Частое выделение АНФ, индуцирующих образо-
вание LE-клеток с мочой больных нефритом про-
гностически неблагоприятных форм позволяет счи-
тать, что механизм их образования в почке тесно
связан с общими патогенетическими закономерно-
стями прогрессирования нефропатий.
Мы также изучили содержание в моче больных
хроническим гломерулонефритом и волчаночным не-
фритом хемотаксических факторов, свободных кис-
лородных радикалов, фибронектина, антигена фак-
тора Виллебранда и его активного компонента [Коз-
ловская Л. В. и др., 1994; Бобкова И.Н. и др., 1995]
и установили, что уровень экскреции с мочой этих
факторов прямо коррелирует с активностью заболе-
вания. При этом высокая концентрация в моче фиб-
ронектина может служить критерием неблагоприят-
ного прогноза, свидетельствуя об интенсивности
процессов фиброзирования в почке.
Таким образом, исследования мочи как суб-
страта, тесно связанного с больным органом
87
(почкой), могут дать новые эффективные под-
ходы к оценке сложных механизмов развития
местной иммуновоспалительной реакции и
определению практически важных критериев
активности и прогноза нефрита.
5.2. Оценка функционального
состояния почек*
Функциональное состояние почек отражает
способность совокупности почечных функций
обеспечивать гомеостаз внутренней среды орга-
низма. К функциям почек относят:
• поддержание постоянства концентрации ос-
мотически активных веществ в крови и дру-
гих жидкостях тела (осморегуляция);
• участие в регуляции объема крови и внекле-
точных жидкостей (волюморегуляция);
• регуляцию ионного состава крови;
• регуляцию кислотно-основного состояния;
• экскрецию конечных продуктов азотистого
обмена и чужеродных веществ;
• экскрецию избытка ряда органических ве-
ществ (аминокислот, глюкозы и др.);
• регуляцию АД и эритропоэза.
Эти функции почек обеспечиваются путем
ультрафильтрации жидкости в почечных клу-
бочках, транспортных процессов, осуществля-
емых паренхимой органа, и синтезом почкой
биологически активных веществ (ренина), ак-
тивной формы витамина D, простагландинов
и т.д. Физиологическое назначение гомеостати-
ческих почечных функций состоит прежде все-
го в регуляции постоянства объема, минераль-
ного состава и кислотно-основного состояния
внутренней среды организма и, в частности,
плазмы крови.
В клинической практике для характеристики
функционального состояния почек оценивают
почечные функции в базальных условиях и в
условиях нагрузочных функциональных проб.
Нагрузочные пробы обычно приме-
няют для характеристики осморегулирующей
(пробы на концентрирование мочи, разведение
мочи) и кислотовыделительной функции по-
чек (пробы с нагрузкой хлоридом аммония или
хлоридом кальция, с пероральной нагрузкой
гидрокарбонатом натрия). При этом под терми-
ном «нагрузка» подразумевается создание усло-
вий, затрудняющих механизмы регуляции вод-
но-электролитного баланса в поддержании го-
меостаза. Полученные в этих условиях резуль-
таты наиболее полно отражают истинное состо-
яние функций.
* Раздел написан И.М.Кутыриной.
К числу функциональных нагрузочных проб
можно отнести также пробу с белковой нагруз-
кой и пробу с введением допамина. Нагрузка
белком, равно как и введение допамина, вы-
зывает увеличение скорости клубочковой филь-
трации (СКФ) и почечного кровотока. Разни-
ца между значениями показателей почечной ге-
модинамики при нагрузке и в базальных усло-
виях характеризует функциональный резерв
почки.
Исследование функционального состояния
почек, прослеженного в динамике с использо-
ванием функциональных нагрузочных проб,
имеет большое клиническое значение, так как
способствует установлению диагноза, оценке
прогноза и эффективности лечения.
В клинической практике определяют следу-
ющие почечные функции: скорость клубочко-
вой фильтрации, клиренс мочевины, эффек-
тивный почечный плазмоток, экскрецию ами-
нокислот, глюкозы, фосфатов, натрия, способ-
ность к осмотическому концентрированию и
разведению мочи, скорость экскреции аммо-
ния, титруемых кислот, водородных ионов,
способность к ацидификации мочи.
Наиболее важное значение из них имеют
определение клубочковой фильтрации, способ-
ности к осмотическому концентрированию и
разведению и исследование способности к аци-
дификации мочи.
Показателями первостепенной значимости
являются концентрация креатинина в крови
и относительная плотность в однократном
анализе или в пробе Зимницкого.
Креатинин крови является конечным продук-
том метаболизма мышечного белка креатинфос-
фата. После отщепления от него креатинфос-
форной кислоты образуется креатин, а при
последующей потере воды — креатинин. Обра-
зование креатинина зависит от мышечной мас-
сы тела и определяется полом, возрастом, раз-
витием мышечной массы и интенсивностью
обмена. При условии, если мышечная масса
тела постоянна, скорость образования креати-
нина и его выброс из мышц в кровь достаточ-
но постоянны. Выделяется креатинин из орга-
низма только почками.
Содержание сывороточного креатинина до-
статочно четко отражает состояние депураци-
онной функции почек. Концентрация его в
крови не зависит от диеты и физической на-
грузки. Это обстоятельство определяет важность
исследования в клинической нефрологии имен-
но количества креатинина крови, а не других
показателей азотистого обмена — мочевины и
остаточного азота. Последние показатели в зна-
88
чительной степени зависят от баланса белков
в организме, вследствие чего менее точно от-
ражают состояние и динамику почечных фун-
кций. Так, содержание мочевины и остаточно-
го азота может повышаться при сохранной
функции почек за счет усиленного катаболиз-
ма белков или при высоком потреблении бел-
ка с пищей и, наоборот, длительное время
может сохраняться на постоянном уровне (при
низком потреблении белка), несмотря на на-
растающее снижение почечной функции.
При нормальном содержании креатинина в кро-
ви основным путем его выделения является клу-
бочковая фильтрация и лишь весьма незначи-
тельная часть выделяется за счет секреции
проксимальными канальцами. Доля канальцевой
секреции креатинина возрастает лишь при раз-
витии почечной недостаточности, в связи с чем
при ХПН возникает определенная диспропорция
между клиренсом креатинина и истинной вели-
чиной скорости клубочковой фильтрации.
В клинической практике для расчета скоро-
сти снижения функции почек используют ве-
личину, обратную концентрации креатинина в
крови (Р сг), — 1/Р сг, соотнесенную к опре-
деленному периоду времени [Mitch W., Walser
М., Shayman J., 1997]. Основанием этому по-
служил тот факт, что для определенного пери-
ода времени скорости образования и экскреции
креатинина в единицу времени (т.е. (J сг х V) —
величины постоянные. Следовательно, справед-
ливо равенство; скорость клубочковой фильт-
рации = клиренс креатинина = (U сг х V): Р
сг = константа/Р сг = 1/Р сг.
Одновременно было установлено, что при
развитии почечной недостаточности показатель
(1/Р сг) снижается линейно вне зависимости
от этиологии болезни. В связи с этим измене-
ние наклона отношения (1/Р сг) во времени
стали использовать в качестве показателя ско-
рости прогрессирования почечной недостаточ-
ности. Крутой наклон кривой указывает на бы-
строе прогрессирование [Mitch W., Walser М.,
1976; Shayman J., 1997].
Для сравнения темпов прогрессирования по-
чечной недостаточности на фоне проводимого
лечения клиницисты наряду с представленным
выше методом используют сравнение тангенсов
наклона кривой 1/Р сг до и во время лечения
и цифровые показатели снижения СКФ в ме-
сяц [Mitch W., Walser М., 1976; Kamper A.L. et
al., 1995; Shayman J., 1997].
Концентрацию креатинина в крови опреде-
ляют химическим путем с использованием ре-
акции Яффе. В норме концентрация креатини-
на в крови составляет 0,062—0,123 ммоль/л; при
снижении почечных функций концентрация
креатинина в крови возрастает.
Другим важнейшим тестом для оценки фун-
кции почек является определение относи-
тельной плотности мочи (см. раздел
5.1). При выявлении плотности мочи более
1020, а по данным Н. de Wardener, — более
1018, в единичном анализе функциональное
состояние почек характеризуется как сохранное.
Тонкие методы функциональных исследова-
ний почек основаны на использовании метода
клиренса (очищения), являющегося основным
для получения количественной характеристики
деятельности почек. Однако необходимо иметь
в виду, что достоверность результатов при ис-
пользовании данного метода достигается лишь
при соблюдении следующих условий;
а величина диуреза должна быть не менее
1 мл/мин (в условиях олигурии или анурии
метод клиренса применять нельзя);
а должна соблюдаться высокая точность изме-
рения диуреза и времени исследования;
а определение концентрации тест-вещества в
моче должно производиться в порции, со-
держащей не менее 100 мл мочи с целью ни-
велирования количества остаточной мочи в
мочевом пузыре.
Результаты клиренсных методов должны
приравниваться к стандартной поверхности
тела — 1,73 м2.
Исследование скорости клубоч-
ковой фильтрации (СКФ). Клубочковая
фильтрация представляет собой ультрафильтра-
цию воды и низкомолекулярных компонентов
плазмы через клубочковый фильтр (см. главу 2).
В клинической практике оценивают скорость
процесса, т. е. клубочковую фильтрацию в еди-
ницу времени.
Для измерения СКФ используют клиренс
веществ, которые в процессе транспорта через
почки только фильтруются, не подвергаясь ре-
абсорбции или секреции в канальцах, хорошо
растворяются в воде, свободно проходят через
поры базальной мембраны клубочка и не свя-
зываются с белками плазмы. К числу таких ве-
ществ относятся инулин, эндогенный и экзо-
генный креатинин, мочевина, этилендиамин-
тетрауксусная кислота (ЭДТА), а также гломе-
рулотропкые радиофармацевтические препара-
ты; ДТПА (диэтилентриаминопентаацетат), ме-
ченный технецием-99т (99тТс-ДТПА), индием-
113m или индием-111 (||3т1п-ДТПА, 1Ип,1п-
ДТПА), иттербием-169 (|69¥Ь-ДТПА), и йота-
ламат натрия, меченный |251 или |3|1.
Клиренс и н у л и н а. Инулин — смесь по-
лимеров фруктозы с молекулярной массой
5200 — является идеальным веществом для оп-
ределения СКФ. Клиренс инулина почками в
количественном отношении идентичен СКФ.
Методика определения клиренса инулина слож-
89
на и относится к дорогостоящим. Она требует
постоянства концентрации инулина в крови,
неоднократного забора проб крови, катетери-
зации мочевого пузыря, что осложняет исполь-
зование этого метода в клинической практике.
Как правило, клиренс инулина определяют как
стандарт, в сопоставлении с которым оцени-
вается клиренс других исследуемых веществ, а
также для научных исследований.
Нормальная величина СКФ при определении
методом клиренса инулина составляет для муж-
чин 124±25,8 мл/(мин • 1,73 м2), для женщин —
109+13,5 мл/(мин- 1,73 м2).
Метод определения клиренса эн-
догенного креатинина является основ-
ным для оценки СКФ. В 1936 г. Е.М.Тареев и
Н.А.Ратнер ввели клиренс эндогенного креати-
нина для определения СКВ в повседневную
клиническую практику7.
Клиренс эндогенного креатинина при со-
хранной функции почек в количественном от-
ношении равен величине клубочковой фильт-
рации, определенной по клиренсу инулина, но
при снижении функций почек превышает ее.
У больных с выраженной почечной недостаточ-
ностью превышение клиренса эндогенного кре-
атинина над истинной СКФ может достигать
25—100 %. Объясняется это тем, что при по-
вышении содержания креатинина в крови вы-
является секреция креатинина почечными ка-
нальцами. Степень канальцевой секреции кре-
атинина отражает коэффициент СКр/Син, кото-
рый обратно коррелирует с СКФ [Shamesh О.
et al., 1985].
В клинической практике метод определения
клиренса эндогенного креатинина выполняется:
а при использовании 24-часового сбора мочи;
а при сборе мочи последовательно за несколь-
ко отдельных периодов в течение суток;
а за короткий интервал времени (10—20 мин)
(в этом случае исследование проводится на
фоне водной нагрузки);
а за два одночасовых периода после умерен-
ной водной нагрузки (500—700 мл) на фоне
диуреза 1,5—2,5 мл/мин.
В последнем случае клиренс эндогенного
креатинина наиболее надежно характеризует
величину клубочковой фильтрации.
Наряду с использованием клиренсных мето-
дов определения СКФ в клинической практи-
ке пользуются расчетными методами его опре-
деления. В основе этих формул — показатели
мышечной массы (как основного источника
креатинина крови), возраста и креатининемии.
Наиболее широкое распространение в клини-
ческой практике получила формула расчета
СКФ, разработанная D.Cockroft и M.Yault
(1976).
СКФ = (140 — возраст) х масса тела (кг) х
х 0,85 (мужчины).
72 х Ркр (мг%).
0,85 х (140 — возраст) х масса тела (кг)
(женщины).
72 х Ркр (мг%).
В норме значения клиренса эндогенного кре-
атинина составляют 97—137 мл/(мин-1,73 м2)
для мужчин и 88—128 мл/(мин*1,73 м2) для
женщин [Тиц Н.У., 1986].
Менее широко, чем клиренс креатинина,
для определения СКФ используют клиренс
мочевины. Это объясняется высокой зависи-
мостью значений клиренса мочевины от диу-
реза. Мочевина — конечный продукт метаболиз-
ма белков, который, свободно фильтруясь в по-
чечных клубочках, подвергается в дальнейшем
реабсорбции в канальцах. Интенсивность реаб-
сорбции мочевины зависит от величины диу-
реза (О.Шюк, Н. de Wardener). У здорового
взрослого человека при диурезе не менее 1,5 мл/
мин клиренс мочевины составляет 75 мл/мин.
Использование гломерулотропных радиофар-
мацевтических препаратов для определения
СКФ детально представлено в специальной
литературе, освещающей использование радио-
нуклидных методов в нефрологии [Rowell К. et
al., 1986, 1987, и др.].
В последние годы наряду с радионуклидны-
ми препаратами для измерения СКФ стали ис-
пользовать не меченные радиоактивными элемен-
тами контрастные вещества. Среди них наи-
большее распространение получили нерадиоак-
тивный йоталамат и иогексол [Sterner G. et al.,
1996; Gaspari F. et al., 1997]. Эти низкоосмоляр-
ные контрастные вещества свободно фильтру-
ются в почках, не метаболизируются, не реаб-
сорбируются и не секретируются в канальцах,
не оказывают токсического воздействия на
почки, т. е. отвечают всем требованиям,
предъявляемым к маркерам скорости клубочко-
вой фильтрации. Как при нормальной функции
почек, так и при ХПН эти методы тесно кор-
релируют с клиренсом инулина, что является
основанием для широкого использования их в
клинической нефрологии. Для определения с
помощью этих веществ СКФ используют метод
жидкостной хроматографии в условиях высоко-
го давления в сочетании с флюоресцентным
анализом.
Функциональная проба с нагрузкой белком для
определения резервов клубочковой фильтрации.
Для оценки резервов клубочковой фильтрации
используют острую (однократную) или крат-
ковременную (в течение 3—5 дней) нагрузку
белком или аминокислотами.
Острая нагрузка белком предусматривает
90
употребление в пищу 70—90 г мясного белка
[Bosch J. et al., 1983], 100 г растительного бел-
ка [Hirschberg К. et al., 1985] или внутривенное
введение набора аминокислот [Weeter Р. et al.,
1985]. Наиболее распространенным набором
аминокислот является раствор, предложенный
N.Vamin (Франция). Он содержит в 1000 мл:
4,1 г L-аспарагиновой кислоты; 9 г L-глутами-
новой кислоты; 3 г L-аланина; 3,3 г L-аргини-
на; 1,4 г L-цистеина/цистина; 6,1 г глицина;
2,4 г L-гистидина; 3,9 г L-изолейцина; 5,3 г
L-лейцина; 3,9 г L-лизина; 1,9 г L-метионина;
5,5 г L-фенилаланина; 8,1 г L-пролина; 7,5 г
L-серина; 3 г L-треонина; 1 г L-триптофана;
0,5 г L-тирозина; 4,3 г L-валина [Weeter Р. et
al., 1985].
Кратковременная нагрузка белком предпола-
гает употребление высокобелковой диеты с со-
держанием белка в рационе в количестве 1,5—
1,8 г/(кг-сут) в течение 3—5 дней [Wetzels J. et
al., 1988].
У здоровых лиц в ответ на острую белковую
нагрузку или введение аминокислот СКФ воз-
растает на 20—65 % в ближайшие 1—2,5 ч пос-
ле нагрузки. Средний резерв КФ в норме со-
ставляет 20—35 мл/мин [Hostetter Т., 1984;
Jones М. et al., 1987]. При кратковременной
нагрузке белком величина КФ у здоровых лиц
возрастает к 3—4-му дню на 10—30 % от ис-
ходного уровня. Средний резерв КФ составляет
10—25 мл/мин [Jones М., 1987]. При заболева-
ниях почек резерв клубочковой фильтрации
остается нормальным или снижается [Chan А.
et al., 1988]. Резкое снижение или отсутствие
резерва наблюдается у больных со сниженной
функцией почек и косвенно отражает состоя-
ние гиперфильтрации в функционирующих
нефронах [Кутырина И.М. и др., 1995; Weeter
Р. et al., 1985; Brenner В. et al., 1996]. Сниже-
ние резерва КФ может выявляться и при ис-
ходно нормальных значениях СКФ — у доно-
ров почки, после частичной резекции одной
почки, при заболеваниях почек. Снижение ре-
зерва КФ в подобной ситуации рассматривает-
ся как ранний признак нарушений фильтраци-
онной функции почек [Bosch J. et al., 1984].
Функциональная проба с допамином. Допа-
мин — фармакологический препарат, аналогич-
ный эндогенному катехоламину дофамину. Для
оценки функционального резерва КФ внутри-
венно вводят малые дозы допамина [1,5—2 мкг/
(кг - мин)] в течение 2 ч. Малые дозы препара-
та не влияют на состояние системной гемоди-
намики, но увеличивают почечный кровоток и
клубочковую фильтрацию.
У здоровых лиц в ответ на пробу с допами-
ном СКФ возрастает на 10—15 % [Beukfof Н. et
al., 1985].
Клиническая оценка состояния фильтрацион-
ной функции почек. Нормальная величина СКФ
у лиц 20—29 лет составляет 90—174 мл/мин для
мужчин и 84—156 мл/мин для женщин. В воз-
расте 50—39 лет показатели СКФ составляют
соответственно 88—168 и 82—150 мл/мин; после
40 лет величина СКФ постепенно снижается
примерно на 1 % в год, или 6,5 мл/мин за
десятилетие. В возрасте 80—89 лет показатель
СКФ составляет у здоровых лиц 39—105 мл/мин
[Тиц Н.У., 1986].
В физиологических условиях СКФ зависит от
психического и физического состояния обсле-
дуемого, состава пищи, степени гидратации,
времени суток и т.д. Однако колебания показа-
теля происходят в близких к норме пределах.
В патологических условиях скорость клубоч-
ковой фильтрации, как правило, снижается.
При заболеваниях, не связанных с почечной
патологией, снижение СКФ чаще всего обус-
ловлено гемодинамическими факторами: гипо-
тонией, шоком, гиповолемией, выраженной
сердечной недостаточностью, дегидратацией.
При заболеваниях почек патофизиологичес-
кой основой снижения фильтрационной фун-
кции почек является:
• снижение коэффициента ультрафильтрации;
• уменьшение фильтрующей поверхности клу-
бочка;
• снижение почечного кровотока;
• обструкция почечных канальцев;
• трансканальцевая «утечка» фильтрата через
поврежденный эпителий канальцев;
• снижение массы действующих нефронов.
В ранних стадиях хронического нефрита ме-
ханизм угнетения СКФ обусловлен в первую
очередь снижением коэффициента ультрафиль-
трации и уменьшением фильтрующей поверхно-
сти клубочка. Снижение почечного кровотока,
обструкция канальцев и «утечка» фильтрата че-
рез поврежденный эпителий являются ведущи-
ми факторами, определяющими снижение СКФ
при остром канальцевом некрозе или ОПП.
При таких хронических заболеваниях почек,
как хронический нефрит, артериолонефроскле-
роз вследствие длительной и тяжелой артери-
альной гипертонии, хронический пиелонефрит,
амилоидоз почек, величина КФ снижена пре-
имущественно за счет уменьшения количества
функционирующих нефронов.
Значительно реже при патологических про-
цессах в почках выявляется повышение
СКФ.
Патофизиологической основой увеличения
СКФ является:
• увеличение давления ультрафильтрации;
• увеличение коэффициента ультрафильтра-
ции;
• увеличение почечного кровотока.
91
Эти факторы определяют механизм повыше-
ния СКФ на ранних стадиях сахарного диабе-
та, гипертонической болезни, СКВ, в началь-
ном периоде формирования нефротического
синдрома, а также в оставшихся нефронах ча-
стично резецированной (ремнантной) почки.
Длительная гиперфильтрация рассматривает-
ся в настоящее время как основной неиммун-
ный механизм прогрессирования почечной не-
достаточности [Кутырина И.М. и др., 1995;
Hostetter Т. et al., 1982; Brenner В., 1983, 1996].
Исследование величины почечного плазмото-
ка и кровотока. Почечный кровоток — это объем
крови, проходящий через почки в единицу
времени (1 мин). В противоположность всем
другим органам кровоснабжение почек опреде-
ляется не уровнем органного метаболизма, а
назначением почек обеспечивать гомеостаз
внутренней среды организма и в первую оче-
редь выполнением депурационной функции. Это
обстоятельство объясняет крайне высокий уро-
вень почечного кровоснабжения. В покое почки
в норме получают 20—25 % всей крови, вы-
брасываемой левым желудочком сердца, т.е. ве-
личина почечного кровотока (ПК) у здорово-
го человека составляет 1100—1300 мл/мин.
В пересчете на 100 г почечной ткани кровоснаб-
жение почки составляет 430 мл/мин, что в 6—
10 раз превышает кровоснабжение сердца, го-
ловного мозга и других органов.
Особенностью почечного кровоснабжения
является неравномерность его распределения в
различных зонах почек: на долю почечной коры
приходится около 80 % кровотока, наружной
зоны мозгового вещества — около 13 %, внут-
ренней зоны — 3—5 % крови, получаемой поч-
кой в единицу времени. Вместе с тем в пере-
расчете на единицу массы органа кора почек
снабжается кровью со скоростью 5 мл/(г- мин),
в то время как внутренний мозговой слой по-
лучает лишь 0,3 мл/(г- мин) крови, т.е. значи-
тельно меньше, чем другие ткани организма
[Наточин Ю. В., 1972; de Wardener Н., 1985].
В клинической практике для определения
величины ПК используют прямые и непрямые
методы исследования. Прямое измерение ПК с
помощью флоуметра возможно лишь в хирур-
гической практике. В общетерапевтической кли-
нике используют непрямые методы определения.
Наибольшее распространение среди них полу-
чил метод клиренса с использованием веществ-
маркеров, которые секретируются эпителием
почечных канальцев. Такими веществами явля-
ются парааминогиппуровая кислота (ПАГ), гип-
пуран и диодон (диодраст), при этом наиболее
распространенным клиренс-методом для опре-
деления ПК является клиренс ПАГ.
Помимо метода клиренса, для определения
ПК рекомендуются радионуклидные клиренс-
92
методы с использованием тубулотропных ра-
диофармакологических препаратов (1311-гиппу-
ран) и исследования с помощью гамма-каме-
ры. Детально радионуклидные методы исследо-
вания почек и мочевыводящих путей освеще-
ны в специальной литературе.
Клиренс парааминопшпуровой кислоты (ПАГ).
Возможность использования клиренса ПАГ для
определения почечного плазмотока (ПП) оп-
ределяется свойством препарата практически
полностью извлекаться из крови клетками про-
ксимальных канальцев и секретироваться в
просвет нефрона за один пассаж через почки.
Непременным условием при этом является
постоянная низкая концентрация ПАГ в кро-
ви. В этих условиях в крови почечной вены об-
наруживается только та часть ПАГ, которая
миновала корковое вещество и поступила в
мозговое вещество почки. Коэффициент извле-
чения ПАГ из крови очень высок и составляет
0,9- Поскольку секреция ПАГ осуществляется
проксимальными канальцами, находящимися в
зоне коркового вещества почек, клиренс ПАГ
отражает кровоснабжение функционирующей
почечной коры и известен как эффективный
почечный плазмоток. Величину почечного кро-
вотока рассчитывают по величине почечного
плазмотока и показателю гематокрита по фор-
муле:
где ПК — величина почечного кровотока
(мл/мин); ПП — величина почечного плазмо-
тока (мл/мин); Ht — показатель гематокрита.
В норме величина эффективного ПП, опре-
деленная методом клиренса ПАГ, составляет
600—655 мл/мин, в среднем 612±68 мл/мин;
эффективного почечного кровотока — 1100—
1300 мл/мин [de Wardener Н., 1985].
Функциональные пробы для определения ре-
зерва почечного кровотока. Определение резерва
ПК производят путем нагрузки белком или
введения сосудорасширяющих фармакологичес-
ких препаратов (допамин, кофеин и др.).
Методика проведения проб с нагрузкой бел-
ком или введением допамина такая же, как при
определении резерва СКФ.
При определении резервов ПК с помощью
других фармакологических вазодилататоров ис-
пользуют метод фармакоангионефросцинтигра-
фии. Этот метод разработан отечественными
авторами и подробно изложен в их работах [Пы-
тель Ю.А. и др., 1983; Зубовский Г.А. и др.,
1986].
Исследование проводят следующим образом:
почечный кровоток, определенный методом ан-
гионефросцинтиграфии, рассчитывают на ос-
новании данных почечной гистограммы, полу-
ченной при прохождении радиофармпрепара-
та (РФП) через почки. В качестве РФП исполь-
зуют "Тс-димеркаптосукциновую кислоту.
Для определения резервов ПК сразу же пос-
ле ангионефросцинтиграфии внутривенно вво-
дят раствор кофеина, наиболее широко упот-
ребляемого дилататора почечных сосудов. Через
1 мин после его введения ангионефросцинти-
графию повторяют.
Реакция сосудов каждой почки на кофеин
определяется по изменению ренально-аорталь-
ного индекса (5РАИ), отражающего изменения
относительной сосудистой емкости почек.
Нормальные значения резерва ПК при на-
грузке белком составляют +20—30 % [Wetzels J.
et al., 1988]; при введении допамина и других
вазодилататоров — более 30 % от исходного
уровня [Зубовский Г.А. и др., 1986; Weeter Р. et
а!., 1986].
Клиническая оценка состояния почечного кро-
воснабжения. У здорового взрослого человека в
нормальных условиях величина эффективного
ПК. составляет 600—655 мл/мин, общего ПК —
680—720 мл/мин и тотального ПК — 1100—
1300 мл/мин.
ПК подвержен суточным колебаниям. Он
увеличивается в дневные часы и снижается в
ночные. Отмечена зависимость величины ПК от
возраста. До 40 лет величина ПК сохраняется
на постоянном уровне, в дальнейшем по мере
увеличения возраста снижается и к 80 годам
составляет лишь 50 % нормальной величины —
почечный плазмоток составляет в среднем
325 мл/(мин • 1,73 м2), ПК — 585 мл/(мин • 1,73 м2).
При физиологических состояниях снижению
ПК способствуют вертикальное положение
тела, физическое напряжение, нервное возбуж-
дение, боль, диета с небольшим содержанием
белка. ПК увеличивается при беременности,
употреблении большого количества белка, ли-
хорадке.
В патологических условиях снижение крово-
снабжения почек выявляют при острой и хро-
нической циркуляторной недостаточности; ги-
поволемия и сердечная недостаточность вызы-
вают выраженную вазоконстрикцию и угнете-
ние почечного кровотока. Уменьшение крово-
снабжения почек имеет место при острых за-
болеваниях мочеполовой системы, при элект-
ролитных нарушениях — дегидратации, гипо-
натриемии, гипокалиемии и гиперкальциемии.
Гипоперфузия почек наблюдается при некото-
рых эндокринных заболеваниях (патология над-
почечников, гипопитуитаризм, микседема).
При заболеваниях почек причинами сниже-
ния перфузии органа являются:
▲ повреждения почечных сосудов, возникаю-
щие вследствие атеросклеротического про-
цесса, тромбоза или эмболии сосудов; дли-
тельная артериальная гипертензия; систем-
ные васкулиты;
▲ уменьшение ОЦК как следствие первично-
почечного поражения; подобные состояния
могут возникать при отечных синдромах, при
сольтеряющей почке (выраженных тубулоин-
терстициальных поражениях почек);
▲ склеротические изменения почек с потерей
массы действующих нефронов; такие изме-
нения являются исходом хронических не-
фритов, амилоидоза и поликистоза почек,
наследственных канальцевых заболеваний,
туберкулеза почек, обструкции мочевыводя-
щих путей и других хронических заболева-
ний почек;
▲ сосочковый некроз, нередко развивающий-
ся при сахарном диабете, серповидно-кле-
точной анемии, анальгетической нефропа-
тии.
Гиперперфузия почек наблюдается на ран-
них стадиях сахарного диабета и СКВ, при ги-
перволемическом варианте нефротического
синдрома.
Исследование осморегулирующей функции
почек. Объем внутриклеточной, внеклеточной
жидкости и ее компонентов и осмотическая
концентрация их относятся к основным кон-
стантам организма. Хорошо известно, что объем
плазмы и внеклеточной жидкости сохраняется
постоянным, несмотря на значительные коле-
бания в ежедневном приеме жидкости и соли.
Более того, значительное поступление жидко-
сти в организм (при внутривенном введении ра-
створов, водной нагрузке) либо ее потери (при
многократной рвоте, диарее, кровотечении)
быстро восстанавливаются. Сохранность водно-
электролитного гомеостаза в этих условиях обес-
печивает осморегулирующая функция почек.
Последняя в значительной степени определя-
ется функционированием противоточно-пово-
ротно-множительной системы и уровнем сек-
реции АДГ (см. главу 2).
В клинической практике для характеристики
осморегулирующей функции почек использу-
ют определение относительной плотности
мочи и осмоляльности сыворотки крови и
мочи.
Простота выполнения и доступность для
любого медицинского учреждения способство-
вали широкому распространению метода опре-
деления относительной плотности мочи (см.
исследование мочи). Вместе с тем этот метод
менее точен по сравнению с исследованием
осмоляльности мочи, так как на значения от-
93
носительной плотности мочи влияют не толь-
ко осмотически активные вещества, но и со-
держание в моче белка, сахара, контрастных
веществ. Так, по данным Н. de Wardener (1985),
относительная плотность мочи после внутри-
венной урографии может достигать 1060; этот
показатель намного выше верхнего предела в
пробах на максимальное концентрирование
мочи. Увеличивается относительная плотность
мочи при глюкозурии и протеинурии.
Колебания относительной плотности мочи в
течение суток оценивают по пробе Зимницко-
го. Проба представляет собой последовательное
определение величины относительной плотно-
сти мочи, собранной в течение суток за 3-ча-
совые периоды. Она проводится в условиях стан-
дартного пищевого и водного режима (при
потреблении около 1,2 л жидкости в сутки) и
обычной двигательной активности.
У здорового человека суточное выделение
мочи составляет 67—75 % от количества выпи-
той жидкости; дневной диурез составляет 65—
80 % количества выделенной за сутки мочи. От-
носительная плотность мочи составляет 1005—1025.
Более тонко оценивают осморегулирующую
функцию почек, исследуя осмоляльность сыво-
ротки крови (Росм, мосмоль/кг) и осмоляль-
ность мочи (Uocm, мосмоль/кг) и последующе-
го расчета производных величин.
Осмоляльность раствора отражает число осмоти-
чески активных частиц, содержащихся в 1 кг воды
(мосмоль/кг Н2О); осмолярность раствора отражает
число осмотически активных веществ в 1 л раство-
ра (мосмоль/кг). Количественные значения осмоляль-
ности и осмолярности испытуемых растворов прак-
тически идентичны.
-у- — концентрационный коэффициент, отража-
ющий степень концентрирования мочи по сравне-
нию с плазмой. Характеризует осмотический гради-
ент мозгового слоя;
ОСЫ
осмолярный клиренс =
u0CMv
р
1 осм
(мл/мин) —
величина, характеризующая количество воды, необ-
ходимое для выведения всех осмотически активных
веществ мочи в связанном с водой состоянии;
EFocm — экскретируемая фракция осмотически
активных веществ, вычисляемая по формуле:
С
^ОСМ
EF0CM =7—х 100 %;
^-'кр
Си,0 — клиренс осмотически свободной воды,
рассчитывающийся как разность между диурезом и
осмолярным клиренсом;
Сн2о = v - сос„ (мл/мин);
Тсц2о — реабсорбция осмотически свободной
воды, численно равная СНз0, но противоположная
по знаку:
Тсн2о = Сосм - V (мл/мин).
Основным фактором, определяющим осмоляль-
ность плазмы, является концентрация натрия
в плазме. Если у больных она ниже 135 ммоль/л,
то диагностируется гипоосмия, если выше
145 ммоль/л, — гиперосмия. Иначе говоря, низ-
кая концентрация натрия в плазме отражает
высокую концентрацию в ней воды, тогда как
высокая концентрация свидетельствует о низ-
кой ее концентрации.
Из расчетных показателей наибольшее зна-
чение имеют величины, представленные ниже.
Клиренс осмотически свободной воды и
реабсорбция осмотически свободной воды —
величины, отражающие интенсивность работы
почек по концентрированию или разведению
мочи. Нулевые значения показателей, выявля-
емые при числовом равенстве осмоляльности
плазмы и мочи и соответственно осмолярного
клиренса и диуреза, свидетельствуют о том, что
в почках вода реабсорбируется только в связан-
ном с осмотическими веществами состоянии и
работы по концентрированию или разведению
мочи не происходит. Отрицательные значения
Сн2о характеризуют процесс концентрирования
мочи и свидетельствуют о том, что, помимо
реабсорбции воды в связанном с осмотически-
ми веществами состоянии, имеет место и до-
полнительная реабсорбция «свободной воды».
Положительные значения этого клиренса харак-
теризуют интенсивность процесса разведения
мочи и свидетельствуют о выведении «свобод-
ной воды». При этом следует иметь в виду, что
«свободная вода» образуется в разводящих сег-
ментах нефрона (в кортикальном отделе восхо-
дящего колена петли нефрона, дистальных из-
витых канальцах и кортикальных отделах соби-
рательных трубок) в условии отсутствия сек-
реции АДГ. Реабсорбция «свободной воды» осу-
ществляется в медуллярном отделе собиратель-
ных трубок.
Для определения осмоляльности крови и
мочи в клинической практике используют кри-
оскопический метод, т.е. определяют точку за-
мерзания испытуемых растворов, так как дока-
зано, что понижение точки замерзания пропор-
ционально концентрации осмотически актив-
ных веществ. С этой целью используют осмомет-
ры, с помощью которых путем сравнения точ-
ки замерзания раствора с известной осмотичес-
кой концентрацией (стандартный раствор хло-
рида натрия) с точкой замерзания исследуемо-
го раствора рассчитывают концентрацию осмо-
тически активных веществ в испытуемом ра-
створе.
Наряду с лабораторными методами опреде-
ления осмоляльности крови в моче широко
распространен и расчетный метод. Осмоляль-
94
ность крови рассчитывают как сумму осмоляль-
ностей осмотически активных компонентов
крови — осмоляльности натрия и его анионов
(преимущественно хлора) и осмоляльности
глюкозы и мочевины. Поскольку осмоляльность
хлора равна таковой натрия, в формулу вводят
коэффициент 2.
Для расчета осмоляльности крови используют
следующие формулы [Клар С., 1987; Тиц Н. У.,
1986]:
глюкоза азот мочевины крови
Р = 2 х (Na + К) +----------+
ОС.М ' ' 1 О
2,8
или
глюкоза азот мочевины крови
Р = Na х 1,86+--------+
““ 18
2,8
Как следует из представленных данных, ос-
моляльность крови определяют электролиты, а
осмоляльность глюкозы и мочевины в сумме
составляет лишь 10 мосмоль/кг, при этом на
долю глюкозы приходится 5,5 мосмоль/кг, а на
долю мочевины — 4,5 мосмоль/кг.
Разница между вычисленной и измеренной
величинами осмоляльности крови в норме не
превышает 10 мосмоль/кг. Эта разница характе-
ризуется как осмолярный интервал, или осмоляр-
ный промежуток. Интервал более 10 мосмоль/кг
выявляется при высокой концентрации липи-
дов или белков сыворотки крови, а также в
условиях метаболического ацидоза за счет уве-
личения в крови концентрации молочной кис-
лоты [Клар С., 1987].
Для расчета осмоляльности мочи наиболее
часто используют приведенную ниже формулу:
U = 2 х (П + IL + U„u ) + U
осы ' Na К NH4' мочевины
Осмолярный интервал мочи в норме равен
80—100 мосмоль/кг [Halperin М. et al., 1988].
Нормальные величины осмоляльно-
сти сыворотки крови у лиц до 60 лет составля-
ют 275—295 мосмоль/кг; после 60 лет — 280—
301 мосмоль/кг. Осмоляльность суточной мо-
чи здорового человека при диурезе около 1,5 л
составляет 600—800 мосмоль/кг. Однако зна-
чения осмоляльности в отдельных порциях
мочи в течение суток могут колебаться от 40 до
1200 мосмоль/кг, что связано с состоянием гид-
ратации организма. Концентрационный коэф-
фициент в норме составляет 1,03—3,0, после
12-часового ограничения приема жидкости —
более 3,0; осмолярный клиренс, рассчитанный в
пробе из суточной мочи, не превышает 3 мл/мин;
клиренс осмотически свободной воды колеблет-
ся от -0,5 до -1,2 мл/мин; показатель реабсор-
бции осмотически свободной воды составляет
0,5—1,2 мл/мин; экскретируемая фракция осмо-
тически активных веществ — 3,5 %.
Функциональные нагрузочные пробы в иссле-
довании осморегулирующей функции почек.
Функциональные нагрузочные про-
бы на концентрирование мочи. Про-
бы на концентрирование мочи характеризуют
способность почек выделять увеличенное коли-
чество осмотически активных веществ для под-
держания гомеостаза организма в условиях ис-
кусственно созданной дегидратации.
Среди проб на максимальное концентриро-
вание мочи наиболее распространены пробы
с сухоядением.
В классической пробе с сухоядением по ме-
тодике Фольгарда [Volhard F., 1910] предусмат-
ривается дегидратация в течение 36 ч. В порци-
ях мочи, выделенной в последние 12 ч иссле-
дования, относительная плотность мочи у здо-
рового человека увеличивается до 1025—1040,
осмоляльность мочи достигает значений 900—
1200 мосмоль/кг, скорость диуреза снижается
до значений менее 0,5 мл/мин. Проведение
пробы Фольгарда, однако, весьма обремени-
тельно для больного; она часто прерывается из-
за плохого самочувствия больного. В этой связи
в клинической практике используют пробы с
сокращенным периодом водной депривации в
течение 24 или 18 ч. При 24-часовой деприва-
ции у здорового человека относительная плот-
ность мочи составляет 1022—1032, осмоляль-
ность мочи — 900—1200 мосмоль/кг; при 18-
часовом лишении жидкости относительная
плотность мочи составляет 1020—1024, осмо-
ляльность мочи — 800—1000 мосмоль/кг.
Для достижения более быстрой дегидратации
организма можно использовать дополнительное
введение мочегонных препаратов. Дегидратация
организма достигается внутривенным введени-
ем фуросемида с последующим полным огра-
ничением жидкости в течение 16 ч. В этих ус-
ловиях максимальные значения осмоляльности
мочи соответствуют таковым, полученным в
условиях 24-часовой дегидратации.
Распространен для исследования концентри-
рующей способности почек тест с питрес-
сино м. Для этого 5 ед. питрессина (вазопрес-
синтанната в масле) вводят подкожно или
внутримышечно вечером накануне дня обсле-
дования. Затем в течение дня определяют от-
носительную плотность и осмоляльность мо-
чи. У здорового человека осмоляльность мо-
чи увеличивается до 800—1200 мосмоль/кг, от-
носительная плотность ее возрастает до 1024 и
более. Методика пробы с питрессином может
быть и более простой: при введении пит-
рессина вечером осмоляльность определяют в
утренней порции мочи или же при введении
питрессина утром ее определяют в 3 порциях
мочи за 8-часовой период после введения пре-
парата.
95
Пробу с питрессином больные переносят
намного легче, чем пробы с сухоядением. Од-
нако в ответ на введение препарата могут раз-
виться аллергические реакции; введение препа-
рата болезненно [de Wardener Н., 1985].
Для определения способности почек к мак-
симальному концентрированию мочи исполь-
зуют метод с введением синтети-
ческого вазопрессина — 1-диамино-8-
D-аргинин-вазопрессина (ДДАВП) или дес-
мопрессина [Tryding N. et al., 1987; Monson J.,
Richards P., 1988].
ДДАВП представляет собой синтетический
аналог аргинин-вазопрессина. Он обладает вы-
раженными антидиуретическими свойствами и
практически лишен сосудосуживающего эффек-
та. Этот метод имеет преимущество по сравне-
нию с питрессиновым тестом в связи с отсут-
ствием побочных эффектов препарата.
ДДАВП может быть применен интраназаль-
но в дозе 20—40 мкг, внутримышечно — в дозе
20 мкг, внутривенно — в дозе 40 мкг и под-
кожно в дозе 4—10 мкг. Наибольшая способ-
ность к концентрированию мочи выявляется
при подкожном и внутри назальном введении
препарата. Максимальные значения осмоляль-
ности мочи при этих способах введения выяв-
ляются через 3—5 ч после применения препа-
рата и достигают 1000—1200 мосмоль/кг, отно-
сительная плотность мочи 1028—1032. При этом
при подкожном введении ДДАВП максималь-
ные значения осмоляльности мочи сохраняют-
ся в течение суток, поэтому исчезает необхо-
димость временного контроля для определения
максимальной осмоляльности мочи [Tryding N.
et al., 1987]. При внутривенном введении
ДДАВП почки менее интенсивно концентри-
руют мочу, в связи с чем этот метод применя-
ется реже.
В клинической практике чаще всего ДДАВП
вводят утром. В день исследования больному ре-
комендуют ограничить прием жидкости. Осмо-
ляльность мочи исследуют в двух порциях мочи,
полученных после введения препарата. При со-
хранной концентрационной функции почек
средняя осмоляльность второй порции мочи
(примерно через 5 — 9 ч после введения
ДДАВП) составляет около 1000 мосмоль/кг, от-
носительная плотность мочи 1020.
Для более точной информации о концент-
рационной способности почек ДДАВП вводят
после 12-часовой депривации. Эффект внутри-
назад ьного введения ДДАВП после 12-часовой
депривации однозначен результатам 36-часовой
депривации. Коэффициент корреляции между
значениями максимальной осмоляльности мочи
при указанных тестах составил 0,82.
Проведение функциональных проб на мак-
симальное концентрирование мочи противопо-
96
казано при обильных экстраренальных потерях
жидкости (рвота, диарея), в раннем детском
возрасте, при беременности, эпилепсии, тяже-
лой форме гипертонической болезни, пиело-
нефрите и мочекаменной болезни в стадии обо-
стрения, при ОПН и при ХПН, когда содер-
жание креатинина в сыворотке крови более
132 мкмоль/л.
Клиническая оценка концентрирующей спо-
собности почек. Во время проведения проб на
максимальное концентрирование мочи работа
почек происходит в условиях усиленной про-
дукции АДГ. Гормон через сложную систему
механизмов увеличивает проницаемость конеч-
ной части дистальных канальцев и собиратель-
ных трубок для воды и мочевины, благодаря
чему достигается высокая степень концентри-
рования мочи (см. главу 2). В итоге неповреж-
денные почки выделяют малый объем мочи с
высокой концентрацией в ней осмотически
активных веществ; осмоляльность мочи пре-
вышает 900 мосмоль/кг, максимальная отно-
сительная плотность мочи более 1025, коэф-
фициент осмоляльность мочи/осмоляльность
крови более 3, диурез — менее 0,5 мл/мин.
Такой тип диуреза характеризуется как «анти-
диурез».
При интерпретации результатов теста следует
учитывать величину осмотической загрузки не-
фронов малореабсорбируемыми осмотически
активными веществами, так как ее увеличение
снижает максимальную осмоляльность мочи.
Повышение осмотической загрузки нефронов
имеет место при осмотическом диурезе, кото-
рый развивается, в частности, и при снижении
массы действующих нефронов, а следователь-
но, и СКФ. За усредненный показатель осмо-
тической загрузки можно принимать величину
фракционной экскреции осмотически активных
веществ, которая определяется как процентное
отношение минутной экскреции осмотически
активных веществ (UocM х V) к клиренсу креа-
тинина:
UOOM х V
—Р-------х 100.
'-'Кр
При условии, если фракционная экскреция осмо-
тических веществ не превышает 1000 мосмоль/(мл • %),
в качестве нижней границы нормы следует прини-
мать осмоляльность мочи, равную 850 мосмоль/кг.
При более высокой экскреции осмотически актив-
ных веществ полученные значения осмоляльности
мочи следует сопоставлять с величинами у здоро-
вых лиц в условиях аналогичной фракционной эк-
скреции осмотически активных веществ.
«Должная» величина максимальной осмотической
концентрации мочи для каждого значения СКФ при-
близительно может быть рассчитана по формуле,
приведенной в монографии М.Я.Ратнер и соавт.
(1977);
1100 мосмоль/кг - 300 мосмоль/кг X КФ мл/мин
105 мл/мин
«Должную» величину реабсорбции осмотически
активных веществ при сниженной СКФ и минутном
диурезе, превышающем 1,5 мл/мин, можно рассчи-
тать также по формуле, предложенной AGydry и соавт.
(1974):
100
Г,)г0 = анти log 0,2672 - 0,1103 X V х-^- >
'"'кр.
при минутном диурезе менее 1,5 мл/мин:
100
ТН2<) = анти log 0,3892 — 0,1413 х V х
к?-
Для легкости расчета максимальной осмоляльно-
U
сти мочи значение Т преобразуют как — 1.
1 оси.
Концентрационную способность почек сле-
дует считать умеренно сниженной при выявле-
нии в условиях функциональных нагрузочных
тестов максимальной осмоляльности мочи в
600—800 мосмоль/кг и при значениях макси-
мальной относительной плотности мочи менее
1020 (1016—1020). Снижение осмоляльности
мочи до 400—600 мосмоль/кг и относительной
плотности мочи до 1015—1016 расценивают как
значительное. О тяжелом поражении функции
почечных канальцев свидетельствуют низкие
значения максимальной осмоляльности мочи —
менее 400 мосмоль/кг и колебания относитель-
ной плотности мочи в пробе Зимницкого в пре-
делах 1010—1012. Подобная ситуация свидетель-
ствует о полном прекращении функции осмо-
тического концентрирования и характеризует-
ся в клинической нефрологйи как изостенурия
(осмотическая концентрация мочи равна осмо-
тической концентрации крови). Состояния, при
которых значения максимальной осмоляльнос-
ти мочи ниже осмоляльности плазмы (200—
250 мосмоль/кг), а относительная плотность
мочи менее 1010 (1005—1008), характеризуют-
ся как гипостенурия. Эта ситуация выявляется
при полном нарушении осморегулирующей
функции почек и свидетельствует о постоянстве
процесса разведения мочи. Гипостенурия выяв-
ляется при тяжелых тубулоинтерстициальных
нефропатиях, хронической почечной недоста-
точности, несахарном диабете.
В клинической практике при интерпретации
результатов теста на максимальное концентри-
рование мочи необходимо также учитывать те
факторы, которые могут влиять на процессы
концентрирования мочи независимо от первич-
но-почечного поражения осморегулирующей
функции почек. Среди них наибольшее значе-
ние имеют следующие:
• концентрация циркулирующего в крови
АДГ;
7—2950
• чувствительность почечных канальцев к АДГ;
• состояние осмотического диуреза.
Концентрация циркулирующего АДГ — ве-
личина, отражающая продукцию гормона ней-
рогипофизом и уровень его метаболизма. Ме-
таболизм гормона происходит в почках и пе-
чени и, как правило, изменяется мало. В этой
связи концентрация АДГ в крови отражает
преимущественно изменения в продукции гор-
мона. Следовательно, любые причины, вызы-
вающие снижение секреции АДГ нейрогипофи-
зом, могут вызывать нарушения концентраци-
онной способности почек. Среди них первосте-
пенное значение имеют заболевания нейроги-
пофиза, в первую очередь несахарный диабет,
и изменения физиологических факторов, регу-
лирующих секрецию АДГ — увеличение объема
внеклеточной жидкости более чем на 10 % от
нормального уровня и уменьшение осмоляль-
ности крови. Снижают секрецию АДГ также из-
быточное потребление жидкости (полидипсия),
алкоголь, карбонат лития, резерпин [Клар С.,
1987; de Wardener Н„ 1985].
Нарушение чувствительности канальцев к
АДГ может быть связано с наследственными за-
болеваниями (наследственный почечный неса-
харный диабет, генетический гипокортицизм)
и быть приобретенным состоянием. Приобре-
тенное нарушение чувствительности канальцев
к АДГ выявляется при синдроме приобретен-
ного (лекарственного) почечного несахарного
диабета, при лихорадочном синдроме, обструк-
ции мочевых путей, электролитных нарушени-
ях (гипокалиемия и гиперкальциемия), водной
интоксикации. При наличии указанных факто-
ров и особенно при выраженных электролит-
ных нарушениях осмоляльность мочи исходно
снижена и мало изменяется в ответ на водную
депривацию или введение препаратов АДГ.
Вместе с тем при устранении указанных состо-
яний концентрирующая способность почек
быстро восстанавливается.
Осмотический диурез, какой бы причиной он
ни был вызван, снижает концентрирующую
способность почек.
Развитие осмотического диуреза связано с
поступлением в проксимальный отдел нефро-
на больших количеств эндогенных (глюкоза,
мочевина, бикарбонат) или экзогенных (ман-
нит, простые сахара) осмотически активных
веществ. Загрузка проксимального отдела не-
фрона осмотическими веществами в концент-
рациях, превышающих максимальную способ-
ность к их реабсорбции, ограничивает обрат-
ное всасывание в этом сегменте соли и воды.
Это приводит к увеличенному их поступлению
в петлю Генле, дистальные канальцы и соби-
рательные трубки — сегменты нефрона со зна-
97
чимо более низкой транспортной способностью
по сравнению с проксимальными канальцами.
Несмотря на чрезмерную загрузку натрием этих
отделов нефрона, реабсорбция натрия и воды
в них возрастает незначительно даже при уве-
личенной продукции АДГ и альдостерона. Вы-
делению большого объема мочи с невысокой
концентрацией в ней осмотически активных ве-
ществ способствует также ускоренный ток жид-
кости через нефрон, который препятствует со-
зданию высокого осмотического градиента по-
чечного интерстиция.
В клинической практике осмотический диу-
рез выявляется при декомпенсированном сахар-
ном диабете, использовании осмотических ди-
уретиков и хронической почечной недостаточ-
ности. В последнем случае вследствие уменьше-
ния числа функционирующих нефронов увели-
чивается загрузка осмотическими веществами
каждого действующего нефрона. Между осмо-
тической загрузкой нефронов и массой действу-
ющих нефронов установлена прямая отрица-
тельная связь [de Wardener Н., 1985].
При первично-почечной патологии патофи-
зиологической основой нарушенной способно-
сти почек максимально концентрировать мочу
являются:
• снижение клубочковой фильтрации с соот-
ветствующим изменением загрузки нефронов
осмотически активными веществами;
• нарушения работы противоточной системы.
В генезе последних большое значение име-
ют интенсивность кровотока в мозговом слое
почек и выраженность органических измене-
ний почечного интерстиция.
При возрастании кровотока в мозговом слое
почек наблюдается «вымывание» осмотически
активных веществ из почечного интерстиция и
сосудов, что приводит к снижению способно-
сти почек всасывать воду и вырабатывать осмо-
тически концентрированную мочу. При сниже-
нии кровоснабжения мозгового слоя почек
уменьшается эффективность концентрирующего
мочу механизма вследствие ишемии этого слоя
почки. В клинической практике снижение кон-
центрационной способности почек вследствие
усиления медуллярного кровотока выявляется
при злокачественной гипертонии, синдроме
Фанкони, при котором усиление кровотока в
мозговом слое почек усугубляется укорочени-
ем проксимального канальца, а также при пит-
рессин-резистентном ноктуральном нефроген-
ном несахарном диабете.
Снижение кровоснабжения почечной медул-
лы как причина нарушенной концентрацион-
ной способности почек наблюдается при сер-
повидно-клеточной анемии.
Склеротические изменения почечного ин-
терстиция, выявляемые при большинстве хро-
нических заболеваний почек (нефриты, амило-
идоз, поликистоз и гидронефроз почек), при-
водят к нарушениям проницаемости дисталь-
ных нефронов и собирательных трубок для воды
и уменьшению в этих отделах нефрона реабсор-
бции воды, несмотря на высокую концентра-
цию АДГ [Conte G. et al., 1985]. Но, поскольку
в мозговом отделе собирательных трубок реаб-
сорбция мочевины зависит от уровня реабсор-
бции воды, выявленные изменения ограничи-
вают рециркуляцию мочевины, снижают осмо-
тический градиент мозгового слоя и концент-
рационную способность почек.
С нарушением накопления мочевины в моз-
говом слое почек связывают и снижение концен-
трирующей функции почек у больных, получа-
ющих малобелковую диету (S.Klahr, G.Alleyne).
Функциональные нагрузочные пробы на раз-
ведение мочи. Пробы на разведение мочи харак-
теризуют способность почек максимально раз-
водить мочу в условиях искусственно созданной
гипергидратации организма.
Состояние гипергидратации достигается вод-
ной нагрузкой, которая может быть однократ-
ной или длительной.
Однократная водная нагрузка в объеме 20—
22 мг/кг (вода, слабый чай) дается больному
натощак в течение 30—45 мин. Затем (с интер-
валом в 1 ч) собирают порции мочи для опре-
деления диуреза, относительной плотности и
осмоляльности мочи.
При длительной водной нагрузке в течение
30—40 мин исследуемые выпивают количество
жидкости, равное 2 % от массы тела. В после-
дующие 3 ч каждые 30 мин собирают порции
мочи для исследований. В дальнейшем водную
нагрузку поддерживают, допивая каждые 30 мин
жидкость, объем которой на 50 мл выше пор-
ции выделенной мочи.
Нагрузочная проба с гипергидратацией про-
тивопоказана при сердечной недостаточности,
олигурии или анурии, остром гломерулонефри-
те, острой почечной недостаточности, нефро-
тическом синдроме, хронической почечной
недостаточности. Важно иметь в виду, что у
больных с исходной гипоосмоляльностью или
нарушением экскреции жидкости водная на-
грузка может привести к судорогам и гипонат-
риемии с летальным исходом [Тиц Н.У., 1986].
Клиническая оценка способности почек к раз-
ведению. В условиях водной нагрузки увеличи-
вается содержание воды во внеклеточной жид-
кости со снижением ее осмоляльности. Гипо-
осмоляльность плазмы приводит к раздражению
периферических осморецепторов и торможению
секреции АДГ нейрогипофизом. В свою очередь
блокада секреции АДГ вызывает резкое сниже-
ние проницаемости дистального отдела нефро-
98
на, кортикального и медуллярного отделов со-
бирательных трубок для воды. В результате в этих
отделах нефрона за счет реабсорбции осмоти-
чески активных веществ без эквивалентного ко-
личества воды образуется «свободная вода».
В итоге выделяется большой объем гипотони-
ческой мочи.
У здоровых лиц при проведении пробы на
максимальное разведение относительная плот-
ность мочи снижается до 1003, осмоляльность
мочи до 50 мосмоль/кг и ниже. В течение пер-
вых 2 ч пробы выделяется более 50 % от обще-
го объема принятой жидкости, в течение 4 ч-
более 80 %. Максимальная скорость выделения
мочи превышает 2—3 мл/мин. Концентрацион-
ный индекс всегда меньше 1, чаще в пределах
0,2—0,3; осмолярный клиренс существенно не
изменяется. Клиренс осмотически свободной
воды — величина всегда положительная и, как
правило, составляет более 10 мл/мин, макси-
мальная — 18 мл/мин [Наточин Ю.В., 1993,
1997]. Описанный вид диуреза известен как
водный диурез.
У больных с диффузным поражением почек
со сниженной величиной клубочковой фильт-
рации и у больных в состоянии осмотического
диуреза при интерпретации теста на максималь-
ное разведение результаты пробы следует со-
относить с величиной фракционной экскреции
осмотических веществ.
Как нарушение функции разведения мо-
чи рассматривают неспособность почек снижать
осмотическую концентрацию мочи менее
80 мосмоль/кг, а относительную плотность
мочи — менее 1004. Полное выпадение этой
функции характеризует состояние изостенурии
(выравнивание осмотической концентрации
мочи и плазмы) или гиперстенурии, когда ми-
нимальная осмоляльность мочи превышает
300 мосмоль/кг, а минимальная относительная
плотность мочи — 1010.
В физиологических условиях нарушения мак-
симального разведения мочи наблюдаются при
изменении физического режима обследуемого.
Так, при переходе от длительной гипокинезии
к обычной двигательной активности задержка
выделения воды обусловлена компенсаторным
перераспределением жидкостных фаз (Ю.В.На-
точин). На результаты пробы оказывают влия-
ние психическое состояние больного, предше-
ствующая кровопотеря, потери через желудоч-
но-кишечный тракт [Рябов С.И. и др., 1979;
de Wardener Н., 1985].
Патофизиологической основой нарушения
способности почек к максимальному разведе-
нию мочи являются:
• недостаточное поступление жидкости в раз-
водящий сегмент нефрона;
•у *
• нарушение реабсорбции электролитов в раз-
водящем сегменте;
• проницаемость дистального отдела нефрона
и собирательных трубок для воды.
В клинической практике нарушение способ-
ности почек к максимальному разведению
мочи, не связанное с патологией почек, вы-
является при синдромах с избыточной секре-
цией АДГ, надпочечниковой недостаточности
(гипокортицизм), гипотиреозе, застойной сер-
дечной недостаточности, циррозе печени, ожи-
рении, синдроме мальабсорбции.
В нефрологической практике нарушение спо-
собности почек максимально разводить мочу
наблюдается при заболеваниях, при которых
имеет место один из перечисленных факторов
или их сочетание:
а снижение величины клубочковой фильтра-
ции;
▲ увеличение проксимальной реабсорбции
соли и воды;
▲ снижение поступления жидкости в разводя-
щий сегмент нефрона;
▲ уменьшение кровотока в мозговом слое почек;
▲ состояние осмотического диуреза. Резко на-
рушается функция осмотического разведения
у больных после трансплантации почки [То-
милина Н. А., 1987].
Нарушают функцию осмотического разведе-
ния ряд лекарственных средств [Клар С., 1987].
Среди них препараты, увеличивающие высво-
бождение АДГ:
• лекарства, имеющие три цикла в структуре
(карбамазепин, амитриптилин, тиотиксен,
фторфеназин);
• винкристин;
• производные сульфанилмочевины (хлорпро-
памид, бутамид);
• морфин;
• барбитураты;
• никотин;
• циклофосфан;
• клофибрат.
К препаратам, нарушающим функцию ос-
мотического разведения, относятся аналоги
АДГ (окситоцин), а также препараты, повыша-
ющие действие АДГ:
• производные сульфанилмочевины (хлорпро-
памид, бутамид);
• парацетамол;
• ацетилсалициловая кислота;
• индометацин;
• ибупрофен.
Исследование функции почек по регуляции
кислотно-основного состояния. Кислотно-основ-
99
ное состояние (КОС) характеризует соотноше-
ние концентрации водородных (Н) и гидро-
ксильных (ОН) ионов во внутренней среде
организма. Поддержание КОС с сохранением
стабильного pH артериальной крови осуществ-
ляется гомеостатическими механизмами, в ос-
нове которых лежат физико-химические свой-
ства крови и тканей и физиологические про-
цессы, происходящие в легких, почках, пече-
ни и желудочно-кишечном тракте.
Почки участвуют в поддержании КОС путем
выделения с мочой избытка кислот и сохране-
ния для организма оснований. Это достигается
реабсорбцией бикарбонатов, образованием так
называемых титруемых кислот, синтезом ка-
нальцевыми клетками аммиака, который, свя-
зываясь в просвете канальца с ионом водоро-
да, образует ион аммония. Титруемые кислоты
составляют часть водородных ионов, секрети-
руемых в просвет канальцев и реагирующих в
нем с главным буфером мочи — щелочными
двузамещенными фосфатами которые в резуль-
тате превращаются в кислые одноосновные
фосфаты [Наточин Ю.В., 1993; de Wardener Н.,
1985; Shayman J.А., 1997].
В клинической практике для оценки способ-
ности почек поддерживать КОС применя-
ют исследование pH мочи, секреции амми-
ака, титруемых кислот и экскреции бикар-
бонатов.
У здорового человека pH мочи в нормаль-
ных условиях может колебаться в пределах 4,5—
7,5, чаще смещаясь к низким значениям (в
кислую сторону). Перегрузка мясной пищей
способствует выделению более кислой мочи, в
то время как овощная диета, обильное щелоч-
ное питье значительно повышают pH мочи.
Экскреция титруемых кислот характеризует
количество секретированных водородных
ионов, связанных с анионами фосфатов и сла-
бых органических кислот. Она определяется
титрованием мочи раствором щелочи до уров-
ня pH крови. В норме экскреция титруемых
кислот составляет 10—30 ммоль/сут, или 7—
21 мкмоль/мин.
Экскреция бикарбонатов в нормальных ус-
ловиях невелика и составляет 1—2 ммоль/сут;
99,9 % профильтровавшихся бикарбонатов ре-
абсорбируется в канальцах почек.
Секреция аммиака у здорового человека,
равная 30—60 ммоль/сут (21—35 мкмоль/мин),
составляет свыше 60 % от общего количества
выводимых ионов водорода. При этом аммиак,
связываясь с водородом, способствует выведе-
нию анионов сильных кислот (в виде солей
аммония). С титрационной кислотностью выде-
100
ляются анионы слабых кислот. Общая экскре-
ция почкой кислот — тотальная экскреция во-
дородных ионов — составляет 40—90 ммоль/сут,
т.е. почки полностью выводят избыток кислот,
содержащихся в обычной диете. Пределом вы-
ведения кислот является тот уровень титраци-
онной кислотности и экскреции аммиака, при
котором pH мочи достигает 4,5. При pH мочи
ниже 6,0, т. е. в условиях полной реабсорбции
бикарбонатов, общая экскреция водородных
ионов составляет сумму суточной экскреции
аммония и титруемых кислот.
Функция аммониогенеза оценивается на
основании показателей экскреции ионов аммо-
ния и так называемого аммонийного коэффи-
циента. Последний характеризует долю секре-
тированных водородных ионов, выделенных в
виде аммония, и в норме составляет 0,645. Ана-
логичной информативностью обладает и отно-
шение суточного выделения ионов аммония к
титруемой кислотности мочи (норма 1—2,5). Эти
показатели наиболее четко характеризуют фун-
кциональное состояние почек и резервы ком-
пенсации в условиях нагрузочных проб.
Функциональные нагрузочные пробы для оцен-
ки кислотовыделительной функции почек. Из кис-
лотных нагрузочных проб наибольшее рас-
пространение получили пробы с нагрузкой
хлоридом аммония. Введенный внутрь хлорид
аммония метаболизируется с образованием
мочевины и соляной кислоты. Дополнительное
поступление ионов водорода в организм опре-
деляет развитие ацидоза, который подтвержда-
ется снижением содержания стандартного би-
карбоната сыворотки крови до 16—19 ммоль/л.
Пытаясь компенсировать ацидоз, почки увели-
чивают экскрецию ионов водорода в виде тит-
руемых кислот, а также и аммония. В результа-
те экскретируется кислая моча.
Функциональную пробу с нагрузкой хлори-
дом аммония оценивают по степени снижения
pH мочи, экскреции титруемых кислот и ам-
мония.
Существует два варианта нагрузочных проб:
проба с однократной нагрузкой (проба Вронга
и Девиса) и проба с длительной нагрузкой
хлоридом аммония (проба Элкинтона).
Проба с однократной нагрузкой хлоридом
аммония. После контрольных проб мочи, со-
бранных дважды в течение часа, обследуемый
утром натощак принимает внутрь хлорид аммо-
ния из расчета 0,1 г/кг м.т., запивая его 800—
1000 мл жидкости. Для профилактики раздра-
жения желудочно-кишечного тракта хлорид
аммония употребляют в желатиновых капсулах.
Мочу собирают ежечасно в течение 8 ч иссле-
дования. Однако, поскольку пик изменений в
моче, как правило, выявляется через 5 ч после
поступления хлорида аммония, можно ограни-
читься пробами мочи, полученными в течение
5—7 ч после начала исследования [de Warde-
ner Н., 1985].
О сохранности кислотовыделительной фун-
кции почек свидетельствуют снижение pH мочи
ниже 5,3; уровни экскреции титруемых кислот
более 25 мкмоль/мин, экскреции аммония —
более 35 мкмоль/мин и общей экскреции ионов
водорода — более 60 мкмоль/мин.
Проба с длительной нагрузкой хлоридом ам-
мония. При выполнении данного варианта про-
бы обследуемый получает хлорид аммония
внутрь в дозе 0,1 г на 1 кг массы тела ежеднев-
но на протяжении 4—5 дней. Препарат вводят
дробно за 2—3 ч. О развитии ацидоза свидетель-
ствует снижение стандартного бикарбоната
сыворотки крови до 16—18 ммоль/л.
В норме максимальная экскреция титруемых
кислот наблюдается на 3—4-й день исследова-
ния, пик экскреции аммония — на 4—5-й день.
У здоровых лиц в конце 4-го дня исследования
pH мочи ниже 5,0, суточная экскреция аммо-
ния превышает 60 ммоль, водородных ионов —
96 ммоль, величина аммонийного коэффици-
ента 64,5 %, суммарная экскреция аммония и
титруемых кислот превышает исходный уровень
более чем на 120 ммоль/сут.
Противопоказаниями к проведению кислот-
ных нагрузочных проб являются заболевания,
осложненные системным ацидозом (сахарный
диабет, недостаточность коры надпочечников,
метаболический ацидоз внепочечного проис-
хождения), и нефропатии различного генеза с
заведомо выраженным нарушением почечных
функций (в том числе почечный канальцевый
ацидоз) в связи с опасностью усугубления ра-
нее имевшегося ацидоза.
Клиническая оценка состояния функций по
регуляции кислотно-основного состояния. Пато-
физиологической основой нарушения кислото-
выделительной функции почек являются:
• неспособность почечных канальцев поддер-
живать нормальный градиент водородных
ионов, что может наблюдаться вследствие
нарушенной способности канальцев секре-
тировать ионы водорода против высокого
градиента или обратной диффузии их из
клеток канальцев;
• снижение канальцевой реабсорбции бикар-
бонатов;
• потеря почками натрия и калия;
• гиперкальциурия.
Нарушение кислотовыделительной функции
почек характеризуется не соответствующим сте-
пени системного ацидоза высоким pH мочи и
снижением экскреции титруемых кислот и
ионов аммония.
При заболеваниях почек, особенно при сни-
жении массы действующих нефронов, для ха-
рактеристики истинного состояния кислотовы-
делительной функции почек и функции аммо-
ниогенеза величины показателей состояния по-
чечных функций следует соотносить со 100 мл
клубочкового фильтрата. При этом, характери-
зуя функцию аммониогенеза, необходимо так-
же учитывать pH мочи и полученные результа-
ты сопоставлять с величиной экскреции аммо-
ния у здоровых лиц при том же pH мочи.
Это обстоятельство связано с тем, что сни-
жение pH канальцевой жидкости способствует
диффузии аммиака из клеток и между pH мочи
и экскрецией аммония имеется обратная линей-
ная зависимость.
Способность адекватно снижать pH мочи
нарушена при почечном канальцевом ацидозе,
при гипокалиемии и гиперкальциурии. Вместе
с тем эта функция может сохраняться ненару-
шенной при ХПН с выраженным снижением
массы действующих нефронов.
Экскреция титруемых кислот снижена при
почечном канальцевом ацидозе, гипокалиемии,
гиперкальциурии и ХПН.
Экскреция аммония снижена при ХПН и
гиперкальциурии. При почечном канальцевом
ацидозе и при гипокалиемии она может быть
нормальной или даже повышенной [de Warde-
ner Н., 1985].
5.3. Визуализирующие методы
исследования*
В современной нефрологии среди большого
числа диагностических методов лучевые (ульт-
развуковые, рентгеновские, радионуклидные,
магнитно-резонансные) имеют важное и час-
то доминирующее значение. Для этих методов
характерна возможность исследования почек,
как и других внутренних органов, без наруше-
ния целостности покровов организма, чаще
всего методы малоинвазивные, без ощутимого
вторжения в организм больного. Каждый из них
позволяет оценивать наличие, расположение,
форму, структуру почек, их подвижность, а
также деятельность мочевых путей, помогая
выявлять патологические изменения, характер-
ные для конкретных заболеваний. Тем самым
эти методы можно рассматривать как «визуали-
зирующие». Неотъемлемой частью лучевых ис-
следовании в нефрологии является своеобраз-
ная демонстрация почек и мочевых путей «в
действии», т.е. функциональная оценка этих ор-
ганов нередко на ранних стадиях болезни, когда
грубые морфологические изменения еще не
* Раздел написан А.В.Амосовым, В.В.Борисовым.
101
наступили. В современных условиях функцио-
нально-диагностические исследования направ-
лены не только на изучение функции органов
и систем, но и на активное выявление их скры-
той недостаточности и резервов деятельности с
помощью нагрузочных тестов. Лучевые методы
исследования обладают для этого всеми возмож-
ностями. Они могут сочетаться с лабораторны-
ми, эндоскопическими и уродинамическими
исследованиями. Эта особенность позволяет го-
ворить об их важной роли в ранней диагности-
ке заболеваний почек и мочевых путей.
Правильная интерпретация результатов лу-
чевых диагностических исследований при забо-
леваниях почек и мочевых путей может осуще-
ствляться только на основе и в совокупности
с клиническими, лабораторными, эндоскопи-
ческими, уродинамическими и морфологичес-
кими данными. Это является гарантией правиль-
ного диагноза и своевременно предпринятого
рационального лечения. Ультразвуковой и рен-
тгеновский методы, обладая наиболее мобиль-
ными возможностями визуализации, служат для
контроля диагностических и лечебных мероп-
риятий (пункционная биопсия, пункция чашеч-
но-лоханочной системы с последующими пер-
кутанными вмешательствами, нефростомия и
пр.). Наконец, не следует забывать о том, что
лучевые исследования — одно из наиболее
эффективных средств контроля лечения, оцен-
ки его эффективности и своевременной коррек-
ции для достижения наилучших результатов.
К лучевым методам диагностики относятся
ультразвуковые, рентгеновские, радионуклид-
ные и магнитно-резонансные исследования.
5.3.1. Ультразвуковые исследования
Метод исследования почек с помощью ультра-
звука появился в конце 40-х — начале 50-х го-
дов как своеобразный прототип ультразвуковой
эхолокации, применяемой в технике. Он осно-
ван на регистрации изменений ультразвуково-
го сигнала, который отражает исследуемый
объект. Вначале подобные исследования были
одномерными и применялись в основном для
диагностики изменений сердца и крупных со-
судов. С развитием техники появилась возмож-
ность получать двухмерное изображение в виде
статических плоскостных срезов, которые ана-
лизировали по серой шкале (ультразвуковое
сканирование). Современная диагностическая
аппаратура позволяет проводить осмотр в ре-
альном масштабе времени, подобно рентгено-
скопии, в разных проекциях. Использование
нескольких датчиков дает возможность получить
трехмерное объемное изображение органа. Ре-
зультаты могут быть документированы с помо-
102
щью отпечатков на принтере, фиксирующих
наиболее демонстративные этапы исследова-
ния, а также путем видеозаписи. Последняя
имеет преимущества, поскольку предполагает
возможность неоднократного повторного вос-
произведения для анализа всего исследования.
Появление совершенной диагностической ап-
паратуры, подготовка специалистов, владеющих
ультразвуковой диагностикой, привели к ши-
рокому распространению этого метода и бла-
годаря малой инвазивности сделали его веду-
щим в скрининг-диагностике почечных заболе-
ваний.
Методика исследования. Ультразвуковое ис-
следование почек проводят как со стороны
спины, так и с передней и боковых поверхно-
стей живота. Для лучшего контакта датчика с
кожей, что обеспечивает надежное прохожде-
ние ультразвукового сигнала внутрь, применя-
ют специальный звукопроводящий гель. По-
скольку верхний сегмент правой и левой поч-
ки закрыт ребрами, для уменьшения помех,
обусловленных ими, осмотр проводят при глу-
боком дыхании или на высоте вдоха. У женщин
во второй половине беременности исследова-
ние почек осуществляют в положении стоя или
на боку.
Обычно осмотр начинают со стороны спи-
ны в положении на животе. Для определения
расположения почек первоначально проводят
продольное сканирование, а затем поперечное.
Исследования со стороны передней и боковой
поверхностей живота существенно дополняют
представления о состоянии паренхимы почки,
чашечно-лоханочной системы и почечных со-
судов. Спереди правую почку исследуют через
печень — орган, хорошо проводящий ультра-
звуковой сигнал. Поэтому правая почка лучше ви-
зуализируется в большинстве наблюдений в от-
личие от левой. При исследовании левой почки
со стороны живота петли кишечника, содержа-
щие газ, могут создавать выраженное препят-
ствие для прохождения ультразвукового сигна-
ла. Для преодоления этого датчик располагают
продольно по левой среднеподмышечной линии.
Для создания объемного представления о поч-
ке и оценки подвижности некоторых образова-
ний, выявляемых в лоханке и почечном сину-
се, нередко возникает необходимость ультразву-
кового исследования на боку. Подвижность по-
чек может быть оценена визуально и измерена
при дыхании, натуживании на высоте глубокого
вдоха (феномен Вальсальвы) и в вертикальном
положении больного.
Нормальная почка. У здорового человека при
ультразвуковом исследовании нормальная длина
почки составляет 7,5—12 см, ширина — 4,5—
6,5 см, толщина — 3,5—5 см. Важно отметить,
что разность длины обеих почек в норме не
должна превышать 1,5—2 см. Толщина парен-
химы варьирует от 1,5 до 2 см. В продольном
направлении почка определяется в виде овощ-
ного эхонегативного образования, несколько
уплощенного в переднезаднем направлении,
которое хорошо дифференцируется от окружа-
ющих тканей. Почечный синус имеет вид удли-
ненного участка повышенной эхогенности, рас-
положенного в центре почки. При поперечном
исследовании он приобретает овальную или
округлую форму. По наружной поверхности
определяется фиброзная капсула почки в виде
четкого эхопозитивного образования толщиной
до 1,5 мм. Кнаружи от нее, особенно у пожи-
лых, бывает видна зона пониженной эхогенно-
сти, которая является прилежащей частью жи-
ровой капсулы (рис. 5.1).
Паренхима почки имеет очень нежную, по-
чти анэхогенную внутреннюю структуру. Это не-
обходимо учитывать, чтобы не принять нор-
мальную структуру паренхимы за множествен-
ные мелкие кисты. Иногда при исследовании в
реальном масштабе времени почечная паренхи-
ма выглядит менее однородной. В ней между
капсулой и синусом, особенно у молодых,
можно видеть множественные почти округлые
эхонегативные образования — почечные пирами-
ды. Их диаметр колеблется от 0,5 до 0,9 см.
В нормальных условиях соотношение площади
паренхимы и элементов почечного синуса со-
ставляет приблизительно 2:1. У детей оно боль-
ше, у пожилых — значительно меньше.
Если чашечки содержат небольшое коли-
чество мочи, они определяются как неболь-
шие округлые эхо негативные (жидкостные) об-
разования, диаметр которых в норме не пре-
вышает 0,5 см. В большинстве случаев в облас-
ти ворот почки удается выявить и лоханку. При
поперечном исследовании она имеет вид либо
двух параллельных эхосигналов с эхонегатив-
ной прослойкой, либо веретенообразного жид-
костного образования. Иногда она лучше оп-
ределяется при поперечном исследовании с
боковой поверхности живота. В отдельных слу-
чаях ее удается получить только при продоль-
ном исследовании со стороны передней брюш-
ной стенки путем постепенного изменения уг-
ла наклона датчика. Величина лоханки под-
вержена значительным индивидуальным коле-
баниям. Ее переднезадний размер в норме ред-
ко превышает 0,5 см. Сосуды почки, как прави-
ло, определяются при поперечном или косом
исследовании со стороны передней брюшной
стенки.
Аномалии почек. К ним относятся аплазия
(врожденная единственная почка, рис. 5.2) и
гипоплазия, дистопии, аномалии взаимоотно-
шения почек, кистозные изменения, а также
удвоение верхних мочевых путей. Аплазия поч-
Рис. 5.1. Ультрасонограмма нормальной почки в про-
дольном сечении.
1 — паренхима; 2 — почечный синус.
Рис. 5.2. Ультрасонограмма врожденной единствен-
ной почки. Размеры ее увеличены, структура парен-
химы однородная, чашечно-лоханочная система не
видна.
ки может быть подтверждена при ультразвуко-
вом исследовании, если с одной стороны поч-
ка визуализируется, а с другой найти ее не
удается в типичном месте и исключается дис-
топия. Поскольку дистопия как аномальное
расположение почки является результатом ее
неправильного продвижения вверх из малого
таза в ходе эмбриогенеза, она бывает тазовой,
подвздошной и поясничной. Крайне редкой фор-
мой дистопии является грудная, когда почка
располагается в полости грудной клетки над
диафрагмой. Характерной особенностью пояс-
ничной дистопии, кроме более низкого по срав-
нению с нормой положения и значительного
ограничения подвижности (за счет увеличения
числа сосудов и их аномального отхождения),
103
Рис. 5.3. Ультрасонограмма почки при поликистозе.
Множественные округлые эхонегативные образова-
ния (кисты) в паренхиме и почечном синусе.
является расположение лоханки спереди и бо-
лее латерально. Последняя при этом бывает
видна чаще и лучше, чем в нормальных усло-
виях. Положение дистопированной почки мо-
жет быть различным: и почти вертикальным,
и горизонтальным, когда нижний сегмент ее
определяется у гребня подвздошной кости.
В отличие от нефроптоза пояснично дистопи-
рованная почка почти не смещается. Для диф-
ференциальной диагностики, подтверждения
нефроптоза и уточнения его выраженности
больного укладывают на живот горизонтально,
находят верхний сегмент почки и в его проек-
ции на коже спины делают метку. Затем паци-
ента просят принять вертикальное положение,
в котором фиксируют верхний сегмент сместив-
шейся вниз почки. Подвижность ее оценивают
в сантиметрах по расстоянию между метками
на коже. При нефроптозе смещающаяся вниз
почка одновременно поворачивается вокруг
вертикальной, горизонтальной и фронтальной
осей. Ее ультразвуковое изображение от этого
меняет свою форму и размеры, что следует
непременно учитывать. Смещение почки вниз
при нефроптозе может нарушать отток мочи из
чашечно-лоханочной системы, что можно ви-
деть при ультразвуковом исследовании по уве-
личению размеров (дилатации) чашечно-лоха-
ночной системы.
Ультразвуковая картина тазово-дистопиро-
ванной почки не менее разнообразна по лока-
лизации, размерам, форме и особенностям ча-
шечно-лоханочной системы. Ее расположение в
тазу делает обнаружение и полипозиционное
ультразвуковое исследование более трудным из-
за близости костных образований, содержаще-
го газ кишечника, а также женских половых ор-
ганов. Иногда для лучшей визуализации необ-
ходимо предварительное опорожнение кишеч-
ника, наполнение мочевого пузыря и пр. Для
таких исследований желательно привлекать спе-
циалистов с большим опытом подобных наблю-
дений и высокой квалификацией.
Диагностика гипоплазии почки представляет
трудности прежде всего потому, что отличить
ее от вторичного сморщивания под влиянием
воспалительного процесса возможно далеко не
всегда. При гипоплазии размеры органа умень-
шены, однако соотношение площади паренхи-
мы и синуса остается таким, как в норме, а
структура и контуры не изменяются. Тем не
менее начальные этапы сморщивания почки мо-
гут иметь похожую картину, поэтому диффе-
ренциальная диагностика не может проводиться
только на основе ультразвуковых данных, она
должна включать обязательное сопоставление
данных УЗ-исследований с клиническими про-
явлениями, результатами лабораторных, рен-
тгеновских, радионуклидных, а в ряде случаев
и морфологических исследований.
Ультразвуковая эхография при удвоении вер-
хних мочевых путей в основном позволяет по-
лучить лишь ориентировочное представление,
на основе которого можно заподозрить данную
аномалию. Обычно при продольном исследова-
нии отмечаются увеличение длины почки и
появление в ней двух отдельно расположенных
структур почечного синуса. Они бывают разде-
лены своеобразной перегородкой из нормаль-
ной почечной паренхимы. Однако ее форма не
всегда позволяет исключить новообразование,
что требует рентгеновских исследований. Ана-
логичная ультразвуковая картина почки может
наблюдаться и при ветвистом строении чашеч-
но-лоханочной системы.
Из всех аномалий наибольшие трудности
ультразвуковая диагностика представляет при
подковообразной почке. Для ее выявления мож-
но проводить поперечное исследование со сто-
роны спины. Однако при этом перешеек, явля-
ющийся абсолютным подтверждением данной
аномалии, не может быть выявлен, поскольку
в зоне его расположения образуется акустичес-
кая тень как результат поглощения ультразву-
кового сигнала позвоночником. Исследование со
стороны передней брюшной стенки позволяет
избежать этого. Для снижения вероятности
ошибок исследование следует проводить утром
натощак после 1—2 сут малошлаковой диеты и
очистительных клизм накануне вечером и утром.
Перешеек подковообразной почки можно вы-
явить как расположенный поперечно тяж, соеди-
няющий чаще нижние сегменты почек, по плот-
ности соответствующий почечной паренхиме.
Большое значение ультразвуковое исследо-
вание имеет в диагностике поликистоза почек
(рис. 5.3). В этих случаях выявляют значительное
104
увеличение размеров почек и множество эхо-
негативных зон различной формы и размеров
в паренхиме. При наличии крупных кист, осо-
бенно в центре органа, область почечного си-
нуса может быть деформирована. Применение
современных ультразвуковых диагностических
средств позволяет достоверно выявлять кисты
цо 1 см в диаметре. Необходимо отметить, что
при обследовании тучных лиц точность диагно-
стики значительно снижается.
Кисты почек при ультразвуковом исследо-
вании выявляются легко. Обычно они имеют
вид четко очерченного округлого или овально-
го эхонегативного образования с ровными внут-
ренними контурами, лишенного внутренних
эхоструктур. При центральном их расположении
область почечного синуса может быть деформи-
рована, расщеплена. Нередко, особенно при
значительных размерах кист, наблюдается уве-
личение размеров и изменение контуров поч-
ки. Достоверность ультразвукового метода в
диагностике солитарных почечных кист дости-
гает 98 %.
Важное значение имеет ультразвуковая ди-
агностика парапельвикальных кист. Характерной
особенностью является их локализация в обла-
сти синуса и ворот почки. Они определяются
как центрально расположенные округлые или
овальные жидкостные образования. Дифферен-
цировать множество подобных образований от
расширенной чашечно-лоханочной системы
бывает трудно. Для этого необходимы обязатель-
ные сопоставления ультразвуковой и урогра-
фической картин. При мулътикистозе жидко-
стными образованиями различных размеров
замещена практически вся почечная паренхи-
ма. Нередко в такой почке могут быть обнару-
жены множественные обызвествления. В отли-
чие от поликистоза, который чаще всего дву-
сторонний, мультикистозная почка обнаружи-
вается с одной стороны (двусторонний муль-
тикистоз — аномалия, несовместимая с жиз-
нью).
Ультразвуковое исследование губчатой поч-
ки при отсутствии расширения чашечно-лоха-
ночной системы отчетливо обнаруживает мно-
жественные эхопозитивные структуры с акус-
тическими дорожками (конкременты) по внут-
реннему краю почечной паренхимы. Их разме-
ры, как правило, не превышают 0,5 см, а ко-
личество и локализация индивидуальны и за-
висят от выраженности конгенитального пора-
жения медуллярного вещества. Подобные изме-
нения приходится дифференцировать от корал-
ловидных конкрементов чашечно-лоханочной
системы и проявлений эмфизематозного пиело-
нефрита.
Опухоль почки. При ультразвуковом исследо-
вании опухоль паренхимы почки определяется
Рис. 5.4. Ультрасонограмма почки. Опухоль нижнего
сегмента. Объяснения в тексте.
как округлое или овальное образование неболь-
шой эхогенности с неровными контурами.
Могут быть выявлены деформация почки и
увеличение ее размеров (рис. 5.4). При распро-
странении новообразования в почечный синус
наступает его деформация, а при смещении и
сдавлении чашечно-лоханочной системы может
быть выявлена ее дилатация. При очень боль-
шой опухоли, занимающий всю почку, изоб-
ражение синуса и чашечно-лоханочной систе-
мы чаще отсутствует. Опухоль может иметь
сложную внутреннюю структуру: наряду с уча-
стками плотной ткани в ней могут выявляться
жидкостные включения разной формы и раз-
меров. Их появление бывает обусловлено кро-
воизлияниями и некрозом ткани опухоли. Иног-
да об этом может свидетельствовать лишь уси-
ление дальнего (по отношению к ультразвуко-
вому датчику) контура образования. Большое
количество жидкостных включений, разделен-
ных тонкими перегородками с отсутствием эле-
ментов плотной ткани, является препятствием
для достоверной ультразвуковой диагностики
опухоли, заставляет дифференцировать ее от
мулътилокулярной кисты и кистозных форм рака
почки.
Довольно часто, особенно при небольших разме-
рах новообразования, опухоль почки по своим аку-
стическим свойствам практически не отличается от
нормальной паренхимы. Именно поэтому самое при-
стальное внимание при ультразвуковом исследова-
нии должно быть уделено неровностям контура поч-
ки, деформации зоны почечного синуса, наличию
утолщений паренхимы. Минимальный размер опу-
холи почечной паренхимы, которая достоверно мо-
жет быть обнаружена при ультразвуковом исследо-
вании, — 2 см, при этом диагностическая достовер-
ность ультразвукового метода достигает 97,3 %. По-
скольку в ряде случаев рост опухоли отмечается не
105
только в толще паренхимы, но может быть и экст-
раренальным, эхография должна проводиться тща-
тельно, последовательно и методично в различных
положениях больного с изменением плоскости ска-
нирования. Именно это позволяет избежать и лож-
ноположительных, и ложноотрицательных результа-
тов.
Применение ультразвуковой эхографии позволяет
уточнить солидный или жидкостный характер ново-
образования. Однако в ряде случаев могут возникать
трудности в дифференциальной диагностике ново-
образований, кист и туберкулезных каверн почки.
Наряду с выявлением опухолевого процесса ультра-
звуковая эхография позволяет получить ценную ин-
формацию о его распространенности. Применение
этого метода, кроме метастатического поражения и
признаков прорастания печени, дает возможность
диагностировать опухолевый тромбоз — распростра-
нение новообразования в просвет почечной и ниж-
ней полой вен, видеть увеличенные лимфатические
узлы, расположенные паракавально и парааорталь-
но. а по расширению аортокавального промежутка —
судить о вовлечении в опухолевый процесс аорто-
кавальных лимфатических узлов.
При небольших размерах папиллярной опухо-
ли лоханки, не нарушающей отток мочи из ча-
шечно-лоханочной системы, эхографическая
картина почки может не отличаться от нормаль-
ной. Обнаружить такую опухоль в виде дефекта
наполнения в лоханке иногда возможно лишь
при полиурии на фоне усиленного приема
жидкости или введения небольших доз салуре-
тиков. При опухоли чашечно-лоханочной сис-
темы, нарушающей отток мочи, инфильтриру-
ющей область ворот и паренхиму почки, могут
быть выявлены ее косвенные признаки в виде
изменения формы почечного синуса, смещения
и расширения чашечек и лоханки, появления
дополнительных теней большей акустической
плотности по сравнению с паренхимой, эле-
ментами синуса и верхних мочевых путей.
Воспалительные процессы. В их диагностике
ультразвуковое исследование оказывает суще-
ственную помощь. При остром пиелонефрите
оно позволяет выявить отек паранефральной
клетчатки, который проявляется не только ог-
раничением дыхательной подвижности пора-
женной почки, но и своеобразным ареолом раз-
режения вокруг нее. Карбункул почки может быть
выявлен в виде небольших размеров (1—1,5 см)
округлого или овального разреженного образо-
вания с четкими, но далеко не всегда ровны-
ми контурами. В нем, как правило, можно за-
метить отдельные нежные эхопозитивные струк-
туры. В месте расположения карбункула контур
паренхимы и капсулы слегка выбухает, может
быть деформирована и область почечного си-
нуса, в котором, как правило, видны расши-
ренные чашечки и лоханка. В отличие от кар-
бункула туберкулезная каверна чаще имеет бо-
106
лее значительные размеры и плотную эхопози-
тивную капсулу. Содержимое ее ближе к жид-
кому, однако чаще неоднородно и может иметь
множественные более плотные включения, а в
случаях петрификации — обызвествления. Кис-
тозные образования, как мы уже отмечали, в
отличие от карбункула обладают четкой, глад-
кой, хорошо различимой капсулой, ровными
контурами и гомогенным содержимым.
В начальных стадиях хронического пиелонеф-
рита применение ультразвукового исследования
не позволяет выявить каких-либо достоверных
признаков данного заболевания. Любые попыт-
ки интерпретировать незначительное уменьше-
ние размеров почки, ее контуры, изменения
структуры паренхимы и почечного синуса как
признаки пиелонефрита в отрыве от клиничес-
ких, лабораторных и рентгеновских данных не
оправданы. При далеко зашедшем воспалитель-
ном процессе с исходом в сморщивание поч-
ки отмечается значительное уменьшение ее раз-
меров при относительном увеличении площа-
ди структур почечного синуса по отношению
к паренхиме. Соотношение величин площади
изображения паренхимы и синуса при этом
приближается к 1,5:1. Паренхима приобретает
неоднородную структуру, неровные контуры,
капсула утолщается.
Наш многолетний опыт ультразвуковых ис-
следований при воспалительных заболевани-
ях убедительно свидетельствует о том, что
вне обострения при хроническом пиелонеф-
рите достоверно отличить ультразвуковую
картину от изменений при других воспали-
тельных и сосудистых изменениях почек (гло-
мерулонефрит, нефросклероз, подагрическая
почка) вне связи с результатами всесторон-
него комплексного обследования больного
невозможно.
В финальных стадиях воспаления, каким
является пионефроз, ультразвуковое исследова-
ние выявляет увеличение почки, утолщение ее
капсулы, уплотнение окружающей паранеф-
ральной клетчатки нередко с ограничением
подвижности пораженной почки, уменьшени-
ем толщины почечной паренхимы с расшире-
нием и неровными контурами чашечек и ло-
ханки, стенки которых в силу рубцовых изме-
нений приобретают повышенную эхогенность.
В их просвете могут выявляться неоднородная
взвесь при наличии гноя и некротических тка-
ней, а также эхопозитивные образования с
акустической тенью (конкременты).
Ультразвуковое исследование оказывает зна-
чительную помощь в диагностике паранефраль-
ного абсцесса и гнойных изменений клетчатки
забрюшинного пространства. Обычно абсцесс
выявляется как расположенное в непосред-
ственной близости от почки эхонегативное
образование овальной формы различных разме-
ров, лишенное практически полностью или
имеющее крайне незначительное количество
внутренних структур. Обычно он имеет четкий
наружный и внутренний контуры, в его поло-
сти могут быть отдельные тонкие едва разли-
чимые перегородки. Если гной, заполняющий
полость абсцесса, очень густой, выявленное
образование может быть ошибочно интерпре-
тировано как опухоль. Гнойные изменения клет-
чатки забрюшинного пространства реже быва-
ют осумкованными и чаще приближаются к
флегмоне. При этом ультразвуковая эхография
позволяет видеть нечеткие контуры мышц и
неоднородное гипоэхогенное содержимое между
ними и в забрюшинном пространстве.
Туберкулез почки. При ограниченных деструк-
тивных нарушениях (папиллит) ультразвуковым
исследованием не удается выявить какие-либо
изменения вне зависимости от распространен-
ности процесса и давности заболевания. Лишь
обызвествление специфических очагов в почеч-
ной паренхиме имеет картину одиночных или
множественных эхопозитивных образований,
нередко причудливой формы, с неровными
контурами, которые создают акустическую тень
и очень похожи на конкременты. Их отличи-
тельным признаком может быть отсутствие свя-
зи с почечным синусом и элементами чашеч-
но-лоханочной системы. Однако для достовер-
ной интерпретации этих сведений необходимы
сопоставления ультразвуковой картины с кли-
ническими, анамнестическими, лабораторны-
ми и рентгеновскими данными, среди которых
не потеряла своего значения и обычная «натив-
ная» томография почек.
Наиболее надежную диагностическую ин-
формацию ультразвуковое исследование пред-
ставляет при фиброзно-кавернозном туберкулезе
почки. Ультразвуковая эхография в этих случа-
ях дает четкое пространственное представление
о размерах, форме и локализации «выключен-
ной» каверны и позволяет уточнить ее взаимо-
отношение с чашечно-лоханочной системой.
При рентгеновском исследовании сделать это
столь полно не всегда удается. Каверна выгля-
дит как четко очерченное округлое или оваль-
ное эхонегативное образование с ровными кон-
турами. В зависимости от плотности содержи-
мого внутренние эхоструктуры могут быть с
отдельными, порой многочисленными более
плотными включениями. В случае преобладания
таких включений она приобретает вид эхопо-
зитивного объемного образования, а его даль-
няя стенка и расположенные за ней ткани, как
при опухоли, бывают видны менее четко, чем
Рис. 5.5. Ультрасонограмма почки. В лоханке опреде-
ляется яркое эхопозитивное образование, позади
которого видна четкая акустическая тень («дорожка»),
лоханка незначительно расширена.
в обычных условиях. Ультразвуковая картина
туберкулезного пионефроза практически не от-
личается от банального калъкулезного. Обнару-
живаемые эхопозитивные образования при
этом, как правило, трактуются как обызвеств-
ленные очаги деструкции, а не как конкремен-
ты.
Нефролитиаз. Выявление конкрементов в поч-
ке, если их величина превышает 0,5 см, как
правило, не представляет трудностей. Одиноч-
ный камень определяется как четко контури-
руемое эхопозитивное образование, располо-
женное в чашечно-лоханочной системе. Диаг-
ноз не вызывает сомнений, когда позади него
четко выявляется акустическая «дорожка» (тень,
провал), которая связана с полным отражени-
ем ультразвукового сигнала от плотных струк-
тур конкремента (рис. 5.5). Ультразвуковым ме-
тодом могут быть обнаружены любые конкре-
менты вне зависимости от их химического со-
става. Определенные трудности могут возникать
в диагностике конкрементов почечной лохан-
ки и чашечек, имеющих незначительный пе-
реднезадний размер (плоский конкремент),
чаще это уратные камни. Направление ультра-
звуковых волн по плоскости конкремента мо-
жет скрыть его, поскольку отраженный сигнал
при этом незначительный и акустическая до-
рожка на экране монитора почти неразличи-
ма.
Для преодоления этих трудностей сканиро-
вание необходимо проводить полипозиционно
в продольном, поперечном и косых положениях
на спине, животе, на боку, желательно в ус-
ловиях относительной полиурии на фоне уси-
ленного приема жидкости или введения неболь-
ших доз салуретиков.
107
Нельзя не остановиться на ультразвуковой
гипердиагностике нефролитиаза. Ограниченный
опыт обследования таких больных, выявление
одиночных или множественных, порой очень
мелких эхопозитивных структур без акустичес-
кой «дорожки» в проекции чашечно-лоханоч-
ной системы могут заставить врача забыть о
других возможных причинах подобных измене-
ний (уплотненные стенки кровеносных сосудов
и других структур почечного синуса). Отсутствие
акустической тени при этом, как правило,
ошибочно объясняют очень маленькими раз-
мерами конкрементов (песок в почке), забы-
вая об ограниченной разрешающей способно-
сти метода ультразвуковой эхолокации и необ-
ходимости учета всех диагностических призна-
ков для правильной интерпретации полученных
данных.
Подобные методические ошибки специали-
ста по ультразвуковой диагностике, как прави-
ло, приводят к необоснованной гипердиагнос-
тике нефролитиаза и ненужным рентгеновским
исследованиям.
При наличии коралловидного камня продоль-
ное сканирование может выявить четко конту-
рируемые эхопозитивные образования различ-
ной величины, не связанные между собой, с
четкими акустическими «дорожками» позади. На
основании одного продольного исследования
создается впечатление о множественных конк-
рементах. Заключение может быть ошибочным,
поскольку в плоскости сканирования были
видны отдельные фрагменты коралловидного
камня. Лишь полипозиционное исследование
позволяет составить правильное представление
о его истинной форме и распространенности.
Коралловидный конкремент в почке может
симулировать картина острого эмфизематозно-
го пиелонефрита. Множество пузырьков газа, об-
разующегося в просвете чашечно-лоханочной
системы и заполняющего чашечки, которые
отражают ультразвуковой сигнал и дают акус-
тические «дорожки» подобно конкрементам,
создают весьма сходные признаки. При образо-
вании пузырьков газа в выводных канальцах
Беллини в центре сосочков аналогичные ульт-
развуковые признаки также бывают видны. Они
характерны для так называемого пиелонефрита
лучистого вида.
Тщательное ультразвуковое Исследование в
подобных случаях может выявить похожие из-
менения и в паранефральной клетчатке, что
несколько облегчает дифференциальную диаг-
ностику. Следует отметить, что во избежание
ошибок окончательное заключение может быть
сделано лишь после сопоставления полученных
данных с клиническими симптомами, течени-
ем заболевания и результатами рентгеновского
исследования.
Ультразвуковое исследование способно вы-
явить конкременты чашечек, лоханки и верх-
ней трети мочеточника. При этом описанные
признаки конкремента (конкрементов) наблю-
даются всегда.
Камни средней и нижней трети мочеточника
не могут быть выявлены, поскольку после-
дние в забрюшинном пространстве ультра-
звуком не визуализируются.
Исключение составляют случаи, когда в
мочеточник предварительно введен катетер или
стент. Тогда, ориентируясь по ходу катетера и
продвигая ультразвуковой датчик в проксималь-
ном или дистальном направлении, можно об-
наружить конкремент. Вторым исключением яв-
ляются камни интрамурального отдела мочеточ-
ника, которые выявляются при условии пред-
варительного наполнения мочевого пузыря как
характерные яркие эхопозитивные образования
с акустической «дорожкой» непосредственно в
толще пузырной стенки в проекции мочеточ-
никового устья.
Наряду с характерными, непосредственно
связанными с конкрементом ультразвуковыми
признаками могут быть выявлены косвенные
данные, свидетельствующие о наличии камня
в мочеточнике.
К ним относятся расширение чашечек, ло-
ханки и проксимального отдела мочеточника,
возникшее на фоне или в результате почечной
колики и обусловленное стазом мочи над кон-
крементом. Окончательный диагноз в этих слу-
чаях может быть поставлен лишь при сопостав-
лении этих данных с результатами рентгенов-
ских исследований.
Гидронефроз. Ультразвуковая картина при
этом заболевании непосредственно зависит от
степени и давности нарушений пассажа мочи
из чашечно-лоханочной системы, выраженно-
сти ретенционных изменений в ней и атрофии
почечной паренхимы. В начальных стадиях при
пиелоэктазии может быть видна лишь расши-
ренная лоханка. Она выявляется в виде округ-
лого, овального, реже конического эхонегатив-
ного образования в области ворот почки. Ча-
шечки могут быть не изменены или слегка рас-
ширены. Толщина почечной паренхимы в этой
стадии заболевания, как правило, не отлича-
ется от нормальной. По мере прогрессирования
обструкции лоханочно-мочеточникового сег-
мента или мочеточника дилатация чашечек и
лоханки увеличивается, возникает гидронефроз
(уретерогидронефроз). Чашечки изменяют свою
форму от буквы С до О, в них могут выявлять-
ся вторичные мелкие, нередко множественные
конкременты (рис. 5.6). Толщина паренхимы
108
f ШЧ I
почки при этом прогрессивно уменьшается.
Ретенционные изменения в чашечно-лоханоч-
ной системе, выявленные с помощью ультра-
звука, во избежание ошибок нередко приходит-
ся дифференцировать от парапельвикальных кист
или кист почечного синуса. Сделать это без рент-
геновского исследования бывает невозможно.
Терминальные стадии гидронефроза при уль-
тразвуковом исследовании характеризуются уве-
личением размеров почки, резким истончени-
ем ее паренхимы вследствие атрофии, множе-
ством расширенных чашечек с ровными, чет-
кими контурами и анэхогенным содержимым,
расширением лоханки. Особую ценность эти ис-
следования приобретают при так называемой
немой почке, не выделяющей рентгеноконтраст-
ное вещество, когда другие исследования ма-
лоинформативны.
Ультразвуковой метод диагностики заболе-
ваний почек получил широкое распростране-
ние благодаря малой инвазивности, высокой
точности, доступности и возможности много-
кратных исследований без вреда для организ-
ма. Полноценное заключение по результатам
ультразвукового исследования может быть дано
только при условии его грамотного проведения
в разных плоскостях при различных техничес-
ких параметрах исследования. Если среди мно-
жества нормальных эхограмм одного и того же
органа или области сканирования появляется
хотя бы одна с патологическими изменениями,
необходимо повторить исследование в разных
проекциях с различными параметрами ультра-
звукового сигнала, а также двумя или тремя
датчиками различной частоты.
При видимой технической простоте прове-
дения подобных исследований нередко выявля-
ются сложные, порой неоднозначные измене-
ния, интерпретировать которые только на ос-
новании ультразвуковых данных нельзя. Имен-
но поэтому ультразвуковой метод диагностики
не может существовать в отрыве от клиничес-
ких проявлений заболевания почек и мочевых
путей, результатов лабораторных, рентгенов-
ских, радионуклидных, магнитно-резонансных,
уродинамических, эндоскопических и морфо-
логических данных.
Функциональная направленность ультразвуко-
вых исследований почек. Ультразвуковые иссле-
дования почек в реальном масштабе времени
позволяют наблюдать их дыхательные экскур-
сии, которые при остром пиелонефрите на
стороне поражения могут быть резко ограни-
чены или полностью отсутствовать. Подвиж-
ность почки, присущая ей в нормальных усло-
виях, может быть оценена при сравнительных
исследованиях в горизонтальном и вертикаль-
ном положениях, на боку, а в некоторых слу-
чаях и в положении сидя. Перенесенные опе-
Рис. 5.6. Ультрасонограмма почки при гидронефрозе.
Истончение паренхимы, резкое расширение чаше-
чек и лоханки.
ративные вмешательства, склерозирующий па-
ранефрит значительно ограничивают эту под-
вижность.
Нерасширенная чашечно-лоханочная систе-
ма с помощью ультразвукового исследования,
как правило, не видна. При нарушенном отто-
ке мочи из верхних мочевых путей (конкремен-
ты лоханки и мочеточника, сужение лоханоч-
но-мочеточникового сегмента и мочеточника)
возникает их расширение. Чашечки, лоханка и
проксимальный отдел мочеточника становятся
отчетливо различимы как жидкостные, хорошо
поглощающие ультразвуковой сигнал образова-
ния. При этом становится возможным четкое
определение их контуров и точных размеров.
Использование функциональной нагрузки в
виде медикаментозной полиурии в ответ на
внутривенное введение минимальной дозы са-
луретика (10 мг фуросемида) позволяет подой-
ти к функциональной оценке резервных воз-
можностей верхних мочевых путей.
Для этого после начального осмотра почек,
определения исходных размеров чашечек, ло-
ханки и введения фуросемида осмотр и изме-
рения чашечек и лоханки повторяют каждые
5 мин. В ответ на полиурию может наступать ди-
латация чашечно-лоханочной системы, степень
которой оценивают путем измерений. Исследо-
вания повторяют до тех пор, пока размеры
чашечно-лоханочной системы не вернутся к
исходным. Зная исходные размеры чашечек и
лоханки, можно рассчитать и выразить в про-
центах степень их увеличения на фоне полиурии.
В нормальных условиях дилатация не бывает
резко выраженной и наблюдается не более
10 мин. Более длительное изображение чаше-
чек и лоханки в ходе фармакоэхографии свиде-
109
тельствует о препятствии оттоку мочи и(или)
о функциональной несостоятельности прокси-
мального отдела мочевыводящих путей.
При врожденном гидронефрозе выявленная
при исходном ультразвуковом исследовании
дилатация чашечно-лоханочной системы пос-
ле введения фуросемида нарастает. В силу не-
достаточной эвакуации мочи из чашечно-лоха-
ночной системы вследствие полиурии и усугуб-
ляющейся обструкции верхних мочевых путей
на стороне поражения может наблюдаться на-
растающая боль в поясничной области. Ее воз-
никновение прогностически благоприятно,
поскольку нарастание дилатации подтверждает
еще оставшуюся эластичность стенок чашечек
и лоханки, их способность к расширению и
сокращению. Боль свидетельствует об относи-
тельной сохранности пораженной почки, по-
скольку по мере прогрессивной утраты функ-
циональной способности иннервация и чув-
ствительность ее, в том числе и болевая, утра-
чиваются. Именно поэтому степень дилатации
чашечно-лоханочной системы при фармакоуль-
тразвуковом исследовании может рассматри-
ваться в качестве критерия оставшейся сокра-
тительной способности верхних мочевых путей.
Отсутствие увеличения размеров чашечек и
лоханки после введения салуретика, напротив,
может служить признаком необратимых проли-
феративных изменений в расширенных чашеч-
ках и лоханке, что прогностически неблаго-
приятно.
5.3.2. Ультразвуковая допплерография
В основу этого метода изучения сосудов поло-
жен физический феномен, открытый в 1842 г.
австрийским ученым И.Допплером и получив-
ший в мировой литературе его имя. Эффект
Допплера заключается в том, что частота ульт-
развукового сигнала при его отражении от дви-
жущегося объекта изменяется пропорциональ-
но скорости его движения вдоль оси распрост-
ранения сигнала. При движении объекта в сто-
рону датчика, генерирующего ультразвуковые
импульсы, частота отраженного сигнала увели-
чивается и, наоборот, при отражении сигнала
от удаляющегося объекта — уменьшается. Та-
ким образом, если ультразвуковой луч встре-
чается с движущимся объектом, отраженные
сигналы будут отличаться по частотному составу
от генерируемых датчиком колебаний. Измеряя
частоту отраженного сигнала и зная частоту
посланного сигнала, можно по сдвигу частоты
определить скорость движения исследуемого
объекта в направлении, параллельном ходу
ультразвукового луча.
Существует два основных вида допплеровских
исследований: непрерывный и импульсный. Приборы
для непрерывной допплерографии имеют 2 пьезо-
кристалла в датчике. Один из них постоянно излу-
чает ультразвуковые волны, второй — непрерывно
воспринимает отраженные. Прибор автоматически
сравнивает частоту генерируемых и отраженных ко-
лебаний, вычисляет ее сдвиг и с поправкой на угол
определяет скорость движения исследуемого объек-
та. Импульсная допплерография, основанная на том
же принципе, в отличие от непрерывной предпола-
гает ультразвуковой датчик, содержащий только один
пьезокристалл, который является одновременно и ге-
нератором, и приемником отраженных колебаний.
Часть времени он может функционировать как пе-
редатчик импульсов, а в остальное время восприни-
мает и передает анализ отраженной волны.
Первая успешная попытка использования
допплеровского метода в изучении кровотока
относится к концу 50-х годов. Для оценки по-
чечного кровотока допплеровская флоуметрия
была применена в пересаженной почке в 1969 г.
С появлением приборов, сочетающих в себе
ультразвуковое изображение и допплеровскую
флоуметрию, появилась возможность более чет-
ко увидеть артерии, измерить их просвет и ско-
рость кровотока. Двухмерную эхографию в ре-
альном масштабе времени в комбинации с им-
пульсной допплерографией называют двойным
сканированием, или дуплексной эходопплерогра-
фией.
Исследование кровотока. Нормальная доппле-
рограмма имеет отчетливо выраженные систо-
лический и диастолический компоненты. В нор-
ме сопротивление в почечных сосудах низкое,
вследствие этого допплерограмма имеет высо-
кий систолический пик с крутым подъемом и
более пологим спуском и плавное равномерное
снижение диастолы. Площадь под систоличес-
кой фазой свободна (систолическое окно), так
как во время систолы медленно перемещается
очень мало^ количество крови.
Для визуализации почечных артерий и по-
лучения допплеровской информации применя-
ют разные доступы: передний (трансабдоминаль-
ный), задний (транслюмбальный), латеральный
(декубитальный). Полипозиционный подход позво-
ляет характеризовать почечные артерии на всем
протяжении от места отхождения до ворот поч-
ки. Причиной неадекватного результата могут
быть скопление жидкости в брюшной полости,
выраженная кальцификация сосудов, избыточ-
ная масса тела больного. Почечный кровоток
оценивают качественно и количественно.
Качественная оценка кровотока. При визуаль-
ной оценке состояния сосудистого русла необ-
ходимо обращать внимание на следующие ха-
рактеристики:
НО
а проходимость сосуда (проходим, окклюзиро-
ван);
▲ размеры сосуда (норма, сужение, дилата-
ция);
▲ подвижность сосудистой стенки (ригидность,
повышенная мобильность);
▲ состояние комплекса интима — медиа (плот-
ность, толщина, форма поверхности, одно-
родность);
▲ изменения внутри сосуда (атеросклеротичес-
кие бляшки, тромбы, оценка их структуры,
размеров, протяженности, патологическая
отслойка интимы, аневризмы);
▲ состояние периваскулярной ткани.
Количественная оценка кровотока — вычис-
ление отдельных индексов и временных парамет-
ров (пульсовой индекс как отношение разности
максимальной и минимальной величин спект-
ра частот к усредненной по времени максималь-
ной частоте допплеровского сдвига по всему
сердечному циклу, индекс циркулярного сопро-
тивления, индекс резистентности, индекс Пур-
селота — соотношение между величиной при-
роста систолического потока и величиной об-
щего потока, индекс периферического сосуди-
стого сопротивления и др.).
Большую диагностическую ценность пред-
ставляет прослушивание звуковых сигналов в
ходе исследования, так как в звуковом отобра-
жении представлены все характеристики сигна-
лов, включая и направление.
Эходопплерография позволяет визуализиро-
вать почечные артерии, измерять их диаметр,
количественно и качественно оценивать крово-
ток, определять его функциональные возмож-
ности на изучаемом участке артериального рус-
ла почки.
Эходопплерографию применяют интраопера-
ционно для определения расположения круп-
ных сосудов. В случае нефротомии это позволя-
ет провести разрез в менее васкуляризованной
зоне. Кроме того, данный метод дает.возмож-
ность следить за изменениями кровотока при
использовании нагрузочных фармакологических
проб, оценивать эффект лечения, а также кро-
воток не только пораженной, но и контрала-
теральной почки.
Режим триплексной допплерографии. После
получения исходных двухмерных изображений,
строго ориентированных в пространстве, про-
водится компьютерное синтезирование трехмер-
ного изображения. Использование трехмерной
допплеровской визуализации позволяет полу-
чить сведения о сосудистой архитектонике, вза-
имоотношении паренхиматозных органов с
рядом расположенными крупными сосудами,
об анатомо-топографических особенностях ис-
следуемой области.
При обследовании больных с новообразова-
ниями различной локализации, заболеваниями
почек и почечных сосудов ультразвуковая доп-
плерография имеет следующие преимущества:
• наглядное представление формы объекта
интереса и его внутренней структуры;
• демонстрация взаимоотношения объемных
образований, расположенных рядом сосуди-
стых структур и других органов;
• определение объема сложных геометрических
тел (почечный синус, киста, опухоль, скоп-
ление жидкости неправильной формы);
• оценка тяжести поражения и функциональ-
ных резервов сосудов на основании фарма-
кологических проб с вазоактивными препа-
ратами.
Трехмерная допплерография. Существуют две фун-
кции трехмерного допплеровского исследования для
более демонстративного показа возможностей диаг-
ностики объемных процессов. Режим интерактивной
сегментации включает выделение цветом зон инте-
реса по их контуру с последующим трехмерным
построением сегментированных объектов и их про-
смотр в виде фильма, во время которого происхо-
дит вращение трехмерного допплеровского изобра-
жения вокруг произвольно выбранной оси. Внутрен-
ний объем объекта может быть представлен как при
различных сечениях массива, так и при обозначении
цветом его структур. Режим полупрозрачности наибо-
лее демонстративен при просмотре триплексного
массива для представления полых объектов (сосудов,
кист).
5.3.3. Рентгенологические
исследования
Рентгенологические методы диагностики вклю-
чают исследования особенностей строения, па-
тологических изменений и динамической актив-
ности почек и мочевых путей, что более четко
определяется при условии их предварительно-
го контрастирования.
Обзорная рентгенография мочевой системы.
Обзорный снимок мочевой системы является
обязательным, с него начинаются все последу-
ющие рентгеноконтрастные исследования. Он
не только позволяет установить диагноз (корал-
ловидный камень почки, эмфизематозный пи-
елонефрит), выявить костные метастазы, но и
наметить объем и последовательность дальней-
ших рентгеновских исследований для получения
максимальной диагностической информации
кратчайшим путем.
Обзорная рентгенограмма должна охватывать
весь мочевой тракт независимо от стороны по-
ражения, начиная от X ребра и кончая ниж-
ним краем лонного сочленения. На снимке дол-
жны быть четко различимы XI и XII ребра,
111
костный скелет, поперечные отростки и тела
поясничных позвонков, контуры поясничных
мышц и почек, по возможности свободные от
просветлений кишечных газов. Кишечный газ в
проекции почек мешает идентифицировать раз-
личные тени, расшифровывать рентгеновское
контрастное изображение. Это не только воздух,
попадающий в желудок и кишечник при еде,
но и продукт жизнедеятельности кишечной
микрофлоры. В то же время определенные скоп-
ления кишечного газа в проекции почек могут
быть следствием некоторых патологических
процессов. Локальная аэроколия может наблю-
даться во время приступа почечной колики на
стороне поражения. Аналогичные скопления
кишечного газа, порой скрывающие контуры
соответствующей почки и поясничной мыш-
цы при закрытой травме, а также наличие реф-
лекторного сколиоза указывают на сторону по-
ражения. Появление пузырьков газа в около-
почечной клетчатке и чашечно-лоханочной
системе наблюдается при эмфизематозном пи-
елонефрите. При изучении обзорного снимка
необходимо обращать внимание на форму, ве-
личину, плотность тени каждой почки, угол
ее наклона по отношению к позвоночнику,
расположение, сохранность тени поясничной
мышцы.
Нормальные почки располагаются с некото-
рым наклоном по отношению к оси позвоноч-
ного столба, их медиальный край проецирует-
ся параллельно тени поясничной мышцы. Тень
левой почки обычно на 1,5—2 см выше пра-
вой и делится XII ребром пополам, тогда как
тень правой пересекается XII ребром на границе
верхней и средней трети. В отличие от нормаль-
ной пиелонефритически сморщенная почка при-
обретает вертикальное положение. Увеличение
размеров почек при острой почечной недоста-
точности является признаком гипергидратации.
Ограничение или отсутствие физиологической
подвижности почки при дыхании (в норме —
половина высоты тела поясничного позвонка)
указывает на воспалительный или склеротичес-
кий процесс в паранефральной клетчатке, а
также на параренальную гематому. При пере-
мещении пациента из горизонтального положе-
ния в вертикальное нормальные почки смеща-
ются вниз на 1—1,5 поясничных позвонка.
Иногда на обзорной рентгенограмме мож-
но увидеть овальное или треугольное выпячи-
вание латерального контура почки чаще в
среднем сегменте слева — так называемая гор-
батая почка. Она является следствием тесного
контакта почки с селезенкой, однако требует
обязательного исключения новообразования в
этой зоне (опухоль, солитарная киста) с по-
мощью ультразвукового и других методов ис-
следования.
112
Наличие тени, подозрительной на конкре-
мент, в проекции почки или мочеточника еще
не дает оснований ставить диагноз камня. Толь-
ко тень коралловидного конкремента, по фор-
ме повторяющая чашечно-лоханочную систему,
не вызывает сомнения в наличии нефролитиа-
за. В остальных случаях могут наблюдаться и
ложные тени, которые требуют дифференци-
альной диагностики.
За камни почки могут быть ошибочно приняты
камни желчного пузыря, поджелудочной железы,
каловые камни, петрифицированные лимфатические
узлы брыжейки, инородные тела кишечника и заб-
рюшинного пространства, окостеневшие передние
концы реберных хрящей, пигментные родимые пят-
на и опухоли на коже спины в проекции почки,
обызвествленные кровеносные сосуды и аневризмы,
омелотворенные туберкулезные очаги и каверны,
обызвествленные солитарные кисты и опухоли по-
чек, эхинококковые кисты.
Камни мочеточника следует дифференцировать от
петрифицированных лимфатических узлов брыжей-
ки, обызвествлений в яичниках и опухолей женских
половых органов, флеболитов, каловых камней, те-
ней кожных опухолей. Большинство ложных камней
мочеточника отличить от истинных удается с помо-
щью экскреторной урографии или обзорной рент-
генографии с введенным мочеточниковым катетером
в разных проекциях. В малом тазу часто встречаются
небольшие ровные округлые или овальные тени —
флеболиты, которые часто приходится дифференци-
ровать от камней дистального отдела мочеточника.
При наполнении мочевого пузыря последние могут
смещаться, тогда как флеболиты остаются на месте.
В сомнительных случаях приходится также прибегать
к экскреторной урографии и(или) рентгенографии
с введенным мочеточниковым катетером.
Обзорная рентгенография мочевой системы
хотя и имеет ограниченные возможности, од-
нако является обязательным этапом рентгено-
вского исследования мочевой системы. От пра-
вильной интерпретации обзорного снимка с
учетом анамнестических, клинических, ультра-
звуковых и других данных во многом зависит
дальнейшее обследование больного.
Цифровая обработка рентгеновского изображе-
ния. Этот метод регистрации рентгеновского
изображения основан на проведении его ком-
пьютерной обработки, которая сочетает одно-
временную суммацию заданного изображения
с подавлением (вычитанием) мягкотканого
сигнала. Иначе говоря, она позволяет получить
при помощи компьютера преимущественное и
более контрастное изображение интересующих
объектов (почка, мочеточник, конкременты,
обызвествления и пр.). Более широкое приме-
нение она находит при рентгеноконтрастных
исследованиях.
Томография — послойное рентгеновское ис-
следование, с помощью которого из проекции
всех последовательных слоев снимаемого объек-
та выделяется и сохраняется на пленке проек-
ция одного слоя. Основным срезом при томо-
графии является тот, который проходит через
ворота почки, лоханку и почечную паренхиму.
Помимо основного среза, через 0,5—1 см про-
водят дополнительные. При выполнении урото-
мографии при вентродорсальном ходе рентге-
новского луча необходимо учитывать, что, хотя
левая почка в норме несколько больше правой,
тень ее на томограмме может быть равна тени
правой почки или быть меньше. Объясняется
это тем, что левая почка расположена ближе к
задней стенке туловища. Если томограмма, вы-
полненная в положении больного на спине, не
дает четкого изображения, исследование надо
провести в положении на животе или на боку.
При полипозиционном исследовании можно по
двум проекциям представить объемное изобра-
жение органа, что особенно важно при топи-
ческой диагностике.
Обзорная томография позволяет определить
размеры, форму и расположение почек, устра-
нить интерпозицию кишечного газа, дифферен-
цировать новообразование почки от экстраре-
нального, истинные камни органов мочевой
системы от ложных, иногда выявить слаборе-
нтгенпозитивные конкременты.
Специальной подготовки больного к томогра-
фии не требуется. Для более четкого выявления
тени почечной паренхимы непосредственно пе-
ред исследованием внутривенно вводят рентгено-
контрастное вещество (нефротомография). Томо-
графию можно сочетать с экскреторной урографией
и ретроградной пиелоуретерографией (см. ниже).
С внедрением в клиническую практику ультразву-
ковых исследований почек, рентгеновской ком-
пьютерной и магнитно-резонансной томографии
показания к томографии почек значительно су-
зились. Однако до сих пор она широко применя-
ется во фтизиоурологической практике в основ-
ном для топической диагностики очагов обызве-
ствления и каверн в почке.
Недостатком томографии является необходи-
мость выполнения нескольких снимков, вслед-
ствие чего возрастает доза рентгеновского об-
лучения больного. В связи с этим была предло-
жена зонография, охватывающая большую тол-
щину выделяемого слоя. При зонографии вы-
деляется зона объекта, а не тонкий слой, как
при томографии. Показанием к зонографии при
отсутствии контрастирования и после контра-
стирования верхних мочевых путей является
трудность анализа рентгенограмм из-за насла-
ивающихся экстраренальных теней.
Рентгеновская компьютерная томография в
последние годы получает повсеместное распро-
странение в клинической практике. Метод ос-
нован на последовательном получении послой-
Рис. 5.7. Рентгеновская компьютерная томограмма,
нормальные почки.
Рис. 5.8. Рентгеновская компьютерная томограмма.
Опухоль правой почки.
ных поперечных томограмм тела, которые фик-
сируются в памяти компьютера и выводятся на
экран дисплея в черно-белом и цветном изоб-
ражении; в последующем оно может быть фик-
сировано на рентгеновской пленке или отпе-
чатано на принтере. В отличие от первых кон-
струкций компьютерных томографов современ-
ные имеют возможность анализировать спираль-
8—2950
113
ные срезы и с помощью специальной програм-
мы реконструировать рентгеновское изображе-
ние в любой заданной плоскости, выделять
особенности расположения, синтопии и струк-
туры интересующего органа (рис. 5.7). В отли-
чие от обычного рентгеновского исследования
оно несет и количественную информацию о
плотности тканей, находящихся в исследуемой
плоскости (шкала Хаусфилда).
Рентгеновская компьютерная томография в
уронефрологической практике применяется для
диагностики новообразований (рис. 5.8), поли-
кистоза и камней почек, а также при заболева-
ниях мочевого пузыря и предстательной желе-
зы. При наличии конкрементов почек по шкале
Хаусфилда может быть оценена их плотность,
что имеет значение при планировании ударно-
волновой литотрипсии. R.S.Breiman и соавт.
(1981) установили, что рентгеновская компью-
терная томография —наиболее точный из неин-
вазивных методов определения объема тканей и
органов. По данным этих авторов, среднее чис-
ло ошибок при измерении объема почки состав-
ляет 3,86 %, ее разрешающая способность —
0,3—0,5 см, а диагностическая точность — 94 %.
Метод может применяться до и на фоне кон-
трастирования верхних мочевых путей.
Самыми частыми показаниями к этим ис-
следованиям являются диагностика новообра-
зований, оценка их локализации и распростра-
ненности, определение радикальности выпол-
ненной операции и регрессии опухолевого про-
цесса под влиянием лучевой терапии, а также
выявление метастазов. Метод высокочувствите-
лен в дифференциальной диагностике плотных
и жидкостных образований почки, позволяет
выявить опухоль надпочечника у больных ар-
териальной гипертензией. Он имеет значение в
дифференциальной диагностике рентгенонега-
тивного камня и папиллярной опухоли почеч-
ной лоханки, а также при травме почки.
Широкое внедрение в клиническую практи-
ку ультразвукового исследования почек, рент-
геновской компьютерной и магнитно-резонан-
сной томографии (см. ниже) позволило в пос-
ледние годы отказаться от таких инвазивных
методов рентгенодиагностики, как пневморен
и пресакральный ретропневмоперитонеум.
Экскреторная урография является наиболее
простым и доступным методом рентгеновско-
го исследования, позволяющим получить боль-
шую информацию о состоянии почек и моче-
вых путей. Ее преимуществом является контра-
стирование мочевых путей естественным путем.
Экскреторная урография основана на способ-
ности почек выделять с мочой рентгеноконт-
растные йодистые препараты. Она позволяет
судить об анатомо-функциональном состоянии
почек, чашечно-лоханочной системы, мочеточ-
114
ников и мочевого пузыря. Для исследования
после обзорного снимка внутривенно вводят в
среднем 20 мл 60—75 % раствора рентгенокон-
трастного вещества, а затем производят серию
рентгенограмм, время выполнения которых от
момента введения зависит от функционально-
го состояния почек и задач исследования (обыч-
но через 7—10, 20—25 мин, а при необходи-
мости и в более поздние сроки.
Как справедливо отмечали А.Я.Пытель и
Ю.А.Пытель (1966), количество и концентра-
ция рентгеноконтрастного вещества не долж-
ны быть предельными. Предпочтительна инди-
видуальная доза в зависимости от массы тела,
возраста, функционального состояния почек и
печени. У взрослого при средней массе тела 60—
70 кг она не должна превышать 100 мг на 1 кг
(суммарно 7 г). Иначе говоря, для получения
отчетливого изображения почек, чашечно-ло-
ханочной системы, мочеточников и мочевого
пузыря взрослому достаточно ввести 20 мл 35 %
раствора рентгеноконтрастного вещества — при
условии, что максимальная его концентрация
в моче не может превышать 5 % [Босин В.Ю.,
Скрипкина Л.А., 1980]. В клинической практи-
ке, опасаясь за качество изображения при экс-
креторной урографии, мы заведомо превыша-
ем эту дозу, вводя минимум 20 мл 60—75 %
контрастного вещества, т.е. в 2 раза больше.
Более контрастное изображение мочевых пу-
тей можно получить при выполнении урогра-
фии на фоне относительного обезвоживания
организма — ограничения приема жидкости,
в постполиурической фазе после введения
малых доз салуретиков или после примене-
ния АДГ.
Ю.АПытель и И.И.Золотарев (1987) предложи-
ли несколько иную методику урографического ис-
следования с целью индивидуализации подхода к
дозировке контрастного вещества, с одной стороны,
и уменьшения вероятности побочных и токсических
реакций, возможности их эффективного купирова-
ния — с другой. Для этого после обзорного снимка
мочевой системы выполняют венепункцию, присо-
единяют систему для капельных вливаний и начи-
нают медленную (около 20 капель в 1 мин) инфу-
зию изотонического раствора натрия хлорида, кото-
рая существенно не влияет на объем циркулирую-
щей крови. Сегодня для пункции могут быть исполь-
зованы устройства для многократного введения ра-
створов в вену и без постоянной инфузии. Далее
внутривенно вводят 20 мл рентгенконтрастного ве-
щества и делают первый рентгеновский снимок. Если
контрастирование мочевых путей недостаточно, до-
полнительно вводят повторную дозу рентгеноконт-
растного вещества. В случае возникновения побочной
реакции она может быть быстро купирована, по-
скольку приспособление для внутривенной инфузии
сохраняют до конца исследования. Такая методика
существенно не нарушает подвижности больного на
съемочном столе и позволяет выполнять рентгено-
граммы полипозиционно в орто-, клиностазе, а при
необходимости и в положении Тренделенбурга.
Экскреторная урография дает возможность
судить о способности почек выделять рентгено-
контрастное вещество. Интенсивность этого
процесса при использовании двухатомных йо-
дистых препаратов соответствовала их функци-
ональной способности. С заменой контрастных
веществ на трехатомные, которые выделяются
преимущественно проксимальными отделами
нефрона, подобная оценка перестала быть до-
стоверной, поскольку даже при сморщенной
почке, утратившей свою функциональную спо-
собность, можно получить достаточно отчетли-
вое и контрастное изображение на экскретор-
ной урограмме. Поэтому при ненарушенном
оттоке мочи о концентрационной способности
почки по данным экскреторной урографии
можно судить лишь косвенно (рис. 5.9).
Традиционно отсутствие тени контрастного
вещества на урограмме (немая почка) считают
нарушением ее функции. Ю.А.Пытель (1975)
убедительно показал, что при острой окклю-
зии верхних мочевых путей такая почка явля-
ется активно функционирующим органом, а
отсутствие изображения чашечно-лоханочной
системы обусловлено выраженной лоханочной
гипертензией. Такую почку ошибочно называть
нефункционирующей. Отсутствие выделения кон-
трастного вещества в чашечно-лоханочную си-
стему при острой окклюзии является защитной
реакцией, оберегающей почку от значительных
повреждений.
Улучшить изображение верхних мочевых путей
пытались применением компрессии мочеточников на
уровне тазового кольца специальными устройства-
ми. Подобная методика обеднила экскреторную урог-
рафию как функциональное исследование, посколь-
ку возникающая искусственно дилатация верхних
мочевых путей выше сдавления лишает их естествен-
ного функционирования. Компрессионная урография
является методом антифизиологичным и небезопас-
ным. При искусственном повышении давления в
верхних мочевых путях искажаются детали строения
чашечно-лоханочной системы, нарушается динами-
ка опорожнения верхних мочевых путей, а в резуль-
тате лоханочно-почечных рефлюксов создаются ус-
ловия для экстравазации мочи, развития острого пи-
елонефрита, возникает опасность диссеминации ту-
беркулеза и метастазирования опухоли почки. С той
же целью для «тугого» заполнения верхних мочевых
путей увеличивали дозу рентгеноконтрастного веще-
ства (инфузионная урография).
Инфузионная урография. Внутривенно вводят
60 мл 60—75 % раствора контрастного вещества
Рис. 5.9. Экскреторная урограмма. Единственная пра-
вая почка. Чашечки деформированы, сосочки отсут-
ствуют, дефект наполнения шейки верхней чашеч-
ки, лоханки, средней и нижней чашечек. Некроз по-
чечных сосочков.
в 120 мл изотонического раствора натрия хло-
рида или глюкозы. Она имеет свои преимуще-
ства и недостатки. Инфузионная урография
выполнима на ранних стадиях почечной недо-
статочности; в этом случае она позволяет по-
лучить более четкое изображение чашечно-ло-
ханочной системы и мочеточников, чем при
обычной урографии. Однако судить о функции
верхних мочевых путей, их тонических и кине-
тических особенностях не представляется воз-
можным, поскольку большое количество трех-
атомного рентгеноконтрастного вещества на
фоне полиурии приводит к увеличению объе-
ма чашечно-лоханочной системы и гипотонии
мочеточников.
Ретроградная пиелоуретерография связана с
необходимостью цистоскопии и катетеризации
мочеточника. «Морфологическое» направление
в рентгенодиагностике заболеваний почек и
мочевых путей получило свое выражение в со-
вершенствовании именно этого метода. Его
широкое внедрение в клиническую практику
позволило еще до появления экскреторной
урографии накопить большой арсенал рентге-
8*
115
новских признаков, характерных для большин-
ства заболеваний почек и мочевых путей.
В последние годы отмечена тенденция к
уменьшению числа ретроградных пиелоурете-
рографий и ограничению показаний к таким
исследованиям. Это обусловлено внедрением
высокоэффективных контрастных веществ, а
также применением инфузионной урографии —
метода более физиологичного, менее опасного
и дающего не менее четкое изображение поч-
ки, чашечно-лоханочной системы и мочеточни-
ка. Кроме того, нельзя забывать о том, что рет-
роградная пиелоуретерография чревата развити-
ем осложнений в виде инфицирования верхних
мочевых путей, появления лоханочно-почечных
рефлюксов, сопровождающихся острым пиело-
нефритом, а также воспалительными заболева-
ниями уретры, предстательной железы и дру-
гих половых органов у мужчин. Однако и сегод-
ня это исследование имеет определенные стро-
гие показания. Оно необходимо в диагностике
туберкулеза почек, поскольку позволяет выяв-
лять ранние деструктивные изменения в чашеч-
ках, при медуллярном некрозе как осложнении
острого пиелонефрита, при папиллярной опу-
холи лоханки и уратном нефролитиазе, стрик-
туре лоханочно-мочеточникового сегмента и
мочеточника, при необходимости уточнить
число и локализацию конкрементов в почке.
Роль инфекции в возникновении осложнений
преувеличена. Она представляет опасность при нали-
чии предрасполагающих факторов (дискинезия, пи-
елоренальный рефлюкс, травма и пр.). Форникаль-
ная зона чашечки вследствие ее особого строения
предрасположена к разрыву даже при сравнительно
небольшом повышении внутрилоханочного давления.
После нарушения целости форникса моча или рент-
геноконтрастная жидкость проникает в почечный
синус. Затекание содержимого лоханки в интерсти-
циальную ткань почки, проникновение ее в сосуды
в результате нарушения целости слизистой чашечки
в области форникса называются форникальным реф-
люксом. Если происходит затекание лоханочного со-
держимого в канальцы сосочка без надрыва слизис-
той оболочки чашечки и затем это содержимое про-
никает из канальцев в межуточную ткань, такой
рефлюкс называется тубулярным. Рефлюксы приво-
дят к почечным экстравазатам, расстройству гемо-
динамики почки вследствие ишемии и отека интер-
стициальной ткани. Высокая лихорадка, особенно
сопровождающаяся ознобом и лейкоцитозом после
ретроградной пиелографии, указывает на пиелоре-
нальный рефлюкс с проникновением контрастиро-
ванной мочи по межтканевым пространствам в ве-
нозную и лимфатическую системы и возможное раз-
витие острого пиелонефрита.
Одномоментная двусторонняя ретроградная
пиелография недопустима, так как при возник-
новении острого пиелонефрита нередко труд-
но определить сторону поражения для выбора
116
операции, и больной оказывается в чрезвычай-
но тяжелом состоянии. Кроме пиелонефрита,
может развиться и острая почечная недостаточ-
ность.
Антеградная пиелография. При антеградной
пиелоуретерографии рентгеноконтрастное ве-
щество вводят в почечную лоханку путем чрес-
кожной пункции под ультразвуковым или рент-
геновским контролем или по нефро(пиело)сто-
мическому дренажу. Этот метод получил свое-
образное второе рождение с широким внедре-
нием в клиническую практику ультразвуковых
исследований и рентгенотелевидения.
Чрескожная антеградная пиелография пока-
зана в тех случаях, когда прочие методы иссле-
дования не позволяют распознать характер за-
болевания почек. Это относится к заболевани-
ям, при которых на экскреторной урограмме
почка не выделяет рентгеноконтрастное веще-
ство, а ретроградная пиелоуретерография невы-
полнима из-за малой емкости мочевого пузы-
ря, непроходимости уретры (стриктура, гипер-
плазия и рак предстательной железы), окклю-
зии мочеточника (камень, стриктура, облите-
рация), преодолеть которую путем ретроградной
катетеризации невозможно. Наиболее часто она
применяется при так называемой нефункциони-
рующей почке, когда необходимо точно уста-
новить уровень и протяженность облитерации
мочеточника. Непременным условием подобно-
го диагностического вмешательства является
предварительно выявленная дилатация чашеч-
но-лоханочной системы, при которой пункция
чашечно-лоханочной системы относительно
безопасна и легко выполнима.
Почечная ангиография является информатив-
ным методом, позволяющим при одном иссле-
довании получить обширную информацию о
сосудах, почках и мочевых путях. В последние
годы совершенствование ультразвуковых, вне-
дрение рентгеновских компьютерных и магнит-
но-резонансных исследований значительно су-
зило показания к почечной ангиографии, но
отнюдь не исключило ее из арсенала лучевых
методов диагностики в уронефрологии. На пер-
вый план в показаниях к реновазографии се-
годня вышли необходимость детализации изме-
нений магистральных почечных сосудов и со-
судистой архитектоники почек для уточнения
вида, характера и технических особенностей
операций, особенно органосохраняющих. Не
потеряли своей актуальности сосудистые иссле-
дования с целью диагностики вазоренальной
гипертензии, изменений надпочечника и пр.
Транслюмбальная аортография, при которой
заполнение контрастным веществом брюшной
аорты и ее ветвей проводится путем пункции
аорты в левом костовертебральном углу, в на-
стоящее время используется крайне редко из-
за частых осложнений. Повсеместно внедрена
трансфеморальная ангиография по Сельдингеру.
Для ее выполнения осуществляют пункцию
бедренной артерии на 1—2 см ниже паховой
связки. В просвет пункционной иглы вводят
металлический проводник, на него надевают
ангиографическии катетер, а проводник удаля-
ют. По катетеру с помощью автоматического
программируемого шприца непосредственно в
сосуды под давлением нагнетают рентгенокон-
трастное вещество.
Для обзорной брюшной аортографии, позволя-
ющей визуализировать все почечные сосуды,
проксимальный конец ангиографического кате-
тера под рентгеновским контролем устанавли-
вают несколько выше нормального уровня от-
хождения почечных артерий (XI—XII грудные
позвонки). Различают 4 последовательные фазы
циркуляции рентгеноконтрастного вещества в
почке: артериальную (рис. 5.10), когда происхо-
дит заполнение аорты, почечных артерий и их
разветвлений; нефрографическую, или паренхима-
тозную (рис. 5.11), во время которой накапли-
вается контрастное вещество в паренхиме с об-
разованием достаточно плотной почечной тени;
венозную (рис. 5.12), когда можно выявить маги-
стральные почечные вены, и экскреторную, при
которой наступает контрастирование мочевых
путей подобно экскреторной или инфузионной
урографии. Таким образом, этот метод позволя-
ет выявить морфологическое и функциональное
состояние не только почек, но и мочевых пу-
тей. Преимуществом обзорной аортографии при
двусторонних почечных заболеваниях является
получение информации о сосудах обеих почек.
Помимо обзорной аортографии, применяют
и селективную почечную артериографию, когда
ангиографический катетер вводят непосред-
ственно в одну из почечных артерий. Она име-
ет свои преимущества и недостатки. Селектив-
ное введение сравнительно небольшого коли-
чества рентгеноконтрастного вещества значи-
тельно улучшает изображение мелких ветвей
почечной артерии благодаря его равномерному
распределению во всех ветвях, усиливает кон-
трастирование почечной паренхимы. На селек-
тивных артериограммах отсутствуют наслоения
тени сосудов соседних органов.
Однако в связи с крайне разнообразными
вариантами отхождения почечных артерий от
аорты на селективных артериограммах может
быть получено изображение, искажающее ис-
тинную сосудистую архитектонику почки. При
селективной катетеризации артерии на артерио-
грамме может наблюдаться усиление сосудис-
того рисунка, а в нефрографической фазе —
увеличение тени в каком-либо из участков поч-
ки. Подобная картина может быть ошибочно ин-
терпретирована как опухоль. Поэтому для пре-
Рис. 5.10. Обзорная брюшная аортограмма. Артери-
альная фаза.
Объяснения в тексте.
Рис. 5.11. Обзорная брюшная аортограмма. Паренхи-
матозная фаза. Накопление контрастного вещества в
почечной паренхиме.
117
Рис. 5.12. Обзорная брюшная аортограмма, левая поч-
ка.
а — венозная фаза (объяснения в тексте); б — экскретор-
ная фаза. Контрастное вещество накапливается в чашечно-
лоханочной системе и мочеточниках.
дотвращения подобных диагностических оши-
бок селективную артериографию следует при-
менять только после обзорной аортографии (рис.
5.13).
Селективная почечная фармакоартериография.
P.Kahn (1965) установил, что после введения
в почечную артерию адреналина происходит ва-
зоконстрикция в области ворот почки. Эта ме-
тодика была предложена для ангиографической
диагностики новообразований почечной парен-
химы. Патологические сосуды в опухоли лише-
ны эластических волокон, мышечные элемен-
ты в их стенке недостаточны, поэтому в ответ
на введение адреналина они не подвергаются
сужению.
Венокавография — рентгенография нижней
полой вены, заполненной рентгеноконтрастным
веществом. В норме нижняя полая вена располо-
жена строго вертикально параллельно позвоноч-
нику, имеет ровные контуры. На уровне впаде-
ния почечных вен можно наблюдать два косых
пробела контрастирования за счет оттеснения
кровотока нижней полой вены неконтрастирован-
ной кровью из почечных вен. При сдавлении
нижней полой вены опухолью или ее тромбозе
на кавограмме могут выявляться почечные и кол-
латеральные венозные сосуды (рис. 5.14).
Нижнюю кавографию выполняют трансфе-
морально путем пункции бедренной вены. При
непроходимости нижней полой вены до уров-
ня впадения почечных вен исследование мо-
жет быть выполнено путем пункции и катете-
ризации плечевой вены с последующим про-
ведением зонда через верхнюю полую вену и
синус правого предсердия в нижнюю полую.
При нижней кавографии сосудистый катетер
располагают у места слияния общих подвздош-
ных вен.
Показаниями к венокавографии являются
опухоль правой почки, необходимость диагно-
стики опухолевых тромбов, метастазов в лим-
фатические узлы, уточнение локализации за-
брюшинных опухолей — первичных и метаста-
тических.
Почечная венография — метод селективного
введения контрастного вещества для ретроград-
ного контрастирования основного ствола почеч-
ной вены и ее ветвей. Из-за значительного по-
Рис. 5.13. Обзорная брюшная аортограмма. Опухоль
верхнего сегмента правой почки. Сосуды левой поч-
ки не изменены.
118
чечного кровотока (400—500 мл в 1 мин на 100 г
почечной ткани) эта методика позволяет по-
лучить изображение лишь первых, наиболее
крупных ветвей магистральной вены. Только
применение специальных методических при-
емов дает возможность получить изображение
более мелких разветвлений.
Селективная почечная венография имеет
наибольшее диагностическое значение при опу-
холи почки, венной почечной гипертензии.
Последняя может быть обусловлена нефропто-
зом, педункулитом, пиелонефритом, адгезив-
ными процессами вокруг магистральных веноз-
ных стволов почки и нижней полой вены, рет-
роаортальным расположением левой почечной
вены, а также сдавлением левой почечной вены
между аортой и верхней брыжеечной артерией
(«аортомезентериальный пинцет»). Венная по-
чечная гипертензия вследствие нарушений от-
тока венозной крови из почки может прояв-
ляться артериальной гипертензией и гематури-
ей. Селективная почечная венография имеет
значение в диагностике пиелонефритически
сморщенной почки, при травме почки, а так-
же для выявления тромбоза почечной и ниж-
ней полой вен.
Фармаковенография основана на ретроград-
ном введении рентгеноконтрастного вещества
в почечную вену с предварительным уменьше-
нием почечного кровотока. Это достигается се-
лективным введением в ствол магистральной
артерии на исследуемой стороне 10—12 мкг
адреналина. Спазм внутрипочечных артерий
приводит к снижению давления в системе внут-
рипочечных вен, поэтому ретроградное контра-
стирование их спустя 10—20 с становится го-
раздо более эффективным.
Цифровая ангиография (вычислительная,
вычитательная, субтракционная) почек внедре-
на в практику реновазографических исследова-
ний сравнительно недавно. Метод регистрации
основан на введении компьютерной обработки
в процесс получения контрастного изображе-
ния. Программа обработки сочетает одновремен-
ную суммацию контрастированного изображе-
ния с подавлением (вычитанием) мягкотканого
и костного компонентов. Она позволяет на эк-
ране и рентгеновском снимке получить объек-
ты, исключительно содержащие контрастное
вещество, в данном случае — почечные сосу-
ды и паренхиму.
Внедрение цифровой субтракционной ангио-
графии позволяет снизить объем вводимого
рентгеноконтрастного вещества в 2—3 раза, а
суммарное содержание йода в однократно инъ-
ецируемом объеме — в 3—4 раза. При этом
возможно даже внутривенное введение контра-
стного вещества для получения изображения
артерий почки [Восьмирко О.Д. и др., 1987].
Рис. 5.14. Венокавограмма. Несколько выше уровня
впадения правой почечной вены — дефект наполне-
ния больших размеров. Опухолевый тромб нижней
полой вены.
Преимуществом метода, кроме того, явля-
ется меньшая инвазивность, поскольку не тре-
буется пункции бедренных сосудов, что позво-
ляет избежать осложнений, особенно у больных
артериальной гипертензией и атеросклерозом.
Функциональная направленность рентгенов-
ских исследований почек и мочевых путей. При
использовании статической рентгенографии
после внутривенного введения контрастного
вещества время его появления в паренхиме
почки и чашечно-лоханочной системе может
давать функциональную информацию. Так, ин-
тенсивная нефрограмма в сочетании с замед-
ленным контрастированием нерасширенной
чашечно-лоханочной системы у больного арте-
риальной гипертензией может быть признаком,
заставляющим подозревать стеноз почечной ар-
терии. Замедленное контрастирование, начина-
ющееся с расширенных чашечек, а затем уве-
личенной лоханки, характерно для обструктив-
ных процессов, нарушающих отток мочи из
чашечно-лоханочной системы. Появление кон-
трастного вещества вне чашечно-лоханочной
системы (чаще на фоне почечной колики) яв-
ляется признаком лоханочно-почечных рефлюк-
119
сов и экстравазации мочи в клетчатку почеч-
ного синуса, кровеносные и лимфатические
сосуды. Выявление подобных изменений позво-
ляет в дальнейшем ожидать необратимых про-
лиферативных изменений со сморщиванием
пораженной почки.
Наиболее наглядную информацию о транспорт-
ной деятельности проксимального отдела мочевыво-
дящих путей дают рентгенотелевизионные исследо-
вания. Они могут применяться при экскреторной и
инфузионной урографии, на этапах комплексного
вазографического исследования почек, когда контра-
стное вещество вводится непосредственно в сосуди-
стое русло, а также при антеградной и ретроград-
ной пиелоуретерографии. При этом отчетливо вид-
ны фазы наполнения и опорожнения чашечек, ло-
ханки и мочеточника, особенности уродинамичес-
ких процессов и их нарушения, обусловленные пре-
пятствием к оттоку мочи и рефлюксом. Осуществ-
ляя рентгенотелевизионную уроскопию в условиях
избытка введенного контрастного вещества, следу-
ет помнить о возможных искажениях уродинамичес-
ких процессов в силу его диуретического эффекта,
быстрого переполнения мочевого пузыря и пр.
В 60-х годах в рентгенодиагностике для улучшения
изображения проксимального отдела мочевыводящих
путей, экономии рентгеноконтрастного вещества при
инфузионной урографии, сокращения времени иссле-
дования, распознавания вазоренальной гипертензии
стали использовать диуретические средства. В 1976 г.
Ю.А.Пытелем и И.И.Золотаревым была предложена
методика фармакоурографии, которая заключалась в
следующем. При удовлетворительном качестве изоб-
ражения верхних мочевых путей на урограммах с
целью определения их реакции на внезапную поли-
урию внутривенно вводили 10—20 мг фуросемида и
делали повторные снимки на 1—3-й минутах после
введения, а при необходимости и в более поздние
сроки. Применение ренттенотелевизионной уроскопии
позволяло наблюдать изменения в динамике, фикси-
ровать их путем видеозаписи для повторного воспро-
изведения и более пристального анализа.
После внутривенного введения салуретика в силу
значительного возрастания эффективного почечно-
го плазмотока при нормальной функции почки и
отсутствии препятствий к оттоку мочи концентра-
ция рентгеноконтрастного вещества, а следователь-
но, и контрастность рентгеновского изображения на
1—3-й минуте после введения салуретика значитель-
но снижаются. Степень разведения зависит от кон-
центрационной способности почек, что косвенно
свидетельствует об их функциональных резервах. При
нарушенном оттоке мочи (конкремент лоханки и
мочеточника, стеноз лоханочно-мочеточникового
сегмента и мочеточника) четкость и контрастность
изображения чашечно-лоханочной системы усилива-
ются, ретенционные изменения могут выявляться
более четко и при снижении концентрации. Усиле-
ние контрастности рентгеновского изображения на
фоне дилатации свидетельствуют об отсутствии ре-
зервной способности почки к разведению контраст-
ного вещества, что прогностически малоблагопри-
ятно. Разведение, наоборот, свидетельствует о со-
120
хранной способности органа отвечать полиурией на
введение минимальной дозы салуретика.
Побочные реакции и осложнения при неперено-
симости рентгеноконтрастных препаратов, меры их
устранения. Рентгеноконтрастные исследования
таят в себе риск осложнений из-за возможной ин-
дивидуальной непереносимости йодистых соеди-
нений. Побочные действия рентгеноконтрастных
веществ делят на побочные реакции и осложнения.
К побочным реакциям относят головную боль,
головокружение, металлический вкус во рту,
ощущение жара, снижение артериального давле-
ния в пределах 20 мм рт.ст. В большинстве случа-
ев они не требуют лечебных мероприятий и про-
ходят бесследно с окончанием введения контра-
стного вещества или к концу исследования. Од-
нако к ним следует относиться с особым внима-
нием, поскольку они могут быть предвестника-
ми более серьезных осложнений.
К осложнениям относят аллергические про-
явления (уртикарная и петехиальная сыпь, ан-
гионевротический отек, слезо- и слюнотечение,
бронхо- и ларингоспазм), а также анафилакти-
ческий шок, коллапс, острую почечную и пе-
ченочную недостаточность, которые могут стать
причиной смерти. Осложнения требуют неза-
медлительных лечебных мероприятий, посколь-
ку отсутствие своевременной помощи утяжеляет
их исход. Аллергические симптомы могут про-
являться йодизмом с раздражением слизистых
оболочек и кожи. Кашель, насморк, слезотече-
ние, кожная сыпь исчезают в первые часы пос-
ле исследования. Бронхо- и ларингоспазм, ана-
филактический шок отмечаются гораздо реже.
При внутривенном введении рентгеноконт-
растных веществ могут наступать изменения
физико-химических свойств крови: снижается
осмотическая резистентность эритроцитов, вы-
зывая гемолиз, происходит деформация эрит-
роцитов, снижается СОЭ как результат наруше-
ния электрического равновесия эритроцитов.
Может также снижаться и содержание гемо-
глобина. При гемолизе высвобождается гиста-
мин, даже небольшие дозы которого в виде
ангионевротической реакции являются причи-
ной металлического привкуса во рту, ощуще-
ний жара, спазма гладкой мускулатуры и ар-
териальной гипотензии.
Нефротоксическое действие рентгенконтраст-
ного вещества может сопровождаться протеину-
рией, острым тубулярным некрозом и острой
почечной недостаточностью. Клинические про-
явления подобных осложнений напоминают
интерстициальный нефрит, канальцевый не-
кроз, шоковую почку. Морфологически выявля-
ют сосудистые изменения — тромбоз, инфаркт,
фибриноидный некроз капилляров клубочков,
междольковых и внутридольковых артерий.
Признаки острой почечной недостаточнос-
ти могут возникнуть в первые часы после вве-
дения в кровоток рентгеноконтрастных веществ.
Несмотря на острую почечную недостаточ-
ность, имеет место гипокалиемия, затем раз-
виваются диспепсия, боль в животе, высыпа-
ния на коже. ОПН является следствием ише-
мии коркового вещества почки в ответ на на-
рушения кровотока. Возможно развитие этого
тяжелого осложнения после экскреторной уро-
графии у больных миеломной болезнью, у ко-
торых возникает обтурация почечных канальцев
белковыми цилиндрами с поражением нефро-
нов и анурией. Во время экскреторной и осо-
бенно инфузионной урографии происходит
дегидратация организма, поэтому после иссле-
дования желательно введение жидкости с пос-
ледующим увеличением диуреза. Эти рекомен-
дации относятся и к больным с протеинурией
неясного генеза, которым показаны рентгено-
контрастные исследования.
Описанные побочные реакции и осложнения
не должны служить поводом для отказа от рен-
тгеноконтрастных исследований, когда они аб-
солютно показаны. Следует иметь в виду, что об-
щая частота побочных реакций и осложнений
составляет около 5 %, а подавляющее большин-
ство из них — это легкие, в основном аллерги-
ческие и сосудистые проявления. Наиболее тя-
желое осложнение — анафилактический шок,
который наблюдается в среднем один раз на 200
тыс. экскреторных урографий [Пытель Ю.А.,
Золотарев И.И., 1987]. Применение предвари-
тельного введения «пробной» дозы контрастно-
го вещества во всем мире оставлено, так как
доза его не имеет существенного значения для
неожиданного проявления порой весьма тяже-
лого осложнения, а предварительное введение
препарата накануне способствует ускоренной
сенсибилизации организма больного. Это может
привести к возникновению осложнений при
введении основной дозы контрастного вещества
на следующий день.
С особой настороженностью необходимо
относиться к больным, у которых ранее про-
водившиеся исследования с внутрисосудистым
введением рентгеноконтрастного вещества со-
провождались проявлениями непереносимости
йодистых препаратов. Именно у них вследствие
сенсибилизации возможны тяжелые осложне-
ния при повторных исследованиях.
Следует также помнить, что меньшая веро-
ятность побочных реакций имеет место при
использовании неионизированных рентгено-
контрастных йодистых соединений (ультра-
вист, омнипак и пр.).
Первая помощь при проявлениях непереноси-
мости рентгеноконтрастных препаратов. При ал-
лергических реакциях прежде всего необходимо
внутривенно ввести антидот йода, которым яв-
ляется 30 % раствор тиосульфата натрия в ко-
личестве 20—30 мл. Как правило, побочные ре-
акции при этом купируются сразу. Если этого не
происходит, прибегают к внутривенному введе-
нию хлорида или глюконата кальция (10 мл
Таблица 5.1. Осложнения и первая помощь при непереносимости рентгеноконтрастных препаратов
Характер осложнения Симптомокомплекс Лечебные мероприятия
Острая левожелудочковая не- достаточность Нарастающие одышка, тахикардия, гипотензия, циркуляторная гипоксия, при выраженной недостаточности — отек легких Внутривенно 0,5—0,7 мл 0,05 % ра- створа строфантина или 0,06 % раство- ра коргликона в 20 мл 40 % раствора глюкозы, 10 мл 10 % раствора хлори- да кальция или глюконата кальция, 2 мл 2,4 % раствора эуфиллина. При отеке легких — кислород, жгуты на ко- нечности, внутривенно 1,5—2 мл тала- монала, глюкокортикоиды
Острая правожелудочковая не- достаточность Нарастающие тахикардия, снижение артериального давления, цианоз, одышка; резкое повышение централь- ного венозного давления Внутривенно 10 мл 10 % раствора хло- рида кальция или глюконата кальция, 10 мл 2,4% раствора эуфиллина
Анафилактический шок Кожный зуд, чувство тяжести, стесне- ния в груди и эпигастральной облас- ти, одышка, покраснение лица, сме- няющееся бледностью, падение ар- териального давления, иногда потеря сознания, судороги Внутривенно или внутрисердечно 0,5— 1 мл 0,1 % раствора адреналина или норадреналина, глюкокортикоиды, эфедрин, димедрол
121
10 % раствора), глюкокортикоидов (30—60 мг
преднизолона в растворе глюкозы), антигиста-
минных препаратов, 20—40 мг фуросемида.
Внезапную выраженную гипертензию, кол-
лапс с бледностью кожных покровов и малым
пульсом необходимо рассматривать как прояв-
ление острой сердечно-сосудистой недостаточ-
ности и провести экстренные лечебные меро-
приятия (табл. 5.1).
5.3.4. Радионуклидные исследования
Радионуклидные (радиоизотопные) исследова-
ния широко используют в уронефрологичес-
кой практике в основном для оценки функ-
ционального состояния почек и косвенно —
мочевых путей. Их нельзя противопоставлять
ультразвуковым и рентгеновским методам, по-
скольку самостоятельного значения в опреде-
лении характера патологического процесса они
не имеют, а должны применяться в сочетании
с ними, дополняя их информацию своей. Толь-
ко в этом случае радионуклидные исследова-
ния почек приобретают важное значение. В ра-
диоизотопной диагностике принято различать
методы радиометрии (для почек — это изотоп-
ная ренография), радиографии (сканирование)
и исследования in vitro. Совершенствование ме-
тодов и технического оснащения, появление
новых, высокоэффективных радиофармпрепа-
ратов, вводимых в организм больного, приве-
ли к отходу от старых методов ренографии и
сканирования. Использование гамма-камеры
позволило дифференцированно подходить к
решению задач, поставленных перед исследо-
ванием, путем применения различных радио-
фармпрепаратов, тропных к сосудистому рус-
лу, клубочкам, канальцам и пр. (табл. 5.2).
С помощью компьютерных средств радиоизо-
топная диагностическая система в каждой точ-
ке проекции почки или в пределах заданной
«зоны интереса» позволяет анализировать по-
ступление, накопление и выведение радиоак-
тивного вещества, получать цифровые значе-
ния этого анализа по установленной програм-
ме, фиксировать результаты в памяти, воспро-
изводить их на экране дисплея для описания
и пр. Эти технические достижения поставили
радиоизотопную диагностику заболеваний по-
чек и мочевых путей на новую, более высо-
кую ступень.
Ренография и динамическая нефросцинтигра-
фия. Для исследования почек со стороны спи-
ны больного размещают детектор гамма-каме-
ры так, чтобы оба органа находились в зоне его
восприятия. При этом центр должен быть на 2—
3 см ниже XII ребра. Как правило, это осуще-
ствляется в положении сидя, но при необхо-
димости исследование может быть выполнено
в положении лежа на животе. Динамику поступ-
ления, накопления и выведения радиофарм-
препарата почкой наиболее наглядно демонст-
рирует введение гиппурана, меченного 1311, ра-
створенного в 0,5—1 мл изотонического раство-
ра натрия хлорида. Активность вводимого радио-
фармпрепарата при ренографии составляет
0,55—0,74 МБк, а при динамической нефро-
сцинтиграфии — 7,4—19,5 МБк. Динамику ра-
диоактивности в каждой из наблюдаемых точек
последовательно отражают сосудистый и сек-
реторный сегменты ренографической кривой,
а выведение препарата — ее экскреторный сег-
мент. Одновременно фиксируют и динамику
очищения крови от введенного радиоактивно-
го вещества.
Количественная оценка ренографической
кривой проводится по трем показателям:
Таблица 5.2. Общая характеристика радиоизотопных методов исследования, применяемых по диагно-
стическим направлениям
Объект основной диагностической информации (диагностическое направление) Метод исследования Используемые радиодиагностические препереты
Состояние почечного кровообращения Интенсивность канальцевой секреции Интенсивность клубочковой фильтрации Функционально-структурное состояние почечной паренхимы Состояние уродинамики верхних мочевых путей Состояние эвакуаторной функции моче- вого пузыря Непрямая радиоизотопная рено- ангиография Радиоизотопная ренография (1 вариант) Радиоизотопная ренография (II вариант) Динамическая и статическая почечная сцинтиграфия Радиоизотопная ренография, ди- намическая почечная сцинти- графия Радиоизотопная урофлоуметрия 99тТс- или 1311-альбумин 1311- или 1251-гиппуран 99тТс- или 1,3т1п-ДТПА 1311- или 1251-гиппуран 99тТс-ДМСА 1311- или 1211-гиппуран 1311- или 1251-гиппуран
122
• время максимального подъема ренограммы,
которое в норме составляет 3—5 мин;
• период полувыведения препарата, равный
8—10 мин;
• период полуочищения крови, который в
норме составляет 5—7 мин.
При динамической нефросцинтиграфии с
использованием гамма-камеры суммарная оцен-
ка подобного процесса в каждой почке осуще-
ствляется компьютерным анализом. Максималь-
ное накопление радиоактивного препарата в
паренхиме также наблюдается к 3—5 мин пос-
ле внутривенного введения. Через 6 мин кон-
трастность в проекции почек уменьшается и на-
чинает определяться мочевой пузырь. К 8—
10 мин контрастность почек еще более умень-
шается, а мочевого пузыря — значительно уве-
личивается. При этом иногда бывает возможно
различить на экране дисплея крупные порции
мочи, транспортируемые мочеточником. При
наличии препятствия к оттоку мочи появляет-
ся изображение, соответствующее расширенной
чашечно-лоханочной системе (гидрокаликоз, гид-
ронефроз) и мочеточнику (уретерогидронефроз).
В нормальных условиях к 15—17 мин от начала
исследования изображение почек едва выявля-
ется, а большая часть препарата определяется
в мочевом пузыре. Иногда возможно наблюдать
обратный (юкстафокальный) ток мочи в на-
правлении почечной лоханки, а при мочеиспус-
кании — пузырно-мочеточниковый рефлюкс. Ко-
личественная оценка уменьшения активности в
проекции мочевого пузыря при его опорожне-
нии (радиоизотопная урофлоуметрия) с уточне-
нием остаточной мочи помогает в диагностике
инфравезикальной обструкции. Благодаря компь-
ютерному анализу и видеозаписи точность ди-
намической нефросцинтиграфии намного пре-
восходит ренографические исследования, а вос-
произведение результатов может осуществляться
многократно.
Непрямая радиоизотопная ангиография почек
(ангионефросцинтиграфия) позволяет осуществ-
лять качественную и количественную оценку
почечного кровообращения. Использование это-
го метода стало возможным благодаря внедре-
нию не только гамма-камер, но и короткоживу-
щих изотопов "П1Тс-пертехнетата и 113mIn. Непре-
менным свойством применяемого радиофарм-
препарата должно быть создание болюса в токе
крови, прохождение которого в артерии, арте-
риолы и капиллярно-венозную сеть каждой
почки фиксируется в ходе исследования. Внут-
ривенно без снятия жгута для создания болю-
са препарата вводят 1 мл (148—222 МБк) 99тТс-
пертехнетата, после чего жгут быстро снимают.
Этапы его транспорта по сосудам фиксируют
с помощью видеозаписи. С учетом более пол-
Рис. 5.15. Магнитно-резонансная томограмма нор-
мальных почек без контрастирования, горизонталь-
ная проекция.
Рис. 5.16. Магнитно-резонансная томограмма нор-
мальных почек без контрастирования, фронтальная
проекция.
ного связывания радиофармпрепарата протеи-
нами плазмы лучших нефротропных качеств для
ангионефросцинтиграфии предпочтительна ди-
меркаптосукциновая кислота (ДМСА), мечен-
ная 99гаТс. Спустя 5—7 с после введения радио-
фармпрепарат в виде болюса попадает в малый
круг кровообращения. Определяется его прохож-
дение через нижние сегменты легких, через
2—3 с — по брюшной аорте и почкам и еще
спустя 2—3 с — в общие подвздошные арте-
123
Рис. 5.17. Магнитно-резонансные томограммы нор-
мальных почек с контрастированием магнивистом.
1 — горизонтальная проекция; 2 — фронтальная проекция.
рии. Для получения представления о почечном
кровообращении оптимальны первые 8—12 с
после внутривенного введения препарата.
Количественными показателями почечного
кровотока являются ренально-аортальный ин-
декс (РАИ), а также индекс почечной цирку-
ляции (ИПЦ), расчет которого проводится
методом деконволюционного анализа.
В зависимости от изменения конфигурации
кривой и увеличения временных параметров в
каждой почке на разных уровнях можно выяв-
лять гемодинамические расстройства при вазо-
ренальной гипертензии и расстройствах крово-
обращения в аномальных почках, при нефро-
птозе, коралловидном нефролитиазе, гидро-
нефрозе, нарушениях кровообращения в транс-
плантированной почке, для контроля эффек-
тивности лечения и пр.
Функциональная направленность радионуклид-
ных исследований. Функциональные радионук-
лидные исследования отличаются необходимо-
стью их повторения в условиях провокации для
последующего сравнения с исходными данны-
ми. При этом лучевая нагрузка на организм
больного, безусловно, несколько больше, но
ценность получаемой информации при условии
минимальной дозы (активности) вводимого ра-
диофармпрепарата оправдывает это. Известна
туберкулин-ренографическая проба, облегчающая
диагностику почечного туберкулеза по очаговой
реакции (изменения сосудистого и секреторно-
го сегментов ренограммы). Введение диурети-
ков (диуретическая ренография) помогает уточ-
нять не только резервы канальцевого аппарата
почек, но и возможности транспорта мочи из
почек в мочевой пузырь. Применение капто-
прила при радионуклидных исследованиях по-
чек способствует диагностике нефрогенной ги-
пертензии. Фармако ангионефросцинтиграфия с
кофеином дает информацию о гемодинамике по-
чек, кровоснабжении каждой почки посегмен-
тарно, позволяет выявлять резервные возмож-
ности их сосудистой сети, скрытые патологи-
ческие изменения сосудов почек и определять
количество функционирующей паренхимы в
каждой почке. Это исследование может прово-
диться и на диагностическом этапе, и для оцен-
ки эффективности терапии.
Противопоказаний к проведению функцио-
нальных радионуклидных исследований нет, но
имеются общие ограничения — беременность
и лактация.
5.3.5. Магнитно-резонансная
томография
Магнитно-резонансная томография — сравни-
тельно молодой, бурно развивающийся неин-
вазивный и высокоинформативный метод ис-
следования. Его преимуществом является воз-
можность получения отчетливого изображения
почек, органов забрюшинного пространства и
брюшной полости не только в горизонтальной
(поперечные срезы), но и в других проекциях,
наиболее распространенными из которых явля-
ются фронтальная и сагиттальная. Сопоставле-
ние данных, полученных при исследовании в
разных проекциях, позволяет воссоздать карти-
ну взаимоотношения патологического очага в
почке (опухоль, киста, конкремент, зона дес-
трукции, ретенции мочи и пр.) с непоражен-
ной частью почки, ее внутриорганными и ма-
гистральными сосудами, чашечно-лоханочной
системой, а также соседними органами. По
124
плотности образования можно с уверенностью
судить о солидном, жидкостном или смешан-
ном его характере. Несомненным достоинством
метода в диагностике заболеваний почек явля-
ется возможность одновременной визуализации
внутрипочечных артерий и вен во взаимоотно-
шении с элементами чашечно-лоханочной си-
стемы, а также аорты и нижней полой вены,
что особенно важно при опухолевой инвазии.
На всем протяжении может быть прослежена
регионарная лимфатическая цепь (паракаваль-
ная, аортокавальная, парааортальная) в про-
дольном изображении.
Получение столь многообразной информа-
ции не только существенно дополняет резуль-
таты других исследований. Оно чрезвычайно
важно у больных, которые не переносят рент-
геноконтрастные вещества, имеют выраженные
атеросклеротические изменения магистральных
сосудов, препятствующие ангиографии, а так-
же у больных хронической почечной недоста-
точностью. Важными преимуществами метода
являются отсутствие лучевой нагрузки, узкий
круг противопоказаний и ограничений к его
проведению.
Информация, полученная в результате ска-
нирования, преобразуется в компьютере с по-
мощью анализатора Фурнье и поступает на
экран черно-белого монитора в виде математи-
ческой модели участка тела больного в 3 вза-
имно перпендикулярных проекциях: аксиальной
(поперечная), коронарной (фронтальная) и са-
гиттальной. При необходимости изображение
может быть построено и в косых наклонных
проекциях (рис. 5.15—5.19). Исследование про-
водят в положении на спине, руки — на голо-
ве больного.
Магнитно-резонансная томография может
выполняться с контрастированием. Магнивист —
парамагнитное контрастное вещество, действу-
ющим началом которого является димеглуино-
вая соль гадопентетной кислоты (гадолиний
ДТПА). Препарат вводят однократно внутривен-
но без предварительной подготовки больного в
дозе 0,2 мл/кг. Аллергические реакции наблю-
даются редко. Накопление магнивиста объем-
ным образованием паренхимы почки свидетель-
ствует о его солидном характере и наоборот.
Ограничением для проведения магнитно-ре-
зонансной томографии является клаустрофобия,
а также наличие в теле металлических предметов
(протезы, фиксаторы), искажающих результаты
исследования и способных смещаться под влия-
нием мощного постоянного магнитного поля.
Лучевые исследования сегодня представля-
ют собой мощный и стройный арсенал диаг-
ностических методов, позволяющих с высокой
точностью определить характер патологического
процесса в почке, его стадию, локализацию и
Рис. 5.18. Опухоль левой почки (указано стрелкой).
Магнитно-резонансная томограмма без контрасти-
рования (в горизонтальной проекции).
Рис. 5.19. Опухоль нижнего сегмента левой почки
(указано стрелкой). Магнитно-резонансная томограм-
ма в сагиттальной проекции с контрастированием
магнивистом.
распространенность. Функциональная направ-
ленность этих методов дает возможность оце-
нивать функциональное состояние почек и
мочевых путей, выявлять их недостаточность и
функциональные резервы. Наблюдение двига-
тельной активности проксимального отдела
мочевыводящих путей, провокационные тесты
помогают этому. Информация, полученная на
основе лучевых диагностических методов, по-
125
зволяет установить диагноз, индивидуально
подойти к выбору лечения и объективно оце-
нивать его результаты.
5.4. Биопсия почки*
Биопсия почки — прижизненное морфологичес-
кое исследование почечной ткани, которое про-
водят закрытым (чрескожная пункция) или
оперативным (открытая, полуоткрытая биопсия)
методом. Исследование широко применяется в
клинической практике с начала 50-х годов пос-
ле разработки технически простого и более до-
ступного клиницистам метода закрытой биопсии
почки [Kark R.M., 1954]. Этот метод в настоя-
щее время используют большинство нефрологов.
В последние годы с внедрением метода уль-
тразвукового секторального сканирования ин-
формативность закрытой биопсии почки суще-
ственно увеличилась и достигла уровня опера-
тивных методов. Кроме того, для повторных
многократных биопсий может использоваться
только закрытая биопсия.
Биопсия почки применяется с диагностичес-
кой целью, при этом в 20—40 % случаев она
принципиально изменяет клинический диагноз.
Диагностическая биопсия почки используется
после того, как исчерпаны возможности других
менее инвазивных диагностических методов: био-
псии слизистой оболочки десны и прямой киш-
ки для верификации амилоидоза, биопсии кожи,
кожных узелков, слизистой оболочки носоглот-
ки, мышц для диагностики системных васкули-
тов, диабетической ангиопатии, подагры и т.д.
Биопсия почки уточняет причину органичес-
кой протеинурии, нефротического синдрома,
разграничивая гломерулонефрит, амилоидоз по-
чек, хронический интерстициальный нефрит
(ХИН), диабетический гломерулосклероз. С по-
мощью биопсии почки могут быть диагности-
рованы острый постинфекционный нефрит, си-
стемная красная волчанка — при обнаружении
соответствующих почечных морфологических
маркеров.
Дополнительные окраски биоптата позволя-
ют отличить первичный амилоидоз от вторич-
ного. В то же время биопсию почки в настоя-
щее время нельзя использовать для установле-
ния паранеопластического генеза нефропатии
(нефрита, амилоидоза) и далеко не во всех
случаях патоморфологическое исследование
биоптатов обеспечивает разграничение первич-
ного (брайтова) нефрита от вторичных нефри-
тов, ХИН — от хронического пиелонефрита.
Диагностическая биопсия почки показана
при рецидивирующей или стойкой гематурии
* Раздел написан А.Ю.Николаевым.
126
(особенно при повторных эпизодах макрогема-
турии, семейной гематурии) после исключения
урологических заболеваний, сопровождающихся
гематурией [Kobrin S. et al., 1996].
Для дифференциальной диагностики остро-
го ГН с болезнью Берже, алкогольным гемату-
рическим нефритом информативно комплексное
(светооптическое, иммунолюминесцентное и
электронно-микроскопическое) исследование.
Биопсия почки показана при канальцевой
дисфункции неясного генеза (синдроме Фанко-
ни, почечном канальцевом ацидозе, почечном
несахарном диабете) для разграничения наслед-
ственных тубулопатий с приобретенными.
A.S.Levey (1995) рекомендует проведение
диагностической биопсии почки при гипертен-
зии неясного генеза (в том числе злокачествен-
ной) с целью дифференциальной диагности-
ки хронического необструктивного пиелонеф-
рита, гипертонической болезни, гемолитико-
уремического синдрома, системных васкулитов,
диабетического гломерулосклероза и подагри-
ческой нефропатии. В то же время следует от-
метить, что биопсия почки при хроническом
пиелонефрите и узелковом полиартериите ма-
лоинформативна и может привести к тяжелым
осложнениям (разрыв внутрипочечной аневриз-
мы с профузным кровотечением, инфицирова-
ние околопочечной клетчатки).
Большое значение имеет биопсия почки при
ренальной острой почечной недостаточности
(ОПН). По данным Итальянского регистра био-
псии почки, опубликовавшего результаты ана-
лиза почти 16 000 биопсий, за последние 7 лет
[Schena F.P., 1997] ОПН послужила показани-
ем к биопсии почки у каждого десятого боль-
ного. При этом лишь у 7,9 % больных с ОПН
была выявлена морфологическая картина ост-
рого канальцевого некроза, у остальных отме-
чены воспалительные причины ОПН: некроти-
зирующие васкулиты (20,1 %), экстракапилляр-
ный пролиферативный нефрит (14 %), острый
лекарственный тубулоинтерстициальный не-
фрит (11,3 %) и др.
Причиной ОПН могут быть диффузный не-
фрит без экстракапиллярной пролиферации
(острый постинфекционный, волчаночный),
ВИЧ-нефропатия, IgA-нефропатия, мезангио-
капиллярный HCV-нефрит с криоглобулинеми-
ей, гемолитико-уремический синдром и тром-
ботическая тромбоцитопеническая пурпура
[Pusey C.D. et al., 1992].
По данным V.E.Andreucci и соавт. (1998),
биопсия почки кардинально изменила диагноз
и терапевтическую тактику у 71 % больных
ренальной ОПН.
При ОПН биопсия почки может проводить-
ся лишь после того, как исключены пререналь-
ная и постренальная (обструктивная) ОПН. Она
показана при ренальной ОПН неустановленной
этиологии, при сочетании ОПН с симптома-
ми гломерулонефрита или экстраренальной
системной манифестации, при подозрении на
лекарственный ОТИН, при анурии, персисти-
рующей более 3 нед [Conlon P.J. et al., 1995;
Kobrin S. et al., 1996].
В то же время в связи с высоким риском
осложнений (усугубление почечной недостаточ-
ности даже при небольшом кровотечении из
пунктированной почки) биопсия может про-
водиться лишь при возможности проведения
срочного гемодиализа (или перитонеального
диализа), после детального обследования с
целью исключения причин ОПН, требующих
принципиально иной лечебной тактики: апо-
стематозного нефрита, тромбоза, эмболии по-
чечных сосудов, миеломной болезни, мочекис-
лой блокады почек, склеродермической почки.
Высока диагностическая ценность биопсии
почечного трансплантата с учетом многообра-
зия причин нарушения его функционирования:
острый канальцевый некроз (ишемический или
лекарственный), острое или хроническое оттор-
жение, сандиммуновая нефропатия, такроли-
мус-нефропатия, рецидив ГН, ГН de novo,
пиелонефрит трансплантата [Solez К. et al., 1993;
Williams W.W., 1997; Yang C.W. et al., 1997].
Установлено, что при эффективном лечении
криза отторжения положительные морфологи-
ческие изменения в биоптате на несколько су-
ток опережают развитие соответствующей био-
химической динамики [Woodie E.S. et al., 1996].
Гистологические признаки нефротоксичности
сандиммуна и такролимуса также опережают
клинические проявления лекарственной нефро-
патии [Andreucci V.E. et al., 1998].
Показания к диагностической биопсии почки
Заболевания Показания к биопсии почки
Нефропатии Нефротический синдром Протеинурия более 1 г/л Стойкая или рецидивирующая гло- мерулярная гематурия Почечная паренхиматозная гипер- тензия неясного генеза Канальцевая дисфункция неясно- го генеза
Ренальная ОПН ОПН неясной этиологии ОПН с системными признаками ОПН с симптомами гломеруло- нефрита ОПН с анурией, персистирующей более 3 нед
Биопсия почки с целью подбора терапии.
У 30—35 % нефрологических больных биопсия
почки, не меняя клинический диагноз, суще-
ственно влияет на терапевтическую тактику,
выявляя стероидорезистентные (мезангиокапил-
лярный, диффузный фибропластический не-
фрит, фокально-сегментарный гломерулоскле-
роз) и стероидочувствительные формы нефрита
(«минимальные» изменения, мембранозный не-
фрит, мезангиопролиферативный нефрит). Био-
псия с целью подбора активной терапии дол-
жна проводиться в ранние сроки (в первые
2 года болезни) при хроническом нефрите с
нефротическим или выраженным мочевым син-
дромом с обязательным применением иммуно-
люминесцентного и электронно-микроскопи-
ческого анализа [Tisher С.С., 1994].
В то же время следует подчеркнуть, что дан-
ные биопсии почки не могут надежно исполь-
зоваться для прогнозирования эффекта глюко-
кортикоидной терапии мембранозного нефри-
та и наиболее распространенного морфологи-
ческого варианта — мезангиопролиферативно-
го нефрита; морфологические критерии прогно-
за терапевтического эффекта должны оцени-
ваться с учетом этиологии, нозологической
принадлежности нефрита [Мухин Н.А., Тарее-
ва И.Е., 1984; Kobrin S. et al., 1996].
Повторные биопсии, контролирующие эф-
фективность терапии, проводят при хроничес-
ком нефрите и амилоидозе почек. Биопсии осу-
ществляют закрытым способом с различной
периодичностью в зависимости от тяжести те-
чения почечного процесса и особенностей им-
мунодепрессивной терапии.
В динамике оценивают степень пролифера-
тивных и фибропластических изменений в клу-
бочках, диффузность отложения и состав гло-
мерулярных депозитов, выраженность и распро-
страненность лимфогистиоцитарной и фибро-
пластической трансформации стромы.
При амилоидозе почек решающее значение
при повторных биопсиях имеют изменения сте-
пени загруженности клубочков амилоидом.
Противопоказания к биопсии почки. C.C.Tisher
(1994) абсолютными противопоказаниями для
осуществления биопсии считает:
• наличие единственной функционирующей
почки;
• нарушения свертывающей системы крови
(гипокоагуляция, тромбоцитопения, гемор-
рагические диатезы);
• повышение венозного давления в большом
круге кровообращения (правожелудочковая
недостаточность);
• тромбоз почечных вен;
• гидро- и пионефроз;
• поликистоз почек;
• наличие аневризмы почечной артерии.
Особо выделяют среди противопоказаний
негативное отношение больного к биопсии, не-
127
возможность контакта с больным (деменция,
кома, психоз). Биопсия противопоказана при
непереносимости новокаина, подозрении на
опухоль почки.
К числу относительных противопоказаний
относятся тяжелая артериальная гипертензия
(диастолическое артериальное давление более
110 мм рт. ст.), выраженная почечная недоста-
точность (содержание креатинина в сыворотке
крови более 0,44 ммоль/л), распространенный
атеросклероз, далеко зашедший нефрокальци-
ноз, узелковый полиартериит, миеломная бо-
лезнь, патологическая подвижность почки.
Биопсию почки нельзя проводить у женщин
в дни, предшествующие менструации.
Подготовка к биопсии почки. Перед биопси-
ей необходимо оценить состояние свертываю-
щей системы крови (коагулограмма, время кро-
вотечения, количество тромбоцитов), опреде-
лить группу крови и резус-фактор, функцио-
нальную способность почек, их расположение
и подвижность. При отсутствии противопоказа-
ний проводится внутривенная урография; рент-
геновские снимки делают в положении боль-
ного лежа и стоя. При снижении концентраци-
онной способности почек, непереносимости
контрастных препаратов используют радионук-
лидные методы (динамическая реносцинтигра-
фия, изотопная ренография) в сочетании с
рентгенотомографией почек или, что предпоч-
тительней, в комплексе с двухмерной эхогра-
фией. Ультразвуковое исследование в отличие
от рентгенологических методов позволяет уста-
новить глубину расположения почек, оно осо-
бенно полезно для выявления таких противо-
показаний к нефробиопсии, как поликистоз
почек.
Подготовка к биопсии больного с тяжелой
артериальной гипертонией заключается в созда-
нии управляемой гипотонии (внутривенное
введение арфонада, нитропруссида натрия,
диазоксида) в момент пункции и в течение 2—
3 сут после нее [Levey A.S., 1995].
Риск кровотечения после биопсии особен-
но высок у больных ОПН, поэтому у них не-
обходим тщательный контроль за системой
коагуляции, функцией тромбоцитов, временем
кровотечения. При ОПН перед биопсией сле-
дует добиться увеличения гематокрита крови
более 30 % (с помощью гемотрансфузий или
препаратов ЭПО), а также корригировать ар-
териальную гипертензию и нарушения сверты-
вания (Andreucci V.E. et al., 1998] — переливани-
ем тромбоцитной массы, криопреципитата, вве-
дением вазопрессина (десмопрессин 0,3 мкг/кг
внутривенно на изотоническом растворе натрия
хлорида).
В том случае, если полная коррекция гипер-
тонии, геморрагического синдрома и гипокоа-
128
гуляции не достигается, вместо чрескожной
применяется трансюгулярная эндоскопическая
биопсия почки [Mai F. et al., 1992]. Биопсия
почки должна производиться не менее чем че-
рез 6 ч после очередного ГД, следующий се-
анс ГД должен выполняться не ранее чем че-
рез сутки после биопсии. Ультразвуковой кон-
троль за состоянием пунктированной почки
проводится сразу после биопсии и спустя 3 ч.
Абсолютные противопоказания к биопсии почки
и методы их выявления
Абсолютные
противопоказания
к биопсии почки
Единственная функцио-
нирующая почка
Выраженная гипокоагу-
ляция
Нарушение кровообра-
щения по большому
кругу
Тромбоз почечных вен
Гидро(пио)нефроз
Поликистозная болезнь
почек
Злокачественная опу-
холь почки
Аневризма почечной
артерии
Непереносимость ново-
каина
Психическая неадекват-
ность
Методы, выявляющие
противопоказания
к биопсии почки
Внутривенная урография,
динамическая нефро-
сцинтиграфия
Тромбоциты крови, коагуло-
грамма
Измерение центрального
венозного давления и
скорости кровотока
УЗИ-допплерография, се-
лективная почечная ве-
нография
УЗИ, внутривенная урогра-
фия
УЗИ, компьютерная томо-
графия
УЗИ, компьютерная томо-
графия
УЗИ-допплерография, по-
чечная селективная ан-
гиография
Данные аллергологическо-
го анамнеза
Консультация психоневро-
лога
Методика биопсии почек. Методика закрытой
биопсии почки, предложенная R.Kark (1954),
предусматривала использование урорентгено-
граммы для поиска и расчета локализации ниж-
него полюса почки. С начала 80-х годов внедрена
методика закрытой биопсии почки под конт-
ролем секторального ультразвукового сканиро-
вания в реальном масштабе времени [Wiseman
D.A. et al., 1990]. При биопсии почки у боль-
ных с избыточной массой тела более эффекти-
вен не ультразвуковой контроль, а компьютер-
ная томография [Sateriale М. et al., 1990].
Способ получения биоптата определяется кон-
струкцией пункционной иглы. Наряду с тради-
ционным мануальным способом все шире при-
меняются автоматические биопсийные иглы
[Christensen J. et al., 1995]. При биопсии автома-
тическими иглами эффективность сопоставима с
мануальным способом, а осложнения развивают-
ся почти в 3 раза реже [Riehl J. et al., 1994]. При
наличии противопоказаний к чрескожной пунк-
ционной биопсии (тяжесть состояния, выражен-
ный геморрагический синдром, полиорганная
недостаточность) может использоваться откры-
тая или трансюгулярная биопсия почки [Mai F.
et al., 1992]. Для биопсии почечного трансплан-
тата преимущественно применяют биопсию ав-
томатическими иглами [Williams W.W., 1997].
Для профилактики осложнений больной в
течение 3 ч после пункции лежит на пузыре со
льдом, затем в течение последующих 2 сут со-
храняет строгий постельный режим. Назначают
гемостатические средства (викасол, хлорид
кальция) и антибиотики (эритромицин, полу-
синтетические пенициллины).
Для оценки эффективности биопсии край-
не важен немедленный визуальный контроль за
качеством биоптата с помощью лупы. Биоптат,
содержащий 8—10 клубочков (количество, не-
обходимое для полноценного морфологического
заключения), может быть получен при закры-
той биопсии с секторальным ультразвуковым
сканированием в 95—100 % случаев.
Осложнения биопсии почки. Типичным ран-
ним осложнением нефробиопсии является кро-
вотечение в почечную лоханку, под капсулу
почки, в паранефральную клетчатку. Кратко-
временная микрогематурия, сохраняющаяся в
первые 2 дня после биопсии, отмечается в 20—
30 % случаев. Макрогематурия наблюдается в
5—7 % случаев, обычно она протекает бессимп-
томно. Массивная макрогематурия может сопро-
вождаться вторичной почечной коликой, дизу-
рией, иногда тампонадой мочевого пузыря кро-
вяными сгустками, что требует урологической
помощи. Длительная макрогематурия или ее
поздний рецидив, как правило, объясняются
инфарктом почки.
По данным J.Christensen и соавт. (1995),
постбиопсийная макрогематурия встречается у
больных с гипертензией в 3 раза чаще, чем при
нормальном АД.
Массивное кровотечение под капсулу, в
паранефральную клетчатку с образованием пе-
риренальной гематомы развивается в 0,5—1,3 %
случаев, проявляется интенсивными постоян-
ными «распирающими» болями в пояснице,
животе, снижением артериального давления,
показателей гематокрита и гемоглобина. Это
серьезное осложнение, которое можно заподоз-
рить при внутривенной урографии («смазан-
ность» контуров, отсутствие смещаемости поч-
ки при дыхании); оно лучше выявляется при
эхографии и компьютерной рентгенотомогра-
фии. Нагноение паранефральной гематомы от-
носится к редким, крайне тяжелым осложне-
ниям, часто несвоевременно диагностируемым
[Kobrin S. et al., 1996]. Особенно трудна диаг-
ностика такого постбиопсийного гнойного па-
ранефрита у больных, длительно получающих
глюкокортикоиды. Имеются описания безлихо-
радочного позднего нагноения паранефральной
гематомы. Из других осложнений, связанных с
подкапсульной гематомой, описано преходящее
прекращение экскреторной функции пунктиро-
ванной, сдавленной гематомой почки с восста-
новлением функциональной способности пос-
ле ликвидации гематомы.
К крайне редким осложнениям относятся
повреждения при биопсии других органов (пе-
чени, селезенки, поджелудочной железы), со-
судов (аорты, нижней полой вены).
Общая частота серьезных осложнений после
биопсии почки составляет 3,6 %, частота нефр-
эктомий — 0,06 %, смертность достигает
0,1 % [Richards N.T. et al., 1994; Kobrin S. et al.,
1996].
Отдаленные осложнения биопсии почки
мало изучены. Предположения о развитии пос-
ле биопсии нефрогенной гипертензии, вызван-
ной организацией нерассосавшейся подкапсуль-
ной гематомы, не подтвердились. Известны слу-
чаи образования посттравматической артерио-
венозной внутрипочечной фистулы при повреж-
дении иглой дуговой артерии и вены. При раз-
рыве фистулы развивается позднее кровотече-
ние, проявляющееся макрогематурией или об-
разованием внутрипочечной гематомы, неред-
ко требующей хирургического вмешательства.
При значительном артериовенозном сбросе
через фистулу может развиться нарушение кро-
вообращения по большому кругу.
Литература
К разделу 5.1
Бобкова И.Н., Полянцева Л.Р., Тареева И.Е., Козлов-
ская Л.В. Клиническое значение определения фак-
тора Виллебранда у больных волчаночным нефри-
том//Тер.арх. — 1995. — № 5. — С. 14—16.
Козловская Л.В., Тареева И.Е., Мухин Н.А. и др. Мо-
чевые тесты воспаления при гломерулонефрите//Тер.
арх. - 1994. - № 4. - С. 11-14.
Тареев Е.М., Козловская Л.В., Белокриницкий Д.В. и
др. Антинуклеарные факторы в моче больных нефро-
патиями//Вестн. АМН СССР. — 1985. — № 11. —
С. 3-7.
Щербин А.А., Николаев А.Ю., Матвеев В.П. Диффе-
ренциальная диагностика гематурии с помощью
фазовоконтрастной микроскопии эритроцитов мочи/
/Тер. арх. -1985. - № 6. - С. 46-50.
Abrass С.К, Laird С. IV. Tamm-Horsfall protein coating
of free cells in urine//Amer. J. Kidney Dis. — 1987. —
Vol. 9, N 1. - P. 44-50.
9—2950
129
Fogazzi G.B., Fenili D. Urinalysis and microscopy//Oxford
Textbook of clinical nephrology/Eds. A.M.Davison,
J.S.Cameron et al. — Oxford — New York — Tokyo,
1998. - P. 21-38.
Guder W. G., Heidland A. Urine analysis/Д. Clin. chem.
clin. biochem. — 1986. — Vol. 24, N 8. — P. 611—620.
Miller R. В. The urinalysis//Textbook of Nephrology/Eds.
S.G.Massry, R.G.Glassock. — Baltimore — London,
1983.
Pels R.J. Dipstick urinalysis screening of asymptomatic
adults for urinary tract disorders-II// J.A.M.A. — 1989. —
Vol. 262. - P. 1221-1224.
Sandoz P.F., Bielmann D., Mihatsch M., Thiel G. Value
of urinary sediment in the diagnosis of interstitial
rejection in renal transplants//Transplantation. — 1986. —
Vol. 41, N 3. - P. 343-348.
Winkelmann M., B'hrrig K.F., Koldovsky U. et al.
Cyclosporin A — altered renal tubular cells in urinary
ecology//Lancet. — 1985. — Vol. 2. — P. 667.
Woolhandler S. Dipstick urinalysis screening of
asymptomatic adults for urinary tract disorders-I//
J.A.M.A. - 1989. - Vol. 262. - P. 1215-1220.
К разделу 5.2
Кутырина И.М., Тареева И.Е., Шестакова М.В.,
Зверев К. В. Нарушения внутрипочечной динамики
при гломерулопатиях//Вестн. РАМН. — 1995. —
№ 5. - С. 47-52.
Наточин Ю.В. Физиология почки//Физиология вод-
но-солевого обмена и почки. — СПб., 1993. — С. 202—
416.
Рябов С.И., Наточин Ю.В. Функциональная нефро-
логия. — СПб., 1997. — 220 с.
Тии Н.У. Клиническая оценка лабораторных тестов:
Пер. с англ. — М.: Медицина, 1986. — 479 с.
Brenner В., Lawler Е., Mackenzie Н. The hyperfritration
theory: A paradigm shift in nephrology//Kidney Int. —
1996. - Vol. 49. - P. 1774-1777.
Chan A.Y.M., Cheng M.L., Keil L.C., Meyers B.D.
Functional response of healthy and diseased glomeruli
to a large meal//J. clin. Invest. — 1988. — Vol. 81, N 1. —
P. 245-254.
Conte G., Canton A.D., Fuiano G. et al. Mechanism of
impaired urinary concentration in chronic primary
glomerulonephritis//Kidney Int. — 1985. — Vol. 27. —
P. 792-798.
Gaspari F., Perico N., Remuzzi G. Measurement of
glomerular filtration rate//Kidney Int. — 1997. — Vol.
52. - Suppl. 63. - P. 151-154.
Halperin M.L., Margolis B.L., Robinson L.A. et al. The
130
urine osmolal gap: a clue to estimate urine ammonium
in «hybrid» types of metabolic acidosis//Clin. and Invest.
Med. - 1988. - Vol. II, N 3. - P. 198-202.
Jones M.G., Lee K, Swaminathan R. The effect of dietary
protein on glomerular filtration rate in normal subjects/
/Clin. Nephrol. - 1987. - Vol. 27, N 2. - P. 71-75.
Monson J.P., Richards P. Desmopressin urine concentra-
tion test//Brit. Med. J. — 1988. — N 1. — P. 24.
Rowell K.L., Stutzman M.E., Scott J.W. Quantitation of
renal function//!. Nucl. Med. Technol. — 1987. — Vol. 15,
N 3. - P. 146-152.
Sterner G., Frennby B., Hultberg B., Almen T. lohexol
clearance for GFR-determination in renal failure —
single or multiple plasmasampling?//Nephrol. Dial.
Transplant. - 1996. - Vol. 11. - P. 521-525.
Try ding N., Sterner G., Berg B. et al. Subcutaneous and
intranasal administration of l-deamino-8-D-arginine
vasopressin in the assessment of renal concentration
capacity//Nephron. — 1987. — Vol. 45, N 1. — P. 27—30.
Weeter P.M., Smit A.J., Rosman J.B. et al. Effect of
intravenous infusion of low-dose dopamine on renal
function in normal individuals and in patients with renal
disease//Amer. !. Nephrol. — 1986. — Vol. 6. — P. 42—46.
К разделу 5.3
Босин В.Ю., Скрипкина Л.А. Физиологический меха-
низм контрастирования мочевых путей и вопросы
интерпретации экскреторных урограмм//Тер. арх. —
1980. - № 7. - С. 88-92.
Восьмирко О.Д., Уколов В.А., Елагин О. С., Сальни-
ков Д.В. Применение цифровой субтракционной ан-
гиографии при полипозиционном исследовании
почек//Урол. и нефрол. — 1987. — № 5. — С. 25—28.
Пытель Ю.А. О патогенезе экстравазации мочи в
почечный синус, паранефральную и периуретераль-
ную клетчатку//Урол. и нефрол. — 1975. — № 4. —
С. 25-30.
Пытель А.Я., Пытель Ю.А. Рентгенодиагностика уро-
логических заболеваний. — М.: Медицина, 1966.
Пытель Ю.А., Золотарев И.И. Фармакоурография с
фуросемидом//Урол. и нефрол. — 1976. — № 1. —
С. 27-30.
Пытель Ю.А., Золотарев И.И. Ошибки и осложнения
при рентгенологическом исследовании почек и мо-
чевых путей. — М.: Медицина, 1987.
К раздел у 5.4
Andreucci V.E., Fuiano G., Stanziale P. Role of renal
biopsy in the diagnosis and prognosis of acute renal
failure//Kidney Int. — 1998. — Vol. 53. — Suppl. 66. —
P. 91-95.
Christensen J., Lindeguist S., Knudsen S. Ultrasoundguided
renal biopsy with biopsy gun technique//Acta Radiol. —
1995. - Vol. 36. - P. 276-279.
Conlon P.J., Kovalik E., Schwab S. Percutaneous renal
biopsy of ventilated intensive care unit patients//Clin.
Nephrol. - 1995. - Vol. 43. - P. 309-311.
Kobrin S., Madajo M.P. Renal biopsy//Principles and
Practice of Nephrology/Eds. H.R.Jacobson, G.E.Striker,
S.Klahr. — St. Louis: Mosby Press, 1996. — P. 67—71.
Levey A.S. Laboratory assesment of renal disease:
Clearance, urinalysis and renal biopsy//Hypertension:
Pathophysiology, diagnosis and management/Eds.
J.H.Laragh, B.H. Brenner. — New York, 1995. — P. 919—
968.
Mai F., Meyrier A., Callard P., Kleinknecht D. The
diagnostic yield of transjugular biopsy. Experience in 200
cases//Kidney Int. — 1992. — Vol. 1. — P. 445—449.
Pusey C.P., Rees A. J. Acute renal failure due to
glomerulonephritis and vasculitis//Kidney Int. — 1992. —
Vol. 1. - P. 1060-1076.
Richards N.T., Darby S., Howie A.J. Knowledge of renal
histology alters patient management in over 40 % of
cases//Nephrol. Dial. Transplant. — 1994. — Vol. 9. —
P. 1255-1259.
Riehl J., Maigatter S., Kierdorf H. Percutaneous renal
biopsy: comparison of manual and automated puncture
techniques with native and transplanted kidneys//Nephrol.
Dial. Transplant. - 1994. - Vol. 9. - P. 1568-1574.
Schena F.P. The Italian Group of renal Immuno-
pathology: Survey of the Italian registry of renal biopsy/
/Nephrol. Dial. Transplant. — 1997. — Vol. 12. — P. 418—
426.
Tisher С. C. Clinical indication for kidney biopsy//Renal
Pathology (2nd ed.)/Eds. C.C.Tisher, B.M.Brenner. —
Philadelphia: J.B.Lippincott comp., 1994.— Vol. L —
P. 75-84.
Williams W. W. Technical aspects of renal allograft biopsy//
Short Courses in Clinical Practice of Nephrology,
Syllabus//30th Annual Meeting. — San-Antonio, 1997. —
P. 84-89.
Wiseman D.A., Hawkins R., Numerow L.M. Percutaneous
native renal biopsy utilizing real time ultrasonic guidance
and semiautomated biopsy device//Kidney Int. — 1990. —
Vol. 38. - P. 347-349.
Yang C. W., Lee S.H., Choi Y. Evaluation of acute renal
failure in bacterial allograft pyelonephritis using
abdominal CT and graft biopsy//Amer. J. Nephrol. —
1997. - Vol. 17. - P. 42-45.
9*
Гпава 6
ИММУНОПАТОЛОГИЯ БОЛЕЗНЕЙ ПОЧЕК
Е.М.Шилов
Первое убедительное доказательство участия
иммунологических механизмов в повреждении
почек было представлено в 1900 г. отечествен-
ным исследователем В.К.Линдеманом, вызвав-
шим у кроликов тяжелое поражение почек пу-
тем введения гетерологичной противопочечной
сыворотки. В дальнейшем исследования были
повторены Masugi (1933), с именем которого
обычно и связывается эта экспериментальная
модель — «нефротоксический нефрит», вызы-
ваемый, как показано в настоящее время, ан-
тителами к специфическому антигену базаль-
ной мембраны почечного клубочка (БМК). В
1905 г. К. von Pirquet и R. Schick обратили вни-
мание на латентный период между введением
гетерологичных сывороток, применявшихся в
то время для лечения инфекционных заболева-
ний, и развитием сывороточной болезни и
предположили, что сывороточная болезнь имеет
иммунную природу и в ее основе лежит взаи-
модействие антител с вводимым извне белком,
в результате чего образуется «новый токсичес-
кий агент», повреждающий ткани; через пол-
века — в 50—60-х годах — двумя группами
исследователей, руководимыми F. Dixon и
F.Germuth, которые изучали в эксперименте
острую и хроническую сывороточную болезнь,
была сформулирована концепция об ИК, об-
разующихся в кровотоке и вызывающих по-
вреждение тканей. В результате было признано,
что экспериментальное повреждение почек
происходит двумя основными механизмами,
действием антител, вырабатываемых против
антигенов БМК (анти-БМК-антитела), и вли-
янием ИК, сформированных в кровотоке
(ЦИК).
Разработка метода иммунофлюоресцентной
микроскопии тканей, а также широкое исполь-
зование с 60-х годов диагностической пункци-
онной биопсии почек позволили выделить два
аналогичных иммунологических механизма раз-
вития гломерулонефрита у человека [Wilson С.,
132
Dixon F., 1974]. Менее чем у 5 % больных в
ткани почек выявляется непрерывное линейное
отложение IgG вдоль стенок капилляров клу-
бочков, соответствующее картине нефрита,
вызываемого антителами к БМК. У 75—80 %
больных обнаружено прерывистое или грану-
лярное отложение (часто вместе с СЗ-компо-
нентом системы комплемента) на клубочковых
мембранах и в мезангии; сходство этой карти-
ны с экспериментальной сывороточной болез-
нью позволило сделать вывод (впоследствии
частично пересмотренный) о пассивном отло-
жении ИК, сформированных в кровотоке.
У 10—15 % больных иммунные депозиты не вы-
являлись.
Иммунопатологические механизмы ГН мо-
гут быть разделены на две основные группы.
Первичные иммунные механизмы начинают по-
вреждение клубочков, хотя сами редко вызы-
вают значительное повреждение. Роль гумораль-
ной иммунной системы известна уже почти
столетие. Распознаны два основных механизма:
локальное (in situ) взаимодействие антител с
антигенами внутри клубочков и связывание
антител с растворимыми антигенами в цирку-
ляции и последующим отложением ИК внут-
ри клубочков. В последнее десятилетие доказа-
но, что клеточная иммунная система также
может вызывать гломерулярное повреждение.
Деление на гуморальные и клеточные механиз-
мы повреждения является искусственным, так
как клеточные и гуморальные иммунные меха-
низмы часто взаимодействуют между собой.
Вторичные иммунные механизмы включают
группу воспалительных медиаторов, которые
активируются после первичной иммунной ата-
ки и значительно расширяют и усиливают по-
вреждение почечной ткани. Состав медиаторов
частично меняется от одной эксперименталь-
ной модели к другой и обычно состоит из цир-
кулирующих клеток крови (нейтрофилы, моно-
циты, тромбоциты) и активированных компо-
нентов каскада комплемента. Собственные (ре-
зидентные) гломерулярные эндотелиальные,
мезангиальные и эпителиальные клетки также
могут активироваться и участвовать в воспали-
тельном ответе. Многие вторичные медиаторы
являются продуктами циркулирующих клеток
или собственных клеток почечных клубочков и
содержат цитокины и факторы роста, активные
метаболиты кислорода, биоактивные липиды
(фактор активации тромбоцитов, эйкозанои-
ды), протеазы и вазоактивные субстанции (эн-
дотелии и эндотелиальный релаксирующий
фактор).
Схематически в иммунном ответе можно выде-
лить афферентную (иммунное распознавание, регу-
ляция) и эфферентную (эффекторную) фазы. Эф-
фекторная фаза иммунного ответа — сложная мно-
гокомпонентная реакция, развивающаяся в направ-
лении преимущественно гуморальной или клеточной
формы иммунного реагирования или вовлекающая
оба пути одновременно. Гуморальный имму-
нитет включает в себя образование антител через
В-лимфоциты (предшественники антителопродуци-
рующих клеток). Антитела различаются по структуре
антигенсвязывающего участка молекул. Эти структур-
ные различия играют роль антигенной детерминан-
ты, называемой идиотипом, способной индуциро-
вать антиидиотипические антитела, обладающие ре-
гуляторной функцией. Антитела специфически рас-
познают и связывают антигены, присутствующие на
клеточных мембранах или находящиеся в свободном
состоянии в жидкостях организма. В результате объе-
динения антигена с антителом образуется иммунный
комплекс.
Термин «клеточно-опосредованный» им-
мунитет объединяет два типа реакций, которые за-
висят от Т-лимфоцитов: гиперчувствительность за-
медленного типа (ГЗТ) и повреждение цитотокси-
ческими Т-клетками. Особыми формами клеточных
реакций являются естественная цитотоксичность (ес-
тественные киллеры — ЕК-клетки) и антителозави-
симая клеточная цитотоксичность (К-клетки), пред-
ставляющая собой мостик между гуморальной и кле-
точной формами иммунитета. Реакции ГЗТ возника-
ют в иммунизированном организме при контакте
небольшого числа сенсибилизированных Т-клеток с
антигеном, находящимся на поверхности макрофа-
га или других вспомогательных клеток [Cohen S.,
1986]. После контакта Т-клетки начинают образовы-
вать и выделять неиммуноглобулиновые медиаторы
(лимфокины), что ведет к развитию воспалительной
реакции — образованию инфильтрата из мононук-
леарных лейкоцитов (моноцитов-макрофагов и лим-
фоцитов). Повреждение ткани в этих реакциях свя-
зано с выбросом ферментов и других внутриклеточ-
ных продуктов клеток инфильтрата, а также с не-
которыми лимфокинами. Реакции ГЗТ у мышей
индуцируют Т-клетки подкласса Lyt 1 (хелперы/ин-
дукторы), у человека аналогичную функцию выпол-
няют клетки подкласса CD4 и, возможно, CD8.
Для разрушения клетки-мишени цитотоксичес-
ким Т-лимфоцитом необходим тесный контакт меж-
ду этими двумя клетками. У мышей цитотоксичес-
кие Т-лимфоциты относятся к подклассу Lyt 2,3, у
человека обычно имеют фенотип CD8. Мишенями
для цитотоксических Т-лимфоцитов являются алло-
генные клетки, клетки с измененными (вирусами,
лекарствами) мембранами, клетки с опухолевыми
антигенами и, возможно, нормальные клетки при
некоторых аутоиммунных заболеваниях. Гистологи-
ческая картина таких реакций мало изучена и пред-
положительно представляет собой инфильтрат из
лимфоцитов, находящихся в тесном контакте с па-
ренхиматозными клетками-мишенями.
Иммунобиология клубочков: функциональная
характеристика клеточных и внеклеточных ком-
понентов. Периферическая часть гломерулярных
капилляров и мезангий — главные отделы клу-
бочка, наиболее часто подвергающиеся иммун-
ному повреждению.
Нормальный мезангий содержит по меньшей
мере две группы мезангиальных клеток: соб-
ственные гломерулярные, так называемые кон-
трактильные мезангиальные клетки и заселяю-
щие клубочки (резидентные) мононуклеарные
фагоциты костномозгового происхождения
[Sterzel R.B. et al., 1982; Schreiner G.F., Unanue
E.R., 1984]. Контрактильные мезангиальные
клетки, составляющие основную массу клеток
мезангия, имеют много общих свойств с глад-
комышечными клетками стенок кровеносных
сосудов и, как полагают, играют важную роль
в регуляции капиллярного кровотока и ультра-
фильтрации, а также обеспечивают физиологи-
ческое обновление и деградацию мезангиально-
го матрикса. Резидентные мезангиальные мак-
рофаги составляют 3—7 % всей популяции
мезангиальных клеток, несут LC-антиген (об-
щий лейкоцитарный антиген, присутствующий
на мембранах клеток костномозгового проис-
хождения — лимфоцитах, моноцитах, грануло-
цитах) [Eddy A.A. et al., 1986]; 35—70 % мезан-
гиальних макрофагов имеют также 1а-антиге-
ны — продукты генов I области (у человека —
DR) главного комплекса гистосовместимости,
которые регулируют клеточные взаимодействия
в иммунной системе, в частности между мак-
рофагами, перерабатывающими антиген, и
лимфоцитами. Мезангиальные макрофаги in
vitro и in vivo фагоцитируют частички латекса,
бактерии, агрегированный гамма-глобулин. Ме-
зангиальные фагоциты, несущие 1а-антигены,
в условиях in vitro представляют антигены Т-
лимфоцитам, специфически активируя их при
условии генетического соответствия 1а-антиге-
нов на макрофагах и Т-лимфоцитах. Указанные
свойства мезангиальных фагоцитов позволили
отнести их к гетерогенной группе тканевых
макрофагов [включающей в себя купферовские
клетки печени, клетки Лангерганса кожи, пе-
ритонеальные макрофаги и альвеолярные мак-
рофаги легких, которые выполняют роль вспо-
-133
могательных (акцессорных) клеток для Т-лим-
фоцитов] [Sharma S.D., 1986].
Поскольку мезангий, видимо, обладает соб-
ственной автономной микроциркуляцией,
предполагается, что даже небольшое число
мезангиальных фагоцитов, выделяя биологичес-
ки активные вещества, характерные для цир-
кулирующих и тканевых моноцитов-макрофа-
гов, может оказывать влияние на всю мезан-
гиальную область [Schreiner G.F., Kohan D.E.,
1990]. Присутствие в нормальных клубочках
небольшого числа la-положительных мононук-
леарных фагоцитов создает условия для локаль-
ной реализации в клубочках иммунных реакций
и свидетельствует об активном участии гломе-
рулярных клеток в иммуновоспалительных про-
цессах.
Наконец, в нормальных условиях в мезан-
гий на время проникают циркулирующие мо-
ноциты, способствующие физиологическому
очищению мезангия (фагоцитирующие не про-
шедшие БМК крупные макромолекулы, в том
числе ЦИК); завершив фагоцитоз, макрофаги
полностью покидают мезангий, не вызывая
какого-либо структурного или функционально-
го повреждения клубочков почек [Sterzel R.B. et
al., 1982].
Таким образом, в настоящее время накоп-
лены факты о свойствах клеток клубочка, со-
ставляющих биологическую основу развития в
клубочках клеточно-опосредованных иммунных
реакций, позволяющие сформулировать пред-
ставление о клубочке как об активном участ-
нике иммуновоспалительных процессов.
6.1. Иммунопатологические
механизмы развития
гломерулонефрита
6.1.1. Гуморальные (связанные с
антителами) механизмы иммунного
повреждения клубочков
Разработка метода иммунофлюоресцентной
микроскопии, а также использование с 60-х
годов пункционной биопсии почек позволили
выделить два иммунологических механизма раз-
вития гломерулонефрита у человека [Wilson С.,
Dixon F., 1974]. Примерно у 5 % больных в клу-
бочках выявляется непрерывное линейное от-
ложение IgG вдоль стенок капилляров, соот-
ветствующее картине экспериментального не-
фрита, вызванного антителами к БМК. У 75—
80 % пациентов обнаружено гранулярное или
прерывистое отложение IgG (часто вместе с
СЗ-компонентом системы комплемента) на
клубочковых мембранах и в мезангии. У 10—
15 % больных иммунные депозиты не выявля-
ются.
Депозиты могут располагаться в различных отде-
лах клубочковых капилляров — под эндотелием,
внутри БМК, под эпителием, а также внутри ме-
зангия.
Локализация депозитов во многом опреде-
ляет морфологический и клинический тип не-
фрита, что, вероятно, связано с активацией
различных систем медиаторов повреждения.
Субэпителиальные депозиты характерны для
острого постстрептококкового ГН, мембраноз-
ной нефропатии, субэндотелиальные — для ме-
зангиокапиллярного ГН I типа, диффузного
пролиферативного волчаночного нефрита; де-
позиты внутри БМК наблюдаются при МКГН
II типа, а также при нефритах, связанных с
антителами против БМК, в том числе при син-
дроме Гудпасчера, внутри мезангия — при IgA-
нефропатии, геморрагическом васкулите Шен-
лейна — Геноха.
Разделение иммунных заболеваний почек на
две категории — анти-БМК-нефрит и нефрит
вследствие отложения циркулирующих ИК —
является упрощенным. Экспериментально дока-
зано, что не только линейный, но и грануляр-
ный тип иммунных депозитов может происхо-
дить от связывания антител с антигенными де-
терминантами собственных структур клубочков.
В то же время гранулярные депозиты могут про-
исходить вследствие не только отложения цир-
кулирующих ИК, но и связывания антител с
антигенами, которые ранее отложились в клу-
бочке (локальное, in situ, формирование ИК)
[Kegashcki D., 1990].
Иммунные комплексы повреждают ткань почек,
активируя многочисленные взаимодействующие
между собой системы медиаторов воспале-
ния — гуморальные (системы комплемента, ко-
агуляции, кининов, вазоактивных аминов, мета-
болитов арахидоновой кислоты) и клеточные
(нейтрофилы, тромбоциты, моноциты-макро-
фаги, лимфоциты).
Депозиты могут формироваться различными
механизмами. Экспериментально установлено,
что мезангиальные и субэндотелиальные депо-
зиты могут происходить в результате как отло-
жения ЦИК, так и локального формирования
ИК; субэпителиальные депозиты — следствие
локального образования ИК, хотя не исключа-
ется, что низкомолекулярные циркулирующие
ИК могут пересекать БМК и конденсировать-
ся в депозиты в субэпителиальном простран-
стве капиллярной стенки клубочков.
Антительный (анти-БМК) гломерулонефрит.
Антительный (анти-БМК) гломерулонефрит
экспериментально воспроизводится в моделях
134
нефротоксического нефрита у кроликов и крыс
и аутоиммунного нефрита у баранов. Антитела
направлены к антигену неколлагеновой части
БМК (гликопротеину), часть из них также ре-
агирует с антигенами базальной мембраны по-
чечных канальцев и альвеол легких.
Классическая модель нефротоксического не-
фрита протекает в две фазы. Первая фаза (гетеро-
логичная) развивается сразу же после соединения
гетерологичных антител с антигеном БМК и свя-
зана с фиксацией и активацией комплемента и об-
разованием хемотаксических факторов, привлека-
ющих нейтрофилы к месту отложения антител. Ак-
тивированные нейтрофилы выделяют лизосомаль-
ные протеолитические ферменты, повреждающие
БМК. Вторая фаза (аутологичная) обусловлена вы-
работкой аутологичных антител к чужеродному им-
муноглобулину, фиксированному на БМК. В этой
фазе наблюдаются наиболее тяжелые структурные
повреждения БМК с развитием полулуний, массив-
ной протеинурии и почечной недостаточности.
Главным медиатором повреждения в этой фазе яв-
ляются моноциты, которые инфильтрируют клу-
бочки, а также формируют полулуния в полости
капсулы Боумена (капсула клубочка), проникая
туда вслед за фибрином через анатомические де-
фекты в БМК.
У человека анти-БМК-нефрит возникает как
изолированное поражение почек или как сис-
темное заболевание с вовлечением в процесс
почек и легких (синдром Гудпасчера), клини-
чески в большинстве случаев он протекает как
быстропрогрессирующий гломерулонефрит,
хотя возможны и более мягкие варианты. Око-
ло 70 % больных имеют и антитела к базаль-
ной мембране почечных канальцев.
При иммунофлюоресценции антитела к БМК
дают характерное линейное свечение иммуногло-
булинов вдоль БМК. Преобладают антитела класса
IgG, но иногда обнаруживаются IgA- или IgM-
антитела. Эти же антитела обнаруживаются в
циркуляции и могут быть элюированы из по-
раженных почек с помощью кислых буферов.
Анти-БМК-антитела, выделенные из почек или
сывороток больных, способны вызвать гломе-
рулонефрит у человекообразных обезьян.
Иммунологический диагноз анти-БМК-гло-
мерулонефрита базируется на иммунофлюорес-
центном выявлении характерного отложения
антител вдоль БМК. У 2/ больных отложения
иммуноглобулинов сопровождаются депозита-
ми СЗ и компонентов классического пути ак-
тивации комплемента. Для исключения неспе-
цифического связывания 1g с БМК иммуно-
флюоресцентный диагноз анти-БМК-гломеру-
лонефрита должен быть подтвержден элюцией
этих антител из ткани почек или их обнаруже-
нием в кровотоке. Циркулирующие антитела к
БМК выявляются методом непрямой иммуно-
флюоресценции или более чувствительным ра-
диоиммунным методом.
Хеймановский нефрит. Помимо антител к
«классическому» антигену БМК, известны ан-
титела к другим структурным антигенам почеч-
ных клубочков [Wilson С., 1984]. Эти антитела
обнаружены в экспериментальных моделях, но
их аналоги, возможно, причастны к развитию
некоторых случаев болезни человека. Хейманов-
ский нефрит развивается спустя 6 нед после
однократного введения крысам антигена, при-
готовленного из щеточной каемки тубулярно-
го эпителия почек крыс (FxIA-антиген). Пора-
жение почек проявляется нефротическим син-
дромом и морфологически соответствует мем-
бранозной нефропатии человека с диффузными
гранулярными депозитами IgG и СЗ, которые
при ультраструктурном исследовании локали-
зуются в субэпителиальном пространстве. Пер-
воначально предполагалось, что откладывают-
ся ЦИК, образованные из FxIA и антител к
нему. Однако недавно установлено, что анти-
тела к FxIA непосредственно связываются с ан-
тигеном плазматической мембраны подоцитов,
гликопротеином с молекулярной массой 330.
Образующиеся в результате этого на поверхно-
сти подоцитов ИК подвергаются агрегации и
сползают с мембраны клеток в субэпителиаль-
ное пространство, где конденсируются в элек-
тронно-плотные депозиты.
Анти-Thy-1-нефрит. Thy-1 — гликопротеин,
присутствующий на клетках тимуса, головного
мозга, а также мезангиальных клетках крыс.
Введение анти-Thy-l-антител позволяет полу-
чить у крыс уникальную модель, во многом
соответствующую мезангиопролиферативному ГН
человека.
При однократном введении антител заболевание
развивается в две фазы. Первая фаза (1—2-й дни) —
повреждение и лизис мезангиальных клеток после свя-
зывания с ними антител, опосредуется комплементом
(образованием МАС-комплекса мембранной атаки).
Вторая фаза (4—14-й дни), соответствующая мезангио-
пролиферативному ГН, — выраженная пролиферация
мезангиальных клеток, зависящая от инфильтрации
клубочков тромбоцитами. Выявляются также нейтро-
филы и моноциты, но их роль не определена. После
однократного введения анти-Thy-l-антител происхо-
дит полное восстановление структуры клубочков, при
повторных — очаговый гломерулосклероз.
Еще один вид антител вызывает спонтанный
гломерулонефрит у кроликов. Антитела направлены
к антигену, который локализуется в области контакта
ножковых отростков подоцитов с БМК. Антитела с
подобной специфичностью выявлены также у одного
больного ГН. Антитела к ДНК непосредственно свя-
зываются с антигенными структурами в клубочках
почек мышей, что позволяет предполагать аналогич-
ный механизм образования ИК при волчаночном
нефрите человека.
135
Иммунокомплексный нефрит. Основные све-
дения о патогенезе иммунокомплексного не-
фрита получены при изучении эксперименталь-
ных моделей сывороточной болезни.
ИК — макромолекулярные соединения, возника-
ющие при взаимодействии антигена с антите-
лами, которое может происходить как в крово-
токе, так и в тканях. Образование и присут-
ствие в кровотоке ЦИК — фундаментальный
физиологический процесс.
С ним связаны важнейшие биологические
функции — избавление организма от биологи-
чески чужеродных антигенов (экзогенных, про-
никающих через дыхательные пути и желудоч-
но-кишечный тракт) и эндогенных (образую-
щихся в результате старения, разрушения и
опухолевых мутаций клеток организма), а так-
же регуляция иммунного ответа. В патологичес-
ких условиях (инфекции, воспаление, ишеми-
ческое или травматическое повреждение тка-
ней, опухолевый процесс) количество ЦИК
резко возрастает. Регуляция иммунного ответа,
его усиление или ослабление осуществляются
взаимодействием ЦИК с рецепторами, распо-
ложенными на клеточных мембранах лимфоци-
тов и моноцитов-макрофагов.
Из кровотока ЦИК удаляются фиксированны-
ми мононуклеарными фагоцитами, тканевыми
макрофагами. ЦИК соединяются с Fc- и СЗЬ-
или CR]-рецепторами, расположенными на
мембране фагоцитов, затем происходит их по-
глощение и внутриклеточное разрушение. Для
быстрого удаления из кровотока ЦИК должны
быть растворимыми, а также содержать в сво-
ем составе достаточное количество СЗЬ-фраг-
ментов комплемента, необходимых для при-
крепления к СЗЬ-рецепторам эритроцитов и
мононуклеарных фагоцитов. CRj-рецепторы
эритроцитов представляют собой систему, обес-
печивающую транспорт ЦИК к мононуклеар-
ным фагоцитам печени, а также снижающую
противовоспалительный потенциал ЦИК
[Schifferli J.A. et al., 1986].
Накоплению ИК в тканях препятствует
активация комплемента. Активация комплемента
по классическому пути в момент образования
ИК подавляет взаимодействие между Fc-фраг-
ментами антител, чем предупреждает форми-
рование крупных нерастворимых преципитатов.
Если образование нерастворимых иммунных аг-
регатов все же произошло, то активация ком-
племента через альтернативный путь до опре-
деленного времени способна растворить преци-
питат с образованием СЗЬ-содержащих ИК.
Поддерживая ИК в растворенном состоянии,
комплемент позволяет ИК диффундировать из
места их образования в кровоток, снижая тем
самым возможность локального воспаления.
136
Содержащие СЗЬ-фрагменты комплемента ра-
створимые ЦИК связываются с CR,-рецепто-
рами и в таком виде транспортируются в пе-
чень, где «передаются» печеночным макрофа-
гам. ИК, локально сформированные в клубоч-
ках почек, обладают выраженной повреждаю-
щей активностью, так как активируют весь
каскад системы комплемента.
В физиологических условиях почти все ЦИК
удаляются из кровотока мононуклеарными фа-
гоцитами печени, но небольшая их часть про-
никает в ткани, где они откладываются, но
затем удаляются местными макрофагами или
вымываются током плазмы, не вызывая каких-
либо патологических последствий. В почечных
клубочках в физиологических условиях ЦИК
откладываются в мезангии, где они фагоцити-
руются резидентными мезангиальными фагоци-
тами или приходящими из циркуляции моно-
цитами-макрофагами, а также растворяются за
счет местной активации комплемента.
Особая по сравнению с другими органами пред-
расположенность почечных клубочков к избы-
точному отложению ЦИК обусловлена их уни-
кальной структурой и функцией.
Кровоток через почки значительно превыша-
ет кровоток через мышечные капилляры и со-
ставляет до 25 % сердечного выброса крови. Из
просвета гломерулярных капилляров плазма че-
рез отверстия (фенестры) в эндотелии с высо-
кой скоростью движется в двух направлениях:
через стенку капилляра клубочка в мочевое про-
странство и через мезангиальную зону в интер-
стиций и лимфатическую систему почки.
Избыточному отложению ЦИК в мезангии
способствуют три группы факторов:
1. Свойства самих ЦИК, в первую очередь их
размер и растворимость, в значительной сте-
пени зависящая от их размера и состояния си-
стемы комплемента. Размер ЦИК определяется
размером молекулы антигена и антитела (мо-
лекула IgM в 5 раз больше молекулы IgG), со-
отношением молекул антигена и антител и их
концентрацией в кровотоке, авидностью анти-
тел, т.е. силой, с которой они связывают ан-
тиген. Крупномолекулярные комплексы более
прочны, хуже растворяются и соответственно
плохо удаляются системой мононуклеарных
фагоцитов (СМФ); комплексы очень малого
размера также не захватываются мононуклеар-
ными фагоцитами печени из-за недостатка СЗЬ-
и Fc-фрагментов; плохо удаляются ЦИК лю-
бого размера, содержащие IgE и IgA, не акти-
вирующие или слабо активирующие компле-
мент.
2. Снижение активности системы мононук-
леарных фагоцитов печени и селезенки и транс-
портной (CR,) системы эритроцитов вследствие
перенасыщения СМФ большим количеством
ЦИК, например при хронических инфекциях,
опухолях. Возможна генетически низкая актив-
ность клеток СМФ: малая плотность мембран-
ных рецепторов для ЦИК, нарушение внутри-
клеточного переваривания и т.д.
3. Местные почечные факторы: повышение
или снижение клубочковой гемодинамики,
снижение активности мезангиальных гладкомы-
шечных клеток и резидентных макрофагов.
Внутриклубочковая гемодинамика контролиру-
ется рядом внепочечных нервных и гумораль-
ных факторов, а также внутрипочечными ре-
гуляторными механизмами (система ренин —
ангиотензин, кинины, вазоактивные проста-
гландины). При иммунных реакциях в области
почечных клубочков выделяются вазоактивные
факторы. Источником гистамина и серотонина
являются тромбоциты, базофилы, тучные клет-
ки, источником простагландинов — тромбоци-
ты и моноциты-макрофаги. Важную роль в ре-
гуляции гломерулярной гемодинамики играют
мезангиальные клетки, по строению напоми-
нающие гладкомышечные клетки кровеносных
сосудов и способные сокращаться или выделять
простагландины под влиянием ЦИК и других
продуктов иммунных реакций. При повышении
капиллярного плазмотока, вызываемом расши-
рением афферентной артериолы клубочка под
влиянием, например, почечных простагланди-
нов, и повышении внутрикапиллярного гидро-
статического давления, вызываемом сокраще-
нием эфферентной артериолы под влиянием
ангиотензина II, гистамина, серотонина, уси-
ливается поступление ЦИК в мезангий. При
снижении капиллярного кровотока проницае-
мость капиллярной стенки резко возрастает,
крупные молекулярные ЦИК под действием
силы диффузии устремляются через фенестры
в БМК и задерживаются в субэндотелиальном
пространстве [Ryan G.B., 1981].
Отложившиеся в мезангии ЦИК фагоцити-
руются резидентными мезангиальными макро-
фагами, являющимися частью СМФ или при-
ходящими из циркуляции моноцитами-макро-
фагами. При эффективной работе этого меха-
низма мезангий справляется с нагрузкой ЦИК
или антигенными макромолекулами плазмы и
быстро очищается. Если же количество отложив-
шихся ЦИК превышает очищающую способ-
ность мезангия, ЦИК длительно персистируют
в мезангии, подвергаются агрегации с образо-
ванием крупных нерастворимых ИК.
В условиях продолжающегося иммунного
ответа в состав ИК включаются новые антите-
ла (в том числе антиидиотипические антитела,
ревматоидные факторы и др.), создавая усло-
вия для фиксации и повреждающей активации
всего каскада комплемента. Новые порции
ЦИК, поступающие в уже перегруженный ме-
зангий, заполняют сначала субэндотелиально-
мезангиальную зону, а затем распространяют-
ся по субэндотелиальному пространству на пе-
риферию капиллярной петли, формируя субэн-
дотелиальные депозиты ИК.
Депозиты ИК могут формироваться в клубоч-
ках и другим путем — локально (in situ) с от-
ложением в клубочках сначала антигена, а за-
тем антител, которые соединяются с антигеном.
При повышении проницаемости капиллярной
стенки молекулы антигенов и антител под влия-
нием силы диффузии могут пересекать БМ и в
субэпителиальном пространстве соединяться друг
с другом, локально формируя депозиты ИК.
Отрицательный заряд БМК способствует
«имплантации» в капиллярную стенку положи-
тельно заряженных антигенных молекул (бак-
териальных, вирусных, опухолевых антигенов,
лекарственных гаптенов и т.д.) с последующим
формированием ИК in situ. Нейтрализация от-
рицательного заряда БМК ведет к повышению
ее проницаемости и отложению в субэндотели-
альном пространстве отрицательно и нейтраль-
но заряженных антигенов. Нейтрализация заряда
БМК — следствие иммунных реакций, которые
вызывают активацию тромбоцитов и нейтрофи-
лов с выбросом их катионных (положительно
заряженных) белков. К образованию ИК in situ
предрасполагает выработка низкоавидных анти-
тел. ЦИК, образованные из этих антител, не-
стойкие, легко диссоциируют с отщеплением
антигенов, которые независимо от антител от-
кладываются в клубочке. Выработка низкоавид-
ных антител — генетически детерминированное
свойство иммунной системы.
6.1.2. Клеточные иммунные
механизмы повреждения клубочков
Первые данные о мононуклеарных лейкоцитах
в почках больных ГН и животных с экспери-
ментальным нефритом получены с помощью
световой и электронной микроскопии. Надеж-
ному выявлению способствует применение мо-
ноклональных антител. Антигены CD3 и CD11
имеются на поверхности всех Т-клеток, анти-
гены CD4 присутствуют на мембране Т-хелпе-
ров и Т-индукторов, CD8 — на мембране Т-
киллеров и Т-супрессоров, антигены Ml и М5
характерны для моноцитов-макрофагов, В1 и
В2 — для В-клеток.
Показано, что у больных с различными ги-
стологическими типами нефрита количество
мононуклеарных лейкоцитов, главным образом
Т-клеток и моноцитов, повышено как в клу-
бочках, так и в интерстиции. В клубочках пре-
обладают моноциты, в интерстиции — Т-лим-
137
фоциты. Инфильтрация клубочков и интерсти-
ция наиболее выражена при экстракапилляр-
ном, мезангиокапиллярном, мембранозном, а
также при волчаночном нефритах. Общее чис-
ло Т-лимфоцитов при этих типах нефрита по-
вышено и в клубочках, и в интерстиции, но
без селективного накопления CD4+- или CD8+-
субпопуляций лимфоцитов. У больных с IgA-
нефропатией мононуклеарные лейкоциты в
клубочках выявляются редко при повышенном
содержании Т-лимфоцитов в интерстиции по-
чек [Шилов Е.М. и др., 1986].
При остром интерстициальном нефрите
(преимущественно лекарственной этиологии)
наблюдается противоположная картина; моно-
нуклеарные инфильтраты присутствуют почти
исключительно в интерстиции почек, причем
главным типом инфильтрующих клеток явля-
ются CD8+-лимфоциты (киллеры/супрессоры).
Эти клетки часто окружают пораженные ка-
нальцы, возможно, являясь эффекторами по-
вреждения. Аналогичное преобладание в интер-
стиции СВ8+-клеток над СВ4+-лимфоцитами
описано у больных с волчаночным нефритом
[Cameron J.S., 1989]. С помощью моноклональ-
ных антител, специфичных к Т-клеткам-килле-
рам, было доказано, что у больных с острым
лекарственным интерстициальным нефритом
значительная часть СВ8+-клеток представляет
собой цитотоксические Т-лимфоциты.
Прямые доказательства роли Т-клеточных меха-
низмов в повреждении клубочков связаны с созда-
нием экспериментальных моделей, в которых нефрит
вызывается реакциями клеточно-опосредованного
иммунитета. Внутривенное введение крысам неболь-
шой дозы кроличьей антисыворотки к крысиной
БМК или растворимых ИК из сывороточного аль-
бумина человека и кроличьих антител к нему вы-
зывало отложение этих чужеродных белков в клубоч-
ках почек без видимого их повреждения. Последую-
щее введение крысам клеток лимфатических узлов
или Т-клеток от сингенных доноров, сенсибилизи-
рованных к гамма-глобулину кролика или к сыво-
роточному альбумину человека, вызывало гиперкле-
точность клубочков, главным образом за счет ин-
фильтрации мононуклеарными лейкоцитами, и не-
кроз клубочков. Очевидно, в этой модели небольшое
число сенсибилизированных Т-лимфоцитов взаимо-
действует с фиксированным в клубочках антигеном,
что ведет к локальной воспалительной реакции с вы-
раженным притоком моноцитов-макрофагов [Tipping
P.G. et al., 1985; Воусе N.W. et al., 1986].
6.1.3. Вторичные медиаторы
гломерулярного повреждения
Моноциты/макрофаги. Существуют эксперимен-
тальные доказательства того, что при иммун-
ном нефрите моноциты вызывают повреждения
138
клубочков. Косвенно об этом свидетельствует
четкая временная связь между появлением в
клубочках моноцитов, развитием гиперклеточ-
ности клубочков и пролиферации внутриклу-
бочковых клеток. Развитие протеинурии совпа-
дает с развитием моноцитарного инфильтрата,
а выраженность протеинурии пропорциональ-
на количеству моноцитов в клубочках. Эти за-
кономерности выявлены при сывороточном (ос-
тром и хроническом) и нефротоксическом не-
фритах. Имеются и прямые доказательства. Раз-
рушение мононуклеарных клеток in vivo при
рентгеновском облучении или введении «анти-
макрофагальной» сыворотки предупреждает
моноцитарную инфильтрацию клубочков и раз-
витие протеинурии как при сывороточном, так
и при нефротоксическом нефрите в аутологич-
ной его фазе. Зависимое от макрофагов повреж-
дение при нефротоксическом нефрите предот-
вращается введением «антилимфоцитарной»
сыворотки.
При экспериментальном иммунном повреждении
моноциты могут мигрировать в клубочки и без уча-
стия Т-клеток, т.е. под воздействием продуктов тка-
невого повреждения, а также механизмов, опосре-
дованных антителами: хемотаксических факторов ак-
тивированного комплемента и связывания мембран-
ных рецепторов моноцитов с Fc-фрагментами анти-
тел [Шилов Е.М. и др., 1986].
Нейтрофилы. Нейтрофилы выявляются в клу-
бочках как при экспериментальных нефроток-
сическом и хроническом сывороточном нефри-
тах, так и при многих типах гломерулонефри-
та человека — остром постстрептококковом,
мезангиокапиллярном, экстракапиллярном,
при нефритах, связанных с системными забо-
леваниями. Предполагается, что именно с ней-
трофилами в значительной степени связано
повреждение клубочков при этих формах не-
фрита.
В одних случаях (гетерологичная фаза нефро-
токсического нефрита) причиной привлечения
нейтрофилов в клубочки является активация
комплемента. В других случаях, когда повреж-
дение не связано с участием комплемента
(аутологичная фаза нефротоксического нефри-
та, сывороточный нефрит), нейтрофилы накап-
ливаются путем взаимодействия клеточных Fc-
рецепторов с Fc-фрагментами, фиксированных
в клубочках антител.
Для того чтобы попасть в очаг воспаления,
нейтрофилы должны пересечь эндотелиальный
барьер. За последние годы выявлено значитель-
ное количество мембранных рецепторов лейко-
цитов, позволяющих нейтрофилам взаимодей-
ствовать с другими клетками, особенно эндо-
телием, и молекулами матрикса, которые об-
нажаются в период воспалительного процесса
[Cosio F.G., Orosz C.G., 1993]. Эти молекулы
и их лиганды (комплементарные рецепторы)
представлены ниже.
Клеточные адгезивные молекулы (КАМ),
обеспечивающие взаимодействия лейкоцитов
с эндотелием и белками матрикса
Адгезивные молекулы
на лейкоцитах
й-Интегрины —
VLA-1... VLA-6
К-Интегрины —
LFA-1, CD11/CD18
Селектины — L, Е, Р
Иммуноглобулино-
подобные КАМ —
ICAM-1,2, VCAM-1
Лиганды на эндотелиальных,
других клетках, белках
матрикса
Коллагены, фибронектин,
ламинин, витронектин,
VCAM-1
Фибриноген, белки матрикса,
ICAM-1, ICAM-2, СЗЬ
Гликопротеины на активиро-
ванных эндотелиальных
клетках
Е-селектин — ELAM-1
LFA-1, VLA-4
Примечание. ICAM — молекула межклеточной адгезии,
LFA — активатор функций лейкоцитов, VLA — антиген очень
поздней активации.
О роли межклеточных и клеточно-матрикс-
ных взаимодействий в патогенезе ГН известно
не очень много, однако данные исследований
других областей организма говорят об их важ-
ном значении.
Антитела против /?2-интегринов могут предупре-
дить наплыв нейтрофилов в ответ на хемоаттрактан-
ты, ишемию, липополисахарид и эндотоксин. Осо-
бенно важны два комплементарных рецептора на
эндотелиальных клетках: ICAM-1, который связы-
вается с двумя из /?2-интегриновых рецепторов, и
ELAM-1 — член семьи селектинов, связывающий-
ся с особым гликаном (sialyl-Lewis X) на мембра-
нах лейкоцитов [Cosio F.G., Orosz C.G., 1993]. Со-
общалось о повышенной мезангиальной экспрессии
ICAM-1 при мышином волчаночном нефрите и
фокально-сегментарном гломерулосклерозе челове-
ка, однако их клеточное происхождение и значение
не были определены [Cosio F.G., Orosz C.G., 1993].
Неясно, почему нейтрофилы и моноциты, часто эк-
спрессирующие те же самые адгезивные молекулы,
в экспериментальных моделях ГН обычно демонст-
рируют независимую миграцию. Необходимо отме-
тить, что экспрессия многих адгезивных молекул
вызывается воспалительными медиаторами, такими
как лимфокины, тромбин, С5а, биоактивные липи-
ды, и что связывание лиганда может вызвать как ак-
тивацию, так и адгезию лейкоцитов.
Нейтрофилы — источник многочисленных
факторов повреждения, среди которых глав-
ные — лизосомальные протеолитические фер-
менты, выделяемые при активации различны-
ми стимулами (С5а, фагоцитоз ИК и др.), сво-
бодные радикалы кислорода (анион супероки-
си О2‘, перекись водорода Н20,, гидроксильный
радикал —- ОН), катионные белки, нейтрали-
зующие отрицательный заряд БМК, прокоагу-
лянтные факторы, фактор активации тромбо-
цитов и др.
Тромбоциты. Тромбоцит — одна из централь-
ных клеток воспалительной реакции, содержит
многие медиаторы воспаления, включая про-
теолитические ферменты, вазоактивные амины,
простагландины, фактор хемотаксиса для ней-
трофилов и моноцитов, митогенный фактор,
стимулирующий пролиферацию мезангиальных
клеток и эндотелиальных клеток почечных клу-
бочков. Активация тромбоцитов — важный мо-
мент для образования депозитов ИК в мезан-
гии и в капиллярной стенке клубочка.
Активированные тромбоциты присутствуют
в кровотоке и в клубочках при различных гис-
тологических типах гломерулонефрита. Актива-
ция тромбоцитов с выбросом их содержимого
происходит или при прямом взаимодействии
тромбоцитов с ИК, или под влиянием факто-
ра активации тромбоцитов, который выделяется
из базофилов, нейтрофилов, моноцитов-макро-
фагов после их активации ИК. В клубочках ак-
тивация тромбоцитов может быть также связа-
на с повреждением эндотелия, который выра-
батывает ПГИ2, предотвращающий агрегацию
тромбоцитов, а также в результате прямого
контакта тромбоцитов с коллагеном БМК,
поврежденной иммунными механизмами [Ши-
лов Е.М., Лесков В.П., 1984].
Гистамин, серотонин, выделяющиеся из
тромбоцитов, повышают резистентность эффе-
рентной артериолы клубочка, что сопровожда-
ется снижением капиллярного кровотока и
повышением внутрикапиллярного давления
[Abboud Н.Е., Dousa Т.Р., 1983], в результате
чего повышается проницаемость капиллярной
стенки клубочка и усиливается поступление
макромолекул в мезангий. Катионные белки
тромбоцитов непосредственно повышают про-
ницаемость капиллярной стенки клубочка, ней-
трализуя ее отрицательный заряд [Camussi G. et
al., 1986].
Комплемент. Комплемент — система из 18
белков сыворотки, состоящая из субстратов, ак-
тиваторов и ингибиторов. Комплемент имеет
важное биологическое значение. Он участвует в
защите организма от бактерий, вирусов, опу-
холевых клеток, вызывает растворение ИК.
В определенных ситуациях активация компле-
мента ведет к патологическим состояниям. Ак-
тивация комплемента представляет собой цеп-
ную реакцию, в которую отдельные компонен-
ты системы вступают в строго определенной
139
последовательности. Продукт, образующийся в
результате вступления в реакцию предшеству-
ющего компонента, является активатором для
последующего компонента системы комплемен-
та. Центральное место в этой цепи занимает СЗ-
компонент, при активации которого в реакцию
вступают все последующие («терминальные») ком-
поненты системы комплемента (С5^С6^С7->
->С8->С9). Активация СЗ происходит двумя пу-
тями: классическим (С1->С4->С2->СЗ) или
альтернативным Спропердин -факторы В и D-*
СЗ).
IgG- и IgM-антитела активируют как клас-
сический, так и альтернативный путь; альтер-
нативный путь активируется IgA, а также не-
специфическими факторами, например бакте-
риальными полисахаридами.
Роль комплемента в повреждении клубочков
связана с его локальной активацией в клубочках
И К или антителами к БМК. В результате акти-
вации образуются факторы, способствующие
прилипанию нейтрофилов (СЗЬ), обладающие
хемотаксической активностью для нейтрофилов
и моноцитов (СЗа, С5а, С5—С7), вызывающие
дегрануляцию базофилов и тучных клеток (СЗа,
С5а), а также «фактор мембранной атаки» (С5—
С9), непосредственно повреждающий мембран-
ные структуры. Образование «фактора мембран-
ной атаки» — единственный известный меха-
низм повреждения БМК при мембранозной не-
фропатии, связанный с локальной активацией
комплемента субэпителиальными депозитами
ИК. В то же время комплемент при гломеруло-
нефрите предупреждает образование нераство-
римых ИК и растворяет образовавшиеся пре-
ципитаты ИК. Наследственный или приобретен-
ный дефицит отдельных компонентов класси-
ческого или альтернативного пути активации
нарушает эффективную обработку, растворение
и быстрое удаление ЦИК из кровотока, созда-
ет тем самым основу для их избыточного отло-
жения в клубочках.
Гуморальными медиаторами воспаления яв-
ляются также гистамин, серотонин, системы
простагландинов и кининов, в определенной
степени факторы свертывающей и противосвер-
тывающей систем. Среди клеточных медиаторов
иммунного повреждения клубочков основную
роль играют нейтрофилы и тромбоциты.
Цитокины и факторы роста. Цитокины и
факторы роста являются полипептидными пе-
реносчиками сигналов, которые, связываясь с
клетками-мишенями с помощью специфичес-
ких мембранных рецепторов, вызывают затем
ряд важных клеточных реакций. Эти факторы
вырабатываются как инфильтрирующими вос-
палительными клетками, так и собственными
почечными клетками клубочков и интерстиция.
Цитокины действуют паракринным (на сосед-
140
ние клетки) или аутокринным (на синтезирую-
щую их клетку) образом. Вызывать реакции в
клубочках могут и циркулирующие ростовые
факторы, имеющие внепочечное происхождение.
Цитокины связываются также с компонен-
тами внеклеточного матрикса, и их действие на
клетки регулируется составом и организацией
матрикса [Nathan С., Sporn М., 1991]. Обнару-
жена экспрессия рецепторов цитокинов на
уровне клубочков: идентифицированы гломеру-
лярные рецепторы для эпидермального факто-
ра роста, инсулиноподобного фактора роста,
тромбоцитарного фактора роста и трансформи-
рующего фактора роста-/Г Выявлены естествен-
ные ингибиторы цитокинов и факторов роста,
которые включают растворимые формы и ан-
тагонисты рецепторов.
Для упрощения возможно деление цитоки-
нов на провоспалительные, пролиферативные
и фиброзирующие, хотя оно является несколь-
ко искусственным из-за значительного пере-
крывания спектров их действия [Isbel N.M.,
Atkins R.C., 1996].
Провоспалительные цитокины: ИЛ-1 и фак-
тор некроза опухоли а (ФНОа). ИЛ-1 и ФНОа
синтезируются сразу же после стимуляции ин-
фекционными и воспалительными медиатора-
ми, обладают множеством провоспалительных
эффектов и действуют как системно, так и ло-
кально. Имеются четыре серии доказательств
роли ИЛ-1 и ФНОа при почечных заболева-
ниях.
▲ Культуры клеток почечных клубочков животных
с различными моделями пролиферативного ГН,
а также больных ГН с полулуниями [Matsumoto
К. et al., 1988] вырабатывают высокие количества
ИЛ-1 и ФНОа. Культуры клеток почечных клу-
бочков на добавление ИЛ-1 и ФНОа отвечают
так же, как при воспалительной реакции: повы-
шаются продукция мезангиальными клетками
ИЛ-6, ИЛ-8, ТцФР, экспрессия адгезивных мо-
лекул, синтез активных радикалов кислорода
[Matsumoto К. et al., 1988].
▲ Инъекция ИЛ-1 или ФНОа крысам с анти-
БМК-нефритом значительно усиливает инфиль-
трацию клубочков нейтрофилами и протеинурию
[IshaN. et al., 1989].
▲ Исследование почечных биоптатов больных под-
тверждает продукцию этих цитокинов в очагах
воспаления. У больных АНЦА-ассоциированным
васкулитом экспрессия ИЛ-1, ФНОа и рецеп-
тора ИЛ-2 продемонстрирована в участках по-
вреждения в клубочках и в интерстиции [Noronha
I.L. et al., 1993]. В биоптатах почек больных IgA-
нефропатией количество гломерулярных клеток,
экспрессирующих ИЛ-1, ИЛ-6 и ФНОа, корре-
лировала со степенью мезангиальной гиперкле-
точности, а интерстициальная экспрессия цито-
кинов соответствовала тяжести тубулоинтерсти-
циального повреждения и протеинурии [Yoshio-
ka К. et al., 1993].
▲ Блокирование цитокинов (введением антител к
ИЛ-1, растворимых рецепторов ИЛ-1 или анта-
гониста рецептора ИЛ-1) приводило к значитель-
ному подавлению анти-БМК-нефрита [Lan N.J. et
al., 1993].
Пролиферативные цитокины — тромбоцитар-
ный фактор роста (ТцФР). ТцФР является важ-
ным регулятором пролиферации мезангиальных
клеток, фибробластов и клеток гладкой муску-
латуры. Тромбоциты представляют собой бога-
тый источник факторов роста, и инфильтрация
тромбоцитами является ранним этапом ответа
на эндотелиальное и мезангиальное поврежде-
ние. ТцФР продуцируется также макрофагами,
мезангиальными и эндотелиальными клетками,
фибробластами. ТцФР аутокринным способом
увеличивает свою собственную продукцию в
мезангиальных клетках, создавая таким обра-
зом петлю усиления [Johnson R. et al., 1992].
На модели мезангиопролиферативного ГН
(анти-Thy-l-нефрит) и у крыс с резекцией 5/6
почек [Noronha I.L. et al., 1995] обнаружено
значительное увеличение экспрессии ТцФР в
период максимальной пролиферации мезанги-
альных клеток. Пролиферация мезангиальных
клеток усиливалась введением рекомбинантного
ТцФР и подавлялась блокированием ТцФР ней-
трализующими антителами, что сопровождалось
снижением тяжести болезни.
В почечных биоптатах больных IgA-нефритом
и АНЦА-ассоциированным васкулитом наблю-
далась повышенная экспрессия ТцФР в мезан-
гиальных областях, коррелирующая с тяжестью
мезангиального повреждения [Noronha I.L. et al.,
1995].
Склерозирующие цитокины — трансформиру-
ющий фактор роста (ТФР/J). ТФР0 играет важ-
ную роль в регуляции продукции матрикса и
клеточной пролиферации. В зависимости от ста-
дии клеточного созревания и микроокружения
он может оказывать на клеточную пролифера-
цию или стимулирующее, или подавляющее
действие.
ТФР/3 секретируется в ответ на повреждение
в латентной форме, а затем активируется для
реализации своего биологического действия.
Фиброгенные свойства ТФР/J продемонстриро-
ваны в экспериментах, когда повторные инъ-
екции цитокина мышам вызывали тяжелый
почечный и печеночный фиброз [Terrell T.G. et
al., 1993].
Фоновая экспрессия ТФР/J в клубочках здо-
ровых крыс и человека позволяет считать, что
он играет роль в нормальном метаболизме мат-
рикса. Исследования на моделях хронических
почечных заболеваний показали персистирующее
повышение экспрессии ТФР/J в мезангиальных
клетках, коррелирующее с наработкой матрик-
са и развитием фиброза [Border W.A. et al., 1995].
Антитела против ТФР/J снижали продукцию бел-
ков матрикса. Наиболее убедительное доказатель-
ство получено в экспериментах с переносом
крысам гена ТФР/J, что приводило к значитель-
ному расширению мезангиального матрикса и
фиброзу, но без развития мезангиальной про-
лиферации [Isaka Y., et al., 1993].
Важная роль ТФР/J в расширении матрикса
продемонстрирована и при ГН человека. Повы-
шенная экспрессия тфрз в мезангиальных
областях опять же коррелировала со степенью
расширения мезангиального матрикса. Наибо-
лее выраженная экспрессия цитокина выявля-
лась в фиброзных полулуниях и областях интер-
стициального склероза [Noronha I.L. et al., 1995].
Цитокиновые цепи взаимодействуют с дру-
гими медиаторами почечного повреждения. Об-
наружено, что ангиотензин II in vivo индуци-
рует экспрессию ТцФР и ТФР0 в гладкомы-
шечных и мезангиальных клетках, приводя к
клеточной пролиферации и продукции матрик-
са. Этот эффект значительно подавлялся введе-
нием ингибиторов АПФ или антагонистов ре-
цептора ангиотензина II [Junaid A. et al., 1993].
Патофизиологическое действие цитокинов
Провоспалшпелъные цитокины ИЛ-1 и ФИО а:
• системные реакции с лихорадкой, гипотен-
зией, продукцией острофазовых белков;
• активация других типов клеток, вовлеченных
в воспалительный ответ, — Т- и В-лимфо-
цитов, эндотелия;
• стимуляция экспрессии адгезивных молекул
(ICAM-1, VCAM-1) и антигенов МНС;
• сильная хемоаттрактантная активность;
• продукция других цитокинов, включая ИЛ-2,
ИЛ-6, ИЛ-8, МСР-1, ТцФР и ТФРЗ;
• стимуляция продукции простагландинов и
оксида азота;
• прокоагулянтная активность.
Пролиферативные цитокины — ТцФР:
• стимуляция пролиферации мезангиальных
клеток, гладкомышечных клеток и фибро-
бластов;
• хемотаксическая активность;
• подавление продукции оксида азота;
• вазоконстрикция и снижение КФ.
Склерозирующие цитокины — ТФРр:
• хемотаксическая активность для моноцитов,
Т-клеток, нейтрофилов и фибробластов;
• подавляет ИЛ-2 зависимую пролиферацию
Т-клеток и экспрессию рецептора для ИЛ-2;
• подавляет продукцию иммуноглобулинов В-
клетками, за исключением IgA (повышается);
• стимуляция продукции цитокинов моноци-
тами и подавление активности клеток по
мере их созревания;
141
• подавление пролиферации эпителиальных,
эндотелиальных клеток, фибробластов, Т- и
В-лимфоцитов;
• двойственное действие на мезангиальные
клетки — в низких концентрациях митоген-
ное, в высоких — подавляющее;
• синтез и метаболизм внеклеточного матрик-
са;
• повышение продукции белков матрикса
(коллагена и протеогликанов); снижение раз-
рушения матрикса за счет активации ин-
гибиторов энзимов, резорбирующих мат-
рикс; повышение экспрессии интегринов,
необходимых для взаимодействия клеток и
матрикса.
6.1.4. Реакции клубочков на
иммунологическое повреждение
Типичные проявления воспалительной реакции
клубочков на иммунное повреждение — про-
лиферация (гиперклеточность) и расширение
мезангиального матрикса. Гиперклеточ-
ность — общая черта многих форм гломеру-
лярного воспаления, следствие двух параллель-
но протекающих процессов: 1) инфильтрации
клубочков циркулирующими мононуклеарными
и нейтрофильными лейкоцитами, являющими-
ся причиной повреждения, и 2) усиленной
пролиферации собственных, мезангиальных,
эпителиальных и эндотелиальных клеток клу-
бочка. С помощью метода культуры гломеруляр-
ных клеток выяснены происхождение и свой-
ства факторов роста, стимулирующих пролифе-
рацию клеток клубочков. Обнаружено, что мно-
гие из факторов роста стимулируют синтез ком-
понентов внеклеточного матрикса отдельными
популяциями гломерулярных клеток, приводя
к накоплению гломерулярного матрикса [Lovett
D.H., Sterzel R.B., 1986].
Накопление гломерулярного
матрикса — проявление длительно текуще-
го воспаления, часто сопровождающегося скле-
розированием и облитерацией клубочков. Это в
свою очередь — наиболее яркий признак не-
уклонного прогрессирования болезни в ХПН
(см. раздел 9.5.1).
Основные источники факторов роста, сти-
мулирующих пролиферацию гломерулярных
клеток, — макрофаги и тромбоциты. Макрофаги
выделяют ряд растворимых медиаторов с про-
воспалительной активностью, наибольшего
внимания среди которых заслуживает ИЛ-1 —
полипептидный монокин низкой молекулярной
массы, играющий важную регуляторную роль
в клеточном иммунитете и воспалении. В тка-
невой культуре макрофагальный ИЛ-1 стиму-
лирует пролиферацию мезангиальных клеток
142
[Иванов А.А. и др., 1991], синтез мезангиаль-
ными клетками коллагена, а также нейтраль-
ной протеиназы — фермента, разрушающего
компоненты нормальной БМК, включая кол-
лаген IV типа. В то же время мезангиальные
клетки сами продуцируют фактор, который
обладает активностью и биохимическими свой-
ствами ИЛ-1: вызывает митогенный ответ ти-
моцитов, выделение Т-лимфоцитами ИЛ-2,
обладает свойствами эндогенного пирогена. Он
поддерживает рост культуры мезангиальных
клеток, вследствие чего, по-видимому, ИЛ-1
мезангиальных клеток действует как аутокрин-
ный фактор роста (обеспечивающий самопод-
держивающий рост популяции клеток), локаль-
ное выделение которого может быть одной из
главных причин мезангиальной пролиферации
и избыточной продукции мезангиального мат-
рикса в период развития хронических форм гло-
мерулонефрита [Lovett D.H. et al., 1986].
Другой фактор роста обнаружен в тромбо-
цитах — тромбоцитарный фактор роста. ТцФР
в тканевой культуре усиливает пролиферацию
мезангиальных клеток и эндотелиальных клеток
почечных клубочков. В то же время мезангиаль-
ные клетки сами выделяют вещество со свой-
ствами ТцФР. Пролиферация эпителиальных
клеток клубочков усиливается лейкотриенами
LTC 4 и LTD 4, а их биосинтетическая актив-
ность — факторами макрофагов.
До настоящего времени нет достаточных све-
дений о внутриклубочковых клеточных взаимо-
действиях, которые контролируют нормальное
состояние гломерулярных клеток, предотвращая
их нежелательную пролиферацию и избыточную
биосинтетическую активность. Между тем изу-
чение этого вопроса имеет важное практическое
значение, так как поможет разработать терапев-
тические меры воздействия, способные обеспе-
чить контроль пролиферации и подавить продук-
цию матрикса клетками клубочка при иммун-
ном воспалении. Реальность таких регуляторных
взаимодействий между клетками клубочков под-
тверждается тем фактом, что эпителий клубоч-
ков in vitro синтезирует гепариноподобное ве-
щество, подавляющее пролиферацию мезанги-
альных клеток [Castellott J.J. et al., 1985].
6.2. Иммунопатологические
механизмы развития
тубулоинтерстициального
нефрита
Те же иммунопатологические реакции, которые
вызывают поражение клубочков, могут повреж-
дать клетки канальцев, сосуды и вызывать мо-
нонуклеарные и нейтрофильные инфильтраты
в интерстиции почек, что объединяется поня-
тием тубулоинтерстициальный нефрит. После-
дний может быть вызван:
• аутоантителами против ТБМ (анти-ТБМ-
антитела);
• иммунными комплексами антиген — анти-
тело;
• клеточно-опосредованными иммунными ре-
акциями.
В ряде случаев тубулоинтерстициальный не-
фрит сопровождает гломерулонефрит, в дру-
гих — изменения в клубочках отсутствуют и ту-
булоинтерстициальный нефрит существует как
самостоятельное заболевание почек.
Тяжелый тубулоинтерстициальный нефрит
можно получить у морских свинок или крыс,
иммунизируя их гетерологичной ТБМ. В почках
вдоль ТБМ проксимальных извитых канальцев
появляются линейные депозиты IgG, характер-
ные для антител, реагирующих с антигенами
базальных мембран. Аутоантитела против
ТБМ присутствуют в сыворотке и могут быть
элюированы из почек больных животных. Пе-
ренос сыворотки от больных животных инду-
цирует тубулоинтерстициальный нефрит у здо-
ровых животных. В раннюю стадию интерстици-
альный инфильтрат состоит из нейтрофилов, в
более позднюю стадию — из лимфоцитов, мак-
рофагов, плазматических и эпителиоидных кле-
ток.
У человека анти-ТБМ-нефрит встречается в
следующих ситуациях:
• в сочетании с ГН, обусловленным наличи-
ем антител к БМК (около 50 % больных
анти - БМК-нефритом);
• при некоторых гломерулонефритах, обуслов-
ленных ИК;
• при лечении метициллином, дифенилгидан-
тоином;
• в почечном аллотрансплантате;
• как изолированная болезнь, не имеющая
видимой связи с другими патологическими
состояниями.
При хронической сывороточной болезни —
классической модели иммунокомплексного гло-
мерулонефрита — гранулярные депозиты
иммунных комплексов наблюдаются не только
в клубочках, но и вдоль ТБМ, в интерстиции.
Эти депозиты состоят из тех же компонентов,
что и гломерулярные депозиты ИК, и предпо-
ложительно образуются вследствие как отложе-
ния ЦИК, так и локального их формирования.
Подобная картина выявляется в почках 50—
70 % больных волчаночным нефритом. Обнару-
живаются гранулярные депозиты, состоящие из
IgG, комплемента и иногда ДНК. Депозиты
локализуются вдоль ТБМ канальцев, в стенках
артерий и перитубулярных капилляров, вдоль
капсулы клубочка. Это сопровождается инфиль-
трацией интерстициальной ткани воспалитель-
ными клетками, повреждением тубулярных
клеток, васкулитом. Аналогичная картина на-
блюдается у больных с синдромом Шегрена.
Имеются две экспериментальные модели, в ко-
торых тубулоинтерстициальный нефрит обусловлен
главным образом реакциями клеточного имму-
нитета. В первом случае тубулоинтерстициальный
нефрит индуцируется у крыс или морских свинок
введением антигена непосредственно в интерстиций
почек с последующим переносом животным лимфо-
цитов, сенсибилизированных к этому антигену. Во
второй модели тубулоинтерстициальный нефрит
вызывают иммунизацией крыс собственной почеч-
ной тканью в адъюванте. В обоих случаях развивает-
ся выраженная инфильтрация интерстиция мононук-
леарными лейкоцитами и деструкция канальцев;
отложения иммуноглобулинов и СЗ-компонента
комплемента отсутствуют. Третья модель — тубуло-
интерстициальный нефрит у морских свинок или
крыс, иммунизированных антителами против ТБМ
(см. выше), представляет собой комбинированное по-
вреждение, обусловленное как антителами, так и ре-
акциями клеточного иммунитета. С помощью иммун-
ных лимфоцитов повреждение может быть перене-
сено от одного животного другому.
У человека клеточные иммунные реакции
играют важную роль в развитии интерстициаль-
ного клеточного инфильтрата при отторжении
почечного аллотрансплантата, тубулоинтерсти-
циального нефрита — идиопатического и свя-
занного с приемом лекарственных препаратов,
а также, возможно, в развитии хронического
бактериального пиелонефрита и рефлюкс-не-
фропатии.
Литература
Иванов А.А., Шилов Е.М., Гладских О.П. и др. Имму-
ногистохимическая характеристика нефротоксичес-
кого сывороточного нефрита у крыс: роль интерлей-
кина 1 в развитии гетерологичной и аутологичной
фаз//Арх. пат. — 1991. — № 7. — С. 15—19.
Иванов А.А., Шилов Е.М., Гладских О.П. и др. Экспе-
риментальное обоснование иммунодепрессивной
терапии гломерулонефрита//Тер. арх. — 1993. —
№ 6. - С. 23-26.
Шилов Е.М., Лесков В.П., Гордовская Н.Б. Роль мо-
нонуклеарных лейкоцитов и клеточного иммуните-
та в повреждении почек у больных нефритами//Тер.
арх. - 1984. - № 3. - С. 138-143.
Border W.A., Noble N.A., Ketteler М. TGF/1: a cytokine
mediator of glomerulosclerosis and a target for
therapeutic intetvention//Kidney Int. — 1995. — Vol. 47. —
P. 59-61.
143
Casio F.G., Orosz C.G. Adhesion molecules and the kidney
in health and disease//!. Nephrol. — 1993. — Vol. 6. — P.
22-32.
Isaka Y., Fujiwara Y, Ueda N. et al. Glomerulosclerosis
induced by in vivo transfection of TGF/J or PDGF gene
into the rat kidney//J. Clin. Invest. — 1993. — Vol. 92. —
P. 2597-2601.
Isbel N.M., Atkins R.C. Cytokines: the kidney as a model
for their role in tissue injury and repair//Aust. N. Z. J.
Med. - 1996. - Vol. 26. - P. 636-639.
Isha N., Cashman S.J., Hay H. et al. Modulation of
antibody mediated glomerular injury in vivo by bacterial
lipopolysaccharide, tumor necrosis factor and IL-1//J.
Immunol. - 1989. - Vol. 142. - P. 3080-3090.
Johnson R., Lida H, Yoshimura A. et al. Plateled derived
growth factor: a potentially important cytokine in
glomerular disease//Kidney Int. — 1992. — Vol. 41. — P.
590-594.
Junaid A., Rosenberg M.E., Hostetter TH Interaction of
angiotensin II and TGF^ in the remnant kidney. (Abstr.)/
/I. Am. Soc. Nephrol. — 1993. — Vol. 4. — P. 772.
Lan N.J., Nikolic-Paterson D.J., Zamara M. et al.
Suppression of experimental crescentic glomerulonefritis
by the interleukin 1 receptor antagonist//Kidney Int. —
1993. - Vol. 43. - P. 479-485.
Matsumoto K., Dowling J., Atkins R.C. Production of
interleukine 1 by glomerular cell cultures from patients
with rapidly progressive crescentic glomerulonephritis//
Am. J. Nephrol. - 1988. - Vol. 8. - P. 463-470.
Nathan C, Spom M. Cytokines in context//!. Cell. Biol. —
1991. - Vol. 113. - P. 981-986.
Noronha I.L., Kruger C., Andrassy K. et al. In situ
production of TNFa, IL-1 jS, and IL-2R in ANCA
positive glomerulonephritis//Kidney Int. — 1993. — Vol.
43. - P. 682-692.
Noronha I.L., NiemirZ., Stein H, Waldherr R. Cytokines
and growth factors in renal disease//Nephrol. Dial.
Transplant. - 1995. - Vol. 10. - P. 775-786.
Terrell T.G., Working P.K., Chow C.P., Green J.D.
Pathology of recombinant human transforming growth
factor-/3 1 in rats and rabbits//Int. Rev. Exp. Pathol. —
1993. - Vol. 34. - P. 43-67.
Yoshioka К, Takemura T, Murakami K. et al. In situ
expression of cytokines in IgA-nephritis//Kidney Int. —
1993. - Vol. 44. - P. 825-833.
Глава 7
ПРОТЕИНУРИЯ И НЕФРОТИЧЕСКИЙ
СИНДРОМ
И. Е. Tapeeea
I
I
7.1. Протеинурия
Протеинурия — выделение с мочой белка в
количестве, превышающем нормальные значе-
ния (50 мг/сут). Это самый частый признак
поражения почек.
В клинической практике обычно использу-
ют стандартные полоски и осаждение белка
сульфасалициловой или трихлоруксусной кис-
лотой с последующей нефелометрией или реф-
рактометрией, которые определяют белок в ко-
личестве, превышающем 20 мг/сут. Несколько
более точными являются биуретовый метод и
метод Кьельдаля, определяющие количество
белка в тканях и жидкостях по азоту (азотомет-
рический метод). С помощью таких методов
белковой химии и радиоиммунных исследова-
ний в моче могут быть выявлены различные
низкомолекулярные (преальбумин, альбумин,
а,-кислый гликопротеин, -микроглобулин,
а,-антитрипсин, а-липопротеин, сидерофи-
лйн, церулоплазмин, гаптоглобин, трансфер-
рин, легкие цепи иммуноглобулинов), а также
высокомолекулярные (а,-макроглобул ин, у-гло-
булин) белки.
Выделение белка в количестве 30—50 мг/сут
считается физиологической нормой для взрос-
лого человека. Это количество в 10—12 раз
меньше, чем то, которое в норме фильтруется
из плазмы крови через клубочки (у здоровых
лиц в сутки фильтруется около 0,5 г альбуми-
на), так как большая часть профильтровавше-
гося белка в норме реабсорбируется в прокси-
мальных канальцах. Тубулярная реабсорбция
происходит путем эндоцитоза белков мембра-
ной щеточной каемки канальцевых клеток. В то
же время некоторые белки секретируются в
мочу клетками канальцевого эпителия (напри-
мер, уропротеин Тамма — Хорсфолла — слож-
, Л.Р.Полянцева
ный гликопротеин с очень высокой молекуляр-
ной массой, синтезируемый и секретируемый
клетками восходящей части петли Генле и ди-
стальными канальцами), а также выходят из
погибших клеток мочевых путей.
При патологии почек (реже при экстраре-
нальной патологии) возникают условия, спо-
собствующие появлению в моче большого ко-
личества белка, прежде всего за счет повыше-
ния фильтрации белков через клубочковый ка-
пиллярный фильтр, а также снижения каналь-
цевой реабсорбции профильтрованных белков.
Фильтрация белков плазмы крови через стен-
ку клубочковых капилляров зависит от структур-
ного и функционального состояния стенки клу-
бочковых капилляров, ее электрического заря-
да, свойств белковых молекул, гидростатическо-
го давления и скорости кровотока, определяю-
щих скорость клубочковой фильтрации.
В норме проникновению плазменных белков в
мочевое пространство препятствуют анато-
мический барьер (структура гломерулярного
фильтра), электростатический заряд капилляр-
ной стенки и гемодинамические силы.
Стенку клубочковых капилляров составляют
эндотелиальные клетки (с округлыми отверсти-
ями между клетками — фенестрами), трехслой-
ная базальная мембрана (гидратированный
гель), а также эпителиальные клетки (подоци-
ты) со сплетением ножковых отростков и по-
рами между ними диаметром около 4 нм (ще-
левидная диафрагма). Благодаря такому слож-
ному строению клубочковая капиллярная стен-
ка может «просеивать» плазменные молекулы
из капилляров в пространство капсулы клубоч-
ка, причем эта функция «молекулярного сита»
в значительной степени зависит от размера и
формы макромолекул.
10—2950
145
Плазменные белки малого размера (лизо-
цим, 03-микроглобулин, рибонуклеаза, свобод-
ные легкие цепи иммуноглобулинов, ретинол-
связывающий белок) легко проходят через эти
поры в пространство капсулы клубочка (боуме-
нова капсула), а затем полностью реабсорби-
руются эпителием извитых канальцев. В патоло-
гических условиях размеры пор увеличиваются,
отложения иммунных комплексов вызывают ло-
кальные изменения капиллярной стенки, по-
вышающие ее проницаемость для макромоле-
кул.
Молекулы альбумина имеют диаметр 3,6 нм
(меньше размера пор), однако в физиологичес-
ких условиях они, как и большинство других
макромолекул, практически не достигают ще-
левидной диафрагмы БМК и задерживаются на
уровне фенестр.
Здесь создается функциональный барьер,
целость которого обеспечивается отрицатель-
ным зарядом и нормальным капиллярным кро-
вотоком. Отрицательно заряжены также клубоч-
ковая базальная мембрана и ножковые отрост-
ки подоцитов.
За отрицательный заряд клубочкового филь-
тра ответственны сиалогликопротеин и глико-
заминогликаны, богатые гепарансульфатом. В
нормальных условиях отрицательный заряд клу-
бочкового фильтра отталкивает анионы — от-
рицательно заряженные молекулы (в том чис-
ле молекулы альбумина). Потеря отрицательного
заряда способствует фильтрации альбумина,
который затем свободно проходит через поры
в щелевидной диафрагме.
Таким образом, экскреция альбумина свя-
зана в первую очередь с потерей отрицатель-
ного заряда клубочковым фильтром; экскреция
более крупных молекул происходит только при
повреждении базальной мембраны.
Помимо отрицательного заряда, функцио-
нальный барьер включает в себя гемодинами-
ческие факторы — нормальный капиллярный
кровоток, баланс гидростатического и онкоти-
ческого давления, разность транскапиллярно-
го гидростатического давления, коэффициент
клубочковой ультрафильтрации.
Проницаемость капиллярной стенки возра-
стает, способствуя протеинурии, как при сни-
жении скорости тока в капиллярах, так и в
условиях гиперперфузии клубочков и внутри-
клубочковой гипертензии, опосредованной ан-
гиотензином II. Введение ангиотензина II или
норадреналина, изменяющих внутриклубочко-
вую гемодинамику, повышает экскрецию бел-
ка с мочой. Возможная роль гемодинамических
изменений должна приниматься во внимание
при оценке патологической протеинурии, осо-
бенно преходящей или возникающей у больных
с недостаточностью кровообращения. Уменьше-
146
ние внутриклубочковой гипертензии с помо-
щью мер, вызывающих расширение эфферен-
тной артериолы (ингибиторы АПФ) или кон-
стрикцию афферентной артериолы (нестероид-
ные противовоспалительные препараты, цик-
лоспорин, низкобелковая диета), может значи-
тельно снизить протеинурию.
Клубочковая протеинурия — наиболее частая
форма протеинурии, связанная с нарушением
проницаемости клубочкового фильтра. Наблю-
дается при большинстве заболеваний почек —
гломерулонефритах (первичных и при систем-
ных заболеваниях), амилоидозе почек, диабе-
тическом гломерулосклерозе, тромбозе почеч-
ных сосудов, а также при гипертонической
болезни, атеросклеротическом нефросклерозе,
застойной почке.
В зависимости от содержания определенных
белков в плазме крови и в моче выделяют се-
лективную и неселективную протеинурию (тер-
мин условный, правильнее говорить о селектив-
ности выделения белковых фракций, селектив-
ности их клиренса). Селективной называют про-
теинурию, представленную белками с низко-
молекулярной массой — не выше 65 000 (в
основном альбумином). Неселективная протеи-
нурия характеризуется повышением клиренса
средне- и высокомолекулярных белков (в соста-
ве беков мочи преобладают а3-макроглобулин,
0-липопротеиды, у-глобулины). Для определе-
ния индекса клубочковой селективности срав-
нивают клиренс иммуноглобулина G с кли-
ренсом альбумина или трансферрина. Селектив-
ная протеинурия прогностически более благо-
приятна, чем неселективная. В настоящее вре-
мя в клинической практике оценка индекса се-
лективности применяется редко, в основном у
детей.
В последнее время внимание исследователей
привлекает микроальбуминурия — выделение с
мочой минимального, лишь слегка превышаю-
щего физиологическое, количества альбумина.
Микроальбуминурия, определение которой
требует применения высокочувствительных ме-
тодов, является первым симптомом диабетичес-
кой нефропатии, отторжения почечного транс-
плантата, поражения почек при гипертоничес-
кой болезни; связана с внутриклубочковой ги-
пертензией.
Канальцевая протеинурия. При снижении спо-
собности проксимальных канальцев реабсорби-
ровать плазменные низкомолекулярные белки,
профильтрованные в нормальных клубочках,
развивается канальцевая протеинурия. Количе-
ство выделяемого белка превышает 2 г/сут,
белок представлен фракциями с низкой моле-
кулярной массой (лизоцим, $2-микроглобулин,
рибонуклеаза, свободные легкие цепи иммуно-
глобулинов).
Кроме того, в моче определяется (и в нор-
ме) особый белок Тамма — Хорсфолла, выде-
ляемый в количестве 20—30 мг/сут неповреж-
денными канальцами — толстым восходящим
коленом петли Генле и начальными отделами
собирательных трубочек.
Канальцевая протеинурия наблюдается при
интерстициальном нефрите, пиелонефрите, ка-
лийпенической почке, остром канальцевом
некрозе, хроническом отторжении почечного
трансплантата, врожденных тубулопатиях (син-
дром Фанкони).
Для определения канальцевой протеинурии
обычно исследуют содержание в моче fl -микро-
глобулина (в норме не превышающее 0,4 мкг/л),
реже — лизоцима; в последние годы в качестве
маркера повреждения канальцев предложено
определение a j-микроглобулина.
Протеинурия переполнения. Повышенная эк-
скреция белка может наблюдаться и при воз-
действии внепочечных факторов. Так, протеи-
нурия переполнения развивается при повышен-
ном образовании плазменных низкомолекуляр-
ных белков (легких цепей иммуноглобулинов,
гемоглобина, миоглобина), которые фильтру-
ются нормальными клубочками в количестве,
превышающем способность канальцев к реаб-
сорбции. Таков механизм протеинурии при ми-
еломной болезни (протеинурия Бенс-Джонса),
миоглобинурии, лизоцимурии, описанной у
больных лейкозами. Возможно, имеют значение
также изменения физико-химических свойств,
конфигурации нормальных белков плазмы. На-
пример, множественные вливания плазмы кро-
ви в связи с нарушениями свертываемости кро-
ви могут вызвать преходящую протеинурию до
5—7 г/сут. Введение альбумина больным с не-
фротическим синдромом может также привес-
ти к усилению протеинурии (хотя при массив-
ных вливаниях могут возникать и изменения
почечной гемодинамики).
Функциональные протеинурии. К функцио-
нальным протеинуриям, точные механизмы
патогенеза которых не установлены, относятся
ортостатическая, идиопатическая преходящая,
протеинурия напряжения, лихорадочная про-
теинурия, а также протеинурия при ожирении.
Для ортостатической протеинурии характер-
но появление белка в моче при длительном
стоянии или ходьбе с быстрым его исчезнове-
нием при изменении положения тела на гори-
зонтальное. Протеинурия обычно не превыша-
ет 1 г/сут, является клубочковой и неселектив-
ной, механизм ее возникновения неясен. Чаще
она наблюдается в юношеском возрасте, у по-
ловины больных исчезает через 5—10 лет. Ме-
ханизм развития, возможно, связан с неадек-
ватно усиленным ответом внутрипочечной ге-
модинамики на изменение положения тела.
Диагноз ортостатической протеинурии ста-
вят при сочетании следующих условий:
• возраст пациентов 13—20 лет;
• изолированный характер протеинурии, от-
сутствие других признаков поражения почек
(изменений мочевого осадка, повышения ар-
териального давления, изменений сосудов
глазного дна);
• исключительно ортостатический характер
протеинурии, когда в анализах мочи, взятых
после пребывания больного в горизонталь-
ном положении (в том числе утром до
подъема с постели), белок отсутствует.
Для доказательства этого диагноза необхо-
димо провести ортостатическую пробу. Для это-
го мочу собирают утром перед вставанием с
постели, затем после 1—2-часового пребывания
в вертикальном положении (ходьба с палкой за
спиной для выпрямления позвоночника). Про-
ба дает еще более точные результаты, если ут-
ренняя (ночная) порция мочи выливается (так
как в мочевом пузыре может быть остаточная
моча), а первая порция собирается после 1 —
2-часового пребывания обследуемого в горизон-
тальном положении.
В юношеском возрасте может наблюдаться
также идиопатическая преходящая протеинурия,
обнаруживаемая у здоровых лиц при медицин-
ском обследовании и отсутствующая при пос-
ледующих исследованиях мочи.
Протеинурия напряжения выявляется у 20 %
здоровых лиц (в том числе спортсменов) пос-
ле резкого физического напряжения. Белок
выявляется в первой собранной порции мочи.
Протеинурия имеет тубулярный характер. Пред-
полагается, что механизм протеинурии связан
с перераспределением тока крови и относитель-
ной ишемией проксимальных канальцев.
Лихорадочная протеинурия наблюдается при
острых лихорадочных состояниях, особенно у
детей и лиц старческого возраста. Она имеет
преимущественно гломерулярный характер.
Механизмы этого вида протеинурии мало изу-
чены, обсуждается возможная роль повышения
клубочковой фильтрации наряду с преходящим
поражением клубочкового фильтра иммунны-
ми комплексами.
Протеинурия при ожирении. Протеинурия
нередко наблюдается при патологическом ожи-
рении (масса тела более 120 кг). По данным
J.P.Domfeld (1989), среди 1000 больных с ожи-
рением у 410 выявлена протеинурия без изме-
нений осадка мочи; описаны и случаи нефро-
тического синдрома. Предполагается, что в ос-
нове развития такой протеинурии лежат изме-
нения клубочковой гемодинамики (внутриклу-
бочковая гипертензия, гиперфильтрация), свя-
занные с повышением при ожирении концен-
10
147
трации ренина и ангиотензина, которая при го-
лодании снижается. При потере массы тела, а
также при лечении ингибиторами АПФ проте-
инурия может уменьшаться и даже исчезать.
Кроме того, протеинурия может иметь вне-
почечное происхождение. При наличии выражен-
ной лейкоцитурии и особенно гематурии по-
ложительная реакция на белок может быть след-
ствием распада форменных элементов крови
при длительном стоянии мочи, в этой ситуа-
ции патологической является протеинурия,
превышающая 0,3 г/сут. Осадочные белковые
пробы могут давать ложноположительные ре-
зультаты при наличии в моче йодистых контра-
стных веществ, большого количества аналогов
пенициллина или цефалоспорина, метаболитов
сульфаниламидов.
7.2. Нефротический синдром
Протеинурия с содержанием белка 3,0—3,5 г/сут
приводит к развитию нефротического синдро-
ма. Нефротический синдром (НС) представляет
собой клиника-лабораторный симптомокомплекс,
включающий в себя, помимо массивной протеи-
нурии (белка более 3,5 г/сут), гипоальбуминемию
(белка менее 30 г/л), гипопротеинемию и отеки.
В детской практике нижней границей содержа-
ния белка при нефротической протеинурии
считают 50 мг/(кг • сут). Частым (но не обяза-
тельным) признаком НС является гиперхолес-
теринемия.
НС — понятие, раньше обозначавшееся тер-
мином «нефроз», введенным в начале века и
получившим распространение благодаря уче-
нию F.Munk, F.Volhard и Th.Fahr (1913-1916)
о липоидном нефрозе как о дегенеративном
изменении канальцевого эпителия. В настоящее
время термин «липоидный нефроз» применя-
ется редко, для обозначения первичного, иди-
опатического НС у детей, развивающегося
вследствие минимальных клубочковых измене-
ний. Термин «нефроз» используется морфоло-
гами для обозначения токсических и некроти-
ческих поражений канальцев («нефроз миогло-
бинурический», «нефроз парапротеинемичес-
кий» и др.).
Принято считать, что термин «нефротичес-
кий синдром» ввел в литературу W.Nonnenbruch
(1949), однако еще за 20 лет до него Е.М.Та-
реев в монографии «Анемия брайтиков» (1929)
писал о «характерно очерченном в клинике
нефротическом синдроме», противопоставляя
его некротическому нефрозу (например, «суле-
мовой почке») преимущественно из-за того,
что при нефротическом синдроме «характерны
дегенеративные изменения не только эпителия
канальцев, но и клубочков». Это принципиаль-
148
но важное положение лежит в основе современ-
ного понимания морфогенеза нефротического
синдрома.
НС развивается чаще всего у детей в возра-
сте от 2 до 5 лет и взрослых от 17 до 35 лет.
Наряду с этим описаны случаи НС и в более
ранние сроки жизни — у новорожденных, а
также в очень пожилом и старческом возрас-
те — 85—95 лет [Abrass Ch., 1985].
Среди наблюдавшихся нами 1000 больных с
НС у 70 возраст превышал 60 лет, максималь-
ный возраст был 90 лет (Л.Р.Полянцева). Пре-
обладание мужского или женского пола среди
больных с НС связано с характером основного
заболевания. Например, среди больных систем-
ной красной волчанкой с НС больше молодых
женщин (90 %, по нашим данным), а среди
больных с НС, возникшим на фоне хроничес-
ких легочных заболеваний или остеомиелита,
преобладают мужчины (85 %).
Наиболее частой причиной НС в терапевти-
ческой и нефрологической клинике является
гломерулонефрит; НС может развиваться при
любых его морфологических формах, однако
наиболее часто — у детей при минимальных из-
менениях клубочков, у взрослых — при мемб-
ранозной нефропатии, мезангиокапиллярном
ГН и фокально-сегментарном гломерулярном
гиалинозе. На втором по частоте месте среди
причин НС стоит амилоидоз почек — вторич-
ный (при ревматоидном артрите, хронических
воспалительных и нагноительных заболеваниях
и др.), первичный и наследственный.
К развитию НС могут приводить системные
заболевания, в первую очередь системная крас-
ная волчанка, геморрагический васкулит Шен-
лейна — Геноха, бактериальный эндокардит,
реже другие васкулиты, системная склеродер-
мия. В последние годы привлекают к себе вни-
мание случаи паранеопластического НС при
раке почки, легкого, кишечника, лимфомах и
др., морфологическим субстратом которого яв-
ляется ГН (чаще мембранозный) или амилои-
доз почек.
Среди более редких причин НС следует на-
звать тромбозы вен и артерий почек, аорты или
нижней полой вены с развитием мембранозно-
го или мезангиокапиллярного ГН, иногда свя-
занные с травмой.
Представляет значительный интерес возмож-
ность развития НС при аллергических (атопичес-
ких) заболеваниях типа поллинозов, пищевой
идиосинкразии (молоко, свинина и др.), аллер-
гии на косметические средства. Первый случай
развития рецидивирующего НС, вызванного ги-
персенсибилизацией к цветочной пыльце, был
описан J.Hardwicke и соавт. (1959). Мы наблю-
дали развитие НС после укусов насекомых у трех
больных [Янушкевич Т.Н. и др., 1998].
H.Howanietz и G.Lubec (1985) описали идиопа-
тический НС, начавшийся в 2-летнем возрасте, дли-
тельно леченный кортикостероидами; через 6 лет
была установлена пищевая аллергия к свинине; пос-
ле назначения элиминационной диеты протеинурия
исчезла. Через 5 лет ремиссии больная случайно съела
свинину, на другой день появился белок в моче
(10 г/сут), уровень IgE составил 540 мг/л. Возобнов-
ление диеты снова привело к ремиссии. G.Lagrue и
соавт. (1986) исследовали у 34 больных с идиопати-
ческим НС тест дегрануляции базофилов с 5 анти-
генами; тест оказался положительным у 1 из 19 до-
норов и у 22 из 34 больных: с белками пшеницы —
у 9 человек, со свининой — у 9, с молоком — у 6,
с говядиной — у 6, с яичным белком — у 5 чело-
век.
НС может развиться при сахарном диабете
(при диабетическом гломерулосклерозе), при
синдроме Альпорта. Описаны случаи НС при
таких редких заболеваниях, как диффузный зоб
(болезнь Грэвса), парциальная липодистрофия,
мукополисахаридоз, болезнь ногтевых пласти-
нок, при гиперкальциемии. Так, S.Teller,
B.Spargo (1987) описали развитие НС у боль-
ной с тяжелой гиперкальциемией (содержание
кальция в сыворотке крови до 3,51 г/л), свя-
занной с первичным гиперпаратиреозом. При
биопсии выявлено отложение электронно-плот-
ного материала (возможно, кальция) в клубоч-
ковой базальной мембране. Все признаки НС
исчезли через 2 нед после нормализации коли-
чества кальция, однако при повторной биопсии
исчезновения депозитов не отмечено.
Большинство из обусловливающих НС забо-
леваний имеет иммунный генез. Долгое время
были неясны патогенетические механизмы идио-
патического НС (липоидного нефроза, мини-
мальных изменений клубочков), когда хорошие
результаты иммунодепрессивной терапии зас-
тавляли предполагать иммунный генез, однако
прямые доказательства этого (в частности, от-
ложения иммуноглобулинов в ткани почек)
отсутствовали. В настоящее время получены фак-
ты, указывающие на роль клеточных иммунных
механизмов. Имеются данные о том, что Т-лим-
фоциты больных с НС вырабатывают фактор,
приводящий к повышению проницаемости клу-
бочковой капиллярной стенки. G.Lagrue и со-
авт. (1975) сообщили, что лимфоциты перифе-
рической крови больных с НС при стимуляции
конканавалином А, введенным в кожу морской
свинки, выделяют фактор, повышающий мес-
тно сосудистую проницаемость. В последующем
было подтверждено выделение фактора сосуди-
стой проницаемости стимулированными лим-
фоцитами больных НС с минимальными клу-
бочковыми изменениями; предполагалось, что
именно это приводит к протеинурии. J.Boulton
и соавт. (1983) показали, что при введении
супернатанта лимфоцитов больных НС в почеч-
ную артерию крыс отмечаются слияние подо-
цитов, снижение заряда клубочковой базальной
мембраны и развитие протеинурии. S.Tomizawa
и соавт. (1985) доказали, что и нестимулиро-
ванные конканавалином А Т-лимфоциты боль-
ных в период высокой активности болезни
выделяют подобный фактор.
За последние годы выявлено и идентифици-
ровано несколько высокоактивных лимфокинов.
Обсуждается роль и других циркулирующих
факторов, повышающих сосудистую проница-
емость и способствующих протеинурии, — вы-
сококатионных белков [Levin М. et al., 1989],
антител к гепарансульфату БМ клубочков [van
den Bom J. et al., 1992] или к антигену подо-
цитов, протеаз плазмы [Ро Kam Cheung et al.,
1996].
Однако не все заболевания, осложняющие-
ся НС, имеют доказанный иммунный генез.
Так, пока еще не ясен патогенез врожденного
НС финского типа (редкое семейное аутосом-
но-рецессивное заболевание), НС при таких ге-
нетически обусловленных болезнях, как муко-
полисахаридоз или болезнь ногтевых пластинок.
По-видимому, еще не раскрытый метаболи-
ческий патогенез имеют и некоторые экспери-
ментальные модели НС: НС, развившийся у
крыс вследствие алиментарной гиперлипиде-
мии, синдрома Фанкони, вызываемого малеи-
новой кислотой, а также НС собак, наблюда-
ющийся после введения в почечную вену 24 %
раствора мочевины. В условиях последней мо-
дели НС массивная протеинурия появлялась
вслед за слиянием и деструкцией отростков
подоцитов и признаками внутрисосудистой
коагуляции при отсутствии иммунных депози-
тов и каких-либо других изменений базальных
мембран клубочковых капилляров.
Механизмы большой потери белка почками
(нефротической протеинурии) нельзя признать
окончательно выясненными. Одним из факто-
ров является потеря отрицательного заряда
клубочковой капиллярной мембраны, связан-
ного в основном с отрицательно заряженным
гепарансульфатом; потеря клубочковых анион-
ных зарядов может наблюдаться и в отсутствие
структурных повреждений, например при ми-
нимальных изменениях клубочков.
Высказывается точка зрения, что в основе
стероидно-чувствительного НС лежит генерали-
зованное расстройство отрицательного заряда
ряда мембран. Эта гипотеза подтверждается тем,
что отрицательный заряд мембран эритроцитов
и тромбоцитов у больных со стероидно-чувстви-
тельным НС значительно меньше, чем у здоро-
вых. По мнению авторов, это вызвано скорее ней-
трализацией, чем отсутствием анионных групп.
Среди возможных причин снижения отри-
цательного заряда клубочковых полианионов
149
обсуждается фиксация на капиллярной стенке
катионных белков нейтрофилов и тромбоцитов,
выделяемых при их активации [Olbricht С. et al.,
1984]. По мнению K.Okada и соавт. (1986), к
очаговой потере и дезорганизации анионных
участков клубочковой базальной мембраны при
мембранозном ГН приводят субэпителиальные
депозиты. Массивное прохождение белка через
боуменову капсулу сопровождается резко повы-
шенным его метаболизмом в проксимальном
канальце.
При НС суточное содержание белка в моче
может достигать 20—50 г и более. При этом ко-
личество экскретируемого белка не зависит от
морфологического типа ГН, хотя, как прави-
ло, протеинурия более выражена при мини-
мальных изменениях клубочков, фокально-сег-
ментарном гломерулосклерозе и мембранозной
нефропатии.
Белки, выделяемые при НС с мочой, имеют
плазменное происхождение, причем состав белковых
фракций мочи качественно близок таковому сыво-
ротки крови, но отличается количественно. Так, в
моче при максимальном количестве альбумина от-
носительно увеличено содержание о^- и /1-глобули-
нов и понижено, иногда до следов, количество «2-
и у-глобулинов.
Среди экскретируемых с мочой белков при НС
выявляется большое количество различных фермен-
тов: трансаминидаз, лейцинаминопептидазы, кислой
фосфатазы, /1-глюкуронидазы, ацетилглюкозамини-
дазы и др. Их активность в моче в десятки и даже
сотни раз выше, чем в моче здоровых людей или
больных с латентной формой нефрита. Кроме этих
белков, в моче больных с НС определяются глико-
протеиды и липопротеиды, в частности липопроте-
иды высокой плотности.
Повреждение клубочков почек и массивная
протеинурия приводят к возникновению дру-
гих больших симптомов НС, в комплексе фор-
мирующих клиническую картину этого состоя-
ния, в первую очередь гипоальбуминемии, ги-
попротеинемии и задержки натрия.
7.2.1. Гипоальбуминемия,
гипопротеинемия
О гипоальбуминемии говорят при содержании
альбуминов сыворотки менее 35 г/л; при тяже-
лом НС содержание альбуминов может снижать-
ся до 15—20 и даже до 8—10 г/л. Гипоальбуми-
немия определяет снижение количества обще-
го белка в сыворотке, уровня онкотического
давления сыворотки, транспортной функции
альбумина как переносчика ряда веществ, в том
числе многих лекарственных препаратов. Свя-
зывание альбумином переносимых веществ спо-
собствует удержанию их в интраваскулярном,
150
а затем и в интерстициальном пространствах,
регулирует транскапиллярный обмен транспор-
тируемых веществ, осуществляет дезинтоксици-
рующую функцию. Так, взаимодействие сыво-
роточного альбумина со свободными жирными
кислотами предохраняет организм от их токси-
ческого влияния. Основной причиной гипоаль-
буминемии при НС является повышенная филь-
трация альбумина через проницаемый клубоч-
ковый барьер, прежде всего в местах потери
анионов капиллярной стенки, при неполной
его реабсорбции в канальцах.
Большое значение имеет также переход аль-
бумина в отечную жидкость, особенно при зна-
чительных полостных отеках. Концентрация
альбумина в абдоминальном и плевральном
транссудатах колеблется от 1 до 5 г/л [Полян-
цева Л.Р., 1985].
Гипопротеинемия — постоянный синдром НС.
Содержание общего белка в сыворотке крови
снижается до 40—30 и даже 25 г/л. В происхож-
дении гипопротеинемии, помимо потери бел-
ков с мочой, играют роль и усиленный их ка-
таболизм, в частности альбумина, IgG и др.,
перемещение белков во внесосудистые про-
странства.
При развитии больших отеков (до 30—40 кг)
из плазмы крови в отечную жидкость перехо-
дит более 30 г белка. Дополнительное значение
имеют потери белков через кишечник и сни-
жение синтеза отдельных белков.
Диспротеинемия, неизменно сопутствующая
гипопротеинемии, выражается не только в рез-
ком уменьшении концентрации альбумина в
сыворотке крови, но и в повышении <х2- (от
12 до 56—74 %) и /1-глобулиновых фракций. В
а2-глобулиновой фракции увеличено содержа-
ние гаптоглобинов и а 2-макроглобулина. Это
обусловлено их избирательной задержкой в
русле крови в связи с большой молекулярной
массой, снижением катаболизма и, возможно,
повышенным синтезом. Учитывая свойства а2-
макроглобулина как поливалентного ингибито-
ра протеаз крови (плазмина, тромбина, каллик-
реина), его способность связывать некоторые
гормоны (инсулин, гормон роста и др.), мож-
но полагать, что повышение или понижение
концентрации а2-макроглобулина может спо-
собствовать различным изменениям гумораль-
ных систем гомеостаза. Содержание у-глобули-
нов обычно снижено, хотя при некоторых не-
фропатиях (волчаночный нефрит, амилоидоз)
может быть и повышено. При выраженном НС
изменяется также соотношение содержания
в крови основных классов иммуноглобулинов:
уменьшается концентрация IgA и IgG и по-
вышается уровень IgM (возможно, вследст-
вие селективной его задержки в сосудистом
русле).
7.2.2. Отеки
Патогенез нефротических отеков сложен и скла-
дывается из ряда патофизиологических механиз-
мов, приводящих к задержке натрия и воды и
их накоплению в интерстиции.
Интерстициальная жидкость и вода плазмы
являются составными частями внеклеточной
жидкости организма. Обе эти части находятся в
динамическом равновесии, определяемом сила-
ми, описанными Старлингом в конце XIX в.
Капилляры проницаемы для воды и электроли-
тов, но относительно непроницаемы для круп-
ных молекул, таких как белки. Равновесие жид-
кости внутри и снаружи капилляров поддержи-
вается гидростатическим давлением внутри ка-
пилляров и онкотическим (коллоидно-осмоти-
ческим) давлением плазмы, которое определя-
ется почти полностью содержанием белка.
На протяжении многих лет в качестве пер-
вичного фактора патогенеза обсуждают роль ги-
попротеинемии, почечной задержки натрия и
системного нарушения сосудистой проницаемо-
сти. Та или иная теория периодически выходит
на первое место, затем сменяется другой с тем,
чтобы на новом витке знаний снова занять гла-
венствующее место.
В первые годы изучения почечного отека
задержка жидкости признавалась прямым след-
ствием повреждения почек. Приводимое
R. Bright объяснение, что отек — простое след-
ствие прекращения выделительной деятельно-
сти почек и изменения гидремических свойств
крови, существовало и до него. Так, Forest еще
в 1651 г. следующим образом формулировал
следствие поражения почек: «... если они не
очищают организм от жидкости, которая оста-
ется в обильном количестве в сосудах, то кровь
делается водянистой, и отфильтровывается
сыворотка».
До начала 80-х годов XX в. общепринятой
была гипотеза, согласно которой центральным
звеном в развитии нефротического отека при-
знавалось снижение онкотического давления
вследствие гипоальбуминемии, определяемой
потерей альбумина с мочой, не полностью ком-
пенсируемой повышением печеночного синте-
за. Снижение онкотического давления плазмы
ведет к выходу жидкости в интерстициальное
пространство, чему способствует повышение
сосудистой проницаемости для воды, и к раз-
витию гиповолемии. Гиповолемия вызывает
компенсаторную активацию синтеза ренина с
последующей усиленной продукцией альдосте-
рона, задержкой натрия, а затем (в том числе
и через повышение синтеза АДГ) — и воды. Из-
за низкого онкотического давления плазмы
задержанный солевой раствор распределяется в
основном в интерстициальном пространстве.
Эта теория, которая в настоящее время на-
зывается «классической», или теорией «непол-
ного русла», подтверждалась выявлением высо-
ких показателей активности ренина и секреции
альдостерона у многих больных с НС.
Однако ряд наблюдений и исследований
дали основания к пересмотру этой теории. Было
обращено внимание на то, что у больных с
врожденной гипоальбуминемией отеки никог-
да не развиваются. Клинические исследования
показали, что гиповолемия не является обяза-
тельным признаком НС, напротив, выявляет-
ся относительно редко.
Е.М.Тареев и В.Х.Цветков (1932), исследуя
массу циркулирующей крови у больных с раз-
личными заболеваниями почек, выявили у не-
фротиков ее повышение — в среднем 88 см3 на
1 кг массы тела, максимально —101 см3/кг (при
показателях у здоровых людей 82 см3/кг). «Срав-
нительно высокие цифры массы крови в этой
группе обусловлены некоторым повышением
против нормы количества плазмы, а не формен-
ных элементов...» [Тареев Е.М., Цветков В. X.,
1932]. Авторы считали, что гиперволемия не-
фротиков (и особенно в период схождения оте-
ков) говорит не только о значении тканевого
и гуморального (гипоонкотического) факторов,
но и подтверждает необходимость признавать и
почечный фактор.
В 1979 г. J.Meltzer и соавт. при детальном
обследовании 16 ранее нелеченных больных
наряду с классическим гиповолемическим ва-
риантом у больных с минимальными измене-
ниями клубочков выделили гиперволемический
вариант. Одновременно сходные данные были
получены E.Dorhout-Mees и соавт. (1979). Авто-
ры обратили внимание и на разнородность
больных по активности ренин-ангиотензин-аль-
достероновой системы (РААС): активация РААС
отмечалась при гиповолемическом варианте и
отсутствовала при гиперволемическом.
В наших исследованиях гиповолемия (ОЦК ме-
нее 70 мл/кг) была выявлена только у 7 из 23 боль-
ных со стабильным НС, гиперволемия (ОЦК более
90 мл/кг) — у 6 [Клепиков П.В. и др., 1984]; актив-
ность ренина плазмы была повышена у больных с
гиповолемией и снижена у больных с гиперволеми-
ей. У больных с повышенной активностью РААС
задержки натрия не было.
Таким образом, ренин-ангиотензин-альдо-
стероновая система не играет роли в задержке
натрия при гиперволемическом НС. Первичным
признается внутрипочечный дефект «обработ-
ки» натрия — снижение величины клубочко-
вой фильтрации и/или увеличение канальцевой
реабсорбции натрия. Эта теория получила на-
звание теории переполненного русла, или пе-
реполнения.
151
Следует отметить, что роль задержки натрия в
патогенезе нефротического отека установлена с на-
чала века. F. Widal и F. Javal (1903) 9 раз изменяли
больному режим питания и всякий раз, когда боль-
ной получал соль, у него повышалась масса тела и
появлялись отеки; когда же исключали из пищи
соль, отмечался «поток» хлорида натрия в моче. По
их представлению, имелась «избирательная утрата
больной почкой способности выделять поваренную
соль...» [Тареев Е.М., 1958].
Наблюдения, показавшие, что величина КФ
в период задержки натрия ниже, чем в период
стабилизации отеков [Кутырина И. М. и др.,
1988], и что начало натрийуреза совпадает с
возрастанием КФ [Dorhout-Mees Е. et al., 1984,
1987], подтверждают значение снижения филь-
трационной функции.
Остается неясным, каким образом при ги-
перволемическом НС массивная протеинурия
дает сигнал канальцам для реабсорбции боль-
шего количества натрия, почему этот внутри-
почечный дефект обработки натрия выявляет-
ся именно при большой протеинурии.
Очевидно, имеют значение также снижение
продукции почечных простагландинов, увели-
чение продукции АДГ, возможно, нарушение
синтеза предсердного натрийуретического фак-
тора и снижение натрийуретического ответа
почек на этот фактор. Могут иметь значение и
такие физические факторы, как снижение он-
котического давления в перитубулярных капил-
лярах, что ведет к повышению реабсорбции
натрия. Возможна роль симпатической нервной
системы, однако ангиотензин как будто не иг-
рает роли в задержке натрия у больных с НС.
Связи между объемом плазмы и концентраци-
ей ренина нет, у большинства больных его кон-
центрация нормальная и блокада ангиотензи-
на II каптоприлом не вызывает диуреза.
На настоящем этапе принимается точка зре-
ния, что оба механизма (т.е. неполное русло и
переполненное русло) играют роль в задержке
натрия у различных больных. Однако частота
того или иного варианта исследователями оце-
нивается различно.
По мнению J.S.Cameron (1988), гиповолеми-
ческая гипотеза, очевидно, применима лишь к
периоду возникновения отеков и начала стаби-
лизации, особенно при быстром развитии мас-
сивной протеинурии при рецидивах «минималь-
ных изменений клубочков» у детей. Однако не-
которые исследователи и в настоящее время
придерживаются классических представлений.
Так, R.Schrier и R.Fassett (1998), критикуя ги-
потезу переполнения, считают, что у большин-
ства больных с НС имеется гиповолемия. Вы-
сокую частоту гиперволемии в ряде исследова-
ний с применением меченого альбумина они
объясняют тем, что при использовании альбу-
мина для исследования ОЦК возможны невер-
ные результаты из-за его двухфазного и быст-
рого исчезновения из кровообращения; приме-
нение же более крупного маркера, например
фибриногена, могло бы давать более верные ре-
зультаты.
В то же время представление о величине
ОЦК при НС имеет отнюдь не только теорети-
ческое, но и важное клиническое значение,
обосновывая показания к назначению диурети-
ков и ультрафильтрации. При гиперволемичес-
ком варианте рекомендуется интенсивное ле-
чение диуретиками, в резистентных случаях
показана и ультрафильтрация. При гиповолеми-
ческом варианте диуретики следует назначать с
осторожностью, чтобы не уменьшить и без того
малый ОЦК и не привести к ОПН; ультрафиль-
трация противопоказана.
R.Schrier и R.Fassett предлагают следующие
ориентиры для оценки ОЦК: гиповолемичес-
кий вариант более вероятен при содержании
альбумина в сыворотке ниже 2 г/дл, величине
СКФ выше 50 % нормальной, при отсутствии
гипертензии, при наличии ортостатической ги-
потензии, при гистологической картине мини-
мальных изменений клубочков. О гиперволеми-
ческом варианте можно думать при содержании
альбумина сыворотки выше 2 г/дл, СКФ ме-
нее 50 % нормальной, наличии гипертензии,
отсутствии ортостатического снижения АД,
других гистологических изменениях почек.
7.2.3. Метаболические нарушения
при нефротическом синдроме
Ярким признаком НС является гиперлипидемия.
Для нефротической гиперлипидемии характер-
но в первую очередь увеличение общего и эс-
терифицированного холестерина (липопротеи-
ды низкой плотности, апоВ). При выраженном
НС повышается и уровень триглицеридов (ли-
попротеиды очень низкой плотности). Содержа-
ние липопротеидов высокой плотности (ЛВП)
чаще нормально или снижено.
Концентрация неэстерифицированных жир-
ных кислот обычно не изменена. Однако в це-
лом их метаболизм, по всей видимости, нару-
шен, так как в результате гипоальбуминемии
значительная часть жирных кислот транспорти-
руется несвязанными, что в свою очередь от-
ражается на обмене липопротеинов.
Тяжесть нефротической гиперлипидемии
нередко определяется нозологической формой
ГН (например, менее выражена при НС, обус-
ловленном люпус-нефритом), течением НС
(особенно высока при персистирующем тече-
нии), приемом глюкокортикостероидов [Неве-
ров Н.И., 1994].
152
Механизм развития нефротической гиперли-
пидемии полностью не выяснен. Наиболее рас-
пространенной в настоящее время является
теория о ведущей роли гипоальбуминемии,
стимулирующей при НС увеличение синтеза как
белка, так и липопротеинов. В дальнейшем бе-
лок теряется с мочой, а гиперлипопротеине-
мия сохраняется. Эта теория подтверждается
обнаруживаемой многими авторами связью вы-
раженности нефротической гиперлипидемии с
гипоальбуминемией (Warwick G. et al., 1994, и
др.]. В реализации этого механизма имеет зна-
чение изменение двух факторов на пути син-
теза в печени холестерина — увеличения актив-
ности ГМГ-КоА-редуктазы и снижения катабо-
лизма мевалоната.
Наряду с мнением о гиперпродукции липо-
протеинов существует теория, отводящая основ-
ную роль нарушению их катаболизма, что свя-
зывают в первую очередь со снижением актив-
ности липопротеин-липазы вследствие потери с
мочой ее активаторов. Это подтверждается сни-
жением содержания липидов в крови, сопровож-
дающим уменьшение протеинурии при неизмен-
ном уровне альбумина крови у больных с НС,
леченных иАПФ [Kaysen G.,1991 ].
Клиническое значение нефротической гипер-
липидемии определяется ее атерогенным эффек-
том и вкладом в прогрессирование повреждения
почек. Возможность ускоренного развития ате-
росклероза на фоне нефротической гиперлипи-
демии до настоящего времени подвергается со-
мнению ввиду отсутствия убедительных проспек-
тивных исследований [Wheeler D.C., Bernard
D.B., 1994]. Вместе с тем существуют клини-
ческие подтверждения атеросклеротического
повреждения аорты даже у 5-месячных детей
|Meyer M.V., Meyer W.W., 1992]. Представля-
ют интерес результаты J.D.Ordonez и соавт.
(1993), сопоставивших частоту тяжелых прояв-
лений ишемической болезни сердца в группе
из 142 больных с НС, каждый из которых имел
пару среди 142 лиц контрольной группы. Авто-
рами установлено, что при НС частота инфар-
ктов миокарда (11 случаев) и смертей от ос-
ложнений ишемической болезни сердца (7 слу-
чаев) была значительно выше, чем в конт-
рольной группе (соответственно 4 и 3 случая).
Морфологические маркеры липидогенных
воздействий на почки представлены крупными
внутриклеточными липидными включениями в
ряде случаев с формированием пенистых кле-
ток. По данным Н.И.Неверова (1994), помимо
гиперлипидемии, появление гломерулярных
липидогенных маркеров определяется морфоло-
гической картиной нефропатии. Так, они по-
чти всегда обнаруживаются в случаях нефроти-
ческой гиперлипидемии, обусловленной так
называемыми невоспалительными нефропати-
ями (минимальные изменения клубочков, мем-
бранозная нефропатия, ФСГС). Внутриклеточ-
ное и внеклеточное накопление липидов в
структурах клубочка стимулирует пролифера-
тивные и склеротические процессы [Attman P.O.
et al., 1997; Kamanna V.S. et al., 1998]. Вероят-
ность такого механизма подтверждена корреля-
циями между выраженностью липидогенных
морфологических изменений и интенсивностью
склеротических (избыточное накопление колла-
гена IV типа, появление коллагенов I и III
типов) и пресклеротических (утолщение ГБМ,
накопление мезангиального матрикса) процес-
сов в клубочке [Неверов Н.И., 1994].
Характерным признаком НС является нару-
шение метаболизма витамина D и связанного с
ним фосфорно-кальциевого обмена. Эти наруше-
ния выражаются в гипокальциемии (главным
образом за счет белковосвязанного кальция, но
также и его ионизированной фракции), гипо-
кальциурии с клиническими признаками тета-
нии (чаще у детей), остеопороза и остеомаля-
ции. В основе этих нарушений лежит дефицит
одного или нескольких метаболитов витамина D.
Один из метаболитов (25-гидроксивитамин D)
циркулирует в крови вместе с а-глобулином,
витамин-D-связывающим белком и при нару-
шенной проницаемости ГБМ выходит в клубоч-
ковый фильтрат. Дигидроксилированные ме-
таболиты [в основном 1,25cx(OH)2D3] образуют-
ся в проксимальных канальцах, и при массив-
ной протеинурии, ведущей к поражению ка-
нальцев, их синтез снижается. Дефицит метабо-
литов витамина D ведет к развитию резистент-
ности скелета к кальциймобилизующему дей-
ствию паратгормона и нарушению всасывания
кальция в кишечнике и тем самым к снижению
ионизированного кальция. Большое значение
имеет снижение связанного с белком кальция,
обусловленное гипоальбуминемией. Снижение
содержания ионизированного кальция стимули-
рует активность паращитовидных желез с раз-
витием вторичного гиперпаратиреоза.
У части больных с НС выявляется диабето-
подобный ответ на нагрузку глюкозой, а также
повышение экскреции инсулина, а в крови —
количества гормона роста. Эти расстройства
чаще наблюдались у больных мембранозной
нефропатией и фокально-гломерулярным скле-
розом. Нередко обнаруживается гипогликемия
натощак одновременно с базальной гиперин-
сулинемией; гликемические кривые у этих боль-
ных уплощенные, резко замедленные.
В наших наблюдениях [Тареев Е.М., Полян-
цева Л.Р. и др., 1975] уровень иммунореактив-
ного инсулина (ИРИ) был максимально высо-
ким (24,0 мкед U/мл) в сыворотке крови боль-
ных с нефротическим синдромом по сравнению
с показателем ИРИ у доноров (17,0 мкед U/мл),
153
у больных с изолированным мочевым синдро-
мом (19,0 мкед U/мл) и у больных с ХПН
(22,0). Это позволило предположить, что при
НС, характеризующемся усиленным липоли-
зом, гиперлипидемией и катаболизмом, имеет
место реактивный усиленный синтез инсулина
как важнейшего гормона антилиполиза, липо-
генеза и анаболизма — своего рода адаптивная
реакция поджелудочной железы. Тот факт, что
базальная гиперинсулинемия при НС была до-
стоверно выше (30) у больных с благоприят-
ным прогнозом по сравнению с больными,
имевшими плохой прогноз (21,0 мкед U/мл),
позволяет рассматривать ее как компенсатор-
ный позитивный признак.
При НС изменяются состав и количествен-
ное соотношение основных микроэлементов как
в плазме крови, так и в клеточных элементах. В
частности, могут выявляться резко выраженная
гипоцинкемия, пониженное содержание железа
и кобальта, на фоне чего развиваются анемия,
тяжелые дистрофические изменения кожи и ее
дериватов, отставание в росте детей с длитель-
но существующим НС.
У больных с массивной протеинурией иног-
да могут быть различные расстройства функции
проксимальных канальцев — аминоацидурия,
глюкозурия, фосфатурия, почечный канальце-
вый ацидоз; в редких случаях эти расстройства
сочетаются, давая клиническую картину синд-
рома Фанкони.
7.2.4. Нарушения гемостаза
Важной особенностью НС является нарушение
функционального состояния системы гемоста-
за, характеризующееся активацией прокоагу-
лянтных и депрессией антикоагулянтных меха-
низмов. Активация механизмов свертывания
крови проявляется гиперфункцией тромбоци-
тов и гиперкоагуляционными изменениями
плазменного звена гемостаза. При этом отмеча-
ются усиление адгезии и агрегации тромбоци-
тов, как спонтанной в кровотоке, так и in vitro
с разными видами индукторов, повышение
плазменного уровня (J-тромбоглобулина ((ПТ),
подтверждающее внутрисосудистую активацию
пластинок. Гиперфункция тромбоцитов способ-
ствует усилению их взаимодействия с сосудис-
той стенкой, что считается важным механиз-
мом развития тромбозов, осложняющих НС.
Активация тромбоцитов при НС имеет много-
факторный патогенез и зависит от выраженно-
сти гипоальбуминемии, гиперлипидемии и ги-
перфибриногенемии [Rabelink Т. et al., 1994].
Гипоальбуминемия повышает доступность сво-
бодной арахидоновой кислоты, в норме связан-
ной с альбумином, приводя к усилению обра-
154
зования в тромбоцитах тромбоксана А2 — мощ-
ного проагрегантного фактора, который под-
держивает их агрегацию. Повышение уровня
липопротеидов низкой плотности (ЛНП) спо-
собствует усилению агрегации пластинок in vitro.
Кроме того, в процессе окисления ЛНП обра-
зуются токсичные для эндотелия сосудов про-
дукты, которые, повреждая его, приводят к
снижению образования эндотелиальными клет-
ками оксида азота (NO), подавляющего в нор-
ме адгезию тромбоцитов.
Гиперфибриногенемия является основой
гиперкоагуляционных изменений плазменного
звена гемостаза при НС. Кроме повышения
плазменного уровня фибриногена, у больных с
НС отмечается повышение уровней V, VII,
VIII, XIII факторов свертывания, фактора Вил-
лебранда. Гиперфибриногенемия сопровождает-
ся ускоренной трансформацией фибриногена в
фибрин, что в системной циркуляции создает
предпосылки к развитию тромбозов, а в почеч-
ной — приводит к усилению отложению фиб-
рина в клубочках, способствуя в конечном ито-
ге их склерозированию. Кроме того, гиперфиб-
риногенемия при НС повышает вязкость крови
и агрегацию эритроцитов, что также вносит свой
вклад в формирование смешанных тромбов. Уси-
ленное отложение фибрина может объясняться
не только высоким уровнем фибриногена, но и
ускоренным образованием тромбина, происхо-
дящим при повышении уровней V и VIII плаз-
менных факторов свертывания.
Активация плазменного и тромбоцитарного
звеньев гемостаза при НС сопровождается деп-
рессией противосвертывающих механизмов —
систем естественных антикоагулянтов и фибри-
нолиза [Тареев Е.М., Полянцева Л.Р. и др.,
1976; Полянцева Л.Р. и др., 1976; Panicucci А.
et al., 1983; Cameron J.St., 1998]. Недостаточно
эффективная ингибиция тромбина, повышаю-
щая риск развития тромбоэмболических ослож-
нений у больных с НС, связана главным обра-
зом с приобретенным дефицитом антитромбина
III (AT III), который развивается у ряда паци-
ентов из-за массивной протеинурии. Несмотря
на нормальный или повышенный уровень про-
теина С и его кофактора протеина S, ингиби-
рующих V и VIII факторы свертывания, сво-
бодный (активный) протеин S при НС может
быть снижен, что также приводит к недоста-
точной ингибиции каскада коагуляции и в ко-
нечном счете тромбина [Rabelink Т. et al., 1994].
Предрасположенность к развитию тромбозов
у больных с НС еще более усиливается депрес-
сией фибринолиза, обусловленной снижением
уровней его активаторов и повышением —
ингибиторов. Наиболее часто отмечается сниже-
ние уровня плазминогена, коррелирующее с
выраженностью протеинурии.
Активация прокоагулянтных и депрессия ан-
тикоагулянтных механизмов системы гемостаза
приводит к развитию тромбоэмболических ослож-
нений, характерных для пациентов с НС. Наи-
более часто наблюдаются тромбозы глубоких вен,
тромбоэмболии ветвей легочной артерии (ТЭЛА),
тромбозы почечных вен, хотя описаны также
тромбозы периферических и коронарных артерий.
Рецидивирующие тромбоэмболические осложне-
ния, преимущественно ТЭЛА, могут стать непос-
редственной причиной смерти больных с НС.
Частота развития тромбозов при НС составляет
10 % [Cameron J.St., 1988], однако есть основа-
ния предполагать, что эта цифра несколько за-
нижена, поскольку большинство тромботических
эпизодов протекает бессимптомно. Факторами
риска развития тромбозов являются гиподинамия
вследствие длительного постельного режима,
применение препаратов, повышающих тромбо-
генный потенциал крови, в первую очередь кор-
тикостероидов, дегидратация, к которой могут
привести интенсивная диуретическая терапия,
инвазивные методы исследования, аллергия.
Кроме тромбозов, серьезным осложнением
НС, связанным с патологией системы сверты-
вания крови, является ДВС-синдром, особен-
но часто развивающийся у больных СКВ. При
этом в большинстве случаев отмечается клини-
ческая симптоматика, свидетельствующая о
локальной почечной внутрисосудистой коагуля-
ции, — олигурия вплоть до анурии, нараста-
ние уровня креатинина сыворотки, увеличение
протеинурии и/или гематурии. Лабораторными
маркерами ДВС-синдрома являются тромбоци-
топения, снижение уровней фибриногена и АТ
III (коагулопатия потребления), повышение
концентрации растворимых комплексов фиб-
рин-мономеров и продуктов деградации фиб-
риногена в плазме крови. Эти явления обрати-
мы при своевременно начатой терапии свеже-
замороженной плазмой и гепарином.
Своеобразно изменена при НС система им-
мунитета: нередко НС относят к приобретенным
иммунодефицитам, прежде всего из-за сниже-
ния содержания в сыворотке крови гамма-гло-
булинов (в основном за счет IgG). Снижена
способность к выработке антител. Выраженные
гуморальные нарушения и изменения в систе-
ме иммунитета сказываются на метаболизме и
функциональном состоянии лейкоцитов крови.
Как показали цитохимические исследования,
при НС в лимфоцитах и в нейтрофильных лей-
коцитах снижается активность ряда ферментов,
что сочетается с ослаблением фагоцитоза.
По-видимому, также вторично по отноше-
нию к главным изменениям гуморальных сис-
тем крови развивается нарушение фагоцитар-
ной функции нейтрофилов и моноцитов (мак-
рофагов) в тканях (коже, почках).
7.2.5. Клинические особенности
нефротического синдрома
Основным клиническим симптомом нефроти-
ческого синдрома (НС) являются отеки. Они
могут развиться постепенно или же бурно, за
одну ночь достигнув степени анасарки. Внача-
ле заметные в области век, липа, поясничной
области и половых органов отеки при прогрес-
сировании распространяются на всю подкож-
ную клетчатку, растягивая кожу до образова-
ния striae distensae. У большинства больных об-
разуются транссудаты в серозные полости:
одно- или двусторонний гидроторакс, асцит,
редко гидроперикард. Из-за отека наружных
половых органов мочеиспускание становится
затрудненным и болезненным. Отек конъюнк-
тивы (хемоз) вызывает слезотечение.
Нефротические отеки рыхлые, легко пере-
мещаются и оставляют ямку при надавливании
пальцем. При больших отеках видны признаки
дистрофии кожи и ее придатков: сухость, ше-
лушение эпидермиса, ломкость и потускнение
волос и ногтей.
В период развития асцита состояние боль-
ного резко ухудшается: появляются поносы,
вздутие живота, тошнота, рвота после еды. При
нарастании гидроторакса и гидроперикарда по-
является одышка при физической нагрузке и
в покое.
По мере схождения отеков становится все
более заметна атрофия скелетной мускулатуры.
Развитие признаков НС может отягощать кли-
ническую картину предшествующего ему забо-
левания, но иногда заметна и другая законо-
мерность — ослабление прежних симптомов
болезни.
Клиническая картина НС обусловлена так-
же его продолжительностью, функциональны-
ми нарушениями почек, наличием или отсут-
ствием осложнений.
При НС описаны изменения в коже, слизи-
стых оболочках, скелетных мышцах, печени,
поджелудочной железе, надпочечниках, крови
и т.д. Значительная роль в их возникновении
принадлежит гемодинамическим расстрой-
ствам, нарушениям микроциркуляции. Измене-
ния мышцы сердца, по-видимому, в наиболь-
шей мере связаны с гипопротеинемией и мо-
гут быть квалифицированы как «нефротическая
(гипопротеинемическая) кардиопатия». Разви-
тие анемии может привести к тахикардии и
появлению систолического шума над верхуш-
кой сердца и в V точке. В гепатоцитах выявля-
ют жировую, гиалиново-вакуольную дистро-
фию, иногда некрозы. Функциональная актив-
ность поджелудочной железы при НС также
изменена.
155
В сыворотке крови больных с НС нами [Самсо-
нов М.С., Полянцева Л.Р. и др., 1976] выявлено
повышение активности липазы, амилазы, трипси-
на, у части больных — повышение содержания ин-
гибитора трипсина. Кроме того, повышенная актив-
ность амилазы и липазы обнаружена в дуоденальном
содержимом. Особенно высокой в этом субстрате
была активность ингибитора трипсина, в 47 раз
превышающая норму, а соотношение трипсин —
ингибитор трипсина снизилось в 65 раз.
Среди других эндокринных органов суще-
ственно нарушаются функции щитовидной
железы и надпочечников. Так, при НС сниже-
ны основной обмен и уровень белковосвязан-
ного йода. Период полураспада введенного ти-
роксина укорачивается вследствие его потери с
мочой. Однако клинических признаков недоста-
точности щитовидной железы не отмечается.
Гипофункция коры надпочечников при НС ус-
тановлена функциональными тестами и под-
тверждается гистологически.
В периферической крови наиболее постоян-
ный признак — увеличение СОЭ, достигающее
иногда 50—60 мм/ч, что, по современным
представлениям, зависит от соотношения кон-
центрации в крови альбумина, IgG, фибрино-
гена и первичных продуктов деградации этого
белка.
Умеренная гипохромная анемия в ранних
стадиях НС выражена лишь у части больных.
В ее патогенезе имеют значение такие факто-
ры, как потеря с мочой трансферрина, плохое
всасывание железа в желудочно-кишечном
тракте с вторичной гипосидерофилией, усилен-
ная экскреция эритропоэтина с мочой и др.
У некоторых больных может отмечаться тенден-
ция к эритроцитозу.
Число лейкоцитов и лейкограмма не имеют
характерных изменений. У некоторых больных
периодически появляется эозинофилия, соче-
тающаяся с клиническими или лабораторны-
ми признаками аллергии (нередко как ответ на
лекарственные препараты).
Моча больных до снижения функции почек
имеет очень высокую относительную плотность
(максимальная относительная плотность мочи
1030—1050). Реакция мочи чаще щелочная
вследствие электролитных сдвигов, ведущих к
алкалозу крови и усиленному выделению ам-
миака.
Лейкоцитурия, иногда значительная, часто
сочетается с выраженной протеинурией и не
всегда имеет связь с бактериальным воспале-
нием почек.
Гематурия может сопутствовать НС, особен-
но при таких заболеваниях, как геморрагичес-
кий васкулит, волчаночная нефропатия, гломе-
рулонефрит.
Функции почек при недавно развившемся
156
НС обычно нормальные, клубочковая фильтра-
ция (КФ) может быть даже повышена. В ста-
дии нормальной КФ информативными в отно-
шении субклинических канальцевых рас-
стройств могут быть такие показатели, как ос-
молярность сыворотки и мочи, клиренс осмо-
тически свободной воды. Содержание креатини-
на в сыворотке крови повышено лишь при
наличии ОПН или ХПН. в то же время содер-
жание азота мочевины часто увеличено, что
отражает изменения в межуточном белко-
вом обмене, состояние печени, катаболизм
белков.
Степень всех проявлений НС может варьи-
ровать: от стадии формирования НС, когда
выражена лишь нефротическая протеинурия, до
умеренной и очень тяжелой клинической кар-
тины этого состояния.
Формирование НС может быть вялым, за-
тяжным и бурным (при остром, подостром гло-
мерулонефрите).
По характеру течения можно выделить три
варианта НС:
• эпизодический, наблюдаемый в начале ос-
новного заболевания с исходом в ремиссию,
или рецидивирующий (встречающийся, по
нашим данным, у 20 % больных), когда ре-
цидивы НС чередуются со спонтанными или
лекарственными ремиссиями. Спонтанные
ремиссии редки, их частота, по данным ли-
тературы, колеблется от 8 до 18 % при раз-
ных нозологических формах НС, у детей —
до 26 %. Продолжительность достигнутой ре-
миссии иногда очень значительна — до 8—
10 лет и даже до 25 лет. Однако случаи выз-
доровления, подтвержденные повторной
биопсией почек, редки (чаще описаны у
детей). Эпизодический и рецидивирующий
варианты течения НС чаще отмечаются при
минимальных гистологических изменениях.
Функции почек при таком течении долго
сохраняются нормальными;
• персистирующий вариант (у 50,4 % боль-
ных), когда НС сохраняется упорно в тече-
ние 5—8 лет, несмотря на активную тера-
пию. Этот вариант течения отмечен при мем-
бранозном, мезангиокапиллярном и даже
фибропластическом типах хронического гло-
мерулонефрита. Через 8—10 лет от начала
развития НС у этих больных постепенно (без
признаков обострения) формируется ХПН;
• прогрессирующий (и быстропрогрессирую-
щий) вариант течения НС с переходом за
1—3 года в стадию ХПН встречается у 29,6 %
больных. Он наблюдается при экстракапил-
лярном гломерулонефрите, мезангиокапил-
лярном, фокально-сегментарном гломеру-
лярном гиалинозе. Как правило, этот вари-
ант течения НС развивается уже в начале
нефропатии или связан с терминальным
обострением почечного процесса.
7.2.6. Осложнения нефротического
синдрома
Осложнения нефротического синдрома зависят
от характера основного заболевания, особенно-
стей нефропатии и степени выраженности НС;
они более закономерны при тяжелых нефроти-
ческих формах брайтова и волчаночного нефри-
тов, менее часты при НС амилоидного генеза
или развившегося на фоне геморрагического
васкулита.
Наиболее серьезными являются следующие
осложнения:
• инфекции (бактериальная, вирусная, гриб-
ковая) ;
• гиповолемический нефротический криз
(шок);
• ОПН;
• отек мозга, сетчатки;
• сосудистые осложнения;
• аллергические проявления.
Частота инфекций, являвшихся в доантибак-
териальную эру основной причиной смерти
больных с НС, объясняется в первую очередь
снижением иммунитета, усугубляемым в совре-
менную эпоху иммунодепрессивной терапией.
Особенно часты пневмонии, плевриты (неред-
ко осумкованные), трансформирующиеся из ре-
цидивирующего гидроторакса, особенно при
повторных эвакуациях содержимого из полос-
ти плевры. В редких случаях у больных с при-
обретенным низким содержанием a j-антитрип-
сина (естественный ингибитор протеиназ, в том
числе лейкоцитарного происхождения) мы
наблюдали спонтанный пневмоторакс (или ге-
мопневмоторакс), развившийся на фоне бакте-
риальной пневмонии. Дальнейшей естествен-
ной эволюцией осумкованного плеврита и осо-
бенно пневмоторакса является эмпиема
плевры.
Развитию инфекции могут способствовать
нарушения целости кожных покровов (трещи-
ны отечной кожи, травма при подкожных инъ-
екциях с клинической картиной рожи).
В этих случаях рожистое воспаление обычно
вызывается 0-гемолитическим стрептококком,
стафилококком или другими грамотрицатель-
ными бактериями. Пораженный участок кожи
имеет яркую и стабильную демаркационную
границу с нормальной кожей. Общая и мест-
ная температура повышена. Участок кожи
(обычно на ноге) гиперемирован, отмечаются
резкая гиперестезия и плотная инфильтрация.
Рожистое воспаление требует лечения антиби-
отиками. Из отечной жидкости из пораженно-
го участка кожи высеваются вышеназванные
бактерии.
Рожистое воспаление требует дифференци-
ального диагноза с мигрирующими эритемами
при нефротическом кризе. Эти образования блед-
но-розового цвета без яркой демаркационной
границы со здоровой кожей располагаются обыч-
но на передней стенке грудной клетки и живо-
та, в ягодичной области, вдоль сосудистого пуч-
ка на бедре. В отличие от рожи пятно при не-
фротическом кризе может довольно быстро ме-
нять свое расположение (ползущая эритема).
Отечная жидкость из подкожной клетчатки в
области пятна всегда стерильна при посеве.
В образовании мигрирующих эритем, как мы
показали [Полянцева Л.Р., Пасхина Т.С. и др.,
1972], важную роль играет локальное образо-
вание свободных кининов.
В доантибиотическую эру часто наблюдалось
развитие пневмококкового перитонита с тяже-
лым прогнозом. В настоящее время первичный
бактериальный перитонит как осложнение НС
характерен для детского возраста. Основными
признаками асцита являются абдоминальные
боли и повышение температуры тела. При пря-
мом микроскопическом исследовании асцити-
ческой жидкости и иммунохимическом опреде-
лении бактериальных антигенов чаще всего вы-
являют пневмококки, Р-гемолитический стреп-
тококк, реже кишечную палочку [Cameron J.,
1998]. Гемокультура нередко положительна.
При затягивании лечения антибиотиками
могут быстро присоединиться коллапс, ОПН и
реже ДВС-синдром со смертельным исходом. В
наших наблюдениях (1000 случаев НС) пнев-
мококковый перитонит развился лишь у 2
взрослых больных (оба наблюдения до 1960 г.),
один из которых умер.
Бактериальный перитонит необходимо диф-
ференцировать от абдоминального нефротичес-
кого криза — одного из начальных проявлений
гиповолемического шока. Нефротический
криз — абактериальное осложнение НС — ха-
рактеризуется анорексией, рвотой и абдоми-
нальными болями при наличии анасарки и тя-
желой гипоальбуминемии. В понятие нефроти-
ческого криза входят также болезненные миг-
рирующие рожеподобные эритемы самой раз-
личной локализации (чаще в области живота,
нижних конечностей). Гиповолемия ведет к раз-
витию циркуляторной недостаточности: объем
циркулирующей плазмы падает до 1,5 л. Гипо-
волемический коллапс, усугубляемый массив-
ной диуретической терапией, иногда приобре-
тает необратимый фатальный характер, несмот-
ря на все современные методы лечения. Дока-
зано, что именно гиповолемия, а не надпочеч-
157
никовая недостаточность является главным па-
тофизиологическим звеном нефротического
криза.
Отечная жидкость в брюшной полости при не-
фротическом кризе имеет характер асептического
транссудата. В ней на высоте абдоминальных болей
мы выявили высокое содержание брадикинина (30—
60 нг/мл) (Полянцева Л.Р., 1985]. Помимо бради-
кинина, были обнаружены также нейтральная ки-
ниногеназа и ее предшественники, идентифициро-
ванные как плазменные калликреин и прекалликре-
ин, высоко- и преимущественно низкомолекулярный
кининогены при низкой кининазной активности и
очень низком уровне -антитрипсина и <х2-макро-
глобулина. Помимо этого, в абдоминальном транс-
судате были найдены значительные количества ли-
попротеидов очень низкой плотности. Несмотря на
различие в содержании общего белка между абдо-
минальным транссудатом и сывороткой крови (4,3
и 48 г/л соответственно), состав их белковых фрак-
ций был сходным.
На основании этих данных и результатов
аналогичных исследований отечной жидкости
различной локализации (отечная жидкость из
голени, плевральный транссудат, абдоминаль-
ный транссудат) у 25 больных с НС сделан
вывод о преимущественной роли кининовой
системы в поддержании рефрактерного нефро-
тического отека, в том числе полостного [По-
лянцева Л.Р., 1985]. Возможно, в ранних ста-
диях НС в повышении сосудистой проницаемо-
сти инициальная роль принадлежит клеточным
факторам (лейкоцитарным) и биологически
активным аминам (гистамин), но позже, ког-
да в ответ на массивную протеинурию синте-
зируются повышенные количества белков-пред-
шественников (прекалликреиноген) и кинино-
генов, создаются условия для активации кини-
новой системы, конечный продукт которой
(брадикинин) усиливает сосудистую проница-
емость и дает болевые эффекты.
Свободный брадикинин обнаружен также в
отечной жидкости из зоны, близкой к роже-
подобной эритеме (при отсутствии брадикинина
в интерстициальной жидкости из подкожной
клетчатки в области голени у больных без эри-
темы). Этот факт, а также положительное вли-
яние антикининовых препаратов позволяют
предположить, что главную роль в механизме
возникновения рожеподобных эритем имеет эк-
стравазальное образование свободных кининов.
Однако во всех случаях рожеподобных эритем
следует проводить дифференциальный диагноз
с настоящей рожей, всегда протекающей у
больных с НС тяжело, нередко с затяжным те-
чением. Нефротический криз следует дифферен-
цировать от криза локальной или диссемини-
рованной внутрисосудистой коагуляции, тече-
ние которой может ухудшиться под влиянием
158
упорной кортикостероидной терапии; при этом
возникают боли в животе, поясничной облас-
ти, резкое снижение артериального давления
(до 80/50 мм рт. ст.), тахикардия, геморраги-
ческая сыпь на коже конечностей.
Острая почечная недостаточность (ОПН) у
нефротических больных — важное, хотя и ред-
кое осложнение НС. Развивается вследствие
тромбоза почечных вен, острого криза локаль-
ной (почечной) гиперкоагуляции, гиповолеми-
ческого шока, при сепсисе, на фоне терапии
диуретиками и НСПП, больших количеств рент-
геноконтрастных веществ. ОПН чаще встреча-
ется в старших возрастных группах (средний
возраст 60 лет), при гистологии минимальных
изменений в биоптате почки, на фоне гипово-
лемических расстройств, более свойственных
этому возрасту. У детей более частой причиной
ОПН являются сепсис и тромбозы.
У большинства больных отмечается очень
низкий уровень альбумина в сыворотке — ме-
нее 10 г/л. Однако роль гиповолемии неясна.
Обсуждается роль снижения КФ и почечного
кровотока на фоне отека вещества почки с
повышением интерстициального давления и
изменением стенки сосудов.
Клинически ОПН проявляется олигурией,
повышением уровня креатинина, снижением
КФ, гиперкалиемией. Иногда требует примене-
ния искусственной почки, в некоторых случа-
ях поддается гепаринотерапии.
Отек мозга при НС встречается очень редко
на высоте развития массивных отеков, но мо-
жет быть следствием и тяжелого гипертоничес-
кого криза. Проявляется вялостью, заторможен-
ностью пациента, которая может перерасти в
мозговую кому. Прогноз серьезный. Требует
немедленных реанимационных мероприятий.
Отек сетчатки глаз встречается у отечных
больных нередко. Обратим по мере уменьшения
общих отеков и повышения в крови альбумина.
К серьезным осложнениям НС относятся
сосудистые-, периферические флеботромбозы,
тромбоэмболия легочной артерии, тромбозы
артерий почки с развитием инфарктов ее па-
ренхимы (иногда множественных), инсульты,
ишемическая болезнь сердца, инфаркты мио-
карда. Существует мнение об особом предрас-
положении больных с НС к развитию ишеми-
ческой болезни сердца и инфаркту миокарда,
выраженной гиперлипопротеидемии. Даже у
детей с НС обнаруживаются анатомические
доказательства развития атеросклероза: атеро-
матоз аорты и скопления нейтральных липидов
под эндотелием аорты, соответствующие ате-
росклеротическим бляшкам.
Инсульты у больных с НС могут развивать-
ся при вторичном фибринолизе, васкулитах
головного мозга и при присоединении злока-
чественной гипертонии в терминальной стадии
заболевания. Инфаркты почек мы обнаружива-
ли (чаще на вскрытии) у очень пожилых лиц
с признаками атеросклероза брюшной части
аорты и почечных артерий. Все сосудистые ос-
ложнения НС опасны, так как возможен смер-
тельный исход.
Аллергические осложнения проявляются непе-
реносимостью лекарственных средств, некото-
рых пищевых продуктов (ананасы, апельсины,
молоко, шоколад и др.). Кожные поражения
бывают в виде экземоподобных дерматитов,
псориаза, плоского красного лишая, рожи и др.
Диагностика НС трудностей не вызывает
(хотя в редких случаях у больных с гипоальбу-
минемией, асцитом и небольшой протеинури-
ей приходится исключать возможную связь оте-
ков с поражением печени). Дифференциальный
диагноз следует проводить для уточнения эти-
ологии заболевания; в первую очередь необхо-
димо исключить амилоидоз почек (биопсия
почки, десны, слизистой оболочки прямой
кишки), паранеопластический НС. При подо-
зрении на множественную миелому следует
помнить, что истинный НС (с гипоальбумине-
мией и отеками) при этом заболевании наблю-
дается редко, несмотря на выраженность про-
теинурии (протеинурия переполнения). При
сочетании НС с лихорадкой, анемией, лейко-
пенией следует исключить СКВ (особенно у
молодых женщин), системные васкулиты, под-
острый инфекционный эндокардит. Установле-
ние связи НС с аллергией (в том числе лекар-
ственной) важно для назначения элиминаци-
онного лечения.
7.2.7. Прогноз при нефротическом
синдроме
Прогноз при НС зависит от многих факторов:
• возраста больных (он лучше у молодых);
• характера основного заболевания;
• клинических особенностей нефропатии (про-
гноз ухудшается при сочетании НС с гипер-
тонией, выраженной гематурией; при ами-
лоидозе прогноз в целом хуже, чем при гло-
мерулонефрите, при СКВ —лучше);
• длительности болезни и НС;
• морфологических особенностей ГН;
• адекватности применяемых лекарственных
препаратов и т.д.
Причины смертельных исходов у больных с
НС:
а активность нефропатии;
а гиповолемический шок;
а инфекционные осложнения (пневмонии,
эмпиема плевры, сепсис из подключичного
шунта, апостематозный нефрит, наслоение
на гломерулонефрит острого пиелонефрита
и др.);
а почечная недостаточность;
а тромбозы, тромбоэмболии, инфаркты мио-
карда;
а ятрогенные причины: агранулоцитоз, крово-
течения из желудочно-кишечного тракта,
прогрессирующий сывороточный гепатит.
7.2.8. Общие принципы лечения
больных нефротическим синдромом
Ввиду потенциальной обратимости НС важное
значение имеют ранняя госпитализация и уточ-
нение нозологической формы, а также харак-
тера нефропатии, обусловившей синдром боль-
шой протеинурии. Для выбора метода лечения
необходимо также определить функции почек.
Режим больного с НС должен быть дозиро-
ванно двигательным (так как гипокинезия спо-
собствует развитию тромбозов), включать ЛФК,
гигиену тела, санацию очагов инфекции (в зу-
бах, деснах и др.), профилактику запоров.
Диета при нормальной функции почек на-
значается бессолевая, богатая калием, с физи-
ологической квотой животного белка (1 г на
1 кг массы тела) или с умеренным его огра-
ничением (0,8 г/кг). Большие белковые нагруз-
ки приводят к усугублению протеинурии и ги-
поальбуминемии и к угнетению фибринолити-
ческой системы крови. Внутривенное введение
различных белковых растворов не может умень-
шить гипопротеинемию и нередко лишь усили-
вает протеинурию. Имеются данные, указыва-
ющие на снижение протеинурии при значи-
тельном уменьшении приема белка с пищей.
G.Kaysen и соавт. (1986) изучали влияние дие-
ты с высоким (1,6 г/кг) и низким (0,8 г/кг)
содержанием белка (при одинаковой калорий-
ности) на обмен альбумина; при высокобелко-
вой диете синтез альбумина был выше, одна-
ко выше была и почечная экскреция альбуми-
на, что в целом приводило к более низкой
концентрации альбумина в сыворотке крови.
Несмотря на подобные исследования, мы пока
не убедились в целесообразности значительно-
го ограничения белка при НС и согласны с
точкой зрения J.St.Cameron (1998), что умень-
шение белковой квоты до 0,6 г/кг в день на
длительный срок не может быть полезной те-
рапевтической мерой.
Обязательно значительное ограничение
соли — до 3 г/сут. При выраженных отечных со-
стояниях способность почек выделять натрий
очень ограничена; некоторые больные выделя-
ют с мочой лишь 25 ммоль/сут. У таких боль-
159
ных прием натрия с пищей должен быть резко
ограничен, настолько, чтобы не превышать
максимального выведения (напомним, что 1 г
натрия соответствует 23 ммоль, в чайной лож-
ке содержится 5 г соли). Следует максимально
исключить пищевые продукты, содержащие
соль, иногда заменить обычную воду для пи-
тья дистиллированной. Ограничение натрия осо-
бенно важно при быстром нарастании отеков.
При длительном нефротическом синдроме,
когда протеинурия и отеки остаются месяцами,
употребление натрия можно расширить, осо-
бенно при применении мощных диуретиков.
Правильнее всего было бы давать столько на-
трия, сколько больной может легко выделить,
но на практике это трудно осуществить.
Если развивается почечная недостаточность
и отеки уменьшаются, важно рекомендовать
больному увеличить прием соли (в противном
случае может развиться дефицит соли, который
может утяжелить почечную недостаточность).
Для улучшения вкусовых качеств пищи ис-
пользуются свежие овощи, зелень, лук, томаты.
Целесообразно включить в диету овес (богатый
фосфолипидами) в виде киселя, каши, отвара.
При приеме кортикостероидов должны быть
ограничены сахар и содержащие его продукты.
Объем жидкости в целом за сутки не должен
превышать диуреза более чем на 200—300 мл.
Следует ограничивать животные жиры. Реко-
мендуется использовать растительное масло,
морские продукты (креветки или пасту криля,
морскую капусту и другие продукты, повыша-
ющие фибринолитическую активность крови),
чеснок.
Лекарственное лечение больных с
НС должно быть направлено на: 1) уменьше-
ние отеков; 2) патогенетическое лечение основ-
ного заболевания; 3) устранение осложнений.
Учитывая гипоальбуминемию, ведущую к сни-
жению связывания лекарств альбумином, дозы
лекарственных препаратов при НС должны быть
полуторные или двойные, распределенные для
приема в течение суток дробно. На высоте отеч-
ного синдрома при нефротических поносах их
лучше вводить внутривенно.
Задержку воды и соли в организме можно
уменьшить, назначив соответствующую патоге-
нетическую терапию заболевания, повышая
сниженный ОЦК, снижая потребление соли, а
главное вводя препараты, способствующие
выведению натрия и воды.
Следует подчеркнуть, что не всегда надо
принимать решительные меры для ликвидации
отеков. При умеренных отеках, не причиняю-
щих больному неудобств, не требуется специ-
альной терапии. Иногда достаточно ограничить
прием соли с пищей до 3—4 г (42—68 ммоль
натрия) в день, возможно назначить мочегон-
160
ные травы (толокнянка, можжевельник, пет-
рушка, брусника). У некоторых больных могут
быть полезны эластичные чулки (местно умень-
шающие фильтрацию жидкости из капилляров).
К повышению диуреза может привести постель-
ный режим, особенно с приподнятым ножным
концом постели.
При неэффективности этих мер следует на-
значать диуретики. Мы лишь коротко остановим-
ся на применении диуретиков при НС, подроб-
но эти вопросы освещены в разделе 9.7.
Если СКФ не снижена или снижена незна-
чительно, можно начать с тиазидовых диуре-
тиков. При их неэффективности или при выра-
женных отеках рекомендуются петлевые диуре-
тики (фуросемид) в постепенно повышающих-
ся дозах — от 40 до 600 мг/сут.
Фуросемид активно реабсорбирует хлор,
действует в основном в области восходящей
части петли Генле, но также в проксимальных
канальцах (в больших дозах). Он обладает быс-
трым, кратковременным и выраженным дей-
ствием, с мочой выделяется 20—30 % профиль-
тровавшегося натрия. Даже при пероральном
применении препарат всасывается быстро и
полностью. Эффект начинается ранее чем че-
рез 1 ч после приема, через 15—20 мин дости-
гает максимума и продолжается в течение 4 ч.
При внутривенном введении действие начина-
ется через несколько минут и кончается через
2 ч. При пероральном приеме фуросемид назна-
чают в начальной дозе 20—40 мг, максималь-
ной — 400—600 мг; при внутривенном введе-
нии доза колеблется от 20 до 1200 мг. В отли-
чие от тиазидов фуросемид несколько повышает
КФ, поэтому он является средством выбора при
почечной недостаточности.
Высокие дозы фуросемида могут быть необ-
ходимы при большой протеинурии и из-за свя-
зывания до 70 % фуросемида внутри просвета
канальца с профильтровавшимся белком [Hanis
R.C., Ismail N., 1994], что препятствует реаб-
сорбции натрия на люминальной стороне вос-
ходящей петли Генле. Рекомендуются дробные
высокие дозы, лучше перорально, или длитель-
ное медленное внутривенное введение (эффек-
тивность зависит от площади под кривой кон-
центрация — время, а не от пика концентра-
ции). У очень отечных больных с резко снижен-
ной экскрецией натрия фуросемид можно со-
четать с другими диуретиками, например ме-
толазоном, и даже с тиазидами. Действие на-
трийуретиков может усилить эуфиллин при его
медленном внутривенном введении на высоте
пика диуреза (через 30 мин после приема фу-
росемида или этакриновой кислоты).
Имеются экспериментальные данные, сви-
детельствующие о том, что восстановлению
действия фуросемида может способствовать
одновременный прием варфарина (непрямой
антикоагулянт), который конкурирует с фуро-
семидом за связывающие места на молекулах
альбумина [Kirschner К. et al., 1991].
Для профилактики гипокалиемии рекомен-
дуется прием препаратов калия. С этой же це-
лью, а также для потенцирования действия
фуросемида назначают спиролактоны (верош-
пирон в дозе 100—600 мг/сут). Диуретическое
действие верошпирона начинается через не-
сколько дней.
При массивных рефрактерных отеках может
быть применен бессолевой альбумин, который
вводят внутривенно в дозе 100 мл 20 % раствора
в сочетании с фуросемидом — 200—240 мг
внутривенно (после введения альбумина) или
250—500 мг перорально. Несмотря на то что
альбумин быстро проходит в мочу, он служит
носителем для повышенной доставки фуросе-
мида к месту его канальцевого действия. По-
вторное применение таких вливаний (лучше
через день) может привести к выведению 10—
15 л отечной жидкости. Важно помнить, что в
отдельности и альбумин, и высокие дозы фу-
росемида могут привести к тяжелым осложне-
ниям: альбумин может вызвать тяжелый отек
легких (в случае, если ОЦК не снижен, —
диурез не развивается), а фуросемид при выра-
женной гипоальбуминемии может вызвать тяже-
лую гиповолемию и гипотензию. Ориентировоч-
но о величине ОЦК можно судить по критери-
ям, предложенным R.Schrier и R.Fassett (см.
выше). Эффективно также введение фуросеми-
да вместе с низкомолекулярными декстранами
(реополиглюкин, реоглюман по 200—400 мл).
Возможно проведение ультрафильтрации
(с оценкой риска последующего падения КФ).
При выраженной почечной недостаточнос-
ти и значительно сниженной протеинемии лик-
видация отеков (массивным назначением диу-
ретиков, ультрафильтрацией) может привести
к резкому падению объема крови и снижению
клубочковой фильтрации, иногда необратимо-
му. даже к гиповолемическому, шоку, крайне
тяжелому прогностически. Так, в течение одно-
го года мы наблюдали 2 больных нефротичес-
ким нефритом с крайней степенью гипоальбу-
минемии, умерших при явлениях не поддаю-
щегося никакой коррекции гиповолемическо-
го коллапса; очевидно, именно в этой ситуа-
ции отеки обладают своего рода противодей-
ствием гиповолемическому коллапсу, что
объясняет нецелесообразность форсированного
диуреза.
При рефрактерности отеков, причиняющих
больному боль и очень неприятные ощущения,
можно рекомендовать такие старые меры, как
прием слабительных (30 г сульфата магния,
сорбит).
При рефрактерных массивных отеках диуре-
тический эффект дает погружение больного до
уровня шеи на 2—4 ч в сидячую ванну или
бассейн с температурой воды до 34 °C, что ре-
комендовали и старые авторы. Во время погру-
жения развивается диурез с усиленной экскре-
цией кальция, бикарбонатов, магния и натрия
[Brown С. et al., 1983]. Подводное погружение
стимулирует выброс натрийуретического пред-
сердного фактора с последующим его влияни-
ем на почки [Miki К. et al., 1986].
Снижение протеинурии. Снижение протеину-
рии при НС (а следовательно, уменьшение
клинических признаков НС и замедление про-
грессирования нефропатии) является основной
целью патогенетической терапии, к которой от-
носятся в первую очередь глюкокортикостеро-
иды, цитостатики и циклоспорин (см. раздел
9.6). К сожалению, иммуносупрессивная тера-
пия эффективна лишь у части больных с НС;
при ее неэффективности показано назначение
других препаратов, обладающих антипротеину-
рическим действием (более подробно вопрос
освещен в разделе 9.6).
Это в первую очередь ингибиторы АПФ, ко-
торые уменьшают протеинурию, снижая внут-
риклубочковую гипертензию, а также уменьшая
проницаемость клубочкового фильтра для мак-
ромолекул. Снижение протеинурии отмечается
часто уже в первый месяц лечения, иногда
позже, продолжается и в последующие меся-
цы. Более эффективны иАПФ длительного дей-
ствия (эналаприл, лизиноприл, рамиприл).
В наших наблюдениях протеинурия снизилась у
43 из 57 больных, леченных иАПФ; к концу пер-
вого месяца лечения протеинурия снизилась с
5,6 до 4,2 г/сут, к 3-му месяцу — до 3,9 г/сут и
к 6-му — до 3,8 г/сут.
Антипротеинурический эффект иАПФ про-
является при ограничении приема натрия, уси-
ливается при резком его ограничении. В наших
наблюдениях всем больным было рекомендова-
но строгое ограничение потребления с пищей
соли (до 5—7 г в сутки). Большинство больных
соблюдали это ограничение. Ни у кого из 5
больных, у которых суточное потребление на-
трия, определенное по экскреции электролита
с мочой, превышало 8,5 г в сутки, протеину-
рия не снизилась [Тареева И.Е. и др., 1995]. Если
больные плохо соблюдают низкосолевую диету,
ее можно заменить приемом мочегонных. Так,
в наблюдениях H.Buter и соавт. (1998) протеи-
нурия у 7 больных с НС после лечения иАПФ
на фоне низконатриевой диеты (50 ммоль/сут)
снизилась с 7,3 до 3,1 г/сут; при повышении
приема натрия до 200 ммоль/сут протеинурия
повысилась до 4,5 г/сут; добавление гидрохлор-
тиазида снова снизило протеинурию до 2,8 г/сут.
Имеются данные, что степень антипротеинури-
11—2950
161
ческого действия иАПФ может быть связана с
полиморфизмом гена АПФ [Moriyama К. et al.,
1995]. В наших наблюдениях среди 28 больных
ХГН, леченных иАПФ, у которых был опре-
делен генотип АПФ, в группах с генотипом II
(6 человек) и генотипом ID (15 человек) про-
теинурия снизилась через 1—3 мес, в то время
как в группе с генотипом DD (7 человек) про-
теинурия в эти сроки осталась на прежнем
уровне [Кутырина И.М. и др., 1999].
При назначении иАПФ следует иметь в виду
возможность падения СКФ и повышения уров-
ня в сыворотке креатинина и калия.
Четким антипротеинурическим действием
обладают НСПП, особенно индометацин; сни-
жение протеинурии при приеме индометацина
начинается через несколько дней и быстро пре-
кращается после отмены препарата. У больных
с гиповолемией индометацин может снижать
СКФ, иногда приводя даже к развитию ОПН,
в связи с чем в настоящее время применяется
редко. Сочетание НСПП и иАПФ может при-
вести к тяжелой гиперкалиемии.
Умеренным антипротеинурическим действи-
ем обладают также дипиридамол и гепарин.
У некоторых больных (чаще это касается
больных с ФСГС), несмотря на применяемые
меры, протеинурия остается массивной, пер-
систируют анасарка и тяжелейшая гиповоле-
мия, повышается уровень креатинина, разви-
вается выраженное белковое голодание. В этих
случаях некоторые авторы рекомендуют не-
фрэктомию — хирургическую или «терапевти-
ческую» [Bienz N. et al., 1994; Rieu P., 1994;
Cameron J.St., 1998] с последующим диализом
или трансплантацией почек. В качестве «терапев-
тических» мер, которые выключают деятель-
ность почек, предлагаются высокие дозы
НСПП, циклоспорин в сочетании с ангиотен-
зином, введение полимеров или жира в почеч-
ную артерию.
Лечение липидных нарушений включает
диетические меры, прекращение курения и
избыточного приема алкоголя, а также приме-
нение ингибиторов ГМГ-КоА-редуктазы (лова-
статин и др.) и пробукола (подробнее см. раз-
дел 9.6).
Литература
Клепиков П.В., Кутырина И.М., Тареева И.Е. и др.
Объем циркулирующей крови и активность ренина
плазмы при нефротическом синдроме//Тер.арх. —
1984. - № 7. - С. 41—44.
Кутырина И.М., Клепиков II.В., Тареева И.Е. О роли
ренин-ангиотензиновой системы в патогенезе не-
фротического синдрома//Тер. арх. — 1988. - № 6. -
С. 32-34.
162
Кутырина И.М., Тареева И.Е., Носиков В.В. и др.
Изучение полиморфизма гена ангиотензинпревраща-
кнцего фермента при хроническом ГН//Тер. арх. —
1999. - № 6.
Неверов Н.И. Роль липидов в прогрессировании не-
фропатий: Автореф. дис. ... д-ра мед. наук. — М., 1994.
Полянцева Л.Р. Клиника и дифференциальный диаг-
ноз нефротического криза//Тер. арх. — 1985. — № 6. —
С. 46-49.
Тареев Е.М. Анемия брайтиков. — М.: Медицина,
1929. - 121 с.
Тареев Е.М. Нефриты. — М.: Медицина, 1985. — 666 с.
Тареева И.Е., Кутырина И.М., Неверов Н.И. Пути
торможения неиммунного прогрессирования нефри-
тов//Клин. мед. — 1995. — № 3. — С. 80—83.
Abrass Ch. Glomerulonephritis in the elderly//Amer. J.
Nephrol. - 1985. - N 5. - P. 409-418.
Attman P. O., Samuelsson M., Alaupovic P. Progression of
renal failure, role of apolipoprotein B-containing
lipoproteins//Kidney Int.— 1997,— Vol.63 (Suppl.63). —
P. 98-101.
Bienz N, Franklin I.M., Adu D. et al. Bilateral
nephrectomy for incontrollable nephrotic syndrome//Clin.
Lab. Haematology. — 1994. — Vol. 16. — P. 85—86.
Buter H, Hemmelder M.H., Navis G. et al. The blunting
of the anti proteinuric efficacy of ACE inhibition by high
sodium intake can be restored by hydrochlorothiazide//
Nephr. Dial. Transpl. — 1998. — Vol. 13. — P. 1682—1685.
Cameron J.St. The nephrotic syndrome: management,
complications, pathophysiology//Oxford textbook of clinical
nephrology. — Ed. 2. — 1998. — Vol. 1. — P. 461—492.
Kaysen G.A. Hyperlipidemiaof the nephrotic syndrome//
Kidney Int. — 1991. — Vol. 39 (Suppl. 31). — P. 8—15.
Lagrue G., Heslan I, Belghiti D. et al. Basophile sensitisation
for food allergens in idiopathic nephrotic syndrome/'/
Nephron. - 1986. - Vol. 42, N 2. - P. 123-127.
Kawanna V.S., Roh D.D., Kirschenbaum M.A. Hyperlipi-
demia and kidney disease: concepts derived from
histopathology and cell biology of the glomerulus//
Histology and Histopathology. — 1998. — Vol. 13. —
P. 169-179.
Miki K., Hajduczek G., Klocke et al. Atrial natriuretic
factor and renal function during water immersion in
conscious dogs//Amer. J. Physiol. — 1986. — Vol. 251,
N 5. - P. 1000-1004.
Moriyama T, Kitamura H, Ochi S. et al. Association of
the ACE gene polymorphism with susceptibility to
anti proteinuric effect of ACE inhibitors in patients with
proteinuria//!. Amer. Soc. Nephrol. — 1995. — Vol. 6. —
P. 1674-1678.
Okada К., Kawakami К, Miyao T, Oite T. Ultrastruc-
tural alterations of glomerular anionic sites in idiopathic
membranous glomerulonephritis//Clin. Nephrol. —
1986. - Vol. 26. - P. 7-14.
Ordonez J.D., Hiatt R.A., Killebrew E.J., Foreman B.H.
The increased risk of coronary heart disease associated
with nephrotic syndrome//Kidney Int. — 1993. —
Vol.44. - P. 638-642.
Rieu P. et al. Medical nephrectomy with CsA and
angiotensin 2 in a case of life-threating membraneous
glomerulonephritis//Nephr. Dial. Transpl. — 1994. — Vol.
9. - P. 82-84.
Schrier R.W., Fassett R.G. A critique of the overfill
hypothesis of sodium and water retention in the
nephrotic syndrome//Kidney Int. — 1998. — Vol. 53. —
P. 1111-1147.
Smith J.D., Hayslett J.P. Reversible renal falure in the
nephrotic syndrome//Amer. J. Kidney Dis. — 1992. — Vol.
19. - P. 201-213.
Tomizawa S., Maruyama K, Nagasawa N. et al. Studies
of vascular permeability factor derived from T
lymphocytes in nephrotic syndrome// Nephron. —
1985. - Vol. 41, N 2. - P. 157-160.
Wheeler D.C., Bernard D.B. Lipid abnormalities in the
nephrotic syndrome: causes, consequences and
treatment//Amer. J. Kidney Dis. — 1994. — Vol. 23. —
P. 331-346.
11
Гпава 8
ПОЧКИ И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
И.М.Кутырина, А.А.Михайлов
Более 150 лет внимание исследователей при-
влекает к себе проблема «Почки и артериаль-
ная гипертензия». Первым исследователем, от-
метившим связь между нарушением функции
почек и развитием артериальной гипертензии
(АГ), был R.Bright (1831). Анализируя резуль-
таты патологоанатомического исследования 100
умерших с «альбуминурией», он высказал пред-
положение о наличии связи между гипертро-
фией миокарда у этих больных с болезнью
почек. Позже, в 1914 г. F.Volhard указал на роль
первичного поражения сосудов почек в разви-
тии АГ и нефросклероза. В 1940 г. в моногра-
фии «Артериальное давление и почки» F.Vol-
hard представил связь между почками и АГ в
виде порочного крута, в котором почки были
одновременно и причиной АГ, и органом-ми-
шенью. В 1948—1949 гг. Е.М.Тареев в моногра-
фии «Гипертоническая болезнь» и в статьях
подробно освещает роль почек в развитии и
становлении артериальной болезни, выделяет в
качестве самостоятельной нозологической фор-
мы злокачественную артериальную гипертонию
(см. далее) и подтверждает тесную этиологичес-
кую взаимосвязь АГ и патологии почек. Этот
постулат сохраняется и до настоящего време-
ни, пополняясь все новыми данными об этио-
логической роли почек в развитии АГ любого
генеза. Так, классические опыты на собаках
Н.Goldblatt в середине 1950-х годов показали,
что АГ развивается в ответ на нарушение по-
чечного кровоснабжения, которое вызывалось
наложением зажима на почечные артерии. Од-
новременно было высказано предположение,
что причиной повышения АД является секре-
ция ишемизированными почками прессорного
констрикторного вещества, которое впослед-
ствии было идентифицировано как ренин. Ис-
следования последующих лет (I.Page, Е.Braun-
Menendez, J.Lee, E.Muirhead) показали, что
наряду с синтезом мощных вазоконстрикторов
почка вырабатывает и ряд веществ, способных
расслаблять сосуды и снижать АД, т.е. по сути
в эти годы была заложена основа знаний о
почечной эндокринной системе, способной
регулировать АД.
Большой вклад в исследование АГ был при-
внесен A.C.Guyton с соавт. (1970—1980). В боль-
шой серии экспериментов авторы доказали роль
первично-почечной ретенции натрия в генезе
эссенциальной АГ и постулировали, что при-
чиной любой АГ является неспособность почек
при нормальных значениях АД обеспечивать
натриевый гомеостаз, т.е. в необходимом коли-
честве выводить NaCl. Поддержание гомеостаза
Na достигается «переключением» почки на ре-
жим работы в условиях более высоких значе-
ний АД, уровень которого затем закрепляется.
В дальнейшем в эксперименте и в клинике
были получены прямые доказательства первич-
ной роли почек в генезе АД. Они основывались
на опыте трансплантации почек. И в эксперимен-
те, и в клинике трансплантация почки от доно-
ра с АГ вызывала развитие АГ у реципиента, в
то время как при трансплантации «нормотензив-
ных» почек ранее высокое АД нормализовалось
[Curtis J. et al., 1983; Retting R. et al., 1990].
Значительной вехой в исследовании пробле-
мы «Почки и артериальная гипертензия» яви-
лись работы В.Brenner с соавт., появившиеся
в середине 1980-х годов. Сохраняя в качестве ос-
новного тезис о первично-почечной ретенции
натрия в генезе АГ, причину этого нарушения
авторы связывают со снижением числа почеч-
ных клубочков, соответствующим снижением
фильтрующей поверхности почечных капилля-
ров, приводящим в итоге к снижению почка-
ми экскреции натрия (гипотрофия почки при
рождении, первично-почечная патология, со-
стояние после нефрэктомии, в том числе и у
доноров почки) [Brenner В., Mackenzie Н.,
1997]. Одновременно авторами рассматривает-
164
ся механизм повреждения почек при АГ как
органа-мишени: АГ поражает почки (первично-
сморщенная почка как исход АГ либо ускоря-
ет темп развития почечной недостаточности) за
счет повышения давления внутри почечных
капилляров (внутриклубочковой гипертензии)
и развития гиперфильтрации. Последние два
фактора в настоящее время рассматриваются
как ведущие факторы неиммунного гемодина-
мического прогрессирования почечной недоста-
точности.
Таким образом, на новом уровне было под-
тверждено, что связь между состоянием почек
и АГ сложна и образует порочный круг, в ко-
тором почки являются одновременно и причи-
ной АГ, и органом-мишенью.
Классификация артериальных гипертензий.
Классификацию артериальных гипертензий
(АГ) на современном этапе проводят по трем
ведущим признакам:
• по уровню артериального давления;
• по этиологии;
• по степени поражения органов-мишеней.
В последние годы наметилась тенденция к
«ужесточению» критериев диагностики АГ, и в
настоящее время под артериальной гипертен-
зией понимают состояние, при котором уро-
вень АД превышает 140/90 мм рт. ст. или пре-
вышал таковой по крайней мере 3 раза при
измерении АД в течение 3—6 мес.
В табл. 8.1. приведена современная классифи-
кация артериальной гипертензии, представлен-
ная экспертами Национального объединенно-
го комитета по выявлению, оценке и лечению
повышенного АД (США, 1993). В качестве оп-
тимального АД рассматривается уровень АД
ниже или равный 120/80 мм рт. ст. АД считает-
ся нормальным, если диастолическое давление
при двукратном измерении не превышает 90 мм
рт. ст., а систолическое — 140 мм рт. ст.
В артериальной гипертензии выделяют 4 ста-
дии, каждая из которых отличается от после-
Таблица 8.1. Классификация артериальной ги-
пертензии у людей в возрасте 18 лет и старше
Категория Систоли- ческое АД, мм рт. ст. Диастоли- ческое АД, мм рт. ст.
Оптимальное <120 <80
Нормальное 120—129 80—84
Повышенное нормальное 130—139 85—89
Артериальная гипертензия:
1-я стадия 140—159 90—99
2-я » 160—179 100—109
3-я » 180—209 110—119
4-я » >210 >120
дующей по систолическому АД на 20 мм рт. ст.,
а по диастолическому — на 10 мм рт.ст.
Более чем у 95 % больных с АГ не удается
выявить ее этиологию. Такую АГ характеризу-
ют как первичную, или эссенциальную. Осталь-
ные виды составляют группу АГ с известной
этиологией или вторичных АГ. Среди причин-
ных факторов ее развития выделяют лекарствен-
ные вещества, заболевания почек, эндокрин-
ные заболевания, заболевания аорты, беремен-
ность, неврологические заболевания и хирур-
гические осложнения (ВОЗ, 1996).
Поражение органов-мишеней. В классифика-
ции АГ, основанной на выраженности орган-
ных поражений, используется термин «стадии
болезни», отражающий прогрессирование бо-
лезни во времени (ВОЗ, 1996). В 1 стадии пора-
жение органов-мишеней отсутствует. Во II ста-
дии среди органных поражений преобладают
сердечно-сосудистые; почечные поражения
проявляются микроальбуминурией и/или незна-
чительным повышением уровня креатинина
крови. В III стадии наряду с тяжелыми пораже-
ниями сердечно-сосудистой системы, мозга
могут выявляться и все признаки почечной не-
достаточности — креатининемия более 2 мг %.
При нефрогенной АГ почки рано становят-
ся ведущим органом-мишенью. При исходном
поражении почек высокое АД неуклонно спо-
собствует развитию и усилению почечной не-
достаточности, действуя через нарушение внут-
рипочечной гемодинамики — развитие внутри-
почечной гипертензии и гиперфильтрации,
которые неуклонно приводят к прогрессирова-
нию почечной недостаточности.
8.1. Почечная гипертензия
Под почечной гипертензией (ПГ) обычно по-
нимают артериальную гипертензию, патогене-
тически связанную с заболеваниями почек. Это
самая большая группа среди вторичных гипер-
тензий. Ниже приведен перечень почечных за-
болеваний, при которых гипертонический син-
дром выявляется с наибольшей частотой (ВОЗ,
1996).
Заболевания почек, сопровождающиеся разви-
тием артериальной гипертензии:
• почечные паренхиматозные заболевания;
• острые гломерулонефриты;
• хронические нефриты;
• хронические пиелонефриты;
• обструктивные нефропатии;
• поликистоз почек;
• заболевания соединительной ткани почек;
• диабетическая нефропатия;
• гидронефроз;
165
• врожденные гипоплазии почек;
• травмы почек;
• реноваскулярная гипертензия;
• ренинсекретирующие опухоли;
• ренопривные гипертензии;
• первичная задержка соли (синдром Лиддла,
синдром Гордона).
8.1.1. Артериальная гипертензия при
почечных паренхиматозных
заболеваниях
Частота выявления АГ при заболеваниях почек
зависит от нозологической формы почечной
патологии и состояния почечных функций.
Практически в 100 % случаев синдром АГ со-
провождает ренинсекретируюгцую опухоль по-
чек — рениному — и поражения почечных
магистральных сосудов — реноваскулярную
гипертензию. При диффузных заболеваниях по-
чек синдром АГ с наибольшей частотой выяв-
ляется при заболеваниях почечных клубочков и
сосудов: первичных гломерулонефритах, нефри-
тах при системных заболеваниях (системной
красной волчанке), при васкулитах (узелковом
периартериите, системной склеродермии), при
диабетической нефропатии. Встречаемость АГ
при этих заболеваниях при сохранной функции
почек колеблется в пределах 30—85 %. При хро-
нических нефритах частота АГ в значительной
степени определяется морфологическим вари-
антом нефрита. Так, по данным E.Ritz с соавт.
(1989) с наибольшей частотой (85 %) АГ вы-
является при мезангиокапиллярном нефрите;
при фокально-сегментарном гломерулосклеро-
зе частота АГ составляет 65 % и значительно
реже встречается при мембранозном (51 %), мез-
ангиопролиферативном (49 %), IgA-нефрите
(43 %), достигая самых низких значений при
нефрите с минимальными изменениями. Высо-
ка частота артериальной гипертензии при диа-
бетической нефропатии. По данным междуна-
родных статистик, при сахарном диабете АГ
чаше развивается у женщин, составляя 50—
64 %, и несколько реже у мужчин — 30—55 %.
Значительно реже (около 20 %) АГ выявляется
при заболеваниях почечных канальцев и интер-
стиция — амилоидозе почек, интерстициальном,
лекарственном нефрите, тубулопатиях.
По мере снижения функции почек частота
АГ резко возрастает, достигая 85—90 % в ста-
дии почечной недостаточности независимо от
нозологии почечного процесса.
8.1.2. Патогенез
Заболевания почек могут быть причиной нару-
шений в регуляции АД и развития АГ путем
166
различных механизмов, главными из которых
являются:
• нарушения водно-электролитного баланса
(задержка натрия и воды);
• активация прессорных гормональных систем;
• угнетение депрессорных гормональных сис-
тем.
При заболеваниях почек генез АГ редко
можно связать с одним единственным механиз-
мом ее развития. Как правило, имеет место
сочетанное воздействие нескольких факторов на
фоне одного ведущего.
Задержка натрия и воды. Непосредственные
эффекты почечной задержки натрия можно
представить следующим образом. Накопление
натрия в организме приводит к развитию гипер-
волемии с последующим увеличением сердечно-
го выброса (СВ). Одновременно увеличивается
объем внеклеточной жидкости, повышается со-
держание натрия в сосудистой стенке, что при-
водит к ее набуханию и повышению чувстви-
тельности к прессорным влияниям вазоконст-
рикторных гормонов (ангиотензина, катехолами-
нов, вазопрессина, сосудосуживающих гормонов
эндотелия). Повышение уровня внутрисосудис-
того натрия сопровождается одновременным
накоплением ионов кальция в цитозоле, что
создает основу высокого общего периферичес-
кого сопротивления (ОПС) и общего почечно-
го сосудистого сопротивления (ОПСС), т.е. за-
держка натрия и воды почками оказывает воз-
действие на оба фактора регуляции АД — на
величину СВ и величину ОПС и ОПСС.
При заболеваниях почек задержка натрия и
воды в организме в первую очередь вызвана по-
чечными причинами — снижением перфузии
органа и нарушенной «обработкой» натрия в не-
фроне — снижением его фильтрации и усиле-
нием реабсорбции электролита по мере прохож-
дения его через почечные канальцы. Причиной
данных нарушений чаще всего является сниже-
ние массы действующих нефронов. Ее причина-
ми в свою очередь могут быть следующие:
▲ развитие склеротических изменений в поч-
ках с запустеванием клубочков и замещени-
ем их соединительной тканью;
▲ острое воспаление почек (иммунное и ин-
фекционное) с развитием интерстициально-
го отека почки и сдавлением почечных клу-
бочков с последующим уменьшением их
фильтрующей поверхности и нарушением
функции канальцев;
▲ врожденная гипоплазия почек;
▲ единственная почка — результат как врож-
денной патологии, так и приобретенной си-
туации — нефрэктомии, в том числе у доно-
ра для трансплантации почки реципиенту.
В последние годы в числе причин задержки
натрия в организме при заболеваниях почек
указывают на повышенную секрецию гормона
коры надпочечника — дигиталисоподобного
вещества оуабаина [Blaustein М., 1996]. Подоб-
ное вещество выделяли ранее и из мозга [de
Wardener Н., 1990]. Оуабаин (или ингибитор
Na-K-АТФазы) блокирует натриевый насос,
посредством которого осуществляется перенос
натрия из просвета нефрона в сосудистую стен-
ку. В результате увеличивается выведение натрия
каждым нефроном, но в цитозоле клеток воз-
растает концентрация кальция, так как нару-
шается Na/Ca обмен внутри клетки. Одновре-
менно оуабаин потенцирует гормоны симпати-
ческой нервной системы, констрикторные гор-
моны эндотелия (эндотелии-1) с одновремен-
ным угнетением продукции эндотелием релак-
сирующего гормона - NO, что приводит к рез-
кому увеличению контрактильности гладкомы-
шечных клеток сосудов и увеличению общего
периферического сопротивления.
Свойственных эссенциальной гипертензии
генетических повреждений мембранной прони-
цаемости для электролитов (Na- Li, Na-H-ко-
транспорт) у больных почечной артериальной
гипертензией не выявляют.
Как указывалось ранее, снижение экскреции
почками натрия и воды часто приводит к ги-
перволемии (увеличению объема циркулирую-
щей крови — ОЦК). Этот механизм с ведущей
ролью гипергидратации, гиперволемии и повы-
шением сердечного выброса имеет основное
значение в развитии гипертензии при остром
гломерулонефрите, острой и хронической по-
чечной недостаточности (особенно при лечении
гемодиализом).
Активация прессорных гормональных систем.
Прессорная система организма представлена:
• системой ренин — ангиотензин и тесно свя-
занным с ней гормоном коры надпочечни-
ков альдостероном, которые вместе состав-
ляют ренин-ангиотензин-альдостероновую
систему;
• симпатоадреналовой системой;
• прессорными гормонами эндотелия и тром-
боцитов.
Ренин-ангиотензин-альдостероновая система
(РААС). Роль РААС в патогенезе почечной ги-
пертензии изучена достаточно хорошо. Актива-
ция этой системы приводит к повышению АД
за счет возрастания ОЦК и увеличения актив-
ности других вазоконстрикторных факторов.
Основными компонентами ренин-ангиотен-
зиновой системы (РАС) являются ферменты
ренин и ангиотензинпревращающий фермент
(АПФ — он же кининаза II) и гормоны —
ангиотензин I, II и III.
Ренин образуется в юкстагломерулярном
аппарате (ЮГА) клубочков почек. Стимулами
для повышенной секреции ренина являются
падение давления в артериальной системе по-
чек (кровопотеря, шок), гиповолемия, дефи-
цит натрия в пище, прием мочегонных препа-
ратов. Под действием ренина из вырабатывае-
мого в печени ангиотензиногена образуется
гормон ангиотензин I, переходящий под вли-
янием находящегося в легких, почках и плаз-
ме АПФ в ангиотензин II — одно из самых
сильных известных прессорных веществ. Ангио-
тензин II вызывает системный и локально-по-
чечный спазм артериол с повышением как
ОПС, так и сопротивления сосудов почки; вы-
зывает усиление реабсорбции натрия, действуя
непосредственно на почечные канальцы и уси-
ливая секрецию альдостерона; увеличивает ги-
пертрофию почечных структур и усиливает про-
теинурию. Ангиотензин III является метаболи-
том ангиотензина II. Он обладает слабо выра-
женным прессорным эффектом, но в значи-
тельной степени стимулирует секрецию альдо-
стерона корой надпочечников.
Оценка активности ренина плазмы (АРП),
а также концентрации ангиотензина II в ряде
случаев способствует уточнению патогенеза
гипертензии при почечной патологии. Как пра-
вило, повышенная АРП играет роль в разви-
тии гипертоний при таких заболеваниях почек,
когда они функционально сохранны, но область
ЮГА ишемизирована — ситуация, наиболее
четко выраженная при стенозе почечной арте-
рии; гиперпродукция ренина имеет место при
ренинсекретирующей опухоли, травме почки,
инфаркте почек, обструкции мочеточников и
др. Высокая АРП выявляется примерно у */5
больных хроническим нефритом с синдромом
артериальной гипертензии на фоне нормальной
функции почек. Ренинзависимая гипертензия
наблюдается у части больных терминальной
почечной недостаточностью, леченных хрони-
ческим гемодиализом. Высокорениновая гипер-
тензия при хроническом нефрите всегда про-
текает со значительно повышенным ОПС и
почечным периферическим сопротивлением.
Однако активация РАС у больных хроничес-
кими диффузными заболеваниями почек не
всегда является единственным фактором пато-
генеза гипертензии. Одновременно у них выяв-
ляются задержка натрия и воды, выраженные
изменения реактивности сосудов, угнетение
синтеза депрессорных субстанций. Одновремен-
ное сосуществование этих факторов приводит
к нарушениям физиологических взаимоотноше-
ний между активностью почечной РАС и состо-
янием водно-электролитного баланса. В норме
в ответ на задержку натрия и воды в организ-
ме продукция ренина ЮГА почек резко сни-
167
жается. При нефрите физиологического угнете-
ния продукции ренина не происходит, что свя-
зано с анатомическими и/или функциональны-
ми изменениями ЮГА почек, которые стано-
вятся «нечувствительными» к изменениям на-
триевого баланса. В этих условиях даже нормаль-
ные абсолютные значения активности ренина
плазмы оказываются физиологически высоки-
ми и свидетельствуют о повышении активнос-
ти РАС [Laragh J. et al., 1982; Sealey J. et al., 1988].
В противоположность больным хроническим
нефритом у больных острым нефритом функ-
циональная активность ЮГА сохранена и в
ответ на гиперволемию у них отмечается выра-
женное снижение активности ренина плазмы.
Несмотря на определенную роль гиперрени-
немии в патогенезе гипертензии при перечис-
ленных выше состояниях, ориентироваться на
АРП как определяющий фактор в дифферен-
циальной диагностике вторичных гипертензий
на современном этапе не представляется воз-
можным. Имеются доказательства, что не все-
гда низкий уровень ренина указывает на пер-
вичный альдостеронизм, а высокий — на по-
ражение почечных сосудов.
Альдостерон — гормон клубочковой зоны
надпочечников — задерживает натрий, увели-
чивая его реабсорбцию в собирательных труб-
ках, и повышает выведение калия. Выделение
альдостерона регулируется АКТГ, концентраци-
ей ионов натрия и калия и активностью РАС.
Следовательно, факторы, стимулирующие выс-
вобождение ренина, одновременно являются
стимулами для повышенной секреции альдо-
стерона. Прессорное действие альдостерона свя-
зано с повышением проницаемости клеточной
мембраны для натрия.
В клинической практике повышенная секре-
ция альдостерона способствует развитию гипер-
тензии во всех случаях активации РААС (вто-
ричный гиперальдостеронизм), а также при
первичном гиперальдостеронизме (опухоли клу-
бочковой зоны надпочечников).
Симпатоадреналовая система. Вегетативная регу-
ляция кровообращения связана с вазомоторными
центрами головного мозга. Эти центры подвержены
влиянию многочисленных факторов. Существенным
признается рефлекторное влияние со стороны баро-
рецепторов, находящихся в каротидном синусе, аор-
те, легочной артерии и других зонах. Основная фун-
кция их сводится к выравниванию артериального
давления путем обратной связи. По современным
представлениям, АГ, вызванная какой-либо причи-
ной и существующая в течение нескольких дней,
приводит к снижению чувствительности барорецеп-
торов, что ориентирует вегетативную регуляцию
кровообращения на более высокий уровень артери-
ального давления.
В последние годы большую роль в развитии и/или
поддержании ПГ отводят также нейроадренергичес-
168
кой системе почек, регулирующей почечное крово-
обращение, процессы фильтрации и реабсорбции,
а также продукцию почкой вазоактивных веществ
[Ди Бона Дж., 1987].
Об активности симпатоадреналовой системы су-
дят по концентрации в крови катехоламинов (адре-
налина и норадреналина) и по экскреции их с мо-
чой. Следует учитывать при этом, что катехолами-
ны, экскретируемые с мочой, могут попадать в поч-
ку с артериальной кровью, высвобождаться из окон-
чаний почечных нервов и продуцироваться почечной
тканью. Считается, что из крови в почку поступает
примерно 30 % экскретируемого с мочой норадре-
налина и 70 % адреналина, остальное количество ка-
техоламинов поступает из почечных нервов.
При ПГ у больных с сохранной или умеренно
сниженной функцией почек концентрация в крови
норадреналина и адреналина повышена, выявляется
тесная корреляционная связь концентрации норадре-
налина с систолическим, диастолическим и средним
артериальным давлением, а адреналина — с пульсо-
вым артериальным давлением [Osamu J., 1989].
При выраженной почечной недостаточности уве-
личению концентрации катехоламинов в крови спо-
собствует замедление их катаболизма и выведения из
организма.
Одновременно, как было показано в после-
дних работах, склеротически измененная поч-
ка сама является источником сильных афферен-
тных сигналов в гипоталамус (область головного
мозга нейрогенно контролирующая АД), под
действием которых активируется секреция не
только норадреналина, но и ранее не извест-
ного, еще более сильного, чем норадреналин,
катехоламина — вазоактивного нейропептида Y
[Ye S. et al., 1997; Odar-Cederlof I. et al., 1998].
Нейропептид Y высвобождается вместе с нор-
адреналином в периваскулярных нервных окон-
чаниях. Он имеет более длительный, чем у но-
радреналина, период действия и одновре-
менно катализирует секрецию других вазокон-
стрикторных гормонов.
При заболеваниях почек отмечают прямую
зависимость активности ренина плазмы крови
и уровня катехоламинов, что значительно уси-
ливает констрикторные воздействия гормонов
[Келехер С. и др., 1987]. Задержка натрия в
организме повышает чувствительность сосуди-
стой стенки к их прессорному влиянию. Кроме
того, как показывают результаты эксперимен-
тальных и клинических исследований, при ги-
пертензии происходит перенастройка бароре-
цепторов, которая приводит к нарушению
прессорного и депрессорного баланса с преоб-
ладанием прессорных реакций.
Повышенная активность симпатической не-
рвной системы при заболеваниях почек сопро-
вождается, как правило, вазоконстрикцией и
повышением ОПС, а также формированием
характерного гиперкинетического типа крово-
обращения.
Сосудосуживающие гормоны эндотелия — эн-
дотелины. Эндотелий — основной функциональ-
ный компонент сосудистой стенки. Сегодня он
рассматривается как сложный эндокринный
орган, продуцирующий различные вазоактив-
ные вещества, среди которых — мощные кон-
стрикторы — эндотелины, в первую очередь эн-
дотелии-1 (ЭТ-1), ангиотензин II, и активные
вазодилататоры — простациклин (простаглан-
дин И-2), кинины и эндотелийрелаксирующий
фактор, известный также как оксид азота — NO.
Одновременно эндотелий участвует в превра-
щении ангиотензина I в ангиотензин II и в
инактивации кининов.
Среди открытых в последние годы гормонов
эндотелия — эндотелинов наибольшей актив-
ностью обладает эндотелии-1. По силе сосудо-
суживающего эффекта он в 30 раз превосходит
ангиотензин II. Увеличение содержания ЭТ-1
вызывает генерализованный спазм сосудов, со-
провождающийся повышением АД и минутно-
го объема сердца. Доказано, что при повреж-
дении сосудистого эндотелия смещается соот-
ношение между медиаторными системами —
эндотелинами и NO, тромбоксаном и проста-
циклином — в пользу активации сосудосужи-
вающих компонентов. Так, при нарушении по-
чечной функции у больных с диффузными за-
болеваниями почек выявляли значительное
повышение в крови концентрации ЭТ-1, а
фармакологическая селективная блокада рецеп-
торов ЭТ-1 приводила к заметному снижению
АД [Takahashi К. et al., 1994; Napoli С. et al.,
1997[.
С учетом выраженного нарушения функции
эндотелия при большинстве почечных заболе-
ваний становится очевидной роль этой эндок-
ринной системы в генезе почечной артериаль-
ной гипертонии.
Депрессорная система. Депрессорная систе-
ма, противостоящая действию прессорных фак-
торов, включает в себя сосудорасширяющие
простагландины, калликреин-кининовую сис-
тему и эндотелийрелаксирующий фактор —
оксид азота (NO).
Почечные простагландины и кинины. Проста-
гландины почек относят к классу тканевых
или местных гормонов. В почках продуцируют-
ся все виды простагландинов. Основа их синте-
за — арахидоновая и другие полиненасыщенные
жирные кислоты. Под воздействием фермента
циклооксигеназы они сначала превращаются в
циклические эндоперекиси, из которых затем в
присутствии специфических ферментов образу-
ются простагландины различных классов —
ПГЕ,, Д2, Ф2а, тромбоксан А,, простациклин
ПГИ',. Простагландины почек (преимуществен-
но ПГЕ2 и простациклин ПГИ2) снижают то-
нус артерий, уменьшают их реакцию на вазо-
прессорные вещества, являются мощными на-
трийуретиками и гидроуретиками. В то же вре-
мя тромбоксан А2 и ПГФ2а вызывают спазм со-
судов. Простациклин является естественным
антагонистом тромбоксана А2. Эффект воздей-
ствия на тонус сосудов и систему гемостаза
определяется соотношением этих биологичес-
ки активных веществ в организме.
Физиологические свойства почечных простаглан-
динов — их сосудорасширяющий и натрийуретичес-
кий эффекты — определяют участие этих гормонов
в регуляции системного артериального давления. В то
же время вопрос о роли этой системы в патогенезе
АГ при заболеваниях почек не решен. Спорным ос-
тается вопрос, является ли изменение продукции по-
чечных простагландинов причиной или следствием
гипертонии. Так, в литературе наряду с данными о
снижении синтеза почечных простагландинов при за-
болеваниях почек с синдромом АГ, особенно выра-
женном в стадию ХПН [Некрасова А.А. и др., 1986;
Lebel М., Grose J., 1986; Takamoto et al., 1990], со-
общается и о повышении простагландинсинтетичес-
кой функции почек. При этом повышение синтеза
почечных простагландинов при нефропатиях с АГ
рассматривается как вторичная компенсаторная ре-
акция организма, направленная на нормализацию
артериального давления и стабилизацию почечных
функций.
Мы провели ряд исследований, направленных на
уточнение роли почечных простагландинов в генезе
ПГ. У больных гипертоническим нефритом была ис-
следована экскреция с мочой ПГЕ2 и ПГФ2 и до-
полнительно оценены клинические эффекты фарма-
кологических модуляторов гормонов: курантила —
стимулятора синтеза простагландинов и индомета-
цина— ингибитора его синтеза [Кутырина И.М. и
др., 1987; Тареева И.Е и др., 1988].
У больных гипертоническим нефритом с сохран-
ной или умеренно сниженной функцией почек мы
выявили выраженное угнетение почечной экскреции
ПГЕ2 (344,8 нг/сут) против нормальных значений
(829,3 нг/сут; р < 0,05) и ПГФ2я (соответственно
474,6 нг/сут против 1381 нг/сут; р < 0,05). Стимуля-
ция синтеза почечных простагландинов курантилом
сопровождалась умеренным, но достоверным гипо-
тензивным эффектом, в то время как блокада син-
теза почечных простагландинов индометацином при-
водила к усугублению АГ.
Полученные данные позволили считать, что сни-
жение простагландинсинтетической функции почек
у больных с диффузными заболеваниями почек сле-
дует рассматривать как причину развития ПГ.
Выраженными сосудорасширяющими свой-
ствами обладают и конечные продукты каллик-
реин-кининовой системы (ККС) — брадики-
нин и каллидин.
Образующиеся в почках кинины увеличивают
кровоснабжение почек, снижают сопротивление по-
чечных сосудов, уменьшают реабсорбцию натрия и
воды в дистальных сегментах нефрона. Указанные
физиологические свойства кининов определяют их
169
значение в генезе эссенциальной гипертонии [Кар-
ретеро О.А., Сцикли А.Г., 1987]. Вместе с тем роль
ККС в патогенезе ПГ изучена недостаточно. Лишь в
отдельных сообщениях отмечается снижение у боль-
ных с ПГ содержания калликреина в моче, увеличе-
ние синтеза почечного калликреина, о^-антитрипси-
на, наличие обратной зависимости между АДср.д„наи и
экскрецией калликреина с мочой, что указывает на
роль этой системы в становлении и поддержании ПГ
[Mayfield R., Margolins Н., 1983].
Экскреция калликреина с мочой служит
показателем вазодилатации и активности на-
трийуретической системы.
Эндотелийрелаксирующий фактор — оксид
азота. Последнее десятилетие ознаменовалось
открытием нового мощного вазодилатирующе-
го фактора эндотелия — оксида азота (NO).
Установлено, что в почках NO продуцируется
эндотелием почечных артериол, областью плот-
ного пятна (macula densa), эндотелием почеч-
ных клубочковых капилляров и канальцев. Фи-
зиологическая роль NO сводится к регуляции
почечного кровотока, высвобождению ренина,
регуляции натрийуреза, т.е. факторам, ответ-
ственным за развитие артериальной гипертен-
зии. Считается уже доказанным, что недоста-
ток в организме NO ответствен за развитие ар-
териальной гипертензии, протекающей с вы-
раженным увеличением почечного сосудисто-
го сопротивления, возрастанием протеинурии
и быстрым развитием гломерулосклероза, а
последовательное введение L-аргинина (пред-
шественника NO) сопровождается нормализа-
цией АД [Patel A. et al., 1993]. Усиленный син-
тез NO из L-аргинина необходим для развития
нормального натрийуретического ответа при
нагрузке натрием. При ХПН выявляют резкое
увеличение концентрации эндотелина-1 и уг-
нетение высвобождения NO [Napoli С. et al.,
1997]. При фармакологической селективной
блокаде рецепторов ЕТ-1 in vivo определялась
усиленная продукция NO, а АД значительно
снижалось [Aiello S. et al., 1998], т.е. при ХПН
дисрегуляция этой системы со снижением син-
теза NO и увеличением концентрации в крови
эндотелинов чревата развитием АГ за счет рез-
кого возрастания ОПС, которое развивается на
фоне усугубления задержки натрия в организме.
В процессе прогрессирования почечной недо-
статочности возрастают частота и тяжесть АГ,
повышается роль задержки натрия и воды в
патогенезе АГ, сохраняют свое значение и
большинство других общих для всех АГ меха-
низмов, включая повышенную выработку ре-
нина сморщенными почками, истощение вы-
работки ими депрессорных гормонов и дисре-
гуляцию гормонов эндотелия. Вместе с тем осо-
бенности состояния — условия уремии — со-
здают еще дополнительные факторы, кото-
170
рые способствуют возникновению и поддержа-
нию АГ.
Так, в последние годы внимание исследо-
вателей, изучающих механизмы развития АГ
при ХПН, привлекает к себе активация
перекисного окисления липидов.
Показано, что при ХПН резко увеличена ак-
тивность свободных кислородных радикалов
(что определяют по уровню малондиальдегида),
значительно снижена антиоксидантная актив-
ность и нарушена антиоксидантная ферментная
система (супероксидная дисмутаза, глутатион-
пероксидаза) [Vaziri N.D. et al., 1998].
Повышение свободных кислородных радика-
лов может потенцировать АГ, внося свой вклад
в повышение ОПС за счет различных механиз-
мов. В их числе — инактивация продукции NO,
усиленное образование вазоконстрикторных
метаболитов за счет окисления арахидоновой
кислоты внутри клубочковых мембран, прямое
вазоконстрикторное действие свободных кисло-
родных радикалов, усиление фиброза и атеро-
склероза в сосудах.
В самое последнее время в литературе актив-
но обсуждают в качестве концепции развития
ХПН у пожилых больных, ранее не страдавших
почечными заболеваниями или АГ, роль ише-
мического повреждения почек. Причиной разви-
тия ХПН у этой категории больных являлся ге-
нерализованный атеросклероз, повреждающий
в том числе и микрососудистое русло почек,
что приводило к развитию гломерулосклероза
[Kasiske B.L., 1986; Bleyer A.J. et al.,1998;
Meyrier A. et al., 1998]. При этом отмечают тес-
ную связь между выраженностью глобального
атеросклероза и гломерулосклероза: последний
выявлялся преимущественно у лиц с тяжелым
и умеренным атеросклерозом [Tracy R.E. et al.,
1986].
У пожилых больных с ХПН ишемическое
повреждение почечных сосудов часто является
причиной развития тяжелой реноваскулярной
гипертензии, которая при жизни, однако, как
правило, остается недиагностированной. Как
показал статистический анализ многочисленных
наблюдений, включающих данные патолого-
анатомических исследований, частота ее у лиц
старше 50 лет возрастает до 15 %, а по данным
сводной статистики ЕДТА (1995), у лиц стар-
ше 65 лет она составляет 21 [Valderrabano R. et
al., 1995].
Следовательно, при достаточной продолжи-
тельности жизни все факторы риска развития
атеросклероза можно рассматривать как факто-
ры риска развития хронического ишемическо-
го повреждения почек, приводящего к разви-
тию АГ и ХПН.
Обобщая данные о патогенезе ПГ, следует
подчеркнуть, что каждый из представленных
механизмов — нарушения водно-электролитно-
го баланса, активация прессорной и снижение
депрессорной гормональной активности — мо-
жет быть единственной причиной развития ПГ,
однако у большинства больных нефропатиями
патогенез ПГ связан с сочетанным воздействи-
ем нескольких факторов.
8.1.3. Клинические проявления
Симптоматика ПГ не отличается от симптома-
тики другого гипертонического синдрома, в ча-
стности гипертонической болезни. Клиническая
характеристика ПГ широко варьирует — от не-
постоянной бессимптомной или малосимптом-
ной гипертонии до злокачественного гиперто-
нического синдрома. Между характером пора-
жения почек (включая морфологические осо-
бенности) и выраженностью ПГ нет строгого
параллелизма, хотя обострение хронического
гломерулонефрита, развитие нефросклероза
чаще сопровождаются нарастанием гипертонии.
Любое заболевание почек может сопровождать-
ся ПГ любой тяжести. В характеристике соб-
ственно ПГ нет каких-либо признаков, кото-
рые позволили бы связать его с почечным за-
болеванием или предсказать дальнейшее его
течение, например переход в злокачественную
форму.
Оценка тяжести гипертонического синдро-
ма может быть сложной. Величина артериаль-
ного давления не является достаточным крите-
рием. Для более полной характеристики гипер-
тонического синдрома желательно определение
базального (утреннего) и случайного (на про-
тяжении дня) АД. Домашнее измерение АД,
выполняемое самим больным или обученным
родственником, признается полезным. Еще бо-
лее информативна оценка суточных колебаний
АД.
В последние годы стало доступным суточное
(амбулаторное) мониторирование АД. Аппара-
тура и методика стандартны [Кобалава Ж.Д. и
др., 1996; Stimpel М., 1996; Mancia G., 1997]. Из-
мерение производят автоматически, аускульта-
тивным методом каждые 15 или 30 мин (по
выбору). Результаты фиксируются на компакт-
ном носимом устройстве и после окончания
измерений анализируются компьютером по спе-
циальной программе. Для трактовки результа-
тов важно, чтобы пациент записывал особен-
ности своей дневной активности.
Суточное мониторирование АД полезно
прежде всего при организации лечения боль-
ного, для подбора гипотензивных лекарств и
времени их приема, для оценки эффективнос-
ти лечения или рефрактерности к нему. Оно по-
зволяет правильно оценить ситуационные
всплески АД (например, «гипертонию белого
халата»), охарактеризовать особенности ночного
(с 0 до 4 ч) АД (у здоровых оно снижается на
10—20 % по сравнению с дневным), просле-
дить за утренним подъемом АД. Суточное мо-
ниторирование АД может помочь в оценке тя-
жести артериальной гипертензии. В общем счи-
тается, что высокий средний показатель АД,
большая доля измерений, выявляющих повы-
шенный уровень, отсутствие ночного снижения
или, напротив, чрезмерное ночное снижение
АД, быстрый и значительный утренний подъем,
чрезмерные колебания АД в течение дня про-
гностически хуже, т.е. связаны с большей ве-
роятностью осложнений.
Эти оценки приложимы к артериальной ги-
пертензии разной природы, включая почечную.
Однако еще не определено, какие характерис-
тики суточной динамики АД считать собствен-
но нормальными. Во всяком случае принятые
сейчас классификации артериальной гипертен-
зии по тяжести базируются еще на спорадичес-
ких измерениях случайного АД и клинических
данных. Почти нет сведений об особенностях
суточного ритма АД при почечной гипертензии.
Отмечено меньшее ночное снижение реновас-
кулярной и ренопаренхиматозной гипертензии
(возможно, в связи с меньшей ролью вегета-
тивной регуляции АД у этих больных). По-ви-
димому, данная методика может быть полезной
и для решения ряда дополнительных задач —
для исключения псевдогипертензии у пожилых,
для оценки выраженности ортостатической
дизрегуляции АД — спонтанной или лекар-
ственной, для диагностики синдрома пейсме-
кера.
Для наиболее тяжелой ПГ характерно не
столько высокое диастолическое артериаль-
ное давление, сколько стойкость его на про-
тяжении значительной части суток, даже во
сне.
Именно стойкая диастолическая гипертония
приводит к значительному увеличению сердца,
изменениям ЭКГ и значительным изменениям
глазного дна. Разумеется, это относится к ги-
пертоническим состояниям разной природы, но
при ПГ это особенно важно подчеркнуть, по-
скольку вопрос касается более широкого воз-
растного диапазона. Нередко отмечают меньшую
выраженность гипертрофии сердца и более по-
зднее нарушение его сократительной функции
при ПГ по сравнению с гипертонической бо-
лезнью, сопоставимой по тяжести. Отчасти это
можно объяснить более молодым возрастом
почечных больных. Одно из возможных объяс-
нений состоит в том, что гипертония с увели-
171
чением сердечного выброса, столь распростра-
ненная при ПГ, по-видимому, «требует» от
сердца меньших энергетических затрат, чем
гипертония сопротивления.
На ЭКГ обнаруживаются признаки увеличе-
ния левого желудочка — увеличение зубца R,
снижение сегмента ST с выпуклостью кверху,
низкие или отрицательные неравносторонние
зубцы Т в отведениях V4 6. Иногда постепенно
формируется блокада левой ножки пучка Гиса.
Изменения ЭКГ при ПГ в основном отражают
именно увеличение левого желудочка и в ка-
кой-то степени характеризуют тяжесть гипер-
тонии. В случае снижения артериального давле-
ния эти изменения могут быть частично обра-
тимыми. Обнаружение высокого диастолическо-
го артериального давления у больного с мало-
измененной ЭКГ обычно указывает на нестой-
кость или недавность гипертонии.
Оценка ЭКГ может быть затруднена, если
накладываются дополнительные изменения,
связанные с сопутствующими заболеваниями
(ишемическая болезнь сердца), лечением (кор-
тикостероиды, салуретики, сердечные гликози-
ды, гемодиализ). Особенно сложные изменения
могут возникнуть при ХПН. При анемии воз-
можно сглаживание зубца Т, при гиперкалие-
мии — тенденция к увеличению и заострению
зубца Г с узким основанием, а при обычном
для таких больных дефиците кальция — увели-
чение продолжительности интервала QT. Уре-
мический перикардит может приводить к харак-
терным изменениям с подъемом сегмента ST
в стандартных отведениях и уменьшением зуб-
цов в случае накопления выпота.
Комплекс метаболических нарушений при
ХПН может обусловить нехарактерную элект-
рокардиографическую картину, сглаживание
собственно «гипертонических» изменений, лож-
ноположительную динамику (переход отрица-
тельного зубца Т в сглаженный или положи-
тельный в случае нарастания гиперкалиемии),
разнообразные аритмии и нарушения проводи-
мости, особенно при лечении гемодиализами,
которое может сопровождаться резкими пере-
падами уровня электролитов крови.
Изменения глазного дна при ПГ в целом
более выражены, чем при гипертонической
болезни. Транссудаты на сетчатке могут наблю-
даться у почечных больных даже при умерен-
ной гипертонии.
Умеренная ПГ (диастолическое артериальное
давление менее 100 мм рт. ст.) обычно мало
влияет на клиническую картину. Тяжелая и
особенно злокачественная гипертония (стойкое
высокое диастолическое артериальное давление,
отек сетчатки, мозговые и сердечные осложне-
ния) резко ухудшают клиническую картину,
ускоряют развитие почечной недостаточности.
Если врач впервые видит больного уже в пе-
риод развития почечной недостаточности, то
бывает трудно решить, первично ли заболева-
ние почек или имеется злокачественная гипер-
тоническая болезнь с вторичным поражением
почек.
8.1.4. Осложнения почечной
гипертензии
Осложнения ПГ такие же, как при гипертони-
ческой болезни. Возможны ускоренное разви-
тие атеросклероза, ИБС и ее последствия, же-
лудочковые аритмии, мерцание предсердий.
Сердечная недостаточность соответствует
выраженности, стойкости и продолжительнос-
ти гипертонии. Поначалу это обычно левоже-
лудочковая недостаточность с одышкой, при-
ступами сердечной астмы, отеком легких, с
рентгенологическими и физическими призна-
ками застоя в легких. В дальнейшем развивает-
ся застой и по большому кругу. Возможен пре-
систолический или протодиастолический галоп.
Обязательным симптомом является гипертро-
фия левого желудочка (данные эхографии, рен-
тгенологические данные, усиление и смещение
верхушечного толчка, расширение тупости,
изменения ЭКГ). При остро возникшей ПГ,
например при остром нефрите, острой почеч-
ной недостаточности, гипергидратация может
обусловить дилатацию сердца и острую сердеч-
ную недостаточность. Диспротеинемия и анемия
способствуют развитию сердечной недостаточ-
ности.
Сердечная недостаточность особенно часто
осложняет злокачественную ПГ, являясь второй
по частоте причиной смерти после почечной
недостаточности.
Гипертоническая энцефалопатия вследствие
ишемии и отека мозга проявляется теми же
симптомами, что и гипертоническая болезнь
(слабость, сонливость, снижение памяти и
концентрации, головная боль, снижение интел-
лекта, депрессия). Однако у молодых лиц с ПГ
клиническая картина гипертонической энцефа-
лопатии редко бывает полной.
Гипертоническая и уремическая энцефало-
патии имеют многие общие признаки.
Гипертонические кризы (дополнительный
острый подъем артериального давления) могут
быть связаны с обострением почечного заболе-
вания, а также с эмоциональной или физичес-
кой нагрузкой, с чрезмерным употреблением
соли или жидкости. Наиболее часты гипертони-
ческие кризы у больных, находящихся на ле-
чении гемодиализом, их природа может быть
различной. Клинически они проявляются ухуд-
шением мозговой, сердечной или, реже, глаз-
172
ной симптоматики, острой левожелудочковой
недостаточностью. Тяжелая ПГ, несомненно,
ускоряет развитие нефросклероза и ХПН у
почечных больных.
8.1.5. Лечение почечной
артериальной гипертензии
Сложная взаимосвязь системной АГ и почек,
усугубляемая на фоне уже имеющейся почеч-
ной патологии, определяет особенности гипо-
тензивной терапии при заболеваниях почек.
Ряд общих положений, на которых строит-
ся лечение АГ, — режим труда и отдыха, сни-
жение массы тела, уменьшение употребле-
ния алкоголя, повышение физической актив-
ности, соблюдение диеты с ограничением соли
и продуктов, содержащих холестерин, отмена
лекарственных средств, вызывающих развитие
АГ, — сохраняют свою значимость при лече-
нии ПГ.
Особенное значение для нефрологических
больных имеет строгое ограничение натрия. Имея
в виду роль натрия в патогенезе АГ, а также
свойственное почечной патологии нарушение
транспорта натрия в нефроне со снижением его
экскреции и увеличением общего содержания
натрия в организме, суточное потребление соли
при нефрогенной АГ должно быть ограничено
до 5 г/сут, что с учетом высокого содержания
натрия в готовых пищевых продуктах (хлеб,
колбасы, консервы и т.д.) практически исклю-
чает дополнительное применение соли при
приготовлении пищи [de Wardener Н.Е., 1985;
ВОЗ, 1996]. Менее жестким должно быть огра-
ничение соли у больных с поликистозом по-
чек, «сольтеряющим» пиелонефритом, при
некоторых вариантах течения хронической по-
чечной недостаточности, когда вследствие по-
ражения почечных канальцев реабсорбция на-
трия в них нарушена и задержки натрия в орга-
низме не наблюдается. В этих ситуациях крите-
рием определения солевого режима больного
является суточная экскреция Na и величина
объема циркулирующей крови. При наличии ги-
поволемии и/или при повышенной экскреции
натрия с мочой ограничивать потребление соли
не следует.
Много внимания в настоящее время уделя-
ется тактике гипотензивной терапии — вопро-
сам темпа снижения АД, установления уровня
АД, до которого следует снижать исходно по-
вышенное АД, а также вопросу, требует ли
постоянного гипотензивного лечения «мягкая»
АГ (АДд.нст 95—105 мм рт. ст.).
На основании проведенных наблюдений в
настоящее время считается доказанным следу-
ющее:
— одномоментное максимальное снижение по-
вышенного АД не должно превышать 25 %
от исходного уровня, с тем чтобы не нару-
шить функцию почек;
— у больных с патологией почек и синдромом
АГ гипотензивная терапия должна быть на-
правлена на полную нормализацию АД, даже
несмотря на временное снижение депураци-
онной функции почек. Данная тактика рас-
считана на устранение системной АГ и тем
самым внутригломерулярной гипертензии
как основных неиммунных факторов про-
грессирования почечной недостаточности и
предполагает дальнейшее улучшение почеч-
ных функций [Brenner В. et al., 1997];
— «мягкая» АГ у нефрологических больных тре-
бует постоянного гипотензивного лечения в
целях нормализации внутрипочечной гемо-
динамики и замедления темпов прогресси-
рования почечной недостаточности.
Особенностью лечения АГ при хронических
заболеваниях почек является необходимость со-
четания гипотензивной терапии с патогенети-
ческой терапией основного заболевания. Сред-
ства патогенетической терапии заболеваний
почек (глюкокортикостероиды, гепарин, куран-
тил, нестероидные противовоспалительные
препараты, сандиммун) сами по себе могут
оказывать различное действие на АД, а их со-
четания с гипотензивными препаратами могут
сводить к нулю либо усиливать гипотензивный
эффект последних.
Гипертонический синдром является проти-
вопоказанием к назначению высоких доз глю-
кокортикостероидов, за исключением случаев
быстропрогрессирующего гломерулонефрита.
У больных с умеренной нефрогенной АГ глю-
кокортикостероиды могут усилить ее, если при
их назначении не развивается выраженный ди-
уретический и натрийуретический эффект, что,
как правило, наблюдается у больных с исход-
ной выраженной задержкой натрия и гиперво-
лемией.
Нестероидные противовоспалительные препа-
раты (НСПП) — индометацин, ибупрофен и
др. — являются ингибиторами синтеза проста-
гландинов. В ряде исследований, и в том числе
наших, показано, что НСПП могут оказывать
антидиуретическое и антинатрийуретическое
действие и повышать АД, что ограничивает их
использование при лечении больных с нефро-
генной АГ. Назначение НСПП одновременно с
гипотензивными средствами может либо ниве-
лировать действие последних, либо значимо
снижать их эффективность [Кутырина И.М. и
др., 1987; Тареева И.Е. и др., 1988]. В противо-
положность этим препаратам гепарин оказыва-
ет диуретическое, натрийуретическое и гипо-
173
тензивное действие [Кутырина И.М. и др., 1985;
Никишова Т.А. и др., 1987; Mandal К. et al.,
1995]. Препарат усиливает гипотензивный эф-
фект других лекарственных препаратов. Наш
опыт свидетельствует о том, что одновремен-
ное назначение гепарина и гипотензивных пре-
паратов требует осторожности, так как может
привести к резкому снижению АД. В этих слу-
чаях терапию гепарином целесообразно начи-
нать с небольшой дозы (15—17,5 тыс. ЕД/сут)
и увеличивать ее постепенно под контролем АД.
При наличии выраженной почечной недоста-
точности (скорость клубочковой фильтрации
менее 35 мл/мин) гепарин в сочетании с ги-
потензивными препаратами следует применять
с большой осторожностью.
Подбор антигипертензивных препаратов и
выделение из их числа наиболее предпочтитель-
ных для лечения нефрогенной гипертензии
базируются на следующих принципах:
— препараты должны воздействовать на пато-
генетические механизмы развития АГ;
— использовать препараты, не снижающие кро-
воснабжения в почках и не угнетающие по-
чечные функции;
— применять препараты, способные корриги-
ровать внутриклубочковую гипертензию;
— использовать лекарственные средства, не
вызывающие нарушений метаболизма и
— обладающие минимальными побочными
действиями.
— начинать лечение с малых доз препаратов,
постепенно их увеличивая до достижения те-
рапевтического эффекта.
Антигипертензивные (гипотензивные) средства.
В настоящее время для лечения больных с нефро-
генной артериальной гипертензией используют
5 классов гипотензивных лекарственных средств:
— ингибиторы АПФ;
— антагонисты кальция;
— /}-блокаторы;
— диуретические средства;
— <х-блокаторы.
Препараты центрального механизма дей-
ствия (препараты раувольфии, а-метилдопа,
клонидин) имеют вспомогательное значение и
в настоящее время применяются лишь по уз-
ким показаниям.
К препаратам первого выбора относят инги-
биторы ангиотензинпревращающего фермен-
та (и-АПФ) и блокаторы кальциевых каналов
(антагонисты кальция).
Эти две группы препаратов отвечают всем
требованиям, предъявляемым к антигипертен-
174
зивным препаратам, предназначенным для ле-
чения нефрогенной артериальной гипертензии
и, что особенно важно, обладают одновремен-
но нефропротективными свойствами.
Ингибиторы АПФ представляют собой класс
антигипертензивных препаратов, основой фар-
макологического действия которых является
ингибиция ангиотензинпревращающего фер-
мента (он же кининаза II).
Физиологические эффекты ангиотензин-
превращающего фермента двояки. С одной сто-
роны, он превращает ангиотензин I в ангио-
тензин II, являющийся одним из самых мощ-
ных вазоконстрикторов. С другой стороны, бу-
дучи кининазой II, разрушает кинины — тка-
невые сосудорасширяющие гормоны. Соответ-
ственно фармакологическая ингибиция этого
фермента блокирует системный и органный
синтез ангиотензина II и накапливает в цир-
куляции и тканях кинины.
Клинически эти эффекты проявляются:
• выраженным гипотензивным эффектом, в
основе которого лежит снижение общего и
локально почечного периферического сопро-
тивления;
• коррекцией внутриклубочковой гемодинами-
ки, в основе которой лежит расширение вы-
носящей почечной артериолы — основного
места приложения локально-почечного ан-
гиотензина II [Ichikawa J. et al., 1984].
В последние годы активно обсуждается реноп-
ротективная роль ингибиторов АПФ, которую
связывают с устранением эффектов ангиотен-
зина, определяющих быстрое склерозирование
почек, т.е. с блокадой роста мезангиальных
клеток, продукции ими коллагена и эпидер-
мального фактора роста почечных канальцев
[Opie L.H., 1992].
В табл. 8.2 приведены наиболее распростра-
ненные ингибиторы АПФ с указанием их до-
зировок.
Таблица 8.2. Торговые названия и дозы ингиби-
торов АПФ
Препарат Торговое название Доза (мг) и кратность приема
• Каптоприл Капотен 75—100 х 3
• Эналаприл Ренитек 5—10—20 х 1—2
• Рамиприл Тритаце 2,5—5 х 1
• Периндоприл Престариум 4—8 х 1
• Цилазаприл Инхибейс 2,5—5 х 1
• Фозиноприл Фозинорм 10—20 х 1
• Квинаприл Аккупро 20—40 х 1
• Трандолаприл Гоптен 2—4 х 1
• Лизиноприл Принивил 10—40—80 х 1
• Беназеприл Беназеприл 10—20—40 х 1
В зависимости от времени выведения из орга-
низма выделяют ингибиторы АПФ первого по-
коления (каптоприл — с периодом полувыве-
дения менее 2 ч и продолжительностью гемо-
динамического эффекта 4—5 ч) и ингибиторы
АПФ второго поколения с периодом полувы-
ведения препарата 11—14 ч и длительностью ге-
модинамического эффекта более 24 ч. Для под-
держания оптимальной концентрации лекарств
в крови в течение суток необходим 4-кратный
прием каптоприла и однократный (иногда дву-
кратный) прием других ингибиторов АПФ.
Почечные эффекты и-АПФ. Влияние всех и-
АПФ на почки практически одинаково. Наш
опыт длительного применения и-АПФ (каптоп-
рила, ренитека, тритаце) у нефрологических
больных с артериальной гипертензией свиде-
тельствует, что при исходно сохранной почеч-
ной функции и-АПФ при длительном их при-
менении (месяцы, годы) увеличивают почеч-
ный кровоток, не изменяют либо несколько
снижают креатинин крови, увеличивая СКФ. В
самые начальные сроки лечения и-АПФ (пер-
вая неделя) возможно небольшое повышение
креатинина крови и уровня калия в крови,
которые самостоятельно в течение ближайших
дней без отмены лекарства возвращаются к нор-
мальным показателям [Кутырина И.М. и др.,
1995].
чение и-АПФ беназеприлом в течение 3 лет,
лечение гемодиализом или трансплантацией по-
чек потребовалось 31 пациенту, в то время как
в группе сравнения из 283 пациентов, получав-
ших плацебо, такая необходимость развилась у
57 больных; при продолжении исследования
(через 6,6 года) терминальная почечная недо-
статочность в группе получавших и-АПФ раз-
вилась у 79 человек, в то время как в группе
сравнения — у 102 [Locatelli F. et al., 1997].
Однако сохраняющееся на протяжении 10—14
дней от начала терапии и-АПФ нарастание
креатинина крови и гиперкалие-
мии является показанием к отме-
не препарата.
Ингибиторы АПФ обладают свойством кор-
ригировать внутрипочечную гемодинамику, сни-
жая внутрипочечную гипертензию и гиперфиль-
трацию. В наших наблюдениях коррекция внут-
рипочечной гемодинамики под влиянием рени-
тека была достигнута у 77 % больных.
Ингибиторы АПФ обладают выраженным
антипротеинурическим свойством.
Максимальное антипротеинурическое дей-
ствие развивается на фоне низкосолевой ди-
еты. Повышенное употребление поваренной
соли приводит к потере антипротеинуричес-
ких свойств и-АПФ [de Jong Р.Е. et al., 1992].
Факторами риска стабильного снижения по-
чечных функций являются пожилой и стар-
ческий возраст пациентов. Доза и-АПФ в этой
возрастной категории должна быть снижена.
Особого внимания к себе требует терапия
и-АПФ у больных с почечной недо-
статочностью. У подавляющего большин-
ства больных скорригированная с учетом сте-
пени почечной недостаточности длительная
терапия и-АПФ оказывает благоприятное вли-
яние на почечные функции: креатининемия
снижается, СКФ возрастает, срок наступления
терминальной почечной недостаточности замед-
ляется. В наблюдениях A.-L.Kamper и соавт.
(1995) 7-летнее непрерывное лечение эналап-
рилом больных с выраженной ХПН (исходная
СКФ в среднем составляла 25 мл/мин) замед-
лило срок наступления терминальной почечной
недостаточности у 12 из 35 больных (в 34 %),
что в 2,5 раза превышало число больных (5 из
35), получавших традиционную антигипертен-
зивную терапию. Окончившееся в 1996 г. про-
спективное рандомизированное, многоцентро-
вое исследование AIPRI также подтвердило
способность и-АПФ замедлять темпы прогрес-
сирования почечной недостаточности. Из 300
больных с выраженной ХПН, получавших ле-
Осложнения и побочные эффекты ингибито-
ров АПФ. Ингибиторы АПФ являются относи-
тельно безопасной группой лекарственных пре-
паратов. Они обладают небольшим количеством
побочных воздействий.
Наиболее частыми осложнениями являются
кашель и гипотензия. Кашель может возни-
кать в различные сроки лечения препаратами —
как на самых ранних, так и спустя 20—24 мес
от начала терапии. Механизм возникновения
кашля связывают с активацией кининов и про-
стагландинов. Основанием к отмене лекарствен-
ных препаратов при появлении кашля являет-
ся значимое ухудшение качества жизни боль-
ного. После отмены препаратов кашель прохо-
дит в течение нескольких дней.
Более тяжелым осложнением терапии инги-
биторами АПФ является развитие гипотен-
зии. Риск ее возникновения высок у больных
с застойной сердечной недостаточностью, осо-
бенно в пожилом возрасте; при злокачествен-
ной высокорениновой артериальной гипертен-
зии, при реноваскулярной артериальной гипер-
тензии. Важным для клинициста является воз-
можность прогнозирования развития гипотен-
зии в процессе применения ингибиторов АПФ.
С этой целью оценивают гипотензивный эффект
первой малой дозы препарата (12,5—25 мг ка-
175
потена; 2,5 мг ренитека; 1,25 мг тритаце). Вы-
раженная гипотензивная реакция на эту дозу
может прогнозировать развитие гипотензии при
длительном лечении препаратами. В случае от-
сутствия выраженной гипотензивной реакции
риск развития гипотензии при дальнейшем
лечении значительно снижается.
Достаточно частыми осложнениями лечения
ингибиторами АПФ являются головная боль,
головокружения. Эти осложнения, как прави-
ло, не требуют отмены лекарственных средств.
В нефрологической практике противопо-
казаниями к применению ингибиторов
АПФ являются:
• стеноз почечной артерии обеих почек;
• стеноз почечной артерии единственной поч-
ки (в том числе трансплантированной поч-
ки);
• сочетание почечной патологии с тяжелой
сердечной недостаточностью;
• тяжелая хроническая почечная недостаточ-
ность, длительно леченная диуретиками.
Назначение в этих случаях ингибиторов АПФ
может осложниться ростом креатинина крови,
падением клубочковой фильтрации вплоть до
развития острой почечной недостаточности.
Ингибиторы АПФ противопоказаны
при беременности, так как их применение во
II и III триместрах могло приводить к гипотен-
зии плода, порокам его развития, гипотрофии
и гибели.
Антагонисты кальция. Механизм гипотензив-
ного действия антагонистов кальция (АК) свя-
зан с расширением артериол и снижением
повышенного ОПС вследствие торможения вхо-
да ионов Са2+ в клетку. Доказана также способ-
ность препаратов блокировать вазоконстриктор-
ный эффект гормона эндотелия — эндотелина.
Современная классификация антагонистов
кальция (АК) выделяет три группы препаратов:
1) производные папаверина (верапамил,
тиапамил);
2) производные дигидропиридина (нифеди-
пин, нитрендипин, нисолдипин, нимодипин);
3) производные бензотиазепина — дилтиазем.
Их называют препаратами-прототипами, или
АК 1-го поколения. По гипотензивной актив-
ности все три группы препаратов-прототипов
равноценны, т.е. эффект нифедипина в дозе
30—60 мг/сут сопоставим с эффектами верапа-
мила в дозе 240—480 мг/сут и дилтиазема в дозе
240—360 мг/сут.
В 80-х годах появились АК 2-го поколе-
ния. Их основными преимуществами яви-
лись большая продолжительность действия, хо-
рошая переносимость и тканевая специфич-
ность. В табл. 8.3 представлены наиболее распро-
страненные препараты этих двух групп.
176
Таблица 8.3. Торговые названия и дозы антаго-
нистов кальция
Препарат Торговое название Дозе (мг) и кратность приема
• Нифедипин Коринфар, кордафен 30—40 х 3—4
• Риодипин Адалат 30—40 х 3—4
• Нифедипин- Форидон* 30—60 х 1
ретард Адалат-SR* 5—10 х 1
• Исрадипин Ломир* 5—10 х 1
• Фелодипин Плендил* 5—10 х 1
• Амлодипин Норваск* 50—100 х 1
• Мифебрадил Позикор* 240—480 х 1
• Верапамил Изоптин SR* 180 х 2
• Дилтиазем Алтиазем РР 60—90—180 X 2-3
* Препараты длительного действия.
По гипотензивной активности АК представ-
ляют собой группу высокоэффективных пре-
паратов. Преимуществами перед другими гипо-
тензивными средствами являются их выражен-
ные антисклеротические (препараты не влия-
ют на липопротеидный спектр крови) и ан-
тиагрегационные свойства. Эти качества дела-
ют их препаратами выбора для лечения пожи-
лых людей.
Почечные эффекты антагонистов кальция.
Антагонисты кальция благоприятно воздейству-
ют на почечную функцию: они увеличивают
почечный кровоток и вызывают натрийурез.
Менее однозначно влияние препаратов на ско-
рость клубочковой фильтрации и внутрипочеч-
ную гипертензию. Существуют данные, что ве-
рапамил и дилтиазем снижают внутриклубоч-
ковую гипертензию, в то время как нифедипин
либо не влияет на нее, либо способствует уве-
личению внутриклубочкового давления [Weid-
mann Р. et al., 1995]. В этой связи для лечения
нефрогенной гипертонии из препаратов груп-
пы АК предпочтение отдается верапамилу и
дилтиазему и их производным.
Всем АК свойствен нефропротективный эф-
фект, который определяется свойствами умень-
шать гипертрофию почек, угнетать метаболизм
и пролиферацию мезангия и этим путем замед-
лять темп прогрессирования почечной недоста-
точности [Mene Р., 1997].
Осложнения и побочные действия антагонис-
тов кальция. Побочные явления связаны, как
правило, с приемом АК группы дигидропири-
дина короткого действия — 4—6 ч. Период по-
лувыведения колеблется от 1,5 до 4—5 ч. В тече-
ние короткого времени концентрация нифеди-
пина в крови варьирует в широком диапазоне —
от 65—100 до 5—10 нг/мл. Плохой фармакоки-
нетический профиль с пиковым повышением
концентрации препарата в крови, влекущем за
собой падение АД на короткое время и целый
ряд нейрогуморальных реакций, например выб-
рос катехоламинов, активация РАС и других
«стресс-гормонов», определяет основные побоч-
ные реакции при приеме препаратов (тахикар-
дия, аритмия, синдром «обкрадывания» с обо-
стрением стенокардии, покраснение лица и
другие симптомы гиперкатехоламинемии), ко-
торые являются неблагоприятными для функ-
ции сердца и почек.
Нифедипин длительного действия и непре-
рывного высвобождения (форма G1TS) обес-
печивает в течение длительного времени посто-
янную концентрацию препарата в крови, в
связи с чем они лишены перечисленных выше
побочных реакций и могут быть рекомендова-
ны для лечения нефрогенной гипертензии.
Вследствие кардиодепрессивного действия
верапамил может вызвать брадикардию, атрио-
вентрикулярную блокаду и в редких случаях
(при сердечной недостаточности в случае при-
менения больших доз) — атриовентрикулярную
диссоциацию. При приеме верапамила часто
развивается запор.
Хотя АК не вызывают негативных метабо-
лических явлений, безопасность их применения
в раннем периоде беременности еще не уста-
новлена.
Прием антагонистов кальция противопо-
казан при исходной гипотензии, синдроме
слабости синусового узла. Верапамил противо-
показан при нарушениях атриовентрикулярной
проводимости, синдроме слабости синусового
узла, выраженной сердечной недостаточности.
Блокаторы fl-адренергических рецепторов вхо-
дят в спектр лекарственных препаратов, пред-
назначенных для лечения ПГ.
Механизм антигипертензивного действия
блокаторов связывают с уменьшением величи-
ны сердечного выброса, торможением секреции
ренина почками, уменьшением ОПС, сниже-
нием высвобождения норадреналина из окон-
чаний постганглионарных симпатических не-
рвных волокон, уменьшением венозного при-
тока к сердцу и объема циркулирующей крови.
В табл. 8.4 представлены наиболее распростра-
ненные препараты этой группы.
Различают /(-блокаторы неселективные (бло-
кирующие и /(,-, /1,-адренорецепторы) и кар-
диоселективные, блокирующие преимуществен-
но /^-адренорецепторы. Некоторые из этих пре-
паратов (окспренолол, пиндолол, ацебутолол,
тали колол) обладают симпатомиметической
активностью, что дает возможность использо-
вать их при сердечной недостаточности, бради-
кардии, у больных бронхиальной астмой.
По длительности действия различают /(-бло-
каторы короткого (пропранолол, окспренолол,
метапролол, ацебуталол), среднего (пиндолол)
Таблица 8.4. Торговые названия и дозы /(-бло-
каторов
Препарат Торговое название Доза (мг) и кратность приема
• Пропранолол’ • Надолол* • Окспренолол* • Пиндолол* • Лабетолол** • Атенолол • Метопролол • Бетаксолол • Талинолол • Карведилол** Анаприлин, индерал, обзидан Коргард Тразикор Вискен Нормодин Тенормин, атенол, принорм Беталок, спесикор Локрен Корданум Дилатренд 80 х 2—4 80—320 х 2—4 120—400 х 2—4 10—60 х 3—4 200—1200 X 2-4 100—200 х 1—2 100-400 х 2—3 5—20 х 1—2 150—600 х 1—3 25—100 X 1—2
* Неселективные бета-блокаторы.
** Препараты, блокирующие а- и /(-рецепторы.
и длительного (атенолол, бетаксолол, соталол,
наполол) действия.
Существенным преимуществом этой группы
препаратов являются их антиангинозные свой-
ства, возможность профилактики развития ин-
фаркта миокарда, уменьшение или замедление
развития гипертрофии миокарда.
Почечные эффекты fl-блокаторов. Препара-
ты не вызывают угнетения почечного крово-
снабжения и снижения почечных функций. При
длительном лечении скорость клубочковой
фильтрации, диурез и экскреция натрия сохра-
няются в пределах исходных значений. При ле-
чении высокими дозами препаратов блокиру-
ется РААС и возможно развитие гиперкалиемии.
Побочные действия /(-блокаторов. Могут раз-
виться выраженная синусовая брадикардия
(ЧСС менее 50 в 1 мин), артериальная гипо-
тензия, усиление левожелудочковой недостаточ-
ности, атриовентрикулярная блокада различной
степени, обострение бронхиальной астмы или
другого хронического обструктивного заболева-
ния легких, гипогликемия (особенно у больных
с лабильным течением сахарного диабета); обо-
стрение перемежающейся хромоты и синдро-
ма Рейно; развитие гиперлипидемии; в редких
случаях наблюдают нарушение половой функ-
ции.
/(-Адреноблокаторы противопоказаны
при острой и хронической сердечной недоста-
точности, выраженной брадикардии, синдроме
слабости синусового узла, атриовентрикулярной
блокаде II и III степени, бронхиальной астме
и тяжелых бронхообструктивных заболеваниях.
Диуретики. Диуретики — препараты, специ-
ально предназначенные для выведения натрия
и воды из организма. Суть действия всех моче-
гонных препаратов сводится к блокаде реабсор-
ции натрия и последовательному снижению ре-
12—2950
177
абсорбции воды при прохождении натрия че-
рез нефрон (см. раздел 9.7).
Гипотензивное действие натрийуретиков ос-
новано на уменьшении ОЦК и сердечного
выброса за счет потери части обменноспособ-
ного натрия и уменьшения ОПС вследствие
изменения ионного состава стенок артериол
(выхода натрия), а также уменьшения их чув-
ствительности к прессорным вазоактивным гор-
монам. Кроме того, при проведении сочетан-
ной терапии гипотензивными препаратами ди-
уретики могут блокировать натрийзадерживаю-
щий эффект основного гипотензивного препа-
рата, потенцировать гипотензивный эффект,
при этом можно несколько расширить солевой
режим, сделав диету более приемлемой для
больных.
Для лечения ПГ у больных с сохранной
функцией почек наибольшее распростра-
нение получили мочегонные препараты, дей-
ствующие в области дистальных канальцев, —
группа тиазидных (гипотиазид, эзидрекс) и ти-
азидоподобных диуретиков, таких как индапа-
мид (арифон).
Для лечения АГ применяют небольшие дозы
гипотиазида — 12,5—25 мг 1 раз в сутки. Выде-
ляется препарат в неизменном виде через поч-
ки. Гипотиазид обладает свойством снижать ско-
рость клубочковой фильтрации, в связи с чем
применение его противопоказано при почечной
недостаточности — уровне креатинина крови
более 2,5 мг%, СКФ менее 30 мл/мин.
Индапамид (арифон) — новое гипотензивное
средство диуретического ряда. Благодаря своим
липофильным свойствам арифон избирательно
концентрируется в стенке сосудов и имеет дли-
тельный период полувыведения — 18 ч. Гипо-
тензивная доза препарата — 2,5 мг арифона
1 раз в день. Механизм его гипотензивного дей-
ствия связывают со способностью препарата
стимулировать продукцию простациклина и тем
самым вызывать сосудорасширяющий эффект,
а также со свойством уменьшать содержание
свободного внутриклеточного кальция, что
обеспечивает меньшую чувствительность сосу-
дистой стенки к действию прессорных аминов.
Диуретический эффект препарата развивает-
ся на фоне приема больших терапевтических доз
(до 40 мг арифона в сутки).
Для лечения ПГ у больных с нарушенной
функцией почек и при сахарном диабете ис-
пользуют диуретики, действующие в области
петли Генле, — петлевые диуретики. Из петле-
вых диуретиков в клинической практике наи-
более распространены фуросемид (лазикс),
этакриновая кислота (урегит), буметанид (бу-
ринекс).
Фуросемид обладает мощным натрийурети-
ческим эффектом. Параллельно с потерей на-
178
трия при применении фуросемида увеличива-
ется выведение из организма калия, магния и
кальция. Период действия препарата корот-
кий — 6 ч, диуретический эффект дозозависим.
Препарат обладает способностью увеличивать
скорость клубочковой фильтрации, в связи с
чем показан больным с почечной
недостаточностью.
Фуросемид назначают по 40—120 мг в сут-
ки внутрь, внутримышечно или внутривенно до
250 мг в сутки.
Побочные действия диуретиков. Среди побоч-
ных эффектов всех диуретических препаратов
наибольшее значение имеет гипокалиемия (бо-
лее выраженная при приеме тиазидовых диуре-
тиков). Коррекция гипокалиемии особенно важ-
на у больных с гипертензией, так как калий сам
по себе способствует снижению АД. При сни-
жении калия ниже 3,5 ммоль/л следует добав-
лять калийсодержащие препараты. Среди дру-
гих побочных явлений имеют значение гиперг-
ликемия (тиазиды, фуросемид), гиперурикемия
(более выраженная при применении тиазидо-
вых диуретиков), развитие дисфункции желу-
дочно-кишечного тракта, импотенция.
(Х-Адреноблокаторы. Из этой группы гипотен-
зивных препаратов наибольшее распростране-
ние получили празозин (пратсиол, минипресс,
адверзутен) и в последние годы новый препа-
рат — доксазозин (кардура).
Празозин (пратсиол, минипресс, адверзутен) —
селективный антагонист пресинаптических ре-
цепторов. Гипотензивный эффект препарата
связан с прямым уменьшением ОПС. Празозин
расширяет венозное русло, уменьшает преднаг-
рузку, что делает оправданным его применение
у больных с сердечной недостаточностью.
Гипотензивное действие празозина при при-
еме внутрь наступает через ‘/2—3 ч и сохраня-
ется в течение 6—8 ч. Период полувыведения —
3 ч. Препарат выводится через желудочно-
кишечный тракт, в связи с чем не требуется
коррекции дозы при почечной недостаточ-
ности.
Начальная лечебная доза празозина 0,5—
1 мг/сут; в течение 1—2 нед дозу увеличивают
до 3—20 мг/сут (в 2—3 приема). Поддерживаю-
щая доза составляет 5—7,5 мг/сут.
Празозин благоприятно влияет на функцию
почек — увеличивает почечный кровоток, ве-
личину клубочковой фильтрации. Препарат об-
ладает гиполипидемическими свойствами, мало
влияет на электролитный метаболизм. Перечис-
ленные свойства способствуют назначению
препарата при хронической почечной недоста-
точности.
В качестве побочных действий отме-
чены постуральная гипотензия, головокруже-
ния, сонливость, сухость во рту, импотенция.
Доксазозин (кардура) структурно близок к
празозину, но обладает длительным действием.
Препарат значительно снижает ОПС. Большим
преимуществом доксазозина является его бла-
гоприятное влияние на метаболизм. Препарат
обладает выраженными антиатеро-
генными свойствами — снижает уровень
холестерина, холестерина ЛПНП и ЛПОНП,
увеличивает ЛВП. Одновременно не выявлено
его отрицательного воздействия на углеводный
обмен. Указанные свойства делают доксазозин
препаратом выбора при лечении АГ у
больных сахарным диабетом.
Доксазозин, так же как и празозин, благо-
приятно влияет на почечную функцию, что оп-
ределяет его использование у больных ПГ в
стадии почечной недостаточности.
При приеме препарата пик концентрации в
крови наступает через 2—4 ч; период полувы-
ведения колеблется от 16 до 22 ч. Лечебные до-
зы — 1—8 мг 1 раз в день.
Среди побочных эффектов отмечают
головокружение, тошноту, головную боль, у
лиц пожилого возраста — гипотонию.
Лечение артериальной гипертензии в стадии
хронической почечной недостаточности. Развитие
выраженной ХПН (СКФ 30 мл/мин и ниже)
вносит свои коррективы в лечение АГ. При
ХПН требуется, как правило, комплексная те-
рапия АГ, включающая ограничение соли в
диете без ограничения жидкости, выведение
избытка натрия с помощью салуретиков и при-
менение эффективных гипотензивных препара-
тов и их сочетаний.
Из диуретиков (салуретиков) наиболее эф-
фективны фуросемид и этакриновая кислота,
доза которых может увеличиваться до 300 и
150 мг/сут соответственно. Оба препарата не-
сколько повышают СКФ и значительно увели-
чивают экскрецию калия. Их обычно назнача-
ют в таблетках, а при ургентных состояниях
(отеке легких) — внутривенно. При примене-
нии больших доз следует помнить о возможно-
сти ототоксического действия. В связи с тем что
одновременно с задержкой натрия при ХПН
нередко развивается гиперкалиемия, калийсбе-
регающие диуретики применяют редко и с боль-
шой осторожностью. Тиазидовые диуретики (ги-
потиазид, циклометазид, оксодолин и др.)
противопоказаны при ХПН. Антагонис-
ты кальция — одна из основных групп гипотен-
зивных препаратов, применяемых при ХПН.
Препараты благоприятно влияют на почечный
кровоток, не вызывают задержки натрия, не ак-
тивируют РАС, не влияют на липидный обмен.
Часто используют сочетание препаратов с /3-
блокаторами, симпатолитиками центрального
действия (например, коринфар + анаприлин +
+ допегит и др).
При тяжелой, рефрактерной к лечению и
при злокачественной АГ больным ХПН на-
значают и-АПФ (каптоприл, ренитек, три-
таце и др.) в сочетании с салуретика-
ми и /3-блокаторами, но доза препарата долж-
на быть уменьшена с учетом снижения его вы-
деления по мере прогрессирования ХПН. Необ-
ходим постоянный контроль за СКФ и уровнем
азотемии, так как при преобладании реноваску-
лярного механизма АГ может резко снижаться
фильтрационное давление в клубочках и СКФ.
При неэффективности медикаментозной те-
рапии показаны экстракорпоральные методы
выведения избытка натрия: изолированная уль-
трафильтрация, гемодиализ (ГД), гемофильтра-
ция. Подробно тактика лечения ПГ у больных,
леченных гемодиализом и после транспланта-
ции почек, освещена в соответствующих раз-
делах руководства. Мы остановимся на общих
положениях.
В терминальной стадии ХПН после перево-
да на программный ГД лечение объем-натрий-
зависимой АГ заключается в соблюдении адек-
ватного режима ГД и ультрафильтрации и со-
ответствующего водно-солевого режима в меж-
диализный период для поддержания так назы-
ваемого сухого веса. При необходимости допол-
нительного антигипертензивного лечения при-
меняют антагонисты кальция или симпатоли-
тики. При выраженном гиперкинетическом син-
дроме, помимо лечения анемии и хирургичес-
кой коррекции артериовенозной фистулы, по-
лезно применение /3-блокаторов в небольших
дозах. В то же время, поскольку фармакокине-
тика /3-блокаторов при ХПН не нарушается, а
большие дозы их подавляют секрецию ренина,
эти же препараты используют и при лечении
ренинзависимой АГ в сочетании с вазодилата-
торами и симпатолитиками.
Более эффективными при АГ, не контроли-
руемой ГД, нередко оказываются /3- + «-бло-
каторы, антагонисты кальция и особенно
и-АПФ, причем необходимо учитывать, что
каптоприл активно выводится во время проце-
дуры ГД (до 40 % за 4-часовой ГД). При отсут-
ствии эффекта антигипертензивной терапии
при подготовке больного к пересадке почки
прибегают к двусторонней нефрэктомии для
перевода ренинзависимой неконтролируемой
АГ в ренопривную объем-натрийзависимую
контролируемую форму.
При лечении АГ, вновь развивающейся у
больных, находящихся на ГД и после транс-
плантации почки (ТП), важно выявление и
устранение причин: коррекция дозы медика-
ментов, способствующих АГ (эритропоэтин,
кортикостероиды, сандиммун), хирургическое
лечение стеноза артерии трансплантата, резек-
ция паращитовидных желез, опухолей и т.д.
12*
179
В фармакотерапии АГ после ТП в первую оче-
редь применяют антагонисты кальция и и-АПФ,
а к диуретикам относятся с осторожностью, по-
скольку они усиливают нарушения липидного
обмена и могут способствовать формированию
атеросклероза, ответственного за ряд осложне-
ний после ТП.
В заключение можно констатировать, что на
современном этапе имеются большие возмож-
ности для лечения ПГ на всех стадиях ее раз-
вития: при сохранной функции почек, на ста-
дии хронической и терминальной почечной не-
достаточности, при лечении программным ГД
и после трансплантации почки. Выбор антиги-
пертензивных препаратов должен основывать-
ся на четком представлении о механизмах раз-
вития АГ и уточнении ведущего механизма в
каждом конкретном случае.
8.2. Реноваскулярная
гипертензия
Реноваскулярная гипертензия обусловлена сте-
нозом почечной артерии и ишемией почки. Она
встречается у 1—5 % лиц с артериальной ги-
пертензией и является самой частой потенци-
ально курабельной формой артериальной гипер-
тензии.
8.2.1. Этиология
Стеноз почечной артерии в большинстве слу-
чаев является следствием местного атероскле-
роза или фибромускулярной гиперплазии,
реже — неспецифического аортоартериита. Ате-
росклероз почечных артерий, почти в полови-
не случаев двусторонний с сужением обычно
в проксимальной трети, чаще наблюдается у
мужчин старше 50 лет с другими признаками
атеросклероза. Атеросклеротические изменения
почечных артерий могут быть непропорцио-
нальны выраженности общего атеросклероза и
других его (включая сердечные) проявлений,
выраженности гиперлипидемии. Фибромуску-
лярная гиперплазия у четверти больных двусто-
ронняя с вовлечением чаще средней или дис-
тальной трети почечной артерии и ее разветв-
лений, а также аортоартериит чаще наблюда-
ются у молодых женщин.
Изредка реноваскулярная гипертензия обус-
ловлена тромбозом почечных артерий или ее
ветвей (при абдоминальной травме, как ослож-
нение почечной ангиографии или ангиопласти-
ки, при мерцании предсердий), сдавлением по-
чечной артерии опухолью (например, надпочеч-
ника) или почечной кистой, перегибом артерии
при смещении почки, аневризмой артерии. Она
ISO
может возникнуть при расслаивающей аневриз-
ме артерии, после пересадки почки, вследствие
местной радиационной терапии. По-видимому,
реноваскулярная гипертензия может быть связа-
на и с некоторыми пороками развития почки и
почечной артерии [Арабидзе Г.Г., 1992].
Реноваскулярная гипертензия возникает при
перекрытии артерии по крайней мере наполо-
вину. Возможны стенозы почечной артерии,
даже значительные, без гипертензии. Стенозы
почечной артерии, связанные с атеросклерозом
и фибромускулярной гиперплазией, могут про-
грессировать, даже если интенсивным гипотен-
зивным лечением удается поддерживать нор-
мальное АД. Нарастание стеноза постепенно, на
протяжении месяцев и лет, может привести к
более тяжелому или злокачественному течению
гипертензии, а также к хронической почечной
недостаточности.
8.2.2. Патогенез
Хотя реноваскулярная гипертензия обусловле-
на сосудистым заболеванием, патогенез соб-
ственно гипертонии связан с патологическими
процессами в почках. Механизм становления ре-
новаскулярной гипертензии, начало изучению
которого было положено Гольдблатом в 1934 г.
(правда, в условиях острого опыта, а не посте-
пенного нарастания ишемии почки), изучен
довольно полно. Он обусловлен активацией ре-
нин-ангиотензин-алъдостероновой системы вслед-
ствие ишемии почки на стороне поражения.
У части больных дополнительно заметна акти-
вация симпатической системы, возможно по-
вышение сосудистой реактивности на вазоак-
тивные вещества. Эти факторы могут быть пред-
ставлены у разных больных в разной пропор-
ции. Несмотря на то что повышение АД улуч-
шает перфузию почки и иногда приводит к
снижению выработки ренина (или препятству-
ет ее чрезмерному повышению), возникающий
вследствие гипертензии артериолосклероз кон-
тралатеральной почки способствует нефроскле-
розу и стабилизации гипертензии.
Со временем (обычно в течение нескольких
лет) ишемизированная почка уменьшается,
функция ее снижается, иногда присоединяет-
ся хронический пиелонефрит. Развитие хрони-
ческой почечной недостаточности возможно
как при двустороннем (чаще), так и односто-
роннем стенозе.
8.2.3. Диагностика
Подозрение на реноваскулярную гипертензию
возникает в том случае, когда появляется тя-
желая артериальная гипертензия или имевша-
яся ранее гипертензия резко утяжеляется и ста-
новится рефрактерной к лечению у мужчин
старше 50 лет или у женщин моложе 30 лет.
Гипертензия сопровождается неспецифической
симптоматикой, признаками увеличения лево-
го желудочка, изменениями глазного дна. По-
дозрение становится более основательным,
если, кроме того, в области пупка, латераль-
ное срединной линии, или над почками со
стороны спины выслушивается (лучше при
положении больного лежа) сосудистый шум
и(или) если обнаруживаются внепочечные при-
знаки сосудистого заболевания, например асим-
метрия АД [Арабидзе Г.Г., 1992]. Изменчивый
сосудистый шум над областью почки выявля-
ется примерно у половины больных с реновас-
кулярной гипертензией. Этот признак не явля-
ется специфичным, он изредка встречается и
у здоровых лиц, у лиц с артериальной гипер-
тензией другой природы, при атеросклерозе
аорты. Примерно у 25—30 % больных, особен-
но при двустороннем стенозе, гипертензия
протекает в злокачественной форме. Возможно
развитие левожелудочковой недостаточности.
Характерна плохая переносимость (падение
функции почек) ингибиторов АПФ, чаще при
двустороннем стенозе, которая, однако, исче-
зает после успешной транслюминальной ангио-
пластики.
Анализы крови и мочи в первые месяцы
болезни обычно нормальные. У части больных
могут быть заметны признаки вторичного ги-
перальдостеронизма, в частности гипокалие-
мия, изредка выявляется небольшой эритроци-
тоз.
У некоторых больных обнаруживают проте-
инурию, редко значительную, или небольшую
эритроцитурию или лейкоцитурию и другие
признаки присоединившегося пиелонефрита.
К моменту установления диагноза у части боль-
ных, особенно при двустороннем стенозе, кре-
атинин сыворотки превышает 2 мг%. При по-
дозрении на реноваскулярную гипертензию
больных следует по возможности быстро на-
правлять в стационар или диагностический
центр для специального обследования.
Диагноз ставят главным образом на основа-
нии сравнительно более специфических инстру-
ментальных и лабораторных данных. Не существу-
ет единообразного подхода к диагностике рено-
васкулярной гипертензии. Сравнительная цен-
ность разных методов (с учетом их информатив-
ности, риска и стоимости) освещена в обобща-
ющих работах последних лет [Арабидзе Г.Г., 1992;
Stimpel М., 1996; Ruggenenti Р., Remuzzi G.,
1997; Badr К., Brenner В., 1998; Mann F.,
Altenberg J., 1998, и др.].
Важное значение имеет сравнение размеров
обеих почек, что достигается посредством ульт-
развукового исследования, экскреторной уро-
графии, сцинтиграфии или компьютерной то-
мографии. В типичных случаях ишемизирован-
ная почка уменьшена на 1,5 см и более. Одна-
ко асимметрия размеров почек может быть свя-
зана и с другими причинами. Экскреторная
урография с быстрым введением контрастного
вещества и ежеминутными снимками позволя-
ет дополнительно выявить запаздывание (на
минуту и более) контрастирования почки на по-
раженной стороне. Эта особенность может быть
установлена и при сцинтиграфии, если исполь-
зуется техника, позволяющая оценить быстро-
ту накопления изотопа в каждой почке. Сцин-
тиграфия информативна и при уже имеющей-
ся почечной недостаточности. Эти неинвазив-
ные методы позволяют выявить, асимметрию
у 75—90 % больных со стенозом почечной ар-
терии. Прием 25—50 мг каптоприла за час до
исследования снижает клубочковую фильтра-
цию постстенотической почки, повышая таким
образом чувствительность метода. Нормальная
сцинтиграмма после ингибирования АПФ по-
зволяет с большой вероятностью исключить ге-
модинамически значимый стеноз почечной
артерии. Однако надо иметь в виду трудности
трактовки при двустороннем стенозе и воз-
можность ложноположительных результатов у
больных артериальной гипертензией другого
генеза.
Допплеровское ультразвуковое исследование
выявляет ускорение кровотока в месте стеноза
(сравнительно со скоростью кровотока в брюш-
ной аорте) и может быть информативно для
выявления стеноза почечной артерии переса-
женной почки, которая расположена более по-
верхностно.
Некоторое диагностическое значение имеют
выявление повышенной активности ренина в пе-
риферической крови и существенное увеличе-
ние ее под влиянием каптоприла. Это исследова-
ние проводят через 7 дней после отмены ги-
потензивного лечения. Трактовка результатов
должна быть осторожной. Значительное повы-
шение активности ренина в плазме крови пос-
ле введения каптоприла свидетельствует о ре-
нинзависимой гипертензии. Необходимо отме-
тить, что повышение активности ренина воз-
можно у больных злокачественной гипертензией
различной природы, у части больных гломеру-
лонефритом с гипертоническим синдромом,
при наличии ренинсекретирующей опухоли, во
время беременности, а также примерно у 10—
15 % больных гипертонической болезнью. По-
вышение активности ренина в периферической
крови позволяет исключить первичный гипер-
альдостеронизм. У многих больных реноваску-
лярной гипертензией активность ренина в пе-
риферической крови нормальная.
181
Решающее значение для установления диаг-
ноза имеют результаты брюшной аортографии.
Это инвазивное исследование целесообразно
проводить главным образом в порядке пред-
операционного обследования у больных, у ко-
торых предыдущие исследования свидетельство-
вали в пользу стеноза почечной артерии. Иссле-
дование связано с риском (порядка 5—10 %)
ухудшения функции почек, особенно при уже
имеющемся снижении функции и при наличии
сахарного диабета. Аортография позволяет ус-
тановить локализацию и выраженность стено-
за, распространенность и характер сосудистого
поражения, состояние сосудов контралатераль-
ной почки.
На основании этих данных иногда можно су-
дить и о природе стеноза. Аортографию неце-
лесообразно проводить у лиц, которые заведо-
мо не являются подходящими кандидатами для
транслюминальной ангиопластики или хирур-
гического лечения.
Для суждения о прогнозе результатов хирур-
гического лечения важно показать, что гипер-
тензия связана именно с ишемией почки на
пораженной стороне. Это может быть установ-
лено с известной (но не абсолютной) надеж-
ностью по разнице в активности ренина в ве-
нозной крови, оттекающей из каждой почки,
для чего необходима раздельная катетеризация
вен обеих почек. Если активность ренина на
пораженной стороне в 1,5—2 раза (и более)
выше, есть основания связать гипертензию с
ишемией почки и предсказать полный или ча-
стичный гипотензивный эффект устранения
стеноза. Разница в активности ренина иногда
обнаруживается и при других несимметричных
или симметричных поражениях почек. При дву-
стороннем стенозе эта разница может отсутство-
вать. Однако и при одностороннем стенозе, и
при отсутствии разницы в активности ренина
коррекция стеноза позволяет у значительной
части больных снизить или нормализовать АД.
Предлагают способы математического прогно-
зирования послеоперационного АД на основе
комплекса дооперационных параметров [Пет-
ров В.И. и др., 1984].
8.2.4. Лечение
Проводят чрескожную баллонную дилатацию
стенозированного участка артерии или выпол-
няют значительно более эффективную рекон-
структивную операцию на артерии. Эти вмеша-
тельства, если они осуществляются не слиш-
ком поздно, позволяют у большинства больных
нормализовать или снизить АД либо сделать его
более податливым для лекарственного лечения,
даже если гипертония была злокачественной,
182
и предотвратить снижение функции почек. Дли-
тельного снижения АД при фибромускулярной
гиперплазии удается добиться чаще, чем при
атеросклеротическом стенозе почечной арте-
рии, который к тому же чаще сочетается с
обычной гипертонической болезнью. Результа-
ты операции несколько хуже, операционная ле-
тальность выше у больных старших возрастных
групп. В дальнейшем, поскольку основная бо-
лезнь этим вмешательством не устраняется, воз-
можны рецидивы стеноза или появление его в
новом месте. Поэтому как до, так и после опе-
рации важно лечить основное заболевание.
В этом плане большего эффекта удается достичь
при аортоартериите, при котором адекватное
противовоспалительное лечение сдерживает
развитие болезни. После транслюминальной
ангиопластики полезно не менее 3 мес для
профилактики тромбоза принимать ацетилсали-
циловую кислоту в дозе 200 мг/сут. После аор-
топочечного шунтирования проводят длитель-
ное (или пожизненное) лечение антикоагулян-
тами непрямого действия. Если реконструктив-
ная операция технически невозможна, произ-
водят нефрэктомию. Хирургические аспекты ле-
чения реноваскулярной гипертонии подробно
излагают F.Mann, J.Allenberg (1998).
Если инвазивное лечение признано непока-
занным, то, помимо лечения основного забо-
левания, используют обычную гипотензивную
терапию. Она включает общие меры и лекар-
ственное лечение — главным образом -адре-
ноблокаторами и антагонистами кальция про-
лонгированного действия. При этой патологии
диуретики и ингибиторы АПФ не являются
средствами первого ряда. При двустороннем
стенозе или стенозе почечной артерии един-
ственной почки ингибиторы АПФ проти-
вопоказаны, поскольку они понижают то-
нус преимущественно эфферентной артериолы
и могут ухудшить функцию ишемизированной
почки вследствие уменьшения градиента филь-
трационного давления. При одностороннем сте-
нозе лечение ингибиторами АПФ также может
осложниться развитием почечной недостаточ-
ности, хотя и реже. Диуретики должны исполь-
зоваться с осторожностью, поскольку они уве-
личивают выделение натрия контралатеральной
почкой, что еще более увеличивает выброс
ренина.
Ишемизированная почка особенно чувстви-
тельна к резким колебаниям АД. Любое быст-
рое снижение АД сравнительно легко может
ухудшить клубочковую фильтрацию и функцию
почки на стороне поражения, что наиболее
опасно при двустороннем стенозе. Поэтому в
процессе лечения важно особенно тщательно
контролировать динамику АД, диурез и фун-
кцию почек.
8.3. Злокачественная
артериальная гипертензия
К злокачественной относят тяжелую артери-
альную гипертензию с отеком зрительного
нерва или обширными экссудатами (часто и
с геморрагиями) на глазном дне, с ранним и
быстро нарастающим поражением почек,
сердца, мозга. АД обычно стойко превыша-
ет 220/130 мм рт. ст.
Гемодинамика характеризуется резким повы-
шением общего периферического сосудистого
сопротивления, особенно почечного, снижени-
ем почечного кровотока и повышением филь-
трационной фракции. Характерной морфоло-
гической особенностью у большинства
больных является тяжелое поражение артери-
ол, преимущественно почечных — фибриноид-
ный некроз с элементами пролиферативного
эндартериита. Участки сужения сосудов череду-
ются с участками их паралитического расши-
рения. Увеличение проницаемости сосудистой
стенки с плазматическим пропитыванием ак-
тивирует механизмы свертывания. Поражение
сосудов напоминает изменения при ангиопати-
ческой гемолитической анемии. Все это наряду
с микротромбозами и инфарктами в условиях
чрезмерного повышения АД обусловливает вы-
раженную местную ишемию и поражение ор-
ганов.
Злокачественная АГ может быть формой
гипертонической болезни или (сейчас значи-
тельно чаще) симптоматической гипертензии.
Гипертоническая болезнь или симптоматичес-
кая гипертензия могут приобрести злокаче-
ственные черты в процессе развития. Подобная
эволюция практически не наблюдается на фоне
адекватного гипотензивного лечения.
Понятия «злокачественный нефросклероз»,
«злокачественная гипертония» ввели Фольгард
и Фар (1914), отнесшие в эту группу 13 % на-
блюдаемых ими больных гипертензией. Эти тер-
мины отражали абсолютно плохой прогноз:
нелеченые больные погибали менее чем через
2 года после установления диагноза в связи с
почечной, сердечной недостаточностью и(или)
инсультом. На протяжении XX в. распространен-
ность этой патологии претерпела необычную
динамику с резким подъемом в 40-е годы (что
связывают с военным психоэмоциональным
стрессом, неблагоприятно влияющим на любую
гипертензию) и значительным снижением в
последующие десятилетия. Е.М.Тареев (1948,
1972) нашел злокачественную гипертоническую
болезнь у 7,5 % «гипертоников» в 1936 г., у
23,5 % — в 1946 г. и у 1 % —в 1965 г. Сходную
динамику для злокачественной АГ приводят за-
рубежные авторы. G.Williams (1998) указывает,
что в настоящее время злокачественная АГ ста-
ла совсем редкой и в целом развивается, по-
видимому, менее чем у 1 % больных эссенци-
альной или вторичной гипертензией. Большую
частоту приводит Г.Г.Арабидзе (1985) на мате-
риале стационара Кардиологического центра,
где концентрируются больные с тяжелой АГ;
при некоторых симптоматических гипертониях
частота злокачественной формы достигает 30 %.
Злокачественный характер АГ, видимо,
обусловлен присутствием или наложением до-
полнительного патогенетического фактора.
Е.М.Тареев настойчиво рассматривал злокаче-
ственную гипертоническую болезнь как особую
форму болезни, полемизируя с другими авто-
рами, рассматривавшими ее как фазу или ста-
дию эссенциальной гипертензии. Можно ду-
мать, что выраженные изменения сосудов мо-
гут быть непосредственным следствием повреж-
дающего действия на сосуды любой тяжелой
нелеченой АГ [Тареев Е.М., 1972; Schwartz G.,
Strong С., 1987]. Повреждение сосудов, по-ви-
димому, определяется высотой и длительнос-
тью гипертензии и возможно как при первич-
ном заболевании, так и при гипертоническом
синдроме. Результатом является ишемия почек,
стимуляция ренин-ангиотензин-альдостероно-
вой системы и, возможно, других вазоактивных
констрикторных гуморальных систем на фоне
снижения депрессорной функции почек. Таким
образом, сочетание сосудистого повреждения с
массивным выбросом вазоконстрикторов позво-
ляет понять особую тяжесть течения и упорство
такой гипертензии, быстрое и тяжелое повреж-
дение органов. Любопытно отметить, что иногда
обнаруживают элементы иммунопатологии, им-
мунные комплексы в сосудистой стенке [Cain Н.
et al., 1970]. СОЭ, отражающая диспротеине-
мию, нередко увеличена при злокачественной
АГ. Однако тяжелейшие сосудистые изменения,
как и изменения глазного дна, потенциально
обратимы (в течение нескольких недель) в слу-
чае адекватного и настойчивого гипотензивно-
го (не противовоспалительного, как при узел-
ковом периартериите) лечения.
По мере совершенствования диагностики
симптоматических гипертоний и расширения
доступности гипотензивного лечения столь зна-
чительные сосудистые повреждения встречают-
ся реже. По-видимому, это — главная причина
повсеместного урежения злокачественной АГ.
Хотя в нашей стране эффективным гипотензив-
ным лечением в целом охвачено около 8 % боль-
ных АГ [Арабидзе Г.Г., 1997], естественно пред-
положить, что в эти 8 % попадают преимуще-
ственно больные с более тяжелым течением АГ.
183
8.3.1. Клиническая картина
Проявления злокачественной гипертонической
болезни детально описаны Е.М.Тареевым
(1972) на основании собственного обширного
опыта. Проявления злокачественного гиперто-
нического синдрома в общем сходны. Злокаче-
ственная АГ возможна у лиц любого пола и
возраста, но чаще возникает у мужчин 30—50
лет. Анамнез, как правило, непродолжителен —
1—2 мес тяжелой гипертензии (порядка 220/130
мм рт. ст. и более без ночного снижения), не
поддающейся обычному лечению часто уже с
признаками поражения органов-мишеней.
В типичных случаях больные бледны (резуль-
тат генерализованного сосудистого спазма),
склонны к потере массы тела вплоть до исто-
щения.
Если исследование глазного дна выявляет
значительные экссудаты и(или) папилледему
(отек диска зрительного нерва), АГ можно от-
нести к злокачественной. Преходящее снижение
зрения на один или оба глаза иногда бывает
начальной жалобой. Следует отметить, что па-
пилледема, часто рассматриваемая в качестве
патогномоничного признака злокачественной
АГ, изредка наблюдается, как и значительные
экссудаты, при нетяжелой ренопаренхиматоз-
ной АГ [Heidbreder Е. et al., 1986].
Одышка, сердечная астма или отек легких,
усиление и смещение латерально-верхушечно-
го толчка, тахикардия, трехчленный ритм со-
ответствуют перегрузке и декомпенсации левого
желудочка. Развитие сердечной недостаточнос-
ти может сопровождаться определенным сни-
жением систолического АД. Выраженность ги-
пертрофии и дилатации левого желудочка уточ-
няются при эхокардиографическом исследова-
нии. Увеличение левого желудочка подтвержда-
ется по ЭКГ и рентгенологически. Возможны
боли стенокардического типа и электрокарди-
ографические признаки коронарной недоста-
точности. У некоторых больных появляется про-
тодиастолический шум относительной аорталь-
ной недостаточности. Изредка злокачественная
АГ осложняется возникновением расслаиваю-
щей аневризмы аорты.
Олигурия, нарастающая азотемия, анемия
отражают раннее развитие терминальной почеч-
ной недостаточности, что весьма характерно
для злокачественной АГ и скорее необычно для
гипертонической болезни «доброкачественного»
течения. Выраженное сморщивание почек на-
блюдается при этом лишь у части больных.
Гипертоническая энцефалопатия может быть
довольно яркой — тяжелая головная боль, бес-
покойство или сонливость, рвота, судороги,
ступор, нарушения мозгового кровообращения
(иногда преходящие). Любой из описанных сим-
184
птомов может быть начальным признаком зло-
качественной АГ.
При лабораторном обследовании выявляет-
ся анемия часто с элементами гемолиза, с фраг-
ментацией эритроцитов, ретикулоцитозом; ко-
агулопатия по типу диссеминированного сосу-
дистого свертывания с развитием тромбоцито-
пении, появлением продуктов деградации фиб-
риногена в крови и моче. СОЭ часто увеличена.
Креатинин крови может быть повышен. У боль-
шинства больных обнаруживается высокая ак-
тивность ренина крови и повышенное содержа-
ние альдостерона. Гипонатриемия (и гиповоле-
мия) возникает чаще, чем при других гиперто-
нических состояниях, и заставляет быть осмот-
рительным при использовании диуретиков. Воз-
можна гипокалиемия (в результате гиперальдо-
стеронизма), сменяющаяся по мере нарастания
почечной недостаточности гиперкалиемией.
Характерны снижение относительной плот-
ности мочи, протеинурия (редко значительная с
развитием нефротического синдрома), эритро-
цитурия. При снижении АД протеинурия может
уменьшиться.
Дальнейшее обследование и лечение долж-
ны проводиться в специализированном стаци-
онаре. Неотложной диагностической задачей
является дифференцирование между злокаче-
ственной формой гипертонической болезни
(очень редкой) и злокачественным гипертони-
ческим синдромом (как правило) и уточнение
нозологического диагноза, поскольку неотлож-
ная терапия, в которой эти больные нуждают-
ся, частично определяется природой АГ. Пред-
шествующий анамнез (гипертоническая болезнь
обычного течения, заболевания почек, некото-
рые васкулиты, особенно узелковый периарте-
риит, выраженный атеросклероз, прием кон-
трацептивов женщинами и др.) может иметь
некоторое диагностическое значение. Однако
наиболее информативно и доказательно целе-
направленное лабораторно-инструментальное
обследование.
8.3.2. Лечение
Злокачественная АГ является неотложным со-
стоянием, и лечение следует начинать в стаци-
онаре. Хотя не существует стандартного алго-
ритма, разумно считать начальной целью лече-
ния снижение АД в течение 2 сут на ‘/3 (диас-
толического — до 95—110 мм рт. ст., не ниже)
и борьбу с осложнениями. Это достигается ис-
пользованием в течение нескольких дней быс-
тродействующих гипотензивных средств, вводи-
мых внутривенно. Дальнейшее снижение АД
должно проводиться медленно (на протяжении
недель) и осторожно, чтобы избежать гипопер-
фузии органов и дальнейшего ухудшения их
функций. Это лечение ориентировано на дли-
тельный срок (месяцы, годы) и предполагает
использование гипотензивных препаратов дли-
тельного действия, принимаемых внутрь. Как
правило, необходимо ограничение
пищевой поваренной соли с учетом
функции почек и содержания натрия в крови.
Для начального лечения удобен нитропруссид
натрия, который вводят путем длительной ка-
пельной инфузии со скоростью 0,2—8 мкг/кг в
1 мин (лучше с использованием инфузомата).
Действие начинается в пределах минуты после
начала инфузии или после изменения скорости
инфузии и поддерживается на протяжении все-
го введения. Необходим постоянный и тщатель-
ный контроль АД и скорости введения препа-
рата. При этих условиях можно во время инфу-
зии поддерживать АД на желаемом уровне и при
меняющемся состоянии больного. Длительные
инфузии мы повторяли в течение 3 дней, но
описывают лечение нитропруссидом и до 6 дней
без токсических осложнений. Возможно также
использование нитроглицерина внутривенно (5—
100 мкг/мин), особенно если выражена коронар-
ная и левожелудочковая недостаточность.
Применяют диазоксид по 50—150 мг внутри-
венно струйно. Действие начинается через 1—
5 мин после введения и продолжается 4—12 ч.
Возможно повторение введения через 10 мин,
если эффект недостаточен. Общая доза не дол-
жна превышать 600 мг/сут. Поскольку доза не
титруется, введение диазоксида изредка приво-
дит к чрезмерному снижению АД. Диазоксид
увеличивает сократительность миокарда, и его
нельзя использовать, если злокачественная АГ
осложнилась инфарктом миокарда или рассла-
ивающей аневризмой аорты.
Эналаприл внутривенно может быть эффек-
тивен как при гипертензии, так и при левоже-
лудочковой недостаточности. Лабеталол — а- и
/Гадреноблокатор — может быть особенно по-
лезен при выраженной коронарной недостаточ-
ности. В связи с 3-блокирующими свойствами
он противопоказан при сердечной недостаточ-
ности, бронхиальной астме, брадиаритмиях и
в случае предшествующего лечения 0-адрено-
блокаторами. Иногда эффективен верапамил
внутривенно (5—10 мг струйно, затем капель-
но) с обычными для верапамила ограничени-
ями. Верапамил не сочетается с лабеталолом и
/1-адреноблокаторами.
Фуросемид внутрь или внутривенно способ-
ствует снижению АД, противодействует отеку
мозга и сердечной недостаточности. Дигоксин
может быть полезен дополнительно при нали-
чии сердечной недостаточности (противопока-
зан пои коронарной недостаточности и рассла-
ивающей аневризме).
У части больных дополнительный эффект
может быть получен при использовании плаз-
мафереза [Михайлов А.А. и др., 1987], гемосор-
бции [Куценко А.И. и др., 1987]. Частные по-
казания для этих методов лечения еще не раз-
работаны. Ультрафильтрация крови может быть
полезной у отдельных больных, у которых отек
мозга и сердечная недостаточность выходят на
первый план.
Если указанное интенсивное лечение прово-
дят в течение 3—4 дней и достигнут желатель-
ный частичный эффект, податливость гипертен-
зии возрастает, то можно сделать попытку пе-
рейти на пероральное лечение обычно с ис-
пользованием трех гипотензивных препаратов
разных групп, подбирая дозы с целью дальней-
шего медленного снижения АД. Могут быть
эффективными различные сочетания, например
миноксидила с 0-адреноблокатером и диуре-
тиком или эналаприла с доксазозином и ам-
лодипином или 0-адреноблокатера с доксазо-
зином и диуретиком [подробнее см.: Opie L.,
Messerli F., 1997].
Надо учитывать, что выраженная почечная
недостаточность ограничивает возможность при-
менения ряда лекарств (миноксидил, ингиби-
торы АПФ, гипотиазид), а возникшая гипонат-
риемия вынуждает воздерживаться от диурети-
ков. Следует также иметь в виду особенности
использования гипотензивных препаратов при
злокачественном гипертоническом синдроме
различной природы. Симпатолитики типа резер-
пина, метилдопы, гуанетидина не должны при-
меняться, если не исключена феохромоцитома
(опасность дальнейшего повышения АД). Инги-
биторы АПФ нельзя использовать, если злока-
чественная АГ связана с двусторонним стено-
зом почечных артерий или стенозом артерии
единственной почки (опасность провоцирова-
ния или нарастания почечной недостаточнос-
ти). В редких случаях возникновения злокаче-
ственной АГ на фоне первичного гиперальдо-
стеронизма в лечение должен быть включен
верошпирон иногда в больших дозах (до 300—
400 мг/сут).
Если на первый план выходит почечная
недостаточность, то применение перитонеаль-
ного диализа или гемодиализа у части больных
помогает справиться с высоким АД. При ренин-
зависимой гипертензии эти методы могут ока-
заться неэффективными в отношении АД и
тогда уместно обсудить вопрос о двусторонней
нефрэктомии (с переводом на регулярный ге-
модиализ). Индивидуальное решение относи-
тельно этой в общем нежелательной меры дол-
жно быть тщательно продумано, поскольку при
этом больной лишается остаточной функции
собственных почек, возникает потребность в
постоянном лечении эритропоэтином, кото-
185
рый, между прочим, способствует повышению
АД, при этом возможно развитие инвалидизи-
рующих остеопатий.
Оперативное лечение (например, по пово-
ду феохромоцитомы, стеноза почечной артерии
и др.) на фоне повреждения органов-мишеней
связано с повышенным риском. АД должно
быть по возможности снижено и стабилизиро-
вано перед операцией, а функция органов
насколько возможно улучшена. Гипотензивные
лекарства больной продолжает принимать до дня
операции, и только диуретик должен быть от-
менен в день хирургического вмешательства.
В ближайшем послеоперационном периоде воз-
можны всплески АД, поэтому гипотензивное ле-
чение (вначале внутривенно, затем внутрь) дол-
жно быть продолжено. В целом хирургическое
лечение приводит к улучшению течения АГ у
55—60 % оперированных, клинические призна-
ки злокачественной гипертензии подвергаются
частичному обратному развитию [Арабидзе Г.Г.,
1985].
Не вызывает сомнений, что эффективное
гипотензивное лечение является решающим
фактором прогноза при злокачественной АГ.
Среди нелеченых больных 80—90 % погибают
в течение года после установления диагноза,
главным образом от уремии. В случае активно-
го лечения половина больных переживают
5-летний рубеж, у некоторых больных частич-
но устраняются сосудистые повреждения и
улучшается функция почек. Результаты лучше,
если адекватное лечение начинают до существен-
ного падения функции почек. С учетом описан-
ных предположений, касающихся природы зло-
качественной АГ, можно думать, что основны-
ми средствами ее профилактики являются ран-
няя диагностика и немедленное адекватное ле-
чение любой артериальной гипертензии.
Литература
Арабидзе Г. Г. Злокачественная артериальная гиперто-
ния//Кардиология. — 1985. — № 1. — С. 5—11.
Арабидзе Г. Г. Симптоматические артериальные гипер-
тонии//Болезни сердца и сосудов/Под ред. Е.И.Ча-
зова. - М., 1992. - Т. 3. - С. 212-218.
Арабидзе Г.Г., Арабидзе Гр.Г. Фармакотерапия арте-
риальной гипертонии//Тер. арх. — 1997. — № 8. —
С. 80-85.
Келехер С.П., Берл Г, Шриер Р.У. Антидиуретичес-
кий гормон//Почечная эндокринология/Под ред.
М.Дж.Данн: Пер. с англ. — М.: Медицина, 1987. —
С. 295-356.
Кобалава Ж.Д., Котовская Ю.В., Кладиев А.А., Мо-
исеев В. С. Суточное мониторирование артериально-
го давления в клинической практике//Клин. фарма-
кол. и тер. — 1996. — № 4. — С. 63—65.
Кутырина И.М., Никишова Т.А., Гареева И.Е. Гипо-
тензивное и диуретическое действие гепарина у боль-
ных гломерулонефритом//Тер. арх. — 1985. — № 6. —
С. 78-81.
Кутырина И.И., Гареева И.Е., Герасименко О.И. и др.
Использование ингибиторов ангиотензинпревраща-
ющего фермента при хронических диффузных забо-
леваниях почек//Тер. арх. — 1995. — № 5. — С. 20—
24.
Михайлов А.А., Воробьев П.А., Дворецкий Л. И. и др.
Гипотензивный эффект плазмафереза при тяжелой
артериальной гипертонии//Кардиология. — 1986. —
№ 10. - С. 98-99.
Тареев Е.М. Гипертоническая болезнь. — М., 1948.
Тареев Е.М. Злокачественная гипертония//Новости
медицины. Гипертоническая болезнь. — 1949. —
№ 214. - Вып. VII. - С. 418-470.
Тареев Е.М. Злокачественная гипертония//Основы
нефрологии/Под ред. Е.М.Тареева. — М., 1972. —
Т. 1. - С. 418-470.
Тареева И.Е., Кутырина И.М. Лечение нефрогенной
гипертонии//Клин. мед. — 1985. — № 6. — С. 20—27.
Aiello S., Remuzzi G., Noris M. Nitric oxide/endothelin
balance after nephron reduction//Kidney Int. — 1998. —
Vol. 53. - Suppl. 65. - P. 63-67.
Badr K.F., Brenner B.M. Vascular injury to the kidney/
/Harrison’s principles of internal medicine.— 14th ed. —
N.Y., 1998. - P. 1558- 1562.
Blaustein M. Endogenous ouabain: Role in the
pathogenesis of hypertension//Kidney Int. —1996. — Vol.
49. - P. 1748-1753.
Brenner B. Hemodynamically mediated glomerular injury
and progressive nature of kidney disease//Kidney Int. —
1983. - Vol. 23. - P. 647-655.
Brenner B., Anderson S. The interrelationships among
filtration surface area, blood pressure and chronic renal
disease//!. Cardiovasc. Pharmacol. — 1992. — Vol. 19. —
Suppl. 1. - P. 1-7.
Brenner B., Lawler E. И, Mackenzie H.S. The hyperfil-
tration theory: A paradigm shift in nephrology//Kidney
Int. - 1997. - Vol. 52. - Suppl. 63. - P. 124-127.
Brenner B., Mackenzie H. Nephron mass as a risk factor
for progression of renal disease//Kidney Int. — 1997. —
Vol. 52. - Suppl. 63. - P. 124-127.
Curtis J., Luke R., Dustar H. et al. Remission of essential
hypertension after renal transptantation//N. Engl. J.
Med. - 1983. - Vol. 309. - P. 1009-1015.
186
De Jong P.E., Heeg J.E., Apperloo A.J., de Zeeuw D.
Anti proteinuric effects of blood pressure-louering agents.
Differences between nondiabetics and diabetics//!.
Cardiovasc. Pharmacol. — 1992. — Vol. 19. — Suppl. 6. —
P. 28-32.
De Wardener HE. The Kidney. — 5th ed. — Edinburgh —
London — Melbourn — New York: Churchill Livings-
tone, 1985. — 605 p.
De Wardener H. The primary role of the kidney and salt
intake in the etiology of essential hypertension//Clin.
Sci. - 1990. - Vol. 79. - P. 193-200.
Ichikawa J., Brenner B. Glomerular actions of angiotensin
II//Amer. J. Med. - 1984. - Vol. 76. - P. 43-49.
Kamper A-L., Strandgaard S., Leyssac P. Late outcome of
enalapril treatment in progressive chronic renal failure. Hard
end-poins and influence of proteinuria//Nephrol., Dial.,
Transplant. - 1995. - Vol. 10, N. 4. - P. 1182-1188.
Kasiske B.L. Relationship between vascular disease and
age-associated changes in the human kidney//Kidney
Int. - 1986. - Vol. 31. - P. 1153-1159.
Locatelli E, Carbarns 1., Maschio G. et al. Long-term
progression of chronic renal insufficiency in the AIPRI
Extension Study//Kidney Int. — 1997. — Vol. 52. — Suppl.
63. - P. 63-66.
Mancia G. Ambulatory blood pressure monitoring for
antihypertensive drug studies and combination therapy/
/Combination drug therapy for hypertension/Eds
L.H.Opie, F.H.Messerli. - N.Y., 1997. - P. 11-23.
Mandal K., Lyden T.W., Saklayen M.G. Heparin lowers
blood pressure: Biological and clinical perspectives//
Kidney Int. - 1995. - Vol. 47. - P. 1017-1022.
Mann F.E., Altenberg J., Luft F.C. Renovascular
hypertension//Oxford textbook of clinical nephrology. —
2nd ed. - 1998. - Vol. 2. - P. 1467-1488.
Mene P. Calcium channel blockers: what they can and
what they can not do//Nephrol., Dial. Transplant. —
1997,- Vol. 12. - P. 25-28.
Meyrier A., Hill G.S., Simon P. Ischemic renal diseases:
New insights into old entities//Kidney Int. — 1998. —
Vol. 54. - P. 2-13.
Napoli C, Di Gregorio E, So rice P. et al. High prevalence
of myocardial ischemia an vasoconstrictive hormonal
release in hypertension during chronic renal failure//
Nephron. - 1997. - Vol. 76. - P. 434-444.
Odar-Cederlof L, Ericson F., Theodorsson E., Kjellstrand
C.M. Is neuropeptide Y a contributor to volume-induced
hypertension?//Amer. J. Kidney Dis. — 1998. — Vol 31,
N 5. - P. 803-808.
Opie L.H. Angiotensin Converting Ensime Inhibitors:
Scientic basis for clinical use. — N.Y., 1992. — 266 p.
Opie L.H., Messerli F.H. Combination drug therapy for
hypertension. — N.Y., 1997. — 176 p.
Patel A., Layne S., Watts D., Kirchner K.A. L-Arginine
administration normalizes pressure natriuresis hyperten-
sive Dahl rats//Hypertension. — 1993. — Vol. 22. —
P. 863-869.
Retting R., Folberth C., Stauss H. et al. Role the kidney
in primary hypertension; a renal transplantation study in
rats//Am. J. Physiol. - 1990. - Vol. 258. - F 606-F 611.
Ritz E., Rambausek M., Hasslacher C, Mann J. Patho-
genesis of hypertension in glomerular disease//Amer.
Nephrol. - 1989. - Vol. 9. - Suppl. A. - P. 85-90.
Ruggenenti P., Remuzzi G. Hypertension and renal disea-
se//Intemational handbook of hypertension. — Frankfurt
am Main: Hoechst Marion Roussel, 1997. — P. 37—52.
Schwartz G.L., Strong C.G. Renal parenchymal
involvement in essential hypertension//Med. Clin. North
Amer. - 1987. - Vol. 71, N. 5. - P. 843-858.
Stimpel M. Arterial Hypertension//De Gruiter. — N.Y.,
1996.
Takahashi K., Totsune K., Mouri T. Endothelin in chronic
renal failure//Nephron. — 1994. — Vol. 66. — P. 373—379.
Valderrabano R., Jones E.H.P., Mallick N.P. Report on
management of renal failure in Europe, XXIV, 1993//
Nephrol., Dial., Transplant. — 1995. — Vol. 10. — Suppl.
5. - P. 1-25.
Faziri N.D., Oveisi E, Ding Y. Role of increased oxygen free
radical activity in the pathogenesis of uremic hyper-
tension//Kidney Int. — 1998. — Vol. 53. — P. 1748—1754.
Weidmann P., Schneider M., Bohlen L. Therapeutic
efficacy of different antihypertensive drugs in human
diabetic nephropathy; an updated meta-analyses//
Nephrol., Dial., Transplant. — 1995. — Vol. 10. — Suppl.
9. - P. 39-45.
Williams G.H Hypertensive vascular disease//Harrison’s
principles of internal medicine. — 14th ed. — N.Y.,
1998. - P. 1380-1394.
Ye S., Ozgur B., Campese V.M. Renal afferent impulses,
the posterior hypothalamus, and hypertension in rats
with chronic renal failure//Kidney Int. — 1997. — Vol.
51. - P. 722-727.
Гпава 9
ГЛОМЕРУЛОНЕФРИТЫ
9.1. Общие вопросы. Клиника*
9.1.1. Этиология, классификация
Гломерулонефриты (ГН) представляют основ-
ной раздел современной нефрологии в терапев-
тической и общей клинике. Особое преимуще-
ство нефрологии в настоящее время связано с
возможностью продления жизни почечным
больным методами заместительной терапии (ге-
модиализ, пересадка почки).
Этапы развития учения о нефритах, как и
о других болезнях, связаны с достижениями
фундаментальных наук, техническим прогрес-
сом и соответствующими отклонениями теории
и практики нефрологии в новых направлени-
ях, доминировавших в свою очередь десятиле-
тиями. К таким этапам можно отнести откры-
тие более 100 лет назад патогенных микробов
(1879, 1880) и по существу одновременно
И.И.Мечниковым защитных систем организ-
ма — фагоцитоза (1883) и «ядов животного про-
исхождения» — цитотоксинов (1900), полнос-
тью индифферентных для здоровых, но при
введении в специфически сенсибилизирован-
ный организм вызывающих смерть «в столь же
малой дозе, как стрихнин или цианистый ка-
лий». Выработанные организмом животного
вещества вызывают цитотоксическое, в том
числе установленное И.И.Мечниковым аутоци-
тотоксическое, повреждение органов. Этим
было положено начало изучению в лаборато-
рии И.И.Мечникова экспериментального цито-
токсического нефрита [Линдеман В.К., 1900;
Нефедьев Н., 1901].
Открытие сывороточной болезни, прообра-
за аллергической патологии, произошло на
* Раздел 9.1 написан Е.М.Тареевым в 1985 г. Печа-
тается с сокращениями. Полностью работа опубли-
кована в 1995 г.
188
рубеже XX в. В.Schick (1909) выдвинул концеп-
цию «вторичного аллергического состояния»
при остром ГН после первичного стрептокок-
кового фарингита, тонзиллита. Одновременно
быстро возникло увлечение инфекционной эти-
ологией болезни, не угасшее и в наши дни,
наряду со скепсисом в отношении неинфекци-
онных патогенных факторов, игнорирование
«нервных» и многочисленных других неин-
фекционных лихорадок. Преклонение перед кон-
цепцией гуморального иммунитета, чему в 30-х
годах способствовал успех сывороточного лече-
ния крупозной пневмонии, привело к практи-
чески полному забвению клеточного иммуни-
тета на 70 лет, считая от начала серотерапии
дифтерии [Филатов Н.Ф., 1899; Roux Н., 1894]
до 1966 г., когда была опубликована работа
Т.Г.Траяновой, В.В.Суры и Г.Я.Свет-Молдав-
ского, доказавших «разрушение лимфоцитами
больных СКВ культуры клеток человеческого
эмбриона — фибробластов и почечного эпите-
лия». Лишь спустя 7 лет в мировой литературе
появилась работа V.Podelsky, в основу которой
была положена теория клеточного иммунитета
Мечникова.
Наряду с изучением аллергических, имму-
нологических, аутоиммунных реакций и болез-
ней, позволившим впервые распознать и лечить
многие болезни с помощью десенсибилизиру-
ющих и подавляющих иммунный ответ средств,
а также с успехами трансплантологии и т.д.
имеются некоторые настораживающие негатив-
ные моменты. Получившие большую извест-
ность термины «аллергический», «инфекцион-
но-аллергический» и др. многие врачи исполь-
зуют чрезвычайно широко, не обосновав тща-
тельно наличие того или иного компонента.
Термин «аллергический» нередко широко
используют без спецификации аллергена — бак-
териального, паразитарного, пищевого, лекар-
ственного, связанного с производством и т.д.
Недостаточно учитывается, что проявления
аллергии (по существу защитная реакция орга-
низма) тесно связаны с нормальной жизнью,
что подчеркивают такие крупные патологи, как
М. А. Скворцов.
В то же время врачи склонны забывать боль-
шое значение подавленных реакций аллергичес-
кого состояния, как, например, при алимен-
тарной дистрофии, которые составляют клини-
ческую картину кахексии при опухолях, маль-
абсорбции и другой патологии, когда организм
не в состоянии при вакцинации образовывать
антитела и остается беззащитным при воздей-
ствии инфекции и т.п.
В патофизиологии почек французские ученые
начала XX в. сделали крупные открытия, под-
черкивающие наблюдавшуюся до 50-х годов
резкую разницу в классификации нефритов
немецкой и французской школ. Представители
немецкой школы, следуя концепциям R.Virchow,
мыслят гистологически, пытаясь наложить кли-
нические проявления на поражения клеток
(анатомо-клиническая концепция), и, наобо-
рот, представители французской школы, вер-
ные учению Cl.Bernard, мыслят физиологичес-
ки: изучают нефриты, уделяя мало внимания
поражениям, но стараясь ответить на вопросы,
каковы функциональные нарушения, проявля-
ющиеся клиническими симптомами (клинико-
физиологическая основа классификации нефри-
тов) [Vallery-Radot Р., Delafontaine Р., 1959].
Работы французских клиницистов E.Widal и
A.Javal (1902), L.Ambard (1904), A.Chauffard и
др. (1911) позволили установить фундаменталь-
ные закономерности влияния задержки натрия
и безнатриевого режима на почечный отек и
почечную гипертонию, роль гормона надпочеч-
ников в происхождении гипертонии, значение
показателей почечного клиренса в режиме ра-
боты здоровых и больных почек, высокой хо-
лестеринемии при нефритах в отличие от сер-
дечной недостаточности. Клиренсовая методи-
ка наряду с достижениями экспериментальных
микрометодик создала устойчивый фундамент
функциональных почечных проб [Cushny А.,
1917; Rehberg Р., 1926; Smith Ch., 1969].
«Наука прогрессирует, разрушая себя каж-
дые 25 лет», — говорил L.Pasteur. Ту же точку
зрения высказывали и другие крупные ученые,
например Cl.Bernard: «Нужно пытаться себя
разрушать, — говорил он, — стараясь опыта-
ми противоположного построения разрушать
свои собственные выводы». Однако концепции
медиков-теоретиков — патофизиологов, пато-
логоанатомов, фармакологов в отношении ГН,
как и других «больших» терапевтических болез-
ней современности, не должны пассивно ос-
ваиваться нефрологом, общим терапевтом, те-
рапевтом-нефрологом. Нередко последняя тео-
ретическая концепция, правильная и прогрес-
сивная, применимая к части больных с данной
нозологической формой, но неприменимая,
возможно, к более редким или кажущимся та-
ковым вариантам, не может и не должна за-
менять индивидуальный, прежде всего чисто
клинический, анамнестический подход. Имму-
нонефрология — прогрессивный раздел тера-
пии, но, как и, например, иммуногематология,
развивающаяся на каких-то этапах параллельно,
не имеет глобального значения. Групповое деле-
ние ГН на иммунные и неиммунные формы, до
сих пор главенствующее в учебниках и врачеб-
ной практике, равно как и на инфекционные
(или постинфекционные) и неинфекционные,
не может быть положено в основу практической
деятельности терапевта-нефролога.
Правильное, точное распознавание индиви-
дуальной нозологической формы в ее этиоло-
гически-эпидемиологическом и патогенетичес-
ки-морфологическом вариантах, точная регис-
трация всех этапов развития болезни, проводи-
мого лечения и клиническое руководство наи-
лучшим образом осуществляются одним леча-
щим врачом, избавляющим больного от избы-
точной лекарственной терапии, хирургических
вмешательств и т.д. Особенно важной следует
считать дифференцированную диагностику ГН
у диспансеризуемых контингентов для того,
чтобы выявить истинную связь заболеваемости
со средой, изменение и оздоровление которой
является основной задачей медицинской науки,
имеющей профилактическое направление.
В отношении происхождения диффузных ГН
надо подчеркнуть, что если, с одной стороны,
единый клинико-морфологический процесс —
поражение почек — может быть вызван совер-
шенно различными и, очевидно, еще не изу-
ченными факторами, то с другой — правилом
скорее является то, что один и тот же этиоло-
гический агент может вызывать различные по-
ражения почек, изолированные или системные.
Так, стрептококковая инфекция может вызвать
типичное послеинфекционное поражение, по
существу плохо поддающееся лечению антиби-
отиками или десенсибилизирующими средства-
ми, хотя в целом имеющее относительно бла-
гоприятное течение, даже в экстракапиллярном
варианте, особенно у детей. Наряду с этим
стрептококк может обусловливать аналогичное
поражение почек — ГН (а также амилоидоз)
при затяжном септическом эндокардите, ког-
да активная противоинфекционная терапия
нередко позволяет излечить далеко зашедшее
поражение почек с азотемией. Определенный
благоприятный эффект наблюдается при лече-
нии в сочетании с кортикостероидами. Если
септический процесс начинается с перифери-
ческого сектора сосудистой системы, например
травматической (огнестрельной) артериовеноз-
189
ной аневризмы, то ликвидация хирургическим
путем септического васкулита способствует из-
лечению поражения сердца и почек (как и в
случаях септического очага на протезированных
клапанах, когда смена протеза может давать
определенный положительный эффект). Следует
напомнить, что при обычном постстрептокок-
ковом нефрите тонзиллэктомия или иная на-
правленная на ликвидацию очаговой инфекции
операция, согласно обширным статистическим
сводкам, не улучшает состояния больных.
Сохраняет большое значение патология по-
чек при малярии у неиммунных контингентов,
особенно при тропической, устойчивой к тра-
диционной терапии, с проявлениями опасно-
го для жизни шока и отека мозга, нередко с
анурией (имеется некоторая аналогия с изучен-
ной в нашей клинике в 40-х годах молниенос-
ной рецидивной малярией терцианой с быст-
ро наступающей смертью вследствие олигопа-
разитарного набухания мозга). Различают ост-
рые нефропатии, поддающиеся противомаля-
рийной терапии с быстрым обратным развити-
ем поражения почек, характерные для тропи-
ческой малярии, вызванной P.falciparum. Хро-
нические нефропатии с выраженным НС про-
грессирующего течения, в большинстве случа-
ев не поддающиеся лечению противомалярий-
ными препаратами, а нередко и кортикостеро-
идами и цитостатиками, развиваются при че-
тырехдневной малярии, вызываемой P.malariae.
Из других инфекций можно назвать бруцел-
лез, доступный профилактике и лечению, ту-
беркулез со своеобразным циклически проте-
кающим обратимым ГН в рамках первичного
туберкулеза взрослых.
По существу каждая редкая и новая инфек-
ция может вызвать ГН, конечно, при условии
достаточной сохранности иммунной реакции
организма человека.
Необходимо назвать трепонемные инфекции
и риккетсиозы. Сифилитический ГН сохраняет
значение особенно в перинатальной патологии
(раньше сифилису излишне приписывали мно-
гие сосудистые и другие поражения), сыпной
тиф вызывает во время эпидемий и ГН, осо-
бенно при ярких васкулитах, подробно описан-
ных Л.В.Поповым и И.В.Давыдовским.
Весьма весомую группу диффузных нефри-
тов способны вызвать вирусные заболевания,
прежде всего грипп, в том числе «испанка»
периода первой мировой войны с гипертокси-
ческой пневмонией и пурпурой легких, что
легло в основу широко известной легочно-по-
чечной болезни (синдрома) Гудпасчера. Конеч-
но, во многих статистиках грипп наряду со
стрептококковым фарингитом необоснованно
занимает большое место, хотя в действитель-
ности речь идет о недифференцированном ка-
190
таре верхних дыхательных путей. Более широко
известны такие вирусные инфекции, как ли-
хорадка Коксаки, корь, краснуха, имеющие
свои особенности.
В настоящее время установлено существова-
ние относительно новой вирусной болезни,
чрезвычайно широко распространяющейся в
виде носительства вируса и весьма значимой
как тяжелое прогрессирующее заболевание HBs-
гепатит. Среди врачей на основании исследова-
ния анкетным методом и лабораторного под-
тверждения на участниках американских конг-
рессов установлено нарастание носительства
вируса параллельно стажу и врачебным контак-
там до значительных цифр, в отдельных груп-
пах (особенно у акушеров, патологов и хирур-
гов) — более 25 %. Таким образом, можно го-
ворить о новом виде риска госпитализма нарав-
не с установленным давно риском для больных
заражения от среднего медицинского персона-
ла (носителей устойчивых стафилококков и
др.), риска прямого занесения вируса хирургом
во время операции.
Благодаря возможности относительно дос-
тупного и, видимо, достоверного вирусологи-
ческого подтверждения сывороточного гепати-
та эта столь частая болезнь и еще значительно
более частое носительство НВ5-антигена зани-
мают одно из первых мест при изучении ви-
русной патологии в терапевтической клинике.
Так, НВ5-антиген неожиданно стали часто об-
наруживать при узелковом периартериите.
Ассоциацию персистирующей НВ8-антигене-
мии с мембранозным ГН впервые описали
В.Combes и соавт. (1971) у 53-летнего мужчи-
ны, заболевшего посттрансфузионным гепати-
том и через 16 мес — НС. С тех пор описан ряд
больных НВ5-вирусной инфекцией в сочетании
с хроническим ГН типа мембранозно-пролифе-
ративного или мембранозного ГН. W.Brzosko и
соавт. (1974) обнаружили НВ5-вирус у 18 из 52
больных ГН различных типов и впервые поста-
вили вопрос о значении этой распространен-
ной вирусной инфекции для ГН. Связь ГН с
начальным клиническим гепатитом труднее
признать при большом разрыве во времени и
возможности нового заражения вирусом боль-
ного при переливании крови или других про-
цедурах. Поражение почек может не проявлять-
ся клинически и обнаруживаться только при
вскрытии трупа больного хроническим гепати-
том.
Из глистных заболеваний следует помнить о
трихинеллезе со своеобразным аллергическим
поражением почек и сосудов, а также миокар-
да, сходным с поражением миокарда при узел-
ковом периартериите и дерматомиозите, а так-
же об альвеококкозе, характеризующемся свое-
образным поражением почек.
Инфекционная концепция является таким
постоянно действующим магнитом, который
отвлекает внимание врачей и крупных ученых
от неинфекционного фактора.
Терапевту-нефрологу, как и терапевту ши-
рокого профиля и представителю любой дру-
гой терапевтической специальности, следует
знать, что не только инфекция является понят-
ным и достаточным этиологическим фактором,
а также аллергия (с возможными генетически-
ми предпосылками), но и ряд других влияний
среды при их индивидуальной интолерантнос-
ти могут стать и действительно являются «при-
чиной» заболевания, в данном случае болезни
почек. Таковы все еще вызывающие сомнение
у современного врача простуда, травма, инсо-
ляция, непереносимость пищи, химикатов,
лекарств и др., особенно психическая травма,
вызывающая часто обострение любого заболе-
вания и также являющаяся самостоятельным
источником (причиной) болезни.
Наряду с этим старый термин «простудный
нефрит» имеет право на существование как
проявление индивидуальной непереносимости,
сверхчувствительности к охлаждению, перено-
симому большинством лиц без выраженной па-
тологии (известны случаи холодовой травмы с
некрозом тканей, не сопровождающиеся диф-
фузным нефритом). На простуду как болезнь
указывал И.П.Павлов.
В настоящее время лекарственные поражения
почек, лекарственные системные заболевания, в
том числе «ревматические», развернутые сосуди-
сто-лихорадочно-многоорганные и др., настоль-
ко часты, имеют такое большое познавательное,
диагностическое и лечебно-профилактическое
значение, что как бы много ни говорили или
писали о лекарственной патологии, при суще-
ствующей весьма консервативной позиции тео-
ретиков-фармакологов, патофизиологов, патоло-
гов, а также терапевтов различных специальнос-
тей все равно этого будет недостаточно.
Следует подчеркнуть разнообразие лекар-
ственных реакций, некоторую как бы нелогич-
ность патогенеза, приравнивая их к другим
параспецифическим реакциям, которые ранее
других стали известными при туберкулезе (па-
ратуберкулезные синдромы), а затем при опу-
холях (чрезвычайно разнообразные паранеопла-
сгические синдромы); такова и парамедикамен-
тозная патология. Примеры ее очень ярки и
неисчислимы. Сосудистые реакции, наблюдаю-
щиеся при периферическом узелковом периар-
териите с некрозами пальцев, типичны и для
лекарственной патологии, например одновре-
менный некроз концевых фаланг всех 20 паль-
цев у подростка, возникающий после приема
пенициллина, с длительной ремиссией или
единственный криз в жизни без других послед-
ствий (подобно тому, как акронекроз может
быть первым проявлением гипернефроидного
рака).
Издавна в числе лекарств «высокого риска»
фигурировали ртуть, йодистые соединения,
хинин (чрезвычайно широко применявшиеся
вследствие гипердиагностики сифилиса и ма-
лярии), а также препараты золота (при лече-
нии туберкулеза и ревматоидного артрита),
вызывающие НС или липоидный нефроз.
В 30-е годы отмечено эпидемиологически
значимое нарастание системных сосудистых за-
болеваний с поражением почек (диффузным
нефритом) при лечении пневмонии сыворот-
кой в сочетании с сульфаниламидными препа-
ратами [Rich А., 1942], что бросило тень на эту
химиотерапию и привело наряду с резким со-
кращением применения сульфаниламидов к
снижению заболеваемости узелковым периар-
териитом. М. А Скворцов (1944) отметил резкое
учащение тяжелых системных васкулитов у де-
тей, не связанных с инфекцией.
Сульфаниламидные лекарственные реакции
весьма демонстративны клинико-морфологи-
ческим разнообразием поражения мочевой си-
стемы, начиная с кристаллурии с обструктив-
ной уропатией, лекарственным гемолизом, ге-
молитической почкой и кончая сульфаниламид-
ным системным поражением типа узелкового
периартериита, а также СКВ и т.п.
По нашему мнению, две проблемы почеч-
ной патологии — развитие ГН вирусной этио-
логии и равным образом лекарственной пато-
логии — имеют огромное значение для прак-
тического здравоохранения.
D-пеницилламин может вызывать у челове-
ка разные поражения, начиная от минималь-
ных изменений клубочка. Наиболее часто раз-
виваются иммунокомплексный мембранозный
ГН с нежными зернистыми гранулярными де-
позитами IgG и СЗ вдоль базальной мембра-
ны клубочка, наблюдающийся у 20 % всех ле-
ченных этим препаратом больных [Golding J. et
al., 1970], НС [Балабанова Р.М. и др., 1980], а
также синдром Гудпасчера [Sternlieb J. et al.,
1975]. Из 82 больных мембранозным ГН, по
данным G.Neild и соавт. (1979), у 19 больных
ГН был индуцирован D-пеницилламином.
Следует подчеркнуть, что одно средство,
например пенициллин, может вызывать целый
комплекс патологических процессов, а морфо-
логически единое поражение, например мемб-
ранозный ГН с характерными депозитами, мо-
жет быть обусловлено многочисленными разно-
образными медикаментами. Причем очевидно,
что собственно этиологический диагноз (лекар-
ство, которое должно быть, безусловно, эли-
минировано) морфолог не устанавливает. Мно-
гие болезни с поражением почек, фигурирую-
191
щие как патология неизвестной причины, на-
пример болезнь Гудпасчера, могут быть вызва-
ны лекарствами.
Особенно широкими, что теперь не кажет-
ся уже неожиданным, оказались «размеры» ле-
карственной патологии, вызванной пеницилли-
ном. Поражение почек при лечении пеницил-
лином известно с 1947 г. [Anderson А., 1947].
Однако только с 1966 г. изучение этой патоло-
гии стало более активным; описаны единичные
случаи пролиферативного и экссудативного ГН
с полулуниями, васкулитами — фибриноидным
некрозом и гиалинизацией сосудистых стенок
[Schrier R. et al., 1966].
Поражение почек наблюдается также при
использовании новых перспективных препара-
тов, что может ограничить их широкое приме-
нение. Так, каптоприл — ингибитор АПФ,
представляющий большой практический инте-
рес, у одной женщины (из 34 наблюдавшихся
больных), страдавшей гипертонической болез-
нью, вызвал мембранозную гломерулопатию
без пролиферативных и экссудативных пораже-
ний с электронно-плотными зернистыми суб-
эндотелиальными депозитами, обнаружившими
иммунофлюоресценцию с IgA, IgG, IgM и СЗ,
что соответствует индуцированному лекарства-
ми мембранозному ГН [Prins Е., 1979].
Весьма реальны вакцинные ГН, как и вак-
цинные системные заболевания с ГН, а также
вакцинный амилоидоз. Известно, что лошади —
продуценты сывороток — погибают от амило-
идоза (разрыв селезенки), если не прекраща-
ется вакцинирование.
Все же категория вакцинных заболеваний, в
том числе системных, среди практических вра-
чей и даже ученых-теоретиков остается до кон-
ца не изученной. Аналогичная «сдержанность»
очевидна и в отношении признания учеными
широкой патологии сывороточной болезни,
хотя именно при ней впервые эксперименталь-
но изучен поздний аллергический диффузный
нефрит [Pirquet С., 1911]; правильнее раньше
назвать экспериментальный сывороточный (ци-
толизиновый) нефрит В.К.Линдемана (1900) и
Н.Нефедьева (1901) из лаборатории И.И.Меч-
никова.
Серотерапия среди многих проявлений сы-
вороточной болезни может вызывать также
диффузные нефриты, имеющие характер неспе-
цифических реакций. Эти нефриты в целом до
настоящего времени мало изучены. Так, напри-
мер, наблюдалось развитие ГН после примене-
ния сыворотки для остановки кровотечения у
больного с ревматическим пороком сердца и т.д.
Монографические издания о сывороточной
болезни остаются редкостью. Между тем сыво-
роточная СКВ известна с 1943 г. В том же году
W.Longcope указал на большой патогенный
192
потенциал лекарственной болезни. По нашему
мнению, если какой-либо агент, в данном слу-
чае сыворотка, способен вызывать ГН в рам-
ках системного заболевания (системный ГН),
то его следует считать нефритогенным факто-
ром. Такого мнения придерживаются большин-
ство авторов.
Сравнительно небольшую, почти казуисти-
ческую, роль играют обусловленные фактора-
ми среды аллергические нефриты, нередко с
микросимптоматикой сывороточной болезни —
сыпью, зудом, повышением температуры и др.
Таковы нефриты, развившиеся в результате
непереносимости белка пшеницы (излечивае-
мые элиминационной аглютеновой диетой),
цветочной пыльцы, поллинозы с рецидивиру-
ющим сезонным ГН, фруктов, парфюмерии и
т.д.
Изредка ГН наблюдают при поллинозах,
иногда даже в сочетании с астмой (редкое со-
четание). Чаще описывают аллергические пище-
вые ГН к определенному пищевому компонен-
ту, протекающие с поражением кожи (крапив-
ница), суставов. В подобных случаях говорят об
атопическом нефротическом или нефритичес-
ком синдроме.
Лишь в последнее время обращено внимание
на поражение почек (ГН или амилоидоз) при
злокачественных новообразованиях, протекающих
с паранеопластическими синдромами. К их чис-
лу относятся гипернефроидный рак, бронхоген-
ный рак, избирательно и преимущественно ме-
тастазирующий в почки, другие карциномы. При
этом в ряде случаев в почках обнаруживают им-
мунные комплексы с опухолевым антигеном,
причем радикальная операция приводит к лик-
видации почечной патологии. Некоторые авторы
считают, что до 10 % диффузных поражений
почек могут иметь опухолевую природу.
Паратуберкулезный, нередко претуберкулез-
ный ГН отмечается чаще в условиях, благопри-
ятствующих развитию первичного туберкулеза
легких.
Нефротический синдром (тот же диффузный
ГН) может развиться также на фоне гиперто-
нии системы почечных вен и крупных веноз-
ных коллекторов, например, вследствие трав-
мы, краш-синдрома с множественными пере-
ломами. Так, у больного с краш-синдромом
развился первичный травматический тромбоз
вен с многолетним прогрессированием, с оте-
ками, холестеринемией и всем комплексом НС,
не поддавшимся терапии, после хирургической
коррекции с устранением венозных стазов по-
чечный статус вернулся к норме.
Больной М., 24 лет, студент. В 18-летнем возрас-
те подвергся сдавлению грудной клетки с образова-
нием обширной гематомы. Через 2 года развилась
клиническая картина инфарктной пневмонии с по-
вторными кровохарканьями, одновременно возникла
гематурия с уже выявленной ранее протеинурией
(1 %о), спустя месяц — тромбоз почечных вен с раз-
витием НС (протеинурия 28 %о), гематурия. Состо-
яние расценено сначала как узелковый периартери-
ит, затем как синдром Гудпасчера. Проведено лече-
ние кортикостероидами (преднизолон по 60 мг) и
цитостатиками. Через 4 мес развился двусторонний
тромбоз подвздошных вен. Направлен в клинику с
диагнозом «синдром Гудпасчера». Принимая во вни-
мание краш-синдром в прошлом и прогрессирую-
щую тромбоэмболическую болезнь, мы отменили
кортикостероиды и цитостатики и назначили анти-
коагулянты; было проведено оперативное вмешатель-
ство для устранения венозной гипертонии. Количе-
ство белка в моче в течение года снизилось до сле-
дов, исчезли и другие признаки НС. В настоящее
время пациент практически здоров. Сохраняется ва-
рикозное расширение вен нижних конечностей, что
не мешает больному много ходить пешком. Окончил
университет, женился.
Классификация ГН, как и любых дру-
гих болезней, основывается на клинико-анато-
мических, клинико-морфологических, функци-
ональных и структурных изменениях, а также
в значительной степени на эпидемиологичес-
ких, этиологических и социально-гигиеничес-
ких закономерностях. Более узкие интересы при
изучении больных могут удовлетворяться спе-
циальными, сокращенными, прикладными
классификациями. До последних лет главенство-
вал органный принцип классификации болез-
ней, созданный G.В.Morgagni (1761) и изло-
женный в труде «О местонахождении и причи-
нах болезней, открываемых посредством рассе-
чения» («De sedibus et causis morborum per
anatomen indagatis»). Однако менее чем через
полвека гениальный клиницист, кардиолог,
личный врач Наполеона Corvisart, хорошо по-
нимая основную роль клинициста в прогрессе
медицины и исходя из формулировки G.В.Mor-
gagni, разрывает два ее компонента словами:
«изучаемых диагностическими признаками»
(«per signa diagnostica investigatis»). Французский
хирург и патолог М.Bichat создает патологию
тканей, a R.Virchow публикует «клеточную па-
тологию» (1858). В наш век субклеточной и мо-
лекулярной патологии органный принцип клас-
сификации болезней тем более теряет свою
ценность.
Эффективное объединение клинико-анато-
мического, функционально-патогенетического
изучения болезней почек представлено перво-
открывателем нефрологии — R. Bright (1827),
указавшим на возможные причинные, средо-
вые факторы «брайтовой болезни».
Клинико-анатомическая классификация дол-
гое время являлась основной и общепонятной
при небольшом разнообразии заболеваний по-
чек в прошлом и, конечно, при всестороннем
клиническом разборе больных, включая анам-
нез и т.д., что отражено в лекциях отечествен-
ных корифеев-терапевтов второй половины XIX в.
и начала XX в. — Г. А. Захарьина, С. П. Ботки-
на, А. А. Остроумова, использовавших термины
«паренхиматозный нефрит» и «нефрит интер-
стициальный» (первичная сморщенная почка,
гипертоническая болезнь).
Так же долго безраздельно признавалась схе-
матическая клинико-анатомическая классифика-
ция клинициста F.Volhard и патолога T.Fahr
(1914), утверждавших, что хронический ГН воз-
никает без исключения («ausnahmlos») из ост-
рого диффузного постстрептококкового ГН и
равнозначен неизлеченному нефриту. Кроме
простоты схемы «трехчленной» патологии по-
чек — воспалительного нефрита, дегенеративно-
го нефроза и склеротической доброкачественной
и злокачественной гипертонии, имела значение,
очевидно, и магия слова «нефроз» (как в наш
век «коллагеноз»). Этиологию указывали редко
и малоудачно: термин «липоидный нефроз» имел
синоним «сифилитическая почка» [Munk F.,
1913], причиной злокачественной гипертонии
считали ревматизм и опять же сифилис.
Излечение острого нефрита представлялось
как радикальная борьба с нефритами в целом.
Одновременно не воспринималось прогрес-
сивное учение английских нефрологов W. Long-
cope (1936) и A.Ellis (1942), выделявших вто-
рой тип хронического нефрита, без острого
начала. В этом учении опять выдвигались те же
вопросы, которые волновали и R.Bright: явля-
ются ли отдельные клинико-анатомические
типы диффузного воспалительного поражения
почек разными стадиями одного и того же за-
болевания или же настоящими самостоятельны-
ми нозологическими формами (вопрос, слиш-
ком просто решенный в классификации F.Vol-
hard и T.Fahr, однако еще не решенный совре-
менными морфологами).
Надо согласиться и с тем, что деление бо-
лезней паренхимы почек на нефриты и нефро-
зы (как при болезнях печени — на гепатиты и
гепатозы), неоднократно выдвигавшееся вновь
как прогрессивное, давно потеряло существен-
ное классификационное значение. Тем более
потеряло значение разграничение нефроза как
патологии канальцев от нефрита как патологии
клубочка.
Является ли термин «гломерулонефрит» бо-
лее правильным, чем «диффузный нефрит» или
какой-либо другой термин? Функционально,
несомненно, страдает весь нефрон. Олигурия
острого ГН не клубочковая, а клубочково-ка-
нальцевая с акцентом на канальцевую реабсор-
бцию. Термин «гломерулонефрит», казалось,
полностью обосновывают большая очевидность,
13—2950
193
разнообразие и значимость клубочковых мор-
фологических изменений, которые и до сих пор
не могут считаться полностью изученными.
Однако при изучении антител к БМ канальцев
установлено, что ГН не ограничен клубочком
в иммунологическом аспекте, хотя нефрологи
и приходят к этому выводу с опозданием. Из-
вестное участие интерстиция, сосудов при ГН
при дальнейшем изучении этой проблемы тре-
бует пересмотра данного вопроса.
С введением И.В.Давыдовским в 1932 г. но-
зологического принципа классификации внут-
ренних болезней, который, по нашему мне-
нию, лучше, чем органный (моноорганный),
отвечает клинической реальности, должны ру-
шиться некоторые привычные перегородки. Что
важнее для врача, сталкивающегося с нозоло-
гическими формами, имеющими связь со сре-
дой, эпидемиологией при конечной цели ме-
дицины — профилактике, а затем искоренении
заболеваний, — делить болезнь по морфологи-
ческим, пусть и интересным деталям, на 2—
3 дробные формы или проводить общие для
всей группы лечебные, профилактические и
противоэпидемические мероприятия?
Совершенно очевидно, что в нозологии,
классификации, номенклатуре, диагностике
нефритов, как и в других разделах клиники,
следует стремиться обоснованно, исходя из
клинико-эпидемиологических факторов и др.,
выделять отдельные нозологические формы с
присущей каждой из них «естественной исто-
рией» болезни, включая феномены вмешатель-
ства, и «неестественной» истории (J.Cameron),
чему, особенно в смысле ятрогении (в широ-
ком понимании термина), мы уже многие годы
придаем особенно большое значение (правиль-
нее, должное). Равным образом и, быть может,
в еще более обязательном порядке должны быть
продуманы, рационализированы группировки
ряда болезней и их наименования, отражающие
динамику клинических концепций.
Так, нозологическая форма «подагра» или
«подагрическая почка» должна включать близ-
кие поражения различного происхождения:
классическую болезнь обмена с индивидуаль-
ным преобладанием тканевого и почечного ге-
неза, болезнь, которая может развиться без
наследственного предрасположения при резком
изменении образа жизни (на это указывали
английские авторы в отношении, например,
шотландских крестьян, перенявших условия
лондонской жизни). Далее собственно уремичес-
кая подагра позднего, терминального периода
ХПН при любой форме исходного заболева-
ния — яркий безошибочный клинический при-
знак декомпенсации, подобный уремическому
перикардиту. Урикемия — маркер алкоголизма
и без почечной ретенции.
194
Приводим классификацию ГН трех типов.
Органная (органопатологическая) классифи-
кация. По существу острый ГН отождествляет-
ся с наиболее изученным постстрептококковым
ГН, с его более выраженным циклическим
течением и лучшим прогнозом (в то же время
кортикостероидоустойчивым). Быстропрогресси-
рующий, нефротический и смешанный ГН
объединяют выраженные клинические призна-
ки болезни Брайта, полнее представленные в
быстропрогрессирующем и смешанном заболе-
вании с высокой липидемией, липидурией,
гипертензией и т.д. в отличие от острого ГН;
липоидный нефроз, как ни старались обособить
эту форму, все же типично эволюционирует
(если не проходит, что знали и раньше) в ХПН.
Целесообразно выделять также латентный ГН
как показатель высокой степени компенсации
поражения организмом, определяющей дли-
тельность срока выживаемости больного. Ни
одна из восьми форм клинической классифи-
кации не имеет самостоятельной, ей одной
присущей этиологии. Даже такая форма, как
быстро прогрессирующий ГН, проявляющийся
неповторимыми клинико-морфологическими
чертами, может быть следствием весьма разно-
образных причин, компонентом разных систем-
ных заболеваний, в том числе профессиональ-
ным заболеванием в результате контакта с гид-
рокарбоновыми растворителями, лекарст-
венным — при лечении D-пеницилламином
и т.д.
Примечание редактора. Классификация
ГН, предложенная Е.М.Тареевым в 1958 г. («Нефри-
ты» — С. 386—387), а затем уточненная в 1972 г. («Ос-
новы нефрологии». — Т. 1. — С. 383), включает в себя
острый; злокачественный (подострый, экстракапил-
лярный, быстропрогрессирующий ГН); хронический
ГН: нефротический ХГН (нефротического типа),
смешанный, латентный ХГН, гипертонический (вас-
кулярный), латентный, претерминальный и терми-
нальный Хгн.
Используя в целом эту классификацию, мы счи-
таем целесообразным выделение также относитель-
но доброкачественного гематурического гломеруло-
нефрита; в то же время представляется менее оправ-
данным, в основном из-за деонтологических сооб-
ражений, применение терминов «претерминальный»
и «терминальный» гломерулонефрит. Таким образом,
в клинической практике мы выделяем следующие
варианты хронического гломерулонефрита: латент-
ный, гематурический, гипертонический, нефроти-
ческий и смешанный [Тареева И.Е., 1988].
В классификации М.Я.Ратнер и соавт. (1987)
выделяются типы гломерулонефрита: нефрити-
ческий (максимально активный, активный и
неактивный), нефротический и нефротически-
гипертонический.
Современная морфологическая классифика-
ция ГН создана благодаря успехам гистологи-
ческого изучения почек, особенно при серий-
ных биопсиях, с использованием всесовершен-
ствующейся электронной, флюоресцентной,
иммунохимической техники, потенциально
позволяющей, как и исследование циркулиру-
ющих иммунных комплексов и пунктатов дру-
гих органов, верифицировать антиген, этиоло-
гию ГН. Эти антигены, эндогенные и экзоген-
ные, весьма многочисленны, но чаще такое
подтверждение может реализоваться при каких-
то клинических, анамнестических «подсказках».
Участие клиницистов должно быть еще более
активным. Клиницист, увлекаясь вместе с па-
тологом видом депозитов, нередко удовлетво-
ряется, находя при жизни тот же гистологичес-
кий вариант ГН, что и прозектор на вскрытии,
получая от последнего заключение о полном
совпадении диагнозов, вместо того, чтобы
тщательно изучить анамнез больного, в том
числе производственный, чтобы самому найти
причину болезни и помочь патологу оконча-
тельно расшифровать ее.
Классификация гломерулонефритов по но-
зологическому принципу основана на нозоло-
гическом принципе преподавания болезней,
предложенном И.В.Давыдовским, пришедшем
на смену органопатологическому, разработан-
ному G. Morgagni.
В нозологическом принципе прежде всего
важно правильное выделение каждой реальной
болезни — нозологической формы, часто вы-
ходящей за границы одного органа, и особен-
но выявление, знание наряду с ее клинико-
морфологической основой также этиологичес-
кого и эпидемиологического факторов, связи
болезни со средой, т.е. предпосылок к решению
основных задач медицинской науки — «пробле-
мы больного и среды, направленного измене-
ния, оздоровления среды» по З.П.Соловьеву,
сближения клиники с социальной гигиеной.
Нефрология как раздел внутренней медици-
ны должна включать и длинный ряд болезней,
которые проявляются разнообразным пораже-
нием почек и находят законное место в других
специальностях. Например, ревматоидный ар-
трит со столь частым амилоидозом и смертью
от уремии, так же как СКВ с быстро ставшим
«классическим» аутоиммунным люпус-нефри-
том в ревматологии; ХАГ с нередким его ком-
понентом — «печеночным нефритом» в гастро-
энтерологии (гепатологии). Хотя с не меньшим
правом можно назвать и кардиологию (под-
острый инфекционный эндокардит с его раз-
нообразными почечными маркерами: диффуз-
ным ГН, амилоидозом, гнездным эмболичес-
ким ГН, в последнее время редким), онколо-
гию (мембранозный ГН и амилоидоз при зло-
качественных опухолях почек, бронхов и т.д.),
генетические болезни (семейная средиземно-
морская лихорадка с ее крупным маркером —
амилоидозом), инфекционную и лекарственную
патологию и т.д.
В отличие от прежних, ставших классичес-
кими, установок отдельным нозологическим
формам невозможно приписывать единство
патогенеза и даже единство этиологии. На при-
мере течения острого постстрептококкового ГН
и перехода его в хроническую стадию мы убеж-
даемся, что высокое артериальное давление не
является постоянным отличительным призна-
ком. Наоборот, при кажущемся выздоровлении
в конце острой фазы характерен переход в суб-
клиническое, или латентное, течение с норма-
лизацией артериального давления. Высокое дав-
ление в острой фазе носит характер гиперто-
нии выброса (гипертензии), а в позднем тер-
минальном и претерминальном периоде — ги-
пертонии сопротивления.
Нозологический принцип классификации болез-
ней, не связанный в отношении любой отдель-
ной нозологической формы отнесением ее к бо-
лее крупным группировкам, даже таким, как ин-
фекционные или неинфекционные, аутоиммун-
ные или неиммунные заболевания и т.д., отве-
чает любой потребности в классификации бо-
лезни для практических вопросов регистрации,
диагностики, лечения и профилактики.
Нозологический принцип классификации
нефрита предполагает выделение нозологичес-
ких форм, представляющих большой интерес с
их характерными особенностями, нередко вы-
ходящими и по поражению самих почек за
рамки собственно ГН. Ограничимся немноги-
ми примерами: лекарственный; вакцинный,
сывороточный, химический; атопический; па-
ратуберкулезный (неспецифический, амикроб-
ный); вирусный НВ^-положительный; малярий-
ный нефрит; травматический.
9.1.2. Острый гломерулонефрит
Наиболее изучен в отношении этиологии и
патогенеза постстрептококковый острый ГН,
развивающийся чаще всего через 10—12 дней
после фарингита или тонзиллита. За этот срок
в организме образуются антитела и нередко
бурно развивается аллергический нефрит. Воз-
будителем являются специфические типы груп-
пы А /1-гемолитического стрептококка (12, 4,
1, 49) и некоторые другие нефритогенные типы.
Развитие острого ГН сопровождается нараста-
нием титра противострептококковых антител.
Постстрептококковый ГН изучен и в дерма-
тогенной форме как следствие первичной ло-
кализации стрептококка определенного типа
13*
195
(49, 12) при импетиго, пиодермии, роже, в
эпидемических размерах наблюдавшийся в раз-
вивающихся странах, например в Тринидаде у
760 больных [Potter Е. et al., 1978], и представ-
ляющий значительный клинико-эпидемиологи-
ческий и, можно сказать, клинико-биологичес-
кий интерес. Аналогично широко распростра-
ненная раньше у некоторых племен Африки
кожная дифтерия, а также экстрабуккальная
ожоговая скарлатина могут вызывать острый
ГН.
По данным В.В.Суры и А.М.Вихерта (1966),
мембранозный острый ГН легко воспроизводит-
ся у животных при введении микобактериаль-
ного адъюванта, стимулятора процессов имму-
ногенеза. К инфекционно-иммунной группе ГН
относят также малоизученные вирусные ГН при
кори, ветряной оспе, вирусном гепатите, эн-
теровирусной инфекции.
В группу ГН неинфекционно-иммунного
происхождения входит ГН, развивающийся
после ряда антигенных воздействий (сыворот-
кой, вакциной, пыльцой растений, ядом на-
секомых, лекарственными и другими химичес-
кими веществами, пищевыми продуктами при
индивидуальной непереносимости). Особое ме-
сто занимает ГН, возникающий при наруше-
нии венозного оттока (частичный тромбоз по-
чечных вен, нижней полой вены, сдавливаю-
щий перикардит, недостаточность трехстворча-
того клапана).
ГН легко воспроизводится в эксперименте
с помощью гетерологических антипочечных сы-
вороток, получаемых при иммунизации живот-
ных почечным антигеном животного другого
вида [Линдеман В.К., 1900; Masugi М., 1934].
Как показали опыты с меченой противопочеч-
ной сывороткой, связывание ее на базальной
мембране клубочков происходит в течение не-
скольких минут [Pressman D., 1948], возникно-
вение клинико-морфологических проявлений
ГН обусловлено фиксацией комплемента в клу-
бочках и зависит от комплементсвязывающей
способности вводимой противопочечной сыво-
ротки.
Для воспроизведения экспериментального
ГН по Масуги используется противопочечная
сыворотка птиц, не обладающая способностью
связывать комплемент млекопитающих. Между
введением сыворотки и возникновением ГН
проходит латентный период (6—8 дней), необ-
ходимый для образования комплементсвязыва-
ющих противопочечных аутоантител. В патоге-
незе этого варианта экспериментального ГН
можно выделить две иммунологические фазы —
фиксацию экзогенных антител в почках и пос-
ледующее образование аутоантител, способных
связывать комплемент.
Эксперименты с использованием адъюван-
196
тов типа Фрейнда [Heymann, 1959] демонстри-
руют значение общей иммунологической реак-
тивности для возникновения ГН. Если введение
животным гомологичного почечного антигена
не вызывает у них развития ГН, то введение
его в составе микобактериального стимулятора
позволяет воспроизвести это заболевание.
Иммуноаллергическая гипотеза патогенеза
ГН подтверждается также данными, получен-
ными при изучении роли стрептококков в его
возникновении. Как показали опыты PA.Cavelti
и F.S.Cavelti (1945), ГН удается вызвать введе-
нием животным смеси из ткани почки и стреп-
тококков. Возможно, стрептококк меняет свой-
ства белков ткани почки, делая их антигенны-
ми; не исключено и его адъювантное действие.
Антиген стрептококка (М-протеин) по своей
химической природе относится к гликопроте-
инам. Доказано антигенное сродство БМ капил-
ляров клубочков и оболочек стрептококков не-
фритогенных штаммов. Часть М-протеина фик-
сируется в клубочках, часть циркулирует в кро-
вяном русле, вызывая образование антител.
Комплексы, образующиеся в результате реак-
ции антиген — антитело, задерживаются клу-
бочковым фильтром с фиксацией комплемен-
та. Образование ИК с фиксацией комплемента
может происходить и непосредственно в клу-
бочках. ИК повреждают почку. При иммуномор-
фологическом изучении иммунокомплексного
ГН скопления комплексов обнаруживают суб-
эндотелиально или субэпителиально в виде
глыбок.
Участие клеточных механизмов иммунитета
в патогенезе ГН, более характерных для мемб-
ранозного ГН, подтверждается возможностью
переноса экспериментального адъювантного
нефрита лимфоцитами (но не сывороткой)
больного животного [Hess Е. et al., 1962] здо-
ровому реципиенту. Механизм такого переноса
объясняется цитопатическим действием лимфо-
цитов в эксперименте [Holm G., 1966], в том
числе в культуре почечной ткани [Траянова Т.Г.
и др., 1966, 1974]. Клубочки повреждаются
высвобождением лизосомальных протеаз из
нейтрофилов и прямым действием активиро-
ванных компонентов комплемента. Пропердин
и СЗ-проактиватор (фактор D) часто обнару-
живают в клубочках, что указывает, возможно,
на активацию комплемента альтернативным
путем.
Заболевают острым постстрептококковым
ГН преимущественно дети (с 2-летнего возра-
ста) и взрослые до 40 лет. Однако известны
случаи заболевания и грудных детей, а также
лиц пожилого и старческого возраста. T.Addis
(1948) наблюдал начало нефрита у 6-месячно-
го ребенка и 87-летней женщины. Среди боль-
ных мужчин в 1,5—2 раза больше.
В отношении даже основных клинических
проявлений острого ГН, в частности гемоди-
намических нарушений, еще недавно господ-
ствовала выдвинутая F.Volhard моноконцепция
ангиоспазма с ишемией почки, артериальной
гипертонией сопротивления, больше свойствен-
ной позднему периоду хронического ГН, но не
имеющей места в инициальном остром перио-
де и в длительном состоянии латентного ГН.
Это и дает основание остановиться подробнее
на особенностях центральной гемодинамики
при остром ГН.
Установленное нами в первую неделю ост-
рого, циклически протекающего постстрепто-
коккового ГН (до волны диуреза) повышение
массы циркулирующей крови [Тареев Е.М.,
Ратнер Н.А., 1935] позволило выдвинуть кон-
цепцию «гиперволемической недостаточности
кровообращения», отвечающую модели форси-
рованного вливания солевого раствора в вену
животным (при остром ГН к гиперволемии
приводит, по-видимому, резко повышенная
водно-натриевая резорбция канальцев).
Внутривенное введение солевого раствора
собакам вызывает расширение полостей серд-
ца, тахикардию, ритм галопа, гидроперикард,
отек легких, увеличение печени, рентгеноло-
гические изменения в легких, повышение ве-
нозного давления и массы крови. При острой
гиперволемии можно думать о рефлекторном
расширении через вазомоторный центр круп-
ных вен печени. Печень и селезенка увеличи-
ваются компенсаторно, выполняя так называ-
емую резервуарную функцию. Расширение пе-
чени и сердца у больных нефритом предупреж-
дает эклампсию [Hobecourt, 1916]. Наибольшее
количество циркулирующей крови (до 181 мл на
1 кг массы тела, или 9 л) наблюдалось нами
именно у больных перед эклампсией [Ефимов
Н.А., 1948]. Обычно имеется олигоцитемическая,
реже нормоцитемическая, гиперволемия. В отсут-
ствие гиперволемии, несмотря на наличие ар-
териальной гипертонии и отеков, нефрит про-
текает обычно без жалоб больных на одышку.
Венозное давление нередко значительно
повышено (до 300 мм вод. ст.) уже в обычном,
спокойном состоянии больного и возрастает
еще больше при некоторых провоцирующих
воздействиях.
Скорость кровотока непостоянно замедлена.
Резкое улучшение кровообращения после кро-
вопускания, так же как и при сухоядении (при
особой чувствительности больных к водно-со-
левым нагрузкам, увеличивающим массу кро-
ви), подтверждает exjuvantibus et nocentibus кон-
цепцию о гиперволемической недостаточности
кровообращения. Введение активного мочегон-
ного оказывает еще более благоприятное воз-
действие с явным снижением венозного и ар-
териального давления, а также ускорением
кровотока.
При самостоятельном выздоровлении одыш-
ка, ортопноэ, расширение сердца, ритм гало-
па и т.д. исчезают очень быстро, что уже само
по себе свидетельствует об отсутствии суше-
ственного самостоятельного поражения миокар-
да. Закономерно также нарастание концентра-
ции общего белка сыворотки крови у больных
часто уже в первые 2 нед болезни (из-за быст-
рого уменьшения отека плазмы).
Судорожный синдром отличает эклампсию
острого нефрита от криза при гипертонической
болезни; кроме того, его развитие тесно связа-
но с отеком мозга, отсутствующим (или редко
наблюдаемым) при гипертонических кризах.
Конечно, и гипертонический фактор должен
занять свое место в концепции происхождения
нефритической эклампсии, в пользу чего гово-
рят, помимо клинической картины, изменения
глазного дна, особенно развитие мозговых кро-
воизлияний при более тяжелом эклампсичес-
ком состоянии.
По существу в происхождении эклампсии
следует учитывать все те сложные нарушения
регуляции водно-солевого обмена и кровообра-
щения, имеющиеся вообще при остром нефри-
те, и рассматривать эклампсию как высшую
степень тех же проявлений.
На современном этапе гемодинамические
нарушения и другие патогенетические механиз-
мы при остром ГН (постстрептококковом)
представляются в следующем виде. У больных
острым ГН гиперволемия является первичным
фактором циркуляторных нарушений. Нормаль-
ная скорость кровотока, неспецифические из-
менения ЭКГ и незначительные гистологичес-
кие изменения в миокарде у больных, умира-
ющих в острой фазе болезни, свидетельствуют
против первичного поражения миокарда. Боль-
шая часть клинических проявлений острого ГН
связана с задержкой натрия и воды, не корре-
лирующей со снижением КФ. Секреция рени-
на не служит первопричиной артериальной
гипертонии при остром ГН.
Клинические проявления острого ГН весьма
разнообразны — от крайне скудных (случайно
в процессе обследования выявленных изменений
мочи) до чрезвычайно ярких, с бурно развива-
ющейся классической триадой симптомов —
отеки, гипертония и гематурия. Этим симптомам
могут предшествовать слабость, жажда, олигу-
рия. При развившейся картине заболевания боль-
ного беспокоят одышка, сердцебиение, голов-
ная боль, тошнота, рвота, боли в пояснице,
отеки разной степени выраженности. Моча при
макрогематурии может быть красной или корич-
невой из-за перехода гемоглобина в гематин при
кислой реакции мочи.
197
Отеки — один из наиболее ранних и частых
признаков ГН — отмечаются у 70—90 % боль-
ных; у 50 % они бывают значительными. Пре-
имущественная локализация отеков на лице,
бледность кожи и набухание шейных вен по-
зволяют говорить (у части больных) о facies
nephritica. Отек лица наиболее выражен утром;
днем он спадает, сменяясь сильным отеком
лодыжек. По мере прогрессирования одышки,
слабости, утомляемости, анорексии нарастает
отек в других тканях, на голенях с тугой кон-
систенцией кожи, что характерно для быстро-
го развития отека под кожей нормального тур-
гора и эластичности.
В период обратного развития признаков ос-
трого нефрита можно наблюдать значительное
снижение массы крови одновременно с умень-
шением видимых отеков.
Остро возникающая гиперволемия приводит
к расширению полостей сердца; размеры его
нормализуются после восстановления диуреза и
спадения отеков. Сила верхушечного толчка
зависит от анасарки (общая водянка), расши-
рения полостей сердца, наличия гидроперикар-
да. При аускультации нередко обнаруживают
ослабление первого тона, акцент II тона на
аорте, систолический шум над верхушкой при
относительной недостаточности митрального
клапана, в тяжелых случаях — ритм галопа. Из-
менения ЭКГ разнообразны и определяются
выраженностью гемодинамических и электро-
литных нарушений. Часто наблюдаются низкий
вольтаж, удлинение интервала P—Q, двухфаз-
ность и уплощение зубца Т, иногда смещение
интервала 5— Т. Изредка возможны острые на-
рушения кровообращения в периферических
артериях, приводящие к очаговому некрозу на
конечностях.
Артериальное давление обычно повышено
умеренно (160/100 мм рт. ст.) у 60—70 % боль-
ных острым ГН. Выраженная артериальная ги-
пертония необычна и говорит скорее о бывшей
до болезни гипертонии или о ее сочетании с
другими болезнями. У лиц с ранее нормальным
артериальным давлением изменений сетчатки
нет. Длительное и стойкое повышение артери-
ального давления прогностически неблагопри-
ятно. Ведущее значение в патогенезе гиперто-
нии при остром ГН придается задержке натрия
и воды, увеличению объема циркулирующей
крови и ударного объема сердца. В первые дни
болезни повышение артериального давления по
гиперкинетическому типу с увеличением сер-
дечного выброса сочетается со снижением пе-
риферического сопротивления. В дальнейшем по
мере снижения артериального давления пери-
ферическое сопротивление нормализуется.
Протеинурия отмечается почти у всех боль-
ных, за исключением редких случаев анальбу-
198
минурического ГН, и может достигать высоких
цифр (до 90 %о). Массивная протеинурия со-
храняется обычно не более 1—2 нед, умерен-
ная — несколько месяцев.
Боли в области поясницы имеют разную
степень выраженности, чаще симметричные,
зависят от набухания почек и растяжения их
капсулы, нарушения уродинамики. Дизуричес-
кие явления возникают редко; вероятно, они
связаны с высокой концентрацией и повышен-
ной кислотностью мочи. Олигурия и даже ану-
рия возможны чаще в первые дни заболевания
и продолжаются обычно 2—3 дня. Более про-
должительная олигурия наблюдается редко. Для
олигурии при остром ГН характерна высокая
относительная плотность мочи. Длительная оли-
гурия, особенно у пожилых больных — плохой
прогностический признак, хотя описаны бла-
гоприятные исходы при олигурии, продолжав-
шейся до 8 нед.
Изменения функции почек разнообразны и
зависят от тяжести процесса. Почечный крово-
ток в норме или увеличен, за исключением
наиболее тяжелых случаев; азотовыделительная
функция обычно не нарушена, но у тяжело-
больных могут наблюдаться олигурия и анурия.
При этом возможны существенные сдвиги типа
ОПН, в том числе такие, как гиперкалиемия;
с началом диуреза обычно к 10—14-му дню они
исчезают.
В крови незначительно снижены гемоглобин
и гематокрит в соответствии со степенью экс-
пансии объема плазмы. Тяжелая анемия указы-
вает на наличие другого заболевания.
Высокая СОЭ не ухудшает прогноза; редко
она может оставаться повышенной при исчез-
новении всех клинических проявлений. С-реак-
тивный белок обычно в норме, а повышение
его содержания может указывать на сопутству-
ющую бактериальную инфекцию.
Прогноз. Летальность при остром ГН обыч-
но невелика и связана главным образом с ос-
ложнениями — кровоизлиянием в мозг, острой
сердечной недостаточностью, инфекционными
осложнениями и тромбозами. Почечная недо-
статочность редко приводит к смерти.
В 10—15 % случаев острый ГН переходит в
хронический. Условно об этом можно говорить,
если в течение года сохраняются гипертония
или отеки либо протеинурия выше 1 %о; од-
нако известны случаи выздоровления спустя
2 года после начала развития этих симптомов.
Трудоспособность больных в зависимости от
формы и тяжести ГН восстанавливается в раз-
личные сроки, обычно через 2 мес. Необходи-
мо остерегаться физических нагрузок; не реко-
мендуется работа, связанная с охлаждением.
Остро возникший аллергический мембраноз-
ный нефрит (также с депозитами ИК) прохо-
дит, если элиминирован антиген: пищевой —
аглютеновой диетой, поллинозный — меньшим
общением с природой, лекарственный (от со-
лей йода, D-пеницилламина, бутадиона и
др.) — отменой препарата.
9.1.3. Быстропрогрессирующий
гломерулонефрит
Синонимы: злокачественный, подострый [Chauf-
fard А., 1911], экстракапиллярный [Volhard F.,
1914], бурный [Lohlein М., 1906], с полулуния-
ми, фульминантный. Заболевание характеризу-
ется наиболее четким клинико-морфологичес-
ким синдромом и очень неблагоприятным те-
чением, сохраняющим в то же время все при-
знаки классического нефрита Брайта. Эту фор-
му с развитием уже через 3—4 мес терминаль-
ного уремического перикардита описал A.Chauf-
fard под названием «подострый нефрит», под-
черкнув упорство болезни.
Быстропрогрессирующий ГН начинается как
обычный острый, иногда без бурных симпто-
мов. Типичны сильные, упорные отеки типа
анасарки, резкая холестеринемия и гипопроте-
инемия, высокая протеинурия. Эти показатели
могут привести к ошибочному диагнозу липо-
идного нефроза, особенно у детей. В то же вре-
мя имеется выраженная гематурия. Относитель-
ная плотность мочи вначале высокая, затем
быстро падает, несмотря на резкую олигурию.
Азотемия, анемия, развивающиеся уже в пер-
вые недели болезни, быстро прогрессируют.
Артериальное давление, как правило, очень
высокое. Развивается выраженная ретинопатия
с отслойкой сетчатки. Гипертрофия сердца не
достигает, однако, больших размеров; масса его
редко превышает 400 г.
Наиболее типична идиопатическая форма
взрослых, встречающаяся у большинства боль-
ных с молниеносным течением, с депозитами
ИК или линейным свечением антител к базаль-
ной мембране в клубочках.
Морфологически характерен пролифератив-
ный гломерулит с фибринозно-эпителиальны-
ми полулуниями, которые, по данным био-
псии, могут развиваться уже спустя неделю,
диффузной пролиферацией эпителиальных кле-
ток в большей части клубочков и тотальной или
сегментарной облитерацией боуменовых про-
странств. Одновременно имеется распространен-
ное канальцевое и интерстициальное пораже-
ние, обусловливающее значительное падение
концентрационной функции. Часто выявляется
фибриноидный некроз клубочков и артериол.
Подострый злокачественный нефрит приво-
дит к прогрессирующей гибели нефронов, де-
формации архитектоники почки и представля-
ет как бы укороченное течение классического
брайтова нефрита с полным набором его сим-
птомов (смешанный нефротически-гипертони-
ческий нефрит). Смерть наступает от почечной
недостаточности.
Злокачественный нефрит можно заподоз-
рить, если уже на 4—6-й неделе остро начав-
шегося нефрита снижена относительная плот-
ность мочи, повышены содержание креатини-
на в сыворотке, холестерина и артериальное
давление, общее состояние тяжелое. Больные
умирают через 6—18 мес. В терминальном пе-
риоде у 30 % больных развивается гипертония
злокачественного типа.
Быстропрогрессирующий нефрит наблюдает-
ся и при системных заболеваниях: тяжелом те-
чении геморрагического васкулита, СКВ, узел-
кового периартериита и других некротизирую-
щих васкулитах, подостром инфекционном
эндокардите, синдроме Гудпасчера (с непосто-
янными иммунофлюоресцентными находками)
и др.
К злокачественному ГН относят также слу-
чаи с постепенным, малозаметным началом,
длительностью до 2 лет и более, с фиброзом
полулуний, тяжелой атрофией канальцев; диф-
фузный интерстициальный фиброз может раз-
виваться еще медленнее (2—3 года и более).
При злокачественном ГН могут отсутствовать
некоторые признаки, например отеки, гипер-
тония. В последнем случае заболевание легко
принять за нефротический ГН. Быстрое и стой-
кое снижение функции почек, нарастающие из-
менения глазного дна имеют решающее значе-
ние в диагностике.
Прогноз злокачественного ГН остается край-
не тяжелым даже у детей, у которых обычно
быстрее наступает восстановление функции
почек.
Приводим наблюдение с крайне острым
началом и развитием болезни.
Мальчик, 14 лет, 06.03.50 г. упал, ударившись
левым боком. Через несколько часов после травмы
появились резкие схваткообразные боли в животе,
частый жидкий стул с кровью, периодически —
рвота с примесью алой крови, нерезкая пастозность
ног. Боли в животе продолжались 1,5—2 нед, затем
появились геморрагические высыпания на голенях и
стопах, предплечьях и лице, общие отеки, частая
рвота. Артериальное давление 150/120 мм рг. сг. В моче
3 %о белка. Госпитализирован с диагнозом: нефрит,
сепсис (?).
В клинике состояние тяжелое, бледен, лицо одут-
ловатое, на руках и ногах геморрагическая сыпь, на
пальцах стоп и лодыжках геморрагические пузыри ве-
личиной с орех. Артериальное давление 140/100 мм
рт. ст. В животе скопление свободной жидкости, рез-
кая болезненность под ложечкой. Моча вида «мяс-
ных помоев», белка 2,4 %о, эритроциты свежие,
местами почти покрывают все поле зрения; относи-
199
тельная плотность мочи по Зимницкому 1,006—1,008.
В крови: НЬ 13,8 г/л, эр. 4,74х10’/л, л. 12,6х10’/л,
нейтрофилы: п. 2 %, с. 82,5 %, лимф. 12,5 %, мон. 3 %;
СОЭ 33 мм/ч. В сыворотке содержание общего белка
46 г/л, холестерина 170 ммоль/л, остаточного азота
107,1 ммоль/л.
Общее состояние быстро ухудшалось, нарастали
кожный зуд, рвота, анорексия, носовые кровотече-
ния, сонливость, гипотермия с новыми волнами ге-
моррагических высыпаний. 10.05: НЬ 10,5 г/л, эр.
2,57хЮ’/л, л. 11,5х10’/л, э. 1 %, нейтрофилы: п. 14 %,
с. 71 %, лимф. 11 %, мон. 3 %; СОЭ 35 мм/ч. Белка в
моче 8—9 %о, в осадке свежие эритроциты.
20.05: боли в горле, правосторонний тонзиллит,
температура 37,5 °C, дыхание шумное, глубокое,
сознание спутанное. Остаточный азот 80 ммоль/л.
Больной впал в бессознательное состояние при на-
растающих явлениях уремии. 25.05 наступила смерть.
Клинический диагноз: хронический нефрит. Ка-
пилляротоксикоз. Хронический тонзиллит. На вскры-
тии обнаружен подострый ГН с выраженным нефро-
тическим компонентом. Умеренная гипертрофия ле-
вого желудочка. Уремия. Двусторонняя очаговая ге-
моррагическая пневмония. Мелкоточечные кровоиз-
лияния в слизистую оболочку желудка и толстой
кишки. Дегенерация миокарда. Очаговое жировое пе-
рерождение печени. Микроскопически установлен
экстракапиллярный подострый ГН.
9.1.4. Клинические варианты
хронического гломерулонефрита
Нефротический гломерулонефрит — нефротичес-
кий тип ГН, липоидный нефроз — это брай-
тов нефрит с многосиндромной симптоматикой
в острой, подострой и хронической формах,
только растянутый на годы, с особенно зако-
номерными ремиссиями и обострениями и
постепенным, реже острым, началом.
В прошлом переоценивали самостоятельность
липоидного нефроза и резкую ограниченность
ГН. Для первого исключалась роль поражения
клубочков с исходом в сморщенную почку при
нередко полном спонтанном излечении, для
второго — подчеркивалась облигатность артери-
альной гипертонии, гематурии. R. Bright расце-
нивал выделяемые им типы лишь как фазы
одной болезни. Эту точку зрения разделяют не-
фрологи и в настоящее время.
Согласно концепции иммунного воспале-
ния, дистрофия почек не отличается от нефри-
та; при НС и амилоидозе в почке происходят
иммунопатологические реакции, дающие нача-
ло выходу с мочой фактора, реализующего
положительный волчаночный тест.
Смешанный хронический ГН соответствует
характеристике классического брайтова отечно-
гипертонического нефрита, сближаясь со зло-
качественным ГН. В последние годы этот вари-
ант реже выделяют и вследствие выраженнос-
ти основных признаков НС (холестеринемия и
200
липидурия) называют обычно нефротическим.
Однако уже клинически, а тем более после
биопсии очевиден компонент пролиферативно-
го гломерулита. Течение более быстрое, чем при
нефротическом нефрите (3—5 лет). Положитель-
ный эффект кортикостероидов и иммунодеп-
рессантов наблюдается редко.
Латентный гломерулонефрит. Это своеобраз-
ное латентное развитие хронического ГН, не
сознаваемое больными, без гипертонии и моз-
говых и сердечных кризов, отеков, большой
гематурии. На вскрытии обнаруживают несом-
ненную вторичную нефритическую сморщен-
ную почку. Больные годами сохраняют работо-
способность, избегают ятрогенных влияний,
благодаря чему несколько отодвигают терми-
нальную катастрофу. Болезнь выявляют в той
или иной стадии при диспансеризации или
случайном обследовании. Иногда лишь при био-
псии почек устанавливают правильный диагноз
нефрита, ведущий к некоторым рациональным,
а иногда и чрезмерно строгим ограничениям
режима. К скрытому варианту хронического
нефрита можно отнести многие случаи детско-
го, а также подросткового нефрита.
Нефротический хронический ГН также вна-
чале нередко протекает латентно. Отеки и дру-
гие очевидные признаки болезни почек выяв-
ляются позже, иногда спустя много месяцев.
При диспансерном обследовании удается выя-
вить раннюю доотечную стадию нефротического
ГН не только по наличию протеинурии, но и
по тенденции к гиперхолестеринемии, гипо-
протеинемии, увеличению СОЭ.
Большая доля латентных случаев приходится
на вторичный скрытый период болезни, полные
или частичные ремиссии, когда чрезвычайно
важно установить степень активности процесса
для прогноза прогрессирования болезни. Латен-
тность после острой атаки охарактеризована так:
«... В моче полностью прекращается выделение
красных частиц, и в зависимости от степени зна-
чения, которое придавалось проявлениям болез-
ни, на них обращают все меньше внимания или
полностью забывают их» [R.Bright, цит. по de
Wardener Н., 1963]. Во вторичном скрытом пе-
риоде, который может продолжаться 20 лет и
более, при обычном анализе мочи нередко вы-
являют весьма скудные, трудные для толкова-
ния отклонения от нормы.
Наряду с ‘/5 больных, проходящих не-
фротическую («дегенеративную») фазу, боль-
шая часть (остальные 4/5) не минуют латент-
ной стадии.
Гипертонический гломерулонефрит — хрони-
ческий ГН гипертонического типа, васкуляр-
ный ГН [Volhard F., 1931], вначале протекает,
как правило, без жалоб, отеков и гематурии.
Преобладает гипертонический синдром как та-
ковой, а не почечный (что отмечал и F.Vol-
hard), функция почек не нарушена.
Характеризуется длительным течением — до
20—30 лет (как при медленно прогрессирующей
гипертонической болезни), хорошо или удов-
летворительно переносимой артериальной ги-
пертонией с небольшой протеинурией и цилин-
друрией, которые при гипертонической болез-
ни медленного течения не всегда развиваются.
Повышение артериального давления первое
время может иметь интермиттирующий харак-
тер. Вскоре гипертония становится постоянной,
давление несколько повышается в вечерние
часы. Нередко даже при систолическом давле-
нии выше 200 мм рт. ст. больные, особенно
молодого возраста, полностью сохраняют рабо-
тоспособность. Иногда развивается кровоизли-
яние в мозг у сравнительно молодых субъектов
даже в период сохранной функции почек. Тя-
желое поражение венечных сосудов сердца с
инфарктом миокарда также менее типично для
гипертонического нефрита в отличие от гипер-
тонической болезни.
Гипертонический ГН при латентном нача-
ле, отсутствии в анамнезе острого нефрита,
токсемии беременных, пиелонефрита распозна-
ют по многолетнему течению, близкому доб-
рокачественной гипертонической болезни, од-
нако с ранним (уже при первых анализах)
выраженным мочевым синдромом.
Высокое артериальное давление до развития
ХПН связано скорее всего с повышенным пе-
риферическим сопротивлением. Вероятно, про-
ходит ранний цикл повышения всего обмено-
способного натрия, внеклеточного объема жид-
кости и «общей воды» организма, что в отсут-
ствие видимых отеков приводит к повышению
артериального давления, за которым следуют
вазоконстрикция, гиперперфузия органов при
нормальном сердечном выбросе.
Артериальное давление резко повышается
при развитии почечной недостаточности, ког-
да болезнь часто впервые проявляется клини-
чески полиурией, никтурией, нарушением зре-
ния в связи с ретинитом или уремическими
явлениями или (еще до полного развития уре-
мии) признаками сердечной недостаточности.
На перегрузку левого сердца указывают припод-
нимающий верхушечный толчок, расширение
тупости сердца влево, хлопающий II тон над
аортой, ритм галопа, кровохарканье, застойный
бронхит, сердечная астма и др. Увеличивается
протеинурия, снижаются функция почек, от-
носительная плотность мочи (до 1,012—1,010).
При резкой гипертонии возможна макрогема-
турия. Развиваются одышка, отеки лодыжек,
слабость, упорная головная боль, тошнота,
рвота, жажда. Снижением артериального давле-
ния можно задержать развитие болезни.
Артериальная гипертония становится более
постоянной и резистентной к лекарственной те-
рапии по мере нарастания почечной недоста-
точности, а в терминальном или претерминаль-
ном периоде приобретает черты злокачествен-
ной гипертонии, когда труднее распознать
длинный нефритический путь развития болез-
ни. При КФ ниже 10 мл/мин у 80 % больных
гипертония становится стабильной, у 25 % из
них — злокачественного, акцелерированного
характера. Отмечено даже, что среди больных
с ХПН и нормальным или сниженным арте-
риальным давлением преобладают больные с
особой формой интерстициального нефрита
или обструктивной нефропатией с преоблада-
ющим поражением канальцев и/или тубуло-
интерстициальным поражением и тенден-
цией к «утечке» натрия, что наблюдается так-
же при фенацетиновой нефропатии, нефроно-
фтизе и поликистозе. Сердечный индекс повы-
шен при ХПН и при нормальном артериаль-
ном давлении уже в зависимости от уремичес-
кой анемии.
Терминальный гломерулонефрит — конечная
стадия ГН любого типа, хроническая уремия
[Тареев Е.М., 1958; Lansing А.М. et al., 1963].
Терминальный ГН в настоящее время зас-
луживает выделения в связи с возможностью
включения именно в этот период активной
заместительной терапии — внепочечного очи-
щения или пересадки почек. Терминальный ГН
является финалом любой формы хронического
ГН, при злокачественном нефрите сливается с
относительно коротким прогредиентным тече-
нием болезни.
Условно можно выделить также претерми-
нальный нефрит (период толерантности или
компенсации), известный старым клиницистам
такой нетипичной клинической картиной, ког-
да больной, оставаясь работоспособным,
предъявляет жалобы лишь на слабость, утом-
ляемость, снижение аппетита или же чувству-
ет себя совершенно здоровым. Благодаря дру-
гим сохраняющимся функциям почти не сецер-
нирующая мочу почка может поддерживать
жизненные силы больного, выделяя в кровь
эритропоэтин, контролируя ренин-ангиотен-
зи новую систему, предотвращая ту резкую сла-
бость, которую испытывает больной после нефр-
эктомии.
При медленно развивающейся и далеко за-
шедшей терминальной стадии морфологически
имеется сморщенная почка — вторичная не-
фритическая, с малохарактерными изменени-
ями, нередко трудноотличимая от первичной
сморщенной при злокачественной гипертони-
ческой болезни или от пиелонефритической
сморщенной почки. В этой фазе иммунологичес-
кая реактивность больных обычно оказывается
201
пониженной по сравнению с более активны-
ми периодами хронического нефрита.
Артериальная гипертония, нередко нараста-
ющая или развивающаяся впервые при перехо-
де заболевания в фазу большой почечной не-
достаточности, может быть близка к злокаче-
ственной. Такая злокачественная гипертония с
диастолическим давлением выше 130 мм рт. ст.
развивается у 5 % больных. Она несколько ме-
нее опасна, чем злокачественная гипертоничес-
кая болезнь, и поддается лечению гипотензив-
ными средствами, но следует помнить, что при
этом ухудшается функция почек.
Зрение ухудшается чаще при уже развитой
азотемии. При злокачественной гипертоничес-
кой болезни, наоборот, этот симптом появля-
ется несколько раньше, чем наступает тяжелая
почечная недостаточность.
Жалобы больных обусловлены уремической
интоксикацией, поражением сердечно-сосуди-
стой системы. Общие отеки сохраняются редко.
В этот период лицо может быть одутловатым. Ха-
рактерны полиурия, изостенурия, низкое со-
держание белка в моче, «широкие» цилиндры
в осадке, происходящие из чрезмерно расши-
ренных канальцев сохранившихся гипертрофи-
рованных нефронов.
Терминальный ГН, в том числе ранее про-
текавший латентно, распознать нетрудно, если
помнить о возможности развития конечной
стадии ГН. Важно учитывать возможность хотя
бы частичной обратимости почечной недоста-
точности и ухудшения состояния больных за
счет каких-либо факторов — злокачественной
гипертонии, водно-солевых перегрузок, интер-
куррентных инфекций, иммунных стрессов,
травмы и т.д.
В ряде случаев терминальный ГН начинает-
ся остро, без предвестников, приступом уре-
мической подагры или уремическим перикар-
дитом, что может служить показанием к гемо-
диализу или трансплантации почки. Тем не
менее не всегда врачи правильно распознают
патологию или склонны применять консерва-
тивное лечение леспенефрилом и другими пре-
паратами. Случаи уремии с коротким предсмер-
тным течением многочисленны. Приводим при-
мер.
Студент 21 года летом купался в море, осенью
сдавал экзамены и до декабря занимался в инсти-
туте с полной нагрузкой, не считая себя больным.
В декабре распух большой палец правой ноги. После
ультрафиолетового облучения припухлость и боли
исчезли. Появились слабость, носовые кровотече-
ния. В анализе мочи: относительная плотность 1,006,
белок 1,6 %. Кровь: эр. 1,9х1012/л, остаточный азот
188,4 ммоль/л; СОЭ 72 мм/ч. АД 175/100—150/85 мм
рт ст. Некротическая ангина. Шумное дыхание, су-
дороги, шум трения перикарда. 26.12 потерял созна-
202
ние и в 14 ч наступила смерть (клиническое тече-
ние болезни 16 дней). Диагноз: хронический нефрит
с исходом в сморщивание почки. Уремический пе-
рикардит подтвержден на вскрытии.
9.1.5. Диагноз и дифференциальный
диагноз гломерулонефритов
Диагноз ГН, занимающего центральное место
в терапевтической, консервативной нефроло-
гии, имеет большое значение прежде всего для
практической деятельности врача, а также для
научной систематизации и направленности
наших знаний.
Не надо думать, что прогресс техники как
таковой обеспечивает легкость установления ди-
агноза. Диагностика ГН трудна из-за того, что
больной не всегда стремится как можно пол-
нее «раскрыть свои карты», особенно если
имеет пристрастие к анальгетикам или нарко-
тикам, или даже (это касается женщин с ар-
тифициальной болезнью) с особой легкостью
симулирует протеинурию или гематурию. Боль-
ным, особенно женщинам, необходимо зада-
вать вопросы об употреблении лекарств, так как
они уже годами не считают таковыми прини-
маемые снотворные или анальгетики, оральные
контрацептивы. При общении с больным, с его
окружающими можно выяснить, что повторно
рецидивирующий НС имеет сезонный характер
и часто связан с поллинозом.
Нефриты при системных заболеваниях при
проведении дифференциального диагноза ста-
вят на первое место, поскольку действительно
правильнее считать изолированное заболевание
одного органа скорее исключением. Недоучетом
системности заболевания обусловлены частые
диагностические ошибки; многие болезни, раз-
вившиеся вследствие инфекционных аллерги-
ческих процессов и осложненные реакциями
лекарственной непереносимости, требуют оцен-
ки состояния целостного организма. К систем-
ным заболеваниям могут быть отнесены цик-
лически протекающие инфекции с тубулоин-
терстициальным поражением почек — вирус-
ная дальневосточная геморрагическая лихорадка
или холера с анурическим некронефрозом, без
исхода в хронический нефрит.
Приводим пример заболевания, длительно
прослеженного и правильно распознанного.
В 1947 г. мы консультировали 13-летнюю девочку
с протеинурией, у которой в течение 5 мес наблю-
далось лихорадочное состояние. Селезенка была уве-
личена. Больной ставили диагноз малярийный не-
фрит (несмотря на отсутствие паразитов в крови).
В результате обследования и наблюдения был рас-
познан затяжной септический эндокардит: у девоч-
ки констатирован врожденный порок сердца, паль-
цы имели вид «барабанных палочек», выявлена резко
положительная формоловая реакция. После единствен-
ного 5-дневного курса пенициллина (45 000 000 ЕД)
состояние улучшилось, многие годы оставалась лишь
протеинурия в виде следов белка в моче. Больная до
сих пор находится под наблюдением. Стабилизация
общего состояния позволила ей выйти замуж; она
родила в барокамере полноценного здорового маль-
чика.
Системность болезней, например СКВ, мо-
жет быть выражена по-разному. Как правило,
висцеральное поражение начинается быстро без
предсистемной дискоидной фазы (когда-то та-
кое течение болезни было редкостью). Ранним
эквивалентом дискоидной волчанки являются
стертый артрит, капилляриты, ЛЕ-клетки.
В случае присоединения нефрита лихорадка, ар-
триты исчезают. Какие-то системные признаки
наряду с поражением почек все же обычно
обнаруживают, например хорею, отличающу-
юся от ревматической только возрастом боль-
ных: болеют подростки (при ревматизме — дети
раннего возраста). Точный диагноз важен для
судьбы больных, являясь основанием для ак-
тивной продолжительной кортикостероидной
терапии.
Хронический активный гепатит у молодых
женщин мог бы найти место среди вирусных
инфекций, но по диапазону клинической сис-
темности и по потенциалу иммунных, по су-
ществу малоспецифических, реакций он стоит
в группе «ревматические болезни» рядом с
СКВ, склеродермией и синдромом Шегрена.
Весьма своеобразно, что у больных хроничес-
ким активным гепатитом ИК с НВ5-антигеном
находят в почках, а не в печени.
Болезни Гудпасчера и Вегенера, протекаю-
щие с инфильтратами в легких и массивным
кровохарканьем или с распадом хрящей горта-
ни и верхних дыхательных путей и нефритом,
требуют особой терапии.
Алкогольный нефрит, описываемый отдель-
но, также можно отнести к системному забо-
леванию — алкоголизму, при котором поража-
ются и поджелудочная железа, и система кро-
ветворения, и легкие, но допускается извест-
ная, даже определенная обратимость процессов
при абстиненции.
При поллинозах, воздействии бытовых ан-
тигенов аллергический нефрит протекает по
типу сывороточной болезни в сочетании с дер-
матитом, артритом, лихорадкой. Прогноз при
этом обычно благоприятный.
Амилоидоз почек, поражающий преимуще-
ственно клубочки (амилоидная гломерулопатия,
внутр и клубочковое сосудистое поражение),
правильнее рассматривать как самостоятельную
системную болезнь. Диагноз ставят прежде всего
по клиническим признакам выявляемой основ-
ной болезни — системному ревматоидному ар-
триту, периодической болезни, злокачествен-
ной опухоли (паранеопластический амилоидоз),
классическим этиологическим факторам — хро-
ническим нагноениям, туберкулезу легких. Пер-
вичный амилоидоз представляет собой пеструю
картину своеобразного системного заболевания
(лихорадочная крапивница, макроглоссия, по-
ражение миокарда). Подтверждение диагноза
амилоидоза возможно на основании биопсии
подслизистого слоя прямой кишки, ткани дес-
ны и др. Амилоидоз важно рано диагностиро-
вать, он до известной степени обратим при
специфическом лечении или прекращении ан-
тигенного воздействия.
Острый ГН с анурией легко переоценивают
как терминальный. Однако при этом варианте
острого ГН сохраняются близкие к норме по-
казатели функции почек и характерные для
острого процесса гемодинамические нарушения.
Отсутствуют такие постоянные признаки тер-
минальной уремии, как задержка урохромов
(окраска кожных покровов), анемия и тем бо-
лее перикардит или уремическая подагра, ней-
ропатия, изменения глазного дна, гипертрофия
сердца. Фуросемид может вызвать диурез. В от-
личие от ОПН за счет некронефроза или тубу-
лоинтерстициального поражения, кроме отсут-
ствия явной причины (хотя она может быть и
не обнаружена), при остром нефрите нет зна-
чительных электролитных сдвигов, которые
требуют срочной коррекции. Однако хроничес-
кий нефрит может долго оставаться нераспоз-
нанным, больной переносит его на ногах, а
уремическая стадия болезни может длиться все-
го только недели и даже дни (в анамнезе мо-
жет не быть указаний на отечный синдром, ар-
териальную гипертонию, протеинурию и др.).
Сохранность больного в этом состоянии может
отвлечь мысли врача от хронического, терми-
нального нефрита и привести к ошибочной ди-
агностике подагрического артрита, болезни
крови, опухоли мозга, эпилептических судорог.
В этом надо видеть неверие клиницистов, даже
умудренных опытом, в силы природы, в воз-
можность организма длительное время, даже
при сморщенной почке, оставаться на уровне
компенсированного «носительства» болезни.
Подобная ошибка может быть обусловлена так-
же формальным заполнением карт диспансер-
ного наблюдения, обследования абитуриентов
при поступлении в вузы и, конечно, домини-
рующим психологическим настроем.
Показательными для терминального ГН яв-
ляются уремическая подагра или более редкая
уремическая периферическая полинейропатия,
уремическая анемия и, конечно, низкая отно-
сительная плотность мочи. Изменений в серд-
це и сосудах иногда не наблюдается.
203
Распознавание острого ГН, как и терминаль-
ного, может быть сопряжено с определенным
казуистическими трудностями, которые клини-
цисту, прежде всего нефрологу, конечно, дол-
жны быть известны.
Особенно трудна диагностика острого ГН
при поражении сердца, у пожилых лиц с воз-
можностью склеротической артериальной ги-
пертонии (с таким же трудом у пожилых вы-
являют инфекционный эндокардит).
Нефролог должен уметь правильно распоз-
навать ОПН, притом не только при наличии
классических этиологических факторов, но и
при другой внутренней патологии — некрозах
поджелудочной железы и печени на почве ал-
коголизма, НВгинфекции, анаэробного сепси-
са с бактериемическим шоком и анурией, об-
ширных сосудистых катастроф, особенно лекар-
ственных нефритах с различными механизма-
ми поражения почек, в том числе у выведен-
ных из анафилактического шока.
В основе ОПН чаще всего лежит ишемичес-
кий некроз канальцев с быстро нарастающей
азотемией вследствие избыточного катаболиз-
ма белка тканей травматического, ишемичес-
кого происхождения, септической инфекции.
При этом состоянии часты водно-солевые пе-
регрузки с отеками, конгестией легких и ги-
понатриемией при избыточном приеме воды в
добавление к эндогенному образованию 400 мл
воды в день. Резко повышается калиемия из
тканей, увеличивается риск фибрилляции же-
лудочков, остановки сердца, вялого паралича
сердечной мускулатуры.
Причиной ОПН могут быть также острые
тубулоинтерстициальные поражения с некрозом
почечных сосочков типа фенацетиновой почки
и аналогичных эффектов ацетилсалициловой
кислоты, анальгина и других анальгетиков.
Дифференциальный диагноз собственно ги-
пертонической болезни в настоящее время
имеет несколько меньшее значение ввиду ред-
кости злокачественной гипертонической болез-
ни и практически отсутствия мочевых призна-
ков и почечной недостаточности при артери-
альной гипертонии пожилых (доброкачествен-
ная гипертония). Однако широкое внедрение
аортографии и других, частично инвазивных,
методов позволяет надежно выявлять реновас-
кулярные варианты. Артериальная гипертония
у больных терминальным хроническим нефри-
том обычно менее упорна, реже вызывает тя-
желую глазную симптоматику и гипертоничес-
кие кризы. Конечно, есть еще ряд болезней,
обусловливающих состояние гипертензии: узел-
ковый периартериит, склеродермическая поч-
ка, свинцовое отравление, кортикостероидная
гипертензия, феохромоцитома и др.
Хорошо и давно известны артериальная ги-
204
пертония и почечная недостаточность при хро-
ническом склерозирующем пиелонефрите. Все же
частота бактериального пиелонефрита, диагно-
стируемого квалифицированными урологически-
ми учреждениями, колеблется значительно. Даже
такие болезни, как поликистоз, опухоль почек,
порой не устанавливают в стационаре, но впер-
вые выявляют на вскрытии, а также после по-
вторных обследований больных при обсуждении
вопросов трансплантации почки и т. д.
Своеобразно поражение почек в отсутствие
протеинурии или патологического мочевого
осадка, но с гипостенурией и прогрессирую-
щей уремией при семейном нефронофтизе. При
пиелографии обнаруживают поражение чаше-
чек и равномерное сморщивание почек.
Интересно отметить, что снижение крово-
очистительной функции почек происходит при
дистрофических состояниях организма, напри-
мер при пернициозной анемии, как это отме-
чалось в начале века: «бросались в глаза свет-
лая окраска и низкий удельный вес мочи» [Пе-
денко А.К., 1903]. Поразительна эффективность
и быстрота переключения приспособительных
реакций. Бедная форменными элементами кровь
при сохранении осевого тока их в капиллярах
сохраняет величину КФ.
С тех же позиций можно подходить и к по-
ниманию функциональной недостаточности
старческой почки. Старческая почка справляется
с задачей очищения крови (нормальная креа-
тининемия) при том образе жизни, который
индивид ведет в старости. Н.Д.Стражеско в ра-
боте «Об особенностях проявления и течения
болезни у стариков» (1940) подчеркивал, что
критическим для развития атеросклероза явля-
ется возраст 50—70 лет. Он указывал, что если
у человека старше этого возраста не имеется
атеросклеротических изменений в аорте и ко-
ронарных сосудах, то в дальнейшем они уже не
образуются и фиброз сосудов и миофиброз сер-
дца развиваются чрезвычайно медленно.
Диагностика активного заболевания, обосно-
ванность этого диагноза, показанность специ-
фического патогенетического лечения — весь-
ма ответственные моменты. Примером являет-
ся состояние декомпенсации деятельности по-
чек, очевидное, например, при выраженном
НС. Однако и здесь более надежной опорой
является воздействие на этиологический фак-
тор, его устранение, чем необоснованная кор-
тикостероидная и иммунодепрессивная терапия
(имеется в виду, в частности, возможность раз-
вития НС при кавапеченочной венозной гипер-
тонии, опухолях, амилоидозе). Возможно, что
протеинурия или другие критерии активности
ГН не так близки к специфической активнос-
ти воспалительного процесса. Остается нере-
шенным вопрос: лихорадка, высокая СОЭ,
высокий а2-глобулин, даже LE-клетки — го-
ворят ли они об активности ГН как такового
или зависят от нераспознанного, нередко свое-
образно протекающего туберкулезного пораже-
ния, кандидоза, пневмококкового перитонита,
или от непереносимости распространенного
антибиотика. Исчезнувшие в период претерми-
нальной уремии LE-клетки в крови больной
волчаночным нефритом могут вновь появиться
после, например, месяца удачно проводимого
гемодиализа, однако может ли быть это повы-
шение активности основной болезни расцене-
но как недостаток лечения, когда одновремен-
но, очевидно, повысится иммунный ответ и на
любую инфекцию.
Другими словами, активность ГН, актив-
ность болезни в целом может быть оценена на
основании глобального постоянного изучения
больного, его реактивности на добавочные,
подключаемые антигены, но это трудно делать
по однажды заданной шкале различных по сво-
ей ценности показателей.
Среди сочетанных болезней, осложнений
выделяются синдромы не столько «переход-
ных», «перекрестных» заболеваний, сколько
формирующихся одновременно с основной
болезнью или не столь активных сателлитов.
Так, например, при основной болезни — ами-
лоидозе — инфильтрация амилоидом слюнных
и слезных желез дает картину сухого синдрома
или же у другого больного — синдрома запяс-
тного канала, а также при миеломе та же ами-
лоидная инфильтрация синовиальной ткани
может симулировать ревматоидный или иной
воспалительный артрит.
Диагноз болезни как нозологической фор-
мы не может ограничиваться только морфоло-
гической характеристикой, даже если подобный
диагноз, например «мембранозной гломеруло-
патии», был бы признан в случае неблагопри-
ятного исхода полностью совпадающим с зак-
лючением патологоанатома. Точный диагноз
должен быть основанием для лечения и профи-
лактики больного.
9.2. Комментарии к разделам,
написанным Е.М.Тареевым*
Новое издание двухтомного руководства «Не-
фрология», естественно, отличаясь от преды-
дущего существенными добавлениями и опре-
деленными изменениями, сохраняет несколь-
ко разделов, написанных выдающимся отече-
ственным клиницистом, с чьим именем связа-
но развитие многих направлений клиники внут-
* Раздел написан Н.А.Мухиным.
ренних болезней, в частности нефрологии, —
Евгением Михайловичем Тареевым, общеприз-
нанным лидером отечественной нефрологии на
протяжении многих десятилетий XX в., осно-
вателем научного общества нефрологов нашей
страны. Эти разделы посвящены наиболее труд-
ным общим аспектам, относящимся как к не-
фрологии в целом, так и к ее наиболее важ-
ной части — учению о гломерулонефрите, по-
скольку именно «гломерулонефрит, представ-
ляющий основной раздел современной нефро-
логии в терапевтической и общей клинике»
(Е.М.Тареев), соединяет в себе многие самые
актуальные проблемы теории и практики ме-
дицины, включая трансплантологию. И хотя
«особое преимущество нефрологии в настоящее
время связано, — как писал Е.М.Тареев, — с
возможностью продления жизни почечным
больным методами заместительной терапии (ге-
модиализ, пересадка почки)», все же додиализ-
ный период гломерулонефрита продолжает при-
влекать пристальное внимание специалистов
самого разного профиля, и именно учение о
гломерулонефрите, одной из «больших терапев-
тических болезней современности» (Е.М.Таре-
ев), отражает достижения фундаментальных
наук на разных этапах развития, а клиничес-
кая медицина в целом тесно переплетается с
нефрологией, обогащается ее успехами.
Сохранение указанных разделов в новом
издании представляется очень важным с раз-
ных точек зрения. Во-первых, читатель имеет
возможность еще раз почувствовать неповтори-
мый стиль изложения, а главное — логику кли-
нического мышления крупнейшего клиницис-
та, его огромный опыт и уникальное владение
данными литературы, позволяющие проводить
яркие, порой неожиданные, но всегда чрезвы-
чайно поучительные сопоставления; во-вторых,
при чтении этих разделов все время сохраня-
ется ощущение необыкновенной современнос-
ти подходов к пониманию сложных механиз-
мов патогенеза болезней почек; в-третьих,
очень четко представляется связь нефрологичес-
кой концепции Е.М.Тареева с его общеклини-
ческой концепцией. И, наконец, становится
еще более понятной сохраняющаяся связь не-
фрологии с клиникой внутренних болезней, из
недр которой она вышла.
Сегодня нефрология — один из интегриру-
ющих разделов внутренней медицины. «Нефро-
логия как раздел внутренней медицины долж-
на изучать, включать длинный ряд болезней,
которые проявляются разнообразным пораже-
нием почек и находят законное место в других
специальностях» (Е.М.Тареев). Основополагаю-
щим началом клинической концепции Е.М.Та-
реева является непреходящий постоянный ин-
терес к этиологии внутренних болезней.
205
При сохраняющемся общем скепсисе к про-
блеме выявления этиологии нефритов Е.М.Та-
реев настойчиво отстаивал тезис большого раз-
нообразия «неинфекционных патогенных факто-
ров», хотя «увлечение инфекционной этиологи-
ей, не угасшее и в наши дни» (Е.М.Тареев),
продолжает занимать доминирующее место.
Действительно, сегодня существенно уточ-
нена роль бактериальной инфекции в развитии
нефритов, получено много данных о вирусной
этиологии почечных болезней — прежде всего
роли вирусов гепатита, Эпштейна — Барр,
цитомегаловируса.
Так, известно, что НВ-вирусный гломеру-
лонефрит становится конкурентом стрептокок-
кового нефрита у детей в Японии и Франции.
По нашим данным, мочевой синдром выявля-
ется у 14 % больных гепатитом В, госпитали-
зируемых в гепатологическое отделение, не
считая больных нефрологического отделения, у
которых связь поражения почек с инфекцией
вирусами гепатита и хроническими диффузны-
ми заболеваниями печени устанавливают в ходе
обследования по поводу заболевания почек.
Причем речь идет не только о часто описыва-
емой у таких больных мембранозной нефропа-
тии, но и о других формах нефрита, вплоть до
быстропрогрессирующего гломерулонефрита
(БПГН); не вызывает сомнения значение ви-
руса гепатита С в развитии БПГН с криогло-
булинемией.
Признание вирусов как важного этиологи-
ческого фактора нефрита по-прежнему не ис-
ключает роли в этиологии, в том числе и в
этиологии обострений нефрита, стрептококка.
Установлено, что уровень противострептокок-
ковых антител к А-полисахариду и стрептоки-
назе увеличивается с нарастанием активности
нефрита, и чем выше уровень этих антител, тем
скорее развивается хроническая почечная не-
достаточность. Быстрое исчезновение из цирку-
ляции полисахаридного антигена стрептококка
«предсказывает» благоприятный исход цикли-
чески протекающего гломерулонефрита у детей.
«Однако терапевту-нефрологу, как и обще-
му терапевту и представителю любой другой те-
рапевтической специальности, следует знать, что
не только инфекция является понятным и дос-
таточным этиологическим фактором, а также
аллергия (с возможными генетическими пред-
посылками), но и ряд других средовых влияний...
Таковы все еще вызывающие сомнение у совре-
менного врача простуда, травма, инсоляция,
непереносимость пищи, химикалий, лекарств и
др. ... психическая травма» (Е.М.Тареев).
Е.М.Тареев подчеркивал реальную возмож-
ность «простудного нефрита», что переклика-
ется с утверждениями его знаменитых предше-
ственников о значении в развитии почечного
206
заболевания «влажного холода» (Р.Брайт). Но
особенно много внимания он уделял лекар-
ственным поражениям почек — начиная от
«вакцинного» и «сывороточного» ГН (часто в
рамках системной сывороточной болезни и
сывороточной волчанки, впервые описанной в
1943 г.), «сульфаниламидной почки» (гемолиз,
обструктивная нефропатия, сульфаниламидный
узелковый периартериит с поражением почек)
и кончая поражением почек при использова-
нии современных препаратов, находящих ши-
рокое распространение (например, ингибито-
ры АПФ с мембранозным ГН от каптоприла).
Лекарственный фактор как причина пораже-
ния почек в ряде случаев приобретает сегодня
популяционный характер, например, в связи с
весьма существенной частотой употребления
анальгетиков и нестероидных противовоспали-
тельных средств. В этих условиях возникновение
и прогрессирование анальгетической нефропа-
тии представляет серьезную проблему — риск
развития последней в десятки раз выше имен-
но у данной категории лиц. Исключение дей-
ствия указанных факторов может не только из-
менить к лучшему судьбу отдельных пациентов,
но и иметь положительное популяционно-про-
филактическое влияние.
Некоторые другие неинфекционные этиоло-
гические факторы, имеющие прямое отноше-
ние к поражению почек, также приобретают в
современных условиях значение популяцион-
ных — к ним относятся ряд факторов окружа-
ющей (включая профессионально-производ-
ственные) среды, распространенные обменные
нарушения (особенно нарушения углеводного
и пуринового обмена), в том числе и при зло-
употреблении алкоголем.
Сегодня свинец и кадмий привлекают осо-
бое внимание как причина возникновения и
дальнейшего развития поражения почек, преж-
де всего тубулоинтерстициального нефрита, в
том числе и через возникающие нарушения
пуринового обмена (варианта хорошо известной
в прошлом «свинцовой подагры») с характер-
ными формами уратной нефропатии.
Распространенность в популяции гиперури-
кемии и особенно гиперурикозурии, по данным
эпидемиологических исследований, весьма зна-
чительна. В ряде случаев гиперурикемия может
быть несомненным и обратимым повреждаю-
щим фактором при нефрите, ускоряющим, как
это было показано в исследованиях в клинике
Е.М.Тареева, не только типичные тяжелые
интерстициальные изменения, но и вызываю-
щим иммунную реакцию клубочков через сти-
мулированную антигенную активность базаль-
ной мембраны канальцев.
Этиологический принцип изучения механиз-
мов развития нефритов лег в основу нового на-
правления современной нефрологии — профи-
лактической нефрологии.
Вообще гломерулонефрит — проявление
индивидуальной реакции на тот или иной фак-
тор, поэтому неудивительна известная ситуа-
ция, когда одна и та же причина может выз-
вать разные клинико-морфологические вариан-
ты нефрита, и наоборот — один и тот же кли-
нико-морфологический вариант нефрита может
быть связан с разными этиологическими фак-
торами. Клиницист-нефролог может привести
немало примеров, подтверждающих реальность
этого положения, но наиболее яркую иллюст-
рацию дает сам Е.М.Тареев: «... стрептококко-
вая инфекция может вызвать типичное после-
инфекционное поражение, по существу плохо
поддающееся лечению антибиотиками.., хотя в
целом имеющее относительно благоприятное
течение... Наряду с этим стрептококк может
обусловливать аналогичное поражение почек —
ГН (а также амилоидоз) при затяжном септи-
ческом эндокардите, когда активная противо-
инфекционная терапия нередко позволяет из-
лечить далеко зашедшее поражение почек с
азотемией». Мы наблюдали недавно девушку с
клинической картиной шунт-сепсиса (источни-
ком септического состояния, как это типично
для данной ситуации, явился вентрикуло-атри-
альныи шунт, сформированный нейрохирурга-
ми ранее по поводу окклюзионной гидроцефа-
лии) с поражением почек — антибактериаль-
ная терапия полностью ликвидировала все про-
явления сепсиса и поражения почек.
Известны разнообразные клинико-морфоло-
гические варианты поражения почек в рамках
паранеопластического и паратуберкулезного
синдромов. Так, в рамках паранеопластическо-
го синдрома при одной и той же опухоли (на-
пример, нефрокарциноме или лимфогрануле-
матозе) у одного пациента может развиться
гломерулонефрит (причем не только мембра-
нозный), у другого —амилоидоз. Предсказать,
как само поражение почек, так и его вариант
практически невозможно, поскольку и в этой
ситуации, как и в ситуации действия «простуд-
ного», лекарственного, наконец, инфекцион-
ного факторов, нефрит есть проявление инди-
видуальной сверхчувствительности. Настойчи-
вый акцент, который делал Е.М.Тареев на этом
тезисе, очень важен для того, чтобы понять его
позицию в отношении теоретических концеп-
ций патогенеза нефрита и особенно подходов
к классификации болезней почек.
Может показаться парадоксальным, с одной
стороны, глубокий интерес Е.М.Тареева к уче-
нию И.И.Мечникова о фагоцитозе, к теории
клеточного иммунитета, в частности известной
работе своих сотрудников Т.Г.Траяновой и
В.В.Суры (совместно с Г.Я.Свет-Молдавским),
доказавших «разрушение лимфоцитами больных
СКВ культуры клеток человеческого эмбриона —
фибробластов и почечного эпителия», с дру-
гой стороны, — его утверждение о том, что
«иммунонефрология — прогрессивный раздел
терапии... не имеет глобального значения. Груп-
повое деление ГН на иммунные и неиммунные
формы, до сих пор главенствующее в учебни-
ках и врачебной практике, равно как и на ин-
фекционные (или постинфекционные) и неин-
фекционные, не может быть положено в основу
практической деятельности терапевта-нефроло-
га». Далее Е.М.Тареев еще более обостряет про-
блему, задавая вопрос: «Что важнее для врача,
сталкивающегося с нозологическими формами,
имеющими связь со средой, эпидемиологией
при конечной цели медицины — профилакти-
ке, а затем искоренении заболеваний, делить
болезнь по морфологическим, пусть и интерес-
ным, деталям на 2—3 дробные формы или
проводить общие для всей группы лечебные,
профилактические и противоэпидемические ме-
роприятия?». Парадоксальность этих позиций
Е.М.Тареева кажущаяся, и она, безуслов-
но, готовит читателя к восприятию его подхо-
да к наиболее сложной проблеме нефрологии
(как и клинической медицины в целом) — про-
блеме классификации нефритов. Во всяком слу-
чае становится понятным, что, по-видимому,
Е.М.Тарееву ближе нозологический принцип
классификации.
Убедительно критикуя ортодоксальные клас-
сификационные подходы немецкой (анатомо-
клинический) и французской (физиологичес-
кий) школ, Е.М.Тареев показывал их ограни-
ченность узким кругом обсуждаемых аспектов,
в том числе и органного поражения. Между тем
нозологическая форма не должна сужаться рам-
ками поражения (пусть даже в качестве комп-
ромисса — «преимущественного поражения»)
конкретного органа, нозологическая форма
часто выходит за пределы одного органа. А глав-
ное, — по мнению Е.М.Тареева, — особенно
важно в нозологическом принципе знание на-
ряду с клинико-морфологической основой но-
зологической формы также «этиологического и
эпидемиологического факторов, связи болезни
со средой». В этом заключается позитивный
перспективный аспект подхода Е.М.Тареева к
проблемам классификации нефритов, позволя-
ющий обсуждать их на более высоком — попу-
ляционном уровне, в частности в решении
вопросов первичной профилактики болезней
почек.
Действительно, в известной классификации
Фольгарда и Фара хронический нефрит рас-
сматривался как болезнь, всегда («без исклю-
чения») возникавшая из острого нефрита как
«неизлеченный» острый нефрит. Некоторые
207
советские клиницисты, последователи этой
концепции, утверждали еще более определен-
но: «Нет необходимости выделять особые эти-
ологические факторы хронического нефрита,
поскольку эта болезнь представляет собой не-
излеченный острый нефрит» (М.С.Вовси). Зна-
чит, с этих позиций радикальным методом
борьбы с хроническим нефритом является «из-
лечение» от острого нефрита, а не стремление
более тщательно изучать этиологию хроничес-
кого нефрита, тем более его эпидемиологию!
Да к тому же почти половина больных острым
нефритом считались «излеченными», если у них
нормализовалось АД и протеинурия не превы-
шала 1 %о. Хорошо известна эволюция «липо-
идного нефроза» — поражения почек по типу
«минимальных изменений» — у части больных
в ХПН, «как бы ни старались обособить эту
форму (Е.М.Тареев)».
Под влиянием самых разных причин может
развиваться и весьма характерный по четким
клиническим признакам быстропрогрессирую-
щий нефрит, при этом клиническая картина
поражения почек практически во всех этих слу-
чаях идентична — одновременное возникнове-
ние отечно-гипертонического и азотемическо-
го синдромов, и морфологически совсем не
обязательно обнаружение «полулуний» в клу-
бочках почки, хотя классические представления
(в первую очередь морфологические) о быст-
ропрогрессирующем нефрите до последнего
времени связываются с подострым («злокаче-
ственным») нефритом с «полулуниями». В оп-
ределении быстропрогрессирующего нефрита
Е.М.Тареев прежде всего подчеркивает четкую
очерченность клинической картины болезни,
которая имеет, как он пишет, «все признаки
классического нефрита Брайта... и очень небла-
гоприятное течение», «как бы укороченное те-
чение классического брайтова нефрита». Имен-
но резко ускоренное развитие почечной недо-
статочности выделяется Е.М.Тареевым в каче-
стве главного признака данного варианта гло-
мерулонефрита, спонтанное течение которого
практически всегда заканчивается уремией в
ближайшие несколько месяцев. Такое течение
характерно в первую очередь для экстракапил-
лярного гломерулонефрита с полулуниями, но
не только для него. Сегодня многие нефрологи
(R.J.Glassock, J.S.Cameron и др.) склонны с
клинических позиций расширять понятие быс-
тропрогрессирующего нефрита, включая в него
большую группу нефропатий, объединяющей
особенностью которых является прежде всего
ряд общих клинических признаков: быстрое
нарастание почечной недостаточности (креати-
нинемии), нередко в сочетании с тяжелой ар-
териальной гипертензией и нефротическим
синдромом, а также в подавляющем большин-
208
стве наблюдений — невозможность спонтанной
ремиссии с неизбежностью быстро наступаю-
щей терминальной уремии, требующей гемо-
диализа или трансплантации почки. При этом
подчеркивается, что данная «группа больных
морфологически и клинически неоднородна»
[Cameron J.S., 1984]. Более определенно о важ-
ности прежде всего клинической картины в
выделении быстропрогрессирующего варианта
нефрита высказывается R.J.Glassock: «Термин
“быстропрогрессирующий гломерулонефрит”
следует использовать в отношении клиническо-
го синдрома быстрого и прогрессирующего
снижения почечной функции, развившегося на
фоне признаков гломерулонефрита, который
без лечения обычно приводит к терминальной
почечной недостаточности в течение недель и
месяцев. Поражение клубочков характеризует-
ся принципиально, но не исключительно вы-
раженными полулуниями». Клиническая карти-
на максимально активного нефрита с быст-
ропрогрессирующим течением наблюдается при
гломерулонефрите с антителами к базальной
мембране клубочков (с легочными геморраги-
ями при синдроме Гудпасчера и без них) и при
гломерулонефрите с гранулярными иммунны-
ми депозитами в клубочках (постинфекционные
нефриты — постстрептококковый, при подо-
стром инфекционном эндокардите; нефриты
при системных заболеваниях — системной крас-
ной волчанке, геморрагическом васкулите,
смешанной криоглобулинемии). Среди нефри-
тов, отличающихся быстропрогрессирующим
течением, выделяют нефриты, связанные с
антителами к цитоплазме нейтрофилов (ANCA —
АНЦА), наблюдающиеся при системных некро-
тизирующих васкулитах — гранулематозе Веге-
нера и микроскопическом полиангиите.
Таким образом, «быстропрогрессирующий
гломерулонефрит, проявляющийся неповтори-
мыми клиническими чертами, может быть след-
ствием весьма разнообразных причин, компо-
нентом разных системных заболеваний,... лекар-
ственным... и т. д.».
Для клинициста это очень важно, посколь-
ку такое быстропрогрессирующее течение не-
фрит приобретает обычно вследствие выражен-
ной активности, обусловленной как инфекци-
ей, так и системным заболеванием, лекарствен-
ным (в том числе сывороточным, вакцинным)
фактором, паранеопластическим синдромом,
что диктует необходимость использования не
только всего современного арсенала патогене-
тического воздействия, но и поиска этиологи-
ческого фактора и возможности радикальной
его элиминации (например, удаление поражен-
ных клапанов сердца при подостром инфекци-
онном эндокардите и связанном с ним быст-
ропрогрессирующем нефрите).
Клиницисту известны ситуации, когда при
конкретной нозологической форме в понима-
нии того или другого ее проявления бывает
трудно ограничиться конкретным патогенети-
ческим механизмом — например, артериальная
гипертония острого периода нефрита (при ос-
тронефритическом синдроме) нередко носит
характер гипертонии выброса, а в более по-
здние стадии болезни — гипертонии сопротив-
ления; в разные стадии нефрита различаются
и механизмы отечного синдрома и т.п.
В связи с этим особого внимания заслужи-
вает проблема острого гломерулонефрита, про-
блема, интересовавшая Е.М.Тареева с разных
точек зрения, — тщательно изученные Е.М.Та-
реевым и сотрудниками клинические детали
очень важны для диагностики болезни и пони-
мания патогенеза острого ГН (например, ост-
ронефритическая эклампсия и гиперволемичес-
кая левожелудочковая недостаточность).
Сегодня в зарубежной литературе практичес-
ки уравниваются острый ГН и остронефрити-
ческий синдром, хотя, конечно, остается очень
важным выявление именно острого ГН как
особой нозологической формы — чаще пост-
стрептококкового, но и «после ряда антиген-
ных воздействий (сывороткой, вакциной, пыль-
цой растений, ядом насекомых, лекарственны-
ми и другими химическими веществами, пи-
щевыми продуктами при индивидуальной не-
переносимости)» (Е.М.Тареев).
Во включенном в новое издание разделе,
посвященном острому ГН, написанном Е.М.Та-
реевым, отличающемся насыщенностью инфор-
мацией, глубокими теоретическими рассужде-
ниями, эта идея нозологического принципа
проводится особенно четко.
Все это еще раз позволяет оценить по дос-
тоинству нозологический принцип классифика-
ции нефрита, выдвинутый Е.М.Тареевым, что
не исключает, а, наоборот, подразумевает воз-
можность «сокращенных, специальных, при-
кладных классификаций», которые смогут удов-
летворять «более узкие интересы» (Е.М.Тареев).
Выявление этиологии, как бы это ни было
сложно, способствует более точному диагнозу
заболевания почек; недоучет же этиологическо-
го фактора, как и системности поражения, усу-
губляет трудности диагностики нефрита, пони-
мания особенностей лечения и прогноза. При
этом надо помнить, что системность процесса
с вовлечением почек присуща не только СКВ,
склеродермии, васкулитам. Хронический вирус-
ный активный гепатит, аутоиммунный гепатит,
алкогольная болезнь, лекарственная болезнь по
диапазону системных проявлений стоят рядом
с СКВ, склеродермией, болезнью Шегрена.
А ведь эти заболевания имеют весьма различ-
ную этиологию, но клинические признаки по-
ражения почек достаточно стандартны («бес-
симптомная» протеинурия — гематурия, нефро-
тический и гипертонический синдромы, быст-
ропрогрессирующее течение с азотемией).
Е.М.Тареев уделял много внимания пробле-
ме выявления нефрита на стадии терминальной
почечной недостаточности, подчеркивал неред-
кую возможность длительного периода скрыто
протекавшего хронического нефрита с мини-
мальной протеинурией, хорошим самочувстви-
ем пациента и «первыми» клиническими эпи-
зодами заболевания в виде, например, подаг-
рического артрита, гематологического криза,
напоминающего острый лейкоз, эпилепсии.
Исследование креатинина крови (наиболее на-
дежного диагностического маркера) обнаружи-
вает терминальную уремию, совершенно нео-
жиданную для пациента (к сожалению, часто
и для врача).
Весьма поучительны и другие диагностичес-
кие ситуации, обсуждаемые в публикуемых раз-
делах Е.М.Тареева, как, например, исчезнове-
ние LE-клеток из крови больной волчаночным
нефритом на терминальной стадии болезни и
их появление через 1—2 мес после удачного
программного гемодиализа — является ли это
признаком активности процесса (хотя морфо-
логические изменения по существу сводятся к
терминальному нефросклерозу)? Или другой
пример — острый ГН без изменений в моче.
Нефрологам должна быть известна эта ситуа-
ция — по-видимому, некоторая часть хроничес-
ких гломерулонефритов формируется именно в
результате перенесенного в прошлом такого
варианта острого ГН (в том числе стрептокок-
кового).
Справедливо обращается внимание на важ-
ность распознавания острой почечной недоста-
точности не только вследствие действия клас-
сических этиологических факторов, но и при
наличии других причин — например, некроза
поджелудочной железы, обширной сосудистой
катастрофы и особенно острых тубулоинтерсти-
циальных поражений почек (вплоть до папил-
лярного некроза) лекарственного генеза (в пер-
вую очередь в связи с анальгетиками). Много-
кратное повторение Е.М.Тареевым тезиса о
реальной возможности лекарственной нефропа-
тии очень актуально и сегодня.
Итак, основополагающий тезис учения
Е.М.Тареева о ГН — это взгляд на ГН как но-
зологическую форму, являющуюся результатом
индивидуальной реакции на тот или иной эти-
ологический фактор. Может быть, этот тезис
Е.М.Тареева позволит расшифровать все еще
остающуюся до конца неясной патологию, име-
нуемую «гломерулонефрит», из которого в пос-
леднее время рядом исследователей выделяют-
ся «невоспалительные нефропатии», «невоспа-
14—2950
209
лительные гломерулопатии» (с сохранением в
этих терминах признаваемого всеми весьма нео-
пределенным понятия «патия»). На первый
взгляд термин «гломерулонефрит» кажется
вполне оправданным теми многообразными
изменениями именно в клубочках почек, ко-
торые обнаруживают при морфологическом (и
иммуноморфологическом) исследовании. Одна-
ко отнюдь не меньшее значение в развитии
этой болезни почек имеет и поражение каналь-
цев, интерстиция, сосудов. Хорошо известно
значение канальцевых антигенов в развитии им-
мунообусловленного поражения почек, еще
более важную роль в прогрессировании болез-
ни почек в настоящее время отводят тубулоин-
терстициальным процессам: накопленные дан-
ные дают основание предполагать существенную
роль в этом активного интерстиция, прежде все-
го интерстициальных макрофагов, продуцирую-
щих регуляторные белки профибротического на-
правления (ТФР, ТрФР), способствующие про-
лиферации эпителиальных и мезангиальных кле-
ток с выработкой ими экстрацеллюлярных мат-
риксных протеинов — коллагенов I, III и IV
типов, фибронектина и ламинина.
Вообще проблема прогрессирования нефрита
всегда привлекала пристальное внимание, по-
скольку во многом оставались загадкой неиз-
бежность развития почечной недостаточности и
ее терминальной (уремической) стадии прак-
тически во всех случаях, так же как и разные
сроки наступления этой стадии — от несколь-
ких месяцев до десятков лет.
Среди различных аспектов изучения патоге-
неза (прогрессирования) нефрита Е.М.Тареев
большое значение придавал вопросу механиз-
ма воспаления как «первому более общему воп-
росу патологии, имеющему и прикладное, ди-
агностическое значение — определение актив-
ности воспалительной реакции в почке».
Важным в таком подходе, по его мнению,
было изучение этой проблемы с позиций насле-
дия И.И.Мечникова по фагоцитозу и учения
А.А. Богомольца об аллергии (аутоиммунитете) как
компоненте общего воспалительного процесса.
В серии исследований, начатых под руковод-
ством Е.М.Тареева еще в 1974 г., установлена
роль в персистировании активного иммунного
воспаления при гломерулонефрите нарушений в
системе циркулирующих и тканевых фагоцитов.
Особый интерес, как это отмечал в свое
время и Е.М.Тареев, представляет возможность
оценки признаков самого почечного воспале-
ния - именно у больных активным нефритом
быстропрогрессирующего течения чаще выяв-
ляется, например, феномен образования LE-
клеток, круглых гематоксилиновых телец, эрит-
роцитофагоцитоза при добавлении мочи боль-
ных нефритом к взвеси лейкоцитов здорового
донора. Это коррелирует с обнаружением в моче
больных иммунофлюоресцентным методом ан-
тинуклеарного фактора (АНФ). Как это пред-
положили Е.М.Тареев и соавт., местная ауто-
иммунная реакция, по-видимому, имеет авто-
номный и, что особенно важно, самоподдер-
живающийся характер, создавая порочный круг
активности и прогрессирования болезни. Про-
спективное исследование показало ускорение
развития хронической почечной недостаточно-
сти в течение уже первых 1,5—2 лет более чем
у половины больных именно этой группы. В свя-
зи с этим представляет интерес высказывание
Е.М.Тареева о том, что «LE-клетки — не только
штамп коллагеноза, очевидно, воспалительные
и другие процессы, сопровождающиеся акти-
вацией и/или нарушениями фагоцитоза, могут
давать реакции, близкие тем, которые мы на-
блюдаем при аутоиммунных состояниях» и да-
лее «... почечная паренхима, по-видимому, бли-
же стоит к сложным иммунным реакциям, чем
мочевыводящие пути, что сближает нефрит с
эпителиальным гепатитом».
Эти работы были одними из первых в по-
явившейся позже большой серии исследований
по изучению при иммунном воспалении внут-
рипочечных межклеточных взаимоотношений и
их медиаторов, к которым в последние годы
проявляется огромный интерес.
Результатом действия разнообразных меха-
низмов повреждения при нефрите является
развитие нефросклероза с потерей функциони-
рующей массы почек, и центральную роль в
этом процессе играет, по-видимому, мезанги-
альная клетка клубочка почки, отличающаяся
известной мультипотентностью. Для понимания
темпов прогрессирования нефрита особенно
важным представляется способность мезанги-
альной клетки продуцировать (накапливать)
белковые компоненты мезангиального матрик-
са, расширение которого стимулирует клеточ-
ную пролиферацию и фиброз.
В свете интереса к детальному изучению роли
эндотелия в развитии болезней почек по-ново-
му представляется значение при них наруше-
ния тромбоцитарно-сосудистого звена гемостаза
и фибринолиза.
Уместно вспомнить многолетние работы
школы Е.М.Тареева, по определению места
среди механизмов прогрессирования диссеми-
нированной и локальной внутрисосудистой
коагуляции, изучаемой в том числе и по пока-
зателям мочи. «Изучение гломерулонефрита
разной этиологии и степени активности по
компонентам мочи, при этом не столько в ас-
пекте кровоочистительной деятельности почек
и ее нарушений, сколько под аспектом содер-
жания в моче продуктов воспаления в одном
органе — почке может дать многое для прак-
210
тики (диагностики и лечения) и для суждения
об общих тенденциях организма».
Так, многочисленные пристеночные эффек-
ты активированного эндотелия, истощение у
больных с активными быстропрогрессирующи-
ми формами нефрита местных резервных воз-
можностей эндотелия к синтезу антикоагулян-
тов, (установленные учениками Е.М.Тареева
при изучении активаторно-ингибиторного зве-
на фибринолиза, непосредственно связанного
с эндотелием, в системном русле и моче в ус-
ловиях пробы с белковой нагрузкой), высво-
бождение из воспалительных клеток медиато-
ров (ИЛ-1 и др.), а также потеря под влияни-
ем ударного действия кровяного потока свой-
ства тромборезистентности позволяют рассмат-
ривать сосудистый эндотелий как связующее
звено между иммунным воспалением, гемоста-
зом и местной гемодинамикой.
Новые данные, уточняющие особенности
развития хронических болезней почек, позво-
ляют надеяться на возможность более эффек-
тивно влиять на активность и прогрессирова-
ние заболевания почек, продлевать додиализ-
ный период жизни пациентов, хотя лечение
нефрологических больных все еще остается слож-
ной задачей, и ее успешное решение во мно-
гом зависит от индивидуального организма, т.е.
от понимания особенностей конкретной нозо-
логической формы у конкретного больного.
«Точный диагноз должен быть основанием
для лечения и профилактики» (Е.М.Тареев).
9.3. Морфология
гломерулонефрита*
Благодаря успехам клинической морфологии
диагноз ГН, построенный на основании дан-
ных комплексного морфологического (светооп-
тического, иммуногистохимического и элект-
ронно-микроскопического) исследования био-
птата почки, имеет конкретное содержание: в
нем отражаются не только морфологическая, но
и иммунологическая характеристика той или
иной формы ГН, возможные пути ее эволю-
ции. Многие формы ГН приобрели значение
самостоятельных нозологических единиц.
9.3.1. Морфологическая
классификация гломерулонефрита
В последнее время морфологические классифи-
кации ГН претерпели существенное изменение.
После выделения F.Volhard и Th.Fahr (1914)
Раздел написан В.В.Серовым, В.А.Варшавским,
А.А. Ивановым.
экстра- и интракапиллярной форм пролифера-
тивного ГН и нефросклероза, которые были
детализированы впоследствии D.Russel (1930),
наиболее существенна классификация В.Bell
(1938, 1946). Он выделил следующие формы ГН:
• диффузный пролиферативный (интра- и
экстракапиллярный);
• экссудативный;
• геморрагический без обструкции капилляров;
• фокальный (тромботический и пролифера-
тивный);
• мембранозный (липоидный нефроз).
Дальнейшие исследования на материале
вскрытий [Alien А., 1951] лишь уточнили от-
дельные морфологические формы ГН.
Пункционная биопсия почек позволила изу-
чить прижизненную морфологию ГН, хотя и не
изменила представлений о его сущности. В 1970 г.
независимо друг от друга В.В.Серов и D.Earle
на основании светооптического исследования
биоптатов почек выделили: 1) минимальные
изменения; 2) пролиферативный (интра- и эк-
стракапиллярный); 3) мембранозный; 4) мем-
бранозно-пролиферативный; 5) фибропласти-
ческий ГН.
Помимо светооптического, иммуногистохи-
мический и электронно-микроскопический
методы изучения биоптатов почек позволили
описать новые формы ГН, а главное установить
их морфо- и патогенез. Морфологические клас-
сификации ГН становятся морфо- и патогене-
тическими. Шагом вперед была классификация
J.Cameron (1972), согласно которой различают
минимальные изменения, мембранозный ГН,
фокальный сегментарный гломерулярный гиа-
линоз и пролиферативный ГН, включающий
мезангиопролиферативный, лобулярный и мем-
бранозно-пролиферативный варианты. Эта клас-
сификация благодаря своей простоте получила
широкое распространение за рубежом, хотя и
имеет существенный недостаток — объединяет
в группу пролиферативного ГН морфологичес-
кие формы, различные по клиническому тече-
нию и прогнозу.
В последнее время неоднократно пытались
классифицировать ГН по морфогенетическому
принципу. Так, В.В.Серов и соавт. (1978) вы-
делили группу мезангиального ГН, включаю-
щую мезангиомембранозный, мезангиопроли-
феративный и мезангиокапиллярный варианты,
уточнили понятие «минимальные изменения»,
под которыми они понимают лишь ультраструк-
турные изменения при липоидном нефрозе,
рассмотрели очаговый фибропластический ГН
как исход ряда заболеваний (фокальный сег-
ментарный гломерулярный гиалиноз, очаговый
мезангиопролиферативный ГН, липоидный не-
фроз).
14*
211
Многие исследователи пытались создать кли-
нико-морфологические классификации ГН
[Habib R., 1961; Zollinger Н., 1966, 1974;
Heptinstall R., 1966; Bohle A. et al., 1969], од-
нако они не получили широкого распростра-
нения, так как недостаточно выдержаны в от-
ношении выбранных критериев. В 1978 г. экспер-
ты ВОЗ предприняли попытку создать морфо-
логическую классификацию первичного ГН,
основанную на результатах лишь светооптичес-
кого исследования нефробиоптатов, которая
оказалась несостоятельной. В 1982 г. J.Churg и
L.Sobin предложили морфологическую класси-
фикацию первичного ГН, учитывающую основ-
ные положения классификации ВОЗ (1978), но
дополненную необходимыми данными, полу-
ченными с помощью иммуногистохимическо-
го и электронно-микроскопического исследо-
ваний, которая в достаточной мере удовлетво-
ряет как патологов-нефрологов, так и клини-
цистов. Она получила одобрение экспертов ВОЗ.
Согласно этой классификации, морфологичес-
кие изменения при первичном ГН разделены
на 3 группы: минимальные, фокально-сегмен-
тарные и диффузные ГН. К минимальным изме-
нениям отнесены 4 формы: липоидный нефроз
(«болезнь подоцитов»), фокальный сегментар-
ный гломерулярный гиалиноз — ФСГГ (началь-
ные изменения), мезангиомембранозные изме-
нения с IgA-, IgG- и СЗ-депозитами, а также
с отрицательными результатами при иммуно-
флюоресценции. Все формы минимальных из-
менений, за исключением липоидного нефро-
за, отражают морфологию начальной стадии
первичного ГН.
О фокально-сегментарных изменениях гово-
рят тогда, когда поражено не более 60 % клу-
бочков в препарате (фокальные) и поражение
захватывает отдельные или группы сосудистых
петель клубочка (сегментарные). К фокально-
сегментарным изменениям относят ФСГГ и
фокальный ГН (фокальный мезангиопролифе-
ративный ГН), который делят на фокальный
ГН с IgA- и IgG-депозитами или с отрица-
тельными результатами иммунофлюоресцен-
ции, с IgG- и СЗ-депозитами линейного ха-
рактера (речь идет о начальных морфологичес-
ких проявлениях синдрома Гудпасчера) и с не-
фротическим синдромом. Диффузные изменения
(диффузный ГН) представлены мембраноз-
ным, пролиферативным и фибропластическим
(склеротическим) ГН. Пролиферативный ГН
рассматривают как групповое понятие, вклю-
чающее эндокапиллярный (постстрептококко-
вый) пролиферативный, мезангиопролифера-
тивный, мезангиокапиллярный (типы I и III),
болезнь плотных депозитов, экстракапилляр-
ный. На наш взгляд, объединение последних 5
форм ГН в группу пролиферативного ГН прак-
212
тического значения для клинического патолога
не имеет.
В 1987 г. В.В.Серов и В.А.Варшавский пред-
ложили выделить из группового понятия «гло-
мерулонефрит» невоспалительные гломерулопа-
тии: минимальные изменения (липоидный не-
фроз), мембранозную нефропатию и ФСГГ,
при которых отсутствуют видимые признаки
воспаления в клубочках. В группе «гломеруло-
нефрита», или воспалительных гломерулопатий,
оставлены морфологические формы гломеруло-
нефрита с выраженной воспалительной реак-
цией: пролиферативный эндо- и экстракапил-
лярный; мезангиопролиферативный и мембра-
нопролиферативный (мезангиокапиллярный) и
фибропластический (склерозирующий). После-
дующие исследования с использованием имму-
ноэлектронной микроскопии подтвердили пра-
вомочность подобного деления [Иванов А.А. и
др., 1994].
Каждая из форм может отражать особеннос-
ти этиологии (наличие инфекции), патогенеза
(характер иммунопатологического процесса),
морфологии (вид и распространенность воспа-
ления в клубочках), клинические проявления
(выраженность почечных и внепочечных симп-
томов) гломерулонефрита, его течения (острое,
подострое, хроническое) и прогноза. Исключе-
ние из группы гломерулонефрита минимальных
изменений (липоидного нефроза), мембраноз-
ной нефропатии и ФСГГ, при которых воспа-
ление в клубочках отсутствует, предполагает
объединение этих самостоятельных заболеваний
в группу первичного нефротического синдрома.
В настоящее время за рубежом широко ис-
пользуется деление хронического гломеруло-
нефрита на воспалительные и невоспалитель-
ные гломерулопатии (на основе формальных
признаков воспаления) [Couser W.G. et al.,
1992; Striker G.H. et al., 1995]. Другие исследо-
ватели выделяют эти группы, опираясь на на-
личие пролиферативных изменений или их от-
сутствие [Hricik D.E.,1998], Группа невоспали-
тельных (непролиферативных) гломерулопатий,
в которую включены болезнь тонких мембран,
коллаген Ш-нефропатия, фибронектин-нефро-
патия, синдром Альпорта и ряд вторичных по-
вреждений почечного клубочка, быстро расши-
ряется.
9.3.2. Острый гломерулонефрит
Морфологическая картина при исследовании
биоптата почки неоднозначна и зависит от
того, как быстро от начала заболевания прове-
дена биопсия. В настоящее время большинство
исследователей считают морфологическим эк-
вивалентом острого ГН картину острого пост-
стрептококкового ГН. Морфология острого за-
тянувшегося ГН часто не отличается от мор-
фологии первичного хронического ГН. Некото-
рые формы хронического ГН могут начинать-
ся остронефритическим синдромом. В таких слу-
чаях значение морфологического диагноза для
дифференциальной диагностики форм ГН воз-
растает.
Изменения в почках при остром постстреп-
тококковом ГН обусловлены отложением в
капиллярах клубочков гетерологичных ИК. В
целом морфологическая картина оценивается
как эндокапиллярный пролиферативный ГН,
который проходит в своем развитии несколько
фаз: экссудативную, экссудативно-пролифера-
тивную, пролиферативную и фазу остаточных
явлений [Серов В.В. и др., 1978, 1983; Rosen
S., 1983], сменяющих друг друга. В процесс
вовлекаются все почечные клубочки. Они уве-
личены, сосудистые петли полностью занима-
ют полость капсулы. Капиллярные петли обли-
терированы набухшими и пролиферирующими
эндотелиальными и мезангиальными клетками,
мезангий инфильтрирован полиморфно-ядер-
ными лейкоцитами. Присутствие в полости кап-
сулы клубочков геморрагического экссудата и
выраженное полнокровие капиллярных петель
позволили выделить геморрагическую форму
|Серов В.В., Варшавский В.А., 1977]. Если в
капиллярах клубочка преобладают лейкоциты,
говорят об экссудативной фазе (форме), при
сочетании пролиферации клеток клубочка с
лейкоцитарной инфильтрацией — об экссуда-
тивно-пролиферативной, в случае преобладания
клеточной пролиферации — о пролифератив-
ной фазе (форме) острого ГН.
Инфильтрация клубочка полиморфно-ядерными
лейкоцитами связана с лейкотоксическим свойством
комплемента, входящего в ИК. Много полиморфно-
ядерных лейкоцитов обычно встречается тогда, ког-
да в клубочках обнаруживается многочисленные ИК.
Полиморфно-ядерные лейкоциты наиболее часто
присутствуют в биоптатах, взятых вскоре после на-
чала заболевания. Иногда в клубочках встречаются
эозинофилы. В препаратах полутонких срезов на эпи-
телиальной стороне стенки капилляра можно уви-
деть узелки — это отложения ИК, которые однако
более достоверно выявляют при иммуногистохими-
ческом и электронно-микроскопическом исследова-
ниях.
В материале повторных биопсий, полученных
у одного больного через разные промежутки
времени от начала заболевания, постоянно
обнаруживали пролиферацию мезангиальных
клеток как выражение репарации и увеличение
мезангиального матрикса (рис. 9.1). Эти изме-
нения могут персистировать в течение несколь-
ких месяцев и лет.
В некоторых клубочках могут пролифериро-
Рис. 9.1. Острый постстрептококковый гломеруло-
нефрит. Пролиферация эндотелия и мезангиальных
клеток, набухание эндотелия (пролиферативная фаза).
Импрегнация серебром полутонких срезов. X 400.
вать клетки, выстилающие их капсулу с обра-
зованием полулуний; возможны синехии меж-
ду капиллярными петлями и капсулой. В пери-
од выздоровления нежные синехии могут со-
храняться.
При иммуногистохимическом исследовании
в ранние сроки заболевания в капиллярах по-
чечных клубочков обнаруживают IgG и СЗ,
которые распределяются диффузно вдоль сте-
нок капилляров в виде мелких нежных или гру-
бых гранул. Менее характерно сочетание грану-
лярного и очагового прерывистого линейного
свечения. В тех случаях, когда выявляют линей-
ное распределение иммуноглобулинов, требу-
ется дополнительное электронно-микроскопи-
ческое исследование для уточнения характера
отложений иммуноглобулинов, что важно для
определения формы ГН. Иногда в клубочках,
мезангии и отдельных капиллярах определяют-
ся фибриноген, пропердин.
По данным электронно-микроскопического
исследования, патогномоничным признаком
острого постстрептококкового ГН служат отло-
жения электронно-плотного материала на эпи-
213
телиальной стороне базальной мембраны ка-
пилляров клубочка — так называемые «горбы»
(humps). Им соответствуют отложения IgG и
комплемента в составе ИК. Эти отложения от-
делены от lamina densa БМ светлой зоной lamina
гага externa. Цитоплазма отростков подоцитов
окружает отложения, в ней появляются элект-
ронно-плотный материал и лизосомы, что сви-
детельствует об элиминации ИК подоцитами.
Наибольшее количество «горбов» обнаружива-
ют в первые 2—6 нед заболевания; со време-
нем их количество уменьшается. Находят утол-
щение и набухание БМ капилляров, ее истон-
чение, расщепление, образование полостей и
разрывов, неравномерную плотность, неправиль-
ные контуры [Серов В.В. и др., 1983; Rosen S.,
1983]; пролиферацию эндотелиальных и мезан-
гиальных клеток и инфильтрацию клубочка по-
лиморфно-ядерными лейкоцитами; часто лей-
коциты выявляют между БМ капилляра и эн-
дотелием.
Изменения канальцев при остром ГН выра-
жены меньше, чем клубочков. У больных с про-
теинурией находят гиалиново-капельную дистро-
фию, реже вакуольную дистрофию эпителия про-
ксимальных канальцев, в просветах канальцев —
эритроциты, белковые цилиндры, иногда лейко-
циты, особенно в тех случаях, когда выражена
лейкоцитарная инфильтрация клубочков. Реже
встречаются некроз клеток канальцев, уплоще-
ние эпителия, субатрофия, расширение просве-
тов дистальных канальцев, разрывы стенок [Hep-
tinstall R, 1974; Rosen S„ 1983; Rotter W., 1985].
В интерстиции почки выражены отек, оча-
говая лейкоцитарная и лимфоцитарная инфиль-
трация, встречаются очаги склероза.
Изменения артерий и артериол представле-
ны обычно плазматическим пропитыванием,
реже фибриноидным некрозом стенок, что со-
провождается острой почечной недостаточнос-
тью (ОПН). Изменения сосудов часто бывают
причиной ишемических повреждений клубоч-
ков [Kincaid-Smith Р., 1975].
Считают, что острый пролиферативный ГН
может трансформироваться в другие формы, в
частности в мезангиопролиферативный, мезан-
гиокапиллярный и фибропластический. Однако
в таких случаях морфологическое исследование
дает основания расценивать ГН как хроничес-
кий. Решить вопрос о переходе острого ГН в
хронический можно лишь после сопоставления
результатов повторных биопсий, в том числе в
ранние сроки заболевания.
Почки при остром ГН симметрично увели-
чены, бледны или полнокровны, с геморраги-
ями. На разрезе ткань выбухает вследствие ин-
терстициального отека, корковый слой утол-
щен, клубочки под лупой обычно определяются
в виде серых прозрачных точек.
214
9.3.3. Быстропрогрессирующий
(подострый) гломерулонефрит
Морфологическим эквивалентом БПГН явля-
ется экстракапиллярный пролиферативный ГН.
Доказано, что именно с экстракапиллярной про-
лиферацией и образованием полулуний в 80 %
почечных клубочков связано быстропрогресси-
рующее течение ГН.
Этиологически и патогенетически экстрака-
пиллярный пролиферативный ГН неоднороден.
Он представлен несколькими заболеваниями,
которые могут рассматриваться как самостоя-
тельные. Основу быстропрогрессирующего ГН
составляют идиопатический быстропрогресси-
рующий ГН и ГН синдрома Гудпасчера — за-
болевания, обусловленного повреждающим
действием антител против антигена гломеруляр-
ной БМ. Кроме того, клинические и морфоло-
гические признаки быстропрогрессирующего
ГН могут иметь формы иммунокомплексного
ГН: острый постстрептококковый и мембраноз-
но-пролиферативный, ГН при синдроме Шен-
лейна — Геноха, узелковом периартериите и
даже мембранозный ГН. Таким образом, при
экстракапиллярном ГН фоном могут быть про-
лиферативные, мезангиопролиферативные,
мезангиокапиллярные, мембранозные измене-
ния.
Для быстропрогрессирующего ГН характер-
ны как интра-, так и особенно экстракапил-
лярные изменения. Обязательным компонентом
внутрикапиллярных изменений являются фиб-
риновые тромбы; фибрин обнаруживают в со-
ставе массивных субэндотелиальных отложений,
а иногда он полностью облитерирует просветы
капилляров. Другой особенностью нарушений
целостности сосудистого пучка клубочка явля-
ются некроз стенок капилляров и их разрывы,
через которые фибрин попадает в полость кап-
сулы клубочка. Некоторые авторы считают, что
в формировании разрывов стенок капилляров
участвуют полиморфно-ядерные лейкоциты
[Серов В.В. и др., 1983; Rosen S., 1983].
Весьма типичны изменения эпителия кап-
сулы клубочка. Он становится высоким, проли-
ферирует, образует скопления, которые частич-
но или полностью окружают капиллярные пет-
ли клубочка — образуются полулуния (рис. 9.2).
Уже на ранних этапах формирования полулу-
ний происходит очаговый коллапс капилляров,
который усиливается по мере увеличения раз-
меров полулуний. По мере того как полулуния
созревают, между эпителиальными клетками
появляются мембраноподобное вещество и пуч-
ки коллагеновых волокон. Эпителиальные по-
лулуния становятся фиброэпителиальными, а
затем полностью склерозируются и гиалинизи-
руются. В формировании полулуний могут
участвовать и подоциты. Подоциты теряют ма-
лые отростки, в их цитоплазме появляется хо-
рошо развитая зернистая цитоплазматическая
сеть. Среди пролиферирующих клеток обнаружи-
вают фибрин, который также встречается в виде
небольших скоплений внутри сформированных
полулуний. Процесс формирования полулуний
сопровождается разрывом капсулы клубочка.
Разрывы обычно встречаются тогда, когда вок-
руг клубочков находят массивные инфильтраты,
состоящие из полиморфно-ядерных лейкоцитов,
мононуклеаров, причем эти клетки иногда про-
никают в полулуния и сосудистый пучок.
В ряде наблюдений экстракапиллярного ГН
интракапиллярная пролиферация клеток и не-
крозы петель отсутствуют, но вместе с тем со-
судистые петли коллабированы и сдавлены по-
лулуниями. В таких случаях чаще выявляют ли-
нейные отложения IgG.
Различный характер иммунофлюоресценции
IgG и СЗ в клубочках (линейный и грануляр-
ный), определяемый при иммуногистохимичес-
ком исследовании ткани почек, свидетельству-
ет в пользу того, что экстракапиллярная реак-
ция в почечных клубочках неспецифическая и
отражает различные иммунопатологические ме-
ханизмы развития экстракапиллярного ГН. Ли-
нейный характер распределения IgG и СЗ рас-
сматривается как доказательство обусловленно-
го антителами механизма поражения БМ. Об
этом механизме говорят и циркулирующие ан-
титела к БМ капилляров клубочка [Wilson С.,
Dixon F., 1978].
Изменения, обнаруживаемые при электрон-
но-микроскопическом исследовании, вариа-
бельны. Для идиопатического быстропрогресси-
рующего ГН и ГН синдрома Гудпасчера харак-
терны расширение lamina гага interna БМ капил-
ляров, разрыв ее, набухание эндотелия, исчез-
новение малых отростков подоцитов, скопле-
ния фибрина в капиллярах. Если экстракапил-
лярный пролиферативный ГН развивается на
фоне другой формы ГН, то при электронно-
микроскопическом исследовании обнаружива-
ют признаки, свойственные этой форме.
В проксимальных и дистальных канальцах
при подостром ГН находят гиалиново-капель-
ную или вакуольную дистрофию эпителия, а
при нефротическом синдроме — и жировую
дистрофию эпителия. В просвете канальцев оп-
ределяются цилиндры и эритроциты. Появля-
ются очаговые некрозы эпителия канальцев с
разрывом тубулярной БМ. Строма коркового и
мозгового отделов отечна, в сосудах — явления
плазморрагии.
Почки увеличены, бледны, с петехиальны-
ми геморрагиями и гладкой поверхностью. Кор-
ковый слой широкий, клубочки под лупой
имеют вид серых прозрачных точек.
Рис. 9.2. Экстракапиллярный пролиферативный ГН.
Пролиферация клеток капсулы клубочка с образова-
ния полулуния. Окраска полутонкого среза метиле-
новым голубым азуром II фуксином, х 400.
9.3.4. Хронический гломерулонефрит
Единого морфологического эквивалента забо-
левания нет. На основании комплексного мор-
фологического исследования почечной ткани
выделено несколько типов (форм), каждый из
которых относительно самостоятелен, за исклю-
чением фибропластического ГН и вторично-
сморщенной почки, завершающих развитие
любого типа хронического ГН.
«Мезангиальный гломерулонефрит». В эту груп-
пу объединены типы (формы), близкие по мор-
фогенезу; их возникновение связано с отложе-
нием ИК в мезангии и под эндотелием капил-
ляров клубочка и реакцией прежде всего ме-
зангия на эти отложения [Серов В.В. и др.,
1978, 1983]. Клинически эта группа неоднород-
на, однако на основании клинико-лаборатор-
ных данных и результатов морфологического
исследования, включающего светооптическое,
иммуногистохимическое и электронно-микро-
скопическое, в ней выделяют относительно
стабильные варианты. Их общими морфологи-
ческими признаками служат расширение мезан-
гия сосудистого пучка клубочка, пролиферация
мезангиальных клеток, накопление мезангиаль-
ного матрикса. Изменения стенок капилляров
обусловлены не только отложением иммуногло-
булинов под эндотелием, но и интерпозицией
мезангия [Arakawa М., Kimmelstiel Р., 1969],
которая представлена выселением отростков
мезангиальных клеток и вещества мезангиаль-
ного матрикса на периферию капиллярных пе-
тель, что создает светооптический феномен
двухконтурности или расщепления БМ капил-
215
ляров клубочка [Серов В.В., 1970, 1983]. По
характеру и выраженности изменений мезангия
и стенок капилляров мезангиальный ГН под-
разделяют на мезангиопролиферативный, ме-
зангиокапиллярный и лобулярный варианты
[Серов В.В. и др., 1978, 1983].
Для мезангиопролиферативного ГН характер-
но расширение мезангия, связанное прежде
всего с пролиферацией мезангиальных клеток.
Она сопровождается очаговым накоплением
мезангиального матрикса, очаговым утолщени-
ем и удвоением БМ в участках капиллярной
стенки, прилежащих к мезангию. Расширение
мезангия в результате гиперплазии мезангиаль-
ных клеток и накопления мембраноподобного
вещества ведет к расширению осевой части
сосудистого пучка, укрупнению сосудистых
долек. Диффузная интракапиллярная пролифе-
рация клеток дополняется фибропластически-
ми изменениями: клубочки приобретают лап-
чатый вид, нередко между капиллярами и кап-
сулой появляются синехии.
Иммуногистохимически в стенках капилля-
ров и мезангии определяют отложения IgG-,
IgA-комплемента. Эти отложения комковатые
или очагово-линейные. При электронно-микро-
скопическом исследовании отложения элект-
ронно-плотного материала находят в мезангии
и под эндотелием; мезангиальные клетки ак-
тивны, их количество увеличено. Изменения
эндотелия и подоцитов не имеют каких-либо
характерных черт.
Мезангиопролиферативный гломерулонеф-
рит, клинически проявляющийся возвратной
гематурией и характеризующийся отложением
IgA в мезангии капилляров клубочков, выделен
J.Berger (1969) в относительно самостоятель-
ную форму — IgA-нефропатию, которая стала
именоваться болезнью Берже. Структура отло-
жений IgA при иммуногистохимическом иссле-
довании может быть гомогенной, иногда не-
жно-гранулярной или кляксоподобной. Элект-
ронно-микроскопически выявляют отложения
электронно-плотного материала в мезангии,
обычно под БМ, реже внутри мезангиального
матрикса, изредка на периферии капиллярных
петель, но, как правило, ближе к мезангию. От-
мечают увеличение количества мембраноподоб-
ного материала в мезангии, гиперплазию ме-
зангиальных клеток [Finlayson G. et al., 1975;
Spargo В. et al., 1980].
Помимо этого, многие исследователи выде-
ляют в группе мезангиопролиферативного гло-
мерулонефрита IgM-нефропатию, поскольку при
иммуногистохимическом исследовании отложе-
ния IgM в мезангии доминируют по сравнению
с IgG и СЗ [Lawler W., 1980; Cohen А.Н., 1992].
Прогноз у больных с этой формой поражения
менее благоприятный. Морфологическая карти-
216
на мезангиопролиферативного гломерулонефри-
та может развиваться и при ряде вторичных
нефропатий, в частности при пурпуре Шенлей-
на — Геноха [Серов В.В., 1995].
Мезангиокапиллярный (мембранопролифера-
тивный) ГН — вариант мезангиального, при
котором наряду с выраженной пролиферацией
мезангиальных клеток наблюдается неравномер-
ное диффузное утолщение стенок капилляров.
При ШИК-реакции и серебрении срезов вы-
являют диффузную двухконтурность базальных
мембран капилляров клубочка (рис. 9.3), кото-
рая служит важным диагностическим призна-
ком этого варианта ГН [Kincaid-Smith Р., 1975;
Rotter W., 1985]. В процесс вовлекаются все
клубочки, они увеличены, сосудистый пучок
имеет дольчатое строение, просветы капилля-
ров сужены, в них иногда обнаруживают по-
лиморфно-ядерные лейкоциты. Иногда встреча-
ются полулуния, синехии сосудистых долек с
капсулой клубочка.
При иммуногистохимическом исследовании
в капиллярах клубочка находят отложения IgG
и СЗ, иногда IgM и IgA, фибрин. Может опре-
деляться только СЗ или другие компоненты
комплемента [Шулутко Б.И., 1983; Habib R. et
al., 1975]. Иммуноглобулины и комплемент рас-
пределены в виде гирлянд или лент по пери-
ферии капилляров, иногда имеют вид гранул
[Серов В. В. и др., 1983; Thoenes W., 1976].
На основании электронно-микроскопичес-
кого исследования выделено три типа мезан-
гиокапиллярного ГН. Первый — МКГН с суб-
эндотелиальными отложениями электронно-
плотного материала ИК [Рябов С.И., 1984;
Habib R., Levy М., 1975]. С отложениями ИК.
под эндотелием в таких случаях сочетаются ги-
перплазия и интерпозиция мезангия, обуслов-
ливающие феномен двухконтурности БМ ка-
пилляров; собственно БМ капилляров клубоч-
ка при этом не изменена (рис. 9.4).
Второй тип — МКГН с плотными отложе-
ниями, или «болезнь плотных отложений»,
«болезнь плотных мембран». Отложения элект-
ронно-плотного материала обнаруживают внут-
ри резко утолщенной lamina densa БМ капил-
ляров; они занимают всю толщу lamina densa и
прослеживаются на всем протяжении базальной
мембраны во всех капиллярах. Лишь иногда эти
отложения могут прерываться, тогда между
ними видны участки нормальной мембраны.
Редко встречаются отложения электронно-плот-
ного материала субэпителиально в виде «гор-
бов» и БМ капсулы клубочков и канальцев. Ги-
перплазия мезангиальных клеток не так выра-
жена, интерпозицию мезангия выявляют непо-
стоянно, но часто развивается пролиферация
клеток капсулы клубочка с формированием
фиброэпителиальных полулуний [Spargo В. et al.,
1980]. При втором типе МКГН в составе внут-
римембранных депозитов отсутствуют иммуно-
глобулины и компоненты комплемента.
Третий тип МКГН [Anders Р., Thoenes V.,
Churg J., Sobin L., 1982] напоминает мембра-
нозный ГН тем, что пролиферация мезангиаль-
ных клеток невелика и при серебрении срезов
в отдельных сегментах встречаются характерные
«шипики». Однако электронно-микроскопичес-
ки обнаруживают участки замещения БМ ма-
териалом, не воспринимающим серебро при
импрегнации ультратонких срезов.
Клинически все три типа мембранопроли-
феративного ГН идентичны.
Лобулярный ГН рассматривается как разно-
видность мезангиокапиллярного. Для него ха-
рактерно расширение мезангия в центральных
отделах сосудистых долек клубочка, что опре-
деляет его дольчатый рисунок на светооптичес-
ком уровне. Вследствие пролиферации мезанги-
альных клеток, выраженного увеличения мезан-
гиального матрикса в центре долек происходят
смещение капиллярных петель к периферии до-
лек, сдавление и сужение просвета капилляров,
что определяет ранний гиалиноз центра сосу-
дистых долек. Иммуногистохимически и элект-
ронно-микроскопически в мезангии и под эн-
дотелием капилляров обнаруживают отложения
И К.
При разных вариантах мезангиального ГН
обязательны изменения эпителия канальцев —
зернистая, гиалиново-капельная или вакуоль-
ная дистрофия. При мезангиопролиферативном
ГН чаще отмечают субатрофию эпителия ка-
нальцев, при мезангиокапиллярном и лобуляр-
ном — атрофию самих канальцев; их БМ утол-
щается и со временем исчезает. Строма корко-
вого и мозгового отделов почек при мезанги-
альном ГН отечна, имеются очаги склероза;
при мезангиопролиферативном и мезангиока-
пиллярном вариантах склероз стромы более вы-
ражен и сопровождается очаговой лимфогистио-
цитарной инфильтрацией. В сосудах — явления
плазморрагии. Если заболевание сопровождается
гипертонией, то обнаруживают утолщение ин-
тимы и признаки склероза стенок сосудов. Если
у больных выражена протеинурия или НС, то
морфологические изменения канальцев, стро-
мы и сосудов характерны для НС.
Почки при мезангиальном ГН, если судить
об их состоянии по удаленному перед транс-
плантацией органу, обычно плотные, бледные,
в корковом слое отмечаются желтые пятна,
артерии хорошо контурированы [Heptinstall R.,
19741.
Мембранозная нефропатия (МН) — это
иммунокомплексное поражение почечных клу-
бочков, вызванное появлением антигена gp330
(иногда карциноэмбриональный антиген) на
Рис. 9.3. Мезангиокапиллярный вариант. Диффузная
двухконтурность БМ капилляров, выраженная про-
лиферация мезангиальных клеток. Импрегнация се-
ребром полутонкого среза, х 400.
Рис. 9.4. Мезангиокапиллярный ГН. Электронно-
плотный материал ИК в субэндотелиальных отделах
БМ.
БМ — базальная мембрана; ИК — иммунный комплекс;
Эн — эндотелий. Электронограмма. X 12 000.
217
Рис. 9.5. «Пунктирность» и «шипики» БМ капилля-
ров клубочка. Импрегнация серебром полутонкого
среза, х 900.
Рис. 9.6. Мембранозный ГН. Гранулярное распреде-
ление IgG в стенках капилляров клубочка. Прямой
метод Кунса, х 600.
поверхности ножек подоцитов [Keijaschki D.,
Farquhar M.G., 1983]. В результате депозиты
иммунных комплексов формируются in situ за
пределами сосудистого русла и воспалительная
реакция в почечном клубочке не развивается.
МН описана у больных с инфекционными
и паразитарными заболеваниями: врожденным
и вторичным сифилисом, филяриатозом, ма-
лярией, шистосомозом. Известно возникнове-
ние МН под влиянием лекарственных препа-
ратов, содержащих золото и ртуть, а также
параметадиона, триметадиона, D-пеницилла-
мина. Во всех клубочках выявляют диффузное
утолщение стенок капилляров, просветы кото-
рых широко открыты, число клеток не увели-
чено, однако возможна небольшая пролифера-
ция мезангиальных клеток, а также возможны
единичные полиморфно-ядерные лейкоциты,
уменьшение числа клеток в клубочке [Серов
В.В., Варшавский В.А., 1987]. В клубочках встре-
чаются склероз отдельных капиллярных петель,
их единичные синехии с капсулой клубочка
[Куприянова Л. А., 1978].
Основным диагностическим критерием на
светооптическом уровне служат «пунктирность»
и «шипики» БМ капилляров, которые выявля-
ют при исследовании тонких срезов, импрег-
нированных серебром по Джонсу — Моури (рис.
9.5). Однако на ранних стадиях заболевания
«пунктирность» и «шипики» могут отсутствовать.
Для поздних стадий характерны «расщепление»
и «удвоение» базальных мембран.
При иммуногистохимическом исследовании
в капиллярах клубочков обнаруживают IgG,
IgA, IgM, СЗ и фибрин. Наиболее характерна
фиксация IgG и СЗ; IgM встречается реже, еще
реже — IgA и фибрин. Характерно диффузное
гранулярное распределение (рис. 9.6) иммуно-
глобулинов и комплемента. Помимо грануляр-
ного, иногда обнаруживают линейное распре-
деление иммуноглобулинов, что связано с не-
достаточной разрешающей способностью опти-
ческих приборов либо с массивностью отложе-
ний иммуноглобулинов, когда гранулы, слива-
ясь между собой, дают эффект линейного све-
чения [Серов В.В., Куприянова Л.А., 1975;
Thoenes W., 1976]. Электронно-микроскопичес-
Рис. 9.7. Мелкозернистый материал иммунных ком-
плексов (ИК) внутри резко утолщенной БМ (III ста-
дия мембранозной трансформации).
Пд — подоцит. Электронограмма. X 12 000.
218
кое исследование устраняет сомнения относи-
тельно характера структурных нарушений в та-
ких наблюдениях.
Фиксация СЗ не так постоянна и интенсив-
на, как IgG, что объясняют существованием
подгрупп IgG, не фиксирующих СЗ или фик-
сирующих другие компоненты системы комп-
лемента [Gluck М. et al., 1973; Berthoux L. et al.,
1984].
Изменения, обнаруживаемые при электрон-
но-микроскопическом исследовании в стенках
капилляров клубочков, J.Churg и E.Grishman
(1959) назвали мембранозной трансформацией.
При этом на субэпителиальной стороне БМ оп-
ределяют электронно-плотный материал (иммуноги-
стохимически ему соответствуют отложения имму-
ноглобулинов и комплемента), отдельные скопления
которого отделены друг от друга выступами lamina
densa в сторону эпителия, в результате чего БМ имеет
вид гребня. В последующих работах [Серов В.В. и др.,
1983; Churg J. et al., 1973] были выделены стадии раз-
вития мембранозной трансформации, прослежена их
динамика (рис. 9.7). О первой стадии мембранозной
трансформации большинство исследователей говорят
тогда, когда светооптически базальная мембрана ка-
пилляров не изменена, а электронно-микроскопи-
чески на ее эпителиальной стороне выявляют гра-
нулы электрон но-плотного материала, хорошо отгра-
ниченные от lamina densa БМ тонким слоем lamina гага
externa; пролиферация клеток отсутствует. Измене-
ния очаговые, сегментарные. Во второй стадии мем-
бранозной трансформации светооптически находят
утолщение стенок капилляров, при серебрении тон-
ких срезов — «пунктирность» БМ и «шипики», от-
ходящие в сторону эпителия. Электронно-микроско-
пически на эпителиальной стороне БМ множество
отложений электронно-плотного материала в виде
гранул, разделенных выростами lamina densa БМ;
гранулы электронно-плотного материала диффузно
распределены по БМ всех капилляров. Третья стадия
мембранозной трансформации светооптически ха-
рактеризуется выраженным диффузным утолщени-
ем и неравномерным окрашиванием стенок капил-
ляров клубочка. При электронно-микроскопическом
исследовании отложения электронно-плотного ма-
териала окружены веществом БМ, имеют зернистую
структуру и меньшую электронную плотность, чем
в первой и второй стадиях. В четвертой стадии (по-
здней) БМ неравномерной толщины, просветы ка-
пилляров резко сужены. Электронно-микроскопичес-
ки в резко утолщенной БМ обнаруживают полости
с остатками бывших там ранее отложений электрон-
но-плотного материала. Иммунофлюоресценция в
этой стадии, как правило, дает отрицательные ре-
зультаты.
Первые две стадии мембранозной трансфор-
мации выявляют у больных на 1—2-м году бо-
лезни; при них возможна ремиссия НС, обус-
ловливаемая регрессом мембранозной транс-
формации. Третью стадию мембранозной транс-
формации наблюдают у больных на 3—4-м году
болезни, а четвертую — в период от 2 до 10
лет болезни и позднее [Echemreich I., Churg J.,
1968].
Изменения мембраны гломерулярного филь-
тра при мембранозном ГН — основная причи-
на высокой протеинурии. Однако она связана
и с резорбтивной недостаточностью канальцев
и стромы. Морфология этой недостаточности
выражается в гиалиново-капельной, гидропи-
ческой и жировой дистрофии и атрофии эпи-
телия канальцев. Атрофия канальцев развивается
по мере прогрессирования заболевания [Heptin-
stall R., 1974; Zollinger Н. et al., 1978; Cotran R.S.,
1983]. В интерстиции — явления склероза; здесь
же обнаруживают большие клетки со светлой
пенистой цитоплазмой. Сосуды в ранние сро-
ки заболевания без особенностей; в более по-
здних стадиях выявляют изменения, характер-
ные для артериальной гипертонии.
Почки больных, умерших на ранних стади-
ях болезни, увеличенные, бледные, гладкие.
Спустя несколько лет болезни при почечной
недостаточности почки нормальной величины
или немного уменьшены, их поверхность глад-
кая или слегка зернистая, на разрезе корковый
слой желтый, пятнистый.
Липоидный нефроз. Термин «липоидный не-
фроз» ввел F.Munk (1913) для обозначения со-
стояний, при которых в моче больных и эпи-
телии канальцев обнаруживают липиды. Автор
полагал, что изменения в почках связаны с
общими нарушениями обмена. F.Volhard и
Th.Fahr (1914) описывали «липоидную дегене-
рацию канальцев» как первичное самостоятель-
ное заболевание.
Позднее M.Ldhlein (1918) и E.Bell (1929,1946)
связали массивную протеинурию при липоидном
нефрозе с повреждением мембран гломерулярных
капилляров. E.Bell в классификации 1946 г. обозна-
чил липоидный нефроз термином «мембранозный
гломерулонефрит». Это определило место липоидного
нефроза в хроническом гломерулонефрите, которое
сохраняется до сих пор, несмотря на то что пред-
ставления о липоидном нефрозе за прошедшие годы
существенно изменились.
Долгое время термины «липоидный нефроз»,
«мембранозный гломерулонефрит», «второй тип не-
фрита» A.Ellis, «нефротический синдром» считали
синонимами [Ehrich W. et al., 1952; Parrish et al.,
1957]. Благодаря работе D.Jones (1957), применивше-
го импрегнацию серебром тонких срезов почечной
ткани у больных с НС, «нефротический нефрит»
был подразделен на несколько форм: минимальные
гломерулярные изменения, мембранозный ГН и
лобулярный ГН. Название «липоидный нефроз» ос-
тавлено только для выделения своеобразной патоло-
гии у детей, проявляющейся нефротическим синд-
ромом и минимальными изменениями в клубочках
почек при светооптическом исследовании почечной
ткани (рис. 9.8). Термины «липоидный нефроз» и
219
Рис. 9.8. Липоидный нефроз. Минимальные измене-
ния. Окраска полутонкого среза. Импрегнация сереб-
ром. х 200.
«минимальные изменения» стали использовать как
синонимы.
Сущность «минимальных изменений» рас-
крылась тогда, когда для исследования биопта-
тов почек был применен электронный микро-
скоп [Farquhar et al., 1957, 1959]. Выяснилось,
что при липоидном нефрозе изменяются подо-
циты, у которых сливаются малые отростки на
всем протяжении гломерулярных капилляров;
БМ остается обычно неизмененной. Эти явле-
ния J.Churg назвал «foot processes type». После
нескольких лет болезни к минимальным изме-
нениям присоединяются очаговое утолщение
БМ капилляров, увеличение мезангиального
матрикса или числа мезангиальных клеток. Если
заболевание ведет к почечной недостаточнос-
ти, то в клубочках обнаруживают фокальный
сегментарный склероз капилляров [Grishman
Е., Churg J., 1975; Zollinger Н., Mihatsch М.,
19781. Однако часть таких наблюдений следует,
видимо, отнести к фокальному сегментарному
гломерулярному гиалинозу.
Иммуногистохимическое исследование био-
птатов почек при липоидном нефрозе дает от-
рицательный результат и помогает дифферен-
цировать липоидный нефроз и другие типы ГН.
Однако поставить окончательный диагноз мож-
но только на основании результатов электрон-
но-микроскопического исследования, посколь-
ку под маской минимальных изменений могут
скрываться начальные стадии мембранозной
нефропатии, ФСГС, мезангиопролиферативно-
го гломерулонефрита, болезнь тонких мембран
[Серов В.В., 1995].
В эпителии проксимальных канальцев в не-
фротической стадии выявляют двоякопрелом-
ляющие липиды и гранулы резорбированного
белка. Со временем липиды исчезают из эпи-
телия, появляются признаки атрофии каналь-
цев, однако атрофия никогда не бывает значи-
тельной, и в большинстве наблюдений каналь-
цы сохранены [Heptinstall R., 1974; Spargo В. et
al., 1980]. Интерстиций почек отечен, к отеку
присоединяется разрастание соединительной
ткани, среди которой находят пенистые клет-
ки. При длительном течении болезни интима
сосудов утолщается.
Вид почек при липоидном нефрозе без по-
чечной недостаточности (смерть наступает от
присоединившейся инфекции) характерен. Они
увеличены, очень бледны, их поверхность глад-
кая, на разрезе ткань набухшая, отечная. В слу-
чаях смерти от почечной недостаточности почки
немного уменьшены, серого цвета, плотные, их
поверхность гладкая, на разрезе желтая пятни-
стость.
Фокальный сегментарный гломерулярный
склероз (гиалиноз) (ФСГС). Результаты исследо-
вания повторных биопсий почек у больных
липоидным нефрозом, длительного наблюдения
за такими больными, их реакция на кортикос-
тероидную терапию позволили выделить особую
форму идиопатического нефротического синд-
рома — фокальный сегментарный гломеруляр-
ный гиалиноз. Впервые характерные для него
изменения в виде сегментарного склероза юк-
стамедуллярных клубочков были описаны
A.Rich (1957) у детей с липоидным нефрозом.
Позднее R.Habib и соавт. (1961) предложили
для этих изменений термин «сегментарный ги-
алиноз», подчеркнув тем самым значение гиа-
линовых отложений.
Другие авторы считают необходимым рас-
сматривать ФСГС как самостоятельное пораже-
ние в силу того, что они имеют различные
гистологические и клинические признаки, про-
гноз и ответ на терапию [Cameron J.S., 1996].
Кроме того, в настоящее время термин ФСГС
употребляют как для обозначения идиопатичес-
кой классической формы, так и для форм сег-
ментарного склероза при других заболеваниях,
причиной которых может быть внеклубочковый
источник повреждения. К настоящему момен-
ту не существует критериев «первичного»
220
ФСГС, в связи с чем в клинической практике
необходимо исключать вторичный ФСГС.
ФСГС — единственное состояние, при котором
гломерулосклероз начинается исключительно в
юкстамедуллярных нефронах [McGovern R.,
Lauer С., 1973]. В процесс вовлекаются отдель-
ные клубочки (фокальные изменения); в них
склерозируются отдельные сегменты сосудисто-
го пучка (сегментарные изменения), остальные
клубочки интактны. В начале заболевания на
светооптическом уровне изменения квалифици-
руют как минимальные [Серов В.В. и др., 1982,
1983].
На ранних стадиях болезни электронно-мик-
роскопическое исследование биоптата почки
позволяет выявить характерный вид БМ капил-
ляров клубочка: неровные контуры эндотели-
альной поверхности, «обтрепанность» БМ
[Kincaid-Smith Р., 1975]. Наиболее частый при-
знак, в большинстве случаев предшествующий
появлению очагов сегментарного гиалиноза, —
единичные нежные синехии капилляров с кап-
сулой клубочка [Saint-Hillar Y. et al., 1975]. При
развернутой морфологической картине в от-
дельных капиллярах клубочков появляется ги-
алиновый материал в виде единичных или мно-
жественных шаровидных отложений, обычно
связанных с капсулой клубочка (рис. 9.9). В ги-
алиновом материале выявляют липиды, поэто-
му он имеет «пенистый» вид, а в клубочках —
«пенистые» клетки — мезангиальные клетки,
содержащие липиды (рис. 9.10) [Серов В.В. и
др., 1978, 1983; Kincaid-Smith Р., 1975]. Они
появляются и в интерстиции, имея там, есте-
ственно, другое происхождение. Появление
пенистых клеток означает плохой прогноз. Фо-
кальному сегментарному гиалинозу иногда
предшествует увеличение мезангиального мат-
рикса в капиллярах клубочка, но пролифера-
ция клеток отсутствует. При иммуногистохими-
ческом исследовании в капиллярах клубоч-
ков находят IgM [Шулутко Б.И., 1983; Cohen А.
et al., 1977]. Возможно, что отложение IgM
вторично и происходит тогда, когда уже сфор-
мировались характерные изменения. Однако
не исключено значение первичного иммун-
ного механизма в развитии гломерулярных
изменений. По мере прогрессирования болезни
в процесс вовлекаются клубочки поверхност-
ных отделов коркового вещества. Выявляют
склероз сосудистых долек, затем он становит-
ся распространенным и постепенно охватыва-
ет сосудистые петли всего клубочка (глобаль-
ный склероз).
В рамках классического ФСГС выделяют не-
сколько гистологических вариантов: «клеточ-
ный» с пролиферацией эндотелия, появлени-
ем пенистых клеток и мононуклеарных лейко-
цитов; «концевой» со склеротическими изме-
Рис. 9.9. Сегментарный склероз и гиалиноз сосудов
клубочков. Окраска полутонкого среза метиленовым
голубым азуром II фуксином, х 400.
Рис. 9.10. Фокальный сегментарный гломерулярный
гиалиноз. Липиды (Л) в цитоплазме мезангиальной
клетки (Мезк). Электронограмма. х 22 000.
нениями рядом с выходом S1-сегмента прокси-
мального канальца из капсулы; «коллабирую-
щая нефропатия» с сегментарным и фокальным
221
коллапсом капилляров и гиперплазией подоци-
тов [Cameron J.S., 1996].
В канальцах обнаруживают жировую и бел-
ковую дистрофию эпителия, гиалиновые ци-
линдры в просветах, мелкие очаги кальцифи-
кации. Патогномонично образование очагов
коллапса и атрофии канальцев, сопровождаю-
щееся склерозом стромы. Распространенность
изменений канальцев пропорциональна выра-
женности изменений в клубочках. Обнаружение
в биоптате почки нормальных клубочков одно-
временно с атрофированными канальцами дол-
жно настораживать в отношении фокального
сегментарного гломерулярного гиалиноза. Вне-
шний вид почек такой же, как при липоидном
нефрозе.
Трудность морфологической диагностики
этой особой формы идиопатического НС в том,
что развитие различных типов ГН может завер-
шиться изменениями, близкими к таковым при
первичном фокальном сегментарном гломеру-
лярном гиалинозе. Диагностика этой формы
зависит от времени первой биопсии и тем ус-
пешнее, чем раньше от начала заболевания
проведена биопсия почки.
Фибропластический гломерулонефрит. Эволю-
ция большинства форм ГН завершается присо-
единением фибропластического компонента:
склероза капиллярных петель клубочка, сине-
хий сосудистых долек с капсулой, фиброэпи-
телиальных и фиброзных полулуний, утолще-
ния и склероза капсулы клубочка. Склероз ка-
пиллярных петель клубочка обусловлен прогрес-
сирующим накоплением в мезангии и за его
пределами мембраноподобного вещества мезан-
гиального матрикса, синтезируемого мезанги-
альными клетками, что приводит к сдавлива-
нию, облитерации и коллапсу капилляров. При
разрывах стенок капилляров мембраноподобное
вещество появляется в полости капсулы. Экст-
ракапиллярная пролиферация клеток и образо-
вание полулуний связаны с разрывами стенок
капилляров и выходом компонентов плазмы в
полость капсулы, возникновением там скопле-
ний фибрина. Появление фиброэпителиальных
полулуний усиливает коллапс сосудов клубоч-
ка и способствует развитию его гиалиноза. Ги-
алиноз сосудов клубочка может быть вызван
также массивными отложениями иммуноглобу-
линов. При гиалинозе клубочка его клеточные
элементы, как правило, атрофируются и поги-
бают.
В начале фибропластической трансформации
клубочков с помощью светооптической микро-
скопии, электронной микроскопии и иммуно-
гистохимии удается выявить признаки, свой-
ственные исходной форме ГН; со временем
фибропластическая трансформация нивелиру-
ет эти признаки. Фибропластические изменения
222
в клубочках сопровождаются дистрофией эпи-
телия проксимальных и дистальных отделов
канальцев, субатрофией эпителия, атрофией и
коллапсом канальцев, на месте которых разра-
стается соединительная ткань. Характерны скле-
роз интерстиция мозгового слоя почечной тка-
ни, лимфогистиоцитарные инфильтраты в стро-
ме, периваскулярный склероз.
В целом фибропластический ГН представляет
собой собирательную эволютивную форму; в
свою очередь она подразделяется на диффузный
и очаговый фибропластический ГН [Серов В.В.
и др., 1978, 1983].
При диффузном фибропластическом ГН
фибропластической трансформации в той или
иной степени подвергаются все клубочки. Ког-
да фибро пластические изменения обнаружива-
ют в отдельных сегментах сосудистого пучка
части клубочков, а остальные клубочки незна-
чительно изменены или совсем не изменены,
можно говорить об очаговом фибропластичес-
ком ГН. Диффузный фибропластический ГН
завершает развитие предшествующих ему диф-
фузных форм, а очаговый фибробластический
ГН — развитие липоидного нефроза, фокаль-
ного сегментарного гломерулярного гиалиноза
(очаговый склерозирующий ГН), очаговые
формы мезангиомембранозного и мезангиопро-
лиферативного ГН. Таким образом, очаговый
фибропластический ГН рассматривается как ге-
терогенная группа [Варшавский В.А., 1979;
Серов В.В. и др., 1983; Kincaid-Smith Р., 1975].
Чаще фибропластический ГН бывает морфоло-
гическим выражением длительно текущей не-
фротической или нефротически-гипертоничес-
кой формы ГН и, как правило, встречается при
терминальном нефрите [Серов В.В., Варшавс-
кий В.А., 1977].
9.3.5. Вторично-сморщенная почка
Вторично-сморщенная почка развивается как
итог различных форм ГН. Многие клубочки в
таких случаях полностью склерозированы и
гиалинизированы, лишь единичные сохранив-
шиеся гломерулы компенсаторно гипертрофи-
рованы. С большим трудом можно найти клу-
бочки с изменениями, характерными для той
или иной формы диффузного ГН. Склероз и
гиалиноз клубочков сопровождаются коллапсом
и атрофией канальцев и разрастанием вокруг
них соединительной ткани. Просветы сохранив-
шихся канальцев кистозно расширены, запол-
нены гиалиновыми цилиндрами, их эпителий
уплощен, субатрофирован или атрофирован.
Строма коркового и мозгового слоев склерози-
рована. В участках склероза обнаруживают лим-
фогистиоцитарные инфильтраты. В стенках ар-
терий и артериол — явления гиалиноза и эла-
стофиброза.
При иммуногистохимическом исследовании
специфическая люминесценция в ткани почек,
как правило, отсутствует; изредка в сохранив-
шихся клубочках можно выявить отложения
IgG, иногда фибриноген.
Характерен внешний вид почек: они малень-
кие, плотные, их поверхность мелкозернистая.
Капсула почки снимается с трудом, вместе с
частичками почечной ткани. На разрезе стенки
сосудов утолщенные. Корковый слой значитель-
но истончен, серого цвета, с геморрагиями,
особенно если заболевание сопровождается
высоким артериальным давлением; у больных
с НС в коре почек обнаруживают желтые пят-
на. Клубочки под лупой не определяются.
У больных, леченных гемодиализом, почки
меньше, чем у тех больных, которым гемодиализ
не проводили. Гиалинозу подвергаются все клубоч-
ки, атрофия канальцев выражена слабее. В клубоч-
ках и канальцах появляются отложения солей каль-
ция, в корковом и мозговом слое — кристаллы
оксалатов, окруженные гигантскими клетками.
9.3.6. Морфология нефротического
синдрома
Говорить о морфологии НС как о чем-то еди-
ном нельзя, так как он объединяет большую
группу заболеваний, каждому из которых при-
суща своя морфология. В то же время у НС есть
общие морфологические проявления, связан-
ные с протеинурией — основным признаком
и слагаемым синдрома. Протеинурия, обуслов-
ленная избыточной фильтрацией белков плаз-
мы, превосходящей реабсорбционные возмож-
ности канальцевого эпителия, вызывает струк-
турную перестройку гломерулярного фильтра и
канальцевого аппарата. Вначале эта перестрой-
ка бывает адаптивной, а затем отражает срыв
адаптивных механизмов, который связан с раз-
витием реабсорбционной недостаточности ка-
нальцев в отношении белка и ведет как к даль-
нейшему повреждению клубочков и канальцев,
так и к изменениям интерстиция и сосудов
почек. Изменения подоцитов однозначны неза-
висимо от причины, с которой связано разви-
тие протеинурии. Вначале происходит набуха-
ние и укорочение малых отростков подоцитов,
фильтрационные щели становятся узкими. Да-
лее наружные листки плазматической мембра-
ны сливаются и образуют соединения, закры-
вающие фильтрационные щели между малыми
отростками. Общее количество малых отростков
подоцитов и фильтрационных щелей уменьша-
ется, и малые отростки подоцитов замещают-
ся уплощенной цитоплазмой тела подоцита.
Вследствие этого происходит смещение филь-
трационной щелевой мембраны в сторону «мо-
чевого пространства», щелевая мембрана обра-
зует складки, как бы удваивается; структура
подоцитов упрощается, сближаются тела и от-
ростки клеток. Нарушения структуры подоци-
тов связаны с изменением электрического за-
ряда в клубочке.
Распространенность изменений подоцитов
пропорциональна величине протеинурии и
выраженности первичных повреждений гломе-
рулярной БМ: очаговые нарушения подоцитов
коррелируют с умеренной протеинурией, вы-
раженные — с тяжелой протеинурией. Соответ-
ственно небольшое количество ИК в гломеру-
лярных капиллярах сопровождается очаговой
перестройкой подоцитов в местах отложений
ИК, массивные отложения вызывают резко
выраженные и распространенные изменения
подоцитов вплоть до оголения гломерулярной
БМ. Поскольку ИК обычно содержат IgG, мо-
лекулы которого нейтральны или являются сла-
быми катионами, их отложение в гломеруляр-
ной БМ нарушает электрическое поле, что
служит причиной повреждения подоцитов и
протеинурии.
При протеинурии в цитоплазме подоцитов на-
блюдаются множество пиноцитозных пузырьков,
хорошо развитая цитоплазматическая сеть, обилие
рибосом и полисом, усиливается фибриллярный
рисунок цитоплазмы, причем фибриллы ориентиро-
ваны по оси возможного сокращения «клеток-насо-
сов». Эти ультраструктурные изменения свидетель-
ствуют о повышенной функциональной активности,
эндотелий не меняет своей структуры, хотя и пи-
ноцитозная активность резко выражена. Гиперфунк-
ция подоцитов сохраняет эндотелий. Морфологичес-
кими проявлениями декомпенсации функции подо-
цитов следует считать выраженную вакуолизацию и
отек их цитоплазмы, исчезновение внутриклеточных
структур и фибриллярного каркаса и, наконец, дес-
квамацию клеток с оголением БМ. Декомпенсация
функции подоцитов ведет к повреждению эндотелия,
он вакуолизируется, набухает, происходит его дес-
квамация, что сопровождается компенсаторной про-
лиферацией клеток эндотелия.
Повреждение гломерулярного фильтра со-
провождается адаптивной гиперплазией мезан-
гиальных клеток, продуцирующих мембранопо-
добное вещество мезангиального матрикса и
вещество БМ. Отложение этого вещества в ме-
зангии и очаговое утолщение БМ вблизи ак-
тивных мезангиальных клеток дополняют струк-
турную адаптивную перестройку гломерулярно-
го фильтра при НС [Серов В. В., Куприяно-
ва Л. А., 1972].
Повышенная фильтрация гломерулярными
капиллярами белка приводит к функциональ-
ному перенапряжению канальцевого аппарата
223
в связи с повышением реабсорбции отфильт-
рованного белка, возникает резорбтивная тубу-
лярная недостаточность [Серов В.В., Варшавс-
кий В.А., 1977]. Морфология функционально-
го перенапряжения и декомпенсация тубуляр-
ного эпителия представлены различными вари-
антами его дистрофии. Повышенную резорбтив-
ную функцию эпителия канальцев отражает
зернистая дистрофия эпителия, которая не со-
провождается изменениями активности дыха-
тельных, гликолитических и гидролитических
ферментов в нефроне [Серов В.В., 1972]. Мор-
фологическим эквивалентом истощения белко-
во-реабсорбционной функции канальцев, а так-
же несостоятельности лизосомально-вакуоляр-
ного аппарата нефроцитов, обеспечивающих в
норме реабсорбцию белка, является гиалино-
во-капельная дистрофия нефроцитов. Гидропи-
ческая дистрофия клеток канальцев и крайнее
ее выражение — баллонная дистрофия — экви-
валент несостоятельности реабсорбции воды ба-
зальным лабиринтом нефроцитов [Ковтун Т.И.,
1982; Серов В.В. и др., 1983].
В финале дистрофических процессов развива-
ются некробиоз и десквамация эпителия — ос-
нова формирования цилиндров, иногда обтури-
рующих дистальные отделы канальцев и приво-
дящих к их кистозному расширению. Дистрофия
эпителия канальцев дополняет атрофию.
Функциональную недостаточность лимфати-
ческой системы почек — второй системы ре-
абсорбции при НС отражает отек интерстиция,
который быстро сменяется склерозом, причем
среди разрастаний соединительной ткани час-
то встречаются большие светлые клетки с пе-
нистой цитоплазмой, которые считают макро-
фагами, фагоцитировавшими липиды. В сосудах
почек находят плазматическое пропитывание и
гиалиноз, склероз стенок.
Морфология первичного (идиопатического)
нефротического синдрома — это морфология
липоидного нефроза, фокального сегментарно-
го гломерулярного гиалиноза, МН.
Врожденный нефротический синдром (микро-
кистоз новорожденных, финский тип НС) воз-
никает в первые дни или недели жизни ребен-
ка и заканчивается смертью на первом году. Это
семейное заболевание, наследуемое по аутосом-
но-рецессивному типу. Оно часто встречается в
Финляндии, поэтому получило название «фин-
ского типа НС».
Клинически заболевание сходно с липоидным
нефрозом, однако плохо поддается лечению.
При светооптическом исследовании в клу-
бочках находят очаговое утолщение стенок ка-
пилляров, очаговую пролиферацию мезангиаль-
ных клеток, иногда эпителия, выстилающего
полость капсулы клубочка, встречаются очаги
гломерулярного склероза. Однако большая часть
224
клубочков может быть интактной, поэтому при
светооптическом исследовании нередко вообще
не обнаруживают изменений. Электронно-мик-
роскопически в клубочках находят лишь пора-
жения подоцитов, сходные с таковыми при
липоидном нефрозе.
Особенно резко изменяются канальцы, при-
чем изменения начинаются в кортикомедулляр-
ной зоне. Проксимальные отделы канальцев ра-
стянуты, их эпителий уплощен, содержит липи-
ды. Иногда растяжение канальцев настолько
выражено, что они напоминают кисты (приме-
нение микродиссекции нефронов показало чет-
кообразное расширение проксимальных отделов
канальцев). Капсулы клубочков также могут быть
кистозно растянуты. Собирательные трубки пер-
вично в процесс не вовлекаются. Иммуногисто-
химически в капиллярах клубочков, правда, не
во всех случаях, обнаруживают IgG, IgM, Cl и
СЗ [Heptinstall R., 1974]. На основании этих дан-
ных предполагают иммунологический механизм
повреждения клубочков. Установлена иммуноло-
гическая несовместимость между матерью и пло-
дом; у матери находят преципитирующие анти-
тела против ткани почек и плаценты.
Считают также [Hoyer J. et al., 1967], что в
развитии заболевания повинны генетически
обусловленные метаболические нарушения, с
которыми связано изменение проницаемости
базальной мембраны капилляров. Кроме того,
установлено, что причина болезни кроется в
нарушении синтеза вещества БМ [Norio R.,
1966]. J.Oliver (1966) связывает это заболевание
с первичной регрессивной дисплазией, резуль-
татом которой служат атрезия, атрофия, раз-
рывы и деструкция нефронов.
Почки при врожденном НС нормальной ве-
личины или несколько увеличены, имеются
кисты в корковом слое.
Морфология вторичного нефротического син-
дрома (см. Классификацию нефротического син-
дрома) связана не только с протеинурией, она
отражает нозологические особенности того за-
болевания, с которым связан этот синдром.
9.4. Механизмы
прогрессирования
гломерулонефрита
9.4.1. Клеточно-молекулярные
механизмы*
Патологический иммунный ответ, вызывающий
повреждение почечной ткани — клубочков,
интерстиция и канальцев (см. главу «Иммуно-
* Раздел написан Е.М.Шиловым.
логические механизмы развития нефритов»), во
многих случаях со временем самостоятельно
прекращается, что особенно четко прослежено
на экспериментальных моделях нефрита. Воспа-
лительная реакция, сопровождающая иммунное
повреждение, заканчивается репарацией (за-
живлением), которая приводит к различным,
порой противоположным, исходам — от пол-
ного восстановления структуры клубочков до
глобального гломерулосклероза — основы про-
грессирующей почечной недостаточности.
Механизмы репарации почечной ткани в
ответ на иммунное (или другой природы) по-
вреждение интенсивно изучаются, так же как
и причины различий в исходах — восстановле-
ния или фиброза. Однако уже ясно, что эти
процессы представляют собой местные почеч-
ные проявления общепатологических механиз-
мов воспаления и фиброза [Пальцев М.А.,
Иванов А.А., 1995; Hunsicker L.G., Levey A.S.,
1995].
Возможно, что различия между восстанов-
лением и фиброзом являются просто различи-
ями в продолжительности или интенсивности
воздействия повреждающего фактора. Так, в
условиях экспериментального повреждения клу-
бочков, вызываемого инъекцией нефротокси-
ческих (анти-БМК) антител, однократное вве-
дение может сопровождаться полным восста-
новлением структуры клубочков, в то время как
множественные инъекции вызывают прогресси-
рующий склероз. Исследования ранней фазы
анти-БМК-нефрита, показали, что в течение
первой недели после острого повреждения,
вызванного введением анти-БМК-антител, в
клубочках повышается уровень мРНК для не-
скольких белков внеклеточного матрикса, а
затем происходит отложение соответствующих
матриксных белков [Goyal М., Wiggins R.C.,
1991]. Однако при отсутствии повторного по-
вреждения эти ранние фиброзные изменения
могут быть полностью обратимыми. При экст-
ракапиллярном анти-БМК нефрите кроликов
первоначально повреждается 90 % клубочков,
50 % восстанавливается до нормы, в 50% раз-
вивается фиброз [Downer G. et al., 1988].
Гломерулосклероз. Развитие прогрессирующе-
го почечного фиброза представляется сегодня
сложной цепью событий, включающей в себя:
• межклеточные взаимодействия гломеруляр-
ных и инфильтрирующих клубочки клеток
крови, которые обеспечиваются выделени-
ем широкого ряда медиаторов, включая ци-
токины и факторы роста;
• последующее изменение функционального
состояния гломерулярных клеток с развити-
ем их пролиферации и избыточного накоп-
ления матрикса;
• развитие гломерулосклероза из-за недоста-
точной утилизации (резорбции) избытка
матрикса.
В развитии и прогрессировании гломеруло-
склероза важнейшую роль играют мезангиаль-
ные клетки — специализированные перициты,
обладающие сократительной, фагоцитарной и
метаболической способностью, необходимой
для поддержания целостности клубочка. В экс-
периментальных и клинических условиях гло-
мерулярного повреждения мезангиальные изме-
нения возникают рано и включают в себя про-
лиферацию мезангиальных клеток, расширение
и склероз мезангиального матрикса [Olson J.L.
et al., 1985]. Расширение и склероз мезангия
являются следствием стимуляции мезангиаль-
ных клеток фиброгенными факторами с повы-
шением синтеза ими внеклеточного матрикса
[Богомазова С.Ю. и др., 1997; Иванов А.А. и др.,
1998; Border W.A., Noble N.A., 1993].
Склерозированию клубочков непосредствен-
но или опосредованно способствуют инфильт-
рирующие клубочки — циркулирующие клетки
крови — нейтрофилы, моноциты, лимфоциты,
тромбоциты (см. главу «Иммунологические ме-
ханизмы развития нефритов»), а также интер-
стициальные фибробласты, проникающие че-
рез прорывы в капсуле Боумена [Striker L.J. et
al., 1984]. Установлено, что мононуклеарные
лейкоциты (моноциты/лимфоциты) в зависи-
мости от локализации в почечных клубочках
продуцируют различный спектр цитокинов, ре-
гулирующих продукцию внеклеточного матрик-
са [Богомазова С.Ю. и др., 1997]. Мононукле-
арные лейкоциты, локализованные в просвете
капиллярных петель (при нефротоксическом
нефрите, НТН) продуцируют ИЛ-1/?, ФНОа
и ТФР/?, в то время как мононуклеарные лей-
коциты, локализованные в мезангии (при пуро-
мицин-аминонуклеозидном нефрозе, ПАН) —
ИЛ-lpa, ФНОа и ТФР/?.
Известно, что источником белков матрикса
являются собственные клетки клубочков. Иссле-
дования in vitro выявили биосинтетический
профиль этих клеток: мезангиальные клетки
продуцируют коллаген I, III, IV и V типов,
ламинин, фибронектин, протеогликаны
[Ishimura Е. et al., 1989], эпителиальные клетки
клубочков — чаще всего белки базальной мем-
браны, коллагены IV и V типов, ламинин, про-
теогликаны. В период развития прогрессирую-
щего гломерулосклероза происходит изменение
фенотипа матрикса с появлением отсутствую-
щих в норме матриксных белков. По данным
С.Ю.Богомазовой и соавт. (1997), хроническая
стадия НТН и ПАН сопровождается выражен-
ным накоплением мезангиального матрикса за
счет коллагена IV типа и ламинина, для хро-
15—2950
225
нической стадии НТН в отличие от хроничес-
кой стадии ПАН характерна выраженная гипер-
клеточность мезангия за счет пролиферации
мезангиальных клеток и инфильтрации его мо-
нонуклеарными лейкоцитами. Избыток моно-
нуклеарных лейкоцитов в мезангии приводит к
появлению в мезангиальном матриксе интер-
стициальных коллагенов I и III типов, усили-
вая риск развития склероза.
Современные представления о регуляции фиб-
рогенеза позволяют предположить, что различия
между заживлением с восстановлением нормаль-
ной структуры и функции и развитием фиброза
ткани являются следствием локального баланса
между эндокринными, паракринными и ауток-
ринными фаторами, которые регулируют про-
лиферацию и синтетическую функцию фибро-
бластов [Пальцев М.А., Иванов А.А., 1995;
Kovacs E.J., 1991]. Особая роль в этом процес-
се принадлежит таким факторам роста, как
трансформирующий фактор роста /? (ТФР/3),
тромбоцитарный фактор роста (ТцФР), основ-
ной фактор роста фибробластов (оФРФ), а так-
же ангиотензину II, более известному по его
гемодинамическим эффектам.
Наиболее убедительные данные о централь-
ной роли факторов роста в патогенезе прогрес-
сирующей почечной недостаточности получе-
ны для ТФР/3 [Border W.A., Noble N.A., 1993],
который впервые изучен при заживлении ран.
При раневом процессе ТФР/3 высвобождается
из тромбоцитов при их агрегации в ответ на
повреждение ткани. Однако связывание тром-
боцитарного ТФР/? с другими типами клеток,
включая мезангиальные, вызывает дальнейшее
высвобождение ТФР/3 уже из этих клеток, уси-
ливая процесс фиброзного заживления [Border
W.A., Noble N.A., 1994].
Эффекты ТФР/3 могут быть разделены на 4
группы:
• ТФР/? обладает антимитотическим действи-
ем, подавляя пролиферацию паренхиматоз-
ных и соединительнотканных клеток;
• стимулирует продукцию коллагена и других
белков, а также протеогликанов, которые
формируют основное вещество соединитель-
ной ткани;
• подавляет секрецию протеиназ, участвующих
в ремоделировании соединительной ткани;
• стимулирует продукцию интегринов — кле-
точных белков, которые важны для взаимо-
действия клеток с окружающей соединитель-
ной тканью.
В норме выделение ТФР/3 прекращается сразу
же после начала процесса заживления. Однако,
если нормальные контролирующие механизмы
недостаточны и выделение ТФР/3 продолжает-
ся, перечисленные эффекты его действия, вза-
226
имодействуя между собой, вместо восстанов-
ления нормальной структуры ведут к образова-
нию рубцовой ткани [Kovacs E.J., 1991].
Роль ТФР/? при почечных заболеваниях впер-
вые изучена на анти-Thy-l-модели мезангио-
пролиферативного ГН [Border W.A. et al., 1995],
которая характеризуется выраженным накопле-
нием мезангиального матрикса в фазу зажив-
ления. В выделенных клубочках был повышен
синтез коллагена и протеогликанов гломеруляр-
ными клетками, а также уровень мРНК для
ТФР/3 и выделение активного цитокина в куль-
туральную среду. Добавление в культуральную
среду антител против ТФР/3 практически пол-
ностью подавляло синтез коллагена и протео-
гликанов, что свидетельствует о регулировании
ТФР/3 синтеза компонентов соединительной
ткани [Border W.A. et al., 1995]. В следующей
серии экспериментов введение крысам с инду-
цированным мезангиальным ГН антител про-
тив ТФР/3 полностью блокировало расширение
мезангиального матрикса. Прямые доказатель-
ства того, что повышенный уровень ТФР/3 спо-
собствует развитию гломерулосклероза, получе-
ны в экспериментах с введением гена цитоки-
на непосредственно в почки крыс [Isaka Y. et al.,
1993].
Трансформирующий фактор роста /? и ос-
новной фактор роста фибробластов могут про-
дуцироваться как в растворимом виде, так и
экспрессироваться на поверхности плазматичес-
кой мембраны клеток или связываться внекле-
точным матриксом. Действие таких цитокинов
осуществляется через прямые межклеточные и
клеточно-матриксные контакты. Нами установ-
лено, что матриксассоциированные формы
оФРФ и ТФР/3 накапливаются в почечном клу-
бочке в острой стадии НТН и ПАН, но в разной
степени [Опаленов К.В. и др., 1998; Ivanov А.
et al., 1998]. Уровень образования мембраноас-
социированных форм зависит от степени по-
вреждения гломерулярных структур. Усиление
образования матриксассоциированных форм
оФРФ и ТФР/3 коррелирует с качественными
и количественными изменениями состава вне-
клеточного матрикса и уровнем пролифератив-
ной активности мезангиальных клеток при НТН
и ПАН. Таким образом, образование матрикс-
ассоциированных форм цитокинов можно рас-
сматривать как один из механизмов репаратив-
ного процесса.
В хронической стадии НТН и ПАН (на фоне
развития гломерулосклероза) происходит
уменьшение содержания в почечном клубочке
матриксассоциированных форм оФРФ и ТФР/1
до полного исчезновения оФРФ при ПАН.
В хронической стадии НТН усиливается не
только инфильтрация почечного клубочка мо-
ноцитами, на поверхности которых появляет-
ся экспрессия ИЛ-1, но и пролиферативная ак-
тивность мезангиальных клеток. При ПАН ин-
фильтрация почечных клубочков моноцитами и
пролиферация мезангиальных клеток отсутству-
ют. Накопление моноцитов в зоне повреждения
вызывает усиление пролиферации мезангиаль-
ных клеток и индуцирует извращенный синтез
внеклеточного матрикса — в клубочках возни-
кают отложения атипичного интерстициального
коллагена I и III типов.
На основании этих данных предполагают,
что уменьшение содержания матриксассоции-
рованных форм оФРФ и ТФР/3 ниже конт-
рольного уровня при экспериментальных гло-
мерулопатиях с иммунным и неиммунным ме-
ханизмом повреждения способствует развитию
склероза. Появление на моноцитах мембрано-
ассоциированного ИЛ-1 инициирует извращен-
ный синтез внеклеточного матрикса, усиливая
развитие склероза.
ТФР/1 также играет роль в развитии интер-
стициального фиброза. На модели экстракапил-
лярного ГН у кроликов перигломерулярный
фиброз коррелировал с количеством ТФР/З,
проникающим через дефекты в капсуле Боуме-
на из клубочков в интерстиций.
Мезангиальная гиперклеточность часто пред-
шествует развитию мезангиального склероза.
Считается, что она является следствием стиму-
ляции мезангиальной пролиферации такими
факторами роста тромбоцитарного и макрофа-
гального происхождения, как ТцФР и оФРФ
[Noronha I.L. et al., 1995]. ТцФР, как и ТФР/1,
видимо, вовлечен в аутокринный механизм, в
котором стимуляция мезангиальных клеток
ТцФР тромбоцитарного происхождения дает
начало синтезу этого цитокина самими мезан-
гиальными клетками. И опять, как в ситуации
с ТФР/3, самоусиливающаяся продукция ТцФР
вызывает нарастающую пролиферацию мезан-
гиальных клеток, если только не включается
ингибирующий механизм, препятствующий
действию ТцФР.
Прогрессирующее поражение почечных клу-
бочков в модели «остаточной почки» у крыс,
обычно объясняемое гемодинамическими меха-
низмами, может в огромной степени зависеть
от действия ТцФР, выделяемого вначале в клу-
бочках активированными тромбоцитами, а за-
тем поддерживаемого самоусиливающимся
аутокринным механизмом [Noronha IL et al.,
1995]. Мезангиальное окрашивание на мРНК и
белок ТцФР в этой модели значительно повы-
шено. Так же как и для ТФР/1, введение гена
ТцФР в клубочки крыс приводило к прогрес-
сирующему гломерулосклерозу, однако в боль-
шей степени характеризовалось клеточной про-
лиферацией, а не расширением мезангиально-
го матрикса.
Резорбция и утилизация отложившегося ме-
зангиального матрикса происходят под действи-
ем выделяемых мезангиумом протеолитических
энзимов. В нормальных клубочках имеются та-
кие разрушающие матрикс энзимы, как сери-
новые протеазы (активаторы плазминогена,
эластаза) и матриксные металлопротеиназы
(интерстициальная коллагеназа, желатиназа,
стромолизин) [Davies М. et al., 1992]. Каждый
из этих ферментов имеет естественные ингиби-
торы. Теоретически увеличение секреции фиб-
ринолитического фермента или уменьшение
активности ингибитора может резорбировать
ранее отложившиеся белки гломерулярного
матрикса.
Относительно in vivo действия этих каска-
дов в период гломерулярного повреждения пока
известно мало. В анти-Thy-l-модели ГН повы-
шенный синтез коллагеназы сочетался с раз-
решением гломерулосклероза [Lovett D.H. et al.,
1992] и, наоборот, сниженная активность гло-
мерулярной коллагеназы в этой же самой мо-
дели сочеталась с прогрессирующим гломеру-
лосклерозом [Tomooka S. et al., 1992]. С.Ю.Бо-
гомазова и соавт. (1997) также наблюдали в не-
фротоксической и пуромицин-аминонуклеозид-
ной моделях ГН в почечных клубочках парал-
лельное с повышением уровня ТФР/3 усиление
экспрессии тканевого ингибитора металлопро-
теиназ-1 (ТИМП-1), препятствующего процессу
деградации внеклеточного матрикса. Это свиде-
тельствует о том, что накопление внеклеточно-
го матрикса происходит как за счет усиления
синтеза ряда его компонентов, так и уменьше-
ния их расщепления.
Представление о ведущей роли нарушений
регуляции фиброгенеза в прогрессировании
почечных заболеваний во многом объясняет
гипотезу о важности гемодинамических факто-
ров и гипертрофии клубочков. Хотя ангиотен-
зин II (А-П) более известен как фактор, вли-
яющий на сосудистый тонус, в настоящее вре-
мя выяснено, что он является важным трофи-
ческим фактором для пролиферации гладкомы-
шечных клеток сосудов и близких к ним мезан-
гиальных клеток почечных клубочков [Wolf G.,
1999]. Недавно установлено, что А-П индуци-
рует синтез гладкомышечными клетками сосу-
дов ТФР/1, ТцФР, оФРФ и активирует ТФР/3
из его латентной формы. Пролиферация глад-
комышечных клеток сосудов в ответ на А-П
зависит от аутокринного действия ТФР/? и
оФРФ. Однако более высокий уровень ТФР/1
подавляет пролиферацию гладкомышечных кле-
ток сосудов в ответ на А-П, способствуя вмес-
то этого повышенному синтезу соединительной
ткани. Это бимодальное действие ТФР/3 на про-
лиферацию сосудистых гладкомышечных клеток
связано с его действием на ТцФР. ТФР/3 сам
15*
227
усиливает синтез ТцФР и в низких концентра-
циях повышает клеточную пролиферацию, од-
нако в высоких концентрациях ТФР/? подавля-
ет экспрессию рецепторов для ТцФР, поэтому
ингибирует его действие.
А-П оказывает также прямое действие —
индуцирует синтез остеопонтина клетками ка-
нальцев, способствуя таким образом развитию
тубулоинтерстициального фиброза, так же как
и мезангиальной пролиферации и фиброзиро-
вания клубочков. Роль А-П как потенциально
повреждающего фактора роста может частично
объяснить наблюдения, сделанные на моделях
гломерулярных заболеваний, когда использова-
ние ингибиторов АПФ защищало от прогрес-
сирования болезни при отсутствии каких-либо
изменений в гломерулярной гемодинамике или
давления в клубочковых капиллярах. В этом от-
ношении интересно то, что ингибиторы АПФ
защищают также против активации ТФР/? в
канальцах при обструктивной уропатии, также
как и против активации в канальцах остеопон-
тина при экспериментальных гломерулярных
заболеваниях. Наконец, следует отметить, что
низкобелковая диета, которая улучшает гломе-
рулярную гемодинамику и снижает клубочко-
вое внутрикапиллярное давление у крыс, так-
же специфически редуцирует синтез в мезан-
гиальных клетках мРНК для ренина и ТФР/?.
Таким образом, гемодинамические послед-
ствия гломерулярной гипертрофии, вызванной
потерей почечной массы, тесно переплетают-
ся с механизмами продолжающегося в почках
воспаления и фиброза через взаимодействие
А-П, ТФР/? и других факторов роста. Механиз-
мы адаптации к потере почечной массы могут
стимулировать выработку и действовать совме-
стно с факторами, способствующими развитию
фиброза.
Тубулоинтерстициальный склероз: роль в про-
грессировании нефрита. Постоянная черта про-
теинурических форм нефрита — наличие од-
новременно с клубочковым и тубулоинтерсти-
циального воспаления. До последнего времени
оставалось неясным — является ли это реакцией
на ишемическую облитерацию перитубулярных
капилляров, которая развивается вслед за скле-
розированием клубочков, или же альбумин и
другие белки, накапливаясь в просвете каналь-
цев, действительно могут вызывать воспаление
интерстиция. В последние годы установлено, что
выраженная и длительная протеинурия действу-
ет на интерстиций как внутренний токсин, так
как реабсорбция профильтрованных белков
активирует эпителий проксимальных канальцев
[Remuzzi G. et al., 1997].
Эпителиальные клетки почечных канальцев,
активно участвуя в клубочковом и тубулоинтер-
стициальном повреждении, играют централь-
228
ную роль в прогрессировании почечного про-
цесса. Установлены две причины, вовлекающие
эти клетки в прогрессирование первичных гло-
мерулярных заболеваний.
Прежде всего цитокины, продуцируемые
клетками, инфильтрирующими почечные клу-
бочки, могут в области рукоятки диффундиро-
вать в тубулоинтерстициальное пространство,
где стимулируют синтез тубулярными клетка-
ми хемокинов, таких как МСР-1 (макрофагаль-
ный хемотаксический протеин-1). В свою оче-
редь эти факторы вызывают развитие и распро-
странение в интерстиции воспалительного ин-
фильтрата [Lan H.Y. et al., 1991].
Вторая причина связана с повреждающим
действием стойкой протеинурии на прокси-
мальные тубулярные клетки [Burton С., Harris
К.Р.С., 1996]. В этом случае выраженная реаб-
сорбция белка клетками проксимальных каналь-
цев активирует лизосомальную ферментную
переработку и антигенное представление бел-
ковых молекул с последующей активацией Т-
клеток хелперов. Помимо этого, активация ту-
булярных клеток в ответ на белковую перегрузку
приводит к стимуляции генов воспалительных
и вазоактивных веществ, таких как провоспа-
лительные цитокины, МСР-1 и эндотелины.
Эти вещества, синтезируемые в большом ко-
личестве, секретируются через базальные отде-
лы тубулярных клеток и, привлекая другие вос-
палительные клетки, способствуют воспали-
тельной интерстициальной реакции, которая
при большинстве форм гломерулонефрита ча-
сто предшествует развитию нефросклероза
[Remuzzi G. et al., 1997].
Большое число гормональных медиаторов и
фиброгенных цитокинов вырабатывается клет-
ками канальцев и играет важную роль в про-
грессировании почечного повреждения. Эти ме-
диаторы включают в себя ангиотензин II, эн-
дотелии, оксид азота, ТФР/?, ТцФР, оФРФ и
остеопонтин [Addy А.А., 1996].
ТФР/? остается наиболее важным фиброген-
ным цитокином, так как он усиливает синтез
и подавляет разрушение матрикса, являясь
сильным хемоаттрактантом для моноцитов и
фибробластов. Главным источником продукции
ТФР/? при интерстициальном воспалении, ви-
димо, являются интерстициальные и тубуляр-
ные клетки [Border W. A., Noble N. А., 1994].
ТцФР также обладает фиброгенным действи-
ем и подобно ТФР/? может трансформировать
интерстициальные фибробласты в миофибро-
бласты, выявляемые как интерстициальные
клетки, экспрессирующие а-актин клеток глад-
кой мускулатуры. Интерстициальные фибробла-
сты, помимо традиционно присутствующих в
этой области, могут иметь и другое происхож-
дение [Schena F.P., 1999]:
• тубулярные клетки, мигрирующие в почеч-
ный интерстиций, в местах повреждения
дифференцируются и превращаются в фиб-
робласты;
• периваскулярные клетки мигрируют в интер-
стиций и превращаются в фибробласты.
Ангиотензин II также вырабатывается тубу-
лярными клетками; он стимулирует продукцию
ТФР/? в почечных тубулярных клетках и вызы-
вает экспрессию ТФР/3 в фибробластах. Нако-
нец, еще одним фиброгенным медиатором яв-
ляется эндотелии-1, который, помимо других
резидентных клеток, экспрессируется клетками
проксимальных и дистальных канальцев. Он
способен стимулировать пролиферацию фиб-
робластов почек человека и усиливать в фиб-
робластах синтез коллагена [Schena F.P., 1999].
9.4.2. Гемодинамические и метаболи-
ческие механизмы прогрессирования
гломерулонефрита*
Замедление или предотвращение прогрессиро-
вания хронических заболеваний почек представ-
ляет собой одну из серьезнейших проблем со-
временной нефрологии. Развитие подавляюще-
го большинства хронических болезней почек
сопровождается потерей функционирующих
нефронов, снижением почечных функций и
развитием почечной недостаточности.
Среди неиммунных механизмов прогрессирова-
ния клубочковых поражений в первую очередь вы-
деляют гемодинамические (системная и внут-
рипочечная гипертензия) и метаболические на-
рушения.
При гломерулонефритах (ГН) почечные
клубочки, сохранившиеся после начального
повреждения, подвергаются адаптивным изме-
нениям для компенсации потери функциони-
рующей почечной массы, которые характери-
зуются гиперфункцией сохранившихся клубоч-
ков и их структурной гипертрофией. Адаптив-
ное повышение функций почечных клубочков
сопряжено с нарушением внутрипочечной ге-
модинамики, а именно с усилением перфузии
оставшихся нефронов, с развитием внутриклу-
бочковой гипертензии и гиперфильтрации.
Гипотеза о роли внутриклубочковой гипер-
тензии, как ведущего фактора неиммунного
поражения почек при первичных гломерулопа-
тиях, впервые была выдвинута группой амери-
канских исследователей во главе с В.Brenner в
начале 80-х годов [Brenner В.М. et al., 1982] и
* Раздел написан И.Е.Тареевой, И.М.Кутыриной,
Н. И. Неверовым.
подтверждена экспериментальными исследова-
ниями на крысах с субтотальной нефрэктоми-
ей. Было установлено, что повышенное давле-
ние внутри клубочковых капилляров передает-
ся на мезангий, что приводит к пролиферации
мезангиальных клеток и гиперпродукции мезан-
гиального матрикса. Одновременно длительно
существующая внутриклубочковая гипертензия
сопровождается нарушением порозности ба-
зальной мембраны капилляров (БМК) клубоч-
ков, что делает их проницаемыми для макро-
молекул белков, липидов и других компонен-
тов плазмы. Проникая через БМК, макромоле-
кулы откладываются в мезангии, стимулируя
его расширение, пролиферацию мезангиальных
клеток и гиперпродукцию мезангиального мат-
рикса, что заканчивается склерозированием
клубочка.
Считается, что таким же путем повреж-
дает почки и системная гипертен-
зия. Факт, что системная гипертензия играет
роль в повреждении почек и способствует бо-
лее быстрому прогрессированию ГН, известен
давно. Повреждение почек традиционно объяс-
няли развитием ишемии клубочков вследствие
сужения просвета прегломерулярных артерий и
артериол. Однако результаты более поздних
исследований свидетельствуют о том, что гло-
мерулосклероз развивается и в отсутствие ате-
росклеротического поражения сосудов, и на-
оборот, системная гипертония в отсутствие
внутриклубочковой гипертонии не приводит к
поражению почек, так как афферентная вазо-
констрикция защищает сосуды клубочка, сохра-
няя нормальное внутриклубочковое гидравли-
ческое давление.
В экспериментальных условиях внутриклубоч-
ковое давление измеряют прямыми методами с
помощью микропункционных исследований.
В клинических условиях прибегают к косвенным
методам — определению фильтрационной
фракции (отношение величины клубочковой
фильтрации к величине почечного плазмотока),
повышающейся при развитии клубочковой ги-
пертензии, или исследованию почечного функ-
ционального резерва (ПФР). Под ПФР понима-
ют способность почек ответить повышением
СКФ на воздействие тех или иных стимулов
(пероральной нагрузки белком, инфузии ами-
нокислот, допамина). У здоровых лиц прирост
СКФ в ответ на стимуляцию составляет 10—
60 %, что оценивается как сохранный ПФР и
отсутствие внутриклубочковой гипертензии.
Снижение СКФ или отсутствие ее динамики
в ответ на воздействие стимула указывает на ис-
тощение ПФР. Это означает, что все имею-
щиеся нефроны работают с предельной нагруз-
кой, в условиях внутриклубочковой гипер-
тензии, и дополнительная стимуляция уже не
229
тя
может повысить фильтрующую поверхность
клубочков.
Мы исследовали состояние внутрипочечной
гемодинамики с помощью ПФР после нагруз-
ки мясным белком у 151 больного хроничес-
ким ГН [Кутырина И.М. и др., 1995]. ПФР ока-
зался сниженным у 64 больных (42 %), чаще
всего у больных с гипертоническим синдромом,
при повышении уровня креатинина сыворотки,
а также при морфологически выявленном фо-
кально-сегментарном гломерулосклерозе и фиб-
ропластическом ГН. В противоположность дан-
ным, согласно которым внутриклубочковая ги-
пертензия при нефритах развивается лишь при
снижении базальной СКФ более чем на 50 %
от нормы [Chan A.Y. et aL, 1988; de Santo N.G.
et al., 1991), в нашем исследовании истощение
ПФР диагностировали на ранних стадиях забо-
левания.
В развитии внутрипочечной гипертонии
большую роль играет активация локально-по-
чечной РААС, влияющей на соотношение то-
нуса почечных артериол. В норме просвет аф-
ферентной артериолы в 2 раза шире просвета
эфферентной артериолы. В физиологических
условиях локально-почечный ангиотензин II
(AT II) модулирует КФ, вызывая изменения
тонуса преимущественно эфферентных арте-
риол, что приводит к возможности ауторегу-
ляции КФ в широком диапазоне. При заболе-
ваниях почек усиливается выработка локально-
почечного АТП, что способствует спазму эф-
ферентной артериолы, определяющему разви-
тие гломерулярной гипертензии за счет увели-
чения градиента почечного транскапиллярного
давления [Ichikawa J., Brenner В., 1984; Wolf G.,
1998].
Снижение массы почек у крысы ведет не
только к гиперфункции, но и к структурной
гипертрофии остаточных нефронов, которой
сейчас придают такое же значение в прогрес-
сировании, как и гиперфункции [Fries J.W. et
al., 1989; Daniels B.S., Hostetter Т.Н., 1990]. В
экспериментальных исследованиях установлено,
что через 2 нед после односторонней нефрэк-
томии и СКФ, и вес оставшейся почки увели-
чиваются на 40 %, а обьем клубочков — на 47,
68 и 74 % на 3-й, 5-й и 9-й неделе [Dworkin
L.D. et al., 1984]. По современным представле-
ниям, гипертрофия остаточных нефронов пред-
сказывает повреждение, которое наступит в
последующем. Так, согласно данным A.Fogo,
J.Ichikawa (1990), ФСГС развивается у тех детей
с минимальными изменениями клубочков, у
которых больше размер клубочков.
Последним этапом пути, которым клубоч-
ковая гипертензия и/или компенсаторный рост
почек приводят к повреждению клубочков и к
склерозу, в настоящее время признают новы-
230
шение напряжения сосудистой
стенки — shear-stress [Rennke H.G. et al.,1993].
В последние годы при изучении механизмов
прогрессирования нефропатий все большее
внимание привлекает к себе роль тубулоинтер-
стициальных изменений. Еще в 1958 г. Н. de
Wardener и соавт. заметили, что уровень креа-
тинина сыворотки у больных ГН больше кор-
релирует с тубулоинтерстициальными измене-
ниями, чем с клубочковыми. В течение многих
лет ведущую роль тубулоинтерстициальных из-
менений в прогрессировании ГН отстаивают
М.Я.Ратнер и соавт. (1983, 1991) и A.Bohle
(1977, 1994, 1998). По выражению Bohle, «ахил-
ловой пятой» почечной функции является не
клубочек, а постгломерулярные капилляры
[Bohle, 1998]. При этом подчеркивается, что
даже тяжелое поражение клубочков не приво-
дит к ХПН в отсутствие тубулоинтерстициаль-
ных изменений.
В повреждении канальцев и интерстиция игра-
ет роль целый ряд факторов — протеинурия
[Burton C.J., Harris К., 1996], трансферринурия
[ZagerR.A. etal., 1993], активация альтернатив-
ного пути комплемента, вызванная повышени-
ем продукции аммония в остаточных нефронах
[Nath К.A. et al., 1985, 1992] избыток образова-
ния в канальцах свободных радикалов кислоро-
да из-за повышенной метаболической нагрузки,
а также ухудшение кровоснабжения канальцев.
Определенное значение имеет повышение
отложения в интерстиции кальция в результа-
те ряда причин, в том числе эпизодической
ишемии клеток (преходящей ОПН) [Bohle А.
et al., 1977]. Однако ведущее значение
отводят повреждающей роли протеинурии.
Если ранее протеинурию рассматривали толь-
ко в качестве маркера тяжести поражения по-
чек, то в настоящее время признают, что бел-
ки, профильтровавшиеся в клубочках, оказы-
вают токсическое действие на почки, которое
способствует прогрессированию почечной не-
достаточности. При этом величина протеинурии
выступает в качестве независимого фактора
прогрессирования. Протеинурия более 1 г в
сутки [D’Amico G. et al., 1986], особенно про-
теинурия нефротического уровня (более 3,5 г в
сутки) определяет темп прогрессирования по-
чечной недостаточности [Burton С., Harris К.,
1996]. Это положение подтверждено рядом кон-
тролируемых исследований (REIN, MDRD
study, AIPRI study). В исследование REIN (The
Gisen Group, 1997) были включены 352 боль-
ных с недиабетической нефропатией с проте-
инурией больше или равной 1 г/сут и клирен-
сом креатинина 20—70 мл/(мин х 1,73 м2). Са-
мый низкий темп падения СКФ (0,16 мл/мин
в 1 мес) и самый низкий процент (7,3) транс-
формации в терминальную почечную недоста-
точность (ТПН) выявили при уровне протеи-
нурии менее 1,9 г/сут, а самый высокий темп
падения СКФ (0,70 мл/мин в 1 мес) и самый
высокий процент развития ТПН (32,5) был при
протеинурии, превышающей 3,9 г/сут.
В основе повреждающего действия протеи-
нурии лежат 2 механизма: токсическое повреж-
дение мезангиальных клеток макромолекулами
белков, профильтровавшимися через БМ ка-
пилляров и дисфункция клеток проксимальных
канальцев, развившаяся вследствие перегрузки
канальцев белками [Burton С., Harris К., 1996].
При этом было установлено, что перегрузка
канальцевых клеток профильтровавшимися бел-
ками не только структурно повреждает эти
клетки и нарушает в них метаболизм, но и
трансформирует клубочковую дисфункцию в
клеточные сигналы развития интерстициального
воспаления с вовлечением в процесс макрофа-
гов, цитокинов, остеопонтина [Abbate М. et al.,
1998]. В конечном итоге и повреждение мезан-
гия, и воспаление интерстиция приводят к
склерозированию почки.
В 1998 г. W.Kriz и соавт. предложили прин-
ципиально новую гипотезу развития
прогрессирующего поражения почек при хро-
нических гломерулопатиях. В эксперименте на
моделях гипер- и нормотензивных крыс с
ФСГС авторы повторными тщательными гисто-
морфологическими исследованиями смогли
проследить трансформацию первичного повреж-
дения почечных клубочков в тотальный нефрос-
клероз. Аналогичные гистоморфологические ис-
следования были выполнены и на аутопсийном
материале больных с ФСГС и диабетической не-
фропатией. Авторы предположили, что в осно-
ве развития нефросклероза лежит повреждение
интерстиция ультрафильтратом плазмы, т.е.
первичной мочой, которая попадает непосред-
ственно в почечный интерстиций при фильт-
рации крови через «экстратерриториальные»
клубочковые капилляры. Последние были обна-
ружены в синехиях, связывающих сосудистый
пучок с капсулой Боумена. Принципиальным
оказалось, что эти капилляры продолжали
фильтровать мочу. Первичная моча, качествен-
но отличная от содержимого капилляров интер-
стиция, попав непосредственно в интерстиций,
осумковывается в нем, затем приводит к раз-
витию дегенеративных изменений почечных
канальцев, их коллапсу, интерстициальному
фиброзу и последующему развитию тотально-
го склероза почек.
Участие вазоактивных гормонов в прогрессиро-
вании ГН, как правило, связывают с активностью
не только системной, но и в большей степени
локально-почечной ренин-ангиотензиновой сис-
темы (РАС), с гормонами эндотелия — эндоте-
лином и эндотелиальным релаксирующим факто-
ром (или оксидом азота), а также с активностью
почечной симпатической нервной системы.
Роль ренин-ангиотензиновой системы в про-
грессировании почечных заболеваний опреде-
ляется почечными воздействиями основного
гормона этой системы — ангиотензина II (АТП).
Установлено, что концентрация AT II в ткани
почек превышает его концентрацию в сыворот-
ке крови более чем в 1000 раз [Seikaly M.G. et
al., 1990]. Свои воздействия AT II реализует пре-
имущественно через АТ. и в меньшей степени
через АТ,-рецепторы. Доказана многофактор-
ность патологических воздействий почечного
АТП при ГН: за счет модуляции тонуса при-
носящей и выносящей артериол он вызывает
развитие внутриклубочковой гипертензии и од-
новременно выступает как мощный фактор
роста. Помимо прямого стимулирующего влия-
ния на рост и пролиферацию мезангиальных
клеток и эпителиальных клеток почечных ка-
нальцев, он действует на паракринном и ауток-
ринном уровне через стимулированную им
продукцию факторов роста, в их числе транс-
формирующего фактора роста — /3, -тромбоци-
тарного фактора роста, интерлейкина-6 и дру-
гих факторов роста, которые вызывают гипер-
трофию и пролиферацию мезангиальных кле-
ток и усиленную продукцию мезангиального
матрикса [Egido J., 1996; Wolf G., 1998]. Разви-
тию гломерулосклероза также способствует
свойство АТП стимулировать фиброгенез пря-
мо и благодаря действию трансформирующего
фактора роста — /?г В итоге сочетанное воздей-
ствие АТП на внутригломерулярную гемодина-
мику почек и негемодинамические свойства
гормона провоцирует развитие необратимых
структурных изменений в клубочках почек и
почечных канальцах, что в конечном итоге
вызывает гломерулосклероз и тубулоинтерсти-
циальный фиброз.
В последние годы большую роль при прогрес-
сировании ГН отводят вазоактивным гормонам
эндотелия — эндотелину-1 и эндотелиальному
релаксирующему фактору — оксиду азота (NO).
В почках эндотелии-1 и NO продуцируются эн-
дотелиальными клетками клубочков и каналь-
цев. Роль эндотелина-1 и NO в прогрессирова-
нии нефропатий рассматривают в первую оче-
редь с позиций их воздействия на почечную ге-
модинамику. Активация синтеза эндотелина-1
или экзогенное его введение сопровождается
выраженной вазоконстрикцией почечных сосу-
дов, что способствует снижению почечного
кровотока и СКФ и ишемическому поврежде-
нию почек. В противоположность эндотелину-1
активация синтеза NO, в том числе и в ответ
231
на добавление L-аргинина, расширяет почеч-
ные сосуды [Aiello S. et al., 1998]. Показано, что
у больных с умеренной и тяжелой почечной не-
достаточностью суточная экскреция NO значи-
тельно снижена, а продукция эндотелина-1
резко повышена. Лечение, направленное на
повышение образования NO (добавление L-
аргинина) или введение селективных антагони-
стов рецепторов эндотелина-1, вызывало замед-
ление прогрессирования почечной недостаточ-
ности [Blum М. et al., 1998; Aiello S. et al., 1998].
В последние годы появились новые данные,
свидетельствующие о действии гормонов эндо-
телия на культуру почечных клеток. Установле-
на способность NO ингибировать пролифера-
цию мезангиальных и гладкомышечных клеток,
а эндотелина-1 их стимулировать [Blum М. et al.,
1998]. Подобно AT II эндотелии-1 стали рас-
сматривать в качестве фактора роста, который
способствует усилению продукции вещества
матрикса клетками мезангия, эпителия и фиб-
робластами и ведет к развитию гломерулоскле-
роза [Egido J., 1996].
Роль почечных катехоламинов в прогресси-
ровании ГН находится в стадии изучения.
В настоящее время доказано, что катехолами-
ны почечного происхождения вызывают гене-
рализованный спазм почечных артериол, сни-
жают гидравлическое давление в клубочке по-
чек и уменьшают коэффициент ультрафильтра-
ции [Insel P.F., Snnavely M.D., 1989]. В экспе-
рименте установлено, что длительная стимуля-
ция симпатических почечных нервов или добав-
ление в среду высоких концентраций адрена-
лина вызывает уменьшение размеров почечных
клубочков. Выявленные изменения связывают с
воздействием почечных катехоламинов на по-
доциты [Pavenstadt, 1998], которым в последние
годы отводят существенную роль в прогресси-
ровании почечных заболеваний [Kriz W., 1997].
Полученные в эксперименте данные об умень-
шении зоны клубочковых и тубулоинтерстициаль-
ных повреждений при введении моксонидина —
препарата, блокирующего выработку катехола-
минов симпатическими нервами [Amann К.
et al., 1996], подтверждают высказанную гипо-
тезу.
Среди метаболических нарушений большое
внимание уделяют липидным сдвигам, особен-
но часто наблюдающимся у больных хроничес-
ким ГН с нефротическим синдромом (НС).
Н.И.Неверов и соавт. (1991) считают, что ос-
новной тенденцией изменений содержания
липидов в крови при ХГН является увеличение
содержания триглицеридов, общего холестери-
на, липопротеинов низкой плотности (ЛПНП),
апопротеина В, неэстерифицированных жирных
кислот, а также увеличение коэффициента
атерогенности. Эти сдвиги более выражены при
232
НС, но возможны у больных без НС, особен-
но при артериальной гипертензии.
Еще в 1913 г. Munk предположил, что нефро-
тическая гиперлипидемия, сочетающаяся с ли-
пидными депозитами в почках, принимает уча-
стие в развитии болезни почек, которую он
назвал липоидным нефрозом, но все же о роли
липидов в прогрессировании поражения почек
заговорили лишь в последние 10—15 лет. В 1982 г.
J. Moorhead и соавт. выдвинули теорию о нефро-
токсическом действии липидов. В последующие
годы появились работы, подтвердившие роль
липидов в развитии и прогрессировании пора-
жения почек [Bernard D.B., 1988; Keane W. et
al., 1988].
В экспериментах было доказано, что различ-
ные модели гиперлипидемии могут сочетаться
с гломерулосклерозом и прогрессирующим
повреждением почек. Чаще всего в эксперимен-
тальных условиях гиперхолестеринемию вызы-
вают, применяя высокохолестериновую диету.
При этом у разных животных параллельно с ги-
перхолестеринемией развивается и умеренный
гломерулосклероз [Keane W. et al., 1989]; сте-
пень клубочкового поражения в целом корре-
лирует с содержанием холестерина сыворотки.
Выраженность клубочкового поражения, выз-
ванного гиперхолестеринемической диетой, в
нормальных почках невелика, однако наличие
предсуществующей клубочковой болезни, сни-
жение числа нефронов или гипертония увели-
чивают распространенность и тяжесть гломеру-
лосклероза.
Аналогичны и клинические наблюдения.
Некоторые нарушения обмена липидов у чело-
века четко сочетаются с развитием спонтанно-
го поражения клубочков. Поражение почек с
ХПН может возникать при накоплении сфин-
голипидов в почках при болезни Фабри, а так-
же при дефиците лецитин-холестерол-ацетил-
трансферазы, когда в клубочках откладывают-
ся аномальные большие липопротеины. Недав-
но в Японии описана липопротеиновая нефро-
патия, характеризующаяся повышенным уров-
нем апоЕ и наличием липопротеиновых тром-
бов в клубочках.
Результаты ряда исследований, проведенных
в 80—90-е годы, позволяют предположить, что
ведущим фактором повреждающего действия
липидов на почки является обусловленное ги-
перлипидемией отложение липидов в структу-
рах почки. Установлено, что гиперхолестерино-
вая диета у экспериментальных животных со-
провождается накоплением холестериновых
кристаллов в клубочках, а также увеличением
мезангиального матрикса, гиперклеточностью
мезангия и моноцитарной инфильтрацией.
Особое значение стали придавать отложению
в почках ЛПНП и аполипопротеинов В и Е, об-
наруживаемых при нефропатиях значительно
чаще, чем ранее предполагали. Депозиты апо-
липопротеинов являются маркером липоидоза
почечной ткани, так же как и пенистые клет-
ки, основной причиной образования которых
считается нефротическая гиперхолестеринемия.
Внутриклубочковые пенистые клетки появляют-
ся в результате захвата ЛПНП мезангиальны-
ми клетками или макрофагами моноцитарного
происхождения; интерстициальные пенистые
клетки могут образовываться из эпителия ка-
нальцев, захватывая избыток фильтрующихся
из крови липидов эпителиальными клетками,
которые проникают в интерстиций, где они
фагоцитируются гистиоцитами.
Мы исследовали у 227 больных хроническим
ГН в ткани почек, полученной при биопсии,
отложения липидов, а также АпоВ и АпоЕ ме-
тодом электронной и иммуноэлектронной мик-
роскопии [Неверов Н.И. и др., 1991]. Внутри-
клеточные липидные включения выявляли в
мезангиальных клетках и подоцитах, при не-
фротическом и смешанном ГН (соответствен-
но у 80 и 86,7 % больных) — чаще всего мел-
кие и крупные, единичные и множественные,
нередко с образованием пенистых клеток, а при
латентном и гипертоническом ХГН — реже
(соответственно 62,5 и 77,8 % больных) и толь-
ко мелкие. Депозиты АпоВ также чаще обнару-
живались при смешанном и нефротическом ГН
(в 70,6 и 77,4 % случаев), а при латентном
ГН — значительно реже (в 20 %). Как липид-
ные включения, так и депозиты АпоВ были за-
фиксированы значительно чаще у больных с
невоспалительными нефропатиями (минималь-
ные изменения, мембранозная нефропатия и
ФСГС). Депозиты АпоЕ в почечной ткани были
выявлены только у больных с НС. Липидоген-
ные морфологические включения сочетались с
маркерами, свидетельствующими об увеличе-
нии риска развития склероза (утолщение ГБМ,
экспансия мезангиального матрикса) и с мор-
фологическими критериями, подтверждающи-
ми склеротические изменения почечной тка-
ни — накопление коллагена 4-го типа и появ-
ление в клубочке интерстициальных коллагенов
1-го и 3-го типов.
Изучая эти проблемы, ряд исследователей
[Bernard D.B., 1988; Keane W.F. et al., 1988]
обратили внимание на структурное сходство
мезангиальных клеток с гладкомышечными
клетками артерий, что позволило сблизить гло-
мерулосклероз с атеросклерозом и прийти к
выводу, что, как и при атеросклерозе, накоп-
ление липидов в почечной ткани индуцирует
склерозирование. Ключевым моментом отложе-
ния липидов в почках считают способность
мезангиальных клеток прямо контактировать с
циркулирующими липопротеинами, так как
мезангий клубочка отделен от просвета капил-
ляра только эндотелием без БМ. ЛПНП инду-
цируют пролиферацию мезангиальных клеток,
а также, изменяя оборот мезангиального мат-
рикса, могут влиять на сосудистый тонус. На-
конец, ЛПНП, окисленные мезангиальными
клетками, обладают еще более выраженным
повреждающим действием, как это предпола-
гается при атеросклерозе.
С липидогенными воздействиями на ткань
почки тесно связаны свободно-радикальные (СР)
процессы и перекисное окисление липидов (ПОЛ).
Внимание к этим процессам в нефрологии
обусловлено их связью с воспалением и дест-
рукцией цитомембран. Одним из источников
реактивных продуктов кислорода являются ин-
терстициальные макрофаги, обязательно при-
сутствующие при прогрессирующей болезни
почек. Причиной увеличения интенсивности
свободно-радикального окисления может быть
также высвобождение железа из трансферрина,
попадающего в мочу в условиях протеинурии
[Alfrey А.С., 1989]. Связывание железа с транс-
феррином зависит от pH, который по ходу
нефрона снижается, при этом железо высво-
бождается из трансферрина и становится дос-
тупным для катализированных окислительных
реакций на поверхности эпителия или внутри-
клеточно. Наконец, избыток активных продук-
тов кислорода может образовываться вследствие
метаболической адаптации остаточных нефро-
нов к потере почечной массы. Nath и соавт.
(1992) предполагают, что метаболическая на-
грузка на остаточные нефроны вслед за поте-
рей массы почек заставляет их потреблять боль-
ше кислорода, что приводит к повышенному
образованию реактивных продуктов кислорода.
В эксперименте они вызывали длительное
(в течение 14 нед) ухудшение антиоксидантной
защиты у крыс диетой с дефицитом селения
(кофактор глютатион-пероксидазы, основного
фермента, разрушающего перекись водорода)
и витамина Е (основного антиоксиданта липид-
ных слоев), способствующей накоплению пе-
рекиси водорода; другая группа крыс была на
такой же диете, но без дефицита витамина Е
и селения. У крыс на дефицитной диете вес
почки повышался быстрее, чем у контрольных,
несмотря на то что общий прирост веса был
ниже, чем в контрольной группе; отношение
веса почек к весу тела увеличивалось на 50 %
к 9-й, 11-й и 14-й неделе. У подопытных крыс
протеинурия была в 2 раза больше, чем у кон-
трольных, СКФ и кровоток были значительно
ниже.
Реактивные продукты кислорода вовлечены
в патогенез многих экспериментальных моделей
ГН, особенно их роль велика при адриамици-
новом нефрозе. В клинических исследованиях ус-
233
тановлено, что хронический ГН сопровождает-
ся активацией СР процессов и накоплением
продуктов ПОЛ как в плазме, так и в мембра-
нах эритроцитов, а также снижением активно-
сти антиоксидантных ферментов в плазме и в
клетках крови. В наших наблюдениях [Неверов
Н.И. и др., 1992] во всех группах больных хро-
ническим ГН, у которых был нарушен мета-
болизм липидов и в почечной ткани выявлены
депозиты ЛПР, была достоверно увеличена
интенсивность хемилюминесценции в моче и
снижено соотношение этого показателя в сы-
воротке и моче. Интенсивность хемилюминес-
ценции сыворотки не отличалась от конт-
рольной группы, даже имела тенденцию к сни-
жению. Вероятно, это было обусловлено тем,
что значительная часть активных продуктов
кислорода терялась с мочой через поврежден-
ный клубочковый фильтр. В увеличении интен-
сивности хемилюминесценции мочи могло иг-
рать роль и местное (почечное) образование СР
с последующим их поступлением в мочу.
Среди других метаболических нарушений,
ведущих к прогрессированию клубочковых и ту-
булоинтерстициальных поражений, упомянем
лишь избыточное отложение кальция. Ряд фак-
тов указывает на его потенциальную роль в
прогрессировании как канальцевых (см. выше),
так и клубочковых поражений. Уже через 3 нед
после операции нефрэктомии в объеме 5/б со-
держание кальция в коре увеличивается вдвое,
а содержание кальция в почках больных с тер-
минальной почечной недостаточностью было в
10 раз выше, чем в почках здоровых лиц.
Внутриклеточный кальций опосредует фун-
кции мезенхимальных, эпителиальных и эндо-
телиальных клеток, являясь физиологическим
медиатором сократимости гладкомышечных и
мезангиальных клеток, пролиферации, роста и
миграции клеток, а также секреторных процес-
сов, включая секрецию белков внеклеточного
матрикса, принимая участие в продукции фак-
торов роста, простаноидов и цитокинов, акти-
вируя протеиназы и тем самым образование
оксидантов, что усиливает опосредованное ней-
трофилами повреждение клеток. Кальций играет
также важную роль в изменении внутрипочеч-
ной и клубочковой гемодинамики, определяя
ответы гладкомышечных и мезангиальных кле-
ток на вазоконстрикторы и вазодилататоры,
регулирует напряжение клубочковой стенки,
действуя в основном на уровне афферентной
артериолы.
Таким образом, на современном этапе раз-
вития медицинской науки проблема неиммун-
ного прогрессирования нефропатий представ-
ляется весьма актуальной и не до конца решен-
ной. Вместе с тем с каждым годом все глубже
становится понимание ведущих патофизиоло-
234
гических процессов неиммунного прогрессиро-
вания — внутриклубочковой гипертензии, ту-
булоинтерстициальных изменений, нефроток-
сичности липидов, роли медиаторов, выделя-
емых инфильтрирующими клубочек клетками,
в мезангиальной пролиферации и в накопле-
нии мезангиального матрикса и др. Соответ-
ственно появляются и новые методы терапев-
тического воздействия — ингибиторы АПФ,
ингибиторы рецепторов к АТП, уменьшающие
внутриклубочковую гипертензию, гиполипиде-
мические препараты, уменьшающие отложение
липидов в почках, моноклональные антитела,
направленные против отдельных цитокинов.
Можно надеяться, что в ближайшем десятиле-
тии нефрологи вплотную приблизятся к реше-
нию этой проблемы.
9.4.3. Коагуляционные механизмы
прогрессирования нефрита*
Механизмы гемостаза участвуют в развитии и
прогрессировании нефрита через локальную
внутрисосудистую коагуляцию крови с образо-
ванием тромбов в клубочковых капиллярах,
отложением в них фибрина и последующим
склерозированием клубочков.
I. Основные механизмы коагуляции и фибри-
нолиза. Поддержание гемостаза — одна из важ-
нейших функций организма, обеспечивающая,
с одной стороны, сохранение крови в жидком
состоянии, а с другой — предупреждение и
остановку кровотечения. Взаимодействие меж-
ду этими процессами координируют нервная и
эндокринная система, а также локальные ме-
ханизмы регуляции гемостаза. Традиционно в
системе гемостаза выделяют сосудисто-тромбо-
цитарное и плазменное звенья, функциониру-
ющие в тесной взаимосвязи друг с другом.
Эндотелий — основной функциональный
компонент сосудистой стенки, обладающий
сложной, сбалансированной системой поддер-
жания гемостатического гомеостаза. В физио-
логических условиях это обусловлено синте-
зом эндотелиальными клетками (в меньшей
степени другими структурами сосудистой
стенки) факторов, одни из которых предуп-
реждают адгезию и агрегацию тромбоцитов,
другие инактивируют появляющиеся в про-
цессе жизнедеятельности организма малые
количества тромбина и активированных фак-
торов свертывания, препятствуя тем самым
тромбообразованию; третьи активируют фиб-
ринолиз, что ведет к растворению образую-
щегося фибрина.
* Раздел написан И.Н.Бобковой, Л.В.Козловской.
Антитромбогенные факторы сосудистой стенки
Факторы
Антиагреганты:
Отрицательный заряд
внутренней поверхнос-
ти эндотелия (гепа-
рансульфат, дерматан-
сульфат и другие гли-
козаминогликаны)
простациклин (PGI2)
оксид азота (NO)
Антикоагулянты:
антитромбин III
(ATIII)
о<2-макроглобулин
Функция
Препятствует адгезии и агре-
гации тромбоцитов
Ингибиторы агрегации тром-
боцитов, вазодилататоры
гепарансульфат
тромбомодулин
Ингибитор тромбина Ха,
IXa, Xia, ХПа, калликреина
Ингибитор тромбина, кал-
ликреина
Вместе с ATIII ингибирует
тромбин
Кофактор активации систе-
мы протеин С-S, активиру-
ющей фибринолиз
Активаторы фибрино-
лиза:
активатор плазмино-
гена
Способствует образованию
плазмина, растворяющего
фибрин
При повреждении стенки сосудов включают-
ся механизмы, направленные на восстановле-
ние ее целости. Из нее высвобождаются факто-
ры, инициирующие тромбоцитарные функции,
активирующие свертывание крови, тормозящие
фибринолиз.
Прокоагулянтные и проагрегантные факторы
сосудистой стенки
Происходит адгезия тромбоцитов к повреж-
денному участку сосудистой стенки через вза-
имодействие с компонентами обнаженного су-
бэндотелия. Связующим звеном между тромбо-
цитами и субэндотелием является фактор Вил-
лебранда, выделяющийся из эндотелиальных
клеток, в меньшей степени из тромбоцитов.
В процессе адгезии тромбоциты из дисковид-
ной формы превращаются в шиповидно-сфери-
ческую, что способствует их контакту друг с
другом и другими структурами. Агрегация тром-
боцитов у места повреждения стенки сосудов
начинается со взаимодействия специфических
рецепторов мембраны тромбоцитов с индукто-
рами агрегации (коллаген, АДФ, тромбин,
катехоламины, фактор активации тромбоцитов
и др.). Это взаимодействие активирует арахидо-
новый каскад тромбоцитов с образованием
мощного индуктора агрегации — тромбоксана
А2. Под влиянием тромбоксана А2 тромбоциты
сокращаются, становятся липкими, взаимодей-
ствуют друг с другом, что ведет к реакции их
освобождения (секреции). Биологически актив-
ные вещества, выделяемые в кровь в реакции
освобождения из различных гранул тромбоци-
тов, ускоряют рост тромбоцитарного тромба и
активируют свертывание крови посредством
освобождения из тромбоцитов прокоагулянтов
и предоставления фосфолипидов, на поверхно-
сти которых образуется протромбиназа.
Тромбоцитарные факторы, принимающие
участие в гемостазе
Фактор Функция
Фактор Функция
Коллаген Активатор фактора XII, ин- дуктор агрегации тромбоцитов
АДФ Индуктор агрегации тромбо- цитов
Фактор Виллебранда Участие в адгезии и агрега- ции тромбоцитов
Тканевый тромбоплас- тин (фактор III) Участие в образовании про- тромбиназы по «внешнему» механизму
Фибринстабилизирую- щий фактор (фактор XIII) Превращает растворимый фибрин S в нерастворимый фибрин I
Ингибиторы актива- торов плазминогена (ПАИ-1, ПАИ-2) Ингибируют действие акти- ваторов плазминогена, пре- пятствуют образованию плазмина
Фибронектин Участие в адгезии тромбоци- тов, межклеточных взаимо- действиях
АДФ
Тромбоксан А2
Серотонин
/З-Тромбоглобулин
Фактор Виллебранда
Фактор 1
Фактор 2
Фактор 3 (тромбоци-
тарный тромбопластин)
Фактор 4 (антигепари-
новый фактор)
Фактор 5 (тромбоци-
тарный фибриноген)
Фактор 7 (тромбасте-
нии)
Тромбоцитарный фак-
тор роста
Индуктор агрегации
Индуктор агрегации, вазо-
констриктор
Индуктор агрегации, ло-
кальный вазоконстриктор
Индуктор агрегации, инги-
битор простациклина
Участие в адгезии и агрега-
ции
Ускоряет превращение про-
тромбина в тромбин
Ускоряет превращение фиб-
риногена в фибрин
Участвует в образовании
протромбиназы
Инактивирует гепарансуль-
фат эндотелиальных клеток
Индуктор агрегации
Сокращение тромбоцитов,
ретракция тромба
Стимулятор освобождения
простациклина, индуктор
пролиферации гладкомы-
шечных клеток
235
Фибринстабилизирую-
щий
Фибронектин
Активатор плазмино-
гена (АП)
Плазминогенового ак-
тиватора ингибитор
(ПАИ)
Тромбоцитарные анти-
плазмины
Лизосомальные фер-
менты
Превращает фибрин S в
факторфибрин I
Участвует в межтромбоци-
тарных взаимодействиях
Активатор фибринолиза
Ингибитор фибринолиза
Ингибиторы фибринолиза
Разрушение тромбоцитарных
агрегатов
Коагуляционный гемостаз, функционируя в
тесной связи с сосудисто-тромбоцитарным ге-
мостазом, включает многоэтапный каскадный
ферментативный процесс, в ходе которого про-
коагулянты превращаются в активные факторы
свертывания. Процесс свертывания крови состо-
ит из нескольких последовательных фаз: обра-
зование протромб иназы, тромбина и фибрина
(кровяного сгустка), ретракции кровяного сгу-
стка. Активация коагуляционного каскада мо-
жет осуществляться двумя взаимосвязанными
механизмами образования протромбиназы —
внешним (при повреждении тканей и контак-
те тканевого тромбопластина со свертывающи-
ми факторами) и внутренним (при поврежде-
нии эндотелия сосудистой стенки). Протромби-
наза — комплекс, в который входят фермент —
фактор Ха, его кофактор — фактор Va, ионы
кальция и фосфолипиды. Под влиянием про-
громбиназы происходит превращение протром-
бина (фактор II) в тромбин. Тромбин играет
ключевую роль в гемостазе. Первые порции
тромбина, образовавшиеся при активации
внешнего и внутреннего механизма гемостаза,
еще недостаточные для образования фибрина,
резко ускоряют агрегацию тромбоцитов, уси-
ливают освобождение из них факторов, способ-
ствующих росту и уплотнению тромбоцитарного
тромба. В больших дозах тромбин ускоряет свер-
тывание крови, активируя факторы коагуляции
VIII, VII, V, ингибируя активатор плазмино-
гена. На заключительном этапе свертывания
крови тромбин преобразует фибриноген в фиб-
рин и активирует фактор XIII, принимающий
участие в образовании стабилизированного
фибрина, укрепляющего тромбоцитарный
тромб. Одновременно с активацией свертыва-
ния крови тромбин запускает противосверты-
вающие механизмы (стимулирует выделение
простациклина, отщепляет от протромбина
ингибитор фактора Ха, активирует систему
протеин S-С и др.), что позволяет локализо-
вать свертывание крови местом повреждения.
Помимо участия в механизмах гемостаза, тром-
бин, фиксируясь на эндотелиальной выстилке
сосудов, стимулирует размножение фибробла-
стов, активирует процесс разрастания клеток,
индуцируемый факторами роста. Ретракция
кровяного сгустка — уменьшение объема тромба
с выделением сыворотки — происходит при
участии контрактильных белков тромбоцитов и
является заключительным этапом формирова-
ния тромба.
Свертывание крови в здоровом организме
сопровождается одновременным повышением
ее фибринолитической активности. Фибрино-
лиз — ферментативное расщепление фибрино-
вых волокон на растворимые фрагменты, ко-
торые в последующем удаляются из сосудисто-
го русла, предупреждая блокаду кровеносных
сосудов тромбами. Этот процесс осуществляет-
ся плазмином, образуемым из плазминогена.
Фибринолиз, как и коагуляция, активируется
двумя путями: активация по внешнему пути
обусловлена поступлением в сосудистое русло
активаторов плазминогена, освобождающихся
из эндотелия при стазе крови, тканевой гипок-
сии, болевом раздражении, стрессе, активации
протеина С и других воздействиях. Пусковым
механизмом активации фибринолитической си-
стемы по внутреннему пути является возника-
ющая при контакте с поврежденной сосудис-
той стенкой активация фактора XII при учас-
тии калликреина и высокомолекулярного ки-
ниногена. Компоненты фибринолитической
системы крови представлены ниже.
Компоненты фибринолитической системы крови
Фактор
Функция
Плазминоген
Активаторы плазминогена
(АП):
тканевый (тАП)
урокиназа (уАП)
фибринолиз, зависи-
мый от фактора XII
Физиологические ингиби-
торы фибринолиза:
ингибиторы АП (ПАИ)
антиплазмины (<х2-мак-
роглобулин, <х2-анти-
плазмин, а -антитрип-
син, С,-ингибитор и др.)
Плазмин
Превращается в плазмин
Активируют превращение
плазминогена в плазмин
Ингибируют действие АП,
тормозят превращение
плазминогена в плазмин
Ингибируют действие плаз-
мина
Растворяет фибрин
Помимо ферментативного фибринолиза,
существует неферментативный, связанный с
гепарином, который вступает в комплексные
соединения с тромбином, фибриногеном, ан-
типлазминами, фактором XIII и др. Эти соеди-
нения обладают способностью лизировать фиб-
рин S, ингибировать полимеризацию фибрин-
мономера и стабилизацию фибрина фактором
XIII.
236
Нарушения сосудисто-тромбоцитарного ге-
мостаза играют важную роль в механизмах раз-
вития и прогрессирования нефрита.
II. Коагуляционные механизмы прогрессирова-
ния нефрита. Внимание исследователей к изу-
чению нарушений коагуляции при нефрите
возросло после того, как в 60-х годах впервые
P.Vassalli и R.Mac Cluskey в эксперименте,
Р.Kincaid-Smith в биоптате почек больных с
различными формами ГН обнаружили отложе-
ния фибрина в капиллярах клубочков и пред-
положили, что локальная внутрисосудистая
коагуляция способствует прогрессированию
поражения почек. В проведенном исследовании
биопсий почек 92 больных, наблюдавшихся в
клинике им. Е.М.Тареева, внутригломерулярные
депозиты фибрина были зафиксированы у 75%
пациентов с прогрессирующим течением не-
фрита и только у 32 % пациентов с латентной
его формой [Варшавский В.А. и др., 1980]. С
высокой частотой морфологические признаки
внутрисосудистой коагуляции выявляют при
волчаночном нефрите (ВН). К.Kant и соавт.
(1985) на материале повторных биопсий почек
больных ВН установили, что внутригломеруляр-
ный тромбоз предшествует развитию почечной
недостаточности. V.Pollak (1991) считает основ-
ным критерием неблагоприятного прогноза при
ВН именно субэндотелиальные отложения фиб-
рина, а не другие признаки активности почеч-
ного процесса (клеточные полулуния, субэндо-
телиальные иммунные депозиты). Образовав-
шийся при локальной внутрисосудистой коагу-
ляции фибрин стимулирует пролиферацию эн-
дотелиальных и мезангиальных клеток, ухудша-
ет микроциркуляцию в клубочках, приводит к
редукции капиллярного русла за счет замеще-
ния его участками гиалина и полями склеро-
за, т.е. является реальным фактором прогрес-
сирования нефрита с исходом в ХПН. О зна-
чении коагуляционных нарушений в прогрес-
сировании нефрита свидетельствуют и резуль-
таты проведенных экспериментальных и клини-
ческих работ о свойствах гепарина, антиагре-
гантов, подавляющих процессы внутрисосуди-
стой коагуляции, тормозить развитие нефрита
[Nequid A. et al., 1998].
Механизмы, приводящие к внутрисосудис-
той коагуляции с последующим образованием
тромбов и отложением фибрина в клубочках
почек при нефрите включают в себя наруше-
ния пристеночных эффектов эндотелия, акти-
вацию тромбоцитарного и плазменного звень-
ев гемостаза, дисфункцию фибринолиза.
Среди инициальных (запускающих) факто-
ров рассматривают отложение циркулирующих
иммунных комплексов или образование их in
situ, компоненты системы комплемента через
XII фактор, микробные эндотоксины, ткане-
вый фактор, выделяемый при повреждении
тканей, тромбоцитарные факторы, кинины,
простагландины. При включении неиммунных
гемодинамических механизмов прогрессирова-
ния нефрита в условиях повышенного внутри-
гломерулярного давления важное значение в
тромбо(фибро) генезе в клубочках почек приоб-
ретает повреждающее действие ударной волны
потока крови на эндотелий (shear stress)
[Rennke Н. et al., 1994]. Вероятно, почки боль-
ше, чем другие органы, зависят от состояния
эндотелия, так как в клубочковых капиллярах
(в почках имеется до 2—2,5 млн сосудистых
клубочков, в каждом из которых около 50 ка-
пиллярных петель) имеется почти ‘/3 всего
сосудистого эндотелия, содержащегося в орга-
низме.
Активации и/или повреждению эндотелия от-
водят центральное место во внутрисосудистом
тромбообразовании при нефрите. На экспери-
ментальных моделях нефрита было показано,
что ультраструктурные и функциональные при-
знаки повреждения эндотелия предшествуют
образованию микротромбов в клубочках почек.
Становясь мишенью действия иммунных ком-
плексов, цитокинов и других медиаторов вос-
паления, эндотелиальные клетки сами проду-
цируют факторы, которые потенцируют иммун-
ный ответ, вызывая локальную адгезию лейко-
цитов к эндотелию, усиливая хемотаксис, фа-
гоцитоз, сосудистую проницаемость, пролифе-
рацию фибробластов и гладкомышечных клеток
[Neguid A. et al.,1998; Bailerman В. et al., 1998].
Одновременно происходит изменение гемоста-
тических функций сосудистого эндотелия с
утратой присущего ему свойства тромборезис-
тентности и усилением прокоагулянтных эф-
фектов, что сопровождается выделением свя-
занных с эндотелием факторов свертывания. У
больных нефритом выявляют увеличение в
плазме крови уровня фактора Виллебранда
(ФВ), ингибитора активатора плазминогена
(ПАИ) и снижение синтеза тканевого актива-
тора плазминогена (АП), оксида азота (NO),
простациклина [Козловская Л.В. и др., 1991;
Полянцева Л.Р. и др., 1994; Wiggins R. et al.,
1994]. Эти факторы рассматривают как марке-
ры повреждения и/или активации эндотелия.
Особого внимания заслуживает оценка эндоте-
лиальных факторов в моче больных нефритом.
В частности, по мере прогрессирования ВН
повышается экскреция с мочой ФВ, причем
содержание не только антигена (который мо-
жет быть представлен неактивными осколками,
попадающими в мочу из плазмы), но и круп-
ных функционально активных мультимеров ФВ,
очевидно, почечного происхождения [Бобкова
И.Н. и др., 1995]. В связи с этим персистирова-
ние высокого уровня активного ФВ в моче боль-
237
ных ВН можно рассматривать, с одной сторо-
ны, как отражение активации (повреждения)
сосудистого эндотелия клубочков почек, а с
другой — как свидетельство прогрессирования
нефрита. Другим признаком локального нару-
шения пристеночных эффектов сосудистого
эндотелия является значительное снижение в
моче активности тканевого АП и увеличение
уровня ПАИ у больных тяжелыми формами
ХГН и ВН [Бумблите И.Д. и др., 1991; Полян-
цева Л.Р. и др., 1994]. Синтезируемые внутри-
гломерулярными клетками разного типа (глав-
ным образом эндотелиальными, а также мезан-
гиальными, эпителиальными) компоненты си-
стемы АП/ПАИ влияют на интенсивность про-
цессов фибринолиза в почках. Результаты экс-
периментальных и клинических работ подтвер-
ждают значение недостаточного синтеза АП и
высокой секреции ПАИ в образовании и пер-
систировании фибриновых отложений в почках
при нефрите [Kant К. et al., 1985; Rondeau Е. et
al., 1990]. Помимо регуляции фибринолиза,
компоненты системы АП/ПАИ регулируют ин-
тенсивность накопления или деградации вне-
клеточного матрикса. Ангиотензин II, эндоте-
лии, трансформирующий фактор роста /3,
тромбоксан А2, тромбин и другие медиаторы,
образующиеся в ходе воспаления при нефри-
те, стимулируют синтез ПАИ эндотелиальны-
ми и мезангиальными клетками почек, что
приводит к замедлению расщепления плазми-
ном основных компонентов мезангиального
матрикса (протеогликанов, фибронектина, ла-
минина, коллагена IV типа) с последующим
их накоплением.
Важную роль в механизмах развития и про-
грессирования нефрита играют тромбоциты,
которые участвуют в иммуновоспалительных
реакциях и процессах коагуляции, активируясь
одновременно с сосудистым эндотелием. Взаи-
модействия активированных тромбоцитов и
секретируемых ими факторов с сосудистой
стенкой многообразны. Острые эффекты акти-
вации тромбоцитов связаны в первую очередь
с микротромбозом в капиллярах клубочков,
долговременные эффекты проявляются продук-
цией факторов роста (тромбоцитарный фактор
роста, трансформирующий фактора роста 0,
фибронектин и др.) с пролиферацией и изме-
нением метаболизма эндотелиальных, мезанги-
альных клеток, фибробластов, ведущих к про-
грессированию склероза почечной ткани
|Wiggins R. et al., 1994; Barnes J., 1997]. В наших
исследованиях признаки активации тромбоци-
тов — усиление адгезии, гиперагрегация при
стимуляции различными индукторами (АДФ,
адреналином, коллагеном, арахидоновой кис-
лотой), усиление метаболической активности (с
изменением в тромбоцитах уровня ферментов —
щелочной фосфатазы, дегидрогеназ лактата,
сукцината и а-глицерофосфата) — сопутство-
вали активным, прогностически неблагоприят-
ным формам ХГН и ВН [Мухин Н.А. и др.,
1988; Тареева И.Е. и др., 1992; Козловская Н.Л.
и др., 1994].
Активация тромбоцитов сопровождается вов-
лечением коагуляционного звена гемостаза с по-
вышением уровня фибриногена, ПДФ в плаз-
ме крови и моче, увеличением РКФМ, XIII
фактора и снижением уровня АТШ в плазме.
При этом уровень активности XIII фактора в
большей степени, чем другие показатели, кор-
релирует с прогрессирующим течением нефрита.
Выраженность гиперкоагуляционных сдвигов
крови у этих больных обусловлена в том числе
и недостаточностью фибринолиза — низкой
активностью тканевого АП и урокиназы в моче,
высокой активностью ПАИ, антиплазминов
(а2-макроглобулина, а2-антиплазмина, о^-ан-
титрипсина) и снижением уровня гепарина в
плазме [Мухин Н.А. и др., 1988; Бумблите И.Д.
и др., 1992]. Среди этих показателей снижение
активности АП в плазме крови, особенно в
моче, а также отсутствие прироста активности
после 20-минутной венозной окклюзии верхней
конечности — наиболее информативные при-
знаки неблагоприятного прогноза при ХГН и
ВН [Бобкова И.Н. и др., 1995; Andreenko G. et
al., 1988].
Локальная активация внутрисосудистого
свертывания крови на определенных этапах
может переходить в диссеминированный про-
цесс. Патофизиологической основой ДВС явля-
ется распространенное внутрисосудистое тром-
бообразование, блокирующее микроциркуля-
цию в органах, с потреблением факторов свер-
тывания и фибринолиза и последующим раз-
витием кровотечений. Однако ДВС-синдром
относится к нечастым осложнениям ХГН: сре-
ди 600 наблюдаемых в клинике им. Е.М.Тарее-
ва больных ХГН нефротического типа ДВС-
синдром зафиксирован только у 12 пациентов
(2 %) [Мухин Н.А. и др., 1988]. Чаще ДВС-син-
дром развивается при подостром ГН и пораже-
нии почек в рамках системных заболеваний —
при СКВ, синдроме Гудпасчера, геморрагичес-
ком васкулите и др. Так, клинико-лаборатор-
ные проявления ДВС (геморрагии, тромбозы,
тромбоцитопения, снижение уровня фибрино-
гена, антитромбина III, активация фибриноли-
за, увеличение в плазме крови продуктов дег-
радации фибрина) были выявлены нами у 36 %
больных быстропрогрессирующим ВН, тогда
как при менее тяжелых формах ВН (с нефро-
тическим и изолированным мочевым син-
дромом) его частота составила соответственно
13 и 5 % [Тареева И.Е. и др., 1992]. При срав-
нении двух групп больных быстропрогрессиру-
238
ющим ВН, леченных только иммунодепрессан-
тами (I группа — 14 человек), и больных, ле-
ченных также антикоагулянтами и антиагреган-
тами (II группа — 18 человек), прогноз был
лучше у больных, получающих терапию, кор-
ригирующую нарушения гемостаза. Частичное
или полное восстановление функции почек
удалось достичь у 33 % больных I группы и у
53 % больных II группы, что подтверждает важ-
ную роль коагуляционных механизмов в про-
грессировании нефрита.
В эксперименте на различных моделях про-
грессирующих заболеваний почек при исполь-
зовании прямых методов микропункций уста-
новлено, что процесс тромбообразования с
окклюзией сосудов приводит к изменению мик-
рогемореологии в клубочках почек, нарушению
окислительно-восстановительных реакций, раз-
витию синдрома капиллярно-трофической не-
достаточности, ишемии и последующему скле-
розу. У больных ХГН и ВН нарушена дефор-
мируемость эритроцитов, отмечается их гипе-
рагрегация, которая проявляется усилением
прочности эритроцитарных агрегатов, разруша-
ющихся лишь при больших скоростях [Козлов-
ская Л.В. и др., 1997]. Наиболее выраженные
реологические сдвиги, вплоть до развития ги-
перагрегационного синдрома (сладж), мы на-
блюдали именно у пациентов с прогрессирую-
щим течением ГН и ВН.
Таким образом, нарушения в системе гемо-
стаза, в основе которых лежит тромбоцитарно-
эндотелиальный механизм, тесно связанный на
ранних этапах течения нефрита с иммунным
воспалением, а на более поздних — с гемоди-
намическими сдвигами и пролиферативными
процессами в клубочках, являются реальным
фактором прогрессирования нефрита.
9.5. Клинические особенности
отдельных морфологических
форм гломерулонефрита*
9.5.1. Минимальные изменения
клубочков
Минимальные изменения клубочков (липоид-
ный нефроз) при световой микроскопии и им-
мунофлюоресцентном исследовании не выявля-
ются. Лишь электронная микроскопия обнаружи-
вает слияние ножковых отростков эпителиаль-
ных клеток (подоцитов), что и считается основ-
ной причиной протеинурии при этой форме.
Согласно одной из гипотез патогенеза основ-
ное значение имеет фактор, повышающий клу-
* Раздел написан И.Е.Тареевой.
бочковую сосудистую проницаемость, продуци-
руемый Т-лимфоцитами. Эта гипотеза была
впервые выдвинута в 1974 г. R.Shalhoub, а в
1975 г. G.Lagrue впервые выявил фактор сосу-
дистой проницаемости (лимфокин) в суперна-
танте активированных конкавалином А лимфо-
цитов больных с минимальными изменениями
клубочков; введение супернатанта внутрикож-
но морским свинкам повышало сосудистую
проницаемость. В дальнейшем было описано не-
сколько лимфокинов, усиливающих сосудистую
проницаемость, содержание которых повыше-
но у больных с минимальными изменениями
клубочков. Установлено, что такими свойства-
ми обладают интерлейкин-2 и интерлейкин-4.
В эксперименте показано, что введение реком-
бинантного ИЛ-2 крысам приводит к уменьше-
нию анионного слоя БМК и исчезновению
ножек подоцитов. Обсуждается возможная роль
ФИО, плазменной протеазы 100 KF [Cheung Р.
et al., 1996] и др.
Недавно описано очень интересное наблю-
дение, подтверждающее правомерность пред-
ставления о минимальных изменениях, как
болезни не столько почек, сколько каких-то
других тканей (лимфоцитов?), выделяющих па-
тологические цитокины. Почки 20-летнего боль-
ного с НС и минимальными изменениями клу-
бочков, погибшего от кровоизлияния в мозг,
были пересажены двум реципиентам с ТПН,
не связанной с НС; у обоих больных первое
время после трансплантации протеинурия со-
хранялась, но через 6 нед исчезла [Ali А, 1994].
Эта морфологическая форма наблюдается
чаще у детей, причем у мальчиков в 2 раза
чаще, чем у девочек, но встречается и у взрос-
лых, в том числе пожилого возраста. Так, в
наблюдениях A.Davison (1996) среди 317 боль-
ных с НС старше 60 лет у 35 (И %) были ми-
нимальные изменения клубочков.
Часто заболевание развивается после инфек-
ции верхних дыхательных путей, аллергических
реакций (пищевая аллергия, укусы насекомых,
лекарства, вакцинация) и нередко сочетается
с атопическими болезнями, аллергическими
расстройствами (астма, экзема, непереноси-
мость молока, поллинозы). Иногда предшеству-
ют и другие инфекции. Роль стрептококка не
доказана, титры антистрептококковых антител
иногда более низкие, чем у здоровых лиц. Опи-
саны отдельные случаи связи с неопластичес-
кими заболеваниями (лимфомами, раком ки-
шечника, легких и др.), но более редкие, чем
при мембранозной нефропатии. Известны се-
мейные случаи, чаще у сиблингов, что гово-
рит о возможности генетической предрасполо-
женности.
У большинства больных отмечается нефро-
тический синдром — с выраженными отеками,
239
анасаркой, массивной протеинурией, резкой
гипоальбуминемией, гиповолемией, очень вы-
раженной липидемией; у детей часто развива-
ется асцит, иногда сопровождающийся болью
в животе. При резкой гиповолемии возможно
развитие нефротического криза с болями в
животе и кожной эритемой (см. главу 7) и сер-
дечно-сосудистого шока с циркуляторной не-
достаточностью, холодными конечностями.
У детей младшего возраста «минимальные
изменения» наблюдаются в 80—90 % всех слу-
чаев НС, у подростков — в 50 %, у взрослых —
в 10—20 %. У ребенка в возрасте до 10 лет, у
которого имеется НС с селективной протеину-
рией и нет гематурии, гипертонии, азотемии
и не снижен уровень комплемента, «минималь-
ные изменения» настолько вероятны, что нет
необходимости делать биопсию почки.
Однако такой изолированный НС (в его «чи-
стом» виде) наблюдается не всегда: у 20—25 %
больных выявляют умеренную эритроцитурию,
у 10 % детей и 30—35 % взрослых — диастоли-
ческую гипертонию. В наблюдениях N.Mallick
(1996) у 47 % взрослых с минимальными из-
менениями клубочков была артериальная ги-
пертония, у 33 % — преходящая микрогемату-
рия, у 96% — гипертриглицеридемия, у 41% —
преходящая гиперурикемия; соотношение муж-
чин и женщин составляло 1:1,4.
В редких случаях развивается задержка азо-
тистых шлаков или даже ОПН, в основе кото-
рой могут быть тяжелая гиповолемия, внутри-
нефронная закупорка белковыми преципитата-
ми, выраженное спаяние подоцитов с закры-
тием щелей в базальной мембране, тяжелый
отек интерстиция, гиперкоагуляция.
СОЭ резко повышена. Во время обострений
уровень IgG обычно снижен, может быть по-
вышен уровень IgE или IgM, фибриногена.
Уровень СЗ-комплемента всегда в норме, а
иногда даже повышен.
Именно при этой форме наиболее эффек-
тивна кортикостероидная терапия, приводящая
нередко за 1 нед к исчезновению отеков. В даль-
нейшем болезнь может принимать рецидивиру-
ющее течение, с развитием стероидной зави-
симости, однако хроническая почечная недо-
статочность (ХПН) развивается редко.
Среди осложнений наиболее тяжелые —
гиповолемический шок, нефротические кризы,
тромбозы, тяжелые инфекции. В прошлом — до
применения антибиотиков и глюкокортикои-
дов — эти осложнения приводили к смерти в
первые 5 лет болезни более 60 % детей. В на-
стоящее время прогноз достаточно благоприят-
ный, несмотря на возможность рецидивов и ос-
ложнений: 5-летняя выживаемость составляет
95 % и выше.
9.5.2. Фокально-сегментарный
гломерулосклероз (ФСГС)
Морфологически характеризуется сегментарным
гломерулосклерозом (склерозируются отдельные
сегменты клубочков) части клубочков (фокаль-
ные изменения); остальные клубочки в начале
болезни интактны. При иммуногистохимичес-
ком исследовании выявляют IgM. Нередко этот
морфологический тип изменений трудно отли-
чить от «минимальных изменений» клубочка,
обсуждаются возможности перехода последних
в ФСГС. Существует мнение, разделяемое не
всеми авторами, что это разной тяжести вари-
анты или разные стадии одного и того же за-
болевания, объединяемые термином «идиопа-
тический нефротический синдром».
Как и при минимальных изменениях клубоч-
ков, при ФСГС основной патологией является
поражение эпителиальных клеток (подоцитов),
выявляемое лишь при электронной микроско-
пии, и обсуждается возможная роль тех же
факторов, ответственных и за сосудистую про-
ницаемость, и за «подоцитоз». Однако при
ФСГС изменения подоцитов, которые неспо-
собны к репликации, постепенно приводят к
развитию склероза. Подтверждением возможной
роли циркулирующего патологического факто-
ра может служить описание женщины со сте-
роидорезистентным ФСГС, которая родила
двоих детей с протеинурией и гипоальбумине-
мией; у обоих детей и протеинурия, и нефро-
тический синдром исчезли соответственно че-
рез 2 и 3 нед после рождения [Lagrue G., 1991].
ФСГС — достаточно редкий вариант ГН,
наблюдается у 5—10 % взрослых больных с ХГН
(по данным нашей клиники, за последние
20 лет — у 6 %). Клинически характеризуется
нефротическим синдромом (в наших наблюде-
ниях НС отмечался у 91 из 135 больных, т.е. в
67 % случаев) или персистирующей протеину-
рией, у большинства больных сочетается с ге-
матурией (хотя макрогематурия редка), у по-
ловины — с артериальной гипертонией. Наблю-
дается у 15—20 % больных с НС, чаще у де-
тей, у которых ФСГС является наиболее час-
той причиной стероидорезистентного НС.
Несмотря на, казалось бы, умеренные мор-
фологические изменения, течение болезни про-
грессирующее, полные ремиссии наблюдаются
редко. Прогноз серьезный, особенно при НС;
это один из наиболее неблагоприятных вари-
антов ГН, достаточно редко отвечающий на
активную иммунодепрессивную терапию. Спон-
танные ремиссии крайне редки. У взрослых 5-
летняя выживаемость составляет 70 [Cameron
J.St. et al., 1977] -73 % [McCoy R., Tisher C,
1983]. Если вообще у взрослых это достаточно
редкий вариант нефрита, то среди больных
240
ТПН его доля значительно возрастает. Так, по
данным USRDS (регистра больных с ТПН в
США), опубликованным в 1998 г., среди 12 970
больных с известной морфологической формой
ГН, которые получали заместительную почеч-
ную терапию в 1992—1996 гг. у 6497 (50 %) был
ФСГС.
Прогноз ухудшают следующие факторы:
• наличие НС,
• выраженная гематурия,
• артериальная гипертония,
• тяжелая гиперхолестеринемия,
• отсутствие ответа на терапию.
В наших наблюдениях 10-летняя выживае-
мость больных ФСГС с НС (91) составила 50 %,
а без НС (44 ) — 90 % [Краснова Т.Н. и др.,
1999]. S.Korbet и М.Schwartz (1994), суммиро-
вав данные литературы, установили, что ТПН
развилась через 5 лет у 55 % больных, не отве-
тивших при первом поступлении на терапию,
и лишь у 3 % ответивших.
Среди морфологических признаков на пло-
хой прогноз указывают развитие склероза в
области рукоятки клубочка, тяжелые измене-
ния канальцев, интерстиция и сосудов, а так-
же гипертрофия клубочков. Размер клубочков
хорошо предсказывает почечную выживаемость
и ответ на стероиды [Nyberg, 1994; Suzuki,
1994].
Выделяют и особую морфологическую фор-
му ФСГС с крайне неблагоприятным прогно-
зом — коллапсирующую гломерулопатию, при
которой отмечают спадение (коллапс) клубоч-
ковых капилляров, а также выраженную гипер-
трофию и гиперплазию эпителиальных клеток,
микрокисты канальцев, дистрофию эпителия
канальцев, отек интерстиция. Такая же карти-
на описана при ВИЧ-инфекции и злоупотреб-
лении героином. Клиника характеризуется тя-
желым НС, ранним повышением креатинина
сыворотки. Иногда отмечаются недомогание и
лихорадка, в связи с чем обсуждается возмож-
ность вирусной этиологии. R.Detwiler и соавт.
(1994) описали 16 таких больных (из них 13
черной расы); из 14 больных, прослеженных
15 мес, у 10 развилась ТПН.
ФСГС достаточно часто рецидивирует в транс-
плантате — примерно у '/4 больных, чаще у де-
тей. Описаны семейные случаи ФСГС
(9 семей), для которых характерны прогрессиру-
ющее течение, резистентность к стероидной те-
рапии и рецидивы ФСГС после трансплантации.
Проблема ФСГС осложняется тем, что такие
же морфологические изменения возможны и
при других патологических состояниях — при
рефлюкс-нефропатии, снижении массы почеч-
ной паренхимы (например, в ремнантной поч-
ке — после удаления в эксперименте 5/6 функ-
ционирующей паренхимы), патологическом
ожирении, генетических, метаболических (ли-
пиды, глюкоза) нарушениях, действии гемо-
динамических факторов (артериальная гиперто-
ния, ишемия, гиперфильтрация), и др.
9.5.3. Мембранозный
гломерулонефрит
(мембранозная нефропатия)
Характеризуется диффузным утолщением сте-
нок капилляров клубочков, связанным с диф-
фузным субэпителиальным отложением иммун-
ных комплексов, расщеплением и удвоением
ГБМ. Клеточной пролиферации нет или она
минимальна. Антиген, ответственный за обра-
зование ИК при первичной мембранозной не-
фропатии, неясен. В эксперименте хеймановс-
кий нефрит, очень напоминающий МН, вызы-
вается у крыс иммунизацией экстрактом ще-
точной каемки проксимальных канальцев. Ан-
тиген щеточной каемки, имеющий общий ан-
тиген с клубочковыми эпителиальными клет-
кам, находят и в проксимальных канальцах
человека.
Частота мембранозной нефропатии среди
всех морфологических типов нефрита составля-
ет, по данным различных авторов, 3—15 %. По
данным P.Zucchelli, S.Pasquali (1998), среди
4060 биопсий, выполненных в течение 25 лет,
мембранозная нефропатия была найдена в 319
случаях (7,8 %).
Развивается в любом возрасте, чаще у взрос-
лых (особенно в возрасте 30—50 лет), чем у де-
тей. У мужчин бывает чаще, чем у женщин, и
протекает тяжелее. У взрослых мембранозная не-
фропатия — самая частая причина НС (20—
40 % случаев), у детей с НС наблюдается ме-
нее чем в 1 % случаев.
У большинства больных основным клиничес-
ким признаком является нефротический синд-
ром, реже протеинурия без НС. У 25—40 %
больных возможна микрогематурия. Макрогема-
турия и гипертония в начале заболевания на-
блюдаются редко, в дальнейшем последняя
развивается у 20—50 % больных. Содержание
сывороточного комплемента почти всегда в
норме, редко — снижено (например, в случа-
ях, этиологически связанных с вирусным гепа-
титом В или с СКВ).
При этом типе нефрита часто (у 30—35 %
больных) удается установить связь с известны-
ми антигенами — вирусом гепатита В, опухо-
левыми, лекарственными (табл. 9.1).
В связи с этим в клинической практике сле-
дует особенно тщательно обследовать больных
с мембранозной нефропатией с целью возмож-
ного выявления в первую очередь опухоли (осо-
16—2950
241
Таблица 9.1. Наиболее частые причины мембра- нозной нефропатии
Инфекции Опухоли Лекарственные средстве
Гепатит В, С Малярия Шистосомоз Филяриоз Сифилис Эхинококкоз Рак почки » легких » кишечника Лимфомы Хронический лимфолейкоз D-пеницилламин Препараты золо- та Каптоприл НСПП Туберкулез
бенно легких, почек), инфицирования вируса-
ми гепатита и др.
Другой особенностью является частая связь
с различными системными и другими заболе-
ваниями — СКВ, аутоиммунным тиреоидитом,
синдромом Шегрена, сахарным диабетом, псо-
риазом и др.
У больных мембранозной нефропатией с НС
чаще, чем при других морфологических вари-
антах ГН, развиваются тромботические ослож-
нения. R.C.Atkins и R.Bellomo (1993) на осно-
ве своих наблюдений и данных литературы
приводят следующие цифры частоты тромбозов
у больных мембранозной нефропатией: тром-
боз почечных вен — у 29 %, легочные эмбо-
лии — у 17 % и глубокие тромбозы конечнос-
тей — у 17 %. Мы недавно наблюдали больную,
у которой именно выявление тромбоза почеч-
ных вен заставило подумать о мембранозной
нефропатии, подтвержденной при биопсии
почки [Козловская Н.Л. и др., 1999].
Течение относительно благоприятное (осо-
бенно у женщин), возможны спонтанные ре-
миссии. Почечная недостаточность развивается
лишь у 50 % больных. S.Hogan и соавт. (1995)
на основе мета-анализа многочисленных опуб-
ликованных сообщений приводят следующую
частоту развития ТПН: 14 % через 5 лет, 35 %
через 10 лет и 41 % через 15 лет. Факторами,
отрицательно влияющими на прогноз, являются
следующие:
• мужской пол;
• возраст старше 50 лет;
• выраженный нефротический синдром;
• протеинурия более 10 г/сут;
• артериальная гипертония;
• раннее повышение креатинина сыворотки (в
первые 3—5 лет);
• выраженные тубулоинтерстициальные изме-
нения;
• отсутствие ремиссий (спонтанных или пос-
ле лечения).
Мембранозная нефропатия рецидивирует в
трансплантате примерно у 10 % больных, а
также может развиться в трансплантате почки
de novo.
9.5.4. Мезангиопролиферативный
гломерулонефрит
Характеризуется пролиферацией мезангиальных
клеток, расширением мезангия, отложением
иммунных комплексов в мезангии и под эндо-
телием. Это достаточно частый морфологичес-
кий тип ГН, отвечающий (в отличие от пре-
дыдущих вариантов) всем критериям ГН как
иммуновоспалительного заболевания. Клиничес-
ки характерны протеинурия, гематурия, в час-
ти случаев нефротический синдром, гиперто-
ния. Течение относительно благоприятное. В
наших ранних наблюдениях 10-летняя выжива-
емость (до наступления терминальной почечной
недостаточности) составила 81 % [Тареева И.Е.
и др.,1992]. В настоящее время наблюдается тен-
денция к более дробной иммуноморфологичес-
кой классификации этой формы с выделени-
ем различных клинико-морфологических вари-
антов в зависимости от класса иммуноглобули-
нов, преобладающих в клубочковых депозитах.
IgA-нефропатия. Основное место среди вари-
антов мезангио пролиферативного ГН занимает
ГН с отложением в клубочках иммуноглобули-
на А — IgA-нефрит, IgA-нефропатия, болезнь
Берже с гематурией как ведущим клиническим
симптомом. Описана была J.Berger и соавт. в
1967 г. как рецидивирующая доброкачественная
гематурия. В последующие годы при длительном
наблюдении установлено, что у 20—50 % взрос-
лых больных со временем ухудшается функция
почек. Сейчас рассматривается как персистиру-
ющая или медленно прогрессирующая болезнь.
В настоящее время рамки IgA-H значитель-
но расширяются. В эту группу ряд исследовате-
лей относят и другие типы нефрита, при ко-
торых в клубочках выявляют IgA. В то же время
термины «IgA-нефрит» или чаще «IgA-нефро-
патия» постепенно начинают заменять термин
«мезангиопролиферативный ГН», и в зарубеж-
ных руководствах, вышедших в 1998 г. в Евро-
пе («Руководство по клинической нефрологии»
под ред. A.Davison и др., «Лечение первичного
ГН» под ред. C.Ponticelli и R.J.Glassock), раз-
делов, специально посвященных мезангиопро-
лиферативному нефриту, нет, хотя упоминает-
ся, что IgA-H относится к большой группе
мезангиопролиферативных нефритов, куда вхо-
дят и ГН с отложениями СЗ и IgG, а также
ГН с депозитами IgM.
Проблема осложняется и неясностью взаи-
моотношений IgA-H с геморрагическим васку-
литом (пурпурой Шенлейна — Геноха), при
242
котором также повышено содержание IgA в
сыворотке и в почках находят депозиты IgA, в
связи с чем существует точка зрения о том, что
IgA-H является моноорганной формой гемор-
рагического васкулита.
Частота IgA-нефрита среди других типов ГН
составляет примерно 30 % в Азии и 10—12 %
в Европе и Австралии. В некоторых странах, как,
например, в Японии, IgA-нефрит стал преоб-
ладать (25—50 %) среди всех случаев хроничес-
кого ГН. По данным нашей клиники [ранняя
серия наблюдений (Николаев А.Ю., 1988)],
IgA-нефрит выявлен у 90 из 706 больных (12,6
%), которым за предыдущие 10 лет была про-
ведена биопсия почки. При последующем ана-
лизе (биопсии с 1980 по 1997 г.) IgA-H выяв-
лена в 12,7 % среди 1218 морфологически под-
твержденных случаев ГН (в 8,5 % всех биопсий).
Этиология и патогенез IgA-H интенсивно
изучаются; ищутся связи между поражением
слизистых оболочек и гиперпродукцией IgA,
причины гиперпродукции полимерного IgA
костномозговыми клетками, которые отвечают
более выраженным повышением на инфекцию
или вакцинацию, чем контрольные. В норме IgA
действует как иммунологический барьер в сек-
ретах и клетках, нейтрализуя патогены через
специфический рецептор. При IgA-H в минда-
линах повышено количество IgA-продуцирую-
щих плазматических клеток и снижено — IgG-
продуцентов. Одна из гипотез предполагает не-
нормальное гликозилирование IgA, что ведет к
его отложению в клубочках и вызывает акти-
вацию лейкоцитов и каскад воспаления.
Как возможные этиологические факторы
обсуждаются вирусные (и другие инфекцион-
ные), пищевые и эндогенные антигены. Среди
вирусов изучают возможную роль респиратор-
ных вирусов, цитомегаловируса и вируса Эп-
штейна — Барр. УВЧ-облучение миндалин (воз-
можно, стимулирующее ОРВИ) ухудшает ана-
лизы мочи, особенно у тех больных, у кото-
рых в анамнезе была макрогематурия.
Интересны сообщения о роли микотоксина.
В 1989 г. N.Pestka и соавт. сообщили, что мико-
токсин деокинилваленол, заражающий зерно,
муку, кофейные зерна и др., вызывает у мы-
шей патологические изменения, похожие на
IgA-H. Авторы установили, что микотоксин из
той же группы — ниваленол, часто заражаю-
щий пищевые продукты в Южной Азии и Япо-
нии, при введении мышам в малых дозах per
os вызывает через 4 нед значительные IgA-де-
позиты в мезангии и повышение IgA в сыво-
ротке. Такой ответ наблюдали у различных
штаммов мышей, степень иммунопатологичес-
ких изменений коррелировала с длительностью
приема и дозой, IgA-антитела в сыворотке об-
ладали высокой аффинностью к микотоксину.
Считают, что этот микотоксин может быть
причиной IgA-H и у людей, поступая в кишеч-
ник и нарушая функцию иммунной системы
слизистой оболочки. Микотоксин может быть и
антигеном в лимфоидных тканях в кишечнике.
Среди пищевых антигенов у некоторых боль-
ных доказана роль глютена. В сыворотке повы-
шены титры IgA-антител к глиадину и другим
пищевым белкам. Возможна роль эндогенных
антигенов, в том числе хит-шоковых белков.
Имеют значение и генетические факторы.
Описаны сильные ассоциации между IgA-нефри-
том и HLA BW35, а также с HLA-DR4 -антиге-
ном. Возможны семейные случаи. По данным
F.P.Shena (1998), среди больных IgA-H 9,6 %
имеют одного или более сиблингов с IgA-H, у
15,6 % родственников отмечаются микрогема-
турия и/или протеинурия, у многих родствен-
ников — аномалии IgA-системы. Генетические
нарушения могут взаимодействовать с факто-
рами окружающей среды. О возможной роли
генетических факторов (или факторов среды?)
свидетельствуют данные о том, что макрогема-
турию чаще выявляют у больных IgA-H в Се-
верной Америке (56 %), Австралии (46,5 %) и
Европе (39,7 %), чем в Азии (11,5 %) [Schena
F.P., 1998]. Имеются указания на связь прогрес-
сирования IgA-H с полиморфизмом гена
АПФ — доля больных с DD-генотипом была
более высокой среди лиц с повышенным уров-
нем креатинина, чем среди больных с нормаль-
ным уровнем (соответственно 33 и 4 %), при
обратном соотношении среди больных с гено-
типами II и ID [Tracy Е., 1996].
Поражение почек характеризуется очаговым
или диффузным мезангиопролиферативным ГН
или другими типами пролиферативного ГН.
В настоящее время имеется тенденция относить
к IgA-H и другие морфологические типы ГН с
отложением в почках IgA (см. выше). Морфоло-
гически активность IgA-H оценивается по тем
же признакам, как и активность других морфо-
логических типов; K.Tashiro и соавт. (1998) при-
дают особое значение наличию апоптоза мезан-
гиальных клеток.
Заболевание развивается в молодом возрас-
те, чаще у мужчин (54 мужчины и 36 женщин
в нашей ранней серии, 73 и 54 соответствен-
но — в последующей). У 50 % больных наблю-
дается рецидивирующая макрогематурия, воз-
никающая при лихорадочных респираторных
заболеваниях в первые дни или даже часы бо-
лезни («синфарингитная макрогематурия»),
реже после других заболеваний, вакцинации
или тяжелой физической нагрузки. Нередко
макрогематурия сопровождается неинтенсивны-
ми тупыми болями в пояснице, транзиторной
гипертонией, иногда лихорадкой. Эпизоды мак-
рогематурии иногда могут быть с преходящей
16*
243
1
олигурической ОПН, предположительно выз-
ванной закупоркой канальцев эритроцитарны-
ми цилиндрами. В большинстве случаев эти
эпизоды проходят бесследно, однако описаны
больные, у которых после ОПН функция по-
чек полностью не восстанавливалась.
У других больных IgA-нефрит протекал ла-
тентно, с микрогематурией, часто с небольшой
протеинурией. У 15—50 % больных (чаще бо-
лее старшего возраста и/или с микрогематури-
ей) на поздних стадиях может присоединиться
нефротический синдром (в наших наблюдени-
ях у 25 % больных), у 30—35 % — артериаль-
ная гипертония. Среди наших больных с мик-
рогематурией нередко отмечались системные
признаки — артралгии, миалгии, синдром Рей-
но, полинейропатия, гиперурикемия.
В сыворотке крови у 35—60 % больных содер-
жание IgA повышено, преобладают его полимер-
ные формы. Степень повышения IgA не отража-
ет клинического течения болезни и не влияет
на прогноз. В сыворотке выявляют также высо-
кие титры IgA иммунных комплексов, которые
в части случаев содержат антитела против бак-
териальных, вирусных и пищевых антигенов.
Комплемент сыворотки обычно в норме.
Дифференциальный диагноз проводят с
мочекаменной болезнью, опухолями почек, с
IgA-нефритом при геморрагическом васкулите
и хроническом алкоголизме, с синдромом Аль-
порта, с болезнью тонких базальных мембран.
Болезнь тонких базальных мембран (добро-
качественная семейная гематурия) — заболева-
ние с очень хорошим прогнозом, протекающее
с микрогематурией; обычно наследуется по ауто-
сомно-доминантному типу; депозитов IgA в поч-
ках нет; для окончательного подтверждения ди-
агноза необходимо измерение при электронной
микроскопии толщины ГБМ, которая составля-
ет, по данным B.Vriesman, при болезни тонких
мембран 191 нм, а при IgA-H — 326 нм.
Течение IgA-H относительно благоприятное,
особенно у больных с макрогематурией. Почеч-
ная недостаточность развивается через 10—15
лет у 15—30 % больных, прогрессирует медлен-
но. Мета-анализ 23 статей, опубликованных в
1966—1989 гг. [Roodnat В. et al., 1991], показал,
что почечная выживаемость через 5, 10 и 15 лет
после появления первых симптомов составляет
93, 85 и 76 %, а после биопсии — 89, 80 и 69 %.
Почечная недостаточность обычно прогрессирует
медленно. На прогноз значительно влияют ве-
личина протеинурии и наличие гипертонии, но
не влияет содержание IgA в сыворотке.
В первой серии наших наблюдений 10-лет-
няя выживаемость всех 90 больных составила
89,8 %, ХПН развилась у 9 человек; в группе
больных с макрогематурией 10-летняя выжива-
емость составила 100 %. При варианте заболе-
244
вания без макрогематурии у 4 больных отмече-
но необратимо прогрессирующее течение, у 2
присоединилась тяжелая гипертония, близкая к
злокачественной.
Факторы, ухудшающие прогноз при IgA-
нефропатии:
• выраженная микрогематурия;
• выраженная протеинурия;
• артериальная гипертония;
• почечная недостаточность;
• тяжесть морфологических изменений;
• отложение IgA в стенках периферических
сосудов;
• мужской пол;
• более старший возраст в начале болезни.
По данным R.Katafuchi и соавт. (1990), о
плохом прогнозе свидетельствуют уровень кре-
атинина выше 1,5 мг/дл у мужчин и выше
1,3 мг/дл у женщин; протеинурия выше 2 г/сут;
морфологически — сегментарные поражения,
занимающие более 25 % клубочка, и интерсти-
циальный фиброз, занимающий более 25 %
корковой области. По данным C.Nieuhoff и со-
авт. (1998), прогрессирующее течение IgA-H с
присоединением гипертонии и исходом в ХПН
наиболее вероятно при персистирующей мик-
рогематурии, обнаружении мезангиальных IgG-
депозитов и признаков фибропластической
трансформации (фокальный или сегментарный
гломерулосклероз, интерстициальный фиброз,
атрофия канальцевого эпителия). L.Frimat и
соавт. (1997) в проспективном исследовании
выделили 3 основных клинических фактора
плохого прогноза: мужской пол, уровень суточ-
ной протеинурии выше 1 г и уровень креати-
нина сыворотки более 150 ммоль/л.
IgA-H часто рецидивирует в трансплантате,
у 50 % реципиентов — в течение 2 лет. Пред-
сказать рецидив IgA-H в трансплантате как
будто позволяет исследование аффинности IgA
к коллагену типа IV. Однако выживаемость
трансплантата лучше, чем при других болезнях
почек. Обсуждается факт, выявленный in vitro,
что IgA блокирует IgG анти-НЬА-антитела. Вы-
живаемость лучше при пересадке трупной поч-
ки, чем от живого донора-родственника (воз-
можна роль генетической предрасположеннос-
ти). Не рекомендуется трансплантация от HLA-
одинаковых сиблингов.
9.5.5. Мезангиокапиллярный
(мембранопролиферативный)
гломерулонефрит
Вариант ГН с прогрессирующим течением до-
статочно редкий. Морфологически характерны
пролиферация мезангиальных клеток, создаю-
шая дольчатость клубочков («лобулярный не-
фрит», описанный еще Фольгардом и Фаром),
и утолщение или двухконтурность стенки ка-
пилляров — за счет проникновения в них (ин-
терпозиции) мезангиальных клеток. По распо-
ложению и характеру электронно-плотных де-
позитов выделяют 3 (иногда и 4) типа мезан-
гиокапиллярного нефрита (МКГН), которые
идентичны клинически и несколько различают-
ся по лабораторным данным и результатам
трансплантации. Чаще встречаются I и II типы.
При I типе иммунные депозиты локализуются
под эндотелием и в мезангиальной области
клубочков (субэндотелиальный или классичес-
кий МКГН), при II типе («болезни плотных
депозитов») особые осмиофильные электрон-
но-плотные депозиты неясной природы распо-
лагаются внутри базальной мембраны. МКГН III
типа сочетается с выраженной фрагментацией
ГБМ; некоторые исследователи выделяют и IV
тип, характеризующийся субэндотелиальными
и субэпителиальными депозитами.
Частота среди других типов ГН в 70-х годах
составляла 10—20 %; в последние годы в стра-
нах Европы и Северной Америки МКГН стал
встречаться реже (5—6 %) за счет снижения
частоты I типа.
Среди причин выделяют вирусные и бакте-
риальные инфекции. Нередко МКГН I типа
развивается при инфицировании вирусом гепа-
тита В, но в последнее время особое внима-
ние обращают на связь МКГН I и III типа с
вирусом гепатита С. У 50—60 % больных МКГН
I типа, инфицированных вирусом гепатита С,
выявляют криоглобулины. Описаны случаи,
связанные со стрептококковой инфекцией, ин-
фекционным эндокардитом, а также с разви-
тием МКГН при шистосомозе, легочном тубер-
кулезе (с исчезновением протеинурии после
противотуберкулезного лечения), малярии.
Наряду с идиопатической формой мезангио-
капиллярный нефрит выявляют при СКВ, сме-
шанной криоглобулинемии, синдроме Шегре-
на, неспецифическом язвенном колите, сарко-
идозе, лимфомах, неоплазмах и др.
В развитии МКГН определенную роль могут
играть генетические факторы. Описаны семей-
ные случаи болезни у сиблингов, а также в
нескольких поколениях.
Особенностью МКГН является гипокомпле-
ментемия со снижением уровня СЗ- и/или С4-
компонентов, которую особенно часто выявля-
ют при II типе. Гипокомплементемия обуслов-
лена нарушением синтеза и катаболизма ком-
племента, а также наличием в сыворотке кро-
ви особого иммуноглобулина — СЗ-нефрити-
ческого фактора, направленного против СЗ-
конвертазы. Активация комплемента при МКГН
II типа происходит по альтернативному пути,
с нормальным уровнем Clq-компонента, а при
МКГН I типа — по классическому пути, уро-
вень Clq снижен. Следует иметь в виду, что
уровень комплемента часто снижен также при
остром ГН и волчаночном нефрите, но оста-
ется в норме при других типах ГН.
МКГН (чаще II типа) сочетается иногда с
парциальной липодистрофией (заболеванием,
которое также протекает с гипокомплементе-
мией); возможность такого сочетания вызыва-
ет ряд патогенетических гипотез.
Заболевают несколько чаще мужчины моло-
дого возраста, а также дети (возраст моложе
при I типе). У пожилых встречается редко.
Клиническая картина одинакова при всех
морфологических вариантах: характерны гема-
турия (у 10—20 % преходящая макрогематурия),
выраженная протеинурия и нефротический
синдром (нередко с элементами остронефри-
тического), снижение функции почек. МКГН
является причиной 10 % случаев НС у взрос-
лых и 5 % у детей. Артериальная гипертония
наблюдается часто, иногда тяжелая. Сочетание
НС с гематурией и гипертонией всегда должно
настораживать в отношении возможности ме-
зангиокапиллярного нефрита. Возможна анемия
(которую связывают с наличием активирован-
ного комплемента на поверхности эритроцитов).
При II типе описывают своеобразную ретино-
патию (диффузные двусторонние симметричные
поражения желтого цвета).
Заболевание нередко начинается с острого
нефритического синдрома, с внезапным разви-
тием гематурии, выраженной протеинурии,
отеков и гипертонии, в этом случае ошибочно
ставят диагноз острого нефрита. Почти у */3
больных болезнь может проявиться быстропрог-
рессирующей почечной недостаточностью с
наличием в почечном биоптате «полулуний».
Из-за частого сочетания МКГН с инфекци-
ями и системными заболеваниями в каждом
случае необходим тщательный поиск сопутству-
ющей патологии.
Течение процесса неуклонно прогрессирую-
щее, спонтанные ремиссии редки. Мезангиока-
пиллярный нефрит — одна из самых неблагоп-
риятных форм, при отсутствии лечения терми-
нальная почечная недостаточность развивается
через 10 лет почти у 50 %, через 20 лет — у
90 % больных. По данным J.St.Cameron и со-
авт. (1983), 10-летняя выживаемость больных с
НС составляла 40 %, больных без НС — 85 %.
Некоторые авторы указывают на лучший про-
гноз при I типе [почечная выживаемость, по
данным G.D’Amico (1992), — 54—64 %]. Как
особую черту течения МКГН отмечают «ступен-
чатое» прогрессирование и относительно вне-
запное ухудшение функции почек у отдельных
больных. Клинически плохими прогностически-
245
ми признаками являются наличие НС, диасто-
лической гипертензии, снижение функции
почек и выявление серологических признаков
HCV- и HBV-инфекции. Уровень комплемента
не имеет прогностического значения.
МКГН, особенно II типа, часто рецидиви-
рует в трансплантате.
9.6. Лечение гломерулонефрита*
9.6.1. Общие положения
При лечении больных ГН перед клиницистом
встают задачи:
• оценить, насколько велика активность и
вероятность прогрессирования нефрита и оп-
равдывают ли они риск применения тех или
иных терапевтических воздействий;
• добиться обратного развития поражения
почек (в идеале полного выздоровления);
• остановить прогрессирование нефрита или
хотя бы замедлить темп нарастания почеч-
ной недостаточности.
Этиологическое лечение. Обратное развитие
почечного поражения может быть достигнуто в
первую очередь путем этиологического подхо-
да к лечению ГН, однако такой подход возмо-
жен лишь у немногих больных. Этиологическим
лечением является применение антибиотиков
при постстрептококковом нефрите и нефрите,
связанном с подострым инфекционным эндо-
кардитом, специфическое лечение сифилити-
ческого и малярийного, паратуберкулезного не-
фрита с освобождением от ИК и полным изле-
чением, удаление опухоли при паранеопластичес-
ком нефротическом синдроме, прекращение
приема соответствующего препарата, вызвавше-
го лекарственный нефрит, абстиненция при ал-
когольном нефрите, исключение аллергизирую-
щих факторов при атопическом нефрите.
Возможность обратного развития при своев-
ременном устранении этиологического факто-
ра вполне реальна, о чем свидетельствуют наши
наблюдения за больными нефритом, обуслов-
ленным подострым инфекционным эндокарди-
том, паранеопластическим нефритом, парату-
беркулезным IgA-нефритом и др.
Патогенетическое лечение. Привести к обрат-
ному развитию почечного процесса, остановить
или замедлить его прогрессирование могут ме-
тоды патогенетической терапии, направленные
на те или иные звенья патогенеза — иммунные
процессы, воспаление, внутрисосудистую коа-
гуляцию. В определенной степени к патогене-
тической терапии относится и антигипертензив-
* Раздел написан И.Е.Тареевой, Е.М.Шиловым.
246
ная терапия, а в отдельных случаях — и диуре-
тическая.
Большая часть средств патогенетической те-
рапии нефритов (глюкокортикоиды, цитоста-
тики, гепарин, плазмаферез) имеет широкий
диапазон действия, грубо нарушает гомеоста-
тические процессы, нередко вызывает тяжелые
осложнения. Выраженная активность и опас-
ность этих методов лечения позволяют называть
их методами «активной» или «агрессивной» те-
рапии нефритов в противоположность более
мягко действующим «щадящим» методам с
применением антиагрегантов и гипотензивных
средств.
Назначение «активной» терапии показано на
тех этапах нефрита, когда очевидна роль имму-
новоспалительных процессов или процессов
внутрисосудистой коагуляции в прогрессирова-
нии заболевания, т.е. в ситуациях, когда име-
ется высокая активность почечного процесса,
определяющая во многом темп его прогресси-
рования. Поэтому важна клиническая и морфо-
логическая оценка активности ГН.
Самый правильный подход — ориентиро-
ваться на морфологическую картину (оценка
формы нефрита, его активности и выраженно-
сти склероза) — не всегда возможен. В связи с
этим в ряде ситуаций приходится ориентиро-
ваться на клиническую картину, клинические
признаки активности процесса. Общие положе-
ния, которыми следует руководствоваться в
такой ситуации:
• при высокой активности ГН, прежде всего
ГН с нефротическим синдромом без гипер-
тонии и признаков почечной недостаточно-
сти, всегда показана иммуносупрессивная
терапия. Лишь при наличии противопоказа-
ний к активной терапии или невозможнос-
ти ее проведения по каким-либо причинам
можно ограничиться симптоматическим ле-
чением, назначением ингибиторов АПФ;
• при впервые возникшем нефротическом
синдроме, особенно без гематурии и гипер-
тонии, — всегда показано лечение глюко-
кортикоидами (ГК). При последующих реци-
дивах — следует начинать с ГК (если началь-
ный эпизод лечения ГК был эффективен),
затем назначают цитостатики или циклоспо-
рин;
• при прогрессирующих формах нефрита (с
быстрым нарастанием уровня креатинина) —
обязательно назначение иммунодепрессан-
тов — большие дозы ГК и цитостатиков
внутрь и/или в виде пульсов;
• при латентном нефрите с протеинурией
> 1 г/сут показаны ингибиторы АПФ;
• в отношении гематурических форм единой
тактики нет (см. Лечение IgA-нефропатии).
В настоящее время для лечения нефритов
применяют следующие группы фармакологи-
ческих препаратов: глюкокортикоиды, цитоста-
тики, ингибиторы АПФ, антикоагулянты, ан-
тиагреганты, гиполипидемические препараты;
в некоторых ситуациях большое значение име-
ет метод «механической» иммуносупрессии —
плазмаферез.
9.6.2. Глюкокортикоиды
Глюкокортикоиды (ГК) в течение нескольких
десятилетий остаются одним из основных
средств патогенетической терапии нефритов.
Механизмы действия. ГК обладают одновре-
менно и противовоспалительным, и иммунодеп-
рессивным действием, вмешиваясь, с одной
стороны, в функцию всех воспалительных кле-
ток и образование гуморальных факторов вос-
паления, а с другой — в иммунный ответ, при-
чем больше в клеточный, чем в гуморальный.
Главными механизмами действия ГК, при-
водящими в конце концов к подавлению вос-
палительной реакции и иммунного ответа, яв-
ляются:
• перераспределение клеток воспаления и
иммунной системы из кровотока в другие
органы иммунной системы, что уменьшает
поступление воспалительных и иммунных
клеток в очаг воспаления, препятствует их
межклеточным взаимодействиям и тем са-
мым тормозит развитие воспалительной, а
также локальной и системной иммунной
реакций;
• подавление продукции многих медиаторов,
участвующих в реализации и персистенции
иммунного ответа и воспаления (цитокинов,
метаболитов арахидоновой кислоты, актив-
ных радикалов кислорода, протеолитических
энзимов и т.д.), а также снижение чувстви-
тельности к этим медиаторам воспалительных
и иммунных клеток, которые являются для
них мишенями (подавление синтеза мембран-
ных рецепторов для цитокинов, повышение
продукции антагонистов рецепторов и т.д.).
Влияние на воспалительную реакцию. ГК вме-
шиваются во все стадии воспалительного отве-
та. Степень противовоспалительной активности
ГК связана с их концентрацией в местах вос-
паления, поэтому зависит от дозы и пути вве-
дения.
ГК нарушают прилипание нейтрофилов к
эндотелию капилляров, в результате чего мень-
шее их число проникает через капиллярную
стенку в очаг воспаления. В фармакологических
дозах ГК лишь умеренно нарушают выделение
лизосомальных энзимов, респираторный взрыв
и хемотаксис в областях воспаления. ГК тормо-
зят приток макрофагов, влияют на их функ-
цию, блокируют выделение цитокинов (IL-1,
IL-6, TNF и др.), а также подавляют продук-
цию макрофагами некоторых протеолитических
ферментов (коллагеназы, эластазы, активатора
плазминогена); в то же время ГК тормозят про-
тивоопухолевую и антимикробную активность
макрофагов.
При внутривенном введении в высоких до-
зах ГК вызывают ряд реакций, которые не
наблюдаются в обычных фармакологических
дозах: подавляют продукцию супероксидных
анионов и ФАТ, изменяют химический состав
БМК с последующим снижением протеинурии.
Влияние на иммунный ответ. У человека ГК
вызывают заметную, но преходящую лимфопе-
нию, связанную с перераспределением лимфо-
цитов в костный мозг. ГК подавляют представ-
ление антигена макрофагами Т-клеткам, акти-
вацию Т-лимфоцитов (за счет снижения про-
дукции IL-2), уменьшают образование, проли-
ферацию и функциональную активность хел-
перных, супрессорных и цитотоксических Т-
лимфоцитов.
В отличие от Т-клеток В-клетки менее чув-
ствительны к ГК. Влияние ГК на продукцию
антител зависит от дозы: низкие дозы не вли-
яют, высокие же могут снижать уровень имму-
ноглобулинов (за счет подавление активности
Т-хелперов).
При внутривенном введении в высоких до-
зах ГК дополнительно к предыдущему оказы-
вают следующее влияние на иммунный ответ:
более выраженное действие на Т-клетки; подав-
ление продукции ряда цитокинов, увеличива-
ющих проницаемость БМК; снижение сосуди-
стой проницаемости, вызванной иммунными
комплексами.
Для клинических целей важно помнить: для
подавления миграции лейкоцитов в места вос-
паления и клеточного иммунного ответа тре-
буются более низкие дозы ГК, а для подавле-
ния функциональной активности лейкоцитов и
гуморального иммунитета — более высокие
дозы ГК.
Общие показания для назначения ГК при не-
фритах. Общими показаниями для назначения
ГК при нефритах являются выраженная актив-
ность почечного процесса, наличие нефроти-
ческого синдрома без выраженной гипертонии
и гематурии (морфологически — минимальные
изменения клубочков, мезангиопролифератив-
ный и мембранозный нефрит). Лечение менее
перспективно при ФСГС, мезангиокапилляр-
ном и диффузном фибропластическом ГН.
Частные показания при отдельных клинико-
морфологических вариантах ГН будут рассмот-
рены ниже.
247
Методы (схемы) глюкокортикоидной терапии
при нефритах. Возможны различные способы
(режимы) применения ГК при ГН. Для дости-
жения эффективных концентраций ГК в обла-
стях иммунного воспаления и отека в почеч-
ной ткани, где кровоток значительно снижен,
эффективны 2 способа введения ГК. При пер-
вом способе используют длительное ежеднев-
ное введение высоких и умеренно высоких доз
ГК (преднизолона) внутрь, при втором — внут-
ривенное введение сверхвысоких доз (так на-
зываемых пульсов) ГК (метилпреднизолона или
преднизолона).
Ежедневный прием высоких доз преднизолона
внутрь. В зависимости от тяжести ГН предни-
золон в высоких дозах (1—2 мг/кг в день в те-
чение 1—2 мес) можно давать внутрь или от-
дельными дозами 2—3 раза в день, или одно-
кратно утром. В первом случае, при дробном
приеме преднизолона, достигается лучший кон-
троль почечного воспаления, но чаще развива-
ются и более выражены ближайшие побочные
эффекты. Поэтому некоторые авторы рекомен-
дуют при первой же возможности (клиничес-
ких признаках улучшения) переводить больно-
го с дробного на однократный прием. Затем при
достижении положительного эффекта суточную
дозу медленно снижают до минимально воз-
можной поддерживающей.
Прием высоких доз преднизолона через день.
При приеме ГК через день значительно мень-
ше, чем при ежедневном приеме, подавляется
функция гипоталамо-гипофизарно-надпочечни-
ковой системы. При этом доза преднизолона,
которую больной принимает через день одно-
кратно утром, эквивалентна двойной суточной
дозе ежедневного приема. Этот метод применя-
ется чаще всего в педиатрической практике,
реже — у взрослых. Эффективность близка к
общепринятой схеме, но побочные явления
наблюдаются реже, у детей не отмечается за-
держки роста. Такой альтернирующий режим
особенно показан для поддерживающей тера-
пии.
Пульс-терапия метилпреднизолоном. Для бы-
строго достижения очень высоких концентра-
ций ГК в плазме крови внутривенные пульсы
метилпреднизолоном в течение многих лет ис-
пользовали для лечения кризов отторжения
почечного аллотрансплантата. Число осложне-
ний, как правило, было невелико. Аналогичный
подход применяется для лечения быстропрог-
рессирующего ГН с полулуниями (как его иди-
опатической формы, так и у больных с систем-
ными заболеваниями) и других тяжелых форм
ГН, протекающих и без образования полулу-
ний (например, диффузного пролиферативно-
го ГН у больных системной красной волчанкой).
Процедура состоит во внутривенном капельном
введении в течение 20—40 мин 0,5—1,5 г ме-
тилпреднизолона (или преднизолона, несколь-
ко менее эффективного в этой ситуации), ко-
торое повторяют еще 2 раза в последующие дни
для достижения общей дозы 3—4 г препарата.
Располагая почти 20-летним опытом примене-
ния такого метода введения ГК, мы считаем его
относительно безопасным способом для быст-
рого достижения контроля над тяжелым воспа-
лением клубочков. Метод противопоказан боль-
ным с тяжелой гипертонией, а также с сопут-
ствующими миокардитом или выраженной кар-
диомиопатией.
Поддерживающая терапия. После проведения
курса лечения высокими дозами (чаще всего в
течение 2 мес) дозу снижают (обычно в тече-
ние такого же срока или при системных забо-
леваниях более медленно) до поддерживающей
(10—20 мг). Сроки поддерживающей терапии
определяют эмпирически, обычно 2 мес, иног-
да (особенно при ГН, связанных с системны-
ми заболеваниями) требуется более длительная
поддерживающая терапия, даже в течение не-
скольких лет, что может вызвать тяжелые по-
бочные эффекты. В то же время терапия через
день вызывает меньше побочных эффектов, чем
ежедневная глюкокортикоидная терапия, даже
когда доза ГК для альтернирующей терапии в
2—3 раза выше, чем при ежедневном приеме.
В связи с этим лучшей тактикой поддержива-
ющей терапии ГК считается снижение ежеднев-
ной дозы до наименьшего возможного уровня,
а затем переход на альтернирующий режим с
использованием 2-кратной дозы ежедневного
прием».
Если для подавления активности ГН или
поддержания нормальной функции почек тре-
буются неприемлемо высокие дозы ГК и если
быстро появляются побочные эффекты ГК-те-
рапии, то целесообразно назначение препара-
тов цитостатического действия. Это позволяет
использовать меньшие дозы ГК и таким обра-
зом снизить риск развития побочных эффектов.
Побочные эффекты глюкокортикоидной тера-
пии. Нежелательные эффекты ГК могут быть
острыми (эйфория, депрессия, бессонница,
повышенный аппетит, кортикостероидный пси-
хоз, задержка жидкости, снижение толерантно-
сти к глюкозе) и хроническими (ожирение,
миопатия, стрии, атрофия кожи, гирсутизм, ка-
таракта, задержка роста, остеопороз, асептичес-
кие некрозы костей, переломы костей, акне и
оппортунистические инфекции). Первые исчеза-
ют после отмены ГК-терапии, вторые могут со-
храняться в течение длительного времени.
Резкая отмена ГК после их длительного при-
ема ведет к опасному для жизни адреналовому
кризу, который связан с подавлением функции
гипоталамо-гипофизарно-надпочечниковой си-
248
стемы и свидетельствует о необходимости за-
местительной терапии. Признаками наступаю-
щего адреналового криза являются недомога-
ние, лихорадка, мышечная и головная боль,
потливость и гипотония с теплыми конечнос-
тями из-за дилатации периферических сосудов.
9.6.3. Цитостатические
(цитотоксические) препараты
9.6.3.1. Алкилирующие агенты
(циклофосфамид и хлорбутин)
Механизмы действия алкилирующих агентов.
Циклофосфамид и хлорбутин являются алкили-
рующими соединениями, которые при приеме
внутрь всасываются в кишечнике, а затем в
печени превращаются в активные метаболиты.
Главный механизм действия этих метаболитов —
перекрестное связывание нуклеиновых кислот,
что нарушает процесс транскрипции информа-
ции, необходимой для синтеза белка, и соот-
ветственно клеточное деление.
Циклофосфамид. Время полувыведения цик-
лофосфамида 6 ч, и оно удлиняется при одно-
временном приеме аллопуринола. В очень вы-
соких дозах циклофосфамид подавляет деление
всех клеток организма, причем клинически
наиболее важны последствия супрессии кост-
ного мозга. При приеме внутрь в дозах, снижа-
ющих уровень лейкоцитов крови до 3000 кл/мкл
(число нейтрофилов 1500 кл/мкл), воспалитель-
ный ответ в коже остается в норме, а иммун-
ный ответ на новые антигены (опосредованный
как Т-, так и В-клетками) серьезно подавля-
ется. Таким образом, в этих дозах циклофосфа-
мид меньше влияет на воспаление, может по-
давлять пролиферацию фибробластов и тем са-
мым развитие фиброза, но его главный эф-
фект — супрессия иммунной системы.
Прием циклофосфамида внутрь. Циклофосфа-
мид принимают внутрь обычно в дозе 2—2,5 мг/кг
в день. При тяжелом поражении почек (по типу
быстропрогрессирующего ГН) при системных
васкулитах можно начинать с дозы 3,5—
4 мг/кг в день. Цель терапии — снижение чис-
ла лейкоцитов в периферической крови при-
близительно до 3500 кл/мкл (но не ниже 3000
кл/мкл) и содержание нейтрофилов должно
составлять 1000—1500 кл/мкл. Число лейкоци-
тов снижается в течение нескольких дней или
недель. В этот период индукции иммунодепрес-
сии очень важно проверять число лейкоцитов
в периферической крови по меньшей мере че-
рез день, с тем чтобы при снижении числа
лейкоцитов до нижнего допустимого уровня
доза препарата могла быть снижена или отме-
нена.
С момента стабилизации уровня лейкоцитов
их содержание следует контролировать по мень-
шей мере 1 раз в 2 нед. Со временем дозу цик-
лофосфамида, необходимую для поддержания
лейкоцитов на должном уровне, приходится
снижать. Если одновременно с циклофосфами-
дом назначают преднизолон (который защища-
ет костный мозг от супрессии), то при сниже-
нии дозы преднизолона необходимо снизить и
дозу циклофосфамцда.
Побочные эффекты лечения циклофосфамидом.
Побочные эффекты при лечении циклофосфа-
мидом могут быть краткосрочными, исчезаю-
щими после прекращения лечения (тошнота,
рвота, понос, алопеция и инфекции, развива-
ющиеся в период лейкопении), и долговремен-
ными (недостаточность гонад с возможностью
последующего бесплодия, о чем надо предуп-
реждать больных, геморрагический цистит, тера-
тогенные эффекты, опухоли и хронические ин-
фекции). При кумулятивных дозах до 200 мг/кг
вероятность тяжелых побочных явлений мала,
однако она значительно повышается при куму-
лятивных дозах выше 700 мг/кг. В связи с этим
при решении вопроса о длительном лечении
циклофосфамидом больных (особенно мужчин
молодого возраста) необходимо предупреждать
о возможных осложнениях. При очень высоких
дозах возможно развитие синдрома неадекват-
ной секреции АДГ.
Внутривенная пульс-терапия циклофосфами-
дом. Группа исследователей-нефрологов, воз-
главляемая J.Balow и A.Steinberg (Национальные
институты здоровья, США), в начале 80-х го-
дов предложила для лечения больных волчаноч-
ным ГН «пульс-терапию» циклофосфамидом,
которая, как считается в настоящее время,
высокоэффективна и в то же время имеет мень-
ше побочных эффектов, чем обычный прием
циклофосфамида внутрь. Применяли дозы 0,5—
2,0 г/м2 поверхности тела, дававшие падение
уровня лейкоцитов максимально до 2000—3000
кл/мкл, что происходит между 8—12 днями, за-
тем лейкоциты возвращаются к норме прибли-
зительно на 3-й неделе. Пульсы использовали
каждые 3 мес, продолжительность лечения была
2 года и более. Установлено, что частота ослож-
нений со стороны мочевого пузыря при таком
режиме (1 пульс в 3 мес) значительно снижа-
ется. Вероятно, это связано с тем, что продол-
жительность контакта токсичных метаболитов
циклофосфамцда со стенкой мочевого пузыря
сокращается приблизительно до 36 ч каждые 3
мес, и общая доза препарата за эти 3 мес так-
же уменьшается. Инфекции, как большие, так
и малые (например, herpes zoster), продолжа-
ли наблюдаться, особенно в период максималь-
ного падения числа лейкоцитов. Серьезной про-
блемой оставалась аменорея, хотя ее частота
249
несколько снизилась (45 вместо 71 %, которая
наблюдается при длительной пероральной те-
рапии).
В последующие годы в нашем и еще в не-
скольких центрах были предложены новые ре-
жимы использования циклофосфамида, в час-
тности увеличение частоты пульсов до 1 раза в
месяц в начальной фазе терапии при лечении
волчаночного, а также хронического идиопати-
ческого ГН. Об эффективности лечения можно
судить не раньше чем через 6 мес, при нали-
чии признаков улучшения — продолжить лече-
ние еще в течение 3 мес; в последующем — при
необходимости продолжения лечения переры-
вы между пульсами следует увеличить до 2—3
мес. Риск развития побочных эффектов зависит
от общей дозы препарата.
При проведении пульс-терапии циклофосфа-
мидом должны соблюдаться следующие усло-
вия:
• для предотвращения тяжелой супрессии ко-
стного мозга доза препарата должна соответ-
ствовать уровню клубочковой фильтрации
(КФ), так как метаболиты циклофосфами-
да выводятся почками: при нормальной
КФ—15 мг/кг массы тела больного (или
приблизительно 0,6—0,75 г/м2 поверхности
тела), при КФ менее 30 мл/мин — 10 мг/кг
(или около 0,5 г/м2). Препарат вводят внут-
ривенно в 150—200 мл изотонического ра-
створа натрия хлорида в течение 30—60 мин;
• необходим строгий контроль уровня лейко-
цитов на 10-й и 14-й день после пульс-те-
рапии: при падении уровня лейкоцитов
<2000 кл/мкл — снизить следующую дозу на
25 %, при уровне лейкоцитов >4000 кл/мкл —
повысить следующую дозу циклофосфамида
на 25 % (до 1 г/м2);
• для предупреждения тошноты и рвоты ре-
комендуют антагонисты серотониновых ре-
цепторов: церукал по 10 мг 3 раза в сутки,
ондансетрон (зофран) 4—8 мг внутрь 3—4
раза каждые 4 ч (в качестве альтернативы —
навобан или латран); можно сочетать с од-
нократным приемом 10 мг дексаметазона
внутрь;
• для предупреждения токсического действия
метаболитов циклофосфамида на слизистую
оболочку мочевого пузыря: стимуляция ча-
стого мочеиспускания (повышенное потреб-
ление жидкости внутрь) и прием месны,
связывающей в мочевом пузыре токсические
метаболиты (4 раза через каждые 3 ч, общая
доза соответствует 80 % дозы циклофосфа-
мида).
С помощью методов математического моде-
лирования мы выявили прогностические при-
знаки, позволяющие заранее предположить
250
чувствительность больного к терапии сверхвы-
сокими дозами циклофосфамида (ЦФА), тем
самым избежать необоснованного назначения
иммунодепрессантов [Шилов Е.М. и др., 1995].
Результаты анализа, проведенного у 44 больных
ГН, свидетельствуют о том, что:
• лечение сверхвысокими дозами ЦФА удов-
летворительно переносят большинство
(89 %) больных хроническим ГН;
• к концу лечения положительный эффект
зафиксирован почти у 50 % больных, ранее
резистентных к пероральным методам имму-
нодепрессивной терапии;
• хороший отдаленный результат можно ожи-
дать у больных с нормальным уровнем кре-
атинина и длительностью болезни не более
2 лет. Для более точного прогноза необхо-
дима морфологическая информация, что де-
лает важным проведение биопсии почки —
особенно при повышенном уровне креати-
нина и давности болезни более 2 лет. Более
высокую эффективность можно предполо-
жить при МН, МПГН и МКГН, более низ-
кую — при ФСГС- и ФП-вариантах ГН;
однако решающее значение имеет степень
активности иммуновоспалительного процес-
са: при всех морфологических вариантах
выживаемость выше при индексе активнос-
ти > 4;
• для достижения эффекта (у больных, потен-
циально чувствительных к ЦФА) необходи-
мо длительное активное лечение (не менее
6,0 г ЦФА в течение 6 мес и более). Недо-
статочное лечение резко ухудшает прогноз,
особенно при повышенном уровне креати-
нина. При этом дополнительное к ЦФА на-
значение ПЗ существенного влияния на вы-
живаемость не оказывало.
• положительный ответ больного к концу кур-
са лечения (полная или частичная ремис-
сия) — показатель хорошего отдаленного
прогноза, отсутствие непосредственного от-
вета делает маловероятным хороший про-
гноз.
Хлорбутин. Назначают в дозе 0,1—0,2 мг/кг в
день, время полувыведения составляет 1 ч, и он
полностью метаболизируется. Хлорбутин действу-
ет медленнее, чем циклофосфамид, и связанная
с ним супрессия костного мозга развивается не
так быстро и более обратима. Побочные эффек-
ты включают в себя желудочно-кишечные рас-
стройства и недостаточность гонад. Более редкие
побочные эффекты: легочный фиброз, судорож-
ные припадки, дерматит и токсическое пораже-
ние печени. Опухоли развиваются реже, чем при
лечении циклофосфамидом.
У молодых мужчин предпочтителен цикло-
фосфамид (менее гонадотоксичен, чем хлорбу-
тин) в дозе < 2 мг/кг; у женщин и пожилых
мужчин — хлорбутин (яичники менее чувстви-
тельны к токсическому действию алкилирую-
щих препаратов) в дозе 0,15 мг/кг.
9.6.3.2. Антиметаболиты
Азатиоприн. Азатиоприн — аналог пуринового
основания гипоксантина — является производ-
ным 6-меркаптопурина. Метаболиты азатиопри-
на ингибируют ферменты, необходимые для
синтеза ДНК, поэтому подавляют любой им-
мунный ответ, который требует клеточного де-
ления. Азатиоприн принимают в дозе 1—3 мг/кг
в день, причем дозу подбирают таким образом,
чтобы поддерживать число лейкоцитов в кро-
ви не ниже 5000 кл/мкл. Главным побочным
эффектом является супрессия костного мозга,
особенно нейтропения с развитием инфекций.
К другим осложнениям относятся анемия,
тромбоцитопения, гепатит, дерматит, стоматит,
алопеция, желудочно-кишечные расстройства и
повышенный риск развития опухолей, особен-
но рака кожи и лимфом.
В целом по сравнению с циклофосфамидом
азатиоприн действует менее активно на почеч-
ное воспаление и вызывает меньше тяжелых
осложнений. У больных с признаками почечной
недостаточности азатиоприн не рекомендуется
назначать вместе с аллопуринолом, который
блокирует его инактивацию.
9.6.4. Селективные
иммунодепрессанты
Циклоспорин А. Циклоспорин А (ЦсА) — цик-
лический полипептид грибкового происхожде-
ния — синтезирован в 1980 г. Из организма
элиминируется печенью через желчные пути.
Влияние ЦсА на иммунный ответ обусловлено
подавлением не только активности Т-хелперов
в момент представления антигена, но и про-
дукции ИЛ-2, пролиферации цитотоксических
Т-клеток, а также косвенно (через подавление
Т-клеток) активации В-клеток. На уже развив-
шийся антительный ответ ЦсА эффекта не ока-
зывает.
Наибольший опыт применения ЦсА накоп-
лен при почечной трансплантации. Последние
годы его применяют для лечения резистентно-
го к стероидам нефротического синдрома, при-
чем для предотвращения нефротоксического
эффекта назначают более низкие дозы, чем при
почечной трансплантации. По некоторым дан-
ным, в отличие от больных с трансплантиро-
ванной почкой эффективность ЦсА у больных
ГН не так четко связана с концентрацией пре-
парата в плазме крови.
В настоящее время результаты исследований
подтверждают, что ЦсА может быть альтерна-
тивным методом лечения больных ГН с резис-
тентным к стероидам или зависимым от сте-
роидов нефротическим синдромом. Главным об-
разом это больные с минимальными измене-
ниями (МИ) (липоидным нефрозом) и фо-
кально-сегментарным гломерулосклерозом
(ФСГС), в патогенезе которых играет роль ги-
перпродукция лимфокинов, подавляемая ЦсА.
Частота положительных результатов лечения
составляет при МИ около 80 %, при ФСГС —
50 %. В наших наблюдениях лечение ЦсА сопро-
вождалось ремиссией у 20 из 25 больных со
стероидозависимым и стероидорезистентным
НС [Тареева И.Е., Краснова Т.Н., 1999].
Перед лечением обязательно проведение
биопсии почки: склероз интерстиция, атрофия
канальцев или поражение сосудов препятству-
ют назначению ЦсА. У больных старше 60 лет
препарат повышает риск развития опухолей.
Начальная доза ЦсА в день для взрослых со-
ставляет 5 мг/кг, для детей — 6 мг/кг. В зависи-
мости от морфологии ГН снижение протеину-
рии обычно наблюдается в течение 1—
3 мес. Уровень ЦсА в крови не всегда коррели-
рует с эффективностью лечения, но полезен для
контроля за четкостью приема препарата боль-
ным и обнаружения возможного взаимодействия
ЦсА с другими лекарствами. Обязателен конт-
роль функции почек: повышение уровня креа-
тинина на 30 % по отношению к исходному тре-
бует снижения дозы ЦсА на 30—50 %.
Наиболее серьезные побочные эффекты —
нефротоксичность, которая зависит от дозы
и обычно обратима, и развитие артериаль-
ной гипертонии, что связывают со спазмом
афферентной артериолы клубочков.
Другие побочные явления — гипертрихоз,
гипертрофия десен (при последней помогает
азитромицин, возможно, и метронидазол).
Нефротоксичность циклоспорина при его
длительном приеме вызывает особое беспокой-
ство, так как клинически ее часто бывает труд-
но оценить. Непрерывный прием циклоспори-
на в течение 12—38 мес сопровождается суще-
ственным нарастанием тубулоинтерстициально-
го фиброза [Meyrier A. et al., 1994]. При этом
тяжесть тубулоинтерстициального фиброза в
повторных биопсиях коррелирует с количеством
клубочков с сегментарным склерозом в первой
биопсии, уровнем креатинина в момент про-
ведения первой биопсии, а также с дозой цик-
лоспорина, превышающей 5,5 мг/кг в день.
Развитие нефротоксичности может быть клини-
чески не заметно, так как прямой корреляции
251
между тяжестью структурных повреждений и
состоянием почечной функции нет. Для предот-
вращения нефротоксичности необходимо адек-
ватное потребление жидкости и исключение,
насколько возможно, других нефротоксических
препаратов, особенно нестероидных противо-
воспалительных, так как у больных с гипово-
лемией блокада выработки простагландинов
может резко ухудшить почечный кровоток.
После отмены ЦсА возможен рецидив не-
фротического синдрома и стероидозависимый
нефротический синдром может превратиться в
ЦсА-зависимый. Однако больные с осложнени-
ями стероидной терапии довольно хорошо пе-
реносят ЦсА.
Такролимус (FK-506) и микофенолат-мофетил.
В настоящее время предпринимаются попытки
применения в нефрологии новых иммунодеп-
рессантов — такролимуса и микофенолат-мо-
фетил а.
Такролимус (FK-506) — по механизму дей-
ствия близок к ЦсА, относительно селективно
подавляет CD4 Т-хелперы, возможно, несколь-
ко сильнее подавляет высвобождение цитоки-
нов; не исключено тормозящее действие на
продукцию фактора сосудистой проницаемос-
ти. В эксперименте введение FK-506 предупреж-
дало развитие аутоиммунного нефрита у крыс
|Nakahama К. et al., 1999].
Микофенолат-мофетил — ингибитор инозин
монофосфат дегидрогеназы, истощающий запа-
сы гуанозиновых нуклеотидов в клетках, селек-
тивно ингибирует пролиферацию Т- и В-лим-
фоцитов, продукцию антител и образование
цитотоксических Т-лимфоцитов. Кроме того,
ингибирует гликозилирование адгезивных мо-
лекул, что может влиять на приток лимфоци-
тов в места воспаления в отторгаемых транс-
плантатах. Применяют в основном в трансплан-
тологии. Подавляет в культуре ткани пролифе-
рацию мезангиальных клеток крысы и челове-
ка без развития клеточного некроза или апо-
птоза [Hauser I.A. et al., 1999].
Клинические наблюдения при ГН пока еди-
ничны. Так, F.Schweda и соавт. (1997) добились
ремиссии при лечении такролимусом молодой
женщины с минимальными изменениями клу-
бочков и НС, резистентным к ГК и ЦсА; ле-
чение в течение 20 мес без видимых побочных
явлений. M.Choi и соавт. (1997) использовали
микофенолат-мофетил для лечения 8 больных
со стероидо- или ЦсА-зависимым НС (с раз-
личной морфологической основой); состояние
улучшилось у 6 больных.
В эксперименте блокада любого из трех ци-
токинов, играющих основную роль в развитии
почечного повреждения (ИЛ-1, ФНО, МИФ),
значительно подавляла ГН с полулуниями [Lan
H.G. et al., 1998].
252
9.6.5. Сочетанные схемы лечения
Среди сочетанных схем лечения наиболее рас-
пространены схемы лечения ГК с цитостати-
ками, а также так называемая 4-компонентная.
ГК в сочетании с различными цитостатика-
ми можно назначать перорально, а также па-
рентерально. Так, например, проводят пульс-
терапию метилпреднизолоном с последующим
пероральным приемом преднизолона и цито-
статиков, пульс-терапию ЦФА и метилпредни-
золоном. Мы применяем следующие сочетанные
схемы пульс-терапии: в 1-й день внутривенно
вводят 800—1200 мг ЦФА и 1000 мг метил-
преднизолона или преднизолона, два последу-
ющих дня — только метилпреднизолон или
преднизолон.
Своеобразная схема приема с чередованием
ГК и цитостатиков предложена C.Ponticelli и
соавт. (1984). В течение первых 3 дней 1-го ме-
сяца лечения внутривенно вводят метилпредни-
золон (по 1000 мг), последующие 27 дней ме-
тилпреднизолон ежедневно перорально в дозе
0,4 мг/кг, т.е. 28 мг при массе тела 70 кг; 2-й
месяц лечения больной принимает только хлор-
бутин в достаточно высокой дозе — 0,2 мг/кг
в сутки, т.е. 14 мг при массе тела 70 кг. Этот
2-месячный цикл повторяют 3 раза, общая дли-
тельность лечения составляет 6 мес.
Шестимесячная терапия метилпреднизолоном
и хлорбутином [Ponticelli С. et al., 1995]
А. Месяцы 1-й, 3-й, 5-й
Метилпреднизолон — 1000 мг внутривенно в те-
чение 3 дней с последую-
щим приемом преднизо-
лона внутрь, 0,5 мг/кг в
день — в течение 27 дней
В. Месяцы 2-й, 4-й, 6-й
Хлорбутин — 0,2 мг/кг в день — в тече-
ние 30 дней
Рекомендации
В/в метилпреднизолон — доза может быть снижена
до 500 мг на пульс у боль-
ных с массой тела <50 кг.
Хлорбутин — доза должна быть сниже-
на до 0,1 мг/кг в день при
уровне лейкоцитов <5000
кл/мм3 и полностью отме-
нена при уровне <3000 кл/
мм3.
Возможные модификации:
Хлорбутин показан в дозе <0,1 мг/кг в день
— у молодых мужчин для предотвращения азо-
оспермии
— у больных, у которых после 1-го месяца лече-
ния развилась лейкопения
В 1968 г. Р.Kincaid-Smith предложила соче-
тать при лечении БПГН иммунодепрессанты
(преднизолон и цитостатики) с антикоагулян-
тами (гепарин с последующей заменой его вар-
фарином — фенилином) и антиагрегантами
(дипиридамол по 400 мг/сут). В дальнейшем
такое сочетание стали называть 4-компонент-
ной схемой. Применяют также аналогичные
схемы, где вместо ЦФА назначают хлорбутин
[Ратнер М.Я. и др., 1985, 1987]. Кроме того,
предложена модифицированная схема: в тече-
ние 8 нед назначают преднизолон в дозе 60 мг/
сут, азатиоприн по 2 мг/кг в сутки, дипирида-
мол по 10 мг/кг в сутки, гепарин — в дозе,
вызывающей удвоение тромбинового времени.
Затем в течение года продолжают лечение аза-
тиоприном и дипиридамолом в этих же дозах,
а гепарин заменяют фенилином (в дозе, вызы-
вающей удвоение протромбинового времени).
Рекомендуются аналогичные схемы без предни-
золона [Kincaid-Smith Р., 1972; Zimmerman N.
et al., 1983].
Предлагаются значительно более сложные
схемы. Например, W.Griswold (1987) успешно
лечил детей с ФСГС следующим образом. В
начале лечения 1 раз через день внутривенно
вводили метилпреднизолон в дозе 30 мг/кг
(максимально 1000 мг), затем внутрь назнача-
ли метилпреднизолон в дозе 2 мг/кг с внутри-
венным его введением в следующем ритме: в
течение 2 мес —1 раз в неделю; в течение сле-
дующих 2 мес — 1 раз в 2 нед; в течение сле-
дующих 8 мес — 1 раз в месяц. У 3 из 7 боль-
ных развилась длительная ремиссия, остальным
4 после недостаточно успешного лечения были
добавлены алкилирующие препараты, что по-
зволило добиться ремиссии.
Схемы, включающие плазмаферез, будут
рассмотрены в разделе «Лечение БПГН».
У некоторых больных с медленно прогрес-
сирующей почечной недостаточностью агрес-
сивное лечение кортикостероидами и/или ци-
тостатиками может улучшить функцию почек.
В то же время больные с почечной недостаточ-
ностью более чувствительны к побочному дей-
ствию иммунодепрессантов. В связи с этим ле-
чение следует применять только при реальных
шансах получить улучшение.
9.6.6. Другие (неиммунные) методы
лечения нефритов
За последнее десятилетие значительно расши-
рились возможности неиммунного воздействия
на прогрессирование ГН в соответствии с но-
выми представлениями о неиммунных механиз-
мах прогрессирования. На современном этапе
можно говорить о четырех методах нефропро-
тективной терапии, влияние которых на про-
грессирование ГН доказано или изучается. Это:
• ингибиторы ангиотензинпревращающего
фермента (АПФ),
• гепарин,
• дипиридамол,
• гиполипидемические препараты.
Обсуждается влияние и других неиммунных
методов лечения (нестероидные противовоспа-
лительные препараты и др.).
Ингибиторы АПФ. Ингибиторы АПФ
(иАПФ) известны в первую очередь как анти-
гипертензивные препараты. АПФ тормозит пре-
вращение малоактивного ангиотензина I в ан-
гиотензин II (АТП). Кроме того, АПФ разру-
шает кинины — тканевые сосудорасширяющие
гормоны. Ингибиция АПФ блокирует систем-
ный и органный синтез АТП и накапливает в
циркуляции и тканях кинины. По существу
любая антигипертензивная терапия благопри-
ятно влияет на течение ГН. Однако действие
иАПФ при ГН не ограничивается снижением
системного АД. Локальнопочечный АТП сужа-
ет просвет эфферентной артериолы, что при-
водит к развитию внутриклубочковой гипертен-
зии — одной из главных причин неиммунного
прогрессирования ГН; соответственно блокада
АТП способствует расширению эфферентной
артериолы и уменьшению внутриклубочковой
гипертензии.
В последние годы стали известны и другие
механизмы, способствующие нефропротектив-
ному действию иАПФ: торможение роста кле-
ток и образования проколлагена, тем самым —
торможение развития склероза клубочков и
интерстиция, уменьшение пролиферации ме-
зангиальных и канальцевых клеток. Кроме того,
в последние годы доказана способность иАПФ
тормозить прохождение макромолекул в мезан-
гий и снижать протеинурию.
Хотя теоретически антипротеинурическое
действие иАПФ может быть следствием сниже-
ния системного артериального давления и рас-
ширения эфферентных артериол, более веро-
ятная причина — изменение проницаемости
клубочка для макромолекул |Heeg J. et al., 1991].
Антипротеинурическое действие иАПФ зависит
от дозы препарата, длительности лечения и
низкого потребления натрия. Установлено, что
лизиноприл в дозе 5 мг снижал протеинурию
на 27 %, а в дозе 10 мг — почти на 63 % [Heeg
J. et al., 1989]. У большинства больных суще-
ственное и устойчивое снижение протеинурии
наблюдается только после нескольких недель
лечения. Более эффективны иАПФ длительно-
го действия (эналаприл, лизиноприл, рамип-
рил). В наших наблюдениях протеинурия снизи-
лась у 43 из 57 больных, леченных иАПФ; к
253
ТИИ"
концу первого месяца лечения протеинурия
снизилась с 5,6±0,5 до 4,2±0,3 г/сут, к 3-му —
до 3,9+0,4 г/сут и к 6-му — до 3,8±0,4 г/сут.
Антипротеинурический эффект иАПФ про-
является при ограничении приема натрия, уси-
ливается при резком его ограничении. При пло-
хой переносимости низкосолевой диеты ее
можно заменить приемом мочегонных. Так, по
данным H.Buter и соавт. (1998), наибольший
антипротеинурический эффект наблюдали при
ограничении натрия в пище до 50—100 mEq/
день, антипротеинурическое действие исчеза-
ло при суточном потреблении натрия 200 mEq;
добавление на этом фоне гипотиазида снова
снизило протеинурию.
Имеются данные, что степень антипротеи-
нурического действия иАПФ может быть свя-
зана с полиморфизмом гена АПФ; в наших
наблюдениях после 3 мес лечения 28 больных
ХГН иАПФ и блокаторами рецепторов АТП
протеинурия снизилась только у лиц с II- и ID-
генотипами АПФ и не снизилась у больных с
DD-генотипом; через 6 мес лечения антипро-
теинурический эффект был одинаковым во всех
группах (Кутырина И.М. и др., 1999].
Сочетание этих многообразных эффектов
свидетельствует о том, что иАПФ при длитель-
ном применении тормозят прогрессирование
гломерулонефрита, что было установлено сна-
чала на экспериментальных моделях, а затем и
в клинической практике. Замедление прогрес-
сирования ХГН подтверждено и в нескольких
больших многоцентровых контролируемых ис-
пытаниях. Так, в исследовании AIPRI (АСЕ
Inhibition in the Progression of Renal Impairment,
1996) длительное (в течение 3 лет) примене-
ние беназеприла снижало на 50 % риск удвое-
ния креатинина сыворотки.
Таким образом, иАПФ (каптоприл, эналап-
рил, рамиприл, фозиноприл и др.) являются
препаратами выбора при гипертонических ва-
риантах нефрита. Кроме того, показанием для
назначения иАПФ при ХГН является наличие
протеинурии (в отсутствие высокой активнос-
ти ГН, требующей иммуносупрессии). По су-
ществу для замедления прогрессирования забо-
левания иАПФ показаны всем больным ХГН,
не имеющим противопоказаний к их назначе-
нию.
Уровень протеинурии позволяет выделить
больных, которые более других выиграют от ре-
нопротективного лечения. Так, в исследовании
MDRD чем выше была протеинурия, тем луч-
ше было влияние контроля гипертонии на про-
грессирование; в исследовании AIPRI при при-
менении беназеприла лучшие результаты в
смысле удлинения времени удвоения креатини-
на были у больных с протеинурией выше 3 г/
сут; в исследовании REIN среди больных с
254
протеинурией выше 3 г/сут рамиприл в самой
высокой степени замедлял падение КФ и сни-
жал риск развития ТПН. Влияние иАПФ на
прогрессирование в большой степени зависит
от их влияния на протеинурию [Gansevoort R.T.
et al., 1995; Remuzzi G. et al., 1997].
На практике для получения максимального
антипротеинурического действия иАПФ необ-
ходимо проинструктировать больного о необ-
ходимости ограничения натрия; начинать лече-
ние с небольших доз препарата (например,
2,5—5,0 мг эналалрила) для проверки перено-
симости и постепенно увеличивать дозу до мак-
симально переносимой (до 10—20 мг), регуляр-
но контролируя уровни креатинина и калия сы-
воротки, риск повышения которых особенно
высок у больных с исходно сниженной функ-
цией почек. Оценить эффективность можно
только после нескольких месяцев непрерывно-
го лечения.
Осложнения терапии иАПФ в нефроло-
гической практике: повышение уровня не толь-
ко креатинина сыворотки (в первые 1—2 нед
лечения обычно преходящее), но и калия сы-
воротки, гипотония, крапивница, отек Квин-
ке, кашель, лейкопения (последняя чаще при
приеме каптоприла, содержащего SH-rpynny).
Противопоказания: выраженная по-
чечная недостаточность (креатинин сыворотки
выше 5—6 мг/дл), гиперкалиемия, стеноз по-
чечной артерии обеих почек, выраженная сер-
дечная недостаточность. В этих ситуациях иАПФ
могут привести к быстрому падению функции
почек. Осторожно надо относиться к назначе-
нию этих препаратов больным ХГН пожилого
возраста. Напомним, что иАПФ противопока-
заны беременным.
Близкими иАПФ общими эффектами (за
исключением антикининового) обладают бло-
каторы рецепторов к ангиотензину II (лозар-
тан, ирбезартан и др.), однако их нефропро-
тективные возможности пока четко не доказа-
ны [McLaughlin К., Jardine А., 1999]. В экспе-
рименте В.Brenner и соавт. (1998) не выявили
различий в действии эналаприла, лозартана или
их сочетания у крыс с субтотальной нефрэк-
томией.
Гепарин. Гепарин представляет собой неодно-
родную смесь гликозаминогликанов с молеку-
лярной массой от 1 до 40 кДа, обладающих
разной антикоагулянтной активностью. Фраг-
менты и фракции гепарина с молекулярной
массой более 10 кДа, имеющие в составе бо-
лее 18 сахарных остатков, связываются с ан-
титромбином III и ингибируют практически все
факторы свертывания крови, главным образом
тромбин и Ха-фактор.
В нефрологической практике гепарин стали
использовать в конце 60-х годов в связи с его
способностью подавлять процессы внутрисосу-
дистой, в том числе внутригломерулярной, ко-
агуляции. Гепарин реализует противотромботи-
ческое действие, влияя не только на плазмен-
ные, но и на сосудистые факторы тромбооб-
разования. Так, он тормозит адгезию и агрега-
цию тромбоцитов; оказывает профибринолити-
ческое действие, усиливая секрецию активато-
ра плазминогена тканевого типа из эндотелия
сосудистой стенки в кровоток, влияет на рео-
логические свойства крови, способствуя увели-
чению кровотока в сосудах. Кроме того, гепа-
рин стимулирует синтез сосудистой стенкой эн-
догенного антикоагулянта — гепарансульфата.
Влияние на процессы тромбообразования —
не единственное свойство гепарина, оправды-
вающее его применение в нефрологической
практике. Установлено, что он оказывает диу-
ретическое и натрийуретическое действие, в
механизме которого ведущая роль принадлежит
подавлению гепарином продукции альдостеро-
на [Кутырина И.М. и др., 1985]. Гепарин ока-
зывает гипотензивное действие, связанное как
со стимуляцией высвобождения цГМФ и оксида
азота (NO), так и со снижением продукции
эндотелина эндотелиальными клетками и ме-
зангиальными клетками почек [Mandal А.К.,
1995]. Кроме того, оказывает антипротеинури-
ческое действие, являясь полианионом и сти-
мулируя синтез отрицательно заряженного ге-
парансульфата, восстанавливая утраченный
базальной мембраной отрицательный заряд и
уменьшая ее проницаемость для молекул бел-
ка. Гепарин влияет на нарушения липидного
обмена, являющиеся самостоятельным факто-
ром повреждения почечной ткани, оказывает
антикомплементарное действие, препятствую-
щее образованию иммунных комплексов.
Нефракционированный гепарин назначают
подкожно в дозе 15 000—40 000 ЕД/сут, в ред-
ких случаях — 50 000—60 000 ЕД/сут. Обычно
суточную дозу делят на 3—4 введения; доза счи-
тается адекватной, если спустя 4—5 ч после
подкожного введения время свертывания кро-
ви увеличивается в 2—3 раза по сравнению с
исходным, а активированное частичное тром-
бопластиновое время (АЧТВ) — в 2 раза. Для
достижения диуретического и гипотензивного
эффекта доза гепарина в 25 000—30 000 ЕД/сут,
как правило, бывает достаточной. Обычно курс
лечения гепарином составляет 6—8 нед; при
необходимости лечение может быть продолже-
но до 3—4 мес. Во избежание реактивной ги-
перкоагуляции (рикошетное действие), особен-
но опасной при внезапной отмене гепарина,
препарат следует отменять медленно (в течение
6—8 дней), постепенно уменьшая разовую дозу,
но не сокращая число инъекций. После окон-
чания лечения рекомендуется на 2—3 мес при-
ем антикоагулянтов непрямого действия (фени-
лин).
Несмотря на многогранные свойства гепари-
на, его эффективное использование затрудне-
но в связи с высокой частотой побочных явле-
ний, главным образом кровотечений. При сред-
них дозах гепарина (15 000—20 000 ЕД/сут)
геморрагические осложнения возникают у 5—
10 % больных, при больших дозах (более 40 000
ЕД/сут) — в 10—30 % случаев. Помимо крово-
течения, лечение может осложниться аллерги-
ческими реакциями (сыпь, головная боль,
миалгия, повышение температуры тела); иног-
да наблюдается синдром селективного гипоаль-
достеронизма с гиперкалиемией [Никишова Т.А.
и др., 1987]; могут развиться остеопороз, тром-
боцитопения иногда с тромбозами.
Непостоянство клинического эффекта, вы-
сокий риск геморрагических осложнений, не-
обходимость строгого лабораторного контроля
за терапией способствовали снижению интереса
к гепарину в нефрологической практике. Однако
в течение последних десятилетий синтезирова-
ны гепарины с низкой молекулярной массой
(НМГ), в том числе и для перорального при-
менения, обладающие рядом преимуществ по
сравнению с обычным нефракционированным
гепарином. Низкомолекулярные (1—8 кДа)
фракции гепарина связываются с антитромби-
ном III, угнетают преимущественно Ха-фактор
свертывания и практически не ингибируют
тромбин. Именно этим свойством низкомоле-
кулярных фракций гепарина можно обьяснить
их противотромботическое действие без выра-
женной антикоагулянтной и геморрагической
активности.
Действие НМГ не зависит от исходного
уровня антитромбина III в плазме, они обла-
дают лучшей биодоступностью, быстро всасы-
ваются из депо, имеют больший период полу-
выведения. НМГ вводят 1—2 раза в сутки под-
кожно или внутримышечно. Контроль за тера-
пией НМГ осуществляют на основании анти-
Ха-фактора активности, хотя определять ее
необязательно, особенно при небольших дозах
препарата (50—60 анти-Ха ЕД на 1 кг массы
тела в сутки). При лечении НМГ требуется
меньшее количество инъекций в сутки, облег-
чен лабораторный контроль за терапией, что
позволяет назначать их амбулаторно и на дли-
тельный срок. Широких клинических исследо-
ваний по применению НМГ при ГН пока не
проводили, однако показана их возможность
снижать протеинурию у больных пролифератив-
ным ГН [Morita Y., 1994], а также благоприят-
ное действие при диабетической нефропатии
[Шестакова М.В., 1997]. Изучается возможность
применения в нефрологии и других гепарино-
идов, лишенных антикоагулянтных свойств, в
255
том числе пентозан полисульфата — олигоса-
харида растительного происхождения, умень-
шающего у крыс с 5/б нефрэктомией внутри-
клубочковую гипертензию и протеинурию
[Striker G.E., 1999].
Появление НМГ, а также получение новых
экспериментальных данных, свидетельствующих
о нефропротективных свойствах гепаринов и гли-
козаминогликанов, возрождают интерес нефро-
логов к этой группе препаратов. На эксперимен-
тальных моделях установлено, что гепарин не-
зависимо от его антикоагулянтного действия,
замедляет прогрессирование нефрита; кроме
того, он снижает пролиферацию мезангиальных
клеток, экспрессию гена коллагена IV типа и
трансформирующего фактора роста 0,, влияет на
синтез и состав внеклеточного матрикса, а так-
же на внутриклубочковую гипертензию.
Дипиридамол. Дипиридамол был предложен
для лечения нефрологических больных одновре-
менно с гепарином. Основанием для его при-
менения явилось антиагрегантное, антитромбо-
цитарное действие препарата. Дипиридамол
способствует повышению содержания цАМФ в
тромбоцитах, препятствующего их адгезии и аг-
регации, а также стимулирует выработку в со-
судистой стенке простациклина — мощного ан-
тиагреганта и вазодилататора. В дальнейшем
была показана его способность умеренно сни-
жать протеинурию и гематурию, а также тор-
мозить ухудшение функции почек. В последние
годы выявлены новые нефропротективные
свойства дипиридамола, в том числе его анти-
оксидантное действие.
Дипиридамол применяют при ГН, сочетая
его с другими препаратами, например ацетил-
салициловой кислотой [Donadio А., 1984], ге-
парином и иммунодепрессантами, и в виде мо-
нотерапии. Особенно широко проводят лечение
ГН дипиридамолом японские нефрологи. Ши-
рокому применению способствуют хорошая пе-
реносимость препарата (хотя возможны силь-
ная головная боль и покраснение лица) и от-
сутствие серьезных побочных явлений. Препа-
рат широко используют в акушерской практи-
ке для профилактики неблагоприятных акушер-
ских исходов беременности у женщин групп
риска, поэтому он особо может быть рекомен-
дован беременным с ХГН (в сочетании с аце-
тилсалициловой кислотой или без нее).
В нефрологической практике дипиридамол
показан в больших дозах — 225—400 мг и даже
600 мг в сутки. Из-за возможных головных бо-
лей лечение начинать лучше с небольшой дозы,
постепенно ее увеличивая (по 25 мг в сутки
каждые 3—4 дня).
Гиполипидемическая терапия. При экспери-
ментальных моделях прогрессирующих пораже-
ний почек антилипемические воздействия —
256
гипохолестериновая диета, а также различные
антигиперлипидемические медикаментозные
средства — фибраты, пробукол, статины (ин-
гибиторы гидроксиметилглутарил-коэнзим А
[ГМ Г-Ко А]-редуктазы, снижающие синтез хо-
лестерина в печени) — замедляют потерю фун-
кции и предупреждают развитие гломерулоск-
лероза [Kasiske В. et al., 1988; Keane W. et al.,
1989; Kim J., Choi I., 1992].
W.Keane и соавт. (1989) установили, что
терапия ловастатином у гипертензивных крыс
Dahl уменьшала альбуминурию и выраженность
фокального гломерулосклероза. Аналогичные
результаты были получены В.Kasiske с соавт.
(1988) при использовании клофибровой кис-
лоты и ловастатина у крыс Zucker, а также
J.Kim, I.Choi (1992) при лечении ловастатином
крыс с ФСГС, индуцированным аминонукле-
озидом пуромицина. M.Mune и соавт. (1993) при
лечении пробуколом крыс с эксперименталь-
ной ХПН, находившихся на гиперхолестерино-
вой диете, наблюдали снижение холестерина и
креатинина сыворотки, протеинурии, количе-
ства апоВ депозитов и выраженности гломеру-
лосклероза.
Установлено, что эффект гиполипемических
веществ связан с опосредованным снижением
уровня липидов в крови, уменьшением отло-
жения липидов в ткани почек с последующим
уменьшением пролиферации мезангиальных
клеток и накопления мезангиального матрикса.
Кроме того, в результате снижения содержания
циркулирующих липопротеинов уменьшается и
содержание их окисленных форм, а также выс-
вобождение факторов роста, привлекается
меньше моноцитов, меньше образуется пенис-
тых клеток.
Положение о роли липидов в прогрессиро-
вании нефропатий привело к новым диетичес-
ким рекомендациям и к применению гиполи-
пидемической терапии в клинике. В настоящее
время больным ХГН, особенно при НС с ги-
перхолестеринемией, рекомендуется ограничи-
вать животные жиры, обогащение диеты поли-
ненасыщенными жирными кислотами (ПНЖК)
классов омега-3 и омега-6, а также содержащие
ПНЖК медикаментозные средства. Показана
гиполипидемическая диета, содержащая менее
200 мг/день холестерина, в которой общие
жиры дают менее 30 %, а полиненасыщенные
жирные кислоты — около 10 % общего числа
калорий, и позволяющая снизить уровень хо-
лестерина на 15—20 %. Более строгое, особен-
но длительное, ограничение больные перено-
сят плохо. Более эффективной в коррекции ги-
перлипидемии оказалась вегетарианская диета
(соя с добавлением эссенциальных аминокис-
лот), также несколько снижающая протеину-
рию [D’Amico G. et al., 1992].
W.Clark и соавт. (1990) показали, что ПНЖК
серии омега-3 у крыс с субтотальной нефрэк-
томией замедляли прогрессирование поражения
почек в большей степени, чем низкобелковая
диета. Обсуждается благоприятное влияние ры-
бьего жира на течение ХГН, в том числе IgA-
нефропатии.
За последние 10 лет проведено очень много
экспериментальных исследований, а клиничес-
кие немногочисленны. G.Fuiano и соавт. (1992)
при лечении больных с мембранозной нефро-
патией и НС правастатином в течение 6 нед
наблюдали увеличение почечного плазмотока и
СКФ. A.Gonzalo и соавт. (1994) описали ремис-
сию НС у больного с мембранозной нефропа-
тией после 6 мес приема ловастатина, причем
предшествовавшая этому 7-месячная терапия хо-
лестирамином не оказала влияния ни на уровень
холестерина сыворотки, ни на протеинурию.
Мы изучили эффективность длительной ги-
полипидемической терапии у 20 больных хро-
ническим ГН с НС; группу сравнения соста-
вили 20 больных, аналогичных по клинической
и морфологической картине и предшествовав-
шей терапии [Тареева И.Е. и др., 1995; Neverov
N.I. et al., 1997]. У всех больных до начала ле-
чения отмечали гиперлипидемию с увеличени-
ем холестерина сыворотки более 250 мг/дл в
сочетании с выраженной протеинурией с фор-
мированием НС у 18 больных в основной группе
и у 18 в контрольной, у 7 больных (и у 5 в
контрольной группе) уровень креатинина был
повышен от 1,6 до 3,7 мг/дл, у 7 (и соответ-
ственно у 6 в контрольной группе) повышено
АД. Морфологическая картина была представ-
лена у половины больных в обеих группах тя-
желыми морфологическими вариантами (вклю-
чая ФСГС у 6, нефросклероз у 2 и мезангио-
капиллярный ГН у 2 в каждой группе). Лече-
ние включало в себя диету и прием ингибито-
ра ГМГ-КоА редуктазы ловастатина. Диета со-
держала нормальное количество белка (1,1 - 1,2
г/кг в сутки), мало холестерина (менее 200—
300 мг/сут) и была богата ПНЖК серий оме-
га-3 (морская рыба) и омега-6 (подсолнечное
масло). Ловастатин назначали в дозах от 0,02 до
0,06 г в сутки. Лечение было длительным (от 7
мес до 1 года), больные переносили его удов-
летворительно и это привело к достоверному
снижению не только концентрации в крови хо-
лестерина, но и протеинурии (с 12,53 до 4,15
г/сут), а также к достоверному увеличению со-
держания альбумина сыворотки (с 2,64 до
3,78 г/дл). У 9 больных наступила ремиссия НС,
у 3 — нормализация уровня креатинина. В кон-
трольной группе достоверных изменений кли-
нических и лабораторных параметров за время
наблюдения не выявлено. Таким образом, на-
стойчиво проводимая гиполипидемическая те-
рапия существенно повлияла на прогрессиро-
вание нефрита.
Больные с НС обычно хорошо переносят
лечение ингибиторами ГМГ-КоА, однако в
первые месяцы лечения возможно небольшое
и преходящее нарастание уровня трансаминаз.
В редких случаях статины могут вызывать раб-
домиолиз с ОПН, частота которого повыша-
ется при одновременном приеме циклоспори-
на, фибратов, никотиновой кислоты, эритро-
мицина, поэтому рекомендуется регулярно кон-
тролировать уровень КФК. При ХПН доза ло-
вастатина должна быть менее 20 мг.
Из других гиполипидемических препаратов
применяют пробукол, никотиновую кислоту,
ионообменные смолы, фибраты. Пробукол не
очень эффективен и снижает не только ЛНП,
но и ЛВП. Никотиновая кислота заметно сни-
жает уровни всех циркулирующих атерогенных
липопротеинов. Однако лекарственная форма,
быстро выделяющая препарат, неприятно рас-
ширяет кожные сосуды; медленно высвобожда-
ющийся препарат приводит к незначительно-
му покраснению кожи, но при этом даже в
умеренных дозах сохраняются раздражение же-
лудка и гепатотоксичность. Ионообменные смо-
лы неприятны при употреблении внутрь, час-
то вызывают абдоминальный дискомфорт и на-
рушают всасывание жирорастворимых витами-
нов и других лекарств. Фибраты, такие, как
клофибрат, безафибрат и гемфиброзил, в боль-
шей степени снижают триглицериды (уровень
которых у больных НС может быть в норме),
чем холестерин. У больных с НС клофибрат
может способствовать появлению рабдомиоли-
за с острой почечной недостаточностью. Фиб-
раты могут вызвать миопатию и камни желч-
ного пузыря.
Применяют и экстракорпоральные методы
лечения нефротической гиперлипидемии.
M.Mune и соавт. (1990) у 3 больных с ФСГС про-
вели по 6 сеансов ЛНП-афереза, через 3 нед
наблюдали снижение протеинурии у 2 и увели-
чение СКФ — у 1. E.Muso и соавт. (1992), про-
ведшие от 2 до 12 сеансов ЛНП-афереза у 6
больных с ФСГС и у 3 с мембранозной нефро-
патией, отметили у 5 больных достоверное сни-
жение протеинурии и повышение протеинемии,
а также уменьшение количества гломерулярных
апоВ-депозитов. C.Faucher и соавт. (1998) доби-
лись ремиссии НС после 10 сеансов ЛНП-афе-
реза у 43-летнего больного с ФСГС, рефрактер-
ного к лечению ПЗ и симвастатином.
Нестероидные противовоспалительные препа-
раты (НСПВП). НСПВП, обладая выраженным
антипротеинурическим свойством, применяв-
шиеся широко в нефрологии (в том числе и
нами) в 70—80-х годах XX в., могут снизить
протеинурию на 50 % и более [Мухин Н.А. и
17—2950
257
др., 1978; Vriesendorp R., 1985; Wong D. et al.,
1986]. Действие препаратов объясняется сниже-
нием не только проницаемости клубочковых
капилляров для белковых молекул, но и дав-
ления внутри капилляров, а также уменьшени-
ем фильтрационной поверхности капилляров.
Особенно выражено антипротеинурическое дей-
ствие у индометацина. Однако у больных с за-
болеваниями почек НСПВП часто вызывают
осложнения, связанные с их локальным почеч-
ным действием: гиперкалиемию, задержку на-
трия (особенно у больных с НС), ухудшение
ответа на диуретики и течения артериальной
гипертензии. Особенно опасно развитие гемо-
динамически обусловленной острой почечной
недостаточности и острого интерстициального
нефрита. Напомним, что высокие дозы индо-
метацина используют для так называемой «те-
рапевтической нефрэктомии» — полного вык-
лючения деятельности почек для прекращения
длительной массивной резистентной ко всем
видам лечения протеинурии.
В настоящее время НСПВП в связи с мно-
гочисленными побочными явлениями в нефро-
логии применяют редко.
9.6.7. Принципы лечения отдельных
клинико-морфологических форм
гломерулонефрита
9.6.7.1. Лечение острого гломерулонефрита
Лечение острого (постстрептококкового) гло-
мерулонефрита включает в себя воздействие на
этиологический фактор (стрептококковую ин-
фекцию), основные клинические проявления
остронефритического синдрома (отеки и арте-
риальную гипертензию) и, главное, на потен-
циально летальные осложнения болезни (ост-
рую почечную недостаточность, гиперкалие-
мию, эклампсию, отек легких).
Лечение острого постстрептококкового
гломерулонефрита
• Лечение стрептококковой инфекции
(больные и их родственники)
• Лечение остронефритического синдрома
• нормализация АД, уменьшение отеков
• поддержание водно-электролитного ба-
ланса
• лечение осложнений (энцефалопатия,
гиперкалиемия, отек легких, ОПН)
• Иммунодепрессивная терапия — при НС
и затянувшемся течении
Учитывая связь развившегося острого нефри-
та со стрептококковой инфекцией, целесооб-
разно в первые дни болезни назначить антиби-
отик из группы пенициллинов (например, фе-
ноксиметилпенициллин — 125 мг каждые 6 ч в
течение 7—10 дней) и при аллергии к ним —
эритромицин (250 мг каждые 6 ч в течение 7-
10 дней). Такая терапия прежде всего показа-
на, если болезнь возникает после перенесенно-
го фарингита, тонзиллита, поражения кожи,
особенно при положительных результатах по-
севов с кожи, зева, а также при высоких тит-
рах антистрептококковых антител в крови. Дли-
тельная настойчивая антибактериальная терапия
необходима при развитии острого нефрита в
рамках сепсиса, в том числе септического эн-
докардита.
Режим и диета. В первые 3—4 нед болезни при
больших отеках, макрогематурии, высокой ги-
пертонии и сердечной недостаточности необ-
ходимо строго соблюдать постельный режим.
В острый период болезни, особенно при
выраженных признаках нефрита (бурном нача-
ле с отеками, олигурией и артериальной гипер-
тонией), следует резко ограничить потребление
натрия (до 1—2 г/сут) и воды. В первые 24 ч
рекомендуют полностью прекратить прием
жидкости, что само по себе может привести к
уменьшению отеков. В дальнейшем прием жид-
кости не должен превышать ее выделения. Ог-
раничение натрия и воды снижает объем вне-
клеточной жидкости, что способствует лечению
артериальной гипертонии. При значительном
снижении КФ, олигурии желательно ограни-
чить прием белка (до 0,5 г/кг в сутки).
Лечение отеков. Из-за первичной задержки
жидкости, способствующей развитию отеков
при ОПСГН, основным условием лечения яв-
ляется ограничение натрия и воды. Особую роль
играют диуретики — гипотиазид по 50—100 мг/
сут (неэффективен при значительном снижении
КФ) или фуросемид по 80—120 мг/сут (эффек-
тивен и при сниженной КФ). Спиронолактоны
и триамтерен не применяют из-за угрозы раз-
вития гиперкалиемии.
Диуретики как компонент гипотензивной
терапии снижают потребность в других гипотен-
зивных препаратах.
Отек легких, осложняющий течение остро-
нефритического синдрома, — обычно следствие
гиперволемии, обусловленной задержкой на-
трия и воды, а не сердечной недостаточности.
В этом случае дигиталис неэффективен и мо-
жет вызвать интоксикацию. Лечение включает
в себя ограничение натрия и воды, сильные
петлевые диуретики, морфин и кислород.
Лечение артериальной гипертензии. Умеренную
артериальную гипертензию (диастолическое АД
<100 мм рт. ст.) обычно контролируют диетой
258
с ограничением натрия и воды, постельным ре-
жимом и применением диуретиков (фуросемид).
При более выраженной и стойкой гипертен-
зии необходимы и другие препараты. Предпочте-
ние отдают вазодилататорам — блокаторам каль-
циевых каналов (нифедипин по 10 мг повторно
в течение суток), ингибиторам АПФ (применя-
ют осторожно из-за риска гиперкалиемии).
Гипертоническая энцефалопатия (некупиру-
емые головная боль, тошнота, рвота) вслед-
ствие отека мозга требует срочных мероприя-
тий — фуросемид в больших дозах, внутривен-
но гидралазин, нитропруссид натрия, диазок-
сид. При развитии судорожного синдрома —
парентеральное введение седуксена (в отличие
от других противосудорожных препаратов ме-
таболизируется в печени и не выводится поч-
ками), при необходимости интубация.
Острая почечная недостаточность. Длительная
олигурия при ОПСГН встречается у 5—10 %
больных. Лечение в этих случаях требует резко-
го ограничения натрия и воды, калия и белка
в диете. При нарастающих азотемии и гиперка-
лиемии показан гемодиализ.
Умеренная гиперкалиемия при ОПСГН на-
блюдается часто, при тяжелой гиперкалиемии
необходимо проведение экстренных меропри-
ятий — применение больших доз фуросемида
для стимуляции калийуреза, внутривенное вве-
дение инсулина, глюкозы, кальция и бикарбо-
ната натрия. При развитии жизненно опасной
гиперкалиемии — срочный гемодиализ.
Иммунодепрессивная терапия. Больным с при-
соединившимся и длительно сохраняющимся
НС (более 2 нед), повышением уровня креати-
нина, который не имеет тенденции к дальней-
шему нарастанию, но и не возвращается к
норме, в случае невозможности проведения
биопсии почки показан преднизолон (1 мг/кг).
Противопоказаны НСПВП, цитостатики.
Больным с быстропрогрессирующей почеч-
ной недостаточностью необходима биопсия
почки. Если обнаруживают полулуния, рекомен-
дуется короткий курс пульс-терапии метил-
преднизолоном (500—1000 мг внутривенно
ежедневно в течение 3—5 дней).
Э.6.7.2. Минимальные изменения клубочков
Минимальные изменения клубочков (МИ)
являются причиной 85 % случаев НС у детей и
примерно 20 % случаев НС у взрослых. Спон-
танные ремиссии НС возможны, но они раз-
виваются спустя длительное время. Из-за опас-
ности осложнений длительного НС, риск ко-
торых, особенно сердечно-сосудистых и тром-
бозов, повышается у взрослых и пожилых боль-
ных, общепринят агрессивный подход — им-
мунодепрессивная терапия (кортикостероиды,
цитостатики, циклоспорин).
При впервые возникшем НС рекомендуется
начинать с преднизолона в дозе 1 мг на 1 кг
массы тела до тех пор, пока не разовьется пол-
ная ремиссия (протеинурия <0,3 г/сут), но не
менее 6—8 нед. В течение 8 нед ремиссия раз-
вивается у 50 % больных, в течение 12—16 нед
- у 60—80 % больных [Korbet S. et al., 1988].
Если наступает частичная ремиссия (проте-
инурия <2,0—3,0 г/сут, но >0,3 г/сут), лечение
продолжают еще в течение 6 нед и более, пос-
ле чего возможен переход на прием препарата
через день со снижением каждый месяц по 0,2—
0,4 мг/кг/48 ч. У 20—40 % больных в последу-
ющем развиваются рецидивы.
Если ремиссия вообще не наступает, то
преднизолон рекомендуют давать с постоянным
снижением дозы в целом в течение 4—6 мес и
только после этого больного рассматривают как
резистентного к кортикостероидам [Korbet S. et
al., 1988; Ponticelli C., Passerini P., 1994].
У больных старше 65 лет, имеющих высокий
риск побочных эффектов стероидной терапии
и достаточно низкий риск рецидивов, снижа-
ют дозу и отменяют преднизолон быстрее. При
развитии тяжелых осложнений стероидной те-
рапии следует быстро отменить препарат
[Ponticelli С., Passerini Р., 1994].
У детей рекомендуется начинать лечение с
преднизолона (60 мг/м2 поверхности тела или
2—3 мг на 1 кг массы тела, максимально — 80—
100 мг/сут), который дают до момента разви-
тия ремиссии (отсутствие протеинурии в тече-
ние 3 последовательных дней), наступающей у
90 % больных в течение первых 4 нед терапии
[ISKDC, 1981], затем принимают преднизолон
через день.
При противопоказаниях к высоким дозам кор-
тикостероидов (например, сахарный диабет,
сердечно-сосудистая патология, тяжелая дисли-
пидемия, облитерирующий атеросклероз пери-
ферических сосудов, психические расстройства,
остеопороз и т.д.) лечение начинают с цикло-
фосфамида (2 мг/кг) или хлорбутина (0,15 мг/
кг), которые при МИ могут привести к ремис-
сии в течение 8—12 нед. Эффективность такого
подхода подтверждена как у взрослых, так и
пожилых больных [Ponticelli С., Passerini Р.,
1994].
Лечение рецидивов. Лечение первого рециди-
ва НС проводят по тем же правилам, как и в
начале болезни: назначают преднизолон в дозе
1 мг/кг для взрослых и 60 мг/м2 для детей, ко-
торый применяют до развития ремиссии. Затем
дозу постепенно снижают и переходят на при-
ем преднизолона через день (40 мг/м2/48 ч для
детей и 0,75 мг/кг/48 ч для взрослых), который
продолжается в течение еще 4 нед.
17*
259
При частых рецидивах или стероидной зави-
симости или выраженных побочных эффектах
глюкокортикоидов (гиперкортицизм) назнача-
ют цитостатики (снижая дозу преднизолона).
Длительное лечение цитостатиками повышает
не только вероятность развития и продолжи-
тельность ремиссии, но и риск тяжелых побоч-
ных эффектов. Обычно алкилирующие цитоста-
тики применяют в течение 12 нед (срок мень-
ший, чем при других морфологических вари-
антах); при этом около 2/3 стероидозависимых
больных остаются в ремиссии в течение 2 лет.
При продолжающихся рецидивах и остаю-
щейся стероидной чувствительности повторно
назначать цитостатики не рекомендуется, так
как их токсичность кумулирует [Ponticelli С.,
Passerini Р., 1994]. Если нет выраженного гипер-
кортицизма, вновь применяют кортикостерои-
ды: сначала в виде пульсов метилпреднизоло-
ном (10—15 мг/кг в/в 3 дня подряд), затем
преднизолон внутрь (0,5 мг/кг) до развития
ремиссии. Такой режим снижает риск осложне-
ний кортикостероидной терапии [Imbasciati Е.
et al., 1985]. Если развивается гиперкортицизм,
то после достижения ремиссии с помощью кор-
тикостероидов назначают циклоспорин в на-
чальной дозе 5 мг/кг. При сохранении ремис-
сии в течение 6—12 мес дозу циклоспорина
начинают медленно снижать (на 25 % каждые
2 мес) для определения минимальной поддер-
живающей дозы (обычно не менее 3 мг/кг).
В любом случае через 2 года лечения циклос-
порин желательно отменить из-за риска нефро-
токсичности [Meyrier A. et al., 1991].
По сравнению с детьми взрослые отвечают
на стероиды медленнее и в меньшем проценте
случаев [Coggins С.Н., 1981; Nolasco F. et al.,
1986]. Полные ремиссии НС у 90 % детей на-
ступают в течение первых 4 нед лечения, в то
время как у взрослых только у 50—60 % — в
течение 8 нед и у 80 % — в течение 16 нед
лечения [Korbet S. et al., 1988]. Это объясняют
различиями в режимах лечения детей и взрос-
лых, в частности более высокими (в 2—3 раза
из расчета на 1 кг массы тела) дозами корти-
костероидов у детей.
В то же время риск рецидивов у взрослых
ниже, чем у детей, что, видимо, связано с
более длительным начальным периодом лече-
ния. Установлено, чем длительнее начальное
лечение кортикостероидами, тем продолжи-
тельнее ремиссия [Brodehl J., 1991].
Риск развития почечной недостаточности у
детей минимален, однако у 14 % больных стар-
ше 60 лет в конце концов развивается ХПН
(табл. 9.2).
При стероидной резистентности, возникшей
при первом эпизоде или при рецидивах, при-
меняют цитостатики (в течение 2—3 мес) или
260
Таблица 9.2. Различия в течении МИ у детей и
взрослых [Nolasco F. et al., 1986; Korbet S. et al.,
1988; Ponticelli C., Passerini P., 1994]
Дети Взрослые
Ответ на стероиды Развитие ХПН Риск рецидивов Частые рецидивы и стероидная зависи- мость 90 % в течение 4 нед Крайне редко Высокий 40—60 % 60 % в течение 8 нед 80 % в течение 16 нед Редко Низкий 10—20 %
ЦсА — по вышеуказанной схеме. Следует от-
метить, что у больных с морфологическим
диагнозом МИ, не отвечающих на достаточно
длительное лечение высокими дозами предни-
золона, в повторных биопсиях рано или поздно
выявляют ФСГС, который требует особого те-
рапевтического подхода (см. «Лечение ФСГС»),
Таким образом, при лечении больных с МИ
следует иметь в виду следующие положения:
• Риск осложнений НС у взрослых и особен-
но пожилых больных выше, чем у детей.
• Стандартное 6—8-недельное лечение пред-
низолоном дает ремиссию только у полови-
ны взрослых больных МИ.
• Продолжение лечения до 12—16 нед вызы-
вает ремиссию у большинства больных.
• При противопоказаниях к стероидной тера-
пии лечение начинают с цитостатиков.
• При часто рецидивирующем течении или
стероидной зависимости используют цитос-
татики и/или циклоспорин.
9.6.7.3. Лечение фокально-сегментарного
гломерулосклероза
Больные ФСГС без НС с клинической кар-
тиной латентного или гипертонического нефри-
та имеют сравнительно благоприятный прогноз
(10-летняя почечная выживаемость >80 %)
[Korbet S. et al., 1994]. Этим больным обычно
активная иммунодепрессивная терапия не по-
казана (за исключением случаев, когда нарас-
тание активности проявляется другими призна-
ками — остронефритическим синдромом). При
артериальной гипертензии необходимы гипо-
тензивные препараты, в первую очередь иАПФ,
которые обладают антипротеинурическим дей-
ствием и замедляют развитие и прогрессирова-
ние ХПН; уровень АД следует снижать до 120—
125/80 мм рт. ст.
У больных ФСГС с НС прогноз серьезный —
терминальная почечная недостаточность (ТПН)
наступает через 6—8 лет, причем при протеи-
нурии >14 г/24 ч течение злокачественное —
ТПН наступает через 2—3 года. Развитие ремис-
сии НС (спонтанной или лекарственной) зна-
чительно улучшает прогноз. Так, среди боль-
ных, ответивших на лечение полной или час-
тичной ремиссией, частота ТПН за 5,5 года на-
блюдения составила 28 % по сравнению с 60 %
у резистентных больных [Korbet S. et al., 1994].
Прогноз зависит также от стабильности ре-
миссии — рецидив НС делает прогноз таким же
плохим, как у первично резистентных больных.
Однако в начале болезни нет надежных клини-
ческих или морфологических признаков, спо-
собных предсказать, какие больные ответят на
лечение, а какие нет [Rydel J. et al., 1995]. В
связи с этим лучшим индикатором прогноза у
нефротиков с ФСГС является сам факт ответа
на лечение — развитие ремиссии НС.
Длительное время считалось, что лечение
больных ФСГС с НС иммунодепрессантами бес-
перспективно. В настоящее время показано, что
у части больных при длительном лечении мо-
жет наступить полная или частичная ремиссия.
Так, почти во всех публикациях после 1980 г.
частота полных ремиссий превышала 30 % и в
большинстве случаев была >40 % [Pei Y. et al.,
1987; Banfi G. et al., 1991; Korbet S. et al., 1994;
Rydel J. et al., 1995]. Повышение частоты ремис-
сий связано с увеличением длительности на-
чальной ГК-терапии. В связи с тем, что началь-
ная доза преднизолона в ранних и поздних
исследованиях в среднем была одинаковой (ко-
лебалась 0,5—2 мг/кг в сутки), главным отли-
чием тактики ведения больных была продолжи-
тельность лечения — менее 3 мес в ранних ис-
следованиях и 5—8 мес — в поздних [Korbet S.
et al., 1994]. Начальную дозу преднизолона
(обычно 1 мг/кг, вплоть до 80 мг/сут) в иссле-
дованиях с большей частотой ремиссий поддер-
живали в течение 2—3 мес, а затем постепен-
но снижали в течение последующего лечения.
Среди взрослых, отвечающих на лечение ГК,
менее чем у '/3 полные ремиссии развиваются
через 2 мес, а у большинства — через 6 мес от
начала терапии. Время, необходимое до разви-
тия полной ремиссии, составляет в среднем 3—
4 мес [Pei Y. et al., 1987; Banfi G. et al., 1991;
Korbet S. et al., 1994]. Исходя из этого, в насто-
ящее время предлагается определять стероидную
резистентность у взрослых с первичным ФСГС,
как сохранение НС после 4 мес лечения пред-
низолоном в дозе 1 мг/кг в сутки [Meyrier А.
et al., 1994].
Начало лечения больных ФСГС. Кортикосте-
роидная терапия больным с первичным ФСГС
показана при:
• наличии НС;
• относительно сохранной функции почек
(креатинин не более 3 мг%);
• отсутствии абсолютных противопоказаний
для кортикостероидной терапии.
Лечение при впервые возникшем НС начи-
нают с преднизолона в дозе 1—1,2 мг/кг в сут-
ки в течение 3—4 мес. При развитии полной или
частичной ремиссии дозу снижают до 0,5 мг/кг
в сутки (или 60 мг через день) и лечение про-
должается еще 2 мес, после чего предни-
золон постепенно (в течение 2 мес) отменяют
[Korbet S. et al., 1994; Pei Y. et al., 1987; Glassock
R., 1993]. У больных, не ответивших на началь-
ный курс, дозу преднизолона можно снижать
быстрее — в течение 4—6 нед.
У больных старше 60 лет преднизолон на-
значают через день (1—2 мг/кг/48 ч, максималь-
но 120 мг), поскольку у пожилых он дает хо-
рошие результаты, сравнимые с эффектом у
более молодых, получающих преднизолон каж-
дый день. Это можно объяснить возрастным
снижением клиренса кортикостероидов, что
продлевает их иммунодепрессивное воздействие.
Цитостатики вместе со стероидами в каче-
стве начальной терапии не увеличивают часто-
ту ремиссий по сравнению с одними только
стероидами, однако в дальнейшем у больных,
получавших цитостатики, наблюдается меньше
рецидивов, чем у получавших только кортико-
стероиды (18 % по сравнению с 55 %), т.е. ре-
миссии оказываются более стабильными [Banfi
G. et al., 1991]. Если ремиссия сохраняется бо-
лее 10 лет, рецидивы редки [Mongeau J.G. et al.,
1993].
Лечение рецидивов у больных, отвечающих на
лечение кортикостероидами. По сравнению с
детьми у взрослых со стероидочувствительным
ФСГС рецидивы наблюдаются реже, причем в
большинстве случаев (>75 %) при повторном
лечении можно вновь получить ремиссию НС
[Pei Y. et al., 1987]. Терапевтический подход
зависит от частоты рецидивов.
При поздних рецидивах (через 6 мес и бо-
лее после отмены кортикостероидов) для по-
лучения ремиссии достаточен повторный курс
кортикостероидной терапии.
При частых обострениях (2 и более рециди-
вов в течение 6 мес или 3—4 рецидива в тече-
ние 1 года), а также при стероидной зависи-
мости или нежелательности высоких доз кор-
тикостероидов показаны цитостатические пре-
параты или циклоспорин А.
Цитостатическая терапия позволяет повтор-
но получить ремиссии у 70 % стероидочувстви-
тельных больных. Циклофосфамид (2 мг/кг) или
хлорбутин (0,1—0,2 мг/кг) в течение 8—12 нед
часто сочетают с коротким курсом преднизоло-
на (1 мг/кг в сутки в течение 1 мес с последу-
261
ющей отменой) [Pei Y. et al., 1987; Banfi G.
et al., 1991].
Циклоспорин (5—6 мг/кг в сутки, в 2 при-
ема) также высокоэффективен у стероидочув-
ствительных больных: у большинства ремиссия
наступает в течение 1 мес. Однако обычно для
поддержания ремиссии необходим постоянный
прием препарата: снижение дозы или отмена в
75 % случаев заканчивается рецидивом.
Лечение больных, резистентных к стероидам.
Это наиболее сложная проблема. Используют 2
подхода:
• лечение цитостатиками или циклоспорином
А;
• неиммунные методы лечения.
Цитостатическая терапия (циклофосфамид
или хлорбутин) независимо от длительности
(от 2—3 до 18 мес) вызывает ремиссии менее
чем у 20 % стероидорезистентных больных
[Korbet S. et al., 1994]. В наших наблюдениях у
25 % стероидорезистентных больных ремиссия
развивалась после 8—12 курсов пульс-терапии
ЦФА.
Почти с такой же частотой (у 25 % больных)
ремиссии развиваются при лечении циклоспо-
рином, особенно при сочетании с низкими
дозами преднизолона; если ремиссия не разви-
вается в течение 4—6 мес, дальнейшее лечение
циклоспорином бесперспективно [Korbet S. et
aL, 1994; Meyrier A., 1994]. В наших наблюде-
ниях [Тареева И.Е., Краснова Т.Н., 1999] цик-
лоспорин вызвал ремиссию у 7 из 10 больных
ФСГС со стероидозависимым или резистентным
НС.
С.Ponticelli и соавт. (1993) сообщили о 50 %
ремиссий (21 % полных и 29 % частичных) при
лечении циклоспорином стероидорезистентных
взрослых с НС и ФСГС. Однако авторы опре-
деляли стероидную резистентность как отсут-
ствие ответа после 6 нед лечения преднизоло-
ном 1 мг/кг в сутки, что не соответствует со-
временным критериям (4 мес безуспешного
лечения [Meyrier A. et al., 1994]) и что могло
сместить результаты в благоприятную сторону.
После отмены препарата частота рецидивов
была высокой, однако число случаев ТПН было
в 3 раза меньше, чем у больных, получавших
плацебо. У части больных, у которых ремиссия
поддерживалась циклоспорином длительное
время (не менее года), появилась возможность
медленно отменить препарат без развития ре-
цидива.
Таким образом, хотя у больных со стероид-
ной резистентностью ни один из подходов не
обладает достаточной эффективностью, циклос-
порин, видимо, имеет некоторое преимущество
перед цитостатиками.
Циклоспорин у больных ФСГС с уже име-
262
ющейся почечной недостаточностью и тубуло-
интерстициальными изменениями следует при-
менять с осторожностью. У больных, нуждаю-
щихся в продолжении лечения циклоспорином
более 12 мес, необходима повторная биопсия
почки для оценки степени нефротоксичности.
Правда, при этом трудно решить, что являет-
ся причиной прогрессирования изменений —
циклоспорин, сама болезнь или оба фактора
одновременно.
Из неиммунных методов лечения при ФСГС
наиболее эффективны иАПФ; определенного
успеха можно достичь и при гиполипидемичес-
кой терапии.
Таким образом, при лечении больных ФСГС
необходимо руководствоваться следующими по-
ложениями:
• заключение о стероидной резистентности
больных с ФСГС и НС может быть сделано
только после 3—4 мес лечения кортикосте-
роидами;
• цитостатики и ЦсА более эффективны у
больных со стероидочувствительным НС (по-
казаны при частом рецидивировании или
стероидной зависимости), но могут привес-
ти к ремиссии в 20—25 % стероидорезистен-
тных случаев;
• при неэффективности или невозможности
проведения иммунодепрессивной терапии
показаны иАПФ и гиполипидемические пре-
параты.
Э.6.7.4. Лечение мембранозной нефропатии
Больные без НС с нормальной функцией по-
чек, по единодушному мнению, не нуждаются
в иммунодепрессивной терапии, так как риск
развития почечной недостаточности у них ми-
нимален и они не подвержены опасным про-
явлениям НС. Эти больные должны находить-
ся под регулярным наблюдением для своевре-
менного выявления повышения уровня АД,
протеинурии, креатинина. При протеинурии
более 1,5—2,0 г/сут показаны иАПФ как для
снижения протеинурии, так и для замедления
прогрессирования болезни, а при повышенном
уровне холестерина — гиполипидемические
препараты.
В отношении больных с НС и сохранной
функцией почек терапевтические подходы раз-
личны. Общепринято проведение этим больным
адекватной симптоматической терапии: диуре-
тики, иАПФ — для снижения протеинурии и
замедления прогрессирования, при необходи-
мости — другие гипотензивные, гиполипиде-
мические препараты, антикоагулянты для пре-
дупреждения тромботических осложнений (о
последнем мнения не столь однозначны).
Необходимость применения иммунодепрес-
сантов — наиболее спорный вопрос.
1. Сторонники иммунодепрессивной терапии
высказываются в пользу раннего лечения, по-
скольку у определенной части больных могут
развиться почечная недостаточность и тяжелые
осложнения НС (особенно тромбозы и другие
сердечно-сосудистые катастрофы). Позднее на-
чало терапии, когда возникают почечная недо-
статочность и тубулоинтерстициальные измене-
ния, менее эффективно; кроме того, у боль-
ных с почечной недостаточностью выше риск
осложнений иммунодепрессивной терапии.
C.Ponticelli (1986), выступая против терапевти-
ческого нигилизма по отношению к мембраноз-
ной нефропатии, считает ее потенциально из-
лечимой болезнью.
2. В то же время противники считают, что
МН имеет достаточно благоприятный прогноз,
поэтому не надо подвергать больных опасной
терапии, за исключением тех ситуаций, когда
развиваются нарушение функции почек, выра-
женная протеинурия (>10 г/сут) или тяжелые
проявления НС, ухудшающие состояние боль-
ного.
Это различие в позициях отражает сохраня-
ющиеся противоречия в представлениях об ес-
тественном течении МН и возможности разви-
тия спонтанных ремиссий. Мы придерживаем-
ся первой точки зрения, считая активную те-
рапию показанной всем больным МН с НС.
Данные последних крупных исследований
свидетельствуют о том, что 10-летняя почечная
выживаемость нелеченых больных МН с НС
составляет 60—65 % [Ponticelli С., 1989,1992;
Hogan et aL, 1995]. У 38 % нелеченых больных
в течение 10 лет развиваются спонтанные (пол-
ные или частичные) ремиссии НС, но в боль-
шинстве случаев они появляются только после
2 лет течения НС и крайне нестабильны
[Ponticelli С., 1989, 1992].
Установлены основные факторы, предсказы-
вающие почечный прогноз: наибольший риск
развития прогрессирующей почечной недоста-
точности имеют пожилые мужчины, больные
с высокой и персистирующей протеинурией
(>10 г/сут), исходным снижением функции
почек, фокальным гломерулосклерозом и тяже-
лыми тубулоинтерстициальными изменениями.
В то же время нельзя предсказать, у кого из
больных разовьется спонтанная ремиссия.
Результаты различных методов лечения. В от-
ношении методов активной (иммунодепрессив-
ной) терапии преимущество отдают цитоста-
тикам (алкилирующим препаратам) или соче-
танию ГК и цитостатиков.
Кортикостероиды и цитостатики. C.Ponticelli
и соавт., обобщив данные ретроспективных не-
контролируемых исследований, касающихся
лечения 88 больных МН, сообщили, что пол-
ные ремиссии НС наблюдались чаще у больных,
леченных кортикостероидами (33 %), чем у
нелеченых больных (22 %), еще чаще полные
ремиссии (46 %) отмечали у больных, полу-
чавших цитостатики (главным образом алкили-
рующие препараты). Аналогичные результаты
получили C.Ponticelli и соавт. (1992) в контро-
лируемом исследовании, в котором непосред-
ственно сравнивали кортикостероиды и цито-
статики и было указано на преимущество пос-
леднего режима.
Наилучшие результаты получены в 10-лет-
нем итальянском многоцентровом исследова-
нии: 6-месячное лечение с ежемесячным чере-
дованием метилпреднизолона и хлорбутина
(схема C.Ponticelli — см. выше) по сравнению
с симптоматическим лечением в 2 раза повы-
сило частоту ремиссий НС (соответственно 62
и 33 %) и снизило частоту ХПН (через 10 лет
8 и 40 %) [Ponticelli С. et al., 1995].
За исключением двух неконтролируемых
исследований на малом числе больных [Came-
ron, 1979; Williams Р., Bone F., 1989], нет дан-
ных, подтверждающих эффективность азатиоп-
рина.
Возможная альтернатива комбинации пред-
низолона и хлорбутина — лечение только кор-
тикостероидами или циклоспорином.
Кортикостероиды. Кортикостероиды как мо-
нотерапию применяют реже. У 5—10 % боль-
ных ремиссия может развиться уже через ко-
роткий срок, но у большинства для ее дости-
жения кортикостероиды необходимо применять
в высоких дозах длительно.
Предлагается прием преднизолона через день
(200 мг каждые 48 ч) в течение 6—12 мес
[Hopper F., 1989].
Внутривенные пульсы метилпреднизолоном
(1 г в течение 3 дней — в 1, 3 и 5 мес) на фоне
приема преднизолона через день (0,5 мг/кг каж-
дые 48 ч) — другой хорошо переносимый ре-
жим, хотя менее эффективный, чем сочетание
преднизолона с хлорбутином [Ponticelli С.,
1992b].
Циклоспорин. В неконтролируемых клиничес-
ких испытаниях в 20 % случаев наблюдали пол-
ные ремиссии НС и еще в 25 % — частичные,
однако после отмены циклоспорина у большин-
ства больных быстро развивались рецидивы. У
некоторых больных ремиссия может длительно
поддерживаться на относительно низких дозах
(3,0—3,5 мг/кг) и при медленной отмене пре-
парата риск обострения значительно снижает-
ся [Rostoker G. et al., 1993; Meyrier A. et al.,
1994].
Лечение больных пожилого возраста. Почеч-
ный прогноз у лиц старше 65 лет обычно хуже,
чем у более молодых. Однако в наблюдениях
263
Таблица 9.3. Показания к лечению больных МН с медленно прогрессирующей почечной недоста- точностью.
Лечить Не лечить
Креатинин УЗИ почек: <4,5 мг% >4,5 мг%
размер Субнормаль- ный Уменьшенный
повышение эхоген- ности Биопсия почек: Умеренное Выраженное
мезангиальный склероз Умеренный Выраженный
интерстициальный фиброз Умеренный Выраженный
иммунные депозиты Свежие Отсутствуют
P.Passerini (1993) и C.Rollino (1995) результа-
ты 6-месячной терапии МП и хлорбутином у
лиц старше и моложе 65 лет существенно не
различались. В то же время побочные эффекты
у пожилых были чаще и тяжелее, поэтому при
иммунодепрессивной терапии дозы препаратов
должны быть меньше у пожилых, чем у моло-
дых.
Подходы к лечению больных с почечной
недостаточностью те же, что и больных с
нормальной функцией почек. Однако из-за
высокой чувствительности этих больных к по-
бочному действию иммунодепрессантов начи-
нать лечение следует только при реальных шан-
сах на успех (табл. 9.3).
Пульсы метилпреднизолоном с последующим
пероральным приемом преднизолона в умерен-
ной дозе у некоторых больных с почечной не-
достаточностью способствуют транзиторному
снижению уровня креатинина. Более обнадежи-
вающие результаты при длительном (1—2 года)
приеме ЦФА или 6-месячном лечении метил-
преднизолоном и хлорбутином, но для сниже-
ния токсичности доза МП должна быть умень-
шена до 0,5 г в/в, а хлорбутина — 0,1 мг/кг.
При противопоказаниях к активной имму-
нодепрессивной терапии или при ее неэффек-
тивности показано лечение иАПФ, гиполипи-
демическими препаратами, дипиридамолом,
возможно, гепарином.
Э.6.7.5. Мезангиопролиферативный
гломерулонефрит (МПГН) и IgA-нефропатия
В настоящее время нет общепринятых терапев-
тических подходов к больным МПГН и IgA-не-
фропатией, что можно объяснить большой ва-
риабельностью исходов болезни (ТПН развива-
ется только у части больных, причем с различ-
ной скоростью) и трудностью предсказания
прогноза у каждого отдельного больного, даже
с учетом уже установленных клинических и
морфологических прогностических факторов.
Отсюда большие трудности в создании больших
прогностически однородных групп больных для
проведения контролируемых клинических ис-
пытаний. Большинство выполненных до насто-
ящего времени исследований, в которых сде-
лан вывод о снижении протеинурии или ста-
билизации функции в результате терапии, ба-
зируются или на отдельных наблюдениях, или
на ретроспективном анализе данных.
Устранение очагов инфекции, тонзиллэктомия.
Все еще дискутируется действенность других
мер, направленных на предупреждение обостре-
ний инфекции, а именно удаления очага ин-
фекции (тонзиллэктомия) и длительной тера-
пии антибиотиками. Тонзиллэктомия действи-
тельно снижает число эпизодов макрогемату-
рии, а иногда также протеинурию и уровень IgA
в сыворотке. Имеются данные о возможном тор-
мозящем влиянии тонзиллэктомии на прогрес-
сирование почечного процесса [Sugiyama N. et
al., 1993]. В связи с этим тонзиллэктомию можно
рекомендовать больным с частыми обострени-
ями тонзиллита.
Некоторые авторы считают, что кратковре-
менное лечение антибиотиками острой респи-
раторной или желудочно-кишечной инфекции
считается оправданным, особенно когда инфек-
ция провоцирует эпизоды макрогематурии
[Tamura et aL, 1993].
Кортикостероиды и цитостатики. Твердых
доказательств существенного влияния иммуно-
депрессантов (кортикостероидов или их комби-
нации с цитостатиками) на течение медленно
прогрессирующих форм заболевания нет.
В контролируемом исследовании из Гонконга
у взрослых с IgA-нефропатией 4-месячное ле-
чение кортикостероидами не предотвратило
ухудшение клубочковой фильтрации в последу-
ющие 3 года [Lai К. et al., 1986]. В японском
исследовании ежедневный прием кортикосте-
роидов сохранил функцию почек у больных с
нормальным уровнем КФ, но не у больных с
КФ <70 мл/мин [Kobayashi Y. et al., 1988]. В
неконтролируемом исследовании из США у
детей, принимавших кортикостероиды через
день, не наблюдалось ухудшения функции (но
у большинства из них риск прогрессирования
был минимальным) [Waldo В. et al., 1993].
В то же время крупное многоцентровое ита-
льянское исследование, оценившее эффектив-
ность кортикостероидов (альтернирующий ре-
жим) у больных с высоким риском прогрес-
сирования — уровнем протеинурии 1—3,5 г/сут,
подтвердило снижение протеинурии и стабили-
зацию функции почек [Pozzi С. et al., 1997].
264
В наших наблюдениях цитостатическая тера-
пия была эффективна у 59 % больных мезан-
гиопролиферативным ГН [Шилов Е.М., 1994].
В рандомизированном проспективном исследо-
вании эффективность пульс-терапии ЦФА была
такой же, как при пероральном приеме, но
было значительно меньше побочных явлений
[Краснова Т.Н. и др., 1998].
Циклофосфамид, дипиридамол, варфарин (фе-
нилин). Этот трехкомпонентный метод (цикло-
фосфамид в течение 6 мес, остальные 2 пре-
парата — 3 года) в контролируемом исследо-
вании из Сингапура снижал протеинурию и
стабилизировал функцию почек [Woo К. et al.,
1987]. Однако результаты не подтвердились в
подобном исследовании, выполненном в Авст-
ралии [Walker R. et al., 1990]. Более того, по-
вторная, через 5 лет, оценка больных Синга-
пурского исследования не выявила разницы в
темпах прогрессирования почечной недостаточ-
ности у леченых и нелеченых больных [Woo К.
et al., 1991].
Циклоспорин. В рандомизированном исследо-
вании циклоспорин в дозе 5 мг/кг в сутки у
леченых больных снижал протеинурию, сыво-
роточную концентрацию IgA и экспрессию ре-
цепторов для ИЛ-2 на Т-клетках [Lai К. et al.,
1989]. V.Chabova и соавт. (1997) лечили ЦсА 6
больных IgA-нефропатией с протеинурией бо-
лее 3,5 г/сут (средняя 4,66 г/сут) и уровнем
креатинина менее 200 мкмоль/л; протеинурия
снизилась через 1 мес до 1,48 и через 12 мес —
до 0,59 г/сут. Осложнения — гипертония
(4 больных), гипертрихоз (2), рвота (1). В на-
ших исследованиях [Тареева И.Е., Краснова
Т.Н., 1999] ЦсА вызвал ремиссию у 4 из 6
больных с резистентным или зависимым от сте-
роидов МПГН с НС.
Рыбий жир. Рыбий жир, содержащий омега-
3-полиненасыщенные жирные кислоты, у боль-
ных IgA-нефритом в трех контролируемых ис-
следованиях [Hamazaki Т. et al., 1984; Bennett W.
et al., 1989; Petterson E. et al., 1994] оказался
неэффективным у больных с нормальной или
умеренно нарушенной функцией, принимавших
рыбий жир от 6 мес до 2 лет, и замедлил про-
грессирование почечной недостаточности еще
в одном контролируемом исследовании [Dona-
dio F. et al., 1994] у больных с умеренно нару-
шенной функцией (креатинин <3 мг%), полу-
чавших рыбий жир 12 г/сут в течение 2 лет.
Таким образом, исходя из тяжести прогно-
за различных вариантов IgA-нефропатии, мож-
но рекомендовать следующие терапевтические
подходы:
• больным с изолированной гематурией (особен-
но с эпизодами синфарингитной макрогема-
турии), небольшой протеинурией (<1 г/сут)
и нормальной функцией почек агрессивная
терапия не показана. Могут быть назначены
иАПФ (с нефропротективной целью), дипи-
ридамол;
• больным с более прогрессирующим течени-
ем (протеинурией >1 г/24 ч, артериаль-
ной гипертензией, нормальной или уме-
ренно сниженной функцией почек или
морфологическими признаками активно-
сти болезни) могут быть назначены:
— АПФ-ингибиторы: применение длитель-
ное даже при нормальном АД;
— рыбий жир: 12 г/сут в течение 2 лет (эф-
фективность все еще сомнительна);
— кортикостероиды: прием преднизолона
внутрь через день, начиная с 60 мг в тече-
ние 3 мес с постепенным снижением дозы;
— больным с протеинурией более 3 г/сут или
НС мы считаем показанной активную те-
рапию — глюкокортикоиды, цитостати-
ки (в том числе в виде ЦФА-пульс-тера-
пии) [Шилов Е.М. и др., 1995; Ши-
лов Е.М., Краснова Т.Н., 1995].
Э.6.7.6. Лечение мезангиокапиллярного
гломерулонефрита
Лечение этой формы нефрита все еще недоста-
точно разработано. Ряд предлагаемых подходов не
имеют достаточного обоснования и многим ав-
торам представляются спорными. Неблагоприят-
ные прогностические признаки — наличие НС и
нарушение почечной функции с самого начала
заболевания. У больных с НС 10-летняя почечная
выживаемость составляет не более 50 %.
Следует помнить о возможности вторичных
форм МКГН, требующих совершенно других
терапевтических подходов — это МКГН при
хронических инфекциях (в том числе при HBV-
и HCV-вирусной инфекции), криоглобулине-
мии и различных формах плазмоклеточных дис-
кразий. Для этих заболеваний могут быть пока-
заны антибактериальная терапия, альфа-интер-
ферон, плазмаферез или химиотерапия.
У остальных больных, если подтверждается
идиопатический МКГН, рекомендуются следу-
ющие подходы.
Больные без нефротического синдрома. Боль-
ные с протеинурией менее 3 г/сут и нормаль-
ной КФ в активной терапии не нуждаются; при
артериальной гипертонии важен строгий кон-
троль АД, предпочтительно ингибиторами
АПФ; при большой протеинурии и снижаю-
щейся КФ можно применить преднизолон и
цитостатики или комбинацию аспирина и ди-
пиридамола.
Больные с нефротическим синдромом. Корти-
костероиды, кортикостероиды и цитостатики.
265
При первой атаке НС и нормальной функции
почек можно начинать с кортикостероидов
(1 мг/кг в течение 2 мес) [Ратнер М.Я. и др., 1992;
Ponticelli С., Passerini Р., 1994]. При этом резуль-
таты лучше у детей, у которых накоплен наиболь-
ший опыт длительной стероидной терапии.
При сочетании кортикостероидов с цитос-
татиками результаты лучше. R.Faedda и соавт.
(1994) при лечении 19 больных кортикостеро-
идами (в начале пульсами метилпреднизолона,
затем преднизолон внутрь) и циклофосфами-
дом в среднем в течение 10 лет с последую-
щим наблюдением (7,5 года) отметили ремис-
сию у 15 из 19 больных (развитие недостаточ-
ности гонад у 40 % больных); у части больных
были рецидивы, также уступавшие сочетанной
терапии. В нашей группе из 28 больных МКГН,
получавших цитостатики (циклофосфамид,
хлорбутин или азатиоприн) в сочетании с
преднизолоном, 10-летняя почечная выживае-
мость составила 71 %, что существенно выше,
чем обычно наблюдается у нелеченых нефро-
тиков с МКГН [Шилов Е.М., 1994]. В другом
нашем исследовании [Шилов Е.М. и др., 1995]
из 9 тяжелобольных МКГН, леченных пульсами
циклофосфана, наилучшие результаты (100 %
почечная выживаемость через 7 лет) зафикси-
рованы у 4 больных с высоким индексом мор-
фологической активности (>4), получивших в
течение 6 мес не менее 6 г препарата. В то же
время у 5 больных с таким же индексом актив-
ности, но менее активно леченных (получив-
ших менее 6 г препарата), почечная выживае-
мость была менее 50 %.
В связи с этим при выраженном НС или НС
со снижающейся функцией почек — лучше
сразу начинать с сочетания кортикостероидов
и цитостатиков (последние можно в виде пуль-
сов ЦФА).
Цитостатики, антикоагулянты и антиагре-
ганты. В неконтролируемых исследованиях ком-
бинация цитостатиков, антикоагулянтов и ан-
тиагрегантов давала хорошие результаты
[Glassock R. et al., 1995]. В контролируемом ис-
следовании, оценившем влияние циклофосфа-
мида, дипиридамола и варфарина, существен-
ного влияния на протеинурию и прогрессиро-
вание почечной недостаточности не обнаруже-
но [Cattran D. et al., 1985]. В другом контроли-
руемом исследовании у больных МКГН I типа
дипиридамол (225 мг/сут) и аспирин (975 мг/
сут) замедляли скорость прогрессирования в
течение первых 4 лет, но к 10-му году эти раз-
личия между лечеными и нелечеными больны-
ми стирались (почечная выживаемость соответ-
ственно 49 и 41 %) [Donadio J. et al., 1984;
Donadio J., Offord K., 1989].
Циклоспорин А. Данные по применению цик-
лоспорина при МКГН весьма ограничены. В не-
266
контролируемых исследованиях циклоспорин
(4—6 мг/кг) в сочетании с низкими дозами
преднизолона вызывал умеренное снижение
протеинурии [Erbay В. et al., 1988; Cattran D. et
al., 1991]. У 2 наших больных МКГН, лечен-
ных циклоспорином, также отмечено улучше-
ние [Краснова Т.Н. и др., 1997], однако из-за
потенциальной нефротоксичности и усиления
гипертонии циклоспорин у больных МКГН в
настоящее время широко не применяется.
Э.6.7.7. Лечение быстропрогрессирующего
(экстракапиллярного) гломерулонефрита
Быстропрогрессирующий ГН (БПГН) встреча-
ется чаще как проявление системного заболе-
вания (СКВ, системные васкулиты, эссенци-
альная смешанная криоглобулинемия и др.),
реже — как идиопатическая болезнь, однако
принципы лечения общие.
Прогноз больных БПГН в первую очередь
определяется тяжестью (распространенностью)
поражения — количеством клубочков, имеющих
полулуния. При обширном поражении (полулу-
ния в 50 % клубочков и более) БПГН редко
подвергается спонтанной ремиссии и при от-
сутствии специальной терапии почечная выжи-
ваемость не превышает 6—12 мес [Cameron J.,
1993 ].
При небольшой степени поражения (30 %
клубочков и более), особенно если полулуния
наслаиваются на ранее существовавший ГН
(например, IgA-нефрит, постстрептококко-
вый), нарушенная функция почек может спон-
танно восстанавливаться, иногда даже до ис-
ходного уровня.
При умеренном поражении (30—50 % клу-
бочков) потеря почечной функции происходит
медленнее, но без лечения все равно развива-
ется ТПН, поэтому иммунодепрессивная тера-
пия показана всем больным БПГН с обшир-
ными полулуниями (при поражении 50 % клу-
бочков и более), если только клинические и
морфологические прогностические факторы не
говорят о необратимости процесса даже при
«агрессивном» лечении и если она не сопряже-
на с высоким риском осложнений.
Если невозможно провести биопсию (что
является достаточно частой ситуацией), подхо-
ды к лечению те же.
Принципы диагностики и лечения БПГН (эк-
стракапиллярного ГН) (схема 9.1 и табл. 9.4):
• для предотвращения необратимой катастро-
фической потери почечной функции необ-
ходимо срочно начинать лечение сразу же
после постановки клинического диагноза
БПГН (остронефритического синдрома в
сочетании с быстропрогрессирующей почеч-
ной недостаточностью при нормальных раз-
мерах почек и исключении других причин
ОПН). Задержка лечения на несколько дней
может ухудшить его эффективность, так как
при развитии анурии лечение почти всегда
безуспешно. Это единственная форма ГН,
при выборе средств активной терапии кото-
рой следует меньше думать о возможности
побочных явлений, так как токсичность ле-
чения у больных не может быть тяжелее ес-
тественного исхода;
• необходимо — по возможности — экстрен-
ное исследование сыворотки на наличие
анти-БМК-антител и АНЦА; биопсия в
меньшей степени нужна для диагноза (вы-
явления ЭКГН и типа свечения антител —
линейного, гранулярного, «малоиммунно-
го») и в большей степени — для оценки
прогноза и подтверждения необходимости
агрессивной терапии;
• начинать лечение следует без промедления
еще до получения результатов диагностичес-
ких исследований (серологических и биопсии
почки) — с пульс-терапии метилпреднизо-
лоном, что в настоящее время считается
международным стандартом [Glassock R.,
1997]. Наш опыт свидетельствует о том, что
такая тактика полностью оправдана, в том
числе и из-за невозможности проведения
биопсии у многих больных [Тареева И.Е. и
др., 1990]. Алкилирующие препараты (лучше
ЦФА в сверхвысоких дозах) — необходимый
дополнительный к кортикостероидам компо-
нент терапии, особенно у больных с васку-
литом (локальнопочечным или системным)
и циркулирующими АНЦА. Интенсивный
плазмаферез в комбинации с иммунодепрес-
сантами является ценным (а) при анти-БМК
нефрите при условии, что лечение начина-
ют рано, до появления потребности в гемо-
диализе, (б) а также у больных с не анти-
БМК ЭКГН, которые уже нуждаются в ге-
модиализе, но в биопсии которых нет при-
знаков необратимости болезни; может быть
полезным и в других ситуациях — перед
проведением «пульсов» ЦФА (так называе-
мая «синхронная» терапия) [Euler Н.Н.,
1994];
• отдаленный прогноз зависит от тяжести на-
чального повреждения почек, частоты реци-
дивов, наличия системной болезни. Важная
задача дальнейшей терапии: предупреждение
и лечение обострений (своевременное повы-
шение дозы иммунодепрессантов) и воздей-
ствие на неиммунные механизмы прогрес-
сирования гломерулонефрита (ингибиторы
АПФ).
Рекомендации по лечению отдельных патоге-
нетических типов ЭКГН
Таблица 9.4. Начальная терапия БПГН (ЭКГН) в
зависимости от патогенетического типа
Тип Серология Терапия потребность в ГД
нет есть
1 Анти-БМК болезнь (а-БМК+) ЦФА КС (внутрь или пульсы) ПФ (интенсивный) Консервативное введение
II ИК-болезнь (а-БМК-) (АНЦА-) КС (внутрь или пульсы) ± Цитостатики (ЦФА — пульсы или внутрь)
III «Малоим- мунный» (АНЦА+) КС (внутрь или пульсы) ЦФА КС (внутрь или пульсы) ЦФА ПФ (интенсивный)
Анти-БМК нефрит (тип I no Glassock, 1997),
в том числе синдром Гудпасчера. При креати-
нине <600 мкмоль/л (6,8 мг%) — преднизолон
(60 мг/кг внутрь), циклофосфамид (2—3 мг/кг)
и ежедневный интенсивный плазмаферез (10—
14 сеансов). По достижении стабильного улуч-
шения дозу преднизолона постепенно снижа-
ют в течение последующих 12 нед, а циклофос-
фамид полностью отменяют после 10 нед ле-
чения. У больных со стабилизировавшейся уме-
ренной почечной недостаточностью и протеин-
урией показан длительный прием ингибиторов
АПФ. При обострениях повторно используют те
же подходы.
При уровне креатинина >600 мкмоль/л —
агрессивная терапия малоэффективна. Больные,
нуждающиеся в гемодиализе, должны лечить-
ся консервативно, за исключением тех случа-
ев, когда болезнь началась недавно с бурным
прогрессированием (в течение 1—2 нед) и из-
менения в почечном биоптате потенциально
обратимы (полулуния клеточного типа, тубу-
лярный фиброз отсутствует или умеренный).
Иммунокомплексный БПГН (тип II по
Glassock, 1997). Лечение то же, но без плазма-
фереза. Чаще начинают с внутривенных пуль-
сов метилпреднизолоном (по 1000 мг в течение
3—5 дней) с дальнейшим приемом преднизо-
лона внутрь (60 мг/кг в сутки). Не все считают
необходимостью добавление цитостатиков (цик-
лофосфамид в пульсах или внутрь) при идио-
патическом БПГН; цитостатики, безусловно,
эффективны при СКВ или криоглобулинемии
(после исключения гепатита, вызванного виру-
сом гепатита С). При инфекции вирусом гепа-
тита С показано добавление интерферона-аль-
фа [Johnson R. et al., 1994]. Польза плазмафере-
267
АЛГОРИТМ ДИАГНОСТИКИ И ЛЕЧЕНИЯ БПГН
Схема 9.1
за доказана лишь при БПГН у больных с крио-
глобулинемией. В случае ответа на начальную
терапию необходим длительный прием предни-
золона, в дальнейшем возможен переход на
азатиоприн (2 мг/кг).
Малоиммунный БПГН, ассоциированный с
АНЦА (тип III по Glassock, 1997). Чаще всего
это больные с некротизирующим васкулитом —
системным (гранулематоз Вегенера или микро-
скопический полиартериит) или ограниченным
только почками. Лучшие результаты получены
при лечении циклофосфамидом (внутрь или
внутривенно в виде пульсов) в сочетании с
кортикостероидами (также внутрь или внутри-
венно). Предложены различные режимы началь-
ной подавляющей и поддерживающей терапии.
Больным гранулематозом Вегенера с ЭКГН III
типа и антителами к протеин азе-3 рекоменду-
ется длительный прием циклофосфамида как
для индукции, так и для поддерживающей те-
рапии. Больным микроскопическим полиарте-
риитом с ЭКГН III типа и антителами к мие-
лопероксидазе рекомендуется более короткий
курс циклофосфамида для индукции и длитель-
ный прием азатиоприна для поддерживающей
терапии. Плазмаферез показан при быстром
развитии почечной недостаточности и наличии
в почечном биоптате потенциально обратимых
изменений. Назначают 7—10 сеансов плазмафе-
реза в течение 2 нед. Отсутствие за это время
положительного эффекта делает дальнейшее
проведение ПФ бесполезным.
9.7. Диуретики*
Диуретики, действующие:
— в проксимальном отделе нефрона (ингиби-
торы карбоангидразы, осмотические);
— в области петли Генле (петлевые);
— в области дистального отдела нефрона (тиа-
зидные и тиазидоподобные);
— в кортикальном отделе собирательных тру-
бок (калийсберегающие).
• Диуретики в нефрологической клинике:
— при отечном и нефротическом синдроме.
• Применение диуретиков при отсутствии
отечного синдрома:
— при артериальной гипертонии;
* Раздел написан И.М.Кутыриной.
268
— при острой почечной недостаточности;
— при почечном канальцевом ацидозе;
— при нарушении метаболизма кальция;
— при неадекватной продукции АДГ;
— при нефрогенном несахарном диабете;
— для подщелачивания мочи.
Диуретики, или мочегонные средства, пред-
ставляют собой группу лекарственных ве-
ществ, обладающих способностью увеличивать
мочеотделение, усиливать выведение солей и
воды почкой.
Из-за свойства диуретиков уменьшать ре-
абсорбцию солей и тем самым усиливать выве-
дение солей и осмотически связанной с ними
воды их часто называют салуретиками.
Основной механизм действия диуретиков
связан с ингибированием реабсорбции натрия и
воды клетками почечных канальцев. Вклад уве-
личения скорости клубочковой фильтрации в
диуретический эффект препаратов невелик.
Силу диуретического эффекта диуретиков обыч-
но определяют по величине экскретируемой
фракции натрия (EF Na), т.е. по проценту вы-
веденного с мочой натрия по отношению к
профильтровавшемуся. В норме величина EF Na
составляет 1 %.
9.7.1. Классификация диуретиков
В настоящее время не создано единой, обще-
принятой и всеобъемлющей классификации ди-
уретиков. В имеющихся классификациях за ос-
нову берется какой-либо один признак этой
группы веществ: их классифицируют по хими-
ческому строению (выделяя тиазидные, произ-
водные ксантина, органические соединения
ртути и др.), механизму действия (осмотичес-
кие), клиническому эффекту (калийсберегаю-
щие), локализации их эффекта в нефроне (пет-
левые). В настоящей главе мы используем клас-
сификацию диуретиков, основанную на выде-
лении места действия диуретика в нефроне.
В зависимости от места ингибирования реаб-
сорбции натрия в нефроне различают диурети-
ки, действующие в проксимальном канальце,
области петли Генле, дистальном канальце и
кортикальном отделе собирательных трубок.
Диуретики, действующие на проксимальные
канальцы, подразделяют на следующие классы:
• ингибиторы карбоангидразы (диакарб, доза
0,125-0,25 г);
• осмотические диуретики (маннитол, доза 1—
1,5 г/кг массы тела в/в, капельно).
Основными препаратами, относящимися к
группе ингибиторов карбоангидразы, являют-
ся диакарб, метазоламид и бензоламид.
Ингибитор карбоангидразы — диакарб (аце-
тазоламид, фонурит, диамокс) относится к
сульфаниламидам, обладает умеренным диуре-
тическим действием — EF Na возрастает до 5 %.
Диуретическая реакция развивается через 3—
4 ч и продолжается 6—8 ч.
Механизм действия', диакарб угнетает карбо-
ангидразу, в результате чего в проксимальном
канальце угнетается реабсорбция бикарбоната.
Стенка почечного канальца слабо проницаема
для иона бикарбоната и он практически оста-
ется в просвете канальца. Напротив, натрий,
для которого стенка канальца легко проницае-
ма, системами активного транспорта перено-
сится в межклеточную жидкость, но вновь воз-
вращается в просвет канальца для электрохи-
мического уравновешивания отрицательно за-
ряженных ионов бикарбоната. В результате по-
вышенный объем жидкости достигает последу-
ющих отделов нефрона и развивается умерен-
но выраженный солевой диурез. Нереабсорби-
рованный натрий выделяется в виде бикарбо-
натов, щелочной резерв крови снижается, а pH
мочи возрастает [Рябов С.И., Наточин Ю.В.,
1997].
Применение', диакарб в силу малой эффектив-
ности не рекомендуется для лечения тяжелого
отечного синдрома. Его активно используют для
лечения глаукомы и как средство для подще-
лачивания мочи.
Осмотические диуретики. В эту группу вхо-
дят вещества, обладающие осмотической актив-
ностью. К таким соединениям относят манни-
тол, мочевину, ацетат калия, гипертонические
растворы натрия, калия, глюкозы. Глюкоза и
мочевина, содержащиеся в конечной моче,
также могут оказывать осмолярный эффект и
таким образом способствуют потере натрия и
воды. Маннитол является одним из самых мощ-
ных диуретиков. Его вводят внутривенно. Диу-
ретический эффект развивается в течение бли-
жайшего периода после введения препарата.
При введении маннитола скорость мочеотделе-
ния может достигать 20 мл/мин (!).
Механизм действия: нереабсорбируемые мо-
лекулы маннитола внутри проксимального ка-
нальца соединяются с водой, в связи с чем в
нем уменьшают реабсорбцию воды и натрия.
В более дистальные отделы нефрона с большой
скоростью поступает большой объем жидкости
и натрия, что приводит к снижению реабсор-
бции натрия и воды и в этих отделах нефрона.
Одномоментно диуретики снижают концентра-
ционный градиент в мозговом слое почки, что
также способствует диуретической реакции
[Клар С., 1987].
Применение: осмотические диуретики эффек-
тивны при острой почечной недостаточности,
для профилактики поражения почек при опе-
269
рациях на сердце и крупных сосудах, при ост-
рых отравлениях. Применение маннитола с те-
рапевтическими целями ограничено в связи с
возможностью развития тяжелых осложнений
лечения — дегидратации, гипонатриемии, на-
рушений в системе гемостаза, желудочно-ки-
шечных расстройств.
Диуретики, действующие в области петли Ген-
ле, преимущественно в толстом восходящем ее
колене, объединены под общим названием
«петлевые диуретики».
Основными их представителями являются:
• фуросемид (доза внутрь 20—40 — 400—600
мг; в/в 20—1200 мг)
• этакриновая кислота (доза внутрь 50 мг)
• буметанид (доза внутрь 0,5—2 мг)
По эффективности 40 мг фуросемида = 50
мг этакриновой кислоты = 1 мг буметанида
• ртутные диуретики (тиомерин, мераллурид
[меркуридин] в клинике практически не ис-
пользуются из-за высокой токсичности).
Фуросемид (лазикс), этакриновая кислота
(урегит) и буметанид (буфенокс) в силу своей
высокой эффективности наиболее распростра-
нены в нефрологической практике. Под влия-
нием этих препаратов EF Na возрастает до 25 %,
время действия диуретиков составляет 6 ч.
Механизм действия: петлевые диуре-
тики, в частности фуросемид, имеют высокое
сродство к белкам крови, т.е. обладают высо-
кой связывающей белки активностью. Будучи
связанными с белками плазмы крови, диурети-
ки лишь в незначительной степени поступают в
просвет нефрона в результате клубочковой филь-
трации. Основным путем поступления их в про-
свет нефрона является секреция клетками про-
ксимальных канальцев. В области восходящего ко-
лена петли Генле петлевые диуретики блокиру-
ют системы транспорта ионов хлора, тем самым
нарушая реабсорбцию хлора и сопряженную с
ней реабсорбцию натрия и воды, что вызывает
обильный салурез и диурез. Нарушение реабсор-
бции натрия и хлора в восходящем колене пет-
ли Генле приводит к снижению осмотического
градиента в мозговом слое почки, что последо-
вательно увеличивает приток натрия и хлора к
дистальным сегментам нефрона и способствует
потере с мочой калия.
Важными для клиницистов в механизме дей-
ствия петлевых диуретиков, в частности фуро-
семида, представляются несколько моментов:
• диуретическое действие оказывает активный,
несвязанный с белками фуросемид. Наличие
в просвете проксимальных канальцев белков
(при высокой протеинурии) ослабляет диу-
ретической эффект препарата [Kirchner К.А.
et al., 1991];
• выявлена дозозависимость эффектов фуросе-
мида, что необходимо учитывать при лече-
нии этим диуретиком;
• фуросемид способен кратковременно увели-
чивать почечный кровоток и способствовать
некоторому увеличению скорости клубочко-
вой фильтрации, что важно для достижения
эффекта у больных с ХПН, ранее рефрак-
терных к действию диуретика;
• рефрактерность к диуретику при ХПН мо-
жет быть объяснена нарушением функции
проксимальных канальцев, что проявляется
снижением не только секреции фуросемида
в просвет канальца, но и реабсорбции жид-
кости из проксимального канальца, что зна-
чимо снижает концентрацию диуретика, а
также наличием в просвете канальца орга-
нических кислот, которые накапливаются в
нем в условиях ХПН [Наточин Ю.В. и др.,
1979; Рябов С.И., Наточин Ю.В., 1997; Клар С.,
1987; Fliser D., 1996].
Применение: петлевые диуретики эф-
фективны для лечения отечного синдрома лю-
бого генеза, в том числе при заболеваниях по-
чек, сердечной недостаточности, циррозе пе-
чени, а также острой почечной недостаточно-
сти. При нарушениях водно-электролитного
баланса у больных с ХПН (при СКФ <40 мл/
мин) эффективны только петлевые диуретики.
Петлевые диуретики показаны при почечной
артериальной гипертонии, артериальной гипер-
тонии при сахарном диабете. Фуросемид при-
меняют в лечении синдрома неадекватной сек-
реции АДГ и гиперкальциемий.
Осложнения: основными побочными
проявлениями петлевых диуретиков являются
электролитные нарушения: в крови снижается
концентрация калия, натрия, магния, в то
время как концентрация мочевой кислоты и
кальция возрастает. Длительное использование
петлевых диуретиков может привести к разви-
тию гиповолемии. Сочетанное применение пет-
левых диуретиков и антибиотиков (гентамици-
на, канамицина и стрептомицина) может ос-
ложниться развитием глухоты.
В области дистального отдела нефрона дей-
ствует группа тиазидных и тиазидоподобных ди-
уретиков, основными представителями являют-
ся следующие:
• гипотиазид (дихлотиазид, доза внутрь — 25—
200 мг);
• циклометиазид (доза внутрь — 0,5 мг);
• оксодолин (гигротон, доза внутрь — 25—100 мг);
• индапамид (арифон, доза внутрь — 2,5 мг);
• ксипамид (аквафор, доза внутрь — 10—40 мг).
Тиазидные диуретики обладают умеренной
диуретической активностью —экскреция натрия
под их влиянием возрастает в 8 раз (EF Na со-
ставляет 8 %), время действия гипотиазида и
циклометиазида — 10—12 я, оксодолина, ин-
дапамида и ксипамида — 24 ч.
Механизм действия: основные тиазид-
ные диуретики {гипотиазид, циклометиазид и
оксодолин), действуя на клетки дистальных ка-
нальцев изнутри, блокируют всасывание хло-
рида натрия, чем и объясняется салуретичес-
кое действие препаратов. Незначительный до-
полнительный вклад в диуретическую актив-
ность тиазидных препаратов вносит их свойство
блокировать карбоангидразу в проксимальном
отделе нефрона. Тиазидные диуретики через
активацию канальцево-клубочкового механиз-
ма снижают скорость клубочковой фильтрации,
что ограничивает их использование при почеч-
ной недостаточности (при СКФ <40 мл/мин).
Индапамид (арифон) по своей структуре,
общей для тиазидов, и по свойству блокиро-
вать транспорт натрия в дистальном канальце
формально относят к диуретикам. Однако в об-
щепринятой терапевтической концентрации (2,5
мг) он оказывает слабое, субклиническое ди-
уретическое действие, обладая при этом выра-
женной гипотензивной активностью. Благодаря
возможности значительно снижать сосудистое
сопротивление, усиливать продукцию сосудо-
расширяющих простагландинов, воздействовать
на трансмембранный обмен кальция препарат
эффективен в лечении артериальной гиперто-
нии [Leenen F., 1988].
Ксипамид (аквафор) действует на клетки
дистального отдела нефрона не изнутри, а сна-
ружи, секретируясь в просвет канальцев из
перитубулярных капилляров. Он ингибирует
реабсорбцию натрия и вызывает усиленное
выведение с мочой натрия, хлора, бикарбона-
тов, кальция и магния. Показан при резистен-
тном отечном синдроме и почечной недоста-
точности.
Применение: тиазидные и тиазидоподоб-
ные диуретики рекомендуются для лечения
отечного синдрома при заболеваниях почек,
сердца и печени. При почечной недостаточно-
сти противопоказаны тиазидные диуретики (ги-
потиазид, циклометиазид и оксо долин), в то
время как новые препараты из группы тиази-
доподобных (арифон и аквафор) не имеют этих
ограничений.
Тиазидные и тиазидоподобные диуретики
эффективны для лечения артериальной гипер-
тонии, несахарного диабета центрального и
почечного генеза, гиперкальциурии, почечно-
го канальцевого ацидоза.
Осложнения: основными побочными
проявлениями тиазидных и тиазидоподобных
диуретиков являются электролитные наруше-
ния — выраженная гипокалиемия, гиперкаль-
циемия и гиперурикемия. Препараты этой груп-
пы снижают толерантность к глюкозе и увели-
чивают ее концентрацию в крови. Их длитель-
ное использование может привести к развитию
импотенции.
В кортикальном отделе собирательных тру-
бок действует группа так называемых калийс-
берегающих диуретиков, в которую входят:
• спиронолактон (верошпирон, альдактон;
доза внутрь 50—300 мг/сут);
• триамтерен (доза внутрь 50—300 мг/сут);
• амилорид (доза внутрь 5—20 мг/сут).
Диуретический эффект представленных пре-
паратов невелик: они увеличивают экскретиру-
емую фракцию натрия (EF Na) лишь в 2 раза.
Однако свойство препаратов снижать выведе-
ние калия с мочой и длительность действия
(20—24 ч) обеспечили широкое их использо-
вание в клинике внутренних болезней, особен-
но в сочетании с тиазидными и петлевыми
диуретиками, которые обладают выраженными
калийтеряющими свойствами.
Механизм действия: спиронолактон —
конкурентный антагонист гормона коры над-
почечников — альдостерона. Он препятствует
связыванию альдостерона с рецептором в клет-
ке и тем самым уменьшает в этом отделе не-
фрона реабсорбцию натрия и секрецию в нем
калия. Амилорид и триамтерен обладают боль-
шим сродством к натриевым каналам. Находясь
в просвете собирательных трубок и связываясь
с натриевыми каналами, они закрывают пос-
ледние и тем самым блокируют в них реабсор-
бцию натрия и опосредованно, через снижение
электроотрицательности люминальной мембра-
ны, вызывают секрецию калия [Рябов С.И.,
Наточин Ю.В., 1997; Garty Н., Benos D., 1988].
Применение: калийсберетающие диуре-
тики показаны при недостаточности кровооб-
ращения и отечном синдроме почечного и пе-
ченочного происхождения. Препараты рекомен-
дуются для лечения артериальной гипертонии,
особенно при первичном и вторичном альдос-
теронизме. Калийсберегающие диуретики про-
тивопоказаны при хронической почечной не-
достаточности.
Осложнения: препараты могут нарушать
менструальный цикл, способствовать развитию
гирсутизма и огрубению голоса у женщин; у
мужчин вызывать гинекомастию и импотенцию.
9.7.2. Диуретики в нефрологической
клинике. Нефротический синдром
Лечение диуретиками при нефротическом син-
дроме (НС) подробно освещено в главе руко-
водства «Протеинурия и нефротический синд-
271
ром». В настоящем разделе мы остановимся
на фармакологических особенностях петлевых
диуретиков и тактике их применения в за-
висимости от функционального состояния
почек.
Почечная ретенция натрия при НС может
быть первопричиной его развития и может воз-
никать вторично как компенсаторная реакция
в ответ на гиповолемию — снижение объема
циркулирующей крови (ОЦК). При первом ва-
рианте ОЦК увеличен или сохраняется в нор-
ме, при втором — снижен (см. Нефротический
синдром). Тактика назначения диуретиков пря-
мо зависит от наполнения сосудистого русла.
При выявлении сниженного ОЦК диуретики
противопоказаны, так как течение болезни
может осложниться развитием тяжелой гипово-
лемии вплоть до гиповолемического коллапса
со снижением почечных функций. Вводить ди-
уретики этим больным можно только после
восполнения ОЦК. В условиях нормо- и гипер-
волемии терапия диуретиками необходима.
Представленные данные говорят о важности
измерения ОЦК у больных с НС. В терапевти-
ческой клинике для определения ОЦК можно
использовать как общепринятые методы иссле-
дования с введением радионуклидов (1251-аль-
бумин, 1311-альбумин, 99111Тс-8п-пирофосфат)
или красителя (Т-1824, краска кардиагрин), так
и косвенные показатели — величину централь-
ного венозного давления (ЦВД) и измерение
АД в положении лежа и стоя. Низкий уровень
ЦВД (в норме 100 мм вод. ст.) и резкое паде-
ние АД в ортостазе свидетельствуют о низком
ОЦК.
Препаратами выбора для лечения выражен-
ного отечного синдрома являются петлевые
диуретики — одни из самых мощных диуре-
тических средств.
При назначении этих препаратов и опреде-
лении дозы их введения необходимо учитывать
функциональное состояние почек.
При нормальной функции почек в мочу
поступает адекватное вводимой дозе количество
диуретика, но при протеинурии нефротическо-
го уровня эффективность петлевых диуретиков
снижается из-за их связывания в просвете ка-
нальцев с альбумином. В результате для дости-
жения адекватного действия дозу петлевых
диуретиков следует увеличивать в 2—4 раза
(до 80—160 мг). Однако даже в этих случаях
EF Na под влиянием лекарств не достигает
должного уровня (20—25 %) и редко превышает
10 %.
272
Другой проблемой являются фармакокине-
тические особенности этой группы препаратов.
После достижения диуретического эффекта,
который проявляется в течение 1,5—3 ч после
в/в введения и в течение 4—6 ч после приема
препарата внутрь, развивается феномен рико-
шета, т.е. состояние антинатрийуреза, когда
экскреция натрия почками становится ниже
исходного уровня [Loon N.R. et al., 1989]. По-
добные особенности препарата можно нейтра-
лизовать дробным, частым введением фуросе-
мида и сочетанным применением петлевых
диуретиков и тиазидов [Fliser D., 1996].
При длительном использовании петлевых
диуретиков возникает новая проблема, извест-
ная в патофизиологии как «тормозной феномен»
(«braking phenomenon») [Loon N.R. et aL, 1989].
Суть феномена заключается в усилении реаб-
сорбции натрия в отделах нефрона, располо-
женных дистальнее места приложения диурети-
ка, т.е. при применении фуросемида — в дис-
тальных канальцах. В ответ на массивное поступ-
ление натрия в дистальные канальцы развива-
ется морфологическая и функциональная пере-
стройка этого отдела нефрона, которая прояв-
ляется гипертрофией эпителиальных клеток,
повышением активности в них Na-K-АТФазы
и трансцеллюлярных систем, обеспечивающих
усиленную реабсорбцию в них натрия. Эта пе-
рестройка особенно выражена при развитии
почечной недостаточности. Решением проб-
лемы является сочетание петлевых и тиази-
довых диуретиков, блокирующих реабсорб-
цию натрия в дистальных канальцах [Fliser D.,
1996].
В условиях хронической почечной недоста-
точности поступление диуретика в просвет не-
фрона снижается параллельно снижению СКФ,
что принципиально важно для всех диуретиков,
за исключением петлевых, которые, как ука-
зывалось выше, попадают в просвет канальцев
в результате секреции в проксимальном каналь-
це. Однако процесс секреции петлевых диуре-
тиков при ХПН также снижен. В связи с этим
для достижения диуретического эффекта реко-
мендуют использовать большие дозы препара-
тов: при СКФ менее 50 мл/мин при в/в введе-
нии фуросемида начальная доза должна состав-
лять 40—80—120 мг, при приеме препарата
внутрь — 80—160—240 мг; при СКФ менее 20
мл/мин — 80—160 мг и 160—320 мг соответ-
ственно. Учитывая представленные выше осо-
бенности фармакокинетики петлевых диурети-
ков (развитие феномена рикошета и тормозного
феномена), при ХПН лечение петлевыми диу-
ретиками следует дополнять назначением тиа-
зидных диуретиков вне зависимости от выра-
женности почечной недостаточности [Fliser D.
et al., 1994; Fliser D., 1996].
ЦШ1
9.7.3. Применение диуретиков при
отсутствии отечного синдрома
В нефрологической клинике в отсутствие отеч-
ного синдрома диуретики используют в следу-
ющих клинических ситуациях:
• при артериальной гипертонии;
• при острой почечной недостаточности;
• при почечном канальцевом ацидозе;
• при нарушении метаболизма кальция;
• при неадекватной продукции АДГ;
• при нефрогенном несахарном диабете;
• для подщелачивания мочи.
Лечение почечной артериальной гипертонии
и острой почечной недостаточности подробно
представлено в главах «Почки и артериальная
гипертония» и «Острая почечная недостаточ-
ность».
В основе развития почечного канальцевого
ацидоза лежит сниженная реабсорбция бикарбо-
натов в проксимальных канальцах, которая при-
водит к нарушению процессов ацидификации
мочи и развитию системного ацидоза. Назначе-
ние в этой ситуации тиазидных диуретиков, об-
ладающих свойством снижать СКФ и, следова-
тельно, объем жидкости, поступающей в прокси-
мальные канальцы, способствует усилению реаб-
сорбции бикарбонатов в этом отделе нефрона и
уменьшению проявлений заболевания.
В связи с этим тиазидные диуретики рассмат-
ривают в качестве патофизиологических препа-
ратов в лечении почечного канальцевого аци-
доза.
При лечении нарушений метаболизма каль-
ция используют свойства петлевых диуретиков
усиливать выведение кальция из организма, а
тиазидных диуретиков — его снижать. Разнонап-
равленность действия указанных диуретиков в
отношении реабсорбции кальция связана с
местом их действия. Реабсорбция кальция осу-
ществляется в восходящем отделе петли Генле,
как раз в том месте, где действуют петлевые
диуретики. В результате под влиянием диурети-
ков параллельно нарушению реабсорбции на-
трия снижается и реабсорбция кальция. Каль-
цийурический эффект фуросемида используют
для лечения гиперкальциемий. Терапия состо-
ит в назначении петлевых диуретиков с воспол-
нением потерь натрия и калия.
Основным местом действия тиазидных диу-
ретиков является дистальный отдел нефрона,
где реабсорбция кальция отсутствует. Из-за
свойства тиазидных диуретиков снижать СКФ
снижается поступающий в канальцы объем
жидкости и возрастает реабсорбция натрия и
кальция в отделах нефрона, расположенных
проксимальнее места действия тиазидов (про-
ксимальные канальцы, петля Генле). Кроме
того, в настоящее время установлено, что ти-
азидные диуретики прямо ингибируют высво-
бождение факторов, вызывающих резорбцию
кости, — остеокальцина, колонийстимулирую-
щего фактора макрофагов [Aubin R. et al., 1996].
Тиазидные диуретики эффективны в лечении
потерь кальция почечного генеза [Danovitch
G.M., 1987].
При неадекватной секреции АДГ рекомен-
дуют препараты из группы петлевых диурети-
ков, рассчитывая на усиленное выведение с
мочой воды и натрия, при этом одновременно
потери натрия восполняются [Клар С., 1987].
Проблемой несахарного диабета почечного
и центрального генеза является мочеизнурение,
которое в тяжелых случаях может быть 20 л в
сутки. Одна из задач лечения — уменьшение
количества выделяемой мочи. С этой целью ис-
пользуют тиазидные диуретики, которые, как
правило, назначают на фоне резкого ограни-
чения натрия в пище и в сочетании с вазоп-
рессином. В основе данной тактики лечения
лежит свойство тиазидных диуретиков снижать
объем профильтровавшейся жидкости и, сле-
довательно, уменьшать количество выделяемой
мочи. Это свойство значительно усиливается на
фоне ограниченного поступления натрия с
пищей. При приеме тиазидовых диуретиков
первоначальный объем мочи может снижаться
до 50 % от исходных значений [Клар С., 1987;
Danovitch G.M., 1987].
Для подщелачивания мочи используют ин-
гибиторы карбоангидразы —производные аце-
тазоламида. Как указывалось выше, эти диуре-
тики угнетают реабсорбцию бикарбонатов в
проксимальных канальцах, что приводит к уве-
личению pH мочи. Высокая pH мочи повыша-
ет растворимость мочевой кислоты и цистина,
препятствуя их камнеобразованию.
В терапевтической практике необходимость
увеличения pH мочи чаще всего возникает в си-
туациях усиленного образования мочевой кис-
лоты на фоне лечения миело- и лимфопроли-
феративных заболеваний. В этих случаях назна-
чение ингибиторов карбоангидразы в сочетании
с достижением высокого диуреза может предот-
вратить развитие уратной нефропатии. Однако
следует иметь в виду, что при длительном при-
еме ингибиторов карбоангидразы появляется
риск усиленного камнеобразования из солей
кальция, так как растворимость этих соедине-
ний в щелочной среде резко снижается.
Литература
К разделу 9.2
(Мечников И.И.) Metschnicov I.I. Sur les cytotoxines//
Ann. Inst. Pasteur. — 1900. — Vol. 14. — P. 369—382.
18—2950
273
(Линдеман В.К.) Lindeman W.K. Sur le mode d’action
de certains poisons renaux//Ann. Inst. Pasteur. — 1900. —
Vol. 14. - P. 49-59.
(Нефедьев H.) Nefediev N. Serum nephrotoxique//Ann.
Inst. Pasteur. - 1901. - Vol. 15. - P. 17-26/
Ратнер М.Я., Серов В.В., Розенфельд Б.И. и др. Кли-
нико-морфологические варианты и прогноз хрони-
ческого гломерулонефрита//Тер. арх. — 1983. — №
6. - С. 10-14.
Траянова Т.Г., Сура В.В., Свет-Молдавский Г.Я. Дей-
ствие лимфоцитов больных системной красной вол-
чанкой на клетки культуры тканей человека//Тер.
арх. — 1974. — № 7. — С. 39—45.
Траянова Т.Г., Сура В.В., Мажаров М.К. Клеточный
иммунитет при гломерулонефрите//Тер. арх. —
1974. - № 7. - С. 39-45.
Addis Т. Glomerular nephritis, diagnosis and treatment. —
New York, 1948.
Cameron J.St. The long-term outcome of glomerular
disease//Diseases of the kidney: 5th ed./Eds R. Shrier,
C.Gottshalk. — Boston: Little Brown, 1993. — P. 1429—
1435.
Ellis S. Natural history of Bright’s disease: clinical,
histological and experimental observations//Lancet. —
1942. - Vol. 1. - P. 72-94.
Glassock R.J. Crescentic glomerulonephritis//Treatement
of primary glomerulonephritis/Eds C.Ponticelli and
R.J.Glassock. — Oxford: Oxford Univ. Press, 1997. —
234 p.
Londcope W. Studies of the variations in the antistrepto-
lysin titer of the blood serum from patients with
hemorrhagic nephritis//!. Clin. Invest. — 1936. — Vol. 15. —
P. 277-285.
Munc F. Klinische Diagnostik der degenerativen
Nierenerkrankungen; degenerative Syphilisniere//Z. klin.
Med. - 1913. - Bd 78. - S. 1-24.
Volhard F., Fahr Т.Н. Die Brightische Nierenkrankheit.
Klinik, Pathologic und Atlas. — Berlin, 1914.
К разделу 9.3
Иванов A.A., Пальцев М.А., Серов В.В., Варшавский
В.А. Еще раз о морфологической классификации
гломерулонефрита//Арх.пат. — 1994. — № 1. — С. 8—
22.
Рябов С. И. Хронический гломерулонефрит//Клин.
мед. - 1984. - № 1. - С. 24-30.
Серов В.В., Варшавский В.А., Куприянова Л.А. Имму-
нопатология почек. — М.: Медицина, 1983.
Серов В.В., Варшавский В.А. Что называть гломеру-
лонефритом: спорные вопросы классификации//Арх.
пат. - 1987. - № 1. - С. 67-75.
Серов В.В. Новые данные о клинико-морфологичес-
кой гетерогенности хронического гломерулонефри-
та//Вестн. РАМН. — 1995. — № 5. — С. 43—47.
Шулутко Б.И. Патология почек. — М.: Медицина, 1983.
Шулутко В. И., Зусь Б.А., Шишкин А.Н. Мембраноз-
ный гломерулонефрит. — 1984. — № 10. — С. ИО-
114.
Шулутко Б. И. Вторичные нефропатии. — Л.: Меди-
цина, 1987.
Berns J.S., Caudio К. М., Krassner I.S. Steroid-responsive
nephrotic syndrome of childhood: A long tem study of
clinical course, histopathology and efficacy of
cyclophosphamide therapy//Amer. J. Kidney. — 1987. —
Vol. 9, N 2. - P. 108-114.
Berthoux EC, Laurent B., Petit J. C. Immunogenetics and
immunopathology of human primary membranous
glomerulonephritis//Clin. Nephrol. — 1984. — Vol. 22. —
P. 15-20.
Cameron J.S. The enigma of focal segmental glomeru-
losclerosis//Kidney Int. — 1996. — Suppl. 57. — P. SI 19—
S126.
Churg J., Sobin L.N. Renal disease. — Tokyo, 1982.
Cohen A.H., Border W.A., Glassock R.S. Nephrotic
syndrome with glomerular mesangial IgM deposits//Lab.
Invest. - 1978. - Vol. 38. - P. 610-615.
Cattran R.S. Tubulo-interstitial Nephropathies. — New
York — London, 1983. — P. 381.
Couser W. G. Pathogenesis of glomerulonephritis//Kidney
Int. - 1993. - Suppl. 42. - P. S19-S25.
Doi T, Kanatsu K, Ehiro F. Clinicopathological study
of patients with mesangial isolated C3 deposition in
various glomerular diseases//Nephron. — 1987. — Vol. 46,
N 2. - P. 188-193.
Garther H. V. Membranous Glomerulonephritis. - Stuttgart,
1980.
Goldszer R.C., Sween J., Cotran R. Focal segmental
glomerulosclerosis//Ann. Rev. Med. Selec. Top. Clin. Sci. —
1984. -Vol. 35. - P. 429-449.
Hofer W. Bioptische diagnostik von Nierenerkrankugen//
Pathologie. - 1984. - Vol. 5. - P. 305-321.
Hricik D.E., Chung-Park M., Sedor J.R. Glomerulo-
nephritis//New. Engl. J. Med. — 1998. — Vol. 339. — P.
667-672.
Kerjaschki D., Farquhar M.G. Immunocytochemical
localization of Heymann antigen (gp 330) in glomerular
274
epithelial cells of normal Lewis rats//J. Exp. Med. —
1983. - Vol. 157. - P. 667—672.
McIver A. G. Diagnosis and classification of primary
glomeruIonephritis//Diagn. Histopathol. — 1982. — Vol.
5.-P. 231-281.
Rohrbach R., Steinhauer H.B., Schollmeyer F. Morphologi-
sche befundvarianten bei der Antibasalmembran//
Pathologie. - 1987. - Vol.8, N 2. - P. 91-102.
Rosen S. Pathology of Glomerular Disease//Ed. S.
Rosen. — New York, 1983.
Rotter W. Color Atlas of Kidney Biopsy. — New York,
1985. - P. 267.
Seymor A.E. Glomerulonephritis: Approaches to
classificatton//PathoIogy. — 1983. — Vol. 17. — P. 225—
238.
Serov V. V., Varshavsky V.A., Schill H., Nizze H. Haiifig-
keit glomerularer Erkrankungen im Nierenbiopsiegut//
Zentralbl. allg. Pathol. Anat. — 1986. — Bd 132. — S. 471—
475.
Soda K., Sugawara M., Nishimura Sh. Clinico-
pathological study of IgA nephropathy with nephrotic
syndrome//Jap. J. Nephrol. — 1986. — Vol. 28. — P. 721 —
728.
Spargo B.H., Seymour A.E., Ordoner N.G. Renal biopsy
Pathology with Diagnostic and Therapeutic Implica-
tions. — New York, 1980.
Striker G.E., He C.J., Liu Z.H., Yang D.C., Zapuls R.K.,
Esposito C., Striker L.J. Pathogenesis of nonimmune
glomerulosclerosis: studies in animals and potential
applications to humans//Lab. Invest. — 1995. — Vol. 73. —
P. 596-602.
Thoenes W. Synoptische Pathologie der Glomerulo-
nephritis//Nieren und Hochdruckkrankh. — 1984. — Bd
l.-S. 1-9.
Wyatt R.J., Kanayama Y., Julian B.A. Complement
activation in IgA nephropathy//Kidney Int. — 1987. —
Vol. 31, N 4. - P. 1019-1023.
К разделу 9.4
Бобкова И.Н., Полянцева Л.Р., Тареева И.Е. и др. Тест
венозной окклюзии в оценке фибринолитической ак-
тивности сосудистого эндотелия у больных волчаноч-
ным нефритом//Тер.арх. — 1995. — № 4. — С. 42—45.
Бобкова И.Н., Полянцева Л.Р., Тареева И.Е., Козлов-
ская Л.В. Клиническое значение определения фак-
тора Виллебранда у больных волчаночным нефри-
том/Дер.арх. — 1995. — № 5. — С. 14—16.
Богомазова С.Ю., Иванов А.А., Гладских О.П. и др.
Цитокины и внеклеточный матрикс при экспери-
ментальных гломерулопатиях//Арх. пат. — 1997. —
№ 6. - С. 75-81.
Козловская Л.В., Полянцева Л.Р., Мухин Н.А. и др.
Функциональное состояние сосудистого эндотелия
при гломерулонефрите и амилоидозе// Тер.арх. —
1991.— № 6. — С. 31—33.
Козловская Н.Л., Артемьева В.Б., Кузнецов С.Л. Гис-
тохимическая оценка метаболизма тромбоцитов при
системной красной волчанке//Тер. арх. — 1994. —
№ 6. - С. 35-36.
Кутырина И.М., Тареева И.Е., Шестакова М.В.,
Герасименко О.И Антипротеинурическое действие ин-
гибиторов ангиотензинпревращающего фермента при
хроническом гломерулонефрите и диабетической не-
фропатии//Тер. арх. — 1994. — № 6. — Р. 19—22.
Кутырина И.М., Тареева И.Е., Шестакова М.В.,
Зверев К.В. Нарушение внутрипочечной гемодинами-
ки при гломерулопатиях//Вестн. РАМН. —1995. —
№ 5. - С. 47-52.
Мухин Н.А., Полянцева Л.Р., Козловская Л.В. и др.
Клиническое значение исследований гомеостаза в
нефрологии//Тер. арх. — 1988. — № 6. — С. 7—12.
Неверов Н.И., Иванов А.А., Тареева И.Е. и др. Мор-
фологические аспекты нефротической гиперлипиде-
мии//Тер. арх. — 1991. — № 6. —Р. 32—37.
Неверов Н.И., Козловская Л.В., Тареева И.Е. Свобод-
но-радикальные процессы и перекисное окисление
липидов при заболеваниях почек//Тер. арх. — 1992. —
№ 11. - Р. 42-44.
Опаленов К.В., Гладских О.П., Пальцева Е.М., Ива-
нов А.А. Роль различных форм основного фактора
роста и трансформирующего фактора роста-/?, в раз-
витии нефротоксического нефрита крыс//Бюл. экс-
пер. биол. мед. — 1998. — № 8. — С. 432—435.
Пальцев М.А., Иванов А.А. Межклеточные взаимодей-
ствия. — М.: Медицина, 1995.
Полянцева Л.Р., Тареева И.Е., Бобкова И. И и др. Фун-
кциональная активность активаторов плазминогена
в плазме крови и моче больных волчаночным нефри-
том//Тер. арх. —1994. — № 6. — С. 39—41.
Ратнер М.Я., Бродский М.Я., Зубкин М.А. Тубулоин-
терстициальный компонент хронического гломеру-
лонефрита//Тер. арх. — 1991. — № 6. — Р. 12—15.
Тареева И.Е. Механизмы прогрессирования гломеру-
лонефрита//Тер. арх. — 1996. — № 6. — Р. 5—10.
Тареева И.Е., Козловская Л.В., Романова М.Д., Януш-
кевич Т.Н. Нарушение гемостаза при волчаночном
нефрите//Тер.арх. — 1992. — № 11. — С.49—52.
Abbate М., Zoja С., Coma D., Remmuzi G. In progressive
nephropathies, overload of tubular cells with filtered
proteins translates glomerular permeability dysfunction
into cellular signals of interstitial inflammation//Journal
of the American Society of Nephrology. — 1998. —
Vol. 9, N 7. - P. 1214-1224.
18
275
Addy A.A. Molecular insights into renal interstitial fibrosis/
/J. Am. Soc. Nephrol. — 1996. — P. 2495—2508.
Aiello S., Remuzzi G., Noris M. Nitric oxide/endothelin
balance after nephron reduction//Kidney Int. — 1998. —
Vol. 53. - Suppl. 65. - P.578-597.
Alfrey A. C. Role of iron and oxygen radicals in progression
of chronic renal failure//American Journal of Kidney
Diseases. - 1994. - Vol. 23, N 2. - P. 183-187.
Alfrey A.C., Froment D., Hammond W.S. Role of iron in
the tubulo-interstitial injury in nephrotoxic serum
nephritis//Kidney International. — 1989. — Vol. 36. —P.
753-759.
Amann K, Nichols C., Tornig J. Effect of ramipril,
nifedipine and moxonidine on glomerular morphology
and podocyte structure in experimental renal failure//
Nephrol. Dial Transplant. — 1996. — Vol. 11. — P. 1003—
1011.
Blum M., Yachnin T, Wollman Y. et al. Low nitric oxide
production in patients with chronic renal failure//
Nephron. - 1998. - Vol. 79. - P. 265-268.
Bohle A. Change of paradigms in nephrology — a view
back and a look forward.
Bohle A., Wehrmann M., Mackensen-Haen S., Muller GA.
Pathogenesis of chronic renal failure in primary
glomerulopathies//Nephrol. Dial Transplant. — 1994. —
Suppl. 13. - P. 4-12.
Border W.A., Noble N.A. Transforming growth factor -
in tissue fibrosis//New. Engl. J. Med. — 1994. — Vol. 331. —
P. 1286-1292.
Border W.A., Noble N.A., Ketteler M. TGF-: a cytokine
mediator of glomerulosclerosis and a target for
therapeutic intervention//Kidney Int. — 1995. — Vol. 47. —
S59-S61.
Brenner B.M., Hostetter T.N. Dietary protein intake and
the progressive nature of kidney: The role of hemo-
dinamically mediated glomerular injury in the patho-
genesis of progressive glomerular sclerosis in aging, renal
ablation, and intristic renal disease//New Engl. J. Med. —
1982. - N 307. - P. 652-659.
Burton C., Harris K.P.G. The role of proteinuria in
progression of chronic renal failure//Amer. J. Kid. Dis. —
1996. - Vol. 27, N 6. - P. 765-775.
Daniels B.S., Hostter Т.Н. Adverse effects of growth in
the glomerular microcirculation//Amer. J. Physiol. —
1990. - Vol. 258. -P. F1409-F1416.
Davies M. et al. Proteinases and glomerular matrix
tumover//Kidney Int. — 1992. — Vol. 41. — P. 671—678.
de Santo N.G., Capasso G., Anastasia A. et al. Renal
functional reserve in children with and without renal
disease//Nephron. — 1991. — Vol. 59. — P. 1—6.
Egido J. Vasoactive hormones and renal sclerosis//Kidney
Int. - 1996. - Vol. 49. - P. 578-597.
Fogo A., Hawkins, Berry P.L. et al. Glomerular
hypertrophy in minimal change disease predicts
subsequent progressive to focal glomerulosclerosis//
Kidney Int. - 1990. - Vol. 38. - P. 115-123.
Kovacs E.J. Fibrogenic cytokines: the role of immune
mediators in the development of scar tissue//Immunol.
Today. - 1991. - Vol. 12. - P. 17-23.
Kriz W. Progression of glomerular disease: is podocyte
the culprit?//Kidney International. — 1998. — Vol. 54. —
Suppl. 3. - P. 687-697.
Lan H.Y., Nikolic-Paterson D.J., Atkins R.C. Initiation
and evolution of interstitial leukocytic infiltration in
experimental glomerulonephritis//Kidney Int. — 1991. —
Vol. 40. - P. 425-433.
Lovett D.H., Johnson R.J., Marti HP. et al. Structural
characterisation of the mesangial cells type IV collagenase
activity and enhanced expression in a model immune
complex glomerulonephritis//Amer. J. Pathol. — 1992. —
Vol. 141. -P. 85-98.
Nequid A., Nahas E. Mechanisms of renal scarring/The
role of endothelium, platelets and coagulation. — In:
Oxford Textbook of clinical nephrology/Eds A.M. Davison
and J.S. Cameron. — 1998.
Noronha I.L., NiemirZ, Stein H., Waldherr R. Cytokines
and growth factors in renal disease//Nephrol. Dial.
Transplant. - 1995. - Vol. 10. - P. 775-786.
Pollak V., Kant K, Hariharan S. Didduse and focal
proliferative LN. Treatment, approaches and results//
Nephron. - 1991. - Vol. 59. - P. 177-193.
Remuzzi G., Ruggenenti P., Benigni A. Undestanding the
nature of renal disease progression//Kidney Int. —
1997.-Vol. 51. - P. 2-15.
Rennke H, Anderson S, Brenner В. The progression of renal:
structural and functional correlation. — In: Renal pathology:
with clinical and functional correlations/Eds C.Tisher and
B.Brenner. — Philadelphia, 1994. — P. 116—139.
Rondeau E., Mougenot B., Lacave R. et al. Plasminogen
activator inhibitor 1 in renal fibrin deposits of human
nephropathies//Clin. Nephrol. — 1990. — Vol. 33. — P. 55—
60.
Schena F.P. Cytokine network and resident renal cells in
glomerular diseases//Nephrol. Dial. Transplant. — 1999. —
Vol. 14. - Suppl. 1. - P. 22-26.
Sterzel R.B., Schulze-Lohoff E., Marx M. Cytokines and
mesangial cells//Kidney Int. — 1993. — Vol. 43. — Suppl.
39. - S26-S31.
Striker L.J., Killen P.D., Chi E., Striker G.E. The
composition of glomerulosclerosis: studies in focal
sclerosis, crescentic glomerulonephritis and membrano-
276
proliferative glomerulonephritis//Lab. Invest. — 1984. —
Vol. 51. - P. 181-192.
Wiggins R., Fantone J., Phan S., Holsman L. Mechanisms
of vascular injury. — In: Renal pathology: with clinical
and functional correlations/Eds C.Tisher and B.Bren-
ner. - Philadelphia, 1994. - P. 1027-1057.
Wolf G. Angiotensin II: a pivotal factor in the progression
of renal disease//Nephrol. Dial. Transplant. — 1999. — Vol.
14. - Suppl. 1. - P. 42-44.
К разделу 9.5
Козловская Н.Л., Медведева Т.Ю., Мирошниченко ИГ.
Тромбоз почечных вен и мембранозная нефропатия/
/Тер. арх. - 1999. - № 12. - С. 65-67.
Краснова Т.И., Лаврова ОН., Шилов Е.М. и др. Кли-
нические особенности фокально-сегментарного гло-
мерулярного склероза//Тер. арх. — 1999. — № 6. — С.
77-80.
Bellomo R., Atkins R.C. Membranous nephropathy and
tromboembolism//Nephron. — 1993. — Vol. 63. — P. 249—
253.
D’Amico G. Influence of clinical and histological features
on renal survival in adult patients//Amer. J. Kid. Dis. —
1992. - Vol. 20. - P. 315-323.
Cameron J., Turner D., Heaton J. et al. Idiopathic
mesangiocapillary glomerulonephritis//Amer. J. Med. —
1983. - Vol. 74. - P. 175-192.
Davison A.M., Johnston P.A. Glomerulonephritis in the
elderly//Nephrol. Dial. Transplant. — 1996. — Vol. 11. —
Suppl. 9. - P. 34-37.
Detwiler R.K., Falk R.J., Hogan S.L., Jennette J.C.
Collapsing glomerulopathy: a clinically and pathologically
distinct variant of FSGS//Kidney Int. — 1994. — P. 1416—
1424.
Hogan S.L., Muller K.E., Jennette C.J., Falk R.J. A review
of therapeutical studies of idiopathic membranous
glomerulonephritis//Amer. J. Kid. Dis. — 1995. — P. 862—
875.
Korbet S.M., Schwartz M.M. An adult with the nephrotic
syndrome unresponsive to treatment//Amer. J. Kid. Dis. —
1994. - Vol. 23. - P. 148-154.
Lagrue G., Branellec A., Niaudet P. et al. Transmission
d’un syndrome nephrotique a deux nouveau-nes.
Regression spontanee//La Presse Medicale. — 1991. — Vol.
20. - P. 255-257.
Mallick N. Minimal change nephropathy in adults//Nephr.
Dial. Transpl. - 1996. - Vol. 11. - P. 482-489.
Nieuwhof C.M., Kruytzer M., Fredericks P. Chronicity
index and mesangial IgG deposition are risk factors for
hypertension and renal failure in early IgA-nephropathy/
/Amer. J. Kid. Dis. - 1998. - Vol. 31. - P. 962-969.
Schena F.P. IgA nephropathies//Oxford textbook of
clinical nephrology/Ed. A. Davison et al. — 2nd ed. —
1998. - Vol. 1. - P. 537-570.
Tashiro K., Kodera S., Takahashi Y. Detection of
apoptotic cells in glomeruli of patients with IgA-
nephropathy//Nephron. — 1998. — Vol. 79. — P.21—27.
USRDS 1998 annual data report//Amer. J. Kid. Dis. —
1998. - Vol. 32. - Suppl. 1.
Friesman B. Thin glomerular basement membrane
nephropathy in adults//Nephron. — 1998. — Vol. 79. —
P. 1-7.
Weiss M.A., Daquioag E., Margolin E.G., Pollak V.E.
Nephrotic syndrome, progressive renal failure and
glomerular «collapse»: a new clinicopathological entity/
/Amer. J. Kid. Dis. - 1986. - Vol. 7. - P. 20-28.
Zucchelli P., Pasquali S. Membranous nephropathy//
Oxford textbook of clinical nephrology/Ed. A. Davison et
al. - 2nd ed. - 1998. - Vol. 1. - P. 571-590.
К разделу 9.6
Краснова Т.Н., Шилов Е.М., Тареева И.Е. и др. Срав-
нение двух методов терапии циклофосфаном у боль-
ных хроническим нефритом с нефротическим син-
дромом//Тер. арх. — 1998. — № 6. — С. 14—17.
Кутырина И.М., Никишова Т.А., Тареева И.Е. Гипо-
тензивное и диуретическое действие гепарина у боль-
ных гломерулонефритом//Тер. арх. — 1985. — № 6. —
С. 78-81.
Кутырина И.М., Тареева И.Е., Носиков В.В. и др.
Изучение полиморфизма гена ангиотензин-превра-
щающего фермента при хроническом ГН//Тер. арх. —
1999. - № 6. - С. 94-96.
Никишова Т.А. Селективный гипоальдостеронизм при
применении гепарина у больных хроническим гломе-
рулонефритом//Клин. мед. — 1987. — № 7. — С. 94—96.
Тареева И.Е., Краснова Т.Н. Сандиммун-неорал в
лечении нефротического синдрома//Врач. — 1999. —
№ 3. - С. 20-21.
Тареева НЕ., Кутырина ИМ., Неверов Н.И. Пути
торможения неиммунного прогрессирования ГН//
Клин. мед. — 1995. — № 3. — С. 80—83.
Тареева И.Е., Янушкевич Т.Н., Шилов Е.М. и др. Бы-
стропрогрессирующий волчаночный нефрит//Тер.
арх. - 1990. - № 6. - С. 46-49.
Шестакова М.В., Чугунова Л.А., Воронцов А.В., Де-
дов И. И. Эффективность сулодексида — низкомоле-
кулярного гепарина — в терапии диабетической не-
фропатии//Тер. арх. — 1997. — № 6. — С. 34—37.
Шилов Е.М. Иммунодепрессивная терапия активных
форм нефрита (клинико-экспериментальное иссле-
дование). Дисс. докт. мед. наук. — М.,1994.
277
Шилов Е.М., Краснова Т.Н. Иммунодепрессивная те-
рапия гломерулонефрита//Ма1епа Medica. — 1995. —
№ 2. - С. 21-38.
Шилов Е.М., Тареева И.Е., Краснова Т.Н., Иванов А.А.
Клиническое испытание нового метода лечения хро-
нического гломерулонефрита сверхвысокими дозами
пиклофосфана//Клин. мед. — 1995. — № 3. — С. 86—90.
Banfi G., Moriggi М., Sabadini Е. et al. The impact of
prolonged immunosuppression on the oucome of
idiopathic focal-segmental glomerulosclerosis with
nephrotic syndrome in adults//Clin. Nephrol. — 1991. —
Vol. 36. - P. 52-59.
Brodehl J. Conventional therapy for idiopathic nephrotic
syndrome in children//Clin. Nephrol. — 1991. — Vol. 35. —
Suppl. 1. — P. 8—15.
Cattran D.C., Cardella C., Roscoe J. et al. Results of
controlled drug trial in membranoproliferative glomeru-
lonephritis//Kidney Int. — 1985. — Vol. 27. — P. 436—
441.
Donadio J. and Offbrd K. Reassessment of treatment results
in membranoproliferative glomerulonephritis, with
emphasis on life-table analysis//Amer. J. Kid. Dis. —
1989.-Vol. 6. - P. 445-451.
Donadio J., Anderson C., Mitchell J. et al. Membrano-
proliferative glomerulonephritis, a clinical trial of platelet
inhibitor therapy//N. Engl. J. Med. — 1994. — Vol. 310. —
P. 1421-1426.
Glassock R. Therapy of idiopathic nephrotic syndome in
adults//Am. J. Nephrol. — 1993. — Vol. 13. — P. 422—428.
Glassock R. Crescentic glomerulonephritis. — In:
Treatment of primary glomerulonephritis/Eds C.Ponticelli
and R.Glassock. — Oxford: Oxford Univ. Press. — 1997. —
P. 234-254.
Glassock R., Cohen A., Adler S. Primary glomerular
disease. — In: The Kidney/Ed. B. Brenner. — 5th ed. —
London: WB Saunders, 1995. — P. 1458—1466.
Gambaro G., Baggio B. Glycosaminoglycans: a new
paradigm in the prevention of proteinuria and progression
of glomerular disease//Nephrol. Dial. Transplant. —
1996. - Vol. 11. - P. 762-764.
Gansevoort R.T., Sluter W.J., Hemmelder M.H., De Zeeuw
D., De Jong P.E. Anti proteinuric effect of blood-pressure-
lowering agents//Nephrol. Dial. Transpl. — 1995.—Vol.
10. - P. 354-357.
Hauser L.A., Renders L., Radeke H. et al. Mycophenolate
mofetil inhibits rat and human mesangial cell proliferation
by guanosine depletion//Nephrol. Dial. Transpl. — 1999. —
Vol. 14. - P. 58-62.
Heeg J.E., De Jong P.E., Van Der Hem G.K., De Zeeuw
D. Efficacy and variability of the anti proteinuric effect
of ACE inhibition by lisinopril//Kidney Int. — 1989. —
Vol. 36. - P. 272-279.
Heeg J.E., De Jong P.E., Van Der Hem G.K, De Zeeuw
D. Angiotensin II does not acutely reverse the reduction
of proteinuria by long-term ACE inhibition//Kidney
Int. - 1991. - Vol. 40. - P. 734-741.
Hopper J. Prednisone in the treatment of idiopathic
membranous nephropathy//N. Engl. J. Med. — 1989. —
Vol. 321. - P. 260.
Mandal A.K., Lyden T. W., Saklaen M.G. Heparin lowers
blood pressure//Kidney Int. — 1995. — Vol. 47. — P. 1017—
1022.
ISKDC — International study of kidney disease in
children: the primary nephrotic syndrome in chldren.
Identification of patients with minimal-change nephrotic
syndrome from initial response to prednisolone//!.
Pediatr. - 1981. - Vol. 98. - P. 561-564.
Kobayashi Y., Fujii K, Hiki Y. et al. Steroid therapy in
IgA nephropathy: a retrospective study in heavy proteinuric
cases//Nephron. - 1988. - Vol. 48. - P. 12-17.
Korbet S., Schwartz M.M., Lewis E.J. Minimal-change
glomerulopathy of adulthood//Am. J. Nephrol. — 1988. —
Vol. 8. - P. 291-297.
Korbet S.M., Schwartz M.M., Lewis E.J. Primary focal
segmental glomerulosclerosis: clinical course and response
to therapy//Am. J. Kidney Dis. — 1994. — Vol. 23. — P.
773-783.
£a/ K, Lai E, Ho C. et al. Corticosteroid therapy in IgA
nephropathy: a long-term controlled trial//Clin.
Nephrol. -1986. - Vol. 26. - P. 174-180.
Lai K, Lai F, Ho C. et al. Corticosteroid therapy in IgA
nephropathy with nephrotic syndrome: a long-term
controlled trial//Clin. Nephrol. — 1989. — Vol. 26. — P.
174-180.
McLaughlin K, Jardine A.G. Angiotensin converting
enzyme inhibitors and angiotensin receptor antagonists:
either or both for primary renal disease?//Nephrol. Dial.
Transpl. - 1999. - Vol. 14. - P. 25-28.
MeyrierA., Condamin М.-C., Bronner D. et al. Treatment
of adult idiopathic nephrotic syndrome with cyclosporin
A: minimal-change disease and focal-segmenatal
glomerulosclerosis//Clin. Nephrol. — 1991. — Vol. 35. —
Suppl. 1. - P. 37-41.
Meyrier A., Noel L.H., Aurihce P., Callard P. Long-term
renal tolerance of cyclosporine A treatment in adult
idiopathic nephrotic syndrome//Kidney Int. —1994. — Vol.
45. - P. 1446-1456.
Morita Y., Makino H, Ota K. et al. Effect of heparin and
low-molecular — weight heparin on proliferative
glomerolonephritis//Nippon-Jinzo-Gakkai-Shi.— 1994.—
Vol. 36. - P. 832-838.
Neverov N.I., Kaysen G.A., Tareyeva I.E. Effect of lipid-
lowering therapy on the progression of renal disease in
nondiabetic nephrotic patients.... — In: Lipids and the
278
Kidney/Eds W.F.Keane, W.H.Hori, B.L.Kasiske. —
Basel: Karger, 1997. — P. 68—78.
Nolasco F, Cameron J.S., Heywood E.F. et al. Aduld-onset
minimal-change nephrotic syndrome: a long-term follow-
up//Kidney Int. - 1986. - Vol. 29. - P. 1215-1223.
Pei Y., Catlran D., Delmore T. et al. Evidence suggesting
under-treatment in adults with idiopathic focal segmental
glomerulosclerosis//Am. J. Med. — 1987. — Vol. 82. — P.
938-944.
Ponticelli C, Passerini P., Altieri P. et al. Remission and
relapses in idiopathic membranous nephropathy//Nephrol.
Dial. Transpl. — 1992a. — Vol. 7. — Suppl. 1. — P. 85—90.
Ponticelli C., Passerini P. Treatment of the nephrotic
syndrome associated with primary glomerolonephritis//
Kidney Int. — 1994. — Vol. 43. — P. 595—604.
Ponticelli C, Zucchelli P., Imbasciati E. et al. Controlled
trial of methylprednisolone and chlorambucil in
idiopathic membranous nephropaty//N. Engl. J. Med. —
1984. - Vol. 310. - P. 946-950.
Ponticelli C, Zucchelli P., Passerini P., Cesana B. et al.
Methylprednisolone plus chlorambucil as compared with
methylprednisolone alone for the treatment of idiopathic
membranous nephropathy//N. Engl. J. Med. — 1992b. —
Vol. 327. - P. 599-603.
Ponticelli C., Zucchelli P., Passerini P. et al. A 10-year
follow-up of randomised study with methylprednisolone
and chlorambucil in membranous nephropathy//Kidney
Int. - 1995. - Vol. 48. - P. 1600-1604.
Pozzi C, Bolasco B.G., Fogazzi G.B. et al. Randomized
trial of steroids in IgA nephropathy with moderate
proteinuria at 5 years of follow-up. XXX Congr. EDTA/
ERA. — Geneva: Abstr. Book, 1997. — P. 89.
Remuzzi G., Ruggenenti P., Benigni A. Understanding the
nature of renal disease progression//Kidney Int. —
1997,- Vol. 51. - P. 2-15.
Rostoker G., Belghiti D., Ben Maadi A. et al. Long-term
cyclosporine A therapy for severe idiopatic membranous
nephropathy//Nephron. — 1993. — Vol. 63. — P. 335—341.
Rollino C., Roccatello D., Vallero A. et al. Membranous
glomerulonephritis in the elderly. Is therapy still
worthwile?//Geriatric Nephrol, and Urol. — 1995. — Vol.
5. - P. 97-104.
Rydel J.J., Korbet S.M., Borok R.Z., Schwartz M.M.
Primary focal segmental glomerulosclerosis in adults:
presentation, course, and response to treatment//Am. J.
Kidney Dis. - 1995. - Vol. 25. - P. 534-542.
Striker G.E. Therapeutic uses of heparinoids in renal
disease patients//Nephrol. Dial. Transpl. —1999. — Vol.
14. - P. 540-543.
Striker G.E., Lupia E., Elliot S. et al. Glomerulosclerosis,
arteriosclerosis and vascular graft stenosis: Treatment
with oral heparinoids//Kidney Int. — 1997. — Vol. 52. —
S.120-123.
Sugiyama N., Shimizu J., Nakamura M. et al. Clinico-
pathologycal study of effectiveness of tonsillectomy in IgA
nephropathy accompanied by chronic tonsillitis//Acta
Otolaryngol. — 1993. — Vol. 508 (Suppl.). — P. 43—48.
Tamura S., Masuda Y., Inokuchi I. et al. Effect of and
indication for tonsillectomy in IgA nephropathy//Acta
Otolaryngol. — 1993. — Vol. 508 (Suppl.). — P. 23—28.
Waldo B., Wyatt R.J., Kelly D.R. et al. Treatment of IgA
nephropathy in children: efficacy of alternate-day
prednisolone//Pediatr. Nephrol. — 1993. — Vol. 7. — P.
529-532.
Walker R. G., Yu S.H., Owen J.E. et al. The treatment of
mesangial IgA nephropathy with cyclophosphamide,
di pyridamole and warfarine: a two year prospective trial/
/Clin. Nephrol. - 1990. - Vol. 34. - P. 103-107.
Woo K.T., Lee G.S., Lau Y.K et al. Effects of triple therapy
in IgA nephritis: a follow-up study 8 years later//Clin.
Nephrol. - 1991. - Vol. 36. - P. 60-66.
К разделу 9.7
Клар С. Почки и гомеостаз в норме и при патоло-
гии. — М., 1987. — 445 с.
Рябов С.И., Наточин Ю.В. Функциональная нефро-
логия. — СПб., 1997. — 300 с.
Aubin R., Menard Р., Lajeunesse D. Selective effect of
thiazides on human osteoblast-like cell line//Kidney
Int. - 1996. - Vol. 50. - P. 1476-1482.
Danovitch G.M. Diuretic use in edematous and none-
dematous states. — In: Current therapy in nephrology and
hypertension-2/Ed. RJ.Glassock. — 1987. — P. 335—338.
Fliser D. Loop diuretics and thiazides — the case for
their combination in chronic renal failure//Nephrol. Dial.
Transplant. - 1996. - Vol. 11. - P. 408-423.
Fliser D., Schroter M., Neubeck M., Ritz E. Coadm-
inistraion of thiazides increases the efficacy of loop
diuretics even in patients with advanced renal failure//
Kidney Int. — 1994. — Vol 46. — P. 482—488.
Garty H., Benos D. Characteristics and regulatory
mechanisms of the amiloride-blockable Na channel//
Physiol. Rev. - 1988. - Vol. 68. - P. 309-373.
Kirchner K. A., Voelker J.R., Beater D.C. Binding inhibitors
restore furosemide potency in tubule fluid containing
albumin//Kidney Int. — 1991. — Vol. 40. — P. 418—424.
Leenen F. Cardiovascular effects of indapamide in
hypertensives with or without renal failure: a dose
response curve//Am. J. Med. — 1988. — Vol. 84. — Suppl.
IB. - P. 76-85.
Loon N.R., Wilcox C.S., Unwin R.J. Mechanism of
impaired natriuretic response to furosemide during
prolonged therapy//Kidney Int. — 1989. — Vol. 36. — P.
682-689.
279
Глава 10
ПОЧКИ ПРИ СИСТЕМНЫХ
ЗАБОЛЕВАНИЯХ
10.1. Поражение почек при
системной красной волчанке*
Системная красная волчанка (СКВ) — наибо-
лее частое заболевание из группы диффузных
болезней соединительной ткани, развивающе-
еся на основе генетического несовершенства
иммунной системы. Характеризуется выработкой
широкого спектра аутоантител к компонентам
клеточного ядра и цитоплазмы, нарушением
клеточного звена иммунитета, приводящим к
развитию иммунокомплексного воспаления. По-
ражаются кожа, суставы, серозные оболочки,
легкие, сердце; наибольшую опасность для
жизни больных представляет поражение ЦНС и
почек. Клинически нефрит выявляется у 50—
70 % больных.
СКВ развивается чаще у женщин детородного
возраста: соотношение с мужчинами составля-
ет 9:1. Распространенность в европейской по-
пуляции 40:100 000 [Hochberg М.,1990].
10.1.1. Патогенез
Волчаночный нефрит — типичный иммуноком-
плексный нефрит, механизм развития которо-
го отражает патогенез СКВ в целом. Основу за-
болевания составляет потеря иммунной толе-
рантности к собственным антигенам, в первую
очередь ядерным, приводящая к неконтроли-
руемой продукции множества антител, которые
оказывают как прямое повреждающее действие
(антиядерные антитела, антитела к клеткам
крови), так и опосредованное — через К-клет-
* Раздел написан И.Е.Тареевой, Т.Н.Красновой.
ки, формирование ИК, через активацию сис-
темы комплемента с образованием продуктов
его распада. Патогенез нефрита при СКВ свя-
зывают с отложением в почках иммунных ком-
плексов, содержащих антиядерные антитела.
Среди них наибольшее значение отводится ан-
тителам к двуспиральной ДНК, которые кор-
релируют с активностью нефрита, нередко
выявляются в составе ЦИК, а также в составе
ИК в клубочках, откуда могут быть элюирова-
ны. Потенциально нефритогенными считаются
антитела к ДНК изотипа IgG2b, запускающие
классический путь активации комплемента.
Помимо антител к нативной ДНК, придается
значение и другим аутоантителам к различным
клеточным структурам, часть которых облада-
ет большой специфичностью и патогенностью.
Так, анти-Ro- и анти-С1ч-антитела ассоцииру-
ются с тяжелым поражением почек, анти-Ьа-
антитела — с сухим синдромом у пожилых
больных, антитела к рибосомальному про-
теину Р — с цереброваскулитом, а возможно,
и с нефритом, анти-Lo- 1-антитела — с мио-
зитом.
С наличием антител к кардиолипину классов
G и М связывают развитие при СКВ антифос-
фолипидного синдрома (АФС). К клиническим
проявлениям АФС относят рецидивирующие ар-
териальные и венозные тромбы, привычное
невынашивание беременности, тромбоцитопе-
нию, сетчатое ливедо, поперечный миелит,
мигрень, хорею, эпилепсию, асептические не-
крозы костей, хронические язвы голеней, не-
инфекционный эндокардит, синдром Рейно,
аутоиммунную гемолитическую анемию, артери-
альную, легочную и портальную гипертензию.
Данные последних лет о механизме потери
иммунологической толерантности позволяют с
280
новых позиций объяснить, каким образом
ДНК, находящаяся в сочетании с гистонами в
нуклеосомах в составе сложной структуры хро-
матина, не встречающаяся в свободной форме,
может стать доступной для иммунной системы
и вызвать образование антител. Толерантность
собственных антигенов основана на физиоло-
гическом процессе физического удаления пу-
тем апоптоза (программированной смерти)
аутореактивных клонов Т-и В-клеток, что кон-
тролируется соответствующими генами (Fas,
Fas-1 и др.). Нарушенный апоптоз ведет к экс-
пансии аутореактивных клонов. В эксперименте
показано, что волчаночноподобный синдром и
лимфопролиферация вызываются или мутаци-
ей генов Fas, Fas-1, или введением в нормаль-
ные В-клетки Bcl-гена, который предупрежда-
ет апоптоз.
Апоптоз происходит поэтапно — уплотнение
и отграничение хроматина, сгущение цитоплаз-
мы, образование пузырьков в мембранах, их
слияние с образованием апоптотичных телец,
фагоцитоз соседними клетками в сочетании с
фрагментацией ядер. Нарушение фагоцитоза
апоптотичных клеток (LE-феномен) ведет к
высвобождению нуклеосом. От мышей и людей
с СКВ выделены клоны Т-хелперов, реагирую-
щих с нуклеосомами, гистонами, что указыва-
ет на роль Т-клеток, сенсибилизированных
против связанных с ДНК белков в хроматине,
в развитии антител к ДНК. Таким образом,
аутоиммунный ответ начинается с потери то-
лерантности к нуклеосомам, которые могут
быть первичным и единственным аутоантиге-
ном при СКВ. Они служат иммуногеном для Т-
хелперов, что приводит к нарушению функции
Т-лимфоцитов, снижению соотношения CD4+/
CD8+ и как следствие поликлональной акти-
вации В-клеток, хотя поликлональная актива-
ция В-клеток может быть связана и с первич-
ным генетическим дефектом. Продукты катабо-
лизма хроматина и особенно нуклеосомы мо-
гут в комплексе с антителами активно связы-
ваться с базальной мембраной клубочков.
В индукции заболевания играют роль как
эндогенные факторы (генетические, половые
гормоны), так и экзогенные (инсоляция, пе-
реохлаждение, вакцинация, бактериальные и
вирусные инфекции).
Генетическая детерминированность измене-
ний иммунного ответа доказана при изучении
СКВ в некоторых этнических группах, у род-
ственников больных СКВ, а также в экспери-
ментальных моделях люпус-нефрита у новозе-
ландских мышей и алеутских норок. Установле-
но, что уровень антител к ДНК и наличие
антител к ядерному антигену у животных и у
людей ассоциированы с аллоангигеном HLA-
В8, DR2, DR3, а также с селективными В-кле-
точными аллоантигенами. Описаны семейные
случаи болезни, в том числе у близнецов, со
схожей клинической картиной, причем часто-
та возникновения у идентичных близнецов до-
стигает 69 %. Мы наблюдали СКВ у сиблингов
(в том числе тяжелейший волчаночный нефрит
с нефротическим синдромом у двух братьев) в
5 семьях. Некоторые фенотипы поражаются
чаще, например лица с дефицитом С2-фрак-
ции комплемента, со снижением активности N-
ацетил-аминотрансферазы. Отрицательное вли-
яние эстрогенов на СКВ подтверждается преж-
де всего клиническими наблюдениями возник-
новения или обострения процесса после родов
и абортов. У мужчин с СКВ обнаружено сни-
жение содержания тестостерона и относитель-
ное повышение эстрадиола. Другим подтверж-
дением протективной роли андрогенов яляет-
ся возрастание частоты СКВ у больных синд-
ромом Клайнфелтера (наследственный гипого-
надизм). Механизм действия гормонов до кон-
ца неясен. Обсуждается возможность нарушения
метаболизма эстрогенов, усиления В-клеточной
дифференциации под влиянием эстрадиола при
митогенной стимуляции лимфоцитов и подав-
ления эстрогенами функциональной активно-
сти Т-супрессоров.
Среди экзогенных факторов важное значе-
ние придается ультрафиолетовому облучению.
В эксперименте показано, что под воздействи-
ем ультрафиолетового облучения появляются
антитела к ДНК, что связано с развитием апо-
птоза кератиноцитов. На этапе образования пу-
зырьков ядерные антигены ДНК и Ro перехо-
дят из ядра на поверхность, где они обычно
не появляются, и таким образом иммунная си-
стема получает доступ к собственным антиге-
нам.
Антигенами, провоцирующими поликло-
нальную активацию В-клеток, могут быть бак-
териальные липополисахариды. Возможна роль
вирусов группы гриппа, парагриппа, Эпштей-
на — Барр, кори, краснухи, ретровирусов. Вни-
мание к вирусам было привлечено обнаруже-
нием в ткани почек больных волчаночным не-
фритом структур, напоминающих скопления
парамиксовирусов. Моделью СКВ являются но-
возеландские мыши, инфицированные Сопс-
ornavirus. Полагают, что определенные частицы
вирусного генома, внедряясь в ДНК нормаль-
ных клеток, могут значительно увеличивать
клеточную активацию и способствовать разви-
тию СКВ. Косвенным подтверждением возмож-
ной причастности вирусов к СКВ являются
наши исследования, выявившие значительную
частоту высоких титров антител к РНК-содер-
жащим вирусам, а также наличие коревого ге-
нома в лимфоцитах больных [Тареева И.Е. и др.,
1989].
281
10.1.2. Морфология
Морфологические изменения в почках при СКВ
встречаются значительно чаще, чем клиничес-
кие проявления нефрита. Иммунофлюоресцен-
тное исследование биоптата или патологоана-
томического материала почки практически у
всех больных выявляет депозиты иммуноглобу-
линов или фракции комплемента в базальной
мембране гломерул. Гистологические изменения
в биоптате находят и у больных СКВ без кли-
нических признаков нефрита. J.Font и соавт.
(1987) при обследовании 15 больных СКВ без
клинических проявлений нефрита у 7 выявили
мезангиальную нефропатию и у 2 — очаговый
волчаночный ГН, причем в основном у боль-
ных, имевших, кроме кожно-суставного синд-
рома, и другие проявления СКВ; авторы ука-
зывают, что именно эта группа больных под-
вержена риску развития почечной патологии в
дальнейшем.
Морфология волчаночного нефрита отлича-
ется значительным полиморфизмом. Помимо
гистологических изменений, свойственных ГН
вообще (пролиферация мезангиальных и эпи-
телиальных клеток, расширение мезангиума,
изменения базальных мембран капилляров и
др.), отмечаются изменения, специфичные
(хотя и не патогномоничные) именно для
СКВ — фибриноидный некроз капиллярных пе-
тель, кариорексис и кариопикноз, гематокси-
линовые тельца, гиалиновые тромбы, «прово-
лочные петли». Эти признаки встречаются с раз-
личной частотой, при этом картина варьирует
не только от больного к больному, но от гло-
мерулы к гломеруле и даже от петли к петле.
Характерные для ВН морфологические из-
менения в биоптатах печки наблюдаются реже,
чем в патологоанатомическом материале.
При иммуногистохимическом исследовании в
клубочках чаще выявляются IgG, СЗ, фибрин;
несколько реже — IgM и IgA, отдельно или в
сочетании. Электронно-микроскопически нахо-
дят субэндотелиальные, иногда одновременно
субэпителиальные и/или интрамембранозные,
мезангиальные отложения иммунных комплек-
сов. Для депозитов при СКВ характерна зерни-
стая структура и вид, напоминающий отпечат-
ки пальцев. Патогномоничным признаком вол-
чаночного нефрита являются внутриэндотели-
альные вирусоподобные включения в капилля-
рах клубочка, напоминающие парамиксовирусы.
Помимо изменений клубочков, в половине
случаев выражены тубулоинтерстициальные
изменения — гиалиново-капельная и вакуоль-
ная дистрофия эпителия канальцев, субатрофия
и атрофия эпителия, мононуклеарные инфиль-
траты в интерстиции, нейтрофилы и эозино-
филы, очаги склероза, часто с отложением ИГ
282
и комплемента в интерстиции и на тубулярной
базальной мембране. Тубулоинтерстициальные
изменения обычно сочетаются с гломерулярны-
ми, соответствуя им по тяжести; изолирован-
ные тубулоинтерстициальные поражения казу-
истически редки. Поражения мелких сосудов
почек встречаются у 20—25 % больных.
В основе классификации волчаночного не-
фрита (ВН) отечественных авторов [Серов В.В.
и др., 1980] лежат характер морфологических
изменений и распространенность процесса. Вы-
деляют следующие формы:
• очаговый волчаночный пролиферативный
нефрит;
• диффузный волчаночный пролиферативный
нефрит;
• мембранозный;
• мезангиопролиферативный;
• мезангиокапиллярный;
• фибропластический.
Современная морфологическая классифика-
ция ВН, предложенная ВОЗ, включает 6 клас-
сов: I класс — нормальные клубочки при све-
товой микроскопии и отсутствие депозитов; II
класс (А и В) — мезангиальный гломерулонеф-
рит с мезангиальными и субэндотелиальными
депозитами; III класс (А, В и С) — очаговый
или фокальный пролиферативный ВН с мезан-
гиальными, субэндотелиальными ± субэпите-
лиальными депозитами; IV класс — диффузный
пролиферативный ВН с мезангиальными, суб-
эндотелиальными ± субэпителиальными депо-
зитами; V класс — мембранозный, при этом
субклассы (А, В, С, D) зависят от локализа-
ции депозитов: только субэпителиальные (А)
или в сочетании с другими; VI класс — скле-
розирующий ВН.
В наших наблюдениях среди 169 больных,
которым проводили биопсию почки, диффуз-
ный пролиферативный ВН был обнаружен у
67, очаговый — у 20, мезангиальные формы —
у 39, мембранозный вариант — у 19 и фибро-
пластический — у 24 больных.
Проводя параллели между этими двумя клас-
сификациями (что нередко необходимо для со-
поставления данных отечественных и зарубеж-
ных исследователей), можно прийти к выводу,
что II класс ВОЗ близок мезангиопролифера-
тивному ГН по классификации В.В.Серова и
соавт., III класс включает в себя лишь часть
случаев, описываемых В.В.Серовым и соавт. под
названием «очаговый пролиферативный ВН»,
так как «очаговость» и «диффузность» по клас-
сификации ВОЗ определяется степенью распро-
страненности всех гистологических изменений,
а по классификации В.В.Серова и соавт. — сте-
пенью распространенности лишь специфичес-
ких волчаночных признаков. Соответственно
класс IV включает в себя не только «диффуз-
ный пролиферативный волчаночный нефрит»,
но и часть случаев «очагового пролиферативно-
го волчаночного нефрита», а также случаи ме-
зангиопролиферативного и мезангиокапилляр-
ного. Наконец, V класс ВОЗ полностью соот-
ветствует мембранозному нефриту в классифи-
кации В.В.Серова и соавт., VI — фиброплас-
тическому.
Для прогноза течения заболевания и выбо-
ра адекватной терапии, помимо морфологичес-
кого типа нефрита, используют полуколиче-
ственные индексы активности (интракапилляр-
ная пролиферация, наличие полулуний, про-
лиферация подоцитов, пролиферация мезанги-
альных клеток, нейтрофильная инфильтрация,
кариорексис, депозиты, воспаление интерсти-
ция, васкулиты) и индекс склероза (сморщен-
ные клубочки, сегментарный склероз и гиали-
ноз, синехии, перигломерулярный склероз,
склероз интерстиция, атрофия канальцев, скле-
роз мезангия) [Austin Н., Balow J., 1984 ]. Вели-
чина индекса склероза имеет значение для оп-
ределения вероятности развития почечной не-
достаточности: риск развития почечной недоста-
точности при обнаружении хотя бы одного при-
знака составляет к 5-му году 25 %, к 10-му —
40 %, а в отсутствие признаков склероза к 5-
му году риск почечной недостаточности равен
нулю и к 10-му — примерно 10 % [Klippel J.,
1986; Balow J. et al., 1987]. В модификации
А.А.Иванова (1990) для вычисления индексов
каждый признак оценивают в трехбалльной
системе и как признак активности учитывают
наличие тромбоцитов в биоптате.
10.1.3. Клинические варианты,
течение, прогноз
Клиническая картина волчаночного поражения
почек крайне разнообразна — от персистиру-
ющей минимальной протеинурии, не влияю-
щей на прогноз, до тяжелейшего быстропрог-
рессирующего нефрита, с отеками, анасаркой,
почечной недостаточностью и гипертонией.
С точки зрения семиологии нет каких-либо при-
знаков, свойственных только волчаночной не-
фропатии, хотя в некоторых случаях определен-
ные особенности клинического течения нефри-
та заставляют заподозрить именно волчаночную
природу поражения почек.
В зависимости от тяжести клинической кар-
тины, течения, прогноза можно выделить не-
сколько вариантов, требующих различного те-
рапевтического подхода: активные формы
нефрита — быстропрогрессирующий и медлен-
но прогрессирующий волчаночный нефрит:
а) с нефротическим синдромом; б) с выражен-
ным мочевым синдромом; неактивный не-
фрит с минимальным мочевым синдромом,
или субклиническая протеинурия.
Быстропрогрессирующий волчаночный не-
фрит (БПВН) по клинической картине соот-
ветствует классическому подострому злокаче-
ственному гломерулонефриту и характеризует-
ся бурным нарастанием почечной недостаточ-
ности, обусловленной активностью почечного
процесса, а также нефротическим синдромом,
эритроцитурией и артериальной гипертензией
преимущественно тяжелого течения. В большин-
стве случаев БПВН сопутствует ДВС-синдром.
Морфологически этому варианту чаще всего
соответствует диффузный пролиферативный ВН
(IV класс) часто с полулуниями. Этот вариант
развивается у 10—45 % больных волчаночным
нефритом. Выделение этой формы диктуется
тяжелым прогнозом, сходством клинической
картины с другими быстропрогрессирующими
нефритами, необходимостью применения мас-
сивной терапии.
По данным многоцентрового исследования,
проведенного в США и охватившего 1103 боль-
ных СКВ [Ginzler Е. et al., 1982], 5-летняя вы-
живаемость больных, у которых содержание
креатинина при первом обращении превыша-
ло 0,26 ммоль/л, составила 29 %.
Медленно прогрессирующий ВН с нефротичес-
ким синдромом развивается у 30—40 % больных
люпус-нефритом (по нашим данным, — у 240
из 584 больных). Особенностями волчаночного
нефротического синдрома являются редкость
очень высокой протеинурии (такой, какая на-
блюдается, например, при амилоидозе), частое
сочетание с гипертонией, гематурией. Протеи-
нурия часто носит неселективный характер;
гипер-о^-глобулинемия выражена менее, чем
при брайтовом нефрите, может отмечаться ги-
пергаммаглобулинемия, содержание холестери-
на редко превышает 7,8—10,3 ммоль/л.
При гистологическом исследовании обычно
выявляется диффузный или очаговый пролифе-
ративный волчаночный нефрит, реже — мем-
бранозный или фибропластический нефрит.
Активный ВН с выраженным мочевым синд-
ромом наблюдается примерно у трети больных
(в 30 % наших наблюдений). Клиническая кар-
тина характеризуется выраженным мочевым
синдромом — протеинурией (содержание бел-
ка более 0,5 г/сут), эритроцитурией, лейкоци-
турией. Эритроцитурия постоянна, обычно на-
блюдается в сочетании с протеинурией; изоли-
рованная гематурия (гематурический нефрит)
редка. Лейкоцитурия может быть как следстви-
ем волчаночного воспалительного процесса в
почках, так и результатом нередкого присое-
динения вторичной инфекции мочевых путей.
Исследование лейкоцитарной формулы осадка
283
мочи помогает дифференцировать обострение
люпус-нефрита (с выраженной лимфоцитури-
ей) от вторичной инфекции (когда в осадке
мочи преобладают нейтрофилы). Очень высокая
лейкоцитурии (выше 50 • 106/сут) всегда явля-
ется следствием вторичной инфекции.
Более чем у половины больных с этой фор-
мой нефрита отмечается гипертония, нередко
усугубляемая стероидной терапией; однако син-
дром злокачественной гипертонии наблюдает-
ся не так часто (10—15 %) и преимущественно
у подростков.
Морфологическая картина одинаково часто
представлена волчаночным пролиферативным
нефритом и мезангиальными формами. Мемб-
ранозный нефрит в наших наблюдениях при
этой клинической форме не встречался.
При этих вариантах активного волчаночно-
го нефрита прогноз значительно более благо-
приятен, почечная недостаточность развивает-
ся обычно в достаточно поздние сроки. В наших
наблюдениях 10-летняя выживаемость больных
медленно прогрессирующим активным волча-
ночным нефритом составила 68 %.
Прогностически серьезным является присо-
единение артериальной гипертензии, отмечаю-
щееся у 60—70 % больных. Повышенное АД
само по себе оказывает повреждающее действие
на почки, сердце, головной мозг и кровенос-
ные сосуды; при СКВ эти органы являются
мишенями и аутоиммунного процесса. АГ ухуд-
шает общую и «почечную» выживаемость, уве-
личивает риск гибели больных от сердечно-со-
судистых осложнений и развития ХПН. Часто-
та АГ и состояние гемодинамики тесно связа-
ны со степенью активности нефрита. Так, в
наших наблюдениях ее частота при БПВН до-
стигала 93 % (в значительной доле это тяжелая
АГ), при активном ВН с нефротическим син-
дромом — 71 %, при активном ВН с мочевым
синдромом — 61 %, при неактивном ВН —
39 %. Обратимость повышения АД при дости-
жении ремиссии ВН также подтверждает связь
АГ при ВН с выраженностью активности про-
цесса. Нефросклероз влияет на уровень АД лишь
в тех случаях, когда он достигает значительной
выраженности: только у 22 из 52 наших боль-
ных с высоким индексом склероза в почечном
биоптате доказана связь АГ исключительно со
склеротическими изменениями [Тареева И.Е.,
Швецов М.Ю.,1998].
При умеренной активности процесса особую
роль как причина АГ приобретает антифосфо-
липидный синдром (АФС). По нашим данным,
частота АГ у больных с АФС была в 1,5 раза, а
злокачественной — в 2 раза выше по сравне-
нию с другими больными.
Риск развития стероидной АГ у больных с
СКВ составляет 8—10 %, а при поражении по-
284
чек — до 20 %. Для развития стероидной ги-
пертензии имеет значение не только доза, но
и длительность назначения стероидов.
Нефротический синдром при волчаночном не-
фрите не имеет такого прогностического зна-
чения, как при брайтовом нефрите. По нашим
данным, 10-летняя выживаемость у больных с
нефротическим синдромом и выраженным мо-
чевым синдромом при отсутствии АГ и сохран-
ной функции почки значимо не различается —
74 и 66 %. В наблюдениях D.Wallace и соавт.
(1981) это различие еще меньше — 65 и 66 %,
однако выявление нефротического синдрома в
начале болезни ухудшало прогноз. Это может
быть объяснено, с одной стороны, большей
активностью иммуновоспалительных процессов,
что приводит к назначению более агрессивных
схем иммуносупрессивной терапии. С другой
стороны, могут играть роль и некоторые осо-
бенности нефротического синдрома при ВН,
например меньшая его выраженность и мень-
шая склонность к рецидированию, чем при
брайтовом нефрите.
Как отдельный вариант мы выделяем нефрит
с минимальным мочевым синдромом, при кото-
ром протеинурия ниже 0,5 г/сут (субклиничес-
кая протеинурия), без лейкоцитурии и, глав-
ное, без эритроцитурии, с нормальной функ-
цией почек и без АГ. Выделение такого типа
нефрита имеет значение для выбора терапии,
при этом интенсивность терапии определена
поражениями других органов. Морфологические
изменения соответствуют ПА классу (минималь-
ные мезангиальные изменения), иногда они со-
провождаются канальцевыми и стромальными
или фибропластическими нарушениями.
Следует специально выделить тубулоинтер-
стициальные изменения, которые клинически
могут проявляться нарушением концентрацион-
ной или кислотовыделительной функций почек
с развитием явной или латентной формы по-
чечного канальцевого ацидоза [O’Dell J.R. et al.,
1985; Park M. et al., 1986]. Описаны единичные
наблюдения гиперкалиемии при СКВ, обуслов-
ленной нарушением канальцевой секреции ка-
лия.
G.Kozeny и соавт. (1987) при изучении функции
канальцев у 30 больных СКВ выявили у 18 дефект
обработки калия, натрия или водородных ионов (в
основном почечный канальцевый ацидоз). В наших
наблюдениях [Тареева И.Е., Потапова А.В., 1985]
при обследовании 25 больных СКВ без клинически
выраженного нефрита у одной выявлен почечный ка-
нальцевый ацидоз, у 5 — латентный дефект ациди-
фикации мочи, у 4 — снижение концентрационной
способности почек; у 12 больных была повышена
экскретируемая фракция /12-микроглобулина, что
говорило о снижении функции проксимальных ка-
нальцев.
Течение волчаночного нефрита. Активный вол-
чаночный нефрит, особенно быстропрогресси-
рующий, развивается обычно в первые годы
СКВ, при высокой иммунологической актив-
ности, во время одного из обострений болез-
ни, чаще при остром или подостром (по клас-
сификации В.А.Насоновой) течении СКВ. Реже
развитие тяжелого поражения почек наблюда-
ется через 5—6 лет болезни. В наших наблюде-
ниях у половины больных активный нефрит
развился в первые два года СКВ. Другие иссле-
дователи подчеркивают еще более раннее
развитие нефрита — у 60—70 % больных в те-
чение первого года СКВ [Estes D., Christian Ch.,
1971; Baldwin D. et al., 1977]. В эру до массив-
ной стероидной терапии появление нефропа-
тии на поздних этапах СКВ считалось вообще
маловероятным. Это становится понятным, если
учесть преобладание в те годы острых и подо-
стрых форм СКВ и выявленные В.А.Насоновой
и соавт. (1971) закономерности в отношении
времени вовлечения почек и остроты волчаноч-
ного процесса; по данным этих авторов, при
остром течении болезни развитие нефрита на-
блюдалось в 1-й год заболевания СКВ, при
подостром — на 3—4-м и при хроническом —
на 8—10-м году. Острые и активные формы не-
фрита развиваются в более молодом возрасте;
старшему возрасту свойственно более спокой-
ное течение как нефрита, так и СКВ в целом.
Это относится как к клиническим, так и к мор-
фологическим вариантам.
Поражение почек почти в 25 % случаев яв-
ляется первым признаком болезни, возникая
одновременно с артралгиями, поражением
кожи, плевритом или даже предшествуя им
(«нефритические маски»).
Мы наблюдали 32 больных (31 женщину и 1
мужчину), у которых СКВ дебютировала изолирован-
ным поражением почек, что привело первоначаль-
но к неправильному диагнозу самостоятельного по-
чечного страдания. У 28 больных на том или ином
этапе заболевания поражение почек протекало как
нефротический синдром; у 19 из них нефротичес-
кий синдром развился в первые 6 мес болезни. Ди-
агноз СКВ был поставлен в сроки от 2 мес до 10
лет после появления первых почечных признаков,
при развитии системных поражений или при обна-
ружении LE-клеток.
Казуистический интерес представляют на-
блюдения, прослеженные с начала возникно-
вения почечного процесса, с отсутствием им-
мунологических и морфологических признаков
СКВ на первых этапах нефрита (обычно мемб-
ранозного) и их появлением в последующие
годы.
Для течения болезни некоторое прогности-
ческое значение имеют возраст больных (более
тяжелое течение у молодых), срок от первых
признаков СКВ до начала нефрита (хуже про-
гноз при ранних нефритах), а также пол —
среди мужчин выживаемость ниже [Тареева
И.Е., Янушкевич Т.Н., 1985]. Морфологические
особенности ВН имеют большое прогностичес-
кое значение; в первую очередь следует отме-
тить наличие полулуний, распространенный
фибриноидный некроз, атрофию канальцево-
го эпителия и степень выраженности склеро-
тических изменений (индекс склероза). Среди
морфологических вариантов наиболее неблаго-
приятен прогноз при диффузном пролифера-
тивном нефрите (IV класс), а наиболее благо-
приятными считаются очаговый пролифератив-
ный и мембранозный нефрит, хотя при совре-
менных методах иммуносупрессии различие в
выживаемости при разных морфологических ва-
риантах стало менее выраженным.
10.1.4. Диагноз и дифференциальный
диагноз
При развернутой клинической картине СКВ
диагноз волчаночного нефрита редко представ-
ляет трудности. Это случаи, когда заболевание
начинается у молодых женщин лихорадочно-
кожно-суставным синдромом с повышенной
СОЭ, лейкопенией, протекает с периодичес-
кими обострениями, иногда связанными с
инсоляцией или беременностью. На высоте од-
ного из обострений присоединяется плеврит
(или перикардит); одновременно или через 1—
2 года появляется протеинурия.
Важными диагностическими пунктами явля-
ются следующие:
• поражение суставов — чаще мигрирующие
полиартралгии или полиартрит с преимуще-
ственным поражением мелких суставов кис-
тей, реже — коленных, локтевых, плечевых
суставов; деформация развивается редко;
• поражение кожи — наличие «бабочки» го-
ворит бесспорно в пользу СКВ, однако ти-
пичная волчаночная эритема может быть
эфемерной и в настоящее время встречает-
ся реже;
• полисерозиты — плеврит, перикардит, час-
то с развивающимся спаечным процессом;
• поражение легких — хронический интерсти-
циальный пневмонит, дисковидные ателек-
тазы, высокое стояние диафрагмы;
• поражение ЦНС — судороги, психозы, эпи-
лептиформные припадки;
• периферические васкулиты — капилляриты
кончиков пальцев, волчаночная эритема
ладоней, хейлит (васкулиты вокруг красной
каймы губ);
285
• синдром Рейно (чаще, правда, у больных
СКВ без поражения почек);
• трофические расстройства — быстрая поте-
ря массы тела, облысение;
• лабораторные показатели — резкое повыше-
ние СОЭ, лейкопения с лимфопенией и
анэозинофилией, анемия, тромбоцитопе-
ния, гипергаммаглобулинемия, гипокомпле-
ментемия (снижение СЗ и С4).
В 90 % случаев в крови находят LE-клетки
и антинуклеарный фактор (которые могут на-
блюдаться в отдельных случаях и при ревмато-
идном артрите, склеродермии, хроническом
активном гепатите) и более специфичные ан-
титела к нативной ДНК. Достоверными гисто-
логическими признаками являются фибриноид-
ный некроз, гематоксилиновые тельца, карио-
рексис.
Дифференциальный диагноз следует прово-
дить с другими системными заболеваниями,
протекающими с поражением почек, — с узел-
ковым периартериитом, геморрагическим вас-
кулитом, с лекарственной болезнью, хроничес-
ким активным гепатитом, ревматоидным арт-
ритом, миеломой, первичным и генетическим
амилоидозом, с инфекциями — затяжным сеп-
тическим эндокардитом, туберкулезом, с опу-
холями. При стертости системных признаков
следует дифференцировать ВН с хроническим
гломерулонефритом. С особой осторожностью
следует ставить диагноз люпус-нефрита при
атипичных клинико-лабораторных данных —
при развитии заболевания у мужчин, при от-
сутствии артралгий, при рефрактерности лихо-
радки к средневысоким дозам стероидов (50—
60 мг/сут), при гематурическом нефрите с мак-
рогематурией, при отсутствии LE-клеток и
антител к ДНК и т. д.
Узелковый периартериит поражает преиму-
щественно мужчин, протекает с периферичес-
кими полиневритами, артралгиями, абдоминаль-
ными кризами, лейкоцитозом, иногда (у жен-
щин) — с бронхиальной астмой и гиперэози-
нофилией. Поражение почек характеризуется
васкулитом почечных сосудов с развитием стой-
кой (часто злокачественной) гипертонии при
умеренно выраженном мочевом синдроме, час-
то с гематурией; нефротический синдром редок.
Нефрит при геморрагическом васкулите ча-
сто протекает с поражением суставов, кожи,
лихорадкой, исхуданием. Заболевают чаще дети,
нередко после респираторной инфекции; харак-
терны симметричные высыпания на голенях,
редко встречающиеся при СКВ; нефрит чаще
носит характер гематурического, с необычной
для СКВ макрогематурией.
Иногда очень трудно дифференцировать СКВ
от поражения почек и лекарственной болезни
286
с нефритом, а также поражение почек при
хроническом активном гепатите. Для первично-
го АФС поражение почек нехарактерно.
Близкая клиническая картина может наблю-
даться при ревматоидном артрите с поражени-
ем почек, особенно с учетом возможности раз-
вития при ревматоидном артрите и других си-
стемных поражений (лимфаденопатии, пораже-
ния сердца, легких) и обнаружения в отдель-
ных случаях LE-клеток. Для ревматоидного ар-
трита характерно многолетнее течение болезни,
с развитием стойких деформаций суставов с
атрофией межкостных мышц, ульнарной деви-
ации кисти, выраженные рентгенологические
изменения суставов, высокие титры ревмато-
идного фактора в сыворотке (при СКВ ревма-
тоидный фактор выявляется нечасто, в низких
титрах). Биопсия почки почти в половине слу-
чаев ревматоидной нефропатии выявляет ами-
лоид, который при СКВ практически не встре-
чается.
В наших наблюдениях амилоидоз выявлен
лишь у одной больной — 42-летней женщи-
ны с выраженным артритом, которая в тече-
ние 12 лет постоянно принимала кортикосте-
роиды. В мировой литературе описано лишь
несколько подобных случаев.
В отдельных случаях приходится проводить
дифференциальный диагноз с поражением по-
чек при миеломной болезни, протекающей
обычно у женщин старшего возраста, с боля-
ми в костях, резким повышением СОЭ, ане-
мией, протеинурией. Диагноз удается уточнить
с помощью иммуноэлектрофореза белковых
фракций сыворотки крови и мочи, стерналь-
ной пункции, рентгенологического исследова-
ния костей; биопсия почки при миеломной
болезни нежелательна из-за опасности крово-
течения.
Еще важнее исключение возможности ин-
фекций, требующих массивной терапии анти-
биотиками; в первую очередь подострого ин-
фекционного эндокардита или туберкулеза по-
чек с параспецифическими реакциями.
Подострый инфекционный эндокардит про-
текает с лихорадкой, лейкопенией, анемией,
повышением СОЭ, поражением сердца, иног-
да — с нефритом. Нефрит чаще гематуричес-
кий, но может развиваться и нефротический
синдром. Следует помнить, что развитие аор-
тальной недостаточности при СКВ встречается
редко. Сохраняют дифференциально-диагности-
ческое значение и такие малые признаки ин-
фекционного эндокардита, как «барабанные
пальцы», ногти в виде «часовых стекол», пят-
на Лукина, положительный симптом щипка.
В сомнительных случаях необходим посев кро-
ви и пробное лечение высокими дозами анти-
биотиков.
Так же важно исключение туберкулеза (ко-
торый может присоединиться к волчаночному
нефриту после массивной иммунодепресии) и
опухоли — особенно гипернефромы с часты-
ми параспецифическими реакциями.
10.1.5. Лечение
Значительные успехи в лечении волчаночного
нефрита достигнуты за последние два десяти-
летия благодаря разработке комплексных тера-
певтических схем, включающих в основном две
группы препаратов — кортикостероиды и ци-
тостатики общего и селективного действия.
Иногда в комплексном лечении тяжелых форм
ВН используют антикоагулянты. Аминохиноли-
новые препараты для подавления активности
ВН неэффективны, их назначают лишь при
периферических формах СКВ. Нестероидные
противовоспалительные препараты, сохраняю-
щие свою актуальность при экстраренальных
проявлениях болезни, при ВН не используют-
ся из-за их способности снижать клубочковую
фильтрацию. Среди экстракорпоральных мето-
дов лечения актуальным остается плазмаферез.
Тяжелые побочные реакции современных
иммуносупрессоров, а также непредсказуемость
течения заболевания, с меняющейся клиничес-
кой картиной и трансформацией морфологи-
ческих данных, заставляют продолжать обсуж-
дение и поиск наиболее рациональных подхо-
дов к лечению и профилактике обострения ВН.
Глюкокортикоиды (ГК) остаются основой
лечения ВН, существенно улучшая прогноз бо-
лезни. При активном нефрите ГК должны при-
меняться в адекватных дозах — 1 мг/(кг сут) в
течение 6—8 нед, после чего дозу можно мед-
ленно уменьшать. Доказано преимущество боль-
ших доз преднизолона (50—60 мг/сут) перед
малыми (30 мг/сут), малые дозы могут подав-
лять лихорадку, кожные поражения, суставной
синдром, серозиты, иногда даже пневмониты
и эндокардит, но мало влияют на почечный
процесс. При длительном применении больших
доз преднизолона эффект отмечается у 50—
80 % больных.
Трудность проведения массивной кортико-
стероидной терапии определяется необходимо-
стью балансирования между стремлением по-
давить активность нефрита и страхом перед
многочисленными побочными явлениями, осо-
бенно часто выявляющимися в последнее вре-
мя асептическими некрозами костей, тяжелы-
ми спондилопатиями, инвалидизирующими
больных. Несколько уменьшило развитие этих
осложнений введение разнообразных схем ле-
чения кортикостероидами — разовый прием
всей дозы утром либо альтернирующая тера-
пия — прием двойной суточной дозы через
день.
Внутривенное введение ударных доз метил-
преднизолона или преднизолона (пульс-терапия
ГК) привлекает более быстрым достижением
эффекта у больных с высокой активностью
болезни. Кроме этого, курсы внутривенной
пульс-терапии ГК влекут за собой изменение
пероральной дозы ГК, что позволяет уменьшить
длительность их применения в высоких дозах и
тем самым снизить риск развития побочных
реакций. При наличии нефротического синдро-
ма и тем более при быстром падении функции
почек оправдано проведение пульс-терапии в
начале заболевания.
Полагают, что ударные дозы глюкокортико-
идов при волчаночном нефрите приостанавли-
вают образование ИК и вызывают изменение
их массы путем вмешательства в синтез анти-
тел к ДНК, что в свою очередь ведет к пере-
распределению отложения ИК и выходу их из
субэндотелиальных слоев базальной мембраны.
Кроме того, ударные дозы метилпреднизолона
изменяют проницаемость базальной мембраны,
увеличивают скорость клубочковой фильтрации
и улучшают кровообращение в почках. Оценка
отдаленных результатов подтверждает эффек-
тивность пульс-терапии. Так, в наблюдениях
С. Ponticelli и соавт. (1987) среди 43 больных с
волчаночным диффузно-пролиферативным не-
фритом (у 17 содержание креатинина в сыво-
ротке крови превышало 140 мкмоль/л, у 26 —
протеинурия превышала 3 г/сут), которым про-
водилась трехдневная пульс-терапия метилпред-
низолоном с последующей терапией малыми
дозами кортикостероидов в сочетании с цито-
статиками, 10-летняя выживаемость составила
87 %, а если исключить случаи смерти не от
почечной недостаточности, то — 91 %. К кон-
цу наблюдения у 21 больного исчезли призна-
ки патологии почек. У больных с хорошим
эффектом от лечения уровень креатинина нор-
мализовался через 22 нед после пульс-терапии,
протеинурия снизилась до минимальных значе-
ний через 55 нед.
По данным Института ревматологии РАМН,
применение пульс-терапии метилпреднизоло-
ном у 120 больных с активным ВН привело к
положительному результату в ближайший пе-
риод в 87 % случаев; анализ отдаленных резуль-
татов показал, что через 18—60 мес у 70 %
сохранялась ремиссия, причем у 28 % из них
полностью исчезли признаки нефрита [Ивано-
ва М.М. и др. 1983; Соловьев С.К. и др., 1985].
После проведения пульс-терапии для дости-
жения стойкого эффекта необходимо продол-
жать прием кортикостероидов внутрь. Вместе с
тем длительное применение ГК. приводит к
развитию тяжелых, иногда угрожающих жизни
287
осложнений. Кроме того, в экспериментальных
моделях и при повторных биопсиях было дока-
зано, что длительная терапия ГК в больших
дозах может приводить к прогрессирующему
гломерулосклерозу.
Цитостатики — вторая группа препаратов,
представляющая собой патогенетически обосно-
ванную терапию. В основном применяют алки-
лирующие агенты — циклофосфамид (ЦФА),
реже хлорбутин, и антиметаболиты: азатиоприн
(АЗА) и метотрексат. В последнее время при-
меняется селективный иммуносупрессор сан-
диммун-неорал.
Среди цитостатиков преимущество отдают
циклофосфамиду (ЦФА) перорально или в
виде внутривенной пульс-терапии. Впервые
внутривенно пульс-терапия ЦФА была предло-
жена Н.Dinant и соавт. в 1982 г. именно для ле-
чения ВН. К концу 80-х годов в ряде клини-
ческих исследований (D.Felson, J. Balow) было
показано, что пульс-терапия ЦФА эффектив-
нее предотвращает снижение функции почек по
сравнению с пульс-терапией метилпреднизоло-
ном с последующим 6-месячным пероральным
приемом ГК. Ежеквартальное проведение пульс-
терапии ЦФА уменьшало вероятность обостре-
ния болезни. Эти данные подтвердил анализ
более 400 клинических исследований (с 1990 по
1995 г.), проведенный V.K.Bansal и соавт. (1997).
Лечебная тактика при ВН зависит от актив-
ности болезни, клинического и морфологичес-
кого варианта ВН. Проведение биопсии почки
необходимо для характеристики морфологичес-
ких изменений с целью выбора адекватной те-
рапии, а также для оценки прогноза заболева-
ния (индексы активности и склероза). Актив-
ность проводимой терапии должна соответство-
вать активности болезни: чем выше активность
процесса и тяжелее клинические и морфоло-
гические признаки болезни, тем раньше сле-
дует назначать весь арсенал терапии, особенно
пульс-терапию ЦФА. Иногда при сопутствую-
щей высокой артериальной гипертензии врачи
воздерживаются от активного лечения. Однако
в большинстве случаев АГ является отражени-
ем активности процесса и исчезает при ремис-
сии заболевания.
Быстропрогрессирующему волчаночному не-
фриту морфологически чаще всего соответству-
ет диффузный пролиферативный ВН (IV класс).
Прогноз больных БПВН тяжелый и зависит от
своевременной максимально активной терапии.
Методом выбора при БПВН является, по на-
шему мнению, пульс-терапия ЦФА (в дозе 15—
20 мг/кг с поправкой на уровень сывороточного
креатинина и скорость клубочковой фильтра-
ции: при креатинине > 4 мг% и КФ < 50 мл/
мин дозу снижают в 2 раза) с интервалом 3—
4 нед в сочетании с терапией КС. Пульс-тера-
пия ЦФА должна проводиться непрерывно не
менее 6 мес (один пульс в месяц), а в даль-
нейшем ее длительность определяется динами-
кой клинико-лабораторных показателей: при
полном восстановлении функции почек и ми-
нимальной активности мочевого синдрома (от-
сутствии гематурии) возможно уменьшение
дозы ЦФА и удлинение интервалов проведения
пульсов (через 2, затем через 3 мес) с после-
дующей полной отменой. Первый «пульс» ЦФА
желательно сочетать с пульсами метилпредни-
золона (по 1 г в течение 3 дней) одновремен- ।
но с назначением преднизолона внутрь в дозе ’
1 мг/кг в сутки. Можно повторять пульсы ме-
типреда в ситуациях, когда возникает необхо-
димость быстрого снижения пероральной дозы
ГК в связи с осложнениями, а активность про-
цесса остается высокой. После внутривенного
введения метипреда дозу перорального предни-
золона можно значительно снизить. Продолжать
прием преднизолона внутрь в суточной дозе
1 мг/кг в сутки следует в течение 6—8 нед с
постепенным ее снижением к 6-му месяцу до
20—30 мг/сут и в последующие 6 мес до под-
держивающей дозы 5—10 мг/сут, которую сле-
дует принимать в течение 2—3 лет, а иногда
5 лет и пожизненно. Обычно при таком тера-
певтическом режиме БПВН клинико-лабора-
торной ремиссии можно достичь через 1,5—
2 года.
Нами проанализированы результаты лечения 38
больных с БПВН. В первой группе (27 больных)
применялись большие дозы преднизолона внутрь —
50—60 мг/кг, в части случаев в сочетании с цитос-
татиками внутрь (чаще всего азатиоприном в дозе
150—200 мг/сут). Больные второй группы (11 боль-
ных) наряду с высокими дозами ГК внутрь получа-
ли пульс-терапию ГК и пульс-терапию ЦФА. У боль-
ных первой группы «почечная» выживаемость в те-
чение первого года составила менее 30 % и через
5 лет — 5 %. Во второй группе через год и через
5 лет почечная выживаемость равнялась 75 %. Важным
прогностическим фактором для результатов терапии
был непосредственный эффект лечения. В случаях
быстрого адекватного ответа у больных второй груп-
пы 5-летняя почечная выживаемость составила 100 %.
При бурном прогрессировании почечной
недостаточности возможно проведение плазма-
фереза (3 раза в неделю в течение 1—3 нед или
один раз в 2—3 нед, всего 6—8 процедур) же-
лательно с заменой объема свежезамороженной
плазмой.
Плазмаферез используют для удаления цир-
кулирующих иммунореактантов, но единого
мнения о целесообразности его применения
при ВН нет. Так, H.Y.Euler и соавт. (1991) с
успехом применили у 14 больных так называе-
мую синхронную терапию: 3 сеанса плазмафе-
реза с последующим проведением 3 сеансов
288
пульс-терапии ЦФА в дозе 12 мг/кг и затем
пероральным приемом в течение 6 мес. Цель та-
кой методики — подавление циркулирующего
пула лимфоцитов в период их максимальной
компенсаторной активации, спровоцированной
плазмаферезом.
E.J. Levis и соавт. (1992) в контролируемом
рандомизированном исследовании влияния
плазмафереза в сочетании с глюкокортикоид-
ной терапией и цитостатической терапией на
течение ВН, проведенном в 14 центрах (89
больных), не выявили преимуществ этого ле-
чения по сравнению с той же схемой, но без
применения плазмафереза.
При необходимости иммуносупрессивную
терапию целесообразно проводить на фоне се-
ансов гемодиализа. При клинических и лабора-
торных признаках ДВС-синдрома показаны
переливания свежезамороженной плазмы в со-
четании с антиагрегантами, антикоагулянтами
и ангиопротекторами. Необходима коррекция
артериальной гипертензии с обязательным ис-
пользованием в схеме ингибиторов АПФ.
Однако не все исследователи считают, что
внутривенная пульс-терапия ЦФА имеет пре-
имущество по сравнению с его пероральным
приемом.
C.Ponticelli (1997) рекомендует начинать
лечение с трех внутривенных введений метил-
преднизолона (по 0,5 г каждый) с последую-
щим назначением преднизолона внутрь в дозе
0,5—1 г/кг в сутки длительностью 1—2 мес; по-
степенно дозу уменьшают до 10 мг ежедневно
или 20 мг через день. При особо тяжелом тече-
нии болезни с самого начала добавляют цито-
статики — вначале ЦФА (1,5—2 мг/кг) в тече-
ние 2—3 мес, а затем азатиоприн (1,5—2 мг/кг
в сутки), который считается менее эффектив-
ным, чем циклофосфамид, но и менее токсич-
ным, что позволяет применять его продолжи-
тельно — до 2 лет. Лечение прекращают посте-
пенно при нормальном уровне сывороточного
креатинина, снижении протеинурии ниже 1 г/с
и отсутствии других признаков болезни. У на-
ходившихся под наблюдением 56 больных с
диффузным пролиферативным ВН, получивших
подобную терапию, 10-летняя выживаемость
составила 98 % и 20-летняя — 77 %. К концу
наблюдения у 24 была отмечена ремиссия, у
18 — нормальная функция почек и симптома-
тическая протеинурия, у 2 больных — нефро-
тический синдром при сохранной функции по-
чек, у 6 — сывороточный креатинин был 1,6—
3 мг/дл, 6 больных получали программный ди-
ализ.
Близкой схемы придерживается и J.S.Came-
ron (1999).
V. К.Banzai и соавт. (1997) сравнили частоту
развития ХПН и летальность у 440 больных,
19—2950
наблюдавшихся в 19 нефрологических центрах
в период за 1970—1995 гг. и получавших одну
из схем терапии: 1) только преднизолон внутрь;
2) азатиоприн и преднизолон внутрь; 3) аза-
тиоприн и циклофосфамид с преднизолоном
внутрь; 4) преднизолон внутрь и циклофосфа-
мид внутривенно. Вероятность развития ХПН и
летальность были ниже у больных, получавших
сочетание цитостатиков и ГК. Не было выяв-
лено преимущества азатиоприна перед цикло-
фосфамидом, а также внутривенной пульс-те-
рапии ЦФА перед его пероральным приемом,
но побочных реакций при в/в пульс-терапии
ЦФА было значительно меньше.
Медленно прогрессирующий вариант ВН с
нефротическим или выраженным мочевым син-
дромом может иметь в основе любой морфоло-
гический вариант. Подходы к лечению при диф-
фузном или очаговом волчаночном нефрите
(ВН) и мезангиокапиллярном гломерулонефрите
(МКГН) должны быть почти такими же актив-
ными, как и при БПВН, поскольку при неадек-
ватной терапии болезнь может прогрессировать
в почечную недостаточность. При других морфо-
логических вариантах (мембранозном и мезан-
гиопролиферативном) иммуносупрессивный ре-
жим может быть более мягким: сочетанная
пульс-терапия в начале лечения с последую-
щим применением ПЗ в дозе 0,5 мг/кг в сутки в
сочетании с пульс-терапией ЦФА или предни-
золон 50—60 мг/сут + ЦФА 100—150 мг/сут
внутрь в течение 2—3 мес; затем суточные дозы
ПЗ снижают до 20—30 мг, ЦФА — до 100—
50 мг или заменяют его азатиоприном в такой
же дозе и проводят лечение до достижения ре-
миссии.
При отсутствии морфологического подтвер-
ждения показанием к активной терапии служит
нефротический синдром, выраженная эритро-
цитурия, артериальная гипертензия, признаки
снижения функции почек. При изолированной
протеинурии с незначительной эритроцитури-
ей возможно менее активное лечение (предни-
золон в дозе 50—60 мг/сут), однако при устой-
чиво сохраняющемся более 8 нед мочевом син-
дроме к лечению следует присоединить цито-
статики.
Еще раз подчеркнем, что снижение дозы ГК
и цитостатиков должно проводиться очень мед-
ленно (значительно медленнее, чем при брай-
товом нефрите), и в любом случае необходима
длительная поддерживающая терапия. Показа-
нием к отмене иммуносупрессивной терапии
независимо от клинической и морфологичес-
кой формы болезни является отсутствие при-
знаков активности нефрита (протеинурия не
более 0,5 г/сут без эритроцитурии) и сероло-
гических признаков активности болезни.
Селективный иммуносупрессор сандиммун-
289
неорал (циклоспорин — ЦсА) при ВН пока не
получил такого широкого распространения, как
при брайтовом нефрите.
E.C.Bergijk и соавт. (1994) в эксперименталь-
ной мышиной модели ВН интраперитонеаль-
но вводили ЦсА в дозе 10, 50, 100 и 250 мг/кг
в неделю через 2, 4 и б нед после индукции
болезни. Инъекции в дозе 10 или 50 мг/кг в
неделю не влияли на развитие нефрита, в дозе
100 мг/кг в неделю предотвращали появление
протеинурии при начале лечения через 2 нед
после индукции болезни. В группе больных с
началом лечения через 6 нед после индукции
заболевания ЦсА был эффективен только в дозе
250 мг/кг в неделю у мышей с небольшой про-
теинурией.
P.D.Yin и X.Y.Yang (1994) у 30 больных с
активным ВН сравнивали эффективность ЦсА
и внутривенной пульс-терапии ЦФА в двух
группах по 15 больных. Снижение активности
болезни и уровня протеинурии, повышение
сывороточного альбумина у леченных ЦсА на-
блюдали на более ранних этапах, хотя общий
эффект был одинаковым. Очевидно, использо-
вание низких доз ЦсА гасило активность ВН на
ранних стадиях терапии, что позволило снизить
дозу КС и ЦФА и уменьшить побочные эффек-
ты. У 8 больных после отмены ЦсА был добав-
лен ЦФА для предупреждения обострения бо-
лезни.
C.Dostal и соавт. (1998) в неконтролируемом
предварительном исследовании, включавшем 11
больных с активным ВН с нефротическим син-
дромом, у 8 из которых предшествующая тера-
пия циклофосфамидом, азатиоприном и глюко-
кортикоидами была малоэффективна, проводи-
ли лечение ЦсА в начальной дозе 3,5—5,5 мг/кг
в сутки. Отмечался быстрый эффект: протеину-
рия снижалась с 9,1 до 1,7 г/сут, при повтор-
ных биопсиях отмечено снижение класса мор-
фологических изменений с IV на III. В дальней-
шем больные получали поддерживающую дозу
2,5—3 мг/кг в сутки.
По клиническому эффекту ЦсА превосходит
глюкокортикоиды, однако его применение ог-
раничивается нефротоксическим действием.
J.Radhakrishnan и соавт. (1996) у 5 больных с
плохим ответом на иммуносупрессивную тера-
пию применяли ЦсА в дозе 4—6 мг/кг в сутки
в течение длительного времени — до 43 мес.
Наряду с клиническим улучшением при по-
вторных биопсиях отмечалось уменьшение при-
знаков активности, однако индекс склероза
увеличился.
ЦсА, очевидно, может быть использован при
медленно прогрессирующих формах, протекаю-
щих без тяжелой артериальной гипертензии и без
выраженного склероза почечной ткани.
С учетом отдельных сообщений складывалось
290
впечатление об улучшении течения ВН при
внутривенном введении иммуноглобулинов,
хотя в контролируемом исследовании его эф-
фективность была подвергнута сомнениям
[Jordan S.C., 1989]. Имеются единичные наблю-
дения эффективного применения микофенолат-
мофетила.
Разрабатываются средства, селективно вли-
яющие на отдельные этапы патогенеза СКВ.
Есть первые экспериментальные и клинические
опыты применения LJP394, селективно воздей-
ствующего на синтез антител к нативной ДНК
В-лимфоцитами, ингибитора С5 фракции ком-
племента «Alexion», простагландина 1, антаго-
нистов рецепторов тромбоксана.
При развитии терминальной почечной не-
достаточности проводится заместительная тера-
пия — гемодиализ и трансплантация почек. По
данным отчета USRDS (United States Renal Data
System), в 1992—1996 гг. в США заместитель-
ную почечную терапию получали 4177 больных
ВН (из них 80,6 % — женщины и 19,4 % —
мужчины).
В нашем центре гемодиализ проводили 32
больным ВН с терминальной почечной недо-
статочностью. По данным ряда исследователей,
результаты гемодиализа были такими же, как
при других заболеваниях почек, однако в на-
ших наблюдениях больные ВН переносили ге-
модиализ хуже, чем больные без системных за-
болеваний.
Особенностью терминальной стадии ВН в
отличие от брайтова нефрита является иногда со-
храняющаяся высокая активность процесса: если
активность СКВ остается к моменту развития
нефросклероза, необходима иммуносупрессив-
ная терапия на фоне сеансов гемодиализа.
Трансплантацию почек производят больным
с развернутой клиникой уремии обязательно
при отсутствии признаков активности СКВ,
поэтому страх перед обострением СКВ с реци-
дивом ВН в трансплантате, по мнению боль-
шинства авторов, следует считать необоснован-
ным, хотя в сообщении G.Nyberg и соавт.
(1992) отмечена высокая частота (у 7 из 16
больных) рецидива ВН в трансплантате.
J. Briggs и Е.Jones от имени Научного коми-
тета ERA-EDTA представили в 1999 г. обобщен-
ные результаты трансплантации почек у боль-
ных СКВ в Европе за 1982—1990 гг. Авторы ус-
тановили, что в целом результаты были таки-
ми же, как у больных первичными заболева-
ниями почек (стандартная группа больных). За
эти годы трансплантация была проведена 539
больным СКВ; средний возраст больных состав-
лял 33 года, преобладали (79 %) женщины. Вы-
живаемость трансплантата (трупного) была
лишь немного ниже, чем в стандартной груп-
пе (5-летняя выживаемость составила соответ-
ственно 65 и 68 %, 10-летняя — 45 и 50 %);
выживаемость больных была практически оди-
наковой: 5-летняя — 91 % в обеих группах, 10-
летняя — 81 и 83 % соответственно. Трехлет-
няя выживаемость трансплантатов от живых
доноров при СКВ была даже выше (87 %), чем
в стандартной группе (79 %). Среди причин
смерти у больных СКВ инфекции встречались
чаще по сравнению со стандартной группой (40
и 26%), тогда как сердечно-сосудистые ослож-
нения — реже. Случаев потери трансплантата
из-за рецидива ВН не отмечено.
10.2. Поражение почек при
узелковом полиартериите*
Среди системных васкулитов — заболеваний, в
основе которых лежит генерализованное пора-
жение артерий и вен различного калибра, осо-
бое место по тяжести вовлечения внутренних
органов принадлежит узелковому полиартери-
иту (УП**).
Узелковый полиартериит (системный некро-
тизирующий васкулит) — заболевание артерий
среднего и мелкого калибра с образованием
аневризм и вторичным поражением органов и
тканей. Болезнь впервые описана A.Kussmaul и
К. Maier в 1866 г. как своеобразное поражение
артерий, протекающее с болезнью Брайта и
быстропрогрессирующим мышечным параличом.
Понимание особенностей поражения почек
при УП связано с современными представле-
ниями об этиологии, патогенезе этого систем-
ного васкулита, что определяет также диагно-
стическую и лечебную тактику как болезни в
целом, так и развивающейся при ней нефро-
патии.
Этиология, патогенез. До недавнего времени
этиология УП считалась невыясненной, хотя
уже в 40-х годах, когда в лечебной практике
стали широко использоваться сульфаниламиды,
появились сообщения о развитии лекарствен-
ного УП, что было подтверждено и экспери-
ментально [Rich A., Gregory J., 1943]. Впослед-
ствии подобные клинические наблюдения ста-
ли настолько многочисленны, что можно было
говорить о своеобразной «эпидемии» сульфанил-
амидного УП. С тех пор лекарственная этиоло-
гия части наблюдений УП не вызывает сомне-
ния, а спектр препаратов все время расширя-
ется (препараты йода, аминазин, антибиотики,
витамины, особенно группы В, и т.п.).
Роль вирусов в этиологии УП стала обсуж-
даться в последние десятилетия. В 1970 г. появи-
* Раздел написан Е.Н.Семенковой.
** Старое название периартериит.
лись описания больных типичным УП с нали-
чием маркеров вируса гепатита В (HBV). В на-
стоящее время четко установлена связь УП
[Guillevin L. et al., 1995] с наличием в сыворотке
крови у 30—80 % больных УП маркеров виру-
са HBV с их репликацией. В наших наблюдени-
ях репликация HBV с обнаружением HBV-ДНК
выявлена у 81 % обследованных больных. Во
Франции до начала активной вакцинации про-
тив вирусного гепатита частота обнаружения
HBV в сыворотке крови у больных УП соста-
вила 36 %, а с 1992 г. (начало проведения вак-
цинации) — только 7 %.
Подтверждением вирусной этиологии УП
являются результаты биопсии печени, выявив-
шие в наших наблюдениях у 95 % обследован-
ных различные морфологические варианты ге-
патита или цирроза печени.
Помимо вируса гепатита В, причиной раз-
вития УП могут быть и другие вирусы — гепа-
тита С, вируса иммунодефицита человека,
цитомегаловируса, парвовируса В19, человечес-
кого лимфотропного вируса I типа. Инфекци-
онный агент (в первую очередь вирус) может
оказывать прямое токсическое воздействие на
эндотелиальные клетки или субэндотелиальные
структуры.
Гломерулярные иммунные отложения либо
отсутствуют, либо содержатся в очень ограни-
ченных количествах, а в сосудах среднего ка-
либра не удается обнаружить никаких электрон-
но-плотных образований, что, несмотря на
высокую частоту ЦИК у больных УП, не по-
зволяет уверенно говорить о связи этого забо-
левания с сосудистыми иммунными отложени-
ями [Brenner М., 1994], тем более еще и по-
тому, что иммунокомплексному механизму
свойственно повреждение стенки мелких арте-
рий и капилляров.
При УП поражаются преимущественно ар-
терии мышечного типа с развитием некроти-
зирующего панваскулита, возможно образова-
ние аневризм. Последствием тяжелого панвас-
кулита могут быть инфаркты, кровоизлияния,
рубцы. Повреждение сосудистой стенки приво-
дит к изменению реологических свойств крови
с агрегацией эритроцитов и тромбоцитов, ги-
перкоагуляцией с развитием тромбозов и ДВС-
синдрома.
Клиническая симптоматика классического
УП, которым болеют преимущественно мужчи-
ны, разделяется на два периода — ранних не-
специфических проявлений и развернутой кли-
нической симптоматики с поражением различ-
ных органов и систем.
Для раннего периода характерны лихорадка,
катастрофическая потеря массы тела, миалгии
(преимущественно икроножных мышц), реже —
артралгии. При изучении анамнеза у многих
19*
291
больных обнаруживают факторы риска зараже-
ния HBV-инфекцией (донорство, наркомания),
а при лабораторном исследовании — лейкоци-
тоз крови, увеличение СОЭ, ферментемию
(повышение АлАТ и АсАТ) и маркеры вируса
гепатита В или С (репликация). Диагностически
значимыми клиническими симптомами класси-
ческого УП являются:
• поражение почек;
• вовлечение периферической нервной систе-
мы в виде асимметричного двигательного по-
линеврита;
• абдоминальный синдром, проявляющийся
болями в животе, диспепсическими призна-
ками и нередко осложняющийся перфора-
цией язв кишечника, желудочно-кишечным
кровотечением, некротизирующим панкре-
атитом или холециститом;
• коронарит с развитием стенокардии или
чаще безболевого инфаркта миокарда.
Астматическим вариантом УП (вариант Чар-
га — Штроусса) болеют чаще женщины; у
большинства больных имеется непереносимость
лекарств и другие аллергические проявления
(поллиноз, аллергический насморк, пищевая
аллергия). Болезнь начинается с бронхиальной
астмы (гиперэозинофильной), в дальнейшем
происходит генерализация с типичным для УП
симптомокомплексом.
Поражение почек. По данным литературы,
частота поражения почек при УП, в большин-
стве случаев определяющего прогноз заболева-
ния, составляет от 60 до 80 %. В наших наблю-
дениях поражение почек имелось у 82 % из 135
больных классическим УП и у 27 % из 55 при
астматическом варианте болезни.
Морфологически обнаруживают поражение
как сосудов, так и клубочков. По современным
представлениям [Brenner М. et al., 1994; Guil-
Ivin L., 1995], для классического УП характер-
ны преобладание васкулита артерий среднего
калибра и минимальные изменения клубочков.
Анализ собственных 22 секционных случаев
классического УП показал, что изолированное
изменение сосудов среднего калибра без пора-
жения клубочков имелось лишь в 5 наблюдениях.
В 8 % УП развивался с клинической симпто-
матикой быстропрогрессирующего гломеруло-
нефрита (БПГН), а в 5 морфологически под-
твержденных наблюдениях установлены подо-
стрый экстракапиллярный ГН и множествен-
ные инфаркты почек. В остальных случаях вас-
кулит артерий среднего калибра сочетался с
другими морфологическими вариантами ГН.
Поражение почек при УП обычно выявля-
ется через 4—6 мес, что свидетельствует о до-
статочно грубых изменениях в органе. Протеи-
нурия обычно невелика, редко достигает не-
292
фротических значений (у 6 % наших больных);
микрогематурия соответствует степени активно-
сти васкулита; при инфаркте почки обнаружи-
вается макрогематурия.
Главный признак тяжелого почечного вас-
кулита и множественных инфарктов почек —
артериальная гипертензия (АГ), которая при
УП возникает обычно рано, у части больных —
при отсутствии изменений в моче. Важной осо-
бенностью АГ, отражающей тяжелые морфоло-
гические изменения в почках, является быст-
рое прогрессирование процесса с развитием
злокачественной формы с характерными изме-
нениями сердца (левожелудочковая недостаточ-
ность), глазного дна (внезапная слепота), эн-
цефалопатией. Возникновение АГ связано с
ишемией паренхимы почек и поддерживается
гиперпродукцией ренина, что подтверждается
обнаружением соответствующих типичных из-
менений ЮГА почек; высокий уровень ангио-
тензина с хорошим эффектом от применения
ингибиторов ангиотензинпревращающего фер-
мента свидетельствует о формировании рено-
васкулярного механизма АГ. Характер сосудис-
тых поражений при УП можно уточнить, оп-
ределив активность ренина в оттекающей от
почки крови или выполнив ангиографию.
У части больных при УП развивается быст-
ропрогрессирующее поражение почек. У 15
(11 %) из 135 наблюдавшихся нами больных
классическим УП поражение почек протекало
по типу БПГН. Все пациенты — мужчины; по-
ражение почек проявлялось в виде мочевого
синдрома и АГ. В 9 наблюдениях протеинурия
превышала 3,5 г/сут, из них у 6 сформировал-
ся нефротический синдром. У 10 больных име-
лась злокачественная АГ (АД 300/160—240/150
мм рт. ст.). При морфологическом исследовании
ткани почки у 5 больных обнаружен ГН с по-
лулуниями, васкулит сосудов почки, лимфоги-
стиоцитарная инфильтрация стромы.
Более редкие варианты поражения почек при
УП — острый тромбоз почечных сосудов с
инфарктом почки и ОПН, разрыв аневризмы
почечной артерии с паранефральной гемато-
мой, канальцевые дисфункции в связи с сосу-
дистыми нарушениями. Возможен стеноз моче-
точников (одно- или двусторонний), протека-
ющий с анурией и почечной недостаточностью
или бессимптомно. Стеноз мочеточников явля-
ется результатом периуретрального васкулита с
последующим вторичным фиброзом.
Течение и прогноз УП зависят от тяжести и
распространенности сосудистого процесса в
целом, характера поражения почек, наличия
или отсутствия антигенемии. Течение нефропа-
тий с HBV-антигенемией при УП более тяже-
лое, на что указывают многие авторы. Сравни-
вая 5-летнюю выживаемость, P.Godeau и соавт.
Ф1"
(1981) показали, что среди больных УП с пер-
систированием HBsAg в конце 5-го года оста-
лись живы 2 %, а без антигенемии — 37,5 %.
Более поздние материалы наших исследований
(Семенкова Е.Н., Апросина З.Г, Лопатки-
на Т.Н., 1992; Семенкова Е.Н., 1994] подтвер-
ждают эти данные: 5-летняя выживаемость со-
ставила 28 и 55 % соответственно. По данным
L.Guillvin (1995), прогностически неблагопри-
ятным фактором при УП, индуцированном
HBV, являются протеинурия >3 г/сут, креати-
нин сыворотки >140 ммоль/л; поражение серд-
ца, желудочно-кишечного тракта, центральной
нервной системы; при наличии двух и более
указанных признаков смертность достигает
46 % (в течение 5 лет).
Диагноз УП часто представляет известные
трудности в связи с неспецифическим харак-
тером клинических проявлений (лихорадка,
миалгии, потеря массы тела, желудочно-кишеч-
ные расстройства, кожные высыпания). Появ-
ление множественного мононеврита, пораже-
ния почек с АГ и HBV-антигенемия позволя-
ют заподозрить УП. Для подтверждения диаг-
ноза васкулита желательна биопсия скелетной
мышцы или сурального нерва, почки, яичка,
печени, прямой кишки. Биопсия мышцы ин-
формативна у 30—50 % больных. Ангиография
сосудов почек или желудочно-кишечного тракта
может выявить микроаневризмы при минималь-
ном риске внутреннего кровотечения, вероят-
ность которого более высока при проведении
биопсии почки.
Дифференциальный диагноз следует прово-
дить с хроническим активным гепатитом (ХАГ)
с системными проявлениями, микроскопичес-
ким полиартериитом. Описаны и более редкие
ситуации, по клинической симптоматике схо-
жие с УП: холестериновые эмболии у больных
атеросклерозом, сепсис, инфекционный эндо-
кардит, миксома левого предсердия, опухоли.
Выбор метода лечения УП в настоящее вре-
мя зависит от наличия или отсутствия HBV-ин-
фекции. Исторически глюкокортикостероиды
(ГКС) стали первым эффективным средством,
использованным при УП: увеличилась средняя
продолжительность жизни от 3 до 63 мес, а 5-
летняя вьгживаемость достигла 50 %. Существу-
ют работы, в которых сообщается об исполь-
зовании как средних доз ГКС, так и схем ле-
чения высокими дозами препарата, причем
результаты выживаемости больных были оди-
наковыми.
Назначение высоких доз ГКС (1 мг/кг) це-
лесообразно в ранние сроки болезни до фор-
мирования тяжелой АГ и нефропатии с почеч-
ной недостаточностью. Общая продолжитель-
ность лечения ГКС зависит от полученного ре-
зультата, но не превышает 18—24 мес. Если
терапия ГКС не позволяет контролировать те-
чение заболевания, через 1—2 мес присоеди-
няют цитостатики (ЦТ). Сравнение эффектив-
ности различных цитостатиков при УП не вы-
явило преимущества циклофосфамида (ЦФА)
перед другими препаратами (азатиоприном). Ряд
авторов отмечают, что ЦФА дает возможность
лучше контролировать течение УП, но не вли-
яет на выживаемость [Lhote F., Guillvin L.,
1992, 1995]. Однако существует и противопо-
ложная точка зрения [D’Agati V., Appel С.,
1994], когда авторы отдают предпочтение ЦФА,
считая его наиболее удачным препаратом для
достижения длительной ремиссии. При тяжелых
органных поражениях или злокачественной АГ
показано сочетанное лечение ГКС (в умерен-
ных дозах) и ЦТ; предпочтение, по нашему
мнению, следует отдавать ЦФА. Азатиоприн
используется преимущественно при астматичес-
ком варианте УП и поражении периферичес-
кой нервной системы.
При УП, индуцированном HBV-инфекцией
с активной репликацией вируса, лечение ци-
тостатиками обычно не показано в связи с
возможностью прогрессирования васкулита и
гепатита. В настоящее время для лечения УП с
HBV- и HCV-инфекцией используются проти-
вовирусные препараты.
Показаниями к лечению УП, индуцирован-
ного HBV- и HCV-инфекцией, являются:
• несомненные доказательства УП (клиничес-
кие, морфологические, ангиографические);
• фаза репликации HBV, HCV (в том числе
наличие HBV-ДНК, HCV-PHK в сыворот-
ке крови);
• отсутствие тяжелой почечной недостаточно-
сти (уровень креатинина сыворотки не выше
3 мг%) и прогрессирующего поражения жиз-
ненно важных органов (сердца, ЦНС, же-
лудочно-кишечного тракта).
Из противовирусных препаратов использу-
ются «-интерфероны (нативные и рекомбинан-
тные) и синтетические нуклеозиды — видара-
бин и фамцикловир.
Лечение УП с HBV-инфекцией целесообраз-
но начинать с назначения высоких доз пред-
низолона (1 мг/кг в сутки), проведения плаз-
мафереза с последующим присоединением про-
тивовирусных препаратов. В нашей стране ис-
пользуется преимущественно «-интерферон по
1 млн ЕД 3 раза в неделю. Длительность прове-
дения лечения зависит от переносимости пре-
парата и срока достижения ремиссии (клини-
ческой и серологической).
При быстропрогрессирующем ГН, который,
как правило, сочетается с активной реплика-
цией HBV-инфекции, лечение цитостатиками
следует проводить крайне осторожно в связи с
293
усугублением вирусемии. Только при высокой
степени активности заболевания возможно на-
значение циклофосфамида в виде нескольких
сеансов пульс-терапии.
Лечение УП без HBV-инфекции проводится
ГКС-гормонами (1 мг/кг массы тела) в течение
1 мес и цитостатиками (циклофосфамид или
азатиоприн — 2 мг/кг). В дальнейшем дозы ГКС-
гормонов и цитостатиков постепенно снижают
(в течение 3—4 мес ГКС до 10—15 мг/сут, а
цитостатиков до 50—75 мг/сут). При астматичес-
ком варианте переходят к применению ингаля-
ционных ГКС. Продолжительность поддержива-
ющей терапии зависит от активности основно-
го заболевания, прогрессирования почечной не-
достаточности, рецидивирования абдоминально-
го синдрома. Обычно длительность сочетанной
терапии составляет не менее 3—4 лет.
Таким образом, поражение почек при УП
проявляется, как правило, на фоне системно-
го заболевания и неспецифических синдромов
в виде лихорадки, потери массы тела, миалгий.
В исключительных случаях возможно изолиро-
ванное поражение почек. Наиболее частыми и
прогностически неблагоприятными симптома-
ми являются артериальная гипертензия (иног-
да злокачественная) и БПГН (в 11 %), при-
чем у половины из них — с развитием нефро-
тического синдрома. Все прогрессирующие ва-
рианты нефропатии при УП сочетаются с ак-
тивной репликацией вируса В (HBV) или С
(HCV), тяжелыми висцеритами (абдоминаль-
ным синдромом, коронаритом) и полинейро-
патией.
Прогноз УП с поражением почек определя-
ют почечная и сердечная недостаточность, ос-
ложнения артериальной гипертензии, частое
сочетание с абдоминальными катастрофами.
10.3. Поражение почек при
гранулематозе Вегенера*
Гранулематоз Вегенера (ГВ) — заболевание из
группы системных васкулитов, для которого ха-
рактерны некротизирующее гранулематозное
воспаление и некротизирующий васкулит с
преимущественным поражением верхних дыха-
тельных путей, легких и почек.
Этот вариант васкулита описан впервые
F.Wegener в 1936 г. и считался до недавнего
времени казуистически редким заболеванием.
Более подробное изучение показало значитель-
но большую, чем предполагалось ранее, частоту
ГВ и существование различных по клиническим
проявлениям и течению вариантов болезни.
Этиология заболевания изучена недостаточ-
* Раздел написан Е.Н.Семенковой.
но. Высказывается мнение о роли инфекцион-
ных факторов в развитии ГВ. Клинические дан-
ные свидетельствуют о нередкой связи между
развитием или обострением ГВ и инфекцией
верхних дыхательных путей, что подтверждается
у некоторых больных ГВ эффективностью ан-
тибактериальной терапии (бисептол).
В основе ГВ лежат разнообразные нарушения
клеточного и гуморального иммунитета. В сы-
воротке больных обнаруживают антинейтро-
фильные цитоплазматические антитела (АНЦА),
реагирующие с несколькими лизосомальными
ферментами нейтрофилов и лейкоцитов (осо-
бенно с протеиназой 3), которые рассматрива-
ются как специфический серологический мар-
кер и вероятный патогенетический фактор за-
болевания [Van der Woude F.J., Rasmussen N.,
1985]. Имеются данные о важном патогенети-
ческом значении клеточных иммунных реакций.
Об этом свидетельствует гранулематозный ха-
рактер поражения внутренних органов и нали-
чие активированных Т-лимфоцитов в воспали-
тельном инфильтрате почек и легких.
Для АНЦА-ассоциированного гломеруло-
нефрита (ГН), который, помимо ГВ, развива-
ется при микроскопическом полиартериите
(МПА) и идиопатическом быстропрогрессиру-
ющем гломерулонефрите (БПГН), характерны
быстропрогрессирующее течение, морфологи-
ческая картина фибриноидного некроза стен-
ки капилляров клубочков и экстракапиллярной
пролиферации с образованием полулуний, ма-
лое содержание или полное отсутствие иммун-
ных депозитов, так называемый малоиммунный
некротизирующий ГН.
Важную роль в развитии ГН и, возможно,
васкулита вообще играют нейтрофилы, являю-
щиеся основными клетками-мишенями и для
АНЦА. Инфильтрация нейтрофилами клубочков
почек является существенным морфологичес-
ким признаком ГН с полулуниями. Ферменты,
образующиеся при дегрануляции нейтрофилов,
обладают способностью повреждать базальную
мембрану гломерул, что достоверно доказано в
эксперименте [Мухин Н.А. и др., 1995].
Поражение почек представляет одно из грех
типичных проявлений ГВ (наряду с вовлечени-
ем верхних дыхательных путей и легких) и
полностью идентично по тяжести морфологи-
ческих изменений другим локализациям систем-
ного васкулита. Это некротизирующий процесс
мелких и средних артерий с быстро развиваю-
щимся фибриноидным некрозом, деструкцией,
массивными полиморфно-клеточными (вклю-
чая Т-клетки) инфильтратами, субэндотелиаль-
ными депозитами 1g часто линейного характе-
ра при иммунофлюоресцентном исследовании,
что придает особый характер картине ГН (сег-
ментарного или фокального, а также пролифе-
294
ративного с интерстициальным компонентом),
обнаруживаемого при биопсии почки (при этом
характерную гранулему обнаружить удается не
всегда). Часто, как указывалось выше, конста-
тируется картина экстракапиллярного нефрита
с полулуниями.
Признаки поражения почек при ГВ обычно
выявляются вслед за язвенно-некротическими
изменениями верхних дыхательных путей и
распадающимися инфильтратами легких, хотя
при быстропрогрессирующем варианте нефро-
патии они возникают одновременно с измене-
ниями респираторной системы, при этом не-
редко последние представлены весьма умерен-
но. Нефропатия проявляется более или менее
выраженным мочевым синдромом с протеину-
рией до 3 г белка в сутки (часто и более),
микрогематурией (постоянный важный признак
активности процесса), изредка — макрогемату-
рией. В части случаев наблюдается нефротичес-
кий синдром (НС) и выявляется АГ.
В наших наблюдениях [Мухин Н.А., Семен-
кова Е.Н., Макарьянц М.Л., 1994] поражение
почек выявлено у 2/3 из 80 больных ГВ, при-
чем у 82 % был мочевой синдром, в 16 % —
нефротический синдром; АГ (преимуществен-
но мягкая) наблюдалась у 55 % больных ГВ.
Почечная недостаточность развилась у 20 боль-
ных ГВ, почти во всех наблюдениях она стала
следствием быстропрогрессирующего течения
нефрита.
Быстропрогрессирующий нефрит отмечен у
22 % больных, у половины из них развился в
среднем через 1,5 мес после возникновения
первых признаков поражения почек. Позднее (в
среднем через 4 года) начало быстропрогрес-
сирующего течения наблюдалось у 9 из 18 боль-
ных, причиной которого чаще всего была не-
адекватная терапия. Одной из клинических осо-
бенностей быстропрогрессирующего течения
нефрита при ГВ была частота олигурической
ОПН и нефротический синдром.
Подтверждением диагноза ГВ может служить
гистологическое исследование слизистой обо-
лочки носа или носоглотки, ткани орбиты,
легкого, почки, при котором обнаруживают
картину некротизирующего васкулита с грану-
лематозом. Диагностически важно обнаружение
в сыворотке крови или лаважной жидкости
АНЦА к протеиназе 3, которые в активную
фазу болезни имелись у 94 % обследованных
нами больных.
Дифференциальный диагноз проводят с дру-
гими системными васкулитами, с поражением
почек при стафилококковых пневмониях. Важ-
ными дифференциал ьно-диагностическими
признаками могут служить типичное для ГВ по-
ражение верхних дыхательный путей, подтвер-
жденное биопсией; обнаружение АНЦА в сы-
воротке крови. В отличие от быстропрогресси-
рующего нефрита в рамках узелкового периар-
териита и геморрагического васкулита при ГВ
редко обнаруживают артериальную гипертен-
зию, но выражена анемия, характерны сопут-
ствующие изменения в легких. Иногда ГВ труд-
но отличить от синдрома Гудпасчера, при ко-
тором чаще и почти всегда одновременно с
легочным поражением развивается быстропрог-
рессирующий нефрит. Важным для диагноза
синдрома Гудпасчера является обнаружение в
биоптате почки иммунофлюоресцентным мето-
дом линейных депозитов IgG, но особенно вы-
явление в сыворотке антител к базальной мем-
бране клубочков.
Гранулематоз Вегенера — заболевание, про-
гноз которого полностью зависит от ранней ди-
агностики и правильно проводимого лечения.
Именно при ГВ, что выделяет это заболевание
из группы системных васкулитов, длительное
лечение циклофосфаном наряду с глюкокорти-
коидами вызывает длительную и стойкую ре-
миссию у подавляющего большинства больных.
Циклофосфан в настоящее время является пре-
паратом выбора при ГВ. Имеются сведения об
успешном лечении ГВ циклофосфаном в случа-
ях, резистентных к приему других цитостати-
ков [Kallenberg G.M., Brouwer Е., 1994]. Пока-
занием к лечению иммунодепрессантами при ГВ
являются все случаи активного заболевания, за
исключением тех, при которых имеются абсо-
лютные противопоказания (агранулоцитоз, не-
переносимость препарата, сепсис).
Лечение ГВ должно быть ранним, комплек-
сным и длительным. Назначают сочетанную
терапию цитостатиками и глюкокортикоидами.
Предпочтительными препаратами, как уже ука-
зывалось, являются циклофосфан в первона-
чальной дозе 200 мг/сут и преднизолон в дозе
40—60 мг/сут в течение 1—2 мес [Gross W.L,
1997; Savage С.О., 1997]. При быстром прогрес-
сировании нефрита используют пульс-терапию
циклофосфаном (от 600 до 1000 мг внутривен-
но в зависимости от функционального состоя-
ния почек) и преднизолоном (800—1000 мг) в
сочетании с плазмаферезом. При достижении
клинико-лабораторной ремиссии переходят на
поддерживающее лечение: циклофосфаном в
дозе 50—100 мг, преднизолоном — 15—20 мг в
течение нескольких лет (3—5 лет). При обостре-
нии заболевания дозу повышают до исходной.
При достижении стойкой ремиссии и появле-
нии осложнений циклофосфан можно заменить
азатиоприном или метотрексатом в адекватной
дозе.
Применяют и другие методы лечения ГВ:
установлена эффективность циклоспорина, осо-
бенно у больных активными формами болезни
после трансплантации почки.
295
Предположение о роли инфекции в гиперп-
родукции АНЦА послужило предпосылкой к
применению триметоприма-сульфометоксазола
(бисептола) при локальных формах болезни.
Появились сообщения об успешном лечении че-
ловеческим иммуноглобулином ГВ, особенно в
случаях, осложненных инфекцией [Jayne D.R.,
Lockwood С.М., 1993].
Прогноз ГВ с поражением почек зависит от
ранней диагностики и правильно проводимого
лечения иммунодепрессантами. Возможны дли-
тельные стойкие ремиссии даже у больных с
быстропрогрессирующими формами ГН. По
нашим данным, 5-летняя «почечная» выжива-
емость при ГВ составила 67 %; значительная
часть летальных исходов наблюдалась в группе
пациентов с быстропрогрессирующим течени-
ем нефрита.
10.4. Поражение почек при
микроскопическом
полиартериите*
Микроскопический полиартериит (МПА) вы-
делен как вариант узелкового периартериита
(УП) в 1948 г. J.Davson, J.Pall, R.Platt у паци-
ентов, у которых поражение почек характери-
зовалось сегментарным некротизирующим гло-
мерулонефритом (ГН). В настоящее время МПА
рассматривается как самостоятельная нозологи-
ческая форма некротизирующего васкулита,
при которой повреждаются мелкие сосуды (ка-
пилляры, венулы или артериолы) без образо-
вания гранулем с небольшим количеством или
отсутствием иммунных депозитов; в клиничес-
кой картине доминируют явления некротизи-
рующего гломерулонефрита и легочные капил-
ляриты.
В 1993 г. на международной конференции в
Северной Каролине (США) была разработана
номенклатура системных васкулитов и дано
современное определение МПА, который от-
несен к АНЦА-ассоциированным формам вас-
кулитов. При СВ обнаруживают два типа анти-
тел к цитоплазме нейтрофилов (АНЦА): анти-
тела к миелопероксидазе, которые встречают-
ся преимущественно при МПА и имеют пери-
нуклеарное свечение (пАНЦА); при гранулема-
тозе Вегенера идентифицируют антитела к про-
теиназе 3, которые вызывают цитоплазматичес-
кое свечение (цАНЦА).
Морфологически обнаруживают некротизи-
рующий васкулит и гломерулит с массивной
инфильтрацией преимущественно сегментоя-
дерными лейкоцитами.
* Раздел написан Е.Н.Семенковой.
296
Наиболее часто при МПА поражаются лег-
кие, почки и кожа. Поражение легких — след-
ствие некротизирующего альвеолита — прояв-
ляется клинически кровохарканьем вплоть до
фульминантного кровотечения; для поражения
кожи характерна геморрагическая пурпура; воз-
можны васкулит желудочно-кишечного тракта,
миалгии, периферический неврит, у части
больных развивается эписклерит. Слизистая
оболочка верхних дыхательных путей вовлека-
ется значительно реже, чем при ГВ (в 35 %
случаев), при этом отсутствуют некроз и пер-
форации носовой перегородки.
Частота поражения почек колеблется от
90 % [Jennette С., Falk R., 1997] до 100 %
[Savage С.О., 1985; Adu D., 1987].
В наших наблюдениях (20 больных) призна-
ки поражения почек были у всех и проявлялись
в 78 % мочевым синдромом и в 22 % — не-
фротическим. АГ (мягкая или умеренная) на-
блюдалась у половины больных МПА в сред-
нем через 11 мес после появления первых при-
знаков нефропатии. Особенностью ГН при
МПА по сравнению с другими некротизирую-
щими васкулитами является высокая частота
быстропрогрессирующих форм [Bacon Р.А. и
др., 1996]. По нашим данным, быстропрогрес-
сирующее течение нефрита наблюдалось у 56 %
больных и выявлялось в среднем через 1,5 мес
после возникновения первых признаков пора-
жения почек.
Клиническими особенностями быстропрог-
рессирующего течения нефрита при МПА были
олигурическая ОПН (42 %) и нефротический
синдром разной степени выраженности с бо-
лее поздним обратным развитием по сравнению
со снижением креатинина сыворотки и гема-
турии при проведении иммуносупрессивной
терапии.
Диагноз МПА ставят на основании клиничес-
ких симптомов заболевания, гистологического
исследования кожи, слизистых оболочек, легко-
го, почек и определении АНЦА в сыворотке
крови, которые достоверно обнаруживаются в
острую фазу болезни у 95—100 % пациентов.
Дифференциальный диагноз проводят с ГВ,
узелковым периартериитом (УП) и заболевани-
ями, основными проявлениями которых был
легочно-почечный синдром; синдромом Гудпас-
чера, синдромом Чарга — Штроусса, пурпурой
Шенлейна — Геноха, криоглобулинемией, вас-
кулитом и нефритом, индуцированными ин-
фекцией. В отличие от УП при МПА поража-
ются мелкие сосуды, отсутствует АГ, инфици-
рование HBV, значительно чаще (в 80—100 %)
обнаруживают АНЦА. В отличие от МПА для ГВ
характерно наличие гранулем респираторного
тракта с распадом; при синдроме Гудпасчера
отсутствуют признаки системного васкулита, в
сыворотке крови и при биопсии почки обна-
руживают антитела к базальной мембране; для
эозинофильного васкулита (Churg — Strauss)
характерны бронхиальная астма, эозинофиль-
ные инфильтраты в органах и тканях, невысо-
кая частота обнаружения АНЦА (10—15 %).
Лечение. Для лечения МПА используют вы-
сокие дозы глюкокортикостероидов (1 мг/кг)
и пульс-терапию циклофосфаном (1000 мг внут-
ривенно) каждые 10—12 дней часто в сочета-
нии с приемом цитостатиков per os; по мере
стихания остроты заболевания переходят на
прием препаратов внутрь. Плазмаферез исполь-
зуют у больных с почечной недостаточностью
(уровень креатинина выше 6 мг%) при подго-
товке к гемодиализу или при легочном крово-
течении. Лечение азатиоприном целесообразно
лишь в период ремиссии. МПА свойственно
рецидивирующее течение, поэтому лечение им-
мунодепрессантами проводят длительно — в
течение нескольких лет.
Имеется опыт лечения внутривенным введе-
нием иммуноглобулина или моноклональных
CDw52 (против антигена всех мононуклеарных
клеток) и CD4 (против молекулы CD4), что
позволило авторам добиться длительной ремис-
сии [Kallenberg G.M., Brouwer Е. et al., 1994].
Прогноз фульминантного МПА серьезен: по
данным С.О.Savage и соавт. (1997), 5-летняя
«почечная» выживаемость у 34 пациентов МПА
составила 55 %. Возраст старше 50 лет и уро-
вень креатинина сыворотки выше 500 ммоль/л
являются прогностически неблагоприятными
признаками [Gordon М., Adu D., 1993]. В на-
ших наблюдениях [Макарьянц М.Л., 1997] 5-
летняя почечная выживаемость при МПА со-
ставила 26 %; неблагоприятными прогностичес-
кими признаками явились олигурия, высокий
уровень креатинина при поступлении, высокая
протеинурия и отсутствие адекватного лечения.
10.5. Поражение почек при
пурпуре Шенлейна — Геноха*
Пурпура Шенлейна — Геноха — ПШГ (анафи-
лактоидная нетромбоцитопеническая пурпура,
геморрагический васкулит) — генерализован-
ный продуктивный васкулит с поражением
мелких сосудов кожи, крупных суставов, желу-
дочно-кишечного тракта, почек.
Этиология. Среди внешних предрасполагаю-
щих факторов выделяют инфекции, особенно
вирусные, в том числе вирусы гепатита В и С,
бактериальную эндотоксинемию, лекарствен-
* Раздел написан А.Ю.Николаевым, О.Г.Кривоше-
евым.
ную непереносимость, пишевые, аэрозольные
и другие аллергены [Somer Т. et al., 1995].
К внутренним факторам, способствующим раз-
витию ПШГ, относятся генетически детерми-
нированные особенности иммунного ответа
[Nathwani D. et al., 1992].
В плазме больных ПШГ повышен уровень
полимерной формы IgA (изомера IgAl), часто
приобретающего свойства ревматоидного фак-
тора, криоглобулинов [Николаев А.Ю., 1995].
Дефект гликозилирования молекул IgA при
ПШГ может способствовать удлинению пери-
ода их циркуляции в крови, обусловливает их
неспецифическую тропность к Fc-фрагментам
антител, компонентам цитоплазмы нейтрофи-
лов, фибронектину плазмы и другим «аутоан-
тигенам» [Ronda N. et al., 1994; Allen A.C.,1995[.
Противоречивость мнений о распространен-
ности нефрита при ПШГ у взрослых связана со
сложностью взаимоотношений ПШГ и болез-
ни Берже (IgA-нефропатии), а также с высо-
кой заболеваемостью взрослых атипичным ге-
моррагическим васкулитом [Glassock R.J. et
al., 1996]. Подчеркивается сходство клинико-мор-
фологических признаков нефрита при ПШГ и
болезни Берже, приводятся описания семей,
члены которых заболевают как ПШГ, так и
болезнью Берже.
Патогенез нефрита при ПШГ связан с от-
ложением в мезангии IgA-содержащих ИК с
последующей активацией системы комплемента
по альтернативному пути. Поражение почек
характеризуется картиной фокального или диф-
фузного мезангиопролиферативного нефрита,
реже пролиферативного экстракапиллярного,
мезангиокапиллярного, диффузно-фокально-
пролиферативного нефрита. Частое обнаружение
депозитов фибрина в клубочках (более чем в
70 % случаев) свидетельствует о патогенетичес-
кой роли локальной (почечной) внутрисосуди-
стой коагуляции.
Морфологический нефрит при ПШГ, по
данным R.Habib и соавт. (1994), трудно отли-
чить от болезни Берже (IgA-нефропатии).
Патогенез гематурии — ведущего симптома
нефрита при ПШГ — обусловлен как гломеру-
лярным поражением, так и острым повышени-
ем проницаемости сосудистой стенки, разви-
вающимся в период атаки васкулита. Мы обна-
ружили продуктивные васкулиты мелких почеч-
ных сосудов более чем у '/3 больных ПШГ.
Экспериментальные и клинические исследо-
вания не выявили зависимости между интен-
сивностью и характером отложения IgA в по-
чечных клубочках и тяжестью клинических и
морфологических проявлений гломерулонефри-
та. Более специфично для нефрита при ПШГ,
по данным D.J.O’Donoghue и соавт. (1991), об-
наружение аутоантител класса IgG, названных
MESCA (mesangial cells autoantibodies); они ре-
агируют с антигенами мезангия и коррелиру-
ют с активностью гломерулонефрита.
Клиника, течение, прогноз. Типично появле-
ние признаков поражения почек в первые 4—
6 нед болезни на фоне развернутой клиничес-
кой картины васкулита.
Атипичный вариант ПШГ, когда заболева-
ние дебютирует нефритом с последующим (спу-
стя несколько месяцев или даже лет) присое-
динением кожной (кожно-абдоминальной)
пурпуры, чаще встречается у взрослых, чем у
детей [Habib R. et al., 1994]. Такой вариант мо-
жет длительно ошибочно трактоваться как пер-
вичный (брайтов) гломерулонефрит.
Клинически нефрит при ПШГ у взрослых в
половине случаев укладывается в рамки латен-
тного нефрита. При этом основным симптомом
является микрогематурия, сочетающаяся с про-
теинурией. Макрогематурия отмечается в сред-
нем у '/, больных, чаще она однократная, раз-
вивающаяся в начале нефрита, реже рециди-
вирующая в период обострений пурпуры, фа-
рингита. Протеинурия (неселективного типа) у
большинства больных не превышает 1—3 г/л.
Нефротический синдром присоединяется в 20—
30 % случаев, стойкая артериальная гипертен-
зия — в 10—15 %. В 20 % случаев рецидивирует
остронефритический синдром, в 5—10 % раз-
вивается быстропрогрессирующая почечная
недостаточность [Glassock R.J. et al., 1996].
По нашим наблюдениям, НС и стойкая ги-
пертензия, как правило, формируются поздно,
на фоне персистировавшего в течение несколь-
ких лет мочевого синдрома. Чаще эти симпто-
мы присоединяются у мужчин.
Течение нефрита при ПШГ у детей в 50 %
случаев благоприятное — с полным клиничес-
ким выздоровлением по мере исчезновения
экстраренальных проявлений болезни [МоШса F.
et al., 1992|. У 90 % взрослых нефрит приобре-
тает хроническое течение: персистирующее, ре-
цидивирующее, прогрессирующее [Никола-
ев А.Ю., 1995; Kaku Y. et al., 1998]. В целом у
взрослых частота исхода нефрита при ПШГ в
ХПН составляет 14—30 % [Glassock R.J. et al.,
1996]. Суммарная 5- и 10-летняя выживаемость
больных ПШГ с нефритом, по нашим данным,
достигает 98 и 69 % соответственно. Нефрит тя-
желее протекает у мужчин — при протеинурии
более 1 г/л, формировании НС, сочетании НС
с гипертензией, а также при выраженной стой-
кой микрогематурии. Многие авторы придают
решающее значение в прогнозе морфологичес-
ким признакам: обнаружению пролиферативно-
го экстракапиллярного, мезангиокапиллярного,
диффузного фибропластического нефрита
[Habib R. et al., 1994], а также IgG-депозитов в
мезангии.
298
По нашим наблюдениям, при вовлечении в
патологический процесс почек спустя год и
более после кожного дебюта заболевания суще-
ственно чаще наблюдается исход в ХПН по
сравнению с вариантом ПШГ-нефрита, клини-
ческая манифестация которого совпадает по
времени с началом кожного васкулита.
Диагноз и дифференциальный диагноз. Нефрит
у больных ПШГ диагностируется при сочета-
нии гематурии с характерной триадой — кож-
ной нетромбоцитопенической пурпурой, сус-
тавным и абдоминальным синдромами. При
стертости клинических экстраренальных прояв-
лений ПШГ, при ее атипичном почечном де-
бюте необходимо дифференцировать нефрит
при ПШГ от острого гломерулонефрита, алко-
гольного гематурического нефрита, болезни Бер-
же, синдрома Альпорта, синдрома тонкой гло-
мерулярной базальной мембраны [Vriesman В.,
1998]. Нередко требуется исключить с помощью
инструментальных методов урологические забо-
левания, сопровождающиеся гематурией: моче-
каменную болезнь, опухоли почки и мочевого
пузыря, папиллярный некроз, туберкулез поч-
ки.
Нефрит с яркими экстраренальными прояв-
лениями ПШГ важно отличать от протекающей
с вторичной пурпурой острой почечной недо-
статочности (ОПН). При этом пурпура может
быть как тромбоцитопенической (ГЛПС, ост-
рый сепсис, синдром Мошковича и гемолити-
ко-уремический синдром, спид, острый
ДВС-синдром), так и нетромбоцитопенической
(СКВ, узелковый периартериит, HCV+криогло-
булинемический васкулит, лекарственная бо-
лезнь, подострый инфекционный эндокардит,
паратуберкулезный и паранеопластический син-
дромы).
Волчаночный нефрит в отличие от нефрита
при ПШГ чаще наблюдается у женщин, неред-
ко сопровождается лихорадкой, полисерозита-
ми, миокардитом, эритематозными высыпани-
ями на лице, анемией, лейкопенией.
Узелковому периартерииту свойственны
упорная высокая лихорадка, быстрая потеря
массы тела, асимметричный полиневрит, тяже-
лая, нередко злокачественная гипертензия.
Микроскопический полиартериит, протекаю-
щий с язвенно-геморрагическим кожным вас-
кулитом, отличается тяжелым поражением лег-
ких в виде некротизирующего альвеолита с
легочными кровотечениями и обнаружением
циркулирующих антител к цитоплазме нейтро-
филов.
Для исключения вторичного геморрагичес-
кого васкулита при инфекциях и системных за-
болеваниях соединительной ткани необходимо
определение в крови криоглобулинов, марке-
ров HCV, HBV, антител к хантаан-вирусу, к
HIV, к цитоплазме нейтрофилов, антинукле-
арного фактора и LE-клеток, исследование ге-
мокультуры, рентгенологическое и эхокардио-
графическое исследование. При подозрении на
хронический активный гепатит с системными
проявлениями выполняют биопсию печени.
Большие трудности вызывает диагностика
ПШГ в старческом возрасте. Необходимо в пер-
вую очередь исключать вторичный геморраги-
ческий васкулит: паранеопластический (адено-
карцинома почки, легкого, злокачественная
лимфома, миеломная болезнь и другие опухо-
ли, продуцирующие криоглобулины), парату-
беркулезный, а также синдром ПШГ при сеп-
сисе и подостром инфекционном эндокардите.
Профилактика и факторы риска. При много-
факторном анализе было установлено, что риск
вовлечения почек с развитием прогрессирую-
щего диффузного нефрита наиболее высок при
персистирующем характере кожной пурпуры,
рецидивирующем тяжелом абдоминальном син-
дроме, а также при низкой концентрации в
крови фактора XIII [Kaku Y. et al., 1998]. При
наличии указанных факторов риска обсуждается
целесообразность раннего назначения глюко-
кортикостероидов. Ценность применения стеро-
идов для профилактики вовлечения почек при
ПШГ подчеркивают ряд клиницистов [МоШса
F. et al., 1992], в то время как другие не нахо-
дят у стероидов нефропротективного эффекта
при их раннем назначении больным ПШГ
[Saulsbury F.T. et al., 1993; Kaku Y. et al., 1998].
Лечение. Наилучшие результаты приносит
этиологическая терапия ПШГ. Так, при лекар-
ственной этиологии болезни ремиссия, быст-
ро наступающая после отмены соответствующе-
го медикамента, рассматривается как один из
важнейших критериев диагноза. При ПШГ,
индуцированной острой бактериальной инфек-
цией, внедрение в клинику высокоэффектив-
ных антибактериальных препаратов существен-
но улучшает прогноз и течение гломерулонеф-
рита [Somer Т. et al., 1995]. При неустановлен-
ной этиологии применяют патогенетическую
терапию ПШГ. Глюкокортикостероиды, купи-
рующие экстраренальные системные проявле-
ния ПШГ, при развернутом ГН, по данным
R.J.Glassock и соавт. (1996), малоэффективны.
В качестве вспомогательных иммуномодули-
рующих методов лечения используют плазма-
ферез, олигоантигенную диету [Lunardi С. et al.,
1992], человеческий донорский иммуноглобу-
лин [Rostoker G. et al., 1994], а также концен-
трат фактора XIII [Utani A. et al., 1991]. По
предварительным данным, лечение иммуногло-
булином и фактором XIII оказывает благопри-
ятное действие как на течение ГН, так и на
системные экстраренальные проявления ПШГ
[Kaku Y. et al., 1998].
При тяжелом ГН (с пролиферативными
полулуниями более чем в половине клубочков)
показана сочетанная иммунодепрессивная тера-
пия: сверхвысокие дозы цитостатиков и глю-
кокортикостероидов вместе с плазмаферезом
[Habib R. et al., 1994; Glassock R.J. et al., 1996].
10.6. Поражение почек при
системной склеродермии*
Системная склеродермия (ССД, системный
прогрессирующий склероз) характеризуется
прогрессирующим фиброзом и распространен-
ной сосудистой патологией по типу облитери-
рующей микроангиопатии, лежащих в основе
генерализованного синдрома Рейно, поражения
кожи, опорно-двигательного аппарата и внут-
ренних органов: легких, сердца, пищеваритель-
ного тракта и почек.
Прогностически наиболее тяжелой является
склеродермическая нефропатия, которая ранее
фигурировала под названием «истинная скле-
родермическая почка»; в настоящее время чаще
используется термин «склеродермический по-
чечный криз». Как правило, склеродермическая
почка развивается в период генерализации про-
цесса, чаще — при быстропрогрессирующей
склеродермии с диффузным поражением кожи
[Гусева Н.Г., 1993].
Патогенез и патоморфология. ССД является
характерным представителем группы диффуз-
ных болезней соединительной ткани со свой-
ственным им сложным комплексом этиологи-
ческих и патогенетических факторов (генетичес-
кие, вирусные, иммунные, нарушения микро-
циркуляции, фиброзообразования и др.).
Роль генетических факторов при ССД обсуж-
дается в настоящее время с позиций детерми-
нированности предрасположения к заболева-
нию и клинического полиморфизма, реализу-
ющихся при наличии дополнительных эндо- и
экзогенных факторов. К последним могут быть
отнесены вирусные, химические, стрессовые
воздействия, охлаждение, вибрация и др.
Выявлено сочетание ССД с определенными
антигенами и аллелями системы гистосовмес-
тимости: HLA А9, В8, В35, DR1, DR3, DR11,
DR52, С4А, варьирующее в различных попу-
ляциях.
Участие иммунного звена в развитии ССД
аргументируется нарушениями клеточного и гу-
морального иммунитета. Выявляются гипергам-
маглобулинемия, главным образом за счет IgG,
ревматоидный фактор (у 40 % больных), анти-
нуклеарные и другие аутоантитела. Наиболее
характерными для ССД являются антицентро-
* Раздел написан Н. Г. Гусевой.
299
мерные антитела, анти-Scl 70 (антитопоизоме-
разные) и антинуклеолярные (анти-РНП, анти-
PM-Scl и др.) антитела. Установлены ассоциа-
ции между специфическими для ССД аутоан-
тителами, генетическими маркерами и опреде-
ленными клиническими характеристиками
(Black С., 1995].
В последние годы обсуждается вопрос об
участии анти нейтрофильных цитоплазматичес-
ких антител (АНЦА) и особенно антимиело-
пероксидазных цитоплазматических антител в
развитии васкулита и почечной патологии у
больных ССД, в том числе при длительном
лечении D-пеницилламином [Endo Н., 1994;
Hillis G. et al., 1997]. Нарушения иммунного
гомеостаза взаимодействуют с характерной для
заболевания патологией фиброобразования и
микроциркуляции [Le Roy Е. et al., 1989].
Мембранные аномалии и относительная ав-
тономность склеродермических фибробластов с
гиперпродукцией коллагена и других компонен-
тов соединительной ткани, последующее актив-
ное фибриллообразование и дисбаланс агрега-
ции коллагеновых фибрилл, избыточное содер-
жание фибронектина («фибронектиновая
шуба») лежат в основе генерализованного фиб-
роза, составляющего специфику заболевания.
Межклеточная кооперация осуществляется ря-
дом медиаторных систем, включая молекулы
адгезии, факторы роста и др.
Нарушения микроциркуляции — важный
фактор локального и общего патогенеза забо-
левания — обусловлены как поражением соб-
ственно сосудистой стенки, так и изменением
внутрисосудистых, плазменных и клеточных
свойств крови. Наблюдаются пролиферация и
деструкция эндотелия, утолщение, гиперплазия
интимы, фибриноидные изменения и склероз
сосудистой стенки, сужение просвета сосудов,
вплоть до облитерации, нарушения проницае-
мости и кровотока, увеличение вязкости, тен-
денция к гиперкоагуляции и угнетению фиб-
ринолиза, агрегация форменных элементов,
стаз, деформация и редукция капиллярной сети
с образованием бессосудистых полей, что реа-
лизуется в клинической картине ССД генера-
лизованным синдромом Рейно, включая его эк-
вивалент в легких и почках, распространенны-
ми трофическими, ишемическими и некроти-
ческими изменениями — от множественных
изъязвлений на кончиках пальцев до истинной
склеродермической почки.
Вазомоторные расстройства, вазоспазм явля-
ются важным механизмом развития поражения
почек при ССД.
При функциональном исследовании почек
выявляется уменьшение скорости КФ и в мень-
шей степени почечного кровотока.
Современным неинвазивным и весьма ин-
300
формативным является метод цветной допплер-
ультрасонографии, позволяющий выявить ре-
нальную патологию у больных ССД (снижение
почечного кровотока) до развития клиничес-
ких симптомов поражения почек [Rivolta R. et
al., 1996]. Возможность раздельной оценки кро-
вотока в основных, междолевых и кортикаль-
ных артериях каждой из почек является осно-
вой ранней и дифференциальной диагностики
сосудистой патологии почек при ССД.
Снижение почечного кровотока может быть
связано как с уменьшением проходимости ар-
териального русла за счет сужения (функцио-
нального и органического) просвета междоль-
ковых артерий и артериол нефрона, так и с
повреждением канальцевого аппарата; возмо-
жен и шунтирующий эффект разрастающейся
соединительной ткани в строме почки. Сниже-
ние КФ, по-видимому, обусловлено поражени-
ем прегломерулярных сосудов и собственно
гломерулярных структур.
Активно обсуждается вопрос о месте систе-
мы ренин — ангиотензин — альдостерон
(РААС) в генезе поражения почек при ССД.
Выявлено повышение активности ренина плаз-
мы (АРП) после холодовой стимуляции у ряда
больных ССД, причем исследование биоптатов
почек показало существенные сосудистые из-
менения у этих больных, в то время как у боль-
ных с нормальным уровнем ренина сосудистой
патологии не отмечено.
Наши наблюдения свидетельствуют о том,
что гиперренинемия отражает тяжесть пораже-
ния почек и заболевания в целом, но лишь
нарастание ее и высокий уровень АРП могут
быть отнесены к угрожающим признакам над-
вигающегося ухудшения в течении болезни.
Морфологические исследования свидетель-
ствуют также о роли сосудистой патологии в
генезе поражения почек при ССД, особенно
при острой склеродермической нефропатии,
которая характеризуется тяжелыми сосудисты-
ми изменениями с множественными корти-
кальными некрозами. Нередко встречается
тромбоз пораженных сосудов.
Более доброкачественные варианты склеро-
дермической нефропатии также характеризуют-
ся сосудистой патологией, которая выражает-
ся в концентрической гиперплазии интимы,
очаговых фибриноидных изменениях, склерозе
и гиалинозе средних и малых артерий с суже-
нием их просвета.
Сопоставление данных световой, иммуноги-
стохимической и электронной микроскопии
показало, что отмечается преимущественное
поражение сосудов мелкого и среднего калиб-
ра (от капиллярных петель клубочков до меж-
дольковых артерий): отек и набухание интимы
междольковых артерий с сужением просвета
сосудов, выявляемые уже при субклинической
склеродермической нефропатии, фибриноид-
ный некроз афферентных артериол клубочков
при выраженной хронической и особенно ост-
рой склеродермической нефропатии. С помощью
электронной микроскопии выявлены ультра-
структурные признаки поражения микропирку-
ляторного русла (утолщение БМ капиллярных
петель клубочков, ретикуляция цитоплазмы эн-
дотелиоцитов и др.).
Современные исследования показали возмож-
ность развития при ССД аутоиммунного БПГН, ас-
социированного с наличием АНЦА. Доказана также
возможность развития мезангиопролиферативного
гломерулонефрита в сочетании с перинуклеарными
АНЦА и анти-МПО-антителами при лечении D-
пеницилламином [Endo Н. et al., 1994; Hillis G. et al.,
1997].
Клиническое течение, диагноз, прогноз. На
основании многолетних наблюдений более 500
больных ССД с поражением и без поражения
почек, клинико-лабораторного и морфологи-
ческого исследования почек мы считаем обо-
снованным выделение двух основных вариан-
тов склеродермической нефропатии: острого,
нередко протекающего с синдромом злокаче-
ственной гипертензии (истинная склеродерми-
ческая почка, склеродермический почечный
криз) и хронического. Выделенные варианты
отличаются по характеру, быстроте развития и
выраженности патологии, что находит отраже-
ние в основной клинико-лабораторной симп-
томатике поражения. Хронический вариант це-
лесообразно подразделить на 3 группы: субкли-
ническая (I); умеренная (II); выраженная (III)
склеродермическая нефропатия.
Острая склеродермическая нефропатия ха-
рактеризуется внезапным началом с быстро
нарастающими изменениями в моче, прогрес-
сирующей почечной недостаточностью, разви-
тием злокачественной гипертонии с ретинопа-
тией и отсутствием, как правило, эффекта от
проводимой терапии, включая гипотензивные
и вазоактивные препараты. Летальный исход
заболевания был у 85,7 % наблюдавшихся боль-
ных в среднем через 1,5—2 мес после появле-
ния изменений в моче. Как показывают отдель-
ные наблюдения, возможно развитие склеро-
дермического почечного криза и почечной не-
достаточности при отсутствии гипертензии [Гу-
сева Н.Г., 1993; Helfrich et al., 1989, и др.].
В отличие от острого поражения почек хро-
ническая склеродермическая нефропатия раз-
вивается в течение ряда месяцев и лет, варьи-
руя по степени выраженности, и протекает
более доброкачественно. Мы выделяем три ва-
рианта хронической склеродермической нефро-
патии:
• незначительные и нестойкие изменения в
моче (следовая протеинурия, преходящие
изменения мочевого осадка) или функцио-
нальные нарушения (снижение клубочковой
фильтрации);
• небольшие, но стойкие изменения в моче
(протеинурия, изменения мочевого осадка)
в сочетании с нарушениями функции почек;
• помимо мочевого синдрома и функциональ-
ных нарушений, наличие гипертензии, кон-
тролируемой гипотензивными препаратами,
гиперренинемии, отеков.
Наиболее важными признаками для выделе-
ния вариантов склеродермической нефропатии
представляются различия в характере и стой-
кости мочевого синдрома, снижении КФ, от-
ражающие степень вовлечения почек в патоло-
гический процесс. При функциональном иссле-
довании выявлено существенное снижение КФ
уже при субклиническом поражении почек.
Величина почечного кровотока при хроничес-
кой нефропатии, несмотря на его снижение у
некоторых больных, в среднем оставалась в
пределах нормы, в то время как при острой
склеродермической нефропатии отмечалось
значительное (почти в 3 раза) его снижение.
Возможны и более редкие варианты пора-
жения почек при ССД, в частности развитие у
отдельных больных нефротического синдрома.
Еще более редким является развитие амилои-
доза, который был выявлен при морфологичес-
ком исследовании (биопсия, вскрытие) у двух
наблюдавшихся нами больных ССД. Эти наблю-
дения периретикулярного амилоидоза при ССД
представляют казуистическую редкость.
В связи с активным использованием D-пе-
ницилламина для лечения ССД появились пуб-
ликации случаев нефротоксической почки как
одного из серьезных осложнений терапии, тре-
бующего немедленной отмены препарата. Харак-
теризуется быстро нарастающей симптоматикой
НС с увеличением протеинурии до 20—46 %о.
В большинстве наблюдений отмена D-пени-
цилламина привела к обратному развитию кли-
нических и морфологических проявлений не-
фропатии. У ряда больных наряду с отменой
препарата потребовалось назначение ГК, им-
муносупрессантов, экстракорпоральной тера-
пии.
Среди наблюдавшихся нами 106 больных ССД,
получавших D-пеницилламин, лекарственная нефро-
патия развилась у 6, она была своевременно распоз-
нана и при отмене препарата постепенно регресси-
ровала. Протеинурия появляется чаще в течение б—
18 мес от начала лечения при использовании срав-
нительно высоких доз D-пеницилламина, что тре-
бует строгого контроля за состоянием почек и от-
мены препарата при появлении даже небольших
301
количеств белка в моче (допустимо наблюдение при
протеинурии до 0,3 г/сут).
Для уточнения прогностической роли почечной
патологии был проведен анализ выживаемости боль-
ных ССД в двух группах: 1-я — без клинических и
функциональных признаков поражения почек (172
больных); 2-я — с поражением почек (90 больных)
|Аникина Н.В., Гусева Н.Г. и др., 1986]. Результаты
исследования показали, что в 1-й группе длительно
сохраняется высокая выживаемость: так, в 1-й год
наблюдения она равнялась 93 %, к 5 годам — 82 %,
к 15 годам остались в живых 72 % больных. При по-
ражении почек прогноз болезни резко ухудшается.
Так, в 1-й год выживаемость составила 73 %, через
5 лет — 48 %, через 10 лет — 24 %, а к 15 годам
остались под наблюдением лишь 13 % больных.
Все случаи острой склеродермической нефропа-
тии отличались внезапностью и остротой развития
и закончились летально через 1—2 мес после появ-
ления ренальной симптоматики. Факторами риска
были острое прогрессирующее течение и активность
ССД. Выживаемость в этой группе больных в 1-й год
наблюдения составила 25 %, а к 6 годам все боль-
ные умерли, т.е. летальность достигла 100 %.
При третьем варианте хронической склеродерми-
ческой нефропатии прогноз также неблагоприятен,
но не столь катастрофичен, как при острой. Пяти-
летняя выживаемость равнялась 64 %.
Наиболее доброкачественны первые два вариан-
та хронической склеродермической нефропатии:
5-летняя выживаемость составила 52 %, 10-летняя —
35 %, что ниже, чем в группе больных без пораже-
ния почек.
Показатели выживаемости позволили изме-
нить существующее мнение о доброкачествен-
ности субклинических форм почечной патоло-
гии, так как, несмотря на более благоприят-
ный прогноз по сравнению с острой склеро-
дермической почкой, даже минимальные при-
знаки, указывающие на вовлечение в патоло-
гический процесс почек, значительно отягоща-
ют прогноз болезни.
В последнее десятилетие, согласно нашим
наблюдениям и отдельным публикациям в за-
рубежной литературе, поражение почек, вклю-
чая склеродермические почечные кризы, встре-
чается значительно реже, что, как мы полага-
ем, в значительной мере обусловлено более
ранней диагностикой и своевременной актив-
ной терапией больных ССД, оказывающей не
только лечебный, но и протективный эффект,
в частности это касается развития ренальной
патологии. Следует также иметь в виду, что вы-
живаемость больных с пораженем почек значи-
тельно улучшилась после включения ингибито-
ров АПФ в комплексное лечение, особенно при
развитии склеродермического почечного криза
|Гусева Н.Г. и др., 1992; Helfrich et al., 1989;
Steen V.D., 1996].
Лечение ССД в связи со сложностью пато-
генеза, быстрым развитием фиброза и тяжелых
302
сосудистых нарушений представляет одну из
труднейших задач ревматологии.
Вопросы ранней диагностики и уточнения
характера поражения почек принципиально
важны для определения прогноза и выбора те-
рапевтической тактики. Изучение механизмов
поражения почек при ССД открывает допол-
нительные перспективы более эффективного
лечения. Однако своевременная терапия забо-
левания, позволяющая предотвратить генерали-
зацию и прогрессирование склеродермическо-
го процесса, включая почечную локализацию,
имеет отчетливые преимущества перед лечени-
ем уже развившегося поражения почек. Следу-
ет учитывать ведущие звенья патогенеза забо-
левания в целом и поражения почек в частно-
сти, когда тяжелая сосудистая патология и на-
рушения микроциркуляции сочетаются с акти-
вацией отдельных компонентов иммунной си-
стемы и генерализованным фиброзом.
Современная патогенетическая терапия в
соответствии со сложным патогенезом заболе-
вания является комплексной и включает 3 ос-
новные группы антифиброзных, противовоспа-
лительных и сосудистых средств [Насонова В.А.,
Гусева Н.Г., 1987; Гусева Н.Г., 1998]. Основу ба-
зисной, главным образом антифиброзной, те-
рапии представляет D-пеницилламин (D-П),
который является «средством выбора» при ос-
трой быстропрогрессирующей ССД, когда по-
ражение почек наиболее часто и прогностичес-
ки неблагоприятно. Рекомендуется длительное
применение D-II (2—5 лет) по определенной
схеме: возрастающие дозы с 300 до 900—
1200 мг в течение 2 мес с последующим мед-
ленным снижением до поддерживающих, ко-
торые могут использоваться годами, адекватно
состоянию бальных. Однако частота побочного
действия D-П (наблюдается у '/3 больных): вы-
сыпания, мочевой синдром, лихорадка, дис-
пепсические явления, реже — лейко- и тром-
боцитопения, миастения и другие — требует
тщательного наблюдения за больным, контро-
ля анализов мочи и крови в течение всего пе-
риода лечения D-П.
Использование D-П при ССД с поражени-
ем почек имеет свои особенности в связи с его
нефротоксическим и, возможно, иммуноопос-
редованным действием у некоторых больных.
Существующее мнение о возможности профи-
лактического действия эффективной терапии
D-П в отношении развития заболевания в це-
лом и склеродермической почки в частности
нам кажется логически оправданным и подтвер-
ждается нашими наблюдениями: из 100 наблю-
давшихся нами больных ССД, включая боль-
ных, длительно получавших D-П, истинная
склеродермическая почка не развилась ни у
одного, в то время как в аналогичной, близ-
кой по характеру течения группе больных пред-
шествующего десятилетия эта тяжелая патоло-
гия отмечена в 12 наблюдениях. Однако у 6
больных (из 106), получавших D-П, наблюда-
лось развитие нефротоксической почки, что
обусловлено тяжелым побочным действием
препарата и требует немедленной его отмены.
У наблюдавшихся нами больных ССД это ос-
ложнение развилось, когда уже имелся в той
или иной степени выраженный положительный
эффект D-П в отношении заболевания в целом.
D-П был полностью отменен, но остальное
лечение продолжалось, а доза ГК была несколь-
ко повышена, что привело к обратному разви-
тию нефротического синдрома. Все больные
остались живы, явления нефропатии стихли.
В литературе имеются единичные наблюдения
смерти больных при развитии нефротоксичес-
кой почки на фоне лечения D-П.
Применение противовоспалительных средств,
в частности ГК, патогенетически оправдано в
связи с воздействием на своеобразный клеточ-
ный и гуморальный компоненты воспаления,
особенно на ранних стадиях, подостром тече-
нии. Мы отдаем предпочтение преднизолону
(средняя доза 20—30 мг), который при острой
и подострой ССД обычно сочетается с D-П и
сосудистой терапией. При хроническом тече-
нии, когда преобладают склероз и атрофия, ГК
практически неэффективны; показаны амино-
хинолиновые и сосудистые средства.
Применение ГК при поражении почек так-
же имеет свои особенности, дифференцирует-
ся в зависимости от варианта почечной пато-
логии и ее симптоматики. Хотя предполагав-
шийся ранее стимулирующий эффект ГК в от-
ношении развития истинной склеродермичес-
кой почки не нашел четкого подтверждения в
наших наблюдениях, как и в исследованиях
других авторов, настороженность в использова-
нии ГК при развитии склеродермической не-
фропатии остается, особенно при наличии зло-
качественной гипертонии, когда на первый
план в комплексном лечении выступают сосу-
дистые, гипотензивные препараты, вазодилата-
торы, дезагреганты и другие средства.
В последнее время возросла роль иммуносуп-
рессивной терапии (циклофосфамид, азатиоп-
рин, метотрексат и др.) в лечении ССД, в том
числе при почечной патологии, фиброзирую-
щем альвеолите, синдроме полимиозита и др.
Обнаружение антинейтрофильных, антимиело-
пероксидазных антител, которые могут участво-
вать в иммунном генезе поражения почек при
ССД, в том числе при длительном лечении D-
пеницилламином [Karpinski I. et al., 1997; Hillis
G. et al., 1997], требует обязательного включе-
ния цитостатиков (циклофосфан) в комплекс-
ное лечение этой категории больных.
Принципиально важно уже с начала забо-
левания воздействовать на систему микроцир-
куляции и синдром Рейно, которым нередко
дебютирует ССД. Имеется большой арсенал
хорошо известных сосудистых средств различ-
ного действия.
Среди вазодилататоров наиболее эффектив-
ны антагонисты кальция, в первую очередь
нифедипин (коринфар), применение которого
показано на любом этапе синдрома Рейно,
включая наличие серьезных трофических нару-
шений и даже начальной гангрены пальцев,
когда в ряде случаев мы наблюдали поразитель-
ный эффект. Дезагреганты (трентал, курантил
и др.) применяются при увеличении агрегаци-
онной активности клеточных элементов крови,
развитии сладж-синдрома; антикоагулянты (ге-
парин и др.) — при склонности к гиперкоагу-
ляции и особенно развитии ДВС-синдрома.
Введение в клиническую практику ингиби-
торов ангиотензинпревращающего фермента
(АПФ) кардинальным образом изменило судь-
бу больных со склеродермической почкой. Уже
при подозрении на развитие острой склеродер-
мической нефропатии, злокачественного гипер-
тонического криза необходимо назначение ин-
гибиторов АПФ с подбором доз, контролиру-
ющих ДД-
Следует учитывать также возможность обще-
го воздействия ингибиторов АПФ на склеродер-
мический процесс, поскольку в последние годы
доказано наличие РААС в тканях, легких и серд-
це. При этом каптоприл, имеющий в химичес-
кой формуле сульфгидрильные группы (анало-
гично D-пеницилламину), по-видимому, может
оказывать и умеренный антифиброзный эффект.
Несомненно перспективным для лечения
больных ССД с периферической сосудистой
патологией является введение в клиническую
практику простагландина Е1 (ПГЕ1). Внутри-
венное введение вазапростана (альпростадил)
привело к уменьшению проявлений синдрома
Рейно, язвенно-некротических изменений, пре-
имущественно в области пальцев рук и ног, и
улучшению состояния у 28 из 30 больных ССД,
лечившихся в Институте ревматологии РАМН.
Влияние ПГЕ1 на почечный кровоток и улуч-
шение функции почек доказаны в эксперимен-
тальных и клинических исследованиях. В экспе-
рименте установлен защитный эффект ПГЕ1
при постишемической почечной недостаточно-
сти. Илопрост (стабильный аналог простаглан-
дина), как показал метод цветной допплер-
сонографии, при внутривенном введении боль-
ным ССД снижает индекс резистентности меж-
долевых и кортикальных артерий, улучшает
почечный кровоток и, следовательно, может
быть использован для лечения склеродермичес-
ких почечных кризов [Scorza R. et al., 1997].
303
Отмечен определенный эффект, хотя дале-
ко не во всех наблюдениях, от сочетания со-
временных мощных гипотензивных средств,
пропранолола, низкомолекулярных декстранов,
гепарина и экстракорпоральных методов лече-
ния (гемодиализ, карбогемоперфузия) наряду
с диуретиками и другой симптоматической те-
рапией.
Гемодиализ чаще дает временный эффект,
но при длительном его использовании в ком-
бинации с активными гипотензивными сред-
ствами или нефрэктомией у некоторых больных
удалось достигнуть восстановления почечных
функций. Обнадеживающие результаты были
получены при проведении двусторонней нефр-
эктомии, однако опыт этой экстремальной те-
рапии при ССД остается ограниченным. Выпол-
нено несколько трансплантаций без рецидива
поражения в пересаженной почке. Рефрактер-
ная гипертензия и необратимая почечная не-
достаточность при отсутствии тяжелого пораже-
ния других органов могут рассматриваться как
показания к двусторонней нефрэктомии и
трансплантации почек.
При умеренных изменениях в почках, ког-
да проводится базисная и симптоматическая
терапия, следует учитывать необходимость под-
держания перфузионного давления, избегать
средств, снижающих почечный кровоток, ши-
роко использовать вазодилататоры и дезагре-
гана ы.
Профилактика склеродермической нефропа-
тии заключается в ранней диагностике заболе-
вания и своевременном, дифференцированном
и активном лечении больных ССД.
10.7. Поражение почек при
смешанной криоглобулинемии*
Смешанная криоглобулинемия (СКГ) — забо-
левание из группы системных васкулитов, ха-
рактеризующееся поражением мелких сосудов
с отложением в них иммуноглобулинов, обла-
дающих свойством обратимо преципитировать
на холоде.
Поражение почек встречается в 20—50 %
случаев, их вовлечение утяжеляет течение и
нередко определяет прогноз.
Впервые на возможность поражения почек
при СКГ сообщили М.Meltzer и соавт., опи-
савшие в 1966 г. клинические проявления так
называемой эссенциальной СКГ, для которой
характерны пурпура, артралгии, слабость (три-
ала Мельтпера) и нередко диффузный гломе-
рулонефрит.
* Раздел написан Н.Б.Горловской, Л.В.Козловской.
304
Подразделение криоглобулинов на типы
(смешанные — II или III типа и моноклональ-
ные — I типа) было предложено I.C.Brouet и
соавт. (1974) на основе иммунохимических
свойств белков, входящих в их состав. Пораже-
ние почек может возникать как при II, так и
при III типе СКГ.
При СКГ выявляют два и более иммуно-
глобулинов (1g), одним из которых является
поликлональный IgG, выступающий обычно
в роли антигена, вторым — aiiTHlgG, чаще
IgM класса — моноклональный при II типе
и поликлональный при III — с активностью
ревматоидного фактора. СКГ (обычно III
типа) может встречаться при болезнях соеди-
нительной ткани, печени, аутоиммунных и
инфекционных заболеваниях. В этих случаях
СКГ рассматривают как вторичную, в отсут-
ствие же связи с определенным заболевани-
ем употребляется термин «эссенциальная», на
долю которой приходится менее */3 всех слу-
чаев СКГ.
Эссенциальная СКГ чаще развивается у жен-
щин старше 40—50 лет. Частота в популяции не
установлена. Наиболее высокая распространен-
ность заболевания отмечена в странах Среди-
земноморья (Италия, Испания, Франция, Из-
раиль) [D’Amico G., 1998].
Моноклональный ревматоидный фактор (РФ)
при эссенциальной СКГ II типа имеет пример-
но в 84 % случаев WA-идиотип (WAmRF), об-
ладающий особой тропностью к почечным
структурам клубочка [Agnello V. et al., 1992,
1997], чем объясняют частоту вовлечения по-
чек при II типе СКГ. Особые клинико-морфо-
логические черты поражения почек при II типе
СКГ позволили G.Mazzuco и соавт. (1986) пред-
ложить для его обозначения термин «криогло-
булинемический гломерулонефрит»; при III
типе изменения в почках неспецифичны.
Криоглобулины I типа состоят только из
моноклональных 1g одного класса, обычно IgM
(иногда IgG и редко IgA), не обладают актив-
ностью РФ. Этот тип криоглобулинов сопро-
вождает лимфопролиферативные заболевания
и не вызывает существенного поражения по-
чек.
Этиология. Новым этапом в представлении о
СКГ, в том числе и о криоглобулинемическом
ГН, стало обнаружение тесной связи СКГ с
вирусом гепатита С, что позволяет сузить рам-
ки понятия «эссенциальная» и делает этот тер-
мин условным [Agnello V. et ai., 1992, 1997].
Частота маркеров HCV при СКГ, по данным
различных авторов, колеблется от 75 до 100 %
[Monti G. et al., 1995]. Маркеры HCV, в том
числе HCV-PHK, обнаруживают не только в
сыворотке крови больных СКГ, но и в крио-
преципитатах, клетках печени, периферических
мононуклеарных клетках, костном мозге [Ferri С.
et al., 1993; D’Amico G.,1998],
Так, C.Ferri и соавт. (1995) выявили марке-
ры HCV у 91 % из ПО больных СКГ и только
у 6,4 % из 110 больных контрольной группы
(ревматоидный артрит, СКВ, синдром Шегре-
на, системная склеродермия), причем у боль-
ных СКГ с поражением печени маркеры были
обнаружены в 96 % случаев, а при вовлечении
почек — в 100 %.
Роль других вирусов, в частности вируса
Эпштейна — Барр, гепатита В [Galli М. et al.,
1992], с которыми в предыдущие годы связы-
вали развитие СКГ, менее значима; так, час-
тота обнаружения HBV, по данным М.Galli
(1995), не превышает 5,4 %.
Важное значение инфекции вируса гепатита
С для развития СКГ подтверждается данными о
частоте СКГ среди больных с доказанным ви-
русным гепатитом С, которая составила 36 %
в исследовании J.M.Pawlotsky и соавт. (1995),
54 % (среди 127 больных) в наблюдениях
F.Lunel и соавт. (1994) и 37 % (среди 130 боль-
ных) в наблюдениях нашей клиники (1998).
Всеми авторами отмечено преобладание СКГ
III типа (у 2/3 больных) по сравнению с СКГ
11 типа (у 7, больных).
В то же время у больных СКГ II типа пора-
жение почек возникает в 3 раза чаще, чем при
III типе, а криоглобулинемический ГН разви-
вается только при II типе [D’Amico G.,
Fornasieri А., 1995; Agnello V., 1997].
Патогенез. Криоглобулинемический нефрит —
типичный иммунокомплексный нефрит. Обра-
зованные in situ и/или захваченные из цирку-
ляции ИК, состоящие из WAmRF и IgG-анти-
тел к HCV, ведут к потреблению комплемента
по классическому пути, вызывают активацию
эндотелия сосудистой стенки и повышение ее
проницаемости, способствуют притоку моноци-
тов из кровяного русла, которые, с одной сто-
роны, являются фагоцитирующими клетками,
а с другой — медиаторами локального повреж-
дения. Число моноцитов в острую стадию за-
болевания может достигать 80 клеток в одном
клубочке. Высвобождающиеся литические энзи-
мы и другие гуморальные факторы способству-
ют пролиферации резидентных клеток. Не ис-
ключается и участие клеточного иммуните-
та, поскольку наряду с моноцитами обнаружи-
вают и Т-лимфоциты (ОКТ8) [D’Amico G.,
1998|.
Роль КГ в гломерулярном повреждении под-
тверждена в эксперименте на крысах, у кото-
рых индуцировали ГН путем внутривенного
введения растворенных криоглобулинов
(IgM’k— IgG) от больного СКГ, инфицирован-
ного HCV [Fornasieri A. et al., 1993]. Выделен-
ный из смешанных криоглобулинов и не содер-
жащий вирусного антигенного компонента
WAmRF после введения мышам откладывался
в клубочках почек и вызывал повреждения,
сходные с теми, которые возникали после вве-
дения смешанных криоглобулинов [D’Amico G.,
1995]. Это убедительно свидетельствует о спе-
цифическом аффинитете WAmRF компонента
криоглобулинов к почечной ткани, возможно,
к фибронектину, постоянному компоненту
мезангиального матрикса. В пользу повреждаю-
щего эффекта криоглобулинов могут служить и
клинические наблюдения. Так, C.Hiesse и со-
авт. (1989) отметили рецидив мезангиокапил-
лярного ГН (МКГН) в почечном трансплан-
тате у 2 больных с «эссенциальной» СКГ при
обострении последней, a D.Burstem и R.Rodby
(1993) сообщили о развитии тяжелого МКГН
с НС после трансплантации печени у больного
с активной вирусной инфекцией гепатита С и
СКГ.
Морфология. Морфологические изменения в
почках при криоглобулинемическом ГН укла-
дываются в картину МКГН, однако имеют в
отличие от идиопатического МКГН некоторые
особенности [D’Amico G., Fornasieri А., 1995].
Этими особенностями являются внутрикапил-
лярные тромбы с фибриллярными или крис-
таллоидными структурами, выявляемыми при
электронной микроскопии (ЭМ). Тромбы тес-
но связаны с сосудистой стенкой и присутству-
ют более чем у 73 больных, особенно в ост-
рый период, сопровождаются массивной про-
лиферацией и экссудацией. По составу тромбы
соответствуют циркулирующим криоглобулинам.
К характерным признакам криоглобулинеми-
ческого ГН также относят утолщение и удвое-
ние БМК, более выраженное, чем при идио-
патическом МКГН (двойной контур является
следствием периферической интерпозиции мо-
ноцитов, что видно при ЭМ), наличие эндо-
капиллярной пролиферации, мононуклеарной
инфильтрации интерстиция и васкулит мелких
и средних почечных артерий. При криоглобули-
немическом ГН экстракапиллярная пролифера-
ция крайне редка. В части случаев (примерно в
10 %) выявляется картина более тяжелого ва-
рианта МКГН с зонами центролобулярного
склероза, который является постоянным фено-
меном.
При иммуногистохимическом исследовании,
как и при идиопатическом МКГН, могут об-
наруживаться гранулярные субэпителиальные
депозиты, содержащие СЗ совместно с IgG и
IgM, аналогичное свечение наблюдается и в
тромбах.
Кроме характерного криоглобулинемическо-
го МКГН, при СКГ могут встречаться и дру-
гие морфологические варианты ГН. Обнаружи-
вают умеренную очаговую пролиферацию ме-
20—2950
305
зангия без значительной моноцитарной ин-
фильтрации и альтерации капиллярной стенки.
Склероз у большинства больных СКГ может
быть довольно «мягким» и обратимым, что
подтверждается повторными почечными био-
псиями на протяжении многих лет от начала
почечного процесса. Нередко, даже в отсутствие
очевидных поражений клубочка, выявляют вас-
кулит мелких и средних артерий почки, кото-
рый характеризуется фибриноидным некрозом
артериальной стенки с периваскулярной моно-
цитарной инфильтрацией, на более поздних
стадиях — периваскулярным фиброзом; может
отмечаться фиброз интимы интерлобулярных
артерий [D’Amico G., 1998].
Клиника, течение. Почечные симптомы при
II типе СКГ обычно появляются через несколь-
ко лет после возникновения первых признаков
васкулита, но могут наблюдаться одновремен-
но с системными проявлениями и даже пред-
шествовать им («нефритические маски»). Так,
A.Tarantino и соавт. (1981) поражение почек в
дебюте болезни отметили у 13 из 44 больных
СКГ (29 %), у остальных больных почечные
симптомы развились в сроки от 2 до 447 мес
(в среднем через 77 мес).
Внепочечные симптомы СКГ, помимо по-
ражения печени, являющейся основным орга-
ном-мишенью при HCV-инфекции, могут
включать пурпуру (в том числе и в рамках три-
ады Мельтцера) иногда с язвенно-некротичес-
кими изменениями кожи, синдром Рейно
вплоть до развития концевых некрозов, пери-
ферическую симметричную сенсомоторную не-
вропатию, абдоминальные боли (как проявле-
ние васкулита ЖКТ), синдром Шегрена.
Поражение почек почти в 25 % случаев на-
чинается с развития остронефритического син-
дрома, проявляющегося гематурией (макрогема-
турией), выраженной протеинурией, артериаль-
ной гипертензией, азотемией, примерно у 5 %
больных осложняется олигурической острой
почечной недостаточностью (ОПН). Уже на этой
стадии заболевания обнаруживают типичную
морфологическую картину криоглобулинеми-
ческого МКГН с массивными внутрикапилляр-
ными тромбами, облитерирующими многие
капиллярные петли, и выраженную моноци-
тарную инфильтрацию. У части больных с ост-
ронефритическим синдромом клиническое
течение соответствует быстропрогрессирующему
ГН (БПГН), быстро нарастают азотемия, ане-
мия, отмечается, как правило, очень высокое
артериальное давление, прогноз неблагоприят-
ный.
У 18—25 % больных (по данным нашей кли-
ники, у 22 %) развивается нефротический син-
дром, при этом морфологическая картина не-
редко соответствует лобулярному МКГН без
306
явных признаков криоглобулинемического ГН.
У остальных больных (обычно при III типе
СКГ) отмечается менее тяжелое поражение
почек, проявляющееся изолированной проте-
инурией, микрогематурией, у части больных
умеренной почечной недостаточностью с отно-
сительно благоприятным прогнозом.
Особенностью всех форм поражения почек
в рамках СКГ является раннее развитие арте-
риальной гипертензии, ее частота оценивается от
50 % [Tarantino A. et al., 1981] до 80—90 % [Гор-
довская Н.Б. и др.,1997; D’Amico G., 1998]. Она
может иметь и тяжелое злокачественное тече-
ние, обычно при БПГН.
У больных СКГ даже в отсутствие клиничес-
ких проявлений поражения почек может раз-
виться ОПН. Предрасполагающими факторами
являются обезвоживание, воздействие холода,
влияние лекарств. Так, J.Barton и соавт. (1987)
описали развитие ОПН у 39-летней больной с
СКГ после внутривенного введения гамма-гло-
булина в связи с легочной инфекцией и гипо-
гаммаглобулинемией; через 5 дней после вве-
дения в почечном биоптате были обнаружены
гиалиновые тромбы в капиллярах клубочков,
некроз клубочков и другие проявления тяже-
лой криоглобулинемической нефропатии. В на-
блюдении P.Verroust и соавт. (1982) кратковре-
менные периоды анурии отмечены у 10 % боль-
ных СКГ.
Примерно у 20—25 % больных наблюдается
рецидивирующее течение ГН с эпизодами остро-
нефритического синдрома или НС, часто со-
впадающими с периодами обострения крио-
глобулинемического васкулита. У остальных боль-
ных нефрит протекает латентно в течение мно-
гих лет, ХПН развивается примерно у 10 %. По
результатам наших исследований, прогрессиро-
вание почечной недостаточности чаще отмеча-
лось у больных с нарастающей или сохраняю-
щейся высокой СКГ (выявлена прямая корре-
ляция между уровнем СКГ и величиной креа-
тининемии г = +0,468) и, напротив, у боль-
ных независимо от исходного уровня СКГ при
ее уменьшении (спонтанном или в результате
лечения) наблюдались клиническое улучшение,
снижение или нормализация уровня креатини-
на крови.
Диагноз. Имеет значение выявление в сыворот-
ке крови криоглобулинов, уровень которых мо-
жет колебаться у разных больных и у одного и
того же больного в разные периоды. Диагности-
ческим считается уровень криоглобулинов свы-
ше 100 мкг/мл, в нашем наблюдении у отдель-
ных больных они достигали 2000—4000 мкг/мл.
Определенное значение для диагноза имеет
выявление сниженного уровня ранних компо-
нентов комплемента, особенно С4 и в меньшей
степени СЗ, повышенный уровень РФ, опре-
деление маркеров HCV (антител к HCV и HCV-
РНК).
Дифференциальный диагноз следует проводить
с заболеваниями, при которых имеется соче-
тание поражения почек с кожной пурпурой, —
геморрагическим васкулитом Шенлейна — Ге-
ноха, вирусным гепатитом В, подострым инфек-
ционным эндокардитом (ПИЭ), системны-
ми васкулитами, В-клеточными лимфомами
и др. У пожилых людей необходимо исключать
макроглобулинемическую пурпуру Вальден-
стрема.
Геморрагический васкулит имеет, как пра-
вило, острое начало, наблюдается чаще в мо-
лодом возрасте до 20 лет, характерны мезан-
гиопролиферативные формы нефрита с отло-
жением IgA депозитов и фибриногена, вазо-
спастические реакции крайне редки. Вирусный
гепатит В отличается маркерами (HBsAF, НВе-
АГ, HBV-ДНК), редкостью МКГН, более ха-
рактерна мембранозная нефропатия. При ПИЭ,
протекающем с лихорадкой, анемией, лейко-
пенией, могут иметь значение признаки пора-
жения клапанного аппарата сердца, тромбоэм-
болические осложнения, бактериемия. Диффуз-
ный пролиферативный ГН часто характеризу-
ется картиной экстракапиллярного нефрита,
МКГН не имеет черт криоглобулинемического
ГН.
Прогноз. В последние годы прогноз изменился
к лучшему, что объясняется прогрессом в ле-
чении васкулитов и возникающих осложнений
[D’Amico G., 1998]. Так, если в работе P.Gorevic
и соавт. (1980), длительно наблюдавших 40 боль-
ных СКГ с поражением почек, продолжитель-
ность жизни в среднем составила 5,6 года (от
2 нед до 8,7 лет), то в более позднем наблюде-
нии A.Tarantino и соавт. (1986) среди 108 боль-
ных, прослеженных около 10 лет, «почечная»
смерть (перевод на регулярный гемодиализ)
отмечена только у 6 человек, а причиной смер-
ти 27 других умерших за этот период были си-
стемный васкулит, сердечно-сосудистые и це-
ребральные осложнения. Близкие результаты
получены G.D’Amico (1998), наблюдавшего 100
больных СКГ; смертность через 10 лет соста-
вила 30 % и существенно не отличалась от этого
показателя в группе больных без поражения
почек.
Неблагоприятными прогностическими фак-
торами у больных СКГ с поражением почек по
результатам многофакторного анализа, прове-
денного A.Tarantino и соавт. (1995), являют-
ся возраст старше 50 лет, пурпура, спленоме-
галия, уровень креатинина сыворотки крови
выше 1,5 мг%, снижение уровня СЗ ниже
54 мг%.
Лечение. В лечении СКГ используются кор-
тикостероиды (КС), цитостатики, плазмаферез
или криоаферез, чаще в комбинации. В острую
стадию болезни при наличии у больного ост-
ронефритического или НС и высокого содер-
жания криоглобулинов в сыворотке крови те-
рапию целесообразно начинать с проведения
криоафереза или плазмафереза (обычно в тече-
ние 2 нед по 3 сеанса в неделю) с целью ме-
ханического удаления избытка криобелков, ан-
тител, медиаторов воспаления и улучшения
микроциркуляции. Кроме того, удаление боль-
шого количества циркулирующих иммунных
комплексов способствует «растормаживанию»
блокированной мононуклеарно-фагоцитирую-
щей системы, что улучшает клиренс криогло-
булинов [Tavoni A. et al., 1995]. Одновременно
проводят активную иммунодепрессивную терапию
КС и цитостатиками. Чаще терапию начинают
с внутривенного введения преднизолона (ме-
тилпреднизолона) и/или циклофосфана в
сверхвысоких дозах (пульс-терапия). Вводят од-
нократно 800—1000 мг циклофосфана и/или
750—1000 мг преднизолона (метилпреднизоло-
на); КС вводят 3 дня подряд с последующим
переходом на прием КС внутрь в дозе 20—
30 мг/сут в течение 4—6 мес.
Для поддержания ремиссии некоторым боль-
ным в течение длительного времени (годы) на-
значают КС в дозе 10—5 мг/сут. В острую ста-
дию болезни возможна сочетанная терапия эти-
ми препаратами назначением только внутрь из
расчета циклофосфана в дозе 2—3 мг/кг в те-
чение 3—4 мес и КС в дозе 1—0,5 мг/кг. При
развитии ОПН или хронической почечной не-
достаточности проводят лечение гемодиализом.
При латентном варианте нефрита и умерен-
но выраженных признаках васкулита терапию
ограничивают гипоаллергенной диетой, при-
менением НПВП или низких доз КС (0,5—
0,3 мг/кг). По показаниям назначают антиги-
пертензивные препараты, ангиопротекторы,
дезагреганты.
Перспективным направлением представляет-
ся терапия противовирусными препаратами, в
частности а-интерфероном [Ferri С. et al., 1993;
Agnello V., 1995; Fukumoto S. et al., 1996, и др.].
К настоящему времени опубликованы резуль-
таты нескольких рандомизированных контроли-
руемых исследований об успешном влиянии а-
интерферона на течение васкулита и элимина-
цию маркеров вируса гепатита С из сыворотки
крови больных СКГ [Dammaco F. et al., 1994;
Misiani R. et al., 1994; D’Amico G., 1998], од-
нако во всех исследованиях обращает на себя
внимание частота рецидивов после прекраще-
ния противовирусной терапии. Влияние проти-
вовирусных препаратов на почечный процесс
не оценено, допускают благоприятное влияние
этой терапии в хроническую (неактивную) ста-
дию нефрита [D’Amico G., 1998].
20
307
10.8. Тромботические
микроангиопатии —
тромботическая
тромбоцитопеническая пурпура
и гемолитико-уремический
синдром*
Тромботическая тромбоцитопеническая пурпура
(ТТП) и гемолитико-уремический синдром
(ГУС) — два близких заболевания, в основе
которых лежит своеобразное повреждение мик-
рососудов, именуемое тромботической микро-
ангиопатией. До сих пор нет единого мнения о
том, являются ли ТТП и ГУС разными заболе-
ваниями или вариантами одной болезни.
Впервые клиническая картина ТТП была
описана в 1925 г. E.Moschowisz у 16-летней де-
вушки, страдающей лихорадкой, гемипарезом,
геморрагической пурпурой и внутрисосудистым
гемолизом с явлениями тромбоза мелких арте-
риол и капилляров. В 1955 г. C.Gasser с соавт.
сообщили о своем наблюдении 5 детей с симп-
томокомплексом Кумбсе — отрицательной ге-
молитической анемии, тромбоцитопении и
острой почечной недостаточности, который
они назвали гемолитико-уремическим синдро-
мом (ГУС).
В дальнейшем при разграничении ГУС и ТТП
стали исходить из представления о ГУС как за-
болевании детей с преимущественным вовле-
чением почек, а о ТТП — как заболевании
главным образом взрослых людей с поражени-
ем нервной системы. Однако по мере накопле-
ния числа наблюдений оказалось, что ГУС раз-
вивается и у взрослых, а ТТП может возникать
у детей, при этом у взрослых больных с ГУС
подобно больным с ТТП отмечаются разной
степени неврологические проявления, а у боль-
ных ТТП наряду с поражением нервной систе-
мы в процесс вовлекаются и почки, что стира-
ет грани между этими заболеваниями и подчас
не позволяет четко дифференцировать их. Неко-
торые исследователи, объединяя ТТП и ГУС,
объясняют разницу в их клинических проявле-
ниях возрастными различиями в механизмах
ингибиции агрегации тромбоцитов [Wigging R.C.
et al., 1994].
В 1952 г. W.S.Symmers применил термин
«тромботическая микроангиопатия» для опре-
деления повреждения микрососудов при ТТП.
Основными чертами этого типа повреждения
является утолщение сосудистой стенки (в ос-
новном капилляров и артериол) с отеком и
отслойкой эндотелиальных клеток от базальной
мембраны, накоплением ворсинчатого матери-
* Раздел написан Л.В.Козловской.
308
ала в субэндотелии. Расширение субэндотели-
ального пространства и образование тромбоци-
тарных тромбов в просвете ведет к частичной
или полной окклюзии сосудов, механическому
разрушению эритроцитов при прохождении
крови через суженное сосудистое пространство
с развитием Кумбс-отрицательной микроангио-
патической гемолитической анемии.
Сходные сосудистые изменения обнаружи-
вают в почках и при ГУС, что дало основание
ряду авторов [Rossi Е.С. et al., 1980; Remuzzi G.,
1987] объединять ГУС и ТТП под общим назва-
нием «тромботическая микроангиопатия». Кон-
цепция связи ТТП и ГУС подкрепляется также
наблюдениями обеих форм у членов одной се-
мьи [Kaplan B.S., Kaplan Р., 1992] и у лиц, ле-
ченных циклоспорином [Dzik W.H. et al., 1987].
Этиология, патогенез. Тромботическая тром-
боцитопеническая пурпура развивается главным
образом у взрослых. У 40 % больных с острой
формой ТТП началу заболевания предшеству-
ет продрома, напоминающая острую вирусную
инфекцию; возможен дебют с псевдомембра-
нозного колита, обусловленного веротоксинп-
родуцирующей E.coli. ТТП хронического тече-
ния ассоциируется с системными заболевани-
ями — СКВ (с частотой 0,5—23 %), синдромом
Шегрена, ревматоидным артритом (РА).
Гемолитико-уремический синдром неодно-
роден по этиологии. Выделяют ГУС, связанный
с инфекцией (инфекционный ГУС) и не свя-
занный с инфекцией, в том числе идиопати-
ческий, когда не удается установить какой-либо
предрасполагающий фактор [Neild G.H., 1998;
Remuzzi G., Ruggenenti P., 1995].
Среди инфекционных форм ГУС большин-
ство составляют формы с кишечной продро-
мой, так называемый типичный, или ассоции-
рованный с диареей, ГУС (ГУС-Д+). Наиболее
значимыми этиологическими агентами при
ГУС-Д+ являются Е. coli, продуцирующая веро-
токсины, чаще ее серотип О157:Н7, и Shigella
dysenteriae-I, вырабатывающая эндотоксины
(Shiga-токсин). ГУС-Д+ развивается преимуще-
ственно у маленьких детей в возрасте до 2 лет,
может иметь характер эпидемий; спорадический
ГУС-Д+ все чаще диагностируется и у взрослых.
Так называемый атипичный, или неассоции-
рованный с диареей, ГУС (ГУС-ДД — наиболее
распространенная форма заболевания у взрос-
лых людей, но наблюдается и у детей разного
возраста. ГУС-Д- может иметь также инфекци-
онную причину, описаны спорадические слу-
чаи возникновения ГУС после перенесенной
вирусной инфекции верхних дыхательных пу-
тей, пневмококковой инфекции, продуцирую-
щей нейраминидазу, вслед за инфекцией мо-
чевых путей, вызванной E.coli О103:Н2, в свя-
зи с ВИЧ-инфекцией. К группе спорадическо-
го ГУС-Д относятся идиопатический ГУС, се-
мейные формы, а также вторичные по отно-
шению к другим заболеваниям формы. Разви-
тие ГУС возможно у женщин во время беремен-
ности, после родов, длительного приема про-
тивозачаточных средств, у реципиентов алло-
трансплантата костного мозга, печени, почек,
сердца при реакции отторжения, после приема
некоторых лекарств (циклоспорин А, митоми-
цин, винбластин, цисплатин). Возникновение
синдрома, сходного с ГУС по клиническим и
морфологическим признакам, может осложнять
течение злокачественной гипертензии, злока-
чественных новообразований, системной крас-
ной волчанки, системной склеродермии.
В патогенезе ГУС и ТТП центральную роль
отводят повреждению эндотелия сосудов в орга-
нах-мишенях [Neild G.H., 1998]. В зоне повреж-
дения эндотелия происходят активация и адге-
зия тромбоцитов с последующим нарушением
микроциркуляции. Однако начальные механиз-
мы повреждения эндотелия остаются во мно-
гом неясными, как и вопрос о первичном или
вторичном характере вовлечения тромбоцитов
и причины преимущественного вовлечения
почек. В качестве пускового фактора при ГУС
изучается роль веротоксинов и нейраминидазы
пневмококка.
Установлено, что веротоксин (ВТ) специфи-
чески связывается своими В-субгруппами с гли-
колипидными рецепторами на поверхности
эндотелиальных клеток и оказывает цитотокси-
ческий эффект [Moake J.L., 1994], причем ци-
тотоксичность ВТ более выражена в отношении
почечного эндотелия, чем, например, эндоте-
лия пупочной вены [Obrig Т.С. et al., 1993].
Свойством экспрессировать большое количество
рецепторов к ВТ in vitro, кроме эндотелия,
обладают мезангиальные клетки почек челове-
ка [Mahan J.D. et al., 1994], а также моноциты
[Van Setten Р.А. et al., 1996]. Под влиянием ВТ
наблюдается дозозависимый синтез моноцитами
цитокинов, в том числе ИЛ-1/1, ИЛ-6, ИЛ-8 и
ФНО. Более того, в эксперименте на трансген-
ных мышах было установлено, что индуциро-
ванный ВТ синтез ФНО происходит в почках,
но не в других тканях [Harel Y. et al., 1993].
Одним из факторов повреждения как эндо-
телиальных клеток, так и эритроцитов счита-
ют усиление перекисного окисления липидов
клеточных мембран под влиянием свободных
кислородных радикалов, возможно, выделяемых
из нейтрофилов [Turi S. et al., 1994].
Определенную роль в механизме поврежде-
ния эндотелиальных клеток при тромботичес-
ких микроангиопатиях отводят сывороточным
аутоантителам, распознающим эндотелиальные
антигены, в норме скрытые и обнажающиеся
в результате мембранных нарушений, вызван-
ных нейраминидазой [Koenig D.W., 1993].
В плазме крови больных ТТП описан фактор,
оказывающий прямое токсическое действие на
эндотелиальные клетки в культуре [Burns Е.,
Zucker-Franklin D., 1982]. Комплементфиксиру-
ющие антитела классов IgG и IgM, лизирую-
щие человеческие умбиликальные клетки в
культуре, обнаружены и в сыворотке крови
детей с острой формой ГУС [Leung D.V. et al.,
1988].
Маркером повреждения эндотелия при обе-
их формах тромботической микроангиопатии
является уровень в крови фактора Виллебран-
да и других связанных с эндотелием факторов,
в том числе тканевого активатора плазминоге-
на, ингибитора активатора плазминогена I
[Wada Н. et al., 1993], которые в норме обеспе-
чивают антитромботические свойства сосудис-
той стенки.
При ТТП и ГУС в результате повреждения или
активации эндотелиальных клеток изменены меха-
низмы, регулирующие синтез и процессинг факто-
ра Виллебранда, с появлением в циркуляции не-
обычно больших мультимеров фактора. Полагают, что
сверхкрупные мультимеры фактора Виллебранда
более эффективно, чем обычные, взаимодействуют
с гликопротеиновыми рецепторами на клеточной по-
верхности активированных тромбоцитов, вызывая их
адгезию и агрегацию [Moake J.L. et al., 1994]. Муль-
тимеры большой молекулярной массы определяют-
ся лишь короткий срок (в начальной фазе обостре-
ния заболевания), затем исчезают параллельно со
снижением числа тромбоцитов (потребляются) и
появляются вновь в период ремиссии. Кроме того, у
больных в острую фазу ГУС и ТТП отмечено сни-
жение в плазме крови активности тканевого акти-
ватора плазминогена [Wada Н. et al., 1993], обуслов-
ленное повышением синтеза эндотелием ингибито-
ра активатора плазминогена (ПАИ-1) [Bergstein J.M.
et al., 1993].
На протяжении ряда лет обсуждается роль
при ГУС и ТТП нарушения продукции эндоте-
лиальными клетками, в том числе почечными,
простациклина (ПП2), одного из вазоактивных
медиаторов с сосудорасширяющими и антиаг-
регантными свойствами [Taylor С.М., Lote С.J.,
1993], что связывают с недостаточностью в
плазме простациклинстимулирующего фактора.
При семейной форме ГУС низкий уровень про-
стациклинстимулирующего фактора обнаружи-
вали у представителей разных поколений, что
свидетельствует о возможном наследственном
дефекте метаболизма простациклина. Имеется
свидетельство того, что в острую фазу ГУС ос-
лаблены синтез и освобождение из эндотели-
альных клеток другого вазодилататора — NO
[Siegler R.J. et aL, 1991], в то же время значи-
тельно повышена продукция эндотелием вазо-
констрикторного пептида — эндотелина [Kohan
309
D.E. et al., 1993]. Роль иммунных механизмов в
патогенезе ТТП и ГУС подвергается сомнению.
В то же время при спорадическом ГУС-Д~ и
семейных формах часто обнаруживают низкий
уровень СЗ компонента комплемента.
Установлено, что СЗ-типокомплементемия при
семейном ГУС является следствием генетического
дефекта фактора Н — основного регуляторного белка
альтернативного пути активации комплемента
[Pichette V. et al., 1994]. Описаны точковые мутации
в гене, кодирующем фактор Н при семейном ГУС,
которыми объясняют структурный и функциональ-
ный полиморфизм фактора Н. Допускают, что ге-
нетические нарушения в комплементарной системе
могут быть одним из предрасполагающих к развитию
ГУС факторов и при приобретенных формах, в том
числе связанном с инфекцией ГУС-Д+ [Noris М.,
Remuzzi G., 1998].
Поражение эндотелия ведет к отложению в
сосудистой стенке тромбоцитов. Об активации
и повышенной агрегации тромбоцитов у боль-
ных ГУС и ТТП свидетельствует увеличение
концентрации в плазме крови -тромбоглобу-
лина, тромбоцитарного фактора-4, укорочение
продолжительности жизни тромбоцитов. При
ГУС-Д+ и ТТП в фазу обострения выявлен цир-
кулирующий плазменный фактор, усиливаю-
щий агрегацию тромбоцитов как здоровых лиц,
так и больных [Monnens L. et al., 1985]. Этот
агрегирующий протеин, по всей вероятности,
идентичен описанному выше мультимерному
фактору Виллебранда. Агрегации тромбоцитов
могут способствовать снижение плазменного
уровня простациклина и а-токоферола и по-
вышение уровня тромбоксана.
Следствием активации и потребления тром-
боцитов в местах повреждения эндотелия явля-
ется развитие тромбоцитопении. Наряду с тром-
боцитами в микроциркуляции откладывается
фибрин, однако коагулопатия потребления и
ДВС-синдром редки.
Прохождение крови через измененный су-
женный сосуд вызывает повреждение, фрагмен-
тацию эритроцитов и внутрисосудистый гемо-
лиз. Кроме механического повреждения, в раз-
витии гемолиза участвуют свободные кислород-
ные радикалы, которые вызывают липидную
пероксидацию эритроцитарной мембраны, в
результате чего эритроциты либо гемолизиру-
ются, либо становятся неспособными к дефор-
мации и легко разрушаются в узких местах со-
судистого русла.
Морфология. Для тромботических микроан-
гиопатий характерно окклюзионное поражение
сосудов (небольших артерий, артериол, капил-
ляров), не сопровождающееся периваскулярной
клеточной инфильтрацией и другими призна-
ками васкулита.
При ГУС наиболее часто поражаются почки,
при ТТП спектр поражения более широк: серд-
це, мозг, почки, поджелудочная железа, надпочеч-
ники.
В почках при ТТП поражены преимуществен-
но артериолы, менее часто — интерлобулярные
артерии. В пораженных сосудах обнаруживают
тромбоцитарные и фибриновые тромбы, закры-
вающие просвет, выраженную пролиферацию
интимы, расширение субэндотелиального про-
странства.
В клубочках отмечают утолщение и удвоение
БМК; тромбы в просвете капилляров находят
реже, чем в более крупных сосудах. Ввиду во-
влечения в процесс артериол клубочки ишеми-
зированы, капиллярные петли утолщены и
сморщены, тубулоитерстициальные изменения
неспецифичны. При электронной микроскопии
в субэндотелиальном пространстве сосудов
выявляют волокнистый мелкогранулярный ма-
териал, состоящий из фрагментов тромбоцитов,
эритроцитов, клеточного детрита и фибрина.
При иммунофлюоресцентном исследовании
отложения фибрина отмечают в тромбах, субэн-
дотелиальном пространстве, стенке артериол и
малых сосудов, могут выявляться депозиты IgG
в артериях и артериолах, иногда вдоль БМК и
в мезангии.
При ГУС условно выделяют следующие типы
поражения почек:
1) кортикальный некроз клубочков и ка-
нальцев часто с включениями гемосидерина
(макроскопически кора имеет красно-пестрый
вид) и явлениями тромботической микроангио-
патии в пограничных зонах; поражение наблю-
дается преимущественно у детей;
2) гломерулярная тромботическая микроан-
гиопатия с изменениями мезангия. Типичные
поражения клубочков в ранней фазе болезни
включают утолщение и двухконтурность капил-
лярной стенки, значительный отек эндотели-
альных клеток, сладж эритроцитов, отложение
тромбоцитов и фибрина в просвете капилляров;
поражение более крупных сосудов нетипично.
Через несколько месяцев от начала заболева-
ния явления микроангиопатии исчезают в боль-
шинстве клубочков (обратимость поражения),
приблизительно 20 % клубочков оказываются
склерозированными — этот тип поражения
наблюдается преимущественно при эпидемичес-
кой форме ГУС у детей младше 2 лет. У детей
более старшего возраста и у взрослых измене-
ния клубочков более гетерогенны. В ранней фазе
они могут напоминать описанные выше у де-
тей младшего возраста, в более поздние сроки
течения болезни превалируют ишемические
изменения клубочков и признаки мезангиоли-
зиса, о чем свидетельствует увеличение гломе-
310
рулярных капиллярных петель, выпячивание и
расширение отдельных сегментов с переполне-
нием их просвета преципитатами белков, эрит-
роцитов, тромбоцитарными тромбами и фиб-
рином, в последующем формируется склероз.
Отмечаются и тубулоинтерстициальные измене-
ния — очаги некроза в проксимальном отделе
канальцевого эпителия, эозинофильные и эрит-
роцитарные цилиндры в просвете дистальных
канальцев;
3) артериальная тромботическая микроанги-
опатия с поражением в основном лобулярных и
арочных артерий без изменения мезангия. Этот
тип поражения выявляется при спорадической
форме ГУС, чаще у взрослых. Ранние изменения
характеризуются отеком, некрозом и инфильтра-
цией стенки, наблюдается аневризматическое
расширение артериол. Позднее преобладает эндо-
телиально-клеточная пролиферация с концент-
рическими образованиями в виде луковицы, уд-
воение внутренней эластической пластинки, что
в конечном итоге завершается фиброзом, суже-
нием или полной окклюзией сосуда.
При иммунофлюоресцентном исследовании
практически постоянно обнаруживают диффуз-
ные или очаговые отложения фибрина вдоль
стенки капилляров и в мезангии, описывают
субэндотелиальные депозиты IgM, СЗ и С, (не
всегда даже в раннюю стадию болезни), край-
не редко — депозиты IgG и IgA.
Клиника. Тромботическая тромбоцитопеничес-
кая пурпура характеризуется микроангиопатичес-
кой гемолитической анемией, тромбоцитопени-
ей, неврологическими нарушениями и вовлече-
нием почек. ТТП развивается чаще в молодом и
среднем возрасте (от 10 до 40 лет с пиком за-
болеваемости в третьей декаде жизни); среди
заболевших преобладают женщины (соотноше-
ние женщины:мужчины 3:1). Начало болезни в
большинстве случаев острое, иногда этому пред-
шествуют респираторные или другие инфекци-
онные заболевания, хирургические вмешатель-
ства, лекарственная непереносимость (пеницил-
лина, сульфаниламидов, препаратов йода). Воз-
можно развитие ТТП на фоне других заболева-
ний (например, СКВ). Первыми признаками
обычно являются слабость, головная боль, го-
ловокружение, тошнота, рвота, боли в животе.
Вскоре развиваются тромбоцитопения с гемор-
рагическим синдромом (петехии, экхимозы,
кровоизлияния в сетчатку глаза, желудочно-ки-
шечные, носовые, маточные кровотечения) и
гемолитическая анемия (бледность, небольшая
желтушность кожных покровов), затем присое-
диняются неврологические расстройства — су-
дороги, параличи черепных нервов, гемиплегия,
нарушения речи, иногда кома, психотическое
поведение, зрительные галлюцинации, бред,
ступор, спутанное сознание. Лихорадка — прак-
тически постоянный признак болезни. Ишемия
миокарда может быть причиной появления арит-
мий (тахикардии, ритма галопа) или сердечной
недостаточности. Поражение легких наблюдает-
ся редко, хотя описаны случаи развития дыха-
тельной недостаточности. Отмечаются также
желтуха (вследствие гемолиза или поражения
печени), явления панкреатита, гепатоспленоме-
галия, лимфаденопатия.
В периферической крови отмечают нейтро-
фильный лейкоцитоз (часто со сдвигом форму-
лы влево), тромбоцитопению (30—100 • 109/л,
иногда ниже 29 • Ю9/л), гемолитическую ане-
мию с повышенным ретикулоцитозом и отри-
цательной реакцией Кумбса, а также измене-
нием формы эритроцитов (фрагментированные
эритроциты — шистоциты) и так называемые
шлемовидные эритроциты. Содержание билиру-
бина нерезко повышено, уровень гаптоглоби-
на сыворотки снижен. Время кровотечения уд-
линено. Содержание ПДФ умеренно повышено,
другие отчетливые лабораторные признаки
внутрисосудистой коагуляции выявляются редко.
Поражение почек наблюдается у подавляюще-
го большинства больных, проявляется протеи-
нурией, микро- и макрогематурией, цилиндру-
рией, азотемией (40—80 %), редко гипертен-
зией. Иногда развивается ОПН с анурией. Те-
чение болезни волнообразное, обычно смерть
наступает от почечной недостаточности в тече-
ние нескольких недель или месяцев. Описаны
молниеносные, а также хронические формы.
Хронические формы обычно развиваются в
ассоциации с системными заболеваниями, кли-
нические симптомы и исходы различны и за-
висят от основного заболевания.
Прогноз ТТП изменился за последние годы
в результате активных методов терапии. Так, по
данным L.Hill и W.Cooper (1968), из описан-
ных в литературе с 1929 по 1968 г. более чем
300 больных выздоровели только 20 (7 %), к
1981 г. выживаемость достигла 46 % (RL.Ridolfi,
W.Bell), а к 1988 г. она составила около 70 %
(C.L.Knupp), в 1991 и 1995 гг. - 75 % (W.R.Bell
с соавт., P.J.Conlon с соавт.).
Гемолитико-уремический синдром включа-
ет триаду признаков: микроангиопатическую ге-
молитическую анемию, тромбоцитопению и
ОПН. Типичный (эпидемический) ГУС — наибо-
лее частая форма у маленьких детей до 2 лет,
в равной мере у мальчиков и девочек, но не
исключается и в других возрастных группах. Во
всех странах отмечаются сезонные вспышки
заболевания в теплые месяцы года.
Началу заболевания обычно предшествуют
эпизоды тошноты, рвоты и часто кровавого
поноса, затем следует светлый период разной
продолжительности. Иногда клинические про-
явления в дебюте могут имитировать острые
311
хирургические состояния — перитонит, перфо-
рацию, острый аппендицит, кишечную непро-
ходимость, язвенный колит. Предвестниками
основных симптомов болезни служат внезапная
слабость, бледность кожных покровов или ге-
моррагическая сыпь, нередко гематурия. Умень-
шается объем мочи, появляется олигурия
вплоть до анурии. Анурическая форма ОПН
развивается у большинства больных. Быстро
присоединяется микроангиопатическая гемоли-
тическая анемия, но, несмотря на гемолиз,
желтуха развивается редко. У 50 % больных
наблюдается артериальная гипертензия с раз-
витием острой сердечной недостаточности.
Пациенты могут быть обезвожены из-за по-
тери жидкости через желудочно-кишечный
тракт, но чаще отечны; отеки усиливаются при
неадекватном (избыточном) введении жидко-
сти. Как и при ТТП, у больных могут наблю-
даться лихорадка, кожная геморрагическая пур-
пура, кровотечения, сплено-, гепатомегалия,
неврологические нарушения, усилению которых
способствуют уремия и гипонатриемия.
Описаны и хорошо документированные на-
блюдения поражения почек в рамках ГУС-Д+
с умеренным снижением почечных функций и
преходящими изменениями в моче. Возможно,
что случаи с подобным течением встречаются
чаще, чем принято считать, так как они плохо
распознаются и не учитываются.
Лабораторные признаки аналогичны наблю-
даемым при ТТП. Эритроциты неправильной
формы, шлемовидные и фрагментированные.
Обычно выявляется тромбоцитопения, чаще не
очень резкая; описаны случаи, когда она отсут-
ствует. Уровень фибриногена может быть сни-
жен, содержание ПДФ повышено.
Прогноз лучше, чем при спорадическом ГУС
и ТТП. Смертность во время острой фазы со-
ставляет в настоящее время 6—9 % по сравне-
нию с 40 % в 1966 г. [Remuzzi G. et al., 1994].
Полное выздоровление с восстановлением по-
чечных функций наступает через 2—3 нед. Про-
должительная олиго- или анурия или персис-
тирующая гипертензия — признаки неблаго-
приятного прогноза с переходом в хроничес-
кую почечную недостаточность.
Атипичный (спорадический) ГУС развивается
у более старших детей и у взрослых, чаще на-
чинается неостро с общих симптомов — сла-
бости, апатии, иногда кожной пурпуры и же-
лудочно-кишечных расстройств (однако крова-
вый понос нехарактерен). Постоянный при-
знак — вовлечение почек с развитием ОПН,
которая приблизительно у половины пациен-
тов требует проведения гемодиализа в острую
фазу болезни. Исход в хроническую почечную
недостаточность наблюдается нередко. Бывают
выражены нарушения центральной нервной си-
312
стемы (от симптомов раздражительности и бес-
покойства до сонливости и спутанности созна-
ния); при наступлении ремиссии неврологичес-
кие проявления стихают, но остаточные явле-
ния могут сохраняться долго.
У взрослых больных клиническая картина
ГУС по частоте и разнообразию неврологичес-
ких симптомов напоминает ТТП, клинически
разграничить эти две формы не всегда удается.
Поэтому в публикациях последних лет их час-
то рассматривают вместе, объединяя под тер-
мином ТТП/ГУС.
A.Schieppati с соавт. (1992) проанализирова-
ли долгосрочный прогноз у 43 взрослых боль-
ных с диагнозом ГУС из 13 нефрологических
центров Италии: 70 % больных нуждались в
гемодиализе в острой фазе болезни, 16 % —
умерли через год от начала болезни, у 20 %
больных отмечено полное восстановление по-
чечной функции, у 32 % развилась артериаль-
ная гипертензия и/или почечная недостаточ-
ность и 26 % больных оставались на регуляр-
ном гемодиализе. Факторами риска плохого
долгосрочного прогноза были старший возраст
и повышение уровня сывороточного креатини-
на в дебюте болезни.
В то же время P.J.Conlon и соавт. (1995),
располагая 68 собственными наблюдениями
ТТП/ТУС, не отметили влияния на прогноз
возраста, пола больных и каких-либо биохими-
ческих показателей, в том числе уровня креа-
тинина в начале болезни.
Лечение. Успех терапии во многом зависит от
ее своевременности. В первую очередь проводят
мероприятия, направленные на ликвидацию
ОПН, коррекцию электролитного и водного
дисбаланса, гематологических нарушений, ар-
териальной гипертензии. При гиповолемии
адекватное восполнение объема циркулирую-
щей крови кристаллоидными растворами может
привести к восстановлению диуреза без гемо-
диализа. Но часто для лечения ОПН приходит-
ся применять гемодиализ и перитонеальный
диализ. При контроле за артериальной гипер-
тензией препаратами выбора являются ингиби-
торы ангиотензинпревращающего фермента.
Наличие выраженной анемии и тромбоцитопе-
нии требует введения эритроцитной и тромбо-
цитной массы, допускается переливание цель-
ной крови (медленно из-за риска острой сер-
дечной недостаточности).
В настоящее время считают, что при эпиде-
мическом типичном ГУС-Д+ у детей (с преиму-
щественно гломерулярным типом поражения
почек) какого-либо специфического (патогене-
тического) лечения не требуется ввиду суще-
ствующей высокой вероятности спонтанных
ремиссии. Так, в многоцентровом контролиру-
емом исследовании [Rizzoni G. et al., 1986] не
отмечено значимого положительного влияния
терапии плазмой на показатель смертности в
остром периоде и на долгосрочный прогноз
детей с ГУС (у всех при биопсии почек отме-
чен гломерулярный тип поражения).
При атипичном ГУС-Д" и ТТП у взрослых
из-за серьезности и непредсказуемости прогноза
требуется ранняя активная терапия. Опыт пос-
ледних 20 лет позволяет считать, что основным
методом лечения являются вливания свежезамо-
роженной плазмы и плазмаферез [Remuzzi G. et
al., 1994; Neild G.H., 1998]. Эффект свежезамо-
роженной плазмы связывают с возмещением
факторов, которые регулируют процессинг
сверхкрупных мультимеров фактора Виллебран-
да, стимулирующих активность простациклина
и оказывающих антиагрегантное и нейтрализу-
ющее антитела действие. Объем вводимой плаз-
мы должен быть достаточным (в первые сутки,
если позволяет функциональное состояние сер-
дечно-сосудистой системы и почек, — из рас-
чета 30 мл/кг, затем ежедневно 15—20 мл/кг,
но не менее 1 л в день), вливания проводят
до тех пор, пока не нормализуется число тром-
боцитов, не прекратится гемолиз и не умень-
шатся неврологические нарушения. В лечении
ТТП более предпочтительным считают плазма-
ферез с удалением 2—3 л плазмы и обменом
ее на свежезамороженную донорскую плазму
[Rock G.A. et al., 1991]. Замещение удаленной
плазмы солевыми растворами и альбумином
эффекта не оказывает. Лучшие результаты ме-
тода плазмообмена объясняют тем, что при
нем, кроме восполнения недостающих факто-
ров, удаляются потенциально токсичные для
сосудистого эндотелия компоненты, включая
антиэндотелиальные антитела, сверхкрупные
молекулы фактора Виллебранда, ингибиторы
фибринолиза.
Благодаря активной терапии плазмой улуч-
шились показатели не только общей выживае-
мости больных ТТП/ГУС, но и «почечной»
выживаемости. Так, в наблюдении P.J.Conlon с
соавт. (1995) среди леченных плазмаферезом 68
взрослых больных ТТП/ГУС (30 имели изна-
чально повышенный уровень креатинина) ге-
модиализ потребовался только 11 (16 %), из них
у 5 функция почек восстановилась (у 3 полно-
стью и у 2 частично), 4 человека умерли и двое
остались на регулярном гемодиализе. В этом
неконтролируемом ретроспективном исследова-
нии не отмечено разницы в выживаемости или
потребности в гемодиализе между больными,
леченными лишь плазмаферезами, и больны-
ми, у которых применяли также другие мето-
ды лечения — глюкокортикоиды, антиагреган-
ты, винкристин, спленэктомия.
Относительно целесообразности терапии
ТТП/ГУС глюкокортикоидами (ГК) единого
мнения нет. Монотерапия ГК малоэффективна,
чаще им отводят дополнительную роль в инги-
биции антиэндотелиальных антител и других
аутоантител, участвующих в повреждении со-
судистого эндотелия и адгезии тромбоцитов
[Bell W.R. et al., 1991], — ГК назначают в вы-
соких дозах (60 мг/сут и более) одновремен-
но с проведением плазмафереза. Имеются со-
общения о положительных результатах длитель-
ного лечения отдельных больных с рецидиви-
рующим течением ТТП комбинацией ГК и аза-
тиоприна (в дозе 100 мк/сут) [Moake J.L. et al.,
1985].
Имеются данные об успешном лечении ТТП со-
четанием плазмафереза и винкристина. Так,
M.L.Sennett, М.Е.Conrad (1986) наблюдали быстрый
эффект уже после первого сеанса плазмафереза с
последующим внутривенным введением 2 мг винк-
ристина.
Делались попытки лечения ТТП внутривенными
вливаниями иммуноглобулинов с целью ингибиции
агглютинирующих тромбоциты факторов плазмы, но
результаты противоречивы [Viero Р. et al., 1986; Chin D.
et al., 1987]. В проведенном рандомизированном кон-
тролируемом исследовании у больных атипичным ГУС
эффективность метода не подтвердилась [Sheth K.J. et
al., 1990].
При рефрактерных формах ТТП отмечен эффект
спленэктомии с развитием длительной ремиссии;
так, по данным D.P.Raniele и соавт. (1991), ремис-
сия была достигнута после спленэктомии у 15 (79 %)
из 19 больных с рецидивом ТТП. Из-за частых пос-
леоперационных осложнений спленэктомию реко-
мендуют только при отсутствии эффекта от других
видов терапии.
Эффективность терапии антикоагулянтами пря-
мого и непрямого действия, в частности гепарином,
в контролируемых исследованиях не подтвердилась
[Fong J., 1980], кроме того, она опасна геморраги-
ческими осложнениями.
Оказалось безуспешным и лечение ГУС тромбо-
литическими препаратами — стрептокиназой, уро-
киназой [Loirat С. et al., 1982]. Недостаточно эффек-
тивны и антитромбоцитарные препараты типа ди-
пиридамола, но они потенцируют активность про-
стациклина и могут применяться при ГУС и ТТП в
дозе 400—600 мг/сут, в том числе в комбинации с
инъекциями простациклина.
Лечение внутривенными вливаниями проста-
циклина еще не окончательно оценено (конт-
ролируемых исследований нет), оно оказалось
успешным лишь у отдельных пациентов с ТТП/
ГУС [Payton C.D. et al., 1985; Guelpa G. et al.,
1986]. Однако, по мнению G.H.Neild (1998),
неудачи лечения связаны с применением его на
поздних стадиях болезни. При раннем назначе-
нии простациклин может вызвать ингибицию
тромбоцитарно-эндотелиальных взаимоотноше-
ний и способствовать усилению диуреза. Инфу-
зии простациклина начинают с дозы 2,5 мг/кг
в 1 мин, постепенно повышая ее до 5 мг/кг и
313
более при хорошей переносимости без разви-
тия побочных явлений — гипертензии и кишеч-
ного дискомфорта.
В тяжелых случаях ГУС/ТТП, сопровождаю-
щихся комой и рефрактерной к лечению арте-
риальной гипертензией, улучшение может на-
ступить после двусторонней нефрэктомии
[Remuzzi G. et al., 1996].
Имеются данные, что у детей с ГУС ле-
чение витамином Е (внеклеточный «убор-
щик» свободных кислородных радикалов) в
дозе 1000 мг/м2 в сутки в течение по крайней
мере 1 нед приводит к улучшению прогноза
[Powell Н. et al., 1984].
Описаны случаи успешной трансплантации
почки у детей и взрослых больных с ГУС.
D.Hebert и соавт. (1986) указали на высокую
частоту возврата ГУС после трансплантации, в
его наблюдении у 5 из 11 детей развились мик-
роангиопатические изменения в транспланти-
рованной почке. Однако в других наблюдениях
[Pirson Y. et al., 1986; Gagnadous M.F. et al., 1989]
это не подтвердилось. Тем не менее, по заклю-
чению этих авторов, у больных с ГУС даже при
отсутствии рецидива болезни потеря трансплан-
тата (вследствие реакции отторжения и других
причин) наблюдается чаще, чем в общей по-
пуляции больных, подвергшихся транспланта-
ции.
Таким образом, на настоящем этапе лучшим
методом лечения тромботических микроангио-
патий являются обменные переливания свеже-
замороженной плазмы; другие методы (предни-
золон, цитостатики, антиагреганты, спленэк-
томия) применяют по показаниям как допол-
нительные. Новые методы находятся в процес-
се клинического испытания.
10.9. Синдром Гудпасчера*
В 1919 г. W. Goodpasture впервые описал особую
болезнь, проявляющуюся тяжелым поражени-
ем почек по типу быстропрогрессирующего
нефрита и легких, так называемый легочно-
почечный синдром. Вначале термином «синдром
Гудпасчера» обозначали все случаи легочно-
почечного синдрома с некротизирующим гло-
мерулонефритом, сочетающимся с легочным
кровотечением. С появлением возможности бо-
лее тщательно изучить характер поражения
почек, в частности с помощью иммунофлюо-
ресцентного метода, этот термин стал приме-
няться только в тех случаях, когда легочно-
почечный синдром вызывается антителами к
БМ клубочков почки (анти-БМК-антитела), так
как только в этих условиях благодаря перекре-
* Раздел написан Н.А.Мухиным.
314
стной реакции анти-БМК почек и антигена БМ
легочных альвеол, развивается содружественное
поражение почек и легких. Данная патогенети-
ческая особенность вместе с обнаруживаемым
методом иммунофлюоресценции линейным
характером отложения иммунных депозитов
считается патогномоничным признаком синд-
рома Гудпасчера, хотя есть и подвергающиеся
сомнению описания гранулярного типа отло-
жений иммуноглобулина, в частности IgM, что
ранее считалось маловероятным.
На основании такого патогенетического ме-
ханизма можно выделить из всей группы боль-
ных нефритом с легочными кровотечениями
истинный синдром Гудпасчера, что составляет
примерно 50 % из них, остальные наблюдения
относятся к системным васкулитам, в том числе
к геморрагическому васкулиту, СКВ, изредка -
криоглобулинемии. Это разделение имеет важ-
ное практическое значение, хотя касается срав-
нительно небольшой группы больных. Во-пер-
вых, заболевания, вызванные антителами к
БМК почек, всегда имеют очень тяжелый про-
гноз, представляют большую опасность для
жизни уже в первые дни возникновения, ког-
да функция почек нередко снижается молние-
носно, что требует неотложного лечения. Во-
вторых, именно при синдроме Гудпасчера в
отличие от других вариантов патологии благо-
даря четкому пониманию антительного меха-
низма нефрита возможна такая же четкая его
диагностика путем обнаружения и количествен-
ного определения циркулирующих анти-БМК-
антител, что позволяет представить связь меж-
ду сывороточными антителами и связанными с
ними поражениями, разрабатывать рациональ-
ную терапию.
Таким образом, в рамках легочно-почечно-
го поражения синдром Гудпасчера является
совершенно самостоятельным, отграниченным
от других подобных заболеваний состоянием.
В качестве причины заболевания называют
инфекции, в частности вирусную (например,
вирус гриппа А2), что отмечалось и в первом
описании W. Goodpasture, касавшегося 18-лет-
него юноши, заболевшего вслед за перенесен-
ной инфлюэнцей. Считается также, что болезнь
может быть спровоцирована действием паров
бензина, лаков, некоторыми лекарствами (D-
пеницилламин). Хотя окончательно этиология
синдрома Гудпасчера неясна, возможно, самые
различные факторы внешней среды вызывают
образование анти-БМК-антител, чему может
способствовать определенная генетическая
предрасположенность, в частности, в виде зна-
чительного учащения обнаружения одного из
главных классов антигенов гистосовместимос-
ти HLA-DRW 2; наследственные особенности
проявляются влиянием на интенсивность им-
мунного ответа и тяжесть течения анти-БМК-
нефрита. Не доказана роль курения в качестве
причины синдрома Гудпасчера, но считается
несомненным, что частота тяжелых легочных
кровотечений при этом состоянии тесно свя-
зана с действием табачного дыма; курение,
высокие концентрации ингалируемого кисло-
рода, как и интеркуррентная инфекция и пе-
регрузка жидкостью, могут в этих случаях уси-
ливать кровотечение.
Заболевание развивается у людей обоего пола
и любого возраста, хотя до последнего време-
ни считалось, что оно обычно поражает моло-
дых мужчин. Более часто синдром Гудпасчера
возникает на третьем десятилетии жизни, но у
людей старше 60 лет возможна и вторая волна.
Обычно заболевание начинается с легочных
симптомов. Появляются кровохарканье, иног-
да профузное легочное кровотечение, которые
имеются на момент осмотра или были в про-
шлом. В мокроте обнаруживаются в большом ко-
личестве сидерофаги, при рентгеновском иссле-
довании выявляются легочные инфильтраты.
Могут быть клинические признаки дыхательной
недостаточности. Как уже говорилось, курение
и присоединение инфекции значительно уси-
ливают риск возникновения тяжелого легочного
кровотечения. Легочные геморрагии приводят к
тяжелой железодефицитной анемии.
Признаки поражения почек возникают вслед
за кровохарканьем и проявляются длительной
протеинурией (развитие НС редко), гематурией
(иногда макрогематурией), но главное — быст-
ропрогрессирующей почечной недостаточностью
с олигурией и даже анурией, которые развива-
ются обычно в течение нескольких недель. Воз-
можно молниеносное течение нефрита, особен-
но при присоединении вторичной инфекции.
Как и НС, артериальная гипертензия при
синдроме Гудпасчера редка и обычно возника-
ет в терминальной стадии азотемии.
Темп прогрессирования почечной недоста-
точности предсказать, как правило, трудно,
однако в последнее время принято считать, что
обнаружение в почке экстракапиллярных эпи-
телиальных «полулуний» на ранних стадиях их
развития в этом отношении является неблаго-
приятным признаком [Rees А., 1987]. Эта осо-
бенность отличает данную группу больных от
больных другими вариантами быстропрогресси-
рующего нефрита, когда в одном биоптате поч-
ки констатируют разные стадии «полулуний», в
том числе и фиброз их, что часто сочетается со
склерозом отдельных клубочков почек.
Среди общих проявлений в клинической
картине синдрома Гудпасчера могут быть ли-
хорадка (резорбтивная), слабость, похудание,
реже имеются артралгии, миалгии, более харак-
терные для других типов быстропрогрессирую-
щих нефритов (например, волчаночного и т.п.).
Более типично прогрессирующее развитие
болезни с нарастающей почечной недостаточ-
ностью или фатальным легочным кровотечени-
ем, которое, по мнению ряда авторов, являет-
ся более частой причиной смерти при синдро-
ме Гудпасчера. Возможно и более медленное
течение болезни, но всегда присоединение не-
фрита значительно ускоряет процесс.
Все указанные особенности прогрессирую-
щего течения болезни связаны с развивающи-
мися при синдроме Гудпасчера тяжелыми из-
менениями в почках и легких, укладывающи-
мися в картину некротизирующего нефрита и
некротического альвеолита с кровоизлияниями,
разрушением межальвеолярных перегородок,
гемосидерозом [Heptinstall R., 1974].
Таким образом, синдром Гудпасчера может
быть заподозрен прежде всего клинически —
даже при отсутствии на момент обследования
легочного кровотечения картина «изолирован-
ного» быстропрогрессирующего нефрита без
типичных признаков системного заболевания,
характерных для других видов быстропрогрес-
сирующих нефропатий, должна заставлять ис-
ключать среди прочих и анти-БМК-антитель-
ный генез нефрита. Если же при этом имеются
кровохарканье, сидерофаги в мокроте, альвео-
лярная инфильтрация на рентгенограммах лег-
ких, железодефицитная анемия, наличие син-
дрома Гудпасчера становится весьма вероятным.
При этом необходимо, конечно, исключить
и более частые причины легочного кровотече-
ния — бронхоэктазы, рак бронха, туберкулез
и др., а также «уремическое» легкое с гемор-
рагиями и уремической пневмонией, обуслов-
ленными брайтовым нефритом, а также более
редкий идиопатический гемосидероз. Следует
иметь в виду возможность быстропрогрессиру-
ющего нефрита в рамках системных заболева-
ний — геморрагический васкулит, СКВ, гра-
нулематоз Вегенера, микроскопический поли-
ангиит, узелковый периартериит, при которых
возникает также и поражение легких, в том
числе и геморрагического характера с крово-
харканьем и даже значительными кровотечени-
ями. В этих трудных диагностических ситуациях
помогает, несомненно, тщательный клиничес-
кий анализ, в том числе отсутствие признаков
системного васкулита.
Но наиболее достоверным доказательством
синдрома Гудпасчера является определение
анти-БМК-антител либо в сыворотке (особен-
но с помощью радиоиммунного метода, более
чувствительного по сравнению с непрямой им-
мунофлюоресценцией), либо в ткани почек
(иммуногистохимическим способом, выявляю-
щим линейный тип отложений иммуноглобу-
лина).
315
Таким образом, для синдрома Гудпасчера
патогномоничным следует считать наличие бы-
стропрогрессирующего нефрита в сочетании с
легочными кровотечениями при обязательном
обнаружении в крови и в почках анти-БМК-
антител.
Правильный, а главное своевременный (как
можно более ранний) диагноз синдрома Гудпас-
чера является чрезвычайно важным, поскольку,
во-первых, характерный для него анти-БМК-ан-
тительный нефрит по ответу на терапию зани-
мает особое место по сравнению со всеми дру-
гими вариантами быстропрогрессирующих не-
фритов и, во-вторых, современная медицина
имеет возможность изменить ранее безнадежный
прогноз этих больных. Учитывая тот факт, что
скорейшая остановка легочного кровотечения и
поражения клубочков могут быть достигнуты
эффективным длительным подавлением синте-
за анти-БМК-антител, диагноз именно анти-
БМК-антительной болезни должен быть под-
твержден как можно раньше, поскольку при
таком механизме повреждения почек и легких
спонтанное затихание процесса практически
невозможно, а гемодиализ и другие симптома-
тические воздействия, согласно анализу ряда
публикаций, приводящихся в обзоре A.Rees
(1987), улучшают состояние лишь 15 % больных.
Из-за редкости заболевания проведение кон-
тролируемых клинических сравнений различных
методов лечения практически невозможно. Од-
нако опыт, накопленный во многих центрах,
позволил прийти к согласию об основных
принципах лечения синдрома Гудпасчера
IBolton W.K., 1996].
Большие дозы кортикостероидов, в том чис-
ле в виде пульс-терапии, обрывают тяжелые
проявления легочного процесса, но не влияют
на течение быстропрогрессирующей почечной
болезни.
В настоящее время общепринят подход,
предложенный более 20 лет назад С.Lockwood
(1976) и позволяющий добиться стабилизации
или улучшения функции почек более чем у
50 % больных. Применяют различные вариан-
ты метода, основа которого — интенсивный
плазмаферез, направленный на удаление цир-
кулирующих анти-БМК-антител, в сочетании с
кортикостероидами и цитостатиками для подав-
ления дальнейшей продукции аутоантител и
легочно-почечного иммунного воспаления. Наи-
более распространенный протокол включает в
себя:
1) интенсивный плазмаферез (удаление 3—
4 л плазмы ежедневно или через день с заме-
щением свежезамороженной плазмой для пре-
дупреждения возможных геморрагических ос-
ложнений, связанных с потерей факторов ко-
агуляции). Плазмаферез продолжают до полно-
316
го исчезновения циркулирующих анти-БМК-
антител, на что обычно требуется 2—3 нед;
2) одновременное назначение преднизоло-
на, вначале в виде пульс-терапии (1000 мг внут-
ривенно в течение 3 дней), а затем внутрь (1—
2 мг/кг) в сочетании с циклофосфамидом (2—
3 мг/кг) или азатиоприном (2—3 мг/кг). При
достижении стабильного улучшения в течение
1 мес дозы преднизолона и цитостатика посте-
лено снижают и сохраняют на поддерживаю-
щем уровне многие годы.
Как и при других формах БПГН, лечение
эффективно только при раннем начале — до
развития олигурии или повышения уровня кре-
атинина более 5 мг%, а также при количестве
полулуний менее чем в 50 % клубочков [Bol-
ton W.K., 1996]. Более выраженный ответ на ле-
чение отмечается у больных, имеющих одно-
временно с анти-БМК-антителами антитела,
направленные к цитоплазме нейтрофилов.
Литература
К разделу 10.1
Иванова М.М., Соловьев С.К., Сперанский А.И. Внут-
ривенное введение ударных доз метилпреднизолона
(пульс-терапия) при люпус-нефрите//Тер. арх. —
1983. - № 7. - С. 103-107.
Серов В.В., Варшавский В.А., Куприянова Л.А. Имму-
нопатология почек. — М.: Медицина, 1983. — 176 с.
Тареева И.Е., Янушкевич Т.Н. Волчаночный нефрит
у мужчин и женщин//Ревматология. — 1985. —
№ 2. - С. 14-16.
Тареева И.Е., Анджапаридзе О.Г., Невраева Е.Г. и др.
Персистенция генома вируса кори при некоторых
аутоиммунных заболеваниях//Вопр. вирусол. —
1989. - № 1. - С. 92-95.
Тареева И.Е., Швецов М.Ю., Краснова Т.Н. и др. Ар-
териальная гипертония при волчаночном нефрите//
Тер. арх. — 1997. — № 6. — С. 13—17.
Тареева И.Е., Шилов Е.М., Краснова Т.Н. и др. Про-
гноз больных быстропрогрессирующим волчаночным
нефритом при различных методах лечения//Тер.
арх. - 1994. - № 6. - С. 4-7.
Balow J.E., Austin НА. Renal disease in systemic lupus
erythematosus//Rheum. Dis. Clin. North. Amer. — 1988. —
Vol. 14, N 1. - P. 117-133.
Balow J.E., Boumpas D.T., Fessler B.J., Austin HI H.A.
Management of lupus nephritis//Kidney int. — 1996. —
Vol. 49. - Suppl. 53. - P. S88-S92.
Bansal J.E., Beto J.A. Treatment of lupus nephritis: A
meta analysis of clinical trials//Amer. J. Kidney Dis. —
1997. - Vol. 29, N 2. - P. 193-199.
Briggs J.D., Jones E. On behalf of the Scientific Advisory
Board of the ERA-EDTA Registry. Renal Transplantation
for uncommon diseases//Nephrol. Dial. Transpl. —
1999. - Vol. 14. - P. 570-575.
Doria A., Vitali C., Tincani et al. International survey on
the management of patients with SLE. III. The results of
a questionnaire regarding renal involvement//Clin. Exp.
Rheumatol. — 1996. — Vol. 14. — Suppl. 16. — P. 31—38.
Ponticelli C. Treatment of lupus nephritis — the
advantages of flexible approach//Nephrology Dial.
Transpl. - 1997. - Vol. 12, N 10. - P. 2057-2060.
USRDS 1998 annual data report//Amer. J. Kid. Dis. —
1998. - Vol. 2. - Suppl. 1. - P. S.46.
К разделу 10.2
Семенкова E.H., Апросина З.Г., Лопаткина Т.Н. Узел-
ковый периартериит и инфицирование вирусом ге-
патита В//Тер. арх. — 1992. — № 11. — С. 16—121.
D’Agati V.D., Appel G.B. Polyarteritis nodosa//Renal
pathology with clinical and functional correlations/Ed.
B.M.Brenner. - 1994. - P. 1084-1094.
Davson J., Ball J., Platt R. The kidney in periarteritis
nodosa// Q. J. Med. - 1948. - Vol. 17. - P. 175-202.
Guillevin L., Lhote F. et al. Prognostic factors in
polyarteritis nodosa and Churg — Strauss syndrome. A
prospective study in 342 patients//Medicine. — 1996. —
Vol. 75, N 1. - P. 17-28.
К разделу 10.3
Мухин H.A., Семенкова Е.Н., Макарьянц М.М. Быст-
ропрогрессирующий нефрит при гранулематозе Ве-
генера//Тезисы I съезда нефрологов России. — Ка-
зань, 1994. — С. 85.
Gross iV.L. et al. Treatment of systemic vasculitis//
Internist. - 1997. - Vol. 6. - P. 520-531.
Jayne D.R., Lockwood C.M. Pooled intravenous
immunoglobulin in the management of systemic
vasculitis//Brit, J. Rheumatol. — 1996. — Vol. 35. — P.
1150-1 153.
Savage C.O., Harper L., Adu D. Primary systemic
vasculitis//Lancet. — 1997. — Vol. 349. — P. 553—558.
Van der iVoude F.J., Rasmussen N. et al. Autoantibodies
against neutrophils and monocytes//Lancet. — 1985. —
Vol. 1. - P. 425-429.
К разделу 10.4
Макарьянц М.М. Клинические особенности пораже-
ния почек при системных некротизирующих васку-
литах — гранулематозе Вегенера и микроскопичес-
ком полиартериите: Автореф. дис. ... канд. мед. наук. —
М., 1997.
Мухин НА., Козловская Л.В., Насонов Е.Л. и др. Кли-
нические и патогенетические аспекты поражения
почек, связанного с антителами к цитоплазме нейт-
рофилов//Вестн. РАМН. — 1995. — № 5. — С. 34—39.
Adu D., Howie A.J., Scott D.G. et al. Polyarteritis and
the kidney//Q. J. Med. - 1987. - Vol. 62. - P. 221-237.
Bacon P.A., Savage C., Adu D. Microscopic polyarteritis
(MPA)//The Vasculitis/Eds B.M.Ansell, P.A.Bacon,
J.T.Lie. - London, 1996. - P. 135-145.
Gordon M., Luqmani R.A., Adu D. et al. Relapses in
patients with a systemic vasculitis//Q. J. Med. — 1993. —
Vol. 86. - P. 779-789.
Jennette J. C., Falk R.L. Small-vessel vasculitis//N. Eng. J.
Med. - 1997. - Vol. 20. - P. 1512-1513.
Kallenberg C.M., Brower E., Wlening J. J. et al. Anti-
neutrophil cytoplasmic antibodies: current diagnostic and
pathophysiological potentiae//Kidney Int. — 1994. — Vol.
46. - P. 1-15 .
Savage C.O., Wiheares C.G., Evans D.J. Microscopic
polyarteritis: presentation, pathology and prognosis//Q.
J. Med. - 1985. - Vol. 220. - P. 467-483.
К разделу 10.5
Николаев А.Ю. Поражение почек при геморрагичес-
ком васкулите//Нефрология/Под ред. И.Е.Тарее-
вой. - М., 1995. - Т. 2. - С. 172-179.
Allen А. С. Abnormal glycosylation of IgA: is it related to
the pathogenesis of IgA-nephropathy?//Nephrol., Dial.,
Transpl. - 1995. - Vol. 10. - P. 1121-1124.
Glassock R.J., Cohen A.H., Adler S.G. Secondary
glomerular disease//The Kidney: Ed. 5/Ed. B.M.Bren-
ner. — Philadelphia, 1996. — P. 1498—1596.
Habib R., Niaudet P., Levy M. Schonlein — Henoch
purpura nephritis and IgA-nephropathy//Renal Pathology:
Ed. 2/Eds C.C.Tisher, B.M.Brenner. — Philadelphia:
Lippincott comp., 1994.— Vol. 1.— P.472—523.
Kaku Y., Nohara K, Honda S. Renal involvement in
Henoch — Schonlein purpura: a multivariant analysis of
prognostic factors//Kidney Int. — 1998. — Vol. 53. — P.
1755-1759.
Lunardi C., Bambara L.M., Bias D. Elimination diet in
the treatment//Clin. Exp. Rheumatol. — 1992. — Vol. 10. —
P. 131-135.
Mollica E, Livolti S., Garoyyo R. Effectiveness of early
prednisone treatment in preventing the development of
nephropathy in anaphylactoid purpura//Eur. J. Pediatr. —
1992. - Vol. 151. - P. 140-144.
Nathwani D., Laing R.B., Smith C.C., Edvard N.
Recurrent post-infective Henoch — Schonlein syndrome:
a genetic influence related to HLA B35//J. Infect, dis. —
1992. - Vol. 25. - P. 205-210.
317
O’Donoghue D.J., Darvill A., Ballardie F. Mesangial cells
autoantigens in IgA-nephropathy and Henoch —
Schonlein purpura//J. Clin. Invest. — 1991. — Vol. 88. —
P. 1522-1530.
Ronda N., Esnault V.L., Lay ward L. Antineutrophil
cytoplasm antibodies (ANCA) of IgA isotype in adult
Henoch — Schonlein purpura//Clin Exp. Immunol. —
1994. - Vol. 95. - P. 49-55.
Rostoker G., Desvaux-Belgiti, Pilatte Y. High-dose
immunoglobulin therapy for severe IgA-nephropathy and
Henoch — Schonlein purpura//Ann. Int. Med. — 1994. —
Vol. 120. - P. 476-484.
Saulsbury F. T. Corticosteroid therapy does not prevent
nephritis in Henoch — Schonlein purpura//Pediatr.
Nephrol. — 1993. — Vol. 7. — P. 69—71.
Somer T, Finegold S.M. Vasculitides associated with
infections, immunization and antimicrobal drugs//Clin.
Infect. Dis. - 1995. - Vol. 20. - P. 1010-1036.
Utani A., Ohta M., Shinya A., Ohno S. Successful
treatment of adult Henoch — Schonlein purpura with
factor XIII concentrate//!. Am. Acad. Dermatol. —
1991. - Vol. 24. - P. 438-442.
Vriesman B. Thin glomerular basement membrane
nephropathy in adults//Nephron. — 1998. — Vol. 79. —
P. 1-7.
К разделу 10.6
Аникина H.B., Гусева Н.Т., Мач Э.С. Нарушения
микроциркуляции в генезе склеродермической не-
фропатии//Тер. арх. — 1986. — № 8. — С. 62—65.
Гусева Н.Г. Системная склеродермия и псевдоскле-
родермические синдромы. — М.: Медицина, 1993.
Гусева Н.Г. Проблемы диагностики и лечения сис-
темной склеродермии//Русск. мед. журн. — 1998. — Т.
6. - № 8. - С. 486-492.
Beckett V.L., Donadio J. И et al. Use of captopril as early
therapy for renal scleroderma: a prospective study//Mayo
Clin. Proc. - 1985. - Vol. 60. - P. 763-771.
Black С. M. The angiopathogenesis of systemic sclerosis/
/ Roy. J. Physic. London. - 1995. - Vol. 29. - P. 119—
130.
Helfric D.J., Banner B., Steen V.D., Medsger T.A.
Normotensive renal failure in systemic sclerosis//Arthritis
and Rheumatism. — 1989. — Vol. 32, N 9. — P. 1128—
1134.
Hillis G.S., Khan I.H. et al. Scleroderma, D-penicillamin
treatment, and progressive renal failure associated with
positive antimyeloperoxidase antineutrophil cytoplas-
mic antibodies//Am. J. of Kidney Dis. — 1997. — Vol. 30,
N 2. - P. 279-281.
Karpinski J., Jothy S. et al. D-penicillamin — induced
318
crescentic glomerulonephritis and antimyeloperoxidase
antibodies in a patient with scleroderma//Am. J.
Nephrol. - 1997. - Vol. 17, N 6,- P. 528-532.
Omote A., Muramatsu M. et al. Myeloperoxidase —
specific anti-neutrophil cytoplasmic autoantibodies —
related scleroderma renal crisis treated with double-
filtration plasmapheresis//Intem. Med. — 1997. — Vol. 36,
N 7. - P. 508-513.
Rivolta R., Mascagni B. et al. Renal vascular damage in
systemic sclerosis patients without clinical evidence of
nephropathy//Arthritis a. Rheumatism. — 1996. — Vol. 39,
N 6. - P. 1030-1034.
Scorza R., Rivolta R. et al. Effect of iloprost infusion on
the resistance index of renal vessels of patients with
systemic sclerosis//!. Rheumatol. — 1997. — Vol. 24, N
10. - P. 1944-1948.
Steen V.D. Scleroderma renal crisis//Rheum. Dis. North.
Am. - 1996. - Vol. 22, N 4. - P. 861-878.
К разделу 10.7
Гордовская Н.Б., Азарова В.В., Артемьева В.Б. и др.
Особенности клинического течения нефрита у боль-
ных с криоглобулинемией//Тер. арх. — 1997. — № 6. —
С. 30-34.
Agnello V. Hepatitis С virus infection and type II
cryoglobulinemia: an immunological perspective//
Hepatology. - 1997. - Vol. 26. - P. 1375-1379.
D’Amico G. The patient with mixed cryoglobulinemia and
hepatitis C infection//Oxford Textbook of Clinical
Nephrology/Eds A.M.Davison et al. — Oxford — New
York - Tokio, 1998. - P. 911-916.
Ferri C., Zignego A.L., Bombardieri S. et al. Etiopatho-
genetic role of hepatitis C virus in mixed cryoglo-
bulinemia, chronic liver diseases and lymphomas//Clin.
Exp. Rheumat. — 1995. — Vol. 13. — Suppl. 13. — P. 135—
140.
Fornasieri A., Li M., Armelloni S. et al. Glomerulonephritis
induced by human IgMk-IgG cryoglobulins in mice//
Lab. Invest. - 1993. - Vol. 69. - P. 531-540.
Galli M. Viruses and cryoglobulinemia//Clin. Exp.
Rheumat. — 1995. — Vol. 13. — Suppl. 13. — P. 63—70.
Monti G., Saccardo F., Pioltelli P. et al. The natural history
of cryoglobulinemia: symptoms at onset and during
follow-up. A report by the Italian Group for the Study
of Cryoglobulinemias (GISC)// Clin. Exp. Rheumat. —
1995. - Vol. 13. - Suppl. 13. - P. 129-133.
Tarantino A., De Vecchi A., Montagnino G. et al. Renal
disease in essential mixed cryoglobulinemia. Long-term
follow-up of 44 patients//Quart. !. Med. — 1981. —
Vol. 50. - P. 1-30.
Tarantino A., Campise M., Banfi G. et al. Long-term
predictors of survival in essential mixed cryoglobulinemic
glomerulonephritis//Kidney Int. — 1995. — Vol. 47. —
P. 618-623.
Tavoni A., Mosca M., Ferri C. et al. Guidelines for the
management of essential mixed cryoglobulinemia//Clin.
Exp. Rheumatol. — 1995. — Vol. 13. — Suppl. 13. — P.191—
195.
К разделу 10.8
Conlon P.J., Howell D.N., Macik G. et al. The renal
manifestations and outcome of thrombotic thrombo-
cytopenic purpura/hemolytic uremic syndrome in adults//
Nephrol. Dial. Transplant. — 1995. — Vol. 10. — P. 1189—
1193.
Moake J.L. Haemolytic-uraemic syndrome: basic science//
Lancet. - 1994. - Vol. 343. - P. 393-397.
Monnens L., Van De Meer W., Langenhuysen C. et al.
Platelet aggregating factor in the epidemic form of
haemolytic uraemic syndrome//Clin. Nephrol. — 1985. —
Vol. 24. - P. 135-137.
Neild G.H. Hemolytic uremic syndrome/thrombotic
thrombocytopenic purpura: pathophysiology and
treatment//Kidney Int. — 1998. — Vol. 53. — P. 45—49.
Noris M., Remuzzi G. Are HUS and TTP genetically
determined?//Kidney Int. — 1998. — Vol. 53. — P. 1085—
1086.
Pichette V., Querin S., Schurch W. et al. Familial
haemolytic-uraemic syndrome and homozygous factor
H deficiency//Am. J. Kidney Dis. — 1994. — Vol. 24. — P.
936-941.
Remuzzi G., Ruggenenti P. The hemolytic uremic
syndrome//Kidney Int. — 1995. — Vol. 48. — P. 2—19.
Remuzzi G., Ruggenenti P., Bertani T. Thrombotic
microangiophaty//Renal pathology: with clinical and
functional correlations/Eds C.Tisher, B.Brenner. —
Philadelphia, 1994. — P. 1157—1184.
Sennett M.L., Conrad M.E. Treatment of thrombotic
thrombocytopenic purpura: plasmapheresis, plasma
transfusions and vincristine//Arch. Intern. Med. — 1986. —
Vol. 146. - P. 266-267.
Taylor C.M., Lote C.J. Prostacyclin in diarrhoea-
associated haemolytic uraemic syndrome//Pediatr.
Nephrol. - 1993. - Vol. 7. - P. 515-519.
Turi S., Nemeth I., Vargha I., Matkovics B. Oxidative
damage of red blood cells in haemolytic uraemic
syndrome//Pediatr. Nephrol. — 1994. — Vol. 8. — P. 26—
29.
Wada H, Kaneko T., Ohiwa M. et al. Increased levels
of vascular endothelial cell markers in thrombotic
thrombocytopenic purpura//Am. J. Hemat. — 1993. —
Vol. 44. - P. 101-105.
К разделу 10.9
Bolton W.K. Goodpasture’s syndrome//Kidney Int. —
1996. - Vol. 50. - P. 1753-1766.
Глава 11
КАНАЛЬЦЕВЫЕ ДИСФУНКЦИИ
И.Е.Тареева, М.С.Игнатова
Канальцевые дисфункции (тубулопатии) —
группа нефропатий, в основе которых лежит
нарушение транспортных процессов в каналь-
цах; характеризуются ранним частичным или
генерализованным нарушением канальцевых
функций при нормальной или несколько сни-
женной СКФ.
В канальцах происходят: 1) реабсорбция цен-
ных для организма органических и неоргани-
ческих веществ, профильтровавшихся в клубоч-
ках; 2) секреция в просвет канальца веществ
как из крови, так и образующихся в клетках ка-
нальцев; 3) концентрация мочи. Эти процессы
детально обсуждаются в главе «Механизмы мо-
чеобразования»; здесь мы коротко остановим-
ся на основных положениях.
В проксимальных канальцах всасывается при-
мерно 60 % профильтровавшихся натрия, хло-
ра. калия, кальция и воды и 80—90 % бикар-
боната (НСО3 ); здесь же почти полностью вса-
сываются глюкоза и аминокислоты. Кроме того,
в проксимальных канальцах осуществляется
реабсорбция фосфатов, которая регулируется
паратгормоном.
В дистальных отделах (включающих в себя
дистальный извитой каналец и собирательные
трубки) окончательно корригируются состав
мочи, содержание натрия и хлоридов. Дисталь-
ные отделы — основное место приложения та-
ких регулирующих натриевый гомеостаз гормо-
нов, как альдостерон и вазопрессин. Здесь про-
исходит секреция калия, обеспечивающая его
выделение с мочой, и водородных ионов (Н+),
соединяющихся с неабсорбируемыми аниона-
ми (в основном с фосфатом), а также с амми-
аком и выделяющихся в виде титруемых кис-
лот и аммония.
Все отделы канальцев участвуют в процес-
сах разведения и концентрации мочи, образуя
вместе с сосудами мозгового слоя противоточ-
ную поворотную множительную систему.
320
Тубулопатии чаще имеют наследственный
характер и наблюдаются в детском возрасте.
Синдромы канальцевой недостаточности встре-
чаются также и у взрослых как поздно распоз-
нанное генетическое заболевание или как при-
обретенный дефект при ряде болезней почек
(пиелонефрит, интерстициальный нефрит и
др.) или при внепочечной патологии (опухо-
ли, аутоиммунные процессы и др.).
Выделяют первичные тубулопатии, при ко-
торых транспорт тех или иных веществ наруша-
ется преимущественно в тубулярном отделе
нефрона, и вторичные тубулопатии, которым
свойствен дефект транспорта генерализованного
характера.
КЛАССИФИКАЦИЯ ТУБУЛОПАТИЙ В ЗАВИСИМОСТИ
ОТ ГЛАВНОГО СИНДРОМА
Тубулопатии
главный синдром первичные вторичные (фенотипически сходные состояния)
Аномалии скелета (по- чечные остео- патии) Фосфат-диабет, бо- Витамин D-зависи- лезнь де Тони — мый рахит, гипофос- Дебре — Фанкони, фосфатазия, цели- почечный каналь- акия, псевдогипо- цевый ацидоз паратиреоидизм
Полиурия Почечная глюкозу- Нефронофтиз Фан- рия, почечный неса- кони, пиелонефрит, харный диабет цистиноз, тирозине- (псевдогипоальдо- мия, ХПН стеронизм)
Нефролитиаз Цистинурия, глици- Оксалоз и вторич- нурия и иминогли- ная гипероксалу- цинурия, дисталь- рия, ксантинурия, ный почечный тубу- синдром Леша — лярный ацидоз Нигана
В основе первичных (наследственных) тубу-
лопатий лежат различные врожденные дефекты:
• изменения структуры мембранных белков-
носителей;
• недостаточность ферментов, обеспечиваю-
щих активный мембранный транспорт (фер-
ментопатии);
• изменения чувствительности рецепторов
клеток тубулярного эпителия к действию
гормонов.
Классифицировать тубулопатии можно по
локализации дефекта, главному клиническому
синдрому или по основному механизму транс-
портных нарушений.
11.1. Нарушения функций
проксимальных канальцев
11.1.1. Нарушения транспорта
фосфатов
Фосфат-диабет (гипофосфатемический рахит,
витамин D-резистентный рахит) развивается
вследствие снижения реабсорбции фосфатов в
проксимальных канальцах, что приводит к ги-
перфосфатурии с последующей гипофосфате-
мией. Может наблюдаться как изолированный
дефект канальцевой функции (наследственное
заболевание, тип наследования — доминант-
ный, сцепленный с X-хромосомой), так и в со-
четании с другими дефектами, в том числе как
один из признаков синдрома Фанкони.
Среди причин снижения реабсорбции фос-
фора обсуждаются отсутствие транспортного
белка, связывающих участков для этого бел-
ка в проксимальном канальце, а также умень-
шение рецепторов к 1 <х,25-диоксивитамину
Ds-
У экспериментальной модели — гипофосфа-
темической мыши — выявлен дефект захвата
фосфатов щеточной каемкой канальцев. У час-
ти больных снижается всасывание кальция в
кишечнике.
Содержание паратгормона в крови в норме
или умеренно повышено, что свидетельствует
о незначительной роли гиперпаратиреоза как
причины гиперфосфатурии (хотя не исключе-
на повышенная чувствительность почечных ка-
нальцев к действию паратгормона). Гипофосфа-
темию обнаруживают сразу же после рождения
ребенка, клинически заболевание проявляется
на 1—2-м году жизни. Характерны задержка
роста (особенно у мальчиков), приземистость
(в основном за счет непропорционально корот-
ких ног), выраженные деформации нижних
конечностей с момента начала ходьбы. В то же
время мышечной слабости нет, дети остаются
активными. Рентгенологически выявляют рахи-
топодобные изменения костей: широкий мета-
физ, утолщение кортикального слоя трубчатых
костей нижних конечностей, грубый рисунок
трабекул. Общее содержание кальция в костях
повышено. У взрослых могут развиться остео-
маляция, ригидность позвоночника, ограниче-
ние движений в конечностях, мышечная сла-
бость.
При лабораторном обследовании выражен-
ная гипофосфатемия (0,6—0,9 ммоль/л при
норме у детей 1-го года жизни 1,29—
2,26 ммоль/л), гиперфосфатурия. Гипофосфате-
мия сохраняется всю жизнь, гипокальциемия
наблюдается у некоторых больных, принима-
ющих препараты фосфора. Может быть повы-
шена активность щелочной фосфатазы.
Заболевание можно заподозрить в тех случа-
ях, когда лечение рахита обычными дозами
витамина D (2000—5000 МЕ/сут) не дает эф-
фекта и деформация костей прогрессирует.
Дифференцируют фосфат-диабет от рахита,
обусловленного другими причинами: дефицит
витамина D, синдром нарушенного всасыва-
ния, почечный канальцевый ацидоз.
Основным препаратом для лечения фосфат-
диабета является витамин D.
Термин «витамин D-резистентный рахит»
условен, так как больных можно успешно ле-
чить витамином D, правда, в дозах, значитель-
но превышающих терапевтические. Лечение
проводят длительно, а иногда в течение всей
жизни.
Для лечения больных фосфат-диабетом на-
значают большие дозы витамина D2 (эргокаль-
циферола, кальциферола) или активного син-
тетического метаболита витамина D3-1<x-okch-
холекальциферола (оксидевита, ван-альфа-аль-
факальцидола, 1 а-оксивитамина D3). Выбор
препарата зависит от типа ответной реакции на
витамин D: если при назначении больших доз
эргокальциферола (40 000—120 000 МЕ/сут)
уменьшается потеря фосфатов с мочой и нор-
мализуется содержание фосфора в крови, то
лечение проводят только этим препаратом,
индивидуально подбирая дозы. Если же реаб-
сорбция фосфора не нормализуется, то следу-
ет снизить активность паратгормона и назначить
один 1<х-оксихолекальциферол (в дозе от 0,002
до 0,004 мг/сут или в сочетании с витамином
D2). Оптимальным считают лечение более ак-
тивным метаболитом витамина D — 1<х,25-ди-
оксивитамином D3 (рокалтролом).
В комплекс терапии должны быть включе-
ны препараты кальция, фосфора. Для введения
внутрь неорганических фосфатов можно ис-
пользовать смесь Олбрайта (лимонная кисло-
та — 24 г, цитрат натрия — 40 г, дистиллиро-
21—2950
321
ванная вода — 400 г). Эту смесь принимают
внутрь по 1 столовой ложке 4—5 раз в день.
Широко используется фитин. Лучше усваивают-
ся кальций и фосфат при назначении нитрат-
ных смесей, способствующих также улучшению
функционального состояния желудочно-кишеч-
ного тракта.
Специально рекомендуется назначать фер-
ментные препараты (фестал, панзинорм, або-
мин и другие в возрастных дозах), а также сред-
ства, уменьшающие проявления дисбактерио-
за (курсами по 30—40 дней). При подозрении
на фосфат-диабет желательно обследовать боль-
ного в специализированной клинике, где под-
бирают дозу лечебных препаратов, а также
проводят медико-генетическое консультирова-
ние в семье.
Псевдогипопаратиреоз — состояние, также
связанное с нарушением транспорта фосфатов,
при котором выявляют повышенное содержа-
ние фосфора в сыворотке крови и низкое каль-
ция, т.е. показатели, характерные для гипопа-
ратиреоза. Однако при этом повышено содер-
жание паратгормона в сыворотке крови. В ос-
нове болезни лежит резистентность прокси-
мальных канальцев к паратгормону (как к эн-
догенному, так и введенному извне). Клиничес-
ки характерны низкий рост, круглое лицо, ос-
теохондродистрофии (укорочение отдельных
костей кистей и стоп), умственная отсталость.
Могут наблюдаться катаракты, гипокальциеми-
ческие судороги, изменения зубов.
11.1.2. Нарушения транспорта
углеводов
Почечная глюкозурия. Небольшое количество
сахара экскретируется с мочой даже у здоро-
вых людей, однако определить это количество
(базальный уровень) можно, лишь используя
тонкие ферментные методы.
Нарушение транспорта глюкозы в прокси-
мальном отделе нефрона приводит к развитию
почечной глюкозурии — одной из наиболее
частых канальцевых дисфункций. Диагноз по-
чечной глюкозурии ставят на основании сле-
дующих признаков:
• глюкозурия при нормальном уровне сахара
в крови натощак;
• наличие глюкозы во всех порциях мочи;
• нормальная или слегка уплощенная кривая
при проведении теста толерантности к глю-
козе.
Содержание глюкозы в сыворотке крови,
как и толерантность к пероральной нагруз-
ке глюкозой, нормальное или несколько сни-
жено.
Существуют несколько причин патофизио-
логического характера, приводящих к почечной
глюкозурии:
уменьшение массы проксимальных каналь-
цев относительно гломерулярной поверхно-
сти, что приводит к нарушению транспорта
глюкозы;
снижение функциональной способности си-
стемы, ответственной за транспорт глюко-
зы против градиента концентрации в мемб-
ранах тубулярного эпителия;
снижение проницаемости для глюкозы кле-
точных мембран;
нарушение способности транспортировать
глюкозу с помощью специфического мемб-
ранного носителя.
В ряде случаев заболевание имеет семейный,
наследственный характер.
Существуют формы аутосомно-доминантной
и аутосомно-рецессивной передачи того или
иного вида нарушения почечного транспорта
глюкозы.
Клинические симптомы заболева-
ния могут отсутствовать, а глюкозурия — вы-
являться случайно. Однако в ряде случаев име-
ется полиурия, иногда сопровождающаяся
жаждой.
Для подтверждения диагноза обязательна
идентификация глюкозы в моче хроматографи-
ческими или ферментными методами, позво-
ляющими отличить глюкозу от фруктозы, пен-
тозы, галактозы (доброкачественная фруктозу-
рия, галактозурия).
Почечная глюкозурия встречается как само-
стоятельное заболевание, сочетается с другими
тубулопатиями (аминоацидурией, фосфат-диа-
бетом), является одним из признаков синдро-
ма Фанкони.
Дифференциальный диагноз изо-
лированной почечной глюкозурии с други-
ми тубулопатиями, сопровождающимися на-
рушением реабсорбции глюкозы, с сахар-
ным диабетом обычно не представляет труд-
ностей.
Изолированная почечная глюкозурия — доб-
рокачественное заболевание, не требующее, как
правило, специального лечения, за исключени-
ем тяжелых случаев, обусловленных значитель-
ными потерями сахара.
Правильный пищевой режим предусматри-
вает достаточное количество углеводов, так как
их избыточное введение способствует усилению
глюкозурии, а уменьшенное может вызвать ги-
погликемию. Целесообразно ввести в пищу су-
хофрукты, так как содержание калия в сыво-
ротке крови может снизиться вследствие поли-
урии.
322
11.1.3. Нарушения канальцевого
транспорта аминокислот
(аминоацидурия)
Аминокислоты реабсорбируются в проксималь-
ных канальцах, где имеется 5 основных транс-
портных систем, общих для нескольких амино-
кислот. Кроме того, очевидно, существуют
транспортные системы, специфичные для от-
дельных аминокислот. Дефекты этих транспор-
тных систем приводят к повышенной экскре-
ции аминокислот с мочой — аминоацидурии.
Другая причина аминоацидурии — повышен-
ное содержание аминокислот в сыворотке кро-
ви (аминоацидурия «переполнения»).
Цистинурия является классическим
примером патологии, связанной с нарушени-
ем транспорта аминокислот в проксимальном
отделе нефрона (детально описана в главе «На-
следственные заболевания почек»). Заболевание
генетически детерминировано, передается по
аутосомно-рецессивному типу наследования. Ос-
новные клинические проявления болезни свя-
заны с формированием цистиновых камней в
почках.
Иминоглицинурия — наследственное
аутосомно-рецессивное заболевание, связанное
с нарушением транспорта и повышением экс-
креции с мочой иминокислот — пролина, гид-
роксипролина и глицина. Характерных клини-
ческих проявлений нет, однако иногда наблю-
даются нефролитиаз, умственная отсталость,
снижение слуха.
Болезнь Хартнупа — наследственное
аутосомно-рецессивное заболевание, обуслов-
ленное нарушением транспорта в почках и ки-
шечнике ряда моноаминокислот. С мочой вы-
деляются в большом количестве аланин, глу-
тамин, гистидин, лейцин, серин, треонин,
тирозин, фенилаланин и триптофан. Клиничес-
кие признаки болезни: фотодерматит, пеллаг-
роидные изменения кожи, мозжечковая атак-
сия, расстройства психики.
Проксимальный почечный канальцевый ацидоз.
Почечный канальцевый ацидоз (ПКА) — син-
дром, характеризующийся постоянным гипер-
хлоремическим метаболическим ацидозом, раз-
вившимся вследствие нарушения подкисления
мочи почками в отсутствие выраженного сни-
жения СКФ. Проксимальный ПКД формируется
при выраженном снижении способности про-
ксимальных канальцев реабсорбировать про-
фильтровавшиеся бикарбонаты — одного из
двух механизмов, посредством которых почки
поддерживают кислотно-основное состояние.
При нарушении второго механизма — секреции
водородных ионов дистальными канальцами —
развивается дистальный ПКА (см. с. 325).
Выявляют значительную бикарбонатурию,
высокий pH мочи, гиперхлоремический ацидоз.
Однако способность дистальных канальцев к
подкислению мочи сохраняется, поэтому при
выраженном системном ацидозе pH мочи все
же может снижаться (в отличие от дистально-
го канальцевого ацидоза). Почти всегда имеет-
ся гипокалиемия, связанная со вторичным ги-
перальдостеронизмом, развивающимся вслед-
ствие выделения большого количества натрия
(бикарбоната натрия) и соответствующего
уменьшения объема внеклеточной жидкости.
Проксимальное нарушение реабсорбции
бикарбонатов редко бывает изолированной ка-
нальцевой дисфункцией, чаще оно сочетается
с другими транспортными нарушениями (с
повышенной экскрецией фосфатов, аминокис-
лот и др.), может быть частью генерализован-
ного дефекта канальцевого транспорта — син-
дрома Фанкони.
Проксимальный ПКА может наблюдаться
как самостоятельное, иногда наследственное за-
болевание, однако чаще сопровождает систем-
ные и общие патологические процессы — те
же, которые приводят к развитию синдрома
Фанкони (см. с. 324).
Если проксимальный ПКА является изоли-
рованным дефектом, клинические признаки
могут отсутствовать. Гиперкальциурии обычно
не бывает, так как повышенное поступление
бикарбонатов в дистальные канальцы стимули-
рует дистальную реабсорбцию кальция; несмот-
ря на ацидоз, нефролитиаз или нефрокальци-
ноз наблюдается редко [Brenner R. et al., 1982].
У детей возможна задержка роста.
Диагноз ставят на основании выявления
гиперхлоремического ацидоза, бикарбонатурии,
щелочной реакции мочи (однако при нагрузке
хлоридом аммония pH мочи становится ниже
6,0).
Лечение предусматривает введение боль-
ших доз щелочей до 10 ммоль/(кг • сут), т.е. око-
ло 1 г бикарбоната натрия на 1 кг массы тела;
меньшие дозы неэффективны. Назначаемые
большие дозы бикарбоната натрия могут уси-
ливать имеющуюся гипокалиемию (поэтому
лучше назначать бикарбонат в виде смеси би-
карбоната натрия и бикарбоната калия). Реко-
мендуются также цитратные смеси (цитрат, ме-
таболизируясь в печени, поглощает Н+).
Потребность в бикарбонате может быть
уменьшена при одновременном назначении
тиазидовых диуретиков, которые повышают ре-
абсорбцию бикарбонатов, вызывая гиповоле-
мию. Одновременно рекомендуется значитель-
но ограничить прием натрия хлорида. Назначе-
ние диуретиков еще более усиливает гипокали-
емию, что диктует необходимость дополнитель-
ного приема калия.
21
323
У детей лечение проксимального ПКА про-
водят всегда. У взрослых лечение обязательно
лишь при развитии проксимального ПКА в
рамках синдрома Фанкони, при изолированном
же проксимальном ПКА ацидоз обычно выра-
жен умеренно и не требует лечения.
Синдром Фанкони (или де Тони — Дебре —
Фанкони) — генерализованная дисфункция
проксимальных канальцев, при которой нару-
шена реабсорбция практически всех веществ,
транспорт которых осуществляется в прокси-
мальных канальцах. Отмечаются следующие
нарушения:
• генерализованная аминоацидурия;
• проксимальный ПКА с бикарбонатурией;
• почечная глюкозурия;
• фосфатурия, гипофосфатемия, гипофосфа-
темический рахит;
• гипостенурия (полиурия);
• протеинурия тубулярного типа (легкие цепи
иммуноглобулинов, низкомолекулярные бел-
ки, /52-микроглобулин). Кроме того, отмеча-
ются потеря натрия, калия, кальция, повы-
шение выделения мочевой кислоты со сни-
жением ее содержания в сыворотке.
Синдром Фанкони чаще развивается при
различных общих заболеваниях, однако может
наблюдаться и как самостоятельная нозологи-
ческая форма (болезнь де Тони — Дебре —
Фанкони) — наследственное заболевание, пе-
редающееся по аутосомно-рецессивному или
аутосомно-доминантному типу, для которого
характерны морфологические изменения про-
ксимального отдела нефрона с дистрофией и
атрофией канальцевого эпителия, деформаци-
ей канальцев в виде «лебединой шеи». F.Manz
и соавт. (1984) описали случай идиопатическо-
го синдрома Фанкони у девочки с полным
отсутствием щеточной каймы проксимальных
канальцев, выявленным при гистологическом
исследовании биоптата, и нарушением функ-
ции проксимального канальца, т.е. в петлю
Генле и дистальный каналец поступал чистый
ультрафильтрат и никаких транспортных про-
цессов в канальцах не происходило.
Основной клинический признак синдрома
Фанкони — поражение костей (деформация
скелета, боли в костях, переломы, диффузная
остеомаляция); у детей развивается рахит, на-
блюдается задержка роста. Могут быть поли-
урия, жажда, редко мышечная слабость (вплоть
до параличей), связанная с гипокалиемией, ги-
покальциемические судороги. Иногда симпто-
мы, обусловленные гипокалиемией, выступа-
ют на первый план. Дети отстают в физичес-
ком, а иногда и в умственном развитии, у них
снижена сопротивляемость к инфекциям. Кли-
нические признаки болезни могут отсутство-
324
вать, диагноз в таких случаях ставят на осно-
вании лабораторных данных, выявляющих ком-
плексное нарушение канальцевых функций.
Несмотря на то что при наследственных
формах первые признаки болезни появляются
в детском возрасте, она иногда распознается в
более старшем возрасте.
Некоторые авторы выделяют две формы де-
бюта болезни в зависимости от возраста боль-
ных. При «детской» форме с началом болезни
в первый год жизни отмечают рахитоподобные
изменения костей, задержку роста, тошноту,
рвоту, лихорадку, мышечную слабость, гипо-
калиемические параличи, снижение сопротив-
ляемости к инфекциям, рецидивирующие ви-
русные заболевания, пневмонии, отиты. При
позднем начале болезни (в 20—30-летнем воз-
расте) первыми симптомами являются поли-
урия, мышечная слабость, боли в костях, осо-
бенно в позвоночнике. При прогрессировании
болезни могут развиться гипертония, почечная
недостаточность.
Причины вторичного синдрома Фанкони мно-
гообразны; каких-либо клинических или лабо-
раторных признаков, отличающих первичный
синдром Фанкони от вторичного, нет, поэто-
му в каждом случае надо проводить тщатель-
ный этиологический поиск.
Причины вторичного синдрома Фанкони.
Врожденные нарушения метаболизма или
транспорта:
• цистиноз;
• тирозинемия;
• гликогеноз;
• галактоземия;
• окулоцеребральный синдром Лоу;
• болезнь Вильсона — Коновалова.
Приобретенные заболевания:
• парапротеинемии (множественная миелома,
болезнь легких цепей);
• злокачественные новообразования (рак яич-
ников, легких, печени, лимфомы);
• гиперпаратиреоз;
• нефротический синдром;
• интерстициальный нефрит;
• трансплантированная почка;
• пароксизмальная ночная гемоглобинурия.
Воздействия экзогенных факторов:
• лекарства (цисплатин, анальгетики, тетра-
циклин с истекшим сроком годности, ген-
тамицин, 6-меркапт'опурин);
• соли тяжелых металлов (свинец, кадмий,
висмут, ртуть, уран);
• органические вещества (малеиновая кисло-
та, лизол, толуол);
• тяжелые ожоги.
При ряде наследственных процессов (глико-
генов, галактоземия, тирозинемия, болезнь
Вильсона — Коновалова) поражаются и поч-
ки, и печень, причем печень может поражать-
ся раньше (так, при галактоземии уже при
рождении ребенка отмечают гепатомегалию и
желтуху).
При болезни Вильсона — Коновалова (ге-
патолентикулярная дегенерация, семейное на-
рушение обмена меди) у 40—50 % больных
выявляют цирроз печени, у 30—40 % — невро-
логическую симптоматику, у 10 % — психиат-
рические и поведенческие отклонения, у 1 %
больных — тубулопатию, чаще у взрослых.
Может быть гемолитическая анемия. Диагнос-
тическое значение имеет зелено-коричневое
кольцо Кайзера — Флейшера по краю радуж-
ной оболочки.
У взрослых чаще всего синдром Фанкони
развивается при множественной миеломе с
протеинурией (к-легкие цепи). Присоединение
синдрома Фанкони характеризуется усилением
болей в костях, мышечной слабостью, полиури-
ей, остеомаляцией. Описаны случаи, когда по-
явление синдрома Фанкони на много лет опе-
режало развитие миеломы [Sevell R., Doreen Р.,
1984].
Синдром Фанкони при отравлении просро-
ченным тетрациклином проявляется миопати-
ей, головокружениями, ацидозом, полиурией,
гипокалиемией.
Лечение включает в себя обильное питье,
лечение проксимального ПКА с гипокалие-
мией, рахита и остеомаляции, при цисти-
нозе описан положительный эффект индоме-
тацина [Haycock G.B. et al., 1982] (назначать с
осторожностью из-за возможности снижения
СКФ).
При паранеопластическом синдроме Фанко-
ни возможно его обратное развитие после уда-
ления опухоли. Так, в наблюдении O.Leehey
(1985) у больного с остеомаляцией были вы-
явлены синдром Фанкони и фиброма голени;
удаление опухоли привело к исчезновению как
остеомаляции, так и других признаков синдро-
ма Фанкони.
11.2. Нарушения функции
дистальных канальцев
11.2.1. Дистальный ПКА
Дистальный ПКА развивается при нарушении
подкисления мочи в дистальном отделе нефро-
на. Патогенез заболевания связывают с отсут-
ствием секреции ионов водорода в просвет
канальца или с обратной диффузией ионов во-
дорода из просвета канальца в клетку. Как воз-
можную причину обсуждают также снижение
доступности мочевых буферов — аммония и
фосфатов. Доступность аммония может быть
снижена из-за ухудшения его образования или
из-за неадекватного накопления в почечном
интерстиции. В любых условиях, даже при на-
личии системного ацидоза (в том числе и при
нагрузке хлоридом аммония), моча остается
щелочной, pH мочи не становится ниже 6,0;
реабсорбция бикарбонатов в проксимальных ка-
нальцах не снижена. Развивается системный
ацидоз с цепью метаболических нарушений,
приводящих к тяжелой гипокалиемии, гипер-
кальциурии. Избыток кальция в моче, а также
снижение почечной экскреции цитратов вслед-
ствие высокого pH мочи создают предпосылки
для образования кальциевых камней, развития
нефрокальциноза (при pH мочи около 6,0 эк-
скретируемый кальций становится нераствори-
мым и легко осаждается). Потеря кальция кос-
тной тканью вызывает рахитоподобные изме-
нения костей. Результатом системного ацидоза
является остеомаляция, нередко тяжелая, со-
провождающаяся болями в костях, патологичес-
кими переломами. Возможны анорексия, затор-
моженность, мышечная слабость.
Дистальный тубулярный ацидоз может быть
самостоятельной нозологической формой (син-
дром Баттлера — Олбрайта). Это наследствен-
ное заболевание, передающееся аутосомно-до-
минантным путем. Первые симптомы болезни
возникают обычно на 2—3-м году жизни, но
могут впервые проявляться и у взрослых, в
связи с чем выделяют «взрослый» тип дисталь-
ного ПКА. Клиническая картина син-
дрома Баттлера — Олбрайта: отставание в рос-
те, мышечная слабость (в тяжелых случаях
вплоть до параличей), полиурия, поражение
костей в виде остеомаляции у взрослых и ра-
хита у детей, возникновение нефрокальциноза
и нефролитиаза с сопутствующим пиелонефри-
том или рецидивирующей инфекцией мочевых
путей.
Кроме первичной, генетически обусловлен-
ной формы, может быть вторичная форма дис-
тального ПКА, которая нередко выявляется при
таких патологических состояниях, как аутоим-
мунные болезни (состояние после трансплан-
тации почки, синдром Шегрена, криоглобули-
немия, фиброзирующий альвеолит, первичный
билиарный цирроз печени, хронический актив-
ный гепатит, СКВ); токсические и лекарствен-
ные нефропатии, возникающие при воздей-
ствии амфотерицина В, метициллина, аналь-
гетиков, лития; первичный гиперпаратиреоиз,
отравление витамином D, гипертиреоз, медул-
лярная губчатая почка; пиелонефрит, обструк-
ция мочевых путей; наследственные системные
325
заболевания (синдром Элерса — Данлоса, сер-
повидно-клеточная анемия, болезнь Фабри).
При дифференциальном диагнозе первично-
го (наследственного) дистального ПКА неко-
торую помощь может оказать определение экс-
креции кальция с мочой, которая будет нор-
мальной или повышенной у больных с генети-
чески обусловленным дистальным ПКА и, как
правило, пониженной у больных с приобретен-
ной формой дистального ПКА. Кроме того,
гипокалиемия чаще возникает при наследствен-
ной форме заболевания.
Основным тестом для диагностики дисталь-
ного ПКА остается нагрузка хлоридом аммония
или хлоридом кальция; при этом pH мочи не
становится ниже 6,0; pH ниже 6,0 и особенно
ниже 5,5 исключает диагноз дистального ПКА.
Введение хлорида аммония или хлорида каль-
ция не показано больным, у которых имеется
выраженный метаболический ацидоз.
Коррекция дистального ПКА требует введе-
ния небольших доз бикарбонатов — 1—3 ммоль/
(кг • сут), т.е. около 0,2 г бикарбоната натрия на
1 кг массы тела.
Наряду с «классическим» дистальным ПКА,
протекающим с гипокалиемией, выделяют ва-
рианты дистального ПКА с гиперкалиемией, на-
рушением синтеза альдостерона и/или появле-
нием резистентности канальцев к альдостеро-
ну. Альдостерон увеличивает секрецию в дис-
тальном нефроне как калия, так и водорода; его
дефицит приводит к снижению секреции ионов
водорода, нарушению ацидификации и к ги-
перкалиемии.
Дистальный ПКА с гиперкалиемией разви-
вается при вторичном и первичном гипоальдо-
стеронизме, врожденной гиперплазии надпо-
чечников с потерей солей, гипоренинемичес-
ком гипоальдостеронизме и псевдогипоальдос-
теронизме.
Гипоренинемический гипоалъдостеронизм —
состояние, в основе которого лежит низкая
секреция ренина, не отвечающая на обычные
стимулы (вертикальное положение, низконат-
риевая диета). Уровень альдостерона снижен,
вторично по отношению к снижению ренина.
Синдром характеризуется метаболическим аци-
дозом и гиперкалиемией, не соответствующи-
ми степени снижения СКФ; наблюдается при
сахарном диабете, тубулоинтерстициальном не-
фрите, обструктивной нефропатии, нефроан-
гиосклерозе с умеренной почечной недостаточ-
ностью. Может развиваться при отторжении
почечного трансплантата, а также при лечении
НСПП [Kutyrina I.M. et al., 1979].
Лечение минералокортикоидами устраняет
гиперкалиемию и метаболический ацидоз (хотя
возможны гипертония и задержка жидкости).
У части больных эффективны «петлевые» диу-
326
ретики в сочетании с бикарбонатом натрия.
Псевдогипоальдостеронизм — это редкий син-
дром, характеризующийся нечувствительностью
рецепторов канальцевого эпителия к альдосте-
рону и его повышенной экскрецией, избыточ-
ной потерей натрия вследствие нарушения его
реабсорбции. Отмечаются большая потеря жид-
кости без чувства жажды, дегидратация, соле-
вое истощение, дистрофия. Содержание альдо-
стерона в сыворотке и моче, а также активность
ренина в плазме крови повышены соответствен-
но степени дегидратации. Заболевание проявля-
ется в детстве, имеет врожденный или наслед-
ственный характер (наследуется по аутосомно-
рецессивному типу).
Лечение заключается в дополнительном при-
еме натрия хлорида. При тяжелой гипонатрие-
мии показано его внутривенное введение (изо-
тонический или даже 2 % раствор натрия хло-
рида, который содержит 34 ммоль натрия в
100 мл).
11.2.2. Нарушения транспорта воды,
натрия, калия
Почечный несахарный диабет — синдром, вклю-
чающий в себя полиурию с неспособностью
концентрировать мочу и полидипсию; развива-
ется при отсутствии реакции клеток эпителия
дистальных канальцев и собирательных трубо-
чек на АДГ (поэтому болезнь называется так-
же вазопрессинрезистентным несахарным диа-
бетом). Несмотря на нормальную концентрацию
биологически полноценного вазопрессина
(АДГ) в крови и нормальную осмолярность
плазмы, экскретируется большое количество
гипотонической мочи. У мальчиков это может
быть самостоятельное наследственное заболева-
ние (с рецессивным, сцепленным с полом
типом наследования). От отца к сыну заболе-
вание не передается, а у матери больного ре-
бенка, как правило, умеренно снижена концен-
трационная функция почек и незначительная
полиурия.
Полиурия, лихорадка, рвота, судороги по-
являются с 1-й недели жизни. Часты дегидра-
тация и гипернатриемия, в тяжелых случаях —
судороги, лихорадка, рвота. Нередко эти сим-
птомы появляются при переходе с грудного
вскармливания на искусственное (коровье мо-
локо), что связано с увеличением осмотичес-
кой нагрузки. У детей старшего возраста выра-
жены полиурия, никтурия, полидипсия, отста-
вание в росте, гидронефроз. У нелеченых боль-
ных повышено содержание в сыворотке крови
натрия, хлоридов, мочевины; характерна гипо-
стенурия (относительная плотность мочи не
превышает 1005).
Чаще почечный несахарный диабет развива-
ется как вторичный синдром при различной
патологии: заболеваниях почек, поражающих
преимущественно дистальный каналец (медул-
лярная кистозная болезнь, хроническая об-
структивная нефропатия, нефрокальциноз,
поликистоз почек), серповидно-клеточной ане-
мии, гипокалиемии, гиперкальциемии, при
воздействии токсинов и лекарств («просрочен-
ный» тетрациклин, соли лития, колхицин, ам-
фотерицин).
Для подтверждения диагноза нефрогенного
несахарного диабета и его отличия от гипофи-
зарного мочеизнурения используют пробу с
вазопрессином: при нефрогенном несахарном
диабете парентеральное (подкожное) введение
вазопрессина не вызывает (в отличие от гипо-
физарного несахарного диабета) концентрации
мочи и уменьшения ее объема. Отрицательный
вазопрессиновый тест не позволяет отдиффе-
ренцировать врожденный и приобретенный
почечный несахарный диабет, однако при при-
обретенном варианте болезни чувствительность
к вазопрессину в какой-то степени может со-
храняться.
Лечение заключается в приеме большого
количества жидкости и назначении гипотиази-
да. Последний, ингибируя реабсорбцию хлорида
натрия в восходящем отделе петли Генле,
уменьшает продукцию осмотически свободной
воды. Необходимо назначать препараты калия и
умеренно ограничивать поступление натрия,
контролируя их содержание в крови и моче.
В тех случаях, когда заболевание развилось в ре-
зультате лекарственного воздействия, обязатель-
но надо устранить токсичный агент. Обычно
после отмены препарата постепенно восстанав-
ливается способность к концентрированию
мочи.
11.3. Канальцевые дисфункции
с гипокалиемией
В эту группу включают заболевания различно-
го генеза, протекающие с гиперкалиурией, ги-
покалиемией и метаболическим алкалозом: в
основном это синдром Барттера и близкие к
нему состояния — синдром Гительмана и пре-
натальный гиперпростагландин — Е-синдром,
а также псевдогиперальдостеронизм (синдром
Лиддла).
11.3.1. Синдром Барттера
Для синдрома Барттера характерны:
• гиперкалиурия;
• гипокалиемия;
• гиперальдостеронизм;
• нормальное артериальное давление.
При синдроме Гительмана, который некото-
рые авторы выделяют из синдрома Барттера,
помимо этих признаков, наблюдаются также
гипомагниемия и гипокальциурия. В основе син-
дрома Барттера — Гительмана лежит усиленная
продукция сосудорасширяющих и натрийурети-
ческих почечных простагландинов, которые,
приводя к гиповолемии, стимулируют ренин-
альдостероновую систему. Обсуждается также
ведущая роль внутрипочечных дефектов транс-
порта натрия, хлоридов и калия. Не полностью
отрицается и первичная резистентность к прес-
сорному действию ангиотензина, предположен-
ная F.Bartter и соавт. (1962).
Синдром Барттера — Гительмана встреча-
ется редко как у детей, так и взрослых. Кли-
нические проявления обусловлены в первую
очередь гипокалиемией. Отмечается выраженная
мышечная слабость, нередки судороги, тета-
ния, купируемые внутривенным введением
калия, глухость сердечных тонов. На ЭКГ вы-
являют признаки гипокалиемии: уплощение, а
затем инверсию зубца Т, снижение сегмента
ST, появление зубца U. Наряду с гипокалиемией
могут быть гипонатриемия, гипокальциемия,
гипофосфатемия. Длительная гипокалиемия
приводит к развитию гипокалиемической не-
фропатии, выражены полиурия, полидипсия,
никтурия, гипостенурия. Реакция мочи щелоч-
ная, потеря хлоридов большая.
Несмотря на крайне высокую активность
ренин-альдостероновой системы и гиперплазию
ЮГА, никогда не отмечается артериальной
гипертонии, артериальное давление не повы-
шается как при увеличении объема внеклеточ-
ной жидкости, так и при введении экзогенно-
го ангиотензина II.
Расшифровка молекулярных основ различ-
ных вариантов течения синдрома Барттера по-
зволяет более четко представить этиологичес-
кую характеристику заболевания (табл. 11.1). Од-
нако описаны случаи развития в семье как
класического синдрома Барттера, так и синд-
рома Гительмана [Turman М., 1998].
Дифференциальный диагноз проводят с ги-
покалиемией, развившейся в результате зло-
употребления диуретиками (необходимы тща-
тельный сбор анамнеза, определение концент-
рации диуретиков в моче), слабительными,
психогенной рвоты (при этом экскреция хло-
ридов с мочой не повышена).
В лечении основное место занимают ин-
гибиторы синтеза простагландинов, снижаю-
щие уровень ренина и альдостерона в крови и
повышающие содержание калия в плазме кро-
ви (индометацин, ибупрофен). Имеется опыт
Таблица 11.1. Генетические варианты синдрома
Барттера [по F.Hildebrandt, 1998]
Варианты болезни Мутантный ген (хромосома) Продукт гена Клиничес- кая кер- тина
Тип 1 NKCC2(15q) Чувствительный к фуросемиду Na/K/2C1 транс- портный белок Неона- тальный
Тип II ROMK(11q24) АТФ-зависимый белок К-канала То же
Тип III CLCNKB(1p36) Белок базодила- терального С1-канала Класси- ческий?
Синдром Гитель- мана NCCT(16q13) Чувствительный к тиазидам Na/CI транспортный белок Синдром Гитель- мана
использования нестероидных противовоспали-
тельных средств при синдроме Барттера на про-
тяжении 25 лет. Возможно нефротоксическое
действие в виде появления протеинурии и сни-
жения СКФ. При отмене ибупрофена признаки
нефротоксичности могут исчезнуть [Schach-
ter A. et al., 1998].
В настоящее время установлено, что синд-
ром Барттера — аутосомно-рецессивно насле-
дуемая тубулопатия с фено- или генотипичес-
кой гетерогенностью [Rodriguez-Soriano J., 1998].
Клинически различают «неонатальный» и
«классический» варианты синдрома Барттера.
Для неонатального синдрома характерны тяже-
лое, угрожающее жизни течение болезни с
полиурией, потерей солей, дегидратацией, ги-
пертермией, гиперкальциурией с развитием
нефрокальциноза и гиперпростагландинурии.
Классический вариант синдрома Барттера на-
чинается позднее, протекает не столь катаст-
рофично, нефрокальциноз для него нехаракте-
рен. Синдром Гительмана может впервые про-
явиться у взрослого человека. Различие клини-
ческого течения синдрома Барттера зависит от
молекулярной основы болезни (см. табл. 11.1).
11.3.2. Псевдогиперальдостеронизм
(синдром Лиддла)
Это наследственное заболевание с передачей по
аутосомно-доминантному типу, характеризую-
щееся гипокалиемией, нормальным или низким
уровнем альдостерона сыворотки, метаболичес-
ким алкалозом и тяжелой гипертонией (низко-
рениновой, объемзависимой). Основной пато-
физиологический механизм — избыточное вы-
деление калия и задержка натрия почечными
канальцами, несмотря на низкое содержание
альдостерона в плазме. У больной, описанной
Лидцлем в 1963 г., через 26 лет (в 1989 г.)
развилась почечная недостаточность.
В настоящее время определена локализация
генов, мутация которых обусловливает разви-
тие болезни Лиддла — это гены на хромосоме
16р 12.2—13.11. и 12р.13.1. Именно эти гены
имеют отношение к водно-натриевому гомео-
стазу [Strautnieks S. et al., 1996].
Лечение — назначение триамтерена или
амилорида, непосредственно действующих на
транспорт натрия в дистальном канальце; если
не помогает один из этих препаратов, следует
назначать другой; препараты не принимают на
ночь, так как реабсорбция и выделение натрия
происходят в основном днем. Необходимо ог-
раничить прием натрия и дополнительно вво-
дить калий. Спиронолактоны обычно неэффек-
тивны. Трансплантация почки корригирует
большую часть нарушений.
Литература
Brenner R.J. Incidence of radiographically evident bone
disease, nephrocalcinosis and nephrolithiasis in various
types of renal tubular acidosis//New Eng. J. Med. —
1982. - Vol. 307. - P. 217-221.
Haycock G.B., AI-Dahhan J., Mak R.H., Chantier C.
Effect of indomethacin on clinical progress and renal
function in cystinosis//Arch. Dis. Child. — 1982. — Vol.
57. - P. 934-939.
Kutyrina I.M., Androsova S.O., Tareyeyva I.E. Indometha-
cin-induced hyporeninaemic hypoaldosteronism//
Lancet. - 1979. - Vol. 1. - P. 785
Rodriguez-Soriano J. Bartter and related syndromes: the
puzzle is almost solved//Pediatr. Nephrol. — 1998. — Vol.
12 (4). - P. 315-327.
Schachter A., Arbus G., Alexander R. et al. Non-steroid
anti-inflammatory drug-associated nephrotoxicity in
Bartter syndrome//Pediatr. Nephrol. — 1998. — Vol. 12. —
P. 775-777.
Turman M. Concomitant occurence of Gitelman and
Bartter syndromes in the same family//Pediatr.
Nephrol. - 1998. - Vol. 12. - P. 23-25.
Глава 12
ТУБУЛОИНТЕРСТИЦИАЛЬНЫЕ
НЕФРОПАТИИ
И.Е.Тареева
Понятие «тубулоинтерстициальные нефропа-
тии» в широком смысле слова включает в себя
воспалительные, метаболические или токсичес-
кие заболевания почек, протекающие в отли-
чие от гломерулярных (клубочковых) болезней
с первичным и преимущественным поражени-
ем канальцев и межуточной ткани почек; в бо-
лее узком смысле слова — метаболические и
токсические поражения без четкого воспали-
тельного компонента; при воспалительных,
иммуновоспалительных поражениях канальцев
и интерстиция используется термин «тубулоин-
терстициальный нефрит», или «интерстициаль-
ный нефрит». Помимо тубулоинтерстициальных
нефропатий как самостоятельных нозологичес-
ких форм, может быть выделен тубулоинтерсти-
циальный компонент при ряде клубочковых
поражений почек, в том числе и при хрони-
ческом гломерулонефрите.
Термин «интерстициальный нефрит» суще-
ствует с середины XIX в., но на протяжении
полутора веков включал в себя различные по-
нятия. Из общих рамок нефрита уже в 1852—
1853 гг. P.Rayer выделил интерстициальный
нефрит. Термин «хронический интерстициаль-
ный нефрит» долгое время соответствовал со-
временному пониманию поражения почек при
гипертонической болезни — нефроангиоскле-
розу, первичной сморщенной почке, т.е. обо-
значал те типы патологии почек, в основе ко-
торых лежит поражение сосудов. Затем в эту
группу стали включать и вторично сморщенную
почку, хронический нефрит гипертонического
типа. Интерстициальному нефриту противопо-
ставляли канальцевый, паренхиматозный не-
фрит с отечным синдромом (соответствовавший
современному нефриту с нефротическим син-
дромом). В первой половине XX в. параллельно
применяли термин «тубулоинтерстициальный
нефрит» для обозначения острой почечной не-
достаточности (ОПН). Е.М.Тареев в руководстве
«Нефриты» не пользовался термином «интер-
стициальный нефрит» для обозначения ОПН,
включая эту форму в группу острых токсичес-
ких и инфекционных поражений почек.
Интерстициальный нефрит (ИН), соответ-
ствующий современному толкованию данного
понятия, был впервые описан в 1898 г. Каун-
сильменом у больных, перенесших дифтерию
и скарлатину. Однако очень долго ИН отожде-
ствляли исключительно с пиелонефритом и он
являлся прерогативой изучения урологов. И в
настоящее время ИН недостаточно известен
широкому кругу врачей, что связано, во-пер-
вых, с относительной редкостью заболевания,
во-вторых, — с неспецифичностью большин-
ства симптомов и, в-третьих, — с тем, что зна-
чительную часть случаев острого ИН в силу
клинических особенностей отождествляют с
ОПН, не определяя ее природу. Так, среди
наблюдавшихся нами до 1992 г. 22 больных ос-
трым ИН 20 поступили с другим диагнозом:
12 — хронический гломерулонефрит; 3 — ост-
рый ГН; 2 — пиелонефрит; 3 — системная крас-
ная волчанка. Вместе с тем ИН в большинстве
случаев — заболевание с установленной этио-
логией, перспективное в плане лечения и про-
филактики.
Современный интерес к тубулоинтерстици-
альным поражениям можно объяснить возмож-
ностью их лечения и профилактики (явно боль-
шими, чем при гломерулярных заболеваниях),
учащением вообще ятрогенной патологии, ус-
тановлением физиологической роли почечно-
го интерстиция с его концентрационно-реаб-
сорбционной и эндокринной функциями, а
также ведущей ролью интерстиция и канальцев
в прогрессировании заболеваний почек.
329
В клинической картине тубулоинтерстици-
альных нефропатий важное место занимают
канальцевые расстройства, с преимуществен-
ным поражением того или иного отдела нефро-
на — полиурия, снижение относительной плот-
ности мочи, почечная глюкозурия, почечный
несахарный диабет, почечный канальцевый
ацидоз, гипо- или гиперкалиемия, гипоурике-
мия, канальцевая протеинурия. Термин «тубу-
лоинтерстициальный нефрит» эквивалентен
термину «интерстициальный нефрит», однако
по сравнению с последним более четко подчер-
кивает функциональные канальцевые аспекты
процесса.
По течению различают острые и хроничес-
кие ИН.
12.1. Острые
тубулоинтерстициальные
нефриты
Острые ИН характеризуются острым началом
с лихорадкой, гематурией, часто с ОПН (с по-
лиурией, реже с олигурией), иногда с болями
в пояснице. Обычна умеренная протеинурия,
небольшая лейкоцитурия; возможна макрогема-
турия, а также эозинофилурия.
Морфологически характерна выраженная
мононуклеарная (в основном лимфоцитарная)
инфильтрация интерстиция; инфильтраты со-
четаются с отеком интерстиция и поражением
эпителия канальцев. Иногда можно выявить
эпителиоидные и гигантоклеточные гранулемы.
Клиническая картина острого ИН во
многом определяется этиологией, в зависимо-
сти от которой острый ИН можно разделить на
следующие группы:
• лекарственные;
• инфекционные;
• связанные с системными болезнями;
• идиопатические.
К развитию лекарственного острого ИН мо-
гут приводить многие лекарственные препара-
ты, чаще всего антибиотики — группы пени-
циллина (пенициллин, ампициллин, оксацил-
лин, метициллин), цефалоспорины, тетрацик-
лины, противотуберкулезные (рифампицин,
этамбутол) и др., а также нестероидные про-
тивовоспалительные препараты. Особенно час-
то острый ИН развивается после лечения ме-
тициллином. Впрочем, случаи острого ИН опи-
саны после лечения и многими другими пре-
паратами, в том числе сульфаниламидами (пер-
вые описания острого лекарственного ИН),
ацикловиром, диуретиками, аллопуринолом,
циметидином, фенилином и даже китайскими
330
лечебными травами (см. также раздел «Лекар-
ственные поражения почек»).
Наиболее признана иммунная концепция
патогенеза лекарственного острого ИН, в
пользу которой говорит обнаружение в ’/ слу-
чаев почечных биопсий мононуклеарно-клеточ-
ных инфильтратов с неказеозными гранулема-
ми в интерстиции, возникновение реакций
гиперчувствительности замедленного типа после
внутрикожной пробы с повреждающим лекар-
ством, преобладание Т-лимфоцитов среди кле-
ток инфильтрата. Иммунофлюоресцентные ис-
следования в некоторых случаях острого ИН
выявляют депозиты иммуноглобулинов и ком-
племента в интерстиции и на тубулярной ба-
зальной мембране, реже — линейное отложе-
ние IgG.
Клинические признаки острого ле-
карственного ИН разнообразны и неспецифич-
ны, иногда об этом заболевании могут свиде-
тельствовать симптомы распространенной ал-
лергии. Первым клиническим признаком лекар-
ственного ОИН бывает также повторная волна
лихорадки после успешного лечения инфекции
антибиотиками, часто в сочетании с эозино-
филией, кожными высыпаниями. Характерна
гематурия; протеинурия обычно умеренная,
редко превышает 2 г/сут. ОПН — один из ос-
новных и наиболее постоянных признаков
ОИН, выявляют одновременно с мочевым син-
дромом: снижена скорость клубочковой филь-
трации; повышен уровень креатинина, поли-
урия; олигурия встречается редко. В наших на-
блюдениях ОПН разной степени выраженнос-
ти диагностирована у 18 из 19 больных, у всех
была полиурия. Существенным диагностическим
признаком является снижение канальцевых
функций — в первую очередь следует обращать
внимание на выраженную депрессию относи-
тельной плотности мочи. Описаны почечный
несахарный диабет, почечный канальцевый
ацидоз, гипонатриемия из-за потери натрия и
гиперкалиемия вследствие нарушения экскре-
ции калия при метициллиновом ИН. С рифам-
пицином связывают такие канальцевые рас-
стройства, как повышение экскреции калия и
мочевой кислоты с соответствующим снижени-
ем этих веществ в крови, глюкозурию. Тетра-
циклины с истекшим сроком годности, а так-
же гентамицин могут вызывать синдром Фан-
кони — комплексную канальцевую дисфунк-
цию.
Из лабораторных показателей характерны
анемия, повышение СОЭ, гиперпротеинемия,
гипергаммаглобулинемия.
В диагностическом плане имеют значение
другие (внепочечные) признаки аллергической
реакции — лихорадка, кожные высыпания,
артралгии, лекарственный гепатит и др. Прав-
'W»"
да, классическая триада — лихорадка, кожные
высыпания и артралгии — встречается лишь в
15—20 % случаев. Среди наших 19 больных с ос-
трым лекарственным ИН все имели те или
иные внепочечные проявления заболевания,
наиболее частыми из которых были лихорадка,
наблюдавшаяся у 2/, больных, и кожный синд-
ром; более редкими были артралгии. У всех
пациентов была резко повышена СОЭ до 40—
60 мм/ч, более чем у '/2 — анемия, у ’/3 —
гиперпротеинемия, у подавляющего большин-
ства — гипергаммаглобулинемия.
Критерии диагностики острого лекарствен-
ного ИН:
• временная связь с приемом лекарств;
• умеренный мочевой синдром с протеинури-
ей, не превышающей 2 г/сут, преобладание
эритроцитов в осадке мочи;
• неолигурическая ОПН разной степени вы-
раженности, не сопровождающаяся гиперка-
лиемией и артериальной гипертонией;
• большая частота разнообразных канальцевых
расстройств, среди которых в 100 % случаев
встречается концентрационный дефект;
• белковые сдвиги в виде увеличения СОЭ,
гиперпротеинемии и гипергаммаглобулине-
мии;
• анемия;
• внепочечные проявления в виде лихорадки,
кожного синдрома, а также поражения пе-
чени.
Лечение — в первую очередь немедленная
отмена лекарственного препарата, приведшего
к поражению почек. При отсутствии эффекта
через 2—3 дня назначают глюкокортикоиды
(преднизолон 60—80 мг/сут); при ОПН прово-
дят гемодиализ.
Острые лекарственные ИН обычно имеют
циклическое течение. При достаточно быстро
поставленном диагнозе ИН после отмены ал-
лергизирующего препарата обычно наступает
выздоровление; случаи хронизации редки, хотя
период обратного развития может быть очень
длительным. Иногда (особенно в запущенных
случаях, с длительным беспорядочным лечени-
ем — обычно антибиотиками, назначаемыми
из-за персистирующей лихорадки) острый ле-
карственный ИН может принимать хроничес-
кое течение.
Лекарственный острый ИН с ОПН может
развиваться и при хроническом ГН, и не только
после приема антибиотиков, но иногда и фу-
росемида, фенилина, аллопуринола и др., си-
мулируя обострение основного заболевания.
К инфекционным ОИН относят вирусные,
бактериальные и паразитарные.
Среди вирусных острых ИН наибольшее зна-
чение имеет геморрагическая (дальневосточная)
лихорадка с почечным синдромом (см. также
главу 35, с. 572). Болезнь впервые описана на
Дальнем Востоке в 30-х годах. Заражение про-
исходит от инфицированных грызунов.
В Южной Корее в 1978 г. выделен специфичес-
кий антиген в криостатных срезах легочной
ткани полевых мышей, а затем и сам вирус,
названный Хантаан, по имени реки, в долине
которой были отловлены инфицированные ви-
русом грызуны. В настоящее время вирус ГЛПС
выделен у 55 видов животных, являющихся его
носителями. Наиболее инфицированы вирусом
несколько видов полевых мышей, серая и чер-
ная крысы. Однако антитела к вирусу выявле-
ны и у таких животных, как морские свинки,
собаки, цыплята и свиньи.
В России природные очаги — на Дальнем
Востоке, в Башкирии, на Урале. Описаны
вспышки ГЛПС в Северном Китае, Южной
Корее, Японии, Венгрии, Скандинавских стра-
нах. Отдельные случаи диагностируются в стра-
нах Центральной Европы. Недавно мы наблю-
дали больного, заразившегося в Московской
области.
Заболевание чаще наблюдается весной и
осенью. Болезнь начинается лихорадкой, недо-
моганием, затем появляются кровоизлияния (в
слизистые оболочки и подкожные кровоизли-
яния), тромбоцитопения, с 5—7-го дня разви-
ваются мочевой синдром и олигурическая ОПН
с выраженными электролитными сдвигами и
гиперволемией. Возможны поражение желудоч-
но-кишечного тракта, органов дыхания, сер-
дечно-сосудистой системы, тяжелая интоксика-
ция. Однако, как правило, именно тяжесть
почечной патологии определяет прогноз болез-
ни. Морфологически характерны интерстици-
альный нефрит и множественные кровоизлия-
ния в почках, особенно в лоханках. Кровоиз-
лияния обнаруживают также под плеврой, эпи-
кардом, капсулой селезенки и т.д. Наряду с
иммунокомплексным механизмом в патогене-
зе ГЛПС обсуждается роль прямого нефроток-
сического действия вируса, нарушений микро-
циркуляции, синдрома ДВС.
Лечение направлено на борьбу с инток-
сикацией и проявлениями ОПН. В настоящее
время начинают применять противовирусную
терапию — рибовирин, специфический имму-
ноглобулин.
Описаны случаи ОИН и при других вирус-
ных инфекциях, вызванных ВИЧ [Nochy D.,
1993], цитомегаловирусом, вирусами Эпштей-
на — Барр, кори, коклюша.
Бактериальный острый ИН чаще полностью
соответствует острому пиелонефриту, который
может быть первичным, возникшим вследствие
гематогенного проникновения инфекции в ин-
терстициальную ткань, или же вторичным,
331
развившимся при наличии факторов, способ-
ствующих фиксации инфекции в почке. Обыч-
но это обструкция мочевых путей (врожденные
аномалии, камни и др.). Вторичный бактериаль-
ный острый ИН может развиваться и ретро-
градно — при пиелоренальном рефлюксе. В ряде
случаев бактериальная инфекция осложняет
абактериальный ИН, вызванный, например,
медикаментами.
ОИН может осложнять инфекции и в отсут-
ствие бактериемии или инвазии бактериями
почечной паренхимы, например при скарлати-
не и дифтерии, развиваясь в течение первой
недели болезни [Colvin R.B., Fang L.S., 1994].
Правда, в настоящее время это осложнение
встречается достаточно редко. ОИН может ос-
ложнять и другие инфекции — инфекционный
мононуклеоз, болезнь Кавасаки, иерсиниоз,
риккетсиозы.
Среди паразитарных острых ИН основное
значение имеет поражение почек при лепто-
спирозе, при котором еще в 1884 г. Н.М.Лю-
бимов описывал «промежуточное набухание по-
чек», а С.П.Боткин подчеркивал постоянство
острого гнездного интерстициального нефрита
(цит. по Е.М.Тарееву, 1958).
В почках, особенно в клетках и просвете
канальцев, обнаруживают многочисленные леп-
тоспиры; интерстиций инфильтрирован лимфо-
цитами, моноцитами, плазматическими клет-
ками и нейтрофилами. Клиническая картина
болезни характеризуется тяжелой интоксикаци-
ей, головной болью, лихорадкой, тахикардией.
На 3—4-й день болезни, часто одновременно
с желтухой и гепатолиенальным синдромом,
появляются протеинурия, эритроцит- и лейко-
цитурия, олигурическая ОПН, В большинстве
случаев признаки поражения почек постепен-
но исчезают; у отдельных больных интерстици-
альная инфильтрация может персистировать
месяцами. В особо тяжелых случаях возможна
смерть от уремии.
ОИН может развиваться при системных за-
болеваниях — СКВ, синдроме Шегрена, васку-
литах, саркоидозе, а также в трансплантирован-
ных почках.
При СКВ описан ряд случаев олигурической
ОПН с выраженными тубулоинтерстициальны-
ми изменениями при лишь умеренной патоло-
гии клубочков, с отложениями IgG и компле-
мента вдоль канальцевой базальной мембраны
[Griinfeld J.P. et al., 1993]. J.Rayadurg и A.E.Koch
(1990) наблюдали ОИН с ОПН у нескольких
больных с первичным синдромом Шегрена;
функция почек нормализовалась после стероид-
ной терапии. Описан острый гранулематозный
ИН (без поражения клубочков и сосудов почек)
у 2 больных с АНЦА — ассоциированным вас-
кулитом [Bridoux F. et al., 1994].
332
ОИН с ОПН может наблюдаться при сар-
коидозе и даже быть его первым изолирован-
ным проявлением [Warren G.V. et al., 1988;
Griinfeld J.P. et al., 1993]. Помимо лимфоцитар-
ной инфильтрации, в интерстиции выявляют
многоядерные гигантские клетки и гранулемы,
иногда — эозинофилы. Лечение преднизолоном
дает быстрый эффект.
В последние 15 лет наблюдают ОИН в соче-
тании с увеитом или с иритом без признаков
другой системной патологии, впервые описан-
ный R.Dobrin в 1975г. (в его наблюдении гра-
нулемы были также в костном мозге и лимфа-
тических узлах). Это сочетание предложено
выделять как отдельный синдром — ТИН-уве-
ит. Заболевание развивается у девочек-подрос-
тков и реже — у взрослых женщин, хорошо
поддается лечению кортикостероидами.
Болезнь начинается среди полного здоровья,
иногда имеются указания на аллергические ре-
акции в анамнезе. Сначала появляются неспе-
цифические симптомы — утомляемость, сла-
бость, потеря массы тела, реже — боли в по-
яснице, животе, суставах, миалгии, кожные
высыпания, лихорадка; через несколько не-
дель — признаки ОИН с дисфункцией прокси-
мальных и/или дистальных канальцев. Увеит,
как правило, развивается одновременно или
вслед за нефропатией, имеет тенденцию к ре-
цидивированию несмотря не лечение. Чаще на-
блюдают передний увеит, реже — задний. Ха-
рактерна гипергаммаглобулинемия.
В 1986 г. мы описали подобное наблюдение (И.Е.Та-
реева и соавт.). У больной П., 47 лет, в феврале 1985 г.
среди полного здоровья развился правосторонний
передний увеит, обнаружено повышение СОЭ до
23 мм/ч. Через 2 Нед присоединились жажда, поли-
урия (диурез 3,8 л/сут). В марте выявлены умеренная
анемия (Hb 11б г/л), увеличение СОЭ до 55 мм/ч,
снижение относительной плотности мочи до 1,007,
значительная лейкоцитурия, минимальная протеи-
нурия (0,09 г/л), глюкозурия (0,5 %). Самочувствие
ухудшилось: слабость, похудание, лихорадка. В апреле
1985 г. госпитализирована в клинику. При обследо-
вании обращали на себя внимание признаки почеч-
ной недостаточности (креатинин сыворотки крови
0,468 ммоль/л, КФ 14,6 мл/мин), гиперпротеинемия
(86 г/л), гипергаммаглобулинемия (32 г/л), гипонат-
риемия (130 ммоль/л), гипокалиемия (3,3 ммоль/л).
Развитие нефропатии с быстро прогрессирующей
неолигурической почечной недостаточностью и вы-
раженными канальцевыми нарушениями позволило
предположить ОИН. Данные пункционной биопсии
почки подтвердили диагноз (обильная диффузная
лимфогистиоцитарная инфильтрация интерстиция и
канальцев коркового и мозгового слоев. Клубочки из-
менены незначительно). Терапия преднизолоном в
дозе 45 мг/сут способствовала исчезновению жалоб
и нормализации большинства лабораторных показа-
телей. Сохранялась небольшая протеинурия (0,6 г/л)
и сниженная относительная плотность мочи (1,010).
При попытке самостоятельно отменить преднизо-
лон снова появились признаки переднего увеита, суб-
фебрильная температура, слабость, жажда, полиурия.
Возобновлен прием преднизолона в дозе 30 мг/сут.
При динамическом обследовании в январе 1988 г.
отмечена стойкая ремиссия. Функция почек нормаль-
ная.
Особенностями данного наблюдения являют-
ся развитие синдрома ИН с увеитом у женщи-
ны в преклимактерическом периоде, дебют
заболевания передним увеитом, выраженные
электролитные расстройства — гипокалиемия и
гипонатриемия, которые в сочетании с тран-
зиторной глюкозурией, умеренной протеинури-
ей и полиурией свидетельствовали о пораже-
нии у больной проксимальных канальцев.
Наконец, ОИН может наблюдаться как са-
мостоятельное изолированное поражение по-
чек — идиопатический ОИН.
Мы наблюдали больную К., 19 лет, у которой в
июне 1985 г. без видимой причины появились суб-
фебрильная температура, слабость, похудание. При
обследовании выявлены: анемия (НЬ 100 г/л), уве-
личение СОЭ (70 мм/ч), гиперпротеинемия (85 г/л),
гипергаммаглобулинемия (26 г/л), снижение отно-
сительной плотности мочи в пробе Зимницкого
(1,003—1,013), протеинурия (0,19 г/л), лейкоцитурия
(30 в поле зрения). Имелись признаки почечной не-
достаточности (креатинин сыворотки 0,12 ммоль/л,
КФ 36 мл/мин). Обращала на себя внимание выра-
женная и стойкая гипоурикемия 231 мкмоль/л.
Тщательное обследование в клинике позволило
исключить заболевание крови, СКВ, ХАГ и диагно-
стировать острый ТИН. Биопсия почки подтвердила
диагноз. При иммунофлюоресцентной микроскопии
выявлена фиксация СЗ на базальной мембране ка-
нальцев.
За время пребывания больной в клинике намети-
лась самостоятельная ремиссия болезни: исчезли ане-
мия, диспротеинемия, снизилась СОЭ до 30 мм/ч. Нор-
мализовались показатели креатинина, мочевой кислоты
в сыворотке крови и клубочковой фильтрации. Исчез
мочевой синдром, относительная плотность мочи по-
высилась до 1,016. При последующем наблюдении в те-
чение 12 лет патологии не выявлено.
Этиологию ОИН у данной больной устано-
вить не удалось. Особенностью данного случая
является стойкая гипоурикемия на высоте за-
болевания, генез которой, очевидно, связан с
нарушением реабсорбции мочевой кислоты в
почечных канальцах.
12.2. Хронические тубулоинтер-
стициальные нефропатии
Хронические тубулоинтерстициальные нефро-
патии — полиморфная группа болезней, свя-
занных с различными этиологическими факто-
рами и протекающих с прогрессирующими
канальцевыми расстройствами, морфологичес-
ки характеризующихся диффузной мононукле-
арной инфильтрацией интерстиция, прогресси-
рующим склерозом стромы, выраженной дис-
трофией или атрофией эпителия канальцев.
Хронические ТИН могут быть обусловлены
лекарственными средствами, метаболическими
нарушениями (гиперурикемия, оксалурия, ги-
перкальциемия), интоксикацией тяжелыми ме-
таллами (свинцом, кадмием, цинком), злока-
чественными новообразованиями, а также не-
которыми заболеваниями с четким иммунным
патогенезом. Таким образом, факторы, приво-
дящие к острым ИН, играют важную роль и в
развитии хронических интерстициальных пора-
жений, но значимость их несколько иная — ме-
ханизм действия лекарств связан скорее с пря-
мым токсическим влиянием, чем с реакциями
гиперчувствительности; этиологическое значе-
ние метаболических расстройств и токсичных
воздействий выше, чем иммунных нарушений.
В ряде случаев причину ХИН установить не
удается (идиопатический ХИН).
Клиническая картина определяется
постепенно прогрессирующими канальцевыми
расстройствами. Относительно рано возникают
нарушения водно-электролитные и концентра-
ционной функции почек, т.е. те функциональ-
ные сдвиги, которые при первично клубочко-
вых поражениях обычно являются признаком
развернутой почечной недостаточности. Нередко
именно выявление водно-электролитных нару-
шений при минимальных изменениях мочево-
го осадка позволяет установить диагноз не-
клубочкового поражения почек. Иногда пора-
жается преимущественно тот или иной отдел
нефрона, что сопровождается функциональны-
ми нарушениями, свойственными именно это-
му отделу, — проксимальной канальцевой не-
достаточностью с развитием проксимального
канальцевого ацидоза, глюкозурии, редко пол-
ного синдрома Фанкони, или дистальной ка-
нальцевой недостаточностью с формировани-
ем дистального канальцевого ацидоза, иногда
с гиперкалиемией или потерей натрия (сольте-
ряющая почка).
Лекарственный ХИН чаще всего развивается
при длительном регулярном приеме ненарко-
тических анальгетиков (анальгетических смесей).
Это так называемая анальгетическая нефропа-
тия — хронический ИН, протекающий с не-
крозом почечных сосочков (см. также раздел
«Лекарственные поражения почек»).
При морфологическом исследовании, поми-
мо признаков хронического ИН, выявляют
некроз почечных сосочков, специфическую
коричневую пигментацию почечных сосочков и
мочевыводящих путей и микроангиопатию со-
333
судов мочеточника (диагностический признак
злоупотребления анальгетиками).
В первые годы изучения АН основную по-
вреждающую роль отводили фенацетину, в свя-
зи с чем существовал термин «фенацетиновый
нефрит». Затем установили, что вреден не чис-
тый фенацетин, а анальгетические смеси,
включающие в себя фенацетин. Наконец, в те-
чение последнего десятилетия исследователи
показали, что АН может развиваться и у лиц,
никогда не принимавших фенацетина, но зло-
употреблявших другими анальгетическими
смесями. Таким образом фенацетин не рассмат-
ривается более как единственный нефротоксич-
ный препарат, подчеркивается возможная по-
вреждающая роль и других анальгетических сме-
сей, включающих два анальгетика, особенно в
сочетании с кофеином или кодеином, влияю-
щими на настроение и способными вызвать
психологическую зависимость от препарата.
АН наблюдается чаще у женщин старше 40
лет, страдающих мигренью или люмбалгиями,
клинически проявляется умеренным мочевым
синдромом (гематурия, небольшая протеину-
рия), полиурией, никтурией, ночными судоро-
гами. Ранним признаком (еще в доклинической
стадии) является снижение относительной
плотности мочи. У 70 % больных выявляют
абактериальную лейкоцитурию, у 33,3 % —
мочевую инфекцию (чаще бессимптомную).
Постепенно развивается ХПН, которая про-
грессирует медленно, сопровождается выражен-
ной остеодистрофией и тяжелым метаболичес-
ким ацидозом. Значительно чаще, чем при дру-
гих типах хронического ИН, наблюдается ги-
пертония, которая иногда может приобретать
злокачественное течение.
У 50 % больных возникает некроз почечных
сосочков, чаще бессимптомный, с минималь-
ной протеинурией, микрогематурией, но иног-
да с макрогематурией, с повторными эпизода-
ми обструктивной ОПН с быстрым спонтан-
ным восстановлением функции почек. Неред-
ким осложнением АН является рак почечных
лоханок; на развитие карциномы мочевыводя-
щего тракта может указывать персистирующая
микрогематурия.
Диагностически важно выявляемое при КТ-
исследовании уменьшение массы обеих почек
в сочетании с их неровными контурами и/или
с кальцификацией сосочков.
Осложнения: обструктивная ОПН (при дву-
стороннем папиллярном некрозе), присоедине-
ние пиелонефрита, нефрокальциноза, нефро-
литиаза. Из внепочечных признаков злоупотреб-
ления анальгетиками выделяют гипохромную
анемию со своеобразным бледно-желтым окра-
шиванием кожного покрова, поражение желуд-
ка (пептическая язва), печени (лекарственный
334
гепатит), ранний атеросклероз с прогрессиру-
ющей ишемической болезнью сердца, психас-
тению, преждевременное старение, раннее
поседение.
К развитию хронических ТИН могут приво-
дить и другие лекарства, например противоопу-
холевые препараты (цис-платина); литий, при-
меняемый в психиатрической практике; препа-
раты золота, циклоспорин и др.
Говоря о ятрогенных поражениях, следует
упомянуть и о радиационном нефрите, который
возникает иногда при лучевой терапии больных
опухолями почки (опухоль Вильмса), яичника,
яичка, забрюшинного пространства. Для ради-
ационного нефрита, описываемого обычно сре-
ди хронических тубулоинтерстициальных не-
фропатий, характерно поражение не только
канальцев и интерстиция, но и клубочков,
сосудов, в тяжелых случаях с их тромбозом и
некрозом, изменениями, напоминающими
ТТП.
При остром радиационном нефрите посте-
пенно появляются одышка, головная боль,
никтурия, отеки и гипертония; выявляют ане-
мию, протеинурию, умеренную азотемию. Хро-
нический радиационный нефрит может быть
исходом острого или развиться постепенно,
манифестируя протеинурией и снижением фун-
кции почек через год и позже после облучения.
Среди метаболических ТИН наиболее часто
встречаются гиперурикемическая и оксалатная
нефропатии. В развитии ИН при гиперурикемии
предполагается роль нескольких патогенетичес-
ких механизмов — закупорки мочеточников,
внутриканальцевого отложения кристаллов ура-
тов, нефротоксического действия гиперурике-
мии как таковой. Оксалатная нефропатия (по-
ражение почек при оксалурии) развивается
обычно в детском возрасте, как наследствен-
ный ИН или мочекаменная болезнь.
Менее часты и менее известны метаболичес-
кие поражения почек, развивающиеся при ги-
перкальциемии и при гипокалиемии.
Гиперкальциемия наблюдается при первичном
и вторичном гиперпаратиреозе, саркоидозе,
злокачественных новообразованиях и т.д. Отли-
чительным морфологическим признаком явля-
ется нефрокальциноз, мелкие отложения каль-
ция часто обнаруживают в почках при биопсии
или на аутопсии, образование камней может
вести к обструктивной нефропатии. Особенно
характерны функциональные сдвиги, в первую
очередь резкое снижение концентрационной
функции почек, связанное не только со струк-
турными изменениями (интралюминальная об-
струкция с асептическим интерстициальным
воспалением), но и с влиянием кальция на
регуляцию КФ и процессов реабсорбции в ка-
нальцах, нарушением внутриклеточного транс-
порта кальция, снижением чувствительности
канальцев к вазопрессину. Обсуждается возмож-
ная роль повышенной секреции простагланди-
нов. Клинически нефропатия характеризуется
полиурией, азотемией, в 50 % случаев — ги-
пертонией, возможны изменения мочи.
Структурные и функциональные изменения
почек развиваются при гипокалиемии (вернее,
не столько при снижении уровня калия во вне-
клеточной жидкости, сколько общего калия в
организме). Морфологически наиболее харак-
терно поражение эпителия проксимальных ка-
нальцев. Интерстиций обычно не поражается,
т.е. это скорее тубулопатия, чем ТИН. Функци-
ональные нарушения выражаются в первую оче-
редь в снижении концентрационной и кисло-
товыделительной функции почек и тенденции
к задержке натрия вплоть до образования оте-
ков.
Среди причин, хронических ТИН имеет
значение контакт с тяжелыми металлами —
свинцом и кадмием, а также ртутью, ураном
и германием.
Выделяют 3 клинические формы свинцовой
нефропатии [Wedeen Р.Р., De Broe М.Е., 1998].
• Острая свинцовая нефропатия, возникающая
после острого отравления свинцом, харак-
теризуется преходящим синдромом Фанко-
ни наряду с классическими признаками
свинцового отравления (боли в желудке, эн-
цефалопатия, периферическая нейропатия,
анемия).
• Хронический медленно прогрессирующий
ИН, развивающийся вследствие постепенно-
го накопления избытка свинца, часто без
симптомов острого отравления. Нередко со-
четается с подагрой и/или гипертонией, по-
является при профессиональных контактах со
свинцом, при длительном потреблении под-
польно производимых крепких напитков (са-
могона), очищаемых в содержащих свинец
емкостях (например, в старых радиаторах),
или при других длительных контактах (по-
суда).
• Гипертония, связанная с длительным кон-
тактом с малыми дозами свинца, возмож-
ность которой доказана эпидемиологически-
ми исследованиями [Nuyts J. et al., 1991].
Кадмий, широко применяющийся в совре-
менной промышленности, приводит к возник-
новению нефропатии, характеризующейся про-
ксимальной дисфункцией вплоть до полного
синдрома Фанкони, а также к развитию ХИН,
почечнокаменной болезни и (что не полностью
доказано) к гипертонии.
К группе ТИН относится также балканская
нефропатия — семейная тубулоинтерстициаль-
ная нефропатия, встречающаяся в отдельных
районах Боснии, Хорватии, Сербии, Болгарии
и Румынии. Болезнь обычно проявляется в воз-
расте 30—50 лет, через 15—20 лет приводя к
развитию ХПН.
Этиология не выяснена, обсуждается
роль тяжелых металлов (свинца, кадмия, крем-
ния), бактерий, вирусов, грибов, токсинов ра-
стений, а также генетических факторов.
Клиническая картина характеризует-
ся полиурией, полидипсией, никтурией, с по-
степенным развитием ХПН. Постоянно наблю-
дается анемия. Протеинурия и изменения мо-
чевого осадка минимальны, гипертония редка.
У больных (а также в их семьях) часты опухо-
ли мочевых путей (аналогично тому, что наблю-
дается при АН).
Следующей группой являются ТИН, разви-
вающиеся при заболеваниях с четким иммунным
патогенезом — при СКВ, синдроме Шегрена,
хроническом активном гепатите, тиреоидите, а
также при отторжении почечного трансплантата.
Наиболее часты тубулоинтерстициальные пора-
жения при СКВ; они развиваются как на фоне
поражения клубочков, так и в результате пря-
мого иммунного повреждения канальцев и ин-
терстиция. Помимо острого ТИН, а также ги-
перкалиемии, которую объясняют первичным
дефектом канальцевой секреции калия, описа-
ны латентные канальцевые дисфункции. Так,
H.Geer и соавт. (1987) наблюдали 25-летнюю
больную СКВ, у которой поражение почек
проявлялось интерстициальным нефритом с
почечным канальцевым ацидозом и почечной
недостаточностью (в литературе 5 таких описа-
ний). Часто обнаруживают ИК и комплемент в
базальной мембране канальцев и перитубуляр-
ных капилляров.
Тубулоинтерстициальные поражения могут
наблюдаться при болезни Шегрена с вовлече-
нием проксимальных канальцев, иногда с раз-
витием проксимального канальцевого ацидоза.
Описан случай болезни Шегрена, впервые про-
явившейся несахарным диабетом в сочетании
с почечным канальцевым ацидозом. В наших
наблюдениях у 6 из 12 больных болезнью Шег-
рена без клинических признаков поражения
почек было повышено содержание экскретиру-
емой фракции />2-макроглобулина, правда, не
так сильно, как при СКВ, у 5 больных была
снижена экскреция аммония.
Среди других системных заболеваний описан
ТИН с почечным тубулярным ацидозом при
хроническом активном гепатите и первичном
билиарном циррозе печени.
У наблюдавшегося нами больного вирусным хро-
ническим активным гепатитом с постоянной (в те-
чение 12 лет) активностью печеночного процесса со
2-го года заболевания были выявлены умеренный
мочевой синдром и щелочная реакция мочи, затем
. 335
развилась полиурия до 3 л/сут, а позднее до 6 л/сут
без эффекта от адиурекрина со снижением относи-
тельной плотности мочи до 1,001—1,003 (т.е. почеч-
ный несахарный диабет) и признаками почечного
канальцевого ацидоза. Повышение дозы преднизоло-
на до 60 мг способствовало восстановлению кислой
реакции мочи, уменьшению диуреза до 2 л и повы-
шению относительной плотности мочи до 1,013.
Больной умер. На вскрытии выявлен тяжелый интер-
стициальный нефрит с мононуклеарной инфильтра-
цией стромы и мозгового вещества, разрушением
инфильтратами базальной мембраны проксимальных
и дистальных канальцев, внедрением отдельных лим-
фоцитов в эпителий канальцев.
Мы наблюдали также тубулоинтерстициаль-
ные изменения при подостром инфекционном
эндокардите, что до 80-х годов в литературе не
описывалось. У 5 больных выраженные тубуло-
интерстициальные изменения были найдены на
вскрытии, у 3 — при биопсии почки; у этих
3 больных отмечалась фиксация СЗ компонен-
та комплемента на канальцевой базальной мем-
бране, у 1 из них вместе с IgG.
Наконец, к тубулоинтерстициальным пора-
жениям могут приводить опухоли (внепочеч-
ные), выделяющие патологические белки, ва-
зоактивные амины, гормоны. Наиболее изуче-
на ТИН при миеломе, составляющая основу
миеломной почки, связанная с избыточным
образованием легких цепей иммуноглобулинов,
которые в норме катаболизируются в почке (см.
главу «Почки при парапротеинемиях»).
Поражение почек, похожее на миеломную
почку, иногда встречается при других опухолях,
при которых наблюдают гиперпродукцию мо-
ноклональных иммуноглобулинов (при злока-
чественных лимфомах, лимфолейкозе, опухо-
ли поджелудочной железы).
Таким образом, если под термином «тубу-
лоинтерстициальные нефропатии» понимать
болезни почек, при которых канальцы и ин-
терстиций являются субстратом первичного
поражения или субстратом, повреждение кото-
рого доминирует в клинической картине, то
становится ясным, насколько часта и многооб-
разна эта патология, нередко приводящая к
развитию ХПН. Изученность этиологических
факторов, часть из которых может быть выяв-
лена и устранена (это касается в первую оче-
редь лекарственных воздействий и метаболичес-
ких нарушений), делает возможным обратное
развитие нефропатий и открывает пути для их
профилактики.
Литература
Тареева И.Е., Кравец Т.А., Проскурнева Е.П. Острый
тубулоинтерстициальный нефрит, сочетающийся с
увеитом//Гер. арх. — 1996. — № 8. — С. 89—92.
Colvin R.B., Fang L.S.T. Interstitial nephritis//Renal
pathology with clinical and functional correlations/Ed.:
C.C.Tisher, B.M.Brenner.— Philadelphia: Lippincott.—
1994. - Vol. 1. - P. 723-768.
Gr'iinfeld J.P., Kleinknecht D., Droz D. Acute interstitial
nephritis//Diseases of the kidney. — 5nd ed./Ed.
R.W.Schrier, C.W.Gottshalk. - 1993. - Vol. 2. - P.
1331-1353.
Nochy D. Renal disease associated with HIV infection//
Nephrology, Dialysis, Transplantation. — 1993. —
Vol. 8. - P. 11-19.
Nuyts G., Dalemans R.A., Jorens J. et al. Does lead play
a role in the development of chronic renal disease?//
Nephrology, Dialysis, Transplantation. — 1991. — Vol.
6. - P. 307-315.
Rayadurg J., Koch A.E. Renal insufficiency from
interstitial nephritis in primary Sjogren’s syndrome//}.
Rheumatology. - 1990. - Vol. 17. - P. 1714-1718.
Warren G. V., Sprague S.M., Corwin H.L. Sarcoidosis
presenting as acute renal failure during pregnancy//Amer.
J. Kid. Dis. - 1988. - Vol. 12. - P. 161-163.
Weeden P.P., De Broe M.E. Heavy metals and the kidney/
/Oxford textbook of clinical nephrology. — 2nd ed./Ed.
A.M.Davison, J.St.Cameron et al. — 1998. — Vol. 2. — P.
1176-1201.
Глава 13
НАСЛЕДСТВЕННЫЕ И ВРОЖДЕННЫЕ
НЕФРОПАТИИ
М. С. Игнатова
На рубеже XX и XXI вв. интенсивно изуча-
ется роль генетических влияний на развитие
разнообразной патологии у человека, что свя-
зано как с увеличением частоты генетически
детерминированных заболеваний, так и с по-
явлением технических возможностей для выяв-
ления этих влияний в связи с развитием моле-
кулярной генетики.
С генетических позиций расшифрована сущ-
ность многих заболеваний, которые длительное
время считались идиопатическими.
Расширяются представления о факторах рис-
ка разнообразных заболеваний почек, предрас-
положенности к ним, выдвигаются концепции,
согласно которым суммирование различных ге-
нетических факторов определяет индивидуаль-
ность течения заболеваний органов мочевой
системы у каждого пациента [Trachtman Н.,
1997].
Современная клиническая генетика пока-
зывает, что молекулярную основу имеют
не только наследственные заболевания, пе-
редающиеся по классическим законам Мен-
деля.
Множество заболеваний, в том числе и не-
фропатии, связаны с генетическими фактора-
ми риска, проявляющими себя при воздействии
неблагоприятных внешних условий.
Благодаря развитию молекулярных техноло-
гий появилась возможность непосредственного
определения этих факторов риска [Clerget-
Darpoux F., 1998].
Именно поэтому правомочно положение,
что к заболеваниям почек, связанным с гене-
тическими влияниями, относятся и те, кото-
рые развиваются в результате воздействия вне-
шних неблагоприятных факторов, но связаны
с наследственным полиморфизмом белков-
ферментов или структурных белков почечной
ткани.
13.1. Терминология
Следует дифференцировать понятия: «семей-
ная», «врожденная», «наследственная нефропа-
тия».
Под термином семейная нефропатия подра-
зумевается наличие заболевания почек у не-
скольких членов семьи. Эта патология может
быть наследственной, но может зависеть и от
однотипных неблагоприятных внешних условий:
питания, места проживания, одномоментного
воздействия вирулентных вирусов или бактерий.
В подобной ситуации можно лишь утверждать,
что почки в данной семье являются органом-
мишенью.
Врожденные заболевания органов мочевой
системы (ОМС) — это врожденные пороки
развития, т.е. стойкие морфологические изме-
нения органа (органов), выходящие за преде-
лы возможных вариаций строения, возникаю-
щие внутриутробно. Не все врожденные поро-
ки проявляются сразу после рождения ребен-
ка, что зависит от характера порока, методов
исследования и времени проведения этих ис-
следований. Выделяют аплазию (агенезию) —
врожденное отсутствие органа, гипоплазию —
врожденное недоразвитие органа и диспла-
зию — нарушение органогенеза. При сочетании
нерезко выраженной гипоплазии и дисплазии
почки можно говорить о гипопластической дис-
плазии почечной ткани [Игнатова М.С., Клем-
бовский А.Н., 1978].
Врожденные пороки могут быть органными,
тканевыми и клеточными. Как правило, наблю-
дается сочетание дизэмбриогенеза почки на раз-
личных уровнях ее организации, однако степень
выраженности этого сочетания неодинакова. При
анатомическом пороке органа могут изменять-
ся форма почки, мочеточника, мочевого пузы-
ря, их количество и расположение. Тканевые
22—2950
337
дефекты — это варианты дисплазии, которые
могут быть кистозными и бескистозными, с
наличием участков мезенхимы, фетальных гло-
мерул и канальцев. Клеточные и/или субклеточ-
ные дефекты проявляются обычно как слож-
ные патологические синдромы с обменными
нарушениями и включением в патологичес-
кий процесс различных органов и систем ор-
ганов.
Врожденные заболевания могут быть наслед-
ственными, связанными с мутацией генов; быть
проявлением хромосомной болезни и тератоген-
ных влияний. Независимо от характера тератогена
его влияние на развитие ребенка в антенаталь-
ный период определяется моментом воздей-
ствия в так называемый критический, или тер-
минационный, период развития органов моче-
вой системы. Различают первичные и вторичные
пороки. Первичные связаны с мутагенным или
тератогенным воздействием, вторичные — ос-
ложнение первичного. Примером первично-
го порока ОМС может служить стеноз моче-
точника, вторичным по отношению к нему ока-
зывается развитие гидронефроза. Говоря о врож-
денных нефропатиях, нельзя забывать о воз-
можности внутриутробного формирования бо-
лезни в связи с токсоплазмозом, герпесви-
русной инфекцией, инфицированностью ма-
тери бледной спирохетой или ВИЧ-инфек-
цией.
В последние годы большое внимание обра-
щают на генно-регуляторные механизмы орга-
нообразования. Немаловажная роль отводится
апоптозу — запрограммированной гибели кле-
ток. Возможны нарушения пролиферативной ак-
тивности клеток, их миграции, нормального
перемещения органов, изменения их дифферен-
цировки, нарушения адгезивных механизмов и
т.д. [Woolf А., 1998].
Наследственными нефропатиями называют
заболевания, этиологическим фактором разви-
тия которых является мутация гена. Если раз-
витие заболевания связано с мутацией одного
гена, речь идет о моногенно-наследуемом забо-
левании почек, если для развития заболевания
необходима мутация нескольких генов, — о
полигенном наследовании. В 1984 г. Н.П.Бочков и
соавт. предложили дифференцировать все забо-
левания в зависимости от роли генетических и
экзогенных факторов на четыре группы. Если
подобное дифференцирование провести по от-
ношению к патологии ОМС, можно выделить
следующие категории нефропатий.
1. Моногенно-наследуемые развиваются в связи
с мутацией одного гена. Реализация однотип-
ного наследственного заболевания может про-
изойти из-за мутации в различных генах, т.е. для
многих моногенно-наследуемых нефропатий
выявлена генетическая гетерогенность. Яркий
338
Таблица 13.1. Некоторые моногенно-наследуе-
мые нефропатии
Болезнь Мутант- ный ген Тип передачи Продукт гена
Синдром Альпорта COL4A5 COL4A3 COL4A4 Х-сцеп- ленный Аутосом- но-рецес- сивный То же Цепи коллагена 4 типа
Финский тип НС 19q13.1 » » Нефрин
Аутосомно- доминант- ная поли- кистозная болезнь 4-я хро- мосома 16-я хро- мосома Аутосом- но-доми- нантный Пол и цистин
Туберозный склероз 9-я хро- мосома 16-я хро- мосома То же Туберин
Нефро- нофтиз 2q12q13 Аутосом- но-рецес- сивный Нефроцистин
пример тому — аутосомно-доминантная (АД)
поликистозная болезнь почек (ПБП). Различа-
ют два типа ПБП: ПБП-1, при котором ген,
ответственный за развитие, локализован на
коротком плече 16-й хромосомы (16р13.3), и
ПБП-2, локус гена которой находится на длин-
ном плече 4-й хромосомы (4q). При ряде мо-
ногенно-наследуемых заболеваний выделен и
продукт гена: при ПБП-1 — это белок поли-
цистин; при туберозном склерозе, системном
наследственном заболевании, для которого ха-
рактерно почечное поражение, — это продукт
генатуберин (табл. 13.1). Моногенные нефропа-
тии всегда врожденные, однако могут прояв-
ляться не сразу после рождения ребенка, что
определяется характером болезни и способно-
стью мутантного гена находиться до определен-
ного возраста в репрессированном состоянии.
2. Полигенно-наследуемые нефропатии — за-
болевания почек, при которых этиологическим
фактором оказывается также мутация, только
не одного, а нескольких генов, однако для
реализации болезни необходимы внешние не-
благоприятные воздействия. В частности, для
развития подагрической нефропатии существен-
ное значение имеет нарушение диеты с потреб-
лением большого количества пуринов.
3. Мультифакториальная патология органов
мочевой системы зависит от воздействия вне-
шних вредных факторов — бактерий, вирусов,
охлаждения, но развивается лишь при генети-
ческом предрасположении.
Предрасположенность к заболеванию может
быть различной: от наличии нефропатии у кого-
то из близких родственников, патологии бере-
менности, до иммунных характеристик (фено-
тип по системе HLA, недостаточность фактора
Н в системе комплемента, наличие структур-
ного дефекта почек и т.д.).
4. Экзогенные нефропатии — заболевания,
которые непосредственно связаны с влиянием
внешних факторов — ожогов, отравлений,
травм, укусов ядовитых змей. Генетические
факторы проявляют себя в процессе репарации,
в развитии компенсаторных механизмов.
Моногенно-наследуемые заболевания разли-
чаются по характеру наследования болезни.
Аутосомно-доминантные (АД) нефропатии
передаются «по вертикали» — от родителей
детям. Классические примеры; АДПБП, 10—
20 % случаев наследственного нефрита (синд-
рома Альпорта), почечная глюкозурия.
Аутосомно-рецессивные (АР) нефропатии
определяются в «горизонтальных» рядах с «про-
скоком» через поколение. Большинство тубуло-
патий, включая цистинурию, первичную окса-
лурию, болезнь де Тони — Дебре — Фанкони,
врожденный нефротический синдром финско-
го типа, синдром Барттера, нефронофтиз Фан-
кони передаются аутосомно-рецессивным путем.
Доминантный сцепленный с Х-хромосомой —
такой тип передачи, при котором у больного отца
больными оказываются только дочери, передача
сыну невозможна. Этим путем наследуются клас-
сический вариант синдрома Альпорта, гипофос-
фатемический рахит, несахарный диабет.
Синдромология. Наследственные и
врожденные нефропатии отличаются выражен-
ным клиническим полиморфизмом даже в рам-
ках одной нозологической формы патологии у
членов одной семьи. Однако для них характер-
ны и общие проявления: случайность обнару-
жения, торпидность течения, склонность к про-
грессированию с ранним снижением почечных
функций по тубулярному типу [Игнатова М.С.,
Вельтищев Ю.Е., 1989].
Маркером наследственных и врожденных за-
болеваний различных органов и систем, в том
числе почечных, считается наличие стигм дизэм-
бриогенеза соединительной ткани, или малых ано-
малий развития. Чаще всего встречаются расши-
ренное переносье, аномальное строение ушных
раковин, высокое (готическое) небо, варусная
девиация мизинца, тенденция к птеродактилии,
гипертелоризм глаз и сосков, сандалевидная
щель, тенденция к синдактилии II и III пальцев
ног. Среди соматических стигм чаще наблюдают-
ся костные аномалии и аномалии ОМС: бугрис-
тость контуров почек, аномалии чашечек, об-
струкция прилоханочных отделов мочеточников.
Встречаются и более редкие внешние и сомати-
ческие аномалии: добавочные соски, дополни-
тельный ряд зубов в челюсти и др. Число малых
аномалий, превышающих 15, чаще всего явля-
ется признаком хромосомной болезни.
Отставание роста и физического развития —
нередкий признак врожденного или наслед-
ственного заболевания ОМС, хотя может на-
блюдаться и при хроническом течении приоб-
ретенной нефропатии.
Синдром интоксикации', бледность, вялость,
мышечная гипотония, анорексия без явных
причин иного характера. Эти симптомы долж-
ны вызвать нефрологическую настороженность
именно с учетом врожденных и наследственных
нефропатий.
Синдром азотемии в виде специфической
«почечной бледности» у ребенка с анорексией,
рвотой, сухой кожей, отставанием в развитии
даже без мочевого синдрома требует нефроло-
гического обследования.
Дизурический и болевой абдоминальный синд-
ромы должны настораживать, имея в виду врож-
денные анатомические аномалии ОМС и ней-
рогенный мочевой пузырь.
Отечный синдром при наследственных забо-
леваниях может проявиться с момента рожде-
ния ребенка, что свойственно врожденному НС
финского типа, но может выявляться при на-
слоении иммунных изменений на наследст-
венный или врожденный дефект почечной
ткани.
Гипертензионный синдром присущ анатоми-
ческим аномалиям почечных сосудов, рефлюкс-
нефропатии, сегментарной гипоплазии, олиго-
нефронии, в стадии развития ХПН — наслед-
ственному нефриту и АД ПБП. При аутосом-
но-рецессивной ПБП (AJP ПБП) он может быть
первым проявлением болезни.
Артериальная гипотензия характерна для
нефронофтиза Фанкони, наследственного
нефрита до стадии ХПН, для многих врож-
денных уропатий, гипопластической дисплазии
почек.
Мочевой синдром нередко бывает не первым
проявлением болезни; при развертывании па-
тологии может иметь полиморфный характер,
но чаше сначала появляется гематурия, затем
присоединяется протеинурия. Необходимо ис-
следовать наличие кристаллурии, оксалурии,
уратурии, аминоацидурии, показателей аммо-
нио- и ацидогенеза.
Номенклатура наследственных и врожденных
нефро- и уропатий [по М.С.Игнатовой, Ю.Е.Вель-
тищеву (1989)].
1. Нефро- и уропатии при анатомических ано-
малиях почек:
22*
339
• количественные (агенезия, аплазия, до-
бавочная почка, удвоение);
• позиционные (дистопия, нефроптоз, ро-
тация);
• нарушение формы (подковообразная, L-
и S-образные почки);
• изменения мочеточников, мочевого пузы-
ря и уретры (количества, калибра, формы);
• изменения почечных сосудов (артериаль-
ных, венозных, лимфатических);
• нарушения иннервации с синдромом
нейрогенного мочевого пузыря.
2. Нефропатии при паренхиматозных аномали-
ях почек:
• Кистозные:
— поликистозная болезнь почек (вариан-
ты АД и АР);
— медуллярная кистозная болезнь (нефро-
нофтиз Фанкони, синдром Сениора);
— финский тип врожденного нефротичес-
кого синдрома;
— кистозные дисплазии;
— гломерулярные кистозы;
— другие.
• Б е с к и ст оз ны е:
— олигонефрония, олигомеганефрония;
— сегментарная гипоплазия (болезнь Аск
— Упмарка);
— при гипопластической дисплазии по-
чек.
• Рефлюкс-нефропатия
3. Нефропатии при клеточных, субклеточных,
мембранных аномалиях почек:
• наследственный нефрит (синдром Аль-
порта);
• тубулопатии первичные:
— с преимущественным поражением про-
ксимальных канальцев (глицинурия,
цистинурия, фосфат-диабет и др.);
— с преимущественным поражением ди-
стального канальца (почечный тубу-
лярный ацидоз I типа, нефрогенный
несахарный диабет, псевдогипоальдо-
стеронизм);
— с повреждением всего канальцевого
аппарата (болезнь де Тони — Дебре —
Фанкони).
• Тубулопатии вторичные при на-
следствен ной патологии обмена веществ:
— дизметаболические нефропатии с кри-
сталлуриями;
----оксалатная нефропатия (дизметабо-
лическая с оксалатно-кальциевой
кристалл урией);
— — уратная (подагрическая) нефропа-
тия.
4. Нефропатии при наследственной системной
патологии:
• болезнь Фабри;
• туберозный склероз.
5. Нефро- и уропатии при хромосомных болез-
нях.
6. Амилоидоз наследственный.
7. Эмбриональные опухоли почек (опухоль
Вильмса).
13.2. Отдельные
моногенно-наследуемые
нефропатии
13.2.1. Наследственный нефрит
(синдром Альпорта)*
История. Первое описание семьи, в которой
наблюдались случаи гематурии в нескольких
поколениях, принадлежит L. Cuthrie (1902).
A. Hurst, продолжая наблюдение за этой семь-
ей, проследил развитие у некоторых ее членов
уремии (1923). В 1927 г. A. Alport отметил, что у
нескольких родственников той же семьи име-
ется тугоухость, а уремия развивается раньше
у мужчин, чем у женщин. Наследственный не-
фрит связывают именно с именем Альпорта.
С 70-х годов XX в. начинается интенсивное изу-
чение этого заболевания. Клинически выделя-
ли наследственный нефрит без тугоухости как
более благоприятное в прогностическом отно-
шении заболевание и синдром Альпорта (СА) —
наследственный нефрит с тугоухостью и ран-
ним развитием ХПН. Нами на основании на-
блюдения за 200 детьми с наследственным не-
фритом высказывалась гипотеза, согласно ко-
торой в основе болезни лежит патология соеди-
нительной ткани. В качестве критерия состоя-
ния соединительной ткани, прежде всего ба-
зальных мембран (БМ) клубочковых капилля-
ров, рассматривались данные экскреции с мо-
чой оксилизингликозидов и их фракций. Было
показано, что независимо от наличия или от-
сутствия тугоухости преобладало выделение
фракции оксилизингликозидов, входящих в
состав БМ клубочков, БМ кортиева органа и
капсулы хрусталика глаза, т.е. органов, страда-
ющих при наследственном нефрите. В 1985 г.
L. Menlove и соавт. сообщили о выявлении гена,
ответственного за развитие синдрома Альпор-
та, который был обнаружен на длинном плече
X хромосомы в зоне 21—22q.
* Раздел написан совместно с Ф.Д.Цаликовой.
340
Терминология. Идентификация в качестве ге-
нетической основы наследственного нефрита
мутации гена, кодирующего альфа-5-цепь кол-
лагена IV типа, сделала ненужным выделение
клинических вариантов наследственного нефрита
с тугоухостью (СА) и без тугоухости, поэтому
в литературе нередко термин «синдром Альпор-
та» употребляют как синоним для всех клини-
ческих вариантов наследственного нефрита.
В современном понимании наследственный
нефрит (синдром Альпорта) — это наследствен-
ная неиммунная гломерулопатия, связанная с
патологией коллагена базальных мембран, про-
являющаяся гематурией и/или протеинурией,
прогрессирующим снижением почечных функ-
ций, нередко сочетающаяся с патологией слу-
ха и зрения.
Эпидемиология и клиническая характеристи-
ка. Наследственный нефрит встречается чаще,
чем диагностируется. По эпидемиологическим
исследованиям, проведенным в России в 70—
80-е годы, частота его среди детской популя-
ции составляла 17:100 000 [Вельтищев Ю.Е.,
Игнатова М.С., 1996]. В Европе 0,6 % случаев
ХПН связаны с синдромом Альпорта; 2,3 %
почечных трансплантаций проводится больным,
страдающим этим синдромом [Atkin С. et al.,
1988].
Наследственный нефрит встречается среди
лиц, проживающих в различных регионах мира,
у представителей разных рас и национально-
стей.
У женщин с наследственным нефритом
(НН) часто отмечаются спонтанные аборты,
мертворождения, нефропатия беременных. Ха-
рактерно патологическое течение беременнос-
ти ребенком, у которого развивается НН. Пер-
вые клинические проявления НН возможны в
любом возрасте. Это обычно гематурия, кото-
рая может быть случайно выявлена при обсле-
довании ребенка, хотя возможна и острая ма-
нифестация патологии. Гематурия может быть
изолированной, но может сочетаться с проте-
инурией. Степень выраженности протеинурии в
большой мере определяет прогноз заболева-
ния — он неблагоприятен при большой проте-
инурии, особенно при развитии НС. Возмож-
на абактериальная лейкоцитурия как проявле-
ние тубулоинтерстициальных изменений.
У большинства больных выражены внешние
и соматические стигмы дизэмбриогенеза. Харак-
терна однотипность стигм у пораженных чле-
нов семьи. Обычны симптомы интоксикации,
нередко возникают головные боли, которые
связывают с сосудистой гипотензией. Гипертен-
зионный синдром развивается обычно при
формировании ХПН.
Снижение слуха в результате неврита слухо-
вого нерва характерно для синдрома Альпорта.
При аудиографическом исследовании снижение
слуха начинается на высоких частотах по зву-
ковоспринимающему типу. У части больных в
возрасте 8—12 лет развивается тугоухость. Воз-
можны случаи, когда тугоухость обращает на
себя внимание ранее, чем симптомы заболева-
ния почек. Тугоухость чаще встречается у пред-
ставителей мужского пола, но возможна и у
женщин.
Приблизительно у ‘/4 больных СА отмечают-
ся аномалии зрения в виде лентиконуса (пере-
днего и заднего), сферофакии, катаракты. Час-
то развиваются миопия, астигматизм, страбизм.
Возможно поражение органа зрения без симп-
томов тугоухости. Почти у 90 % больных выра-
жена неврологическая симптоматика. Интеллект
соответствует возрастным нормам. Анатомичес-
кие аномалии строения почек являются сома-
тическими стигмами дизэмбриогенеза.
Для наследственного нефрита характерно
раннее снижение функции почек. Прежде все-
го страдает тубулярный отдел нефрона. По мере
развития заболевания отмечаются гомеостати-
ческие нарушения, наиболее ранними оказы-
ваются метаболический ацидоз и дизэлектроли-
темия. В подростковом возрасте отмечаются ком-
бинированные нарушения гомеостаза — присо-
единяется азотемия, возможно развитие анемии
и гипертензии. ХПН, как правило, формиру-
ется при достижении пациентами совершенно-
летия, однако при юношеском типе патологии
возможно и раннее формирование ХПН. Из на-
блюдаемых нами 200 больных с различными
клиническими вариантами НН у 5 подростков
в возрасте 13—15 лет была развернутая карти-
на ТЙН, потребовавшая проведения почечной
трансплантации. ХПН чаще развивается у муж-
чин.
Анализ симптомов, выявляемых при наслед-
ственном нефрите, показал, что непосредствен-
но с самим патологическим процессом связа-
ны гематурия, артериальная гипотензия, аудио-
графические нарушения слуха, врожденные
аномалии хрусталика глаза. Стигмы дизэмбрио-
генеэа — маркер наследственной патологии. По-
явление интоксикации, протеинурии, лейкоци-
турии, обменных нарушений, снижение почеч-
ных функций, глухота — следствие прогресси-
рования болезни.
Морфология и патогенез. При светооптичес-
ком исследовании нефробиоптата выявляется
неоднородность гломерулита у одного и того же
больного от фокального минимального мезан-
гиального, мезангиопролиферативного до скле-
розирующего поражения. Типично сочетание
иммунонегативного гломерулита с атрофией
канальцев и лимфогистиоцитарной инфильтра-
цией стромы (рис. 13.1). Возможен очаговый
склероз почечной паренхимы. Ярким, но непо-
341
Рис. 13.1. Наследственный нефрит (синдром Альпор-
та). Световая микроскопия. Гломерулонефропатия с
атрофией канальцев и лимфогистиоцитариой инфиль-
трацией стромы.
Рис. 13.2. То же заболевание, что на рис. 13.1. Свето-
вая микроскопия. Очаговый склероз почечной парен-
химы. Видны пенистые клетки.
стоянным проявлением патологии оказывается
обнаружение «пенистых клеток», которые со-
держат многочисленные суданофильные и ос-
миофильные включения липидов, т.е. по сути
являются липофагами (рис. 13.2). Их диагности-
ческое значение условно и касается тех случа-
ев НН, когда при выраженной гематурии от-
сутствует протеинурия. Специфичными для на-
следственного нефрита оказываются изменения
БМ клубочковых капилляров. БМ — довольно
сложное образование, которое состоит из пра-
вильно расположенных молекул коллагена IV
типа и других полисахаридных компонентов.
При НН происходит истончение БМ, особен-
но средней пластинки — lamina densa, расщеп-
ление БМ и появление ее слоистости. Это про-
342
исходит в связи с изменением свойств моле-
кул коллагена. При электронной микроскопии
(ЭМ) наряду с тонкими БМ клубочков могут
быть утолщенные БМ с участками просветле-
ния, напоминающие пчелиные соты; внутри
мембран находятся скопления тонкогрануляр-
ного вещества (рис. 13.3). Прогрессирование на-
следственного нефрита происходит при тяже-
лой деструкции мембран с их утолщением и
дистрофией.
Генетика. Вслед за идентификацией гена
Со14А5, ответственного за альфа-5-цепь колла-
гена IV типа, последовала серия исследований,
обнаруживающих гены, ответственные за ос-
тальные 5 цепей IV фракции коллагена
[Mochizuki N. et al., 1994]. Со МАЗ и Со14А4 на-
ходятся на 2-й хромосоме. Их мутация харак-
терна для аутосомно-рецессивного типа пере-
дачи НН. Одновременная мутация Со14А5 и
Со14Аб присуща синдрому Альпорта, протека-
ющему с лейомиозом пищевода [Heidet L. et al.,
1995]. Важность изучения генов, кодирующих
альфа-цепи коллагена IV типа, связана с тем,
что в зависимости от варианта мутации нару-
шается сборка молекулы коллагена БМ, что и
является основой патологии при НН (рис. 13.4).
Доминантный сцепленный с полом тип на-
следования характерен для наследственного
нефрита с тугоухостью и ранним развитием по-
чечной недостаточности, т.е для классическо-
го синдрома Альпорта [Grunfeld J., Knebelmann
В., 1998]. Наши исследования в большой вы-
борке российской популяции показали, что
нередким типом наследования оказывается
аутосомно-доминантный — 16 %. Аутосомно-
рецессивный тип болезни отмечен нами у 6 %
больных.
Рис. 13.3. То же заболевание. Электронная микро-
скопия. Истончение базальной мембраны клубочков
с участками утолщения и просветления и скоплени-
ем тонкогранулярного вещества.
Нормальная ГБМ
a1(IV), a2(IV)
Ранний СА
Эндотелий
<x1(IV), a2(IV)
<x3(IV), <x4(IV)
и a5(IV)
Истончение БМ
(ГБМ, капсула хрусталика)
Гематурия и лентиконус
Поздний СА
Утолщение и
дезорганизация ГБМ
Рис. 13.4. Характеристика ба-
зальных мембран капилляров
клубочков при наследствен-
ном нефрите.
1 2 М
«*- 459 п.н.
•<— 316 п.н.
252 п.н.
<— 158 п.н.
(19 экзон гена
дистрофина)
(43-44 зкзоны)
(47 зкзон)
(42 зкзон)
Протеинурия и снижение
функции почек
риант мутации гена, ответственного за патоло-
гию.
В семье С. 2 детей — мальчик и девочка — двою-
родные сибсы (рис. 13.7); их матери — родные сест-
ры. С первых лет жизни дети имели гематурию. Дед
по линии матери и ее двоюродный брат умерли в
возрасте до 40 лет при выраженной ХПН и тугоухо-
сти. При почечной биопсии у детей обнаружен ме-
зангиопролиферативный иммунонегативный нефрит.
При ЭМ — типичные изменения БМ в виде их утол-
щения, деструкции с отложением гранулярного ве-
щества в центре мембран. Дополнительное обследо-
вание матерей обоих детей выявило у них гемату-
рию. ДНК-диагностика обнаружила обширную деле-
нию многих экзонов гена, кодирующего альфа-5-
цепь коллагена IV типа у пораженных детей и их
матерей. Таким образом, характер родословной под-
сказывал возможность НН, но до проведения ЭМ
нефробиоптата этот диагноз ставился под сомнение.
Окончательный диагноз поставлен после проведения
Рис. 13.5. Мультиплексная амплификация в гене
COL4A5 пробанда семьи В.
1-я полоска — здоровый донор; 2-я полоска — пробанд с
делецией; М — маркер молекулярной массы.
Исследования характера мутации у наблю-
даемых нами больных с НН позволили выявить
у них либо делецию, либо однонуклеотидную
замену (точковая мутация) (рис. 13.5, 13.6). При
наличии делеции отмечаются большая тяжесть
патологического процесса, сочетание почечного
поражения с экстраренальными проявлениями
патологии и ранним развитием ХПН. При точ-
ковых мутациях выявляется моноорганное по-
ражение со сравнительно благоприятным раз-
витием болезненного процесса. У всех поражен-
ных в одной семье отмечается однотипный ва-
Рис. 13.6. Метод SSCP в COL4A5 пробанда семьи Б.
для определения точковой мутации.
Полоска 3 — ДНК пробанда семьи Б. с точковой мутацией
в COL4A5; полоска 6 — маркер молекулярной массы; ос-
тальные полоски — контроль.
343
Рис. 13.7. Пресимптоматическая диагностика пере-
дачи X-хромосомы в семье Хвт.: мать, старший и
младший сибсы имеют идентичную Х-хромосому,
средний сибс здоров.
ДНК-диагностики. Динамическое наблюдение за
больным мальчиком показало, что в 9 лет у него
появилась тугоухость, а после 10 лет начал снижаться
клиренс эндогенного креатинина.
ДНК-диагностика имеет существенное зна-
чение в раннем возрасте и в случае техничес-
кой невозможности клинико-морфологического
обследования ребенка. На основании идентифи-
кации Х-хромосом матери, пробанда и необс-
ледованного сибса можно определить наличие
или отсутствие болезни у этого сибса. Нами
было проведено такое обследование, позволив-
шее определить, что необследованный морфо-
биоптически и с помощью ДНК-проб сибс и
пробанд получили от матери разные Х-хромо-
сомы, следовательно, у необследованного ре-
бенка нет Х-сцепленного НН (см. рис. 13.7).
Диагноз и дифференциальный диагноз. Пред-
положительный диагноз наследственного не-
фрита ставится на основании данных родослов-
ной (рис. 13.8). Для диагностики НН (синдрома
Альпорта) необходимо наличие трех из следу-
ющих 5 признаков:
— гематурия или летальный исход от ХПН в
семье;
— гематурия и/или протеинурия в семье;
— у больного специфические изменения гломе-
рулярных БМ при электронной микроскопии
биоптата;
— снижение слуха по данным аудиографии;
— врожденная патология зрения [Kashtan С. et
al., 1993].
При возникновении наследственного нефри-
та de novo диагностика усложняется; по совре-
менным представлениям, необходимы не толь-
ко ЭМ биоптата, но и ДНК-исследование.
Дифференциальную диагностику обычно
проводят с гематурической формой гломеруло-
нефрита. Как правило, при ГН в семье нет слу-
чаев однотипных почечных заболеваний, туго-
ухости, ХПН. При морфобиоптическом ис-
следовании выявляется иммунный вариант гло-
мерулонефрита, при ЭМ типичные признаки
синдрома Альпорта отсутствуют.
Необходимость дифференцирования с диз-
метаболической нефропатией, протекающей с
оксалатно-кальциевой кристаллурией, возника-
ет при насыщенности родословной заболевани-
ями почек. Однако они не однотипны, часто в
старших поколениях встречается мочекаменная
болезнь, при морфобиоптическом исследовании
определяется тубулоинтерстициальный нефрит
344
и обнаруживаются кристаллы оксалатов в ка-
нальцах. ЭМ не дает специфических изменений.
Проводится дифференциальный диагноз с
болезнью тонких БМ, для которой характерны
аутосомно-доминантное наследование гематурии
при равномерном истончении БМ гломерул и
благоприятный прогноз [Bodziak К. et al., 1994].
Определенные сложности возникают при
дифференцировании наследственного нефрита
от нефропатии, связанной с гипопластической
дисплазией, особенно в случаях ее аутосомно-
доминантной передачи. При этом следует обра-
тить внимание на то, что при гипопластичес-
кой дисплазии почек раньше наступает ХПН,
а при морфобиоптическом исследовании име-
ются выраженные признаки структурного диз-
эмбриогенеза, свойственного этой патологии.
Лечение и прогноз. Специфического лечения
наследственного нефрита не существует. Основ-
ная задача — замедлить снижение функцио-
нального состояния почек. Для этой цели ре-
комендуется отказ от занятий спортом, сбалан-
сированное по основным ингредиентам пита-
ние, максимальное ограничение контактов с
инфекционными больными. Вакцинации воз-
можны только по эпидемиологическим пока-
заниям. Особое внимание должно быть уделено
санации очагов инфекции. Многочисленные ис-
следования, предпринятые в различных странах
мира, показали, что ни стероидная терапия, ни
использование основных иммуносупрессантов
не приводят к улучшению состояния. Правда,
L.Callis и соавт. (1999) сообщили, что циклос-
порин, назначаемый на протяжении 7—10 лет
8 детям с синдромом Альпорта, вызывал умень-
шение протеинурии и сохранение стабильнос-
ти функционального состояния почек. При по-
вторной биопсии, проведенной через 5 лет ле-
чения, ухудшения морфологических проявле-
ний заболевания не отмечалось.
Обнаружение у больных при морфобиопти-
ческом исследовании дистрофии и атрофии ка-
нальцевого эпителия с явлениями тубулярной
недостаточности является, на наш взгляд, ос-
нованием для использования пиридоксина,
АТФ и кокарбоксилазы в возрастных дозиров-
ках. По нашим данным, эти препараты способ-
ствуют улучшению самочувствия больных,
уменьшению проявлений тубулярной неполно-
ценности. Подобного же эффекта удавалось
достигнуть при применении ретаболила. Для
этих же целей в настоящее время нами исполь-
зуется гипербарическая оксигенация, после
курса которой, как правило, несколько умень-
шается гематурия и улучшаются показатели
функционального состояния почек.
Основным методом лечения при развитии
ХПН является своевременное проведение по-
чечной трансплантации.
Яша Б. поступил под наблюдение в 15 лет с ди-
агнозом: синдром Альпорта. ТПН. Ему была прове-
дена трансплантация трупной почки, и с первых
недель после операции началось восстановление го-
меостаза. Улучшился и слух больного. Полная реаби-
литация наступила через год. Он закончил техникум,
работал, женился, имел дочь. Через 15 лет постоян-
ного использования иммуносупрессантов самоволь-
но отменил их, что привело к отторжению почки.
Дочь Яши наблюдается в клинике с первых месяцев
жизни. В полтора года у нее впервые появилась гема-
турия, в настоящее время ей 6 лет, имеется нерез-
кое снижение тубулярных функций. Таким образом,
при типичном СА своевременная трансплантация
почки привела к реабилитации больного, однако это
не исключило передачи заболевания ребенку.
Прогноз наследственного нефрита зависит от
формы заболевания, своевременности замести-
тельной терапии. Пренатальная диагностика в
принципе возможна, но и она не решит все
проблемы, так как предугадать экспрессивность
мутантного гена затруднительно. Поставлена
задача использования генно-инженерних мето-
дов лечения НН [Tryggvason К., 1998]. Как мо-
дель для такого рода терапии планируется ис-
пользовать собак канадской линии «Samoyed
dog», у которых имеется точковая мутация в 35
экзоне гена Со14А5 [Zheng К. et al., 1994].
13.2.2. Медуллярная кистозная
болезнь. Нефронофтиз Фанкони.
Синдром Сениора
История и терминология. Впервые в 1945 г. была
описана «врожденная медуллярная кистозная
болезнь почек с тяжелой рефрактерной анеми-
ей» [Smith et al., 1945]. Однако лишь после
описания С. Fanconi и соавт. в 1951 г. идентич-
ного заболевания, названного им «семейный
нефронофтиз», в литературе получил граждан-
ство термин «нефронофтиз Фанкони». В после-
дующие годы были опубликованы многочислен-
ные описания медуллярного кистоза, который
имеет различные клинические проявления,
всегда сочетающиеся с развитием почечной не-
достаточности, отставанием в росте, выражен-
ной анемией. В связи с этим считается возмож-
ным объединение в одну группу заболеваний с
близкой клинической и морфологической сим-
птоматикой, но различных в генетическом от-
ношении, под термином «медуллярная кистоз-
ная болезнь почек». Из нее четко выделяются
нефронофтиз Фанкони (НФ) — генетически
детерминированное заболевание, передающее-
ся аутосомно-рецессивным путем, и синдром
Сениора, при котором нефронофтиз сочетает-
ся с офтальмологическими поражениями в виде
тапеторетинальной дегенерации.
Клиническая характеристика. Основные кли-
345
нические проявления нефронофтиза Фанко-
ни — полиурия, полидипсия, анемия, степень
выраженности которой не коррелирует с про-
явлениями азотемии. Заболевание одинаково
часто встречается у лиц обоего пола, нередко
в семьях, где имеются родственные браки. На
основании наличия полиурии и обнаружения
кист в мозговом веществе почек диагноз может
быть поставлен в первые годы жизни ребенка.
Однако типичной клиническая картина стано-
вится после 6 лет, когда появляются полидип-
сия, задержка роста и развития, потеря солей
и связанная с ней гипонатриемия, гипокалие-
мия и гипокальциемия. АД остается длительное
время либо ниже нормального возрастного
уровня, либо в пределах нормы. Только при
развитии ТПН может наблюдаться его некото-
рое повышение. Характерна небольшая проте-
инурия. При прогрессировании заболевания
выявляются признаки остеодистрофии, неред-
ки проявления вторичного гиперпаратиреоидиз-
ма. ХПН развивается обычно на втором деся-
тилетии жизни.
Клинические проявления синдрома Сенио-
ра [Senior В. et al., 1961] отличаются от тако-
вых при нефронофтизе Фанкони (НФ) ярки-
ми офтальмологическими проявлениями в виде
тапеторетинальной дегенерации. Часто патоло-
гия зрения первой обращает на себя внимание.
Изменения со стороны почек развиваются по-
зднее, чем при НФ, часто при достижении
соверше н нолетия.
Морфология и патогенез. При первых прояв-
лениях заболевания почки могут быть нормаль-
ных размеров, что устанавливается при УЗИ и
рентгеноконтрастных исследованиях. Уменьше-
ние размеров почек происходит постепенно за
счет истончения коркового вещества. Современ-
ная ультразвуковая аппаратура дает возможность
обнаружения мелких кист в мозговом слое по-
чек, но обычно их выявляют при морфобиоп-
тическом исследовании. Размеры кист могут
быть различными, имеются также перитубуляр-
ные фибропластические изменения. При ЭМ
определяются утолщенные БМ канальцев и со-
бирательных трубочек. При иммунофлюоресцен-
тном исследовании нет фиксации ни иммуно-
глобулинов, ни комплемента.
При микродиссекции отмечаются кистозные
изменения в собирательных трубочках и дис-
тальных канальцах, в то время как проксималь-
ные канальцы и петля Генле оказываются не-
измененными [Sherman F. et al., 1971]. Вокруг
кист обнаруживаются скопления белка Тамма —
Хорсфолла. Патогенез заболевания неясен, од-
нако исследования A.Cohen, J.Hoyer (1986) по-
казали, что у больных с НФ отмечались истон-
чение и расслоение БМ канальцев. Ламинин и
IV фракция коллагена присутствовали в обыч-
346
ных количествах, однако антитела к БМ ка-
нальцев практически не определялись, что
позволяло предположить отсутствие некоторых
компонентов БМ. С учетом проведенного иссле-
дования была высказана гипотеза, что генез НФ
близок по своей сути к СА, т.е. речь идет о
генетически детерминированной неполноцен-
ности коллагена БМ.
Генетика. Медуллярная кистозная болезнь
наследуется аутосомно-рецессивным путем,
реже аутосомно-доминантным. Возможны спо-
радические случаи, генетическая природа ко-
торых не установлена. Ген нефронофтиза Фан-
кони находится на 2-й хромосоме (2ql2—ql3).
Продукт гена — нефроцистин [Hildebrandt F. et
al., 1998].
Диагностика. Диагноз нефронофтиза ставят
обычно в случае, когда при нарушении роста
и развития определяются полиурия — полидип-
сия, гипостенурия, изостенурия, анемия. Обна-
ружение кист при УЗИ и компьютерной томо-
графии — это поздний диагноз, когда выраже-
ны признаки ХПН. Морфобиоптическое опре-
деление кист собирательных трубочек, дисталь-
ных канальцев и выраженных тубулоинтерсти-
циальных изменений, имеющих характер тя-
жей, подтверждает наличие медуллярной кис-
тозной трансформации почек. Данные родослов-
ной могут помочь при диагностике в большой
семье с несколькими детьми, так как заболе-
вание передается аутосомно-рецессивным пу-
тем.
При синдроме Сениора диагностику облег-
чает наличие тапеторетинальной дегенерации.
В случаях спорадического развития патологии
основными в диагностике оказываются резуль-
таты почечной биопсии.
Лечение. Специфического лечения медулляр-
ной кистозной болезни нет. Однако оптималь-
ный вариант диеты, достаточно калорийной и
содержащей аминокислотные добавки, должен
использоваться с момента появления призна-
ков заболевания. Необходимы достаточный вод-
ный режим и контролируемое введение солей
в связи с их потерей. Обязательно применение
кальция в сочетании с витамином D для кор-
рекции остеодистрофии. Борьба с гипокалиеми-
ей может привести к уменьшению слабости и
степени полиурии. Целесообразно восполнить
запасы железа в организме, если выражена
анемия и имеется снижение содержания желе-
за в крови. Для улучшения роста при дефиците
цинка в организме можно рекомендовать курс
терапии цинком.
Симптоматическая терапия не может предот-
вратить развития ХПН, в связи с чем эти боль-
ные — кандидаты для проведения почечной
трансплантации. Обязательно медико-генетичес-
кое консультирование.
г
13.2.4. Врожденный нефротический
синдром финского типа
Терминология. Под врожденным нефротическим
синдромом понимается НС, развившийся у
ребенка до 3-месячного возраста. Врожденный
НС может быть первичным, генетически детер-
минированным и вторичным при врожденной
цитомегалии, токсоплазмозе, сифилисе, тубер-
кулезе, тромбозе почечных вен, СПИДе. Осо-
бое место среди врожденного НС занимает пер-
вичный наследственный, так называемый врож-
денный нефротический синдром финского типа.
Это аутосомно-рецессивнб наследуемая патоло-
гия, проявляющаяся с первых дней жизни ре-
бенка тяжелым нефротическим синдромом с
большой протеинурией и резкой гипопротеи-
немией. При «естественном» течении летальный
исход наступает до 1 года, причем к нему при-
водят либо развитие почечной недостаточнос-
ти, либо септические осложнения.
История и эпидемиология. Впервые заболева-
ние описано в 1966 г. R.Norio. При анализе цер-
ковно-приходских книг в юго-западном регио-
не Финляндии, где наиболее часто встречалось
это заболевание, был обнаружен родоначаль-
ник патологии — финн, который проживал в
этом регионе во второй половине XVI в. До
проведения антенатальной диагностики заболе-
вание встречалось с частотой 1:8200 рождений.
Аналогичные случаи регистрируются в северо-
западном районе России, в Ленинградской
области. Не всегда удается подтвердить этничес-
кую (финскую) принадлежность семьи. Этот
вариант патологии неоднократно описывался в
различных странах мира у лиц нефинской на-
циональности.
Клиническая характеристика. Течение бере-
менности тяжелое, роды, как правило, преж-
девременные, масса плаценты составляет более
'/4—'/2 массы новорожденного. Чаще ребенок
рождается уже с выраженными отеками, но они
могут появиться несколько позднее — к концу
первого месяца жизни. Протеинурия достигает
10 г за сутки. Резко выражена гипоальбумине-
мия, имеет место повышение липидов сыворот-
ки крови. При уменьшении отечного синдрома
после введения диуретиков обращают на себя
внимание резкая дистрофия ребенка, множе-
ственные стигмы дизэмбриогенеза. Резко сни-
жены показатели иммунной защиты, что явля-
ется основой развития гнойных осложнений.
Возможны тромбоэмболии. АД снижено или в
пределах нормы. В амниотической жидкости и
сыворотке крови беременных в высоком титре
содержится альфа-фетопротеин [Theile U. et al.,
1982]. Обнаружение этого феномена позволило
проводить своевременную антенатальную диаг-
ностику.
Морфология и патогенез. При гистологичес-
ком исследовании почек обнаруживаются мик-
рокистоз проксимальных канальцев в кортико-
медуллярной зоне, мультигломерулярность и
другие признаки незрелости почечной ткани,
пролиферация мезангиальных клеток, фиброз-
ные изменения [Huttunen N. et al., 1980].
Врожденный нефротический синдром фин-
ского типа относится к гломерулярным болез-
ням, причем продукт гена — нефрин — лока-
лизован на подоцитах. Недостаточность нефри-
на вызывает протеинурию еще в антенатальном
периоде развития ребенка [Tryggvason К., 1998].
Генетика. Врожденный НС финского типа
наследуется аутосомно-рецессивным путем.
M.Kestila и соавт. (1994) при исследовании 17
семей с указанной патологией не обнаружили
дефекта ни в одном из генов альфа-1-, альфа-2-,
альфа-3- и альфа-4-цепи коллагена IV типа, а
также основных генов цепей ламинина и гепа-
рансульфат-протеогликана, кодирующих основ-
ные компоненты БМ клубочков. Получены убе-
дительные данные, что мутантный ген локали-
зован на 19ql3, этот ген — NPHSI — кодирует
трансмембранный протеин — нефрин, прису-
щий подоцитам.
Современными исследованиями выяснено,
что в различных регионах мира, где выявлялся
врожденный НС, близкий по сути финскому,
имеется около 40 мутаций гена NPHSI. Однако
в Финляндии у больных и носителей обнару-
жены только 2 идентичные мутации этого гена.
В семьях, где имеется врожденный НС, в про-
цессе медико-генетического консультирования
беременные женщины обязательно обследуют-
ся на наличие у них в крови альфа-фетопроте-
ина. При его обнаружении рекомендуется пре-
рывание беременности.
Диагностика. Рождение в семье ребенка с
врожденным НС требует прежде всего выясне-
ния этнических корней. Обязательно исключе-
ние вторичного НС, связанного с внутриутроб-
ными инфекциями. Врожденный НС финского
типа следует дифференцировать от семейного
НС, который описан в различных странах мира
у людей различной национальности (см. ниже).
О финском типе НС говорят тяжелая беремен-
ность, наличие очень крупной плаценты, об-
наружение при морфобиоптическом исследова-
нии микрокистоза проксимальных канальцев.
Лечение. Несмотря на то что в Финляндии
проводится активное выявление семей, где
возможно развитие врожденного НС финского
типа, все же и в настоящее время рождаются
дети с этой тяжелой патологией. Ни симптома-
тическая терапия, ни стероиды и иммуносуп-
рессоры не вызывают улучшения у больных с
врожденным НС финского типа.
Рекомендуется высокобелковая и высокока-
347
лорийная диета наряду со строжайшим водно-
электролитным сбалансированным режимом до
10—12 мес жизни ребенка. К этому возрасту
удается довести его массу тела до 10 кг, лик-
видировать дистрофию и отечный синдром.
После нефрэктомии проводят почечную транс-
плантацию. Десятилетнее наблюдение за груп-
пой, включавшей около 40 детей, убедительно
свидетельствует о хорошей реабилитации таких
больных [Holmberg Ch. et al., 1995].
13.2.5. Семейный нефротический
синдром
Терминология и эпидемиология. Термин «семей-
ный нефротический синдром» используется
тогда, когда НС возникает не менее чем у 2
членов одной семьи, чаще у сибсов. Однако в
наших наблюдениях были случаи однотипного
течения НС у матери и ее сына, у матери и ее
дочери. Семейные случаи НС встречаются зна-
чительно чаще, чем это предполагалось до спе-
циальных эпидемиологических исследований.
Клиническая характеристика. Заболевание
может возникнуть в различном возрасте, но
обычно начало клинических проявлений болез-
ни происходит примерно в одно и то же время.
Среди больных семейным НС мы длительно
наблюдали двух братьев, у которых заболевание
развилось в возрасте 2 лет и 6 мес. К моменту
поступления мальчиков под наше наблюдение
старшему было 15, младшему — 8 лет. Оба ле-
чились преднизолоном с эффектом, но имелись
рецидивы. Протеинурия достигала у обоих 5—
10 г в сутки. Были выражены распространенные
отеки, гипопротеинемия, гиперлипидемия. При
биопсии у обоих был выражен мезангиопроли-
феративный гломерулонефрит. Таким образом,
у двух братьев отмечался НС, имеющий кон-
кордантные признаки, что характерно для се-
мейного НС, который может протекать с ге-
матурией, гипертензией, быть гормонорезис-
тентным.
Морфология. Морфологические изменения в
почках у больных семейным НС могут быть раз-
нообразными: от минимальных, мезангиопро-
лиферативных до фокально-сегментарного и
диффузного склероза в гломерулах. Морфоло-
гически, как и клинически, отмечается конкор-
дантность признаков.
Генетика. Предположение о полигенном на-
следовании было высказано в монографии
Р.Royer в 1973 г. В настоящее время обнаружен
мутантный ген на 1-й хромосоме с маркером
D1S416 на длинном плече хромосомы [Niaudet
Р. et al., 1998]. Установлено, что заболевание пе-
редается аутосомно-рецессивным путем. Одна-
ко в тех случаях, когда НС с идентичными про-
348
явлениями отмечается у одного из родителей и
у его ребенка, можно предполагать аутосомно-
доминантное наследование. Существуют обосно-
ванные предположения, что гормонорезистен-
тный НС у девочек может быть связан с мута-
цией гена WTI (ген опухоли Вильмса).
Диагностика. Обнаружение НС у двух и бо-
лее членов семьи позволяет говорить о нали-
чии семейного нефротического синдрома.
Лечение. Появление признаков типичного НС
служит показанием к проведению стероидной
терапии в дозе 2 мг на 1 кг массы тела ребен-
ка в сутки на протяжении не менее 4 нед. В этих
условиях устанавливается гормоночувствитель-
ность больного. Появление заболевания в том
же возрасте у другого ребенка в семье застав-
ляет ставить диагноз семейного НС. При гор-
моночувствительносГи у первого сибса следует
проводить идентичную терапию второму ребен-
ку. Сложнее обстоит дело, если у первого за-
болевшего проявилась гормонорезистентность. У
другого сибса, не применяя стероидов, целе-
сообразно проведение почечной биопсии, ко-
торая позволит выявить вариант ГН и соответ-
ствующим образом подойти к терапии.
Под нашим наблюдением находятся два брата из
семьи Н-ых. Оба мальчика заболели в возрасте между
3 и 4 годами; длительно без отчетливого эффекта ле-
чились стероидами. При морфобиоптическом иссле-
довании почек обнаружена картина иммунопозитив-
ного мезангиопролиферативного ГН в сочетании у
одного с гипопластической дисплазией, у другого —-
с аномалией сосудов почечной паренхимы. Прово-
дили плазмаферез и пульс-терапию циклофосфаном
в сочетании со стероидами. Получена ремиссия,
которая продолжалась несколько месяцев. При но-
вом обострении, когда старшему было 14, а млад-
шему 12 лет, начато лечение циклоспорином А. При
этом у обоих братьев развилась ремиссия, которая
продолжается несколько месяцев.
Прогноз зависит от типа морфологического
поражения и ответной реакции на терапию.
13.3. Паренхиматозные
аномалии строения почек без
кистозной трансформации
13.3.1. Олигонефрония,
олигомеганефрония
Терминология. Под олигомеганефронией пони-
мается паренхиматозная аномалия строения
почек, при которой отмечается уменьшение
количества и в некоторых случаях увеличение
в объеме гломерул. Заболевание проявляется
протеинурией и нередко гипертензией, склон-
но к прогрессированию с развитием ХПН.
Клиническая характеристика. Олигонефро-
ния может иметь два варианта течения. При
первом уже на первом году жизни у детей
отмечаются эпизоды дегидратации и гипертер-
мии. Выявляется и медленно нарастает проте-
инурия. Другой вариант связан с развитием
протеинурии на втором году жизни, при этом
выявляется и артериальная гипертензия, кото-
рая нарастает и очень плохо корригируется ги-
потензивными средствами. Исход заболева-
ния — развитие почечной недостаточности,
при первом варианте течения возможно даже
на первом году жизни.
Морфология и патогенез. В основе заболева-
ния лежит дизэмбриогенез почечной паренхи-
мы в виде уменьшения числа нефронов. При
этом, как правило, наблюдается увеличение
размеров оставшихся клубочков и канальцев
(рис. 13.9). Число нефронов может составлять */5
от нормы, а размер почки бывает резко умень-
шенным. При гистологическом исследовании
полноценного биоптата почки определяются
редко расположенные клубочки увеличенного
размера. Выражены гиалиноз и склероз отдель-
ных гломерул, а также перигломерулярный
склероз. При первых описаниях заболевания оно
представлялось как типичная эмбриопатия с
отсутствием повторных случаев в семье [Royer
Р. et al., 1973]. Однако в нашем наблюдении
[Игнатова М.С., Вельтищев М.Е., 1978] в се-
мье было два сибса, страдающих олигонефро-
нией (рис. 13.10, б).
Диагностика. Предполагать наличие олиго-
нефронии можно на основании сочетания про-
теинурии с неконтролируемой гипертензией
при отсутствии признаков анатомической ано-
Рис. 13.9. Паренхиматозная аномалия строения по-
чек без кистозной трансформации. Световая микро-
скопия. Олигонефрония, увеличение оставшихся клу-
бочков и канальцев. Видны редко расположенные уве-
личенные клубочки.
малии почечных сосудов. Однако подтвердить
диагноз можно лишь при морфобиоптическом
исследовании почки.
Рис. 13.10. Фрагменты родословных при различных
нефропатиях.
Черные фигуры — различные нефропатии; то же с черточ-
ками, выходящими за пределы фигуры, — мочекаменная
болезнь; крестик — смерть; а — нефропатия, связанная с
гипопластической дисплазией; б — олигофрения; в — по-
ликистозная болезнь; г — дизметаболическая нефропатия.
Стрелкой обозначен пробанд.
349
Рис. 13.11. Сегментарная гипоплазия. Световая мик-
роскопия.
Объяснение в тексте.
Лечение. Лечение симптоматическое до раз-
вития ХПН, когда необходимы нефрэктомия
из-за выраженной гипертензии и почечная
трансплантация.
13.3.2. Сегментарная гипоплазия
(почка Аска — Упмарка)
Терминология. Под сегментарной гипоплазией
понимается врожденная паренхиматозная ано-
малия, которая связана с остановкой нефроге-
неза в одной или нескольких дольках развиваю-
щегося органа на этапе, следующем за образо-
ванием юкстамедуллярных нефронов, когда из-
за дизэмбриогенеза сосудов в отдельных сегмен-
тах почек нарушаются кровоснабжение и диф-
ференцировка тканевых структур (рис. 13.11).
Клиническая характеристика. Подробное
описание сегментарной гипоплазии дано
P.Royer и соавт. (1973). Выделено 5 групп боль-
ных в зависимости от выраженности процесса
в одной или обеих почках на основании дан-
ных рентгеноконтрастного исследования. В 1-ю
группу выделены больные с односторонней сег-
ментарной гипоплазией, у которых выявляют-
ся компенсаторная гипертрофия другой почки,
одностороннее повышенное выделение ренина.
Во 2-ю группу объединены больные с двусто-
ронней сегментарной гипоплазией; обычно вы-
является асимметрия поражения. Наиболее тя-
желой в прогностическом отношении является
3-я группа, так как у больных выявляется дву-
стороннее симметричное поражение почек.
Больные, объединенные в 4-ю группу, имеют
нерезко выраженную патологию, характеризу-
ющуюся латентным течением заболевания с
минимальным мочевым синдромом. Сегментар-
ную гипоплазию в сочетании с обструктивной
уропатией имеют пациенты 5-й группы. Про-
грессирование болезни и ее исход в этих слу-
чаях связаны с рецидивированием инфекции
мочевой системы.
Основные клинические признаки заболева-
ния — тяжелая гипертензия, которая может
впервые проявиться в возрасте от 4 до 12 лет.
Отмечаются головная боль, изменения глазно-
го дна. Возможны судороги. При УЗИ и рент-
геноконтрастном исследовании выявляются
неровность контуров почек, сегментарное ис-
тончение коркового слоя. Ангиографическое
исследование уточняет характер и степень рас-
пространения процесса.
Морфология и патогенез. При исследовании
удаленной почки в случаях односторонней сег-
ментарной гипоплазии или сегмента почки
выявляются участки структурного дизэмбриоге-
неза с явлениями недоразвития сосудов почеч-
ной паренхимы и выраженный нефросклероз.
При морфобиоптическом исследовании обна-
ружить типичную картину сегментарной гипо-
плазии можно, если проводится открытая био-
псия почки. Основная гипотеза по поводу про-
исхождения сегментарной гипоплазии связана
с дизэмбриогенезом, обусловленным воздей-
ствием различных тератогенов. Среди наблюдав-
шихся нами больных был пациент с ганглио-
бластомой той же почки, в которой была выра-
жена сегментарная гипоплазия [Игнатова М.С.,
Вельтищев Ю.Е., 1989]. В другом наблюдении
отмечалось присоединение к типичной карти-
не сегментарной гипоплазии мембранопроли-
феративного иммунопозитивного ГН, который
протекал с неполным нефротическим синдро-
мом и был резистентен к терапии.
Диагностика. Наличие у больного стойкой
гипертензии требует исключения сегментарной
гипоплазии почек. В порядке дифференциальной
диагностики необходимо исключить возмож-
ность рефлюкс-нефропатии.
Лечение. При односторонней сегментарной
гипоплазии с выраженной компенсаторной
гипертрофией другой почки наиболее целесо-
образна нефрэктомия. При двустороннем пора-
жении возможна симптоматическая терапия до
наступления ХПН. Почечная трансплантация
должна проводиться после двусторонней нефр-
эктомии.
13.3.3. Нефропатия при
гипопластической дисплазии почек
Терминология и классификация. Нефропатия,
связанная с гипопластической дисплазией поч-
ки, — врожденная патология, проявляющаяся
350
недостаточной зрелостью и аномалией разви-
тия нефронов, выявляемая, как правило, «слу-
чайно», протекающая с изолированным моче-
вым синдромом в виде гематурии и/или про-
теинурии, ранним снижением почечных функ-
ций по тубулярному типу и прогрессирующим
течением. Выделяются нефропатии, связанные
с гипопластической дисплазией (ГПД):
• sui generis;
• в сочетании с метаболическими нарушени-
ями;
• в сочетании с обструктивной уропатией;
• с наслоением гломерулонефрита или тубу-
лоинтерстициального нефрита.
Клиническая характеристика, генетика. Под
нашим систематическим наблюдением в насто-
ящее время находится несколько десятков боль-
ных, у которых выявлена нефропатия, связан-
ная с ГПД почек.
Нефропатия, связанная с ГПД sui generis,
составляет не более 1/3 наблюдаемых больных.
У остальных либо выражены анатомические
аномалии органов мочевой системы вплоть до
обструктивной уропатии, либо имеются мета-
болические нарушения. Кроме этих трех групп
больных, существует четвертая — с отчетливой
морфологической картиной гломерулонефрита
или тубулоинтерстициального нефрита.
Вне зависимости от формы патологии забо-
левание чаще выявляется случайно: при обсле-
довании, диспансеризации. Острое начало ха-
рактеризует наслоение иммунного или микроб-
но-воспалительного процесса. При обследова-
нии больного нередко отмечаются отставание
физического развития, симптомы интоксика-
ции. Определяется 5—7 и даже более стигм со-
единительнотканного дизэмбриогенеза. АД либо
имеет склонность к гипотензии, либо нормаль-
ное, гипертензия развивается только на стадии
ХПН. Отечный синдром выявляется при насло-
ении нефрита. При раннем обнаружении изо-
лированного мочевого синдрома биохимические
параметры крови остаются в пределах возраст-
ных колебаний. Однако при прогрессировании
болезни характеристика белковых, липидных
показателей изменяется, приближаясь к тем,
которые выявляются при нефрите. Уже на ста-
дии изолированного мочевого синдрома почеч-
ные функции снижаются по тубулярному типу.
В первую очередь это нарушение водно-элект-
ролитного баланса и сдвиг кислотно-основно-
го состояния в сторону метаболического аци-
доза.
Больные с разными формами нефропатии,
связанной с ГПД, имеют тенденцию к прогрес-
сированию заболевания. Нередко признаки
ХПН выявляются уже в детском возрасте. Од-
нако в некоторых случаях, особенно у взрос-
Рис. 13.12. Гипопластическая дисплазия почек. Све-
товая микроскопия.
Рис. 13.13. Истончение и утолщение БМ с наруше-
нием их структуры. Электронная микроскопия.
дых, болезнь расценивается как ГН или пие-
лонефрит, а обнаруженные морфологические
признаки кистоза, наличие мезенхимы в поч-
ках ошибочно воспринимаются патологоанато-
мами как вторичные изменения.
В 5 наблюдаемых семьях имело место доми-
нантное наследование ГПД. У остальных речь
шла о мультифакториальной патологии.
Морфология и патогенез. Нами [Игнато-
ва М.С., Клембовский А.И., 1978] выделены
при светооптическом и ЭМ-исследовании ос-
новные морфологические признаки гипоплас-
тической дисплазии почек:
• сближенность и гроздевидность расположе-
ния клубочков;
• незрелость клубочков в виде уменьшения их
размеров по сравнению с нормой (рис.
13.12) и одновременно с увеличением их ко-
351
личества на единицу площади коркового ве-
щества (мультигломерулярность);
• наличие так называемых штампованных ка-
нальцев — групп однотипных канальцев не-
большого диаметра, расположенных в кор-
ковом веществе почки, но исходящих из
мозгового вещества;
• раннее фиброзирование гломерул, не корре-
лирующее по выраженности с характером
воспалительных изменений в почке;
• при ЭМ истончение или утолщение БМ с
нарушением их структуры (рис. 13.13).
У всех больных, которым проводилось мор-
фобиоптическое исследование почек, выявля-
лась атрофия и дистрофия извитых канальцев
различной степени выраженности. Эти явления
вторичны, как вторичен порок распределения
клубочков в виде «грозди винограда», что за-
висит от первичного дефекта — дефицита ко-
личества петель извитых канальцев нефрона.
Определить единую причину развития гипо-
пластической дисплазии не представилось воз-
можным. Элементы гипопластической диспла-
зии выявляются при морфобиоптическом ис-
следовании детей с эконефропатиями (см. гла-
ву 26).
Диагностика. Случайное обнаружение изо-
лированного мочевого синдрома у ребенка, на-
личие множественных стигм дизэмбриогенеза,
как внешних, так и соматических (в основном
со стороны почек), выраженные тубулярные
дисфункции в виде нарушения аммонио- и аци-
догенеза и дизэлектролитемии позволяют запо-
дозрить наличие ГПД почки. Этому способству-
ют также отсутствие типичной для ГН склон-
ности к артериальной гипертензии, отсутствие
отечного синдрома и выраженных изменений
метаболизма белка и липидов, что характерно
для иммунной нефропатии. Диагноз подтверж-
дается при проведении морфобиоптического
исследования.
Лечение. Специфического лечения нефро-
патии, связанной с гипопластической диспла-
зией, нет. Мероприятия, которые используют-
ся при ее лечении, связаны с формой пато-
логии.
При сочетании ГПД с метаболическими
нарушениями проводят мембранотропную и ан-
тиоксидантную терапию. В случае сочетания с
обструктивной уропатией по консультации с
урологами осуществляют необходимую хирур-
гическую коррекцию. По мнению С.ЯДолецко-
го и А.И.Клембовского, после ранней хирур-
гической коррекции возможно некоторое доз-
ревание почечной ткани. При наслоении ГН на
нефропатию, связанную с гипопластической
дисплазией, проводят лечение ГН. Эффект от
подобной терапии меньше, чем при ГН, не
связанном с гипопластической дисплазией по-
чек, однако ремиссии, чаще неполные с сохра-
нением мочевого синдрома, развиваются. При
нефропатии, связанной с ГПД sui generis, те-
рапия симптоматическая. При ТПН проводят
диализ и почечную трансплантацию почки.
Индометацин противопоказан, так как способ-
ствует развитию гипоренинемического гипоаль-
достеронизма.
13.4. Дизметаболические
нефропатии с кристаллуриями
Эту группу составляют типичные тубулопатии:
• первичная наследственная гипероксалурия,
цистинурия и болезнь Леша — Найена;
• вторичные тубулярные синдромы, иначе
называемые дизметаболическими расстрой-
ствами с кристаллуриями, которые могут
быть полигенно-наследуемыми или мульти-
факториальными.
Эти заболевания нами были объединены
термином «дизметаболические диатезы и не-
фропатии» [Вельтищев Ю.Е., Игнатова М.С.,
1992]. Под диатезом понимается наличие пред-
расположенности к заболеванию.
Щавелевокислый (оксалатный) диатез, цисти-
новый диатез, мочекислый диатез. Каждый из
указанных диатезов фенотипически (клиничес-
ки) и генотипически различны, объединяет их
наличие кристаллурии, которая нередко оказы-
вается маркером развивающейся мочекаменной
болезни.
13.4.1. Щавелевокислый
(оксалатный) диатез
Щавелевая кислота в организме образуется как
конечный продукт окисления или окислитель-
ного переаминирования глицина, серина, эта-
ноламина, аланина. Небольшие количества ок-
салата образуются из пролина. Источником ок-
салатов мочи являются аскорбиновая кислота,
оксалаты пищи, хотя на их долю приходится
не более 10 % общего количества оксалатов,
выводимых с мочой. Главным предшественни-
ком оксалатов в организме является глиокси-
ловая кислота. При окислении глицина через
глиоксиловую кислоту образуется почти поло-
вина вводимых оксалатов. Этот процесс конт-
ролируется глициноксидазой, поддерживающей
процессы перекисного окисления. Наряду с
окислением в организме постоянно происходит
процесс переаминирования (трансаминирова-
ния), в результате которого образуется глиок-
силовая кислота (схема 13.1). Процесс осуще-
352
Схема 13.1
ПОСЛЕДОВАТЕЛЬНОСТЬ МЕТАБОЛИЗМА
ОБРАЗОВАНИЯ ЩАВЕЛЕВОЙ КИСЛОТЫ
ствляется с участием аланин-глиоксилат- и гли-
цин-глиоксилаттрансаминаз. У здорового чело-
века этот процесс сдвинут в сторону синтеза
аминокислот. Патологический синтез глиокси-
ловой кислоты происходит при недостаточно-
сти трансаминаз. Кофактором трансаминаз слу-
жит пиридоксин, поэтому при его недостатке
отмечается повышенное выделение оксалатов с
мочой. Образованию нерастворимых оксалатов
кальция, кроме тиоловых соединений, препят-
ствуют пирофосфаты, ионы магния, цинка,
нитраты. Моча человека часто пересыщена Са2+
и оксалатом, однако кристаллизация происхо-
дит при уменьшении в моче ингибиторов каль-
цеобразования и повышения промоторов, что
может наблюдаться при мембранодеструктивных
процессах в почечном эпителии. Специально
проведенные исследования материала вскрытия
при различных патологических процессах пока-
зали, что частота обнаружения кристаллов окса-
лата кальция в почках составляет 6 % [Barratt Т.
et al., 1977].
13.4.2. Первичная гипероксалурия
(оксалоз)
Терминология, патогенез. Первичная гипероксалу-
рия — моногенно-наследуемая патология обме-
на глиоксиловой кислоты, характеризующаяся
оксалатно-кальциевым нефролитиазом и разви-
тием ХПН. Метаболический блок в обмене гли-
оксиловой кислоты проявляется повышенным
синтезом гликолевой, глиоксиловой и щавеле-
вой кислот, концентрация которых повышает-
ся в биологических жидкостях и моче.
23—2950
Выделяется два типа первичной гиперокса-
лурии. Метаболический дефект при 1-м типе
обусловлен недостаточностью пероксисомаль-
ного фермента аланин-глиоксилат-аминотран-
сферазы [Danpure С., Jennis Р., 1987]. В связи с
блокированием в печени процесса переамини-
рования происходит накопление глиоксилата,
легко окисляющегося в оксалат. При 2-м типе
первичной гипероксалурии патология связана
с ферментом, обеспечивающим реакцию пере-
хода глиоксилата в гликолат. Блок касается од-
ного из ключевых ферментов, обеспечивающих
эту реакцию, — D-глицератдегидрогеназы или
лактатдегидрогеназы. При 2-м типе патологии
в моче гликолат не обнаруживается, а выявля-
ются значительные количества L-глицериновой
кислоты.
Клиническая картина, морфология. Клиничес-
кая картина у больных с 1-м и 2-м типом пер-
вичной гипероксалурии одинакова, хотя пер-
вый вариант встречается в несколько раз чаще,
чем второй. Начальные признаки болезни вы-
являются в раннем возрасте. Заболевают почти
с равной частотой представители обоих полов.
Первые проявления болезни — макрогемату-
рия, приступы почечной колики. С мочой мо-
жет выделяться песок, всегда обнаруживается
оксалатно-кальциевая кристаллурия. Кристаллы
крупные, агрегированные. При УЗИ и рентге-
нологическом исследовании области почек вы-
являются нефрокальциноз и уролитиаз. При
тяжелом течении заболевания обычно отмеча-
ются отставание в физическом развитии, задер-
жка роста. Диагноз устанавливают при исследо-
вании экскреции с мочой оксалатов. Количе-
ство экскретируемых оксалатов достигает 1110—
4440 мкмоль/24 ч/1,73 м2, что на порядок пре-
вышает показатели, определяемые при других
формах нарушения щавелевого обмена.
Вторичное проявление первичной гиперок-
салурии — гидронефроз с наслоением инфек-
ции мочевой системы. Микроскопически выра-
жены интерстициальный фиброз и тубулоин-
терстициальный нефрит (ТИН), в паренхиме
встречаются кристаллы оксалатов разных раз-
меров и формы, в основном в проксимальных
отделах канальцев. Возможен гиалиноз гломерул.
Внепочечные отложения кристаллов обнаружи-
ваются в головном мозге, в костях, хрящах, в
стенках сосудов. Кристаллы могут быть округ-
лой, шаровидной или ромбовидной формы, на
разрезе подобны розеткам с поперечной исчер-
ченностью. Кристаллы слегка желтоватого цве-
та; гематоксилин-эозином и по Коссу не ок-
рашиваются.
Генетика. Заболевание передается аутосом-
но-рецессивным путем, однако известны слу-
чаи доминантного наследования.
Лечение. Радикальным лечением первичной
353
гипероксалурии является своевременная транс-
плантация печени, после чего в организм на-
чинает поступать фермент пероксисом-глиокси-
лат-аланиновая аминотрансфераза. Опыт тако-
го рода лечения ограничен, применяется в
Англии, Швейцарии, США. При развитии ХПН
больным проводят почечную трансплантацию,
однако это не спасает от продолжающегося на-
рушения метаболизма щавелевой кислоты с
дальнейшим отложением кристаллов оксалата
кальция в различных органах.
Консервативное лечение первичной гиперок-
салурии предусматривает раннее использование
мер, направленных на снижение синтеза и эк-
скреции оксалатов, а также на предупреждение
образования оксалатно-кальциевых камней. Для
этой цели используют высокие дозы пиридок-
сина (до 400 мг в день на протяжении до 3 мес).
Назначают окись магния (0,15—0,2 г/сут). По-
казано использование ортофосфатов для воз-
можного снижения концентрации кальция в
моче, что в какой-то мере уменьшает кристал-
лизацию. Паллиативные меры не предупрежда-
ют прогрессирования болезни.
13.4.3. Дизметаболическая
нефропатия с оксалатно-кальциевой
кристаллурией (оксалатная
нефропатия)
Терминология, патогенез. Дизметаболическая
нефропатия с оксалатно-кальциевой кристал-
лурией (ОКК), или оксалатная нефропатия, —
мультифакториальная патология, связанная с
нарушением обмена оксалатов при семейной
нестабильности почечных цитомембран, прояв-
ляющаяся изолированным мочевым синдромом
с наличием оксалатно-кальциевой кристаллу-
рии, тубулярными дисфункциями с прогресси-
рованием от тубулярных изменений к тубуло-
интерстициальному нефриту и мочекаменной
болезни.
Метаболические процессы, которые лежат в
основе щавелевокислого диатеза, многообраз-
ны. Локальное образование кристаллов оксала-
та кальция в почках и мочевыводящей системе
может быть связано с различными факторами.
К ним относятся:
• усиление синтеза глиоксилата из глицина и
пролина в условиях окислительного стресса,
активации моноаминооксидаз и недостаточ-
ности системы местной антиоксидантной за-
щиты;
• неполноценность мембранных механизмов
защиты клетки от ионов кальция;
• возможна частичная недостаточность ала-
нин-глиоксилат-трансаминазы;
354
• активация фосфолипаз и ускоренный мета-
болизм мембранных фосфолипидов — фос-
фатидилсерина и фосфатидилэтаноламина
как источников серина и этаноламина, окис-
ляющихся в щавелевую кислоту;
• дефицит или разрушение химических и био-
логических стабилизаторов ионов щавелевой
кислоты и кальция в метастабильном состо-
янии (при нормальном или несколько по-
вышенном содержании щавелевой кислоты
и ионов кальция);
• эпитаксия (способность других солей инду-
цировать кристаллообразование данной соли).
Показано, что риск формирования агреги-
рованных кристаллов оксалата кальция воз-
растает при повышении концентрации мо-
чевой кислоты в крови и моче. Урикозурия
нередко сочетается с оксалурией. Возможно,
что кристаллы уратов могут стать центром
нуклеации оксалата кальция.
Эпидемиология, клиническая характеристика.
При проведении эпидемиологических исследо-
ваний в регионе, где отсутствует эндемия по
мочекаменной болезни, но отмечается антро-
погенная экологическая нагрузка, у 20 % де-
тей обнаружена оксалатно-кальциевая кристал-
лурия. Примерно у 14 % детей она сочетается
с гипероксалурией (выведение более 130
мкмоль в сутки). Крупные агрегированные кри-
сталлы выявлены почти у половины детей,
преимущественно старшего возраста и обычно
в сочетании с мочевым синдромом — гемату-
рией и/или протеинурией [Балтаев У.Б., 1990].
При анализе родословных в этих семьях в стар-
ших поколениях, как правило, отмечались слу-
чаи мочекаменной болезни (МКБ) и/или ту-
булоинтерстициального нефрита (ТИН).
В регионе, отягощенном тяжелыми металла-
ми, при частоте патологии органов мочевой
системы 187:1000, среди обследованных детей
примерно 2/3 имели признаки дизметаболичес-
кой нефропатии с ОКК. Морфобиоптическое
исследование выявило у них ТИН и признаки
гипопластической дисплазии. Все эти дети про-
живали в экологически загрязненном регионе
с антенатального периода развития, а их роди-
тели, как правило, жили в этом регионе с дет-
ства (см. главу 26).
Первые признаки заболевания могут про-
явиться уже в первые недели жизни. У ребенка
нередко отмечаются боли в животе, имеются
признаки кожного аллергоза. Временами наблю-
дается уменьшение объема мочи, она имеет
насыщенный характер. Обострение заболевания
чаще отмечается в возрасте 7 и 10—14 лет, т.е.
в наиболее напряженные возрастные периоды.
Как правило, дети развиты соответственно воз-
расту, у некоторых отмечается ожирение. Веге-
тососудистая дистония выявляется практичес-
ки у всех детей, как правило, с явлениями ар-
териальной гипотензии или тенденций к ней.
Отмечаются гематурия, протеинурия и/или
лейкоцитурия. Последняя носит обычно абак-
териальный характер, лишь наслоение инфек-
ции мочевой системы знаменуется появлением
бактериурии. Оксалурия выражена примерно у
половины больных, однако она на порядок
менее того, что отмечается при первичной мо-
ногенно-наследуемой гипероксалурии. У всех
больных выражена оксалатно- или фосфатно-
кальциевая кристаллурия. Кристаллы оксалатов
кальция чаще объединены в агрегаты различ-
ной величины и формы. У этих больных сни-
жена антикристаллообразующая способность
мочи, что связано с обеднением мочи есте-
ственными ингибиторами кристаллообразова-
ния, как АТФ, пирофосфаты, образование
которых снижается в условиях нарушения це-
лости клеточных мембран. При исследованиях
выявляются фосфолипидурия, повышение фос-
фолипазной активности в моче и крови.
Содержащиеся в моче свободные или конъ-
югированные с этаноламином жирные кисло-
ты являются нуклеотидами, образующими с
кальцием прочные нерастворимые комплексы.
Образованию оксалата кальция (СаОх) способ-
ствует также белок, который находится в раз-
личных субклеточных субстанциях, более все-
го в печени и почках [Adhirai М., Selvam R.,
1998]. Кристаллизация осуществляется в почках
в конечном итоге с образованием камней. Кро-
ме белка, связывающего СаОх, выделен белок
уропонтин, который защищает почку от кам-
необразования [Asplin J. et al., 1998].
Прогрессирование дизметаболической не-
фропатии с ОКК может привести к развитию
ТИН, а при наслоении инфекции — к возник-
новению пиелонефрита. МКБ выявляется обыч-
но у взрослого человека.
Морфология. При морфобиоптическом иссле-
довании определяются деструкция щеточных
каемок проксимальных и изменения дистальных
канальцев с отрывом части из них и заполне-
нием просвета канальцев ШИК-положительным
веществом. У больных выражены лимфогистио-
цитарная инфильтрация интерстиция, явления
фокального склероза. У некоторых больных,
кроме ТИН, выявляется мезангиопролифератив-
ная реакция гломерул. В просвете канальцев и в
интерстиции нередко обнаруживаются кристал-
лы СаОх. При сканирующей микроскопии вид-
ны кристаллы оксалатов (рис. 13.14).
Генетика. В исследованиях, проведенных
Д.Ишкабуловым (1980) и У.Б.Балтаевым
(1990), была показана доля генетической и сре-
довой компоненты в развитии оксалатной не-
фропатии (табл. 13.2).
Рис. 13.14. Дизметаболическая нефропатия с окса-
латно-кальциевой кристаллоурией. Сканирующая
микроскопия. Видны кристаллы оксалатов.
Полученные результаты дают право выска-
зываться в пользу мультифакториального гене-
за дизметаболической нефропатии с ОКК с
полигонным типом наследования.
Диагностика. При наличии в семье заболе-
ваний почек и обменных нарушений случайно
выявленный мочевой синдром с обнаружени-
ем в моче ОКК — основа для предположения
о наличии у пациента дизметаболической не-
фропатии с оксалурией. УЗИ указывает на свое-
образное очаговое повышение эхогенности по-
чечной паренхимы, что предполагает наличие
кристаллов. Определение в моче повышенного
количества оксалатов, фосфолипидов, фосфо-
липаз, этаноламина, серина при наличии ана-
логичных изменений в моче у ближайших род-
ственников позволяет ставить диагноз дизмета-
болической нефропатии с ОКК. При проведе-
нии дифференциального диагноза нужно иметь
в виду, что гипероксалурия может быть вторич-
ной при тяжелом течении гломерулонефрита,
пиелонефрита, при наличии у ребенка струк-
турного почечного дизэмбриогенеза.
Лечение. Основу лечения дизметаболической
нефропатии с ОКК составляет диета, ограни-
Таблица 13.2. Доля генетической и средовой
компоненты при оксалатной нефропатии (по Д.Иш-
кабулову, 1980)
Факторы Способы вычисления
по Edvards по Falconer по Smith
Генетические 71,5 61,8 77,6
Средовые 28,5 38,2 22,4
23
355
Таблица 13.3. Антиоксалурическая (картофельно-капустная) диета
Прием пищи День нвдепи
1-й 2-й 3-й
Завтрак Каша гречнеаая, хлеб белый с маслом, напиток из абрико- сов Пшенная каша, хлеб белый с маслом, напиток из кураги Отварной картофель в смета- не, хлеб белый с маслом, на- питок из абрикосов
Обед Щи вегетарианские, бефст- роганов с картофелем, хлеб черный, яблоки Щи вегетарианские, котлеты мясные с картофелем, хлеб черный, яблоки Суп вегетарианский карто- фельный, рулет мясной с кар- тофелем, хлеб черный, ябло- ки
Полдник Картофель тушеный с мясом, напиток из яблок Картофель печеный, яблоки Картофельные котлеты, ябло- ки
Ужин Картофельные котлеты со сметаной, напиток из груш Капустная запеканка, хлеб белый с маслом, напиток из яблок Капустные котлеты, напиток из груш, хлеб
Прием пищи День недепи
4-й 5-й 6-й 7-й
Завтрак Тушеная капуста, хлеб белый с маслом, на- питок из кураги Геркулесовая каша, хлеб белый с маслом напиток из кураги Тушеный картофель со сметаной, хлеб бе- лый с маслом, напи- ток из кураги Тушеная капуста, хлеб белый с маслом, на- питок из кураги
Обед Суп вегетарианский, суфле мясное с туше- ным картофелем, хлеб черный, арбуз Щи вегетарианские, мясной фарш с карто- фелем, хлеб черный, арбуз Суп картофельный, голубцы с мясом, хлеб черный, арбуз Щи вегетарианские, рулет мясной с карто- фелем, хлеб черный, арбуз
Полдник Картофель отварной, яблоки Картофель отварной, яблоки Картофель печеный, яблоки Картофель печеный, яблоки
Ужин Картофельные котле- ты со сметаной, напи- ток из яблок Тушеный картофель со сметаной, напиток из груш Капустные котлеты со сметаной, хлеб белый, напиток из яблок Картофельные ола- дьи, груши
чивающая поступление в организм щавелевой
кислоты. Для этой цели может быть использо-
вана так называемая картофельно-капустная,
или антиоксалурическая, диета (табл. 13.3). Пре-
дусматривается исключение насыщенных экст-
рактивных мясных блюд, оксалогенных продук-
тов, к которым относятся щавель, шпинат, са-
лат, чай, какао, шоколад, свекла, морковь,
клюква. Рекомендуются груши, курага, черно-
слив.
Для лечения дизметаболической нефропатии
с ОК.К широко используют антиоксиданты и
мембрацотропные средства. В качестве антиок-
сидантов применяют витамины Е и А. Для по-
вышения ингибиторных свойств мочи по отно-
шению к процессу кристаллизации использу-
ют пиридоксин (не менее 40—60 мг в сутки)
и окись магния. В качестве комплексона приме-
356
няют ксидифон. Последний повышает раство-
римость солей кальция и препятствует росту
кристаллов. Перечисленный комплекс меропри-
ятий можно назначать профилактически в се-
мьях, где уже есть больные с оксалатной не-
фропатией.
13.4.4 . Цистиновый диатез (цистиноз,
цистинурия)
Цистиноз. Терминология и патогенез. Цистиноз
(синдром Абдергальдена — Линьяка — Кауф-
мана) — редкая моногенно-наследуемая пато-
логия, обусловленная первичным нарушением
обмена цистина с отложением кристаллов ци-
стина в лизосомах различных органов, в том
числе в почках. Предполагается недостаточность
г
фермента цистинредуктазы, восстанавливающе-
го цистин в цистеин. Накопление цистина про-
исходит в органах в виде кристаллов как внут-
риклеточно, так и внеклеточно. Первоначаль-
но считалось, что цистиноз идентичен цисти-
нурии. Ch.Dent (1951) показал, что цистиноз
не сочетается с цистинурией, хотя в обоих слу-
чаях происходит вовлечение в процесс почек.
Клиническая картина. Различают почечную
и внепочечную формы цистиноза [Cahl Н. et al.,
1995]. Внепочечный цистиноз диагностируется
офтальмологами на основании помутнения ро-
говицы. Почечный цистиноз имеет три клини-
ческие формы.
1. Детская форма. Ребенок рождается клини-
чески здоровым, но в первые месяцы жизни
появляются полиурия, дегидратация, рециди-
вирующая лихорадка. Развитие ребенка замед-
ляется, появляются признаки рахита, не под-
дающегося лечению витамином D. Ранний при-
знак — помутнение роговицы и обнаружение
в клетках крови кристаллов цистина. Развива-
ется синдром Дебре — де Тони — Фанкони:
аминоацидурия, фосфатурия, глюкозурия, про-
теинурия, полиурия. Именно этот синдром и
является ведущим, определяющим развитие
ХПН до 10-летнего возраста.
2. Ювенильная форма. Заболевание развивает-
ся позднее. Рост детей замедляется, обнаружи-
ваются ретинопатия, светобоязнь. Кристаллы
цистина находят в лейкоцитах, клетках кост-
ного мозга, роговице, конъюнктиве. Нефропа-
тия проявляется после 10 лет с меньшими ту-
булярными, но выраженными гломерулярными
изменениями. Кристаллы откладываются в гло-
мерулах. Прогрессирование болезни приводит к
ХПН.
3. Взрослый тип. Доброкачественная форма,
которая клинически может не проявляться, но
кристаллы цистина обнаруживаются в клетках
крови и роговице.
Морфология. Гистологически в корковом слое
почечной паренхимы обнаруживается множе-
ство бледно-серых кристаллических образований
различной формы: прямоугольные, шестигран-
ные пластинки и их осколки [Broyer М. et al.,
1981]. Находясь в просвете проксимальных ка-
нальцев, кристаллы обтурируют и растягивают
их. В некоторых местах определяются некрозы.
В строме — лимфогистиоцитарная инфильтра-
ция. Картина ТИН и фиброз стромы нараста-
ют по мере прогрессирования болезни. Кристал-
лы цистина хорошо идентифицируются при по-
ляризационной микроскопии.
Генетика. Цистиноз относится к лизосомным
болезням. Наследуется аутосомно-рецессивным
путем. В лейкоцитах родителей больных содер-
жание цистина в 5—6 раз выше нормы. Уровень
цистина повышается в клетках амниотической
жидкости при беременности гомозиготным
плодом, что может быть использовано для це-
лей пренатальной диагностики. Ген цистиноза
картирован на хромосоме 17р. Исследования
С.Jean и соавт. (1998) показали, что делеция
гена отмечена только у больных европейской
популяции. Всего выделено 14 мутаций гена
цистиноза.
Диагностика. Диагностика цистиноза осно-
вывается на обнаружении кристаллов цистина
в радужной оболочке глаз, в лейкоцитах крови.
Нередко эти исследования проводят уже после
того, как выявлен синдром Дебре — де Тони —
Фанкони.
Лечение. Диета предусматривает уменьшение
поступления с пищей серосодержащих амино-
кислот, прием большого количества жидкости,
в том числе и перед сном. Предлагается исполь-
зовать тиоловые соединения — пеницилламин
(цистеамин) с целью активизации тиолзависи-
мых ферментов. Лечение цистеамином необхо-
димо начинать как можно раньше [Cahl W. et
al., 1995]. Начальная доза 10 мг/кг в сутки с
5-разовым приемом равных количеств препарата.
В течение недели дозу увеличивают до макси-
мальной — 50 мг/кг, или 1,3 мг/м2 в сутки. Че-
рез 6 ч после приема максимальной дозы ре-
комендуется проверить содержание цистина в
лейкоцитах; количество последнего должно
быть менее 1 нмоль в 1 мг белка. Лечение про-
водят годами с успехом. В случае внепочечного
цистиноза назначают капли цистеамина в гла-
за. Почечную трансплантацию рекомендуется
проводить до развития ТПН. J.Brodehl (1989),
располагая опытом 33 трансплантаций у детей
с цистинозом, указывает, что максимальный
срок жизни после пересадки почки — 19 лет.
Цистин после трансплантации откладывается не
в канальцах, а в интерстиции и мезангиуме.
Цистинурия. Терминология, патогенез. Цисти-
нурия — моногенно-наследуемая патология, ха-
рактеризующаяся нарушением транспорта ами-
нокислот: цистина, лизина, аргинина, орнити-
на в эпителии почечных канальцев и кишеч-
ника и формированием цистиновых конкремен-
тов в почках. В 1951 г. Ch.Dent установил, что в
основе патологического процесса лежит увели-
чение почечного клиренса цистина и диамино-
карбоновых аминокислот. Была высказана гипо-
теза, которая в дальнейшем получила подтвер-
ждение о наличии в почках единого стереоспе-
цифического транспортного механизма для
цистина, лизина и аргинина. Патогенез цисти-
нурии связан с повышением концентрации
цистина в провизорной моче. В физиологичес-
ких условиях цистин хорошо фильтруется в
клубочках, и почти 30 % его реабсорбируется
в почечных канальцах. Мутантный ген в гомо-
зиготном состоянии обусловливает бездействие
357
транспортных систем, благодаря чему цистин
накапливается в канальцах. В связи с его пло-
хой растворимостью при превышении порога
насыщения происходит выпадение кристаллов
цистина в осадок. Образуются кристаллы, ко-
торые ведут к развитию МКБ.
Эпидемиология, клиническая картина. Данные
о частоте заболевания в различных регионах раз-
личны — от 1:14 000 до 1:40 000 популяции,
биохимическими методами повышенная почеч-
ная экскреция цистина обнаруживается в Ев-
ропе у 1:250 жителей. Цистиновые камни встре-
чаются примерно у 2 % больных МКБ, чаще у
мужчин.
В настоящее время известны 3 варианта ци-
стинурии, которые характеризуются повышен-
ной почечной экскрецией цистина и диамино-
карбоновых кислот, но различаются по такому
признаку, как наличие или отсутствие их ки-
шечного транспорта:
• тип 1 — отсутствие транспорта цистина (Цт)
и диаминокарбоновых кислот (ДКК) в поч-
ках и кишечнике;
• тип 2 — сниженный наполовину транспорт
Цт в почках, отсутствие транспорта ДКК в
почках и кишечнике;
• тип 3 — сниженный транспорт Цт и ДКК в
почках при нормальном в кишечнике.
Заболевание может проявиться в любом воз-
расте, но чаще после 10 лет. Возникают почеч-
ные колики. Возможны обструкция мочевых
путей, присоединение рецидивирующей инфек-
ции органов мочевой системы. Позднее разви-
вается артериальная гипертензия, формирует-
ся ХПН.
Морфология. Гистологические проявления
цистинурии: абактериальный ТИН, пиелонеф-
рит, картина нефролитиаза.
Генетика. Заболевание наследуется аутосом-
но-рецессивным путем. При исследовании 129
членов из 23 неродственных семей, где выяв-
лен 41 член с цистиновой МКБ, превалирую-
щей мутацией оказался ген rBAT М467Т [Bruno
М. et al., 1995]. Авторы делают вывод, что в
итальянской популяции при цистинурии пре-
обладает этот вариант мутации.
Диагностика. В каждом случае МКБ должна
быть исключена цистинурия. Для этой цели в
качестве скринирующего используют цианид-
нитропруссидный или йод-азидный тест, а так-
же микроскопическое исследование осадка
мочи. При положительном результате количе-
ственное определение цистина осуществляют в
моче методом тонкослойной хроматографии,
высоковольтного электрофореза или хромато-
графии на ионообменных смолах. Здоровые дети
и взрослые выделяют с мочой 75—125 мг цис-
тина на каждый грамм креатинина мочи, при
358
цистинурии экскреция Цт превышает 250 мг на
1 г креатинина и более.
Лечение. Для лечения цистинурии широко
используется «картофельная» (антицистинури-
ческая) диета, которая, кроме разнообразно
приготовленного картофеля, включает овощные
супы, пироги с вареньем, капустой, сливочное
и растительное масло, фрукты, сладости. По-
ступление при этой диете серосодержащего
метионина ограничено до 0,7 г в сутки. Такая
диета, применяемая дольше 3—4 нед, небезо-
пасна для растущего организма ребенка. Поэто-
му вслед за ней назначают диету типа «пече-
ночной». Обязательно используют цитратные
смеси, ингибиторы карбоангидраз (диакарб),
гипотиазид. Почечную экскрецию Цт может
несколько снизить глутамин. С целью повыше-
ния растворимости Цт используют пеницилл-
амин. В связи с его токсичным действием в кли-
нике испробовано применение купренила (ана-
лог пеницилламина) в уменьшенной дозе од-
новременно с ксидифоном с удовлетворитель-
ным эффектом [Дегтярева Э.М. и др., 1984].
Должен назначаться пиридоксальфосфат, так
как при назначении пеницилламина происхо-
дит инактивация последнего. Обязательно ак-
тивное лечение инфекции мочевой системы.
При обструкции мочевых путей прибегают к хи-
рургическому вмешательству.
13.4.5 . Мочекислый (уратный) диатез
Пуриновый обмен. Нарушение метаболизма пу-
ринов происходит при дефектах репарации
ДНК, дефектах ферментов: гипоксантин-гуа-
нинфосфорибозилтрансферазы (ГГФТ), адено-
зин-деаминазы, аденинфосфорибозилтрансфе-
разы. Растворимость мононатриевой соли моче-
вой кислоты при определенном составе в био-
логических жидкостях (pH 7,4, t = 37 °C, кон-
центрация натрия — 140 ммоль/л) составляет
0,57 ммоль/л. Риск кристаллизации мочевой
кислоты возникает при превышении этого по-
рога. Охлаждение, снижение pH, повышение
концентрации ионов кальция снижают порог
кристаллизации уратов.
Термин «мочекислый диатез» был введен
Н.Ф.Филатовым в 1902 г. Л.Н.Астахова (1985),
проводя эпидемиологическое исследование,
выявила гиперурикемию у 16 % обследованных
детей. У большинства из них гиперурикемия
имела транзиторный характер и была связана
с дефектами питания, заболеваниями сердеч-
но-сосудистой системы, крови, почек. У всех
детей с гиперурикемией отмечалась высокая ча-
стота нервно-психических отклонений: недаром
М.С.Маслов (1964) называл уратный диатез
нервно-артритическим.
13.4.6 . Синдром Лёша — Найена
Синдром Леша — Найена — моногенно-насле-
дуемое заболевание, связанное с полным от-
сутствием гипоксантингуанинфосфорибозил-
трансферазы (ГГФТ), характеризующееся тяже-
лой гиперурикемией, спастическим церебраль-
ным параличом, хореоатетозом, аутоагрессией
с серьезными самоповреждениями. Для больных
характерна нефропатия, проявляющаяся гема-
турией, отложением мочевой кислоты и ксан-
тина в почках, развитием МКБ. При отсутствии
ГГФТ блокировано образование промежуточных
продуктов метаболизма пуринов, в том числе
пуриновых нуклеотидов. В этих случаях весь цикл
синтеза пуринов происходит в одном направ-
лении — синтез мочевой кислоты.
Тип наследования — рецессивный, связан-
ный с Х-хромосомой. Определен мутантный
ген — Xq26—q27.2, в котором чаще выявляет-
ся делеция [Schriver С. et al., 1995].
13.4.7 . Уратная нефропатия
Терминология, патогенез. Под уратной (подагри-
ческой) нефропатией понимается прогрессиру-
ющее заболевание почек, связанное с несбалан-
сированностью урикоземии и урикозурии, ко-
торая проявляется гематурией и/или протеину-
рией, уратной кристаллурией с формировани-
ем ТИН и/или МКБ. В основе лежит повыше-
ние активности фосфорибозилпирофосфатсин-
тетазы или частичная недостаточность ГГФТ.
Клиническая картина. Для уратной нефропа-
тии характерно латентное развитие процесса,
которое может быть и без клинических призна-
ков подагры со стороны суставов. Тубулоинтер-
стициальный процесс может быть абактериаль-
ным, но может осложняться инфекцией моче-
вой системы. Другой вариант уратной нефропа-
тии — это образование уратных камней, при-
чем камни имеют, как правило, смешанный
состав. Кроме уратов, обнаруживают оксалаты
и фосфаты. Необходимо подчеркнуть, что при
эпидемиологических исследованиях, направлен-
ных на выявление оксалатной нефропатии (диз-
метаболической нефропатии с ОКК), нередко
в семье в старших поколениях отмечалась не ок-
салатная, а уратная кристаллурия. Редкий ва-
риант уратной нефропатии связан с острой
мочекислой блокадой почек в связи с быстрым
развитием массивной гиперурикемии, сопро-
вождающейся повышенной урикозурией и
осаждением кристаллической или аморфной
мочевой кислоты внутри почечных канальцев.
Уратная нефропатия может быть не только
подагрической, но и связанной с недостаточ-
ностью глюкозо-6-фосфатазы, которая лежит в
основе I типа гликогеновой болезни.
Гиперурикемия может быть при недостаточ-
ности фермента аденинфосфорибозилтрансфе-
разы, преобразующего аденин в фосфорибозил-
пирофосфат и адениловую кислоту, что в ко-
нечном итоге приводит к накоплению мочевой
кислоты в крови.
Гиперурикемия может сочетаться с ожире-
нием. Известно, что при гиперлипопротеинемии
IV, а также III и V типов имеется частичная
недостаточность фосфорибозилтрансферазы и
глюкозо-6-фосфатазы, что может сопровож-
даться тем же феноменом, что и гликогеновая
болезнь I типа.
Повышение почечного клиренса мочевой
кислоты может наблюдаться при дефиците ксан-
тиноксидазы. Правда, в этих случаях речь чаще
идет о формировании ксантиновых камней.
Лечение. Основная задача при лечении боль-
ных с гиперурикемией — снизить ее концент-
рацию в крови до 6 мг/100 мл и менее, чтобы
установить отрицательный тканевый баланс.
Наиболее часто употребимое средство — алло-
пуринол — ингибитор ксантиноксидазы, кото-
рый блокирует переход пуринов в мочевую
кислоту. Клинически это проявляется снижени-
ем уровня уратов в крови и моче уже через 24—
48 ч после приема, однако при этом повыша-
ется в крови уровень ксантина, что чревато
образованием ксантиновых камней. Назначает-
ся аллопуринол в дозе 200—300 мг в 2—3 при-
ема в течение не менее 6 мес. Урикозурическо-
го эффекта можно достигнуть, применяя оро-
товую кислоту в дозе 2—6 мг в сутки. В после-
днее время при гиперурикемии с явлениями
нефропатии используется колхицин, который
влияет на метаболизм пуринов и оказывает
противовоспалительное действие. Рекомендуют-
ся длительные курсы колхицина — 2 мг в день
на протяжении нескольких лет. При уратной
нефропатии обязательны соблюдение диеты с
уменьшенным содержанием пуринов (мясо,
особенно птица), прием повышенного количе-
ства жидкости. Рекомендуются уродан, магур-
лит и их аналоги. В качестве мембранотропного
средства используется ксидифон.
13.5. Нефропатии при
наследственных системных
заболеваниях
13.5.1. Диффузная ангиокератома
Фабри (болезнь Андерсона — Фабри)
Терминология, патогенез. Диффузная ангиокера-
тома — моногенно-наследуемая лизосомная бо-
лезнь, связанная с недостаточностью лизосо-
359
мального фермента альфа-галактозидазы-А-це-
рамид-тригексозидазы, проявляющаяся пораже-
нием сосудов кожи, глаз, почек и других орга-
нов. Дефект фермента сострит в нарушении
метаболизма гликосфинголипидов, которые
откладываются в сосудах различных органов.
Клиническая картина. Заболевание встречает-
ся с частотой 1:40 000 новорожденных. Первые
симптомы — появление телеангиэктазий на
коже туловища, бедер, ягодиц, в генитальной
области в виде темно-красных точек и пятен,
которые не исчезают при надавливании, неред-
ко располагаются симметрично. Могут быть
боли в суставах, животе. Нередко поражается
сердечно-сосудистая система: сфинголипиды
откладываются в миокарде, аорте, коронарных
сосудах, что дает соответствующие клиничес-
кие проявления [Nakao S. et al., 1995]. Харак-
терны изменения глаз, чаще всего наблюдает-
ся дистрофия роговицы. Неврологическая сим-
птоматика разнообразна — от эпизодов парес-
тезий часто одновременно с подъемами темпе-
ратуры до цереброваскулярных изменений с
ишемическими или геморрагическими измене-
ниями. Нефропатия проявляется протеинурией,
эритроцитурией, гипостенурией и признаками
почечного несахарного диабета. Заболевание
развивается постепенно и в зрелом возрасте
приводит к ХПН.
Морфология. Отложения гликосфинголипидов
(церамидтригексозидов) в почках приводят к
тубулоинтерстициальным изменениям, которые
медленно прогрессируют, приводя к нефроск-
лерозу. На вскрытии обнаруживаются аналогич-
ные изменения в легких, в сердечно-сосудис-
той системе и других органах.
Генетика. Заболевание сцеплено с полом,
встречается исключительно у представителей
мужского пола, хотя некоторые клинические
проявления, в частности телеангиэктазии, мо-
гут быть и у женщин. В настоящее время опре-
делен мутантный ген на длинном; плече Х-хро-
мосомы в зоне Xql3—22 DXS17 и DXYS1 [Мас
Dermot К. et al., 1987].
Диагностика. Основные клинические прояв-
ления болезни Фабри позволяют заподозрить
наличие этого заболевания, однако для под-
тверждения необходимо исследовать уровень це-
рамидтригексозидазы в крови и моче. Нередко
по мере появления различных клинических
симптомов диагноз заболевания многократно
меняется [Коровина НА. и др., 1987].
Мальчик Ш. от второй беременности, протекав-
шей с нефропатией. В 4 года обратили внимание на
симметрично расположенные геморрагические вы-
сыпания на нижних конечностях, ягодицах. Постав-
лен диагноз: геморрагический васкулит. С 6 лет не-
редко отмечался фебрилитет. Диагноз изменен на
болезнь Виллебранда. С 8 лет появились абдоминаль-
ный синдром, рвота. При обследовании на кафедре
педиатрии ЦОЛИУв обратили внимание на харак-
тер высыпаний — размером от точечных до гороши-
ны и от розового до вишневого цвета с элементами
кератоза, которые не исчезали при надавливании.
Обнаружены ампулообразные в виде узелков расши-
рения сосудов конъюнктивы. При фиброгастроско-
пическом исследовании выявлены дуоденит и ант-
ральный гастрит. В моче изменения минимальны. В
крови — значительная недостаточность альфа-D-га-
лактозидазы (3,6 %). При биопсии кожного узелка и
в верхней части дермы обнаружены варикозно-рас-
ширенные сосуды, «забитые» эритроцитами и обту-
рированные тромбами. При ЭМ клетки эпителия
заполнены гликолипидными гранулами. Диагноз:
ангиокератоз.
Таким образом, у мальчика на протяжении не-
скольких лет развивался болезненный процесс, ко-
торый трактовался по-разному в связи с теми или
иными симптомами. Окончательный диагноз был
поставлен при определении в крови недостатка фер-
мента альфа-D-галактозидазы и выявлении при био-
псии типичных гликолипидных отложений, харак-
теризующих болезнь Фабри.
Лечение. Специфического лечения нет. Про-
водится симптоматическая терапия, при разви-
тии ХПН — заместительная. Рекомендуется
пересадка трупной почки. Отложение гликос-
финголипидов в трансплантате происходит, но
в небольших количествах [Morgan S., 1998].
Возможен пренатальный диагноз путем опре-
деления активности альфа-В-галактозидазы в
амниоцитах и лейкоцитах.
13.5.2. Нефропатии при туберозном
склерозе
Терминология. Туберозный склероз — моноген-
но-наследуемый гамартоз, проявляющийся в
различных органах — прежде всего в нервной
системе, коже и почках. Поражение почек при
туберозном склерозе — одно из обязательных
проявлений заболевания [Comez М., 1984]. По
нашим наблюдениям, при туберозном склеро-
зе могут выявляться ангиомиолипоматоз, поли-
кистоз, анатомические аномалии почек и диз-
метаболические расстройства в виде оксалатной
нефропатии [Катышева О.В. и др., 1997].
Клиническая характеристика. Основные кли-
нические проявления туберозного склероза:
• младенческие спазмы;
• участки шагреневой кожи и депигментации;
• себорейная аденома;
• ретинальная гамартома;
• субэпендимальная или кортикальная кальци-
фикация, определяемая при компьютерной
томографии черепа;
• опухоли почек или кисты почек;
• рабдомиома сердца.
360
Рис. 13.15. Фрагмент родословной се-
мьи Г. Диагноз: туберозный склероз.
а — ХПН; б — умственная отсталость; в —
кожные проявления; г — полистоз почек;
д — возраст смерти; е — возраст. Стрелкой
обозначен пробанд.
Почечный поликистоз, по данным F.Stap-
leton и др. (1980), может обнаруживаться в ран-
нем детстве и быть первым клиническим про-
явлением болезни. В наших наблюдениях поли-
кистоз был выявлен у 6 из 30 обследованных
больных.
В семье Г., где мать и ее старший брат умерли от
ХПН в связи с поликистозной болезнью, имелось
четверо детей, старшая — от первого брака. У дево-
чек 5 и 7 лет при УЗИ обнаружена типичная карти-
на почечного поликистоза (рис. 13.15). У младшей
была удалена одна почка в связи с наличием ангио-
миолипомы и при хирургическом вмешательстве
был выявлен распространенный кистоз удаленной
почки. У обеих — типичные кожные изменения: се-
борейная аденома, участки шагреневой кожи. При
компьютерной томографии черепа у обеих выраже-
ны множественные кальцификаты в субэпендималь-
ных зонах. При динамическом наблюдении на про-
тяжении 2 лет отмечалось дальнейшее снижение
функции почек, которое было минимально выраже-
но при первом поступлении. Отмечались повышение
АД и снижение фильтрации. Таким образом, в
семье, где причина почечного поликистоза, при-
ведшего к летальному исходу у старшего поколе-
ния, не была установлена, у детей погибшей жен-
щины первыми клиническими проявлениями, обра-
тившими на себя внимание, были поражения по-
чек — поликистоз и ангиомиолипоматоз туберозно-
го склероза.
До развития почечного поликистоза и ангио-
миолипоматоза при УЗИ у части больных нами
выявлялся феномен повышенной эхогенности
почечной паренхимы чаще линейного характе-
ра, что позволяет предполагать начальную ста-
дию формирования структурных патологичес-
ких изменений (рис. 13.16). В тех случаях, когда
у больных не определялось ни почечного по-
ликистоза, ни ангиомиолипоматоза, биохими-
ческие показатели свидетельствовали о наличии
мембранопатологического процесса типа диз-
метаболической нефропатии с ОКК наряду
с отчетливыми изменениями состояния каль-
циевого метаболизма [Soukhorourov V. et al.,
1996]. Мочевой синдром был непостоянным у
всех обследованных больных и проявлялся про-
теинурией и/или эритроцитурией, лейкоциту-
рией.
Рис. 13.16. Кистозная трансформация в почке при
туберозном склерозе.
361
Показатели До лечения После лечения
Кристаллы оксалатов В
Кальций (N = 1,5 - 4,0) мМ/24 ч -1 ' ' ~~ '
Липиды (№0) о II I
Перекиси (№0) -0 ' ' ~
Щелочная фосфатаза (N < 5 мМ/л в 1 мин) -0 —
a
Показатели До лечения После лечения
Кристаллы оксалатов Е)
Кальций (N = 1,5 -4,0) мМ/24 ч А 1 1
Липиды (N = 0) 1 1 1 о
Перекиси (N = 0) 1 1 1 о
Щелочная фосфатаза (N < 5 мМ/л в 1 мин) 2. 1 1
б
Рис. 13.17. Лабораторные пока-
затели исследования мочи у
детей с туберозным склерозом
до и после лечения ксидифо-
ном.
а — Оля М., 4 лет; б — мальчик
Саша П., 13 лет.
Морфология и патогенез. По данным морфо-
логических исследований, J.Bernstein (1990) на
ранних стадиях формирования почечных кист
отметил уникальную по характеру гиперплазию
эпителия почечных канальцев, способную выз-
вать закупорку просвета канальца и начало фор-
мирования кисты. В случаях обнаружения про-
явлений дизметаболической нефропатии с ОКК
у детей с туберозным склерозом можно пред-
положить несколько вариантов ее развития:
• это феномен, связанный с гиперпластичес-
кой реакцией эпителия, свойственного ту-
берозному склерозу;
• развитие мембранопатологических измене-
ний из-за нарушения кальциевого метабо-
лизма;
• вариант, объединяющий две предыдущие
гипотезы — нарушение кальциевого обмена
вследствие гиперплазии тубулярного эпите-
лия и обусловленное им усугубление нару-
шения кальциевого гомеостаза.
Генетика. Заболевание передается аутосомно-
доминантным путем. В настоящее время опре-
делено, что имеет место два фенотипических и
генотипических варианта TSC (международная
аббревиатура): TSC1 развивается при мутации
гена в области 3q34, TSC2 — в связи с мута-
цией гена, картированного на хромосоме 16р13.
Продуктом гена TSC2 является туберин
[Wienecke R. et al., 1996], который способству-
ет гиперпластическим процессам в организме,
что может вести к мембранопатологическим
362
изменениям в почечной ткани даже на началь-
ных стадиях патологии.
Лечение туберозного склероза касается в
большой мере неврологических проявлений, в
частности судорожного синдрома. Для лечения
нефропатии при TSC применяли ксидифон —
отечественный препарат, известный как мемб-
раностабилизатор и стабилизатор кальциевого
метаболизма. Назначали в дозе 10 мг на 1 кг
массы тела ребенка 3 раза в день с минималь-
ным курсом 3 мес. При таком лечении отмече-
ны некоторое улучшение неврологических про-
явлений и улучшение показателей, свидетель-
ствующих о мембранопатологических изменени-
ях (рис. 13.17).
13.5.3. Поражение почек при
наследственной остеоониходисплазии*
Наследственная остеоониходисплазия (НООД) —
наследственное заболевание, характеризующе-
еся гипоплазией или отсутствием надколенни-
ков, дистрофией ногтей и поражением почек.
Существуют многочисленные синонимы этого
названия: синдром Тернера — Кайзера, синд-
ром Остеррейхера, синдром Фонга, наслед-
ственный остеоониходизостоз, наследственная
артроостеоониходисплазия. Однако наиболее
известным и широко распространенным явля-
ется английское название — nail-patella
syndrome, т.е. синдром ногти-надколенник.
Заболевание было впервые описано в 1897 г.
английским врачом Е.Little, который объеди-
нил 42 известных к тому времени наблюдения
и самостоятельно изучил случаи наследствен-
ного отсутствия надколенников. В 50-х годах XX
века С.Hawkins и О.Smith, обобщив имеющие-
ся сведения о документированной протеинурии
у пациентов с отсутствием надколенников,
предположили, что нефропатия является
неотъемлемой составной частью данного син-
дрома. Последующие морфологические исследо-
вания почек у подобных больных полностью
подтвердили это предположение, а в 1971 г.
M.Ben-Bassat и соавт. описали ультраструктур-
ную патологию базальной мембраны капилля-
ров клубочков, патогномоничную для НООД.
Наследственная остеоониходисплазия — ред-
кое заболевание, встречающееся с частотой
около 22 случаев на 1 млн [Kemper R., 1994];
наследуется по аутосомно-доминантному пути.
Локус гена НООД находится на длинном пле-
че 9-й хромосомы (9q34) рядом с генами АВО
групп крови и аденилатциклазы [Е.Campeau et
al., 1995]. Считается, что для больных НООД,
* Раздел написан Н.Л.Козловской.
в чьих семьях имелись родственники с явными
признаками поражения почек, риск появления
ребенка с нефропатией составляет 1:4, а риск
развития у этого ребенка ХПН — 1:10.
Патология скелета и ногтей. Аномалия ног-
тей — самый частый признак наследственной
остеоониходисплазии, встречающийся у 80—
90 % пациентов. Изменения ногтевых пластинок
всегда симметричны, пальцы рук, особенно
большой и указательный, поражаются чаще,
чем на ногах. Патология ногтей разнообразна и
включает отсутствие или дистрофию ногтевых
пластинок, продольные бороздки на них, тре-
угольные лунки, обесцвечивание, койлонихию
(ложкообразные ногти). У 60 % больных отсут-
ствует или гипоплазирован надколенник. При
этом может отмечаться рецидивирующий под-
вывих в коленном суставе с постепенным фор-
мированием деформации типа «раздробленно-
го» колена. Аномалии коленной чашечки могут
также привести к развитию остеоартрита с
выпотом в полость коленного сустава и остео-
артроза. Около 80 % пациентов с НООД име-
ют так называемый подвздошный рог — дву-
сторонние симметричные костные выросты на
передней поверхности крыльев подвздошных
костей, которые считаются патогномоничным
рентгенологическим признаком этого заболе-
вания.
Кроме описанных признаков, у больных с
НООД встречаются более редкие аномалии
скелета — утолщение лопаток, аплазия или
гипоплазия локтевых отростков, головок луче-
вых костей, что приводит к деформациям и
нарушению функции локтевых суставов. В осно-
ве патологии ногтей и скелета лежит недораз-
витие тканей эктодермального и мезодермаль-
ного происхождения.
Клинико-морфологические признаки поражения
почек. Клинические признаки нефропатии вы-
являются примерно у 30 % носителей гена
НООД. Наиболее часто встречается изолирован-
ная протеинурия, в ряде случаев — нефроти-
ческий синдром, реже — микрогематурия и
артериальная гипертензия. У большинства боль-
ных течение нефропатии доброкачественное,
однако у 10 % пациентов развивается прогрес-
сирующая почечная недостаточность [Chan Р.С.
et al., 1988]. Вариабельность темпов прогресси-
рования заболевания иллюстрирует наблюдение
A.Meyrier и соавт. (1990) двух семей. В одной из
них у 64-летнего мужчины с многолетней про-
теинурией отмечались начальные признаки
ХПН, тогда как его брат умер от уремии в воз-
расте 25 лет. В другой семье НООД страдали
братья-близнецы, у одного из которых выявле-
на терминальная почечная недостаточность,
а у другого — лишь незначительная протеи-
нурия.
363
Морфологическая картина нефропатии на
светооптическом уровне значительно варьирует.
У пациентов с сохранной функцией почек и
минимальной протеинурией в большинстве
случаев не обнаруживается изменений в клубоч-
ках. При сниженной функции почек и при на-
растающей протеинурии наиболее характерна
картина фокально-сегментарного или диффуз-
ного гломерулосклероза [Cohen A., Adler S.,
1994].
Тубулоинтерстициальные изменения в виде
атрофии канальцев и фиброза интерстиция, как
правило, коррелируют со степенью нарушения
функции почек.
Если выраженность светооптических измене-
ний, по данным многих авторов, хорошо кор-
релирует с выраженностью клинических про-
явлений почечного страдания, то ультраструк-
турная патология ГБМ отмечается у всех без ис-
ключения больных НООД независимо от нали-
чия протеинурии. Патогномоничным для этого
заболевания признаком считается выявляемое
при электронной микроскопии неравномерное
утолщение гломерулярной базальной мембраны
(ГБМ) с мелкими очагами разрежения, повы-
шенной прозрачности, создающими характер-
ную картину «изъеденности молью», «обветша-
лости» ГБМ. Реже аналогичная картина наблю-
дается в мезангиальном матриксе. В участках
разрежения отмечают отложения волокон кол-
лагена, как правило, собранных в пучки. Фиб-
риллы коллагена могут располагаться как
в маленьких сегментах, так и вдоль всей
ГБМ. Тубулярные базальные мембраны при
НООД не имеют каких-либо специфических
признаков.
Иммуногистохимическое исследование по-
чечных биоптатов у большинства больных с
НООД не выявило специфического свечения,
поскольку в основе нефропатии лежит не им-
мунное воспаление, а дефект коллагена ГБМ.
Однако в ряде случаев при наличии сегмен-
тарного или диффузного гломерулосклеро-
за описаны депозиты IgM и СЗ, которые
располагаются как вдоль ГБМ, так и в ме-
зангии.
Кроме патологии ГБМ, у пациентов с
НООД описаны другие структурные аномалии
почек и мочевыводящих путей, которые мож-
но обнаружить при рентгенологическом и уль-
трасонографическом исследовании — дилата-
цию чашечек с истончением паренхимы в об-
ласти полюсов, одностороннюю гипоплазию
почки, гипоплазию с удвоением контралате-
ральной почки, удвоение чашечно-лоханочной
системы и другие пороки развития мочевыво-
дящей системы.
Клинические признаки поражения почек у
пациента с патологией ногтей позволяют запо-
364
дозрить НООД. Для подтверждения диагноза
необходимо выявить гипоплазию надколенни-
ков и локтевых суставов, подвздошный рог, по-
скольку именно эти симптомы встречаются
практически со 100 % частотой. Кроме того, у
части пациентов имеется гетерохромия радуж-
ки, в связи с чем необходимо обращать вни-
мание на цвет глаз. Желательно также обследо-
вать семью. Показана пункционная биопсия
почки с обязательным электронно-микроско-
пическим исследованием материала.
Лечение. Специфическая терапия НООД от-
сутствует. Принимая во внимание характер мор-
фологии почечного процесса и лежащую в его
основе структурную аномалию коллагена, а не
иммунное воспаление, активная иммунодепрес-
сивная терапия у подобных больных нецелесо-
образна. При развитии у пациентов нефротичес-
кого синдрома или артериальной гипертензии
показана лишь симптоматическая диуретичес-
кая или антигипертензивная терапия. Транс-
плантация почки у пациентов с НООД высо-
коэффективна, поскольку в трансплантате из-
менения ГБМ не развиваются [Chan Р. et al.,
1988].
Мы наблюдали пациентку 27 лет с классичес-
ким nail-patella синдромом и поражением почек,
первые признаки которого были обнаружены еще в
детстве.
Деформация ногтей на руках отмечалась с рож-
дения, а гипоплазию обоих надколенников и изо-
лированную протеинурию выявили в возрасте 10 лет
при обследовании в связи с подозрением на ревма-
тоидный артрит, диагноз которого не подтвердился.
В клинику нефрологии ММА им. И.М.Сеченова была
госпитализирована в связи с резким нарастанием не-
фротического синдрома во время беременности и
после родов, что потребовало исключения СКВ. При
обследовании впервые была заподозрена связь меж-
ду деформацией ногтей, патологией надколенников
и НС. Рентгенологическое исследование костей, вы-
явившее, кроме гипоплазии надколенников, двусто-
ронний подвздошный рог, подтвердило диагноз на-
следственной остеоониходисплазии, тем более что у
годовалой дочери больной отмечалась грубая дефор-
мация ногтевых пластинок на больших пальцах рук.
Биопсия почки выявила фокально-сегментарный
гломерулосклероз с фиксацией IgM и СЗ на БМК
очагово-гранулярного характера и тубулоинтерстици-
альными изменениями в виде атрофии эпителия
канальцев и очагового склероза стромы, что не про-
тиворечило диагнозу НООД. При электронно-мик-
роскопическом исследовании обнаружено утолщение
ГБМ с мелкими очагами повышенной прозрачнос-
ти — феномен «изъеденности молью», несомненно
подтверждающее диагноз синдрома nail-patella. В свя-
зи с этим иммунодепрессивная терапия не назна-
чалась. Через несколько месяцев у пациентки было
впервые отмечено повышение креатинина сыворот-
ки, которое прогрессивно нарастало. Полтора года
спустя констатирована терминальная почечная не-
достаточность и начато лечение гемодиализом. В те
же сроки отмечено появление протеинурии у доче-
ри больной.
В литературе описаны два варианта течения
нефропатии при наследственной остеоонихо-
дисплазии: длительное латентное с минималь-
ным мочевым синдромом и быстропрогресси-
рующее с массивной протеинурией и ранним
развитием терминальной почечной недостаточ-
ности [Meyrier A. et al., 1990]. Представленное
наблюдение является своеобразным «промежу-
точным» вариантом течения нефропатии с от-
носительно долгим — более 10 лет — существо-
ванием изолированной протеинурии, сменив-
шейся нефротическим синдромом с быстро-
прогрессирующей почечной недостаточностью.
13.6. Поражение почек при
хромосомных болезнях
Терминология. Хромосомные болезни (ХБ) —
большая группа патологических состояний, эти-
ологическим фактором которых является хро-
мосомная, или геномная, мутация, как прави-
ло, не передающаяся по наследству. Аномалии
почек и органов мочевыведения — частое кли-
нико-морфологическое проявление ХБ. Реаль-
ная частота структурных аномалий хромосом
составляет */3 всех оплодотворений. В процессе
эмбриогенеза часть плодов или эмбрионов по-
гибает. Среди новорожденных ХБ составляют
0,4—2,4:1000 новорожденных.
Варианты хромосомных болезней. Выделяют 3
группы ХБ:
1) нарушение плоидности (у человека изве-
стна только триплоидия);
2) нарушение числа хромосом (у человека
чаще трисомия). При моносомии по одной из
аутосом эмбрион нежизнеспособен. У человека
возможна лишь моносомия Х-хромосомы;
3) нарушения структуры хромосом (делеция,
транслокация и т.д.).
Численные и структурные аномалии в хро-
мосомном наборе, обусловливающие ХБ, могут
возникнуть под влиянием мутагенных факторов
физической (радиация), химической (ингибито-
ры синтеза ДНК, алкилирующие агенты и др.)
и биологической природы (вирусы, нарушения
метаболизма при эндокринной патологии).
Клиническая характеристика. Для ХБ харак-
терны множественные пороки развития различ-
ных органов. Как правило, страдает ЦНС, по-
этому довольно редко за медицинской помо-
щью обращаются именно в нефрологическую
клинику. Однако при очень многих ХБ выявля-
ются нефро- и уропатии. Их систематика, про-
веденная Э.М.Дегтяревой (1989), представлена
в табл. 13.4.
Нефропатии, связанные с ХБ, встречаются
сравнительно редко: 0,28 % среди 2859 боль-
ных, наблюдаемых в клинике на протяжении
15 лет. Чаще это были НС, гипопластическая
дисплазия почек, вторичный пиелонефрит,
связанный с обструктивной уропатией и диз-
метаболической нефропатией с оксалатной и
уратной кристаллуриями. Как правило, больные
поступали с установленным диагнозом: болезнь
Дауна, синдром Шерешевского — Тернера.
Однако наблюдались случаи, когда ребенок
поступал в клинику как нефрологический боль-
ной и только при наблюдении за ним появля-
лась необходимость проведения цитогенетичес-
кого обследования.
Надя Ц. наблюдалась в клинике на протяжении
10 лет. Девочка от второй беременности, протекав-
шей с артериальной гипертензией и ОРВИ на 12-й
неделе. Роды на 2 нед позднее срока, масса тела при
рождении 4200 г. В 5 мес обнаружена протеинурия,
затем появились отеки, что в стационаре было рас-
ценено как нефротическая форма нефрита, и был
применен преднизолон. Эффекта от лечения не было.
В возрасте 3 лет определено неполное удвоение поч-
ки, и с диагнозом «НС при дисплазии почек» де-
вочка поступила в клинику. При осмотре выявлено
более 15 малых аномалий телосложения. При рент-
генологическом исследовании челюсти выявлена
диспластичная деформация костной структуры обе-
их челюстей. АД 130/80 мм рт.ст., потеря белка с
мочой до 32 г/сут. При биопсии почечной ткани —
кистозная дисплазия. При последующем поступлении
в клинику через 5 лет отмечено отставание роста и
массы тела на 2 и 3,5 сигмы соответственно. Выра-
жены отставание психологического развития, частые
эпилептиформные судороги. АД до 190/100 мм рт.ст.
Отмечены анемия, ацидоз, гиперкреатинемия. Пси-
хоневрологические симптомы при наличии более 15
внешних стигм дизэмбриогенеза, анатомической и
структурной аномалии почек были основанием для
проведения цитогенетического исследования, кото-
рое выявило 46XX/46XX/13q-, что соответствует
синдрому Орбели (мозаичный вариант).
Таким образом, у девочки со стероидорезистен-
тным НС выявлены множественные стигмы дизэм-
бриогенеза, кистозная дисплазия почек, отставание
в психическом развитии, позволившие предположить
наличие хромосомных аберраций, что подтвержде-
но цитогенетическим исследованием. Именно нефро-
логическая патология была основой болезни и оп-
ределила ее прогноз, но связана она была с ХБ.
Диагностика. Множественные пороки разви-
тия в сочетании с 15 и более внешними малы-
ми аномалиями и нарушениями психического
развития всегда являются основанием для ци-
тогенетического исследования.
При обнаружении хромосомных аберраций
лечение должно быть максимально щадящим и
не включать стероиды, цитостатики и другие
сильнодействующие средства.
365
Таблица 13.4. Клиническая симптоматика основных хромосомных болезней
Клинические варианты хромосомных болезней Наиболее характерные пороки органов мочевой системы Пороки других органов Характерные внешние аномалии
Синдром Патау Синдро Поликистоз, гидронефроз, мы аутосомных трисомии Пороки сердца, желудоч- Широкая переносица, низко располо-
Синдром повышенная дольчатость почек Агенезия, удвоение, под- но-кишечного тракта, по- ловых органов Пороки сердца, желудоч- женные деформированные ушные ра- ковины, микрогнатия То же + эпикант
трисомии 8 Синдром Дауна ковообразная почка, по- ликистоз Различные аномалии по- но-кишечного тракта То же Монголоидный разрез глаз, эпикант,
Синдром Эдвардса чек: гипо- и аплазии, приз- наки тканевой незрелости Подковообразная почка, » » уплощенная и широкая переносица, укорочение конечностей, микробрахи- цефалия Микрогения, низко расположенные де-
Синдром перекрестная эктопия по- чек со сращением, удвое- ние почек и мочеточников Кистозная дисплазия по- Пороки сердца, патоло- формированные ушные раковины, вы- сокое небо, множественные аномалии опорно-двигательного аппарата Расщелина губы и неба, низко располо-
триплоидии чек, гидроуретер, гидро- гия желез внутренней сек- женные ушные раковины с недоразви-
нефроз реции, множественные пороки глаз той мочкой, гипертелоризм, микро- фтальм, синдактилия, клинодактилия
Синдромы частичных аутосомных трисомий
Синдром Агенезия, гипоплазия, Пороки сердца, аномалия Колобома радужки, сетчатки или зри-
«кошачьего глаза» подковообразная почка, желудочно-кишечного трак- тельного нерва, микрофтальмия, пре-
Синдромы частич- поликистоз, гидронефроз, обструкция уретры, удво- ение лоханок и мочеточ- ников Гидронефроз та (ректальные атрезии), микроцефалия Нехарактерны аурикулярные сосочки или фистулы, клинодактилия мизинцев, недостаточ- ная дифференцировка ушных раковин, отсутствие XII ребер Микроцефалия, энофтальм, выступаю-
ной трисомии 4-й хромосомы: 4р‘ 4q+ Гидронефроз, гипопла- Пороки сердца щее надпереносье, густые широкие брови, синофрис, гипертелоризм, мак- ростомия, низкое расположение ушей с большими раковинами, короткая шея, контрактуры коленных суставов, клино- дактилия V пальцев кистей Пороки I пальца рук, микроцефалия с
Синдром частич- зия почек, подковообраз- ная почка, тазовая дис- топия, поликистоз Удвоение лоханок, стеноз Пороки сердца деформацией мозгового черепа, гипер- телоризм, эпикант, узкие глазные щели с антимонголоидным разрезом, густые брови, микрофтальмия, микроретрогна- тия, косолапость, вывих в тазобедрен- ных суставах, крипторхизм Задержка роста, микробрахицефалия,
ной трисомии 9-й хромосомы: 9р+ Синдромы частич- мочеточников, гидронеф- роз, кисты, подковообраз- ная почка Односторонняя агенезия, Пороки сердца антимонголоидный разрез глаз, эноф- тальм, гипертелоризм, гипоплазия ди- стальных фаланг пальцев рук, гипо- и дисплазия ногтей Физическое недоразвитие, пренаталь-
ной трисомии 10-й хромосомы: Юр* 10q* поликистоз, кистозная дисплазия Микрокистоз, кистозная Пороки сердца (дефект ная гипоплазия, деформация черепа, диспластичные ушные раковины, мон- голоидный разрез глазных щелей, рас- щелина губы и неба, макрогения, косо- лапость Высокий лоб, тонкие дугообразные
366 дисплазия, гипоплазия, односторонняя агенезия межжелудочковой пере- городки), множественные пороки глаз брови, микрофтальм, блефарофимоз, птоз, короткий нос с гипоплазией спин- ки и крыльев, длинная верхняя губа, ретрогения, низко расположенные уш- ные раковины
Продолжение таблицы
Клинические верианты хромосомных болезней Неиболее характерные пороки органов мочевой системы Пороки других органов Характерные внешние аномалии
Синдромы частичных аутосомных моносомий
Синдром Вольфа — Хиршхорна (4р ) Синдром «кошачьего крика» (5р- или 5г) Синдром Орбели (13q‘ или 13г) Агенезия, гипоплазия, гидронефроз, поликистоз, тазовая дистопия Агенезия, подковообраз- ная почка, удвоение, эк- тазия дистальных каналь- цев Гипоплазия, гидронефроз Пороки сердца, половых органов Пороки сердца, половых органов Пороки желудочно-кишеч- ного тракта (атрезия анального отверстия), по- роки сердца Резкая задержка физического разви- тия, низкое расположение крупных уш- ных раковин, микрогения, аномалия носа (клювовидный нос), «рыбий рот», гемангиомы кожи лица, аномалия сто- пы, сакральный синус Микроцефалия, широкая переносица, низко расположенные деформирован- ные уши, эпикант, лунообразное лицо Микроцефалия с тригоноцефалией и краниостенозом, аплазия или гипопла- зия I пальца кистей, микрофтальмия, колобома
Синдромы, связанные с нарушениями в системе половых хромосом
Синдром Шерешевского — Тернера Синдром Клайнфелтера Подковообразная почка, удвоение, незавершенный поворот почек, гипоплазия Поликистоз, гидронефроз Коарктация аорты Микроорхидизм, крипторхизм «Шея сфинкса», гипертелоризм сосков, микрогнатия, аномалия ушных раковин Гинекомастия
13.7. Лечение и медико-
генетическое консультирование
больных с наследственными и
врожденными нефропатиями
Если заболевание связано с мутацией генов,
которые ответственны за тот или иной вид
обмена веществ, подход к лечению может быть
кардинальным или паллиативным. Кардиналь-
ное воздействие — это воздействие на уровне
ДНК с тем, чтобы мутантный ген заменить на
здоровый. Паллиативный — метод воздействия
на других уровнях передачи генетической ин-
формации. С момента удачной трансдукции гена
в клетку с помощью фага (1971) начался от-
счет времени новой науки — генной инженерии.
В 1990 г. была проведена первая успешная пе-
ресадка гена человеку при дефиците аденин-
диаминазы как причины тяжелейшего иммуно-
дефицита. В настоящее время продолжают раз-
рабатываться методы доставки ДНК в клетки
больного человека. В большинстве случаев для
этих целей используются модифицированные
вирусы или «вирусные векторы». Чаще исполь-
зуют мышиные ретровирусы, превращая их в
векторы путем удаления нуклеотидов, ответ-
ственных за их размножение. Введенный с век-
тором ген передается дочерним клеткам при
клеточном делении. Другой вариант вирусных
векторов — это аденовирусы, из которых уда-
лены нуклеотиды, ответственные за реплика-
цию. В этих случаях переносимая аденовирусом
ДНК не встраивается в геном человека, она
остается вне хромосомы, но проявляет генную
активность.
Наряду с биологическими используются
физико-химические методы введения ДНК. Раз-
работана технология введения ДНК с помощью
липосом. Имеются экспериментальные разра-
ботки с помощью липосом направить гены,
ориентированные на гломерулярные клетки,
путем почечной перфузии аденовирусных век-
торов [Imai Е., Isaka J., 1997]. Разработаны ме-
тодики внутривенного введения олигонуклео-
тидов в клетки проксимального отдела нефро-
на. Эти исследования сфокусированы в основ-
ном на трансплантированную почку. Опыт ген-
но-инженерной терапии учит, что подсадка
мутантного гена может помочь:
• путем коррекции клеточных дисфункций,
зависящих от дефектного гена собственного
организма,
• путем добавления новых функций за счет
пересаженного гена,
• путем ингибиции нежелательных функций,
367
которые возникают в организме в связи с
нарушенной генной регуляцией.
В настоящее время поставлена задача разра-
ботки генно-инженерной терапии при наслед-
ственной патологии базальных мембран. На
протяжении ряда лет в нефрологии использу-
ются лекарственные средства, изготовленные с
помощью генной инженерии: это рекомбинан-
тный гормон роста, рекомбинантный эритро-
поэтин, рекомбинантный интерферон.
13.8. Заместительная терапия
Паллиативные методы терапии наследственных
и врожденных нефро- и уропатий могут быть
отнесены к заместительной терапии. Одно из
наиболее популярных лечебных воздействий —
диета, которую называют «инженерией среды».
Это антиоксалурическая, антицистинурическая
диеты. Использование кетостерила при малобел-
ковой диете помогает больным с ХПН, в том
числе с врожденной и наследственной патоло-
гией почек.
Хирургические методы лечения обструктив-
ных уропатий очень важны при врожденных и
наследственных аномалиях почек и мочевыво-
дящих путей. Известен период увлечения фе-
тальной хирургией, когда при УЗИ обнаруже-
ние гидронефроза у плода являлось показани-
ем к внутриматочному устранению этой об-
струкции. В последние годы от этого отказыва-
ются, во-первых, в связи с большим числом
осложнений, а во-вторых, потому, что у части
новорожденных в первые недели жизни может
происходить восстановление уродинамики и
исчезновение гидронефроза. Широко использу-
ется эндоскопический метод лечения пузырно-
мочеточникового рефлюкса. Большие успехи
достигнуты в области трансплантации почек
больным с врожденными и наследственными
нефро- и уропатиями. Пересаженный орган
привносит в организм те белки и ферменты,
продукция которых была нарушена в связи с
генным дефектом.
Среди паллиативных методов можно назвать
средства, которые индуцируют продукцию фер-
ментов, недостаточных в связи с мутацией ге-
нов. Для этой цели при дефиците глюкозо-6-
фосфатдегидрогеназы могут применяться глю-
кокортикоиды. Индукция ферментов может быть
обусловлена витаминами. В частности, при эс-
сенциальной эпителиопатии с синдромом ме-
галобластной анемии (синдром Иммерслунд)
при длительном применении витамина В12 ис-
чезает не только анемия, но постепенно пре-
кращается и протеинурия, зависящая от дефи-
цита ферментных систем, определяющих реаб-
368
сорбцию белка в канальцах [Левицкая С.В. и
др., 1963]. Применение пиридоксина сопровож-
дается улучшением метаболизма при нефропа-
тиях с кристаллуриями (оксалатной, уратной),
цистинурией. При сочетании пиридоксина с
АТФ и кокарбоксилазой повышается содержа-
ние альфа-глицерофосфатдегидрогеназы лимфо-
цитов крови при наследственном нефрите (СА),
что сказывалось на состоянии больных.
Паллиативные методы терапии включают и
использование антиметаболитов. Ярким приме-
ром может служить аллопуринол, так как он
улучшает метаболизм при уратной нефропатии.
Заместительная терапия проводится при вита-
мин-D-резистентном рахите.
При лечении больных с врожденными и на-
следственными нефропатиями необходимо учи-
тывать достижения фармакогенетики, которая
пропагандирует индивидуальный подход к на-
значению лекарственных средств. Это нередко
очень сложная задача, особенно если какое-то
лекарственное вещество применяется впервые.
Известно, что у людей с дефицитом глюкозо-
6-фосфатдегидрогеназы назначение салицилатов
в сочетании с сульфаниламидами может вызвать
бурную гемолитическую реакцию с ОПН. Есте-
ственно, что в дальнейшей жизни такое соче-
тание лекарств больному противопоказано.
При клиническом использовании гипотен-
зивных, диуретических, кардиотропных и дру-
гих лекарственных средств обычно дозу препа-
рата подбирают постепенно, т.е. учитывают
принцип фармакогенетики — индивидуализа-
ции в зависимости от чувствительности паци-
ента к применяемому средству. Необходимо
также подчеркнуть, что и хронобиологические
особенности организма также генетически де-
терминированы, поэтому их нужно учитывать
при лечении больных, особенно при исполь-
зовании высокоактивных препаратов.
Медико-генетическое консультирование. В свя-
зи с тем что многие наследственные и врож-
денные заболевания или инкурабельны, или
дают тяжелейшую инвалидизацию с раннего
возраста, важна профилактика рождения таких
детей. Одним из методов, предупреждающих
рождение неизлечимо больного ребенка, явля-
ется антенатальная диагностика. Однако еще
более щадящим оказывается проведение меди-
ко-генетического консультирования (табл. 13.5).
Правда, всегда нужно помнить, что окончатель-
ное решение вопроса — иметь или не иметь
ребенка — принадлежит семье. Врач должен
только правильно оценить риск развития пато-
логии у ожидаемого члена семьи. Кроме того,
нужно помнить, что по мере развития меди-
цины ряд инкурабельных болезней врожденного
или наследственного характера перестают тако-
выми быть.
Таблица 13.5. Показания к медико-генетическому консультированию нефрологической ориентации
Показания
Возможная патология
Заболевания почек в семье
Однотипные заболевания почек в семье
Наличие у близких родственников дизметаболических расстройств
при выраженном почечном заболевании у ребенка
Повышенная частота заболеваний органов мочевой системы в
районе проживания семьи
Ранние формы гипертонической болезни в семье, артериальная
гипертензия в сочетании с минимальным мочевым синдромом
Стойкий гипотонический синдром при наличии внешних признаков
дизэмбриогенеза даже при минимальных изменениях в моче
Множественные признаки дизэмбриогенеза, особенно при тран-
зиторном мочевом синдроме
Множественные пороки развития органов
Наличие в семье случаев тугоухости при патологии почек у
ребенка
Наличие в семье патологии глаз, слуха при развившемся моче-
вом синдроме у ребенка
Геморрагический синдром в сочетании со снижением почечных
функций
Ранние летальные исходы в семье вследствие почечных заболе-
ваний
Случаи ХПН в семье с неясным почечным заболеванием или по-
чечной дисплазией
Заболевание близнецов
Кровное родство родителей
Отставание в умственном развитии и изменения в моче
Отставание в физическом развитии и изменения в моче
Ожирение, сочетающееся с гипогонадизмом, слабоумием, изме-
нениями в моче
Аномалии костной системы или упорно прогрессирующий рахит
Семейные случаи бронхолегочных заболеваний в сочетании с
расстройствами питания и изменениями в моче
Семейные случаи аллергозов
Экзема, особенно в сочетании с неврологической симптоматикой
и признаками поражения почек
Гепато- и(или) спленомегалия с изменениями в моче
Глюкозурия
Разнообразные нефро- и уропатии
Наследственные аномалии строения почек,
НН
Дизметаболические нефропатии, включая мо-
чекаменную болезнь
Заболевания типа балканской нефропатии, ге-
моррагической лихорадки с почечным син-
дромом
Гиперлипопротеидемия (семейная) и вторич-
ная нефропатия с ранней гипертонической
болезнью
Гипопластическая дисплазия
Почечный дизэмбриогенез (различные вари-
анты)
Пороки развития органов мочевой системы,
возможна хромосомная патология
НН (синдром Альпорта)
НН (включая синдром Альпорта)
Гемолитико-уремический синдром, возможно
семейный
Семейный почечный дизэмбриогенез
Дисплазия почек
Все заболевания почек
Тубулопатия с аутосомно-рецессивным типом
наследования
Гиперпролинемия, гидроксипролинемия
Муковисцидоз (почечная форма)
Синдром Лоуренса — Муна — Барде — Бид-
ля
Фосфат-диабет, синдром Дебре — де Тони —
Фанкони, почечный тубулярный ацидоз,
цитиноз
Муковисцидоз
Аллергические поражения почек
Пиридоксинзависимые состояния
Поражение почек при гликогеновой болезни,
галактоземии и др.
Почечная глюкозурия, диабетическая нефро-
патия
Роль генетики в развитии современной не-
фрологии трудно переоценить. Прежде всего —
это возможность расшифровать сущность не-
фропатий, которые считались идиопатически-
ми. Второе — возможность прогнозировать раз-
витие в семье аналогичной патологии. Третье —
появление фактов, говорящих о том, что пред-
ставление о наследственной патологии почек
как абсолютно неизлечимых болезнях несколь-
ко преувеличено. И, четвертое, необходимость
четкого понимания, что большинство нефро-
патий, связанных с внешнесредовыми влияни-
ями, относятся к мультифакториальной пато-
логии.
Литература
Бочков Н.П., Захаров А.Ф., Иванов В.М. Медицинс-
кая генетика. — М.: Медицина, 1984.
24—2950
369
Вельтищев Ю.Е., Игнатова М.С. Наследственные и
врожденные болезни почек и мочевыводящих пу-
тей//Наследственная патология человека/Под ред.
Ю.Е.Вельтищева, Н.П.Бочкова. — М.: Медицина,
1992. - Т. 2. - С. 3-71.
Игнатова М.С., Клембовский А. И. Проблема почеч-
ных дисплазий с позиций клинициста и нефроло-
га//Тер. арх. - 1978. - № 6. - С. 11-18.
Игнатова М.С., Вельтищев Ю.Е. Детская нефрология:
Руководство для врачей. — Л.: Медицина, 1989. —
455 с.
Катышева О.В., Игнатова М.С., Харина Е.А. и др.
Почечные синдромы при туберозном склерозе//
Практич. нефрол. — 1997. - № 3. - С. 20—25.
Цаликова Ф.Д., Игнатова М.С., Краснопольская К.Д.
и др. Первый опыт использования ДНК-диагности-
ки при синдроме Альпорта в семье со своеобразием
морфологической картины почечного поражения//
Тер. арх. - 1995. - Т. 4. - С. 45-47.
Adhirai М., Selvam R. Renal calcium oxalate binding
protein: Studies on its properties//Kidney Intern. —
1998. - Vol. 53. - P. 125-129.
Asplin S., Arseniault D., Paris S. et al. Contribution of
human uropontin to inhibition of calcium oxalate
crystallization//Kidney Intern. — 1998. — Vol. 53. — P.
194-199.
Atkin C.L., Gregory M.S., Border W.A. Alport syndro-
me//Diseases of the Kidney/Ed. R.W.Schrier, C.M.Gott-
schalk. — 4th ed. — Boston: Little, 1989. — Vol. 1. —
P. 617-641.
Barratt T.M., Chozali S. The aethiology of renal stones in
children//Postgrad. Med. J. — 1977. — Vol. 53. — P. 35—42.
Ben-Bassat M., Cohen L., Rosenfleld J. The glomerular
basement membrane in the nail-patella syndrome//Arch.
Pathol. - 1971. - Vol. 92. - P. 350-355.
Bernstein J. The cystic disease/Ed. K. Gardner, J. Bern-
stein. — Lancaster: Klumer Acad. Publishers, 1990. —
P. 147-170.
Brodehl J. Cystinosis//Oxford Textbook of Clinical
Nephrology/Ed. A.Davison, S.Cameron, J.Griinfeld et
al. — 2th ed. — Oxford — New-York, Tokyo: Oxford
Universyty Press, 1998. — Vol. 3. — P. 2457—2463.
Bodziak K.A., Hammond W.S., Molitoris B.A. Inherited
diseases of the glomerular basement membrane//Am. J.
Kidney Dis. - 1994. - Vol. 4. - P. 605-618.
Callis L., Vila A., Carrera M., Nieto J. Long-term effects
of cyclosporine A in Alport’s syndrome//Kidney Int. —
1999. - Vol. 55. - P. 1051-1056.
Campeau E., Watkins D., Rouleau G.A. et al. Linkage
analysis of the nail-patella syndrome//Am. J. Hum.
Genet. - 1995. - Vol. 56. - P. 243-247.
Chan P.C., Chan K.W., Cheng I.K., Chan M.K. Living
related renal transplantation in a patient with nail-patella
syndrome//Nephron. — 1988. — Vol. 50. — P. 164—166.
Cherget-Darpoux F. Overview of strategies for complex
genetic diseases//Kidney Intern. — 1998. — Vol. 53. —
P. 1441-1445.
Cohen A., Hoyer J. Nephronophtisis. A primary tubular
basement membrane defect//Lab. Invest. — 1986. — Vol.
55, N 5. - P. 564-571.
Cohen A., Adler Sh. Nail-patella syndrome//Renal
Pathology with Clinical and Functional Correlations.
Second Edition/Ed. C.C.Tisher, B.M.Brenner. —
Philadelphia: J.B.Lippincott Comp., 1994,— Vol. 2.—
P. 1267-1290.
Danpure C., Jennis P. Peroxisomal alanine — glioxilate —
aminotranspherase deficiency in primary hyperoxaluria
type 1//FEBS Lett. - 1987. - Vol. 201. - P. 20-24.
Cahl H, Schneider J., Aula P. Lysosomal transport
disorders: cystinosis and sialic acid storage disorder//The
metabolic and molecular basis of inherited disease/Ed.
C.Scriver et al. — 7th ed. — New York: McGraw-Hill,
1995. - P. 3783-3797.
Griinfeld J., Knebelmann B. Alport’s syndrome//Oxford
Textbook of Clinical Nephrology/Ed. A.Davison et al., —
2 ed. — Vol. 3. Oxford — New York, Tokyo: Oxford
University Press, 1998. — P. 2427—2437.
Holmberg Ch., Antikainen M., Ronnholm K. et al.
Management of congenital nephrotic syndrome of the
Finnish type//Pediatr. Nephrol. — 1995. — Vol. 9. —
P. 87-93.
Huttunen M., Rapola J., Vilska J., Hallman N. Renal
pathology in congenital nephrotic syndrome of Finnish type:
a quantitative light microscopic study on 50 patients//Inteni
J. Pediatr. Nephrol. - 1980. - Vol. 1, N 1. - P. 10-16.
Kashtan C., Micael A. Alport syndrome: from bedside to
genome to bedside//Amer, J. Kidney Dis. — 1993. — Vol.
22. - P. 627-640.
Mac Dermot K.D., Morgan S.H., Cheshire J.K., Hilson
T.M. Anderson — Fabry disease a close linkage with
hightly polymorphic DNA, markers DXS17, DXS87,
DXS88//Hum Genet. - 1987. - Vol. 77. - P. 263-266.
Mayrter A., Rizzo R., Gubler M.C. The nail-patella
syndrome: A. review//J. Nephrol. — 1990. — Vol. 2. —
P. 133-140.
Menlove L., Kirscher N., Nguen N. et al. Linkage between
Alport syndrome — like hereditary nephritis and X-linked
PFLPS//Cytogenet. a Cell. Genet. - 1985. - Vol. 40, N
4. - P. 697-698.
Mochizuki N., Lemmink H.H., Mariyama M. et al.
Identification of mutations in the alpha 3(IV) and alpha
4(IV) collagen genes in autosomal recessive Alport
syndrome//Nat. Genet. — 1994. — Vol. 1. — P. 77—82.
370
Morgan S. Anderson — Fabry disease other inherited
metabolic storage disorders with significant renal
involvement//Oxford Textbook of Clinical Nephrology/
Ed. A.Davison, S.Cameron, J.Griinfeld et al. — 1998. —
2 ed. — Vol. 3. — Oxford, New York, Tokyo: Oxford
University Press, 1998. — P. 2437—2446.
Nakao S., Takenata T., Maeda M. et al. An atypical
variant of Fabry’s disease in men with left ventricular
hypertrophy//New Engl. Joum. Med. — 1995. — Vol.
333. - P. 288-293.
Norio R. Hereditary in the congenital nephrotic syndrome.
A genetic study of 57 Finnish families with a review of
reported cases//Ann. Paediat. Fenn, (suppl. 27). — 1966. —
Vol. 12. - P. 271-294.
Nyberg G., Frtiman S. Spectrum of hereditary renal disease
in a kidney transplant//Nephrol. Dial. Transplant. Nephrol.
Diasysis Transpl. — 1995. — Vol. 6. — P. 859—865.
Rapola J. Congenital nephrotic syndrome//Pediatr.
Nephrol. — 1987. — Vol. 1, N 3. — P. 441—446.
Resnick J., Vernier R. Renal cystic diseases and renal
Dysplasia//Pediatric nephrology. — 2 ed./Eds: M.Holliday
et al. — Baltimore — London — Sydney, 1987. — P. 371—
383.
Schriver C., Beaudet A., Sly H. et al. (eds). The metabolic
and molecular basis of inherited diseases. 7 ed. McGraw-
Itill, New York, 1995.
Trachtman H. The year 1995—1996 in review: genetically
re-engineering clinical nephrology//Pediatr. Nephrol. —
1997. - Vol. 11, N 3. - P. 377-387.
Wienecke R., Maize J., Shoarinejad F. et al. Co-localization
of the TSC2 product tuberin with its target Rapl in the Golgi
apparatus//Oncogene. — 1996. — Vol. 13. — P. 913—923.
Woolf A. Emerging roles of obstruction and mutations in
renal malformations//Pediat. Nephrol. — 1998. — Vol. 12,
N 8. - P. 690-694.
Zheng K., Thorner P., Marrann P. et al. Canine X-
chromosome-linked hereditary nephritis: a genetic model
for human X-linked hereditary nephritis resulting from
a simple base mutation in the gene encoding the alpha-
5 chain of collagen type IV//Proceedings of the National
Academy of Sciences of the United States of America. —
1994. - Vol. 91. - P. 3989-3993.
24*
Глава 14
ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ПОЧЕК
И.Е.Тареева, А.Ю.Николаев, С.О. Андросова
В настоящее время все чаще встречаются
случаи лекарственной патологии, особенно ле-
карственных поражений почек. Эта проблема
имеет как чисто клинический, так и теорети-
ческий интерес. Клиническое значение объяс-
няется частотой лекарственных поражений по-
чек в практике врачей любой специальности,
теоретическое — тем, что изучение лекарствен-
ных поражений почек — нефропатий с четким
этиологическим фактором — позволяет понять
многие механизмы развития поражения почек
вообще и взаимодействия различных почечных
структур в реализации повреждения в частно-
сти.
Одно и то же лекарство может вызвать са-
мые разнообразные поражения почек. Так, не-
наркотические анальгетики способны приводить
к умеренным расстройствам почечной гемоди-
намики, к ОПН, вызывая острый канальцевый
некроз, острый интерстициальный нефрит
(ОИН), к хроническому интерстициальному
нефриту с некрозом почечных сосочков. Обрат-
ное развитие многих из этих заболеваний пос-
ле прекращения действия этиологического (ле-
карственного) фактора подчеркивает важность
изучения этиологии болезней почек вообще,
открывая перспективы этиологического лечения.
«По нашему мнению, — писал Е.М.Тареев
(1983), — два раздела почечной патологии —
развитие гломерулонефрита вирусной этиоло-
гии и равным образом лекарственной патоло-
гии — представляют два наиболее существен-
ных поля роста медицинской науки, имеющих
огромное теоретическое и практическое значе-
ние в оздоровлении населения».
Функция почек при лекарственной патоло-
гии нарушается особенно часто. Уязвимость
почек объясняется рядом факторов:
• почечный кровоток очень высок (около 25 %
сердечного выброса);
• в канальцевых клетках с большой скоростью
происходят метаболические и транспортные
процессы, имеются многочисленные фер-
ментные системы;
• большинство лекарств выделяются почками;
концентрация лекарств, фильтруемых в клу-
бочках, растет по мере концентрации филь-
трата в канальцах, к тому же почка выделя-
ет лекарства (как и любые другие ксеноби-
отики) не только путем фильтрации, но и
вследствие канальцевой секреции, значи-
тельно повышающей концентрацию веществ
в канальцах. «Почечный фактор освобожде-
ния организма от лекарств особенно важен...
в отношении тех из них, которые выделя-
ются активной секрецией канальцев при
высоких показателях клиренса» [Тареев Е.М.,
1958];
• многие лекарства обладают прямым нефро-
токсическим действием; концентрация не-
фротоксических веществ возрастает по мере
ухудшения функции почек.
Помимо прямого нефротоксического дей-
ствия препаратов, влияния на метаболические
и транспортные процессы, важными механиз-
мами лекарственного повреждения почек явля-
ются аллергия с развитием иммунного воспа-
ления почек с поражением интерстиция, со-
судов и/или клубочков как изолированного, так
и развивающегося на фоне большой лекар-
ственной болезни, а также влияние на почеч-
ную гемодинамику и эндокринную систему
почек.
Следует подчеркнуть, что, помимо пораже-
ния паренхимы почек, лекарства могут инду-
цировать поражение мочевых путей. Лекарствен-
ный литиаз может развиваться при длительном
назначении триамтерена, систематическом при-
менении больших доз витамина С (аскорбино-
вой кислоты), при лечении урикозурическими
средствами (бенемид и др.). Длительное исполь-
зование всасывающихся антацидов, кальциевой
372
соли ПАСК может привести к нефролитиазу,
нефрокальцинозу. Цитостатики (циклофосфа-
мид) могут индуцировать геморрагический
цистит. Многие случаи ретроперитонеального
фиброза связывают с продолжительным приме-
нением полусинтетических производных споры-
ньи (метизергида, эрготамина, амфетамина),
гидралазина, допегита.
Ряд особенностей характеризует острые и
хронические лекарственные поражения почек.
К острым лекарственным поражениям отно-
сят острый канальцевый некроз, функциональ-
ную (электролитно-гемодинамическую) почеч-
ную недостаточность, острый интерстициаль-
ный нефрит, острый лекарственный гломеру-
лонефрит, некротизирующий ангиит сосудов
почек, билатеральный кортикальный некроз,
внутриканальцевую обструкцию (кристаллами
уратов, сульфаниламидов), некроз почечных
сосочков.
Острые лекарственные поражения чаще все-
го проявляются клинически снижением функ-
ции почек вплоть до развития ОПН (см. также
с. 000—000). Мы не будем касаться случаев ле-
карственной ОПН вследствие приема токсичес-
ких доз препаратов — случайного или с суи-
цидальными целями, разбирая лишь пораже-
ния, развивающиеся при приеме терапевтичес-
ких доз. В этой ситуации причиной ОПН чаще
является прямое нефротоксическое действие
лекарств с развитием острого канальцевого
некроза.
Нередки общие гемодинамические наруше-
ния при лекарственном анафилактическом
шоке с развитием острого кортикального или
канальцевого некроза, но чаще функциональ-
ные, преходящие (вследствие гиповолемии,
снижения АД), развивающиеся при лечении
диуретиками, гипотензивными препаратами,
или местные гормонально-гемодинамические
нарушения, касающиеся только почки, приво-
дящие к снижению почечного кровотока, филь-
трации и/или электролитным сдвигам. Несколь-
ко реже возникают реакции гиперчувствитель-
ности с развитием острого интерстициального
нефрита, в патогенезе которого, по-видимому,
играют роль клеточные иммунные механизмы.
В последние годы участились случаи лекар-
ственной ОПН за счет внутриканальцевой об-
струкции, что отчасти связано с осложнениями
лечения распространяющегося в мире СПИДа.
Помимо «сульфаниламидной» внутриканальце-
вой обструкции, могут наблюдаться мочекис-
лая внутриканальцевая обструкция при химио-
терапии лимфом, а также миоглобинурийный
нефроз с тяжелой ОПН — осложнение лекар-
ственного рабдомиолиза при применении ази-
дотимидина, пентамидина, ацикловира [D’Agati
V. et al., 1997], метотрексата, современных ги-
полипидемических препаратов — статинов и
фибратов, фоскарнета (при тяжелой цитомега-
ловирусной инфекции).
Среди лекарств, приводящих к ОПН, на
первом месте стоят антибиотики. К острому ка-
нальцевому некрозу (ОКН) чаще приводят ан-
тибиотики группы аминогликозидов, в основ-
ном гентамицин и канамицин. Поражение по-
чек развивается почти у 10 % больных, лечен-
ных аминогликозидами. Токсичность аминогли-
козидов зависит от количества свободных ами-
ногрупп — их 6 у очень нефротоксичного нео-
мицина, 5 — у гентамицина, канамицина и
тобрамицина и всего 2 — у малотоксичного
стрептомицина.
Аминогликозиды экскретируются почками в
неизменном виде, после прохождения через
гломерулярный фильтр связываются щеточной
каймой извитых канальцев и накапливаются в
лизосомах тубулярного эпителия. Их нефроток-
сичность обусловлена преимущественно клеточ-
ным тубулотоксическим поражением (разруше-
нием лизосом, повреждением мембран мито-
хондрий, генерацией свободных радикалов) и
отличается от ишемического ОКН отсутствием
увеличения концентрации цитозольного каль-
ция [Kaloyanidis G., 1993]. Риск аминогликозид-
ной нефротоксичности повышен у больных с
хроническими заболеваниями почек (особенно
со сниженной функцией), высокой лихорад-
кой, водно-электролитными нарушениями (ги-
поволемия, дефицит калия, магния, ацидоз),
а также у лиц старческого возраста. Нефроток-
сичность аминогликозидов усугубляется при
комбинации с петлевыми диуретиками, цефа-
лоспоринами, ванкомицином, амфотерицином
В, антагонистами кальция, рентгеноконтраст-
ными средствами [Kaloyanidis G.I., 1993].
При «аминогликозидном» ОКН яркие клини-
ческие проявления отсутствуют. Наблюдаются
умеренная олигурия, гипостенурия с потерей
натрия с мочой. Минимально выраженный
мочевой синдром (следовая протеинурия, мик-
рогематурия) нередко сочетается с поражени-
ем внутреннего уха с потерей слуха. Почечная
недостаточность нарастает относительно мед-
ленными темпами, как правило, обратима пос-
ле отмены препарата.
К ОКН могут приводить и другие антибио-
тики — ампициллин, цефалоридин, цефалог-
лицин, цефаклор, цефазолин, амфотерицин В
[Tune В.М., 1993] и др.
Антибактериальные средства — метициллин,
ампициллин, пенициллин, рифампицин, суль-
фаниламиды (в том числе бисептол) — чаще
других препаратов вызывают и острый интер-
стициальный нефрит (ОИН). Описаны случаи
ОИН при лечении цефалоспоринами, фторхи-
нолонами. Лечение ципрофлоксацином может
373
осложниться как окн, так и острым тубуло-
интерстициальным нефритом [Dhamidharka V.R.
et al., 1998].
ОИН клинически проявляется неинтенсив-
ными люмбалгиями, полиурией, умеренно
выраженной протеинурией тубулярного или
смешанного типа, абактериальной лейкоциту-
рией, реже — микрогематурией. Характерно
быстрое присоединение к раннему нарушению
концентрационной способности почек нараста-
ющей азотемии без олигурии (неолигурическая
ОПН) [Colvin R.B. et al., 1994]. АД нормальное.
При часто наблюдающемся резком сниже-
нии тубулярной реабсорбции натрия формиру-
ется синдром солътеряющей почки', артериальная
гипотония с ортостатическим коллапсом, сим-
птомы дегидратации, метаболический ацидоз,
резкая мышечная слабость. Опасная для жизни
ранняя гиперкалиемия может развиться вслед-
ствие почечного канальцевого ацидоза с нару-
шением экскреции калия. В тяжелых случаях
могут присоединиться некротический папиллит
(макрогематурия с вторичной почечной коли-
кой и обструктивной ОПН), синдром Фанкони
(потеря с мочой фосфатов, глюкозы, амино-
кислот).
Системные (внепочечные) симптомы меди-
каментозной аллергии (крапивница, бронхо-
спазм, эозинофилия) сопровождают ОИН да-
леко не во всех случаях и не имеют решающе-
го диагностического значения [Tune В.М.,
1993].
В наших наблюдениях последних лет наибо-
лее частой причиной ОИН были полусинтети-
ческие пенициллины, тетрациклины и сульфа-
ниламиды. Длительность курса антибактериаль-
ной терапии до появления первых признаков
поражения почек составляла от нескольких дней
до нескольких недель.
Описаны и поздние реакции на антибиоти-
ки. Так, по наблюдениям М.Cogan (1983), у 61-
летнего мужчины через 6 нед после лечения
метициллином развились дегидратация (сольте-
ряющая почка), ацидоз, азотемия и гиперка-
лиемия. Диагностирован почечный канальцевый
ацидоз дистального типа со снижением способ-
ности выделять калий, при биопсии — карти-
на ОИН.
Второй по частоте группой лекарственных
препаратов, вызывающих острые нефропатии,
являются нестероидные противовоспалительные
препараты (НСПП — индометацин, ибупро-
фен, пироксикам, пиразолоны, аспирин) и
ненаркотические анальгетики (ННА — аналь-
гин, фенацетин, парацетамол). Острые пораже-
ния почек, возникающие чаще при лечении
НСПП, связаны в первую очередь с влиянием
на почечную гемодинамику.
Функция почек у здоровых лиц (и в еще
374
большей степени при некоторых патологичес-
ких состояниях) поддерживается за счет ло-
кальных почечных простагландинов (ПГ). ПГ
являются аутокоидами, т.е. синтезируются ря-
дом с теми клетками, на которые действуют.
Ключевым ферментом метаболизма арахидоно-
вой кислоты (предшественника ПГ) является
циклооксигеназа (ЦОГ). Именно с ингибици-
ей ЦОГ и подавлением синтеза ПГ связывают
противовоспалительное, анальгетическое и
жаропонижающее действие НСПП и ННА.
В последние годы открыты две основные изо-
формы этого фермента: ЦОГ-1, отвечающая за
синтез ПГ, регулирующих физиологическую ак-
тивность клеток, и ЦОГ-2, принимающая уча-
стие в синтезе «провоспалительных» ПГ. Боль-
шинство НСПП и ННА подавляют преимуще-
ственно активность ЦОГ-1, с чем связывают
побочные реакции этих лекарств.
В почках ПГ ответственны за перфузию,
вызывая вазодилатацию, поддерживают почеч-
ный кровоток и скорость клубочковой фильт-
рации, повышают высвобождение ренина, вы-
деление натрия и воды, участвуют в гомеоста-
зе калия. У здоровых лиц в регуляции этих про-
цессов участвуют и другие механизмы. При по-
давлении синтеза локально-почечных ПГ лекар-
ственными препаратами почка здоровых лиц в
большинстве случаев справляется с этой ситу-
ацией путем ряда компенсаторных реакций.
Однако при некоторых патологических (и фи-
зиологических) состояниях с исходно снижен-
ной почечной перфузией, при которых роль ПГ
является критической для сохранения функции
почек, такая компенсация затруднена, что и
является причиной многих почечных эффек-
тов — нарушения водно-электролитного равно-
весия и снижения функции почек вплоть до
развития острой почечной недостаточности
(ОПН). К этим состояниям относятся заболе-
вания печени (особенно цирроз), алкоголизм,
заболевания почек, пересаженная почка, гипо-
натриемия и гиповолемия, в том числе вызван-
ная лечением диуретиками, сердечная недоста-
точность, артериальная гипертония, системная
красная волчанка, состояние после оператив-
ных вмешательств, а также пожилой возраст. По
данным Bush и соавт. (1991), НСПП вызывают
поражение почек у 5 % больных, леченных
этими препаратами; у пациентов с факторами
риска нефротоксический эффект отмечается в
20 % случаев.
Наиболее частым почечным эффектом
НСПП и ННА является нарушение водно-элек-
тролитного баланса. Этот эффект объясняется
снижением ПГ (обладающих натрийуретичес-
ким действием) с последующим повышением
секреции антидиуретического гормона, повы-
шением высвобождения ренина и как следствие
повышением секреции альдостерона. Клини-
чески задержка натрия и воды характеризу-
ется развитием отеков, повышением артериаль-
ного давления, снижением эффективности ди-
уретиков и гипотензивных препаратов. Реже раз-
вивается гиперкалиемия. Факторами риска ги-
перкалиемии считают наличие почечной и сер-
дечной недостаточности, сахарного диабета,
множественной миеломы, лечение диуретика-
ми и ингибиторами АПФ [Whelton A., Hamilton
C.W., 1991]. Возможно также развитие синдро-
ма гипоренинемического гипоальдостеронизма с
гиперкалиемией.
Гемодинамические нарушения — небольшое
снижение почечного кровотока и КФ — наблю-
даются также чаще при приеме индометацина.
В наших наблюдениях при лечении индомета-
цином 310 больных различными формами ХГН
у 20 % пациентов (преимущественно с нефро-
тическим синдромом) выявлено снижение КФ
(до лечения — в среднем 90,0 мл/мин, в пери-
од лечения — 52,8 мл/мин), что сопровожда-
лось повышением уровня креатинина и азота
мочевины в крови [Андросова С.О., Кутырина
И.М., 1983].
В отдельных случаях гемодинамические на-
рушения выражены резко, приводя к острому
канальцевому некрозу с ОПН: чаще при при-
еме НСПП, реже — анальгина и аспирина.
ОПН может развиться в разные сроки лече-
ния — от нескольких часов до нескольких меся-
цев. Мы наблюдали у 38-летнего больного разви-
тие ОПН на 3-й день приема большой дозы
анальгетиков (7 г анальгина и 2 г амидопирина).
ОПН, вызванная НСПП, описана у моло-
дых здоровых людей, которые после приема
ибупрофена употребляли алкоголь, и у здоро-
вых марафонцев, принимавших напроксен в
течение недели и прекративших прием препа-
рата за 36 ч до бега [Vitting К.Е. et al., 1986; Wen
S.F. et al., 1992].
В многоцентровом исследовании, выполнен-
ном во Франции, посвященном изучению ча-
стоты и исходов лекарственной ОПН, из 398
больных с ОПН 147 (36,9 %) принимали
НСПП или анальгетики; у трети больных с
НСПП — индуцированной ОПН потребовалось
лечение гемодиализом; у 28 % функция почек
не восстановилась. S.W.Shankel и соавт. (1992)
описали 27 больных с НСПП — индуцирован-
ной ОПН; у 12 из них проводился диализ, у
двух почечная недостаточность персистировала,
двое умерли.
В наших наблюдениях среди 30 больных ОПН
лекарственного генеза у 8 причиной ее разви-
тия был прием НСПП (у 3 больных в сочета-
нии с антибиотиками). У 6 больных была об-
ратимая ОПН, в двух случаях проводился ге-
модиализ.
ОИН при лечении НСПП (индометацином,
ибупрофеном) развивается примерно у 1—2 из
10 000 человек [Molzahn М. et al., 1998]. Осо-
бенностями заболевания являются более частое
развитие у женщин и пожилых, более редкое
(по сравнение с ОИН после антибиотиков)
появление системных аллергических реакций,
а также возможность развития выраженной
протеинурии. Имеются сообщения об ОИН в
сочетании с нефротическим синдромом; мор-
фологически в клубочках выявляются мини-
мальные изменения [Warren G.V. et al., 1989].
Описано развитие острого ИН после приема
ибупрофена у реципиента почечного транс-
плантата [Stoves J., 1998]. Не исключается, что
у больных с пересаженной почкой адаптация
СКФ к потере функционирующей почечной
паренхимы также зависит от простагландинов;
кроме того, циклоспорин снижает синтез ПГ,
и эта ситуация увеличивает потенциальную
опасность НСПП.
Острые лекарственные нефропатии с разви-
тием ОПН могут возникать и при лечении пре-
паратами других групп. Так, при лечении цик-
лоспорином А может развиться как ОКН, так и
преренальная быстрообратимая ОПН за счет
эндотелинзависимой почечной вазоконстрик-
ции с гипоперфузией клубочков [Bennett W.M.
et al., 1994], а также ХТИН. Острую нефроток-
сичность ЦсА усиливают аминогликозидные ан-
тибиотики, рентгеноконтрастные средства
(РКС), НСПП, фуросемид, каптоприл, цип-
рофлоксацин, амфотерицин В, бисептол, ди-
гоксин [Шумаков В.И. и соавт., 1994].
При лечении ингибиторами АПФ может раз-
виться резкое снижение СКФ вплоть до ОПН.
Факторами риска развития ОПН являются дву-
сторонний стеноз почечных артерий или сте-
ноз артерии единственной почки, тяжелая сер-
дечная недостаточность, нефроангиосклероз, а
также поликистозная болезнь почек. Во Фран-
ции частота преренальной ОПН, вызванной
иАПФ, составляет 2,3 % всех случаев лекар-
ственной ОПН; у пожилых лиц частота выше —
от 6 до 23 % [Lemaire N., 1998].
Заслуживают упоминания тиазиды, фуросе-
мид, фенилин, аллопуринол, ранитидин, ацик-
ловир, способность которых вызывать ОПН
(чаще аллергического генеза с развитием
ОТИН) мало известна, хотя в литературе опи-
саны десятки подобных наблюдений.
Значительно реже наблюдаются острый ле-
карственный гломерулонефрит (ГН), иногда с
ОПН, нередко с очаговым некрозом клубоч-
ков и возможностью хронизации, а также по-
чечные васкулиты после введения сывороток и
вакцин, пенициллина, сульфаниламидов, ам-
фетамина, героина.
Описаны случаи быстропрогрессирующего
375
ГН после длительного приема гидралазина, в
основном у медленных ацетиляторов, при ле-
чении D-пеницилламином.
При появлении первых признаков острого
лекарственного поражения почек необходима
срочная отмена препарата. При недостаточной
эффективности отмены используются специ-
фические антидоты и экстракорпоральные ме-
тоды, элиминирующие нефротоксичный пре-
парат.
Для лечения лекарственной внутриканальце-
вой обструкции проводят интенсивную инфузи-
онную ощелачивающую терапию (бикарбонат
натрия, маннитол, изотонический раствор на-
трия хлорида, глюкоза) с фуросемидом, допол-
ненную аллопуринолом при острой мочекислой
нефропатии [Lazarus J.M. et al., 1993]. С помо-
щью ГД и ПД из крови удаляются низкомоле-
кулярные водорастворимые медикаменты. Для
элиминации крупномолекулярных плохо ра-
створимых в воде лекарств используют гемо-
фильтрацию, гемосорбцию, плазмаферез.
К заместительной терапии ГД прибегают
при развитии ОПН при наличии соответству-
ющих показаний (см. главу ОПН). При лекар-
ственном ОТИН рекомендуются высокие дозы
глюкокортикостероидов — внутрь или в виде
пульс-терапии [Tune В.М., 1993; Тареева И.Е.,
1998; Colvin R.B. et al., 1994]. Лечение стерои-
дами также эффективно при лекарственных им-
мунокомплексных гломерулонефритах и нефри-
те в рамках сывороточной болезни.
Если говорить не только о лекарственных,
но и — шире — об ятрогенных нефропатиях,
то по частоте вызываемой ОПН к НСПП при-
ближаются рентгеноконтрастные средства
(РКС). Ведущим механизмом нефротоксичнос-
ти РКС является нарушение почечной гемоди-
намики. Усиление тубулярной реабсорбции
кальция, активация РААС, увеличение синте-
за Тх-А2 и эндотелина способствуют почечной
вазоконстрикции, ведущей к гипоксии мозго-
вого слоя почек [Дзгоева Ф. и др., 1995; Deray
G. et al., 1990; Lazarus J.M. et al., 1993].
К тяжелому поражению почечных канальцев
приводит также прямое токсическое поврежде-
ние РКС канальцевого эпителия, связанное с
увеличением концентрации цитозольного каль-
ция, а также с гиперурикозурией и гиперок-
салурией с последующей внутриканальцевой
обструкцией.
Среди причин госпитальной ОПН РКС за-
нимают 3-е место, что составляет 13 % всех
случаев госпитальной ОПН с летальностью,
достигающей 29 % [Nash К. et al., 1996].
При этом в 70 % случаев наблюдается обра-
тимая, чаще преренальная, ОПН, в остальных
30 % — ренальная ОПН с менее благоприят-
ным прогнозом [Porter G.A., 1994].
376
Клинически поражение почек характе-
ризуется ОПН (чаще неолигурической), несе-
лективной минимальной протеинурией. Одно-
временно, особенно после применения высо-
коосмолярных РКС, могут развиться гиперто-
нический криз, острая энцефалопатия, дегид-
ратация с повышением вязкости крови. Призна-
ки восстановления функции почек при прере-
нальной ОПН обычно появляются через 8—10
дней. При развитии ОКН обнаруживается по-
теря натрия с мочой, темпы нарастания азоте-
мии выше, а ее длительность больше, чем при
преренальной ОПН. Для внутриканальцевой
обструкции РКС характерна микрогематурия с
кристаллурией (уратной, оксалатной) и олигу-
рическая ОПН. Хронизация с последую-
щим переводом на программный ГД наступает
в среднем в 18 % случаев, чаще после олигу-
рической ОПН. Вероятность развития олигури-
ческой ОПН и хронизации особенно велика
при инсулинзависимом сахарном диабете с ди-
абетической нефропатией, а также при нару-
шении функции почек [Lazarus J.M. et al., 1993].
Среди других факторов риска наблюдаются де-
гидратация, гиперурикемия, гиперурикозурия,
миеломная болезнь, застойная сердечная недо-
статочность, старческая почка [Weisberg L.S. et
al., 1994]. ОПН, обусловленную РКС, следует
дифференцировать от множественной эмболии
сосудов почек кристаллами холестерина. При
этом ОПН развивается у больных с тяжелым
атеросклерозом после рентгеноконтрастного со-
судистого обследования, часто сопровождается
гипертоническим кризом с острой левожелу-
дочковой недостаточностью, острой ишемией
мезентериальных артерий, поражением сетчатки
и кожи.
Для профилактики нефротоксичности РКС
следует применять низкоосмолярные неионо-
генные препараты (гипак, омнипак, ультра-
вист). Перед проведением рентгеноконтрастно-
го исследования целесообразны гидратация
путем внутривенного введения изотонического
раствора натрия хлорида, назначение антагони-
стов кальция.
Учитывая трудности разграничения лекар-
ственных поражений почек, протекающих с
ОПН, мы считаем, что важнее установить сам
факт лекарственной ОПН, так как основным
терапевтическим вмешательством является
прежде всего отмена препарата (хотя при ал-
лергических нефритах может быть эффективным
назначение высоких доз преднизолона). Все же
упомянем о некоторых главных дифференциаль-
но-диагностических признаках. Диурез при ос-
тром канальцевом некрозе и остром интерсти-
циальном нефрите обычно сохранен (неолигу-
рическая ОПН), при остром ГН и обструкции
мочевых путей часта олигурия-анурия; экскре-
ция натрия и его экскретируемая фракция при
канальцевом некрозе и интерстициальном не-
фрите обычно повышены (низкое количество
натрия в моче говорит против прямого тубуло-
токсического действия препарата). При остром
интерстициальном нефрите часто развиваются
другие экстраренальные признаки гиперсенси-
билизации: повышение в крови уровня IgE,
сенсибилизация Т-лимфоцитов крови к лекар-
ственным препаратам, увеличение экскреции с
мочой бета-2-микроглобулина [Команденко
М.С., 1997]. Выраженная протеинурия характер-
на для острого ГН. Наконец, всегда следует
оценивать характер лекарственного препарата и
иметь представление о наиболее выраженном
механизме его действия.
К хроническим лекарственным поражениям
почек относят в первую очередь хронический
интерстициальный нефрит и хронический ГН;
кроме того, лекарства могут приводить к разви-
тию калийпенической почки, синдрома Фанко-
ни, синдрома почечного несахарного диабета,
нефролитиаза, ретроперитонеального фиброза.
Хронический лекарственный тубулоинтерсти-
циальный нефрит (ХТИН) может развиться
при злоупотреблении анальгетиками, при ле-
чении цисплатиной, литием, сандиммуном.
Анальгетическая нефропатия (АН) развива-
ется у лиц, злоупотребляющих анальгетиками
в течение многих лет, характеризуется прогрес-
сирующим течением с частым присоединени-
ем сосочкового некроза и постепенным разви-
тием ХПН. При морфологическом исследова-
нии, помимо признаков хронического ИН,
выделяют склероз капилляров слизистой обо-
лочки мочевых путей (у 80—90 %), сосочковый
некроз (у 15—40 %), фокальный сегментарный
гломерулосклероз, опухоли мочевых путей
[Mihatsch M.Y. et al., 1994].
Наиболее нефротоксичны смеси анальгети-
ков, особенно включающие в себя фенацетин.
При добавлении к смеси кофеина или кодеи-
на, влияющих на настроение, может наступать
психологическая зависимость от препарата. В от-
дельных случаях АН может развиться и после
приема какого-либо одного анальгетика.
В большом исследовании, проведенном в 15
европейских странах, среди 226 больных с АН,
диагностированных с помощью компьютерно-
томографических критериев (см. ниже), 219
больных принимали два и более анальгетика (у
173 из них одним из анальгетиков был фена-
цетин) в сочетании с кофеином и/или кодеи-
ном; у 46 больных, не принимавших фенаце-
тина, нефротоксичность отмечена при сочета-
нии аспирина с парацетамолом, аспирина с
пиразолонами, парацетамола с пиразолонами
и двух пиразолонов [Elseviers М.М., De Broe
М.Е., 1992].
Процент населения, регулярно принимаю-
щего анальгетики, в большинстве стран неиз-
вестен. По данным некоторых европейских ис-
следований, он колеблется между 3 и 4 %, но
с большей частотой их принимают женщины
среднего возраста. Так, популяционные иссле-
дования, проведенные в Швейцарии, показа-
ли, что регулярно употребляют анальгетики
4,4 % мужчин и 6,8 % женщин fGutswiller F.,
Zemp Е., 1986]. Однако АН развивается лишь
у части лиц, принимающих эти средства.
В Швейцарии в течение 20 лет наблюдались 576
лиц, злоупотреблявших анальгетиками, при
этом лишь у 20 из них развилась уремия; риск
развития терминальной почечной недостаточ-
ности составил 1,7 на 1000 в год.
Механизмы повреждающего действия аналь-
гетиков до сих пор точно не выяснены. Указы-
вают на роль нарушений процессов окисления
в эпителии канальцев и в интерстициальной
ткани, подавление синтеза локально-почечных
ПГ — главных регуляторов медуллярного кро-
вотока в почках, а также на возможность пря-
мого токсического действия лекарств на моз-
говой слой почки. Имеют значение и генети-
ческие факторы, описаны семейные случаи АН
[Kincaid-Smith Р., 1988].
АН наблюдается чаще у женщин старше 40
лет, страдающих мигренью или люмбалгиями.
Для проявления нефротоксичности необходим
длительный многолетний прием анальгетиков,
что и объясняет развитие АН у больных стар-
шего возраста.
Среди наблюдавшихся нами 13 больных было
11 женщин и двое мужчин в возрасте от 43 до
68 лет. 10 из 13 пациентов принимали различ-
ные анальгетические смеси, 3 — анальгин с ко-
феином. Длительность приема анальгетиков до
момента обследования в клинике составляла от
5 до 35 лет, а суммарные дозы — от 4 до 35 кг
(в том числе, по приблизительным подсчетам,
дозы фенацетина — от 60 г до 11 кг).
АН клинически проявляется по-
лиурией, умеренным мочевым синдромом.
В качестве раннего признака (еще в доклини-
ческой стадии) рассматривается снижение от-
носительной плотности мочи, обнаруживаемое
у всех больных. У 25 % отмечается нарушение
ацидификации, а у 10 % — развитие явного
почечного канальцевого ацидоза (мышечная
слабость, судороги, кальцификация мозгового
слоя почки, камни почек, остеодистрофия). Все
наши больные предъявляли жалобы на жажду
и полиурию. Нередко именно неутолимая жажда
и выраженная полиурия заставляют больных с
АН впервые обратиться к врачу, что мы и на-
блюдали у 4 наших пациентов.
Мочевой синдром представлен микрогемату-
рией и умеренной протеинурией. Увеличение
377
гематурии и появление макрогематурии может
быть вызвано сосочковым некрозом, сопутству-
ющей инфекцией мочевых путей. В то же время
развитие стойкой макрогематурии заставляет
думать и о возможности уроэпителиальной кар-
циномы. Появление массивной протеинурии
(более 3 г в сутки) указывает на тяжелое по-
ражение клубочков (обычно фокально-сегмен-
тарный гломерулосклероз) и является плохим
прогностическим признаком, свидетельствую-
щим о возможности скорого (через 1—2 года)
развития терминальной почечной недостаточ-
ности (ТПН).
У 70 % больных АН выявляется абактери-
альная лейкоцитурия, у 30 % — мочевая ин-
фекция (чаще бессимптомная). Из 13 наших
больных у 9 отмечена рецидивирующая инфек-
ция мочевых путей. Часто выявляется гиперури-
кемия. Значительно чаще, чем при других ти-
пах хронического ИН, развивается гипертония,
которая иногда может приобретать злокаче-
ственное течение. Гипертония может сочетать-
ся с солевым истощением (вследствие потери
хлорида натрия с мочой). В наших наблюдени-
ях артериальная гипертония диагностирована у
4 больных, причем в одном случае — злокаче-
ственного течения.
Некроз почечных сосочков может привести к
эпизодам обструктивной ОПН с быстрым спон-
танным восстановлением функции почек, ре-
цидивами заболевания с почечной коликой,
атаками пиелонефрита. У большинства больных
сосочковый некроз протекает бессимптомно
(так называемое неполное отторжение некро-
тизированного почечного сосочка) и проявля-
ется умеренным мочевым синдромом. Именно
увеличение числа случаев АН ответственно за
учащение сосочкового некроза, бывшего дос-
таточно редким в первой половине века.
Причинами развития ОПН, помимо сосочко-
вого некроза с обструкцией, может быть зло-
качественная гипертония, гипотония из-за раз-
вития дегидратации, инфаркт миокарда, желу-
дочно-кишечные кровотечения, острый панк-
реатит. Обструкция, осложненная инфекцией,
может вызвать пионефроз, сепсис.
По данным ряда исследователей, АН диаг-
ностируется у 80 % больных в стадии ХПН, у
10 % — при ТПН. ХПН развивается постепен-
но и прогрессирует медленно. Имеются указа-
ния на увеличение частоты и тяжести остеоди-
строфии у больных ХПН при АН по сравне-
нию с больными хроническим гломерулонеф-
ритом.
Высок риск развития злокачественных опухо-
лей мочевых путей. Их находят у 10 % пациен-
тов, злоупотребляющих анальгетиками. Особен-
но часто встречаются опухоли мочевого пузы-
ря (50 %). Причиной развития уроэпителиаль-
378
ной карциномы считают воздействие N-гидро-
оксилированных метаболитов фенацетина. Воз-
можно, имеет значение одновременное воздей-
ствие курения.
Учитывая широкое применение анальгети-
ков, часто встречающийся их бесконтрольный
прием, трудности диагностики АН на ранних
стадиях болезни, необходимо тщательно про-
водить расспрос больных, обращая особое вни-
мание на факторы риска (мигрень, люмбалгия,
суставные боли) и возможное в связи с этим
злоупотребление анальгетиками. Снижение от-
носительной плотности мочи и ее ацидифика-
ции — самые ранние лабораторные признаки
заболевания. Наличие при этом мочевого син-
дрома позволяет заподозрить АН.
Отличительными особенностями АН являют-
ся сочетание стойкой асептической лейкоциту-
рии с эпизодами почечной колики, сопровож-
даемой макрогематурией, при отсутствии не-
фролитиаза, полиурия, уменьшение размеров
почек, анемия, не соответствующая тяжести
ХПН. При УЗИ почек даже в стадиях далеко
зашедшей ПН может быть выявлена типичная
картина гирлянд кальцифицированных сосоч-
ков вокруг почечного синуса [Segasothy М. et al.,
1984]. Изменения сосочков варьируют от отека
до дефектов различной степени выраженности.
Некротизированные сосочки могут остаться на
месте и кальцифицироваться или оторваться в
паренхиму почки, проявляясь рентгенологичес-
ки как дефекты наполнения. Компьютерно-то-
мографическое исследование без контраста
[Elseviers М.М., De Broe М.Е., 1995] выявляет
уменьшение размеров обеих почек в сочетании
с неровными контурами или кальцификацией
сосочков. КТ — наиболее адекватный метод
диагностического исследования, поскольку
позволяет определить наиболее патогномонич-
ный признак заболевания — кальцификацию
почечных сосочков.
Биопсия почки малоинформативна и пока-
зана лишь при наличии признаков поражения
клубочков или сосудов. Важным диагностичес-
ким признаком, который может быть обнару-
жен при цистоскопии, является характерная
пигментация треугольника мочевого пузыря.
При биопсии слйзистой оболочки этого участ-
ка обнаруживают микроангиопатию.
Возможность поражения, кроме почек, дру-
гих внутренних органов и систем, многочислен-
ность этих внепочечных поражений привели к
формулировке понятия «анальгетический синд-
ром». Среди клинических признаков этого син-
дрома выделяют:
1) поражения желудочно-кишечного тракта
(рецидивирующий стоматит, пептическая язва
желудка);
2) гематологические (железодефицитная,
гемолитическая и макроцитарная анемии, спле-
номегалия);
3) сердечно-сосудистые (гипертония, гене-
рализованный атеросклероз с возможным сте-
нозом почечной артерии, периферических ар-
терий, сосудов головного мозга, ИБС);
4) нервно-психические расстройства, отме-
чающиеся у 80—90 % больных и проявляющие-
ся головной болью, мигренью, личностными
нарушениями, психозами; при этом часто отме-
чается злоупотребление слабительными, психо-
тропными препаратами, алкоголем, курением;
5) влияние на гонадную функцию (беспло-
дие), токсикоз беременных, тератогенность (?);
6) пигментация кожных покровов больных
(бледно-желтый цвет) вследствие наличия в
коже вещества, близкого к липофусцину, ко-
торая может усиливаться при уремии и разви-
тии сольтеряющего состояния;
7) преждевременное старение.
Нередко именно наличие какого-либо из
признаков анальгетического синдрома в соче-
тании с мочевым синдромом позволяет врачу
заподозрить злоупотребление анальгетиками.
Лечение больных АН должно начинать-
ся с полного прекращения приема всех аналь-
гетиков, включая и условно «безопасные», а
также НСПП. Проводимые скрининговые ана-
лизы мочи у больных АН показывают, что бо-
лее 85 % пациентов прекращают прием ле-
карств, однако 10—15 % продолжают принимать
их постоянно или эпизодически. Необходим
прием большого количества жидкости (не ме-
нее 2 л в день). Показаны коррекция метабо-
лического ацидоза и электролитных нарушений,
раннее лечение нарушений метаболизма каль-
ция и фосфора.
Во всех ситуациях с наличием факторов
риска лекарственного поражения почек следу-
ет запретить прием анальгетических смесей.
Больным, у которых ранее развивалась ОПН
после приема анальгетических смесей или
НСПП, эти препараты назначать не следует.
В случае возникшей крайней необходимости на-
значения анальгетического средства препаратом
выбора может считаться парацетамол, облада-
ющий наименьшей нефротоксичностью.
J.D.Briggs и E.Jones от имени Научного ко-
митета ERA-EDTA представили в 1999 г. обоб-
щенные данные, касающиеся трансплантации
почек в Европе за 1982—1990 гг. у 798 больных
АН; их средний возраст составил 53 года. 82 %
больных были старше 45 лет; преобладали
(72 %) женщины. Выживаемость транспланта-
та через 8 лет была такой же, как у больных с
первичными заболеваниями почек (соответ-
ственно 51 и 47 %), однако выживаемость боль-
ных была значительно ниже (5-летняя — 83 и
88 %, 10-летняя — 61 и 77 % соответственно).
Более высокую смертность больных АН авто-
ры объясняют более высокой долей больных
старшего возраста и значительно более высо-
кой частотой неоплазм (17 и 6 %).
Хронический ТИН может развиваться при
лечении цисплатиной (в онкологической прак-
тике).
Выраженной нефротоксичностью обладает
циклоспорин А (ЦсА, сандиммун), приводя-
щий к развитию своеобразного хронического
ТИН (сандиммуновая нефропатия), который
развивается как в пересаженной почке, так и
в собственных почках реципиента при пересадке
сердца, печени и т.д. [Шумаков В.И. и др., 1994].
При применении высоких доз сацдиммуна (10—
15 мг/кг) после трансплантации сердца или
печени сандиммуновая нефропатия приводит к
терминальной уремии на 7—8-м году пересад-
ки у каждого 10-го реципиента; значительно
реже наблюдается развитие сандиммуновой
нефропатии при применении низких доз пре-
парата — 5 мг/кг [Bennett W.M. et al., 1994]. К
механизмам хронической нефротоксичности
сандиммуна относятся сужение афферентной
артериолы, индукция NO-зависимого апопто-
за клеток тубулярного эпителия и интерстици-
ального фиброза [Solez К. et al., 1993], стиму-
ляция синтеза трансформирующего фактора
роста (TGF-/^) и прямое повреждающее дей-
ствие на эндотелий сосудов почек и рецепто-
ры тромбоцитов [Bennett W.M. et al., 1994].
Патогенетическую роль играют также сан-
диммуновая объем-натрийзависимая гиперто-
ния и развивающиеся при длительном лечении
сандиммуном метаболические нарушения: ги-
перурикемия [Marceu R. et al., 1995] и гипер-
гомоцистеинемия. Сандиммуновая нефропатия
чаще манифестирует на 2—4-м году лечения,
характеризуется прогрессирующим интерстици-
альным фиброзом, артериальной гипертонией
и медленно прогрессирующей почечной недо-
статочностью. Реже встречаются облитерирую-
щая артериолопатия с гломерулопатией по типу
ФСГС и гемолитико-уремический синдром,
отличающиеся трудноконтролируемой гиперто-
нией с высокой протеинурией (без НС) и бо-
лее быстрыми темпами прогрессирования по-
чечной недостаточности [Bennett W.M. et al.,
1994].
Для профилактики нефротоксичности
сандиммуна рекомендуют малые и средние
дозы препарата с обязательным мониторирова-
нием его концентрации в крови. Эффективны
и антагонисты кальция. Они корригируют «сан-
диммуновую» гипертонию и почечную вазокон-
стрикцию, оказывают положительное влияние
на функцию Т-лимфоцитов и фармакодинамику
сандиммуна. Применение верапамила, дилтиа-
зема, амлодипина позволяет снизить суточную
379
дозу сандиммуна. Натрийуретический гор-
мон (атриопептид) также рекомендуется для
профилактики нефротоксичности сандим-
муна.
Такролимус (Т-506), в последние годы с ус-
пехом применяемый в трансплантологии при
резистентности к сандиммуну, также обладает
нефротоксическим эффектом, особенно выра-
женным при применении высоких доз. При
этом «такролимусовая» нефропатия по клини-
ческим и морфологическим признакам сходна
с сандиммуновой, хотя реже проявляется ги-
пертонией и гемолитико-уремическим синдро-
мом [Kleim V. et al., 1998].
Различные лекарства могут вызывать выра-
женные канальцевые дисфункции, нередко не
сопровождающиеся морфологической картиной
ТИН. При лечении препаратами лития (психи-
чески больных и больных с диффузным токси-
ческим зобом) поражение почек проявляется
почечным несахарным диабетом и канальцевым
ацидозом дистального типа, иногда и хрони-
ческим ТИН. R.Boton и соавт. (1987), проана-
лизировав опубликованные данные о 1172 боль-
ных, длительно получавших лечение литием,
отметили у 54 % из них снижение концентра-
ционной способности почек с выраженной
полиурией. Предполагается, что вызванный
литием синдром почечного несахарного диабета
связан с накоплением лития в клетках собира-
тельных трубочек, где он взаимодействует с
циклическим АМФ, что приводит к ингибиции
регуляции транспорта воды антидиуретическим
гормоном.
К развитию почечного несахарного диабета
могут приводить также амфотерицин В и дифе-
нилгидантоин.
Препараты, вызывающие гипокалиемию
различными путями: длительно применяемые
слабительные; диуретики, действующие в тол-
стой восходящей части петли Генле (фуросе-
мид, этакриновая кислота) или в начальной
части дистальных канальцев (тиазиды) — мо-
гут приводить и к развитию калийпенической
нефропатии, которая характеризуется сниже-
нием почечного кровотока и СКФ, а при дли-
тельной и тяжелой гипокалиемии — хрони-
ческим ТИН, образованием кист в почечной
ткани.
Вторую группу хронических лекарственных
нефропатий составляют иммунные гломерулонеф-
риты, развивающиеся в исходе острого лекар-
ственного (а также вакцинного, сывороточно-
го) нефрита или начинающиеся исподволь.
Такое постепенное начало, часто с развитием
нефротического синдрома, характерно для не-
фритов, возникающих при лечении препарата-
ми золота, D-пеницилламином, препаратами
ртути, висмута, антидиабетическими сульфани-
380
ламидами, противосудорожными препаратами,
каптоприлом. При этом чаще возникает мемб-
ранозный нефрит, хотя возможны и более тя-
желые варианты с депозитами на базальных
мембранах, но без ЦИК, что заставляет пред-
полагать местное их образование.
«Золотая нефропатия» может развиться не
только при парентеральном, но и пероральном
лечении препаратами золота. Гистологически
характеризуется различными морфологически-
ми вариантами (чаще развивается мембраноз-
ный нефрит, реже — минимальные изменения,
мезангиопролиферативный ГН), отличается
благоприятным естественным течением с пол-
ной нормализацией анализов мочи в среднем
через 11 мес после отмены препаратов золота.
В связи с этим представляется сомнительной
целесообразность иммунодепрессивной тера-
пии.
В наблюдениях R.Cattran и соавт. (1983) про-
теинурия отмечена у 9 % больных, леченных
D-пеницилламином. Интересно, что «пеницилла-
миновая» нефропатия развивается чаще у тех
больных, у которых ранее отмечалась протеи-
нурия при кризотерапии.
Препараты золота могут вызывать у больных
ревматоидным артритом не только типичный
нефротический нефрит, но и совершенно дру-
гие типы поражений почек — канальцевые
дисфункции, острый интерстициальный нефрит
(с обнаружением золота в интерстиции при
рентгеноструктурном анализе) с почечной
недостаточностью, васкулиты почечных со-
судов.
Литий, чаще вызывающий канальцевые дис-
функции, иногда также приводит к развитию
нефротического нефрита. В одном нашем наблю-
дении у больной маниакально-депрессивным
психозом после лечения карбонатом лития зна-
чительно улучшилось психическое состояние,
но развился НС (при биопсии выявлены мини-
мальные изменения клубочков) с хорошим
ответом на терапию ГК.
Лекарства могут индуцировать и другие по-
ражения почек. Так, сульфаниламиды, аллопу-
ринол, триамтерен, фуросемид, соли кремния,
гидроокись алюминия при длительном приме-
нении могут привести к развитии нефролити-
аза. Метизергид, бета-блокаторы, бромокриптин
могут индуцировать ретроперитонеальный фиб-
роз.
Таким образом, большинство лекарств мо-
гут повреждать почки, любой препарат потен-
циально нефротоксичен. Отрицательные лекар-
ственные воздействия на почки многообразны,
одни и те же лекарства могут повреждать поч-
ки различными путями и приводить к разно-
образным структурно-функциональным по-
вреждениям. Все же каждому из них свойствен
наиболее частый путь повреждения, знание
которого позволяет врачу более целенаправлен-
но проводить профилактику почечных лекар-
ственных повреждений.
Для профилактики следует помнить и о фак-
торах риска нефротоксичности. Еще раз напом-
ним, что риск нефротоксического эффекта ле-
карства велик в старческом возрасте, при обмен-
ных заболеваниях (подагра, сахарный диабет, ге-
нерализованный атеросклероз), хронической сер-
дечной недостаточности, циррозе печени, при
алкоголизме и наркомании, при хронических за-
болеваниях почек (особенно при снижении их фун-
кции) и после трансплантации [Тареева И.Е. и
др., 1995; Kaloyanidis G.J., 1993; Lazarus J.M. et
al., 1993].
Литература
Андросова С. О., Кутырина И.М. Побочные действия
нестероидных противовоспалительных препаратов на
функцию почек//Ревматология. — 1983. — № 3. —
С. 57-61.
Дзгоева Ф.У., Милованов Ю.С., Кутырина И.М. Ост-
рая почечная недостаточность, связанная с приемом
рентгеноконтрастных средств и индометацина//Тер.
арх. - 1995. - № 5. - С. 36-39.
Команденко М.С., Сережин Б.С., Козлов В.В. Роль
сенсибилизации в прогрессировании тубулоинтер-
стициальной патологии//Нефрология. — 1997. —
№ 2. - С. 55-58.
Лемер Н. (Н.Lemaire). Новые достижения в лечении
острой почечной недостаточности//Материалы меж-
дународного нефрологического симпозиума. — М.,
1988. - С. 45-55.
Тареева И.Е. Тубулоинтерстициальный нефрит//Русск.
мед. журн. - 1998. - № 1. - С. 22-26.
Тареева И.Е., Николаев А. Ю., Андросова С. О. Лекар-
ственные поражения почек//Нефрология/Под ред.
И.Е.Тареевой. - М., 1995. - Т. 2. - С. 299-311.
Шумаков В.И., Мойсюк Я.Г., Петров Г.И. Опыт при-
менения циклоспорина А в России//Трансплантоло-
гия и искусственные органы/Под ред. В.И.Шумако-
ва. - М„ 1994. - № 2. - С. 37-40.
D’Agati V., Appel G.V. HIV infection and the kidney//J.
Am. Soc. Nephrol. - 1997. - Vol. 8. - P. 1138-1152.
Bennet W.M., Burdmann E.A., Andor T.E. Nephrotoxicity
of immunosupressive drugs//Nephrol. Dial. Transplant. —
1994. - Vol. 9. - P. 141-145.
Baton R., Gaviria M., Batlle D.C. Prevalence,
pathogenesis and treatment of renal dysfunction
associated with chronic lithium therapy//Amer. J. Kidney
Dis. - 1987. - Vol. 10. - P. 329-345.
Briggs J.D., Jones E. On behalf of the Scientific Advisory
Board of the ERA-EDTA Regystry. Renal Transplantation
for uncommon diseases//Nephrol. Dial. Transpl. —
1999. - Vol. 14. - P. 570-575.
Colvin R.B., Fang L.S. Interstitial nephritis//Renal
Pathology/Edit. C.C.Tisher, B.M.Brenner. — Philadel-
phia, 1994. - Vol. 1. - P. 732-768.
Deray G., Martinez F. Role for adenosine, calcium and
ischemia in radiocontrast-induced intrarenal vaso-
constriction//Am. J. Nephrolog. — 1990. — Vol. 10. — P.
316-322.
Dhamidharka V.R., Nadeau K, Cannon C.L. Ciproflo-
xacin overdose: Acute renal failure with prominent
apoptotic changes//Am. J. Kidney Dis. — 1998. — Vol.
31. - P. 710-712 .
Elseviers M.M., De Broe M.E. Diagnostic criteria of
analgesic nephropathy in patients with end-stage renal
failure: results of the Belgium study//Nephrol. Dial.
Transpl. - 1992. - Vol. 7. - P. 479-486.
Elseviers M.M., De Broe M.E. High diagnostic perfor-
mance of CT scan for analgesic nephropathy in patients
with incipient to severe renal failure//Kidney Intern.—
1995. - Vol. 48. - P. 1316-1323.
Gutswiller E, Zemp E. Der Analgetikakonsuni in der
Bevolkerung//Das Analgetiksyndrom//Ed. M.J.Mi-
hatsch. — 1986. — P. 19—25.
Kaloyanidis G.I. Aminoglycosid nephrotoxicity//Diseases
of the Kidney (5-th ed.)/Edit. R.W.Schrier, C.W.Got-
tschalk, Little Brown. — Boston, 1993. — P. 1131—1164.
Kincaid-Smith P. Analgesic-induced renal disease//
Diseases of the Kidney/Edit. R.W.Schrier, C.W.Got-
tshalk. - 1988. - P. 1202-1216.
Kleim V., Brunkhorst R. Tacrolimus in kidney transplan-
tation//Nephron. — 1998. — Vol. 79. — P. 73—80.
Lazarus J.M., Brenner B.M. Radiocontrast-induced
nephropathy//Acute renal failure. — 3-d ed./Edit.
B.M.Brenner. — New-York: Churchill Livingston,
1993. - P. 369-371.
Mihatsch M.J., Brunner F.P., Gloor F.G. Analgesic
nephropathy and papillary necrosis//Renal Pathology/
Edit: C.C.Tisher. - 1994. - P. 905-937.
Molzahn M., Pommer W., De Broe M.E., Elseviers M.M.
Analgesic nephropathy//Oxford Textbook of Clinical
Nephrology/Edit. A.M.Davidson, J.S.Cameron,
J.P.Griinfeld. - 1998. - P. 1129-1146.
Nash K, Hafee Z.A., Abrinko P. Hospital acquired acute
renal failure//!. Am. Soc. Nephrol. — 1996. — Vol. 7. — P.
1376 (abstr.).
Pommer W., Bronder E., Greiser E. Regular analgesic
intake and risk of end-stage renal failure//Amer. J.
Nephrol. - 1989. - Vol. 9. - P. 403-412.
381
Porter G.A. Radiocontrast-induced nephropathy//Nephrol.
Dial. Transplant. - 1992. - Vol. 9. - P. 146-156.
Shankel S.W., Johnson D.C., Clark. R.S., Shankel T.L.
Acute renal failure and glomerulopathy caused by
nonsteroidal antiinflammatory drugs//Arch. int. Med. —
1992. - Vol. 152. - P. 986-990.
Segasothy M., Tong B.K., Kamal A., Murad Z. Analgesic
nephropathy associated with paracetamol//New Zealand
J. Med. - 1984. - Vol. 4. - P. 83-87.
Solez K, Racusen L.C., Marcussen N. Morphology of
ischemic acute renal failure, normal function and
cyclosporine toxicity in cyclosporine treated renal allograft
recipients//Kidney Int.— 1993.Vol.43,— P. 1058—1067.
Stoves J., Rosenberg K, Hamden P., Turney J.H. Renal
disease and use of topical nonsteroidal antiinflammatory
drugs//Neprol. Dial. Transplant. — 1998. — Vol. 13. —
P. 227-228.
Tune B.M. The nephrotoxicity of beta-lactam antibio-
tics//Toxicology of the kidney (2-nd ed.)/Edit. J.B.Hook,
R.S.Goldstein. — New-York: Raven Press, 1993. —
P. 257-287.
Weisberg L.S., Kurnik P.B. Risk of radiocontrast
nephropathy in patients with and without diabetes
mellitus//Kidney Int. - 1994. Vol. 45. - P. 259-265.
Wen S.F., Parthasarathy R., Iliopoulos O., Oberley T.D.
Interstitial nephritis and nephrotic syndrome//Amer. J.
Kidney Dis. - 1992. - P. 281-285.
Whelton A., Hamilton C.W. Analgesic use and chronic
renal disease//!. Clin. Pharmacol. — 1991. — Vol. 31. —
P. 588-589.
Глава 15
ПИЕЛОНЕФРИТ
И. А. Борисов
15.1. Терминология,
классификация
Гермином «пиелонефрит» обозначают неспеци-
фический инфекционно-воспалительный про-
цесс, протекающий преимущественно в лоха-
дочно-чашечной системе почки и ее тубулоин-
терстициальной зоне. Этим подчеркивается за-
кономерность сочетанного поражения указан-
ных структур органа, обусловленная их анато-
чо-функциональным единством (прежде всего
герез форникальный аппарат почки) и путя-
ми распространения в нем инфекции.
Лежащая в истоках болезни бактериальная
инвазия лоханки, чашечек и паренхимы поч-
ки, связанная с местным действием бактерий
этветная воспалительная реакция в виде оча-
гово-деструктивных и очагово-гранулематозных
процессов с исходом в рубцевание почечной
ткани, распространяющееся при хронизации
болезни, поражение всех структур органа с
приобретением черт «нефрита» в широком по-
нимании этого термина (Е.М.Тареев) с про-
грессирующим сморщиванием почки и ее не-
достаточностью вплоть до уремии и уремичес-
кой смерти позволяют рассматривать «пиело-
нефрит» как самостоятельную нозологическую
форму с только ей присущими морфо- и па-
тогенезом.
При этом даже возможность присоединения
иммунного (аутоиммунного) тубулоинтерсти-
циального компонента как этапа патогенеза
пиелонефрита, что особенно активно обсужда-
ется в последнее время в связи с расширяю-
щимся спектром обнаруживаемых при нем ауто-
антител к различным канальцевым структурам,
не меняет ведущей роли инфекционно-воспа-
лительной сущности этой болезни, о чем сви-
детельствует клинический опыт. Успех в лече-
нии пиелонефрита до сих пор достигается лишь
рациональным использованием антибактериаль-
ных средств, эффективность же иммуномоду-
лирующих и неспецифических противовоспали-
тельных препаратов при ближайшем рассмот-
рении дискутабельна, а применение иммуно-
депрессантов (в эксперименте) утяжеляет те-
чение процесса.
В последнее время намечается тенденция
относить пиелонефрит к тубулоинтерстициаль-
ным нефритам, вызываемым инфекционными
агентами, термины «пиелонефрит» и «инфек-
ционный тубулоинтерстициальный нефрит»
считать синонимами.
Однако «инфекционный тубулоинтерстици-
альный нефрит» является лишь составной час-
тью нозологической формы «пиелонефрита».
Акцентуация внимания на преимущественно
паренхиматозных почечных изменениях ведет к
недооценке или просто к игнорированию дру-
гой важной стороны болезни, где чаще всего
кроются ее истоки и начальный морфогенез —
поражения лоханочно-чашечной системы поч-
ки и ее форникального аппарата. Поэтому, на
наш взгляд, термин «пиелонефрит» наиболее
отвечает сущности этой болезни, и отказ от
него не представляется оправданным.
В классификационных схемах самого пиело-
нефрита, ни одна из которых пока не может
претендовать на достаточно широкий охват
проблемы, вплоть до последнего времени со-
храняется понятие о его первичности или вто-
ричное™ и о его необструктивности или об-
структивное™. При этом имеется в виду, что
первичный, или необструктивный, пиелонеф-
рит возникает в не измененных до того почках
и мочевых путях, а вторичный, или обструк-
тивный — на фоне изначально измененных
почек или мочевых путей.
Однако за последнее время понятие об об-
струкции мочевых путей претерпело существен-
ные изменения и стало более емким. Оно объе-
диняет сейчас представления не только о ме-
383
ханических препятствиях току мочи, но и о
динамических, или, как их еще называют,
«функциональных», нарушениях деятельности
мочевых путей, их гипер- или гипокинезии,
дистонии, также нарушающих нормальный
пассаж мочи.
Внедрение в клиническую практику все бо-
лее совершенных методов обследования боль-
ных, позволяющих оценивать состояние моче-
вых путей не только в статике, но и в динами-
ке, а также осуществлять более точный и ди-
намичный контроль за системной и почечной
гемодинамикой, дающих возможность прижиз-
ненно изучать морфологию почек, и др., по-
могает чаще выявлять обструктивные измене-
ния, предшествующие возникновению пиело-
нефрита. Экспериментальные данные также
убедительно свидетельствуют, что без предва-
рительного нарушения уродинамики или почеч-
ной гемодинамики пиелонефритический про-
цесс не возникает, и наиболее важную роль в
его возникновении играет обструкция мочевых
путей.
Таким образом, пиелонефрит все более чет-
ко предстает как процесс вторичный, «вторая
болезнь» в патогенетической цепочке, что,
однако, как и прежде, не ставит под сомне-
ние его нозологическую самостоятельность.
Понятия о необструктивном и обструктив-
ном пиелонефрите сохраняют свою клиничес-
кую значимость, однако несколько иную смыс-
ловую нагрузку. В первом случае речь, как пра-
вило, идет лишь об отсутствии механической
обструкции мочевых путей, при этом не исклю-
чаются динамические нарушения процесса мо-
чевыделения. Этот вариант пиелонефрита чаще
ассоциируется с гематогенным (более редким)
путем инфицирования почек, метастатическим
поражением их в рамках системных инфекций,
сепсиса; наслоением инфекции на другие не-
фропатии, нарушившие почечную гемодинами-
ку. Во втором случае констатируется обструк-
ция мочевых путей — механическая или «фун-
кциональная», а генез пиелонефрита чаще ас-
социируется с восходящим, уриногенным пу-
тем инфицирования почек, с повышением
внутрилоханочного давления, с инфицирован-
ными рефлюксами.
С клинических позиций в классификаци-
онные схемы пиелонефрита включают поня-
тие о характере течения процесса (острая или
хроническая форма заболевания; некоторые
авторы выделяют рецидивирующую форму,
хотя не всегда легко бывает провести грань
между рецидивом и повторным заболевани-
ем) и его распространенности (одно- или дву-
сторонний).
С эпидемиологической точки зрения, в наи-
большей степени подвержены риску развития
384
этого заболевания 3 группы населения — де-
вочки раннего возраста, беременные женщины
и родильницы, лица преклонного возраста.
Соответственно этому некоторые авторы выде-
ляют среди этих групп населения пиелонефрит
девочек (О.Л.Тиктинский), гестационный
(Ю.А.Пытель, М.М.Шехтман) и старческий
(И.А.Борисов, В.В.Сура).
В сущности термин «пиелонефрит» объеди-
няет группу заболеваний, гетерогенных как с
точки зрения эпидемиологии и этиологии, так
и клинических особенностей, естественного
течения и прогноза.
15.2. Эпидемиология,
этиология, патогенез
Пиелонефрит является самым частым заболе-
ванием почек и одной из распространенных
болезней инфекционного генеза. Несмотря на
разноречивость эпидемиологических данных о
распространенности этой болезни в различных
возрастно-половых и региональных группах, что
зависит от многих факторов, прежде всего от
различий в научных интересах и возможностях
диагностики, патоморфологические данные о
частоте выявления пиелонефрита во время
вскрытия характеризуются завидным постоян-
ством, на которое ни время, ни расстояния
существенно не влияют. На основании данных
вскрытий пиелонефрит выявляют примерно у
каждого 12—10-го умершего [Лопаткин Н.А.,
Шабад А.Л., 1985; Zollinger Н., Mihatsch М.,
1978], будучи в значительном проценте случа-
ев не распознанным при жизни. У лиц пожи-
лого и старческого возраста на вскрытии пие-
лонефрит выявляют еще чаще — практически
у каждого 5-го умершего [Борисов И.А. и др.,
1983]. Почти в каждом 4-м случае пиелонефри-
та при вскрытии констатируется его острая или
гнойная форма, что свидетельствует о тяжести
этой патологии на финальном этапе жизни.
Как и при других заболеваниях инфекцион-
ной природы, в их этиологии и патогенезе тре-
буют рассмотрения инфект и его вирулент-
ность, факторы, способствующие инфицирова-
нию органа или тканей, характер иммунного
ответа макроорганизма с помощью антиген-
специфических реакций, фагоцитоза, неспеци-
фических факторов защиты. Ключевые звенья
патогенеза пиелонефрита представлены на схе-
ме 15.1.
Пиелонефрит способны вызывать многие
виды микроорганизмов, но наиболее частыми
возбудителями его являются бактерии, имею-
щие отношение к микрофлоре кишечника че-
ловека — облигатное или факультативное (табл.
15.1).
ПАТОГЕНЕЗ ПИЕЛОНЕФРИТА
Антиген- <—
специфический
МАКРООРГАНИЗМ
Иммунный ответ
Фагоцитоз
Клеточные реакции:
цитокины
гидролазы
супероксид
Воспалительный ответ
ПИЕЛОНЕФРИТ
Проникновение в почку
Продвижение------» Пиеловенозный
по стенке рефлюкс
мочеточника
Адгезия к------> Функциональная *—Противодействие
уроэпителию обструкция опсонизации и
мочеточника фагоцитозу
Р-фимбрии О-антиген К-антиген
МИКРООРГАНИЗМ
Ведущими этиологическими агентами, ин-
фицирующими мочевые пути и почки, являют-
ся представители семейства Enterobacteriaceae,
из которых большая часть приходится на ки-
шечную палочку — около 80 %. Патогенность
микроорганизма характеризуется его способно-
стью к адгезии, инвазии и повреждению тка-
ней, а также к пролиферации в среде обита-
ния. Кишечные палочки в отличие от стафило-
кокков способны размножаться даже в нормаль-
но функционирующем мочевом пузыре, что
может рассматриваться как ключевой момент в
патогенезе восходящей инфекции мочевых пу-
тей [Сидоренко С.В., 19991-
Вирулентность бактерий (речь идет также о
Схема 15.1
Другие факторы
защиты
Таблица 15.1. Частота высеваемости возбудите-
лей пиелонефрита (в процентах)
Возбудитель Честота высеваемости
средняя разброс
Кишечная палочка 39,8 27,2—68,0
Энтерококки 21,1 4,6—36,7
Протей 16,3 6,5—41,6
Синегнойная палочка 10,6 2,1—18,7
Стафилококки 7,6 5,1—11,5
Клебсиелла 3,2 2,3—8,0
Ассоциации возбудителей 26,9 4,1—45,5
представителях семейства Enterobacteriaceae)
определяется их способностью к феномену
«бактериальной адгезии»; наличием у них кап-
сулярных антигенов (К-АГ), подавляющих оп-
сонизацию, фагоцитоз и комплементзависимую
бактерицидную активность крови, и эндоплаз-
матических антигенов (О-АГ), вызывающих
эндотоксикоз и нарушение нормальной цисто-
идной функции мочеточников; возможностью
вырабатывать факторы, повреждающие эпите-
лий мочевых путей, — цитотоксический некро-
тизирующий фактор 1, гемолизин, аэробактин
[Yamamoto S. et al., 1995].
Способность микроорганизмов к адгезии
обусловлена наличием у них специализирован-
ных органелл — фимбрий (или пилей). Клас-
сифицируются эти органеллы по их способно-
сти агглютинировать эритроциты различных
видов животных и по виду сахаров, предотвра-
щающих агглютинацию. Сейчас изучены фим-
брии 1-го типа, чаще ассоциируемые с вызы-
ваемым их носителями циститом, Р-фимбрии,
чаще ассоциируемые с пиелонефритом, и S-
фимбрии. Кроме фимбрий, способность кишеч-
ной палочки к адгезии может поддерживать и
вырабатываемый ею афимбриальный адгезии 1
[Blanca М. et al., 1997].
Наиболее вирулентны штаммы кишечной
палочки, обладающие маннозорезистентными
Р-фимбриями, относящиеся к О-серотипам 2,
6 или 75 и содержащие высокие титры К-АГ,
жгутикового Н-АГ и гемолизина [Brooks H.J.I.
et al., 1980, 1981].
Основной путь инфицирования мочевых
путей и почек — восходящий, уриногенный; ге-
матогенное их инфицирование происходит
лишь в 3—5 % случаев, как правило, в ходе
системных инфекционных процессов, протека-
ющих с бактериемией. Инфекция мочевых пу-
тей (ИМП) поражает преимущественно жен-
щин. Распространенность ИМП в зависимости
от возраста составляет: 20 % у женщин 16—35
лет, 35 % — у женщин 36—65 лет, 40 % — у
женщин 65 лет и старше [Лоран О.Б., 1999]; у
25—2950
385
мужчин эти цифры равны соответственно 1, 20
и 35 %. Частота возникновения острых цисти-
тов (ОЦ) у женщин составляет 0,5—0,7 эпизо-
да на 1 женщину в год [Hooton Т.М. et al.,
1996], у мужчин — 6—8 случаев на 10 000 че-
ловек в год [Hooton Т.М. et al., 1997]. По рас-
четным данным распространенность ОЦ в Рос-
сии может составлять 26—36 млн случаев в год,
а острого пиелонефрита — 0,9—1,3 млн [Лоран
О.Б., 1999]. Соотношение встречаемости ОЦ и
острого пиелонефрита приближается к 18:1
[Stamm W.E. et al., 1991].
В норме возможно инфицирование лишь
дистального отдела уретры микроорганизмами,
колонизующими периуретральную область и
промежность. Предварительным условием ин-
фицирования мочевых путей часто является
смена микробного пейзажа этих областей, когда
дифтероиды, стрептококки и стафилококки, в
норме их населяющие, уступают свое место
грамотрицательной флоре кишечной группы,
преимущественно факультативной. Причины
этого явления пока остаются неясными, хотя
следует иметь в виду его возможную связь с
дисбактериозом кишечника, гормональным
дисбалансом, а у пожилых женщин — с повы-
шением pH среды влагалища в результате де-
фицита эстрогенов с заменой в норме преоб-
ладающих там лактобактерий различными эн-
теробактериями. Применение диафрагм или
внутриматочных контрацептивных средств так-
же может нарушать нормальную экологию вла-
галища. Установлено, что женщины, использу-
ющие контрацептивные диафрагмы, чаще под-
вержены ИМП по сравнению с женщинами,
пользующимися другими методами контрацеп-
ции.
Следующим этапом является инфицирование
мочевого пузыря, свойственное преимуще-
ственно женщинам. Попадание бактерий в мо-
чевой пузырь женщин облегчается короткостью
женского мочеиспускательного канала и бли-
зостью к нему анального отверстия. Полагают
также, что массаж влагалища во время поло-
вого сношения может способствовать проник-
новению бактерий в мочевой пузырь. Имеет
значение и положение уретрального отверстия
женщин во время полового акта, в частности,
подчеркивается, что если оно во время акта
подвергается давлению, то возрастает возмож-
ность возникновения ИМП. Рубцевание дев-
ственной плевы может влиять на ориентацию
уретрального отверстия, а хирургическая кор-
рекция этой аномалии может снижать наклон-
ность к ИМП. Наличие цервикальных эрозий
может быть постоянным источником ИМП. У
мальчиков большую роль играет состояние
крайней плоти. Известно, что при необрезан-
ной крайней плоти, особенно неопрятной,
386
чаще возникает ИМП. Обсуждаются особенно-
сти гидродинамики струи мочи в женской урет-
ре и возможность рефлюкса мочи из уретры в
пузырь, повышенная аффинность клеток сли-
зистой оболочки этих отделов к патогенным
штаммам кишечной палочки, дефекты локаль-
ной выработки IgA-антител против возбудите-
лей.
Третьим этапом является проникновение
бактерий в почечные лоханки и далее в ткань
почек. Здесь следует обсудить многие факторы,
прежде всего те, которые способствуют ретрог-
радному току мочи — рефлюксы мочи.
В последнее время все больше обращают
внимание на несоответствие частоты ИМП в
популяциях как детей (бактериурию выявляют
у 1 % новорожденных и у 1 % девочек школь-
ного возраста), так и молодых женщин (бакте-
риурию находят в 3—10 % случаев), и относи-
тельной редкости вызываемой ее ХПН, особен-
но ТПН. Можно придти к выводу, что сама по
себе ИМП редко сопровождается тяжелыми па-
ренхиматозными почечными процессами и
последние для своего возникновения требуют
дополнительных условий. Одним из главных
среди этих условии считают врожденный или
приобретенный пузырно-мочеточниковый реф-
люкс (ПМР).
При нормальном развитии мочевой системы
ПМР не возникает или возникает редко. Это
связано с нормальным функционированием
клапанного механизма внутрипузырной части
мочеточника, проходящей в стенке мочевого
пузыря в косом направлении на протяжении
1—2 см. При этом мышечные волокна мочеточ-
ника, имеющие спиралевидное направление
для обеспечения его цистоидной функции, во
внутрипузырной части приобретают продоль-
ную направленность, препятствующую перис-
тальтике мочеточника в этом участке. Сокраще-
ние мочевого пузыря приводит к замыканию
отверстий мочеточника. ПМР развивается в тех
случаях, когда длина внутрипузырной части мо-
четочника оказывается слишком короткой, при
этом, как правило, мочеточник располагается
и более латерально (латеральная эктопия мо-
четочника). С ростом ребенка внутрипузырная
часть мочеточника может удлиняться, что по-
вышает состоятельность клапанного механизма,
который в итоге может восстановиться полно-
стью. Поэтому врожденный ПМР выявляют у
маленьких детей, чаще в возрасте 2—3 лет, и
он может полностью исчезать, чаще к 5—6
годам. Если он сохраняется у детей 10—11 лет,
то спонтанное прекращение его становится ма-
ловероятным.
Распространенность врожденного ПМР со-
ставляет примерно 1 случай на 100 детей (у
чернокожих детей он наблюдается значительно
реже) и имеет тенденцию к семейной агрега-
ции. Предполагается доминантность гена с не-
полной пенетрацией, есть данные о большей
частоте в популяции детей с ПМР таких типов
HLA-антигенов, как AW32, В12, В15, А9.
Врожденный ВУР может быть одно- и двусто-
ронним. Его обнаруживают у 30—50 % детей с
рецидивирующей ИМП, у 85—100 % детей и у
50 % взрослых с хроническим пиелонефритом
и рубцовой деформацией почек [Элдер Д.С.,
1998].
Вторичный ПМР чаще возникает при уре-
тероцеле, наличии клапанов задней уретры,
нейрогенном мочевом пузыре, гипертрофичес-
ких процессах в предстательной железе.
Внутрипочечный рефлюкс (ВПР) — это
обратный ток мочи в венозную форникальную
систему почки или в почечные канальцы. Он
развивается обычно во время мочеиспускания,
т.е. относится к рефлюксам высокого давления,
и происходит в сложных чашечках почек, рас-
положенных в их полюсах. При уплощении в ре-
зультате повышенного давления мочи сосочков
сложных чашечек (а это требует относительно
небольшого повышения давления) угол откры-
тия собирательных трубочек начинает прибли-
жаться к прямому, что и облегчает возникно-
вение рефлюкса.
Чаще всего ПМР и ВПР приводят к фокаль-
но-сегментарным или генерализованным пора-
жениям паренхимы почек с рентгенологичес-
кими признаками ее рубцевания (симптом Ход-
сона), а также различным степеням выявляе-
мой каликоэктазии. Это обозначается и как
рефлюксная нефропатия (РНП) и как атрофи-
ческий хронический пиелонефрит (ХП). И хотя
считается, что рефлюкс стерильной мочи не
должен приводить к рубцовым изменениям
почек, есть и противоположные мнения, и до
сих пор существуют трудности в разделении
этих двух вариантов поражения почек. И лишь
убедительная связь рубцевания почки с инфек-
цией (что доказательно далеко не всегда даже
при наличии ИМП) позволяет поставить ди-
агноз ХП.
Другими факторами, предрасполагающими к
формированию инфекционного процесса в
мочевых путях и почках, являются:
• обструкция мочевых путей, ведущая к появ-
лению остаточной мочи в мочевом пузыре
и, следовательно, к облегчению его инфи-
цирования из-за снижения выработки фак-
торов защиты растянутой со сниженным
кровотоком слизистой оболочки последнего;
• инструментальные исследования мочевых
путей, способствующие их прямому инфи-
цированию;
• беременность из-за косвенного (гиперэстро-
генемия и расстройства цистоидной функ-
ции мочеточников) и прямого (увеличенная
матка) влияния на мочевые пути, ведущего
к нарушению оттока мочи;
• сахарный диабет, сопровождающийся нару-
шением ПК, прогрессирующим гломерулос-
клерозом, нейрогенной дисфункцией моче-
вого пузыря и, вероятно, иммунной несос-
тоятельностью из-за гликозилирования бел-
ков, участников иммунного процесса;
• неинфекционная патология почек (ГН, ИН
и др.), вызывающая также нарушение ПК,
гломеруло- и тубулоинтерстициальный скле-
роз;
• иммуносупрессивная терапия и связанные с
ней изменения иммунитета и неспецифичес-
ких факторов защиты мочевых путей и орга-
низма в целом.
Вместе с тем простого инфицирования мо-
чевых путей и почек недостаточно для реали-
зации в них воспалительного процесса. И сли-
зистая оболочка мочевого пузыря, и структу-
ры почек легко освобождаются от проникшей
в них инфекции, если этому не препятствуют
дополнительные факторы. Наиболее эффектив-
но инфекционный процесс реализуется в ус-
ловиях совпадающего по времени проявления
вирулентных свойств бактерий, неадекватнос-
ти иммунного реагирования организма по от-
ношению к конкретным бактериальным анти-
генам, нарушения уродинамики или внутрипо-
чечной гемодинамики, причем последние не-
редко инициируются также инфекционным
агентом.
Характер инфекционного процесса, по-ви-
димому, в значительной степени зависит от фе-
нотипических особенностей облигатной ауто-
флоры, выступающей в качестве возбудителей
пиелонефрита. Длительное и эффективное со-
существование ее с организмом дает возмож-
ность некоторым из этих бактерий, преимуще-
ственно кишечной палочке, «обрасти» набором
различных гетероантигенов, сходных с рядом
аутоантигенов организма, и тем самым приоб-
рести своеобразный «зонтик» иммунологичес-
кой толерантности. Известно, что примерно
половина штаммов кишечной палочки облада-
ют подобными свойствами, позволяющими им
«ускользать» от иммунного надзора (феномен
бактериальной мимикрии), длительно персис-
тировать в ткани органа, поддерживать вяло
текущий, склонный к очагово-гранулематозным
изменениям процесс. С наличием общих гете-
рогенных антигенов у некоторых штаммов ки-
шечной палочки и эритроцитов, определяющих
групповые характеристики крови, в частности
по системе AB0, связаны известные различия
в течении коли-бациллярного пиелонефрита у
25
387
лиц с разными группами крови — более стер-
тое у лиц с группой крови 0 и более яркое у
лиц с группами В и АВ. Вероятно этим обус-
ловлена и способность кишечной палочки к
трансформации в L-формы (или другие без-
оболочечные формы), длительно персистирую-
щие в интерстиции почек и вновь реверсиру-
ющие в исходные формы, инициируя обостре-
ния процесса. Возможно, указанные обстоятель-
ства определяют и более легкое в целом тече-
ние коли-бациллярного пиелонефрита по срав-
нению с пиелонефритами, вызываемыми дру-
гими возбудителями, особенно протеем.
Пиелонефрит, вызванный протеем, проте-
кает чаще тяжело, нередко осложняется поли-
органной недостаточностью (печеночно-почеч-
ной) и бактериемическим (эндотоксическим)
шоком. Предположительно, это можно объяс-
нить тем обстоятельством, что протей, будучи
редкой факультативной флорой кишечника,
сохраняет свою фенотипическую индивидуаль-
ность, не вырабатывает гетероантигенов и не
входит в круг бактерий, способных к мимик-
рии. Более того, появляясь в кишечнике лишь
при выраженном дисбактериозе, когда среди
условно-патогенной флоры резко возрастает
удельный вес штаммов микроорганизмов с
патогенными свойствами, блокирующих про-
цесс дезаминирования, способствующих накоп-
лению биогенных аминов (гистамина, серото-
нина) и тем самым подготавливающих орга-
низм к измененному, аллергическому (или
правильнее псевдоаллергическому) реагирова-
нию, протей в силу высокой антигенности сво-
их эндотоксинов может формировать гиперчув-
ствительный воспалительный ответ с его мор-
фологическими проявлениями в виде альтера-
тивно-деструктивных.
Между этими крайними вариантами, веро-
ятно, следует поместить и все промежуточные
варианты формирования воспалительного отве-
та, определяющего клинические проявления
страдания.
Очевидно, что сила и отрегулированность
иммунного ответа, т.е. аллергическое, а при
бактериальных инфекциях чаще псевдоаллерги-
ческое реагирование организма, которое «ин-
дивидуально раскрашивает всю заболеваемость
человека, придавая ей черты чего-то изменчи-
вого, случайного и даже парадоксального»
(И.В.Давыдовский), имеют как генетически
детерминированные, так и инволютивно-средо-
вые основы, каждая из которых накладывает
свой отпечаток на формирование воспаления.
Сам же воспалительный ответ приобретает
свое лицо в многосложном взаимодействии кле-
точных реакций и межклеточного матрикса
(пролиферативных, экссудативных, альтератив-
ных), поддерживаемом многочисленными фак-
388
торами межклеточных взаимодействий (ауток-
ринных, паракринных, эндокринных), вклю-
чающих наряду с антигенспецифическими ре-
акциями вазоактивные пептиды, анафилаток-
сины, комплекс «мембранной атаки» компле-
мента, интерлейкины, колониестимулирующие
факторы роста и другие менее известные фак-
торы.
Таким образом, именно сложные связи меж-
ду вирулентностью бактерий, путями их про-
никновения в почки и факторами, способству-
ющими этому, характером иммунного реагиро-
вания организма и обстоятельствами, на него
влияющими, так же как наличие или отсутствие
предсуществующих функциональных или орга-
нических заболеваний мочевых путей и почек,
формируют особенности возникновения, тече-
ния, прогноза пиелонефритов в конкретных
случаях.
Труднее обстоит дело с пониманием меха-
низмов хронизации воспалительного процесса
и его течения в латентных фазах болезни. Кли-
ническая симптоматика болезни в этих случаях
бывает или минимальной, или отсутствует,
морфологически же констатируют очаги скле-
роза с маловыраженными клеточными реакци-
ями, которые скорее характеризуют как невос-
палительные. Учитывая это, в механизмах про-
грессирующего склерозирования почек вне атак
пиелонефрита допустимо видеть невоспалитель-
ные, а прежде всего гемодинамические, гипер-
фильтрационные факторы, что сейчас актив-
но обсуждается в приложении к гломерулярным
заболеваниям почек.
15.3. Патоморфология
пиелонефрита
Прижизненное изучение пиелонефрита с помо-
щью инцизионных и пункционных биопсий
почек позволило углубить представления о его
морфологии, в том числе в зависимости от
форм и стадии заболевания.
При остром пиелонефрите выделяют 3 мор-
фологические формы [Серов В.В., Пытель Ю.А.
и др., 1973] — серозную, гнойную и гнойную
с мезенхимальной реакцией, которые рассмат-
ривают как стадии воспалительного процесса,
связанные временными отношениями.
Макроскопически почка увеличена в объе-
ме, отечна, при гнойных вариантах в коре и
медуллярной зоне на разрезе обнаруживают
многочисленные абсцессы (мелкие при апосте-
матозе или сливающиеся с формированием
крупных абсцессов или карбункула). Лоханка
почки расширена, слизистая оболочка ее набух-
шая, рыхлая, гиперемированная, иногда по-
крыта гнойными налетами, иногда кровоизли-
яниями и язвами, особенно при сопутствующей
мочекаменной болезни.
Микроскопически иногда удается проследить
динамику процесса, который начинается чаще
всего с очагового серозного воспаления в стро-
ме почки, обычно в мозговом веществе, и ха-
рактеризуется полнокровием и отеком стромы
с наличием в серозном экссудате единичных
нейтрофильных лейкоцитов, появлением дис-
трофических и некробиотических изменений
эпителия канальцев. При дальнейшем прогрес-
сировании процесс переходит в гнойную фор-
му, сначала с очаговым скоплением на фоне
вышеописанных изменений сегментоядерных
лейкоцитов, затем — с диффузной лейкоцитар-
ной инфильтрацией стромы, с частым проры-
вом гнойного экссудата в канальцы. На следу-
ющем этапе формируются абсцессы с возник-
новением на фоне диффузной гнойной инфиль-
трации участков гистолиза. При благоприятном
течении процесса наблюдаются стихание лей-
коцитарной инфильтрации и смена ее проли-
ферацией гистиолимфоцитарных элементов, что
отражает мезенхимальную реакцию.
При хроническом пиелонефрите морфология
отличается от вышеописанной и представлена
главным образом неравномерно выраженными
мононуклеарной клеточной инфильтрацией,
очагово-диффузным склерозом и соответству-
ющими изменениями паренхимы.
Макроскопически почки с многочисленны-
ми рубцами на поверхности, с преимуществен-
ной локализацией рубцов в области полюсов
органа, с мелкозернистой поверхностью. Неред-
ко наблюдают уменьшение размеров органа той
или иной степени, пиелонефритически смор-
щенные почки обнаруживают примерно в 1,5 %
вскрытий, причем в 1/3 этих случаев констати-
руют одностороннее сморщивание почки, а в
2/ — двустороннее [Zollinger H.U., Mihatsch
М., 1978]. Лоханка почек, как правило, расши-
рена, выявляют деформации чашечек, особен-
но в их углах, и их расширение. Слизистая обо-
лочка лоханки и чашечек утолщена, тусклого
вида, иногда гиперемирована и изъязвлена (при
наличии в лоханке конкрементов).
Микроскопически в почках обнаруживают
лимфогистиоцитарные инфильтраты (от еди-
ничных мелких до крупных, нередко сливаю-
щихся между собой), склероз и фиброз стро-
мы (от мелкоочагового до диффузного, в том
числе перигломерулярный склероз), склероз
сосудов, преимущественно артерий. Завершают
картину атрофия и замещение соединительной
тканью канальцев. Собственно капиллярные
клубочки изменяются мало. Часто при выражен-
ном фиброзе и связанной с ним блокаде от-
дельных групп нефронов некоторые группы ка-
нальцев кистозно расширены, их просвет за-
полнен гомогенным коллоидом, эпителий уп-
лощен, что придает паренхиме органа сходство
с тканью щитовидной железы — «тиреоидиза-
ция почки». Каждый из этих признаков сам по
себе не патогномоничен для пиелонефрита и
может встречаться-при нефросклерозах другой
этиологии, но при их сочетании картина ста-
новится достаточно характерной. В связи с пре-
обладанием инфильтрата, поражений паренхи-
матозных элементов или изменений сосудов, а
также степени выраженности этих изменений
иногда выделяют различные морфологические
формы пиелонефрита: с минимальными нару-
шениями, с компонентами стромально-клеточ-
ным, тубулостромальным и стромально-сосуди-
стым, формы смешанной и с исходом в смор-
щивание [Серов В.В., Пытель Ю.А. и др., 1973].
В финале заболевания, когда развивается пие-
лонефритически сморщенная почка, особенно
отчетливо проявляется неравномерность, оча-
говость процесса и его асимметричность в обе-
их почках.
В рамках хронического пиелонефрита выде-
ляют также и хронический пиелонефрит с обо-
стрением, когда морфологически констатиру-
ют сочетание различных форм острого и хро-
нического процессов. Здесь также подчеркива-
ется зависимость остроты воспалительного про-
цесса от времени его начала.
Одним из главных признаков пиелонефри-
та, отличающим его от других тубулоинтерсти-
циальных поражений почек, является обяза-
тельное содружественное вовлечение в процесс
и чашечно-лоханочной системы органа. В связи
с этим необходимым условием для морфоло-
гической документации заболевания на опера-
ционном и патологоанатомическом материале
является соответствующее поражение лоханки
с признаками острого (отек, нарушение мик-
роциркуляции, инфильтрация сегментоядерны-
ми лейкоцитами) или хронического (лимфоги-
стиоцитарная клеточная инфильтрация, скле-
роз) воспаления.
15.4. Клиника, диагноз,
дифференциальный диагноз
Острый пиелонефрит. Чаще всего к развитию
острого пиелонефрита приводит острая окклю-
зия мочевых путей, у ряда больных он разви-
вается после диагностических и лечебных ма-
нипуляций на мочевых путях или как следствие
системных инфекций. Апостематозный нефрит,
абсцесс и карбункул почки, некротический
папиллит являются вариантами течения остро-
го пиелонефрита. В клинических проявлениях за-
болевания важную роль играют особенности
инфекта, его обусловившего. Наиболее тяжелое
389
течение с септикопиемией, поражением кон-
тралатеральной почки, метастатическими гной-
ными очагами, желтухой и гепаторенальной
недостаточностью наблюдают при остром об-
структивном процессе, вызванном протеем или
плазмокоагулирующим стафилококком; колиба-
циллярный пиелонефрит в столь тяжелых фор-
мах встречается редко.
Примерно в 80 % случаев начало острого
пиелонефрита характеризуется резким и значи-
тельным повышением температуры тела (до
39—40 °C, иногда и выше), потрясающим оз-
нобом, потом, артралгиями, миалгиями, быс-
трым нарастанием симптомов общей интокси-
кации — слабости, вялости, разбитости, тош-
ноты, рвоты, т.е. признаками тяжелого инфек-
ционного заболевания. Лихорадка обычно ре-
миттирующего характера, иногда — постоянно-
го, может сопровождаться высыпаниями про-
стого герпеса.
Типичным проявлением заболевания является
боль в области поясницы, иногда тупая; иногда
достигающая значительной интенсивности. Весь-
ма часто, как следствие и одновременно теку-
щего цистита, появляются дискомфорт при
мочеиспускании, поллакиурия или дизурия.
Примерно в 20 % случаев боль возникает
лишь на 3—5-й, еще реже на 7—15-й день бо-
лезни, к этому же времени начинает развора-
чиваться и другая клиническая симптоматика,
что более характерно для необструктивных ва-
риантов острого пиелонефрита.
При осмотре обычно обращают на себя вни-
мание признаки дегидратации, сухой обложен-
ный язык. Возможны умеренное вздутие живо-
та, повышение тонуса поясничных мышц, вы-
нужденное сгибание и приведение ноги к ту-
ловищу на стороне поражения. Как правило,
обнаруживают болезненность при надавливании
в костовертебральном углу соответствующей
стороны, положительный симптом Пастернац-
кого, иногда удается прощупать плотную болез-
ненную почку. Одновременная бимануальная
пальпация поясничной и подреберной облас-
тей позволяет нередко определить локальную
болезненность в пояснице и ощутить даже
незначительное напряжение мышц передней
брюшной стенки [Пытель Ю.А., 1980]. Этот сим-
птом, характерный уже при переходе серозного
воспаления в гнойное, как правило, удается вы-
являть при гнойном пиелонефрите. Определяют
учащенный пульс, при отсутствии сочетанной
патологии — тенденцию к гипотонии.
Примерно у 10 % больных с острым обструк-
тивным пиелонефритом развивается картина
бактериемического шока с резкой тахикарди-
ей, падением АД ниже 80—70 мм рт.ст., сни-
жением клубочковой фильтрации с олигурией,
иногда анурией, метаболическим ацидозом. От
390
глубины и длительности шока зависит клини-
ческая картина острой почечной недостаточно-
сти, наблюдаемой в последующие дни и в ряде
случаев требующей гемодиализа. Среди больных
острым пиелонефритом с бактериемическим
шоком преобладают пожилые и старые люди.
Клиническая картина острого пиелонефрита
у старых людей отличается значительным раз-
нообразием и во многом зависит от другого
болезненного окружения, среди которого он
протекает. Наибольшее влияние на его прояв-
ления оказывает старческая кахексия. У наибо-
лее ослабленных кахектичных больных даже
гнойный пиелонефрит, осложненный паранеф-
ритом, может быть практически бессимптом-
ным или проявляться интоксикационным син-
дромом и анемией [Борисов И. А. и др., 1983].
В то же время при меньшем влиянии общих ди-
строфических факторов атаки старческого пи-
елонефрита могут протекать в «классических»
рамках с выраженной лихорадочной реакцией,
ознобом, адекватным ответом пораженного
органа в функциональном плане.
Острый пиелонефрит беременных реже дости-
гает степени гнойного. Однако гнойные формы
протекают очень тяжело, почти в половине
случаев при них констатируется развитие бак-
териемического шока, и почти в '/4 случаев —
появление признаков почечной недостаточно-
сти. Острый гнойный пиелонефрит у беремен-
ных почти в половине случаев возникает на 20—
30-й неделе и почти в 1/3 случаев — на 31—
40-й неделе беременности.
Ранними лабораторными симптомами остро-
го пиелонефрита являются бактериурия и лей-
коцитурия, хотя они могут и отсутствовать при
окклюзии мочеточника на стороне поражения.
Олигурия и высокая относительная плотность
мочи находятся в зависимости от теряемых
объемов жидкости за счет лихорадки и катабо-
лизма. Протеинурия, как правило, бывает не-
значительной, возможны микрогематурия и
очень небольшая цилиндрурия, преимуществен-
но за счет гиалиновых, иногда — лейкоцитар-
ных цилиндров. Макрогематурия может наблю-
даться на фоне почечной колики или папил-
лонекроза.
В крови выявляют лейкоцитоз (нередко —
гиперлейкоцитоз, превышающий 20 • 109/л и
даже 30 • 109/л лейкоцитов) со сдвигом лейко-
цитарной формулы влево, появлением юных
форм нейтрофилов, токсической их зернисто-
сти; возможна анэозинофилия.
Характерны умеренное снижение уровня
гемоглобина, заметное повышение СОЭ. При
тяжелом течении заболевания с вовлечением в
процесс контралатеральной почки и печени с
недостаточностью этих органов появляются азо-
темия, гипербилирубинемия. При нормальной
функциональной способности контралатераль-
ной почки повышение уровня мочевины может
быть одним из предвестников бактериемичес-
кого шока и, следовательно, показанием к
экстренной операции.
Диагноз острого пиелонефрита в типичных
случаях, как правило, не представляет больших
трудностей. Лихорадка, интоксикационный син-
дром, боль в пояснице с признаками пораже-
ния почки, лабораторные данные создают до-
статочно четкие предпосылки для распознава-
ния болезни. С целью уточнения диагноза и вы-
работки терапевтической тактики необходимы
методы дополнительного обследования, наибо-
лее информативными из которых являются хро-
моцистоскопия, обзорная и экскреторная уро-
графия, ультразвуковое сканирование почек.
Хромоцистоскопия дает возможность оце-
нить степень нарушения пассажа мочи из вер-
хних мочевых путей, определить показания к
катетеризации мочеточника.
Обзорная и экскреторная урография позво-
ляет локализовать обструкцию мочевых путей,
оценить состояние не только чашечно-лоханоч-
ной системы почки, но и контралатеральной
почки, выявить признаки вовлечения в процесс
паранефральной клетчатки. Последнее осуще-
ствляется с помощью снимков на вдохе и вы-
дохе на одной пленке.
При ультразвуковом исследовании можно
выявить расширение чашечно-лоханочной си-
стемы при нарушенном пассаже мочи, обнару-
жить камень. Округлое, эхонегативное образо-
вание на ультрасонограмме с четкими конту-
рами, не всегда ровными, является отражени-
ем карбункула почки, а овальное или непра-
вильной формы эхонегативное образование,
расположенное в непосредственной близости от
почки, — паранефрального абсцесса.
С позиции интересов клинической практи-
ки вновь обсуждается вопрос о выделении при
остром пиелонефрите топических форм с пре-
обладанием элементов «пиелита» или «гнойного
нефрита». Различаясь патогенетически, морфо-
логически и клинически, они требуют и раз-
личных терапевтических подходов.
Действительно, как показывает клиническая
практика, острым пиелонефритом с преобла-
данием элементов «пиелита» страдают почти
исключительно женщины, процесс имеет в
своей основе уриногенный путь инфекции с
преобладанием условно-патогенной флоры ки-
шечника, в клинической картине его законо-
мерна дизурия как проявление одновременно
текущего цистита. В то же время острый пиело-
нефрит с преобладанием элементов «гнойного
нефрита» более характерен для мужчин, обус-
ловлен чаще гематогенным инфицированием
почек с более частым обнаружением гноерод-
ной кокковой флоры, протекает нередко в рам-
ках системных инфекций. Поэтому выделение
этих топических форм острого пиелонефрита
представляется правомочным и практически
значимым.
Дифференциально-диагностичес-
кие проблемы при остром пиелонефрите
чаще возникают у детей и больных пожилого,
особенно старческого возраста, в частности при
отграничении болезни от сепсиса, гриппа,
пневмонии, малярии, некоторых кишечных
инфекций. Нераспознавание или запоздалое
распознавание острого пиелонефрита, протека-
ющего под маской сальмонеллеза, является
одной из частых диагностических ошибок. Осо-
бенно большие трудности возникают при диф-
ференциальной диагностике сальмонеллеза и
острого пиелонефрита в случаях, когда первый
из них осложняется шоком, а в клинической
картине второго преобладают черты уросепси-
са. По имеющимся данным, среди больных,
госпитализируемых с ошибочным диагнозом
пищевой токсикоинфекции, примерно у 15 %
в последующем выявляют заболевание мочевой
системы и прежде всего пиелонефрит. Иногда
острый пиелонефрит может симулировать кар-
тины острого аппендицита, холецистита, ад-
нексита.
У старых людей частота гнойных форм пие-
лонефрита значительно возрастает. Развитие
гнойного пиелонефрита у них происходит, как
правило, на фоне обструкции мочевых путей
при мочекаменной болезни или опухолевых
процессах. Однако в клиническом диагнозе эти
формы пиелонефрита находят отражение лишь
в редких случаях, более чем в 90 % случаев их
обнаруживают лишь при вскрытии [Бори-
сов И.А. и др., 1986], т.е. здесь дифференциаль-
но-диагностические трудности возникают при
оценке активности процесса на фоне мульти-
морбидной старческой патологии с ее прояв-
лениями системных сосудистых болезней, опу-
холевых процессов или обменных нарушений.
Трудно распознать такие осложнения ост-
рого пиелонефрита, как паранефрит или не-
кротический папиллит, хотя последний рас-
сматривают и как одну из форм острого пие-
лонефрита.
Хронический пиелонефрит чаще всего является
следствием перенесенного острого процесса.
Механизмы хронизации во многом остаются
неясными, имеют значение состояние макро-
организма, особенности инфекта, адекватность
терапии и многие другие факторы, в том чис-
ле «невозможность завершения острого воспа-
ления регенерацией» (И.В.Давыдовский).
Клиническая картина хронического
пиелонефрита очень разнообразна. Это обуслов-
ливается распространенностью воспалительно-
391
го или склеротического процесса в почках, ак-
тивностью воспаления, особенностями инфек-
та, глубиной нарушений функционального со-
стояния почек, наличием сопутствующих забо-
леваний и т.д. При поражении пиелонефритом
одной почки нередко вплоть до стадии ее смор-
щивания процесс может не проявлять себя
клинически.
Хронический пиелонефрит вне обострения
протекает с весьма малой симптоматикой. Лишь
целенаправленный расспрос больных помогает
выявить такие симптомы, как боль в пояснич-
ной области, эпизоды как будто бы немотиви-
рованного субфебрилитета, познабливаний,
расстройств мочеотделения (полиурия или ник-
турия) и мочеиспускания (дизурия, поллакиу-
рия). Обычны проявления инфекционной асте-
нии — утомляемость, чувство разбитости, сни-
жение работоспособности, хотя эти симптомы
настолько распространены, что редко уже ас-
социируются клиницистами с какой-либо кон-
кретной нозологической формой.
Проявлениями, нередко единственными,
хронического пиелонефрита могут быть изоли-
рованный мочевой синдром (лейкоцитурия раз-
личной степени, бактериурия, протеинурия,
чаще не превышающая 1 г/сут), анемия, труд-
но поддающаяся лечению (также и при отсут-
ствии признаков почечной недостаточности),
синдром артериальной гипертонии. Особой
склонностью к развитию артериальной гипер-
тонии, даже с тенденцией к ее злокачествен-
ному течению, отличается пиелонефрит, раз-
вивающийся в гипоплазированных почках.
Иногда хронический пиелонефрит впервые
клинически проявляется уже симптомами хро-
нической почечной недостаточности, включа-
ющей в себя и артериальную гипертонию, и
анемию.
У детей нередким проявлением хронического
пиелонефрита является задержка роста и раз-
вития.
Диагноз хронического пиелонефрита ба-
зируется на выявлении признаков поражения
паренхимы почки, преимущественно тубулоин-
терстициальной зоны, и ее чашечно-лоханоч-
ного аппарата, при одновременном подтверж-
дении бактериального генеза этих поражений.
В диагностике хронического пиелонефрита
большое значение имеют данные анамнеза, си-
стематические исследования мочи, бактериоло-
гические, рентгенологические, радиоизотоп-
ные, ультразвуковые и клиренсовые методы
исследования почек.
Анамнестические данные позволяют судить
о ранее перенесенном остром пиелонефрите,
инфицированное™ мочевого тракта, других
факторах риска развития хронического пиело-
нефрита.
392
Систематические исследования мочи направ-
лены прежде всего на выявление бактериурии
и лейкоцитурии, уточнение их выраженности
и динамики.
Более четкое представление о лейкоцитурии
дают методы количественной оценки (пробы
Нечипоренко, Каковского — Аддиса с соответ-
ственно минутным и суточным контролем лей-
коцитурии).
Не должно переоцениваться в плане диаг-
ностической значимости обнаружение в моче
так называемых активных лейкоцитов и кле-
ток Штейнгермера — Мальбина, чему ранее
придавали большое значение, а их находки
расценивали как патогномоничный признак.
Дело в том, что подобные изменения лейко-
цитов происходят в условиях низкого осмоти-
ческого давления мочи, при его повышении
измененные лейкоциты могут вновь трансфор-
мироваться в обычные. Хронический пиело-
нефрит характеризуется довольно рано начи-
нающимся снижением способности почки к
осмотическому концентрированию мочи и,
следовательно, становлением гипостенурии,
углубляющейся по мере прогрессирования
процесса. В этих условиях, естественно, чаще,
чем при других заболеваниях, возможна кон-
статация таких изменений лейкоцитов в моче,
что, однако, не является патогномоничным
именно для пиелонефрита.
Особое значение для верификации хроничес-
кого пиелонефрита имеют рентгенологические
методы исследования — внутривенная и инфу-
зионная урография. Ранними рентгенологичес-
кими признаками служат снижение тонуса вер-
хних мочевых путей, уплощенность и закруглен-
ность углов форниксов, сужение и вытянутость
чашечек. В поздних стадиях отмечают резкую
деформацию чашечек, их сближение, пиелоэк-
тазии, наличие пиелоренальных рефлексов.
Характерны увеличение ренально-кортикально-
го индекса (РКИ) выше 0,4 (рис. 15.1), а так-
же симптом Ходсона — уменьшение толщины
паренхимы почек на полюсах по сравнению с
ее толщиной в средней части (рис. 15.2).
Расширяет диагностические, особенно диф-
ференциально-диагностические, возможности
при пиелонефрите компьютерная томография
почек. Она позволяет составить четкое представ-
ление о массе и плотности паренхимы почки,
состоянии лоханки, сосудистой ножки, пара-
нефральной клетчатки. Так, на рис. 15.3 отчет-
ливо видно значительное уменьшение правой
почки, жидкостное образование неправильной
формы (48x44 мм), но с четкими контурами в
проекции лоханки этой почки, некоторое от-
теснение кпереди сосудистой ножки при хоро-
шей ее дифференцированности, дифференци-
рованность паранефральной клетчатки, отсут-
a — длина почки; б — ширина почки; в — длина и
г — ширина чашечно-лоханочной системы почки (в норме
РКИ = 0,37-0,4).
ствие изменений регионарных лимфатических
узлов и левой почки, что позволяет сделать
вывод о гидронефротической трансформации
правой почки с ее сморщиванием.
Микционная цистография или ее модифи-
кации (рентгеноурокинематография, крупно-
кадровая цистоуретрофлюорография) позволя-
ют обнаружить пузырно-мочеточниковые реф-
люксы и инфравезикальную обструкцию.
Радиоизотопные методы (ренография, дина-
мическая компьютерная сцинтиграфия почек)
дают возможность наблюдать асимметрию и
изменение характера ренограмм, особенности
накопления и распределения изотопа в почках,
что обогащает диагностику хронического пие-
лонефрита как с топических позиций, так и в
функциональном плане (рис. 15.4; 15.5).
Все большее место в диагностике хроничес-
кого пиелонефрита, а также в динамическом
наблюдении за этими больными начинают зани-
мать ультразвуковые методы, чему способствует
высокая разрешающая способность современной
ультразвуковой техники. С ее помощью удается
Рис. 15.2. Симптом Ходсона (схема). Пунктиром обо-
значен нормальный контур почки.
оценить соотношение паренхимы почки и ее
синуса, у молодых, особенно у детей, — состо-
яние пирамид почки, ее лоханки и чашечек.
Биопсия почки имеет меньшее значение в
диагностике хронического пиелонефрита, чем
гломерулонефропатий. Здесь имеет значение
лишь обнаружение характерной морфологичес-
кой картины, что, по данным различных авто-
ров, оказывается возможным примерно в 70 %
случаев. Отсутствие в биоптате почки подобной
Рис. 15.3. Хронический пиелонефрит.
Гидронефротическая трансформация правой почки с ее
сморщиванием. Компьютерная томография.
393
2097
011--1--1-I-1--1-1-1--1_I
Рис. 15.4. Хронический левосторонний пиелонефрит.
Начало сморщивания почки. Ренография.
картины из-за гнездности процесса не исклю-
чает возможности заболевания.
Несмотря на достаточно широкий арсенал
диагностических возможностей, надежная вери-
фикация хронического пиелонефрита остается
трудной задачей. Особенно это относится к
пожилым и старым людям. Как свидетельству-
ют наши данные [Борисов И. А. и др., 1986],
расхождение клинических и патологоанатоми-
ческих диагнозов в этом плане фиксируют ча-
сто. Примерно в 13 % случаев пиелонефрит не
выявляют при жизни больных, примерно в
10 % случаев имеет место его клиническая ги-
пердиагностика. Просматривается пиелонефрит
чаще всего у мужчин от 60 до 70 лет, когда пре-
валирует опухолевая патология, подавляющая
своей симптоматикой как клинические прояв-
ления других болезней, так и диагностический
настрой клиницистов. Гипердиагностика чаще
имеет место у женщин 80—90 лет, когда труд-
но адекватно оценить анализы мочи.
Рис. 15.5. Хронический левосторонний пиелонефрит.
Начало сморщивания почки. Динамическая сцинти-
графия.
Дифференциальный диагноз. Зна-
чительные дифференциально-диагностические
трудности могут возникать при моносимптом-
ном (моносиндромном) течении хроническо-
го пиелонефрита, особенно на ранних этапах,
при отсутствии отчетливых признаков пораже-
ния как паренхимы почки, так и ее чашечно-
лоханочного аппарата.
Наличие бактериурии, особенно ее сочета-
ния с лейкоцитурией, при отсутствии измене-
ний не только чашечно-лоханочной системы
почки, но и контуров почки рубцового харак-
тера, дает основание употреблять термины —
«бактериурия» и «инфекция мочевых путей».
Считается, что при современных возможностях
источник «бактериурии», а тем более уровень
«инфекции мочевых путей» должен быть обна-
ружен, на практике это не всегда оказывается
возможным. Клинический опыт свидетельству-
ет, что диагностически значимые в этом пла-
не методы, в частности пункция мочевого пу-
зыря, раздельная катетеризация лоханок, мо-
четочников и мочевого пузыря, в том числе с
фармакологическими пробами, в широкой
практике малодоступны также из-за возможно-
сти их осложнений, нового инфицирования
мочевых путей; более же доступные методы
недостаточно информативны.
Вместе с тем клинический опыт подтверж-
дает также, что нередко при длительном наблю-
дении за людьми, казалось бы, с изолирован-
ной бактериурией рано или поздно удается
констатировать у них признаки поражения по-
чек или развернутую клиническую картину
пиелонефрита. Поэтому есть основания отно-
ситься к истинной бактериурии, особенно
упорной, как к эквиваленту латентного пиело-
нефрита. Это целесообразно еще и потому, что
воспалительные заболевания нижних мочевых
путей (уретрит, цистит), так же как и предста-
тельной железы, в отличие от пиелонефрита,
лишь за редким исключением, не проявляют
себя клинически. Подобный практический под-
ход, даже с еще большей определенностью,
целесообразен и при выявлении изолированных
«инфекций мочевых путей»; оправданной пред-
ставляется и активная терапевтическая тактика.
Изолированная пиурия нередко является
поводом для проведения дифференциальной
диагностики между хроническим пиелонефри-
том и туберкулезом почек. При туберкулезе
почек пиурия свидетельствует о том, что уже
образовалось сообщение между туберкулезным
очагом и лоханкой почки и, следовательно,
возможны деформации чашечек, могущие си-
мулировать картину пиелонефрита. В этой ситу-
ации только обнаружение микобактерий тубер-
кулеза позволяет решить дифференциально-
диагностическую задачу.
394
В случаях, когда хронический пиелонефрит
проявляет себя изолированным синдромом ар-
териальной гипертонии, приходится проводить
дифференциальную диагностику с гипертони-
ческой болезнью или симптоматическими ар-
териальными гипертониями. Здесь внимание к
себе привлекают молодой возраст больных,
анамнестические указания на перенесенные
«циститы», «пиелиты», наличие мочекаменной
болезни. Для выявления скрытой лейкоцитурии
иногда приходится прибегать к провокацион-
ным пробам, например преднизолоновой. Од-
нако решающее значение для диагностики име-
ют рентгенологические исследования, в том
числе при необходимости контрастная вазогра-
фия почек, а также радиоизотопные исследо-
вания. Наиболее часто при этом выявляют асим-
метрию размеров и функции почек, деформа-
ции чашечно-лоханочной системы почек на эк-
скреторных урограммах, симптом «обгорелого
дерева» на ангиограммах.
При манифестации хронического пиелонеф-
рита синдромом ХПН дифференциально-диаг-
ностическая задача становится наиболее труд-
ной. В этих случаях моча, как правило, бедна
форменными элементами, сморщенные почки
теряют рентгенологическую, радиоизотопную и
ультразвуковую специфику пиелонефрита, и
только выявление истинной бактериурии и
положительный ответ почек на антибактериаль-
ную терапию, прежде всего в функциональном
плане, позволяют остановиться на диагнозе
именно этого заболевания. Иногда выражен-
ность суточной потери натрия также может
стать дополнительным аргументом в пользу пи-
елонефрита (сольтеряющая почка).
15.5. Лечение
Лечение пиелонефрита базируется прежде все-
го на коррекции нарушений уродинамики и
адекватной антибактериальной терапии.
Подходы к лечению больных острым и хро-
ническим пиелонефритами имеют свои особен-
ности.
Острый пиелонефрит без признаков обструк-
ции мочевых путей подлежит незамедлительно-
му лечению антибактериальными средствами.
Каждый больной острым обструктивным пие-
лонефритом должен рассматриваться как кан-
дидат на оперативное пособие, а отказ от пос-
леднего должен быть мотивирован. В этой ситу-
ации лечение начинают с восстановления пас-
сажа мочи с помощью катетера (стента) или
нефростомии, после этого проводят антибак-
териальную терапию. Если изменить последова-
тельность действий, возможно развитие эндо-
токсического шока.
Лечение хронического пиелонефрита условно
подразделяют на два этапа — лечение обостре-
ния (активной фазы болезни), близкое по сво-
им принципам к лечению острого пиелонеф-
рита, и противорецидивное лечение. На каждом
из этих этапов необходимо знать возбудителя
болезни и его чувствительность к антибактери-
альным препаратам, состояние уродинамики и
особенности пассажа мочи, функциональные
возможности почек. Но и здесь основу терапии
составляют также антибактериальные средства.
В настоящее время клиницист имеет в сво-
ем распоряжении достаточно широкий выбор
антибактериальных средств, способных оказать
эффективную помощь больным пиелонефрита-
ми. Среди этих средств — антибиотики, фтор-
хинолоны и нефторированные хинолоны, про-
изводные налидиксовой и пипемидовой кислот,
производные нитрофурана, триметоприм и три-
метоприм в сочетании с сульфаметоксазолом,
большая группа растительных антисептиков.
Для лечения тяжелых и среднетяжелых форм
пиелонефритов сейчас назначают полусинтети-
ческие пенициллины (чаще аминопеницилли-
ны, в том числе с ингибиторами /^-лактамаз),
цефалоспорины трех поколений, аминоглико-
зиды, реже карбапенемы. Практически для этих
целей не применяют биосинтетические пени-
циллины и фениколы. Антибиотики других
групп, в частности тетрациклины, макролиды,
рифампицины, используют для лечения инфек-
ций нижних мочевых путей, обусловленных
хламидийной, уреаплазменной и микоплазмен-
ной инфекциями, распространившимися в на-
стоящее время весьма широко.
Антибиотики, применяемые при лечении
пиелонефритов, и их дозы представлены ниже.
Полусинтетические пенициллины:
аминопенициллины:
• ампициллин — в/м или в/в 1,5—2 г/сут
на 4—6 инъекций; внутрь 2 г/сут на 2
приема;
• амоксициллин — внутрь 1,5—3 г/сут на 3
приема;
карбоксипенициллины:
• карбенициллин — в/м 4—8 г/сут на 4
инъекции;
• тикарциллин — в/в 12—18 г на 4—6 инъ-
екций;
уреидопенициллины:
• азлоциллин — в/в 8—12 г/сут на 3—4 инъ-
екции;
• пиперациллин — в/м или в/в 4—6 г/сут
на 2—3 инъекции.
Полусинтетические пенициллины в сочетании
с ингибиторами fl-лактамаз:
• аугментин (амоксициллин + клавулановая
395
кислота) — внутрь 1,125—1,875 г/сут в 3 при-
ема или в/в 3,6 г/сут на 3 инъекции;
• уназин (ампициллин + сульбактам) —
внутрь 0,375—0,75 г/сут на 2 приема;
• тиментин (тикарциллин + клавулановая кис-
лота) — в/в 12,4—18,6 г/сут на 4—6 инъек-
ций;
• тазоцин (пиперациллин + тазобактам) — в/
в 13,5 г/сут на 3 инъекции.
Цефалоспорины:
• 1-го поколения:
— цефазолин (кефзол) — в/м или в/в 2 г/
сут на 2 инъекции;
— цефалексин — внутрь 0,5—1 г/сут в 2 при-
ема;
• 2-го поколения:
— цефуроксим — 0,25—0,5 г/сут в 2 приема;
— цефаклор — внутрь — 0,75 г/сут в 3 при-
ема;
• 3-го поколения:
— цефотаксим (клафоран) в/в 2—4 г/сут на
2 инъекции;
— цефтазидим — в/м или в/в 1—2 г/сут на
2 инъекции;
— цефтриаксон — в/м или в/в 1—2 г/сут од-
нократно.
Аминогликозиды:
1-го поколения: гентамицин — в/м 3—4 мг/кг
в сутки на 3 инъекции; 2-го — амикацин —
в/м или в/в — 10 мг/кг массы в сутки на 2—
3 инъекции; 3-го — нетромицин — в/м — 4—
6 мг/кг массы в сутки на 2—3 инъекции.
Карбопенемы:
• \ меронем (меропенем) — в/в 1,5 г/сут на 3
инъекции;
• тиенам (имипенем + циластатин натрия) —
в/м +1,5 г/сут на 3 инъекции.
Ряд из указанных антибиотиков обладают
активностью и по отношению к синегнойной
палочке — карбенициллин, тикарциллин, аз-
лоциллин, пиперациллин, цефотаксим, цефра-
зидим, цефаперазон, карбопенемы, а также ти-
ментин и тазоцин. Следует иметь в виду, что
тиментин в сочетании с аминогликозидами
проявляет синергизм в отношении влияния на
палочку сине-зеленого гноя, но эти препара-
ты не следует применять в одном растворе,
поскольку в этом случае снижается эффектив-
ность аминогликозида.
При известной чувствительности возбудителя
предпочтение при выборе антибиотика долж-
но отдаваться тому препарату, который обла-
дает наиболее узким спектром действия. Пос-
ледовательность выбора антибиотика при этом
может быть следующей: аминопенициллины —
цефалоспорины 1-го или 2-го поколений —
396
уреидопенициллины — цефалоспорины 3-го
поколения — карбоксипенициллины — карбо-
пенемы или фторхинолоны. При тяжелом тече-
нии пиелонефрита возможна комбинация ука-
занных антибиотиков (за исключением карбопе-
немов и фторхинолонов) с аминогликозидами.
По последним данным, кишечная палочка ока-
зывается резистентной к ампициллину у 30 % и
к амоксициллину у 30 % больных, наблюдаю-
щихся в домах престарелых, и у 50 % больных,
получающих лечение в стационарах. Эффект ауг-
ментина, хотя он продолжает применяться, все
чаще оказывается разочаровывающим.
Допустимой представляется и рекомендация
использования некоторых стандартизованных
схем эмпирического лечения пиелонефрита с
ориентацией на первичность или повторность
атаки заболевания, наличие или отсутствие
нарушений уродинамики, наличие другого па-
тологического фона, возраста пациента, имев-
ших место урологических манипуляций.
При тяжелом течении болезни целесообраз-
но начинать с внутривенных инъекций (до нор-
мализации температуры и улучшения состояния
больного) цефалоспоринов 3-го поколения
(или уреидопенициллинов, или карбоксипени-
циллинов) в сочетании с внутримышечным
введением аминогликозидов. В настоящее вре-
мя многие авторы отдают предпочтение перед
гентамицином тобрамицину или нетромицину
из-за их меньших токсических влияний. Амика-
цин используют в случаях устойчивости фло-
ры к другим аминогликозидам.
Следует помнить, что тазоцин и карбопене-
мы, обладающие на сегодняшний день самым
широким спектром действия, должны рассмат-
риваться как препараты эмпирического выбо-
ра лишь в случаях тяжелых, преимущественно
внутрибольничных инфекций, чаще являющих-
ся смешанными и полирезистентными. Нельзя
не отметить, что на долю именно этих инфек-
ций приходится около 20 % случаев лихорадок,
возникающих в условиях стационаров.
Препараты, относящиеся к группе фторхи-
нолонов, нефторированных хинолонов и близ-
ких к ним налидиксовой и пипемидовой кис-
лот, и их дозы представлены ниже.
Фторхинолоны:
монофторированные:
• пефлоксацин (абактал) — внутрь 0,8—1,2 г/
сут в 2 приема или в/в 0,8 г/сут на 2 инъек-
ции;
• офлоксацин (таривид) — внутрь 0,4 г/сут в
2 приема или в/в 0,2—0,4 г/сут на 2 инъек-
ции;
• ципрофлоксацин (ципробай) — внутрь
0,25—1 г/сут или в/в 0,2—0,4 г/сут на 2 инъ-
екции;
дифторированные:
• норфлоксацин (нолицин) — внутрь 0,4 г/сут
в 2 приема;
• ломефлоксацин (максаквин) — внутрь 0,4 г/
сут однократно;
трифторированные:
• флероксацин (хинодис) — внутрь 0,2—0,4 г/
сут однократно.
Создаются новые поколения фторхиноло-
нов — руфлоксацин, спарфлоксацин, пазуфлок-
сацин, тровафлоксацин и т.д. Фторхинолоны,
быстро образующие в моче концентрации, зна-
чительно превосходящие минимальную ингиби-
рующую для большинства основных возбудите-
лей пиелонефрита, должны рассматриваться
как препараты резерва и использоваться в пер-
вую очередь при осложненных инфекциях мо-
чевых путей и почек.
Нефторированные хинолоны:
• нитроксолин (5-НОК) — внутрь 0,4 г/сут в
4 приема;
• оксолиновая кислота (грамурин) — внутрь
1,5 г/сут в 3 приема;
• циноксацин (цинобак) — внутрь 1 г/сут в 2
приема.
Производные нафтиридина:
• налидиксовая кислота (неграм) — внутрь 2—
4 г/сут в 4 приема;
• пипемидовая кислота (палин) — внутрь 0,8
г/сут в 2 приема.
Применяют для лечения пиелонефритов
производные нитрофуранов (0,2—0,4 г/сут в 4
приема), триметоприм (0,04-0,06 г/сут одно-
кратно), триметоприм в сочетании с сульфа-
метоксазолом (ко-тримоксазол, септрин, бисеп-
тол внутрь 0,96 г/сут в 2 приема).
Фторхинолоны начинают конкурировать при
лечении госпитальных инфекций с аминогли-
козидами и бета-лактамами, хинолоны продол-
жают сохранять высокую эффективность, осо-
бенно нитроксолин. Налидиксовая кислота, со-
храняя эффективность по отношению к грамот-
рицательной флоре, оказывается неэффектив-
ной в отношении сапрофитного стафилокок-
ка — одного из частых возбудителей ИМП в
последнее время. Нитрофураны неэффективны
по отношению к протею. По чувствительности
к антибактериальным препаратам кишечную
палочку можно разделить на три группы рези-
стентности. Высокий ее уровень выявлен к ам-
пициллину (33,3 %), триметоприму (20,3 %) и
ко-тримоксазолу (18,4 %). Средний уровень ре-
зистентности — к гентамицину (5,9 %), нали-
диксовой кислоте (5,5 %) и пипемидовой кис-
лоте (4,4 %). Наибольшей активностью в отно-
шении ее в настоящее время обладают фтор-
хинолоны и нитрофурантоин [Страчунский
Л.С., 1999]. Помимо указанных антибактериаль-
ных средств, для лечения пиелонефритов, как
правило, вне обострений находят свое место
растительные антисептики, например чай
«Урофлюкс» (состоящий из коры ивы, листьев
березы, листьев толокнянки, трав хвоща и зо-
лотника, корней рудбекии, лакричника, сталь-
ника, корневищ злаков; его употребляют по 3—
5 чашек в день) или «Канефрон» (включающий
в себя золототысячник, кожуру шиповника,
любисток, розмарин — его принимают по 50
капель или по 2 драже 3 раза в день). Исполь-
зуются в различных комбинациях сборы и дру-
гих лекарственных растений — плоды можже-
вельника, шиповника, земляники, листьев чер-
ной смородины, брусники, подорожника, кра-
пивы, цветки василька, шишки хмеля и др.
У женщин в постменопаузальном периоде
периуретральное и интравагинальное примене-
ние содержащих эстрогены (0,5 мг/г) кремов
каждую ночь в течение 2 нед с последующим
использованием 2 раза в неделю в течение 8
мес может значительно снизить частоту обо-
стрений ИМП. Такое лечение рекомендуется до
начала профилактического применения анти-
бактериальных препаратов [Набер К., 1999].
Лечение острого пиелонефрита, за исключе-
нием случаев легкого течения (субфебрилитет,
отсутствие признаков интоксикации, преобла-
дание симптомов цистита и пиелита над сим-
птомами паренхиматозного почечного процес-
са), следует проводить в стационарных условиях
из-за необходимости парентеральной антибак-
териальной и дезинтоксикационной терапии, а
в случаях обструкции мочевых путей — из-за
необходимости восстановления пассажа мочи с
помощью катетеризации мочеточников или не-
фростомии. Пристальное внимание должно уде-
ляться поддержанию достаточного диуреза — не
менее 30—40 мл в час путем введения жидко-
стей и при необходимости мочегонных средств
под контролем состояния центральной гемоди-
намики.
В ситуациях, исключающих ожидание резуль-
татов посева мочи, а таковыми являются прак-
тически все случаи острого пиелонефрита, эм-
пирическую антибактериальную терапию целе-
сообразно начинать с препаратов, высокоактив-
ных в отношении кишечной палочки, так как
именно она вызывает большинство случаев
острого, особенно неосложненного, пиелонеф-
рита. Препаратами выбора могут стать цефалос-
порины 2-го и 3-го поколений, аминогликози-
ды, фторхинолоны, аминопенициллины с ин-
гибиторами ft-лактамаз [Набер К., 1999].
При подозрении на внутрибольничную ин-
фекцию препаратом выбора может стать тазо-
цин в сочетании с аминогликозидом. При по-
397
дозрении на синегнойный пиелонефрит лучше
использовать тиментин в сочетании с аминог-
ликозидом. Следует иметь в виду, что сочета-
ние аминогликозидов с цефалоспорином 2-го
поколения требует особенно внимательного
контроля за функциональным состоянием по-
чек, так как в этом случае может потенциро-
ваться их нефротоксичность. Вероятно, следует
избегать комбинаций фторхинолонов с аминог-
ликозидами из-за широкого круга побочных
реакций.
При среднетяжелом течении болезни воз-
можно ограничение лечения одним антибиоти-
ком — внутривенным введением цефалоспори-
на 2-го или 3-го поколения или внутримышеч-
ным введением аминогликозида.
После нормализации температуры тела и
улучшения состояния пациента парентеральное
введение препаратов заменяют их приемом
внутрь.
При легком течении пиелонефрита лечение
может быть ограничено приемом препаратов
внутрь. Средствами выбора в этом случае могут
быть цефалоспорины 2-го поколения, а также
хинолоны или септрин (ко-тримоксазол).
В случаях очень тяжелого («септического»)
течения пиелонефрита, особенно у пожилых
больных, возможна попытка иммунокоррекции
внутривенным введением больших доз иммуно-
глобулинов — интраглобина, пентаглобина и
др., а при синегнойном пиелонефрите — вве-
дение антисинегнойной плазмы.
При антибактериальной терапии необходи-
мы постоянный контроль за функциональным
состоянием почек и соответствующая ему кор-
рекция доз препаратов. Ориентирами здесь мо-
гут служить уровень креатинина сыворотки или
скорость КФ. Повышение первого или сниже-
ние второй, кратное нормальному, требует
столь же кратного снижения дозы вводимого
антибиотика или увеличения интервалов меж-
ду его введением. У пожилых людей для уточ-
нения величины КФ целесообразно пользовать-
ся формулой Cockroft — Gault (см. главу «Стар-
ческая почка»). При снижении функций почек
первая доза антибиотика («доза насыщения»)
должна быть полной, последующие сориенти-
рованы на уровень почечной недостаточности.
Следует учитывать также, что выраженная де-
гидратация организма (ориентация на осмо-
ляльность крови и уровень натриемии) может
усиливать токсические эффекты антибиотиков.
Следует также обращать внимание на pH мочи,
ибо при разных величинах этого показателя
изменяется эффективность некоторых антибак-
териальных средств. Так, оптимум pH мочи для
аминопенициллинов, нитроксолина, налидик-
совой кислоты и нитрофуранов колеблется в
пределах 5,0—5,4. Гентамицин более активен
398
при щелочной моче (pH 7,5—8,0). Цефалоспо-
рины проявляют свою активность в широких
пределах pH мочи (2,0—8,5).
Лечение обострений хронического
пиелонефрита проводят по аналогичным
ориентировочным схемам.
Противорецидивная терапия при хроничес-
ком пиелонефрите после купирования атаки
болезни предполагает длительное (многомесяч-
ное) лечение антибактериальными препарата-
ми в малых дозах. С этой целью используют
ежедневный перед сном прием цинобака по
0,25 г или триметоприма по 0,1 г или бисепто-
ла по 0,48 г (хотя к этому препарату в после-
днее время в нашей стране отмечают все боль-
шую резистентность). Сохраняют свое значение
в ряде случаев и так называемые «роторные»
схемы противорецидивной терапии. Последние
строят следующим образом: в течение первой
недели месяца пациенты принимают антибак-
териальный препарат, следующие 2 нед — ра-
стительные антисептики (сборы лекарственных
трав), последняя неделя месяца предназнача-
ется витаминизации, приему клюквенного мор-
са или отвара шиповника. В это же время про-
изводят посев мочи, чтобы к следующему циклу
антибактериальной терапии подобрать соответ-
ствующий препарат.
При латентном течении хронического пие-
лонефрита наряду с поиском инфекта и борь-
бой с ним пристальное внимание должно уде-
ляться эффективной коррекции артериальной
гипертонии и метаболических нарушений —
прежде всего гиперлипидемии, гипергликемии
и гиперурикемии, так как это позволяет ото-
двинуть наступление ХПН. Определенное зна-
чение имеет улучшение реологических свойств
крови (трентал и другие антиагреганты) и, сле-
довательно, гемодинамики почек, антиоксидан-
тная терапия (пикногенол, пентоксил, орото-
вая кислота). В некоторых случаях оправдано
применение полиферментных препаратов типа
вобензима.
Прогноз при остром пиелонефрите для
жизни в целом благоприятен. Раннее распозна-
вание болезни в серозной стадии и адекватная
ранняя терапия с восстановлением пассажа
мочи позволяют, как правило, своевременно
купировать инфекцию и избежать оперативно-
го вмешательства, особенно при остром пие-
лонефрите беременных. Своевременно предпри-
нятое при гнойных формах болезни оператив-
ное вмешательство также обеспечивает благо-
приятный прогноз. Несвоевременно предприня-
тые вмешательства, особенно у престарелых
людей и при осложнении заболевания бакте-
риемическим шоком, сопровождаются высокой
летальностью — до 20 % и выше.
Считается, что острый необструктивный
пиелонефрит при раннем распознавании и
адекватной терапии должен заканчиваться выз-
доровлением практически во всех случаях. Ост-
рый обструктивный пиелонефрит, даже при
адекватном лечении, примерно лишь у 60 %
больных заканчивается выздоровлением, а в ос-
тальных случаях приобретает прогрессирующее
течение.
Прогноз при хроническом пиелонефрите
приходится оценивать весьма сдержанно. Кли-
нически пиелонефрит предстает заболеванием
многоликим. Он может протекать полностью
бессимптомно и проявлять себя лишь уже вы-
раженной, иногда терминальной уремией, но
может проявляться острейшей симптоматикой
с симптомами септического шока и острой
многоорганной недостаточности. Он может дол-
го «молчать» даже в окружении «агрессивных»
факторов риска, но может и бурно активизи-
роваться без видимых на то причин. Именно
при хроническом пиелонефрите, как ни при
одном другом заболевании почек, клиницист
сталкивается с наиболее впечатляющими, иног-
да драматическими колебаниями функциональ-
ного состояния почек, которые, однако, мо-
гут полностью или почти полностью выравни-
ваться при рациональной терапии и сохранять-
ся в последующем на удовлетворительном уров-
не долгие годы (особенно это касается старчес-
кого пиелонефрита). Показательно, что на по-
добные колебания почечных функций могут
оказывать влияние не только обострения вос-
палительного процесса в почках, но и колеба-
ния гемодинамики и гидратации организма,
лекарственные влияния.
Что касается практики последнего времени
в отношении лечения инфекций нижних моче-
вых путей (уретрит, цистит), то она свидетель-
ствует о высокой чувствительности их (особенно
впервые возникших) практически ко всем ан-
тибактериальным препаратам. При этом оказы-
ваются эффективными даже средние и низкие
дозы препаратов и даже назначаемые коротки-
ми курсами. Между тем рецидивы ИМП обыч-
но свидетельствуют о возникновении или обо-
стрении именно пиелонефрита.
Литература
Борисов И.А. Пиелонефрит и его лечение на совре-
менном этапе//Тер. арх. — 1997. — Т. 69, № 8. —
С. 49-54.
Калугина Г.В., Клушанцева М.С., Шехаб Л.Ф. Хрони-
ческий пиелонефрит. — М.: Медицина, 1993. — 239 с.
Лоран О. Б. Эпидемиологические аспекты инфекций
мочевыводящих путей//Инфекции мочевыводящих
путей у амбулаторных больных: Материалы между-
народного симпозиума. — М., 1999. — С. 5—9.
Сидоренко С.В. Микробиологическая характеристика
инфекций мочевых путей. — Там же, с. 9—15.
Страчунский Л. С. Норфлоксацин (нолицин) в лече-
нии инфекций мочевых путей. — Там же, с. 29—32.
Набер К. Оптимальная терапия неосложненных и
осложненных инфекций мочевыводящих путей. —
Там же, с. 15—23.
Стамм У.Е., Турк М. Инфекционные заболевания
мочевых путей, пиелонефрит и родственные с ними
состояния//Внутренние болезни/Под ред. Е.Браун-
вальда. К.Дж.Иссельбахера и др. — М.: Медицина,
1995. - Т. 6. - С. 329-345.
Эдлер Д. С. Пузырно-мочеточниковый рефлюкс//Сек-
реты урологии/Под ред. М.И.Резника, Э.К.Новика. —
СПб., 1998. - С. 164-173.
Blanco М., Blanco ЕЕ., Alonso М.Р. et al. Detection of
pap, sfa, and afa adhesion-encoding operons in
uropathogenic Escherichiacoli strains: relationschip with
expression of adhesion and production of toxins//Res.
Microbiol. - 1997. - Vol. 48. - P. 745-755.
Elooton T.M., Scholes D., Elunghes P. et al. A prospective
study of risk factors for symptomatic urinary tract
infection in young women//N.E.J.M. — 1996. — Vol.
335. - P. 468-474.
Elooton T.M., Stamm W.E. Diagnosis and treatment of
uncomplicated urinary tract infection//Inf. Dis. Clin. North.
Am. - 1997. - Vol. 11 (3). - P. 551-581.
Yamamoto S., Terai A., Yuri K. et al. Detection of
urovirulens factors in Escherichia coli by multiplex
polymerase chain reaction//FEMS Immunol. Med.
Microbiol. - 1995. - Vol. 12. - P. 85-90.
Глава 16
КСАНТОГРАНУЛЕМАТОЗНЫЙ
ПИЕЛОНЕФРИТ
Ю.Г. Аляев, Т.Н.Ганзен, Н.А.Григоръев
В 1916 г. F.Schlagenhaufer описал 4 наблю-
дения необычного заболевания. У пациентов с
клинико-диагностическими проявлениями пио-
нефроза в удаленных почках было обнаружено
разрастание плотной желтоватой ткани, кото-
рая распространялась в паранефральную клет-
чатку. Ученый обозначил открытый им патоло-
гический процесс как «своеобразный стафило-
микоз почки и околопочечной клетчатки». Спу-
стя 18 лет в 1934 г. W.Putschar обнаружил в
почке у больного, погибшего от пионефроза,
аналогичные изменения и, проведя микроско-
пические исследования необычной ткани, вы-
явил, что она включает в себя большое коли-
чество клеток со светлой цитоплазмой, макро-
фагов, плазматических клеток, содержащих
капельки жира. Только в 1944 г. S.Osterling,
встретив аналогичную морфологическую карти-
ну, предложил именовать это редкое заболева-
ние «ксантогранулематозный пиелонефрит».
Ксантогранулематозный пиелонефрит
(КГП) — это своеобразная, агрессивная фор-
ма интерстициального нефрита, для которого
характерно сочетание гнойного деструктивно-
го и пролиферативного процессов в почке с об-
разованием гранулематозной ткани, содержа-
щей большое количество нагруженных липида-
ми макрофагов, которые именуются ксантом-
ными, или «пенистыми», клетками.
Главной особенностью ксантогранулематоз-
ного пиелонефрита является отсутствие харак-
терной клинической картины, лабораторных
тестов, характерных ультразвуковых, рентгено-
логических и других диагностических призна-
ков. Он может протекать под маской разнооб-
разных урологических заболеваний, таких как
пионефроз, карбункул почки, туберкулез и др.,
но особенно важно то, что в ряде случаев его
клиническая картина и данные обследования
могут полностью имитировать проявления рака
почки [Hoeffel J.C. et al., 1998; Parsons M.A. et
al., 1983]. Кроме того, заболевание может си-
мулировать симптоматику острого живота.
Окончательный диагноз этого заболевания
возможен только при морфологическом иссле-
довании патологических тканей, получаемых
главным образом путем оперативного вмеша-
тельства, которое выполняется практически
каждому пациенту с КГП, но обычно с совер-
шенно иным предоперационным диагнозом.
Оперативное пособие при данном воспалитель-
ном процессе проводят порой излишне расши-
ренно, особенно когда дооперационно ошибоч-
но установлен рак почки.
Агрессивность заболевания заключается в
том, что образующаяся интраренально ксанто-
гранулематозная ткань способна к прорастанию
за пределы почки и инфильтрации соседних
органов и тканей, их деструкции вплоть до
формирования свищей. Так, описаны наблюде-
ния КГП с образованием почечно-толстоки-
шечных и тонкокишечных свищей [Hortling N.
et al., 1997], почечно-плевральных и бронхи-
альных, а также почечно-кожных свищей са-
мой разнообразной локализации, начиная от
свищей в поясничной области и заканчивая
свищами в области мошонки, бедра [Biyani C.S.
et al., 1997]. КГП далеко не всегда осложняет-
ся образованием свищей, но экстраренальное
распространение процесса наблюдается посто-
янно, как минимум в паранефральную клетчат-
ку. Имеются наблюдения, когда КГП манифе-
стировал кровохарканьем в результате внедре-
ния ксантогранулематозного процесса в легоч-
ную ткань [Urbat В.Е. et al., 1998].
По данным литературы, с момента первого
описания ксантогранулематозного пиелонефри-
та в 1916 г. это заболевание долгое время счи-
400
талось редким. Оно мало известно широкому
кругу врачей, а нередко и узким специалистам.
В последние десятилетия с каждым годом по-
является все больше сообщений о КГП. К 1986 г.
в мировой литературе насчитывалось около 150
сообщений, охватывающих более 400 наблюде-
ний этого заболевания. К настоящему времени
клиницистами и морфологами описано более
1500 наблюдений КГП. Очевидно, данная фор-
ма поражения почек встречается чаще, чем
принято думать, поскольку наряду с разнооб-
разной клинической картиной и результатами
обследования гистологическая картина этого
заболевания может напоминать светлоклеточ-
ный вариант почечно-клеточного рака, тубер-
кулез, малакоплакию. Это влечет за собой
ошибки не только в клинической, но и в мор-
фологической диагностике.
Заболевание встречается в любом возрасте и
описано у больных от 12-го дня жизни до 94
лет [Кравцова Г.И. и соавт., 1988; Me Donald
G.S., 1981], однако чаще КГП встречается в
возрасте 35—55 лет. Расовой и национальной
предрасположенности не отмечено. Чаще боле-
ют женщины. Процесс, как правило, односто-
ронний. Описаны лишь единичные наблюдения
билатерального КГП. В 52—60 % заболеваний
поражается левая почка.
Патогенез. Подавляющее большинство ис-
следователей признают в патогенезе главенству-
ющую роль обструкции верхних мочевых путей
в сочетании с хроническим пиелонефритом.
Действительно, КГП часто возникает на фоне
нефролитиаза, особенно при наличии коралло-
видных камней [Parsons М.А. et al., 1983]. Од-
нако в ряде наблюдений отсутствуют проявле-
ния обструкции и инфицирования верхних
мочевых путей. Самым ярким примером тому
может служить заболевание 12-дневного мла-
денца без указанных выше патологических из-
менений [Кравцова Г.И. и др., 1988]. Возник-
новение КГП не удалось связать с инфициро-
ванием каким-либо микробным агентом, хотя
такие предположения были. Высказывались
мысли об особой роли Proteus в патогенезе
[Gradinger R.G. et al., 1982], однако обнаруже-
ние в моче и операционном материале разно-
образных микроорганизмов, а в ряде случаев их
полное отсутствие позволило исключить зави-
симость между развитием КГП и инфицирова-
нием определенным микробным агентом. Чаще
других, однако, выявляются E.coli и Proteus
[Parsons М.А. et al., 1983].
Определенная роль в патогенезе отводится
нарушению артериального притока к почке
[Ганзен Т.Н. и др., 1983; Antonakopoulus G.N.
et al., 1988; Parsons М.А. et al., 1983], венозно-
го оттока и лимфатического дренажа [Tolia B.M.
et al., 1981], что может приводить к развитию
инфарктов в пораженном органе, кровоизлия-
ний, высвобождению при этом липидов, их
аккумуляции с последующим формированием
гранулем.
Многие исследователи считают, что разви-
тию КГП способствует длительная, интенсив-
ная терапия воспалительного процесса в почке
различными антибактериальными и химиопре-
паратами, что изменяет свойства бактерий,
приводит к нарушению метаболизма липидов,
расстройству почечной васкуляризации и нару-
шению деятельности иммунной системы орга-
низма [Antonakopoulos G.N. et al., 1988]. Пос-
ледняя безусловно играет определенную роль в
патогенезе, что доказывается развитием КГП у
больных после трансплантации почки на фоне
иммунодепрессивной терапии. При этом забо-
левание может поражать как трансплантат, так
и контралатеральную почку.
Немаловажное значение в качестве предрас-
полагающего фактора к развитию КГП играет
сахарный диабет [Me Donald G.S. et al., 1981;
Parsons М.А. et al., 1983].
С учетом особенностей морфологического
субстрата ксантогранулематозного пиелонефри-
та вопрос о том, что является первичным —
нарушение жирового метаболизма с развитием
ксантоматоза и воспалительной реакцией или
воспаление с вторичным появлением ксантом-
ных клеток, поднимался еще на заре изучения
данного процесса. Учитывая, что в мировой
литературе не описано ни одного наблюдения,
где КГП сочетался бы с системным нарушени-
ем жирового метаболизма или с ксантоматоз-
ными поражениями других органов, следует
предполагать первичным все-таки воспалитель-
ный процесс.
Морфология. Существует две морфологи-
ческие формы КГП: диффузный и очаговый.
При диффузном КГП ксантогранулематозная
ткань стремится к распространению на весь
орган, что приводит к деструкции чашечно-ло-
ханочной системы и практически полной ги-
бели почечной паренхимы с замещением ее
плотной белесовато-желтой тканью (рис. 16.1).
При очаговой форме заболевания ксантограну-
лематозная ткань формируется в почке в виде
одного или нескольких опухолеподобных узлов
белесовато-желтого цвета, внешне очень напо-
минающих рак почки, а остающаяся часть по-
чечной паренхимы и чашечно-лоханочной си-
стемы визуально не изменяется (рис. 16.2). При
этой форме заболевания способность ксанто-
гранулематозной ткани распространяться на
соседние с почкой органы значительно более
выражена, чем при диффузном КГП и весьма
напоминает раковую инфильтрацию.
Микроскопическая картина обеих форм КГП
практически одинакова. Определяется полиморф-
26—2950
401
Рис. 16.1. Диффузный ксантогранулематозный пие-
лонефрит. Макропрепарат.
Паренхима замещена плотной белесовато-желтой тканью,
чашечки расширены и деформированы, заполнены густым
зеленоватым гноем, стенки их изъедены.
ная по составу гранулематозная ткань, состоя-
щая из лимфоидных, плазматических клеток,
макрофагов, полиморфно-ядерных лейкоцитов,
большого количества ксантомных клеток, об-
разующих местами обширные скопления, чере-
дующиеся с полями соединительной ткани (рис.
16.3). Изредка среди гранулематозной ткани
встречаются гигантские клетки.
Как уже было сказано выше, микроскопи-
ческая картина КГП в ряде случаев может ими-
тировать другие патологические состояния: ту-
беркулез, малакоплакию. Нередко ошибочно
устанавливают диагноз «светлоклеточный рак
почки».
Эти особенности данного заболевания, обус-
ловливающие большие трудности диагностики,
требуют тесного контакта клиницистов и мор-
фологов для успешной постановки точного ди-
агноза.
Нам на основании собственных исследова-
ний 34 наблюдений КГП удалось установить
определенную закономерность между развити-
ем той или иной морфологической формы КГП
и наличием или отсутствием предрасполагаю-
щих к данному заболеванию факторов, главным
образом обструкции верхних мочевых путей. Это
дало основание выделить две формы КГП: пер-
вичную и вторичную. Вторичный КГП возни-
кает на фоне заболеваний, резко нарушающих
уродинамику верхних мочевых путей. Морфоло-
гически при этом развивается диффузный про-
цесс, и заболевание протекает, как правило,
под маской пионефроза. При первичной фор-
ме не удается обнаружить каких-либо других
заболеваний почек или мочевых путей, кото-
рые могли бы способствовать развитию КГП.
Морфологически в почке развивается очаговый
(опухолевидный) процесс, что обычно при
обследовании заставляет предполагать рак.
Клиническая картина и диагно-
стика. Клинические проявления КГП весьма
разнообразны и выделить какие-либо симпто-
мы, характерные лишь для этого заболевания,
Рис. 16.3. Ксантогранулематозный пиелонефрит. Мик-
ропрепарат.
В гранулематозной ткани среди полиморфного по составу
клеточного инфильтрата определяются многочисленные
ксантомные клетки. По периферии (внизу и справа) мас-
сивные поля соединительной ткани. Окраска гематоксили-
ном и эозином, х 160.
Рис. 16.2. Очаговый ксантогранулематозный пиело-
нефрит. Макропрепарат.
Опухолевидное новообразование нижнего сегмента почки
белесоватого цвета с желтыми вкраплениями, прорастаю-
щее фиброзную капсулу и распространяющееся на пара-
нефрий. Остальная часть почки визуально не изменена.
402
г
нельзя, причем клиническая картина не зави-
сит от формы КГП. Как при первичной, так и
при вторичной форме заболевания, наиболее
частым симптомом является боль в поясничной
области или животе на стороне поражения. Она
носит тупой, ноющий характер. Отмечена не-
которая закономерность между интенсивностью
боли и другим, наиболее часто встречающим-
ся симптомом — лихорадкой. Значительное
повышение температуры тела сопровождается
уменьшением боли, и, наоборот, снижение
температуры тела усиливает боль. Нельзя выде-
лить какое-либо преимущественное время су-
ток для возникновения боли, она может бес-
покоить больных как днем, так и ночью. Весь-
ма быстро при КГП появляются признаки ин-
токсикации: общее недомогание, тошнота, рво-
та, похудание, иногда резкое и значительное
(в одном наблюдении до 12 кг за 1,5 мес). Нуж-
но подчеркнуть, что для КГП характерна тя-
желая интоксикация, которая при первичной
форме заболевания имеет место у 100 % боль-
ных в отличие от больных раком почки, у ко-
торых интоксикация отмечается преимуще-
ственно при распаде опухоли и метастазирова-
нии. При вторичном КГП тяжесть интоксика-
ции более выражена, чем у больных только с
пионефрозом.
Существует один характерный для КГП сим-
птом — «тяга к теплу» [Аляев Ю.Г. и др., 1995].
Больные ощущают потребность прижаться спи-
ной к горячему предмету (печке, радиатору и
т.п.). Появление этого симптома не зависит от
интенсивности боли, он может возникать и при
ее отсутствии.
При осмотре пациентов отмечается бледность
кожи и видимых слизистых оболочек. Кожа ла-
доней может иметь желтоватый оттенок. Паль-
паторно возможно обнаружение новообразова-
ния в проекции пораженной почки. Оно, как
правило, неподвижное, безболезненное или ма-
лоболезненное, поверхность его гладкая или
слегка бугристая, консистенция весьма плотная.
Это образование может представлять собой как
увеличенную почку или ее участок, так и плот-
ную склерозированную паранефральную клет-
чатку вследствие экстраренального распростра-
нения ксантогранулематозной ткани.
Лабораторные проявления КГП, так же как
и клинические, могут быть весьма разнообраз-
ными и соответствовать различным заболевани-
ям. Чаще всего встречаются анемия, высокие
цифры СОЭ (до 70 мм/ч и более). Менее часто
наблюдаются лейкоцитоз, пиурия, бактериурии.
Последние два лабораторных признака прису-
щи главным образом вторичному КГП. Опре-
деленное значение в лабораторной диагности-
ке КГП имеет выявление «пенистых» клеток
при цитологическом исследовании осадка мочи.
Рис. 16.4. Первичный ксантогранулематозный пие-
лонефрит. Ультрасонограмма.
В нижнем сегменте почки определяется неоднородной струк-
туры новообразование, деформирующее почечный синус
(указано стрелкой).
Наряду с тем что клинические и лаборатор-
ные признаки первичного и вторичного КГП
весьма схожи, результаты инструментального
исследования при этих двух формах заболевания
существенно различаются. При первичном КГП
ультразвуковое исследование (рис. 16.4) позво-
ляет выявить новообразование в почке, но от-
дифференцировать его от опухоли практически
невозможно. Это образование имеет, как прави-
ло, неоднородную структуру: в солидной опу-
холи определяются участки пониженной эхоген-
ности различной формы и размеров. Контуры но-
вообразования обычно не вполне четкие. При
КГП лоцируемая «опухоль» распространяется на
всю толщу паренхимы и имеет связь с синусом
почки: либо деформирует его, либо проксималь-
ная зона новообразования располагается на гра-
нице паренхимы и почечного синуса. Особое
значение имеет то, что пораженная почка вне
зависимости от размеров новообразования рез-
ко ограничена в подвижности при дыхании, что
при раке почки наблюдается лишь при далеко за-
шедшем процессе и большом размере опухоли.
При вторичном КГП результаты ультразву-
кового исследования соответствуют таковым
при пионефрозе. Пораженная почка увеличена,
ее контуры неровные, местами нечеткие. Ча-
шечно-лоханочная система дилатирована, не-
редко содержит конкременты, в том числе ко-
ралловидные, может быть представлена полос-
тями с неоднородным жидкостным содержи-
мым за счет наличия в ней гнойных масс. В сох-
ранившихся участках паренхимы могут опреде-
ляться округлые зоны пониженной эхогеннос-
ти. При дыхании пораженная почка резко ог-
раничена в подвижности.
26
403
Рис. 16.5. Первичный ксантогранулематозный пие-
лонефрит слева. Экскреторная урограмма (7 мин).
С помошью экскреторной урографии при
первичной форме заболевания обычно выявля-
ют признаки новообразования почки в виде
деформации чашечно-лоханочной системы. При
вторичном процессе пораженная почка не вы-
деляет контрастное вещество, но могут обна-
руживаться конкременты и тень увеличенного
в размерах органа.
Компьютерная и магнитно-резонансная то-
мография, как и любой другой отдельно взя-
тый метод диагностики, не позволяют устано-
вить диагноз КГП. При первичной форме за-
болевания находят новообразование почки,
которое не накапливает вещества, используе-
мые для контрастирования при этих исследо-
ваниях (рис. 16.5). Однако указанные методы
диагностики могут позволить выявить прорас-
тание ксантогранулематозной ткани в соседние
органы, что, впрочем, не может быть отдиф-
ференцировано от злокачественной инвазии.
Кроме того, тот или иной метод томографии в
ряде наблюдений позволяет установить утолще-
ние фасции Герота, что является признаком
воспалительного процесса в забрюшинном про-
странстве и может свидетельствовать в пользу
КГП, конечно, при наличии других клинико-
диагностических признаков. При вторичной
форме заболевания КТ и МРТ позволяют выя-
вить увеличение пораженной почки, деструк-
цию паренхимы и дилатацию чашечно-лоханоч-
ной системы, при этом отличить данный про-
Ампутация нижней чашечки левой почки, смещение квер-
ху средней чашечки.
Рис. 16.6. Компьютерная томограмма при первич-
ном ксантогранулематозном пиелонефрите. Новооб-
разование в нижнем сегменте левой почки, не на-
капливающее контрастное вещество.
Рис. 16.7. Селективная почечная артериограмма при
первичном левостороннем ксантогранулематозном
пиелонефрите. Бессосудистое новообразование в ниж-
нем сегменте почки.
404
цесс от проявлений пионефроза невозможно.
При обеих формах заболевания могут быть об- '
наружены увеличенные лимфатические узлы в
забрюшинном пространстве, в которых при
КГП происходит неспецифическая лимфоидная
гиперплазия (рис. 16.6).
Немаловажное значение в диагностике имеет
ангиография, главным образом при первичной
форме заболевания, когда обнаруживается бес-
сосудистый или малососудистый характер но-
вообразования (рис. 16.7). Это, конечно, не
может позволить установить диагноз КГП, учи-
тывая существование бессосудистого рака поч-
ки, но в сочетании с другими признаками
может свидетельствовать в пользу этого забо-
левания. Некоторые исследователи высказыва-
ли мысль о нецелесообразности использования
инвазивных методов, таких как ангиография и
биопсия в диагностике КГП. Эту точку зрения
отчасти можно признать только при вторичной
форме заболевания, когда ангиография демон-
стрирует обеднение сосудистого рисунка всей
почки вследствие диффузной гибели почечной
паренхимы, а установление морфологической
природы заболевания не может существенно
повлиять на тактику лечения. Тяжелые деструк-
тивные изменения, вызванные ли КГП или
банальным пионефрозом, требуют оперативно-
го удаления пораженной почки. При первичном
КГП, когда чаще всего приходится дифферен-
цировать это заболевание от рака почки, дол-
жна быть использована любая возможность до-
операционного установления диагноза, по-
скольку это может существенно изменить так-
тику лечения. Поэтому ангиография на сегод-
няшний день является одним из основных ме-
тодов в диагностике первичной формы КГП.
Пункционная биопсия также должна быть ис-
пользована в диагностике этого заболевания
несмотря на определенные сложности. После-
дние связаны с возможностью ошибочной ди-
агностики вследствие получения материала не
из очага поражения, а также при схожести
морфологической картины КГП с другими за-
болеваниями, о чем упоминалось выше. Тем не
менее пункционная биопсия является един-
ственной возможностью точного дооперацион-
ного установления диагноза этого заболевания.
Лечение. Основным методом лечения КГП
является оперативный. Больным вторичной
формой заболевания показана только нефрэк-
томия. При первичном КГП наряду с нефрэк-
томией в зависимости от распространенности
процесса возможны варианты органосохраняю-
щих операций — резекция почки или энуклеа-
ция ксантогранулематозного узла. Оперативные
пособия при любой форме КГП протекают тех-
нически сложно, поскольку паранефральная
клетчатка подвергается тяжелым склеротичес-
ким изменениям. Целью операции является
удаление очага воспаления и всей ксантограну-
лематозной ткани в случае ее широкого распро-
странения, в том числе резекция вовлеченных
в ксантогранулематозный процесс органов: тол-
стой кишки, печени, поясничных мышц и др.
Есть описания единичных случаев консерватив-
ной терапии КГП (очаговой его формы) ан-
тибактериальными препаратами [Brown P.S. et
al., 1996]. Наш собственный опыт включает одно
наблюдение 34-летней пациентки с морфоло-
гически верифицированным диагнозом первич-
ного КГП, которой успешно проведена тера-
пия с использованием простагландина Е1 (ва-
запростан), нестероидных противовоспалитель-
ных средств (вольтарен) и отменой всех анти-
бактериальных препаратов, которые она полу-
чала длительное время в больших дозах, по-
скольку, как указывалось выше, антибиотико-
терапия может явиться пусковым моментом к
развитию КГП.
Вопрос о консервативной терапии первич-
ного КГП требует дальнейшего изучения и
доработки, но в любом случае попытки такого
рода терапии могут быть предприняты только
при морфологически подтвержденном диагно-
зе КГП и исключении рака почки.
Прогноз при КГП в целом благоприят-
ный, если речь идет об одностороннем процес-
се и не возникает осложнений, связанных не-
посредственно с оперативным вмешательством.
В мировой литературе есть описание лишь од-
ного случая возникновения заболевания в кон-
тралатеральной почке после нефрэктомии по
поводу КГП [Golomb J. et al., 1986]. Более ник-
то из исследователей не отмечал ни в ближай-
шем, ни в отдаленном послеоперационном
периоде возникновения КГП в контралатераль-
ной почке или рецидива заболевания в ипси-
латеральной — после выполнения органосохра-
няющей операции.
Литература
Аляев Ю.Г., Ганзен Т.Н., Григорьев НА. Ксантогра-
нулематозный пиелонефрит//Урол. нефрол. — 1995. —
№ 2. - С. 22-26.
Ганзен Т.Н., Аляев Ю.Г, Халаби Д.А. Ксантогрануле-
матозный Пиелонефрит//Арх. патол. — 1983. — № 4. —
С. 42-49.
Кравцова Г.И., Клетский С.К., Сорока А.А. Врожден-
ный ксантогранулематозный пиелонефрит//Арх. па-
тол. - 1988. - № 10. - С. 61-63.
Пытель А.Я. О диагностике и лечении ксантограну-
лематозного пиелонефрита//Урол. нефрол. — 1981. —
№ 3. - С. 52-55.
405
Antonakopoulos G.N., Chapple C.R., Newman J., Crocker J.
Xanthogranulomatous pyelonephritis: A reappraisal and
immunohistochemical study//Arch. Pathol. Lab. Med. —
1988. - Vol. 112 (3). - P. 275-281.
Biyani C.S., Torella E., Cornford P.A., Brough S.J.
Xanthogranulomatous pyelonephritis with bilateral
nephrocutaneous fistulae//Urol. Int. — 1997. — Vol. 59
(1). - P. 46-47.
Brown P.S. Jr, Dodson M., IVeintmh P.S. Xanthogranulo-
matous pyelonephritis: report of nonsurgical management
of a case and review of the literature//Clin. Infect. Dis. —
1996. - Vol. 22 (2). - P. 308-314.
Golomb J.L., Solomon A., Peer G. et al. Bilateral
metachronous xanthogranulomatous pyelonephritis in
end-stage renal failure//Urol. Radiol. — 1986. — Vol. 8
(2). - P. 95-99.
Grainger R.G., Longstaff A.J., Parsons M.A. Xanthogra-
nulomatous pyelonephritis: A reappraisal// Lancet. —
1982. - Vol. 1. - P. 1398-1401.
Hoejfel J.C., Chastagner P., Boman F. et al. Misleading
leads: focal xanthogranulomatous pyelonephritis in
childhood//Med. Pediatr. Oncol. — 1998. — Vol. 30 (2). —
P. 122-124.
Hording N., Layer G., Albers P., Schild H.H. Xanthogra-
nulomatous pyelonephritis with septic lung metastases
and infiltration of the colon//Aktuelle Radiol. — 1997. —
Vol. 7(6). - P. 317-320.
Me Donald G.S. Xanthogranulomatous pyelonephritis//
J. Pathol. - 1981. - Vol. 133. (3). - P. 203-213.
Osca J.M., Peiro M.J., Rodrigo M. et al. Focal
xanthogranulomatous pyelonephritis: partial nephrectomy
as definitive treatment//Eur. Urol. — 1997. — Vol. 32. —
P. 375-379.
Ozcan H., Akyar S., Atasoy C. An unusual manifestation
of xanthogranulomatous pyelonephritis: bilateral focal
solid renal masses//Amer. Roentgenol. — 1995. — Vol. 165
(6). - P. 1552-1553.
Parsons M.A., Harris S.Q., Longstaff A.J., Grainger R.G.
Xanthogranulomatous pyelonephritis: A pathological,
clinical and aetiological analysis of 87 cases//Diagn.
Histopathol. - 1983. - Vol. 6. - P. 203-219.
Sugie S., Tanaka T., Nishikawa A. et al. Fine-needle
aspiration cytology of xanthogranulomatous pyelo-
nephritis//Urology. — 1991. — Vol. 37 (4). — P. 376—
379.
Suzer O., Baltaci S., Kuzu I. Bilateral xanthogranu-
lomatous pyelonephritis in a child//Brit. J. Urol. — 1996. —
Vol. 78 (6). - P. 950-951.
Tolia B.M., Iloreta A., Freed S.Z. et al. Xanthogranulo-
matous pyelonephritis. Detailed analysis of 29 cases and
a brief discussion of atypical presentations//.!. Urol. —
1981. - Vol. 126 (4). - P. 437-442.
Urbat B.E., Haapaniemi J.R., Weyhing B.T., Baciewicz
F.A. Jr. An unusual cause of hemoptysis//Ann. Thorac.
Surg. - 1998. - Vol. 65 (2). - P. 539-540.
Глава 17
РЕФЛЮКС-НЕФРОПАТИЯ
А.В.Кухтевич
Рефлюкс-нефропатия является тубулоинтер-
стициальным нефритом, развивающимся на
фоне персистенции пузырно-мочеточникового
рефлюкса (точнее сказать, пузырно-мочеточни-
ково-лоханочного рефлюкса), и характеризуется
развитием грубых рубцов в почечной ткани.
По-видимому, не вполне оправдано отно-
сить к рефлюкс-нефропатии все случаи обна-
ружения рефлюкса в мочевом тракте. Рефлюк-
сы периодически могут наблюдаться как у здо-
ровых индивидов (на фоне интенсивной вод-
ной нагрузки и принудительного удержания
мочи в мочевом пузыре), так и у лиц, страда-
ющих различными заболеваниями почек (пие-
лонефрит, уролитиаз, нефроптоз, обструктив-
ная уропатия и пр.). При этом морфологичес-
кие субстраты рефлюкса мочи — рубцы в по-
чечной ткани (или его эквиваленты, выявляе-
мые при визуализирующих инструментальных
обследованиях) — могут образоваться через
годы течения болезни и лишь тогда, постфак-
тум, можно с уверенностью говорить о нали-
чии рефлюкс-нефропатии. В то же время мно-
гие случаи рефлюкса не сопровождаются раз-
витием рубцового процесса или же нельзя ис-
ключить формирования рубцов под влиянием
основного заболевания (пиелонефрит, уролити-
аз и пр.).
Среди рефлюксов, которые могут развивать-
ся в мочевом тракте, выделяют также лоханоч-
но-почечный (из почечной лоханки — в парен-
химу почки и ее сосуды), мочеточниково-веноз-
ный (из мочеточника — в крупные вены и лим-
фатические сосуды), мочеточниково-лимфати-
ческий (из мочеточника — в лимфатические со-
суды), уретро-венозный (из уретры — в вены
таза), уретроэякуляторный (из уретры — в се-
мявыносящий проток), а также такую редкую
разновидность, как пиело-пиелярный рефлюкс
(рефлюкс мочи в удвоенной почке: из одной
лоханки этой же почки — в другую). Не все из
указанных рефлюксов имеют большое клини-
ческое значение в нефрологии (являясь преро-
гативой урологии), а их своевременная диагно-
стика нередко затруднена.
Распространенность. Истинную рас-
пространенность пузырно-мочеточникового
рефлюкса и рефлюкс-нефропатии установить
весьма затруднительно. С определенностью мож-
но говорить о том, что эти патологические
состояния преобладают среди женщин и детей.
Хотя, по-видимому, около 0,5 % новорож-
денных имеют пузырно-мочеточниковый реф-
люкс, однако рубцевание наблюдается лишь у
малой части таких детей. Если в период ново-
рожденное™ рефлюкс отмечается примерно с
одинаковой частотой среди младенцев мужского
и женского пола, то в последующем пузырно-
мочеточниковый рефлюкс выявляется преиму-
щественно среди женщин, а среди лиц, у ко-
торых определяются рубцовые процессы, выз-
ванные рефлюксом, соотношение женшин и
мужчин составляет 5:1.
У 1—2 % школьниц обнаруживается бакте-
риурия, а из этого числа у 20—35 % — пузыр-
но-мочеточниковый рефлюкс, что свидетель-
ствует о его распространенности в популяции
порядка 0,5 %. Точно такие же данные, полу-
ченные при исследовании взрослых женщин,
3—5 % из которых имеют бактериурию, пока-
зывают, что около 10—20 % из этого числа
имеют рубцы в почках; все это свидетельству-
ет о распространенности рефлюкс-нефропатии
среди женщин, составляющей 0,3—0,5 %.
Необходимо еще раз подчеркнуть, что про-
грессирование процесса в сторону развития
рефлюкс-нефропатии, завершающейся рубцева-
нием почечной ткани, наблюдается лишь у
определенной части детей с пузырно-мочеточ-
никовым рефлюксом; максимальную цифру
(30—60 %) приводят Smelie и соавт. (1975).
Этиология. Многие врожденные и приоб-
ретенные патологические состояния, сопровож-
дающиеся нарушениями уродинамики и об-
407
струкцией мочевого тракта, могут приводить к
развитию пузырно-мочеточникового рефлюкса
(обструктивная уропатия, нейрогенный моче-
вой пузырь, уролитиаз, нефроптоз, пиелонеф-
рит, у пожилых мужчин — аденома предста-
тельной железы). В то же время существует мне-
ние, что необходимым условием для развития
рефлюкса, а тем более рефлюкс-нефропатии
являются пороки развития не только мочевой
системы (удвоение лоханки, мочеточников,
наличие задних клапанов уретры), но и самой
почечной ткани, в частности ее дисплазии,
поскольку у 10 % таких детей старше 5 лет
выявляется задержка дифференцировки элемен-
тов нефрона [Леонова Л.В., Ческис А.Л., 1988].
Исследования в семьях позволяют предпо-
лагать, что пузырно-мочеточниковый рефлюкс
детерминирован генетически; полагают также,
что наследование имеет аутосомно-доминант-
ный характер с неодинаковой пенетрантностью
соответствующего гена. Частота рефлюкса, опи-
сываемая у сибсов (братьев и сестер от одних
и тех же родителей) детей с пузырно-мочеточ-
никовым рефлюксом достигает 45 %.
Есть данные о том, что DD-генотип АПФ
ассоциируется не только с высоким уровнем
АПФ, но и с 9-кратно повышенным риском
рубцевания почек при рефлюкс-нефропатии
[Ozen S. et al., 1997].
Сложность оценки каузальной роли тех или
иных этиологических факторов состоит в том,
что рубцовые изменения в почках (основные
морфологические субстраты рефлюкс-нефропа-
тии) могут вызываться весьма разнообразны-
ми причинами, поэтому подчас трудно отгра-
ничить патологию, индуцированную самим
рефлюксом, от изменений, вызванных други-
ми имеющимися факторами (обструкция, мо-
чевая инфекция). Так, в англоязычной научной
литературе рефлюкс-нефропатию традиционно
связывают с мочевой инфекцией [Bailey R.,
1998]; примечательно, что прежним термином,
обозначавшим это состояние, был «хроничес-
кий необструктивный атрофический пиелонеф-
рит» [Hodson С., Edwards D., I960].
Патогенез. В норме, если давление в мо-
чевом пузыре превышает таковое в мочеточнике
(например, при мочеиспускании или при пе-
реполнении мочевого пузыря), рефлюксу мочи
вверх по мочеточнику препятствует наличие
клапанного механизма в месте пузырно-моче-
точникового сочленения. Одностороннее на-
правление действия клапана определяется ко-
сым углом, под которым мочеточниковый тон-
нель проходит через мышечный слой стенки
мочевого пузыря, что находит выражение в
протяженности интрамурального сегмента мо-
четочника. Считается, что примерно у 0,5 %
новорожденных этот механизм развит недоста-
408
точно: мочеточниковый тоннель проходит под
слишком большим углом, и моча забрасывает-
ся в мочеточник, в особенности при мочеис-
пускании (так называемый активный рефлюкс),
что может быть выявлено при микционной
цистографии, причем через цистоскоп видно,
что устье мочеточника шире нормального и рас-
полагается более латерально, чем в норме. По
мере взросления индивида мочеточниковый
тоннель удлиняется: это приводит к прекраще-
нию рефлюкса у большинства индивидов по до-
стижении ими подросткового возраста, что
наиболее вероятно при слабой выраженности
рефлюкса.
По-видимому, рефлюксу способствует та или
иная степень врожденных нарушений нейро-
мышечного аппарата, контролирующего уроди-
намику, что подтверждается наличием в таких
случаях везико-перинеальной дискоординации
в сочетании с нестабильным мочевым пузырем
[Seruca Н., 1989], а также частым сочетанием
рефлюкса с неврологической патологией, в
частности с менингомиелоцеле (незаращением
дужек позвонков) [Okamura К. et al., 1988]. Не
исключено, что возникновению рефлюкса спо-
собствует также врожденная патология соеди-
нительной ткани, что находит выражение в не-
редком сочетании пузырно-мочеточникового
рефлюкса, нефроптоза, пролапса митрального
клапана и наличия spina bifida.
У некоторых детей при микционной цисто-
графии можно наблюдать заброс рентгеноконтра-
стного вещества вплоть до сосочковых протоков.
Внутрипочечный рефлюкс наиболее часто
наблюдается в области полюсов почек, где в
последующем и формируются рубцы. Сосочки
почек могут быть простыми и сложными. По-
чти у 90 % почек выявляются один или более
сложных сосочков. Почечный сосочек (усечен-
ная и закругленная верхушка почечной пира-
миды) имеет 10—25 отверстий, которыми за-
канчиваются сосочковые протоки, являющие-
ся продолжением собирательных почечных тру-
бочек почечных пирамид. Место расположения
этих отверстий называют решетчатым полем.
Внутрипочечный рефлюкс, как правило, име-
ет место в сложных (составных) сосочках на
полюсах почек, где часто наблюдаются расши-
ренные рефлюксирующие устья сосочковых
протоков (решетчатое поле), непохожих на
щелеподобные нерефлюксирующие устья про-
токов, характерных для простых сосочков.
В связи с этим при выраженном пузырно-мо-
четочниковом рефлюксе моча может забрасы-
ваться во внутрипочечные структуры, распре-
деляясь при этом соответственно наличию
сложных сосочков. В последующем это опреде-
ляет характер и закономерности процесса руб-
цевания.
Проспективные исследования, проведенные
среди детей, не исключают того, что иниции-
рующим событием, ведущем к рубцеванию
почки, является инфекция мочевого тракта.
Считают, что пузырно-мочеточниковый реф-
люкс может приводить к внедрению микроор-
ганизмов во все отделы почки, затрагиваемые
внутрипочечным рефлюксом, вследствие чего
возникают локальные очаги острой бактериаль-
ной инфекции в почках с последующим руб-
цеванием пораженных почечных пирамид. В этом
сегменте почки патологический процесс про-
грессирует в направлении фиброзного сморщи-
вания, тогда как остальная часть почки нор-
мально растет или даже гипертрофируется; со-
ответственно этому глубина рубца увеличива-
ется параллельно возрасту ребенка.
Было высказано предположение, что про-
цесс рубцевания развивается вслед за первыми
1—2 эпизодами мочевой инфекции. Соответ-
ственно этому больные часто уже имеют руб-
цы на момент, когда болезнь проявляется кли-
нически, а новые рубцы нечасто развиваются
в ранее нормальных почках.
В то же время у некоторых больных (в ос-
новном мужского пола) с рубцеванием, типич-
ным для рефлюкс-нефропатии, предшествую-
щий анамнез не позволяет думать о мочевой
инфекции. В эксперименте показано, что внут-
рипочечный рефлюкс может вызывать фокаль-
ное рубцевание даже без сопутствующей моче-
вой инфекции — за счет повышения внутри-
почечного давления; это так называемый сте-
рильный рефлюкс. Полагают, что рефлюкс
может быть врожденным и сочетаться с поро-
ками развития мочевой системы.
С учетом пропорционального «вклада» реф-
люкса и мочевой инфекции фактически все
рубцовые процессы в почках полностью разви-
ваются в отрочестве, последующее же прогрес-
сирование болезни по существу не зависит от
вышеупомянутых факторов, а определяется в
основном развитием сегментарного гломеруло-
склероза в остаточных нефронах.
Патоморфология. Характерные для реф-
люкс-нефропатии почечные рубцы представля-
ют собой участки значительного углубления
коркового слоя, лежащего на дилатированной,
булавовидно-измененной чашечке. Могут быть
поражены одна или обе почки. Рубцы часто по-
ражают верхние и нижние полюса (фокальная
рефлюкс-нефропатия), но могут также вовле-
кать латеральные чашечки или всю почку це-
ликом (генерализованная рефлюкс-нефропатия).
Каждый рубец обычно включает одну или бо-
лее фиброзно-измененных почечных пирамид.
В непораженной ткани почки наблюдается ком-
пенсаторная гипертрофия, усиливающая неров-
ность контура почки.
Микроскопически рефлюкс-нефропатия
проявляется фокальными очагами хронического
тубулоинтерстициального нефрита с атрофией
и дилатацией почечных канальцев, а также
коллагеновыми рубцами и клеточными инфиль-
тратами в интерстиции. Канальцы часто нахо-
дятся в состоянии белковой дистрофии, «тирео-
идизации» вплоть до полной атрофии [Леоно-
ва Л.В., Ческис А.Л., 1988].
Изменения клубочков могут включать мезан-
гиальную пролиферацию в отсутствие фокаль-
ного гломерулосклероза, даже при наличии
нарушения функции почек [Ishi Т. et al., 1988].
Описаны отложения иммуноглобулинов клас-
сов М, G, СЗ- фракции комплемента. Часто
выражен периваскулярный и перигломеруляр-
ный фиброз. Изменения клубочков могут рас-
пространяться на его отдельные сегменты или
же на весь клубочек. Описаны склероз или ги-
алиноз клубочков [Becker С., 1988].
Как уже указывалось, обсуждается возмож-
ная связь рефлюкс-нефропатии и дисплазии
почечной ткани. Так, у 10 % детей в возрасте
до 5 лет наблюдается задержка дифференциров-
ки элементов нефрона, причем после хирурги-
ческого лечения рефлюкса процесс дифферен-
циации почечной ткани у детей в возрасте до
10 лет ускорялся, а у больных старше 10 лет
рост «маленькой» почки не возобновлялся [Ле-
онова Л.В., Ческис А.Л., 1988].
Классификация. Пузырно-мочеточнико-
во(-лоханочный) рефлюкс может классифици-
роваться по степени выраженности в соответ-
ствии с данными микционной цистографии. По
классификации Хейкеля и Парккулайнена
[Heikel Р., Parkkulainen К., 1966] выделяют 5 сте-
пеней пузырно-мочеточникового рефлюкса:
• I степень: моча забрасывается до средней
трети мочеточника;
• II степень: моча забрасывается до почечной
лоханки;
• III—IV степень: контраст заполняет чашеч-
но-лоханочную систему;
• IV степень: пиелоэктазия и огрубения сво-
дов;
• V степень: деформация чашечно-лоханочной
системы, гидронефротические изменения.
Возможно подразделение рефлюкса на пас-
сивный и активный. Первый вариант при по-
вышении внутрипузырного давления вне акта
мочеиспускания, второй — при мочеиспуска-
нии, что диктует необходимость его исключе-
ния с помощью ультразвукового исследования
(УЗИ) в ходе акта мочеиспускания (А.В. Амо-
сов).
Клиническая карти н а. Проявлениями
пузырно-мочеточникового рефлюкса могут
быть: боль в области почек в момент мочеис-
409
пускания, симптомы нейрогенного мочевого пу-
зыря (редкое мочеиспускание в связи с отсут-
ствием позывов; потребность в сильном нату-
живании для начала мочеиспускания; частое
мочеиспускание без дизурии; энурез, в том чис-
ле и ночной, двухтактное мочеиспускание).
Пузырно-мочеточниковый рефлюкс может
протекать бессимптомно и манифестироваться
только в случае присоединения мочевой инфек-
ции (что наблюдается далеко не всегда) или при
появлении симптомов далеко зашедшего пора-
жения почек — никтурии, полиурии, артери-
альной гипертонии.
При рефлюкс-нефропатии может наблюдать-
ся протеинурия, которую связывают с пораже-
нием клубочков (фокальный гломерулосклероз).
Около 45 % взрослых с рефлюкс-нефропатией
экскретируют с мочой более 0,2 г белка в сут-
ки, а 20 % — более 1 г в сутки. Протеинурия
более часто встречается у больных с наруше-
нием функции почек; существует мнение, что
наличие и выраженность протеинурии корре-
лирует с почечным прогнозом.
Гематурия, как изолированная, так и в со-
четании с протеинурией, может наблюдаться
при рефлюкс-нефропатии.
Симптомы инфекции мочевого тракта могут
сочетаться с пузырно-мочеточниковым реф-
люксом и рефлюкс-нефропатией. При выражен-
ном рефлюксе стаз мочи, вызванный большим
объемом забрасываемой мочи, хотя бы частично
обусловливает предрасположенность к инфек-
ции мочевого тракта, однако в менее тяжелых
случаях такая предрасположенность к развитию
инфекции в мочевом пузыре может быть слу-
чайным совпадением.
У новорожденных мочевая инфекция неред-
ко проявляется в виде лихорадки и ухудшения
общего состояния, что может влиять на разви-
тие ребенка. У более взрослых и пожилых боль-
ных обычные симптомы — дизурия, изменение
частоты мочеиспускания, может развиться ост-
рый пиелонефрит. Первый зафиксированный
эпизод мочевой инфекции может развиться в
детстве, у женщин с началом половой жизни
или в период беременности. У большинства
таких больных мочевые инфекции склонны к
рецидивированию.
Рефлюкс-нефропатия часто вызывает разви-
тие артериальной гипертонии, и она ответствен-
на за развитие более чем 60 % случаев этого
заболевания у детей. Около 60 % взрослых боль-
ных с рефлюкс-нефропатией имеют артериаль-
ную гипертонию в момент обращения к врачу.
Описывают образование камней в почках как
проявление пузырно-мочеточникового рефлюкса.
Рефлюкс-нефропатия является причиной
хронической почечной недостаточности (ХПН)
примерно у 10 % больных, поступающих на
410
хронический диализ в Австралии и Европе и
имеющих средний возраст 30 лет; в Турции, по
данным некоторых статистик [Bereket G. et al.,
1998], около 24 % больных в возрасте до 17 лет
поступают на хронический гемодиализ в связи
с терминальной уремией, развившейся в исходе
рефлюкс-нефропатии. Это наиболее низкий
средний возраст начала заместительного лече-
ния среди больных с наиболее распространен-
ными причинами ХПН. Частота развития по-
чечной недостаточности, вызванной рефлюкс-
нефропатией, примерно одинакова у обоих по-
лов.
Рубцовый процесс в почках и предрасполо-
женность к мочевым инфекциям могут оказы-
вать значительное влияние на беременность.
Атаки острого пиелонефрита, артериальная
гипертония, развивающаяся при беременности,
преэклампсия и недоношенность плода — не-
редкие осложнения беременности у женщин с
рефлюкс-нефропатией. У женщин с рефлюкс-
нефропатией, уже имевших нарушенную фун-
кцию почек, в ходе беременности почечная
недостаточность может развиваться ускоренны-
ми темпами.
Диагностика. Заподозрить наличие реф-
люкса можно на основании ряда анамнестичес-
ких и клинических данных: рефлюкс в семей-
ном анамнезе, наличие симптомов нейроген-
ного мочевого пузыря, энуреза, лихорадки, ре-
цидивирующей мочевой инфекции и пр. Име-
ющиеся предположения должны быть подтвер-
ждены данными инструментальных методов ди-
агностики.
Следует отметить, что наличие пузырно-
мочеточниково(-лоханочного) рефлюкса и при-
знаков рефлюкс-нефропатии как таковой — это
не одно и то же. Первое должно подтверждать-
ся установлением факта обратного заброса мочи
или контрастного вещества из мочевого пузы-
ря в верхние мочевые пути и/или их транзи-
торной обструкции, второе — наличием спе-
цифических признаков рубцевания почечной
ткани.
Ультразвуковое исследование (УЗИ) мочевой
системы не является абсолютно точным мето-
дом диагностики пузырно-мочеточникового
рефлюкса. В то же время его неинвазивность,
сравнительная простота и доступность позволя-
ют рекомендовать его в качестве скрининг-ме-
тода, а также метода «первой линии», позво-
ляющего предположить и даже подтвердить
наличие рефлюкса.
Дилатация лоханки, регистрируемая в усло-
виях физиологически наполненного мочевого
пузыря (240—260 мл) и исчезающая или умень-
шающаяся после акта мочеиспускания, являет-
ся признаком так называемого пассивного пу-
зырно-мочеточниково(-лоханочного) рефлюк-
:а. Следует подчеркнуть, что перерастяжение
кочевого пузыря приемом или удержанием за-
ведомо избыточного количества жидкости (бо-
гее 300—350 мл), может сопровождаться раз-
штием рефлюкса даже у здорового индивида,
>днако такое диагностическое заключение не
[вляется достоверным.
УЗИ также позволяет выявить рубцовые из-
денения почек и чашечек, рассматриваемые в
юдразделе «Рентгенологические исследования»,
фичем УЗИ не уступает в информативности и
[меет преимущество в отсутствие лучевой на-
рузки и необходимости контрастирования ча-
иечно-лоханочной системы.
Данные, касающиеся применения УЗИ по-
(ек плода, находящегося в утробе матери, по-
воляют предполагать, что выявление дилати-
юванной почечной лоханки может использо-
аться для предсказания выраженного рефлюкса.
7ЗИ, проводимое после рождения, тоже мо-
жет способствовать установлению диагноза реф-
юкса.
Рентгенологические исследования. Диагности-
ка рефлюкс-нефропатии главным образом за-
исит от идентификации типичного рубцевания
ри внутривенной урографии. Над дилатирован-
[ыми чашечками определяются грубые впади-
:ы коркового слоя. Это может иметь место во
сех отделах почки, однако ее полюса повреж-
аются наиболее часто. Характерна гипертрофия
:еповрежденной ткани, часто отмечается зна-
ительное уменьшение размеров почки. В итоге
югут возникать различного рода искривления
онфигурации почки, определяющиеся выра-
женностью и распределением рубцов.
Дифференциальный диагноз должен прово-
иться с обструктивной уропатией, при кото-
ой дилатация чашечек и утоныление корко-
ого слоя приобретают генерализованный ха-
актер (если только обструкция не повредила
ишь часть почки); с некрозом почечных со-
очков, при котором обычно обе почки пора-
жены одинаково и рубцовый процесс выражен
е так грубо; с туберкулезом почек, когда
триктуры наблюдаются так же часто; с сосу-
истым инфарктом почечных пирамид, при
отором чашечки не должны быть булавовид-
о изменены. В связи с последним замечанием
ледует привести данные Gedroyc и соавт.
1988), которыми было показано, что обнару-
жение рубцов в почечной паренхиме в сочета-
ии с неизмененными чашечками, типичное,
ак считалось раньше, для сосудистой этиоло-
и нефропатии, все же может наблюдаться и
ри рефлюкс-нефропатии, подтверждаемой
[икционной цистографией.
Микционная цистография и цистоскопия. Ди-
гноз может быть подтвержден микционной ци-
тографией, демонстрирующей наличие реф-
люкса (заброс контрастного вещества из моче-
вого пузыря в верхние мочевые пути), или ци-
стоскопией, при которой могут быть видны
зияющие устья мочеточников. Поскольку ре-
зультаты этих двух исследований редко изменя-
ют тактику ведения больных, то в связи с их
инвазивностью и неудобством для больных не
рекомендуется проводить их в рамках обычно-
го обследования; исключение составляют необ-
ходимость обследования очень маленьких детей
и ситуации, когда обсуждается возможность
хирургического лечения.
Радионуклидные исследования с использовани-
ем соединений, задерживаемых клетками прок-
симальных канальцев, таких как меченная 99тТс
димеркаптосукциновая кислота (DMSA), пока-
зали высокую чувствительность в выявлении
ранних признаков рубцевания или участков
воспаленной, но еще не сморщенной ткани, у
детей младшего возраста.
Биопсия почки обычно не показана больным
с рубцово-измененными рефлюксирующими
почками. Иногда биопсия почки у больного с
кажущейся нормальной внутривенной урограм-
мой дает гистологическую картину, соответ-
ствующую рефлюкс-нефропатии. Тщательное
изучение данных внутривенной урографии и
DMSA-сцинтиграфии зачастую выявляет не-
большие отклонения. Существование рефлюкс-
нефропатии без рубцевания, диагностируемой
лишь гистологически, вызывает противоречи-
вые мнения, но теоретически это возможно,
тем более что визуализирующие методы, при-
меняемые для выявления рубцов в почках, в
определенной мере малочувствительны.
Лечение. Существуют консервативные и
оперативные методы лечения рефлюкса. По
мнению некоторых специалистов, наиболее
важным аспектом консервативной тактики ве-
дения при рефлюкс-нефропатии является кон-
троль мочевой инфекции и артериальной гипер-
тонии. У детей с пузырно-мочеточниковым реф-
люксом или рефлюкс-нефропатией рекоменду-
ется профилактическая антибактериальная те-
рапия для предотвращения мочевой инфекции
или регулярное наблюдение по поводу асимп-
томатической бактериурии. Рекомендуют про-
филактическую терапию антибиотиками до до-
стижения пубертатного возраста или же до тех
пор, пока не будет обнаружено исчезновение
рефлюкса.
Вместе с тем убедительные признаки моче-
вой инфекции присутствуют далеко не у всех
больных, а применение антибактериальной
терапии в исследовании H.Seruca (1989) сопро-
вождалось полной регрессией рефлюкса у
53,7 % больных, его уменьшением — у 19,4 %,
отсутствием эффекта — у 22,4 %, усугублени-
ем — у 4,5 % обследованных. В то же время при-
411
менение антихолинергических препаратов (бак-
лофен, флавоксат, дицикломин) и диазепама
(альтернативой являются седуксен, амитрипти-
лин) сопровождалось полной регрессией реф-
люкса в 91,8 % и значительным его уменьше-
нием — в 8,2 % случаев [Seruca Н., 1989].
Не без успеха применяют также методы
электростимуляции мочевого пузыря.
Контроль артериальной гипертонии. Около
20 % детей с рефлюкс-нефропатией становят-
ся гипертониками, а сама болезнь является од-
ной из наиболее распространенных причин
ускоренного развития артериальной гипертонии
в детском возрасте. Свыше 60 % взрослых с руб-
цовыми изменениями почек, вызванными реф-
люксом, страдают артериальной гипертонией,
которая является основным фактором риска не
только для сердечно-сосудистых заболеваний,
но и для последующего снижения функции
почек. Особенно быстрое снижение функции
может отмечаться в случае ускоренного разви-
тия и нарастания артериальной гипертонии. В со-
ответствии с этим следует регулярно контро-
лировать артериальное давление и своевремен-
но его корректировать. Подростковый возраст —
время особой заботы и внимания, поскольку
многие больные в этот период выпадают из на-
блюдения, а затем появляются уже с тяжелой
артериальной гипертонией и нарушенной фун-
кцией почек.
В последние годы в связи с данными о свя-
зи частоты рубцевания почек с DD-генотипом
АПФ предлагается лечить таких больных инги-
биторами АПФ [Ozen S. et al., 1997].
Антирефлюксные хирургические операции. Зна-
чение антирефлюксной хирургии и различных
оперативных манипуляций в предотвращении
прогрессирования болезни достаточно противо-
речиво. Парадоксально, но при этой болезни,
возникающей именно вследствие пузырно-моче-
точникового рефлюкса, имеется мало доказа-
тельств того, что устранение рефлюкса изменяет
ход болезни.
Антирефлюксные операции обычно основы-
ваются на формировании для мочеточника но-
вого, более длинного интрамурального тонне-
ля. В 1984 г. О’Доннелом и Пьюри был разрабо-
тан новый, менее инвазивный метод, при ко-
тором в ходе цистоскопии осуществляют инъ-
екции таких материалов, как, например, по-
литетрафторэтилен или коллаген, вокруг устья
мочеточника, что в итоге усиливает и укреп-
ляет интрамуральный тоннель и в ряде случаев
позволяет устранить рефлюкс. Эффективность
этих методов в устранении рефлюкса может
достигать 70—98 % [Brown S., 1989], однако,
как указывалось выше, ликвидация рефлюкса не
означает остановки прогрессирования рефлюкс-
нефропатии.
412
Мнения о применении антирефлюксных
методов у очень маленьких детей с выражен-
ным рефлюксом противоречивы. Хотя два ши-
рокомасштабных испытания, проведенных сре-
ди детей, получавших профилактически также
и антибиотики, так и не смогли показать
уменьшения рубцевания при проведении анти-
рефлюксных операций, эти испытания еще не
завершены и многие педиатры-урологи по-пре-
жнему рекомендуют в такой ситуации хирур-
гическое лечение. Несомненно, в случае пло-
хой переносимости профилактических меро-
приятий, направленных против мочевой инфек-
ции, не следует отказываться от хирургических
методов.
Как у взрослых, так и у детей антирефлюк-
сные методы, по-видимому, не снижают час-
тоты рецидивов цистита; вместе с тем, по-
скольку атаки острого пиелонефрита встреча-
ются реже, хирургические методы могут быть
показаны больным с рецидивирующим пиело-
нефритом, не поддающимся контролю с помо-
щью профилактической терапии антибиотика-
ми. У взрослых устранение рефлюкса не влияет
на прогрессирование почечной недостаточнос-
ти, в связи с чем хирургическое лечение не
должно выполняться для этих целей.
Литература
Леонова Л.В., Ческис А.Л. Особенности поражения
почек при пузырно-мочеточниковом рефлюксе у
детей//Педиатрия. — 1988. — № 5. — С. 25—29.
Bailey В. Vesicoureteric reflux and reflux nephropathy//
Oxford textbook of Clinical Nephrology. Second Edition/
Edit. A.Davison, J.Cameron, J.-P.Griinfeld, D.Kerr,
E.Ritz, C.Winearls. — Oxford — New York — Tokyo:
Oxford University Press, 1998. — P. 2501—2521.
Becker C. Nephropathie par reflux//J. Int. Med. — 1988. —
Vol. 88, N 115. - P. 29-41.
Brown S. Open versus endoscopic surgery in the treatment
of vesico-ureteral reflux//Urol. — 1989. — Vol. 142,
N 2. - Pt. 2. - P. 499-500.
Gedroyc W., Chandhuri R., Saxton H. Normal and near
normal caliceal patterns in reflux-nephropathy//Clin.
Radiol. - 1988. - Vol. 39, N 6. - P. 615-619.
Ishi T, Nishioka T, WakabayaM A. Pathological study
on reflux-nephropathy//Acta Urol. Jap. — 1988. — Vol. 34,
N 3. - P. 440-445.
Ozen S., Alikasifoglu M., Tuncbilek E. et al. Polimorphism
in angiotensin converting enzyme gene and reflux
nephropathy: a genetic predisposition to scar formation?
//Nephrol. Dial. Transpl. — 1997. — Vol. 12, N 9. —
P. 2031-2032.
Глава 18
ПОЧЕЧНОКАМЕННАЯ БОЛЕЗНЬ
И.Е.Тареева, А.В.Кухтевич
Распространенность. Почечнокамен-
ная болезнь (нефролитиаз, уролитиаз, мочека-
менная болезнь) — хроническое заболевание,
характеризующееся нарушением обменных про-
цессов в организме и местными изменениями
в мочевой системе с образованием камней,
формирующихся из солевых и органических со-
единений мочи. Уролитиаз (термин, обознача-
ющий камни почек, мочеточников и мочевого
пузыря) известен с древних времен и является
одной из наиболее широко распространенных
болезней мочевой системы. В настоящее время
образование камней в мочевом пузыре встре-
чается относительно редко, преобладают кам-
ни почек (мочеточников), в связи с чем чаще
употребляется термин «почечнокаменная бо-
лезнь».
Почечнокаменная болезнь встречается повсе-
местно, но с неодинаковой частотой в различ-
ных географических регионах. Так, высокая
частота почечнокаменной болезни отмечается в
странах с жарким климатом (Индии, Китае, на
Ближнем Востоке, в Средней Азии, на Кавка-
зе, в Латинской Америке, Австралии), где еже-
годная заболеваемость составляет в среднем
около 2,5—3,6 на 10 000 жителей. В странах с
холодным и умеренным климатом ежегодная
заболеваемость нефролитиазом в целом ниже —
0,19—1,0 на 10 000 жителей. Вместе с тем даже
и в климатически однородных регионах распро-
страненность болезни неравномерна: так, сре-
ди европейских стран она сравнительно высо-
ка в Германии и Нидерландах, а среди азиат-
ских и африканских — низка соответственно в
Японии и ЮАР.
Отдельные статистические материалы свиде-
тельствуют о возможном влиянии пола на рас-
пространенность мочекаменной болезни. Так,
по данным 1993—1994 гг., в Италии соотноше-
ние мужчин и женщин с нефролитиазом со-
ставляло 18,4:16,1 на 1000, причем с увеличе-
нием возраста диспропорция возрастала еще
больше: после 65 лет этот показатель составлял
47,3:34,2 на 1000 [Serio A. et al., 1999]. Нараста-
ние частоты мочекаменной болезни с возрас-
том у мужчин обычно связывают с развитием
инфравезикальной обструкции мочевых путей
(доброкачественные и злокачественные опухо-
ли предстательной железы).
Особенности питания и образ (в том числе
и уровень) жизни до известной степени также
влияют на распространенность мочекаменной
болезни. Так, в Италии с 1983 по 1993 г. число
таких больных возросло с 665 тыс. до 974 тыс.
человек, причем ежегодный прирост увеличил-
ся с 30 тыс. до 95 тыс. человек. При этом рас-
пространенность нефролитиаза была выше сре-
ди лиц без образования или с низким образо-
вательным уровнем, а также среди безработных.
Алиментарные особенности, в частности избы-
точное употребление пуринов (мясо, алкоголь)
и продуктов, богатых кальцием, считаются
немаловажным фактором риска развития уро-
литиаза.
Определенное значение имеет наследствен-
ная предрасположенность, так как нередко уро-
литиаз прослеживается в нескольких поколени-
ях семьи.
Классификация. Мочекаменную болезнь
можно классифицировать по локализации кам-
ней: камни почек и мочеточников (нефроуре-
теролитиаз), камни мочевого пузыря. Возмож-
но подразделение уролитиаза в соответствии с
составом конкрементов, хотя с учетом слож-
ного и смешанного состава большинства кам-
ней эта классификация в известной степени
условна.
По химическому составу выделяют:
• ураты — мочевая кислота [C5H4N4O3], ура-
ты аммония и натрия;
• оксалаты кальция — дигидрооксалат каль-
ция — веделлит [СаС2О4 • 2Н2О]; гидроокса-
лат кальция — вевеллит [СаС2О4 • Н2О];
413
• фосфаты, фосфорнокислые соли: магнезия ам-
мония фосфат — струвит [MgNH4PO4 • 6Н2О];
кислый фосфат магния — ньюбериит
[MgNH4PO4 • ЗН2О];
• карбонаты кальция (кальциевые соли угольной
кислоты — карбонат апатит [Са10(РО4СО3)6];
• цистиновые камни (сернистое соединение
аминокислоты цистеина);
• белковые камни (фибрин с примесью солей
и бактерий);
• холестериновые камни.
Сведения о распространенности камней раз-
личного химического состава варьируют в раз-
ных источниках, однако считается, что прибли-
зительно 70 % всех камней почек содержат каль-
ций (кальция оксалат, кальция фосфат или их
сочетание). По данным D.Bushinsky (1998), 37 %
камней состоят из оксалата и фосфата кальция,
26 % — из оксалата кальция, 7 % — из фосфа-
та кальция, 5 % — из мочевой кислоты, 22 % —
это струвиты, 2 % — цистиновые камни.
Камни почек могут быть одиночными и
множественными; выделяют корраловидные кам-
ни (чаще встречаются у женщин), выполняю-
щие чашечно-лоханочную систему как слепок
с утолщениями на концах отростков, находя-
щихся в чашечках.
Камни в правой почке, по данным некото-
рых авторов, встречаются чаще, чем в левой; у
15—30 % больных наблюдаются двусторонние
камни.
Этиология. При всем многообразии при-
чин, определяющих химический состав камней,
можно выделить ряд общих факторов, способ-
ствующих камнеобразованию:
• прием небольшого количества жидкости и
выделение малого количества мочи;
• перенасыщение мочи солями в связи с из-
быточным их выделением (из-за тех или
иных обменных нарушений или малого ди-
уреза), если реакция мочи препятствует их
растворению;
• инфекция мочевых путей;
• алиментарный фактор;
• дефицит ингибиторов камнеобразования,
которые связывают ионы, сохраняя их в ра-
створенном состоянии.
В зависимости от состава камней возможна
роль и более конкретных этиологических фак-
торов, к которым относятся следующие.
Уратный литиаз:
• гиперурикозурия, гиперурикемия (подагра,
алиментарные факторы, миелопролифера-
тивные заболевания, псориаз);
• постоянно кислая реакция мочи (pH < 5,5;
болезни желудочно-кишечного тракта с по-
носами, канальцевые дисфункции).
414
Кальциевый литиаз:
• идиопатическая гиперкальциурия;
• гиперпаратиреоз;
• интоксикация витамином D;
• дистальный почечный канальцевый ацидоз;
• саркоидоз;
• миеломная болезнь;
• метастазы опухолей;
• молочно-щелочной синдром (встречается
при язвенной болезни желудка или двенад-
цатиперстной кишки: сочетание молочной
диеты и ятрогенного алкалоза, вызванного
приемом ощелачивающих веществ); в насто-
ящее время встречается редко.
Оксалатный литиаз:
• первичная гипероксалурия (в том числе свя-
занная с дефицитом пиридоксина);
• повышенное употребление оксалатов с пи-
щей (салат, щавель, шпинат, крепкий чай
и пр.);
• повышенное употребление веществ, метабо-
лизирующихся в оксалаты (аскорбиновая
кислота);
• поражения кишечника (болезнь Крона, маль-
абсорбция, резекция тонкой кишки) на-
рушение всасывания жиров, которые при
этом связывают кальций, -> увеличение вса-
сывания свободных оксалатов.
Фосфатный литиаз:
• резко щелочная реакция мочи (pH > 7,0);
• инфекции мочевой системы [щелочная ре-
акция мочи + бактерии, выделяющие уреа-
зу и способные расщеплять мочевину (про-
тей, синегнойная палочка) осаждение
фосфатов];
• нарушения оттока мочи и/или обструкция
мочевых путей.
Патогенез. Механизм камнеобразования
сложен и не до конца ясен. Общепринято по-
ложение о перенасыщении мочи с повышением
активности химически свободных ионов, кото-
рые при соответствующих условиях становятся
компонентами камня. Активность химически
свободных ионов зависит от их концентрации
(обратно пропорциональной объему мочи), pH
мочи и от их связывания с другими компонен-
тами мочи (например, с цитратами, которым
свойственно образовывать растворимые комп-
лексы и тем самым снижать активность свобод-
ных ионов).
Образование и рост камня происходят через
стадию нуклеации (образования ядра). При го-
могенной нуклеации возрастание активности
химически свободных ионов приводит к пере-
насыщению раствора мочи, вследствие чего
нарушается равновесие его растворимых частей
и они переходят в постоянную твердую фазу,
давая начало росту кристаллов камня. При ге-
терогенной нуклеации рост кристаллов проис-
ходит уже при имеющейся твердой фазе — на
поверхности разнородных, но взаимодополня-
ющих кристаллов или же на принципиально
иной субстанции (например, сгустке крови). In
vivo гетерогенная нуклеация преобладает над го-
могенной, поскольку наличие твердой фазы
ведет к росту кристаллов при меньшей степе-
ни гиперсатурации мочи (так называемый ме-
тастабильный раствор).
Хотя у так называемых камнеобразователей
перенасыщение мочи в целом более выражено,
чем у здоровых лиц, однако даже при одина-
ковой степени перенасыщения мочи у одних
индивидов камни образуются, а у других — нет
[Bushinsky D. et al., 1998]. Это противоречие
может быть объяснено недостатком в моче ин-
гибиторов кристаллизации (цитрат, уропонтин,
нефрокальцин, пирофосфат) у больных уроли-
тиазом, однако прямая связь между этой недо-
статочностью и наличием мочекаменной болез-
ни, а также частотой камнеобразования не
доказана.
В последние годы появились новые сведения
о возможных механизмах нуклеации почечных
камней. Так, получены данные о возможности
участия в образовании ядра будущего камня
нанобактерий — грамотрицательных атипичных
бактерий, продуцирующих карбонат кальция
(апатит) на стенках клеток. N.Ciftcioglu и со-
авт. (1999) выявили нанобактерии в 97 % всех
исследованных типов почечных камней. Изоли-
рованная культура нанобактерий, выделенная
из почек человека, продуцирует апатит в усло-
виях in vitro. При этом известно, что апатит вхо-
дит в состав практически всех типов почечных
камней. N.Ciftcioglu и соавт. (1999) полагают,
что можно говорить о «нанобактериальной»
болезни, проводя аналогию с Helicobacter
pylori, которому приписывается немаловажная
роль в развитии язвенной болезни.
Патологическая анатомия. Патомор-
фологические изменения, вызываемые уроли-
тиазом, весьма разнообразны и зависят от та-
ких факторов, как размер, форма камня и его
локализация в мочевом тракте; наличие или от-
сутствие сопутствующего пиелонефрита, об-
струкции — ее продолжительности и выражен-
ности (длительная обструкция ведет к развитию
обструктивной уропатии), а также исходных
анатомических особенностей почки, включая
аномалии развития.
В эксперименте показано, что даже 7-днев-
ная обструкция может в ряде случаев вызывать
необратимые повреждения нефронов. Как пола-
гают, нарушение оттока мочи при уролитиазе,
не осложненном пиелонефритом, индуцирует
сначала альтеративно-экссудативные и продук-
тивные, а затем атрофические и склеротические
процессы в почечной лоханке, а в последующем
и в интерстициальной ткани почки. Нередко
образуются участки дистрофического кальциноза
в сосочках пирамид (так называемые бляшки
Ранделла). Секвестрация таких бляшек вместе с
органической матрицей сосочка может стать
ядром внутрилоханочного камня.
При «инфицировании» камней (развитии
калькулезного пиелонефрита, наблюдающего-
ся отнюдь не во всех случаях нефролитиаза)
воспалительно-дистрофический процесс рас-
пространяется по направлению от мозгового к
корковому слою, захватывает как канальцы, так
и клубочки. Крайним проявлением этого про-
цесса может стать гнойное расплавление почеч-
ной ткани — пионефроз.
Клиническая к а р т и н а. Наиболее ха-
рактерными для нефроуретеролитиаза являют-
ся развитие картины почечной колики и такой
патогномоничный симптом, как отхождение
конкремента с мочой.
Почечная колика — это спастические боли в
пояснице, частые императивные позывы на мо-
чеиспускание с отхождением мочи по капле,
нередко лихорадка, желудочно-кишечные сим-
птомы (тошнота, рвота, задержка стула), на-
пряжение мышц передней брюшной стенки.
Почечная колика зачастую развивается при
физическом напряжении, вибрации тела (бег,
тряская езда), приеме алкоголя или больших
объемов жидкости; нередко колике предшеству-
ет экспозиция этих факторов.
Клиническая картина почечной колики ха-
рактеризуется острой и интенсивной болью на
стороне поражения. Больные мечутся в посте-
ли, не находя облегчения от смены положения
тела или позы. При локализации камня в поч-
ке боли захватывают преимущественно поясни-
цу, бок, хотя могут иррадиировать в солнеч-
ное сплетение и в паховую область. Движение
камня из почки вниз в мочеточник, сопровож-
дающее колику, или его манифестация уже в
период нахождения в мочеточнике характери-
зуются болью преимущественно в области жи-
вота (подвздошная область) с иррадиацией в
пах (в половой член и яичко у мужчин, в по-
ловые губы и клитор у женщин) и в бедро.
Считается, что почечная колика вызывает-
ся резкой закупоркой верхних мочевых путей
камнем или массой мелких камней, так назы-
ваемым песком, с последующим повышением
внутрилоханочного давления, которому проти-
востоит ригидная фиброзная капсула почки.
Вместе с тем нередко конкремент как причи-
ну колики обнаружить не удается, и тогда раз-
витие колики объясняют отхождением массы
мелких конкрементов (песок), хотя пассаж
визуально различимой значительной массы со-
415
лей (например, уратов) часто наблюдается и
при банальных лихорадочных реакциях (ОРЗ,
грипп) и при этом не сопровождается коли-
кой. Сказанное свидетельствует в пользу слож-
ного и не до конца ясного механизма вегета-
тивных реакций, лежащих в основе феномена
почечной колики.
Отхождение конкремента с мочой — пато-
гномоничный симптом уролитиаза. Конкремен-
ты, как правило, отходят не на фоне колики,
а после нее — через несколько часов, дней или
педель и даже месяцев. Процесс отхождения
может быть практически безболезненным и
сопровождаться непродолжительной дизурией и
симптомом «закладывания» (прерывания) струи
мочи, что чаще наблюдается у мужчин в связи
с большей протяженностью и извитостью урет-
ры. Отхождение конкремента может сопровож-
даться кратковременной микро- или макроге-
матурией, транзиторной лейкоцитурией.
Гематурия, варьирующая от микро-(10—
30 эритроцитов в поле зрения) до макроско-
пической, сопутствует почечной колике или на-
блюдается после нее. Иногда наличие гемату-
рии во время приступа колики или после него
является косвенным свидетельством того, что
закупорки почки камнем нет, тогда как отсут-
ствие гематурии позволяет заподозрить полную
блокаду оттока мочи из почки с одной сторо-
ны. Макрогематурия, обусловленная наличием
камня в почке или в мочеточнике, всегда то-
тальная. Гематурию принято связывать с трав-
матизацией окружающих тканей (уротелия)
камнем или с резким повышением внутрило-
ханочного давления (в ходе колики) с разры-
вом вен форникальных сплетений. В то же вре-
мя гематурия может наблюдаться при нефро-
уретеролитиазе и в так называемый холодный
период, точно так же как периодами она мо-
жет полностью отсутствовать. Это указывает на
многообразие факторов, вызывающих гемату-
рию при уролитиазе; среди них следует иметь
в виду и нередко сопутствующий нефроптоз,
персистирующую кристаллурию и пр.
Лейкоцитурия, пиурия являются симптомами
мочевой инфекции (пиелонефрит, пионефроз,
уретрит), осложняющей нефроуретеролитиаз
или сочетающейся с ним в 60—70 % случаев.
Решающего значения для диагностики уроли-
тиаза они не имеют, однако в ряде случаев
могут представлять известную ценность. Так,
длительная и упорная лейкоцитурия порядка
50—100 в поле зрения и выше, резистентная к
антибактериальной терапии, даже при отсут-
ствии почечных колик должна быть основани-
ем для исключения нефроуретеролитиаза (бе-
зусловно, наряду с прочими возможными при-
чинами лейкоцитурии, включая сахарный ди-
абет и туберкулез).
416
Дизурия нередко сопровождает уролитиаз, в
первую очередь во время почечной колики,
движения и/или отхождения конкремента. Су-
ществует точка зрения, что выраженность ди-
зурии тем больше, чем ниже камень в моче-
точнике.
Олигурия или анурия встречаются редко — в
основном при частичной или полной закупор-
ке почек камнями с обеих сторон, при сопут-
ствующем значительном поражении почечной
паренхимы (в исходе склеротических процессов
или при тяжелом обострении двустороннего
пиелонефрита); таким случаям обычно сопут-
ствует развитие симптомов острой почечной
недостаточности.
Физический осмотр больных может выявлять
положительный симптом поколачивания по
пояснице на стороне поражения, болезненность
при попытке пальпации почек или зоны про-
екции мочеточников. Увеличенная и/или опу-
щенная почка может быть пропальпирована при
остром пиелонефрите или пионефрозе, кото-
рые нередко осложняют нефроуретеролитиаз.
У женщин камень, находящийся в околопузыр-
ном отделе мочеточника, иногда пальпируется
через стенку влагалища.
Диагностика. При наличии типичной
клинической картины в виде почечной колики
и/или отхождения конкремента с мочой диаг-
ностика нефроуретеролитиаза не представляет
существенных затруднений. В то же время при-
мерно у 13 % больных заболевание протекает
бессимптомно и может быть впервые выявлено
случайно при обследовании по другому поводу.
Лабораторные методы диагностики в основ-
ном служат задачам подтверждения диагноза
уролитиаза, получения косвенных данных о
возможном составе конкрементов (кристаллу-
рия — ураты, фосфаты, оксалаты; гиперкаль-
циурия; гиперурикемия или гиперкальциемия),
наличии или отсутствии сопутствующего вос-
паления (лейкоцитурия, пиурия). Оценивают
также pH мочи (для большей достоверности —
троекратно), поскольку оксалатные камни и
особенно фосфаты (струвиты) чаще образуют-
ся в щелочной моче, уратные — в кислой.
По возможности следует стремиться к иден-
тификации точного химического состава кон-
крементов с помощью спектрального анализа
(инфракрасная спектроскопия) или оптической
кристаллографии. Вместе с тем в определенной
степени можно ориентироваться на внешний
вид и консистенцию камней. Так, оксалат-
ные камни — плотные, черно-серого цвета,
с шиповидной поверхностью (легко ранящей
слизистую оболочку мочевого тракта, в резуль-
тате чего кровяной пигмент окрашивает их в
черный или темно-коричневый цвет); каль-
ций-фосфатные камни — белого или свет-
г
Рис. 18.1. Камень правой почки на обзорном снимке
мочевой системы.
ло-серого цвета, поверхность их гладкая или
слегка шероховатая, консистенция не очень
плотная, образуются в щелочной моче; каль-
цийкарбонатные камни — белого цвета,
гладкие, относительно мягкие; уратные
камни —- желто-кирпичного цвета, с гладкой
поверхностью, твердой консистенции, образу-
ются в моче, имеющей кислую реакцию; ци-
стиновые камни — желтовато-белого цве-
та, гладкие, мягкие; белковые камни — бе-
лого цвета, мягкие (образуются в основном из
фибрина с примесью солей и бактерий); хо-
лестериновые камни — черного цвета,
мягкие (состоят из холестерина).
Известны также экспресс-методы идентифи-
кации химического состава камней. Так, на
предметное стекло помещают часть конкремен-
та и петлей наносят несколько капель 20 %
раствора сульфосалициловой кислоты и калий-
ной щелочи. При быстром растворении конк-
ремента можно думать об урате, при медлен-
ном растворении без образования пены —
о фосфате кальция, с образованием пены —
о карбонате кальция; не поддаются растворе-
нию оксалаты, частично растворяются, но при
этом остается аморфная масса — камни сме-
шанного состава.
Косвенно судить о возможном составе име-
ющихся конкрементов позволяет определение
характера кристаллурии, однако корреляция
между составом камней и характером кристал-
лурии прослеживается далеко не всегда. Исполь-
зуют обычную микроскопию, оптимально —
фазово-контрастную микроскопию. Кристаллы
оксалата кальция имеют бипирамидную форму
(дигидрат, веделлит) или овоидную форму
(моногидрат, вевеллит); кристаллы мочевой
кислоты — ромбовидную форму, янтарный
цвет; аморфные фосфаты, триппельфосфаты —
гробовидную форму.
Инструментальные методы диагностики, в
первую очередь визуализирующие методы, за-
нимают ведущее место в выявлении и/или под-
тверждении уролитиаза. В последние 15—20 лет
ультразвуковая диагностика (УЗИ) в силу сво-
ей неинвазивности и высокой информативно-
сти оттеснила с лидирующих позиций рентге-
нологические методы. УЗИ позволяет визуали-
зировать конкременты размером более 3—5 мм
и любого химического состава (включая рент-
генонегативные) в почках, в отдельных сегмен-
тах мочеточника (лоханочно-мочеточниковый,
Рис. 18.2. Коралловидный камень правой почки на
обзорном снимке мочевой системы.
27—2950
417
Рис. 18.3. Камень в лоханочно-мочеточ-
никовом сегменте правой почки на экс-
креторной урограмме.
околопузырный), в мочевом пузыре; выявлять
признаки нахождения конкремента в невизуа-
лизируемых отделах мочеточника по таким кос-
венным симптомам, как дилатация вышележа-
щих отделов мочеточника и чашечно-лоханоч-
ной системы (рис. 18.1 — 18.5).
Рентгенологические методы не утратили сво-
ей значимости, хотя в связи с прогрессом уль-
тразвуковой диагностики показания к их при-
менению несколько изменились. По-прежнему
для визуализации камней мочеточников обзор-
ный снимок мочевой системы, экскреторная
или ретроградная пиелография (применяемая
все реже), отчасти компьютерная томография
остаются наиболее информативными. Следует
при этом иметь в виду: 1) возможность оши-
бочного принятия за конкремент флеболитов,
каловых камней, обызвествленных лимфатичес-
ких узлов; 2) рентгенонегативность конкремен-
тов определенного состава (ураты, белковые
камни) требует верификации диагноза уроли-
тиаза с привлечением косвенных и дополни-
тельных данных.
Ангиографические методы диагностики, и
прежде не имевшие решающего значения для
диагностики мочекаменной болезни, с внедре-
нием допплеровского УЗИ применяются все
реже. Необходимость в исследовании почечно-
го кровотока или особенностей сосудистой ар-
хитектоники возникает при оценке васкуляри-
зации почечной паренхимы или выборе опера-
тивной тактики при хирургическом лечении
мочекаменной болезни.
Изотопные (радионуклидные) методы диаг-
ностики используют при нефроуретеролитиазе
для оценки парциальных нарушений почечной
функции.
Эндоскопические методы диагностики (цис-
тоскопия, хромоцистоскопия) применяют в
последние годы нечасто в связи с высоким рис-
ком присоединения восходящей инфекции (в
первую очередь у женщин) даже вследствие про-
стейших урологических манипуляций (катетери-
зация). Вместе с тем цистоскопия позволяет уви-
деть конкремент в устье мочеточника, а хромо-
цистоскопия — при отсутствии выделения из
устья мочеточника индигокармина в течение
10—12 мин после его внутривенного введения —
указывает на окклюзию мочеточника.
Дифференциальная диагностика.
Почечную колику в ряде случаев приходится
дифференцировать от острого хирургического
заболевания брюшной полости (острый аппен-
дицит, холецистит или панкреатит; прободная
язва желудка либо двенадцатиперстной кишки)
или малого таза (внематочная беременность).
Важным дифференциально-диагностическим
признаком почечной колики является выражен-
ный положительный эффект от теплой ванны,
новокаиновой блокады семенного канатика или
круглой связки матки. При почечной колике
больные мечутся, не находя облегчения от сме-
ны положения тела, тогда как при остром жи-
воте они находят антальгическую позу, умень-
шающую симптомы раздражения брюшины, о
наличии которых свидетельствуют симптомы
418
Рис. 18.4. Камень на границе верхней и средней тре-
ти правого мочеточника на обзорном снимке моче-
вой системы.
Щеткина — Блюмберга, доскообразный живот.
Локализация болей до известной степени также
позволяет уточнить диагноз: боли в правой под-
вздошной и эпигастральной области — при ап-
пендиците, в правом подреберье с иррадиаци-
ей в спину и в правую подключичную ямку
(френикус-симптом) — при холецистите, опо-
ясывающие боли, уменьшающиеся в коленно-
локтевом положении, — при панкреатите. При
прободной язве в дебюте характерна «кинжаль-
ная» боль в эпигастрии. В случае внематочной
беременности выражена картина внутреннего
кровотечения, антальгической позой является
положение лежа на спине с согнутыми ногами.
Может потребоваться дифференциальный
диагноз уролитиаза с рядом болезней почек,
сопровождающихся гематурией (рак почки,
туберкулез, гематурический нефрит), а также
при рентгенологическом или ультразвуковом
выявлении очаговых образований в ткани поч-
ки (опухоль, туберкулема, паразитарные пора-
жения). Верификация диагноза подчас бывает
нелегкой и должна производиться с учетом
комплекса анамнестических, клинических дан-
ных и результатов лабораторно-инструменталь-
ных методов исследования, а также требует
знания казуистики. Так, описаны случаи рака
почки, когда в ткани опухоли находился кон-
кремент [Оболонков В.Ю. и др., 1998]; нам до-
велось наблюдать пациента с почечной коли-
кой, причиной которой было отхождение с
мочой паразитарных кист (альвеококковых).
Лечение. Выделяют консервативные мето-
ды лечения уролитиаза, оперативные методы
(включая способы чрескожного удаления кам-
ней почек и мочеточников и эндоурологичес-
кие манипуляции), а также получившие широ-
кое распространение в последние 10—15 лет
методы экстракорпоральной ударно-волновой
литотрипсии.
Консервативные методы включают меропри-
ятия, направленные на:
• облегчение отхождения конкремента;
• растворение конкремента;
• торможение дальнейшего роста камней и
профилактику образования новых конкре-
ментов.
Рис. 18.5. Камень в верхней трети правого мочеточ-
ника на ЭКСК (правосторонний гидронефроз и симп-
том указующего перста).
Отсутствие контрастирования мочеточника ниже уровня
обструкции. Левый мочеточник контрастирует на всем про-
тяжении.
27*
419
Общими принципами консервативного ле-
чения и профилактики уролитиаза являются:
• прием значительного количества жидкости
(до 2,5—3 л/сут), увеличение объема мочи;
• разрыв нормального цикла концентрации
мочи;
• влияние на реакцию мочи;
• сбалансированность диеты.
Следует, однако, признать наиболее убеди-
тельными результаты реализации первых двух
принципов, тогда как выполнение остальных не
обеспечивает столь весомых результатов, что
может объясняться мультифакториальностью
патогенеза литиаза, смешанным составом мно-
гочисленных камней, этнической неоднородно-
стью популяции и географическими различия-
ми в среде обитания.
Тем не менее рекомендуются следующие
схемы консервативного лечения уролитиаза.
Уратный литиаз:
1) ощелачивание мочи (поддержание pH
мочи в пределах 6,2—6,5, не больше, так как
иначе начнется выпадение кальция в осадок);
используют натриевые соли лимонной и уксус-
ной кислот, сок лимона, соду;
2) ограничение мяса, рыбы, алкоголя, бо-
бовых, баклажанов;
3) исключение из рациона наваристых мяс-
ных бульонов, мозгов, печени, почек, свини-
ны, шпрот;
4) употребление молочных продуктов, кар-
тофеля, овощей, фруктов, лимонов, зеленых
яблок, огурцов;
5) прием препаратов, содержащих цитрат-
ные смеси: магурлит, уралит-U, блемарен, со-
луран (в среднем по 2 г 3 раза в сутки, ориен-
тируясь на данные контроля pH мочи с помо-
щью лакмусовых полосок);
6) при наличии гиперурикемии и гиперури-
козурии — прием аллопуринола (200—300 мг/сут).
Кальциевый литиаз:
1) подкисление мочи (метиленовый синий);
2) ограничение употребления молочных
продуктов;
3) ограничение в рационе овощей, фруктов,
чая, салата, щавеля; белок, сахар и соль огра-
ничивают из-за кальцийурического действия;
4) употребление мяса, рыбы (умеренно —
1 раз в сутки), мучных продуктов, круп, рас-
тительного масла;
5) прием гипотиазида — по 25—50 мг 2 раза
в сутки (следует помнить о возможных побоч-
ных эффектах — гипокалиемии, гиперурике-
мии, иногда гиперкальциемии, при развитии
которой следует искать возможный гиперпара-
тиреоз);
6) прием окиси магния (жженой магне-
зии) — по 0,2—0,5 г 3 раза в сутки;
7) прием препаратов фосфора — 2—3 г в
сутки элементарного фосфора в виде натрие-
вых и калиевых солей (возможно развитие по-
носа).
Оксалатный литиаз:
1) ощелачивание мочи (единого мнения не
существует);
2) исключение чая, салата, ревеня, шпина-
та, щавеля;
3) ограничение мяса, рыбы, картофеля,
помидоров;
4) прием пиридоксина — до 200 мг 2—3 раза
в сутки (рекомендуется в первую очередь при
первичной гипероксалурии, однако распрост-
раняется и на все ее виды);
5) прием препаратов магния (жженой маг-
незии) — по 0,2—0,5 г 3 раза в сутки;
6) прием препаратов фосфора — 1—1,5 г в
сутки элементарного фосфора в виде натрие-
вых и калиевых солей;
7) при так называемой кишечной оксалу-
рии — холестирамин 8—16 г в сутки; низкожи-
ровая диета; коррекция нарушенного всасыва-
ния жиров; лактат кальция — 8—14 г в сутки
(осаждает оксалаты в кишечнике).
Смешанные формы литиаза, включающие фос-
фаты:
1) подкисление мочи (борная кислота —
1 г 3 раза в сутки; бензойная кислота — 0,05 г
3 раза в сутки; хлорид аммония — 1—2 г 3 раза
в сутки; метионин — 0,5 г 3—4 раза в сутки);
2) борьба с мочевой инфекцией;
3) теоретически при достижении стерильно-
сти мочи возможно растворение камней ацето-
гидроксамиевой кислотой — ингибитором уре-
азы.
Выведению камней способствуют цисте -
нал (по 4—5 капель на сахар 3 раза в сутки за
0,5—1 ч до еды), олиметин (энатин; по 1—
2 капсулы 3—4 раза в сутки), экстракт марены
красильной (по 0,25 мл 3—4 раза в сутки на 0,5
стакана теплой воды), марелин (по 2—4 таблет-
ки 3 раза в сутки), фитолизин (по 1 чайной
ложке в 0,5 стакана теплой воды 3 раза в сут-
ки).
Известны методики выведения камней с
помощью водной нагрузки (до 2—3 л) в соче-
тании с мочегонным средством (лазикс, фуро-
семид) и спазмолитиками (баралгин, максиган).
Во второй половине 1980-х годов определенное
распространение получили методы вибрацион-
ного воздействия (отечественный аппарат ам-
плипульс), которыми не без успеха стимулиро-
вали движение камней почек и мочеточников.
Общими противопоказаниями к изгнанию кам-
420
ней следует считать нарушение оттока мочи,
гидронефроз, острый пиелонефрит.
Экстракорпоральная ударно-волновая литот-
рипсия (ЭУВЛ) получила распространение в
первой половине 80-х годов, революционным
образом изменив тактику лечения нефроурете-
ролитиаза. ЭУВЛ обеспечивает воздействие на
конкремент сфокусированной ударной волны с
частотой до 200—400 в 1 мин, требует неболь-
шой анестезии, в части случаев может выпол-
няться в амбулаторном режиме, применяется у
лиц различного возраста — от 7 до 78 лет [Обо-
лонков В.Ю. и др., 1998].
Оптимальный размер камней для дробле-
ния — 10—20 мм, для их дробления требуется
в среднем 4200 ударов шоковой волны; при
камнях диаметром < 10 мм в среднем требует-
ся около 3400 ударов шоковой волны, диамет-
ром > 20 мм — в среднем 5200 ударов. Сред-
няя суммарная продолжительность сеансов
ЭУВЛ составляет при указанных размерах кам-
ней около 64 мин [Psihramis К. et al., 1994].
Возможно дробление конкрементов диаметром
> 20 мм, включая коралловидные (по некото-
рым данным, диаметром до 30 мм, а иногда
более), однако при таких камнях нередко при-
ходится дополнять ЭУВЛ чрескожной литото-
мией. Определенные трудности встречаются при
дроблении с помощью ЭУВЛ камней в чашеч-
ках (в первую очередь нижних) и особенно в
дивертикулах чашечек — в последующем слу-
чае камни редко отходят самопроизвольно,
нередко вызывают локальное воспаление с ис-
ходом в фиброз стенки дивертикула.
Полагают, что даже асимптоматические кам-
ни, не вызывающие обструкции и имеющие
диаметр < 5 мм, целесообразно своевременно
раздробить посредством ЭУВЛ, так как 50 % из
них в противном случае будут мигрировать в
мочеточник [Renner Ch. et al., 1999].
В целом у 2/3 больных с нефроуретеролитиа-
зом дезинтеграцию камня удается выполнить за
1 сеанс ЭУВЛ, у */3 — за 2 сеанса и более.
Среднее число сеансов ЭУВЛ на 1 больного со-
ставляет 1,41 [Оболонков В.Ю. и др., 1998].
Повторные сеансы нередко требуются для де-
зинтеграции «каменной дорожки» в мочеточни-
ке, которая может иметь размеры от 5—6 до
10—12 мм. Отхождение мелких фрагментов де-
зинтегрированного конкремента может наблю-
даться в сроки до 3—6, реже до 8—12 мес
[Renner Ch. et al., 1999]. При наличии конкре-
ментов в нижней группе чашечек диаметром
< 5 мм и < 10 мм процент больных, «свобод-
ных» от конкрементов через 12 мес после ле-
чения ЭУВЛ, составлял 84 и 90 % соответствен-
но [Renner Ch. et aL, 1999].
ЭУВЛ не лишена побочных эффектов и ос-
ложнений. В 82 % случаев наблюдается кратко-
временная гематурия, в 23 % — почечная ко-
лика, в 8 % — кратковременная гипертермия,
в 1,8 % — обострение пиелонефрита. Описаны
случаи субкапсулярной, периренальной гемато-
мы, повреждения позвонков, петель кишок и
даже сквозного повреждения диафрагмы
[Brahim М. et al., 1998].
Чрескожная литотомия и так называемая
эндоурологическая техника в настоящее время
применяются при неэффективности ЭУВЛ,
считающейся процедурой «первой линии», а
также в ряде случаев при камнях в дивертику-
лах чашечек.
Пиелолитотомия в настоящее время все реже
используется для лечения нефролитиаза. Среди
сохраняющихся показаний к ее применению —
гидронефротическая трансформация, коралло-
видные камни, развитие атаки острого пиело-
нефрита.
Литература
Оболонков В.Ю., Халезов С.П., Лебедев Ю.И. и др.
10-летний опыт применения дистанционного удар-
но-волнового разрушения камней почек и моче-
точников на аппарате НМ-3 «Дорнье»//Тер. арх. —
1998. - Т. 70. - № 3. - С. 30-32.
Brahim М., Mutter D., Heibel F. et al. Hydrothorax par
fuite du dialysat peritoneal secondaire a une rupture
diaphragmatique//Nephrologie. — 1998. — Vol. 19. —
P. 281.
Bushinsky D. Nephrolithiasis//!. Am. Soc. Nephrol. —
1998. - Vol. 9. - P. 755-762.
Ciftcioglu N., Bjorklund M., Kuorikoski K., Bergstrom K.,
Kajander O. Nanobacteria: an infection cause for kidney
stone formation//Kidney Int. — 1999. — Vol. 56. — P.
1893-1898.
Psihramis K., Jewett M., Bombardier C. et al. Lithostar,
extracorporeal shock wave lithotripsy: the first 1000
patients//!. Mai. — 1994. — Vol. 147. — P. 1006—1009.
Renner Ch., Rassweiler J. Treatment of renal stones by
extracorporeal shock wave lithotripsy//Nephron. —
1999. - Vol. 81 (suppl. 1). - P. 71-81.
Serio A., Fraioli A. Epidemiology of nephrolithiasis//
Nephron. - 1999. - Vol. 81 (suppl. 1). - P. 26-30.
Глава 19
ПОДАГРИЧЕСКАЯ ПОЧКА
Н.А.Мухин, И.М.Балкаров
Подагрическая почка (уратная нефропатия)
в широком понимании — это поражение по-
чек, развивающееся при нарушении пуринового
обмена. Существующее представление о подаг-
ре как заболевании, обязательным признаком
которого является типичное поражение суста-
вов, сужает спектр клинических проявлений на-
рушения пуринового обмена. Этот спектр дос-
таточно широк, в подавляющем числе случаев
развивается и протекает вне суставного синд-
рома, причем поражение почек занимает одно
из ведущих мест. По-видимому, более правиль-
но говорить об уратной, нежели подагрической,
нефропатии. Повреждающее действие гиперури-
кемии на почки доказано в эксперименте
[SokoloffL., 1957; Stavric В. et al., 1969; Bluestone
et al., 1975], поэтому термин «бессимптомная
гиперурикемия» отражает, по-видимому, толь-
ко отсутствие одного из основных проявлений
заболевания — суставного синдрома, но не
исключает возможность развития другой пато-
логии, связанной с избытком уратов, в первую
очередь нефропатии [Балкаров И.М., 1996].
Выделены следующие клинике-морфологи-
ческие варианты уратной нефропатии:
• острая мочекислая нефропатия (ОМН);
• уратный нефролитиаз;
• хронический уратный тубулоинтерстициаль-
ный нефрит;
• иммунокомплексный гломерулонефрит.
Острая мочекислая нефропатия (ОМН) зани-
мает особое место среди вариантов поражения
почек при гиперурикемии (гиперурикозурии).
В результате кристаллизации мочевой кислоты
в дистальных почечных канальцах, собиратель-
ных трубочках, лоханках почек, иногда и в мо-
четочниках развивается блокада мочевыводящих
путей [Nickleit V. et al., 1997]. Нередко этот ва-
риант уратного поражения почек сопровожда-
ется развитием острой почечной недостаточно-
сти (ОПН), отличительной особенностью ко-
422
торой является не встречающаяся при ОПН
другой этиологии значительная гиперурикозу-
рия, переходящая по мере уменьшения диуре-
за в гиперурикемию, степень которой неадек-
ватна (особенно на начальных стадиях ОПН)
накоплению азотистых шлаков, в частности
уровню повышения креатинина крови.
Клинической моделью данного варианта
уратного поражения почек могут служить эпи-
зоды гиперпродукции мочевой кислоты, наблю-
дающиеся при лечении цитостатиками или при
радиационной терапии лимфопролиферативных
заболеваний, опухолей (синдром распада, «ли-
зиса» опухоли, когда обнаруживают также ги-
перфосфатемию и угрожающую жизни гипер-
калиемию).
В настоящее время известен большой круг
причин повышенного образования мочевой
кислоты в организме. Среди них выделяют пер-
вичные генетически детерминированные дефек-
ты обмена пуринов, однако практическая ве-
рификация их затруднена.
К развитию уратной нефропатии также мо-
жет приводить вторичная гиперпродукция мо-
чевой кислоты, наблюдаемая при достаточно
широком круге заболеваний.
При острой массивной гиперпродукции мо-
чевой кислоты ее кристаллизация обусловлена
преимущественно резким повышением концен-
трации уратов, превышающей порог раствори-
мости. В педиатрической практике даже у но-
ворожденных регистрируется возможность кри-
сталлизации мочевой кислоты в мочевыводящих
путях — так называемый уратный инфаркт по-
чек, который проявляется бурой мочой и кри-
сталлами мочевой кислоты на пеленках [Мат-
веев М.П., Коровина Н.А., 1972]. В случаях
«хронического» и, как правило, невыраженного
повышения синтеза мочевой кислоты и не столь
высокой гиперурикозурии образование кристал-
лов происходит только при многофакторном
воздействии, повышающем риск кристаллиза-
ции. Уменьшение диуреза, в частности, при
малом употреблении жидкости, лихорадочных
состояниях, пребывании в жарком климате,
сауне, значительных физических нагрузках, а
также избыточное употребление алкоголя, мяс-
ной пищи, закисление мочи являются факто-
рами, которые могут привести к кристаллиза-
ции мочевой кислоты и развитию ОМН.
В норме при исключении алкоголя и избы-
точного употребления богатой пуринами пищи
почечная суточная экскреция мочевой кисло-
ты колеблется в пределах 400—600 мг/сут. Не-
зависимо от причины повышенного образова-
ния мочевой кислоты в организме развивающа-
яся при этом гиперурикозурия является факто-
ром риска повреждения почек. По данным про-
веденного нами совместно с ВНИЦ профилак-
тической медицины М3 РФ [Бритов А.Н. и др.,
1991] эпидемиологического исследования, в
популяции регистрируется 19,2 % лиц с повы-
шенной почечной экскрецией мочевой кисло-
ты и 6,7 % с гиперурикемией. По-видимому, у
определенной части лиц развитие гиперурике-
мии происходит на фоне повреждения почек
вследствие кристаллизации мочевой кислоты,
обусловленной исходной гиперурикозурией.
Так, у 124 наблюдаемых нами молодых па-
циентов с наследственной отягощенностью по
подагре выявлена гиперурикозурия от 800 до
2100 мг/сут, в среднем 12681126 мг/сут, с
нормальным уровнем мочевой кислоты в кро-
ви (от 4,6 до 6,2 мг%). Повышенная экскреция
мочевой кислоты сохранялась и существенно не
изменялась при повторных исследованиях на
фоне низкопуриновой диеты. У 68 из 124 па-
циентов при динамическом наблюдении выяв-
лены признаки уратной нефропатии (стабиль-
ная минимальная протеинурия, микрогемату-
рия) и соли мочевой кислоты в осадке. Неред-
ко это были повторные проявления ОМН в
виде эпизодов бурой мочи (иногда только в
течение одного дня) с повышением АД. Спе-
цифическим следствием кристаллизации и раз-
вития обструктивной нефропатии было сниже-
ние гиперурикозурии и появление гиперурике-
мии, на первых этапах преходящей, с доста-
точно быстрым восстановлением повышенной
экскреции уратов. Последнее происходит не
всегда. Так, у 8 пациентов на фоне повторных
эпизодов кристаллизации мы наблюдали ста-
бильное снижение урикозурии и развитие по-
стоянной гиперурикемии. У 16 пациентов с
гиперурикозурией без изменений в общих ана-
лизах мочи или с преходящей эритроцитурией
отмечалась отчетливая тенденция к снижению
почечной экскреции мочевой кислоты и уве-
личению урикемии.
Повышение активности канальцевого фер-
мента Н-ацетил-^-В-глюкозаминидазы (НАГ)
в моче может свидетельствовать об уратном
повреждении почек при гиперурикозурии. При
проведении суточного автоматического мони-
торирования АД у пациентов с нарушениями
пуринового обмена мы наблюдали отклонения
параметров суточного профиля АД [Мухина
Н.А., 1999]. Характерной особенностью паци-
ентов с гиперурикемией являлась более выра-
женная, чем у больных с гиперурикозурией,
тенденция к артериальной гипертонии. При
гиперурикемии отмечалась высокая частота
инверсии суточного ритма диастолического АД
(24 % по типу ночной гипертонии — night-
peakers — против 10 % в группе с гиперурико-
зурией). Характерной была и более высокая
вариабельность дневного и ночного АД в груп-
пе с гиперурикемией по сравнению с гиперу-
рикозурической группой (у 33 и 17 % пациен-
тов соответственно).
Возможность ранних структурных и функци-
ональных повреждений почек, даже при мини-
мальном повышении АД [Kaplan N.M., 1994],
обусловливает значимость формирующейся АГ
как дополнительного фактора прогрессирования
уратной нефропатии. Предполагается, что по-
вреждение почек может реализоваться вслед-
ствие эпизодических подъемов АД, которые
обусловливают поражение околоканальцевых
капилляров, вызывая тубулоинтерстициальное
повреждение и местную ишемию. Поражение
околоканальцевых капилляров с микрососуди-
стыми повреждениями, локальной ишемией
могут привести к местной тканевой гипоксии,
которая также нарушает уратный клиренс
[Richard J. et al., 1999].
ОМН может развиться у пациентов с дли-
тельно существующей подагрой. Мы наблюда-
ли мочекислую обструкцию мочевыводящих
путей у 6 больных подагрой и хроническим
уратным тубулоинтерстициальным нефритом
при отсутствии нефролитиаза. У 4 из 6 больных
произошло восстановление диуреза и исходно-
го уровня почечной функции, для чего одно-
му из них потребовалась установка мочеточни-
ковых катетеров сроком на 2 нед. Два других
пациента погибли, несмотря на попытки бужи-
рования мочеточников и применение гемодиа-
лиза. Приводим одно из этих наблюдений.
Больной В., 56 лет. С 28 лет беспокоили рециди-
вирующие 1—2 раза в год почечные колики. После-
дние 5—7 лет колики не отмечались. С 35-летнего воз-
раста появились острые артриты. Диагностирована
подагра. Лечение только симптоматическое во вре-
мя суставных атак (1 раз в год). Вне приступов арт-
ритов чувствовал себя удовлетворительно, вел актив-
ный образ жизни.
Резкое ухудшение состояния с развитием ночью
острого артрита, появлением бурой мочи, уменьше-
нием ее количества и последующей анурией про-
423
1
изошло внезапно после употребления накануне ве-
чером алкоголя и большого количества мясной пищи.
На третий день после ухудшения госпитализирован
в урологическое отделение. При поступлении состо-
яние тяжелое, умеренные периферические отеки,
одышка до 26 в 1 мин, в нижних отделах легких
влажные хрипы, АД 150/90 мм рт.ст. Креатинин
сыворотки — 0,932 ммоль/л, мочевая кислота —
0,784 ммоль/л. Данные УЗИ: почки нормальных раз-
меров, расширение ЧЛС с обеих сторон, камней нет.
Цистоскопия: на дне мочевого пузыря — большое
количество кристаллов мочевой кислоты, попытка
катетеризации мочеточников не удалась из-за непре-
одолимого препятствия на протяжении 2 и 3 см.
У пациента нарастали признаки левожелудочковой
недостаточности. Несмотря на начатое лечение гемо-
диализом, купировать отек легких не удалось, па-
циент погиб. Диагностированная острая мочекислая
нефропатия с ОПН у больного с нелеченой подаг-
рой была подтверждена при патологоанатомическом
исследовании, на фоне интерстициального нефри-
та, диффузного склероза стромы выявлялось скоп-
ление солей мочевой кислоты в канальцах, собира-
тельных трубках с обтурацией их просвета.
Для предупреждения кристаллизации моче-
вой кислоты в мочевыводящих путях показано
назначение аллопуринола. Данный препарат,
ингибируя ксантиноксидазу, тормозит образо-
вание мочевой кислоты, на уровне ее предше-
ственников — ксантина и гипоксантина, име-
ющих почти в 10 раз большую растворимость.
Растворимость уратов повышает также сдвиг pH
мочи в щелочную сторону, в связи с чем в ос-
трых ситуациях целесообразны внутривенные
введения бикарбоната натрия под контролем
волемии из-за опасности гипергидратации и
развития острой левожелудочковой сердечной
недостаточности. При олигурии целесообразна
попытка увеличения диуреза с помощью моче-
гонных средств. При анурии показан перевод
пациента на гемодиализ. Высокий риск тяже-
лой ОМН, например при синдроме распада
опухоли, требует обязательных превентивных
мер. В частности, необходимо назначение боль-
ших доз аллопуринола — 600—900 мг/сут за 3—
5 дней до начала химиотерапии, обеспечение
диуреза не менее 3000 мл/сут с внутривенным
введением изотонического раствора натрия хло-
рида, ощелачивание с внутривенным введени-
ем бикарбоната натрия, ацетазоламида (инги-
битора карбоновой ангидразы).
Повышенная экскреция мочевой кислоты с
мочой является фактором развития и другого
варианта поражения почек — уратного нефро-
литиаза. Среди больных подагрой почти у по-
ловины встречаются уратные конкременты. Уль-
тразвуковые методы исследования почек позво-
лили значительно улучшить выявление уратных
камней, в том числе более мелких и «бессимп-
томных». Процесс образования рентгенонега-
424
тивных уратных камней до конца не ясен. Из-
вестно, что, помимо перенасыщения мочи мо-
чевой кислотой, для камнеобразования необ-
ходимо стойкое закисление мочи. Определенная
роль в возникновении мочекислого нефролити-
аза принадлежит локальным почечным факто-
рам, в частности нарушениям гемодинамики
почки вследствие сопутствующего интерстици-
ального нефрита [Пытель Ю.А. и др., 1985].
Важным лабораторным методом исследования
на этом этапе являются определение суточной
почечной экскреции и клиренса мочевой кис-
лоты, а также pH мочи. Наиболее яркие кли-
нические признаки уратного нефролитиаза —
почечные колики с отхождением конкрементов
или песка, гематурия.
Как ОМН, так и уратный нефролитиаз яв-
ляются предшественниками развития хроничес-
кого поражения почек при нарушении пурино-
вого обмена. Течение уратной нефропатии при-
обретает хронический характер с постепенным
прогрессирующим вовлечением в процесс по-
чечного интерстиция. Характерны диффузные
или тофусоподобные включения кристаллов
уратов в почечную ткань, прежде всего в ин-
терстиций мозгового вещества почки, с воспа-
лительной реакцией и гигантоклеточными ин-
фильтратами. Артериальная гипертония, частые
бактериальные инфекции усугубляют прогрес-
сирование нефросклероза.
Медленно развивающийся хронический урат-
ный тубулоинтерстициальный нефрит — один из
наиболее частых вариантов подагрической поч-
ки. Развитие этой формы поражения почек
обусловлено нарушением баланса урикемии и
урикозурии и включает период, когда гипер-
продукция мочевой кислоты в организме урав-
новешивается повышенной экскрецией уратов.
В этот период могут отмечаться преходящие
эпизоды обструкции почечных канальцев, раз-
виваться уратный нефролитиаз. Гиперурикемия
появляется значительно позже, нередко через
годы, и сочетается с постепенным снижением
почечной экскреции мочевой кислоты. Меха-
низм парциального уменьшения почечной эк-
скреции мочевой кислоты до конца не ясен,
но, по-видимому, наибольшие нарушения вы-
деления уратов регистрируются на уровне ту-
булярной экскреции. Это может быть связано с
почечным дефицитом глутамина.
Обмен уратов в почке происходит в несколь-
ко этапов. Первый этап — фильтрация плазмен-
ных уратов со скоростью фильтрации инулина,
второй и третий этапы — практически полная
их реабсорбция и секреция, чрезвычайно чув-
ствительная к различным метаболитам, гормо-
нам, лекарствам; четвертый этап — реабсорб-
ция большей части секретированных уратов.
Важнейшими факторами, регулирующими этот
""ЧТ
многоступенчатый процесс обмена, являются
концентрация уратов в плазме, почечный плаз-
моток, объем внеклеточной жидкости. Среди
экзогенных влияний следует назвать медикамен-
тозные воздействия. Урикозурическим эффектом
обладают салицилаты, оротовая кислота, эст-
рогены, тетрациклины с просроченным сроком
действия и др. В противоположность им этам-
бутол, хлортиазид, этакриновая кислота и фу-
росемид являются антиурикозурическими сред-
ствами.
Таким образом, уровень экскреции мочевой
кислоты с мочой в конечном итоге зависит от
сбалансированности процессов секреции и ре-
абсорбции уратов. Поэтому гиперурикемия мо-
жет быть результатом процессов, приводящих
к торможению секреции уратов и увеличению
их тубулярной реабсорбции. По-видимому, дан-
ная поломка происходит на определенном этапе
заболевания, а не является исходным первич-
ным почечным звеном развития подагры.
Об этапах развития подагры свидетельству-
ет следующее наше наблюдение.
Больной Л., 28 лет, наблюдался в течение 6 лет.
При первой госпитализации зарегистрированы ар-
териальная гипертония, минимальный мочевой син-
дром с упорной микрогематурией, склонность к
ожирению. Креатинин крови 0,096 ммоль/л, КФ
115 мл/мин, мочевая кислота крови 0,31 ммоль/л,
суточная экскреция мочевой кислоты 930—860 мг,
уровень холестерина 5,85 ммоль/л, триглице-
ридов 3,11 ммоль/л. При выписке рекомендова-
ны гипотензивная терапия, низкопуриновая диета.
Во время второй госпитализации через 2 года со-
держание креатинина в крови — 0,123 ммоль/л,
КФ 96 мл/мин, содержание мочевой кислоты в кро-
ви — 0,507 ммоль/л, ее суточная почечная экскре-
ция 560 мг, уровень холестерина 7,41 ммоль/л, триг-
лицеридов 3,377 ммоль/л. На 4-м году заболевания
у больного развился острый артрит I пальца левой
стопы, спустя несколько месяцев — артрит 1 паль-
ца правой стопы.
Типичные для подагры артриты, ожирение
у нескольких родственников по отцовской ли-
нии и склонность к ожирению у самого боль-
ного, наличие гиперлипидемии позволили ус-
тановить первичное нарушение пуринового
обмена. На первом этапе заболевания нормаль-
ный уровень мочевой кислоты в крови поддер-
живался повышенной ее экскрецией почками.
Позже отмечалось снижение урикозурии, раз-
вилась гиперурикемия, присоединились подаг-
рические артриты.
О возможности коррекции повышенного
образования мочевой кислоты в организме с
поддержанием ее нормального уровня в крови
за счет повышенной почечной экскреции нор-
мально функционирующим почечным транс-
плантатом свидетельствует наблюдение за боль-
ным подагрой, перенесшим операцию пересад-
ки почки.
Больной Л., 54 лет, инвалид II группы. В возрас-
те 34 лет зарегистрирована артериальная гипертония,
с 38 лет отмечались рецидивирующие острые арт-
риты, в 42 года и 48 лет перенес мелкоочаговый
инфаркт миокарда. С 39-летнего возраста отмечалась
никтурия. В 46 лет при первом обследовании в клини-
ке выявлена гиперурикемия — 0,554—0,601 ммоль/л,
урикозурия — 530 мг/сут. Диагностированы по-
дагра с поражением почек, хронический интерсти-
циальный нефрит с нарушением концентрационной
и азотовыделительной функции почек (креатинин
крови 0,211 ммоль/л). В период лечения аллопури-
нолом содержание мочевой кислоты колебалось от
0,424 до 0,395 ммоль/л, почечная экскреция моче-
вой кислоты — 420—360 мг/сут. При прекращении
лечения вновь быстро развивалась высокая гиперу-
рикемия и несколько повышалась почечная экскре-
ция мочевой кислоты. Однако с каждым годом ури-
козурия имела тенденцию к снижению, но не па-
дала ниже 300 мг/сут даже в период терминальной
уремии, развившейся после 6 лет наблюдения за па-
циентом. В 50-летнем возрасте больному было нача-
то лечение хроническим гемодиализом и через год
произведена трансплантация почки. Через 6 мес при
нормальном функционировании трансплантата и от-
сутствии азотемии уровень мочевой кислоты был
нормальным — 0,271 и 0,306 ммоль/л, ее суточная
экскреция почти вдвое превышала норму (1120 и
1340 мг/сут).
Внутриканальцевые отложения при гиперу-
рикозурии способствуют снижению почечной
экскреции мочевой кислоты, а в последую-
щем — появлению гиперурикемии. В этой ста-
дии возрастает риск повышения концентрации
уратов в интерстиции и образования микрото-
фусов. Предполагается, что кристаллы представ-
лены в основном мочевой кислотой и моноура-
том натрия. Это подтверждается данными рент-
геноструктурного анализа, который указывает
на то, что мочевая кислота содержится в ос-
новном в системе трубочек, а натрия моно-
урат — в интерстиции [Barlow К.А., 1968].
Вследствие хорошей растворимости солей мо-
чевой кислоты при обычных методах фиксации
и окрашивания они не выявляются и могут об-
наруживаться при поляризационной микроско-
пии только после фиксации спиртом. Отложе-
ние кристаллов натрия моноурата, их агрегация
в подагрические узелки, появление лимфоци-
тов, моноцитов, гигантских клеток и фиброб-
ластов в интерстиции — наиболее характерная
картина при хроническом тубулоинтерстициаль-
ном уратном нефрите.
Клиническая картина у больных ту-
булоинтерстициальным нефритом характеризо-
валась минимальным мочевым синдромом (про-
теинурия, как правило, не превышала 1 г/л),
а нередко не определялась вовсе. Необходимо
425
отметить, что при отсутствии или минималь-
ной протеинурии первыми проявлениями по-
чечной патологии были никтурия и снижение
концентрационной функции почек. Для 70 %
больных характерной являлась микрогематурия,
часто с эпизодами макрогематурии, как пра-
вило, кратковременной, проходящей самосто-
ятельно. Данные проявления нередко возника-
ли на фоне респираторных заболеваний после
нескольких дней лихорадки. В некоторых случаях
наблюдались бурый оттенок мочи и значитель-
ное уменьшение диуреза. Добиться полной лик-
видации мочевого синдрома коррекцией пури-
нового обмена даже на ранних стадиях заболе-
вания достаточно трудно, возможно, вследствие
того, что, по имеющимся экспериментальным
данным, воспалительная реакция в интерсти-
ции в ответ на наличие уратов представлена в
основном мононуклеарными клетками и поэто-
му может быть отнесена к иммуноопосредован-
ной и самоподдерживающейся. В наших наблю-
дениях при морфологическом исследовании
почечных биоптатов у больных гиперурикеми-
ей и гиперурикозурией выявлялся преимуще-
ственно мезангиопролиферативный нефрит.
Значительное распространение известных фак-
торов риска подагры у родственников этих
больных, регистрация у них не только гиперу-
рикемии, но и гиперурикозурии, свидетель-
ствующие о гиперпродукции мочевой кислоты,
позволяют предполагать первичное уратное
поражение почек у этих пациентов и с учетом
этого обсуждать возможность развития иммун-
ного нефрита при подагре. Иммуногистохими-
ческое исследование почечных биоптатов у этих
пациентов обнаруживает свечение иммунных
глобулинов и СЗ-фракции комплемента в поч-
ках, что соответствовало картине типичного
иммунокомплексного гломерулонефрита [Паль-
цев М.А., Варшавский В.А., 1988].
При этом наиболее часто на БМК и в ме-
зангии выявлялось свечение СЗ-фракции и IgG,
реже обнаруживались IgM и IgA. Электронно-
микроскопическое исследование выявило суб-
эндотелиальные и мезангиальные электронно-
плотные депозиты, что подтвердило иммуно-
комплексный генез гломерулонефрита. Особен-
ностью морфологических проявлений иммуно-
комплексного уратного гломерулонефрита яв-
лялась высокая частота и значительная степень
выраженности тубулостромально-сосудистых
изменений почек, подтвержденная при морфо-
метрическом исследовании полутонких срезов
почечных биоптатов с обнаружением значитель-
ного увеличения относительной площади ин-
терстиция, превышающей нормальную долю
стромы почти в 3 раза.
Исследование особенностей клеточного им-
мунитета с помощью РТМЛ выявило относи-
426
тельно низкую частоту клеточной сенсибили-
зации к антигену БМК и большую частоту кле-
точной реактивности на нефритогенную фрак-
цию антигена щеточной каемки проксимальных
извитых канальцев, что в определенной мере
объясняет сочетанное поражение клубочков и
канальцев у подобных больных. Эти данные
расширяют представления о возможных вари-
антах поражения почек при нарушении пури-
нового обмена и, помимо таких известных
форм, как острая мочекислая блокада, нефро-
литиаз и тубулоинтерстициальный нефрит,
включают в себя развитие иммунных реакций.
Последнее значительно осложняет проблему
идентификации первичной подагрической не-
фропатии, особенно на ранних стадиях заболе-
вания [Thiele Р. et al., 1986].
В последние годы особенно заметно учаще-
ние вторичных гиперурикемий, обусловленных
применением различных лекарств (тиазидовые
диуретики, салицилаты, цитостатики) и зло-
употреблением алкоголем. Гиперурикемия не-
редко обнаруживается при поликистозе почек,
анальгетической и свинцовой нефропатии, у
больных амилоидозом почек. Попытки норма-
лизации урикемии при ее высоком исходном
уровне, по-видимому, целесообразно проводить
как можно раньше с целью предупреждения
дополнительного поражения почек солями мо-
чевой кислоты или развития подагры.
Таким образом, патогенез поражения почек
при нарушении пуринового обмена определя-
ется взаимоотношением концентрации уратов
в крови, канальцевой жидкости, интерстиции.
Можно выделить стадии развития заболевания:
гиперурикозурическую нефропатию с типичны-
ми для этого периода нефролитиазом, эпизо-
дами неполной канальцевой уратной блокады,
прогрессированием интерстициальных измене-
ний и парциальным нарушением почечной
экскреции мочевой кислоты; гиперурикемичес-
кую нефропатию с повышением уровня моче-
вой кислоты в крови, возможным развитием
подагрического артрита и нефроангиосклероза
с ХПН.
Помимо гематурии и нефролитиаза, по мере
прогрессирования почечного процесса становит-
ся более выраженной артериальная гипертония,
нередко сочетающаяся с ранним развитием об-
щего атеросклероза. Яркое описание этой кли-
нической картины приводит Е.М.Тареев (1948),
ассоциируя этих больных с ожирелыми гипер-
стениками, у которых возможны нарушение
белкового обмена, «засорение» крови холесте-
рином, мочевой кислотой, а в семейном анам-
незе констатируются случаи смерти от кровоиз-
лияния в мозг, инфаркта миокарда, сердечной
недостаточности, уремии, а также ожирение и
различные проявления «артритизма».
Нарушение пуринового обмена небезразлич-
но для почек, что необходимо учитывать при
трактовке обнаруживаемых минимальных при-
знаков их поражения. Это прежде всего важно
при уже выявленной патологии, когда коррек-
ция сдвигов в пуриновом обмене может ока-
зать существенное влияние на почечный про-
гноз. Но не меньшее значение имеет насторо-
женность, касающаяся возможного в будущем
поражения почек у лиц, у которых отмечают-
ся лишь факторы риска нарушения обмена
мочевой кислоты. Указанная категория лиц дол-
жна не только динамически наблюдаться и быть
объектом при необходимости целенаправленно-
го изменения образа жизни. Переедание, как и
гиподинамия, — несомненный фактор риска
заболевания подагрой. Поэтому как в предуп-
реждении, так и в лечении ее умеренно кало-
рийная диета с ограничением пуринов и актив-
ный образ жизни имеют решающее значение.
В комплекс мероприятий, направленных на
предупреждение дальнейшего прогрессирования
подагры, необходимо включать поддержание
достаточного объема плазмы. Поэтому обильное
питье (до 2 л и более жидкости в сутки) явля-
ется важным условием лечения подагры. Сле-
дует иметь в виду возможность усугубления ар-
териальной гипертонии, если обильное питье
не сочетается с соответствующей гипонатрие-
вой диетой. Коррекции артериальной гиперто-
нии принадлежит существенная роль, так как,
помимо известных, связанных с повышением
артериального давления факторов риска разви-
тия инфаркта миокарда и инсульта, отмечает-
ся снижение экскреции уратов. При подагре
противопоказаны препараты, способствующие
гиперурикемии, в частности тиазидовые моче-
гонные, салицилаты и др. Необходимо учиты-
вать, что при снижении относительной плот-
ности мочи или клубочковой фильтрации ис-
пользование урикозурических средств нецеле-
сообразно, как и при мочекаменной болезни.
В то же время и урикостатические препараты
(аллопуринол) даже при начальной почечной
недостаточности значительно чаще вызывают
такие побочные реакции, как головная боль,
диарея, лихорадка, экзантемы, поражение пе-
чени с повышением содержания билирубина,
трансаминаз, щелочной фосфатазы и такого
крайне тяжелого осложнения, как токсический
эпидермальный некролиз [Kantor G.L., 1970;
Andrade R. J., 1997]. Прямая зависимость меж-
ду клиренсом креатинина и клиренсом окси-
пуринола — главного метаболита аллопурино-
ла — является, по-видимому, основным фак-
тором, ведущим к учащению побочного дей-
ствия аллопуринола при ухудшении функции
почек. Поэтому при ХПН аллопуринол следует
применять в значительно меньших дозах, под-
бирая их индивидуально, контролируя содер-
жание мочевой кислоты в крови и тщательно
наблюдая за больным с целью ранней диагно-
стики осложнений.
У всех больных, получающих аллопуринол,
необходима профилактика ксантинового нефро-
литиаза, что достигается поддержанием боль-
шого диуреза и подщелачиванием мочи.
При обнаружении иммунокомплексного по-
ражения почек у больных нефропатией с на-
рушением пуринового обмена в целях стабили-
зации почечного процесса возможно использо-
вание методов сочетанного лечения урикоста-
тическими препаратами и общепринятыми ме-
тодами лечения хронических гломерулонефри-
тов. Учитывая, что основным клиническим
признаком нефропатии при нарушении пури-
нового обмена является умеренный мочевой
синдром, нередко сочетающийся с синдромом
артериальной гипертонии, назначение ГК или
цитостатиков не всегда целесообразно. При этом
возникают значительные трудности подбора
дозы аллопуринола в случае необходимости
сочетанного его применения с цитостатиками,
что нередко встречается в гематологической
практике.
Поиски новых подходов к лечению подагри-
ческой нефропатии достаточно обоснованы тем
фактом, что даже длительная коррекция гипер-
урикемии при развернутой картине заболевания
недостаточно эффективна. Совершенно ясна
необходимость раннего включения в програм-
му лечения данных пациентов активной анти-
гипертензивной терапии с достижением макси-
мальной нормализации АД. Крайне важно ис-
ключать из лечения мочегонные препараты, как
известно, усугубляющие нарушение пуринового
обмена. Возможно, раннее выявление наруше-
ний пуринового обмена с его прежде всего не-
лекарственной коррекцией приведет к больше-
му эффекту не только лечения, но и предуп-
реждения развития патологии почек.
Вторичная гиперурикемия при миело-, лим-
фопролиферативных заболеваниях и гемолити-
ческих анемиях:
• истинная полицитемия (эритремия, болезнь
Вакеза);
• вторичные полицитемии (адаптационная при
легочной недостаточности, плетора);
• парапротеинемические гемобластозы (мие-
ломная болезнь, макроглобулинемия Валь-
денстрема);
• гемобластозы;
• лимфомы;
• инфекционный мононуклеоз;
• пернициозная анемия;
• хронические гемолитические анемии;
• гемоглобинопатии.
427
Вторичная гиперурикемия в смешанной
группе болезней:
• псориаз;
• саркоидоз;
• гипер-, гипопаратиреоз;
• гипотиреоз;
• адреналовая недостаточность;
• болезнь Педжета;
• алкогольная болезнь.
Литература
Балкаров И.М. Терапевтические аспекты уратной
нефропатии//Практикующий врач. — 1996. — № 2. —
С. 31-35.
Бритов А.Н., Мухин НА., Елисеева НА., Балкаров
И.М. Изучение взаимосвязей артериального давления
с некоторыми показателями пуринового и электро-
литного метаболизма//Тер. арх. — 1991. — № 1. —
С. 100-104.
Мухин Н.А., Балкаров И.М., Шоничев Д.Г., Лебедева
М.В. Формирование артериальной гипертонии при
уратном тубулоинтерстициальном поражении почек
//Тер. арх. - 1999. - № 6. - С. 23-27.
Мухин Н.А., Серов В.В., Варшавский В.А. и др. Неко-
торые особенности гиперурикемического варианта
нефрита//Тер. арх. — 1986. — № 6. — С. 43—46.
Пальцев М.А., Варшавский В.А., Максимов Н.А., Бал-
каров И.М. Морфологическая характеристика гипер-
урикемического варианта хронического латентного
гломерулонефрита//Арх. патол. — 1988. — № 6. —
С. 8-15.
Пытель Ю.А., Золотарев И.И., Чабанов В.А. и др.
Основные принципы медикаментозной терапии
больных мочекислым (уратным) нефролитиазом. —
М.: Медицина: 1985.
Тареев Е.М. Гипертоническая болезнь. — М.: Медгиз,
1948.
Andrade R.J., de la Mata M., Lucena M.I. et al. Severe acute
hepatitis due to allopurinol in a patient with asymptomatic
hyperuricemia and kidney failure. A review of the literature
and an analysis of the risk factors//Gastroenterol.-Hepa-
tol. - 1997. - Vol. 20 (7). - P. 353-356.
Barlow K.A., Beilin KJ. Renal disease in primary gout//
Q. J. Med. - 1968. - Vol. 37. - P. 79-96.
Bluestone R., Waisman J., Klinenberg J.R. Chronic
experimental hyperuricemic nephropathy — biochemical
and morphological characterization//Lab. Invest. —
1975. - Vol. 3 (3). - P. 273-279.
Kantor G.L. Toxic epidermal necrolylisis, azotemia, and
death after allopurinol therapy//J.A.M.A. — 1970. — Vol.
212. - P. 478-479.
Kaplan N.M. Clinical Hypertension. — Williams &
Wilkins, 1994.
Nickleit V., Mihatch M.J. Uric acid nephropathy and end-
stage renal disease — review of a non-disease//Neph. Dial.
Transp. - 1997. - Vol. 12 (6). - P. 1832-1838.
Richard J., Johnson M.D., Salah D., Kivlighn Ph.D. et al.
Reapraisal of Pathogenesis and Consequences of
Hyperuricemia in Hypertension, Cardiovascular Disease
and Renal Disease// Am. J. Kid. Dis. — 1999. — Vol. 33
(2). - P. 225-234.
SokoloffL. The pathology of gout//Metabolism. — 1957. —
Vol. 6. - P. 230-243.
Stavric B., Johnson W.J., Grict H.C. Uric acid
nephropathy: An experimental model//Proc. Soc. Exp.
Med. - 1969. - Vol. 130. - P. 512-516.
Thiele P., Heidelmann G. Hyperurikamie und Gicht. —
Jena: VEB Gustav Fischer Verlag, 1986.
Гпава 20
ТУБЕРКУЛЕЗ ПОЧКИ
Ю. Г. Аляев, В. В. Борисов
Туберкулез почки занимает первое место
среди внелегочных органных форм туберкуле-
за: он наблюдается в 30—40 % случаев первич-
ных легочных поражений [Грунд В.Д., 1975;
Пытель Ю.А., 1995].
Внелегочный туберкулез — условное понятие,
объединяющее формы туберкулеза любой лока-
лизации, кроме легких и других органов дыха-
ния. В соответствии с клинической классифи-
кацией туберкулеза, принятой в нашей стране,
кроме почек, мочевых путей и половых орга-
нов, к ним относят туберкулез мозговых обо-
лочек и центральной нервной системы, кишеч-
ника и брыжеечных лимфатических узлов, ко-
стей и суставов, кожи, периферических лим-
фатических узлов и пр.
Если в первой половине XX в. значительным
приоритетом среди внелегочных форм туберку-
леза обладал костно-суставной, в 50—60-е годы
до настоящего времени он сменился урогени-
тальным. Обычно туберкулезное поражение
почки возникает на фоне относительного при-
обретенного иммунитета, когда первичный ту-
беркулез теряет свою активность спустя 5—10
лет и более. По данным А.Л.Шабада (1978), у
75 % больных интервал между проявлениями
внепочечного и почечного туберкулеза превы-
сил 15 лет. Другие литературные данные пос-
ледних лет свидетельствуют о постепенном уд-
линении этого периода.
Из общих патогенетических факторов осно-
вополагающими являются инфицированность
туберкулезными микобактериями или наличие
туберкулезного очага, ослабление иммунобио-
логических сил и реактивности организма. Ту-
беркулез легких или других органов в анамне-
зе, внепочечный туберкулез, сосуществующий
с почечным, туберкулез у ближайших родствен-
ников, контакт с туберкулезными больными,
характерные для перенесенного туберкулеза
изменения, выявляемые при рентгеновском
исследовании легких, — все это позволяет за-
подозрить специфическую природу заболевания
почек, а перечисленные моменты анамнеза счи-
тать проявлениями инфицированности. У боль-
шинства больных туберкулезом почки при все-
стороннем обследовании можно обнаружить
поражение специфическим процессом других
органов и систем. Более чем в 50 % случаев у
мужчин туберкулезный процесс затрагивает и
половые органы (предстательная железа, при-
датки, яички). У женщин это наблюдается зна-
чительно реже, не более чем в 5—10 % случа-
ев. Туберкулез почки встречается одинаково
часто у мужчин и женщин и, как правило, воз-
никает в возрасте 30—50 лет [Пытель Ю.А.,
1995; Лопаткин Н.А., 1998; Шабад А.Л., 1978].
Особую актуальность диагностика и терапия
урогенитального туберкулеза приобретает сегод-
ня, когда наметилась выраженная тенденция
роста заболеваемости туберкулезом легких. Кли-
ницисты — урологи и нефрологи — должны
быть всесторонне подготовлены к своевремен-
ному выявлению и лечению этих больных, зна-
чительный рост числа которых в ближайшие
годы неизбежен.
Этиология и п а т о г е н е з. Возбудителем
специфического процесса наиболее часто явля-
ются микобактерии туберкулеза человеческого
типа. Они представляют собой тонкие, прямые
или слегка изогнутые палочки длиной 1 —
10 мкм, шириной 0,2—0,6 мкм, при окраске по
Цилю — Нильсену гомогенные или зернистые
со слегка закругленными концами, в препара-
те склонны выстраиваться в цепочку (стрепто-
бациллы). Вне организма они весьма устойчи-
вы даже под влиянием дезинфектантов, выде-
ляющих свободный активный хлор, их гибель
происходит через 3—5 ч. Основным источником
возбудителей инфекции является больной, вы-
деляющий микобактерии в окружающую среду.
Основной путь проникновения возбудителя в
почку гематогенный. Это происходит, как пра-
вило, на этапе формирования легочного оча-
429
га, когда «нестерильный» иммунитет к возбу-
дителю должным образом не действует.
Гематогенное проникновение микобактерий
туберкулеза приводит к инфицированию обеих
почек. Какой-либо разницы в частоте поражения
правой и левой почки установить не удается.
Несмотря на инфицирование обеих почек, пос-
ледующее развитие специфического воспали-
тельного процесса, как правило, наблюдается с
одной стороны. Существование очагов воспале-
ния в противоположной почке может носить ла-
тентный характер, редко они могут подвергать-
ся обратному развитию. Для развития туберку-
леза почки должны возникнуть определенные
местные условия. Ими служат локальные рас-
стройства кровообращения, в основе которых
могут быть и заболевания, и нарушения пасса-
жа мочи, сопровождающиеся гипоксией корко-
вого слоя почки. Именно этим можно объяснить
тот факт, что в начальных стадиях туберкулез-
ного воспаления в почке изменения локализу-
ются преимущественно в корковом веществе.
Морфологические изменения. Ха-
рактерным морфологическим признаком тубер-
кулезного процесса любой локализации и поч-
ки в частности является очаг специфического
воспаления {туберкулезный бугорок), в котором
могут наблюдаться черты инфильтративной, де-
структивной и пролиферативной фаз воспале-
ния. В центре такого очага, как правило, име-
ется участок казеозного некроза, окруженный
валом лимфоидных, эпителиоидных и гигант-
ских клеток Пирогова — Лангерганса. Характер-
ной чертой туберкулезного, как, впрочем, и
всякого специфического воспаления, является
выраженная продуктивная тканевая реакция,
стремящаяся к формированию гранулемы — от-
граничению очага от окружающих здоровых
тканей. Эти очаги в процессе развития воспа-
ления могут сливаться между собой, подвер-
гаться дальнейшему казеозному некрозу и рас-
плавлению с образованием каверны. Однако
процесс не всегда бурно прогрессирует: защит-
ные силы организма могут уменьшить и при-
остановить развитие заболевания. При этом воз-
никает зона перифокального воспаления, в
стенке каверны появляются фиброзные волок-
на, она становится более плотной (фиброзно-
кавернозная стадия). Конечным этапом разви-
тия воспалительного процесса является рубце-
вание нередко с петрификацией (обызвествле-
нием).
При поражении почки туберкулезом в пато-
логический процесс быстро вовлекаются моче-
вые пути: возникают специфический каликопи-
елит, уретерит, цистит [Мочалова Т.П., 1976].
На слизистой оболочке появляются туберкулез-
ные высыпания в виде бугорков, при некрозе
которых возникают язвы, способные быстро
430
подвергаться рубцеванию с развитием грубой
соединительной ткани, что обусловливает сте-
ноз шейки чашечки и гидрокаликоз, сужения
лоханочно-мочеточникового сегмента с появ-
лением гидронефротической трансформации и
мочеточника, чаще в терминальном отделе, с
уретерогидронефрозом. Нарушения оттока
мочи, ее ретенция в проксимально расположен-
ных отделах мочевых путей усугубляют рас-
стройства уро- и гемодинамики почки, что
способствует бурному прогрессированию тубер-
кулезного процесса [Шабад А.Л., 1978: Эпш-
тейн И.М., 1941].
Классификация. Динамику развития
специфического воспалительного процесса в
почке отражает классификация, представленная
школой Н.А. Лопаткина. В зависимости от объе-
ма и глубины поражения почечной паренхимы
она предполагает I стадию — недеструктивный
(инфильтративный) туберкулез почки, за кото-
рой следует II стадия — начальная деструкция,
сопровождающаяся папиллитом или небольши-
ми (не более 1 см в диаметре) одиночными ка-
вернами. В III стадии {ограниченная деструкция)
наблюдаются каверны больших размеров или
поликавернозный процесс в одном из сегмен-
тов почки. В IV стадии имеет место тотальная
или субтоталъная деструкция — поликаверноз-
ный туберкулез двух и более сегментов, тубер-
кулезный пионефроз, омелотворение почки.
С позиций клинициста стадии и формы раз-
вития туберкулезного процесса в почке более
конкретно могут быть описаны путем оценки
клинико-рентгенологических форм почечного
туберкулеза, также принятых и применяемых во
фтизиоурологической практике. К ним относят-
ся туберкулез почечной паренхимы, характеризу-
ющийся множественными воспалительными
очагами в почечной коре и медуллярной зоне.
Второй формой, характеризующей в большей
степени деструктивные тенденции, является
туберкулезный папиллит, когда процесс лока-
лизуется в основном в почечном сосочке. По-
ражение может быть как одиночным, так и мно-
жественным. Кавернозный процесс может воз-
никать в корковом веществе, распространяясь
на мозговое, и приобретать сообщение с про-
светом чашечки, куда постепенно отторгаются
казеозные массы, приводя к образованию оди-
ночной или множественных полостей {каверноз-
ный туберкулез почки). Иногда на фоне тубер-
кулезного папиллита наступает преимуществен-
ное поражение одной или нескольких шеек
чашечек с последующим стенозированием и об-
литерацией. При этом возникает полость, со-
стоящая из зоны разрушенного сосочка и ре-
тенционно измененной чашечки, и, как пра-
вило, возникает фиброзно-кавернозный туберку-
лез, а очаг деструкции и воспаления подверга-
ется «выключению», которое характеризует со-
ответствующую клинико-рентгенологическую
форму течения специфического процесса в
почке [Пытель Ю.А., 1995; Лопаткин Н.А.,
1998].
Одно из проявлений действия защитных сил
организма — выраженное ограничение специ-
фического воспалительного очага с пропиты-
ванием зоны поражения солями кальция. В ре-
зультате образуются так называемые казеомы
или туберкулемы, а процесс носит характер
омелотворения почки. Несмотря на такой, ка-
залось бы, более благоприятный исход тубер-
кулезного поражения, его не следует считать
неактивным. Очень часто после резекции оме-
лотворенного участка почки или нефрэктомии
исследование очага поражения позволяет убе-
диться в активности туберкулезного процесса.
При возникновении стеноза и облитерации
лоханочно-мочеточникового сегмента, как пра-
вило, деструкция прогрессирует и завершается
специфическим казеозным расплавлением по-
чечной паренхимы с формированием туберку-
лезного пионефроза, который является последней
клинико-рентгенологической формой туберку-
леза почки.
Диагностика. Туберкулез относится к он-
тофилогенетически наиболее «старым» инфек-
ционным заболеваниям человека, организм ко-
торого за долгое время приспособился к воз-
будителю, сделав ряд клинических проявлений
нерезко выраженными, порой нехарактерными,
а течение заболевания, за редким исключени-
ем, более вялым, имеющим черты подострого
и хронического процесса. Несмотря на подроб-
но описанные клинические, лабораторные и
другие проявления этого распространенного
заболевания, успехи фтизиатрии, урологии и
нефрологии, диагноз, к сожалению, далеко не
всегда ставится быстро и своевременно, что ли-
шает пациента возможности полноценного кон-
сервативного лечения и делает исход болезни
далеко не всегда благоприятным. Достаточно
подчеркнуть, что, по данным исследований
отечественных и зарубежных авторов, многие
больные впервые выявленным туберкулезом
почки страдают тяжелыми запущенными фор-
мами заболевания и нуждаются в нефрэктомии.
Так, за рубежом, по сообщению ABenchekroun
(1987), этот процент составлял 54,0; в нашей
стране, по данным И.Ю.Старикова (1995), он
несколько превысил 13 %. Следует подчеркнуть,
что такая поздняя диагностика почечного ту-
беркулеза обусловлена не столько нетипичным
или скрытым течением болезненного процес-
са, сколько недостаточной и порой неверной
информацией практических врачей об этом
серьезном и нередком заболевании. По данным
Московского фтизиоурологического центра,
длительность периода с момента обращения к
урологу до установления диагноза туберкулеза
почки составляет от 2 до 8 лет. При этом 12,5 %
больных (каждый 8-й) сами просят уролога
провести дополнительные исследования для
выявления туберкулезного процесса. Определен-
ную отрицательную роль в отсутствие насторо-
женности практических врачей, касающейся
почечного туберкулеза, сыграли преждевремен-
ные утверждения организаторов здравоохране-
ния СССР в 60—70-е годы о том, что туберку-
лез в нашей стране во многом побежден.
Клинические проявления туберкулеза почки
немногочисленны и мало характерны. Гораздо
большую информацию дает анамнез: перенесен-
ный туберкулез легких, лимфатических узлов,
экссудативный плеврит, туберкулез костей и
суставов и пр. заставляют подозревать возмож-
ный туберкулез почки. Большое анамнестичес-
кое значение имеет длительный контакт с ту-
беркулезными больными в семье и быту, в
производственных коллективах, в тюрьме и пр.
В паренхиматозной стадии, когда очаги воспа-
ления имеются лишь в ткани органа, клини-
ческие симптомы могут быть минимальными,
скудными в виде легкого недомогания, изред-
ка субфебрильной температуры. По мере про-
грессирования болезненного процесса могут
наблюдаться боль в поясничной области, мак-
рогематурия и дизурия.
Боль на стороне поражения наблюдается
нечасто, может носить характер тупой ноющей
на фоне развития и прогрессирования инфиль-
тративного воспаления и постепенно развива-
ющихся процессов, нарушающих отток мочи из
почки. При возникновении деструкции, оттор-
жении некротических казеозных масс, особен-
но при наличии изменений лоханочно-мочеточ-
никового сегмента и мочеточника, боль может
напоминать почечную колику со всеми ее кли-
ническими особенностями, сопровождаться
ознобами, лихорадкой, признаками интоксика-
ции. Следует отметить, что при этом яркие
проявления острого воспалительного процесса
в почке могут отсутствовать.
Макроскопическая гематурия при туберку-
лезе почки по сводной статистике встречается
лишь в 8—10 % случаев, не бывает массивной
и редко сопровождается отхождением с мочой
кровяных сгустков. Наиболее часто болезнь про-
является дизурией: частым болезненным моче-
испусканием. Это происходит вследствие ран-
него поражения мочевого пузыря. Так, более
чем у 50 % больных туберкулезом почки при
отсутствии видимых изменений слизистой обо-
лочки мочевого пузыря при тщательном гисто-
логическом исследовании биоптатов, получен-
ных эндовезикально, в подслизистом слое мож-
но обнаружить гигантские клетки Пирогова —
431
Лангерганса, указывающие на специфическое
поражение.
Лабораторные исследования в диагностике
туберкулеза почки играют важную роль. Как ни
странно, но наиболее важную и достоверную
информацию, позволяющую заподозрить тубер-
кулезное поражение, дает общий анализ мочи:
стойкая, резко кислая реакция, протеинурия
(которая является ложной, не превышает 1 %о
и не сопровождается формированием цилинд-
ров), значительная лейкоцитурия, менее выра-
женная микрогематурия при отсутствии баналь-
ной микрофлоры. Посев мочи при этом, не-
смотря на достоверные признаки воспаления
почек и мочевых путей, как правило, бывает
стерильным (асептическая пиурия). При коли-
чественном исследовании мочи (проба Нечипо-
ренко) могут быть получены более достовер-
ные данные, если мочу получают непосред-
ственно из пораженной почки путем катетери-
зации. В сомнительных случаях возможен срав-
нительный анализ лейкоцитурии до и на фоне
провокации подкожным введением туберкули-
на (прототип пробы Коха), увеличивающей ин-
тенсивность лейкоцитурии при наличии специ-
фического процесса. Не менее ценны результа-
ты посева и бактериологического исследования
мочи, полученной непосредственно из пора-
женной почки. Следует подчеркнуть, что сово-
купность описанных лабораторных признаков
непременно должна настораживать любого вра-
ча на наличие специфического поражения.
Обнаружение микобактерий туберкулеза в
моче. Микроскопия осадка суточной мочи, осо-
бенно при использовании методов обогащения
(флотация), позволяет при тщательном осмот-
ре далеко не всегда видеть кислото-спиртоус-
тойчивые стрептобациллы, подозрительные на
микобактерии туберкулеза. На основании этого
достоверно поставить диагноз туберкулезного
процесса сегодня невозможно.
Наиболее достоверным методом диагности-
ки этого заболевания можно по праву считать
бактериологический. Для этого в стерильных
условиях под контролем медицинского персо-
нала в стерильную посуду собирают утреннюю
порцию мочи для посева на специальные элек-
тивные среды. Это позволяет через 3 нед мето-
дом флюоресцентной микроскопии выявить
начальный рост микобактерий и дать ответ, ко-
торый носит ориентировочный характер, а в
течение 3 мес при наличии микобактерий в
моче получить их рост с определением чувстви-
тельности к препаратам. Метод дорогой, требует
специального оснащения микробиологической
лаборатории и подготовки персонала. Подобные
лаборатории работают в составе противотубер-
кулезных диспансеров, их объединений и бо-
лее крупных противотуберкулезных учреждений.
432
Показанием к подобным исследованиям долж-
но быть подозрение на туберкулез, подтверж-
денное анамнестическими, клиническими, ла-
бораторными и другими данными, полученны-
ми в ходе предварительного обследования боль-
ного. Биологические пробы, проведенные внут-
рибрюшинным введением мочи больного мор-
ской свинке, несмотря на чувствительность
(могут быть положительными даже при крайне
низком титре возбудителя вплоть до единичных
микобактерий), сегодня не находят широкого
применения из-за необходимости значительных
финансовых затрат.
В последние годы определенное распростра-
нение получила идентификация микробактерий
туберкулеза методом ПЦР (полимеразная цеп-
ная реакция).
Таким образом, в современных условиях
достоверный диагноз туберкулезного пораже-
ния может быть поставлен лишь с помощью
двух диагностических методов — бактерио-
логического (рост микобактерий туберкулеза
при посеве мочи) и морфологического, когда
при гистологическом исследовании ткани
почки, мочевых путей, биоптата стенки моче-
вого пузыря могут быть выявлены характер-
ные признаки туберкулезного воспаления с
наличием гигантских клеток Пирогова — Лан-
герганса.
Ведущим скрининг-методом диагностики
патологических изменений почек сегодня по
праву следует считать ультразвуковое исследо-
вание. К сожалению, этот метод не позволяет
диагностировать ранние проявления туберкулеза
почки, он эффективен лишь при деструктив-
ных, кавернозных формах данного процесса.
При кавернозном поражении почки удается
выявить округлые эхонегативные образования,
которые окружены плотной оболочкой, дающей
выраженный эхопозитивный эффект. Это свя-
зано с тем, что оболочка каверны в отличие
от кисты представляет собой достаточно плот-
ное образование. Иногда в центре каверны в
жидком содержимом бывают видны отдельные
эхопозитивные включения за счет ее более
плотного и неоднородного содержимого. В зоне
омелотворения при ультразвуково1м исследова-
нии выявляется картина, характерная для мно-
жественных мелких конкрементов с отчетливой
акустической дорожкой. Дифференцировать
множественные камни и инкрустации каверны
невозможно. При пионефрозе ультразвуковая
картина также мало отличается от банального
калькулезного процесса с неспецифическим
гнойным расплавлением почки или терминаль-
ного гидронефроза с той лишь разницей, что
стенки расширенных полостей более плотные.
Ультразвуковая диагностика не позволяет дос-
товерно диагностировать специфический про-
цесс в почке, однако значительно помогает в
установлении точной локализации деструктив-
ных изменений. Результаты ультразвукового
исследования позволяют уточнить показания к
другим лучевым исследованиям, а также дают
возможность судить о регрессии или прогрес-
сировании специфического процесса на фоне
терапии.
Одно из ведущих мест в диагностике тубер-
кулеза почки занимают рентгеновские методы.
На обзорном снимке и нативных нефротомо-
граммах можно видеть усиление контуров поч-
ки, участки обызвествления чаще в случаях,
когда речь идет об омелотворении участка или
всей почки (рис. 20.1). Обычно скопление и
форма теней при омелотворении носят нерав-
номерный, пестрый характер. Большое значе-
ние в получении сведений о характере, лока-
лизации и распространенности туберкулезного
поражения традиционно отводят экскреторной
урографии и ретроградной уретеропиелографии
(рис. 20.2). Экскреторная урография с введени-
ем достаточной дозы контрастного вещества с
применением рентгенотелевидения и видеоза-
писи, цифровой обработкой рентгеновского
изображения, с фиксацией наиболее информа-
тивных этапов исследования статическими рен-
тгенограммами и отпечатками на принтере зна-
чительно повышает свою информативность. Она
может сочетаться с послойной рентгенографи-
ей фонография). Исследование должно прово-
диться полипозиционно — не только в пере-
днезадней проекции на спине, но и в полубо-
ковых, а для получения более отчетливого
изображения сводов, сосочков и чашечек при
подозрении на папиллит — на животе в усло-
виях «физиологической» компрессии верхних
мочевых путей. Кроме признаков разрушения
почечных сосочков и сводов чашечек, экскре-
торная урография позволяет обнаружить округ-
лые полости (каверны), а также признаки де-
формации чашечек, пролиферативных измене-
ний, характеризующих сморщивание лоханки
(симптом «маргаритки»), стенотического пора-
жения лоханочно-мочеточникового сегмента и
мочеточника. При «выключении» очагов дест-
рукции могут наблюдаться ампутация одной
или нескольких чашечек, а также признаки их
сдавления и деформации объемными образова-
ниями, расположенными в паренхиме — вы-
ключенными кавернами. При необратимых тер-
минальных изменениях (туберкулезный пионеф-
роз) пораженная почка может не выделять рен-
тгеноконтрастное вещество. Для детализации де-
Рис. 20.1. Обызвествление в проекции нижнего сег-
мента почки. Прицельный обзорный снимок правой
почки.
структивно-пролиферативных изменений верх-
них мочевых путей и почки, в частности для
выявления каверн, которые могут плохо кон-
трастироваться при экскреторной и инфузион-
ной урографии, во фтизиоурологической прак-
тике широко применяют ретроградную урете-
ропиелографию, которую сочетают с количе-
ственным и бактериологическим исследовани-
ями мочи, полученной при катетеризации не-
посредственно из пораженной почки.
Применение компьютерной и магнитно-ре-
зонансной томографии, особенно с контрасти-
рованием, у больных туберкулезом почки по-
зволяет четко выявлять очаги деструкции, рас-
положенные в паренхиме, поскольку сделать
это непосредственно с помощью экскреторной
урографии и ретроградной пиелоуретерографии
не представляется возможным. Эти методы дают
возможность наглядно оценить взаимоотноше-
ние деструктивных очагов с чашечно-лоханоч-
ной системой, элементами почечного синуса и
магистральными сосудами, а также уточнить
28—2950
433
Рис. 20.2. Туберкулезный папиллит. Экскреторная
урограмма правой почки.
Средняя и нижняя чашечки контрастированы, неравно-
мерно деформированы.
вовлечение в воспалительный процесс регио-
нарных лимфатических узлов.
Почечная ангиография при туберкулезе поч-
ки не дает достоверных отличительных призна-
ков этого заболевания, позволяющих поставить
диагноз. Она помогает уточнить характер кро-
воснабжения пораженного органа, сохранность
паренхимы в целом и по сегментам, оценить
технические возможности выполнения органо-
сохраняющей операции и ее возможный харак-
тер (кавернотомия, кавернэктомия, резекция
почки), что важно в определении лечебной
тактики.
Среди других методов диагностики, особен-
но в сомнительных случаях, применяют так
называемые провокационные тесты с исполь-
зованием туберкулина. Его доза для этих це-
лей обычно составляет 20 ТЕ, при необходи-
мости она может быть увеличена до 100 ТЕ.
После его подкожного введения оценивают
очаговую реакцию путем исследования мочи.
При этом подтверждением специфического
характера воспаления является увеличение
титра форменных элементов в осадке, особен-
но при исследовании почечной мочи. Иногда
удается добиться роста микобактерий туберку-
леза. Поскольку туберкулезный процесс в поч-
ке чаще односторонний, а в пузыре моча раз-
водится за счет контралатеральной стороны,
титр клеток, особенно микобактерий, резко
падает, и результаты провокации при иссле-
довании только пузырной мочи могут быть не-
гативными. Поэтому провокационные туберку-
линовые тесты целесообразно сочетать при
необходимости с катетеризацией соответству-
ющего мочеточника для ретроградной урете-
ропиелографии, чтобы получить мочу непо-
средственно из почки и тем самым повысить
информативность исследования.
Радионуклидные исследования (динамичес-
кая нефросцинтиграфии) позволяют получить
представление о функциональной способно-
сти почки в целом и посегментарно, оцени-
вая динамику поступления, накопления ра-
диофармпрепарата в паренхиме и выведения
его мочевыми путями. При этом возможно
применение изотопных препаратов, тропных
в большей степени к сосудистой, клубочко-
вой и канальцевой системе почки. С успехом
используются сочетания подобных исследова-
ний с провокацией туберкулином. Ухудшение
показателей функции почки после введения
туберкулина по сравнению с исходными кос-
венно указывает на возможность специфичес-
кого поражения.
Туберкулез почки может сочетаться с неспе-
цифическим пиелонефритом, особенно у боль-
ных, подвергавшихся инструментальным диаг-
ностическим обследованиям и массивной анти-
микробной терапии. Подобное сочетание во
многом затрудняет распознавание туберкулез-
ного процесса, поскольку присоединяется вто-
ричная неспецифическая флора, изменяется
реакция мочи в сторону нейтральной или ще-
лочной. Хотя это наблюдается не столь часто,
тем не менее о туберкулезе почки следует все-
гда помнить.
434
Отсутствие должного эффекта на фоне ба-
нальной антибактериальной и противовоспа-
лительной терапии у больных пиелонефри-
том даже при наличии неспецифической
флоры служит показанием к посевам мочи и
бактериологическим исследованиям для ди-
агностики туберкулеза.
Дифференциальная диагностика
при туберкулезе почки должна проводиться с
гидронефрозом, уретерогидронефрозом, пиело-
нефритом, особенно с исходом в пионефроз и
наличием гнойных свищей в поясничной обла-
сти. Рентгенологические признаки процесса не-
обходимо отличать от медуллярного некроза,
осложняющего течение гнойного пиелонефри-
та, аномалий медуллярного вещества (губчатая
почка, дивертикул чашечки, мегакаликс, ме-
гакалиоз). Выключенные деструктивные очаги
при туберкулезе могут походить на кистозные
и плотные опухолевидные образования в парен-
химе, деформирующие контуры почки и чашеч-
но-лоханочную систему. Критериями в этих
случаях должны быть сопоставления клиничес-
ких, лабораторных, ультразвуковых, рентгено-
вских и других данных. Стойкая дизурия и пи-
урия являются показанием к исключению ба-
нального хронического воспаления с помощью
лабораторных исследований мочи в 2 порциях
(у мужчин в 3 порциях) с исследованием сек-
рета простаты и бактериологических исследо-
ваний, а также уретроцистоскопии и эндове-
зикальной биопсии.
Лечение больных туберкулезом почки
должно быть индивидуальным и включать при-
менение специфических противотуберкулезных
средств [Пытель Ю.А., 1995; Лопаткин Н.А.,
1998]. Они делятся на основные (первого ряда)
и резервные. К первому ряду принято относить
производные ГИНК (тубазид и пр.), рифампи-
цин, этамбутол и стрептомицин, к резерв-
ным — препараты второго ряда: этионамид,
протионамид, циклосерин, ПАСК, канамицин
и др. Лечение противотуберкулезными средства-
ми должно быть комплексным с использовани-
ем всего арсенала средств, индивидуальной до-
зировкой с учетом характера и стадии процес-
са, общего состояния больного, тяжести тубер-
кулезной интоксикации, состояния других ор-
ганов и систем. Следует учитывать, что многие
противотуберкулезные препараты способны
нарушать функцию печени и почек, вызывать
тяжелый дисбактериоз, аллергические и другие
нежелательные побочные действия. Консерва-
тивная медикаментозная терапия должна соче-
таться с приемом ангиопротекторов и неспе-
цифических нестероидных противовоспалитель-
ных средств, предотвращающих пролиферацию
грубой соединительной ткани. Более предпоч-
тительны вольтарен и его аналоги, которые в
отличие от производных индометацина в мень-
шей степени при длительном приеме оказыва-
ют повреждающее действие на эпителий почеч-
ных канальцев. При наличии признаков нару-
шения оттока мочи из пораженной почки он
должен быть восстановлен с помощью катете-
ра-стента или нефростомии. Консервативное
лечение, проводимое на первых этапах, долж-
но быть длительным (6—9 мес, иногда до года).
Лишь после оценки результатов консервативной
терапии в случаях деструктивного туберкулеза
почки решается вопрос об оперативном лече-
нии.
При туберкулезном пионефрозе длительное
лечение туберкулостатиками бесперспективно.
Бывает достаточно курса предоперационной
терапии в течение 2—3 нед с последующей
нефрэктомией и продолжением специфическо-
го лечения для предотвращения вспышки ту-
беркулезного процесса в единственной остав-
шейся почке. Если деструктивный процесс но-
сит локальный характер и расположен в одном
из сегментов почки, специфическая терапия
должна сочетаться в дальнейшем с удалением
(резекция почки, кавернэктомия) или санаци-
ей (кавернотомия) измененных участков. Если
ангиоархитектоника пораженной почки позво-
ляет (это подтверждается данными комплекс-
ной ангиографии), среди органосохраняющих
операций следует отдавать предпочтение резек-
ции почки с последующей специфической ме-
дикаментозной терапией. Двустороннее пораже-
ние туберкулезом или туберкулез единственной
почки приводит к развитию хронической по-
чечной недостаточности [Шабад А.Л., 1978].
При этом не исключена необходимость соот-
ветствующего консервативного лечения у не-
фролога и применения различного вида мето-
дов очищения крови (перитонеальный диализ,
гемодиализ).
Туберкулез почки, сочетаясь с туберкулезом
мочевых путей, в виде каликопиелита, урете-
рита, цистита создает условия для нарушения
пассажа мочи из верхних мочевых путей. По-
скольку именно это является ведущим факто-
ром в нарушениях почечного кровообращения,
во многом обусловливающих прогрессирование
специфического процесса в почке, раннее вос-
становление оттока мочи служит немаловажным
фактором комплексной терапии. Именно оно во
многом определяет успех противотуберкулезно-
го лечения. Его осуществляют в специализиро-
ванных фтизиоурологических отделениях с по-
мощью установления в мочевые пути внутрен-
него катетера-стента, пункционной нефросто-
мии под ультразвуковым и рентгеновским кон-
28*
435
тролем или оперативным путем. Это особенно
важно в условиях почечной недостаточности
при туберкулезе единственной почки. Прогноз
течения туберкулеза почки может быть оценен
как благоприятный лишь при условии ранней
диагностики и успешной консервативной тера-
пии.
Диспансеризация. Каждый клини-
цист — уролог, нефролог, интернист, фтизи-
атр, работая в амбулатории и в стационаре,
должен помнить, что туберкулез почки суще-
ствует. Особенно важно помнить об этом, стал-
киваясь с воспалительными заболеваниями
почек и мочевых путей, протекающими упор-
но с отсутствием должного эффекта антибак-
териальной и противовоспалительной терапии,
с признаками деструктивных изменений в поч-
ке. При подозрении на туберкулез почки и
мочевых путей необходимо направить больно-
го в специализированное противотуберкулезное
учреждение (диспансер, больницу, институт и
пр.), где в кратчайшие сроки должно быть про-
ведено соответствующее всестороннее обследо-
вание. Положительный результат отмечен в
Москве, где на базе Клинической противоту-
беркулезной больницы № 7 уже более 25 лет
успешно функционирует городской фтизиоуро-
логический центр, объединяющий всех фтизио-
урологических больных и всех урологов район-
ных противотуберкулезных диспансеров, име-
ющий современную амбулаторию и фтизиоуро-
логический стационар для консервативного и
оперативного лечения. Медикаментозное лече-
ние должно осуществляться в диспансерах, спе-
циализированных больницах и санаториях при
условии своевременного клинического, лабора-
торного, ультразвукового и рентгенологическо-
го контроля.
Все больные, перенесшие туберкулез легких,
несмотря на наступившее клиническое изле-
чение, должны находиться на диспансерном
учете и периодически подвергаться обследо-
ванию. Через 5—10, а иногда и 15 лет у них
может возникнуть туберкулез почки. Система-
тические (не реже 2 раз в год) анализы мочи,
ежегодное ультразвуковое исследование по-
чек могут во многом помочь раннему выяв-
лению туберкулеза почки и позволят тем са-
мым улучшить результаты лечения этого за-
болевания.
Литература
Грунд В.Д. Ошибки в диагностике и лечении тубер-
кулеза органов мочеполовой системы. — М.: Меди-
цина, 1975.
Мочалова Т.П. Туберкулез мочевых путей. — Ташкент:
Медицина, 1976.
Пытель Ю.А. Туберкулез почки//Нефрология: Руко-
водство/Под ред. И.Е.Тареевой. — М.: Медицина,
1995. -Т. 2. - С. 370-377.
Руководство по урологии/Под ред. Н.А.Лопаткина. —
М.: Медицина, 1998. — Т. 2. — С. 450—630.
Шабад А.Л. Патогенез и диагностика туберкулеза
почки. — Ташкент, 1978.
Эпштейн И.М. Туберкулез почки. — М., 1941. — 288 с.
Гпава 21
ПОЛИКИСТОЗ ПОЧЕК
И. М. Куш ырина
Поликистоз почек, известный также под на-
званием аутосомно-доминантная поликистозная
болезнь взрослых (АДПБВ), представляет собой
наследственное заболевание, относящееся к
группе кистозных болезней почек. Поликистоз
взрослых — самая частая форма из этой груп-
пы почечных болезней. Частота его в популя-
ции составляет приблизительно 1:1000 населе-
ния, что соответствует выявлению около 6000
новых случаев болезни в год в таких странах,
как Россия и США. У подавляющего большин-
ства больных поликистозом почек развивается
почечная недостаточность. Среди больных уре-
мией, леченных хроническим гемодиализом,
больные поликистозом почек составляют в
среднем 8—10 % [Matson М.А., 1990].
Кисты в почках являются определяющим
фактором для всей группы кистозных болезней.
Кисты представляют собой наполненные жид-
костью структуры различной величины, выст-
ланные одним слоем измененного канальцево-
го эпителия. Кисты обнаруживают повсемест-
но: в корковом и мозговом слое почек, в об-
ласти лоханок почек и окололоханочной обла-
сти, реже на полюсах почки. Размер кист и
количество жидкости в них широко варьируют:
малые кисты (менее 2 мм в диаметре) содер-
жат, как правило, не более 3 мл жидкости, в
то время как в больших кистах количество
жидкости может исчисляться литрами. Кисты в
почках могут иметь как одинаковый размер (при
поликистозе у детей), так и существенно раз-
личаться по форме и размеру (при поликисто-
зе у взрослых). По мере прогрессирования бо-
лезни число кист возрастает, увеличиваются их
размер и соответственно размер почек, повер-
хность которых становится неровной, похожей
на «виноградную кисть». Почки при поликис-
тозе могут достигать в длину 40 см и весить
более 8 кг [Пытель Ю.А., 1995].
При гистологическом исследовании ткани
почек кисты выявляют по ходу проксимальных
и дистальных канальцев, петли Генле, собира-
тельных трубочек, в области капсулы клубочка
(боуменовой капсулы). При этом кистозные
изменения сосуществуют с участками неизме-
ненной почечной паренхимы. В «проксималь-
ных» кистах концентрация натрия, калия, хло-
ридов, ионов водорода, креатинина и мочеви-
ны не отличается от плазменной, в содержи-
мом «дистальных» кист она значимо ниже.
Жидкость в кистах, как правило, сообщает-
ся с канальцевым содержимым, ряд кист мо-
жет иметь сообщение с кровеносными сосуда-
ми почек и редко — с содержимым почечной
лоханки.
Поликистоз почек взрослых — генетически
детерминированное заболевание, которое насле-
дуется по аутосомно-доминантному типу. Это
означает, что вероятность развития заболевания
у детей, родители которых страдают поликис-
тозом почек, составляет 50 %. Нет различий в
наследовании болезни в зависимости от того,
является ли носителем патологического гена
отец или мать, равным образом нет половых
различий и при наследовании самого заболе-
вания.
В настоящее время различают несколько ге-
нетических вариантов АДПБВ. Первый (тип 1) —
наиболее часто встречающийся вариант — вы-
являют примерно у 85 % всех больных. Он свя-
зан с дефектом гена в коротком плече 16-й
хромосомы. Второй вариант (тип 2) с частотой
выявления 10—15 % определен дефектом гена
в 4-й хромосоме [Kimberling W.J. et al., 1993].
Предполагается существование и поликистоза
типа 3, хотя убедительных данных о локализа-
ции патологического гена пока не получено
[Daoust М.С.,1995]. Локализация генных нару-
шений влияет на естественное течение поли-
кистоза взрослых: при типе 1 наблюдается са-
мый быстрый темп развития почечной недоста-
точности, в то время как при типах 2 и 3 тече-
ние поликистоза благоприятно и развитие тер-
437
минальной почечной недостаточности выявля-
ют в возрасте больных старше 70 лет [Ravine D.
et al.,1992].
21.1. Этиология и патогенез
Этиология поликистоза взрослых и механизм
кистообразования в настоящее время оконча-
тельно не определены. Активное изучение кле-
точных механизмов, лежащих в основе кисто-
образования, привело к заключению, что важ-
нейшими звеньями этого процесса являются:
• клеточная пролиферация, приводящая к
обструкции канальцев, повышению внутри-
канальцевого давления и растяжению ка-
нальцев [Klingel R. et al., 1992];
• наследственная нарушенная растяжимость
базальной мембраны канальцев, приводящая
к расширению канальца даже при наличии
нормального внутриканальцевого давления
[Wilson P.D. et al., 1993];
• избыточное накопление жидкости, которое
может быть связано с нарушенной полярно-
стью натриевого насоса и соответствующим
поступлением натрия внутрь кисты, а не в
кровь, а также с продукцией эпителиальны-
ми клетками кист нейтральных жировых те-
лец, которые способствуют накоплению
жидкости внутри кисты [Hayashi М. et al.,
1997; Zeiler М. et al., 1988].
Следует иметь в виду, что поликистоз раз-
вивается под воздействием ряда факторов. Среди
них химические и лекарственные вещества —
инсектициды, консерванты продуктов, дифенил-
амин, все антиоксиданты, препараты лития,
аллоксан и стрептозотоцин, ряд противоопухо-
левых препаратов, в том числе цисплатин и др.
[Kenneth D., Gardner Jr., 1988; Grantham J.J.,
1997]. У больных, имеющих ген поликистоза,
воздействие перечисленных выше факторов
проявляется более ранним развитием клиничес-
ких признаков болезни.
21.2. Почечные проявления
поликистоза почек
Первые клинические признаки АДПБВ, как
правило, развиваются в возрасте около 40 лет,
однако начало болезни может быть как более
ранним (до 8 лет), так и более поздним (после
70 лет).
Двумя наиболее частыми клиническими сим-
птомами поликистоза почек являются боль в
брюшной полости (или спине) и гематурия.
Боль в брюшной полости, чаще развивающа-
яся у женщин, возникает на ранней стадии
438
болезни, может быть периодической или посто-
янной и различной по интенсивности. У подав-
ляющего большинства больных боль достаточ-
но интенсивна и часто вынуждает больных
принимать большое количество анальгетиков,
в том числе нестероидных противовоспалитель-
ных препаратов, которые в подобной ситуации
могут способствовать развитию артериальной
гипертензии и снижению почечных функций.
Нередко интенсивность болей требует введения
наркотических анальгетиков. Генез болевого
синдрома связывают с растяжением капсулы
почек.
Гематурия, чаще микрогематурия, — второй
ведущий симптом поликистоза. Однако более
чем у трети больных течение болезни ослож-
няется периодическими эпизодами макрогема-
турии. Провоцирующими факторами их разви-
тия могут быть даже незначительная травма или
массивная физическая нагрузка. Увеличивается
частота макрогематурии у больных с резко уве-
личенными почками и при наличии высокой
артериальной гипертонии. Наличие этих факто-
ров следует рассматривать как риск развития
почечного кровотечения. Причинами гематурии
являются также истончение или разрывы сосу-
дов в стенке кисты, инфаркты почки, инфек-
ция или пассаж почечных камней.
Артериальная гипертония выявляется у 60 %
больных поликистозом почек до развития у них
хронической почечной недостаточности. Повы-
шение артериального давления может быть пер-
вым клиническим признаком поликистоза по-
чек и развиваться уже у подростков; по мере
увеличения возраста частота артериальной ги-
пертензии увеличивается. Потеря циркадного
ритма АД с сохранением его высоких значений
или даже повышением в ночные и ранние ут-
ренние часы — характерная черта артериальной
гипертонии при поликистозе почек. Подобный
характер артериальной гипертонии и длительное
ее существование оказывают свое повреждающее
действие на такие органы-мишени, как сердце,
вызывая развитие гипертрофии левого желудочка
и недостаточность его кровоснабжения, что со-
здает угрозу развития инфаркта миокарда, а
также на почки, значимо ускоряя темп прогрес-
сирования почечной недостаточности.
Генез артериальной гипертонии в первую
очередь связывают с ишемическим компонен-
том, ведущим к активации ренин-ангиотензи-
новой системы (РАС). Показано, что сдавление
соседними кистами почечных сосудов вызыва-
ет повышенное образование в почках ренина с
активацией как системной, так и локально-по-
чечной РАС. Приводятся сообщения и о ати-
пичной локализации продукции ренина в поч-
ках [Harrap S.B. et al., 1991]. Другим звеном
патогенеза артериальной гипертонии является
задержка натрия в организме. Несмотря на при-
сущую поликистозу почек инверсию полярно-
сти натриевого насоса, в последние годы до-
казан факт почечной ретенции натрия при этой
патологии [Schmid М. et al., 1990; Schwenger V.,
Zeier M., 1999].
Протеинурия при поликистозе почек, как
правило, невелика (до 1 г в сутки). Умеренная
или выраженная протеинурия ускоряет разви-
тие почечной недостаточности и ухудшает
длительный прогноз больных поликистозом.
Примерно у 60 % больных в моче определяют
липидные тельца, местом происхождения ко-
торых считают неповрежденные кистами почеч-
ные канальцы или сообщающиеся с канальца-
ми малые кисты [Duncan К.А. et al., 1985].
Инфекция мочевых путей осложняет течение
болезни примерно в 50 % случаев. У женщин
она развивается чаще, чем у мужчин. При по-
ликистозе почек инфекция мочевых путей мо-
жет проявляться циститом и пиелонефритом.
Развитие высокой лихорадки, усиление боле-
вого синдрома, появление пиурии без лейко-
цитарных цилиндров, а также нечувствитель-
ность к стандартной для пиелонефрита терапии
свидетельствуют в пользу проникновения ин-
фекции внутрь почечных кист. В этих ситуациях
помогают подтвердить диагноз данные ультра-
звукового исследования, сканирования с гал-
лием или результаты компьютерной томогра-
фии почек.
При исследовании почечных функций обра-
щают на себя внимание возникающие на самых
ранних этапах болезни снижение относительной
плотности мочи, развитие полиурии и никту-
рии [Gabow Р.А. et al., 1989]. В основе наруше-
ний концентрационной функции почек лежит
не столько наличие самих кист в мозговом слое
почек, сколько структурные изменения в ка-
нальцах и интерстиции [Grantham J.J., 1997].
21.3. Внепочечные проявления
и осложнения поликистоза
почек
Наряду с поражением почек при поликистозе
с высокой частотой выявляют аномалии в
структуре других органов.
Кисты в печени — наиболее часто встречаю-
щееся внепочечное проявление поликистоза
почек. Они обнаруживаются в 38—65 % случаев.
У женщин кисты в печени развиваются чаще,
чем у мужчин, что связывают с воздействием
женских половых гормонов. В подавляющем
большинстве случаев кисты печени не прояв-
ляются клинически и не влияют на функцию
органа.
С высокой частотой (до 80 % и более), осо-
бенно в стадии почечной недостаточности, у
больных с поликистозом почек развивается
поражение желудочно-кишечного тракта. В срав-
нении с общей популяцией при поликистозе в
5 раз чаще обнаруживают дивертикулы в кишеч-
нике и грыжи [Scheff R.T. et al., 1980]. У трети
больных поликистозом почек диагностируют
изменения в аортальных и митральных клапа-
нах сердца, в то время как поражение трикус-
пидального клапана не превышает по частоте
6 % [Watson M.L., 1997]. В отдельных случаях
обнаруживают кисты яичников, матки, пище-
вода и головного мозга.
Обращает на себя внимание высокая часто-
та (8—10 %) поражения сосудов головного моз-
га с развитием аневризм. Этот показатель вдвое
чаще встречается у больных поликистозом по-
чек при наличии у них отягощенной наслед-
ственности (аневризмы сосудов головного мозга
у родственников).
Разрыв аневризм с развитием субарахнои-
дальных кровотечений — частая причина смер-
ти этих больных в возрасте до 50 лет. По дан-
ным G.K.Gick и соавт. (1995), 12 % больных по-
ликистозом почек погибают от неврологичес-
ких осложнений, при этом 6 % больных — от
субарахноидального кровотечения.
Риск разрыва аневризмы возрастает по мере
увеличения ее размера и считается высоким при
аневризме, превышающей 10 мм [Weibers D. et
al., 1987]. Наличие аневризмы такого размера
считается показанием к оперативному лечению.
В настоящее время для диагностики пораже-
ний сосудов головного мозга при поликистозе
почек успешно применяют магнитно-резонан-
сную томографию. С помощью этого метода
можно диагностировать аневризмы сосудов го-
ловного мозга размером менее 5 мм [Black W.C.,
1994]. Этот метод рекомендуют в качестве скри-
нингового при обследовании лиц с отягощен-
ной наследственностью (цереброваскулярные
осложнения).
Среди осложнений поликистоза почек
ведущими являются:
• кровотечения в кисты или ретроперитоне-
альное пространство;
• инфицирование кист;
• образование камней в почках;
• развитие полицитемии.
Кровотечения в кисты или ретроперитонеаль-
ное пространство клинически, как правило,
проявляются макрогематурией и болевым син-
дромом. Причинами их развития могут быть
высокая гипертензия, физическая нагрузка либо
травма брюшной полости. При соблюдении ох-
ранительного режима эпизоды кровотечений в
кисты чаще всего проходят самостоятельно. При
439
Г"
подозрении на кровотечение в ретроперитоне-
альное пространство проводят ультразвуковую
диагностику, компьютерную томографию или
ангиографию. При подтверждении кровоизли-
яния в ретроперитонеальное пространство не-
редко возникает необходимость в хирургичес-
ком вмешательстве.
Инфекция мочевых путей является основ-
ным фактором риска инфицирования почечных
кист-, реже источником инфицирования явля-
ется гематогенная инфекция. В большинстве
случаев в кистах выявляют грамотрицательную
флору. Трудности при лечении инфицирован-
ных кист обусловлены необходимостью проник-
новения антибактериального вещества внутрь
кисты.
Этими свойствами обладают лишь липо-
фильные антибактериальные препараты — цип-
рофлоксацин (квинтор, ципробай), бактрим
(бисептол), клиндамицин и левомицетин, в то
время как аминогликозиды и пенициллины с
трудом проникают в кисты, не накапливаясь в
них, и поэтому неэффективны.
Нефролитиаз осложняет течение поликистоза
почек более чем у 20 % больных [Schwenger V.,
Zeier М., 1999]. Чаще всего при поликистозе
обнаруживают уратные, оксалатные или каль-
циевые камни. Причинами их образования яв-
ляются нарушения в метаболизме и в пассаже
мочи.
Частым осложнением поликистоза почек
является полицитемия. Генез ее связывают с из-
быточной продукцией мозговым веществом
почки эритропоэтина [Eckardt K.U. et al., 1989].
Эритроцитоз при поликистозе играет двойную
роль, с одной стороны, очевидна его защит-
ная функция от развития при ХПН и ТПН
анемии, с другой — это фактор риска разви-
тия тромботических осложнений.
В течение многих лет считалось, что поли-
кистоз почек часто осложняется развитием в
почках опухолей. Однако при сравнении часто-
ты встречаемости почечных новообразований в
общей популяции и у больных поликистозом
почек существенной разницы не обнаружено
|Schwenger V., Zeier М., 1999]. Высокая пред-
расположенность к опухолеобразованию в на-
стоящее время доказана в отношении больных
уремией, длительно леченных хроническим ге-
модиализом. Через 10 лет подобного лечения у
них в 100 % случаев развивается приобретен-
ная кистозная болезнь с крайне высокой час-
тотой трансформации в опухоль почки [Huang
X. et al., 1999].
Прогрессирование почечной недостаточности
при поликистозе почек. У подавляющего боль-
шинства больных поликистозом почек до 30 лет
функциональное состояние почек сохраняется
нормальным. В последующие годы практически
440
у 90 % больных развивается различной степени
выраженности почечная недостаточность. У по-
ловины из них терминальная почечная недоста-
точность (ТПН), требующая заместительной
терапии, развивается после 60 лет [Churchill
D.N. et al., 1984] и у половины больных она
выявляется намного раньше. По данным N.Gretz
и др. (1989), у мужчин потребность в лечении
гемодиализом возникает на 5—7 лет раньше,
чем у женщин, — в среднем в возрасте 52,5
года, в то время как у женщин — в 58,1 года.
Объяснение подобных различий лежит в осо-
бенностях генетики при этой патологии — ге-
нетически детерминировано развитие почечной
недостаточности в зависимости от генотипа по-
ликистоза почек, пола и расы.
Исследования в эксперименте и в клинике
показывают, что при типе 1 поликистоза по-
чек ТПН развивается на 10—12 лет раньше, чем
при поликистозе типа 2. Молекулярная основа
этих различий пока не выяснена, но клиничес-
кие данные свидетельствуют, что при полики-
стозе типа 2 кисты в почках развиваются по-
зднее, а артериальная гипертония менее выра-
жена [Ritz Е. et al., 1996].
Более высокий темп прогрессирования по-
чечной недостаточности отмечен у лиц черной
расы.
Помимо генетики, среди механизмов про-
грессирования поликистоза почек активно об-
суждаются еще 3 гипотезы:
• роль компрессионной атрофии (сдавление
функционирующей почечной ткани киста-
ми);
• роль гиперперфузии и внутригломерулярной
гипертонии;
• роль артериальной гипертонии.
Роль компрессионной атрофии почечной тка-
ни как ведущего фактора прогрессирования по-
чечной недостаточности в настоящее время
вызывает сомнения. В самые последние годы
получены убедительные доказательства о том,
что размер и количество кист не определяют
темп снижения почечных функций [Ritz Е. et al.,
1996]. Декомпрессия кист не предотвращает
прогрессирования и не приводит к уменьшению
артериальной гипертензии [Zeier М. et al., 1992;
Elzinga L.W. et al., 1992].
Фундаментальные исследования по этой
проблеме привели к заключению, что прогрес-
сирование почечной недостаточности опреде-
ляет состояние неповрежденной почечными
кистами почечной ткани. При этом от темпа
развития в ней склеротических и фиброзных
изменений зависит активность выделяемых в
процессе межклеточных взаимодействий моле-
кулярных медиаторов — протоонкогенов, фак-
торов роста, хемокинов, металлопротеиназ и т.д.
[Schwenger V., Zeier M., 1999]. Наряду с мо-
лекулярными медиаторами в прогрессировании
поликистоза взрослых большое значение в по-
следние годы стали придавать апоптозу [Savill J.
et al., 1996].
Подвергнута сомнению и роль гиперперфузии
почечных клубочков с развитием в них гиперфилъ-
трации [Zeier М. et al., 1992]. Гистоморфологи-
ческим эквивалентом гиперперфузионного по-
ражения почек является фокально-сегментар-
ный гломерулосклероз (ФСГС). При поликис-
тозе почек ФСГС выявляют крайне редко (ме-
нее чем у 5 % больных); основными морфоло-
гическими изменениями в почках являются
склероз сосудов и клубочков почек и интерсти-
циальный фиброз с наличием инфильтратов в
интерстиции или без таковых [Grantham J.,
1997; Schwenger V., Zeier М., 1999]. Несостоя-
тельность этой теории подтверждают также на-
блюдения, в которых почечная недостаточность
не ускорялась после удаление одной из почек
[Zeier М. et aL, 1992]. В условиях гиперперфу-
зионного поражения почек удаление одной из
них сопровождается резким снижением почеч-
ных функций оставшейся почки.
В настоящее время большинство исследова-
телей склонны считать, что ведущую роль в
прогрессировании почечной недостаточности
сохраняет за собой артериальная гипертония
[Gonsalo A. et al.,1996]. Механизм воздействия
высокого АД на функцию почек при поликис-
тозе почек не отличается от такового при дру-
гой почечной патологии (см. главу гемодинами-
ческие и метаболические механизмы прогрес-
сирования гломерулонефрита).
21.4. Диагноз
Диагноз поликистоза почек ставят на основа-
нии типичной клинической картины заболева-
ния — выявления изменений мочи, артериаль-
ной гипертонии, почечной недостаточности у
лиц с отягощенной наследственностью по за-
болеваниям почек. Подтверждают диагноз дан-
ные клинического обследования больного —
обнаружение при пальпации увеличенных буг-
ристых почек и данные инструментальных ис-
следований. В основе инструментальной диагно-
стики этого заболевания лежит выявление кист
в почках — основного клинического маркера
поликистоза почек. С этой целью в настоящее
время широко используют современные мето-
ды диагностики почечных кист — ультразвуко-
вое исследование, сцинтиграфию и компьютер-
ную томографию почек. При ультразвуковом
исследовании и сцинтиграфии выявляются ки-
сты размером более 1,5 см, при компьютерной
томографии — более мелкие (от 0,5 мм). Экск-
реторная урография менее предпочтительна в
связи с нефротоксичностью рентгеноконтрас-
тых веществ; ретроградная урография не про-
водится в связи с высоким риском распрост-
ранения мочевой инфекции и нефротоксично-
стью контрастного препарата. Учитывая, одна-
ко, частое выявление кист в почечной ткани,
не связанное с данной патологией, для поста-
новки диагноза поликистоза почек в настоящее
время приняты следующие критерии.
Для лиц с отягощенной наследственностью
критерием диагноза является один из приведен-
ных ниже вариантов соотношения количества
кист в почках и возраста, даже при отсутствии
клинических признаков болезни [Ravine D. et
aL, 1994]:
• наличие 2 кист в одной или обеих почках в
возрасте до 30 лет;
• наличие по 2 кисты в каждой почке в воз-
расте 30—59 лет;
• наличие не менее 4 кист в каждой почке в
возрасте старше 60 лет.
Для лиц без генетического анамнеза, что имеет
место примерно в 25 % случаев, диагноз ста-
вят на основании типичной клинической кар-
тины заболевания, подтвержденной данными
инструментального обследования почек и при
обнаружении гена поликистоза.
21.5. Лечение
Специфического лечения поликистоза почек
нет. Применяют симптоматическое лечение и
разрабатывают терапевтические мероприятия,
направленные на торможение прогрессирования
почечной недостаточности.
Купирование болевого синдрома. При полики-
стозе почек для уменьшения болевого синдро-
ма анальгетики и нестероидные противовоспа-
лительные препараты не показаны в связи с не-
фротоксичностью и риском снижения почечных
функций. Не оправдало себя и введение в кис-
ты склерозирующих веществ (алкоголя) [Uema-
su J. et aL, 1993]. Аспирация жидкости из кист
приносит временное облегчение, однако при
проведении повторных подобных мероприятий
сроки безболевых периодов резко сокращают-
ся. В настоящее время для уменьшения болево-
го синдрома используют введение трицикличес-
ких антидепрессантов, которые одновременно
действуют и как болеутоляющие. При их неэф-
фективности применяют инвазивные и хирур-
гические лапароскопические методы лечения —
декомпрессию и иссечение кист, нефрэктомию
[Watson M.L., 1997].
Эффективный контроль артериальной гипер-
тонии — одна из основных задач как лечения
441
поликистоза почек, так и профилактики быст-
рого прогрессирования почечной недостаточно-
сти. Учитывая роль в патогенезе АГ при поли-
кистозе почек активации РАС, препаратами
выбора являются ингибиторы ангиотензинпрев-
ращающего фермента, способные не только
успешно контролировать АД, но и тормозить
развитие почечной недостаточности (см. главу
«Почки и артериальная гипертония»). В числе
других гипотензивных препаратов при полики-
стозе используют блокаторы кальциевых кана-
лов длительного действия и бета-блокаторы. Ди-
уретики не показаны вследствие инверсии на-
триевых насосов и полицитемии.
Для поликистоза принципиальным являет-
ся раннее начало гипотензивной терапии, еще
в период до выявления почечных дисфункций.
По данным A.Chapman и др. (1995), постоян-
ный тщательный контроль АД, начатый сразу
же по выявлении АГ, значительно замедлял
сроки развития почечной недостаточности. В то
же время контроль гипертонии, начатый на
фоне уже сниженной функции почек, не при-
водил к желаемому результату. Об этом сви-
детельствуют данные контролируемого иссле-
дования MDRD (Modification of Diet in Renal
Disease) [Klahr S. et al., 1995]. В исследование
были включены 200 больных поликистозом
почек в стадии почечной недостаточности —
СКФ в пределах 25—55 мл/мин. Ни использо-
вание малобелковой диеты, ни строгий конт-
роль АД (АД сР обычно менее 92 мм рт.ст. у
больных 18—60 лет и менее 98 мм рт.ст. у боль-
ных старше 60 лет) не оказались эффективны-
ми в замедлении темпа падения почечных
функций.
Лечение больных в стадии терминальной по-
чечной недостаточности включает в себя ис-
пользование хронического гемодиализа и транс-
плантации почки. Выживаемость больных, на-
ходящихся на гемодиализе, и после трансплан-
тации почек практически не отличается от та-
ковой при других хронических диффузных за-
болеваниях почек [Singh S., Hariharan S., 1991].
Литература
Пытель Ю.А. Поликистоз почек//Нефрология: Руко-
водство/Под ред. И.Е.Гареевой. — М.: Медицина,
1995. - Т. 2. - С. 362-370.
Black W.C. Intracranial aneurysm in adult polycystic
kidney disease: is screening with MR angiography
indicated?// Radiology. — 1994. — Vol. 191. — P. 18—20.
Chapman A., Johnson A., Gabow P., Schrier R. Rate of
loss of renal function in hypertensive and normotensive
autosomal dominant polycystic kidney disease patients
//!. Am. Soc. Nephrol. - 1995. - Vol. 6. - 718 p.
442
Daoust M.C., Reynolds D.N., Bichet D.G., Somlo S.
Evidence for a third genetic locus for autosomal
dominant polycystic kidney disease//Genomics. —
1995. - Vol. 25. - P. 733-736.
Elzinga L.W., Barry J.M., Torres V.E. et al. Cyst
decompression surgery for autosomal dominant polycystic
kidney disease//!. Am. Soc. Nephrol. — 1992. — Vol. 2. —
P. 1219-1226.
Fick G.M., Johnson A.M., Hammond W.S., Gabow P.A.
Causes of death in autosomal dominant polycystic kidney
disease//!. Am. Soc. Nephrol. — 1995. — Vol. 5. — P. 2048—
2056.
Gonsalo A., Gallego A., Rivera M. et al. Influence of
hypertension on early renal insufficiency in autosomal
dominant polycystic kidney disease//Nephron. — 1996. —
Vol. 72. - P. 225-230.
Grantham J. J. Mechanisms of progression in autosomal
dominant polycystic kidney disease//Kidney Int. —
1997. - Vol. 52 (suppl. 63). - P. 93-97.
Harrap S.B., Davies D.L., Macnicol A.M. et al. Renal,
cardiovascular and hormonal characteristics of young
adults with autosomal dominant polycystic kidney
disease//Kidney Int. - 1991. - Vol. 40. - P. 501-508.
Hayashi M., Yamaji Y, Monkawa T. et al. Expression
and localisation of the water channels in human
autosomal dominant polycystic kidney disease//Neph-
ron. - 1997. - Vol. 75. - P. 321-326.
Kenneth D., Gardner Jr. Cystic kidneys//Kidney Int. —
1988. - Vol. 33. - P. 610-621.
Klahr S., Breyer J.A., Beck G.J. et al. Dietary protein
restriction, blood pressure control and the progression
of polycystic kidney disease//!. Am. Soc. Nephrol. —
1995. - Vol. 5. - P. 2037-2047.
Klingel R, Dippold W., Storkel S. et al. Expression of
differentiation antigens and growth-related genes in
normal kidney, autosomal dominant polycystic kidney
disease, and renal cell carcinoma//Am. !. Kidney Dis. —
1992. - vol. 19, N 1. - P. 22-30.
Matson M.A., Cohen E.P. Acquired cystic kidney disease:
Occurrence, prevalence and renal cancers//Medicine. —
1990. - Vol. 69. - P. 217-226.
Ravine D., Walker R.G., Gibson R.N. et al. Phenotype
and genotype heterogenity in autosomal dominant
polycystic kidney disease//Lancet. — 1992. — Vol. 340. —
P. 1330-1333.
Ravine D., Gibson R, Walker R.G. et al. Evaluation of
ultrasonographic diagnostic criteria for autosomal
dominant polycystic kidney disease 1//Lancet. — 1994. —
Vol. 2. - P. 824-827.
RitZ E., Zeier M., Waldherr R. Progression to renal
insufficiency//Polycystic Kidney Disease/Ed. M.L.Wat-
son, V.E.Torres. — Oxford: Oxford Press, 1996. — P.
430-449.
Schmid M., Mann J., Stein G. et al. Natriuresis-pressure
relationship in polycystic kidney disease//!. Hypertens. —
1990. - Vol. 8. - P. 277-283.
Schwenger V., Zeier M. Autosomal dominant polycystic
kidney disease//Saudi J. Kidney Dis. Transplant. —
1999.— Vol. 10, N 1. - P. 7-20.
Singh S., Hariharan S. Renal replacement therapy in
autosomal dominant polycystic kidney disease//
Nephron. - 1991. - Vol. 57. - P. 40-44.
Uemasu J., Fujiwara M., Munemura C. et al. Effects of
topical instillation of minocycline hydrochloride on cyst
size and renal function in polycystic kidney disease//Clin.
Nephrol. - 1993. - Vol. 39. - P. 140-144.
Watson M.L. Clinical developments in polycystic kidney
disease//Nephrol. Dial. Transplant. — 1996. — Vol. 11. —
P. 764-766.
Watson M.L. Complications of polycystic kidney disease
//Kidney Int. - 1997. - Vol. 51. - P. 353-365.
Zeier M., Geberth S., Gonzalo A. et al. The effect of
uninephrectomy on progression of renal failure in
autosomal dominant polycystic kidney disease//!. Am. Soc.
Nephrol. - 1992. - Vol. 3. - P. 1119-1123.
Гпава 22
НЕФРОПТОЗ
А.В.Кухтевич
Нефроптоз — опущение, смещение почки,
ее патологическая подвижность. Почка при этом
заболевании может смещаться как по вертика-
ли (вниз), так и ротироваться вокруг своей оси.
Чаще всего наблюдается правосторонний не-
фроптоз. Двусторонний нефроптоз обычно не
является самостоятельным заболеванием, а раз-
вивается на фоне висцероптоза (спланхнопто-
за). Выделяют и так называемый вторичный
нефроптоз, возникающий в результате увели-
чения массы почки при патологических процес-
сах (опухоль, поликистоз, гидронефроз и т.д.).
Точные цифры распространенности нефро-
птоза неизвестны, поскольку многие случаи
протекают латентно и не распознаются; не все
врачи владеют методикой пальпации почки —
это требует навыков и опыта. Нефроптоз встре-
чается преимущественно у женщин (73 %).
Этиология. Имеют значение слабость свя-
зочного аппарата почки (нередко системного
характера, при патологии мезенхимы, нарушен-
ном тонусе соединительной ткани, что приво-
дит к висцероптозу) или его повреждение в
результате травмы (падение с высоты, сильное
сотрясение), значительное похудание с умень-
шением количества жировой ткани (жировая
капсула, околопочечная клетчатка), ослабление
тонуса передней брюшной стенки со снижени-
ем внутрибрюшного давления.
Патогенез. Половые анатомические раз-
личия способствуют более легкому возникно-
вению нефроптоза у женщин. Паравертебраль-
ные ниши у мужчин глубокие, длинные, рез-
ко суживаются книзу, имеют коническую, во-
ронкообразную форму, тогда как у женщин они
мелкие, короткие, широко открывающиеся
книзу или цилиндрические, что облегчает сме-
щение и ротацию почки, особенно при ослаб-
лении тонуса мышц передней брюшной стен-
ки (вследствие родов), в условиях физических
нагрузок и пр. При смещении и/или ротации
почки в связи с перегибом и натяжением ар-
444
терий и вен могут развиваться нарушения ге-
модинамики: расстройства артериального при-
тока и венозного оттока. Нарушения уродина-
мики развиваются реже, они могут быть обус-
ловлены перегибом или перекрутом мочеточни-
ка, рубцовыми сращениями с окружающей
клетчаткой в области лоханочно-мочеточнико-
вого сегмента, однако стойкая дилатация ча-
шечно-лоханочной системы и тем более гидро-
нефротическая трансформация наблюдаются
нечасто.
Патологическая анатомия. Выра-
женные морфологические изменения формиру-
ются далеко не всегда, чаще при так называе-
мом фиксированном нефроптозе; они могут
развиваться в паренхиме почки, а также вокруг
самого органа. При нарушениях гемодинамики
(артериального притока и венозного оттока)
возникают пролиферативные изменения в па-
ренхиме почки, адвентиции почечных сосудов
(вплоть до фиброзного или фибромускулярно-
го стеноза почечных артерий) и тканях, окру-
жающих ножку почки. Затрудненный венозный
отток ведет к венозной гипертонии в почке
подчас с разрывом варикозно-измененных вен
(клинически проявляется гематурией). При раз-
витии нефрогенной артериальной гипертонии
могут наблюдаться гипертрофия юкстагломеру-
лярного комплекса, увеличение количества и
размеров эпителиоидных клеток с большим ко-
личеством секреторных гранул. При перегибе
и/или перекруте мочеточника вследствие повы-
шения внутрилоханочного давления появляются
лоханочно-почечные рефлюксы — попадание
мочи в клетчатку почечного синуса может при-
водить к ее инфильтрации и склерозированию.
Частые смещения и ротация почки ведут к вос-
палительным, а затем и рубцовым изменени-
ям околопочечной клетчатки и как следствие —
рубцовым сращениям вокруг почечных сосудов
и лоханочно-мочеточникового сегмента с их
стенозированием, что в итоге может приводить
к фиксации почки в нефизиологическом поло-
жении — фиксированный нефроптоз.
Клиническая картина. Нефроптоз
часто может годами протекать латентно, не
давать осложнений и обнаруживаться случайно
при обследованиях по иному поводу. Клиничес-
кие симптомы нефроптоза нередко определя-
ются степенью нарушения гемо- и уродинами-
ки. По Я.С.Хаимчаеву (1969, 1970), выделяют
3 стадии нефроптоза:
• I стадия — нефроптоз без жалоб и без объек-
тивных изменений в почке и верхних моче-
вых путях (на вдохе пальпируется нижний
полюс почки, на выдохе он уходит в под-
реберье);
• II стадия — нефроптоз, проявляющийся
жалобами общего характера, но без анато-
мических или функциональных изменений в
почке (в вертикальном положении вся поч-
ка выходит из подреберья и значительно ро-
тируется вокруг сосудистой ножки, в гори-
зонтальном положении почка возвращается
на место);
• III стадия — опущение почки с локализо-
ванными жалобами, анатомическими и фун-
кциональными изменениями в почке (поч-
ка полностью выходит из подреберья, сме-
щается в полость большого и малого таза,
при этом возникает стойкий перегиб моче-
точника, нарушаются кровообращение и
отток мочи).
Частота и интенсивность болей в правом
боку и/или в пояснице справа обычно корре-
лирует со стадией процесса, однако может ва-
рьировать в зависимости от лабильности пси-
хоэмоционального фона больных. С.П.Боткин
(1950) отмечал, что низко опущенная почка
(иногда до полости малого таза) беспокоит
больных меньше, чем та, которая стоит высо-
ко (не ниже пупочной линии). Он же указывал
на связь нефроптоза и психоэмоциональной
лабильности, сопутствующих астеновегетатив-
ных явлений: головокружения, обмороки, ис-
терия, сердцебиения, метеоризм, рвота, рас-
стройства стула — симптомы, часто наблюдае-
мые у женщин с нефроптозом. Боли в области
опущенной почки могут быть периодическими
или постоянными, чаще усиливаются к вечеру,
после длительного пребывания в ортостазе, иног-
да могут приобретать характер колики (перегиб
мочеточника, дискинезия верхних мочевых путей,
осложнение нефроптоза уролитиазом).
Гематурия, являясь вторым ведущим симп-
томом нефроптоза, может варьировать от мик-
ро- до макрогематурии. Будучи обусловленной
в основном нарушением венозного оттока (то-
нус артерий выше, поэтому при перегибе или
ротации вокруг сосудистой ножки больше стра-
дает именно венозный отток, а не артериаль-
ный приток), она обычно носит перемежаю-
щийся характер, чаще возникает после длитель-
ного пребывания в ортостазе и/или после фи-
зических нагрузок. Нередко в таких случаях ве-
нозное полнокровие сначала вызывает боль,
которая затем уменьшается и исчезает после
почечного кровотечения.
Артериальная гипертония может развивать-
ся в исходе нефроптоза. Вначале она может
иметь характер ортостатической (вследствие
сужения просвета почечной артерии из-за опу-
щения или ротации почки при переходе боль-
ного в ортостаз) и транзиторной (нормализу-
ется при переходе в клиностаз), а затем, по
мере нарастания пролиферативных и склероти-
ческих изменений в паренхиме почки, может
приобретать стойкий характер.
Диагностика при кажущейся простоте
может представлять известные трудности, по-
этому необходимо учитывать и сопоставлять все
прямые и косвенные доказательства в пользу
нефроптоза.
Жалобы и анамнез. Связь болей в пояснице и
в боку с ортостазом, особенно их усиление пос-
ле долгого пребывания в вертикальном поло-
жении, к вечеру, нередкое их сочетание с ге-
матурией; травмы области почек (удары), силь-
ные сотрясения тела (падения с высоты, авто-
мобильные аварии) должны привлечь внима-
ние врача. Немаловажное диагностическое зна-
чение имеет факт быстрого похудания более
чем на 3—5 кг от идеальной массы тела.
Физическое исследование. Важное значение
имеет грамотная пальпация почек (в первую
очередь правой почки, поскольку она опуска-
ется чаще, чем левая), которую следует про-
водить всем нефрологическим больным (не-
фроптоз может сочетаться с другими заболева-
ниями почек и, привнося свою стимптомати-
ку, создавать впечатление о большей активно-
сти основного заболевания, чем это есть на
самом деле) и особенно женщинам и худым
субъектам обоего пола. Почки полагается паль-
пировать в положениях лежа и стоя, на глубо-
ком вдохе, когда они максимально смещаются
вниз. Симптом поколачивания по пояснице
играет относительную роль. Определенное ди-
агностическое значение имеет измерение арте-
риального давления в положении лежа и стоя.
Повышение давления (в первую очередь диас-
толического) в ортостазе является косвенным
признаком нефроптоза.
Данные лабораторных исследований. Нефро-
птоз может не сопровождаться изменениями ла-
бораторных показателей. В других случаях харак-
терны непостоянство мочевого синдрома, пре-
обладание гематурии и протеинурии (протеи-
нурия может варьировать от следовой до уме-
445
Рис. 22.1. Правосторонний нефроптоз, выявленный
на экскреторной урограмме.
ренной; она может быть и ложной — за счет
белка эритроцитов). Лейкоцитурия обычно по-
является в условиях присоединения мочевой
инфекции. Определенную ценность имеет орто-
статическая проба: два общих анализа мочи, за-
бираемых до (предпочтительно, чтобы больной
выпускал мочу рано утром, после сна, в по-
ложении лежа) и через 2 ч после пребывания
в ортостазе (желательно в условиях интенсив-
ной ходьбы). Появление или усиление гемату-
рии и протеинурии во втором анализе в срав-
нении с первым является доводом в пользу
нефроптоза (хотя иногда это может наблюдаться
и при гематурическом нефрите).
Данные инструментальных методов исследо-
вания. Наиболее доступен и наименее инвази-
вен ультразвуковой метод, однако он подчас
оказывается малоинформативным, особенно
если исследование проводится только в поло-
жении лежа. При необходимости уточнения
диагноза и для дифференциальной диагности-
ки нефроптоза с такими заболеваниями, как
гломерулонефрит, следует обратиться к экск-
реторной урографии (со снимком стоя), кото-
рая способна наглядно продемонстрировать
смещаемость почки вниз и/или ее ротацию вок-
446
руг своей оси, а также возможные изменения
мочеточников (перегиб), которые не визуали-
зируются при ультразвуковом исследовании
(рис. 22.1).
Менее часто для диагностики используют
радионуклидные исследования, однако при ди-
намической нефросцинтиграфии и сканирова-
нии почек в положении сидя и лежа можно
установить степень смещения почки и наруше-
ния ее функции.
Более сложные методы (аортография, селек-
тивная венография) применяются реже, в ос-
новном при необходимости дифференциальной
диагностики (см. ниже) или же для определе-
ния лечебной тактики. Так, выявление при се-
лективной почечной венографии (с сопутству-
ющим измерением венозного давления) выра-
женной венной почечной гипертонии, варикоз-
ного расширения внутрипочечных вен, призна-
ков коллатерального оттока в виде варикозных
вен мочеточников, семенных вен может быть
аргументом в пользу оперативного вмешатель-
ства, поскольку сопутствующие в ряде случаев
нефроптозу артериальная гипертония и форни-
кальные кровотечения могут быть следствием
нарушенного венозного оттока.
Дифференциальный диагноз про-
водят с гломерулонефритом (гематурический
вариант), мочекаменной болезнью, опухолью
почки, дистопией почки.
В пользу гломерулонефрита свидетельствует
большее постоянство мочевого синдрома, как
правило, отсутствие патологической подвижно-
сти почки, отсутствие характерного для не-
фроптоза болевого синдрома.
Колики могут наблюдаться как при мочека-
менной болезни, так и при нефроптозе, однако
при нефроптозе они встречаются реже, не
имеют такой интенсивности и продолжитель-
ности (при уролитиазе — до 12—48 ч). Оконча-
тельную ясность вносят ультразвуковые и/или
рентгенологические исследования, верифици-
рующие наличие конкрементов, однако воз-
можно сочетание нефроптоза и уролитиаза.
Пораженная опухолью почка может быть до-
ступна при пальпации (являя собой феномен
так называемого вторичного нефроптоза — см.
выше), однако для опухоли почки характерна
триада — боли, лихорадка, гематурия (встре-
чается и безболевая форма, иногда в виде эпи-
зодов, отстоящих друг от друга на месяцы и
даже годы). Нередко опухоли почки сопутству-
ют варикоцеле и варикозное расширение вен
половой губы на стороне поражения, что не-
характерно для нефроптоза. Наибольшую яс-
ность вносят ультразвуковое сканирование,
компьютерная томография или аортография,
позволяющие верифицировать диагноз опухо-
ли почки.
Дистопия почки — аномалия расположения
почки (тазовая дистопия), при которой почеч-
ная артерия отходит от аорты ниже тела I по-
ясничного позвонка. При дистопии почки в
тазовой области может пальпироваться безбо-
лезненное бобовидное образование, которое в
отличие от нефроптоза не смещается вверх в
положении лежа и соответственно не сопровож-
дается нарушениями гемодинамики, что под-
тверждается при измерении артериального дав-
ления в орто- и клиностазе, а также при вер-
тикальной аортографии. Для дистопированной
почки нехарактерен болевой синдром, она ча-
сто уменьшена в размерах, функция ее может
быть снижена (или даже отсутствовать вслед-
ствие морфологической незрелости, что может
быть источником артериальной гипертонии).
Осложнения — пиелонефрит, артериаль-
ная гипертония, форникальное кровотечение,
реже уролитиаз. Причины осложнений в основ-
ном связаны с нарушениями гемо- и уродина-
мики (см. выше). Коррекция осложнений вклю-
чает как лечение самого нефроптоза (см. «Ле-
чение»), так и симптоматическую терапию (ан-
тибактериальные, гипотензивные, гемостати-
ческие препараты; диета, растворение камней,
литотрипсия).
Лечение зависит от стадии заболевания
и наличия осложнений. При I—II стадиях (не-
выраженные клинические проявления, отсут-
ствие нарушений гемо- и уродинамики) оправ-
дана консервативная тактика: лечебная физ-
культура (укрепление мышц брюшного пресса),
режим (исключение подъема и ношения тяже-
стей более 3 кг, частых сотрясений тела по вер-
тикальной оси — бег, прыжки, игра в теннис,
бадминтон и пр.), для лиц с дефицитом мас-
сы тела — прибавка недостающих килограммов.
При этом еще С.П.Боткин (1950; цит. по изда-
нию 1867 г.) рекомендовал придерживаться оп-
ределенной диеты, способствующей растяжению
кишечника газами и каловыми массами, кото-
рые выполняют роль своеобразного бандажа, ог-
раничивающего подвижность почки. С этой це-
лью больным предлагалось употребление грубой
пищи — гречневой каши, капусты, грибов.
Ношение почечного бандажа как метод кон-
сервативного лечения нефроптоза не утратило
своего значения, хотя многие больные отказы-
ваются от его постоянного применения, моти-
вируя это плохой субъективной переносимос-
тью (ощущение жара, потливость), громоздко-
стью и косметическими соображениями.
При нефроптозе, осложнившемся пиелонеф-
ритом, артериальной гипертонией, форникаль-
ным кровотечением, гидронефротической
трансформацией, показана нефропексия, вклю-
чающая фиксацию почки на должном уровне,
коррекцию ее сосудов и мочеточника при их
поражении. Известно более 100 модификаций
нефропексии, включая способ Ривуара (исполь-
зование мышечного лоскута из поясничной
мышцы) и А.Я.Пытеля и Н.А.Лопаткина (не-
фропексия к диафрагме). Нефропексия не оп-
равдана при спланхноптозе, так как может даже
ухудшить состояние больных.
Прогноз в целом благоприятный, особенно
если не развиваются осложнения нефроптоза.
Литература
Боткин С.П. О подвижности почек//Курс клиники
внутренних болезней и клинические лекции. — В 2-х
томах. - М., 1950. - Т. 2. - С. 173-184.
Гпава 23
ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ
Н.А.Мухин, М.В.Шестакова
Диабетическая нефропатия (ДН) — общее
понятие, объединяющее ряд вариантов пораже-
ния почек при сахарном диабете, в том числе
гломерулосклероз, инфекцию мочевых путей с
пиелонефритом и папиллярным некрозом, а
также атеросклеротический нефроангиосклероз.
Хотя наиболее характерным с исторических
позиций для сахарного диабета считаются диа-
бетический гломерулосклероз, описанный впер-
вые в 1936 г. Киммельстилом и Вильсоном, и
в меньшей степени инфекционные почечные
осложнения, в ряде руководств все чаще для
обозначения основных изменений в почках при
сахарном диабете используют термин «диабети-
ческая нефропатия», поскольку термин «диа-
бетический гломерулосклероз» отражает дале-
ко зашедшие морфологические изменения у
больных данной группы.
Вместе с нейропатией и ретинопатией не-
фропатия относится к наиболее тяжелым про-
явлениям распространенной диабетической
микроангиопатии — грозного осложнения са-
харного диабета, привлекающего внимание
многочисленных исследователей. Именно в со-
четании с другими вариантами микроангиопа-
тии, особенно с ретинопатией, возникает не-
фропатия. Диабетическая нефропатия у ряда
больных определяет прогноз, особенно у лиц,
страдающих диабетом 1-го типа — инсулинза-
висимым диабетом, при котором частота по-
ражения почек составляет 40 % [Viberti G.,
1987], а смерть от уремии возникает у 48 %
больных этим вариантом диабета в возрасте до
20 лет. Поражение почек у больных сахарным
диабетом является причиной смерти значитель-
но чаще, чем другие висцеральные поражения.
При развитии нефропатии у 80 % больных
инсулинзависимым диабетом смерть наступает
от уремии и только у 20 % — от инфаркта
миокарда и других причин. Вот почему, по-ви-
димому, среди причин ХПН, требующей лече-
ния перитонеальным диализом или гемодиали-
448
зом, частота диабетической нефропатии состав-
ляет 17 % в Европе, 36 % — в США, 28 % —
в Японии [Ritz Е. et al., 1998].
Таким образом, проблема диабетической
нефропатии остается одной из ведущих не толь-
ко в эндокринологии, но и в нефрологии.
Частота выявления ДН находится в тесной
зависимости от длительности сахарного диабе-
та. Эта зависимость более изучена у больных
диабетом типа 1, поскольку этот вариант диа-
бета, как правило, имеет более точное время
своего дебюта. По данным Ch.Hasslacher и др.
(1989), частота развития ДН у больных с дли-
тельностью диабета типа 1 до 10 лет составля-
ет 5—6 %, до 20 лет — 20—25 %, до 30 лет —
35—40 %, до 40 лет — 45 %. При длительности
заболевания более 35—40 лет, если нефропатия
еще не развилась, вероятность ее возникнове-
ния крайне мала (не превышает 1 % новых
случаев в год), что свидетельствует об опреде-
ленной защищенности этих больных (возмож-
но, генетической ) от патологического воздей-
ствия метаболических факторов на почки. Мак-
симальный пик развития нефропатии приходит-
ся на сроки от 15 до 20 лет существования са-
харного диабета.
При сахарном диабете типа 2 (инсулинне-
зависимом) прослеживается такая же, как и
при диабете типа 1, зависимость частоты раз-
вития диабетической нефропатии от длитель-
ности заболевания, составляющая 7—10 % у
больных с длительностью диабета не более 5
лет, 20—35 % — у пациентов, страдающих ди-
абетом в течение 20—25 лет, и 50—57 % — при
более длительных сроках заболевания [Hassla-
cher Ch. et al., 1989].
Диагностика. Учитывая тяжесть и быст-
рое прогрессирование уже возникших измене-
ний почек, необходимость своевременной ди-
агностики возможно более ранней стадии по-
ражения- почек представляется чрезвычайно
важной. Поскольку на ранних стадиях диабета,
Таблица 23.1. Стадии развития ДН (по С.Е.Мо-
gensen)
Стадия ДН Основные характеристики Время появления от начала диебета
1 — гипер- Доклиническая стадия Гиперфильтрация Дебют сахар-
функции Гиперперфузия ного диабета
II — началь- Гипертрофия почек Нормоальбуминурия (< 30 мг/сут) Утолщение базальной Более 2 лет
ных структур- ных измене- мембраны клубочков Экспансия мезангиума То же
ний почек III — начина- Гиперфильтрация Нормоальбуминурия < 30 мг/сут) Микроальбуминурия Более 5 лет
ющейся ДН IV — выра- (от 30 до 300 мг/сут) Нормальная или умерен- но повышенная СКФ Клиническая стадия Протеинурия Более 10—15
женной ДН V — уремии Артериальная гипертензия Снижение СКФ Склероз 50—75 % клу- бочков Снижение СКФ лет Более 15—20
< 10 мл/мин Тотальный диффузный или узелковый гломеру- лосклероз лет
еще до возникновения клинических признаков
нефропатии, обнаруживается ряд функциональ-
ных и морфологических признаков поражения
почек, в 1983 г. была предложена новая класси-
фикация стадий развития диабетической нефро-
патии, в которой выделяется «доклиническая»
(бессимптомная) стадия развития патологии
почек при диабете [Mogensen, 1983] (табл. 23.1).
Клиническая картин а. Как видно из
табл. 23.1, протеинурия — первый клинический
признак патологического процесса в почках —
появляется лишь на IV стадии развития ДН.
Первые же три стадии протекают бессимптом-
но и клинически не выявляются (так называе-
мая доклиническая стадия ДН). Наиболее надеж-
ным диагностическим маркером этой стадии
является микроальбуминурия (МАУ), т.е. экск-
реция альбумина с мочой, превышающая нор-
мальные значения, но не достигающая степе-
ни протеинурии. Диапазон МАУ составляет от
30 до 300 мг/сут, или от 20 до 200 мкг/мин.
Выявление МАУ у больного сахарным диабе-
том типа 1 с вероятностью 80 % свидетельствует
о том, что в ближайшие 5—7 лет у него разо-
вьется протеинурия (т.е. клиническая стадия ДН).
Драматизм диабетического поражения почек
заключается в том, что только первые три (бес-
симптомные) стадии ДН могут быть обратимы-
ми при тщательной и рано начатой коррекции
гипергликемии: нормализуются внутрипочечная
гемодинамика и объем почек, исчезает МАУ и
даже подвергаются обратному развитию струк-
турные изменения клубочков. Появление же
протеинурии говорит о том, что уже около 50—
75 % клубочков склерозировано и процесс в
почках принял необратимый характер. С момен-
та появления протеинурии при сахарном диа-
бете скорость клубочковой фильтрации (СКФ)
начинает снижаться с математически рассчи-
танной величиной, составляющей 1 мл/мин в
месяц (или около 10 мл/мин в год), что при-
водит к развитию терминальной почечной не-
достаточности уже через 7—10 лет с момента
выявления стойкой протеинурии [Hasslacher
Ch., 1990]. На этой стадии даже самая тщатель-
ная коррекция нарушений углеводного обмена
уже не способна остановить или существенно
затормозить столь быстрое прогрессирование
ДН.
Прогностически тяжелым клиническим при-
знаком ДН является НС, развивающийся в 10—
15 % случаев. НС обычно возникает постепен-
но, имеет все характерные клинико-лаборатор-
ные признаки, у части больных отличается рано
возникающей резистентностью очень выражен-
ных отеков к мочегонным препаратам. В отли-
чие от НС другой этиологии при диабетичес-
кой нефропатии с развитием НС обычно сни-
жается СКФ, отеки сохраняются, несмотря на
развитие ХПН (что часто наблюдается и при
амилоидозе).
У больных сахарным диабетом отмечается
склонность к инфекции мягких тканей конеч-
ностей, туберкулезу, кандидамикозам, но осо-
бенно к инфекции мочевых путей; она может
быстро распространяться, приводить к пиело-
нефриту и апостематозному нефриту или па-
пиллярному некрозу, которые следует иметь в
виду при наличии стойкой лихорадки, болей в
пояснице, особенно почечной колики с отхож-
дением некротических масс, иногда закупори-
вающих мочеточник, что может привести к раз-
витию прогностически неблагоприятной ОПН.
Внутривенная урография обнаруживает харак-
терные для папиллярного некроза изменения
чашечек («изъеденные молью»),
У больных диабетической нефропатией все-
гда имеется та или другая степень ретинопатии,
возникновение которой закономерно в рамках
генерализованной диабетической микроангио-
патии. Нередко встречается и распространенное
29—2950
449
атеросклеротическое поражение артерий, что
при наличии артериальной гипертонии значи-
тельно повышает частоту ИБС, поражения
магистральных периферических сосудов.
Следует отметить, что внезапное развитие
НС, особенно у молодых пациентов, страдаю-
щих диабетом, при отсутствии четких данных
о предшествующем нарушении функции почек,
не должно автоматически связываться только с
диабетом. Известны описания развития у боль-
ных диабетом НС в связи с минимальными
изменениями и хорошим эффектом от лечения
ГК и сочетания диабета с постстрептококко-
вым нефритом, нефритом с полулуниями и
другими вариантами нефрита [Viberti G.C. et al.,
1992]. Поэтому весьма целесообразным, особен-
но в неясных случаях, следует считать прове-
дение пункционной биопсии почки, которая
особенно показана:
♦ при развитии протеинурии ранее чем через
5 лет от дебюта инсулинзависимого сахарно-
го диабета;
♦ при чрезвычайно быстром нарастании про-
теинурии или внезапном появлении нефро-
тического синдрома;
♦ при стойкой микро- или макрогематурии;
♦ при отсутствии ретинопатии и полинейро-
патии на фоне выраженной протеинурии.
Патогенез. Механизмы развития пораже-
ния почек при сахарном диабете до конца не
ясны. Имеющиеся гипотезы патогенеза, есте-
ственно, связаны с существующими представ-
лениями о патогенезе диабета в целом и раз-
вивающейся вместе с основной болезнью гене-
рализованной микроангиопатии.
Наиболее распространенной концепцией
патогенеза является метаболическая, согласно
которой все варианты поражений при сахарном
диабете, в том числе и сосудов, их базальной
мембраны, связаны с первичным расстройством
липидного, гликопротеинового, белкового и уг-
леводного обмена вследствие полной или час-
тичной недостаточности инсулина.
Механизм повреждающего воздействия ги-
пергликемии на органы и ткани при сахарном
диабете связывают по крайней мере с тремя
процессами [Lorenzi М., 1992]:
• неферментным гликозилированием белков и
липидов, что приводит к нарушению их
структуры и функции;
• активацией полиолового пути обмена глю-
козы, приводящего к накоплению сорбито-
ла в клетках органов-мишеней и их осмоти-
ческому отеку;
• прямой глюкозотоксичностью, связанной с
активацией фермента протеинкиназы С, вы-
зывающей пролиферацию клеток и ангиоге-
нез.
450
С метаболической гипотезой патогенеза ди-
абетической нефропатии тесно связана гемоди-
намическая концепция развития патологии по-
чек, объясняющая формирование диабетичес-
кого гломерулосклероза нарушением внутри-
почечной гемодинамики, т.е. развитием внутри-
клубочковой гипертонии (высокого гидростати-
ческого давления внутри капилляров клубоч-
ков) и гиперфильтрации (высокой скорости клу-
бочковой фильтрации) [Zatz R., Brenner В.М.,
1986].
Генетическая теория связывает развитие ДН
с различными наследственными и генетически-
ми факторами (в частности, с наличием на-
следственной предрасположенности к артери-
альной гипертонии; генетического дефекта
трансмембранного транспорта катионов; с по-
лиморфизмом генов, регулирующих синтез ан-
гиотензинпревращающего фермента, и др.)
[Schmidt S., Ritz Е., 1997].
В то же время иммунологическая теория раз-
вития диабетической нефропатии, интенсивно
изучавшаяся в 70—80-е годы, не получила до-
статочного подтверждения. Так, в исследовании
E.Mathiensen и соавт. (1984) больных сахарным
диабетом, включавшем 50 больных сахарным
диабетом типа 1 с клинической картиной ДН
и 20 больных без ДН, не было выявлено вза-
имосвязи циркулирующих иммунных комплек-
сов или активации системы комплемента с раз-
витием ДН. Антигены, иммунореактивные к ба-
зальной мембране клубочков, были обнаруже-
ны только у 1 из 50 больных с ДН. Не получено
также убедительных данных и о роли контрин-
сулиновых антител в генезе поражения почек
при сахарном диабете. Титр антител к инсулину
был одинаков у больных с ДН и без нее.
Морфологические изменения, характерные
для поражения почек при сахарном диабете,
хорошо изучены как на светооптическом, так
и электронно-микроскопическом уровне при
уже выраженном интеркапиллярном гломеру-
лосклерозе; более ранние стадии диабетической
нефропатии исследованы меньше. Наиболее
значительным изменениям подвергаются сами
клубочки, а также артерии и артериолы почек.
Помимо утолщения базальной мембраны, от-
мечают 4 вида поражений: это узловатая и диф-
фузная формы гломерулосклероза, «капсульные
капли» и «фибриноидные шапочки» (экссуда-
тивная форма). В настоящее время общепризна-
но, что из всех морфологических вариантов
поражения почек патогномоничными для диа-
бетической нефропатии являются изменения
типа узловатого гломерулосклероза, которые
возникают вследствие увеличения мезангиаль-
ного матрикса.
Расширение мезангиального матрикса начи-
нается еще на самых ранних (клинически не
уловимых) стадиях диабетической нефропатии,
причем этот процесс, как правило, наиболее
выражен в области «рукоятки» клубочка, т.е. в
месте соприкосновения мезангия с приносящей
и выносящей артериолами клубочков. Именно
в этом месте создается максимальный градиент
внутриклубочкового гидростатического давле-
ния и развивается внутриклубочковая гиперто-
ния. Морфологические изменения мезангиаль-
ного матрикса в области рукоятки клубочков
подтверждают роль внутриклубочковой гипер-
тонии в развитии диабетической нефропатии
[Shestakova M.V., 1992].
В отличие от двух форм гломерулосклероза
так называемые «капсульные капли» (гомоген-
ные различных размеров массы, располагающи-
еся между базальной мембраной и эпителием
капсулы клубочка) и «фибриноидные шапоч-
ки» (эозинофильные липидосодержащие обра-
зования в просвете капиллярных петель клубоч-
ков) не являются специфичными морфологи-
ческими признаками диабетической нефропа-
тии, но их обнаружение, как и «гликогеновый
нефроз» с атрофией канальцев, свидетельству-
ет о тяжелом характере поражения почек.
Выраженные изменения находят в артериях
и артериолах клубочков, при этом сочетание ар-
териолосклероза с гиалинозом настолько харак-
терно для диабетической этиологии сосудистого
поражения, что R.H.Heptinstall (1966) считает
их одним из маркеров диабетической нефропа-
тии даже при отсутствии заметных клубочко-
вых изменений.
Изменения интерстициальной ткани почек
при сахарном диабете не носят специфическо-
го характера и характеризуются утолщением
тубулярных базальных мембран, развитием диф-
фузного фиброза интерстиция, атрофией ка-
нальцев. Ряд авторов утверждают, что тубуло-
интерстициальные изменения почечной ткани
даже предшествуют склеротическим изменени-
ям клубочков при сахарном диабете [Ziyadeh F.,
1996]. Вопрос о том, что является первичным
при развитии диабетической нефропатии — из-
менения клубочков или канальцев, остается от-
крытым. Большинство исследователей придер-
живаются мнения, что клубочковые и интер-
стициальные изменения, как и гиалиноз ар-
териол, развиваются одновременно и парал-
лельно.
Иммунофлюоресцентные исследования вы-
являют обычно диффузные линейные отложе-
ния IgG вдоль базальной мембраны, клубоч-
ков (БМК); нередко в этих депозитах можно
обнаружить другие компоненты плазмы — IgM,
IgA, фибриноген, альбумин, церулоплазмин,
что до последнего времени считалось отличи-
тельной чертой линейных отложений при диа-
бете в сравнении с анти-БМК-антительными
заболеваниями (синдром Гудпасчера). В насто-
ящее время отсутствие антительной против
БМК активности при сахарном диабете дока-
зано и более прямым путем — элюаты из де-
позитов почек при диабетической нефропатии
не обладают сродством к БМК.
Профилактика диабетической
нефропатии — эффективная и стабильная
коррекция метаболических изменений, харак-
терных для сахарного диабета. Контроль уров-
ня гликемии является основной проблемой при
лечении диабетической нефропатии, поэтому
важная роль отводится диете и использованию
инсулина.
При выраженной диабетической нефропатии
пероральные сахароснижающие препараты (из
группы сульфанилмочевины или бигуанидов)
отменяют и больных переводят на терапию
инсулином.
Наиболее крупным и важным исследовани-
ем, подтвердившим возможность предотвраще-
ния развития диабетической нефропатии при
идеальной компенсации углеводного обмена,
явилось исследование DCCT (Diabetes Control
and Complication Study), проведенное в 29 цен-
трах США в период с 1984 по 1993 г. [the
Diabetes Control and Complications (DCCT)
Research Group]. В это исследование включены
1441 больной ИЗСД, из них 726 — без каких-
либо признаков диабетических микроангиопа-
тий (с нормоальбуминурией и неизмененными
сосудами сетчатки) и 715 больных с диабети-
ческой нефропатией различной степени выра-
женности. Результаты исследования оказались
более чем убедительны. Через 9 лет наблюде-
ния у хорошо компенсированных больных, у
которых гликозилированный гемоглобин не
превышал 7,2 % (норма до 6,4 %), риск разви-
тия микроальбуминурии был на 34 %, а про-
теинурии — на 43 % ниже, чем в группе
плохо компенсированных больных (гликози-
лированный гемоглобин — HBAlc — более
8,5 %).
Лечение. Активное лечение диабетической
нефропатии необходимо начинать на стадии
микроальбуминурии. Основными принципами
лечения на этой стадии, помимо оптимальной
компенсации углеводного обмена, являются
нормализация внутрипочечной и системной
гипертонии. С этой целью среди медикаментоз-
ных препаратов предпочтение отдают ингиби-
торам АПФ (каптоприл, эналаприл, рамиприл,
периндоприл и др.). Основным показанием к
назначению этих препаратов служит стойкая
микроальбуминурия даже при нормальном
уровне системного АД. Доказано, что именно
эти препараты обладают наиболее выраженным
нефропротективным эффектом у больных са-
харным диабетом [Mulec Н., 1994].
29
451
На стадии клинически выраженной диабе-
тической нефропатии, характеризующейся раз-
витием протеинурии, артериальной гиперто-
нии, снижением скорости клубочковой филь-
трации, гиперлипидемией с преобладанием ате-
рогенных фракций липидов, основными прин-
ципами лечения являются:
• низкобелковая и бессолевая диета: ограни-
чение употребления животного белка до
0,6—0,7 г/кг в сутки и ограничение соли до
3—5 г/сут;
• нормализация артериального давления (так
же как и на III стадии ДН, предпочтение
отдают ингибиторам АПФ). Могут приме-
няться и другие антигипертензивные препа-
раты: антагонисты кальция, селективные
бета-блокаторы;
• коррекция гиперлипидемии: соблюдение
гиполипидемической диеты. При повышении
общего холестерина более 6,5 ммоль/л (нор-
ма до 5,2) и триглицеридов сыворотки
более 2,2 ммоль/л (норма до 1,7) реко-
мендуется присоединение лекарственных
средств, нормализующих липидный спектр
крови.
Исходя из многообразия патогенетических
механизмов развития ДН, в настоящее время
ведутся поиски новых возможных путей профи-
лактики и лечения этого осложнения сахарно-
го диабета. Наиболее перспективными из них
являются применение препаратов, воздейству-
ющих на биохимические и структурные изме-
нения базальных мембран капилляров клубоч-
ков почек.
В частности, длительное воздействие гипер-
гликемии приводит к снижению синтеза глико-
заминогликанов (а именно гепарансульфата),
составляющих основу структуры базальных мем-
бран клубочков и обеспечивающих селективную
проницаемость клубочкового фильтра для бел-
ков. Утрата этих соединений сопровождается
развитием неселективной протеинурии. В насто-
ящее время апробирован и разрешен к приме-
нению в клинической практике препарат из
группы гликозаминогликанов сулодексид, пред-
ставляющий собой гепариноподобное соедине-
ние. Этот препарат, не влияя на свертывающую
систему крови, способен повышать содержание
гепарансульфата в мембранах клубочков, восста-
навливать селективную проницаемость почечного
фильтра и предотвращать развитие склеротичес-
ких процессов в ткани почек. Максимальная
эффективность этого препарата отмечается при
его раннем применении — на стадии микроаль-
буминурии [Шестакова М.В., 1997].
Для достижения хорошего эффекта (более
длительной выживаемости) у больных сахар-
ным диабетом желательно начинать замести-
452
тельную диализную терапию при СКФ не мень-
ше 10 мл/мин (креатинин сыворотки крови не
выше 600 мкмоль/л), т.е. гораздо раньше, чем
при поражении почек недиабетического генеза.
Это связано с тем, что чем выраженнее сте-
пень почечной недостаточности, тем тяжелее
общее соматическое состояние больного сахар-
ным диабетом вследствие галопирующего про-
грессирования всех микро- и макрососудистых
осложнений сахарного диабета.
Выживаемость больных сахарным диабе-
том, находящихся на гемодиализе и перитоне-
альном диализе, схожа и составляет (по дан-
ным США на 1994 г.) через 1 год — 85 %,
2 года — 55—65 %, 3 года — 40—45 % [Held Р.
et al., 1994].
Литература
Шестакова М.В., Чугунова Л.А., Воронцов А.В., Де-
дов И. И. Эффективность сулодексида — низкомоле-
кулярного гепарина — в терапии диабетической не-
фропатии//Тер. арх. — 1997. — № 6. — С. 34—37.
Hasslacher Ch. Albuminuria in diabetes mellitus//Klin.
Wschr. - 1990. - Vol. 35. - P. 9-12.
Hasslacher Ch., Wahl P., Ritz E. Similar risk of
nephropathy in patients with type I and type II diabetes
mellitus//Nephrol. Dial. Transplant. — 1989. — Vol. 4. —
P. 859-863.
Held P.J., Port E.K., Tureene M.N. et al. Continous
ambulatory peritoneal dialysis and hemodialysis:
comparison of patient mortality with adjustment for
comoibid condition//Kidney Int. — 1994. — Vol. 45. — P.
1163-1169.
Lorenzi M. Glucose toxicity in the vascular complications
of diabetes: the cellular perspective//Diabetes. Metab.
rew. - 1992. - Vol. 8. - P. 85-103.
Mathlensen E.R., Wieslander J., Wewer U. et al. No
evidence of circulating immune complexes or humoral
immunoreactivity to glomerular basement membrane in
early diabetic nephropathy//Diabetic nephropathy. —
1984. - Vol. 3. - P. 140-144.
Mogensen C.E., Christensen C, Vittinghus E. The stages
in diabetic renal disease witn emphasis on the stage of
incipient diabetic nephropathy// Diabetes.— 1983.— Vol.
32. - P. 64-78.
Mulec H., Johnsen S., Bjorck, S. Long-term enalapril
treatment in diabetic nephropathy//Kidney Int. —
1994. - Vol. 45 (suppl. 45). - P. 141-144.
Ritz E., Mogensen C.E., Cordonnier P.J. Renal failure due
to diabetes mellitus//Oxford textbook of clinical neph-
rology/А.М.Davidson, J.S.Cameron, J.P.Grunfeld. —
Oxford University Press. — 1998. — Vol.3. — P. 2273—
2292.
Schmidt S., Ritz E. Genetec determinants of diabetic renal
disease and their impact on therapeutic interventions//
Kidney Int. - 1997. - Vol. 52. - P. 27-31.
Shestakova M. V., Mukhin N.A., Dedov LI. et al. Protein-
loading test, urinary albumin excretion and renal
morphology in diagnosis of subclinical diabetic nephropathy/
/J. Int. Med. - 1992. - Vol. 231. - P. 213-217.
The Diabetes Control and Complications (DCCT)
Research group. Effect of intensive therapy on the
development and progression of diabetic nephropathy in
the Diabetes Control and Complications Trail//Kidney
hit. - 1995. - Vol. 47. - P. 1703-1720.
Viberti G.C. Renal complications in diabetes mellitus//
Current therapy in nephrology and hypertension/Ed.
R.J.Glassock. - 1987. - P. 109-115.
Viberti G.C., Walker J.P., Pinto J. Diabetic nephropathy/
International textbook of diabetes mellitus/Ed. K.G.M.M.
Alberti, R.A.De Fronzo, H.Keen, P.Zimmet. — 1992. —
Vol. 2. - P. 1267-1328.
Zatz R-, Brenner B.M. Diabetic microangiopathy: the
hemodynamic view//Am. J. Med. — 1986. — Vol. 80. —
P. 443-453.
Ziydeh F. Significance of tubulointerstitial changes in
diabetic renal disease//Kidney Int. — 1996. — Vol. 49
(suppl. 54). - P. 10-13.
Гпава 24
ПОРАЖЕНИЕ ПОЧЕК ПРИ
АЛКОГОЛИЗМЕ
А. Ю. Николаев
Различают острые и хронические алкоголь-
ные поражения почек. Острые поражения про-
являются острой почечной недостаточностью
(ОПН), хронические — алкогольным хроничес-
ким гломерулонефритом (ХГН), пиелонефри-
том, почечным канальцевым ацидозом (ПКА).
Поражение почек при алкоголизме развива-
ется вследствие нефротоксического действия
алкоголя, а также гемодинамических, иммун-
ных и других механизмов. Характер и тяжесть
нефропатии определяется формой висцерально-
го алкоголизма, длительностью злоупотребле-
ния алкоголем, тяжестью поражения внутрен-
них органов (печени, поджелудочной железы,
скелетных мышц, системы иммунитета и кро-
ветворения), что позволяет рассматривать по-
ражения почек при алкоголизме в рамках ал-
когольной болезни [Мухин А.С., Серов В.В.,
1985]. Для алкогольного цирроза печени (ЦП),
индуративного панкреатита, алкогольной ми-
опатии особенно характерны тяжелые формы
поражения почек, часто определяющие прогноз
алкогольной болезни в целом.
24.1. Острая почечная
недостаточность при
алкоголизме
С 1990 по 1996 г. в РФ на фоне увеличения по-
требления алкоголя почти в 1,5 раза (в расчете
на человека) отмечен рост смертности от сер-
дечно-сосудистых, желудочно-кишечных, онко-
логических и легочных заболеваний, а также от
ОПН, в том числе от отравлений алкоголем и
его суррогатами [Кошкина Е.А. и др., 1996].
ОПН может быть вызвана внутриканальце-
вой обструкцией, острым канальцевым некро-
зом, гепаторенальным синдромом (ГРС), по-
454
лиорганной недостаточностью. Нефротоксичны-
ми являются суррогаты алкоголя, алкоголь,
ацетальдегид, бактериальный эндотоксин, лак-
тат и другие метаболиты, накапливающиеся в
крови в результате обменных нарушений, свой-
ственных алкоголизму.
Пусковым механизмом патогенеза многих из
перечисленных форм ОПН является взаимодей-
ствие алкоголя с медикаментами. Так, сочета-
ние алкоголя с антидиабетическими сульфанил-
амидами, бисептолом, салицилатами нередко
ведет к гипогликемической коме, комбинация
с бигуанидами — к лактатацидотической коме,
а с тиазидными диуретиками и антацидами —
к гипофосфатемической коме с внутрисосуди-
стым гемолизом [Николаев А.Ю., 1990]. При
алкогольном циррозе салуретики и НСПП ча-
сто индуцируют развитие ГРС, Н2-блокаторы
(циметидин, ранитидин) и антациды, способ-
ствуя всасыванию эндотоксина [Wardle E.N.,
1994], повышают риск развития полиорганной
недостаточности. Установлено потенцирующее
влияние алкоголя на нетравматический рабдо-
миолиз и на развитие острой внутриканальце-
вой обструкции — лекарственной (от НСПП,
рентгеноконтрастных средств, тиазидов) и мо-
чекислой, а также анальгетической нефропатии
[Drenth J., 1994].
Острая внутриканальцевая обструкция. Может
быть вызвана массивным внутрисосудистым ге-
молизом, рабдомиолизом, гиперурикемией.
Обструкция за счет гемоглобинурийного нефроза.
Среди причин внутрисосудистого гемолиза: ги-
пофосфатемия или выраженная гипертриглице-
ридемия (синдром Циве). При обнаружении ге-
молиза с нормальным содержанием фосфора и
липидов крови следует думать об отравлении ге-
молитическими ядами (уксусной эссенцией).
Характерно сочетание олигурической ОПН
с прогрессирующей гемолитической анемией и
нарастающей гиперкалиемией. В моче обнаружи-
вается свободный гемоглобин, в клетках ка-
нальцевого эпителия — гемосидерин. При ин-
токсикации уксусной эссенцией выявляется
картина ожогового шока с тяжелым поражени-
ем пищевода и желудка.
Мочекислая обструкция. ОПН часто предше-
ствуют повторные почечные колики, моноарт-
риты мелких суставов, появление новых тофу-
сов.
Поражение почек проявляется дизурией,
олигурией с гематурией, быстро переходящей
в анурию [Мухин Н.А. и др., 1995]. Характерна
выраженная гиперурикемия, опережающая тем-
пы нарастания креатинина крови. При инстру-
ментальном обследовании часто обнаруживают-
ся уратные конкременты.
Обструкция за счет миоглобинурийного нефро-
за — наиболее частая и наиболее тяжелая форма
острой внутриканальцевой обструкции при ал-
коголизме [Шиманко И.И. и др., 1993].
Частое развитие рабдомиолиза (травматичес-
кого и нетравматического) при алкоголизме
связано с высокой чувствительностью больных
хронической алкогольной миопатией к гипок-
сии и физическим нагрузкам. К провоцирую-
щим факторам нетравматического рабдомиоли-
за относятся: суррогаты алкоголя, наркотики,
некоторые медикаменты (анальгетики, стати-
ны, фибраты), а также электролитные наруше-
ния (выраженный дефицит калия, фосфора).
Поражению почек при рабдомиолизе способ-
ствуют ряд свойственнных алкоголизму обмен-
ных нарушений: гипоальбуминемия, гиповоле-
мия, анемия, метаболический ацидоз, гипер-
урикемия, бактериемия. Нефротоксическое дей-
ствие рабдомиолиза связано как с прямым
повреждением (тубулотоксическое действие
миоглобина, внутриканальцевая обструкция
пигментными цилиндрами и уратами), так и с
почечной ишемией за счет вазоконстрикции
(эндотоксинемия, гиперпродукция цитокинов
и свободных радикалов) и гиповолемии [Sala-
hudecu A. et al., 1996].
ОПН за счет рабдомиолиза часто сопровож-
дается болезненностью и отеком поврежденных
мышц, а также биохимическими признаками
мышечного некроза (резкое повышение уров-
ня аминотрансфераз, ЛДГ, альдолазы, креатин-
фосфокиназы крови). Одновременно обнаружи-
ваются гиперурикемия, гипокальциемия и быс-
тро нарастающая гиперкалиемия. Количество
мочи (красного или коричневого цвета) умень-
шено. Экскреция натрия часто снижена. При рас-
пространенном рабдомиолизе гиперкалиемия
быстро достигает критических цифр и может
вызвать внезапную смерть от остановки сердца.
Острый канальцевый некроз. ОКН может быть
вызван нефротоксинами — суррогатами алко-
голя (гликоли, метиловый спирт, хлорирован-
ные углеводороды), бактериальным эндотокси-
ном или ишемическим повреждением почек
[Шиманко И.И. и др., 1993; Breen D., 1998].
Распространенность ишемического ОКН объяс-
няется склонностью больных алкогольной бо-
лезнью к развитию коматозных состояний. По-
мимо кетоацидотической, гипоксической (при
кровотечении из варикозно-расширенных вен
пищевода и желудка) и печеночной комы, у
страдающих алкоголизмом часто встречаются
гипогликемическая, панкреатическая и лактат-
ацидотическая комы. Нередко развивается ко-
матозное состояние при критической гипофос-
фатемии, а также при отравлениях суррогата-
ми алкоголя и передозировке лекарств и нар-
котиков.
ОКН при алкоголизме проявляется олигури-
ческой необструктивной острой почечной не-
достаточностью с выраженным мочевым син-
дромом (протеинурия, микрогематурия, цилин-
друрия) и нередко экстраренальными симпто-
мами. Так, при отравлении гликолями ОПН
сочетается с тяжелой острой энцефалопатией,
трудно контролируемой гипертонией, острым
гастроэнтеритом. При фульминантном гепати-
те, вызванном воздействием на «алкогольную»
печень гепатотропных вирусов (HCV или
HBV+HDV) или гепатотоксичных лекарств
(природные тетрациклины, сульфаниламиды,
тубазид), ОКН сочетается с признаками холе-
стаза, цитолиза и печеночной энцефалопатии.
Своевременная диагностика и установ-
ление причины ОКН при алкоголизме долж-
ны базироваться на комплексном клинико-ла-
бораторном подходе и инструментальных мето-
дах. При ОПН, индуцированной коматозным
состоянием, важно установить причину комы
с помощью биохимических методов. Необходи-
мо определение в крови уровня гемоглобина,
билирубина, печеночных, мышечных, панкре-
атических индикаторных ферментов, глюкозы,
фосфора, калия, натрия, мочевой и молочной
кислот, кетоновых тел и КОС. Следует также
оценить дефицит объема: крово- и плазмопо-
тери, дефицит воды и электролитов. Для диаг-
ностики фульминантного гепатита показано
вирусологическое обследование (маркеры виру-
сов и их репликации), дополненное при необ-
ходимости биопсией печени (лапароскопией).
Нефротоксин может быть идентифицирован
при изучении анамнеза, токсикологическом
исследовании крови, мочи, промывных вод
желудка.
К ранним признакам ОКН относятся быст-
рое снижение концентрационной способности
почек, избыточная потеря натрия с мочой,
увеличение сопротивления сосудов почечной
паренхимы при ультразвуковой допплерографии
455
(резистивный индекс более 0,75), резкое сни-
жение концентрации креатинина и мочевины
мочи. При далеко зашедшем ОКН наступает
анурия с типичными уремическим симптома-
ми — азотемией, гипергидратацией, гиперка-
лиемией, декомпенсированным метаболичес-
ким ацидозом.
Гепаторенальный синдром. ГРС — пререналь-
ная гемодинамическая ОПН, осложняющая де-
компенсированный алкогольный цирроз пече-
ни. Отличается крайне неблагоприятным тече-
нием, сочетанием ОПН с печеночно-клеточной
недостаточностью и нарастающей портальной
гипертензией. В основе патогенеза ГРС ле-
жит выраженая активация почечных вазокон-
стрикторных факторов: ангиотензина II, эндо-
телина, лейкотриенов [Bataller R. et al., 1998]
при угнетении почечного синтеза сосудорасши-
ряющих простагландинов (ПГ) и оксида азота
(Davison А.М., 1996]. Несмотря на гипергидра-
тацию с гипоосмолярностью плазмы, нараста-
ет продукция АДГ (аргинин-вазопрессина),
ведущая к гипонатриемии и способствующая
почечной вазоконстрикции и энцефалопатии.
Ведущую роль в патогенезе играет высокая
портальная гипертензия с персистирующим ас-
цитом [Roberts L.R.., 1996]. Так, у больных ал-
когольным ЦП с асцитом риск развития ГРС
к концу 1-го года наблюдения составляет 20 %,
а на 5-м году — достигает 40 %.
Выделяют факторы риска развития ГРС
[Gines A. et al., 1993]. Среди клинических фак-
торов риска — частые рецидивы асцита, сни-
жение диуретического ответа на водную нагруз-
ку, тенденция к кахексии, наличие варикозно-
расширенных вен пищевода, артериальной ги-
потонии, отсутствие гепатомегалии. К лабора-
торным факторам риска относятся гипонатри-
емия с гипоосмолярностью плазмы и сниже-
нием натрийуреза, увеличение концентрации
калия, ренина и норадреналина крови, умерен-
ное снижение КФ (до 50—60 мл/мин), увели-
чение индекса сопротивления сосудов почечной
паренхимы (резистивного индекса). Развитие
ГРС иногда провоцируется алкогольным эксцес-
сом, кровотечением, коллапсом, лекарственной
терапией (салуретики, НСПП, лактулоза), па-
рацентезом или спонтанным бактериальным
перитонитом [Bataller R. et al., 1998].
В зависимости от тяжести клинических про-
явлений и прогноза A. Gines и соавт. (1993) раз-
личают I и II типы ГРС. При алкогольном цир-
розе чаще наблюдается I тип ГРС, характери-
зующийся быстрым неблагоприятным течени-
ем с летальностью 80—90 %. Этот тип ГРС ча-
сто развивается в отсутствие каких-либо про-
воцирующих факторов. Он отличается выражен-
ной задержкой жидкости и натрия, прогресси-
рующей артериальной гипотонией, желтухой с
456
энцефалопатией и геморрагическим синдро-
мом, быстрым нарастанием BUN и гиперкали-
емии в отсутствие выраженного метаболичес-
кого ацидоза. Смерть от уремии или печеноч-
ной комы наступает в течение 2 нед. Течение
II типа ГРС более благоприятно. II тип ГРС раз-
вивается при циррозе без тяжелой печеночно-
клеточной недостаточности. При этом не на-
блюдается быстро нарастающей азотемии, на
первый план выходят выраженный резистент-
ный к диуретикам асцит и олигурия.
Для диагностики ГРС информативны
клинические, лабораторные и инструменталь-
ные методы (см. факторы риска). При ГРС в от-
личие от других форм преренальной ОПН не
наблюдается нормализации КФ после увеличе-
ния ОЦК путем внутривенного введения изо-
тонического раствора натрия хлорида [Bataller
R. et al., 1998]. Диагностическая значимость
определения креатинина и мочевины крови при
ГРС снижена (кахексия, уменьшение печеноч-
ного синтеза мочевины). Информативна доппле-
рография сосудов почек, выявляющая увеличе-
ние резистивного индекса более 0,75, что не-
характерно для других форм преренальной ОПН
[Maroto A. et al., 1994]. В то же время морфоло-
гические изменения в почечных клубочках и
канальцах при ГРС минимальны и неспецифич-
ны, патология в анализах мочи нередко отсут-
ствует [Николаев А.Ю., 1995; Glassock R.J. et al.,
1996].
Полиорганная недостаточность. Алкогольный
ЦП — одна из наиболее частых причин поли-
органной недостаточности, которой свойствен-
но сочетание ОПН с дыхательной, сердечной,
печеночной, надпочечниковой недостаточнос-
тью [Wardle E.N., 1994]. Полиорганная недоста-
точность связана с накоплением в крови эндо-
токсина грамотрицательных бактерий (E.coli),
поступающего из ЖКТ в условиях высокой
портальной гипертензии, нарушений детокси-
цирующей функции печени и снижения имму-
нитета. Эндотоксин, вызывая системную вазо-
дилатацию с увеличением, а затем с падением
сердечного выброса (эндотоксический шок),
одновременно инициирует синтез вазоконст-
рикторных цитокинов: тромбоксана, фактора
некроза опухоли, интерлейкина-6, лейкотрие-
нов, эндотелина. Эти «медиаторы шока» резко
нарушают гемодинамику и микроциркуляцию
(особенно — в почках, в печени, в легких), ин-
дуцируют гиперкатаболизм и гиперкоагуляцию
[Breen D. et al., 1998]. В результате формируется
ОПН (преренальная, с последующей трансфор-
мацией в ишемический ОКН) в сочетании с
респираторным дистресс-синдромом, острой
печеночной недостаточностью, признаками
острого ДВС-синдрома.
Клинические проявления ОПН в рамках по-
лиорганной недостаточности крайне полимор-
фны. Наблюдаются повторные сосудистые кол-
лапсы, рецидивирующий отек легких и мозга,
сменяющийся эпизодами дегидратации. Типи-
чен выраженный гиперкатаболизм с крайне
высокими темпами нарастания азотемии, ги-
перкалиемии и метаболического ацидоза, а так-
же резкое угнетение иммунитета с присоеди-
нением различных оппортунистических инфек-
ций. Прогноз неблагоприятен, течение трудно
предсказуемо — во многом зависит от состоя-
ния функции легких, сердца, печени [Wardle
E.N., 1994; Breen D. et al., 1998].
24.2. Лечение и профилактика
острой почечной недостаточно-
сти при алкоголизме
Лечение и профилактика ГРС. Для
профилактики ГРС следует избегать примене-
ния парацентеза, больших доз салуретиков, ис-
ключить нестероидные противовоспалительные
препараты (НСПП). Увеличение диуреза и
уменьшение асцита иногда достигаются при
сочетании спиронолактонов с помещением
больного на 3—4 ч в высокую сидячую ванну
(water immersion). Важное значение имеют кор-
рекция гипокалиемии и гипоальбуминемии, а
также обеспечение стабильной гемодинамики.
В лечении ГРС наилучшие результаты дает
трансплантация печени, как правило, восста-
навливающая функцию почек [Davison А.М.,
1996]. Трехлетняя выживаемость больных ГРС
после трансплантации печени составила 60 %,
терминальная ХПН развилась менее чем в 7 %
случаев [Gonwa Т.А. et al., 1991]. Предлагается
проводить трансплантацию печени до развития
ГРС при наличии соответствующих факторов
риска [Gines A. et al., 1993; Bataller R. et al.,
1998].
В том случае, если ГРС I типа уже развился,
для подготовки к трансплантации печени нужно
использовать весь комплекс консервативных
методов [Roberts L.R. et al., 1996]. Введение ва-
зоконстрикторов (А-П, норадреналин) вместе
с почечными вазодилататорами (допамин, про-
стациклин) и альбумином может временно
стабилизировать функцию почек [Salo J. et al.,
1996]. Хотя контролируемое исследование не
подтвердило влияние перитонеально-венозно-
го шунта на выживаемость при ГРС, появились
данные об обратном развитии ГРС под влия-
нием портокавального шунта, имплантируемого
эндоваскулярным (трансюгулярным) методом
[Brensing К.А. et al., 1997]. При отсутствии эф-
фекта от указанных методов для подготовки к
трансплантации печени используются ГД, ге-
мофильтрация, перитонеальный диализ (ПД)
[Perez G.O. et al., 1996; Davison A.M., 1996].
Лечение острого канальцевого
некроза. Своевременно начатая терапия ише-
мического ОКН должна быть направлена на
борьбу с коллапсом. Необходимо внутривенное
введение крупномолекулярных декстранов,
плазмы в сочетании с прессорными средства-
ми (допамин, стероиды), фуросемидом, ман-
нитолом.
При ОКН, вызванном суррогатами алкого-
ля или комбинацией алкоголя с нефротоксич-
ными медикаментами, показаны элиминирую-
щие нефротоксин экстракорпоральные методы
[Шиманко И.И., Мусселиус С.Г., 1993]. При
этом выбор конкретного метода (ГД, ПД, ге-
мосорбция, плазмаферез) определяется моле-
кулярной массой и физико-химическими свой-
ствами патологического агента, а также особен-
ностями его фармакодинамики.
Лечение ОПН при внутриканаль-
цевой обструкции. При рабдомиолизе и
гемолизе важнейшее значение имеет коррекция
гиперкалиемии: внутривенное введение препа-
ратов кальция, глюкозоинсулиновой смеси, 5 %
раствора гидрокарбоната натрия, высоких доз
фуросемида. Если при внутриканальцевой об-
струкции диурез сохранен, проводят непрерыв-
ную (до 60 ч) инфузионную ощелачивающую
терапию (раствор бикарбоната натрия, глюко-
зы, изотонический раствор натрия хлорида,
маннитол и фуросемид), поддерживающую ди-
урез в пределах 100—200 мл/ч, а pH мочи —
на уровне 6,5. Такая терапия обеспечивает ра-
створение патологических цилиндров и крис-
таллов с выведением свободного миоглобина,
гемоглобина, мочевой кислоты. При гемоглоби-
нурийном нефрозе наряду с ощелачивающей
терапией необходима коррекция анемии и об-
менных нарушений (гипофосфатемии, гиперли-
пидемии). При мочекислой обструкции ощела-
чивающую и диуретическую терапию дополня-
ют аллопуринолом.
Лечение полиорганной недоста-
точности. Наиболее сложной задачей являет-
ся лечение полиорганной недостаточности
вследствие эндотоксического шока. Е.Wardle
(1994), D.Breen и соавт. (1998) к принципам ее
лечения относят:
• уменьшение образования эндотоксина и его
всасывания (антибиотики широкого спект-
ра, препараты желчных кислот);
• элиминация эндотоксина и цитокинов (ге-
мофильтрация, плазмаферез);
• нейтрализация эндотоксина моноклональны-
ми антителами;
• нейтрализация цитокинов — медиаторов
эндотоксического шока;
457
• применение заместительных экстракорпо-
ральных методов (диализ, ИВЛ, перфузия
через взвесь аллогенных гепатоцитов, внут-
риаортальная баллонная контрапульсация);
• применение полного парентерального пита-
ния.
В связи с нестабильностью гемодинамики и
крайне высокой скоростью гиперкатаболизма
при полиорганной недостаточности использу-
ют постоянные диализные методы: постоянная
артериовенозная гемофильтрация, постоянный
артериовенозный гемодиализ, постоянный ве-
новенозный гемодиализ [Davison А.М., 1996;
Ronco С. et al., 1998].
24.3. Хронические алкогольные
поражения почек
Включают в себя алкогольный хронический
гломерулонефрит (ХГН), почечный канальце-
вый ацидоз (ПКА), пиелонефрит.
24.3.1. Алкогольный хронический
гломерулонефрит
Патогенез. По нашим наблюдениям, у
20—25 % больных латентным гематурическим
нефритом выявляется алкогольная этиология
ХГН. Морфологически алкогольный ХГН чаще
характеризуется картиной фокального или диф-
фузного мезангиопролиферативного нефрита
(МПГН) с мезангиальными IgA-депозитами и
относится к группе вторичных IgA-нефритов
[Glassock R.J. et al., 1996]. При этом наряду с
клинически развернутым ХГН выделяют суб-
клинический вариант алкогольного IgA-нефрита.
Последний вариант диагностируется при так
называемой печеночной гломерулопатии, выяв-
ляемой у каждого десятого больного алкоголь-
ным ЦП [Серов В.В. и др., 1979; Nakamoto Y. et
al., 1981].
Патогенез ХГН связывают с повреждающим
влиянием алкоголизма на иммунитет. При этом
угнетение иммунитета объясняют как прямым
мембранотоксическим эффектом алкоголя, на-
рушающим продукцию цитокинов лимфоцита-
ми и макрофагами, так и нарушением регуля-
ции иммунитета в ЦНС. В то же время обнару-
жено, что при хроническом алкоголизме раз-
вивается сенсибилизация к метаболитам алко-
голя, многим белковым и бактериальным ан-
тигенам, к антигену алкогольного гиалина с
повышением в крови уровня IgA- и IgE-анти-
тел. Наряду с отложением IgA-содержащих им-
мунных комплексов в ткани печени и в почеч-
ных клубочках нередко наблюдаются кожные
реакции на алкоголь немедленного типа с при-
458
ступами бронхоспазма, а также генерализован-
ная микроангиопатия, напоминающая аллерги-
ческий панваскулит [Гуревич З.П. и др., 1983].
В условиях глубокого нарушения иммунного
ответа (на стадии алкогольного ЦП) важное
значение приобретают нефритогенные инфек-
ционные факторы. Эндотоксин грамотрицатель-
ных бактерий, концентрация которого повыше-
на при тяжелой алкогольной болезни печени,
активирует систему комплемента по альтерна-
тивному пути [Davison А.М., 1996]. У больных
с алкогольным ХГ или ЦП частота обнаруже-
ния HCV-Ab и HCV-PHK нередко превышает
50 % [Лопаткина Т.Н и др., 1997; Sherlock S.,
1997].
Среди невоспалительных нефритогенных фак-
торов при алкоголизме выделяют алкогольную
гипертонию и нарушения пуринового обмена.
Так, по наблюдениям В.Л.Громова, И.М.Балка-
рова и соавт. (1996), 20 % всех случаев так на-
зываемой эссенциальной гипертонии имеет ал-
когольную этиологию. У 25 % больных с алко-
гольной гипертонией обнаруживается гиперури-
кемия. При этом риск развития гипертонии резко
нарастает с повышенным употреблением алко-
голя и при увеличении дозы более 35 г/сут дос-
тигает 90 %.
Клиническая картина. Симптомами
алкогольного ХГН являются персистирующая
безболевая микрогематурия, сочетающаяся с
минимальной или умеренной протеинурией,
значительное стойкое повышение уровня IgA
крови. Нефротический синдром (НС) присое-
диняется, по нашим данным, в 24 % случаев.
При этом суточная потеря белка редко превы-
шает 6—8 г. НС наблюдается при быстропрог-
рессируюшем (экстракапиллярном) варианте,
при фибропластической трансформации
МПГН, при сочетании IgA-нефрита с мембра-
нозным нефритом.
Л.А.Цинева и соавт. (1996) отметили учаще-
ние развития остронефритического синдрома
(ОНС) при алкогольном ХГН в последние годы.
ОН С наблюдался в первые сутки после алко-
гольного эксцесса более чем у половины боль-
ных ХГН, сочетался с олигурией со снижени-
ем функции почек. При этом в 10 % случаев
развивалась ОПН, требовавшая применения
гемодиализа. В последующем на фоне абстинен-
ции наступали полное восстановление функции
почек и нормализация АД.
По нашим данным, при гипертоническом
варианте алкогольного ХГН, встречавшемся в
16 % случаев, часто обнаруживались наруше-
ния пуринового обмена (гиперурикозурия, ги-
перурикемия). АД контролировалось гипотен-
зивными средствами.
Типичным для всех вариантов ХГН являет-
ся выраженность тубулоинтерстициального ком-
понента с преобладанием дистрофических и
склеротических изменений стромы и канальце-
вого эпителия над воспалительными. Другая
особенность алкогольного ХГН — экстрареналь-
ные проявления алкогольной болезни. Особен-
но часто отмечалось сочетание ХГН с пораже-
нием печени. Мы диагностировали алкогольную
болезнь печени у 65 % больных алкогольным
ХГН. Нередко обнаруживались и другие экст-
раренальные висцеральные проявления: хрони-
ческий панкреатит, кардиомиопатия. При об-
следовании у всех больных алкогольным ХГН
выявлялись клинические стигмы хронического
висцерального алкоголизма (полинейропатия,
контрактуры Дюпюитрена, гигантский паротит,
пальмарная эритема, гинекомастия).
Течение и прогноз. Для алкогольного
ХГН наиболее характерно рецидивирующее,
персистирующее и медленно прогрессирующее
течение. По нашим наблюдениям, 5-, 10-, 15-
летняя выживаемость составила 81, 76, и 48 %
соответственно. В 19 % случаев развилась тер-
минальная почечная недостаточность. Почти у
половины больных ХГН прослеживалась связь
обострений почечного процесса с алкогольным
эксцессом и быстрая (за 3—4 нед) положитель-
ная динамика при абстиненции. Параллельно
снижению протеинурии, микрогематурии, АД
и нормализации КФ отмечались обратное раз-
витие синдрома холестаза с сокращением раз-
меров печени, нарушений пуринового обмена,
исчезновение признаков кардиомиопатии, вос-
становление синусового ритма.
Персистирующее течение характеризовалось
постоянной умеренной активностью ХГН. При
этом четко очерченных обострений, связанных
с алкогольным эксцессом, не наблюдалось.
В 6 % случаев при далеко зашедшей алкоголь-
ной болезни отмечалось быстропрогрессирующее
течение с острым (нефротическим или остро-
нефритическим) началом нефрита и исходом в
необратимую ХПН на 1—2-м году болезни. Для
быстропрогрессирующего алкогольного ХГН
характерны выраженная нормохромная анемия,
резкое увеличение СОЭ. Морфологически этот
вариант часто проявляется картиной пролифе-
ративного экстракапиллярного или мезангио-
капиллярного нефрита. Быстропрогрессирующее
течение алкогольного нефрита связывают с пер-
систирующей бактериальной или вирусной ин-
фекцией, с обострением алкогольного панкре-
атита [Sherlock S. et al., 1997]. К критериям не-
благоприятного прогноза алкогольного ХГН
относятся протеинурия более 1 г/л, формиро-
вание НС, стойкая артериальная гипертония,
длительный (более 10 лет) «алкогольный» стаж,
репликация вируса гепатита С (HCV).
Диагноз и дифференциальный
диагноз. Диагностика алкогольного ХГН не-
редко затруднительна из-за неспецифичности
симптома гематурии и полиморфности прояв-
лений алкогольной болезни. Гематурия, поми-
мо алкогольного ХГН, может быть вызвана не-
фролитиазом (в том числе рентгенонегативны-
ми уратными конкрементами), некротическим
папиллитом, опухолью, туберкулезом почки,
гипокоагуляцией при декомпенсированном ал-
когольном ЦП. Для исключения урологических
заболеваний, сопровождающихся гематурией,
должен использоваться комплекс рентгеноло-
гических, ультразвуковых и радионуклидных
методов, оценивающих состояние паренхимы,
чашечно-лоханочной системы и сосудов почек.
Однако трудности трактовки изолированной ге-
матурии при алкоголизме не исчерпываются
проблемой разграничения алкогольного ХГН с
урологическими заболеваниями. Бывает нелег-
ко отличить алкогольный ХГН от современно-
го острого гломерулонефрита, характеризующе-
гося «стертостью» клинических проявлений, и
особенно от первичного IgA-нефрита, болезни
Берже. По нашим данным, в отличие от ост-
рого нефрита и болезни Берже при алкоголь-
ном ХГН отсутствует симптом синфарингитной
гематурии (связь гематурии с предшествующей
инфекцией верхних дыхательных путей), реже
выявляется стойкая артериальная гипертония.
В половине случаев несвоевременная диагно-
стика алкогольного ХГН обусловлена многооб-
разием системных и метаболических проявле-
ний алкогольной болезни (гиперурикемия, на-
рушения углеводного обмена при алкогольном
панкреатите, поражение миокарда, перифери-
ческой нервной системы, ЖКТ с синдромом
нарушенного всасывания, анемия). Многие
больные алкогольным ХГН длительно наблю-
даются с ошибочными диагнозами: подагричес-
кая нефропатия, диабетическая нефропатия,
генерализованный амилоидоз, узелковый поли-
артериит, подострый инфекционный эндокар-
дит. Быстропрогрессирующий алкогольный ХГН
следует дифференцировать от других причин
ОПН при алкоголизме (см.), а также с пора-
жением почек при сепсисе, героиновой нарко-
мании, ВИЧ-инфекции.
Опорными пунктами диагностики алкоголь-
ного ХГН считаются:
• связь обострений почечного процесса с ал-
когольным эксцессом и быстрый положи-
тельный эффект абстиненции;
• обнаружение картины IgA-нефрита;
• выявление острого алкогольного гепатита,
цирроза печени, а также клинических и ла-
бораторных стигм хронического висцераль-
ного алкоголизма.
Лечение алкогольного ХГН.Основ-
ной принцип лечения алкогольного ХГН —
459
полное исключение алкогольных напитков. Абсти-
ненция приводит к быстрому развитию ремис-
сии латентного (в 50—60 % случаев) и нефро-
тического (в 30 % случаев) вариантов алкоголь-
ного ХГН.
При алкогольном ХГН со стойким наруше-
нием пуринового обмена, не корригируемым
абстиненцией и малопуриновой диетой, пока-
зано лечение аллопуринолом (200—400 мг/сут)
на фоне обильного щелочного питья.
При нефротическом и быстропрогрессирую-
щем вариантах могут использоваться глюкокор-
тикостероиды, цитостатики, плазмаферез, од-
нако эффективность этих методов при алкоголь-
ном ХГН не доказана. При обнаружении у боль-
ных алкогольным нефротическим или быстро-
прогрессирующим нефритом репликации виру-
са гепатита С может быть оправдана попытка
противовирусной терапии. Однако последняя
перспективна только в условиях полной абсти-
ненции, так как прием алкоголя, с одной сто-
роны, стимулирует репликацию HCV, с дру-
гой — в несколько раз ослабляет эффект ин-
терферона-альфа [Лопаткина Т.Н. и др., 1997;
Bereira J.G. et al., 1997].
При назначении гипотензивной терапии
алкогольного ХГН следует избегать гепатоток-
сичных препаратов (допегит, ганглиоблокато-
ры, тиазидные диуретики). Предпочтительнее
ингибиторы АПФ, клофелин [Громов Г.Л. и др.,
1996]. При отсутствии тяжелой алкогольной кар-
диомиопатии могут применяться бета-адрено-
блокаторы и антагонисты кальция. Системати-
ческое назначение петлевых диуретиков, кото-
рые могут усугубить гиперурикемию, дефицит
калия и кальция, а при сопутствующем пор-
тальном циррозе спровоцировать ГРС, нецеле-
сообразно.
24.3.2. Хронический пиелонефрит
при алкоголизме
Это одна из наиболее часто встречающихся
форм поражения почек при алкоголизме. По на-
шим наблюдениям и литературным данным
[Edmondson Н. et al., 1966], частота тяжелого
пиелонефрита при алкогольном ЦП достигает
2,8—3,5 %. Его возбудители — чаще всего ус-
ловно-патогенная грамотрицательная флора
(кишечная палочка, протей), эпидермальный
стафилококк.
Патогенез. Легкость инфицирования почеч-
ной ткани при алкоголизме связана с наруше-
ниями иммунологической реактивности и эндок-
ринным дисбалансом, а также с частым ослож-
нением алкоголизма мочекаменной болезнью.
К факторам, благоприятствующим пиело-
нефриту, относятся бактериемия, алкогольная
460
гипертония, нарушения пуринового обмена,
гиперкальциурия, гипокалиемия, анемия [Бо-
рисов И.А., 1995; Мухин Н.А., 1995]. Наруше-
нию уродинамики способствуют алкогольный
хронический простатит, гиперэстрогенемия,
развивающаяся при алкогольном ЦП, а также
нефролитиаз. Типичными осложнениями алко-
голизма являются не только уратный нефроли-
тиаз при алкогольной подагре, но и наступаю-
щие при далеко зашедшей алкогольной болез-
ни нарушения фосфорно-кальциевого обмена с
увеличением потери с мочой кальция и фос-
фатов, что ведет к формированию кальциевых
конкрементов. Почечный канальцевый ацидоз
при ЦП (см. ниже) также способствует обра-
зованию кальциевых конкрементов и нефро-
кальцинозу. Злоупотребление ненаркотически-
ми анальгетиками, практикуемое при алкого-
лизме, нарушает кровоснабжение почечных
сосочков (вплоть до индукции некротического
папиллита), что также облегчает инфицирова-
ние чашечно-лоханочной системы (ЧЛС) и
мозгового слоя почек за счет лоханочно-веноз-
ных рефлюксов.
Клиника, течение, диагностика.
Пиелонефрит при алкоголизме протекает в виде
необструктивного, обструктивного и гнойного
(деструктивного) вариантов.
Необструктивный вариант чаще встречается
у женщин. Протекает латентно, малосимптом-
но. Выявляются умеренная лейкоцитурии, не-
постоянная бактериурия, анемия. Для обостре-
ний типичны дизурия, субфебрилитет, тупые
боли в пояснице. При сморщивании почек при-
соединяются гипертония и признаки ХПН,
однако последняя прогрессирует медленными
темпами. Данный вариант дифференцируют от
ХГН, туберкулеза почки, синдрома Рейтера.
Обструктивный пиелонефрит присоединяет-
ся к нефролитиазу (уратному или кальциево-
му) или некротическому папиллиту. Обычно
повторные атаки пиелонефрита развиваются на
высоте затянувшейся почечной колики, ослож-
нившейся лоханочно-почечным рефлюксом.
Появляются повторные ознобы, высокая лихо-
радка, нейтрофильный лейкоцитоз, пиурия.
При полной односторонней обструкции анализ
мочи может оставаться нормальным.
При алкогольных нарушениях пуринового
обмена часто отмечаются суставной синдром и
стойко кислая реакция мочи с уратной крис-
таллурией и рентгенонегативными конкремен-
тами в ЧЛС обеих почках, в мочевом пузыре.
При кальциевом (кальциево-фосфатном)
нефролитиазе обнаруживают гиперкальциурию,
гиперфосфатурию, нефрокальциноз, диффуз-
ный остеопороз. Нередко диагностируют почеч-
ный канальцевый ацидоз со стойко щелочной
рекцией мочи. При пиелонефрите, вызванном
протеем, наблюдается резко щелочная реакция
мочи с усугублением фосфатурии и формиро-
ванием быстрорастущих (нередко коралловид-
ных) конкрементов.
Обструктивный вариант отличается рециди-
вирующим течением. Нередки повторные эпи-
зоды обратимой ОПН (постренальной или ре-
нальной за счет мочекислой внутриканальцевой
обструкции), формирование вторичного гидро-
(пио)нефроза. ХПН присоединяется поздно из-
за преимущественно одностороннего пораже-
ния.
Дифференциальный диагноз про-
водят с первичной подагрой, анальгетической
нефропатией, первичным гиперпаратиреозом.
Гнойный (деструктивный) вариант часто яв-
ляется исходом обструктивного пиелонефрита,
но может развиться и в отсутствие обструк-
ции — при декомпенсированном алкогольном
ЦП и индуративном панкреатите с тяжелым
иммунодефицитом и бактериемией. Манифес-
тирует симптомами тяжелой общей интоксика-
ции с нарастанием почечной и печеночной не-
достаточности, метаболического ацидоза, ане-
мии. Характерны адинамия, артериальная гипо-
тония, многократные ознобы с проливным по-
том. При этом высокая лихорадка отсутствует
или сохраняется в течение нескольких дней,
умеренно выражены болевой синдром и лейко-
цитоз. Рано присоединяются тяжелые осложне-
ния: апостематозный нефрит, гнойное расплав-
ление почечных сосочков, бактериемический
шок, уросепсис, септицемия. Развитие метаста-
тических гнойников, прогрессирование пече-
ночной недостаточности маскируют первичный
очаг в почке и нередко приводят к смерти еще
до наступления уремии — от гнойного менин-
гита, абсцедирующей пневмонии, печеночной
комы, бактериемического шока.
Дифференциальный диагноз про-
водят с подострым инфекционным эндокарди-
том, лимфогранулематозом, аденокарциномой
почки. Бактериемический шок следует диффе-
ренцировать от гипогликемической, гипофос-
фатемической, панкреатической, лактатацидо-
тической комы, а также от гепаторенального
синдрома.
Лечение и профилактика. В первую
очередь назначают меры профилактики нефро-
литиаза. При кальциево-фосфатном нефролити-
азе с остеопорозом целесообразно применение
препаратов, уменьшающих потери кальция (ти-
азидные диуретики, малые дозы кальцитриола).
При кальциевом нефролитиазе у больного с
ЦП необходима коррекция ПКА, тиазиды про-
тивопоказаны. При уратном нефролитиазе при-
меняют аллопуринол, цитратные смеси, обиль-
ное щелочное питье.
Антибактериальную терапию пиелонефрита
при алкоголизме начинают только после вос-
становления нормального пассажа мочи по
мочеточникам и с учетом состояния почек и
печени. Исключают как нефротоксичные, так
и гепатотоксичные препараты: природные тет-
рациклины, сульфаниламиды, нитрофураны,
линкомицин, НСПП. Лечение бактериемичес-
кого (эндотоксического) шока направлено на
борьбу с острой сосудистой недостаточностью
(внутривеное введение полиглюкина, плазмы,
стероидов, допамина), элиминацию эндотокси-
на экстракорпоральными методами и профи-
лактику ОПН (фуросемид, маннитол). При
гнойном варианте пиелонефрита возможно
только хирургическое лечение.
24.3.3. Почечный канальцевый
ацидоз
Почечный канальцевый ацидоз (ПКА) дисталь-
ного типа выявляется у 40 % больных алкоголь-
ным декомпенсированным ЦП [Caregaro L. et
al., 1981].
Патогенез. Нарушение ацидогенеза в ди-
стальных почечных канальцах обусловлено рез-
ким уменьшением натрийуреза (см. раздел «Ге-
паторенальный синдром»), потерей с мочой
калия, а также токсическим влиянием желчных
пигментов на эпителий извитых почечных ка-
нальцев. В результате дефекта ацидогенеза теря-
ется способность почек компенсировать мета-
болический ацидоз адекватным увеличением
экскреции с мочой Н-ионов: несмотря на на-
грузку кислотами, моча остается щелочной.
Вследствие потери с мочой калия и кальция
ПКА часто осложняется гипокалиемией, не-
фролитиазом, нефрокальцинозом. Кроме того,
при циррозе печени ПКА усугубляет внутрикле-
точный ацидоз и аммониемию.
Клиническая к а р т и н а. ПКА, как пра-
вило, протекающий субклинически или латен-
тно, может быть заподозрен у больного алко-
гольным ЦП с рецидивирующим кальциевым
нефролитиазом, диффузным остеопорозом,
стойко щелочной реакцией мочи и гипокалие-
мией. После пробы с нагрузкой хлоридом каль-
ция, несмотря на усиление метаболическо-
го ацидоза, реакция мочи остается щелочной
(pH > 6,0), титруемая кислотность мочи — низ-
кой. Суточная экскреция кальция с мочой уве-
личена, натрийурез резко снижен.
При дифференциальной диагностике следу-
ет иметь в виду возможность развития при ал-
когольном ЦП лактатацидоза с последующим
исходом в прогностически крайне неблагопри-
ятную лактатацидотическую кому.
Лечение почечного канальцевого ацидо-
за сводится к назначению препаратов калия,
461
гидрокарбоната натрия, цитратов. Для увеличе-
ния экскреции натрия с мочой могут быть ис-
пользованы спиронолактоны.
Лечение хронической почечной недостаточно-
сти при алкоголизме. Хроническая почечная не-
достаточность часто развивается при алкоголь-
ном ХГН или пиелонефрите на стадии ЦП на
фоне тяжелой алкогольной кардиомиопатии,
что осложняет проведение диализного лечения
и выполнение трансплантации почки. Эффек-
тивный программный ГД затруднителен
[Davison А.М., 1996; Perez G.O., 1996] из-за
артериальной гипотонии, гиповолемии, гемор-
рагического синдрома и метаболических нару-
шений (гипоальбуминемия, эндотоксинемия,
гипофосфатемия, респираторный алкалоз, на-
рушения углеводного обмена, печеночная эн-
цефалопатия). Более эффективен и безопасен
постоянный перитонеальный диализ, хотя ча-
стота развития перитонита, остеодистрофии,
синдрома mal-nutrition при лечении перитоне-
альным диализом алкогольного нефрита выше,
чем при лечении брайтова нефрита.
При трансплантации почки больным алко-
гольным ХГН или пиелонефритом повышает-
ся риск инфекционных и онкологических ос-
ложнений, а также острой печеночной недоста-
точности. Вследствие алкогольного иммуноде-
фицита у больных повышена инфицированность
микобактериями туберкулеза, патогенными
грибами, многими вирусами (HBV, HCV,
CMV), а также заболеваемость рядом онколо-
гических заболеваний (цирроз — рак печени,
рак щитовидной железы, гортани, пищевода,
поджелудочной железы, яичек, меланома) [Ви-
ноградова Л. Г., 1990]. В связи с этим возраста-
ет вероятность того, что после трансплантации
почки на фоне применения иммунодепрессан-
тов (сандиммуна, глюкокортикостероидов)
наступит генерализация инфекции в виде ци-
томегаловирусной пневмонии, милиарного ту-
беркулеза, вирусного ХАГ, фульминантного
острого вирусного гепатита или разовьются
онкологические осложнения [Bereira J.G. et al.,
1997]. Поэтому больные в терминальной стадии
алкогольного ХГН или хронического пиелонеф-
рита перед проведением трансплантации дол-
жны быть всесторонне обследованы и при не-
обходимости вакцинированы к HBV.
Литература
Борисов И.А. Пиелонефрит//Нефрология/Под ред.
И.Е.Тареевой. — М.: Медицина, 1995. — Т. 2. —
С. 109-141.
Виноградова Л.Г., Жарков О.Б. Поражения желудочно-
кишечного тракта при алкоголизме//Алкогольная бо-
лезнь/Под ред. В.С.Моисеева. — М., 1990. — С. 32—40.
Громов В.Л., Балкаров И.М., Лопаткина Т.Н. Алко-
гольная артериальная гипертония//Тер. арх. — 1996. —
№ 6. - С. 75-77.
Кошкина Е.А., Паронян И.Д., Павловская Н.И. Оцен-
ка алкогольной ситуации в России//Русск. мед.
журн. - 1996. - № 7. - С. 421-424.
Лопаткина Т.Н., Косминкова Е.Н., Николаев А.Ю.
Варианты поражения почек при хронических диф-
фузных заболеваниях печени вирусной и алкоголь-
ной этиологии//Практ. нефрол. — 1997. — № 2. —
С. 14-21.
Мухин Н.А., Балкаров И.М. Подагрическая почка//
Нефрология/Под ред. И.Е.Тареевой. — М.: Медици-
на, 1995. - Т. 2. - С. 321-331.
Николаев А.Ю. Поражения почек при алкоголизме//
Алкогольная болезнь/Под ред. В.С.Моисеева. — М.,
1990. - С. 73-94.
Цинева Л.А., Левицкая Т.Б., Попова В.В., Балкарова
О. В. Остронефритический синдром при алкогольном
нефрите//Тер. арх. — 1996. — № 6. — С. 16—18.
Шиманко И.И., Мусселиус С.Г. Острая печеночно-
почечная недостаточность. — М., 1993.
Bataller R., Sort Р. Hepatorenal syndrome: definition,
pathophysiology, clinical features and management//
Kidney Int. - 1998. - Vol. 53. - P. 47-53.
Bereira J.G., Levey A.S. Hepatitis C virus in dialysis and
renal transplantation//Kidney Int. — 1997. — Vol. 51. —
P. 981-999.
Breen D., Bihari D. Acute renal failure as a part of multiple
organ failure//Kidney Int. — 1998. — Vol. 53 (suppl. 66). —
P. 25-33.
Brensing K.A., Textor J., Strunk H. Transjugular
intrahepatic portosystemic stent-shunt for hepatorenal
syndrome//Lancet. — 1997. — Vol. 349. — P. 697—698.
Davison A.M. Hepatorenal syndrome//Nephrol. Dial.
Transplant. — 1996. — Vol. 11 (suppl. 8). — P. 24—31.
Drenth J.P. Acute renal failure with paracetamol ingestion
in alcoholic patients//Nephron. — 1994. — Vol. 67. —
P. 483-485.
Gines A., Escorsell A., Gines P. Incidence, predictive
factors and prognosis of hepatorenal syndrome//
Gastroenterology. — 1993. — Vol. 105. — P. 229—236.
Glassock R.J., Cohen A.H., Adler S.G. Secondary
glomerular disease//The Kidney. — 5-th ed./Ed
B.M.Brenner. — Philadelphia, 1996. — P. 1498—1596.
Gonwa T.A., Morris C.A., Goldstein R.M. Long-term
transplantation in patients with and without hepatorenal
syndrome. Experience in 300 patients//Transplantation. —
1991. - Vol. 52. - P. 428-430.
462
Maroto A., Salo J., Claria J. Diagnosis of functional
kidney failure in cirrhosis with Doppler sonography:
Prognostic value of resistive index//Hepatology. —
1994. - Vol. 20. - P. 839-844.
Perez G.O., Gopler T.A., Epstein M. Dialysis, hemofi-
ltration and other extracorporal techniques in the
treatment of renal complications of liver disease//Kidney
in Liver Disease. — 4-th ed./Ed. M.Epstein. —
Philadelphia: Hanley, Belfus Inc. — 1996. — P. 517—528.
Roberts L.R., Kamath P.S. Ascites and Hepatorenal
syndrome: pathophysiology and management//Mayo Clin.
Proc. - 1996. - Vol. 71. - P. 874-881.
Ronco C., Bellomo R. Continuous renal replacement
therapy: evolution in technology and current nomenc-
lature//Kidney Int. — 1998. — Vol. 53 (suppl. 66). —
P. 160-164.
Salahudecu A., Wang C. Nephrotoxic effects of
rhabdomyolisis//Nephrol. Dial. Transplant. — 1996. — Vol.
11. - P. 635-642.
Salo J., Gines A., Quer J.C. Renal and neurohumoral
changes following simultaneus administration of systemic
vasoconstrictors and renal vasodilatators in patients with
hepatorenal syndrome//J. Hepatol. — 1996. — Vol. 25. —
P. 916-923.
Sherlock S., Dooley I. Diseases of the liver and biliary sys-
tem. — 10-th ed. — Blackwell Science, 1997. — P. 129—132.
Wardle E.N. Acute renal failure and multiorgan failure
//Nephrol. Dial. Transplant. — 1994. — Vol. 9 (suppl. 4). —
P. 104-107.
Гпава 25
ПОЧКИ И БЕРЕМЕННОСТЬ
В.А.Рогов, Н.Б.Гордовская
25.1. Почки при нормальной
беременности
25.1.1. Изменения мочевой системы
во время физиологической
беременности у здоровых женщин
У беременных женщин отмечается увеличение
почек: размер по длине возрастает на 1,5—2 см.
Наиболее существенным изменениям подверга-
ется чашечно-лоханочная система. Уже в нача-
ле беременности она расширяется, что обуслов-
лено гормональными факторами, прежде все-
го гиперпрогестинемией. Во вторую половину
беременности к гормональным причинам ди-
латации прибавляется механическое воздей-
ствие увеличенной матки. Дилатация иногда
достигает значительных размеров и может быть
асимметричной, обычно она больше выражена
справа. Расширение верхних отделов мочевых
путей является фактором, способствующим
развитию мочевой инфекции и пиелонефрита
у беременных.
Уже в ранние сроки беременности возраста-
ют почечный кровоток (на 25—35 %) и клубоч-
ковая фильтрация (на 35—50 %), снижаясь толь-
ко непосредственно перед родами [Шрайер Р.В.,
1997]. Изменения почечной гемодинамики со-
провождаются снижением сывороточного уров-
ня продуктов азотистого метаболизма.
Нормальные значения концентрации креати-
нина во время беременности не превышают
1 мг% (90 мкмоль/л), азота мочевины — 12 мг%
(43 ммоль/л), мочевой кислоты — 4,5 мг%
(0,27 ммоль/л). Нормальные значения скорости
клубочковой фильтрации, рассчитанные по кли-
ренсу эндогенного креатинина, у беременных
составляют 120—150 мл/мин. Для правильного
измерения скорости клубочковой фильтрации
необходимо добиться достаточного диуреза, по
крайней мере не ниже 1500 мл/сут. Это обыч-
464
ное требование к методу у беременных являет-
ся особенно важным в связи с повышением
вероятности получения ошибочных (меньше
истинных) значений из-за увеличения «мертвого
пространства» дилатированных мочевых путей.
Возрастание клубочковой фильтрации не
сопровождается повышением канальцевой ре-
абсорбции, поэтому во время беременности в
моче могут появляться различные вещества,
которые отсутствуют у небеременных женщин.
Так, иногда развивается физиологическая про-
теинурия и глюкозурия. Считается, что уровень
физиологической протеинурии у беременных
при использовании количественных методов ее
определения не превышает 0,3 г/сут. Значения
глюкозурии могут достигать очень высоких
цифр без развития существенных изменений
концентрации глюкозы в крови. У беременных
увеличивается экскреция бикарбонатов. Это
компенсаторная реакция в ответ на развитие
дыхательного алкалоза вследствие физиологи-
ческой гипервентиляции. Моча приобретает
устойчивую щелочную реакцию. Щелочная ре-
акция мочи не является признаком мочевой
инфекции, хотя может способствовать ее раз-
витию.
Наиболее существенные изменения проис-
ходят в сфере водно-солевого гомеостаза. Вслед-
ствие гормональных изменений, прежде всего
гиперпродукции минералокортикоидов, в орга-
низме беременной женщины задерживаются
натрий и вода. К концу беременности суммар-
ное накопление натрия достигает примерно 900
мэкв, что соответствует 6—8 л жидкости. Две
трети этого количества натрия, или его объем-
ного эквивалента, распределяются в организ-
ме плода, а одна треть — в организме матери. В
организме матери натрий накапливается во
внеклеточном пространстве равномерно в ин-
терстиции и в сосудистом русле. Ткани стано-
вятся гидрофильными, а внутрисосудистый
объем возрастает.
Вследствие склонности беременных женщин
к задержке натрия и воды у них могут разви-
ваться физиологические отеки, особенно пос-
ле провоцирующих факторов (злоупотребление
солью, физическая перегрузка, жаркая погода).
Отличие физиологических отеков от патологи-
ческих состоит в их эфемерности. Такие отеки
нестойкие и легко исчезают после устранения
провоцирующего фактора или в состоянии
физического покоя, особенно в положении на
левом боку. Это положение оптимально для
работы почек и способствует улучшению пас-
сажа мочи по мочевым путям. Физиологичес-
кие отеки развиваются в различные периоды бе-
ременности примерно у 80 % здоровых женщин
и не требуют специального лечения [Robertson
E.G., 1971].
Другим следствием задержки натрия и воды
является феномен разведения крови. Увеличе-
ние объема плазмы приводит к снижению ге-
матокрита, который не превышает 35—36 %.
Отмечается относительное снижение числа
эритроцитов и концентрации гемоглобина в
крови, что часто симулирует развитие анемии.
Нормальные значения гемоглобина крови у бе-
ременных составляют 100—120 г/л. Примерно на
10 г/л уменьшается сывороточная концентрация
общего белка и альбумина. Относительное сни-
жение содержания белка в сосудистом русле
может способствовать развитию физиологичес-
ких отеков. Гипопротеинемия в ряде случаев
может симулировать формирование нефротичес-
кого синдрома, особенно у беременных с хро-
ническими заболеваниями почек.
25.1.2. Изменения гемодинамики и
АД во время физиологической
беременности у здоровых женщин
Вследствие задержки натрия и воды у беремен-
ных женщин объем циркулирующей плазмы
возрастает на 30—40 %, т.е. на 1—1,5 л. Минут-
ный объем кровообращения также увеличива-
ется на 40—60 % за счет ударного объема сер-
дца и тахикардии. Возможно развитие умерен-
ной гипертрофии левых отделов сердца.
Однако увеличения АД не происходит вслед-
ствие значительного снижения периферическо-
го сосудистого сопротивления. Напротив, АД
уменьшается и достигает минимальных значе-
ний к концу I триместра. По сравнению с уров-
нем АД до беременности систолическое АД
снижается на 10—15 мм рт.ст., а диастоличес-
кое — на 5—15 мм рт.ст. Это связано с тем, что
сосудистый эндотелий претерпевает определен-
ные функциональные изменения. Повышается
синтез простациклина (PG12) и эндотелиально-
го релаксирующего фактора (оксида азота, NO).
Эти два биологически активных вещества на
уровне локальной и системной циркуляции
являются мощными вазодилататорами и анти-
агрегантами. Именно с гиперпродукцией PG12
и NO принято связывать развивающиеся у бе-
ременных адаптационные изменения гемодина-
мики: снижение артериального давления, уве-
личение внутрисосудистого объема, рефрактер-
ность артериальной стенки к действию прессор-
ных факторов. Может развиться физиологичес-
кая гипотония (АД 90/60 мм рт.ст. или менее),
часто отмечаются ортостатические явления, об-
морочные состояния.
Регионарная гемодинамика у беременных
существенно не изменяется, за исключением
почек и матки. О почках уже упоминалось, а
что касается маточного кровотока, то он воз-
растает в 10 раз, достигая 800 мл/мин.
На протяжении II триместра беременности
существенных изменений гемодинамики не
происходит, АД остается на уровне, достигну-
том к концу I триместра.
С III триместра отмечается постепенное уве-
личение периферического сосудистого сопро-
тивления без существенного изменения ударно-
го объема сердца. Вследствие этих изменений
АД увеличивается и к моменту родов достига-
ет уровня, отмечавшегося до беременности, или
даже на 10—15 мм рт.ст. выше.
Очень важно, что указанная динамика АД
характерна не только для здоровых женщин, но
и для женщин, страдающих любой формой
артериальной гипертонии.
25.2. Заболевания почек,
вызванные беременностью
Беременность может быть причиной возникно-
вения специфической нефропатии — тяжелого
состояния, не существующего у человека в
других условиях. Кроме того, беременность
может способствовать развитию различных ва-
риантов мочевой инфекции и острой почечной
недостаточности.
25.2.1. Нефропатия беременных
(преэклампсия, протеинурическая
гипертония)
Общепринятого определения нефропатии бере-
менных не существует. Это связано с отсутстви-
ем четкого представления о природе (этиоло-
гии) синдрома. Обычно используют диагнос-
тические критерии этого состояния.
Нефропатия беременных — осложнение вто-
рой половины беременности, проявляющееся
артериальной гипертонией, протеинурией, а
30—2950
465
нередко отеками и способное прогрессировать
до развития критических состояний у матери и
плода (эклампсия, ДВС-синдром, HELLP-син-
дром, ОПН, внутриутробная задержка разви-
тия и гибель плода).
По клиническим критериям отечественный тер-
мин «нефропатия беременных» более всего со-
ответствует международному термину «преэк-
лампсия» или «протеинурическая гипертония».
В то же время классификации этого синдро-
ма, принятые в России и за рубежом, разли-
чаются. В России нефропатия беременных —
одна из 4 форм (стадий) гестоза, который ра-
нее назывался «ОПГ-гестозом»*, а еще рань-
ше «поздним токсикозом» (токсемией). В рам-
ках гестоза принято выделять водянку (изоли-
рованные отеки), нефропатию беременных (со-
четание гипертонии и протеинурии), преэклам-
псию (нефропатия и умеренное поражение
ЦНС) и эклампсию (нефропатия и тяжелое
поражение ЦНС с комой и судорогами).
ВОЗ (1996) рассматривает преэклампсию как
одну из форм гипертонии беременных.
Классификация гипертонии беременных (ВОЗ,
1996):
• преэклампсия/эклампсия;
• хроническая гипертония;
• хроническая гипертония с сопутствующей
преэклампсией/эклампсией;
• транзиторная гипертония.
В соответствии с этой классификацией пре-
эклампсия/эклампсия характеризуется гиперто-
нией и протеинурией, иногда нарушением
свертываемости крови и функции печени. Оте-
ки уже не рекомендуется рассматривать как ди-
агностический критерий преэклампсии/эклам-
псии в силу их неспецифичности из-за часто-
ты физиологических отеков. Преэклампсия/эк-
лампсия в основном развивается во время пер-
вой беременности после 20-й недели. Отмеча-
ется, что преэклампсия может перейти без
предвестников в судорожную фазу, известную
как эклампсия.
Под «хронической гипертонией» понимают
артериальную гипертонию любой природы,
которая существовала до беременности или в
течение первой ее половины. Транзиторная (по-
здняя, гестационная) гипертония характеризу-
ется изолированным (без протеинурии) нео-
сложненным повышением АД, впервые возник-
шем во вторую половину беременности, кото-
рое после родов нормализуется. Обычно спустя
годы именно у этой категории больных разви-
* ОПГ — аббревиатура от слов отек, протеинурия
и гипертония; гесгоз от латинского gestare — носить.
466
вается эссенциальная, или вторичная, гипер-
тония.
Необходимо упомянуть еще один термин,
который часто встречается в зарубежной лите-
ратуре, — «гипертония, вызванная беременно-
стью». Этим термином обычно объединяют пре-
эклампсию/эклампсию и транзиторную гипер-
тонию, отличая их от «хронической гиперто-
нии».
Распространенность нефропатии беременных.
В различных странах мира гипертонию диагно-
стируют у 5—10 % всех беременных. Иногда эти
цифры достигают 20 % и даже более. В докладе
ВОЗ (1996) указывается, что распространен-
ность гипертонии у беременных не превышает
5 %.
По данным проведенного в России эпиде-
миологического исследования [Вихляева Е.М.,
Супряга О.М., 1998], гипертония выявлялась у
20,2 % беременных. В то же время официаль-
ные данные, основанные на анализе работы
службы родоразрешения, показали, что в 1993 г.
в России диагноз «гестоз» был установлен у
13,5 % всех беременных.
Значительная вариабельность данных о час-
тоте артериальной гипертонии среди беремен-
ных обусловлена большими различиями диаг-
ностических критериев, классификаций и спо-
собов статистического учета, используемых в
разных исследованиях по всему миру.
Что касается нефропатии (преэклампсии,
протеинурической гипертонии), то она обна-
руживается, по разным данным, у 0,9—3 % всех
беременных [Fitzpatrick С. et al., 1987; Campbell
D.M., MacGillivray I., 1985]. Однако при стро-
гой оценке, учитывающей постродовую дина-
мику клинико-лабораторных проявлений, ока-
зывается, что наиболее вероятная распростра-
ненность нефропатии составляет примерно 1 %.
Нефропатия остается одной из главных при-
чин материнской и перинатальной смертности,
составляя 20—33 % всех случаев гибели женщин
в связи с беременностью [Kincaid-Smith Р.,
1994]. Потери плода и новорожденного при
нефропатии возрастают почти в 2 раза [Cham-
berlain G. et aL, 1978].
Факторы риска нефропатии беременных. Бес-
спорным фактором риска нефропатии беремен-
ных являются первые роды. Нефропатия разви-
вается преимущественно у первородящих жен-
щин и в 15 раз реже у повторнородящих
[MacGillivray, 1958]. Возможность нефропатии
у повторнородящих, как правило, связывают с
беременностью от нового полового партнера.
Другим серьезным фактором риска нефропатии
беременных считается наличие у женщины хро-
нических заболеваний сердечно-сосудистой си-
стемы и почек. В первую очередь — это различ-
ные варианты артериальной гипертонии, гло-
мерулонефрит, сахарный диабет, системные за-
болевания соединительной ткани и васкулиты.
В зависимости от тяжести перечисленных заболе-
ваний риск развития нефропатии беременных
повышается в 2—9 раз. Выделяют также другие
менее очевидные факторы риска, прогностичес-
кая роль которых активно обсуждается в акушер-
ской литературе. Это наследственность, отягощен-
ная по нефропатии беременных [Chesley L.C.,
1978], слишком юный или, напротив, значи-
тельный возраст первородящей женщины, мно-
гоплодная беременность, курение и т.д.
Патофизиологические изменения при нефро-
патии беременных. На сегодняшний день уста-
новлено, что при нефропатии имеются струк-
турные повреждения системного эндотелия (эн-
дотелиоз) [Bernheim J., 1997; Roberts J.M.,
Redman C.W., 1993]. Они развиваются в различ-
ных сосудистых регионах, прежде всего на уров-
не капилляров. Происходит расширение эндо-
телиальной клетки, в ее цитоплазме обнаружи-
ваются электронно-плотные включения.
Повреждение эндотелия связано с его ме-
таболической дисфункцией. Снижается синтез
сосудорасширяющих, антиагрегантных и анти-
коагулянтных факторов (простациклина, оксида
азота, антитромбина-3). Напротив, высвобож-
дение вазоконстрикторов и проагрегантов (эн-
дотелина, фибронектина, тромбоксана, факто-
ра Виллебранда и др.) возрастает.
Дисфункция эндотелия проявляется рядом
патофизиологических изменений:
— повышается чувствительность сосудов к
прессорным воздействиям, что приводит к
сужению просвета сосудов;
- увеличивается проницаемость сосудистой
стенки, в результате чего значительная часть
плазмы перемещается в интерстициальное
пространство. Появляются отеки, уменьша-
ется внутрисосудистый объем, а кровь сгу-
щается;
— поврежденный эндотелий активирует тром-
боцитарное звено гемостаза, которое затем
«запускает» весь каскад свертывающей сис-
темы крови.
Уменьшение сосудистого просвета и гипо-
волемия, повышение вязкости крови и обра-
зование микротромбов приводят к нарушению
перфузии органов и тканей, развивается их
ишемия. Гемодинамические изменения носят
системный характер, но клиническая картина
нефропатии (преэклампсии) определяется пре-
имущественно нарушением кровообращения
почек, плаценты, головного мозга и печени.
Имеются различные объяснения первопри-
чины описанных патофизиологических процес-
сов. Так, Н.С.S.Wallenburg (1990) считает, что
первична функциональная неспособность эндо-
телия вырабатывать вазодилатирующие и анти-
агрегантные вещества. Это приводит к недоста-
точной гемодинамической адаптации организ-
ма к беременности. Данная гипотеза подтверж-
дается фактом, что нефропатия чаще развива-
ется у беременных с измененными сосудами:
гипертонией, диабетом, системными заболева-
ниями соединительной ткани.
Напротив, C.J.M. de Groot и R.N.Taylor
(1993) полагают, что первичным является на-
рушение адаптации спиральных артерий матки
к развивающейся беременности, которое при-
водит к плацентарной циркуляторной недоста-
точности. Ишемизированная плацента начина-
ет продуцировать в кровоток факторы, облада-
ющие свойствами эндотелиальных токсинов и
ответственных за повреждение системного эн-
дотелия при нефропатии. Вот почему синдром
развивается только во вторую половину бере-
менности, когда заканчивается формирование
собственной системы кровообращения плацен-
ты (обычно к 18—22 нед). Данная точка зрения
подтверждается феноменом переноса «эндоте-
лиального токсина», когда плазма больных
преэклампсией повреждает эндотелий в куль-
туре клеток. К сожалению, гипотеза не объяс-
няет, что вызывает нарушение гестационной
трансформации спиральных артерий матки.
Поражение органов и систем при нефропатии
беременных. Сердечно-сосудистая система.
Основное проявление нефропатии беремен-
ных — артериальная гипертония, а именно по-
вторное повышение АД до 140/90 мм рт.ст. или
более. В первую очередь и более интенсивно
повышается диастолическое АД. Гипертония
может прогрессировать или иметь кризовое те-
чение. Характерно ночное повышение АД.
В половине случаев гипертония носит тяжелый
характер, когда АД достигает уровня 170/110 мм
рт.ст. и более. Могут развиться острые ослож-
нения гипертонии: гипертензивная энцефало-
патия и кровоизлияние в мозг, левожелудоч-
ковая недостаточность с отеком легких, отслой-
ка сетчатки.
Обычно любое прессорное воздействие (вол-
нение, изменение положения тела и др.) вы-
зывает значительное повышение АД. Эти реак-
ции связаны с выраженными аномалиями со-
судистого тонуса. Для нормальной беременно-
сти характерна потеря сосудистых реакций,
обычных для небеременных женщин. Инфузия
беременным ангиотензина II или других прес-
сорных веществ не вызывает повышения АД.
Напротив, сохранение прессорной реакции в
ответ на инфузию ангиотензина служит ранним
признаком нефропатии беременных. Данная
проба трудно осуществима в повседневной
практике и обычно проводится с исследователь-
скими целями. Ее более доступными клиничес-
30*
467
кими эквивалентами являются тест «перевер-
тыш»* (roll-over test), тест с изометрической
нагрузкой и холодовой тест. Повышение АД у
беременной женщины при проведении пере-
численных тестов (положительная проба) ука-
зывает на риск развития или уже имеющуюся
нефропатию. Однако диагностическая и прогно-
стическая значимость этих тестов признается не
всеми исследователями.
Имеющаяся при нефропатии беременных
ангиопатия может быть установлена также пу-
тем определения сывороточных факторов, от-
ражающих состояние эндотелия (простациклин,
эндотелии, эндотелиальный релаксирующий
фактор, фибронектин и т.д.).
При вскрытии женщин, погибших от эклам-
псии, в сердце обнаруживают субэндокардиаль-
ные кровоизлияния. Поскольку аналогичные
изменения бывают в случаях гибели от шока, их
происхождение при этом синдроме связывают с
развитием острой гиповолемии [Weiner Р., 1987].
Действительно, характерным изменением цен-
тральной гемодинамики является уменьшение
объема циркулирующей крови (ОЦК) за счет
повышения сосудистой проницаемости. Наибо-
лее простым и надежным клиническим крите-
рием гиповолемии служит увеличение гематок-
рита крови более 36 %.
Могут выявляться также другие признаки
сгущения крови — повышение концентрации
гемоглобина и сывороточных белков.
Переход жидкой части крови из внутрисо-
судистого в интерстициальное пространство со-
провождается развитием пастозности тканей и
«сосудистыми» отеками. Они локализованы рав-
номерно на лице, кистях, лодыжках и харак-
теризуются, в отличие от физиологических оте-
ков, устойчивостью или нарастанием, а также
отсутствием очевидной связи с провоцирующим
фактором. В связи с развитием отеков диурез
может снизиться, масса тела бурно нарастает
(более 500 г/нед), появляется жажда.
Почки. Морфологические варианты пораже-
ния почек при нефропатии беременных разно-
* Тест «перевертыш»: АД измеряют на правой руке
в положении больной на левом боку (после 20 мин
покоя) и после переворота на спину (в течение
первых 3 мин).Тест с изометрической нагрузкой:
больная в течение 3 мин удерживает кистевой си-
ломер на уровне ’/, максимальной силы сжатия для
данной руки, АД измеряют на противоположной
руке до и после нагрузки. Холодовой тест: пациент-
ка погружает предплечье в холодную (+4 °C) воду
на 3 мин; АД измеряют на противоположной руке
до и после охлаждения. Во всех трех случаях тест
считается положительным, если в результате прово-
димых действий диастолическое АД повышается на
20 мм рт.ст. или более.
468
образны. Типичным является развитие гломеру-
лярно-капиллярного эндотелиоза, при котором
наблюдается значительное уменьшение просвета
петель клубочков за счет диффузного набуха-
ния эндотелия. Эти клетки приобретают пени-
стый вид, их цитоплазма вакуолизируется, в
ней накапливаются липиды, органеллы гипер-
трофируются. Иногда отмечается интерпозиция
мезангия с отложением в мезангиальном мат-
риксе фибриноподобного материала, иммуно-
глобулинов М и G. Гломерулярно-капиллярный
эндотелиоз полностью обратим, после родов он
исчезает в течение нескольких дней, иногда
недель. Соответственно исчезают все клиничес-
кие признаки поражения почек.
При ранних и тяжелых формах нефропатии
беременных биопсия почки, проведенная в пос-
леродовый период, выявляет иногда фокально-
сегментарный гломерулярный гиалиноз (ФСГГ).
Обсуждается вопрос о том, является ли ФСГГ
причиной или следствием тяжелой нефропатии
беременных [Nochy D., 1994]. Среди механиз-
мов развития ФСГГ при токсикозе предпола-
гают роль гломерулярного эндотелиоза, внут-
риклубочковой гипертонии и гиперкоагуляции.
У 20—30 % больных с постродовым ФСГГ пер-
систирует артериальная гипертония, тогда как
протеинурия отсутствует или минимально вы-
ражена. Течение ФСГГ у женщин, перенесших
нефропатию беременных, более благоприятное,
чем течение ФСГГ в рамках хронического не-
фрита или сахарного диабета.
Другой морфологической находкой, обнару-
живаемой при тяжелом течении нефропатии
беременных, является фибриноидный некроз и
склероз междольковых артерий почек [Burden R.
et al., 1979; Aber G., 1978]. Эти изменения раз-
виваются в результате прямого повреждающе-
го действия острой и высокой гипертонии. В
отдаленный послеродовой период у 75 % жен-
щин со склерозом междольковых артерий со-
храняется устойчивая артериальная гипертония,
нередко со злокачественным течением.
Очевидно, что именно ФСГГ и склероз
внутрипочечных артерий лежат в основе «оста-
точных изменений» после перенесенной нефро-
патии беременных, протекающих обычно под
маской «гипертонической болезни» или «гипер-
тонического нефрита».
Основным клиническим признаком пораже-
ния почек при нефропатии беременных яв-
ляется протеинурия.
Она неселективна и при использовании ко-
личественных методов определения всегда пре-
вышает уровень 0,3 г/сут [Dovey D.A., MacGil-
livray I., 1986]. Нередко она достигает значитель-
но более высоких цифр — от 3 до 15 и даже до
50 г/л. Протеинурия отличается быстрым (иног-
да почасовым) нарастанием. Вследствие этого
гипопротеинемия (альбумин крови менее 25 г/л)
и нефротические отеки могут отсутствовать в
первые дни развития нефропатии.
Нефротические (гипопротеинемические)
отеки следует отличать от «сосудистых» отеков,
связанных с повышением сосудистой проница-
емости. Нефротические отеки более значитель-
ны и локализуются преимущественно на голе-
нях и крестце. Могут быть асцит и гидроторакс.
Развитие отечного синдрома может сопровож-
даться олигурией и снижением клубочковой
фильтрации.
Другим характерным признаком поражения
почек при нефропатии беременных является
прогрессирующее повышение сывороточного
уровня мочевой кислоты — более 6,0 мг%. Ги-
перурикемия может достигать 9—10 мг%. Повы-
шение мочевой кислоты в крови считается ран-
ним симптомом и, вероятно, обусловлено ухуд-
шением почечной перфузии [Redman C.W.,
1993].
Осложнениями нефропатии беременных яв-
ляются различные варианты острой почечной
недостаточности (ОПН), в основе которых ле-
жат острый канальцевый некроз и реже острый
кортикальный некроз [Grunfeld J.P., Pertuiset N.,
1987].
Маточно-плацентарно-плодный комплекс.
В своем развитии плацента проходит ряд ста-
дий. На 5—7-й день после оплодотворения за-
родыш вступает в контакт с поверхностью эн-
дометрия и в течение последующих 2 сут по-
гружается в его толщу. Наружный слой клеток
зародыша называется трофобластом. Трофобласт
обладает способностью к инвазивному росту в
глубь матки и образованию ворсин. Постепен-
но ворсины разрастаются, в них формируется
собственная сосудистая система, связанная че-
рез пуповину с кровеносной системой плода.
Одновременно под влиянием растущего тро-
фобласта происходит изменение структуры спи-
ральных артерий матки, которые свободно от-
крываются в межворсинчатое пространство. Эти
артерии теряют свой мышечный и соединитель-
нотканный слой, вследствие чего теряют спо-
собность к уменьшению просвета, в ответ на
прессорные воздействия распрямляются, уко-
рачиваются и расширяются. Это обеспечивает
интенсивный приток материнской крови в меж-
ворсинчатое пространство. Изменения спираль-
ных артерий матки и образование сосудистой
системы плаценты и плода завершаются к 18—
22 нед беременности.
Для нефропатии беременных наиболее ха-
рактерны структурные изменения именно спи-
ральных артерий матки. Материал для исследо-
вания получают в случаях удаления матки или
при ее биопсии из зоны плацентарного ложа.
Спиральные артерии лишены адаптивных из-
менений, свойственных беременности. Они не
распрямлены, недостаточно расширены или
даже имеют суженый просвет, сохраняют час-
тично или полностью свой фибромускулярный
слой. В стенке спиральных артерий появляются
пенистые клетки. В просвете артерий обнаружи-
ваются микротромбы и скопления макрофагов.
Имеется фибриноидный некроз и периваску-
лярная инфильтрация мононуклеарами. Разви-
вается картина некротизирующей ангиопатии,
получившая название острого атероза спираль-
ных артерий.
Повреждение спиральных артерий приводит
к нарушениям маточно-плацентарного крово-
обращения. Вот почему нефропатия беременных
является страданием не только матери, но и
плода. По данным различных исследователей,
вероятность задержки внутриутробного разви-
тия и гибели плода при нефропатии беремен-
ных возрастает в 2—10 раз [Weiner С.Р., 1987].
То же относится к преждевременной отслойке
нормально расположенной плаценты.
Для оценки состояния плаценты и плода
наиболее информативным является ультразву-
ковое исследование. Нарастающее отставание
размеров плода от показателей, соответствую-
щих гестационному сроку, свидетельствует о за-
держке его развития. На ухудшение состояния
плода указывают нарушения кровотока в маточ-
ных артериях и артерии пуповины, выявляемые
при допплерометрии. Могут определяться откло-
нения в сердечной деятельности плода, его
дыхательной и двигательной активности.
Система свертывания крови. Нарушения гемо-
стаза при нефропатии беременных имеются
практически всегда. Ранее других появляются
признаки активации тромбоцитов как следствие
распространенного повреждения эндотелия,
сгущения крови, гипоксии тканей и развития
ацидоза. Повышается их агрегация в тестах in
vitro, в крови увеличивается содержание про-
дуктов тромбоцитарного происхождения (тром-
боксан, тромбоглобулин).
Может развиться ДВС-синдром. Он имеет
различные проявления в зависимости от глуби-
ны и стадии нарушений, а также в зависимос-
ти от клинического варианта течения.
Наиболее типичными лабораторными изме-
нениями являются тромбоцитопения, фрагмен-
тирование эритроцитов, гипофибриногенемия,
активация фибринолиза и повышение продук-
тов деградации фибриногена в плазме. Диагно-
стика ДВС-синдрома облегчается, если есть
возможность оценивать лабораторные показате-
ли гемостаза в динамике.
При прогрессировании ДВС-синдрома к
469
лабораторным изменениям добавляются клини-
ческие проявления. Это геморрагии различной
локализации, нарушение функции легких, по-
чек, печени вследствие внутриорганной тром-
ботической микроангиопатии. В тяжелых случа-
ях ДВС-синдром может осложниться профуз-
ным маточным кровотечением в родах и мас-
сивным гемолизом. Гемолиз проявляется нара-
стающей анемией, повышением уровня непря-
мого билирубина в крови, гемоглобинурией.
Центральная нервная система. При нефропа-
тии беременных поражение головного мозга
может иметь различную природу. Наиболее спе-
цифическим и грозным неврологическим син-
дромом является эклампсия. Она наблюдается
у 0,04—0,2 % всех беременных и остается од-
ной из основных причин материнской и пери-
натальной смертности.
Эклампсия является проявлением церебраль-
ной ишемии на фоне микроангиопатии, ангио-
спазма и внутрисосудистой гиперкоагуляции.
Вследствие повышенной сосудистой проница-
емости развиваются петехиальные кровоизли-
яния и отек мозгового вещества. Церебральные
сосудистые изменения исчезают после родораз-
решения не сразу, а в течение нескольких дней,
иногда недель. Вот почему сохраняется риск раз-
вития эклампсии в постродовой период. Пост-
родовая эклампсия возможна также при непол-
ном отделении плаценты.
Эклампсия характеризуется развитием комы,
обычно в сочетании с гиперрефлексией и су-
дорогами. Очевидной связи между тяжестью
гипертонии и эклампсией нет. Более того, в
значительном числе случаев эклампсия разви-
вается при относительно невысоких цифрах АД
либо при чрезмерно активной тактике гипотен-
зивной терапии [Weiner С.Р., 1987].
В табл. 25.1 представлены наши данные, по-
лученные при анализе клинических проявле-
ний, предшествовавших развитию эклампсии у
14 больных [Рогов В.А. и соавт., 1995]. Так, в
14 % случаев эклампсия наступала при АД ме-
нее 140/90 мм рт.ст. и в 36 % случаев — при
умеренном повышении АД (140/90—165/105 мм
рт.ст.). Характерным было увеличение протеи-
нурии при каждом последующем анализе мочи
с быстрым обратным развитием после родов. Во
всех случаях общий анализ мочи выявлял уро-
вень протеинурии, превышавший 0,3 г/л. Оте-
ки были частым проявлением (86 %), но все
же не абсолютно обязательным. Нередко отме-
чались клинические проявления плацентарной
недостаточности (внутриутробная задержка раз-
вития и гибель плода, отслойка плаценты).
Эклампсии могут предшествовать различные
неврологические симптомы. Это пульсирующая
головная боль, тошнота, рвота, лихорадка цен-
трального генеза, субъективные и объективные
Таблица 25.1. Частота различных клинических
проявлений, предшествовавших эклампсии у 14 бе-
ременных (все первородящие) [Рогов В.А. и соавт.,
1995]
Клинический признак Частота признака, п (%)
Отсутствие гипертонии 2(14)
АД 140/90—165/105 мм рт.ст. 5 (36)
АД 170/110 мм рт.ст. и более 7(50)
Протеинурия более 0,3 г/л Бурное прогрессирование про- теинурии с быстрым снижени- 14 (100)
ем после родов 14 (100)
Отеки Внутриутробная задержка раз- 12 (86)
вития плода 9 (64)
Внутриутробная гибель плода Преждевременная отслойка 1 (7)
плаценты 3(21)
зрительные нарушения. Головная боль, как
правило, плохо поддается воздействию обыч-
ных анальгетиков, для нее характерна локали-
зация в каких-либо определенных зонах (лоб,
виски), она часто сопровождается чувством
страха и возбуждением.
Лихорадка, особенно в сочетании с тошно-
той и рвотой, может симулировать пищевую
токсикоинфекцию.
Зрительные нарушения при нефропатии бе-
ременных относительно редки и включают
амавроз (полная слепота), диплопию (расплыв-
чатость и двоение), одностороннюю гемианоп-
сию (половинное зрение с одной и той же сто-
роны в обоих глазах), скотому (выпадение по-
лей зрения) и хроматопсию (усиление цвето-
вого зрения).
Острая тяжелая гипертония у ранее здоро-
вой женщины всегда опасна развитием гипер-
тензивных осложнений со стороны головного
мозга. Одно из них кровоизлияние в мозг и его
оболочки. Геморрагический инсульт является
причиной смерти у 15—20 % беременных, по-
гибших от поражения мозга. Однако кровоиз-
лияние в мозг, проявляясь очаговой невроло-
гической симптоматикой, отличается от эклам-
псии.
Другим следствием повышения АД являет-
ся гипертензивная энцефалопатия. Она прояв-
ляется головными болями, мельканием «му-
шек» перед глазами, тошнотой и рвотой, ко-
торые практически невозможно отличить от
симптомов, предшествующих эклампсии.
В тяжелых случаях нефропатии беременных,
сопровождающихся ДВС-синдромом и акушер-
ским кровотечением, может развиться глубокая
и необратимая ишемия головного мозга.
470
Печень. Поражение печени развивается ред-
ко и при наиболее тяжелых формах нефропа-
тии беременных, протекающих с эклампсией
или ДВС-синдромом. Морфологической осно-
вой печеночных изменений является тромботи-
ческая микроангиопатия с формированием
очагов ишемии. Обнаруживают внутрипеченоч-
ные геморрагии, жировую дистрофию гепато-
цитов, перипортальные некрозы.
Поражение печени проявляет себя специфи-
ческой клинической картиной — гемолизом,
гиперферментемией и тромбоцитопенией. Эта
триада получила название HELLP-синдром
(HELLP — Н-Hemolysis, EL — Elevated Liver
enzymes, LP — Low Platelet count). Поражение
печени может проявляться также болями в эпи-
гастрии и правом подреберье. Считается, что
причиной болей являются субкапсулярные кро-
воизлияния в печень, ее отек и перерастяже-
ние капсулы. Эти боли могут быть предвестни-
ками эклампсии.
При несвоевременном родоразрешении бе-
ременная с HELLP-синдром погибает от пече-
ночно-почечной недостаточности или массив-
ного акушерского кровотечения.
Течение нефропатии беременных.
Нефропатия возникает всегда во вторую поло-
вину беременности (после 20—22-й недели).
Только при пузырном заносе ее развитие мо-
жет иметь место в более ранние сроки. Среди
первых проявлений нефропатии обсуждаются
нарушения сосудистого тонуса и лабораторные
признаки эндотелиально-тромбоцитарной дис-
функции. Затем появляются и нарастают дру-
гие симптомы, прежде всего протеинурия, ги-
пертония и гиперурикемия. Замедляется разви-
тие плода.
Нефропатия беременных — подострое ослож-
нение беременности. Однако у разных больных
имеются существенные различия в темпах раз-
вития патологических изменений. По наблюде-
ниям C.Redman (1987, 1993), время от первых
клинических проявлений нефропатии до разви-
тия критических состояний, требующих сроч-
ного родоразрешения, колеблется от 2 дней до
3 нед, составляя в среднем 12 дней. Максималь-
ная длительность докритической стадии не
превышает 4—5 нед. В то же время известны
отдельные случаи острейшего фульминантного
течения нефропатии, когда от момента- полно-
го клинического благополучия до смерти про-
ходит всего несколько часов.
Принято выделять также атипичные формы
нефропатии: это эклампсия или гемолитико-уре-
мический синдром, возникшие как первое про-
явление нефропатии во время или после родов.
В большинстве случаев эти состояния развива-
ются в родах, реже в течение первых 2 сут пос-
ле родов или даже в более отдаленные сроки.
Для нефропатии беременных характерно
прогрессирующее течение. Это выражается в не-
уклонном нарастании тяжести отдельных про-
явлений или присоединении новых клиничес-
ких признаков. Ухудшается состояние не толь-
ко беременной женщины, но и плода. В итоге
развиваются такие критические состояния, как
эклампсия, острые осложнения гипертонии,
ДВС-синдром, почечная и печеночная недоста-
точность, отслойка плаценты, гибель плода.
Консервативное лечение, как правило, не
влияет на характер течения нефропатии. В луч-
шем случае можно надеяться на некоторое за-
медление прогрессирования. Единственным ра-
дикальным методом лечения нефропатии оста-
ется прерывание беременности. Если родораз-
решение не проведено своевременно, может на-
ступить смерть матери или ребенка.
После родоразрешения сразу начинается
обратное развитие всех проявлений нефропатии.
В большинстве случаев этот процесс протекает
динамично и заканчивается не позднее чем
через 1,5 мес. Реже выздоровление растягивает-
ся на 3—6 мес. При неосложненных формах
нефропатии выздоровление, как правило, пол-
ное, в то время как при осложненном течении
нефропатии некоторые изменения могут сохра-
няться.
Профилактика нефропатии бере-
менных. Беременная женщина должна нахо-
диться под особым контролем, если у нее име-
ются факторы риска нефропатии. Польза спе-
циальных профилактических мер у этой кате-
гории пациенток однозначно не обоснована.
В связи с тем что основные патологические и
патофизиологические изменения при нефропа-
тии обусловлены эндотелиально-тромбоцитар-
ными нарушениями, большое значение в пос-
ледние годы уделялось применению ангиопро-
тективных и антитромбоцитарных препаратов.
Прежде всего это АСК в малых дозах (от 60 до
125 мг/сут), механизм действия которой обус-
ловлен избирательным торможением синтеза
тромбоксана в тромбоцитах.
Исследования, выполненные на небольшом
числе наблюдений, показали эффективность
раннего назначения (со II триместра) АСК в
предотвращении нефропатии у беременных с
системной красной волчанкой или осложнен-
ным акушерским анамнезом [Beaufils М. et al.,
1985; Wallenburg H.C.S. et al., 1986; Benigni A. et
al., 1989; Schiff E. et al., 1989]. В многоцентро-
вом плацебо-контролируемом исследовании
CLASP (1994), которое включало 9364 беремен-
ные женщины «высокого риска», АСК снижал
вероятность преэклампсии на 12 %, однако
недостоверно. Эффективность АСК оказалась
статистически значимой только у больных с
ранним (до 32 нед) развитием нефропатии. В
471
другом большом плацебо-контролируемом ис-
следовании, включавшем 3135 беременных жен-
щин [Sibai В.М. et al., 1993], АСК также сни-
жала риск преэклампсии, но недостоверно.
В ряде исследований АСК комбинировали с
другим антитромбоцитарным препаратом — ди-
пиридамолом. Дипиридамол, по некоторым
данным, способен стимулировать продукцию
простациклина в эндотелии. Действие дипири-
дамола дозозависимо, поэтому его назначают
обычно в больших дозах (150—225 мг/сут). Если
эффективность АСК и дипиридамола по отно-
шению к нефропатии не очевидна, то их спо-
собность улучшать перинатальный прогноз не
вызывает сомнений. Во всех исследованиях при-
менение у беременных АСК и дипиридамола
отличалось высокой безопасностью.
Лечение нефропатии беременных.
Нефропатия беременных является малокура-
бельным синдромом. Сохранение беременнос-
ти при ней опасно для матери и плода из-за
неизбежного прогрессирования и возможности
развития критических состояний, прогнозиро-
вать которые невозможно. Нарастание плацен-
тарной недостаточности не только приостанав-
ливает созревание ребенка, оно может ухудшить
его состояние или даже привести к гибели. По-
пытка длительной консервативной терапии не-
фропатии приводит к нивелированию симпто-
мов и созданию картины ложного благополу-
чия. У этих больных почти всегда возникает
рецидив патологического процесса, причем в
более тяжелой форме [Стрижова Н.В., 1987;
Redman C.W., 1987, 1993]. Вот почему установ-
ление достоверного диагноза нефропатии слу-
жит показанием для родоразрешения. Это един-
ственный метод радикального лечения.
До родоразрешения больная нефропатией
должна быть обязательно госпитализирована в
отделение интенсивного наблюдения. Показан
палатный режим. Важно организовать динами-
ческую оценку тяжести состояния матери и
плода. Она состоит из регулярного контроля
АД, ежедневного (иногда почасового) опреде-
ления протеинурии и диуреза. Биохимическое
исследование крови должно включать опреде-
ление креатинина, мочевой кислоты, печеноч-
ных трансаминаз. Показана оценка коагулограм-
мы, тромбоцитов крови, гематокрита. Исследо-
вание плода включает ультразвуковые и биофи-
зические методы.
Цель консервативной терапии состоит в
предупреждении перехода нефропатии в ста-
дию критических проявлений и в непосред-
ственной борьбе с ее осложнениями. Основные
мероприятия включают седативную терапию,
коррекцию гиповолемии, гемодинамических и
коагуляционных нарушений, гипотензивное
лечение.
472
Для уменьшения возбудимости ЦНС и сни-
жения сосудистой реактивности препаратом
выбора является сульфат магния. Нейролепти-
ки (дроперидол), транквилизаторы (диазепам),
рекомендуемые некоторыми исследователями,
по всей видимости, уступают сульфату магния
по своей эффективности и безопасности
[Cunningham F.G., Pritchard J.A., 1984]. Широ-
та терапевтической дозы сернокислой магне-
зии, безвредность для плода позволяют вводить
препарат в различных режимах в зависимости
от тяжести состояния. При нефропатии сульфат
магния вводят сначала струйно (до 6 г), а за-
тем капельно (1 г/ч) в течение длительного
времени. При замедлении частоты дыхания до
14 в 1 мин или снижении диуреза до 100 мл/ч
инфузию препарата необходимо прекратить и
ввести антидот — глюконат кальция.
Инфузионная терапия имеет целью коррек-
цию реологического состояния крови и устра-
нение гиповолемии для улучшения перфузии
органов и тканей, прежде всего маточно-пла-
центарного комплекса. Она проводится под тща-
тельным контролем АД, ЦВД, диуреза, гема-
токрита [Fliegner J.R., 1987], чтобы избежать
гипергидратации и отека легких. Используются
растворы как низкомолекулярных (глюкоза, рео-
полиглюкин), так и высокомолекулярных ве-
ществ (альбумин, протеин, плазма крови). Пос-
ледние действуют наиболее значимо, они ис-
пользуются при развитии тяжелых клинических
форм нефропатии.
Коагуляционные нарушения обусловлены раз-
витием ДВС-синдрома и должны корригировать-
ся в зависимости от его тяжести и стадии. Мо-
гут использоваться аспирин в малых дозах (60—
125 мг/сут), гепарин (10 000—20 000 ЕД/сут под-
кожно), дипиридамол (до 300 мг/сут). Наиболее
эффективно переливание свежезамороженной
плазмы (не менее 800 мл/сут), содержащей ак-
тивную форму антитромбина III, Переливание
плазмы в ряде случаев целесообразно совмещать
с процедурой плазмафереза [Spencer C.D. et al.,
1982]. Антикоагулянтная и антиагрегантная те-
рапия должна осуществляться под строгим кон-
тролем показателей гемостаза.
Окончательно не решен принципиальный и
сложный вопрос о тактике антигипертензивного
лечения нефропатии беременных [Maikranz Р.,
Lindheimer M.D., 1987]. Большинство исследо-
вателей придерживаются мнения о том, что
уменьшение АД может дополнительно снизить
и без того скомпрометированный кровоток в
почках, головном мозге и в плаценте и тем
самым ухудшить состояние матери и плода
[Redman C.W., 1987, 1993]. Поэтому гипотен-
зивную терапию при нефропатии беременных
следует проводить с осторожностью с учетом
гемодинамических последствий. Это касается
прежде всего мягкой и умеренной гипертонии.
При этих формах способность гипотензивной
терапии улучшать исходы беременности в кон-
тролируемых исследованиях пока не подтверж-
дена.
Гипотензивное лечение обязательно должно
назначаться при тяжелой гипертонии (АД 170/
ПО мм рт.ст. и более), когда возникает риск
развития собственно гипертензивных осложне-
ний у матери (кровоизлияние в мозг, левоже-
лудочковая недостаточность и т.д.). Кризовой ха-
рактер гипертонии также является безусловным
показанием к лечению. Оптимальным следует
считать поддержание АД на уровне 130—140/
85—90 мм рт.ст. Подбор и контроль гипотензив-
ной терапии у беременных с нефропатией це-
лесообразно проводить с помощью суточного
(особенно ночного) мониторирования АД.
Безопасным антигипертензивным средством
считают а-метилдопу [Svensson А., 1993], од-
нако она эффективна только в высоких дозах,
превышающих обычные в 2—3 раза, что связа-
но с ускорением метаболизма препарата в пе-
чени во время беременности. Препаратами вы-
бора являются /1,-селективные адреноблокато-
ры длительного действия, которые назначают
в обычных суточных дозах: атенолол — 50—100
мг/сут в 2 приема; бетаксолол — 5—20 мг/сут
в один прием; метопролол — 100—200 мг/сут
в 2 приема. /1-Блокаторы могут использоваться
для приема внутрь и парентерально, что пред-
ставляется важным в случаях неотложной тера-
пии. Хорошо зарекомендовал себя а,/1-адреноб-
локатор лабеталол (100—200 мг/сут в 2 приема).
В качестве резервных препаратов могут исполь-
зоваться а-адреноблокаторы (празозин, докса-
зозин), нифедипин, гидралазин, диазоксид.
Тиазидовые и другие диуретики в качестве
антигипертензивных средств в последние годы
не рекомендуются. Считается, что они могут
уменьшить объем циркулирующей крови и спо-
собствовать гемодинамическим нарушениям в
органах и тканях. Диуретики должны приме-
няться только в крайних случаях, когда име-
ются трудно контролируемая гипертония и риск
гипертензивных осложнений.
Не следует назначать при нефропатии бере-
менных ганглио- и постганглиоблокирующие
симпатолитики (пентамин, октадин, резерпин,
раунатин) и содержащие их комплексные пре-
параты типа адельфана, так как они вызывают
острую кишечную непроходимость у плода.
Абсолютно противопоказаны ингибиторы ангио-
тензинпревращающего фермента (каптоприл,
эналаприл, рамиприл), которые могут привес-
ти к внутриутробной гибели плода, острой
почечной недостаточности и незаращению ар-
териального (боталлова) протока у новорожден-
ного.
25.2.2. Мочевая инфекция
у беременных
Мочевая инфекция, осложняющая беремен-
ность, может проявляться как бессимптомной
бактериурией, так и острым циститом или ост-
рым пиелонефритом. Пиелонефрит занимает
первое место в структуре экстрагенитальных за-
болеваний у беременных и родильниц; его час-
тота, по наблюдению З.М.Ахтамовой (1990), за
последние 20 лет возросла с 2 до 10 %. Около
10 % женщин, перенесших пиелонефрит бере-
менных, в последующем страдают хроническим
пиелонефритом [Лопаткин Н.А., Шабад А.Л.,
1985].
Острый пиелонефрит беременных развивает-
ся у 30—40 % женщин с нелеченой до бере-
менности бессимптомной бактериурией, что
позволяет рассматривать последнюю как важ-
ный фактор риска развития гестационного пи-
елонефрита. Под бессимптомной бактериурией
понимают бактериурию, количественно соот-
ветствующую истинной (более 100 000 бакте-
рий в 1 мл мочи), при отсутствии симптомов
мочевой инфекции; бессимптомная бактериу-
рия наиболее значительна между 9-й и 17-й
неделями беременности [Stenquist К. et al., 1989].
Даже без развития клинически выраженного
пиелонефрита бессимптомная бактериурия мо-
жет приводить к преждевременным родам, ане-
мизации беременной, ПЭ, низкой массе тела
новорожденного и внутриутробной гибели пло-
да [Davison J.M. et al., 1984, 1998; Graham J.M.
et al., 1993]. К факторам риска пиелонефрита
относят также пороки развития почек и моче-
вых путей (у 6—18 % женщин), камни почек и
мочеточников (примерно у 6 %), пузырно-мо-
четочниковый рефлюкс при цистите, воспали-
тельные заболевания женских половых органов,
сексуальную активность, прием контрацепти-
вов, метаболические нарушения, нейрогенный
мочевой пузырь и другие факторы. Риск моче-
вой инфекции увеличен у женщин, имеющих
поликистоз почек, губчатую почку, интерсти-
циальный нефрит, другие болезни почек. Су-
ществует мнение, что острый пиелонефрит
беременных всегда является обострением ранее
латентно протекавшего хронического пиело-
нефрита [Тиктинский О.Л., 1984]. Способству-
ют возникновению гестационного пиелонефри-
та и нарушения уродинамики, обусловленные
беременностью (расширения внутриполостной
системы почки). Таким образом, группу повы-
шенного риска для возникновения гестацион-
ного пиелонефрита составляют:
• беременные, ранее перенесшие урологичес-
кие заболевания;
• латентно протекающие заболевания почек;
473
• бактериурия;
• наличие интеркуррентных воспалительных
заболеваний;
• местные факторы, нарушающие уродинами-
ку (крупный плод, узкий таз, многоводие,
многоплодие).
Основной причиной гестационного пиело-
нефрита является кишечная палочка (в 75—
85 %), сравнительно реже встречаются энтеро-
кокки, стафилококки, клебсиелла, протей, си-
негнойная палочка. A.Hart и соавт. (1996), ис-
следуя по О-антигену E.coli как причину гес-
тационного пиелонефрита от 57 беременных,
выявили, что в I триместре преобладают серо-
типы 01, 03, 06, 015 и 075, в III тримест-
ре — серотип 075. Именно эти штаммы чаще
других высевают при заболеваниях мочевого
тракта. Найдена также связь между наличием
обогащенных К-рецепторами штаммов E.coli и
вовлечением в инфекционный процесс почеч-
ной паренхимы у беременных [Forland М., 1989].
В последние годы возросла роль госпитальных
штаммов грамотрицательных бактерий, отлича-
ющихся высокой вирулентностью и множе-
ственной резистентностью к антимикробным
препаратам как возбудителей тяжелых форм пи-
елонефрита.
Острый пиелонефрит беременных примерно
в половине случаев развивается на 20—30-й
неделе и почти в трети случаев — на 31—40-й
неделе беременности. В более ранние сроки,
когда матка еще находится в малом тазе и
оказывает давление на мочевой пузырь, чаще
развивается цистит (примерно у 1 % беремен-
ных). После родов опасность развития пиело-
нефрита остается высокой еще в течение 2—3
нед, пока сохраняется дилатация верхних мо-
чевых путей.
Патогенетической основой развития
инфекции является нарушение кровообращения
в почке, главным образом венозного оттока,
обусловленное расстройствами уродинамики.
Повышение внутрилоханочного и внутричашеч-
ного давления ведет к сдавлению тонкостенных
вен почечного синуса, разрыву форникальных
зон чашечек с прямым, попаданием инфекции
из лоханки в венозное русло почки.
Клиническая к а р т и н а. Острый пиело-
нефрит беременных обычно начинается с ост-
рого цистита (учащенное и болезненное моче-
испускание, боли в области мочевого пузыря,
терминальная гематурия), спустя 2—5 дней
(особенно без лечения) присоединяются лихо-
радка с ознобами и потами, боли в пояснич-
ной области, явления интоксикации (головная
боль, иногда рвота, тошнота), лейкоцитурия
(пиурия), бактериурия, хлопья, муть в моче.
Протеинурия, как правило, незначительная,
474
возможны гематурия (макрогематурия при по-
чечной колике, сосочковом некрозе), цилинд-
рурия; в крови — лейкоцитоз, возможны лей-
кемоидные реакции, умеренное снижение уров-
ня гемоглобина (в тяжелых случаях), диспро-
теинемия. Олигурия и высокая относительная
плотность мочи находятся в зависимости от
теряемых объемов жидкости за счет лихорадки
и катаболизма; пиелонефрит нередко сопровож-
дается заметным снижением клубочковой филь-
трации и креатининемией, в тяжелых случаях
(в 3—5 %) развитием ОПН. Полагают, что со-
судистая стенка беременных очень чувствитель-
на к вазоактивному эффекту бактериальных
эндотоксинов или цитокинов [Petersson С. et al.,
1994].
Для диагноза имеют значение местные
симптомы (боль и напряжение мышц в пояс-
ничной области, положительный симптом по-
колачивания), исследования осадка мочи коли-
чественными методами, бактериологическое ис-
следование мочи, ультразвуковое сканирование
почек, хромоцистоскопия. Нарушение выделе-
ния индигокармина у беременной во II и III
триместрах при наличии признаков острого пи-
елонефрита требует катетеризации мочеточни-
ков с обеих сторон как с диагностической, так
и с лечебной целью. Ультразвуковое исследо-
вание позволяет выявить конкременты, круп-
ные гнойники, дилатацию чашечно-лоханочной
системы. Обзорная и экскреторная урография,
радиоизотопная ренография используются толь-
ко в послеродовом периоде, хотя допускают
применение обзорной урографии после 2-го
месяца беременности при показаниях к опера-
тивному вмешательству.
Дифференциальный диагноз у бе-
ременных следует проводить при лихорадке —
с инфекцией респираторного тракта, виреми-
ей, токсоплазмозом (серологический скрининг);
при острых абдоминальных болях — с острым
аппендицитом, желчной коликой, гастроэнте-
ритом, фиброматозом матки, отслойкой пла-
центы и др.
Для острого аппендицита характерны лока-
лизация болей по центру живота, рвота, тем-
пература (обычно не столь высокая, как при
пиелонефрите) без озноба и потливости.
Упорные боли и гематурия при пиелонеф-
рите могут быть связаны как с его осложения-
ми, так и с другими причинами. Иногда ана-
томические изменения, обусловленные бере-
менностью, могут проявляться очень значитель-
ным растяжением лоханки, мочеточников, что
приводит к так называемому синдрому чрезмер-
ного растяжения и/или гипертензии [Satin S. et
al., 1993]. Определенным ориентиром служит
улучшение симптоматики после позиционной
терапии (придание положения на здоровом
боку, коленно-локтевое положение), при отсут-
ствии облегчения возможна катетеризация, в
том числе катетером-стентом и даже нефро-
стомия. Грозным осложнением гестационного
пиелонефрита является респираторный дист-
ресс-синдром, сопровождающийся печеночны-
ми и гематологическими нарушениями [Cun-
ningham F.B. et al., 1987, и др.], сепсис, бакте-
риемический шок, нетравматические разрывы
мочевого тракта. Диагностику латентно текущего
хронического пиелонефрита у беременных ос-
ложняет присоединение нефропатии беремен-
ных с тяжелым гипертоническим синдромом,
маскирующим основное заболевание.
Лечение мочевой инфекции у беремен-
ных должно быть эффективным по отношению
к возбудителю и безопасным для плода. Риск
возникновения патологических изменений в
организме плода особенно велик в первые 8 нед
беременности (период эмбриогенеза), поэтому
лечение гестационного пиелонефрита следует
проводить с учетом срока беременности (триме-
стра), начинать после восстановления нормаль-
ного пассажа мочи, определения возбудителя с
учетом его чувствительности, реакции мочи и
нарушения функции почек. Для лечения моче-
вой инфекции беременных используют антибакте-
риальные препараты (антибиотики, уроантисеп-
тики), позиционную терапию, катетеризацию
мочеточников, в том числе катетером-стентом,
оперативное вмешательство (декапсуляция поч-
ки, вскрытие гнойных очагов, наложение не-
фростомы, нефрэктомию), дезинтоксикацион-
ную терапию, физиотерапию (табл. 25.2).
Профилактика. Антибактериальная тера-
пия бессимптомной бактериурии снижает веро-
ятность возникновения острого пиелонефрита
у 80 % беременных [Kiningham R., 1993]. Для
лечения бессимптомной бактериурии использу-
Таблица 25.2. Применение антимикробных пре-
паратов во время беременности
Противопоказаны Применять с осторожностью Применение безопасно
Левомицетин Тетрациклины Фторхинолоны Гентамицин Ампициллин Ампиокс Амоксициллин Карбенициллин
Стрептомицин Имипенем Цефалоспорины
Фуразолидон Триметоприм Фурагин’
Бисептол Сульфанилами- ды пролонгиро- ванного дейст- вия Клиндамицин Уросульфан, эта зол 5-НОК Макролиды
* Отменять за 2—3 нед до родов.
ют фурагин по 0,1 г 3 раза в сутки, ампицил-
лин по 0,5 г 4 раза в сутки, цефалексин по 0,5 г
4 раза в сутки. Курс лечения 7—14 дней, хотя
существует точка зрения о целесообразности
применения однократной высокой дозы препа-
рата [Zinner S.H., 1992]. Удобен в применении
монурал (препарат широкого спектра действия
для лечения инфекции нижних мочевых путей,
содержит фосфомицин трометазол). Препарат
назначают однократно в разовой дозе 3 г, жела-
тельно вечером перед сном после освобожде-
ния мочевого пузыря. Аналогичная терапия
применяется у беременных для лечения остро-
го цистита. Необходимо помнить, что жалобы
на частые позывы к мочеиспусканию, диском-
форт в надлобковой области, «слабый мочевой
пузырь», никтурия могут быть связаны с самой
беременностью и требуют лечения лишь при
обнаружении бактериурии, гематурии. При раз-
витии острого пиелонефрита, если состояние
больной тяжелое и существует угроза для жиз-
ни, лечение начинают сразу после взятия мочи
для посева препаратами широкого спектра дей-
ствия, эффективными против наиболее частых
возбудителей пиелонефрита (ампициллин, ам-
пиокс, карбенициллин, цефалоспорины). Эф-
фективность препаратов может быть оценена
уже через 48 ч от начала терапии. При менее
тяжелом состоянии назначение антимикробных
препаратов имеет смысл отсрочить до получе-
ния данных о чувствительности возбудителя к
определенным антибиотикам. При выявлении
клебсиеллы, синегнойной палочки, устойчивых
к пенициллинам и цефалоспоринам, возмож-
но применение аминогликозидов. Препаратом
выбора в таких ситуациях является гентамицин
(во II—III триместре), при наличии ограниче-
ний к его применению можно применять азт-
реонам (монобактамы).
Наряду с антибиотиками при лечении пие-
лонефрита беременных во второй полови-
не беременности назначают уроантисептики:
5-НОК (нитроксолин), фурагин, уросульфан.
Сульфаниламиды и нитрофураны должны быть
отменены за 2—3 нед до родов из-за риска ос-
ложнений для плода (ядерная желтуха, гемо-
лиз).
Лечение острого пиелонефрита (или обостре-
ния хронического) должно быть длительным
(не менее 3 нед); при проведении терапии толь-
ко в течение 2 нед частота рецидивов достига-
ет 60 % [Шехтман М.М., 1996].
Критерием излеченности пиелонефрита бе-
ременных и родильниц служат исчезновение
клинических признаков болезни, изменений
лабораторных показателей при трехкратном
исследовании, отсутствие бактериурии через 5—
7 дней после отмены антибактериальных
средств. С увеличением срока беременности
475
возрастает роль механического фактора в раз-
витии обструкции мочевых путей, в связи с
этим применяют позиционную терапию, при
необходимости дренирование почки специаль-
ным мочеточниковым катетером-стентом. По
показаниям назначают инфузионную, спазмо-
литическую, десенсибилизирующую, симптома-
тическую терапию, хирургическое лечение. Ос-
трый и обострившийся пиелонефрит не явля-
ется показанием к прерыванию беременности,
если заболевание не запущено, нет терминаль-
ной ХПН или тяжелой артериальной гиперто-
нии [Лопаткин Н.А., Шабад А.Л., 1985].
Профилактика гестационного пиелонефри-
та направлена на выявление ранних признаков
заболевания и предупреждение его обострений.
В течение всей беременности необходимо ди-
намическое наблюдение с исследованием мочи
(цитологическое и бактериологическое) не
реже одного раза в 14 дней, раннее выявление
нарушений уродинамики, своевременное назна-
чение необходимой терапии.
25.2.3. Острая почечная
недостаточность у беременных
Острая почечная недостаточность (ОПН) явля-
ется угрожающим жизни осложнением беремен-
ности. В 60-е годы частота ОПН составляла 0,5
на 1000 беременностей, в настоящее время в
большинстве стран Европы и США не превы-
шает 1 на 20 000 родов и составляет менее 10 %
всех случаев ОПН, хотя в странах Азии эта доля
остается высокой — от 15 до 20 % [Rahman М.,
Hossain М., 1991]. Изменилась и частота леталь-
ных исходов от ОПН среди беременных; смер-
тность, достигавшая ранее 56 %, снизилась до
10 %. По данным Всемирной организации здра-
воохранения, основной причиной ОПН (до
40 %) в развивающихся странах является сеп-
тический аборт. Частыми причинами ОПН,
кроме септического аборта, являются тяжелые
формы нефропатии беременных (эклампсия,
HELLP-синдром), профузные акушерские кро-
вотечения (преждевременная отслойка плацен-
ты, гипотоническое маточное кровотечение),
на долю которых приходится более половины
случаев ОПН беременных. В 3—5 % случаев
ОПН обусловлена гестационным пиелонефри-
том, в 15—20 % — внутриутробной смертью
плода, эмболией околоплодными водами и
другими причинами. В 10—15 % случаев ОПН
наблюдается в раннем послеродовом периоде
(ГУС, сепсис, трансфузионные осложнения)
[Beaufils М., 1998].
ОПН обычно развивается у женщин при
развитии вазоконстрикции и гиповолемии. Спо-
собствуют уменьшению циркулирующего объе-
476
ма крови дегидратация вследствие диареи, рво-
ты, кровопотери, назначение салуретиков, не-
стероидных противовоспалительных препаратов,
отечный синдром различного генеза. Следстви-
ем резкого уменьшения циркулирующего объе-
ма является нарушение почечного кровообра-
щения.
Морфологической основой ОПН, связанной
с беременностью, являются острый канальце-
вый некроз, наиболее характерный для ПЭ и/
или HELLP-синдрома, микроангиопатия, ле-
жащая в основе гемолитико-уремического синд-
рома (ГУС), и двусторонний кортикальный не-
кроз, развивающийся при любом из этих ослож-
нений беременности. На долю беременности
приходится до 5—8 % всех случаев двусторон-
него кортикального некроза [Kleinknecht D. et al.,
1973; Chugh K.S. et al., 1994]. Выраженность по-
чечной недостаточности зависит от степени
сосудистых повреждений и наличия ишемии.
Показано, что ишемия и/или вазоконстрикция
в коре почки вызывает прямое повреждение
клеток проксимальных отделов канальцев и
особенно чувствительных к гипоксии и ишемии
клеток восходящего толстого отдела петли не-
фрона (петли Генле) [Brezis М., Rosen S., 1995].
Повреждение канальцев значительно увеличи-
вается при снижении простациклина и оксида
азота или избыточном содержании эндотели-
на — факторов эндотелиальной дисфункции,
лежащих в основе большинства осложнений бе-
ременности. Так, после преждевременной от-
слойки плаценты немедленно возникает вазо-
констрикция, при ее. продолжительности более
часа развивается очаговый, а затем диффузный
канальцевый некроз [Sheehan H.L., 1981]. Даль-
нейшее сохранение вазоконстрикции приводит
к развитию двустороннего кортикального не-
кроза — до 36 % [Chugh K.S. et al., 1994]. По-
вреждение почечной коры развивается и при
тяжелых вариантах нефропатии беременных,
протекающих с ДВС-синдромом. В этом случае
причиной поражения почек является тромбоз
капилляров клубочков с образованием очаго-
вых инфарктов или тотального некроза корко-
вого слоя почек. При тяжелом ДВС-синдроме,
протекающем с массивным гемолизом, может
развиться обструкция почечных канальцев мо-
лекулами гемоглобина.
У беременных могут развиваться все формы
ОПН: преренальная (гиповолемическая), ре-
нальная (при канальцевом или кортикальном
некрозе), постренальная (вследствие обструк-
тивных причин).
Для нефропатии беременных (преэклампсия,
эклампсия) более характерны преренальная
ОПН и канальцевый некроз. При пререналъной
(гиповолемической) ОПН изменения в анали-
зах мочи часто отсутствуют, может быть повы-
шенное число гиалиновых и зернистых цилин-
дров; характерны олигурия со снижением на-
трийуреза (концентрация натрия в моче менее
10 ммоль/л), увеличение осмолярности мочи,
отношение креатинина мочи к креатинину
плазмы свыше 10. Азотовыделительная функция
почек относительно сохранена. Восстановлению
почечных функций способствует быстрое вос-
полнение объема крови.
Острый канальцевый некроз проявляется рез-
кой олигурией и мочевым синдромом (безбо-
левая микрогематурия, умеренная протеинурия,
цилиндрурия). Относительная плотность мочи и
концентрация в ней креатинина резко сниже-
ны, экскреция натрия увеличена. Быстро
присоединяется азотемия. При УЗИ размеры
почек не уменьшены. Канальцевый некроз чаще
полностью или частично обратим.
Варианты нефропатии беременных, проте-
кающие с ДВС-синдромом (HELLP-синдром,
ГУС), ряд акушерских осложнений (внутриут-
робная гибель плода, эмболия околоплодными
водами, грамотрицательный сепсис) могут ос-
ложняться наиболее тяжелой ренальной формой
ОПН — кортикальным некрозом (до 30 % слу-
чаев ОПН, обусловленной беременностью).
Появляются интенсивные боли в поясничной
области, лихорадка с нейтрофильным лейко-
цитозом, макрогематурия с протеинурией (не-
редко высокой), олигурия, быстро переходящая
в анурию. При анурии, сохраняющейся более
15—20 дней, несмотря на проводимую терапию,
диагноз кортикального некроза очевиден. АД
умеренно повышено, в последующем может
присоединиться злокачественная гипертония.
Диагностическое значение имеют быстрое
уменьшение размеров почек и кальциноз коры
при ультразвуковом сканировании и компью-
терной томографии. Кортикальный некроз не-
редко заканчивается сморщиванием почек и
уремией. Высокая смертность (до 61 %, по дан-
ным K.S.Chugh и соавт., 1994) при кортикаль-
ном некрозе может быть связана с такими ос-
ложнениями как септицемия, отек легкого,
желудочно-кишечное кровотечение, развитием
не только почечной недостаточности, но и
полиорганной в связи с обширными некроза-
ми во многих органах — надпочечниках, селе-
зенке, легких, поджелудочной железе, матке.
Дифференциально-диагностические крите-
рии клинических синдромов, приводящих к
ОПН, представлены в табл. 25.3.
Частота обструкции мочевого тракта, при-
водящая к ОПН у беременных с двусторонним
нефролитиазом или наличием камней в един-
ственной почке, практически не отличается от
таковой у небеременных женщин. Клиническая
картина характеризуется болями в поясничной
области и/или макрогематурией нередко с при-
Таблица 25.3. Клинико-лабораторные признаки
основных клинических синдромов, приводящих к
ОПН беременных
Признаки
Синдром и период развития
ПЭ, III три- местр HELLP, III три- местр ГУС, после родов
Связь с ПЭ, % ++ Возможно
Гипертония, % +++ ++ +
Тромбоцитопения + +++ +
две + ++ ++
Трансаминазы — +++ —
Билирубин — + ++
Гемолитическая анемия — ++ +++
Неврологические симптомы + + +
Примечание. ПЭ — преэклампсия, ГУС — гемолитико-уре-
мический синдром; + — частота признака: ± — есть, нет,
+ — редко, ++ — часто, +++ — постоянно (всегда).
знаками мочевой инфекции. Предпочтительный
диагностический метод — УЗИ почек, выявля-
ющее дилатацию ЧЛС, а нередко и камни. Для
устранения обструкции используют мочеточни-
ковые стенты, чрескожную нефростомию
[Hendricks S.A., 1991]. К крайне редким причи-
нам ОПН беременных относят сдавление мо-
четочников беременной маткой [Brandes J.C.,
Fritsche С., 1991]; наблюдалось при беременно-
сти двойней, многоводии, из 14 сообщенных
случаев 11 относились к первородящим.
Описано два случая острой мочекислой бло-
кады канальцев почек как причины ОПН у бе-
ременных (в обоих случаях уровень мочевой
кислоты в сыворотке крови превышал 700
мкмоль/л). Гидратация, ощелачивание и фор-
сированный диурез с маннитолом способство-
вали восстановлению почечных функций
[Alexopoulos Е. et al., 1992].
Редкой причиной ОПН беременных являют-
ся осложняющие острый пиелонефрит бактери-
емический шок, апостематозный нефрит. Бак-
териемический шок может быть обусловлен
назначением антибактериальной терапии при
пиелонефрите без предшествующего восстанов-
ления пассажа мочи; как правило, вызван гра-
мотрицательной флорой. ОПН быстро нараста-
ет на фоне коллапса, гипотермии, прекоматоз-
ного состояния, нередко присоединяется ДВС-
синдром. При этом сосудистый коллапс усугуб-
ляется острой надпочечниковой недостаточно-
стью (за счет кровоизлияния в надпочечники),
что может привести к острому канальцевому
некрозу. В диагностике бактериемического шока
важное значение имеет установление окклюзии
мочевых путей (хромоцистоскопия, рентгено-
логические и радионуклидные методы).
477
ОПН у беременных может быть обусловле-
на заболеваниями, не связанными с беремен-
ностью; среди них — острый гломерулонефрит,
ХГН, интерстициальный нефрит, ПИЭ, ВН,
васкулиты, возникновение и обострение кото-
рых нередко наблюдаются у беременных.
Лечение ОПН у беременных проводится
по принципам лечения ОПН (см. главу 28), од-
нако имеет некоторые особенности. Прежде все-
го необходимо исключить наличие скрытого
маточного кровотечения, являющегося триггер-
ным или провоцирующим фактором ОПН,
провести коррекцию гемодинамических нару-
шений с учетом патофизиологических механиз-
мов, выявить причину и решить вопрос о по-
казаниях к немедленному родоразрешению.
При достаточном гестационном сроке (свы-
ше 30—34 нед) рекомендуется быстрое родо-
разрешение, позволяющее исключить замедле-
ние роста или внутриутробную смерть плода и
улучшающее дальнейший прогноз матери.
При развитии преэклампсии, HELLP-синдро-
ма вне зависимости от гестационного возраста
плода единственным средством, предотвраща-
ющим прогрессирование заболевания, приво-
дящее к смерти матери, является родоразреше-
ние. При ситуациях, не угрожающих жизни
матери, возможно продолжение беременности
[Beaufils М., 1998].
При преренальной ОПН необходимо прежде
всего ликвидировать гиповолемию — восстано-
вить внутрисосудистый объем жидкости путем
вливания физиологического раствора, плазмы,
крупномолекулярных декстранов, альбумина;
корригировать водно-электролитные наруше-
ния, гипопротеинемию. Не использовать пре-
параты, которые могут поддерживать гипово-
лемию (диуретики, нестероидные противовос-
палительные препараты).
При остром канальцевом некрозе беременных
лечение направлено на борьбу с ишемией (вос-
становление кровоснабжения почек), поддержа-
ние баланса жидкости и электролитов, лечение
инфекции. При отсутствии эффекта допустимо
проведение гемодиализа, перитонеального диа-
лиза. Рекомендуется осуществлять такой режим
диализа, при котором уровень мочевины крови
не превышает 20 ммоль/л и не нарушается ма-
точно-плацентарное кровообращение.
На ранней стадии кортикального некроза
используется терапия, включающая антикоагу-
лянты (гепарин, антитромбин III), антиагреган-
ты (курантил), обменные переливания натив-
ной или свежезамороженной плазмы. При от-
сутствии эффекта применяется гемодиализ.
При развитии обструктивной ОПН необхо-
димы восстановление пассажа мочи, при необ-
ходимости массивная антибактериальная, де-
зинтоксикационная терапия (гестационном
пиелонефрите), борьба с сосудистой недоста-
точностью при осложнении бактериемическим
шоком.
25.3. Хронический гломеруло-
нефрит и беременность
25.3.1. Взаимовлияние хронического
гломерулонефрита и беременности
Распространенность ХГН у беременных состав-
ляет 0,1—0,2 %, а по данным В.Н.Серова и
соавт. (1988), имеет тенденцию к увеличению
в последние годы до 0,5—0,8 %. В литературе
анализируются более 800 беременностей у по-
чти полутысячи больных ХГН. Наш собствен-
ный опыт касается наблюдения более 150 бе-
ременных с ХГН. Влияние беременности на
течение нефрита и, напротив, нефрита на ис-
ходы беременности представлено в табл. 25.4 и
25.5 [Katz A.I. et al., 1980; Barcelo P. et al., 1986;
Packham D.K. et al., 1988, 1989; Kincaid-Smith P.
et al., 1992; Jungers P., Chauveau D., 1997].
Таблица 25.4. Течение ХГН во время беремен-
ности
Нефрологические осложнения Данные литературы Собственные данные
Увеличение протеинурии, % 7—59 34,6
Появление de novo или 4—58 29,5
обострение гипертонии, %
Снижение функции почек, % 3—17 15,4
Таблица 25.5. Частота перинатальных и акушер-
ских осложнений беременности при ХГН
Осложнения беременности Популяция в целом (данные литера- туры) Беременные с ХГН
(данные литера- туры) (собст- венные данные)
Совокупные потери плода и новорожден- ного, % 0,6—6,3 7—20 15,4
Внутриутробная за- держка развития пло- да, % 4,1—7,8 4—26 25
Преждевременные роды, % Преждевременная от- 1,0—10,3 10—24 17,3
слойка плаценты, % 0,1—0,5 2—4 1,9
Нефропатия беремен- ных, % 0,9—3 10—40 7,7
478
Различные гестационные осложнения ХГН,
по нашим данным, отмечаются почти у поло-
вины всех больных, при этом у 2/3 беременных
изменения являются обратимыми и исчезают
после родоразрешения. У другой половины
больных беременность не оказывает существен-
ного влияния на течение ХГН.
Перинатальные и акушерские осложнения
развиваются у каждой второй беременной с ХГН.
Их частота в 2—3 раза выше, чем в популяции.
Но все же почти у 85 % больных ХГН беремен-
ность завершается рождением живых детей, сре-
ди которых более 60 % доношены и имеют нор-
мальную массу тела. В целом 52 % всех беремен-
ностей у больных ХГН завершается рождением
в срок детей с нормальной массой тела.
Обращают на себя внимания большие раз-
личия в данных литературы о числе нефроло-
гических и акушерских осложнений, приводи-
мых в табл. 25.4 и 25.5. Это связано главным об-
разом с различиями диагностических критери-
ев тех или иных осложнений, применяемых в
исследованиях и неодинаковым отбором боль-
ных для анализа.
Негативное взаимовлияние беременности и
ХГН связывают с развитием у ряда больных
внутриклубочковой гипертонии (гиперфильтра-
ции) [Packham D. et al., 1988; Ishitohi F. et al.,
1991; Kincaid-Smith P. et al., 1992; Nochy D. et
aL, 1994], а также co значительной функцио-
нальной активацией тромбоцитов и эндотелия
сосудов [Тареева И.Е. и др., 1996; Pomeranz М.
et al., 1995]. Однако полностью механизмы не-
фрологических, акушерских и перинатальных
осложнений у беременных с ХГН неясны.
25.3.2. Прогноз осложнений
Среди клинических признаков нефрита самы-
ми прогностически неблагоприятными являют-
ся гипертония и почечная недостаточность.
По данным различных исследований, при
гипертензивных вариантах нефрита по сравне-
нию с нормотензивными формами у больных в
3 раза чаще присоединяется нефропатия бере-
менных, в 2—4 раза чаще происходят преждев-
ременные роды, в 2—9 раз чаще — потери пло-
да и в 6—7 раз чаще — гипотрофия плода. Та-
кое грозное осложнение, как преждевременная
отслойка плаценты, развилось только у беремен-
ных с гипертонией [Шехтман М.М., 1987].
Имеет значение время развития гипертонии.
У больных ХГН с гипертонией, предшествовав-
шей наступлению беременности (так называе-
мая хроническая гипертония), потери плода
отмечены в 5 раз чаще, чем у беременных с
гипертонией, впервые возникшей в III триме-
стре. Раннее (до 32 нед беременности) присо-
единение гипертонии или ее тяжелая форма
(диастолическое АД >110 мм рт.ст.) также свя-
заны с увеличением потерь плода и прежде-
временных родов.
По нашим данным, наличие гипертонии
указывает на вероятность ухудшения функции
почек во время беременности и потерю плода
у каждой пятой и каждой третьей больной со-
ответственно. Кроме того, при гипертонии воз-
растает риск преждевременных родов (29 %
больных) и внутриутробной задержки развития
плода (43 % больных).
При почечной недостаточности исходы бе-
ременности наименее благоприятны. Некоторые
исследователи считают, что беременность не
ухудшает течения ХГН, если функция почек
нормальная. Если же в момент зачатия уровень
креатинина крови больше 180 мкмоль/л (2 мг %),
то имеется высокий риск дополнительного
ухудшения функции почек во время беремен-
ности.
Почечная недостаточность является прогно-
стическим фактором потерь плода и преждев-
ременных родов. По нашим данным, у больных
со сниженной функцией почек в 2,4 раза воз-
растает риск гестационного увеличения АД
(50 % больных) и почти в 5 раз — потерь пло-
да (58 % больных). У трети больных роды яв-
ляются преждевременными, т.е. более чем в
2 раза чаще по сравнению с больными ХГН с
нормальной функцией почек.
Беременность при выраженной почечной
недостаточности встречается редко. Несмотря на
то что репродуктивная функция у большинства
женщин с уремией нарушена вследствие гипер-
пролактинемии (ановуляция, аменорея), в не-
которых случаях беременность возможна. У та-
ких женщин, находящихся на лечении диали-
зом, беременность в 75—80 % случаев заверша-
ется гибелью плода или новорожденного. Жи-
вые новорожденные в 60 % случаев рождаются
преждевременно (до 36 нед беременности) и
более чем в 40 % — с дефицитом массы тела.
У матери возможны нарастание тяжести гипер-
тонии, преждевременная отслойка плаценты,
прогрессирование остеодистрофии, усугубление
анемии, ухудшение результатов пересадки поч-
ки и др. [Hou S., 1999].
Мнения исследователей о прогностическом
значении нефротического синдрома не всегда
совпадают. М.М.Шехтман (1987) считает, что
беременность при изолированном нефротичес-
ком синдроме протекает с увеличением числа
случаев гипотрофии и преждевременных родов.
Сообщается также, что протеинурия нефро-
тического уровня связана с увеличением потерь
плода [Packham D.K. et al., 1988, 1989]. В то же
время, по данным P.Barcelo и соавт. (1986),
частота неблагоприятных исходов беременнос-
479
ти для матери и плода была одинаковой в 3
группах больных ХГН, отличавшихся по уров-
ню протеинурии. При высокой протеинурии
достоверным было только рождение детей с де-
фицитом массы тела.
По нашим данным, у больных ХГН нефро-
тический синдром в 4,6 раза повышает риск
преждевременных родов (64 % больных) и в 1,9
раза — риск задержки развития плода (52 % боль-
ных). При нефротическом синдроме в 2,4 раза
чаще присоединяется или обостряется гиперто-
ния (44 % больных) и почти в 5 раз чаще ухуд-
шается функция почек (25 % больных), чем у бе-
ременных с ХГН без нефротического синдрома.
Данные о гестационных осложнениях в зави-
симости от морфологического типа нефрита от-
ражены в табл. 25.6 |Katz A.I. et al., 1980; Barcelo
P. et al., 1986; Packham D.K. et al., 1988, 1989;
Kincaid-Smith P. et al., 1992; Jungers P., Chauveau
D., 1997]. Как следует из таблицы, частота ослож-
нений у матери и плода имеет очень широкий
диапазон, что снижает прогностическую ценность
морфологических критериев.
Наиболее серьезным прогноз представляет-
ся при фокально-сегментарном склерозе и ме-
зангиокапиллярном нефрите, а наименее тре-
вожен он при минимальных изменениях. Из не-
специфических морфологических проявлений
прогностическое значение имеют сосудистые
(артериолярные) и тубулоинтерстициальные
повреждения. Чем больше этих изменений, тем
тяжелее течение беременности.
25.3.3. Профилактика нефрологических
акушерских и перинатальных
осложнений
Профилактика гестационного ухудшения не-
фрита и различных осложнений беременности
у больных ХГН основана на представлении о
роли в их развитии эндотелиально-тромбоци-
тарной гиперактивности. С этой целью исполь-
зуют обычно антитромбоцитарные и ангиопро-
текторные препараты. Наибольший опыт накоп-
лен в отношении аспирина, дипиридамола и
гепарина. В большинстве исследований они на-
значались в течение второго и третьего триме-
стра. Специальных противопоказаний к исполь-
зованию этих препаратов во время беременно-
сти не установлено.
АСК в малых дозах снижает продукцию
тромбоксана в тромбоцитах, а дипиридамол
повышает содержание циклического аденозин-
монофосфата в тромбоцитах. В конечном счете
они снижают функциональную активность
тромбоцитов и улучшают кровообращение в
плаценте, почках и других органах. Гепарин
является антикоагулянтом прямого действия и
обладает ангиопротективными свойствами. При
его использовании необходим контроль за со-
стоянием гемостаза.
АСК в дозе 60—80 мг/сут (в том числе в
комбинации с дипиридамолом) предотвращала
задержку развития и потери плода, преэклам-
псию у беременных с системной красной вол-
чанкой или осложненным акушерским анам-
незом [Wallenburg Н.С. et al., 1986, 1987, 1988;
Elder M.G. et al., 1988]. Нами было показано,
что у больных ХГН АСК (125 мг/сут) в соче-
тании с дипиридамолом (150—225 мг/сут), на-
значавшиеся с 16—20-й недели беременности
вплоть до родоразрешения, достоверно снижа-
ли частоту клинических проявлений плацен-
тарной недостаточности [Рогов В.А. и др.,
1993].
Гепарин (15 000 ЕД/сут подкожно в течение
II и III триместров) в комбинации с дипири-
дамолом (300 мг/сут) у беременных с хрони-
ческими почечными заболеваниями оказался
эффективным в профилактике преэклампсии и
потерь плода [North R.A. et al., 1990].
Таблица 25.6. Исходы беременности для матери и плода (в процентах) в зависимости от морфологи-
ческого типа ХГН
Осложнение ФСГГ/С МКГН МГН 1дА-МПГН Не 1дА-МПГН МИ
Увеличение протеинурии 0—71 59—67 22—80 7—62 53—73 0—33
Появление или усиление гипертонии 20—68 49—71 0—83 7—52 33—61 0
Присоединение или прогрессирование почечной недостаточности 0—50 12—25 0—50 0—26 3—33 0
Совокупные потери плода 6—50 16—26 0—35 7—30 18—20 0—33
Преждевременные роды 0—40 13—50 10—50 0—22 12—39 0—17
Внутриутробная задержка развития , плода 0—29 25 10—50 — 12—27 0—66
Условные обозначения: ФСГГ — фокально-сегментарный гломерулярный гиалиноз/склероз; МКГН — мезангиокапил-
лярный гломерулонефрит; МГН — мембранозный гломерулонефрит; 1дА-МПГН — мезангиопролиферативный гломерулонеф-
рит с фиксацией иммуноглобулина А; Не 1дА-МПГН — мезангиопролиферативный гломерулонефрит, не связанный с фиксаци-
ей иммуноглобулина А; МИ — нефрит с минимальными изменениями.
480
Таким образом, использование антитромбо-
цитарных, антикоагулянтных и ангиопротектор-
ных препаратов оправдывает себя в профилак-
тике, прежде всего плацентарной недостаточ-
ности. Менее очевиден их эффект в предупреж-
дении гестационных осложнений нефрита.
25.3.4. Особенности нефрологического
и акушерского ведения беременных
с ХГН
Режим и диета. Показаны ограничение физичес-
кой нагрузки и абдоминальная декомпрессия,
т.е. отдых в течение дня в коленно-локтевом
положении или положении на левом боку. Од-
нако клиническая целесообразность этих мер
подвергается сомнению некоторыми исследова-
телями [Wallenburg Н.С., 1990; Redman C.W.,
1993].
Не следует рекомендовать беременным с
ХГН значительное ограничение поваренной
соли и жидкости, а при наличии отеков и/или
гипертонии назначать диуретики. Считается, что
действия, способные привести к уменьшению
объема плазмы и повышению вязкости крови,
могут спровоцировать перфузионные наруше-
ния органов, в том числе плаценты. Больная
должна ориентироваться на свой солевой ап-
петит и чувство жажды.
У больных с начальной почечной недоста-
точностью может возникнуть вопрос о необхо-
димости соблюдения малобелковой диеты. В этих
случаях степень уменьшения потребляемого
белка должна определяться индивидуально. Рас-
ширение белковой диеты приводит к росту
креатинина в крови. В то же время белковое
голодание может быть причиной развития ане-
мии у матери, а также нарушить созревание
плода.
Больным ХГН во II и III триместрах бере-
менности следует рекомендовать дополнитель-
ное потребление кальция. Метаболизм кальция
возрастает во время беременности, его экскре-
ция увеличивается в 3—4 раза, он расходуется
на построение скелета плода. Кроме того, по
некоторым данным, кальций предотвращает
развитие гипертензивных осложнений беремен-
ности. В качестве пищевых добавок кальций
применяется в форме карбоната, глюконата,
цитрата или лактоглюконата в дозе 1500—2000
мг/сут.
Сообщается о пользе рыбьего жира, содер-
жащего полиненасыщенные жирные кислоты,
из которых в организме синтезируется проста-
циклин. Показано, что беременные, получавшие
рыбий жир, имели более продолжительные сро-
ки вынашивания, а новорожденные у этих жен-
шин —более высокую массу тела, чем у жен-
щин, не получавших рыбьего жира [Olsen S.F.
et al., 1992]. В качестве пищевой добавки рыбий
жир должен применяться в дозе 3—4 г/сут.
Наблюдение и родоразрешение, диагностика
нефропатии беременных. Беременные с ХГН
являются группой риска по развитию различ-
ных осложнений и, следовательно, подлежат
регулярному акушерско-нефрологическому дис-
пансерному наблюдению. Частота обследова-
ний, используемые методы исследования зави-
сят от течения нефрита и течения беременно-
сти у конкретной больной. Но обычно это тща-
тельный контроль (самоконтроль) АД, уровня
протеинурии и концентрации креатинина крови.
Протеинурию определяют не реже 1 раза в 2—
3 нед. Биохимическое исследование крови про-
водят не реже 1 раза в 1—1,5 мес.
Для своевременной диагностики внутриутроб-
ной задержки развития плода целесообразно пе-
риодически проводить ультразвуковую фетомет-
рию, начиная с 20—22-й недели. Необходим
контроль двигательной активности плода.
Вопрос о досрочном (т.е. до 36 нед включи-
тельно) родоразрешении у больных ХГН наи-
более часто возникает в случае некорригируе-
мого гестационного обострения или быстрого
прогрессирования нефрита со снижением фун-
кции почек и нарастанием тяжести гипертонии.
Гестационное обострение ХГН не отличается
существенно от обострения, возникшего вне бе-
ременности. Оно характеризуется развитием de
novo остронефритического (появление или уси-
ление артериальной гипертонии и/или гемату-
рии, повышение протеинурии, развитие отеков
и олигурии) или нефротического синдрома.
Нарастание уровня креатинина крови может
происходить постепенно у больных с уже на-
рушенной функцией почек или относительно
быстро при тяжелом обострении нефрита.
Любое проявление нефрита, будь то проте-
инурия или гематурия, почечная недостаточ-
ность или артериальная гипертония, еще не яв-
ляется основанием для прерывания беременно-
сти. Важнее динамика этих клинико-лаборатор-
ных проявлений. Нарастание изменений, не
поддающихся коррекции, — вот серьезная при-
чина для досрочного родоразрешения у боль-
ных ХГН.
При ухудшении нефрита в I триместре ра-
зумной тактикой ведения больной следует при-
знать прерывание беременности с последующим
активным лечением стероидами и/или иммуно-
депрессантами. Сложнее принять решение о
прерывании беременности при ухудшении ХГН
во II и III триместрах. Напротив, это решение
облегчается при беременности 34 нед и более.
Новорожденные, родившиеся в эти сроки,
имеют все шансы выжить и нормально разви-
ваться в будущем.
31—2950
481
К акушерским показаниям к досрочному
родоразрешению у больных ХГН относятся все
формы плацентарной недостаточности: хрони-
ческая, в случае ее прогрессирования, острая
и подострая. Основным проявлением хроничес-
кой плацентарной недостаточности является
задержка развития плода. Отставание в разви-
тии на 3—4 нед и более обычно является пред-
вестником внутриутробной гибели плода. Ост-
рая плацентарная недостаточность проявляется
преждевременной отслойкой плаценты с раз-
витием маточного кровотечения и высоким
риском гибели плода. К подострой форме пла-
центарной недостаточности относится нефро-
патия беременных (преэклампсия, протеинури-
ческая гипертония).
Ранняя диагностика нефропатии беременных
при ХГН сложна, так как основные клиничес-
кие проявления (гипертония и протеинурия)
обоих состояний одинаковы. Протеинурия и
повышенное АД, так же как их абсолютный
уровень, не могут быть надежными ориентира-
ми при выявлении нефропатии у беременных
с ХГН. Эти и другие проявления нефропатии
(гиперурикемия, отеки, roll-over-тест) у бере-
менных с ХГН оказываются в значительной
степени неспецифичными (табл. 25.7).
Мы считаем, что принципиальное значение
имеет динамика клинических и лабораторных
проявлений. Присоединение нефропатии у бе-
ременных с ХГН характеризуется стремитель-
ным нарастанием протеинурии до высокого уровня
часто в сочетании с обострением артериальной
гипертонии [Рогов В.А. и др., 1995]. При геста-
ционном обострении ХГН протеинурия увели-
Таблица 25.7. Чувствительность и специфич-
ность различных признаков нефропатии беремен-
ных (в докритическую стадию) у беременных с хро-
ническими заболеваниями почек (по В.А.Рогову и
ДР- 1995)
Признак нефропатии беременных Чувстви- тель- ность, % Специ- фич- ность, %
АД 140/90—165/105 мм рт.ст. 33 53
АД 170/110 мм рт.ст. и выше 66 91
Протеинурия 0,3 г/сут и выше 100 32
Отеки 100 35
Интенсивная прибавка массы тела 100 35
Мочевая кислота крови 4,5—6 мг% 7 47
Мочевая кислота крови более 6 мг% 57 80
Положительный roll-over-тест 66 70
Внутриутробная задержка разви- тия плода 66 95
Нарушения маточно-плацентарно- го кровотока (допплерометрия) 83 43
Первые предстоящие роды 83 39
чивается постепенно, стабилизируясь затем на
более высоком, чем прежде, уровне. Кроме
того, присоединение нефропатии беременных
у больных ХГН можно предполагать при воз-
никновении гипертонии в тяжелой форме,
признаках задержки развития плода.
Лечение нефрита во время беременности.
Принципиальным является вопрос о безопас-
ности и эффективности активного лечения
нефрита во время беременности. Сообщения на
эту тему единичны, что на сегодняшний день
не позволяет дать убедительных рекомендаций.
Имеется опыт использования глюкокортикои-
дов, плазмафереза, антитромботических и ги-
потензивных препаратов.
Описаны случаи лечения глюкокортикоида-
ми, в том числе сверхвысокими дозами (пульс-
терапия), мезангиопролиферативного нефрита
и ФСГС во время беременности [Packham D. et
al., 1988; Komatsuda A. et al., 1994]. Эффектив-
ность терапии была различна, побочные эффек-
ты не зарегистрированы.
Мы располагаем 6 наблюдениями больных,
у которых активное лечение нефрита предни-
золоном (40—60 мг/сут) проводилось в III три-
местре беременности в течение 5—13 нед. У 2
больных достигнута полная ремиссия нефрита,
у двух — неполная ремиссия со стабилизацией
клинико-лабораторных показателей, у двух —
эффекта от лечения не было. Таким образом,
эффективность стероидотерапии при гестацион-
ном обострении ХГН существенно не отлича-
лась от таковой при обострениях, не связанных
с беременностью, и зависела от общих факто-
ров (длительность нефрита, характер морфоло-
гических изменений в почках). Все 6 женщин
родили жизнеспособных детей, ни в одном слу-
чае не отмечено побочных эффектов стероидов
у новорожденных в неонатальном периоде.
При активных формах нефрита нередко име-
ются гиперкоагуляция и гиперагрегация. Во
время беременности нарушения гемостаза на-
растают, особенно при развитии плацентарной
недостаточности. Вот почему назначение анти-
тромботических препаратов представляется осо-
бенно оправданным. Чаще других применяют-
ся гепарин, дипиридамол, АСК в малых дозах.
Их назначение обосновано также с точки зре-
ния профилактики акушерских и перинаталь-
ных осложнений (см. выше).
Если характер течения нефрита требует
включения в терапию плазмафереза, беремен-
ность не является противопоказанием к его
проведению. Практический опыт применения
плазмафереза у беременных с ХГН ограничен.
В единичных наблюдениях плазмаферез приме-
нялся в качестве монотерапии или в сочетании
со стероидами и гепарином у беременных с
быстропрогрессирующим мезангиокапилляр-
482
ным нефритом или ФСГС [Harbord M.G. et al.,
1980; Packham D.K. et al., 1988; Morton M.R. et
al., 1993]. Лечение было эффективным, хотя и
в разной степени. Побочные эффекты не отме-
чены.
У беременных с ХГН гипертония ухудшает
нефрологический, акушерский и перинаталь-
ный прогноз. Поэтому гипотензивная терапия
(см. выше) может замедлить прогрессирование
нефрита и уменьшить число осложнений бере-
менности.
Литература
Рогов В.А., Тареева И.Е., Сидорова И. С. и др. Ацетил-
салициловая кислота и курантил в профилактике
зсложнсний беременности при гломерулонефрите и
'ипертонической болезни//Гер. арх. — 1993. — № 6. —
65—68.
рогов В.А., Зозуля О.В., Тареева И.Е. и др. Значение
шнамики протеинурии и АД для выявления поздне-
о токсикоза у беременных с хроническими заболе-
иниями почек и гипертонической болезнью//Гер.
ipx. - 1995. - № 5. - С. 24-27.
эогов В.А., Тареева И.Е., Зозуля О.В. и др. Особен-
юсти диагностики позднего токсикоза у беремен-
<ых с гипертонической болезнью и хроническими
аболеваниями почек//Гер. арх. — 1995. — № 10. —
:. 65-69.
"упряга О.М. Артериальная гипертензия у беремен-
1ых: частота, структура и перинатальные исходы
популяционное исследование)//Вестн. акушера-ги-
1еколога. — 1995. — № 2. — С. 7—17.
Гареева И.Е., Козловская Н.Л., Крылова М.Ю. и др.
'ромбоцитарныс нарушения у беременных с хрони-
еским гломерулонефритом и гипертонической бо-
езнью/Дер. арх. — 1996. — № 10. — С. 52—55.
Вехтман М.М. Лечение пиелонефрита у беременных//
ер. арх. - 1996. - № 10. - С. 55-59.
\lexopoulos Е., Tampakoudis Р., Bill Н., Mantalenakis
'. Acute uric acid nephropathy in pregnancy//Obstetrics
nd gynecology. — 1992. — Vol. 80. — P. 488—489.
lernheim J. Hypertension in pregnancy//Nephron. —
997. - Vol. 76. - P. 254-263.
'LASP Collaborative Group. CLASP: a randomised trial
f low-dose aspirin for the prevention and treatment of
re-eclampsia among 9364 pregnant women//Lancet. —
994. - Vol. 343. - P. 619-627.
'rezis M., Rosen S. Hypoxia of the renal medulla — its
nplications for disease//New Engl. J. Med. — 1995. —
ol. 332. - P. 647-655.
Chugh K.S., Singhal P.C., Sharma B.K. et al. Acute renal
cortical necrosis. A study of 113 patients//Renal
Failure. - 1994. - Vol. 16. - P. 37-47.
Cunningham F.B., Lucas MJ. Urinary tract infections
complicating pregnancy//Baill. Clin. Obstet. Gynaecol. —
1994. - Vol. 8. - P. 353-373.
Davison J.M. Renal complications that may occur in
pregnancy//Oxford textbook of Clinical nephrology. —
1998. - Vol. 3. - P. 2317-2325.
De Groot C.J.M., Taylor R.N. New insights into the etiology
of preeclampsia//Ann. Med. — 1993. — P. 243—249.
Hart A., Pham T., Nowincki S. et al. Gestational
pyelonephritis assotiated Escherichia coli isolates represent
a nonrandom, closely related population//Am. J. Obstet.
Gynecol. - 1996. - Vol. 174. - P. 983-989.
Hou S., Firanek C. Management of the Pregnant Dialysis
Patient//Advances in Renal Replacement Therapy. —
1998. - Vol. 5, N 1. - P. 24-30.
Hou S. Pregnancy in chronic renal insufficiency and end-
stage renal diesease//Am. J. Kidney Diseases. — 1999. —
Vol. 33. - P. 235 - 252.
Jungers P., Chauveau D. Pregnancy in renal disease//
Kidney Int. - 1997. - Vol. 52. - P. 871-885.
Kincaid-Smith P., Fairley K, Packham D. Pregnancy in
membranous glomerulonephritis//Nephrol. Dial.
Transplant. — 1992 (suppl. 1). — P. 60—63.
Nochy D., Heudes D., Glotz D. et al. Preeclampsia
associated focal and segmental glomerulosclerosis and
glomerular hypertrophy: a morphometric analysis//Clin.
Nephrol. - 1994. - Vol. 42, N 1. - P. 9-17.
Pomeranz M., Podjarny E., Bernheim J. et al. Effect of
recurrent pregnancies on the evolution of adriamycin
nephropathy//Nephrol. Dial. Transplant. — 1995. — Vol.
10. - P. 2049-2053.
Redman C.W.G., Roberts J.M. Management of preec-
lampsia//Lancet. — 1993. — Vol. 341. — P. 1451 — 1454.
Roberts J.M., Redman C.W.G. Preeclampsia: more than
pregnancy induced hypertension//Lancet. — 1993. — Vol.
341. - P. 1447-1450.
Sibai B.M. et al. Prevention of preeclampsia with low dose
aspirin in healthy nulli parous pregnant women//New
Engl. J. Med. - 1993. - Vol. 329. - P. 1213-1218.
Svensson A. Hypertension in pregnancy//Clin. Exp.
Hypertension. — 1993. — Vol. 15. — P.1353—1361.
Wallenburg H.C.S. Placental insufficiency: pathophysiology
and therapeutic approaches/yTriangle. — 1990. — Vol. 29,
N4. - P. 171-179.
31*
483
Гпава 26
ОСОБЕННОСТИ ПАТОЛОГИИ
ПОЧЕК У ДЕТЕЙ
М. С. Игнатов a
26.1. Морфофункциональные
особенности почек у детей
Формирование вторичной (окончательной)
почки у эмбриона человека отмечается уже на
5-й неделе внутриутробного развития, процес-
сы мочеотделения — на 9-й неделе. Почки плода
могут осуществлять разведение и подкисление
мочи, транспорт органических веществ, реаги-
ровать на паратгормон. Однако основным экс-
креторным органом плода оказывается плацента.
Только после рождения ребенка почки берут на
себя гомеостатические функции [Длуга Г. и др.,
1981]. Морфологическое и функциональное раз-
витие почек к моменту рождения ребенка еще
не закончено, особенно у недоношенных. Од-
нако даже доношенный хорошо развитый но-
ворожденный должен быть защищен от осмо-
тических и водных нагрузок наиболее рацио-
нальным питанием — молоком матери. В поч-
ках новорожденных преобладают медуллярные
и среднекортикальные нефроны; корковые не-
фроны развиваются в постнатальном периоде.
По мере созревания почки меняются особен-
ности ее функционирования. Фильтрующая по-
верхность почек у новорожденных в 5 раз мень-
ше, чем у взрослых, КФ составляет 20—30 мл/
мин, однако уже к 6-му месяцу у большинства
детей клубочковая фильтрация в пересчете на
стандартную поверхность тела (1,73 м2) дости-
гает значений, близких к таковым у взрослых.
Правда, определение ее по клиренсу эндоген-
ного креатинина не отражает истинного поло-
жения дел, так как у детей 1-го года жизни
креатинин частично реабсорбируется в каналь-
цах.
В процессе роста ребенка изменяется соот-
ношение содержания в моче аминокислот,
мочевины, мочевой кислоты: в первые 3 мес
484
жизни отмечаются относительно низкое выве-
дение мочевины и наибольшая экскреция мо-
чевой кислоты. Это связано с тем, что в ран-
ние возрастные периоды нейтрализация амми-
ака происходит путем синтеза мочевой кисло-
ты, и лишь в следующие возрастные периоды
начинает преобладать более совершенный
путь — синтез мочевины. В связи с активными
процессами ассимиляции у детей первых лет
жизни отмечается высокая степень реабсорбции
аминокислот в тубулярном отделе нефрона, что
следует учитывать при диагностике аминоаци-
дурий и тубулопатий. У детей раннего возраста
отмечается функциональная недостаточность
систем транспорта глюкозы, что в некоторых
случаях проявляется физиологической глюкозу-
рией.
Имеются характерные особенности водно-
солевого обмена ребенка. Критическими этапа-
ми в созревании системы регуляции водно-со-
левого обмена оказываются следующие перио-
ды: 1) от новорожденное™ до 2—3 лет; 2) от
4—5 до 7—8 лет; 3) подростковый. Именно в
эти возрастные интервалы происходят измене-
ния как фоновых показателей, так и реакции
на нагрузки. Особенностью обмена натрия у но-
ворожденных и детей первых месяцев жизни
является большой размах колебаний его кон-
центрации в крови: стабилизация уровня отме-
чается после 3 лет, что происходит параллель-
но с развитием осморегулирующих систем. Ог-
раничивающим фактором концентрирования
мочи оказывается возрастное своеобразие про-
тивоточно-обменного механизма, связанное с
тем, что у детей раннего возраста петля Генле
коротка. По-видимому, сохранение этой особен-
ности строения петли нефрона при почечном
дизэмбриогенезе определяет нарушение водно-
электролитного обмена и способности к кон-
центрированию у детей при гипопластической
дисплазии почек [Игнатова М.С., Гроссман П.,
1986].
Содержание калия в сыворотке крови у де-
тей 1-го года несколько выше, чем у детей бо-
лее старшего возраста, что связано с относи-
тельно низкой гломерулярной фильтрацией. Со-
держание аниона хлора в крови ребенка доволь-
но стабильно и практически не отличается от
показателей у взрослого человека. Содержание
кальция общего у новорожденных низкое, но
в течение нескольких дней оно достигает уров-
ня, отмечаемого в более взрослом состоянии;
показатели ионизированного кальция крови
практически стабильны в различные возрастные
периоды. Показатели неорганических фосфатов
в крови у детей первых месяцев жизни несколь-
ко выше, чем в возрастные периоды старше
2 лет, когда они не отличаются от цифр взрос-
лого человека.
КОС крови и внеклеточной жидкости у но-
ворожденных и детей первых месяцев жизни
поддерживается на оптимуме с большим напря-
жением, чем в старшие возрастные периоды.
Склонность к ацидозу может появиться уже в
первые минуты и часы жизни новорожденного
в связи с тем, что в процессе родовой деятель-
ности из-за мышечного напряжения в организ-
ме матери накапливаются органические (неле-
тучие) кислоты, развивается ацидоз, поэтому
часть водородных ионов поступает плоду. Этот
процесс усугубляется при патологии беремен-
ности и родов, когда в той или иной степени
проявляется гипоксия плода. Наибольшее зна-
чение для поддержания КОС крови у детей ран-
него возраста имеют буферные системы внекле-
точной жидкости. Большую долю в сохранение
оптимума кислотно-основного гомеостаза вно-
сит буферная система фосфатов, причем ее
активность зависит от поступления неоргани-
ческих фосфатов с молоком. Коровье молоко
содержит много фосфатов, поэтому фосфатный
буфер оказывается основным при регуляции
кислотно-основного равновесия при искусст-
венном вскармливании. При грудном вскармли-
вании выведение ионов водорода осуществля-
ется при помощи аммониогенеза. Регуляция
равновесия кислот и оснований становится
более устойчивой у детей старше 1 года, чему
способствует и повышение фильтрации, усили-
вающее выведение из организма кислых про-
дуктов обмена.
Функциональное состояние почек ребенка
находится под сложным нейрогуморальным
контролем. Возможно, что в раннем постнаталь-
ном периоде почка обладает большей автоно-
мией, чем в более поздние периоды жизни. Кос-
венным подтверждением этого являются дан-
ные о недостаточной чувствительности рецеп-
торов почек к действию гормонов. Для детей
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Годы
Рис. 26.1. Возраст детей, умерших от ХПН, развив-
шейся при различных заболеваниях почек. На оси
абсцисс — возраст, годы; на оси ординат — число
умерших.
а — гломерулонефрит; б — пиелонефрит; в — поликистоз
почек; г — дисплазия и гипоплазия; д — синдром Альпор-
та; е — врожденный нефротический синдром; ж — нефро-
литиаз; з — амилоидоз; и — опухоль Вильмса; к — апла-
зия почек.
раннего возраста характерен гиперальдостеро-
низм: физиологическая целесообразность это-
го явления может быть связана с необходимо-
стью индукции развития канальцевого транс-
порта ионов.
В последние годы все большее внимание
уделяется неэкскреторным функциям почек.
Данные о почечном метаболизме пептидных
гормонов, полученные в эксперименте у взрос-
лых людей, можно лишь условно экстраполи-
ровать на почки детей различных возрастных
периодов [Клар С., 1987]. Однако это необхо-
димо в связи с тем, что в случаях дизэмбрио-
генеза почек обнаруживается своеобразный
феномен повышения или снижения содержа-
ния в крови гормонов, ответственных за рост
и дифференцировку тканей, в частности тире-
оидных гормонов [Ignatova M.S. et al., 1988].
Таким образом, каждому возрастному пери-
оду свойственно определенное функциональное
состояние почек, причем в здоровом организ-
ме оно максимально соответствует ее потреб-
ностям. Однако при этом пределы адаптации,
как правило, более сужены, чем у взрослых.
Периодизация в развитии, начиная от ан-
тенатального периода, проявляется в том, что
именно в критические периоды развития ребен-
ка создаются возможности для реализации не-
485
Таблица 26.1. Критические периоды развития ребенка и патология органов мочевой системы
Период Структурно-функциональные особенности Класс болезней
Внутриутробный «Критические периоды» максимальной диффе- ренцировки тканей. Формирование органов мо- чевой системы. Ограниченное функционирова- ние почек. Возможна арения Дизэмбриогенез органов мочевой систе- мы (наследственные синдромы, диспла- зия, включая гипопластическую) Поражения почек при хронических инфек- циях матери (токсоплазмоз, цитомегалия)
Неонатальный Метаболическая адаптация в связи с переходом к внеутробному существованию. Сохранение эм- бриональных структур почечной ткани. Возмож- ность транзиторной почечной недостаточности Врожденный нефротический синдром Патология почек при гемолитической бо- лезни новорожденных Гемолитико-уремический синдром Инфекция мочевой системы Обструктивные уропатии
Грудного возраста Максимальная интенсивность роста и энергети- ческого обмена. Переход от максимальной адап- тации к высокожидкостной (молоко матери) пи- ще, к независимому от материнского организма питанию. Развитие кортикальных нефронов и местного иммунитета Гемолитико-уремический синдром Инфекция мочевой системы Нефротический синдром Дизметаболическая нефропатия
Преддошкольный, Относительная стабилизация основных показа- Тубулоинтерстициальный нефрит бакте-
дошкольный и ран- телей обмена. «Дозревание» структурных эле- риальный и абактериальный. Гломеруло-
НИЙ школьный ментов почки. Возможность анатомической дис- пропорции роста почки нефрит: 1) нефротическая форма (чаще в преддошкольном и дошкольном возрасте); 2) гематурическая форма (чаще в школь- ном возрасте)
Пубертатный Модуляция обмена под влиянием половых гор- монов. Окончательное формирование фенотипа. Возможность транзиторного гипертензионного синдрома и появление так называемой ортоста- тической протеинурии Гломерулонефрит (все формы) Нефрит при системных заболеваниях Почечный амилоидоз Тубулоинтерстициальный нефрит (все формы)
благоприятных внешних воздействий, возник-
новения болезни и ее исхода (табл. 26.1). На рис.
26.1 показано, что на 1-м году жизни причина
ХПН — почечный дизэмбриогенез, в пубертат-
ном периоде — чаще приобретенные заболева-
ния почек.
В связи с тем что жизнеспособным считается
ребенок массой ниже 1000 г (даже при его мас-
се 500 г) большое внимание уделяется органо-
генезу почек и органов мочевыведения с уче-
том возможности их функционирования у такого
маловесного новорожденного [Robillard J., 1987].
С момента рождения ребенка независимо от
сроков гестации ведущее значение в поддержа-
нии гомеостаза занимают почки. Почечный
кровоток у новорожденного сразу после рож-
дения должен резко возрасти, что может ока-
заться несколько затрудненным у глубоко не-
доношенного ребенка. В соответствии с морфо-
логическим развитием от мозгового вещества
почки к корковому в ранний постнатальный
период большая доля крови поступает в юкста-
медуллярную зону. Именно поэтому в ранний
постнатальный период большую часть функции
по поддержанию гомеостаза берут на себя юк-
стамедуллярные нефроны. По мере повышения
артериального давления улучшается кровоснаб-
жение коры, что сказывается на морфофунк-
циональном состоянии кортикальных нефронов.
Одним из основных отличий детского орга-
низма от взрослого является процесс роста и
развития; у здорового ребенка всегда должен
преобладать синтез, что необходимо для его
развития.
26.2. Синдромология болезней
почек в детском возрасте
Классическим со времен Брайта для диффуз-
ных заболеваний почечной паренхимы счита-
ется присутствие триады синдромов: отечного,
гипертензионного и мочевого. Это положение
сохраняется и для нефрологической патологии
детского возраста, но с рядом оговорок. Во-
первых, в детской нефрологии существенное
место занимают пограничные состояния меж-
ду нефрологией и урологией, так как ряд бо-
лезней почек связан с нарушениями уродина-
мики врожденного характера. Во-вторых, у де-
тей значительно чаще, чем у взрослых, впер-
вые выявляются наследственные и врожденные
заболевания органов мочевой системы (ОМС).
В-третьих, в последние годы у детей отмечает-
486
Таблица 26.2. Болезни ОМС у детей, рожденных
от матерей с нефропатиями
Болезнь у ребенка Заболевания матери Особенности наблюдений
ГН (п = 13) пиело- нефрит (п = 49)
Пиелонефрит 3 25
ГН 0 3
Оксалатная нефро- патия 4 7
ТИН 1 6
Аномалии ОМС 4 35 У половины де- тей наследст- венно обуслов- лены
Дисплазии почек 0 4
Семейная нефро- патия 0 4 Биопсия почек не проводилась
Нейрогенная дис- функция мочево- го пузыря 1 5
ся преобладание скрытого латентного течения
многих заболеваний ОМС.
Первое, на что рекомендуется обратить вни-
мание при обследовании ребенка, — это нали-
чие предрасположенности к развитию патологии
почек.
При обследовании детей, матери которых
страдали ГН или пиелонефритом, отмечено,
что у их детей часто развиваются заболевания
ОМС (табл. 26.2). При этом нередко наблюда-
лось сочетание у одного ребенка нескольких
нозологических форм патологии ОМС.
Мочевой синдром может быть единственным
проявлением заболевания. Гематурия может вы-
являться случайно и в дальнейшем носить пер-
систирующий или рецидивирующий характер.
Причинами изолированной гематурии могут
быть наследственный нефрит, нефропатия,
связанная с гипопластической дисплазией, ге-
матурическая форма нефрита.
Сочетание гематурии с протеинурией чаще
характеризует ГН или структурный почечный
дизэмбриогенез. Если гематурия сочетается с
оксалатно-кальциевой или уратной кристаллу-
рией, то возможность наличия оксалатной или
уратной нефропатии очень велика.
Изолированная протеинурия возможна в
детском возрасте, однако чаще при ее нарас-
тании появляются признаки НС. В некоторых
случаях протеинурия — одно из проявлений
болезни (или синдрома) де Тони — Дебре —
Фанкони.
Лейкоцитурия, как единственное проявление
патологии, встречается крайне редко. Чаще изо-
лированная лейкоцитурия выявляется у детей,
у которых проводилось лечение инфекции мо-
чевой системы, бактериурия исчезла, но про-
явления воспаления в виде лейкоцитурии со-
хранились.
Пиурия — признак инфекции мочевой сис-
темы вне зависимости от уровня поражения
ОМС.
По поводу изолированной бактериурии идут
бесконечные дискуссии в литературе, но боль-
шинство в настоящее время склоняется к точ-
ке зрения, что это нередко проявление уста-
навливающегося биоценоза и рекомендуется
наблюдение за такими детьми без назначения
терапевтических средств.
Оксалатно-кальциевая, фосфатно-кальцие-
вая кристаллурия могут быть единственными
признаками оксалатного диатеза. В динамике к
кристаллурии присоединяется гематурия или
лейкоцитурия.
Появление уратной кристаллурии может го-
ворить либо о развитии уратной нефропатии,
либо, если нет других симптомов, — об урат-
ном диатезе (см. главу 13).
Отечный синдром у детей может иметь харак-
тер нефритического или нефротического.
Нефротический отечный синдром — часто
проявление болезни почек с минимальными
изменениями гломерул, реже ГН других мор-
фологических типов вплоть до фибропластичес-
кого.
Гипертензионный синдром — нечастое прояв-
ление почечной патологии у детей. Чаще обна-
руживается нормотония, тенденция к артери-
альной гипотонии или выраженная гипотония
(см. ниже).
Синдром дизурических расстройств может
сочетаться с абдоминальным синдромом или
быть изолированным. В качестве дизурических
явлений расценивается боль или резь при мо-
чеиспускании, учащение или урежение моче-
испусканий, недержание (ночное или дневное)
или неудержание мочи. Эти симптомы обычно
нацеливают внимание на возможность инфек-
ции мочевой системы, но могут быть проявле-
ниями нейрогенной дисфункции мочевого пу-
зыря. Если выражен болевой абдоминальный
синдром даже без изменений в моче, то в 40 %
случаев эти боли связаны с врожденными ана-
томическими аномалиями ОМС [Державин В.М.
и др., 1984].
Малые аномалии развития (внешние стигмы
дизэмбриогенеза) — маркеры наследственной
или врожденной патологии ОМС.
Отставание в росте и физическом развитии
может быть связано как с длительно тяжело
протекающим приобретенным патологическим
процессом в почках, так и с врожденной (на-
следственной) патологией.
487
Таблица 26.3. Характеристика АД у детей при на-
личии гипертонии
Возраст АД, мм рт.ст.
систолическое диастолическое
До 7 дней > 96
8—30 > 104
До 2 лет > 112 > 74
3—5 » > 116 > 76
6—9 » > 122 > 78
10—12 » > 126 > 82
13—15 > 136 > 86
16—18 > 142 > 92
Остеопатия и начальные признаки ХПН мо-
гут быть первыми проявлениями нефро- или
уропатии у ребенка.
Характеристика артериального давления у де-
тей с заболеваниями почек. По мере роста и
развития ребенка артериальное давление меня-
ется. Нами используется метод определения
средних показателей АД на основании расчета:
• возраст ребенка 1 день — 11 мес: 80 + п =
систолическое (сист.) давление (мм рт.ст.),
где п — количество месяцев ребенку; диас-
толическое (диаст.) = сист./2 + 5 мм рт.ст.;
• возраст 1 год — 15 лет: сист. = 90 +2 п мм
рт.ст., где п — количество лет жизни ребен-
ка; диаст. = СИСТ./2 + 5 мм рт.ст. Возможны
индивидуальные колебания в пределах
± 10 %.
О выраженной гипертонии, по материалам
Second Task Force on Blood Pressure Control in
Children [цит. no L.Feld et al., 1990], можно
говорить при данных, равных или превышаю-
щих цифры, приведенные в табл. 26.3.
Гипертензионный синдром нередко опреде-
ляет прогноз нефрологического заболевания у
ребенка [Dillon М., 1987]. По нашим данным
[Игнатова М.С. и др., 1998], артериальная ги-
пертензия в последние годы при патологии
органов мочевой системы встречается относи-
тельно редко (табл. 26.4).
Стойкий гипертензионный синдром свой-
ствен больным с тяжелым почечным дизэмб-
риогенезом (см. главу 13). Часто АГ бывает ос-
новным патологическим синдромом при врож-
денных аномалиях почечных сосудов. Структур-
ный почечный дизэмбриогенез — олигонефро-
ния и сегментарная гипоплазия почек — прежде
всего могут проявиться артериальной гиперто-
нией. При наследственной патологии гипертен-
зионный синдром появляется очень рано при
аутосомно-рецессивном поликистозе почек. При
аутосомно-доминантной поликистозной болез-
ни почек (АДПБП) повышение АД происхо-
Таблица 26.4. Характеристика АД у детей в не-
фрологическом отделении за 1995—1996 гг. (в про-
центах)
Болезни Нор- маль- ное АД Гиперто- ния Гипото- ния
Гломерулонефрит, формы: • нефротическая (п = 186) 56 7 37
• гематурическая (п = 51) 76 (транзи- торная) 6 18
• смешанная’ (п = 10) 72 12 16
Пиелонефрит, формы: • обструктивный (п = 16) 38 62
• метаболический (п = 25) 96 — 4
• обструктивно-метаболи- ческий (п = 43) 65 — 35
Наследственный нефрит (п = 50) 70 6 24
Гипопластическая диспла- зия (п = 25) 84 — 16
Оксалатная нефропатия (п = 33) 88 — 12
Другие (включая ХПН) (п = 24) 75 4 21
Всего (п = 476) 66 6 28
* Определение см. ниже.
дит, как правило, у взрослых больных. Однако
при наслоении ГН на АДПБП, что мы отме-
чали у 5 из 11 наблюдаемых детей, как прави-
ло, была выражена артериальная гипертония.
Артериальная гипертония появляется у боль-
ных детей с пузырно-мочеточниковым рефлюк-
сом (ПМР), когда у них начинает развиваться
рефлюкс-нефропатия. При пиелонефрите в дет-
ском возрасте АГ наблюдается чрезвычайно
редко.
Для гломерулонефрита характерно повыше-
ние АД в начальной стадии заболевания: это
может быть при остром нефрите, при смешан-
ной форме гломерулонефрита, при котором
само название — смешанная — подразумевает
присутствие мочевого, отечного и гипертензи-
онного синдромов. У детей с нефротическим
синдромом, чаще в случаях гормонорезистент-
ного, но возможно и при гормоночувствитель-
ном вариантах, во время лечения кортикосте-
роидами нередко отмечается транзиторная ги-
пертония.
При гипертонии, развивающейся у детей в
связи с патологией почек, наряду с диетети-
ческими воздействиями, ограничивающими
488
потребление поваренной соли и жидкости,
рекомендуется использовать ингибиторы ангио-
тензинпревращающего фермента (АПФ), кото-
рые индивидуально подбирают для ребенка,
контролируя АД вслед за применением мини-
мальной и увеличивающихся доз препарата.
Блокаторы кальциевых каналов относятся ко
второй довольно популярной группе препара-
тов, используемых у детей при АГ почечного
происхождения. При стойко повышенном АД
используют диуретики — лазикс, триампур, а
также периферические бета-адреноблокаторы.
Дозы указанных препаратов, как правило, под-
бираются индивидуально.
Значительно чаще, чем гипертония, у детей
с различными заболеваниями ОМС наблюдается
артериальная гипотония или тенденция к ней.
Чаще это выражено при инфекции мочевой си-
стемы, включая различные формы пиелонеф-
рита. Артериальная нормотония и гипотония
свойственны больным с оксалатной нефропа-
тией, с нефропатией, связанной с гипоплас-
тической дисплазией. При нефронофтизе Фан-
кони повышения АД, как правило, не отмеча-
ется. Пониженным АД оказывается и у детей с
экодетерминированными нефропатиями, при-
чем обычно это сочетается с выраженной ас-
тенизацией ребенка.
Причина артериальной гипотонии у детей с
различными заболеваниями почек не совсем
ясна. Основу гипотонии нередко связывают с
вегетососудистой дистонией, свойственной
этим детям [Белоконь Н.А., 19871 или с дис-
функцией надпочечников [Фокеева В.В., 1989].
26.3. Нарушения уродинамики
в детском возрасте
Уродинамика — это процесс активного выведе-
ния мочи из организма в результате координи-
рованной деятельности нервно-мышечного ап-
парата чашечек, почечных лоханок, мочеточ-
ников, мочевого пузыря, мочеиспускательно-
го канала и мышц тазового дна. В нижнем от-
деле мочевого тракта уродинамика имеет фаз-
ный характер: чередование накопления и опо-
рожнения, что составляет микционный цикл.
Микционный цикл включает множество пара-
метров, основными из которых являются:
— общий и эффективный объем мочевого пу-
зыря;
— внутрипузырное давление в фазы накопле-
ния и опорожнения;
— объемная и линейная скорость потока мочи,
его турбулентность, сопротивление и эффек-
тивное сечение уретры;
— сила и давление струи мочи и др.
Для регистрации фазы накопления предло-
жены методы:
• ретроградная пистометрия;
• профилометрия уретры и уретеровезикально-
го соустья;
• электромиография наружного уретрального,
анального сфинктеров и мышц тазового дна.
Для оценки фазы опорожнения необходимы:
• прямая цистометрия;
• урофлуометрия и ректоманометрия;
• электромиография вышеуказанных мышеч-
ных структур.
Эти исследования могут осуществляться на
отечественной уросистеме «РЕЛЬЕФ», сопос-
тавимой по своим возможностям с лучшими
зарубежными образцами.
Нейрогенный мочевой пузырь — собирательное
понятие, объединяющее большую группу забо-
леваний, при которых нарушается фаза накоп-
ления и опорожнения мочевого пузыря в свя-
зи с поражениями нервной системы от коры
головного мозга до интрамурального аппарата.
В патогенезе нейрогенного мочевого пузыря
ведущая роль принадлежит гипоталамо-гипофи-
зарной недостаточности, наличие которой ус-
танавливается на основании неврологического
и эндокринологического обследования. При
успешном лечении нейрогенного мочевого пу-
зыря происходит и улучшение функции гипо-
таламо-гипофизарной системы.
Диагностика нейрогенного моче-
вого пузыря. К ведущим симптомам нару-
шения акта мочеиспускания относятся полла-
киурия, императивные позывы, императивное
недержание мочи и энурез (см. ниже). Догоспи-
тальное обследование ребенка включает опре-
деление ритма спонтанных мочеиспусканий с
определением объема выделяемой мочи. В нор-
ме частота мочеиспусканий у детей 4—6 лет
должна быть 5—6 раз, 8—11 лет — 4—5 раз, а
12—14 лет — обычно 4 раза в сутки.
Средний нормальный объем мочи во время
одного акта мочеиспускания у детей обоего пола
увеличивается с возрастом от 130 до 200 мл.
Минимальный и максимальный объем мочи
может значительно колебаться. При регистрации
спонтанных мочеиспусканий важно определить
учащение или урежение ритма мочеиспускания
и установить объем, который при нейрогенном
мочевом пузыре может резко отличаться от
средневозрастного.
При нормальном объеме мочевого пузыря и
нормальном ритме мочеиспускания говорят о
иорморефлекторном, при сниженном объеме и
учащенном мочеиспускании — о гиперрефлек-
торном, при повышенном объеме и редком
ритме — о гипо рефлекторном мочевом пузыре.
489
Гипер- и гипорефлекторный мочевой пузырь —
это варианты нейрогенного мочевого пузыря.
Для гиперрефлекторного мочевого пузыря
характерны: поллакиурия малыми порциями,
минимальные объемы мочи могут быть 20—
40 мл, императивные позывы и стремительный
характер мочеиспускания. При этом объем мо-
чевого пузыря уменьшен и остаточная моча
отсутствует. При гипорефлекторном мочевом
пузыре частота мочеиспусканий уменьшена,
объемы мочи могут превышать 400 мл, позыв
ослаблен, мочеиспускание медленное, может
быть несколькими порциями, объем мочевого
пузыря увеличен, есть остаточная моча.
При проведении специальных исследований
ценную информацию дает ретроградная цисто-
метрия, при которой графически регистриру-
ется внутрипузырное давление в течение всего
периода заполнения мочевого пузыря [Вишнев-
ский Е.Л., 1996]. По соотношению показателей
давление/объем можно судить об адаптацион-
ных возможностях, чувствительности и рефлек-
торной возбудимости мочевого пузыря. Этот и
другие инструментальные методы исследования
позволяют наметить терапию, цель которой —
восстановление резервуарной функции мочево-
го пузыря и управляемого мочеиспускания за
счет влияния на тонус детрузора и функцию
сфинктеров.
Лечение нейрогенной дисфунк-
ции мочевого пузыря. Атропин и его
производные — основная группа лекарственных
веществ, которые могут восстановить детрузор-
но-сфинктерную диссоциацию. Атропин или его
производные назначают на 10 дней в возраст-
ной дозировке в комбинации с коферментны-
ми формами витаминов В2 и В6. Повторное
исследование спонтанного ритма мочеиспуска-
ний и данные ретроградной цистометрии оце-
нят эффективность лечения. При неэффектив-
ности показана УЗ-терапия. Лечение повторя-
ют не менее чем через 1,5—2 мес. Альтернатив-
ным является использование лазеротерапии.
Применяют гелий-неоновый лазер, излучаю-
щий монохроматический красный свет. Лазеро-
терапию проводят, воздействуя на рефлексоген-
ные точки.
Спектр лекарственных препаратов, которые
применяют при нейрогенной дисфункции мо-
чевого пузыря, довольно обширен, так как
необходимы и средства, нормализующие состо-
яние нервной системы. Для этих целей исполь-
зуют нейротропные средства (пантогам), анти-
депрессанты (мелипрамин), средства, воздей-
ствующие на скелетную мускулатуру (диазепам,
но-шпа, папаверин), антихолинэстеразные пре-
параты (прозерин).
Из физиотерапевтических средств при гипер-
рефлекторном мочевом пузыре используют те,
490
которые улучшают кровоснабжение мочевого
пузыря: аппликации с парафином, озокеритом.
Более широким спектром действия обладают:
• диадинамические токи на низ живота;
• ультразвук на надлобковую область;
• электрофорез с атропином на область моче-
вого пузыря;
• электростимуляция анального сфинктера и
перианальной области.
С помощью урологов проводят внутрипузыр-
ное применение ультразвука и электростимуля-
цию уретеровезикального соустья.
При гипорефлекторном мочевом пузыре
используют электрофорез с прозерином на низ
живота. На эту же область синкопами приме-
няют диадинамические токи, проводят лазеро-
терапию и трансректальную электростимуляцию
мочевого пузыря. Назначают тепловые проце-
дуры до 30 на курс. Применяют также электро-
процедуры — 10—12 на курс с повторением
лечения через 2—4 ч.
Обязательно лечение сопутствующих заболе-
ваний, чаще это инфекция мочевой системы
(ИМС), причем в некоторых случаях ИМС ока-
зывается первичной по отношению к расстрой-
ствам функции мочевого пузыря. Однако даже
в этих случаях наряду с лечением ИМС долж-
ны проводиться после соответствующего обсле-
дования мероприятия, направленные на нор-
мализацию детрузорно-сфинктерных наруше-
ний.
Энурез — термин, который используется по-
разному: либо как недержание мочи в любое
время суток, либо как ночное недержание мочи.
По-видимому, более целесообразно этот термин
использовать для ночного недержания мочи,
что нередко в западной литературе обознача-
ется как «мокрая постель». Для дневного нару-
шения мочеиспускания более целесообразно
применять термин «дневное неудержание мочи».
В данном разделе рассматривается энурез как
ночное непроизвольное мочеиспускание, ког-
да ребенок не просыпается. Как правило, при
этом нет дневного непроизвольного мочеиспус-
кания или оно иногда возникает во время глу-
бокого дневного сна ребенка. В 1989 г. предло-
жена классификация энуреза, основанная на
одновременном мониторировании сна ребенка
и проведении цистометрии. Выделяют ночной
энурез с наличием нейрогенной дисфункции
мочевого пузыря [Watanabe Н., 1997].
Существует четкое выделение первичного и
вторичного энуреза. При первичном энурезе
«мокрая постель» появляется у психически и
физически здорового ребенка, не имеющего
заболеваний, которые могут вызвать энурез, —
травм, спинномозговой дизгенезии, рецидиви-
рующей ИМС. Существует так называемый се-
мейный энурез, причем отягощенная наслед-
ственность в этом отношении отмечается по-
чти в 50 % случаев. Привлечение внимания к
генетическому фактору при энурезе привело к
обнаружению мутантного гена на 13-й хромо-
соме. Вторичный энурез сопровождается днев-
ным неудержанием мочи и связан с различны-
ми ренальными или экстраренальными заболе-
ваниями.
Частота в популяции и патоге-
нез. А.В.Папаян и Д.В.Марушкин (1997) ука-
зывают на колебания показателя частоты пер-
вичного энуреза от 2,5 до 28 % (по данным
различных исследователей). Частота энуреза с
возрастом уменьшается, у подростков и взрос-
лых она не превышает 1,5 %.
По современным представлениям, развитие
энуреза связано с нарушениями антидиурети-
ческой функции гипофиза. АДГ регулирует вы-
деление и реабсорбцию осмотически свободной
воды. В ночное время активность вазопрессина
(АДГ) повышается, что сопровождается увели-
чением реабсорбции свободной воды и умень-
шением ее поступления в мочевой пузырь.
Имеются данные, говорящие о снижении про-
дукции АДГ в ночное время у людей, страда-
ющих энурезом, в связи с чем повышается
выработка конечной мочи и как следствие не-
контролируемое мочеиспускание при глубоком
сне. Ю.В.Наточин и др. в 1997 г. представили
данные, на основании которых энурез можно
рассматривать как аутокоидоз, т.е. состояние,
связанное с нарушением физиологической фун-
кции аутокоидов — белков, посредством кото-
рых осуществляется трансмембранный транспорт
воды в различных тканях, включая почки. При
энурезе речь идет о нарушении продукции ауто-
коидов, что уменьшает ответ клетки на вазо-
прессин даже при достаточной его выработке.
Лечение. Успех лечения зависит от мно-
жества факторов. Один из них — настойчивость
выполнения рекомендаций. До назначения ле-
карственной терапии рекомендуется:
• не бранить ребенка за «мокрую постель», так
как это чревато отрицательным влиянием на
его психику;
• ограничивать прием жидкости после 18 ч;
• в первую половину ночи в одно и то же
время будить ребенка, чтобы он проснулся
и помочился;
• настраивать ребенка, чтобы он сам проснул-
ся при позыве к мочеиспусканию. Детям
старшего возраста рекомендуется занимать-
ся аутотренингом.
При изолированном первичном энурезе ле-
карственную терапию следует начинать с 5 лет.
Обычно используют седативные средства, тран-
квилизаторы, антидепрессанты и средства,
уменьшающие образование мочи. Широко при-
меняют физиопроцедуры, направленные на
улучшение кровоснабжения мочевого пузыря и
нормализующие состояние вегетативной не-
рвной системы. Хороший эффект оказывает аку-
пунктура по рефлексогенным зонам.
Для лечения первичного энуреза использу-
ют синтетические аналоги АДГ (вазопрессина),
в том числе адиуретин СД — десмопрессин.
У этих препаратов по сравнению с природным
гормоном усилен антидиуретический эффект,
а воздействие на сосудистую стенку сведено к
минимуму. Назначают препарат после исключе-
ния вторичного энуреза. Десмопрессин закапы-
вают в нос перед сном после опорожнения
мочевого пузыря, равномерно распределяя пре-
парат между носовыми ходами [Miller К. et al.,
1989]. Если площадь поверхности тела ребенка
менее 1 м2 (дети дошкольного возраста), адиу-
ретин СД начинают применять с 2 капель ин-
траназально; у старших детей с большей повер-
хностью тела — соответственно с 3 капель. Если
применение этой дозы дает эффект, лечение
продолжают до 4 нед. Если через неделю эф-
фекта нет, дозу увеличивают на 1 каплю; при
неэффективности терапии постепенно доводят
дозу до 6 капель младшим и 8 капель старшим
детям. В тех случаях, когда максимальная доза
не оказывает эффекта в течение 4 нед, лече-
ние прекращают. Положительный эффект дес-
мопрессина имел место у 52 % детей с пол-
ным исчезновением «мокрых ночей» при по-
вторном использовании препарата [Wikstrom S.
et al., 1997].
Адиуретин СД был нами применен детям с
энурезом при наличии у них гиперрефлектор-
ного мочевого пузыря, диагностированного на
основании нарушения акта мочеиспускания,
подтвержденного ретроградной цистометрией
[Игнатова М.С., Байгильдина Л.М., 1998]. На-
ряду с прекращением энуреза у наблюдаемых
детей исчезали признаки гиперрефлекторного
мочевого пузыря.
Эти данные пока немногочисленны, но они
позволяют предполагать, что возможно лечение
нейрогенного мочевого пузыря, по крайней
мере его гиперрефлекторного варианта, даже
без энуреза, десмопрессином.
Рефлюкс-нефропатия. С нарушениями уроди-
намики в детском возрасте связано развитие
тяжелого прогрессирующего заболевания, ка-
ким является рефлюкс-нефропатия.
Терминология и патогенез. Реф-
люкс-нефропатия — заболевание, связанное с
наличием пузырно-мочеточникового рефлюкса
(ПМР) и внутрипочечного рефлюкса, характе-
ризующееся развитием фокального нефроскле-
роза и как его следствия — артериальной ги-
пертензии, протеинурии, снижения почечных
491
функций вплоть до развития ХПН. ПМР по со-
временным классификациям имеет 5 степеней:
I — заброс контрастного вещества только в мо-
четочник при микционной цистографии; II —
заброс в лоханку и чашечки без их дилатации;
III — слабая степень дилатации и извитости мо-
четочников, минимальное огрубление сводов
чашечек; IV — выраженное расширение и из-
витость мочеточника, дилатация лоханки и
чашечек при сохранности папиллярного рисун-
ка во многих чашечках; V — самая тяжелая
степень, при которой практически отсутствует
рисунок лоханки и чашечек из-за их дилатации
и огрубления.
При IV—V степенях ПМР и развивается
обычно рефлюкс-нефропатия; при менее выра-
женной степени ПМР должны обязательно быть
другие факторы, способствующие ее формиро-
ванию.
Эпидемиология, клиническая ха-
рактеристика. В возрасте от рождения ре-
бенка до 15 лет частота ПМР отмечается, по
данным различных исследователей, у 0,4—1,8 %
детей. С возрастом наблюдается уменьшение
частоты рефлюкса, что связано с удлинением
интрамурального отдела мочеточника.
Рефлюкс-нефропатия при ПМР диагности-
руется у 44 % больных, из них у 40 % детей
отмечается рецидивирующая инфекция мочевой
системы [Hill G., 1989]. Рефлюкс-нефропатия с
равной частотой возникает у представителей
обоих полов, но исход в ХПН почти в 2 раза
чаше развивается у мальчиков. Наибольший
риск формирования рефлюкс-нефропатии су-
ществует у детей первых лет жизни.
Рефлюкс-нефропатия на ранних стадиях сво-
его развития не имеет отчетливых клинических
проявлений.Чаще это симптомы ИМС или ней-
рогенной дисфункции мочевого пузыря. По
мере склерозирования участков паренхимы и
усиления выброса в кровь ренина происходит
повышение АД, начиная с диастолического. За-
тем присоединяется протеинурия, начинают
снижаться тубулярные функции, к которым
присоединяется и снижение клубочковой филь-
трации.
В диагностике важную роль играет УЗИ, при
котором выявляются уменьшенная почка, не-
ровность ее контура, дилатация и деформация
полостной системы. Внутривенная урография
позволяет оценить состояние коркового слоя
почек, наличие дополнительных анатомических
аномалий. При одностороннем поражении дру-
гая почка, как правило, компенсаторно увели-
чена.
Прогрессированию рефлюкс-нефропатии
способствует рецидивирующая ИМС.
Лечение, п р о ф и л а к т и к а. Лечение
ПМР и рефлюкс-нефропатии взаимосвязано.
492
Существует несколько подходов к лечению
ПМР: консервативный, эндоскопический и хи-
рургический. Консервативное лечение предус-
матривает применение антибактериальных
средств в связи с ИМС. Лечение следует начи-
нать уже на 1-м году жизни. При устойчивости
микроорганизмов к антибиотикам пеницилли-
нового ряда рекомендуются цефалоспорины III
поколения. Важна дезинтоксикационная тера-
пия. Целесообразно длительно (до 2 лет) при-
менять препараты нитрофуранового ряда в по-
ловинной терапевтической дозе в вечерние часы
как метод профилактики рецидивов ИМС.
Эндоскопический метод лечения заключает-
ся в введении в подслизистый слой мочеточ-
ника биопрепарата, коллагена и др. Этот метод
применяют при ПМР III и более выраженной
степени. К хирургической коррекции прибега-
ют при неэффективности консервативной и эн-
доскопической терапии ПМР, а также при
развитии рефлюкс-нефропатии вне зависимо-
сти от степени рефлюкса. Большое место в пре-
дупреждении развития рефлюкс-нефропатии
занимает лечение нейрогенной дисфункции мо-
чевого пузыря.
I.Smellie, N.Prescod (1998) представили дан-
ные о наблюдении в течение 10—43 лет за
людьми, у которых в детском возрасте отмеча-
лись ПМР и ИМС. Все 226 детей длительно
лечились консервативно, '/6 из них — хирур-
гически. Те, у кого уже в детском возрасте были
признаки рефлюкс-нефропатии, имели тяжелые
осложнения в подростковом возрасте. Взрослые,
у которых активная терапия ИМС и ПМР пре-
пятствовала формированию в детстве рефлюкс-
нефропатии, были практически здоровы.
Лечение рефлюкс-нефропатии направлено
на снижение АД. Используют ингибиторы АПФ.
Имеется в виду не только гипотензивный, но
и антипротеинурический эффект этих препара-
тов. При развитии ХПН необходима замести-
тельная терапия обычно после нефрэктомии.
26.4. Особенности заболеваний
органов мочевой системы
у новорожденных и детей
первых месяцев жизни
Особенности различных заболеваний, в том
числе и органов мочевой системы, известны не
только в отношении взрослые — дети, но и в
аспекте дети старшего — дети младшего воз-
раста. В периоде новорожденное™ не развива-
ются острый постстрептококковый нефрит и
системная патология соединительной ткани с
почечным вовлечением. В то же время только у
новорожденного может развиться ТПН в связи
с агенезией почек и проявиться врожденный
нефротический синдром финского типа.
Этиология, п а то ге н е з. Причины за-
болеваний ОМС у новорожденных и детей пер-
вых месяцев жизни разнообразны. Хромосомные
болезни, моногенно-наследуемые заболевания
— болезнь де Тони — Дебре — Фанкони, син-
дром Барттера, аутосомно-рецессивная полики-
стозная болезнь почек и ряд других — прояв-
ляют себя нередко уже в периоде новорожден-
ное™. Заболевания, связанные с воздействием
тератогенных факторов, манифестируют очень
часто с первых дней постнатального развития.
Если это двусторонние пороки с олигогидрам-
нионом, то они, как правило, несовместимы
с жизнью. Классический пример — синдром
Поттер (двусторонняя агенезия почек, множе-
ство других пороков и типичное, с большим
количеством стигм дизэмбриогенеза, лицо).
Инфекционные агенты оказываются серьез-
ным этиологическим фактором патологии ОМС
у новорожденного. Это может быть внутриутроб-
ная инфекция: токсоплазмоз, цитомегаловирус,
сифилис, СПИД. Инфицирование может про-
изойти и во время родов с развитием хлами-
дийной или микоплазменной инфекции, пора-
жающих и ОМС.
В качестве патогенетического фактора может
выступать гипоксия плода и новорожденного,
что нередко незамедлительно проявляется син-
дромом ОПН. При нерезко выраженной гипок-
сии у таких детей выявляется оксалатный или
уратный диатез с развитием в дальнейшем ок-
салатной или уратной нефропатии. При прове-
дении реанимационных мероприятий ребенку
с родовой травмой трудно избежать полипраг-
мазии, что является основой развития тубуло-
интерстициального нефрита. По данным В.А.Та-
эолина и соавт. (1994) и Г.А.Маковецкой и
соавт. (1988), 50 % новорожденных, прошедших
через отделение реанимации, имели патологию
ОМС.
Синдромология и клиническая
характеристика. Для новорожденных и де-
гей первых месяцев жизни проявлениям пато-
логии ОМС свойственны те же симптомы, ко-
торые наблюдаются у старших детей и у взрос-
лых: отеки, гипертония и изменения в моче.
Необычным оказывается расстройство мочеис-
пускания. Здоровый новорожденный должен
помочиться через 24—48 ч после рождения.
Отсутствие акта мочеиспускания возможно по
двум причинам, объясняющим этот феномен:
нарушение мочеобразования и препятствие от-
току мочи.
Нарушение мочеобразования может быть
обусловлено следующими факторами:
• двусторонняя почечная агенезия;
• постнатальная внутрисосудистая гиповоле-
мия;
• ограничение приема жидкости;
• кортикальный или тубулярный некроз;
• двусторонний тромбоз почечных вен;
• врожденный нефротический синдром.
Препятствия оттоку мочи могут быть связа-
ны с такими явлениями, как:
• облитерация крайней плоти;
• стриктура или дивертикул мочеиспускатель-
ного канала;
• гипертрофия семенного бугорка или нали-
чие внешнего образования, препятствующего
мочеотделению;
• наличие мегауретера или уретероцеле;
• нейрогенная дисфункция мочевого пузыря.
Среди клинических синдромов, которые
нередко выявляются у новорожденных и детей
первых месяцев жизни, особое место занима-
ют нефромегалия и выраженная интоксикация.
Нефромегалия встречается у 0,5—1,02 % де-
тей и может быть связана с гидронефрозом,
тромбозом почечных вен, опухолью, кистозом
почек [Папаян А.В. и др.,1997]. Выраженная ин-
токсикация обычно сочетается с задержкой
внутриутробного развития и явлениями гипот-
рофии. Обычно это признак тяжелой врожден-
ной патологии почечной паренхимы и/или
внутриутробного инфекционного процесса.
При наличии у новорожденного отечного
синдрома в сочетании с большой протеинури-
ей, гипопротеинемией, гиповолемией возника-
ет вопрос о причине врожденного НС. Финс-
кий тип этой патологии в нашей стране встре-
чается исключительно редко.
НС как проявление минимальных изменений
в гломерулах (нефротическая форма ГН) мо-
жет развиваться на первом году жизни ребен-
ка, но чаще в его второй половине.
НС может быть связан с токсоплазмозом,
цитомегалией, сифилисом. Диагностика обяза-
тельно должна включать тесты, направленные
на выяснение специфики болезненного процес-
са. При подозрении на указанные инфекции
должны быть обязательно обследованы родите-
ли ребенка.
Редкие варианты НС при синдроме Лоу,
опухоли Вильмса, гемолитико-уремическом
синдроме, проявившиеся в неонатальном пе-
риоде, представлены Н.Д.Савенковой и А.В.Па-
паяном (1997).
Гипертензионный синдром у новорожденного —
чаще следствие врожденной аномалии почеч-
ных сосудов, что требует своевременной хирур-
гической коррекции. При гипертонии у детей,
проявившейся в конце первого года жизни,
необходимо исключить олигонефронию (см.
493
главу 13), а также рефлюкс-нефропатию (см.
выше).
Пиурия у новорожденного или ребенка пер-
вых месяцев жизни обычно сочетается с симп-
томами тяжелого септического процесса.
У новорожденного моча может быть необыч-
но интенсивной окраски, что определяется по
цвету пятен на пеленке. При исследовании мочи
выявляют кристаллурию — обычно это прояв-
ление мочекислого диатеза, который в более
старшем возрасте дает картину дизметаболичес-
кой нефропатии с оксалатной или уратной
кристаллуриями.
При наличии у новорожденного гематурии,
если она сочетается с кровотечениями, велика
возможность коагулопатии и тромбоцитопатии.
Чаще гематурия сочетается с лейкоцитурией,
дизурическими явлениями, а также выраженной
интоксикацией. В этих случаях чаще речь идет об
инфекции мочевой системы как одном из про-
явлений септического процесса. При этом воз-
можны апостематозный нефрит, карбункул поч-
ки и пиелонефрит. Если гематурия сочетается с
отеками и олигурией — возможно наличие тром-
боза почечных вен. При нефромегалии в сочета-
нии с гематурией и протеинурией необходимо
исключить наличие опухоли. Гематурическим
синдромом может проявляться в первые дни
жизни ребенка идиопатическая кальциурия с
последующим развитием уролитиаза.
Лечение и пр о ф ил акт и к а. При раз-
витии нефрологической патологии у новорож-
денного и ребенка первых месяцев жизни оп-
тимально проводить лечение в палате интенсив-
ной терапии с контролем за основными жиз-
ненными параметрами, причем немаловажную
роль играют правильно налаженный режим
питания (грудное молоко) и инфузионно вво-
димые контролируемые жидкость и необходи-
мые электролиты, так как склонность к экси-
козу может смениться гипергидратацией и на-
оборот, гипергидратация — дегидратацией.
Инфекция мочевой системы, будучи прояв-
лением общесептического процесса, требует
использования антибиотиков направленного
действия. Хороший эффект оказывает амокси-
циллин от 20 до 50 мг/кг в сутки внутримы-
шечно 2 раза в день, который следует приме-
нять не менее 14 дней. При генерализованной
инфекции возможно сочетание амоксицилли-
на с гентамицином в дозе 6 мг/кг в сутки 2 раза.
Следует помнить о нефротоксичности гентами-
цина и ограничивать срок его использования.
При обструктивной уропатии желательно не от-
кладывать хирургическое вмешательство. При
наличии признаков нефротического синдрома,
связанного с внутриутробным инфицировани-
ем токсоплазмозом, цитомегаловирусом, сифи-
лисом, наряду с использованием глюкокорти-
494
коидов обязательно лечение специфической
инфекции. Целесообразно использовать также
такие иммуномодуляторы, как реаферон.
Профилактика патологии новорожденного —
это контролируемое ведение беременности со
своевременным УЗИ, позволяющим выявить
отклонения от правильного развития плода,
своевременное лечение женщин до беременно-
сти по поводу хронических инфекционных про-
цессов. Профилактика заболеваний ОМС у де-
тей старшего возраста и взрослых предусматри-
вает активное лечение патологии ОМС у ново-
рожденного и ребенка первых месяцев жизни.
26.5. Инфекция мочевой системы
и тубулоинтерстициальный
нефрит
Терминология и эпидемиология.
Инфекция мочевой системы (ИМС) собира-
тельный термин, объединяющий микробно-
воспалительные изменения на различных «эта-
жах» ОМС. Для педиатров и педиатров-нефро-
логов этот термин необходим, так как в детс-
ком возрасте при склонности ребенка к гене-
рализации болезненного процесса нередко
очень сложно дифференцировать инфекцию
нижних мочевых путей от микробно-воспали-
тельного процесса в почечной паренхиме. У де-
вочек, которым свойственна короткая и доволь-
но широкая уретра, воспаление наружных по-
ловых органов нередко сопровождается уретри-
том, что может способствовать развитию цис-
тита.
Если имеется пузырно-мочеточниковый реф-
люкс (ПМР) или нейрогенная дисфункция
мочевого пузыря, если выражены анатомичес-
кие аномалии мочеточников и/или почек, то
избежать восходящей инфекции в почечной
паренхиме очень трудно.
Пиелонефрит — микробно-воспалительный
процесс в лоханке и паренхиме почки, преж-
де всего в тубулоинтерстициальном ее отделе.
Долгое время считалось, что пиелит как само-
стоятельный болезненный процесс у детей не
развивается. Однако уникальный опыт проведе-
ния трансуретральной уретеропиелоскопии по-
зволил установить наличие различных вариан-
тов острого пиелита у детей, о циклическом
развитии которого свидетельствовали катамне-
стические наблюдения за больными после уст-
ранения обструкции [Теблоева Л.Т., Кирил-
лов В.И., 1998].
Под первичным пиелонефритом понимается
микробно-воспалительный процесс в паренхи-
ме почек, когда причина фиксации микроор-
ганизмов в тубулоинтерстиции не определена.
Вторичный пиелонефрит связан с выявленной
наследственной, врожденной или приобретен-
ной, органической или функциональной об-
струкцией в органах мочевой системы. Вторич-
ный пиелонефрит в детской нефрологической
практике подразделяется на обструктивный,
связанный с уропатией, дизметаболический,
развивающийся при наличии цистинурии, ок-
салатной или уратной нефропатии, и обструк-
тивно-метаболический, когда имеются обструк-
тивная уропатия и предсуществующие метабо-
лические нарушения.
Для характеристики степени выраженности
воспалительного процесса используется термин
активность. Минимальная степень активнос-
ти — I, когда у больного имеет место только
патологический мочевой синдром; при II сте-
пени активности, кроме мочевого синдрома,
имеются нерезко выраженные экстраренальные
проявления: дизурические расстройства, боли
в животе, пояснице; III (максимальная) сте-
пень активности характеризуется тяжелыми эк-
страренальными проявлениями: лихорадкой,
резко выраженной интоксикацией, обменными
нарушениями и выраженной пиурией.
В диагнозе обычно указывают вариант тече-
ния: латентное, острое, волнообразное, торпид-
но-прогрессирующее, а также степень наруше-
ния функционального состояния почек [Игна-
това М.С., Вельтищев Ю.Е., 1989].
По данным эпидемиологических исследова-
ний, проведенных в 13 регионах России в 80-е
годы XX в., частота инфекции мочевой систе-
мы, включая пиелонефрит, составляла 18:1000
детского населения. В 90-е годы при эколого-
эпидемиологических исследованиях большая
частота микробно-воспалительных заболеваний
ОМС отмечалась в регионе, загрязненном ас-
бестом и цементом.
ЧАСТОТА НЕФРОПАТИИ В ПОПУЛЯЦИИ ДЕТЕЙ
В 80-Е ГОДЫ НА 1000 ДЕТСКОГО НАСЕЛЕНИЯ
(обследовано более 100 000 детей в 13 регионах
России)
Инфекция мочевой системы (включая пиело-
нефрит) 18
Гломерулонефрит 3,3
Дизметаболическая нефропатия (включая уро-
литиаз) 1,4
Интерстициальный (абактериальный) нефрит 1
Анатомические аномалии органов мочевой сис-
темы 1,3
Прочие 4
Этиология, патогенез, клиничес-
кая характеристика. По существующим
международным статистикам ИМС, включая
пиелонефрит, во много раз чаще встречается у
девочек, чем у мальчиков. Склонность к ИМС
у девочек объясняется относительно широкой
и короткой уретрой, что может способствовать
проникновению инфекции восходящим путем.
Исследования J.Winberg и сотрудников его
школы показывают, что у девочек с инфекци-
ей мочевой системы, имеющей склонность к
рецидивированию, наблюдается врожденный
дефект рецепторного аппарата эпителия ниж-
них мочевых путей, что способствует фиксации
микроорганизмов и развитию воспалительного
процесса [Jodal U., Winberg J., 1987]. Наличие
патологической бактериурии у мальчиков все-
гда должно настораживать в плане существова-
ния обструктивной уропатии как основы пато-
логического процесса.
Этиология пиелонефрита у детей отличается
от таковой у взрослых. Очень часто выявляется
инфицированность протеем. По данным Л.Т.Теб-
лоевой, суммировавшей сведения о серогруппах
кишечной палочки, обнаруживаемой у больных
пиелонефритом, преобладают серогруппы 06; 02;
075; 04; 01, т.е. те, которые включены Между-
народным центром по эшерихиям в число уро-
патогенных. При серотипировании по К-антиге-
ну в московской популяции больных пиелонеф-
ритом чаще выявляются К,- и К2-АГ, которые
считаются наиболее уропатогенными.
Путь распространения инфекции у детей
первых недель и первых месяцев жизни, как
правило, гематогенный. В последующие годы
чаще развивается восходящая инфекция. Лим-
фогенный путь распространения инфекции на-
блюдается редко у детей.
Пиелонефрит может развиться в любом воз-
расте, при этом чем тяжелее обструктивная
уропатия у ребенка, тем тяжелее протекает
наслаивающийся уже в раннем возрасте мик-
робно-воспалительный процесс в почечной па-
ренхиме.
Уже в перинатальном периоде следует обра-
щать специальное внимание на детей, которые
рождаются от матерей, страдающих пиелонеф-
ритом. Во-первых, возможна наследственная пе-
редача обструктивной уропатии или дизметабо-
лических расстройств, способствующих разви-
тию воспалительного процесса в почечной па-
ренхиме (рис. 26.2).
Во-вторых, известно внутриутробное инфи-
цирование ребенка; в-третьих, существует боль-
шая вероятность тератогенного воздействия на
плод как самого пиелонефрита у беременной,
так и тех лекарственных средств, которые дол-
жна получать беременная женщина, если про-
исходит активация патологического процесса.
Поэтому необходимо стремиться проводить
противорецидивное лечение пиелонефрита до
начала беременности.
Лейкоцитурия даже без значительной бакте-
риурии у новорожденных и детей первых меся-
495
II III fill • III III
2 1 2 3 4
Рис. 26.2. Родословная (фрагмент)
и схематическое изображение рент-
генологических изменений в почках
в семье Г., страдающей аномалией
органов мочевой системы.
I, II, III — поколения: 1, 2, 3, 4 — чле-
ны семьи в поколении; а — аномалия
органов мочевой системы.
цев жизни может рассматриваться как проявле-
ние пиелонефрита [Гельдт В.Г., 1998J. При нор-
мально сформированных почках это может быть:
• первичный острый гематогенный пиелонеф-
рит;
• метастатический пиелонефрит при наличии
сепсиса;
• посткатетеризационный пиелонефрит.
Вторичный пиелонефрит в этом возрасте мо-
жет сформироваться при наличии:
— гидронефроза;
- пузырно-мочеточникового рефлюкса;
— стеноза терминального отдела мочеточника;
— дивертикула мочевого пузыря;
— врожденных пузырно-уретро-кишечных сви-
щей.
В отличие от детей более старшего возраста
ИМС у новорожденных чаще развивается у
мальчиков, чем у девочек, что связано с более
частыми у них пороками мочевой системы.
У детей, достигших возраста 1 года, ИМС
может развиться манифестно с лихорадкой,
ознобом, головной болью, болями в животе.
Дети более старшего возраста локализуют боль
либо в пояснице, либо внизу живота. Часты
дизурические расстройства, выраженность ко-
торых нередко связана со степенью поражения
мочевого пузыря. Длительность, интенсивность
болевого, дизурического синдромов и темпера-
турная реакция зависят от возраста ребенка,
выраженности патологического процесса и ин-
тенсивности противовоспалительных меропри-
ятий. Нередко амбулаторно назначенный анти-
биотик без определения органа поражения при-
водит к исчезновению патологических измене-
ний в моче, а нераспознанность заболевания
способствует в дальнейшем затяжному, скры-
тому развитию болезни.
496
Изолированная лейкоцитурия может зависеть
от изменения профиля бактериурии. Чтобы оп-
ределить, с чем связана абактериальная лейко-
цитурия у детей с латентным течением пиело-
нефрита, нами обследованы 64 ребенка. При-
меняя метод полимеразной цепной реакции
(ПЦР), был изучен осадок мочи на наличие
внутриклеточных микроорганизмов: хламидий,
микоплазм, уреаплазм [Белостоцкий В.М. и др.,
1997]. Хламидийная инфекция чаще выявлялась
у детей до 5 лет, проявлялась нерезко выражен-
ной лейкоцитурией, имелись симптомы ката-
рального цистита и гиперрефлекторного моче-
вого пузыря. Уреаплазменная инфекция опре-
делялась у детей старше 12 лет с гипорефлек-
торным мочевым пузырем. Имели место не
только мочевой синдром, но увеличение СОЭ
и повышение экскреции уратов. Лечение было
наиболее эффективным в тех случаях, когда
одновременно применяли антибиотикотерапию
и лазер как средство воздействия на нейроген-
ную дисфункцию мочевого пузыря.
Течение, прогноз. Течение инфекции
мочевой системы (ИМС) у детей, часто боле-
ющих респираторными заболеваниями и полу-
чающих при этом многократно антибактериаль-
ные препараты, имеет свои особенности. У этих
детей наблюдается снижение иммунитета и пи-
елонефрит обычно выявляется случайно, неред-
ко поздно, когда уже начинается склерозиро-
вание почечной ткани. Острое манифестное
начало ИМС более благоприятно, так как ди-
агноз ставится своевременно и проводится адек-
ватное лечение. Волнообразному и торпидно
прогрессирующему течению пиелонефрита спо-
собствуют обструктивная уропатия или выра-
женные метаболические нарушения. У детей,
как и у взрослых, возможно развитие ослож-
нений: артериального или венозно-лимфатичес-
кого педункулита, форникальных кровотечений
и папиллонекроза, что, к счастью, в последнее
время встречается довольно редко. Возможно со-
четание пиелонефрита и гломерулонефрита.
Развитие ХПН при пиелонефрите у детей
наблюдается в случаях тяжелой обструктивной
уропатии с часто рецидивирующим микробно-
воспалительным процессом в почечной ткани.
Лечение. При лечении детей с ИМС,
включая пиелонефрит, ставят следующие за-
дачи:
• воздействие на микробную инфекцию;
• нормализация иммунологического состояния
ребенка;
• улучшение обменных процессов;
• нормализация функции почек;
• стимуляция регенераторных процессов.
При выборе антибактериальных препаратов
важно учитывать, что некоторые антибиотики
для ребенка более нефротоксичны, чем для
взрослого.
При III степени активности пиелонефрита
лечение обычно проводится в стационаре. Ре-
комендуется отдавать предпочтение паренте-
рально вводимым цефалоспоринам II—III по-
колений, аминогликозидам, бета-лактамазоус-
тойчивым пенициллинам (амоксициллин). При
II—I степени активности лечение обычно про-
водят амбулаторно, используя препараты, при-
меняемые перорально. Вслед за антибиотиками
назначают нитрофураны, препараты налидик-
совой кислоты и др. «Ступенчатая» этапная те-
рапия ИМС получила распространение сравни-
тельно недавно [Коровина Н.А. и др., 1998]. Она
заключается в том, что после 3—4 дней парен-
терально используемого антибиотика к нему
присоединяют тот же препарат перорального
применения, вслед за этим через 1—2 дня ос-
тавляют только антибиотик, используемый пе-
рорально. При хламидийной и уреаплазменной
инфекции очень эффективны макролиды.
Длительность антибактериальной терапии
определяется наличием обструктивного и диз-
метаболического процесса в ОМС, степенью
иммунной защиты. Существуют тенденции уко-
рачивать длительность антибактериальной тера-
пии при «видимом» излечении. Однако наш
более чем 30-летний опыт лечения таких детей
показывает, что поддерживающая антимикроб-
ная терапия при инфекции нижних мочевых
путей должна продолжаться не менее 3 мес, а
при пиелонефрите — не менее 6 мес. В процес-
се поддерживающей терапии целесообразно че-
редовать химиопрепараты со сборами трав,
оказывающих не только противовоспалитель-
ное, но и регенераторное действие. Существу-
ет методика поддерживающей терапии препа-
ратами нитрофуранового ряда, которые приме-
няют в половинной дозе в вечерние часы на
32—2950
протяжении 2 лет. Такое лечение обычно назна-
чают детям с органической или функциональ-
ной обструкцией ОМС.
В качестве иммунокорригирующих средств
используют левамизол, иммунал, нуклеинат
натрия, реаферон.
Для коррекции обменных нарушений назна-
чают антиоксиданты и мембранотропные сред-
ства: витамины А, Е, Вб, ксидифон, димефос-
фон. Для реабилитации применяют физиотера-
певтические процедуры.
Тубулоинтерстициальный нефрит абактериаль-
ный часто развивается при оксалатной и урат-
ной нефропатиях, при экодетерминированной
патологии почек. Возможно развитие ТИН у
детей при вирусных инфекциях, при наличии
паренхиматозного дизэмбриогенеза почек.
Для лечения используют симптоматичес-
кие средства, обязательны препараты, улучша-
ющие микроциркуляцию.
26.6. Возрастные особенности
гломерулонефрита у детей
Терминология, этиология, патоге-
нез. Острый нефрит — спорадическое, диффуз-
ное остроманифестирующее заболевание по-
чек, проявляющееся гематурией, гипертонией
и нефритическими отеками. Заболевание име-
ет связь со стрептококковой инфекцией зева
или кожи, склонность к циклическому течению.
Развивается у детей через 2—3 нед после анги-
ны, через 3—4 нед после импетиго. Обязатель-
но выражен синдром гематурии; отеки и гипер-
тензия отмечаются в 90 и 80 % случаев соот-
ветственно [Rodriguez-Iturbe В., 1998]. Острый
нефрит в экономически развитых странах в пос-
ледние годы встречается довольно редко. По
данным А.В.Папаяна и соавт. (1997), острый
нефрит у детей в нашей стране вновь регист-
рируется значительно чаще, чем в два преды-
дущих десятилетия.
Гломерулонефрит диффузный — клинический
термин, употребляемый в детской нефрологии,
подчеркивающий наличие двустороннего абак-
териального иммунного воспаления в почечной
ткани с преимущественным первичным пора-
жением гломерул. Термин «гломерулонефрит
первичный» подчеркивает самостоятельность
почечного поражения, вне зависимости от си-
стемного заболевания.
Гематурическая форма гломерулонефрита —
клиническое определение, подчеркивающее
преобладание в мочевом осадке эритроцитов.
К этой клинической группе относится и болезнь
Берже, выделение которой происходит после
иммунофлюоресцентного исследования почеч-
ного биоптата, выявляющего IgA-свечение.
497
Нефротическая форма гломерулонефрита — в
клиническом аспекте у детей имеет несколько
терминологических эквивалентов, наиболее
распространенный — нефротический синдром
с минимальными изменениями в гломерулах.
Смешанная форма гломерулонефрита — тер-
мин, употребляемый в педиатрической нефро-
логии для тяжело протекающего нефрита с
выраженными гипертензионным, отечным и
мочевым синдромами, включающими гемату-
рию. Морфологической основой являются скле-
розирующие варианты патологии.
Выделение клинических форм, активности и
вариантов течения заболевания было предложено
Г.Н.Сперанским и соавт. (1965—1966) и допол-
нено М. С. Игнатовой и Ю.Е.Вельтищевым (1989).
Термин «активность» подразумевает клиничес-
кую выраженность воспалительного процесса в
почках. Выделяют I степень активности, подра-
зумевающую наличие только мочевого синдро-
ма; II степень, при которой наряду с мочевым
синдромом присутствуют обменные нарушения,
пастозность тканей, склонность к повышению
АД; III степень активности — это выраженная
гипертензия, нефритические и/или нефротичес-
кие отеки, мочевой синдром вплоть до макро-
гематурии, отчетливые обменные нарушения.
По характеру течения заболевания выделя-
ют острый (циклический), затяжной, волнооб-
разный, торпидно-прогрессирующий, латент-
ный ГН. Термины «затяжное», «волнообразное»,
«торпидно-прогрессирующее», «латентное» те-
чение эквиваленты термину «хронический гло-
мерулонефрит». В диагнозе также указывается
состояние почечных функций, начиная с ми-
нимальных почечных нарушений, определяемых
при нагрузочных тестах, — парциальные нару-
шения (ПН1). При прогрессировании нефрита
с появлением тубулярных и гломерулярных
дисфункций речь идет о ПН2а и ПН26, пос-
ледние являются ранней стадией ХПН [Игна-
това М.С., Гроссман П., 1986].
Гематурическая форма гломерулонефрита
может развиться у ребенка, начиная с дошколь-
ного возраста. Наиболее часто нефротическая
форма ГН возникает в возрасте 2—4 лет. Сме-
шанная форма ГН чаще развивается в препу-
бертатном или пубертатном периоде.
Четкой корреляции между клиническим и
морфологическим вариантом ГН у детей нет.
Правда, для гематурической формы более свой-
ствен мезангиопролиферативный вариант, для
нефротической — минимальные изменения и
фокально-сегментарный гломерулосклероз
(ФСГС), при смешанной форме ГН встречают-
ся все гистологические варианты ГН, кроме
минимальных изменений. Как правило, при
смешанной форме ГН выражен тубулоинтерсти-
циальный компонент.
498
ГН у детей чаще связан со стрептококковой
инфекцией. IgA-нефропатия, нефротическая и
смешанная формы ГН могут зависеть от вирус-
ного инфицирования. В последние годы все чаще
приходится наблюдать сочетанное поражение
печени и почек при HBs-инфекции. Наиболее
неблагоприятным в прогностическом отноше-
нии оказывается ГН у детей, у которых при
морфобиоптическом исследовании в гломеру-
лах обнаружены антигены простого герпеса I
типа [Длин В.В., 1993].
У детей ГН чаще бывает иммунокомплекс-
ным. Однако при нефротической форме разви-
вается в ряде случаев патология, связанная с
реакцией гиперчувствительности немедленного
типа. Это свойственно нефротическому синдро-
му с атопией. Чрезвычайно редко ГН у детей
связан с наличием антител к БМ гломерул.
Прогностически наиболее неблагоприятны у
детей ФСГС и различные клинико-морфологи-
ческие варианты при сочетании ГН со струк-
турным почечным дизэмбриогенезом, включая
гипопластическую дисплазию (см. главу 13).
Нефротический синдром (НС) как клиничес-
кий симптомокомплекс типичен для детей.
Существует множество классификаций НС.
В педиатрической практике целесообразно
пользоваться модифицированной классифика-
цией М.П.Матвеева (1975) и G.Ameil (1976).
Нефротический синдром подразделяют на
следующие формы:
• врожденный, который включает в себя фин-
ский тип:
— семейный, связанный с мутацией гена,
картированного на 1-й хромосоме;
— при синдроме Дэнис — Драша (НС, гер-
мафродитизм и нефробластома), завися-
щем от мутации гена WT1 (ген опухоли
Вильмса).
• первичный: а) синоним «нефротической фор-
мы ГН», для которого характерны мини-
мальные изменения в гломерулах, но могут
наблюдаться ФСГС, мезангиопролифератив-
ный ГН.
• вторичный: б) при других формах ГН, ко-
торый может возникать:
— при системных болезнях соединительной
ткани и сосудов;
— врожденных инфекциях (сифилис, токсоп-
лазмоз, цитомегаловирусная инфекция);
— хронических инфекциях (туберкулез, ма-
лярия, СПИД);
— тромбозе почечных вен;
— структурном почечном дизэмбриогенезе;
— хромосомных болезнях (синдром Орбели,
болезнь Дауна и др.);
— ожоговой болезни;
— амилоидозе;
— редких синдромах (саркоидоз, синдром
Клиппеля — Триноне и др.).
Клинические варианты НС при гло-
эулонефрите у детей дифференцируются в за-
:имости от чувствительности больных к глю-
сортикоидам. Выделяют гормоночувствитель-
1 НС, когда у ребенка, получающего адек-
ную дозу преднизолона (2 мг/кг в сутки в
ение 4—8 нед), развивается клинико-лабо-
орная ремиссия. Гормонозависимый НС —
>едкий вариант у детей, когда ремиссия пос-
адекватной дозы глюкокортикоидов разви-
тей, но при отмене стероидов возникает
;идив. Чем ребенок моложе, тем чаще наблю-
)тся рецидивы [Kabuki N. et al., 1998]. О гор-
юрезистентном НС говорят в тех случаях,
да после 8 нед адекватной дозы стероидов
[иссия отсутствует. Гормонорезистентный НС
хе наблюдается у пациентов с HLA DR7.
келее НС протекает у детей с отставанием
шческого развития [Zidar N. et al., 1998].
Нефротический синдром с атопией — вариант
ологии, нередкий в детском возрасте, так как
ергический диатез отмечается у 24—54 %
гй в популяции [Вельтищев Ю.Е., Стефани
., 1996]. Атопия — генетически детермини-
анная склонность к повышенной продукции
щх и специфических IgE. Наши исследова-
:, проведенные совместно с Е.С.Москалевой,
азали, что у 50 % детей с гормоночувстви-
ьным НС и у их ближайших родственников
ют место атопические проявления в виде
ергического ринита, нейродермита, отеков
шке. При ГН без НС частота атопических
знаков у детей и родственников в 4 раза
ыпе. Была проверена гипотеза мультифакто-
льного генеза НС с атопией по Falkoner
>5) и Edwards (1966). Оказалось, что частота
этических факторов (атопические симптомы
5мье) превышает частоту средовых (частые
усные инфекции, вакцинации и др.). Вклад
вых составляет 60—70 %, вторых — 40—30 %
гветственно, что доказывает мультифактори-
гостъ НС с атопией.
Нефротический синдром с атопией имеет
эенности:
голее раннее начало;
большая выраженность отечного синдрома;
1аличие эозинофилии и повышения IgE
срови, мочи;
юльшая частота рецидивов до назначения
щтостатиков;
леньшая степень снижения почечных функ-
1ий;
ормоночувствительность.
/ многих больных при НС с атопией реци-
ы возникали после контакта с причинно-
значимым аллергеном. Так, в одном из наших
наблюдений у девочки с 3 лет отмечался часто
рецидивирующий НС, обострения которого
развивались во время весеннего цветения трав.
При элиминации аллергенов (девочку ежегод-
но на протяжении 6 лет вывозили в другую
климатическую зону) рецидивов НС не было.
Новая встреча с теми же аллергенами в 12 лет
сопровождалась тяжелым обострением НС с вы-
сокими показателями IgE крови и мочи.
Лечение гломерулонефритов. В ос-
трый период заболевания вне зависимости от
формы гломерулонефрита ребенку рекоменду-
ется постельный режим с ограничением в ди-
ете поваренной соли. Стол с резким ограниче-
нием животного белка может назначаться боль-
ным детям только на период выраженной ги-
пертонии и распространенных отеков.
Лечение острого постстрептококкового не-
фрита предусматривает строгое соблюдение
постельного режима, гипохлоридного стола,
использование гипотензивных и диуретических
препаратов до исчезновения гипертензии и оте-
ков. Обязательность выполнения указанных ме-
роприятий связана с возможностью развития
эклампсии и почечной недостаточности острого
периода (вариант ОПН), которые, по данным
А.В.Папаяна (1997), могут возникнуть в 2 и 5 %
случаев соответственно. На срок 1,5—2 мес на-
значают антибактериальную терапию. При на-
личии хронического тонзиллита и/или адено-
идита рекомендуется к концу второго месяца
болезни проведение оперативной санации ука-
занных очагов инфекции под контролем анти-
биотиков и антигистаминных средств. При ге-
матурии, сохраняющейся более 2 мес, рекомен-
дуется назначение препаратов 4-аминохиноли-
нового ряда в дозе 5—10 мг/кг массы ребенка
на срок до 6 мес. Одновременно применяют
курантил в дозе 5 мг/кг. Лечение гепарином
проводят при наличии признаков гиперкоагу-
ляции в первые месяцы болезни.
В тех случаях, когда не наблюдается цикли-
ческого развития болезни, ориентировочно
через 6 мес рекомендуется проведение морфо-
биоптического исследования, и при наличии
мезангиопролиферативного иммунопозитивного
ГН может быть назначен азатиоприн в дозе
1,5—3 мг/кг в сутки на срок 6—8 нед с после-
дующим переходом на поддерживающую поло-
винную дозу на срок не менее года. Эта тера-
пия оказывается эффективной при ее назначе-
нии через 6—12 мес от начала заболевания
[Харина Е.Л. и др., 1998].
При гематурической форме гломерулонефрита
терапия близка тому, что рекомендуется при
остром постстрептококковом нефрите. Уже в
первые недели заболевания используют анти-
агреганты и антикоагулянты. Редко назначают
499
резохин или аналоги, а в сроки 6—8 мес от
начала заболевания при отсутствии цикличес-
кого течения болезни рекомендуется назначе-
ние азатиоприна в вышеуказанных дозах.
При нефротической форме гломерулонефрита,
т.е. при наличии у ребенка нефротического син-
дрома без гематурии или с минимальной гема-
турией, назначают преднизолон в дозе 2 мг/кг
в сутки на срок 4—8 нед. При исчезновении
отеков, протеинурии, повышении альбумина
крови (т.е. если больной оказывается гормоно-
чувствительным) рекомендуется перевести его
на лечение преднизолоном в дозе 1,5 мг/кг в
сутки. Эту дозу препарата используют через день
(альтернирующий курс) на протяжении 8 нед.
Преднизолон применяют в утренние часы (до
11 ч утра) и отменяют либо быстро, либо по-
степенно на протяжении полугода. Это зависит
от сохраняющихся признаков активности ГН,
сопутствующих заболеваний, быстроты разви-
тия ремиссии. При пролонгированной отмене
преднизолона дозу препарата постепенно
уменьшают и перед отменой чаще используют
прерывистый курс (3 дня — прием преднизо-
лона, 3—4 дня — интервал).
При рецидивах НС преднизолон назначают
в дозе 2 мг/кг в сутки ежедневно в течение не
менее 2 нед. Критерием для перехода на мень-
шую дозу препарата является исчезновение про-
теинурии при трехкратных ежедневных анали-
зах в течение 3 дней. Вслед за этим преднизо-
лон рекомендуется назначить в дозе 1,5 мг/кг в
сутки альтернирующим курсом продолжитель-
ностью 4 нед, а затем постепенно отменить на
протяжении 2 нед. Если рецидивы частые (воз-
никают 4 раза и более в год), то, кроме пред-
низолона, используют цитостатики. С наиболь-
шим эффектом применяют алкилирующие
агенты: хлорбутин и циклофосфан. Назначая
цитостатики, следует придерживаться курсовой
дозы препарата; для циклофосфана — 200—250
мг/кг, для хлорбутина — 8—11 мг/кг. При уве-
личении этих доз повышается риск осложнений:
угнетение гемопоэза, появление гонадотоксич-
ности, восприимчивости к инфекциям, онко-
генного эффекта [Brodehl J., 1991]. Хлорбутин
или циклофосфан применяют одновременно с
преднизолоном в дозе 1—1,5 мг/кг в сутки аль-
тернирующим курсом на протяжении 8 нед.
Ежедневная доза хлорбутина — 0,2 мг/кг в сут-
ки, циклофосфана — 2,5 мг/кг в сутки.
Больному ребенку с гормонозависимым НС
курс цитостатиков продлевают до 12 нед, от-
давая предпочтение циклофосфану. Обязатель-
но назначают поддерживающую терапию сте-
роидами. При таком виде терапии у 2/3 больных
отмечается стойкая ремиссия — более двух лет
после отмены преднизолона [Ponticelli С.,
Passerini Р., 1994].
500
При нефротическом синдроме с атопией вме-
сто преднизолона может быть использован це-
лестон, обладающий большим антиаллергичес-
ким действием. Для получения ремиссии нами
совместно с Е.С.Москалевой были использова-
ны кромолин-натрий (интал) или кетотифен
(задитен) в возрастных дозировках на протяже-
нии месяца. У большинства детей отмечалась
ремиссия, правда, нестойкая. Для получения
стойкой клинико-лабораторной ремиссии про-
водили лечение преднизолоном и цитостатика-
ми в вышеуказанных дозировках [Игнато-
ва М.С., Вельтищев Ю.Е., 1989]. Рекомендует-
ся назначать задитен детям при наличии НС с
атопией на период постепенной отмены пред-
низолона и в течение нескольких дней после
его отмены.
Лечение гормонорезистентного нефротическо-
го синдрома и смешанной формы гломерулонеф-
рита имеет много общего. Обычно лечение
проводят после морфобиоптического исследо-
вания почечной ткани и установления гисто-
логического варианта патологии [Webb N. et al.,
1996]. Используют трех-, четырех- и в некото-
рых случаях пятикомпонентное применение
препаратов. К ним относятся антикоагулянты,
антиагреганты, глюкокортикоиды, цитостати-
ки и в ряде случаев иммуномодуляторы типа
реаферона. Лечение при гормонорезистентном
НС, при нефротической и смешанной формах
ГН различается тем, что при последней в свя-
зи с большей выраженностью гипертензионной
реакции, еще до глюкокортикоидной терапии,
требуется использование гипотензивных средств
(см. выше).
До назначения иммуносупрессантов прово-
дят активную диуретическую терапию, вклю-
чающую инфузионное введение реополиглюки-
на, лазикса, 20 % альбумина. У детей с наибо-
лее тяжелым течением гломерулонефрита перед
назначением иммуносупрессантов может быть
осуществлен плазмаферез, что, по нашим дан-
ным [Москалева Е.С. и др., 1994], способству-
ет эффективности иммуносупрессантов.
В настоящее время наиболее популярны два
вида активной терапии гормонорезистентного
НС при нефротической и смешанной формах ГН.
Первый вариант — использование циклофосфа-
на одновременно с поддерживающей дозой
преднизолона в дозе 1—1,5 мг/кг в течение 48 ч.
Циклофосфан может назначаться внутрь по
2,5 мг/кг в сутки в течение 14 нед или внутри-
венно по 12—17 мг/кг 1 раз в месяц. Второй ва-
риант — использование метилпреднизолона в
дозе до 30 мг/кг внутривенно первые 2 нед 3 раза
в неделю, следующие 7 нед — 1 раз в неделю с
одновременным альтернативно используемым
преднизолоном внутрь (2 мг/кг за 48 ч). В следу-
ющие 8 нед больной ребенок получает метилпред-
низолон 1 раз в 2 нед, а дозу перорально использу-
емого преднизолона уменьшают до 1,5 мг/кг
за 48 ч. Последующие 8 мес метилпреднизолон
применяют 1 раз в месяц и, наконец, последние
8 мес — 1 раз в 2 мес. В это же время постепен-
но отменяют и преднизолон, назначаемый
внутрь (Waldo F. et al., 1992].
Накопленный нами опыт использования
плазмафереза позволяет рекомендовать модифи-
кацию вышеуказанных методов терапии следу-
ющим образом. Проводят 3 курса плазмафере-
за с удалением плазмы в общем объеме до 45
мг/кг с замещением 10 % альбумином и рео-
полиглюкином. При необходимости плазмафе-
рез может быть повторен через 3—4 нед. С пер-
вого дня лечения больные дети получают пред-
низолон в дозе 2 мг/кг в сутки ежедневно в
течение около 3 нед, а затем альтернативным
курсом. После 2 и 3 сеансов плазмафереза в тот
же день внутривенно вводят циклофосфан в
дозе 10 мг/кг или метилпреднизолон в дозе до
30 мг/кг. В наиболее тяжелых случаях применя-
ют метилпреднизолон и циклофосфан. В даль-
нейшем лечение проводят по принципам, ука-
занным выше. При таком лечении у ряда боль-
ных получен эффект, которого не было без
применения плазмафереза (рис. 26.3).
Сравнительно новый вариант лечения гор-
монорезистентного НС — это использование
циклоспорина А. Опыт его применения при гор-
моночувствительном НС уже известен [Niaudet
Р. et al., 1991]. Его начали применять при гор-
монозависимом и гормонорезистентном НС.
В настоящее время мы располагаем совместно
с Э.Г.Курбановой опытом успешного примене-
ния циклоспорина А (ЦсА) у 25 детей с инди-
видуальным подбором дозы, которая в среднем
составила 5—6 мг/кг в сутки; при этом мы ори-
ентировались на содержание препарата в кро-
ви на уровне 80—150 нг/мл. Первые 1—2 мес
ЦсА применяли одновременно с преднизоло-
ном в дозе 1 мг/кг в сутки альтернирующим
курсом, затем преднизолон постепенно отме-
няли, а ЦсА при его эффективности исполь-
зовали 6—12 и даже 18 мес. Противопоказания
к назначению ЦсА детям с НС являются:
• неконтролируемая гипертония;
• повышение креатинина крови до уровня
более 130 мкМ/л;
• нарушение функции печени с повышением
уровня трансаминаз в 2 раза.
Продолжается поиск средств, которые мо-
гут помочь детям с гормонорезистентным НС.
Ребенку 12 лет с НС, резистентным ко всем
видам иммуносупрессивной терапии, нами
было проведено лечение человеческим иммуно-
глобулином — октагамом. Препараты человечес-
кого иммуноглобулина используются при им-
Рис. 26.3. Эффективность лечения прогрессирующих
вариантов гломерулонефрита у 52 детей с использо-
ванием плазмафереза.
а — ближайший эффект; б — отдаленный эффект.
мунодефицитных и аутоиммунных заболевани-
ях, в том числе при волчаночном нефрите
[Мартин Т.Д., 1996], однако есть лишь единич-
ные наблюдения по его применению детям с
НС. Нами использован курс лечения в виде
3 инфузий по 350 мг/кг на 48 ч. Отмечались
уменьшение протеинурии в 5 раз, нормализа-
ция уровня сывороточного альбумина, повыше-
ние в 6 раз резко сниженного IgG крови, по-
вышение индекса CD4/CD?, Снижение активно-
сти процесса было нестойким, но значитель-
ное улучшение иммунологического состояния
больного позволило применить иммуносупрес-
сивную терапию более успешно, чем до при-
менения октагама.
Последовательность использования медика-
ментов при нефротическом синдроме у детей:
• преднизолон; при НС с атопией — целестон;
• при частом рецидивированни НС и при гор-
монозависимости — алкилирующие препа-
раты (хлорбутин или циклофосфан);
• при гормонорезистентности: комплексная
терапия (плазмаферез, глюкокортикоиды,
цитостатики, антиагреганты и антикоагулян-
ты, реаферон);
• циклоспорин А — при неэффективности
предшествующей терапии у больных гормо-
норезистентным и гормонозависимым НС.
Успех терапии должен прослеживаться дли-
тельно и продолжаться при необходимости у
подростков и взрослых по близким по сути
методикам лечения.
26.7. Экодетерминированная
патология почек у детей
Введение и терминология. В настоящее
время с достаточной убедительностью показа-
но, что не только у людей, работающих на про-
изводстве с вредными веществами, но и у лиц,
проживающих рядом с таким производством,
501
могут развиваться аналогичные патологические
состояния. Это в большой мере относится к
детям как в связи с недостаточной зрелостью
у них органов выведения, в том числе почек,
так и с приближенностью ребенка к среде оби-
тания: земле, снегу, растениям, где нередко
накапливаются экотоксиканты. ПДК для раз-
личных ксенобиотиков разработаны для здоро-
вых людей, работающих на производстве, од-
нако их нет для детей. Говоря о детях, необхо-
димо пользоваться беспороговой оценкой вли-
яния различных ксенобиотиков, так как пато-
логическое влияние на детский организм ока-
зывают любые дозы ксенобиотиков.
Экодетерминированная нефропатия — заболе-
вание почек, возникающее в регионе, отяго-
щенном экотоксинами, которые длительно
поступают в организм ребенка и документиру-
ются данными их обнаружения в биологичес-
ких средах пациентов.
Эконефропатия с гематурией — экодетерми-
нированная патология почек, выявленная в
регионе, отягощенном солями тяжелых метал-
лов, — проявляется гематурией с последующим
присоединением протеинурии, тубулярными
дисфункциями, повышенной экскрецией с
мочой тяжелых металлов (кадмия, хрома, сурь-
мы), наличием при морфобиоптическом исле-
довании тубулоинтерстициального нефрита и
признаков гипопластической дисплазии почек.
Патогенез. Все многообразие неблагопри-
ятных воздействий экологического характера на
почку может быть разделено следующим обра-
зом:
1) физические, прежде всего радиационные
и механические, главным образом вибрацион-
ные;
2) биологические, среди которых в основ-
ном рассматриваются вирусные воздействия,
что объясняется быстрым изменением свойств
вирусов под влиянием изменяющихся внешних
факторов;
3) химические, к которым относится все
многообразие ксенобиотиков, исчисляемых в
настоящее время многими тысячами веществ.
Ксенобиотики, поступающие в организм
ребенка с воздухом, водой, пищей, в конеч-
ном итоге выводятся почками, при этом воз-
можно их повреждающее действие. Токсиканта-
ми, поражающими почку, нередко оказываются
различные металлы. Одновалентные металлы
(литий, бор) почти полностью фильтруются в
клубочке и активно реабсорбируются в каналь-
цах, конкурируя с ионами натрия и калия.
Двухвалентные металлы (кадмий, цинк, сви-
нец) связываются с сульфгидрильными груп-
пами специфических или неспецифических бел-
ков, выполняющих транспортную функцию.
К специфическим белкам относятся металло-
502
тионеин, связывающий кадмий и цинк, сви-
нецсвязывающий белок, трансферрин, церу-
лоплазмин. Транспортные белки могут обусло-
вить нефротоксичность металлов при их избы-
точном поступлении в организм, так как при
этом образуется комплекс металл-протеин, ко-
торый, являясь транспортной формой металла,
способствует его фильтрации и повышенной аб-
сорбции в почечной ткани. Механизмы действия
ксенобиотиков различны.
Эмбриотоксическое действие металлов. Изве-
стно эмбриотоксическое влияние кадмия, свин-
ца, ртути и других металлов. Ксенобиотики
могут быть причиной асинхронии развития тка-
ней, что, по мнению Ю.Е.Вельтищева (1996),
может быть причиной возникновения тканевой
гипопластической дисплазии.
Генотоксическое действие металлов проявля-
ется в нарушениях репарации ДНК, нестабиль-
ности хромосом, хромосомных аберрациях.
Ферментотоксическое действие металлов свя-
зано с тем, что двухвалентные металлы ингиби-
руют жизненно важные ферменты за счет связы-
вания SH-групп или вытеснения эссенциальных
элементов из металлоферментов [Cobach Т.
et aL, 1996].
Цитотоксическое действие металлов в основ-
ном касается усиления перекисного окисления
липидов, нарушения кальциевого гомеостаза и
окислительного метаболизма клеток.
Цитотоксическое влияние обусловлено и
воздействием на митохондрии клеток, что свя-
зано преимущественно с митохондриальным
распределением тяжелых металлов в клетках.
Нарушение функции митохондрий ведет к сни-
жению продукции макроэргов, уменьшению
соотношения АТФ/АДФ. Это проявляется и в
снижении фермента Ca-Mg-АТФазы за счет
нарушения фосфорилирования фермента. Под
влиянием ксенобиотиков изменяется кальцие-
вый и магниевый гомеостаз клетки.
Тяжелые металлы вызывают иммуносупрес-
сию, что связано с соматическими мутациями
и нарушением репарации ДНК лимфоцитов.
Это отмечено при воздействии кадмия, хрома,
кобальта, меди. Нарушается синтез цитокинов:
гамма-интерферона и интерлейкина-2, наруша-
ется функция клеточных рецепторов ИЛ-2. Под
влиянием кадмия, меди и свинца снижается
синтез иммуноглобулинов А и G. Ртуть влияет
на систему комплемента.
Развитие клеточно-опосредованных реакций
аллергии отмечается при действии хрома, кад-
мия и никеля. Необходимо отметить, что хи-
мически опосредованная патологическая реак-
ция со стороны почек имеет прогрессирующий
и практически необратимый характер даже
после элиминации причинно-значимого эко-
токсина [Iwata К. et al., 1993].
Эпидемиология, клиническая
характеристика. Об эконефропатиях у де-
тей можно говорить при наличии определенных
условий:
• если установлено повышение нефротокси-
кантов в регионе (содержание этих веществ
измеряют на предприятиях);
• если в этом регионе по обращаемости отме-
чается значительное (в 2—3 раза) превыше-
ние заболеваний ОМС по сравнению с об-
щей популяцией;
• если отмечается своеобразный «мозаицизм»
распределения пораженных детей, когда ча-
стота патологии среди детей, непосредствен-
но проживающих около предприятия, зна-
чительно выше, чем среди тех, кто прожи-
вает в этом же регионе, но в отдалении от
промышленных предприятий;
• если отмечается нарастание частоты патоло-
гии ОМС с возрастом детей;
• если у пораженных отмечается сходная кли-
нико-лабораторная характеристика заболева-
ния почек;
• если у детей, проживающих в данном реги-
оне с антенатального периода, выявляются
множественные стигмы дизэмбриогенеза, а
при УЗИ и рентгеноконтрастном исследова-
нии обнаруживаются анатомические анома-
лии ОМС;
• если у больных и детей без явных призна-
ков болезни из того же региона имеются
мембранопатологические изменения.
Мы провели эколого-эпидемиологические иссле-
дования в нескольких регионах Москвы, Подмос-
ковья, районах центральной европейской части Рос-
сии, где имелись разнообразные химические загряз-
нители [Игнатова М.С., 1996]. Контролем для на-
ших исследований служили результаты, полученные
в относительно чистом районе Московской облас-
ти, где нет промышленных предприятий. Общая
частота патологии ОМС составила 60:1000 детского
населения. В районе Москвы, загрязненном тяже-
лыми металлами в связи с активным функциони-
рованием электронной промышленности устаревше-
го образца, частота патологии ОМС у детей была в
3 раза выше по сравнению с общепопуляционной.
Специальные геохимические исследования, прове-
денные фирмой «Амис», выявили повышенное со-
держание ряда токсичных тяжелых металлов в пес-
ке, на растительности, на снегу, в подпочвенных
водах. На предприятиях отмечалось большое число
больных с МКБ и другими заболеваниями органов
мочевой системы. Совокупность указанных данных
и явилась основой для эколого-эпидемиологических
исследований.
Оказалось, что после трехэтапного обследования
22 000 детей, завершающим этапом которого было
исследование в специализированной нефрологичес-
кой клинике, частота патологии ОМС составила
187:1000 детского населения, что более чем в 3 раза
превышала таковую в «чистом» регионе. Отмечены
нарастание частоты патологии почек с возрастом де-
тей и значительное преобладание заболеваний ОМС
у детей, проживающих непосредственно вблизи про-
мышленных предприятий, по сравнению с данны-
ми, выявленными в районах, отдаленных от этих
предприятий. У обследованных детей ведущим кли-
ническим проявлением патологии была гематурия,
что отличало указанный регион от других, в част-
ности с асбестовыми загрязнениями, где ведущими
были заболевания, протекающие с лейкоцитурией.
У детей, проживающих с антенатального периода в
данном регионе, были выражены множественные
стигмы дизэмбриогенеза, а при УЗИ и рентгенокон-
трастном исследовании определялись соматические
стигмы, прежде всего со стороны ОМС и костной
системы. У всех больных были выражены мембрано-
патологические изменения.
В процессе клинического обследования, которое
осуществлялось в Институте педиатрии и детской хи-
рургии М3 РФ, оказалось, что имеет место полиор-
ганносгь поражения: у большинства детей были вы-
ражены признаки вегетососудистой дистонии или ма-
лой мозговой дисфункции, у трети детей отмечались
патологические изменения желчевыводящей системы
и желудочно-кишечного тракта У отдельных детей вы-
являлись пролапс митрального клапана или дополни-
тельные трабекулы в сердце. Аллергические проявле-
ния в регионе встречались чаще там, где имелась боль-
шая загрязненность солями тяжелых металлов. При ге-
неалогическом исследовании оказалось, что родители
больных детей в 3 раза чаще, чем родители здоровых,
страдают МКБ и/или пиелонефритом.
Примерно у пятой части детей выявлялись все
признаки, характеризующие синдром де Тони —
Дебре — Фанкони (протеинурия, аминоацидурия,
глюкозурия, фосфатурия). Поражение проксимального
отдела нефрона подтверждалось повышенной экскре-
цией бета-2-микроглобулина. У большинства детей
была выражена оксалатно-кальциевая и у некото-
рых — уратная кристаллурия. С мочой в повышенных
количествах экскретировался этаноламин, фосфаэта-
ноламин, продукты перекисного окисления липидов,
была выражена оксалурия. Кроме дисфункции про-
ксимального отдела нефрона, чаще у детей школь-
ного возраста выявлялись признаки нарушенного
аммонио- и ацидогенеза, нередко наблюдалось сни-
жение относительной плотности мочи в пробе Зим-
ницкого, у '/10 больных выявлялась тенденция к сни-
жению клиренса эндогенного креатинина (рис. 26.4).
Функция почек снижается с возрастом больных,
несмотря на стабильную гематурию (рис. 26.5).
При обследовании больных оказалось, что с мо-
чой выделяется в 4—5 раз больше кадмия, хрома,
мышьяка и сурьмы, чем у детей, проживающих на
других территориях города, не имеющих аналогич-
ных загрязнений. При этом мониторинг, который
проводили с интервалом 2—4 года, показал, что у
детей сохранялось повышенное выделение с мочой
ксенобиотиков. Аналогичные изменения наблюдались
и у родителей больных детей.
Нескольким детям была проведена почечная био-
псия, которая выявила тубулоинтерстициальные
изменения разной степени выраженности и призна-
ки гипопластической дисплазии почек.
503
100
a
Рис. 26.4. Частота функциональных нарушений по-
чек в зависимости от возраста у детей с нефропатия-
ми из региона, загрязненного тяжелыми металлами
(в процентах).
а — дисфункция проксимального канальца; б — дисфунк-
ция дистального канальца; в — снижение концентрацион-
ной функции; г — снижение клубочковой фильтрации.
Рис. 26.5. Возрастная динамика функциональных на-
рушений почек и гематурии у детей с нефропатиями
из региона, загрязненного тяжелыми металлами.
а — частота сочетанных канальцевых нарушений (%); б —
гематурия (млн/сут).
Лечение, профилактика. В настоящее
время лечение детей с экозависимыми заболе-
ваниями ОМС включает симптоматическую те-
рапию и использование препаратов, элимини-
рующих тяжелые металлы из организма. Симп-
томатическая терапия в основном воздейству-
ет на сопутствующие состояния: холепатию, ве-
гетососудистую дистонию, аллергию, патоло-
гию ЛОР-органов и др. Используются мембра-
нотропные вещества, иммуномодуляторы и ан-
тиоксиданты. Последние представлены витами-
нами А и Е, которые рекомендуются в возра-
стных дозировках. Витамин В6 рекомендуется
назначать курсами — 2 нед каждого месяца в
дозе не менее 40—60 мг в сутки.
Существующие представления об экопатоло-
гии как «тотальной аллергии» предусматрива-
ют своевременное использование иммуномоду-
ляторов — левамизола и реаферона.
К мембранотропным средствам относятся
отечественные лекарственные формы — ксиди-
фон и димефосфон. Ксидифон является есте-
ственным регулятором обмена кальция и неор-
ганических пирофосфатов. Применяют в виде
2 % раствора в дозе 10 мг/кг массы ребенка в
течение 2—4 нед. Димефосфон регулирует кис-
лотно-основное состояние крови, активирует
окислительные процессы в митохондриях, улуч-
шает микроциркуляцию. Применяют 15 % ра-
створ внутрь после еды по 30 мг/кг (1 мл 15 %
раствора на 5 кг массы тела) 3 раза в день.
Ксидифон и димефосфон повышают выведение
тяжелых металлов из организма.
В последнее время все большее внимание
привлекают энтеросорбенты в виде пищевых
добавок: кламин, альгинат натрия и альгинат
кальция (альгисорб). Их действие проявляется
в выведении токсикантов в основном через
Рис. 26.6. Динамика некоторых показателей на фоне
лечения альгисорбом у детей с нефропатиями из ре-
гиона, загрязненного тяжелыми металлами.
а — гематурия; б — оксалурия; в — липидурия; г — хром
.мочи; д — кадмий мочи.
Рис. 26.7. Динамика некоторых показателей на фоне
лечения димефосфоном у детей с нефропатиями из
региона, загрязненного тяжелыми металлами.
а — гематурия; б — оксалурия; в — липидурия; г — хром
мочи; д — кадмий мочи.
504
Схема 26.1
РАЗВИТИЕ НЕФРОПАТИЙ У ДЕТЕЙ ИЗ РЕГИОНА, ЗАГРЯЗНЕННОГО ТЯЖЕЛЫМИ МЕТАЛЛАМИ
Повышенная
индивидуальная
чувствительность к
тяжелым металлам
Наследственная
предрасположенность
к патологии почек
Сг, Cd
Развитие
нефропатии
Гипероксалурия Снижение канальцевой
Нестабильность
цитомембран
экскреции
желудочно-кишечный тракт, что щадяще вли-
яет на фильтрующие мембраны клубочков и
мембраны почечного эпителия. Являясь продук-
тами морских водорослей, они не несут допол-
Нарушение
концентрационной
функции почек
Снижение
клубочковой
фильтрации
нительного повреждающего химического веще-
ства. Применяют альгинат натрия в дозе 15—
20 мг/кг в сутки, кламин — 20—30 мг/кг в
сутки, альгисорб — 150 мг/кг в сутки в тече-
ние 3—4 нед.
При сравнении эффективности различных
групп препаратов [Игнатова М.С., Харина Е.А.
и др., 1996] оказалось, что значительное уве-
личение выведения тяжелых металлов из орга-
низма происходит практически при всех при-
мененных лекарственных средствах. Однако ис-
пользование димефосфона сопровождалось не-
которым ухудшением показателей, указываю-
щих на состояние цитомембран. Оптимальным
можно считать применение альгината натрия,
альгисорба и ксидифона. В результате лечения
улучшалось самочувствие больного, уменьша-
лась гематурия, отмечалась тенденция к норма-
лизации параметров, свидетельствующих о мем-
бранопатологическом процессе. Одновременно
с этими процессами наблюдалось отчетливое
повышение экскреции с мочой тяжелых метал-
лов (рис. 26.6—26.7; схема 26.1).
505
В связи с тем что заболевание нередко про-
текает субклинически, возникает необходимость
в определении предрасположенности к разви-
тию эконефропатии. Простейшим способом
определения такой предрасположенности явля-
ется анализ родословной, в частности выясне-
ние, не являются ли почки в данной семье ор-
ганом-мишенью.
Вторым по значимости и простоте оказыва-
ется проведение in vitro пробы на лейкоцито-
лиз [Юрьева Э.А. и др., 1996]. Повышение раз-
рушаемости лейкоцитов под влиянием свинца,
кадмия, хрома и др. свидетельствует о чувстви-
тельности обследуемого к данному веществу.
Дети с эконефропатиями имеют фенотип быс-
трых ацетиляторов. Помощь в установлении
предрасположенности к экопатологии почек в
условиях загрязнения тяжелыми металлами
может оказать определение экскреции их с
мочой как до, так и после нагрузки хелатором.
Наконец, важную информацию о повышенной
чувствительности может дать исследование ча-
стоты соматических мутаций, в частности ло-
куса гипоксантин-гуанин-фосфорибозилтранс-
феразы Т-лимфоцитов. Все вышеуказанные ме-
тоды в регионе, отягощенном ксенобиотиками,
позволяют выделить индивидуумов, у которых
высок риск развития эконефропатий. Для про-
филактики развития патологии можно реко-
мендовать те же средства, что и для ее ле-
чения. Важно проводить профориентацию под-
ростков.
26.8. Особенности течения
наследственных и врожденных
нефропатий у детей
Представление о том, что все наследственные
и врожденные заболевания должны проявить-
ся в раннем детском возрасте, не соответству-
ет действительности. Особенно это относится к
врожденной патологии органов мочевой систе-
мы, так как она нередко развивается скрыто,
прогрессирует без выраженных экстраренальных
проявлений и нередко обращает на себя вни-
мание лишь при развитии симптомов почечной
недостаточности. При этом у ребенка может
длительно отсутствовать мочевой синдром.
Своевременное определение врожденных
аномалий строения почек и органов мочевыве-
дения возможно еще в антенатальный период
при своевременно проводимых УЗИ, однако
отсутствие выявления аномалий строения ОМС
не исключает необходимости проведения не-
фрологического исследования ребенка, если
уже в периоде новорожденное™ обращают на
себя внимание стигмы дизэмбриогенеза. Осо-
506
бенно это необходимо, если в семье ребенка
имеются родственники с заболеваниями почек.
Среди врожденных пороков развития ОМС
уже в периоде новорожденное™ выявляют,
кроме агенезии, обструктивные уропатии с
наслоением микробно-воспалительного процес-
са в почках и признаками сепсиса. При нару-
шениях уродинамики в более позднем периоде
развития ребенка наслоение бактериального
или абактериального тубулоинтерстициального
процесса привлекает к себе внимание более,
чем основа — врожденный анатомический де-
фект, причем особенно ярко подобный фено-
мен проявляется в том случае, если анатоми-
ческий порок развития впервые обнаруживается
у взрослого человека.
На первом году жизни наиболее часто про-
являют себя различные тубулопатии (цистину-
рия, первичная оксалурия, болезнь де Тони —
Дебре — Фанкони). В конце первого, чаще на
2-м году жизни проявляется фосфат-диабет (ви-
тамин-О-резистентный рахит).
Нефропатия, связанная с гипопластической
дисплазией, выявляется как нефритоподобное
заболевание чаще в дошкольном или раннем
школьном возрасте изолированным мочевым
синдромом, снижением тубулярных функций.
Другие формы почечных дисплазий могут об-
наруживаться в различном возрасте. Кистозная
дисплазия нередко манифестирует нефротичес-
ким синдромом.
Наследственный нефрит проявляется гема-
турией еще на первом году жизни. Изменения
относительной плотности мочи могут встречать-
ся в раннем возрасте у ребенка с нефроноф-
тизом Фанкони.
Полигенно наследуемая патология (оксалат-
ная, уратная нефропатия) может проявить себя
в различном возрасте и даже у взрослых, но
признаки диатеза в виде кристаллурии и нару-
шения функционального состояния цитомем-
бран могут обнаруживаться в раннем детском
возрасте.
Своеобразными маркерами врожденной и
наследственной патологии являются случай-
ность выявления, торпидность течения, раннее
развитие почечной недостаточности.
Прогрессирование нефропатий, связанных с
генетическими и тератогенными факторами в
детском возрасте, может иметь несколько ва-
риантов: наслоение иммунного процесса —
чаще при гипопластической дисплазии, воз-
можно при кистозной дисплазии, при аутосом-
но-доминантной поликистозной болезни почек
(АДПБП); наслоение микробно-воспалительно-
го процесса — чаще при врожденных аномалиях
строения почек и органов мочевыведения, при
гипопластической дисплазии, при нейрогенной
дисфункции мочевого пузыря, редко — при
наследственном нефрите, нефронофтизе Фан-
кони, АДПБП.
Прогрессирующая дистрофия почечной па-
ренхимы наблюдается при нефронофтизе Фан-
кони, олигомеганефронии, гипопластической
дисплазии. Развитие ХПН в детском возрасте
свойственно прежде всего наследственным и
врожденным заболеваниям. Это было показано
в монографии «Хроническая почечная недоста-
точность у детей» в совместной работе отече-
ственных и немецких коллег [Игнатова М.С.,
Гроссман П.,1986]. В настоящее время данный
факт подчеркивается в отчетах европейской и
американской ассоциаций по диализу и транс-
плантации.
Литература
Белостоцкий В.М., Игнатова М.С., Вишневский Е.Л.
и др. Персистенция хламидий и уреаплазм у детей с
пиелонефритом и нейрогенной дисфункцией моче-
вого пузыря//Практич. нефрол. — 1997. — № 3. —
С. 5-11.
Вельтищев Ю.Е., Игнатова М.С. Наследственные и
врожденные болезни почек и мочевыводящих путей
//Наследственная патология человека/Под ред.
Ю.Е.Вельтищева, Н.П.Бочкова. — М., 1992. — Т. 2. —
С. 3-71.
Вишневский Е.Л. Диагностика и лечение нейрогенных
дисфункций мочевого пузыря у детей//С.И.Игнатов,
М.С.Игнатова. Лечение соматических заболеваний у
детей. — М.: Стар’Ко, 1996. — С. 165—176.
Державин В.М., Казанская И.В., Вишневский Е.Л. и
др. Диагностика урологических заболеваний у де-
тей. — М.: Медицина, 1984.
Игнатова М. С. Терапевтические подходы к экопато-
логии у детей//С.И.Игнатов, М.С.Игнатова. Лечение
соматических заболеваний у детей. — М.: Стар’Ко,
1996. - С. 38-44.
Игнатова М.С., Вельтищев Ю.Е. Детская нефроло-
гия. — Л.: Медицина, 1989. — С. 445.
Игнатова М.С., Харина Е.А., Длин В.В. и др. Нефро-
патии в регионе, загрязненном солями тяжелых
металлов, возможности лечебно-профилактических
мероприятий//Тер. арх. — 1996. — № 8. — С. 31—35.
Игнатова М.С., Харина Е.А., Соблирова Ж.Х. и др.
Артериальная гипер- и гипотензия при нефропати-
ях у детей//Практич. нефрол. — 1998. — № 1. — С. 33—
37.
Мартин Т.Д. Вопросы применения вводимого внут-
ривенно иммуноглобулина//Тер. арх. — 1996. — № 10.
Маковецкая Т.А., Романова ТА. Перинатальные не-
фропатии//Вопр. охр. мат. и дет. — 1988. — № 1. —
С. 58-61.
Москалева Е.С., Игнатова М.С., Корнеева В.А. и др.
Плазмаферез в. комплексной терапии прогрессиру-
ющих форм гломерулонефрита//Тер. арх. — 1994. —
№ 6. - С. 42-45.
Наточин Ю.В. Клиническая физиология почек у де-
тей//А.В.Папаян, Н.Д.Савенкова. Клиническая не-
фрология детского возраста. — СПб.: Сотис, 1997. —
С. 9-42.
Наточин Ю.В., Кузнецова А.А. Ночной энурез как
проявление аутокоидоза//Тер. арх. — 1997. — Т. 69,
№ 12. - С. 67-72.
Папаян А.В., Савенкова Н.Д. Клиническая нефроло-
гия детского возраста. — СПб.: Сотис, 1997. — С. 625—
636.
Савенкова Н.Д., Папаян А.В. Нефротический син-
дром у детей//Папаян А.В., Савенкова Н.Д. Кли-
ническая нефрология детского возраста: Руко-
водство для врачей. — СПб.: Сотис, 1997. — С. 347—
426.
Харина Е.Л., Приходина Л. С., Курбанова Э.Г. Азати-
оприн при лечении гломерулонефрита у детей//
Практич. нефрол. — 1998. — № 1. — С. 28—32.
Хроническая почечная недостаточность/Под ред.
М.С.Игнатовой, П.Гроссмана. — М.: Медицина,
1986.
Юрьева Э.А., Османов И.М., Яковлева И.И. и др. Кли-
нико-биохимические аспекты интерстициального
нефрита при гипероксалурии//Практич. нефрол. —
1998. - № 2. - С. 57-58.
Brodehl J. Conventional therapy for idiopathic nephrotic
syndrome//Clin. Nephrol. — 1991. — Vol. 35 (suppl. 1). —
P. 8-15.
Cobach T., Beduk Y., Iscan M. In vitro effects of
cadmium and nickel on glutation, lipid peroxidation and
glutathion S-transferase in human kidney//Toxicology in
Vitro. - 1996. - Vol. 10. - P. 241-245.
Dillon M. Clinical aspects of hypertension//Pediatric
nephrology. — 2 ed. — Ed. M.Holliday, M.Barratt,
R. Vernier. — Baltimore — Hong-Kong — London —
Sydney: Williams a. Wilkins, 1987. — P. 743—757.
Feld L., Springate J., Izzo J. Special consideration in
Hypertension//Kidney Electrolyte Disorders/Ed. J. Chain,
J.Gill. — New York — Edinburg — London: Churchill
Livingstone, 1990. — P. 565—599.
Iwata K, Saito H, Moriyama M. et al. Renal tubular
function after reduction of environment cadmium
exposure: A ten years follow-up//Arch. Environ. Health. —
1993. - Vol. 48/3. - P. 157-163.
Kabuki N., Okugawa T, Hayaakawa H. et al. Influence
of age at onset on the outcome of steroid-sensitive
nephrotic syndrome//Pediatr. Nephrol. — 1988. — Vol.
12. - P. 467-470.
507
Kido Г, Honda R.J., Tsuritani I. et al. Progress of renal
dysfunction in inhabitants environmentally exposed to
cadmium//Arch. Environ. Health. — 1988. — Vol. 43/3. —
P. 213-217.
Miller K., Goldberg S., Atkin B. Nocturnal enuresis:
Experience with long term use of intranasally
administered desmopressin//Pediatr. — 1989. — Vol.
114. - P. 723-726.
Niaudet P., Broyer M., Habib R. Treatment of idio-
pathic nephrotic syndrome with cyclosporin A in
children//Clin. Nephrol. — 1991. — Vol. 35 (suppl. 1). —
P. 31-36.
Ponticelli C., Passerini P. Treatment of the nephrotic
syndrome associated with primary glomerulonephritis//
Kidney Int. - 1994. - Vol. 46. - P. 595-604.
Rodriguez-Iturbe B. Acute endocapillary glomerulo-
nephritis//Oxford textbook of clinical nephrology. — 2nd
ed./A.Davison, S.Cameron, J.-P.Gr'iinfeld, D.Kerr et
al. — Oxford, New York, Tokyo: Oxford University press,
1988. - Vol. 1. - P. 613-624.
Waldo F., Benfield M., Kohaut E. Methylprednisolone
treatment of. patient with steroid-resistent nephrotic
syndrome//Pediatric Nephrol. — 1992. — Vol. 6. — P. 503—
505.
Watanabe H., Imada N., Kawauchi A. et al. Phisiological
background of enuresis type I. A preliminary report//
Scand J. Urol. Nephrol. — 1997. — Vol. 31 (suppl. 183). —
P. 7-10.
Webb N., Lewis V., Iqbal J. et. al. Childhood steroid-
sensitive nephrotic syndrome: Does the histology matter?
//Amer. J. Kidney Dis. — 1996. — Vol. 27. — P. 484—488.
Wikstrom S., Stapper J. Are repeated desmopressin
treatment attempts successful?//Scand. J. Urol. Nephrol. —
1997. - Suppl. 183. - P. 33-35.
Zidar N., Cavic M., Kenda R. et al. Unfavourable course
of minimal change nephrotic syndrome in children with
intrauterine growth retardation//Kidney Int. — 1998. —
Vol. 54. - P. 1320-1323.
Гпава 27
СТАРЧЕСКАЯ ПОЧКА
И.А. Борисов, Ю.Л. Перов
Популяционный сдвиг, происходящий во
второй половине нашего века и приводящий к
заметному постарению населения Земли, уже
сейчас оказывает значительное влияние на
структуру заболеваемости и смертности населе-
ния и требует, с учетом прогнозируемой ди-
намики этого процесса, серьезного усиления
внимания к патологии старости. Старческая
патология с характерной для нее мультимор-
бидностью, сложной многоплановой клиничес-
кой картиной, нередкой полиорганной несос-
тоятельностью предполагает отказ от ставшей
привычной дезинтеграции врачевания. Тем не
менее на данном этапе развития наших знаний
проникновение в глубины такой патологии не-
возможно без специального изучения особен-
ностей ее органных проявлений и их взаимо-
влияния. Почки, обладающие фундаментальной
ролью в поддержании гомеостаза организма,
наделенные также специфическими инкретор-
ными и метаболическими функциями, привле-
кают к себе в этом плане особое внимание.
Заболевания почек не могут не оказывать вли-
яния на становление и течение старческой па-
тологии, так же как и она не может не воз-
действовать, иногда решающим образом, на
структуру и функциональное состояние почек.
Сейчас хорошо известны нарастающие с
возрастом ограничения резерва функциональ-
ных возможностей почек, частота и тяжесть
почечных страданий.
Проведенные исследования показывают, что
популяционный уровень заболеваний почек у
людей старше 60 лет почти в 3 раза превосхо-
дит таковой у людей моложе 60 лет (соответ-
ственно 6,02 и 2,14 %), что популяционный
уровень ХПН различается у них более чем на
порядок (соответственно 0,77 и 0,05 %), что по
мере утяжеления мультиморбидной старческой
патологии увеличивается и частота заболеваний
почек, возрастающая к финальному отрезку
жизни, также более чем на порядок и превы-
шающая к этому времени 60 % [Борисов И.А.,
1990].
Данные мировой санитарной статистики,
касающиеся случаев «почечной смерти», также
свидетельствуют о том, что подавляющая ее
часть приходится на лиц 60 лет и старше. В ев-
ропейских странах, например, она составляет
в среднем 72 %, а во Франции и Италии дос-
тигает 80 и 81 % соответственно [Berthoux F. et
al., 1998].
27.1. Инволютивные изменения
стареющей почки
Патология стареющей почки формируется на
фоне ее структурных и функциональных инво-
лютивных изменений.
Интегральным показателем инволютивных
изменении стареющей почки является ее атро-
фия, выраженная в той или иной мере. Она
проявляется снижением массы и объема поч-
ки, выявляется уже макроскопически и более
ярко у мужчин. Поверхность почки при этом
становится зернистой вследствие западения ее
участков, соответствующих запустевшим и скле-
розированным нефронам. При разрезе отмеча-
ется уменьшение величины коркового слоя. При
средней массе почек у молодых людей 285 г
масса их у людей старше 80 лет снижается в
среднем до 210 г у женщин и до 180 г у муж-
чин. Эти и другие данные, касающиеся срав-
нительной характеристики основных структур-
ных элементов почек у молодых и пожилых лю-
дей, по данным разных авторов, представлены
в табл. 27.1.
Инволютивные изменения «нормально» ста-
реющей почки в самом общем виде могут быть
охарактеризованы как прогрессирующее накоп-
ление соединительнотканных компонентов.
Последнее происходит неравномерно в разных
структурных элементах и разных зонах почки и
509
Таблица 27.1. Инволютивные изменения струк-
туры почек
Показатель У моло- дых У пожи- пых
Масса почек, г 290 200
Количество нефронов, млн 2 1
Количество морфологически анор- мальных нефронов, % 5 30
Количество юкстамедуллярных нефронов, % 8 6
Объем канальцев юкстамедулляр- ных нефронов, % 15 9
Клубочковая поверхность нефрона, мм2 0,254 0,155
Объем мезангиального матрикса, % 6,2 10,4
Толщина БМ клубочков, нм 25—40 До 300
Длина проксимального канальца, мм 19,36 12,50
Объем проксимального канальца, мм3 0,076 0,052
Состояние дистальных канальцев — Дивер- тикул ез
не всегда выливается в морфологию хорошо
известного нефросклероза. Инволютивные из-
менения почек имеют широкий спектр инди-
видуальных колебаний, обусловленных генети-
ческой программой развития организма, поэто-
му с точки зрения инволютивных процессов
старики одного возраста оказываются далеко не
одинаковыми.
Сложившееся еще со времен классических
работ так называемого анатомического перио-
да изучения старческой почки представление о
том, что возрастные изменения в почках име-
ют прежде всего сосудистый генез, сейчас пред-
ставляется не столь очевидным. Целенаправлен-
ные исследования не смогли подтвердить убе-
дительной связи между изменениями сосудов
почек и гломерулосклерозом у стариков
[McLachlan M.S. et al., 1977], что ранее подчер-
кивал A.Furno (1909).
Как представляется в настоящее время, ин-
волютивная перестройка структурных элемен-
тов внутренних органов, в том числе и почек,
в процессе старения связана прежде всего с пе-
рестройкой базальных мембран капилляров
клубочков и канальцев (в чем пытаются видеть
один из универсальных феноменов старения),
клеток, межклеточного матрикса.
Инволютивные изменения нефронов, начи-
нающиеся, как считают, уже в конце внутри-
утробной жизни плода, особенно отчетливо
проявляются после 40 лет. В течение каждого
последующего десятилетия жизни из нормаль-
ного функционирования вследствие инволютив-
ных изменений выключается примерно по 10 %
нефронов. К 70 годам жизни доля склерозиро-
510
ванных нефронов начинает приближаться к
30 %, а к 90 годам — почти к 50 %.
Процесс склерозирования нефрона начина-
ется обычно с гиалиноза клубочков. Этому
предшествует накопление в клубочке коллаге-
на в виде как базально-мембраноподобного
вещества, так и структурированных коллагено-
вых фибрилл, прежде всего на «территории»
мезангиума и в базальной мембране клубочко-
вых капилляров. Увеличивается объем мезанги-
ального матрикса, происходят редупликация и
фокальное, а затем и диффузное утолщение
базальной мембраны капилляров. Существенно
ухудшается дренажная функция мезангиума по
отношению к периферической базальной мем-
бране капиллярных петель клубочка, снижает-
ся эффективность фильтрации. Полагают, что
накопление соединительнотканных компонен-
тов в мезангиуме связано с функциональными
нарушениями мезангиальной клетки, которая
с возрастом все более начинает работать как
фибробласт и постепенно снижает и утрачива-
ет другие, специализированные функции.
Дистрофическим изменениям подвергаются
и наиболее высокодифференцированные и спе-
циализированные клетки клубочка — подоци-
ты. В некоторых случаях дистрофия этих клеток
достигает крайних степеней, вплоть до частич-
ной гибели подоцитов и нарушения самого
важного элемента клубочкового фильтра (ще-
левой мембраны), определяющего селектив-
ность фильтрации белка.
Прогрессирование инволютивных изменений
приводит к уменьшению числа клубочковых
долек, а затем и числа самих клубочков, к
уменьшению суммарной площади капиллярных
петель и соответственно фильтрационной по-
верхности клубочков. Клубочковая поверхность
нефронов в старческой почке по сравнению с
таковой в почках молодых людей уменьшается
почти на 40 % [Darmadi Е.М. et al., 1973].
Количество гиалинизированных клубочков в
старческой почке больше у мужчин, чем у
женщин, при этом не просматривается четкой
связи между нарастанием сосудистых измене-
ний в почке и количеством гиалинизированных
клубочков.
Изучение патогенеза старческого гломеру-
лосклероза, в том числе и в эксперименте на
долгоживущих крысах линии Sprague-Dawley
[Couser W.Y., Stilmant M.M., 1973; Bolton W.K.
et al., 1976; Bolton W.K., Sturgill B.C., 1980],
пока не позволяет делать каких-то определен-
ных выводов, тем более что фокальный гломе-
рулосклероз старых крыс существенно отлича-
ется от гломерулосклероза старых людей. Однако
можно предполагать, что основную роль в раз-
витии этих изменений играет перегрузка мезан-
гиума, особенно когда начинают проявляться
ис. 27.1. Инволюция клубоч-
ов почек (схема) [по Така-
ikuraE., 1972].
— кортикальные; II — юкста-
едуллярные.
оследствия уменьшенной массы почек и ги-
ертонии (по аналогии с неиммунологически-
и механизмами гломерулосклероза в остаточ-
ых нефронах при некоторых заболеваниях по-
ж) [Baldwin D.S., 1982].
С возрастом даже при отсутствии АГ и про-
влений атеросклероза прогрессируют склеро-
гческие изменения внутрипочечных сосудов
азного калибра, преимущественно артериаль-
ых, что не может не влиять на инволюцию
ефрона в целом. В крупных сосудах склероти-
зские изменения, развиваясь преимуществен-
о эксцентрически, как правило, не оказыва-
ет выраженного влияния на просвет сосуда,
более мелких артериях (дистальные отделы
еждольковых артерий, приносящие артерио-
ы клубочков) склероз и гиалиноз сосудистой
генки могут суживать просвет их весьма зна-
ительно, приводя к снижению как клубочко-
эго, так и перитубулярного кровотока.
В разных зонах почки последствия снижения
тубочкового кровоснабжения выглядят неоди-
аково. В клубочках корковой зоны быстрее
аерозируются капиллярные петли и запусте-
ет выносящая артериола с редукцией крово-
габжения соответствующего канальца. В юкста-
едуллярных клубочках, находящихся в усло-
4ях кровоснабжения с более высоким уровнем
сериального давления («распределительная»
ша почки), чаще возникают шунты между
«носящей и приносящей артериолами (рис.
7.1). При этом остается относительно сохран-
им кровоснабжение соответствующих каналь-
ев, медуллярный кровоток также нарушается
мало. Несмотря на это, эффективность проти-
воточно-множительного осмоконцентрирующе-
го механизма почек нарушается, так как имен-
но те нефроны, которые ответственны за ос-
мотическое концентрирование мочи, начина-
ют получать недостаточное количество фильт-
рата. Важное значение при этом имеет также и
уменьшение с возрастом общего числа юкста-
медуллярных нефронов.
В канальцевой части нефрона инволютивные
изменения характеризуются утолщением базаль-
ной мембраны и нарастанием дистрофических
изменений в клетках канальцев. Базальная мем-
брана канальцев из тонкого легкопроницаемого
образования превращается в многослойную с
многочисленными включениями структуру, тре-
бующую больших энергозатрат для своего пре-
одоления. Изменения в клетках при изучении в
световом микроскопе имеют вид умеренно вы-
раженной зернистой дистрофии. Электронно-
микроскопическое исследование выявляет
уменьшение в них специализированных струк-
тур плазматической мембраны (базально-лате-
ральных инвагинаций, апикального пиноцитоз-
ного аппарата и др.), снижение специфической
активности микросомальных и митохондриаль-
ных ферментов, накопление в цитоплазме клет-
ки балластных органелл (лизосом, миелиновых
фигур и др.). По мере прогрессирования инво-
лютивные изменения приводят к уменьшению
длины и объема проксимальных канальцев, раз-
витию дивертикулеза в дистальных канальцах.
В дивертикулах дистальных канальцев часто скап-
ливается бактериальная флора.
511
Интерстиции стареющей почки, как и ме-
заигиум, постепенно накапливает коллаген и
гликозаминогликаны, что, как полагают, свя-
зано с нарушением синтетической функции
интерстициальной клетки, которая подобно ме-
зангиальной филогенетически переходит на
более древнюю функцию. Накопление этих суб-
станций постепенно приводит к пространствен-
ному и биохимическому разобщению канальца
и перитубулярного капилляра, возникновению
так называемого перитубулярного блока.
Перестройке в пожилом и старческом воз-
расте подвергается и юкстагломерулярный ап-
парат почки (ЮГА). Гиалиноз приносящих ар-
териол отчетливо нарушает рецепторную фун-
кцию его и ренинпродуцирующую способность.
Избыточное отложение из-за тесной связи с
мезангиумом на «территории» ЮГА вещества
базальной мембраны и межклеточного матрикса
приводит также к разобщению отдельных фун-
кциональных элементов его (ренинпродуциру-
ющих клеток, эпителиоидных клеток, клеток
Гуртмагтига и др.), атрофии их, перестройке
ультраструктуры юкстагломерулярных клеток на
рениндепонирующий тип обмена.
Инволютивные изменения структуры стар-
ческой почки влекут за собой снижение функ-
циональных возможностей органа, так как при
этом нарушаются практически все процессы,
обеспечивающие адекватное функционирование
почки, — почечная гемодинамика, клубочко-
вая фильтрация (КФ), канальцевый транспорт
веществ, инкреторная функция. Сравнительные
характеристики основных процессов, обеспечи-
вающих функции почек, у молодых и старых
людей, усреднено, по данным разных авторов,
представлены в табл. 27.2.
Первые сдвиги показателей функционально-
го состояния почек начинают выявляться весь-
ма рано, по некоторым данным, уже в 20-лет-
нем возрасте. Они нарастают с каждым после-
дующим 5-летием, после 35 лет по большин-
ству показателей становятся достоверными. К 60
годам и более отмечается выраженная депрес-
сия показателей, отражающих функционирова-
ние почек.
В старости при практически сохраненных
церебральной и легочной фракциях в минутном
объеме кровообращения почечная фракция су-
щественно снижается с 25 % у 20-летних до
10 % у 90-летних людей. По мере увеличения
возраста констатируется и прогрессирующее
снижение почечного кровотока (ПК), превос-
ходящее соответствующее возрастное снижение
сердечного выброса. При этом наблюдается от-
четливое различие между снижением корти-
кального и юкстамедуллярного кровотока. Если
первый снижается примерно на 40 %, то вто-
рой только на 15 %, а это приводит к относи-
512
Таблица 27.2. Инволютивные изменения функ-
ции почек
Показатель У моло- дых У пожи- лых
Почечный кровоток, мл/(г-мин):
• общий 3,0 1,65
• кортикальный 4,0 2,40
• юкстамедуллярный 0,7 0,59
Эффективный почечный плазмо- ток, мп/мин 650 250
Резистентность почечных сосудов, 6200— 14 500—
ДИН/(С'1"СМ'5) 7000 19 000
Кпубочковая фипьтрация, мп/мин 120 75—60
Фипьтрационная фракция, % 20 32
Максимальная экскреция параами- ногиппуровой кислоты, мг/мин 80 56
Максимальная экскреция глюко- зы, мг/мин 330 110
Максимальная осмоляльность 1100— 900—
мочи, мосм/кг Н2О Клиренсы, мл/мин: 1400 750
• свободной воды 16,0 6,0
• калия 7,5 4,1
• кальция 2,4 1,6
• натрия 0,8 0,6
тельному усилению кровоснабжения в медул-
лярном слое старческой почки по сравнению
с корковым и сопровождается «вымыванием»
из медуллярного слоя его основного осмотичес-
кого градиента — мочевины.
Параллельно снижению ПК снижаются эф-
фективный почечный плазмоток (ЭПП) и КФ.
Последняя после 40 лет редуцируется в сред-
нем на 0,75 мл/мин ежегодно [Lindeman R.D.
et aL, 1985]. У людей в возрасте 80 лет и стар-
ше КФ, рассчитанная по очищению от эндо-
генного креатинина, составляет в среднем
60 мл/мин против 120 мл/мин у молодых лю-
дей. В связи с этим закономерно было бы ожи-
дать у этих людей повышения содержания сы-
вороточного креатинина до верхних границ его
нормы или более. Однако этого не происходит,
так как с возрастом снижается и мышечная
масса, являющаяся основным источником об-
разования креатинина в организме. Этот фак-
тор требует учета при оценке величин КФ у
людей преклонного возраста, в противном слу-
чае возможны ошибки, даже влияющие на те-
рапевтические подходы. Для более точного рас-
чета КФ в гериатрической практике может ока-
заться полезной формула, разработанная
D.W.Cockroft и M.N.Gault (1976):
(140 — возраст (в годах) X масса тела (кг)
72 х креатинин крови (мг%)
для женщин — минус 15 %.
Снижение клиренса мочевины у людей 80
;т и старше до 20 мл/мин против 60 мл/мин
молодых людей в связи с лабильностью пула
, зависимого в том числе от питания и от вы-
женности катаболических процессов, неред-
) сопровождается повышением содержания
эчевины в крови, иногда значительным (при
аорадках, опухолевых процессах), при низ-
)й суточной экскреции этого вещества.
Снижение клиренсов электролитов у пожн-
ях людей не сказывается существенно на со-
;ржании их в крови (лишь между количеством
ыия и возрастом прослеживается более чет-
1я обратно пропорциональная связь) [Сох
.R., Shalaby W.A., 1981]. Это обычно связыва-
т как с подвижностью регуляторных механиз-
ов электролитного гомеостаза, так и с неко-
>рым перераспределением в старости пула
[ектролитов между жидкостями и тканями
эганизма, в частности с повышением содер-
ания в тканях натрия и кальция (с чем, в ча-
гности, связывали формирование старческих
этропатий и артериолосклероза) и понижени-
и количества калия и магния.
Снижение клиренса свободной воды, с од-
ой стороны, нередко сказывается на реакции
гарческого организма на водную нагрузку,
плоть до появления признаков «водной» ин-
эксикации [de Broe М.Е., de Ridder F., 1983].
другой стороны, в старческом возрасте сни-
мется способность к сохранению жидкости в
рганизме вследствие редукции концентраци-
нной способности почек, что обусловлено
арушением противоточно-множительного ме-
анизма, «вымыванием» мочевины из мозгового
лоя почки. Однако четкая зависимость сниже-
ия концентрационной способности почек от
озраста больных просматривается лишь при
остаточно долгой депривации, более 12 ч.
Нарушение механизмов канальцевого транс-
юрта веществ в старческой почке проявляется
нижением максимальной реабсорбции глюко-
ы и максимальной секреции парааминогиппу-
>ата в среднем на 30 % к 80 годам, снижени-
ем общей экскреции кислот. Это следует иметь
1 виду при изучении состояния углеводного
)бмена, оценке адекватности экскреции ряда
юкарственных веществ, особенно некоторых
штибиотиков. Следует иметь в виду и нередкие
гарушения кислотно-основного равновесия у
пожилых людей со склонностью к развитию
щидоза.
В процессе старения изменяется секреция
почкой ренина и соответственно плазменная
активность его. Нарушается секреторный ответ
на обычные стимулирующие секрецию ренина
факторы, такие как ортостаз или диуретики
или, наоборот, нагрузка натрием.
Вместе с тем существенного нарушения про-
дукции ренинсубстрата не наблюдается, а сек-
реция Low-ренина даже повышается [Parsons V.,
1977]. Отмечается снижение секреции альдосте-
рона и АДГ [Seybold D., Yessler U., 1981].
Определяющей характеристикой реактивно-
сти старческой почки на нагрузку является тор-
пидный тип ее реакции. Конечный, хотя в це-
лом и удовлетворительный, результат достига-
ется старческой почкой в среднем в 2 раза
позже, чем почкой молодого человека. В регу-
ляции функции почки отмечается снижение не-
рвного звена и повышение роли гуморального
звена с увеличением чувствительности к адре-
налину, альдактону, АДГ.
Старческая почка постепенно теряет способ-
ность как к адекватной задержке натрия при ма-
лосолевой диете, так и к быстрой элиминации
его при избыточных нагрузках. Последнее об-
стоятельство может вести к увеличению в орга-
низме объема жидкости и артериальной гипер-
тонии. В становлении старческой гипертонии
наряду с объемными механизмами, по-видимо-
му, имеют значение симпатическая гиперактив-
ность, повышение содержания норадреналина
в плазме.
Обобщая все сказанное, можно сформули-
ровать следующие характеристики старческой
почки:
• артериолосклероз, гиалиноз клубочков, ди-
строфия канальцев, склероз интерстиция;
• повышение почечного сосудистого сопротив-
ления;
• снижение ОПК преимущественно за счет
кортикального слоя при относительно со-
хранном медуллярном;
• снижение КФ;
• снижение канальцевого транспорта веществ;
• снижение осмотической концентрации и
разведения мочи;
• нарушение гормональной регуляции процес-
са мочеобразования.
Вместе с тем в отличие от сравнительных
(cross-sectional) возрастных исследований, до-
статочно четко подтверждающих зависимое от
возраста снижение функциональных показате-
лей деятельности почек, динамические, про-
долженные во времени (longitudinal) наблюде-
ния свидетельствуют, что этот факт является
все же непостоянным и неодинаковым для всех
изучаемых субъектов, как это отмечалось выше
и в отношении морфологических изменений
почек.
Так, исследования, проведенные в Балтимо-
ре [Lindeman R.D. et al., 1984, 1985], показа-
ли, что примерно у '/3 стариков снижения
функций почек с увеличением возраста не на-
блюдалось, а у незначительной части из них
констатировалось даже повышение КФ. Иссле-
33—2950
513
дования, проведенные в Бронксе [Feinfeld D.A.
et al., 1995], показали стабильность уровня кре-
атинина сыворотки крови за более чем 3-лет-
ний период у большинства из 500 изученных
субъектов преклонного возраста, хотя ориента-
ция у стариков на уровень креатинина требует
известной осторожности, о чем говорилось ра-
нее. В связи с этим закономерен вопрос о том,
насколько изменения параметров деятельности
почек являются функцией возраста, а насколь-
ко — функцией других факторов, обозначаемых
по аналогии с сердечными как «факторы по-
чечного риска», особенно учитывая свойствен-
ную старости мультиморбидность и эксквизит-
ность понятия «здоровый старик». Данные мно-
жественного регрессивного анализа демографи-
ческих, клинических и биохимических пере-
менных (Italian Longitudinal Study of Aging —
В.Baggio et al., 1998) свидетельствуют, что на-
ряду с возрастом только курение и патологи-
ческий уровень ЛПВП плазмы крови можно
считать статистически значимыми и независи-
мыми переменными, влияющими на уровень
КФ. В то же время у пожилых с артериальной
гипертонией и сердечной недостаточностью по
сравнению с людьми аналогичного возраста, но
без указанных факторов также четко констати-
руются различия в величинах КФ, ПП и сосу-
дистого почечного сопротивления [Fisher D. et
al., 1997].
Таким образом, у подавляющего большин-
ства людей пожилого и старческого возраста
инволютивные изменения почек оказываются
тесно сопряженными и с образом жизни, и с
патологическими влияниями, прежде всего со-
судистыми и метаболическими.
Поскольку старческая почка работает в ус-
ловиях уменьшения активно функционирующей
массы тела и снижения напряженности мета-
болических процессов, ее функциональные
возможности для сохранения гомеостаза в
обычных условиях жизни оказываются достаточ-
ными, однако экстремальные воздействия,
даже относительные, легко вызывают развитие
почечной недостаточности, что подтверждает
клинический опыт.
27.2. Заболевания почек у лиц
пожилого и старческого возраста
Частота заболевания почек в популяции людей
60 лет и старше составляет около 6 %, а среди
секционных случаев она возрастает почти на
порядок — до 63,4 % (наши данные) — 64,4 %
[Giarelli L. et al., 1976]. Особенностью патоло-
гии старческой почки является резко нараста-
ющий в ее структуре удельный вес ангионеф-
росклероза и пиелонефрита, занимающих бо-
514
лее 4/5 структурного поля, а также частота со-
четанных поражений почек, наблюдающихся
более чем в '/3 случаев. Попытки структуриро-
вания поражения почек у пожилых, пусть даже
по основной патологии, являются в значитель-
ной мере условными, так как реальное число
почечных диагнозов оказывается выше 100 %
(в наших наблюдениях — около 150 %). К осо-
бенностям патологии старческой почки следу-
ет отнести и значительную частоту ОПН, дос-
тигающую у стационарных больных 6—9 %.
Говоря о структуре старческой почки, нельзя
не отметить существенного возрастания за пос-
ледние годы выявления как клинически, так и
по данным прозекторских исследований сосу-
дистых поражений почек, диабетического гло-
мерулосклероза и подагрических изменений
почек, миеломной нефропатии. В определенной
мере влияют на структуру патологии старчес-
кой почки успехи терапии ряда общих заболе-
ваний, существенное продление жизни людей
после повторных сердечно-сосудистых и мозго-
вых катастроф, пролонгация течения сахарно-
го диабета и т.д., так же как и применение
новых морфологических методик, когда, напри-
мер, более систематическое использование тио-
флавина позволяет заметно увеличить выявле-
ние макроскопически неочевидных форм ами-
лоидоза.
Одновременно с собственно нефрологичес-
кой патологией в старческом возрасте имеют-
ся и другие заболевания, создающие своеобраз-
ный фон для развертывания почечной патоло-
гии. Патология и функциональная недостаточ-
ность у пожилых распространяется на различ-
ные органы и системы, складываясь в понятие
«полипатии» или «качественно нового целост-
ного образования, не сводимого к своим со-
ставляющим ни в патогенетическом, ни в сим-
птоматологическом аспектах». Наиболее часто в
старости наблюдаются хронические заболевания
сердечно-сосудистой системы, обусловленные
атеросклерозом или гипертонической болезнью,
хронические неспецифические заболевания лег-
ких, онкологические процессы, хронические
дегенеративные поражения суставов и позво-
ночника, диабет, литиаз, инфекционные забо-
левания легких и почек. Именно для этой ка-
тегории больных важно понимание диагноза не
как стабильного ярлыка, а как категории, из-
менчивой из-за появления новых признаков бо-
лезни, сложной и продолжительной вследствие
присоединяющихся заболеваний. Такие больные
нуждаются в особом тактическом подходе, ра-
циональном отступлении от принятых схем
лечения, в особой осторожности при назначе-
нии лекарств.
Сосудистые поражения почек. Первое место по
частоте выявляемых изменений почек у преста-
>елых людей занимают сосудистые поражения.
Строго говоря, термин «ангионефросклероз»
[вляется сборным понятием, объединяющим
:ак собственно атеросклеротические поражения
«судов почек на различных уровнях, так и
ипертонический артериолосклероз. Констати-
>уемый преимущественно морфологами ангио-
[ефросклероз в клинических диагнозах на-
одит явно не соответствующее своей частоте
(вето — лишь несколько более 10 % случаев.
1астота ангионефросклероза нарастает с каж-
,ым десятилетием жизни престарелых людей
с 7 % у людей 60—69 лет до 65 % у людей 90
ет и старше), особенно у женщин.
Клинически ангионефросклероз проявляется
[епостоянной протеинурией, как правило, не
(ревышающей 1 г в сутки, редко сопровожда-
ющейся изменениями осадка мочи и постепен-
ю проявляющейся ХПН. Последняя характери-
уется относительно мягким течением, лишь в
диничных случаях достигает терминальной ста-
ии и требует лечения гемодиализами. Быстрое
:арастание почечной недостаточности у больных
нгионефросклерозом почти всегда обусловли-
ается присоединением пиелонефрита.
Пиелонефрит. Второе место по частоте в
труктуре патологии стареющей почки, но, не-
омненно, первое по клинической и прогнос-
ической значимости принадлежит пиелонеф-
иту. Это заболевание является основной про-
лемой гериатрической нефрологии. Его частота
общей популяции лиц старших возрастов
остигает, по данным разных авторов, 15—
5 %, на его долю приходится почти 80 % слу-
аев так называемой почечной смерти среди
иц этих возрастов.
Более четкое представление о частоте пиело-
ефрита у пожилых и старых людей дает анализ
той патологии по десятилетиям жизни (табл.
7.3), свидетельствующий о ее прогрессивном
арастании как у мужчин, так и у женщин.
Подобная динамика частоты пиелонефрита у
тих людей обусловливается накоплением с воз-
астом «факторов риска» развития заболевания,
асающихся практически всех известных сторон
го патогенеза, нередко приближающих ситуа-
,ию к экспериментально воспроизводимой.
Действительно, по мере старения чаще раз-
виваются различные виды патологии:
• нарушение уродинамики, в том числе с воз-
никновением рефлюксов на различных уров-
нях, вследствие развития нейрогенного мо-
чевого пузыря (сахарный диабет, остеохон-
дроз поясничного отдела позвоночника),
аденомы предстательной железы у мужчин,
мочекаменной болезни, опухолей мочевых
путей;
• нарушения почечной гемодинамики вслед-
ствие сочетания инволютивных изменений
почечных сосудов с их атеросклеротическим
поражением и поражением при гипертони-
ческой болезни;
• воспалительные заболевания других органов,
увеличивающие риск инфицирования почек
(простатит, аднексит, холецистит, пневмо-
ния и др.), возникающие чаще в результате
обусловленной ими бактериемии;
• нарушения адекватности иммунного ответа
за счет нередких старческих иммунодефици-
тов, чаще имеющих функциональный харак-
тер;
• заболевания, сопровождающиеся выражен-
ными метаболическими нарушениями, вли-
яющими на почки прямо или опосредован-
но (сахарный диабет, подагра, миеломатоз
и инволютивный остеопороз с гиперкальци-
емией и гиперкальциурией и др.).
Пожилые люди чаще подвергаются инстру-
ментальным методам обследования почек и мо-
чевой системы, катетеризации мочевых путей,
что влечет за собой повышенный риск инфи-
цирования их, оперативным пособиям.
Для пожилых людей характерна также по-
липрагмазия с применением нефротоксичес-
ких препаратов, использованием рентгенокон-
трастных средств, осмотически активных ве-
ществ и т.д.
Анализ историй болезни пожилых людей,
страдающих пиелонефритом, свидетельствует о
том, что сочетание у них различных факторов
риска развития этой болезни является не ис-
ключением, а правилом (табл. 27.4), особенно
а блица 27.3. Частота пиелонефрита улиц пре-
понного возраста по десятилетиям жизни (в про-
ентах)
Пол Возраст, годы
60—69 70—79 80 и старше
1ужчины 12,6 25,6 36,4
<енщины 19,4 22,4 29,6
Таблица 27.4. Частота сочетания пиелонефрита
и других болезней у лиц пожилого и старческого
возраста(в процентах)
Болезнь Мужчины Женщины
Аденома простаты 40,0 —
Мочекаменная болезнь 36,6 22,0
Злокачественные опухоли 33,3 28,0
мочеполовой сферы
Сахарный диабет 31,6 38,0
Нефроангиосклероз 10,0 14,0
з
515
у мужчин. Наличие двух таких факторов выяв-
ляется более чем у 50 % мужчин, а трех —
почти у 15 %.
С учетом сказанного понятны тяжесть мор-
фологических проявлений старческого пиело-
нефрита, неуклонное снижение с возрастом
частоты односторонних его форм, которые к
концу 8-го десятилетия жизни, особенно у
мужчин, практически перестают встречаться, и
нарастание наиболее опасных гнойных форм,
частота которых, по нашим данным, основан-
ным на патологоанатомическом материале, у
мужчин приближается к 25 %, а у женщин —
к 15 %.
Наиболее частыми возбудителями пиелонеф-
рита в старческом возрасте являются кишечная
и синегнойная палочки, энтерококки и протей
(в наших исследованиях соответственно пример-
но у 60, 17, 13 и 7 % больных), другие возбу-
дители встречаются значительно реже. Пример-
но у каждого 5-го больного выявляются мик-
робные ассоциации с наиболее частым сочета-
нием кишечной палочки и энтерококков. В те-
чение болезни нередко наблюдается смена воз-
будителя, последним, как правило, оказывается
протей или синегнойная палочка.
Бактериурия является характерным симпто-
мом старческого пиелонефрита, а нередко и до-
статочно четко отражает тяжесть процесса. Бу-
дучи, как правило, истинной, т.е. достигающей
105 микробных тел в 1 мл мочи, при более
тяжелых вариантах течения болезни она дости-
гает 505,106 и даже более.
Клиническая картина пиелонефри-
та у пожилых и старых людей разнообразна и
во многом зависит от «болезненного окруже-
ния», особенно от общедистрофических про-
цессов, кахексии.
На фоне кахексии клиническая картина даже
гнойного пиелонефрита бывает слабо выраже-
на, выявляются только изменения в анализах
мочи, трудные для трактовки, особенно у жен-
щин. Возможны проявления гнойного пиело-
нефрита в виде изолированного интоксикаци-
онного синдрома или выраженной анемии, за-
ставляющих клинициста искать онкологическую
патологию. И хотя в большинстве этих случаев
диагноз пиелонефрита все-таки ставится, он
оказывается формальным, не отражающим тя-
жести поражения почек.
При меньшей выраженности кахексии, сни-
жения иммунных реакций организма на инфек-
цию атаки пиелонефрита протекают в более
«классическом» варианте с адекватной темпе-
ратурной реакцией, ознобами, болевым синд-
ромом, нарушениями функций пораженного
органа.
Атаки пиелонефрита, обусловленного грам-
отрицательной флорой, являются одной из
516
наиболее частых причин бактериемического
шока и септицемии с последующим развити-
ем острой почечной недостаточности. Прежде
всего такие больные попадают в инфекционные
стационары, которые являются одним из наи-
более частых «перевалочных пунктов» для лиц
преклонного возраста. В дальнейшем после об-
следования больных переводят в специализиро-
ванные стационары.
Более редким проявлением обострения пи-
елонефрита, но характерным преимуществен-
но для лиц старших возрастных категорий бы-
вают острые нарушения кислотно-основного
состояния, становящиеся ведущими в клини-
ческой картине заболевания. Как правило, раз-
вивается ацидоз, приводящий к внезапным
ухудшениям состояния больных. Остро возни-
кающая в этих случаях одышка заставляет вклю-
чать в круг дифференциального диагноза мно-
гие ургентные ситуации, вплоть до исключения
тромбоэмболии легочной артерии.
Течение старческого пиелонефрита непред-
сказуемо. Иногда поражают длительность кажу-
щегося благополучия в условиях «агрессивно-
го» окружения с выраженными нарушениями
уродинамики или фатальность течения под вли-
янием, казалось бы, второстепенных факторов,
например нарушений общей гемодинамики.
О трудностях диагностики пиелонефри-
та свидетельствует частое расхождение клини-
ческого и патологоанатомического диагнозов.
Клиницисты не диагностируют его примерно в
13 % случаев и допускают гипердиагностику в
10 % случаев. Не диагностируется пиелонефрит
чаще у мужчин 7-го десятилетия жизни, осо-
бенно отягощенных онкологической патологи-
ей, гипердиагностируется чаще у женщин 8-го
и особенно 9-го десятилетия жизни. В последнем
случае этому, видимо, способствует трудность
адекватной оценки анализов мочи.
Лечение пиелонефрита у лиц пожилого и
старческого возраста сопряжено с большими
трудностями, что обусловлено невозможностью
во многих случаях эффективно воздействовать на
факторы, провоцирующие его возникновение и
поддерживающие его активность. Пестрота кли-
нических проявлений старческого пиелонефри-
та, и этиологическая неоднородность болезни
также диктуют необходимость неформального
подхода к лечению этого страдания. В основе
последнего лежат коррекция уродинамики и
адекватная антибактериальная терапия. Подходы
к лечению больных острым и хроническим пи-
елонефритом имеют свои особенности.
Острый пиелонефрит без признаков обструк-
ции мочевых путей подлежит антибактериаль-
ной терапии, чаще парентеральной. При выра-
женной клинической картине выбор делается
между аминогликозидами и цефалоспоринами
II или III поколений. При очень тяжелом со-
стоянии пациента возможно назначение препа-
ратов этих групп одновременно, при этом це-
фалоспорин, как правило, вводят внутривен-
но, а аминогликозид — внутримышечно. Неко-
торые специалисты начинают отдавать предпоч-
тение не гентамицину, а тобрамицину и нетил-
мицину, отмечая меньшую их нефротоксич-
ность. Амикацин применяют в случае устойчи-
вости флоры к другим аминогликозидам. Вне
зависимости от функционального состояния
почек первую дозу препаратов (дозу насыще-
ния) вводят полностью, в дальнейшем дозу
корректируют с учетом функции почек. Воз-
можно использование при этом формулы
Cockroft — Gault, приведенной выше. Концен-
трация аминогликозидов в крови должна кон-
тролироваться каждые 2—3 дня. Цефазолин
(кефзол) продолжает считаться одним из наи-
более эффективных препаратов при лечении
уросепсиса. Каждый больной острым пиелонеф-
ритом с признаками обструкции мочевых пу-
тей должен рассматриваться как кандидат на
оперативное лечение, отказ от которого должен
быть мотивирован. В этом случае лечение начи-
нают с восстановления оттока мочи с помощью
катетера или нефростомы, после чего перехо-
дят на антибактериальную терапию.
Лечение хронического пиелонефрита подраз-
деляется на лечение обострений (активной фазы
болезни) и противорецидивное лечение. На
каждом из этих этапов лечение должно бази-
роваться на четком впечатлении о возбудителе
болезни и его чувствительности к антибактери-
альным средствам, на представлении о состо-
янии уродинамики и особенностях пассажа
мочи, на оценке функционального состояния
почек. Подробнее об этом см. главу «Пиелонеф-
рит».
Гломерулонефриты (ГН). Среди мультимор-
бидной старческой патологии ГН занимают от-
носительно ограниченное пространство, хотя
этиологическое родство их может быть просле-
жено со многими группами «классических»
старческих страданий, как и со многими тера-
певтическими средствами, применяемыми при
лечении последних.
Наши популяционные исследования опреде-
ляют частоту ГН у людей моложе и старше 60
лет в 0,3 и 0,4 % соответственно, т.е. в цифрах
вполне сопоставимых и значимых для решения
дифференциально-диагностических задач.
Анализ данных ряда зарубежных нефрологи-
ческих учреждений также приводит к выводу об
отсутствии существенных различий в частоте
ГН в этих популяциях населения. Так, в когор-
те лиц, подвергшихся биопсии почек с целью
уточнения причин быстро прогрессирующей
почечной недостаточности, нефротического
синдрома или мочевого синдрома в трех нефро-
логических центрах США и Франции, доля
людей 60 лет и старше составила около 15 %,
т.е. примерно столько же, сколько составляет
доля людей этих возрастов в общей популяции
населения указанных стран. В регистре медицин-
ского исследовательского центра по ГН Вели-
кобритании (UK MRC GN Register, 1998),
включившим 7161 биопсию почек, на долю
людей 60 и старше лет пришлось 1814 биопсий,
или 25,3 %, что также сопоставимо с популя-
цией пожилых. При этом частота обнаружения
при биопсии именно ГН, как и морфологичес-
кие характеристики последнего, оказывались,
за небольшими исключениями, почти одина-
ково разнообразными и у молодых, и у старых
людей.
Частота различных морфологических вариантов
ГН у старых людей (сводные усредненные
данные)
Вариант ГН Больные, %
Мембранозный ГН 34,7
Пролиферативный ГН 16,9
Фокально-сегментарный ГН 12,1
Быстропрогрессирующий ГН 11,5
Минимальные изменения клубочков 10,3
Мембранопролиферативный ГН 6,8
Хронический (неклассифицируемый) ГН 3,3
IgA-нефропатия 2,8
Острый (постстрептококковый) ГН 1,6
Сравнительный анализ частот некоторых
вариантов ГН у молодых и старых людей сви-
детельствует о значимых различиях в частоте
БПГН и мембранозного ГН в пользу старых
людей в 4 и 3 раза соответственно (A.V.Moorthy,
S.W.Zimmermann) и практически одинаковой
частоте выявления у тех и других минимальных
изменений почек, что является достаточно нео-
жиданным фактом.
ГН с острым началом в пожилом возрасте
почти одинаково часто возникают как в изо-
лированном варианте, так и в рамках систем-
ных васкулитов. Об этом свидетельствуют как
сводные данные AJ.Arief и соавт. (1970) —
45,7 % случаев ГН, протекавших в рамках си-
стемных васкулитов, так и наши данные [Бо-
рисов И.А. и др., 1986], полученные с интер-
валом в 25 лет — 48,1 % случаев системных ГН.
Круг системных васкулитов при этом очерчи-
вался узелковым периартериитом, геморраги-
ческим васкулитом Шенлейна — Геноха, не-
кротизирующим васкулитом, синдромами Ве-
генера и Гудпасчера, СКВ, гемолитико-уреми-
ческим синдромом, тромботической тромбоци-
топенической пурпурой, а в последние годы и
ANCA-ассоциированными васкулитами, дебю-
517
тирующими острой или быстропрогрессирую-
щей почечной недостаточностью на фоне пре-
имущественно экстракапиллярных ГН, сочета-
ющихся с легочными кровотечениями или аль-
веолярными инфильтратами [De Lucia E.D. et al.,
1998].
В наших наблюдениях имел место случай
острого нефритического синдрома у 72-летней
больной с болезнью Хортона с хорошим отве-
том на кортикостероидную терапию большими
дозами.
Появляются данные о нарастании частоты
васкулитов и БПГН у людей в возрасте 70 лет
и старше. Так, по данным R.H.Higgins и соавт.
(1996), число подобных больных увеличилось с
10 % в серии, относящейся к 1980-м годам, до
30 % в серии, относящейся к 1990-м годам.
Отмечают также и учащение мембранозной
нефропатии. За два последовательных 13-летних
отрезка времени отмечено увеличение частоты
этого заболевания с 3,7 случаев за год до 10,8
и увеличение процента лиц старше 60 лет с
этой патологией с 14,6 до 33 % [Donadio
S.,1990].
Наши наблюдения свидетельствуют о том,
что при так называемых системных ГН по срав-
нению с изолированными ГН с острым нача-
лом у стариков оказывается менее выраженной
острота гиперволемии и соответственно тяжесть
артериальной гипертонии и сердечной недоста-
точности. Вместе с тем функциональное состо-
яние почек при этой форме ГН страдает более
тяжело из-за частоты именно злокачественной
(экстракапиллярной) морфологии процесса,
что отмечали также и J.Montolin и соавт., под-
черкивавшие статистически значимый более
высокий уровень креатинина у этих больных. В
наших наблюдениях почти у половины больных
«системный» ГН дебютировал явлениями ОПН.
Типичный острый (постстрептококковый) ГН,
достаточно редкий в общей структуре ГН у ста-
риков, приобретает диагностическую и клини-
ческую значимость в группе ГН с острым на-
чалом в старческом возрасте, где его частота
приближается к 15 %.
Развитие острого ГН на фоне мультиморбид-
ной старческой патологии ставит перед клини-
цистами сложные задачи по выяснению при-
чин появления или утяжеления синдрома ар-
териальной гипертонии, причин появления или
нарастания признаков сердечной недостаточно-
сти у больного с длительным «сердечным анам-
незом», трактовке отечного синдрома, почеч-
ной недостаточности, особенно если последняя
обнаружена на фоне локальной или системной
инфекции, и т.д. Поэтому до сих пор нередки
случаи запоздавшей постановки этого диагно-
за, первичное направление больного в любое
отделение, кроме нефрологического, чаще в
5Г8
кардиологическое и инфекционное. Особенно
трудны для трактовки начальные системные
проявления — субфебрилитет, артралгии или
артриты, увеличение СОЭ, диспротеинемия и
т.д., направляющие диагностический поиск
прежде всего в сторону опухолевой патологии,
дамокловым мечом продолжающей висеть над
клиницистами.
Хронический ГН у стариков, как правило,
исходно латентный процесс, позволяющий
больным дожить до старости; часто он ослож-
няется второй болезнью (пиелонефрит или
амилоидоз почек), во многом и определяющей
затем клиническую картину почечного страда-
ния.
Лечение ГН у людей старших возрастов
принципиально по своим подходам не отлича-
ется от такового у людей молодых. При БПГН
подчеркивается лучший эффект у пожилых от
цитостатиков, особенно циклофосфамида. При
мембранозной нефропатии, если она не вто-
рична и нет возможности воздействовать на ее
непосредственную причину, также лучшие ре-
зультаты наблюдают при комбинированной те-
рапии циклофосфамидом в сочетании с неболь-
шими дозами преднизолона. При остром нефри-
те кортикостероиды допустимы при дебюте
болезни почечной недостаточностью.
При БПГН выживаемость в течение 1-го и
2-го годов заболевания составляет 62,5 и 50 %
соответственно [Higgins R.H. et al., 1996], если
же больные переживают 1-й и 2-й годы болез-
ни, то 90 и 100 % из них в дальнейшем не
нуждаются в гемодиализах. На прогноз этой
болезни оказывают влияние «патологическое
окружение», качество ответа на иммунодепрес-
санты и склонность болезни к спонтанным
ремиссиям. Естественное течение идиопатичес-
кой мембранозной нефропатии, по-видимому,
не хуже, чем у молодых [Donadio S., 1990].
Исход острого постстрептококкового ГН у по-
жилых благоприятен и, как подчеркивает
Ch.K.Abrass (1985), сопоставим с таковым у
людей молодых.
Интерстициальный нефрит (ИН) . По данным
биопсий почек, ИН ненамного, но достовер-
но чаще обнаруживается у людей 60 лет и стар-
ше — в 8,8 и 5 % случаев соответственно
[Davison А.М., Jones С.Н., 1998].
Острый ИН у пожилых людей редко бывает
идиопатическим, как правило, его природа
оказывается лекарственной, метаболической,
реже — инфекционной. Нередко эти причины
оказываются взаимозависимыми. Среди лекарств
наиболее часто вызывают острый ИН антиби-
отики, особенно пенициллиновой группы (ме-
тициллин может быть причиной ИН у 17 %
больных, получавших его), и ингибиторы АПФ.
Последняя группа препаратов приобретает все
большее значение как в связи с нарастающей
частотой их назначения, так и в связи с осо-
бенностями их влияния на почечную гемоди-
намику. Острая гиперурикемия, гиперкальцие-
мия, гипокалиемия являются наиболее часты-
ми метаболическими причинами этого заболе-
вания. Среди инфекционных причин обращают
на себя внимание кишечные инфекции, в ча-
стности сальмонеллез, иерсиниоз, кампилобак-
териоз, реже отмечаются цитомегаловирусная
инфекция, риккетсиозы, микоплазмоз.
Острый ИН у пожилых в половине случаев
проявляется ОПН, в 15 % случаев при этом
может наблюдаться «классическая» аллергичес-
кая триада — лихорадка, кожная сыпь, как
правило, макуллезно-папулезная, и артралгии.
Подобная клиническая картина в первую оче-
редь характерна для больных, леченных анти-
биотиками пенициллинового ряда, особенно
метициллином, когда она почти в 100 % случа-
ев обогащается еще и эозинофилией [Gaplin J.E.
et al., 1978; Pusey C.D. et al., 1983]. Лечение
рифампицином наряду с ОПН может сопро-
вождаться фланковыми болями, гемолизом и
тромбоцитопенией [Ten R.M. et al., 1988]. В бо-
лее легких случаях наблюдается изолированный
мочевой синдром с преобладанием эритроци-
турии или протеинурии (не превышающей
обычно 2 г/сут). Возможен гиперхлоремический
ацидоз.
Симптомы лекарственного острого ИН воз-
никают в 3/4 случаев через 10 дней от начала
лечения. Отмена препарата и назначение пред-
низолона в дозе 40—60 мг в сутки обычно ока-
зываются эффективными.
Среди причин хронического ИН у пожилых
людей большую роль играют длительное приме-
нение анальгетиков, нпвс, лечение противо-
опухолевыми (цисплатина, нитрозомочевина),
мочегонными средствами (этакриновая кислота,
тиазиды, фуросемид), антиконвульсантами, ан-
тагонистами Н2-рецепторов, аллопуринолом. У
многих из этих" препаратов, особенно у аллопу-
ринола, отмечается отчетливый дозозависимый
эффект. Рентгене- и радиотерапия опухолей,
обструктивно-рефлюксное состояние мочевого
тракта, подагра, саркоидоз, миелома и лимфо-
ма, синдром Шегрена, первичный биллиарный
цирроз печени также могут сопровождаться раз-
витием хронического ИН.
Симптомы заболевания появляются обычно
спустя время от начала действия фактора, иног-
да месяцы, характеризуются различной выра-
женности мочевым синдромом, примерно у
15 % больных возможно формирование нефро-
тического синдрома, у 73 больных формирует-
ся ХПН. Артериальная гипертония наблюдает-
ся относительно редко, примерно в 10 % слу-
чаев [Davison А.М., Jones С.Н., 1998].
Лечение хронического ИН у пожилых
представляет определенные трудности, связан-
ные прежде всего с возможностями воздействия
на инициирующий заболевание фактор.
Почечная недостаточность является одним из
наиболее важных синдромов, характеризующих
особенности поражения почек у лиц пожилого
и старческого возраста. Нарушения функций
почек в виде ОПН или ХПН мы наблюдали у
20,6 % больных, т.е. практически у каждого 5-го
пациента. Конечно, частое развитие почечной
недостаточности характерно именно для фи-
нального периода старческой патологии, тем
не менее этот факт подчеркивает интегрирую-
щее влияние почек в клинике внутренних бо-
лезней и высокую прогностическую значимость
их патологии у лиц преклонного возраста.
Острая почечная недостаточность (ОПН)
занимает особое место в структуре патологии
почек у лиц пожилого и старческого возраста,
как и в гериатрической клинике в целом.
Хорошо известны различия между частотой
ОПН в популяциях молодых и старых людей,
достигающие порядковых величин, — в попу-
ляции людей в возрасте 15—39 лет 20 случаев
на миллион в год, в популяции же людей 65 и
старше лет — 228 случаев [Feest T.G. et al.,
1993].
Среди умерших больных в многопрофильных
больницах частота ОПН составляет в среднем
7—9 %, что ставит ее в ряд весьма актуальных
клинических проблем. У мужчин развитие это-
го синдрома наблюдается несколько чаще, чем
у женщин; около 70 % его приходится на лю-
дей старше 70 лет.
Причины ОПН у престарелых людей весь-
ма разнообразны (табл. 27.5), однако, как и у
молодых людей, среди них могут быть выделе-
ны ведущие к преренальной ОПН (процессы,
ведущие прежде всего к снижению перфузии
почек), к ренальной (прежде всего БПГН,
идиопатический или возникший в рамках сис-
темных заболеваний и острый ИН), к постре-
нальной (обструктивные процессы в канальцах
почек и мочевых путях).
В большинстве случаев (более чем в 80 %)
ОПН у престарелых людей обусловливается
преренальными механизмами, связанными с
уменьшением внутрисосудистого объема и сер-
дечного выброса, с недостаточностью тканевой
перфузии и низким центральным давлением.
Патология старости, часто сопровождающаяся
редукцией сердечного выброса (застойная сер-
дечная недостаточность), дегидратацией орга-
низма на фоне диетических ограничений (осо-
бенно соли), частотой нефротоксических воз-
действий (рентгеноконтрастные вещества при
поиске опухолевых процессов, аминогликозид-
ные антибиотики при инфекционных процес-
519
Таблица 27.5. Причины ОПН у лиц пожилого и
старческого возраста
Заболевания Абс. число %
Терапевтические: 90 61,2
• сердечно-сосудистые 38 25,8
— острый инфаркт миокарда 30 20,3
— острый инсульт мозга 7 4,8
— аритмогенный шок 1 0,7
• инфекционно-воспалительные: 43 29,3
— острая атакв пиелонефрита 15 10,2
— острая пневмония 15 10,2
— грипп, рожистое воспаление 9 6,2
и др.
— сепсис 4 2,7
• другие: 9 6,2
— нефрит с острым началом 4 2,7
— острая миеломная почка 2 1,4
— амилоидоз надпочечников 1 0,7
— тромбоз почечных вен 1 0,7
— гиповолемия 1 0,7
Хирургические: 57 38,8
• послеоперационная ОПН: 41 27,9
— операции на сосудах (аорта, 17 11,6
крупные периферические ар-
терии)
— операции по поводу злока- 10 6,8
чественных опухолей
— другие операции 14 9,5
• заболевания желчно-панкреати- 9 6,2
ческой зоны (холангит, пан-
креонекроз)
• травмы с рабдомиолизом 4 2,7
• кровотечения 3 2,0
Всего... 147 100,0
сах), широким использованием при ней НПВС
и иАПФ и протекающая на фоне инволютив-
но ограниченного почечного резерва, как буд-
то бы специально разворачивает перед клини-
цистами палитру факторов риска ОПН.
Хорошо известно развитие ОПН при лече-
нии артериальной гипертонии или сердечной
недостаточности ингибиторами АПФ у больных
со стенозом почечных артерий — заболевания
преимущественно старческого, однако и в слу-
чае его отсутствия сочетание иАПФ с низко-
солевой диетой и диуретиками также может
привести к развитию ОПН [Bridoux F. et al.,
1992], с чем все чаще приходится сталки-
ваться в последнее время [Mandall A.K. et al.,
1994].
С нарастанием возраста пациентов увеличи-
вается риск развития у них лекарственной ОПН.
По данным A.Baraldi и соавт. (1998), средний
возраст больных с этой формой ОПН был ста-
тистически значимо выше, чем возраст боль-
ных с ОПН, обусловленной другими причина-
ми (72,6 года против 63,2), факторами риска
ее развития наряду с возрастом являлись сосу-
дистые заболевания и парапротеинемии, при
этом удельный вес лекарственной ОПН среди
всех ее форм составил в наблюдениях этих ав-
торов 35 % (!).
И все же, как показывает более углублен-
ный анализ случаев ОПН у людей старших
возрастов, выделение однозначных механизмов
развития этого синдрома — преренальных, ре-
нальных, постренальных, так же как и анало-
гичный подход к выделению его причин у этих
людей, страдает, как правило, односторонно-
стью, обедняет картину реально возникающих
ситуаций. Лишь менее чем в 10 % случаев на-
ших наблюдений мы смогли с достаточной
долей вероятности констатировать однофактор-
ный генез ОПН (вследствие кардиогенного
шока при инфаркте миокарда, при остром на-
рушении мозгового кровообращения, при ге-
моррагическом инсульте, при остром гнойном
пиелонефрите и в некоторых других ситуаци-
ях). В остальных случаях несомненным представ-
лялся многофакторный генез этого синдрома,
причем в 65 % наших наблюдений таких фак-
торов было от 3 до 5. При этом одним из наи-
более характерных сочетаний факторов, веду-
щих к развитию ОПН у пожилых, становились
нарушения в наиболее важных и взаимозави-
симых видах гомеостаза — водно-электролитном
и циркуляторном, развивавшиеся, как прави-
ло, в рамках полиорганной недостаточности.
Эти обстоятельства наряду с последствиями
структурных и функциональных инволютных
изменений стареющей почки нарушают цик-
личность течения ОПН, характерную для мо-
лодых больных, усугубляют тяжесть течения ее,
обусловливают высокую смертность, причем в
танатогенезе этих больных оценка значения
ОПН также далеко не всегда бывает однознач-
ной.
Ограничение функциональных резервов
старческой почки, принудительность полиурии
со сравнительно низкой максимальной осмо-
ляльностью мочи, как интегральным показате-
лем иного уровня ее функционирования, ста-
новятся причиной более частого, чем у людей
молодого возраста, развития так называемых
неолигурических форм ОПН у стариков, выяв-
ляющихся, по некоторым данным, у 30 % боль-
ных [Radaelli L. et al., 1980], что вносит допол-
нительные трудности в своевременную диагно-
стику этого вида патологии.
Особенно легко у пожилых людей наруша-
ется водно-электролитный гомеостаз как вслед-
ствие редукции почечного механизма его кон-
троля, так и более значительного, чем у моло-
дых, влияния на него экстраренальных факто-
ров. Хорошо известно влияние ряда заболева-
ний пожилого и старческого возраста — застой-
520
ной сердечной недостаточности, цирроза пече-
ни, лимфостаза, деструктивного панкреатита,
некоторых опухолей, сопровождающихся экто-
пической секрецией АДГ (карциномы легких,
поджелудочной железы, мочеточника и др.) на
баланс в организме наиболее осмотически ак-
тивного электролита — натрия. Известно так-
же влияние на секрецию АДГ или экскрецию
свободной воды лекарственных препаратов, на-
значаемых преимущественно пожилым лю-
дям, — парацетамола, индоцида, тегретола,
амитриптилина, барбитуратов. Часто пожилым
людям рекомендуются диетические ограничения
натрия.
Акцентуация внимания на необходимости
тщательного контроля за водно-электролитным
гомеостазом у людей преклонного возраста важ-
на прежде всего потому, что, как показывает
опыт, его нарушения встречаются в клиничес-
кой практике весьма часто, влекут за собой
нарушения циркуляторного гомеостаза, неред-
ко с трудно контролируемой гипотонией, дру-
гие клинические проявления, которые неред-
ко ставят клиницистов перед большими диф-
ференциально-диагностическими трудностями.
Симптомы электролитных нарушений,
прежде всего дисбаланса натрия, относятся пре-
имущественно к разряду неврологических, что
обусловлено или отеком мозга за счет набуха-
ния его клеток при гипонатриемии, или, на-
оборот, дегидратацией клеток мозга при гипер-
натриемии. Это зачастую ведет к неправильной
оценке состояния пожилых людей с исходно
имеющейся неврологической симптоматикой и
соответственно к неадекватной терапевтической
тактике, усугубляющей имеющиеся нарушения.
Сонливость, спутанность сознания, головная
боль, мышечные спазмы, судороги, развитие
гемипарезов и комы характеризуют углубляю-
щуюся гипонатриемию, а апатия, раздражи-
тельность, прогрессирующая мышечная ригид-
ность, тремор, гиперрефлексия, атаксия, судо-
роги, угнетение сознания и кома — гипернат-
риемию. Однако эту симптоматику необходимо
дифференцировать в первую очередь от нару-
шений сосудистого генеза.
У пожилых и старых людей активная дегид-
ратационная терапия, чаще связанная с лече-
нием острых нарушений мозгового кровообра-
щения или острой сердечной недостаточности,
особенно легко вызывает гиперосмолярные
синдромы с олигурией и нарастающей азоте-
мией, при этом олигурия нередко трактуется
как показание к продолжению настойчивой
диуретической терапии, что может вести к рез-
кому снижению объема внеклеточной жидко-
сти, сужению периферических сосудов и вто-
ричной циркуляторной недостаточности с при-
знаками уже многоорганной недостаточности,
в том числе печеночной [Борисов И.А. и др.,
1987]. При этом осмолярность крови достигает
иногда крайних величин — 467 моем на 1 кг
воды (!), в наших наблюдениях при натрие-
мии — до 179 ммоль/л, а ориентировочный де-
фицит воды в организме превышает 10 л, что,
конечно, почти несовместимо с жизнью.
В генезе нарушений циркуляторного гомео-
стаза, ведущего к развитию ОПН у людей пре-
клонного возраста, важное место принадлежит
и ДВС-синдрому, предрасположенность к раз-
витию которого часто обусловлена особеннос-
тями старческой патологии. В наших наблюде-
ниях этот синдром нарушения циркуляторного
гомеостаза выявлялся при генерализованных
инфекциях, как правило, с грамотрицательной
флорой, злокачественных опухолях паренхима-
тозных органов, всех видах шока, травматичес-
ких хирургических вмешательствах, терминаль-
ных состояниях. В этих случаях ОПН являлась,
как правило, лишь одним из проявлений мно-
гоорганной недостаточности.
Очень важен в этих случаях вопрос о крите-
риях оценки дегидратации организма, особен-
но лабораторных, так как оценивать клиничес-
кие признаки этого состояния у стариков все-
гда трудно. Как свидетельствует наш опыт, толь-
ко динамический контроль за натриемией, ос-
молярностью крови, суточной и фракционной
экскрецией натрия с мочой, хотя последний
показатель у стариков не всегда надежен, мо-
жет дать достаточно уверенное представление о
ситуации. Меньшее значение, особенно у ис-
тощенных больных, имеют показатели экскре-
ции с мочой креатинина и мочевины в сопос-
тавлении с показателями в сыворотке крови. Все
показатели должны контролироваться с первого
дня наблюдения за больными. При этом умень-
шение суточной экскреции натрия должно рас-
сматриваться не как проявление почечной не-
достаточности, а как показатель функциональ-
ной сохранности канальцевой клетки. Такую же
оценку следует давать и временной олигурии.
Для ориентировочной оценки дефицита воды
в организме полезны предлагаемые формулы:
PNa действительное
Дефицит воды = ——-------------х ОВО - ОВО.
PNa желаемое
где ОВО соответствует 60 % массы тела данно-
го пациента в килограммах. Или:
0,4
Дефицит воды (л) = (1 - ~_) х 20 % массы тела,
Ht
где Ht — гематокрит.
Лечение ОПН у престарелых больных —
крайне трудная задача. Являясь чаще всего лишь
составным элементом сложной многоорганной
патологии, в том числе нередко и с многоор-
521
ганной недостаточностью, в плане терапии она
требует практически всегда индивидуального
подхода, особенно при коррекции объемов
жидкостей в организме.
При лечении этих больных гемодиализом
также возникают трудности, обусловленные
прежде всего нестабильностью гемодинамики,
тенденцией к гипотонии или сердечной недо-
статочности.
Прогноз ОПН у людей старших возрас-
тов в целом представляется более тяжелым, чем
у молодых людей. Хотя полного согласия в том,
что возраст является независимым фактором,
определяющим смертность больных при этой
патологии, пока нет, многофакторный анализ
указывает на существенное его влияние на ле-
тальность [Лемер Н., 1998].
Летальность при ОПН среди пожилых лю-
дей колеблется, по данным разных авторов, от
27 % [Huh W.S. et al., 1995] до 68 % [Blackstock
D.G., Friedman E.A., 1995]. У молодых людей —
от 12 % [Huh W.S. et al., 1995] до 57 % [Drumpl
W. et al., 1994]. При этом подчеркивается особо
высокая летальность у пожилых при развитии
острого тубулярного некроза с олигурией — до
76 % [Santacrus F. et al., 1996].
Имеются, однако, данные и об отсутствии
статистически значимых различий в смертнос-
ти от ОПН пожилых и молодых людей. Так, по
данным W.Drumpl и соавт., смертность людей
65 лет и старше составила 61 % (причем у лю-
дей 80 лет она была не выше, чем у 65—68-
летних), 64—19 лет — 59 %, моложе 18 лет —
57 %, что статистической достоверностью не
различалось. Не отметили различия в смертно-
сти у старых и молодых больных ОПН и
J.Pascual и соавт. (1995). В их наблюдениях эти
цифры соответственно составляли 45 и 41 %.
Анализируя эти данные, следует иметь в
виду отчетливые различия в частоте смертей
больных, страдающих преренальной формой
ОПН (в среднем 35 %) и страдающих острым
тубулярным некрозом (как правило, выше
60 %).
Факторами, прямо влияющими на леталь-
ность пожилых больных с ОПН, являются:
• наличие полиорганной недостаточности;
• необходимость искусственной вентиляции
легких;
• олигурия;
• степень белкового катаболизма;
• гипотензия;
• повышение лактата сыворотки [Andreucci V.E.
et al., 1998].
Наиболее частыми причинами смерти этих
больных становятся сепсис с септическим шо-
ком и многоорганная недостаточность, а так-
же кровотечения.
522
Представление о том, что исход ОПН может
быть улучшен с помощью более раннего или
более интенсивного гемодиализа, обеспечиваю-
щего уровень азота мочевины в пределах 80—
100 мг/дл (29—36 ммоль/л), сейчас подвергает-
ся сомнению. Проведенный мета-анализ не по-
зволил подтвердить существенную значимость
профилактического или интенсивного диализа.
Более того, в этих случаях не исключаются воз-
можность усугубления повреждения почек и от-
срочка восстановления их функций [Лемер Н.,
1998].
Хроническая почечная недостаточность (ХПН).
Несмотря на успехи клинической медицины в
целом и нефрологии в частности, частота ХПН
растет. Это связывается с постоянным увеличе-
нием численности людей преклонного возрас-
та в общей популяции населения, причем это
увеличение происходит темпами, опережающи-
ми рост общей популяции. Характерные циф-
ры в этой связи приводит P.W.Eggers (1990).
Если в 1974 г. американская программа меди-
цинской помощи людям, страдающим ХПН,
охватывала 15 168 человек и из них только 24 %
лиц были старше 65 лет, то в 1987 г. она охва-
тывала уже 33 646 человек, среди которых доля
лиц 65 лет и старше возросла до 38,1 %. Если
за эти годы общая популяция больных с ХПН
увеличилась на 122 %, то популяция людей 65—
74 лет с ХПН — на 192 %, а популяция людей
75 лет и старше — на 461 % (!).
В Италии число пациентов, нуждающихся в
терапии гемодиализами, с 1981 по 1996 г. воз-
росло с 254 до 623 человек на миллион населе-
ния, при этом в 1996 г. среди них было 43,7 %
людей в возрасте 65 лет и более [Berardinelli L.,
Vegeto А., 1998]. В США число пожилых людей,
получающих лечение гемодиализом, также пре-
высило 42 %.
Важнейшей характеристикой ХПН у людей
старших возрастов является ее многофактор-
ность как в морфологическом аспекте с неред-
ким обнаружением сочетанных почечных про-
цессов (например, сочетание пиелонефрита с
ангионефросклерозом или диабетической не-
фропатией, гломерулонефрита с пиелонефри-
том или амилоидозом почек и т.д.), так и в
аспекте функциональном с отчетливым влия-
нием на течение ХПН нарушений уродинами-
ки, состояния центральной или почечной ге-
модинамики, медикаментозных воздействий и
ряда других факторов. В структуре ХПН в на-
ших наблюдениях основные места принадлежа-
ли пиелонефриту (более 60 %), ангионефроск-
лерозу (более 20 %) и диабетической нефро-
патии (около 10 %), хотя с учетом сочетанно-
сти почечной патологии сумма составляющих
ее нозологических форм превышала 100 %.
Так, анализ патологии почек у пожилых и
старых больных подагрой с клиническими при-
знаками ХПН (содержание креатинина более
300 мкмоль) наряду с собственно подагричес-
кой нефропатией выявил кисты почек у 6 че-
ловек, пиелонефрит — у 2, диабет — у 2, ар-
териальную гипертонию, возникшую задолго до
клинических проявлений подагры, — у 4. Та-
ким образом, трактовка основных причин ХПН
у таких больных очень трудна.
Главной причиной этого синдрома является
хронический пиелонефрит, второе место при-
надлежит ангионефросклерозу. Остальная пато-
логия имеет меньшее значение, хотя эти циф-
ры не в полной мере соответствуют реальнос-
ти.
Структура патологии почек, являющейся
непосредственным или одним из главных фак-
торов танатогенеза, несколько отличается от
общей структуры ХПН, хотя в основе ее чаще
лежит пиелонефрит (у 76,1 % больных). При-
чиной почечной смерти были также миелом-
ная нефропатия (7,5 %), амилоидоз почек
(5,9 %), хронический нефрит (4,6 %), ангио-
нефросклероз (4,6 %) и диабетическая нефро-
патия (1,5 % больных). Если учитывать сочетан-
ную патологию, то процент нозологических
форм, ее составляющих, превысит 150.
Течение ХПН у пожилых и старых больных
не отличается сколько-нибудь значительно от
такового у молодых людей и в значительной
мере непредсказуемо. При этом совсем не ред-
кими оказываются случаи успешной терапии
этих больных даже в ситуациях, первоначаль-
но представляющихся практически безнадежны-
ми, что свидетельствует в ряде случаев о пора-
зительной жизнестойкости их и необходимос-
ти пересмотра некоторых устоявшихся врачеб-
ных стереотипов.
Синдромологический анализ ХПН у этих
людей труден, что обусловлено разнообразием
старческой патологии. Так, закономерные про-
явления системного атеросклероза с церебро-
васкулярной недостаточностью, поражение сер-
дца, периферических сосудов затрудняют оцен-
ку нейропсихических, неврологических, сер-
дечно-сосудистых синдромов. Гиперкатаболизм
с кахексией при опухолевых заболеваниях зат-
рудняет оценку недостаточности экскреции
некоторых веществ. Перечень подобных трудно-
стей можно продолжать и далее.
Наиболее четко в связи с ХПН у этих боль-
ных прослеживаются кахектический, анемичес-
кий и диспепсический синдромы, наблюдаю-
щиеся примерно в половине случаев. Изучение
особенностей фосфорно-кальциевого обмена в
связи с общей проблемой старческого остеопо-
роза не выявило существенных его отличий по
сравнению с ХПН у молодых людей. Выражен-
ный дисбаланс кальция и фосфора, повыше-
ние содержания паратгормона и кальцитонина
мы констатировали только при снижении уров-
ня КФ до 20 мл/мин и менее. Колебания пока-
зателей костной фракции щелочной фосфата-
зы были неоднозначными. Клинические прояв-
ления ренальной остеодистрофии учащаются на
фоне длительного лечения гемодиализами.
Консервативная терапия ХПН у преста-
релых больных базируется на общепринятых
принципах. Очень важен отказ от курения. Се-
рьезным компонентом комплексного лечения
ХПН является диета. С ее помощью можно
уменьшить выраженность интоксикации, сни-
зить проявления вторичного гиперпаратиреоза,
отдалить момент перехода к лечению гемодиа-
лизами. Диетотерапия должна начинаться на
ранней стадии ХПН. Энергетическая ценность
пищи, оцениваемая в 30—35 ккал/кг в сутки,
после 60 лет может уменьшаться на 10 % в
каждом последующем десятилетии. Целесооб-
разна ранняя добавка незаменимых аминокис-
лот в виде кетостерила. Для коррекции вторич-
ного гиперпаратиреоза применяют соли каль-
ция, предпочтительнее карбонат кальция (кон-
троль кальциемии !), малые дозы 1,25(ОН)2
витамина D или малые дозы рокальтрола
(0,25 мкг в сутки). Для коррекции анемии по-
казаны препараты эритропоэтина лучше с од-
новременным внутривенным введением препа-
ратов железа. Для коррекции АГ — ингибито-
ры АПФ и блокаторы рецепторов ангиотензи-
на (крайне осторожно — при повышении уров-
ня креатинина сыворотки более 300 мкмоль/л).
Для коррекции дислипидемии возможно при-
менение статинов.
Возраст пациентов в настоящее время не
является противопоказанием к активной тера-
пии с использованием программного гемодиа-
лиза и трансплантации почки.
Средний возраст начала заместительной те-
рапии гемодиализами возрос с 35 лет в 1968 г.
до 61 года в 1993 г. (Чарра Б. и др., 1998], а в
Италии и Франции он составляет 64 года
[Berthoux F. et al., 1998]. В настоящее время не
являются абсолютными противопоказаниями к
этому виду лечения перенесенные сосудистые
катастрофы (инфаркт миокарда, инсульт, по-
ражение крупных периферических сосудов),
сердечная недостаточность, а сахарный диабет
становится одной из важнейших причин, приво-
дящих пациентов в центры гемодиализа. Пяти-
летняя выживаемость людей 60—69 лет, нахо-
дящихся на гемодиализе, составляет 54 %, 70—
79 лет — 44 %, 80 лет и старше — 29 %. Если
гемодиализ начинается в возрасте 80 лет, сред-
няя продолжительность жизни этих пациентов
составляет 28,3 мес [Rohrich В. et al., 1998].
Возраст реципиентов почечного транспланта-
та также постоянно возрастает. В 1980 г. средний
523
возраст составлял 38,2 года, в 1985 — 42,7, в
1991 — 44,5. Доля пациентов старше 55 лет, под-
вергшихся трансплантации почки, увеличилась
с 3,6% в 1980 г. до 23,9 % в 1991 г., т.е. перспек-
тивы лечения ХПН и ее терминальной стадии
у пожилых людей расширяются. Вместе с тем АГ
все более четко рассматривается как фактор
риска хронической прогрессирующей дисфунк-
ции почечного трансплантата [Фрай У., 1998].
27.3. Оценка состояния больных
и принципы лечения в
старческом возрасте
Прежде всего следует ясно представлять себе
ограничение функциональных возможностей
старого человека и трудность переносимости им
экстремальных ситуаций — болезней, дегидра-
тации, физических перегрузок, ятрогенных воз-
действий и т.д. Вместе с тем следует не забы-
вать о том, что при умеренных воздействиях
повреждающего фактора возможен выход, ка-
залось бы, из крайне тяжелых ситуаций, напри-
мер из ОПН, связанной с водно-электролит-
ными нарушениями, при минимальной раци-
ональной терапии.
Необходимо установление основных этиоло-
гических механизмов, число которых с возрас-
том увеличивается, а их роль в неблагоприят-
ном течении болезни возрастает, так же как
попытка их устранения или коррекции. Среди
них — выявление инфекционных факторов,
обследование с онконастороженностью, выяв-
ление обменных нарушений, прежде всего ди-
абета, подагры, бытовых (алкоголь) и лекар-
ственных интоксикаций и воздействий, пони-
мание последствий обездвиженности, особен-
но в неврологической, психиатрической кли-
никах, травматологии.
Целесообразно осуществлять лечение инфек-
ции как мочевых путей, так и иной локализа-
ции, устранение дисбактериоза с использова-
нием максимально щадящих, но эффективных
препаратов, рационально подобранных при
нередко сниженной реактивности больных,
дезинтоксикационную терапию при интоксика-
циях, обусловленных инфекционными заболе-
ваниями. В процессе лечения необходимо учи-
тывать склонность больных к грибковым пора-
жениям, авитаминозам, сопутствующим нару-
шениям водно-электролитного баланса, к дис-
трофии органов, в том числе почек.
Систематически проводить лечение сердеч-
но-сосудистых нарушений, ухудшения общей и
почечной гемодинамики, вызывающих ОПН
или ОПН на фоне ХПН, даже при сохранен-
ном на обычном для больного уровне АД при
524
падении сердечного выброса, а также местных
циркуляторных расстройств, поражения слизи-
стых оболочек желудочно-кишечного тракта,
кожных покровов, последующей бактериальной
и тканевой интоксикации, ДВС-синдрома.
В случае преобладания инфекционно-инток-
сикационных, обменных (преимущественно ин-
терстициальных) и сосудистых поражений по-
чек возможны преимущественно гломерулярные
поражения, протекающие чаще в мультимор-
бидном окружении, что делает терапию этих
процессов общепринятыми методами гораздо
более рискованной, поскольку возможно отри-
цательное воздействие кортикостероидов, ци-
тостатиков, гепарина, нестероидных противо-
воспалительных процессов, мочегонных и даже
антиагре гантов.
Лечение больных пожилого и старческого
возраста требует постоянной ятрогенной насто-
роженности, рационального применения лекар-
ственных препаратов.
Литература
Борисов И.А. Патология почек у лиц пожилого и стар-
ческого возраста: Автореф. дис. ... докт. мед. наук. —
М., 1990.
Лемер Н. Новые достижения в лечении острой по-
чечной недостаточности//Современные аспекты за-
местительной терапии при почечной недостаточно-
сти: Международный нефрологический симпозиум. —
М., 1998. - С. 45-54.
Фрай У. Диализный пациент и трансплантация поч-
ки//Там же. — С. 80—89.
Чарра Б., Калемар Э., Лоран Г. Значимость длитель-
ности процедуры и контроля артериального давле-
ния для достижения большой продолжительности
жизни пациентов на диализе//Там же. — С. 42—45.
Andreucci Р.Е., Fuiano G., Russo D. et al. Vasomotor
nephropathy in the eldderly//Nephrol. Dial. Transplant. —
1998. - Vol. 13 (suppl. 7). - P. 17-24.
Baggio B., Budakovic A., Gambaro G. Cardiovascular risk
factors, smoking and kidney function//Ibid. — P. 2—5.
Baraldi A., Ballestri M., Rapana R. et al. Acute renal
failure of medical type in an elderly population//Ibid. —
P. 25-29.
Brisoux E, Hassan M., Pallet I.L. Acute renal failure after
the use of ACE-1 in patients without renal-artery
stenosis//Ibid. — 1992. — Vol. 7. — P. 100—107.
Drumpl W., Lax F., Grimm G. et al. Acute renal failure
in the elderly 1975—1990//Clin. Nephrol. — 1994. — Vol.
41. - P. 342-349.
Pascual J., Liano F., Ortuno J. The elderly patient with
acute renal failure//.!. Am. Soc. Nephrol. — 1995. —
Vol. 6. - P. 144-153.
Гпава 28
ОПУХОЛИ почки
Ю.Г.Аляев, А.А.Крапивин
Опухоли почки включают весьма многочис-
ленную группу новообразований различной
морфологической структуры. Различают опухо-
ли почки доброкачественные и злокачественные.
Наиболее распространенным является почечно-
клеточный рак (ПКР), который, по различным
литературным источникам, составляет 85—90 %
опухолевых образований этого органа. Термин
«аденокарцинома почки» употребляется только
для обозначения одного из морфологических
вариантов ПКР. Достоверно известно развитие
ПКР из эпителия проксимального извитого
канальца, поэтому гипотеза Гравитца, который
в 1883 г. описал так называемый гипернефро-
идный рак, о нарушении висцерального эмб-
риогенеза, когда клетки надпочечника, забро-
шенные в ткань почки, являются источником
развития опухолевого процесса, неправомочна,
а термины «опухоль Гравитца», «гипернефро-
ма», «гипернефроидный рак» имеют лишь ис-
торическое значение. Среди доброкачественных
новообразований почки, составляющих 6—8 %,
чаще других наблюдают ангиомиолипому, аде-
ному, онкоцитому. Хотя в последнее время
появились исследования, направленные на оп-
ределение доброкачественного или злокаче-
ственного характера образования в почке на
основании ультразвуковых или рентгенологи-
ческих методов, установить истинный характер
заболевания можно только путем морфологи-
ческого исследования. Во многих литературных
источниках указывается, что опухоли почки со-
ставляют около 3 % всех новообразований в
организме.
Частота выявляемых опухолей в почке в после-
дние два десятилетия резко возросла (по неко-
торым данным, более чем вдвое) за счет асим-
птоматических новообразований, обнаруживае-
мых при ультразвуковом исследовании и компь-
ютерной томографии.
С помощью этих методов стало возможным
выявление рака почки на ранних стадиях забо-
левания. Более отчетливо определяется весьма
характерная черта этого заболевания — у зна-
чительной части больных рак почки протекает
медленно, опухоль увеличивается за один год
на 1—2 см [Лопаткин Н.А. и др., 1992].
Заболеваемость раком почки в среднем со-
ставляет 4 человека на 100 000 населения. По
общей статистике, мужчины болеют в 2 раза
чаще, причем пик заболеваемости у них наблю-
дается в возрасте старше 50 лет, в то время как
у женщин заболевание чаще возникает в тре-
тьем и четвертом десятилетии жизни.
По-прежнему остается неизвестной этиоло-
гия почечных новообразований. Среди факто-
ров, способствующих появлению опухоли поч-
ки, указывают курение, травму почки, контакт
с нитрозосоединениями и циклическими угле-
водородами, асбестом, а также злоупотребле-
ние анальгетиками, регулярное использование
гемодиализа у больных с хронической почеч-
ной недостаточностью.
По данным Т.Н.Ганзен (1993), возникнове-
нию опухоли почки способствуют фоновые за-
болевания, приводящие к нефросклерозу, наи-
более частыми из которых являются гиперто-
ническая болезнь, сахарный диабет, нефроли-
тиаз, хронический пиелонефрит и др. Исходя
из этого, очевидна необходимость обязательно-
го ультразвукового исследования у больных с
заболеваниями, приводящими к нефросклеро-
зу, даже при отсутствии каких-либо жалоб,
характерных для опухоли почки.
Целенаправленно проведенные исследова-
ния, касающиеся генетики почечно-клеточно-
го рака, установили транслокацию 3-й и 11-й
хромосом. Доказано значение наследственных
факторов при ПКР. Подразумевается наследо-
вание предрасположенности к возникновению
опухоли, а не самого новообразования. У па-
525
циентов с такими наследственными синдрома-
ми, как болезнь фон Хиппеля — Линдау и
болезнь Бурневиля — Прингла (туберозный
склероз), помимо проявлений нарушения эм-
бриогенеза, имеется генетическая предрасполо-
женность к ПКР, причем опухолевый процесс
зачастую двусторонний и мультифокальный, а
очаги бластоматозного процесса чередуются с
кистами.
Выделено несколько клинико-морфологи-
ческих форм почечно-клеточного рака: светло-
клеточный (наиболее частая форма ПКР), зер-
нистоклеточный, саркомоподобный рак (верете-
ноклеточный и полиморфно-клеточный вари-
анты), железистый (обычная аденокарцинома).
Нередко встречается сочетание гистологических
вариантов (смешанно-клеточный вариант). Ин-
тересны и представляют практическую ценность
некоторые особенности новообразований поч-
ки различной морфологической структуры. Од-
ними из главных биологических особенностей
рака почки являются венотропность и распро-
странение его в виде опухолевого тромба по
интраренальным венам в основной ствол, а за-
тем в нижнюю полую вену иногда вплоть до
правого предсердия. Для ангиомиолипомы весь-
ма характерны данные ультразвукового исследо-
вания и особенно компьютерной томографии,
свидетельствующие о преимущественном содер-
жании жира в выявленном образовании, а так-
же склонность этой опухоли к самопроизволь-
ному разрыву при достижении ее размеров бо-
лее 5 см и нередкая локализация в обеих поч-
ках. Онкоцитома имеет характерную ангиографи-
ческую картину (симптом «спиц велосипедного
колеса»), Ксантогранулема (ксантогранулематоз-
ный пиелонефрит) всегда бессосудиста.
Симптомы рака почки чрезвычайно много-
образны (табл. 28.1). Из-за этого заболевание
получило такие различные наименования, как
«терапевтическая» опухоль или как «величай-
ший имитатор клинической медицины». Суще-
ствуют многочисленные предложения клиници-
стов систематизировать симптомы по группам,
отражающим клинические особенности течения
рака почки. Одни авторы предлагают выделять
местные и общие проявления, а также симп-
томы, обусловленные метастазами. Предлагается
и более подробное деление по группам: локаль-
ные симптомы; системные признаки; паране-
опластический синдром; сочетание типично
урологических с системными или паранеопла-
стическими; бессимптомность. Не умаляя дос-
тоинств такой подробной детализации клини-
ческих проявлений, вероятно, все же более це-
лесообразно разделять симптомы рака почки на
ренальные и экстраренальные.
Ренальные симптомы включают в себя клас-
сическую триаду: гематурия, боль и пальпируе-
526
Таблица 28.1. Проявления рака почки (собствен-
ные наблюдения) (в процентах)
Симптом Име- ется Возни- кает первым Бывает единст- венным
Гематурия 53—58 16—18 10—11
Боли в пояснице 44—52 9—14 6—7
Повышенная СОЭ 42—48 7—13 4—7
Пальпируемое образование 38—41 7—10 2—3
Анемия 26—34 2—3 1
Гипертермия 22—26 12—16 4
Отсутствие аппетита 14—18 3 1
Артериальная гипертония 15—16 10—12 6—8
Пиурия 10—12 2 —
Похудание 9—14 1 —
Синдром Штауффера 7—14 1—3 —
Диспепсия 8—12 4—5 1
Варикоцеле 3—7 1—2 1
Эритроцитоз 1—2 — —
Миопатии, артралгии 1—2 1 —
Гиперкальциемия 1 — —
мое образование в подреберье. Совокупность этих
признаков считалась характерным клиническим
проявлением этой опухоли. На сегодняшний
день эта триада не позволяет установить диаг-
ноз своевременно, так как она характерна для
далеко зашедшего опухолевого процесса и на-
блюдается лишь у 8 % больных. Сочетание двух
из этих симптомов, а именно боли и гемату-
рии, встречается также при нефролитиазе.
Дифференциально-диагностическим призна-
ком служит последовательность появления
этих симптомов: при мочекаменной болезни
сначала возникает почечная колика, и лишь
после ее купирования или стихания опреде-
ляется наличие крови в моче, а при опухоли
почки колика появляется после тотальной
безболевой макрогематурии вследствие об-
турации мочеточника червеобразным сгуст-
ком крови.
Боль обычно имеет ноющий характер.
Эпизод тотальной безболевой макрогематурии
может внезапно возникнуть среди полного здо-
ровья и также неожиданно прекратиться. При-
чина гематурии — разрыв варикозно-расширен-
ных вен форникальной зоны. Как уже отмеча-
лось, в моче нередко появляются сгустки кро-
ви, которые представляют собой слепок моче-
точника и имеют червеобразную форму.
При обнаружении крови в моче грубейшей
ошибкой будет применение различных крово-
останавливающих средств. Необходимо проведе-
ние цистоскопии для определения источника кро-
вотечения'. При цистоскопии есть возможность
видеть опухоль и другие заболевания мочево-
э пузыря или поступление мочи, окрашенной
ровью, из устья мочеточника, что направит
иагностические усилия врача на эту сторону.
Несмотря на то что пальпируемое образова-
ие в подреберье зачастую трактуется как про-
вление запущенности, оно может быть и пер-
ым симптомом заболевания. Далеко не всегда
ри пальпации живота и поясничной области
ожно определить признаки, характерные для
пухоли почки: плотность, бугристость. Доступ-
ость пальпации неизмененной нижней поло-
ины почки может быть обусловлена смещени-
м почки книзу в случае локализации новооб-
азования в верхнем сегменте почки. При этом
шибкой будет отказ от поисков опухоли поч-
и, связанный с тем, что врач на основании
альпации диагностирует нефроптоз.
Каждое пальпируемое опухолевидное обра-
зование, симптом его баллотирования долж-
ны заставить врача обязательно прибегнуть
к ультразвуковому, а при необходимости и к
рентгенологическому исследованию почек
для исключения рака.
При раке почки у мужчин наблюдается ва-
икоцеле, обусловленное сдавлением яичковой
ены опухолью или ее перегибом вследствие
мещения почки книзу. При прорастании или
ромбозе яичковой вены варикоцеле наблюда-
тся как в орто-, так и в клиностазе. При пе-
егибе яичковой вены в горизонтальном поло-
жении варикоцеле обычно исчезает. Идиопати-
еское варикоцеле, относящееся к пубертатно-
iy периоду, наблюдается слева.
возникновение варикоцеле в зрелом возрас-
зе, появление варикоцеле справа должно насто-
ожить врача и заставить подозревать опухоль
очки.
Необходимо подчеркнуть многообразие экст-
аренальных симптомов опухоли почки. Н.А.Му-
ин и соавт. (1995) выделяют при опухолях
ючек следующие паранеопластические реак-
щи: общие (анорексия, кахексия), иногда дол-
о не связанные с интоксикацией, лихорадоч-
:ую, гематологическую, диспротеинемическую,
ндокринопатическую, неврологическую (ней-
юмиопатия), кожную (дерматозы), суставную
иногда остеоартропатия), нефротическую. Бо-
iee того в настоящее время можно говорить о
жатоморфозе заболевания (экстраренальные
:имптомы стали типичным проявлением ПКР),
щоизошедшим во многом в связи с улучше-
шем его диагностики. В литературе появились
юобщения о развитии точных методов иссле-
(ования с целью максимально раннего выяв-
ления опухоли почки, в основу которых поло-
жено определение иммунологическими метода-
ми активных пептидов, отвечающих за различ-
ные проявления паранеопластического синдро-
ма. В связи с этим рассмотрение экстрареналь-
ных симптомов именно в таком аспекте своев-
ременно.
Лихорадка лишь изредка связана с сопутству-
ющей инфекцией и другими заболеваниями;
она объясняется, возможно, выделением эндо-
генных пирогенов (например, интерлейкина-1).
Синтезированные в лейкоцитах пирогены про-
никают в головной мозг и там воздействуют не-
посредственно на нейроны передней гипотала-
мической области — центр терморегуляции. Эти
нейроны на своих мембранах имеют специфи-
ческие рецепторы, при контакте которых с
пирогенами приводится в действие аденилат-
циклазная система. В результате в клетках уве-
личивается количество циклического аденозин-
монофосфата, который изменяет чувствитель-
ность нейронов центра терморегуляции к холо-
довым и тепловым сигналам: к холодовым чув-
ствительность повышается, а к тепловым —
снижается.
Было доказано, что эндогенные пирогены
могут высвобождать лактоферрин. Этот глико-
протеин содержится в большинстве жидкостей
организма и в полиморфно-ядерных лейкоци-
тах, обладает способностью связывать двухва-
лентное железо и тем самым удаляет его из
циркуляции. Некоторые исследователи считают
этот эффект основной причиной анемии. Ряд
ученых связывают возникновение анемии с ток-
сическим воздействием опухоли почки на кос-
тный мозг, что приводит к угнетению его фун-
кции. При выявлении же эритроцитоза не сле-
дует торопиться с диагнозом эритремии. Нару-
шение венозного оттока из почки вследствие
опухолевого поражения магистральной почеч-
ной вены приводит к усилению продукции
эритропоэтина, который в свою очередь стиму-
лирует красный росток костного мозга. Поми-
мо этого, некоторые авторы связывают с тром-
бозом или сдавлением почечных вен опухоле-
выми массами, увеличенными забрюшинными
лимфатическими узлами, возникновение арте-
риальной гипертонии. Необходимо отметить, что
повышение артериального давления зачастую
отмечается у пациентов без венозного стаза,
вследствие компрессии опухолью интрареналь-
ных сосудов.
Штауффер в 1961 г. первым описал обрати-
мую дисфункцию печени у пациентов с почеч-
но-клеточной карциномой. Это нарушение пе-
ченочной функции манифестирует повышени-
ем уровня щелочной фосфатазы и непрямого
билирубина, удлинением протромбинового вре-
мени, диспротеинемией (повышение уровня
альфа-2- и гамма-глобулинов). Синдром Штауф-
фера неспецифичен для почечно-клеточной
карциномы. Гистологически определяются про-
лиферация звездчатых ретикулоэндотелиоцитов
(купферовских клеток), печеночно-клеточная
пролиферация и фокальные некрозы. Патогенез
этого синдрома до конца не известен. Среди
причин рассматривается печеночно-токсический
фактор, который либо продуцируется опухолью
либо образуется организмом в ответ на опухоль.
Эта теория печеночно-токсического фактора
подтверждается гем, что нарушения функции
печени у большинства пациентов исчезают
после нефрэктомии. Необходимо подчеркнуть,
что в то время как наличие синдрома Штауф-
фера перед началом терапии не имеет прогно-
стического значения, отсутствие нормализации
показателей печеночной функции или появле-
ние изменений вновь свидетельствует, по дан-
ным различных авторов, о рецидиве опухоли.
Гиперкальциемия без доказанного поражения
костей рассматривается как проявление пара-
неопластического синдрома при многих злока-
чественных заболеваниях. Целый ряд факторов,
таких как образование эктопического паратгор-
мона, витамин D и его метаболиты, фактор
активации остеобластов, простагландины и
факторы роста, предлагается различными ис-
следователями в качестве причины повышения
уровня кальция сыворотки крови. Хотя гипер-
кальциемия при почечно-клеточной карцино-
ме может быть обусловлена любым из этих ве-
ществ, недавно появились многочисленные
доказательства того, что медиатором является
подобное паратгормону вещество. Было доказа-
но, что это вещество имитирует целый ряд био-
логических эффектов нормальной молекулы
паратгормона. Так, подобный паратгормону
пептид регулирует, среди прочего, уровень
сывороточного кальция путем увеличения ре-
абсорбции в дистальном извитом канальце
кальция и уменьшения реабсорбции фосфата в
проксимальном извитом канальце, а также под-
держивает резорбцию кальция из костной тка-
ни, что в совокупности ведет к повышению
уровня сывороточного кальция.
Некоторые экстраренальные симптомы пока
не изучены настолько, чтобы можно было го-
ворить о субстанциях, ассоциированных с их
возникновением. В настоящее время продолжа-
ются поиски, в том числе на генетическом
уровне, причин, вызывающих экстраренальные
симптомы, с целью выявления опухолевых
маркеров.
Как уже отмечалось, выявляемые в после-
днее время опухоли почки у 25—30 % больных
бессимптомны. Эти опухоли стали обнаруживать
при профилактических ультразвуковых исследо-
ваниях у 0,4—0,95 % обследованных.
Появилось мнение, что рак почки небольших
размеров метастазирует очень редко. Вместе с тем
у 5 % больных первые проявления заболевания
бывают обусловлены метастазами в отдаленные
органы (кашель, кровохарканье при метастазах
в легкие; упорная головная боль при метастазах
в головной мозг; часто рецидивирующие или по-
стоянные радикулиты, межреберные невралгии
при метастазах в кости и т.д.). Установить пер-
воисточник опухоли в таких ситуациях бывает
чрезвычайно трудно, тем более что многочис-
ленными клиническими наблюдениями доказа-
но, что новообразование в почке может быть
очень небольших размеров.
Еще раз считаем необходимым подчеркнуть,
что если ранее экстраренальные симптомы рас-
сматривали как атипичные, то в настоящий
момент благодаря накопленному опыту можно
говорить, что экстраренальные симптомы — это
характерные проявления опухоли.
Таблица 28.2. Классификация рака почки (1997)
Ста- дия Т—первичная опухоль N—регио- нарные пимфа- тические узпы /И—отда- пенные метаста- зы
1 Т1 — опухоль до 7 см, огра ничена почкой •NO — по- ражения нет МО — ме- тастазов нет
2 Т2 — Т1, Т2 опухоль более 7 см, ограничена почкой NO — по- ражения нет N1 —еди- ничный МО — ме- тастазов нет МО
3 ТЗа — опухоль распростра- няется на надпочеч- ник или паранеф- ральную клетчатку в пределах фасции Ге- рота NO, N1 МО
ТЗЬ — инвазия опухоли в почечную вену и ниж- нюю полую вену до диафрагмы NO, N1 МО
ТЗс — внутривенная инва- зия опухоли выше уровня диафрагмы NO, N1 МО
4 Т4 — опухоль распростра- няется за пределы фасции Герота NO, N1 МО
Т — любая N2 — более одного МО
т — любая N — лю- бая М1 — имеются метаста- зы
528
Международный противораковый союз внес
чцественные изменения в TNM-классифика-
!Ю почечно-клеточного рака, предложенную
1989 г. (табл. 28.2).
При обнаружении опухоли почки у детей
|едует думать об опухоли Вильмса, так как
1стота других опухолевых поражений почек у
лей крайне низкая. У взрослых, наоборот,
[ухоль Вильмса встречается редко — в 0,5—
% случаев. Опухоль Вильмса (нефробластома)
ила описана М.Wilms в 1899 г. н считается
[личной опухолью детства. Из группы нефро-
астом выделены мезобластическая нефрома и
фробластоматоз. Происхождение опухоли сея-
но с ненормальной пролиферацией метанеф-
тенной бластемы. Существующая в настоящее
>емя неясность в определении течения забо-
вания у взрослых связана, по-видимому, с
м, что ни один из авторов не располагает до-
аточным количеством собственных наблюде-
на вследствие крайней редкости заболевания
взрослых. В литературе описано всего около
0 случаев опухоли Вильмса у взрослых, мак-
мальпый возраст пациента с опухолью Виль-
:а составил 85 лет. Однако анализ собствен-
тх наблюдений (5 больных) и литературных
иных позволяет говорить о длительном бес-
мпто.мном течении заболевания, когда опу-
ль достигает больших размеров и может ма-
[фестировать проявлениями метастатическо-
поражения (чаще легких) или видимой
имметрией живота за счет огромных разме-
в новообразования. Возможные трудности ди-
чостики данного заболевания у взрослого
тут быть связаны с тем, что пациенты по-
ло обращаются за медицинской помощью и
частую поступают в стационар в тяжелом
стоянии, с признаками раковой интоксика-
и и кахексии, проявлениями метастатичес-
го поражения различных органов и объемным
разовапием в животе, в которое включены
ухоль почки, пораженные метастазами реги-
арные лимфатические узлы, подпаянные
тли кишечника и инфильтрированный саль-
к. Все это в сочетании е крайней редкостью
эй опухоли у взрослых может создавать зна-
тельные трудности в правильной интерпре-
дии первичного очага бластоматозного пре-
сса в почке. Существенную помощь при этом
азывают современные инструментальные
тоды обследования (ультразвуковое исследо-
чие, компьютерная и магнитно-резонансная
чография).
Диагноз опухоли почки основан на кли-
ческих признаках, результатах лабораторных,
итгенологических, радиоизотопных, ультра-
левых исследований, а также данных гисто-
гичсского исследования биоптатов опухоле-
го узла и метастазов. Наиболее информатив-
ными методами диагностики считают ультразву-
ковое исследование, компьютерную и магнит-
но-резонансную томографию. Типичный рак
почки (рис. 28.1) представлен плотным эхоген-
ным образованием (рис. 28.2); при компьютер-
ной томографии с контрастированием (рис.
28.3) для него характерны меньшее усиление
плотности, чем в нормальной рядом располо-
женной почечной паренхиме, и наличие гипер-
васкуляризации при вазографических исследо-
ваниях (рис. 28.4). Чувствительность ультразву-
кового исследования в диагностике объемных
образований почки составляет 97,3 %, компь-
ютерной томографии — 100 %. Целесообразно
начинать обследование больных с подозрени-
ем на опухоль почки с ультразвукового иссле-
дования.
К признакам опухоли относят неровность
контуров образования и почки, различие эхо-
структуры образования и нормальной почеч-
ной ткани, отсутствие усиления эхосигналов
по дистальной границе образования, дефор-
мацию чашечно-лоханочной системы.
При центральном расположении опухоль
оттесняет и деформирует лоханку и чашечки,
паренхима почки уплотняется. При перифери-
ческом расположении опухоли выявляют нор-
мальную лоханку и чашечки и дефект в кор-
ковом слое.
Уточненная диагностика рака почки
предусматривает четкое определение всех пара-
метров по классификации TNM. При 1-й и 2-й
стадии опухоли оцениваются фиброзная капсу-
ла почки и размеры образования; при 3-й ста-
дии — фиброзная капсула, паранефральная
клетчатка, надпочечник, почечная и нижняя
полая вены; при 4-й — ткани за пределами
фасции Герота и соседние органы. При опре-
делении отношения опухоли к фиброзной кап-
суле почки, паранефральной клетчатке, фасции
Герота и соседним органам наибольшими воз-
можностями обладает компьютерная томогра-
фия (информативность 67—91 %). Информатив-
ность ультразвукового исследования — 50—
78 %, магнитно-резонансной томографии —
74—82 %, ангиографии — 60—74,2 %. При оп-
ределении стадии ЗЬ и Зс (венозная инвазия)
наиболее информативны селективная почечная
венография и нижняя кавография (86—98 %).
Эти методы имеют основное значение в опре-
делении распространенности опухолевого тром-
ба, причем при наличии «блока» на нижней
ретроградной кавограмме обязательной счита-
ется чреспредсердная ретроградная нижняя ка-
вография. Для обнаружения опухолевого тром-
ба в интраренальных венах за пределами опу-
—2950
529
Рис. 28.1. Опухоль почки. Макропрепарат.
Рис. 28.2. Плотное эхогенное образование в верхнем
сегменте почки. Продольная эхограмма.
холевого узла проводят селективную почечную
фармаковенографию. Среди других методов наи-
более информативны для выявления опухоле-
вого тромбоза нижней полой вены ультразву-
ковое исследование и компьютерная томогра-
фия, но они не заменяют нижнюю кавографию.
Лимфогенные метастазы могут присутство-
вать в неувеличенных лимфатических узлах и,
напротив, увеличение узла не всегда свидетель-
ствует о его метастатическом поражении, так
как при раке почки лимфоидная гиперплазия
и лимфаденит без метастазов не являются ред-
костью (составляют около 30 %).
И все же обнаружение увеличенных (более
2 см) лимфатических узлов (в области почеч-
ной ножки, паракавальных или парааорталь-
ных) до операции заставляет предполагать их
метастатическое поражение. Визуализацию лим-
фатических узлов при ультразвуковом исследо-
вании значительно затрудняют эхотени от ки-
шечника, лишь у 50 % пациентов удается уви-
деть узлы размером не менее 3 см. Увеличен-
ные лимфатические узлы значительно чаще
обнаруживают при компьютерной томографии
(63—81 %), при этом регистрируют узлы раз-
мером не менее 1,5—2 см. Преимуществом ком-
пьютерной томографии является определение
плотности ткани, что дает возможность выска-
зать предположение о воспалительном или ме-
тастатическом характере процесса. Информатив-
ность магнитно-резонансной томографии в
выявлении регионарных метастазов недостаточ-
но изучена. Информативность сосудистых мето-
дов исследования в диагностике метастатичес-
кого поражения лимфатических узлов состав-
ляет 30—40 % и определяется преимуществен-
но косвенными признаками (деформация кон-
тура нижней полой вены, увеличение аортока-
вального промежутка, выявление слабо васку-
ляризированной округлой тени в области по-
Рис. 28.3. Опухоль левой почки с меньшим усилени-
ем плотности по сравнению с нормальной паренхи-
мой. Компьютерная томограмма с контрастировани-
ем.
530
чечной ножки, паракавальной или в парааор-
тальной зоне).
Отдаленные метастазы чаще всего локализу-
ются в легких, костях, печени, головном моз-
ге. Для их обнаружения предложены различные
методы, однако ни один из них не позволяет
полностью исключить наличие бессимптомных
отдаленных метастазов. Об этом свидетельству-
ют многочисленные факты появления метаста-
зов рака почки спустя очень большой срок
после нефрэктомии. Во многих исследованиях
на момент установления диагноза рака почки
у 23—40 % больных уже имелись отдаленные
метастазы. С учетом наибольшей частоты мета-
стазов рака почки в легкие и кости перед опе-
рацией принято проводить рентгенографию лег-
ких, черепа, позвоночника, таза, метафизов
трубчатых костей. Для исключения костных
метастазов широко применяют изотопную
сцинтиграфию, а для исключения метастазов в
лимфатические узлы средостения, печень, го-
ловной мозг, легкие —компьютерную томогра-
фию.
Таким образом, ультразвуковое исследова-
ние, компьютерная и магнитно-резонансная
томография позволяют выявить объемные об-
разования почки более чем у 95 % больных,
установить природу заболевания почти у 90 %,
определить стадию рака у 80—85 %. Выбор опе-
ративного доступа и планирование операции
осуществляют с помощью комплексного вазо-
графического исследования. Не все указанные
методы должны использоваться у каждого боль-
ного раком почки. Если при ультразвуковом
исследовании имеется типичное плотное обра-
зование в почке, следующим этапом должно
стать вазографическое исследование, дающее
информацию, необходимую для проведения
операции. Если ультразвуковое исследование не
позволяет поставить точный диагноз, целесо-
образно провести компьютерную или магнит-
но-резонансную томографию с последующей
вазографией.
Необходимо помнить, что ни один из мето-
дов диагностики не может быть идеальным,
разные методы дополняют друг друга, поэтому
необходим комплексный подход в диагностике.
Дифференциальная диагностика
при опухоли почки должна проводиться с про-
стой кистой, поликистозом, гидронефрозом,
нефроптозом, карбункулом почки, пионефро-
зом, опухолью забрюшинного пространства и
другими заболеваниями, при которых почка
увеличивается и меняет свою конфигурацию.
Проведение дифференциальной диагностики
ПКР в некоторых ситуациях является крайне
трудным.
Дифференциальный диагноз опухоли и ки-
сты почки в настоящее время достаточно прост
Рис. 28.4. Гиперваскуляризация верхних 2/3 левой поч-
ки за счет опухолевых новообразованных сосудов.
Селективная артериограмма.
и осуществляется в подавляющем большинстве
случаев при помощи ультразвукового исследо-
вания. При ультразвуковом исследовании раз-
личают 3 вида объемных образований почки:
плотные, жидкостные и смешанные. Для плот-
ной опухоли характерна негомогенная структу-
ра, обусловливающая появление внутреннего
эхосигнала. Для кисты почки характерны ров-
ные контуры, отсутствие внутренних эхострук-
тур, усиление отраженных ультразвуковых волн
на дистальной границе образования. Однако
аналогичная картина может наблюдаться при
абсцессе, гематоме, аденоме и липоме и даже сар-
коме, поэтому нельзя судить о морфологичес-
кой структуре опухоли на основании неморфо-
логических методов. При сомнениях в плотном
или жидкостном характере образования прово-
дят пункцию его под ультразвуковым контро-
лем с цитологическим исследованием получен-
ной жидкости и кистографией. При ультразву-
ковом исследовании у части больных внутри
жидкостного образования выявляют плотные
эхоструктуры. Такая картина заставляет прово-
дить дифференциальный диагноз между муль-
34*
531
тилакунарной кистозной нефромой, кистозным
вариантом светлоклеточного рака почки, эхи-
нококкозом почки, а также раком почки с
резко выраженными явлениями некроза и рас-
пада. При ангиографии чаще всего выявляют
бессосудистое образование. При компьютерной
томографии устанавливают так называемую
неопределенную плотность. У большинства
больных окончательный диагноз можно устано-
вить только при морфологическом исследова-
нии удаленной почки.
Определяемое при пальпации двустороннее
увеличение почек в сочетании с их бугристос-
тью должно наводить на мысль о поликистозе.
Хотя редко, но может наблюдаться опухоль по-
ликистозной почки.
Как указывалось выше, дифференциальная
диагностика опухоли почки и нефроптоза на
основании лишь пальпаторных данных трудна.
Поэтому при выявлении при пальпации объем-
ного образования живота или поясничной об-
ласти необходимо применение комплекса ме-
тодов обследования: ультразвуковых и рентге-
нологических.
Диагноз гидронефроза устанавливают при
помощи ультразвукового исследования, при
котором видны истончение почечной паренхи-
мы, расширение лоханки и чашечек, если нет
терминальной стадии гидронефроза. Это мож-
но подтвердить экскреторной урографией. Труд-
ности дифференциальной диагностики опухо-
ли почки и пионефроза связаны с тем, что тол-
щина стенки пионефротического мешка и
включения внутри него напоминают при ульт-
развуковом исследовании картину опухоли с
кровоизлиянием внутри. При этом приходится
прибегать к компьютерной томографии и ком-
плексной ангиографии.
У 1—2 % больных возникают трудности в
определении органной принадлежности обра-
зований забрюшинного пространства и брюш-
ной полости (при опухолях надпочечника, хво-
ста поджелудочной железы, редко встречаю-
щихся новообразованиях соединительнотканно-
го генеза, новообразованиях I сегмента пече-
ни, а также при увеличенной селезенке). В та-
ких случаях наиболее информативна селектив-
ная почечная артериография.
Доброкачественные новообразования составля-
ют около 6—8 % всех опухолей почки. Заподо-
зрить доброкачественную опухоль можно у 11 %
больных с выявленными при ультразвуковом
исследовании объемными образованиями поч-
ки. Дооперационная дифференциальная диагно-
стика между раком почки и доброкачественны-
ми новообразованиями возможна для жиросо-
держащих опухолей типа ангиомиолипомы и ли-
помы на основании наличия гиперэхогенного
образования и жировых включений, хорошо
532
определяемых при компьютерной томографии.
На ангиограммах эти образования гиперваску-
лярны.
Доброкачественность новообразования дол-
жна быть подтверждена с помощью аспира-
ционной биопсии.
При наличии достаточного опыта этот ме-
тод прост, безопасен, весьма информативен и
позволяет поставить правильный цитологичес-
кий диагноз примерно в 80—87 % случаев. Од-
нако получить достаточно материала для цито-
логической оценки удается не всегда, кроме
того, есть вероятность неправильной интерпре-
тации данных из-за возможной деформации
клеток при выполнении аспирационной био-
псии, а также сосуществования в одной опу-
холи клеток доброкачественного и злокаче-
ственного новообразования.
У 7—9 % больных выявить опухоль и уста-
новить ее природу трудно даже с использова-
нием всех современных методов. Это особенно
касается новообразований диаметром менее
3 см. Маленькие образования: нередко прихо-
дится дифференцировать от добавочной дольки
почечной паренхимы, особенно при так называ-
емой горбатой почке. В таких случаях использу-
ют компьютерную томографию, информатив-
ность которой увеличивается за счет внутривен-
ного усиления, позволяющего четче дифферен-
цировать патологическую ткань.
Очень трудно дифференцировать рак почки
и узловую форму ксантогранулематозного пиело-
нефрита. Сходство клинической картины, плот-
ное образование в почке у большинства боль-
ных заставляет предполагать рак почки и пред-
принимать нефрэктомию. Заподозрить и под-
твердить экспресс-биопсией ксантогранулема-
тозный пиелонефрит можно у пациентов, у
которых плотное новообразование в почке при
вазографии не имеет сосудов, а во время опе-
рации выявляется перифокальный инфильтра-
тивный процесс, характерный для ксантогра-
нулемы.
Операция остается единственным методом,
позволяющим рассчитывать на излечение или
продление жизни при раке почки. Паспортный
возраст больных раком почки не должен быть
определяющим в отказе от операции. Тяжесть
интеркуррентных заболеваний и степень выра-
женности интоксикации, а также большая
предполагаемая интраоперационная кровопоте-
ря должны оцениваться для отбора пациентов,
подлежащих оперативному лечению в услови-
ях гипербарической оксигенации. Единственно
возможной органоуносящей операцией при
раке почки является радикальная нефрэктомия,
i которой почку удаляют в едином блоке с
анефральной клетчаткой и фасциями. Реги-
рная и юкстарегионарная лимфаденэктомия
зательна при NO и N1. Органосохраняющие
рации при опухоли почки имеют абсолют-
: и относительные показания. Абсолютные —
единственной или обеих почек, рак одной
функциональная несостоятельность (вслед-
ие каких-либо заболеваний) другой почки
яраженной хронической почечной недоста-
ностью. Относительные — заболевания кон-
латеральной почки с латентной стадией
Н. Оценка контралатеральной почки долж-
осуществляться с учетом длительно суще-
/юших фоновых заболеваний, обусловлива-
их нефросклероз как в почке, пораженной
холью, так и в противоположной.
Лризнана правомочной и целесообразной
жция пораженной раком почки при здоро-
контралатеральной, если она технически
ществима в пределах здоровых тканей. Воз-
сность мультифокальное™ процесса в одной
ке требует использования всех доступных
одов для отрицания или подтверждения ее
эльных с планируемой органосохраняющей
рацией.
Эмболизация почечной артерии может быть
ользована как метод остановки кровотече-
у неоперабельных больных. Лучевое лече-
может оказаться полезным для уменыне-
размеров сомнительно операбельной опу-
и и у оперированных больных с морфоло-
ески доказанными метастазами в лимфати-
<их узлах, а также для уменьшения боли при
гных метастазах. Химиотерапия пока еще ис-
ьзуется при метастазах в легкие. Иммуноте-
ия не столь эффективна при распространен-
: формах рака, сколь настоятельно необхо-
ia как в пред-, так и в послеоперационном
иодах, но с обязательным контролем им-
[ного статуса у больных с Т1 — ТЗ без отда-
ных и лимфогенных метастазов. Комбиниро-
ные операции, включающие нефрэктомию
даление (или резекцию) соседнего органа,
отором имеется опухолевая инвазия или
итарный метастаз, целесообразны при Т1—
1N0-1 или при T4M0N0-1. Операции оправ-
ы при ТЗЬ и ТЗс (внутрикавальной инва-
), если нет отдаленных метастазов или лим-
енных в стадии N2.
Рецидив рака в ложе удаленной почки под-
:ит удалению, если это технически осуще-
ямо и нет отдаленных метастазов.
Контрольные обследования больных, опери-
рованных по поводу рака почки, должны осу-
ществляться не реже одного раза в 4 мес пер-
вые 3 года, каждые 6 мес через 3—5 лет и не
реже 1 раза в год на протяжении всей жизни
после 5 лет.
Литература
Аляев Ю.Г. Диагностика и лечение опухоли почки//
Пленум Всероссийского общества урологов. — Ке-
мерово. — 1995. — С. 4—32.
Ганзен Т.Н. Почечно-клеточный рак: морфогенез,
клинико-морфологическая характеристика, диффе-
ренциальная диагностика: Автореф. дис. ... докт. мед.
наук. — М.: ММА им. И.М.Сеченова, 1993. — 43 с.
Лопаткин Н.А., Козлов В.П., Гришин М.А. Рак почки:
нефрэктомия или резекция?//Урол. и нефрол. —
1992. - № 4—6. - С. 3-5.
Мавричев А.С. Почечно-клеточный рак. — Минск:
Белорусский центр научн. мед. информации, 1996. —
С. 148-164.
Мазо Е.Б., Артемова Л.Г., Герливано Б.А. и др. Резек-
ция почки при раке//Урол. и нефрол. — 1992. —
№ 4-6. - С. 6-10.
Переверзев А. С. Хирургия опухолей почки и верхних
мочевых путей. — Харьков, 1997. — С. 245—305.
Степанов В. И, Колпаков И. С. Консервативная хирур-
гия при опухолях паренхимы почек//Урол. и не-
фрол. - 1995. - № 6. - С. 16-18.
Трапезникова М.Ф., Дутов В.В., Уренков С.Б. и др.
Тактика лечения больных при сочетании опухоли
почки и мочекаменной болезни//Урол. и нефрол. —
1995. - № 6. - С. 18-22.
Giuliani L. Atlas of surgery for renal cancer. — Genoa:
Ottavia de Ferrari Breggia, 1989.
Giuliani L. Radikale Chirurgie der Nierentumoren//
Ausgewahlte urologische OP-Techniken. — 1997. —
S. 56-72.
Novick A. C. Partial nephrectomy for renal cell carcinoma
//Urology. - 1995. - Vol. 46 (2). - P. 149-152.
Vogelzang N.J., Scardino P. T, Shipley W. U, Coffley D.S.
Comprehensive Textbook of Genitourinary Oncology. —
1996. - P. 187-216.
Гпава 29
ДОБРОКАЧЕСТВЕННАЯ ГИПЕРПЛАЗИЯ
(АДЕНОМА) ПРЕДСТАТЕЛЬНОЙ
ЖЕЛЕЗЫ
В. А. Рогов
Доброкачественная гиперплазия (правиль-
нее — возрастная гиперплазия) предстательной
железы (ДГПЖ) — неопухолевое увеличение
железы, сопровождающееся развитием обструк-
тивных и ирритативных нарушений мочеиспус-
кания. Термин «гиперплазия», по мнению боль-
шинства зарубежных и отечественных специа-
листов, наиболее полно отражает морфогенез
заболевания. Вот почему его использование счи-
тается предпочтительным в сравнении со ста-
рым термином «аденома», который подразуме-
вает развитие доброкачественной опухоли из
железистого эпителия.
Актуальность проблемы ДГПЖ для интерни-
стов возрастает в связи со значительным поста-
рением населения и увеличением числа мужчин
с симптомами ДГПЖ. Кроме того, в последние
годы появилась реальная возможность медика-
ментозного лечения таких больных, а число
операций по поводу ДГПЖ имеет устойчивую
тенденцию к снижению повсеместно в мире.
ДГПЖ — наиболее частое заболевание у
мужчин старше 50 лет. Гистологические призна-
ки ДГПЖ выявляются более чем у 50 % лиц в
возрасте 60 лет и почти у 90 % лиц в возрасте
80 лет [Berry S.J., 1984]. Около половины муж-
чин с гистологически подтвержденной ДГПЖ
имеют увеличение железы, а половина из их
числа — клинические симптомы ДГПЖ [Isaacs
J.T., 1990]. От 50 до 75 % больных с симптома-
тической ДГПЖ считают, что болезнь прино-
сит страдание и ухудшает качество жизни
[Garraway W.M.,1993], Именно они обращают-
ся за соответствующей помощью и нуждаются
в лечении.
Морфология и патогенез. В предста-
тельной железе выявляются множественные
534
узлы железисто-эпителиальной гиперплазии.
Однако в этих узлах обнаруживают пролифера-
цию не только эпителиальных, но также глад-
комышечных и соединительнотканных клеток,
соотношение которых может быть различным.
Рост ткани происходит преимущественно в
области шейки мочевого пузыря и вокруг мо-
чеиспускательного канала (его простатической
части), что служит анатомической причиной
обструктивных нарушений мочеиспускания
(статический компонент обструкции). В 8,7 %
случаев гиперплазия носит атипический харак-
тер, при котором имеется потенциальный риск
развития рака предстательной железы. Почти
всегда (96,7 %) в гиперплазированной железе
обнаруживаются признаки воспаления вплоть
до микроабсцессов [Кудрявцев Ю.В., Романо-
ва Л.М., 1997]. Эти изменения объясняют эф-
фективность противовоспалительной терапии в
устранении клинических симптомов ДГПЖ.
Среди механизмов развития гиперплазии
наиболее изучена роль простатического фермен-
та 5-а-редуктазы, ответственного за трансфор-
мацию циркулирующего тестостерона в актив-
ную тканевую форму — дигидротестостерон
[Пытель Ю.А., Винаров А.З., 1997]. Установле-
но, что с возрастом параллельно со снижени-
ем выработки тестостерона в тестикулах увели-
чивается активность 5-а-редуктазы и в предста-
тельной железе накаливается дигидротестосте-
рон, способствующий повышению синтеза ро-
стовых факторов, увеличению числа и объема
клеток железы. Причины активации 5-а-редук-
тазы до конца не ясны. Обсуждается роль раз-
личных факторов, в особенности роль эндоген-
ных эстрогенов. У пожилых мужчин их синтез
из надпочечниковых гормонов-предшественни-
ков под воздействием ароматазной ферментной
системы активируется. Предполагается также,
что циркулирующие эстрогены могут замедлять
процесс естественного старения и отмирания
клеток (апоптоз) предстательной железы.
При ДГПЖ хорошо изучена также роль не-
рвно-мышечного механизма нарушений моче-
испускания. У больных с этим заболеванием в
железе развивается значительная гиперплазия
мышечной ткани. Соотношение фибромускуляр-
ной ткани и эпителия, составляющее в норме
2:1, при ДГПЖ может увеличиваться до 5:1
[Bartsch G., 1979]. Доля мышечных клеток в
гиперплазированной предстательной железе
может достигать почти 40 % [Shapiro Е., 1992].
Тонус гладкомышечных волокон железы, а так-
же ее капсулы, шейки мочевого пузыря и про-
статической части уретры регулируется посред-
ством а,-адренергических рецепторов и прямо
зависит от активности симпатической нервной
системы. При ДГПЖ эти мышечные волокна
находятся в состоянии гипертонуса, что усили-
вает обструктивные нарушения мочеиспускания
(динамический компонент обструкции) и в
значительной степени отвечает за ирритативные
симптомы.
Клинические проявления и ди-
агностика. К обструктивным нарушениям
мочеиспускания (симптомы задержки) относят
затрудненное и прерывистое начало мочеиспус-
кания, слабую струю мочи, выделение мочи
каплями в конце мочеиспускания, ощущение
неполного опорожнения мочевого пузыря.
Ирритативными нарушениями мочеиспускания
(симптомы раздражения) считают учащенное
необильное мочеиспускание в дневное и ноч-
ное время, императивные позывы, неприятные
ощущения, связанные с мочеиспусканием.
Диагноз ДГПЖ может быть подтвержден
рядом дополнительных методов исследования.
Для объективизации обструктивных и иррита-
тивных нарушений принято использовать спе-
циальные шкалы, позволяющие оценить выра-
женность симптомов в баллах.
Обструктивные нарушения мочеиспускания
количественно оценивают при урофлоуметрии
и при инвазивном исследовании внутрипузыр-
ного давления.
Пальцевое ректальное исследование позволя-
ет установить консистенцию предстательной
железы, ее размеры и форму. Размеры, конфи-
гурацию и структуру железы более точно мож-
но определить и зарегистрировать при помощи
трансабдоминального или трансректального
ультразвукового исследования. Этот же метод
позволяет определить объем остаточной мочи в
мочевом пузыре и наличие в нем конкремен-
тов. Для диагностики сопутствующей мочевой
инфекции необходим общий анализ мочи, а
для оценки функции почек — определение
уровня креатинина крови.
Перечисленных методов обычно достаточно,
чтобы дифференцировать ДГПЖ от пер-
вичных заболеваний мочевого пузыря и урет-
ры, простатита. Сложнее исключить рак пред-
стательной железы. В качестве скрининг-теста
этого заболевания используют определение
уровня простатоспецифического антигена
(ПСА) крови [Лоран О.Б., 1997]. Уровень ПСА
более 4 нг/мл требует настороженности в от-
ношении рака простаты при отсутствии других
причин для его повышения (значительная ги-
перплазия, хирургические и диагностические
манипуляции на простате, острая задержка
мочи и др.). Диагноз становится более вероят-
ным, если темпы нарастания уровня ПСА об-
гоняют темпы увеличения размеров железы.
Диагноз еще более вероятен в том случае, если
при ректальном пальцевом исследовании обна-
руживается, что увеличение предстательной
железы незначительное, она асимметрична
и/или имеет «каменную» плотность. В этих слу-
чаях показана полифокальная биопсия предста-
тельной железы для окончательной верифика-
ции рака [McConnel J.D., 1996].
Данные о естественном течении ДГПЖ не-
многочисленны. Возможны длительные перио-
ды (до 5—7 лет) стабилизации или даже умень-
шения симптомов заболевания. От 10 до 70 %
больных отмечают улучшение состояния в те-
чение 1 года наблюдения [Валу М., 1994]. Мно-
гие мужчины приспосабливаются к имеющим-
ся нарушениям мочеиспускания и не обраща-
ются за медицинской помощью.
Прогрессирование заболевания у нелеченых
больных проявляется отчетливо только по про-
шествии длительного срока. Вот почему наибо-
лее надежным фактором тяжелого прогноза
ДГПЖ является возраст. Так, показания к опе-
рации у 70-летнего мужчины возникают в 6—
11 раз чаще, чем у 40-летнего [Arrighi Н., 1991].
В целом ДГПЖ отличается трудной предсказу-
емостью течения и отсутствием связи между
степенью увеличения железы и выраженностью
обструктивных и ирритативных нарушений мо-
чеиспускания [Lepor Н., 1996].
Осложнения. ДГПЖ не несет прямую уг-
розу жизни больного. В то же время она может
быть причиной ряда осложнений, прежде все-
го острой задержки мочи. Это осложнение мо-
жет наступить неожиданно в любую стадию об-
структивных нарушений мочеиспускания. Но все
же чаще острая задержка мочи развивается у
больных более старшего возраста, при больших
размерах предстательной железы, значительном
снижении объемной скорости мочеиспускания
и тяжелых обструктивных и ирритативных сим-
птомах. По данным разных исследователей,
535
острая задержка мочи развивается за 10 лет бо-
лезни у 4—73 % больных ДГПЖ [Birkoff J.,
1976; Ball А., 1981]. Было рассчитано, что лю-
бой 60-летний мужчина при последующих 20
годах жизни будет иметь хотя бы один эпизод
острой задержки мочи с вероятностью 23 %
[Oishi К., 1998].
При длительно существующих нарушениях
мочеиспускания у больных ДГПЖ развивается
обструктивная уропатия, характеризующаяся
растяжением мочевого пузыря и ослаблением
его сократимости [Степанов В.Н., 1997]. Про-
исходит структурная перестройка стенки моче-
вого пузыря и сфинктеров. Клинически это
проявляется несостоятельностью мочевого пу-
зыря, т.е. неполным его опорожнением. Иног-
да наблюдается непроизвольное подтекание
мочи при потере способности больного к са-
мостоятельному мочеиспусканию (парадоксаль-
ная ишурия). В тяжелых случаях количество ос-
таточной мочи может превышать 2 л, а изме-
нения мочевого пузыря после операции необра-
тимы. Данные о возможности восстановления
сократительной функции мочевого пузыря в
более легких случаях противоречивы [Levin R.,
1990; Jones D., 1991].
Умеренную азотемию находят у 1,6—7,1 %
больных ДГПЖ, готовящихся к операции [Sacks S.,
1989; Beck А., 1989]. В центрах по лечению ост-
рой почечной недостаточности больные с нару-
шением уродинамики на фоне ДГПЖ составля-
ли 11 — 14 % [Chisholm G., 1970; Kaufman J.,
1991]. Возможно, что в ряде упомянутых слу-
чаев почечная недостаточность, хроническая
или острая, вызвана обструктивной нефропати-
ей вследствие ДГПЖ.
Тяжелые варианты мочевой инфекции у боль-
ных ДГПЖ редки. В то же время W.Mebust
(1989) сообщает, что в США рецидивирующая
инфекция мочевых путей является показанием
к операции у 12 % больных ДГПЖ. ДГПЖ в
8 раз увеличивает риск образования камней мо-
чевого пузыря, которые обнаруживаются у 1 —
2 % оперированных больных и в 3,4 % случаев
при патологоанатомическом исследовании
[Grosse Н., 1990].
Лечение. Консервативное ведение больных
ДГПЖ включает в себя стратегию «бдительно-
го наблюдения» и медикаментозное лечение.
Состояние больного должно контролироваться
для оценки развития болезни. Периодичность
обследований зависит от конкретных обстоя-
тельств, но обычно проводится не реже одно-
го раза в год. Для уменьшения обструктивных
симптомов и профилактики острой задержки
мочи больному рекомендуют избегать ситуаций,
вызывающих перерастяжение мочевого пузы-
ря — интенсивного потребления жидкости, ис-
пользования мочегонных препаратов, отсрочен-
536
ного мочеиспускания. Больной должен ограни-
чить употребление алкоголя, ему следует избе-
гать приема лекарств, способных усилить мы-
шечный тонус простатической части уретры и
сфинктеров. К таким лекарствам относятся ад-
реномиметики (норадреналин), холинолитики
(атропин, платифиллин), в том числе централь-
ные холинолитики для лечения паркинсониз-
ма (циклодол), опиоидные анальгетики (фен-
танил), антидепрессанты, особенно трицикли-
ческие (амитриптилин). Обструктивные симп-
томы могут усиливаться при переохлаждении,
запорах.
Медикаментозное лечение ДГПЖ основано
на представлении о двух компонентах обструк-
тивных нарушений мочеиспускания [Caine М.,
1986]. Первый компонент, статический, связан
с анатомическим увеличением предстательной
железы. Второй компонент, динамический,
обусловлен гипертонусом гладких мышц желе-
зы и простатической части уретры. Вклад ста-
тического и динамического компонентов в об-
щее уретральное сопротивление определяется
примерной величиной 60 и 40 % соответствен-
но [Raz S., 1973; Furuya S„ 1982]. Для ограни-
чения роста железы используют ингибиторы
5-а-редуктазы, а для уменьшения динамичес-
кого компонента применяют блокаторы а ^ад-
ренорецепторов [Cockett А.Т.К., 1993].
Ингибитор 5-а-редуктазы финастерид (про-
скар) значительно снижает уровень дигидротес-
тостерона, приводя к уменьшению размеров
железы, улучшению мочеиспускания и ослабле-
нию обструктивных симптомов [Gormley G.L.,
1992]. При многолетнем применении финасте-
рид уменьшает риск острой задержки мочи
[McConnell J.D., 1998]. Препарат проявляет
максимальную эффективность у больных, у ко-
торых увеличение предстательной железы обус-
ловлено преимущественно гиперплазией же-
лезистого эпителия, в наибольшей степени за-
висящей от активности 5-а-редуктазы. Обыч-
но это больные с начальной стадией заболева-
ния или с малосимптомным увеличением про-
статы. У больных с выраженным стромально-
мышечным компонентом гиперплазии финас-
терид малоэффективен. У этих больных в кон-
сервативном ведении предпочтение следует
отдавать а -адреноблокаторам.
Финастерид назначают в дозе 5 мг один раз
в день в течение 3—6 мес. Именно такой срок
требуется для развития первых признаков улуч-
шения. Если препарат эффекта вен, необходима
последующая длительная поддерживающая тера-
пия [Peters D.H., 1993]. Если финастерид не вы-
зывает улучшения в течение 3—6 мес, продол-
жение лечения не имеет смысла. У 4—9 % боль-
ных препарат может вызывать нарушения либи-
до и потенции, а также ретроградную эякуля-
цию (уменьшение объема семяизвержения). Кро-
ме того, он примерно в 2 раза уменьшает уро-
вень простатоспецифического антигена крови.
Эго свойство финастерида может маскировать
развитие рака предстательной железы.
Имеется большой клинический опыт лече-
ния больных ДГПЖ с помощью а ]-адренобло-
каторов [Caine М. et al., 1976, 1978; Abrams Р.Н.
et al., 1982; Cockett A.T.K., 1991]. К ним отно-
сятся альфузозин, доксазозин, празозин, там-
сулозин. теразозин. а,-Адреноблокаторы умень-
шают напряжение мышц не только в самой
железе, но и в ее капсуле, а также в шейке мо-
чевого пузыря и проксимальной уретре. Под
влиянием этих препаратов увеличивается ско-
рость потока мочи, уменьшается давление из-
гнания мочи из мочевого пузыря. В результате
мочеиспускание облегчается, исчезают или ос-
лабляются симптомы обструкции, снижается
объем остаточной мочи. Ирритативные симпто-
мы также уменьшаются. Эффекты а,-адрено-
блокаторов проявляются быстро, практически
уже после первого приема лекарства, что по-
вышает заинтересованность больного в продол-
жении лечения |Jardin A. et al., 1994].
Кроме нижних мочевых путей, (^-адреноре-
цепторы в большом числе располагаются в
стенке сосудов и в центральной нервной сис-
теме. Вот почему блокада этих рецепторов не
только уменьшает проявления обструкции при
мочеиспускании, но может вызвать гемодина-
мические изменения (гипотонию, увеличение
частоты сердечных сокращений и др.) и реак-
ции со стороны ЦНС (слабость, вялость, голов-
ную боль и головокружение), а,-Адреноблока-
торы различаются между собой по соотноше-
нию уродинамических, гемодинамических и не-
врологических эффектов. Причины этих разли-
чий до конца не ясны. Для лечения ДГПЖ
наибольшее значение имеют так называемые
уроселективные а (-адреноблокаторы. Они ха-
рактеризуются преимущественным влиянием на
мочеиспускание при незначительном воздей-
ствии на гемодинамику и ЦНС [Anderson К.Е.,
1998].
Наиболее уроселективными a t-адреноблока-
торами являются альфузозин (дальфаз), докса-
зозин (кардура) и тамсулозин (омник). Имен-
но эти препараты получили широкое примене-
ние для лечения ДГПЖ [Лопаткин НА., Пе-
реианова Т.С., 1997]. Но все же при использо-
вании лаже этих уросслективных а, -адренобло-
каторов у 10—16 % больных возможно разви-
тие таких побочных явлений, как снижение АД,
ортостатическая гипотония (в том числе в ка-
честве «эффекта первой дозы»), тахикардия,
слабость, головокружение и головная боль. Из-
за риска снижения АД при назначении «,-ад-
реноблокаторов следует учитывать сопутствую-
щую гипотензивную терапию, которая должна
быть уменьшена. Особая осторожность нужна
при одновременном назначении а -адренобло-
каторов и антагонистов кальция (нифедипин,
исрадипин, амлодипин).
Начальная доза альфузозина 5 мг на ночь.
При хорошей переносимости дозу увеличива-
ют до 10 мг в день в два приема. У больных
старше 65 лет суточная доза не должна превы-
шать 5 мг. Доксазозин назначают в начальной
дозе 2 мг однократно. При необходимости доза
может быть увеличена до 4 и даже 8 мг один
раз в сутки. Тамсулозин назначают по 0,4 мг
один раз в день, при этом подбор дозы не тре-
буется.
а [-Адреноблокаторы являются препаратами
первой линии в лечении симптоматической
ДГПЖ [Chapple C.R., 1998]. Лечение о^-адре-
ноблокаторами должно проводиться длительно
(в течение нескольких лет), при этом их эф-
фективность и переносимость не меняется. Так,
альфузозин не только устойчиво сдерживал
проявления ДГПЖ, но и достоверно снижал
число случаев острой задержки мочи и хирур-
гических вмешательств на протяжении 3-летне-
го лечения [Lukacs В. et al., 2000]. Добавление
финастерида к а,-адреноблокаторам не имело
дополнительных преимуществ в устранении
симптомов ДГПЖ и уродинамических наруше-
ний на протяжении 6—12 мес наблюдения
[Lepor Н. et al., 1996; Debruyne F.M., 1998].
Однако комбинированная терапия ДГЖП пре-
паратами разного механизма действия требует
дальнейших исследований.
Целесообразность применения растительных
препаратов при ДГПЖ является предметом дис-
куссии. С одной стороны, Международный ко-
митет по ДГПЖ не рекомендует их для лече-
ния этого заболевания [Cockett А.Т.К., 1993].
С другой стороны, в некоторых странах расти-
тельные препараты получили широкое распро-
странение. Наиболее известен экстракт вееро-
листной пальмы (пермиксон, серпенс). Приме-
няют также экстракт коры африканской сливы
(таденан, трианол), масло семян тыквы (тык-
веол, пепонен) и некоторые другие. Механизм
действия растительных препаратов четко не оп-
ределен. Обсуждаются их антиандрогенное и ан-
тиэстрогенное влияние, противовоспалитель-
ный и другие эффекты [Сивков А. В., 1997].
Способность растительных препаратов умень-
шать симптомы ДГПЖ и улучшать объективные
показатели мочеиспускания подтверждена пре-
имущественно в открытых исследованиях и при
непродолжительном наблюдении [Fitzpatrick
J.M., Lynch Т.Н., 1996]. Однако при сравни-
тельных исследованиях их эффективность была
невелика и уступала а,-адреноблокаторам
[Grasso М. et al., 1995; Adriaazola Semino M. et al.,
537
1992] и финастериду [Carraro J.С. et al., 1996].
Несомненными достоинствами растительных
препаратов является их безопасность и хорошая
переносимость. Считается, что к назначению
этих средств можно прибегать в начальных ста-
диях заболевания в качестве альтернативы «бди-
тельному наблюдению», а также когда имеют-
ся какие-либо ограничения для использования
а, -адреноблокаторов (тяжелая ишемическая бо-
лезнь, склонность к ортостатической гипото-
нии) и финастерида (молодые больные из-за
риска импотенции).
Оперативное лечение ДГПЖ является наибо-
лее эффективным в устранении обструктивных
нарушений мочеиспускания. Нередко оно при-
водит к радикальному излечению. Получили
распространение трансуретральное рассечение
и резекция железы, а также открытая простат-
эктомия. «Золотым стандартом» эффективнос-
ти лечения ДГПЖ является трансуретральная
резекция предстательной железы. Каждый вид
пособия используется в зависимости от особен-
ностей заболевания у конкретного больного,
однако имеются общие показания к оператив-
ному лечению. Абсолютные показания включа-
ют острую задержку мочи при отсутствии са-
мостоятельного мочеиспускания после удаления
мочевого катетера (или максимальную скорость
мочеиспускания менее 5 мл/с), обструктивную
уропатию с остаточной мочой в объеме 300 мл
и более, рецидивирующую мочевую инфекцию
и макрогематурию, дивертикулы и камни мо-
чевого пузыря, почечную недостаточность,
обусловленную ДГПЖ. Относительными пока-
заниями являются тяжелые нарушения мочеис-
пускания (максимальная скорость мочеиспуска-
ния 5—10 мл/с; объем остаточной мочи 100—
200 мл), которые изнуряют больного и резко
снижают качество жизни. Необходимость опе-
ративного лечения становится более настоятель-
ной при быстром увеличении размеров железы
и прогрессировании симптомов ДГПЖ. Данная
тактика представляется оправданной также у
больных, имеющих в перспективе высокий
риск ухудшения сопутствующих заболеваний
или общего состояния, которые могут сделать
невозможным радикальное оперативное лече-
ние в последующие годы.
При выборе оперативного метода предпола-
гаемая польза от лечения должна быть больше
возможного риска. Не следует прибегать к хи-
рургическому лечению до купирования актив-
ной мочевой инфекции, а также при наличии
общих противопоказаний к операциям (нару-
шениях гемостаза, функциональной недостаточ-
ности жизненно важных органов и др.). Число
различных осложнений при использовании опе-
ративных методов лечения ДГПЖ остается вы-
соким. По данным C.G.Roehrborn (1996), пос-
538
леоперационные осложнения наблю-
даются у 12—25 % больных. Это кровотечение
(0,5—2,9 %), инфекция мочевых путей (2,6—
15,5 %), эпидидимит (1,1—3,6 %) и другие ос-
ложнения. Может возникнуть стриктура уретры
(1,9—7,7 %) и недержание мочи (1,9—3,2 %),
очень часто развиваются сексуальные наруше-
ния (4,6—31,5 %) и почти всегда ретроградная
эякуляция [Лопаткин Н.А., 1997].
Операционная смертность колеблется от 0,5
до 3,8 %, составляя в среднем 1,5 % [McConnell
J.D., 1994].
Учитывая, что оперативное лечение связа-
но со значительным риском осложнений, ак-
тивно изучаются эффективность и безопасность
новых высокотехнологичных микроволновых и
радиоволновых, лазерных и ультразвуковых мето-
дов лечения ДГПЖ [Аполихин О.И., 1997; Мар-
тов А.Г, Камалов А.А., 1997; Stein B.S., 1996;
Devonec М.А., 1996; Madersbacher S., Marberger
M., 1996]. Эти методы используют различные
способы передачи энергии, но имеют общий
лечебный принцип — нагрев ткани. Нагрев до
42—44 °C оказывает терапевтический эффект.
Более высокие температуры, особенно в диа-
пазоне 60—70 °C, вызывают коагуляционный
некроз клеток гиперплазированной железы. При
нагреве более 100 °C происходит выпаривание
и мгновенная деструкция тканей. Доставка энер-
гии может осуществляться через уретру, пря-
мую кишку или путем вколов (также через урет-
ру, прямую кишку или промежность) специ-
альных излучателей непосредственно в предста-
тельную железу. Эффективность и безопасность
лучевых методов значительно различаются. Она
в большой степени зависит от технических де-
талей и не всегда полно изучена в сравнитель-
ных исследованиях. В настоящее время идет на-
копление объективных данных, которые в бу-
дущем позволят более точно определить место
этих перспективных методов в лечении ДГПЖ.
Наиболее вероятно, что по эффективности и
безопасности они займут промежуточное поло-
жение между медикаментозными и оперативны-
ми методами лечения. Уже сейчас их можно
рекомендовать в случаях неэффективности кон-
сервативного ведения больных ДГПЖ с серьез-
ной сопутствующей патологией, ограничиваю-
щей использование оперативного лечения.
К новым технологиям относят баллонную ди-
латацию и стентирование (установление внутри-
уретральной спирали) простатического отдела
уретры [Vale J.A., Christmas Т., 1996; Nordling J.,
1996]. Эти методы лечения также развиваются
очень динамично. Обычно они используются для
временного улучшения уродинамики.
Сложившийся к настоящему времени опыт
свидетельствует о необходимости активного
участия больного в выборе тактики лечения
|McConnell J.D., 1994]. Роль врача — объектив-
но информировать больного о существующих
альтернативах лечения, их преимуществах и
недостатках. Роль пациента — определить свои
предпочтения на основании полученной от
врача информации. Наблюдательная тактика и
медикаментозное лечение рекомендуются обыч-
но больным с мягкими и умеренными клини-
ческими проявлениями заболевания соответ-
ственно. В то же время субъективная оценка
больным своего состояния может быть более се-
рьезной, и он может склоняться к радикаль-
ным оперативным методам. Хирургическое ле-
чение рекомендуется больным с тяжелыми
признаками обструктивного поражения нижне-
го мочевого тракта. Однако оно может быть от-
ложено, когда у больного отсутствует опыт
медикаментозного лечения и имеется вероят-
ность значительного улучшения состояния пос-
ле назначения a (-адреноблокаторов или фина-
стерида.
Литература
Лопаткин Н.А., Перепанова ТС. Клинический опыт
лечения больных доброкачественной гиперплазией
предстательной железы, а-адреноблокатором альфу-
зозином//Урол. и патол. — 1997. — № 3. — С. 14—16.
Лоран О. Б. Диагностика и дифференциальная диагно-
стика доброкачественной гиперплазии предстательной
железы//Доброкачественная гиперплазия предстатель-
ной железы/Под ред. Н.А.Лопаткина. — М.: Всерос-
сийское общество урологов, 1997. — С. 51—61.
Пытель Ю.А., Винаров А.З. Этиология и патогенез
гиперплазии предстательной железы//Доброкаче-
ственная гиперплазия предстательной железы/Под
ред. Н.А.Лопаткина. — М.: Всероссийское общество
урологов, 1997. — С. 19—32.
Anderson К.Е. The concept of Uroselectivety//Eur.
Urol. - 1998. - Vol. 33 (suppl. 2). - P. 7-11.
Barry M. Natural history of untreated benign prostatic
hyperplasia//The epidemiology of prostate disease/Ed.
M.Garraway. — Heidelberg: Springer — Verlag, 1994.
Debruyne Jardin A., Colloi D. et al. Sustained-
Release Alfuzosin, Finasteride and the Combination of
Both in the treatment of benign prostatic hyperpla-
sia//Eur. Urol. — 1998. — Vol. 34. — P. 169—175.
Garraway W.M., Russel E.B., Lee R.J. et al. Impact of
previously unrecognized benign prostatic hyperplasia on
the daily activities of middle-aged and elderly men//Br.
J. Gen. Pract. — 1993. — Vol. 43. — P. 318—321.
Gormley G.J., Stoner E., Bruskewitz R. C. et al. The effect
of finasteride in men with benign prostatic hyperplasia
//New Engl. J. Med. - 1992. - Vol. 327. - P. 1185-1191.
Jardin A. et al. Long term treatment of benign prostatic
hyperplasia with alfuzosin: a 24—30 month survey//Br. J.
Urol. - 1994. - Vol. 74. - P. 579-584.
Lukacs B., Grange J. C., Comet D., McCarthy C. History
of 7093 patients with lower urinary tract symptoms
related to benign prostatic hyperplasia treated with
alfuzosin ip general practice up to 3 years//Eur. Urol. —
2000. - Vol. 37. - P. 183-190.
McConnell J.D. Guidelines for diagnosis and management
of benign prostatic hyperplasia//Textbook of benign
prostatic hyperplasia/Ed. R.Kirby. — Oxford: ISIS Medical
Media, 1996. - P. 507-525.
McConnell J.D., Bruskewitz R., Walsh P. et al. The effect
of finasteride on the risk of acute unnary retention and
the need for surgical treatment among men with benign
prostatic hyperplasia//N. Engl. J. Med. — 1998. — Vol.
338. - P. 557-563.
Peters D.H., Sorkin E.M. Finasteride. A review of its
potential in the treatment of benign prostatic hyperplasia
//Drugs. - 1993. - Vol. 46. - P. 177-208.
Гпава 30
ПАРАНЕОПЛАСТИЧЕСКИЕ
НЕФРОПАТИИ
Н. А. Мухин, Н. Н. Хасабов
Поражение почек, часто значительно ухуд-
шающее течение основного заболевания, при
различных злокачественных новообразованиях
чрезвычайно разнообразно. Можно выделить
следующие варианты вовлечения по-
чек при опухолевых заболеваниях:
• собственно опухолевая (в том числе и мета-
статическая) инфильтрация почек;
• гидронефроз, вторичная мочевая инфекция,
обусловленные сдавлением мочевых путей;
• сдавление вен, нарушение венозного отто-
ка, венозный тромбоз с развитием гломеру-
лопатии с нефротическим синдромом;
• прогрессирующие хронические или острые
поражения, обусловленные метаболически-
ми, гормональными, электролитными нару-
шениями;
• неспецифические (паранеопластические)
нефропатии (амилоидоз, гломерулопатия,
канальцевые нарушения).
Отдельно следует назвать поражение почек
в связи с проводимым антиопухолевым лече-
нием (радиационная, химиотерапия), к кото-
рому почки весьма чувствительны.
При обширном метастазировании
опухоли почки вовлекаются довольно часто,
хотя клинически метастазы опухоли в почки ди-
агностируются обычно лишь у 20—25 % боль-
ных. Это связано с тем, что значительные ме-
тастатические изменения в почках, в частно-
сти деструктивный процесс, проявляются при
жизни еще реже и поэтому специальное иссле-
дование почек (обзорный рентгеновский сни-
мок, тем более внутривенная урография, томо-
графия почек, ультразвуковое исследование,
наконец, ангиография и компьютерная томо-
графия) при опухолях внепочечной локализа-
ции обычно не проводится, хотя указанные ме-
540
тоды могут выявить изолированный метастати-
ческий узел в почке и отличить его от кисты.
Такое уточнение важно при наличии, хотя и
редко встречающегося, метастаза только в поч-
ку, особенно если имеется связанная с ним вы-
раженная опасная для жизни гематурия или
сильная боль, когда направленная на метастаз
радиационная терапия или метастазэктомия
(часто нефрэктомия) могут дать облегчение и
продлить жизнь. Такое метастатическое пораже-
ние почек чаще возникает при опухолях легко-
го, молочных желез, желудка.
Рак желудочно-кишечного тракта и молоч-
ной железы может давать метастазы в ретропе-
ритонеальные лимфатические узлы, что приво-
дит к обструкции мочеточников (гид-
ронефрозу) и крупных вен, сопровожда-
ющейся нередко инфекцией мочевых путей с
пиелонефритом или нарушением оттока веноз-
ной крови с развитием клубочкового пораже-
ния (гломерулопатия с нефротическим синдро-
мом).
Лейкозы и лимфомы иногда вызывают опу-
холевую инфильтрацию почек, что обычно
возникает в разгар болезни и проявляется на-
рушениями функции почек. Обычно такое по-
ражение почек уменьшается под влиянием хи-
миотерапевтических препаратов, которые экс-
кретируются почками (например, метотрексат),
в сочетании с лучевым лечением.
Отдельную группу поражения почек при
опухолях различной локализации составляют
нефропатии, вызванные гормонально-мета-
болическими и электролитными нарушениями,
которые возникают или в связи с распадом
массы опухолевых клеток, или эктопической
продукцией опухолью различных биологически
активных субстанций, или предпринимаемым
лечением опухоли. Поступление в кровь боль-
шого количества освобождающихся внутрикле-
точных метаболитов нуклеиновых кислот и
электролитов (так называемый синдром лизи-
са опухоли) приводит к гиперурикемии, гипер-
калиемии, гиперфосфатемии, гипокальциемии.
С этими нарушениями гомеостаза в основном
и связаны прежде всего возникающие эпизоды
острой почечной недостаточности (острая мо-
чекислая нефропатия, острый нефрокальциноз,
вторичный по отношению к гиперфосфате-
мии), хотя тяжелое состояние пациентов мо-
жет быть, конечно, связано с гиперкалиемией
и гипокальциемией. Безусловно, повышенный
риск для развития указанных осложнений име-
ется у лиц с предшествующей ХПН, так как
экскреция всех этих вешеств (мочевой кисло-
ты и фосфатов) тесно связана с их почечным
клиренсом. Наиболее часто данные метаболи-
ческие и электролитные нарушения возникают
при опухолях, общая клеточная масса которых
и скорость клеточного роста очень большие. Это
относится в основном к гематологическим опу-
холям (недифференцированные лимфомы, ос-
трый лимфобластный лейкоз, лимфома Беркит-
та, Т-клеточная лимфобластная лимфома).
Клетки этих опухолей обладают очень высокой
чувствительностью к противоопухолевому лече-
нию, поэтому дисметаболическое поражение
почек у больных может развиться уже в пер-
вые 2—3 дня специального лечения, и предуп-
редить его можно, назначив профилактические
курсы аллопуринола, антацидов, щелочных
растворов, обильного питья.
Специально следует выделить острую ка-
нальцевую блокаду почек с анурией,
возникающую вследствие токсического дей-
ствия белка Бенс-Джонса или закупорки этим
белком просвета почечных канальцев у больных
множественной миеломой.
Особую группу представляют поражения
почек, составляющие одно из проявлений так
называемого паранеопластического
си ядром а.
В последнее время все большее внимание
привлекают необычные, на первый взгляд,
проявления опухолевых заболеваний, характе-
ризующиеся выраженным клиническим поли-
морфизмом. Злокачественные опухоли легких,
щитовидной железы, почек, желудочно-кишеч-
ного тракта, лимфогранулематоз и др., поми-
мо симптомокомплекса, обусловленного непос-
редственной локализацией опухолевого процес-
са или его метастазами, могут сопровождаться
связанными с ними неспецифическими, так
называемыми паранеопластическими реакция-
ми. Впервые этот термин был введен в середи-
не 50-х годов. С этого времени описан целый
ряд подобных проявлений, маскирующихся
иногда под хорошо известную нозологическую
форму. В нашей стране интерес к этой пробле-
ме вызван прежде всего работами Е.М.Тареева
и его сотрудников.
Практически трудно найти какой-либо орган
или систему, не вовлекающуюся в паранеоп-
ластический процесс. Это различные кожные
(эритема, гипертрихоз, пемфигоид, гиперкера-
тоз), гематологические (эритроцитоз и анемия,
тромбоцитоз и тромбоцитопения, лейкемоид-
ные реакции), многочисленные эндокринные
(вирильный синдром, гипо- и гипертиреоидизм
и др.), водно-электролитные нарушения и мно-
гие другие.
Хорошо известны такие «нозологические»
маски паранеопластического процесса, как дер-
матомиозит, ревматоидный артрит, тиреоидит.
Чрезвычайно многообразно и пара неоп-
ластическое поражение почек, которое
клинически может проявляться как изолирован-
ными изменениями мочи, так и картиной нефро-
тического синдрома с присоединением в после-
дующем ХПН. Различные канальцевые дисфунк-
ции и их сочетания очень характерны для свя-
занных с опухолевым процессом паранеоплас -
тических обменно-электролитных и гормональ-
ных реакций. Так, при бронхогенном раке,
опухолях поджелудочной железы, кишечника
может возникнуть метаболический алкалоз; ме-
таболический ацидоз сопровождает острый лей-
коз и нередко в виде типичного синдрома
Фанкони взрослых выявляется при миеломной
болезни. Ренальный тубулярный ацидоз вместе
с потерей калия выявляется не только при
опухолях надпочечников, но и при раке под-
желудочной железы. Как и другие признаки па-
ранеопластического синдрома, эти проявления
могут опережать более известные симптомы
самой опухоли.
Нефротический синдром занимает особое
место среди нефрологических паранеопласти-
ческих реакций. Он может быть одним из пер-
вых почечных признаков опухолевого процес-
са, но, к сожалению, обычно долго не оцени-
вается как проявление паранеопластического
процесса, тогда как рак встречается в 10 раз
чаще именно у больных с нефротическим син-
дромом по сравнению со здоровыми людьми.
Так, в большой серии наблюдений J.C.Lee
(1966) среди 101 больного с нефротическим
синдромом у 10,9 % была обнаружена карци-
нома, такую же закономерность выявили
M.C.Dalakas и соавт. (1984).
Среди наблюдавшихся нами больных (41
пациент), поступивших в нефрологическое от-
деление клиники с диагнозом хронический
нефрит или хронический пиелонефрит, у ‘/3
регистрировался нефротический синдром (про-
теинурия до 13 г/л, общий белок крови до
51 г/л, альбумины до 21 г/л, холестерин до
541
Таблица 30.1. Сроки установления диагноза рака
от момента появления признаков поражения почек
Авторы Число больных Сроки установления диагноза
J.C.Lee и соавт. 11 От 1 до 14 мес
L.Loughriidge 6 От 5 нед до 12 мес
C.H.Antolin и соавт. 2 2 мес
Собственные данные 41 От 5 до 13 мес
11,7 ммоль/л), у ‘/4 — ХПН. Почти у полови-
ны больных отмечена микрогематурия.
При обследовании у больных были обнару-
жены различные опухоли, чаще других выяв-
лялись рак паренхимы почки (у 9) и лимфо-
гранулематоз (у 8). Рак мочевого пузыря диаг-
ностирован у 3 человек, рак желудка — у 3,
рак толстой кишки - у 2, бронхогенный рак
легкого — у 2, периферический рак легкого —
у 2, менингиома — у 2, рак молочной желе-
зы — у 2, прочие опухоли (хемодектома, сар-
кома желудка, хронический лимфолейкоз, ме-
ланома, семинома, остеобластокластома и
др.) — у 8 человек.
Сроки установления диагноза рака от
момента появления нефротического синдрома
колебались от 5 до 13 мес (в среднем 8 мес),
что совпадает с данными других авторов (табл.
30.1).
У 37 больных для уточнения характера по-
ражения почек была произведена биопсия поч-
ки или слизистой прямой кишки. У 16 больных
выявлен амилоидоз, у 21 — нефропатия по типу
гломерулонефрита.
Клиническая карт и н а, помимо при-
знаков поражения почек, характеризовалась
рядом таких неспецифических синдромов опу-
холи, как общая слабость, бледность, похуда-
ние, кахексия. Отмечались и другие паранеоп-
ластические проявления: лихорадка (46,4 %),
остеоартропатия (10 %), артриты (7,1 %), лим-
фаденопатия (7,1 %, не считая больных лим-
фогранулематозом), а также тромбофлебиты,
трофические расстройства, синдром нарушен-
ного всасывания, анемия. Обычно дифферен-
циальный диагноз паранеопластического пора-
жения почек проводится между амилоидозом и
нефропатией по типу гломерулонефрита.
Хорошо известна возможность сочетания
амилоидоза и рака паренхимы почки, миелом-
ной болезни, лимфогранулематоза. Так, сразу
же после введения R.Virchov (1853) понятия
«амилоид» появилось сообщение об амилоидо-
зе при лимфогранулематозе. Среди наблюдав-
шихся нами 33 больных с опухолями паренхи-
мы почки паранеопластический нефротический
синдром развился у 7 (18 %), т.е. примерно так
542
же часто, как и паранеопластическая нейромио-
патия, но реже, чем лихорадочный (у 56 %) и
гематологический (у 60 %) синдром [Мухин
Н.А. и др., 1978]; 6 из этих 7 больных умерли,
у 5 на вскрытии был обнаружен амилоидоз
почек. Примерно с такой же частотой возни-
кает амилоидоз и при лимфогранулематозе
[Вермель А.Е. и др., 1974].
Амилоидоз при более распространенных
опухолях (рак бронхов и желудка) возникает,
очевидно, реже, что подтверждается данными
J.Azzopardi и соавт. (1966), которые обнаружи-
ли его только у 7 из 2622 больных карциномой
и саркомой. Амилоидоз почек в большинстве
случаев проявляется типичным нефротическим
синдромом, который выступает как первый
признак амилоидоза, хотя у части больных и
удается обнаружить короткую протеинуричес-
кую стадию. Быстрая смена этих стадий явля-
ется особенностью амилоидоза, обусловленно-
го опухолевым процессом, что подтверждается
следующим наблюдением.
Больной П-в, 54 лет, водитель, поступил в кли-
нику с жалобами на кашель с небольшим выделе-
нием мокроты, похудание, отеки на ногах. Считает
себя больным с конца 1983 г., когда появились ка-
шель, слабость; с января 1984 г. после простудного
(?) заболевания выявлены изменения в анализах
мочи; с марта 1984 г. — отеки голеней, быстро уве-
личившиеся до степени анасарки. Состояние было
расценено как острый нефрит. Проводилась терапия
метиндолом, достигнуто некоторое улучшение.
Клинические симптомы при поступлении: поху-
дание, выраженный отечный синдром, кашель с
мокротой, изменение ногтей в виде часовых стекол.
Отмечались анемия (НЬ 102 г/л), увеличение СОЭ
до 68 мм/ч, суточная протеинурия до 8,5 г, при био-
химическом исследовании — признаки нефротичес-
кого синдрома (общий белок 41 r/л, альбумины
18 г/л, холестерин 10,8 ммоль/л), функция почек со-
хранена (креатинин 90 мкмоль/л, КФ 99,6 мл/мин).
Предположение о возможности амилоидоза с пре-
имущественным поражением почек было подтверж-
дено биопсией слизистой оболочки прямой кишки.
При тщательном исследовании легких был выявлен
периферический рак верхней доли левого легкого.
Больной переведен в хирургическое отделение.
Нефротический синдром значительно ухуд-
шает состояние больных, увеличивает количе-
ство диагностических и терапевтических оши-
бок в ведении больных, в частности частое и
неоправданное назначение кортикостероидных
препаратов, ускоряющих течение амилоидоза и
приводящих к развитию ХПН.
Патогенетические механизмы развития па-
ранеопластического амилоидоза до конца не
ясны. Ряд фактов может служить основанием
для признания прямой связи между амилоидо-
зом и опухолью, например обнаружение отло-
жений амилоида внутри карциномы — в мие-
ломатозных узлах, опухолевых узлах при лим-
фогранулематозе; в опухолевой ткани нефро-
карциномы [Мухин Н.А. и др., 1980]. Возмож-
ность синтеза клетками опухоли моноклональ-
ных иммуноглобулинов, легких цепей иммуно-
глобулинов, особенно А-цепей, включающих-
ся в амилоидную фибриллу, также свидетель-
ствует в пользу такой связи. Мы наблюдали
редкое сочетание амилоидоза с хроническим
лимфолейкозом.
В пользу единства опухолевого процесса и
амилоидоза могут служить случаи развития у
больных, перенесших трансплантацию почки и
получающих мощную иммунодепрессивную те-
рапию, сначала опухоли, а затем амилоидоза
[Thova Y. et al., 1978], что позволяет предпола-
гать возможность иммунного генеза паранеоп-
ластического амилоидоза.
Прямая связь между опухолью и амилоидо-
зом в определенной степени подтверждается
случаями регрессии клинических проявлений
амилоидоза после радикального удаления опу-
холи. Наше наблюдение также подтверждает это
положение.
У больной Л., 41 года, в связи с появлением
кровавого цвета мочи при обследовании выявлены
протеинурия до 6—16 г/л, а при внутривенной уро-
графии — признаки опухоли правой почки. Произ-
ведена правосторонняя нефрэктомия. В нижнем по-
люсе удаленной почки обнаружен узел опухоли (ги-
стологически — рак паренхимы почки). Вне опухо-
ли выявлен склероз многих клубочков и стенок ар-
териол. В стенках мелких сосудов, в базальной мем-
бране клубочков и в интиме крупных сосудов обна-
ружен амилоид. В связи с амилоидозом начата тера-
пия делагилом в сочетании с приемом сырой пече-
ни, проводившаяся в течение года. За это время от-
мечены нормализация СОЭ, гемоглобина, снижение
протеинурии до 0,9—0,6 г/л, полное восстановление
белкового состава крови.
Таким образом, среди патогенетических ме-
ханизмов паранеопластического амилоидоза
можно предположить подавление иммунной
системы опухолевым ростом, распад опухоли с
постоянной антигенной стимуляцией, выработ-
ку предшественника амилоида непосредствен-
но самой опухолью (локальный амилоид стро-
мы опухоли эндокринных желез), присоедине-
ние инфекции к опухолевому процессу.
С учетом этого понятна общность паранеоп-
ластического амилоидоза и различных видов
вторичного амилоидоза, что подтверждается
морфологическими свойствами опухолевого
амилоида — наличием белка ДА.
В отличие от амилоидоза, возможность свя-
зи которого с опухолью отмечается давно, па-
ранеопластическую нефропатию, напоминаю-
щую нефрит, стали описывать лишь в после-
днее время, особенно после широкого внедре-
ния в практику прижизненной биопсии почки
с применением современных методов изучения
состава обнаруживаемых на БМ клубочка ИК.
В частности, установлены идентичность анти-
генных свойств компонентов ИК базальных
мембран клубочков и отдельных детерминант
опухоли — рака легкого, рака толстой кишки.
Высказывается также предположение о ме-
таболическом механизме развития паранеопла-
стического НС (дефицит L-аспарагина). Наибо-
лее часто паранеопластическая нефропатия по
типу нефрита развивается при бронхогенном
раке легкого, раке желудка и кишечника (осо-
бенно раке толстой кишки) и лимфопролифе-
ративных опухолях (в первую очередь лимфо-
мах, особенно лимфогранулематозе). Клиничес-
ки паранеопластическая гломерулопатия отли-
чается от обычного (брайтова) нефрита боль-
шей частотой типичного нефротического син-
дрома и быстрым наступлением почечной не-
достаточности. При таком «злокачественном»
быстропрогрессирующем течении нефропатии
необходимо всегда исключать ее паранеоплас-
тический генез.
Наиболее часто поражение почек при пара-
неопластической гломерулопатии характеризу-
ется мембранозным или мембранозно-пролифе-
ративным (мезангиокапиллярным) ГН с типич-
ными субэпителиальными электронно-плотны-
ми депозитами, при иммуногистохимическом
исследовании выявляются отложения IgG и
IgM и СЗ-фракция комплемента.
Важно иметь в виду также и то, что опухо-
ли самой почки, помимо амилоидоза, индуци-
руют развитие нефрита, который вследствие
нередко длительного существования нефрокар-
циномы может даже претерпевать морфологи-
ческую эволюцию в сторону фибропластичес-
кой трансформации.
В последнее время появились описания раз-
вития фокально-сегментарного гломерулярно-
го гиалиноза при опухолях (феохромоцитома,
лимфогранулематоз), причиной которого, как
считают авторы, является локальная гиперко-
агуляция.
Таблица 30.2. Морфологические изменения в
почках (в процентах) при паранеопластической гло-
мерулопатии
Морфологический вариант нефрита PM.Cos- ta Собст- венные данные
Мембранозный 89 25
Лобулярный 5,5 —
Мезангиокапиллярный — 31,2
Мезангиопролиферативный — 37,5
Фибропластический — 6,3
«Минимальные» изменения 5,5 —
543
Наши наблюдения (табл. 30.2) также свиде-
тельствуют о большом разнообразии морфоло-
гических вариантов паранеопластической гло-
мерулопатии, при этом каких-либо закономер-
ностей их сочетания с особенностями опухоли
выявить не удается.
Лечение паранеопластических поражений
почек хотя и представляет весьма трудную за-
дачу, но прежде всего должно быть этиологи-
ческим. Своевременное и радикальное удаление
опухоли приводит к быстрому уменьшению
признаков нефротического синдрома, а его
рецидив или появление у больного, опериро-
ванного ранее в связи с новообразованием,
может свидетельствовать о рецидиве опухоли
или метастазировании, что подтверждает так-
же прямую связь между опухолью и паранеоп-
ластическим вовлечением в процесс почек.
Приводим наблюдение.
Больной Т., 64 лет, в 1971 г. перенес удаление
опухоли гипофиза. С ноября 1978 г. выявлены изме-
нения в моче: протеинурия до 6 г/л, эритроцитурия,
периферические отеки. В марте 1979 г. при обследова-
нии в клинике — картина нефротического синдрома
(содержание общего белка 60 г/л, альбуминов 28 г/л,
холестерина 8,49 ммоль/л), гиперфибриногенемия,
гипергаммаглобулинемия. При пункционной биопсии
почки выявлен мембранозный гломерулонефрит. В ре-
зультате «прицельного» повторного обследования
обнаружен рецидив опухоли гипофиза.
Влияние успешной химиотерапии опухоли
на течение паранеопластической нефропатии
демонстрирует следующее наблюдение.
Больная П-ва, 37 лет, заболела в декабре 1984 г.,
когда появились резкая слабость, субфебрильная тем-
пература, озноб, похудание. В это же время обнару-
жены протеинурия до 0,5 г/л, эритроцитурия. Диаг-
ностирован острый нефрит. Проводилась терапия пе-
нициллином, метиндолом; эффекта не было. Через 1,5
мес сформировался нефротический синдром, появи-
лись увеличенные, болезненные при пальпации шей-
ные и подмышечные лимфатические узлы. Биопсия
лимфатического узла выявила картину лимфограну-
лематоза. Для уточнения характера поражения почек
больная поступила в клинику. Констатирован нефро-
тический синдром с максимальной протеинурией до
10 г/сут, увеличением СОЭ до 54 мм/ч. При биопсии
почки выяапена картина мезангиокапиллярного ГН.
Начата терапия преднизолоном, циклофосфамидом,
винкристином. После 3-го курса химиотерапии состо-
яние больной значительно улучшилось, в анализах
мочи содержание белка 0,3 г/л.
Таким образом, точное знание причины
поражения почек чрезвычайно важно для судь-
бы больного: поражение, обусловленное пара-
неопластической гломерулопатией, часто хоро-
шо поддается лечению ГК и цитостатиками; в
то же время течение амилоидоза может ухуд-
шиться под действием этих средств.
544
Когда паранеопластический нефротический
синдром обнаруживается после выявления опу-
холи или одновременно с ней, связь этих со-
стояний не вызывает сомнений. Значительно
труднее заподозрить паранеопластический генез
поражения почек при отсутствии непосред-
ственных признаков локализации опухоли. Из-
менения в моче и тем более нефротический
синдром нередко долго рассматривают как изо-
лированный нефрит, назначая ГК и отклады-
вая хирургическое лечение опухоли. В этих слу-
чаях возраст больного (40 лет и более), у кото-
рого впервые появились признаки поражения
почек, «внезапное» развитие нефротического
синдрома, быстрая смена стадий поражения
почек, особенно быстропрогрессирующее тече-
ние нефропатии, наличие системных проявле-
ний (кожно-мышечно-суставных, гематологи-
ческих и других паранеопластических реакций),
обнаружение при биопсии почки мембранозных
изменений или амилоидоза при отсутствии
причин для вторичного амилоидоза, а также на-
следственное предрасположение к опухолевым
заболеваниям позволяют заподозрить опухоле-
вую (паранеопластическую) этиологию пораже-
ния почек.
Выделение «почечных» масок паранеоплас-
тических реакций имеет большое практическое
значение, так как позволяет в более короткие
сроки и более целенаправленно обследовать
больного, а значит, раньше поставить правиль-
ный диагноз и предпринять соответствующее
лечение.
Отдельную проблему представляют пора-
жения почек, обусловленные лече-
нием злокачественных заболеваний.
Как одно из осложнений лучевой терапии опу-
холей яичка, яичников, других опухолей малого
таза и брюшной полости может возникнуть ра-
диационный нефрит — острый, хронический, а
также бессимптомная протеинурия и гиперто-
ния, в том числе злокачественная. Морфологи-
чески радиационные поражения почек харак-
теризуются постепенным развитием клубочко-
вого и интерстициального фиброза, степень
которого зависит от дозы и длительности об-
лучения. Если острый радиационный нефрит
развивается в течение первого года после лу-
чевой терапии и проявляется отеками, проте-
инурией, анемией, азотемией, присоединяю-
щейся часто злокачественной гипертонией, то
хронический радиационный нефрит может воз-
никнуть через 2—5 лет после лучевой терапии
и проявиться признаками ХПН с синдромом
тяжелой гипертонии (особенно после односто-
роннего облучения), иногда с хорошим резуль-
татом после нефрэктомии.
Используемые в настоящее время противо-
опухолевые химиопрепараты обладают опреде-
ленной нефротоксичностью, обычно сочетаю-
щейся с системным побочным действием; это
относится к метотрексату, циклофосфамиду,
митомицину С, цисплатину. Нефротоксичность
названных препаратов проявляется не только
быстрым возникновением протеинурии и гема-
турии, но и более выраженными признаками
повреждения канальцев вплоть до канальцево-
го некроза с острой почечной недостаточнос-
тью. Особенностью такого токсического дей-
ствия цисплатина является гипомагниемия,
требующая назначения препаратов магния, при
применении митомицина С развивается своеоб-
разная микроангиопатия с гемолитической ане-
мией, тромбоцитопенией (своеобразный гемо-
литико-уремический синдром), при использо-
вании циклофосфамида возможно развитие
тяжелого острого и хронического поражения
мочевого пузыря (геморрагический цистит,
фиброз мочевого пузыря, опухоли мочевого
пузыря и почек).
Таким образом, поражение почек при раз-
личных злокачественных опухолях весьма мно-
гообразно — от вовлечения почек в метастати-
ческий процесс до выраженных метаболичес-
ких и электролитных повреждений. Особую
группу представляют паранеопластические не-
фропатии (амилоидоз, гломерулопатия типа
нефрита, гормонально-обусловленные нефропа-
тии), развивающиеся или вследствие иммунных
механизмов, или в результате эктопической
продукции опухолью биологически активных
веществ. Отдельно выделяются опухолевые па-
рапротеинемические поражения почек (см. со-
ответствующий раздел).
Наконец, в современных условиях исполь-
зования активного противоопухолевого лечения
выделяется проблема нефротоксического дей-
ствия такой терапии.
Литература
Мухин Н.А., Полянцева Л.Р., Хасабов Н.Н. Паранео-
пластические реакции при злокачественных опухо-
лях паренхимы почек//Урол. и нефрол. — 1978. —
№ 4. - С. 65-68.
Мухин Н.А., Хасабов Н.Н., Дзгоева Ф.У. Паранеопла-
стический амилоидоз//Тер. арх. — 1980. - № 4. -
С. 95-97.
35—2950
Гпава 31
АМИЛОИДОЗ ПОЧЕК
Н. А. Мухин, В. В. Серов, Л. В. Козловская
Амилоидоз — групповое понятие, объединя-
ющее заболевания, отличительным признаком
которых является внеклеточное отложение в
тканях специфического нерастворимого фиб-
риллярного белка — амилоида. Почки часто во-
влекаются при генерализованных формах ами-
лоидоза; амилоидная нефропатия может прева-
лировать в клинической картине или конкури-
ровать с поражением других жизненно важных
органов — сердца, нервной системы, желудоч-
но-кишечного тракта, значительно утяжеляя
течение заболевания и определяя прогноз.
Термин «амилоид» ввел R.Virchow, который
выявил свойство вещества, выпадающего в
тканях при так называемой сальной болезни
(у больных туберкулезом, актиномикозом, си-
филисом), окрашиваться йодом, подобно крах-
малу. Несмотря на то что в дальнейшем была
выяснена белковая природа амилоида, термин
закрепился в медицинской литературе. Особен-
ностью амилоидной фибриллы по сравнению с
другими фибриллярными белками интерстиция
является своеобразная пространственная орга-
низация молекулы, проявляющаяся в ее кросс-
/3-складчатой конформации. Благодаря ^-склад-
чатой структуре фибрилла амилоида обладает
свойством двойного лучепреломления, т.е. рас-
щепляет падающий световой луч на два, один
из которых поглощается молекулой (дихроизм
молекулы). Это свойство используется в диаг-
ностике амилоидоза: в поляризованном свете
наличие амилоида в морфологических препара-
тах, окрашенных красным конго, определяет-
ся по характерному зеленому свечению.
Распределение амилоидоза среди населения
земного шара изучено недостаточно.
В США заболеваемость AL-амилоидозом со-
ставляет 5,1—12,8 на 1 млн населения в год (в
среднем 1275—3200 новых случаев ежегодно),
частота АА-амилоидоза оценивается в 9— 11 раз
выше [Rodney Н. et al., 1997]. По данным ЕДТА,
среди причин почечной недостаточности в
546
1992 г. на амилоидоз почек пришлось около 1 %,
в некоторых странах Северной Европы (Фин-
ляндия, Норвегия, Швеция) — значительно
выше (в Финляндии около 19 %) за счет рас-
пространенного в этих странах семейного
ATTR-амилоидоза.
Согласно регистру Медицинского научного
совета Великобритании по гломерулонефриту,
в 1985 г. амилоидоз почек выявлен у 2,8 % сре-
ди 3362 больных, кому проведены биопсии
почек. По данным регистра биопсий почек, в
Италии частота амилоидоза почек составила в
среднем 2,5 % (от 3,2 до 2,2 %) среди 14 477
биопсий, выполненных за период 1987—1993 гг.
в 71 центре страны. По материалам прозектуры
ММА им. И. М.Сеченова за 20 лет [Серов В. В.,
Шамов И. А., 1977], на долю амилоидоза при-
шлось 1,08 % всех вскрытий, из них на первич-
ный AL-амилоидоз — 0,1 %.
Классификация амилоидоза,
этиология, патогенез. Амилоидная фиб-
рилла представляет собой продукт конденсации
различных белков. Основной фибриллярный
белок, содержание которого в амилоиде дости-
гает 80 %, образуется из белка-предшественни-
ка, специфичного для каждого типа амилоида.
Строгое соответствие основного белка-пред-
шественника определенному клинико-морфоло-
гическому типу амилоида дает ключ к понима-
нию патогенеза разных форм амилоидоза. На
принципе дифференциации типов амилоида и
соответствующих белков-предшественников
построены современные классификации амило-
идоза.
В классификации ВОЗ 1993 г. каждый тип
амилоида имеет буквенное обозначение, в ко-
тором первая прописная буква А указывает на
«амилоид», последующие — на краткое назва-
ние основного фибриллярного белка амилоида.
Выделяют системные (генерализованные) и
локальные формы амилоидоза.
К системному (генерализованному) амило-
Таблица 31.1. Классификация системного амилоидоза (ВОЗ, 1993)
Белок амилоида Белок-предшестеенник Вариант белка Клиническая форма
АА ApoSAA — сыворо- точный А-белок SAA2a, SAA20 • Вторичный амилоидоз • Периодическая болезнь • Синдром Макла — Уэлса
AL к, А — легкие цепи иммуноглобулинов AkIII, aavi • Первичный амилоидоз • Ассоциированный с В-лимфоцитарными дискразиями
ATTR Транстиретин “Met 111Met Немутантный TTR Семейная амилоидная полинейропатия » » кардиопатия Системный сенильный амилоидоз
ААроА-1 Аполипопротеин 1 26Arg Семейная амилоидная полинейропатия с гепа- тоспленомегалией
AGel AFib ALis А£2М Гелсолин Фибриноген Аа Лизоцим /32-Микроглобулин 187(15)Asn Семейная амилоидная полинейропатия » » нефропатия » » » Связанный с хроническим гемодиализом
идозу относятся (табл. 31.1) АА-амиловдоз, AL-
амилоидоз, семейный ATTR-амилоидоз и дру-
гие формы семейного амилоидоза (распростра-
ненные в определенных районах земного
шара — в Швеции, Дании, Португалии, Фин-
ляндии и др.), сенильный ATTR-амилоидоз,
/?2М-амилоидоз (диализный).
АА-амилоидоз объединяет вторичный реак-
тивный амилоидоз, амилоидоз в рамках пери-
одической болезни и синдрома Макла — Уэл-
са. Среди причин вторичного АА-амилоидоза
большая роль принадлежит ревматоидному ар-
триту (РА), анкилозирующему спондилоартриту
(болезнь Бехтерева), псориатическому артриту
и опухолям, в том числе гематологическим
(лимфома, лимфогранулематоз). В странах Ев-
ропы амилоидоз развивается у 10 % больных РА
и ювенильным РА (ЮРА). По материалам кли-
ники им. Е.М.Тареева ММА им. И.М.Сеченова
[Мухин Н.А. и др., 1980; Кочубей Л.Н. и др.,
1993], РА, ЮРА и болезнь Бехтерева занима-
ют первое место в ряду предрасполагающих к
вторичному АА-амилоидозу заболеваний, со-
ставляя 43 % среди 146 больных, паранеопла-
стический АА-амилоидоз — 17 % (из 25 боль-
ных с опухолями у 14 был выявлен лимфогра-
нулематоз, у 7 — опухоль почек, у 2 — менин-
гиома, у 1 — хемодектома, у 1 больного —
хронический лимфолейкоз). Возрастающее зна-
чение в структуре причин АА-амилоидоза при-
обретают хронические заболевания кишечни-
ка — неспецифический язвенный колит и бо-
лезнь Крона. Сохраняется значение хроничес-
ких гнойно-деструктивных процессов и тубер-
кулеза, хотя они отступают на второй план в
связи с внедрением эффективных методов ле-
чения.
АА-амилоидоз развивается у 40 % больных
периодической болезнью, средиземноморской
лихорадкой [Виноградова О.М., 1973], которая
наблюдается у выходцев из района Средизем-
ного моря, у нас в стране — среди армян и
евреев, имеет рецессивный тип наследования
и характеризуется рецидивирующими присту-
пами лихорадки, болей в животе, грудной клет-
ке, суставах. К АА-амилоидозу относится так-
же синдром Макла — Уэлса — доминантно-
наследуемая семейная нефропатия с крапивни-
цей и глухотой. В России 2 случая семейного
амилоидоза, клинически сходного с синдромом
Макла — Уэлса, были описаны О.М.Виногра-
довой (1980).
АА-амилоид образуется из сывороточного
предшественника (SAA) — острофазового бел-
ка, продуцируемого в ответ на воспаление, при
котором его количество повышается во много
раз; SAA является а-глобулином, по своим
функциональным свойствам близким С-реак-
тивному белку; у человека и животных синте-
зируется клетками разных типов (гепатоцита-
ми, нейтрофилами, фибробластами).
Органами-мишенями АА-амилоидоза явля-
ются почки, печень, селезенка, кишечник,
надпочечники.
AL-амилоидоз включает первичный (идиопа-
тический) амилоидоз, амилоидоз при миелом-
ной болезни и В-клеточных опухолях (болезнь
Вальденстрема и др.). Большинство исследова-
телей рассматривают AL-амилоидоз (и первич-
ный, и связанный с миеломой) в рамках еди-
ной В-лимфоцитарной дискразии. Полагают,
что аномальный клон плазматических или В-
клеток в костном мозге продуцирует иммуно-
глобулины, обладающие амилоидогенностью.
Предшественниками AL-амилоида служат ва-
риабельные участки легких цепей монокло-
нального иммуноглобулина, чаще А-, реже
к-типов.
35
547
Основными органами-мишенями при AL-
амилоидозе являются сердце, язык, желудоч-
но-кишечный тракт, нервная система, кожа, а
также почки.
К А ТТR-амилоидозу относятся семейная ами-
лоидная полинейропатия (реже кардиопатия и
нефропатия) с аутосомно-доминантным типом
наследования, системный старческий амилои-
доз. Сывороточным белком-предшественником
амилоидоза в этой группе является компонент
молекулы преальбумина транстиретин — транс-
портный белок для тироксина и ретинола, пер-
вично синтезируемый в печени. Установлено,
что наследственный семейный амилоидоз явля-
ется результатом мутации в гене, ответствен-
ном за синтез молекулы транстиретина. Мутан-
тные формы и других белков — аполипопроте-
ина А-1, гелсолина, фибриногена Аа и лизо-
цима также могут вести к развитию наслед-
ственного амилоидоза, в том числе нефропа-
тического (см. табл. 31.1), однако мутантный
(вариантный) TTR является наиболее частым
предшественником семейного амилоидоза.
В основе системного старческого амилоидо-
за лежит немутантный (невариантный) транс-
тиретин. Старческий системный амилоидоз
имеет в качестве основных органов-мишеней
сердце, сосуды, отличается от кардиопатии при
AL-амилоидозе в целом меньшей тяжестью
поражения, нередким сочетанием с атероскле-
розом.
АД2М(диализный)-амилоидоз (подробнее см.
главу «Хроническая почечная недостаточ-
ность») — форма системного амилоидоза, раз-
вивающаяся у пациентов, находящихся на дли-
тельном гемодиализе (в среднем через 7 лет).
Белком-предшественником является ^-микро-
глобулин (₽2М), который плохо фильтруется
через большинство диализных мембран совре-
менного типа и задерживается в организме.
Основными органами-мишенями являются ко-
сти, периартикулярные ткани (могут возникать
переломы костей, требующие ортопедических
мероприятий вплоть до протезирования). Часто
наблюдается синдром карпального канала (оне-
мение и боль в первых 3 пальцах кисти, рас-
пространяющиеся на предплечье, с последую-
щим развитием атрофии мышц тенара) из-за
сдавления срединного нерва отложениями ами-
лоидных масс в области карпальной связки.
Амилоидогенез является сложным и многосту-
пенчатым процессом, многие звенья которого
остаются неясными [Серов В.В. и др., 1995;
Rodney Н., Falk M.D. et al., 1997].
Известные в настоящее время белки-пред-
шественники системных форм амилоидоза,
циркулирующие в крови больных амилоидозом,
обнаруживаются и в крови здоровых индиви-
дов. Среди причин появления (усиления) ами-
548
лоидогенности белков-предшественников кро-
ви в настоящее время рассматривают их моле-
кулярную гетерогенность, т.е. существование
амилоидогенных аллотипов белка. Амилоидоген-
ный вариант белка-предшественника может
наследоваться либо возникать в результате
спонтанных мутаций в течение жизни.
Так, в эксперименте показано, что L-цепи
подтипов AVI и к! вследствие отдельных ами-
нокислотных замен в вариабельных участках
отличаются молекулярной нестабильностью и
способны образовывать фибриллярные белко-
вые комплексы in vitro [Bellotti V. et al., 1990;
Hurle M.R. et al., 1994]. Именно эти подтипы
L-цепей чаще циркулируют в крови больных
идиопатическим и ассоциированным с В-кле-
точными опухолями амилоидозом. Большинство
семейных форм амилоидоза характеризуется
циркуляцией в крови вариантных форм транс-
тиретина с измененной аминокислотной по-
следовательностью. На примере этой формы
амилоидоза было показано [McCutchen S.I.,
1993], что нарастание амилоидогенности мутан-
тного транстиретина может быть связано с на-
рушением поверхностного pH, появлением
аномальных электрических зарядов в активных
центрах белковых субъединиц, изменением гид-
рофильности молекулы. В результате дестабили-
зируется архитектоника белковой молекулы,
повышается ее химическая реактогенность, что
способствует конденсации образующихся про-
дуктов в малорастворимые макромолекулярные
белковые комплексы с образованием в конеч-
ном итоге амилоидных фибрилл.
Известно более 50 вариантов транстиретина с
аминокислотной заменой в том или ином положе-
нии [Jawara S. et al., 1983; Wallace M.R. et al., 1986].
Биохимическая вариабельность транстиретина вли-
яет на характер клинических проявлений семейного
амилоидоза [Benson M.D., 1995]. Так, при португаль-
ском типе, проявляющемся полинейропатией с пре-
имущественным поражением нервных стволов ниж-
них конечностей и органов таза, белком-предше-
ственником является транстиретин с заменой мети-
онина на валин в 30-м положении (ATTR [30Met]-
амилоидоз), в то же время преимущественно карди-
опатический датский тип амилоидоза ассоциируется
с транстиретином, в котором метионин в 111-м по-
ложении заменен на лейцин (ATTR[1,1 Met]-амило-
идоз).
Считается, что старческий системный амилоидоз
ассоциируется с транстиретином, имеющим неиз-
мененную аминокислотную последовательность,
однако недавно [Jacobson D.R. et al., 1996, 1997] у
пожилых американцев негроидной расы больных
ATTR-амилоидозом был выявлен амилоид, постро-
енный из остатков транстиретина с заменой изолей-
цина в 122-м положении на валин. Показано, что но-
сителями этого аллеля гена, ответственного за син-
тез транстиретина, являются 3,9 % американцев чер-
ной расы, но обусловленная им амилоидная кар-
диопатия из-за позднего начала распознается редко,
так как маскируется атеросклерозом. Таким образом,
патогенетические различия между старческим систем-
ным амилоидозом и семейным ATTR-амилоидозом
стираются, в связи с чем эти формы амилоидоза все
больше считают вариантами одной болезни.
В последние годы было показано, что попу-
ляция белка SAA также гетерогенна, как это ус-
тановлено для L-цепей и транстиретина. Фраг-
менты не менее 5 молекулярных форм SAA об-
наруживают в амилоидных депозитах. Возмож-
но, что именно эти молекулярные формы SAA
амилоидогенны [Faulkes D.J. et al., 1994].
Конечный этап амилоидогенеза — образова-
ние фибрилл амилоида клетками-амилоидобла-
стами в межклеточном матриксе. Так, считают,
что образование АА из SAA осуществляется
путем неполного расщепления протеазами, свя-
занными с поверхностной мембраной моноци-
тов-макрофагов [Кочубей Л.Н. и др., 1988;
Silverman J. et al., 19821. Полимеризация раство-
римого АА-белка в фибриллы происходит так-
же на поверхности макрофагов механизмом
перекрестного связывания полипептидов при
участии мембранных ферментов. В эксперимен-
те с казеиновым амилоидозом у мышей пока-
зана важная роль в индукции АА-отложений так
называемого амилоидускоряющего фактора
(АУФ), образующегося в селезенке и печени
[Axelrod М. et al., 1980].
Высказывается мнение [Kay J., 1993], что $2М
приобретает амилоидогенные свойства вследствие
частичного протеолиза, обусловленного возможным
действием цитокинов (фактор некроза опухоли а,
интерлейкин-1, интерлейкин-6 и др.), высвобожде-
ние которых стимулируется различными субстрата-
ми — диализной мембраной, компонентами диализ-
ной жидкости и др. Показано, что 02М проявляет
значительную коллагенсвязываюгцую активность,
чем может быть обусловлено преимущественное от-
ложение амилоида в костно-суставных структурах.
Семейный ATTR-амилоидоз, несмотря на
его наследственную природу, обычно проявля-
ется только к середине жизни; развитие сис-
темного старческого ATTR-амилоидоза наблю-
дается исключительно у пожилых людей стар-
ше 70 лет, что рассматривают как убедитель-
ный аргумент в пользу существования «возра-
стных» триггеров амилоидогенеза [Westermark Р.
et al., 1990]. В амилоидогенезе при старческом
амилоидозе, по-видимому, имеют значение
конформационные нарушения белков при на-
растающей с возрастом брадитрофии тканей
(Серов В.В., 1995].
Почки вовлекаются в разной степени при
всех формах генерализованного амилоидоза, од-
нако наибольшее клиническое значение име-
ют АА- и AL-амилоидоз почек. Амилоидная
нефропатия — основное проявление АА-ами-
лоидоза, но и при AL-амилоидозе, который
традиционно рассматривают как кардиопати-
ческий амилоидоз, вовлечение почек наблюда-
ется примерно с той же частотой, что и серд-
ца [Виноградова О.М., 1980]. Более того, в
наблюдении G. Banti, G.Marinone (1995) среди
40 пациентов с AL-амилоидозом у 30 % почки
были единственным органом, поражение кото-
рого клинически выявлялось на момент поста-
новки диагноза. При вскрытии амилоидные
отложения в почках находят в 80 % случаев
первичного AL-амилоидоза.
Морфологическая картина. В боль-
шинстве случаев амилоидоза почки увеличены,
выглядят светлыми с гладкой ровной поверх-
ностью, общая почечная масса может достигать
600 г. Граница между корой и медуллярным сло-
ем плохо различима, размыта. Иногда (в 10 %
случаев) почки имеют неровную поверхность
из-за очаговой атрофии коры, связанной с ар-
териолосклерозом и/или окклюзией почечных
сосудов амилоидными массами. Нередко выяв-
ляется тромбоз почечных вен.
При АА- и AL-амилоидозе амилоид может
располагаться во всех отделах почек, но преиму-
щественно поражаются клубочки [Серов В.В.,
Шамов И. А., 1977; Striker L. J. et al., 1994]. При
AL-амилоидозе амилоидные отложения могут
ограничиваться внегломерулярными областями,
не затрагивая самих клубочков.
В световом микроскопе амилоид выглядит
как аморфные слегка эозинофильные массы,
принадлежность которых к амилоиду подтвер-
ждается при окраске конго красным (розово-
красное окрашивание) с последующей микро-
скопией в поляризованном свете (появление
зеленого свечения из-за характерного свойства
двойного лучепреломления). Другие методы
выявления амилоида — с помощью тиофлави-
на-Т (коричнево-зеленое окрашивание), крис-
таллического фиолетового (коричнево-красное
окрашивание) — по специфичности уступают
окраске конго красным. Типировать AL- и АА-
амилоид возможно, применяя окраску конго
красным с добавлением трипсина или перман-
ганата калия, при этом АА-амилоид утрачива-
ет свойство двойного лучепреломления и теря-
ет окраску, в то время как AL-амилоид благо-
даря устойчивости к протеолизу сохраняет ок-
раску. Сходный принцип используется и в ме-
тоде дифференциации AL- и АА-амилоидоза с
добавлением щелочного гуанидина. Эффектив-
ным методом является применение специфи-
ческих антисывороток (антитела к АА-амилои-
ду и легким цепям иммуноглобулинов) в ком-
бинации с иммунопероксидазной окраской,
однако и с помощью этого подхода не всегда
удается идентифицировать AL-тип амилоида.
549
На ранней стадии поражения почек отложе-
ния амилоида обнаруживаются в мезангии в
виде очагов (узлов) вблизи основания сосуди-
стого пучка. При этом отсутствует пролифера-
ция мезангиальных клеток, базальная мембра-
на клубочка (БМК) интактна. По мере прогрес-
сирования происходит распространение амило-
ида через капиллярный пучок к периферии
клубочка. Вначале наблюдается очаговая ин-
фильтрация капиллярной стенки с расположе-
нием амилоида вдоль эндотелиальной поверх-
ности БМК, затем отдельные массы амилоида
появляются в субэпителиальном пространстве,
вблизи больших отростков подоцитов, посте-
пенно они охватывают всю длину стенки. На
более поздней стадии нормальная структура
клубочка стирается, амилоидные массы слива-
ются с БМК. Иногда на границе с амилоидны-
ми депозитами видны гигантские многоядерные
клетки, участвующие в резорбции амилоидных
фибрилл амилоида. Могут выявляться (редко)
и клеточные полулуния в капсуле клубочка
(боуменовой капсуле). В конечном итоге разви-
вается полная облитерация клубочков, причем
они остаются увеличенными, на периферии
формируются зоны коллагена. Как правило,
амилоидом инфильтрированы сосуды (артерии
и вены) разных калибров, при этом с самого
начала поражается вся толща сосудистой стен-
ки, включая адвентиций.
Отложения амилоида обнаруживаются и в
других структурах почки — вдоль тубулярной ба-
зальной мембраны дистальных канальцев и
петли Генле с возможной атрофией канальцев,
интерстициальной ткани.
В электронном микроскопе фибриллы ами-
лоида имеют 8—10 пм в ширину и 30 пм (до
Г мкм) в длину, отличаются компактным и
параллельным расположением; при световой
микроскопии они могут напоминать «шиповид-
ные» образования при мембранозной нефропа-
тии.
Показано, что проникновение амилоида в
субэпителиальное пространство вызывает сли-
яние ножек подоцитов, конденсацию в них
микрофиламентов, отделение от lamina гага
externa с фокальным обнажением БМК. Эти
изменения коррелируют с выраженностью про-
теинурии. Подоциты, по-видимому, играют ос-
новную роль и в процессах репарации в клу-
бочках. Во время репаративной фазы, которая
продолжается в течение нескольких лет, подо-
циты медленно восстанавливаются, начинают
синтезировать новую БМК, которая образует
второй мембранный слой, что приводит к сни-
жению протеинурии и улучшению почечной
функции.
Клиническая картина. Амилоидоз
почек манифестирует обычно протеинурией,
550
которая при АА-амилоидозе обнаруживается
чаще и более выражена, чем при AL-амилои-
дозе. Так, частота выявления протеинурии при
АА-типе составляет 100 % [Мухин Н.А., 1981],
при AL-амилоидозе — 82 % [Kyle R.A., Greipp
P.R., 1983]. Протеинурия как наиболее досто-
верный признак поражения почек выявляется
в разные сроки: по нашим данным, одинаково
часто как в первые 3 года, так и после 10 лет
существования основного заболевания. В ранний
период болезни протеинурия может эпизоди-
чески уменьшаться или усиливаться, особенно
при обострении основного заболевания. Но
обычно она довольно скоро принимает посто-
янный и достаточно выраженный характер. Зна-
чительная потеря белка почками, а также ряд
других факторов (усиление катаболизма белка
в организме, уменьшение всасывания и усилен-
ное выделение белка через желудочно-кишеч-
ный тракт) приводят к развитию гипопротеи-
немии с гипоальбуминемией (до 10 г/л) и свя-
занного с ними отечного синдрома. Более ха-
рактерно постепенное развитие нефротическо-
го синдрома (НС) вслед за стадией умеренной
протеинурии, иногда весьма длительной.
Но достаточно часто — у 46—50 % больных
с АА-амилоидозом [Кочубей Л.Н. и др., 1993]
и у 32 % — с AL-амилоидозом [Виноградо-
ва О. М., 1980; Kyle R. A. et al., 1983] — забо-
левание диагностируется на стадии НС. По
сводным данным F.P.Schena и соавт. (1996),
среди 259 пациентов с почечным амилоидозом
(и АА-, и AL-типов) НС отмечен у 80 %. Воз-
можная связь нефротического синдрома с ами-
лоидозом увеличивается с возрастом. Так, сре-
ди 317 пациентов пожилого возраста (старше 60
лет) амилоидоз как причина развития у них НС
выявлен у 10,7 % [Johnston Р. A. et al., 1992]. НС,
обусловленный амилоидозом, может протекать
со всеми классическими симптомами — массив-
ной протеинурией, гипоальбуминемией, гипер-
холестеринемией и большими отеками. Как
правило, отеки развиваются довольно рано,
приобретают распространенный и упорный
характер, оставаясь значительными и в терми-
нальном уремическом периоде. Хотя отеки при
амилоидозе возникают у большинства больных,
их отсутствие возможно в связи с потерей на-
трия (инфильтрация амилоидом надпочечни-
ков).
Среди других манифестаций амилоидоза
почек наблюдается почечная недостаточность.
По данным F.P.Schena и соавт. (1996), ХПН к
моменту подтверждения амилоидоза почек вы-
являлась у 33 % и ОПН — у 6 % больных.
В 12,5 % случаев [Falack Н.М. et al., 1983]
возможно начало клинических проявлений ами-
лоидоза почек с почечной недостаточностью
без протеинурии, что объясняют преимуще-
ственным поражением амилоидом сосудов без
существенного вовлечения клубочков, чаще при
AL-амилоидозе. Иногда при амилоидозе почек
независимо от его типа отмечается быстрое
прогрессирование почечной недостаточности в
результате тромбоза почечных вен (реже) и/или
выраженной атрофии канальцев (чаще). Тубу-
лоинтерстициальные нарушения с развитием
интерстициального фиброза в большей степе-
ни, чем количество отложений амилоида в клу-
бочках, коррелируют с выраженностью почеч-
ной недостаточности, поэтому выявление ка-
нальцевой дисфункции, в том числе и с по-
мощью радионуклидных методов, имеет важное
прогностическое значение.
Несмотря на хроническую почечную недо-
статочность, размеры почек при УЗИ остают-
ся увеличенными в большинстве случаев. К
особенностям амилоидной нефропатии, как уже
было сказано, относится также сохранение
нефротического синдрома при развитии почеч-
ной недостаточности, даже если уровень клу-
бочковой фильтрации снижается до критичес-
кого.
Для амилоидоза почек характерен скудный
мочевой осадок, в том числе у больных с мас-
сивной протеинурией, однако это классическое
представление правомерно не всегда. Может вы-
являться (по разным данным, в 3,3—11,5 % слу-
чаев) стойкая микрогематурия, иногда (у 0,3 %
больных) макрогематурия, которая требует
исключения опухолевого процесса. Асептичес-
кая лейкоцитурия встречается у 30—40 % боль-
ных без сопутствующего пиелонефрита. Соответ-
ственно степени протеинурии обнаруживаются
гиалиновые и реже зернистые цилиндры, да-
ющие резко положительную ШИК-реакцию, а
также липидурия с наличием двоякопреломля-
ющих кристаллов и капель в осадке мочи.
Примерно у 25 % больных с AL-амилоидо-
зом отмечается ортостатическая гипотония
вследствие нарушений вегетативной нервной
системы (диффузная автономная нейропатия).
Даже при прогрессировании почечной недоста-
точности со значительным повышением уров-
ня сывороточного креатинина системная гипер-
тония у больных с AL-амилоидозом развивается
редко. У больных с АА-амилоидозом артериаль-
ная гипертония наблюдается в 23 % случаев,
чаще в конечной стадии болезни как проявле-
ние ХПН, но может быть обнаружена у 15 %
еще до появления ХПН. Обычно артериальная
гипертония невысокая, хотя может быть и зло-
качественной; редки, но возможны, тяжелые
гипертонические кризы.
Внепочечные проявления амилоидоза зави-
сят от типа амилоида и стадии болезни. Для
системного амилоидоза, особенно первично-
го, характерно последовательное присоеди-
нение новых симптомов, создающих поли-
морфную клиническую картину с многоорган-
ными проявлениями, что важно иметь в виду
при диагностике амилоидоза, в том числе с
преимущественным поражением почек.
Сердце часто вовлекается в процесс при AL-
амилоидозе; при АА-типе клинически значимое
поражение сердца наблюдается редко. Амилои-
доз сердца при AL-амилоидозе характеризует-
ся в первую очередь развитием рефрактерной
к лечению застойной сердечной недостаточно-
сти по рестриктивному типу. У 23 % больных
сердечная недостаточность диагностируется уже
в дебюте болезни и затем быстро прогрессиру-
ет, являясь причиной смерти 40 % пациентов
[Виноградова О.М., 1980]. В зависимости от
локализации депозитов амилоида в миокарде
могут наблюдаться синдром слабости синусо-
вого узла, атриовентрикулярная блокада, раз-
нообразные аритмии, очаговые поражения
миокарда (псевдоинфаркт).
На ЭКГ наиболее часто встречаются сниже-
ние вольтажа зубцов, нарушения ритма и про-
водимости. При ЭхоКГ отмечается картина ре-
стриктивной кардиопатии с признаками диас-
толической дисфункции, которая лучше диаг-
ностируется по изменению трансмитрального
кровотока при допплерэхокардиографии.
Периферическая и вегетативная нервная сис-
тема может поражаться при AL-амилоидозе: от-
мечаются повреждения аксонов с поражением
тонких миелинизированных и немиелинизиро-
ванных нервных стволов. Периферическая по-
линейропатия — сенсорная, редко моторная
(как правило, симметричная, начинающаяся с
дистальных отделов конечностей и распростра-
няющаяся на проксимальные), развивается у
17 % больных и может преобладать в клиничес-
кой картине, создавая диагностические трудно-
сти. Нарушения вегетативной нервной системы
(автономные дисфункции) проявляются сим-
птомами ортостатической гипотонии, импотен-
цией, сфинктерными расстройствами. У 20 %
больных AL-амилоидозом развивается синдром
карпального канала (парестезии и боли в кис-
тях по ходу ветвей срединного нерва), который
может предшествовать развитию других симп-
томов болезни; при АА-амилоидозе он не на-
блюдается.
Желудочно-кишечный тракт при амилоидозе
поражается на всем протяжении. Макроглос-
сия — нечастый (у 22 %), но очень характер-
ный признак AL-амилоидоза, при АА-амило-
идозе макроглоссия не развивается. Может по-
ражаться пищевод, иногда находят опухолевид-
551
ное отложение амилоида в желудке или кишеч-
нике. Возникновение поноса и других проявле-
ний кишечной диспепсии у больных амилои-
дозом обусловлено гипермоторной энтеропати-
ей вследствие отложения амилоида по ходу не-
рвных сплетений кишечника. Диарея как про-
явление изолированного синдрома нарушенного
всасывания в тонком кишечнике встречается
лишь у 5 % больных AL-амилоидозом и у 13—
20 % больных АА-амилоидозом, так как отло-
жения амилоида в ворсинках тонкого кишеч-
ника редки, депозиты амилоида чаще обнару-
живаются в подслизистом слое. В связи с этим
для выявления амилоида рекомендуют прово-
дить биопсию слизистой оболочки кишечника
с подслизистым слоем.
Поражение амилоидом поперечнополосатой
мускулатуры характерно для AL-амилоидоза.
Мышцы больных выглядят плотными, увели-
ченными, отмечается выраженная мышечная
слабость (псевдогипертрофия).
Печень закономерно вовлекается в патологи-
ческий процесс у 30 % больных AL- и у 50—
60 % АА-амилоидозом. Гепатомегалия появля-
ется уже на ранних стадиях амилоидоза, одна-
ко белково-синтетическая и другие функции
печени на протяжение всего заболевания, как
правило, остаются сохранными. Амилоидоз пе-
чени чаще проявляется симптомами умеренного
холестаза.
Селезенка увеличена только у 5 % больных
AL-амилоидозом, у больных АА-амилоидозом
спленомегалия выявляется у 30—40 %.
Респираторный тракт чаще вовлекается в
процесс при AL-амилоидозе — у 50 % боль-
ных (при АА-амилоидозе — у 10—14 %). Охрип-
лость голоса, связанная с вовлечением голосо-
вых связок, по данным больших статистик,
опережает проявления, обусловленные отложе-
ниями амилоида в дистальных отделах — брон-
хах, альвеолярных перегородках и сосудах. Воз-
можен опухолевидный легочный амилоидоз,
имитирующий картину рака легкого.
У больных AL-амилоидозом наблюдаются
развитие геморрагического синдрома с харак-
терными кровоизлияниями вокруг глаз («глаза
енота», «симптом очков»), вовлечение щито-
видной железы, надпочечников (с их недоста-
точностью), самые различные изменения кожи
(папулы, узлы, бляшки, диффузная инфильт-
рация кожи с трофическими изменениями),
суставов.
Изменения лабораторных показателей неспе-
цифичны: увеличение СОЭ, гиперглобулине-
мия, тромбоцитоз, который наряду с малыми
размерами тромбоцитов и появлением в цир-
куляции эритроцитов с тельцами Жолли рас-
сматривают как свидетельство функционального
гипоспленизма, дефицит X фактора свертыва-
552
ния при AL-амилоидозе (как и поражение со-
судов, его считают причиной развития гемор-
рагий). У больных с AL-амилоидозом выявля-
ется плазматизация костного мозга. При первич-
ном амилоидозе плазматические клетки в мие-
лограмме составляют в среднем 5 %, у */4 боль-
ных они превышают 10 % (11—22 %), но при
этом не отмечается лизиса костей и столь вы-
сокого, как при миеломной болезни, уровня
моноклонального иммуноглобулина в сыворот-
ке крови (выше 3 г/дл) и моче (более 2,5 г/сут).
При иммуноэлектрофорезе концентрирован-
ной мочи моноклональные легкие цепи (бе-
лок Бенс-Джонса) выявляются у 72 % больных
AL-амилоидозом [Kyle R.A., Greipp P.R.,
1983] — у 93 % больных с миеломой соотно-
шение к- и Л-цепей составило 50 и 43 %, у
66 % первичным амилоидозом /<:А — 18:48 %.
Диагноз и дифференциальный
диагноз. При диагностике системного амило-
идоза опираются на выявление возможной свя-
зи клинических проявлений, включая пораже-
ние почек, с предшествующим заболеванием и
клинические особенности, обусловленные
тропностью каждого типа амилоида к опреде-
ленным органам и системам. Появление у боль-
ных группы риска АА-амилоидоза (периодичес-
кая болезнь, РА, хронические воспалительные
заболевания и др.), протеинурии позволяет
предполагать в первую очередь амилоидоз, учи-
тывая частоту вовлечения почек при АА-ами-
лоидозе. Однако отсутствие протеинурии, на-
пример у больного периодической болезнью,
еще не означает отсутствия амилоидных отло-
жений в почках, поскольку не наблюдается
полного соответствия между клиническими
признаками и анатомическими находками ами-
лоида. Амилоидные депозиты при гистологичес-
ком изучении обнаруживаются во многих орга-
нах (тканях), но клинические проявления за-
висят от преимущественно вовлеченных орга-
нов и/или систем.
В дифференциальной диагностике системно-
го амилоидоза следует принимать во внимание,
что АА-тип — более молодой: средний возраст
заболевших моложе 40 лет, при AL-амилоидо-
зе — 65 лет. При обоих типах отмечают преоб-
ладание мужчин (1,8:1). Такой клинический
признак, как макроглоссия, свойствен только
AL-амилоидозу и не встречается при АА-типе.
Дефицит Х-фактора коагуляции, параорбиталь-
ные геморрагии, синдром карпального канала
также нехарактерны для АА-амилоидоза. При
АА-типе реже, чем при AL-амилоидозе, наблю-
дается ортостатическая гипотония.
Диагноз амилоидоза должен подтверждать-
ся морфологически. Информативным методом
и при AL-, и при АА-амилоидозе является
исследование биоптата стенки прямой кишки
(желательно слизистого и подслизистого слоев),
при котором вероятность выявления амилоида
составляет 50—70 %. При проведении биопсии
пораженного органа — почки, печени и др. —
амилоид удается обнаружить в 90—100 %. При
AL-амилоидозе применяют также биопсию дес-
ны, костного мозга и метод аспирационной
биопсии подкожной жировой клетчатки из пе-
редней брюшной стенки. При А^2М-амилоидозе
обнаружить амилоид можно в осадке синови-
альной жидкости.
Для выявления амилоидных масс в гистоло-
гических срезах применяют окрасочные мето-
ды (см. «Морфологическая картина»).
Важно не только обнаружить факт наличия
амилоида в тканях, но и провести его типиро-
вание, что возможно также с помощью окра-
сочных методов, с использованием, например,
щелочного гуанидина [Варшавский В. А. и др.,
1998]. Указанным способом лучше диагностиру-
ется АА-амилоидоз; дифференциация AL-ами-
лоидоза не всегда надежна. Более точные резуль-
таты получают, применяя антисыворотки (по-
ли- и моноклональные антитела) к основным
белкам амилоидных фибрилл. Для установления
типа амилоида проводят иммунопероксидазную
реакцию с набором (панелью) этих антисыво-
роток.
В последние годы в клинической практике
применяют метод сцинтиграфии с меченным
'-'4 сывороточным P-компонентом (SAP) для
оценки in vivo распределения амилоида в орга-
низме [Aprile С. et al., 1995]. P-компонент со-
держится в небольшом количестве (5—10 %) в
амилоиде всех типов; радиоактивный SAP, вве-
денный больному амилоидозом, специфически
связывается с амилоидными депозитами; он
может быть визуализирован и количественно
оценен на серии сцинтиграмм. Метод особен-
но полезен для контроля за динамикой ткане-
вых отложений амилоида в процессе лечения.
Течение и прогноз. Течение системно-
го амилоидоза прогрессирующее, прогноз раз-
личается в зависимости от формы амилоидоза,
сроков диагностики и степени вовлечения жиз-
ненно важных органов. На основании анализа
474 случаев AL-амилоидоза [Kyle R.A., Gertz
М.А., 19951 средняя продолжительность жизни
у больных составляет 2—3 года. Самая низкая
выживаемость отмечена у больных с застойной
сердечной недостаточностью (6 мес); у больных
с вовлечением почек она выше — в среднем
21 мес.
По сообщению G.Banti и соавт. (1988), на-
блюдавших 65 больных с AL-амилоидозом (срок
наблюдения 0,5—120 мес), 12-месячная выжи-
ваемость составила 30 % у лиц с миеломной бо-
лезнью и 70 % — у лиц с первичным амилои-
дозом; к 24 мес кривые выживаемости сблизи-
лись: ее показатели равнялись соответственно
30 и 50 %.
A. Bohle и соавт. (1993), изучавшие долгосроч-
ный прогноз у 225 больных амилоидозом по-
чек (143 человека с АА- и 82 — с AL-типом),
установили, что независимо от типа амилои-
доза прогноз хуже, если на время биопсии
(подтверждения диагноза) у больных наблюдал-
ся нефротический синдром; прогноз был зна-
чительно хуже, если отмечались эпизоды ОПН
и выявлялись морфологические признаки ин-
терстициального фиброза.
Среднюю продолжительность жизни у боль-
ных с АА-амилоидозом трудно оценить из-за ге-
терогенности этой популяции, но она больше,
чем у больных AL-амилоидозом; по данным
D.Wegelius и соавт. (1980), она составила 30—
60 мес. Согласно данным Л.Н.Кочубей и соавт.
(1993), основанным на большом материале
клиники им. Е.М.Тареева, средняя продолжи-
тельность жизни больных составила 13,3 года
при вторичном и 6,7 года — при естественном
течении периодической болезни. Показатели 5-
и 10-летней выживаемости в общей группе
больных вторичным АА-амилоидозом от момен-
та выявления протеинурии составили соответ-
ственно 77 и 44 %, у больных периодической
болезнью — 48 и 24 %. Показатель 10-летней
выживаемости (отдаленный прогноз) зависел
от характера предлежащего заболевания и воз-
можности его эффективного лечения: у боль-
ных ревматоидным артритом (болезнью Бехте-
рева) и хроническими воспалительными забо-
леваниями кишечника он был ниже, чем у
больных с хроническими нагноениями и тубер-
кулезом, и при всех этих заболеваниях — ниже
у больных с активным или постоянно рециди-
вирующим течением, чем у больных с достиг-
нутой ремиссией.
Лечение амилоидоза должно быть направ-
лено на уменьшение синтеза предшественни-
ков, из которых строится белок амилоида [Tan
S.Y. et al., 1995].
Лечение АА-амилоидоза включает обязатель-
ное удаление источника продукции SAA —
опухоли, костных секвестров, резекцию киш-
ки (при тяжелых осложненных формах неспе-
цифического язвенного колита или болезни
Крона), излечение туберкулеза, других хрони-
ческих инфекций. При длительном лечении
ревматоидного артрита (более года) цитостати-
ками — циклофосфаном, хлорамбуцилом (об-
суждается также эффективность лечения мето-
трексатом) амилоидоз возникает реже, а при
уже развившемся амилоидозе наблюдается
уменьшение его клинических проявлений —
стабилизация почечной функции и снижение
протеинурии вплоть до исчезновения нефроти-
ческого синдрома, нормализация уровня С-ре-
553
активного белка и, вероятно, SAA. Так, в кон-
тролируемом исследовании, проведенном в
середине 80-х годов [Ahlmen М. et al,, 1987],
сравнивали 2 группы пациентов (в каждой по
11 больных АА-амилоидозом, развившимся на
фоне РА), одни из которых получали цитоста-
тики (хлорамбуцил, циклофосфамид или аза-
тиоприн), а другие — не получали такого ле-
чения. В первой группе только у 2 больных че-
рез 54 мес развилась ХПН, у остальных функ-
ция почек оставалась стабильной, наблюдалось
либо исчезновение нефротического синдрома,
либо уменьшение протеинурии на 50 %. Во
второй группе больных у 7 развилась почеч-
ная недостаточность в более короткие сроки
(46 мес), у остальных наблюдалось усиление
протеинурии или развитие нефротического син-
дрома. В другом (неконтролируемом) многолет-
нем (10—21 год) наблюдении [Bergland К. et al.,
1993] среди 16 больных РА, ЮРА и анкилози-
рующим спондилоартритом с АА-амилоидозом,
которых лечили повторными курсами хлорам-
буцила и/или циклофосфамида, у 75 % функ-
ция почек оставалась сохранной в течение 10
лет, у большинства больных отмечено сниже-
ние протеинурии и у всех — нормализация
уровня С-реактивного белка.
При лечении АА-амилоидоза в рамках пери-
одической болезни препаратом выбора являет-
ся колхицин, который в эксперименте блокирует
образование амилоидускоряющего фактора
(АУФ), ингибирует синтез и секрецию SAA,
влияет на хемотаксическую активность поли-
морфно-ядерных лейкоцитов крови. Лечение
колхицином может предупредить возникнове-
ние амилоидоза у больных периодической бо-
лезнью. При уже возникшем амилоидозе почек
проводят длительное (пожизненное) лечение
колхицином в дозе 1,5—2 мг (при почечной не-
достаточности дозу уменьшают соответственно
степени снижения клубочковой фильтрации).
По данным О.М.Виноградовой, Л.Н.Кочубей,
Т.В.Чегаевой (1990), положительный эффект
(уменьшение или полное исчезновение НС и
протеинурии) наблюдался у 95 % из 47 боль-
ных периодической болезнью с амилоидозом,
получавших колхицин в течение 4 лет. Препа-
рат оказывал положительное влияние и у боль-
ных с начальной стадией ХПН (уровень креа-
тинина крови менее 0,264 ммоль/л), вызывая
стабилизацию почечной функции. Изучение вы-
живаемости показало, что в результате приме-
нения колхицина средняя продолжительность
жизни больных периодической болезнью с ами-
лоидозом от момента выявления протеинурии
возросла с 6,7 до 16 лет. Колхицин достаточно
хорошо переносится, возникающие иногда дис-
пепсические явления обычно не требуют пол-
ной отмены препарата. Имеются наблюдения
554
успешного применения колхицина и при вто-
ричном АА-амилоидозе.
Признается положительный эффект диме-
тилсулъфоксида — ДМСО, обладающего пря-
мым рассасывающим (резорбтивным) действи-
ем на амилоидные отложения [Tan S.Y. et al.,
1995]. Препарат может быть эффективным лишь
в дозе не менее 10 г/сут при продолжительно-
сти лечения 6 мес и более, что не всегда уда-
ется выполнить из-за нередких аллергий и не-
приятного запаха изо рта, связанного с особен-
ностями метаболизма препарата. Определенный
эффект может быть достигнут при лечении де-
лагилом, особенно у больных с вторичным ами-
лоидозом в рамках ревматоидного артрита. При-
менение сырой печени по-прежнему рекомен-
дуется в качестве пищевой добавки.
При AL-амилоидозе, как и миеломной бо-
лезни, применяют различные схемы полихимио-
терапии с целью уменьшения продукции лег-
ких цепей иммуноглобулинов [Schena F.P. et al.,
1998]. Наиболее хорошо проанализирована схема
мелфалан — преднизолон. Применяются интер-
миттирующие схемы (мелфалан по 0,15 мг/кг
и преднизолон по 0,8 мг/кг 7-дневными кур-
сами с перерывом 4—6 нед), так как мелфа-
лан является токсичным препаратом и среди
отдаленных последствий его применения воз-
можно развитие второй опухоли (острый лей-
коз или другие заболевания, в частности мие-
лодиспластический синдром). Лечение должно
быть длительным — не менее 6 мес — 1 года.
У пациентов с почечной недостаточностью
(клиренс креатинина менее 40 мл/мин) дозу
мелфалана необходимо снизить на 50 %; тера-
пия прекращается, если через 3 мес лечения
отмечается дальнейшее снижение почечной
функции.
Вероятность положительного эффекта тера-
пии у больных с НС выше при исходно нор-
мальном уровне креатинина крови и отсутствии
амилоидной кардиомиопатии. По результатам
крупного исследования [Gertz М. A., Kyle R. А.,
1992], включившего 153 больных с AL-амило-
идозом, при лечении по схеме мелфалан —
преднизолон в течение 24—36 мес положитель-
ный эффект наблюдался в среднем у 18 % боль-
ных; у больных с сердечной недостаточностью
результаты хуже. Продолжительность жизни
больных, ответивших на лечение, может соста-
вить 5 лет, что по сравнению с естественным
течением означает большой прогресс.
В наблюдении G.Merlini и соавт. (1994) лечение
по схеме мелфалан — преднизолон не менее 6 мес
оказалось успешным у 38 из 97 пациентов AL-ами-
лоидозом с улучшением выживаемости (в среднем
до 120 мес против 14 мес в контроле). В наблюде-
нии G.Banfi, G.Marinone (1995) 40 больных AL-ами-
лоидозом с поражением почек, принимавших схе-
мы мелфалан — преднизолон по крайней мере 6 мес,
были далее прослежены в течение в среднем 36 мес.
Среди ответивших на лечение за этот срок только у
4 больных развилась терминальная почечная недо-
статочность, в то время как среди больных, не от-
ветивших на терапию, 50 % достигли терминальной
ХПН и 70 % умерли в течение 12 мес. Монотерапия
колхицином при AL-амилоидозе оказалась неэффек-
тивной, добавление колхицина к схеме мелфалан —
преднизолон также не привело к существенному
улучшению результатов.
В последнее время у больных AL-амилоидо-
зом моложе 60 лет все чаще применяют более
агрессивные схемы полихимиотерапии с вклю-
чением винкристина, доксорубицина, цикло-
фосфана, мелфалана, дексаметазона в разных
комбинациях с последующей трансплантацией
стволовых клеток.
Лечение застойной сердечной недостаточно-
сти у больных с AL-амилоидозом сводится, по
сути дела, только к назначению массивных доз
мочегонных средств, так как отмечается повы-
шенная чувствительность к сердечным глико-
зидам, ингибиторам кальциевых каналов, 0-
блокаторам. В настоящее время для лечения ами-
лоидной кардиомиопатии начинает внедряться
трансплантация сердца. Пока о результатах этого
метода лечения судить преждевременно.
При ортостатической гипотонии полезна
диета с высоким содержанием поваренной соли
(более 6 г/сут), назначают также минералокор-
тикоиды. При диарее показана диета с пони-
женным содержанием жиров, растительной
клетчатки, ограничение потребления жидкости.
Современные методы трансплантационной
терапии и экстракорпоральные методы вносят
большие изменения в лечение амилоидной не-
фропатии на стадии почечной недостаточнос-
ти. Больные с ХПН на гемодиализе живут при-
мерно столько же-, сколько и другие больные
с системными заболеваниями, например сахар-
ным диабетом. При проведении гемодиализа
возникают осложнения, связанные с фистулой,
гипотонические кризы из-за поражения надпо-
чечников и ортостатической гипотонии. Кроме
того, гемодиализ не защищает больного от про-
грессирования амилоидоза, может наступить
смерть в связи с амилоидозом других локали-
заций, например сердца, даже при вторичном
амилоидозе, для которого тяжелое поражение
сердца не столь характерно. Некоторые преиму-
щества перед гемодиализом имеет амбулатор-
ный перитонеальный диализ, поскольку при
его проведении не требуется сосудистый доступ,
из-за малых кровопотерь удается поддерживать
достаточный уровень гематокрита у больных.
Однако при перитонеальном диализе возможны
инфекционные осложнения, особенно в усло-
виях продолжения медикаментозного лечения
амилоидоза, включающего цитостатики. Кроме
того, описаны случаи инфильтрации амилоидом
брюшины, что снижает функциональные воз-
можности этого природного фильтра.
Хорошая или удовлетворительная реабилита-
ция достигается более чем у 60 % больных неза-
висимо от типа амилоидоза (АА или AL). Так, в
наблюдении G.Moroni и соавт. (1992) среди 43
пациентов, находящихся на хроническом гемо-
диализе (16 больных с AL- и 21— с АА-амилои-
дозом), 68 % прожили в течение года и 30 % —
5 лет от начала заместительной терапии. Выжи-
ваемость больных, находящихся на перитонеаль-
ном диализе, сходна с этим показателем у боль-
ных, получающих гемодиализ.
Трансплантация почек — более перспектив-
ный метод у больных амилоидозом АА- и AL-
типа с почечной недостаточностью. Она пока-
зана больным с медленно прогрессирующим
течением заболевания и отсутствием тяжелого
амилоидного поражения сердца и желудочно-
кишечного тракта.
После трансплантации показатели выжива-
емости больного и трансплантата сопоставимы
с этими показателями в других группах паци-
ентов с пересаженной почкой. В наблюдении
Hartmann и соавт. (1992) показатель 3-летней
выживаемости больных составил 51 %, 10-лет-
ней — 43 %; соответствующие показатели вы-
живаемости трансплантата — 62 и 41 %. Небла-
гоприятными прогностическими факторами при
трансплантации почек у больных амилоидозом
АА- и AL-типа были возраст более 40 лет и
многоорганные вовлечения. В среднем через 3
года после трансплантации возникает реамило-
идоз в трансплантированной почке, что дока-
зано как при биопсии трансплантата, так и при
сцинтиграфическом исследовании. В наблюде-
нии К. L. Harrison и соавт. (1993) среди больных
АА-амилоидозом с трансплантированной поч-
кой у лиц с периодической болезнью (17 %)
и хронической инфекцией (13 %) реамилои-
доз возникал чаще, чем у лиц с РА и анкило-
зирующим спондилоартритом (6 %); у больных
с первичным AL-амилоидозом — у 28 %. По-
теря трансплантата отмечена у 2 % больных с
АА-амилоидозом и у 3 % — с AL-типом.
В лечении семейного ATTR-амилоидоза ос-
новным направлением является трансплантация
печени — органа, в котором происходит син-
тез транстиретина; к 1995 г. сообщено более чем
о 60 таких трансплантаций. Трансплантация
печени приводит к улучшению (восстановле-
нию) автономных (вегетативных) функций
(сфинктерных нарушений, кишечных рас-
стройств, ортостатической гипотонии). Что ка-
сается периферической нейропатии, то восста-
новить ее не удается, если развились необра-
тимые дистрофические изменения нервных
555
стволов. Кроме того, трансплантация печени
оказывается менее эффективной при одновре-
менном поражении сердца и гипотонии.
Проблема лечения диализного амилоидоза
изучена мало. Наилучшие результаты удается до-
стигнуть при трансплантации почек, в частно-
сти, быстро уменьшается до нормального уро-
вень 02М, исчезают клинические признаки
амилоидоза, однако отложения амилоида про-
слеживаются долго — более 10 лет.
Сохраняется значение симптоматического
лечения. При наличии синдрома карпального
канала используют наложение шин на запястье,
тепловые процедуры и двигательные упражне-
ния, при шейной деструктивной спондилоарт-
ропатии — воротниковую иммобилизацию шеи.
По данным J.Kay (1993), аппликации на лопат-
ку 10 % гидрокортизоновой мази с помощью
фонофореза или внутрисуставные инъекции кор-
тикостероидов заметно уменьшают боль, вызван-
ную плечелопаточным периартритом. Хирурги-
ческое рассечение карпальной связки может быть
неэффективным, так как известны случаи по-
вторного развития симптомов сдавления средин-
ного нерва. Необходимость в хирургическом вме-
шательстве с целью повышения прочности ко-
стно-суставных структур возникает, как прави-
ло, при накоплении больших масс амилоида.
Литература
Кочубей Л.Н., Виноградова О.М., Серов В.В. и др. AL-
и АА-амилоидоз (состояние проблемы)//Клин. мед. —
1988. - № 8. - С. 7-16.
Козловская Л.В., Варшавский В.А., Чегаева Т.В. и др.
Амилоидоз: современный взгляд на проблему//Прак-
тич. нефрол. — 1998. — № 2. — С. 16—23.
Кочубей Л.Н., Виноградова О.М., Серов В.В., Васи-
льева Н.А. Прогноз и выживаемость больных вторич-
ным амилоидозом (анализ 146 случаев)//Тер. арх. —
1993. - № 6. - С. 48-54.
Серов В.В. Старческий амилоидоз и его место в па-
тологии человека//Клин. геронтол. — 1995. — № 1. —
С. 3-7.
Серов В.В., Шамов И.А. Амилоидоз. — М.: Медици-
на, 1977.
Виноградова О.М. Первичный и генетические вари-
анты амилоидоза. — М.: Медицина, 1980.
Мухин Н.А. Клинические проблемы амилоидоза по-
чек//КлиН. мед. — 1983. — № 10. — С. 12—17.
Kyle R.A., Gertz М.А. Primary systemyc amyloidosis:
Clinical and laboratory Features in 474 cases//Semin.
Hematol. - 1995. - Vol. 32. - P. 45-59.
Falk R.H., Comenzo R.L., Skinner M. The systemic
amyloidoses//New Engl. J. Med. — 1997. — September,
25. - P. 898-909.
Schena F.P., Pannarale G., Carbonara M.C. Clinical and
therapeutic aspects of renal amyloidosis//Nephrol. Dial.
Transplant. — 1996. — Vol. 11 (suppl. 9). — P. 63—68.
Bohle A., Wehrmann M., Eissele R. et al. The long-
term prognosis of AA and AL renal amyloidosis and
the pathogenesis of chronic renal failure in renal
amyloidosis//Path. Res. Pract. — 1993. — Vol. 189. —
P. 316-331.
Tan S.Y., Pepys M.B., Hawkins P.N. Treatment of
amyloidosis//Am. J. Kidney. Dis. — 1995. — Vol. 26, N 2
(August). — P. 267—285.
Tisher C.C., Brenner B.M. Renal Pathology. — 2nd ed. —
Philadelphia, 1993.
Гпава 32
ПОРАЖЕНИЕ ПОЧЕК ПРИ
ПАРАПРОТЕИНЕМИЯХ
И.Е.Тареева, Н.Б.Гордовская
Группа парапротеинемий (диспротеинозов,
жоклоновых гаммапатий) включает в себя
тожественную миелому, макроглобулинемию
ыьденстрема, криоглобулинемию, болезнь
желых цепей. Поражение почек имеет место
'и всех этих заболеваниях, однако наиболее
сто наблюдается, определяя прогноз больных,
и множественной миеломе.
Множественная миелома (ММ) — наиболее
стое заболевание в группе диспротеинозов. В
нове болезни лежит пролиферация одного
она (моноклональная) плазматических кле-
< с гиперпродукцией легких цепей иммуно-
эбулинов, каппа- или лямбда-типов.
Заболевание поражает несколько чаще жен-
IH, возрастной пик приходится на 60—70 лет.
иническая картина обусловлена поражением
лей (боли, переломы, гиперкальциемия, Бы-
вающая анорексию, депрессию и рвоту) и
гек; могут наблюдаться геморрагии, невро-
ические симптомы. Характерны анемия, рез-
5 повышение СОЭ, гиперпротеинемия, на-
ше парапротеинов (M-компонента) в сыво-
ке крови и в моче; в стернальном пунктате
зышено содержание плазматических клеток.
Поражение почек при ММ является следстви-
гиперпродукции и избыточной экскреции
моноклональных легких цепей иммуноглобу-
линов;
этложения парапротеинов в виде амилоид-
ных фибрилл и/или легких цепей в почеч-
ных сосудах, БМК, интерстиции;
инфильтрации плазматическими клетками
таренхимы почки.
«роме того, в генезе поражения почек иг-
)т роль гиперкальциемия (достаточно часто
людаемая при ММ), гиперурикемия, ин-
фекция мочевых путей, повышенная вязкость
крови. В отдельных случаях наблюдается разви-
тие иммунокомплексного ГН в рамках систем-
ных проявлений заболевания [Ronco P.M. et al.,
1998].
Отложения моноклональных белков могут
иметь различный характер: в виде слепков,
кристаллов, фибрилл или гранулярных преци-
питатов, что зависит от их различных физико-
химических свойств — молекулярной массы,
электрофоретической подвижности, степени
полимеризации, гликолизации и т.д. Эти свой-
ства определяют выпадение в осадок, взаимо-
действие с почечной тканью после осаждения;
не исключена роль локальных тканевых факто-
'ров [Chauveau D., Choukroun G., 1996].
Особенно характерны изменения канальце-
вого аппарата почек, значительно реже в про-
цесс вовлекаются клубочки; нередко выявляется
нефрокальциноз, обычно связанный с гипер-
кальциемией; можно обнаружить и явления
ишемии, что соответствует частоте возникно-
вения миеломы в пожилом возрасте.
Специфическим для ММ поражением почек
является нефропатия, связанная с избыточной
экскрецией легких цепей и их повышенной
реабсорбцией в проксимальных канальцах (ми-
еломная почка, цилиндровая нефропатия, не-
фропатия со слепками), для которой характер-
ны преимущественно тубулоинтерстициальные
изменения. Перенасыщение клеток проксималь-
ных канальцев легкими цепями приводит к
истощению катаболических ферментов, сниже-
нию реабсорбции и переполнению просвета
канальцев легкими цепями; развиваются атро-
фия и некроз клеток канальцев, разрушение их
стенки, приводящие к выходу белков из про-
света канальцев в интерстициальное простран-
ство. Легкие цепи могут оказывать и прямое
557
токсическое действие на клетки канальцев, что
также снижает способность клеток к реабсорб-
ции легких цепей, особенно нефротоксичны
катионные легкие цепи [Clyne D.H. et al., 1979].
Характерны внутриканальцевые преципита-
ты («слепки», «цилиндры»), основу которых
составляют легкие цепи (белок Бенс-Джонса),
связывающиеся с гликопротеином Тамм —
Хорсфолла, синтезируемым клетками толстого
восходящего сегмента петли Генле; преципита-
ты могут содержать также альбумин, фибрино-
ген, канальцевый эпителий, нейтрофилы, лим-
фоциты, моноциты, плазматические клетки
[Huang Z.Q., Sanders P.W., 1995]. Преципита-
ции белков способствуют низкий pH каналь-
цевой жидкости, ее ионный состав (высокое со-
держание кальция), использование НПВП,
диуретиков, снижающих объем внеклеточной
жидкости, рентгеноконтрастных препаратов и
другие факторы. Некоторые препараты, в том
числе колхицин, пеницилламин, наоборот, пре-
пятствуют связыванию ЛЦ с белком Тамм —
Хорсфолла, что открывает новые перспективы
в лечении миеломной нефропатии [Sanders P.W,
Booker В.В, 1992].
Внутриканальцевые преципитаты могут быть
гомогенными, гранулярными или кристалли-
ческими; они формируются в дистальном от-
деле нефрона и собирательных трубках (в тя-
желых случаях преципитаты обнаруживаются и
в проксимальном отделе и даже в боуменовом
пространстве), обычно окружены большими
мононуклеарными многоядерными клетками
(от 2 до 20 ядер и более) макрофагального
происхождения, которые практически не встре-
чаются при хронических заболеваниях почек, не
относящихся к плазмоклеточным дискразиям
[Pirani C.L., 1988; Shaker Y. et al., 1993].
Л.Д.Сидорова и соавт. (1988), изучавшие
развитие миеломной почки в динамике (на
основании биопсийного и патологоанатомичес-
кого материала), показали, что на ранней (док-
линической) стадии, когда нет еще протеину-
рии, уже определяются признаки белковой
дистрофии клеток канальцев (зернистой, гиа-
линово-капельной); изменения в клубочках и
интерстиции на этой стадии не обнаружены.
Среди больных ММ с далеко зашедшим почеч-
ным процессом преобладают (63—87 %) боль-
ные с миеломной почкой (цилиндровой нефро-
патией) [Pasquali S. et al., 1990; Ganeval D. et
al., 1992].
Вовлечение в процесс клубочков при ММ
связано преимущественно с отложением ами-
лоида, осложняющего ММ в 5—15 % случаев
[Ivanyi В, 1990]. Полагают, что определенные
легкие цепи (чаще типа А) могут приобретать
особую складчатую (фибриллярную) конфигу-
рацию с характерными тинкториальными свой-
558
ствами и формировать амилоидные фибриллы
AL-типа. Очаги отложения амилоида отмечают-
ся не только в клубочках, но и в стенках арте-
рий и интерстиции; возможно сочетанное от-
ложение легких цепей в виде амилоидных фиб-
рилл и в виде неамилоидных гранул ЛЦ.
В отдельных случаях поражение клубочков не
связано с развитием AL-амилоидоза. Иногда об-
наруживается диффузное уплотнение капилляр-
ных стенок, умеренное расширение мезангиаль-
ного матрикса, при далеко зашедших процес-
сах напоминающее диабетический гломеруло-
склероз. Полагают, что формированию нодуляр-
ного гломерулосклероза способствуют катион-
ные к-ЛЦ, которые нейтрализуют отрицатель-
ные полианионы в клубочках [Palant С.Е. et al.,
1980]. Допускается возможность более выражен-
ных гломерулярных поражений за счет интра-
мембранозных или субэндотелиальных депози-
тов парапротеина. Имеются отдельные наблю-
дения развития у больных миеломой МПГН,
МКГН, в том числе и быстропрогрессирующего
[Ronco Р.М. et al., 1998]. Образование полулу-
ний связывают с пролиферацией эпителиаль-
ных клеток капсулы в ответ на «протечку» в
капсулярное пространство фибрин-фибриноге-
на через поврежденные депозитами легких це-
пей БМК. Накопление легких цепей в капил-
лярных петлях, возможно, меняет структуру
БМ через ишемию, некроз или способствует
высвобождению нейтрофилами и макрофагами
медиаторов воспаления с последующим по-
вреждением БМ [Meyrier A. et al., 1984].
Опухолевидная инфильтрация миеломными
клетками паренхимы почек встречается обыч-
но уже в терминальной стадии и не имеет кли-
нико-патологического значения, ее частота не
превышает 4—7 % [Kyle R.A., 1986].
Клинически миеломная почка характе-
ризуется протеинурией различной выраженно-
сти с признаками почечной недостаточности
или без них. Величина протеинурии колеблет-
ся от следовой до значительной, достигающей
20 г/сут и более (у отдельных больных — до 60—
80 г/сут), однако НС не развивается, посколь-
ку белки мочи представлены преимуществен-
но легкими цепями, что не сопровождается
снижением альбуминов сыворотки крови. НС
обычно развивается при амилоидной нефропа-
тии, осложняющей течение миеломы.
По нашим данным, среди наблюдавшихся 27
больных с множественной миеломой и пораже-
нием почек протеинурия составляла до 1 г/сут
у 6 человек, от 1,1 до 5 г/сут — у 8, от 8,1 до
10 г/сут — у 6, более 10 г/сут — у 7 человек;
НС не был выявлен ни у одного из этих боль-
ных. У 7 человек обнаружена эритроцитурия, у
7 других — лейкоцитурия [Гордовская Н. Б. и
др., 1986].
Основную массу белков мочи составляет
белок Бенс-Джонса, представляющий собой
однородную популяцию легких цепей иммуно-
глобулинов (типа к или Л). Белок обладает осо-
бым свойством термолабильности (при нагре-
вании до 56 °C преципитирует, а до 100 °C —
растворяется, вновь осаждаясь при охлаждении
мочи). Впрочем, «миеломная почка» может вы-
являться и в отсутствие белка Бенс-Джонса в
моче, а протеинурия Бенс-Джонса не всегда
сопровождается развитием «миеломной почки».
Примерно у 20 % больных протеинурия Бенс-
Джонса предшествует другим проявлениям ММ,
а в 60—80 % появляется в течение болезни.
Особенностью мочевого синдрома при ММ
является относительная изолированность про-
теинурии, хотя последняя может сочетаться с
незначительной лейкоцитурией, эритроцитури-
ей, цилиндрурией. Микрогематурия (чаще тран-
зиторная) обнаруживается примерно у ‘/3 боль-
ных (с большей частотой при IgA-миеломе);
исключительно редко встречается макрогемату-
рия. Клиническая картина поражения почек при
ММ, несмотря на кажущееся однообразие (про-
теинурия с нарастающей ПН, редкость отеч-
ного НС и нефрогенной гипертонии), может в
ряде случаев приобретать особенности, связан-
ные с нарушением канальцевых функций
[Yonemura К. et al., 1997].
Тяжелое поражение канальцевого аппарата
может проявляться клинически как парциаль-
ные нарушения функции проксимальных ка-
нальцев. Описываются ренальная глюкозурия и
аминоацидурия, необычно высокий клиренс
фосфатов и мочевой кислоты, канальцевый
проксимальный ацидоз, иногда сочетающиеся
с генерализованной остеомаляцией, т.е. по су-
ществу синдром Фанкони.
Синдром Фанкони развивается у больных
ММ, экскретирующих к-ЛЦ [Uchida S. et al.,
1990]. Морфологический субстрат и механизмы,
посредством которых к-ЛЦ вызывают синдром
Фанкони, остаются неизвестными. Не исклю-
чается непосредственное воздействие их на
эпителий проксимальных канальцев. В эпители-
альных клетках при электронной микроскопии
обнаруживают кристаллические структуры,
сходные с теми, которые находят в плазмати-
ческих клетках, полученных из костного мозга
[Shichiri М. et al.,1982]. Представляет интерес тот
факт, что при сочетании синдрома Фанкони и
миеломы (достаточно редком) первый почти
всегда предшествует диагнозу миеломы. Такая
своеобразная стадия болезни может продол-
жаться многие годы; известны отдельные сооб-
щения о продолжительности синдрома до 13 и
16,5 лет [Maldonado J.E. et al., 1975]. Приводим
собственное наблюдение тубулопатии, предше-
ствовавшей развернутой клинике миеломы.
У больной Б., 60 лет, заболевание началось с
полиурии, никтурии, жажды. При обследовании
выявлена минимальная протеинурия (0,5 г/сут) в
сочетании с умеренной анемией (НЬ 100 г/л), по-
вышенной СОЭ (74 мм/ч) и креатининемией (0,264
ммоль/л). В течение года протеинурия и почечная
недостаточность нарастали. Больная с диагнозом
«ХГН в стадии почечной недостаточности» была
направлена в клинику, где выявлена протеинурия
Бенс-Джонса типа каппа, в сыворотке парапротеин
типа каппа, плазматизация костного мозга 15 %.
В противоположность этим вариантам дис-
функция дистальных канальцев при миеломе
редка и никогда не обнаруживается в отсутствие
легких цепей глобулинов в моче. Наконец, со-
четание функциональных нарушений прокси-
мального и дистального канальцев, в частно-
сти в виде вазопрессинрезистентного нефроген-
ного диабета, описано у больных с наличием
легких цепей иммуноглобулинов в моче, но без
диагностических признаков миеломы («нефро-
патия легких цепей»). Все эти данные представ-
ляют определенную практическую ценность,
так как заставляют длительно наблюдать и по-
вторно обследовать эту категорию больных с
целью выявления миеломы.
Возникновение и прогрессирование с нара-
стающей скоростью почечной недостаточнос-
ти — важнейший фактор прогноза при множе-
ственной миеломе [Hemery М. et al., 1987].
Средняя продолжительность жизни больных
с выраженной почечной недостаточностью со-
ставляет около 17 мес, при восстановлении
почечных функций она увеличивается прибли-
зительно до 24 мес, а при необратимой почеч-
ной недостаточности составляет, по данным
S.Rota и соавт. (1987), лишь 5 мес.
Развитие почечной недостаточности обычно
связывают с характерной для миеломы тубуляр-
ной обструкцией или реже с присоединением
амилоидоза. Определенную роль в развитии
почечной недостаточности могут играть и дру-
гие факторы — повышенная вязкость плазмы,
усиление внутрисосудистой коагуляции, гипер-
кальциемия, гиперурикемия [Rota S. et al., 1987].
Важным фактором, определяющим прогрес-
сирование почечной недостаточности, являет-
ся степень выраженности атрофии канальцев и
интерстициального фиброза.
В функциональной недостаточности почек
при миеломе особое место занимает ОПН,
которая иногда осложняет течение болезни.
Возникновению ОПН прежде всего способству-
ют дегидратация и связанные с ней повыше-
ние концентрации мочи, снижение скорости
течения тубулярной жидкости. В этих условиях
быстрее проявляется нефротоксическое дей-
ствие белка Бенс-Джонса. Следует избегать вве-
дения больным с миеломой контрастных ве-
559
ществ, а если внутривенная урография являет-
ся крайне необходимой, надо предварить ее
гидратацией. Н.Е.Андреева (1987) наблюдала 3
больных множественной миеломой, у которых
смерть наступила после рентгеноконтрастного
исследования почек. Наконец, необходимо по-
мнить о большой опасности для этих больных
гиперкальциемии, особенно при неукротимой
рвоте, когда концентрация кальция в крови
может достигать 3,6 ммоль/л и больше.
Трудности распознавания множественной
миеломы с доминирующим поражением почек
нередко связаны с недооценкой диагностичес-
кого значения сочетания протеинурии с повы-
шенной СОЭ и анемией. При развернутой кар-
тине нефропатии врача должны настораживать
такие признаки, как выраженность протеину-
рии при нормальном содержании альбуминов
сыворотки и нормальном или даже повышен-
ном уровне общего белка крови.
Сложнее поставить диагноз при кажущемся
изолированном поражении почек, однако все-
гда следует исключать миелому при изолиро-
ванном мочевом синдроме, при труднообъяс-
нимой протеинурии, особенно массивной, но
без признаков НС (гипоальбуминемия при ми-
еломе может наблюдаться лишь при развитии
амилоидоза почек), так же как при симптомах
парциальной недостаточности канальцев почек,
прежде всего у пожилых больных.
Для диагноза имеет значение выявление
парапротеина в сыворотке крови и/или моче.
В качестве скрининг-теста используют электро-
форез (моноклональный белок образует область
преципитации в виде узкой плотной полосы,
обычно в у-зоне, реже в зонах /}- и «^глобу-
линов — М-градиент). Для определения класса
моноклонального иммуноглобулина и типа лег-
ких цепей применяют иммуноэлектрофорез с
моноспецифическими сыворотками или метод
иммунофиксации.
Поражение канальцев подтверждается увели-
ченной концентрацией в моче белков с низкой
молекулярной массой, обычно реабсорбирую-
щимися в проксимальных канальцах, увеличен-
ной экскрецией лизосомального фермента fi-
ацетил-В-глюкозаминидазы [Cooper Е. et al.,
1984], нарушением ацидификации и концент-
рационной способности почек.
Исследование стернального пунктата и рент-
генография костей позволяют с полной уве-
ренностью подтвердить диагноз миеломной бо-
лезни; из-за частого развития осложнений к
пункционной биопсии почки следует прибегать
лишь в особенно сложных диагностических слу-
чаях. При этом нужно помнить, что нефропа-
тия долгое время может быть единственным
проявлением общего заболевания. Только у 6 из
27 наблюдавшихся нами больных предположе-
560
ние о связи поражения почек с множествен-
ной миеломой было высказано на догоспиталь-
ном этапе, у подавляющего большинства боль-
ных (21 человек) миеломная почка впервые
диагностирована в нашей клинике, у 13 из этих
больных признаки поражения почек предше-
ствовали другим клиническим проявлениям
множественной миеломы или долго оставались
ее единственной манифестацией, что особен-
но затрудняло правильную диагностику [Гор-
довская Н.Б. и др., 1986].
При проведении дифференциального диаг-
ноза следует помнить о возможности пораже-
ния почек при других диспротеинозах, а так-
же о редких миеломоподобных нефропатиях при
некоторых опухолях внутренних органов. Так,
при медуллярной карциноме щитовидной же-
лезы, аденокарциноме поджелудочной железы
могут экскретироваться избытки аномального
протеина, который свободно фильтруется клу-
бочками почек и преципитируется в канальцах,
напоминая нефропатию при множественной
миеломе.
Лечение ММ. Патогенетическая терапия
направлена на уменьшение массы опухолевой
ткани и тем самым уменьшение продукции
парапротеинов; симптоматическая терапия на-
правлена на предотвращение внутриканальце-
вой обструкции почек.
Наибольший эффект достигается при назна-
чении алкилирующих препаратов (мелфалан,
сарколизин, циклофосфан) и производных нит-
розомочевины (BCNU, CCNU). Препаратами
первой линии для впервые диагностированных
больных являются мелфалан (по 0,15 мг/кг
в день) и преднизолон (по 0,8 мг/кг в день).
Лечение проводят курсами по 4—7 дней через
каждые 4—6 нед. При такой схеме терапии
ремиссия достигается у 50 % больных, про-
должительность ремиссии составляет в сред-
нем около 24 мес. При сниженной СКФ (менее
25 мл/мин) доза мелфалана должна быть сни-
жена на 50 %.
В качестве начальной терапии применяют
также сочетания циклофосфана и преднизоло-
на, BCNU и преднизолона, различные комби-
нации алкилирующих средств. Проведенный в
1992 г. метаанализ 18 публикаций, содержащих
результаты применения у 3814 больных ММ
различных режимов химиотерапии, не выявил
существенной разницы в эффективности комби-
нированной химиотерапии и схемы мелфалан +
преднизолон [Alexanian R., Dimopoulos М.А.,
1995]. При неэффективности терапии первой
линии или при рецидиве чаще применяют схе-
му ВАД (винкристин + адриамицин + дексаме-
тазон или метилпреднизолон), приводящую к
эффективному ответу у 40—75 % больных; воз-
можно ее назначение и в качестве первой ли-
г
нии (снижения доз при почечной недостаточ-
ности не требуется) — относительно быстрое
достижение ремиссии наблюдается примерно у
50 % больных. Применяют и более агрессивные
схемы, включающие сверхвысокие дозы мелфа-
лана (или циклофосфана) внутривенно с пос-
ледующей поддержкой кроветворения с помо-
щью трансплантации аллогенного или аутоло-
гичного костного мозга или стволовых клеток,
выделенных из периферической крови [Fermand
J.P., 1993; Chauveau D., Choukroun G.,1996]. Для
поддерживающей терапии после высоких доз
мелфалана и комбинированных схем использу-
! ют «-интерферон, что улучшает выживаемость
больных. Продолжительность терапии у больных
с уремией не разработана.
Для оценки воздействия химиотерапии на
почечные функции требуется не менее 4—6
нед, иногда свыше 1 года. Обратимость почеч-
ной недостаточности составляет около 50 %
(17—83 %) и наиболее вероятна в первые ме-
сяцы лечения [Alexanian R., Dimopoulos М.,
1994]. Это в основном касается больных, име-
ющих IgG- и IgA-миелому, при миеломе Бенс-
Джонса успех значительно хуже: по данным
R.Alexanian и соавт. (1990), — 24 %.
Во время цитостатической терапии необхо-
дим тщательный контроль за анализами крови,
определение содержания парапротеинов в кро-
ви и моче; при хорошем ответе на лечение (на-
блюдающемся у 5/6 больных) количество М-
протеина должно постепенно уменьшаться. Лу-
чевую терапию можно назначать в основном для
уменьшения болей в костях.
Дегидратация и повышение вязкости крови
могут резко ухудшить поражение почек, поэто-
му необходимо обеспечить большой диурез (не
менее 3 л/сут), что в сочетании с ощелачивани-
ем мочи, уменьшающим преципитацию белка
Бенс-Джонса, долго сохраняет функцию почек.
При выраженной гиперкальциемии, которая
может быть ускорена постельным режимом, ин-
фекцией или дегидратацией, показано внутривен-
ное введение больших доз изотонического раство-
ра хлорида натрия вместе с фуросемидом (что-
бы поддержать диурез около 1 л/ч в течение 6—
24 ч) с коррекцией развивающейся гипокалие-
мии. В дальнейшем показан пероральный прием
кортикостероидов и препаратов фосфора.
Ухудшить функцию почек может и гиперу-
рикемия; поэтому до начала химиотерапии сле-
дует назначать аллопуринол. В некоторых случаях
хороший эффект может дать плазмаферез, ко-
торый в сочетании с химиотерапией способ-
ствует как освобождению крови от легких це-
пей иммуноглобулинов, так и предотвращению
отложения в тканях, прежде всего почках.
Особенно показан плазмаферез у больных с
высокой вязкостью крови. В рандомизированном
исследовании при использовании плазмафере-
за W.J.Jonson и соавт. (1990) отметили улучше-
ние почечных функций и выживаемости. Однако
в целом результаты исследований эффективно-
сти плазмафереза у больных ММ являются
противоречивыми [Winearls C.G., 1995].
Проведение агрессивной противоопухолевой
терапии стало возможным и при ХПН благо-
даря использованию хронического гемодиали-
за, продлевающего жизнь больных. Однако ге-
модиализ не удаляет легкие цепи из циркуля-
ции, поэтому при неэффективности химиоте-
рапии миеломы существенного влияния на со-
стояние функции почек этот метод не оказы-
вает, более того, при длительном использова-
нии гемодиализа, по-видимому, возможно от-
ложение легких цепей иммуноглобулинов в
различных органах, например в миокарде, с
чем связывают возникновение у этих больных
сердечных аритмий.
Выживаемость на хроническом гемодиализе
при ММ на 20 % ниже, чем в общей диализ-
ной популяции, и составляет в среднем 20 мес,
у 30 % больных — более 3 лет.
Перитонеальный диализ более эффективно
элиминирует IgG и свободные легкие цепи,
однако из-за риска перитонита и инфекционных
заболеваний в период химиотерапии предпочти-
тельным остается гемодиализ [Winearls C.G.,
1995]. Трансплантация почки возможна лишь у
отдельных больных ММ [Walker F., Bear R.A.,
1983; Choukroun G. et al., 1995].
Макроглобулинемия Вальденстрема составляет
примерно 10 % всех моноклоновых гаммапатий.
В основе заболевания лежит пролиферация кло-
на В-клеток, секретирующих моноклональный
IgM. Заболевают в основном пожилые лица
(средний возраст больных около 60 лет), чаще
мужчины. Основные клинические признаки —
геморрагии (особенно носовые кровотечения и
пурпура), а также нарушение зрения и невро-
логические симптомы, связанные с гиперпро-
дукцией макроглобулинов и повышением вяз-
кости крови. Могут отмечаться синдром Рейно,
увеличение лимфатических узлов, гепатоспле-
номегалия, повышение объема циркулирующей
плазмы с развитием сердечной недостаточнос-
ти [Ries С.А., 1988].
Поражение почек наблюдается реже, чем
при множественной миеломе, и обычно менее
тяжелое. Поражение почек носит преимуще-
ственно характер гломерулопатии без призна-
ков канальцевой патологии, чаще всего обна-
руживаются изменения типа гломерулосклеро-
за, нередко с эозинофильными гиалиновыми
тромбами в просвете капилляров, окклюзия
клубочковых капилляров субэндотелиальными
депозитами из агрегированных IgM-белков,
инфильтрация интерстиция лимфоидными
36—2950
561
клетками. Эти изменения обычно обратимы, не
ведут к пролиферации клубочковых клеток.
Лимфоцитарная инфильтрация почки может
быть такой степени, что почки увеличиваются
в объеме. Реже наблюдается амилоидоз почек,
описаны отдельные случаи ГН, в том числе с
полулуниями [Linstrom F. et al., 1980; Meyrier
A. et al., 1984; Oganii Y. et al., 1989].
Клинически поражение почек проявля-
ется умеренной протеинурией и микрогемату-
рией. В 80—90 % случаев выявляется белок Бенс-
Джонса, однако его концентрация в отличие от
ММ мала (обычно не превышает 200 мг/сут),
что не приводит к образованию миеломной
почки (цилиндровой нефропатии). Массивная
протеинурия и НС редки (около 5 %), чаще раз-
виваются при амилоидозе почек, хотя могут
быть и проявлением ГН [Gertz М.А. et al., 1993;
Veltman G.A. et al., 1997]. Тяжелая острая по-
чечная недостаточность развивается редко
(вследствие повышенной вязкости крови или
дегидратации).
Лечение: цитостатики (ЦФА, хлорамбу-
цил, мелфалан), при резко повышенной вяз-
кости крови — плазмаферез.
Литература
Гордовская Н.Б., Кравец Т.А., Тареева И.Е. Пораже-
ние почек при множественной миеломе//Тер. арх. —
1986. - № 8. - С. 45-48.
Сидорова Л.Д., Дегтярева М.М., Тов Н.Л., Шабуро-
ва Л.Ф Миеломная нефропатия//Тер. арх. — 1988. —
№ 6. - С. 103-106.
Alexanian R., Dimopoulos М.А. Management of multiple
myeloma//Sem. Hematol. — 1995. — Vol. 32. — P. 20—30.
Chauveau D., Choukroun G. Bence-Jones proteinuria and
myeloma kidney//Nephrol. Dial. Transplant. — 1996. — Vol.
11. - P.413-415.
Choukroun G, Varet B., Griinfeld J.-P. Multiple myeloma/
/Nephron. — 1995. — Vol. 70. — P. 11—17.
Huang Z.Q., Sanders P.W. Biochemical interaction
between Tamm-Horsfall glycoprotein and Ig light chains
in the pathogenesis of cast nephropathy//Lab. Investig. —
1995. - Vol. 73. - P. 810-817.
Ganeval D., Rabian C., Guerin V. et al. Treatment of
multiple myeloma with renal involvement//Advances in
Nephrology from Necker Hospital. — 1992. — Vol. 21. —
P. 347-370.
Ivanyi B. Frequency of light chain deposition nephropathy
relative to renal amyloidosis and Bence-Jones cast
nephropathy in a necropsy study of patients with
myeloma//Arch. of Pathology and Laboratory Medi-
cine. - 1990. - Vol. 114. - P. 986-987.
Jonson W.J., Kyle R.A., Pineda A.A. et al. Treatment of
renal failure associated with miltiple myeloma.
Plasmapheresis, hemodialysis and chemotherapy//Arch.
Intern. Med. — 1990. — Vol. 150. — P. 863—869.
Ronco P.M., Aucouturier P., Mougenot B. Kidney
involvement in plasma cell dyscrasias//Oxford textbook
of clinical nephrology/Ed. A.Davison, J.Cameron,
J.-P.Griinfeld et al. - 1998. - Vol. 2. - P. 811-835.
Sanders P.W., Booker B.B. Pathobiology of cast
nephropathy from human Bence-Jones proteins//!. Clin.
Invest. - 1992. - Vol. 89. - P. 630-639.
Veltman G.A.M., Van Veen S., Kluin-Nelemans J.C. et al.
Renal disease in Waldenstrom’s macroglobulinaemia//
Nephrol. Dial. Transplant. — 1997. — Vol. 12. — P. 1256—
1259.
Winearls C.G. Acute myeloma kidney//Kidney Int. —
1995. - Vol. 48. - P. 1347-1361.
Yonemura K, Matsushima H., Kato A. et al. Acquired
Fanconi syndrome associated with IgGk multiple
myeloma: observations on the mechanisms of umpaired
renal acid excretion//Nephrol. Dial. Transplant. — 1997. —
Vol. 12. - P. 1251-1253.
Глава 33
ПОРАЖЕНИЕ ПОЧЕК ПРИ ПОДОСТРОМ
ИНФЕКЦИОННОМ ЭНДОКАРДИТЕ
А.Ю. Николаев
Подострый инфекционный эндокардит
(ПИЭ)— своеобразный септический процесс в
аллергизированном организме, локализующий-
ся на сердечных клапанах, отличающийся яр-
кими неспецифическими системными проявле-
ниями и отсутствием нагноений. Вторичный
ПИЭ, осложняющий пороки сердца (ревмати-
ческие, врожденные), встречается в 2—3 раза
чаще первичного ПИЭ, поражающего неизме-
ненные клапаны, как правило, аортальные.
Наиболее частые возбудители ПИЭ — зеле-
нящий стрептококк и стафилококк (золотис-
тый, белый, плазмокоагулирующий), энтеро-
кокк [Виноградова Т.Л. и др., 1998]. В последние
десятилетия роль стафилококковой инфекции
в этиологии ПИЭ существенно возросла.
В 15—20 % случаев ПИЭ не удается выделить
гемокультуры. В качестве провоцирующих фак-
торов важное значение имеют интеркуррентные
инфекции, инвазивные вмешательства (имп-
лантация кардиостимуляторов, катетеризация
полостей сердца, мочевого пузыря, наложение
шунта для проведения гемодиализа, экстракция
зуба, аборт, тонзиллэктомия). Многие авторы
выделяют особые формы современного ПИЭ:
госпитальный, стоматологический, стафило-
кокковый ПИЭ у наркоманов, грибковый ПИЭ
на протезированных (искусственных) клапанах
сердца.
ПИЭ у наркоманов, больных, находящихся
на диализе, больных СПИДом чаще вызывает-
ся стафилококком, энтерококком, грамотрица-
тельными бактериями и патогенными грибами
[Rubinstein Е., 1995; Сипе Р., 1995; Pulvirenti J.J.,
1996].
Диагностика современного ПИЭ, часто ин-
дуцированного маловирулентным возбудителем,
может вызывать большие трудности. Типичные
симптомы (интермиттирующая лихорадка с
ознобами и потом, быстрое формирование кла-
панного порока, тромбоэмболический синд-
ром) могут отсутствовать, а на первый план
выступают неспецифические симптомы васку-
лита, анемия, выраженные иммунные сдвиги,
поражение почек [Михайлов А.А. и др., 1995].
В 40 % случаев отмечается гипо- или гипер-
диагностика современного ПИЭ.
Поражение почек в 50—80 % случаев ослож-
няет ПИЭ и нередко определяет прогноз.
У 10 % больных с поражением почек развива-
ется ХПН. Наряду с поражением почек, непос-
редственно связанным с ПИЭ (ГН очаговый и
диффузный, инфаркт почки, двусторонний
кортикальный некроз, амилоидоз почек), все
чаще наблюдаются лекарственные нефропатии,
вызванные массивной антибактериальной тера-
пией (острый канальцевый некроз, острый ин-
терстициальный нефрит), применением моче-
гонных, нестероидных противовоспалительных
препаратов (гемодинамическая ОПН по типу
гепаторенального синдрома, калийпеническая
почка).
Патогенез. Инфаркты почек вызваны эм-
болией в системе почечной артерии (реже —
васкулитом почечных сосудов), как правило,
мало влияют на прогноз. Патогенез других,
более тяжелых вариантов поражения почек при
ПИЭ, по мнению большинства авторов, реа-
лизуется иммунными механизмами. При этом
отсутствует зависимость между тяжестью нефро-
патии и выраженностью поражения сердечных
клапанов.
Для ПИЭ с вовлечением почек характерны
значительное повышение уровня сывороточных
IgG и IgM, высокая концентрация ЦИК (бо-
лее чем у 90 % больных), гипокомплементемия
(за счет СЗ-фракции), выраженность которой
коррелирует с тяжестью почечной недостаточ-
36*
563
ности [Gallo G.R. et al., 1994]. ЦИК, как пра-
вило, относятся к криоглобулинам смешанно-
го (IgG — IgM) типа, обладают активностью
ревматоидного фактора, содержат в своем со-
ставе бактериальный антиген, специфичный к
БМК клубочков, эндотелию сосудистой стен-
ки, миокарду. При эффективной антибактери-
альной терапии ПИЭ уровень ЦИК, иммуно-
глобулинов и СЗ-фракции комплемента быст-
ро нормализуется.
Гистологически при ПИЭ различают фокаль-
ный и диффузный пролиферативный ГН. Диффуз-
ный пролиферативный ГН часто характеризу-
ется картиной мезангиокапиллярного или эк-
стракапиллярного нефрита, реже — МПГН
[Gallo G.R. et al., 1994]. К особенностям нефрита
при ПИЭ относятся частое обнаружение вне-
гломерулярных васкулитов (эндартериита) по-
чечных сосудов и выраженного тубулоинтерсти-
циального компонента (ТИК). Генез ТИК, со-
храняющегося и после уменьшения гломеруляр-
ных воспалительных изменений, связывают с
реакцией стромы на гематогенное бактериаль-
ное обсеменение с применением больших доз
антибиотиков [Сште P.F. et al., 1995]. В подав-
ляющем большинстве случаев ГН обнаружива-
ется диффузное отложение гломерулярных ИК
(мезангиальных, субэндотелиальных, субэпите-
лиальных), содержащих различные иммуногло-
булины (А, М, G) вместе с СЗ, а нередко СЗ
изолированно. В составе гломерулярных депози-
тов выявляются бактериальные антигены, иден-
тичные тем, которые входят в состав ЦИК.
При необратимой ОПН обнаруживается дву-
сторонний кортикальный некроз — крайне тя-
желое осложнение ПИЭ, вызванного грамот-
рицательной флорой.
Клиника. Диффузный ГН встречается при
вторичном ПИЭ в 20 % случаев, при первичном
ПИЭ — в 1,5—2 раза чаще. Он развивается у боль-
шинства больных спустя 3—6 мес от начала за-
болевания. Однако первичный ПИЭ нередко ма-
нифестирует почечной «маской» — остронефри-
тическим синдромом или (реже) — НС.
К типичным клиническим проявлениям
диффузного ГН относятся значительная проте-
инурия и гематурия. Последняя нередко дости-
гает степени макрогематурии. НС развивается в
14—30 % случаев. Стойкая артериальная гипер-
тония нехарактерна. Важным признаком явля-
ется прогрессирующее течение с падением клу-
бочковой фильтрации и появлением азотемии
уже спустя 6—10 мес от дебюта нефрита, что
иллюстрирует следующее наблюдение.
Больной В., 54 лет, летчик. После охлаждения
появились повторные приступы лихорадки (до 40 °C)
с ознобом и профузными потами. При обследовании
по месту жительства выявлены анемия, резкое уве-
564
личение СОЭ, умеренная протеинурия. Лихорадка не
уступала терапии пенициллином, через 4 мес сни-
зилась спонтанно до субфебрильных цифр. Резко
похудел (на 20 кг), появилась стойкая микрогема-
турия на фоне нарастания протеинурии и СОЭ (до
60 мм/ч). При поступлении в клинику терапии и
профболезней состояние относительно удовлетвори-
тельное. На коже туловища множественные липомы
и мелкоточечная зудящая сыпь. Температура тела
37,5 °C. Тоны сердца приглушены, шумов нет. Пульс
72 в минуту. АД 120/80 мм рт.ст. Печень и селезенка
не пальпируются. Анемия (НЬ 80 г/л), увеличение
СОЭ (76 мм/ч), протеинурия (3 г/сут), микрогема-
турия (60 000 эр. в 1 мл мочи), гипергаммаглобули-
немия (33 %). Признаков НС и почечной недостаточ-
ности нет. В процессе обследования (стернальная пун-
кция, лапароскопия, биопсия прямой кишки, пе-
чени) в первую очередь исключались миеломная бо-
лезнь, паранеопластический амилоидоз. При ком-
пьютерной рентгенотомографии и почечной ангио-
графии было высказано подозрение на опухоль ле-
вой почки, отвергнутое урологами. Сохранялся ми-
нимально выраженный субфебрилитет. Из 4 посевов
крови рост был получен лишь в одном (эпидермаль-
ный стафилококк). При рентгенологическом и эхо-
кардиографическом обследовании не было получе-
но данных за формирование порока. Антибактериаль-
ная терапия не проводилась. В последующие 3 мес
прогрессировала почечная недостаточность (содержа-
ние креатинина в крови 0,22—0,37 ммоль/л) без
формирования нефротического и гипертонического
синдромов. В конце 3-го месяца госпитализации (бо-
лее чем через год от начала заболевания) появился
мягкий систолический шум над верхушкой сердца,
при ЭхоКГ заподозрены вегетации на хордах мит-
рального клапана. Через неделю наступила внезап-
ная смерть от острой сосудистой недостаточности.
На вскрытии диагностирован первичный ПИЭ с
язвенно-бородавчатыми наложениями на митраль-
ном и аортальном клапанах. Обнаруживались мно-
жественные инфаркты селезенки, кровоизлияние в
полость IV желудочка мозга (непосредственная при-
чина смерти). При микроскопии почечной ткани
выявлена картина экстракапиллярного пролифера-
тивного нефрита с фибропластической трансформа-
цией. Большинство клубочков с «полулуниями» скле-
розировано, в сохранившихся клубочках — выражен-
ная диффузная пролиферация мезангиальных и эн-
дотелиальных клеток. В строме коркового и мозгово-
го слоя видны обширные лимфогистиоцитарные
инфильтраты.
В данном случае своевременная диагностика
ПИЭ была затруднительна в связи с минималь-
ной выраженностью лихорадки (субфебрили-
тет), длительным (в течение всего первого года
болезни) отсутствием признаков поражения
сердца.
Трудности диагностики первичного ПИЭ и
эффективность этиологической терапии демон-
стрирует следующее наблюдение.
У больного Ш., 24 лет (шофера), клинические
проявления заболевания — рецидивирующая макро-
гематурия, упорная лихорадка (до 40 °C), анемия (НЬ
90 г/л), резкое увеличение СОЭ (52 мм/ч) — позво-
лили заподозрить опухоль почки. При поступлении
в клинику был выявлен НС (протеинурия 6 г/л, об-
щий белок крови 45 г/л, альбумин 18 г/л). Аускуль-
тация, ФКГ, рентгенологическое и ультразвуковое
обследование не обнаружили признаков поражения
сердца. Однако диагноз ПИЭ не исключался. Прове-
ден курс лечения высокими дозами пенициллина —
без эффекта. Данные дальнейшего обследования
(УЗИ почек, внутривенная урография, компьютер-
ная рентгенотомография, почечная рентгеноконтра-
стная ангиография) подтверждали диагноз бласто-
мы правой почки. На операции (люмботомии) в
области неизмененного нижнего полюса правой
почки были выявлены увеличенные паракавальные
лимфатические узлы, создававшие видимость объем-
ного образования в почке. После перевода из уроло-
гического отделения на фоне сохранявшейся лихо-
радки отмечено нарастание НС, появление призна-
ков почечной недостаточности (содержание креати-
нина в крови 0,17 ммоль/л), систолического шума
(над верхушкой и в V точке), наметилась тенденция
к снижению диастолического АД (до 60 мм рт.ст.).
При повторной ЭхоКГ отмечены признаки форми-
рования недостаточности аортального клапана. При
биопсии почки был диагностирован мезангиокапил-
лярный нефрит. Лечение антибиотиками (гентами-
цин, затем цефамизин) привело к быстрой норма-
лизации температуры тела, НЬ, содержания креати-
нина в крови, исчезновению НС, уменьшению ге-
матурии. При контрольном обследовании через 2 года
анализы мочи нормальные, аортальный порок не
сформировался.
Таким образом, быстрая полная ремиссия
мезангиокапиллярного нефрита, развившегося
в рамках ПИЭ, была достигнута за счет анти-
бактериальной терапии, которая в данном слу-
чае являлась этиологическим лечением.
Инфаркт почки обнаруживается у 30—60 %
больных |Gallo G.F. et al., 1994]. Может разви-
ваться в начале заболевания, часто сочетается
с эмболиями в сосудах других органов. Прояв-
ляется интенсивными болями в пояснице или
эпигастральной области, сопровождающимися
тошнотой, задержкой стула, макрогематурией,
повышением артериального давления.
Острая почечная недостаточность может
быть вызвана двусторонней эмболией почеч-
ных артерий, билатеральным кортикальным
некрозом, осложнениями антибактериальной
терапии (острый канальцевый некроз, острый
интерстициальный нефрит), нарушениями
почечной гемодинамики (сердечная недоста-
точность с низким выбросом). Проявляется
олигурией (анурией) и быстро нарастающей
азотемией.
Амилоидоз почек развивается в 3—5 % случа-
ев на фоне длительного течения ПИЭ. Прояв-
ляется массивной протеинурией, переходящей
в НС с исходом в ХПН.
У больной С., 37 лет, в возрасте 14 лет после
охлаждения развилась высокая лихорадка с озноба-
ми, полиартритом. При обследовании в ВКНЦ была
выявлена гипертония (с резким повышением АД на
руках и нормальными цифрами на нижних конеч-
ностях), систолический шум над верхушкой сердца
и аортой, гепатолиенальный синдром, анемия, мик-
рогематурия. Диагностирован вторичный ПИЭ (на
фоне коарктации аорты), проводилась антибактери-
альная терапия. В последующие 20 лет состояние
оставалось относительно удовлетворительным, не
лечилась. Периодически отмечались познабливание,
кожные высыпания по типу пурпуры, артралгии.
После аборта возобновилась высокая лихорадка с
ознобом, потом, появились повторные приступы
болей в пояснице с рецидивирующей макрогемату-
рией. Антибактериальная терапия дала кратковремен-
ный эффект. Через год присоединились отеки, азо-
темия. При поступлении: кожные покровы бледные,
с желтоватым оттенком. Массивные отеки голеней.
Тоны сердца приглушены. На всех точках выслуши-
вается интенсивный систолический шум, прово-
дящийся в межлопаточную область. АД на руках
210/90 мм рт.ст., на ногах — 150/80 мм рт.ст. Уве-
личение печени (+2 см) и селезенки (+3 см). Ане-
мия (НЬ 60 г/л), НС (протеинурия 4,9 г/сут, содер-
жание общего белка 53 г/л, альбуминов 30 г/л),
почечная недостаточность (содержание креатинина
0,76 ммоль/л, КФ 12 мл/мин). В биоптате слизистой
оболочки десны выявлен амилоид. Посев крови ро-
ста не дал. Несмотря на массивную антибактериаль-
ную терапию (пенициллин, цепорин), повторялся
озноб, нарастала почечная недостаточность (количе-
ство креатинина в крови 1,18 ммоль/л, КФ 2,4 мл/
мин). Больная умерла от уремии. На вскрытии диаг-
ноз амилоидоза подтвердился.
Таким образом, амилоидоз почек осложнил
вторичный ПИЭ, протекавший длительно (бо-
лее 20 лет), недостаточно леченный антибио-
тиками.
Мы наблюдали и более доброкачественное
течение вторичного амилоидоза при ПИЭ.
У больного Н., 35 лет, с компенсированным
комбинированным (митрально-аортальным) поро-
ком сердца, развившимся в исходе перенесенного
интенсивно леченного ПИЭ (в детстве, 20 лет на-
зад), при диспансеризации была выявлена массив-
ная протеинурия (3 г/л). При обследовании в нефро-
логическом отделении: функциональная способность
почек сохранена, признаков НС нет. В биоптате сли-
зистой оболочки прямой кишки обнаружено отло-
жение амилоида. В последующие 15 лет рецидивов
ПИЭ не наблюдалось, антибактериальная терапия не
проводилась. При контрольном обследовании функ-
ция почек сохранена, протеинурия уменьшилась до
следовых цифр.
Очевидно, при излечении от ПИЭ возмож-
но обратное развитие (или прекращение про-
грессирования) вторичного амилоидоза почек.
Диагноз и дифференциальный
диагноз. ПИЭ, особенно первичный, проте-
565
кающий с поражением сердца, кожи, почек,
нередко трудно отличить от системных васку-
литов, паранеопластического амилоидоза (осо-
бенно при опухоли почки, лимфогранулемато-
зе), злокачественной лимфомы, лекарственной
болезни.
Наиболее информативны лихорадка, ане-
мия, похудание, тромбоэмболический синдром,
увеличение селезенки, признаки поражения
клапанного аппарата сердца, застойная сердеч-
ная недостаточность.
Гемокультура обнаруживается в 70 % случа-
ев, пятна Лукина и узелки Ослера — менее чем
у 20 % больных [Виноградова Т.Л. и др., 1998].
По данным K.Dura (1994), комплекс совре-
менных методов позволяет считать клинический
диагноз ПИЭ достоверным в 70—80 % случа-
ев, вероятным — в 20—30 % случаев.
Особенно большие трудности возникают
при ПИЭ правых камер сердца, все чаще встре-
чающемся в современных условиях в связи с
распространением наркомании и внедрением
диализных методов лечения. При этом варианте
ПИЭ, как правило, вызванном стафилокок-
ком, сердечная декомпенсация наступает позд-
но, а церебральные тромбоэмболии, инфарк-
ты почек и селезенки вообще не развивают-
ся, кардиальные шумы появляются в далеко
зашедшей стадии болезни и носят изменчивый
характер, антибактериальная терапия малоэф-
фективна.
ПИЭ трехстворчатого клапана часто проте-
кает в виде септической или пневмонической
«маски». Наблюдается двусторонняя рецидиви-
рующая, часто абсцедирующая пневмония с
микроэмболиями в системе легочной артерии
и инфарктами легкого [Шевченко Ю.Л., 1995;
Pulvurenti J.J., 1996].
Значительные трудности возникают при
дифференциальной диагностике ПИЭ с неин-
фекционным (асептическим) тромботическим
эндокардитом [Михайлов А.А. и др., 1995]. Пос-
ледний осложняет онкологические заболевания,
сахарный диабет, тяжелую анемию, антифос-
фолипидный синдром. Проявляется тромбоэм-
болиями, меняющимися кардиальными шума-
ми, псевдовегетациями.
Лечение. Выбор метода лечения ПИЭ оп-
ределяется особенностями возбудителя, лока-
лизацией и обширностью клапанного пораже-
ния, тяжестью кардиальных и экстракардиаль-
ных (почечных) осложнений, в том числе сте-
пенью нарушения фильтрационной функции
почек. Длительность антибактериальной терапии
не должна быть меньше 6 нед.
При обнаружении в крови зеленящего стреп-
тококка назначают пенициллин каждые 3 ч
(8 инъекций в сутки). В первые 3 сут вводят 6—
8 млн ЕД в сутки. При отсутствии эффекта су-
566
точную дозу увеличивают до 15—20 млн ЕД,
присоединяют стрептомицин (внутримышечно
по 0,5 г 2 раза в сутки). При отсутствии улуч-
шения через 3—5 сут переходят на другие ан-
тибиотики: цефалотин или цефазолин (6 г/сут)
в сочетании с гентамицином (внутримышечно
120 мг/сут) или рифампицин (внутривенно 500
мг/сут).
При стафилококковой этиологии заболевания
назначают полусинтетические пенициллины —
оксациллин в сочетании с ампициллином (внут-
римышечно 10—12 г/сут). При отсутствии эффек-
та присоединяют гентамицин или канамицин
(внутримышечно по 0,5 г 2 раза в сутки). При
непереносимости пенициллинов используют
цефалоспорины: клафоран, кетоцеф, цефами-
зин, цефобид (внутримышечно 4—6 г/сут).
При неэффективности препараты могут быть за-
менены ристомицином (внутривенно 1200—
1800 мг/сут), ципрофлоксацином (внутривен-
но 200 мг 2 раза в сутки), ванкомицином (внут-
ривенно 2 г/сут). Кроме того, может быть при-
менен сандоглобулин (внутривенно 1 г/кг в
сутки). При энтерококковом ПИЭ применяют
высокие дозы пенициллина (20—30 млн/сут) со
стрептомицином или полусинтетические пени-
цилллины с гентамицином. При обнаружении
грамотрицательного возбудителя назначают це-
фалоспорины III поколения (клафоран, мокса-
лактам, лонгацеф) с тобрамицином (внутри-
мышечно 15 мг/кг в сутки), азлоциллин (15—
20 г/сут) или мезлоциллин (200—300 мг/кг в
сутки). Могут использоваться также ципрофлок-
сацин, тиенам (внутримышечно 1—2 г/сут),
карбенициллин (внутримышечно 10 г/сут), мет-
ронидазол (внутривенно 500 мг 3 раза в сут-
ки), бактрим (внутримышечно 240 мг 2 раза в
сутки).
При лечении грибкового ПИЭ показаны
амфотерицин В (внутривенно 1 мг/кг в сутки)
или флуконазол (внутривенно 3—6 мг/кг в сут-
ки) [Rubinstein Е., 1995].
В тех случаях, когда возбудитель не удается
выделить, лечение обычно начинают с пеницил-
лина по 20 млн ЕД/сут в сочетании с гентами-
цином или стрептомицином. При отсутствии
эффекта переходят на другие антибиотики.
После достижения эффекта (нормализации
температуры, картины крови, уменьшения
мочевого синдрома, почечной недостаточнос-
ти) антибактериальная терапия продолжается
не менее 4—6 нед. Аминогликозидные антиби-
отики не должны применяться более 10 дней
без перерыва.
Если после достижения эффекта антибакте-
риальной терапии сохраняется высокая актив-
ность почечного процесса, к антибиотикам
следует присоединить глюкокортикоиды —
преднизолон (40—50 мг/сут внутрь).
При неэффективности консервативной тера-
и ПИЭ используется хирургическое лече-
; — замена протезом пораженных клапанов
дца, что может привести к обратному раз-
'ию нефрита.
Показания к операции протези-
вания клапана: вовлечение второго кла-
ta, эндокардит правых камер сердца, гриб-
1ый эндокардит, рецидивирующие тромбоэм-
гии, присоединение застойной сердечной
[остаточности [Шевченко Ю.Л., 1995].
тература
юградова Т.Л., Чипигина Н.С. Подострый инфек-
>нный эндокардит — вопросы диагностики//Тер.
. - 1998. - № 6. - С. 35-38.
хайлов А.А., Черейская Н.К. Эндокардиты//Спра-
ник терапевта. — М.: ^Медицина, 1995. — Т. 1. —
133-435.
Шевченко Ю.Л. Хирургическое лечение инфекцион-
ного эндокардита. — СПб., 1995.
Curre P.F. A review of endocarditis in AIDS//Eur.
Heart. J. - 1995. - Vol. 16 (suppl. В). - P. 15-18.
Dura K. New criteria for diagnosis of infective
endocarditis: utilization of specific echocardiographic
fmding//Am. J. Med. - 1994. - Vol. 96. - P. 200-208.
Gallo G.R., Nengarten J., Baldwin D.S. Glomerulonephritis
associated with bacterial endocarditis//Renal Patho-
logy. — 2-nd ed./Ed. C.C.Tisher, B.M.Brenner. —
Philadelphia: Lippincott company, 1994.— Vol. 1.—
P. 564-574.
Pulvurenti J. J. Infectious endocarditis in drug users:
importance of HIV virus serostatus and degree of
immunosuppression//Clin. Inf. Dis. — 1996. — Vol. 22. —
P. 40-45.
Rubinstein E. Fungal endocarditis//Eur. Heart. J. —
1995. - Vol. 16 (suppl. В). - P. 84-89.
Глава 34
ПОРАЖЕНИЕ ПОЧЕК ПРИ
СИНДРОМЕ ПРИОБРЕТЕННОГО
ИММУНОДЕФИЦИТА
А.Ю.Николаев
При ВИЧ-инфекции признаки вовлечения
почек обнаруживаются в 30 % случаев. При этом
поражения почек, развивающиеся как у виру-
соносителей, так и у больных СПИДом, как
правило, приобретают прогрессирующее тече-
ние, ведущее к острой или хронической почеч-
ной недостаточности. Учитывая высокую частоту
и тяжесть поражения почек и массовое распро-
странение СПИДа (более 20 млн инфицирован-
ных к началу 1997 г.), предполагается, что уже
в ближайшие годы возникнет необходимость в
существенном увеличении мощности диализных
центров [D’Agati V. et al., 1997]. Так, с середи-
ны 90-х годов в США среди самых частых при-
чин терминальной ХПН ВИЧ-нефропатия за-
нимает 3-е место после диабетической нефро-
патии и гипертонической болезни [Humphrey
М.Н.,1995; Burns G.C. et al., 1997], а ассоции-
рованная с ВИЧ-инфекцией тромботическая
тромбоцитопеническая пурпура является самой
частой формой тромботической микроангиопа-
тии у взрослых [Remuzzi G., 1998].
Этиология и патогенез. Поражение
почек может быть вызвано ретровирусом
(HIV) — возбудителем СПИДа, водно-электро-
литными и гемодинамическими нарушениями,
инфекционными и онкологическими осложне-
ниями далеко зашедшего СПИДа, а также не-
фротоксическим действием лекарств. Получены
данные в пользу специфической вирусной эти-
ологии ВИЧ-нефропатии: быстропрогрессиру-
ющего фокально-сегментарного гломерулоскле-
роза (ФСГС). В эпителии почечных канальцев
и в эндотелии клубочков обнаружены вирусо-
подобные цитоплазматические и внутриядерные
включения [D’Agati V. et al., 1997], а в интер-
стициальной ткани почек — лимфогистиоци-
тарные инфильтраты, содержащие CDST-клет-
ки [Wiecek A. et aL, 1994]. При этом предпола-
гается, что синтезируемые инфицированными
вирусом лимфоцитами и макрофагами цитоки-
ны и лейкотриены индуцируют гиперперфузи-
онное поражение почек с прогрессирующим
ФСГС с сегментарным или диффузным коллап-
сом сосудистых петель. Особенно важная роль
в патогенезе ФСГС отводится гиперпродукции
ангиотензина II [Burns G.C. et al., 1997].
Этиология иммунокомплексных нефропатий
(IgA-нефропатии, мембранозной нефропатии)
и тромботической тромбоцитопенической пур-
пуры (ТТП), нередко развивающихся при ВИЧ-
инфекции, не установлена. Патогенез ТТП при
ВИЧ-инфекции не связан с действием вероток-
сина — эндотоксина особого штамма E.coli.
Обсуждается роль паранеопластических реак-
ций, нефритогенности медикаментов, других
персистирующих вирусов: HBV, HCV, CMV
[Bourgoignie J., 1990; Remuzzi G. et al., 1998].
Повышение полимерного IgAl и IgA-содержа-
щих иммунных комплексов в крови обнаружи-
вается у большинства ВИЧ-инфицированных.
При этом IgAl нередко обладает антительной
активностью к анти-HIV IgG и анти-HIV IgM
[Kimmel Р., 1992]. Кроме того, удалось обнару-
жить HIV-антигены в составе циркулирующих
и мезангиальных IgA-содержащих иммунных
комплексов.
ОПН, осложняющая СПИД, может быть
преренальной, ренальной и постренальной
[Bourgoignie J., 1990]. Преренальная, наиболее
обратимая ОПН, может развиться на ранней
стадии болезни за счет дегидратации с дефи-
цитом натрия, гиповолемического шока, гипо-
осмолярного синдрома, эндотоксического шока.
568
Ренальная ОПН, как правило, осложняет раз-
вернутый СПИД. Она может быть обусловлена
различными механизмами: ОКН (ишемическим
или лекарственным), внутриканальцевой об-
струкцией (мочекислой, лекарственной), апо-
стематозным нефритом, грибковыми, парази-
тарными и опухолевыми поражениями почек,
ОДИН. Постренальную ОПН вызывает ретро-
перитонеальный фиброз за счет быстро расту-
щих забрюшинных злокачественных лимфом.
Клиника. I. Острая почечная недостаточ-
ность. К преренальной ОПН чаще приводят
потери воды и Na через кишечник (профузные
длительные поносы). Дегидратация может быть
индуцирована и почечной потерей воды и соли:
при аддисоническом кризе у больных с тубер-
кулезным или грибковым поражением надпо-
чечников, при гиперкальциемическом кризе
при осложняющих СПИД гранулематозных за-
болеваниях или костных метастазах опухоли
[Bourgoignie J., 1990]. При этом ОПН манифе-
стирует на фоне гиповолемии, гипонатриемии,
сосудистого коллапса или гипертонического
криза. Реже ОПН может быть вызвана гипер-
волемической гипергидратацией при непропор-
циональной секреции АДГ у больных нейро-
СПИДом. Кроме того, преренальную ОПН
могут спровоцировать медикаменты: НСПП,
кетоконазол, рентгеноконтрастные препараты
[D’Agati V. et al., 1997].
Однако чаще лекарства, особенно антибио-
тики и жаропонижающие, широко применяе-
мые в развернутую стадию СПИДа, вызывают
ренальную ОПН. Так, самой частой причиной
лекарственного ОКН при СПИДе являются
НСПП, пентамидин, амфотерицин В. Несколь-
ко реже ОКН осложняет применение амино-
гликозидных антибиотиков, цефалоспоринов,
рентгеноконтрастных препаратов. ОПН за счет
внутриканальцевой обструкции обусловлена
бисептолом, азидотимидином, ацикловиром,
наркотическими анальгетиками. От лекарствен-
ной следует отличать внутриканальцевую об-
струкцию миеломными цилиндрами (при диф-
фузной миеломе) и кристаллами мочевой кис-
лоты. Острая мочекислая обструкция часто выз-
вана гиперкатаболизмом —- последствием лече-
ния (цитостатического, лучевого) онкологичес-
ких осложнений СПИДа. Реже наблюдается
ОТИН: лекарственный аллергический, который
может осложнять применение пенициллинов,
рифампицинов, сульфаниламидов или обуслов-
ленный инфекцией (цитомегаловирусы, леги-
онеллы, сальмонеллы, иерсинии).
II. Полиорганная недостаточность. Наиболее
прогностически неблагоприятная [D’Agati V. et
al., 1997]. Проявляется сочетанием ренальной
ОПН с острой легочной, сердечной, печеноч-
ной недостаточностью. ОПН с острым бакте-
риальным эндокардитом и с трансформацией
в полиорганную недостаточность развивается
при септических осложнениях СПИДа [Pulvi-
renti J.,1996]. ОПН часто ассоциирована с дву-
сторонней интерстициальной пневмонией, свя-
занной с оппортунистической инфекцией
(пневмоцисты, стафилококки, цитомегаловиру-
сы, атипичные микобактерии) или с фульми-
нантным вирусным гепатитом [Bourgoignie J.,
1990].
III. ВИЧ-нефропатия. Развивается вслед за
инфицированием вирусом (HIV), чаще у негров.
У 20—40 % ВИЧ-инфицированных обнаружи-
вается протеинурия, превышающая 1 г/л, у 3—
10 % — достигающая нефротического уровня.
Характерна стертость клинических проявлений
ВИЧ-нефропатии: отсутствие артериальной
гипертонии и отеков, несмотря на биохимичес-
кие признаки нефротического синдрома
[Humphrey М.Н., 1995]. В то же время возмож-
ны яркие рецидивы в виде эпизодов преходя-
щей (чаще преренальной) ОПН — при соче-
тании ВИЧ-нефропатии с тяжелой дегидрата-
цией или острой сосудистой недостаточностью
[D’Agati V. et al., 1997]. ВИЧ-нефропатия отли-
чается быстропрогрессирующим течением с
исходом в терминальную ХПН в течение 3—6
мес [Bourgoignie J., 1990; D’Agati V. et al., 1997].
Морфологическая характеристика ВИЧ-нефро-
патии (ФСГС с коллапсом сосудистых петель)
представлена выше.
IV. IgA-нефропатия. Развивается на ранней
стадии болезни — у ВИЧ-инфицированных.
При изучении аутопсий H.Beaufils и соавт.
(1995) обнаружили мезангиальные IgA-депози-
ты почти у 8 % умерших от СПИДа. По наблю-
дениям М.Н.Humphrey (1995), ВИЧ + IgA-не-
фропатия чаще протекает латентно с мини-
мальным мочевым синдромом (микрогематури-
ей). При этом выявляется гистологическая кар-
тина фокального мезангиопролиферативного
нефрита с депозитами, содержащими IgA, IgM
(реже — IgG) и СЗ. В то же время описаны
случаи ВИЧ + IgA-нефропатии, характеризую-
щиеся экстракапиллярной пролиферацией, мас-
сивной протеинурией и быстропрогрессирую-
щим течением [Jindal К. et al., 1991; Kimmel Р.
et al., 1992].
V. Тромботическая тромбоцитопеническая пур-
пура. Тромботическая тромбоцитопеническая
пурпура (ТТП), тромботическая микроангиопа-
тия — малоизученное нередкое почечное ос-
ложнение вирусоносительства и развернутой
стадии СПИДа. Манифестирует остронефрити-
ческим синдромом с микроангиопатической
анемией и энцефалопатией. Отличается трудно-
контролируемой ренинзависимой гипертонией,
особенно быстрым прогрессированием с разви-
тием уремии за 2—3 мес [Remuzzi G. et al., 1998].
569
Прогноз хуже, чем при идиопатической ТТП,
хотя возможны ремиссии — спонтанные или
после применения плазмафереза.
Диагноз. Связь нефропатии с ВИЧ-инфек-
цией можно предположить при развитии пора-
жения почек на фоне известной триады: лихо-
радки постоянного или интермиттирующего
типа, упорной диареи и снижения массы тела
(более чем на 10 % за 1—2 мес). Характерны
также анемия, лимфопения с увеличением зад-
нешейных и подмышечных лимфатических уз-
лов. Типично поражение кожи и слизистых: ге-
нерализованный зудящий дерматит (стафило- и
стрептодермии, отрубевидный лишай, герпес
простой и опоясывающий), кандидоз носоглот-
ки, кожи и ногтей (себорееподобный дерма-
тит), тромбоцитопеническая пурпура, очаговое,
реже тотальное облысение.
Дифференциальная диагностика проводится
с подострым инфекционным эндокардитом,
первичным железистым туберкулезом, саркои-
дозом, бруцеллезом, сифилисом, инфекцион-
ным мононуклеозом, острым вирусным гепа-
титом (HBV, HCV), онкологическими заболе-
ваниями (лимфогранулематоз, аденокарцинома
почки), системными заболеваниями соедини-
тельной ткани. Учитывая социальную специфи-
ку контингента больных, ВИЧ-нефропатию с
изолированными почечными проявлениями
следует дифференцировать с быстропрогресси-
рующим ФСГС у употребляющих героин нар-
команов, с мембранозной нефропатией у ин-
фицированных HBV или HCV, а также с си-
филитической нефропатией. Решающую роль в
установлении диагноза имеет обнаружение в
крови антител к HIV.
Прогноз и течение. Прогноз прере-
нальной ОПН, ОКН и внутриканальцевой об-
струкции обычно благоприятен. Полиорганная
недостаточность отличается крайне высокой ле-
тальностью. ВИЧ-нефропатия и ТТП характе-
ризуются быстрыми темпами прогрессирования.
При этом терминальная ХПН, требующая ле-
чения программным гемодиализом, как прави-
ло, формируется еще на стадии вирусоноси-
тельства.
Лечение. Эффективность лечения ОПН за-
висит от ее формы и от стадии СПИДа. При
преренальной ОПН проводится массивная ин-
фузионная терапия, направленная на коррек-
цию водно-электролитных нарушений и устра-
нение острой сосудистой недостаточности. При
ренальной ОПН, как правило, необходимо ле-
чение ГД в течение 2—3 нед, после чего функ-
ция почек восстанавливается. При ОТИН ин-
фекционной этиологии диализное лечение со-
четают с антибактериальной (противовирус-
ной) терапией. При полиорганной недостаточ-
ности прогноз неблагоприятен. Лечение осно-
570
вано на комбинации экстракорпоральных (ГД,
ИВЛ, перфузия крови через взвесь аллогенных
гепатоцитов) и лекарственных методов.
Назначение больным ВИЧ-нефропатией ази-
дотимидина, зидовудина, цитостатиков (вклю-
чая циклоспорин) малоэффективно [D’Agati V.
et al., 1997]. Стабилизирующее влияние глюко-
кортикостероидов на функцию почек отмеча-
ют лишь отдельные авторы [Smith М.С. et al.,
1996]. В то же время обнадеживающие резуль-
таты получены при применении ингибиторов
АПФ. По предварительным данным ингибито-
ры АПФ снижали протеинурию и существенно
замедляли прогрессирование почечной недоста-
точности при ВИЧ-нефропатии [Burns G.C. et
al., 1997; Klotman P.E., 1998]. Рекомендуется
начинать лечение ингибиторами АПФ на ран-
ней стадии ВИЧ-нефропатии: до формирования
НС, независимо от величины АД.
При ВИЧ+ ТТП назначение стероидов и
цитостатиков (винкристин) нецелесообразно
из-за высокого риска усугубления иммунодефи-
цита. Вместе с тем интенсивная гипотензивная
терапия (периферические вазодилататоры, ин-
гибиторы АПФ) в сочетании с плазмаферезом,
антиагрегантами или внутривенным введением
высоких доз человеческого иммуноглобулина
может привести к ремиссии ВИЧ + ТТП
[Remuzzi G. et al., 1998]. При отсутствии эффек-
та прогрессирование энцефалопатии при ТТП
может остановить билатеральная нефрэктомия.
При исходе ВИЧ-нефропатии или ТТП в
терминальную уремию показано диализное
лечение. При этом по эпидемиологическим
соображениям предпочтительней домашний
(амбулаторный) перитонеальный диализ
[Humphrey М.Н.,1995]. Следует подчеркнуть,
что переносимость диализного лечения может
оставаться удовлетворительной в течение не-
скольких лет вирусоносительства: до тех пор,
пока не разовьется развернутый СПИД или
специфическая энцефалопатия с деменцией
(нейроСПИД). Пересадка почки вирусоносите-
лям противопоказана, так как длительное при-
менение циклоспорина и других иммунодепрес-
сантов после трансплантации может ускорить
прогрессирование ВИЧ-инфекции.
Литература
Bourgoignie J. Renal complication of AIDS virus type 1
//Kidney Int. - 1990. - Vol. 37. - P. 1571-1584.
Bums G.C., Paul S.K., Toth I.R. Effect of ACE-inhibition
in HIV-associated nephropathy//!. Am. Soc. Nephrol. —
1997. - Vol. 8. - P. 1140-1146.
D’Agati V., Appel G.B. HIV infection and the kidney//
J. Amer. Soc. Nephrol. - 1997. - Vol. 8. - P. 138-152.
Humphrey M.H. Human immunodeficience virus-
associated glomerulosclerosis//Kidney Int. — 1995. — Vol.
48. - P. 311-320.
Jindal K.K., Trillo A., Bishop G. Crescentic IgA-
nephropathy as a manifestation of HIV//Am. J.
Nephrol. - 1991. - Vol. 11. - P. 147-150.
Kimmel P.L., Philips T.M., Ferreira-Centero A. Idiotypic
IgA-nephropathy in HIV patients//New Engl. J. Med. —
1992. - Vol. 327. - P. 702-706.
Klotman P.E. Early treatment with ACE inhibition may
benefit HIV-associated nephropathy patients//Am. J.
Kidney Dis. - 1998. - Vol. 31. - P. 719-720.
Pulvurenti J. Infectious endocarditis in drug users:
importance of HIV virus serostatus and degree of
immunosuppression//Clin. Inf. Dis. — 1996. — Vol. 22. —
P. 40-45.
Remuzzi G., Ruggenenti P. The hemolytic uremic
syndrome//Kidney Int. — 1998. — Vol. 53 (suppl. 66). —
P. 54-57.
Rousseau E., Russo P., Lapointe N. Renal complicatious
of AIDS in children//Amer. J. Kidney Dis. — 1998. —
Vol. 11. - P. 48-50.
Smith M.C., Austen J.L., Emansipator S.N. Prednisolone
improves renal function and proteinuria in HlV-nephro-
pathy//Amer. J. Med. — 1996. — Vol 101. — P. 41—48.
Wiecek A., Zeier M., Ritz E. Role of infection in the
genesis of acute renal failure//Nephrol. Dial. Trans-
plant. — 1994. — Vol. 9 (suppl. 4). — P. 1—18.
Глава 35
ГЕМОРРАГИЧЕСКАЯ ЛИХОРАДКА
С ПОЧЕЧНЫМ СИНДРОМОМ
(эпидемическая геморрагическая
лихорадка, эпидемическая
нефропатия, геморрагический
нефрозонефрит, мышиная
вирусная нефропатия)
А. Ю. Николаев
Одна из самых частых нефротропных при-
родно-очаговых инфекций, особенно в странах
Юго-Восточной Азии и Китае (вирусы Hantaan,
Seoul, Fojnica). Распространена в Скандинавс-
ких странах (вирус Puumala), на Балканах (ви-
рус Dobrava/Belgrade), в РФ (Hantaan, Puumala).
Наиболее патогенен хантаанвирус, особенно его
азиатские и дальневосточные разновидности
[Lee J.S., 1991]. При инфицировании вирусом
Puumala, встречающимся в странах Северной и
Восточной Европы, наблюдается более легкое
течение заболевания [Van Ypersele D. S., 1991;
CoIlan Y. et al., 1991]. В США, Канаде и Брази-
лии обнаружена новая разновидность инфек-
ции: вирус-возбудитель хантаанлегочного син-
дрома — ХЛС, тяжелого интерстициального
отека легких [Glass G., 1989].
Этиология и эпидемиология. В РФ
заболевание вызывается РНК-содержащим ар-
бовирусом — чаще вида Hantaan, реже —
Puumala. Может протекать суб клинически. Ос-
тавляет стойкий пожизненный иммунитет.
Предполагается, что в РФ заболеваемость ге-
моррагической лихорадкой с почечным синд-
ромом (ГЛПС) значительно выше регистриру-
емой. У 5—8 % практически здоровых взрослых
лиц в отсутствие соответствующего почечного
572
анамнеза в крови обнаруживаются антитела к
вирусу ГЛПС.
Природные очаги ГЛПС в нашей стране:
Башкирия, регионы Средней Волги, Оренбург-
ский и Хабаровский край. Однако спорадичес-
кие случаи заболевания в последние годы ста-
ли отмечаться в Европейской части РФ. Забо-
левание имеет сезонный (летне-осенний) ха-
рактер, передается мышевидными грызунами
(рыжая полевка), алиментарным, пылевым,
воздушно-капельным путем.
Патогенез и м о р ф о л о г и я. Нефропа-
тия развивается у подавляющего большинства
больных. При этом пусковым механизмом слу-
жит поражение вирусом, специфическими АТ и
ИК эндотелия мелких сосудов и базальных мем-
бран почечных канальцев с развитием острого
тубулоинтерстициального нефрита (ОТИН), уси-
лением синтеза цитокинов, опасностью ДВС-
синдрома [CosgriffT.M., 1991]. Одновременно за
счет гиперпродукции гистамина, серотонина и
активации калликреин-кининовой системы рез-
ко повышается сосудистая проницаемость, про-
грессируют отек, кровоизлияния и нарушения
микроциркуляции почечной ткани [Сиро-
тин Б.З., 1981], что может осложниться спон-
танным разрывом (надрывом) коры почки. Плаз-
мо(крово)потеря, усугубляемая дегидратацией
при рвотах, сосудистым коллапсом и эндокрин-
ной недостаточностью (гипофизарной, надпо-
чечниковой), нередко приводит к гиповолеми-
ческому шоку с преренальной ОПН, а при не-
своевременной коррекции гиповолемии — к
ишемическому ОКН. С другой стороны, ГЛПС
со спонтанным надрывом коры часто осложня-
ется приступом почечной эклампсии с тяжелым
гипертоническим кризом и кардиогенным оте-
ком легких [Ковальский Г.С. и др., 1990].
Более редким осложнением является пост-
ренальная ОПН при массивной макрогемату-
рии — за счет обструкции мочевых путей кро-
вяными сгустками или фибриновыми слепка-
ми. Морфологически при ГЛПС почки увели-
чены в размерах, с кровоизлияниями в меж-
канальцевых пространствах, надрывами и не-
крозами мозгового слоя, сосочков, лоханки.
При этом выраженные некробиотические изме-
нения канальцев сочетаются с минимальным
вовлечением клубочков [Сиротин Б.З., 1981;
Siamopoulos К.С., 1994].
Клинические проявления. Типично
циклическое течение болезни [Рощупкин В.И.
и др., 1990; Lee J.S., 1991]. Характерно острое
начало нефропатии, когда на 5—7-й день вы-
сокой лихорадки с ознобом и тяжелой инток-
сикацией появляются интенсивные боли в по-
яснице (мышцах живота) с олигурией и изме-
нениями в моче. С этого же времени присоеди-
няется и нарастает геморрагический синдром
(кожная пурпура, носовые, желудочные, маточ-
ные кровотечения), многократная, часто неук-
ротимая рвота. Мочевой синдром чаще прояв-
ляется микрогематурией и протеинурией. Пос-
ледняя может быть высокой. Однако НС не раз-
вивается. Макрогематурия отмечается в 10 %
случаев. В моче также выделяются фибриновые
слепки, иногда вызывающие почечную колику.
Признаки почечной недостаточности выявляют-
ся рано и исчезают после прекращения олигу-
рии, которая в нетяжелых случаях длится 3—5
дней и сменяется полиурией [Рощупкин В.И. и
др., 1990]. АД нормально или снижено. Гипер-
тония наблюдается в 40 % случаев, может при-
соединиться с наступлением полиурии на фоне
усиления люмбалгий, что требует исключения
спонтанного надрыва почки.
При тяжелом течении нарастают тромбоци-
топеническая пурпура, протеинурия и олигурия
и развивается выраженная ОПН. Для последней
нетипична гиперкалиемия и гиперволемия. Од-
нако нередко обнаруживаются лейкоцитоз,
повышение в крови аминотрансфераз и ЛДГ,
часто прогрессирует гипонатриемия, которая
может привести к фатальному гипоосмолярно-
му синдрому еще до наступления развернутой
уремии [Ковальский Г.С. и др., 1990]. Нередко,
особенно в неэндемичных районах, встречает-
ся атипичное течение ГЛПС: без выраженного
геморрагического и болевого синдрома. Одна-
ко тяжелое поражение почек может осложнять
и малосимптомный вариант ГЛПС.
Диагноз и дифференциальный
диагноз. При атипичном малосимптомном
течении ГЛПС необходимо его разграничение
с другими ОТИН инфекционной этиологии
(лептоспироз, йерсиниоз, легионеллез, сальмо-
неллез), с острым гнойным пиелонефритом, с
острым сепсисом и подострым инфекционным
эндокардитом, с туберкулезом, тифами, а так-
же с болезнью Шенлейна — Геноха и лекар-
ственным аллергическим ОТИН. О ГЛПС сле-
дует думать при сочетании лихорадки и гипе-
ремии склер, верхних отделов груди и спины
с выраженной интоксикацией (нестерпимая
головная боль, неукротимая рвота), а по-
зднее — с люмбалгиями и геморрагическими
высыпаниями в отсутствие гепатолиенального
и суставного синдромов.
Из лабораторных показателей следует выде-
лить микрогематурию, нейтрофильный лейко-
цитоз с резким ускорением СОЭ, тромбоцито-
пению. Специфическая диагностика обеспечи-
вается обнаружением в крови 4-кратного нара-
стания титра антител к вирусу ГЛПС методом
непрямой иммунофлюоресценции. Более чув-
ствителен иммуноферментный метод (РНК-
полимеразная реакция).
Прогноз и течени е. Обычно наблюда-
ется циклическое обратимое течение ГЛПС с
полным выздоровлением в течение 4—6 нед. Ле-
тальность в целом достигает 2—5 %, при
ОПН — 12—15 %. Среди причин смертности,
помимо ОПН, — гипофизарная кома, острая
надпочечниковая недостаточность, гиповолеми-
ческий шок, острая дыхательная недостаточ-
ность (включая ХЛС), острый ДВС-синдром.
Отдаленные исходы ГЛПС недостаточно изу-
чены. Многие исследователи нередко выявляли
признаки хронизации, частота которой не за-
висела от тяжести острой фазы ГЛПС [Siamo-
poulos К., 1994; Шутов А.М., 1997]. При этом
у 15—25 % больных формировались артериаль-
ная гипертония со снижением функционально-
го почечного резерва, почечный канальцевый
ацидоз, снижение концентрационной способ-
ности почек [Glass G.E., 1989; Elisaf М. et al.,
1993]. У 4—9 % больных в последующем разви-
валась ХПН. Среди причин хронизации обсуж-
даются повреждающее влияние на почки арте-
риальной гипертонии, пиелонефрита, персис-
тенции хантаанвируса [Elisaf М., 1993].
Лечение и профилактика. Из общих
мероприятий проводится дезинсекция и защи-
та мест хранения продуктов от грызунов, лич-
ная гигиена. Однако единственным надежным
573
методом профилактики ГЛПС является вакци-
нация населения, проживающего в природных
очагах заболевания.
Этиологическая противовирусная терапия
ГЛПС включает рибавирин [Huggins J., 1991],
донорскую иммунную плазму или препараты,
содержащие моноклональные антитела к хан-
таанвирусу. В то же время применение препа-
ратов интерферона малоэффективно. Патогене-
тическая и симптоматическая терапия заклю-
чается в коррекции гиповолемии, тромбоцито-
пении, электролитных нарушений и сосудис-
той недостаточности, а также при сильных бо-
лях, в применении анальгетиков (включая нар-
котические). Большинство клиницистов высту-
пает против использования высоких доз глю-
кокортикостероидов. Консервативное лечение
преренальной ОПН проводится в соответствии
с общими принципами (см. соотв. раздел). Оно
включает массивную инфузионную и сосудис-
тую терапию, коррекцию гипоосмолярного
синдрома (дефицита натрия) и ДВС-синдрома.
Необходим строго индивидуальный подход
к показаниям к лечению ГД больных ГЛПС.
С одной стороны, при ГЛПС повышен риск ос-
трых диализных осложнений за счет выражен-
ного геморрагического синдрома (в том числе
острых эрозивных поражений ЖКТ), нестабиль-
ности гемодинамики, опасности спонтанного
разрыва почки. С другой стороны, требуется
крайне осторожная трактовка таких клиничес-
ких симптомов, как олигурия, острая энцефа-
лопатия, отек легких ввиду их полиэтиологич-
ности при ГЛПС. Гиперкалиемия, редко раз-
вивающаяся даже при далеко зашедшей ОПН
при ГЛПС, не должна рассматриваться как
основное показание к ГД. Наряду с уремичес-
ким отеком легких, требующим срочного ГД,
ГЛПС осложняется хантаанлегочным синдро-
мом — ХЛС. При ХЛС тяжелый интерстициаль-
ный отек легких не связан с гипергидратацией
и острой левожелудочковой недостаточностью,
часто не уступает стандартному ГД.
Диализные методы применяют после исклю-
чения преренальной и постренальной (обструк-
тивной) ОПН при достижении креатинина
крови 7—8 мг%, при начинающемся уремичес-
ком отеке легких [Siamopoulos К.С., 1994]. Тя-
желая гипергидратация с умеренно выраженной
азотемией (Сг < 5 мг%) может быть корриги-
рована изолированной или постоянной артерио-
венозной ультрафильтрацией. При тяжелой
ОПН с нестабильной гемодинамикой более
эффективны методы постоянного артериовеноз-
ного и вено-венозного ГД. При ГЛПС, ослож-
ненном ДВС-синдромом, диализные методы
комбинируют с плазмаферезом.
Использование диализных методов снизило
летальность от тяжелых форм ГЛПС в 3 раза.
574
Чрезвычайно важен вопрос о тактике при
спонтанном разрыве (надрыве) почки. При
этом, несмотря на ультразвуковой мониторинг
и гемостатическую терапию, более чем в по-
ловине случаев возникает потребность в хирур-
гическом лечении. Из-за опасности рецидива
разрыва в контралатеральной почке нефрэкто-
мия противопоказана, должны применяться
органосохраняющие операции без декапсуляции
почки и пиелостомии.
Литература
Ковальский Г.С., Войно-Ясенецкий А.М., Петричко
М.И. Клиника и лечение неотложных состояний при
геморрагической лихорадке с почечным синдромом
//Клин. мед. - 1990. - № 3. - С. 138-144.
Рощупкин В.И., Суздальцев А.А. Геморрагическая ли-
хорадка с почечным синдромом. — Куйбышев, 1990.
Сиротин Б.З. Пути развития и особенности патоло-
гии почек при геморрагической лихорадке//Тер.
арх. - 1981. - № 6. - С. 64-67.
Шутов А.М., Шутова Л.А., Шапиро Г.Р. Течение и
исходы ОПН у больных геморрагической лихорад-
кой, леченных гемодиализом//Тер. арх. — 1997. —
№ 6. - С. 51-53.
Collan Y., Mihatch M.J., Lahdevirta J. Nephropathia
epidemica: mild variant haemorrhagic fever with renal
syndrome//Kidney Int. — 1991. — Vol. 40 (suppl. 35). —
P. 62-71.
Cosgriff T.M. Mechanisms of disease in Hantavirus infec-
tion//Rev. Infect. Dis. - 1991. - Vol. 13. - P. 97-107.
Elisaf M., Korakis H., Siamopoulos K. Chronic renal
dysfunction in haemorrhagic fever with renal syndro-
me//Renal Failure. - 1993. - Vol. 15. - P. 623-627.
Glass G.E., Childs J.E., Watson A. J. Association of
chronic renal disease, hypertension and infection with a
ratbome hantavirus//Abstr. 2-nd Symp. Arboviruses Medit.
Countries. — Dubrovnic, 1989. — 20 p.
Huggins J., Cosgriff T.M. Prospective double-blind placebo
controlled clinical trial of ribavirin therapy of
haemorrhagic fever with renal syndrome//!. Infect.
Dis. - 1991. - Vol. 164. - P. 1119-1127.
Lee J.S. Clinical features of haemorrhagic fever with renal
syndrome in Korea//Kidney Int. — 1991. — Vol. 40 (suppl.
35). - P. 88-93.
Siamopoulos K.C. Virus-related acute renal failure//
Nephrol. Dial. Transplant. — 1994. — Vol. 9 (suppl. 4). —
P. 111-115.
Van Ypersele D.S. Clinical features of haemorrhagic fever
with renal syndrome in Europe//Kidney Int. — 1991. —
Vol. 40 (suppl. 35). - P. 80-83.
Глава 36
ПОРАЖЕНИЕ ПОЧЕК ПРИ МАЛЯРИИ
А.В.Кухтевич
Поражение почек при малярии описано в
форме острой почечной недостаточности
(ОПН), острого гломерулонефрита, прогресси-
рующего гломерулонефрита, тубулоинтерстици-
ального нефрита. Дифференциальная диагнос-
тика различных форм малярийных нефропатий
нередко затруднена вследствие сходства их кли-
нических проявлений, распространенности
транзиторной лихорадочной протеинурии и ци-
линдрурии. Выделяют также гемоглобинурий-
ную лихорадку, которую считают осложнени-
ем противомалярийного лечения.
Малярия остается одной из ведущих причин
ОПН в Юго-Восточной Азии, Вьетнаме, Ин-
дии и Африке, а также повинна в большом
проценте случаев хронических гломерулопатий
среди африканских детей. Также растет число
реципиентов почечного трансплантата, у кото-
рых на фоне иммуносупрессии реактивируется
ранее перенесенная малярия.
Этиология и патогенез. Возбудители
малярии — одноклеточные простейшие, отно-
сящиеся к роду Plasmodium. У человека маля-
рию вызывают Plasmodium (Pl.) vivax — трех-
дневную малярию; Pl. malariae — четырехднев-
ную; Pl.falciparum — тропическую малярию; Pl.
ovale Stephens — овале-малярию. Цикл разви-
тия плазмодиев протекает со сменой хозяина:
половое развитие (спорогония) происходит в
организме самок комаров рода Anopheles, бес-
полое развитие (шизогония) — в организме че-
ловека, где выделяют две фазы развития воз-
будителя малярии — внеэритроцитарную (в
клетках печени) и эритроцитарную (в эритро-
цитах).
Разрушение эритроцитов в результате шизо-
гонии, гемолиз интактных эритроцитов, вы-
званный. образованием аутоантител, приводят
к развитию гемолитической анемии и гемогло-
бинурии. Выделяют также и гемоглобинурийную
лихорадку, возникающую в связи с приемом
хинина и 8-аминохинолинов лицами с врож-
денным дефицитом защитного фермента эрит-
роцитов — глюкозо-6-фосфатдегидрогеназы
(при низком содержании которой уменьшает-
ся образование АТФ с последующей задержкой
Na+ и воды в эритроцитах, их набуханием и ге-
молизом). При тропической малярии в услови-
ях выраженной паразитемии капилляры (в том
числе паренхиматозных органов) заполняются
зараженными эритроцитами, что ведет к ста-
зу, повреждению эндотелия, агрегации тром-
боцитов с внутрисосудистой коагуляцией и
последующим возможным развитием ОПН.
Другим вариантом поражения почек, наблюда-
емым при тяжелом течении тропической маля-
рии являются различные клинические вариан-
ты острого гломерулонефрита или тубулоинтер-
стициального нефрита, который обычно разре-
шается после излечения малярии, но иногда
может приобретать хроническое прогрессирую-
щее течение вплоть до развития уремии.
Клиническая картина. Поражение
почек охватывает вышеупомянутые клинико-
морфологические варианты (острый канальце-
вый некроз, гломерулонефрит, тубулоинтерсти-
циальный нефрит), которые в определенной
мере взаимосвязаны, а развитие и дальнейшая
эволюция того или иного из них во многом за-
висят от клинического варианта малярии, тя-
жести ее течения, возраста больного.
Гломерулонефрит — поражение клубочков
может встречаться при falciparum-малярии и
малярии, вызванной Pl. malariae, чаще всего
встречается в эндемичных районах (западная,
в меньшей степени восточная, центральная и
южная Африка); упоминание о сходной с ГН
клинической картине находили еще в трудах
Гиппократа. Считают, что частота гломеруло-
нефрита в целом уменьшилась на фоне успе-
хов в борьбе с малярией. Гломерулонефрит,
сочетаясь с клиникой малярии, не имеет черт
специфичности, встречается у лиц разных воз-
растов, однако дети представляют собой кон-
575
тингент наиболее высокого риска. Точная рас-
пространенность такого гломерулонефрита не
известна, поскольку многие случаи протекают
в стертой, субклинической форме или их за-
тмевают другие осложнения малярии. В 20—50 %
подтвержденных случаев наблюдают незначи-
тельную протеинурию, микрогематурию (чаще
у пожилых) и цилиндрурию. Малярию счита-
ют одной из самых частых причин НС в Афри-
ке. Описывают острый нефритический синдром;
артериальная гипертония нехарактерна и явля-
ется поздним симптомом. Несмотря на успеш-
ное излечение самой малярии, развившийся
гломерулонефрит может приобретать прогрес-
сирующее течение, которое через 3—5 лет спо-
собно закончиться уремией. В сыворотке может
отмечаться снижение уровня СЗ- и С4-фракций
комплемента. В отличие от нефропатии при
четырехдневной малярии (Pl. malariae) falcipa-
rum-нефропатия регрессирует в течение 2—
6 нед после излечения малярии.
Морфологически falciparum-нефропатия ха-
рактеризуется мезангиальной пролиферацией с
большим количеством транзиторных моноци-
тов; экспансия мезангиального матрикса уме-
ренная, изменения базальной мембраны неха-
рактерны. Описаны отложения эозинофильно-
го гранулярного материала вдоль стенки капил-
ляров, в мезангии, в капсуле Боумена — Шум-
лянского. Часто фиксируется запустевание ка-
пилляров клубочков, или же в них могут нахо-
диться эритроциты, содержащие паразитов или
гигантские ядерные массы, что характерно для
больных, имевших сопутствующий ДВС-синд-
ром. Морфологические изменения — фокальные
и сегментарные вначале — в последующем
могут трансформироваться в диффузные и не-
редко прогрессируют вплоть до глобального
склероза. Полагают, что прогрессирование клу-
бочковых поражений, как и при других пара-
зитозах, может быть мультифакториальным, оп-
ределяться генетической предрасположеннос-
тью к пролиферативно-склеротическим процес-
сам, усугубляться недоеданием, присоединени-
ем инфекции, вызываемой вирусом Эпштей-
на — Барр.
Иммунофлюоресценция выявляет грануляр-
ные депозиты иммуноглобулинов класса G, М
и СЗ-фракции комплемента вдоль стенок ка-
пилляров и в мезангии. Малярийные антигены
в 25—33 % обнаруживаются вдоль эндотелия
капилляров клубочков и в капиллярах мозгового
слоя. Электронная микроскопия определяет суб-
эндотелиальные и мезангиальные электронно-
плотные депозиты гранулярного, фибриллярно-
го и аморфного характера.
Изменения в канальцах включают облако-
видное набухание и отек, гранулярные отложе-
ния гемосидерина и различные стадии клеточ-
576
ного некроза. В просвете канальцев нередко
обнаруживают слепки гемоглобина. Почечный
интерстиций характеризуется отечностью, ин-
фильтрацией мононуклеарами, а в его венулах
определяются пробки из эритроцитов, содер-
жащих паразитов.
ОПН или острый канальцевый некроз при
малярии связывают с Pl.falciparum (с которым
ассоциируют также острый интерстициальный
нефрит и пролиферативный гломерулонефрит).
Частота острого канальцевого некроза при
falciparum малярии колеблется от 1 до 4 % всех
случаев, достигая 60 % при злокачественных
вариантах течения. Характерна желтуха, по-
скольку в основе нарушений лежат гемолиз,
гипербилирубинемия, внутрипеченочный холе-
стаз. Гиперкатаболизм осложняется рабдомио-
лизом. Наблюдаются сильное потемнение мочи
(«черная моча»), уменьшение ее количества
вплоть до анурии. В итоге развиваются глубокие
нарушения микроциркуляции, ДВС-синдром,
которые ведут к нарушению перфузии органов
и тканей, что сопровождается лактацидозом,
накоплением свободных радикалов. В ряду био-
химических нарушений также отмечаются ги-
перкалиемия, гиперурикемия, гипогликемия.
Определенное патогенетическое значение при-
дают рабдомиолизу [Allo J. et al., 1997], кото-
рый при малярии вызывается мионекрозом,
индуцированным малярийными эндотоксина-
ми, лактацидозом или миотоксическим дей-
ствием высвобождающегося фактора некроза
опухоли (а). Олигурическая фаза ОПН продол-
жается от нескольких дней до нескольких не-
дель. Прогноз зависит от тяжести состояния,
ассоциированных внепочечных нарушений (при
фульминантном течении может развиваться ос-
трый респираторный дистресс-синдром), ответа
на противомалярийную терапию, доступности
экстракорпоральных методов лечения. Смерт-
ность колеблется в пределах 15—30 %; в тяже-
лых случаях, сочетающихся с гемоглобинурий-
ной лихорадкой, летальный исход почти неиз-
бежен.
Острый интерстициальный нефрит описан у
грызунов, но не у человека; в то же время вос-
палительные изменения интерстиция почек
часто обнаруживаются при морфологическом
исследовании у лиц с острым канальцевым не-
крозом и острым гломерулонефритом при ма-
лярии, вызванной Pl. falciparum.
Гемоглобинурийная лихорадка встречается в
основном при тропической малярии; ее нередко
описывают как осложнение малярии, тогда как
она является осложнением противомалярийного
лечения у лиц, имеющих дефицит глюкозо-6-
фосфатдегидрогеназы — защитного фермента
эритроцитов. Наблюдается у лиц, длительно
находящихся в эндемичных зонах, неоднократ-
но перенесших малярию, через несколько ча-
сов после приема хинина (реже 8-аминохино-
линов), чаще всего встречается у коренного на-
селения Африки, средиземноморского бассей-
на и Закавказья.
Клиника гемоглобинурийной лихорадки:
внезапный озноб, повышение температуры до
высоких цифр, головная боль, боли в суставах,
пояснице, рвота, икота, гепато- и спленоме-
галия с болезненностью этих органов. После
озноба, длящегося около 2—4 ч, — состояние
прострации, слабый, малый пульс. Кожа жел-
теет и становится синюшной. Конечности хо-
лодеют, иногда появляются крапивница, кож-
ный зуд. Основной симптом — появление мочи
цвета черного кофе, что связано с наличием в
ней оксигемоглобина. В моче определяются
эритроциты, гиалиновые и зернистые цилинд-
ры, белок в большом количестве. Выделение
темной мочи продолжается 1—3 сут, вслед за
чем может развиться анурия и наступить смерть
от ОПН. При благоприятном варианте через 3—
5 дней отмечается снижение температуры, по-
светление мочи и постепенное улучшение со-
стояния.
Диагностика. Исходит из характерного
эпидемиологического анамнеза, наличия кли-
ники малярии и лабораторного подтверждения
диагноза малярии (обнаружение плазмодиев
при микроскопии так называемой толстой кап-
ли крови, положительные серологические ре-
акции). В таких случаях имеющаяся ОПН или
гломерулонефрит с наибольшей вероятностью
имеют малярийную этиологию.
Лечение и профилактика. В лечении
нефропатий, ассоциированных с малярией, при-
меняют противомалярийные препараты: в 1-й
день хлорохин (перорально или внутривен-
но) — 10 мг/кг, затем 5 мг/кг каждые 6—8 ч в
течение 2—3 дней. Результаты лечения хлоро-
хинрезистентных форм менее удовлетворитель-
ны; используют хинидин — 6,25 мг/кг, затем
постоянные инфузии в дозах 0,125 мг/кг — до
тех пор, пока процент эритроцитов, поражен-
ных плазмодиями, не будет ниже 1 %. Альтер-
нативой является пероральный прием хини-
на — 10 мг/кг каждые 8 ч в течение 10 дней
или же 750 мг мефлохина или 3 таблеток фан-
зидара (пириметамин, 75 мг + сульфадоксин,
1500 мг) в виде однократной дозы.
Лечение кортикостероидами, несмотря на
предполагаемый аутоиммунный компонент в
патогенезе малярийных нефропатий, оказалось
безрезультатным и не рекомендуется к приме-
нению.
При развитии ОПН на ранней стадии при-
меняют регидратацию изотоническими раство-
рами или назначают мочегонные (фуросемид и
маннит). При возникновении стойкой анурии
необходимы экстракорпоральные методы: гемо-
диализ предпочтительнее перитонеального ди-
ализа (особенно в случаях гиперкатаболического
состояния), однако в эндемичных районах пос-
ледний может быть более доступен. Обменное
переливание крови показано при тяжелой па-
разитемии и выраженной желтухе. Описано ус-
пешное применение плазмафереза при анурии,
сочетающейся с церебральными и легочными
осложнениями малярии. Есть сообщения о по-
лезном эффекте простациклина при выражен-
ном внутрисосудистом гемолизе.
В связи с обостряющейся проблемой резис-
тентности малярии к медикаментозному лече-
нию все большее значение придают вакцина-
ции (например, Spf-66 вакциной) в эндемич-
ных регионах.
Прогноз. Своевременное лечение благо-
приятно протекающей малярии обеспечивает
полное выздоровление, поражение почек ред-
ко переходит в хроническую форму. При тяже-
лом течении малярии прогноз серьезный у де-
тей и беременных.
Литература
Allo J., Vincent F., Barboteu М., Schlemmer В.//Nephrol.
Dial Transplant. - 1992. - Vol. 12. - P. 2033-2034.
Barsoum R.S. Malarial nephropathies//Nephrol. Dial.
Transplant. - 1998. - Vol. 13. - P. 1588-1597.
37—2950
Гпава 37
ПОРАЖЕНИЕ ПОЧЕК
ПРИ ШИСТОСОМАТОЗЕ
А.В.Кухтевич
Поражение мочеполовой системы при шис-
тосоматозах (бильгарциозе) охватывает мочевой
пузырь и мочеточники, у мужчин — простату
и семенные пузырьки, у женщин — матку;
среди осложнений отмечается гидронефроз,
нефролитиаз, пионефроз и уросепсис. Допуска-
ют возможность развития специфического гло-
мерулонефрита с нефротическим синдромом
(цифры протеинурии подчас достигают 5 г/л)
[Rasendramino М. et al., 1998], что, однако, не
подтверждено морфологическими данными.
Шистосоматоз по распространенности зани-
мает второе место в мире после малярии: он
зарегистрирован более чем в 70 странах; по
данным ВОЗ, им страдают более 300 млн жите-
лей Африки, юга Азии и Латинской Америки,
а около 500 млн подвержены риску заражения.
Этиология и патогенез. Возбудители
шистосоматозов (бильгарциоза) — шистосо-
мы — относятся к типу плоских червей — тре-
матод. Шистосомы имеют сложный цикл раз-
вития со сменой хозяев, окончательными из ко-
торых являются млекопитающие и человек. Про-
никнув через кожу человека в его кровеносную
систему, шистосомы затем паразитируют в ве-
нах, в частности мочевого пузыря. Миграция
яиц возбудителя из просвета сосудов в моче-
вой пузырь через его стенку индуцирует вос-
палительную реакцию, клинически проявляю-
щуюся гематурией (геморрагический цистит),
морфологически характеризующуюся грануле-
матозом, развитием фиброзной ткани и каль-
цификацией.
Процесс обызвествления вокруг яиц гель-
минтов (залегающих во всех слоях стенки мо-
чевого пузыря) перемежается с образованием
новых гранулем, которые, вскрываясь, ведут к
образованию язв, рубцов и даже папиллом,
способных к малигнизации. Воспалительный и
578
рубцовый процесс захватывает не только стен-
ки мочевого пузыря, но и мочеточников, что
в итоге ведет к склерозу и уменьшению объе-
ма этих органов, к нарушению уродинамики и
развитию гидронефроза, уролитиаза.
Клиническая картина. Так называе-
мый мочеполовой шистосоматоз, как правило,
проявляется терминальной гематурией через 4—
6 нед после заражения (в 4—14 % случаев это-
му предшествует картина острой инвазии: дер-
матит в месте проникновения, нередко с лихо-
радочной реакцией, которые регрессируют за 5—
6 дней; еще через 1—3 нед — картина острого
бронхита, нередко с кровохарканьем, миалгии,
артралгии, продолжающиеся около 7—14 дней).
Гематурии может сопутствовать дизурия, тяжесть
в промежности. Вовлечение мочеточников про-
является усилением гематурии, присоединени-
ем коликообразных болей в пояснице, а в по-
следующем и формированием гидронефроза.
Другим, значительно более редким вариан-
том поражения почек при шистосоматозе яв-
ляется гломерулонефрит, который манифести-
рует отеками, артериальной гипертонией, про-
теинурией и даже почечной недостаточностью.
Диагностика базируется на эпидемио-
логическом анамнезе, характерной клинике
(терминальная гематурия, дизурия) и верифи-
кации шистосоматоза. Для этих целей исполь-
зуют определение яиц шистосом в моче, соби-
раемой между 10 и 14 ч дня (время их макси-
мальной экскреции) и фильтруемой через спе-
циальный мембранный фильтр, позволяющий
задерживать яйца; гельминтов затем идентифи-
цируют при световой микроскопии под 10-крат-
ным увеличением. Применяют также иммуно-
логические методы диагностики: реакцию свя-
зывания комплемента, методы иммунофлюо-
ресценции, энзимиммунологический метод.
Инструментальные методы — цистоскопия,
УЗИ, рентгенография. При цистоскопии выяв-
ляют шистосомные бугорки, просвечивающие
через истонченную слизистую оболочку пузы-
ря; биопсия слизистой в 80—90 % случаев вы-
являет живые и/или кальцифицированные яйца
гельминтов. При УЗИ определяются деформа-
ции мочевого пузыря, остаточная моча в нем,
дилатация чашечно-лоханочной системы. На
обзорной урограмме могут наблюдаться очень
четкие контуры органов мочевого тракта, что
связано с уплотнением и/или кальцификаци-
ей его стенок. При внутривенной урографии
могут идентифицироваться уменьшение объема
мочевого пузыря, стриктуры нижних отделов и
дилатация верхних отделов мочеточников в
сочетании с расширением чашечно-лоханочной
системы.
Лечение. В основе гломерулонефрита при
шистосоматозе лежит, как считают, иммуноком-
плексное поражение мезангия с фокальной или
диффузной клеточной пролиферацией. При этом
выявляют мезангиальные депозиты IgM, СЗ и
антигенов шистосом. Описана сочетанная инва-
зия шистосомами и сальмонеллами, при которой
наблюдается массивная протеинурия, нефроти-
ческий синдром, умеренное нарушение функции
почек и картина системного воспаления.
У 15 % больных с гломерулопатией, вызван-
ной шистосомами, выявляется амилоид типа
АА [Barsoum R.S., 1993], причем у некоторых
из них массивное отложение амилоида в клу-
бочках доминирует над типичной для шисто-
соматоза клубочковой пролиферацией. Клини-
чески такие больные неотличимы от индиви-
дов с классическим почечным шистосоматозом,
в исходе у них развивается уремия. Не исклю-
чают генетической, детерминированности ами-
лоидоза в таких случаях, что косвенно подтвер-
ждается преобладанием определенных типов
HLA у этих больных.
Терминальная уремия в исходе различных
вариантов мочеполового шистосоматоза разви-
вается достаточно часто. Так, в Египте 20 %
популяции больных, находящихся на хроничес-
ком гемодиализе, имеют в качестве причинного
заболевания именно шистосоматоз. При этом
иммунокомплексный нефрит при шистосома-
тозе является причиной уремии у 9 % больных
из общей популяции, находящейся на хрони-
ческом гемодиализе |Barsoum R.S., 1998].
Наиболее часто используют празиквантел
(отечественный аналог — азинокс) в дозе 20—
60 мг/кг в течение одного дня. Лечение празик-
вантелом эффективно и при нефротическом син-
дроме, вызванном шистосоматозом [Turner I.
et al., 1987].
При сочетанной инвазии шистосомами и
сальмонеллами комбинируют празиквантел с
препаратами, активными против сальмонелл.
Серьезную проблему представляет лечение
больных с уже развившимися обструкцией мо-
чевых путей, рефлюксом, нефролитиазом, а
также при наличии мезангиокапиллярного гло-
мерулонефрита, фокального склероза и амило-
идоза, поскольку празиквантел в таких ситуа-
циях неэффективен.
Шистосоматоз создает немалые проблемы и
при проведении заместительного лечения. По-
ражение печени и селезенки шистосомами
может вызывать асцит, что препятствует ис-
пользованию перитонеального диализа, а вари-
коз вен пищевода делает рискованным прове-
дение гемодиализа. Развитие гранулем в моче-
выводящих путях затрудняет формирование
анастомозов при пересадке почки, а пораже-
ние печени нарушает метаболизм иммунодеп-
рессантов, применяемых у реципиентов почеч-
ного трансплантата.
Прогноз благоприятен при отсутствии ос-
ложнений в виде фиброзирования и обызвеств-
ления участков мочевого тракта, исходом ко-
торых могут явиться гидронефроз, пионефроз,
уролитиаз и уремия.
Литература
Barsoum R.S. Schistosomal glomerulopathies//Kidney
Int. - 1993. - Vol. 44. - P. 1-12.
Barsoum R.S. Urinary schistosomiasis//Amer. J. Kidney
Dis. - 1998. - Vol. 32. - P. Xliii-Xlvi.
Rasendramino M.H., Rajaona H.R., Ramarokoto C.E. et
al. Prevalence des retentissement uro-nephrologiques de
la bilharziose urinaire dans un foyer hyperendemique de
Madagaskar//Nephrologie. — 1998. — Vol. 19. — P. 341—
345.
Turner I., Harrison A., Ibels L.S. et al. Minimal change
glomerulonephritis associated with S. haematobium
infection. Resolution with praziquantel treatment//Aust.
NZJ Med. - 1987. - Vol. 17. - P. 596-598.
37*
Гпава 38
ОСТРАЯ ПОЧЕЧНАЯ
НЕДОСТАТОЧНОСТЬ
В. М. Ермоленко
Острая почечная недостаточность (ОПН) —
потенциально обратимое, развивающееся в те-
чение нескольких часов или дней нарушение
гомеостатической функции почек, чаще всего
ишемического или токсического генеза.
Эпидемиология. Четверть века назад
считали, что на 1 млн взрослого населения в
течение 1 года приходится 40 случаев ОПН, для
лечения которых необходимо проведение 200
гемодиализов, однако это не отражает истин-
ной распространенности ОПН, поскольку да-
леко не каждому больному с острым наруше-
нием функции почек требуется заместительная
терапия. В настоящее время в неселективной
популяции частота ОПН приближается к 200 на
1 млн населения, и она возникает в 5 раз чаще у
пожилых, чем у молодых [Klinknecht D., Pallot L,
1998].
В последние годы также подверглись карди-
нальным изменениям причины ОПН и выжи-
ваемость больных. Например, по данным
В.Brenner и J.Lasarus (1983), в 60-е годы на
долю акушерско-гинекологических причин при-
ходилась почти половина всех случаев ОПН и
в 90 % из них она была следствием криминаль-
ного аборта. С 1969 г. аборт в Великобритании
стал легальным, а случаи акушерской ОПН
эпизодическими. Согласно P.Kellerman (1994),
частота ОПН после хирургических вмешательств
на сердце в 1954 г. составляла 1,8 %, а к 1994 г.
увеличилась в 2 раза, причем почти половине
больных требовался гемодиализ. По H.Kierdorf
(1994), начиная с 90-х годов прослеживается
устойчивая тенденция, в соответствии с кото-
рой ОПН все чаще становится не моноорган-
ной патологией, а составляющей синдрома по-
лиорганной недостаточности (ПОН), неблаго-
приятно влияя на выживаемость больных. Счи-
тают, что эта тенденция сохранится и в XXI в.
580
Общепринято подразделять ОПН на прере-
нальную, обусловленную недостаточным крово-
обращением почек, ренальную, вызываемую
поражением собственной почечной паренхимы,
и постреналъную, связанную с препятствием
оттоку мочи.
При преренальной ОПН функция почек
полностью сохранена, однако нарушение гемо-
динамики и уменьшение циркулирующего
объема крови приводят к почечной вазоконст-
рикции и снижению почечного кровотока, в
результате уменьшается перфузируемый через
почки объем крови, происходит недостаточное
ее очищение от азотистых метаболитов и раз-
витие азотемии.
Основными причинами преренальной ОПН
являются:
• состояния, сопровождающиеся уменьшени-
ем сердечного выброса (кардиогенный шок,
тампонада сердца, аритмии, сердечная не-
достаточность, эмболия легочной артерии);
• вазодилатация (сепсис, анафилаксия);
• уменьшение объема внеклеточной жидкости
(ожоги, кровопотеря, дегидратация, диарея,
цирроз печени с асцитом, нефротический
синдром, перитонит).
На долю преренальной приходится 40—60 %
всех случаев ОПН [Alexopoulos Е. et al., 1994],
однако при своевременно недиагностированной
длительно персистирующей преренальной ОПН
она может переходить в ренальную, а гипопер-
фузия почек делает их более чувствительными
к различным нефротоксическим стимулам,
включая лекарственные препараты.
Ренальная ОПН в 75 % случаев обусловлена
ишемическим (шок и дегидратация) и токсичес-
ким (нефротоксины) поражением почек и в
25 % случаев — другими причинами: воспале-
нием в почечной паренхиме и интерстиции (ос-
трый гломерулонефрит, интерстициальный не-
фрит), сосудистой патологией (васкулиты,
тромбоз почечных артерий, вен, расслаивающая
аневризма аорты и т.д.).
У 3/4 больных с ренальной ОПН морфоло-
гическим субстратом поражения почек являет-
ся острый тубулярный некроз.
Постренальная ОПН, составляющая пример-
но 5 % случаев острого нарушения функции
почек, в отличие от преренальной и ренальной
чаше сопровождается анурией (менее 50 мл
мочи в сутки), причем препятствие оттоку мочи
может находиться на любом уровне, начиная
от почечных лоханок и кончая отверстием мо-
чеиспускательного канала.
38.1. Патологическая анатомия
и патогенез
Наиболее частой причиной ОПН является
ишемия почек, которая развивается не только
при различных видах шока — гиповолемичес-
ком, кардиогенном, септическом и т.д., но и
под воздействием нефротоксинов, гемолиза и
т.д., причем при нефротоксической ОПН на-
ряду с гемодинамическими расстройствами
имеет значение непосредственное влияние не-
фротоксинов на канальцевый эпителий во вре-
мя резорбции или экскреции токсичных ве-
ществ.
Гистологически при световой микроскопии
клубочки больных с ишемической ОПН вы-
глядят интактными. В проксимальных канальцах
выявляется очаговый некроз эпителия, высота
щеточной каемки обычно снижена, на отдель-
ных участках она полностью отсутствует, что
дает повод ошибочно распознавать их как дис-
тальные. Наблюдается отслойка эпителия от
базальной мембраны. Просвет проксимальных
канальцев обычно не заполнен, их диаметр не
превышает норму, в то время как дистальные
канальцы обычно расширены, в них содержат-
ся гиалиновые и гранулярные цилиндры или
пигмент у больных с гемолизом и рабдомио-
лизом.
При экспериментальной ишемической ОПН
некрозу подвергается небольшая часть эпителия
проксимальных канальцев, промежуточное чис-
ло клеток находится в состоянии апоптоза
(фрагментация ДНК эндонуклеазами), а основ-
ная масса, повреждаясь сублетально, остается
жизнеспособной и в последующем восполняет
утраченный эпителий. У человека, если биопсия
почки выполнена не в первые дни после раз-
вития ОПН, эти вновь образованные клетки
могут выглядеть нормальными. Подвергнутся
клетки некрозу или апоптозу или останутся
неповрежденными, зависит от их обеспеченно-
сти АТФ. При уменьшении запасов АТФ < 15 %
от исходного содержания развивается некроз.
Если степень дефицита меньше (25—70 %),
возникает апоптоз [Lieberthal W. et al., 1998],
сохраняющийся усиленным вплоть до 4 мес
после ишемического повреждения. В семейство
эндонуклеаз (протеазы клеточной смерти, кас-
пазы) входят интерлейкин 1-/Lконвертирующий
энзим (ИКЭ) и другие ферменты. G.Kaushal и
соавт. (1998) установили, что после ишемии в
ткани почек усилена экспрессия каспазы-1,
ИКЭ, каспазы-2 (Nedd 2), каспазы-3 (СНН 32)
и каспазы-6 (Meh 2).
Сразу после возобновления кровотока начи-
наются пролиферация жизнеспособных клеток,
достигающая максимальной выраженности на
2—3-и сутки от начала реперфузии, и их миг-
рация, восстанавливающая целостность эпите-
лиального покрова [Bonventre I., 1993]. Перси-
стирующий апоптоз усиливает репарационный
процесс [Shimizu A., Yamanka N., 1993]. Спо-
собствуют стабилизации элементов цитоскеле-
та тепловые шоковые протеины 25, 70 и 72,
экспрессия которых в ткани почек достигает
максимума в первые часы после восстановле-
ния кровотока [Aufricht Ch. et al., 1998].
Первичная патология, вызвавшая ОПН,
придает определенные особенности морфоло-
гической картине поражения почек.
У больных с гепаторенальным синдромом
дополнительно к картине острого тубулярного
некроза в канальцах обнаруживают зелено-го-
лубые кристаллы лейцина, окрашенные желчью
цилиндры, окруженные полиморфно-ядерны-
ми лейкоцитами, вакуолизацию сохранившего-
ся эпителия проксимальных канальцев с жел-
чными пигментами в цитоплазме. При нефро-
тическом синдроме, развившемся на фоне ми-
нимальных изменений, несмотря на клинику
ОПН, гистологические изменения широко ва-
рьируют от нормальной гистологической кар-
тины до острого тубулярного некроза.
При ОПН вследствие острого интерстициаль-
ного нефрита, часто лекарственного генеза, в
интерстиции выявляют инфильтраты, состоящие
из больших и малых лимфоцитов и эозинофи-
лов. Канальцевый эпителий местами сохраняет
нормальную структуру, в других участках нахо-
дят изменения, характерные для острого тубу-
лярного некроза. В зонах выраженной инфильт-
рации наблюдают разобщение и полное пережа-
тие канальцев клетками инфильтратов, в сохра-
нившихся канальцах — дезинтеграцию базаль-
ных мембран с утечкой белкового канальцевого
ультрафильтрата. Интерстициальный объем уве-
личен до 60 % вместо 10—15 % в норме.
Ранее считали, что ишемическому повреж-
дению наиболее подвержены проксимальные
581
канальцы, однако M.Brezic и соавт. (1984),
S.Rosen и соавт. (1992) и др. показали, что вне-
шняя полоска внутренней медуллы, и в физи-
ологических условиях функционирующая на
грани гипоксии (10 % почечного кровотока),
не менее уязвима при нарушении кровообра-
щения почек.
В этой области расположено восходящее ко-
лено петли Генле, в котором в норме реабсор-
бируется до 20 % профильтрованного натрия.
Если потребность в энергии, необходимой для
транспорта ионов, перестает соответствовать
поступлению кислорода, гипоксия может усу-
губляться и развиваются морфологические из-
менения.
В чем же причина того, что нередко незна-
чительные морфологические изменения сопро-
вождаются столь тяжелым нарушением функ-
ции почек?
Апикальные и базолатеральные мембраны
клеток проксимальных канальцев различны в
функциональном и морфологическом отноше-
нии, обеспечивая полярность клеток, поддер-
живаемую актином. Достаточно жесткий цито-
скелет необходим для гомеостатической функ-
ции этого отдела нефрона: участки апикальной
мембраны каждые 10 мин образуют эндоплаз-
матические выросты, имеющие жидкостную и
абсорбтивную фазы, во время которых проис-
ходит поглощение веществ или удаление мак-
ромолекул из гломерулярного ультрафильтра-
та, а на базальной мембране расположена Na,
К-АТФаза, играющая ключевую роль в процес-
сах реабсорбции.
При экспериментальной ишемии уже через
5—10 мин после пережатия почечной артерии
нарушается строение доменов апикальной и
базолатеральной мембран, что сопровождается
транслокацией Na, К-АТФазы на апикальную
мембрану, а лейцинаминопептидазы — на ба-
зальную. Дислокация Na, К-АТФазы приводит
к нарушению реабсорбции натрия и ряда дру-
гих веществ, транспорт которых сопряжен с
натрием. Возникает именно та ситуация, когда
кажущиеся морфологически нормальными
клетки не в состоянии поддерживать водно-
электролитный баланс. Сроки восстановления
цитоскелета и полярности клетки зависят от
длительности ишемии: при 15-минутном пре-
кращении почечного кровотока для этого тре-
буются 1 сут, а при 50-минутной ишемии —
много дней.
Некоторые нефротоксины, в частности S-
конъюгаты L-цистеина, повреждая F-актин
цитоскелета, вызывают отслойку клеток прокси-
мальных канальцев и в конечном итоге такое же
нарушение цитоскелета с диспозицией важней-
ших клеточных структур [van de Water В. et al.,
1994].
582
При нефротоксической ОПН отслоившиеся
клетки могут обтурировать просвет канальцев,
а через места разрыва тубулярной базальной
мембраны происходит утечка ультрафильтрата.
Эти нарушения по механизму обратного тубу-
логломерулярного взаимодействия вызывают
спазм почечных сосудов и падение клубочко-
вой фильтрации.
Недавно M.Goligorsky и соавт. (1993) пока-
зали, что обтурация канальцев происходит слу-
щенным, но жизнеспособным эпителием, ко-
торый благодаря взаимодействию интегринов со
специфическим мембранным рецептором при-
липает к плазменным мембранам. Введение в
почечную артерию крыс после периода ише-
мии синтетического пептида, блокирующего
это взаимодействие, предупреждает обструкцию
канальцев и снижение клубочковой фильтра-
ции.
Утечка ультрафильтрата через поврежденные
стенки канальцев ответственна не более чем за
5 % снижения функции почек при остром ту-
булярном некрозе, тогда как уменьшение вы-
соты щеточной каемки проксимальных каналь-
цев и площади базолатеральных мембран кор-
релируют с максимумом функциональных рас-
стройств во время ОПН [Olsen I., Solez А.,
1987].
Эпителий проксимальных канальцев — ос-
новное место транспорта натрия. Нарушение
процессов реабсорбции его приводит к усилен-
ному поступлению натрия в область macula densa
и стимулирует продукцию ренина, который
вызывает и поддерживает спазм приводящих
артериол с перераспределением почечного кро-
вотока и запустеванием сосудов коры. Афферен-
тная вазоконстрикция сопровождается сниже-
нием интракапиллярного давления в гломеру-
лярных капиллярах, чем можно объяснить сни-
жение клубочковой фильтрации, характерное
для ОПН, и транскапиллярного транспорта
растворов.
Значение активации ренин-ангиотензиновой
системы в поддержании спазма почечных сосу-
дов подтверждается как закономерным обнару-
жением гиперренинемии у больных с ОПН, так
и невозможностью вызвать ОПН у эксперимен-
тальных животных, у которых запасы ренина
истощены длительным содержанием на бедном
натрием рационе или предшествующей ОПН.
Лозартан, блокируя специфические АТ,-рецеп-
торы ангиотензина II, ускоряет восстановление
почечных функций [Kontogiannis J., Burns К.,
1998].
В то же время ангиотензин II чрезвычайно
важен для нормального развития ткани почек.
В физиологических условиях он, связываясь со
специфическими рецепторами на тубулярной
базальной мембране, стимулирует гипертрофию
канальцевого эпителия и, индуцируя образова-
ние эпидермального фактора роста, усиливает
митоз клеток [Wolf et al., 1993]. Большинство
мышей с точечной мутацией компонентов ло-
кальной ренин-ангиотензиновой системы и от-
сутствием ангиотензиногена или АТ^-рецепто-
ров погибают в младенческом возрасте, а у
животных, переживших период грудного вскар-
мливания, выявляют гипертрофию сосудов,
фокальное отсутствие канальцев, интерстици-
альные инфильтраты [Nimura F. et al., 1995].
Помимо ренина, на тонус почечных сосу-
дов влияют катехоламины, образующиеся
вследствие активации симпатической нервной
системы, эндотелии, нарушение синтеза оксида
азота и другие факторы.
В настоящее время накапливается все боль-
ше экспериментальных и клинических данных,
свидетельствующих, что влияние констриктив-
ных стимулов на сосуды при ОПН реализуется
в результате изменения внутриклеточной кон-
центрации кальция. Согласно этим данным,
начальная ишемия или нефротоксины вызыва-
ют повреждение плазменных мембран каналь-
цевых клеток, увеличивая их проницаемость для
кальция. Последний первоначально поступает в
цитоплазму, а затем с помощью специального
переносчика, локализованного на внутренней
поверхности митохондриальных мембран, в
митохондрии. Энергия, используемая перенос-
чиком, необходима и для начального этапа
синтеза АТФ. Дефицит энергии, как упомина-
лось, приводит к некрозу клеток, а образовав-
шийся клеточный детрит обтурирует канальцы,
усугубляя анурию. После восстановления почеч-
ного кровотока образовавшиеся кислородные
радикалы, повышая активность фосфолипаз,
способны поддерживать нарушения мембранной
проницаемости, вследствие чего продолжается
аккумуляция кальция в клеточных органеллах
(митохондриях и плазматическом ретикулуме),
и пролонгировать таким образом олигурическую
фазу ОПН. Поэтому одновременное с ишеми-
ей или непосредственно после нее введение
животным блокаторов Са-каналов, нифедипи-
на или верапамила препятствует поступлению
кальция в клетки и благодаря этому предупреж-
дает или облегчает течение ОПН.
Синергическое действие оказывают ингиби-
торы активности фосфолипаз и вещества, спо-
собные улавливать кислородные радикалы, на-
пример глутатион, содержание которого повы-
шено в ткани почек гипотиреоидных животных
[Paller М., 1986], у которых трудно воспроиз-
вести ишемическую ОПН.
Помимо блокаторов Са, митохондрии от
повреждения предохраняют ионы магния и
адениннуклеотиды.
Примерно 10 % всех поступлений больных
в центры острого гемодиализа обусловлено
ОПН, вызванной нефротоксинами.
Среди более чем 100 известных нефроток-
синов важную роль играют лекарственные ве-
щества и в первую очередь аминогликозиды,
применение которых в 5—20 % случаев ослож-
няется умеренной и в 1—2 % — выраженной
ОПН. Развитие ОПН описано и при исполь-
зовании нестероидных противовоспалительных
препаратов, рентгеноконтрастных средств,
хинина, анестетиков, содержащих фтор, кап-
топрила и т.д.
Аминогликозиды — сахара с молекулярной
массой 500, содержащие в боковых цепях сво-
бодные аминогруппы, количество которых оп-
ределяет нефротоксичность препаратов. У нео-
мицина их 6, при его парентеральном приме-
нении необходимо соблюдать крайнюю осто-
рожность, а у остальных наиболее популярных
в клинике препаратов — гентамицина, тобра-
мицина, амикацина, канамицина — по 5.
Все аминогликозиды не всасываются в же-
лудочно-кишечном тракте, почти полностью
распределяются во внеклеточной жидкости и,
не метаболизируясь в организме, на 99 % вы-
водятся с мочой в неизмененном виде, филь-
труясь, подобно креатинину, в клубочках, при-
чем их клиренс практически равен клиренсу
креатинина.
Как показали эксперименты на животных,
после введения меченный тритием профильт-
рованный гентамицин связывается в просвете
канальцев с везикулами апикальной мембраны,
поглощается путем пиноцитоза и секвестриру-
ется в лизосомах клеток преимущественно из-
витых проксимальных канальцев и петли Ген-
ле, причем концентрация препарата в коре
почек значительно превосходит его содержание
в сыворотке. У крыс время полувыведения ген-
тамицина и тобрамицина из почечной ткани в
200 раз превышает период полувыведения из
сыворотки (соответственно 30 мин и 100 ч).
После однократной подкожной инъекции пре-
параты обнаруживают в моче в течение не-
скольких недель.
В отличие от ишемической ОПН, при кото-
рой происходит стимуляция активности фосфо-
липаз клеточных мембран с повышением их
проницаемости для кальция, при аминоглико-
зидном поражении почек изменения мембран
связаны с увеличением в них анионных фос-
фолипидов, в частности фосфатидилинозитола.
Одновременно повреждаются и митохондриаль-
ные мембраны, что сопровождается потерей
внутриклеточного калия и магния, нарушени-
ем окислительного фосфорилирования и дефи-
цитом энергии и гибелью клеток.
Усиливают нефротоксичность аминогликози-
дов их сочетание с другими антибиотиками (це-
583
фалоспорины), нефротоксическими препарата-
ми (циклоспорин), гипокалиемия. Напротив,
кальций, препятствуя связыванию аминоглико-
зидов с щеточной каемкой проксимальных ка-
нальцев, уменьшает нефротоксичность амино-
гликозидных антибиотиков.
Регенерирующий канальцевый эпителий ста-
новится резистентным к токсическому влиянию
амино гликозидов.
ОПН при применении других антибиоти-
ков — полусинтетических пенициллинов, ри-
фампицина, особенно при интермиттирующем
приеме последнего, а также цефаклора, анту-
рана, тримоксазола и т.д., обычно связана с
развитием интерстициального нефрита.
От 6 до 8 % всех случаев ОПН обусловлено
приемом нестероидных противовоспалительных
препаратов (НПВП), которые в настоящее вре-
мя прописывают практически каждому седьмо-
му жителю планеты. Они вызывают острое на-
рушение функции почек, изменяя внутрипочеч-
ную гемодинамику и индуцируя интерстициаль-
ный нефрит. Ингибируя активность локализо-
ванной на микросомальной мембране клеток
циклооксигеназы, НПВП препятствуют синтезу
простагландинов из арахидоновой кислоты —
структурного липида клеточных мембран, вы-
зывают снижение почечного кровотока и в
конечном итоге азотемию, особенно в услови-
ях предшествующего спазма почечных сосудов.
Не случайно нарушение азотовыделительной
функции почек под влиянием НПВП развива-
ется в первую очередь у больных с сердечной
недостаточностью, циррозом печени, нефроти-
ческим синдромом. ОПН, обусловленная нару-
шением внутрипочечной гемодинамики, опи-
сана также у детей, которым НПВП назнача-
ют для скорейшего закрытия боталлова (арте-
риального) протока.
Острый интерстициальный нефрит с явле-
ниями ОПН на фоне приема НПВП нередко
сочетается с массивной протеинурией. В этих
случаях при морфологическом исследовании
почечной ткани наряду с поражением каналь-
цев и инфильтратами в интерстициальной тка-
ни обнаруживают расплавление эпителиальных
отростков подоцитов, причем в клеточных ин-
фильтратах преобладают Т-лимфоциты.
В 1986 г. описано еще одно осложнение, раз-
вивающееся на фоне приема небольших доз
НПВП и проявляющееся болями в пояснице и
снижением клубочковой фильтрации. Этот син-
дром наблюдают преимущественно у мужчин в
состоянии дегидратации, например после тя-
желой физической работы, и, как полагают, он
связан с обструкцией канальцев уратами.
ОПН, развивающаяся на фоне применения
НПВП, обычно обратима, однако при длитель-
ном приеме препаратов этой группы пораже-
584
ние почек может иметь и более тяжелый про-
гноз. Так, D.Adams и соавт. (1986) наблюдали 5
больных, принимавших напроксен или пиро-
ксамин в течение 18 мес — 10 лет, у которых
выявлена ХПН, причем гломерулонефрита,
амилоидоза или обструктивной уропатии у этих
больных не было. При биопсии почки был об-
наружен фиброз, аналогичный фиброзу при
анальгетической нефропатии, а у 1 больного
при внутривенной урографии — папиллярный
некроз.
Описано токсическое воздействие на почки
ингибитора конвертирующего фермента каптоп-
рила с развитием ОПН [Fortino S., Sporn Р.,
1983], однако поражение почек при примене-
нии этого препарата чаще связано с гемодина-
мическими расстройствами и наблюдается глав-
ным образом у больных реноваскулярной гипер-
тонией и у реципиентов почечного трансплан-
тата со стенозом артерии пересаженной почки,
у которых адекватная перфузия почек поддер-
живается ангиотензином II. Продукция после-
днего резко снижается при приеме каптоприла
и препаратов аналогичного действия.
Препараты, сравнительно недавно внедрен-
ные в клиническую практику, также способны
вызывать ОПН.
Транзиторное нарушение функции почек
возможно на фоне приема омепразола, ацик-
ловира, фоскарнета, ципрофлоксацина, новых
сульфонамидов — сульфадиазина и мезалази-
на, применяемых для лечения микробных ос-
ложнений у больных СПИДом и язвенным ко-
литом, при введении интерлейкина-2, раство-
ренных в декстрозе иммуноглобулинов, стреп-
токиназы.
Н.Manley и соавт. (1998) описали развитие
билатерального кортикального некроза почек
после приема цефуроксима, назначенного 47-
летней больной в связи с обострением хрони-
ческого бронхита. После 18 мес лечения гемо-
диализом ей была успешно пересажена почка.
ОПН (повышение содержания креатинина в
сыворотке на 50 %) при применении рентге-
ноконтрастных средств наблюдают у 5 % боль-
ных, которым проводят это исследование. В
случае предшествующего нарушения функции
почек частота ОПН возрастает до 76 %, а у
больных диабетом — до 83—100 %. У диабети-
ков с ненарушенной функцией почек риск
развития ОПН также превышает таковой в
здоровой популяции.
С одной стороны, рентгеноконтрастные ве-
щества после короткого периода вазодилатации
вызывают при участии ренин-ангиотензиновой
системы спазм приводящих артериол, а с дру-
гой, — повышая вязкость крови, нарушают
микроциркуляцию и оказывают непосредствен-
ное токсическое действие на канальцевый эпи-
телий, вероятно, путем генерации свободных
радикалов кислорода [Bakris G. et al., 1990].
Известно, что чаще вызывают нарушение
функции почек рентгеноконтрастные средства
с высокой осмолярностью, чем препараты с
низкой осмолярностью.
Так, по данным G.Porter (1993), проанали-
зировавшего осложнения 1390 коронарографий,
ОПН наблюдали в 7,1 % случаев при приме-
нении высокоосмолярного рентгеноконтраста
диатриозата и в 3,2 % — низкоосмолярного
иогексола.
В то же время при достаточной гидратации
больных и в отсутствие факторов риска (диа-
бета, нарушения функции почек) рентгенокон-
трастное исследование вне зависимости от ос-
молярности применяемых веществ становится
безопасным [Deray С. et al., 1991].
Исследования, проведенные в последние
годы, свидетельствуют о том, что причиной
спазма сосудов почек при введении рентгено-
контрастных веществ являются усиление про-
дукции эндотелина и тромбоксана, а также де-
фицит оксида азота [Дзгоева Ф. и др., 1996;
Haylor Н. et al., 1992; Oldroyd S. et al., 1994].
Назначение антагонистов кальция в период
проведения рентгеноконтрастного исследования
ингибирует синтез эндотелина и тромбоксана,
а также предупреждает нарушение функции
почек |Дзгоева Ф. и др., 1996].
Пигменты, гемоглобин и миоглобин, вы-
свобождающиеся из кровяных и мышечных кле-
ток, являются второй по значимости после
лекарств причиной возникновения нефроток-
сической ОПН. До 1950 г. внутрисосудистый
гемолиз развивался главным образом вследствие
переливания несовместимой крови, а к рабдо-
миолизу приводили тяжелые травмы, особен-
но в военное время (краш-синдром).
В настоящее время, помимо сохраняющего
свое значение травматического рабдомиолиза
(землетрясения, транспортные и промышлен-
ные катастрофы), все большее значение при-
обретает нетравматический рабдомиолиз (алко-
гольная и наркотическая комы и т.д.), а также
поражение мышц, связанное с электролитны-
ми нарушениями и наследственным дефицитом
ферментов. Ниже приведены различные причи-
ны миоглобинурии.
I. Травматическая:
синдром раздавливания (краш-синдром)
экстремальные физические нагрузки
судороги, включая столбняк
ишемия мышц
ожоги
II. Нетравматическая:
грипп
миопатии:
дефицит фосфолипазы (синдром McArd-
le)
дефицит фосфофруктокиназы (синдром
Taruis)
дефицит карнитинпальмитилтрансфера-
зы
длительные комы:
алкоголь, наркотики, седативные сред-
ства
гиперосмолярная кома
гиперпирексия
отравление окисью углерода
выраженная гипокалиемия
выраженная гипофосфатемия
идиопатическая пароксизмальная миогло-
бинурия
III. Токсическая:
диуретики (гипокалиемия)
салицилаты
амфетамины
теофиллин
В последнее время все чаще описывают слу-
чаи рабдомиолиза с ОПН, связанного с при-
менением статинов [Meier С. et al., 1995] и дру-
гих гиполипидемических препаратов |Kante-
rewicz Е. et al., 1992]. Нейролептический злока-
чественный синдром, заключающийся в дис-
функции симпатической нервной системы,
ригидности мышц, гипертермии и миоглоби-
нурии с поражением почек, наблюдают при
приеме галоперидола, трифлуперазина, перфе-
назина, препаратов, назначаемых при дистони-
ях, при передозировке амоксанина, доксени-
на, нитразепама [Jermain D., Crisman L., 1992].
Аналогичные осложнения способны вызывать
агонисты Д-адренорецепторов [Rumpf W.,
Henning Н., 1990]; эпсилон-аминокапроновая
кислота [Seymour В., Rubinger М., 1997].
Повреждающее действие на почки оказыва-
ет и гемоглобин. Так, рифампицин, помимо
нередко встречающегося интерстициального
нефрита с ОПН, способен вызвать иммунный
внутрисосудистый гемолиз и острый канальце-
вый некроз [Perlira A. et al., 1991; Gupta A. et al.,
1992]. Гемолиз и ОПН описаны при дефиците
глюкозо-6-фосфатдегидрогеназы в эритроцитах.
Механизм развития ОПН при гемолизе и
рабдомиолизе не вполне ясен, поскольку' нет
убедительных доказательств нефротоксичности
миоглобина и гемоглобина.
В эксперименте ОПН возникала у животных,
которым переливали свободную от гемоглоби-
на строму несовместимых эритроцитов, в то
время как строма совместимых эритроцитов не
оказывает нефротоксического действия.
При гемолизе, связанном с применением
585
хинина, последнему приписывают прямое не-
фротоксическое действие, а при тропической
малярии гемолиз протекает с внутрисосудистой
коагуляцией.
К нефротоксинам традиционно относят соли
тяжелых металлов (ртути, золота), соединения
брома и хлора, желтый фосфор, четыреххлори-
стый углерод, этиленгликоль и другие вещества.
Иногда нефротоксины могут попадать в
организм необычным путем или оказываться в
самых разных изделиях. Описаны случаи нефро-
токсической ОПН после применения содержа-
щей ртуть мази у больного с послеожоговой
кожной инфекцией, а также дизельного топ-
лива вместо шампуня для мытья головы и т.д.
A.Cohen (1987) наблюдал пакистанского биз-
несмена, у которого ОПН развилась после при-
ема в течение 2 мес растительного тоника,
содержащего, как оказалось впоследствии, эти-
ленгликоль.
Некоторые нефротоксины вызывают специ-
фическое поражение почечной ткани со свое-
образным течением патологического процесса.
Например, при отравлении мышьяковистым
водородом, помимо канальцев, поражается ин-
терстиций, что приводит к затяжному течению
процесса и заканчивается сморщиванием почек
и ХПН. Продукты распада этиленгликоля и
содержащего фтор анестетика метоксифлурана
способствуют отложению кристаллов оксалатов
в канальцах и интерстиции, а после воздействия
последнего нередко развивается несахарный
диабет.
При остром гломерулонефрите ОПН имеет
различный генез. У больных с нефротическим
синдромом и нормальным АД она может быть
связана с отеком интерстициальной ткани,
повышением гидростатического давления в про-
ксимальных канальцах и боуменовой капсуле и
соответственно со снижением фильтрационного
давления и клубочковой фильтрации. Гемодиа-
лиз с массивной ультрафильтрацией или вве-
дение обессоленного альбумина с маннитолом,
устраняющие интерстициальный отек, способ-
ны восстановить функцию почек. В ряде случа-
ев анурия при гломерулонефрите может быть
следствием обтурации канальцев белковыми
массами или кровяными сгустками, например,
у больных IgA-нефропатией с эпизодами мак-
рогематурии.
Снижение клубочковой фильтрации может
быть обусловлено процессами быстро развива-
ющейся пролиферации в клубочках со сдавле-
нием капиллярных петель и/или тубулоинтер-
стициальными изменениями, а также высво-
бождением вазоактивных веществ и цитокинов
из моноцитов и других клеток, что является
прямым показанием для проведения плазмафе-
реза. Интересно, что у больных эндокапилляр-
586
ным гломерулонефритом, протекающим с
ОПН, прогноз, как показало последующее
наблюдение, оказался не хуже, чем у больных
без нарушения функции почек.
При остром необструктивном пиелонефрите
транзиторная олигурия может быть следствием
воспалительных инфильтратов в интерстиции,
разрешающихся на фоне антибиотикотерапии.
Обтурация собирательных лоханок и даже
мочеточников кристаллами сульфаниламидов
была нередкой причиной нарушения функции
почек в первые годы их применения. В настоя-
щий момент блокада канальцев почти исклю-
чительно уратами чаще всего развивается при
лечении иммунодепрессантами миеломы, раз-
личных вариантов лейкоза, у больных, прини-
мающих НПВП, а также у лиц, не акклимати-
зировавшихся к жаре, во время тяжелой фи-
зической работы.
У больных лимфомами и миеломой, поми-
мо обтурации солями мочевой кислоты, при-
чинами ОПН могут быть блокада канальцев
белковыми цилиндрами, билатеральное сдавле-
ние (прорастание) мочеточников опухолевыми
массами, гиперкальциемия, а также инфильт-
рация ткани почек опухолевыми клетками.
В мировой литературе описано 17 случаев, когда
ОПН вследствие этого процесса была первым
проявлением лимфомы. ОПН на почве метаста-
зов семиномы в почки с последующим восста-
новлением их функции после рентгеновского
облучения описана H.Abboud и соавт. (1981).
Особую роль среди причин ОПН играет па-
тология сосудов. Примерно в 1 % случаев ОПН
развивается в результате системного васкулита
с вовлечением в процесс почечных сосудов.
К ним в первую очередь относятся узелковый
периартериит, гранулематоз Вегенера, острая
склеродермическая почка. Распознавание этих
состояний чрезвычайно важно, поскольку адек-
ватная иммунодепрессивная терапия на фоне
гемодиализа, а при острой склеродермической
почке назначение ингибиторов ангиотензин-
превращающего фермента могут способствовать
восстановлению почечной функции. Массивная
антигипертензивная терапия показана и при
злокачественной гипертонии с ОПН.
Одностороняя эмболия почечной артерии не
приводит к ОПН. Последняя возможна только
при двустороннем поражении или окклюзии
артерии единственной почки. Источником эмбо-
лов при эмболии почечной артерии, редко рас-
познаваемой при жизни, могут быть левое пред-
сердие у больного со стенозом митрального от-
верстия, оторвавшиеся вегетации с клапанов
сердца при эндокардите, атероматозная аорта.
Больным с подозрением на эмболию почечных
артерий необходимо немедленно произвести
аортографию, поскольку удаление эмбола даже
через 12 ч, а при частичной окклюзии через
несколько дней восстанавливает функцию почек.
Тромбоз почечных артерий с ОПН может воз-
никнуть при артериографии, остром панкреа-
тите, на фоне ДВС-синдрома. У новорожден-
ных тромбоз почечных артерий часто развива-
ется вследствие гастроэнтерита и дегидратации.
Как и тромбоз почечных вен, он приводит к
ОПН, даже при одностороннем поражении.
Тромбоз обычно появляется на фоне дегид-
ратации (высокий гематокрит) и манифести-
руется болями в области поясницы, лихорад-
кой, диспепсическими расстройствами. Часто
наблюдают тромбоцитопению, удлинение про-
тромбинового времени и другие изменения
коагулограммы. В моче обнаруживают белок и
эритроциты. Почка увеличена в размерах, не
экскретирует контрастное вещество при внут-
ривенной урографии. На ретроградной пиело-
грамме видны сдавленные чашечки, экстрава-
заты контрастного вещества в паренхиму, кро-
вяной сгусток в лоханке. Прогноз, как прави-
ло, неблагоприятный. Тромбэктомия после фле-
бографии — экстренная мера, способная сохра-
нить одну или даже обе почки. При односто-
роннем процессе прибегают к нефрэктомии.
Выздоровление возможно и при консерватив-
ном лечении, включающем терапию основно-
го заболевания, регидратацию, антикоагулян-
ты, борьбу с проявлениями уремии.
В ряде случаев тромбоз почечных вен начи-
нается исподволь и приводит к нефротическо-
му синдрому, а в конечном итоге — к ХПН.
ОПН развивается при тромбозе вен на фоне
амилоидоза почек (необратимая) и при тром-
бозе вен почечного трансплантата. У таких ре-
ципиентов своевременная тромбэктомия восста-
навливает функцию трансплантата.
При резекции аневризмы аорты развиваю-
щаяся ОПН может быть как следствием тром-
боза почечных вен, так и острого тубулярного
некроза из-за коллапса во время операции
Повреждение эндотелия мелких сосудов вслед-
ствие снижения активности простациклина с
вторичным нарушением коагуляции и гемоли-
зом лежит в основе ОПН при гемолитико-уре-
мическом синдроме (ГУС) и тромботической
тромбоцитопенической пурпуре (болезни Мош-
ковича), имеющих, как правило, серьезный
прогноз. В части случаев ГУС развивается на
фоне приема хинина, митомицина С и других
лекарственных препаратов [Desablens В. et al.,
1986; McDonald S. et al., 1997].
ОПН возникает и при травматическом по-
ражении почечных сосудов. Полный двусторон-
ний разрыв почечной связки с проходящими
в ней сосудами возможен при автомобильной
катастрофе, падении с высоты и т.д. При од-
ностороннем поражении в неповрежденной
почке может развиться острый тубулярный не-
кроз. Травматический тромбоз почечной арте-
рии также чаще всего наблюдают при дорож-
ных катастрофах, но он может развиться и при
менее драматических обстоятельствах, например
при падении на улице или во время катания
на санках.
Односторонний травматический тромбоз
почечной артерии чаще диагностируют как раз-
рыв почки, однако обнаружение нефункциони-
рующей почки при внутривенной урографии с
нормальной картиной при ретроградной пие-
лографии позволяет установить правильный
диагноз, подтверждаемый данными аортогра-
фии. Иногда артериальная окклюзия, полная
или парциальная, развивается при кровоизли-
янии под интиму сосуда.
Постренальная ОПН. Основные причины
постренальной ОПН приведены ниже.
Причины постренальной ОПН
Механические
Камни мочеточников
Опухоли
Обструкция катетера
Окклюзия мочеточников кро-
вяными сгустками
Ретроперитонеальный фиб-
роз
Стриктуры мочеточников
Гипертрофия простаты
Воспалительный отек
Обструкция шейки мочевого
пузыря
Функциональные
Заболевания головного
мозга
Диабетическая нейро-
патия
Беременность
Длительное примене-
ние ганглиоблокато-
ров
Наиболее часто обструкцию мочеточников
вызывают камни и опухоли, локализующиеся
в малом тазе или мочевом пузыре. В случае опу-
холи обтурация нарастает медленно, а начало
анурии может быть острым.
Непроходимость мочеточников нередко раз-
вивается на фоне массивной гематурии, в то вре-
мя как при ударноволновой литотрипсии при-
чиной ОПН может быть как обтурация мочевы-
делительных путей обломками конкрементов,
так и контузия почек [Kleinknecht D. et al., 1994].
Л.С.Бирюкова и соавт. (1993) наблюдали 15-
летнюю пациентку, у которой на 3-й день после
аппендэктомии появилась выраженная гемату-
рия, связанная, как полагают, с лекарственным
некротическим папиллитом (канамицин), а
назначение эпсилон-аминокапроновой кисло-
ты привело к тампонаде лоханок кровяными
сгустками, анурии и острой уремии. Во время
лечения гемодиализом у больной длительно
отходили сгустки «старой» крови.
587
К лекарственным препаратам, способным
вызвать задержку мочи и в ряде случаев нару-
шение функции почек, относят также антихо-
линергетики (атропин и препараты подобного
действия), симпатомиметики, антагонисты
кальция, некоторые психотропные препараты
и т.д. [Kawabe К., 1993].
При снижении почечного кровотока и клу-
бочковой фильтрации вследствие обструктивной
уропатии не только повышается внутрипочеч-
ное интерстициальное давление, но и умень-
шается продукция оксида азота [Reyer A. et al.,
1992] и, возможно, других веществ, влияющих
на внутрипочечную гемодинамику.
При восстановлении проходимости мочеточ-
ников функция почек нормализуется, иногда
даже после длительно существовавшей окклю-
зии. В равной степени это относится к ретро-
перитонеальному фиброзу, развитие которого
все чаще связывают с приемом различных ле-
карственных препаратов. Описаны случаи рет-
роперитонеального фиброза после приема пре-
паратов спорыньи (метизергид, диэтиламид,
лизергиевая кислота, эрготамин), метилдопа,
фенацетина, кодеина и т.д. J.Bawler и соавт.
(1986) наблюдали это осложнение у больного
58 лет, длительно принимавшего бромкриптин
(парлодел) в связи с паркинсонизмом.
При неустранении причин обструкции на-
рушение функции почек становится необрати-
мым, причем основные патологические изме-
нения первично возникают в интерстиции, куда
мигрируют лейкоциты и макрофаги, секрети-
рующие трансформирующий фактор роста-/!,
фактор некроза опухоли и другие цитокины. В ко-
нечном итоге развивается интерстициальный
фиброз с вовлечением клубочков и канальцев.
При некоторых экспериментальных нефро-
патиях (пассивный нефрит Хеймана, цикло-
спориновая нефропатия, нефроз, индуцирован-
ный аминонуклеозидом пуромицина, и т.д.)
отмечают аналогичную последовательность
патологического процесса.
Ингибиторы ангиотензинпревращающего
фермента (АПФ) способны оказывать нефро-
протективный эффект при этих состояниях.
S.Klahr (1998) считает, что необходимы экс-
периментальные и клинические исследования,
уточняющие роль ингибиторов АПФ в замед-
лении прогрессирования нарушений функции
почек и при обструктивной уропатии.
38.2. Клиническая картина
Течение ОПН традиционно делят на 4 фазы:
начальную, олигурическую, восстановления
диуреза и полного выздоровления.
Состояние больного и продолжительность
начальной фазы зависят не столько от уреми-
ческой интоксикации, сколько от причины,
вызвавшей заболевание.
Общим клиническим симптомом этого пе-
риода является циркуляторный коллапс, кото-
рый в одних случаях бывает настолько непро-
должительным, что остается незамеченным, а
в других — длится сутки и более.
Олигурия развивается обычно в первые 3 дня
после травмы или хирургического вмешатель-
ства. В последние годы в связи с изменениями
причин ОПН (учащение послеоперационного
сепсиса) ее начало сдвигается и олигурия воз-
никает на 14—28-й день после операции. Счи-
тается, что чем позднее развилась ОПН, тем
хуже ее прогноз.
Длительность олигурической фазы варьиру-
ет в широких пределах, составляя 5—10 сут.
Если олигурия продолжается более 4 нед, с
большой вероятностью можно предполагать
развитие двустороннего кортикального некро-
за, однако описаны случаи восстановления
функции почек и после И мес олигурии.
Во время фазы олигурии моча обычно тем-
ного цвета, содержит большое количество белка
и цилиндров, осмолярность не превышает ос-
молярности плазмы, а содержание натрия не
более 50 ммоль/л. Характерны анорексия, тош-
нота, рвота, вздутие кишечника. Диарея может
усугубляться при назначении антибиотиков, на
фоне присоединившейся кандидозной инфек-
ции. В последующем понос может смениться
запором. Потливость, заторможенность, кома,
судороги, психозы типичны для больных сеп-
сисом и с другими тяжелыми осложнениями,
но они возникают сравнительно редко при
правильной и ранней терапии.
Одним из наиболее серьезных осложнений
являются желудочно-кишечные кровотечения,
наблюдаемые у 10 % больных. Причины крово-
течений — нарушение коагуляции, эрозии и язвы
слизистой оболочки желудка и кишечника.
Анемия развивается вследствие гемолиза,
снижения продукции эритропоэтина, задерж-
ки созревания эритроцитов. Характерна тром-
боцитопения с выраженным дефектом адгезив-
ной способности пластинок.
При ОПН угнетена фагоцитарная функция
лейкоцитов, нарушены образование антител и
клеточный иммунитет. В результате возникает
чрезвычайная подверженность инфекциям, ко-
торая является одной из основных причин ле-
тальных исходов. Типичны острые стоматиты,
паротиты, пневмонии. Нередко инфицируются
мочевые пути, операционные раны, места вы-
хода на кожу артериовенозного шунта, веноз-
ного катетера. Возможно развитие сепсиса.
В значительном проценте случаев инфекци-
онные осложнения вызываются флорой, нор-
588
мально обитающей в носоглотке, верхних ды-
хательных путях, промежности. Предваритель-
ное уточнение чувствительности этих штаммов
к антибиотикам целесообразно для назначения
ранней противоинфекционной терапии.
Гиперкалиемию обычно наблюдают у боль-
ных с обширными травмами, гематомами, при
продолжающемся желудочно-кишечном крово-
течении, гиперкатаболизме, переливании боль-
шого количества крови или плазмы. В условиях
повышенного обмена, особенно при сепсисе,
быстро развивается метаболический ацидоз,
усугубляющийся нередким повреждением орга-
нов дыхания, присоединением инфекции и т.д.
Выраженному ацидозу сопутствует большое
шумное дыхание (Куссмауля), которое сохра-
няется и во время гемодиализа, поскольку pH
нормализуется позднее в цереброспинальной
жидкости, чем в крови. Скорость прироста
мочевины в крови варьирует от 5—10 ммоль/л
при акушерско-гинекологической ОПН до
25 ммоль/л в сутки при обширных травмах и
инфекциях, при которых симптомы уремии мо-
гут маскироваться проявлениями основного за-
болевания.
У 10 % больных наблюдается неолигуричес-
кая ОПН (сравнительно нетяжелое поражение
почек), при которой азотемия развивается
вследствие гиперкатаболизма.
Ранняя фаза восстановительного периода
обычно продолжается 5—10 дней, в течение
которых быстро уменьшается протеинурия, но
нередко обнаруживают инфекцию мочевых пу-
тей, начавшуюся еще во время олигурии. Ко-
личество мочи быстро увеличивается, однако
функция канальцев восстанавливается медлен-
нее, что может привести к резкой дегидрата-
ции, избыточной потере натрия и калия и даже
гипокалиемическому параличу. Полностью фун-
кция почек, включая способность к максималь-
ному концентрированию, восстанавливается в
течение 6—12 мес.
38.3. Диагноз
Чаще всего ОПН фиксируют при травме, хи-
рургических вмешательствах, как осложнение
беременности. Запоздалая диагностика этого ос-
ложнения в перечисленных ситуациях может
оказаться фатальной, так как гиперкалиемию
с остановкой сердца иногда наблюдают уже
через 1,5 сут после возникновения ОПН.
Тщательное измерение диуреза позволяет
своевременно диагностировать нарушение дея-
тельности почек более чем у 90 % больных,
однако следует помнить, что олигурию неред-
ко выявляют лишь через 24—48 ч после разви-
тия ОПН. Поэтому полностью оправдано ежед-
невное определение в плазме содержания ка-
лия, мочевины и креатинина у внушающих
подозрение больных.
Если больные поступают в стационар с кли-
нической картиной ОПН, необходимо уточ-
нить, не было ли в недавнем прошлом эпизо-
дов гипотензии, не принимал ли больной по-
тенциально нефротоксических лекарственных
препаратов, не подвергался ли интоксикации
на производстве, не контактировал ли с жи-
вотными-переносчиками лептоспироза.
Существенное значение имеет исследование
мочи. Присутствие в осадке эритроцитарных ци-
линдров свидетельствует о поражении клубоч-
ков (например, острый гломерулонефрит);
обильный клеточный детрит указывает на ише-
мическую или нефротоксическую ОПН; нали-
чие полиморфно-ядерных лейкоцитов или эози-
нофилов характерно для интерстициального
нефрита. При ОПН, обусловленной рентгено-
контрастными средствами, в моче повышена
активность гамма-глутамилтрансферазы и дру-
гих ферментов щеточной каемки [Donadio С. et
al., 1998].
Практически важно отличать преренальную
ОПН от ренальной. В первом случае на умень-
шение перфузии почки отвечают усиленным
сохранением натрия и воды, во втором — они
утрачивают эту способность.
При преренальной ОПН содержание в моче
натрия и хлора снижено, а соотношение креа-
тинин мочи/креатинин плазмы (Крм/Кр ) по-
вышено, что свидетельствует о сохранной кон-
центрационной функции. Соотношение при
ренальной ОПН обратное (табл. 28.1).
Фракционная экскреция мочевой кислоты
обычно возрастает при увеличении объема вне-
клеточной жидкости и снижается в условиях
дегидратации. Поскольку последняя свойственна
больным с преренальной ОПН, K.Fushimi и
соавт. (1990) предлагают использовать этот по-
казатель для дифференциации преренальной и
ренальной ОПН.
Однако следует учитывать, что исследование
состава мочи при ряде ситуаций не имеет ре-
Таблица 28.1. Исследование мочи при ОПН
Показатель Острая почечная недостаточность
пререналь- ная ренальная
Концентрация Na, ммоль/л < 20 > 20
крм/кр„ > 20 < 20
Экскретируемая фракция Na Na Кр " х 100 Na„ КР„ < 1 % > 1 %
589
тающего диагностического значения. Напри-
мер, при назначении диуретиков содержание
натрия в моче при преренальной ОПН может
быть повышено, а в случае предшествующего
поражения почек преренальный компонент
можно не выявить, поскольку почки не спо-
собны сохранять натрий и воду. При остром гло-
мерулонефрите состав мочи в первые дни за-
болевания может быть таким же, как при пре-
ренальной ОПН, а в дальнейшем — ренальный.
Согласно данным F.Brosius и K.Low (1986),
низкую фракционную экскрецию натрия на-
блюдают также в следующих ситуациях: при
нетяжелой ОПН, определении этого показате-
ля в первые часы поражения почек и началь-
ном уменьшении внутрисосудистого объема.
В последующем в 80 % случаев фракционная
экскреция натрия повышается.
Острая обструкция мочевых путей изменяет
состав мочи, характерный для преренальной
ОПН, а хроническая — для ренальной. Низкую
экскретируемую фракцию натрия находят у
больных гемоглобин- и миоглобинурической
ОПН. Это свидетельствует о том, что наруше-
ние почечной гемодинамики и тубулярная об-
струкция, а не токсическое повреждение ка-
нальцев играют решающую роль в патогенезе
обструктивной формы ОПН.
Если соотношение Крм/Крп помогает уточ-
нить тяжесть поражения почек, то соотноше-
ние мочевая кислота/креатинин (МК/Кр) в
моче может с определенной вероятностью ука-
зывать на причину ОПН. Значение МК/Кр ме-
нее 1,0 часто наблюдают при ОПН лекарствен-
ного генеза, а более 1,0 — при ОПН вследствие
малярии, лептоспироза и других состояний,
сопровождающихся гиперкатаболизмом.
38.4. Лечение
Для лечения экспериментальной ОПН, ишеми-
ческой или миоглобинурической, не без успе-
ха животным вводят простациклин, простаглан-
дин Е2, субстраты, усиливающие продукцию
АТФ, вещества, восстанавливающие медулляр-
ный кровоток и нейтрализующие свободные
радикалы кислорода (супероксиддисмутаза),
инсулиноподобный фактор роста-1, способству-
ющий регенерации, атриальный натрийурети-
ческий пептид, предупреждающий снижение
клубочковой фильтрации, и т.д., однако резуль-
таты клинического использования перечислен-
ных препаратов не дали ожидаемого эффекта,
вероятно, вследствие более сложных и разно-
плановых механизмов повреждения почек у
человека.
В 90 % случаев причиной ОПН является
шок, поэтому терапия шока — важнейший
590
фактор профилактики и лечения ОПН. Для вос-
полнения объема циркулирующей крови при-
меняют плазму, белковые растворы, крупномо-
лекулярный декстран (полиглюкин, реополиг-
люкин), которые необходимо вводить под кон-
тролем центрального венозного давления. Его
повышение до +10 см вод.ст. чревато опаснос-
тью отека легких.
При операциях на сердце и крупных сосу-
дах профилактически показано введение ман-
нитола, сохраняющего нормальное распределе-
ние почечного кровотока и предупреждающе-
го образование цилиндров. Аналогичное дей-
ствие оказывают и петлевые диуретики (фуро-
семид), ингибирующие реабсорбцию натрия в
восходящем колене петли Генле и одновремен-
но уменьшающие в силу этого потребность в
энергии.
Общепринятая практика интраоперационно-
го введения маннитола и/или фуросемида, как
показали проверочные исследования, позволяет
увеличивать диурез, но не уменьшает частоту
ОПН. Следует также учитывать, что фуросемид
в больших дозах может вызвать необратимую
потерю слуха и способен усилить нефротоксич-
ность аминогликозидов и цефалоспоринов,
поэтому при этих формах ОПН не показан.
Еще менее обнадеживающи результаты при-
менения дофамина в «нефропротективных»
дозах (3 мкг/кг в 1 мин), предположительно
способствующих почечной вазодилатации. В на-
стоящее время установлено, что даже неболь-
шие дозы дофамина могут индуцировать арит-
мию, ишемию миокарда и кишечника, связан-
ную с прекапиллярной вазоконстрикцией, и
транслокацию бактерий или их токсинов из
просвета кишечника в системную циркуляцию.
J.Chen и М.O’Shea (1998) наблюдали при вве-
дении дофамина в периферическую вену экст-
равазацию препарата в подлежащие ткани с
развитием массивных кожных некрозов. В лю-
бом случае введение дофамина следует прекра-
тить, если не увеличивается диурез или про-
исходит прирост концентрации креатинина в
сыворотке. Аналогичные сомнения уместны и в
отношении применения небольших доз норад-
реналина, хотя J.Cesare и соавт. (1993) на фоне
внутривенного введения 0,05—0,1 мкг/кг пре-
парата в течение 1 ч наблюдали у 7 больных
повышение диуреза на 48 %, в то время как
основные показатели гемодинамики практичес-
ки не изменились.
Больным с уже развившейся ОПН угрожа-
ют гипергидратация, гиперкалиемия, уремия и
инфекция. Усугубляют состояние анемия, на-
рушения электролитного баланса, ацидоз.
Больным с умеренно выраженной ОПН без
признаков усиленного катаболизма можно на-
значить консервативное лечение, при котором
особое внимание уделяют соблюдению водно-
го режима. Суточное введение жидкости долж-
но восполнять все ее потери с мочой, рвотой,
диареей и т.д. плюс 400 мл жидкости внутри-
венно или лучше перорально. Водный баланс
контролируется ежедневным взвешиванием
больных. При соблюдении этих рекомендаций
масса тела больных ежедневно уменьшается на
0,25—0,5 мг. Параллельно следует определять
концентрацию натрия в плазме. Ее снижение —
признак гипергидратации, диктующий более
строгое ограничение жидкости.
Для предупреждения гиперкалиемии необхо-
димо резко ограничить поступление калия с
пищей, своевременно хирургически обработать
раны с удалением некротических участков, дре-
нированием полостей и т.д. Уменьшить белко-
вый катаболизм пытаются настойчивым лече-
нием инфекции, назначением анаболических
стероидов.
Для купирования желудочно-кишечных кро-
вотечений успешно применяют конъюгирован-
ные эстрогены, представляющие собой смесь
эстрона сульфата, эквилина сульфата и 17-Д-
эстрадиола [Heunisch С. et al., 1998].
Следует иметь в виду, что фармакокинети-
ка антибиотиков, как и других лекарственных
препаратов, у больных ОПН нарушена вслед-
ствие прекращения экскреторной функции
почек, электролитных сдвигов, ацидоза, увели-
чения проницаемости естественных барьеров.
Даже сравнительно малотоксичные пенициллин
и цефалоспорины могут усугубить у больных с
ОПН геморрагические осложнения в результа-
те влияния на адгезивность тромбоцитов и про-
тромбин. Поэтому антибиотики необходимо на-
значать в дозах, соответствующих тяжести по-
ражения почек. Например, при полной анурии
доза моксалактама не должна превышать 0,5 г/сут
и только по витальным показаниям может быть
увеличена до I г/сут.
При необходимости следует использовать
гемотрансфузии свежецитратной крови или
крови, предварительно диализируемой против
бескалиевого диализирующего раствора. Лекар-
ственное лечение гиперкалиемии проводят по
общим правилам.
Диета больных должна быть безбелковой,
но обеспечивать поступление не менее 1500—
2000 ккал/сут. При невозможности приема
пищи внутривенно вводят глюкозу, смеси ами-
нокислот, интралипид.
Показанием к лечению гемодиализом служат
повышение содержания калия в крови (более
7 ммоль/л), мочевины (до 24 ммоль/л), появ-
ление симптомов уремии (тошнота, рвота, за-
торможенность), гипергидратация и ацидоз.
Процедуры гемодиализа проводят ежедневно
или через день, увеличивая пищевую квоту
белка до 40 г/сут и разрешая употреблять боль-
ным до 1 л жидкости сверх экстраренальных
потерь.
В настоящее время при лечении ОПН все
чаще прибегают к раннему и даже «профилак-
тическому» гемодиализу, что предупреждает
развитие тяжелых метаболических осложнений,
однако интенсивный гемодиализ с поддержа-
нием в крови содержания азота мочевины ме-
нее 60 мг/дл и креатинина менее 5 мг/дл не
увеличивает выживаемости больных [Gillum D.
et al., 1986].
Лечение различных форм ОПН имеет свои
особенности. Например, при ОПН в результа-
те сепсиса и при отравлениях гемодиализ ком-
бинируют с гемосорбцией, которая обеспечи-
вает удаление из крови различных токсинов.
Больным миеломой, тромботической тром-
боцитопенической пурпурой, криоглобулине-
мией, осложненными ОПН, показан плазма-
ферез, как и больным быстропрогрессирующим
гломерулонефритом и с ДВС-синдромом.
В недалеком прошлом плазмаферез широко
применяли при краш-синдроме для удаления из
циркуляции миоглобина, высвобождающегося
из распадающейся мышечной ткани. Однако
еще в 1984 г. было установлено, что объем рас-
пределения миоглобина приблизительно равен
28 л и только 10 % может быть удалено за про-
цедуру плазмафереза. К тому же период полу-
распада миоглобина составляет 3—6 ч и сниже-
ние его содержания в плазме может быть не
следствием элиминации, а распада [Szpirt W.,
1997].
Более целесообразны при краш-синдроме
наряду с противошоковой терапией обменные
переливания крови, инфузия бикарбоната,
предупреждающего преципитацию миоглобина
в канальцах, назначение диуретиков при появ-
лении первых признаков гипергидратации.
Для профилактики ОПН у больных с трав-
матическим рабдомиолизом показано макси-
мально возможное удаление некротизированных
тканей, а при невозможности хирургического
вмешательства (физиологическая ампутация) —
наложение на размозженные конечности жгу-
тов и обкладывание их сухим льдом. Так,
G.Winburn и соавт. (1993) накладывали жгут в
среднем на 15,6 дня 5 больным с тяжелым
мионекрозом нижних конечностей (активность
КФК в сыворотке в среднем 20270 ед/мл) и
добились у всех наблюдавшихся исчезновения
миоглобинурии в сроки от 1 до 5 дней. У 2 из
5 пациентов удалось избежать гемодиализа.
Существуют и менее травматичные способы
профилактики и лечения осложнений рабдоми-
олиза.
М.Daniels и соавт. (1998) наблюдали моло-
дого пехотинца, у которого после 90-километ-
591
рового марша по пустыне развились тепловой
удар с тонико-клоническими судорогами, де-
лирий, рабдомиолиз и ОПН (активность креа-
тинкиназы в сыворотке 6975 ед/л, концентра-
ция миоглобина 8830 нг/мл при норме 0—
120 нг/мл, креатинина 141 мкмоль/л). После
внутривенного введения гипертонического ра-
створа натрия хлорида, бикарбоната, диазепа-
ма и охлаждения организма состояние больно-
го улучшилось, однако на 2-й день появились
боли и отек правой голени, затруднение дви-
жения и неврологические нарушения (падаю-
щая стопа). Синдром острой компартментали-
зации (серьезное осложнение рабдомиолиза с
повышением интракомпартментального давле-
ния и тампонадой мышц) был устранен по-
вторным внутривенным введением 25 г манни-
тола, который рекомендуется при внутриткане-
вом давлении, не превышающем 40 мм рт.ст.
При преодолении этого предела показана фас-
циотомия, нередко осложняющаяся диссемини-
рованной инфекцией.
За время стандартной процедуры гемодиали-
за концентрация гентамицина в крови снижа-
ется в среднем на 28 %, а через 12 ч вновь
повышается почти до исходного уровня (фено-
мен рикошета). Поэтому больным с передози-
ровкой аминогликозидов для снижения концен-
трации антибиотиков в сыворотке крови сле-
дует проводить перитонеальный диализ (пери-
тонеальный клиренс гентамицина составляет
10,0+3,65 мл/мин) | Indraprasit S. et al., 1986] или
гипертоническую гемо диафильтрацию (с реин-
фузией в конце процедуры гипертонического
раствора натрия хлорида), при которой клиренс
аминогликозидов примерно в 2 раза выше, чем
во время гемодиализа.
Совершенно экзотическим выглядит предло-
жение l.Schentag и соавт. (1984), которые, ос-
новываясь на способности тикарциллина и кар-
бен ициллина образовывать in vivo и in vitro с
аминогликозидами биологически неактивный
комплекс, рекомендуют вводить больным с ген-
тамициновой ОПН эти препараты. У 7 больных
с умеренно выраженной ОПН, которым авто-
ры вводили этот препарат, период полувыве-
дения гентамицина укорачивался в 5,5 раза, а
естественный клиренс повышался на 126 %. По
мнению авторов, применение комплексации,
равной по эффективности гемодиализу, пока-
зано больным, которым необходимо продолже-
ние антибиотикотерапии. Понятно, что у этих
пациентов не должно быть непереносимости
тикарциллина и карбенициллина.
При блокаде канальцев кристаллами моче-
вой кислоты на фоне цитостатической терапии
больным назначают маннитол и фуросемид или
проводят гемодиализ или перитонеальный ди-
ализ. Диурез обычно восстанавливается, когда
содержание мочевой кислоты в крови снижа-
ется до нормы.
При обтурации мочеточников камнем фун-
кция почек восстанавливается после удаления
препятствия оттоку мочи, а при ретроперито-
неальном фиброзе — после уретеролизиса.
Иногда даже, казалось бы, в безнадежной
ситуации «изобретательная» терапия может быть
эффективной, значительно улучшая функцию
почек. C.Flombaum и соавт. (1986) наблюдали
2 больных с опухолевой обструкцией мочеточ-
ников (у мужчины 68 лет лимфогранулематоз,
у женщины 77 лет опухоль шейки матки), у ко-
торых внутривенное введение 500—1000 мг ме-
тилпреднизолона вызвало массивный диурез и
снижение азотемии, вероятно, вследствие
уменьшения отека опухолевой ткани, и позво-
лило начать лучевую терапию (1 больной).
ОПН встречается у 2—5 % госпитализирован-
ных больных [Hou S. et al., 1985; Shusterman N.
et al., 1987]. В отделениях интенсивной терапии
нарушение функции почек нередко в рамках
синдрома ПОН регистрируют в 30 % случаев, а
летальность достигает 60—70 % [Corwin Н.,
Bonventre J., 1988; Lameire N. et al., 1987].
R.Hakim и соавт. (1994), очевидно, первы-
ми обратили внимание на тот факт, что вы-
живаемость больных повышается при проведе-
нии процедур гемодиализа с использованием
синтетических мембран с лучшей биосовмести-
мостью, чем целлюлозных.
В последующие годы эти данные в равной
степени подтверждались или не подтверждались
различными авторами. В одной из последних
работ V.Gasparovic и соавт. (1998) сравнивали
исходы лечения при применении диализных
мембран из полисульфона и ацетата целлюло-
зы у 47 больных с ОПН. Хотя группы больных
заметно не различались по численности, демог-
рафическим показателям и причинам пораже-
ния почек, из 24 выжили 13, которые получа-
ли лечение на полисульфоновых мембранах и
только 5 из 23 — на мембранах из ацетата цел-
люлозы. Первым до восстановления функции
почек было необходимо провести в среднем 9,85
процедуры гемодиализа, вторым — 21,20.
В мультицентровом исследовании среди 72 боль-
ных с ОПН, у которых использовали биосов-
местимые мембраны, выживаемость составила
57 % и функция почек восстановилась в 64 %,
а среди 81, применявшего бионесовместимые
мембраны, соответствующие значения состави-
ли 46 и 43 % [Himmelfar I. et al., 1998].
Хотя вопрос о влиянии диализных мембран
на выживаемость больных с ОПН не получил
окончательного разрешения, представляется
целесообразным не упускать возможности улуч-
шить прогноз этой категории больных.
В последние годы для лечения больных с
592
ОПН, особенно когда она является одним из
проявлений синдрома ПОН, все чаще вместо
интермиттирующего гемодиализа применяют
медленные постоянные способы очищения кро-
ви — постоянную гемофильтрацию, постоян-
ный гемодиализ, гемодиафильтрацию.
В соответствии с характером сосудистого
доступа эти методы могут быть артериовеноз-
ными, не требующими помпы для продвиже-
ния крови по экстракорпоральному контуру,
или вено-венозными. Для проведения этих про-
цедур, длительность которых может превышать
5—7 дней, используют высокопроницаемые
гемофильтры. Скорость перфузии крови за счет
разницы гидростатического давления в артерии
и вене составляет 50—200 мл/мин, скорость
диализата — 15 мл/мин. Невысокая скорость
перфузии крови, не усугубляя сердечно-сосу-
дистую нестабильность у больных в критичес-
ком состоянии, позволяет элиминировать не
только азотистые метаболиты, но и различные
токсины и цитокины, например фактор некроза
опухоли-альфа [Тимохов В.С. и др., 1997]. Од-
новременно происходит коррекция водно-элек-
тролитных нарушений, кислотно-основного
баланса, обеспечивается возможность паренте-
рального питания.
Поскольку клиренс мочевины при постоян-
ной артериовенозной гемофильтрации (ПАВГФ)
существенно ниже, чем во время постоянно-
го артериовенозного гемодиализа (9,5 против
23 мл/мин), последний выгодно применять при
гиперкатаболизме, а ПАВГФ лучше переносит-
ся больными с нестабильной гемодинамикой,
нарушением функции легких и расстройствами
метаболизма [Никифоров Ю.П. и др., 1995]. Без-
ацетатная биофильтрация не уступает бикарбо-
натному гемодиализу в коррекции кислотно-
основного баланса, но позволяет избегать эпи-
зодов гипотензии [Bret U. et al., 1997]. Сочета-
ние ПАВГФ со стандартным гемодиализом ока-
залось особенно эффективным в элиминации
миоглобина у больного с тяжелым травматичес-
ким рабдомиолизом после огнестрельного ра-
нения и ОПН [Berns J. et al., 1991].
Как считают R.Bellomo и соавт. (1992), у
больных с ПОН и недостаточностью 2—4 ор-
ганов постоянные способы заместительной те-
рапии, в частности ПАВГДФ, повышают по
сравнению со стандартным гемодиализом вы-
живаемость с 31,1 до 53,8 %.
Инфекция — основное осложнение у боль-
ных с ОПН, нередко обусловливающее леталь-
ный исход, поэтому борьба с ней должна вклю-
чать тщательную обработку ран, выделение
больным отдельных палат для предупреждения
внутрибольничного инфицирования, строгого
соблюдения асептики при проведении различ-
ных процедур.
На показатель выживаемости влияют возраст
больных и в решающей степени характер ос-
новного заболевания.
При изолированной акушерской ОПН ле-
тальность не превышает 8—15 %, при присое-
динении легочной, сердечной или печеночной
недостаточности она повышается до 70 %, а
при сочетанном поражении органов — до
100 %.
Последняя категория — наиболее тяжелый
контингент больных, на лечение которых рас-
ходуется максимум средств.
За десятилетие (с 1975 по 1985 г.) возраст
больных с ОПН повысился в среднем с 46,8
до 57,9 года [Abreo К. et al., 1986] и измени-
лась структура причин этого осложнения: в 10
раз увеличилось число больных, у которых
ОПН развилась после хирургических вмеша-
тельств, возросло число случаев ОПН после
использования антибиотиков и рентгеноконт-
растных препаратов.
Поскольку объем оперативных вмешательств
постоянно увеличивается, нет оснований в бу-
дущем надеяться на снижение летальности от
ОПН, несмотря на применение самых совре-
менных методов лечения.
У выживших больных, перенесших ОПН,
полное восстановление функции почек наблю-
дается в 35—40 % случаев, частичное — в 10—
15 %, а 1—3 % (билатеральный кортикальный
некроз, гемолитико-уремический синдром, не-
кротические васкулиты) — переводятся на по-
стоянную заместительную терапию. По данным
S.Bhandary и J.Turney (1996), у больных, пере-
несших тяжелую ОПН, необходимость посто-
янной заместительной терапии определяется ос-
новным заболеванием: она максимальна (41 %)
при ренальных формах ОПН (васкулиты) и ми-
нимальна (3 %) при акушерской и травмати-
ческой ОПН. В среднем в постоянной замести-
тельной терапии, по данным этих авторов,
нуждается 16,2 % больных.
После перенесенной ОПН у взрослых наи-
более частым осложнением являются инфекция
мочевых путей и хронический пиелонефрит с
последующим возможным исходом в ХПН.
Литература
Бирюкова Л. С., Гумин Л.М., Городецкий В.М. Острая
почечная недостаточность, обусловленная обструк-
цией верхних мочевых путей на фоне применения
аминокапроновой кислоты//Тер. арх. — 1993. —
№ 7. - С. 83-85.
Дзгоева Ф.У., Кутырина И.М., Мусселиус С.Г. и др.
Острая почечная недостаточность при токсическом
действии рентгеноконтрастных средств//Урол. и не-
фрол. - 1996. - № 1. - С. 9-12.
38—2950
593
Дзгоева Ф.У., Кутырина И.М., Мусселиус С.Г. и др.
Новые подходы к патогенетической терапии и про-
филактике острой почечной недостаточности, свя-
занной с рентгеноконтрастными средствами//Тер.
арх. - 1996. - № 6. - С. 37-40.
Никифоров Ю.В., Максименко В.А., Чудаков И.Е.
Критерии выбора метода экстракорпоральной деток-
сикации у больных с послеоперационной острой по-
чечной недостаточностыо//Анест. и реаниматол. —
1995. - № 4. - С. 38-41.
Тимохов В.С., Яковлева И.И., Калашникова Е.А.,
Семенов В.Н Кинетика фактора некроза опухоли при
заместительной почечной терапии у пациентов сеп-
сисом и с полиорганной недостаточностыо//Тер.
арх. - 1997. - № 11. - С. 38-39.
Abreo К., Moorty V., Osborne М. Changing patterns and
outcome of acute renal failure requiring hemodialysis//
Arch. Intern. Med. — 1986. — Vol. 146. — P. 1338—1341.
Alexopolos E., Vakianis P., Kokolina E. et al. Acute renal
failure in medical setting: changing patterns and
prognostic factors//Renal Fail. — 1994. — Vol. 16. — P.
273-284.
Aufricht Ch., Ardito Th., Thulin G. et al. Heat-shock
protein 25 induction and redistribution during actin
reorganization after renal ischemia//Amer. J. Physiol. —
1998. - Vol. 274. - P. F215-F222.
Barkis G., Loss N., Gaber O. et al. Radiocontrast medium
induced declines in renal function: a role of oxygen free
radicals//Am. J. Physiol. - 1990. - Vol. 258. - P. F115-F120.
Bellomo R., Mansfield D., Rumble S. et al. Acute renal
failure in critical illneas: conventional dialysis versus acute
continuous hemodiafiltration//ASAIO J. — 1992. — Vol.
38. - P. M654-M657.
Berns J., Cohen R., Rudnick M. Removal of myoglobin
by CAVHD in traumatic rhabdomyolysis//Amer. J.
Nephrol. — 1991. — Vol. 11. — P. 73.
Bhandary S., Turney J. Survivors of acute renal failure
who do not recover renal function//Q. J. Med. — 1996. —
Vol. 89. - P. 415-421.
Bonventre J. Mechanisms of ischemic acute renal failure
//Kidney Int. - 1993. - Vol. 43. - P. 1160-1178.
Brenner B., Lasarus J. (eds). Acute renal failure. —
Saunders: Philadelphia, 1983.
Bret M., Hurot J., Mercatello A. et al. Acetate-free
biofiltration for acute renal failure//Renal Fail. —
1998. - Vol. 20. - P. 493-503.
Brosius F., Lau K. Low fractional excretion of sodium in
acute renal failure: role of timing of the test and ische-
mia//Amer. J. Nephrol. — 1986. — Vol. 6. — P. 450—457.
Cesare J., Ligas J., Hirvela E. Enhancement of urine
output and glomerular filtration in acutely oliguric
patients using low-dose norepinephrine//Circulatory
Schock. - 1993. - Vol. 39. - P. 207-209.
Chen J., O’Shea M. Extravasation injury associated with
low-dose dopamine//Ann. Pharmacotherapy. — 1998. —
Vol. 32. - P. 545-548.
Cohen A. Two cases of acute renal failure unknown
etiology//Am. J. Med. — 1987. — Vol. 7. — P. 330—335.
Corwin H, Bonventre J. Acute renal failure in the intensive
care unit (Part 2)//Intensive care Med. — 1988. — Vol.
14. - P. 86-96.
Daniels M., Reichman J., Brezis M. Mannitol treatment
acute compartment syndrome//Nephron. — 1998. — Vol.
79. - P. 492-493.
Desablens B., Fievet P., Claisse J. et al. Hemolytic-uremic
syndrome after cancer chemotherapy without mitomycin
C//Nephron. - 1986. - Vol. 42. - P. 343-344.
Donadio C, Tramont G., Lucchesi A. et al. Gamma-
glutamyltransferase is a reliable marker for tubular effects
of contrast media//Renal Fail. — 1998. — Vol. 20. — P.
319-324.
Flombaum C., Schroy P., Watson R., Vanamee P.
Treatment of acute obstructive renal failure with high-
dose methylprednisolone//Arch. intern. Med. — 1986. —
Vol. 146. - P. 58-61.
Fushimi K, Shichiri M., Marumo F. Decreased fractional
excretion of urate as an indicator of prerenal azotemia//
Amer. J. Med. — 1990. — Vol. 10. — P. 489—494.
Gasparovic V., Dakovic K, Gasparovic H. et al. Do
biocompatible membranes make a difference in the
treatment of acute renal failure?//Dial. & Transplant. —
1998. - Vol. 27. - P. 621-626.
Gillum D., Dixon B., Yanover M. et al. The role of
intensive dialysis in acute renal failure//Clin. Nephrol. —
1986. - Vol. 25. - P. 249-255.
Goligorsky M., Lieberthal W., Racussen L., Simon E.
Integrin receptors in renal tubular epithelium: insights
into pathophysiology of acute renal failure//Amer. J.
Physiol. - 1993. - Vol. 264. - P. F1-F8.
Grcevka L., Polenacovic M., Dzikova S., Grozdanovski
R. Acute renal failure with severe tubulointerstitial changes
in a patient with minimal change nephrotic syndrome
treated with enalapril//Clin. Nephrol. — 1997. — Vol.
48..- P. 331-334.
Gupta A., Sakhuia V., Gupta K, Chugh K. Intravascular
hemolysis and acute renal failure following intermittent
rifampin therapy//Int. L. Leprosy. — 1992. — Vol. 60. — P.
185-188.
Hakim R., Wingard R., Parker R. Effect of dialysis
membrane in the treatment of patients with acute renal
failure//N. Engl. J. Med. - 1994. - Vol. 331. - P. 1338—
1341.
594
Haylor H., Brown P, Oldroyd S. et al. Contrast media and
isollated kidney//Nephrol. Dial. Trasplant. — 1992. — Vol.
7. - P. 1150.
Himmelfarb J., Tolkoff-Rubin N., Chandran P. et al. Akute
Nierenversagen: Vorteile der biokompatiblen Dialyse-
membranen//Dial. J. — 1998. — Bd 60. — S. 257—266.
Hou S., Bushinsky D., Wish J. et al. Hospital acquired
renal insuffiency; a prospective study//Amer. J. Med. —
1983. - Vol. 74. - P. 243-248.
Indraprasit S., Uakarvichien V., Pummangura S., Kaojarem
S. Gentamicin removal during intermittent peritoneal
dialysis//Nephron. — 1986. — Vol. 44. — P. 18—21.
Jermain D., Crismon L. Psychotropic drug-related
rhabdomyolysis//Ann. Pharmacotherapy. — 1992. — Vol.
26. - P. 948-954.
Kanterewicz E., Sanmarti R., Riba J. et al. Bezafibrate
induced rhabdomyolys//Ann. Rheumat. Dis. — 1992. — Vol.
51. - P. 536-538.
Kaushal G., Sigh A., Shan S. Identification of gene of
caspases in rat kidney and altered expression in ischemia-
reperfusion injury//Amer. J. Physiol. — 1998. — Vol.
274. - P. F587-F595.
Kawable K. Drug-induced urinary retention//Asian Med.
J. - 1993. - Vol. 36. - P. 206-213.
Kellerman P. Perioperative care of renal patients//Arch.
intern. Med. - 1994. - Vol. 154. - P. 1674-1688.
Kierdorf H. Das akute Nierenversagen an der Schwelle
zum 21. Jahrhundert//Nieren und Hochdruckkrankh. —
1994. - Bd 23. - S. 614-621.
Klahr S. Obstructive nephropathy//Kidney int. — 1998. —
Vol. 54. - P. 286-300.
Kleinknecht D., Pallot J.-L. Epidemiologie et prognostic
de 1’insuffisance renale aigue en 1997. Donnees recentes
//Nephrologie. - 1998. - Vol. 19. - P. 49-55.
Kleinknecht D., Pallot J.-L., Chauveau P. Bilateral acute
tubular necrosis after unilateral extracorporeal chock-wave
lithotri psy//Nephron. — 1994,— Vol.66,— P.360—361.
Kontogiannis J., Burns K. Role of ATI angiotensin II
receptors in renal ischemic injury//Amer. J. Physiol. —
1998. - Vol. 274. - P. F79-F90.
Liberthal W., Menza S., Levine J. Graded ATP depletion
can cause necrosis or apoptosis of cultured mouse
proximal tubular cells//Amer. J. Physiol. — 1998. — Vol.
274. - P. F315-F327.
McDonald S., Shanahan E., Thomas A. et al. Quinine-
induced hemolytic uremic syndrome//Clin. Nephrol. —
1997. - Vol. 47. - P. 397-400.
Meier C., Stey C., Brack T. et al. Rhabdomyolyse bei mit
Simvaststin und Ciclosporin behandelten Patienten: Rolle
der Aktivitat des Cytochrom-P450-Enzymsystems der
Leber//Schweiz. Med. Wochenschr. — 1995. — Bd 125. —
S. 1342-1346.
Oldroyd S., Slee S.-J., Haylor J. et al. Role for
endothelin in the renal responses to radiocontrast media
in the rat//Clin. Sci. - 1994. - Vol. 87. - P. 427-434.
Pereira A., Sanz C., Cervantes F., Castillo R. Immune
hemolytic anemia and renal failure associated with
rifampicin-dependent antibodies with anti-I-specificity
//Ann. Hematol. — 1991. — Vol. 63. — P. 56—58.
Porter G. Modifying contrast associated nephropathy
(CAN): a comparison between ionic and non-ionic
contrast media//Farmakoterapi. — 1993. — Vol. 49. — P.
26-27.
Reyer A., Martin D., Settle S., Klahr S. EDRF role in
renal function and blood pressure of normal rats and rats
with obstructive uropathy//Kidney int. — 1992. — Vol.
41. - P. 403-413.
Rosen S., Epstein E, Brezis M. Determinants of intrarenal
oxygenation: factors in acute renal failure//Renal Fail. —
1992. - Vol. 14. - P. 321-325.
Rumpf W., Henning H. Rhabdomyolysis and beta
adrenoreceptor agonists//Nephron. — 1990. — Vol. 55. —
P. 346-347.
Shusterman N., Strom B., Murray T. et al. Risk factors
and outcome of hospital-acquired acute renal failure//
Amer. J. Med. - 1987. - Vol. 83. - P. 65-71.
Seymour B., Rubinger M. Rhabdomyolysis induced by
epsilon-aminocaproic acid//Ann. Pharmacotherapy. —
1997. - Vol. 31. - P. 56-58.
Szpirt W. Plasmapheresis is not justified in treatment of
rhabdomyolysis and acute renal failure//!. Cardiovasc.
Suig. - 1997. - Vol. 38. - P. 557.
Turner J., Ellis C, Parsons F. Obstetric acute renal failure
1956—1987//Brit. J. Obstetr. and Gynaecol. — 1989. — Vol.
96. - P. 679-687.
Winburn G., Hawkins M., Wood M. Physiologic
amputation prevents myoglobinuria from lower extremity
myonecrosis//Southem Med. J. — 1993. — Vol. 86. —
P. 1101-1105.
38*
Гпава 39
ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ
НЕДОСТАТОЧНОСТЬ
В. М. Ермоленко
Хроническая почечная недостаточность
(ХПН) — симптомокомплекс, развивающийся
в результате постепенной гибели нефронов при
любом прогрессирующем заболевании почек.
Почки, играющие важнейшую роль в экскре-
ции различных метаболитов и обеспечивающие
водно-электролитный и осмотический гомео-
стаз, обладают большими компенсаторными
возможностями, и гибель даже 50 % из общего
количества 2 млн нефронов может не сопро-
вождаться никакими клиническими проявлени-
ями и только при снижении клубочковой филь-
трации (КФ) до 30—40 мл/мин (соответствует
снижению численности нефронов до 30 %) в
организме происходят задержка мочевины,
креатинина и других продуктов азотистого об-
мена и повышение их концентрации в сыво-
ротке крови. При терминальной уремии вели-
чина нефронной популяции составляет менее
10 %.
39.1. Этиология и патогенез
Основными причинами ХПН являются:
• заболевания, протекающие с преимуще-
ственным поражением клубочков (хроничес-
кий и подострый гломерулонефрит), каналь-
цев и интерстиция (хронический пиелонеф-
рит, интерстициальный нефрит);
• диффузные болезни соединительной ткани
(СКВ, системная склеродермия, узелковый
периартериит, гранулематоз Вегенера, ге-
моррагический васкулит), протекающие с
поражением почек;
• болезни обмена веществ (сахарный диабет,
амилоидоз, подагра, цистиноз, гиперокса-
лурия);
• врожденные заболевания почек (поликистоз,
596
гипоплазия почек, синдром Фанкони, син-
дром Альпорта, диффузный мезангиальный
нефросклероз, naiii-pateiia-синдром и другие
врожденные заболевания скелета, сочетаю-
щиеся с нефропатией);
• первичные поражения сосудов: злокачествен-
ная гипертония, стеноз почечных артерий,
гипертоническая болезнь (эссенциальная ги-
пертония);
• обструктивные нефропатии: мочекаменная
болезнь, гидронефроз, опухоли мочеполовой
системы.
Морфологический субстрат ХПН — гломе-
рулосклероз, характеризующийся независимо от
первичной патологии почек запустеванием клу-
бочков, склерозом мезангия и экспансией вне-
клеточного матрикса, основными компонента-
ми которого являются ламинин, фибронектин,
гепарансульфат протеогликан, коллаген IV типа
и интерстициальный коллаген, в норме не
присутствующий в клубочках. Увеличение вне-
клеточного матрикса, замещающего функцио-
нально-активную ткань, представляет комплек-
сный процесс, протекающий с участием раз-
личных факторов роста, цитокинов и тепловых
шоковых протеинов (ТШП) 73, 27 и т.д., но
только один из них — ТШП 47 — наделен
уникальной способностью связываться с про-
коллагеном и коллагеном. Локализованный в
эндоплазматическом ретикулуме ТШП 47 (мо-
лекулярная масса 47 000) в нормальных усло-
виях служит молекулярным проводником про-
коллагена, связываясь с ним во время образо-
вания и диссоциируя перед его секрецией. При
различных повреждениях тканей он предупреж-
дает образование аномального проколлагена,
задерживая его в эндоплазматическом ретику-
луме на длительный срок.
M.Sumamoto и соавт. (1998) установили, что
у крыс через 7 нед после субтотальной нефрэк-
томии в сохранившихся (ремнантных) клубоч-
ках экспрессия мРНК ТШП 47, коллагена I и
IV типов оказалась повышенной соответствен-
но в 3,4; 3,6 и 2,8 раза по сравнению с ложно-
оперированными животными. При гибридиза-
ции in situ мРНК ТШП была локализована в
участках формирующегося гломерулосклероза.
Используя лишенный смысла (antisense) оли-
гонуклеотид ТШП 47, авторы в настоящее вре-
мя предпринимают попытки затормозить экс-
прессию мРНК коллагена у животных с экс-
периментальным нефритом и тем самым замед-
лить процесс склерозирования.
Еще недавно первично почечные заболева-
ния — хронический гломерулонефрит, пиело-
нефрит, отчасти поликистоз и т.д. — рассмат-
ривались в качестве основных причин ХПН.
Например, в США с 1974 по 1981 г. на хрони-
ческий гломерулонефрит приходилось 20,9 %
новых случаев терминальной уремии, а возраст
больных, которым начинали заместительную
терапию, в большинстве случаев не превышал
35 лет. Ежегодно число новых случаев ТПН
составляло 133,1 на 1 млн населения [Weller I.
et al., 1985].
Через 15 лет, по сведениям М.Moore и соавт.
(1993), частота ТПН возросла до 162,4 на 1 млн
населения, в структуре ТПН стали преобладать
сахарный диабет (32,1 %) и гипертония (27,5 %),
а возраст 41,2 % больных при поступлении на
заместительную терапию превышал 65 лет.
По данным US Renal Data System (USRDS),
в 1996 г. в США на заместительную терапию
было принято 71 090 больных, что составляет
268 на 1 млн населения, у 31 000 из которых
причиной уремии был сахарный диабет
(42,4 %), у 18 000 (24,6 %) — гипертензия, у
7900 (10,8 %) — гломерулонефрит и у 1800
(2,5 %) — поликистоз. Повышение удельного
веса диабета и гипертензии в развитии ТПН в
несколько меньшей степени наблюдают и в Ев-
ропе. Таким образом, доля диабета, учащение
которого в популяции сравнивается с эпидеми-
ей, и артериальной гипертонии среди причин
ХПН продолжает увеличиваться.
Нередкими стали лекарственные нефропа-
тии, причем лекарства могут обладать как соб-
ственно нефротоксическими свойствами (фена-
цетин, золото), так и вызывать поражение по-
чек посредством других механизмов, например
аллергических. Нефротоксичность циклоспорина
обусловливает возникновение терминальной
уремии, требующей гемодиализа, у 5—10 %
реципиентов сердца и легких [Brocrooelofs J. et
al., 1995; Goldstein D. et al., 1996].
Длительный прием анальгетиков вызывает
особую форму поражения почек — анальгети-
ческую нефропатию, занимающую заметное ме-
сто в отдельных странах в структуре ХПН. Зап-
рет безрецептурной продажи анальгетиков при-
вел в Европе к снижению частоты анальгети-
ческой нефропатии, требующей диализа, с 3 %
в 1980 г. до 1 % в 1990 г., а в Швейцарии это
снижение было особенно впечатляющим — с
28 до 12 % [Brunner F., Seiwood N., 1994].
У детей основной причиной ХПН являются
наследственные и врожденные болезни почек.
Особую группу представляют урологические
заболевания, сопровождающиеся обструкцией
мочевых путей (камни, опухоли, гипертрофия
простаты, ретроперитонеальный фиброз), при
которых оперативное лечение позволяет в зна-
чительном проценте случаев надеяться на час-
тичное восстановление функции почек даже
при длительном существовании препятствия
оттоку мочи.
Несмотря на многообразие этиологических
факторов, морфологические изменения в поч-
ках при выраженной ХПН однотипны и сводятся
к преобладанию фибробластических процессов
с замещением функционирующих нефронов
соединительной тканью, гипертрофии оставших-
ся (ремнантных) нефронов и утратой морфоло-
гического своеобразия исходного процесса. По-
вышенная нагрузка на функционирующие не-
фроны усугубляет их структурные изменения и
является, по современным представлениям, ос-
новным неиммунологическим механизмом про-
грессирования ХПН. В то же время при уремии
наблюдается ряд приспособительных феноменов,
облегчающих работу почек. Например, хорошо
известна ретенция уратов у больных с ХПН, что
приводит не только к повышению содержания
мочевой кислоты в сыворотке крови, но и вы-
падению ее кристаллов в мягких тканях. Парал-
лельно задержке уратов в сыворотке крови боль-
ных накапливаются гиппуровая кислота и индок-
силсульфат, ингибирующие транспорт уратов в
канальцах и способствующие увеличению фрак-
ционной экскреции мочевой кислоты. Сказан-
ное справедливо и в отношении ряда других
веществ. Так, повышение в крови количества
азотистых шлаков увеличивает осмотическую
нагрузку на почки, что приводит к повышению
экскреции воды, мочевины, креатинина и т.д.
Не случайно после первых процедур гемодиализа
у большинства больных одновременно со сни-
жением концентрации в крови мочевины сокра-
щается и диурез.
3 9.1.1. Уремические токсины
Еще недавно считалось, что изменения, наблю-
даемые при уремии в различных органах и тка-
нях, обусловлены задержкой конечных продук-
597
тов азотистого обмена и в первую очередь мо-
чевины и креатинина. Исследования последних
лет не подтвердили этого предположения. Мо-
чевина, с которой связывают развитие таких
уремических симптомов, как тошнота, рвота,
головная боль, склонность к кровоточивости,
является, по-видимому, наименее токсичным
продуктом. Во всяком случае создание у боль-
ных во время гемодиализа высокой концентра-
ции мочевины в крови путем добавления ее к
диализирующему раствору не сопровождалось
какими-либо болезненными симптомами, за
исключением нетолерантности к углеводам. Не-
толерантность к глюкозе развивается и у здо-
ровых при введении им мочевины.
Имеется мало доказательств токсичности
креатинина, хотя некоторые продукты его рас-
пада — N-метилгидантоин, креатин, саркозин,
метиламин, очевидно, могут оказывать токси-
ческий эффект.
Многие симптомы уремии, в том числе ги-
пертриглицеридемия и нарушение всасывания
кальция в кишечнике, наблюдаются при вве-
дении животным средних доз метилгуаниди-
на — метаболического предшественника креа-
тинина. При больших дозах животные погиба-
ют в течение 15 дней при явлениях гемолиза,
ульцерации желудочно-кишечного тракта, рас-
стройств ЦНС и периферической нервной сис-
темы.
В то же время значение так называемых сред-
них молекул — веществ с молекулярной мас-
сой от 500 до 5000, с задержкой которых в
организме больных с уремией связывали раз-
витие анемии, полинейропатии, нетолерантно-
сти к глюкозе, нарушение иммунитета и ряд
других синдромов, в патогенезе уремических
расстройств подвергается справедливому сомне-
нию.
С одной стороны, высокие значения сред-
них молекул в сыворотке обнаруживают при
многих острых и хронических заболеваниях, не
имеющих отношения к уремии, — инфаркте
миокарда, панкреатите, экзогенных отравлени-
ях, циркуляторных расстройствах, а с дру-
гой, — перевод больных на гемодиализ с мем-
бранами повышенной проницаемости, имею-
щих высокий клиренс средних молекул, не
улучшает состояние больных. В настоящее вре-
мя определение клиренса средних молекул при-
меняют в основном для тестирования новых
диализных мембран, по его величине судят о
функции пересаженной почки, реже использу-
ют в качестве маркера отторжения почечного
трансплантата.
Согласно Sh.Massry и соавт. (1985), критери-
ем истинного уремического токсина являются
вещества с расшифрованной структурой и из-
вестным местом образования в организме, кон-
598
центрация которых в крови больных с ХПН
повышена и гиперпродукцией которых можно
объяснить те или иные проявления уремии.
К таким уремическим токсинам с полным пра-
вом может быть отнесен паратгормон (ПТГ),
гиперсекреция которого изначально направле-
на на коррекцию свойственных уремии гипо-
кальциемии и гиперфосфатемии, а в конечном
итоге индуцированный ПТГ вторичный гипер-
паратиреоз приводит к ренальной остеодистро-
фии, гипертриглицеридемии, усугубляет ане-
мию и ряд других расстройств. Такое некласси-
ческое действие избытка ПТГ на различные
органы и системы обусловлено экспрессией
специфических ПТГ-рецепторов не только в
костной ткани и почках — классических орга-
нах-мишенях воздействия ПТГ, но и в легких,
сердечно-сосудистой системе, коже, эритроци-
тах и т.д. мРНК ПТГ/ПТГ-рецепторов обнару-
жена практически во всех органах и тканях,
причем если в почках и скелете верифициро-
ваны ПТГ-рецепторы I типа, то рецепторы II
типа выявлены в головном мозге, легких, сер-
дце. В большинстве неклассических объектов
воздействия гормона присутствуют ПТГ род-
ственные пептиды (ПТГрП), представляющие
аутокринно/паракринную систему этих объек-
тов, однако их концентрация в норме остается
крайне низкой. ПТГрП обладают таким же
сродством к рецепторам, как и ПТГ, и вызы-
вают активацию вторичных мессенжеров.
При уремии в условиях супрафизиологичес-
ких концентраций ПТГ последний может реа-
гировать с ПТГ/ПТГрП-рецепторами в тканях
неклассических объектов и таким образом про-
являть свое действие как уремический токсин.
Неспособность сморщенных почек метаболи-
зировать /?2-микроглобулин ()?2-МГ) сопровож-
дается его накоплением в крови больных и
определяет развитие диализного амилоидоза.
Таким образом, основная масса веществ,
рассматриваемых в качестве уремических ток-
синов, представляет собой соединения, экск-
ретируемые или метаболизируемые нормальны-
ми почками. Некоторые из них подвергаются
определенной модификации в организме боль-
ных и после этого проявляют свое «токсичес-
кое» действие. Считают, например, что обра-
зованию амилоидных фибрилл из ^2-МГ спо-
собствует его гликирование — неферментное
взаимодействие с остатками углеводов.
В настоящее время, если не преследуются
специальные научные задачи, для оценки адек-
ватности диализа предпочитают не измерять в
крови концентрацию различных экзотических
метаболитов, а устанавливать дозу диализа,
представляющую отношение суточного клирен-
са мочевины к объему ее распределения в орга-
низме (Kt/V), хорошо коррелирующую с вы-
г
живаемостью больных. Гемодиализ считается
адекватным при Kt/V > 1,2, а для больных на
ПД значение Kt/V не должны быть менее 1,7
и даже 2,0.
3 9.1.2. Водно-электролитны
расстройства
Следствием неспособности почек при уремии
обеспечить поддержание водно-электролитного
баланса является развитие ряда осложнений,
угрожающих жизни больного. Уже на ранних ста-
диях ХПН нарушается способность почек к кон-
центрированию мочи. Помимо анатомических
причин (повреждение мозгового слоя почки),
имеют значение снижение чувствительности
собирательных трубочек к вазопрессину, а так-
же развитие осмотического диуреза в оставшихся
нефронах. Последние «работают» в условиях по-
вышенной осмотической нагрузки и должны
выводить в минуту гораздо больше растворимых
веществ, чем нормальные нефроны. Это дости-
гается повышением объема мочи с появлением
полиурии, нарушением нормального ритма вы-
ведения мочи (никтурия). Постепенно снижает-
ся относительная плотность мочи, которая ста-
новится равной относительной плотности без-
белкового фильтрата плазмы (1010—1012), воз-
никают изостенурия, затем гипостенурия, ког-
да относительная плотность не превышает 1008.
Нарушение концентрационной функции особен-
но рано выявляют при интерстициальцом не-
фрите, пиелонефрите, поликистозе почек. Не-
сколько позже нарушения концентрационной
функции почки теряют способность к разведе-
нию мочи. При терминальной почечной недо-
статочности суточный диурез снижается до 600—
800 мл, что является одним из показаний к
началу лечения гемодиализом.
В норме почка фильтрует в сутки 550—600 г
(24 000 ммоль) натрия, экскреция данного
электролита составляет 3—6 г/сут (140—
280 ммоль/сут). При повышении приема с пи-
щей хлорида натрия экскретируемая фракция
натрия (т.е. отношение выделенного натрия к
принятому) возрастает.
Способность почек выделять с мочой натрий
в количестве, примерно равном поступившему,
сохраняется при почечной недостаточности
достаточно долго. Механизм адаптации натри-
евого гомеостаза при значительном снижении
массы действующих нефронов обеспечивается
за счет резкого снижения реабсорбции элект-
ролита в проксимальном и дистальном нефро-
нах и повышения экскретируемой фракции
натрия, которая при выраженной ХПН, когда
количество профильтровавшегося натрия сни-
жается в 15—20 раз, достигает 10—20 %. По
мере прогрессирования почечной недостаточно-
сти механизмы адаптации истощаются и поч-
ки теряют способность сохранять натрий. При
неспособности почек снизить концентрацию в
моче натрия до 40—50 ммоль/л может развиться
солевое истощение (сольтеряющая почка), что
нередко бывает при пиелонефрите, поликисто-
зе, гиперхлоремическом ацидозе.
Клинически солевое истощение проявляет-
ся слабостью, гипотонией, резким ухудшени-
ем почечной функции. Напротив, у других боль-
ных ХПН возникает тенденция к задержке на-
трия, что является основной причиной разви-
тия артериальной гипертонии, которая почти
в 100 % случаев осложняет течение уремии.
У большинства больных ХПН нарушена так-
же способность быстро реагировать на резкое
изменение содержания натрия и воды в орга-
низме. Понос, рвота и другие потери натрия не
сопровождаются компенсаторной его задерж-
кой, что приводит к гипонатриемии, уменьше-
нию объема внеклеточной жидкости, почечной
вазоконстрикции с дальнейшим ухудшением
почечной функции.
Около 90—95 % поступающего в организм
калия экскретируется почками. Поскольку экс-
креция калия определяется в основном функ-
цией дистального канальца и минимально за-
висит от величины клубочковой фильтрации,
у больных ХПН она остается адекватной по-
ступлению калия до тех пор, пока сохраняется
достаточный диурез. У больных ХПН гиперка-
лиемия (повышение концентрации калия в
сыворотке больше 5 ммоль/л) обычно разви-
вается при падении КФ менее 15 мл/мин.
У части больных ХПН степень гиперкалие-
мии не пропорциональна КФ. У них может
выявляться дефект продукции альдостерона —
основного гормонального регулятора секреции
калия, обусловленный нарушением секреции
ренина (гипоренинемический гипоальдостеро-
низм). Это состояние регистрируют при диабе-
тической нефропатии, тубулоинтерстициальных
заболеваниях почек и повреждении юкстагло-
мерулярного аппарата. При увеличении секре-
ции ренина, например при ликвидации отеков,
продукция альдостерона полностью восстанав-
ливается, свидетельствуя о том, что этот дефект
имеет функциональный характер.
На фоне применения для контроля гипер-
тонии ингибиторов АПФ, блокирующих пре-
вращение ангиотензина I в антиотензин II, в
крови повышается активность ренина, однако
отсутствует стимуляция продукции альдостеро-
на. Развитие в этих условиях гиперкалиемии
является следствием лекарственного гиперрени-
немического гипоальдостеронизма.
Назначение гепарина больным ХПН также
может сопровождаться гиперкалиемией, по-
599
скольку антикоагулянт нарушает синтез альдо-
стерона надпочечниками (селективный гипоаль-
достеронизм).
Усугублять гиперкалиемию при ХПН могут
усиленный метаболизм (инфекция, лихорадка,
травма), гемолиз, избыточное поступление ка-
лия с пищей, прием калийсберегающих диуре-
тиков (спиронолактонов, триамтерена, амило-
рида), ацидоз.
Основное физиологическое действие ка-
лия — обеспечение электрического потенциа-
ла клеточных мембран. При умеренной гипер-
калиемии снижается потенциал покоя мембран
мышечных и нервных клеток (в норме 90 мВ),
что уменьшает разницу между потенциалом
покоя и действия и резко повышает возбуди-
мость клеток. При повышении концентрации
калия в крови до 7,5 ммоль/л потенциал по-
коя практически равен потенциалу действия,
следствием чего является полная потеря клет-
ками возбудимости с развитием мышечного
паралича и брадикардии, вплоть до полной
остановки сердца. На ЭКГ признаками гипер-
калиемии служат высокий зубец Т и уширение
комплекса QRS.
Концентрация калия в крови в пределах
7,5 ммоль/л и более считается опасной для жиз-
ни, а более 8,5 ммоль/л, если не принять эк-
стренных мер, приводит к остановке сердца.
При наличии предшествующего поражения сер-
дца с нарушением проводимости блокада мо-
жет наступить при содержании калия менее
7,5 ммоль/л.
Гипокалиемия обычно свойственна ранней
полиурической стадии ХПН. Ее причинами
могут быть недостаточное поступление калия с
пищей, потери калия с мочой вследствие при-
менения калийуретических мочегонных препа-
ратов, выведение калия через желудочно-ки-
шечный тракт.
Клиническими признаками гипокалиемии
являются выраженная мышечная слабость, ги-
повентиляция, одышка, судороги. При ЭКГ-ис-
следовании выявляют нарушения ритма по типу
различных форм желудочковой экстрасистолии,
уплощение зубца Т и выраженный зубец U.
Нарушение способности почек поддерживать
кислотно-основное равновесие приводит к раз-
витию метаболического ацидоза обычно при
снижении величины КФ менее 25 % от нор-
мального уровня.
Умеренный ацидоз, как правило, клиничес-
ки не проявляется, признаком тяжелого аци-
доза служит дыхание Куссмауля. Лабораторные
признаки метаболического ацидоза: снижение
pH плазмы крови ниже 7,35, стандартного би-
карбоната менее 20 ммоль/л, pH мочи до 4,8—
5,0. Экскреция с мочой титруемых кислот обыч-
но нормальная или умеренно снижена, экск-
600
реция аммония падает до 50 % от нормальных
значений.
Развитию метаболического ацидоза при
ХПН способствует потеря бикарбоната вслед-
ствие нарушения процессов его реабсорбции в
канальцах.
39.2. Клиническая картина
и диагностика
В отсутствие тяжелой гипертонии и ее ослож-
нений — ретинопатии, сердечной недостаточ-
ности и т.д. начальный период ХПН беден яр-
кими клиническими симптомами. Больные чаще
всего предъявляют жалобы на слабость, сниже-
ние аппетита, нарушение сна, трудоспособно-
сти, однако эти жалобы могут быть и при дру-
гих заболеваниях.
Наличие у больного анемии, полиурии и
никтурии должно настораживать в отношении
возможного заболевания почек и ХПН. Реша-
ющее значение в диагностике ХПН в этот пе-
риод имеют лабораторные методы, из которых
основным является определение креатинина
крови и удельной плотности мочи. Величина
последней больше 1018 фактически исключает
уремию.
Поскольку содержание креатинина в сыво-
ротке мало зависит от характера питания и
белкового катаболизма, его уровень в сыворотке
объективно отражает азотовыделительную фун-
кцию почек, и не случайно практически во всех
классификациях деление ХПН по тяжести про-
изводят на основании уровня креатинина в
крови и величины КФ.
В большинстве случаев КФ обратно пропор-
циональна креатининемии, однако у больных
с уменьшенной мышечной массой (пожилой
возраст, истощение) содержание креатинина в
сыворотке не соответствует степени нарушения
функции почек.
В то же время некоторые лекарственные
препараты, конкурирующие с креатинином за
секреторную транспортную систему в почечных
канальцах, могут повышать уровень креатини-
на в сыворотке, не ухудшая функции почек.
Например, на фоне приема антиконвульсанта
фенацемида уровень креатинина в сыворотке
может повышаться на 120—170 % [Cahen R. et
al., 1994]. Менее выраженный прирост креати-
нинемии (10—40 %) наблюдают у больных,
получающих циметидин или триметоприм.
Аналогичные проблемы возникают при оп-
ределении величины КФ у больных ХПН по
клиренсу эндогенного креатинина, поскольку
чем выше уровень креатинина в сыворотке, тем
масштабнее становится его секреция в каналь-
цах. У больных с предтерминальной уремией
40 % выделяемого с мочой креатинина попа-
дает в нее не в результате фильтрации в клу-
бочках, а вследствие секреции, что завышает
вычисленную величину КФ. В связи с этим для
определения величины КФ у больных с нару-
шенной функцией почек предпочитают исполь-
зовать другие маркеры — цистатин С и метабо-
лит креатинина — креатол, более точно кор-
релирующие с показателями КФ, определяемы-
ми радиоизотопными методами или рассчитан-
ными по формуле Cockcroff и Gault [Nakamura К.
et al., 1994; Kyhse-Andersen J. et al., 1994]. Оп-
ределить истинную величину КФ по клиренсу
креатинина помогает проба с циметидином. По
данным В. van Acker и соавт. (1992), после при-
ема циметидина (400 мг болюсно и в последу-
ющем по 200 мг каждые 3 ч) у 8 больных с
исходно сниженной клубочковой фильтрацией
отношение клиренс инулина/клиренс креати-
нина снизилось с 1,24—2,27 до 1,02 за счет
резкого угнетения секреции креатинина в ка-
нальцах. Согласно M.Ixkes и соавт. (1997), про-
ба с циметидином позволяет четко разграни-
чить в моче профильтрованный и просекрети-
рованный креатинин.
Завышать значение креатинина в сыворотке
при колориметрическом его определении с
помощью реактива Jaffe могут глюкоза, моче-
вая кислота и цефалоспорины.
«Золотым стандартом» КФ, в том числе у
больных уремией, является клиренс инулина,
поскольку содержание последнего в моче со-
ответствует профильтрованному количеству.
О тяжести нарушения функции почек судят
не только по уровню креатинина, но и по кон-
центрации мочевины и остаточного (небелко-
вого) азота в сыворотке. Последний в норме на
50 % состоит из азота мочевины. При ХПН доля
азота мочевины в остаточном азоте повышает-
ся до 90 %, а суточный клиренс азота мочеви-
ны входит в формулу (Kt/V), отражающую
адекватность заместительной терапии.
У здорового человека содержание мочевины
в крови колеблется от 2,5 до 7,5 ммоль/л, а кли-
ренс составляет в среднем 75 мл/мин. При пе-
регрузке белком содержание мочевины в крови
может транзиторно повышаться и при нормаль-
ной функции почек, однако это повышение не
бывает значительным и продолжительным. Уве-
личение концентрации мочевины в крови в от-
сутствие почечной патологии возможно также
при обезвоживании в результате рвоты и поно-
са, а также при гиперкатаболизме.
Стойкое увеличение концентрации мочеви-
ны в сыворотке, как и креатинина, наблюдают
при снижении КФ ниже 40 % нормы. Строгого
соответствия между содержанием в крови моче-
вины и креатинина нет, но ориентировочно
можно считать, что повышению концентрации
креатинина до 0,1—0,35 ммоль/л соответствует
уровень мочевины до 16,7 ммоль/л, при уровне
креатинина 0,44—0,62 ммоль/л содержание мо-
чевины равняется 25—30 ммоль/л, а при более
высоких значениях (> 0,7 ммоль/л) повышает-
ся до 33 ммоль/л и более.
При бедной белком диете у больных ХПН
количество мочевины в крови может значитель-
но снизиться, но при этом функция почек не
улучшается, не возрастает КФ и даже может не-
сколько повыситься содержание креатинина.
В диагностике ХПН существенное значение
имеет установление размеров почек, для чего
используют методы рентгеновского и ультразву-
кового исследования. На обзорной рентгено-
грамме после хорошей подготовки больного
(очищение кишечника) при ХПН, как прави-
ло, обнаруживают уменьшенную плотную ткань
почек. При ХПН, развившейся на фоне ами-
лоидоза и поликистоза, уменьшение размеров
почек не так выражено, как на конечных ста-
диях гломерулонефрита и пиелонефрита. Нор-
мальные размеры почек при нарастающей ХПН
позволяют думать об обострении патологичес-
кого процесса в почках, при настойчивом ле-
чении которого еще можно добиться улучше-
ния почечной функции.
Размеры и положение почек можно опреде-
лить также при эхографии — ультразвуковом
сканировании почек. У больных ХПН неясного
генеза эхография может иметь диагностическое
значение, поскольку дает возможность выявить
очаговый патологический процесс в почке (опу-
холь, киста, абсцесс, туберкулезный очаг, не-
фролитиаз).
Весьма чувствительным методом раннего
выявления снижения функции почек является
радиоизотопная ренография, основанная на
способности канальцевого эпителия почек из-
влекать из кровотока и секретировать меченый
1311-гиппуран. При ХПН ренографические кри-
вые выглядят плоскими и вытянутыми.
При прогрессировании ХПН клиническая
картина становится более яркой. Усиливаются
слабость, сонливость, утомляемость, апатия
(уремическая энцефалопатия), мышечная сла-
бость; мышечные подергивания связаны с элек-
тролитными расстройствами, в первую очередь
с гипокальциемией. Развиваются разноообраз-
ные поражения костной системы, обусловлен-
ные нарушением фосфорно-кальциевого обме-
на: остеомаляция (с болями в костях, часто с
проксимальной миопатией), фиброзирующий
остеит при вторичном гиперпаратиреозе — с
повышением содержания кальция в крови и
активности щелочной фосфатазы, субпериос-
тальными эрозиями фаланг, метастатическими
кальцификатами в периферических артериях
конечностей и мягких тканях, остеопорозом.
601
С задержкой «уремических токсинов» связа-
ны кожный зуд, иногда мучительный, парес-
тезии, носовые кровотечения, кровотечения из
десен, желудочно-кишечные, маточные, под-
кожные геморрагии. При длительной задержке
мочевой кислоты может возникнуть «уремичес-
кая подагра» с характерными болями в суста-
вах, тофусами.
Ярким признаком уремии является диспеп-
сический синдром — тошнота, рвота, икота,
потеря аппетита, вплоть до отвращения к пище,
понос (реже — запор), стоматит, глоссит, хей-
лит. Рвота может быть мучительной, приводить
к дегидратации, электролитным сдвигам, по-
худанию, препятствовать приему пищи, вызы-
вая дефицит калорий и потерю массы тела.
Осмотр больного выявляет бледно-желтова-
тый цвет лица (сочетание анемии и задержки
урохромов), «синяки» на руках и ногах. Кожа
сухая, со следами расчесов, язык сухой, ко-
ричневатый. При выраженной уремии изо рта
ощущается запах мочи или аммиака, а не мо-
чевины, которая не имеет запаха. Моча очень
светлая, низкой концентрации, лишена уро-
хромов.
У 80 % больных задержка натрия вызывает
гипертонию, часто тяжелую, с чертами злока-
чественности, ретинопатией, сердечной аст-
мой, ритмом галопа, ускоряющую темп про-
грессирования почечной недостаточности. Ги-
пертония, анемия, а также электролитные
сдвиги ведут к развитию тяжелого поражения
сердца с аритмиями, застойной сердечной не-
достаточностью. Гиперкалиемия, гиперлипиде-
мия с атеросклерозом, дефицит витаминов и
микроэлементов в пище, гиперпаратиреоз при-
водят к поражению миокарда. В терминальной
стадии развивается перикардит, фибринозный
или выпотной, проявляющийся выраженными
загрудинными болями, одышкой. Шум трения
перикарда выслушивается лучше всего в обла-
сти нижней трети грудины.
До появления в I960 г. программного ге-
модиализа шум трения перикарда считался
плохим прогностическим признаком («похорон-
ный звон» уремиков). Гемодиализ способство-
вал уменьшению прогностической значимости
перикардита, однако привел к появлению
форм, крайне редко встречающихся при есте-
ственном течении уремии, таких как хроничес-
кий констриктивный перикардит, тампонада
сердца.
По мере прогрессирования уремии нараста-
ет неврологическая симптоматика, возникают
судорожные подергивания, усиливается энце-
фалопатия, вплоть до развития уремической
комы, с большим шумным ацидотическим
дыханием (дыхание Куссмауля). Иногда разви-
вается тяжелая миопатия (больные не могут
602
подняться на ступеньки, стоять в вертикальном
положении).
Следует иметь в виду возможность частых
инфекций, в том числе пневмоний, которые
резко ухудшают функции почек. Картину, на-
поминающую при рентгенологическом иссле-
довании двустороннюю пневмонию, может дать
«уремическое легкое» (двусторонние облаковид-
ные инфильтраты, идущие от ворот легкого,
связанные с общей гипергидратацией и лево-
желудочковой недостаточностью или с повы-
шенной транссудацией из легочных капилля-
ров).
Прогрессирует анемия, развиваются лейко-
цитоз и умеренная тромбоцитопения, способ-
ствующая кровоточивости.
Характерны множественные эндокринные
нарушения, в том числе импотенция, амено-
рея, гинекомастия, обусловленные задержкой
пролактина и др.
Казалось бы, описанная картина терминаль-
ного нефрита, выделенного Е.М.Тареевым в
отдельную клиническую форму, не должна
встречаться при современном развитии замес-
тительной терапии, однако, как показывает
опыт даже московского здравоохранения, где
потребность в заместительной терапии удовлет-
воряется на 80 %, в стационар нередко посту-
пают больные с креатинином свыше 2000
мкмоль/л и с полным набором уремических
симптомов.
39.3. Течение и прогноз
ХПН может нарастать различными темпами,
давать неожиданные ремиссии, а нередко так-
же неожиданно под влиянием инфекции, трав-
мы, обезвоживания (понос и т.д.) в несколь-
ко дней закончиться смертью. Еще R.Bright го-
ворил о таких ремиссиях с возвращением боль-
ного к активной деятельности и терминальной
олигурии, «свертывании» жизни, отеке легких,
асфиктическом или коматозном статусе и зло-
вещем уремическом перикардите. Н. de Wardener
(1967) подчеркивал, что при хроническом пи-
елонефрите сниженная функция почек может
не меняться на протяжении 10—20 лет, но вне-
запно ухудшается, и больной через несколько
дней умирает.
Для суждения о болезни, приведшей к тер-
минальной уремии, необходимо учитывать ряд
обстоятельств: частоту заболеваний у лиц раз-
ного возраста и пола, семейный анамнез (кис-
тозные почки, периодическая болезнь с ами-
лоидозом, гипертоническая болезнь, подагра),
диагноз основной болезни, осложняющейся
поражением почек (бронхоэктазы, многолетний
ревматоидный артрит, лимфогранулематоз,
диабет, затяжной септический эндокардит,
коллагенозы). Перенесенная «острая токсикоин-
фекционная почка», как правило, не вызыва-
ет хроническую почечную недостаточность.
Для установления диагноза таких заболева-
ний, как пиелонефрит, особенно без урологи-
ческой обструкции, например камнями, дол-
жны быть веские основания. Кроме обычных
клинических проявлений (лихорадочные атаки
с болями, дизурией, пиурия, бактериурия,
связь с беременностью и т.д.), следует учиты-
вать характерные особенности, поражение пре-
имущественно канальцев, с падением концен-
трационной функции почек, частоту гиперхло-
ремического ацидоза, большую потерю натрия
И т.д.
Прогноз зависит от возможности коренным
образом изменить течение основного заболева-
ния, конечно, при своевременном правильном
распознавании, степени, фазы развития ХПН,
ее обратимости, от предупреждения и лечения
серьезных осложнений, рационального приме-
нения лечебных мероприятий в любой фазе
развития болезни.
39.4. Консервативное лечение
Ввиду большой сложности, ограниченной пер-
спективности лечения ХПН, особенно терми-
нальной уремии, большое значение приобре-
тают активное лечение основной патологии,
которая чаще ведет к ХПН, точное распозна-
вание индивидуальной болезни, диспансериза-
ция, систематическая плановая «вторичная»
профилактика ХПН.
Методы такого профилактического лечения
имеют, с одной стороны, общий характер: ра-
циональная диета и общий режим, борьба с
артериальной гипертонией, с инфекцией и
обструкцией мочевых путей (камни, стенозы,
опухоли и т.д.), с другой стороны, необходи-
мо специальное — более узкое — лечение при
отдельных болезнях, например диабетической,
подагрической почке, поликистозе и т.д.
Бессимптомную бактериурию без грубых уро-
логических отклонений у детей и молодых лиц
не следует переоценивать как причину терми-
нальной почечной недостаточности.
Важно правильное ведение больных как с
медленно прогрессирующими формами (поли-
кистоз, мочекаменная болезнь, хронические
латентные гломерулонефриты), так и с быст-
рыми, даже скоротечными, процессами, таки-
ми как злокачественный (экстракапиллярный)
гломерулонефрит.
При первых формах заболеваний достаточ-
но прежде всего спокойного наблюдения, кон-
троля артериальной гипертонии, назначения
ингибиторов АПФ для замедления прогресси-
рования, при вторых (в частности, при злока-
чественном гломерулонефрите) необходима
полная мобилизация современных видов лече-
ния, включая плазмаферез и гемодиализ.
Лечение больных ХПН является одновремен-
но патогенетическим и симптоматическим и
включает мероприятия, направленные на нор-
мализацию АД, коррекцию анемии, водно-
электролитных расстройств, предупреждение
накопления в организме токсичных продуктов
обмена. Важнейший компонент комплексного
лечения больных ХПН — диета.
Суточная продукция мочевины в организме
пропорциональна потреблению белка: при ка-
таболизме 100 г протеина образуется около 30 г
мочевины. Уменьшить продукцию мочевины
можно, ограничив потребление белка.
У больных с заболеваниями почек содержа-
ние мочевины в крови при нормальном потреб-
лении белка повышается только при падении
клубочковой фильтрации до 25 мл/мин; такие
симптомы уремии, как кожный зуд, анорексия,
тошнота, рвота, диарея и т.д., обычно не раз-
виваются, пока концентрация мочевины не
достигнет 17,7 ммоль/л. Если удается снизить
содержание мочевины в крови, то эти прояв-
ления уменьшаются или исчезают. Однако сни-
жение концентрации мочевины в крови боль-
ных — одна из главных, но не основная задача
диетического лечения.
39.4.1. Диета
Пища оказывает разнообразное влияние на
функцию почек. Как свидетельствуют данные
литературы [Bergstrom J. et al., 1985, и др.], разо-
вая белковая нагрузка у здоровых лиц способна
транзиторно повысить КФ в среднем на 30 %,
что используется в клинической практике для
уточнения резерва КФ, в том числе и у реци-
пиентов почечного трансплантата.
В эволюционном аспекте повышение КФ
после белковой нагрузки оправдано, посколь-
ку способствует быстрому выведению продук-
тов метаболизма и восстановлению электролит-
ного баланса после удачной охоты и т.д. В то
же время длительное повышение КФ, напри-
мер при плохо контролируемой гипергликемии
у больных сахарным диабетом или при ожире-
нии, может вызвать стойкие и даже необрати-
мые изменения структуры и функции нефро-
нов.
Нежелательно также поддержание состояния
гиперфильтрации в сохранившихся (ремнант-
ных) нефронах при ХПН. У животных после
хирургического уменьшения массы почек в
ремнантных нефронах резко усиливается мета-
603
болизм (поглощение кислорода в отдельном
нефроне повышается в 3 раза, продукция глю-
козы — на 138 %), в 2 раза увеличивается КФ
и на 20 % транскапиллярное гидравлическое
давление [Harris L. et al., 1988]. Это сопровож-
дается увеличением проницаемости базальных
мембран клубочковых капилляров для макро-
молекул, в частности альбумина и ЛПНП. По-
теря мембранами поверхностного отрицатель-
ного заряда усугубляет их проницаемость, след-
ствием чего являются развитие протеинурии и
аккумуляция плазменных белков и липидов в
мезангиуме.
В эксперименте белковая нагрузка в услови-
ях редуцированной массы почек ускоряет про-
грессирование ХПН, в то время как ограниче-
ние белка в диете замедляет темпы снижения
функции почек и повышает выживаемость жи-
вотных. Положительное влияние малобелковой
диеты наблюдают у животных как с различны-
ми формами экспериментального гломеруло-
нефрита, так и при ХПН, вызванной субто-
тальной нефрэктомией.
Определенное влияние на прогрессирование
ХПН оказывает, очевидно, не только количе-
ство, но и качество пищевого белка. Согласно
данным A.Williams и соавт. (1987), показатель
выживаемости у крыс с парциальной нефрэк-
томией, находящихся на диете, в которой ис-
точником белка служила соя, был выше, чем
у животных, получавших казеин.
Диету с ограничением белка с целью отда-
лить появление некоторых симптомов уремии
стали применять более 50 лет назад. Действи-
тельно, у больных, получавших пищу с огра-
ничением белка, улучшалось общее состояние,
уменьшалась выраженность диспепсических яв-
лений, уменьшалось содержание азота мочеви-
ны в крови; снижался ацидоз. В 1964 г. S.Giova-
netti и Q. Maggiore доказали, что диета с содер-
жанием 24—25 г белка в суточном рационе с
добавлением эссенциальных аминокислот спо-
собна увеличить выживаемость больных с вы-
раженной ХПН, а С.Giordano (1981) и G.Mas-
shio и соавт. (1981) показали, что у больных с
начальной ХПН малобелковая диета предуп-
реждает прогрессирование уремии. Эффект от
применения малобелковой диеты обусловлен
благоприятным влиянием на внутрипочечную
гемодинамику, в частности устранением гипер-
фильтрации в резидуальных нефронах, которая,
согласно В.Brenner и соавт. (1982), способна
усугублять поражение клубочков при различных
нефропатиях у человека и индуцировать гломе-
рулярный склероз в «старческой» почке и в
эксперименте при хирургическом уменьшении
массы почек.
В 1984 г. было закончено первое проспектив-
ное исследование, подтвердившее сдерживаю-
604
щее влияние малобелковой диеты на прогрес-
сирование ХПН [Rosman J. и соавт., 1984],
однако уже в том же году появились сообще-
ния, что малобелковые диеты более эффектив-
ны при интерстициальном нефрите, нежели
при гломерулонефрите [El-Nahas A. et al., 1984],
а на фоне малобелковой диеты основными де-
терминантами прогрессирования становятся
гипертония и величина протеинурии [Alarizzi L.
et al., 1985]. Тогда же W.Mitch (1984) устано-
вил, что у больных с ХПН продукция креати-
нина и его клиренс стабилизируются на новом
уровне в течение нескольких недель после пе-
ревода на диету с ограничением белка, поэто-
му оценивать ее эффективность следует не в
ближайшие сроки, как это практиковалось в
ранних исследованиях, а не менее чем через
4 мес.
В последующие годы с одинаковой частотой
появились сообщения, подтверждающие и не
подтверждающие значение малобелковой дие-
ты в сохранении остаточной функции почек,
однако все они выявили сложности подбора
сравниваемых групп и высветили 3 основные
причины, затрудняющие оценку малобелковых
диет:
• больные ХПН на свободной диете вследствие
спонтанного снижения аппетита потребля-
ют количество белка меньше ожидаемого;
• больные, которым прописывают резкое ог-
раничение белка, как правило, не придер-
живаются этих рекомендаций;
• кооперативность (compliance) больных дос-
тигается при содержании не менее 0,6 г/кг
белка в суточном рационе.
По данным F.Locatelli и соавт. (1991), этио-
логия нефропатии и постоянное наблюдение
имели большее значение в прогресси]ровании
ХПН, чем нахождение на малобелковой диете.
В то же время при диабетической нефропатии
значение ограничения белка более очевидно. Во
всяком случае скорость снижения клубочковой
фильтрации у 20 больных диабетом I типа на
малобелковой диете составила 0,26 мл/мин в
1 мес, а у 15 пациентов, не ограничивающих
белок, — 1,01 мл/мин [Zeller К. et al., 1991].
В последние годы было проведено 2 методо-
логически безупречных многоцентровых иссле-
дования по уточнению роли малобелковой дие-
ты в замедлении ХПН. В одном из них [Klahr S.
et al., 1994], охватывающем 585 больных с КФ
от 25 до 55 мл/мин, пациентам назначали обыч-
ную диету с содержанием белка 1,3 или 0,58 г/кг
и 255 больным с КФ от 13 до 24 мл/мин — ма-
лобелковую диету с содержанием белка 0,58 и
0,28 г/кг. Вывод, сделанный на основании по-
лученных данных, звучит не очень обнадежи-
вающе: умеренное ограничение белка в диете
замедляет прогрессирование всего на 28 %,
причем у больных с преимущественно началь-
ной или умеренно выраженной ХПН.
Спустя 10 мес после окончания 4-летнего
исследования функция почек была перепрове-
рена у 540 больных: только у 15 % обследован-
ных, находившихся на малобелковой диете,
креатинин сыворотки был ниже, чем на обыч-
ной диете.
Положительным итогом работы можно счи-
тать установленную возможность длительного
пребывания на малобелковой диете и зависи-
мость скорости прогрессирования от нозологии
первичного поражения почек.
В другом исследовании [D’Amoco G. et al.,
1994] 128 больным с ХПН рандомизированно
назначали малобелковую диету (0,6 г/кг) или
обычную диету (1,0 г/кг белка). За 27-месячный
период наблюдения произошло 50 % снижение
клиренса креатинина, у 40 % больных на обыч-
ной диете и у 28 % — на малобелковой диете.
На небольшом материале и более коротких
сроках наблюдения можно получить более оп-
тимистические результаты. Согласно данным
M.Aparicio и соавт. (1996), скорость снижения
клиренса креатинина у 27 больных, получав-
ших диету с содержанием белка 0,3 г/кг массы
тела за 12-месячный период наблюдения, ока-
залась в 3 раза ниже, чем у 13, не соблюдав-
ших ее. Строгое соблюдение малобелковой ди-
еты сопровождалось уменьшением скелетной
патологии и нормализацией активности Na-K-
АТФазы в лейкоцитах.
Таким образом, результаты проведенных к
настоящему времени исследований определен-
но свидетельствуют о том, что малобелковая
диета, назначенная на сравнительно ранних
стадиях ХПН, способна в известной степени
замедлять прогрессирование уремии. Отсутству-
ют данные о развитии malnutrition или каких-
либо других тяжелых осложнений, связанных с
диетическим ограничением белка, летальность
диализных больных, находившихся до начала
лечения на строгой малобелковой диете, не
превышает летальности остального диализного
контингента [Coresh J. et al., 1995]. Однако сле-
дует учитывать, что положительный результат
от ее применения возможен только при стро-
гом соблюдении диеты, а на кооперативность
больных можно надеяться при содержании в
рационе белка не менее 0,6 на 1 кг массы тела.
39.4.2. Энтеросорбция
Незначительного снижения содержания в сы-
воротке больных с ХПН продуктов азотистого
метаболизма можно добиться назначением эн-
теросорбентов.
Теоретически энтеросорбция основана на
способности связывать секретируемые в желу-
дочно-кишечный тракт вместе с пищеваритель-
ными соками креатинин, мочевину и другие
токсичные продукты, не допуская их обратно-
го всасывания. Существует множество сорбен-
тов (окисленный крахмал, оксицеллюлоза, ак-
тивированные угли, полифепан и т.д.), обла-
дающих in vitro большой сорбционной емкос-
тью в отношении креатинина, мочевины и
других метаболитов, однако все они лишены
селективности и в условиях пищеварения свя-
зывают пептиды, аминокислоты, липиды и т.д.
Следствием этого является существенное сни-
жение их возможности связывать азотистые
метаболиты. Как показали ранее проведенные
нами исследования, на фоне приема энтеродеза
(поливинилпирродалина) по 5 г 3—4 раза в
сутки за 1,5—2 ч до еды уровень креатинина в
сыворотке к концу 4 нед снизился на 15 %,
мочевины — на 8 %, мочевой кислоты — на
8 % и фосфатов — на 10 %.
Хотя серьезных побочных явлений от при-
ема сорбентов не зафиксировано, в настоящее
время их редко используют у больных с ХПН,
как и кишечный диализ, бывший весьма по-
пулярным в Азии и других регионах, не обес-
печенных заместительной терапией.
39.4.3. Лечение артериальной
гипертонии
В отличие от злокачественной эссенциальная
гипертония существенно реже приводит к не-
фросклерозу и ХПН (риск уремии в 10 раз
выше у негров), однако почечная гипертензия,
частота которой увеличивается по мере сниже-
ния функции почек, является одним из фак-
торов, определяющих не только прогрессиро-
вание ХПН, но и летальность.
У 90 % больных с ХПН гипертония связана
с гипергидратацией, обусловленной задержкой
выделения натрия и жидкости.
Выведение избытка натрия и жидкости из
организма достигается назначением салурети-
ков, наиболее эффективными из которых яв-
ляются фуросемид (лазикс), этакриновая кис-
лота (урегит), буфенокс (отечественный аналог
буметанида). При ХПН доза фуросемида увели-
чивается до 160—240 мг/сут, урегита — до 100
мг/сут, буфенокса — до 4 мг/сут. Препараты не-
сколько увеличивают КФ и значительно повы-
шают экскрецию калия. Диуретики обычно на-
значают в таблетках, при отеке легких и дру-
гих ургентных состояниях — внутривенно. Сле-
дует помнить, что в больших дозах фуросемид
и этакриновая кислота могут снижать слух,
усиливать токсическое действие цепорина, бу-
605
фенокс способен индуцировать мышечные бо-
ли и скованность. При ХПН осторожно приме-
няют спиронолактон (верошпирон), триамте-
рен, амилорид и другие препараты, способству-
ющие задержке калия. Миноксидил вызывает
вторичный гиперальдостеронизм с задержкой
воды и натрия, поэтому его прием целесооб-
разно комбинировать с -блокаторами и диу-
ретиками.
При выраженной ХПН в условиях увеличе-
ния фильтрационной нагрузки на функциони-
рующие нефроны за счет конкурентного транс-
порта органических кислот нарушается поступ-
ление диуретиков в люминальное пространство
канальцев, где они, связываясь с соответству-
ющими переносчиками, ингибируют реабсорб-
цию натрия.
Повышая люминальную концентрацию пре-
паратов, например петлевых диуретиков увели-
чением дозы или постоянным внутривенным
введением последних, можно в определенной
степени усилить диуретический эффект фуро-
семида (лазикса), буфенокса, торесемида и
других препаратов этого класса (см. главу «Ди-
уретики»).
Тиазиды, местом действия которых являют-
ся кортикальные дистальные канальцы, при
нормальной функции почек оказывающие уме-
ренный натрий- и диуретический эффект (в
месте их действия в нефроне реабсорбируется
всего 5 % профильтрованного натрия), при КФ
менее 20 мл/мин становятся мало или полнос-
тью не эффективными.
При КФ, равной 100 мл/мин, через почки
за сутки проходит 144 л крови и экскретирует-
ся 200 мэкв Na (1 %). У больных с клубочко-
вой фильтрацией 10 мл/мин через почки пер-
фузируется 14,4 л/сут крови и, чтобы элими-
нировать 200 мэкв Na, экскретируемая фрак-
ция должна составлять 10 %. Для удвоения эк-
скреции Na его фракционная экскреция у здо-
ровых должна увеличиться на 1 %, а у боль-
ных — на 10 %. Тиазиды, даже в высоких до-
зах, не могут обеспечить столь выраженное тор-
можение реабсорбции Na.
При тяжелой рефрактерной к лечению ар-
териальной гипертензии у больных ХПН повы-
шаются активность ренина и содержание аль-
достерона в плазме.
Блокаторы ^-адренорецепторов — пропрано-
лол (анаприлин, обзидан, индерал), оксипре-
нолол (тразикор) и др. — способны снижать
секрецию ренина. Поскольку ХПН не влияет на
фармакокинетику ^-блокаторов, их можно при-
менять в высоких дозах (360—480 мг/сут). Бло-
катор а- и $-адренорецепторов лабетолол в
дозе 600—1000 мг/сут также значительно сни-
жает активность ренина плазмы. При гиперто-
нии и сердечной недостаточности /?-адреноб-
606
локаторы следует назначать с осторожностью,
сочетая их с сердечными гликозидами.
Блокаторы кальциевых каналов (верапамил,
нифедипин, дилтиазем) в настоящее время все
шире используют для лечения почечной гипер-
тонии у больных с ХПН. Они, как правило, не
оказывают отрицательного влияния на почеч-
ную гемодинамику, а в ряде случаев способны
несколько повышать КФ за счет уменьшения
сопротивления прегломерулярных сосудов.
У больных ХПН выведение нифедипина (ко-
ринфара) замедляется пропорционально сни-
жению клиренса креатинина, а гипотензивный
эффект усиливается [Kleinblosem С. et al., 1985].
Фармакокинетика и гипотензивное действие
верапамила у больных с различной степенью
нарушения функции почек и здоровых лиц
практически одинаковы и не меняются во вре-
мя гемодиализа.
При уремии не изменяется фармакокинетика
и мибефрадила, представляющего собой новый
класс блокаторов кальциевых каналов. Являясь
дериватом тетралола, препарат обладает 80 %
биодоступностью после приема внутрь и пери-
одом полувыведения в среднем 22 ч, что по-
зволяет принимать его 1 раз в сутки. Мибефра-
дил метаболизируется преимущественно в пе-
чени, а в сыворотке на 99,5 % связан с белка-
ми плазмы (преимущественно кислым а ^гли-
копротеином), поэтому его элиминация во
время гемодиализа незначительна [Welkter Н. et
al., 1998].
Большинство ингибиторов АПФ (каптоприл,
эналаприл, лизиноприл, трандолаприл) элими-
нируется из организма почками, что необходи-
мо учитывать при их назначении больным с
ХПН. Фозиноприл, рамиприл, темокаприл и др.
выводятся в неизмененном виде и в виде ме-
таболитов не только с мочой, но и с желчью,
и при ХПН их печеночный путь элиминации
компенсаторно усиливается. Для таких препара-
тов не требуется уменьшения дозы при назна-
чении больным даже с резко нарушенной фун-
кцией почек, хотя частота побочных реакций
может несколько увеличиваться. Наиболее се-
рьезными из них являются гиперкалиемия (ги-
перренинемический гипоальдостеронизм) и
ухудшение функции почек, которое в первую
очередь грозит больным реноваскулярной ги-
пертонией (чаще с двусторонним стенозом
почечных артерий) и реципиентам почечного
трансплантата при развитии стеноза артерии
пересаженной почки.
Z.Wu и Х.Вао (1998) установили, что инги-
битор АПФ беназеприл в дозе 10—20 мг/сут
наряду со снижением артериального давления
уменьшает также резистентность к инсулину и
нетолерантность к глюкозе у больных с пред-
терминальной уремией.
Большинство ингибиторов АПФ, снижая
концентрацию АН II в циркуляции, не способ-
но блокировать образование АН II на тканевом
уровне, поскольку в сердце без участия АПФ
под действием сериновых протеиназ (химазы)
образуется до 80 % АН II, а в стенке артерий
70 % АН II генерируется под влиянием хима-
зоподобного фермента CAGE (chymosin-sensitive
angiotensin II — generating enzyme).
Ослабить нежелательную активацию ренин-
ангиотензиновой системы, в том числе на тка-
невом уровне, можно путем блокирования спе-
цифических рецепторов (ATJ, опосредующих
действие АН II.
Первым синтезированным пептидным бло-
катором АТ, был саралазин, вызывавший стой-
кое снижение артериального давления у крыс
с одной пережатой почечной артерией и у че-
ловека при внутривенном введении в дозе от
0,1 до 10 мг/кг.
В 1982 г. была выявлена способность дерива-
тов имидазола блокировать некоторые эффек-
ты АН II, что послужило основой для после-
дующей разработки и клинического примене-
ния непептидных блокаторов АТГ Одним из
первых препаратов этой группы, оказывающих
антигипертензивный эффект при пероральном
приеме, был лозартан. В последующем он и
аналогичные препараты, как и ингибиторы
АПФ, стали широко использовать не только
при артериальной гипертонии, но и при сер-
дечной недостаточности, для предупреждения
прогрессирования ХПН и уменьшения проте-
инурии. В эксперименте блокаторы АТ1 улучша-
ли функцию миокарда при его гипертрофии,
вирусном поражении и т.д.
У больных с ХПН практически не требует-
ся уменьшения дозы блокаторов АТ1 и редко
возникают побочные явления (кашель, ангио-
отек и т.д.), свойственные ингибиторам АПФ.
В настоящее время лекарственная терапия
артериальной гипертонии настолько эффектив-
на, что позволяет в сочетании с нелекар-
ственными методами (ультрафильтрация, гемо-
диафильтрация) отказаться от еще недавно
практиковавшейся у больных, взятых на гемо-
диализ, бинефрэктомии или эмболизации по-
чечных артерий.
Для купирования гипертонических кризов при
выраженной ХПН, кроме традиционных ганг-
лиоблокаторов, симпатолитиков и др., могут
применяться парентерально антагонист кальция
верапамил (изоптин) и периферические вазо-
дилататоры: диазоксид и нитропруссид натрия.
Гипотензивное действие этих препаратов насту-
пает в ближайшие минуты после введения, но
продолжается недолго. Изоптин вводят внутри-
венно струйно в дозе 5—10 мг, продлить его
эффект можно капельным введением до общей
дозы 30—40 мг. Наиболее сильный вазодилата-
тор нитропруссид натрия назначают только
внутривенно капельно (50 мг в 250 мл 5 %
раствора глюкозы) в течение 6—9 ч с посто-
янным контролем уровня АД и регуляцией ско-
рости введения. Диазоксид (гиперстат, ойде-
мин) по 300 мг вводят внутривенно струйно в
течение 15 с, гипотензивное действие продол-
жается до 6—12 ч. Многократное применение
вазодилататоров ограничено из-за опасности
побочных явлений (нитропруссид натрия мож-
но вводить не более 3 раз в связи с накопле-
нием токсичного метаболита — тиоцианата, а
диазоксид может снизить, хотя и обратимо,
почечный кровоток и КФ).
Нередко быстрое купирование гипертоничес-
кого криза наблюдают при сублингвальном
применении 5—10 мг нифедипина или 12,5—
25 мг каптоприла.
Длительная гипертония в сочетании с уре-
мической интоксикацией, гипергидратацией,
ацидозом, анемией, электролитными и други-
ми сдвигами является причиной поражения
мышцы сердца, что приводит к сердечной
недостаточности, при которой показаны
сердечные гликозиды. Назначая сердечные гли-
козиды, необходимо учитывать пути и скорость
выведения их из организма и содержание ка-
лия в плазме. Строфантин выводится преиму-
щественно почками, поэтому при выраженной
ХПН время полувыведения его возрастает бо-
лее чем в 2 раза, а доза должна быть снижена
до 50—75 % от обычной. Суточная доза дигок-
сина при ХПН не должна превышать 50—60 %
нормальной, т.е. не более 0,5 мг/сут, чаще
0,125 мг/сут. Дигитоксин в основном метаболи-
зируется в печени, время его полувыведения
при ХПН почти не отличается от нормы, од-
нако в связи с изменением чувствительности
миокарда к гликозидам рекомендуется назна-
чать 60—80 % от обычной дозы (0,15 мг/сут).
Впрочем, нарушение систолической функ-
ции сердца редко наблюдают при умеренно
выраженной ХПН. Диастолическую дисфунк-
цию корригируют назначением ингибиторов
АПФ, блокаторов АТ^рецепторов, нитратов.
Определенную пользу в плане коррекции
кардиопатии могут принести анаболические
стероиды — метандростенолон (неробол) по
5 мг 1—2 раза в день, ретаболил, метиландро-
стендиол, нестероидные анаболические веще-
ства (оротат калия), витамины группы В и др.
Ацидоз обычно не вызывает выраженных
клинических симптомов. Основная причина его
коррекции — профилактика развития костных
изменений при постоянной задержке водород-
ных ионов, а также гиперкалиемии. При уме-
ренном ацидозе помогает ограничение белка.
Для коррекции выраженного ацидоза рекомен-
607
дуется гидрокарбонат натрия по 3—9 г/сут, в
острых ситуациях — внутривенное введение
4,2 % раствора гидрокарбоната натрия (вводить
медленно). Его количество зависит от дефици-
та буферных оснований (ДБО).
Принимая во внимание, что 1 мл 4,2 %
раствора гидрокарбоната натрия содержит 0,5
ммоль гидрокарбоната, можно вычислить объем
раствора, необходимый для восполнения ДБО,
однако введение за 1 прием более 150 мл ра-
створа нежелательно из-за опасности угнетения
сердечной деятельности и развития сердечной
недостаточности. Несколько менее эффективен
карбонат кальция (по 2 г 4—6 раз в день). При-
ем больших доз карбоната кальция может выз-
вать запор.
Ургентная коррекция ацидоза необходима
при нарастающей гиперкалиемии, разви-
вающейся при олигурии или назначении калий-
сберегающих диуретиков (верошпирон, триам-
терен). Повышение содержания калия в сыво-
ротке до 6 ммоль/л обычно не сопровождает-
ся клиническими симптомами. При выражен-
ной гиперкалиемии возможно развитие мышеч-
ных параличей и, что особенно опасно, нару-
шений сердечного ритма, вплоть до полной ос-
тановки сердца.
Лечение острой, угрожающей жизни гипер-
калиемии начинают с инфузии физиологичес-
кого антагониста калия — кальция, который
вводят внутривенно в дозе 2 г в виде 10 % ра-
створа глюконата кальция каждые 2—3 ч. Пере-
ход калия из внеклеточной жидкости в клетки
достигается внутривенным введением гидрокар-
боната (необходимо повысить концентрацию
бикарбоната в сыворотке до 15 ммоль/л) и кри-
сталлического цинка-инсулина (15—30 ЕД, каж-
дые 3 ч с 2—5 г глюкозы на единицу инсулина
для предупреждения гипогликемии). Инсулин
повышает активность натрий-калиевого клеточ-
ного насоса и поступление калия в клетки.
Удаление калия из организма достигается
приемом ионообменной смолы по 40—80 мг/сут,
что снижает концентрацию калия в сыворотке
на 0,5—1 ммоль/л. Этот препарат часто комби-
нируют с сорбитом, вызывающим диарею. На-
значение смолы рекомендуется для профилак-
тики гиперкалиемии и при ОПН. При некупи-
рующейся гиперкалиемии проводят гемодиализ
или перитонеальный диализ.
В связи с потенциальной нефротоксичнос-
тью многих лекарственных препаратов важное
значение приобретает правильное лечение при
уремии различных инфекционных ос-
ложнений. При локальных бактериальных
инъекциях, например пневмонии, целесообраз-
но назначать пенициллины и цефалоспорины,
обладающие небольшой токсичностью даже при
значительной аккумуляции в плазме. Амино-
608
гликозиды, имеющие «узкий коридор безопас-
ности» — небольшой разрыв между терапевти-
ческой и токсической дозой, могут вызвать ухуд-
шение функции почек, нервно-мышечный блок,
неврит слуховых нервов. Их применение оправ-
дано при тяжелых септических состояниях. Кон-
центрация гентамицина, тобрамицина и других
препаратов этой группы в сыворотке можно
снизить до субтерапевтической при совместном
применении с карбенициллином или гепарином.
Элиминация тетрациклинов у больных с ХПН
замедлена, что требует соответствующего умень-
шения обычной дозы примерно на '/3. Следует
помнить, что препараты этой группы могут усу-
гублять азотемию и усиливать ацидоз.
Аналогичным образом необходимо умень-
шать дозу фторхинолонов, хотя они частично
метаболизируются в печени.
При инфекции мочевых путей предпочтение
отдают также пенициллину и цефалоспоринам,
которые секретируются канальцами. Благодаря
этому обеспечивается их достаточная концент-
рация даже при снижении КФ. В равной степе-
ни это относится к сульфаниламидам, в том
числе пролонгированного действия. Невозмож-
но достичь терапевтической концентрации ами-
ногликозидов в мочевых путях при КФ менее
10 мл/мин.
39.4.4. Анемия при ХПН и ее лечение
39.4.4.1. Патогенез анемии при ХПН
Срок жизни нормальных эритроцитов состав-
ляет 100—120 сут. Развитие нормохромной и
нормоцитарной анемии с низким ретикулоци-
тозом у больных ХПН традиционно связывают
с 3 основными причинами: дефицитом эндо-
генного ЭРП, укорочением сроков жизни эрит-
роцитов и присутствием в циркуляции ингиби-
торов кроветворения. Существенное значение
имеет также усиление кровоточивости, обуслов-
ленное дефектом тромбоцитов, частично кор-
ригируемым гемодиализом.
Еще в 1953 г. было высказано предположе-
ние, что в сыворотке больных уремией присут-
ствуют субстанции, ингибирующие эритропо-
эз. Ранее к ним относили метилгуанидин и
креатинин, полиамины — кадаверин, спермин
и путресцин, простагландины, рибонуклеазу,
средние молекулы, пептиды, паратгормон, ин-
гибитор, секретируемый моноцитами, и мно-
гие другие соединения.
Недавно в список ингибиторов внесена фу-
ранкарбоксиловая кислота (ФКК), накаплива-
ющаяся в сыворотке больных с нарушением
функции почек и способная ингибировать ми-
тохондриальное дыхание. Во время гемодиали-
за ФКК не элиминируется даже через высоко-
проницаемую мембрану [Siniukhin V., Stetsyuk
Е., 1992], в то время как перитонеальная мем-
брана проницаема для связанной с альбумином
ФКК и с этим обстоятельством связывают
обычно меньшую степень анемии у больных на
перитонеальном диализе, чем на гемодиализе.
Объединяющей чертой перечисленных инги-
биторов является отсутствие специфичности.
Например, упомянутый моноцитарный ингиби-
тор, обнаруживаемый в сыворотке больных
уремией, оказался идентичным веществу, об-
наруживаемому при опухолевой патологии
|Cassidy М. et al., 1994].
В настоящее время роль присутствующих в
сыворотке больных уремией ингибиторов эрит-
ропоэза считается малосущественной. Косвен-
ным свидетельством утраты интереса к инги-
биторам эритропоэза служит заметное умень-
шение публикаций по этой проблеме в после-
дние 5—7 лет.
С. Emerson в 1948 г. установил уменьшение
периода полужизни (Т|/2) эритроцитов при
уремии, которое обычно коррелирует со степе-
нью нарушения функции почек и, как полага-
ют, зависит от присутствия в сыворотке раз-
личных токсичных веществ, например фенолов,
и от ацидоза.
Ни гемодиализ, ни перитонеальный диализ
не способны заметно увеличить Т|/2, но в сы-
воротке здоровых людей продолжительность
жизни уремических эритроцитов полностью
нормализуется, свидетельствуя, что снижение
Т|/2 обусловлено не дефектом самих эритроци-
тов, а уремическим окружением. Отсюда сле-
дует, что чем более адекватна замещающая
функцию почек терапия, тем мягче влияние
уремического окружения на эритроциты. Сле-
дует также иметь в виду, что из-за сниженного
содержания глутатиона эритроциты больных
легко повреждаются различными окислителя-
ми, например хлорамином, используемым для
обеззараживания водопроводной воды.
Усиливать гемолиз могут концентрирован-
ные растворы глюкозы и NaCl, вводимые боль-
ным во время эпизодов диализной гипотензии,
а также повышение в сыворотке уровня цин-
ка, никеля и марганца из-за перераспределе-
ния между жидкой частью крови и эритроци-
тами.
У ряда больных, находящихся на гемодиа-
лизе, гемолиз и уменьшение Т./2 эритроцитов
связаны с гиперспленизмом на фоне хроничес-
кой инфекции, чаще всего вирусного гепатита
В [Ермоленко В.М., 1982].
Гемолиз зависит и от механического повреж-
дения эритроцитов при прокачивании крови
через гемодиализатор с помощью насоса.
В равной степени уменьшение Т 2 эритро-
цитов регистрируют и у больных на перитоне-
альном диализе [Hefti J. et al., 1998].
Усугубляет анемию, придавая ей микроци-
тарный характер, интоксикация алюминием,
который уменьшает утилизацию железа и тор-
мозит синтез гема в митохондриях эритроци-
тарных предшественников [Lou D., 1992].
Еще недавно в патогенезе анемии у больных
с ХПН немаловажное значение придавали на-
рушению баланса водорастворимых витаминов,
в первую очередь фолиевой кислоты (ФК) и
витамина В12.
Действительно, при экспериментальной уре-
мии абсорбция ФК в желудочно-кишечном
тракте у крыс оказалась сниженной, а у части
больных на гемодиализе было выявлено низкое
содержание этого витамина в сыворотке, что
являлось следствием потерь фолатов в диали-
зирующий раствор (от 30—40 до 75 мкг за про-
цедуру), однако в эритроцитах оно сохранялось
в норме [Fisher J. et al., 1997], что более точно
отражает состояние запасов ФК в организме.
Минимальная суточная потребность в ФК
составляет у здоровых 50—100 мкг, в то время
как запасы в организме превышают 5 мг. С мо-
чой у здоровых людей теряется около 10 мкг/
сут ФК, что практически соответствует вычис-
ленной суточной потере у гемодиализных боль-
ных (16 мкг). У больных, находящихся на пе-
ритонеальном диализе, потери фолатов еще
меньше (2 мкг/сут). Таким образом, у диализ-
ных больных с нормальным питанием нет пред-
посылок для возникновения дефицита ФК и
они не нуждаются в ее дополнительном назна-
чении. Более того, назначение фолатов, хотя и
повышает концентрацию ФК в сыворотке, не
только не отражается на показателях гемогло-
бина и гематокрита, но и в ряде случаев спо-
собно усугубить неврологическую патологию
[Leung A. et al., 1985]. Не нуждаются в допол-
нительном назначении ФК и больные, полу-
чающие рекомбинантный человеческий эритро-
поэтин (рчЭРП) [Ono R. et al., 1992].
J.Lash и E.Smith (1990) рекомендуют назна-
чать ФК лишь при нарушении питания, при
синдроме мальабсорбции, при алкоголизме и
некоторых особых ситуациях.
Равным образом у больных, находящихся на
лечении гемодиализом и другими методами за-
местительной терапии, не выявлено снижения
в сыворотке концентрации витамина В12, не-
смотря на потери в диализирующий раствор,
хотя в отдельных случаях степень анемии умень-
шалась при парентеральном его назначении.
Существенное значение в усугублении ане-
мии имеют кровопотери, связанные как с ге-
модиализом (кровь, остающаяся в гемодиали-
заторах, магистралях, кровопотери при пунк-
ции артериовенозной фистулы), так и с взя-
39—2950
609
тием крови на анализы, суммарно достигающие
8—12 мл/сут [Шостка Г.Д., 1997], а также
скрытые кровопотери в желудочно-кишечный
тракт. Последние обусловлены дефектом тром-
боцитов и усугубляются на фоне применения
гепарина.
Роль перечисленных факторов в патогенезе
анемии у больных с ХПН не вызывает сомне-
ний, однако основное значение в ее развитии
принадлежит дефициту эндогенного эритропо-
этина (ЭРП).
Предположение о гуморальной регуляции
кроветворения еще в 1906 г. высказали профес-
сор Парижского университета Р.Carnot и его
помощница C.Deflandre, а гипотетическое ве-
щество, находящееся в крови кроликов с ане-
мией, способное вызывать ретикулоцитоз у ин-
тактных животных, было названо ими гемопо-
этином. В 1954 г. L.Jacobson и соавт., экспери-
ментируя на крысах, установили, что у живот-
ных, перенесших двустороннюю нефрэктомию,
способность продуцировать стимулятор крове-
творения — эритропоэтин, отсутствует. Тем
самым было доказано, что почки являются
основным местом выработки эритропоэтина.
В чистом виде эндогенный ЭРП был выде-
лен в 1977 г. из мочи больных апластической
анемией Т.Miyake и соавт., которым пришлось
переработать 2550 л мочи, чтобы получить 10 мг
вещества. Часть препарата была израсходована
для малоуспешного лечения в течение 1 нед
100 больных анемией, а анализ оставшегося ко-
личества позволил расшифровать строение гор-
мона, что в последующем сыграло решающую
роль в разработке рчЭРП, являющегося основ-
ным средством лечения анемии у больных
ХПН.
Уремии свойствен абсолютный и относи-
тельный дефицит эндогенного ЭРП. Титр эн-
догенного ЭРП у больных ХПН не только зна-
чительно ниже, чем у здоровых, но и у боль-
ных с такой же тяжестью анемии другой этио-
логии — постгеморрагической, апластической,
сидероахрестической.
Заканчивая краткое обсуждение патогенети-
ческих механизмов анемии у больных ХПН,
следует отметить, что, хотя основной ее при-
чиной является относительный дефицит ЭРП,
другие факторы, частично поддающиеся и не
поддающиеся коррекции, заметно влияют на
кроветворение. Например, любая замещающая
функцию почек терапия, за исключением ус-
пешной трансплантации почки, оставляет боль-
ных в состоянии субуремии и не способна нор-
мализовать срок жизни эритроцитов, как и
полностью избавить больных от перегрузки алю-
минием.
В то же время адекватный гемодиализ умень-
шает в сыворотке содержание «уремических»
610
токсинов, включая возможные ингибиторы
эритропоэза, и положительно влияет на про-
дукцию эритроцитов. Так, D.Lindholm и соавт.
в 1969 г. установили, что интенсивный гемоди-
ализ уменьшает анемию, а по данным мульти-
центрового исследования в Европе [Geerlings W.
et al., 1993], сокращение диализного времени
с 15 до 12 ч в неделю снижает средний уро-
вень гемоглобина с 95 до 85 г/л.
Положительный эффект оказывает уменьше-
ние оккультных и ятрогенных кровопотерь.
Например, A.Linton и R.Lindsay (1977) обсле-
довали 2 группы больных на гемодиализе с
гематокритом < 15%и>24%и выявили с
помощью меченых 51 Сг эритроцитов у первых
повышенную потерю крови через кишечник
вследствие геморрагического гастрита или «не-
мой» язвы или массивную кровопотерю при
пункции артериовенозной фистулы. Устранение
этих кровопотерь привело к увеличению гема-
токрита на 21—67 %.
Уменьшение количества не всегда обосно-
ванных биохимических анализов дает такой же
результат, а при необходимости их проведения
J.Bergstrom и соавт. (1978) советуют предвари-
тельно отстаивать кровь в шприце, забирать
сыворотку для исследования, а эритроциты
возвращать больному.
На фоне непрекращающихся кровопотерь,
при дефиците Fe и т.д. возрастает доля неэф-
фективного эритропоэза — запрограммирован-
ной смерти нормобластов [Шостка Г.Д., 1997],
а повышение дозы рчЭРП, заметно не увели-
чивая продукции эритроцитов, усиливает не-
эффективный эритропоэз [Paganini Е., 1994].
39.4.4.2. Биология и механизмы действия
ЭРП
Трансформация мультипотентных стволовых
клеток в зрелые эритроциты морфологически
осуществляется стадийно и частично под кон-
тролем ЭРП.
На ранней стадии кроветворения небольшие
мононуклеарные клетки, экспрессирующие на
поверхности гликофосфопротеин CD34, функ-
ционально подразделяются на мультипотентные
стволовые клетки, способные к самообновле-
нию, и унипотентные клетки, дающие начало
различным клеточным линиям, причем процесс
разделения происходит в значительной степени
случайно, а начальный этап дифференциации
протекает с участием неспецифических цитоки-
нов — фактора стволовых клеток, интерлейки-
на-3, инсулиноподобного фактора роста и т. д.
Эритроидные предшественники, теряющие
способность к самообновлению, приобретают
эритропоэтиновые рецепторы, а начальная
клетка эритроидного каскада имеет рецепторы
как к неспецифическим цитокинам, так и к
ЭРП, и при оптимальной концентрации фак-
торов роста взрывообразно (burst) образует
колонии, содержащие тысячи ядерных предше-
ственников эритроцитов.
По мере созревания ранние бурст-формиру-
ющие единицы (БОЕэ) в возрастающей степе-
ни зависят от ЭРП, а терминальные прогени-
торные клетки — колониеобразующие едини-
цы (КОЕэ) — превращаются в предшественни-
ки эритроцитов только в присутствии ЭРП.
В противном случае они подвергаются апопто-
зу. In vitro при нормальной концентрации ЭРП
(8—18 мед/мл) из каждой БОЕэ формируется
от 4 до 6 КОЕэ.
Начальные этапы дифференцировки стволо-
вых клеток в эритроидные предшественники
также не требуют участия ЭРП. Так, у плодов
мышей с отсутствием генов ЭРП или ЭРП-ре-
цепторов в печени образуются БОЕэ и КОЕэ,
хотя эритропоэз практически отсутствует [Wu Н.
et al., 1995].
Выжившие КОЕэ на определенной стадии
созревания активируются и трансформируются
в эритробласты, способные синтезировать ге-
моглобин. Дальнейшие этапы образования эрит-
роцитов уже не зависят от ЭРП или других фак-
торов и протекают с фиксированной скорос-
тью в присутствии достаточного количества ви-
тамина В|3 и фолиевой кислоты.
На клеточном уровне ЭРП наряду с проли-
ферацией обеспечивает программу дифферен-
цировки и выживания клеток. При нормальном
эритропоэзе выживает меньшинство ЭРП-зави-
симых прогениторных клеток, а в условиях тка-
невой гипоксии различного генеза большинство
в норме обреченных предшественников под
влиянием продуцируемого в большом количе-
стве ЭРП выживает, превращаясь в ретикуло-
циты, а в последующем в эритроциты. При
дефиците эндогенного ЭРП, что характерно для
большинства больных с ХПН, выживающие в
норме предшественники погибают и развива-
ется анемия.
Взаимодействие ЭРП с клеткой-мишеныо
зависит от присутствия на ее поверхности ЭРП-
рецептора.
Эритропоэтиновый рецептор представляет
собой трансмембранный протеин с молекуляр-
ной массой 55 000 Да, принадлежащий к су-
персемейству цитокиновых рецепторов. Связы-
вание ЭРП с внеклеточным доменом рецепто-
ра инициирует фосфорилирование внутрикле-
точных белков с высвобождением вторичных
месенджеров, необходимых для пролиферации
прогениторных клеток.
Пять эксонов гена ЭРП кодируют 166 ами-
нокислот (одна теряется при транскрипции), из
которых состоит ЭРП. мРНК, транслирующая
последовательность аминокислот в ЭРП-поли-
пептиде, обнаружена в почечных интерстици-
альных кортикальных клетках, расположенных
возле проксимальных канальцев.
Эти клетки являются трансформированны-
ми макрофагами, экспрессирующими ген ЭРП
по закону «все или никто» и скорость продук-
ции ЭРП определяется числом клеток, содер-
жащих мРНК.
Образованный в интерстиции ЭРП, не на-
капливаясь в почечных клетках, быстро секре-
тируется в кровь, возвращаясь в почки с при-
текающей кровью. Обладая сравнительно не-
большой молекулярной массой (30 500), ЭРП
фильтруется в клубочках и частично подверга-
ется деградации в почечной ткани. Обнаружение
ЭРП в клубочках является следствием именно
этого процесса, а высказывавшаяся гипотеза о
синтезе ЭРП в клубочках [Павлов Ф., Морща-
кова Е.Ф., 1987] не нашла подтверждения.
Не отличающийся по строению и биологи-
ческой активности ЭРП, помимо почек, про-
дуцируется также гепатоцитами, интерстици-
альными клетками печени (Ito-клетки), напо-
минающими соответствующие клетки почек,
макрофагами и, по-видимому, эритробластами,
однако суммарная доля этих внепочечных ис-
точников ЭРП не превышает 10—15 % общей
продукции.
Агонистами продукции ЭРП служат андро-
гены, инсулиноподобный фактор роста, ко-
бальт.
Противоположное влияние оказывают цитоки-
ны — фактор некроза опухоли, интерферон-у,
интерлейкин-1, трансформирующий фактор
роста.
Ген, кодирующий ЭРП, локализован на 7-й
хромосоме и содержит 5 эксонов и 4 интрона.
Промотер гена непосредственно не реагирует на
гипоксию, однако с противоположной сторо-
ны к гену примыкает кислородочувствительный
усилитель (enhancer), который, связываясь с
фактором, индуцируемым гипоксией (hypoxia
inducible factor, HIF-1), вызывает транскрип-
цию гена ЭРП [Semenza G. et al., 1992].
Остается не окончательно решенным вопрос
о локализации сенсора О2 и механизмах, с
помощью которых снижение напряжения О2 в
крови реализуется в адаптивные изменения,
развивающиеся в организме.
Локализация в почках продуцирующих ЭРП-
клеток в непосредственной близости к прокси-
мальным канальцам позволяет предположить,
что дефицит О2 первично улавливается каналь-
цевыми клетками, потребляющими большое
количество энергии, и затем транслируется на
менее нуждающиеся в О2 интерстициальные
клетки.
39*
611
По современным данным, О^-сенсор пред-
ставляет собой специфический белок гема,
обратимо взаимодействующий с молекулярным
кислородом.
В условиях острой тяжелой гипоксии на долю
печени приходится 40 % дополнительного уве-
личения экспрессии мРНК ЭРП, в то время
как она гораздо слабее экспрессирует мРНК в
ответ на умеренную гипоксию. Таким образом,
почки и печень различно реагируют на гипок-
сические стимулы. Усиление печеночной про-
дукции ЭРП является перспективным методом
коррекции анемии при ХПН.
В норме ЭРП, синтезированный в почках
или экстраренально, поступает в циркуляцию,
частично утилизируется клетками-мишенями и
частично инактивируется. Период полувыведе-
ния как эндогенного, так и рчЭРП из плазмы
колеблется у человека от 2,5 до 11 ч. Удаление
из крови ЭРП, как и других гликопротеинов,
происходит главным образом в печени, где он
в лизосомах подвергается ферментативному
расщеплению, причем первым этапом этого
процесса является десиализация. Частично дег-
радацию ЭРП наблюдают и в почечной ткани.
В циркуляции полной десиализации подвер-
гаются в первую очередь «старые» гликопроте-
ины, которые, лишившись углеводного компо-
нента, быстро захватываются печенью и под-
вергаются деградации. Тем самым регулируется
уровень ЭРП в крови.
Во время острого вирусного гепатита на
фоне дисфункции печеночных клеток процесс
десиализации нарушается, что сопровождается
повышением концентрации в крови эндогенно-
го ЭРП и соответствующим увеличением гемо-
глобина и гематокрита.
Другими описанными причинами повыше-
ния гемоглобина и гематокрита у больных на
гемодиализе, не страдающих наследственным
или приобретенным поликистозом, являются
констриктивный перикардит, скорее всего
вследствие сгущения крови, и перегрузка ко-
бальтом [Dalmark S. et al., 1997], влияющим, как
упоминалось, на транскрипцию гена ЭРП.
39.4.4.3. Применение рчЭРП и причины
рефрактерности
Теоретически введение рчЭРП возможно внут-
ривенно, подкожно, внутрибрюшинно и внут-
рикожно.
После внутривенного введения препарата в
дозе 50 ед/кг его концентрация в плазме по-
вышается до 600—900 мед/кг, период полувы-
ведения (Т|/2) равняется 5,4—8,02 ч, а объем
распределения составляет 70—79,7 мл/кг. При
подкожном введении в такой же дозе макси-
612
мальная концентрация достигает только 5 %
значения внутривенной, но Т1/2 увеличивается
до 8,6—35,2 ч; длительное лечение не влияет
на фармакокинетические параметры рчЭРП.
Аналогичные тенденции прослеживаются и
у здоровых испытуемых.
Биодоступность рчЭРП при внутрибрюшин-
ном введении, которое на практике возможно
только у больных на перитонеальном диализе,
составляет всего 3—8 % [Macdougall I. et al.,
1991], поскольку его всасывание из брюшной
полости, как и других макромолекулярных со-
единений, осуществляется преимущественно
лимфатической абсорбцией, скорость которой
не превышает 1,5 мл/мин. Вследствие этого до-
стижение целевого гематокрита с использова-
нием одинаковых доз препарата при внутри-
брюшинном введении происходит в 2 раза мед-
леннее, чем при подкожном [Frenken L. et al.,
1992].
При введении рчЭРП в осушенную брюш-
ную полость его биодоступность увеличивается
в 9 раз, что определяет равный с подкожным
введением эритропоэтический ответ.
У больных на гемодиализе практикуется как
внутривенное, так и подкожное введение ЭРП.
Больным на перитонеальном диализе и с пред-
терминальной ХПН препарат назначают под-
кожно, причем они могут вводить его самосто-
ятельно, используя специальные шприцы на-
подобие инсулиновых.
Внутрикожное введение препарата по эф-
фективности не уступает подкожному, но тех-
нически оно сложнее и применяют его редко.
Оценка эффективности внутривенного и
подкожного введения рчЭРП свидетельствует
по меньшей мере о сопоставимости этих спо-
собов, а в ряде исследований [Eidemark I. et al.,
1991] целевой гематокрит при подкожном вве-
дении достигался значительно раньше, чем при
внутривенном (42 против 84 сут), и меньшими
кумулятивными дозами препарата (873—924
против 2066 ед/кг); почти на 50 % была мень-
ше и поддерживающая доза.
Каким должен быть целевой гематокрит?
Такие симптомы уремии, как слабость, невоз-
можность концентрирования внимания, нето-
лерантность к физической нагрузке, сексуаль-
ные дисфункции и т.д., ранее расценивавшие-
ся как проявления уремии, являются, как по-
казали последующие исследования, следстви-
ем анемии.
Ранее в Европе, Австралии, Японии и Ка-
наде считали, что гематокрит у больных, на-
ходящихся на диализе, на фоне лечения рчЭРП
должен быть не менее 30 %, в США — 30—
33 %.
В последующем Ad hos Committee целевым
был признан гематокрит > 33 % (33—38 %),
поскольку только при таких значениях после-
днего уменьшалась выраженность ишемических
изменений на ЭКГ во время тредмил-теста и
выравнивались гемодинамические сдвиги (сни-
жался сердечный выброс и повышалось общее
сосудистое сопротивление).
Однако выживаемость больных при гематок-
рите > 33 % заметно не увеличивалась, гипер-
тония труднее поддавалась контролю и несколь-
ко снижалась эффективность гемодиализа
|Madore Е et al., 1996], а в одновременно про-
веденных физиологических исследованиях было
продемонстрировано, что оптимальная оксиге-
нация печени, кишечника, почек и других
органов сохраняется при гематокрите не менее
40 %. Эти экспериментальные данные были
подтверждены клиницистами, показавшими,
что максимальное поглощение кислорода
(VO2max), функция сердца, толерантность к
физической нагрузке, иммунитет, когнитивные
способности, а также качество жизни больных,
находящихся на диализе, улучшаются при ге-
матокрите от 35 до 42 %.
На фоне гематокрита > 42 % у больных нор-
мализовались сон, различные функции головно-
го мозга, метаболизм аминокислот с коррекци-
ей malnutrition, уменьшался в сыворотке уро-
вень полиаминов [Barani Р. et al., 1996], в то
время как контроль за артериальным давлени-
ем заметно не усложнялся (Berns J. et al., 1996].
Вместе с тем увеличение массы циркулиру-
ющих эритроцитов и вязкости крови компен-
саторно приводило к гиперволемии (в ответ на
повышение массы эритроцитов), гипертонии,
увеличению нагрузки на сердце, что неблаго-
приятно сказывалось на состоянии сердечно-со-
судистой системы, особенно у больных пожи-
лого возраста из-за снижения эластичности
сосудов.
По данным S.Roger и соавт. (1992), быстрая
коррекция гематокрита может вызвать и эксги-
поксическую вазоконстрикцию, в основе которой
лежит повышенная продукция эндотелина-1,
вазоконстрикторных простаноидов, активация
локальной ренин-ангиотензиновой системы и
экспрессия индуцированных ангиотензином II
факторов роста, что чревато резким повыше-
нием артериального давления.
В известной степени по этой причине ранее
запланированного срока было прекращено
Amgen-исследование в США, изначально вклю-
чавшее 1265 больных. В группе из 634 больных
с высоким на фоне рчЭРП-терапии гематок-
ритом смертность составила 35 %, а в конт-
рольной группе со стандартным гематокри-
том — 29 %. Особенностью исследования был
большой процент больных с высоким сердеч-
но-сосудистым риском |Goodkin D., 1996].
В настоящее время аналогичное исследова-
ние, охватывающее 300 больных, проводят в
Скандинавских странах и Канаде, однако из них
исключены больные с сердечно-сосудистыми
нарушениями [Macdougall Т., 1998].
Таким образом, вопрос о целевом гематок-
рите не может считаться окончательно решен-
ным.
E.Ritz и К.Amann (1998) считают, что ско-
рее всего целевой гематокрит должен быть ин-
дивидуальным и различаться у пожилых и мо-
лодых, у ведущих активный и неактивный об-
раз жизни, у больных с И ЕС и без патологии
коронарных сосудов. В любом случае повыше-
ние гематокрита должно быть постепепенным
с ежемесячным увеличением дозы рчЭРП не
более чем на 25 % [Minetti L., 1997], а у боль-
ных с сердечной патологией необходимо в этот
момент предусмотреть использование вазодила-
таторов и строго контролировать артериальное
давление с мониторированием его циркадных
ритмов.
На фоне коррекции анемии под влиянием
рчЭРП у больных уремией кровообращение
теряет гипердинамический профиль за счет
снижения минутного объема, уменьшаются
размеры и масса левого желудочка, улучшают-
ся метаболизм мозга, нормализуются сон, па-
мять и другие когнитивные функции, улучша-
ется состояние вегетативной и периферической
нервной системы, активируется иммунитет,
восстанавливается гормональный баланс с улуч-
шением сексуальной способности у мужчин. У
больных нормализуется метаболизм ряда ами-
нокислот, состояние питания и в целом каче-
ство жизни.
В то же время далеко не у всех больных,
получающих рчЭРП, удается достичь целевого
гематокрита.
У 20—25% больных целевой гематокрит дос-
тигается применением ЭРП в дозе <105 ед/кг
в неделю (ЭРП-чувствительные), 60—70 % от-
вечают на дозу 105—450 ед/кг в неделю (respon-
ders), а 10 — 15 % требуют дозы > 450 ед/кг в
неделю. О сниженной чувствительности к ЭРП
говорят, когда уровень гемоглобина повышается
менее чем на 2 г/дл в течение 12 нед при дозе
препарата > 150 ед/кг в неделю [Muirhead N. et
al., 1995] или менее чем на 1 г/дл в течение 4 нед
при дозе > 100 ед/кг в неделю [Macdougall I.,
1995].
Наиболее частой причиной неэффективно-
сти терапии рчЭРП является абсолютный или
относительный дефицит железа. Его возникно-
вение у больных на гемодиализе традиционно
связывают как с повышенными потерями же-
леза вследствие желудочно-кишечных микро-
кровотечений, задержки некоторого количества
крови в гемодиализаторе после очередной про-
цедуры, взятия крови для анализов и т.д., так
613
и с недостаточным потреблением и всасывани-
ем железа в кишечнике.
Маркерами дефицита железа, указывающи-
ми на необходимость назначения препаратов
железа, являются:
• содержание ферритина сыворотки < 200
мкг/л у больных на гемодиализе и < 100
мкг/л у больных на перитонеальном диали-
зе и с предтерминальной ХПН;
• насыщение трансферрина < 20%;
• уровень ЦПП > 90 мкмоль/моль гема;
• число гипохромных эритроцитов в циркуля-
ции (ГЭР) >10 %. Три последних показате-
ля служат маркерами функционального де-
фицита железа и только содержание ферри-
тина в сыворотке отражает запасы железа в
организме.
В организме железо сохраняется в РЭС, пе-
чени, селезенке, костном мозге, эритроцитах.
Функциональный пул включает эритроциты и
их предшественники. Запасы Fe у мужчин со-
ставляют 50 мг/кг, у женщин — 35 мг/кг.
Абсолютный дефицит железа развивается
при уменьшении его запасов в депо, например
вследствие кровопотерь, включая ятрогенные,
или при сниженной абсорбции железа в желу-
дочно-кишечном тракте.
Уровень ферритина в сыворотке в известной
степени соответствует запасам железа, функци-
ональный дефицит которого нередко развива-
ется у больных с уремией на фоне лечения
ЭРП, когда возрастающая потребность в желе-
зе не соответствует его биодоступности.
В циркулирующих эритроцитах при нормаль-
ном гематокрите содержится 2—3 г железа, а
эритропоэз, в процессе которого оно расходу-
ется на синтез гема, является одной из основ-
ных причин высвобождения железа из мест его
хранения в организме. Перенос железа к клет-
кам крови осуществляется трансферрином, а в
клетки оно поступает посредством эндоцитоза
через трансферриновый рецептор.
Трансферриновые рецепторы экспрессирова-
ны на поверхности всех клеток, нуждающихся
в железе. Поскольку железо в основном расхо-
дуется на синтез гемоглобина, 80 % рецепто-
ров локализовано на поверхности эритроидных
предшественников, содержащихся в костном
мозге. Определенная часть этих рецепторов выс-
вобождается в циркуляцию, образуя раствори-
мые трансферриновые рецепторы, — димерные
протеины с молекулярной массой 190 000 Да,
каждая из субъединиц которых способна свя-
зывать молекулу трансферрина.
Из 1 г железа, хранящегося в РЭС, только
4 мг захватываются трансферрином, процент
насыщения которого отражает биодоступность
железа.
614
Лечение больных с ХПН препаратами же-
леза рекомендуется начинать при снижении
ферритина сыворотки менее 150 мкг/л и под-
держивать его на уровне 200 мкг/л. Показани-
ем для терапии железом является также сни-
жение насыщения трансферрина < 20 %.
В последнее время предложены более чувстви-
тельные, но и технически более сложные мето-
ды определения запасов железа в организме.
Одним из таких методов является исследо-
вание в эритроцитах протопорфирина и/или
цинк-протопорфирина (ЦПП). На завершающей
стадии синтеза гема в протопорфирин включа-
ются Fe2+, причем этот процесс катализирует-
ся гемсинтетазой (феррохелатазой). При дефи-
ците железа, интоксикации свинцом и неко-
торых других состояниях протопорфирин не
расходуется на синтез гема и накапливается в
эритроцитах или вместо железа в кольцо про-
топорфирина включается цинк. По мнению
J.Hastka и соавт. (1991), у больных, находящихся
на диализе, повышение ЦПП считается более
чувствительным маркером дефицита железа, чем
снижение ферритина сыворотки. Обнаружение
у больных на диализе повышенной концентра-
ции ЦПП в эритроцитах (> 90 мкмоль/моль гема,
норма < 40 мкмоль) выявляет дефицит желе-
за с 90 % чувствительностью и 87 % специфич-
ностью.
Приобретающее все большее распростране-
ние автоматизированное исследование крови
позволяет получить ряд расчетных показате-
лей — эритроцитарных индексов (MCV, МСН
и др.), с учетом которых можно судить о запа-
сах железа в организме.
Если сниженный средний объем эритроци-
тов (MCV) выявляет дефицит железа в 36 %,
то сочетание MCV с определением диаметра
эритроцитов увеличивает выявляемость вдвое.
Эритроцитарные индексы, MCV и МСН,
отражают усредненные показатели всей попу-
ляции циркулирующих эритроцитов.
В последние годы благодаря использованию
проточной цитометрии стало возможным вы-
являть эритроциты с недостаточной гемоглоби-
низацией (< 28 г/дл). В 1992 г. I.Macdougall и
соавт. опубликовали первые результаты опреде-
ления ГЭР у больных на гемодиализе, получав-
ших рчЭРП. До начала ЭРП-терапии доля ГЭР
составляла 3,7 % (в норме < 2,5 %), через 4
нед лечения — 11,7 % и через 8 нед — 17,2 %.
При внутривенном введении препаратов желе-
за процент ГЭР снижался.
По данным R.Schaefer и L.Schaefer (1995),
Е.Golan и соавт. (1994) и др., у больных с пе-
регрузкой железа число ГЭР не превышает 1 %,
а при его дефиците повышается до 22 %.
I.Macdougall (1998) считает процент ГЭР
самым чувствительным показателем функцио-
нального дефицита железа. Для выявления функ-
ционального дефицита железа перспективно
определение содержания гемоглобина в рети-
кулоцитах.
У больных на гемодиализе выявлена линей-
ная зависимость между содержанием гемогло-
бина в ретикулоцитах и эритроцитах, а при кон-
центрации гемоглобина в первых менее 26 пг
можно предположить дефицит железа со 100 %
чувствительностью и 80 % специфичностью
[Fishbane S. et al., 1997]. По мнению S.Bhandari
и соавт. (1998), определение среднего содержа-
ния гемоглобина в ретикулоцитах (СНг) и сред-
ней концентрации гемоглобина в ретикулоци-
тах (СНСМг) позволяет с высокой вероятнос-
тью обнаруживать дефицит железа у больных на
диализе с нормальными значениями феррити-
на сыворотки и насыщения трансферрина.
Однако ни один из показателей не дает од-
нозначного ответа на вопрос о состоянии за-
пасов и биодоступности железа, и только од-
новременное определение нескольких показа-
телей позволяет получить представление о раз-
личных сторонах метаболизма железа.
В соответствии с Согласительным докладом,
опубликованным в 1996 г. W.Horl и дополнен-
ным в последующем и другими авторами
[Driieke Т. et al., 1997], о запасах железа в орга-
низме судят по уровню ферритина в сыворот-
ке или окрашиваемому железу в костном моз-
ге, а о биодоступности железа, находящегося
в циркуляции, — по показателям сывороточ-
ного железа и проценту насыщения трансфер-
рина. Об адекватном поступлении железа в
эритроидный костный мозг свидетельствует
концентрация трансферриновых рецепторов в
сыворотке, ферритин и протопорфирин эрит-
роцитов. Маркерами утилизации железа эрит-
роидным костным мозгом являются эритроци-
тарные индексы (MCV и МСН), процент ги-
похромных эритроцитов и ретикулоцитов, а
также концентрация в них гемоглобина.
39.4.4.4. Восполнение существующего
дефицита железа
Приемом железа внутрь можно восполнить его
недостаток у больных на диализе, однако эта
терапия хотя и безопасна, но эффективна лишь
при точном расчете дефицита и кооперативно-
сти больных. На практике последнее случается
достаточно редко, поскольку препараты желе-
за плохо переносятся, а больные вынуждены,
помимо них, принимать большое количество
других лекарственных препаратов — антигипер-
тензивных, фосфатсвязывающих гелей, витами-
нов, Н,-блокаторов, снижающих внутрижелу-
дочный pH, и т.д. Некоторые из этих препара-
тов, в частности фосфатсвязывающие гели,
способны уменьшать всасывание железа.
В свою очередь препараты Fe при перораль-
ном назначении нарушают всасывание в желу-
дочно-кишечном тракте тетрациклина и его
дериватов, полусинтетических пенициллинов,
допегита, ципрофлоксацина и т.д., образуя с
ними комплексы.
Лучше переносятся протеинизированные
препараты железа, однако высвобождение из
них элементарного железа происходит выше
места максимального всасывания и в целом
эффект от перорально назначаемого железа не-
достаточный, особенно при исходном уровне
ферритина сыворотки < 100 мкг/л [Barany Р.
et al., 1995].
E.Anastassiades (1993) считает, что для вос-
полнения дефицита больные на гемодиализе,
получающие рчЭРП, должны перорально при-
нимать не менее 300 мг элементарного железа
в сутки в течение длительного времени, одна-
ко до 30 % пациентов не переносят вдвое мень-
шее количество. О неспособности перорально
назначаемого железа поддерживать его необхо-
димые запасы у больных на гемодиализе сви-
детельствуют данные G.Markowitz и соавт. (1997).
По мнению G.Dunea и соавт. (1994), перораль-
ное назначение железа малоэффективно у боль-
ных на гемодиализе. Скорее его можно рекомен-
довать больным с предтерминальной ХПН или
больным на ПАПД, достаточно редко посеща-
ющих стационар, однако последние публика-
ции [Ahsan N., 1998] подтверждают, что и у
больных на перитонеальном диализе однократ-
ное в месяц в течение полугода внутривенное
введение 1000 мг железа декстрана (ЖД) эф-
фективнее в плане достижения целевого гема-
токрита ежедневного перорального приема же-
леза сульфата (195 мг элементарного железа) в
течение такого же срока. Для быстрого попол-
нения запасов железа в организме и поддержа-
ния их на достаточном уровне, особенно в ус-
ловиях его повышенного потребления на фоне
ЭРП-терапии, рекомендуется внутривенное
введение препаратов железа.
В настоящее время практикуются различные
схемы внутривенного введения соединений же-
леза от 10—20 до 100 мг и более после каждой
процедуры гемодиализа до 40 мг в неделю или
100 мг каждые 2 нед [Macdougall I., Tucker В.,
1993].
Последние рекомендации [Driieke Т. et al.,
1997] предусматривают применение в началь-
ной фазе коррекционного периода рчЭРП-те-
рапии у больных с исходным ферритином сы-
воротки < 100 мкг/мл ударных доз железа
(6 доз по 100 мг в течение 2 нед) с последую-
щим их уменьшением до 10—20 мг 3 раза в не-
делю, но не более 100 мг/нед при достижении
615
целевого гематокрита. Согласно M.Kotaki и со-
авт. (1997), дозы железа < 100 мг/нед способ-
ны поддерживать необходимый запас железа в
организме и не приводят к заметному повыше-
нию ферритина сыворотки.
С особой осторожностью следует назначать
железо больным с исходным уровнем ферри-
тина > 1000 мкг/мл или насыщением трансфер-
рина > 50 % [Driieke Т. et al., 1997]. В любом
случае препараты железа следует вводить мед-
ленно, а еще лучше в течение всей процедуры
гемодиализа. При этом потери железа в диали-
зирующий раствор остаются незначительными.
C.Granolleras и соавт. (1997) рекомендуют
вводить железо совместно с гепарином в одном
шприце при проведении постоянной гепарини-
зации. Авторы использовали этот способ введе-
ния железа во время 30 000 процедур гемодиа-
лиза и ни в одном случае не наблюдали побоч-
ных реакций.
Внутривенное введение железа устраняет
проблему некооперативности больных, возни-
кающую при пероральном приеме, и способ-
но в короткие сроки пополнить запасы железа
в организме. Нередко оно оказывается эффек-
тивным, когда пероральное назначение железа
безуспешно [Macdougall I. et al., 1989].
Длительное систематическое внутривенное
введение железа больным, получающим
рчЭРП, позволяет на 25—70 % снизить без
ущерба для конечного эффекта дозу рчЭРП,
уменьшая, таким образом, стоимость лечения.
R.Fudin и соавт. (1998) сумели длительным
(в течение 26 мес), настойчивым внутривенным
введением железа глюконата 20 больным на
гемодиализе повысить уровень гемоглобина в
среднем с 78 до 126 г/дл даже без назначения
рчЭРП.
39.4.4.5. Осложнения рчЭРП-терапии
Важнейшим является усугубление или развитие
de novo артериальной гипертонии. Последняя
развивается у 20—30 % больных ТПН, получа-
ющих рчЭРП, и в 2 % сопровождается возник-
новением гипертонической энцефалопатии с
судорожным синдромом [Beccari М., 1995], в
основе которого лежат вазоспазм или наруше-
ние ауторегуляции мозгового кровотока с по-
вышением проницаемости гематоэнцефаличес-
кого барьера, экссудацией плазмы и отеком
мозга.
В развитии гипертонии основное значение
имеют устранение гипоксической вазодилата-
ции, увеличение вязкости крови, повышение
в крови концентрации эндотелина, ингибиция
гемоглобином синтеза NO эндотелием сосуди-
стой стенки, повышение реактивности сосудов
616
к норадреналину и ангиотензину II, тогда как
активность общей ренин-ангиотензиновой си-
стемы практически не изменяется.
На клеточном уровне гипертония, индуци-
руемая рчЭРП, реализуется через повышение
внутриклеточного Са2+ [Tepel М. et al., 1995] и
для ее коррекции в первую очередь использу-
ют препараты, непосредственно влияющие на
сосудистый тонус, в частности блокаторы каль-
циевых каналов.
Увеличение на фоне рчЭРП-терапии вязко-
сти крови в основном за счет повышения чис-
ла эритроцитов и концентрации фибриногена
в плазме, снижение уровня некоторых есте-
ственных антикоагулянтов [Jaar В. et al., 1997]
и тенденция к тромбоцитозу с усилением спон-
танной и индуцированной агрегации тромбоци-
тов создают условия, способствующие тромбо-
тическим осложнениям и в первую очередь
тромбозу сосудистого доступа, что регулярно
фиксировали на начальных этапах применения
рчЭРП.
У больных с высоким гематокритом несколь-
ко увеличивается расход гепарина на процеду-
ру гемодиализа, а повышенная вязкость крови
в определенной степени влияет на эффектив-
ность гемодиализа.
Приблизительно у 4 % больных введение
больших доз рчЭРП сопровождается возникно-
вением гриппоподобного (flu-like) синдрома,
характеризующегося болями в мышцах, артрал-
гиями и повышением температуры до фебриль-
ных цифр. В настоящее время он наблюдается
заметно реже и предупреждается приемом аце-
тилсалициловой кислоты или других нпвп.
Имеются единичные сообщения о появлении
при внутривенном введении рчЭРП зудящих
папулезных высыпаний на конечностях, остав-
ляющих после отмены препарата коричневую
гиперпигментацию, тромбоцитопении, комы и
дыхательной недостаточности [Borghi В. et al.,
1997].
Предполагают взаимосвязь рчЭРП-терапии с
развитием адинамического заболевания скеле-
та [Smans К. et al., 1996], однако это предпо-
ложение нуждается в тщательной проверке.
В целом, за исключением гипертонии, ослож-
нения от применения рчЭРП редки и, как пра-
вило, не требуют прекращения или модифика-
ции лечения.
39.4.4.6. Причины рефрактерности к рчЭРП
Воспалительные процессы, инфекционные и
неинфекционные, резко снижают эффектив-
ность рчЭРП. Так, M.Duranay и соавт. (1998)
наблюдали, несмотря на продолжавшуюся в
высоких дозах (175 ед/кг) терапию рчЭРП,
снижение гемоглобина до 4,5 г/дл у больного
с парвовирусной инфекцией, находившегося на
диализе, a D.Tarng и T.Huang (1997) — паде-
ние гематокрита с 27 до 23 % на фоне возрас-
тающих доз рчЭРП у больных с выпотным пе-
рикардитом. В обоих случаях после разрешения
процесса показатели красной крови у больных
улучшились.
Воспаление сопровождается усиленной про-
дукцией цитокинов, некоторые из которых (фак-
тор некроза опухоли, интерлейкин-10, интер-
ферон-у, трансформирующий фактор роста)
способны, как упоминалось, ингибировать вы-
работку эндогенного ЭРП и ответ на рчЭРП.
Подавление активности воспалительного
процесса восстанавливает чувствительность к
рчЭРП. Так, I.Tzanakis и соавт. (1996) добились
этого назначением преднизолона 2 больным на
гемодиализе с обострением ревматоидного ар-
трита и узелкового периартериита.
Дефицит таких водорастворимых витаминов,
связанных с кроветворением, как фолиевая
кислота и витамин В12, у диализных больных
развивается редко, хотя описаны случаи пре-
одоления резистентности к рчЭРП на фоне их
введения.
При терминальной уремии вследствие пер-
вичного оксалоза или миеломы полная или
частичная резистентность к рчЭРП обусловле-
на уменьшением плацдарма кроветворения из-
за отложения кристаллов оксалатов в костном
мозге или замещения эритроидного ростка
плазматическими клетками [Lorenzo V. et al.,
1992].
Уменьшение плацдарма кроветворения на-
блюдают и при вторичном гиперпаратиреозе.
После субтотальной паратиреоидэктомии сте-
пень анемии и потребность в гемотрансфузиях
уменьшается, однако интенсивность эритропо-
эза по результатам определения в сыворотке
концентрации трансферринных рецепторов не
меняется |Teruel J. et al., 1997], позволяя пред-
полагать, что ПТГ не оказывает прямого ин-
гибирующего влияния на эритропоэз, а пара-
тиреоидэктомия способствует кроветворению,
уменьшая фиброз костного мозга.
Антитела против эндогенного ЭРП в редких
случаях выявляют у больных с апластической
анемией. Недавно анти-рчЭРП-антитела обна-
ружены у 63-летнего больного, находящегося на
гемодиализе в связи с гипертензивным нефро-
склерозом, у которого степень анемии умень-
шилась только после отмены рчЭРП [Prabhakar
S. et al., 1997].
Резистентность к ЭРП может иметь и лекар-
ственный генез. Ингибирующим влиянием на
эритропоэз обладают витамин А, аллопуринол
и блокаторы Н2-рецепторов [Ikeda Y., 1997], но-
вейший антибиотик широкого спектра из клас-
са стрептограминов синецид [Launay О. et al.,
1997].
Чаще всего резистентность к рчЭРП разви-
вается на фоне широко назначаемых ингиби-
торов АПФ.
H.Hirakata и соавт. (1984), очевидно, впервые
отметили усугубление анемии у 9 из 12 боль-
ных на гемодиализе, лечившихся каптоприлом.
В 1986 г. в более углубленном исследовании эти
же авторы выявили зависимость между сниже-
нием на фоне приема каптоприла концентра-
ции в крови ангиотензина II и усугублением
анемии, еще раз подтвердив связь кроветворе-
ния с функцией ренин-ангиотензиновой сис-
темы.
В последующем оказалось, что аналогичным
ингибирующим эффектом обладают и другие
препараты этой группы, которые с успехом
стали применяться для коррекции не частых
эритроцитозов у больных на гемодиализе
[Yoshida A. et al., 1991], но особенно у реципи-
ентов трансплантата почки [Torregrosa J. et al.,
1994]. Позднее для лечения посттрансплантаци-
онного эритроцитоза стали использовать бло-
катор АТ -рецепторов ангиотензина II лозартан
[Navarro J. et al., 1997].
Алюминий, вмешиваясь в синтез гема и
влияя на метаболизм железа, усугубляет свой-
ственную больным с уремией анемию, делая ее
резистентной к рчЭРП.
Несмотря на обязательную в настоящее вре-
мя подготовку и очистку воды, используемой
для приготовления диализирующего раствора,
у длительно находящихся на гемодиализе боль-
ных выявляют перегрузку алюминием. По дан-
ным N.DiPaolo и соавт. (1997), концентрация
алюминия в сыворотке крови (42,9 против 19,0
мкг/л), моче (39,3 против 4,1 мкг/л) и желчи
(185 против 5 мкг/л) у диализных больных была
во много раз выше, чем у лиц контрольной
группы. У умерших пациентов содержание алю-
миния в тканях легких было в 4,5 раза больше,
чем в контроле, в печени, костях и аорте — в
8 раз, в хрящах — в 9 раз и в селезенке — в 2
раза.
Отрицательное влияние алюминия на эрит-
ропоэз проявляется не только на фоне высо-
ких значений алюминия в сыворотке, но и при
умеренно выраженной интоксикации.
Основные причины резистентности к рчЭРП
суммированы ниже.
ПРИЧИНЫ РЕЗИСТЕНТНОСТИ К рчЭРП
Уменьшение продукции эритроцитов:
Дефицит железа;
состояния, сопровождающиеся гиперпродукцией ИЛ-1,
ИЛ-6, ФНО: инфекция, воспаление, злокачественный
рост;
617
Дефицит витамина В12, фолиевой кислоты, карнитина;
Al-интоксикация;
неадекватный диализ;
ацетатный диализ (?); reuse (?);
неадекватные дозы рчЭРП;
анти-ЭРП-антитела
Лекарственные препараты: ингибиторы АПФ, блока-
торы АТ^рецепторов Ан II, аллопуринол, кетансерин,
вальпроевая кислота, Н2-блокаторы;
malnutrition;
гипотиреоз;
беременность;
вторичный гиперпаратиреоз, оксалоз, миелома и дру-
гие состояния, характеризующиеся уменьшением
плацдарма кроветворения
Уменьшение продолжительности жизни эритроцитов
Кровопотери, включая ятрогенные.
Супрафизиологический гемолиз.
Гемоглобинопатии.
39.4.4.7. Возможности усиления
эритропоэтического эффекта рчЭРП
Наряду с обеспеченностью железом адекват-
ность гемодиализа или перитонеального диализа
является эссенциальной для успешного лечения
рчЭРП. Так, T.Depner и соавт. (1990) считают,
что использование высокопроницаемых гемоди-
ализных мембран и поддержание KT/V > 1,2
позволяют добиваться целевого гематокрита
минимальными дозами рчЭРП. У больных на
ПАПД КТ/V и недельный клиренс креатинина
прямо коррелирует с гематокритом [Opatrny К.
et al., 1993], а неадекватность заместительной
терапии служит одной из причин рефрактер-
ности к рчЭРП.
Еще в 1975 г. Y.Yawata и H.Jacob установили,
что в эритроцитах больных с уремией, несмотря
на адекватный гемодиализ, нарушен метаболизм
глюкозы, что является одной из причин усилен-
ной продукции СРК, a O.Giardini и соавт. (1984)
обнаружили в эритроцитах этих больных повы-
шение концентрации малонового диальдегида и
уменьшение содержания токоферола, представ-
ляющего естественный антиоксидант.
Выявленные изменения метаболизма эрит-
роцитов, обусловленные снижением активно-
сти пентозофосфатного шунта, сопровождаются
накоплением в эритроцитах NAD и снижени-
ем NAD PH. Эти отклонения регистрируют не
только у больных на гемодиализе, но и при
сравнительно умеренной азотемии; они ком-
пенсаторно увеличивают содержание в клетках
и плазме крови редуцированного глутатиона,
стабилизирующего эритроциты. Дополнительное
введение диализным больным редуцированно-
го глутатиона транзиторно увеличивает Ti/2
618
эритроцитов и позволяет уменьшить дозы
рчЭРП.
Аналогичный эффект, по-видимому, дают
L-карнитин в высоких дозах [Labonia W., 1995]
и фолиевая кислота в дозе 10 мг/сут [Pronai W.
et al., 1993].
L-карнитин особенно показан пожилым
больным, поскольку его продукция почками
снижена не только вследствие уремии, но и
возраста [Caruso U. et al., 1998].
А.Ю.Николаев и соавт. (1995), S.Carozzi и
соавт. (1993), S.Albitar и соавт. (1997) показа-
ли, что у больных на гемодиализе с умеренны-
ми проявлениями гиперпаратиреоза назначение
метаболитов витамина D3 усиливает эритропо-
этический ответ на рчЭРП, однако не уточне-
но, является ли это следствием прямого влия-
ния метаболитов или оно опосредуется через
подавление вторичного гиперпаратиреоза. Пос-
ледние данные свидетельствуют, что кальци-
триол способен увеличивать на эритроцитарных
предшественниках число ЭРП-рецепторов
[Magocsi М. et al., 1997].
P.Raiola и соавт. (1995) преодолевали резис-
тентность к рчЭРП синтетическим иммуномо-
дулятором тимопентином, который в дозе 50
ед/кг вводили внутривенно после каждой про-
цедуры гемодиализа. Через 2 мес лечения гемог-
лобин крови повысился у больных с 7,5 до 10,5
г/дл и гематокрит — с 23,8 до 32,6 %.
В единственном исследовании повышало
чувствительность к рчЭРП больных с перегруз-
кой железа внутривенное введение больших доз
витамина С [Gastaidello К. et al., 1995].
Сообщения о синергичном влиянии рчЭРП
и андрогенов также единичны [Ballal S. et al.,
1991]. В эксперименте усиливали эффекты
рчЭРП инсулиноподобный фактор роста-1 и
интерлейкин-3 [Вгох A. et al., 1996].
Учет факторов, ослабляющих или усилива-
ющих эритропоэтические эффекты рчЭРП,
необходим для осмысленного применения этого
препарата.
39.5. Методы внепочечного
очищения крови
39.5.1. Хронический гемодиализ
Хронический (программный) гемодиализ и
трансплантация почки остаются основными
методами лечения больных с терминальной
почечной недостаточностью, хотя в последние
годы все большее распространение получают
перитонеальный диализ и его различные раз-
новидности, а применение гемофильтрации и
гемодиафильтрации сокращается.
Гемодиализ основан на диффузии из крови
через полупроницаемую мембрану в диализи-
рующий раствор мочевины, креатинина, моче-
вой кислоты и других веществ, задерживающих-
ся в крови при уремии.
Впервые с помощью диализа J.Abel и соавт.
в 1913 г. удалили из крови животных вещества,
способные диффундировать через полупрони-
цаемую мембрану, a J.Nechles (1923) пытался
поддерживать гемодиализом жизнь бинефрэкто-
мированных собак. Первый гемодиализ челове-
ку был проведен в октябре 1924 г. G.Haas, ра-
ботавшим в Германии в клинике г. Гессен. Пер-
вая процедура длилась 15 мин и за это время
150 мл крови было очищено от индикана. Со-
судистый доступ обеспечивался канюлировани-
ем под местной анестезией лучевой артерии и
антекубитальной вены, а в качестве антикоа-
гулянта использовался гирудин. В 1925 г. крат-
ковременному и поэтому терапевтически неэф-
фективному гемодиализу подверглись еще 4
больных с хронической уремией.
Гемодиализы больным с ОПН в Европе ста-
ти проводить W.Kolff и H.Berk с 1943 г. Пер-
вые 15 больных умерли, но в 1946 г. 67-летней
больной с обострением хронического холеци-
стита, желтухой и ОПН, развившейся на фоне
приема сульфатиазида, был проведен И-часо-
вой гемодиализ, во время которого азот моче-
вины снизился со 105 до 56 мг/дл и калий
сыворотки — с 13,7 до 4,7 мэкв/л. Через день у
больной началась полиурия и жизнь ее оказа-
лась вне опасности. В этом же году успешный
гемодиализ был проведен в США, хотя его
подробное описание появилось в печати толь-
ко через 3 года [Murray G. et al., 1949]. Инте-
ресно, что аппарат «искусственная почка» был
изготовлен автором публикации в подвале соб-
ственного дома и обошелся в 8000 долл. Пер-
вые попытки применения «искусственной поч-
ки» у больных с хронической уремией были
предприняты J.Merrill и соавт. (1950).
В настоящее время в мире жизнь более 1 млн
больных продолжается благодаря замещающей
герапии и 2/3 из них проводят хронический ге-
модиализ. В развитых странах число больных, на-
ходящихся на хроническом гемодиализе, со-
ставляет 600—1100 на 1 млн населения, хотя
сравнительно недавно считалось, что больных,
нуждающихся в этом виде лечения, значитель-
но меньше.
Неуклонное увеличение популяции больных,
получающих лечение гемодиализом, связано
как с увеличением продолжительности их жиз-
ни (нередко превышает 30—40 лет), так и с пе-
ресмотром многих критериев, регламентирую-
щих отбор больных. Практически упразднены
почти все противопоказания к началу гемоди-
ализа (исключение составляют слабоумие, рас-
пространенный опухолевый процесс, продол-
жающееся кровотечение), а обеспеченность
«диализными местами» зависит от экономичес-
кого положения страны.
Стоимость лечения 1 больного гемодиализом
в течение года колеблется в разных центрах от
15 до 80 тыс. долларов США и определяется
различием в наборе калькулируемых услуг. Что-
бы минимизировать эти различия, R.Klefter и
В.Nielsen (1998) предлагают учитывать расходы
по 14 основным статьям, которые включают
стоимость не только одноразовых аксессуаров
(диализаторы, магистрали), но и их утилизации,
лабораторных исследований, лекарственных пре-
паратов, зарплату медперсоналу и т.д.
Подсчитано, что в мире на замещающую
терапию ежегодно расходуется около 100 млрд
долларов и совершенно оправдано стремление
снизить эти расходы, что не всегда выполни-
мо. Крайне важно, чтобы уменьшение стоимо-
сти лечения не ухудшало качества жизни боль-
ных. Например, в Дании число больных, на-
ходящихся на гемодиализе, с 1990 по 1995 г.
удвоилось, а расходы снизились всего на 400
долларов на 1 больного в год. В 1991 г. в США
диализ проводили почти 150 тыс. больным, а
общую стоимость лечения оценивали в 6,1 млрд
долларов. К 1996 г. число больных увеличилось
до 283 932 и 73 000 было принято на лечение,
а его стоимость возросла до 10,4 млрд долла-
ров. Стоимость годового лечения 1 больного в
1991 г. составила 35 652 долл., а в 1995 г. воз-
росла до 45 тыс.
В Великобритании лечение 1 больного на
домашнем гемодиализе в первый год обходит-
ся в 28 000 фунтов стерлингов и в последую-
щие годы в 17 000, на госпитальном гемодиа-
лизе — 22 500 и 22 000, на перитонеальном
диализе — 23 500 и 21 000 соответственно. Опе-
рация пересадки почки стоит 25 000 фунтов
стерлингов, однако в последующие годы сто-
имость лечения снижается до 1500 [Ashley С.,
1998].
В большинстве стран число реабилитирован-
ных диализных больных превышает 80 %.
Весьма важен вопрос о сроках направления
больных на лечение гемодиализом. В государ-
ствах, в которых ликвидирован дефицит «диа-
лизных мест», а оборудование отличается вы-
соким качеством и безопасностью, предпочи-
тают не ждать развития таких угрожающих жиз-
ни симптомов уремии, как перикардит, гипер-
гидратация и т.д., а переводить больных на ге-
модиализ еще при сохранном диурезе, повыше-
нии содержания креатинина в сыворотке не бо-
лее 700—800 мкмоль/л, КФ не менее 10 мл/мин.
Согласно данным V.Bonomini (1985), у этих
больных не только меньше осложнений во вре-
мя лечения гемодиализом, но и лучше резуль-
619
таты трансплантации почки. Особенно важно
раннее направление на гемодиализ детей и
больных сахарным диабетом, склонных к гипер-
гидратации, инфекционным заболеваниям и т.д.
Но и будучи на гемодиализе, больные диабе-
том входят в группу повышенного риска из-за
свойственных им сосудистых осложнений.
Очень важно заранее планировать воз-
можность поступления больного на лечение ге-
модиализом. Подходит ли больной для гемо-
диализа или трансплантации почки, следует
решать при уровне креатинина в сыворотке до
600 мкмоль/л. В случае положительного реше-
ния и при повышении креатинина до 700—
800 мкмоль/л больному накладывают артерио-
венозную фистулу и при дальнейшем ухудше-
нии функции почек начинают гемодиализ. Со-
гласно данным M.Colombi (1974), при исполь-
зовании такого подхода и отбора больных вре-
мя начального пребывания больного в стацио-
наре снижается в несколько раз.
В настоящее время гемодиализы больным с
ТПН, как правило, проводят с использовани-
ем внутренней артериовенозной фистулы, име-
ющей ряд преимуществ по сравнению с наруж-
ным артериовенозным шунтом. Шунт устанав-
ливают при необходимости проведения экст-
ренного гемодиализа, например при быстром
нарастании симптомов уремии, развитии гипер-
гидратации и гиперкалиемии, поскольку для
формирования фистулы надо не менее 2—3 нед.
Нередко больным, требующим экстренного
гемодиализа, накладывают одновременно арте-
риовенозный шунт и фистулу и в дальнейшем
после стабилизации состояния больных и со-
зревания фистулы шунт снимают. Вместо вре-
менной установки артериовенозного шунта воз-
можны и другие методы соединения сосудис-
той системы больного с аппаратом искусствен-
ная почка (чрескожная пункция бедренной ар-
терии или вены с возращением крови в одну
из поверхностных вен, катетеризация для за-
бора крови подвздошной или нижней полой
вены, подключичной вены).
Наиболее часто фистулу накладывают в ниж-
ней трети предплечья «бок в бок» между
a.radialis и v.cephalica. Возможны и другие спо-
собы наложения анастомоза «конец в конец»,
конец артерии в бок вены, конец вены в бок
артерии. Если установить фистулу на лучевой
артерии невозможно, накладывают соустье
между a.ulnaris и v.basilica. В случае необходи-
мости фистула может быть наложена на пред-
плечье проксимальнее или в локтевой ямке.
Создание фистулы возможно и на сосудах ниж-
них конечностей. Если наложение фистулы на
поверхностные сосуды невозможно, артерию и
вену соединяют биологическим или небиоло-
гическим протезом.
620
Продолжительность периода ввода больных
в программу гемодиализа в зависимости от
исходного состояния занимает от нескольких
дней до нескольких недель. В это время гемо-
диализы проводят ежедневно или через день
(для предупреждения синдрома нарушенного
равновесия); их продолжительность ограничи-
вается 2—3 ч.
Первые гемодиализы осуществляют с ульт-
рафильтрацией, чтобы достичь «сухой массы»
больных, при которой дальнейшее уменьшение
объема внеклеточной жидкости приводит к
гипотензии. «Сухого веса», необходимого для
контроля гипертонии и выработки рекоменда-
ций по питьевому режиму, следует достигать
постепенно, так как избыточная ультрафильт-
рация способна активизировать ренин-ангио-
тензиновую систему и вместо снижения арте-
риального давления привести к его подъему. В
центрах, где соблюдается это условие, крайне
редко встречаются больные с синдромом зло-
качественной гипертонии. Во время первых ге-
модиализов рекомендуется систематически кон-
тролировать в крови содержание мочевины,
креатинина и основных электролитов.
По окончании адаптивного периода часто-
та гемодиализов и их продолжительность ме-
няются. Процедуры проводят 2—3 раза в неде-
лю; их продолжительность колеблется от 4 до
6 ч. Количество диализного времени в неделю
в зависимости от площади используемого ге-
модиализатора, вида мембран и т.д. составля-
ет 12—15 ч.
Существенным образом меняется диета боль-
ных. До начала лечения гемодиализом и во вре-
мя адаптивного периода больные получают
диету с низким содержанием белка (40 г/сут).
По мере улучшения состояния больных диету
расширяют, приближая по своему составу и ка-
лорийности к диете здоровых лиц. По современ-
ным представлениям, диета больных должна
содержать 1 — 1,3 г белка на 1 кг массы тела с
общей калорийностью не менее 2500 ккал. Из
общего количества белка 75 % должен состав-
лять протеин животного происхождения, в ко-
тором содержатся все незаменимые аминокис-
лоты. Только при соблюдении этого условия
восполняются происходящие во время гемоди-
ализа потери аминокислот через диализную
мембрану и поддерживается положительный
азотистый баланс.
Потребление калия не должно превышать
2500 мг/сут, натрия — 400—500 мг (1,4 г NaCl).
Особенно строго следует ограничивать поступ-
ление с пищей натрия у больных, страдающих
гипертонией. При олигоанурии суточное коли-
чество потребляемой жидкости ограничивают
до 600—800 мл. Благодаря этому прибавка мас-
сы тела в междиализный период не превышает
1,5—2 кг, что легко корригируется ультрафиль-
трацией во время гемодиализа.
С началом лечения гемодиализом потреб-
ность в приеме многих лекарств отпадает.
У больных исчезает сердечная недостаточность,
легче купируются инфекционные осложнения,
снижается артериальное давление.
При назначении больным, находящимся на
гемодиализе, различных препаратов нужно учи-
тывать не только время выведения этих лекарств
из организма, но и их способность проникать
во время гемодиализа через полупроницаемую
диализную мембрану. Наиболее полно удаляют-
ся во время гемодиализа препараты с неболь-
шой молекулярной массой, ограниченным
объемом распределения, минимальным аффи-
нитетом к тканям и не связывающиеся с бел-
ками плазмы. В норме такие вещества элими-
нируются из организма почками, попадая в
мочу главным образом посредством фильтрации
в клубочках.
Осложнения со стороны сердечно-сосудистой
системы, в первую очередь сердечная недоста-
точность, ишемия и инфаркт миокарда, пери-
кардиты, по своему влиянию на процесс и
исходы лечения хроническим гемодиализом
занимают особое место, являясь в конечном
итоге непосредственной причиной летальных
исходов у 30—50 % больных ТПН.
Гипертонию наблюдают у подавляющего
большинства больных с ТПН, находящихся на
лечении гемодиализом. В зависимости от влия-
ния лечения на величину АД гипертонию при-
нято делить на контролируемую, когда АД сни-
жается при ограниченном употреблении соли
и выведении натрия и избытка жидкости пу-
тем ультрафильтрации во время гемодиализа,
и неконтролируемую по существу злокачествен-
ного течения, когда эти мероприятия даже в
сочетании с интенсивной антигипертензивной
терапией не дают желаемого результата.
В основе повышения АД у больных с ТПН
с контролируемой гипертонией лежит задерж-
ка натрия и воды, что приводит к увеличению
объема циркулирующей плазмы и внеклеточной
жидкости, в то время как концентрация рени-
на в плазме обычно остается нормальной или
сниженной. У большинства больных с контро-
лируемой гипертонией сердечный выброс уве-
личен, а общее периферическое сопротивление
(ОПС) нормально или повышено незначитель-
но. У этих больных 2—3-разовый гемодиализ с
ультрафильтрацией 0,5—2 кг за процедуру и
ограничением жидкости и соли в междиализ-
ный период приводит в течение первых 2 мес
лечения к достижению «сухой массы тела» и
нормализации АД. Большинству из них уже не
нужны гипотензивные препараты. После каж-
дой процедуры АД снижается до нормальных
цифр и умеренно повышается параллельно уве-
личению массы тела в интервалах между гемо-
диализами. Таким образом, при этой форме
гипертонии не происходит активации ренин-
ангиотензиновой системы, и такую гипертонию
называют объем-зависимой обусловленной за-
держкой натрия и воды. У сравнительно неболь-
шой группы больных во время лечения гемо-
диализом, несмотря на ультрафильтрацию и
уменьшение массы тела, АД не снижается, а
дегидратация сопровождается слабостью, апа-
тией, анорексией, усиленной жаждой. Этим
больным свойственны транзиторные невроло-
гические расстройства и тяжелые изменения
глазного дна.
У больных с неконтролируемой гипертони-
ей содержание натрия в плазме, объем цирку-
лирующей крови и внеклеточной жидкости,
обменоспособный натрий и сердечный выброс
ниже, а ОПС выше, чем у больных с контро-
лируемой гипертонией. Содержание в плазме
ренина, ангиотензина II и альдостерона повы-
шено, причем концентрация ренина возраста-
ет еще больше во время гемодиализа по мере
уменьшения объема циркулирующей крови и
выведения натрия, что, возможно, связано с
непропорционально высоким выбросом рени-
на в ответ на незначительные изменения на-
триевого баланса. В отличие от зависящей от
соли и воды контролируемой гипертонии не-
контролируемая гипертония получила название
ренин-зависимой.
Различна и гемодинамическая характеристи-
ка контролируемой и неконтролируемой гипер-
тонии. При контролируемой гипертонии преоб-
ладает гиперкинетический синдром с высоким
сердечным выбросом и нормальным ОПС, а у
больных с неконтролируемой гипертонией по-
вышение АД обусловлено значительным увели-
чением ОПС. Важно, что выявленная законо-
мерность сохраняется и во время гипертоничес-
ких кризов. При контролируемой гипертонии
они происходят на фоне резкого возрастания
сердечного выброса, а при неконтролируемой
гипертонии — за счет повышения ОПС.
Гемодинамическое различие обусловливает
различную терапевтическую тактику: при кон-
тролируемой гипертонии рекомендуются геми-
тон, умеренные дозы блокаторов /2-адренерги-
ческих рецепторов, уменьшающие сердечный
выброс, обзидан и т.д., а у больных с неконт-
ролируемой гипертонией гипотензивный эф-
фект достигается введением препаратов, влия-
ющих на сосудистый тонус (антагонисты каль-
ция), а также ингибиторов АПФ и больших доз
бета-адреноблокаторов, угнетающих секрецию
ренина.
Например, сравнимый антигипертензивный
эффект оказывают блокаторы кальция мибеф-
621
радил и нифедипин, не ухудшающие функцию
почек у больных с предтерминальной ХПН
[Woittiez A. et al., 1998] и блокатор рецепторов
ангиотензина II лозартан [Toto Е. et al., 1998],
который, будучи связанным с белками плазмы,
практически не элиминируется во время гемо-
диализа [Sica D. et al., 1995].
Контроль гипертонии повышает выживае-
мость диализных больных.
У 20—25 % больных во время гемодиализа
развивается выраженная гипотония (падение
систолического АД > 30 мм рт.ст.), влияющая
не только на самочувствие, но и на кровоток
через гемодиализатор, определяя адекватность
лечения.
У большинства из этих пациентов вне гемо-
диализа АД нормально или повышено и толь-
ко у небольшой группы не превышает до про-
цедуры 100 мм рт.ст. У последних, как прави-
ло, находящихся на лечении в течение многих
лет или нередко перенесших бинефрэктомию,
даже умеренная ультрафильтрация с небольшим
снижением систолического АД вызывает чув-
ство дурноты, потемнение в глазах, тошноту,
рвоту и другие симптомы, сопровождающие
гипотонию.
Физиологический ответ на ультрафильтра-
цию, уменьшающую внутрисосудистый объем,
вызывает поступление в циркуляцию интерсти-
циальной жидкости для восполнения образую-
щегося дефицита, и только при несбалансиро-
ванном поступлении вступают в действие до-
полнительные механизмы компенсации, вклю-
чающие повышение симпатической активнос-
ти, активности РАС, ЧСС и сосудистого тону-
са, увеличение содержания катехоламинов в
плазме, венозного возврата вследствие перерас-
пределения артериального кровотока (снижение
кожной и спланхнической циркуляции — фе-
номен De Krogh — Jaeger) и, возможно, ак-
тивной веноконстрикции.
Гипотония развивается при недостаточном
восполнении, дисфункции симпатической не-
рвной системы, нарушении диастолической
функции левого желудочка и дисбалансе ве-
ществ, регулирующих сосудистый тонус.
Причинами недостаточного восполнения
чаще всего бывают высокая скорость ультра-
фильтрации, ошибки определения «сухого
веса», низкая осмоляльность плазмы при ис-
пользовании гипонатриевого диализирующего
раствора, снижение онкотического давления
при гипоальбуминемии, увеличение гидроста-
тического давления в капиллярах при сопутству-
ющей сердечной недостаточности.
Для коррекции гипотонии, развивающейся
по описанному механизму, рекомендуют умень-
шать скорость ультрафильтрации, применять
изолированную (отдельную от гемодиализа)
622
ультрафильтрацию, не влияющую на осмоляль-
ность плазмы, использовать диализирующий
раствор с высоким содержанием натрия (может
усиливать жажду и способствовать избыточно-
му увеличению массы тела в междиализный
период) и, наконец, проводить профилирован-
ную ультрафильтрацию, например, удалять 2/3
жидкости в первую половину гемодиализа или
профилировать натрий. Применяя последний
подход, L.Coli и соавт. (1998) смогли стабили-
зировать гемодинамику у 12 больных, склон-
ных к гипотензии во время стандартного гемо-
диализа.
Приблизительно у 70 % диализных больных
фиксируют гипертрофию левого желудочка
[Parfrey Р. et al., 1990]. Причинами последней,
помимо гипертензии, являются анемия, гипер-
паратиреоз, свойственное уремии уплотнение
сосудистой стенки, в частности недостаточная
растяжимость аорты. Дополнительными факто-
рами риска служат возраст, значительное уве-
личение массы тела в интервале между проце-
дурами гемодиализа, величина пульсового дав-
ления в ночное время [Washio М. et al., 1997;
Savage Т. et al., 1998]. У таких больных обычно
развивается концентрическая гипертрофия ле-
вого желудочка с повышением конечного диа-
столического давления. Систолическая функция
обычно не страдает и фракция выброса оста-
ется высокой. Нарушение диастолической функ-
ции само по себе не вызывает гипотонии, од-
нако препятствует адаптации к уменьшению
внутрисосудистого объема из-за невозможнос-
ти увеличения ударного и минутного объемов.
В результате развивается быстрое выраженное
падение АД, а компенсаторная тахикардия
вследствие укороченного периода наполнения
еще больше снижает ударный объем и веноз-
ный возврат. Сердце оказывается пустым, что
может рефлекторно (рефлекс Bezold — Jarisch)
вызвать парадоксальную брадикардию.
Восполнение внутрисосудистого объема
обеспечивает адекватное наполнение левого
желудочка и быстро стабилизирует гемодина-
мику. В этой ситуации важно не переусердство-
вать с введением растворов, поскольку это
может привести к отеку легких. Улучшение
диастолической функции наблюдают и на фоне
длительного применения ингибиторов АПФ.
Уремии свойственна дисфункция симпати-
ческой нервной системы, выявляемая уже на
ранних стадиях нарушения функции почек и
препятствующая компенсаторной тахикардии и
повышению сосудистого тонуса во время ульт-
рафильтрации у больных на гемодиализе.
В то же время увеличение содержания кате-
холаминов в плазме вследствие их недостаточ-
ной элиминации и базально высокий симпати-
ческий тонус приводят к уменьшению количе-
ства адренергических рецепторов в сердце и
сосудах и уменьшают их ответ к симпатическим
стимулам. У больных с таким нарушением по-
казано использование охлажденного диализи-
рующего раствора (температура 35 °C) и не ре-
комендуются действия, способствующие пере-
распределению крови, например прием пищи.
Y.Shibagaki и K.Takaichi (1998) установили, что
во время стандартного обеда объем крови в
больших сосудах уменьшался в среднем на 14 %
(максимально на 28,2 %) и это уменьшение
персистировало в среднем 43 мин. Скорость уль-
трафильтрации оставалась постоянной и до
приема пищи объем крови снижался на 3,24 %
в 1 ч.
У ряда больных стабилизирующее влияние
на гемодинамику оказывал мидодрин — аго-
нист а-адренорецепторов [Cruz D. et al., 1998].
При применении диализных мембран с не-
достаточной биосовместимостью активирован-
ные макрофаги могут продуцировать интерлей-
кин-1, индуцирующий высвобождение в цир-
куляцию простагландинов и вазодилатацию. В то
же время роль NO в эпизодах гипотонии оста-
ется недоказанной, хотя активность NO-синтаз
у диализных больных повышена, а в плазме
увеличено содержание оксида азота [Kang Е. et
al., 1992]. У бинефрэктомированных больных на
гемодиализе активность ренин-ангиотензиновой
системы снижена и это является основной при-
чиной гипотонии.
Поскольку результаты коррекции эпизодов
гипотензии нередко остаются неудовлетвори-
тельными, особое внимание следует уделять их
профилактике.
Еще в 1970 г. K.Kim и соавт. показали, что в
80 % эпизоды гипотонии развиваются при сни-
жении внутрисосудистого объема менее 50 мл/кг
массы тела.
В настоящее время разработаны методы мо-
ниторирования on line концентрации гемогло-
бина и значения гематокрита в экстракорпо-
ральном контуре, позволяющие предупреждать
пороговый дефицит объема крови. Применяя
этот подход, L.Mancini и соавт. (1995) сумели
значительно уменьшить число эпизодов гипо-
тонии у наблюдавшихся больных.
У 75 % больных на гемодиализе регистриру-
ют аритмию, чаще всего желудочковую экст-
расистолию. Помимо случаев, связанных с рез-
ким изменением концентрации калия в сыво-
ротке во время гемодиализа, высоким исход-
ным уровнем кальция и фосфора [Kimura К. et
al., 1989], гиперсекрецией паратгормона
[Ramirez G. et al., 1984], основной причиной
нарушения ритма является ишемическая бо-
лезнь сердца [Wizemann V. et al., 1985]. Не слу-
чайно аритмии обычно во время процедуры или
в ближайшие 4 ч после ее окончания развива-
ются преимущественно у больных пожилого
возраста [Cocchi A. et al., 1988], которые в на-
стоящее время преобладают среди больных,
находящихся на диализе.
Из 172 гемодиализных больных, наблюдав-
шихся K.Tamura и соавт. (1998), у 30 при 24-
часовом мониторировании с момента начала
процедуры выявлены прогностически тяжелые
формы желудочковой экстрасистолии (класс 4А
и 4В по Lown). Возраст больных с этими арит-
миями был значимо старше (62 против 55 лет),
чем у пациентов без аритмий, выше индекс
массы левого желудочка (167 против 140 г/м2),
снижена подвижность стенки левого желудоч-
ка. Мультивариантный регрессионный анализ
свидетельствовал о том, что основными детер-
минантами развития злокачественных аритмий
являются пожилой возраст, мужской пол и из-
менения индекса массы и подвижности стен-
ки левого желудочка, но не присутствие по-
здних потенциалов или симпатическая дисфунк-
ция. Интенсивность последней, считающейся,
по данным ряда авторов, предиктором аритмии
и даже внезапной смерти, уменьшается под
влиянием приема ненасыщенных жирных кис-
лот [Christensen J. et al., 1998].
Согласно R.Suzuki и соавт. (1998), к возник-
новению эпизодов аритмии также предраспо-
лагают снижение фракций выброса и удлине-
ние интервала QT, что нередко бывает при
диабете.
Нередко аритмии не возобновляются после
нормализации показателей кислотно-основно-
го и электролитного баланса, но в ряде случа-
ев принимают опасный характер, требующий
для восстановления нормального ритма кардио-
версии или установки искусственного водите-
ля ритма [Kohno Н. et al., 1991].
При назначении больным антиаритмических
препаратов следует помнить, что их фармако-
кинетика изменяется как под влиянием нару-
шения функции почек, так и самой процеду-
ры гемодиализа. Например, период полувыве-
дения дизопирамида, равный у здоровых 4—
8 ч, увеличивается у больных с терминальной
уремией в 5 раз. Клиренс препарата во время
процедуры гемодиализа колеблется от 33 до
43 мл/мин. Производное лидокаина токаинид на
60 % элиминируется из организма с желчью,
поэтому препарат, как и флекаинид, назнача-
ют при уремии в тех же дозах, что и при не-
нарушенной функции почек [Braun J. et al.,
1986]. Аритмии на фоне интрадиализного сни-
жения концентрации калия в сыворотке чаще
развиваются у больных, получающих сердечные
гликозиды и в связи с этим содержание калия
в диализирующем растворе не должно быть ме-
нее 3 ммоль/л [Dolson С., 1997]. Бикарбонат-
ный диализирующий раствор считается менее
623
аритмогенным, чем ацетатный [Fantuzzi S. et al.,
1991].
Эпизоды гипотонии во время гемодиализа
часто провоцируют фатальную аритмию. Пос-
ледняя, как считают, является основной при-
чиной внезапной смерти диализных больных.
Тяжелые аритмии, острый инфаркт миокар-
да, сердечная недостаточность, развивающая-
ся на фоне гипертрофии и нарушения систо-
лической и диастолической функции левого
желудочка, и сосудистые поражения ЦНС слу-
жат основными причинами смерти больных на
гемодиализе и перитонеальном диализе.
Риск развития этих осложнений, в том чис-
ле острого коронарного синдрома, усугубляет-
ся ускоренным формированием коронарного и
периферического атеросклероза. Риск сердечной
смерти у больных на гемодиализе в 5—20 раз
выше, чем в общей популяции, а частота рес-
теноза после чрескожной ангиопластики дос-
тигает 70 % по сравнению с 25—30 % в любых
других группах риска.
Как и в общей популяции, основными фак-
торами риска коронарного атеросклероза у ди-
ализных больных являются артериальная гипер-
тония, гипертрофия левого желудочка, липид-
ные нарушения, нетолерантность к глюкозе.
При гипертонии в первую очередь наруша-
ется функция эндотелия, в результате чего
вследствие дисбаланса местно продуцируемых
факторов повышается сосудистый тонус и про-
исходит пролиферация гладкомышечных кле-
ток, что наряду с откладыванием липидов в
стенку сосуда является ранней стадией форми-
рования атеросклеротической бляшки.
Нормальный эндотелий конституционно не
экспрессирует рецепторов для конечных про-
дуктов гликирования (КПГ), однако когда их
преимущественно почечная элиминация из
организма нарушена, КПГ-рецепторы экспрес-
сируются на эндотелии артериол и капилляров.
Взаимодействуя с этими рецепторами, КПГ ак-
тивируют NF-кв нуклеарный фактор, усилива-
ющий продукцию адгезивных молекул, и вы-
зывают прилипание к эндотелию моноцитов и
других клеток.
Гликированные липопротеиды после взаимо-
действия с эндотелиальными рецепторами под-
вергаются эндоцитозу, трансцитозу и в конеч-
ном итоге включаются в субэндотелиальный
матрикс, а модифицированный коллаген ста-
новится хемотоксичным для макрофагов, экс-
прессирующих КПГ-рецепторы, отличные от
scavenger-рецепторов, улавливающих ЛПНП.
Последние транспортируют эндогенные липи-
ды к периферическим тканям. В результате де-
фектного взаимодействия ЛПНП с рецептора-
ми возрастают количество ЛПНП в циркуля-
ции и их поглощение макрофагами. Следстви-
624
ем этих процессов является активация макро-
фагов с усиленной продукцией цитокинов и
факторов роста, формирование атерогенных
ЛПНП-иммунных комплексов, образование
пенистых клеток, накапливающих липиды.
Продуцируемый нормальным эндотелием
NO вызывает вазодилатацию, ингибирует про-
лиферацию гладкомышечных клеток, препят-
ствует агрегации тромбоцитов и токсичности
макрофагов и тем самым предупреждает разви-
тие атеросклероза.
NO синтезируется в стенке сосудов из L-
аргинина, а последний образуется в почке из
цитрулина с участием L-аргининсинтетазы. При
почечной недостаточности не только снижает-
ся продукция L-аргинина, но и в результате
накопления асимметричного диметил-L-арги-
нина (АДМА) ингибируется активность NO-
синтетазы. С дефицитом NO связывают у диа-
лизных больных повышение артериального дав-
ления в отсутствие заметного увеличения мас-
сы тела. Поэтому при уремии рекомендуется ди-
етическая нагрузка L-аргинином, а более адек-
ватный диализ увеличивает клиренс АДМА.
Нарушение липидного профиля наблюдают
уже на начальных стадиях ХПН.
Больным на заместительной терапии свой-
ственна гипертриглицеридемия, повышение
богатых триглицеридами ЛПОНП и ЛПП, а
также апо-В. Повышение апо-С-Ш выражено
умеренно, но этого достаточно, чтобы подавить
активность липопротеидной липазы.
Гипертриглицеридемия обусловлена сниже-
нием активности не только липопротеидной
липазы, но и печеночной триглицеридлипазы,
а резистентность к инсулину, наблюдаемая при
уремии, увеличивает продукцию триглицеридов
в печени. В большей степени она усилена у боль-
ных на перитонеальном диализе. Концентра-
ция ЛПВП обычно снижена и, хотя выражен-
ная гиперхолестеринемия встречается редко,
дислипидемия, наблюдаемая у диализных боль-
ных, имеет ярко выраженный атерогенный ха-
рактер.
Усугубляют положение высокий уровень в
плазме больных липопротеида (a) [Lp(a)], яв-
ляющегося независимым фактором риска не
только коронарного, но и цереброваскулярно-
го атерогенеза.
Lp(a), состоящий из ЛПНП и апо-а, в вы-
сокой степени гомологичного плазминогену,
синтезируется в печени, а деградация его про-
исходит в почках. Уровень Lp(a) в сыворотке
повышен у больных с нефротическим синдро-
мом при нормальной функции почек и еще
более увеличивается при падении клубочковой
фильтрации менее 70 мл/мин. У больных с не-
фропатиями Lp(a), особенно его окисленные
формы, активируют продукцию свободных ра-
алов кислорода и тем самым способствуют
грессированию ХПН.
Трепараты, уменьшающие протеинурию
)тикостероиды, ингибиторы АПФ, нестеро-
ые противовоспалительные препараты),
еобны снизить содержание Lp(a) в плазме
ьных без нарушения функции почек, а при
шнальной уремии его уровень удается по-
ить только ЛПНП-аферезом.
Структурно Lp(a) связан с апо-В и апо-А,
объясняется его атерогенный эффект, а
ология с плазминогеном придает Lp(a)
^фибринолитическую активность.
Слючевым моментом в развитии атероскле-
1 является окисление лпнп, позволяющее
взаимодействовать с соответствующими ре-
горами сосудистых макрофагов, что в ко-
ном итоге приводит к образованию пенис-
клеток в стенке сосудов.
Сак уже упоминалось, пенистые клетки (ос-
а атеросклеротических бляшек) представля-
собой макрофаги, аккумулирующие холес-
гн, привнесенный ЛПНП. Окисленные
НП имеют более выраженный аффинитет к
рофагам. Гемодиализ предрасполагает к
слительному стрессу, что подтверждается
оким титром антител к окисленным ЛПНП.
шове окислительного стресса лежат процес-
бионесовместимости с секвестрацией лей-
итов в легочной ткани с высвобождением
иаторов воспаления и свободных радикалов
порода, присутствием в крови КПГ и сни-
ием резервов антиоксидантной защиты.
Тараоксоназа (анилдиалкилфосфатаза) и
гилгидролаза фактора, активирующего тром-
иты, присутствующие в сыворотке, способ-
предупреждать или уменьшать окисление
НП. Как показали исследования De McMus-
и соавт. (1998), активность этих ферментов
яворотке больных снижена, что также, по-
имому, способствует прогрессированию ате-
клероза.
1овышение концентрации гомоцистеина в
зме предопределяет ускоренный атероскле-
и ишемические осложнения не только у
ьных с нарушенной функцией почек, но и
эпуляции здоровых мужчин среднего возра-
[Perry I. et al., 1995] и у других категорий
иентов с наследственными или приобретен-
ии нарушениями метаболизма метионина,
гример, к гипергомоцистинемии склонны
ипиенты почечного трансплантата, получа-
ие циклоспорин, влияющий на процесс
«метилирования метионина [Dicloux D. et al.,
8]. У больных с гипергомоцистинемией в
ви обычно снижено содержание фолиевой
лоты и витаминов группы В. Большие дозы
шевой кислоты (10—15 мг/сут) и поливита-
гы рекомендуются диализным больным для
предупреждения и коррекции гипергомоцисти-
немии. Впрочем, прием фолиевой кислоты
(> 400 мкг/сут) с такими же целями не повре-
дит не только больным, но медперсоналу диа-
лизных отделений и другим категориям населе-
ния [Omenn G. et al., 1998].
У 40 % больных, начинающих лечение диа-
лизом, имеются клинические признаки ИБС и
еще у 40 % в додиализный период выявляют
сердечную недостаточность. В целом у 80 %
больных с ТПН, начинающих заместительную
терапию, обнаруживают нарушения структуры
или функции сердца. Среди пациентов, нахо-
дящихся на гемодиализе, у 70 % наблюдают
гипертрофию левого желудочка, у 28 % — его
дилатацию с сохранной систолической функ-
цией и у 16 % — ее нарушение. Только у 16 %
больных размеры сердца, его морфология и
контрактильная функция были нормальными.
Не удивительно, что состояние сердечно-сосу-
дистой системы определяет прогноз у 50 %
больных.
По данным А.В.Смирнова и В.В.Козлова
(1998), среди 76 больных на гемодиализе со сро-
ками лечения более 4 лет проявления атеро-
склероза обнаружены у 67 %, причем у поло-
вины — в первый год лечения. Основным фак-
тором риска его развития являлся возраст боль-
ных старше 40 лет, в то время как величина
артериального давления, нозология первично-
го поражения почек и другие факторы имели
меньшее значение.
Главной причиной смерти диализных боль-
ных считается сердечная недостаточность в ос-
новном ишемического генеза, однако у 20—
30 % ИБС протекает бессимптомно, у 20—
30 % симптомы возникают на фоне неизменен-
ных коронарных сосудов. Так, P.Conbon и со-
авт. (1998) у 23 % из 70 наблюдавшихся боль-
ных на гемодиализе зафиксировали депрессию
сегмента ST, не ассоциированную с ИБС. Эти
транзиторные изменения ЭКГ не влияли на
2-летнюю выживаемость больных и в последу-
ющем на частоту нефатального инфаркта мио-
карда, а риск операций на открытом сердце,
например аортокоронарного шунтирования у
больных на диализе, сопоставим с таковым в
общей популяции [Bhattacharya et al., 1997].
У реципиентов трансплантата почки острый
инфаркт миокарда и другие сердечно-сосудис-
тые осложнения в первый год после операции
встречаются реже.
Перикардит, впервые описанный при уре-
мии в 1836 г. R.Bright, характеризуется как асеп-
тический воспалительный процесс со скудным
серозно-фибринозным экссудатом и выпадени-
ем фибрина на листках перикарда.
Развитие перикардита при уремии до недав-
него времени считали неблагоприятным про-
-2950
625
гностическим признаком, продолжительность
жизни большинства больных после появления
симптомов воспаления сердечной сорочки не
превышала 2—16 дней. Использование для ле-
чения больных с ТПН программного гемодиа-
лиза не только изменило прогностическое зна-
чение перикардита, но и в значительной сте-
пени повлияло на морфологию процесса, обус-
ловив появление таких форм, как подострый и
хронический констриктивный перикардит, а
также тампонады сердца, которая исключитель-
но редко встречается при естественном течении
уремии.
Во время лечения гемодиализом перикардит
развивается примерно у 14 % больных. Его воз-
никновение часто связано с каким-либо стрес-
сом — оперативным вмешательством, инфек-
цией, неадекватным гемодиализом. Иногда пе-
рикардит представляет собой проявление основ-
ного заболевания — СКВ, инфаркта миокарда
и т.п.
P.Joffe и A.Johannessen (1987) описали мини-
эпидемию перикардита в центре гемодиализа,
во время которой в течение 6 нед среди 102
больных у 5 зарегистрировано это осложнение.
У 2 больных перед развитием перикардита от-
мечали симптомы респираторного вирусного за-
болевания. У одного из больных в крови был
повышен титр антител против респираторного
синцитиального вируса.
Весной 1995 г. мы наблюдали в течение 1,5
мес 3 случая перикардита, из которых 1 закон-
чился тампонадой сердца, однако титр антител
против вируса гриппа, парагриппа, Коксаки А
и В, кори и оспы у пациентов с перикарди-
том и без него был одинаковым. Позднее мы
наблюдали несколько случаев перикардита у
больных острым вирусным гепатитом В тяже-
лого течения.
Несомненно, острый вирусный гепатит, как
и другие инфекционные осложнения, способен
усиливать катаболизм и индуцировать перикар-
дит, однако в ряде случаев следует иметь в виду
и другую возможность поражения сердца. Еще
в 1983 г. Z.Twazdowski и соавт. установили, что
в сыворотке больных с уремией с перикарди-
том, плевритом и другими серозитами присут-
ствуют в высоком титре иммунные комплексы,
а В.Dawe и соавт. (1983) показали, что в со-
став комплексов, обнаруживаемых в перикар-
де больных с HBs-антигенемией, входит HBs-
антиген.
Клинически перикардит проявляется давящи-
ми болями за грудиной, иррадиирующими в
спину, плечевые и локтевые суставы, позвоноч-
ник и усиливающимися при глубоком дыхании
и движении. В ряде случаев интенсивность болей
настолько велика, что требует применения нар-
котиков. У большинства больных наблюдается
626
лихорадка, которая, как и боли, предшествует
появлению шума трения перикарда. По сравне-
нию с уремическим перикардитом, быстро раз-
решающийся уже в начале гемодиализа, «диа-
лизный» перикардит, развивающийся на фоне
лечения гемодиализом, склонен к затяжному
течению, выраженному болевому синдрому,
обладает способностью вызывать или усиливать
сердечную недостаточность, приводит к наруше-
нию ритма сердца. Самыми серьезными ослож-
нениями диализного перикардита являются вы-
пот в полость перикарда и тампонада сердца.
Накопление жидкости в полости перикарда
сопровождается исчезновением верхушечного
толчка, глухостью сердечных тонов, снижени-
ем АД, острой правожелудочковой недостаточ-
ностью, непрослушиваемостью шума трения
перикарда. Рентгенологическими признаками
выпота в полость перикарда служат увеличение
поперечника сердца, исчезновение пульсации
его контура, расширение верхней полой вены.
На ЭКГ снижение вольтажа и зубца Т в стан-
дартных и грудных отведениях и переход его в
отрицательный или двухфазный, на ФКГ ис-
чезают характерные для шума трения перикар-
да, не связанные с определенными циклами
сердечной деятельности осцилляции.
Причиной геморрагического выпота в пери-
кард считают нарушение процессов свертывае-
мости крови, свойственное уремии, экссудацию
геморрагической жидкости через измененную в
процессе воспаления сосудистую мембрану,
однако большинство авторов связывают разви-
тие геморрагического выпота и тампонады с
гепаринизацией, а также с действием часто
назначаемых больным для предупреждения
тромбоза шунта антикоагулянтов непрямого
действия. Наши данные также подтверждают
роль гепаринизации в развитии тампонады.
Последняя, как правило, возникала в ближай-
шие часы после гемодиализа.
Поскольку перикардит чаще всего является
осложнением уремии, всех больных перикарди-
том переводят на интенсивный гемодиализ с
увеличением диализного времени до 15—20 ч
в неделю. Если он развивается на фоне повтор-
ного тромбоза или инфекции артериовенозно-
го шунта, прибегают к перестановке последнего.
При других инфекционных осложнениях, как
и при «шунтитах», и на время нахождения ка-
тетера в полости перикарда назначают массив-
ную антибиотикотерапию. Для предупреждения
выпота в перикард гемодиализы проводят с
дозированной или регионарной гепаринизаци-
ей, спустя 4—6 ч после окончания гемодиали-
за при низкой свертываемости крови вводят
1 % раствор протамина сульфата.
Возникающие во время перикардита ослож-
нения лечат по общим принципам: при сердеч-
ной недостаточности назначают сердечные гли-
козиды, при аритмиях — индерал, обзидан,
панангин (если нет гиперкалиемии); 1 больно-
му с непрекращавшимся в течение 3 дней тре-
петанием предсердий мы вынуждены были
провести дефибрилляцию.
Как показали контролируемые исследования
D.Spector и соавт. (1983), индометацин, назна-
чаемый больным перикардитом, быстро при-
водит к исчезновению лихорадки, но не влия-
ет на выраженность болевого синдрома, дли-
тельность шума трения перикарда и частоту
развития выпота.
В связи с этим, если нет противопоказаний,
больным перикардитом назначают преднизолон
(0,5—1 мг/кг) на 10—14 дней, что приводит к
быстрому снижению температуры тела, умень-
шению болей и предупреждает развитие выпо-
та в полости перикарда. Выпот в полость пери-
карда может рассосаться, приводить к подо-
строму или хроническому констриктивному пе-
рикардиту и тампонаде сердца, при которой
спасающей жизнь процедурой является экстрен-
ная пункция перикарда.
Удаление жидкости из полости перикарда
способствует улучшению состояния у большин-
ства больных уже во время самой процедуры:
повышается АД, исчезает заторможенность,
пульс становится полным, менее частым. Че-
рез несколько дней вновь начинает прослуши-
ваться шум трения перикарда. Рентгенологичес-
ки уменьшение поперечника сердца происхо-
дит медленнее, иногда в течение нескольких
недель. Поскольку накопление жидкости в по-
лости перикарда может рецидивировать, через
пункционную иглу на 5—12 сут вводят мягкий
катетер, чтобы избежать повторных пункций
перикарда. Показанием для эвакуации экссуда-
та через катетер служат снижение АД, учаще-
ние пульса, набухание печени. Распознать на-
копление экссудата в полости перикарда и ус-
тановить его количество позволяет эхография,
с помощью которой можно обнаружить даже
небольшое (до 100 мл) количество жидкости.
После дренирования через катетер в полость
перикарда вводят неабсорбируемые стероиды,
чаще всего триамцинолон, которые предупреж-
дают накопление экссудата. Излечивание выпот-
ного перикардита дренированием полости пе-
рикарда и локальным введением стероидов
позволяет избежать достаточно травматичной
фенестрации перикарда или перикардэктомии.
Последняя показана главным образом при раз-
витии констриктивного перикардита. В то же
время Е.Rutsky и S.Rostand (1987) считают, что
перикардотомия под визуальным контролем
дает меньше осложнений, чем пункция пери-
карда при рецидивирующем выпотном перикар-
дите.
Осложнения при сосудистом доступе. У боль-
шинства больных, находящихся на гемодиали-
зе, постоянный доступ к сосудистой системе
осуществляется с помощью естественной ар-
териовенозной фистулы, формируемой на пред-
плечье анастомозированием бок в бок или ко-
нец в бок a.radialis и v.cephalica, на плече —
a.brachialis и v.cephalica выше локтя и реже,
a.brachialis и v.basilica. Полное созревание натив-
ной фистулы происходит в течение 3—6 мес и
ее нужно накладывать больным, отобранным на
гемодиализ, не позднее чем за полгода до на-
чала систематического лечения.
Синтетический сосудистый протез (graft) из
политетрафлурэтилена (ПТФЭ), который в
США применяют у 70 % больных, поступаю-
щих на гемодиализ, может быть использован
уже через 3—4 нед после установки. Данный
протез позволяет соединять сосуды в различных
частях тела.
При необходимости проведения экстренно-
го гемодиализа сосудистый доступ обеспечива-
ется установкой артериовенозного шунта или
катетера в яремную вену.
На осложнения, ассоциированные с артерио-
венозной фистулой, приходится 25 % всех дней
госпитализации и 50 % стоимости пребывания
больных в стационаре. Расходы на лечение этих
осложнений достигают 17 % от общей стоимо-
сти пребывания больных на гемодиализе.
Прекращение функционирования артериове-
нозной фистулы в 80 % обусловлено ее необра-
тимым тромбозом и в 15—20 % — инфициро-
ванием и другими причинами. Первичная (до
первого вмешательства) и кумулятивная (сро-
ки функционирования вне зависимости от чис-
ла вмешательств) выживаемость нативной фи-
стулы в 3—6 раз выше, чем ПТФЭ-протеза, что
лишний раз подчеркивает необходимость свое-
временного направления больных на лечение
гемодиализом.
У подавляющего большинства больных (бо-
лее 80 %) тромбоз нативной фистулы и про-
теза обусловлен стенозом вены, локализован-
ным на расстоянии 3—4 см от конца анасто-
моза и развивающимся вследствие эндотелиаль-
ной и фибромускулярной гиперплазии. Причи-
нами фибромускулярной гиперплазии являют-
ся турбулентный ток крови и растяжение со-
суда. Дополнительным фактором служит воздей-
ствие на стенку сосуда фактора роста тромбо-
цитов, высвобождаемого после каждой пункции
вены.
Артериальный стеноз является причиной
тромбоза только у 2 % больных. После 3 лет «экс-
плуатации» 40 % нативных фистул остаются
потентными. Срок их функционирования может
быть увеличен устранением ранних проявлений
стеноза, назначением дипиридамола, ингиби-
40
627
рующего продукцию цитокинов тромбоцитами,
рентгеновским облучением венозного конца
анастомоза для устранения турбулентности кро-
вотока.
Гемодинамически значимый стеноз (50—
70 %) можно устранить транслюминальной ан-
гиопластикой, которую в большинстве случаев
приходится повторять через 6 мес. При «элас-
тичном» стенозе, рецидивирующем немедлен-
но после ангиопластики, уместна установка в
сосуд стента. При стенозе, превышающем 90 %,
показана хирургическая коррекция проходимо-
сти сосуда (6—12 мес выживаемость фистулы
в 60—70 %), в то время как только 40 % фис-
тул продолжают без хирургического вмешатель-
ства функционировать через 3 мес у больных с
такой выраженностью стеноза.
Тромбозу артериального шунта способству-
ют механические факторы (перегрузка шунти-
рованной конечности, случайное пережатие во
время сна и т.д.), общие расстройства крово-
обращения (выпотной перикардит с повыше-
нием венозного давления), гипотония в резуль-
тате чрезмерной ультрафильтрации или на фоне
лихорадки. Среди местных причин выделяют
уменьшение кровотока вследствие атеросклеро-
тической бляшки, холодового спазма, повреж-
дение интимы, отсутствие соосности сосуда и
канюли, тромбоз глубоких вен и т.д.
Местные ишемические расстройства, край-
не редкие при использовании шунта, значи-
тельно чаще наблюдают у больных с артерио-
венозной фистулой. В основе ишемических на-
рушений лежат изменения местной гемодина-
мики, вызванные сбросом крови через сосуди-
стый анастомоз из магистральной артерии в
венозную систему, что приводит к нарушению
снабжения периферических тканей артериаль-
ной кровью. При нарушении венозного оттока
на конечности описано поражение кожи по
типу псевдосаркомы Капоши [Bogaert F. et al.,
19871. Среди других осложнений, обусловленных
использованием фистулы, следует выделить об-
разование гематомы и аневризмы. Первые воз-
никают в области пункционных отверстий глав-
ной вены и легко инфицируются. Их вскрыва-
ют обычно через боковой разрез, параллельный
венам. Вторые образуются вследствие инфекци-
онного повреждения стенки сосуда и являются
местом тромбообразования и разрыва и подле-
жат ушиванию.
В связи с тем что при инфицировании ге-
матом нагноение развивается в непосредствен-
ной близости от травмированного сосуда, а
зачастую и в его стенке, патогенный агент (в
большинстве случаев золотистый стафилококк)
попадает в кровеносное русло и вызывает сеп-
тицемию. Иногда инфекция в области фистулы
приводит к развитию хронического воспаления
628
в сосудистой стенке с эндотелиальными разра-
станиями в просвете сосуда, напоминающими
поражения клапанов при септическом эндокар-
дите. В эндотелии обычно находят возбудителя.
Лечение проводят большими дозами антибио-
тиков, пораженный участок вены иссекают или
закрывают анастомоз.
Наиболее грозным осложнением при ис-
пользовании как шунта, так и фистулы явля-
ется шунтовый сепсис, клинические проявле-
ния которого обусловлены однократным или
постоянным проникновением инфекции в кро-
воток. Инфекцией могут поражаться любые
органы, но чаще она локализуется в легких и
сердце. Характерна метастатическая пневмония,
очаговая или инфильтративная, с образовани-
ем одного или нескольких абсцессов. Септичес-
кое поражение эндо-, мио- и перикарда рас-
познается на основании появления грубых шу-
мов, ослабления сократительной способности
миокарда, нарастающей сердечной недостаточ-
ности, развития недостаточности трехстворча-
того, реже аортального и митрального клапа-
нов с поражением одной или нескольких ство-
рок.
Гемокультура в тех случаях, когда ее удает-
ся выделить, как правило, бывает идентичной
микрофлоре нагноившегося шунта гематомы.
Генерализованная инфекция — самое частое
осложнение, развивающееся при использовании
для доступа к кровотоку центрального катете-
ра. Результаты исследования I.Dittmer и соавт.
(1999) свидетельствуют о том, что 68 % кате-
теров колонизируется микрофлорой в среднем
в течение 27 дней после их установления и у
35 % больных вследствие этого развивается бак-
териемия. Вероятность последней достигает
100 % в случае, если в 1 мл аспирированной
из катетера крови число микробных колоний
превысит 3000.
При генерализации инфекции максимальные
дозы антибиотиков назначают с учетом их по-
бочного действия, кумуляции, способности
диализироваться через мембрану, чувствитель-
ности микрофлоры. Хирургическое пособие —
вскрытие абсцесса, флегмоны, иссечение
вены — должно быть своевременным незави-
симо от начавшейся антибактериальной тера-
пии. Если наступает деструкция сердечных кла-
панов и развивается сердечная недостаточность,
прибегают к протезированию клапанов. Описа-
ны больные, регулярно получающие гемодиа-
лиз, перенесшие несколько операций протези-
рования сердечных клапанов.
Данные об элиминации ряда противоинфек-
ционных препаратов во время стандартного
гемодиализа и за сутки у больных на постоян-
ном амбулаторном перитонеальном диализе
(ПАПД) приведены в табл. 39.1.
Таблица 39.1. Диализуемость препаратов (в % к
введенной дозе)
Препараты Гэмодиализ ПАПД
Аминогликозиды 50 20—25
Карбапенемы: • имипенем 80—90 Незначительная
Цефалоспорины: • цефакмер 33
• цефоперазон Незначительная Незначительная
• цефотаксим 60 »
• цефтазидим 50 16
• цефалексин 50 Незначительная
Макролиды: • клиндамицин Незначительная Незначительная
• линкомицин » »
Пенициллины: • амоксициллин 30 —
• ампициллин 40 —
• карбенициллин 50 —
• клоксациллин Незначительная —
• диклоксациллин » —
• метициллин » —
• пиперациллин 30—50 6
• тикарциллин 50 Незначительная
Хинолоны: • ципрофлоксацин Незначительная Незначительная
• эноксацин » »
• ломефлоксацин » —
• офлоксацин 15—25 4—6
• норфлоксацин Незначительная —
• темафлоксацин 9,4 —
Сульфонамиды: • сульфаметоксазол 50 8
• триметоприм 50 7
Тетрациклины: • доксициклин Незначительная Незначительная
• миноциклин » »
• ванкомицин » 15—20
• тейкопланин » 5
Противогрибковые: • амфотерицин В Незначительная
• флуконазол 40 18
Антималярийные: • хлорохин Незначительная —
• хинин » —
Антипаразитарные: • метронидазол 45 Незначительная
• тинидазол 40
Противотуберкулез- ные: • этамбутол 35—50
• изониазид 75 —
• ПАСК 50 —
Противовирусные: • ацикловир 60 < 10
• амантадин Незначительная —
• ганцикловир » —
• рибавирин 8 —
• видарабин 50 —
• цизовудин Незначительная Незначительная
Очевидно, что препараты, в значительной
степени элиминируемые во время гемодиали-
за, следует вводить по окончании процедуры.
У 0,1—1 % больных с фистулой развивается
гиперкинетическая сердечная недостаточность.
При создании фистулы в результате сброса
крови из артериальной системы уменьшается
общее периферическое сопротивление, компен-
саторно увеличивается минутный объем и та-
ким образом среднединамическое давление со-
храняется на прежнем уровне. Увеличение ми-
нутного объема происходит за счет резервов
миокарда. Однако у больных уремией они ог-
раничены, и по истечении периода компенса-
ции возникает сердечная недостаточность.
Для предупреждения неблагоприятного воз-
действия фистулы на гемодинамику рекомен-
дуют создавать анастомоз «конец в конец» или
«конец артерии в бок вены» размером не бо-
лее 3 мм, что обеспечивает достаточный для
адекватного гемодиализа кровоток, но не вли-
яет на гемодинамику. Развитие сердечной не-
достаточности — показание к закрытию или
уменьшению диаметра анастомоза.
Нарушение общей гемодинамики наблюда-
ют при установке фистулы на крупных сосудах
и практически исключено при ее создании на
предплечье.
У больных, длительно находящихся на ге-
модиализе, у которых нет места для сосудис-
того доступа на конечностях или для времен-
ного сосудистого доступа, прибегают к установ-
ке катетера в подключичной вене. Нередко этот
доступ используют в течение нескольких меся-
цев. Следует иметь в виду, что нахождение ка-
тетера в подключичной вене обязательно сле-
дует контролировать рентгенологически, по-
скольку описано проникновение катетера в
верхнюю полую и югулярную вены, в полость
миокарда с развитием острой и хронической
тампонады, гидро- и гемоторакса, эмболии
легких, ранением грудного лимфатического
протока. Возможно также возникновение ин-
фекции и тромбирования катетера, причем в
ряде случаев причиной тромбоза служил свер-
нувшийся в узел эластичный проводник.
С учетом перечисленных осложнений A.Firek
и соавт. (1987) рекомендуют использовать бед-
ренную вену для временного сосудистого дос-
тупа даже у амбулаторных больных.
Больным, у которых сосудистый доступ в
течение длительного времени осуществляется с
помощью катетера, грозит его инфицирование
с последующей генерализацией инфекции.
Оригинальное решение проблемы сосудис-
того доступа предложили G.Bellinghieri и соавт.
(1998). У 2 больных диабетом, длительно нахо-
дившихся на гемодиализе, у которых отсутство-
вали места для наложения артериовенозной
629
фистулы, они создали 2 подкожных резервуа-
ра емкостью по 0,8 см3, расположенных в пе-
реднебоковых отделах туловища. В каждый ре-
зервуар, закрытый силиконовой крышкой,
выдерживающей более 400 пункций (4 года ра-
боты), кровь поступает через индивидуальный
катетер, проведенный в правое предсердие.
Пункцию резервуаров осуществляют чрескож-
но специальной фистульной иглой, скорость
кровотока через которую достигает 250 мл/мин.
За 2 года работы не отмечено ни одного слу-
чая тромбоза или инфицирования резервуаров.
Они не оказывали отрицательного влияния на
гемодинамику.
При современном в известном смысле ме-
ханистическом подходе к диализному лечению
в условиях жесткого мониторирования Kt/V
уремическую полинейропатию редко на-
блюдают у больных в центрах замещающей те-
рапии, а поражение периферической нервной
системы является чаще осложнением основно-
го заболевания — диабета, алкоголизма и т.д.
Вместе с тем патогенез уремической полиней-
ропатии, впервые описанный в XIX в. Charcot,
далек от окончательного выяснения.
Клинически уремическая полинейропатия не
отличима от полинейропатии неуремического
происхождения и характеризуется симметрич-
ным поражением в первую очередь дистальных
отделов нижних конечностей.
Наряду с чувствительными расстройствами
(онемение, болезненные парестезии и т.д.) для
ранних стадий уремической полинейропатии
характерен синдром беспокойных ног (restless
legs), известный еще в XVII в., но наблюдае-
мый и при других формах поражения перифе-
рической нервной системы. Первым объектив-
ным признаком полинейропатии является на-
рушение вибрационной чувствительности. По-
зднее присоединяются двигательные расстрой-
ства, утрачиваются сухожильные, в первую оче-
редь ахилловы рефлексы, в далеко зашедших
случаях развивается атрофия мышц. При элек-
трофизиологическом исследовании находят за-
медление нервной проводимости на верхних и
нижних конечностях по моторным и чувстви-
тельным фибриллам, увеличение латентного
периода и снижение амплитуды вызываемого
потенциала.
Снижение скорости проведения возбуждения
по нервам обратно коррелирует с клиренсом
креатинина и часто предшествует клиническим
проявлениям нейропатии.
Морфологическим субстратом полинейропа-
тии служат локальная дегенерация, сегментар-
ная демиелинизация, уменьшение диаметра
аксонов. Согласно P.Dyck и соавт. (1971), пос-
леднее является следствием нарушенного при
уремии метаболизма, а изменения миелиновой
630
оболочки развиваются вторично. В то же время
O.Appenzeller и соавт. (1971), обнаружившие в
периферических нервах больных уремией умень-
шение содержания стеариновой кислоты и по-
вышение холестерина, считают, что первично
развивается процесс демиелинизации.
Как упоминалось, патогенез уремической
полинейропатии окончательно не выяснен. Пер-
воначально на основании сходства морфологи-
ческой картины уремической полинейропатии
и поражения периферической нервной систе-
мы при недостаточности витаминов группы В
предполагали, что лечение гемодиализом, во
время которого закономерно происходит поте-
ря водорастворимых витаминов, способствует
возникновению или прогрессированию уреми-
ческой полинейропатии. Однако в последующем
это предположение не подтвердилось, так как
были продемонстрированы идентичность кли-
нических и гистологических проявлений поли-
нейропатии у больных уремией, находящихся
на хроническом гемодиализе, и пациентов,
получавших консервативную терапию, а также
обратное развитие симптомов поражения пери-
ферической нервной системы под влиянием
адекватного и интенсивного гемодиализа. Вме-
сте с тем настойчивое применение водораство-
римых витаминов у больных, находящихся на
хроническом гемодиализе, практически не вли-
яло на течение полинейропатии.
S.Giovannetti и соавт. (1970) зафиксировали
в эксперименте поражение нервной системы
наряду с другими симптомами уремии, вводя
собакам метилгуанидин — азотистый метабо-
лит, концентрация которого в крови больных
уремией повышена. R.Sterzel и соавт. (1971) по-
казали, что в сыворотке крови больных уремией
содержится фактор, ингибирующий активность
транскетолаз нервной ткани, влияющих на
метаболизм миелина, причем скорость выведе-
ния этого ингибитора из сыворотки во время
гемодиализа ниже, чем скорость элиминации
продуктов азотистого обмена.
Доказанным нейротоксическим действием
обладает миоинозитол — соединение, входящее
в состав фосфолипидов. В эксперименте введе-
ние крысам миоинозитола вызывало у живот-
ных снижение скорости проведения возбужде-
ния по нерву. Согласно данным Sh.Melmed и
соавт. (1977), у здоровых концентрация миоино-
зитола в сыворотке крови равняется в среднем
5,6 мкг/мл, а у больных с ХПН с клиренсом
эндогенного креатинина от 38 до 3,8 мл/мин —
28,6 мкг/мл. Во время гемодиализа концентра-
ция миоинозитола снижается в среднем на 48 %,
однако в междиализный период его содер-
жание в крови повышается быстрее, чем мо-
чевины и креатинина, и только после успеш-
ной трансплантации почки становится нормаль-
ной. При уремии концентрация миоинозитола
повышена также в цереброспинальной жидко-
сти.
В сыворотке больных уремией присутствует
ингибитор транскетолаз — ферментов, участву-
ющих в поддержании и сохранении миелино-
вых цилиндров. Во время гемодиализа концен-
трация ингибиторов снижается и с этим обсто-
ятельством связывают благоприятное влияние
адекватного диализа на течение полинейропа-
тии. Равным образом в биологических жидко-
стях у больных с уремией обнаружен ингиби-
тор Na-К-АТФазы, препятствующий элимина-
ции натрия из клеток и снижающий трансмем-
бранный потенциал покоя, в результате чего
замедляются деполяризация и проведение им-
пульса. Впрочем, в последнее время патогене-
тическое значение ингибиторов, как и «сред-
них молекул», в патогенезе поражения перифе-
рических нервов при уремии подвергается со-
мнению [Pietrzak I. et al., 1996], но бесспорно,
что только совокупная элиминация различных
задерживающих при уремии в крови больных
субстанций способна предупреждать и облегчать
ее течение [Teschan Р. et al., 1983]. Так, M.Sobh
и соавт. (1998) добились улучшения нейромы-
шечной функции у 22 больных на гемодиали-
зе, увеличив KT/V до 1,3—1,6 и повысив по-
требление белка и калорий. Некоторый эффект
при уремической полинейропатии оказывают
биотин, гаптомиозид и проведение гемосорб-
ции. Синдром беспокойных ног как при уреми-
ческой, так и неуремической полинейропатии
уступает клонидину, L-дофа, психотропным
препаратам. Кардинальным решением пробле-
мы является своевременная трансплантация
почки, причем улучшение нервной проводимо-
сти наступает еще до восстановления выдели-
тельной функции трансплантата вследствие
способности последнего метаболизировать ток-
сические субстанции.
Заметно реже периферическая полинейропа-
тия развивается у больных на перитонеальном
диализе.
Поражение симпатической нервной систе-
мы, обычно развивающееся одновременно с
периферической полинейропатией, проявляется
снижением активности барорецепторов, отсут-
ствием брадикардии во время пробы Вальсаль-
вы, гипотензией во время гемодиализа вне из-
быточной ультрафильтрации и т.д. В большей
степени к симпатической полинейропатии
склонны больные сахарным диабетом, у кото-
рых она развивается еще в рамках основного за-
болевания. G.Vita и соавт. (1996) нашли, что
симптомы поражения симпатической нервной
системы становятся менее выраженными при
переводе больных на бикарбонатный гемо-
диализ.
Более ранние сроки направления больных на
замещающую терапию заметно снизили часто-
ту и тяжесть синдрома «нарушенного равнове-
сия», который раньше нередко встречался при
форсированном гемодиализе.
Основными проявлениями синдрома, обыч-
но развивающегося или во время процедуры
гемодиализа, или вскоре после ее окончания,
являются преходящие тошнота, рвота, мышеч-
ные подергивания, в более тяжелых случаях
наблюдают дезориентацию судороги, делирий,
повышение внутриглазного давления. Причиной
синдрома считают отек мозга, развивающийся
вследствие замедленного удаления осмотичес-
ки активных веществ из крови по сравнению
со СМЖ, в результате чего возникающий ос-
мотический градиент вызывает переток жидко-
сти из кровяного русла в мозг. К числу осмо-
тически активных веществ относили натрий,
«идиогенные осмоли», органические кислоты и
т.д., однако многочисленные исследования,
в том числе проведенные и в последнее
время [Silver S., 1998], позволяют считать мо-
чевину основным осмотически активным веще-
ством.
Внутривенное введение маннитола или аль-
бумина уменьшает проявления синдрома, тог-
да как инфузия изотонического раствора натрия
хлорида малоэффективна.
Профилактикой этого осложнения является
постепенный ввод больных в программу гемо-
диализа.
Сочетание артериальной гипертонии, пере-
межающейся гипергидратации, повышенной
проницаемости капилляров, гипоксии ЦНС,
обусловленной анемией и нередкой сердечной
недостаточностью, утратой на фоне ацидоза
способности мозговых сосудов к ауторегуляции
кровотока, электролитные расстройства и, на-
конец, накопление в головном мозге мочеви-
ны и аммония, в избытке образующегося в же-
лудочно-кишечном тракте из мочевины и т.д.,
приводят к развитию у больных с ХПН мета-
болической энцефалопатии, биохимической
основой которой является сдвиг pH мозговой
ткани в кислую сторону, нарушение утилиза-
ции клетками питательных веществ и глюкозы,
угнетение митохондриальных ферментных сис-
тем, обеднение мозга норадреналином и избы-
точное накопление серотонина и эндогенных
опиатов. Психоневрологическими проявления-
ми метаболической энцефалопатии, обратимой
на фоне замещающей функцию почек терапии,
являются повышенная нейромышечная возбу-
димость, депрессия, нарушение сна, загружен-
ность, в ряде случаев делирий и т.д. Депрессия
и тревожность, поддерживаемые зависимостью
от машинного лечения, снижением качества
жизни и т.д., нередко сохраняются у больных,
631
получающих программный гемодиализ, и про-
воцируют суицидальные попытки, частота ко-
торых у этой категории больных в 15 раз выше,
чем в популяции.
Особое место среди поражений ЦНС у боль-
ных, находящихся на гемодиализе, зани-
мает церебральная атрофия и диализная де-
менция.
Первая гистологически характеризуется
уменьшением числа нейронов, дендритов и
нервных фибрилл, расширением мозговых же-
лудочков и в известной степени напоминает
уремические изменения периферических нер-
вов.
При компьютерной томографии у больных,
находящихся на гемодиализе или перитонеаль-
ном диализе более 5 лет, обнаруживают расши-
рение мозговых бороздок и увеличение объема
желудочков мозга [Baner L. et al., 1989], а при
исследовании когнитивных функций находят их
снижение, опережающее таковое у людей оди-
наковой возрастной группы в общей популя-
ции [Musolino R. et al., 1992].
Патогенез этого осложнения изучен недоста-
точно. Определенное значение имеют уремичес-
кие токсины, вызывающие поражение как пе-
риферических нервов, так и ЦНС, нарушение
проницаемости гематоэнцефалического барье-
ра для ароматических аминокислот с образова-
нием ложных нейромедиаторов (гомованилино-
вой кислоты, октопамина, фенилэтаноламина
и т.д.), нарушающих функции адренергической
и допаминергической систем, снижение кисло-
родного обеспечения мозга вследствие атеро-
склеротического изменения сосудов, нарушение
ауторегуляции мозгового кровотока, анемия,
быстрая регидратация мозговой ткани в меж-
диализный период, дефицит водорастворимых
витаминов в ткани мозга, в частности биоти-
на, пиридоксина и ниацина, принимающих
участие в качестве коферментов в различных
ферментных реакциях. В происхождении этого
нарушения C.Hershey и соавт. (1985) не исклю-
чают роль кремния, содержание которого в
мозговой ткани больных повышено.
Более грубая форма поражения ЦНС, про-
являющаяся расстройствами речи, прогресси-
рующей деменцией, судорожным синдромом,
характерными изменениями ЭЭГ, связана у
больных уремией с накоплением алюминия в
сером веществе головного мозга. Как показали
исследования G.Wen и H.Wisnewski (1985), в
нейронах алюминий связывается с РНК, вслед-
ствие чего нарушается синтез белка филамент,
а также с ДНК, что изменяет процессы транс-
крипции генов и снижает продукцию и поли-
меризацию нейротубулина и уменьшает обра-
зование в клетках микротрубочек, являющих-
ся основными внутриклеточными органеллами.
632
Последние обеспечивают доставку в дисталь-
ные дендриты нейромедиаторов и фермен-
тов, необходимых для их синтеза, и макро-
молекул, обеспечивающих жизнеспособность
клеток.
Следствием этих процессов является дегене-
рация дендритов, которая в сочетании с ней-
ротубулярной дегенерацией и образованием
пучков из филамент считается характерным
морфологическим проявлением хронической
интоксикации ЦНС алюминием.
В эксперименте алюминий в концентрации,
наблюдаемой в сыворотке крови больных с
ХПН, ингибирует активность цитозольной и
митохондриальной гексокиназы — ключевого
фермента, обеспечивающего гликолиз и утили-
зацию глюкозы нервными клетками, что ска-
зывается на активности ряда ферментов и при-
водит в конечном итоге к нарушению синтеза
нейромедиаторов, в частности ацетилхолина, и
у-аминобутиловой кислоты.
Аналогичные изменения активности фермен-
тов обнаружены и в головном мозге больных,
находящихся на лечении гемодиализом, на
фоне хронической интоксикации алюминием
[Perry F. et al., 1985]. P.Altmann и соавт. (1987)
обнаружили у 38 больных с гипералюминеми-
ей, получающих лечение гемодиализом, сниже-
ние активности дегидроптеринредуктазы в эрит-
роцитах, в то время как концентрация дерива-
тов биоптерина в сыворотке была повышена.
Дегидроптеринредуктаза — основной фермент,
участвующий в образовании нейромедиаторов
в головном мозге, а его активность в эритро-
цитах отражает, как считают, активность фер-
мента в ЦНС.
Диализную энцефалопатию, связанную с
интоксикацией алюминием, диагностируют
на основании клинических данных и обнару-
жения гипералюминемии, в то время как
давление и состав СМЖ, проведение пневмо-
энцефалографии, компьютерной томографии,
ангио- и цистернографии и сканирования
мозга не выявляют заметных отклонений от
нормы.
На ЭЭГ у больных деменцией находят нор-
мальную или умеренно замедленную базальную
активность, прерываемую во фронтальных зо-
нах синхронными дельта-волнами и эпилепти-
формной активностью. Подобные изменения,
отражающие расстройства функции кортикаль-
ных и ретикулокортикальных неврозов, обыч-
но выявляют при различных токсических и
метаболических нарушениях, в том числе у
больных уремией без деменции.
Лечение далеко зашедшей диализной демен-
ции малоперспективно, хотя в ряде случаев
удается добиться обратного развития симпто-
мов поражения ЦНС использованием безалю-
миниевого диализирующего раствора, прекра-
щением перорального приема препаратов, со-
держащих алюминий, в том числе гидроокиси
алюминия, применяемой для контроля гипер-
фосфатемии, введением в течение длительно-
го времени десферриоксамина (десфераля) —
хелатирующего соединения, вытесняющего
алюминий из его комплекса с белками плаз-
мы. Нередко лечение гемодиализом с безалю-
миниевым диализирующим раствором и дес-
ферриоксамином комбинируют с плазмафере-
зом [Kubota D. et al., 1987] или вместо гемоди-
ализа проводят гемофильтрацию [Kubota D. et
al., 1982], во время которой элиминируется
больше алюминия, чем при гемодиализе.
Вместо вводимого внутривенно десферриок-
самина, вызывающего ряд побочных явлений
(нарушение цветового зрения и слуха, подвер-
женность глубоким микозам и т.д.) с успехом
используют пероральный хелатор деферипрон.
По данным G.Kontoghiorghes и соавт. (1994),
после приема деферипрона концентрация алю-
миния в сыворотке гемодиализных больных
повышалась на 90 %, что обеспечивало его
более энергичную элиминацию, а у больного
на перитонеальном диализе в диализате, эва-
куируемом из брюшной полости, содержание
алюминия увеличилось в 30 раз. Полное исчез-
новение симптомов Al-деменции отмечено у
больных после трансплантации почки, однако
успех этого метода лечения зависит, очевидно,
от стадии процесса.
Факторами, ускоряющими развитие энцефа-
лопатии, являются иммобилизация, оператив-
ttbic шншьсщ тис кортикостероида-
ми и гипофосфатемия.
Поскольку лечение деменции, связанной с
интоксикацией алюминием, малоперспективно,
основное внимание уделяют профилактике это-
го осложнения, которая сводится к предупреж-
дению перорального (антациды, препараты,
используемые для контроля гиперфосфатемии)
и парентерального (из диализирующего раство-
ра) поступления алюминия. В настоящее время
в связи с обязательной очисткой водопровод-
ной воды от алюминия обратным осмосом слу-
чаи выраженной AI-деменции практически не
встречаются.
Следует также иметь в виду, что энцефало-
патия у диализных больных может быть след-
ствием обстоятельств, непосредственно не свя-
занных с диализом. Так, O.Oyman и соавт.
(1994) наблюдали у диализного больного гипер-
аммониевую энцефалопатию, обусловленную
избыточным поступлением аммония из желу-
дочно-кишечного тракта на фоне многодневных
запоров, а Е.Descombes и соавт. (1991) описа-
ли острую энцефалопатию, развившуюся на
фоне тиаминовой недостаточности.
39.5.2. Осложнения хронического
гемодиализа
39.5.2.1. Диализный амилоидоз
Диализный амилоидоз. Карпальный синдром
(КС) — ущемление срединного нерва в запяст-
ном канале между ладонной и поперечной связ-
ками, проявляющийся парестезиями с болями
в I—II пальцах, усиливающимися ночью или
при поднятии руки — с нарастающей частотой
стали выявлять у больных, находящихся на
диализе, с 1975 г. [Warren D., Otieno L., 1975]
и первоначально его ассоциировали с техничес-
кими погрешностями во время установления
артериовенозного шунта или фистулы. Лишь
спустя 10 лет при иммунохимическом анализе
тканей, полученных во время хирургического
высвобождения ущемленного нерва, было ус-
тановлено, что иссеченные ткани содержат ги-
алиновый материал, обладающий многими тин-
кториальными свойствами амилоида, однако не
реагирующий с большинством антиамилоидных
сывороток, за исключением антисыворотки к
P-компоненту [Morita Т. et al., 1985]. Через 1 год
стало ясно, что речь идет о новом типе амило-
ида, фибриллы которого сформированы />,-мик-
роглобулином (32-МГ) [Gejyo F. et al., 1986].
Последний представляет собой пептид с мо-
лекулярной массой 11 818, состоящий из 99 ами-
нокислотных остатков, идентичный по строению
с легкими цепями иммуноглобулинов.
В организме /?2-МГ локализуется главным
образом на поверхности клеток, где он явля-
стся составной частью тканевых антигенов си-
стемы HLA I класса (HLA А, В и С).
В норме этот пептид, скорость образования
которого в организме (в основном лимфоцита-
ми) составляет около 25 молекул в 1 мин (120
мкг/кг в 1 ч), после фильтрации в клубочках по-
чти полностью катаболизируется в проксималь-
ных почечных канальцах, поэтому с мочой в сут-
ки его выделяется всего 0,3 мг. Более высокие
значения экскреции 32~МГ свидетельствуют о
дисфункции проксимальных канальцев.
При уремии катаболизм $2-МГ резко сни-
жается (период полувыведения, равный у здо-
ровых 107 мин, увеличивается в 10—15 раз) и,
несмотря на возрастание экскреции, его уро-
вень в крови повышается до 25—60 мг/л
(в норме 2,0—2,5 мг/л).
В противоположность другим низкомоле-
кулярным белкам и сывороточному альбумину
32-МГ специфически взаимодействует с различ-
ными видами коллагена, что, как полагают,
является определяющим механизмом его акку-
муляции в тканях больных, находящихся на
хроническом гемодиализе и перитонеальном
диализе. Детали процесса превращения натив-
633
ного $2-МГ в амилоидные фибриллы оконча-
тельно не расшифрованы, однако установлено,
что содержащийся в последних /3,-МГ имеет
несколько меньшую молекулярную массу, бо-
лее закислен и содержит конечные продукты
гликирования, реагирующие со специфически-
ми антителами.
Предполагают, что модификация 32~МГ,
составляющего основную массу амилоидных от-
ложений, происходит с участием свободных
радикалов кислорода, генерируемых нейтрофи-
лами синовиальной оболочки и других тканей.
Модифицированный $2-МГ обладает способ-
ностью активировать моноциты/макрофаги, по-
буждая их продуцировать интерлейкин (ИЛ) -
10, фактор некроза опухоли а, ИЛ-6 и другие
цитокины, вызывающие резорбцию и деструк-
цию костной ткани.
Помимо $,-МГ, в отложениях амилоида за-
кономерно обнаруживают амилоидный Р-ком-
понент (АР), образующийся из сывороточного
АР (SAP), кальций, гликозаминогликаны,
скопления макрофагов, апо Е. Кодируемый ге-
ном, локализованным на хромосоме 1, SAP
образуется в печени и способен кальций-зави-
симо связываться с различными лигандами,
включая амилоидные фибриллы.
Излюбленные места отложения амилоида у
больных, находящихся на диализе, — межпоз-
воночные диски, в основном шейного отдела
позвоночника, — деструктивная спондилоарт-
ропатия, протекающая в ряде случаев с мие-
локомпрессией [Aussewinkler М. et al., 1990],
суставные поверхности — диализная артропа-
тия с поражением синовиальных оболочек раз-
личных суставов, костная ткань, в которой
скопления амилоидных масс, рентгенологичес-
ки симулируя кисты, обусловливают патологи-
ческие переломы [Di Raimondo С. et al., 1986].
Описаны также отложения $2-МГ амилоида
в сосудах, островках Лангерганса, слизистой
оболочке желудочно-кишечного тракта, в язы-
ке, мышце сердца, почечных кистах при при-
обретенной кистозной болезни, среднем ухе,
надпочечниках, яичках и т.д.
Иногда эти отложения вызывают тяжелые и
даже фатальные осложнения. Так, T.Shinoda и со-
авт. (1989) описали у мужчины, находившегося
на программном гемодиализе свыше 14 лет, вы-
раженное расширение желудка с соответствую-
щей клинической симптоматикой вследствие от-
ложения амилоидных масс в стенку органа, а
G.Khan и соавт. (1997) — перфорацию стенки
пищевода в месте накопления /1,-МГ. Иногда
амилоид присутствует в самых неожиданных
местах. I.Floege и соавт. (1989) наблюдали боль-
ного, у которого массивные отложения ами-
лоида образовались в области m.gluteus и ме-
шали ему сидеть, a H.Ozasa и соавт. (1989) и
634
К.Watanabe и соавт. (1989) обнаружили амило-
ид в отходивших почечных камнях. В то же вре-
мя в подкожной жировой ткани отложения 0,-
МГ амилоида обычно отсутствуют и ее биопсия
не имеет диагностической ценности.
Использование l23I-SAP позволяет устанавли-
вать места накопления амилоида в организме
больных, находящихся на диализе [Nelson А. и
соавт., 1991].
Порогом для развития диализного амилои-
доза считается накопление в организме 400—
600,0 г 32-МГ, что достигается в среднем за 4—
6 лет лечения гемодиализом. У больных, спо-
собных более интенсивно катаболизировать 02-
МГ, этот срок увеличивается до 8—13 лет. Этим
можно объяснить, почему больные амилоидо-
зом имеют, как правило, значительный «диа-
лизный стаж» и в среднем старше пациентов
без данного осложнения.
Диагноз диализного амилоидоза устанавли-
вают на основании клинико-морфологических
данных (карпальный синдром, поражение шей-
ного отдела позвоночника, артропатия, обна-
ружение 32-МГ в иссеченных участках сухожи-
лий при хирургической декомпрессии средин-
ного нерва), ультразвукового измерения диа-
метра сухожилий на ладони, предплечье,
ligamentum supraspitanus на плече, бедре. Отло-
жения амилоидных масс в костной ткани вы-
являют рентгенологически и с помощью маг-
нитно-ядерного резонанса. Технически сложнее
использование l23I-SAP и |3|132-МГ.
Лечение диализного амилоидоза, как и мно-
гих других болезней, может быть симптомати-
ческим и патогенетическим.
При суставном синдроме применяют НПВП,
преднизолон по 5—10 мг в сутки или через день,
колхицин. Уровень 32~МГ пытаются понизить,
применяя высокопроницаемые мембраны с хо-
рошей биосовместимостью, не вызывающие
активацию макрофагов, являющиеся основны-
ми продуцентами /1,-МГ — материала, из кото-
рого формируются амилоидные фибриллы.
Полисульфон и другие синтетические мем-
браны обеспечивают более полное по сравне-
нию с купрофаном удаление 32~МГ из цирку-
ляции (мембрана AN69 еще и сорбирует 02~
МГ), но не достаточное, чтобы предупредить
развитие амилоидоза. Это же справедливо в от-
ношении различной диализной техники — ге-
мофильтрации, гемодиафильтрации, постоян-
ной артериовенозной гемофильтрации и т.д.
С учетом высокой стоимости синтетических
мембран их применение целесообразно у пожи-
лых больных с высоким риском развития ами-
лоидоза или у молодых пациентов, не подле-
жащих трансплантации, так как только послед-
няя способна прекращать прогрессирование
амилоидоза и вызывать его частичную медлен-
ную регрессию (костные кисты сохраняются).
Считают, что суставной синдром проходит
раньше под влиянием кортикостероидов.
Для профилактики диализного амилоидоза
чрезвычайно важным представляется использо-
вание стерильного диализирующего раствора,
исключающего поступление в кровь токсинов
посредством обратной фильтрации, способных
активировать макрофаги. В отделениях гемодиа-
лиза, в которых удается обеспечить такие ус-
ловия проведения процедуры, частота диализ-
ного амилоидоза снижается.
39.5.2.2. Вирусный гепатит
Заболевание печени у больных на программном
гемодиализе может быть следствием различных
причин: вирусной инфекции — заражение ви-
русами гепатита А, В, С, D и др., вирусами
герпетической группы (герпес симплекс, гер-
пес зостер), цитомегаловирусом, вирусом Эп-
штейна — Барр, токсического поражения, воз-
действия лекарств (например, на фоне приме-
нения антигипертензивных препаратов) и т.д.
Способны также индуцировать гепатопатию
дезинфектанты, используемые для стерилиза-
ции диализного оборудования, а также веще-
ства, высвобождающиеся из него (частички
кремния).
Среди перечисленных причин вирусным
инфекциям, прежде всего гепатиту В и С (ГВ,
ГС), отводится главное место как по удельно-
му весу, так и по влиянию на исходы лечения
и жизненный прогноз больных, находящихся
на гемодиализе, и реципиентов почечного
трансплантата.
Ущербный иммунный статус больных уре-
мией, приводящий к длительной персистенции
вирусов в организме, превращает диализные
отделения в резервуар вируса, в которых серь-
езной опасности подвергаются не только боль-
ные, но и персонал диализных центров.
С 1970 г., когда стало рутинным определе-
ние в сыворотке поверхностного антигена ви-
руса гепатита В (HBsAg), установлено, что по-
давляющее большинство вирусных гепатитов в
диализных центрах обусловлено именно этим
возбудителем.
После разработки серологических маркеров
идентификации HBV и HAV был выявлен еще
один тип вируса, получивший название вирус
гепатита ни А ни В. В дальнейшем выяснилось,
что это не один, а два вируса: вирус гепатита
С, передающийся парентерально, и Е, имею-
щий фекально-оральный путь передачи. Как и
в общей популяции, у диализных больных
HCV-инфекция вызывает хронические заболе-
вания печени и способна индуцировать разви-
тие гепатоцеллюлярной карциномы.
Утяжеление течения гепатита В наблюдают
при одновременном инфицировании дельта-
вирусом (HDV). Последний представляет РНК-
вирус, репликация которого происходит толь-
ко в присутствии HBV. HDV-инфекцию чаще
выявляют у больных после трансплантации
почки (в условиях дополнительной иммуносуп-
рессии).
Эпидемиология. Отделение гемодиали-
за считается инфицированным, если в нем в
течение года зарегистрировано не менее 2 слу-
чаев заболевания ГВ среди больных и медпер-
сонала. В 1967 г. в Европе было инфицировано
23 % диализных центров из 81, в 1972 г. — 43 %
из 367, в 1972 г. на вирусный гепатит приходи-
лось около 2 % смертей больных уремией, а к
80-м годам заболеваемость ГВ достигла 44 слу-
чая на 1000 диализных больных.
В 1982 г. после начала активной вакцинации
против ГВ наметилось снижение частоты инфи-
цирования в Европе и США, особенно замет-
ное среди медперсонала и в меньшей степени
среди диализных больных. В Москве 6—11 %
больных отделений гемодиализа страдают хро-
ническим гепатитом В и являются носителями
HBsAg, и у 2 % выявляют маркеры гепатитов В
и С [Зубкин М.Л., 1999].
Основным источником инфекции в отделе-
ниях гемодиализа являются больные с бессимп-
томным персистированием HBV, в то время как
пациенты с острым ГВ ответственны за 4—6 %
случаев передачи инфекции. Аналогична по
значимости роль больных хроническим гепати-
том В, часто не знающих о своем заболевании,
которым процедуры гемодиализа продолжают
проводить в общем зале.
Наиболее часто заражение ВГВ происходит
при использовании медицинского или лабора-
торного инструментария и аппаратуры, конта-
минированных этим вирусом. Реже инфициро-
вание является следствием переливания зара-
женных вирусом ГВ компонентов крови. В об-
щей популяции этот вид инфицирования так-
же занимает довольно скромное место: в Мос-
кве больные посттрансфузионным ГВ состави-
ли 2,4—14,6 % от общего числа ОГВ за 1986—
1989 гг.; в 1991 г. - 7,5 %; в 1993 г. - 4,5 %.
Тенденция к уменьшению удельного веса по-
сттрансфузионного ГВ имела место и в других
регионах России. Несомненно, положительную
роль в этом сыграли отмена использования
РИГА для тестирования доноров на наличие
HBsAg и более тщательный их отбор с помо-
щью ИФА.
Вместе с тем по мере уменьшения удельно-
го веса больных с артифициальными путями
передачи HBV возросла доля больных с про-
фессиональным и бытовым путями инфициро-
вания (чаще всего такая передача возможна в
635
семьях больных ХГВ и «носителей» HBsAg по-
средством реализации «кровяных контактов в
быту»).
По данным литературы, в отделениях гемо-
диализа маркеры ГВ суммарно выявляют у 61,4 %
больных (в том числе HBsAg у 11,9 %), антите-
ла к HCV — у 25 %. Установлена прямая зави-
симость частоты выявления этих маркеров от
длительности пребывания на программном ге-
модиализе: при продолжительности лечения до
1 года их определяют у 34,8 % больных, при
сроках лечения от 2 до 3 лет — у 59,2 %, а сре-
ди больных, леченных 5 лет и более, — 68,8 %.
Сравнительно недавно благодаря появлению
специфических тест-систем стала возможной
оценка инфицирования HCV групп риска пу-
тем определения антител к вирусу гепатита С
методом ИФА, а также PHK-HCV полимераз-
ной цепной реакцией (ПЦР). Антитела к HCV
обнаруживают у 17,4 % больных, находящихся
на программном гемодиализе до 1 года, и у
40,6 % — с продолжительностью лечения 5 лет
и более.
У медперсонала частота обнаружения анти-
тел к HCV в 3 раза выше, чем у доноров.
До начала широкой программы иммуниза-
ции против вирусного гепатита В надолго HCV-
инфекции приходилось около 25 % гепатитов
среди диализных больных и 3—6 % среди мед-
персонала. С уменьшением в результате имму-
низации заболеваемости гепатитом В в отделе-
ниях гемодиализа доля гепатита С заметно уве-
личилась.
Вирус ГВ присутствует в высоких концент-
рациях в крови, сперме, секрете влагалища
больных ОГВ, ХГВ и «здоровых носителей»
HBsAg. Высокочувствительными методами ви-
рус выявляют в слюне, асцитической жидко-
сти, моче, желчи этих больных, однако реаль-
ную эпидемическую опасность представляют
только кровь и сперма.
Заражение возможно при попадании крови
на поврежденную кожу или неповрежденную
слизистую оболочку при пункции артериове-
нозной фистулы или удалении диализата при
проведении перитонеального диализа (хотя пос-
леднее спорно), при контакте с одеждой, бе-
льем больного, диализным расходным матери-
алом. Заражение медперсонала чаще происхо-
дит при случайном уколе иглой, попадании
крови в глаза или рот и, возможно, при куре-
нии или приеме пищи в диализном зале или
смежных помещениях. Инфицироваться могут
не только медсестры, врачи и техники, рабо-
тающие непосредственно в отделении гемоди-
ализа, но и рентгенологи, хирурги, стоматоло-
ги, лабораторный персонал, имеющие контакт
с больными, кровью или биопсийным матери-
алом. В популяции (реже среди больных, нахо-
636
дящихся на диализе) инфицирование возмож-
но и при половом контакте.
Патогенез и клиника гепатитов В
и С. Инфицирование HBV не вызывает в от-
личие от вируса гепатита А цитолиза гепато-
цита. Первоначально вирус, фиксируясь на ре-
цепторах, проникает внутрь клетки, размножа-
ется и, предъявляя свои антигены на мембра-
не гепатоцита иммунной системе организма,
вызывает лимфоцитарную реакцию, направлен-
ную против гепатоцита и вируса. На HBsAg, эк-
спрессированном на мембране гепатоцита, дей-
ствует интерферон, а антигены вируса, пред-
ставленные Т-хелперами, активизируют Т-кил-
леры и В-лимфоциты и в конечном итоге ин-
фицированные гепатоциты лизируются Т-кил-
лерами и NK-клетками. Освободившиеся вири-
оны связываются специфическими антителами
(HBsAg и др.) и образуют иммунные комплек-
сы (ИК), которые в дальнейшем элиминиру-
ются из организма. При дефекте иммунной
системы (нарушение продукции интерферона,
функции Т-хелперов, Т-киллеров и В-лимфо-
цитов) или под влиянием факторов, связанных
с вирусом (например, мутации генома), иммун-
ная система теряет способность элиминировать
ИК и последние могут усугубить не только
повреждение печени, но и других органов,
вызывая гломерулонефриты, апластическую
анемию, лейко- и тромбоцитопению, артриты,
синдром Шегрена, панкреатит, тиреоидит,
узелковый периартериит, полиневрит, узлова-
тую эритему, крапивницу и др. У диализных
больных на фоне ГВ тяжелого течения описано
развитие иммунокомплексного перикардита,
причем в состав ИК входил HBsAg.
После инфицирования, начиная с 4—6 нед,
в сыворотке больного можно обнаружить
HBsAg, который персистирует в остром пери-
оде болезни, элиминируясь в течение 1 мес
после появления желтухи. Пик его концентра-
ции регистрируют за несколько дней до повы-
шения активности печеночных ферментов, ко-
торые являются наиболее ранним биохимичес-
ким индикатором начала болезни; почти одно-
временно с HBsAg появляется HBeAg, свиде-
тельствующий о репликации вируса. HBeAg
обнаруживают только в первой половине ост-
рого периода, в течение приблизительно 4—6
нед, исчезая через 1—3 нед после появления
желтухи. Самый надежный маркер репликации
вируса — ДНК-HBV, выявляемая с помощью
ПЦР.
Иммунный ответ манифестируется антитела-
ми к HBeAg, которые обнаруживают почти
сразу после появления HBeAg. НВсАЬ класса
IgM подтверждают наличие острой инфекции
HBV или активного хронического процесса,
НВсАЬ класса IgG — перенесенной инфекции.
^реконверсия HBeAg на НВеАЬ говорит о
юкращении репликации вируса. НВеАЬ нахо-
т в течение нескольких лет, но титр их по-
епенно снижается. Примерно через 3 мес
еле начала гепатита появляются HBsAb. Об-
ружение HBsAg, HBeAg, НВеАЬ (IgM) бо-
e 6 мес свидетельствует о хронизации про-
сса.
В зависимости от иммунного ответа возмож-
1 те или иные варианты поражения печени:
«здорового» носительства HBV, когда в пе-
ни обнаруживают большое количество HBsAg
хгсутствие некроза гепатоцитов (при наличии
3V-Ab), до острого течения, выраженность
горого варьирует от безжелтушного до фуль-
нантного варианта гепатита.
В классическом варианте заболевание начн-
ется постепенно с преджелтушного (продро-
льного) периода, который продолжается 2—
нед. Желтуха нарастает постепенно, однако
кесть заболевания часто не соответствует
раженности желтухи. Длительность желтуш-
го периода колеблется от 2—4 нед до 2 мес. В
зиоде выздоровления желтуха постепенно
рессирует, нормализуются размеры печени,
[езенки, кал и моча приобретают нормаль-
о окраску (последнее соответствует понятию
сризисе болезни). Выздоровление может за-
иваться и иметь волнообразный характер, но
юльшинстве случаев полную нормализацию
шических и лабораторных показателей отме-
от не позднее 6 мес от начала заболевания.
Свойственное больным с уремией наруше-
е иммунитета, усугубляющееся на фоне
lV-инфекции, приводит к отсроченной эво-
ции серологических маркеров. Так, времен-
I интервал в 6 мес, обычно достаточный для
ютатации выздоровления или хронизации
олевания, увеличивается у диализных боль-
х до 12 мес. Лишь по истечении этого срока
«но говорить у них об исходе ОГВ.
Для диализных больных характерно преоб-
ание легких безжелтушных форм ОГВ. Про-
вальный период прослеживается только в
[овине случаев и характеризуется усугубле-
:м слабости, усилением кожного зуда, ухуд-
чием аппетита, т.е. жалоб, в большей или
шшей степени свойственных этим пациен-
. Период разгара ОГВ длится от 3 до 40 нед
опровождается диспепсией, склонностью к
1воточивости, гипотонии. Печень увеличена
О % больных, значения аминотрансфераз в
днем не превышают 2—3 нормы. В то же
мя сравнительно нечастые желтушные вари-
ы могут протекать тяжело, с развитием пе-
очной недостаточности и энцефалопатии.
Из внепеченочных проявлений ОГВ у диализ-
< больных описаны перикардит, миокардит,
врит, асцит, усугубление полинейропатии и
острой миелополирадикулоневрит (синдром
Гийена — Барре).
Имеются данные, что диализные больные с
хроническим вирусным гепатитом подвержены
более частым и тяжело протекающим инфек-
циям, включая сепсис.
Риск хронического носительства, определя-
емый в общей популяции 1,5—2 % от числа ин-
фицированных, возрастает у больных с уреми-
ей до 30 %. Фактически около половины боль-
ных, инфицированных в диализных центрах,
становятся бессимптомными носителями HBsAg
без биохимических сдвигов, характерных для ге-
патита. Мужчины более склонны к развитию
носительства, что связано с их генетической
предрасположенностью (гены, ответственные за
образование антител, локализуются в Х-хромо-
соме, у женщин больше вариаций для образо-
вания антител).
У 10—15 % больных в общей популяции с
персистирующей HBV-инфекцией происходит
спонтанная сероконверсия с первоначальным
исчезновением из циркуляции ДНК-HBV,
HBeAg и появлением анти-НВе. Распространя-
ется ли эта закономерность на пациентов от-
делений диализа, подлежит дальнейшему уточ-
нению.
У реципиентов почечного трансплантата
способность к продукции HBsAb, имеющая
основное значение для элиминации вируса,
практически отсутствует (наличие антител оп-
ределяется у 2 на 1000 больных) и ОГВ у них
почти в 100 % случаев трансформируется в
хронический.
Инфицирование HCV также может вызвать
желтушные и безжелтушные формы гепатитов.
Для желтушных форм ОГС в отличие от ОГВ
нехарактерно тяжелое течение (среднетяжелые
формы ОГС встречаются в 2 раза чаще).
Инкубационный период у больных с жел-
тушной формой ОГС длится в среднем 45,8 дня,
а у пациентов, у которых известна дата гемо-
трансфузии, — 37,9±2,9 дня. Основные симп-
томы продромального периода: слабость, ано-
рексия, кожный зуд, артралгии, тошнота, рво-
та, дискомфорт в животе. Длительность продро-
мы составляет 10,7 дня (от 1 до 32 дней), но
последняя может и отсутствовать. Желтушный
период характеризуется волнообразным течени-
ем (волнообразный характер гипераминотран-
сфераземии, гипербилирубинемии, которые не
коррелируют с клиникой).
HCVAb появляются в интервале 1—6 мес от
начала желтушного периода, при безжелтушной
форме ОГС к концу 1-го месяца от начала ги-
пераминотрансфераземии, но в 4 раза реже,
чем при желтушной форме. При длительности
биохимических сдвигов более 1 года можно
говорить о хронизации процесса.
637
В развитых странах в 90 % случаев посттранс-
фузионные гепатиты вызваны HCV, из них
более 50 % приводят к хроническим заболева-
ниям печени и у 20 % больных с ХГС развива-
ется цирроз печени.
Хроническая HBV-инфекция может сопро-
вождаться репликацией вируса с наличием со-
ответствующих серологических маркеров
(HBsAg, HBeAg, HBV-DNA, ДНК-полимераза,
HBcAb-IgM) или протекать без репликации,
когда вирус интегрирован в геном гепатоцита.
В последнем случае в сыворотке определяют
HBsAg и НВсАЬ.
Вирусологический статус не имеет прямого
отношения к степени поражения печени и се-
рологические маркеры не коррелируют с гис-
тологическими изменениями печеночной тка-
ни и, следовательно, не могут служить прогно-
стическими ориентирами.
В соответствии с международной классифи-
кацией у носителей HBsAg без нарушения фун-
кции почек чаще всего выявляют ХГВ, кото-
рый подразделяют на персистирующий и актив-
ный с циррозом или без него, однако у диа-
лизных больных различие между хроническим
персистирующим и активным гепатитом — ус-
ловно, поскольку воспалительный процесс не
имеет четкого отграничения и некроз гепато-
цитов обычно отсутствует или мало выражен.
Поэтому у данной группы больных различают
функционально-неповрежденную печеночную
ткань и наличие ХГВ с циррозом или без него.
В целом частота носительства вируса и хро-
нических заболеваний печени у диализных боль-
ных достигает 60 %, однако печеночная недо-
статочность редко является причиной их смер-
ти, а летальность больных с HBsAg и без него
от других причин значимо не различается.
Исходя из приведенных сведений, можно
сформулировать несколько правил, которые
целесообразно соблюдать в отношении данных
больных для выявления у них признаков вирус-
ных гепатитов.
• У всех больных, вновь поступающих на ди-
ализ, необходимо определять наличие в кро-
ви HBsAg, HBcAb-IgM и IgG (любой из этих
маркеров считается подтверждением HBV-
инфекции), HCV-Ab.
• У всех больных на программном диализе
целесообразно ежемесячное мониторирова-
ние активности аминотрансфераз и повтор-
ное исследование на наличие HBsAg и HCV-
Ab 1 раз в 2 мес.
• Всем больным, у которых характерные био-
химические сдвиги фиксируют на протяже-
нии 12 мес и более, показана биопсия пе-
чени для определения степени и характера
ее поражения.
Вирусный гепатит и трансплантация почки.
Длительное время существовала гипотеза о луч-
шей выживаемости почечного трансплантата у
лиц с HBsAg-емией, основанная на том, что
персистирование HBsAg отражает дефект им-
мунного ответа и, следовательно, должно со-
четаться с меньшей выраженностью иммунных
реакций против аллотрансплантата.
Анализ наблюдений, посвященных этой про-
блеме, проведенных в последние 5 лет, не под-
твердил эту гипотезу: выживаемость почечно-
го трансплантата у HBsAg позитивных и нега-
тивных реципиентов оказалась одинаковой. В то
же время смертность в послетрансплантацион-
ном периоде у HBsAg позитивных больных в 3—
5 раз превышает таковую в группе HBsAg не-
гативных пациентов. Основной причиной повы-
шения смертности является острая или хрони-
ческая печеночная недостаточность. При этом
определяющим фактором служит наличие гис-
тологических изменений в печени: среди HBsAg
позитивных больных с гистологическими при-
знаками хронического гепатита примерно 50 %
впоследствии умирают от печеночной недоста-
точности, которая развивается в сроки до 5—7
лет после пересадки почки. Такие же исходы
наблюдают у HBsAg позитивных больных с по-
вышенным в течение 1 года до трансплантации
уровнем трансаминаз. У больных без морфоло-
гических изменений в печени прогноз более
благоприятный.
Таким образом, иммуносупрессия, проводи-
мая в послеоперационном периоде для предот-
вращения и лечения реакции отторжения, по-
тенцирует репликацию HBV. Признаки репли-
кации вируса (по серологическим маркерам) вы-
являют почти в 100 % случаев у реципиентов
почки, у которых до пересадки определяли HBs-
антигенемию. Риск развития гепатоцеллюлярной
карциномы у реципиентов почечного трансплан-
тата также заметно выше, чем у больных, на-
ходящихся на хроническом гемодиализе.
Обнаружение у предполагаемого реципиента
HBsAg не является абсолютным противопоказа-
нием к пересадке почки, но следует иметь в виду
возрастающий риск тяжелого заболевания пече-
ни и информировать об этом больного.
Лечение гепатитов В и С. Диализ-
ным больным с ВГ традиционно показаны
диета, близкая к диете № 5, и щадящий дви-
гательный режим. Питание должно быть полно-
ценным высококалорийным, но при ухудшении
функции печени ограничивают прием белков.
Потребление жидкости увеличивают только тем
больным, у которых имеется остаточный диу-
рез и нарастание массы тела в междиализный
период не превышает 1—1,5 кг.
Гиперкатаболизм, сопровождающий инфек-
ционное заболевание, требует увеличения ди-
638
ализного времени для поддержания показате-
ля KT/V > 1,0. Возможны перевод больных на
гемодиафильтрацию или гемофильтрацию или
замена гемодиализов этими процедурами. Этио-
тропная терапия вирусных гепатитов не разра-
ботана. Четких данных об эффективности ацик-
ловира нет.
Для подавления репликации вируса у боль-
ных с ОГВ, ОГС среднетяжелого и тяжелого
течения и с ХАГ используют интерферон. Наи-
более перспективен рекомбинантный «-интер-
ферон (интрон), который вводят внутривенно,
внутримышечно, в свечах. При острых гепати-
тах назначают по 1—2 млн МЕ/сут 5—7 дней,
в дальнейшем 2 раза в неделю до 1 мес. При
хронических гепатитах его применяют длитель-
ными курсами, например 3—5 млн МЕ/сут
ежедневно или через день 4 мес.
На фоне применения интерферона реплика-
ция вирусов, в частности HCV, подавляется на
длительный срок у 25 %, а у остальных после
прекращения лечения в сыворотке вновь повы-
шается активность АлАТ и в циркуляции с
помощью ПЦР обнаруживают вирусную РНК.
Заметно лучших результатов длительной инги-
биции (47 %) достигают при сочетанном ис-
пользовании «-интерферона с рибавирином —
нуклеозидным аналогом с противовирусной
активностью. У реципиентов почечного транс-
плантата с реактивацией вирусной инфекции
обнадеживающий результат получен при при-
менении ганцикловира [Aningen М. et al., 1998].
Уменьшает прогрессирование фиброза пече-
ни противовирусный препарат ламивудин в дозе
100 мг/сут, испытания которого недавно завер-
шены в ряде стран Азии, в которых преоблада-
ет вертикальная передача вируса, и в США, где
доминирует половой путь заражения [Zarkin V.,
1998].
Профилактика гепатитов В и С в
центрах гемодиализа. Основными принципами
предотвращения распространения HBV и HCV
в центре гемодиализа являются:
• своевременная идентификация и немедлен-
ное удаление из неинфицированного цент-
ра зараженного больного. При невозможно-
сти перевода в специализированный центр —
изоляция инфицированного больного в от-
дельном диализном зале с индивидуальным
аппаратом «искусственная почка»;
• исключение возможности заражения вируса-
ми ГВ и ГС больных через аппаратуру; раци-
ональное ее использование, качественная
предстерилизационная очистка и дезинфек-
ция;
• использование крови для гемотрансфузий
только после ее тестирования на HBsAg и
HCV-Ab методом ИФА, медицинского и ла-
бораторного инструментария одноразового
пользования;
• строгое соблюдение правил общей гигиены
в отделении — пользование резиновыми пер-
чатками, масками, очками при манипуляци-
ях с фистулой и кровопроводящими магис-
тралями, недопустимость курения и приема
пищи в диализных залах и помещениях,
смежных с ними;
• обязательная маркировка крови и другого
материала для анализов с целью предупреж-
дения работников лаборатории, информиро-
вание о наличии HBV и HCV инфекции у
больного всех медработников больницы, ко-
торые привлекаются к его лечению и обсле-
дованию (рентгенологов, хирургов, стомато-
логов и др.);
• динамическое обследование на маркеры ГВ
и ГС больных центров гемодиализа;
• регулярное обследование медперсонала на
HBsAg и HCV-Ab при поступлении на ра-
боту, а далее не реже 1 раза в год.
Реализация перечисленных правил позволи-
ла эффективно снизить заболеваемость в отде-
лениях гемодиализа Великобритании и Шве-
ции, в которых она еще до программы имму-
низации была во много раз ниже, чем в дру-
гих странах Европы.
Пассивную иммунизацию против ГВ осуществ-
ляют с помощью специфического иммуногло-
булина (ИГ), выделенного из пула сывороток,
содержащих в высоком титре HBsAg. Стандарт-
ный ИГ, несмотря на низкое содержание
HBsAg, также дает частичный эффект и его
можно применять при отсутствии специфичес-
кого ИГ.
Пассивную иммунизацию можно использо-
вать как постконтактную защиту (после перели-
вания инфицированной крови, попадания ви-
руса на слизистые оболочки и т.д.) и как регу-
лярную превентивную меру в условиях повышен-
ного риска заболевания. Профилактическое вве-
дение ИГ проводят обычно не позднее 48 ч
после контакта с инфекцией. Инъекцию (3 мл
с содержанием 200 МЕ/мл HBsAb) повторяют
через 30 дней, поскольку титр антител посте-
пенно падает. Наилучшая защита достигается при
интервале между инъекциями не более 2 мес.
При 3- и 6-месячных интервалах риск зараже-
ния заметно возрастает. Для медперсонала раз-
работан следующий режим пассивной иммуни-
зации: повторные инъекции каждые 5 нед в
течение первых 4 мес работы в диализном от-
делении и каждые 8 нед в последующее время.
Пассивная иммунизация достаточно эффек-
тивна, но имеет ряд серьезных недостатков:
частые болезненные инъекции, реакции гипер-
чувствительности, требующие прекращения
639
иммунизации, недостаток доноров с высоким
титром HBsAb, дороговизна препарата.
Активная иммунизация против ГВ основана на
продукции специфических антител в ответ на
введение очищенных частиц поверхностного
антигена вируса. В связи с невозможностью
культивирования HBV in vitro первые вакцины
были приготовлены из плазмы хронических
носителей HBsAg. Плазма, содержащая HBsAg
и полные вибрионы, при нагревании до 98 °C
в течение 1 мин теряет инфекционные, но со-
храняет иммуногенные свойства. К настояще-
му времени в разных странах создано 12 плаз-
менных вакцин, но лицензированы из них толь-
ко 3: Heptovax В (Merck, Sharp & Douhme,
США), HEVAC В (Пастеровский институт,
Франция), CLB (Служба переливания крови
Красного Креста, Голландия). Отсутствие у этих
вакцин способности вызывать ГВ широко про-
верено на шимпанзе (единственных животных,
пригодных для проверки концентрации и бе-
зопасности HBV-вакцин). С 1982 г. было введе-
но более 4 млн доз этих вакцин человеку без
каких-либо серьезных осложнений. Они также
безопасны и по вирусу СПИД.
По мере возрастания числа вакцинаций ста-
ли выявлять недостатки вакцин первого поко-
ления: дефицит стартового материала, дорого-
визна производства, особенно проверочных ис-
пытаний на шимпанзе. На смену им пришли
вакцины второго поколения (генно-инженер-
ные, продуцируемые in vitro синтетические по-
липептиды, созданные по рекомбинантной
ДНК-технологии). В России лицензированы и
разрешены к применению Re-combivax (Merck,
Sharp & Douhme, США), Engerix (Smith-Kline,
Бельгия) и Эбербиовак (Куба), иммуноген-
ность которых не уступает вакцинам первого
поколения.
Медработникам, не имевшим при предвари-
тельном обследовании маркеров ГВ (HBsAg и
HBsAb), 1 дозу вакцины (20 мкг) вводят в дель-
товидную мышцу плеча с интервалом 0—1—6
мес. Трехкратное введение вакцины вызывает
появление HBsAb в протективных титрах (10
МЕ/л и выше) у 90—95 % иммунизированных
лиц, не имевших перед вакцинацией антител.
Около 5 % здоровых лиц не реагируют на стан-
дартный режим введения вакцин, в связи с чем
им показаны повторный курс или дополнитель-
ные дозы вакцины через 12 и 18 мес. Иммун-
ный ответ у носителей HLA DR7 и DR3 анти-
генов также слабый.
Оптимальным для хранения вакцины явля-
ется температурный интервал от 2 до 8 °C, в
то время как замораживание ее инактивирует.
Играет роль и место инъекции: ягодица и под-
лопаточная область в меньшей степени пригод-
ны, чем дельтовидная мышца.
640
Поскольку большинство медработников на-
чинают свою работу в лечебных учреждениях,
в том числе в центрах гемодиализа, будучи
восприимчивыми к HBV (инфицирование HBV
наиболее интенсивно в первые годы их работы
в этих учреждениях), необходимо проводить
вакцинацию против ГВ перед окончанием уче-
бы и началом профессиональной деятельности
(студенты выпускных курсов медучилищ и ин-
ститутов).
Выраженный иммунодефицит наблюдают у
всех больных с ХПН. В связи с этим до и во
время лечения диализом используют единый
протокол вакцинации. Общепринятым счита-
ется проведение 1-й вакцинации за 1 год до
поступления на программную заместительную
терапию, т.е. при уровне креатинина плазмы
500—700 мкмоль/л. Больных отделений гемо-
диализа, не имеющих в крови HBsAg и
HBsAb, вакцинируют двойными дозами вак-
цины (по 2 мл генно-инженерной вакцины,
содержащей 40 мкг HBsAg) по схеме 0—1 —
2—6 мес.
Вакцина Engerix В, несмотря на увеличение
дозы и кратности иммунизации, обеспечивает
протективный титр HBsAb лишь у 76,5 % при-
витых через 1 мес после завершения курса им-
мунизации, а через 1 год только у 53,3 % со-
хранился достаточный титр антител. Нестойко-
стью поствакцинального иммунитета у пациен-
тов отделений гемодиализа можно объяснить
низкую эффективность вакцинации.
Подавляющее большинство больных — лица
старше 50 лет, которым при слабой (HBsAb ме-
нее 10—100 МЕ/л) или отрицательной (HBsAb
менее 10 МЕ/л) иммунной реакции необходи-
мо через 1 год дополнительно ввести вакцину.
Учитывая нарушения иммунного статуса, перс-
пективным может оказаться одновременное вве-
дение вакцины и иммуномодуляторов.
Вакцины против ГВ слабореактогенны и бе-
зопасны для применения; поствакцинальных
осложнений не зарегистрировано.
У медработников, у которых кровь попала на
слизистую оболочку или поврежденные кожные
покровы при манипуляциях, проводимых с
больными ОВГ, ХВГ и носителями HBsAg,
рекомендуется комбинированная пассивно-ак-
тивная иммунизация. В связи с тем что пассив-
ное введение HBsAb не нарушает иммунного
ответа к HBsAb, введение специфического
иммуноглобулина и вакцины против ГВ прово-
дят одновременно, но в разные мышцы.
Аналогичные меры принимают при внепла-
новом поступлении больного на диализ и эк-
стренном переводе медработника на работу в
отделение диализа.
Среди вакцинированных больных в первые
месяцы после вакцинации возможно появление
инфицированных лиц, заражение которых при-
шлось на период слабого антительного ответа,
однако в большинстве случаев иммунизация
ограничивает репликацию вируса и предотвра-
щает носительство HBsAg. Повторная иммуни-
зация хронических носителей HBsAg с целью его
элиминации не оказала желаемого эффекта.
Активная и пассивная иммунизация способ-
ны значительно снизить заболеваемость гепати-
том В, но даже в тех странах, где вакцинацию
персонала и больных диализных отделений
проводят в обязательном порядке на протяже-
нии 10 лет и более, проблема диализного ге-
патита не исчезла. В этиологической структуре
заметное место стало принадлежать гепатиту С.
Перенесенные гепатиты В, С и D значитель-
но ухудшают прогноз реципиентов почечного
трансплантата, что требует жесткого соблюде-
ния мер профилактики и своевременного вы-
явления больных этими инфекциями.
39.5.2.3 . Приобретенная кистозная болезнь
почек
Приобретенная кистозная болезнь почек (ПКБП),
впервые описанная M.Diinnill и соавт. (1977),
представляет собой одно из осложнений хро-
нической уремии, которое независимо от пер-
вичного заболевания почек нередко встречает-
ся у больных с предтерминальной ХПН, но
особенно часто во время лечения гемодиали-
зом. По данным O.Miskisch и соавт. (1984), ее
выявляют у 35 % больных перед началом гемо-
диализа, а через 8 лет лечения — практически
в 100 % случаев.
Согласно данным I.Ishikawa (1980), размер
почек у больных в течение первых 3 лет лече-
ния гемодиализом уменьшается, а затем у боль-
шинства из них начинает увеличиваться вслед-
ствие кистозной трансформации, которую ав-
торы с помощью компьютерной томографии
(КТ) обнаружили у 86 из 96 больных после
3 лет лечения гемодиализом.
При кистозной трансформации у больных с
ХПН вследствие гломерулонефрита, пиелонеф-
рита и других заболеваний в почках преимуще-
ственно в корковом веществе начинают обна-
руживать многочисленные кисты, заполненные
серозной или геморрагической жидкостью, pH
которой обычно несколько ниже pH плазмы,
имеющие в отличие от наследственного поли-
кистоза сравнительно небольшие размеры (от
0,5 до 3 см).
Как показали микродиссекционные и мик-
роскопические исследования, кисты развивают-
ся из дилатированных мешкообразно расширен-
ных канальцев и окружены утолщенной базаль-
ной мембраной, коллагеновыми и эластически-
ми волокнами. Изнутри кисты выстланы куби-
ческим или цилиндрическим эпителием с яв-
лениями папиллярной или аденоматозной про-
лиферации, и в ряде случаев вместо жидкости
они содержат органический ШИК-положитель-
ный материал, имеющий фибриллярную струк-
туру.
Тщательные исследования, выполненные с
помощью сканирующей и трансмиссивной
электронной микроскопии, показали, что ку-
бический эпителий, выстилающий кисты, ана-
логичен эпителию проксимальных канальцев,
а цилиндрический — эпителию дистальных
канальцев и собирательных трубочек. Нередко
эпителиальные структуры встречаются в не-
обычных местах. Например, тубулярный эпите-
лий вместе с базальной мембраной выявляют
в венулах, венах и почечных нервах, а в неко-
торых канальцах он замещен клетками, напо-
минающими метанефрий с картинами митоза.
Причины кистозной трансформации почек
у больных уремией не известны. У больных, не
лечившихся гемодиализом, определенное зна-
чение в развитии кист имеют ишемия почеч-
ной ткани и обструкция канальцев кристалла-
ми различных солей, главным образом оксала-
тов, амилоидными конкрециями, а также раз-
витие фиброза в окружающем канальцы интер-
стиции.
У крыс ПКБП развивается под воздействи-
ем дифениламина и дифенилтиазола, нордигид-
рогваретовой кислоты, цисплатина. Не исклю-
чено, что почки больных таким образом реа-
гируют на пока не идентифицированные мета-
болиты, задерживающиеся в крови при уремии.
У больных, находящихся на лечении гемодиа-
лизом, наряду с этими факторами в индукции
ПКБП, по-видимому, участвуют вещества,
высвобождающиеся из диализной аппаратуры.
Во всяком случае длительное вскармливание
крыс эфирами фталата, содержащимися в ге-
модиализаторах, способствует образованию
множественных кист и нарушению функции
почек [Crocker et al., 1984]. В то же время кис-
тозная трансформация почек описана также у
больных, которым проводили перитонеальный
диализ [Narasimhan N. et al., 1984; Katz A. et al.,
1987].
У мужчин ПКБП возникает чаще, чем у
женщин. I.Ishikawa и соавт. (1985) считают, что
эндогенные гормональные субстанции имеют
значение в происхождении ПКБП у человека.
В последнее время широкую известность
приобрела гипотеза, объясняющая развитие
ПКБП и злокачественных новообразований
единым патогенетическим механизмом. Соглас-
но этой гипотезе, потеря критической массы
нефронов приводит к усилению продукции
ренотропного фактора (РФ), вызывающего ги-
перплазию функционирующих клубочков, ка-
41—2950
641
нальцев и собирательных трубочек. Длительная
стимуляция почечных структур РФ вызывает их
изменение, образование кист, а в ряде случа-
ев — злокачественных опухолей. Очевидно, ле-
чение гемодиализом и перитонеальным диали-
зом не элиминирует РФ, в то время как после
успешной трансплантации почки уменьшается
размер собственных почек реципиента и кист.
Кистозная трансформация почек сопровож-
дается рядом осложнений, основными из ко-
торых являются гематурия, ретроперитонеаль-
ные кровотечения и, как упоминалось, злока-
чественные новообразования.
В целом, несмотря на иммунодепрессивное
влияние уремии, что является важнейшим
предрасполагающим фактором злокачественно-
го роста, злокачественные новообразования в
различных органах, за исключением почек,
образуются у больных с ХПН не чаще, чем у
лиц соответствующего возраста в общей попу-
ляции. В то же время ПКБП создает определен-
ные предпосылки для развития злокачествен-
ных опухолей почек.
Согласно данным I.Ishikawa (1986), аденокар-
циномы встречаются в кистозно-измененных поч-
ках у 1,5 % больных, находящихся на лечении
гемодиализом, что существенно превышает час-
тоту возникновения опухолей почек в популяции.
Мы также наблюдали развитие злокачествен-
ных новообразований на фоне ПКБП у 2 па-
циентов из числа всех больных, лечившихся в
течение последних нескольких лет в нашем
центре гемодиализа. Интересно, что у обоих
больных основным клиническим признаком
опухоли являлась паранеопластическая миопа-
тия и у 1 больного — лихорадка.
Диагноз ПКБП и опухолей почки устанав-
ливают на основании ультразвукового исследо-
вания и КТ почек, однако опухоли небольших
размеров не всегда можно выявить с помощью
этих методов.
Имеется ряд особенностей лечения больных
с ПКБП. В случае ретроперитонеального кро-
вотечения при неэффективности гемостатичес-
кой терапии прибегают к эмболизации почеч-
ных артерий или нефрэктомии. Больным, на-
ходящимся на лечении гемодиализом более
3 лет, необходимо ежегодно проводить компь-
ютерное или ультразвуковое исследование по-
чек. Опухоли почек диаметром менее 3 см ред-
ко метастазируют, поэтому при обнаружении
небольшой опухоли (диаметром менее 3 см) ре-
комендуется повторять эти исследования каж-
дые полгода или чаще.
При увеличении размеров опухоли проводят
нефрэктомию. При выявлении опухоли почки
у предполагаемого реципиента почечного транс-
плантата показана срочная бинефрэктомия не-
зависимо от ее размера.
642
У больных с ПКБП с большими размерами
кист, как и при наследственном поликистозе,
фиксируют более высокие значения гемоглоби-
на и гематокрита.
39.5.2.4 . Проблема биосовместимости
В 1968 г. L.Kaplow и J.Goffmet впервые зареги-
стрировали факт снижения количества лейко-
цитов в периферической крови у больных с
уремией через 10—15 мин после начала гемо-
диализа с восстановлением исходного уровня
к концу процедуры.
Позднее установили, что транзиторная лей-
копения, сопровождающаяся у 10—15 % боль-
ных болями в пояснице, грудной клетке, обус-
ловлена секвестрацией в легких в основном
нейтрофилов и патогенетически связана с не-
достаточной биосовместимостью крови и диа-
лизного оборудования, главным образом диа-
лизных мембран.
В настоящее время проблеме биосовместимо-
сти, определяемой как сумма специфических и
неспецифических реакций между кровью и
биоматериалами, уделяется большое внимание,
поскольку с ее решением связано предупреж-
дение таких развивающихся во время гемодиа-
лиза осложнений, как гипоксемия, уменьше-
ние мышечной массы, остеопения и т.д.
В отличие от обычной регенерированная
целлюлоза, из которой производят диализные
мембраны, содержит на своей поверхности ОН-
радикалы, вызывающие при контакте с кровью
активацию комплемента по альтернативному
пути с образованием биологически активных
соединений СЗа и С5а. Активация комплемен-
та достигает пика как раз через 15 мин после
начала гемодиализа, и в течение 90 мин эти
анафилактоидные субстанции путем потери
аргининовых остатков переводятся в менее ак-
тивные СЗа desArg и С5а desArg, концентрация
которых в крови больных после гемодиализа в
5 раз выше преддиализного уровня. Комплемент
активирует нейтрофилы, из которых высвобож-
даются лизосомальные гранулы, содержащие
лактоферрин, миелопероксидазу, эластазу и
другие ферменты, а моноциты, несущие рецеп-
торы к С5а, высвобождают после контакта с
С5а ИЛ-1 — вещество, осуществляющее реак-
ции защиты организма.
Многократно повторяющаяся дегрануляция
снижает продолжительность жизни нейтрофи-
лов, уменьшает их способность к хемотаксису
и фагоцитозу, с чем в определенной степени
связывают сниженную резистентность к инфек-
ции больных, находящихся на лечении гемо-
диализом.
ИЛ-1, продуцируемый моноцитами также в
ответ на микробные эндотоксины и ацетат ди-
ч
ализирующего раствора, являясь компонентом
острофазовой реакции, вызывает протеолиз в
мышечной ткани, увеличивает синтез белка в
печени, индуцирует бластогенез Т- и В-клеток,
высвобождение ПГИ2 из эндотелия сосудов с
вазодилатацией и пролиферацией фибробластов.
У больных, которым проводят гемодиализ, он
ответствен за лихорадочные реакции, истоще-
ние, остеопению и т.д. У больных, находящихся
на перитонеальном диализе, с высвобождени-
ем ИЛ-1 из перитонеальных макрофагов свя-
зывают развитие склерозирующего перитонита
и снижение ультрафильтрационной способно-
сти перитонеальной мембраны.
Мурамилдипептидазы, высвобождающиеся
из гликопротеина бактериальной стенки под
влиянием лизоцима сыворотки, в 10 раз актив-
нее эндотоксина.
Купрофан и другие диализные мембраны,
содержащие целлюлозу, обладают наибольшей
способностью индуцировать лейкопению во
время гемодиализа, в то время как бионесов-
местимость не содержащих целлюлозу мембран
(полиакрилнитриловой, полиметилметакрилат-
ной и полисульфоновой) менее выражена. Со-
гласно данным И.С.Ярмолинского и соавт.
(1987), D.Chenoweth и соавт. (1983), R.Hakim
и соавт. (1984), при использовании этих мемб-
ран практически не происходит снижения числа
лейкоцитов в крови во время гемодиализа и их
способности к фагоцитозу, хемотаксису и т.д.
Степень биосовместимости уменьшается так-
же при повторном использовании гемодиали-
заторов (resp. диализных мембран). При этом
снижается число связанных с бионесовмести-
мостью побочных реакций и срок пребывания
больных в стационаре (в 3 раза). Это объясня-
ется тем, что во время первой процедуры ге-
модиализа СЗЬ ковалентно связывается с тио-
этилэстеровыми участками целлюлозных диа-
лизных мембран и при повторных процедурах
не происходит активации комплемента [Pang-
burn М., Muller Н., 1980].
Другой возможностью улучшить биосовмес-
тимость является уменьшение площади диализ-
ных мембран, а также очищение диализирую-
щего раствора или покрытие мембран биосов-
местимым полимером, не влияющим на их кли-
ренсовые характеристики.
Значение феномена бионесовместимости в
происхождении гипотонии, гипоксемии и дру-
гих осложнений, развивающихся во время ге-
модиализа, признают далеко не все.
В известной работе V.Bonomini и соавт. (1994)
в течение 5 лет 53 больным гемодиализы про-
водили на купрофане ацетатцеллюлозе, а у 43
пациентов использовали синтетические мемб-
раны — полисульфон, AN69, Eval, полиметил-
метакрилат. Пятилетняя выживаемость у боль-
ных обеих групп значимо не различалась (34 и
37 %), а сердечно-сосудистые осложнения чаще
регистрировали во второй (50 % против 22 %).
Хотя элиминация 02-МГ за процедуру у пер-
вых составляла 2—3 %, а у вторых —34—56 %,
его уровень в сыворотке был одинаковым, а
операции по поводу карпального синдрома
чаще подвергались больные второй группы
(23,8 % против 13,2 %). Авторы считают, что с
отсутствием явных преимуществ и высокой сто-
имости синтетические мембраны должны при-
менять только у ограниченного контингента
больных (пожилой возраст, нестабильная гемо-
динамика и т.д.).
В то же время ряд синтетических мембран с
хорошей биосовместимостью, не приводящих к
лейкопении и активации комплемента, спосо-
бен вызывать другие нежелательные явления.
Например, полиакрилнитриловая мембрана
AN69 в силу отрицательного заряда индуциру-
ет активацию калликреин-кининовой системы,
что у больных, получающих ингибиторы АПФ,
может вызвать тяжелую анафилактоидную ре-
акцию. Эта же мембрана приводит к значитель-
но большей экспрессии мРНК фактора некро-
за опухоли а на мононуклеарах, чем мембраны
из полисульфона и полиэтилена [Kushihota S. et
al., 1998].
Выживаемость больных зависит от возраста,
причины поражения почек и вида гемодиализ-
ной терапии. Выживаемость максимальна у мо-
лодых больных, не имеющих системных болез-
ней, которых лечат на дому (5- и 10-летняя
выживаемость составляет 90 %), минимальна —
у больных диабетической нефропатией (5-лет-
няя выживаемость 20 %). Эти больные входят в
группу повышенного риска; 6—12 % больных
умирают в первые 3 мес после начала лечения
гемодиализом и их в ряде стран не включают в
официальную диализную статистику.
Как показали исследования J.De Lima и со-
авт. (1998), умрет ли больной в ближайшие
месяцы после начала лечения или станет диа-
лизным долгожителем (10 лет и более), зави-
сит в решающей степени от ряда исходных
параметров. Заметно хуже шансы стать долго-
жителями у больных пожилого возраста со срав-
нительно невысокими значениями креатинина
сыворотки, высоким отношением мочевина/
креатинин в крови (> 18,0) и низким уровнем
альбумина сыворотки. Три последние показателя
характеризуют нутритивный статус и интенсив-
ность катаболизма. Низкое содержание альбуми-
на сыворотки предопределяет неблагоприятный
прогноз и у больных на перитонеальном диа-
лизе.
На выживаемость больных существенно вли-
яет улучшение качества диализного оборудова-
ния. Так, 4-летняя выживаемость больных всех
41*
643
возрастных групп (от 0 до 65 лет и старше),
лечившихся в 1990—1994 гг., стала на 14—23 %
выше, чем больных, начавших лечение на 10
лет раньше. Примечательно, что это повыше-
ние показателя выживаемости произошло, не-
смотря на изменение структуры причин ХПН
с заметным увеличением среди больных лиц
пожилого возраста и больных системными за-
болеваниями, в частности диабетом и артери-
альной гипертонией.
Основными причинами смерти больных,
находящихся на лечении гемодиализом, явля-
ются, как упоминалось, сердечная недостаточ-
ность, инфаркт миокарда, аритмии, развива-
ющиеся нередко во время эпизодов гипотензии
и вызывающие внезапную смерть, сосудистые
поражения ЦНС и инфекция.'
39.5.3. Реабилитация
При своевременно начатом лечении и отсут-
ствии осложнений уже через несколько недель
после начала лечения большинство больных
становятся реабилитированными в медицинс-
ком отношении, а часть возвращается к преж-
ней работе, если она не связана с существен-
ной физической нагрузкой. В Европе 2/, мужчин,
которым гемодиализ проводят в стационаре,
трудоспособны. Среди больных, находящихся на
домашнем гемодиализе, процент трудовой ре-
абилитации еще выше.
Согласно социологическим исследованиям,
на полноту реабилитации не влияют семейное
положение больных, число детей в семье, уро-
вень интеллигентности. Индивидуальная способ-
ность к реабилитации определяется свойствами
характера, которые присущи больному до на-
чала заболевания, а также длительностью тру-
довой незанятости перед началом гемодиализа:
чем продолжительнее этот период, тем мень-
ше стремление к возобновлению трудовой де-
ятельности. На современном этапе возможность
трудовой реабилитации не рассматривается как
непременное условие отбора больных на лече-
ние. В большой степени восстановить трудоспо-
собность удается, как правило, у больных с
высокой профессиональной квалификацией.
Как и прежде, большое внимание уделяет-
ся психологической пригодности больных, ко-
торую рассматривают в качестве важнейшей
предпосылки успешного лечения. Для больных,
не способных соблюдать диетические рекомен-
дации, заботиться о сосудистом доступе, акку-
ратно принимать антикоагулянты, антигипер-
тензивные препараты, более перспективна
трансплантация почки. Существенно хуже ре-
зультаты лечения больных, слишком ушедших
в свое заболевание, не имеющих личных или
644
общественных целей, воплощение которых в
жизнь прямо связано с самочувствием и опре-
деляет качество жизни больных. Например,
данные опроса в Москве 269 диализных паци-
ентов показали, что после начала гемодиализа
продолжают трудиться на прежней или облег-
ченной работе только 14 % из числа опрошен-
ных (до начала работало 243 человека), а 81 %
не работает по состоянию здоровья.
С учетом этих и упоминавшихся выше эко-
номических предпосылок трансплантацию поч-
ки необходимо рассматривать в качестве опти-
мального метода лечения терминальной уремии.
Хронический гемодиализ и другие методы за-
мещающей терапии применяют больным, ко-
торым по каким-то причинам трансплантация
почки не показана (преклонный возраст, ано-
малии мочевой системы, высокий титр пред-
существующих антител и т.д.).
В настоящее время гемодиализ и трансплан-
тация почек считаются взаимно дополняющи-
ми друг друга методами лечения больных с тер-
минальной почечной недостаточностью. Успеш-
ная трансплантация невозможна без поставлен-
ного на современный уровень хронического
гемодиализа, который необходим не только для
подготовки больного к операции, но и для
лечения его в послеоперационном периоде.
Значение гемодиализа особенно велико при
трансплантации трупной почки, когда зачастую
требуется многократное проведение гемодиали-
за как в предоперационном периоде (прежде
чем удастся подобрать подходящего донора),
так и после операции, если вследствие длитель-
ной ишемии в трансплантате развиваются яв-
ления острой почечной недостаточности. Лече-
ние гемодиализом вновь становится необходи-
мым после отторжения почечного трансплан-
тата. Вместе с тем удачная трансплантация поч-
ки обеспечивает больным более полную степень
реабилитации и лучшее «качество жизни», чем
гемодиализ.
39.5.4. Другие методы лечения ХПН
39.5.4.1. Перитонеальный диализ
Для лечения больных с ТПН наряду с гемоди-
ализом и трансплантацией почки все чаще в
качестве первого метода лечения используют
перитонеальный диализ (ПД). Например, в Ве-
ликобритании его широкое применение в се-
редине 80-х годов позволило за короткий срок
удвоить число диализных больных.
ПД, как и гемодиализ, служит для удаления
из организма креатинина, мочевины и других
веществ, накапливающихся в организме при
уремии, однако роль полупроницаемой мемб-
раны, через которую эти вещества диффунди-
руют в диализирующий раствор, выполняет
брюшина. Обычно 2 л диализата с различной
периодичностью через специальный катетер
вводят и удаляют из брюшной полости. Упаков-
ки стерильного диализата, изготавливаемые
промышленностью, содержат Na (132 мэкв/л),
Са (2,5 мэкв/л), Mg (0,5 мэкв/л), лактата 40 и
глюкозу в различной концентрации (1,5; 2,5 и
4,25 мг/дл), что изменяет осмолярность раство-
ра (344; 395 и 483 мосм/л) и позволяет регу-
лировать величину ультрафильтрации. Перед
стерилизацией для предотвращения карамели-
зации глюкозы в диализат добавляют НО и ко-
нечная pH раствора обычно бывает меньше 6,0,
что в конечном итоге неблагоприятно влияет
на свойства брюшины.
Исторически первой разновидностью ПД
был интермиттирующий перитонеальный диа-
лиз (ИПД), который на современном этапе
проводят 2 раза в неделю по 20 ч с автомати-
ческой сменой порций диализата каждые 30
мин. Между процедурами брюшная полость
остается пустой.
Дневной амбулаторный перитонеальный
диализ (ДАПД) продолжается 12—16 ч со сме-
ной порций раствора через 3—4 ч. Процедуры
ночного интермиттирующего перитонеального
диализа (НИПД) длятся 8—12 ч каждую ночь
и осуществляются специальным циклером. При
укороченном режиме (8—10 ч) дополнительно
назначают одну дневную смену диализата.
Наиболее распространен постоянный ам-
булаторный перитонеальный диализ (ПАПД),
при котором раствор в брюшной полости сме-
няют через 6 ч (в ночное время интервал боль-
ше), а в брюшной полости постоянно находит-
ся диализат. Последнее обстоятельство помога-
ет избегать свойственных гемодиализу и ИПД
колебаний уровня мочевины и креатинина в
крови больных, поддерживать постоянным вод-
но-электролитный баланс, легче контролиро-
вать гиперфосфатемию и предупреждать эпизо-
ды гиперкалиемии, несмотря на свободную в
отношении калия диету. Вариантами ПАПД
являются постоянный циклический перитоне-
альный диализ (ПЦПД), при котором 3 смены
диализата выполняют ночью с помощью цик-
лера, и ночной приливной (tidal) перитонеаль-
ный диализ (НППД), во время которого мно-
гократно обменивается примерно половина
находящегося в брюшной полости диализата.
Применение автоматизированного ПД и НППД
позволяет интенсифицировать лечение.
В отличие от гемодиализа, элиминационную
эффективность которого можно повысить, уве-
личивая площадь гемодиализатора, скорость
кровотока и диализирующего раствора, возмож-
ности влиять на эффективность ПД ограниче-
ны и касаются в основном количества диали-
зата. Поэтому в обеспечении адекватности ПД
важную роль играет остаточная функция почек
и, хотя показания для гемодиализа и ПД оди-
наковы, последний следует начинать при со-
хранном диурезе и более низких значениях кре-
атинина сыворотки. Утрата остаточной функции
почек и нарушение транспортных характерис-
тик брюшины являются причинами ежегодно-
го перевода 10 % больных с ПД на хроничес-
кий гемодиализ.
Противопоказаниями для начала ПД служат
спаечный процесс в брюшной полости, нали-
чие абдоминальной грыжи, большая масса тела
при отсутствии остаточной функции почек.
Лечение ПД предпочтительнее гемодиализа
у детей, у которых трудно обеспечить сосудис-
тый доступ, у пожилых, у больных с нестабиль-
ной гемодинамикой и диабетом, у которых
применяемый во время гемодиализа гепарин
способен усугубить проявления диабетической
ретинопатии.
У больных на ПД практически отсутствуют
кровопотери, вследствие чего у них ниже вы-
раженность анемии, легче регулируется артери-
альное давление, диализирующий раствор мож-
но менять не только в стационаре и дома, но
и в других условиях, что делает больных мо-
бильными и улучшает качество их жизни.
Вместе с тем лечение ПД не свободно от
осложнений, важнейшими из которых являются
перитонит, бактериальный, грибковый, хими-
ческий, осложнения, обусловленные катетером
(его дислокация, нарушение проходимости,
инфекция выходного отверстия, колонизация
микробной флорой), нарушение транспортных
и ультрафильтрационных характеристик брю-
шины, различные метаболические расстройства
в связи с ежесуточным поступлением в орга-
низм 200,0—400,0 г глюкозы. Как свидетельству-
ют литературные и собственные данные (табл.
39.3), это усугубляет свойственные уремии ли-
пидные нарушения, способствуя различным
сердечно-сосудистым катастрофам.
Из 107 больных, лечившихся в отделении
перитонеального диализа Больницы им. С.П.Бот-
кина в течение 4 лет, умерло 14, в том числе 5
от острого нарушения мозгового кровообраще-
ния и 5 от острого инфаркта миокарда. Трое
перенесли нефатальный инфаркт миокарда.
Особенно часто сосудистые осложнения возни-
кали у больных сахарным диабетом. У 2 из них
развилась гангрена нижних конечностей, потре-
бовавшая у одного ампутации большого паль-
ца правой стопы и у второго — ампутации ле-
вой ноги до верхней трети бедра, у 4 диагнос-
тирована диабетическая стопа, 1 больной пол-
ностью потерял зрение на фоне прогрессиро-
вания диабетической ретинопатии.
645
Таблица 39.3 Динамика липидного спектра сыворотки крови у больных на ПАПД
Показатели, мг/дл Срок лечения, мес
0 (п = 19) 12 (п = 19) 24 (п = 12) 36 (п = 10)
ОХ (общий холестерин) 232,8±39,9 248,1+60 254,7+57,8 292±54,6 (Р < 0,01)
ТГ (триглицериды) 130,9+49,8 157,5±89,4 204,7±96,4 243,6±120 (Р < 0,01)
ЛПВП (липопротеиды высокой плотности) 60,4±22,4 66,5±25,8 49,1 ±23,2 34,6±5,8 (Р < 0,01)
ЛОНП (липопротеиды очень низкой плотности) 26,1+9,9 31,5±17,9 41,1 ±19,2 48,7±24,1 (р < 0,01)
ЛПНП (липопротеиды низкой плотности) 146,1 ±35,5 150±59,5 164,3±51,6 208,8±38,8 (р < 0,01)
ИА (индекс атерогенности) 2,8 2,7 4,2 7,4
Р — достоверность различия в сравнении с исходным уровнем.
Попытки замены глюкозы в диализирующем
растворе другими осмотически активными ве-
ществами не получили широкого промышлен-
ного внедрения в основном из-за высокой сто-
имости, однако последняя все же заметно ниже
стоимости гемодиализа, поскольку не требует-
ся первоначальных затрат на оборудование.
Эпизоды перитонита, чаще всего вызываемые
кокковой флорой, клинически проявляются
болями в животе, повышением температуры,
помутнением эвакуируемого из брюшной по-
лости диализата. Перитонит лечат внутрибрю-
шинным введением антибиотиков первоначаль-
но широкого спектра, а после получения дан-
ных посева — с учетом чувствительности вы-
деленного штамма. При грибковых перитонитах,
плохо поддающихся даже современным анти-
фунгинальным средствам, почти в 100 % слу-
чаев приходится заменять катетер. Частоту пе-
ритонитов, которая пропорциональна кратно-
сти доступа к брюшной полости, пытаются
уменьшить применением специальных коннек-
торов, устройств для смены порций диализа-
та, тщательным обучением больных, самосто-
ятельно проводящих эту процедуру.
Наиболее тяжелым осложнением, препят-
ствующим продолжению ПАПД, является, к
счастью, редко встречающийся склерозирующий
перитонит, заканчивающийся летально у 50—
95 % больных из-за кишечной непроходимости.
В литературе также описано 6 случаев каль-
цификации брюшины у больных, находящих-
ся на ПАПД, развитие которой связывают с
длительно существующим гиперпаратиреозом
[Farmer С. et al., 1998].
Выживаемость больных, леченных с помо-
щью ПАПД и постоянного циклического пе-
ритонеального диализа, с учетом возраста, со-
путствующих заболеваний и других факторов,
в первые 2 года лечения превосходит выжива-
емость больных, находящихся на гемодиализе
[Fenton S. et al., 1997; Foley R. et al., 1998]. Это
обстоятельство в сочетании с меньшей стоимо-
стью лечения делает ПД более привлекатель-
ным, чем гемодиализ, первичным методом за-
мещающей терапии не только для определен-
ных категорий пациентов (дети, пожилые,
больные диабетом), но и для всех больных,
находящихся на диализе.
В конце 1996 г. 85,2 % больных, находивших-
ся на диализной терапии в Европе, лечились
гемодиализом и 14,8 % — перитонеальным
диализом. В странах Южной Америки, напри-
мер в Мексике, превалирует ПД.
39.5.4.2. Гемофильтрация, гемодиафильтрация
Другие методы хронической замещающей тера-
пии, бывшие популярными 10—15 лет назад, —
гемофильтрация (ГФ), гемодиафильтрация
(ГДФ) в значительной степени утратили свое
значение.
Например, в Европе, по данным EDTA,
только 1,8 % больных терминальной уремией
лечились ГФ. В Дании, Великобритании и
Швейцарии в 1994 г. ГФ не значилась среди
используемых методов заместительной терапии,
а частота применения ГДФ составляла 0, 0 и
3%.
646
В основе гемодиализа, как упоминалось,
лежат процессы диффузии в силу концентра-
ционного градиента преимущественно низко-
молекулярных веществ через полупроницаемую
мембрану. В то же время человеческая почка
под влиянием гидростатического давления с
одинаковой эффективностью очищает кровь
как от креатинина (мол. масса ИЗ), так и от
инулина (мол. масса 5200). Аналогичный эф-
фект наблюдают и при ГФ, во время которой
жидкая часть крови фильтруется через высо-
копроницаемые мембраны со скоростью 70—
80 мл/мин при трансмембранном градиенте
гидростатического давления, равном 500 мм
рт.ст. За 4 ч процедуры ГФ из организма эли-
минируется и возмещается 18—20 л жидкости
(раствор Рингера).
Поскольку повышение содержания общего
белка сыворотки и гематокрит снижают вели-
чину ультрафильтрации, часть жидкости пред-
почтительнее вводить до начала или в самом
начале процедуры.
Клиренс веществ при ГФ зависит от ско-
рости ультрафильтра и коэффициента прони-
цаемости мембраны, который представляет
собой соотношение концентрации данного
вещества в плазме и ультрафильтрате. Значе-
ния коэффициента колеблются от 1,0 до 0,
когда вещество практически не проходит че-
рез мембрану. В мембранах, чаще всего исполь-
зуемых для ГФ, коэффициент проницаемости
для витамина В с мол. м. 1200 равен 1,0, а
для инулина — 0,8. Альбумин не проходит че-
рез мембрану, его коэффициент проницаемо-
сти равен 0.
Во время ГФ клиренс мочевины в зависи-
мости от скорости кровотока и способа введе-
ния замещающего раствора (пост- или предди-
люция) колеблется от 60 до 200 мл/мин (в
среднем 140 мл/мин), но остается более низ-
ким, чем во время гемодиализа, электролитный
состав плазмы практически не изменяется, за
исключением некоторого повышения содержа-
ния кальция и уменьшения хлора и фосфора;
в ультрафильтрате обнаруживают большое ко-
личество средних молекул, а их концентрации
в сыворотке уменьшаются.
С ультрафильтратом теряются белок (до 10 г
за процедуру), аминокислоты (6,5 г), некото-
рые гормоны (тестостерон, гастрин, паратгор-
мон, гастроинтестинальный пептид, соматоми-
дин В), однако уровень этих гормонов в плаз-
ме остается неизмененным, что свидетельствует
о значительных секреторных возможностях же-
лез, продуцирующих эти гормоны. Гормон ро-
ста, кортизон и тиреотропный гормон в ульт-
рафильтрате не находят. За счет элиминации
липидов и гастроинтестинального пептида, сти-
мулирующего секрецию инсулина у больных,
нормализуется содержание липидов в сыворот-
ке, что имеет значение для предупреждения
развития атеросклероза.
У больных даже с рефрактерной к гемодиа-
лизу гипертонией в течение 1—7 мес лечения
гемофильтрацией (ГФ) снижается активность
ренина в плазме и нормализуется АД, хотя вне-
клеточный объем существенно не меняется.
Таким образом, дегидратация во время ГФ до-
стигается удалением не внеклеточной, а внут-
риклеточной жидкости.
Во время ГФ, несмотря на такую же, как
при гемодиализе, нагрузку ацетатом, оказыва-
ющим сосудорасширяющее действие, общее
периферическое сопротивление не уменьшает-
ся, а при выведении жидкости скорость воспол-
нения объема внутрисосудистой жидкости бо-
лее высокая. Учитывая изложенное, проводить
ГФ целесообразно не только при гипертонии,
рефрактерной к лекарственному лечению, но
и при нестабильной гемодинамике, диабете с
симпатической нейропатией, склонностью к
снижению АД, при выраженном ацидозе (по-
скольку при ГФ лучше, чем во время гемоди-
ализа, поддерживается кислотно-основной ба-
ланс), а также при гиперпаратиреозе.
В то же время у больных ХПН, длительно
лечившихся ГФ, повышается содержание в
крови мочевины, креатинина и мочевой кис-
лоты по сравнению с этими показателями у
больных, находящихся на гемодиализе. Тем не
менее 5-летняя выживаемость пациентов моло-
дого возраста, получающих гемодиализ и ГФ,
примерно одинаковая, однако степень реаби-
литации у больных после ГФ выше, чем у боль-
ных, которым проводили гемодиализ, за счет
уменьшения сроков госпитализации.
Основными причинами смерти больных пос-
ле ГФ и гемодиализа являются сердечно-сосу-
дистые и цереброваскулярные осложнения.
ГФ достаточно дорогая процедура, поскольку
требует большего количества замещающих сте-
рильных растворов. В последнее время предло-
жены методы регенерации ультрафильтрата с
его последующим введением больному. Это су-
щественно уменьшает стоимость 1 процедуры.
Гемодиафильтрация (ГДФ), в основе которой
лежит одновременный процесс диффузии и кон-
векции, сочетает 2 метода — гемодиализ и ГФ.
ГДФ, проводимая с использованием гемофиль-
тров с высокопроницаемыми мембранами, по-
зволяет удалять из крови вещества как с низ-
кой, так и со среднемолекулярной массой. Уль-
трафильтрат плазмы замещается 8-—18 л стериль-
ного раствора, содержащего электролиты.
Гипертоническая ГДФ, во время которой
замещающий раствор содержит натрий в кон-
центрации от 180 до 220 ммоль/л, практичес-
ки предупреждает уменьшение объема внутри-
647
сосудистой жидкости, а также останавливает
прогрессирование периферической полинейро-
патии [Basile N. et al., 1987, 1988].
Показания к ГДФ по существу такие же, как
к ГФ, она позволяет сократить время проце-
дуры и количество замещающего раствора по
сравнению с ГФ, однако стоимость ГДФ ли-
митирует ее широкое применение.
39.5.5. Хроническая почечная
недостаточность у детей*
Частоту развития ХПН в детском возрасте труд-
но определить, и тем не менее, несмотря на
неоднородность данных в разных странах и в
различные годы, можно предположить, что
ежегодно по крайней мере от 4 до 6 детей на
1 млн детского населения до 15 лет нуждаются
в почечно-заместительной терапии (ПЗТ)
[EDTA, Игнатова М.С., Вельтищев Ю.Е., 1989;
Папаян А.В., Савенкова Н.О., 1997]. С возрас-
том частота развития ХПН у детей увеличива-
ется. В возрастной группе от 0 до 5 лет она со-
ставляет 1,6, у детей от 5 до 10 лет — 4,0, от
10 до 16 лет — 8,1 на 1 млн детского населе-
ния. Поданным US Renal Data Systems, часто-
та развития терминальной стадии ХПН у де-
тей до 19 лет составляет 11 на 1 млн населе-
ния США в год, причем чаще встречается в
возрасте от 15 до 19 лет.
У детей с ХПН наиболее часто выявляют
наследственные и врожденные нефропатии, но
с возрастом характер почечных заболеваний
меняется, и на смену врожденной патологии
приходят приобретенные заболевания почек.
Для периода новорожденности характерны та-
кие пороки развития мочевой системы, как
агенезия или гипоплазия почек, поликистоз,
мегауретер, внутри- и инфрапузырная обструк-
ция, пороки развитая чашечно-лоханочной
системы и структуры почек, кистозные дисп-
лазии. В грудном возрасте сохраняют значение
те же заболевания и присоединяются послед-
ствия перенесенной патологии (гемолитико-
уремический синдром, канальцевый некроз,
тромбоз почечных вен и пр.). В дошкольном и
старшем возрасте все большую роль играют
приобретенные заболевания.
По данным EDTA, среди заболеваний по-
чек, приведших к ТХПН у детей в 1987—1991 г.
в Европе, наибольшее число составили обструк-
тивные уропатии; на долю почечной гипопла-
зии, дисплазии и пиелонефрита приходится
36 %. Далее следуют гломерулопатии — 26 %,
фокально-сегментарный гломерулосклероз с не-
фротическим синдромом — 9,4 %. Наследствен-
* Раздел написан Д. В.Зверевым.
648
ные нефропатии (поликистоз почек, нефро-
нофтиз, цистиноз и пр.) составили 17,3 %,
ГУС - 4,5 %.
Обмен веществ у новорожденных и грудных
детей в 5 раз выше, чем у подростков, и лю-
бые хронические заболевания, особенно ХПН,
сопровождаются выраженными метаболически-
ми нарушениями. Клинически это проявляется
анорексией, рвотой, метаболическим ацидозом,
почечной остеодистрофией, задержкой ум-
ственного развития. При тяжелой степени врож-
денной ХПН указанные симптомы наблюдают
уже с первых месяцев жизни. Поэтому новорож-
денные с гипоплазией почек и обструктивной
уропатией часто нуждаются в интенсивной те-
рапии уже в неонатальном периоде. При оли-
гурии концентрация креатинина в сыворотке
новорожденных может увеличиваться до 450—
900 ммоль/л, но даже при остром повышении
креатинина редко возникает необходимость в
диализе, а объем мочи довольно быстро уве-
личивается. На 3—4-й неделе жизни почки по-
степенно адаптируются к внеутробным услови-
ям, концентрация креатинина снижается обыч-
но до 90—270 ммоль/л. Как правило, развива-
ется полиурия с потерей солей. В этот период
необходим тщательный контроль за балансом
жидкости и электролитов. Это очень сложная
задача, так как на фоне выраженного метабо-
лического ацидоза у таких детей развивается
анорексия, а съеденную пищу они плохо удер-
живают. Для обеспечения адекватного питания
часто требуется кормление через желудочный
зонд. В течение второго полугодия жизни сим-
птомы интоксикации постепенно уменьшают-
ся. Но достигнутое равновесие в обмене очень
хрупкое, и любое интеркуррентное заболевание
приводит к декомпенсации. Артериальное дав-
ление у новорожденных с гипоплазией почек
обычно не повышается. Для детей с ХПН ха-
рактерна мышечная слабость, которая являет-
ся одним из симптомов почечной остеодистро-
фии на фоне нарушения метаболизма витами-
на D. Считается, что периферическая нейропа-
тия очень редко бывает у детей с ХПН, одна-
ко при тяжелых врожденных пороках мочевой
системы возможны также нарушения в ЦНС.
Практически все дети отстают в росте и рече-
вом развитии от умеренной до тяжелой степе-
ни, но нет четкой взаимосвязи между возрас-
том, тяжестью ХПН и степенью этих наруше-
ний [Fennell R.S. et al., 1990]. Очевидно, сама
по себе уремия не является единственной при-
чиной отставания, однако пороки ЦНС клини-
чески проявляются в более поздние сроки на
фоне длительного выживания с помощью ПЗТ.
Клинические проявления почечной остеоди-
строфии в растущем детском организме выра-
жены сильнее, чем у взрослых. У маленьких
детей изменения скелета сходны с поздними
рахитическими (четки, харисонова борозда,
увеличение запястий, лодыжек и костно-хря-
щевых соединений). Деформация конечностей
отмечается чаще в метафизарных зонах, в то
время как типичного искривления диафизарных
отделов длинных костей нет. Довольно редки
краниотабес, а также образование лобных буг-
ров. В школьном и препубертатном возрасте у
детей с ХПН возникают скелетные деформа-
ции типа Х-образного искривления коленных
и девиация локтевых суставов, развивается
«утиная походка». Все эти симптомы обуслов-
лены миопатией и эпифизиолизом.
Эпифизиолиз —- наиболее серьезное ослож-
нение тяжелого гиперпаратиреоидизма и выра-
женной почечной фиброзной остеодистрофии
[Krempien В. et al., 1974]. Интерпретация рент-
генологических проявлений эпифизарной зоны
роста у детей с ХПН из-за отсутствия доста-
точных гистологических исследований долгое
время оставалась затруднительной. Изменения
трактовались как проявления рахита, вызван-
ного дефицитом витамина D или его активных
метаболитов. Однако при ХПН повреждение ме-
тафизов обычно является результатом фиброз-
ного остеита вследствие гиперпаратиреоза. Об-
ласть субэпифизарного просветления на рент-
генограмме — это не хрящевые ткани в зоне
роста, как при витамин-Э-дефицитном рахи-
те, а деминерализация костной ткани или раз-
витие фиброзной ткани в губчатом веществе ме-
тафиза кости [Krempien В. et al., 1974]. В участ-
ках скелета вне зон роста рентгенографические
изменения у детей с уремией принципиально
не отличаются от таковых у взрослых, но их
интенсивность и скорость появления могут быть
значительно выше.
За исключением содержания неорганическо-
го фосфора и щелочной фосфатазы, уровень
которых в крови в детском возрасте выше, хи-
мический состав плазмы у детей при уремии
такой же, как и у взрослых с ХПН. Кальцифи-
каты в мягких тканях и сосудах встречаются у
60 % детей с ТХПН [Milliner V. et al., 1990].
Наиболее часто отложение кальция находят в
легких, миокарде и коронарных артериях.
Принципы профилактики и лечения почеч-
ной остеодистрофии у детей такие же, как и у
взрослых [Mehls О., Ritz Е., 1987], и заключа-
ются в сочетанном назначении активных мета-
болитов витамина D — 24,25-дигидроокси ви-
тамина D3 в дозе 10—25 мкг/сут вместе с каль-
цитриолом — 1,25(ОН)2 витамином D3 в дозе
0,25—1 мкг/сут или в сочетании с оксидеви-
том — <х(ОН)Э3-дигидроокси витамином D3 —
0,25—1,5 мкг/сут, а также в назначении фос-
фатсвязывающих препаратов — карбоната или
ацетата Са. Подобная терапия позволяет в боль-
шинстве случаев корригировать содержание Са
и Р в крови и нормализовать уровень паратгор-
мона [Цыбышева А.К., 1998]. При повышенном
содержании в плазме паратиреоидного гормо-
на предложено проведение пульс-терапии
1,25(ОН)2 витамином D3 в дозе 1—2 мг 3 раза
в неделю, причем отмечено, что доза кальци-
триола не коррелирует с размером и массой
тела [Klaus G. et al., 1994] и ее подбирают эм-
пирически у каждого конкретного пациента на
основе анализа эффекта терапии — уровню сы-
вороточного паратиреоидного гормона. У паци-
ентов, у которых развилась гиперкальциемия и
нет адекватного ответа на терапию в течение
3 мес, можно предполагать гиперплазию пара-
щитовидных желез, и тогда необходима их ча-
стичная резекция. Необходимо стремиться под-
держивать нормальную концентрацию сыворо-
точного фосфора и кальция, так как гиперфос-
фатемия и гипокальциемия стимулируют про-
дукцию паратиреоидного гормона [Brown et al.,
1993; Kilav et al., 1995а]. Длительное примене-
ние высоких доз кальцитриола может способ-
ствовать адинамическому или апластическому
заболеванию костей. Клинической альтернати-
вой такой терапевтической тактики являются
эпифизиолиз бедренных костей и выраженные
костные деформации. Ранние хирургические
вмешательства по коррекции эпифизиолиза
головки бедренной кости с использованием
таких механических приспособлений, как про-
волоки, гвозди и винты, приводят к катастро-
фическим результатам. В настоящее время реко-
мендуется сначала корригировать метаболичес-
кие нарушения в кости назначением витамина
D3, с помощью которого удается стабилизиро-
вать положение даже «соскользнувшей» голов-
ки бедренной кости за несколько недель. От хи-
рургической коррекции необходимо воздержи-
ваться до тех пор, пока не будет достигнута по-
ложительная рентгенологическая динамика те-
чения остеодистрофии. После этого может быть
выполнена корригирующая остеотомия для
предотвращения артрозов и некрозов головки
бедренной кости [Mehls О. et al., 1981].
У детей при снижении скорости клубочковой
фильтрации (СКФ) ниже 35 мл/мин/1,73 м2
заметно снижен уровень гемоглобина (менее
120 г/л). При одинаковой степени почечной не-
достаточности концентрация гемоглобина у
взрослых больше, чем у детей [Scharer К.,
Muller-Wiefel D.E., 1987]. При уровне креати-
нина сыворотки у детей 350 мкмоль/л содер-
жание гемоглобина у них будет около 90 г/л,
при 900 мкмоль/л — 65 г/л. У взрослых при том
же уровне креатинина гемоглобин выше при-
близительно на 20 г/л.
Анемия является основной причиной асте-
нии, повышенной утомляемости и снижения
649
аппетита у детей с ХПН. Коррекция анемии в
какой-то степени снимает эти проблемы. Ане-
мию можно предупредить назначением реком-
бинантного эритропоэтина в дозах 100—400 ед
на 1 кг массы тела в неделю. Как и у взрослых,
при дефиците железа последнее назначают пе-
рорально и даже внутривенно.
У большинства детей по мере нарастания
ХПН развивается та или иная степень артери-
альной гипертонии (АГ). K.Scharer и соавт.
(1981) при обследовании 119 детей с умерен-
ной и тяжелой ХПН установили, что у 79 %
из них АД было повышено и они нуждались в
медикаментозной терапии. Частота и тяжесть АГ
варьирует в зависимости от причины заболева-
ния, стадии ХПН и характера терапии. Тенден-
ция к повышению АД при гломерулярной па-
тологии, ГУС и рефлюкс-нефропатии выраже-
на больше, чем при врожденных заболеваниях
почек. В терминальной стадии ХПН АД редко
остается в норме. Среди детей, находящихся на
регулярном гемодиализе, 40 % нуждаются в
антигипертензивной терапии, однако с увели-
чением продолжительности лечения эта потреб-
ность уменьшается. АД и после трансплантации
повышено у 60—90 % пациентов. У детей с
патологией почек часто возникает клиника ги-
пертонического криза, это осложнение может
развиться даже при «умеренном» повышении
АД (до 150/100 мм рт.ст.).
По данным EDTA, гипертония встречается
у '/3 детей на постоянном амбулаторном пери-
тонеальном диализе (ПАПД). У детей на гемо-
диализе чаще отмечается диализзависимая ги-
пертония: если до диализа АД повышено при-
близительно у 50 % детей, то после сеанса
диализа — у 15 %. Перегрузка жидкостью (до
20 % массы тела) — обычное осложнение для
детей, находящихся на программном гемодиа-
лизе, так как потребление жидкости у них выше
по сравнению со взрослыми. Удаление жидко-
сти в объеме более 10 % массы тела во время
одного сеанса гемодиализа весьма затруднитель-
но. Если удается справиться с гипергидратаци-
ей, что очень затруднительно из-за жажды и
недисциплинированности детей, то артериаль-
ную гипертонию удается контролировать обыч-
ными антигипертензивными средствами (соче-
тание пролонгированных ингибиторов АПФ с
{3-блокаторами и блокаторами кальциевых ка-
налов). При этом с учетом всей необходимой
обшей терапии ребенку или подростку на диа-
лизе иногда требуется принимать 10 таблеток
и более в сутки.
Кардиоваскулярные заболевания являются
важной причиной смертности у детей с ХПН,
46 % всех осложнений у больных на ГД и у
детей на ПАПД [Rizzoni et al., 1990].
Такие типичные для взрослых заболевания,
650
как атеросклероз, ишемическая болезнь серд-
ца и бактериальный эндокардит, редко встре-
чаются в детском возрасте, но сердечная недо-
статочность и перикардит — довольно частое
явление у детей с уремией. Как правило, зас-
тойная сердечная недостаточность осложняет
течение ХПН после того, как креатинин сы-
воротки достигает 450 мкмоль/л, и выявляется
у 24 % детей на диализе [Coren A. et al., 1993].
Кардиомегалию находят почти у 2/3 детей на ге-
модиализе, но она является физиологической
адаптацией на повышенный ударный объем, а
не отражением истинной дилатации сердца.
Возможно также нарушение и диастолической
функции желудочков [Bosch A. et al., 1990].
У детей реже, чем у взрослых, выявляют
изменения на ЭКГ, однако исследования по-
казали, что они не столь необычны для детей.
Признаки гипертрофии левого желудочка име-
ются у 1/3 детей, особенно при артериальной
гипертонии [Morris et al., 1993]. По мнению
авторов, по ЭКГ трудно определить степень
гипертрофии левого желудочка, и необходимо
выполнение Эхо-КГ. Довольно типично нали-
чие шумов в сердце, которые могут имитиро-
вать врожденные заболевания сердца. Эти
шумы, по-видимому, обусловлены сочетанием
артериальной гипертонии, тяжелой анемии и
гипергидратации. Частота уремического пери-
кардита у детей при ХПН может достигать 10 %
и зависит от качества ПЗТ. Профилактика и
лечение сердечных осложнений такие же, как
и у взрослых.
ХПН обычно осложняется замедлением или
прекращением роста, несмотря на соответству-
ющее лечение и успешную трансплантацию
почки. В число основных причин задержки ро-
ста при ХПН входят первичные заболевания
почек, недостаточное питание, остеодистро-
фия, эндокринные нарушения и ацидоз. На
разных стадиях развития ребенка каждый из
этих факторов вносит свой вклад.
Процесс скелетного роста делят на 3 фазы:
фазу младенчества, фазу детства и пубертатную
фазу. В младенческой фазе, которая охватывает
первый год жизни, линейный рост весьма ин-
тенсивен, затем он снижается; последующий
период роста прерывается пубертатным скачком.
У девочек он начинается примерно в 11 лет, у
мальчиков — на 2 года позже. Следовательно,
дети в грудном и пубертатном периодах наи-
более подвержены повреждающим воздействи-
ям на рост.
На первом году жизни значительная доля
энергетических затрат расходуется на рост, и
любое заболевание, сопровождающееся наруше-
нием питания и сокращением энергетических
поступлений в этот период, существенно вли-
яет на рост. В связи с этим при лечении ребен-
ка в данном периоде основной задачей являет-
ся организация рационального питания, осно-
ванного на принципе адекватного обеспечения
энергией и ограничения в белке. При вскарм-
ливании нормального ребенка материнским
молоком достигается максимально сбалансиро-
ванное питание, которое обусловливает низкую
экскреторную нагрузку, так как избыток нут-
риентов расходуется на рост и построение тела.
Если во время первой фазы на показатели
роста главным образом влияет поступление пи-
тательных веществ, то во второй — скорость
роста в основном связана с действием гормо-
на роста. Скорость роста в этом периоде часто
не нарушена, а отставание является следстви-
ем замедления роста в первой фазе. Этим объяс-
няется интерес исследователей к уровню сек-
реции гормона роста или эффективности его
действия при ХПН.
Гормон роста (ГР) — пептидный гормон с
молекулярной массой 21 500, секретируемый
передней долей гипофиза. Его синтез контро-
лируется гипоталамическим гормоном ГР-рили-
зинг-гормоном, он стимулирует продукцию ин-
сулиноподобного фактора роста 1 (соматомедин
С) печенью и другими периферическими тка-
нями, является анаболическим и вызывает по-
вышенную ретенцию белка. Во многих работах
показано влияние рекомбинантного человечес-
кого гормона роста (РЧГР) на скорость роста
у детей с ХПН, хотя полностью механизм этого
влияния остается неясным. Эффективность ле-
чения РЧГР была также подтверждена у боль-
шой группы детей с задержкой роста с претер-
минальной ХПН [Fine R.N. et al., 1996]. Семь
из 8 пациентов, лечившихся РЧГР более 36
мес, достигли соответствующего возрасту рос-
та, но дети на диализе хуже отвечали на лече-
ние РЧГР [Wuhl Е., 1996].
Дети препубертатного периода с терминаль-
ной ХПН как на перитонеальном диализе, так
и на гемодиализе также отвечали на лечение
РЧГР [Mehls О., Broyer М., 1994], хотя ответ
был менее выражен, чем у детей с предтерми-
нальной ХПН. Причина этих различий не совсем
понята; это может быть связано, по крайней
мере частично, с более старшим возрастом па-
циентов в диализной группе и тяжестью уремии
у этих детей. Для достижения оптимального эф-
фекта лечение РЧГР необходимо начинать в
раннем возрасте и в додиализный период.
Доза РЧГР в упомянутых исследованиях со-
ставила около 1 МЕД/кг или 0,5 мг/кг подкож-
но 1 раз в неделю.
Одними из осложнений уремии являются
снижение половой функции и замедление по-
лового созревания.
По данным G.Rizzoni и соавт. (1986), от '/
до '/2 всех детей пубертатного возраста с ТХПН
имеют отставание в развитии половых органов
и задержку полового созревания. Результаты
исследований свидетельствуют о том, что выз-
ванные уремией повреждения репродуктивной
системы, наступившие до созревания гонад и
во время полового созревания, вызывают боль-
шие изменения в экзокринной тестикулярной
функции, чем при развитии ХПН после созре-
вания гонад. Однако при долгосрочных наблю-
дениях отмечено, что если ребенок в пубертат-
ном периоде длительное время страдал ХПН,
то даже в этом случае в дальнейшем возможно
восстановление эндокринной функции гонад
после успешной трансплантации почки.
Патогенез задержки полового развития у
детей с ХПН до сих пор остается неясным: то
ли пубертатное развитие задерживает недоста-
точность выработки андрогенов, то ли это след-
ствие неадекватной стимуляции развивающей-
ся репродуктивной системы. Возможно, уремия
нарушает центральные механизмы, контроли-
рующие пульсирующее высвобождение гонадо-
тропин-рилизинг-гормона.
По данным EDTA, в 1992 г. в Европе при-
мерно 2000 детей моложе 15 лет находились на
ПЗТ: 25 % - на ГД, 18 % - на ПД, 57 %
перенесли трансплантацию [Loirat С. et al.,
1994].
В настоящее время не существует общих
противопоказаний к диализу и трансплантации
даже у очень маленьких детей, так как техни-
чески диализ можно провести и новорожден-
ному [Bunchman Т.Е., 1995]. Однако диализную
терапию у детей с ХПН начинают только с
целью последующей трансплантации почек. На
каком бы виде диализа дети ни находились, их
длительная реабилитация и жизнь на диализе
невозможны.
До начала 80-х годов ГД во всем мире был
основным видом ПЗТ у детей.
Основные принципы проведения гемодиали-
за у детей такие же, как у взрослых, но име-
ются некоторые особенности в технике прове-
дения и требованиях к аппаратуре. Большой
проблемой у маленьких пациентов является
создание сосудистого доступа. У младенцев для
хронического ГД может быть использован си-
ликоновый катетер с дакроновой манжеткой с
внутренним диаметром от 1,6 до 2,6 мм. Кате-
тер вводят через подключичную или внутрен-
нюю яремную вену, манжетку фиксируют в
подкожном канале. Эти катетеры могут оста-
ваться на месте довольно длительное время.
У детей грудного возраста с массой тела около
10 кг уже можно сформировать петлевую фис-
тулу из v.saphena с созданием анастомоза меж-
ду дистальным ее концом в бок a.femoralis.
У старших детей обычно формируют артерио-
венозную фистулу Cimino — Brescia. Для полу-
651
чения адекватного потока крови требуются фи-
стульные иглы размеров 18—14. При очень ко-
роткой области, доступной для пункции, впол-
не адекватным может быть проведение диали-
за по системе «единственная игла». Экстракор-
поральный объем не должен превышать 8 мл/кг
МТ или 10 % ОЦК, поэтому для проведения
ГД у детей требуются специальные педиатри-
ческие кровопроводящие системы и диализато-
ры с малым объемом заполнения и площадью
поверхности от 0,25 до 0,9 м2. Нестабильная ге-
модинамика — одно из наиболее частых ослож-
нений при проведении ГД у детей. В целях пре-
дотвращения эпизодов гипотонии необходимы
бикарбонатный диализ, индивидуально подо-
бранный и точно контролируемый режим ульт-
рафильтрации. Желательно, чтобы объем ульт-
рафильтрации за 1 сеанс не превышал 5 % МТ.
При необходимости удалить большее количество
воды следует прибегать к раздельной ультра-
фильтрации или гемофильтрации. Обычная про-
должительность сеанса диализа у ребенка — 3—
4 ч с кратностью 3 раза в неделю.
Острые осложнения у детей такие же, как у
взрослых, но у них чаще развивается синдром
нарушенного равновесия (disequilibrium syndro-
me), поэтому при вхождении в диализную про-
грамму первые сеансы диализа следует прово-
дить ежедневно по 2 ч и с небольшим пото-
ком по крови. Уровень натрия в диализате дол-
жен быть немного выше, чем в плазме.
В 80-е годы отмечается стремительный рост
доли ПД среди других видов ПЗТ. Впервые у
ребенка постоянный амбулаторный перитоне-
альный диализ (ПАПД) был применен в То-
ронто в 1978 г. В Европе к 1982 г. было зареги-
стрировано 156 детей на ПАПД. К 1995 г. из 2000
детей, получавших диализ в США, 65 % были
на ПД. У детей грудного возраста с ХПН в 97 %
случаев применяется ПД. Это можно объяснить
простотой, безопасностью, эффективностью,
относительной дешевизной метода и тем фак-
том, что усовершенствование систем для ПАПД
позволило снизить частоту перитонитов — наи-
более частого и опасного осложнения ПД — с
1 случая за 1 мес лечения в 1970 г. до 1 случая
за 35 мес (по данным 1990 г.). У детей частота
перитонита выше — 1 раз за 16,5 мес лечения
ПАПД [Venina Е., 1995]. Относительно высокий
риск перитонита в детском возрасте может быть
приемлем ввиду более короткого времени ожи-
дания трансплантации почек.
У детей площадь брюшины по отношению
к массе тела больше, чем у взрослых, однако
клиренс очищения по мочевине примерно тот
же. Это в какой-то степени связано с тем, что
у детей значительно больше объем общей воды
организма, и, следовательно, для снижения
уровня мочевины в крови необходимо пропус-
652
тить через мембрану больший объем воды. При
соответствующем пересчете площадь эффектив-
ной мембранной поверхности и ее клиренс для
большинства низкомолекулярных растворов
практически одинаковые у взрослых и детей.
Однако у детей в связи с относительно боль-
шим объемом залива (объем одного залива 35—
45 мл на 1 кг массы тела) ПД все же эффек-
тивнее, чем у взрослых.
Наблюдение за детьми с ХПН на ПАПД
подтвердило теоретические предпосылки, ко-
торые определяются биологической сущностью
ПД. Действительно, у больных исчезают про-
блемы, связанные с биосовместимостью мем-
бран, поддерживается сравнительно постоян-
ный электролитный, водный и осмотический
баланс организма. Возможно поэтому у больных
с ХПН на ПД более длительно сохраняется
остаточная функция почек, чем на ГД.
Цикличность ГД приводит к резким перепа-
дам в наполнении кровеносного русла, в меж-
клеточном и внутриклеточном пространствах,
к быстрому падению осмолярности крови, мас-
сивному поступлению ацетата в кровь (при
ацетатном ГД).
Клинически это проявляется:
• во время ГД — ухудшением самочувствия
больного, тошнотой и рвотой, эпизодами
гипотензии, которые во время ГД могут быть
очень тяжелыми вплоть до коллапса с нару-
шением мозгового кровообращения. Особен-
но тщательного контроля требует проведе-
ние ГД у детей. Несмотря на регулярно по-
вторяющийся характер процедуры, каждый
сеанс ГД — стресс для ребенка, связанный
с болевыми ощущениями (пункция фисту-
лы, тошнота, головная боль и пр.);
• после диализа и в междиализном периоде у
детей чаще, чем у взрослых, бывает синд-
ром нарушенного равновесия, они тяжелее
переносят жажду и чаще страдают от чрез-
мерного увеличения массы тела и артериаль-
ной гипертонии.
У детей на ПАПД практически не бывает
внезапной гипотензии и синдрома нарушенного
равновесия. Сама процедура смены пластиковых
мешков с раствором для ПД, как правило, без-
болезненна, происходит дома, в привычной
обстановке, и ее могут выполнять родители.
Средняя длительность обучения родителей при-
мерно 1—2 нед. Периодически (1 раз в 2 нед)
производят анализы крови и осмотр ребенка
врачом в клинике. Для ПАПД не требуется
сложного электронного оборудования, частого
посещения больницы. В связи с этим для детей,
живущих на далеком расстоянии от диализно-
го центра, ПАПД предпочтительней ГД.
Важным преимуществом является тот факт,
что у детей при переходе с ГД на ПД увели-
чивается содержание гемоглобина. Это объясня-
ется уменьшением кровопотери и гемолиза во
время сеансов ГД, лучшим удалением токси-
нов с высокой молекулярной массой.
ПАПД позволяет жить практически без ог-
раничения в диете, что важно для детей, ко-
торые трудно соблюдают диету и водный ре-
жим.
Обеспечение адекватного сосудистого досту-
па для проведения хронического ГД — очень
сложная хирургическая проблема, иногда это
калечащая операция, а риск ее часто неоправ-
данно высок. В то же время перитонеальный
доступ даже у новорожденных легко выполним,
если же возникают осложнения, связанные с
катетером, то они, как правило, не опасны для
жизни.
Суммируя изложенное выше, можно ска-
зать, что ПД является терапией выбора для
детей, ожидающих пересадки почки, и тем бо-
лее для тех, кому трансплантация временно не
показана.
Результаты диализа и трансплантации у де-
тей немного лучше, чем у взрослых. Трехлет-
няя выживаемость после первой трупной транс-
плантации возросла во всех странах с 89 % в
1980—1985 гг. до 94 % в 1986—1991 гг. Увеличе-
ние выживаемости наблюдалось во всех возра-
стных группах, хотя смертность остается не-
сколько выше у детей младшей группы.
Литература
К разделу 39.1—39.5.4
Ермоленко В.М. Хронический гемодиализ. — М.: Ме-
дицина, 1982. — С. 117—139.
Николаев А.Ю., Клепиков П.В., Лашу тин С. В., Кух-
тевич А.В. Эффективность комбинации эритропоэ-
тина с кальцитриолом у больных с хронической
почечной недостаточностью на программном гемо-
диализе//Тер. арх. — 1995. — № 5. — С. 27—31.
Смирнов А., Козлов В. Клинические проявления ате-
росклероза у больных на гемодиализе//Нефроло-
гия. - 1998. - № 5(2). - С. 68-76.
Шостка Г.Д. Анемия и пути ее коррекции//!? кн.:
Лечение ХПН. - СПб. - 1997. - С. 242-274.
Шостка Г.Д. Анемия при почечной недостаточнос-
ти//Нефрология. — 1997. — № 1. — С. 12—18.
Ahsan N. Intravenous infusion of total dose iron is
superior to oral iron in treatment of anemia in peritoneal
dialysis patients: a single center comparative study//J. Am.
Soc. Nephrol. — 1998. — Vol. 9. — P. 664—668.
Albitar S., Genin R., Fen-Chong M. et al. High-dose
alfacalcidol improves anaemia in patients on haemo-
dialysis//Nephrol. Dial. Transplant. — 1997. — Vol. 12. —
P. 514-518.
Amico G., Gentile M., Fellin G. et al. Effect of dietary
protein restriction of renal failure: a prospective
randomized trial//Nephrol. Dial. Transplant. — 1994. —
Vol. 9 - P. 1590-1593.
Aparicio M., Combe C., Lafage M. et al. Метаболичес-
кие эффекты низкобелковой низкофосфорной дие-
ты у больных с хронической почечной недостаточ-
ностью//Клин. фармакол. и тер. — 1996. — № 5. —
С. 15-18.
Ascer В., Коотеп G., Коортап М. et al. Creatinine
clearance during cimetidine administration for measu-
rement of glomerular filtration rate//Lancet. — 1992. —
Vol. 340. - P. 1326-1329.
Ashley C. The pharmacoeconomics of treating renal
patients//.!. Pharm. Pharmacol. —1998. — Vol. 50. — P. 35.
Bonomini V., Coli L. Feliciangeli G., Nanni A. et al. Long-
term comparative evaluation of synthetic and cellulosis
membranes in dialysis//Int. J. Artif, Organs. — 1994. — Vol.
17. - P. 397-398.
Brenner B., Meyer T., Hostetter T. Dietary protein intake
and the progressive nature of renal disease: the role of
hemodynamically mediated glomerular injury in the
pathogenesis of progressive glomerular sclerosis in ageing
renal ablation and intrinsic renal disease//New Engl. J.
Med. - 1982. - Vol. 307. - P. 6520-659.
BroxA., Zhang F., Guyda EL, Gagnon P. Subtherapeutic
erythropoietin and insulin-like growth factor-1 correct
the anemia of chronic renal failure in the mouse//Kidney
Int. - 1996. - Vol. 50. - P. 937-943.
Coli L., Manna G., Dalmastri V. et al. Evidence of profiled
hemodialysis efficacy in the treatment of intradialytic
hypotension//Int. J. Artif. Organs. — 1998. — Vol. 21. — P.
398-402.
Coresh J., Walser M., Hill S. Survival on dialysis among
chronic renal failure patients treated with a supplemented
low-protein diet//J. Am. Soc. Nephrol. — 1995. — Vol. 6. —
P. 1379-1385.
Cruz D., Mahnensmith R., Brickel H., Perazella M.
Midodrine is effective and safe therapy for intradialytic
hypotension over 8 months of follow-up//Clin.
Nephrol. - 1998. - Vol. 50. - P. 101-107.
Bitter I., Sharp D., McNulty C.A.M., Williams A., Banks
R. et al. A prospective study of central venous hemodialysis
catheter colonization and peripheral bacteremia//Clin.
Nephrol. - 1999. - Vol. 51, N 1. - P. 34-39.
Dolson G. Do potassium deficient diets and K+ removal
by dialysis contribute to the cardiovascular morbidity and
mortality of patients with end stage renal disease?//Int.
J. Artif. Organs. - 1997. - Vol. 20. - P. 134-13.
653
Drueke T, Barany P., Cazzola M. et al. Management of
iron deficiency in renal anemia: guidelines for the
optimal therapeutic approach in erythropoietin-treated
patients//Clin. Neprol. — 1997. — Vol. 48. — P. 1—8.
Ducloux D., Fournier V., Rebibou J. et al. Hyperhomo-
cyst(e)inemia in renal transplant recipients with and
without cyclosporine//Clin. Nephrol. — 1998. — Vol. 49. —
P. 232-233.
Dunea G., Swagel M., Bodiwala U, Arruda J. Intradialytic
oral iron therapy//lnt. J. Artif. Organs. — 1994. — Vol.
17. - P. 261-264.
Eidemark I., Friedberg M., Ladefoged S. et al. Intravenous
versus subcutaneous administration of recombinant
human erythropoietin in patients on haemodialysis and
CAPD//Nephrol. Dial. Transplant. — 1991. — Vol. 7. — P.
526-529.
Erem C., Kulan К., Tuncer C. et al. Cardiac arrhythmias
in patients on maintenance hemodialysis//Acta
Cardiol. - 1997. - Vol. 52. - P. 25-36.
Fantuzzi S,.Caico S., Amatruda O. et al. Hemodialysis-
associated cardiac arrhythmias: a lower risk with
bicarbonate?//Nephron. — 1991. — Vol. 58. — P. 196—
200.
Farmer C., Goldsmith D., Sharpstone P., Kingsswood J.
Maintenance of adequate dialysis in patient with
peritoneal calcification using tidal peritoneal dialysis//
Clin. Nephrol. - 1998. - Vol. 49. - P. 55-58.
Fenton S., Schaubel D., Desmeules M. et al. Hemodialysis
versus peritoneal dialysis: a comparison of adjusted
mortality rates//Am. J. Kidney Dis. — 1997. — Vol. 30. —
P. 334-342.
Fishbane S., Galgano C., Langley R. et al. Reticulocyte
hemoglobin content in the evaluation of iron status of
hemodialysis patients//Kidney Int. — 1997. — Vol. 52. —
P. 217-222.
Fudin R, Jaichenko J., Shostak A., Bennett M., Gotloib L.
Correction of uremic iron deficiency anemia in
Hemodialyzed Patients: a prospective study//Nephron. —
1998. - Vol. 79. - P. 299-305.
Gastaidello K., Vereestraeten A., Nzame-Nze T. et al.
Resistence to erythropoietin in iron-overloaded
hemodialysis patients can be overcome by ascorbic acid
administration//Nephrol. Dial. Transplant. — 1995. — Vol.
10. - Suppl. 6. - P. 44-47.
Gejyo E, Odani S., Yamada T. et al. /?2-Microglobulin: a
new form of amyloid protein associated with chronic
hemodialysis II//Kidney Int. — 1986. — Vol.30. —
P. 385 -390.
Giordano C. Prolongation of survival for decade or more
by low protein diet//In: Giordano C., Friedman E. (eds)
Uremia. Pathobiology of patients treated for ten years
or more. — Milan, 1981. — P. 4—7.
Giovannetti S., Maggiore Q. A low nitrogen diet with
proteins of high biological value for severe chronic
uremia//Lancet. — 1964. — Vol. 1. — P. 1000—1003.
Golan E., Radnay J., Goldman J. et al. Relation between
transferrin saturation index and red cell size and
haemoglobin content in haemodialysis patients//Nephrol.
Dial. Transplant. — 1994. — Vol. 9. — P. 1030—1031.
Granolleras C., Zein A., Oules R. et al. Continuous
administration of intravenous iron during haemodialysis
//Nephrol. Dial. Transplant. — 1997. — Vol. 12. — P. 1007—
1008.
Hasselwander O., Master D., Fogarty D. et al. Serum
paraoxonase and platelet-activating factor acethydrolase
in chronic renal failure//Clin. Chem. — 1988. — Vol. 44. —
P. 179-181.
Horl W., Cavill I., Macdougall I. C. et al. How to diagnose
and correct iron deficiency during r-huEPO therapy —
a consensus report//Nephrol. Dial. Transplant. — 1996. —
Vol. 11. - P. 246-250.
Ixkes M., Koopman M., Asker B. et al. Cimetidine
improves GFR-estimation by the Cockcroft an Gault
formula//Clin. Nephrol. - 1997. - Vol. 4. - P. 229-236.
Jaar B., Denis A., Viron B. et al. Effects of long-term
treatment with recombinant human erythropoietin on
physiologic inhibitors of coagulation//Am. J. Nephrol. —
1997. - Vol. 17. - P. 399-405.
Khan G., Lewis F., Dasgupta M. /?2-Microglobulin
amyloidosis presenting as esophageal perforation in a
hemodialysis patients//Am. J. Nephrol. — 1997. — Vol.
17. - P. 524-527.
Kimura K, Tabei K, Asano T, Hosoda S. Cardiac
arrythmias in hemodialysis patients//Nephron. — 1989. —
Vol. 53. - P. 201-207.
Klahr S., Levey A., Beck G. et al. The effects of dietary
protein restriction and blood pressure control on
progression of chronic renal disease//New Engl. J.
Med. - 1994. - Vol. 330. - P. 877-884.
Klefter R., Nielsen B. A hundred billion dollars a year on
dialysis. How to calculate and what to compare?//Int. J.
Artif. Organs. — 1998. — Vol. 21. — P. 319—320.
Kostner K, Clodi M., Bodlaj G. et al. Decreased urinary
apolipoprotein (a) excretion in patient with impaired
renal function//Europ. J. Clin. Invest. — 1998. — Vol. 28. —
P. 447-452. •
Kotaki M., Uday K, Henriquez M. et al. Maintenance
therapy with intravenous iron in hemodialysis patients
receiving erythropoietin//Clin. Nephrol. — 1997. — Vol.
48. - P. 63-64.
Labonia W. L-Carnitine effects on anemia in hemo-
dialyzed patients treated with erythropoietin//Am. J.
Kidney Dis. - 1995. - Vol. 26. - P. 757-764.
654
Lash J., Smith E. Is folate supplementation necessary in
dialysis patients?//Int. J. Artif. Organs. — 1990. — Vol. 13. —
P. 785-786.
Lima D., Fonseca J., Godoy D. Baseline variables
associated with early death and extended survival on
dialysis//Renal Failure. — 1998. — Vol. 20. — P. 581—587.
Locatelli E, Alberti D., Graziani G. et al. Prospective
randomized multicentre trial of effect of protein
restriction on progression of chronic renal failure//
Lancet. - 1991. - Vol. 337. - P. 1299-1304.
Macdougall L, Hutton R.D., Cavill I. et al. Poor response
to treatment of renal anemia with erythropoetin corrected
by iron given intravenously//Brit. J. Med. —1989. — Vol.
299. - P. 157-158.
Macdougall I. Poor response to erythropoetin: practical
guideness on investigation and management//Nephrol.
Dial. Transplant. - 1995. - Vol. 10. - P. 607-614.
Macdougall I Merits of percentage hypochromic red cells
as marker of functional iron deficiency//Nephrol. Dial.
Transplant. - 1998. - Vol. 13. - P. 847-849.
Macdougall I. Meeting the challenges of a new millennium:
optimizing the use of recombinant human erythropoietin
//Nephrol. Dial. Transplant. — 1998. —Vol. 13. — Suppl. 2. —
P. 230-270.
Magocsi M., Takacz Sz-, Arati A. et al. Calcitriol enhances
the effect of Rh-Epo on erythroid differentation//Int. J.
Artif. Organs. — 1997. — Vol. 20. — P. 502.
Markowitz G.S., Kahn G.A., Feingold R.E. et al. An
evaluation of the effectiveness of oral iron therapy in
temodialysis patients receiving recombinant human
erythropoietin//Clin. Nephrol. — 1997. — Vol. 48. — P. 34—
10.
Minetti L. Erythropoietin treatment in renal anemia. How
ligh should the target hematocrit be?//!. Nephrol. —
997. - Vol. 10. - P. 117-119.
With W. The influence of the diet on progression of renal
nsufficiency//Ann. Rev. Med. — 1984. — Vol. 35. — P.
149—264.
diyake T, Kung СК-H., Goldwasser E. Purification of
niman erythropoietin//!. Biol. Chem. — 1977. — Vol.
52. - P. 5558-5564.
doore M., Eggers P. Minorities have the highest incidens
f end stage kidhey disease in the U.S.//Hypertension. —
993. - Vol. 21. - P. 591.
Loore M. End-stage renal disease: a southern epidemic
/Southern Med. J. - 1994. - Vol. 87. - P. 1013-1017.
Lorita T., Suzuki M., Kamimura A., Hirasawa Y.
.myloidosis of a possible new type in patients receiving
>ng-term hemodialysis//Arch. Path. — 1985. — Vol. 109 —
. 1029-1032.
Muirhead N., Bagrman J., Burgess E. et al. Evidence-based
recomendation for the clinical use of recombinant
human erythropoietm//Am. J. Kidney Dis. — 1995. — Vol.
26. - Suppl. 1. - P. 1-24.
Musolino R., De Domenico P., Troilo G. et al. Cerebral
atrophy and cognitive impairment in long-term
hemodialyzed patients//New Trends Exp. and Clin.
Psychiatry. — 1992. — Vol. 8. — P. 119—125.
Nahas A., Masters-Thomas A., Brady S. et al. Selective
effects of low protein diets in chronic renal disease//Brit.
Med. J. - 1984. - Vol. 289. - P. 1337-1341.
Nelson S., Hawkins P., Richardson S. et al. Imaging of
hemodialysis-associated amyloidosis with 123I-serum
amyloid P component//Lancet. — 1991. — Vol. 338. — P.
3350-3390.
Omenn G., Beresford S., Motulsky A. Preventing coronary
heart disease: В vitamins and homocysteine//Circulat-
ion. - 1998. - Vol. 97. - P. 421-424.
Oymak O., Akpolat T, Arik N. et al. Hyperammonemic
encephalopathy due to vitamin D — induced hypercal-
cemia in a uremic patients//Nephron. — 1994. — Vol.
66. - P. 369.
Perry I., Refsum H, Morris H. et al. Prospective study of
serum total homocysteine concentration and risk of stroke
in middle-agea british men//Lancet. — 1995. — Vol.
346. - P. 1395-1398.
Pietzak I., Czarnecki R., Baczyk K, Antoniewicz K.
Uremic polyneuropathy in conservatively treated (non-
dialyzed) or in dialyzed patients//Przeg. Lek. —
1996. - Vol. 53. - P. 544-548.
Potter G., Johnson R., Fink G. Role of endothelin in
hypertension of experimental chronic renal failure//!. Am.
Heart Ass. - 1997. - Vol. 30. - P. 1578-1584.
Ramirez G., Bruegeemeyer C., Newton J. Cardiac
arrhythmias on hemodialysis in chronic renal failure
patients//Nephron. — 1984. — Vol. 36. — P. 212—218.
Riley S., Rutherford S., Rutherford P. Low carnitine levels
in hemodialysis patients: relationship with functional
activity status and intra-dialytic hypotension//Clin.
Nephrol. - 1997. - Vol. 48. - P. 392-393.
Ritz E., Amman K. Optimal haemoglobin during treatment
with recombinant human erythropoietin//Nephrol. Dial.
Transplant. — 1998. — Vol. 3. — Suppl. 2. — P. 16—22.
Rumble J., Cooper M., Soulis T. et al. Vascular
hypertrophy in experimental diabetes: role of advanced
glycation products//!. Clin. Invest. — 1997. — Vol. 99. —
P. 1016-1027.
Savage T, Giles M., Tomson C. and A.E.Raine. Gender
differences in mediators of left ventricular hypertrophy
in dialysis patients//Clin. Nephrol. — 1998. — Vol. 49. —
P. 107-112.
655
Shibagaki Y., Takaichi K. Significant reduction of the
large-vessel blood volume by food intake during
hemodialysis//Clin. Nephrol. — 1998. — Vol. 49. — P. 49—
54.
Silver S. Cerebral edema after hemodialysis: the «reverse
urea effect» lives//Int. J. Artif. Organs. — 1998. — Vol. 21. —
P. 247-250.
Siniukhin V., Stetsyuk E. Furancarboxylic acid — factor
of hemodialysys anemia?//Int. J. Artif. Organs. — 1992. —
Vol. 15. - P. 541.
Smans K., Van Landeghem G., D’Hae P. et al. Is there a
link between erythropoietin therapy and adynamic bone
disease?//Nephrol. Dial. Transplant. — 1996. — Vol. 11. —
P. 1248-1249.
Sobh N., Sheashaa H., Tantawy A., Ghonein M. Study
of effects of optimization of dialysis and protein intake
on neuromuscular function in patients under mainte-
nance hemodialysis treatment//Am. J. Nephrol. — 1998. —
Vol. 18. - P. 399-403.
Sombolos K, Tsitamidou Z., Kyriazis G. et al. Clinical
evaluation of four different high-flux hemodialyzers
under conventional conditions in vivo//Am. J. Nephrol. —
1997. - Vol. 17. - P. 406-412.
Stein G., Funfstuck R., Klemm A., Maiwald J. Protein-
jestriktion bei chronischer Niereninsuffizienz//Nieren
and Hochdruckkrank. — 1997. — Bd 26. — S. 272—276.
Sidzbacher 1., Delling G. Dialyseassoziierte Amyloidose
als Ursache fur Schenkelhalsfrakturen//Nieren und
Hochdruckkrank. - 1998. - Vol. 27. - S. 262-269.
Sumamoto M., Kuze K, lehara N. et al. Expression of
heat shock protein 47 is increased in remnant kidney and
correlates with disease progression//Int. J. Exp. Path. —
1998. - Vol. 79. - P. 133-140.
Suzuki R., Tsumura K., Inoue T. et al. QT Interval
prolongation in patients receiving maintenance
hemodialvsis//Clin. Nephrol. — 1998. — Vol. 49. — P. 240—
244.
Tarng D., Huang T. Uraemic pericarditis: a reversible
inflammatory state of resistance to recombinant human
ervthropoietin in haemodialysis patients//Nephrol. Dial.
Transpl. - 1997. - Vol. 12. - P. 1051-1054.
Toto R., Shults L. et al. Efficacy and tolerability of iosartan
in hypertensive patients with renal impairment//
Hypertension. — 1998. — Vol. 31. — P. 684—691.
Vita G.. Savica K, Milone S. et al. Uremic autonomic
neuropathy: recovery following bicarbonate hemodialysis/
/Clin. Nephrol. — 1996. — Vol. 45. — P. 56—60.
Washio M., Okida S., Mizoue T. et al. Risk factors for
left ventricular hypertrophy in chronic hemodialysis
patients//Clin. Nephrol. — 1997. — Vol. 47. — P. 362—
366.
656
Weller J., Wu S., Ferguson C, Hawthorne V. End-stage
renal disease in Michigan//Am. J. Nephrol. — 1995. —
Vol. 5. - P. 84-95.
Woittiez A., Huysmans F., Bailey R. et al. A comparison
of the safety and efficacy of mibefradil and nifedipine
SR in patients with renal disease and hypertension//Clin.
Nephrol. — 1998. — Vol. 49. — P. 160—166.
Wu Z., Bao X. Effects of benazepril on insulin resistance
and glucose tolerance in uremia//Clin. Nephrol. —
1998. - Vol. 50. - P. 108-112.
Zazgornic J., Biesenbach G., Forsteinlehner M., Stum-
mvoll K. Profile of antihypertensive drugs in hypertensive
patients on renal — replacement therapy (RRT)//Clin.
Nephrol. - 1997. - Vol. 48. - P. 337-340.
К разделу 39.5.5
Игнатова M.C., Вельтищев Ю.Е. Детская нефроло-
гия. — Л.: Медицина, 1989. — 456 с.
Папаян А.В., Савенкова Н.Д. Клиническая нефроло-
гия детского возраста. — СПб., 1997. — 637 с.
Цыбышева А.К. Нарушения фосфорно-кальциевого
обмена у детей с хронической почечной недостаточ-
ностью//Современные методы диагностики и лече-
ния нефро-урологических заболеваний у детей. —
1998. - С. 103-107.
Bosch A., Ulmer Н.Е., Keller Н.Е. et al. Electrocardio-
graphic monitoring in children with chronic renal failure
//Pediatric Nephrology. — 1990. — Vol. 4. — P. 40—44.
Brown E.M., Gamba G., Riccardi R. et al. Cloning and
charactirization of an extracellular Ca2-sensing receptor
form bovine parathyroid//Nature. — 1993. — Vol. 366. —
P. 575-580.
Bunchman T.E. Chronic dialysis in the infant less than 1
year of age//Pediatr. Nephrol. — 1995. — Vol. 9. — Suppl. 1.
Fennell R.S., Fennell E.B., Carter R.L. et al. Association
between renal function and cognition in childhood
chronic renal insufficiency//Pediatric Nephrology. — 1990.
- Vol. 4. - P. 16-20.
Fine R.N., Kohaut E., Brown D. et al. Long-term treatment
of growth retarded children with chronic renal insuf-
ficiency with recombinant human growth hormone//
Kidney Int. - 1990. - Vol. 49. - P. 781-785.
Goren A., Glaser J., Drukker A. Diastolic function in
children and adolescents on dialysis and after kidney
transplantation: an echocardiographic assessment//
Pediatric Nephrology. — 1993. — Vol. 7. — P. 725—728.
Kilav R., Silver J., Naveh-Many T. Parathyroid hormone
gene expression in hypophosphatemic rats//Journ. Clin.
Investig. — 1995. — Vol. 96. — P. 32—33.
Klaus G., Mehls O., Ritz E. Is intermittent calcitriol safe
and effective in renal secondary hyperparathyroidism?//
Lancet. - 1996. - Vol. 337. - P. 800-801.
Krempien B., Mehls O., Ritz E. Morphological studies on
pathogenesis of ephiphyseal slipping in uremic children
//Virchows Archiv. — 1974. — Vol. 362. — P. 129.
Loirat C. et al. Report on management of renal failure in
children in Europe, ХХШ, 1992//Nephrology Dialysis
Transplantation. — 1992. — Suppl. 1. — P. 26—40.
Mehls O., Ritz. E. Renal osteodystrophy//Pediatric
nephrology (2nd edn)/Ed. M.A.Holliday, T.M.Barratt a.
R.L.Vernier. — Baltimore: Williams and Wilkins, 1987. —
P. 852-879.
Mehls O., Broyer M. Growth response to recombinant
human growth hormone in short prepubertal children
with chronic renal failure with or without dialysis//Acta
Paediatrica Suppl. — 1994. — Vol. 399. — P. 81—87.
Milliner D.S., Zingmeister A.R., Lieberman E., Landing В.
Soft tissue calcification in pediatric patients with end-
stage renal disease//Kidney hit. — 1990. — Vol. 38. —
P. 931-936.
Morris K.P., Skinner J.R., Wren C. et al. Cardiac
abnormalities in end-stage renal failure and anemia//
Archives of Disease in Childhood. — 1993. — Vol. 68. —
P. 637-643.
Rizzoni G. et al. Combined report on regular dialysis and
transplantation of children in Europe 1985//EDTA
Registration Committee. — 1986.
Rizzoni G., Broyer M., Ehrich J.H.H. et al. The use of
continuous peritoneal dialysis in Europe for the treatment
of children with end-stage renal failure//EDTA Registry,
Nephrology Dialysis Transplantation. — 1990. — Vol. 5. —
P. 985-990.
Scharer K., Rauh W., Ulmer H.E. The management of
hypertension in children with chronic renal failure//
Hypertension in children and adolescents/Ed. S.Giovan-
netti, M.I.New, S.Gorini. — New York: Raven Press,
1981. - P. 239.
Scharer K., Muller-Wiefel D.E. Haematological
complication of renal failure//Pediatric nephrology (2nd
edn.)/Ed. M.A.Holliday, T.M.Barratt, R.L.Vemier. —
Baltimore: Williams a. Wilkins, 1987. — P. 880—886.
Uerrina E., Zacchello G. et al. And Italian Registry of
Pediatric CPD Italy. Clinical experience in the treatment
of very young infants with CPD//Perit. Dial. Intern. —
1995. - Vol. 15. - Suppl. 1.
Wuhl E., Harmer D., Nissel R. et al. Short children on
dialysis treatment respond less to growth hormone than
patients with chronic renal failure prior to dialysis//
Pediatr. Nephrol. — 1996. — Vol. 10. — P. 294—298.
42—2950
Гпава 40
ТРАНСПЛАНТАЦИЯ ПОЧКИ
В.И.Шумаков, Я.Г.Мойсюк, Н.А.Томилина
Почка — первый орган, трансплантирован-
ный в эксперименте, а затем и в клинике. Эк-
спериментальная трансплантация почки впер-
вые была выполнена E.Ulmann на собаках в
1902 г. За ней последовали операции М.Jaboulay
и А.Саге1. Два последующих десятилетия харак-
теризовались робкими и безуспешными попыт-
ками аллогенных и ксеногенных эксперимен-
тальных пересадок почки. Однако даже безус-
пешные эти операции, с одной стороны, зна-
меновали собой открытие в хирургии — разра-
ботку техники сосудистого шва, а с другой —
они привели к выводу о существовании неко-
его биологического барьера, препятствующего
успеху трансплантации. Важнейшим событием
этого периода стала первая в мире аллотранс-
плантация трупной почки человеку, выполнен-
ная в 1933 г. советским хирургом Ю.Ю.Воро-
ным. Однако, несмотря на проходимость сосу-
дов, трансплантированная почка не функцио-
нировала. В 1946 г. в Бостонском госпитале груп-
пой американских врачей под руководством
M.Hufnagel была предпринята попытка алло-
трансплантации трупной почки на сосуды руки
больной с острой почечной недостаточностью.
На этот раз функция пересаженной почки, хотя
и кратковременная, способствовала выздоров-
лению пациентки. Это событие стимулировало
в начале 50-х годов интерес к трансплантации
и диализу.
В тот же период две группы в Париже и
Бостоне одновременно начали трансплантации
почки в клинике [Kiiss R., 1951; Hume D., 1955].
Даже при отсутствии иммуносупрессии иногда
они давали кратковременный эффект. Парижс-
кая серия включала первый случай пересадки
почки от живого родственного донора, кото-
рая, однако, закончилась необратимым оттор-
жением на 22-й день. Неудачи вновь ослабили
интерес к трансплантации почки в клинике.
Однако 23 декабря 1954 г. в Бостоне была вы-
658
полнена первая трансплантация почки от од-
нояйцевого близнеца [Murray D., 1958]. Как и
последующие подобные, она оказалась успеш-
ной. И часть реципиентов, оперированных еще
в то время, вот уже более 3 десятилетий сохра-
няет вполне удовлетворительное состояние.
Первые попытки подавления иммунитета при
трансплантации, предпринятые в 1959—1962 гг.,
состояли в тотальном облучении тела реципи-
ента. В 1961 г. с этой целью был применен иму-
ран, с 1963 г. этот препарат стали сочетать с
преднизолоном, что стало стандартным при
трансплантации. В сочетании с подбором пар
донор — реципиент по лейкоцитарным антиге-
нам системы HLA это способствовало значитель-
ному улучшению результатов операции.
Середина 60-х годов стала периодом опти-
мизма, связанного с прогрессом гемодиализа,
широким внедрением в клиническую практи-
ку тканевого типирования и предварительной
перекрестной пробы между лейкоцитами доно-
ра и сывороткой реципиента. В эти годы во всем
мире увеличилось количество операций с ис-
пользованием органов как от живого, так и от
трупного донора, результаты этих операций
улучшились. Прогресс 70-х годов связан с раз-
работкой консервирующих растворов, распро-
странением концепции смерти мозга и дальней-
шим совершенствованием иммуносупрессии.
В этот период летальность реципиентов и свя-
занный с этим риск операции существенно
снизились, но срок выживания трансплантатов
все еще оставался невысоким. Через 1 год пос-
ле операции функционировало лишь 40—50 %
из них. Конец 70-х годов отмечен двумя важ-
нейшими открытиями, которые стали началом
современной эры клинической трансплантации
почки и других жизненно важных органов.
В 1978 г. R.Calne впервые использовал в кли-
нике циклоспорин А (ЦсА). Одновременно была
доказана важнейшая роль HLA-DR-совместимо-
сти при трансплантации органов, и в первую
очередь почки [Caine R., 1978; Ting А., 1978].
Внедрение в клиническую практику ЦсА повы-
сило годичную выживаемость трансплантатов на
20—30 %. К концу 1996 г. в мире зарегистриро-
вано более 600 центров трансплантации почки,
в которых выполнено более 400 000 операций,
а максимальный срок жизни пациента с пере-
саженной почкой к настоящему времени пре-
высил 34 года.
40.1. Показания.
Предоперационное
обследование и подготовка
реципиентов
Принципиальным показанием к транс-
плантации почки является терминальная ХПН
вне зависимости от первичного заболевания.
Операции подлежат пациенты в возрасте до
65—70 лет без патологии нижних мочевыводя-
щих путей, активной инфекции, выраженной
кахексии, злокачественных опухолей или сис-
темных заболеваний соединительной ткани в
стадии активности.
В настоящее время эту операцию выполня-
ют и тем больным, которым совсем недавно
она считалась противопоказанной и которые
относятся к группе так называемого высокого
риска. Это пожилые пациенты, больные гипер-
сенсибилизированные или страдающие сахар-
ным диабетом.
Трансплантация почки является методом
выбора у детей, у которых диализ нередко со-
пряжен со значительными техническими про-
блемами.
Абсолютными противопоказаниями
к трансплантации почки являются диссемини-
рованные опухолевые заболевания, тяжелая
хроническая сердечная недостаточность (ПБ—
III степень), хроническая дыхательная недоста-
точность, ХНЗЛ, активный гепатит, цирроз
печени, распространенный атеросклероз с по-
ражением сосудов сердца, головного мозга,
нижних конечностей, хронические инфекции,
рефрактерные к терапии, определенные психи-
ческие расстройства, СПИД.
Обследование перед трансплантацией почки
включает в себя ряд специальных тестов: тка-
невое типирование, определение группы кро-
ви и резус-фактора, предсуществующих анти-
лейкоцитарных антител, HBs-антигена, а так-
же антител к вирусам гепатита В, С, герпеса,
цитомегаловирусу (ЦМВ) и ВИЧ.
Для исключения поражений печени выпол-
няют соответствующие биохимические пробы;
для выявления скрытых очагов инфекций — по-
севы мочи, мокроты, санацию полости рта;
необходимы также консультации гинеколога,
отоларинголога и стоматолога.
В число обязательных обследований входят
также рентгенография грудной клетки, ЭКГ,
УЗИ сердца, органов брюшной полости и ма-
лого таза, эзофагогастродуоденоскопия.
Консультации эндокринолога и офтальмоло-
га необходимы при подготовке к транспланта-
ции больных сахарным диабетом. В этих же слу-
чаях, как и в других при соответствующих по-
казаниях, целесообразна консультация карди-
олога.
Консультация уролога обязательна для муж-
чин старше 45 лет. По показаниям проводят
подробное урологическое обследование. Для
диагностики активного или пассивного реф-
люкса при обструктивных поражениях нижних
мочевыводящих путей, нейрогенном мочевом
пузыре, хроническом пиелонефрите выполня-
ют восходящую цистоуретерограмму.
В большинстве случаев пузырно-мочеточни-
кового рефлюкса необходима билатеральная
или односторонняя нефроуретерэктомия, кото-
рую можно осуществлять как предварительно,
так и одновременно с трансплантацией почки.
При большом количестве остаточной мочи в
связи со стриктурой уретры, нейрогенным мо-
чевым пузырем или аденомой предстательной
железы показано урологическое лечение или со-
ответствующее оперативное вмешательство. У
детей при обструктивных поражениях мочевы-
водящих путей или при нейрогенном мочевом
пузыре перед трансплантацией почки должен
быть выполнен один из видов кишечной плас-
тики мочевых путей. При активном пиелонеф-
рите, гидронефрозе, нефролитиазе, а также при
не контролируемой гемодиализом и лекарствен-
ными препаратами артериальной гипертонии
рекомендуется билатеральная нефрэктомия. В
последнем случае при сморщивании почек и
отсутствии признаков активной инфекции аль-
тернативным методом является эмболизация
почечных артерий.
При поликистозе почек вопрос о нефрэкто-
мии решается индивидуально. Удаление почек
перед трансплантацией показано при их огром-
ных размерах либо при течении заболевания с
частыми вспышками мочевой инфекции, обра-
зованием камней, массивными кровотечения-
ми. У части больных измененные почки могут
быть оставлены на месте.
При повторной трансплантации предыдущий
почечный трансплантат подлежит удалению
только при выявлении инфекции или активного
отторжения, которое проявляется дискомфор-
том в области пересаженной почки, интокси-
кацией, лихорадкой и/или выраженной гема-
турией.
42*
659
При язвенных поражениях желудка или две-
надцатиперстной кишки с целью профилакти-
ки острых желудочно-кишечных кровотечений
в условиях последующей кортикостероидной
терапии необходимо противоязвенное лечение
до полной ремиссии. При хронических язвен-
ных заболеваниях могут потребоваться вагото-
мия и пилоропластика или селективная прокси-
мальная ваготомия.
Камни желчного пузыря, нередкие у боль-
ных, получающих программный гемодиализ,
также требуют хирургического лечения. Холеци-
стэктомия уменьшает риск острого холецисти-
та и сепсиса после трансплантации.
Непосредственно перед операцией следует
повторить ЭКГ и рентгенографию грудной клет-
ки, определить электролиты плазмы крови, и
при повышении К плазмы до 6 ммоль/л и
более рекомендуется экстренный гемодиализ.
Несмотря на современные возможности про-
лонгированной консервации почки (до 24 ч при
использовании раствора Евроколлинз и до 48 ч
при применении растворов Висконсинского уни-
верситета и Бретшнайдера), каждый дополни-
тельный час холодовой ишемии увеличивает ве-
роятность острого канальцевого некроза (ОКН)
и даже гибели трансплантата. В связи с этим
трансплантацию трупной почки обычно выпол-
няют в экстренном порядке, по завершении всех
необходимых подготовительных процедур.
В отечественной практике, как правило,
используют трупные донорские органы и суще-
ственно реже — родственные. Критерии селек-
ции пар донор — реципиент, вопросы органи-
зации, техники изъятия и консервации органов
подробно описаны в руководстве «Трансплан-
тология» [Шумаков В.И., 1995].
40.2. Техника операции
Операцию проводят в условиях общей или пе-
ридуральной анестезии, принципы которой
детально разработаны и описаны в специаль-
ных руководствах. Основным из них, с точки
зрения обеспечения функции трансплантата,
является инфузионная нагрузка, которая дол-
жна дозироваться таким образом, чтобы, с
одной стороны, устранить гиповолемию, воз-
можную в условиях программного гемодиали-
за, а с другой — предупредить гипергидрата-
цию. Анестетики выбирают селективно с уче-
том их метаболизма в почках. Во время опера-
ции обязателен контроль электролитов плазмы,
КОС, ЦВД, гематокрита.
В подавляющем большинстве случаев транс-
плантат помещают в гетеротопическую пози-
цию в подвздошную область, контралатераль-
ную по отношению к донорской почке. Сосу-
660
ды трансплантата анастомозируются с под-
вздошными сосудами реципиента, мочеточ-
ник — с мочевым пузырем или ипсилатераль-
ным мочеточником реципиента.
40.3. Принципы ведения
ближайшего послеоперационного
периода
Среди мероприятий ближайшего послеопераци-
онного периода следует выделить специальные,
нацеленные на создание оптимальных условий
для работы пересаженной почки.
Функция трансплантата может быть немед-
ленной, если начинается сразу после реваску-
ляризации донорского органа, или отсрочен-
ной, когда с момента операции в течение не-
скольких дней и даже недель возможна олиго-
анурия.
Немедленную функцию трансплантата оцени-
вают как хорошую при адекватном диурезе и
отсутствии потребности в послеоперационном
диализе. Уровень креатинина в таких случаях
нормализуется в течение 7—12 сут.
Отсроченная функция является клиническим
проявлением ОКН трансплантата. По данным
разных центров, он развивается в 20—80 %
случаев, в нашем центре — у 40—50 % реци-
пиентов. Его частота и тяжесть зависят от со-
стояния донора перед изъятием почки, усло-
вий консервации донорского органа и харак-
тера консервирующего раствора, длительности
тепловой и холодовой ишемии, течения анес-
тезии во время трансплантации, адекватности
послеоперационной инфузионной терапии и
начального режима иммунодепрессии.
Данные о влиянии отдельных факторов на
частоту ОКН противоречивы. В то время как
одни авторы отрицают корреляцию между ОКН
и сроком консервации трансплантата, другие —
констатируют снижение его частоты при умень-
шении времени холодовой ишемии. Установле-
но также, что почки, изъятые в условиях смер-
ти мозга, реже проходят стадию посттрансплан-
тационной олигоанурии по сравнению с транс-
плантатами от доноров с небьющимся сердцем.
Специального лечения ОКН не требует. В
большинстве случаев он обратим, и до восста-
новления функции донорского органа продол-
жается лишь программный гемодиализ. Тем не
менее в этой стадии трансплантат особенно
уязвим в отношении как острого отторжения,
так и острого токсического эффекта ЦсА [Ко-
тенко О.Н., 1997; Laine L, 1995]. Диагностика
и той, и другой патологии в условиях олиго-
анурии представляет значительные трудности.
Поэтому в этом периоде контроль состояния
трансплантата включает, помимо общеклини-
ческих оценок, УЗИ, изотопную сцинтиграфию
и при необходимости пункционную биопсию.
В 8—10 % случаев функция трансплантата не
восстанавливается. Это может быть обусловле-
но как особой тяжестью его ишемического
повреждения с исходом в кортикальный не-
кроз, так и наслоением на ишемическую не-
фропатию сверхострого или ускоренного оттор-
жения.
Для профилактики ОКН могут быть реко-
мендованы антагонисты кальция, простаглан-
дины, допамин; в частности, установлено, что
дилтиазем и верапамил улучшают внутрипочеч-
ный кровоток, снижают степень реперфузион-
ных повреждений и противодействуют нефро-
токсическому эффекту ЦсА [Шаршаткин А.В. и
др., 1997; Ргоррег D.J. et al., 1989, и др.]. При-
менение в ближайшем послеоперационном пе-
риоде дилтиазема снижает число первично не-
функционирующих трансплантатов на 21 %, а
верапамила — на 31 % [Dawidson et al., 1995],
а интраоперационная инфузия исрадипина спо-
собствует уменьшению на 20 % частоты ОКН
|Шаршаткин А.В. и др., 1997].
В ближайшем посттрансплантационном пе-
риоде особому вниманию подлежит контроль
ЦВД, которое следует поддерживать на уровне
10—12 см вод.ст. Это достигается инфузиями
изотонического раствора натрия хлорида и 5 %
раствора глюкозы. При немедленной функции
трансплантата объем инфузии в первые сутки
должен превышать объем диуреза примерно на
30 %. При полиурии возможны гипокалиемия
и дегидратация, что требует соответствующей
коррекции.
Если при достаточном восполнении внутри-
сосудистого объема, темп мочеотделения не
достигает 100 мл/ч, оправдано применение
натрийуретиков, как правило, лазикса в дозе
100-200 мг.
Гемотрансфузии во время операции и сразу
после нее показаны только при снижении ге-
матокрита ниже 20 %.
Среди обязательных послеоперационных назна-
чений, помимо иммуносупрессии, следует вы-
делить:
• профилактическое введение антибиотиков
широкого спектра действия в течение 5—7
сут в сочетании с противогрибковыми пре-
паратами (чаще с нистатином), при дозиро-
вании которых следует учитывать функцию
трансплантата;
• противоязвенную терапию антацидами и
блокаторами Н,-рецепторов;
• гипотензивную терапию, при подборе кото-
рой в последнее время предпочтение отда-
ется антагонистам кальция.
40.4. Иммуносупрессия при
трансплантации почки
Проблема иммуносупрессии при пересадке
почки, как и при трансплантации других орга-
нов, не исчерпывается созданием эффективных
иммуносупрессантов, но включает в себя и
поиски оптимальных путей их использования.
Режим иммуносупрессии оптимальный, когда
при максимально эффективной профилактике
отторжения риск серьезных осложнений имму-
носупрессантов минимален.
Начиная с 80-х годов, неотъемлемым ком-
понентом подавляющего большинства совре-
менных режимов иммуносупрессии стал ЦсА.
Однако и этот высокоэффективный иммуносуп-
рессант имеет ряд серьезных побочных, токси-
ческих эффектов [Котенко О.Н. и др., 1997;
Caine R. et al., 1978; Dieperink R. et al., 1987;
Kahan B., 1988; Michatsch B., 1995, и др.].
Стремление снизить их риск при сохранении
максимальной эффективности иммуносупрес-
сии стимулировало разработку многочисленных
протоколов, различающихся как по числу ис-
пользуемых иммуносупрессантов (1-, 2-, 3- и
4-компонентные режимы), так и по их дози-
ровкам, последовательности и длительности
введения. По нашему мнению, выбор конкрет-
ного протокола в каждом отдельном случае
определяется рядом факторов, среди которых
можно назвать первичность или повторность
трансплантации, исходное состояние реципи-
ента, его иммунный статус и специально уро-
вень предсуществующих антител.
Весь период иммуносупрессии после пере-
садки почки может быть разделен на 2 фазы —
индукции и поддерживающей терапии.
Фаза индукционной терапии охватывает
примерно первые 12 нед после трансплантации,
для которых характерны неустойчивая функция
трансплантата и повышенная аллореактивность
с наиболее высокой вероятностью кризов от-
торжения.
Соответственно индукционная иммуносуп-
рессия должна эффективно предупреждать ос-
трое отторжение пересаженной почки при ми-
нимальном риске дополнительных повреждений
уже исходно пострадавшего трансплантата, а
также других серьезных, в первую очередь ин-
фекционных осложнений.
В настоящее время для индукционной имму-
носупрессии предложено несколько протоко-
лов.
• Монотерапия ЦсА с использованием высоких
доз препарата (10—15 мг/кг массы тела в
сутки). Ее достоинством является полное ус-
транение кортикостероидов, что весьма су-
щественно при высокой опасности их побоч-
661
ных эффектов (сахарный диабет, язвенное
поражение желудочно-кишечного тракта)
или когда применение преднизолона край-
не нежелательно (у детей).
Однако монотерапия ЦсА чревата повышен-
ным риском токсических эффектов препарата
[Caine R., 1978; Touchard G. et al., 1997], осо-
бое место среди которых при пересадке почки
занимает нефротоксичность, наиболее вероят-
ная при ОКН [Laine J. et al., 1995]. В этих слу-
чаях монотерапия ЦсА может усугублять тубу-
лонекроз и тормозить регрессию постишемичес-
ких повреждений трансплантата. Кроме того,
олигоанурия может маскировать наслоение на
уже имеющуюся патологию кризов отторжения,
склонность к которым в условиях ОКН также
возрастает. Как показывают результаты изуче-
ния биологии донорского органа, повышение
вероятности острого отторжения в ишемизиро-
ванной почке следует считать закономерным.
Все это создает особые трудности индукци-
онной монотерапии ЦсА, особенно в условиях
ОКН. Тем не менее данные литературы свиде-
тельствуют о высокой ее эффективности. Так,
по данным G.Opelz (1997), обобщившего ре-
зультаты около 100 000 трансплантаций почки,
операция была наиболее успешной у тех 2500
реципиентов, которые на стадии индукции не
получали кортикостероидов. Правда, избежать
кортикостероидов на этом этапе удается лишь
у 20—58 % реципиентов [Touchard G. et al.,
1997, и др.]. В остальных случаях их назначение
неизбежно в связи с токсическими эффектами
высоких доз ЦсА, с одной стороны, и криза-
ми отторжения — с другой.
• Двухкомпонентный режим индукционной им-
муносупрессии предполагает комбинацию
средних доз ЦсА (6—10 мг/кг в сутки) с кор-
тикостероидами (0,8—1 мг/кг в сутки). В даль-
нейшем дозу ЦсА регулируют по его уров-
ню в крови таким образом, чтобы концент-
рация препарата находилась в пределах 150—
200 нг/мл (моноклональный RIA-test). Доза
кортикостероидов снижается до 10 мг/сут к
концу 3-го месяца.
Этот вариант иммуносупрессии более попу-
лярен. Его достоинством является использова-
ние более низкой, чем при монотерапии, на-
чальной дозы ЦсА. При этом преднизолон, хотя
и применяют, но также в дозировке, снижен-
ной по сравнению с традиционной в доцикло-
спориновую эру. Это способствует уменьшению
риска опасных побочных эффектов обоих пре-
паратов, с одной стороны, и снижению час-
тоты ОКН и кризов отторжения — с другой.
662
• Трех- и четырехкомпонентные режимы индук-
ционной иммуносупрессии предусматривают
использование еще более низкой исходной
дозы ЦсА, но при условии его сочетания с
двумя другими иммуносупрессантами или
более. Таким образом удается обеспечить до-
статочную иммуносупрессию при минималь-
ном риске острой токсической дисфункции
трансплантата. В целом частота ОКН в этих
условиях не превышает наблюдаемую при
традиционной иммуносупрессии преднизо-
лоном и азатиоприном, хотя период анурии
в случаях, когда ЦсА используют непосред-
ственно после операции, может быть более
продолжительным.
Один из таких протоколов индукционной
иммуносупрессии успешно применяют в НИИ
трансплантологии и искусственных органов М3
РФ в течение последних 10 лет. Он использует-
ся не менее чем у 95 % реципиентов, включа-
ет 3 компонента — ЦсА, назначаемый с пер-
вых часов после операции, преднизолон и аза-
тиоприн. Однако лечебная тактика при немед-
ленной и отсроченной функции трансплантата
несколько различается.
При ОКН трансплантата начальная доза
ЦсА составляет 2—4 мг/кг в сутки, преднизо-
лона — 0,8 мг/кг в сутки, азатиоприна — 1,5—
2 мг/кг в сутки. Дозу преднизолона снижают до
0,5 мг/кг к концу первого месяца. С восстанов-
лением почечной функции дозу ЦсА повыша-
ют, причем таким образом, чтобы концентра-
ция препарата в крови достигла целевого, те-
рапевтического уровня (150—200 нг/мл).
Преимуществом такой лечебной тактики мы
считаем создание условий, в которых благода-
ря снижению дозировки ЦсА регрессия пост-
ишемического ОКН трансплантата, а следова-
тельно, и восстановление его функции проис-
ходят быстрее.
При немедленной функции трансплантата с
первого дня используют более высокие дозы
ЦсА (5—6 мг/кг массы тела) и несколько сни-
женные дозы преднизолона (не более 0,5 мг/кг
массы). Доза азатиоприна практически не зави-
сит от характера начальной функции транс-
плантата и, как и при ОКН, составляет 1,5—2
мг/кг.
Дальнейшую дозу ЦсА и в этих случаях ре-
гулируют по его концентрации в крови, и оп-
тимальным мы считаем тот же диапазон 150—
200 нг/мл. При неизмененной дозе он достига-
ется, как правило, к концу 2-й недели после
операции. В противном случае, если трансплан-
тат функционирует, дозу повышают. При устой-
чивом снижении уровня ЦсА в крови могут
быть использованы такие препараты, как дил-
тиазем, верапамил или кетоконазол (низорал),
ингибирующие цитохром Р-450 микросомной
ферментной системы печени и замедляющие
метаболизм ЦсА, что способствует повышению
его концентрации в крови. Азатиоприн дозиру-
ется с учетом количества лейкоцитов и тром-
боцитов в периферической крови, а также фун-
кции печени.
Мы контролируем адекватность иммуносуп-
рессии и морфологическим исследованием био-
птатов пересаженной почки.
Как показывает накопленный нами опыт,
эффективность описанных вариантов 3-компо-
нентной индукционной иммуносупрессии не
различается. В обоих случаях однолетняя выжи-
ваемость реципиентов и трансплантатов состав-
ляет соответственно 89 и 82 %.
В последнее время в качестве цитостатика на
этапе индукции мы начали с успехом исполь-
зовать микофенолат мофетил (селлсепт). И хотя
наш опыт еще невелик, тем не менее его пред-
варительный анализ, как и данные мировой
литературы, свидетельствует о существенном
снижении в этих условиях частоты кризов оттор-
жения [Корсакова Т.В. и др., 1998; Sollinger Н.
et al., 1995]. Селлсепт назначают в дозах от 1,0
до 3,0 г/сут, причем оптимальной считается
доза 2,0 г/сут.
• Четырехкомпонентная индукционная иммуно-
супрессия также имеет 2 модификации. Пер-
вая состоит в фактическом использовании
одномоментно лишь 3 иммунодепрессантов,
структуру комбинации которых меняют в за-
висимости от функционального состояния
трансплантата. При ОКН ЦсА из иммуносуп-
рессии полностью исключают. Ее начинают
с преднизолона, азатиоприна и одного из
препаратов поли- или моноклональных ан-
тител — АЛГ, АТГ, ОКТ-3. После восстанов-
ления функции почки, т.е. через 1—3 нед
после операции, назначают ЦсА, а препа-
рат антилимфоцитарных антител отменяют.
В условиях такой терапии частота и длитель-
ность ОКН минимальны. Однако антилим-
фоцитарные антитела резко повышают риск
серьезных побочных эффектов, в частности
ЦМВ-инфекции, для профилактики которой
одновременно с упомянутыми иммуносуп-
рессантами следует применять ганцикловир.
Широкое использование этого варианта ин-
дукционной иммуносупрессии ограничива-
ется и его высокой стоимостью.
Вторая модификация состоит в одновремен-
ном применении четырех иммуносупрессантов
при высоком иммунологическом риске, что
имеет место при повторных трансплантациях,
если предыдущий трансплантат был утрачен в
связи с острым отторжением, либо при высо-
ком (более 30 %) титре предсуществующих
антител, когда особенно высок риск ускорен-
ного или раннего острого отторжения.
В таких случаях ЦсА, хотя и в малых дозах,
назначают сразу после трансплантации и ком-
бинируют с тремя иммуносупрессантами —
преднизолоном, цитостатиком и антилимфоци-
тарными антителами, причем АЛГ вводят в те-
чение 2—3 нед, ОКТ-3 — 7—10 дней.
Как показывает наш опыт, у гиперсенсиби-
лизированных реципиентов профилактическое
введение с первого дня после трансплантации
АТГ («Фрезениус», Германия, «Пастер Мерье»,
Франция) или ОКТ-3 («Силаг», Швейцария)
высокоэффективно и позволяет добиться успеха
даже тогда, когда уровень предсуществующих
антител составляет 80—100 %. Однако, как уже
отмечалось, эти препараты значительно повы-
шают риск инфекций (как бактериальных, так
и тяжелых вирусных, особенно цитомегалови-
русной). В наших наблюдениях их частота при
ОКТ-3 оказалась в 2 раза выше, чем при при-
менении АТГ. По нашему мнению, ОКТ-3
предпочтительнее для лечения, но не для про-
филактики отторжения.
Фаза поддерживающей иммуносупрессии
следует после индукционной и обычно харак-
теризуется стабильной функцией транспланта-
та, отсутствием или малой выраженностью
дисфункции других органов и менее значитель-
ным риском инфекционных заболеваний. Как
полагают, в этой фазе аллореактивность посте-
пенно уменьшается. В связи с этим многие кли-
ницисты считают целесообразным дополнитель-
но подразделять эту фазу на два периода, один
из которых охватывает первые 6 мес после опе-
рации, а другой — весь последующий посттранс-
плантационный период.
Поддерживающая иммуносупрессия должна
обеспечить профилактику хронического оттор-
жения трансплантата при минимальном риске
побочных эффектов иммуносупрессантов в ус-
ловиях многолетнего их применения. При этом
можно использовать монотерапию ЦсА либо
комбинации этого препарата с цитостатиком
(как правило, с азатиоприном) и/или с кор-
тикостероидами .
В НИИ трансплантологии и искусственных
органов М3 РФ традиционно применяют 3-ком-
понентную поддерживающую иммуносупрес-
сию, включающую ЦсА, преднизолон и азатио-
прин (менее чем 20 % реципиентов азатиоприн
не назначают). Показаниями к отмене азатиоп-
рина являются лейкопения и хронический ак-
тивный гепатит.
Как и в фазе индукции, дозу ЦсА опреде-
ляют по его концентрации в крови, которую
мы стремимся поддерживать на уровне не ниже
100 нг/мл и оптимально — в диапазоне ПО-
ПО нг/мл. Доза преднизолона к концу 1 года
663
составляет 5—10 мг/сут, доза азатиоприна —
0,8—1,5 мг/кг в сутки.
Вопрос о сравнительной эффективности
различных режимов поддерживающей иммуно-
супрессии до сих пор дискутабелен. На матери-
але примерно 100 000 трансплантаций базы
данных Многоцентрового Трансплантационного
Исследования (CTS) G.Opelz (1997) показал,
что пересадка почки наиболее успешна, если
ЦсА применяют как монотерапию или только
в сочетании с азатиоприном, т.е. при полном
исключении кортикостероидов. В этих условиях
5-летняя выживаемость трансплантатов прибли-
жается к 80 % и оказывается примерно на 10 %
выше, чем при одновременном использовании
преднизолона. Преимущества исключения из
поддерживающей иммуносупрессии кортикос-
тероидов подтверждают также G.Touchard и
соавт. (1997) и др. Стремление к отказу от их
постоянного применения в последние годы
становится все более популярным, так что ряд
авторов после 3—6-месячного их использования
переходит на поддерживающую монотерапию
ЦсА. Примером такого перехода служит систе-
ма, принятая как стандартная в Центре транс-
плантации в Мюнхене. В соответствии с нею
3-недельная индукционная иммуносупрессия 3
иммуносупрессантами сменяется комбинацией
ЦсА и кортикостероидов, а спустя 6 мес пос-
ле трансплантации последние отменяют, и ре-
ципиента постепенно переводят на монотера-
пию ЦсА. Однако полностью исключить корти-
костероиды можно только у части (у 58—75 %)
реципиентов, в то время как у остальных их
возобновление неизбежно, чаще всего в связи
с кризами отторжения [Opelz G., 1998; Tou-
chard G. et al., 1997].
Другой важный вывод исследования G.Opelz
(1997) состоит в том, что наиболее распрост-
раненный вариант поддерживающей иммуно-
супрессии, а именно комбинация ЦсА, корти-
костероидов и азатиоприна [Шумаков В.И.,
1995; Ватазин А.В. и др., 1998; Amenabar J. et
al., 1998, и др.], не имеет особых преимуществ
по сравнению с использованием ЦсА только с
кортикостероидами. Пятилетняя выживаемость
трансплантатов в условиях обоих поддержива-
ющих режимов оказалась примерно одинакова
и составила около 70 %. К такому же выводу
пришли R.Kunz и соавт. (1997), которые пред-
ставили результаты мета-анализа 449 сообще-
ний по этому вопросу. Из этого анализа следу-
ет, что, отмечая возможную недостаточность
иммуносупрессивного эффекта при исключении
азатиоприна, многие авторы предпочитают
2-компонентную иммуносупрессию ЦсА и кор-
тикостероидами, поскольку она менее угрожа-
ема в отношении тяжелых инфекционных ос-
ложнений. Лишь по данным С.Ponticelli и со-
664
авт. (1997), в этих условиях значимо возрастает
частота осложнений, что, по-видимому, связа-
но с применением этими авторами более вы-
соких доз ЦсА. Наши собственные исследова-
ния не выявили различий в частоте побочных
эффектов в условиях 2- и 3-компонентной
иммуносупрессии. Исключение азатиоприна в
наших наблюдениях повышало вероятность хро-
нического отторжения трансплантированной
почки. Частота последнего в первые 5 лет пос-
ле трансплантации в условиях 3-компонентно-
го режима составила 52 %, на фоне 2-компо-
нентного — 79 % (р < 0,001). Мы полагаем, что
отличия наших данных от большинства лите-
ратурных могут быть объяснены применением
нами более низких доз ЦсА [Ким И.Г., 1999].
Как показывает анализ литературы, концент-
рация этого препарата в крови при отмене аза-
тиоприна поддерживается, как правило, на
уровне не ниже 150 нг/мл.
Значение дозы ЦсА вот уже на протяжении
2 десятилетий остается предметом многочислен-
ных сообщений. По материалам 8-летних наблю-
дений у 31 915 реципиентов аллогенной почки
G.Opelz (1998) установил, что оптимальной
является доза ЦсА от 3 до 5 мг/кг в сутки;
8-летняя выживаемость трансплантатов мини-
мальна (55—62 % ) при дозе ниже 3 мг/кг и
выше 6 мг/кг в сутки. Отрицательное влияние
высокой дозы препарата рассматривают как
следствие хронической ЦсА-нефротоксичности,
а низкой — хронического отторжения в резуль-
тате недостаточной иммуносупрессии [Opelz G.,
1998]. Эти данные согласуются и с более ран-
ними исследованиями H.Almond и соавт. (1993),
согласно которым через 5 лет после операции
частота хронического отторжения возрастает бо-
лее чем в 1,5 раза, если доза ЦсА в течение пер-
вого года после операции не достигает 5 мг/кг
в сутки.
Однако в связи с особенностями фармако-
кинетики ЦсА [Kalian В., Grevel J., 1988] наи-
более широкое распространение получило до-
зирование препарата по уровню в крови. В прак-
тических целях концентрацию ЦсА определя-
ют в пробах крови, взятых натощак, через 12 ч
после предыдущего и непосредственно перед
очередным приемом препарата.
Адекватность иммуносупрессии обеспечива-
ется, если уровень ЦсА в крови поддерживает-
ся в пределах так называемого терапевтическо-
го окна, т.е. в диапазоне от 100 до 400 нг/мл
при использовании моноклонального радиоим-
мунного теста [Kahan В., Grevel J., 1988]. Оп-
тимальный уровень для каждого конкретного
пациента зависит от срока после транспланта-
ции, сопутствующей иммуносупрессии, реналь-
ных и/или экстраренальных осложнений и ряда
других факторов.
Общепризнано, что в первые месяцы после
трансплантации оптимальной является более
высокая концентрация препарата, соответству-
ющая верхней половине «терапевтического»
диапазона. То же самое, как уже упоминалось,
относится и к монотерапии ЦсА или к его
комбинации с азатиоприном при исключении
кортикостероидов.
Важным аспектом применения ЦсА являет-
ся также необходимость стабилизации его уров-
ня в крови (см. ниже).
Таким образом, различные современные
протоколы поддерживающей иммуносупрессии
обеспечивают высокую выживаемость транс-
плантатов и различаются в основном характе-
ром и частотой побочных эффектов. Рекомен-
довать какой-либо один из них как «идеальный»
не представляется возможным. Выбор того или
иного режима иммуносупрессии определяется,
с одной стороны, индивидуальными особенно-
стями реципиента, а с другой, — традициями
работы конкретного центра трансплантации.
Конверсия циклоспорина А в течение ряда
лет была предметом широкой дискуссии. Как
показали исследования G.Opelz (1994), осно-
ванные на анализе материалов более 15 000
трансплантаций почки, 5-летняя выживаемость
трансплантатов после отмены ЦсА примерно на
14 % ниже, чем при его непрерывном приме-
нении. Однако этому противоречат данные дру-
гих авторов |Newstead С. et al., 1998, и др.|.
В наблюдениях C.Newstead и соавт. (1998) пос-
ле конверсии 5-летняя выживаемость транс-
плантатов, функционировавших не менее 1 го-
да, составляет около 85 % и существенно не от-
личается от этого показателя в «неконвертиро-
ванной» группе. Весьма вероятно, что приведен-
ные противоречия связаны с различиями усло-
вий конверсии. Однако, даже отрицая влияние
конверсии ЦсА на отдаленную судьбу переса-
женной почки, все исследователи отмечают,
что отмена препарата провоцирует кризы от-
торжения.
В связи с этим ряд авторов указывают на
необходимость при отмене ЦсА превентивного
усиления традиционной иммуносупрессии
jShen S. el al., 1989].
Изучение этой проблемы было предметом и
нашего специального исследования [Ким И.Г.
и др., 1997]. Попытку отмены ЦсА мы предпри-
няли у 70 реципиентов аллогенной трупной
почки. У 25 из них препарат отменяли посте-
пенно (в течение 8—12 нед) на фоне неизме-
ненной традиционной иммуносупрессии неза-
висимо от сроков после операции и функцио-
нального состояния трансплантированной поч-
ки. У 45 реципиентов режим конверсии отли-
чался обязательным превентивным усилением
базисной иммуносупрессии, в связи с чем не
позднее чем за 2 нед до отмены ЦсА дозу азатио-
прина повышали до 2 мг/кг в сутки, а при сни-
жении концентрации ЦсА крови до 50 нг/мл
увеличивалась и доза преднизолона (до 0,5—
0,6 мг/кг массы тела). После завершения кон-
версии дозы обоих препаратов постепенно сни-
жали до исходных. Кроме того, в таких случаях
конверсию осуществляли не ранее чем через 8—
12 мес после трансплантации и только при
условии стабильной удовлетворительной фун-
кции трансплантата. При подозрении на субкли-
ническую активность отторжения проводили
пункционную биопсию трансплантата, а при
верификации отторжения — профилактическую
пульс-терапию кортикостероидами |Shen S. et
al., 1989]. Длительность наблюдения после кон-
версии ЦсА составила 43,4±2,8 мес.
При использовании первой методики ЦсА
удалось отменить только у 4 из 25 больных
(16 %). В то же время в условиях второй мето-
дики она оказалась успешной в 51,1 % случаев
(р < 0,01). Хотя кризы отторжения в обеих
группах возникали с одинаковой частотой, хро-
ническое отторжение трансплантата и «почеч-
ную смерть» в условиях первой методики на-
блюдали значительно чаще. При этом течение
хронического отторжения отличалось более
быстрым прогрессированием.
Таким образом, в наших наблюдениях кон-
версия ЦсА резко повышала вероятность хро-
нического отторжения пересаженной почки,
если ослабление иммуносупрессии в связи с
отменой ЦсА не компенсировалось повышени-
ем доз традиционных иммуносупрессантов, а
также если конверсию производили относитель-
но рано после трансплантации и без учета воз-
можности латентного отторжения. В то же вре-
мя при соблюдении этих условий 5-летняя
выживаемость трансплантатов (рис. 40.1) зна-
чимо не отличалась от показателя в группе ре-
ципиентов, не подвергавшихся конверсии (со-
ответственно 66 и 75 %, р > 0,05).
В настоящее время конверсия ЦсА в связи
с риском активации отторжения единодушно
признается как крайне нежелательная. Она
допустима только в исключительных случа-
ях и при соблюдении специальных, изложен-
ных выше условий.
40.5. Отторжение в раннем
послеоперационном периоде
Отторжение является наиболее серьезной про-
блемой раннего послеоперационного периода и
одной из основных причин ранних потерь
трансплантата.
665
В этом периоде выделяют сверхострое, уско-
ренное и острое отторжение. Все они могут быть
определены как поражение трансплантирован-
ной почки, вызванное специфической реакцией
иммунной системы реципиента на трансплан-
тационные антигены донора [Ратнер М.Я.,
1977; Томилина Н.А., 1988; Hamburger J. et al.,
1964].
Сверхострое отторжение, наблюдаемое, по
нашим данным, в 2—3 % случаев, развивается
сразу после включения трансплантата в крово-
ток и связано с действием присутствующих в
сыворотке реципиента предсуществующих ан-
тител к лейкоцитарным антигенам донора.
Сверхострое отторжение возникает, как прави-
ло, при высоком предоперационном титре ан-
тител (более 50 %), причем отрицательный
результат прямой перекрестной пробы между
лейкоцитами донора и сывороткой больного не
исключает возможности его развития.
В таких случаях уже через 15—20 мин после
включения трансплантата в кровоток резко сни-
жается его тургор, цвет становится синюшным.
Прекращается мочеотделение.
Внутриартериальное введение вазодилатато-
ров, кортикостероидов, эуфиллина неэффек-
тивно. Трансплантат подлежит немедленному
удалению.
Ускоренное отторжение может рассматривать-
ся как вариант сверхострого, поскольку оно
преимущественно обусловлено действием гумо-
ральных факторов и развивается в течение 12—
72 ч после операции.
Клинически оно проявляется отсутствием
функции трансплантата. В этих случаях необхо-
дим дифференциальный диагноз с ОКН, по-
казана биопсия трансплантата.
Как и для предупреждения, для лечения
ускоренного отторжения целесообразна 4-ком-
понентная индукционная иммуносупрессия,
возможно в сочетании с плазмаферезами.
Острое отторжение (криз отторжения), даже
в условиях современной высокоэффективной
иммуносупрессии, возникает у 60—70 % реци-
пиентов. Как правило, оно развивается в тече-
ние первых 3 мес и чаще всего в первые 6 нед
после операции, хотя иногда может появлять-
ся и в отдаленные сроки.
Кризы отторжения могут протекать с пре-
обладанием клеточного либо гуморального ком-
понентов иммунного ответа, а также по сме-
шанному типу.
При доминировании клеточного компонен-
та морфологически на первый план выступает
картина острого тубулоинтерстициального не-
фрита, и при этом патогномоничным призна-
ком криза является тубулит. При преобладании
гуморальных механизмов возникает острый
ангиит с поражением мелких и средних арте-
666
рий трансплантата, иногда с сопутствующим
гломерулитом [Solez К. et al., 1993].
Течение и прогноз острого отторжения тес-
но коррелируют с его иммунопатологическими
механизмами. При так называемом клеточном
типе криз отторжения хорошо контролируется
массивной иммуносупрессией. В то же время
сосудистый вариант острого отторжения отли-
чается рефрактерностью к терапии.
Для криза отторжения характерны повыше-
ние температуры тела, нередко опережаю-
щее падение функции трансплантата, боли и
дискомфорт в области трансплантата, увели-
чение его размеров, снижение диуреза, по-
вышение уровня креатинина плазмы крови,
артериальная гипертония.
Однако следует иметь в виду, что в услови-
ях действия ЦсА клиническая картина криза не-
редко оказывается нечеткой. И, как уже упо-
миналось, наиболее труден этот диагноз на
фоне ОКН и олигоанурии с исходно высоким
уровнем азотемии.
УЗИ выявляет увеличение размеров транс-
плантата, который зачастую приобретает ша-
ровидную форму, утолщение коркового слоя,
увеличение размеров и снижение эхогенности
мозгового вещества, снижение эхогенности
почечного синуса, а также утолщение стенки
чашечно-лоханочной системы почки. При доп-
плеросонографии снижается артериальный
кровоток за счет повышения периферическо-
го сопротивления сосудистого русла почки,
что выражается снижением или отсутствием
артериального кровотока в диастоле. Появле-
ние реверсивного кровотока в диастоле — до-
статочно специфичный признак тяжелого от-
торжения.
Для уточнения диагноза рекомендуется био-
псия трансплантата под ультразвуковым конт-
ролем.
Лечение отторжения начинают обычно с
пульс-терапии метилпреднизолоном, который
вводят внутривенно в дозе 500—1000 мг в те-
чение 3 сут. Кроме того, может быть увеличена
базисная иммуносупрессия, особенно если от-
торжение развивается на фоне низкого уровня
ЦсА в крови.
При стероидрезистентных кризах отторжения
должны быть использованы препараты поли-
(АТГ, АЛГ) и моноклональных (ОКТ-3) анти-
тел к Т-лимфоцитам. АТГ применяют в дозе 4—
5 мг/кг в течение 14—21 сут и, как правило,
его хорошо переносят больные, за исключени-
ем редких случаев аллергических (вплоть до
анафилактоидных) реакций. ОКТ-3, вводимо-
му в дозе 5 мг/сут в течение 10 дней, свойствен-
ны более выраженные побочные эффекты, осо-
бенно при первых двух инъекциях. Характерна
гипертермия, но возможны отек легких, судо-
роги, асептический менингит.
Наш собственный опыт использования АТГ
или ОКТ-3 для лечения тяжелых кризов оттор-
жения свидетельствует о высокой их эффектив-
ности. В случаях рефрактерности и к этим пре-
паратам мы присоединяли плазмаферезы, что
позволяло купировать достаточно тяжелые кри-
зы отторжения. Тем не менее в связи с неболь-
шим опытом мы не можем определенно выс-
казаться об эффективности и безопасности это-
го метода.
Во избежание тяжелых вирусных инфекций
лечение АТГ или ОКТ-3, как и их профилак-
тическое применение, следует сочетать с вве-
дением ганцикловира или ацикловира [Мойсюк
Я.Г. и др., 1997].
При лечении повторных кризов отторжения,
которое не отличается от терапии первого эпи-
зода, необходимо иметь в виду, что суммарная
доза метилпреднизолона не должна превышать
5 г, а повторные курсы АТГ или ОКТ-3 зачас-
тую неэффективны из-за формирования к ним
антител.
40.6. Отдаленные результаты
Современный прогресс трансплантологии прин-
ципиально изменил течение и исход первого
года после трансплантации почки, но сравни-
тельно мало повлиял на отдаленные результа-
ты операции. Последние, по общему призна-
нию, до настоящего времени остаются неудов-
летворительными.
Число трансплантатов, функционирующих к
концу 1-го года после операции, к настояще-
му времени превысило 80 %, а в ряде центров
даже достигло 90—95 %, однако число почеч-
ных трансплантатов, продолжающих функцио-
нировать в течение 5 и особенно 10 лет после
операции, остается невысоким. Пятилетняя вы-
живаемость первичного трупного транспланта-
та составляет лишь 58—62 %, а 10-летняя —
только 42—48 % [Opelz G., 1997; Newstead С.
et al., 1998]. При родственных пересадках отда-
ленные результаты несколько лучше, и 5-лет-
няя выживаемость трансплантатов равна при-
мерно 75 % [Dunn J. et al., 1990; Cecka J. et al.,
1996, и др.].
Естественно, что у пациентов группы повы-
шенного риска, в том числе у больных сахар-
ным диабетом и у пожилых, отдаленный ис-
ход трансплантации почки хуже, чем у «неди-
абетиков», а также у лиц моложе 60 лет. По
данным G.Opelz (1997), обобщающим резуль-
таты 11 773 трансплантаций трупной почки при
сахарном диабете, выживаемость этих реципи-
ентов через 10 лет после операции составляет
только 45 %, а доля трансплантатов, функци-
онирующих к этому сроку, равна лишь 30 %.
Отсутствие заметных позитивных сдвигов в
отдаленных результатах трансплантации почки
выступает еще демонстративнее при изучении
так называемого периода полужизни. Этим тер-
мином обозначают интервал времени, в тече-
ние которого «погибает» (прекращает работу)
50 % от общего числа трансплантатов, «пере-
живших» 1 год после операции.
Если показатели выживаемости транспланти-
рованной почки отражают общий, итоговый
результат операции, ибо при их вычислении
принимаются во внимание все трансплантации,
то период полужизни, расчет которого имеет
в виду только трансплантаты, «пережившие»
первый посттрансплантационный год, характе-
ризует именно отдаленную судьбу пересаженно-
го органа.
Как показывает международный опыт, за
последние 2 десятилетия этот показатель при
первичных трансплантациях трупной почки
увеличился лишь примерно на 2 года и в на-
стоящее время составляет в среднем 8,6—10 лет
[Ким И.Г., 1999; Gjertson D., 1992; Opelz G.,
1997; Terasaki P. et al., 1992, и др.]. Период по-
лужизни родственного трансплантата в 1,7—2,3
раза больше и находится в диапазоне 14,7—23,4
года [Dunn J. et al., 1990; Cecka J. et al., 1996].
Среди причин, ограничивающих срок жиз-
ни трансплантированной почки, главную роль
играет хроническое отторжение. Возникая у 35—
70 % реципиентов, эта патология весьма суще-
ственно (до 31 % и более) снижает 5-летнюю
выживаемость трансплантатов [Almond H.S. et
al., 1993; Kasiske B.L., 1997].
40.7. Хроническое отторжение
трансплантированной почки
Хроническое отторжение трансплантированной
почки (ХОТ) в настоящее время определяют
как ее необратимое поражение, основным про-
явлением которого является постепенно про-
грессирующее снижение почечных функций с
исходом в хроническую почечную недостаточ-
ность, если при этом исключаются все другие
возможные причины ренальной дисфункции.
С морфологической точки зрения, ХОТ
представляет собой фибропролиферативный
эндартериит в сочетании с тубулоинтерстици-
альным фиброзом и гломерулосклерозом
[Rossmann Р., Jirka Е, 1979; Solez К. et al., 1993,
и др.].
667
Рис. 40.1. Влияние конверсии ЦсА на выживаемость
трансплантатов (в процентах).
а — нсконвсртированная группа (п = 144); б — конверти-
рованная группа (п = 45).
Вопрос о наиболее вероятных сроках возник-
новения ХОТ изучен мало. Особый интерес в
этом отношении представляют исследования
G.Opelz (1997). Использовав материалы 97 502
первичных трансплантаций трупной почки,
автор определил риск «потери» трансплантата
в течение первых 10 посттрансплантационных
лет. В пределах указанного срока он рассчитал
выживаемость трансплантатов, «переживших»
1, 2, 3 года и более. Кривые выживаемости,
полученные таким образом, оказались практи-
чески параллельными (рис. 40.1). Угол их накло-
на не зависел от времени, прошедшего с мо-
мента трансплантации. Это позволило G.Opelz
(1997) сделать важный вывод о том, что риск
«потери» пересаженной почки в течение по
крайней мере всего рассмотренного им 10-лет-
него периода остается одинаковым. Полученные
данные позволили также автору утверждать, что
вероятность прекращения функции трансплан-
тированной почки не зависит от длительности
предшествующего периода ее «жизни» в организ-
ме реципиента, а допущение рядом исследова-
телей возможной, возникающей со временем
адаптации донорского органа неправомочно.
Мы проследили сроки возникновения ХОТ на
материале 232 первичных трансплантаций трупной
почки, произведенных в 1989—1992 гг. Срок наблю-
дения после операции составил от 12 до 107 мес (в
среднем 53+27,6 мес) (Ким И.Г., 1999].
ХОТ констатировано нами у 129 из 232 реципи-
ентов (в 56 % случаев) и, как правило (в 127 случа-
ях), в первые 5 лет после трансплантации. Далее ак-
туариальным методом мы рассчитали так называе-
мую функциональную выживаемость (ФВ) транс-
плантатов, т.е. долю трансплантатов, функция кото-
рых к определенному сроку после операции обеспе-
чивала стабильный нормальный уровень креатини-
на в плазме крови, что указывало на отсутствие ХОТ.
668
У прослеженных реципиентов 5-летняя ФВ транс-
плантатов составила 45 %, причем пологий харак-
тер наклона кривой (рис. 40.2) позволил предпола-
гать одинаковый риск выявления ХОТ на всем про-
тяжении указанного срока. Для проверки этого пред-
положения мы использовали такой же подход, как
и G.Opelz (1997), и рассчитали раздельно ФВ транс-
плантатов в подгруппах реципиентов, не имевших
ХОТ через 1, 2, 3, 4 и 5 лет после операции (рис.
40.3). Кривые 5-летней ФВ в этих подгруппах оказа-
лись почти параллельными, что означает равную
степень риска ХОТ в течение первых 5 лет после
трансплантации. Вместе с тем из анализа кривых ФВ
стало очевидным также, что спустя 5 лет темп при-
роста впервые выявляемого ХОТ замедляется. Таким
образом, в наших наблюдениях наиболее вероятным
сроком выявления ХОТ оказались первые 5 лет пос-
ле операции. Окончательное выяснение этого воп-
роса требует дальнейших исследований.
Вопрос о факторах риска и патогенетичес-
ких механизмах ХОТ уже многие годы являет-
ся предметом интенсивного изучения. Если ра-
нее полагали, что оно возникает вследствие
специфического ответа иммунной системы ре-
ципиента на трансплантационные антигены
донора [Ратнер М.Я. и др., 1977; Томили-
на Н.А., 1988; Шумаков В.И. и др., 1982;
Rossmann Р., Jirka, 1979; Hayry Р., 1981], то в
настоящее время все популярнее становится
точка зрения, согласно которой ХОТ иниции-
руется также и различными неспецифически-
ми механизмами. Важная роль последних была
столь убедительно продемонстрирована экспери-
ментально и клинически [Brenner В., Milford Р.,
1993; Mackenzie Н. et al., 1995; Chertow G. et al.,
1995, 1997; Ritz E., 1997, и др.], что позволи-
ло B.M.Brenner (1995) полностью отрицать зна-
чение в патогенезе ХОТ иммунологических, ан-
тигензависимых механизмов и рассматривать эту
патологию только как прогрессирующий не-
фросклероз, индуцируемый различными неспе-
цифическими стимулами, связанными со сни-
жением массы (числа) действующих нефронов
(МДН) трансплантата, изначального или воз-
никающего de novo. Однако этой полярной точ-
ке зрения противостоит мнение большинства
других исследователей, которые, не отрицая
значения неспецифических факторов, настаи-
вают на одновременной роли специфических
иммунологических механизмов [Sollinger Н.,
1995; Opelz G., 1997; Kasiske В., 1997; Paul L.
et al., 1997, и др.]. В наших собственных иссле-
дованиях в регрессионной модели Кокса также
подтвердилось значение последних, притом что
одновременно высокозначимым оказалось и
действие неспецифических факторов [Ким И.Г.,
1999].
Таким образом, в настоящее время природа
ХОТ рассматривается как комплексная, вклю-
чающая действие как антигензависимых меха-
низмов, так и неспецифических антигеннеза-
висимых факторов | Peelers J. et al., 1995; Paul L.
et al., 1997, и др.).
Ниже рассмотрено значение важнейших из
них.
40.7.1. Специфические,
антигензависимые механизмы
хронического отторжения
трансплантированной почки
Гистосовместимость. Вопрос о связи между от-
даленной судьбой аллотрансплантированной
почки и тканевой несовместимостью в течение
многих лет остается предметом дискуссии. И все
же в настоящее время большинство авторов
склонны рассматривать этот фактор как один
из важных пусковых механизмов ХОТ [Thoro-
good J. et al., 1992; Kasiske B.L, 1997; Opelz G.,
1997; Paul L. et al., 1997, и др.].
Его значение не вызывает сомнений при
трансплантации почки от живого донора
ITerasaki Р. et al., 1992; Opelz G., 1994, и др.].
Особенно ярко это описано в монографии
P.Terasaki и соавт. (1992), в которой авторы,
обобщив свой многолетний опыт, показали, что
период полужизни трансплантатов у HLA —
идентичных сиблингов почти в 2 раза больше,
чем у гаплосовместимых (более 20 и 10 лет со-
ответственно). Интересно, что у последних он
оказался только на 2—3 года больше периода
полужизни при трансплантации трупной поч-
ки, не совместимой по всем антигенам систе-
мы HLA.
В одном из наиболее полных и обстоятельных
многоцентровых исследований |Opelz G., 1997]
на материале почти 100 000 трансплантаций
почки установлена достоверная и статистичес-
ки высокозначимая корреляция (р < 0,0001)
между числом несовпадений по антигенам HLA
А, В, DR, с одной стороны, и 20-летней вы-
живаемостью первичного трупного трансплан-
тата, а также периодом полужизни — с другой.
При полном совпадении по всем 6 антигенам
выживаемость трансплантатов через 20 лет пос-
ле операции составила 32 %, а период полу-
жизни — 13,1 года. При отсутствии полной со-
вместимости по мере увеличения числа несов-
падений оба показателя прогрессивно снижа-
лись. Таким образом, 20-летняя выживаемость
и период полужизни были равны соответствен-
но: при несовпадении по 1 антигену 23 % и 10,1
года, по 2 — 22 % и 10,2 года, по 3 — 19 % и
9,1 года, по 4 — 18 % и 8,8 года, по 5 — 15 %
и 7,9 года и при полном несовпадении по 6 ан-
тигенам системы HLA — только 12 % и 7 лет.
Из этих данных видно, что для отдален-
ных результатов трансплантации трупной
Рис. 40.2. Функциональная выживаемость трансплан-
татов (в процентах).
Рис. 40.3. Вероятность ХОТ в разные сроки после
трансплантации почки (100 % — число транспланта-
тов со стабильной удовлетворительной функцией).
почки, с одной стороны, принципиальное зна-
чение имеет полная гистосовместимость, а с
другой — различия в судьбе пересаженной
почки при расхождении в пределах от 1 до 3 и
даже до 4 антигенов несущественны. Однако и
в этих случаях операция результативнее, чем
при расхождении по 5 или 6 антигенам. Опре-
деляющее значение для судьбы пересаженной
трупной почки полной совместимости или не-
совместимости по всем 6 антигенам системы
HLA подтверждают также и J.Thorogood и со-
авт. (1991). По их наблюдениям, в первом слу-
чае 5-летняя выживаемость трансплантатов рав-
на 79 %, а во втором — только 51 %. Период
полужизни при этом различается примерно в
1,7 раза и равен соответственно 13,2 и 7,8 года.
Интересно, что второй показатель практичес-
ки совпадает с величиной, приводимой
P.Terasaki и соавт. (1992), именно для таких же
случаев.
По данным Евротранспланта и UCLA, со-
вместимость по разным антигенам системы
HLA имеет неодинаковое значение. В частности,
есть основания считать, что совпадения по
669
HLA-DR особенно существенны для 1-летней
выживаемости трансплантированной трупной
почки, а совместимость по антигенам HLA-B
влияет в основном на ее отдаленную судьбу
IThorogood J. et al., 1992|. По материалам 12 883
операций было установлено, что при совмес-
тимости по обоим антигенам сублокуса HLA-B
период полужизни достигает 13,2 года, в то
время как при их несовпадении он равен лишь
9 годам (р = 0,013).
Вместе с тем J.Pirsch и соавт. (1996) утвер-
ждают, что совместимость по HLA-DR имеет
значение и для поздних результатов трансплан-
тации трупной почки. По данным этих авторов,
5-летняя выживаемость, рассчитанная для
трансплантатов, которые функционировали не
менее 1 года, при полной совместимости по
HLA-DR достигает 95 %, а при полном несов-
падении — 79 % (р = 0,005).
Однако результатам многоцентровых иссле-
дований противоречат данные ряда отдельных
центров трансплантации, отрицающие значение
гистосовместимости для отдаленного исхода
трансплантации трупной почки [Tesi R., 1993,
и др.]. Это противоречие можно объяснять раз-
ными причинами, но важнейшими из них,
видимо, являются различия в объеме анализи-
руемого материала и так называемый эффект
центра, что означает специфику работы после-
днего, определяющую присущие только этому
центру результаты операции.
Независимо от причины указанное противо-
речие заслуживает особого внимания. Оно дает
основание считать, признавая гистонесовмес-
тимость бесспорным патогенетическим механиз-
мом хронического отторжения аллогенной поч-
ки, что при трансплантации трупного донорс-
кого органа она все-таки не имеет решающего
значения. Это убедительно подтверждают ре-
зультаты трансплантации от живого неродствен-
ного донора. Продиктованная постоянным де-
фицитом донорских органов эта операция ока-
залась не менее успешной, чем родственная
трансплантация, и в связи с этим находит все
больше сторонников. По данным регистра
США, 3-летняя выживаемость почек, транс-
плантированных от супругов, достигает 85 %,
при использовании живого неродственного
донора — 81 %, при трансплантации почки от
родителей — 82 %, но она равна только 70 %,
если был использован трупный донорский
орган |Terasaki Р. et al., 1995]. Интересно, что
результаты трансплатации трупной почки ока-
зались наиболее низкими даже при лучшем
индексе совместимости по HLA-A, В и DR. И
хотя последняя, несомненно, влияла на исход
пересадки от живого неродственного донора и
число несовпадений по HLA-DR коррелировало
с частотой кризов отторжения, тем не менее
670
результаты пересадки трупной почки были ме-
нее эффективными, чем трансплантация от
живого неродственного донора. Более подроб-
ный анализ показал, что это отличие могло
быть поставлено в связь только с определенной
частотой шока у доноров в агональном перио-
де [Terasaki Р. et al., 1995].
40.7.2. Кризы отторжения
Более весомым аргументом в пользу антиген-
зависимой природы ХОТ является связь между
кризами отторжения и отдаленной судьбой
трансплантированной почки [Томилина Н.А.,
1988; Ким И.Г., 1999; Lindholm A. et al., 1993;
Yilmas S., Hayry P., 1993; Matas A. et al., 1994;
Flechner S. et al., 1996, и др.], многократно про-
демонстрированная исследованиями разных
авторов. По данным A.Lindholm и соавт. (1993),
при пересадке трупной почки кризы отторже-
ния способствуют снижению периода полужиз-
ни трансплантатов почти в 2 раза — с 12,5 до
6,6 года (р < 0,0001). В наблюдениях A.Matas и
соавт. (1994), также касающихся пересадки
трупной почки, период полужизни при отсут-
ствии кризов достигал даже 33 лет, а в случа-
ях, осложнявшихся лишь 1 эпизодом отторже-
ния, снижался до 22 лет. В исследованиях
A.Lindholm и соавт. (1993) кризы отторжения
еще заметнее влияли на отдаленную судьбу поч-
ки, трансплантированной от живого донора. При
этом период полужизни снижался более чем в
3 раза — с 39,2 года до 9 лет (р < 0,001). В на-
ших исследованиях 5-летняя ФВ трансплантиро-
ванной трупной почки составляла 54 % при бес-
кризовом течении и только 36 %, если оно ос-
ложнялось кризами (р < 0,01) (рис. 40.4, а, б)
[Ким И.Г., 1999]. Более того, ранее нами было
установлено что для реципиентов, перенесших
эпизоды отторжения, в отличие от не имевших
этого осложнения характерно относительно
раннее (уже спустя 4 года после операции)
прогрессирующее снижение способности к ос-
мотическому концентрированию мочи с исхо-
дом в ХПН, означавшую манифестацию ХОТ
[Томилина Н.А., 1988].
Однако, по мнению ряда авторов, отрица-
тельное влияние на отдаленную судьбу транс-
плантата оказывают не все кризы. По данным
Y.Vanrenterghem (1995), 5-летняя выживаемость
трансплантатов и период полужизни практичес-
ки одинаковы при послеоперационном течении
без кризов либо с одним кризом отторжения,
тогда как после повторных кризов она снижа-
ется с 78 до 51,9 % (р < 0,0005). При этом пе-
риод полужизни уменьшается примерно на 7—
9 лет — до 12,7 года. В наблюдениях A.Matas и
соавт. (1994) этот эффект еще заметнее — при
Рис. 40.4. Связь между кризами отторжения и ХОТ.
а — течение без кризов (п = 119); б — течение с кризами
(п = 113); в — один криз (90); г — повторные кризы (23).
течении с 1 кризом отторжения период полу-
жизни составлял 22 года, но он снижался до
5 лет, если они возникали повторно. В наших
наблюдениях после повторных кризов вероят-
ность ХОТ возрастала в 2,4 раза. Соответствен-
но 5-летняя ФВ при течении с 1 кризом оттор-
жения составила 40 %, а при их повторяемос-
ти — только 18 % (р < 0,033) (см. рис. 40.4, в, г)
[Ким И.Г., 1999].
Значение кризов отторжения в патогенезе
ХОТ убедительно доказано и морфологически.
S.Yilmaz и Р.Наугу (1993) на модели трансплан-
тации почки у крыс продемонстрировали зна-
чимую корреляцию между интенсивностью
пролиферации интимы артерий и числом кри-
зов отторжения.
Результаты изучения биоптатов трансплан-
тированной почки в клинике полностью согла-
суются с этими данными. G.Basadonna и соавт.
(1993), Y.Vanrenterghem и соавт. (1997) показа-
ли, что частота ХОТ, по данным гистоморфо-
логического исследования, прямо зависит от
количества перенесенных реципиентом кризов
отторжения, причем это относится в равной
мере как к трупному, так и к родственному до-
норскому органу. В частности, Y.Vanrenterghem
и соавт. (1997) констатировали патоморфоло-
гическую картину ХОТ только в 14 % случаев
при течении без либо с одним кризом оттор-
жения и в 35,7 %, если кризы были повтор-
ными (р = 0,035). Эти данные позволили
Y.Vanrenterghem и соавт. (1997) сделать заклю-
чение о том, что серьезную угрозу для «жизни»
пересаженной почки на всех этапах после транс-
плантации представляют не единичные ранние
эпизоды отторжения, а множественные кризы,
которые и влияют значимо на отдаленный исход
операции.
Другим весьма важным предиктором ХОТ
является срок возникновения криза отторжения.
Чаще всего оно развивается в исходе поздних
кризов, возникающих спустя 2—3 мес после
операции. В наблюдениях S.Flechner и соавт.
(1996) через 5 лет после трансплантации при-
знаки ХОТ выявляли лишь у 19 % реципиен-
тов, перенесших ранние (в первые 2 мес) эпи-
зоды отторжения, но были констатированы
примерно в 70 % случаев, протекавших с бо-
лее поздними кризами (р = 0,001). Сходные
результаты опубликованы G.Bassadonna и соавт.
(1993), причем эта группа авторов подтверди-
ла полученные данные и на материале род-
ственных трансплантаций. В наших наблюдени-
ях ранние обратимые кризы отторжения также
существенно не сказывались на частоте ХОТ.
Наконец, важным аспектом связи между ХОТ
и кризами отторжения является тяжесть после-
дних. В публикациях различных авторов в каче-
стве критериев тяжести рассматривают разные
параметры — от степени и темпа нарастания
гиперкреатининемии до ответа на терапию. Од-
нако, по какому бы критерию ни оценивали
тяжесть криза отторжения, его влияние на ве-
роятность ХОТ очевидно. По данным J.Cecka и
соавт. (1989), криз не отражается на дальнейшей
судьбе трансплантата, если он протекает с по-
вышением креатинина плазмы крови не более
чем на 133 мкмоль/л, но снижает вероятность
последующего годичного «выживания» транс-
плантата до 50 %, если проявляется ростом кре-
атининемии более чем на 310 мкмоль/л.
671
a -- течение без кризов; б - ранние кризы обратимые и
в - частично обратимые.
Рис. 40.6. Значение дозы ЦсАдля профилактики ХОТ.
а — ЦсА крови 100—200 нг/мл (п - 150); б — ЦсА крови
менее 100 нг/мл (и 14).
S.Flechner и соавт. 61996) установили, что ча-
стота ХОТ значимо возрастает после кризов, с
трудом поддающихся терапии, когда, вопреки
лечению, креатинин плазмы крови неуклонно
повышается вплоть до 5 сут (р = 0,03). В наших
наблюдениях ХОТ оказалось практически зако-
номерным исходом тяжелых, лишь частично
уступавших терапии кризов (рис. 40.5) |Ким
Й.Г., 19991. Их особенностью было неполное
устранение развившейся почечной недостаточ-
ности. Однако еше ранее мы доказали, что толь-
ко персистирование вызванной кризом изоли-
рованной канальцевой дисфункции, даже при
полном восстановлении клиренса креатинина,
является важным предиктором ХОТ [Томили-
на Н.А., 1988].
Таким образом, рассматривая кризы оттор-
жения как важный антигензависимый фактор
риска и патогенетический механизм ХОТ, сле-
дует иметь в виду, что наиболее значимы в этом
отношении повторные, преимущественно по-
здние и особенно тяжелые кризы.
40.7.3. Режим иммуносупрессии
В качестве третьего весомого аргумента в пользу
значения иммунологических, антигензависимых
механизмов в патогенезе ХОТ рассматривают
связь между его возникновением и неадекват-
ностью иммуносупрессии.
Снижение уровня ЦсА ниже порогового, т.е.
ниже 100 нг/мл, резко повышает вероятность
ХОТ [Kahan В. et al., 1988; Dunn J. et al., 1990;
Ponticelli C., Tarantino A., 1997, и др]. В наших
исследованиях 5-летняя ФВ трансплантатов в
таких случаях составила только 9 %, в то вре-
мя как при стабилизации ЦсА в пределах от 100
до 250 нг/мл она была значимо выше и равня-
лась 52 % (р < 0,004) (рис. 40.6) [Ким И.Г.,
1999].
Другим условием, несоблюдение которого
существенно повышает вероятность ХОТ, явля-
ется вариабельность концентрации ЦсА в кро-
ви | Шумаков В.И. и др., 1995; Savodi S. et al.,
1997]. Специальные исследования В.Kahan
(1998) свидетельствуют о том, что частота ХОТ
в течение 4—9 лет после трансплантации поч-
ки ниже 15 % при относительно стабильном
уровне ЦсА крови возрастает до 30 % с рос-
том коэффициента вариации концентрации
препарата (р = 0,008) и достигает 50 % при
максимальной ее вариабельности (р < 0,0001).
Значимость неадекватности иммуносупрес-
сии как антигензависимого патогенетического
механизма ХОТ становится еще очевиднее при
конверсии ЦсА, если ее проводят без превен-
тивного усиления традиционной иммуносупрес-
сии.
Наконец, дополнительным аргументом в
пользу значимости иммунологических патоге-
нетических механизмов ХОТ служит улучшение
отдаленных результатов трансплантации почки
в связи с внедрением в клиническую практику
новых эффективных иммуносупрессантов, таких
как микофенолат мофетил (селлсепт) и про-
граф (такролимус, FK = 506). И хотя опыт их
применения еще относительно невелик и не-
продолжителен, тем не менее к настоящему
времени уже получены данные, позволяющие
прогнозировать их эффективность в отношении
профилактики ХОТ. Так, в Европейском мно-
гоцентровом исследовании (1996) было уста-
новлено, что селлсепт примерно на 7 % повы-
шает 3-летнюю выживаемость трансплантатов.
Еще более разителен эффект FK-506. При рет-
роспективном анализе выяснилось, что пери-
од полужизни трансплантата при его исполь-
672
зовании (544 трансплантации) составил 15,3 го-
да, а при применении ЦсА (35 147 трансплан-
таций) он был равен 8,5 года [Gjertson D. et al.,
1995]. Кроме того, FK-506 может способство-
вать не только профилактике, но и торможе-
нию прогрессирования ХОТ.
40.7.4. Антигеннезависимые факторы
риска хронического отторжения
трансплантированной почки
При обсуждении антигеннезависимых патогене-
тических механизмов ХОТ основное внимание
концентрируется на значении недостаточного
числа нефронов донорского органа. Именно в
этом аспекте чаще всего обсуждаются возраст,
пол, расовая принадлежность донора и реци-
пиента, тяжесть ишемического повреждения
трансплантата, степень восстановления его
функции к 4—6-му месяцу после операции, а
также артериальная гипертония, протеинурия.
Все больше внимания уделяют также гиперли-
пидемии, ожирению, посттрансплантационным
инфекциям.
Малая масса действующих нефронов (МДН)
донорского органа. Аллотрансплантация почки
предполагает замещение работы парного орга-
на единственной почкой, что означает поддер-
жание гомеостаза лишь половиной массы ин-
тактной почечной паренхимы. Уже только по-
этому, исходя из современных представлений
о значимости уменьшения числа функциони-
рующих нефронов в механизме нефросклероза,
недостаточная МДН трансплантата может
рассматриваться как один из важнейших не-
специфических патогенетических факторов
ХОТ [Brenner В. et al., 1982; Hostetter Т.,
1994].
Однако результаты многолетних наблюдений
свидетельствуют о том, что в длительно функ-
ционирующих трансплататах значимый склероз
может отсутствовать. Он не выявляется также в
почках доноров спустя многие годы после од-
носторонней нефрэктомии. Для трансплантатов
от живых доноров характерен более чем 20-лет-
ний срок «жизни» в организме реципиента.
Однако при пересадке трупной почки даже при
самых благоприятных показателях гистосовме-
стимости и оптимальном режиме иммуносуп-
рессии функция пересаженной почки в боль-
шинстве случаев прекращается в течение 10 лет
после операции [Hostetter Т., 1994]. Эти дан-
ные становятся понятными, если принять во
внимание, что скорость формирования нефро-
склероза прямо зависит от степени уменьше-
ния МДН. Соответственно при лишь 50 % сни-
жении последней, как это имеет место после
односторонней нефрэктомии у донора почки и
нередко при трансплантации от живых доно-
ров, темп склерозирования сопоставим с на-
блюдаемым при биологическом старении [Nahas
А, 1998]. В то же время при пересадке трупной
почки утрата МДН может быть более значитель-
ной, что стимулирует ускоренное формирова-
ние нефросклероза. В этом аспекте специальное
внимание исследователей привлекает и тот
факт, что клиническая картина и патоморфо-
логия трансплантата, сопутствующие постепен-
ному прекращению функции пересаженной
трупной почки, весьма напоминают наблюда-
емые в терминальной стадии заболеваний соб-
ственных почек независимо от их природы
[Hostetter Т., 1994; Chertow G. et al., 1995, и
ДР-]-
Данный анализ позволил пересмотреть тра-
диционные представления о природе ХОТ и
стимулировать специальное направление иссле-
дований — выяснение роли недостаточной
МДН донорского органа в механизме постепен-
ного угасания функции трансплантированной
почки. Вопрос, сформулированный В.М.Вгеппег
(1995), — «Сколько нефронов достаточно?»,
означает: в какой мере МДН трансплантата
достаточна, чтобы, «не жертвуя собой», обес-
печить гомеостаз и продолжительную жизнь
реципиента.
В настоящее время установлено, что число
нефронов в почке отдельных взрослых индиви-
дуумов весьма вариабельно и, составляя в сред-
нем около 600 000 при среднем квадратичном
отклонении более 200 000, находится в тесной
зависимости от пола, расы и возраста [Nyen-
gaard J., Bendtsen T., 1992; Hostetter T., 1994;
Chertow G. et al., 1995]. Очевидно также, что
МДН трансплантата может снижаться вслед-
ствие разнообразных воздействий, непосред-
ственно связанных с операцией.
Таким образом, при изучении роли этого
фактора в патогенезе ХОТ, с одной стороны,
анализируется значение демографических и не-
которых других характеристик донора, а с дру-
гой — повреждений донорского органа, неиз-
бежно сопутствующих пересадке трупной поч-
ки в связи с обстоятельствами смерти доно-
ра, изъятия, ишемии и консервации трупно-
го органа.
40.7.5. Недостаточная МДН
трансплантата, обусловленная
характеристиками донора
Возраст донора. Специальные исследования по-
казали, что между возрастом донора и отдален-
ными результатами трансплантации трупной
почки имеется определенная, криволинейная
зависимость. G.Chertow и соавт. (1995, 1997),
43—2950
673
проанализировав результаты 31 437 трансплан-
таций трупной почки базы данных Объединен-
ной Сети Распределения Органов США
(UNOS), установили, что наиболее высокая
3-летняя выживаемость трупных трансплантатов
(77,7 %) наблюдается при пересадке от доно-
ра в возрасте 20—24 лет и наиболее низкая,
если донор моложе 4 (60 %) или старше 60—
65 (59—58 %) лет. При разделении доноров на
возрастные группы с интервалом в 5 лет авто-
ры констатировали, что показатели как 1-, так
и 3-летней выживаемости пересаженной труп-
ной почки возрастают по мере увеличения воз-
раста донора от 0—4 до 15—19 лет. При даль-
нейшем повышении возраста вплоть до 30—
34 лет показатели выживаемости остаются от-
носительно стабильными, после чего постепен-
но снижаются, так что при использовании орга-
на от донора старше 60 лет 3-летняя выживае-
мость трансплантата составляет лишь 58—59 %.
Таким образом, для максимального успеха
трансплантации оптимальным является исполь-
зование органа от донора в возрасте 25—
35 лет.
В другой серии исследований авторы просле-
дили такую же закономерность для трансплан-
тации родственной почки. По материалам 10-лет-
них наблюдений 8582 реципиентов они устано-
вили, что риск потери трансплантата минима-
лен, если возраст донора от 30 до 49 лет, и
значимо возрастает, если донор старше 59 лет.
S.Flechner и соавт. (1996) также пришли к зак-
лючению, что результаты операции снижают-
ся, если используют трансплантат от донора
старше 50 лет.
Полагают, что влияние возраста донора
обусловлено недостаточной МДН детской поч-
ки при ее трансплантации взрослому реципи-
енту либо атеро- и/или артериосклерозом в
сочетании с возрастным гломерулосклерозом у
пожилого донора.
Таким образом, в настоящее время имеют-
ся основания считать, что пересадка почки от
доноров моложе 10 и старше 50 лет снижает
отдаленные результаты операции.
Пол донора. По современным представлени-
ям число нефронов в женской почке меньше,
чем в мужской [Nyengaard J., Bendtsen Т., 1992;
Hostetter Т., 1994]. Эти данные послужили ос-
нованием для выяснения связи между полом
донора и отдаленными результатами трансплан-
тации почки.
Как выяснилось, трансплантаты от женщин,
особенно пожилого возраста, при пересадке
мужчинам отличаются сниженной выживаемо-
стью [Hostetter Т., 1994]. G.Chertow и соавт.
(1995) установили, что влияние пола не зави-
сит от других характеристик донора, в частно-
сти при одинаковом возрасте донора — в диа-
674
пазоне от 35 до 49 лет — 3-летняя выживаемость
трансплантированной женской почки составля-
ла 68,6—68 %, в то время как мужской — 70,1—
74,1 %. Такая же разница прослеживалась и
далее.
Результаты многофакторного анализа пока-
зали, что трансплантация трупной почки наи-
более успешна, если донором является мужчина
в возрасте от 15 до 35 лет. При этом 3-летняя
выживаемость трансплантатов достигает 76,5—
78,5 % [Chertow G. et al., 1995].
Раса. Специальными исследованиями было
доказано, что размеры почек афро-амери-
канцев при одной и той же массе тела уступа-
ют размерам почек европейцев [Brenner В.,
Milford Е., 1993]. Установлено также, что меж-
ду числом функционирующих нефронов и раз-
мерами почки имеется тесная корреляция
[Nyengaard J., Bendtsen Т., 1992]. В связи с этим
не удивительны более низкие отдаленные ре-
зультаты трансплантации при пересадке почки
от афро-американцев европейцам [Brenner В.,
Milford Е., 1993].
Соответствие размеров донорской почки по-
верхности тела реципиента. В настоящее время
поверхность тела реципиента рассматривают как
лучший доступный индекс «физиологических
потребностей» организма [Chertow G. et al.,
1995]. Полагают также, что МДН транспланта-
та следует считать достаточной в том случае,
когда она адекватна этим потребностям. В про-
тивном случае трансплантированная почка ока-
зывается в условиях гиперфункции, обусловлен-
ной необходимостью поддержания гомеостаза
в условиях метаболизма, к которому она не
адаптирована. Эти соображения стимулировали
специальное изучение роли в патогенезе ХОТ
несоответствия между МДН трансплантата и
поверхностью тела реципиента [Brenner В.,
Milford Е., 1993; Hostetter Т., 1994]. G.Chertow
и соавт. (1995) установили, что 3-летняя выжи-
ваемость аллогенной мужской почки при пере-
садке ее реципиентам с поверхностью тела в
пределах 1,4—1,8 м2 достигает 75 %, а в тех же
случаях женской почки — примерно на 4 %
ниже. Этот показатель снижается еще значитель-
нее (до 65 %), если почка от женщины транс-
плантируется крупному реципиенту, у которо-
го поверхность тела превышает 2,2 м2. Макси-
мальное снижение 3-летней выживаемости
трансплантатов (до 40,4—51,5 %) авторы кон-
статировали при пересадке этим реципиентам
трупного органа от донора моложе 15 и стар-
ше 50 лет.
В свете изложенных данных представляется
весьма убедительным, что вероятность ХОТ в
современном понимании этой патологии воз-
растает тогда, когда МДН трансплантата недо-
статочна для конкретного реципиента.
40.7.6. Приобретенное уменьшение
МДН донорского органа
Ишемическое повреждение трансплантата возни-
кает не только в связи с его изъятием и вре-
менным исключением из системы кровообра-
щения. Оно возможно также и на всех других
этапах трансплантации, начиная с агонально-
го периода донора. Тяжелая сосудистая недоста-
точность, нередко сопутствующая смерти доно-
ра, не может не сопровождаться ишемией по-
чечной паренхимы. Именно это имеют в виду
P.Terasaki и соавт. (1995), которые считают глав-
ной причиной снижения отдаленной выжива-
емости пересаженной трупной почки шок,
имевший место у донора. G.Chertow и соавт.
(1995) по материалам анализа 31 437 транс-
плантаций трупной почки установили, что
3-летняя выживаемость трансплантатов дости-
гает 76 %, если причиной смерти донора была
дорожная катастрофа, но она снижается до
71 %, если у донора были геморрагический ин-
сульт или другие заболевания (р < 0,0001). Ав-
торы полагают, что неизбежное вовлечение
почки в заболевание может неблагоприятно
отразиться на последующей судьбе трансплан-
тата.
Тем не менее связь между отдаленной судь-
бой трансплантированной почки и ее исходным
ишемическим повреждением до настоящего
времени остается предметом дискуссии. Прини-
мая во внимание, что при пересадке трупной
почки тяжесть ишемической нефропатии не
может определяться только длительностью пе-
риода тепловой и холодовой ишемии, боль-
шинство исследователей характеризуют ее по
функциональному состоянию трансплантиро-
ванной почки непосредственно после реваску-
ляризации. Ишемическую нефропатию оцени-
вают как тяжелую, если в ближайшем после-
операционном периоде развивается ОКН с
типичной олигоанурией, либо как умеренную,
если функция трансплантата начинается сразу
после включения в кровоток.
Результаты ряда исследований свидетельству-
ют о том, что неизбежным следствием тяже-
лой первоначальной ишемической нефропатии
является снижение отдаленной выживаемости
трансплантатов. По данным O.Koning и соавт.
(1997), A.Ojo и соавт. (1997), через 4—5 лет пос-
ле трансплантации оно составляет приблизи-
тельно 10—11 % (р < 0,001), а в случаях, ког-
да тубулонекроз осложняется кризами отторже-
ния, 5-летняя выживаемость трансплантатов
снижается еще значительнее — до 35 %.
Однако взгляд на тубулонекроз как на без-
условный предиктор ХОТ разделяют не все ис-
следователи. Ряд авторов не наблюдают связи
между отсроченной функцией трансплантиро-
ванной почки и ее дальнейшей судьбой
[Isoniemi Н. et al., 1996; Massy Z. et al., 1996].
Эти противоречия могут быть разрешены,
если принять, что судьба трансплантата зави-
сит не столько от состояния его начальной
функции, сколько от обратимости ишемичес-
ких повреждений донорского органа. При их
полной или практически полной регрессии
тяжесть ишемической нефропатии не должна
сказываться заметно на его отдаленной судьбе.
Если же исходом тяжелой ишемии является за-
метная утрата МДН трансплантата, это неми-
нуемо повлияет на срок его функции.
По нашим наблюдениям, максимальное вос-
становление функции трансплантата заверша-
ется в течение первых 4 мес после операции,
и при полном восстановлении клубочковой
фильтрации дальнейшая динамика его дисфун-
кции не зависит от тяжести исходного ишеми-
ческого повреждения [Ратнер М.Я. и др., 1977;
Томилина Н.А., 1988].
40.7.7. Дисфункция трансплантата
по завершении периода
послеоперационного восстановления
Между уровнем креатинина в плазме крови
через полгода после трансплантации и после-
дующей манифестацией ХОТ имеется тесная и
высокозначимая корреляция [Nicol D. et al.,
1993; Flechner S. et al., 1996]. По данным
S.Flechner и соавт. (1996), вероятность ХОТ в
течение первых 5 лет возрастает в 3 раза, если
к 6-му месяцу после операции креатинин плаз-
мы крови повышен до 2 мг/дл и более. Эти
данные подтверждают и наши исследования. В
регрессионной модели Кокса мы обнаружили
значимую связь между дисфункцией трансплан-
тата через 6 мес после операции и последую-
щим выявлением ХОТ, причем эта связь отно-
силась не только к повышению креатинина
плазмы крови, но и к снижению максималь-
ной осмоляльности мочи (г = 1,9; р < 0,00001
и г = —0,03; р = 0,002 соответственно).
Как известно, концентрация креатинина в
плазме крови отражает величину клубочковой
фильтрации — признанного показателя МДН
[Гинецинский А.Г., 1952; Наточин Ю.В., 1972;
Ратнер М.Я. и др., 1977, и др.]. Таким образом,
повышение этого показателя означает уменьше-
ние МДН. Соответственно тесная высокозначи-
мая корреляция между уровнем креатининемии
и отдаленной судьбой пересаженной почки
может рассматриваться как еще одно доказа-
тельство значимости уменьшения МДН в па-
тогенезе ХОТ.
Природа этого уменьшения может быть раз-
личной. Если в одних случаях оно является след-
43*
675
Рис. 40.7. Связь между артериальной гипертензией и
ХОТ.
Артериальное давление: а — =S 140/90 мм рт.ст. (п = 33);
б — >140/90 мм рт.ст. (п = 31); в — 140/90мм рт.ст. (п = 79);
г — >160/100 мм рт.ст. (п = 52).
ствием необратимого ишемического поврежде-
ния донорского органа, то в других — может
быть исходом тяжелых, рефрактерных к тера-
пии кризов отторжения. В наших наблюдениях
связь между дисфункцией трансплантата к 6 мес
после операции и тяжестью ишемического по-
вреждения донорского органа отсутствовала.
Однако при этом корреляция между повыше-
нием к тому же сроку креатинина в плазме
крови и ранними кризами отторжения (г = 0,22;
р = 0,001) была высокозначимой. Следователь-
но, можно предположить, что в наших наблю-
дениях дисфункция трансплантата спустя 6 мес
после операции была обусловлена главным
образом неполным восстановлением МДН пос-
ле кризов отторжения.
40.7.8. Другие неспецифические
патогенетические механизмы хронического
отторжения трансплантированной почки
Артериальная гипертония (АГ) после трансплан-
тации почки имеет сложную природу и наблю-
дается у 60—75 % реципиентов. Ее причинами
являются побочное действие кортикостероидов
и ЦсА, снижение МДН трансплантата, стеноз
его артерии, отторжение, прессорный эффект
собственных почек реципиента [Curtis J., 1997].
При этом повышение АД связывают с ретен-
цией натрия, гиперсекрецией ренина, источ-
ником которой могут быть собственные почки
пациента либо аллотрансплантат, с дисбалан-
сом прессорной и депрессорной почечных си-
стем, а также с наследственной предрасполо-
женностью к АГ.
Пересаженная почка, даже при полной ин-
тактности донорского органа, представляет
собой частный случай умеренного уменьшения
МДН. В связи с этим повышение АД, если оно
не вызвано относительно редким стенозом ар-
терии трансплантата, неизбежно ускоряет про-
цессы гломерулосклероза, присущие любому
уменьшению МДН. В основе этого эффекта, как
и при поражениях собственных почек, лежит
нарушение внутрипочечной ауторегуляции со
снижением тонуса афферентной артериолы и
трансмиссией системной гипертензии на гло-
мерулярное капиллярное русло, что не может
не ускорять процессы, лежащие в основе гло-
мерулосклероза.
По данным G.Opelz и соавт. (1998), 7-лет-
няя выживаемость трансплантатов при нормаль-
ном систолическом АД в течение первого года
после трансплантации на 19 % выше, чем при
его повышении до 180 мм рт.ст., причем риск
ХОТ возрастает уже при повышении АД до
140/90 мм рт.ст. По мнению E.Ritz (1997), важ-
ное прогностическое значение имеет даже ми-
нимальное повышение диастолического АД; если
последнее не превышает 60 мм рт.ст., 6-летняя
выживаемость пересаженной почки на 15 %
выше, чем при диастолическом АД, равном
90 мм рт.ст. В наших наблюдениях 5-летняя ФВ
трансплантатов была максимальной (70 %) при
нормальном АД и минимальной (35 %) — при
АД > 160/100 мм рт.ст. на фоне гипотензивной
терапии [Ким И.Г., 1999] (рис. 40.7).
676
Связь между уровнем АД и скоростью про-
грессирования ХОТ в наших наблюдениях была
столь очевидной, что послужила основанием
для выделения особого, гипертонического, про-
гностически неблагоприятного клинического
типа хронической нефропатии отторжения
[Томилина Н.А., 1988]. Доминирующее влияние
артериальной гипертонии на темп прогресси-
рования ХОТ подтвердили и наши клинико-
морфологические исследования [Столяревич
ЕС. и др., 1997]. Оказалось, что при сопоста-
вимой выраженности нефросклероза и морфо-
логических признаков активности отторжения
«почечная смерть» наступает значительно быс-
трее, если ХОТ протекает с выраженной арте-
риальной гипертонией. И напротив, при нор-
мальном или лишь слегка повышенном АД ста-
билизация начальной ХПН длительная (вплоть
до нескольких лет).
Наши данные позволяют также рассматри-
вать АГ не только как один из важных меха-
низмов ХОТ, но и как его предиктор.
Возраст реципиента. По данным Многоцент-
рового исследования, представленного G.Opelz
(1997), вероятность 10-летней выживаемости
трансплантата тем ниже, чем моложе реципи-
ент. Она составляет около 50 % у пациентов в
возрасте от 16 до 40 лет, примерно 60 % — в
возрастной группе от 41 года до 50 лет, 65 % —
у лиц от 51 года до 60 лет и 70 % — у лиц стар-
ше 60 лет. По материалам J.Pirsch и соавт.
(1992), 5-летняя выживаемость трансплантатов
у пациентов моложе 30 лет равна приблизитель-
но 60 %, а у лиц старше 30 лет —превышает
80 %. Точно так же J.Peeters и соавт. (1995) в
многофакторной регрессионной модели Кокса
обнаружили обратную корреляцию между вы-
живаемостью трансплантатов и возрастом реци-
пиентов. G.Chertow и соавт. (1997) выявили
такую же закономерность и при транспланта-
ции от родственного донора.
По мнению G.Opelz (1997), «парадоксаль-
ный» эффект возраста связан с более высокой
активностью иммунных реакций в молодом
возрасте. С такой точкой зрения согласуются и
наши собственные данные, в которых конста-
тирована обратная связь между возрастом ре-
ципиента и частотой кризов отторжения.
Неподатливость пациента (noncompliance). Так
называемая неподатливость пациента, его не-
готовность следовать всем медицинским пред-
писаниям крайне отрицательно сказывается на
отдаленных результатах трансплантации почки
|Dunn J. et al., 1990, и др.]. В Университетской
клинике Майами (1993) было установлено, что
10-летняя выживаемость трансплантатов в груп-
пах HLA-идентичных сиблингов более чем в
2 раза ниже у реципиентов, которых они ха-
рактеризуют как «неподатливые» (noncompliant).
Такую же закономерность мы наблюдаем и в
своей практике. Вследствие этой особенности
пациенты нарушают режим иммуносупрессии,
отказываются от ее регулярного мониторинга,
что в конечном счете резко повышает вероят-
ность хронического отторжения трансплантата.
40.8. Диагностика
и клиническое течение
хронического отторжения
Как следует из определения, основным призна-
ком хронического отторжения трансплантирован-
ной почки является постепенное и неуклонно
прогрессирующее снижение почечных функций.
Как правило, его констатируют при первом
выявлении начальной ХПН, если другие ре-
нальные или экстраренальные причины после-
дней исключаются. Однако результаты наших
исследований свидетельствуют, что более ран-
ним признаком ХОТ, который нередко выяв-
ляют за 6 мес и более до повышения креати-
нина плазмы крови, является нарушение спо-
собности к осмотическому концентрированию
мочи [Томилина Н.А., 1988].
Дисфункция трансплантата может возникать
бессимптомно либо сопровождаться появлени-
ем протеинурии и/или артериальной гиперто-
нии. У ряда больных (при отсутствии адекват-
ной гипотензивной терапии) АГ может повы-
шаться до уровня злокачественной. Иногда по-
вышение АД служит единственным клиничес-
ким проявлением ХОТ. Редким, но прогности-
чески весьма серьезным признаком последне-
го является гематурия, требующая, однако,
тщательного обследования пациента для исклю-
чения других причин.
Течение хронического отторжения характе-
ризуется неуклонным прогрессированием с
исходом в терминальную ХПН. При этом ско-
рость прогрессирования может варьировать от
нескольких месяцев до 3—5 лет и даже более.
По данным P.Rossmann, J.Jirka (1979), характер
течения нефропатии отторжения зависит в зна-
чительной степени от его морфологической
картины. Прогрессирование процесса замедле-
но при доминировании тубулоинтерстициаль-
ных изменений и ускорено при тяжелом анги-
ите. По нашим данным, имеется связь между
характером течения ХОТ и его клинической
картиной [Томилина Н.А., 1988]. Медленное
прогрессирование с исходом в терминальную
ХПН более чем через 3 года мы наблюдали при
бессимптомном течении. При выраженной ар-
териальной гипертонии и протеинурии «почеч-
ная смерть» наступала, как правило, в течение
1,5—2,5 лет.
677
Диагностика ХОТ базируется как на вы-
явлении описанной выше симптоматики, так
и данных пункционной биопсии.
Возможности терапии ХОТ ограничиваются
лишь мероприятиями, направленными на за-
медление прогрессирования нефросклероза.
Основную роль среди них играют эффективная
гипотензивная терапия и нормализация АД. В
последнее время с этой же целью назначают
ингибиторы АПФ. Однако при этом следует
помнить, что в условиях даже гемодинамичес-
ки незначимого стеноза артерии транспланта-
та действие этих препаратов чревато резким
снижением функции пересаженной почки,
вплоть до олигоанурии. Массивные дозы кор-
тикостероидов, как и другие мощные иммуно-
депрессанты, при лечении ХОТ неэффективны.
Нефротоксичность циклоспорина-А. В основе
нефротоксического действия ЦсА, впервые
описанного R.Caine и соавт. (1978), лежит вас-
кулотоксический эффект. Хотя морфологичес-
кие изменения эпителия проксимальных ка-
нальцев в виде гигантских митохондрий, изо-
метрической вакуолизации и микрокальцифи-
кации при действии препарата и не вызывают
сомнений [Dieperink Н., 1987; Michatsh М. et al.,
1995, и др.], однако они не сопровождаются
нарушением канальцевых функций. Прокси-
мальная реабсорбция клубочкового фильтрата
под влиянием ЦсА даже усиливается [Котенко
О.Н., 1997; Dieperink Н. et al., 1987; Propper D.
et al., 1989, и др.].
По общему признанию, ЦсА вызывает спазм
внутрипочечных артериол, преимущественно
афферентной. Он возникает как следствие дис-
баланса внутрипочечных прессорной и депрес-
сорной систем с преобладанием действия та-
ких вазопрессоров, как ангиотензин II, эндо-
телии. Спазм афферентной артериолы приводит
к внутринефронному снижению клубочковой
фильтрации, что сопровождается увеличением
проксимальной канальцевой реабсорбции на-
трия и воды из единицы профильтрованного
объема (фракционной проксимальной реабсор-
бции). Усилению этого процесса способствуют
также снижение гидростатического давления в
перитубулярных капиллярах, а также прямая
стимуляция канальцевого транспорта натрия
ангиотензином II и эндотелином.
Таким образом, дисфункция трансплантиро-
ванной почки при нефротоксическом действии
ЦсА проявляется снижением клубочковой
фильтрации с повышением уровня креатини-
на в плазме крови и усилением проксимального
канальцевого транспорта натрия. Последнее
определяют по снижению клиренса лития, об-
ратная величина которого характеризует про-
ксимальную канальцевую реабсорбцию натрия
и воды.
678
Задержка натрия лежит в основе такого по-
бочного действия ЦсА, как артериальная гипер-
тония.
ЦсА-нефротоксичность может протекать как
острый эпизод или быть хронической. В первом
случае она имеет функциональный характер и,
как правило, устраняется при уменьшении дозы
препарата.
При хронической нефротоксичности основ-
ным объектом поражения также являются по-
чечные артериолы [Michatsh М. et al., 1995, и
др.]. Препарат действует прежде всего на мы-
шечный слой артериол, вызывая некроз мио-
цитов с последующим их замещением белко-
выми депозитами. При иммунофлюоресцентном
исследовании сосудистая стенка приобретает
характерный вид «бриллиантового ожерелья»
или «кленового листа». ЦсА может поражать и
интиму артериол. Процесс завершается гиали-
нозом артериол с последующим сужением со-
судистого просвета вплоть до полной облите-
рации. Для хронической ЦсА-нефротоксичнос-
ти характерен также диффузный или (реже) так
называемый полосатый склероз почечного ин-
терстиция. Он рассматривается как результат
хронической ишемии органа, а также непосред-
ственной стимуляции препаратом процессов
фиброгенеза.
В редких случаях, чаще при трансплантации
костного мозга и печени, нефротоксическое дей-
ствие ЦсА не ограничивается артериолопатией,
но распространяется также и на почечный клу-
бочек, вызывая капиллярные микротромбозы.
При этом возникает синдром, сходный с гемо-
литикоуремическим [Remuzzi G., 1989].
Течение нефропатии, обусловленной хро-
ническим токсическим эффектом ЦсА, отли-
чается крайне медленным прогрессированием,
так что на протяжении лет концентрация кре-
атинина в плазме крови остается на одном и
том же слегка повышенном уровне. Таким об-
разом, прогноз ЦсА-нефротоксической нефро-
патии благоприятен. Исход в терминальную
ХПН описан только при трансплантации сер-
дца, при которой применяют более высокие
дозы препарата.
Диагностика ЦсА- нефротоксичности
основывается на анализе истории болезни, кли-
нических признаках, гистопатологических дан-
ных, а также УЗИ и радиоизотопном исследо-
вании. Следует иметь в виду, что при повтор-
ной пересадке почки более вероятной причи-
ной почечной дисфункции в ближайшем пос-
леоперационном периоде является эпизод от-
торжения, а при продолжительной консервации
и вторичной тепловой ишемии, гипотонии в
пожилом возрасте донора, как и при других
факторах риска ОКН, возрастает опасность
острой нефротоксичности.
40.9. Экстраренальные
осложнения после
трансплантации
Экстраренальные осложнения после трансплан-
тации почки являются одним из серьезных фак-
торов, ограничивающих успех этой операции.
Важнейшие из них, помимо хорошо известных
и связанных с действием кортикостероидов, —
инфекционные, сердечно-сосудистые и онко-
логические.
Наиболее обстоятельный анализ структуры
фатальных осложнений после пересадки почки
представлен G.Opelz (1997). Проанализировав
материалы наблюдений 1040 реципиентов,
умерших через 1—10 лет после трансплантации
трупной почки, автор установил, что в тече-
ние первого года после операции среди всех фа-
тальных осложнений наиболее значимы инфек-
ции, частота которых составляет примерно 36 %.
Однако уже со второго года ведущее значение
приобретают сердечно-сосудистые осложнения,
частота которых возрастает примерно до 30 %,
а доля инфекций снижается до 14 %. Вероят-
ность фатальной патологии сердечно-сосудис-
той системы не зависела от возраста в отличии
от других фатальных осложнений. У реципиен-
тов моложе 50 лет практически с одинаковой
частотой наблюдали опухоли (12,5 %), инфек-
ции (14,4 %) и цереброваскулярную болезнь
(11,7 %). В то же время среди пациентов стар-
ше 50 лет летальность вследствие онкологичес-
ких заболеваний (23,7 %) была относительно
высокой и возрастала по мере увеличения сро-
ка после операции.
Среди инфекционных осложнений особого
внимания заслуживают туберкулез, вирусные и
грибковые инфекции. В последнее время гене-
рализованные формы бактериальной инфекции
в виде сепсиса наблюдают реже.
Одним из наиболее серьезных инфекцион-
ных осложнений является инфекция, вызывае-
мая полигистиотропным цитомегаловирусом
(ЦМВ) из группы герпетических вирусов.
ЦМВ-инфекция возникает обычно в первые
100 дней после трансплантации в результате
реактивации вируса у ЦМВ-серопозитивных
реципиентов или первичного инфицирования
серонегативных больных в связи с пересадкой
почки от серопозитивного донора. В послед-
нем случае заболевание протекает особенно тя-
жело.
Первыми признаками болезни являются не-
правильный субфебрилитет с постепенным
повышением температуры тела до фебрильной,
артралгии, миалгии. Характерна лейкопения,
иногда тромбоците- и эритроцитопения. На
этом фоне выявляют одно из органных пора-
жений. Возможны ретинит, энтерит, нередко
осложняющийся кровотечениями, гепатит, по-
ражение центральной нервной системы и, на-
конец, пневмония. Легочная форма представля-
ет собой наиболее опасный вариант заболева-
ния. Рентгенологически она проявляется двусто-
ронней диффузной инфильтрацией в виде так
называемой снежной бури. При несвоевремен-
ном или неадекватном лечении быстро разви-
вается дыхательная недостаточность. Ее стреми-
тельное нарастание чаще всего связано с супер-
инфекцией — пневмоцистной и/или кандидоз-
ной.
Диагностика ЦМВ-инфекции основана
на определении повышения не менее чем в 4
раза титра специфических антител IgG и вы-
явлении специфических антител IgM, обнару-
жении антигена вируса (рр 65) в нейтрофилах
крови и клетках бронхоальвеолярного лаважа,
а также на методах генодиагностики с помо-
щью полимеразной цепной реакции. При ин-
терпретации результатов этих исследований
следует иметь в виду, что их положительный ре-
зультат может рассматриваться как подтверж-
дение ЦМВ-болезни только при соответствую-
щей клинической картине.
Для лечения ЦМВ-инфекции используют
ганцикловир, эффективность которого тем
выше, чем раньше он применен. В связи с этим
терапию целесообразно начинать при лихорад-
ке и положительных серологических тестах до
появления органной симптоматики. Обычно
препарат назначают в дозе 10 мг/кг в сутки (при
нормальной функции трансплантата) в течение
14—21 дня. Снижение или полная отмена им-
муносупрессии показаны только при тяжелых
формах (пневмония, требующая искусственной
вентиляции легких). Серонегативным больным
рекомендуются также специфические анти-
ЦМВ-иммуноглобулины, но их применение
ограничено из-за высокой стоимости.
Среди сердечно-сосудистых осложнений специ-
ально выделяют ишемическую болезнь сердца,
цереброваскулярные заболевания, сердечную
недостаточность, тромбоэмболию легочной ар-
терии.
Коронарный атеросклероз и ишемическую
болезнь сердца у реципиентов аллогенной поч-
ки фиксируют в 7—10 раз чаще, чем в общей
популяции. Как полагают, этому способствуют
снижение толерантности к глюкозе, нарушение
обмена липидов, побочное действие кортико-
стероидов. Особая роль отводится артериальной
гипертонии.
Наиболее частым фатальным осложнением
является инфаркт миокарда, на долю которого
приходится примерно 16 % всех смертей, обус-
ловленных сердечно-сосудистыми осложнени-
ями. В последние годы обращает на себя вни-
679
мание тенденция к учащению этого осложне-
ния. По нашим данным, в течение 1 года пос-
ле трансплантации сердечно-сосудистые ослож-
нения составляют около 20 %, в интервале от
2 до 5 лет после операции их частота возраста-
ет до 47 %, а в более поздние сроки — еще
значительнее (примерно до 60 %). При этом
доля ИБС в общей структуре этих осложнений
достигает 56 % и в половине случаев ИБС ос-
ложняется инфарктом миокарда. Профилакти-
ка и лечение этих осложнений соответствуют
общепринятым, при этом особое значение
имеет гипотензивная терапия.
Литература
Ватазин А. В., Пасов С.А., Щербакова Е.О. и др. При-
менение циклоспорина А у больных после пересад-
ки трупной почки//Трансплантология и искусствен-
ные органы. — 1998. — № 1. — С. 3—8.
Гинецинский А. Г. Методы количественной оценки
функции почек//Физиологические методы в клини-
ческой практике. — Л, 1952. — 139—184 с.
Ким И.Г., Томилина Н.А. Опыт конверсии циклоспо-
рина А после аллотрансплантации почки//Транс-
плантология и искусственные органы. —1997. —
№ 3. - С. 17-20.
Ким И. Г. Отдаленные результаты трансплантации
почки и факторы риска хронического отторжения//
Дис... канд. мед. наук. — М., 1999.
Котенко О.Н., Федорова Н.Д., Томилина Н.А. К ди-
агностике циклоспориновой нефротоксичности после
трансплантации почки//Тер. арх. — 1993. — № 6. —
С. 58-61.
Котенко О Н. Ренальная дисфункция почечного ал-
лотрансплантата при применении циклоспорина А
//Дис. ... канд. мед. наук. — М., 1997.
Корсакова Т.В., Петрова Т.Н., Мойсюк Я.Г. Первый
клинический опыт применения мофетила микофе-
нолата у больных после трансплантации почки//
Трансплантология и искусственные органы. —
1998. - № 4. - С. 22-23.
Мойсюк Я.Г., Герасимов А.А., Цветков Д.В., Арутю-
нян С.М. Профилактика цитомегаловирусной инфек-
ции после трансплантации органов//Трансплантоло-
гия и искусственные органы. — 1996. — № 3. —
С. 107-109.
Наточин Ю.В. Реабсорбция и секреция органических
веществ//Физиология почки. — Л., 1972. — 83—115 с.
Ратнер М.Я. Оценка почечных функций и классифи-
кация их расстройств при заболевании почек//Ре-
нальные дисфункции/Ратнер М.Я., Серов В.В., То-
милина Н.А. — М.: Медицина, 1977. — 32—42 с.
680
Столяревич Е.С., Ильинский И.М., Варшавский В.А.,
Томилина Н. С. и др. Факторы прогрессирования хро-
нической нефропатии отторжения: клинико-морфо-
логический анализ//Нефрология. — 1998. — № 2. —
С. 45-51.
Томилина Н.А. Нефропатия отторжения (диагности-
ка, клинические варианты течения, антикоагулянт-
но-антиагрегантная терапия)//Дис. ... докт. мед.
наук. — М., 1988.
Шумаков В.И., Левицкий Э.Р., Порядин Н.Ф. Синд-
ром отторжения при трансплантации почки. — М.:
Медицина, 1982. — 106—107; 190—191 с.
Шумаков В.И., Мойсюк Я.Г., Томилина Н.А. и др.
Трансплантация почки. Трансплантология: руковод-
ство/Под ред. В.И.Шумакова. — М.: Медицина,
1995. - 194-196 с.
Шумаков В.И., Петрова Т.Н., Мойсюк Я.Г. и др. Пер-
вый опыт применения новой формы циклоспори-
на А — неорала при трансплантации почек//Транс-
плантология и искусственные органы. — 1995. — № 1.
Шаршаткин А.В., Арутюнян С.М., Цветков Д.В.,
Мойсюк Я. Г. Интраоперационная инфузия исрадипи-
на в артерию почечного трансплантата//Трансплан-
тология и искусственные органы. — 1997. — № 2. —
С. 65-69.
Amenabar J.J., Gomez-Ullate Р., Garcia-Lopez F.J. et al.
A randomized trial comparing cyclosporine and steroids
with cyclosporine, azathioprine, and steroids in cadaveric
renal transplantation//Transplantation. — 1998. — Vol.
65. - P. 653-661.
Almond H.S., Matas A., Gillingham K. et al. Risk factors
for chronic rejection in renal allograft recipients//
Transplantation. - 1993. - Vol. 55. - P. 752-757.
Basadonna G.P., Matas A.J. et al. Early versus late acute
renal allograft rejection: Impact on chronic rejection//
Transplantation. — 1993. — Vol. 55. — P. 993—995.
Brenner B.M., Meyer T.W., Hostetter Т.Н. Dietary protein
intake and progressive nature of kidney disease//New
England. J. Med. - 1982. - Vol. 307. - P. 652-660.
Brenner B.M., Milford E.L. Nephron underdosing: a
programmed cause of chronic renal allograft failure//Am.
J. Kidney Dis. - 1993. - Vol. 21. - P. 66-72.
Caine R.Y., White D.J.G., Thiru S. et al. Cyclosporine A
in patients receiving renal allografts from cadaver donors
//Lancet. - 1978. - Vol. 2. - P. 1323-1327.
Chertow G.M., Brenner B.M., Mackenzie H.S., Milford
E.L. Non-immunologic predictors of chronic renal
allograft failure: Data from the United Network of Organ
Sharing//Kidney Int. - 1995. - Vol. 48. - P. 48-51.
Chertow G.M., Brenner B.M., Mori M., Mackenzie H.S.,
Milford E.L. Antigen-independent determinants of graft
survival in living-related kidney transplantation//Kidney
Int. - 1997. - Vol. 52. - Suppl. 63. - P. 84-86.
Cecka J.M., Terasaki P.I. The UNOS Scientific Renal
Transplant Registry//Clinical Transplants, 1995, ed. Cecka
J.M., Terasaki P.I.//Los Angeles: UCLA Tissue
Laboratory. — 1996. — P. 1—18.
Curtis J. J. Treatment of hypertension in renal allograft
patients: Does drug selection make a difference?//Kidney
Int. - 1997. - Vol. 52. - Suppl. 63. - P. 75-77.
Dunn J., Grevel J., Napoli K. et al. The impact of steady-
state cyclosporine concentrations on renal allograft outcome
//Transplantation. — 1990. — Vol. 49. — P. 30—34.
Dieperink H, Leyssac P.P., Kemp E. et al. Nephrotoxicity
of cyclosporine A in humans: effects of glomerular
filtration and tubular reabsorbtion rates//Eur. J. Clin.
Invest. - 1987. - Vol. 17, N 6. - P. 493-497.
Flechner S.M., Modtin C.S., Serrano D.P., Goldfarb D.A.,
Papajcik D., Mastroianni B., Goormastic M., Novick A. C.
Determinants of chronic renal allograft rejection in
cyclosporine-treated recipients//Transplantation. —
1996. - Vol. 62. - P. 1235-1241.
Gjertson D. W. Survival trends in long-term first cadaver-
donor kidney transplants//CIinical Transplants, ed. Cecka
J.M., Terasaki P.I. — Los Angeles, 1992. — P. 225—235.
Hamburger J., Crosnier J., Dormont J. Observation in
patients with a well-tolerated homotransplanted kidney,
possibility of a new secondary disease//Ann. New York
Acad. Sci. - 1964. - Vol. 120. - P. 558-577.
Hayry P. Immunology of transplant rejection//Ann. Clin.
Res. - 1981. - Vol. 13. - P. 172-198.
Heering P., Westhojf A., Buch D. et al. Renin-aldosterone
system and renal function under cyclosporine A//
Transplant. Proc. — 1988. — Vol. 20. — P. 556—562.
Hostetter Т.Н. Chronic transplant rejection//Kidney
Int. - 1994. - Vol. 46. - P. 266-279.
Isoniemi H., Lehtonen S., Salmela K, Ahonen J. Does
delayed kidney graft function increase the risk of chronic
rejection?//Transplant. Int. — 1996. — Vol. 9. — Suppl. 1. —
P. 5-7.
Kahan B.D., Grevel J. Optimization of cyclosporine therapy
in renal transplantation by a pharmacokinetic strategy//
Transplantation. — 1988. — Vol. 46. —P. 531—644.
Kahan B.D. Pharmacokinetics of cyclosporin formulations
and their relationship to clinical outcome//Focus on
medicine. — 1998. — N 13. — P. 3—6.
Kasiske B.L. Clinical correlates to chronic renal allograft
rejection//Kidney Int. — 1997. — Vol. 52. — Suppl. 63. —
P. 71-74.
Koning O.H.J., Ploeg R.J., J.H. van Bockel et al. Risk
factors for delayed graft function in cadaveric kidney
transplantation//Transplantation. — 1997. — Vol. 63. —
P. 1620-1628.
Kunz R., Neumayr H.H. Maintenance therapy with triple
versus double immunosupressive regimen in renal
transplantation//Transplantation. — 1997. — Vol. 63. —
P. 386-392.
Laine J., Krogerus L., Jalanko H. et al. Renal allograft
histology and correlation with function in children on
triple therapy//Nephrol. Dial. Transplant. — 1995. —
Vol. 10. - P. 95-103.
Lindholm A., Ohlman S. et al. The impact of acute
rejection episodes on long-term graft function and out-
come in 1347 primary renal transplants treated by 3
cyclosporine regimens//Transplantation. — 1993. —
Vol. 56. - P. 307-315.
Mackenzie H.S., Az.uma H., Rennke H.G. et al. Renal mass
as a determinant of late allograft outcome: Insights from
experimental studies in rats//Kidney Int. — 1995. —
Vol. 52. - P. 38-42.
Massy Z.A., Guijarro C. et al. Chronic renal allograft
rejection: Immunologic and non-immunologic risk
factors//Kidney Int. — 1996. — Vol. 49. —P. 518—524.
Matas A.J, Gillingham K.J., Payne W.D., Najarian J.S.
The impact of an acute rejection episode on long-term
renal allograft survival T „//Transplantation. — 1994. —
Vol. 57. - P. 857.
Mihatsch M.J., Riff el B. and Gudat F. The differen-
tial diagnosis between rejection and cyclosporine toxi-
city//Kidney Int. — 1995. — Vol. 48. — Suppl. 52. —
P. 63-69.
Nahas A.M.E. Mechanisms of experimental and clinical
renal scarring//Oxford Textbook of Clinical Nephrology
//ed. Davison, Cameron, Grunfeld et al. — 1998. —
Vol. 3. - P. 1749-1776.
Newstead C.G., Johnston P.A., Will E.J., Davison A.M.
The case for withdrawal of cyclosporin after renal
transplantation//Nephrol. Dial. Transplant. — 1998. —
Vol. 13. - P. 28-31.
Nyengaard J.R., Bendtsen T.F. Glomerular number and
size in relation to age, kidney weight, and body surface
in nonnal man//Anat. Rec. — 1992. — Vol. 232. — P. 194—
201.
Nicol D., MacDonald A.S., Lawen J, Belitsky P. Early
prediction of renal allograft loss beyond one year//
Transplantation. — 1993. — Vol. 6. — P. 153—157.
Ojo A.O., Wolfe R.A., Held P.J., Port F.K., Schmouder
R.L. Delayed graft function: risk factors and implications
for renal allograft survival//Transplantation. — 1997. —
Vol. 63. - P. 968-974.
Opelz G. Effect of maintenance immunosuppressive drug
regimen on kidney transplant outcome//Transplan-
tation. — 1994. — Vol. 58. — P. 443—446.
681
Opelz G. Collaborative Transplant Study. Chronic graft loss
in kidney and heart transplant recipients//Late graft loss/
ed. Touraine J.L., Traeger J., Betuel H. et al. — Dor-
drecht — Boston — London. — 1997. — P. 3—12.
Opelz G. Collaborative Transplant Study/Newsletter 3. —
1998. - 5 p.
Paul L.C., Muralidharan et al. Immunological mechanism
of chronic rejection//Late graft loss/ed. J.L.Touraine,
J.Traeger, H.Betuel et al. — Dordrecht — Boston —
London. — 1997. — P. 51—61.
Pirsch J.D., Ploeg R.J., Gange S. et al. Determinants of
graft survival after renal transplantation//Transplanta-
tion. - 1996. - Vol. 61. - P. 1581-1586.
Propper D.J., Whiting P.H., Power D.A. et al. The effect
of nifedipine on graft function in renal allograft recipients
treated with cyclosporine A//Clin. Nephrol. — 1989. —
Vol. 32. - P. 62-67.
Peeters J., Roels L., Vanrenterghem M. Chronic renal
allograft failure: Clinical overview//Kidney Int. —
1995. - Vol. 48. - Suppl. 52. - P. 97-101.
Ponticelli C., Tarantino A. Immunosupressive protocols
for renal transplantation//Nephrol. Dial. Transplant. —
1997. - Vol. 12. - P. 45-50.
Remuzzi G., Bertram T. Renal vascular and thrombotic
effects of cyclosporin//Am. J. Kidney Dis. — 1989. — Vol.
13. - P. 261-272.
Rossmann P., Jirka J. Rejection nephropathy. — Amsterdam.
Elsevier//N.-Holl. Biomed. Press. — 1979. — 368 p.
Ritz E. Hypertonie und Niere//Arzneim.-Forsch/Drug Res.
47 (11). - 1997. - P. 1297-1301.
Savodi S., Maiorica R., Madema R. et al. Low intrapatient
variability of blood cyclosporin levels is correlated with
excellent graft survival//Transplant. Proc. — 1997. — Vol.
29. - P. 288-289.
Shen S.Y., Weir M.R. Renal allograft biopsy and
conversion of CsA to Aza//Transplantation. — 1989. —
Vol. 47. - P. 223-229.
Sollinger H.W. for the U.S. Renal Transplant Mycophe-
nolate Mofetil Study Group. Mycophenolate mofetil for
the prevention of acute rejection in primary cadaveric
renal allograft recipients//Transplantation. — 1995,—
P. 225-232.
Solez K., Axelsen R.A., Benediktsson H. et al. International
standardization of criteria for the histologic diagnosis of
renal allograft rejection: The Banff working classification
of kidney transplant pathology//Kidney Int. — 1993. —
Vol. 44. - P. 411-422.
Terasaki P.I., Cecka J.M., Gjertson D. et al. A ten year
prediction for kidney transplant survival//Clinical
Transplants/ Eds. P.I.Terasaki, J.M.Cecka. — 1992. —
501-512 p.
Terasaki P.I., Cecka J.M., Gjertson D. et al. High survival
rates of kidney trasplants from spousal and living
unrelated donors//New Engl. J. Med. — 1995. — Vol. 92. —
P. 333-336.
Tesi R.J., Henry M.L. et al. Predictors of long-term
primary cadaveric renal transplant survival//Clin.
Transplant. - 1993. - Vol. 7. - P. 345.
Thorogood J., Van Houwelingen J.C., Van Rood J. J. et al.
Factors Contributing to Long-Tenn Kidney Graft Survival
in Eurotransplantat//Transplantation. — 1992. — Vol. 54
(1). - P. 152-158.
Touchard G., Hauet T. et al. Maintenance cyclosporin
monotherapy after renal transplantation-clinical
predictors of long-term outcome//Nephrol. Dial.
Transplant. - 1997. - Vol. 12. - P. 1956-1960.
Vanrenterghem Y.F.C., Peeters J. for the Leuven
Collaborative Group for Transplantation. The impact of
acute rejection in the longterm outcome after renal
transplantation//Late graft loss/Ed. J.L.Touraine,
J.Traeger, H.Betuel et al. — Dordrecht — Boston —
London. — 1997. — 85—89 p.
Yilmas S., Hayry P. The impact of acute episodes of
rejection on the generation of chronic rejection in rat
renal allografts//Transplantation. — 1993. — Vol. 56. — P.
1153-1156.
Предметный указатель
Агенезия 337
Аденома предстательной железы 534
а-Адреноблокаторы 178, 473, 537
Азот остаточный 601
Азотемия 536
Азотистый метаболизм 605
Альпорта синдром 340
Алюминий плазмы 69
— интоксикация 67
Амилоидоз почек, классификация
203, 546
---диализный 598
---наследственный 340
---при инфекционном эндокардите
565
---семейный 549
---системный 547
Аминоацидурия 43, 323
Аминогликозиды 583
— канальцевый острый некроз «ами-
ногликозидный» 373
— лечение пиелонефрита 396
— поражение почек 373
Аминокислоты 43, 484
— нарушения канальцевого транспорта
323
Ангиография почечная 116, 418
Ангиокератома Фабри диффузная 359
Андерсона—Фабри болезнь 359
Анемия гемолитическая 427, 575
— при опухолях 525
---хронической почечной недоста-
точности 608
— — — — — восполнение дефицита
железа 615
Аномалии органов мочевой системы
496
— строения почек 348
Антибиотики, лечение 396, 584
— профилактика при трансплантации
почки 661
Антиген простатоспецифический 535
Антидиуретический гормон гипофиза
19
Антиметаболиты 251
Антимикробные препараты, примене-
ние у беременных 475
Анурия 416, 455
Аортография брюшная 117, 181, 586
— транслюмбальная 116
Аппарат(ы) Гольджи 12, 42
— юкстагломерулярный 16, 19, 20, 22
Арифон см. Индапамид
Артериальная гипертензия, классифи-
кация 165
---злокачественная 184
---лечение 173, 184, 258
--- почечная 165
------осложнения 172
------симптоматика 171
Артериография, осложнения 587
Асцит 155, 457
Атрофия почечной ткани 440
Аутосомно-доминантная поликистоз-
ная болезнь взрослых 437
Ацидоз метаболический 600
— почечный канальцевый 323, 325,
461, 607
---типа I 323, 340
------II 323
Базальная мембрана 12, 14, 16, 26,
145
---при наследственном нефрите 342
------нефропатии 572
Бактериурия 390, 392
Баланс водно-электролитный, нару-
шения 55, 60
— калия 59
— натрия 55
Барттера синдром 327
Барттера—Гительмана синдром 327
Батглера—Олбрайта синдром 325
Белки 42, 84
— Бенс-Джонса 559
— витамин D-связывающие 63
— матрикса 225
— протеинурия 145
— реабсорбция 18
— Тамма—Хорсфолла 84
— чувствительные к тиазидам 327
Беременность, изменения мочевой
системы 464
— заболевания почек 465, 473
— поражение органов при нефропатии
беременных 467
— прогноз осложнений 479
Бикарбонаты 49
Биопсия почки 126, 132, 251, 411
---осложнения 129
--- противопоказания 127
Биохимические маркеры ремоделиро-
вания костной ткани 70
Болезнь(и) Андерсона—Фабри 340,
359
— Аск—Упмарка 340
— аутосомно-доминантная поликис-
тозная 437
— Вильсона—Коновалова 325
— Гудпасчера 192
— Дауна 365, 498
— де Тони—Дебре—Фалькони 44, 340
— Леша—Найена 352, 359
— медуллярная кистозная 340, 345
— «плотных дипозитов» 245
— почек, иммунопатология 132
--- кистозная приобретенная 641
---поликистозная 340
---почечнокаменная 413, 526
---тяжелых цепей 557
— Фабри 340, 360
— Хартнупа 323
— хромосомные 365
— Шенлейна—Геноха 573
— экозависимые мочевой системы у
детей 501
Вальденстрема макроглобулинемия 561
Варикоцеле 526, 527
Васкулит геморрагический см. Шенлей-
на—Геноха пурпура
— системный 294, 297, 304
Вегенера гранулематоз 294
Венография почечная 118
Венокавография 118
Виллебранда фактор 237, 309
Вильмса опухоль 340
ВИЧ-нефропатия 569
Внутриканальцевая обструкция острая
454
Внутриклеточная дегидратация 56
Волюморегуляция 24
Вторично-сморщенная почка 222
Выделение веществ неорганических 28
---органических 40
- Н+ 39
— воды 35
— конечных продуктов азотистого об-
мена 46
— эндогенных пирогенов при раке
почки 527
Гамартоз моногенно-наследуемый 360
Гематурия 81, 87, 297, 330, 339, 410
Гемоглобинурия 575
Гемодиализ 69, 72, 582, 586, 598, 610
— хронический 618
---осложнения 621, 633
--- реабилитация 644
Гемодиафильтрация 646
Гемолиз внутрисосудистый 454, 585
Гемолитико-уремический синдром 308
Гемолитическая анемия 575
Геморрагический(ая) нефрозонефрит
572
— эпидемическая лихорадка 572
Гемофильтрация 646
Гепарин, применение, осложнения
61, 254
Гиалиноз 16, 220
Гиалиновые цилиндры 84
Гидронефроз, диагностика 108, 419, 540
— у детей 493
Гиперальдостеронизм 59, 327
683
Гипергликемия 450
Гиперкалиемия 375, 528, 541
Гиперкальциемия 334, 375, 528, 541
Гиперкальциурия 416
Гиперлипидемия 152
Гиперлипопротеидемия 158
Гипернатриемия 55
Гипероксалурия 352, 596
Гиперпаратиреоз вторичный 70
Гиперплазия предстательной железы 534
-------доброкачественная 534
-------лечение 536
-------скрининг-тест 535
Гипсрстснурия 99
Гипертензия артериальная 164, 184
---злокачественная 183
--- почечная 165
--- реноваскулярная 180
---системная 229
Гиперурикемия 334, 359, 427, 541
Гиперфосфатемия 65, 71, 541
Гипоальбуминемия 150
Гипоальдостсронпзм 60
Гипокалиемия 57, 59, 327, 585, 600
Гипонатриемия 49, 573
— гиповолемическая 55
- изоволемичсская 56
Гипоплазия сегментарная 337, 350
Гипопротеинемия 150
Гипотензивные средства 174, 178
Гл и ци нурия 340
Гломерулонефрит 13, 22, 138, 173,
188
— алкогольный хронический 458
— быстропрогрессирующий 199, 208,
214
— гематуричсская форма 497
— диффузный 497, 564
— иммунокомплексный 143
— лекарственный острый 375
— мезангиальный 242, 244, 215, 264
— мембранозный 241
— особенности у детей 497
— острый 195, 212, 258
— отечный 198
— постстрептококковый 518
— прогрессирование 224, 229
— у лиц старческого возраста 517
— фибропластический 222
— хронический и беременность 478
Гломерулопатия паранеопластическая
543
Гломерулосклероз 225, 227, 260
— фокально-сегментарный, лечение
220
Гломерулярный фильтр 13, 16, 25, 145
Глюкоза 40, 153
— гипергликемия 449, 450
— .механизм реабсорбции 41
— нарушения транспорта углеводов 322
— экскреция с мочой 41
Глюкозурия 322, 369
Глюкокортикоиды, механизм действия
247
Гормон(ы) антидиуретический гипо-
физа 19
— вазоактивные, роль в прогрессиро-
вании гломерулонефрита 231
Гудпасчера синдром 314
ДВС-синдром 289, 469, 472, 476, 572
Дефероксиамин 69
Диабет несахарный вазопрессинрези-
стентный 326
Диабетически й(ая) гломерулосклероз 448
Диазоксид 185
Диализная деменция 632
Диатез(ы) дизметаболические 352
---мочекислый 359
---цистиновый 356
---щавелевокислый 352
---уратный см. Диатез мочекислый
Дизурия 416
Дисфункции(я) канальцевые 320, 327
— мочевого пузыря нейрогенная 490
Диурез водный 54, 89, 99
— осмотический 97, 99
— увеличение при гепаторенальном
синдроме 457
Диуретики 30, 39, 58, 60, 177, 585
— калийсберегающис 179, 271
- классификация 269
— осмотические 269
— - петлевые 178, 270, 272
— побочное действие 178, 585
— тиазидные 270
Доксазозин см. а,-Адреноблокаторы
Допплерография ультразвуковая НО
Заболевания почек, вызванные бере-
менностью 465
---приводящие к потере натрия 55
— у лиц пожилого возраста 514
IgA-нефропатия 569
Изостенурия 99
Иминоглицинурия 43
Иммунодепрессанты селективные, ле-
чение гломерулонефрита 251
Иммуносупрессия при трансплантации
почки 661
Индапамид, гипотензивное средство
178
Индекс пульсовой 111
— Пурс илота 111
— резистентности 111
— ренально-кортикальный 392
— циркулярного сопротивления 111
Индометацин 54, 60, 99, 173
Интоксикация алюминием 67, 69
— лекарственная 372, 377, 524
Инулин 89, 424, 601
Инфаркт почки 292, 565
Исслсдование(я) ангиографическое
418
— вазографическое 531
— величины почечного кровотока 92,
110
---плазмотока 92
- - гистологическое 529
— глазного дна при артериальной ги-
пертензии 184
— иммунофлюоресцентное 132
— компьютерное 404
— концентрирующей способности
почек 96
— лабораторные 416, 552
— лучевые 101
- - морфологическое 432
— мочевой системы 410
— мочи 76, 93, 100, 432
— осморегулирующей функции почек
93, 99
— радиоизотопные 393, 601
— рентгенологический 101, 411, 418
— скорости почечной фильтрации 89
— томография 113, 123, 525, 529
--- магнитно-резонансная 124
— ультразвуковое(ая) 102, 106, 403
---допплерография ПО
---функциональная направленность
109
— уродинамики 489, 451
Инфекция мочевой системы 83, 116, 157
------у беременных 473
--------- детей 494
Калий 32, 51
— гиперкалиемия 60, 375
— гипокалиемия 57
— почечные (ая) потери 58
---регуляция баланса 57
Каллидин 169
Калликреин-кининовая система 53,
169
Кальций 33, 62, 65, 71
— гиперкальциемия 375, 528
— оксалаты 413
— реабсорбция 33
— транспорт в нефроне 57
Кальцитонин 63
Кальцитриол 72
Камнеобразование 112, 410, 413, 416
— выведение камней 420
Канальцевые дисфункции 320
---с гипокалиемией 327
Карбункул почки 106
Катехоламины 53, 232
— роль в прогрессировании гломеру-
лонефрита 232
Кинины 53, 169, 174
Кисты печени 439
— почек 104, 105, 437
Клетки АПУД-системы 22
— гигантские Пирогова—Лангганса
432
— ксантомные 401
— «пенистые» 342, 625
Клиренс инулина 89, 601
— парааминогиппуровой кислоты 92
Клубочковая протеинурия 146
— фильтрация 27, 37, 182, 511, 603
— — скорость 50, 59, 89
Колика почечная 415, 526
Коллапс циркуляторный 588
Комплемент, роль в повреждении клу-
бочков почки 139
Кортизон 19
Коэффициент ультрафильтрации 26
Краш-синдром 59, 192
Криз(ы) гипертонический 172, 607
— нефротический 157, 240
— отторжения трансплантата почки
666
Кристаллурии 352, 487
Кровоток почечный, возрастные изме-
нения 512
---допплеровский метод исследова-
ния 110
---оценка качественная ПО
------количественная 111
Ксантогранулема почки 526
Лейкоцитурия 82, 87, 390, 392, 394
Липиды, отложение в структурах по-
чек 219
684
— — — — — гиполипидсмическая
терапия 256
Литиаз кальциевый 414
— оксалатный 414
— уратный 414
— фосфатный 414
Лихорадка 147, 566
— гемоглобинурийная 575
— геморрагическая с почечным син-
дромом 572
Магний 34
Макрогематурия 80
— безболевая тотальная 526
Матрикс внеклеточный 596
— гломерулярный 142
— мезангиальный 16, 227
Медиаторы гломерулярного поврежде-
ния 138
Мсзангиальная(ый) гиперклеточность
227
— матрикс 16
Мезангий, строение 15, 16
Метаболизм азотистый 605
— витамина D, нарушения 153
Метаболический алкалоз 58
— ацидоз 58
Метод(ы) диагностики бактериологи-
ческие 432
---биопсия почки 101, 126, 450, 532
---визуализирующие 417
---внепочечное очищение крови 618
--- допплеровский 110
---иммунофлюоресцентная микро-
скопия тканей 132
---инфузионная урография 115
— — инструментальные 417, 446
---лабораторные 83, 390, 432, 445
---полимеразная цепная реакция 496
— — радионуклидные 122, 418, 433
---рентгенологические 111, 527
---урография инфузионная 115
--- экскреторная 114
---хромоцистоскопия 391
— ретроградной пиелографии 115
— ультразвуковой 102, 106, 391, 393
— цистоскопии 526
— эндоскопический 418
Механизм(ы) коагуляции при нефрите
234
— мочеобразования 24, 27
— нервной регуляции функции почек
21
— повреждения клубочков 137
— развития гломерулонефрита иммун-
ные 134
---тубулоинтерстициального нефри-
та 142
— фибринолиза 234
Миелома множественная см. Парапро-
теинемии
Микроальбуминурия 449
Микроангиопатии тромботические 308
Микрогематурия 80
Микрокистоз новорожденных 224
Минералокортикоидная недостаточ-
ность 60
Миоглобинурия 585
Моча, задержка 536
— механизм образования 24, 27
— неорганический осадок 86
— — — метод полимеразной цепной
реакции 496
— осмотическое концентрирование 35
---разведение 35
Мочевая кислота 46, 86, 484, 589
— система, врожденные заболевания
337
Мочевина 36, 47, 484, 601
Нарушение(я) водно-электролитного
баланса 374, 585
— гемостаза при нефропатии беремен-
ных 460
— гомеостаза 154
— диффузорно-сфинктерные 490
— метаболизма пуринов 358, 458
---врожденные 324
— метаболические при нефротическом
синдроме 152
— мочеиспускания 535, 536
— уродинамики в детском возрасте 489
— фосфорно-кальциевого обмена 601
— транспорта аминокислот 323
---витамина D 153
— воды электролитов 311, 326
Наследственны й(ая) нефрит 340
— остеоониходисплазия 363
Натрий 28, 49, 52, 55, 56
— гипернатриемия 56
— гипонатриемия 55
— задержка при почечных заболевани-
ях 166
— нарушения баланса 55
— причины потери 55
— реабсорбция в клетках нефрона 30
Нейрогенный мочевой пузырь 484, 490
Нейтрофилурия 84
Некроз казеозный 430
— канальцевый острый 455
— кортикальный 477
— папиллярный 449
— тубулярный острый 581
— фибриноидный 468
Нестероидные противовоспалительные
препараты 257, 374
Нефрит бактериальный острый 331
— быстропрогрессирующий волчаноч-
ный 288
— иммунокомплексный 136, 143
— интерстициальный в пожилом воз-
расте 518
---острый 373
------у детей 494
---хронический 126
— криоглобулинемический 305
— лекарственный острый 330
— мезангиопролиферативный 135
— наследственный см. Альпорта синд-
ром
— радиационный 544
— тубулоинтерстициальный 142, 330,
373
---уратный хронический 424
— хеймановский 135
Нефробластома см. Опухоль Вильмса
Нефрогенный несахарный диабет 340
Нефроз липоидный 219, 239
Нефрозонефрит геморрагический 572
Нефролитиаз 107 , 440 , 460
Нефромегалия 493
Нефрон(ы), инволюция 510
— иннервация 21
— петля Генле 17, 30, 36, 49
— склерозирование 510
— строение 12, 17
— юкстамедуллярные 37, 510
Нефронофтиз Фанкони 340, 345
Нефропатия(и) «анальгетическая» 333
— ассоциированная с малярией 575
— беременных 465, 472
— бескистозная 340
— врожденные 337, 339
— диабетическая 448
— дизметаболические с кристаллоури-
ями 352
— лекарственная 375
— мембранозная, лечение 217, 241,
262
— моногенно-наследуемые 339, 340
— мышиная вирусная 572
— наследственные 337—339
— особенности течения у детей 506
— острая мочекислая 422
— паранеопластические 540, 545
— полигенно-наследуемые 338, 352
---при остеоониходисплазии 363
— сандиммуновая 379
— склеродермическая 301
— свинцовая 335
— при туберозном склерозе 360
— тубулоинтерстициальные 329
— уратная 359, 422
— хронические 333
— частота у детей 491, 495
— экзогенные 339
IgA-нефропатия 264, 265
Нефроптоз 104, 340, 444
Нефротический(ая) криз 157, 240
— синдром 148
---врожденный 224
---лечение 159
---осложнения 157
Нефросцинтиграфия 122
Новообразования почки доброкаче-
ственные 532
---злокачественные 525
Обструкция крупных вен мочеточни-
ков 540
Оксалоз 353
Оксид азота 13, 169, 170, 231, 255
Олигомеганефрония 340, 348
Олигонефрония 340, 348
Олигурия 193, 332, 416, 573, 588
Опухоль(и) почки 105, 113, 444, 525
— Вильмса 340, 529
Осмоляльность сыворотки крови 93, 98
Осморегуляция 24, 93
Осмотическое концентрирование мочи
35
Основания 44
Особенности патологии почек у детей
484
Остеобласты 70
Остеодистрофия ренальная 66
Остеокласты 66
Остеомаляция 66, 601
Остеоониходисплазия наследственная
363
Острая(ый) почечная недостаточность
580
-------нефротоксическая 581
-------патогенез 581
-------постренальная 587, 590
------- преренальная 580
-------при алкоголизме 454
------------гепаторенальный синд-
ром 456
685
—--------— полиорганная недоста-
точность 456
---------СПИДе 569
Отеки нефротические 151, 155, 198,
239
Относительная плотность мочи 78, 89
— — — проба на максимальное раз-
ведение 98
Папиллит 107
Парааминогиппурат 44
Паранефральный абсцесс, диагности-
ка 106
Парапротеинемии 557
— множественная миелома 557
— синдром Фанкони 559
Паратгормон 33, 63, 73
Перекисное окисление липидов, связь
с деструкцией цитомембран 233
--- — активация 170
Первая помощь при непереносимости
рентгеноконтрастных препаратов
121
Первичная гипероксалурия 353
Перитонеальный диализ 618, 644
Петля Генле 17, 18, 30, 31, 36, 54
Пиелография антеградная 116
Пиелоуретерография ретроградная 82,
115
Пиелонефрит в пожилом возрасте 515
— ксантогранулематозный 400
— лечение 395
— острый 106, 388, 389
---беременных 473
— у детей 494
— хронический 391
---при алкоголизме 460
Плазмаферез 185, 288, 501, 596
Подоксалин 12
Поликистоз почек 38, 104, 437, 444
--- лечение 441
---осложнения 439
Полиурия 326, 573, 600
Полицитемия 440
Поражения(е) почек алкогольные хро-
нические 454
---лекарственные 372, 377
--- паранеопластическое 541
---при ВИЧ-инфекции 568
------гранулематозе Вегенера 294
------злокачественных новообразо-
ваниях 540
------лечении злокачественных за-
болеваний 544
— — — малярии 575
— — — наследственной остеоонихо-
дисплазии 363
------парапротеинемиях 557
— — — подостром инфекционном
эндокардите 563
------полиартериите узелковом 291
--------- микроскопическом 296
— — — пурпуре Шенлейна—Геноха
297
------хромосомных болезнях 365
------ВИЧ-инфекции 568
— сосудов головного 'мозга с развити-
ем аневризм 439
Почечная(ый) ангиография 116
— аортография 116, 323, 325
— ацидоз канальцевый 461
---тубулярный 340
— венография 118
— гиперкалиемия 59
— гипертензия 165, 172
— глюкозурия 322
— канальцевая фильтрация 89
— колика 415, 526
— недостаточность острая 126, 179
-------в пожилом возрасте 519
-------у беременных 476
---хроническая 38, 45, 55, 596
— поликистоз 340, 361, 438, 440, 442
— простагландины 169
— фармакоартериография селективная
118
— функциональный резерв 229
Почечно-клеточный рак 525
Почка(и), аномалии 103, 348
---гипоплазия 104
--- добавочная 339
---нефроптоз 104, 340
--- Z-образная 340
--- S-образная 340
— — подковообразная 104, 340
---пояснично-дистопированная 104
---при системных заболеваниях 280
---тазово-дистопированная 104
---Удвоение верхних мочевых путей
104, 339
— архитектоника кровяной системы 20
— Аска—Упмарка 350
— вторично-сморщенная 222, 392, 598
— гипоплазия сегментарная 340
— гломерулярные кистозы 340
— дисплазии 340
— интеграция клеточных функций 48
— исследование осморегуляции 93
— калийпеническая 563
— кисты 105, 340, 361
— методы исследования 101
— оценка функционального состояния
88
---------методы исследования 101
— при беременности 464, 479
---нефропатии беременных 468
— размеры при хронической почечной
недостаточности 601
— регуляция баланса калия 57
-------натрия 50
---объема жидкости 49
— ротация 340
— старческая 509
— трансформация 658, 665, 676
— тубулопатии 340
Празозин см. а,-Адреноблокаторы
Преднизолон, дозы при нефрите 248
Предсердный натрийуретический ат-
риопептид 52
Преэклампсия см. Нефропатия беремен-
ных
Приобретенная кистозная болезнь по-
чек 641
Пробы(а) Зимницкого 37, 88
— нагрузочные функциональные 95,
100
— — — для оценки кислотовыдели-
тельной функции почек 100
-------на разведение мочи 98
— с нагрузкой хлоридом аммония 100,
101
-------допамином 91
— Фольгарда 37
Простагландины 20, 21, 54, 169, 374
Протеинурическая гипертония 465
Протеинурия 18, 87, 145, 149,223, 230
— Бенс-Джонса 559
Процесс осмотического концентриро-
вания мочи 35
---разведения мочи 35
Псевдогиперальдостеронизм 328
Псевдогипоальдостеронизм 340
Псевдогипопаратиреоз 322
Псевдоподагра 69
Пузырно-мочеточниковый рефлюкс
407
Пульс-терапия метилпреднизолоном
248
— циклофосфамидом 249
Пурсилота индекс 111
Рак почки 526
------ диагностика 529
---классификация 528
Реабсорбция канальцевая белка 18
— веществ 24, 27, 31, 51
— глюкозы 41
— электролитов, нарушение 29, 99
---натрия 51
---фосфата 62
Реакции клубочков на иммунологичес-
кое повреждение 142
Регуляция баланса натрия 49, 54
— кислотно-основного состояния 39
— объема жидкости 49, 54
— фосфорно-кальциевого обмена 65
— фиброгенеза 226
Ренальная остеодистрофия 71
Ренин плазмы(а) 22, 25, 53, 58, 375, 606
— гипоренемический гипоальдостеро-
низм 60
— повышение активности 167, 181
Ренин-ангиотензин-альдостероновая
система, роль в патогенезе почеч-
ной гипертензии 167
Ренография 122
Рентгенография мочевой системы об-
зорная 111
Рентгеноконтрастные препараты, не-
переносимость, первая помощь 121
Рефлюкс, антирефлюксные операции
412
— внутрипочечный 408, 491
— мочеточниково-венозный 407
— мочеточниково-лимфатический 407
— пиеловенозный 385
— пиело-пиелярный 407
— пузырно-мочеточниковый 407, 491,
494
— уретровенозный 407
— уретроэякуляторный 407
Рефлюкс-нефропатия 340, 491
Салуретики см. Диуретики
Секреция веществ в канальцах почек
24, 27
Симптомы рака почки 526
— указующего перста 419
— Ходсона 392
— экстраренальные 528
Синдром (ы) Абдергальдена—Линья-
ка—Кауфмана см. Цистиноз
— Альпорта 340, 369, 596
— аутосомных трисомий 366
---моносомий 367
— антифосфолипидный 280
— Барттера 327
— Барттера—Гительмана 327
686
— Баттлера—Ольбрайта 325
— болевой абдоминальный 339
— Вольфа—Хиршхорна 367
— врожденный 224, 347
---морфология 223
— гемолитико-уремический 308
— гепаторенальный 456
— гипоосмолярный 573
— гипоренинемический с гиперкали-
емией 375
— Гитауффера 526, 527
— Гительмана 327
— гормонорезистентный нефротичес-
кий 500
— Гудпасчера 314
— Дауна 366
— Денис—Драша 498
— Иценко—Кушинга 40, 56
— Клайнфелтера 367
— «кошачьего глаза» 366
— «кошачьего крика» 367
— Лоуренса—Муна—Барде—Бидля 369
— Кушинга 59
— Леша—Найена 359
— Лиддла 328
— Майкла—Уэлса 547
— мочевой 283, 284, 339, 487, 559
— нарушенного равновесия 631
— нефротический семейный 348
------финского типа 340, 347
— Орбели 367, 498
— Остеррейхера 363
— отечный 272, 339, 487, 493
— Патау 366
— Рейно 299
— Сениора 340, 345
— сольтеряющий почки 374
— Тернера—Кайзера 363
— триплоидии 366
— трисономии 366
— тромбоэмболический 566
— Фанкони 31, 321, 324, 541, 559
— Фонга 363
— Циве 454
— Шерешевского—Тернера 367
— Штауффера 526, 527
— Эдвардса 366
Синдромология болезней почек в детс-
ком возрасте 486, 489, 492, 497, 501
Синтез веществ в канальцах почек 27
Система активного транспорта нефро-
на 27
— почки депрессорная 169
--- кровеносная 20
---лимфатическая 20
--- мочевая, исследования 111
--- нервная 21
— калликреин-кининовая 23, 51, 53,
169, 572
— комплемент 139
— — особенности заболеваний у де-
тей 492, 494
— прессорная гормональная 167
— ренин -ангиотензин-альдостероновая
167, 327
— ренин-ангиотензиновая 231
— симпатоадреналовая 168
— фибринолитическая крови 236
Сканирование двойное НО
Спиронолактоны 60
Старческая почка, структура 509
Строма почек 20
«Сульфаниламидная почка» 206
Тамма—Хорсфолла белок 84
Тест на максимальное концентрирова-
ние мочи 96
— с дефероксиамином 69
---питрессином 95
--- преднизолоном 82
Тирокальцитонин 33
Томография магнитно-резонансная 124
Трансплантация почки 290, 658
— — ведение послеоперационного
периода 660
---иммуносупрессия 661, 672
— — отторжение трансплантата 665,
667, 669, 676
--------- диагностика 677
---показания 659
---техника 660
Транспорт воды, нарушения 326
— калия 326
— натрия 53, 326
— фосфатов, нарушения 321
Трансферринурия 230
Тромбоз почечных артерий 587
Тромботические микроангиопатии 308
Тромбоцитопеническая пурпура 308,
569, 573
Тромбоциты, роль в развитии нефри-
та 238
Туберкулез внелегочный 429
— почки 429
---диагностика 107, 431
---классификация 430
--- лечение 435
Туберкулезная(ый) каверна почки 106
— папиллит 430, 434
Туберозный склероз 340, 360
Тубулоинтерстициальный склероз 228
Тубулопатии, классификация 320,
340, 352
Ударно-волновая литотрипсия 421
Узелковый полиартрит Чарга—Штро-
усса 292
Ультрасонограмма почки при полики-
стозе 104
Ультрафильтрат 25, 28
Ультрафильтрация жидкости в клубоч-
ках почек 24, 25, 27
Ураты 413, 422, 424
Уремическая(ие) подагра 602
— токсины 597
Уремия 448, 597, 599, 602, 642
— хроническая 641
Урография 114, 115
Уродинамика 489
Уропатии(я) врожденные 339, 352
— наследственные 339
— обструктивная 536
Фабри диффузная ангиокератома 359
Фазово-контрастная микроскопия 83
Факторы Виллебранда 237, 309
— риска стабильного снижения почеч-
ных функций 175
— роста, роль при почечных заболе-
ваниях 140
— эндотелиальный релаксирующий см.
Оксид азота
Фанкони нефронофтиз 231, 345
Фармакоартериография почечная се-
лективная 118
Феномен Вальсальвы 102
Фильтрационная фракция 25
Фильтрация клубочковая почечная 24,
145, 449
— исследование скорости 89, 91
Финастерид 536
Флоуметрия допплеровская НО
Фокальный сегментарный гломеруляр-
ный склероз 220
Фосфат-диабет 321, 340
Фосфатемия 70
Фосфаты 63, 65, 71, 86
— нарушение транспорта 321
Фосфор 34
— фосфорно-кальциевый обмен 62,
153
Функциональная(ые, ое) морфология
почек 12
— пробы 90, 95, 100
— состояние почек, оценка 88, 101
Фуросемид, натрийуретическое сред-
ство 30, 178, 185
Хартнупа болезнь 323
Хеймановский нефрит 135
HELLP-синдром 471, 476, 478
Хлор 28, 49
Хлорбутин 250
Ходсона симптом 392
Холекальциферол 63
Хроническая почечная недостаточ-
ность 38, 45, 55, 596
------активация перекисного окис-
ления липидов 170
------анемия 608
— — — водно-электролитные рас-
стройства 599
------ диагностика 600
—-----лечение 603, 605, 644
---------артериальной гипертензии
179
---------методы внепочечного очи-
щения крови 618
------нарушение концентрационной
способности почек 38
---------фосфорно-кальциевого об-
мена 65, 601
------ прогноз 602
------рефлюкс-нефропатия 410
— — — — у лиц пожилого возраста
522
------ течение 602
— — — трансплантация почки 618,
658
------ у детей 647
------уремические токсины 597
---— уремия 528, 599, 602
------ энтеросорбция 605
------ этиология 596
Цефалоспорины 396
Циклофосфамид 249
Цилиндры гиалиновые 84
— жировые 85
— зернистые 85
— лейкоцитарные 85
— эритроцитарные 85
Цистиноз 356
Цистинурия 43, 323, 340
Цистометрия 490
Цистоскопия 526
Цитокины 140, 385, 572, 610
Цитостатики 249, 261, 264
— лечение системных заболеваний 288
687
Чарга— Штроусса узелковый полиар-
трит 292
Шенлейна—Геноха пурпура 297
Шок гиповолемический см. Нефроти-
ческий криз
Элементы интеграции деятельности
почек 48
Эмболия почечной артерии 586
Эналаприл 185
Эндокардит инфекционный 563
Эндотелий 234
Эндотелийрелаксирующий фактор
170, 231
Энтеросорбция 605
Энурез 490
Энцефалопатия гипертоническая 172,
184
— уремическая 172
Эозинофилурия 84
Эпидемическая геморрагическая лихо-
радка 572
— нефропатия 572
Эритропоэтин, дефицит при уремии
610
Этакриновая кислота 30
Эффект Допплера ПО
Эходопплерография дуплексная см.
Сканирование двойное
Юкстагломерулярный аппарат 16, 20,
167, 327
---- строение 22
Руководство
Нефрология
Зав. редакцией Т.П.Осокина
Редакторы
Т.П.Осокина, Л.В.Левушкина
Художественный редактор
С.Л.Андреев
Технический редактор
В. И. Табенская
Корректоры
Т. Г. Ганина, М.П. Молокова
ЛР № 010215 от 29.04.97. Сдано в на-
бор 31.07.2000. Подписано к печати
14.11.2000. Формат бумаги 84х1081/,6.
Бумага офсетная № 1. Гарнитура Таймс.
Печать офсетная. Усл. печ. л. 72,24.
Усл. кр.-отг. 72,24. Уч.-изд. л. 81,50.
Тираж 10 000 экз. Заказ № 2950.
Ордена Трудового Красного
Знамени издательство «Медицина».
101000, Москва,
Петроверигский пер., 6/8.
ОАО «Ярославский полиграфкомбинат».
150049, Ярославль, ул. Свободы, 97.