Автор: Мухин Н.А.
Теги: заболевания мочеполовой системы урология медицина нефрология
ISBN: 978-5-699-29633-0
Год: 2010
Текст
ПРОФЕССИОНАЛЬНАЯ МЕДИЦИНА
НЕФРОЛОГИЯ
НЕОТЛОЖНЫЕ СОСТОЯНИЯ
Под редакцией Н. А. Мухина
Рекомендовано Учебно-методическим объединением
по медицинскому и фармацевтическому образованию вузов
России в качестве учебного пособия для послевузовского
профессионального образования врачей
ЭКСМО
МОСКВА
2010
УДК 616.6
ББК 56.9
Н58
Авторский коллектив
МУХИН Н. А.
академик РАМН, д.м.н., профессор, заведующий кафедрой терапии и Г1ро(|и>ол<*зиейг
директор клиники нефрологии, внутренних и профессиональных болезней им.
Е.М. Тареева ММА им И.М. Сеченова
КОЗЛОВСКАЯ Л. В.
д.м.н., профессор кафедры терапии и профболезней ММА им И.М. С< чснова
ПАЛЬЦЕВА Е.М.
К.М.Н., доцент, заведующая лабораторией электронной микроскопии и иммуногисто-
химии Централизованного патолого-анатомического отделения ММА им. И.М. Се'
ченова
ФОМИН В. В
д.м.н., доцент кафедры терапии и профболезней, ученый секретарь Научно-исследо-
вательского центра ММА им. И.М. Сеченова
Титульный редактор
МУХИН Н. А.
академик РАМН, д.м.н., профессор, заведующим кафедрой терапии и профболезней,
директор клиники нефрологии, внутренних и профессиональных болезней им
Е.М. Тареева ММА им И.М. Сеченова
Нефрилошя : неотложные состояния / Под ред. Н.А. Мухина.
Н 58 М.: Эксмо, 2010. — 288 с. — (Профессиональная медицина).
ISBN 978-5-699-29633-0
ISBN 978-5-699-39093-9 (В суперобложке)
Клиницист любой специальности сталкивается с неотложными нефрологическими
состояниями, которые могут с греми сельпо привести к угрожающим жизни осложнениям.
В книге впервые четко определены состояния в нефрологии, которые следует рас-
сматривать как неотложные, требующие экстренных терапевтических мероприятии
Клинические проявления резкого ухудшения почечной функции зачастую малозамет-
ны. поэтому особое внимание уделено анализу динамики лабораторных показателен
с подробным описанием маркеров.
Полное описан не неотложных состояний в нефрологии осуществлено по нозологи-
ческому принципу. Эго особенно удобно для лечебном иракзики, поскольку особенцо-
сти заболевания ночек часто становятся сироте еяющими при выборе тактики ведения.
Независимо от этиоло] ической и патогенетической природы во всех случаях обемтюва
ны общие принципы лечения.
Книга создана российскими специалис га.мн знаменитой Тареевскоб клини ки и реко-
мендована У МО по медицинскому и фармацевтическому образованию вузов России в
качестве учебного пособия для послевузовского ирафсссиопа.№Ного образования врачей.
УДК 616.6
ББК 56.9
ISBN 978-5-699-29633-0
ISBN 978-5-699-39093-9 (В суперобложке)
Мухин Н.А., редакция, 2009
© Коллектив авторов, 2009
© ООО Издательство «Эксмо*, 2009
Оглавление
Введение............................................................. 4
ГЛАВА 1. Нарушение электролитного гомеостазт..........................8
ГЛАВА 2. Нефротический криз ............................. .., .......32
ГЛАВА 3. Быстропрогрессирующий гломерулонефрит.......................41
ГЛАВА 4. Злокачественная артериальная гипертензия....................61
ГЛАВА 5. Гипертонический криз........................................84
ГЛАВА 6. Холестериновая эмболия почечных артерий....................100
ГЛАВА 7. Тромбоз и тромбоэмболия почечных сосудов................. 117
ГЛАВА 8. Почечные тромботические микроангиопатии....................134
ЛАВА 9. Поражение почек при хронической сердечной недостаточности...148
ГЛАВА 10. Склеродермический почечный криз...........................161
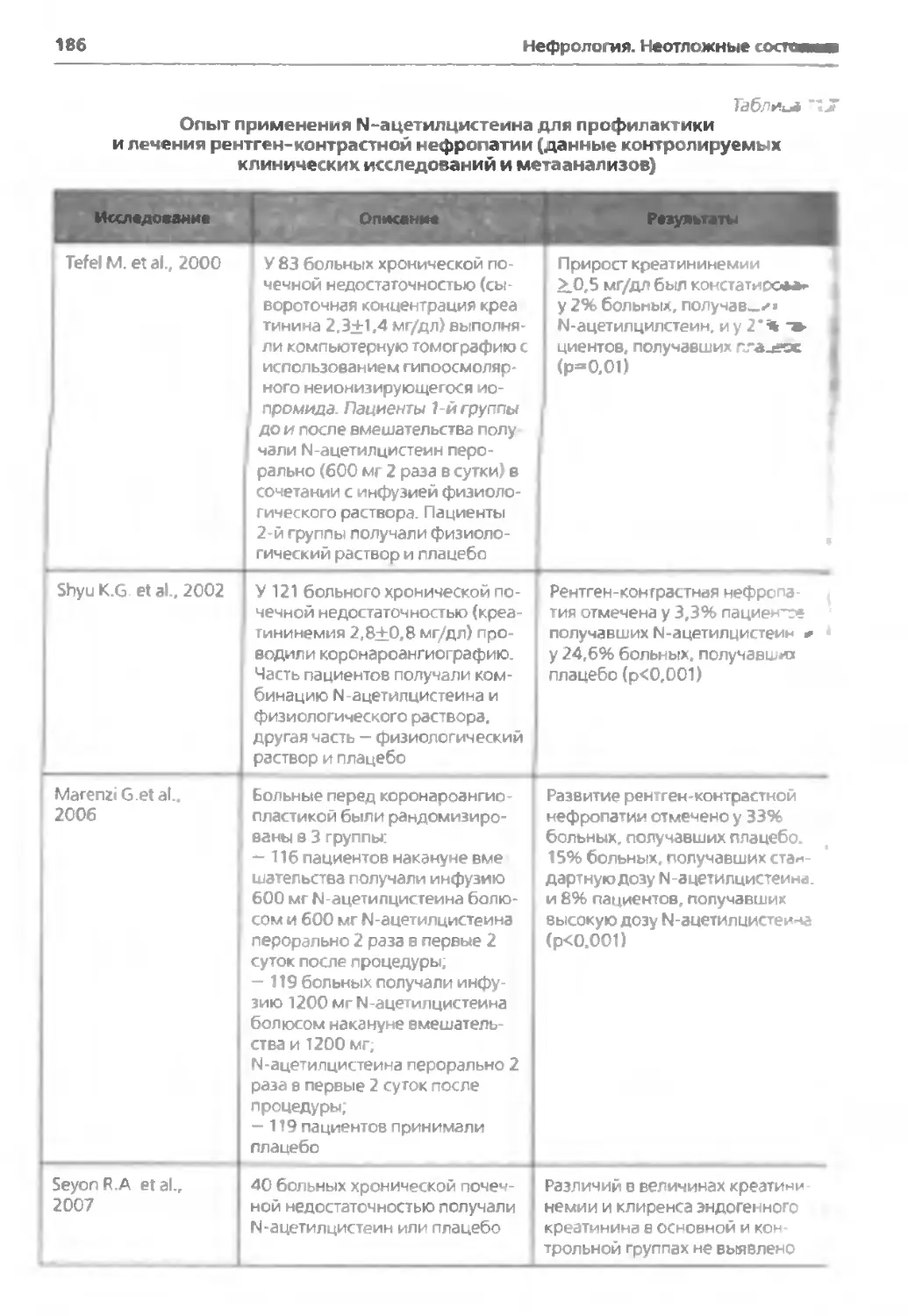
ГЛАВА И. Рентген-контрастная нефропатия........................... 172
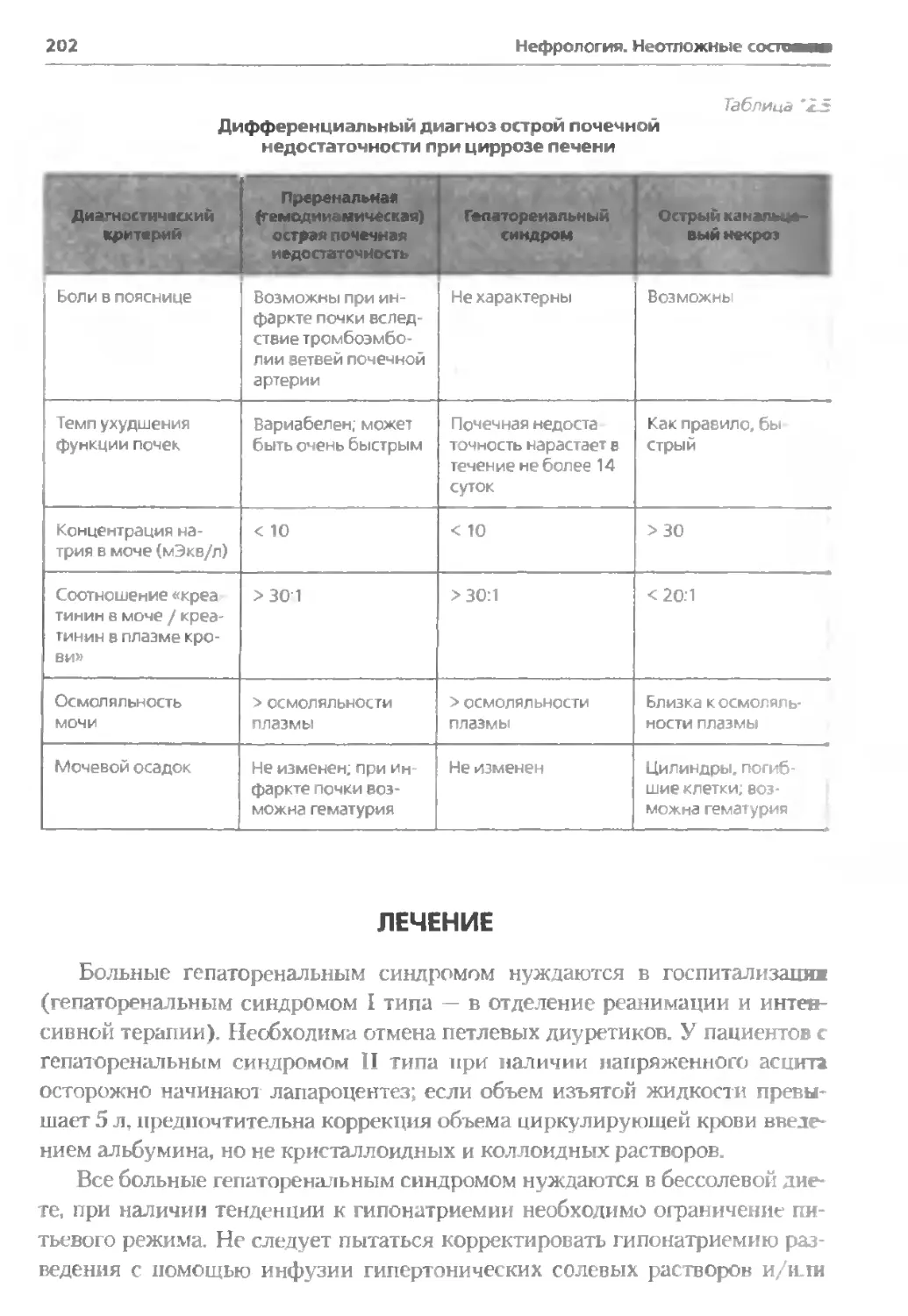
ГЛАВА 12. Гепаторенальный синдром...................................191
ГЛАВА 13. Острый тубуло-иитерстициальный нефрит......................209
ГЛАВА 14. Уратный почечный криз ........................... ....... 231
ГЛАВА 15. Острая пигментная нефропатия .............................240
ГЛАВА 16. Геморра! ическая лихорадка с почечным сгн дромо.м ... --... 251
ГЛАВА 17. Острая нефропатия, вызванная применением
ингибиторов кальцинейрина .......................................261
Список использованной литературы ...................................270
Введение
Неотложными принято считать состояния, которые при отсутствии соот-
ветствующих экстренных терапевтических мероприятий способны очень бы-
стро приводи гь к угрожающим жизни осложнениям и/ичи смерти. Варианты
неотложных состояний, возможных в ряде разделов клиники внутренних бо-
лезней (пульмонологии, кардиологии), в настоящее время четко определены,
подходы к обследованию и лечению таких пациентов алгоритмизированы,
при этом выбор дна! ностических и лечебных вмешательств, как правило, осу-
ществляется с учетом данных медицины, основанной на доказательс гвах, по-
зволяющих лс только обоснованно соотнести риск и пользу от их примене-
ния, но и предсказать долгосрочное влияние на прогноз.
В отличие от этого в нефрологии понятие о неотложных состояниях в
настоящее время сформировано менее четко. Нередко в качестве неотлож-
ного нефрологического состояния называют только различные варианты
острой почечной недостаточности, стратегия ведения которой при этом
ограничивается до соответствующей инфузионной терапии и проведения
экстренного гемодиализа. Вместе с тем именно в нефрологии рассмотрение
проблемы неотложных состояний, по-видимому, чолжни осуществляться по
нозоло! ичес кому принципу, поскольку особенности заболевания почек ча-
сто становятся определяющими при выборе тактики ведения, иногда отли-
чающейся радикально при относительно стереотипных клинических и ла-
бораторных проявлениях.
Основными особенностями неотложных состояний в нефрологии сле-
дует считать:
• возможность бурного развития при отсутствии заболевания почек, ис -
ходно сохранной функции почек или умеренном почечном поражении
(типично для лекарственных и сосудистых нефропатий):
• нередкое отсутствие или малую демонстративность клинических про-
явлений, затрудняющие раннюю диагностику и выделение достовер-
ных предвестников. При этом ориентация на жалобы практически не
может бы гь использована для распознавания нефрологических неот-
ложных состояний в отличие от того, что наблюдается при других за-
болеваниях: например, боль за грудиной является основным шагно-
сгически.м признаком острого коронарного синдрома,
• стереотипность лабораторных изменений (например, рост креатини-
немии и калиемии как интегральный маркер быстро ухудшающейся
почечной функции);
Введение
5
• кроме того, риск необратимого ухудшения почечной функции, как
правило, дополняется драматически возрастающей вероятностью
сердечно-сосудистых осложнений, что дополнительно ухудшает про-
гноз.
Как уже было сказано, клинические проявления неотложных нефроло-
гических состояний зачастую мало заметны, в связи с чем решающее значе-
ние в их выявлении приобретает анализ динамики лабораторных показате-
лем. Маркерами неотложных состояний в нефрологии можно считать:
• быстрый рост АД: формирование артериальной гипертензии de novo
или снижение/утрату эффективности антигипертензивной терапии;
• ускоренно развивающееся поражение органов-ми теней артериальной
гипертензии — острую левожелудочковую недостаточность, ухудше-
ние зрения вплоть до слепоты (отек диска зрительного нерва — маркер
созлокачествления» артериальной гипертензии, возможны также эм-
болии и тромбозы сосудов сетчатки), общемозговую си.мптоматику
(заторможенность, нарушения сознания);
• быстро нарастающие i инеркреатининемию и снижение скорости клу-
бочковой фильтрации (определяемой расчетными метода.ми — с по-
мощью формул Cockroft-Gault или MDRD);
• рост плазменной концентрации калия (одно из наиболее угрожающих
жизни проявлений);
• рост или снижение плазменной концентрации натрия;
• снижение плазменной концентрации альбумина (особенно при не-
фротическом синдроме);
• развитие артериальной гипотензии (прежде всего при нефротическом
синдроме, при котором оно указывает на развитие нефротического
криза);
« появление неврологической симптоматики (может свидетельствовать
как о нарушениях мозгового кровообращения, так и о нарушениях
электролитного гомеостаза).
Нефрологические неотложные состояния возникают особенно часто в
следующих клинических ситуациях:
• при первом назначении любого лекарственною препарата;
• у пожилых больных;
• при исходной хронической почечной недостаточности (феномен acute
on chronic — развитие острою ухудшения функции почек при исхо-
дном стойком ее снижении представляет собой одну из наиболее про-
гностически неблагоприятных ситуаций) и/или хроническом заболе-
вании почек:
• при сахарном диабете II типа;
« при хронической сердечной недостаточности;
6
Нефрология. Неотложные состояния
• при распространенном атеросклерозе;
• при нестабильных гемодинамических показателях;
• при вмешательстве на сосудах;
• при применении рентген-контрастных агентов.
Опыт любой многопрофильной клиники свидетельствует о реальной
возможности возникновения у больного той илн другой нефрологической
ситуации, в том числе требующей неотложной помощи, включая перевод
больного в отделение интенсивного наблюдения. Своевременная расшиф-
ровка этих неотложных состояний позволяет во многих случаях не только
сохранить жизнь, но и во многом повлиять на долгосрочный прогноз тяже-
лых больных. Еще более четко реальность подобных ситуаций подтвержда-
ет опыт работы нефрологических отделений таких многопрофильных кли-
ник, нозологический профиль которых включает ие только «первичные»
заболевания почек (различные варианты гломерулонефрита и др.), но и по-
ражение почек при системных заболеваниях (системной красной волчанке,
васкулитах, «склеродермической почке», нарушениях внутрисосудистого
свертывания с тромбозами, тромбоэмболиями, тромботической микроан-
гиопатией), а также поражение почек у больных с прогрессирующими за-
болеваниями печени (такими, как тяжелые варианты криоглобулинемиче-
ского васкулита у больных с хроническим вирусным гепатитом С,
гепаторенальным синдромом), гипертоническим кризом, тяжелой хрониче-
ской сердечной недостаточностью.
«Первичные» поражения почек также могут быть причиной развития
неотложной ситуации: тяжелый нефротический синдром с нефротическим
кризом, быстропрогрессирующий нефрит с постоянной опасностью различ-
ных ургентных состояний, острый тубулоинтерстициальный нефрит раз-
личной этиологии, поражение почек при миоглобинурии и гемоглобинурии,
а также почечные осложнения проводимого патогенетического лечения (на-
пример, при лечении больного нефритом циклоспорином).
В настоящее время хорошо известны остро возникающие нефрологиче-
ские осложнения при проведении исследований с введением контрастных
препаратов (рентгенконтрастные нефропатии), а также при манипуляциях
на сосудах, например при стентировании коронарных артерий (холестери-
новые эмболии сосудов почек).
Современная активная терапия различных заболеваний не лишена це-
лого ряда нежелательных явлений, предвидеть и предупредить которые
возможно (например, острую уратную нефропатию, возникающую в резуль-
тате синдрома лизиса опухоли при химиотерапии)
Серьезные неотложные ситуации возникают при нарушениях электро-
литного гомеостаза, что может наблюдаться при самых различных заболе-
ваниях и их лечении.
Введение
7
Специального внимания заслуживают проблемы острой и хронической
почечной недостаточности, в том числе так называемой «тихой уремии». Ее
клинические признаки в течение длительного периода выражены мини-
мально, и потому «дебютом» становится терминальная стадия уремии, про-
являющаяся остро отеком тегкого, одышкой, вызванной тяжелой анемией,
или ... первым в жизни приступом подагрического артрита (выраженная ги-
перурикемия в рамках терминальной азотемии). Однако названные пробле-
мы, как и возможные осложнения у больных, находящихся на лечении хро-
ническим гемодиализом, детально обсуждаются в специальных изданиях.
Такого же отдельного подробного обсуждения требует и проблема по-
ражения почек в рамках полиорганной недостаточности, в том числе при
ДВС-синдроме, детально представленная в соответствующих руководствах.
Необходимо подчеркнуть, что неотложное нефрологическое состояние мо-
жет быть отмечено в практике клинициста любой специальности. Нередко
оно сочетается с поражением других органов: например, холестериновая эм-
болия почечных артерий приводит к одновременному поражению артери-
альной системы нижних конечностей, а также ветви брюшной аорты. Одной
из наиболее четких эпидемиологических тенденций является неуклонное
увеличение числа случаев ятрогенной острой почечной недостаточности, в
том числе обусловленной неадекватным применением лекарственных пре-
паратов или рентген-контрастных агентов.
Независимо от этиологической и патогенетической природы неотлож-
ных нефрологических состояний, во всех случаях обосновано соблюдение
некоторых общих принципов ведения, позволяющих предсказать и преду-
предупредить их развитие:
• строгий мониторин] показателей, характеризующих функцию почек,
электролитный гомеостаз, а также изменение мочи;
• контроль и при необходимости коррекция гемодинамических показа-
телей;
• максимально возможное уменьшение числа лекарственных препара-
тов с отменой тех, которые способны провоцировать дальнейшее ухуд-
шение почечной функции;
• своевременное применение ультрафильтрации и экстренного гемоди
ализа.
Все пациенты, у которых констатировано неотложное нефрологическое
состояние, должны находиться в отделении реанимации и интенсивной те-
рапии, располагающем возможностями заместительной почечной терапии,
желательно иод постоянным наблюдением нефролога. Обоснован учет по-
добных пациентов в региональных регистрах хронических болезней почек.
Глава 1
НАРУШЕНИЕ ЭЛЕКТРОЛИТНОГО
ГОМЕОСТАЗА
Нарушение электролитного гомеостаза — выраженное и нередко очень
быстрое изменение плазменной концентрации натрия и/или калия — мо-
жет стать фатальным даже тогда, когда другие гомеостатические показатели
сохранны, а фильтрационная функция почек остается нормальной или
ухудшена лишь умеренно. Расстройство электролитного гомеостаза, как
правили, устраняют рациональными терапевтическими мероприятиями, но
лишь в том случае, если тщательно учтено влияние предрасполагающих к
их возникновению факторов, часто имеющих ятрогенное происхождение
(передозировка салуретиков, инфузия гипоосмолярных растворов в чрез-
мерных количествах, прием блокаторов реиин-ангиотензин-альдостероно-
вой системы).
НАРУШЕНИЕ НАТРИЕВОГО ГОМЕОСТАЗА
Рост или снижение плазменной концентрации натрия - одни из наибо-
лее часто встречающихся форм нарушения электролитного гомеостаза.
Следует тем не менее подчеркнуть, что плазменная концентрация натрия
далеко не полностью характеризует общее содержание натрия в организме
человека, но в целом достаточно адекватно отражает соотношение содер-
жания натрия и воды, а также их распределение между плазмой крови и
тканями.
Плазменная концентрация натрия — основной показатель, определя-
ющий величину осмоляльности плазмы крови.
Осмоляльность плазмы крови = 2 (плазменная концентрация натрия) +
+ гликемия/18+азот мочевины/2,8
На практике для расчета осмоляльности плазмы крови используют
упрошенную формулу.
Г Осмоляльность плазмы крови - 2 (плазменная концентрация натрия) + |
+ 10 мосмоль 1
Нарушение электролитного гомеостаза
9
Гипонатриемия
Гипонатриемию констатируют при снижении плазменной концентра-
ции натрия ниже 135 мЭкв/л; при снижении до 130 мЭкв/л она становится
особенно опасной.
Патологические последствия гипонатриемии включают:
• артериальную гипотензию со снижением органной перфузии;
• неврологическую симптоматику (подавленность, слабость, ухудшение
памяти» сонливость, при выраженной гипонатриемии кому);
• отек головного мозга, нередко фатальный,
• значительное ухудшение общего прогноза, отмечаемое уже при уме-
ренной бессимптомной гипонатриемии (например, у больных хрони-
ческой сердечной недостаточностью снижение плазменной концен-
трации натрия сопряжено с увеличением смертности в период госпи-
тализации и на амбулаторном этапе ведения).
Опасность гипонатриемии заключается также и в том, что в процессе
чрезмерно быстрой ее коррекции, особенно при инфузии гипертонических
растворов пациентам, у которых снижение плазменной концентрации на-
трия наблюдалось длительно, возможна острая дегидратация головного
мозга с появлением в его белом веществе очагов демиелинизации. «Осмо-
тическое» демиелинизирующее повреждение головного мозга, наблюдаю-
щееся в процессе инфузионной коррекции гипонатриемии, как правило,
проявляется после непродолжительного улучшения состояния и регресса
невролшической симптоматики (в том числе нарушений сознания), обу-
словленных непосредственно снижением концентрации натрия в плазме
крови. Клинические признаки демиелинизации белого вещества головного
мозга, обусловленной резкой дегидратацией и отмечаемой у лиц с исходной
гипонатриемией при ее неадекватной инфузионной коррекции, включают:
• двигательные нарушения, иногда вплоть до тетраплегии и паралича
дыхательной мускулатуры;
• нарастающие нарушения сознания:
• псевдобульбарный синдром.
Очаги демиелинизации белого вещества головного мозга могут быть вы-
явлены у таких пациентов с помощью компьютерной или магнитно-
резонансной томографии. Вместе с тем клинические проявления демиели-
низирующего повреждения головного мозга, возникающего после коррекции
гипонатриемии, нередко отмечаются намного раньше, чем его удается выя-
вить с помощью лучевых методов исследования. Большинство подобных
больных погибают в течение 3—5 недель.
С позиций клинической практики следует выделять два основных пато-
генетических варианта гипонатриемии:
10
Нефрология. Неотложные состояния
• гипонатриемию, характеризующуюся истинным снижением суммар-
ного содержания натрия в организме человека;
• гипонатриемию, возникающую при увеличении количества осмотиче-
ски свободной воды (гипонатриемия разведения, «отравление во-
дой»).
Выяснение причин гипонатриемии (табл. 1.1) необходимо, прежде все-
го, потому, что позволяет определить эффективную тактику ведения боль-
ных. Многие причины снижения плазменной концентрации натрия могут
быть полностью устранены.
Таблица 1.1
Причины снижения плазменной концентрации натрия
Патогенетический
вариант гипонатриемии
Истинное снижение плазменной концентра- ции натрия Почечные потери натрия. • прием салуретиков (петлевые и тиазидовые диуретики); • феномен сольтеряющей почки (в том числе лри канальцевых дисфункциях с гипокалиемией, например синдроме Барттера); • ; эчност минералокортикоидов Внепочечные потери натрия. • через желудочно-кишечный тракт (диарея, рвота, в том числе при остром панкреатите); • через кожу (обширные ожоги, безмерное потоотделение); • кровопотеря (в том числе послеоперационная и при обильной менструации)
Гипонатриемия разведе- ния Нарушение почечной экскреции осмотически свободной воды: увеличение реабсорбции осмотически свободной воль в прок симальном канальце нефрона (возможно при гипотиреозе); снижение экскреции осмотически свободной воды в собира- тельной трубочке (синдром неадекватной секреции антидиу- ретического гормона, недостаточность глюкокортикостерои- дов); • увеличение реабсорбции осмотически свободной водь1 и снижение ее экскреции (хроническая сердечная недоста_оч- ность, декомпенсированные циррозы печени, нефротический синдром). Избыточное потребление воды: • полидипсия различного генеза; • инфузия гипоосмолярных растворов
Частота обнаружения гипонатриемии изучена у пациентов различных
возрастных групп. Так, при обследовании бегунов — участников марафона в
Цюрихе в 2006 году (продолжительность состязания, проводившегося в хо-
лодную погоду, — около 5 часов) было выявлено, что у 3% соревновавшихся
произошло бессимптомное снижение плазменной концентрации натрия.
Была обнаружена зависимость между динамикой плазменной концентра-
ции натрия, массой тела и суммарным количеством жидкости, употреблен-
ной во время марафонского бега.
Нарушение электролитного гомеостаза
11
Ретроспективный анализ 7965 случаев внебольничной пневмонии у го-
спитализированных больных продемонстрировал, что у 8,1% этих больных
развилась гипонатриемия (содержание натрия в плазме крови менее
135 мЭкв/л). Больные с гипонатриемией оказались достоверно старше, ха-
рактеризовались большим числом сопутствующих заболеваний и достовер-
но чаще оказывались в отделениях интенсивной терапии. При внебольнич-
ной пневмонии гипонатриемия обусловливала достоверное увеличение
смертности в период госпитализации, продолжительности пребывания в
стационаре, частоты возникновения потребности в переводе в отделение
интенсивной терапии, искусственной вентиляции легких, а также стоимо-
сти стационарного ведения пациентов.
Изучение анамнеза 8142 пациентов, в течение 6 лет (2000—2006 годы)
оказывавшихся в отделениях хирургической реанимации, показало, что у
11% из них снижена плазменная концентрация натрия.
Снижение сывороточной концентрации натрия наблюдается доста-
точно часто — в первую очередь у пациентов пожилого возраста н/нли на-
ходящихся в критическом состоянии, [ипонатрнемия чаще возникает на
амбулаторном этапе ведения пациентов.
В процессе исследований удалось выяснить как причины возникновения
гипонатриемии в различных группах пациентов, так и факторы риска ее по-
явления. Амбулаторная гипонатриемия, сопровождающаяся клиническими
проявлениями и требующая госпитализации (плазменная концентрация на-
трия при поступлении — 118,8 ммоль/л), ассоциирована с одновременной
гиповолемией (32.6% случаев), хронической сердечной недостаточностью
(26%), синдромом неадекватной секреции антидиуретического гормона
(26%), приемом тиазидовых диуретиков (26%) и селективных ингибиторов
обратного захвата серотонина (26%). Более чем у 20% пациентов удается вы-
делить несколько предрасполагающих факторов. У 71% пациентов, госпита-
лизированных в связи с клинически очевидной гипонатриемией, снижение
плазменной концентрации натрия удавалось выявить уже на амбулаторном
этапе. Гипонатриемия, развивающаяся у госпитализированных пациентов,
также ассоциирована с приемом тиазидовых диуретиков, препаратов, стиму-
лирующих секрецию антидиуретического гормона, хирургическим вмеша-
тельством и внутривенной инфузией гипотонических растворов.
Прием салуретиков, в первую очередь тиазидовых диуретиков, пред-
ставляет особой одну из основных детерминант гипонатриемии, особенно
возникающей амбулаторно и зачастую амбулаторно интерпретируемой
У пожилых больных, которым их назначают для лечения артериальной ги-
пертензии или хронической сердечной недостаточности, тиазидовые диуре-
тики провоцируют снижение плазменной концентрации натрия достаточно
часто, но далеко не всегда ее удается своевременно распознать (предложен
12
Нефрология. Неотложные состояния
термин «тихой эпидемии» тиазид-индуцированной гипонатриемии у пожи-
лых). Тиазид-нндуцированная гипонатриемия возникает чаще у пожилых
людей, особенно с дефицитом массы тела (в том числе синдромом mal-
nutrition), нередко одновременно с гипокалиемией. Увеличение возраста на
каждые 10 лет сопряжено с ростом риска провоцируемой тиазидами гипо-
натриемии в 2 раза; повышение массы тела на каждые 5 кг ассоциировано со
снижением вероятности гипонатриемии на 27%. Коррекцию спровоциро-
ванной тиазидовыми диуретиками гипонатриемии, проводимую с исполь-
зованием гипертонических растворов натрия, следует осуществлять осто-
рожно: рост плазменной концентрации натрия на 20 мЭкв/л и более опасен
развитием демиелинизации.
Гипонатриемия разведения нередко развивается при декомпенсиро-
ванном циррозе печени (см. «Гепаторенальный синдром»), а также у боль-
ных хронической сердечной недостаточностью, особенно в стадии близкой
к декомпенсации. Снижение сывороточной концентрации натрия у пациен-
тов с хронической сердечной недостаточностью нередко бывает связано с
задержкой осмотически свободной воды, но решающим фактором, обуслов-
ливающим ее возникновение, почти всегда становится прием салуретиков,
особенно тиазидовых диуретиков.
Синдром неадекватной секреции антидиуретического гормона — наибо-
лее демонстративный пример гипонатриемии разведения, развивающейся
вследствие снижения клиренса осмотически свободной воды, обусловлен-
ного гиперпродукцией вазопрессина и последствиями его взаимодействия с
У2-рецепторами. Причины синдрома неадекватной секреции антидиурети-
ческого гормона разнообразны и включают прием определенных лекар-
ственных препаратов, стимулирующих секрецию вазопрессина, а также
заболевания, при которых развивающаяся гипонатриемия всегда обуслов-
ливает дальнейшее ухудшение прогноза (табл. 1.2).
Причины синдрома неадекватной секреции
антидиуретического гормона
Таблица 1.2
Группа причин
Опухоли
Заболевания централь-
ной нервной системы
• легких / средостения (бронхогенный рак легких, мезотелиома,
тимома);
• другой локализации (рак двенадцатиперстной кишки, подже-
лудочной железы, предстательной железы, тела матки, лейко-
зы)
• внутричерепная «ппюс»-ткань (опухоли, абсцессы, гематомы)
• воспалительные заболевания (энцефалит, менингит, волчаноч-
ный цереброваскупит);
• нейродегенеративные и демиелинизирующие заболевания,
• другие (травмы, алкогольный психоз)
Нарушение электролитного гомеостаза
13
Продолжение табл. 1.2
Группа причин Лекарственные препа- раты Причина • стимулирующие секрецию вазопрессина (никотин, трицикли- ческие антидепрессанты, ингибиторы обратного захвата серо тонина); • потенцирующие эффекты вазопрессина (десмопрессин, окси- тоцин); • неустановленного механизма действия (хлорпропамид, кпо- фибрат карбамазепин, циклофосфамид, винкрисгин)
Заболевания легких • инфекционные (туберкулез, асгергиллез, эмпиема плевры); • хроническая обструктивная болезнь легких; • искусственная вентиляция легких
Гипонатриемия всегда приводит к значительному ухудшению общего
прогноза, независимо от исходной тяжести состояния больных. Сниже-
ние плазменной концентрации иатрия в период госпитализации сопряжено
с достоверным увеличением смертности и частоты перевода в отделение ин-
тенсивной терапии. Так, у больных хронической сердечной недостаточно-
стью снижение плазменной концентрации натрия на каждые 3 мкмоль/л
сопровождается увеличением риска смерти во время пребывания в стацио-
наре на 19.5% и риска смерти в течение последующих 3 месяцев на 10%.
Снижение плазменной концентрации натрия на 1 мкмоль/л ассоциировано
с ростом смертности лиц, находящихся в листе ожидания трансплантации
печени, на 5%. Обусловленная гипонатриемией энцефалопатия у пожилых
приводит к увеличению риска падений и их последствий, например пере-
ломов. Именно этим можно объяснить установленный в эпидемиологиче-
ских исследованиях более чем 4-кратный рост риска переломов у пожилых
пациентов со сниженным сывороточным уровнем натрия. В свою очередь,
частота гипонатриемии у пожилых больных с переломами более чем в 4 раза
выше, чем у пожилых людей без переломов.
Неотложные терапевтические мероприятия необходимы в первую
очередь при гипонатриемии, сопровождающейся клиническими проявле-
ниями; при бессимптомной гипонатриемии достаточным может оказаться
только устранение факторов риска.
Острая гипонатриемия (возникшая в течение менее 48 часов) требует
осторожной инфузии изотонических или гипертонических растворов на-
трия и контроля динамики его плазменной концентрации: во избежание де-
миелинизирующего поражения белого вещества головного мозга ее прирост
должен составлять не более 2 мЭкв/л/час.
При хронической гипонатриемии (возникшей в течение более 48 часов)
темп начального прироста плазменной концентрации натрия может дости-
гать 10 мЭкв/л/час. После устранения неврологической симптоматики
14
Нефрология. Неотложные состояния
темп инфузии должен быть уменьшен таким образом, чтобы скорость увеличе-
ния плазменной концентрации натрия составляла не более 1,5 мЭкв/л/час.
Коррекцию бессимптомной гипонатриемии осуществляют в зависимо-
сти от того, сочетается ли она со снижением объема циркулирующей крови
или с его увеличением (табл. 1.3). Решающее значение в лечении подобных
пациентов имеет устранение выявленных факторов риска. Ближайшие пер-
спективы в терапии гипонатриемии разведения связывают с внедрением в
клиническую практику антагонистов У2-рецепторов вазопрессина
Таблица 1.3
Лечение гипонатриемии, сочетающейся с изменением
объема циркулирующей крови
Гипонатриемия, сочетающаяся с 1 «поволемией Гипонатриемия, сочетающаяся с гипернатриемией
• Инфузия изотонического раствора хлори- да натрия. • Устранение причин потери натрия и воды (рвота, диарея и т д.) • Ограничение потребления поваренной соли. • Ограничение потребления воды. • Замена тиазидовых диуретиков гетлево ми (если диуретики необходимы). • Устранение факторов риска (например, приема трициклических антидепрессан- тов и ингибиторов обратного захвата се- ротонина • Использование антагонистов \/2-рецепто- ров вазопрессина (если эти препараты до- ступны)
Гипернатриемия
Гипернатриемию констатируют, если плазменная концентрация нагрия
превышает 145 мЭкв/л. Как и гипонатриемия, гипернатриемия может обу-
словливать быстрое развитие фатальных осложнений. Гипернатриемия
особенно часто встречается у госпитализированных больных, в первую
очередь пожилых; так, ее удается выявить у 26% пациентов, находящихся в
отделениях интенсивной терапии. Смертность пациентов с |ипернатриеми-
ей оказывается в 2 раза выше, чем смертность тех больных, у кого плазмен-
ная концентрация натрия остается в пределах нормы. Гипернатриемию, со-
четающуюся с дегидратацией и гиповолемией, обнаруживают у 2,9%
пациентов, госпитализируемых в специализированный геронтологический
клинический центр. Распространенность гиповолемической гипернатрие-
мии существенно увеличивается с возрастом, составляя 1,6% у людей моло-
же 65 лет и достигая 5,3% у пациентов старше 85 лет. Среди патентов мно-
гопрофильиой терапевтической клиники не менее 1,2% больных относятся
к группе риска развития гипернатриемии.
Нарушение электролитного гомеостаза
15
Гипернатриемия опасна развитием дегидратации головного мозга и од-
новременных расстройств церебральной микроциркуляции, в том числе на-
растающего клеточного сладжа, формирования микротромбов и кровоиз-
лияний. С прогностической точки зрения, гипернатриемия всегда приводит
к значительному увеличению риска смерти, в том числе в период пребы-
вания пациента в стационаре. Установлено, что по мере увеличения ги-
пернатриемии у пожилых пациентов в период госпитализации достоверно
возрастает смертность: от 33,3% в группе больных с концентрацией натрия
в плазме от 151 до 153 мЭкв/л до 71,4% при концентрации натрия
> 154 мЭкв/л. У больных, госпитализируемых в неврологические отделения
интенсивной терапии, гипернатриемия сопряжена с более выраженными
нарушениями сознания, оцениваемыми по шкале комы Glasgow большей
частотой возникновения потребности в искусственной вентиляции легких
(80,5% против 41,5 в группе без гипернатриемии, р<0,001), большей часто-
той развития почечной недостаточности (10,3% против 0,9%, р<0,001) и
значительно более высокой смертностью (30,1% против 10,2%, р<0,001).
Повышение плазменной концентрации натрия удается зарегистриро-
вать у 7,9% пациентов, требующих пребывания в отделении интенсивной
терапии неврологического профиля, при этом гипернатриемия у них неред-
ко бывает спровоцирована резким снижением объема циркулирующей кро-
ви, связанным с применением маннитола (у получавших этот осмотический
диуретик частота гипернатриемии достигает 24,3%). Ятрогенная гиперна-
триемия, по-видимому, наиболее опасна прогностически. Так, ориентируясь
на данные, полученные при обследовании пациентов многопрофильного те-
рапевтического стационара, смертность больных с гипернатриемией, воз-
никшей в период госпитализации, достоверно превосходит таковую у тех, у
кого повышение плазменной концентрации натрия возникло на амбулатор-
ном этапе (47,6 и 28%, соответственно, р~0,03).
Гипернатриемия может быть связана с потерями преимущественно
осмотически свободной воды (например, при несахарном диабете), умень-
шением объема вне- и внутриклеточной жидкости, сопряженным с избы-
точной эксрецией некоторых ионов, а также может быть обусловлена избы-
точным поступлением в организм натрия (табл. 1.4). Уточнение состояния
водного гомеостаза у больных с гипернатриемией необходимо в первую
очередь для определения рациональной тактики ведения пациентов.
Гипернатриемия, обусловленная снижением содержания в организме
воды, в том числе осмотически свободной, может наблюдаться у пациентов
со сниженным чувством жажды, употребляющих в связи с этим значитель-
но меныпие по сравнению с необходимым объемы жидкости. Уменьшение
(в ряде случаев — полное отсутствие) чувства жажды наблюдают при забо-
леваниях, непосредственно поражающих гипоталамус (первичная гиподип-
сия), или болезнях, обусловливающих «общемозговую» неврологическую
симтоматику (вторичная гинодипсия) (табл. 1.5).
16
Нефрология. Неотложные состояния
Патогенетические варианты гипернатриемии
Таблица 1.4
Патогенетические
варианты гмперматрио^и
Пример
Дефицит преимуществен-
но осмотически свобод-
ной воды (объем внутри
клеточной жидкости мо-
жет оставаться нормаль-
ным)
Дефицит воды, сочетаю-
щийся с потерями ионов
(объем внутриклеточной
жидкости уменьшен)
Избыточное поступление
в организм натрия
Несахарный диабет (недостаточность эффектов антидиурети
ческого гормона - вазопрессина).
Гипоталамический диабет (снижение продукции вазопрессина,
плазменная концентрация вазопрессина снижена) Причинами
могут служить
• хирургическое вмешательство на структурах гипоталамуса и
гипофизе;
• травма головы,
• опухоли (первичные (дисгерминома, краниофарингиома),
метастатические (рак молочной железы, лимфома);
• сосудистые заболевания (аневризмы, последствия мозгового
инсульта), синдром Шихена (инфаркт гипофиза и гипоталами-
ческих структур, возникающий у рожениц вследствие массив-
ной кровопотери и артериальной гипотензии во время родов);
• инфекционные поражения (энцефалит, менингит, туберку
лез, сифилис),
• гранулематозные заболевания (саркоидоз, гранулематоз из
клеток Лангерганса (гистиоцитоз X);
• аутоиммунное поражение гипоталамуса / задней доли гипо
физа,
• генетически детерминированная недостаточность вазопрес-
сина.
Нефрогенный диабет (снижение или отсутствие чувствительно-
сти \/2-рецепторов эпителиоцитов собирательных трубочек к
вазопрессину, плазменная концентрация вазопрессина повы-
шена):
• лекарственная терапия (препаратами лития, амфотерицином В),
• тубуло-интерстициальное поражение при гиперкальциемии
и гипокалиемии,
• обструктивная нефропатия;
• врожденные аномалии (генетически детерминированные де-
фекты \/2-рецепторов к вазопрессину или мутации гена, ко-
дирующего аквапорин-2)
Избыточный диурез:
• леоедозировка диуретиков (форсированный диурез пои при-
менении петлевых диуретиков, но особенно - осмотических
диуретиков (маннитола));
• полиурия после устранения обструкции мочевыводящих путей
Потери воды через желудочно-кишечный тракт
• рвота;
• назогастральный зонд;
* искусственная кишечная фистула;
• диарея.
Потери воды через кожу:
• обширная ожоговая раневая поверхность;
• чрезмерное потоотделение
• злоупотребление поваренной солью (преобладание в рацио
не соленой пищи);
• инфузия гипертонических растворов NaCl и NaHCO3:
Нарушение электролитного гомеостаза
17
Причины снижения чувства жажды (гилодипсии)
Таблица 1 5
Вариант гилодипсии П >* *»ина
। Гиподипсия, обусловленная непосредствен- ным поражением структур гипоталамуса / i гипофиза (первичная гиподипсия) • травма,- • краниофарингиома; • метастатическое поражение; • сосудистое поражение (кровоизлияние, инфаркт)
Гиподипсия, обусловленная поражением го- ловного мозга и расстройствами его функ- ции, вовлекающими гипоталамус / гипофиз (вторичная гиподипсия) • цереброваскулярные заболевания; • деменция: • делирий; • умственная отсталость
Наиболее значимые факторы риска гипернатриемии:
• пожилой возраст (особенно при наличии сосудистой деменции, ней-
родегенеративных / демиелинизирующих заболеваний);
• госпитализация, особенно в отделение интенсивной терапии;
• инфузия гипертонических растворов;
• кормление через желудочный зонд;
• применение осмотических диуретиков (маннитол);
• применение лактулозы:
• искусственная вентиляция легких;
• нарушения сознания;
• заболевания, сопровождающиеся полиурией.
Лечение гипернатриемии должно обязательно включать устранение
возможных факторов риска Кроме того, для определения тактики ведения
таких пациентов необходим расчет возможного дефицита воды.
Дефицит воды (л) - 0,6 х масса тела (кг) х (плазменная концентрация на-
трия (мЭк/л)/140) - 1
Стратегия лечения гипернатриемии включает:
• обильное питье воды и инфузию 5%-ного водного раствора деке грозы
(темп инфузии должен обеспечивать снижение концентрации натрия
в плазме, составляющее 2 мЭкв/л/час);
• контроль неврологической симптоматики;
• мониторинг концентрации натрия и калия в плазме крови.
В течение первых 12—24 часов должна быть восполнена половина от
рассчитанного дефицита воды. Оставшуюся половину восполняют в тече-
ние последующих 24 часов.
18
Нефрология. Неотложные состояния
НАРУШЕНИЕ КАЛИЕВОГО ГОМЕОСТАЗА
Подъем или снижение плазменной концентрации калия, зачастую не де-
монстрирующие специфических клинических проявлений, могут очень бы-
стро приводить к смерти. Распознавание нарушений калиевого гомеостаза
основано в первую очередь на выделении типичных групп риска и тщатель-
ном мониторинге динамики калиемии.
Гипокалиемия
Гипокалиемией считают стойкое снижение плазменной концентрации
калия ниже 3,5 мЭкв/л. Гипокалиемию нередко обнаруживают у госпитали-
зированных больных. Так, при обследовании 1178 больных, госпитализиро-
ванных в терапевтическую клинику в течение 3 месяцев, у 140 из них (12%)
была обнаружена гипокалиемия, при этом у 104 (74%) человек она возник-
ла в период пребывания в стационаре.
Клинические проявления гипокалиемии включают:
• миопатию (мышечные боли, слабость, при выраженном снижении сы-
вороточного уровня калия возможен рабдомиолиз, иногда фаталь-
ный);
• тахикардию, наджелудочковую экстрасистолию, фибрилляцию пред-
сердий;
• снижение интенсивности перистальтики кишечника, запоры;
• периферическую полинейропатию с парестезиями.
Гипокалиемия, как правило, сопровождается изменениями ЭКГ. Риск
провоцируемых гипокалиемией фибрилляции предсердий и желудочковой
экстрасистолии максимален у пациентов, страдающих заболеваниями
сердечно-сосудистой системы, а также у принимающих дигоксин и другие
сердечные гликозиды. ЭКГ-признак гипокалиемии включает:
• увеличение частоты сердечных сокращений:
• уменьшение амплитуды зубца Г;
• удлинение интервала Q—Т;
• расширение комплекса QRS’,
• появление зубца U\
• атриовентрикулярную блокаду.
• наджелудочковые и желудочковые экстрасистолы;
• пароксизмальную фибрилляцию предсердий.
Стойкая гипокалиемия ассоциирована со значительным ухудшением
сердечно-сосудистого прогноза, обусловленным появлением эктопических
очагов в желудочках сердца и удлинением интервала Q— Т. считающихся
факторами риска внезапной смерти. Так, увеличение вероятности внезан-
Нарушение электролитного гомеостаза
19
вой смерти выявлено у лиц с гипокалиемией, обусловленной постоянным
приемом тиазидовых диуретиков, не получавших калийсберегающих пре-
паратов. В пользу «вклада» гипокалиемии в развитие внезапной смерти
свидетельствует и частое обнаружение сниженной сывороточной концен-
трации калия у пациентов, перенесших сердечно-легочную реанимацию.
Уровень плазменного калия менее 3,5 мЭкв/л был зарегистрирован у 23%
зольных с желудочковой тахикардией.
Другой мишенью гипокалиемии являются структуры почечного тубуло-
жнтерстиция, прогрессирование поражения которых происходит несколько
медленнее, чем развитие нарушений ритма сердца. При длительно суще-
ствующем снижении сывороточного уровня калия наблюдают нарастающий
тубулоинтерстициальный фиброз, проявляющийся полиурией и снижени-
ем относительной плотности мочи и способный приводить к терминальной
точечной недостаточности, чаще наблюдаемой при «злокачественной» ги-
зкжалиемии (синдром Барттера, синдром Лиддла). Характерным призна-
ком пораженной почки являются множественные кисты.
Длительно существующая гипокалиемия, в том числе индуцированная
джемом тиазидовых диуретиков, сопровождается увеличением риска раз-
ягтия сахарного диабета II типа. Вероятность дебюта сахарного диабета
Л типа максимальна у лиц с тенденцией к повышению сывороточного уров-
и глюкозы, а также у больных, получающих тиазидовые диуретики в со-
^тании с p-адреноблокаторами. Считают, что гипокалиемия обусловливает
усугубление нарушения секреции инсулина р-клетками островков Лаш ер-
теса поджелудочной железы. Рост риска сахарного диабета II типа под
действием тиазидовых диуретиков установлен в нескольких крупных кон-
тролируемых исследованиях, в частности в широко известном псследова-
м» ASCOT (blood pressure lowering arm).
Таким образом, гипокалиемия ухудшает общий прогноз за счет значи-
ж*ного увеличения рисков нарушения сердечного ритма и внезапной
ажртн а также поражения почечного губулоинтерстиция и прн ее дли-
гтя пол существовании — сахарного диабета П типа.
Причины гипокалиемии разнообразны (табл. 1.6). Одной из самых ча-
пыг сч!ггают «внепочечную» потерю калия при обильной рвоте или шарее,
атжже недостаток калия в пишевых продуктах при особом типе питания —
тж называемой диете «чай с тостом» («tea and toast diet»), а также у голо-
жяан людей. Существенную роль среди причин гипокалиемии играют
иорства. в том числе часто назначаемые в популяции.
Отдельно рассматривают гипокалиемию, не связанную с потерями ка-
ж а обусловленную его перемещением из плазмы крови и внеклеточного
^странства внутрь клеток. Снижение сывороточного уровня калия, ииду-
«фованиое избытком инсулина, секретировавшегося в ответ на гипергли-
20
Нефрология. Неотложные состояния
кемию, или введением его препаратов, нередко наблюдают у больных сахар-
ным диабетом. Гипокалиемию также регистрируют при эндогенном избытке
катехоламинов или передозировке р2-агонистов.
Значительная часть случаев стойкого снижения сывороточного уровня
калия связана с избыточным выделением его с мочой (так называемые «по-
чечные» потери калия). В дифференциальном диагнозе этого варианта ги-
покалиемических состояний следует учитывать наличие или отсутствие у
пациента артериальной гипертонии.
Причины гипокалиемии
Таблица 1.6
Г руппа причин Причина
Внепочечные потери калия • Рвота • Диарея
Почечные потери калия Прием лекарственных препаратов • диуретиков - петлевых, тиазидовых, осмотических (манни- тол). Заболевания и состояния, сопровождаемые артериальной ги- пертонией: • первичный гиперальдостеронизм; • реноваскулярная артериальная гипертензия; • длительный прием кортикостероидов; • дефицит 11-гидроксистероид-де идрогеназы: - генетически детерминированный (синдром мнимого из- бытка минерал кортикоидов); - приобретенный (лакрица, карбеноксолон). • опухоль, секретирующая ренин; • синдром Лиддла. Заболевания, протекающие с нормальным уровнем артери- ального давления: • синдром Бартера (в том числе вариант Гительмана); • проксизмальный почечный канальцевый ацидоз, • >ис альчыи точечный канал цевыиацидо
Другие Недостаточное потребление калия с пищей. Гипокалиемия, обусловленная избыточным транспортом ка- лия в ткани в результате- • введения инсулина; • избытка катехоламинов (острый стресс); • семейного nepi одического гипокалиемического паралича
В основе развития клинических признаков первичного гиперальдосте-
ронизма лежит гиперсекреция альдостерона аденомой или диффузно ги-
перплазированной тканью одного или обоих надпочечников»
При первичном гиперальдостеронизме выделение альдостерона проис-
ходит независимо от плазменной активности ренина, в связи с чем первич-
ный гиперальдостеронизм всегда является гипо- или норморенинемиче-
Нарушение электролитного гомеостаза
21
ехмм Выделяют несколько основных причин и, соответственно, несколько
морфологических вариантов первичного гиперальдостсронизма:
• аденома надпочечников, продуцирующая альдостерон (альдосгерима);
• билатеральная идиопатическая гиперплазия надпочечников;
• гиперальдостеронизм, подавляемый глюкокортикоидами;
• карцинома надпочечников.
Более 2/3 всех случаев первичного гиперальдостеронизма обусловлены
солитарной аденомой надпочечника, продуцирующей альдостерон (альдо-
гтеромой). Размер ее. как правило, не превышает 0,5—2.0 см. Установлено,
лто альлостеромы встречаются почти в 3 раза чаще у мужчин, чем у жен
иин. Этиология альдостером неясна, однако нельзя исключить значение
генетических факторов: так, эти опухоли рассматривают в качестве одного
жз компонентов синдрома множественной эндокринной неоплазии (МЭН)
I типа
Гиперальдостеронизм, подавляемый глюкокортикоидами, и карцинома
кадлочечников встречаются крайне редко.
Самым частым клиническом признаком первичного гиперальдостеро-
гизма считают высокую систоло-диастолическую артериальную гиперто-
нию. как правило, дебютирующую в относительно молодом возрасте. По-
лагают, что на первичный гиперальдостеронизм приходится не менее 7%
всех случаев трудно контролируемой артериальной гипертонии, считаю-
иейся зссенциальной. Частота первичного гиперальдостеронизма макси-
мальна среди больных артериальной гипертензией Ш степени.
Одной из современных тенденций считают увеличение числа случаев
□ервичного гиперальдостеронизма, не сопровождающихся типичными кли-
пгаески.ми признаками синдрома Конна (в первую очередь явной гипока-
лиемией), и отсутствие у многих больных четкого морфологического суб-
страта. объясняющего стойкое повышение сывороточной концентрации
альдостерона при сниженной или нормальной активности ренина плазмы.
Взаимосвязь между лабораторными признаками первичного гиперальдо-
стеронизма (в том числе соотношением «сывороточная концентрация аль-
достерона / активность ренина плазмы») и ростом АД подтверждена в на-
стоящее время результатами эпидемиологических исследований. Так,
данные, полученные при наблюдении за 1688 представителями полудн-
ями — потомками участников оригинальной когорты The Framingham Неап
Srudv (исследование Framingham Offspring), свидетельствуют о том, что по
мере увеличения сывороточной концентрации альдостерона достоверно
возрастает вероятность развития артериальной гипертонии. У лиц из 4-й
квартили (с максимальными величинами этого показателя) риск возникно-
вения артериальной гипертонии в течение 4 лез оказался в 1,6 раза выше,
22
Нефрология. Неотложные состояния
чем у представителей 1-й квартили, у которых сывороточный уровень аль-
достерона был минимален.
Гипертензивное действие альдостерона складывается главным образом
из его так называемых негеномных эффектов — индукции фосфолирирова-
ния цГМФ и увеличения концентрации ионов кальция в гладкомышечных
клетках сосудов, способствующих стойкой вазоконстрикции. Кроме того,
избыток альдостерона обусловливает ухудшение опосредуемого NO про-
цесса вазодилатации (за счет снижения чувствительности к нему эндоте-
лиоцитов) и увеличение жесткости аорты и крупных артерий.
Гипокалиемия может быть умеренной и длительно оставаться практиче-
ски бессимптомной. Заподозрить первичный гиперальдостеронизм возмож-
но на основании значительного увеличения экскреции калия с .мочой при
одновременном уменьшении выделения натрия. Сывороточная концентра-
ция калия нередко остается сниженной даже после назначения антигипер-
тензивных препаратов, способствующих «псевдопормализапии» этого по-
казателя — ингибиторов АПФ и блокаторов рецепторов ангиотензина II.
Выраженная гипокалиемия, наблюдающаяся у 15—20% больных, всегда
указывает на тяжелое поражение надпочечников.
Диагноз первичного гиперальдостеронизма подтверждают определен и
ем плазменной активности ренина и сывороточной концентрации альдосте-
рона. До выполнения этого исследования следует заблаговременно (жела-
тельно не менее чем за 3 недели) отменить ингибиторы АПФ, блокаторы
рецепторов ангиотензина II, антагонисты альдостерона, петлевые и тиази
довые диуретики, а также p-адренобликаторы. Считают, что препаратами
выбора в период, предшествующий забору крови. являются а-адрено-
блокаторы, при их недостаточной эффективности рекомендуют присоеди-
нение антагонистов кальция.
При обследовании больных первичным гиперальдостеронизмом обяза-
тельно применение визуализирующих методов исследования, из которых
преимуществами обладают компьютерная и магнитно-резонансная томо-
графия, позволяющие четко определить его морфолога чески й вариант. При
ультразвуковом исследовании брюшной полости надпочечники не видны,
но если их удастся обнаружить, это всегда указывает на их гиперплазию.
Подтверждают диагноз первичного гиперальдостеронизма лаборатор-
ные и визуализирующие методы исследования (табл. 1.7). Его своевремен-
ное распознавание важно, прежде всего, потому, что первичный гиперальдо-
стеронизм представляет собой относительно часто встречающуюся в
популяции и потенциально полностью устранимую причину высокой арте-
риальной гипертонии и гипокалиемии.
Шрушение электролитного гомеостаза
23
Ориентировочная программа диагностики
первичного гиперальдостеронизма
Таблица 1.7
Этап и метод диагностики Клинические признаки 1 1 1 1— - Диагностический признак и результат диа ностикш • высокая систоло-диастолическая АГ в относи- тельно молодом возрасте; • клинические признаки гипокалиемии (миопати ческий синдром, нарушения ритма и проводи- мости сердца)
! Лабораторные тесты 1 । 1 1 • снижение плазменной концентрации калия*; • снижение экскреции натрия с мочой и значи тельное увеличение экскреции калия*; • увеличение сывороточной концентрации альдо- стерона при снижении плазменной активности ренина
। Визуализирующие методы: компьютерная томография; магнитно-резонансная томография • уточнение морфологического варианта гипе- ральдостеронизма
Дополнительные исследования (определение концентрации альдо стерона в надпочечниковых венах при их селективной катетеризации**) • значительное увеличение концентрации альдо- стерона в надпочечниковых венах
• Иногда сохраняющиеся, несмотря на прием ингибиторов АПФ и блокаторов рецепторов
ангиотензина II.
• * Не является обязательным. Проводят только у лип с крупными аденомами в обоих надпо-
чечниках. удаляют тот надпочечник, в вене которого концентрация альдостерона значительно
выше
Выраженная гипокалиемия может наблюдаться при так называемых ка-
нальцевых дисфункциях с гипокалиемией (синдром Бартера, вариант Ги-
тельмана). Развитие большинства канальцевых дисфункций с гипокалие-
мией связано с мутациями генов, кодирующих структурные белки ионных
каналов эпителиоцитов.
Синдром Барттера обусловлен гиперпродукцией почечных простаглан-
динов. Синдром Барттера проявляется гипокалиемией, гипонатриемией и
.метаболическим алкалозом. Экскреция натрия и калия, а также хлоридов,
как правило, значительно повышена. Артериальное давление всегда остает-
ся нормальным, значительные потери натрия могут обусловливать тенден-
цию к артериальной гипотонии
При развитии гиперальдостеронизма по варианту Гительмана помимо
уже названных признаков у пациентов выявляют гипомагниемию и гипо-
кальциурию, а при гистологическом исследовании почечной ткани не обна-
руживают гиперплазии юкстагломерулярного аппарата.
24
Нефрология. Неотложные состояния
Все варианты синдрома Барттера наследуются по аутосомно-реце-
ссивному типу. Отдельно рассматривают неонатальный вариант синдрома
Барттера, для которого характерно тяжелое течение с выраженными полиу-
рией, дегидратацией, гипертермией, гиперкальциурией и ранним развитием
кальциевого нефролитиаза. Дети с неонатальным вариантом синдрома
Барттера, как правило, быстро «огибаю!.
Синдром Барттера, проявившийся позднее («классический» вариант),
протекает более доброкачественно. Вариант Гительмана может быть впер-
вые диагностирован у взрослого человека. Большинство больных начинают
предъявлять жалобы в возрасте до 25 лет. Типичными симптомами являют-
ся признаки гипокалиемии: мышечная слабость, парестезии, судороги. Зна-
чительное снижение уровня сывороточного калия может приводить к раб-
домиолизу, осложняющемуся острой почечной недостаточностью.
Снижение осмотического давления крови, связанное с уменьшением
концентрации натрия, может сопровождаться появлением небольших оте-
ков, для борьбы с которыми пациенты самостоятельно начинают принимать
петлевые и тиазидовые диуретики. Эти препараты оказываются малоэф-
фективными, но реализуют свои побочные эффекты — способствуют усугу-
блению потерь натрия и калия, а также развитию гиисрурикемии, которая
наряду с гипокалиемией повреждает почечный тубулоинтерстииий с после-
дующим необратимым ухудшением функции почек.
Длительно существующий синдром Барттера с гипонатриемией может
сопровождаться развитием вторичного гиперальдостеронизма. У таких
больных гипокалиемия может быть особенно выраженной.
Гипомагниемия (при варианте Гительмана) сопровождается кальцифи-
кацией суставных хрящей, проявляющейся упорными артралгиями. Кроме
того, у этих больных описаны депозиты кальция в склере и радужной обо-
лочке глаза.
Примером канальцевой дисфункции с гипокалиемией и тяжелой арте-
риальной гипертонией является псевдогиперальдостероиизм (синдром
Лиддла) — заболевание, наследующееся по аутосом но-доминантному типу
при котором обнаруживают выраженную гипокалиемию и метаболический
алкалоз с одновременной задержкой натрия. Концентрация альдостерона в
крови ие изменена или снижена.
Как правило, удается установить генетическую предрасположенность к
псевдогиперальдостеронизму. G.W. Liddle и соавт. (1963) описали семью, у
членов которой рано развивалась тяжелая артериальная гипертония и от-
мечалась стойкая гипокалиемия Концентрации ренина и альдостерона при
этом оставались пониженными
Назначение блокаторов трансмембранною транспорта натрия (триам-
терена) позволяет уменьшить выраженность симптомов этого заболевания.
Нарушение электролитного гомеостаза
25
Спиронолактон, напротив, не эффективен. Это свидетельствует о том, что
альдостерон не участвует в патогенезе синдрома Лиддла. Именно поэтому
последний и обозначают термином «псевдогиперальдостеронизм».
Положительное действие триамтерена позволило предположить, что
в основе развития синдрома Лиддла лежит генерализованный дефект
трансмембранного переноса натрия, в частности, нарушение транспорта
этого иона при псевдогиперальдостеронизме было обнаружено и в эри-
троцитах.
Задержка натрия при синдроме Лиддла обусловлена мутациями генов,
кодирующих р- и у-субъединнцы натриевых каналов эпителиоцитов почеч-
ных канальцев. Эти гены расположены на хромосоме 16. Идентифицирова-
но несколько вариантов мутаций, вызывающих развитие псевдогиперальдо-
стеронизма.
Синдром Лиддла наследуется по аутосомно-рецессивному типу. Заболе-
вание протекает, как правило, тяжело: выявляют выраженный метаболиче-
ский алкалоз, гипокалиемию, артериальное давление может достигать вы-
соких величин. Псевлогиперальдостеронизмможетприводить к хроническом
почечной недостаточности, однако описан полный регресс его симптомов
после трансплантации почки.
Дистальный почечный канальцевый ацидоз, характеризующийся от-
сутствием экскреции протонов в дистальном сегменте нефрона или их
избыточной реабсорбцией, нередко сочетается с фосфат-диабетом и гипока-
лиемией. Заболевание может быть наследственным (синдром Баттлера—
Олбрайта; или вторичным, что наблюдается при синдром< Шегрена, си-
стемной красной волчанке, криоглобулинемическом гломерулонефрите,
первичном билиарном циррозе.
Клиническая картина, сходная с первичным гиперальдостеронизмом,
в том числе гипокалиемия, наблюдается при увеличении плазменной кон-
центрации кортизола, вызывающего эффекты, присущие минералкорти-
коидам. Синдром мнимого избытка минералкортикоидов наследуется по
аутосомно-рецессивному типу и проявляется главным образом артериаль-
ной гипертонией, при этом содержание ренина и альдостерона в крови
снижено.
Развитие синдрома мнимого избытка минерал кортикоидов обусловлено
генетически детерминированной недостаточностью 1 lp-гидрокеистероид-
дегидрогеназы. В норме этот фермент, существующий в двух изоформах,
участвует в преобразовании кортизола в малоактивный кортизон. Изофор-
ма 2, экспрессирующаяся преимущественно в органах-мишенях альдосте-
рона, определенным образом модулирует его активность за счет инактива-
ции кортизола — потенциального конкурента за рецепторы к минерал-
кортикоидам.
м
ci
Дифференциальный диагноз гипокалиемии, обусловленной почечными потерями калия
Таблица 1.8
Синдром Барттера — Вариант Синдром Гительмана Лиддла Гиперальдостеро- ИМЭМ4 ПбДсШНгёМЫЙ ГКО — J J Синдром мнимого избытка МК»
Молекулярная осно- ’ ва поражения Мутация гена NKCC (Na*/K+2CI котранспортера) в толстом восходящем сегменте петли Ген- ле со снижением его активности Мутация гена калие- вого канала ROMK со снижением его активности. Мутация гена CICNB (CI канал базолате- ральной поверхно- сти эпителиоцитов) со снижением его активности Мутация гена CaSR (рецепторы, чув ствительные к каль- цию) Мутация гена NCC (NayCI котранспортера) со снижением его ак- тивности. Мутация гена CICNB (CI канал базолате- ральной поверхно- сти эпителиоцитов) со снижением его активности. Мутация гена Na\K-АТФазы Увеличение числа субъединиц эпите- лиальных натриевых каналов (ENaC) в со- бирательных тру бочках Увеличение синтеза МК. индуцируемое АКТГ Снижение активно- сти 11 гидроксистероид- дегидрогеназы
Клинические прояв- ления Отставание в разви- тии; изменения кро- ви и мочи Судороги; измене- ния крови и мочи Высокое АД. Семейный анамнез Высокое АД. Семейный анамнез Высокое АД Семейный анамнез
Возраст дебюта Детский Подростковый; воз- можен дебют у взрослых Подростковый Молодой Дети
Нефрология. Неотложные состояния
Лекарства, приводи рующие развитие гипокалиемии 1 Тет левые диурет ики Тиа видовые диурез ТИКИ
Объем внеклеточ ной жидкости Снижен Снижен
АД Нормальное Нормальное
Почечная недоста- точность Развивается, но про- грессирует медлен- но Развивается мед леннее, чем при синдроме Барттера
Концентрация маг- ния в плазме крови Может быть сниже- на Всегда снижена
Дополнительные признаки Осложняется гипер- ренинемическим ги- пера лъдоггерон из- МОМ Гипокальциурия
•ГКС - глюкокортикостероиды; МК - минералокортикоиды.
Амфотерицин В Минералокортикои- ды Глицирритиповая кислота карбенок солон
Повышен Повышен Повышен
Тяжелая артериаль- ная гипертензия Артериальная ги- пертензия Артериальная ги- пертензия
Развивается быст- ро, вплоть до тер минальной почеч- ной недостаточно- сти Может не разви- ваться Может не разви- ваться
Нормальная или по- вышена Нормальная или по- вышена Нормальная или по- вышена
Отвечает на амило- рид, но не на спиро- нолактон Клинические и ла- бораторные призна- ки устраняются дек саметазоном Нередко развивает- ся при злоупотре- блении продуктами, содержащими ла- крицу
NJ
41
28
Нефрология. Неотложные состояния
Мутации в гене, кодирующем изоформу 2 1 lp-гидроксистероид-деги-
дрогеназы, приводя1 к недостаточности этого фермента, что сопровождает-
ся развитием синдрома мнимого избытка минералкортикоидов. У больных
развивается артериальная гипертония, обусловленная связыванием корти-
зола с рецепторами к минералкортикоидам, также возможно снижение сы-
вороточной концентрации калия. При синдроме мнимого избытка минерал-
кортикоидов отмечают увеличение содержания метаболитов кортизола
(тетрагидрикортизола), в то время как концентрация метаболитов кортизо-
на (тетрагидрокортизона) остается нормальной.
Употребление лакрицы и препаратов, изготовленных на ее основе (кар-
беноксонолона, использовавшегося для лечения диспепсии), также приво-
дит к увеличению концентрации в крови кортизола. Почти 50% больных,
принимавших карбеноксолон, страдали артериальной гипертонией, связан-
ной с действием кортизола на минералкортикоидные рецепторы, а нередко
и гипокалиемией.
Лакрица и ее производные содержат глицирризнновую кислоту, при ги-
дролизе которой образуется глнцирретиновая кислота. Оба вещества явля-
ются ингибиторами llp-гидроксистероид-дегидрогеназы В связи с этим у
больных, употребляющих лакрицу или принимающих карбеноксонолон,
развивается приобретенная форма синдрома мнимого избытка минералкор-
тикоидов.
Дифференциальный диагноз преимущественно почечных потерь ка-
лия проводят с учетом возраста дебюта заболевания и сопутствующих
электролитных нарушений (табл. 1.8). Кроме того, как уже было сказано
выше, следует учитывать величину АД и темп развития почечной недо-
статочности.
К редко встречающимся формам гипокалиемии относят семейный пе-
риодический паралич с гипокалиемией, который представляет собой редкое
генетически детерминированное заболевание, проявляющееся шнзодами
мышечной слабости, провоцируемыми воздействием холода или длитель-
ным пребыванием в покое, а также пищей, богатой углеводами Мужчины
болеют в два раза чаще, чем женщины.
На ЭКГ всегда выявляют признаки гипокалиемии, особенно типичным
считают удлинение интервала Q—T. У пациентов, страдающих семейным
периодическим параличом с гипокалиемией, часто развиваются желудочко-
вые нарушения ритма сердца, иногда фатальные.
Развитие семейного периодического паралича с гипокалиемией связы-
вают с мутацией гена, кодирующего а-субъединицу кальциевого канала,
чувствительного к дигидропиридинам (локализация — lq31-32). Кроме
юго, это заболевание может быть обусловлено мутациями в гене, кодирую-
щем натриевый канал поперечно-полосатых мышц (SCN4A). Нирмализа-
Нарушение электролитного гомеостаза
29
ция сывороточного уровня калия позволяет устранить мышечную слабость,
но малоэффективна в предупреждении нарушений ритма сердца. Антиарит-
мическая терапия не разработана; противоаритмические препараты I класса
противопоказаны.
Хорошо отвечает на назначение препаратов калия своеобразный вари-
ант семейного периодического паралича с гипокалиемией, получивший на-
звание синдрома Андерсона. Для больных синдромом Андерсона характер-
но низкое расположение ушных раковин и гипоплазия нижней челюсти.
Генетическая основа синдрома Андерсона не идентифицирована.
Снижение сывороточной концентрации калия, связанное с повышением
интенсивности транспорта этого электролита в клетки, может наблюдаться
при назначении препаратов инсулина. Гипокалиемия, возникающая при
длительном приеме кортикостероидов, связана с минералкортикоидными
эффектами, присущими этим препаратам, и может принимать участие в
формировании «кортикостероидного» миопатического синдрома.
Основная причина лекарственной гипокалиемии — петлевые и тиазидо-
вые диуретики. Их длительное применение требует увеличения потребле-
ния пищевых продуктов, содержащих калий, также оправдано назначение
антагонистов альдостерона и препаратов калия.
Гипокалиемия, развивающаяся у пациентов, получающих тиазидовые
диуретики в качестве антигипертензивных препаратов, всегда требует
устранения. В исследовании SHEP снижение сывороточного уровня ка-
лия было зарегистрировано у 7,2% больных, получавших хлорталидон, и
только у 1% из группы плацебо (р<0,001). Развитие гипокалиемии у боль-
ных, получавших хлорталидон, сопровождалось значительным снижени-
ем его способности предупреждать сердечно-сосудистые осложнения.
Риск сердечно-сосудистых осложнений, сердечно-сосудистой смерти и
.мозгового инсульта у пациентов с гипокалиемией, индуцированной хлор-
тал идоном, оказался, соответственно, на 51%, 52% и 71% выше, чем у тех,
у кого на фоне приема тиазидового диуретика сывороточный уровень ка-
лия остался нормальным.
Больным с гипокалиемией целесообразно назначать препараты калия.
Пероральное их назначение более безопасно; при однократном приеме
доза калия не должна превышать 20—40 мЭкв. При тяжелой гипокалие-
мии (калий плазмы < 3 мЭкв/л) растворы калия хлорида вводят внутри-
венно; оптимальная скорость инфузни — не более 10 ммоль/час. При вну-
тривенном введении калия необходимы мониторинг ЭКГ и определение
уровня калиемии каждые 2—3 часа. Кроме того, целесообразно увеличе-
ние потребления пищевых продуктов, содержащих достаточное количе-
ство калия (табл. 1.9).
30
Нефрология. Неотложные состояния
Содержание калия в некоторых пищевых продуктах
Таблица 1.9
—’ ЧГ* " r-W ’ -""'Г " 1 - 1 ж <
ПадДевой продую Содержание додо . у- _______,
*»Г \ МЭк*
1 Фасоль (1 стакан) Изюм (1 стакан) 1 Банан (1 шт.) 1 Томат (1 шт) Апельсин (1 шт.) Молоко (1 стакан) 1370 1106 440 366 333 351 35 28 11 9 9 9 1
Уменьшения экскреции калия достигают назначением калий-
сберегающих диуретиков — антагонистов альдостерона (спиронолактона) и
блокаторов гране мембран ною траспорта натрия и калия (триамтерена,
амилорида). Некоторые антигипертензивные препараты — ингибиторы
АПФ и блокаторы рецепторов ангиотензина II — также могут препятство-
вать развитию гипокалиемии. Следует по возможности полностью устра-
нять причину гипокалиемии тогда, когда это возможно, например при пер-
вичном 1иперальдос1е1Х)низме1 обусловленном солитарной аденомой
надпочечника. При синдроме Барттера обосновано назначение нестероид-
ных противовоспалительных препаратов, уменьшающих продукцию почеч-
ных простагландинов, однако у пациентов с почечной недостаточностью
эти препараты противопоказаны.
Гиперкалиемия
Гиперкалиемию констатируют при повышении плазменной концентра-
ции калия > 5 .мЭкв/л. Если концентрация калия превышает 6,5 мЭкв/л,
следует обсуждать экстренное проведение гемодиализа.
Лечебная тактка при гиперкалиемии во мши ом зависит от причины, ее
вызвавшей (табл. 1.10). Среди причин шперкалиемии особое значение име-
ют лекарственные препараты.
Даже выраженная гиперкалиемия может не сопровождаться клиниче-
скими проявлениями. Специфических клинических признаков гиперкали-
емии не существует. Возможно снижение частоты сердечных сокращений.
ЭКГ-признаки гиперкалиемии включают:
• рост амплитуды 7-зубца (высота его может достигать высоты зуб-
ца 7?);
• уплощение и или исчезновение зубца
• расширение комплекса QRS.
Нарушение электролитного гомеостаза
31
Причины гиперкалиемии
Таблица 110
Группа причин Причина |
Снижение почечной экскреции калия Острая и хроническая почечная недостаточность. Стенозирующее поражение почечных артерий. Лекарственные препараты: • калийсберегающие диуретики (спиронолактон, амилорид триамтерен); • антибактериальные препараты (триметоприм, пентамидин); • ингибиторы АПФ; • блокаторы рецепторов ангиотензина II, • нестероидные противовоспалительные препараты; • циклоспорин
Высвобождение калия из клеток • Рабдомиолиз • Синдром распада опухоли
Псевдогиперкали ем и я [ .... • Гемолиз • Тромбоцитоз • Выраженный лейкоцитоз
Специфические изменения ЭКГ при гиперкалиемии являются показа-
нием к выполнению экстренного гемодиализа. Гиперкалиемия осложняется
фатальными желудочковыми арит миями. Если концентрация калия в плаз-
ме достипи т 7 мЭкв/л, проведение экстренного гемодиализа может быть
обоснованным даже при отсутствии изменений на ЭКГ.
Стратегия лечения гиперкалиемии включает:
• внутривенное введение 20 -30 мл 10%-ного раствора кальция глюко-
ната пли 10%-ного раствора кальция хлорида; спустя 5 минут возмож-
но повторное введение, если ЭКГ-признаки сохраняются;
• внутривенное вве дение 10 единиц короткодействующего инсулина в
сочетании с 5%-ным раствором глюкозы;
® внутривенное введение 40—80 мг фуросемида или прием этой же дозы
per os',
• при калиемии > 6.5 мЭкв л может быть обоснованным проведение
экстренного гемодиализа.
У всех пациентов с гиперкалиемией должны быть отменены лекарствен-
ные препараты, способствующие дальнейшему нарастанию плазменной
концентрации калия. Возможно назначение ионообменных смол Дальней-
шее ведение больных с гиперкалиемией во многом зависит от причины, об-
условившей се возникновение (см. также «Злокачественная артериальная
гипертензия», «Тромботические микроангиопатии*, «Тромбоз почечных со-
судов», «Острая склеродермическая нефропатия», «Холестериновая эмбо-
лия почечных артерий»).
Глава 2
НЕФРОТИЧЕСКИЙ КРИЗ
Нефротический криз — резкое снижение объема циркулирующей кро-
ви, обусловленное падением онкотического давления. У больных нефро-
тическим синдромом с выраженной гипальбуминемией ои проявляется
артериальной гипотензией и болезненной мигрирующем эритемой, воз-
никновение которой связано с локальной кожной гиперпродукцией ки-
нинов. Нефротический криз — одна из причин острого ухудшения сос-
тояния пациентов с нефротическим синдромом — нередко становится
фатальным.
Нефротический синдром, как и другие «большие» нефрологические
синдромы, может очень быстро сопровождаться острым развитием угрожа-
ющих жизни осложнений. Часть из них не являются строго специфичными
именно для нефротического синдрома, их возникновение отражает в боль-
шей степени эволюцию хронических болезней почек и/или расстройства
водно-электролитного обмена. Ведущее значение для прогноза нередко
приобретают также осложнения иммуносупрессивной терапии (табл. 2.1).
Одиако только для нефротического синдрома характерно «формирование
быстро нарастающей гиповолемии (вплоть до гиповолемического шока),
имеющей характерные клинические проявления и получившей название
нефротического криза
Таблица 2. ?
Потенциальные осложнения нефротического синдрома
ОСЛОЖНЕНИЙ
Осложнение
Осложнения, вызванные
снижением онкотического
давления крови вследствие
| гиповолемии
отеки, достигающие степени анасарки;
артериальная гипотензия;
нефротический криз
Осложнения, связанные с
задержкой натрия и гипер
волемией
Осложнения, связанные с
активацией тромбогенеза
• артериальная гипертензия,
• острая певожелудочковая недостаточность с отеком легкого;
• острое нарушение мозгового кровообращения (транзитор
ная ишемическая атака / мозговой инсульт)
• тромбоз глубоких вен;
• тромбоэмболия легочной артерии;
• тромбоз почечных вен;
• тромбоз печеночных вен;
• тромбоз нижней полой вены
Нефротический криэ
33
Продолжение табл. 2.1
Группа осложнении
Осложнение
Метаболические наруше-
ния
Осложнения иммуносу-
прессивной терапии
• гиперхолестеринемия,
• гипертриглицеридемия;
• нарушения фосфорно кальциевого обмена, остеопороз;
• атрофия поперечно-полосатой мускулатуры
• неспецифичные для определенных классов препаратов
(цитопении, инфекции, септические состояния),
• специфичные для определенного класса препаратов (на
пример, нефропатия, индуцированная ингибиторами
кальцинейрина)
Этиология
Нефротический криз всегда развивается только при уже сформировавшем-
ся нефротическом синдроме, наблюдающемся при различных заболеваниях
(табл. 2.2). Обязательные признаки нефротического синдрома включают:
• относительно длительную «большую» протеинурию > 3 г сутки;
• выраженную гипальбуминемию;
• массивные отеки, нередко достигающие степени анасарки.
В качестве дополнительных признаков нефротического синдрома рас-
сматривают нарушения обмена липопротеидов — увеличение сывороточной
концентрации общего холестерина и триглицеридов, достигающей значе-
ний. практически не отмечающихся в популяции, лаже при первичных, ге-
нетически детерминированных дислииопротеилемиях.
Этиология нефротического синдрома
Таблица 2.2
Группа причин [ . Лримии.
। Первичные формы хрониче- । ского гломерулонефрита | мембранозная нефропатия (первичная и вторичная, напри- мер, паранеопластическая); нефропатия минимальных изменении, фокально -сегментарный гломерулосклероз; мезангиопропиферативный гломерулонефрит, мезангиокапиллярный гломерулонефрит
Системные заболевания системная красная волчанка; ANCA ассоциированные системные васкулиты; пурпура Шенлейна—Геноха, инфекционный эндокардит
Обменные заболевания сахарный диабет 1 го и 2-готипов; амилоидоз
। Другие । лекарства (D-пеницилламин, антибиотики); инфекции (HBV-, HCV-, ВИЧ, туберкулез)
2 Нефрология
34
Нефрология Неотложные состояния
Факторы риска нефротического криза четко не определены, и, кроме
того, трудно однозначно выделить почечные заболевания, при которых он
развивается чаще. Тем не менее можно утверждать, что нефротический криз
развивается преимущественно при так называемом гиповолемическом ва-
рианте нефротического синдрома, который, по-видимому, несколько чаще
наблюдается при хроническом гломерулонефрите (мембранозной нефропа-
тии, фокально-сегментарном гломерулосклерозе, волчаночном нефрите), а
также при IV—V стадиях диабетической нефрона гни. Гиповолемический
вариант нефротического синдрома ориентировочно выделяют на основании
оценки АД и альбуминемии. Кроме того, для него несколько чаще свой-
ственно снижение скорости клубочковой фильтрации (табл. 2.3).
Таблица 2.3
Дифференциация гиперволемического и гиповолемического вариантов
нефротического синдрома
Дивгн0сп4чвским ярмэмк Гйисиюлемича^сий вариант j Гиперволемический варкам*
Альбуминемия, г/л Скорость клубочковой фильтрации Протеинурия* -2 < 50% от нормальной вели- чины Суммарная экскреция белка с мочой может быть очень высокой >2 • Mid > 50% от нормальной вели чины Более 3 г/сутки
Повышение АД Нет, возможна артериальная гипотензия Есть
Ортостатическая артериаль мая гипотензия Есть Нет
*Сама по себе величина экскреции белков, в том числе альбумина, с мочой далеко не всегда
является детерминантой гипальбуминемии При сохранной белок-синтетической функции печени
и/или в ситуации, когда пул белков, попадающих в мочу, представлен не альбумином (например,
протеинурия переполнения при парапротеинемии), даже очень большая протеинурия может не
сопровождаться снижением концентрации альбумина в плазме крови.
Нефротический криз может развиваться спонтанно и непредсказуемо.
Тем не менее в значительной части случаев развитие нефротического криза
провоцируют приводимые ниже факторы:
• потеря жидкости и натрия, связанные с приемом или инфузией неа-
декватно большой дозы петлевого диуретика;
• потеря жидкости при диарее любого происхождения;
• инфекционное осложнение (инфицирование кожных покровов, пнев-
мония, кишечная инфекция) с подъемом температуры тела и артери-
альной гипотензией.
Нефротическим криз
35
ПАТОГЕНЕЗ
Многие аспекты патогенеза нефротического криза остаются до конца нс
изученными. Вместе с тем можно предполагать, что развитие нефротиче-
ского криза, наблюдающегося преимущественно при его гиповолемическом
варианте, может быть обусловлено:
• практически полной утратой селективности гломерулярной базаль-
ной мембраны, наблюдающейся при серьезном ее повреждении, ти-
пичном для тяжелого гломерулонефрита- IV—V стадии диабети-
ческой нефропатии и амилоидоза;
• значительными потерями альбумина с мочой, приводящими к даль-
нейшему снижению онкотического давления крови;
• снижением сывороточной концентрации натрия, обусловленным как
избыточным выходом его из циркулирующей плазмы в тканевую
отечную и накапливающуюся в серозных полостях жидкость, так и
потерями с мочой, возникающими при передозировке петлевых диу-
ретиков:
• увеличением клиренса осмотически свободной и осмотически связан-
ной воды (как правило, происходит при передозировке петлевых диу-
ретиков).
У пациентов с гиповолемическим вариантом нефротического синдрома,
у которых развивается нефротический криз, как правило, исходно снижена
активность рснии-ашиотснзин-альдостероновой системы. Вместе с тем
далеко не всегда удается установить строгое соответствие между сыворо-
точной концентрацией отдельных составляющих ренмн-ангиотензин-
альдостероновой системы (например, ангиотензина II или альдостерона) и
выраженностью их локально-почечных эффектов, в частности способно-
стью препятствовать экскреции натрия. На экспериментальных моделях
нефротического синдрома было показано, что по .мере увеличения его про-
должительности в клетках-мишенях (эпителиоциты почечных канальцев и
собирательных трубочек) значительно возрастает экспрессия субъединиц
эпителиальных натриевых каналов (eNaC), в том числе основной —
а-субъединицы (aENac), которую индуцируют также ангиотензин II, взаи-
модействующий с рецепторами I типа, и альдостерон.
Хорошо известно, что при нефротическом синдроме значительно сни-
жается эффективность фуросемида, и именно отсутствие заметного приро-
ста диуреза в ответ иа парентеральное введение его первой большой дозы
заставляет клинициста применять его повторно. Однако следует иметь в
виду, что фармакокинетика фуросемида при нефротическом синдроме ха-
рактеризуется неравномерностью его распределения в плазме крови, свя-
занной со значительным снижением плазменной концентрации альбуми-
36
Нефрология. Неотложные состояния
на — основного транспортера фуросемида к клеткам толстого восходящего
сегмента петли Генле. Кроме того, большая часть (около 80%) попавшего в
организм человека фуросемида реализует свои диуретический эффект при
взаимодействии с апикальным полюсом эпителиоцитов толстого восходя-
щего сегмента петли 1ёнле. Таким образом, для обеспечения постоянства
диуретического эффекта фуросемида во времени необходима непрерывная
фильтрация его в первичную мочу У пациентов с гиповолемическим вари-
антом нефротического синдрома скорость клубочковой фильтрации всегда
снижена. При массивной протеинурии значительная часть фуросемида в
первичной моче остается связанной с экскретируемым альбумином, не ока-
зывая, следовательно, реального диуретического действия. В связи с этим
диуретический эффект фуросемида при нефротическом синдроме, как пра-
вило, ослабевает и, кроме того, отличается неравномерностью: отсутствие
прироста диуреза непосредственно после перорального приема или внутри-
венного введения препарата может сменяться периодом форсированного
диуреза (особенно если вслед за первой дозий фуросемида были введены
еще несколько), и именно в этот период опасность развития нефротическо-
го криза .максимальна.
1 иповолемнческий нефротический синдром — одна из наиболее труд-
ных для подбора дозы петлевых диуретиков ситуация. Факторы, обуслов-
ливающие формирование резистентности к диуретикам при нефротическом
синдроме, включают:
• артериальную гипотензию (типична для амилоидоза почек и гипово-
лемического варианта нефротического синдрома другого происхожде-
ния; может усугубляться при передозировке антигипертензивных
препаратов, развитии инфекционных осложнении с лихорадкой, а
также для тромбоэмболии ветвей легочной артерии );
• гипалтуминсмию, которая особенно существенно влияет па диурети-
ческую эффективность фуросемида;
• снижение скорости клубочковой фильтрации, приводящее к умень-
шению выраженности диуретического действия фуросемида и утра-
те эффективности тиазидовых диуретиков. Оно может быгьобустов-
лено активностью почечного поражения илн связано с фибротичс-
ской трансформацией почечной ткани, лежащей в основе хрониче-
ской почечной недостаточности. Потенциально обратимые причины
снижения скорости клубочковой фильтрации — гипоперфузия по-
чечной ткани (в том числе вследствие системной артериальной гипо-
тензии или при образовании тромбов во внутрипочечном сосудистом
русле), обструкция почечных канальцев (например, кристаллами
ура юн);
Нефротический криз
37
• тромбоз почечных вей;
• гипонатриемию любого происхождения.
Универсальный молекулярный механизм формирования указанной ре-
зистентности к диуретикам — снижение чувствительности эпителиоцитов
почечных канальцев к натрийуретическим пептидам (предсердному, мозго-
вому), а также их паракринным аналогам (урогуанилину). Показано, что в
сравнении со здоровыми лицами у больных нефротическим синдромом на-
блюдается достоверно меньший прирост экскреции натрия после инфузии
предсердного натрийуретического пептида. Снижение чувствительности
клеток-мишеней к натрийуретическим пептидам при нефротическом син-
дроме определяется постепенным истощением экспрессии цГМФ — уни-
версального вторичного мессенджера для этих гормонов. При инфузии
цГМФ у пациентов с нефротическим синдромом нс удается отметить повы-
шения мочевой экскреции: очевидно, цГМФ полностью потребляется эпи-
телиоцитами почечных канальцев.
Формирование одного из наиболее характерных признаков нефротиче-
ского криза — мигрирующей болезненной кожной эритемы, а также болей в
животе — связано с локальной гиперпродукцией кининов, подтверждаемой
обнаружением повышенного содержания калликреина и брадиникина в
Отечной жидкости, особенно полученной из эритематозных участков кожи
и экссудата, локализующегося в серозных полостях. При гиповолемическом
варианте нефротического синдрома, особенно при развивающейся рези-
стентности к диуретикам, наряду с повышением концентрации компонен-
тов калликреин-кининовой системы наблюдается очень низкая активность
ферментов, разрушающих кинины (кининаз, al-антитрипсина, нейтраль-
ной эндопептидазы, активность которых может также быть подавлена при
применении ингибиторов ангиотензин-превращающего фермента). Уста-
новлено, что достоверное повышение экскреции с мочой калликреина (по
сравнению с таковой у здоровых представителей контрольной группы) на-
блюдают у больных нефротическим синдромом как при нормальной, так и
при повышенной активности ренина плазмы. Следовательно, при нефроти-
ческом синдроме постепенно исчезает физиологическая взаимосвязь между
активностью ренин-ангиотензин-альдостероновой и калликреин-кининовой
систем. Более того, активация калликреин-кининовой системы, играющая
одну из главных ролей в патогенезе нефротического криза, наблюдается
именно при нефротическом синдроме, но не других «больших * нефрологи
ческих синдромах. Показано, что при хроническом гломерулонефрите с мо-
чевым синдромом экскреция с мочой калликреина снижается пи сравнению
с нормой более чем в 2,5 раза, а при хроническом гломерулонефрите с не-
фротическим синдромом — возрастает более, чем в 2 раза. Обследование
больных нефротическим синдромом в нашей клинике позволило устано-
38
Нефрология. Неотложные состояния
вить связь между показателями, характеризующими активность каллик-
реин-кининовой системы, и клиническими проявлениями нефротического
синдрома (табл. 2.4). Увеличение концентрации н продолжительности дей-
ствия компонентов калликреин-кининовой системы обусловливает форми-
рование болезненной кожной эритемы, болей в животе, а также усиление
вазодилатации, вызывающей нарастание артериальной гипотензии.
Артериальная гипотензия, возникающая или нарастающая при нефро-
тическом кризе, обусловлена как вазодилатирующим действием кининов,
так и гиповолемией, связанной со снижением онкотического давления кро-
ви, а также, возможно, гипонатриемией. Артериальная гипотензия приво-
дит к снижению перфузии почечной ткани, в связи с чем при нефротиче-
ском кризе наблюдают снижение скорости клубочковой фильтрации,
нередко сопровождающееся олигоанурией.
Таблица 2.4
Содержание кининов в биологических жидкостях при различных клинических
проявлениях нефротического криза (по Л.Р. Полянцевой, 1985)
Локализация L 2 Концентрация свободных кинннов (нг/мл) Клиническое проявление
I Экссудат брюшной полости >30 Боль в животе
Экссудат плевральной поло- сти > 10 Быстрое накопление значи- тельного (> 4 л) объема плев- рального выпота, несмотря на повторные плевральные пункции с торакоцентезом
Отечная жидкость подкожной жировой клетчатки >5 Мигрирующая рожегодобная эритема и отеки, резистент- ные к диуретикам
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина нефротического криза достаточно характерна.
Нередко развитие его происходит под действием названных выше прово-
цирующих факторов (например, при передозировке петлевых диуретиков)
но часто бывает и спонтанным. В целом всех больных нефротическим син-
дромом с тенденцией к артериальной гипотензии, в том числе ортостатиче-
ской, но особенно с гипальбуминемией < 2 г/л следует относить в группу
высокого риска развития нефротического криза.
Клинические признаки нефротического криза включают:
• нарастающую артериальную гипотензию с головокружением, слабо
стью, в дальнейшем — нарушениями сознания;
Нефротический криз
39
• тошноту, рвоту;
• боли в животе иногда в сочетании с другими признаками «острого жи-
вота»;
• мигрирующую болезненную эритему, локализующуюся на боковых
поверхностях передней брюшной стенки и бедрах;
• как правило, олигоанурию.
ДИАГНОЗ
Если нефротический синдром распознан своевременно и при этом про-
водится мониторинг АД и диуреза, диагноз нефротического криза зачастую
не вызывает затруднений Дифференциация нефротического криза с рожи-
стым высыпанием осуществляется на основании особенностей клинико-
лабораторных анализов (табл. 2.5).
Таблица 2.5
Дифференциальный диагноз нефротического криза
Диагностически* признаки Нефротический криз — _ Р<?жа
Локализация эритемы Боковые поверхности пе- редней брюшной стенки, бедра Конечности (чаще нижние)
Особенности эритемы Склонность к миграции Склонность к распростране- нию («ползущая»)
Артериальная гипотензия Всегда Может отсутствовать, за ис- ключением периодов лихо- радки
Гипальбуминемия Выраженная Отсутствует
Протеинурия > 3 г/сутки Может отсутствовать
Снижение скорости клубоч- ковой фильтрации Всегда Не характерно
Лихорадка Возможна Всегда
Лейкоцитоз Как правило, отсутствует Всегда
Увеличение гематокрита Резкое Умеренное
ЛЕЧЕНИЕ
Основу лечения нефротического криза составляет коррекция объема
циркулирующей крови. Единственный подход, эффективный при нефроти-
ческом кризе, — трансфузия плазмы крови. Инфузия альбумина заведомо
менее эффективна.
40
Нефрология. Неотложные состояния
Селективные антикининовые препараты н< разработаны Свойствами
антагониста брадикинина обладает пармидин, ранее использовавшийся так-
же как антигиперлипидсмичсский препарат. Назначают пармидин внутрь,
минимальная доза — 0,25 мг 3—4 раза в день; возможно увеличение разовой
дозы до 0,75 мг. Пармидин имеет только дополнительное значение в лечении
нефротического криза и в настоящее время в нашей стране малодоступен.
Больные нефротическим кризом характеризуются максимальным ри-
ском венозных тромбозов и эмболий. В связи с этим им может быть показа-
но назначение низкомолекулярных гепаринов в профилактических дозах,
однако безопасность этих препаратов именно при нефротическом кризе
(обоснованноеib их назначения больным нефротическим синдромом не вы-
зывает сомнения) требует дальнейшею уточнения.
ПРОГНОЗ
Прогноз при нефротическом кризе груднопредсказуем Хотя бы один
эпизод нефротического криза существенно затрудняет подбор терапии
(как патогенетической, так и диуретической) нефротического синдрома.
По-видимому, риск фатального исхода максимален при развитии нефро-
тического криза у больного амилоидозом почек.
ПЕРСПЕКТИВЫ
Перспективы в лечении и профилактике нефротического криза опреде-
ляются совершенствованием протоколов инфузии плазмы и альбумина, а
также разработкой антикининовых препаратов с направленным (таргет-
ным) действием. Для предупреждения развития нефротического криза осо-
бое значение приобретают создание и клиническая апробация препаратов,
селективно и управляемо уменьшающих проницаемость гломерулярной ба-
зальной мембраны для альбумина.
Неотложные мероприятия
• Отменить диуретики.
• Начать инфузию свежезамороженной плазмы
• Осуществлять мониторинг АД и биохимических показателей крови
(креатининемня, альбуминемия).
• Выполнить общий анализ крови.
Больной нефротическим кризом всегда должен находиться в условиях
отделения реанимации и интенсивной терапии.
Глава 3
БЫСТРОПРОГРЕССИРУЮЩИЙ
ГЛОМЕРУЛОНЕФРИТ
Быстропрогрессирующий гломерулонефрит — в первую очередь
к шническое понятие, и выделяют его, ориентируясь иа темпы ухуд-
шения почечной функции. Быстропрогрессирующий гломерулонефрит
констатируют, если сывороточная концентрация креатинина возрастает
в 2 и более раза каждые 3 месяца. Ухудшение фильтрационной функ-
ции почек при быстропрогрессируюшем гломерулонефрите иногда
приобретает фульминантный характер, в течение нескольких недель
достигая степени терминальной почечной недостаточности, которая,
тем не менее, нередко демонстрирует способность к обратному разви-
тию при своевременном применении агрессивных комбинации иммуно-
депрессантов.
В качестве единого морфологического почечного субстрата, соответ-
ствующего клинически диа1ностированному быстрипргнрессируюшему
гломерулонефриту, рассматривают экстракапиллярные клеточные или
фиброзно-клеточные полулуния (экстракапиллярный гломерулонефрит),
обнаруживаемые не меиее чем в 50% клубочков. Вместе с тем констатиро-
вать точное соответствие \юрфолО1ических изменений почечной ткани
быстроте ухушения функции почек удается далеко не всегда, поскольку по-
чечное поражение может принимать быстропрогрессирующее течение в
связи с присоединением почечной тромботической микроангиопатии,
острых ту було-интерстициальных процессов, спровоцированных, напри-
мер, примененными лекарственными препаратами (нестероидными проти-
вовоспалительными препаратами, антибиотиками и противогрибковыми
агентами).
Быстропрогрессирующий гломерулонефрит — всегда неотложная ситу-
ация, но, тем не менее, далеко не всегда характеризующаяся однозначно не-
благоприятным прогнозом, поскольку своевременная иммуносупрессивная
терапия, возможно, в комбинации с аферезными методами лечения может
«оборвать» почечный процесс и привести если не к полному восстановле-
нию фильтрационной функции почек, то по крайней мере к ее значительно-
му улучшению.
42
Нефрология. Неотложные состояния
ЭПИДЕМИОЛОГИЯ
Данные, характеризующие эпидемиологию быстропрогрессирующего
гломерулонефрита, получают главным образом при анализе регистров
больных острой почечной недостаточностью или архивов биопсий почки
Так, в медицинском центре Университета Чикаго в течение 7 лет было об-
следовано 259 пациентов с острой почечной недостаточностью в возрасте
старше 60 лет. которым была выполнена биопсия почки. У 31,2% из них был
диагностирован быстропрогрессирующий малоиммунный (pauci-) гломеру-
лонефрит с полулуниями, еще у 4,0% — антительный сто вариант, отличав-
шийся наличием антител к базальной мембране клубочка (анти-БМК-
антител). При анализе другого регистра биопсий почки, включавшего
возникшие в течение 15 лет 1122 случая острой почечной недостаточности,
было выяснено, что в 9,4% случаев причиной ее был экстракапиллярный
гломерулонефрит с типичными клубочковыми полулуниями. Анти-БМК-
антительный (тип I) и иммунокомплексный (тип II) типы быстропрог-
рессирующею гломерулонефрита были обнаружены у 10,1% из 2281 паци-
ента, которым в течение 12 лет была выполнена биопсия почки в связи
с необъяснимой очевидными причинами острой почечной недостаточ-
ностью.
Быстропрогрессирующий гломерулонефрит занимаег определенное ме-
сто и в структуре хронических болезней почек, выясняемой на основании
анализа архивов биопсий почки, выполненных по разнообразными поводам
в разных странах. Так, по данным регистра, включающего 635 биопсий поч-
ки, выполненных за 10 лет в 2 регионах Румынии, наличие экстра капилляр-
ного гломерулонефрита с полулуниями было отмечено в 7,9% случаев, что
соответствует заболеваемости, составляющей 3,3 случая па 1 млн человек.
По данным V. Paninchi и соашг. (2007), из 3810 биопсий почки, выполнен-
ных в нефрологическом отдетения госпиталя Пизы (Италия) с 1977 по
2005-й годы, в 2,7% случаев был выявлен именно быстропрогрессирующий
гломерулонефрит с полулуниями
В большинстве стран отмечается неуклонный рост заболеваемости
быстропрогрессирующим гломерулонефритом, в том числе постепенное
увеличение числа заболевших в группе лиц пожилого и старческого воз-
раста. Развитие быстропрогрсссируюшего гломерулонефрита все чаще
наблюдают и у детей Понятно, что эпидемиологическая характеристика
быстропрогрессирующего нефрита, основанная только на результатах ана-
лиза баз данных биопсий почки, позволяет составить представление о рас-
пространенности лишь его отдельных морфологических форм, например
эктракапиллярного гломерулонефрита с полулуниями и почечных васку-
литов. По-нрежиему актуальными остаются описания отдельных наблю-
Быстропрогрессирующий гломерулонефрит
43
дений быстропрогрессирующего гломерулонефрита, во многом расширя-
ющие представления о возможных этиологических факторах этого забо-
левания.
ЭТИОЛОГИЯ
Пока не идентифицированы этиологические факторы, однозначно вызы-
вающие развитие быстропрогрессирующего гломерулонефрита. Тем нс ме-
нее в отдельных случаях связь его развития с отдельными повреждающими
воздействиями (например, первым приемом гекарственного препарата, ин-
фекцией) бывает очевидной. Четко продемонстрировано частое развитие
быстропрогресснрующего гломерулонефрита при некоторых системных за-
болеваниях (HCV-инфекции, особенно ассоциированной со смешанной
криоглобулинемией, системных ANCA-ассоциированных некротизирующих
васкулитах, системной красной волчанке) (табл. 3.1). Особый интерес пред-
ставляет пока не имевшее особого успеха выделение факторов риска быстро-
прогрессирующего гломерулонефрита, способных на любом этапе обуслов-
ливать озлокачествление любого хронического почечного заболевания, в
частности исходно прогрессирующего благодаря участию преимущественно
неиммунных механизмов (например, диабетической нефропатии).
Известно также, что в одних и тех же условиях (например, при холе-
стериновой эмболии внутрипочечных артериол) почечный процесс может
развиваться как типичным образом (острый «аллершческий» эозино-
фильный тубуло-интерстициальный нефрит с острой почечной недоста-
точностью), так и с ускоренным формированием быстропрогрессирующе-
го гломерулонефрита, в том числе ANCA-ассопиированного. В связи г
этим нельзя полностью исключить, что к быстропрогрессирующему гло-
мерулонефриту существует определенная наследственная предрасполо-
женность, однако уже в настоящее время очевидно, что конкретные гене-
тические детерминанты трудно установить, и само по себе их носительство
не является достаточным для развития почечного поражения. Тем не ме-
нее у больных антительным (тип I) анти-БМК-ассоциированным быстро-
прогрессирующим гломерулонефритом в рамках синдрома Гудпасчера
удавалось констатировать значительную частоту обнаружения некоторых
классов антигенов гистосовместимости (HLA DRB1-15, HLA DQB1-6.
HLA-DRW 2). Можно тем не менее утверждать, что фенотипическому
проявлению генетических детерминант быстропрогрессирующего гломе-
рулонефрита, в том числе развивающегося в рамках синдрома Гудпасчера,
почти всегда способствует действие экзогенных факторов, устранение ко-
торых зачастую не сопряжено с увеличением вероятности достижения ре-
миссии почечного поражения.
44
Нефрология. Неотложные состояния
Таблица 3 1
Этиология быстропрогрессирующего гломерулонефрита
При ин* Пример * -
। Инфекции и параз итарные инвазии г г Бактериальные • нефритогенные штаммы стрептококка (острый пост- стрептококковый гломерулонефрит может трансформиро- ваться в быстропрогрессирующий); • микобактерии, в том числе атипичные {Mycobacterium afocans, Mycobacterium kansasn. Mycobacterium avium intracellulare). Вирусные: • HCV (особенно при HCV-ассоциирован ной смешанной кри- оглобулинемии); • ВИЧ; вирус гриппа. Грибковые: • Pneumocystis саппн; • Candida spp. (особенно у лиц с иммунодефицитом); • Histoplasma capsulatum. Паразитарные инвазии: • Strongyioides stercorahs, • шистозомы; • малярийный плазмодий
Системные заболевания • ANCA-ассоциированные системные некротизирующие ва скулиты (гранулематоз Вегенера, микроскопический поли- ангиит); • системная красная волчанка" • пурпура Шенлейна-Геноха. • инфекционный эндокардит/сепсис; • холестериновая эмболия с поражением внутрипочечных ар- терий и артериоп, • злокачественные опухоли (солидные, макроглобулинемия Вальденстрема)
Экзогенные факторы • лекарственные препараты (рифампицин, D-пеницилламин). • наркотики (кокаин, реже - героин); • ромышленные углеводороды, • асбест; • соли кремниевой кислоты
ПАТОГЕНЕЗ
Особенности клинической эволюции и прогноза быстропрогрессирую-
щего гломерулонефрита во многом определяются типом участвующих в
почечном поражении антител и вариантом их взаимодействия с гломеру-
лярной базальной мембраной. Именно поэтому общепризнано разделение
быстроирогрссснрующего i ломерулонефрита на иммунопато! ене i ические
варианты (табл. 3.2), определяемые на основании оцениваемого при имму-
нофлуоресцентнон микроскопии типа свечения антител в образцах ткани
Быоролрогрессирующим гломерулонефрит
45
почки, полученной при биопсии, и наличия определенных сывороточных
маркеров (антител к цитоплазме нейтрофилов (ANCA), анти-БМК-ан-
титет).
Таблица 3.2
Иммумопатогенетические типы быстропрогрессирующего нефрита
Патоганетмче- скмйгип \ Тил свечения при иммуно- флуоресцентной микроско- пии почечной ткани Сывороточный маркер
анти- БМК- АТ АНСД Снмжеюм сывороточ- ного уровня комн помещу
Тип 1 Линейное + —
Тип II Гранулярное — -
Тип III Как правило, не обнаружи- вается +
Tun I (антительный, анти-БМК-нефрит) существует изолированно
или сочетается с поражением легких (легочно-почечный синдром, синдром
Гудпасчера). Циркулирующие антитела к базальной мембране клубочка до-
ступны для определения в сыворотке крови.
При II (иммунокомплексном) типе депозиты иммунных комплексов
обнаруживают в .мезангии и стенке капилляров почечного клубочка. Харак-
терные серологические маркеры отсутствуют, за исключением сниженного
сывороточного уровня комплемента, который может косвенно указывать на
связьбыстропрогрессируклцегогломерулонефритасИС¥-ассоЦ11пронаннпй
смешанной криоглобулинемией или системной красной волчанкой.
Почечное поражение при III (малоиммунном) типе быстронрогресси-
рующего гломерулонефрита определяется клеточными иммунными реак-
циями, индуцируемыми ANCA. Быстропрогрессирующий гломерулонеф-
рит Ш типа может быть локально-почечным, или, сочетаясь с поражением
других органов, существовать как одно из проявлений системных \NCA-
ассопиированных некротизирующих васкулитов (гранулематоз Вегенера,
микроскопический полиангиит).
Более половины всех случаев быстропрогрессмрующего гломерулонеф-
рита относится к III типу, частота встречаемости I и 11 типов примерно оди-
накова (20-25%).
Одним из центральных звеньев патогенеза быгтропрогрессирующего
экстракапиллярною гломерулонефрита с полулуниями считают проникно-
вение белков плазмы крови и воспалительных клеток в пространство капсу-
лы Шумлянского- Боумена Накопление макрофагов вследствие миграции
их предшественников из циркулирующей крови и пролиферации резидент-
46
Нефрология Неотложные состояния
ных клеток дополняется миграцией из почечного интерстиция фибробла-
стов и миофибробластов. Эти клетки начинают в избытке продуцировать
компоненты экстрацеллюлярного матрикса (фибронектин, коллагены I и
III типов), что способствует значительному повышению интенсивности фи-
броза полулуний, лежащего в основе необратимого ухудшения фильтраци-
онной функции почек. Следует тем не менее подчеркнуть, что далеко не
всегда при быстропрогрессирующем гломерулонефрите удается установить
четкое соответствие между выраженностью почечной недостаточности и
количеством полулуний, подвергшихся фибротической трансформации.
С одной стороны, суммарное число почечных клубочков, в которых выявля-
ются полулуния, можно считать решающим в развитии быстропрогресси-
рующего гломерулонефрита. Однако его формирование регистрируют и
тогда, когда число клубочковых полулуний не достигает 50% или они прак-
тически отсутствуют.
Межклеточным взаимодействиям в полулуниях, регулируемым опреде-
ленными хемокинами (моноцитарным хемотаксическим протеином I типа
(МСР-1), макрофагальным воспалительным протеином типа la (MIPla)),
очевидно, принадлежит решающая роль в формировании быстрой регресси-
рующего гломерулонефрита. Так, при экстракапиллярном гломерулонеф-
рите установлена прямая корреляция между выраженностью фиброза по-
лулуний и количеством экспрессирующих а-гладкомышечный актин
миофибробластов в интерстиции в местах, близких к точкам разрыва капсу-
лы Боумена; там же, а также в интерстициальных клетках, окружающих со-
суды, с наибольшей интенсивностью синтезируется коллаген III тина.
Трансформирующий фактор роста р-1 при экстракапиллярном гломеруло-
нефрите обнаруживают преимущественно в канальцевых эпителиоцитах.
Число миофибробластов, экспрессирующих a-гладкомышечный актин, и
количество коллагена IV в почечном интерстиции позволяют предсказать
вероятность необратим» >го ухудшения функции почек и ответ на иммуносу-
прессивную терапию. Показано, что нарастание экспрессии миофибробла-
стов ассоциировано с усилением процессов апоптоза клеток почечного
тубуло-интерстиция с одновременным увеличением синтеза медиаторов
фиброгснсза, в первую очередь трансформирующего фактора роста-р.
Установлено, что при экстракапиллярном гломерулонефрите интенсив-
ная экспрессия трансформирующего фактора роста-p ассоциирована с уве-
личением числа полулуний, подвергшихся фибротической трансформации.
Более того, мочевая экскреция трансформирующего фактора роста-Р у
больных экстракапиллярным гломерулонефритом, не ответивших на имму-
носупрессивную терапию и продемонстрировавших быстрое развитие тер-
минальной почечной недостаточности, не менее чем в 2,5 раза превосходит
Быстропрогрессирующий гломерулонефрит
47
таковую у тех пациентов, у кого прогрессирование заболевания удалось за-
держать с помощью иммуносупрессивной терапии.
Роль избытка трансформирующего фактора роста-0 в прогрессировании
быстропрогрсссирующего экстракапиллярного гломерулонефрита, очевид-
но, не исчерпывается только его участием в процессах почечного фиброге-
неза. Хорошо известно, что трансформирующий фактор роста-0 — один из
наиболее мощных физиологических индукторов клеточного апоптоза. Вы-
сокая интенсивность синтеза этого медиатора при экстракапиллярном гло-
мерулонефрите может отражать блокаду соответствующих рецепторов и
связанное с ней торможение процессов апоптоза, представляющее собой
один из механизмов формирования полулуний. В норме трансформирую-
щий фактор роста-0 индуцирует клеточный апоптоз путем взаимодействия
со специфическим рецептором BMRP (bone morphogenetic protein receptor—
рецептором костного морфогенетического белка). Установлено, что при
.малоиммунном (тип 111) варианте быстропрогрессирующего гломеруло*
нефрита в почечных клубочках и интерстиции, в том числе в области
полулуний, существенно возрастает экспрессия белка гремлина — антаго-
ниста BMRP, препятствующего таким образом взаимодействию этого бел-
кового рецептора с трансформирующим фактором роста-0. В результате
блокады BMRP гремлином миофибробласты и фибробласты не вступаю!
в процесс апоптоза, а продолжают пролиферировать и дифференцировать-
ся, что приводит к дальнейшему образованию новых полулуний и их ин-
тенсивному фиброзу, несмотря на возникающую по механизму отрица-
тельной обратной связи гиперпродукцию трансформирующего фактора
роста-0, который в этой ситуации начинает реализовывать свое профибро-
генное действие другими путями, например через провокацию экспрессии
медиаторов эндотелий-зависимого звена гемостаза (ингибитора активато-
ра плазминогена-1).
Представление о быстропрогрессирующем гломерулонефрите как о за-
болевании, в основе развития которого лежит патология индуцируемого
трансформирующим фактором роста-0 апоптоза, открывает новые перспек-
тивы в лечении этого заболевания. Наряду с ингибированием блокирующе-
го рецепторы BMRP гремлина можно рассчитывать на терапевтическую
эффективность введения в почечную ткань доноров BMRP, в том числе кле-
ток костного мозга. Показано, что костный мозг может быть источником по-
чечных мезангиоцитов и эндотелиоцитов, трансдифференциация которых
осуществляется в условиях характерного микроокружения и при участии
некоторых факторов роста, в частности тромбоцитарного. Гиперпродукция
блокаторов BMRP или недостаточная экспрессия этих рецепторов могут
рассматриваться как одно из наиболее важных обстоятельств, предраспола-
гающих к развитию именно быстропрогрессирующего экстракапиллярного
48
Нефрология. Неотложные состояния
гломерулонефрита. Более того, сама по себе недостаточность рецепторов
BMRP может быть генетически детерминированной (аналогично первич-
ной легочной гипертензии — другому заболеванию, в основе которого ле-
жит патология апоптоза отдельных клеточных пулов с их избыточной про-
лиферацией, при котором носительство мутантных форм гена BMRP четко
продемонстрировано и обусловливает семейные случаи) Следовательно,
изучение вариантов гена BMRP и интенсивности экспрессии его блокато-
ров (в частности, гремлина) может способствовать более детальному пони-
манию процессов, лежащих в основе развития быс гропрогрессирующе! о
гломерулонефрита, в том числе объяснению его развшия у лиц, исходно
страдающих другим хроническим заболеванием ночек, например диабети-
ческой нефропатией.
Понятно, что каждый из типов быстропрогрессирующего гломеруло-
нефрита имеет определенные патогенетические особенности.
Развитие синдрома Гудпасчера (тип I — антите. 1ьный — быстропрогрес-
сирующего гломерулонефрита) связывают со специфическими анти-
БМК антителами, связывающимися с базальной мембраной альвеол и по-
чечного клубочка и обладающими высокой специфичностью к а-3 цепи
коллагена IV типа. Связь анти-БМК антител с а-3 цепью коллагена IV типа
происходит через содержащийся в ней так называемый неколлагеновый
(NC) домен. Существует 4 типа анти-БМК антител (А, В, АВ, X). А и В типы
взаимодействуют с определенными эпитопами (А или В, соответственно),
АВ — с обоими названными эпитопами, точка приложения действия анти-
БМК антител X типа неясна. Все эти эпитопы расположены на NC домене.
В настоящее время синдром Гудпасчера продолжают интенсивно изу-
чать на экспериментальных моделях: создан синтетический аналог соответ-
ствующего антигена, при введении которого животным у них развивается
легочно-почечный синдром, обязательно включающий антительный бы-
стропрогрессирующий гломерулонефрит. У крыс с синдромом Гудпасчера
удалось детально проследить эволюцию почечного поражения. Депозиты
IgG на базальной мембране формируются через 2 недели после иммуниза-
ции, одновременно констатируют отек клубочковых эндотелиоцитов и по-
явление альбуминурии. Клеточный инфильтрат представлен преимуще-
ственно СВ4-позитивными Т-лимфоцитами На 3-й неделе начинают
образовываться полулуния, в капсуле Боумена накапливается большое ко-
личество фибрина, гломерулярный инфильтрат представлен преимуще-
ственно СВ8-позитивными Т-лимфоцитами и макрофагами. Характерны
множественные разрывы базальной мембраны.
Показано, что в формировании тканевого повреждения при синдроме
Гудпасчера существенную роль играют Т-лимфоциты. Продемонстрирова-
но значительное нарастание числа СВ4-позитивиых Т-лимфоцитов, распо-
Быстропрогрессирующий гломерулонефрит
49
знающих NC-домен «-3 цепи коллагена IV типа в периферической крови в
острую фазу заболевания. Если обострение удается прервать, число их су-
щественно уменьшается. Развитие синдрома Гудпасчера может быть также
обусловлено нарушениями регуляции экспрессии IgG. Так, в эксперименте
удавалось воспроизвести синдром Гудпасчера у мышей с отсутствующим
Fc-гамма рецептором ПВ, играющим центральную роль в контроле экспрес-
сии IgG. Часть случаев синдрома Гудпасчера может также быть обусловлена
моноклональной пролиферацией IgA.
При синдроме Гудпасчера фибробласты почечного тубуло-интерстиция
активно экспрессируют «-гладкомышечный актин, в то время как вименти-
на и трансформирующего фактора роста-0 на их поверхности обнаружить
не удается. Показано, чти блокада моноцитарного хемоаттрактантного про-
теина I гипа позволяет уменьшить выраженностьтубуло-интерстициалъного
повреждения при синдроме Гудпасчера, что также открывает определенные
перспективы в лечении данного заболевания.
Иммунокомплексный (тип II) вариант быстронрогрессирующего гломе-
рулонефрита развивается при наличии соответствующего субстрата для об-
разования иммунных комплексов. В качестве такового могу г выступать
бактериальные антигены, лекарственные препараты или их метаболиты,
криоглобулины при HCV-ассоциированной смешанной криоглобулинемии,
антитела к ДНК при системной красной волчанке.
Почечное поражение при III (малоиммунном, pauci) типе быстропро-
грессирующего гломерулонефрита определяется тканьдеструктивным дей-
ствием ANCA, степень повышения сывороточном концентрации которых,
как правило, отражает активность заболевания. Взаимодействие между Fc-
рецепторами нейтрофилов, миелопероксидазой, протеинкиназой-3 и ANCA
сопровождается гиперпродукцией супероксид-иона, перекисей, а также
провоспалительных цитокинов. Одновременно возрастает экспрессия 02-
интегрина — молекулы адгезии, принимающей непосредственное участие
во взаимодействии нейтрофилов с эндотелиоцитами (повреждение эндоте-
лиоцитов при ANCA-ассоциированном быстропрогрессирующем гломеру-
лонефрите может также быть связано с продукцией антиэндотелиальных
антител). В тканях-мишенях ANCA формируются также олигоклональные
пулы Т-лимфоцитов. Эти Т-лимфоциты, модулируя продукцию интерфе-
рона-у и «-фактора некроза опухолей, принимают непосредственное уча-
стие в образовании полулуний. Более тяжелое почечное поражение наблю-
дают при преобладании CD28 Т-лимфоцитов.
Детали патогенеза отдельных вариантов быстропрогрессирующего гло-
мерулонефрита продолжают уточняться. Для разработки селективных те-
рапевтических воздействий необходимо уточнение механизмов формирова-
ния полулуний и индукторов их фибротической трансформации.
50
Нефрология. Неотложные состояния
МОРФОЛОГИЯ
Гломерулонефрит с полулуниями (быстропрогрессирующий, подо-
стрый, злокачественный, экстракапиллярный пролиферативный) — тяже-
лая форма гломерулонефрита, при которой в большинстве клубочков фор-
мируются эпителиальные полулуния.
Важный патогенетический фактор формирования полулуний в про-
странстве Боумена — выход фибрина в просвет капсулы почечного тельца.
Вероятно, фибрин и другие белки плазмы крови, а также моноциты попа-
дают в просвет капсулы почечного тельца через разрывы в воспаленных
капиллярах клубочков. Фибрин и его компоненты являются стимулом
для миграции моноцитов. Макрофаги, образующиеся из моноцитов, про-
лиферирующие париетальные эпителиальные клетки и полиморфно-
ядерные лейкоциты образуют «клеточные*- полулуния. Эти полулуния
постепенно сдавливают капиллярный клубочек, серьезно затрудняя и
даже прекращая образование первичной мочи с развитием олигоурии и
анурии. Спавшиеся капиллярные петли пропитываются фибрином По
мере прогрессирования процесса полулуния приобретают фиброзный ха-
рактер, в них появляются фибробласты и коллаген. В финале клубочек
полностью склерозируется.
Гломерулонефрит с полулуниями в большой степени является результа-
том клеточно-опосредованного иммунного повреждения клубочков. В раз-
витии данного заболевания определенная роль отводится гиперчувстви-
тельности замедленного типа (ГЗТ). при которой сенсибилизированные
Т- лимфоциты привлекают и активируют макрофаги. При этом отмечается
значительная локальная экспрессия тканевого фактора в почечных клубоч-
ках. Наблюдается выраженная гломерулярная аккумуляция CD4+ Т-лим-
фоцитов. Обнаружение CD8+ Т-лимфоцитов свидетельствует об участии
Т-клеточно-опосредованной цитотоксичности в патогенезе гломерулонеф-
рита с полулуниями. Цитотоксические Т-лимфоциты вызывают поврежде-
ние как секретируя цитотоксические молекулы, так и с помощью клеточных
медиаторов (фактора некроза опухолей а-ФНО и Fas-лиганды), взаимодей-
ствующих со своими рецепторами на клетках-мишенях и вызывающих их
апоптоз. Известно, что в интрагломерулярных мононуклеарных клетках
происходит усиленная продукция РНК провоспалительных цитокинов
ФНО-а и интерлейкина-ip (ИЛ-ip) Считается, что ИЛ-tp продуцируют в
основном макрофаги в полулуниях, в то время как ФНОа продуцируется
клетками почечных клубочков, в том числе мезангиальных, и эпителиаль-
ными клетками почечных канальцев. Продукция ИЛ-ip и его взаимодей-
ствие со своим рецептором I типа на клетках почечных клубочков вызывает
экспрессию ФНО-а и дальнейшее повреждение клубочков.
Быстропрогрессирующий гломерулонефрит
51
Важную роль в регуляции макрофагальной инфильтрации почечных
клубочков при гломерулонефрите с полулуниями играет моноцитарный хе-
моаттрактантный белок-1 (МСР-1) и его рецепторы. В почечных клубочках
отмечается усиленная экспрессия МСР-1 клетками полулуний, париеталь-
ными эпителиальными клетками, эпителием канальцев и инфильтрирую-
щими интерстиций лейкоцитами. Также возрастает экспрессия хемокино-
вого рецептора 2В, обнаруживаемого в основном на монону клеарных
лейкоцитах, инфильтрирующих клубочек и полулуния. В привлечении лей-
коцитов и формировании инфильтрата определенную роль играют адгезив-
ные молекулы ICAM-1 и VCAM-1, повышенная экспрессия которых выяв-
ляется в пораженных почечных клубочках пациентов с гломерулонефритом
с полулуниями (анти-ГБМ и малоиммунном типах)
Макроскопически при быстропрогрессирующем гломерулонефрите
почки увеличены в размерах, дряблые; кора широкая, желто-серая, тусклая
с красным крапом, резко отграничена от темно-красных пирамид — «боль-
шая пестрая почка», или красная, сливается с пирамидами — «большая
красная почка».
В гистологической картине доминирует образование полулуний, кото-
рые могут занимать только отдельные сегменты пространства капсулы по-
чечного тельца или полностью окружать клубочек. Развитие полулуний
проходит несколько стадий: от клеточных полулуний к фиброзно-кле-
точным, а затем — фиброзным. Как уже было сказано, «клеточные»
полулуния, занимающие пространство между капсулой и капиллярным
клубочком, представлены пролиферирующими париетальными эпители-
альными клетками и макрофагами, также в них обнаруживаются нейтрофи-
лы и лимфоциты В течение нескольких недель в полулуниях развиваются
процессы организации с формированием соединительнотканного матрикса,
который хорошо выявляется при серебрении. Полулуния, полностью окру-
жающие клубочки, вызывают тотальный склероз. Наблюдаются также отек,
инфильтрация и склероз стромы, атрофия канальцев.
Быстропрогрессирующий гломерулонефрит подразделяют на 3 группы:
анти-ГБМ гломерулонефрит; иммунокомплексный гломерулонефрит с по-
лулуниями; малоиммунный гломерулонефрит с полулуниями.
Анти-ГБМ гломерулонефрит характеризуется линейными отложени-
ями IgG и СЗ компонента комплемента вдоль гломерулярной базальной
мембраны. Вызывается аутоантителами к а-3 цепи коллагена IV типа. Со-
ставляет от Ю до 20% случаев гломерулонефрита с полулуниями. Анти-
ГБМ гломерулонефрит может ограничиваться поражением почек или раз-
виваться в форме почечно-легочного синдрома. Классическим примером
последнего является быстропрогрессируюший гломерулонефрит, связан-
ный с синдромом Гудпасчера. Антитела к БМК перекрестно реагируют с ба-
52
Нефрология. Неотложные состояния
зальными мембранами легочных альвеол. Обусловливают появление кли-
нической картины легочных кровоизлияний, сопровождающихся почечной
недостаточностью. Кроме того, анти-ГБМ гломерулонефрит может быть
осложнением других заболеваний, например развиваться de novo после
трансплантации почки у пациентов с синдромом Альпорта, а также обнару-
живаться у пациентов с мембранозным гломерулонефритом с образованием
полулуний. Примерно у 1/3 пациентов с анти-ГБМ гломерулонефритом
выявляются циркулирующие антинейтрофильные цитоплазматические ан-
титела (ANCA), и данное заболевание у них ассоциировано с васкулитом
мелких сосудов различных органов (не только почек и легких).
Типичной картиной при световой микроскопии является некротизиру-
ющий гломерулонефрит с очаговым или диффузным формированием по-
лулуний. В пораженных участках капилляров почечных клубочков обнару-
живаются скопления лейкоцитов. Непораженные участки могут иметь
нормальный вид или быть инфильтрированными лейкоцитами и монону-
клеарными клетками воспаления.
При электронной микроскопии обнаруживают разрывы гломерулярной
базальной мембраны и отложения фибрина. Характерной чертой анти-ГБМ
гломерулонефрит является отсутствие отложений иммунных комплексов.
При иммунофлюоресцентном исследовании в базальной мембране капил-
лярных петель клубочков выявляют линейные отложения IgG и СЗ. Линей-
ные отложения IgG иногда определяются и при других заболеваниях почек
(диабетической нефропатии), поэтому требуется дополнительное определе-
ние циркулирующих анти-ГБМ антител. При сахарном диабете линейные
отложения нс являются отражением специфической иммунной реакции и
обычно содержат альбумины и фибриноген
Иммунокомплексный гломерулонефрит с полулуниями встречается
в 40% случаев гломерулонефрита с полулуниями и протекает менее агрес-
сивно, чем остальные формы. Чаще всего он служит осложнением других
иммунокомплексных нефритов, например постинфекционного гломеруло-
нефрита, IgA-нефропатии, криоглобулинемического гломерулонефрита,
болезни Шенлейна-Геноха, системной красной волчанки. Изредка причи-
ну установить не удается, и заболевание считается идиопатическим.
Гистологическая картина иммунокомплексного гломерулонефрита с по-
лулуниями зависит от основного заболевания почек. В участках почечных
клубочков, прилегающих к полулуниям, часто обнаруживается некроз, но
не такой выраженный, как при анти-ГБМ и малоиммунном гломерулонеф-
рита*. Признак, позволяющий дифференцировать иммунокомплексный
гломерулонефрит с полулуниями от названных двух вариантов, — наличие
утолщения стенок капилляров и пролиферации клеток капилляров почеч-
ных клубочков.
Быстропрогрессирующий гломерулонефрит
53
При электронной микроскопии и иммунофлюоресценции обнаружива-
ют иммунные комплексы, демонстрирующие гранулярный тип свечения.
Малоиммунный гломерулонефрит с полулуниями наблюдается нам
более часто (в 40—50% случаев гломерулонефрита с полулуниями). Диа-
гноз устанавливается после исключения участия в патогенезе иммунных
комплексов и анти-ГБМ антител. Иммунные комплексы в клубочках при
этом обнаруживают очень редко или не обнаруживают вовсе. Малоиммун-
ный гломерулонефрит развивается или самостоятельно, или как компонент
системного некротизирующего васкулита (гранулематоза Вегенера, микро-
скопического полиангиита). У 80—90% пациентов с малоиммунным гломе-
рулонефритом с полулуниями обнаруживают циркулирующие ANCA, на-
правленные к протеиназе 3 или миелопероксидазе; у остальных пациентов
циркулирующие ANCA не выявляются. У ANCA-отрицательных пациен-
тов, как правило, заболевание ограничивается поражением почек но про-
текает тяжелее: у них более высокая протеинурия, больше выражен нефро-
тический синдром и хуже прогноз.
Гистологическая картина малоиммунного гломерулонефрита с полулу-
ниями схожа с таковой анти-ГБМ гломерулонефрита. При этом морфоло-
гические изменения у ANCA-потожительных и ANCA-отрицательных па-
циентов несколько отличаются. У ANCA-отрицательных пациентов
отмечают более выраженные поражения почечных клубочков (меньше со-
хранных клубочков) и более выраженный интерстициальный фиброз.
При малоиммунном гломерулонефрите в фиброзно-клеточных полулу-
ниях обнаруживают миофибробласты, обладающие одновременно чертами
фибробластов и гладкомышечных клеток и способные синтезировать кол-
лаген и таким образом приводить к дальнейшему фиброзированию полулу-
ний. Источником миофибробластов являются, вероятнее всего, париеталь-
ные эпителиальные клетки, подвергающиеся эпителиально-мезенхимальной
трансдифференцировке под влиянием различных цитокинов и факторов
роста. В пользу этой гипотезы о происхождении миофибробластов свиде-
тельствует коэкспрессия ими на переходной стадии эпителиальных марке-
ров (цитокератинов) и гладкомышечного актина. Этот процесс является до-
вольно ранним в фиброзировании клубочков, и такие «переходные» клетки
(в отличие от зрелых миофибробластов) обнаруживают только на стадии
клеточных и фиброзно-клеточных полулуний. Другими возможными ис-
точниками миофибробластов являются мезангиальные клетки почечных
клубочков и пери гломерулярные интерстициальные фибробласты, мигри-
рующие в пространство Боумена через разрывы в капсуле и трансформи-
рующиеся в миофибробласты под действием трансформирующего фактора
роста р. Под действием этого фактора роста они синтезируют коллагены III
и IV типов.
54
Нефрология. Неотложные состояния
При малоиммунном гломерулонефрите в интерстиции отмечается ин-
тенсивная инфильтрация лейкоцитами, в том числе периг.юмерулярная с
сопутствующим разрывом капсулы Боумена. В отдельных случаях неригло-
мерулярные инфильтраты очень массивны и напоминают гранулематозную
реакцию с накоплением эпителиоидных клеток. По данным U. Eisenberger и
F. Fakhouri, при ANCA-негативном малоиммунном гломерулонефрите в
95% случаев (биопсий) в почечном тубуло-интерстиции отмечается интен-
сивная лимфоцитарно-макрофагальная инфильтрация с примесью лейко-
цитов, в 80% случаев — тубуло-ингерстициальиый фиброз. При малоим-
мунном гломерулонефрите макрофаги, обильно инфильтрирующие почеч-
ные клубочки, продуцируют большое количество тканевою фактора,
усиливающего формирование полулуний
При иммунофлюоресцентном исследовании иммунные депозиты в по-
чечных клубочках чаще всего нс выявляются, иногда бывают обнаружены
небольшие очаговые отложения СЗ. Фибриноген накапливается в полулу-
ниях или участках некроза почечных клубочков. При электронно-микро-
скопическом исследовании выявляют разрывы базальной мембраны клу-
бочков и отложения фибрина. Иммунные комплексы отсутствуют. В исходе
гломерулонефрита с полулуниями развивается вторично сморщенная поч-
ка с очень быстро формирующейся почечной недостаточностью.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина бысгропрогрессирующего гломерулонефрита
складывается из сочетания 3 «больших» нефрологических синдромов
(табл. 3.3), каждый из которых может на определенном этапе приобретать
ведущее значение. Жалобы пациента и тяжесть его состояния во многом
обусловлены развитием соответствующих осложнений — острой левожелу-
дочковой недостаточности с отеком легких, отека мозга и острых наруше-
ний мозгового кровообращения при злокачественной артериальной 1 ипер-
тензии. нефротического криза (см. «Нефротический криз»). Необходимо
также иметь в виду, что определенная часть угрожающих жизни осложне-
ний быстропрогрессирующего гломерулонефрита, например гиперкалие-
мия, выраженность которой может стать первоочередным показанием к
проведению острого гемодиализа, нередко остаются почти бессимптомны-
ми, или их признаки, в частности тенденция к брадикардии, могут быть сво-
евременно не замеченными. Названное обстоятельство подчеркивает необ-
ходимость тщательного клин и ко-лабораторного мониторинга состояния
пациентов с быстропрогрессирующим гломерулонефритом, который зача-
стую может быть осуществлен только в условиях отделения интенсивной
терапии.
Быстропрогрессирующий гломерулонефрит
55
Клиническая картина быстропрогрессирующего
гломерулонефрита
Таблица 3.3
«Большой» нефрологи- ческий синдром — . . Проявление Угрожающая жизни осложнение
Остронефритический • артериальная гипертензия; • гематурия (в том числе ма- крогематурия); * отеки • острая левожелудочковая сердечная недостаточность с отеком легких; • отек мозга; • гипертензивная энцефало- патия; • транзиторная ишемическая атака / мозговой инсульт
Нефротический • протеинурия >13 г/сутки; • гипал ьбуминемия; • отеки, достигающие степени анасарки • венозные и артериальные тромбозы; • венозные тромбоэмболии; нефротический криз с гипо- волемическим шоком, • инфекционные осложнения (в т.ч. сепсис); • левожелудочковая сердеч- ная недостаточность (при гиперволемическом вариан- те)
Быстро прогрессирую щая почечная недоста- точность • нарастающая гиперкреати- нинемия; • неуклонное снижение ско- рости клубочковой филь- трации; • олигоанурия* • гиперкалиемия • острая левожелудочк эвая недостаточность;
' Может отсутствовать на первых этапах формирования быстропрогрессирующего гломеру-
лонефрита.
Необходимо также иметь в виду, что значительную роль в клинической
картине быстропрогрессирующего гломерулонефрита наряду с проявлени-
ями собственно почечного процесса и его осложнений, нередко приобрета-
ют признаки поражения других органов. Выраженность этих симптомов за
висит от особенностей системного заболевания: так, при гранулематозе
Вегенера могут наблюдаться геморрагический и/или фиброзирующий аль-
веолит, поражение ЛОР-органов с перфорацией носовой перегородки, сте-
нозом трахеи или гранулематозным расплавлением костей глазницы и
основания черепа, при НCV-ассоциированной смешанной криоглобулине-
мии — триада Мельтцера (кожная пурпура, артралгии, слабость) и ишеми-
ческие некрозы дистальных фаланг пальцев рук и ног, а при системной
красной волчанке — волчаночные кардит и цереброваскулит.
56
Нефрология. Неотложные состояния
ДИАГНОЗ
Быстропрогрессирующий гломерулонефрит диагностируют на основа-
нии оценки скорости ухудшения фильтрационной функции почек и выде-
ления ведущего на момент обследования нефрологическою синдрома
(остронефритического и/или нефротического).
Наряду с динамикой биохимических параметров крови (в том числе
креатининемии с последующий расчетом скорости клубочковой фильтра-
ции и калиемии) и показателей периферической крови (сывороточного со-
держания юмоглобина, количества эритроцитов, лейкоцитов и тромбоци
тов) необходимо также оценить сывороточный уровень иммуноглобулинов
А, М и G, комплемента, ANCA (с типированием их по фракциям антитела
к миелопероксидазе, антитела к лротеинкиназе-3), анти-БМК-антмтел, а
также антител к кардиолипину.
Всем больным быстропрогрессирующим гломерулонефритом показана
биопсия почки. Проведение ее необходимо в первую очередь с целью опре-
деления прогноза и выбора оптимального метода лечения: своевременно
примененная агрессивная схема иммуносупрессивной терапии иногда по-
зволяет добиться улучшения или даже восстановления почечной функции
даже в ситуации, когда степень ее ухудшения достигла терминальной по-
чечной недостаточности. В связи с этим при быстропрогрессирующем гло-
мерулонефрите биопсию почки необходимо выполнять и при выраженной,
требующей проведения гемодиализа почечной недостаючности.
Быстропрогрессирующий гломерулонефрит следует дифференцировать
с состояниями, воспроизводящими его клинически (табл. 3.4), при которых
тактика лечения может радикально отличаться. Следует тем не менее иметь
в виду, что ни одно из хронических заболеваний почек не исключаем воз-
можности присоединения быстропрогрессируюшего гломерулонефрита.
Состояния, воспроизводящие клиническую картину
быстропрогрессирующего гломерулонефрита
Таблица 3.4
Состояим*. еопроимлдяим
клин 4*еску*0 картинубыстролро- I Отлич- отглшмруяенвфрйта
Ф*сс руюшаго гломерупотфрите
* — - ~ .—-—• ---— —
Антифосфолипидный синдром / • Наличие сывороточных антител к кардиолипину
гемолитико-уремический син классов IgM и IgG и/или антител кр-гликопротеиду;
дром • повышение плазменной концентрации D димера,
продуктов деградации фибрина;
• возможна тромбоцитопения;
| • отсутствие или малая выраженность изменений
мочи (обычно «следовая» протеинурия) при суще-
ственном снижении скорости клубочковой фильтра
ции;
Быстропрогрессирующий гломерулонефрит
57
Продолжение табл 3.4
Состояние eonpo»i водящее клиническую картину быстропро- грессируюммго гломерулонефрита Отличие от том рутжефрита
• клинические проявления артериальных (острый ко- ронарный синдром / острый инфаркт миокарда, острое нарушение мозгового кровообращения) и венозных (сетчатое ливедо, тромбоз глубоких вен голеней, тромбоэмболия легочных артерий, тром- боз почечных вен) тромбозов; • связь с инфекционной диареей (при гемолитико- уремическом синдроме)
Склеродермическая нефропатия 1 • Кожные и органные признаки системной склеродер- мии. особенно леченной высокими дозами глюко- кортикостероидов в дебюте заболевания; • выраженный и некупируемый подъем АД, • отсутствие изменений мочи (или умеренная протеи- нурия без изменения мочевого осадка)
1 Острый канальцевый некроз 1 1 • Связь с приемом лекарственного препарата (особен- но нестероидного противовоспалительного сред- ства, ненаркотического анальгетика, антибактери ального препарата); • макрогрматурия (возможно отхождение сгустков крови); • быстрое развитие олигоанурии: • возможны боли в поясничной области
Острый тубуло-интерстициальный нефрит • Как правило, четкая причина (употребление лекар- ственного препарата, саркоидоз); • снижение относительной плотности мочи при отсут- ствии выраженной протеинурии
Холестериновая эмболия внутри- почечных артерий и артериол* 1 » • Связь с эндоваскулярной процедурой,, тромболизи- сом, тупой травмой живота; • выраженный подъем АД, • признаки острофазового ответа (лихорадка, поте ря аппетита, массы тела, артралгии, увеличение СОЭ, сывороточной концентрации С-реактивного белка); • гиперэозинофилия, эозинофилурия; • сетчатое ливедо строфическими язвами (чаще - на коже нижних конечностей); • системные признаки холестериновой эмболии (вне- запная односторонняя слепота, острый панкреатит, гангрена кишки, кожное сетчатое ливедо, трофиче- ские язвы)
• В редких случаях приводит к развитию быстропрогрессирующего гломерулонефрита, в том
’Пеле ANCA-ассоциированного.
58
Нефрология Неотложные состояния
ЛЕЧЕНИЕ
Основной принцип лечения быстропрогрессирующего гломерулонеф-
рита — максимально активная иммуносупрессивная терапия даже при вы-
раженном ухудшении почечной функции. При быстропрогрессирующем
гломерулонефрите риск нежелательных явлений, обусловленных агрессивной
иммуносупрессивной терапией, всегда меньше, чем не устранимая другими
способами вероятность необратимого ухудшения функции почек и связанно-
го с этим фатального исхода.
Пульс-терапию необходимо начать до получения биопсийных результа-
тов морфологического исследования гкани почки, метилпреднизолоном.
Циклофосфамид в сверхвысоких дозах присоединяют в первую очередь при
III типе быстропрогрессирующего гломерулонефрита и наличии ANCA в
сыворотке крови.
Эффективность иммуносупрессивной терапии существенно повышает-
ся при одновременном проведении плазмафереза. Плазмаферез абсолютно
показан всем больным синдромом Гудпасчера (анстельный (I) тип быстро-
прогрессирующего гломерулонефрита). Плазмаферез желательно прово-
дить перед очередной инфузией циклофосфамида. При II (иммуноком-
плексном) пше быстрон регрессирующего гломерулонефрита плазмаферез
менее обоснован, за исключением HCV-индупированной смешанной крио-
глобулинемии, при которой также целесообразна противовирусная терапия
(интерфероном-а в сочетании с рибавирином). Больные гранулематозом
Вегенера, как правило, нуждаются в длительном приеме циклофосфамида;
при микроскопическом полиангиите возможен прием азатиоприна.
Выраженность почечной недостаточности, как правило, ограничивает
применение при быстропрогрессирующем гломерулонефрите метотрексата.
Положительный опыт применения циклоспорина исчерпывается пока от-
дельными наблюдениями. Для достижения ремиссии бысгроирогрессирую-
щего гломерулонефрита III типа (в рамках гранулематоза Вегенера и ми-
кроскопического полиангиита) с успехом применяли внутривенный
иммуноглобулин, не позволивший тем не менее полностью отказаться от
стандартных схем иммуносупрессивной терапии. Для индукции ремиссии
быстропрогрессирующего гломерулонефрита при гранулематозе Вегенера у
пациентов, не переносивших циклофосфамида, возможно применение
микофенолата мофетила, хотя обоснованность этого требует уточнения в
специально планируемых контролируемых клинических исследованиях.
Продолжаются контролируемые исследования, посвященные оценке эф-
фективности ритукси.маба — моноклональных антител к CD20 — при гра-
нулематозе Вегенера; показано, что этот препарат способен уменьшать сы-
вороточный титр ANC A. Следует тем не менее подчеркнуть, что обоснование
Быстропрогрессирующий гломерулонефрит
59
применения того или иного иммунодепрессанта при быстропрогрессирую-
щем гломерулонефрите требует включения в контролируемые исследова-
ния пациентов с соответствующими исходными характеристиками» Без
предварительного изучения на быстропрогрессирующий гломерулонефрит,
очевидно, нельзя полностью экстраполировать лечебные тактики, оказав-
шиеся эффективными при других органных поражениях.
С учетом установленной на экспериментальных моделях роли проис-
ходящих из костного мозга клеток в репарации костной гкани можно пред-
полагать высокую эффективность этого лечебного подхода при быстропро-
грессирующем гломерулонефрите. При экспериментальном гломеруло-
нефрите инъекции костномозговых клеток приводили к уменьшению
инфильтрации почечной ткани макрофагами, снижению распространенно-
сти гломерулосклероза, улучшению функции почек и увеличению выжи-
ваемости животных. Показано также, что инъекции происходящих из кост-
ного мозга клеток-предшественников эндотелиоиитов при эксперимен-
тальном гломерулонефрите сопровождаются уменьшением повреждения
клубочковых эндотел ионитов и активации мезангиоцитов. В ближайшем
будущем целесообразна попытка применения этого лечебного подхода и в
клинических исследованиях.
ПРОГНОЗ
Вероятность терминальной почечной недостаточности возрастает по
мере увеличения числа почечных клубочков с полулуниями. Показано, что
при поражении 30% и более почечных клубочков у всех пациентов в тече-
ние 2 лет возникает потребность в программном гемодиализе. Потребность
в гемодиализе в дебюте болезни и пожилой возраст также ухудшают про-
гноз. При малоиммунном (pauci, III тип) быстропрогрессирующем гломе-
рулонефрите риск необратимого ухудшения функции почек возрастает в
1,8 раза при увеличении числа полностью склерозированных клубочков на
10% и в 1,5 раза — при увеличении количества клубочков с полулуниями на
10%. Выраженное поражение почечного тубуло-интерстипия, экспрессия
его структурами трансформирующего фактора роста-0 и мембранатакую-
щего комплекса комплемента (фракции С5Ь—С9) свидетельствуют в поль-
зу высокой вероятности отсутствия ответа на лечение.
До применения активной иммунодепрессивной терапии почти у 100%
больных в течение года развивалась терминальная почечная недостаточ-
ность. В настоящее время более чем у 80% пациентов удается добиться ре-
миссии. Прогноз при системных заболеваниях может определяться также
поражением других органов (сердечно-сосудистой системы, легких).
60
Нефрология, неотложные состояния
Выживаемость почечного трансплантата у больных быстропрогресси-
рующим гломерулонефритом в течение 1 года достигает 90%. Риск рециди-
ва заболевания в почечном трансплантате может быть несколько выше при
некоторых системных заболеваниях (некротизирующих ANCA-ассоцииро-
ванных васкулитах, системной красной волчанке).
ПЕРСПЕКТИВЫ
Эффективность лечения быстропрогрессирующего гломерулонефрита
может быть существенно повышена с помощью активно разрабатываемых в
настоящее время суперселективных терапевтических стратегий (с исполь-
зованием антител к трансформирующему фактору роста-Р и его рецепторам,
блока юров гремлина), тормозящих почечный фиброгенез, пролиферацию
составляющих клубочковые полулуния клеток и, возможно, индуцирую-
щих их контролируемый апоптоз.
Для первичной и вторичной профилактики быстропрогрессирующего
гломерулонефрита первоочередное значение приобретает формирование
рехистров, включающих значительное число пациентов и обеспечивающих
возможность длительного наблюдения за ними, благодаря чему можно рас-
считывать на выделение достоверных и потенциально устранимых факто-
ров риска.
Глава 4
ЗЛОКАЧЕСТВЕННАЯ АРТЕРИАЛЬНАЯ
ГИПЕРТЕНЗИЯ
Представления о злокачественной артериальной гипертензии начали
формироваться еще в первой половине XX века во многом благодаря рабо-
там Е Volhard и Т. Fahr, в которых впервые была четко описана связь стой-
кого повышения АД с быстро появляющимися признаками поражения
органов-мишеней — слепотой, неврологической симптоматикой, нарастаю-
щей левожелудочковой сердечной недостаточностью, но особенно — с неу-
клонным ухудшением фильтрационной функции почек, обусловленным
обнаруженным при аутопсии глобальным нефросклерозом. сопровождае-
мым генерализованным гиалпнозом мелких внутрипочечных артерий и ар-
териол («злокачественным нефроангиосклерозом»). В связи с отсутствием
в то время эффективных способов лекарственного снижения АД приори-
тетным направлением в научных исследованиях, посвященных проблеме
злокачественной артериальной гипертензии, оставался поиск возможных
причин и механизмов ее озлокачест вления. Работы Е.М. Тареева, обобщен-
ные в широко известной mohoi рафии «Гипертоническая болезнь», наиболее
полно охарактеризовали клинические проявления и патогенез злокаче-
ственной артериальной гипертензии, в них также были приведены некото-
рые подходы к ее лечению, сохраняющие актуальность и в настоящее время
(например, резкое ограничение потребления поваренной соли) Более того,
именно в исследованиях Е.М. Тареева и его учеников акцент в терапевтиче-
ской тактике впервые был смещен с использования заведомо неэффектив-
ных симптоматических средств к применению .мер, непосредственно на-
правленных на снижение АД. Например, результатами оригинального
клинического анализа была доказана неэффективность использовавшегося
при лечении характерной для злокачественной артериальной гипертензии
головной боли калия родоната, не влиявшего на тонус сосудов, объем цир-
кулирующей крови и натриевый гомеостаз и, таким образом, не способного
оказывать антигипертензивное действие.
Кроме того, в публикациях Е.М. Тареева были заложены основы следу-
ющего этана изучения злокачественной артериальной гипертензии, реали-
зация которого стала возможной только благодаря существенному расши-
рению с начала 1950-х голов возможностей методов обследования. Этот
этап характеризуется интенсивной разработкой принципов, позволяющих
отличать злокачественный вариант эссенциальной артериальной гипертен-
зии (гипертонической болезни) от вторичной артериальнй гипертензии.
62
Нефрология. Неотложные состояния
также нередко обладающей чертами злокаче< гвенности (ГГ Арабидзе и со-
авт.). Одновременно были уточнены детали патогенеза отдельных потенци-
ально злокачественных форм вторичной артериальной гипертензии, в пер-
вую очередь нефрогенных (М.А. Пальцев и соавт.).
В настоящее время выяснение возможных причин озлокачествления арте-
риальной гипертензии остается приоритетной задачей при обследовании паци-
ентов, и для ее решения могут быть применены современные визуализирующие
и молекулярно-генетические методы. Эволюция представлений о злокачествен-
ной артериальной гипертензии, таким образом, всегда была подчинена потреб-
ностям оптимизации тактики ведения подобных больных (табл. Г1).
Таблица 4.1
Этапы изучения злокачественной артериальной гипертензии
Этап " ’ Г" • Характеристика । Достижения и ткмдекция
1 (1920-е - 1940 е) Во время Первой мировой войны (1914-1918 гг.) было от- мечено значительное увеличе- ние распространенности зло- качественной артериальной гипертензии. Эффективные антигипертензивные препара ты отсутствовали, прогноз всегда был фатальным ' Уточнен морфологический суб 1 страт злокачественной артериаль- ной гипертензии, в том числе по- | чечный («злокачественный не- фроангиоскпероз»). Изучение злокачественной арте риальной гипертензии впервые обозначило «почечную» составля ющую в патогенезе любой артери альной гипертензии
П (1940-е - середи на 1950-х) Период Второй мировой вой- 1 ны (1939-1945 гг.) характери- . зовался еще более резким ро- стом распространенности зло- качественной артериальной гипертензии Детально охарактеризованы кли- ническая картина и исходы злока- чественной артериальной гипер- тензии. Предприняты первые по пытки ее симптоматического и па- тогенетического лечения
III (середина 1950-х - середина 19В0-Х) Значительное снижение рас- пространенности злокаче- ственного варианта эссенци- альной артериальной гипер- тензии Выяснено отличие эссенциальной артериальной гипертензии (ги- пертонической болезни) от злока- чественных вариантов вторичной артериальной гипертензии. Уточ- нены механизмы развития каждой из них. Усовершенствованы диаг- ностические стратегии (исследо- вания сывороточной концентра- ции гормонов, их предшественни ков и метаболитов, визуализирую- щие методы) Увеличено число классов антигипертензивных пре- паратов с патогенетически обо- снованным действием
IV (середина 1980-х - настоящее время) Применяется комбинирован ная антигипертензивная тера- пия, при необходимости соче- тающаяся с аферезными и диа- лизными методами лечения Ведется поиск детерминант озло- качествления артериальной ги- пертензии, в том числе генетиче- ских (например, первичных тром- бофилий с поражением почек)
Злокачественная артериальная гипертензия
63
Понятие «злокачественная артериальная гипертензия» может быть ин-
терпретировано как:
• вариант эссенциальной артериальной гипертензии (по Е.М Тарееву,
1948). характеризующийся очень быстрым, часто необратимым, пора-
жением органов-мишеней и в связи с этим — неблагоприятным про-
гнозом;
• форма вторичной артериальной гипертензии, которая, если ее при-
чину не выявили или не устраняют, приобретает злокачественное
течение.
Очевидно, что к признакам озлокачеств ления артериальной гипертен-
зии не следует относить только непосредственно повышение АД. Быстро-
пршрессирующее поражение органов-мишеней возможно и тогда, koi да
рост АД не достигает III степени артериальной гипертензии (> 180/110 мм
рт. ст.) по классификации European Society of Hypertension / Российского
Медицинского Общества Артериальной Гипертензии. По-видимому, в диа-
гностике злокачественной артериальной гипертензии мало применим «кри-
териальный» подход: ее выявление должно основываться на тщательной
оценке динамики клинических, лабораторных и инструментальных показа-
телей, отражающих как состояние центральной и органной гемодинамики,
так и степень поражения органов-мишеней (головной мозг, миокард, сосу-
дистая стенка, почки).
Признаками злокачественной артериальной гипертензии следует счи-
тать:
• выраженный подъем АД (систоло-диастолическая или изолированная
систолическая артериальная гипертензия), > 180/110 МхМ рт. ст.;
♦ резистентность к комбинированной антигипертензивной терапии
(при злокачественной артериальной гипертензии всегда возникает
потребность в повторном парентеральном применении короткодей-
ствующих антигипертензивных препаратов);
• быстро прогрессирующее и потенциально фатальное поражение ор-
ганов-мишеней.
Подъем АД при злокачественной артериальной гипертензии может воз-
никать de novo при исходно нормальном АД, что особенно типично для зло-
качественного (по Е.М. Тарееву, 1948) варианта эссенциальной артериаль-
ной гипертензии. В процессе его формирования в течение первых часов с
момента начала роста АД поражение органов-мишеней становится клини-
чески очевидным (например, ухудшение зрения вплоть до полной слепоты,
левожелудочковая сердечная недостаточность с отеком легких, гипертони-
ческая энцефалопатия с нарушением сознания и/или острое нарушение
мозгового кровообращения, острая почечная недостаточность с олигоану-
рией). Наибольшую опасность с прогностической точки зрения представля-
64
Нефрология. Неотложные состояния
ст рост систолического АД (особенно при остающемся нормальным или
почти нормальным диастолическом АД), сопровождающийся одновремен-
ным увеличением пульсового АД и характеризующийся очень высоким ри-
ском органных осложнений, развивающихся за счет повреждения сосуди-
стой стенки, в том числе эндотелиоцитов, и гемодинамического удара,
складывающегося из суммирующихся систолической и отраженной пульсо-
вых волн.
Резистентную артериальную гипертензию диагностируют при невоз-
можности снижения АД с использованием сочетания из представителей 3
классов антигипертензивных препаратов в адекватных дозах (обязательно
включая диуретик) и немедикаментозных методов лечения. Резистентность
к антигипертензивной терапии — обязательный признак злокачественной
артериальной гипертензии, хотя резистентная артериальная гипертензия
далеко не всегда исходно обладает чертами злокачественной (см. ниже).
При злокачественной артериальной гипертензии клинически ведущим
может стать вовлечение одного из органов-мишеней, однако на определен-
ном этане поражение всегда с 1анови гея полиорганным (табл. 4.2). Пораже-
ние каждого из органов-ми июней при злокачественной артериальной ти-
пертензии является потенциально фатальным.
Таблица 4.2
Вариант поражения
Органы-мишени и варианты их поражения
при злокачественной артериальной гипертензии
Головной мозг • Гипертензивная энцефалопатия (головная боль, нарушение со- знания «без» или «с» очаговой неврологической симптомати- кой); • транзиторная ишемическая атака / ишемический мозговой лн сульт; • геморрагический мозговой инсульт; • субарахноидальное кровоизлияние
Орган зрения . . . . . . • Спазм и тромбоз сосудов сетчатки. • ухудшение зрения вплоть до полной слепоты
Сердце • Острый коронарный chi дром / острый инфаркт миокарда с подъемом сегмента 57; • острая левожелудочковая недоста очность с отеком легких
Сосудистая с генка • Генерализованный периферический вазоспазм. • тромботическая микроангмопа ия; • расслаивающаяся аневризма аорты
Почки • М 1Кроальбумичурия / протеинурия, • снижение СКФ- • гиперкалиемия; • олигоанурия
Злокачественная артериальная гипертензия
65
С клинической точки зрения представляется целесообразным выделе-
ние 5 аспектов проблемы злокачественной артериальной гипертензии в не-
фрологической практике:
• злокачественный вариант эссенциальной артериальной гипертензии
как причина почечного поражения;
• злокачественная артериальная гипертензия как маркер активности и/
или быстрого прогрессирования почечного поражения при хрониче-
ских заболеваниях почек;
• злокачественная артериальная гипертензия как признак терминаль-
ной почечной недостаточности;
• резистентная артериальная гипертензия, потенциально озлокачест-
вляющаяся;
• злокачественная артериальная гипертензия, обусловленная причина-
ми, непосредственно не связанными с хронической болезнью почек.
ЭПИДЕМИОЛОГИЯ
Считают, что распространенность злокачественного варианта эссенци-
альной артериальной гипертензии была особенно велика во время Первой и
Второй мировых войн и значительно снизилась в 1950—1960-е годы про-
шлого века. Высокую частоту злокачественной эссенциальной артериаль-
ной гипертензии в указанные периоды объясняют в первую очередь продол-
жительным действием на крупные группы взрослого населения необычного
по силе психоэмоционального стресса, а также особенностями питания. Яр-
кий пример последнему — жители блокадного Ленинграда, привычный ра-
цион которых содержал количество поваренной соли, более чем в 10 раз
превышавшее общепринятые нормы. В блокадном Ленинграде злокаче-
ственная артериальная гипертензия носила как типичный — «кризовый» -
характер, так и приводила (при относительно невысоком АД) к тяжелым
дистрофическим изменениям в органах-мишенях и их последующему фа-
тальному поражению.
В целом рост заболеваемости злокачественной эссенциальной артери-
альной гипертензией, отмеченный в первой половине XX века, можно свя-
зать именно с последствиями Второй мировой войны Так, по данным
Е.М. Тареева (1948), частота возникновения злокачественной эссенциаль-
ной артериальной гипертензии, составлявшая в 1936-м году 7,5%, к 1946-м
гтш увеличилась более чем в три раза.
С другой стороны, отмеченное в последующем снижение заболеваемо-
сти злокачественным вариантом эссенциальной артериальной гипертензии
в определенной степени связано с расширением возможностей прижизнен-
5 Нефрология
66
Нефрология. Неотложные состояния
ной диат ностики вторичных форм артериальной гипертензии, способных к
озлокачествлению. Так, уже в начале 1950-х годов XX века из числа случаев
злокачественной артериальной гипертензии, исходно интерпретируемой
как эссенциальная, стали выделять наблюдения, связанные с атеросклеро-
тическим стенозом почечных артерий. В последующем стало возможным
своевременное распознавание феохромоцитомы и катехоламин-продупи-
рующих опухолей в ненадпочечниковой локализации, а также выявление
первичного антифосфолинидного синдрома и других тромботических ми -
кроангиопатий, среди клинических проявлений которых ведущим оказыва-
ется именно синдром злокачественной артериальной гипертензии. Таким
образом, ранее стереотипно интерпретируемая как эссенциальная, злокаче-
ственная артериальная гипертензия стала «разделяться» иа отдельные фор-
мы в зависимости от конкретной причины, обусловливающей ее возникно-
вение.
В когортном исследовании, выполнявшемся в течение 12 лет в Амстер-
даме, были собраны сведения о 122 больных злокачественной эссен-
циальной артериальной гипертензией, средний возраст которых составлял
44+12 лет. Среди этих пациентов преобладали мужчины (66%), 47% боль-
ных относились к черной расе, 58 — исходно страдали эссенциальной арте-
риальной гипертензией, в дальнейшем озлокачествившейся, 37 — получали
антигипертензивную терапию, а 23 — самостоятельно ее прекратили. Ори-
ентируясь на результаты данного исследования, можно сказать, что заболе-
ваемость злокачественной эссенциальной артериальной гипертензией со-
ставляет 2,7+0,9 случаев на 100 000 представителен популяции.
По-видимому, основными эпидемиологическими характеристиками
злокачественного варианта эссенциальной артериальной гипертензии сле-
дует считать:
• возникновение ес у лиц молодого и среднего возраста (то есть меньше-
го, чем типичного для дебюта эссенциальной артериальной гипертен-
зии);
• преобладание мужчин среди заболевших;
• большую частоту заболеваемости среди представителей черной расы,
особенно афроамериканцев, являющих собой «естественную» модель
злокачественного течения эссенциальной артериальной гипертензии,
поражения почек и органа зрения.
До конца не определена и истинная распространенность потенциально
злокачественной резистентной артериальной гипертензии. Изучение ее
эпидемиоло! ии затруднено в первую очередь тем, что далеко не все пациен-
ты исходно получают анти| ипертепзивную терапию, соответствующую
общепринятым стандартам. Выявление феномена резистентности артери-
альной гипертензии, исходя из его формальных критериев, зачастую невоз-
Злокачественная артериальная гипертензия
67
можно и тогда, когда величины АД остаются очень высокими, несмотря на
использование сочетания препаратов, которое само по себе (например, на-
значение p-адреноблокатора и нсдигидропиридинового антагониста каль-
ция) нередко является необоснованным. Кроме того, до конца нс установле-
ны и сроки, которые должны пройти от начала систематического лечения
артериальной гипертензии и до того времени, когда можно было бы утверж-
дать, что артериальная гипертензия действительно не уступает комбинации
из антигипертензивных препаратов, обязательно включающей диуретик.
J.P. Garg и соавт. (2005) проанализировали базу данных, содержащую
информацию о 1281 больном, обратившемся в специализированное отделе-
ние артериальных гипертензий в течение 8 лет. Только у 141 пациента
(11,0%) была констатирована истинно резистентная артериальная гипер-
тензия. М.А. Brown и соавт. (2001) среди 611 лиц, направленных на 24-
часовой амбулаторный мониторинг АД в связи с отмеченным при амбула-
торном наблюдении отсутствием его контроля, выделили ipynny из 118
больных (19,3%), страдавших именно резистентной формой артериальной
гипертензии Пациенты с резистентной артериальной гипертензией были
старше и отличались достоверно более высоким систолическим (но не диа-
столическим) АД. У 38% из них был комета i провал феномен «белого хала-
та», более выраженный при измерении АД врачом, а не медицинской се-
строй.
Распространенность злокачественной артериальной гипертензии, оче-
видно. зависит также от особенностей обследуемой группы лиц. Сравни-
тельно редко встречающаяся в настоящее время в популяции злокачест-
венная артериальная гипертензия значительно чаще обнаруживается у
пациентов, госпитализированных в отделения нефролоши и/или артери-
альной гипертензии, особенно у демонстрирующих стойкое снижение СКФ
н гиперкрсатининемию. Очевидна значительная частота развития злокаче-
ственной артериальной гипертензии при некоторых заболеваниях, сопрово-
ждающихся тяжелым поражением почек — системной красной волчанке,
первичном антифосфолипид ном синдроме, системной склеродермии, а так-
же системных васкулитах, например узелковом полиартериите.
ЭТИОЛОГИЯ
Этиологические факторы, обусловливающие озлокачествление артери-
альной гипертензии, разнообразны (табл. 4.3), но попытка их выявления
всегда оправдана, так как во многих случаях дает возможность их устране-
ния, направленною если не на нормализацию, то по крайней мере на сни
жение АД. Среди возможных причин развития злокачественного варианта
68
Нефрология Неотложные состояния
эссенциальной артериальной гипертензии называют избыточное психоэмо-
циональное напряжение, травмы и ожоги. Известно, что в короткий срок
после начала действия необычного по силе психотравмирующего фактора
возможен резкий подъем АД с поражением ирга нов-мишеней. Так, описан
случай тяжелого гипертонического криза, сформировавшегося при исходно
нормальном АД у молодого врача, работавшего в блокадном Ленинграде и
проводившего обход в палате в момент попадания в нее артиллерийского
снаряда.
Генетические детерминанты злокачественной эссенциальной гипертен-
зии установить не удается как в силу относительно редкого выявления этой
формы болезни, так и в связи с тем, что даже в периоды, когда частота за-
болеваний возрастала, семейные случаи практически нс наблюдались. Тем
не менее, у части пациентов приобретение артериальной гипертензией зло-
качественного течения, в том числе за счет поражения почечного микропир-
куляторного русла по типу тромботической микроангиопатии, может быть
связано с носительством определенных генетических маркеров. Реализуя
свое протромбшсиние действие, генетические детерминанты тромбофилий
могут непосредственно модулировать формирование почечного артериоло-
склероза — одной из ключевых составляющих морфогенеза злокачествен-
ной артериальной гипертензии. Так, анализ биопсий почки, выполненных в
госпитале университета штата Айова (США), выявил, что в группе боль-
ных, у которых был констатирован артериолосклероз неустановленного
происхождения, не менее 10% пациентов демонстрировали носительство
мутанни фактора V ( Leiden) или 20210А варианта геиа протромбина, а поч-
ти 30% — Т1 -вариант гена метилентетрагидрофолат-редуктазы. Частота об-
наружения генетических детерминант первичной тромбофилии у лиц, у ко-
торых при морфологическом исследовании гкани почки были выявлены
изменения, расцененные как артериолосклероз неясного генеза, оказалась
достоверно выше, чем у больных с другими морфологическими вариантами
почечного поражения.
Таблица 4.3
Этиология злокачественной артериальной гипертензии
Труппа угийлогичвемих факторов МНВВМНВИВвН
Внеш несредовые • Психоэмоциональный стресс; • избыточное потребление поваренной соли • нарушение нутритивного статуса (голодание, кахек- сия); • травма; • тяжелый ожог
Злокачественная артериальная гипертензия
69
Продолжение табл. 4.3
Группа этиологических факторов Генетические детерминанты* Пример • Полиморфизм генов, кодирующих компоненты ренин ангиотензин-альдостероновой системы и ре- цепторы к ним (АПФ, ангиотензиногена. рецепторов к ангиотензину типа 1, альдостерон-синтазы); • генетические маркеры тромбофилий (фактор V (Leiden). С/Т-полифорфизм гена метилентетрагидрофолат-редуктазы (MTHFR), 4С/5О-полиморфизм гена ингибитора ак t иватора плазминогена типа 1 (РАМ), 20210А вариант гена протромбина)
Заболевания почек • Хронический “ломерулонефрит; • реноваскулярная артериальная гипертензия (фибро- мускулярная дисплазия, атеросклеротический стеноз почечных артерий); • тромбоз и тромбоэмболия почечных артерий; • холестериновая эмболия внутрипочечных артерий
Системные заболевания • Системная красная волчанка; • HCV-ассоциированная смешанная криоглобулине мия; • системная склеродермия; • узелковый пол мастери из. • первичный антифосфолипидный синдром; • гемолитико-уремический синдром 1 тромботическая тромбоцитопеническая пурпура
Эндокринные нарушения • Феохромоцитома и вненадпочечниковые катехо- ламин продуцирующие опухоли (хромаффиномы); • ренин-продуцирующие опухоли из клеток юкста гломерулярного аппарата
Лекарственные препараты • Оральные контрацептивы; • наркотики (кокаин, экстази) и психоактивные веще- ства, • эфедрин и его производные, используюширгя для по- давления аппетита
’ Значение не установлено, хотя роль маркеров первичных тромбофилий представляется
весьма вероятной.
При поиске генетических детерминант злокачественной артериальной
гипертензии определенные перспективы связывают с изучением клиниче-
ского и прогностического значений полиморфизма генов, кодирующих ком-
поненты ренин-ангиотензин-альдостероновой системы и рецепторы к ним.
При обследовании 101 пациента, которых в течение 10 лет наблюдали в
одном клиническом центре, было установлено, что носительство ТТ-ва-
тнганта гена ангиотензиногена (М235Т-полиморфизм) было ассоциировано
с ростом вероятности возникновения злокачественной артериальной гипер-
тензии в 14,3 раза чате, чем у представителей контрол иной группы, у кото-
рых была диагностирована артериальная гипертензия, не имевшая призна-
70
Нефрология. Неотложные состояния
ков злокачественности, и в 9,4 раза чаше, чем у нормотензивных лиц.
Выявление генетических факторов, предрасполагающих к злокачественной
артериальной гипертензии, могло бы способствовать оптимизации ведения
пациентов" например, применению антикоагулянтов у носителей маркеров
первичных тромбофилий или использованию агрессивной фармакологиче-
ской блокады ренин-ангиотензин-альдостероновой системы (ингибитора
АПФ + блокатора рецепторов ангиотензина II, возможно, в сочетании с
прямым ингибитором ренина или антагонистом альдостерона) у пациентов,
у которых были обнаружены прогностически неблагоприятные варианты
соответствующих генов.
Озлокачествление артериальной гипертензии при хроническом гломе-
рулонефрите может отражать не только нарастание активности поражения
почек (при этом удается определить и другие его маркеры — увеличение
протеинурии, гематурии), в том числе формирование остронефритическо-
го синдрома, но и свидетельствовать о приобретении почечным процессом
быстропрогрессирующего течения (при этом всегда отмечают рост гипер-
креатининемии и снижение СКФ). Иногда при хронических нефропатиях
констатируют сочетание причин, обусловивших озлокачествление артери-
альной гипертензии: В.Р. Nguen и соавт. (1988) описали злокачественную
артериальную гипертензию, возникшую у исходно нормотензивного боль-
ного первичной (идиопатической) мембранозной нефропатией вследствие
тромбоза почечных вен и развития быстропрогрессирующего варианта по-
чечного поражения (было отмечено возникновение типичных гломеруляр-
ных полулуний). При некоторых хронических заболеваниях почек форми-
рование злокачественной артериальной гипертензии может определяться
наличием особых иммунопатогенетических маркеров (при IgA-нефропатии
таковыми могут быть антиэндотелиальные антитела класса IgA).
Злокачественная артериальная гипертензия, нередко полностью обрати-
мая после своевременной реваскуляризации почек, может наблюдаться при
стенозирующем поражении почечных артерий вследствие фибромускулярной
дисплазии, атеросклероза, воспалительных изменений при аортоартериите
Такаясу, а также при их окклюзирующем тромбозе. В качестве ведущего фак-
тора, обусловливающего нарастание АД, ее резистентности к комбинирован-
ной антигипертензивной терапии и приобретение артериальной гипертензией
злокачественного течения, выступает гипоперфузия — ишемия почечной тка-
ни, сопровождающаяся гиперпродукцией ренина и последующей активацией
ренин-анпютензин-альдостеронового каскада, а также образованием других
медиаторов стойкого вазоспазма, например зндотелина-t. Злокачественная
артериальная гипертензия возможна и при эмболических поражениях вну-
трипочечных артерий и артериол, например, кристаллами холестерина
(см. «Холестериновая эмболия почечных артерий»).
Злокачественная артериальная гипертензия
71
Формирование злокачественной артериальном гипертензии может отра-
жать тяжесть почечного поражения при системных заболеваниях- активность
почечного васкулита при HCV-ассоциированной смешанной криоглобулине-
мии, распространенный тромбоз почечного микроциркуляторного русла при
первичном антифосфолипидном синдроме и других тромботических микро-
ангиопатиях, генерализованное вовлечение почечного микроциркуляторного
русла в процессе развития истинной склеродермической почки и необрати-
мой почечной недостаточности. Выраженная артериальная гипертензия, в
том числе с признаками злокачественности, отличает прогностически небла-
гоприятныг типы волчаночного нефрита, в частности ассоциированного с
антифосфолипидным синдромом, а также позднюю стадию поражения почек
при узелковом полиартериите и гранулематозе Вегенера, характеризующую-
ся глобальным нефриангмоклерозом и тубуло-интсрстициальным фиброзом
и уже нс требующую применения иммунодепрессантов.
Как в популяции, так и у больных хроническими заболеваниями почек
озлокачествление артериальной 1 ипертензии может быть обусловлено нали-
чием катехоламин-продуцируюших опухолей: опухоли надпочечников (фе-
охромоцитомы) или опухоли вненадпочечниковой локализации (хромаф-
финномы). Как правило, не метастазирующие и по формальным критериям
остающиеся доброкачественными феохромоцитомы нередко характеризуют-
ся крайне недоброкачественным течением, поскольку как при первом подъе-
ме ЛД, так и при резком его снижении, в том числе спонтанном, развиваются
опасные для жизни сердечно-сосудистые осложнения.
Подавляющее большинство случаев феохромоцитомы являются спора-
дическими, однако при билатеральном расположении опухолей можно
предполагать их генетическую детерминированность. Феохромоцитому
рассматривают как составляющую ряда «больших* наследственных заболе-
ваний, например болезни von Hippel-Lindau, множественной зидокринной
неоплазии II типа, нейрофиброматоза I типа (заподозрить который можно
на основании обнаружения на коже типичных пятен цвета «кофе с моло-
ком» — <cafi' au lait>), а также у носителей мутантных субъединиц гена, ко-
дирующего сукци нат-дегидрогеназу.
Злокачественное течение артериальной гипертензии может также быть
связано с наличием рениномы — опухоли из юкста-гломерулярных клеток,
секретирующей ренин. Обычно рениномы представляют собой узлы с чет-
кими границами, размер их не превышает 8—10 мм; опухолевые клетки име-
ют круглую, овальную и веретеиовидную форму и демонстрируют признаки
ядерной атипии. В опухолевой ткани, как правило, обнаруживают также
инфильтраты из мастоцитов. Ведущий признак ренином — высокая систоло-
диастолическая артериальная гипертензия, в том числе имеющая кризовое
течение. Во время гипертонических кризов возможно развитие ишемии го~
72
Нефрология. Неотложные состояния
лонного мозга, миокарда, почек, а также стенки тонкой кишки с соответ-
ствующими клиническими проявлениями. Описано развитие обусловлен-
ной рениномой злокачественной артериальной гипертензии у больного
первичной (идиопатической) мембранозной нефропатией.
Развитие злокачественной артериальной гипертензии может быть свя-
зано с приемом лекарственных препаратов определенных классов, в том
числе неконтролируемым. Активация компонентов эндотелий-зависимого
звена гемостаза, иногда наблюдающаяся вследствие приема эстроген-
содержащих препаратов, в том числе оральных контрацептивов, может при-
водить к развитию почечной тромботической микроангиопатии, проявляю-
щейся в том числе злокачественной артериальной гипертензией.
Тромботическая микроангиопатия может развиваться и у лиц, употре-
бляющих кокаин, по крайней мере, среди причин смерти кокаинистов опре-
деленное значение имеет злокачественная артериальная гипертензия. При
морфологическом исследовании ткани почек больных злокачественной ар-
териальной гипертензией, индуцированной кокаином, обнаруживают фи-
бриноидный некроз стенок ар1ериол и множественные тромбы в них. Зло-
качественная артериальная гинер 1ензия у кокаинистов может сочетагься с
тромбоцитопенией и гемолизом, воспроизводя клинико-лабораюрную кар-
тину гемолшико-уремнческого синдрома.
Злокачественную артериальную гипертензию относят также к нежела-
тельным явлениям, сопряженным с приемом психотропных препаратов, в
частности клозапина.
В качестве индуктора злокачественной артериальной гипертензии мо-
гут выступать препараты с выраженной симпатомиметической активно-
стью, в том числе средства традиционной медицины, не применяемые в
.медицинских учреждениях, прошедших официальную процедуру государ-
ственного лицензирования К числу таковых относятся алкалоиды эфедры,
содержащиеся в том числе в составе растительных препаратов, используе-
мых для лечения ожирения. Применение алкалоидов эфедры может сопро-
вождаться резистентным к стандартным методам терапии подъемом АД и
быстрому поражению органов-мишеней.
Еще более разнообразны причины резистентной артериальной гипер-
тензии. течение которой может приобретать злокачественный характер, при
этом следует напомнить, что многие из них потенциально полностью устра-
нимы (табл. 4.4). Так, по данным J.P. Garg и соавт. (2005), по вкладу в струк-
туру причин резистентной артериальной гипертензии лидируют неадекват-
ность антигипертензивной герамии (58%) и нежелание больных лечиться
(16%). Определенная часть (9%) больных резистеншой артериальной ги-
пертензией не лечатся из-за некоторых психологических причин, например
нежелания признать артериальную гипертензию болезнью и/или постоян-
Злокачественная артериальная гипертензия
73
но принимать лекарственные препараты при удовлетворительном самочув-
ствии. У 6% пациентов резистентность артериальной гипертензии обуслов-
лена феноменом «белого халата» (феномен «white coat», изолированная
офисная артериальная гипертензия): величины АД, оцененные в медицин-
ском учреждении, у таких больных значительно превосходят величины, по-
лучаемые при измерении АД вне его стен. После подробного обследования,
направленного на уточнение причины резистентной артериальной гипер-
тензии, у 53% больных удается снизить АД до 140/90 мм рт. ст. и ниже за
счет оптимизации антигипертензивной терапии, в частности режима прие-
ма диуретиков, и увеличения числа используемых препаратов (в среднем
с 3,7±0,9 до 4,1±1,0).
Повторные попытки уточнения этиологии злокачественной и/илн рези-
стентной артериальной гипертензии, требующие применения высокотехно-
логичных и нередко дорогостоящих методов обследования, тем не менее
обоснованны, поскольку только после устранения конкретной причины
можно рассчитывать если не на нормализацию, то по крайней мере на сни-
жение АД у этой категории пациентов.
Известно, что позднее этиотропное лечение злокачественной резистент-
ной артериальной гипертензии заведомо менее эффективно. Так, результа-
ты анализа итальянской базы данных, в которую вошли сведения о 284 па-
циентах с феохромоцитомой, наблюдавшихся в 18 клинических центрах с
1978 по 1997-й годы после хирургического вмешательства, показали, что ар-
териальная гипертензия полностью регрессировала у 59,3% больных, у
26,8% — она стала доступной фармакологическому контролю, а у 13.9% — ее
выраженное!ь не изменилась, что можно объяснить именно поздней диа-
гностикой феохромоцитомы. Следует специально подчеркнуть, что при не-
возможности воздействия на главную причину любая патогенетическая те-
рапия злокачественной артериальной гипертензии оказывается заведомо
малоэффективной.
Этиология резистентной артериальной гипертензии
Таблица 4.4
Пример
Особенности лечения • Неадекватное лечение (нерациональный выбор классов анти-
гипертензивных препаратов, их доз и режима приема);
• задержка натрия и воды у гациентов, которым показаны диуре-
тики;
• одновременное применение препаратов рекомбинантного че-
ловеческого эритропоэтина в высоких дозах, глюкокорти косте
роидов, циклоспорина, такролимуса,
• использование препаратов, содержащих алкалоиды эфедры
(в т.ч в составе средств традиционной медицины).
• применение нес ероидных противовоспалительных препара-
тов и ненаркотических анальгетиков (в т.ч. самостоятельное)
74
Нефрология. Неотложные состояния
Продолжение табл. 4.4.
Причина
Пример
Особенности пациента
• Курение,
• злоупотребление алкоголем (в тч по типу запоев).
• артериальная гипертензия «белого халата» (изолированная
офисная артериальная гипертензия) или изолированная амбу-
латорная артериальная гипертензия;
• отсутствие приверженности лечению;
• употребление наркотиков (резистент пая артериальная -hi ео
тензия может быть следствием их приема (кокаин), но можез
развиваться и в период синдрома отмены);
• употребление большого количества пищевых продуктов, со-
держащих глицирризиновую кислоту (леденцы, жевательные
резинки с лакрицей)
Особенности артери- • Хроническая болезнь почек / стойкое снижение скорости клу-
альной гипертензии
бочковой фильтрации;
• ~*н |рующее поражение почечных артерий
• феохромоцитома;
• первичный гиперальдостеронизм,
• ожирение / метаболический синдром.
• гипертиреоз / гипотиреоз;
• болезнь Кушинга
ПАТОГЕНЕЗ
Патогенез злокачественной артериальной гипертензии мало изучен, но
уже в настоящее время можно уверенно говорить о гетерогенности механиз-
мов ее развития, преобладающих при конкретных заболеваниях. Неодно-
кратно предпринимавшиеся попытки выделения универсального циркули-
рующего фактора, индуцирующего развитие злокачественного варианта
эссенциальной артериальной гипертензии, успеха не имели. Тем не менее
можно предполагать наличие общих механизмов становления злокачествен-
ной артериальной гипертензии и поражения органов-мишеней, сохраняю-
щих свое значение независимо от исходного пускового фактора. К таким
механизмам относятся:
• массивная гинерпродукция циркулирующих и тканевых медиаторов
вазоконстрикции (ренина, ангиотензинов, эндотел и на 1);
• угнетение эндотелиальной NO-синтазы и образования эндотелиаль-
ного релаксирующего фактора (NO), снижение чувствительности эн
дотелиоцитов к образовавшемуся NO:
• расе гппиства внутриорганной гемодинамики с глобальной гипоксией
органов-мишеней, приводящей к активации образования в их тканях
профиброгенных хемокинов;
Злокачественная артериальная гипертензия
75
• активация эндотелийзависимого и сывороточного звеньев гемостаза
(так, продемонстрировано, что у больных злокачественной артериаль-
ной гипертензией по сравнению с нормотензивными представителями
контрольной группы достоверно снижена активность ADAMTS13-
протеазы, разрушающей фактор von Willebrand, концентрация кото-
рого при этом нарастает);
• снижение скорости клубочковой фильтрации, сопровождающееся
дальнейшим усугублением дисфункции эндотелия;
• гипоперфузия — ишемия почечных канальцев с задержкой натрия и
воды, способствующей нарастанию перегрузки объемом;
• постепенное снижение сердечного выброса, провоцирующее нараста-
ние периферического вазоспазма и перегрузки сопротивлением;
• быстро прогрессирующие тканевой тромбо- и фиброгенез, приводя-
щие к функциональной недостаточности органов-мищенеЙ.
МОРФОЛОГИЯ
Характерной чертой раннего злокачественного нефросклероза, разви-
вающегося при злокачественной артериальной гипертензии, является изме-
нение внутрипочечной гемодинамики Вначале происходит повреждение
сосудов почек — либо вследствие длительно существующей доброкаче-
ственной гипертензии, сопровождающейся повреждением стенок артериол,
либо de novo вследствие коагулопатии, артериита или какого-то воздей-
ствия, вызывающего обострение гипертензии. В результате усиливаются
проницаемость стенок мелких сосудов для фибриногена и других белков
плазмы, повреждение эндотелия, гибель отдельных клеток сосудистой стен-
ки и агрегация тромбоцитов. Все эти изменения приводят к развитию фи-
бриноидного некроза артериол и мелких артерий, отеку интимы и тромбозу
сосудов. Митогенные факторы, выделяемые тромбоцитами (например,
тромбоцитарный фактор роста) и другими клетками, вызывают гиперпла-
зию гладкомышечных клеток сосудов, что приводит к формированию ти-
пичного для злокачественной гипертензии гиперпластического артериоло-
склероза и сужению просвета сосудов — развивается ишемия почек.
Описанные изменения отличаются в первую очередь в почечных аф-
ферентных артериолах, активизируется рснин-ангиотензиновая система,
играющая решающую роль в патогенезе злокачественной артериальной
гипертензии. Как уже было сказано, у пациентов со злокачественной арте-
риальной гипертензией повышен уровень ренина в плазме. При этом
формируется самостимулирующаяся система: ангиотензин II вызывает
констрикнию сосудов почек, а присутствующая почечная ишемия стиму-
76
Нефрология. Неотложные состояния
лирует секрецию ренина. Воздействие различных медиаторов, в том числе
тромбина и ангиотензина II, на эндотелиальные клетки сосудов почек сти-
мулирует продукцию эндотелина, также оказывающего вазоконстриктор-
ный эффект. На моделях злокачественной артериальной гипертензии у
крыс выявлено, что экспрессия эндотелина в почках при этом состоянии
значительно увеличивается. Показатель уровня эндотелина в ткани почки
наиболее объективно отражает его активнос ть, так как плазменный эндо-
телии обладает коротким периодом полураспада и очень небольшой кон-
центрацией в плазме.
На моделях злокачественной гипертензии у животных выявлено, что
блокирование рецептора 1 типа ангиотензина II предотвращает ее развитие.
Ангиотензин II при связывании со своим рецептором I типа инициирует экс-
прессию в ткани почки хемокина МСР-1 (макрофагального хемоаттрактант-
ного белка), который вместе с другими хемокинами вызывает макрофагаль-
ную инфильтрацию. Этот провоспалительный эффект, опосредуемый через
рецептор I типа ангиотензина II, играет нс последнюю роль в развитии злока-
чественного нефросклероза. Высокое АД «заставляет» мезангиальные клетки
почечных клубочков продуцировать ангиотензин II На культуре клеток по-
чечных клубочков показано, что при пом усиливаются пролиферация и
апоптоз мезангиальных, эндотелиальных и эпителиальных клеток. Одной из
возможных причин постоянной активации ренин-ангиотензиповой системы
являеюя также мнкроаш иопатнческий гемолиз, приводящий к сужению и
тромбозу почечных артерии и, следовательно, к реноваскулярной ишемии.
Таким образом, повышенный уровень ренина в плазме, наблюдаемый при
злокачественной артериальной гипертензии, обусловливает повреждение со-
судов и нарушение функции почек.
Сосуды почек подвергаются различным патологическим изменениям,
обусловленным повышенным давлением. Если при небольшом повышении
артериального давления возникает приспособительная вазоконстрикция
почечных артериол с целью поддержания постоянной тканевой перфузии и
предотвращения передачи высокого давления на мелкие сосуды, то при вы-
соком АД этот физиологический механизм авторегуляцни нарушается, и
давление в почечных сосудах становится пропорциональным общему АД,
что приводит к повреждению стенок сосудов. Наиболее подвержены такому
повреждению артерии мелкого калибра и артериолы, среди которых в боль-
шей степени поражаются прегломерулярные сосуды.
Самым серьезным поражением почечных сосудов при артериальной ги-
пертензии, служащим отличительной особенностью злокачественной ги-
пертензии, является фибриноидный некроз, в первую очередь афферентной
артериолы. Чаше всего некроз развивается в гиал и визированных артерио-
лах, но у молодых пациентов с тяжелой злокачественной гипертензией он
может поражать и неизменные сосуды. Вслед за некротическими измене-
Экжачественная артериальная гипертензия
77
анями в пораженных сосудах происходит отложение эозинофильного фи-
бриллярного вещества, представленного фибрином и фибриногеном, что
можно выявить с помощью гистохимической окраски и иммувофлюорес-
оенции Просвет артериол уменьшается в размере в результате утолщения
их стенки, .жстравазапии эритроцитов и тромбоза. В стенке артериол могут
обнаруживаться лейкоциты, что свидетельствует о развитии воспалитель-
ного процесса.
Вторым типичным изменением сосудов почек при злокачественной ар-
териальной гипертензии является также миоинтимальная гипертрофия и
гиперплазия, характеризующаяся гиперпластическими изменениями глад-
комышечных клеток и интимы мелких артерий и артериол. На ранних ста-
диях эти изменения проявляются выраженным утолщением интимы вслед-
ствие разрастания миксоидной малоклеточной соединительной ткани, что
приводит к уменьшению просвета сосуда. С течением времени происходит
ее замещение зрелой соединительной тканью и концентрическое утолщение
сосудистой стенки вследствие пролиферации концентрически расположен-
ных гладкомышечных клеток и отложения вещества, напоминающего веще-
ство базальных мембран. Такие изменения называют «луковичной шелу-
хой». Наблюдаются они чаще всего в дугообразных и интерлобулярных
артериях.
При злокачественной гипертензии в почечных клубочках развиваются
ишемические изменения, характеризующиеся сморщиванием и коллапсом
капиллярных петель. Кроме этих диффузных ишемических повреждений
могут также отмечаться сегментарные изменения, проявляющиеся участка-
ми некроза ткани почки в местах фибриноидного некроза артериол, а также
образованием мелких эпителиальных или фиброэпителиальных полулу-
нии. При электронно-микроскопическом исследовании выявтяется, что эн-
дотелий отечен и местами разрушен или отделен от гломерулярной базаль-
ной мембраны прозрачным материалом. Изредка обнаруживают нити
фибрина, расположенные субэндотелиально или интракапиллярно. С по-
мощью иммунофлюоресценции можно выявить очаговые отложения фи-
брина, фибриногена, IgM и компонентов комплемента.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Клинические проявления злокачественной артериальной гипертензии
складываются в первую очередь из признаков поражения органов-мишеней.
Вместе с тем предположение об озлокачествлении артериальной гипертен-
зии или развитии ее dp novo может быть сделано уже на основе анализа
л . '.г> н характеристик подъема АД (табл 4.5). Общепринятый маркер
злокачественной артериальной гипертензии — двусторонний отек
78
Нефрология, неотложные состояния
диска зрительного нерва, который может сочетаться с кровоизлия-
ниями в роговицу и стекловидное тело, а также развитием инфарктов
спинного мозга. Каждое нз клинических проявлений злокачественной
артериальной гипертензии следует рассматривать как потенциально фа-
тальное.
Клинические проявления злокачественной
артериальной гипертензии
Таблица 4.5
Клиническое промление Описание
Подъем АД • Формирован ие denovo (при исходной артериальной нормо- или гипотензии) или на фоне ранее существовавшей артери- альной гипертензии; • АД быстро достигает очень высоких величин; • исчезновение периодов физиологического снижения АД (на- пример, ночных) - «сближенные гипертонические кризы» по Е М. Гарееву (1948) [1], • нарастание АД ночью; • резистентность к комбинации из препаратов, представляю щих 3 класса антигипертензивных средств, включая диуре тик, примененных в максимальных дозах
Поражение центральной нервной системы • Трудно переносимая головная боль, • сонливость днем, отсутствие сна ночью, • нарушение сознания (ступор — сопор — кома, бред, галлюци нации); • очаговая неврологическая симптоматика (при ишемическом или геморрагическом инсульте), постоянная или исчезающая в течение первых 24 часов (транзиторная ишемическая ата- ка); • Менингеальные симптомы (при кровоизлиянии всубдураль ное или эпидуральное пространство)
Поражение глаз • Ухудшение зрения на оба глаза, • выпадение полей зрения; • слепота (транзиторная или необратимая)
Поражение сердца • Нарастающая левожелудочковая недостаточность с отеком легких; • острый коронарный синдром / острый инфаркт миокарда с подъемом сегмента ST; • остро возникающие дилатация сердца, митральная и трику- спидальная регургитация; • фибрилляция предсердий, желудочковые аритмии
Поражение стенки аорты и крупных сосудов • Утрата эластических свойств и увеличение жесткости стенок сосудов, сопровождающиеся дальнейшим ростом систоличе- ского АД, • расслоение стенки аорты, особенно в области аневризмат» ческих мешков
Злокачественная артериальная гипертензия
79
Продолжение табл 4.5
ГКЛИН»Ч»«О. I ОПЖ.НИ.
проявлен»»
T-“*3U'A1JMC ПЛИОк * 'Я 3 ПЕ2ш_>1 4t2i f’T) ’
Поражение почек • Падение СКФ; • нарастание креатининемии; • олигоанурия, • микроальбуминурия - протеинурия; • гематурия (в том числе макрогематурия); • гиперкалиемия; • инфаркты почек
«Общие» • ухудшение аппетита; • снижение массы тела вплоть до кахексии; • сетчатое ливедо. • резкая бледность кожных покровов; • снижение температуры тела; • увеличение СОЭ; • анемия; • тромбоцитопения / тромбоцитоз; • рост сывороточного уровня С-реактивного белка
ДИАГНОСТИКА
Наряду со своевременным распознаванием озлокачеств ления основной
задачей диагностики злокачественной артериальной гипертензии остается
выявление ее возможных причин. В связи с зтим обследование пациента со
хтокачественной артериальной гипертензией включает различные инстру-
ментальные и лабораторные методы (табл 4.6). Обследование больных зло-
качественной артериальной гипертензией следует осуществлять только в
условиях специализированного стационара.
Методы обследования больных злокачественной
артериальной гипертензией
Таблица 4.6
Метод с^следования Комментарий. Возможное показание к л» имененм»р
Общий анализ крови Выявление анемии, тромбо- цитопении / тромбоцитоза, । оценка СОЭ Всем больным
Биохимический анализ соови Оценка креатининемии, ка лиемии, натриемии, сыво роточной концентрации аль- бумина, мочевой кислоты, мочевины, КФК, гликемии Всем больным
80
Нефрология. Неотложные состояния
Продолжение табл. 4.6
Метод обследования Комментарий Возможное показание К применению
Расчет скорости клубочко- вой фильтрации по формуле Cockroft-Gault или MDRD Оценка фильтрационной функции почек, в том числе ее динамики Всем больным
Общий о на л из мочи Выявление протеинурии, ге- матурии, оценка относи- тельной плотности мочи Всем больным
Определение сывороточно- го уровня С-реактивного белка (высокочувствитель- ным методом) Наиболее точный метод оценки динамики данного показателя Всем больным
Коагулограмма Обязательная оценка МНО, АЧТВ, плазменного уровня D-димера Всем больным
Определение плазменной концентрации тропонина Т или 1 Наиболее надежный метод диагностики острого коро нарного синдрома При наличии болей за гру- диной
Иммунологические маркеры (антитела к ДНК, антитела к кардиолипину, ANCA, крио- глобулины) Выявление связи злокаче- ственной артериальной ги- пертензии с системными за- болеваниями Желательно выявлять у всех пациентов, особенно при наличии соответствующих клинических признаков
Оценка сывороточной кон- центрации Т4 и тиреотроп- ного гормона Выявление нарушения функ- ции щитовидной железы как возможной причины злока чественной артериальной гипертензии При наличии клинических признаков
Оценка плазменной актив- ности ренина и сывороточ- ной концентрации альдосте- рона Выявление признаков пер- вичного гиперальдостеро- низма. рениномы и ренова- скулярной артериальной ги пертензии По возможности — всем больным (необходимо со- блюдение правил забора образцов крови)
Оценка плазменной концен- трации катехоламинов и их метаболитов, экскреции их с мочой Диагностика феохромоци- томы и хромаффинном При наличии соответствую- щих показаний
Эхокардиография Оценка размеров полостей сердца, состояния сердеч ных клапанов, сократитель- ной Функции миокарда ле- вого желудочка Всем больным
Ультразвуковое исс ледова ние брюшной полости Оценка размеров почек, пе- чени, селезенки, возможное выявление увеличения над почечников Всем больным
Змжэчественная артериальная гипертензия
81
Продолжение табл. 4 6
метод обсл*до**мия Комментарий Возможное показание К Применению
Мультиспиральная компью- -ерная томография или магнитно-резонансная то- мография органов брюшной олости, аорты и ее ветвей Диагностика различных форм вторичной артериаль- ной гипертензии (может по- требовать применения кон- трастных агентов) При наличии соответствую- щих признаков
Автоматический суточный мониторинг АД Метод оценки суточной ди намики АД, в том числе под действием лечения Всем больным
«огтеровский мониторинг Выявление эпизодов мио- кардиальной ишемии и па- роксизмальных нарушений сердечного ритма Всем больным
а-а лиз генетических марке- ров Результаты могут быть ин- терпретированы с клиниче- ских позиций только е отно- шении генетических марке ров тромбофилий При наличии клинических и анамнестических признаков
ЛЕЧЕНИЕ
Все больные, у которых предполагается или констатирована злокаче-
ственная артериальная гипертензия, подлежат экстренной госпитализации
э отделение интенсивной терапии, располагающее возможностями проведе
а,ся жстренного гемодиализа, ультрафильтрации и плазмафереза. Обще-
принятая тактика лечения злокачественной артериальной гипертензии не
заработана; возможные терапевтические варианты экстраполируют из
схем ведения больных осложненными формами гипертонического криза
«см. также гл. 5 «Гипертонический криз*).
Первоочередной целью лечения злокачественной артериальной пгпер-
’•язии является торможение прогрессирования поражения органов-
мишеней и предупреждение необратимой утраты их функций. Достижение
ватной цели возможно только при нормализации или по крайней мере сни-
жении АД, в связи с чем у пациентов со злокачественной артериальной ги-
"верп нзией приходится применять комбинации антигипертензивных пре-
паратов, в том числе короткодействующих и используемых парентерально
' табл. 4.7), которые далеки ие всегда соответствуют общим правилам анти-
теле ртензивной терапии. Медикаментозные методы лечения могут соче-
ться с плазмаферезом или ультрафильтрацией, особенно обоснованных
тон нарастании сердечной и/или почечной недостаточности.
82
Нефрология. Неотложные состояния
Таблица 4 7
Подходы к выбору схемы медикаментозного лечения
злокачественной артериальной гипертензии
ж • - Клиническая характеристика поражения [ FT— _ । Лекарственный препарат Лемрспижныипр.пар., . «Хрыймож.тбыт* или«н«.ни.прм>«рето.
1 Быстро л регрессирующее поражение органов - мишеней Ингибиторы АПФ (капто- прил, эналаприлат), лабета- лол, клонидин, фуросемид -
Гипертензивная энцефало- патия Натрия нитропруссид, лабе талон Клонидин, метилдопа
Внутричерепное кровоизли- яние / мозговой инсульт Натрия нитропруссид лабе- талол Диазоксид, нифедипин
Сердечная недостаточность / отек легкого Петлевой диуретик 4- инги битор АПФ + натрия нитро- пруссид или нитроглицерин Р-адреноблокатор, верапа- мил
Острый коронарный син- дром / острый инфаркт ми- окарда Нитроглицерин + р-адрено- блокатор; натрия нитропруссид ± Р-адреноблокатор Диазоксид, гидралазин
Расслаивающаяся аневриз- ма аорты Р-адреноблокатор, лабета- лол + натрия нитропруссид Диазоксид нифедипин, ги- дралазин
Гиперкатехоламинемия Натрия нитропруссид, фен- толамин, лабеталол (J-адреноблокатор в режиме монотерапии
ПРОГНОЗ
Прогноз больных злокачественной артериальной гипертензией наибо-
лее неблагоприятен среди всех вариантов артериальной гипертензии.
Структура осложнений зависит прежде всего от заболеваний, лежащих в
основе озлокачествления артериальной гипертензии. Почти у трети нацией -
тов развивается почечная недостаточность, более чем у 10% — фатальный
мозювой инсульт и хроническая сердечная недостаточность. Факторы риска
и детерминанты прогноза при злокачественной артериальной гипертензии
убедительно не установлены, а проведение исследований, направленных иа
их выявление, осложнено трудностью формирования репрезентативных
групп пациентов. По данным G.Y. Lip и соавт. (2000), риск смерти и необ-
ратимого ухудшения функции почек у больных злокачественной артери-
альной гипертензией возрастает по мере увеличения возраста, диастоличе
скоро АД и креатинииемии в дебюте заболевания.
Люначественная артериальная гипертензия
83
ПЕРСПЕКТИВЫ
Возможности улучшения ближайшего и отдаленною нршноза больных
хтокачественной артериальной гипертензией во многом определяются со-
вершенствованием диагностической тактики, направленной на выявление
этиологии заболевания. Особенно актуально выделение ранних, доклини-
ческих маркеров и факторов риска озлокачествления артериальной гипер-
тензии, в связи с чем необходимо продолжение обсервационных исследова-
ний и формирование крупных регистров пациентов. По мере составления
одобиых регистров станет возможным проведение контролируемых кли-
нических исследований, направленных на совершенствование лечебной
тактики и включение в нее препаратов, представляющих новые классы ан-
тигипертензивных средств (прямых ингибиторов ренина, антагонистов
эндотелина-!. ншибиюров нейтральной вазопептидазы).
Неотложные мероприятия
• Контроль гемодинамических показателей (АД, частоты сердечных со-
кращений).
• Контроль диуреза, общего анализа мочи, показателей, характеризую-
щих функцию почек (креатининемии, калиемия, скорость клубочко-
вой фильтрации).
• При появлении неврологической симптоматики — консультация не-
вролога.
• Определение показаний к конкретным классам антшипертензивных
препаратов и экстракорпоральным методам лечения (плазмаферез).
• При калиемии > 6.5 мЭкв/л — обсуждение вопроса о проведении экс-
тренного гемодиализа.
Глава 5
ГИПЕРТОНИЧЕСКИЙ КРИЗ
Предложено несколько определений гипертонического криза, ориенти-
рованных как на абсолютные величины АД, так и на скорость его нараста-
ния. величину риска и геми вовлечения органов мишеней. При гипертони-
ческом кризе рост АД, как правило, сопровождается определенной клини-
ческой симптоматикой, а предупреждение поражения органов-мишеней
невозможно без быстрого начала лечебных мероприятий, направленных н«=
контролируемое снижение АД. Именно поэтому гипертонический кри
всегда рассматривают как неотложное состояние, в том числе как одно иг
показаний к госпитализации
В качестве одного из наиболее часто используемых диагностиче-
ских критериев гипертонического криза называют величин} диастоличе-
ского АД >120 мм рт. ст., а также повышение систолического АД до
180 мм рт. ст. и выше.
В 2008-м году в рекомендациях РМОАГ/ВНОК (третьего пересмотра)
по диагностике и лечению артериальной гипертензии было сформулирова-
но определение гипертонического криза:
гипертонический криз — остро возникшее выраженное повышение АД, со-
провождающееся клиническими симптомами, требующее немедленного кон-
тролируемого его снижения с целью предупреждения или ограничения пора-
жения органов-мишеней.
Клиническая оценка предполагаемого гипертонического криза требует
решения нескольких приведенных ниже задач:
• тифференциаиии гипертонического кри ja от персистирующего повы-
шения АД;
• своевременного выделения предикторов и ранних маркеров пораже-
ния органов-мишеней:
• констатации признаков озлокачествления артериальной гипертензии
(см. «Злокачественная артериальная гипертензия»);
• выявления причин гипертонического криза (см. ниже);
• определения оптимальной схемы купирования гипертоничек кого кри-
за, контроля ее реализации с предупреждением последствий чрезмер-
ного и, или очень быстрого снижения АД.
В нефрологической практике, в том числе у пациентов с ранее диагно-
стированной хронической болезнью почек, гипертонический криз может
отражать:
Ъпертонический криз
85
• нарастание активности почечного процесса (развитие гипертониче-
ского криза может опережать соответствующую динамику изменений
мочи и функции почек);
• приобщение почечной болезнью быстропрогрессирующего характера'
• развит не терминальной почечной недостаточности;
• появление острых нарушений почечной гемодинамики с ишемией тка-
ни почек, в первую очередь тромбозов и эмболии почечных артерий;
• возникновение последствий от применения лекарственных препара-
тов, способствующих росту АД (глюкокортикостероидов, циклоспо-
рина, эритропоэтина в чрезмерных дозах);
• недостаточную приверженность пациента рекомендованной антиги-
пертензивной терапии.
ЭПИДЕМИОЛОГИЯ
Данные о распространенности гипертонических кризов немногичислен-
-»ы. а существенные различия в характеристиках обследованных групп па-
тентов затрудняют их однозначную интерпретацию. Основной энидемио-
' <ической закономерностью является снижение числа гипертонических
кризов, особенно осложняющихся поражением ормнов-мишеней, по мерс
. зеличения числа пациентов со своевременно распознанном артериальной
~»пертензией. получающих анти! ипертензивную терапию. Вопреки раенро-
• граненному ошибочному представлению гипертонический криз редко от-
ражает истинный дебют артериальном гипертензии Более чем у 90% бочь-
-ых. госпитализированных в связи с гипертоническим кризом и его
-ложнениями, артериальная гипертензия была диагностирована задолго
-» возникновения этого эпизода.
В Российской Федерации распространенность артериальной гипертен-
ип. ее тяжесть и частота угрожающих жизни осложнений неуклонно воз-
легают. При этом число пациентов, у которых удается достичь целевого
\Д (то есть тех. у кого антигипертензивная терапия может быть признана
<*фективной), не превышает 15%-ного от общего количества страдающих
-этериальний 1ипсртензией. Во многом именно этими обстоятельствами
можно объяснить отмечаемый в нашей стране рост частоты гнпергониче-
ких кризов: в течение каждых 2 лет количество вызовов бршал «Скорой
медицинской помощи» в связи с их развитием увеличивается почти на 10%.
М« жно утверждать также, что количество обращений к врачу, связанных с
"ляертоническим кризом или его последствиями, одинаково или даже прс-
<ходит число плановых посещений амбулаторных медицинских учрежле-
•ч! с целью динамического, в том числе профилактического, обследования.
86
Нефрология, неотложные состояния
1аким образом, существенная распространенность гипертонических кри-
зов — один па наиболее ярких показателей, по крайней мере частично объ-
ясняющий высокую частоту фатальных и инвалидизирующих сердечно-
сосудистых осложнений, в том числе мозговых инсультов
ЭТИОЛОГИЯ
Гинер юни чес кий криз может возникать у пациентов, страдающих как
зссе1 шпальной, так и вторичными артериальными 1 ипертензиями. Тем не
.менее ням ио себе вторичный характер артериальной гипертензии нс всегда
яв 1ястся достаточным ,ьля объяснения гипертонического криза (табл. 5.1)
Кризовое течение является типичным для вторичной артериальной гипер-
тензии. вызываемой катехоламинпродуцирующимн опухолями (феохромо-
цитомой и локализующимися вне надпочечников — хромаффиномами)
Как правило, не метаоазирующие и по формальным критериям остающие-
ся добро качественным и (феохромоцитомы нередко характеризуются крайне
недоброкачественным течением в связи г возможностью развития опасных
для жизни сердечно-сосудистых осложнений. Продемонстрировано, что \
59,7% нацист ок с (феохромоцитомой случаются гипертонические кризы,
вне которых у 21,1% АЛ остается нормальным как в горизонтальном. Так и
в вертикальном положении.
Причины гипертонического криза
Группа причин
Таблица 5 >
Причина
Общие
• Психоэмоциональный стресс.
• физическая нагрузка (особенно анаэробная).
• интенсивное курение.
• перегрузка объемом (неадекватная доза или несоблюдение ре
жима приема диуретиков у пациентов, в них нуждающихся);
• употребление большого количества продуктов, содержащих пова
ренную соль,
• неадекватные дозы и режим приема препаратов;
• невыполнение рекомендаций врача (снижение приверженности
лечению);
• прием лекарственных препаратов, усугубляющих артериальную
гипертензию (адреномиметиков (в том числе в виде сосудосужи-
вающих «капель в нос»), нПВП, ненаркотических анальгетиков,
препаратов эритропоэтина, циклоспорина, такролимуса, ингиби-
торов моноаминоксидаэы),
• употребление большого количества глицирризиновои кислоты
(жевательной резники, леденцов с лакричным вкусом);
• злоупотребление алкоголем (особенно по типу «запоев»), период
абстиненции;
• употребление наркотиков (кокаина, производных амфетамина.
в период абстиненции - героина)
Ью*гртонический криз
87
Продолжение табл. 5.1
Группа причин
“слчины, вызываю-
щие развитие вто-
z ичных форм арте-
z иальной гипертен
Причина
• Феохромоцитома и хромаффиномы с гилеркатехоламинемиеи.
• тиреотоксикоз;
• ренин-секретирующие опухоли (источник — клетки юкиагломеру
лярного аппарата),
системные васкулиты (узелковый полиартериит, аортоартериит
Такаясу) с ишемическим и воспалительным поражением почек;
• нарастание активности хронического почечного заболевания
(обычно совпадает с увеличением выраженности изменений мочи -
протеинурией, гематурией и/или ухудшением функции почек),
• резкое и/или необратимое ухудшение функции почек;
• стенозирующее поражение почечных сосудов (реноваскулярная
артериальная гипертензия),
• преэклампсия — эклампсия;
• опухоли мозга с внутричерепной гипертензией
Вместе с тем тпсртонические кризы типичны далеко не для всех форм вто-
тсгчных артериальных гипертензий. Так, для первичного гинеральдостерониз.ма
:• лее типична стойкая систоло-диа толпческая артериальная г инертензия, до-
—игающая по выраженности подъема АД III степени. Гипертонические кризы
три первичном гиперальлостеронизме регистрируют сравнительно редко.
Хорошо известно, что развитие гипертонического криза может отражать
называемую изолированную офисную артериальную гипертензию, или
стернальную гипертензию «белого халата» («white coat») Артериальная
'глертепзия «белого халата» может быть первоначально расценена как рези-
-ентная. Так, М.А. Brown и соавт. (2001) среди 611 лиц, направленных на
амбулаторный 24-часовой мониторинг АД в связи с отсутствием его контро-
ля на амбулаторном этапе ведения, выделили группу из 118 больных (19,3%),
которых была констатирована резистентная форма артериальной гипер-
-* *нзии. При этом у 38% пациентов с резистентной артериальной гипертензи-
ей был отмечен феномен «белого халата», более выраженный при измерении
*Д врачом, а не медицинской сестрой. Распознавание изолированной офис-
-й артериальной гипертензии требует выполнения амбулаторного автома-
“лческого 24-часового мониторинга АД.
Среди «общих» причин, обусловливающих развитие гипертонического
<гиза. необходимо специально подчеркнуть несоответствие тактики анти-
•’.лертензивной терапии общепринятым стандартам. Хорошо известны наи-
5 лее распространенные тактические ошибки при проведении антигипер-
- нзивной терапии:
• применение только короткодействующих антигипертензивных препа-
ратов;
• попытка достижения целевого АД с помощью одного антигипертезив-
ного препарата (в том числе с помощью максимальных доз) при исхо-
88
Нефрология Неотложные состояния
дном систолическом АД > 160 мм pi ст. и/или величинах АД. превы-
шающих целевые более чем на 20/10 мм рт. ст.;
• использование малых доз антигипертензивных препаратов,
• назначение антигипертензивных препаратов, отсутствуют!их в обще
принятых рекомендациях;
• пренсбреженш немедикаментозными методами лечения артериаль-
ной гипертензии (низко- и бессолевой диетой, дозированными аэроб-
ными физическими нагрузками).
Наряду с этим снижение эффективности антигипертензивной терапии,
сопровождающееся увеличением вероятности развития гипертонического
криза, может также быть связано со снижением приверженности пациента
назначенному лечению. По данным некоторых клинических исследований
более 50% пациентов, госпитализированных в специализированные стацио-
нары в связи с осложненным течением гипертонического криза, в течение
предшествующей недели не выполняли данных им рекомендации по прие-
му антигипертензивных препаратов. Недостаточная приверженность анти-
гипертензивной терапии может объясняться:
• плохой! ее переносимостью, связанной как с развитием специфичных
для конкретного класса антигипертензивных препаратов побочных
явлений (например, кашля, индуцированного ингибиторами АПФ
эректильной дисфункции, возникающей при приеме тиазидовых диу-
ретиков), так и с ухудшением самочувствия вследствие резкого сни-
жения АД (головокружений, слабости);
• неатекватным представлением пациента ош л i лечения артериальной
гипертензии, которая заключается не только в улучшении самочув-
ствия, а в первую очередь в снижении риска ин вал и лизирующих и фа-
тальных осложнений. Достижение этой цели подразумевает пожиз-
ненный прием антигипертензивных препаратов;
• высокая стоимость антигипертензивных препаратов
Снижение приверженности антигипертензивной терашш. как и неадек-
ватный выбор дозы и режима их приема, обусловливают существенное уве-
личение вероятности гипертонических кризов. Данная группа причин со-
храняет свос значение как при эссенциальной, так и при вторичных
артериал ьн ых ги пертензня х.
ПАТОГЕНЕЗ
Патогенез гипертонического криза складывается ил двух взаимно до-
полняющих составляющих, к которым относятся (габл. 5.2):
• чрезмерная активация эндогенных систем, обусловливающих вазо-
констрикцию и увеличение общего периферического еопрошвления с
Ьюертонический криз
89
одновременно нарастающей задержкой натрия, приводящей к усугу-
блению перегрузки объемом,
• угнетение систем, регулирующих вазодилатацию и натрийурез, и или
избыточную активность систем, обусловливающих вазоконстрикцию
и задержку натрия.
Таблица 5.2
Механизмы патогенеза гипертонического криза
мциа механизмов. способсгкукикмх
нарастанию АД
• -«^ивация ренин-ангиотензим-
з-ьдостероновой системы с последующи-
ми персистирующей органной вазокон-
-рикцией, задержкой натрия и воды, уве-
'имением экспрессии медиаторов ткане-
вого фиброза
• ~ эвреждение эндотелиоцитов гемодина
мическим ударом с активацией системы
а-<дотепинов (в первую очередь -
^ндотелина 1).
• "и’-ерактивация симпатической нервной
:истемы с нарастанием частоты сердечных
гокращений, сердечного выброса и спаз-
мом сосудов
-----------------------------------------
Недостаточность махаиижмоа
способствующих снижению АД
• Сохранение базального тонуса системы
натрий-уретических пептидов или ее ак-
тивация, недостаточная для эффективно-
го противодействия ренин-аигиотензин-
альдостероновой системе
• Угнетение эндотелиального релаксирую-
щего фактора (оксида азота — NO) и сни
жение чувствительности эндотелиоцитов
к образовавшемуся NO.
• Снижение тонуса системы вазодипататор-
ных простагландинов (в том числе почеч-
ных)
• Недостаточная активность парасимпати
ческой нервной системы
Избыток в циркулирующей крови ангиотензина II и энлителина-1. от-
мечающийся в период гипертонического криза, а также собственно гемоди
-лмичсский удар по эидотелиоцитам, возникающий в процессе резкого
одъема АД, определяют становление приоритетного механизма развития
• ложней ни [ ипертопического криза — глобальной эндотелиальной дне-
- • нкции. Гемодинамическое повреждение эндотелиоцитов в виде их чрез-
мецного растяжения и деформации сопровождается явлениями, определя-
• .дими дальнейшее повреждение органов-мишеней. — прежде всего
репрессией этими клетками ряда тканьдеструктивных медиа юров, в гом
•»сле:
• ялерного фактора транскрипции медиаторов фиброгенеза (TGF0,
RANTES) NF-кВ и связанных с ним провой целительных цитокинов
( и нтерлей кина-6);
« моноцитарного хемотокс и некого протеина типа 1 (МСР-1) и интер-
лейкина-8;
• молекул адгезии (Р-селектина, Е-селектина, ICAM-1);
• эндоеелина-Е
Персистирующий вазоспазм усугубляется возникающим при раггяже-
-ии эндотелиальных клеток накоплением в их цитоплазме и сосудистых
.1ЛКОМЫП1СЧНЫХ клетках ионов кальция. Таким образом, возможное по-
90
Нефрология Неотложные состояния
вреждение органов-мишеней, осложняющее i ипертоническии криз, во мно-
гом определяется последствиями нарушения функции эндотел иоцито в, за-
кономерно нарастающими в условиях стойкого подъема АЛ, в свою очередь
постепенно усиливающегося по мере присоединения новых механизмов,
поддерживающих стойкий вазоспазм (экспрессии эндотелина-1, накопле-
ния внутриклеточного кальция), и становящегося все труднее устранимым
с помощью антигипертензивных препаратов.
МОРФОЛОГИЯ
Симптомы гипертонического криза обусловлены острым повреждением
эндотелия сосудов и активацией тромбоцитов. Развивающаяся ишемия со-
судистой стенки, несоответствие между вазоконстрикцией и дилатацией,
увеличение сосудистой проницаемости вызывают нарушение функций
сердца, центральной нервной системы и почек. В отсутствие немедленной
адекватной терапии в результате ишемии и кровоизлияний развиваются не-
обратимые повреждения органов.
При исследовании артериол, как правило, обнаруживается их гиалиноз.
который в случаях развития криза на ранней стадии заболевания может от-
сутствовать. При электронно-микроскопическом исследовании артериол
хорошо видны следующие морфологические признаки криза:
• спазм артериолы, проявляющийся гофрированностью и множествен-
ными разрывами базальной мембраны интимы;
• разрыхление сосудистой стенки за счет плазматического пропитыва-
ния;
• фибриноидный некроз сосудистой стенки;
• диапедезные кровоизлияния, проявляющиеся экстраваскулярным
расположением форменных элементов крови;
• тромбоз.
Применение специальных методов окраски демонстрирует увеличе-
ние экспрессии зндотелиицитами эндотелина-1, NFKB, молекул адгезии
(1САМ-1, Е— и Р-селектина).
Универсальным морфологическим субстратом осложненного гинерю-
нического криза является деструкция эндотелиоцитов и фибриноидный не-
кроз органных артериол. Учалки тромбоза микроциркуляторного русла до-
полняются очагами диапедезных кровоизлияний. Венулы часто бывают
полнокровными. Признаки тканевого повреждения зависят от вида кон-
кретного осложнения, к наиболее серьезным из которых относят ишемиче-
ский или геморрагический мозговой инсульт, острый инфаркт миокарда,
острую левожелудочковую недостаточность с отеком легких.
Ъпертоиический криз
91
При осложненных гипертонических кризах почти всегда выявляют отек
белого вещества головного мозга, клинически проявляющийся гилертони-
«tv'KOH энцефалопатией. Возможно также обнаружение очагов ишсмичсско-
т и или геморрагического инсультов, кровоизлияния в мягкие мозговые
холочки. При осложнении гипертонического криза фатальной сердечной
^достаточностью левый желудочек может быть расширен, в его миокарде
клможно наличие очагов ишемического некроза; легкие полнокровны,
:~ечны.
КЛИНИЧЕСКАЯ КАРТИНА
Выделяют две основные клинические фирмы гипертонического криза.
• осложненный гипертонический криз сопровождается быстро разви-
вающимися угрожающими жизни осложнениями, появлением или
усугублением поражения орган ив-ми теней. Он требует немедленного
начала лечебных мероприятий, направленных на снижение АД, с по-
мощью парентерального введения антигипертензивных препаратов;
• неосложненный гипертонический криз характеризуется соответ-
ствующими клиническими проявлениями (головной болью, гошно-
той, одышкой, стабостью), но не сопровождается очевидным пораже-
нием органов-мишеней
Осложненный гипертонический крнз может стать дебютом злокаче-
ственной артериальной гипертензии (см «Злокачественная артериальная
-ипертензия»). Признаки осложненного гипертонического криза включают:
• гипертоническую энцефалопатию (судороги, нарушения сознания);
• мозговой инсульт;
• острый коронарный синтром:
• острую левожелудочковую недостаточное! ь с от» ком нтких
• расслаивающуюся аневризму аорты;
• острую или быстропрогрессирующую почечную недостаточноеть
Гипертонический криз всегда рассматривают как осложненный, если он
хл ни кает:
• при феохромоцитоме или катехиламин-продуцируклцих опухолях
вненадпочечниковой локализации (хромаффинномах):
• при преэклампсии или эклампсии беременных;
• в сочетании с субарахноидальным кровоизлиянием или после травмы
головного мозга;
• у послеоперапионных больных и/или при наличии высокого риска
кровотечения;
• на фоне приема наркотиков (амфетаминов, кокаина).
92
Нефрология. Неотложные состояние
Гипертонический криз всегда отличается внезапностью и быстротой
возникновения жалоб. Жалобы, типичные для гипертонического криза,
включают:
« головную боль;
♦ головокружение;
• тошноту;
• ухудшение зрения;
• кардиалгии;
• ощущение сердцебиения, перебоев в работе сердца,
• одышку;
• озноб;
• повышенную влажность, шнеремию или бледность кожных покровов.
Сочетание гипертонического криза со стенокардией может свидетель-
ствовать о развитии острого коронарного синдрома, а также и расслоении
аневризмы аорты, при этом, как правило, также возникает одышка. Нарас-
тание одышки, положение ортопноэ — признаки острой левожелудочковой
11СДОСТЭТОЧ ности.
Выраженная головная боль, головокружение, сонливость, заторможен-
ность указывают на развитие гипертонической энцефалопатии, изменения
сознания (ступор — сопор — кома) и /или очаговая невролш ичсская сим-
птоматика — на острое нарушение мозгового кровообращения
Формирование острой почечной недостаточности может выражаться в
олигоанурии.
При гипертоническом кризе Moiyr также проявляться признаки заболе-
вания обусловливающие его развитие: например, резкая тахикардия и соот-
ветствующие глазные симптомы — при тиреотоксикозе, выраженная ги-
перемия кожи и возбуждение — при свойственной феохромоцитомам
гиперкатехоламинемии.
ДИАГНОСТИКА
Задачи диагностики гипертонического криза включают ;
• дифференциацию i ипсртопического криза от персистирующего выра-
женного повышения АД, типичного для тяжелой артериальной гипер-
тензии,
• определение клинического варианта гипертонического криза (ослож-
ненный, неосложненный) и риска поражения органов-мшпеиси,
• уточнение причины гипертонического криза и характера заболевания,
лежащего в его основе.
тектонический криз
93
Отличить длительно существующую выраженную артериальную гипер-
-тн-шю от гипертонического криза можно, ориентируясь на особенности
хзлиб пациента и динамику признаков поражения органов-мишеней. Диф-
ференциация л их состояний необходима в первую очередь для определе-
ния тактики ведения больных (табл. 5.3).
Таблица 5 3
Отличия гипертонического криза от длительно существующей
тяжелой артериальной гипертензии
признаки Гипцртоиический криэ Тяжелая автвриа лъная гипертензии
“здъем АД Неуклонное быстрое нарас- тание АД АД стабильно высокое, мо гут отмечаться его колеба- ния (не всегда только подъ- ем)
« эдобы Всегда Нередко отсутствуют
_эг1знаки «неотложности» гхтояния (стенокардия, —аэрологическая симптома- --•<а) Могут быть ведущими в клинической картине При осмотре нередко не вы являются
“сизнаки поражения тг"анов-мишеней Возникают впервые и/или быстро нарастают Могут обнаруживаться; не- редко присутствуют ста- бильные признаки функцио- нальной недостаточности органов-мишеней
"э^тика ведения Необходима быстрая нор- мализация АД: в дальней- шем — подбор постоянной антигипертензивной тера- пии Подбор комбинированной антигипертензивной тера- пии с учетом особенностей поражения органов мишеней
Программа обследования больного гипертоническим кризом должна
включать:
• измерение АД на обеих руках (различие > 20 мм рт. ст. может указы-
вать на аортоартериит Такаясу — атеросклеротическое поражение ар-
терий верхних конечностей, которое может сочетаться с атеросклеро-
тическим стенозом почечных артерий);
• определение частоты сердечных сокращений (при тиреотоксикозе и
гинеркатехоламинемии, свойственной феохромоцитоме и хромаф-
фин номам, возможна выраженная тахикардия);
• определение пульса (частоту сердечных сокращений следует оцени-
вать при аускультации сердца): быстрое изменение его наполнения
или постепенное исчезновение — признаки расслаивающейся анев-
ризмы аорты-
94
Нефрология. Неотложные состояв ея
• аускультацию живота — возможно обнаружение шема над аортой и
почечными артериями;
• электрокардиографию;
• эхокардшл рафию;
• ультразвуковое исследование брюшной полости;
• общий анализ крови;
• биохимическое исследование крови:
• при предположении об остром коронарном синдроме — определение
плазменной активности тропонина Т или I;
• общин анализ мочи;
• определение концентрации катехоламинов и/или их метаболитов в
крови и моче — предпочтителен забор образцов крови на «высоте* ги-
пертоническою криза
У больных осложненным гипертоническим кризом, госпитализирован-
ных в стационар, целесообразно проводить мониторит ЭКГ и АД. Про-
грамма обследования больных гипертоническим кризом может быть расши-
рена, если врач предполагает, что в ею основе нежит заболевание, которое
может сопровождаться резким подъемом АД.
ЛЕЧЕНИЕ
Лечение гипертонического криза следует начинать немедленно. При
неосложненном гипертоническом кризе в течение первых 2 часов АД следу-
ет снижать не более чем на 25% от исходной величины. Достижение целево-
го АД осуществляют в течение нескольких часов, но нс более чем в течение
первых 24- 48 часов от начала лечения.
Все больные осложненным гипертоническим кризом должны быть го-
спитализированы в отделение интенсивной терапии. В течение первых
30—120 минут АД снижают не более чем на 25% от исходною, спустя сле-
дующие 6 часов АД должно составлять не более 160/100 мм рт ст. При
расслаивающейся аневризме аорты и острой левожелудочковой недоста-
точности необходимо добиться снижения АД на 25% от исходного в те-
чение первых 5 -10 минут; оптимальная продолжительность достижения
величины систолического АД в 100 -110 мм рт. си. составляет около
20 ми ну г.
При 1 ипертоническом кризе применяют короткодействующие ангши-
пертензивныс препараты, как правило, парентерально. Выбор антигипер-
гензишюги препарата осуществляют с учетом клинических особенностей
гипертонического криза (табл. 5.4).
—ср тонический криз
95
Принципы выбора антигипертензивных препаратов,
использующихся для лечения гипертонического криза
Таблица 5.4
Мрмантгмтртонйчдемого легких с систолической дис- Суакцией левого желудочка " «— Предлоч - пьныйантигр11ерт*нзииныи препарат ил и сФчетжни* пр»л« етои Обязателен петлевой диуретик; натрия нитропруссид, никардипин или фенолдопам в сочетании с нитрогли- церином
2~ек легких с диастолической .^функцией левого желудочка Эсмолол, лабеталол. метопролол или верапамил в со- четании с нитроглицерином и петлевым диуретиком
т~рый коронарный синдром Лабеталол. эсмолол в комбинации с нитроглицерином
>~ертоническая энцефалопатия Никардипин. лабеталол или фенолдопам
-а спаивающаяся аневризма Лабеталол или комбинация эсмолола с никардипином. или комбинация натрия нитропруссида с эсмололом или метопролола тартратом (вводимым внутривенно)
~эеэкламсия, экламсия Лабеталол или никардипин
2срая почечная недостаточность Никардипин. верапамил
>~ертонус симпатической нерв- -о> системы, в том числе после риема кокаина Верапамил, дилтиазем, никардипин в сочетании с бензодиазепинами
> ертонический криз, возник- _.»л в послеоперационном пери- не Эсмолол, лабеталол или никардипин i 1 - _ . _ 1
Cr-оый ишемический инсульт / £-»-ричере лное кровоизлияние Никардипин, лабеталол, фенолдопам
Натрия нитропруссид — прямой вазодилататор, одновременно сниэкаю-
гз»й тонус артериол и венул и таким образом уменьшающий как пре-, так и
гостнагрузку. Натрия нитропруссид быстро снижает АД, не приводя тем не
менее к его неконтролируемому падению. Следует иметь в виду возмож-
ное, ь феномена «рикошета» — быстрого подъема АД после прекращения
жвфузии натрия нитропруссида. При наличии гипертонической энцефало-
патии. развитии гранзиторной ишемической атаки, ишемического или ге-
моррагического инсульта, а также кровоизлиянии в мозговые оболочки на-
трия нитропруссид противопоказан в связи со способностью повышать
знл'тричерепное давление. Установленная в контролируемых исследовани-
ях способность натрия нитропруссида увеличивать смертность больных
хтрым коронарным синдромом / острым инфарктом миокарда объясняет-
ся его способностью ухудшать регионарный миокардиальный кровоток, в
связи с чем при гипертоническом кризе, ассоциированном со стенокардией,
96
Нефрология. Неотложные состояние
этот препарат противопоказан. Передозировка натрия нитропруссида опас-
на в связи с развитием цианидной интоксикации (этот препарат содержит
до 40% цианидов), в связи с чем его назначение недопустимо при почечной
и печеночной недостаточности. При передозировке натрия нитропруссида
назначают тиосульфат натрия и витамин В12.
Нитраты применяю! для снижения АД у пациентов с острым коронар-
ным синдромом / острым инфарктом миокарда, а также при острой левоже-
лудочковой недостаточности. Чаще всего используют нитроглицерин и изо-
сорбида динитрат. Установлено, что болюсное введение изосорбила нитрата
больным гипертоническим кризом с кардиогенным отеком легких позволяет
достичь дополнительного снижения частоты случаев возникновения потреб-
ности в искусственной вентиляции легких по сравнению с комбинацией изо-
сорбида динитрата, вводимого внутривенно капельно, и фуросемида [31 ].
При остром коронарном синдроме, расслаивающейся аневризме аорты и
отеке легких, связанном с диастолической дисфункцией левого желудочка,
целесообразно парентеральное применение кардиоселективпых р-адрено-
блокаторов. Эсмолол — карлиоселективный р-адреноблокаюр ультрако-
роткого действия, антигипертензивное действие которого начинается уже
спусчя первые 60 секунд после начала болюсного введения. Продолжитель-
ность действия эсмолола составляет 10—20 минут [3]. 1 (аряду с земололом
для купирования гипертонических кризов используют также метопролола
тартрат.
Селективный блокатор а-1-адренорецепторов и неселективный р-адрг-
иоблокатор — лабеталол — вызывает снижение АД спустя 2—5 минут после
инфузии; продолжительность его действия составляет 2—4 часа. Лабеталол
в мспыпей степени, чем «чистые» р-адреноблокаторы, снижает сердечный
выброс. Его широко применяют для купирования гипертонических кризов,
в том числе при беременности (этот препарат практически нс растворим
жирами, в связи с чем почти не проникает через плаценту).
В последние годы для купирования гипертонических кризов широко ис-
пользуют препараты новых поколений дигидропиридиновых антагонистов
кальция. Никардипин способен существенно улучшать коронарный и цере-
бральный кровотоки, причем дозу препарата не изменяют в зависимости от
массы тела пациента. Клевидипин — дигидропиридиновый антагонист
кальция III поколения с ультракороткой продолжительностью действия
В настоящее время клевидипин рассматриваю г как препарат выбора для ле-
чения гипертонических кризов, возникших в послеоперационном периоде.
Фенолдопам — периферический вазодилататор, реализующий свое дей
ствиезасчет стимуляции периферических допаминовых рецепторов J типа.
Начало гипотензивного эффекта наблюдают спустя 5 минут после инфу-
зии, продолжительность его составляет 30—60 минут. Отмена или прекра-
Ьпертонический криз
97
пение действия препарата не сопряжены с феноменом «рикошета». Уста-
новлено, что фенолдопам может улучшать почечный кровоток и в связи с
этим способствовать росту СКФ.
При прсэкламсии для снижения АД но-прежнему используют внутри-
JtHHoc введение 25%-ного раствора сульфата магния. Препарат в дозе
5—10 мл вводят внутривенно струйно, после чего начинаю! длительную ин-
t V3ino со скоростью 1 г/час.
Петлевые диуретики применяют при гипертонических кризах, ассоции-
рованных с острой левожелудочковой недостаточностью, их можно соче-
тать с ингибиторами АПФ.
При неосложненном гипертоническом кризе антигипертензивные пре-
хараты (каптоприл, клонидин гидрохлоротиазид) назначают также перо-
рально. Использования нифедипина следует по возможности избегать в
гзязи с риском неконтролируемого снижения АД и других угрожающих
кизни нежелательных явлений. Гидрохлоротиазид оптимален при боль-
шинстве вариантов неосложненного гипертонического криза, поскольку
ж жет выступать альтернативой препаратам, назначаемым парентерально, а
1 дальнейшем — назначаться па длительный срок в составе комбинирован*
*>й антигипертензивной терапии.
При стойком ухудшении функции почек наиболее обосновано использо-
вание никардипина, фенолдопама, возможно также назначение верапамила,
•абеталола, .смолола и метопролола. Использования каптоприла и энала-
zp плата следует пи возможности избегать в связи с риском неконтролируе-
мой гиперкалиемии, нарастанием креатининемии.
Таким образом, выбор тактики лечения гипертоническою криза осу-
л-ествляется с учетом его клинических особенностей. Лекарственные пре-
врати применяют по определенным схемам и с обязательным контролем
э чможных нежелательных явлений (табл. 5.5).
Таблица 5.5
Схемы применения препаратов, использующихся для лечения
гипертонического криза, и возможные нежелательные явления
Препарат
?-злап рилат
Схем* приема
1,25 мг в течение 5 минут каждые
4—6 часов; возможно повышение
дозы на 1.25 мг каждые 12-24 часа
до максимальной - 5 мг/6 часов
Неж«ла?елы*ы»«елемия
_____ _____ _ _
Артериальная гипотензия (осо
бенно при высокооен иновых со-
стояниях), головная боль, голо-
вокружение, кашель
Эсмолол
500 мкг/кг массы тела (нагрузоч-
ную дозу) вводят в течение 1 ми-
нуты, в дальнейшем — инфузия со
скоростью 25-50 мкг/кг/мин, воз-
можно ее увеличение на 25 мкг/
кг/мин каждые 10-20 минут до
максимальной — 300 мк'/кг/мин
Головокружение, чувство жара,
нарушения внутрисердечной
проводимости, боль в месте
инъекции
* Л^фрология
98
Нефрология. Неотложные состояния
Продолжение табл. 5.5.
— x Смемалрмема Нежелательные явления Н » 1* ДДМВ, - L - я
Лабеталол Начальный болюс - 20 мг, по- вторные — 20—80 мг или инфузия со скоростью 2 мг/мин до дости- жения максимальной суммарной суточной дозы 300 мг Артериальная гипотензия, голо- вокружение, тошнота, рвота, па- рестезии, бронхоспазм
Фенолдопам 0,1 мкг/кг/мин — начальная ско- рость введения, ее увеличивают на 0,05—0,1 мкг/кг/мин до макси мальной —1,6 мкг/кг/мин Тошнота, головная боль
Никардилин 5 мг/час, прирост на 2,5 мг/час каждые 5 минут до максималь- ной — 15 мг/час Головная боль, головокружение, чувство жара, тошнота, отек ло- дыжек, тахикардия
Натрия нитропрус- сид 0.5 мкг/кг/мин, максимально - 2 мкг/кг/мин Интоксикация цианидами, го- ловная боль, тошнота/рвота, мышечный спазм, чувство жара
Нитроглицерин 5 мкг/мин, прирост на 5 мкг/мин каждые 5—10 минут до макси- мальной - 60 мкг/мин Головная боль, головокружение, тахифилаксия
Прогноз
Осложненный гипертонический криз всегда ассоциирован со значи-
тельным ухудшением прогноза, связанным с увеличением риска фатальных
осложнений — сердечно-сосудистых и почечной недостаточности Неослож-
ненный гипертонический криз также следует относить к категории очень
высокого риска, особенно тогда, когда его развитие не сопровождается по-
следующей коррекцией антигипертензивной терапии, направленной на до-
стижение и поддержание целевого АД.
Перспективы
Перспективы лечения гипертонических кризов определяются разработ-
кой новых препаратов с управляемым и быстро наступающим гипотензив-
ным эффектом. Очевидно, чти такие препараты должны обладать суперсе-
лективиым действием; к их числу сегодня можно отнести £-адреноблокатор
эсмолол и антагонист кальция клевидипин, а также фенолдопам. Повыше-
ния эффективности предупреждения осложненных гипертонических кри-
зов можно добиться только за счет более четкого и раннего выявления и
рационального лечения большинства больных артериальной гипертензией,
а также выявления и ус1ранения причин, способствующих ее нарастанию.
Втертонический криз
99
Неотложные мероприятия
• Госпитализация в отделение интенсивной терапии (показания см.
выше).
• Подбор антигипертензивных препаратов для купирования гипертони-
ческого криза.
• Контроль динамики АД, частоты сердечных сокращений (если паци-
ент госпитализирован, оптимальным является автоматический мони-
торинг АД и частоты сердечных сокращений);
• Контроль динамики показателей, характеризующих функцию почек
(креатининемии, скорости клубочковой фильтрации, калиемии).
Глава 6
ХОЛЕСТЕРИНОВАЯ ЭМБОЛИЯ
ПОЧЕЧНЫХ АРТЕРИЙ
Холестериновая эмболия внутрипочечных артерий, проявляющаяся в
первую очередь ухудшением функции почек вплоть до острой почечной
недостаточности, длительно считалась казуистически редкой и распозна-
валась только на аутопсии. В настоящее время можно констатировать су-
щественный «вклад» холестериновой эмболии почечных артерий в структу-
ру причин острой и быстропрогрессирующей почечной недостаточности,
особенно заметный у некогорых категорий пациентов (табл. 6.1). Таких па-
циентов, как правило, госпитализируют в соответствующие «профильные»
отделения, где у них впервые, ино1да очень быстро, развивается острая по-
чечная недостаточность, возможности адекватной интерпретации и лечения
которой нередко бывают затруднены. В связи с этим представления о холе-
стериновой эмболии почечных артерий необходимы клиницистам различ-
ных специальностей, в практике которых могут быть случаи повреждения
атеросклеротических бляшек брюшной аорты с высвобождением частиц хо-
лестеринового детрита и последующей эмболией внутрипочечных артерий
и артериол.
Таблица 6.1
Категории пациентов, у которых возможно
развитие холестериновой эмболии
' Больные сердечно-
сосудистыми заболе-
ваниями
Обстоятельство, при котором
развивается холестеринов**
эмболия
• Диагностическое и/или ле-
чебное вмешательство на
аорте и ее ветвях (брюшная
аортография; коронароанги-
ография);
• тромболизис (при остром ин-
фаркте миокарда, ишемиче-
ском мозговом инсульте);
• передозиоовка антикоагуляь
тов, в том числе непрямых
(фенилина, варфарина, ку
маролов)
Отделение,
которое госпитализируют
таких пациентов
• Отделение кардиологии
(в том числе интервенцион
ной);
• отделение интенсивной теоа-
пии и реанимации,
• отд ел pi иесегцечнс
сосудистой хирургии
Холестериновая эмболия почечных артерий
101
Продолжение табл. 4.6
Категория
пациентов
Пожилые больные
Обстмтепыггво. при котором
развивается холестериновая
эмболия
• Падение;
• травма;
в которое госпитализируют
таких пациентов
• Неврологическое отделение.,
• отделение травматологии и
• тупая травма живота
ортопедии;
• геронтологическое отделение
Реципиенты почечно-
'о трансплантата
• Ближайший период после
трансплантации почки,
• то же, что и в других группах
• Клинический центр, где про-
водят трансплантацию почки
и осуществляют наблюдение
эа реципиентами почечного
трансплантата
ЭПИДЕМИОЛОГИЯ
Риск холестериновой эмболии почечных артерий трудно предсказуем, а
данные о частоте ее возникновения противоречивы. Тем не менее установ-
лено, что 5—10% случаев острой почечной недостаточности, возникающей в
период госпитализации, и не менее 4% всех консультаций нефролога, про-
водимых в стационарах, связаны именно с холестериновой эмболией вну-
трипочечных артерий. Считают также, что частота возникновения холесте-
риновой эмболии внутрипочечных артерий возрастает по мере увеличения
числа процедур ангиографии. Источником подобных сведений служат так-
же базы данных пациентов, которым выполняли тромболизис. Постоянно
увеличивается число случаев развития новой формы холестериновой эмбо-
лии внутрипочечных артерий, поражающей артериальную сеть почечного
трансплантата и достоверно увеличивающей риск его отторжения и полно-
го прекращения его функции.
Установлено, что по мере увеличения квалификации персонала, выпол-
няющего диагностические и лечебные вмешательства на аорте и ее ветвях,
риск разрыва фиброзной покрышки атеросклеротической бляшки с высво-
бождением холестериновых эмболов снижается: так. M.G. Saklayen и соавт.
11997) не отметили ни одного подобного случая при проведений 267 коро-
дароангио графин в течение 15 месяцев. Однако в нашей стране можно про-
гнозировать рост частоты холестериновой эмболии внутрипочечных арте-
эии по мере увеличения числа диагностических и лечебных вмешательств
на сердце и сосудах и процедур тромболизиса, а также клинических цен-
тров. где их выполняют. По-видимому, распространенность холестериновой
эмболии почечных артерии достигнет максимума у пожилых больных с
клиническими проявлениями распространенного атеросклероза.
102
Нефрология. Неотложные состояния
ЭТИОЛОГИЯ
Травмагизапия фиброзной покрышки атеросклеротической бляшки с
последующим высвобождением холестериновых кристаллов может быть
спонтанной, но в большинстве случаев холестериновая эмболия почечных
артерии и артериол возникает как следствие:
• надрыва фиброзной покрышки атеросклеротической бляшки в брюш-
ной аорте при продвижении катетера в процессе выполнения лечеб-
ных и диагностических вмешательств на артериях различной локали-
зации;
• изъязвления и фрагментации покрывающего ее тромба при примем
нии тромболитиков (источником холестериновых эмболов в этой си-
туации становится, очевидно, поврежденная атеросклеротическая
бляшка, целостность фиброзной покрышки которой исходно была на-
рушена, а рост тромба в месте разрыва стал причиной острого инфар-
кта миокарда или ишемического инсульта) или передозировке анти-
коагулянтов;
• повреждения фиброзной покрышки атеросклеротической бляшки при
тупой травме живота, удары при падении.
Можно предполагать также, что часть разрывов фиброзной покрышки
атерослеротической бляшки, сопровождающихся холестериновой эмболи-
ей внутрипочечных артерий и артериол (особенно при ее хроническом и ре-
цидивирующем течении, когда одномоментное поражение почечного сосу-
дистого русла бывает не столь выраженным и. следовательно, не удается
констатировать резкого ухудшения функции почек), могут возникать вслед-
ствие действия на стенку аорты и ее крупных ветвей гемодинамического
удара, в том числе возникающего при наложении систолической и отражен-
ной пульсовых волн. Данный механизм может играть ведущую роль при
изолированной систолической артериальной гипертензии, характеризую-
щейся выраженным нарастанием ригидности аортальной стенки» а также
при гипертонических кризах. И хотя подтверждение его с клинических по-
зиций малореально, холестериновую эмболию внутрипочечных артерии,
очевидно, следует учитывать в ряду причин ухудшения функции почек у
пожилых больных изолированной систолической артериальной гипертен-
зией, особенно тогда, когда его впервые зарегистрировали после гипертони-
ческого криза.
«Фоном» для возникновения холестериновой эмболии внутрипочечных
артерий, как правило, служит распространенный атеросклероз — пораже-
ние сонных артерий, в том числе окклюзирующее и/или сочетающееся с
мозговыми инсультами, синдром перемежающейся хромоты и ишемическая
болезнь сердца. Диагностические или лечебные вмешательства на аорте и ее
Холестериновая эмболия почечных артерий
ЮЗ
крупных ветвях, в первую очередь коронарных артериях, занимают лиди-
рующее положение в структуре причин холес! ери новой эмболии внутрипо-
чечных артерий’ по мере прохождения катетера возможно повреждение фи-
брозной покрышки атеросклеротической бляшкой с высвобождением
холестериновых эмболов.
К холестериновой эмболии внутрипочечных артерий предрасполагает
выраженное атеросклеротическое поражение брюшной аорты. Так, по дан-
ным J. Theriault и соавт. (2003), проанализировавших 46 случаев холестери-
новой эмболии внутрипочечных артерий, в которых потребовалось экстрен-
ное выполнение гемодиализа (в 1984—2000-м годах), было выявлено, что у
90% больных к моменту развития острой почечной недостаточности наблю-
далась артериальная гипертензия, 80% — страдали ишемической болезнью
сердца, 50 — синдромом перемежающейся хромоты; тяжесть атеросклеро-
тического поражения брюшного отдела аорты у 60% больных была под-
тверждена наличием аневризмы Факторами, предрасполагавшими к нару-
шению целостности фиброзной покрышки атеросклеротической бляшки в
брюшной аорте, были: коронароангиография (у 58% пациентов), ангиогра-
фия другой локализации (у 26% больных), хирургическая операция на пе-
риферических сосудах (у 16% пациентов). Только у одного больного было
констатировано спонтанное развитие холестериновой эмболии внутрипо-
чечных артерии; еще у одного — ее формирование можно было связать с
неадекватной антикоагулянтной терапией.
Холестериновая эмболия внутрипочечных артерий может сопутство-
вать атеросклеротическому стенозу почечных артерий (ишемической бо-
лезни почек), обнаруженному D.G. Vidi и соавт. (1989) у 19 из 24 обследо-
ванных в течение 8 лет пациентов. У 95 из 105 больных ишемической болез-
нью почек, наблюдавшихся в клинике нефрологии, внутренних и
профессиональных болезней нм. Е.М. Тареева ММ А им И.М. Сеченова,
> далось выявить причины нарастания почечной недостаточности, среди ко-
торых был отмечен и один случай холестериновой эмболии внутрипочеч-
ных артерий и артериол, возникший в процессе коронароангиографии. При
мультиспиральной компьютерной томографии, выполненной в режиме ан-
гиоконтрастирования, удалось обнаружить очаг диссекции интимы стенки
брюшной аорты, очевидно, ставший источником холестериновых эмболов.
Нарастание почечной недостаточности и системные проявления холестери-
=*овой эмболии (сетчатое лнведо и ишемические трофические язвы на дис-
тальных фалангах пальцев ног) удалось купировать с помощью глюкокор-
тикостероидов, примененных парентерально в сверхвысоких дозах. Опыт
«следования пациентов, страдающих ишемической болезнью почек, на-
копленный в зарубежных клинических ueHipax, свидетельствует о еще
большей частоте встречаемости холестериновой эмболии внутрипочеч-
104
нефрология, неотложные состояния
иых артерий среди причин дальнейшего ухудшения функции почек, что.
по-видимому, связано с более интенсивным выполнением этим больным
диагностических и лечебных вмешательств на аорте и ее ветвях (табл. 6.2)
Причины нарастания почечной недостаточности
при ишемической болезни почек
Таблица 6.2
Ингибиторы АПФ 57,0% «14%
Блокаторы рецепторов ангиотен- зина II 1,0%
Нестероидные противовоспали- тельные препараты —♦ 3,1%
Антибиотики — • 3.1%
Рентген-контрастные агенты 4,7% 3.1%
Тромбоз почечной артерии и/или брюшной аорты 28,5% - •
Острый тубуло-интерстициальный нефрит 4.7%
Холестериновая эмболия внутри почечных артерий 4.7% 1,0%
• Не зарегистировано
Дестабилизация атеросклеротической бляшки возможна при неадекват-
ном режиме применения антикоагулянтов (например, варфарина и кума-
дина), а также тромболитических препаратов. Развитие острой почечной
недостаточности, в том числе необратимой, описано после применения
стрептокиназы, а также рекомбинантного тканевого активатора плазмино-
гена. При появлении признаков холестериновой эмболии внутрипочечных
артерий эти препараты приходится отменять, хотя при этом далеко не всег-
да удается зарегистрировать улучшение функции почек.
Попытки выделения достоверных факторов риска возникновения
острой почечной недостаточности, обусловленной холестериновой эмболи-
ей внутрипочечных артерий, пока особого успеха-не имели. Среди возмож-
ных факторов риска в проспективном исследовании Cholesterol Embolism
Study (CHEST) было отмечено увеличение сывороточной концентрации
Холестериновая эмболия почечных артерий
105
С-реактивного белка, регистрируемое до вмешательства на сосудах и, оче-
видно, отражающее нестабильность атеросклеротических бляшек. В связи с
этим в качестве потенциальных факторов риска холестериновой эмболии
почечных артерий называются те, участие которых в дестабилизации атеро-
склеротической бляшки доказано. К ним относят:
• ЛНП и Л ОН П, особенно подвергшиеся перекисному окислению;
• курение, сопровождающееся избыточным образованием свободных
кислородных радикалов и перекисей.
ПАТОГЕНЕЗ
Острое ухудшение фильтрационной функции почек, наблюдающееся
при холестериновой эмболии почечных артерий и артериол, обусловлено
двумя взаимно дополняющими механизмами:
• очаговой ишемией почечной ткани при обструкции внутрипочечных
артерий и артериол кристаллами холестерина;
• провокацией холестериновыми кристаллами воспалительной реак-
ции, реализующейся при участии эозинофилов преимущественно в
почечном тубуло-интерстини и.
Острые, внешне напоминающие иглы, кристаллы холестерина разры-
вают стенку мелких артерий и артериол, таким образом контактируя с ре-
зидентными клетками ткани почек, в том числе иммунокомпетентными.
Под действием холестерина наблюдается активация одного из компонен-
тов комплемента (С5Ь), обладающего хемоаттрактантными в отношении
эозинофилов свойствами. Массивная мобилизация эозинофилов под-
тверждается отмечаемым при холестериновой эмболии почечных артерий
нарастанием их содержания в периферической крови. Миграция этих кле-
ток в ткань почки сопровождается быстрым развитием острого «аллерги-
ческого» тубуло-интерстиального нефрита, способствующего дальнейше-
му падению С КФ.
Воспалительное повреждение почечного тубуло-интерстиция эозино-
филами дополняется развитием ишемии тех участков почечной ткани, где
скапливается особенно большое количество холестериновых эмболов.
Именно поэтому острая почечная недостаточность при эмболии внутрипо-
чечных артерий кристаллами холестерина значительно чаще, чем при
рентген-контрастной нефропатии, становится необратимой и даже при
успешных терапевтических воздействиях функция почек полностью не вос-
станавливается почти никогда.
Среди вероятных исходов острого периода эмболии внутрипочечных
артерий холестериновыми кристаллами называют также фокально-сегмен-
106
Нефрология. Неотложные состояния
тарный гломерулосклероз. Кроме того, при попадании холестериновых эм-
болов в артериальное русло почек наблюдали также развитие некротизи-
рующего гломерулонефрита и экстракапиллярного гломерулонефрита с
появлением в крови циркулирующих антител к цитоплазме нейтрофилов
(ANCA). Подобные варианты воспалительного ответа на холестериновую
эмболию почечных артерий наблюдают казуистически редко, и потому
сложно сказать, связан ли быстропрогрессирующий гломерулонефрит, в
том числе ассоциированный с продукцией ANCA, с эмболией почечных ар-
терий кристаллами холестерина или же его развитие демонстрирует нали-
чие наследственной предрасположенности, стереотипно реализующейся
под действием различных повреждающих стимулов (холестериновых кри-
сталлов, криоглобулинов и других парапротеинов, антител к базальной
мембране гломерулярных капилляров и других).
МОРФОЛОГИЯ
Как правило, удается обнаружить распространенное атеросклеротиче-
ское поражение аорты. Многие атеросклеротические бляшки могут быть
изъязвлены, покрыты тромбами, в том числе организовавшимися.
Инфаркты почки с участками кровоизлиянии могут сочетаться с ише-
мическими некрозами других внутренних органов, например петель кишеч-
ника, поджелудочной железы, инфарктами селезенки.
Эмболизация кристаллами холестерина — одна из основных причин
развития быстролрогрессирующей почечной недостаточности при ишеми
ческой нефропатии. Холестериновые эмболы повреждают нреимуществеи-
но артерии почек среднего калибра — дуговые и междольковые артерии, в
меньшей степени — капилляры. Повреждение чаще носит очаговый харак-
тер, эмболы из кристаллов холестерина обычно не полностью перекрывают
сосуд. Диагностика холестериновой эмболии почечных артерий при морфо-
логическом исследовании почечной ткани не всегда бывает успешной в свя-
зи с небольшим размером биоптатов и очаговым характером поражения, а
также необходимостью применения специальных красителей, выявляющих
частицы холестерина, например Судана III. Кристаллы холестерина часто
вымываются при обычной гистологической обработке образна ткани поч< к
и при окраске гематоксилином и эозином образуют характерные пустоты
двояковыпуклой игольчатой формы. Считается, что диагностическая чув
ствительность единичной биопсии почки при данном заболевании состав-
ляет 75% (холестериновые эмболы обнаруживают в 75% случаев), при взя-
тии двух образцов почечной ткани — 94 %.
Холестериновая эмболия почечных артерий
107
На начальных стадиях окклюзии почечных сосудов холестериновыми
эмболами развивается периваскулярная инфильтрация полиморфно-
ядерными лейкоцитами и эозинофилами разной степени выраженности.
Кристаллы холестерина выступают хемоаттрактантами и для других моно-
нуклеарных клеток воспаления, которые затем появляются в очаге повреж-
дения. В воспалительном инфильтрате можно также обнаружит ы игантскне
многоядерные клетки. Большое значение имеет распространение воспали-
тельной реакции с сосудистого русла на почечную паренхиму, что в значи-
тельной степени определяет своеобразие клинической картины поражения
почек при этой патологии С течением времени развивается гиперплазия
интимы и периваскулярный фиброз пораженных сосудов, что приводит к
еше большему их сужению или окклюзии. Это вызывает ишемию почечной
ткани и формирование фиброза дистальнее холестериновою эмбола. Таким
образом, на более поздних стадиях течения заболевания из-за ишемии по-
чечной ткани развиваются гломерулосклероз и интерстициальный фиброз.
Также обнаруживаются дистрофия и атрофия проксимальных и дисталь-
ных почечных канальцев. Поскольку распространение холестериновых эм-
болов по сосудистому руслу может происходить в разные интервалы време-
ни. то в почечных биоптатах при гистологическом исследовании, как
правило, обнаруживают участки с различной степенью поражения
Окклюзия холестериновыми эмболами почечных артерий среднего ка-
либра и артериол может привести к ишемическим повреждениям и инфар-
ктам ткани почки. В биоптатах почек часто обнаруживают морфологиче-
ские признаки некротизирующего гломерулонефрита и гломерулонефрита
с полулуниями.
При хроническом (рецидивирующем) течении холестериновой эмболии
почечных артерий специфические изменения почечной ткани сменяются
распространенным гломерулосклерозом и тубуло-интерстициальным фи-
брозом. В интерстиции среди клеток воспалительного инфильтрата обнару-
живают преимущественно макрофаги и Т-лимфоциты.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления холестериновой эмболии почечных артерий
могут быть условно разделены на 2 группы:
• связанные с непосредственным попаданием кристаллов холестерина
во внутрипочечные артерии и артериолы;
• внепочечныс и «системные» — обусловленные фиксацией холестери-
новых эмболов в других внутренних органах, а также развитием про-
воцируемого ими острофазового ответа (табл, 6.3).
108
Нефрология. Неотложные состояния
Таблица 6 3
Клинические признаки холестериновой эмболии
Почечный I I • Острая почечная недостаточность с олигоанурией; • медленно прогрессирующая почечная недостаточность (при хроническом рецидивирующем течении); • выраженный и труднокупируемый подъем АД; • боли в поясничной области, • эозинофилурия; • макрогематурия (б период, предшествующий анурии, моча мо- жет приобретать вид «мясных помоев»; кроме того, в ней могут быть обнаружены сгустки крови)
Внепочечный ♦ Острое нарушение мозгового кровообращения (транэитэрная ишемическая атака, мозговой инсульт); • выпадение полей зрения, внезапная слепота, • бляшки Holtenhorst, выявляемые на сетчатке глаза пси офталь- москопии, • острый коронарный синдром; • «ишемические» кишечные боли, ишемический некроз петель кишечника; • острый панкреатит, панкреонекроз, • инфаркты селезенки; • кожное сетчатое ливедо; • трофические кожные язвы
«Системный» • Лихорадка; • потеря массы тела; • утрата аппетита; • боли в суставах без их деформации; • увеличение СОЭ; • эозинофилия, гипокомплементемия; • увеличение сывороточной концентрации С реактивного белка
У большинства пациентов обусловленное холестериновой эмболией
ухудшение функции почек происходит драматически быстро и. как прави-
ло, отличается яркими клиническими признаками. Резкое уменьшение ко-
личества мочи (вплоть до анурии) наблюдают в течение первых часов после
спровоцировавшего эмболию почечных артерий кристаллами холестерина
лечебного или диагностического эндоваскулярного вмешательства: также
возможны напоминающие почечную колику боли в пояснице и макрогема-
турия. Кроме того, типичен резкий и трудноку пируем ни, аналогичный от-
мечаемому при злокачественной артериальной гипертензии, подъем АД,
иногда сопровождающийся выраженной гипертензивной энцефалопатией и
острой левожслу дичковой недостаточностью с отеком легкого, в том числе
фатальным.
Холестериновая эмболия почечных артерий
109
Значительный рост АД, типичный для холестериновой эмболии вну-
трипочечных артерий, может быть ассоциирован с существенным увеличе-
нием плазменной акгивности ренииа. М. Tanaka и соавт. (2004) отметили
развитие почечной недостаточности и выраженной артериальной гипертен-
зии. ассоциированной с гиперренинемией, у 70-летнего больного, через 5
дней погибшего от гангрены петель кишечника с перитонитом. На аутопсии
были отмечены изъязвление нескольких атеросклеротических бляшек в
брюшной аорте и эмболия кристаллами холестерина артерий почек, желуд-
ка, печени, поджелудочной железы и толстой кишки
Реже диагностируемый хронический рецидивирующий вариант холе-
стериновой эмболии почечных артерий сопряжен с постепенным ухудше-
нием фильтрационной функции почек, при котором, как правило, не удает-
ся установить заметного снижения диуреза. Преимущественное поражение
почечного тубуло-интерсгиция может сопровождаться никтурией с пос-
тепенным снижением относительной плотности мочи, подтверждаемым
результатами пробы Зимницкого. При этом рост АД может быть менее за-
метным, чем в случае острой массивной эмболии почечных артерий кри-
сталлами холестерина.
При холестериновой эмболии внутрипочечных артерий могут наблю-
даться боли в пояснице, напоминающие почечную колику. В период, пред-
шествующий анурии, моча может приобретать вид «мясных помоев», кроме
того, в ней могут быть обнаружены сгустки крови
Существенное значение среди клинических проявлений холестерино-
вой эмболии могут приобретать ее «внепочечные» признаки, связанные с
вовлечением артериального русла других внутренних органов. Эмболия ар-
терий сетчатки глаза приводит к внезапному выпадению полей зрения с
возможной дальнейшей полной слепотой, типична офтальмоскопическая
картина в виде так называемых бляшек Hollenhorst. желтовато-белых, с не-
ровными контурами, нередко с очагами кровоизлияний. Повреждение фи-
брозной покрышки атеросклеротической бляшки» расположенной в дуге
аорты, может приводить к эмболии церебральных артерий и развитию
острых нарушений мозгового кровообращения, а также острому коронарно-
му синдрому, возникающему при окклюзии коронарных артерий.
Если источником холестериновых эмболов становится атеросклероти-
ческая бляшка, локализованная в брюшной аорте, то очень часто поража-
ются кожные ветви артерий нижних конечностей. Типичные признаки их
эмболии — распространенное сетчатое ливедо и трофические язвы, образу-
ющиеся в основном на дистальных фалангах пальцев ног. Возможно также
появление геморрагической пурпуры. Большой объем поражения может
обусловить асептический некроз мышц нижних конечностей с развитием
сухой гангрены.
110
Нефрология. Неотложные состояния
Наряду с почечными артериями, мишенями холестериновых эмболов не-
редко становятся и другие висцеральные ветви брюшной аорты, при этом
возникают фатальные инфаркты кишечника, возможно — острый панкреатит
с характерными опоясывающими болями и гиперамилаземией, прогрессиру-
ющий вплоть до панкреонекроза. Возможны также инфаркты селезенки.
Холестериновая эмболия внутрипочечных артерий почти всегда, осо-
бенно при массивном поражении, сопровождается «системными» признака-
ми, свидетельствующими о выраженности острофазового ответа. Лихорад-
ка, артралгии дополняются потерей аппетита и постепенным снижением
массы тела; последнее при хроническом варианте холестериновой эмболии
почечных артерий происходит медленно и обычно интерпретируется кли-
ницистами неадекватно.
Часто наблюдают эозинофилию периферической крови, как правило, —
увеличение СОЭ и сывороточной концентрации С-реактивного белка. Био-
химическое исследование крови наряду с гиперкреатининемией и ростом
концентрации калия в сыворотке крови может демонстрировать увеличе-
ние сывороточной активности печеночных трансаминаз (ACT и АЛТ), а при
поражении артерий поджелудочной железы — амилазы. Возможно также
повышение активности КФК в плазме крови, которое будет указывать как
на ишемический некроз поперечно-полосатых скелетных мышц, так и на
поражение холестериновыми эмболами коронарных артерий г последую-
щим формированием острого коронарного синдрома / острого инфаркта
миокарда. При подозрении на последние необходимо определение концен-
трации в плазме крови тропонина Т или I. Развитие провоцируемого хо-
лестериновыми кристаллами острого «аллергического» эозинофильного
тубулоинтерстициального нефрита сопровождается потреблением компле-
мента, в связи с чем возможно выявление гипо- и акомплементемии.
В период, предшествующий анурии, при холестериновой эмболии вну-
трипочечных артерий регистрируют транзиторную лейкоцитурию. Пул экс-
кретируемых в мочу лейкоцитов представлен преимущественно эозино-
филами. Подтверждение наличия эозинофилурии требует применения
специальных окрасочных методов.
ДИАГНОСТИКА
Диагноз холестериновой эмболии почечных артерий основан на тща-
тельной интерпретации клинических данных и внимательном изучении
анамнеза. От других вариантов острого ухудшения почечной функции, воз-
никающего во время или после процедур ангиографии, холестериновую эм-
болию почечных артерий отличает в первую очередь яркость внепочечных
и системных проявлений (табл. 6.4).
Холестериновая эмболия почечных артерий
111
Дифференциальный диагноз холестериновой
эмболии почечных артерий
Таблица 6.4
миффереиииру««нм заболевание Рентген-контрастная нефро- патия । 1 J 1 » Отличия • Отсутствуют боли е пояснице; • изменений мочи (гематурии, лейкоцитурии, в том числе эозинофилурии), как правило, нет; • подъем АД менее выражен или отсутствует; • признаки острофазового ответа (лихорадка, артралгии, похудение, увеличение СОЭ, сывороточной концентра ции С-реактивного белка) не типичны; • отсутствуют признаки поражения других внутренних органов-мишеней, а также кожи (трофические язвы, сетчатое ливедо); • рост сывороточного уровня креатинина часто бывает умеренным и клинически не проявляется либо регрес- сирует после достаточной гидратации и приема антаго- нистов кальция, а также, возможно, N-ацетилцистеина
Быстропрогрессирующий гло- мерулонефрит* 1 • Развивается протеинурия >1 r/сутки, в том числе «боль- шая» (>3 г/сутки) и сопровождающаяся развитием не- фротического синдрома; • характерна гематурия как составляющая осгронесррити- ческого синдрома; • олигурия редка, • менее тиг ичны системные проявления; признаки ише- мии внутренних органов отсутствуют; • присутствуют серологические феномены (ANCA, анти- тела к базальной мембране почечных клубочков); • с помошью своевременно примененной патогенетиче ской терапии нередко удается добиться улучшения по- чечной функции.
Преренальная ишемическая острая почечная недостаточ- ность • Характерна связь с резкой дегидратацией, кровопоте рей, а также применением искусственного кровообра- щения; • изменение мочи (гематурия, протеинурия) нетипично: • чаще присутствуют тенденция к снижению АД или арте- риальная гипотензия; • признаки острофазового ответа отсутствуют
Острый канальцевый некроз • Типична связь с приемом лекарственных препаратов, особенно некоторых антибактериальных (например, гентамицина), кестероидных противовоспалительных средств и ненаркотических анальгетиков; • протеинурия отсутствуем ипи «следовая», • характерно появление в моче сгустков крови, содержа- щих также некротические массы; • системных проявлений, как правило, нет
* Казуистически редко холестериновая эмболия почечных артерий и артериол может ослож-
няться быстропрогрессирующим гломерулонефритом, иногда - некротизирующим почечным ва-
скулитом, ассоциированным с пиперпродукцией ANCA
112
Нефрология. Неотложные состояния
Всем больным, у которых предполагают холестериновую эмболию по-
чечных артерий, необходимо выполнить:
• общий анализ крови (регистрируют увеличение СОЭ, лейкоцитоз, эо-
зинофилию, возможна анемия);
• биохимический анализ крови (выявляют гиперкреатининемию, ги-
перкалиемию, увеличение сывороточной активности АЛТ, ACT, ами-
лазы, КФ К);
• общий анализ мочи (выявляют микро- или макрогематурию, лепко-
цитурию, зозинофилуриюя (дифференциация эозинофилов в моче
требует специальных окрасочных методов), снижение относительней!
плотности мочи);
• определение сывороточного уровня комплемента, иммуноглобулинов
А, М и G;
• электрокардиографию;
• ультразвуковое исследование почек и органов брюшной полости;
• исследование сывороточного титра ANCA;
• при наличии болей за грудиной, воспроизводящих стенокардию, осо-
бенно нестабильную — исследование плазменной концентрации тро-
понина Т или I.
Дополнительное подтверждение поражения поджелудочной железы, в
том числе панкреонекроза и инфарктов селезенки, может быть получено
при проведении компьютерной томографии. Проведение данного обследо-
вания ограничивается необходимостью применения контрастных агентов,
опасных возможностью провокации дальнейшего ухудшения почечном
функции.
Биопсия почки при холестериновой эмболии почечных артерий обос-
нована, но зачастую трудновыполнима в связи с тяжестью состояния па-
циентов.
Холестериновые эмболы могут быть выявлены при морфологическом
исследовании образцов кожи, полученных из участков сетчатого ливедо и/
или ишемических трофические язв.
ЛЕЧЕНИЕ
Эффективность большинства методов лечения (табл. 6.5) холестерино-
вой эмболии внутрипочечных артерий не была объектом специально плани-
руемых контролируемых исследований, поэтому опыт их применения осно-
ван на описании отдельных наблюдений или их небольших серий.
Купирование угрожающих жизни осложнений холестериновой эмболии по-
чечных артерий, во многом являющихся производными острого ухудшения
Жслестеринсвая эмболия почечных артерий
113
рх нкции почек, очевидно, должно дополняться патогенетической терапией,
-направленной на сдерживание иммуновоспалительного поражения органов,
э артериальное русло которых проникли холестериновые эмболы.
Таблица 6.5
Походы к лечению холестериновой эмболии почечных артерий
ЬмИиая стратегия методлечения Комментарии
«эрекция нарушения "С-ечной функции • Гемодиализ; • плазмаферез Экстренный гемодиализ показан боль- шинству больных с массивной эмболи- ей внутрипочечных артерий кристалла- ми холестерина. Плазмаферез может применяться и с целью повышения эффективности им- мунодепрессантов
Снижение ловышенно- --АД • Гемодиализ. • ультрафильтрация; • антигипертензивные препараты Показанием к началу экстренного ге- модиализа или ультрафильтрации мо- жет стать некупируемый подъем АД с признаками гипертензивной энцефа лопатии и/или острой левожелудочко- вой недостаточности с отеком легкого. Оптимальные схемы применения анти- гипертензивных препаратов не отрабо- таны: можно обсуждать целесообраз- ность сочетания антагонистов кальция (в том числе в парентеральных фор мах), петлевых диуретиков, инт ибито ров АПФ и блокаторов рецепторов ан- гиотензина И (необходим частый кон троль капиемии), а также нитроглице рина
•меньшение выражен - -сети поражения зэганов-мишекей • Глюкокортикостеро- иды; • циклофосфамид, • статины Ориентируясь на обобщении серии на- блюдений, глюкокортикостероиды, примененные в сверхвысоких дозах, позволяют добиться по крайней мере частичного восстановления почечной Функции. Циклофосфамид применяют в сочета- нии с глюкокортикостероидами при малой эффективности последних, а также при появлении в сыворотке кро- ви ANCA. Статины показаны всем пациентам с хо- лестериновой эмболией почечных ар- терий для стабилизации атеросклеро- тической бляшки и уменьшения выра женности провоцируемой холестери- новыми кристаллами воспалительной реакции в почечном тубуло интерсти- ции 1
114
Нефрология. Неотложные состояние
Общепринятые протоколы лечения острой почечной недостаточности
связанной с холестериновой эмболией внутрипочечных артерий, отсутству-
ют. Выраженное ухудшение функции ночек с гиперкалиемией, а также ке-
ку пируем ый гипертонический криз, осложняющийся энцефалопатией и
или отеком легкого, могут потребовать проведения экстренного, а в даль-
нейшем, если регресса почечной недостаточности добиться не удастся, и
программного гемодиализа.
С патогенетической точки зрения при эмболии внутрипочечных арте-
рий кристаллами холестерина может быть обосновано применение глюко-
кортикостероидов: первоочередной мишенью их действия является вызван-
ное эозинофилами воспаление почечного тубуло-интерстиция Опыт
применения глюкокортикостероидов при холестериновой эмболии внутри-
почечных артерий пока ограничивается небольшим числом наблюдений:
как правило, эффективными оказываются высокие дозы этих препаратов
Продемонстрирована также возможность устранения под их действием вне-
почечных проявлений эмболии холестериновыми кристаллами, например
абдоминальных. В ряде случаев применение глюкокортикостероидов соче-
тали с сеансами плазмафереза. А.Е. Yiicel и соавт. (2006) наблюдали умень-
шение выраженности почечной недостаточности (по-видимому, поражение
почек было представлено некротизирующим гломерулонефритом) и кож-
ных признаков холестериновой эмболии при сочетании глюкокортикосте-
роидов с циклофосфамидом.
Отдельные наблюдения указывают также на эффективность статинов
которые, очевидно, не следует отменять даже в период олигоанурии; можно
обсуждать обоснованность повышения доз этих препаратов до максималь-
ных терапевтических. Положительное действие статинов при холестерино-
вой эмболии внутрипочечных артерий объясняется не столько их вмеша-
тельством в процесс синтеза атерогенных фракций холестерина, сколько
так называемыми плейотропными эффектами этих препаратов, подразуме-
вающими способность непосредственно уменьшать интенсивность воспале-
ния почечной ткани за счет блокады экспрессии провоспалительииго фак-
тора транскрипции (NF-кВ) и связанных с ним хемокинов, например
моноцитарного хемотоксического протеина типа I (МСР-1). Именно проти-
вовоспалительная составляющая действия статинов может оказаться реша-
ющей в смысле благоприятного влияния на функцию почек при холестери-
новой эмболии внутрипочечных артерий.
Выраженный подъем АД наряду с ультрафильтрацией и экстренным ге-
модиализом требует также применения комбинации антигипертензивных
ггрепаратов, в том чисае парентеральных. С патогенетической точки зрения
может быть обоснованным применение ингибиторов АПФ и блокаторов ре-
цепторов ангиотензина II; при их использовании необходим тщательный
Холестериновая эмболия почечных артерий
115
мониторинг динамики сывороточной концентрации калия. С целью сниже-
ния АД оправдано также использование антагонистов кальция (в том числе
парентеральных), петлевых диуретиков, возможно — нитроглицерина и па-
рентеральных p-адреноблокаторов (эсмолола). Оптимальная схема дости-
жения нормального АД нс разработана. В процессе снижения АД необходи-
ма тщательная оценка изменения выраженности клинических проявлений
органного поражения и показателей, характеризующих функцию ночек.
Холестериновая эмболия почечных артерий и артерий друюй локали-
зации — единственная ситуация, когда образующийся на месте разрыва
фиброзной покрышки атеросклеротической бляшки тромб способствует
ее стабилизации, сопровождающейся уменьшением интенсивности выхо-
да холестериновых кристаллов в кровиiок. В связи с этим при развитии
эмболии внутрипочечных артерий и артериол кристаллами холестерина,
ло-видимому, желательна отмена антитромбоцитарных средств (ацетил-
салициловой кислоты, клопидогреля), нефракшюнированного и низ-
комолекулярных гепаринов, а также непрямых антикоагулянтов (вар-
фарина).
Прогноз
Риск смерти в остром периоде холестериновой эмболии внутрипочеч-
ных артерий и в дальнейшем остается очень высоким; но некоторым дан-
ным. смертность таких больных может превышать 60%. По данным S. Нага
г соавт. (2002), улучшения функции почек чаще удается добиться при ис-
ходно меньшей креатининемии и по пока не вполне ясным причинам — при
большем числе эозинофилов в периферической крови в остром периоде эм-
болии. На роль потенциальных детерминант неблагоприятного прогноза
могут претендовать:
• быстро формирующаяся острая почечная недостаточность с анурией;
• резистентный к антигипертензивной терапии подъем АД;
• одновременное вовлечение других органов, особенно сосудов голов-
ного мозга, сердца, кишечника и поджелудочной железы;
• развитие холестериновой эмболии почечных артерий в процессе вы-
полнения тромболизиса или экстренно выполняемого эндоваскуляр-
ного вмешательства (например, коронароангиопластики при остром
коронарном синдроме без подъема сегмента 57);
• наличие предшествующей почечной недостаточности, в том числе уме
ренного (30—.59 мл/мин) снижения СКФ, соответствующего И стадии
хронической болезни почек;
• сочетание с нарушениями гемостаза, в том числе ДВС-синдромом.
116
Нефрология, неотложные состояния
Перспективы
В ближайшие годы не приходится рассчитывать на появление методов
лечения холестериновой эмболии почечных артерий, которые обладали бы
эффективностью, радикально превосходящей используемые в настоящее
время. В связи с этим нуждаются в дальнейший оптимизации схемы ис-
пользования гемодиализа и аферезных методов лечения, а также тактика
патогенетической терапии, включающей применение глюкокортикостерои-
дов и циюстагиков (циклофосфамида). Проведение контролируемых кли-
нических исследований при холестериновой эмболии почечных артерий за-
труднено малой реальностью одновременного включения в подобное
исследование достаточного числа больных. Тем не менее в ситуации, когда
ухудшение функции почек и другие органные поражения не могут быть
остановлены только использованием глюкокортикостероидов, в гом числе в
сверхвысоких дозах, становятся обоснованными попытки применения бо-
лее селективных стратегий. В этом случае возможно назначение препара-
тов, тормозящих миграцию, активацию и пролиферацию клеток эозино-
фильного ряда (гидроксимочевины, иматиниба мезилата), а также статинов
в сверхвысоких дозах. Для предупреждения холестериновой эмболии вну-
трипочечных артерий и артериол особое значение имеет дальнейшее уточ-
нение факторов риска и совершенствование оборудования, используемого
при эндоваскулярных вмешательствах (например, разработка специальных
ловушек для холестериновых эмболов), и схем их поддержки антикоагу-
лянтами.
Неотложные мероприятия
• Мониторинг показателей, характеризующих функцию почек (креати-
нинемию, скорость клубочковой фильтрации, калиемию).
• Мониторинг АД и частоты сердечных сокращений.
• Назначение преднизолона парентерально (при выраженном ухудш
нии функции почек и/или мультиорганном поражении возможна ком-
бинация с ииклофосфамидом).
• Отмена антикоагулянтов и антитромбоцитарных средств.
• Назначение статинов в высоких дозах (при отсутствии повышения
сывороточной активности КФК).
• При анурии / гиперкалиемии — экстренный гемодиализ.
• При развитии острого панкреатита — назначение сандостатина.
• При появлении признаков ин емического некроза петель кишечни-
ка — экстренная лапаротомия.
Глава 7
ТРОМБОЗ И ТРОМБОЭМБОЛИЯ
ПОЧЕЧНЫХ СОСУДОВ
Клинические проявления, течение и исходы тромбоза и тромбоэмболии
почечных сосудов во многом определяются массивностью поражения и ка-
либром вовлеченного участка сосудистого русла и представляют собой ти-
пичный пример острой ишемической почечной недостаточности, иногда
развивающейся катастрофически быстро и становящейся необратимой.
Тромбоз почечных вен нередко осложняет течение других хронических забо-
леваний почек, особенно протекающих с нефротическим синдромом. С кли-
нической точки зрения можно выделить три основных аспекта проблемы
тромботического и тромбоэмболического поражения почечного сосудистого
русла:
• тромбоз почечных артерий:
• тромбоз и тромбоэмболия почечных артерий, в том числе магистраль-
ных;
• тромбоз и тромбоэмболия поче чного микросудистого русла (почечная
тромботическая микроангиопатия) (см. гл. 8 «Почечные тромботиче-
ские микроангиопатии»).
ТРОМБОЗ И ТРОМБОЭМБОЛИЯ
ПОЧЕЧНЫХ АРТЕРИЙ
.Местом, где формируется тромботический очаг, или мишенью для тром-
боэмболов могут стать как магистральные почечные артерии, так и их ветви,
з том числе внутрипочечные. Клинически! проявления и последствия гром-
эотического или тромбоэмболического эпизода зависят в первую очередь от
распространенности и выраженности ишемического повреждения почечной
ткани, во многом определяющейся калибром пораженного сосуда.
Эпидемиология
Точные данные, характеризующие распространенность тромбозов и
тромбоэмболий, отсутствуют во многом потому, что многие случаи их оста-
ются нераспознанными, и в связи с этим последствия инфарктов почек —
характерные соединительнотканные рубцы — нередко оказываются случай-
118
Нефрология. Неотложные состоянии
ной находкой на аутопсии. Тем не менее опыт отдельных нефрологических
центров свидетельствует о том, что частота возникновения инфаркта почхж
составляет 0,007% случаев в течение 3 месяцев. Инфаркт почки может воз-
никать в различном возрасте (в указанной серии наблюдений возраст паци-
ентов составлял от 30 до 87 лет).
Тромбоз и тромбоэмболию магистральных почечных артерий, в том чис-
ле окклюзирующие, описывают преимущественно в виде отдельных наблю-
дений. Тем не менее частота их может быть весьма значительной в группах
риска, например у пациентов с тяжелым атеросклеротическим поражением
аорты и почечных артерий, у больных фибрилляцией предсердий, при пер-
вичных тромбофилиях (антифосфолипидном синдроме, носительстве гене-
тических детерминант — 40/40варианта гена — ингибитора активатора
плазминогена типа 1, 677ТТ-варианта гена метилентетрагидрофолатредук-
тазы). Так, по данным J.M. Alcazar и соавт. (2000), в структуре причин
острой почечной недостаточности, развивающейся при атеросклеротиче-
ском стенозе почечных артерий (ишемической болезни почек), доля тром-
бов, возникающих на атеросклеротической бляшке составляет почти 30%.
Очевидно, что тромбоз и тромбоэмболия почечных артерий имеют не по-
следнее значение среди причин острой почечной недостаточности, в том
числе ухудшения функции почек, отмечаемого у пациентов с артериальны-
ми тромбозами или тромбоэмболиями другой локализации.
Этиология
По-видимому, тромбоз и тромбоэмболия почечных артерий не возника-
ют при отсутствии предрасполагающих факторов, в целом близких к тако-
вым для артериальных тромбозов другой локализации (табл. 7.1), хотя их
далеко не всегда идентифицируют. Как и при других органных тромбозах и
тромбоэмболиях, для активации тромбогенеза и/или фрагментирования
уже существующего пристеночного тромба, становящегося источником
тромбоэмболов, необходимо несколько взаимодополняющих условий. Сре-
ди них:
• активация плазменных, эндотелиальных и/или тромбоцитарных зве-
ньев гемостаза, индуцированная внешними факторами и/или возни-
кающая при наличии генетических детерминант;
• недостаточность факторов противосвертывающей системы крови
(приобретенная или врожденная);
• нарушение органной гемодинамики и уменьшение объема циркулиру-
ющей крови, предрасполагающие к стазу и сладжу клеток крови;
• поражение сосудистой стенки, стимулирующее агрегацию тромбоци-
тов, активацию эндотелийзависимого звена гемостаза и образование
"Чромбоз и тромбоэмболия почечных сосудов
119
тромбов (воспаление, изъязвление фиброзной покрышки атероскле-
ротической бляшки с обнажением тромбогенного холестеринового де-
трита липидной сердцевины).
Факторы, предрасполагающие к тромбозу
и тромбоэмболии почечных артерий
Таблица 7.1
Группе факторов . Предрасполагающий фактор .VJ . —Ш
“ервичные и генетические Т-аллель и ТТ генотип гена метилентетрагидрофолат- редуктазы с гипергомоцистеинемией; 4G-аллель и 4 G/4G-генотип гена ингибитора активатора плазминогена типа 1; 20201 -мутация гена протромбина; первичный антифосфолипидный синдром
Приобретенные, в том числе эяешнесредовые Злокачественная опухоль с паранеопластической тромбо- филией; распространенный атеросклероз аорты с поражением по- чечных артерий; фибрилляция предсердий (в первую очередь у пациентов, не получающих антикоагулянты), сепсис / инфекционный эндокардит
Генетически детерминированные тромбофилии, предрасполагающие к
артериальным тромбозам и, в частности, к тромбозу почечных артерий, обу-
словливают гиперпродукцию маркеров :>ндогелийзависимого звена
гемостаза (например, ингибитора активатора плазминогена I типа) или на-
копление в плазме крови веществ, активирующих гемостаз (например, го-
моцистеина, что происходит при недостаточности метилентетра! идро-
Фолатредуктазы, связанной с носительством Т-аллеля ее гена, особенно в
гомозиготном варианте). Необходимо подчеркнуть, что большинство дан-
ных, указывающих на роль генетических факторов в формировании пред-
расположенности к артериальным тромбозам, получены преимущественно
в отношении острого коронарного синдрома / ос трого инфаркта миокарда и
ишемического мозгового инсульта. Однако они, очевидно, могут быть экс-
траполированы и на артериальное тромботическое поражение артерий дру-
гих локализаций, в том числе почечных.
Индуцировать тромбогенез могут также взаимодействующие с фосфо-
липидами мембран тромбоцитов и р-тромбопитарпыми рецепторами анти-
тела к кардиолипину, гиперпродукцию которых наблюдают при первичном
и вторичных вариантах антифосфолипиднпго синдрома. Для антифосфоли-
пидного синдрома в первую очередь характерно развитие почечной тромбо-
тической микроангиопатии, хотя возможен и тромбоз крупных ветвей по-
чечной артерии с развитием инфарктов почек.
120
Нефрология. Неотложные состояние
Тромбоз почечных артерий может развиваться при нарушении целост-
ности фиброзной покрышки атеросклеротической бляшки, локализующей-
ся непосредственно в почечных артериях или в близких к ним участках
брюшной аорты. Как и при холестериновой эмболии почечных артерий (см.
«Холестериновая эмболия почечных артерий»), повреждение фиброзной
покрышки атеросклеротической бляшки и обнажение тромбогенного холе-
стеринового детрита липидной сердцевины нередко бывает штедствием про-
цедур ангиографии или тупой травмы живота.
Тромбоз и тромбоэмболия почечных артерий возможны при паранео-
пластических тромбофилиях, для которых более типичны венозные тром-
бозы, в том числе в почечных венах. При инфекционном эндокардите, по-
ражающем митральный или аортальный клапаны, а также при сепсисе
возможно тромбоэмболическое поражение ветвей почечной артерии, ино-
гда приводящее к выраженному ухудшению функции почек, ио в ряде слу-
чаев остающееся малосимптомным (и тогда инфаркты почек оказываются
случайной находкой).
Поданным различных авторов, тромбоэмболия почечных сосудов, приво-
дящая к развитию инфарктов почек, является, как правило (в 94 % случаев),
следствием заболеваний сердца (фибрилляции предсердий, инфаркта мио-
карда и эндокардитов), при которых развивается тромбоэмболический син-
дром. Среди факторов риска тромбоэмболии почечных артерий, как и других
крупных ветвей аорты, особое значение имеет персистирующая и постоянная
фибрилляция предсердий, особенно у пациентов, не принимающих антикоа-
гулянты или получающих их в неадекватной дозе В серии наблюдений
Z. Korzers и соавт. (2002) 6 из 10 больных с ’тромбоэмболическими инфаркта-
ми почки страдали постоянной фибрилляцией предсердий. По данным
N. Hazanov и соавт. (2004), обследовавших 44 пациентов с инфарктами почки
и фибрилляцией предсердий, наблюдавшихся в одном клиническом центре в
течение 18 лет, только 9 человек (20,5%) принимали варфарин, не достигая
однако, общепринятых значений международного нормализованного отно-
шения (у всех них величины этого показателя составляли менее 1.8).
Часть факторов, предрасполагающих к тромбозу и тромбоэмболии по-
чечных артерий, потенциально устранимы. Тем не менее большинство из
них (генетически детерминированные тромбофилии, первичный антифос-
фолинидный синдром, фибрилляция предсердий) обусловливают дли (ель-
нос, иногда пожизненное, применение антикоагулянтов.
Патогенез
Поражение почек при тромбозе и тромбоэмболии почечных артерии
определяется ишемией почечной ткани: тотальной (при поражении маги-
стральных стволов) или очаговой (при вовлечении ее ветвей, особенно вну-
^омбоэ и тромбоэмболия почечных сосудов
121
трипочечных). Степень ухудшения почечной функции и ее обратимость во
многом зависят от распространенности поражения.
Составляющие патогенеза почечного поражения при тромбозе и тром-
боэмболии почечных артерий включают:
• высвобождение проренина из гранул юкстагломерулярных клеток и
трансформацию его в ренин, что происходит непосредственно после
окклюзии почечной артерии,
• активацию ренин-ангиотензин-альдостеронового каскада;
• избыточное образование перекисей и реактогеиных субстанций кис-
лорода с повреждением ими гломерулярных эндотелиоцитов и струк-
тур почечного тубуло-интерстиция;
• наблюдающуюся в условиях ишемии гиперпродукцию эндотелина-1;
• угнетение эндотелиальной NO-синтазы;
• резкий спазм приносящей и выносящей гломерулярных артериол;
• активацию медиаторов фиброгенеза (TGF, RANTES);
• высвобождение клеточных протеаз, разрыв митохондриальных мем-
бран;
• гибель канальцевых эпителиоцитов и клубочковых эндотелиоцитов,
разрыв гломерулярных базальных мембран.
При тромбозе и тромбоэмболии почечных артерий снижение скорости
клубочковой фильтрации всегда сочетается с канальцевой дисфункцией.
Проявления последней, в первую очередь гиперкалиемия, могут быть опре-
деляющими как с клинической, так и с прогностической точки зрения.
Морфология
Тромб может располагаться непосредственно в почечной артерии (ча-
сто - на поверхности изъязвленной атеросклеротической бляшки), в брюш-
ной аорте и ущках левого предсердия (при длительно существующей фи-
брилляции предсердий полость его расширяется), а также на митральном
жли аортальном клапанах. Если произошла тромбоэмболия почечной арте-
рии или ее ветвей, тромб может быть частично фрагментированным. Ин-
фаркты, целиком захватывающие почку при окклюзии главной почечной
артерии, встречаются редки, но в таких условиях она полностью утрачивает
гэою функцию.
Уже примерно через 24 -48 часов после окклюзии ветви почечной арте-
2«и можно увидеть область, контрастирующую своим «бледным видом» с
жружающей гканью, — участок треугольной формы (что связано с ангиоар-
хжтектоникой), верхушка которого обращена к воротам органа, основание —
г капсуле. По внешнему контуру зона инфаркта окружена областью гипере-
мии темно-красного цвета — белый инфаркт с геморрагическим венчиком.
122
Нефрология. Неотложные состояния
Через 7 дней начинается организация зоны инфаркта (замещение некроти-
ческих масс соединительной тканью). Втяжение коры в этой области можно
обнаружить через 28 дней после окклюзии артерии.
Все структуры в зоне повреждения некротизируются. В результате ги-
поперфузии почечной ткани развивает ся тубулярный некроз. Может также
развиться кальцификация некротизированных канальцев, которая начина-
ется через 3 дня после окклюзии артерии, продолжается в течение следую-
щей недели и более выражена в канальцах, располагающихся ближе к
поверхности почки В участках старых инфарктов обнаруживаются облите-
рированные клубочки, атрофичные канальцы, фиброз и лимфоцитарная
инфильтрация интерстиния.
Тромбы или тромбоэмболы могут определяться и во внутрипочечных
артериях. Участки, где располагаются тромбы, нередко окружены скопле-
ниями полиморфно-ядерных лейкоцитов и макрофагов. Эпителиоциты ка-
нальцев находятся в состоянии белковой дистрофии, их клеточная мембра-
на местами разорвана. Некоторые клубочки коллабированы, в них
появляются очаги деструкции базальной мембраны. Гломерулярные эндо-
телиоциты увеличены, деформированы, местами разрушены
Острый иостгравматический билатеральный тромбоз почечных артерии
встречается редко. Наиболее вероятным механизмом его развития является
образование разрывов интимы сосуда с последующим тромбозом. Место
повреждения почечной артерии располагается, как правило, в 1 -2 см от
аорты вследствие наибольшего изгиба артерии и давления иа ее стенку в
этой области. Другой возможный механизм — контузия почечной артерии
вследствие сдавления между передней брюшной стенкой и телами позвон-
ков. В результате развивается билатеральный мультифокальный ин-
фаркт почек.
Клинические проявления
Выраженность клинических проявлений тромбоза и тромбоэмболии по-
чечных артерий зависит от калибра пораженных артерий и распространен-
ности поражения. Клиническая картина включает признаки, непосредст-
венно обусловленные ишемией почечной ткани, а также проявления ее
необратимого повреждения (табл. 7.2). Необходимо имегь в виду, что при
хроническом или подостром течении тромбоэмболия почечных артерий мо-
жет не сопровождаться яркими симптомами, а длительно остающееся уме-
ренным ухудшение фильтрационной функции почек у таких больных часто
интерпретируют неадекватно, и инфаркты почек нередко впервые распозна-
ют только при проведении аутопсии. Тромбоэмболии почечных артерий,
очевидно, часто сочетаются с тромбоэмболиями ветвей аорты другой лока-
^омбоз и тромбоэмболия почечных сосудов
123
.газации, а также ветвей легочной артерии, становясь одним из возможных
угрожающих жизни последствий ДВС-синдрома. За своевременно не диа-
гностированной тромбоэмболией почечных артерий при отсутствии анти-
шагулянтов или применении их в неадекватной дозе могуч последовать
фатальный эпизод тромбоэмболии церебральных, коронарных, брыжееч-
яых артерий или тромбоэмболия легочной артерии. Тромбозы и тромбоэм-
болии почечных артерий могут, таким образом, рассматриваться как состав-
ная часть «большой» тромбоэмболической болезни.
Таблица 7.2
Клинические признаки тромбоза / тромбоэмболии почечных артерий
проявление почечной ишемии
• Олигоанурия (при спонтанном лизисе
'ромбов может сменяться эпизодами по-
лиурии);
• выраженный и практически не купируе-
мый подъем АД;
• резкое или нарастающее исподволь сни-
жение скорости клубочковой фильтра-
ции;
• '^леркреатининемия;
• -лперка пиемия
Проявление необратимого ишемического
повреждения структур почечной ткани
• Боль в пояснице,
• гематурия (в гом числе макрогематурия);
• лихорадка;
• потеря массы тела;
• увеличение сывороточной активности
лактат-дегидрогеназы;
• увеличение сывороточной концентрации
С-реактивного белка
Диагноз
Общепринятый протокол диагностики тромбоза и тромбоэмболии по-
чечных артерий в настоящее время отсутствует. Наряду с клиническими
данными для распознавания тромботического и тромбоэмболического по-
ражения почечных артерий используют:
• общий анализ крови (выявление анемии, тромбоцитоза, при ДВС-
синдроме — тромбоцитопении, увеличения СОЭ);
• контроль диуреза (контроль олигоанурии, при благоприятном исходе
сменяющейся полиурией);
• общий анализ мочи (выявление протеинурии, гематурии, в том числе
.макрогематурии, снижения относительной плотности мочи);
• биохимический анализ крови (выявление ги перкреатин и немии, ги-
перкалиемии, увеличения содержания сывороточной лактат-дегидро-
геназы);
• определение скорости клубочковой фильтрации (по формулам Соск-
roft-Gault и/или MDRD);
124
Нефрология. Неотложные состояния
• анализ крови на гемостаз (определение показателей коагулограммы:
обязательно исследование активированного частичного тромбопла-
стинового времени, протромбинового времени, международною нор-
мализованного отношения);
• исследование плазменной концентрации D-димера;
• определение сывороточного титра антител к кардиолипину, Р-глико-
протеиду (проводят при наличии соответствующих клинических по-
казаний, наиболее обосновано — при почечных тромботических ми-
кроангиопатиях (см. гл. 8 «Почечные тромботические микроангиопа-
тии»));
• ультразвуковое исследование почек (может выявить инфаркты почек,
в режиме допплеровского картирования — тотальное или очаговое
обеднение кровотока, связанное с тромбозом / тромбоэмболией кро-
воснабжакяцих эти участки артерий);
• компьютерную томографию почек в режиме ангиоконтрастирования
(с большей, чем ультразвуковое исследование, достоверностью де-
монстрирует инфаркты почек и наличие тромбов в почечных артери-
ях, однако применение контрастного агента опасно при креатинине-
мии > 2 мг/лл и/или расчетной скорости клубочковой фильтрации
< 60 мл/мин.);
• магнитно-резонансную томографию ночек с контрастным усилени-
ем (демонстрирует инфаркты почек и участки нарушения кровот ока.
соответствующие расположению тромбов; контрастные агенты, ис-
пользуемые при магнитно-резонансной томографии, более безопас-
ны для функции почек, чем применяемые при компьютерном томо-
графии);
• контрастную ангиографию почечных артерий (позволяет с наиболь-
шей достоверностью обнаружить тромбы, но опасна в связи с риском
дальнейшего ухудшения функции почек)
Тактика обследования пациента с тромбозом / тромбоэмболией почеч-
ных артерий может быть дополнена в зависимости ог вероятных предрас-
полагающих факторов. Так, при фибрилляции предсердий показана эхокар-
диография, позволяющая оценить размеры полости левого предсердия и
выявить наличие в ней тромбов (наибольшей точностью в этом отношении
характеризуется чреспищеводная эхокардиография) При возникновении
не объяснимых очевидными причинами артериальных тромбозов и/илн
тромбоэмболий у молодых людей, особенно в ситуации, когда очевидные
факторы риска отсутствуют, необходимо обследование, направленное на
выявление соответствующих генетических детерминант.
тромбоз и тромбоэмболия почечных сосудов
125
Лечение
Тактика лечения тромбоза и тромбоэмболии почечных артерий анало-
гична принято!] для лечения тромботических и тромбоэмболических пора-
жения артерий другой идеализации. Основу лечения составляют низкомо-
лекулярные гепарины с возможным в дальнейшем переводом на пероральные
антикоагулянты (варфарин). Следует избегать передозировки антикоагу-
лянтов, так как из-за нее может произойти фрагментация тромба в почеч-
зых артериях и развиться эмболия дистальной части почечного сосудистого
□уела мелкими тромботическими частицами.
Длительный прием антикоагулянтов направлен на предупреждение
тромбозов и тромбоэмболий артерий другой локализации. Если тромбоз
али тромбоэмболия почечных артерий возникли на фоне атеросклероза, по-
казаны также антитромбоцитарные препараты (возможна комбинация
аспирина с клопидогрелем). статины в высоких дозах. К сожалению, эффек-
тивность и безопасность антикоагулянтов и антитромбоцитарных препара-
тов для предупреждения тромбоза и тромбоэмболии именно почечных
артерий пока не стали объектом изучения специально планируемых клини-
ческих исследований.
Следует подчеркнуть, что, если некоторые предрасполагающие факторы
( например, злокачественная опухоль) в полной мере не устранены, риск ре-
цидивов тромбоза и тромбоэмболии почечных артерий остается очень вы-
соким.
Все пациенты, перенесшие эпизод тромбоза или тромбоэмболии по-
чечных артерий, нуждаются в продолжительной профилактике повтор-
нъгх артериальных тромбозов и тромбоэмболий по общепринятым пра-
вилам: оправдано сочетание пероральных антикоагулянтов (варфарина)
z антитромбоцитарных препаратов. В ситуации, когда варфарин прихо-
дится отменять (планируемое оперативное вмешательство, беремен-
ность. риск нежелательного взаимодействия с другими лекарственными
препаратами), необходим возврат к использованию низкомолекулярных
гепаринов.
Опыт тромболизиса при тромбозе и тромбоэмболии почечных артерий
счерпывается описанием отдельных наблюдений и небольшими клиниче-
гкими исследованиями. При успешно выполненном тромболизисе, как пра-
вило. удается добиться снижения АД и стабилизации (но не полного вос-
гтановления) почечной функции. Польза от тромболизиса максимальна,
если эту процедуру выполнять в сравнительно короткий срок после дебюта
'ромбоза или тромбоэмболии почечных артерий. Впрочем, продолжитель
яость этого периода для почечной гкани несколько больше, чем при остром
инфаркте миокарда в связи с большей, чем в миокарде, исходной развито-
126
Нефрология. Неотложные состояния
стью сосудистых коллатералей. При передозировке тромболитика или трав-
ме тромба катетерОлМ возможна его фрагментация с последующим нараста-
нием почечной недостаточности.
Прогноз
На прогноз развития тромбозов и тромбоэмболий почечных артерий
оказывают влияние, с одной стороны, выраженность поражения почек и
степень утраты их функции, с другой стороны, особенности предраспола-
гающих к тромботическим и тромбоэмболическим осложнениям факторов
и заболеваний (вероятность неблагоприятного исхода максимальна при па-
ранеопластической тромбофилии). Кроме того, следует иметь в виду на-
блюдающийся у таких больных значительный риск потенциально фаталь-
ных повторных тромбозов и тромбоэмболий другой локализации как
артериальных (острого коронарного синдрома / острого инфаркта миокар-
да с подъемом сегмента ST, острого нарушения мозгового кровообращения
ишемии и инфаркта кишечника), так и венозных (тромбоэмболии легочной
артерии). Риск смерти максимален в ближайший период после эпизода
тромбоза или тромбоэмболии почечной артерии: по данным N. Hazanov и
соавт. (2004), смертность в течение первых 30 дней составляет 11,8%. В даль-
нейшем более чем у 50% пациентов удается добиться полного или, чаше,
частичного восстановления функции ночек. Основными моментами, спо-
собствующими улучшению прогноза, по-видимому, являются своевремен-
ность выяснения и устранения причин развития тромбозов и тромбоэмбо-
лий почечных артерий и предрасполагающих к ним факторов, а также
адекватность антикоагулянтной терапии.
Перспективы
Эффективность лечения тромбоза и тромбоэмболии почечных артерий
может быть существенно повышена за счет совершенствования режимов
антикоагулянтной терапии и повышения селективности антикоагулянтов
С этой точки зрения значительный интерес представляют селективные
антагонисты а-субъединиды фактора X, не вмешивающиеся в «физиологи-
ческую» составляющую системы гемостаза (фондапаринукс — препарат
данной группы, продемонстрировал эффективность, сопоставимую с эф-
фективностью низкомолекулярного гепарина, и разрешен к клиническому
применению), а также прямые ингибиторы тромбина. Совершенствование
профилактики тромбоза и тромбоэмболии почечных артерий во многом
определяется своевременностью выявления и полнотой устранения соот-
ветствующих факторов риска.
I
^•мбоз и тромбоэмболия почечных сосудов
127
ТРОМБОЗ ПОЧЕЧНЫХ ВЕН
Тромбоз почечных вен может развиваться изолированно или в рамках
^игпростраиенного венозного тромбоза, вовлекающего систему нижней пи-
лой вены. Опасность тромбоза почечных вен состоит как в развитии харак-
трного почечного поражения, так и в том, что осложнением его может стать
жггенциально фатальная тромбоэмболия легочной артерии
Эпидемиология
Традиционно рассматриваемый как казуистически редкий тромбоз по-
чечных вен, тем не менее, нередко осложняет различные заболевания,
омзровождающиеся увеличением риска венозных тромбозов и тромбо-
яоолий, в том числе первичные тромбофилии, например первичный анти-
фосфолип и дный синдром. Односторонний или двусторонний тромбоз по-
чечных вен может наблюдаться почти у 30% пациентов с длительно
счцествуюшим нефротическим синдромом, чаще всего (37%) — при мем-
бранозной нефропатии, реже (около 25%) — при мезангиокаииллярном гло-
грудонефрите и нефропатии минимальных изменений. Следует тем не
'ждее подчеркнуть, что приведенные данные были получены еще до широ-
сго внедрения в практику видения пациентов с нефротическим синдромом
«□временных антикоагулянтов.
Анализ крупных баз данных свидетельствует о том, что частота визник-
жиения тромбоза почечных вен при нефротическом синдром< не превыша-
ет 05%. Реальная величина данного показателя, очевидно, существенно
sene в связи с тем, что многие случаи тромботического поражения почеч-
жех вен своевременно не распознают, тем более при нефротическом син-
jprwe. при котором дебют клинических признаков (увеличение протеину-
^ql гематурия, снижение скорости клубочковой фильтрации) часто
стереотипно интерпретируют как нарастание активности основного почеч-
мго заболевания.
Этиология
Причину возникновения тромбоза почечных вен далеко не всегда удает-
ся своевременно распознать. Развитие тромбоза почечных вен, как и других
аюзных тромбозов, как правило, обусловлено наличием первичных или
игрнчных тромбофилий (табл. 7.3).
128
Нефрология. Неотложные состояли
Таблица 7 J
Этиология тромбоза почечных вен
Вариант тромбофилии Причина развития & «МГоэв почечным аан
Первичная • Мутация фактора V (Leiden); • мутация 20201 гена протромбина; • носительство 4G аллеля гена ингибитора активатора плазминогена типа 1, особенно в гомозиготном варианте сопровождающееся его гиперпродукцией; • носительство! аллеля (особенно ТТ-генотипа) метилентетрагидрофолат-редуктазы; • первичный антифосфолипидныи сичдром, • врожденная гиперфибриногенемия
Вторичная • • Гиповолемия (особенно у новорожденных и маленьких детей), • вторичным антифосфолипидныи синдром (ассоциировав ный с системной красной волчанкой, злокачественными опухолями), • злокачественные опухоли (паранеопластическаятромбс филия); • острый панкреатит (особенно с панкреонекрозом), • нефротический синдром (чаще при мембранозной не- фропатии); • беременность и послеродовый период, осложненные тромбофлебитом вен малого таза; • воспалительные заболевания кишечника (болезнь Крона, язвенный колит); • тупая травма живота*
* По-видимому, может провоцировать тромбоз почечных вен только при наличии други»
причин, в частности первичных тромбофилий
Взаимосвязь тромбоза почечных вен с нефротическим синдромом хоро-
шо известна: чаше всего он возникает у больных мембранозной нефропати-
ей. Тромбоз почечных вен нередко наблюдают в гиперкоагуляционную фаз)
ДВС-синдроми, часто в сочетании с венозными тромбозами другой локали-
зации Именно поэтому тромбоз почечных вен нередко вносит вклад в даль-
нейшее ухудшение состояния пациентов, находящихся в критическом по-
ложении вследствие полиорганной недостаточности при заболеваниях, при
которых одна из ведущих ролей в ее формировании принадлежит генерали-
зованным расстройствам в системе гемостаза (например, при остром пан-
креатите с панкреонекрозом). Тромбофлебит вен малого таза у беременных
и рожениц может сопровождаться тромбозами в системе нижней полон
вены с вовлечением почечных вен. Тромбоз почечных вен — вероятное
осложнение некоторых системных болезней, в том числе системной крас-
ной волчанки, особенно ассоциированной с антифосфолипидным синдро-
мом. и воспалительных заболеваний кишечника — болезни Крона и язвен
ного колита.
^омбоз и тромбоэмболия почечных сосудов
129
Первичный антифосфолипидный синдром и генетически детерммниро-
занные (резистенгносгью к акшвиронанному проюину С, мутацией факто-
re V (Leiden), мутацией 20201 гена протромбина, носительством Т-аллеля
* особенно в гомозиготной форме) генаметилентетрагид рофолат-редуктазы,
«личном 4G-генотипа гена ингибитора активатора плазминогена типа 1)
тэомбофилии — ведущие причины тромбоза почечных вен у детей, в том
•меле новорожденных. О носительстве генетических детерминант первич-
ных тромбофилий и его лабораторных маркерах, например гипергомоци-
—еинемни, являющейся следствием наличия ТТ-генотипа метилентетра-
тирофолат-редуктазы и имеющей самостоятельное значение как фактор
г«*ска венозных тромбозов, следует думать во всех случаях, когда происхо-
ждение тромбоза почечных вен не очевидно. В|южденная резистентность к
мотивированному протеину С является одной из наиболее частых причин
rt-меиного тромбоза. При наличии мутации фактора V (Leiden), выявляю-
щейся в 30 -60% случаев семейной тромбофилии, риск тромбоза увеличи-
вается примерно в 1,5—2 раза при гомозиготном носительстве и на 5 -10% -
три гетерозиготном. Также с увеличенным риском венозного тромбоза
ассоциировано увеличение плазменного уровня фак юра VIII
Необходимо иметь в виду и возможность нарангипластическиго проис-
хождения тромбоза почечных вен, особенно у пожилых больных. Тромбоз
точечных вен наблюдают как непосредственно при злокачественных опухо-
ых почек (при этом в тромботических массах возможно обнаружение ати-
1хчных клеток), так и при неоплазмах отдаленной локализации, сопрово-
ждающихся развитием пара неопластической тромбофилии. Первый эпизод
тх-мбоза почечных вен возможен, в том числе непосредственно после хи-
у-гического удаления опухоли, сеанса химио- или лучевой терапии, как
сзестно, сопровождающихся дальнейшим увеличением риска тромботиче-
то и тромбоэмболического поражения крупных вен.
Тромбоз почечных вен может быть спровоцирован тупой травмой живо-
а также хирургическим вмешательством на венах. В таких случаях веро-
г^ость развития венозных тромбозов, в том числе тромбоза почечных вен,
повышается при наличии других факторов риска (генетически детермини-
хваннои тромбофилии, ожирения, приема эстрогенсодержащих препара-
“~в >
Патогенез
Патогенез почечного поражения при тромбозе почечных вен складыва-
ния из последствий венозного застоя, обусловливающего:
• нарастающие расстройства внутрипочечной гемодинамики с ухудше-
нием фильтрационной функции почек;
*—вы ~х~ия
130
Нефрология. Неотложные состояние
• развитие ишемии почечной ткани (в первую очередь, структур почеч-
ного тубуло-интерстиция ),
• повышение плазменной активности ренина (возможен подъем АД ):
• постепенную утрату гломерулярной базальной мембраной свойств се
лективности с повышением проницаемости ее для альбумина;
• пропотевание в интерстициальное пространство компонентов плазмы
крови.
Выраженность почечного поражения зависит от темпов формирования
окклюзии почечной вены. Формирование коллатерального венозною кро-
вотока занимает не менее нескольких суток, в связи с чем при локализации
тромбов в обеих магистральных почечных венах поражение нередко приоб-
ретает необратимый характер.
Морфология
Специфические морфологические признаки поражения почек при тром-
бозе почечных вен не описаны. Макроскопически — почки увеличены, циа-
нотичны При микроскопическом исследовании отмечают полнокровие по-
чечных клубочков, стаж и сладж эритроцитов в дилатированных
капиллярных петлях, участки микротромбоза. Проксимальные и дисталь-
ные канальцы нередко дистрофичны. Возможны гиперплазия структур юк-
стагломерулярного аппарата и насыщенность его клеток рениновыми гра-
нулами (маркеры нарастающей почечной ишемии).
Иногда в результате тромбоза почечных вен развиваются геморрагиче-
ские инфаркты почек, при гистологическом исследовании представленные
типичными участками некроза почечной ткани.
Клиническая картина
Клинические признаки тромбоза почечных вен во многом определяются
предрасполагающими факторами и в первую очередь заболеваниями, в рам
ках которых он развивается (например, мембранозной нефропатией с не-
фротическим синдромом). Кроме тою, нередко возникает не только тром-
боз почечных вен, но развиваются шлюзные тромбозы и тромбоэмболии
другой локализации, которые (как. например, тромбоэмболия легочной ар-
терии) часто приобретают самостоятельное клиническое и прогностическое
значение.
При выявлении признаков окклюзирующего тромбоза почечных вен
следует принимать во внимание быстроту и внезапност ь их возникновения.
В пользу тромбоза почечных вен свидетельствуют:
• быстрое увеличение почки на стороне поражения (нередко она стано-
вится доступна для пальпации);
*фом6оз и тромбоэмболия почечных сосудов
131
• боли в поясничной области (могут воспроизводить почечную колику);
• гематурия (чаще впервые выявляют микрогематурпю);
• протеинурия, иногда нарастающая:
• снижение скорости клубочковой фильтрации;
• гиперкреат ишшемия,
• тромбоцитоз ' тро\|боцитопения;
• лейкоцитоз:
• метаболический ацидоз,
• уветичение сывороточной активности лактат- ier идрогеназы.
У новорожденных детей (тромбоз почечных вен может начинаться вну-
триутробно) на первый план среди клинических проявлений могут высту-
пать признаки интоксикации — лихорадка, иногда с очетающаяся с фсбрить-
«ыми судорогами, тошнота, рвота, быстрая дегидратация и нарушение
дознания. Смерть может наступать в течение нескольких часов.
Диагностика
Диагностика тромбоза почечных вен основывается на своевременном
выявлении соответствующих клинических признаков, предрасполагающих
Факторов, а также на данных визуализирующих и лабораторных методов
.^следования. К таким признакам относят:
• увеличение СОЭ. гейкоцитоз, тромбоцитоз / (ромбоцитопсния (по
данным общего анализа крови);
• .микрогематурия. протеинурия (по данным общего анализа мочи),
• гиперкреатининсмия. ги перу ри кем ия, увеличение сывороточной ак-
iявности ЛДГ (по данным биохимического анализа крови);
• снижение скорости клубочковой фильтрации (расчш анион по форму
лам Cockroft-Gauk, MDRD);
• повышение сывороточного уровня фибриногена, возможно
(‘-реактивного белка-
• повышение плазменной концентрации D-димера:
• увеличение одной или обеих почек (по данным рентгенографии но-
чек);
• увеличение одной или обеих иоче к обеднение внутрипочечного крн
вотока, снижение эхогенности почечной паренхимы ла счет отека
структур губуло-интарстиция (поданным УЗИ брюшной полости, в
гом числе в допплеровском режиме);
• тромбы в почечных в<'пах (по (энным компьютерной tomoi рафии и
Mai нитно-резонансной iомографии, выпилиеных в режиме аш иокип-
трастирования).
132
Нефрология. Неотложные состояние
«Золотым» стандартом диагностики тромбоза почечных вен является
селективная венография — инвазивный метод обследования, часто трудно
выполнимый. В процессе селективной венографии почечных вен может
быть выполнен тромболизис.
Лечение
Пациентам, у которых развился тромбоз почечных вен, показаны анти-
коагулянты Предпочтительны низкомолекулярные гепарины, в дальней-
шем, с целью профилактики рецидивов венозных тромбозов, показано на-
значение варфарина.
Опыт тромболизиса при тромбозе почечных вен исчерпывается описа-
нием отдельных наблюдений, как правило, с относительно благоприятным
исходом. Для тромболизиса при тромбозе почечных вен применяют стреп-
токиназу, урокиназу, а также рекомбинантный тканевой активатор плазми-
ногена. Очевидно, что выполнение тромболизиса обосновано только в тече-
ние относительно короткого периода с момента окклюзии почечной артерии.
Ориентировочными показаниями к тромболизису при тромбозе почечных
вен следует считать:
• неэффективность гепаринов, в гом числе низкомолекулярных;
• тромбоз обеих почечных вен;
• острую почечную недостаточность, связанную с окклюзией почечных
вен;
• большой и/или растущий тромб, создающий опасность формирова-
ния громбоэмболов с последующим попаданием их в нижнюю полую
вену и ветви легочной артерии;
• сочетание с тромбоэмболией легочной артерии;
• выраженную, не купируемую стандартными терапевтическими мето-
дами, боль в поясничной области.
По данным систематизированных обзоров, тромболизис в настоящее
время выполняют не более чем у 15% больных тромбозом почечных вен
Прогноз
Тромбоз почечных вен всегда прогностически неблагоприятен, в том
числе потому, что ассоциирован с очень высоким риском рецидива и веноз-
ных тромбозов, и тромбоэмболий другой локализации. Установлено, что
выживаемость пациентов с тромбозом почечных вен достоверно меньше,
чем у лиц с тромбозом глубоких вен голеней. Прогноз при тромбозе почеч-
ных вен во многом определяется также особенностями заболевания, при
котором он возник. Независимыми факторами риска смерти являются
Тромбоз и тромбоэмболия почечных сосудов
133
ассоциации с инфекцией и злокачественной опухолью. Использование вар-
фарина, напротив, приводит к увеличению выживаемости.
При тромбозе почечных вен у новорожденных почка подвергается атро-
фии не менее чем в 70% случаев; 19,3% выживших детей в дальнейшем де-
монстрируют стойкую артериальную гипертензию, 3% — нуждаются в за-
местительной почечной терапии.
Перспективы
Эффективность лечения состоявшегося тромбоза почечных вен может
быть повышена за счет совершенствования антикоагулянтов (см. «Тромбоз
точечных артерий»). Для профилактики принципиальное значение имеют
своевременное выявление и устранение вторичных и первичных факторов
риска, в том числе проведение скрининговых популяционных обследова-
нии. направленных на выявление генетических детерминант тромбофилий
с последующим проведением профилактических и лечебных мероприятий
Неотложные мероприятия
• Мониторит показателей периферической крови, диуреза, общего
анализа мочи, а также показателей, характеризующих функцию почек
(таких, как креатининемия, калиемия, скорость клубочковой филь-
трации).
• Мониторинг стандартных параметров коагулограммы и плазменного
уровня D-димера.
• 1 {азначение низкомолекулярных гепаринов в лечебных дозах.
• При анурии / гиперкалиемии > 6,5 мЭкв/л обсуждение вопроса о
проведении экстренного гемодиализа.
* При доказанной локализации тромба в магистральной почечной арте-
рии или вене тактику ведения следует определять совместно с сосуди-
стым хирургом.
Глава 8
ПОЧЕЧНЫЕ ТРОМБОТИЧЕСКИЕ
МИКРОАНГИОПАТИИ
Почечные тромботические микроангиопатии — группа заболеваний,
характеризующихся поражением артериол и клубочковых капилляров
с утолщением их стенок, образованием тромбоцитарных тромбов в их
просвете и полной или частичной их обструкцией. Как правило, громбо-
тические микроангиопатии возникают при одновременно или последова-
тельно возникающих расстройствах cwuopoi очною и тромбоцитарного
звеньев гемостаза, а также при вовлечении эндотел иоцигов. Наряду с хо-
рошо известными вариантами почечных тромботических микроангиопа-
тий (тромботической тромбоцитопенической пурпурой и гемолитико-
уремическим синдромом) их число в последние годы существенно расши-
рилось, в первую очередь — за счет генетически детерминированных
(первичных) тромбофилий, а также антифосфолипидного синдрома, как
первичного, так и ассоциированного с системными заболеваниями, в пер-
вую очередь сис темной красной волчанкой.
ЭПИДЕМИОЛОГИЯ
Тромботическую тромбоцитопеническую пурпуру принято считать
казуистически редкой, однако в течение последнего десятилетия можно
констатировать увеличение частоты ее обнаружения, связанное, ио-
видимому, с улучшением качества диагностики. Ежегодно регистрируют
О1 3 до 10 новых случаев идиопатической тромботической тромбоцитопе-
нической пурпуры на 1 миллион населения. Тем не менее существуют ка-
тегории больных, у которых частота возникновения вторичной тромбо-
цитопенической пурпуры может достигать 5—10%. Это пациенты со
злокачественными опухолями (раком молочной железы, раком легкого,
тимомой, лимфогранулематозом и неходжкинскими лимфомами, страда-
ющие ВИЧ-инфекцией, а также реципиенты трансплантата клеток-пред-
шественников гемопоэз.
Гемолитико-уремический синдром, ассоциированный с диареей, наблю-
дается преимущественно у детей, хотя в последние годы появляется все
Почечнь е тромботические микроангиопатии
135
больше наблюдении, демонстрирующих возможность развития его у взрос-
лых. Данный вариант гемолитико-уремического синдрома нередко наблю-
дается в виде эпидемических вспышек, харак1еризуюшихся резким подъе-
мом заболеваемости кишечной инфекцией, вызванной 0157. Н7 штаммами
Echerichia coll, при этом по 10 (в отдельных ситуациях — до 30%) случаев
coli-инфекции могут осложняться почечной тромботической микроан-
гиопатией. Считают, что вероятность ассоциированно! о с диареей гемолити-
ко-уремического синдрома возрастает при попытках лечения кишечных
инфекции антибактериальными препаратами. Гемолитико-уремический
синдром, не ассоциированный с диареей, составляет не более 10% всех слу-
чаев этого заболевания.
Внедрение в клиническую практику высокочувствительных методов
выявления серологических маркеров антифосфолинидного синдрома (ан-
ти карл вол и пиновых антител, антител к Р-2-гликопротеиду I) позволило
продемонстрировать его значительную распространенность в обшей попу-
ляции, по существу, объясняющую многие ранее нс расшифровываемые
случаи злокачественной артериальной гипертензии, отличавшиеся бы» гро
прогрессирующим поражением почек, а также атипичные формы течения
почечного процесса при системной красной волчанке, отличавшиеся на-
растающим ухудшением почечной функции, нс совпадавшим с другими
маркерами активности волчаночного нефрита (в том числе величиной про-
теинурии).
Наблюдения за больными почечной тромботической мпкроаш иопатией
при генетически детерминированных тромбофилиях (например, гиперго-
моцистеииемин) пока единичны и не позволяют составить представление
об истинной распространенности этой формы заболевания. Тем нс менее
как и в случае с антифосфолипидным синдромом, можно предполагать ре-
шающий вклад первичных генетически детерминированных тромбофилий
в развитие хронической болезни почек, причине которой при стандартном
обследовании установить не удается.
ЭТИОЛОГИЯ
Выделяют генетически детерминированные и приобретенные вари-
анты почечных тромботических микроангиопатий (табл. 8.1). Число ве-
роятных этиологических факторов этих заболеваний постоянно увели-
чивав 1СЯ.
136
Нефрологий. Неотложные состояния
Таблица 8 1
Этиологические варианты почечных тромботических
микроангиопатий
Группа м£ом«анм4 Этно логическая форма и/нлм причина мбомадипя
Приобретена е • Ассоциированная с инфекцией энтеротоксигенных штаммов Echerichta colt; • ассоциированная с дефицитом протеазы фактора von Willebrand; • ассоциированная с беременностью; • ассо (иированная с системными заболеваниями (системная красная волчанка), • ассоциированная с приемом лекарственных препаратов (ин- гибиторы кальцинейрина, тиклопидин, хинин); • развивающаяся у реципиентов органных трансплантатов
Генетически детермини роеанные • Недостаточность фактора Н комплемента; • недостаточность фактора 1 комплемента; • недостаточность мембранного кофактора протеина; • недостаточность протеиназы фактора von W'llebrand (ADAMTS13); • первичный антифосфолипидный синдром. • первичная тромбофилия (мутация фактора V (Leiden), Т-аллель гена метилентетрагидрофолатредуктазы)*
• Случаи ассоциации с почечной тромботической микроангиопатией в настоящее время но-
сят казуистический характер
ПАТОГЕНЕЗ
В патогенезе тромботических микроангиопатий можно выделить два
основных звена: повреждение и активацию эндотелиальных клеток и агре-
гацию тромбоцитов. Оба процесса приводят к сужению просвета сосуда
тромбом и вазоконстрикции с последующей ишемией почечной ткани дис-
тальнее повреждения. Повреждение эндотелия различными токсинами при-
водит к развитию микроангиопатии, которая может формироваться не-
сколькими путями:
• под поврежденным эндотелием открывается потенциально тромбо-
генная субэндотелиальная соединительная ткань;
• уменьшение продукции простагландина 12 и NO, в норме вызываю-
щих вазодилатацию и подавляющих агрегацию тромбоцитов, ини-
циирует. соответственно, вазоконстрикцию и усиление агрегации
тромбоцитов;
• эндотелиальные клетки вырабатывают необычно крупные мультиме-
ры фактора фон Виллебранда, вызывающие агрегацию тромбоцитов.
Почечные тромботические микроангиопатии
137
Высокомолекулярные полимеры фактора фон Виллебранда в норме на-
ходятся в эндотелиальных клетках, поэтому их обнаружение в плазме паци-
ентов с тромботической микроангиопатией свидетельствует о повреждении
эндотелия. В норме эти мультимеры расщепляются металлопротеиназой
ADAMTS13; при тромботической тромбоцитопенической пурпуре ее уро-
вень в плазме понижен, кроме того, в ней обнаруживают блокирующие ан-
титела. При обследовании пациентов с тромботической тромбоцитопениче-
ской пурпурой выявлено, что эти показатели являются предикторами
рецидива заболевания. Недостаточность AD AMTS 13 крайне редко встре-
чается при классическом (детском) гемолитико-уремическом синдроме,
развивающемся под действием шигатоксина (для его обозначения ранее
использовали также термин «веротоксин»). При врожденной или приобре-
тенной потере активности металлопротеиназы ADAMTS13 крупные мулъ-
тимеры фактора фон Виллебранда циркулируют в крови и вызывают агре-
гацию тромбоцитов и образование тромбов в сосудах микроциркуляторного
русла.
В патогенезе гемолитико-уремического синдрома, сопровождающегося
диареей, основная роль отводится повреждению эндотелия почечных со-
судов токсинами, продуцируемыми Е. Culi и Shigella. При более редком
варианте гемолитико-уремического синдрома, не сопровождающемся диа-
реей (атипическом гемолитико-уремическом синдроме), зачастую обнару-
живают гетерозиготную мутацию в одном из четырех генов, кодирующих
факторы комплемента Н. I. В и мембранный ко-фактор протеин (CD46).
Снижение активности приводит к потере ими способности подавлять акти-
вацию комплемента. Эндотелий капилляров почечных клубочков особенно
чувствителен к нарушению регуляции системы комплемента, в связи с чем
при данной форме гемолитико-уремического синдрома преимущественно
поражается микрососудистое русло почек. О нарушении метаболизма ком-
понентов базальной мембраны капилляров почечных клубочков при тром-
ботических микроангиопатиях свидетельствует повышенная концентра-
ция ламинина-Р1 (ламинина-гликопротеина базальных мембран) в плазме
крови.
МОРФОЛОГИЯ
Заболевания, объединенные в группу тромботических микроангиопа-
тий, характеризуются не только схожей клинической картиной (развивают-
ся микроангиопатическая гемолитическая анемия, тромбоцитопения, пора-
жение почек), но и близкой морфологической, проявляющейся тромбозом
капилляров и артериол различных органов, в том числе и почек. Поражение
138
Нефрология. Неотложные состот—
почек проявляется образованием тромбов, состоящих из тромбоцитов илж
тромбоцитов и фибрина, в междольковых артериях, артериолах и капилля-
рах клубочков, а также некрозом и утолщением стенок сосудов. Морфоло-
гическая картина изменений сосудов почек схожа с таковой при злокаче-
ственной гипертензии и системной склеродермии. Изредка злокачественная
гипертензия может быть ассоциирована с реиалъиой тромботической ми-
кроангиопатией, при этом в почках можно обнаружить изменения, харак-
терные для последней.
В биоптате почечной ткани, взятом на ранней стадии заболевания, мож-
но выявить фибриноидный некроз, отложения фибрина в интиме или под
интимой, тромбоз, пролиферацию эндозелиальных клеток мелких артерии
и артериол. В почечных клубочках обнаруживают острые ишемические по-
вреждения. В капиллярах — отек эндотелия с сужением просвета сосуда
Отмечается расширение мезангия, а в тяжелых случаях — мсзангиолизис
С течением времени заболевание прогрессирует, и через несколько недель
происходит утолщение шпимы мелких артерий и артериол со значитель-
ным сужением просвета. Утолщение интимы возникает вследствие ее муко-
идного отека, который при окраске гематоксилином и эозином имеет базо-
фильный вид. Типичной находкой являются аневризматические расширения
некоторых артериол.
При электронно-микроскопическом исследовании можно выявить наи-
более характерную черту гемолитико-урехмического синдрома — сужение
просвета капилляров в результате значительного расширения подэндотели-
ального пространства, заполненного бледным фибриллярным материалом,
который при использовании иммуногистохимического метода окрашивает-
ся антителами к фибриногену. Между эндотелиальными клетками и этой
электронно-прозрачной зоной обнаруживается тонкий слой мембранопо-
добного вещества, который под микроскопом выглядит двухконтурным.
Фибрин и агрегированные тромбоциты закрывают просвет капилляров, эн-
дотелий в этих участках часто разрушен. Мезангиальные клетки гипертро-
фированы и отечны, содержат много фаголизосом. На более поздних стади-
ях в междольковых артериях и артериолах обнаруживают облитерирующий
эндартериит, напоминающий «луковичную шелуху».
КЛИНИЧЕСКАЯ КАРТИНА
Считают, что для тромботической тромбоцитопенической пурпуры в
большей степени характерно поражение центральной нервной системы, в то
время как при гемолитико-уремическом синдроме в качестве основного
органа-мишени выступают почки. Тем не менее в настоящее время конста-
Почечные тромботические микроангиопатии
139
тируют постоянное увеличение количества случаев тромботической тром-
боцитопенической пурпуры, при которой развивается тяжелое поражение
почек.
Для тромботической тромбоцитопенической пурпуры типичны тромбо-
цитопения и гемолиз, развивающийся преимущественно на уровне микро-
циркуляторного русла. В связи с этим к характерным изменениям перифе-
рической крови относят также анемию и появление шизоцитов. На коже
выявляют характерную сыпь (пурпуру). Поражение центральной нервной
системы при тромботической тромбоцитопенической пурпуре может быть
очень тяже 1ым и приводи и» к смерти. Признаки его включают:
• повышенную возбудимость;
• слабость, утомляемость;
• мышечные подергивания;
• судороги;
• транзиторное ухудшение зрения;
• мозжеч кову ю атака i ю;
• нарушение сознания вн. ютъ до комы.
Вовлечение почек при тромботической тромбоцитопенической пурпуре
проявляется нарастающей пшеркреатининемией, тем не менее сравнитель-
но редко обусловливающей необратимое ухудшение почечной функции.
Артериальная гипертензия нехарактерна. Генетически детерминированную
форму тромботической тромбоцитопенической пурпуры дифференцируют
с генетически детерминированными вариантами гемолитико-уремического
синдрома, не ассоциированного с диареей (табл. 8.2).
Таблица 8.2
Дифференциация генетически детерминированной тромботической
тромбоцитопенической пурпуры и генетически детерминированного
гемолитико-уремического синдрома
Наследственные (не ассоииироеанные с диареей]
формы ГУС”
Показатель Наследственная "’ттп- JESaLiJ Недостаточность фактора Н комплемента . 4 Недостаточность фактора! комплемента Недостаток* ость мембранного кофактора протеина
Генетическая детерминанта ADAMTS14 Ген фактора Н комплемента Ген фактора 1 комплемента Ген мембранно- го кофактора протеина
Число наблю- дений Возможно фор мирование групп больных и проведение статистического анализа >50 Единичные слу- чаи Не более 20 случаев
140
Нефрология. Неотложные состоямо
Продолжение табл 8 2
Показатель -ДгС .С Наследственная ТТЛ» Наследственные (не ассоциированные с диареей} формы ГУС**
Недостаточность фактораН комплемента Недостаточность фактора! «ОМГОММОНта Недостаточное! * мембранно е . кофактора протеина
Тип наследова- ния Аутосомно- доминантный Аутосомно- рецессивный Не установлен Не установлен
Возраст дебюта От новорожден- ных до взрослых От новорожден- ных до взрослых От новорожден- ных до взрослых Только у ново- рожденных и детей
Неврологиче- ская симптома- тика Типична Нехарактерна Не характерна Не характерна
Артериальная гипертензия Встречается редко Типична Типична Типична
Острая почечная недостаточность У небольшой ча сти больных Типична Типична Типична
Хроническая по- чечная недоста- точность в исхо- де болезни Не развивается Типична Типична Типична
Критерии поста- новки диагноза Снижение ADMATS13 в плазме крови < 10%; обследование родителей; типирование ге- нов Определение сывороточной активности фак- тора Н, типирование ге- нов Определение сывороточной активности фак тора 1; типированиеге- нов Определение сывороточной активности мем- бранного ко- фактора протеи- на; типирование ге- нов
Инфузия плазмы Эффективна (проводят каж- дые 2—3 недели) Может быть эф- фективна Эффективность не установлена По-видимому, неэффективна ।
Рецидив в по- чечном транс- плантате Потребность в трансплантации почки не возни- кает Да Да Не описан
Воспроизведе ние в экспери- менте Возможно Возможно (од- новременно яв- ляется моделью мезангиокапил лярного гломе- рулонефрита) Нет Нет
• ТТП - тромботическая тромбоцитопеническая пурпура.
** ГУС — гемолитико-уремический синдром.
Почечные тромботические микроангиопатии
141
Гемолитико-уремический синдром, ассоциированный с диареей,
обычно дебютирует бурно. Геморрагическая некупируемая диарея с лихо-
радкой быстро дополняется олигоанурией. Ухудшение почечной функции
может быть очень значительным. Для ассоциированного с диареей гемо-
литико-уремического синдрома типична высокая артериальная гипертен-
зия, не уступающая комбинации антигипертензивных препаратов. Генети-
чески детерминированные формы гемолитико-уремического синдрома,
для которых диарея не характерна, отличаются большей выраженностью
некоторых клинических признаков и в целом более злокачественным те-
чением (табл. 8.3).
Таблица 8.3
Клинические особенности ассоциированного с диареей и генетически
детерминированных форм гемолитико-уремического синдрома
Показатель - — Г«молитико-ур«мич»Скмй синдром
Ассоциированным с диарый Не ассоциированный с диареей (спорадический генетически детерминиро- ванный]
Генетическая предрасполо- | женность По-видимому, не играет су- щественной роли Имеет решающее значение и может быть выявлена при генетическом исследовании
J Возраст дебюта болезни 2 и более года Новорожденные / дети пер- вого года жизни
Сезонность Чаще летом В любое время года
Социальные особенности Чаще у жителей пригородов, представителей белой расы Отсутствуют
Продромальный период Кровавая диарея Отсутствует
Особенности начала болез ни Бурное Как правило, постепенное
Вовлечение центральной нервной системы Редко Более характерно
Рецидивы Крайне редки Характерны
Терминальная почечная не- достаточность Крайне редко Типична
Смерть Крайне редко Типична
При антифосфолипидном синдроме возможно одновременное или по-
следовательное вовлечение почечных артерий различного калибра, как со-
ставляющих почечное микроциркуляторное русло, так и магистральных,
142
Нефрология Неотложные состояние
стенозирование просвета которых организующимися тромботическими
массами может приводить к формированию тяжелой реноваскулярной
артериальной гипертензии. Особенностями почечной тромботической
микроангиопатии при антифосфолипидном синдроме следует считать уме-
ренность изменений в составе мочи (часто ограниченных «следовой» про-
теинурией, сочетающейся с высокой артериальной гипертензией, выражен-
ным снижением скорости клубочковой фильтрации, гиперкреатининемией
и нередко — гиперкалиемией), а также артериальные тромбозы другой ло-
кализации (транзшорную ишемическую атаку / ишемический мозговой
инсульт, тромбоз артерий сетчатки глаза, острый коронарный синдром
острый инфаркт миокарда), проявления которых нередко выходят на пер-
вый план в к типической картине.
Иногда почечная недостаточность приобретает быстропрогрессирую-
щий характер, одновременно развиваются артериальные и венозные тром-
бозы нескольких сосудистых бассейнов, обусловливающие резкое ухудше-
ние состояния пациента. Подобный вариант течения аитифосфолииидного
синдрома получил название катастрофического.
Закономерности клинической эволюции почечной тромботической ми-
кроангиопатии, заключающиеся в преобладании выраженности ухудшения
фильтрационной функции почек над изменениями в составе мочи, под-
тверждены работами отечественных авторов и в отношении его вторичных
форм. Так, при волчаночном нефрите наличие циркулирующих антител к
кардиолипину и тем более клинических проявлений антифосфолипидного
синдрома ассоциировано с юстоверным нарастанием частоты транзитор-
ной гиперкреатишшемии. Проявления почечной тромботической микроан-
гиопатии при других вариантах генетически детерминированных первич-
ных тромбофилий (например, гипергомоцнетеинемии или носительстве
мутации фактора V (Leiden)), по-видимому, близки к антифосфолипид но-
му синдрому, однако уточнение особенностей их течения требует накопле-
ния большего опыта длительного наблюдения за группами подобных паци-
ентов.
ДИАГНОСТИКА
Диагностика почечных тромботических микроангиопатии основана на
сопоставлении данных анамнеза, клинических’ проявлений и табораторных
признаков почечного поражения, в том числе динамики показателей, харак-
теризующих функцию почек, и изменений в составе мочи. При гемолитико-
уремическом синдроме, ассоциированном с диареей, нередко выявляют ги-
понатриемию.
Почечные тромботические микроангиопатии
143
Генетически детерминированную тромботическую тромбоцитопениче-
скую пурпуру подтверждают дефицит ADMATS13 (снижение ее активно-
сти менее 10%) и данные семейного анамнеза. Генетическим скрининг по-
зволяет обнаружить и причины спорадических (не ассоциированных с
диареей) вариантов гемолитико-уремического синдрома.
Инфицирование антеро!иксигенными штаммами Echerichia сой и Shigella
dysenteriu типа I, обусловливающее развитие ассоциированного с диареей
гемолитико-уремического синдрома, может быть подтверждено с помощью
бактери ологического исследования.
Лабораторную диагностику антифосфилинидного синдрома осущест-
вляют с помощью тесгов на специфические маркеры (антитела к кардиоли-
пину, антитела к р2-гликопротеиду типа I). Снижение скорости клубочко-
вой фильтрации при отсутствии или минимальной выраженности изменений
в составе мочи, артериальной гипертензии и рецидирующих тромбозах ве-
нозной / артериальной локализации может рассматриваться как показание
к обследованию, направленному на выявление генетических маркеров тром-
бофилий, и определению плазменной концентрации гомоцистеина.
Ухудшение внутрипочечного кровотока, типичное для почечных тром-
ботических микроангиопатий, может быть подтверждено с помощью уль-
тразвуковой допплерографии внутрипочечных артерий. Выявляемые этим
методом нарушения почечного кровотока могут оказаться по крайней мере
частично обратимыми при правильно выбранной патогенетической тера-
пии. При соответствии клинических и анамнестических данных выполне-
ние биопсии почки для диагностики большинства вариантов почечных
тромботических микроангиопатий не обязательно.
ЛЕЧЕНИЕ
Различные варианты почечных тромботических микроангиопатий в те-
чение последнего десятилетия становились объектом контролируемых кли-
нических исследований (табл. 8.4). У детей применяли преимущественно
антикоагулянты и препараты с дезагрегантным действием (дипиридамол), а
также инфузию свежезамороженной плазмы; опыт лечения взрослых боль-
ных в основном накоплен в отношении плазмафереза.
Инфузию свежезамороженной плазмы / плазмаферез рассматривают
как один из наиболее эффективных среди доступных в настоящее время ме-
тодов лечения почечных тромботических микроангиопатий. При тромботи-
ческой тромбоцитопенической пурпуре, развитие которой обусловлено де-
фицитом протеазы ADAMTS13 фактора von Willebrand, свежезамороженная
плазма является ее источником. Ориентировочные показания к инфузии
Таблица 8.4
Контролируемые клинические исследования, посвященные оценке
эффективности и безопасности различных методов лечения почечных тромботических микроангиопатий
Литературный источник Схема исстмдо- аачигг | А * — Вариант ТМ А* toXZ* Л.ЧМ.И. ’"Г"™
Д?™
Loirat С. et al, I 1984 [24] Проспективное рандомизиро- ванное мульти- центровое Гемолитико- уремический синдром 33 Основная группа — гепарин + урокиназа; контрольная - под- держивающее лечение Выживаемость, клиническое те- чение и гистологическая карти- на в основной и контрольной группах сопоставимы
I RizzoniG. etal, 1988 [25] Проспективное рандомизиро- ванное мульти- центровое Гемолитико уремический синдром 32 Свежезамороженная плазма (10-30 мл/кг/сутки); контроль- ная группа - поддерживающее лечение Выживаемость, клиническое те- чение и гистологическая карти- на в основной и контрольной группах сопоставимы
GianvitiA etal. 1993 [26] Ретроспективное мульти центровое Гемолитико- уремический синдром; к моменту включения в исследование у всех больных развилась острая почечная недо статочность 33 Плазмаферез (3-10 сеансов), контрольная группа - поддер- живающее лечение Частота резидуальной почечной недостаточности была ниже у тех, кому выполняли плазмафе- рез (18 и 43%. соответственно)
Взрослые
French Cooperative Study Group for Adult HUS. 1992 [27] Ретроспективное мультицентровое Гемолитико- уремический синдром 53 Плазмаферез (2—21 сеанс); кон- трольная группа — поддержива- ющее лечение У тех пациентов, которым про- водили плазмаферез, оказалась меньшей смертность (0 и 23%, соответственно) и частота тер- минальной почечной недоста- точности (26 и 64%)
Rock GA. et al, 1991 [28] Проспективное рандомизиро- ванное мульти- центровое Тромботическая тром- боцитопеническая пур- пура 102 Плазмаферез (3-36 сеансов); контрольная группа - инфузия свежезамороженной плазмы, ацетилсалициловая кислота, дипиридамол Меньшая смертность и большая частота достижения ремиссий у тех, кому выполняли плазмафе- рез
• ТМА - тромботическая микроангиопатия
144 Нефрология. Неотложные состояние
Почечные тромботические микроангиопатии
145
свежезамороженной плазмы / плазмаферезу при почечных тромботических
микроангиопатиях включают:
• спорадический (генетически детерминированный) гемолитико-уре-
мический синдром, не ассоциированный с диареей,
• дефицит протеазы фактора von Willebrand (врожденный и приобретен-
ный) (для данной формы заболевания это — наиболее эффективные
методы лечения, позволяющие добиться увеличения продолжительно-
сти жизни; можно сочетать с применением глюкокортикостероидов);
• тромботическая тромбоцитопеническая пурпура, ассоциированная с
беременностью (в данном случае это также методы лечения, позволя-
ющие продлить жизнь; при HELLP-синдроме и тромботической тром-
боцитопенической пурпуре, развивающейся у рожениц, применение
возможно, но заведомо менее эффективно);
• тромботическая тромбоцитопеническая пурпура, ассоциированная с
системной красной волчанкой (как правило, необходима одновремен
ная иммуносупрессивная терапия);
• любая форма почечной тромботической микроангиопатии, индуциро-
ванная лекарственными препаратами (обязательна отмена лекар-
ственного препарата, спровоцировавшего ее развитие);
• тромботическая тромбоцитопеническая пурпура у реципиентов орган-
ных трансплантатов (лечение показано, но зачастую малоэффективно).
Инфузию свежезамороженной плазмы и плазмаферез можно применять
и при других вариантах почечных тромботических микроангиопатий. Ни
при одном из пих лтп методы лечения не противопоказаны, но эффектив-
ность их пока четко не установлена.
При почечных тромботических микроангиопатиях применяют также
антитромбоцитарные препараты (ацетилсалициловую кислоту), средства с
лезагрегатным действием (дипиридамол), антикоагулянты (нефракшюни-
рованный и низкомолекулярный гепарины), тромболитические (урокина-
зу) и иммуносупрессивные (глюкокортикостероиды, винкрнстин) препара-
ты. Представление об их эффективности и безопасности в настоящее время
основано только на опыте наблюдения за отдельными пациентами и не-
большими их группами, в связи с чем показания к назначению этих препа-
ратов следует определять строго индивидуально с учетом особенностей
патогенеза заболевания, в рамках которого развивается почечная тромбо-
тическая микроангиопатия (так, при системной красной волчанке обосно-
вано назначение глюкокортикостероидов и цитостатиков) Четко установ-
лено, что у больных нефропатией, ассоциированной с антифосфолиппдным
синдромом, почечный прогноз может быть существенно улучшен при дли-
тельном применении антикоагулянтов — низкомолекулярных гепаринов с
последующей заменой их варфарином.
146
Нефрология. Неотложные сост —»>«
ПРОГНОЗ
У подавляющего большинства пациентов с генетически детерминиро-
ванными вариантами гемолитико-уремического синдрома (не ассоцииро-
ванного с диареей) развивается терминальная почечная недостаточность
прогноз крайне неблагоприятен. При гемолитико-уремическом синдроме
частота полного восстановления функции ночек может достигать 70%. Про-
гноз для больных антифосфолипидным синдромом зависит от формы пс»~
чечного поражения, выраженности почечной недостаточности и артериаль-
ной гипертензии, а также степени поражения других артериальных к
венозных бассейнов. В целом необходимо иметь в виду, что развитие почеч-
ной тромботической микроангиопатии всегда сопряжено с резким ухудше-
нием прогноза выживаемости.
ПЕРСПЕКТИВЫ
В настоящее время разработаны и клинически апробируются высо-
коаффинные антитела, а также углеводородные молекулы-лиганды
(Synsorb-Pk — STARFISH), нейтрализующие шигатоксин и, по-видимому
уже в ближайшем будущем позволяющие эффективно купировать гемо-
литико-уремический синдром, ассоциированный с диареей. Также разраба-
тываются препараты, нейтрализующие фактор von Willebrand и необходи-
мые для патогенетического лечения тромботической тромбоцитопенической
пурпуры, обусловленной врожденным или приобретенным дефицитом
ADAMTS13.
Неотложные мероприятия
• Провести мониторинг показателей периферической крови (в том чис-
ле количества тромбоцитов) и общего анализа мочи.
• Контролировать цинамику креатининемии, скорости клубочковой
фильтрации, калиемии, натриемии.
• Определить стандартные показатели ксшулограммы и плазменный
уровень D-димера.
• Обсудить проведение инфузии свежезамороженной плазмы / выпол-
нение плазмафереза (абсолютно показаны при тромботической тром-
боцитопенической пурпуре).
• При почечных тромботических микроангиопатиях, обусловленных
системными заболеваниями, определить режим иммуносупрессивном
Почечные тромботические микроангиопатии
147
терапии, как правило, подразумевающий применение глюкокортико-
стероидов и цитостатиков в сверхвысоких дозах.
• При тромботической тромбоцитопенической пурпуре может быть
обоснованной трансфузия тромбоцитарной массы.
• Экстренную спленэктомию у больных тромботической тромбоцито-
пенической пурпурой следует обсуждать только при очень выражен-
ном снижении количества тромбоцитов и развитии угрожающих жиз-
ни органных осложнений (например, тяжелом поражении централь-
ной нервной системы с нарушением сознания).
• При антифосфолипидном синдроме назначить низкомолекулярные
гепарины в лечебных дозах.
Глава 9
ПОРАЖЕНИЕ ПОЧЕК ПРИ ХРОНИЧЕСКОЙ
СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Почка занимает центральное место в регуляции обмена натрия и воды,
и, следовательно, параметры системной гемодинамики зависят от состоя-
ния ее функции не в меньшен степени, чем от сократительной способно-
сти миокарда левого желудочка. Кроме того, именно почечная ткань пред-
ставляет собой основную мишень для большинства медиаторов, препят-
ствующих натрийурезу (ангиотензина 11, альдостерона) и одновременно, к
многом за счет тканьспецифичного негемодинамического воздействия спо-
собствующих дальнейшему усугублению хронической сердечной недоста-
точности. Кроме того, особенности кровоснабжения почки и внутрипочеч-
ной гемодинамики предопределяют возможность их дальнейшего быстрого
ухудшения с одновременным снижением клубочковой фильтрации Усугу-
бляющаяся при этом гипоперфузия почечного губуло-интерстерстиция об-
условливает дисфункцию канальцев с угрожающими жизни расстройства-
ми электролитною юмеистаза, прежде всего в связи с гинеркалиемиеи.
Следует подчеркнуть, чю степень ухудшения почечной функции далеко не
всегда коррелирует с тяжестью хронической сердечной недостаточности
поскольку вновь возникшая или нарастающая почечная недостаточнэстъ
может быть связана с нарушением водно-электролитного гомеостаза и/пли
действием ятрогенных факторов.
ЭПИДЕМИОЛОГИЯ
Признаки ухудшения функции почек нередко сопутствуют хронической
сердечной недостаточности как нарастающей, так и уступающей патогене
тической терапии; при этом используемые лекарственные средства могул
сами по себе обусловливать снижение скорости клубочковой фильтрации
и/или канальцевую дисфункцию. Часто возникающие уже на амбулатор-
ном этапе гиперкреатининемия, снижение СКФ и/или i инеркалиемня
впервые выявляются, как правило, в период госпитализации в стационар,
часто совпадающий г ухудшением течения хронической сердечной недоста
точности.
Результаты анализа j руппы из 1004 пациентов, госпитализированных в
связи с хронической сердечной недостаточностью в 11 клинических центров.
Поражение почек при хронической сердечной недостаточности
149
свидетельствуют о том, что у 27% из них происходит ухудшение функции
почек, определяемое по приросту креатипинемии более чем на 0,3 мг/дл.
Частота ухудшения функции почек оказалась максимальной в течение пер-
вых трех суток с момента госпитализации. Риск ухудшения функции почек
был достоверно выше при наличии сахарного диабета II типа, исходно по-
вышенного сывороточного уровня креатинина (> 1,5 мг/дл), а также при
значении систолического АД выше 160 мм рт. ст.
В исследовании POSH, включавшем 299 пациентов — жителей стран
Европейского Союза с декомпенсированной хронической сердечной недо-
статочностью, прирост сывороточного уровня креатинина более чем на
0.3 мг/дл, рассматриваемый как ухудшение функции почек, был отмечен
у 29% обследованных. Вероятность ухудшения функции почек увеличива-
лась по мере роста исходной креатининемии, а также при наличии отека
легких и фибрилляции предсердий.
Согласно результатам мета-анализа 8 клинических исследований, вклю-
чавших суммарно 18 634 больных хронической сердечной недостаточно-
стью, прирост креатипинемии и/или снижение расчетном скорости клубоч-
ковой фильтрации наблюдался у 25% из них. Ухудшение функции почек у
больных хронической сердечной недостаточностью нередко серьезно огра-
ничивает подбор доз препаратов патогенетической терапии (в первую оче<-
редь ингибиторов АПФ, блокаторов рецепторов ангиотензина II. спиро-
нолактона и дигоксина) и обусловливает дальнейшее увеличение как
частоты их [оспитализации, гак и продолжительности пребывания в ста-
ционаре.
ЭТИОЛОГИЯ
Ухудшение функции почек, в том числе драматически быстрое, у боль-
ных хронической сердечной недостаточностью может быть спровоцировано
различными факторами, но в первую очередь — ятрогенными (табл. 9.1).
Уязвимость почечных канальцев, находящихся в состоянии стойкой гипо-
перфузии, быстро достигающей степени ишемии при резком снижении АД,
связанном с применением препаратов, оказывающих антигипертензивный
эффект, передозировкой петлевых и тиазидовых диуретиков, неблагопри-
ятным перераспределением тубулярного кровотока при приеме ингибито-
ров АПФ и блокаторов рецепторов ангиотензина II — одно из ведущих зве-
ньев патогенеза быстрого ухудшения функции почек у больных хронической
сердечной недостаточностью.
В хорошо известном исследовании SOLVD вероятность ухудшения
функции почек в группе пациентов, получавших эналаприл, была на
150
Нефрология. Неотложные состот—
33% больше, чем у больных, не принимавших этого препарата. «Вклад»
пожилого возраста и одновременного приема диуретика в нарастание
риска ухудшения функции почек был также более заметным у прини-
мавших эналаприл. Вероятность дальнейшего прироста креатининемч»
под действием эналаприла, напротив, снижалась, если больной получал
Р-адреноблокатор. Очевидно, что последний препарат назначали толькс
при нормальном или повышенном АД. В этой связи можно сделать
вывод о том, что ингибитор АПФ может способствовать ухудшение
функции почек преимущественно при тенденции к артериальной гипо-
тензии.
Анализ группы пациентов, включенных в исстедование SOLVE), свиде-
тельствует о том, что нарастанию креатининемии при хронической сер-
дечной недостаточности способствуют пожилой возраст, прием диу-
ретиков и сахарный диабет II типа
Наряду с постоянной потребностью в петлевых диуретиках детерминан-
тами ухудшения функции почек при сердечной недостаточности могут так-
же являться более низкие значения таких показателей, как фракция выбро-
са и толерантность к физическими нагрузкам. Возникновение иля
нарастание почечной недостаточности при существующей сердечной недос-
таточности сопряжены со значительным увеличением риска смерти и
повторной госпитализации.
Следует специально подчеркнуть, что ухудшение почечной функции,
наблюдающееся у больных хронической сердечной недостаточностью, бы-
вает вызвано не столько непосредственно приемом ингибиторов АПФ
сколько их сочетанием с неадекватно примененными лекарственными
препаратами, обусловливающими ухудшение внутрипочечной гемодина-
мики за счет провокации дальнейшего снижения АД и/или объема цирку-
лирующей крови, например петлевыми диуретиками и антагонистами
кальция. В связи с этим объяснимо установленное в уже упоминавшемся
крупном исследовании POSH увеличение риска нарастания почечной не-
достаточности при декомпенсированной хронической сердечной недоста-
точности, а также при наличии фибрилляции предсердий. По-видимо.му
появление de novo или нарастание нарушения почечной функции у
больных хронической сердечной недостаточностью возникает осо-
бенно часто при сочетании нескольких предрасполагающих факторов
(например, при приеме нестероидных противовоспалительных препаратов
пациентом со сниженной фракцией выброса левого желудочка и гипе-
рурикемией, постоянно получающим петлевые диуретики в больших
дозах).
Поражение почек при хронической сердечной недостаточности
151
Таблица 9.1
Причины и факторы риска ухудшения функции почек у больных
хронической сердечной недостаточностью
। Лекарственные препараты, провоцирующие ухудше- 1 ние функции почек । • Ингибиторы АПФ и блокаторь рецепторов ангиотензина 1Г, • нестероидные противовоспалительные пpei араты; • рентген-контрастные агенты; • антибактериальные и противогрибковые препараты
Заболевания и патологи- ческие состояния, на фоне , которых происходит ухуд- шение функции почек Декомпенсация хронической сердечной недостаточности; • фракция выброса лево-о желудочка <40% • потребность в постоянном приеме петлевых диуретиков, особенно в больших дозах; • фибрилляция предсердий; • исходные гиперкреатининемия / снижение скорости клу- бочковой фильтрации любого происхождения, • сахарный диабет II типа; • гиперурикемия; • артериальная гипотензия (пароксизмальная или постоян- ная), • гипонатриемия
* Могут выступать как единственная причина (например, при сочетающемся с хронической
сердечной недостаточностью атеросклеротическом стенозе почечных артерий) или как фактор
писка
ПАТОГЕНЕЗ
Хроническая сердечная недостаточность всегда сопровождается деза-
даптивными изменениями внутрипочечной гемодинамики. Одним из наи-
более типичных изменений считают стойкое увеличение почечного сосуди-
стого сопротивления, возникающее за счет спазма преимущественно
выносящей (эфферентной) клубочковой артериолы. Констрикцию ее при
относительно постоянном диаметре приносящей артериолы обеспечивают
ангиотензин И, а также влияние симпатической нервной системы, избыточ-
ная активность которой представляет собой один из фундаментальных ме-
ханизмов прогрессирования поражения органов-мишеней при хронической
сердечной недостаточности. Последующее снижение почечного кровотока с
одновременным увеличением давления в клубочках могут также способ-
ствовать проникновению в просвет канальцев белковых молекул, главным
образом альбумина, обладающего низкой молекулярной массой.
Хорошо известно, что при хронической сердечной недостаточности про-
исходит гиперпродукпия ангиотензина II, индуцирующего экспрессию
воспалительных хемокинов (в том числе моноцитарного хемоаттрактант-
ного протеина-1 (МСР-1), макрофагального воспалительного протеина-1
152
Нефрология. Неотложные составе
(MIP-1) и эндотелина-1) за счет активации одного из основных ядер&ж
факторов транскрипции — NF-кВ. Эти свойства ангиотензина II определя-
ют его провоспалительное и профиброгенное воздействие на ткани-мн’иеяг
(миокард, сосудистую стенку, почечную ткань). Имеет ли значение назван-
ное негемодинамическое воздействие ангиотензина II в развитии почеч юг*
поражения при хронической сердечной недостаточности? Обнаруженные
Н. Matsusima и сиавг. (2002) увеличенные содержания трансформирующе-
го фактора риста-pj (TGF-p,) (одного из основных маркеров гломеру.тярао-
го повреждения) в моче больных хронической сердечной недостаточности^,
а также повышенные концентрации эндотелина-1 и тканевою ингибитора
металлопротеиназы-1 (TIMР-1) в плазме этих пациентов свидетельствуют
о существенной роли прямого повреждающего действия ангиотензина II s
почечную ткань при хронической сердечной недостаточности. Оказалось
что в группе больных, получавших ингибиторы АПФ, величина альбумину-
рии и, что особенно важно, концентрация TGF-p, в моче оказались досто-
верно меньше, чем у пациентов, не получавших эти препараты. Отмеченная
корреляция между экскрецией альбумина с мочой и активностью канальое-
вою фермента 1Ч-ацетил-р-В-глюкаминидазы свидетельствует о возможной
токсическом действии экскретируемых с мочой белков на структуры почет-
ного интерстиция, что считается в настоящее время одним из фундамен-
тальных механизмов почечного фиброгенеза.
Любой лекарственный препарат в условиях наблюдающейся при хрони-
ческой сердечной недостаточности стойкой хишшерфузии почечной ткан»
потенциально опасен. Риск ухудшения функции почек максимален при на-
значении антибактериальных и противогрибковых препаратов, нестерона-
ных противовоспалительных средств и рентген-контрастных агентов, осо-
бенно у больных, получающих ингибиторы АПФ и/или петлевые диуретик»
в больших дозах.
Петлевые и тиазидовые диуретики нередко провоцируют гиперурии-
мию, которая может сопровождаться обструкцией части почечных каналь-
цев уратами и нарастанием гиперкреатининемии. Вероятность развит»
гиперурикемии, индуцированной диуретиками, увеличивается прежде все-
го у пациентов с ожирением и/или злоупотребляющих алкоголем. Показа-
но, что риск острого подагрического артрита особенно высок при назначе-
нии петлевых диуретиков.
Итак, механизмами ухудшения функции почек при хронической сер-
дечной недостаточности являются:
• гипоперфузия почечной ткани, сопровождаемая снижением скорост»
клубочковой фильтрации и развитием ишемии почечного тубуло
интерстиция. нарастающей при избыточном снижении АД (в том чис-
ле при гипонатриемии), потере жидкости во время «форсированного»
Поражение почек при хронической сердечной недостаточности
153
диуреза и потенциально дезадпаптивном перераспределении внутри-
почечного кровотока, которое может наблюдаться при назначении ин-
гибиторов АНФ и блокаторов рецепторов ангиотензина П, а также
при угнетении продукции почечных простагландинов под действием
ингибиторов АПФ и блокаторов рецепторов ангиотензина П;
• повреждение гломерулярного эндотелия и ишемизированных почеч-
ных канальцев рентген-контрастными препаратами;
• обструкция почечных канальцев уратами;
• прямое токсическое действие на ишемизированные почечные каналь-
цы антибактериальных и противогрибковых препаратов;
• тромбоз in situ в почечном микроциркуляторном русле, тромбоэмбо-
лия почечной артерии и ее ветвей (см. «Тромбозы и тромбоэмболии
почечных сосудов»).
МОРФОЛОГИЯ
При декомпенсированной хронической сердечной недостаточности поч-
ки несколько увеличены, отечны, цианотичны. Возможно обнаружение све-
жих инфарктов различного размера, а также постинфарктных рубцов с втя
жением почечной капсулы. Микроскопические изменения гкани почек при
хронической сердечной недостаточности считают малоспецифичны мм при
этом обнаруживают дистрофию и атрофию канальцев, возможно — их об-
струкцию уратами, полнокровие венул, нарастающий тубуло-иитерсти-
циальный фиброз. Зачастую выявляют артериосклероз мелких артерий по-
чек. Устойчивая недостаточность перфузии почек влечет за собой острые
тубуло-некротические поражения.
Более характерным именно для тяжелой хронической сердечной недо-
статочности вариантом почечного поражения считают так называемую ме-
зангиолитическую гломерулопатию (при ее формировании, как правило,
наблюдается нарастающая протеинурия) и увеличение размеров почечных
клубочков в сочетании с инфильтрацией мононуклеарными лейкоцитами.
Микроскопически мезангиолизис определяют по наличию микроаневризм
капилляров почечных клубочков, дегенерации мезангиального матрикса, а
в более тяжелых случаях — сегментарного мезангиального некроза. В ре-
зультате гипоксии развивается гипертрофия почечных клубочков, харак-
терны также гиперклеточность клубочков и расширение мезангиального
матрикса. Мононуклеарные лейкоциты, среди которых большую часть со-
ставляют CD68+ макрофаги, усиливают мезангиолизис, продуцируя про-
теолитические ферменты, свободные радикалы и оксид азота.
154
Нефрология. Неотл >жмые состоя»»
Б процессы развития гипертрофии почечных клубочков и склероза во-
влечен ангиотензин II, когорый сшмулирует мезаы иальные клетки к про-
дукции ТФР-р, что в свою очередь приводи! к увеличению синтеза компо
• нентов внеклеточного матрикса, таких, как бигликан, коллаген I типа а
фибронектин. Следует тем не менее подчеркнуть, что строгое соответствие
между выраженностью морфологических изменений ткани почек, степень»?
ухудшения функции почек и ухудшением прогноза нередко отсутствует.
КЛИНИЧЕСКАЯ КАРТИНА
Типичными проявлениями поражения почек при хронической сердеч-
ной недостаточности считают олигурию, умеренное снижение относитель-
ной плотности мочи, а также протеинурию, как правило, не превышающую
1 г/сутки и часто не выходящую за границы микроальбуминурии (30—
300 мг/сутки). Значительное увеличение экскреции белков с мочой наблю-
дают редко и, как правило, только при декомпенсированной хронической
сердечной недостаточности. Протеинурия, превышающая 500 мг/сут. у
больных хронической сердечной недостаточностью развивается только при
отеке легких. Отличительной чертой протеинурии как проявления «застой-
ной* почки является ее быстрое исчезновение по мере эффективного лече-
ния хронической сердечной недостаточности. Следует иметь в виду что
неуклонное увеличение экскреции белков с мочой может быть следствием
поражения почек в рамках основного заболевания (сахарного диабета
2-го типа, эссенциальной артериальной гипертонии, хронических заболева-
ний почек), ставшего причиной и/или усугубившего течение хронической
сердечной недостаточности.
Изменения мочи при хронической сердечной недостаточности, интер-
претируемые в рамках феномена «застойной» почки, как правило, мало де-
монстративны. Следует иметь в виду возможность резкого ухудшения по-
чечной функции — нарастающей гиперкреатининемни, снижения скорости
клубочковой фильтрации и нередко угрожающего жизни подъема сыворо-
точной концентрации калия, наблюдающихся у пациентов с хронической
сердечной недостаточностью пол действием неадекватно примененных ле-
карственных препаратов (блокаторов ренин-ангиотензин-альдостероновои
системы, калийсберегающих диуретиков, нестероидных противовоспали-
тельных препаратов) и при отсутствии протеинурии
Гиперкалиемия, нередко опережающая нарастание креатининемии,
одно из самых угрожающих жизни проявлений ухудшения функции почек
при хронической сердечной недостаточности. Стереотипно связываемая
только с назначением ингибиторов АПФ, она может быть в большей степе-
Поражение почек при хронической сердечной недостаточности
155
ни обусловлена одновременным приемом нестероидных противовоспали-
тельных препаратов и ненаркотических анальгетиков. Более опасными,
способными провоцировать почечную недостаточность становятся и се-
лективные ингибиторы циклооксигеназы-2. Блокируя синтез почечных
простагландинов и тем самым способствуя дальнейшему ухудшению кро-
воснабжения структур почечного тубуло-интерстиция, нестероидные про-
тивовоспалительные препараты обусловливают нарастающую дисфункцию
канальцев и гиперкалиемиею, особенно частых при артериальной гипотен-
зии, передозировке петлевых диуретиков или приеме калийсберегающих
диуретиков в неадекватных дозах.
Значительный рост сывороточной концентрации калия, отмеченный у
больного хронической сердечной недостаточностью при первом приеме ин-
гибитора АПФ, может указывать на наличие атеросклеротического стеноза
почечных артерий — ишемической болезни почек Наличие атеросклероти-
ческого стеноза почечных артерий нередко приводит к тому, что хрониче-
ская сердечная недостаточность становится резистентной к патогенетиче-
ской герапни, что сопровождается появлением повторных эпизодов
молниеносного отека легких, часто совпадающих с некупируемыми гипер-
тоническими кризами и исчезающих только после хирургической реваску-
ляризации почек.
При обследовании в нашей клинике 105 пациентов, страдавших ишеми-
ческой болезнью почек, хроническая сердечная недостаточность была диа-
гностирована у 21 (20%) из них. У 8 больных хроническая сердечная недо-
статочность соответствовала III функциональному классу (NYHA), П-б
стадии (ОССН ВНОК), а у 13 — II функциональному классу (NYHA), П-а
стадии (ОССН ВНОК). Степень снижения скорости клубочковой фильтра-
ции у 14 больных достигала IV стадии хронической болезни почек по NKF
DOQI, у 7 больных — III стадии. К моменту диагностики ишемической бо-
лезни почек большая часть (18 из 21) больных хронической сердечной не-
достаточностью получали ингибиторы АПФ, которые в последующем бы пи
отменены. Спиронолактон применяли у 6 больных, у 4 из них в высоких
(более 100 мг) дозах; 7 больных, страдавших хронической сердечной недо-
статочностью, получали гидрохлортиазид (который был применен до об-
следования в нашей клинике, несмотря на наличие у пациентов хрониче-
ской почечной недостаточности), и только 3 — фуросемид. Анализ
фармакотерапии хронической серлечной недостаточности, которую прово-
дили до того, как был распознан атеросклеротический стеноз почечных ар-
терий, свидетельствует, таким образом, о ее неадекватности. Применение
ингибиторов АПФ, продолжавшееся несмотря на существенное снижение
скорости клубочковой фильтрации, дополнялось назначением увеличиваю-
щего риск гиперкалиемии спиронолактона в больших лозах и частым при
156 Нефрология. Неотложные состоянии
менением гидрохлортиазида, использование которого у таких больных не-
целесообразно из-за наличия у них стойкого снижения скорости клубочковое
фильтрации.
Рост сывороточной концентрации калия, отмечаемый у больных хрони-
ческой сердечной недостаточностью, может быть связан с чрезмерной д ной
спиронолактона и других калийсберегающих диуретиков. Спровоцирован-
ный спиронолактоном подъем калиемии может наблюдаться у 55% пожи-
лых пациентов с хронический сердечной недостаточностью, в том числе у
10% калиемия может превосходить 6 мЭкв/л. При этом риск роста сыворо-
точной концентрации калия может быть выше при назначении спиронолак-
тона именно в высоких дозах, которые применяют, рассчитывая на увеличе-
ние диуреза, что, ориентируясь на общепринятые рекомендации по ведению
больных хронической сердечной недостаточностью, в настоящее время счи-
тается необоснованным. Цель назначения спиронолактона при хроническое
сердечной недостаточности — устранение тканевых, профиброгенных <ге-
номных» эффектов избытка альдостерона, достижимое, как свидетельству-
ют результаты крупных контролируемых исследований, при использовании
небольших доз этого препарата, при которых гиперкалиемию наблюдают не
столь часто.
Наряду с гиперкалиемией прогностически неблагоприятным феноме-
ном у больных хронической сердечной недостаточностью является также
снижение сывороточной концентрации натрия, наблюдающееся, поданным
некоторых авторов, не менее чем у 20% госпитализированных больных. Не-
адекватно большие дозы диуретиков, петлевых и тиазидовых, а также за-
держка осмотически свободной воды («дилюционная гипонатриемия») мо-
гут приводить к гипонатриемии, возникающей во время госпитализации и
всег да сопровождающейся значительным увеличением смертности. Смерт-
ность у пациентов с госпитальной гипонатриемией более чем в 2 раза пре-
восходит таковую у больных, у которых сывороточная концентрация на-
трия остается нормальной.
«Вклад»? тиазидовых диуретиков в формирование гипонатриемии зави-
сит от возраста и нутритивного статуса. Установлено, что риск тиазиз-
индуцированнох о снижения сывороточной концентрации натрия возраста-
ет в 2 раза на каждые 10 лет увеличения возраста и на 27% на каждые 5 кт
снижения массы тела. Гипонатриемия обусловливает трудно контролируе-
мое снижение АД, нарушение сознания и затрудняет подбор доз большин-
ства препаратов, использующихся для лечения хронической сердечной не-
достаточности. С целью профилактики снижения сывороточного уровня
натрия необходимо оптимизировать режим приема петлевых и тиазидовых
диуретиков, режим питания прежде всего у пожилых больных с сосудистой
деменцией, максимально рационально использовать гипотонические инфу-
Поражение почек при хронической сердечной недостаточности
157
зионныс растворы и некоторые психотропные препараты, вызывающие не-
адекватную гинер продукцию антидиуретического гормона.
Поражение почек при хронической сердечной недостаточности зача-
стую проявляется изменением именно «лабораторных» показателей:
• появлением микроальбуминурии / протеинурии;
• снижением относительной плотности мочи;
• снижением скорости клубочковой фильтрации;
• появлением гиперкреатинннемии, обычно умеренной;
• тенденцией к гиперкалиемии;
• наличием гипонатриемии
Данные признаки часто остаются своевременно нс выявленными или их
неадекватно интерпретируют, и под действием соответствующих факторов
риска ухудшение функции почек нередко усугубляйся, приобретая
быстропрогрессирующий, фульминан гный характер. При .этом всегда уве-
личивается вероятность декомпенсации хронической сердечной недоста-
точности, а возможности терапевтического воздействия на ухудшающуюся
функцию почек при этом также оказываются ограниченными.
ДИАГНОСТИКА
Диагностика почечного поражения при хронической сердечной недоста-
точности осуществляется с использованием общепринятых диагностиче-
ских методов:
• общего анализа мочи (желательно также приведение качественного
теста на микроальбуминурию);
• биохимического анализа крови (обязательно определение уровня кре-
атинине.мии, калиемии н урикемии);
• расчета скорости клубочковой фильтрации по формулам Cockroft-
Gault и/или MDRD.
Показатели, характеризующие функцию почек, у больных хронической
сердечной недостаточностью следует определять при каждом очередном
динамическом обследовании, а также при изменении доз. режима приема и
назначении новых лекарственных препаратов.
Объем дополнительного обследования, в том числе применения доба-
вочных лабораторных и инструментальных методов, определяется индиви-
дуально и может увеличиваться в ситуации, когда признаки почечного по-
ражения нельзя интерпретировать однозначно, а, напротив, можно связать
не только с хронической сердечной недостаточностью, ио и с другими хро-
ническими заболеваниями почек.
158
Нефрология Неотложные -остош—
ЛЕЧЕНИЕ
Специфические методы лечения поражения почек при хронической сер-
дечной недостаточности не разработаны. Общие принципы ведения это»
категории пациентов включают:
• минимизацию числа используемых лекарственных препаратов;
• назначение нестероидных противовоспалительных средств, ненарко-
тических анальгетиков, антибактериальных и противогрибковых пре-
паратов строю по показаниям и с обязательным контролем уровня
креатининемии и калиемии;
• осторожный подбор доз диуретиков, ингибиторов АПФ и блокаторов
рецепторов ангиотензина П:
• контроль АД со своевременным выяснением и устранением обстоя-
тельств, способствующих артериальной гипотензии, в том числе из-
быточных доз лекарственных препаратов и/или нерационального ре-
жима их приема, приводящего к суммации их гипотензивного дей-
ствия;
• минимизацию частоты применения рентген-контрастных агентов;
• тщательный мониторинг диуреза, изменений в составе мочи, сыворо-
точных концентраций креатинина, калия, натрия и мочевой кислоты,
а также расчетной скорости клубочковой фильтрации.
Хорошо известно, что у больных хронической сердечной недостаточно-
стью для улучшения долгосрочного прогноза необходимо сохранять посто-
янный прием ингибитора АПФ, несмотря на имеющиеся возможные проти-
вопоказания. М. Kittleson и соавт. (2003) в течение 8,5 месяца наблюдали за
пациентами с хронической сердечной недостаточностью. Было выяснено,
что смертность среди больных, которым ингибиторы АПФ в связи с суще-
ствовавшими ограничениями (пожилой возраст, низкое систолическое АД.
исходные гипонатриемия и гиперкреатининемия) назначены не были, ока-
залась более чем в 2 раза выше, чем у тех, у кого эти препараты все же были
применены (57 и 22% соответственно, р=0,0001). Именно в группе больных
хронической сердечной недостаточностью, характеризующейся высоким
риском ухудшения функции почек, могут оказаться значимыми различия,
обусловленные особенностями фармакокинетики и фармакодинамики не-
которых препаратов класса ингибиторов АПФ и петлевых диуретиков.
Торасемид, зарегистрированный в нашей стране под торговым названи-
ем «Диувер», единственный среди петлевых диуретиков, эффективность
которого (в том числе способность индуцировать натрийурез) почти нс из-
меняется при снижении СКФ и гипальбуминемии. Выбор именно этого
препарата у больных хронической сердечной недостаточностью с исходны-
ми гиперкреатинпиемией и/или снижением СКФ определяется в первую
Мцнжение почек при хронической сердечной недостаточности
159
очередь установленными в крупных контролируемых исследованиях, в
частности. в исследовании TORIC, преимуществами его перед фуросеми-
юм с точки зрения улучшения прогноза пациентов и переносимости. За
I счет наличия свойств антагониста альдостерона торасемид в меньшей сте-
зени. чем фуросемид, усугубляет почечные потери калия, а также, устраняя
«геномные» эффекты альдостерона, может тормозить процессы фиброгене-
за в миокарде и почечной ткани. Кроме того, применение торасемида сопря-
жено с меньшим, по сравнению с фуросемидом, увеличением числа мочеи-
спусканий, что повышает приверженность пациентов лечению.
Нарушение обмена мочевой кислоты, провоцируемое диуретиками, не
является показанием для их отмены при хронической сердечной недоста-
точности. При острых атаках подагрического артрита целесообразно назна-
чение нестероидных противовоспалительных препаратов в малых дозах
< из-за опасности реализации их нефротоксического действия), затем бы-
строе дополнительное применение колхицина и введение в полость пора-
женного сустава глюкокортикостероидов. У больных хронической сердеч-
ной недостаточностью с гиперурикемией оправдано также раннее начало
лечения аллопуринолом, дозу которого меняют по мере изменения скоро-
сти клубочковой фильтрации.
При декомпенсированной хронической сердечной недостаточности, со-
четающейся с ухудшением функции ночек, можно обсуждать целесо-
образность проведения ультрафильтрации. Положительное влияние на
фильтрационную функцию почек могут оказать также инотропные препа-
раты — добутамин и левосимендан. однако сохраняется оно до тех пор, пока
сохраняется достигнутое с их помощью улучшение сократительной функ-
ции миокарда левого желудочка.
Для улучшения фильтрационной функции почек, которое может прои-
зойти за счет предупреждения развития тромбозов в почечном микроцир-
куляторном русле, при хронической сердечной недостаточности, сочетаю-
щейся с ухудшением функции почек, может оказаться обоснованным
назначение низкомолекулярных гепаринов в профилактических дозах.
Впрочем, их эффективность и безопасность в этой ситуации требуют изуче-
ния в рамках специальных контролируемых исследований.
ПРОГНОЗ
Ухудшение функции почек при хронической сердечной недостаточно-
сти всегда прогностически неблагоприятно и сопряжено со значительным
увеличением риска декомпенсации и смерти. Установлено, чти увеличение
креатининемии более чем на 0,3 мг/дл сопряжено с увеличением риска
160
Нефрология. Неотложные состомяв
смерти в период госпитализации в 7,5 раз, риска любых других осложне-
ний — в 2,1 раза, увеличения продолжительности пребывания в стационаре
более 10 дней — в 3,2 раза. В уже упоминавшемся мета-анализе было выяс-
нено, что ухудшение функции почек при хронической сердечной недость
точности приводит к росту вероятности смерти — на 67%, повторной госпи-
тализации — на 30%.
ПЕРСПЕКТИВЫ
Перспективы лечения и профилактики поражения почек при хрониче-
ской сердечной недостаточности во многом определяются совершенствова-
нием методов выявления и устранения соответствующих факторов риска, а
также подходов к оценке фильтрационной функции почек. С этой точкж
зрения большой интерес представляег внедрение в клиническую практио
теста с циста! ином С-эпдогенным белком, продуцируемым большинством
клеток нашего организма в постоянном количестве, отчего на его концен-
трация} в плазме не оказывают влияния ни возраст, ни мышечная масса че-
ловека (в отличие от тою, что происходит с концентрацией креатинина»
Дополнительное положительное влияние на функцию почек у больных
хронической сердечной недостаточностью могут также оказывать активно
изучаемые в настоящее время новые классы лекарственных препаратов, на-
пример акваретики (антагонисты У2-реценторов вазопрессина), увеличи-
вающие клиренс осмотически свободной воды и таким образом предупре-
ждающие гипонатриемию и связанное с ней усугубление артериальной
гипотензии.
Неотложные мероприятия
• Контроль диуреза, общего анализа мочи, крсатининемни. калиемн и
• При гиперкалиемии отмена антагонистов альдостерона, умень-
шение дозы или отмена ингибитора АПФ, назначение петлевых диу-
ретиков.
• При стойкой гиперкреагининемии и/илн гиперурикемии — отмена
тиазидовых диурв! и ков.
• Назначение низкомолекулярных гепаринов в профилактических
дозах.
Глава 10
СКЛЕРОДЕРМИЧЕСКИЙ
ПОЧЕЧНЫЙ КРИЗ
Острая склеродермическая нефропатия (склеродермический почеч-
ный криз) — острая или быстропрогрессирующая почечная недоста-
точность, обусловленная тяжелым генерализованным окклюзнрующим
поражением внутрипочечных сосудов, патогенетически связанным с си-
стемкой склеродермией. Как правили, склеродермический почечный криз
возникает в течение первых 5 лет с момента дебюта болезни у пациентов с
распространенным поражением кожи и различных внутренних органов (пи-
щевода, сердца, легких) Тем не менее острая склеродермическая нефропа-
тия может стать и первым проявлением системной склеродемии, разви-
вающимся «долго до других ее характерных клинических признаков.
Склеродермический почечный криз всегда свидетельствует о тяжелом тече-
нии системной склеродермии и является одним из наиболее достоверных
маркеров неблаюприятного прогноза.
ЭПИДЕМИОЛОГИЯ
Источником данных о частоте встречаемости склеродерм и чес кош по-
чечного криза служат преимущественно составляемые в специализирован-
ных клинических центрах регистры, суммирующие опыт обследования, ле-
чения н длительного наблюдения за больными системной склеродермией.
Можно предполагать, что острая склеродермическая нефропатия явля-
ется самой частой при системной склеродермии формой поражения почек,
требующей специализированной медицинской помощи. Другие варианты,
например хроническая склеродермическая нефропатия, нередко остаются
малосимн юмными, в связи с чем их во многих случаях своевременно не
распознают. S. Gueriiii и соавт. (2007) обнаружили признаки почечного по-
ражения v 19 из 193 обследованных пациентов, страдавших системной скле-
родермией. У 11 из 19 больных был констатирован склеродермический
почечный криз, у 5 — хроническая склеродермическая нефропатия, у 2 —
нефротическим синдром, индуцированный D-пеницилламином, у 1 —
ЛХСА-ассониированный гломерулонефрит. Б целом признаки острой скле-
□одермической нефропатии обнаруживают не более чем у 10% больных
системной склеродермией, но в группе высокого риска, характеризующейся
высокой активностью заболевания и быстрым поражением органов-ми-
1 нефрология
162
Нефрология. Неотложные состояние
шеней, а также среди пациентов, получающих некоторые лекарственные
препараты (см. ниже), частота склеродермического почечного криза может
достигать 20%. Острая склеродермическая нефропатия как первое проявле-
ние системной склеродермии встречается крайне редко и описана лишь в
отдельных клинических наблюдениях.
ЭТИОЛОГИЯ
Роли генетических детерминант, возможно, предрасполагающих к раз-
витию системной склеродермии, например HLA-DQB1, HLA-DR5, 1ILA-
DR2, в формировании склеродермического почечного криза установить не
удалось. В то же время известно, что склеродермический почечный криз
развивается у 25% пациентов, имеющих антитела к PH К-полимеразе III. а
также у пациентов с антителами к топоизомеразе. При этом он редко выяв-
ляется у пациентов, имеющих антицентромерные антитела и страдающих
лимитированной формой склеродермии (процесс ограничен кожей кистей,
шеи и лица, органные нарушения менее выражены и присоединяются позд-
но). Очевидно, большее значение имеют внешние факторы, воздействие ко-
торых можно наблюдать при определенных особенностях течения болез-
ни — ее высокой активности, сохраняющейся обычно на протяжении первых
4—5 лет ее существования.
Среди факторов, инициирующих склеродермический почечный криз,
большое значение имеют неспецифические (табл. 10.1). Провоцировать раз-
витие острой склеродермической нефропатии может также беременность,
при этом экскреция белка с мочой может достигать значительных величин,
что не вполне типично для склеродермического почечного криза, развиваю-
щегося при других обстоятельствах. Описано формирование склеродерми-
ческого почечного криза непосредственно после аборта. Кроме того, острая
склеродермическая нефропатия может развиваться после травмы, перео-
хлаждения, кровотечения, например из желудочно-кишечного тракта, со-
провождающегося массивной кровопотерей. У большинства пациентов ин-
дуктор почечного склеродермического криза выделить не удается.
Исходно тяжелое кожное и органное поражение при системной склеро-
дермии — один из главных факторов риска острой склеродермической
нефропатии. Вероятность склеродермического почечного криза выше в те-
чение первых 5 лет с момента дебюта болезни, а также при наличии выра-
женного распространенного уплотнения кожи, перикардиального выпота и
хронической сердечной недостаточности, обусловленной склеродермиче-
ским поражением сердца Нарастание плотности кожи нередко непосред-
ственно предшествует развитию острой склеродермической нефропатии
Анализ состояния 133 больных системной склеродермией, включенных в
Склеродермический почечный криз
163
исследование The High-Dose Versus Low-Dose D-Peniciilamine in Early
Diffuse Systemic Sclerosis Trial, продемонстрировал, что вероятность склеро-
дермического почечного криза возрастает в 10 раз — при выраженном
уплотнении кожи (величина кожного индекса Rodnan > 20), в 16,1 раза —
при поражении крупных суставов, в 2,9 раза — при наличии признаков по-
ражения сердца и в 3,6 раза — у пациентов, принимающих преднизолон.
Таблица 10.1
Пусковые факторы и факторы риска склеродермического
почечного криза
группа факторов Фактор
Пусковые факторы • Инфекция (вирусная, бактериальная); • переохлаждение; • инсоляция, • травма; • кровотечение, в том числе из желудочно-кишечного тракта; • прекращение приема препаратов, использующихся для лече- ния системной склеродермии
Факторы риска • Распространенное кожное поражение, особенно прогрессиру- ющее, • «стаж» заболевания <_5 лет. • прогрессирующее поражение внутренних органов - сердца, легких (в том числе легочная артериальная гипертензия), • "сражение крупных суставов (локтевых, коленных); • анемия, особенно гемолитическая; • высокие дозы глюкокортикостероидов л применение их в де- бюте болезни, • прием циклоспорина; • применение рентген-контрастных агентов (особенно содер жащих гадолиний); • употребление наркотиков (кокаина)
Развитие острой склеродермичечкой нефропатии чаще наблюдают у
больных, принимающих глюкокортикостероиды, особенно у тех, кому эти
препараты назначили уже в начале заболевания. Именно поэтому использо-
вание глюкокортикостероидов принято считать одним из главных факторов
риска склеродермического почечною криза, и данная точка зрения поддер-
живается многочисленными описаниями его развития непосредс]венио по-
сле начала приема преднизолона или метилпреднизолона, особенно в сверх-
высоких дозах. В исследовании типа «случай—контроль», включавшем 110
пациентов, страдавших системной склеродермией, было отмечено, что
острая склеродермическая нефропатия развивается в 3 раза (36 н 12% соот-
ветственно, р<0,0001) чаше у тех. кто в течение предшествующих 6 месяцев
получал глюкокортикостероиды (преднизолон или его эквиваленты) в вы-
соких дозах (> 15 мг/сутки). Напросив, прием низких доз глюкокортико-
стероидов, в том числе продолжительный, не был сопряжен с увеличением
риска развития склеродермического почечного криза.
164
Нефрология. Неотложные состоим
Приведенные данные заставляют с осторожностью относиться к приме-
нению глюкокортикостероидов у пациентов с активной системной склеро-
дермией. особенно в течение первых 5 лет существования заболевания г
при прогрессирующем поражении кожи, крупных суставов и внутренние
органов У этой категории больных назначение больших доз глюкокортико-
стероидов может приводиib к увеличению риска склеродермическою по-
чечного криза Можно предполагать, что глюкокортикостероиды в высоких
дозах усугубляют типичное для системной склеродермии нарушение ми-
кроциркуляции крови, в том числе локалыю-почечно1, что является ини-
циальным зтапом формирования острой склеродермической нефропатии.
По-видимому, расстройства микроциркуляции максимальны посте прекра-
щения использования сверхвысоких доз глюкокортикостероидов, и именно
поэтому непосредственно после сеансов «пульса-терапии этими препарата-
ми возможно возникновение склеродерми четкого почечного криза.
Т^м не MCH<ie сам по себе факт применения глюкокортикостероидов не
следует однозначно рассматривать как обстоятельство, предрасполагающее
к возникновению острой склеродермической нефропатии. Связь увеличе-
ния риска ее формирования с приемом глюкокортикостероидов в высокп
дозах может быть, по крайней мере, частично объяснена тем, что их назна-
чают преимущественно наиболее тяжелым пациентам с прогрессирующих
течением системной склеродермии, подразумевающим возможность вовле-
чения почек. Так, в уже упоминавшемся исследовании The High-Dose Versus
Low-Dose D-Penicillamine in Early Diffuse Systemic Sclerosis Trial было по-
казано, что частота острой склеродермической нефропатии возрастает }
больных, получающих преднизолон только в том случае, если v них имеют-
ся выраженное уплотнение кожи и поражение крупных суставов. 11апротив.
при отсутствии тяжелого кожного и суставного поражения частота склеро-
дермического почечного криза не увеличивалась даже в труппе больных,
принимавших преднизолон.
Таким образом, применение глюкокортикостероидов ассоциировано с
увеличением риска острой склеродермической нефропатии при назначении
их в высоких дозах, относительно небольшой продолжительности течения
системной склеродермии, но особенно — при активном кожном, суставном
и висцеральном поражении, оказавшемся наиболее значимым независимых
фактором риска ее возикновения.
Среди лекарственных препаратов с иммунодепрессивным действием,
провоцирующих склеродермический почечным криз, называют также ци-
клоспорин. С ледует гем не менее подчеркнуть, что острая склеродермиче-
ская нефропатия, в том числе фатальная, чаще возникает не в процессе
лечения, а после отмены циклоспорина. Установлена возможность возник-
новения острой склеродермической нефропатии у лиц, злоупотребляющих
кокаином.
Склеродермический почечный криз
165
Примером ятрогенной системной склеродермии, протекающей с развити
ем склеродермического почечного криза, является состояние, возникающее
после магнитно-резонансной томографии с использованием галолинийсодер-
жагцих контрастных агентов. В течение нескольких недель после процедуры
на коже больного образуются болезненные красные бляшки, которые в даль-
нейшем сменяются распространяющимися очагами кожного уплотнения,
приобретающими вид кожуры апельсина. В последующем поражаются круп
ныс суставы, возможно — легкие и сердце, почти всегда отмечается нарастаю-
щая почечная недостаточность, первоначально стереотипно интерпретируе-
мая как связанная с рентген-контрастной нефропатией. Данную клиническую
ситуацию иногда обозначают как нефрогенную системную склеродермию. Как
правило, выраженность кожного процесса коррелируете тяжел ью почечного
поражения. Смертность при индуцированном газолин и йсолержаши ми кон-
трастными агентами почечном скдеродермическом кризе может достигать
30%. Факторами риска в этом случае считают исходное ухудшение фильтра-
ционной функции почек, в том числе достигающее степени терминальной по-
чечной недостаточности, высокие дозы примененных контрастных агентов, а
также эндотелиальную дисфункцию любого происхождения, синдром пере-
грузки железом и метаболический ацидоз.
Причину и факторы риска острой склеродермической нефропатии уда-
ется идентифицировать далеко не всегда. Болес того, даже если причина,
спровоцировавшая склеродермический почечный криз, установлена, ес
устранение часто нс сопровождается отчетливой положительной динами-
кой признаков почечного поражения. В связи с этим неотложные лечебные
мероприятия, направленные на предупреждение угрожающих жизни ослож-
нений острой склеродермической нефропатии, связанных преимуществен-
но с нарастанием почечной недостаточности и выраженной артериальной
гипертензией, необходимо начинать немедленно, еще до выявления воз-
можных этиологических факторов.
ПАТОГЕНЕЗ
Инициальные звенья патогенеза острой склеродермической нефропа-
тии остаются не установленными. Принципиально важными механизмами
развития склеродермического почечного криза считают:
• генерализованное поражение почечного микроциркуляторного русла
в виде отека и набухания эндотелиоцитов и спазма приносящих гло-
мерулярных ар гер иол («почечный синдром Рейно»);
• нарушение барьерной функции эндогелиоцигов. экснре< сию ими май
керов эндотелийзависимого звена гемостаза, медиаторов фиброгенеза
166
Нефрология. Неотложные состава*
(трансформирующего фактора роста р — TGFp) и вазоконостриктх-
ных молекул (ангиотензина II, эндотел и на-1);
• расстройство внутрипочечной гемодинамики с нарастающей ишемг-
ей почечной ткани;
• гиперпродукцию ренина с последующей выраженной активапкес
ренин-ан гиотензин-альдостероновой системы;
• спазм приносящей и выносящей артериол почечных клубочков с даль-
нейшим нарастанием нарушений внутрипочечной гемодинамики, усу-
губляемым ростом системного АД, трансмиссирукицего на гломеру-
лярные капилляры;
• задержку натрия вследствие преобладания анти натри йурети чес кит
гуморальных систем (в том числе ренин-ангиотензин-альдостеро-
новой);
• реализацию негемодинамических эффектов ангиотензина П и альдо-
стерона — локально-почечную активацию медиаторов фиброгенеза
(например, TGFp);
• тромбогенез на уровне почечного микроциркуляторного русла, реали-
зующийся в основном за счет увеличения активности эндотслийзави-
симого звена гемостаза и одновременной депрессии локальн:-
почечиых систем фибринолиза;
• быстро прогрессирующий почечный фиброгенез.
Становление острой склеродермической нефропатии подразумевает ин-
тенсивную фибротическую трансформацию как клубочков, так и структур
почечного тубуло-интерстиция и внутрипочечных сосудов с одновремен-
ным накоплением экстрацеллюлярного матрикса. В патогенезе склеродер-
мического почечного криза могут принимать непосредственное участие
также и некоторые патологические иммунологические феномены, потенци-
ально ассоциированные с системной склеродермией. Например, при нали-
чии антител к кардиолипину в почечном поражении преобладает тромбег
тическая микроангиопатия.
Развитие почечного склеродермического криза, индуцируемого гадоли-
ниевыми контрастными агентами, связывают с их ионизацией, сопровожда-
ющейся появлением иона Gd3+ и депозицией содержащих его комплексов •
органах-мишенях (почке, коже), что приводит к миграции и активация
CD34+, CD45+, проколлаген-*- предшественников фибробластов. В даль-
нейшем эти клетки играют центральную роль в модуляции процессе»»
органного фиброгенеза. При стойком снижении СКФ экскреция гадолини-
евых контрастных агентов замедляется, что приводит к заметному увеличе-
нию риска возникновения «острой склеролермической почки» у пациентов
с исходно существующей хронической почечной недостаточностью.
Склеродермический почечный криз
167
Острая склеродермическая нефропатия, таким образом, представляет
собой модель быстропрогрессирующего почечного фиброза, в основе кото-
рого лежат генерализованные расстройства микроциркуляции, а также ге-
модинамические и ишемические (но не иммунные) механизмы. Дальней-
шее изучение патогенеза склеродермического почечного криза представляет
большой интерес в первую очередь в свете разработки новых терапевтиче-
ских стратегий, направленных на торможение нефросклероза.
МОРФОЛОГИЯ
Основные морфологические изменения при почечном склеродермиче-
ском кризе наблюдаются в междольковых почечных артериях, в которых
происходит утолщение интимы из-за накоп 1ения рыхлой, миксоидной фи-
брозной ткани. Также можно обнаружить субэндотелиальные отложения
фибрина. В междольковых артериях и артериолах развиваются фибриноид-
ный некроз (неотличимый от изменений при злокачественной гипертензии)
и тромбоз с облитерацией просвета сосудов. В результате этих изменений
значительно сужается просвет пораженных сосудов, что приводит к ише-
мии ткани почки. В почечных клубочках отмечают ишемические поврежде-
ния различной степени выраженности, изредка — фибриновые тромбы в
просвете капилляров. При электронной микроскопии в пораженных кро-
веносных сосудах почек выявляют утолщение интимы, развивающееся
вследствие накопления аморфного прозрачного вещества, имеющего под
световым микроскопом вид миксоидной фиброзной ткани (см. выше).
В клубочках обнаруживают сморщивание базальной мембраны с очаговым
отложением нитей фибрина под эндотелием.
При иммуногистохимическом исследовании выявляют усиление экс-
прессии рецепторов эндотелина-1 и эндотелина-В. Маркерами поврежде-
ния эндотелиальных клеток служат высокие уровни в крови растворимых
молекул адгезии (VCAM-1, I САМ-1 и Е-селектина).
Острые патоморфологические изменения ткани почек (набухание инти-
мы артерий, фибриноидный некроз и тромбоз артериол, интракапиллярные
фибриновые тромбы), носящие выраженный диффузный характер, посто-
янно отмечаются у пациентов при склеродермическом кризе независимо от
высоты артериального давления.
Наряду с сосудистыми (гломерулярными) изменениями при острой
склеродермической нефропатии развиваются и тубуло-интерстициальные:
инфаркты небольших групп канальцев или в более тяжелых случаях —
крупные кортикальные инфаркты.
Хотя терапия острого склеродермического почечного криза предотвра-
щает быструю прогрессию поражения почек, у многих пациентов в последу-
168
Нефрология. Неотложные состоя—
юшем развивается нарушение почечной функции. Основными причинам?
npoi реагирования поражения почек являются: накопление внеклеточного
матрикса в почечных клубочках и тубуло-интерстиции, эпителиально
мезенхимальная трансформация и сосудистые изменения. Перечисленные
изменения обусловлены активацией ренин-ангиотензин-альдостероновоё
системы и профиброгенных факторов роста (TGF0, фактора роста фибро-
бластов). В почечном трансплантате повторный склеродермический почеч-
ный криз развивается крайне редко (не более 5 % случаев в течение первых
двух лет пос тс пересадки ночки).
КЛИНИЧЕСКАЯ КАРТИНА
Достоверных предвестников острой склеродермической нефропатии не
существует, очень часто она развивается внезапно. Как правило, к моменту
et дебюта у пациентов уже бывает выявлено распространенное поражение
кожи, нередко — сердца и легких.
К клиническим признакам склеродермического почечного криза отно-
сятся:
• появление или нарастание артериальной гипертензии, приобретаю-
щей признаки злокачественности,
• прогрессирующее ухудшение функции почек; нередко с уменьшением
диуреза вплоть до олигоанурии;
• протеинурия (нефротический синдром не характерен), микрогемату-
рия;
• гипертоническая ретинопатия с возможным ухудшением зрения;
• гипертензивная энцефалопатия (типичны судорот);
• хроническая сердечная недостаточность, осложняющаяся отеком лег-
ких и обусловленная как озлокачествлением артериальной гипертен-
зии, так и склеродермическим поражением сердца.
Случаи, когда склеродермический почечный криз протекает без артери-
альной гипертензии» возможны, но встречаются крайне редко. Возможно
также сочетание острой склеродермической нефропатии с генерализован-
ным поражением сосудов малого круга кровообращения, сопровождающим-
ся легочной артериальной гипертензией, и альвеолярным кровотечением, в
том числе диффузным.
Склеродермический почечный криз может сочетаться с гемолитическом
анемией. Типично значительное увеличение активности ренина плазмы, в
определенной степени отражающее тяжесть прогноза.
Склеродерм ический почечный криз
169
ДИАГНОЗ
Склеродермический почечный криз диа! ностируют, ориентируясь на
результаты анализа особенностей анамнеза (быстропрогрсссирукиций ха-
рактер почечной недостаточности, появление или нарастание артериальной
гипертензии), клинических (гипертензивная энцефалопатия, левожелудоч-
ковая сердечная недостаточность) и лабораторных (гиперкреатипинемиясо
значительным снижением СКФ, гиперкалиемия, гемолитическая анемия,
увеличение плазменной активности ренина плазмы) признаков. Биопсию
почки при острой склеродермической нефропатии, как правило, не прово-
дят из-за тяжести состояния пациентов. Склеродермический почечный криз
дифференцируют от других вариантов почечною поражения, возможного
при системной склеродермии (табл. 10.2).
Дифференциальный диагноз острой
склеродермической нефропатии
Таблица 10 2
армант почачкото поражения с которым проводят дифференци- ацией Ан* - — - Отличие €т острой склеродермической мвфропатии
; Хроническая склеродермическая нефрола’/ия • Характерно длительное латентное течение. • умеренная протеинурия; • льная гипертензия J-II степени без при знаков озлокачествления;
1 1 • функция почек сохранна, или определяется уме- ренное, ненарастающее снижение СКФ
ANCA-ассоииированный гломеруло- нефрит • ANCA в сыворотке крови. • сочетание остронефри ического синдрома с бы строп регрессирующим ухудшением почечной функции; • возможен нефротический синдром
"гомерулонефрит, индуцированный D -пен иц и л л амином • Характерен нефротический синдром, • АД может оставаться нормальным. • функция почек остается сохранной; • полностью регрессирует при своевременной от- мене D-пеницилламина
ЛЕЧЕНИЕ
Лечение склеродермического почечного криза направлено на решение
нескольких задач (табл. 10.3):
• снижение АД;
• торможение прогрессирования почечного фиброза.
• предупреждение угрожающих жизни сердечно-сосудистых ослож-
нений.
170
Нефрология. Неотложные состоямш
Вместе с тем многим пациентам требуется экстренный, а в дальнейшем
и программный гемодиализ. При необратимом ухудшении функции почек в
исходе острой склеродермической нефропатии может быть выполнена так-
же и трансплантация почки: выживаемость почечного трансплантата в те-
чение первого года и в дальнейшем превышает 60%.
Подходы к лечению склеродермического
почечного криза
Таблица 10 3
задача «и гхшания
1 Снижение АД* • Ультрафильтрация (в первую очередь при появлении признаков злокачественной артериальной гипертонии). • гемодиализ (при появлении признаков злокачествен ной артериальной гипертонии); * плазмаферез; • ингибиторы АПФ. • антагонисты кальция
Торможение прогрессирования почечного фиброза • Ингибиторы АПФ (внедрение их в практику ведения больных острой склеродермической нефропатией спо- собствовало более чем двукратному увеличению часто- ты достижения ремиссии и стабилизации почечной функции**); • D-пеницилламин
Предупреждение угрожающих жизни сердечно-сосудистых осложнений • Плазмаферез; • гемодиализ; • ингибиторы АПФ; • препараты простагландинов***
• Применение диуретиков при отсутствии явной гиперволемии может способствовать нарас-
танию почечной недостаточности; £-адреноблокаторов — усугублять синдром Рейно.
* • Целенаправленного изучения требуют быстродействующие парентеральные препараты —
каптоприл, эналаприлат, а также блокаторы рецепторов ангиотензина II
• •• Необходимо пооведение специальных клинических исследовании.
ПРОГНОЗ
Прогноз при острой склеродермической нефропатии остается неблаго-
приятным: именно она по-прежнему занимает одно из перших мест в струк-
туре причин смерти больных системной склеродермией. Выживаемость в
течение 5 лет не достигает 60%; 23% пациентов после первой атаки склеро-
дермического почечной» криза нуждаются ь периодическом проведении ге-
модиализа в течение последующих 3 лет, еще у 41% в результате первой же
атаки функция почек ухудшается необратимо, в связи с чем эти пациенты
постоянно нуждаются в программном гемодиализе. Хотя результаты неко-
Склеродермический почечный криз
171
торых клинических наблюдений говорят о том, что антигипертензивная те-
рапия при острой склеродермической нефропатии зачастую оказывается
малоэффективной, внедрение в практику ведения таких больных ингибито-
ров АПФ позволило заметно снизить скорость необратимого ухудшения у
них почечной функции. Смерть при склеродермическом почечном кризе
наступает от терминальной почечной недостаточности, острых нарушений
мозгового кровообращения или отека гегких как осложнения левожелудоч-
ковой сердечной недостаточности.
ПЕРСПЕКТИВЫ
Перспективы в предупреждении и лечении почечного склеродермиче-
ского криза связаны с поиском новых препаратов, обладающих антифибро-
генным действием, в том числе блокаторов профиброгенных хемокинов и
рецепторов к ним (например, пирфенидона — антагониста TGP). Кроме
того, такие задачи, как снижение скорости поражения почечной ткани и
борьба с выраженной артериальной гипертензией, требуют целенаправлен-
ного изучения эффективности и безопасности агрессивной фармакологиче-
ской блокады ренин-ангиотензин-альдостероновой системы (ингибитор
АПФ + блокатор рецепторов ангиотензина И). С учетом наблюдающегося
при острой склеродермической нефропатии значительного повышения плаз-
менной активности ренина можно прогнозировать высокую эффективность
прямого ингибитора ренина (алискирена). Восстановлению внутрипочечной
гемодинамики при склеродермическом почечном кризе могут также способ-
ствовать синтетическиеаналсл и простагландинов. антагонисты эндотелина-1
и низкомолекулярные гепарины. Внедрению этих препаратов в практику ве-
дения больных острой склеродермической нефропатией должны предше-
ствовать специальные контролируемые клинические исследования.
Неотложные мероприятия
• Контроль показателей, характеризующих функцию почек (креатини-
немии, скорости клубочковой фильтрации, калиемии).
• Мониторинг АД и частоты сердечных сокращений.
• Назначение ингибиторов АПФ (в том числе каптоприла, эналаприла-
та в парентеральных формах).
• При выраженной артериальной гипертензии назначение антагони-
сюв кальция (в том числе дигидропиридиновых парентерально).
• При озлокачествлении артериальной гипертензии • ультрафильтра-
ция; при наличии гиперкалиемии — экстренный гемодиализ.
Глава 11
РЕНТГЕН-КОНТРАСТНАЯ НЕФРОПАТИЯ
Клинически рентген-коитрастиая нефропатия (контраст-индуцм-
рованная нефропатия) выражается в нарастании креатииинемии более
чем на 25% от исходной величины или более чем на 0,5 mi/дл в течение
48 часов после выполнения диагностического или лечебного вмешатель-
ства, в ходе которого были применены рентген-коптрастные агенты
Рентген-контрастную нефропатию диагностируют только при отсутствии
других причин, способных обусловить нарастающее ухудшение фильтраци-
онной функции почек (например, холестериновой эмболии внутрипочеч-
ных артерий и артериол, возникшей после эндоваскулярной процедуры).
Почечная недостаточность, возникшая после применения рентген-конт -
растных агентов, сохраняется не менее двух суток.
ЭПИДЕМИОЛОГИЯ
Частота возникновения рентген-контрастной нефропатии неуклонно
возрастает по мере расширения возможностей визуализирующих методов
обследования, требующих применения контрастных агентов, и увеличе-
ния частоты их использования. Известно, что в последние годы в странах
Европейского Союза число выполняемых компьютерных томографий
грудной и брюшной полостей в течение каждых 5 лет возрастает более чем
на 10%. Сегодня в развитых странах ежегодно наблюдают около 600 000
случаев рснтген-контрастной нефропатии. По данным крупных эпидемио-
логических исследований, на долю рентген-контрастной нефропатии, от-
вечающей общепринятому определению (прирост сывороточной концен-
трации креатинина на 25% и более в течение первых 5 суток после
вмешательства), приходится около 14,5% всех случаев острой почечной
недостаточности. При наличии наиболее значимых факторов риска (са
харного диабета II типа, исходной почечной недостаточности) ее доля мо-
жет достигать 5U—90%.
В целом в структуре причин острой почечной недостаточности, возник-
шей у госпитализированных больных, на долю рентген-контрастной нефро-
патии приходится около 11% случаев Тем не менее при использовании со-
временных визуализирующих методов и адекватных профилактических
Рентгеноконтрастная нефропатия
173
мероприятий (достаточной гидратации до и после вмешательства) частота
возникновения рентген-контрастной нефропатии может быть не столь зна-
чительной. Так, она возникла всего у 2% больных мозговым инсультом,
у которых с помощью компьютерной томографии оценивали перфузию го-
ловного мозга и состояние церебральных сосудов, применяя неионизирую-
щийся, низкоосмолярный йодсодержащий контрастный агент (Ультравист
300); ухудшение функции почек у них всегда оставалось умеренным и не
требовало выполнения гемодиализа. Показано, что частота развития
pcHi ген-контрасI ной нефропатии минимальна при выполнении компью-
терной томографии и достигает максимума после проведения ангиографии
сосудистых бассейнов (исключением является коронарография, после пла-
нового выполнения которой рентген-контрастную нефропатию отмечают у
6.5—8,1% пациентов). По данным регистра клиники Мауо, содержащего ин-
формацию о 7586 пациентах, которым выполняли чрескожную транслюми-
нальную коронароангиопластику, рентген-контрастная нефропатия возник-
ла у 3,3% больных.
Таким образом, распространенность рентген-контрастной нефропатии
остается значительной, особенно в группах риска (см. ниже). Некоторому
снижению частоты ее возникновения способствуют разработка и внедрение
визуализирующих методов обследования, при которых используют наиме-
нее опасные для функции почек контрастные агенты; к таким методам от-
носят компьютерную и магнитно-резонансную томографию.
ЭТИОЛОГИЯ
При определенных обстоятельствах практически любой рентген-конт-
растный агент может спровоцировать развитие рентген-контрастной не-
фропатии В связи с этим особое значение приобретает выявление факторов
риска развития рентген-контрастной нефропатии, в том числе основанное
на рекомендациях экспертов соответствующих профессиональных обществ,
таких как European Society of Urogenital Urology (табл. 11.1).
Одним из главных факторов риска рентген-контрастной нефропатии
является исходное ухудшение функции почек. Так, установлено, что
рентген-контрастная нефропатия может развиваться почти у 50% пациен-
тов. у которых сывороточная концентрация креатинина превосходит
2—2.5 мг/дл. В качестве признаков, характеризующих ухудшение почечной
функции и предрасполагающих к рентген-контрастной нефропатии, назы-
вают снижение скорости клубочковой фильтрации, клиренса эндогенного
креатинина, а также гиперкреатининемию.
174
Нефрология. Неотложнь е состояния
Таблица п '
факторы риска рентген-контрастной нефропатии
Группа фактор» риска Факторриекв
Метаболические наруше- ния Сахарный диабет Ч типа, особенно с поражением почек; • гиперурикемия; • гиперхолестеринемия
Заболевания • Исходная почечная недоста-очность (снижение СКФ. кли- ренса эндогенного креатинина, гиперкреатининемия); • артериальная гипертензия любого происхождения • гиповолемия любого происхождения, • хроническая сердечная недостаточность; • хроническое заболевание почек с протеинурией, • цирроз печени, • множественная миелома; • стенозирующее поражение периферических сосудов любо- го, в том числе атеросклеротического, генеза
Лекарственные препараты • Нестероидные противовоспалительнь е препараты; • ингибиторы кальцинейрина (циклоспорин, такролимус), • антибактериальные (аминогликоэиды) и противогрибко- вые препараты; • диуретики
Другие особенности паци ентоа • Пожилой возраст; • повторное применение рентен-контрастных агентов
Решающее значение в развитии рентген-контрастной нефропатии не-
редко имеет наличие у пациента сахарного диабета, особенно уже достиг-
шего стадии клинически очевидного поражения почек, прежде всего — диа-
бетической нефропатии, особенно тогда, когда она сопровождается стойким
ухудшением почечной функции. Наличие сахарного диабета с поражением
почек сопряжено с увеличением относительного риска возникновения рент-
ген-контрастной нефропатии в 3,6 раза. Частота возникновения рентген-
контрастной нефропатии при сахарном диабете почти в 4 раза выше, чем у
лиц бел нарушений обмена глюкозы Кроме того, у больных рентген-
контрастной нефропатией, развившейся при сахарном диабете, потреб-
ность в остром гемодиализе возрастает в 5 раз по сравнению с теми, у кого
сахарный диабет отсутствует.
С учетом вклада различных факторов риска в развитие реитген-
контрастной нефропатии были предложены подходы к прогнозированию ее
развития. В табл 11.2 представлена шкала, разработанная A. Mehran et al.
(2004) на основании анализа базы данных, содержащих сведения о 8357
больных, которым были выполнены ангиохирургические вмешательства,
позволяющая предсказать вероятность развития рентген-контрастной не-
фропатии после чрескожного вмешательства на коронарных артериях.
Рентген-контрастная нефропатия
175
Таблица 11.2
Шкала прогнозирования вероятности развития рентген-контрастной
нефропатии после чрескожного вмешательства на коронарных артериях
(по IMehran A. et all, (2004))
Фактор риска Артериальная гипотензия Проведение внутриаортальной контрпульса- ции Увеличение риски реэаигим рентген* контрастной нефропатии (а баллах) 5 5
Хроническая сердечная недостаточность 5
Креатининемия >1,5 мг/дл 4
Возраст >75 лет 4
Анемия 3
Сахарный диабет 3
Объем контрастного агента, введенного при чрескожном вмешательстве на коронарных артериях if Категория риска Низкий Умеренный I (на каждые 100 мл введенного агента) Число баллов — — L " 1
Высокий 11-15
Очень высокий >_16
Вероятность развития рентген-контрастной нефропатии существенно
возрастает по мере увеличения возраста пациента (каждый прожитый гол
увеличивает риск примерно на 2% [11]), что во многом объясняется драма-
тическим увеличением распространенности III и последующих стадий
хронической болезни почек именно в старших возрастных группах. Так, у
пациентов с острыми травмами возраст, в котором развивается рентген
контрастная нефропатия, развивалась в достоверно более старше возраст-
ной группе (средний возраст 61 гид и 43 года у лиц с сохранной почечной
функцией, р“0,003). Возраст старше 75 лет был сопряжен с увеличением
вероятности развития рентген-контрастной нефропатии в 7,7 раза.
Некоторые рентген-конграстные агенты могут прецииизировать в по-
чечных канальцах в комплексе с белками, попадающими в первичную мочу,
176
Нефрология. Неотложные состояния
в том чис гс с парапротеинами. Именно этим объясняют увеличение риска
рент ген-контрас гной нефропатии при хронических заболеваниях почек с
протеинурией, а также множественной миеломе. При данных заболеваниях
вероятность рентген-контрастной нефропатии достоверно возрастает при
наличии других ассоциированных факторов риска (гиповолемии, гипер-
кальциемии, гиперурикемии), также предрасполагающих к повреждению
почечных канальцев.
К числу этих факт оров относят стойкое повышение концентрации моче-
вой кислоты в сыворотке крови. Установлено, что при наличии гиперурике-
мии у пациентов, коюрым выполняют коронароангиографию. риск рентген-
кон1 растной неф|юпатии возрастает более чем в 4,5 раза. Кроме того, при
развитии поражения почек, индуцированного рептгеи-контрагтиыми аген-
тами, ухудшение функции почек, оцененное по приросту креатиннемии. у
таких больных оказывается достоверно более выраженным
Вероятность развития рентген-контрастной нефропатии возрастает в
ситуациях, для которых характерна стойкая гипоперфузия почечной ткани
(см. «Патогенез»), в частности структур тубуло-интерстиция. то есть при
хронической сердечной недостаточности, в том числе требующей примене-
ния больших доз петлевых диуретиков, а также при гиповолемии любого
происхождения.
У пожилых пациентов и при исходно сниженной скорости клубочковой
фильтрации ишемию почечных канальцев могут провоцировать ингибито-
ры АИФ и блокаторы рецепторов ангиотензина, и именно поэтому прием
этих препараты рассматривают в качестве самостоятельного фактора риска
разни 1 ия рентген-контрастной нефропатии.
Риск возникновения рентген-контрастной нефропатии закономерно
возрастает и при использовании других лекарственных нефротоксичных
средств, в том числе некоторых антибактериальных и противогрибковых
препаратон, а также ингибиторов кальцинейрина (циклоспорин, такроли-
мус). Особенно опасным представляется сочетание рентген-контрастных
агентов с нестсроидными противовоспалительными препаратами, при ко-
тором выраженность ишемического повреждения почечных канальцев
достигает максимума. Вероятность острой почечной недостаточности, ин-
дуцированной сочетанием рентген-контрастного агента и иестероидного
противовоспалительного препарата, возрастает особенно существенно при
персистирующей почечной гипоперфузии, например у больных хрониче-
ской сердечной недостаточностью.
На риск рентген-контрастной нефропатии влияет также тип используе-
мого контрастного агента. Вероятность острого ухудшения функции почек,
как правило, меньше при использовании гипо- или изоосмоляриых кон-
трастных агентов. Результаты ряда контролируемых клинических исслето-
Реитген-контрастная нефропатия
177
ваний (табл. 11.3) демонстрируют преимущества изоосмолярных контраст-
ных агентов перед гипоосмолярными, впрочем, наиболее впечатляющие
различия были отмечены только в исследовании NEPHR1C, в котором уча-
ствовали больные сахарным диабетом со стойкой умеренной гииеркреаги-
нинемией Вместе с тем полученный к настоящему времени опыт сравнения
безопасности различных рентген-контрастных агентов позволяет говорить
о преимуществах йодиксанола. по крайней мере — при контрастировании
аорты и ее ветвей, в том числе коронарных артерий. В качестве возможных
путей снижения риска развития рентген-контрастной нефропатии у паци-
ентов из труппы высокого риска называют также проведение магнитно-
резонансной ангиографии с использованием гадолинипсодержащих кон-
трастных агентов, практически не ионизирующихся. По-видимому,
магнитно-резонансная ангиография с гадолиниевыми контрастными аген-
тами характеризуется несколько меньшим риском дальнейшего ухудшения
функции почек но сравнению с компьютерной томографией, выполняемой
в режиме ангиоконтрастирования. Тем не менее результаты систематизиро-
ванного обзора 17 клинических исследовании, обнаруженных в ходе поиска
в 5 базах данных (в том числе MEDLINE, Current Contents, Embasc и
Cochrane Centra! Register of Controlled Trials), не выявили достоверных
преимуществ гадолиниевых контрастов, особенно примененных в высоких
дозах, перед йодсодержащими
Выявление факторов риска развития рентген-контрастной нефропатии
необходимо еще до применения рентген-контрастного агента. Оценка веро-
ятности развития почечного поражения необходима для определения соот-
ношения «риск/польза» оч предполагаемого дна! нистичсскиго вмешатель-
ства, а также для рационального выбора рентген-контрастного агента.
Следует иметь в виду, что риск возникновения рентген-контрастной нефро-
патии существенно возрастает при внутриартериальном введении рентген-
контрастного агента, а также по мере увеличения его лозы. В группах высо-
кого риска (у пациентов с сахарным диабетом, стойким снижением скорости
клубочковой фильтрации и/или гиперкреатининемией) предпочтение сле-
дует отдавать непонизирующимся мзоосмолярным рентген-контрастным
агентам, в том числе йодиксанолу, в большинстве клинических исследова-
ний показавшему меньшее, чем гипоосмолярные рентген-контрастныг аген-
ты. влияние на фильтрационную функцию почек. Что же касается исследо-
вания ACTIVE, в котором более частый и значительный рост креатининемии
был отмечен в i руппе пациентов, получавших именно йодиксанол (а не
гипоосмолярный иомепрол), то подобные результаты moi ут быть объясне-
ны тем, что в этой группе оказалось достоверно большее число больных са-
харным диабетом II типа.
178
Нефрология. Неотложные составив
Таблице " J
Результаты контролируемых исследований,
в которых сравнивали «почечную безопасность» различных
рентгеноконтрастных агентов в группах высокого риска
Исследование
Aspelin Р. et all., 2003
(NEPHRIC)
У 129 больных сахарным
диабетом и умеренной
(1,5—3.0 мг/дл) гиперкреа-
тининемией выполняли ко
ронароангиографию или
аортофеморальную ангио-
графию. Изоосмолярный
неионизирующийся кон-
трастней агент йодиксанол
сравнивали с низкоосмо-
лярным неиониэирующим
В течение 3 суток после процедур» »
группе больных, у которых был
менен иогексол, креатининемия
личилась на 0,42 мг/дл по сравне-хс
с теми, у кого использовали йоди^сэ
нол (р~0.001). Средняя динами*’
креатининемии в течение 7 суточ
после вмешательства составила
0,07 мг/дл у получивших йодикса-с-
и 0,24 мг/дл у получивших иогексо-
(р=0,003) Частота роста креатин^-*
ся иогексолом
мии более чем на 0,5 мг/дл состав.".*
3% при применении йодиксанола
и 26% при использовани иогексогг
(р=0,002)
Jo S.H. et all., 2006
(RECOVER)
У 300 больных с клиренсом
эндогенного креатинина
< 60 мл/мин применяли
йодиксанол или ионизиру-
ющийся димерный йодик-
салатдля коронарографии
с возможной ЧТ К А*
Частота рентген-контрастной неФос-
патии при применении йодиксанол*
оказалась достоверно ниже, чем при
использовании йодиксалата (7,9 и
17,0% соответственно, р=0,02Т)
диксанол достоверно реже, чем йо-
диксалат. вызывал рентген-
контрастную нефропатию в группа»
McCullough Р.А. et
all., 2006 (мета-
анализ)
Метаанализ данных о
2727 пациентах, включен-
ных в 16 контролируемых
исследований, во время
которых пациентам интра-
артериально вводили йо-
диксанол или гипо-
осмолярные контрастные
। агенты
пациентов с клиренсом эндогенное
, креатинина < 30 мл/мин, при сахас
ном диабете, а также если суммар-
ный объем использованного кон-
! TgacTMpro агента составлял ^.140 м -
Максимальный прирост креатинине
мии в течение 3 суток после вмеша
тельства был достоверно меньшим
при применении йодиксанола. чем
при введении гипоосмолярных
рентген-контрастных агентов
(0.06 мг/дл против 0,1 мг/дл, р<0.00’
особенно у пациентов с хронической
болезнью почек (0,07 мг/дл против
0,16 мг/дл, р=0,004) и хронической
болезнью почек и сахарным диабе-
том (0,1 мг/дл против 0.33 мг/дл.
р=0,003). Рентген контрастная не-
фропатия у пациентов, получавших
йодиксанол, также развивалась реже
(1,4% против 3.5, р<0,001). в том
числе при хронической болезни 'те-
чек (2,8 и 8,4%. р=0,001) и при хро-
нической болезни почек и сахарном
диабете (3 и 15,5%, р=0.003)
Рентген-контрастная нефропатия
179
Продолжение табл. 11.3
Исследование Описание Результаты
Bader Т. et all., 200В (ACTIVE) У 148 пациентов с хрониче- ской почечной недостаточ- ностью (креатин инемия > 1,5 мг/дл и/или клиренс эндогенного креатинина < 60 мл/мин) при прове- дении мультиспиральной компьютерной томографии с контрастным усилением были применены йодикса- нол или низкоосмолярный иомепрол 6,9% пациентов, у которых был при- менен йодиксанол. и ни один из больных, у которых был использован иомепрол, не продемонстрировал роста креатининемии более чем на 0,5 мг/дл Средний рост креатинине- мии оказался достоверно большим у пациентов, получавших йодиксанол. чем при применении иомепрола (0,06 +0,27 мг/дл против -0,04 + 0,19 мг/дл, р -0.017)
BottnerR. et all., 2008 (VALOR) У 337 пациентов с хрониче- ской болезнью почек для проведения коронароанги- ографии использовали йодиксанол или гипо осмолярный иоверсол Частота рентген-контрастной нефро патии в двух группах достоверно не отличалась, различие между средним приростом креатининемии также не достигло статистической достоверно- сти. Тем не менее у больных сахар- ным диабетом, получивших йодикса нол, средний рост креатининемии был достоверно меньше, чем у тех, у кого был использован иоверсол (12,9% и 22,4%, соответственно, р=0,01)
’ЧТКА — чрескожная транслюминальная коронароангиопластика
ПАТОГЕНЕЗ
Патогенез рентген-контрастной нефропатии все еще продолжают уточ-
нять, однако принципиальные составляющие его в настоящее время уже
подробно охарактеризованы. Нарастающая ишемия почечной ткани, в том
числе наиболее уязвимых тубуло-интерстициальных структур, дополняет-
ся негативным влиянием рентген-контрастных агентов, индуцирующих
дисфункцию гломерулярных эндотелиопитов и токсически воздействую-
щих на канальцевые эпителиоциты (табл. 11.4). Каждый из механизмов раз-
вития рентген-контрастной нефропатии может быть объектом профилакти-
ческого и терапевтического воздействия.
180
Нефрология. Неотложные соггояи»
Патогенез рентген-контрастной нефропатии
Таблица ’ ‘ *
Патог«н«тмч*скии
м«ханнзм
Описание
Нарушение внутрипочеч-
ной гемодинамики с ише-
мией ткани почек
Прямое токсическое дей
ствие рентген-
контрастных агентов на
эпителиоциты почечных
канальцев
Расстройство регуляции
осмолярности мочи
• Преходящее кратковременное увеличение почечного крове
тока с его последующим стойким ухудшением;
• индукция дисфункции эндотелиоцитов почечных артериог г
клубочков;
• продукция эндотелиоцитами ангиотензина II и эндотелина '
обусловливающих персистирующий вазоспазм с усугубле-
нием ишемии почечной ткани, прежде всего — тубуло-
интерстиции;
• увеличение вязкости крови с развитием стаза и сладжа в в=»
носящих артериолах клубочка; дальнейшее расстройство
гломерулярной гемодинамики,
• снижение продукции внутрипочечных простагландинов,
• интенсивная продукция перекисей и свободных радикалов :
нарастанием дисфункции гломерулярных эндотелиоцитов
• Вакуолизация канальцевых эпителиоцитов;
• некроз канальцевых эпителиоцитов;
• формирование воспалительных инфильтратов в почечном
тубуло-интерстиции
• Увеличение осмолярности первичной мочи и ее обьема,
• doct -идростатическо'о давления в канальцах;
• компрессия канальцевых эпителиоцитов, усугубляющая их
ишемию, стаз и сладж в сосудах почечного тубуло-
интерстиция
Основные механизмы, приводящие к развитию рентген-контрастнои не-
фропатии, — .это гипоксия мозгового слоя почки и прямое токсическое воз-
действие на эпителиальные клетки канальцев. После введения контрастно-
го вещества развивается кратковременное усиление почечного кровотока,
за которым следует период снижения кровотока вследствие сужения сос> -
дов. Применение контрастного вещества вызывает внутрипочечную вазо-
констрикцию, опосредованную различными медиаторами, включая эндоте-
лии, вазопрессин, внутриклеточный кальций, аденозин, чти приводит к
снижению кровотока и ишемии почечной ткани, особенно выраженной в
мозговом слое — области, наиболее подверженной ишемическому пов-
реждению. Аденозин, а также йод, содержащиеся в контрастном веществе,
воздействуют на привлеченные в очаг повреждения полиморфно-ядерные
лейкоциты, вызывая продукцию свободных радикалов кислорода (гидрок-
сильных радикалов, сулероксид-аниона), что в свою очередь усиливает
ишемию. В то же время снижается синтез NO и простагландинов, обладаю-
щих сосудорасширяющими свойствами.
Рентген-контрастная нефропатия
181
МОРФОЛОГИЯ
При рентген-контрастной нефропатии обнаруживают морфологические
признаки, характерные для тубулярного некроза ишемического генеза. Вы-
являют дистрофию, вакуолизацию и очаговый некроз эпителия прокси-
мальных канальцев: слущивание тубулярных клеток в просвет канальцев и
формирование цилиндров. Также наблюдается усиление апоптоза клеток
канальцевого эпителия, нарушение состояния молекул адгезии.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина рентген-контрастной нефропатии нсспецифична.
Единственной жалобой может быть уменьшение количества выделяемой
мочи и/или сопутствующий развитию острой почечной недостаточности
подъем АД. Следует подчеркнуть, что обусловленное действием рентген-
контрастных агентов ухудшение функции почек может формироваться без
олигоанурии. В связи с этим большое значение в распознавании рентген-
контрастной нефропатии имеют результаты лабораторных исследований в
том числе биохимического исследования крови, выявляющего гиперкрса-
тининемию, гиперкалиемию, а также снижение скорости клубочковой
фильтрации. Рентген-контрастные агенты могут обусловливать возникно-
вение своеобразной реакции, воспроизводящей быстро прогрессирующую
системную склеродермию с распространенным поражением кожи, суставов,
почек и сердца (см. «Острая склеродемическая нефропатия»’).
ДИАГНОСТИКА
Диагноз рентген-контрастной нефропатии ставят после изучения анам-
неза (при возникновении симптомов в течение ближайших двух суток с
момента применения рентген-контрастного агента, наличии факторов ри-
ска) и оценки динамики креатининемии, калиемии и расчетной скорости
клубочковой фильтрации. Необходим также мониторинг величины диуре-
за и АД. Изменения мочи для рентген-контрастной нефропатии не типич-
ны. Возможна микроальбуминурия. Результаты визуализирующих мето-
дов псе шдовання, как правило, не информативны. Биопсия почки
нецелесообразна. Дифференциальный диагноз рентген-контрастной не-
фропатии проводят с другими причинами острой почечной недостаточно-
сти, возникаю!цей после эндоваскулярных диагностических и лечебных
вмешательств (1абл. 11.5).
182
Нефрология. Неотложные состоим*
Для профилактики рентген-контрастной нефропатии и связанно! v с ь*я
выраженною ухудшения функции почек особое значение приобретает ь»-
деление ее ранних доклинических маркеров. На эту роль в настоящее вреш
претендует ассоциированный с желатиназой нейтрофилов липокалин — бе-
лок, плазменная концентрация и мочевая экскреция которого существенж
возрастают при развитии рентген-контрастной нефропатии. Величина экс-
креции липокалина может также быть использована для прогноза ухудше-
ния почечной функции под действием рентген-контрастного агента. В каче-
стве раннего лабораторного признака рентген-контрастной нефропатия
предлагают также использовать мочевую жскрецию интерлейкина-18.
Таблица '' 5
Дифференциальный диагноз рентген-контрастной нефропатии
Диагностический признак чачных артерий Тромбоз почечнык
| Почечная недо- статочность Варьирует от умерен- ной до быстро - прогрессирующей Нередко приобретает быстропрогрессиру ющий характер и ста- новится необратимой Почечная недоста- точность изменяемся от умеренной до бы стро прогрессирую щей
Олигурия/анурия Могут отсутствовать Характерны Наблюдаются при двустороннем тром- бозе магистральны» почечных артерий или распространен ном тромбозе вну трилочечных артерий
Подъем АД Может быть умерен ным Выраженный и неку- пируемый, нередко приобретает черты злокачественной ар термальной гипер тензии Определяется степе нью ишемии почеч- ной ткани, обуслов- ливаемой распро- страненностью тром- боза
Изменения мочи Отсутствуют, за ис- ключением возмож- ной микроапьбуми нурии и увеличения мочевой экскреции специфических мар- керов, не определяе- мых в настоящее вре мя в рутинной клини- ческой практике (ас- социированного с желатиназой нейтро филов липокалина. интерлейкина-1 В} Эозинофилурия, «следовая» протеи- нурия, возможно — гематурия Минимальны (ми- кроальбуминурия, «следовая» протеи- нурия)
Рентген-контрасгная нефропатия
183
Продолжение табл. 11.5
Диагностический признак Рентген-коитрастная нефропатия Холестериновая ! змболнк внутрипо- чечных артерий Тромбоз почечных артерий
«Системные» проявления Не типичны (исклю- чение - индуцируе- мая гадолиниевыми контрастны м и аген - та ми склеродерме подобная реакция) Признаки острофазо- вого ответа (лихорад ка, артралгии, потеря массы тела, увеличе- ние СОЭ, сывороточ- ного уровня С-реак- тивного белка). Кожное сетчатое ли- ведо с трофическими язвами (чаще - на дистальных фалангах пальцев ног). Признаки эмболии органных артерий (бляшки Холленхор ста на сетчатке глаз, ишемический ин сульт. острый коро нарный синдром/ острый инфаркт мио- карда, ишемические кишечные боли/ин- фаркт кишечника, острый панкреатит, инфаркт селезенки) Сетчатое ливедо. Признаки тромботи- ческого / тромбоэм- болического пораже- ния внутренних орга- нов
ЛЕЧЕНИЕ
Лечение рентген-контрастной нефропатии включает применение не-
скольких патогенетически аргументированных стратегий, степень обосно-
ванности которых различна (табл. 11.6). Острая почечная недостаточность
с гиперкалиемией при рентген-контрастной нефропатии может стать осно-
ванием для выполнения экстренного гемодиализа.
Таблица 11.6
Подходы к лечению и профилактике рентген-контрастной нефропатии
Терапевтическая стратегия Степень обоснованности - Режим применения (комментарий)
Диуретики (фуросе- ; ымд и маннитол) 1 Несколько рандоми- зированных контро лируемых исследова- ний Фуросемид по 40-80 мг перед введением рентген-контрастного агента (прлимуще ства не установлены; применять нецелесо образно) Маннитол по 25 г внутривенно за 1 час до введения контрастного агента (преимуще- ства не установлены, применять нецелесо- образно)
184
Нефрология. Неотложные состомм
Продолжение табл * ’ £
Терялевгичеосм стратегия ! :— Степень обоснованности _ J Режим применения (комментарии)
1 Допамин Несколько рандоми- зированных контро- лируемых исследова- ний 2-5 мкг/кг/мин внутривенно перед ино. - эией рентген-контрастного агента и в ’еде- ние 12 часов после инфузии (малая продолжительность действия. жет быть опасным; широкое использовз ние нецелесообразно)
Рекомбинантный предсердный на- трийуретический гормон Несколько рандоми- зированных контро- лируемых исследова НИЙ 50 мкг внутривенно болюсно. скорост- и— фузии — 1 мкг/мин в течение 12 часов ' _ еле процедуры (данные о безопасное’^* противоречивы; в настоящее время не се комендуется)
Антагонисты кальция Несколько рандоми- зированных контро- лируемых исследова- ний Эффективность убедительно не доказав но в настоящее время эта стратегия явл»е* ся одной из самых доступных. Риск неже нательных явлений меньше, чем при при- менении других методов лечения
Антагонисты эндстелина-1 Контролируемые ис- следования пока не- многочисленны Результаты противоречивы; дальнейшее внедрение в клиническую практику огр= ничивается высокой стоимостью этих пре паратов
N-ацетил цистеин Рандомизированные контролируемые ис- следования, мета- анапизы Рандомизированные клинические иссге дования подтверждают эффективности метаанализы показывают отсутствие до стоверного эффекта Тем не менее в на- стоящее время применение N-ацетил- цистеина рассматривается как одна из наиболее эффективных и безопасных терапевтических стратегий
Метилксантины <тео - филлин) Ра ндом изированные контролируемые ис- следования Эффективность установлена
Простагландины (PGE1) Малочисленные ран- домизированные контролируемые клинические иссле- дования Перспективная профилактическая и тера- певтическая стратегия, но эффективное» нуждается в дальнейшем уточнении
Подходы к профилактике и лечению рентген-контрастной нефропатии
продолжают уточняться, ни уже в настоящее время очевидно, что наиболь-
шей эффективности следует ожидать of использования комбинированные
Рентген-контрасткая нефропатия
185
стратегий. Briguori С. et al. (2007) в рандомизированном исследовании
REMEDIAL сопоставили эффективность комбинаций физиологического
раствора с N-ацетилцистеином, натрия бикарбоната с N ацетилцистеином н
физиологического раствора с N-ацетилцистеином и аскорбиновой кисло-
той, примененных у 327 пациентов с хронической болезнью почек (креати-
нинемия > 2 мг/дл, скорость клубочковой фильтрации < 40 мл/мин). Всем
больным проводили коронароангиографию или ангиографию перифериче-
ских артерий с использованием йодиксанола. Рентген-контрастную нефро-
патию диагностировали при росте креатининемии более чем на 25% в тече-
ние 48 часов после вмешательства. Поражение почек, индуцированное
рентген-контрастным агентом, было отмечено у 9,9% больных в первой
группе, у 1,9% — во второй группе и у 10,3% — в третьей группе (р=0,019).
Таким образом, комбинация натрия бикарбоната с N-ацетилцистеином по-
зволяет с большей вероятностью предупредить рентген-контрастную не-
фропатию. чем сочетание физиологического раствора с N-ацетилцистеином,
даже тогда, когда его эффект пытаются усилить добавлением обладающей
антиоксидантными свойствами и в связи с этим потенциально полезной
аскорбиновой кислоты.
В другом рандомизированном контролируемом исследовании примене-
ние аскорбиновой кислоты для профилактики рениен-контрастной нефро-
патии также оказалось неэффективным.
В целом натрия бикарбонат, очевидно, превосходит по эффективности
физиологический раствор, однако его преимущество становится практиче-
ски незначимым при использовании изоосмолярных рентген-контрастных
агентов, в частности йодиксанола, характеризующихся наименьшим риском
рентген-контрастной нефропатии.
Одними из наиболее интенсивно изучавшихся в контролируемых кли-
нических исследованиях следует считать N-ацетилцистеин (табл. 11.7) и
теофиллин (табл. 11.8). Несмотря на то что эффективность этих препаратов
в ряде контролируемых исследований и метаанализов подтвердить не уда-
лось, высокая безопасность позволяет рекомендовать их для профилактики
и лечения рентген-контрастной нефропатии. Работы последних лет указы-
вают на меньшую эффективность теофиллина и N-апетилцистеина во мно-
гом потому, что в них применяют менее опасные, практически не про-
воцирующие развития рентген-контрастной нефропатии, изиосмолярные
контрастные агенты. По-видимому, способность N-ацетилцистеина пре-
дупреждать рентген-контрастную нефропатию возрастает при применении
высоких еги доз.
186
Нефрология. Неотложные составам
Таблица "IJT
Опыт применения N-ацетилцистеина для профилактики
и лечения рентген-контрастной нефропатии (данные контролируемых
клинических исследований и мета анализов)
Результаты
Описания
Исследование
Tefel М. et al., 2000 | У 83 больных хронической по-
I чечной недостаточностью (сы
вороточная концентрация креа
тинина 2.3+1.4 мг/дл) выполня-
ли компьютерную томографию с
использованием гипоосмоляр-
ного неионизирующегося ио-
лромида. Пациенты 1-й группы
| до и после вмешательства полу
| чали N-ацетилцистеин перо-
рально (600 мг 2 раза в сутки) в
сочетании с инфузией физиоло-
гического раствора. Пациенты
2-й группы получали физиоло-
гический раствор и плацебо
Прирост креатининемии
>,0.5 мг/дл был констатиосМ'-
у 2% больных, получав—*’»
N-ацетилцилстеин, и у 2’W »>
циентов, получавших гга_еос
(р^0,01)
I Shyu K.G et а!.. 2002
У 121 больного хронической по-
чечной недостаточностью (креа-
тининемия 2,8+0,8 мг/дл) про-
водили коронароангиографию.
Часть пациентов получали ком-
бинацию N-ацетилцистеина и
физиологического раствора,
другая часть - физиологический
раствор и плацебо
Рентген-контрастная нефропа-
тия отмечена у 3,3% пациенте*
получавших N-ацетилцистеин * *
у 24,6% больных, получавших
плацебо (р<0,001)
MarenziG.etaL.
2006
Больные перед коронароангио-
пластикой были рандомизиро-
ваны в 3 группы:
— 116 пациентов накануне вме
шательства получали инфузию
600 мг N-ацетилцистеина болю-
сом и 600 мг N-ацетилцистеина
перорально 2 раза в первые 2
Развитие рентген-контрастной
нефропатии отмечено у 33%
больных, получавших плацебо.
15% больных, получавших стан-
дартную дозу N-ацетилцистеина.
и 8% пациентов, получавших
высокую дозу N- ацетил цисте ина
(р<0.001)
суток после процедуры.
-119 больных получали инфу-
зию 1200 мг N-ацетилцистеина
болюсом накануне вмешатель-
ства и 1200 МГ;
N-ацетилцистеина перорально 2
раза в первые 2 суток после
процедуры;
-119 пациентов принимали
плацебо
SeyonR.A etal.,
2007
40 больных хронической почеч-
ной недостаточностью получали
N-ацетилцистеин или плацебо
Различий в величинах креатини-
немии и клиренса эндогенного
креатинина в основной и кон-
трольной группах не выявлено
х
Рентген-контрастная нефропатия
187
Продолжение табл. 11 7
Исследование
8agshawS.M. etal.,
2004
Описание
Метаанализ 14 клинических ис-
следований (1261 больной)
Результаты
Применение N-ацетилцистеина
снижает риск рентген-
контрастной нефропатии на
46% (р—0.02), но достоверных
различий в величинах креа^ини-
немии спустя 48 часов после
процедуры у больных, получав-
ших и не получавших
N-ацетилцисгеин, не отмечено.
Однозначно интерпретировать
результаты данного мета-
анализа нельзя в связи со значи-
тельным различием в методиках
использованных для анализа ис-
следований
Liu R. etal., 2005
Метаанализ 9 рандомизирован-
ных контролируемых исследо-
ваний
Zagier A. et al., 2006
Метаанализ 13 клинических ис-
следований G892 пациента)
Включенные в метаанализ ис-
следования существенно разли
чались между собой по числу
включенных пациентов, их исхо
дным характеристикам и про-
должительности наблюдения.
Тем не менее использование
N-ацетилцистеина сопровожда
лось снижением риска развития
рентген-контрастной нефропа-
тии в среднем на 57%
Результаты метаанализа одно-
значно не подтверждают, но и не
опровергают протективное дей-
ствие N-ацетил цистеина
Таблица 1Т8
Теофиллин в профилактике и лечении рентген-контрастной нефропатии
(данные контролируемых клинических исследований и метаанализов)
ErteyCM. et all.. 1999
У ВО больных хронической по-
чечной недостаточностью
(сывороточный креатинин
> 1,5 мг/дл) в качестве рентген-
контрастного агента был приме-
нен иопромид. Все больные со
блюдали адекватный режим ги-
дратации, часть из них получа-
ли теофиллин (810 мг/сутки),
I Частота ухудшения функции по-
I чек в обеих группах достоверно
не отличалась. В групге, полу-
I чавшей плацебо констатировано
достоверное увеличение моче-
1 вой экскреции N ацетил-D-глю
каминидазы — маркера поврех
дения эпителиоцитов почечных
I канальцев
остальные — плацебо
188
Нефрология. Неотложные cc—^ni—
Продолжение табл “ €
Исследование» - < Описание Результаты
Huber w. et al., 2003 В исследовании участовали 100 больных с креатининемией >11,3 мг/дл. Часть из них за 30 минут до проведения коронаро- ангиографии получали 200 мг теофиллина, остальные - толь- ко физиологический раствор Прием теофиллина позволил до стоверно уменьшить частоту воз- никновения рентген-контраст ной нефропатии (у 4% больны» против 20% - в группе получав- ших физиологический раствор р=0,0138)
Bagshaw S.M. et al., 2005 Метаанализ и систематизиро- ванный обзор 9 рандомизиро- ванных контролируемых иссле- дований (585 больных) В группе больных, получавши* теофиплин, креатининемии ока- залась достоверно меньше, чем у тех, у кого теофиллин не при- меняли
Д.Л.Я лечения рентген-контрастной нефропатии может быть примене-
на вено-венозная гемофильтрация, приводящая к меньшим нарушениям
системной гемодинамики, чем экстренный гемодиализ. Профилактиче-
ское выполнение гемодиализа у пациентов с хронической почечной не-
доста!очностью не приводит к снижению риска рентген-контрастной не-
фропатии.
Глюкокортикостероиды и антигистаминные препараты не были объек-
том специальных контролируемых исследований, включавших больных
рентген-контрастной нефропатией. Их применение можно обсуждать в си-
туации, когда рентген-контрастная нефропатия возникает вследствие при-
менения йодсодержащих контрастных агентов, способных индуцировать
ал чергическое повреждение почечных канальцев, выраженность которого
может быть уменьшена с помощью глюкокортикостероидов и антигиста-
минных препаратов.
ПРОГНОЗ
Развитие рентген-контрастной нефропатии всегда сопряжено с увеличе-
нием риска стойкого ухудшения почечной функции, сердечно-сосудистых
осложнений, а также продолжительности пребывания в стационаре.
Смертность пациентов составляет не менее 1,5%. Прирост креатининемии
более чем на 0,5 мг/дл указывает на достоверное увеличение вероятности
наступления потребности в гемодиализе и смерти в течение ближайших
30 дней.
Рентгеноконтрастная нефропатия
189
ПЕРСПЕКТИВЫ
Дальнейшему повышению эффективности профилактики рентген-
контрастной нефропатии может способствовать внедрение в клиническую
практику новых неионизирующихся изоосмолярных рентген-контрастных
агентов, позволяющих добиться удовлетворительного качества визуализа-
ции при применении их в малых лозах. Кроме того, необходимо совершен-
ствование протоколов профилактической гидратации.
Особую актуальность представляет также разработка новых терапевти-
ческих стратегий Опыт применения антагонистов эндотелина-1, показан-
ных для патогенетической терапии, пока оказался неоднозначным с точки
зрения безопасности; в дальнейшем уточнении нуждается также и целесоо-
бразность назначения препаратов простагландинов.
Благодаря своим плейотропным эффектам, заключающимся в спо-
собности нормализовывать функцию эндотелия и тормизить процессы тка-
невою воспаления и свободно-радикального повреждения, одними из
наиболее перспективных препаратов для лечения рентген-контрасшой не-
фропатии являются статины. Тем не менее эффективность их пока не уда-
лось подтвердить в контролируемых клинических исследованиях, напри-
мер исследовании PROMISS.
Одной из первоочередных мер, позволяющих предупредить рентген-
кон граетную нефропатию, является устранение соответствующих факторов
риска, возможное только при надлежащей информированности врачей,
остающейся пока далеко не идеальной. Телефонный и интернет-опрос 509
радиологов, работавших в 10 странах Европы, показал, что только 45% из
них диагностируют рентген-контрастную нефропатию, ориентируясь на
общепринятые критерии. Среди остальных 26, 30 и 46% врачей не рассма-
тривают, соответственно, пожилой возраст, дозу рентген-контрастпого пре-
парата и хроническую сердечную недостаточность как факторы риска
рентген-контрастной нефропатии. 56% радиологов не считают, что рентген-
контрастная нефропатия сопряжена с увеличением смертности а 28% ни-
когда не привлекали нефролога для консультации своих пациентов. В связи
с этим необходимо целенаправленное формирование соответствующей «на-
строенности» радиологов, кардиологов и врачей других клинических спе-
циальностей на выявление факторов риска и ранних признаков рентген-
контрастной нефропатии.
Неотложные мероприятия
• Провести мониторинг диуреза величины креатининемии, скорости
клубочковой фильтрации и калиемии.
190
Нефрология Неотложные состоам
• Обеспечи гь больному достаточную гидратацию, в том числе нероралэг
ную (возможно применение как физиологического раствора, так и на-
трия бикарбоната).
• При использовании йодсодержащих рентген-контрастных агента»
можно назначить преднизолон (30-60 мг per os), хлоропропиамт
(20-40 мг).
• При подъеме АД — применить антагонисты кальция.
• Назначить теофиллин.
• Попытаться применить N-ацетилцистеин.
• Отменить петлевые диуретики, ингибиторы АПФ и блокаторы рецеп-
торов ангиотензина II.
• При калиемии > 6,5 мЭкв/л — обсуждать выполнение экстренного ге-
модиализа.
Глава 12
ГЕПАТОРЕНАЛЬНЫЙ СИНДРОМ
Гепаторенальный синдром — потенциально обратимое ухудшение функ-
ции почек» наблюдающееся у больных терминальным циррозом печени или
фульминантной печеночной недостаточностью, характеризующееся зна-
чительным снижением скорости клубочковой фильтрации и почечного
плазмотока и возникающее при отсутствии других причин острой почечной
недостаточности. Обязательным признаком гепаторен&сыюго синдрома
является выраженная констрикция внутрипочечных сосудов, которой
предшествует периферическая вазодилатация. Функция почечных каналь-
цев на первом этапе остается сохранной; изменения мочи отсутствуют.
Выделяют лва типа гепаторенального синдрома, отличающиеся по лабо-
раторным признакам и прогнозу (табл. 12.1) Для гепаторенального синд-
рома I типа характерно быстропрогрессирующее течение, к тому же его раз-
витие часто бывает обусловлено очевидным провоцирующим фактором
(например, употреблением алкоголя больным тяжелым алкогольным цир-
розом печени). Прогноз при II типе гепаторенального синдрома более бла-
гоприятен.
Таблица 12.1
Клинические варианты гепаторенального синдрома
Тга'.п.тор.нм’.ного Клииич«к«я характеристике
синдром*
I • Прирост креатининемии на 100% и более (до величины, пре-
вышающей 2.5 мг/дл) или снижение клиренса эндогенного
креатинина на 50% (до величины < 20 мл/мин) в течение ме-
нее чем двух недель.
• Крайне неблагоприятный ближайший прогноз
F 1 ” “ “ ' '
II • Креатининемия >1.5 мг/дл, темп ухудшения функции почек
не соответствует I типу гепаторенального синдрома.
• Как правило, развивается рефрак~еоный асцит
• Прогноз более благоприятен, чем при гепаторенальном син
дроме I типа
ЭПИДЕМИОЛОГИЯ
По данным мульти центрового ретроспективного исследования, в кото-
ром участвовали 423 пациента с циррозом печени, 20% всех случаев возник-
шей у них острой почечной недостаточности пришлись на гепаторенальный
192
Нефрология. Неотложные состоя»^
синдром 1 lima, еще 6,6% — на гепаторенальный синдром II типа. Гепаторе-
нальный синдром был констатирован у 49 из 102 больных (48%) циррозом
печени, находившихся в листе ожидания трансплантации печени и проде-
монстрировавших ухудшение функции почек, чю потребовало проведен! л
заместительной почечной терапии. Таким образом, гепаторенальный син-
дром наряду с острым тубул о-интерстициальным нефритом, в первую оче-
редь лекарственным, и нарушением системной гемодинамики, занимает
одно из первых мест в структуре причин острой почечной недостаточности,
развивающейся у больных циррозом печени.
ЭТИОЛОГИЯ
Считают, что гепаторенальный синдром несколько чаше развивается >
больных алкогольным циррозом печени, хотя в целом его формирование
возможно при декомпенсированном циррозе печени любой этиологии
У пациентов с гепаторенальным синдромом I типа провоцирующие факто-
ры обычно очевидны. Нередко гепаторенальный синдром развивается при
одновременном действии нескольких провоцирующих факторов, хотя воз-
можно и его спонтанное формирование.
Факторами, предрасполагающими к развитию гепаторенального син-
дрома, являются:
• спонтанный бактериальный перитонит (осложняйся гепатореналь-
ным синдромом у 20 -30% больных);
• парацентез с удалением большого объема жидкости, не сопровождаю-
щимся адекватным возмещением плазмой и раствором альбумина
(осложняется гепаторенальным синдромом не менее чем в 15% слу-
чаев);
• острый алкогольный гепатит (приводит к развитию гепаторенального
синдрома в 25% случаев);
• желудочно-кишечное кровотечение (осложняется гепаторенальным
синдромом в 8 раз чаще, чем у больных без кровотечений, хотя у таких
больных острая почечная недостаточность может быть пререналь-
ной — прямым последствием гиповолемии):
• перс юзировка петлевых диуретиков (значение этого фактора под-
тверждено не во всех клинических исследованиях)
В настоящее время установлены факторы, позволяющие предсказать
риск развитя гепаторенального синдрома: так, вероятность его возникно-
вения у больных циррозом печени в течение 5 лет составляет почти 40% и
достигает максимума при наличии гипонатриемии и повышенной активно-
сти ренина плазмы. В качестве доклинических маркеров риска сенаторе-
Гепаторенальный синдром
193
надыюго синдрома можно также рассматривать допплерографические па-
раметры внутрипочечного кровотока, указывающие на генерализованную
констрикцию почечного сосудистого русла. Так, рост резистивного индекса
коррелирует со значительным увеличением частоты развития rtnai ире-
нал ьного синдрома.
Необходимо иметь в виду, что резкое ухудшение функции почек у боль-
ных циррозом печени может бьпь обусловлено не только гепаторенальным
синдромом, но и другими причинами, нередко сочетающимися между собой
(например, резким уменьшением объема циркулирующей крови в связи с
потерями жидкости через назогастральный зонд или во время диареи)
(табл. 12.2). Сочетание причин, как правило, приводит к более быстрому
нарастанию острой почечной недостаточности, часто приобретающей в свя-
зи с этим трудно обратимый характер.
Причины острой почечной недостаточности
у больных циррозом печени
Таблица 12.2
Группа причин Причина i : -
Сосудистые и гемоди- намические нарушения • Гиповолемия с артериальной гипотензией; • хроническая сердечная недостаточность III-IV функционально го класса; • потеря жидкости при рвоте, диарее, через назогастральный зонд; • тромбоз и тромбоэмболия почечных артерий и вен; • артериальная гипотензия, обусловленная генерализованной перифеоической вазодилатацией при сепсисе, спонтанном бактериальном перитоните; • артериальная гипотензия как следствие неадекватного поиме- нения анестезирующих агентов
Гепаторенальный син- дром • Гепаторенальный синдром I типа (быстропрогрессирующий), • гепаторенальный синдром II типа (медленно прогрессирую- щий, как правило, сопряженный с рефрактерным асцитом)
Поражение почек • Острый канальцевый некроз (лекарственный, гемодинамиче- ский); • острая । игментная нефропатия (рабдомиолиз после алкоголь него эксцесса); • лекарственный острый тубуло-интерстициальный нефрит (при циррозе печени риск повышается многократно по сравнению с риском у лиц с сохранной функцией печени)
Обструкция мочевыво- дящих путей Пассаж камня, • сгусток крови; • компрессия извне (рагтущия злокачественная опухоль)
7 ВехЬрология
194
Нефрология. Неотложные соппм—
ПАТОГЕНЕЗ
Формирование гепаторенального синдрома определяется участием не-
скольких звеньев патогенеза, в результате действия которых происходит
прямое или опосредованное ухудшение перфузии ткани почек, в дальней-
шем приводящее к стойкой констрикции почечных сосудов. Таким образом,
ухудшение фильтрационной функции почек при гепаторенальном синдро-
ме имеет преимущественно гемодинамическую природу, хотя и не может
быть объяснено только механизмами развития, типичными для прерсналь-
ной острой почечной недостаточности («шоковой почки»). Известно, что
нарушения внутрипочечной гемодинамики, предрасполагающие к развп
тмю гепаторенального синдрома, наблюдают у 80% госпитализированных
больных циррозом печени, а у 15—20% из них эти нарушения прогрессиру-
ют вплоть до формирования гепаторенального синдрома.
Одним из центральных патогенетических звеньев гепаторенального
синдрома, приводящим к гипоперфузии ткани почек и стойкой констрик-
ции почечного сосудистого ложа, является увеличение депонирования
крови на периферии (в том числе во внутренних органах), связанное с гло-
бальной и трудно устранимой периферической вазодилатацией. (Для обо-
значения дилатации артериального русла внутренних органов используют
также термин «спланхническая вазодилатация».) По существу, при деком-
пенсированном циррозе печени, осложняющемся гепаторенальным синдро-
мом, можно говорить об атонии стенки периферических сосудов. Стойкой
периферической вазодилатации при циррозе печени способствуют гм пер-
продукция у этих пациентов воспалительных медиаторов (например.
a-фактора некроза опухолей — ФНО-«). Концентрация ФНО-« нарастает
но мере усугубления типичной для цирроза печени эндогенной знлотоксе-
мии (хорошо известно, что у больных циррозом печени проницаемость кп
шечной стенки для эндотоксинов значительно выше, чем у здоровых) и до-
стигает максимальных значений при асцит-перитоните, при котором риск
гепаторенального синдрома наиболее высок.
Ключевым медиатором стойкой спланхничсской вазодилатации, во
многом определяющим формирование гепаторенального синдрома, являет-
ся NO, гиперпродукция которого всегда наблюдается по мере нарастания
тяжести цирроза печени. Именно NO обусловливает расширение перифе-
рических сосудов, приводящее к системной артериальной гипотензии и
стойкой почечной гипоперфузии, что вызывает локально-почечную актива-
цию систем вазоконстрикции (в первую очередь ренин-ангиогензин-
альдостероновой, а также эндотелина-1) и в результате — постоянный спазм
сосудистого русла почек и резкое снижение скорости клубочковой филь-
трации.
Гепаторенальный синдром
195
В качестве пусковых факторов продукции NO эндотелиоцигами пери-
ферических сосудов при циррозе печени могут выступать медиаторы вос-
паления, в том числе ФНО-ot и интерлейкин-6. Установлено, что при цир-
розе печени возрастает активность не только эндотелиальной, но и
индуцируемой NO-синтазы, локализующейся в том числе на мембанах ней-
трофилов и макрофагов и у здоровых людей практически нс экспрессирую-
щейся, но начинающей преобладать при различных формах системного вос-
палительного ответа, например при септицемии.
Гиперпродукция NO, в определенной степени связанная с активацией
индуцируемой изоформы NO-синтазы, сближает патогенез расстройства
системной гемодинамики лежащего в основе гепаторенального синдрома, с
патогенезом гемодинамических нарушений, наблюдающихся при септиче-
ских состояниях. Это объясняется тем, что как при сепсисе, так и при цир-
розе печени активация системы синтеза NO происходит под действием бак-
териальных эндотоксинов, которые при септических состояниях образуются
непосредственно в кровотоке, а у больных циррозом печени попадают туда
вследствие значительного увеличения проницаемости кишечной стенки,
приводящего по существу к утрате ею барьерной функции. Установлено,
что проницаемость кишечной стенки при циррозе печени с аспитом более
чем в 1,5 раза превосходит таковую при компенсированном циррозе печени
без асцита и у здоровых лиц. При этом мочевая экскреция нитрит-иона —
маркера активности синтеза NO — у больных циррозом печени с асцитом
оказывается достоверно выше, чем при циррозе печени без асцита.
Таким образом, увеличивающаяся по мере декомпенсации цирроза пе-
чени проницаемость кишечной стенки приводит к нарастающей эндо-
токсемии и обусловливает активацию эндотелиальной и индуцируемой
изоформ NO-синтазы А связанная с этим гиперпродукция NO играет ре-
шающую роль в развитии спланхнической вазодилатации и артериальной
гипотензии, а также последующих реактивных расстройств внутрипочеч-
ной гемодинамики, определяющих формирование гепаторенального син-
дрома.
Значение избытка оксида азота в патогенезе гепаторенального синдрома
подтверждается результатами клинических и экспериментальных исследо-
ваний, в которых фармакологическая блокада эндотелиальной и индуци-
руемой изоформ NO-синтазы приводила к улучшению функции почек у
животных с циррозом печени. Установлено, что у пациентов с циррозом пе-
чени и асцитом, в том числе асцит-перитонитом, наблюдается корреляции
.между концентрациями метаболитов NO в сыворотке крови и асцитической
жидкости. Оказалось, что пи мере увеличения концентрации метаболитов
NO в асцитической жидкости у больных достоверно возрастает риск ухуд-
шения функции почек, обусловленного гепаторенальным синдромом. В экс-
196
Нефрология. Неотложные состоянмв
периментальных исследованиях специфические ингибиторы эндотелиаль-
ной и индуцируемой изоформ NO-синтазы позволяли улучшить функцию
почек у экспериментальных животных с циррозом печени, индуцирован-
ным четыреххлористым углеродом (СС14). Наибольшим положительным
влиянием на почечную функцию почек обладал ингибитор индуцируемой
NO-синтазы.
Последствием гиперпродукции NO. i енерализованной вазодилатации
снижения периферического сосудистого сопротивления и артериальной ги-
потензии является локалыю-иочечная активация вазоконстрикторов, в пер-
вую очередь рснин-ангиотензин-альдостериновой системы, а также семей-
ства эндотилинов. Индуцируемый этими медиаторами стойкий снаэч
приносящей и выносящей артериол определяет снижение скорости клубоч-
ковой фильтрации и нарастающую гииеркреатининемию. Кроме того, пер-
систирующие снижение общего периферическою сопротивления и артери-
альная гипотензия обусловливают дальнейшее увеличение активности
симпатической нервной системы.
Хорошо известно, что гипертонус симпатической нервной системы на-
блюдается у больных циррозом печени и при отсутствии гепаторенального
синдрома. Впервые D.R. Kostreva et all. (1980) наблюдали в эксперименте
повышение тонуса почечных симпатических нервов после увеличения вну-
три печеночного давления, обусловленного перевязкой нижней полой вены.
Позжс наличие этого рефлекса, получившего название гепаторенального,
было обнаружено и у человека: так, повышение внутрипеченочного давле-
ния обусловливает стойкий гипертонус почечных симпатических нервов с
последующим спазмом почечного сосудистого ложа и снижением скорости
клубочковой фильтрации. По мере развития гепаторенального синдрома
нарастающая артериальная гипотензия, связанная со спланхнической вазо-
дилатацией, определяет дальнейшую гиперактивацию симпатической нерв-
ной системы, усугубляющую характерные расстройства внутрипочечном
гемодинамики.
Внутрипочечные гемодинамические нарушения нарастают и в связи с
формированием так называемой цирротической кардиомиопатии, ранняя
стадия которой характеризуется увеличением частоты сердечных сокраще-
ний и развивается также преимущественно в связи с персистирующей гипе-
рактивацией симпатической нервной системы. В дальнейшем происходит
нарушение диастолической, а позже и систолической функций миокарда,
угнетающее действие на сократительную способность которого оказывают
различные медиаторы воспаления (например, ФНО-а), накапливающиеся
в плазме крови но мере декомпенсации цирроза печени. Наряду с этим в
условиях стойкой периферической вазодилатации и артериальной гипер-
тензии закономерно уменьшается венозный возврат к сердцу, что приводит
Гепаторенальный синдром
197
к снижению сердечного выброса. Развитие поражения сердца у больных
циррозом печени отражает повышение плазменной концентрации харак-
терных диагностических маркеров хронической сердечной недостаточно-
сти, например предсердного натрийуретического пептида.
Таблица 12.3
Патогенез гепаторенального синдрома
амнья патолвн«м Предрасполагающие и провоцирующие факторы Пат<нем*тмч«€«ий фактор • Асцит, сопровождающийся транслокацией альбумина и электролитов в асцитическую жидкость, • гипальбуминемия, обусловленная печеночно-клеточной не- достаточностью; • усугубление гипальбуминемии после чрезмерного парацен- теза; • артериальная гипотензия и гипонатриемия, нарастающие после неадекватного парацентеза; • желудочно-кишечное кровотечение (в т.ч из варикозно рас- ширенных вен пищевода) с кровопотерей и нарастанием водно-электролитных расстройств; • передозировка петлевых диуретиков с лотерей жидкости и натрия; • повышение плазменной концентрации медиаторов воспал“ ния (ФНО-а, интерлейкина-6); • неконтролируемое увеличение проницаемости кишечной стенки для эндотоксина; • нарастающая эндотоксемия, • гиперактивация симпатической нервной системы, обуслов- ленная повышением внутрипеченочного давления
Изменение системной ге- модинамики и регулирую- щих ее систем • Индукция дисфункции эндотелиоцитов медиаторами еоспа ления (ФНО-а, интерлейкином-6) и бактериальными эндо- токсинами; • увеличение экспрессии индуцируемой изоформы NO синтазы под действием медиаторов воспаления и бактери- альных эндотоксинов; • выраженное увеличение ин енсивности синтеза NO; • периферическая, в т.ч. висцеральная (спланхническая) вазо- дилатация; • артериальная гипотензия
Изменение внутрипочеч- ной гемодинамики и регу- лирующих ее систем • Снижение перфузии почечной ткани вследствие спланхни ческой вазодилатации и системной артериальной гипотен- зии; ♦ активация внутрипочечной ренин-ангиотензи! альдостероновой системы; • активация си темы эндотелинов (эндотелина-1); • активация почечных симпатических нервов, • пеосистиоуюшии а азы приносящей и выносящей астепиол почечного клубочка, • снижение скорости клубочковой Фильтрации и гиперкреа- тининемия
198
Нефрология, неотложные соггои—
Продолжение табл '1 •
Чмнья патогене»
_ .____12
Изменение водно-натрие-
вого гомеостаза и систем,
его регулирующих
Нарушение функции
сердца
Петогематмческиб фактор
• Повышенная секреция вазопрессина;
• увеличение экспрессии аквапорина-2 эпителиоцитами а
бирательных трубочек;
• снижение клиренса осмотически свободной воды,
• гемодилюция и снижение осмоляльности крови;
• гипонатриемия разведения, сопровождаемая усугублением
артериальной гипотензии и дальнейшей активацией
локально-почечной ренин -ангиотензин-альдостероновой
системы
• Стойкое увеличение частоты сердечных сокращений
• диастолическая дисфункция левого желудочка,
• уменьшение венозного возврата к сердцу;
• угнетение сократимости миокарда медиаторами воспаление
(ФИО-);
• снижение сердечного выброса,
• увеличение продукции натрийуретических пептидов
В связи со стойкой гиперактивацией симпатической нервной системы
при циррозе печени, особенно с тенденцией к декомпенсации, возрастает и
секреция антидиуретического гормона вазопрессина. Взаимодействуя с V2-
рецепторами, вазопрессин стимулирует эпителиоциты собирательных тру-
бочек молекулярного водного каналакувеличениюэкспрессии аквапорина-2.
ответственного за захват молекул осмотически свободной воды. Рост экс-
прессии аквапорина-2 и связанное с ним снижение клиренса осмотически
свободной воды, выражаемые в том числе увеличением экскреции аква-
порина-2 с мочой, приводят к гемодилюции, снижению осмоляльности кро-
ви и развитию прогностически опасного феномена гипонатриемии разведе-
ния, типичного для гепаторенального синдрома, Установлено, что рост
мочевой экскреции аквапорина-2 и снижение клиренса осмотически сво-
бодной воды нарастают по мере увеличения тяжести цирроза печени, таким
образом внося вклад в патогенез гепаторенального синдрома. Гипонатрие-
мия при циррозе печени может также усугубляться переходом значитель-
ной части плазменного пула натрия в асцитическую жидкость. Снижение
плазменной концентрации натрия, с одной стороны, приводит к нарастанию
системной артериальной гипотензии, с другой — обусловливает дальней-
шую активацию локально-почечной ренин-ангиотензин-альдостероновои
системы и усугубление лежащего в основе развития гепаторенальною син-
дрома нарушения внутрипочечной гемодинамики.
Таким образом, принципиально важной особенностью патогенеза гепа-
торенального синдрома является несоответствие между системным сосуди-
стым тонусом и состоянием внутрипочечной гемодинамики, приводящее к
Гепаторенальный синдром
199
нарастающему ухудшению фильтрационной функции почек (табл. 12.3).
Это несоответствие усугубляется по мере увеличения дисбаланса между гу-
моральными системами, регулирующими процессы вазоконстрикции и ва-
зодилатации, нарушения сократимости миокарда левого желудочка, а также
расстройства водно-электролитного гомеостаза.
МОРФОЛОГИЯ
Специфические морфологические признаки поражения почек при гепа-
торенальном синдроме не описаны. Почки могут быть отечны, ткань их
бледная, цианотичная. Приносящие и выносящие артериолы клубочков
спазмированы. Почечные клубочки спавшиеся, отдельные гломерулярные
петли коллабированы. Возможны очаги лизиса мезангиоцитов Клетки юк-
стагломерулярного аппарата гипертрофированы, содержат значительное
количество секреторных гранул ренина. По мере увеличения продолжи-
тельности существования гепаторенального синдрома происходит атрофи-
ческое изменение почечных канальцев.
КЛИНИЧЕСКАЯ КАРТИНА
Изменение лабораторных показателей, типичное для гепаторенального
синдрома и нередко прогностически неблагоприятное, опережает появле-
ние его клинических признаков. Характерные жалобы выделить не удается.
При гепаторенальном синдроме II типа почти всегда отмечают напряжен-
ный, нередко — резистентный к диуретикам асцит. Возможны клинические
признаки артериальной гипотензии (головокружение, в том числе при пере-
ходе в ортостаз, слабость). Гепаторенальный синдром може1 быть сопряжен
с резким нарастанием признаков печеночной энцефалопатии У больных ге-
паторенальным синдромом может развиваться желтуха, в том числе выра-
женная, нередко отражающая декомпенсацию печеночного процесса, хотя
корреляции между выраженностью гипербилирубинемии и степенью ухуд-
шения фильтрационной функции почек пока выявить не удалось.
ДИАГНОСТИКА
Диагностика гепаторенального синдрома основана на выделении не-
скольких четких критериев (табл. 12.4), впервые предложенных R. Hecker и
S. Sherlock (1956). У больных предполагаемым гепаторенальным синдро-
мом целесообразно осуществлять мониторинг гемодинамических пока-
200
Нефрология. Неотложные состоямм
зателей (АД, частоты сердечных сокращений), а также параметров, характе-
ризующих функцию почек, печени и состояние водно-электролитного
гомеостаза:
• протромбинового индекса;
• альбуминемии;
• сывороточной активности холинэстеразы;
• сывороточной активности ACT АЛТ, щелочной фосфатазы и у-ГТ:
• креатин мнении;
• скорости клубочковой фильтрации (возможно использование формул
Cockroft-Gault и/или MDRD);
• калиемии;
• натриемии.
Необходимо также определение показателей периферической крови с
оценкой уровня тромбоцитов. Формирующаяся анемия — вероятное указа-
ние на развитие желудочно-кишечного кровотечения, источником которого
могут быть варикозно расширенные вены пищевода. В подобной ситуация
необходима экстренная эзофагогастродуоденоскопия.
Сохраняет свою актуальность выделение ранних доклинических марке-
ров гепаторенального синдрома, в том числе — указывающих на высокий
риск его развития. По-видимому, среди подобных признаков особое значе-
ние имеют гипонатриемия и увеличение активности ренина плазмы (если
этот показатель определяли). Исследование активности ренина плазмы мо-
жет иметь значение для раннего выявления гепаторенального синдрома
лишь в том случае, если этот показатель оценивали в динамике, поскольку
результаты однократного определения могут быть малоинформативными в
связи с тем. что большинству пациентов с циррозом печени и асцитом свой-
ствен вторичный (гиперренинемический) гиперальдостеронизм. В связи с
этим впервые выявленное повышение активности ренина плазмы может
быть расценено и как .маркер локально-почечной активации ренин-
ангиотензин-альдостероновой системы, характерной для формирующегося
гепаторенального синдрома, и как признак вторичного гипсральдостеро-
низма.
На роль доклинического маркера развивающегося гепаторенального
синдрома претендует увеличение резистивных индексов, оцениваемых при
ультразвуковой допплерографии почек, позволяющей оценить внутрипо-
чечный кровоток. Установлено, что внутрипочечные резистивные индексы
достоверно повышаются у больных циррозом печени с асцитом; при этом
почти у 50% из них удается выявить признаки гепаторенального синдрома.
Таким образом, обнаружение допплерографических признаков повышения
сосудистого сопротивления в почках, свидетельствующего о преобладании
Гепаторенальный синдром
201
вазоспазма, может указывать на формирующийся гепаторенальный син-
дром, особенно если они выявлены у пациентов с соответствующими кли-
ническими характеристиками (декомпенсированным циррозом печени, ас-
цитом, артериальной гипотензией, гипонатриемией).
Таблица 12.4
Диагностические критерии гепаторенального синдрома
(по R- Hecker и S. Sherlock (1956))
Дмасноспемскм* крмт«риА
Групп*
Болыиие (для постановки диа
гноза необходимо наличие
всех больших критериев)
Малые (не обязательны для
диагноза, но могут рассматри-
ваться как дополнительные ар
гументы в пользу гепаторе-
нального синдрома)
• Печеночно-клеточная недостаточность, сопровождае-
мая портальной гипертензией;
• снижение скорости клубочковой Фильтрации (креати-
нинемия >1,5 мг/дл или клиренс эндогенного креати
нина < 40 мл/мин);
• отсутствие шока, значительных потерь жидкости, ин-
фекции или применения нефротоксичных лекарствен-
ных препаратов;
• отсутствие улучшения почечной функции после отмены
петлевых диуретиков и инфузии 1.5 л изотонического
раствора.
• протеинурия < 500 мг/сутки при отсутствии ультразву
ковых признаков обструкции мочевыеодящих путей и
хронических заболеваний почек
• Диурез < 500 мл/сутки;
• натриурия <10 мЭкв/л;
осмоляльность мочи, превышающая осмоляльность
плазмы крови;
• менее 50 эритроцитов в попе зрения в моче;
• натриемия < 130 мЭке/л
Дифференциальный диагноз гепаторенального синдрома проводят с
острым тубулярным некрозом, у больных циррозом печени, чаще всего име-
ющим лекарственный генез, а также с преренальной (гемодинамической)
острой почечной недостаточностью (табл. 12.5). Следует иметь в виду, что
при циррозе печени могут сочетаться несколько патогенетических вариан-
тов острой почечной недостаточности. Так, спланхническая вазодилатация
и артериальная гипотензия, обусловливающие развитие гепаторенального
синдрома, мигут определять формирование нарастающей гипоперфузии по-
чечной ткани (так называемая преренальная (гемодинамическая) острая
почечная недостаточность). А назначение многих лекарственных препара-
тов. особенно потенциально нефротоксичных (нестероидных противовос-
палительных препаратов, аминогликозидов), именно в этой ситуации со-
пряжено с максимальным риском возникновения острого канальцевого
некроза.
202
Нефрология. Неотложные составам
Дифференциальный диагноз острой почечной
недостаточности при циррозе печени
Таблиц^ '25
Диагностический критерий Преренальная (гемодинамическая) острая почечная недостаточность Гепаторенальный синдром Острый канальце* вый некроз
Боли в пояснице Возможны при ин- фаркте почки вслед- ствие тромбоэмбо- лии ветвей почечной артерии Не характерны Возможны
Темп ухудшения функции почек Вариабелен; может быть очень быстрым Почечная недоста точность нарастает в течение не более 14 суток Как правило, бы стрый
Концентрация на- трия в моче (мЭкв/л) < 10 < 10 >30
Соотношение «креа тинин в моче / креа- тинин в плазме кро- ви» > 30 1 >30:1 < 20:1
Осмоляльность мочи > осмоляльности плазмы > осмоляльности плазмы Близка к осмоляль- ности плазмы
Мочевой осадок Не изменен; при ин- фаркте почки воз- можна гематурия Не изменен Цилиндры, погиб- шие клетки; воз- можна гематурия
ЛЕЧЕНИЕ
Больные гепаторенальным синдромом нуждаются в госпитализации
(гепаторенальным синдромом I типа — в отделение реанимации и интен-
сивной терапии). Необходима отмена петлевых диуретиков. У пациентов с
гепаторенальным синдромом II типа при наличии напряженного асцит»
осторожно начинаю! лапароцентез; если объем изъятой жидкости превы-
шает 5 л, предпочтительна коррекция объема циркулирующей крови введе-
нием альбумина, но не кристаллоидных и коллоидных растворов.
Все больные гепаторенальным синдромом нуждаются в бессолевой дие-
те, при наличии тенденции к гипонатриемии необходимо ограничение пи-
тьевого режима. Не следует пытаться корректировать гипонатриемию раз-
ведения с помощью инфузии гипертонических солевых растворов и/и_т
Гепаторенальный синдром
203
увеличения содержания поваренной соли в пище, поскольку это приведет
только к дополнительной задержке жидкости.
При разработке стратегии лечения гепаторенального синдрома опреде-
ленные надежды связывали с применением вазодилататоров, эффективно
расширяющих внутрипочечные сосуды, таких, как фенолдопам, простаглан-
дины и их аналоги, допамин. Одиако в контролируемых исследованиях
применение допамина, принимаемого per os аналога простагландина Е1
мизопростола и внутривенных инфузий простагландина, позволяло лишь
кратковременно улучшить внутрипочечный кровоток, но не сопровожда-
лось положительной динамикой скорости клубочковой фильтрации и креа-
тининемии. В связи с этим вазодилататоры, снижающие тонус внутрипо-
чечных сосудов, в настоящее время не рассматривают в ряду препаратов,
применяемых для лечения гепаторенального синдрома.
Для улучшения внутрипочечной гемодинамики путем устранения
с план хни ческой вазодилатации и связанной с ней артериальной гипотен-
зии при гепаторенальном синдроме могут быть применены препараты с
вазоконстрикторным действием, в том числе вазопрессин и его синтетиче-
ские аналоги. Эти препараты повышают тонус сосудистой стенки за счет
стимуляции VI-рецепторов к вазопрессину и, таким образом, не усилива-
ют типичных для цирроза печени негативных последствий активации
У2-вазопрессиновых рецепторов (снижения клиренса осмотически сво-
бодной воды). Вазопрессин и его синтетические аналоги (терлипрессин,
оринпрессин) — агонисты преимущественно V1-вазопрессиновых рецеп
торов — продемонстрировали свою эффективность и относительную безо-
пасность в нескольких контролируемых исследованиях (табл. 12.6). Анализ
базы данных исследований Cochrane (6 рандомизированных контролируе-
мых исследований, в которых использовали терлипрессин) показал, что
применение терлипрессина при гепаторенальном синдроме I и II типов со-
провождается снижением смертности (в среднем на 34%), повышением
клиренса креатинина (в среднем на 21 мл/мин), уменьшением креатинине-
мии (в среднем на 219 мкмоль/л) и увеличением диуреза (в среднем на
707 мл/сутки). Основные нежелательные явления, наблюдавшиеся при на-
значении терлипрессина, включали головную боль, боль в животе, наруше-
ние сердечного ритма и подъем АД. Следует также иметь в виду, что при
применении препаратов с вазоконстрикторным действием, в том числе при
инфузии вазопрессина и его аналогов, возможно развитие ишемических
осложнений — некрозов дистальных фаланг пальцев рук, острых наруше-
ний мозгового кровообращения, спазма коронарных артерий с формиро-
ванием острого коронарного синдрома. Эти препараты следует с особой
осторожностью использовать у пациентов, страдающих артериальной ги-
пертензией и другими сердечно-сосудистыми заболеваниями.
204
Нефрология. Неотложные cocroew
Таблица 2 i
Контролируемые исследования и мета-анализы,
в которых оценивали эффективность вазопрессина
и его синтетических аналогов при гепаторенальном синдроме
Литературный источи к Количество больных Схьмл исследоынме ! Результаты
Moreau R. et al., 1 2002 99 (ГРС* 1 типа) мультицентровое ретро- спективное; применяли терлипрессик (75% паци- ентов получали также ин- фузии альбумина); исхо- дная креатининемия со- ставляла 272+114 мкмоль/л Улучшение функции по чек (снижение креатив немии к концу лечения ас значений менее 130 мкмоль/л, или на 20%). отмечено у 58% циентов, 3% больных б течение первого месяца потребовалась замести- тельная почечная тера'ия. у 33,3% больных отмене- ны связанные с приемом терлипрессина нежела- тельные явления
Halimi C. et al., 2002 18 (у 16- ГРС 1 типа; у 2 - ГРС II типа) Мультицентровое пилот- ное ретроспективное; терлипрессин применяли в течение 2—16 дней, исходная креатининемия составляла 298±124 мкмоль/л Креатининемия к концу наблюдения снизилась в среднем до уровня 145±25 мкмоль/л, у 13 из 18 больных функ ция почек улучшилась, v 8 - к 5-му дню лечения функция почек нормали- зовалась. У 3 пациентов отмечены нежелательные ишемические явления; еще 1 погиб от обструк- ции бронхов
Solanski P. etal., 2003 24 (ГРС 1 типа) Рандомизированное, ллацебо-контролируемое исследование, все боль- ные получали альбумин; терлипрессин применяли в течение 4—15 дней; ис- ходная креатининемия составляла 2.9+0,1 мг/дл _______ К 15-му дню печения в группе пациентов, полу- чавших терлипрессин, креатининемия составила 1.2±0.2 мг/дл; в группе плацебо к 8-му дню она составила 3.9±0,2 мг/дл. 5 из 12 па циентов. получавших тер липрессин, выжили; в группе плацебо к 15-му дню все погибли
Fabrizi F. et al, 2006 154 пациента с ГРС _— —-1 Мета-анализ 10 клиниче- ских исследовании (в г.ч двух контролируемых); Больные получали терли прессин У 52% пациентов терли- прессин привел к регрес су ГРС, 55% - ответили на препарат; у 29% разви- лись нежелательные яв- ления. Риск смерти у не ответивши* на терлипрес- син в 5,7 раза выше, чем у ответивших
Гепаторенальный синдром
205
Продолжение табл. 12.6
Литератур ый i Количество
источник больных
Martnn-LlahH | 47 больных
I M et all., 2008 ГРС
Схема исследования
Рандомизированное кон-
тролируемое исследова-
ние; больные получали
терлипрессин в комбина-
ции с альбумином или
только альбумин
Чзультаты
-------------:----------!
Улучшение функции по-
чек отмечено у 43,5%
больных, получавших
терлипрессин в комбина-
ции с альбумином, и
лишь у 8,7% больных, по-
лучавших только альбу
мин (р=0,017).
У 10 пациентов, получав-
ших терлипрессин, воз
никли нежелательные яв-
ления; у 3 из них потребо-
валась отмена препарата
•ГРС - гепаторенальный синдром.
Эффективность норадреналина при гепаторенальном синдроме vcra-
новлена менег четко, хотя результаты отдельных исследовании все же под-
тверждают целесообразность применения этого препарата. Так, инфузия
норадреналина (0,5—3,0 мг/час) в сочетании с альбумином позволила до-
биться регресса гепаторенального синдрома 1 типа у 10 (83%) из 12 боль-
ных циррозом печени Креатининемии снизилась у них белее чем двукрат-
но; клиренс креатинина возрос с 13+9 до 40+15 мл/мин (р=0,003). Только
у одного пациента, у которого скорость инфузии норадреналина составля-
ла 1.5 мг/час, наблюдался обратимый эпизод ухудшения сократимости
миокарда.
Инфузия норадреналина — одна из наиболее доступных стратегий лече-
ния гепаторенального синдрома, особенно I типа, так как применение этого
препарата характеризуется сравнительно небольшим числим неже отель-
ных явлений. Для более детальной оценки безопасности и отработки опти-
мальных режимов инфузии необходимо проведение специальных контро-
лируемых исследований. В связи с риском подъема АД, спазма коронарных
артерий и развития гипогликемии инфузию норадреналина желательно
проводить в отделениях интенсивной терапии, внимательно контролируя
гемоди намические показатели.
Опыт применения октреотида при гепаторенальном синдроме, в том
числе в сочетании с инфузией альбумина, пока остается нс вполне позитив-
ным; положительного влияния этого препарата на функцию почек и выжи-
ваемость пациентов пока продемонстрировать не удалось. Тем не менее при
гепаторенальном синдроме I типа комбинация иэ октреотида, альбумина и
а-адреномиметика мидодрина позволила достичь достоверного улучшения
206
Нефрология Неотложные гостсии—
функции почек и продолжительности жизни пациентов, при этом моноте-
рапия мидодрином, как и октреотидом, оказалась неэффективной.
Таким образом, назначение препаратов, обладающих системным вазо-
констрикторным действием, несмотря на риск возникновения определен-
ных нежелательных явлений, в том числе сердечно-сосудистых осложне-
ний, позволяет добиться улучшения функции почек и увеличения
продолжительности жизни больных гепаторенальным синдромом. Наибо-
лее обоснованным можно считать назначение вазопрессина и его синтети-
ческих аналогов, если они доступны, а также норадреналина (инфузию этих
препаратов следует сочетать с введением альбумина) и, по-видимому, ком-
бинации из октреотида, мидодрина и альбумина
Среди инвазивных методов лечения гепаторенального синдрома опре-
деленное место отводят грансъюгулярным внутрипеченочным портоси-
стемным шуитам (transjugular intrahepatic portosystemic shunt — TIPS),
которые уменьшают выраженность портальной 1ииертензии и, по-
видимому, одновременно тормозят реализацию гепаторенальною рефлек-
са, обусловливающего гипертонус почечных симпатических нервов и стой-
кий спазм почечных сосудов. В небольших по числу включенных пациентов
клинических исследованиях удалось продемонстрировать, что спустя один
месяц после имплантации TIPS у больных гепаторенальным синдромом
достоверно снижается креатпнипемия, увеличиваются скорость клубочко-
вой фильтрации и диурез; кроме того, у них удалось констатировать умень-
шение концентрации медиаторов вазоконстрикции в плазме крови. При
гепаторенальном синдроме TIPS позволяет также отказаться от проведе-
ния гемодиализа у части больных, исходно в нем нуждавшихся. Однако
имплантация TIPS может приводить к улучшению функции почек лишь
спустя определенный период времени (2—4 недели), и, кроме того, эта про-
цедура у пациентов с терминальным циррозом печени может осложняться
существенным нарастанием печеночной энцефалопатии Именно иоэтом\
имплантацию TIPS рассматривают как метод лечения гепаторенального
синдрома лишь у тех пациентов, у которых невозможно выполнение транс-
плантации печени.
С учетом небольшого, ни весьма убедительного клинического опыта
значительные перспективы в лечении гепаторенального синдрома в бли-
жайшее время связаны с сочетанным применением комбинации вазокон-
стрикторов (в частности, терлипрессина или октреотида и мидодрина) с
альбумином и установки TIPS.
У пациентов с гепаторенальным синдромом предпринимали попытки
импланшции перитонеовенозного шунта, предложенной II.Н. LeVeen el al
(1974) для лечения рефрактерного асцита. Имплантация перитонеокеноз-
ного шунта, как было показано, позволяет добиться улучшения почечной
Гепаторенальный синдром
207
функции, но не оказывает положительного влияния на продолжительность
жизни и выживаемость больных.
Пациентам с выраженным ухудшением функции почек начинают про-
водить заместительную почечную терапию, как правило, гемофильтрацию.
Гемодиализ оправдан только у пациентов, находящихся в шсте ожидания
трансплантации печени. Гемодиализ, по-видимому, позволяет увеличить
продолжительность жизни больных гепаторенальным синдромом, но его
эффективность с прогностической точки зрения существенно уменьшается
по мере нарастания печеночно-клеточной недостаточности или возникно-
вении потребности в искусственной вентиляции легких.
Можно рассчитывать также иа улучшение функции почек и увеличение
продолжительности жизни пациентов с гепаторенальным синдромом с помо-
щью молекулярной абсорбирующей рециркулирующей системы (MARS) —
альбумин-опосредованного диализа, уменьшающего сывороточную концен-
трацию медиаторов воспаления (ФНО-а. интерлейкина-6). Введению
MARS в схемы лечения больных гепаторенальным синдромом должны
предшествовать контролируемые клинические исследования, посвященные
в том числе сравнению эффективности и безопасности MARS с эффектив-
ностью и безопасностью гемофильтрации и гемодиализа.
Трансплантация печени — радикальный метод лечения гепаторенально-
го синдрома. Следует вместе с тем иметь в виду, что по мере исходного ухуд-
шения функции почек выживаемость пациентов, перенесших транспланта-
цию печени, уменьшается; у больных гепаторенальным синдромом I типа
она минимальна.
ПРОГНОЗ
При гепаторенальном синдроме I типа прогноз крайне неблагоприятен:
средняя продолжительность жизии таких больных не превышает 14 дней, и
лишь не более 10% пациентов переживают период госпитализации. Гепато-
ренальный синдром II типа также характеризуется неблагоприятным про-
гнозом, но продолжительность жизни этих пациентов несколько больше
(около 6 месяцев).
ПЕРСПЕКТИВЫ
Консервативное лечение больных гепаторенальным синдромом может
стать более эффективным, если с помощью с юциальных контролируемых
исследований удастся оптимизировать режим использования препаратов с
вазоконстрикторным действием (вазопрессина и его синтетических анало-
208
Нефрология. Неотложные состояние
гов, норадреналина, октреотида, мидодрина) и инфузии альбумина Для
устранения спланхн и ческой вазодилатации перспективным представляется
уменьшение интенсивности синтеза NO, в том числе с помощью селектив-
ных ингибиторов индуцируемой NO-синтазы. Необходимо также совер-
шенствование диализных методов лечения гепаторенального синдрома, в
том числе оценка эффективности и безопасности MARS. Весьма актуально
также выявление новых доклинических маркеров риска гепаторенального
синдрома, в том числе с помощью специальных лабораторных и инструмен
тальных методов обследования.
Неотложные мероприятия
• Осуществлять мониторинг креатининемии, скорости клубочковой
фильтрации (расчет пи формулам Cockroft-Gauk, MDRD), калиемии.
патриемии, альбуминемии, сывороточной активности ACT, АЛТ, хо-
линэстеразы, протромбиновою индекса, гемодинамических показате-
лей (АД, частоты сердечных сокращений).
• Отменить петлевые диуретики.
• Проводить инфузию раствора альбумина.
• При гепаторенальном синдроме II типа — обсудить парацентез с за-
мещением асцитической жидкости раствором альбумина.
• Назначить октреотид в комбинации с мидодрином
• Провести инфузию вазопрессина или его синтетических аналогов,
если они доступны.
• Осуществлять мониторинг выраженности печеночной энцефало-
патии.
Глава 13
ОСТРЫЙ
ТУБУЛО-ИНТЕРСТИЦИАЛЬНЫЙ НЕФРИТ
Острый тубуло-интерстициальный нефрит характеризуется нарастаю-
щим, иногда очень быстрым, ухудшением функции почек, обусловленным
преимущественным повреждением почечных канальцев. Острый тубуло-
интерстициальный нефрит может приводить к необратимой почечной не-
достаточности, хотя при своевременном устранении многих провоцирую-
щих факторов ее зачастую можно избежать. Возможность развития
острого тубуло-интерстициального нефрита всегда следует учитывать при
дифференциальном диапюстике острой почечной недостаточности, харак-
теризующейся преимущественно изменением лабораторных показателей
(шперкрсатининемией, гиперкалиемией) и проявляющейся олигоанурией.
ЭПИДЕМИОЛОГИЯ
С читают, что острый тубуло-интерстициальный нефрит лежит в основе
не менее чем 15% всех случаев острой почечной недостаточности. Достовер-
но распространенность его характеризует анализ баз данных биопсий почки
(табл. 13.1).
Таблица 13 1
Эпидемиология острого тубуло-интерстициального нефрита
Литературный источник Бака дачных Частота встречаемости ТИН*
Rychlik Let al.. 2004 t 3874 больных (4004 выпол- ненных биопсии почки), вклю- ченных в Чешский оегистр би- опсий почки Частота развития Тин состав- ляет 4,4%; в группе пациентов, которым биопсию почки вы- полнили при выраженном ухудшении функции лочек, — 11,6% (самое частое заболева- ние в этой группе). Расчетная заболеваемость тин составля- ет 2.4 случая на 1 млн человек
Wang Y. el al., 2005 i 1 Госпиталь Университета Пеки- на; 209 больных острой почеч- ной недостаточностью, госпи- тализированных в 1993—2004 -одах Из 78 больных, которым вы- полняли биопсию почки. 53.8% страдали острым ТИН
210
Нефрология. Неотложные состояв^
Продолжение табл. '3"
Литературный источник Covic A etal., 2006 База данных 1 H— И * * IB 635 биопсий почки из двух ре- гионов Румынии Частота встреча» мости ТИМ* ЧастотаТИН - 1,5%
Panichi V. et al.. 2007 3810 биопсий почки, выпол- ненных в нефрологическом центре Пизы с 1977 по 2005 год Частота ТИН - 4,2%
Lopez-Gomez J.M. et al., 2008 2281 биопсия почки, выпол- ненные в Испании по поводу острой почечной недостаточ- ности с 1994 по 2006 год Частота ТИН - 23.3%
• Тубуло-интерстициальный нефрит
Можно утверждать, что распространенность острого тубулоинтерсти-
циального нефрита особенно велика в следующих группах пациентов
• у принимающих лекарственные препараты некоторых классов (несте-
роидные противовоспалительные средства, ненаркотические анальге-
тики, антибактериальные и противовирусные препараты, некоторые
цитостатики и моноклональные антитела),
• у ci радаклцих некоторыми системными заболеваниями (саркоидозом,
болезнью Шегрена, системной красной волчанкой);
• при злокачественных опухолях;
• у пожилых людей.
Кроме того, острый тубуло-интерстициальный нефрит может наблкь
дагься при некоторых инфекционных заболеваниях (лептоспирозе), в том
числе во время их. шидемических вспышек. Значительный «вклад* острого
тубуло-интерстициального нефрита в структуру причин острой почечное
недостаточности является основанием для обсуждения этого диагноза во
всех случаях, когда этиология ухудшения функции почек не очевидна и. га
причина его может оказывать непосредственное повреждающее действие на
структуры почечного тубуло-интерстиция.
ЭТИОЛОГИЯ
В отличие от этиологии других заболеваний почек этиология острого
тубули-интерстициального нефрита часто бывает очевидной (табл. 13.2) и
своевременное устранение причины оказывается решающим в достижении
регресса или, по крайней мере, стабилизации поражения почек. Среди при-
чин острого тубуло-интерстициального нефрита лидирующими по частоте
Острый тубуло-интерстициальмыи нефрит
211
нередко оказываются лекарственные препараты. При анализе 1068 биопсий
почки, выполненных с 1968 по 1997 год, острыи тубуло-интерстициаль-
ный нефрит был обнаружен у 6,5% больных. При этом 10% случаев острого
тубуло-интерстициального нефрита имели инфекционное происхождение,
в 4 — причину установить не удалось, а 85% случаев были обусловлены при-
емом лекарственных препаратов (чаще всего — ненаркотических анальгети-
ков и нестероидных противовоспалительных препаратов, а также антибио-
тиков и диуретиков)
Таблица 13.2
Этиология острого тубуло-интерстициального нефрита
Группа этиологи ч*ск их факторов Этиологический фактор
Лекарственные препараты* • Антибактериальные препараты. • ненаркотические анальгетики, • нестероидные противовоспалительные препаоаты, • диуретики, противосудорожные: • блокаторы протонной помпы; • цитостатики; • противовирусные антикоагулянты: • моноклональные антитела; • наркотики; • средства традиционной медицины
Инфекционные, грибковые и паразитарные агенты • Лептоспира, • иерсинии; • рикеттсии; • ВИЧ; • аденовирус; • папилломавирус, • HBV и HCV; • гистоплазма; • Strongyloidesstercoraiis
Системные заболевания • Системная красная волчанка; • саркоидоз: • болезнь Шегрена
Злокачественные опухоли • Солидные опухоли; • лейкозы; • неходжкинские лимфомы
* См. также табл 13.3.
Теоретически любое лекарство уже при первом его приеме может спро-
воцировать развитие острого тубуло-интерстициалыюю нефрита, в пато-
генезе которого решающее значение имеет индивидуальная реакция ги-
перчувствительности Тем не менее многие лекарственные препараты,
например нестероидные противовоспалительные средства, обладают ено-
212
Нефрология. Неотложные состояв
собнистью провоцировать развитие острого тубуло-интерстициального не-
фрита за счет особенностей механизма своего действия. Кроме того, некото-
рые лекарственные препараты вызывают острое повреждение структур
тубуло-интерстиция чаще, чем другие, хотя патогенез его далеко не всегэ
ясен.
Таблица
Лекарственные препараты, провоцирующие развитие острого
тубуло-интерстициального нефрита
Г 1 Группа лесарстммных „ . препаратов Препарат, провоцирующим развитие острого тин
Антибиотики Чувствительные к -лактамазе производные пенициллина • амоксициллин; • ампициллин; • метициллин; • оксациллин; • пенициллинб Цефалоспорины: • цефаклор • цефотаксим; • цефалексин Фторхи нолоны: • ципрофлоксацин. • норфлоксацин. Макролиды: • эритромицин. Другие антибиотики и противотуберкулезные г репарать • тетрациклин; • гентамицин: • линкомицин; • ванкомицин. • изониазид
Противовирусные препараты • Ацикловир. • компоненты HAART-*: • атазанаэир; • тенофовир
Ненаркотические анальгетики и нестероидные противовос- палительные препараты • Аминопирин; • ацетипсалициловая кислота; • ацетаминофен, • сульфинпираэон; • метам изол; • диклофенак, • ибупрофен. • индометацин, • фенилбутазон • пироксикам; • миелоксикам
Производные 5-аминоса- лиииловой кислоты • Сульфасалазин; • месалазин
Острый тубуло-интерстициальный нефрит
213
Продолжение табл. 13.3
Группа лекарственных поепархтоа 1 I F*—1 Препарат, провоцирующий развитие острого ТИН*
Диуретики • Хлорталидон; гидрохлортиазид; • триамтерен; • фуросемид
Психотропные препараты • Карбамазепин • диазепам; - фенобарбитал; • фенитоин; • соли вальпроевой кислоты; • кокаин
Другие Ингибиторы протонной помпы: • омепразол; • рабепразол Антикоагулянты. • варфарин. Противоаритмические препараты • аймалин. Цитостатики • азатиоприн. Биологические препараты: • интелейкин-2; • интерферон-; • этанерсепт; • сунитиниб Средства традиционной медицины: • китайские травы, содержащие аристолохиевую кислоту
•ТИН - тубуло-интерстициальный нефрит;
••HAART (Highly Active Antiretroviral Therapy) - высоко активная антиретровирусная терапия
Формирование острого тубуло-интерстициалыюго нефрита могут про-
воцировать пенициллины, в том числе устойчивые к Р-лактамазе, цефало-
спорины, сульфаниламиды, фторхииолоны, тетрациклин и его произво-
дные, а также ванкомицин и противотуберкулезные агенты (рифампицин).
При применении фторхинолонов (наибольшее число описаний относятся к
ципрофлоксацину) ухудшение функции почек может быть связано как с
острым тубуло-интерстициальным нефритом, так и с дополняющей его об-
струкцией почечных канальцев содержащими антибактериальный препарат
кристаллами, чаще преципитирующими при щелочной реакции мочи
(pH > 6,8).
Острый тубуло-интерстиинальный нефрит является редким и трудно
предсказуемым нежелательным явлением, возникающим при применении
блокаторов протонной помпы. Систематизированный обзор электронных
214
Нефрология. Неотложные comow
баз данных (Medline, ЕМ BASE, GOOGLE, LILACS, Cochrane) выявил 6*
подобных случая, произошедших в течение 36 лет.
Острый тубуло-интерстициальный нефрит может быть спровоцировав
психотропными препаратами, например натрия вальпроатом, при продол-
жении приема которого ухудшение функции почек может прогрессировать
вплоть до терминальной почечной недостаточности, а также кломипрамина
индуцирующего канальцевое поражение, как правило, обратимое при сво-
евременной отмене препарата. Неоднократно описано развитие остроге
тубуло-интерстициального нефрита после ингаляции кокаина, в том числе
однократной
Острый тубули-ннтерстициальный нефрит с почечной недостаточно-
стью у большинства больных регрессирующей после отмены препарата
наблюдают при длительном приеме производных 5-аминосалициловоЙ кис-
лоты (сульфасалазина, месалазина) в больших дозах. Чаще всего ато неже-
лательное явление развивается у пациентов, страдающих болезнью Кронь
или язвенным колитом. Возможно сочетание сульфасалазин-индуциро-
ванного тубуло-интерстициального нефрита с другими органными пораже-
ниями, например лейкопенией, анемией или фиброзирующим альвеолитом
[24]. Показано, что риск острого тубуло-интерстициального нефрита повы-
шается почти в 4,2 раза у пациентов, принимающих препараты 5-амино-
салициловои кислоты, у тех же, кто использовал их ранее (последний при-
ем более 12 месяцев назад), риск поражения также остается повышенным
(более чем в 1,8 раза).
С точки зрения вероятности развития поражения почечного тубуло-
интерстиция сульфасалазин и месалазин одинаково опасны. По данным
R.A.J. Ransford и соавт. (2002), в течение 8 лет (1991—1998 годы) проанали-
зировавших 4,7 миллиона назначений сульфасалазина и 2,8 — месалазина
тубуло-интерстициатьный нефрит, обусловленный приемом названных
производных 5-аминосалициловой кислоты, уступал по распространенно-
сти только таким нежелательным лекарственным реакциям, как поражение
системы крови, в частности анемия и лейкопения (23 и 42% соответствен-
но). При этом частота случаев индуцированного сульфасалазином и меса-
лазином тубуло-интерстициального нефрита во много раз превосходит чис-
лослучаев поражения почек и других внекишечиых проявлений хронических
воспалительных заболеваний кишечника — язвенного колита и болезни
Крона, — в терапии которых эти препараты используют.
Провоцирующие развитие острого тубуло-интерстициального нефрита
лекарственные препараты могут одновременно обусловливать и поражение
других органов. Так, прием варфарнна может сопровождаться одновремен-
ным формированием острого аллергического тубуло-интерстициального не-
фрита, гиперэозииофилии и кожного лейкоцитокластического васкулита.
Острый тубуло-интерстициальный нефрит
215
Тяжелое поражение почечного тубуло-интерстиция, нередко проявляю-
щееся быстро нарастающей почечной недостаточностью и тяжелым рас-
стройством электролитного гомеостаза, может быть следствием приема не-
наркотических анальгетиков и нестероидных противовоспалительных
препаратов, особенно в больших дозах и неконтролируемого. Предраспола-
гающими факторами в этом случае служат пожилой возраст, хронические
болевые синдромы (головные боли, в том числе мигрени, синдром боли в
нижней части спины (low back pain syndrome), артралгии), депрессия.
Острый тубуло-интерстициальный нефрит, нередко приводящий к необра-
тимому ухудшению почечной функции и приобретающий особенно небла-
гоприятное течение при одновременном развитии острого папиллярного
некроза, может развиваться уже при нервом приеме нестероидных противо-
воспалительных препаратов и ненаркотических анальгетиков.
Определенный оптимизм в отношении предупреждения нежелательных
последствий полной блокады всех изоформ циклооксигеназы был связан с
применением селективных ингибиторов циклооксигеназы-2 (ЦОГ-2). Было
показано, что вероятность поражения желудочно-кишечного тракта (Н П ВП-
гастропатии) при применении ингибиторов ЦОГ-2 снижается. Если же го-
ворить о поражении почек, то эти препараты оказались почти столь же
опасными, как и неселективные ингибиторы ЦОГ. Уже первое использовав
ние ингибиторов ЦОГ-2 может сопровождаться развитием острой почечной
недостаточности, в основе которой лежит острый тубуло интерстициальный
нефрит.
Индуцировать острый тубуло-интерстициальный нефрит могут также раз-
личные противовирусные препараты, входящие в состав комплекса HAART
(highly active antiretroviral therapy — высокоактивная антиретровирусная тера-
пия), используемого у больных ВИЧ-инфекцией. Провоцируемый антиретро-
вирусными препаратами острый тубуло-интерстициальный нефрит, иногда
сочетающийся с острой канальцевой обструкцией, — одна из самых частых
причин острой почечной недостаточности у ВИЧ-инфицированных.
Возникновение острого тубуло-интерстициального нефрита, связанное
с реакцией гиперчувствительности, возможно после внутрипузырной ин-
стилляции БЦЖ, используемой для лечения рака мочевого пузыря. Число
препаратов, способных вызывать острый тубуло-интерстициальный не-
фрит, продолжает непрерывно увеличиваться. Сюда относят и антицитоки-
новые препараты (например, блокатор a-фактора некроза опухолей этанер-
септ), и ингибиторы тирозин-киназы (например, назначаемый при раке
почки сунитиниб).
Значительную опасность с точки зрения возможности развития острого
тубуло-интерстициального нефрита представляют препараты традицион-
ной медицины, при использовании которых ухудшение функции почек мо-
216
Нефрология. Неотложные cocroni —
жет стать необратимым. Так, в начале 1990-х годов в странах Европейск
Союза (Бельгии, Германии, Франции, Люксембург) было зарегистрирова-
но несколько случаев быстрого развития терминальной почечной недоста-
точности у молодых женщин, проходивших курс лечения ожирения в кли
никах, специализирующихся на использовании средств традиционнее
медицины. Все эти пациентки принимали препараты, состоявшие из опре-
деленных видов китайских трав. Морфологическое исследование ткани
почек, полученной при биопсии, выявило у них выраженный тубуло-
интерстициальный фиброз. Изменения в моче у этих пациенток былг.
минимальны, артериальная гипертония — умеренной, но функция почет
ухудшалась значительно быстрее, чем при других видах тубулоинтерсти-
циальной нефропатии.
Установлено, что токсическим действием на почечный тубуло-интег-
стиций обладает содержащаяся в некоторых китайских травах аристолохие-
вая кислота. Как показано в клинических и экспериментальных исследова-
ниях, эю вещество не только обладает профиброгенным действием, но и
способствует развитию злокачественных опухолей мочевыводящих путей
Если суммарная доза аристолохиевой кислоты достаючно велика, пораже-
ние почечного тубуло-интерстиция может продолжать прогрессировать и
тогда, когда прием китайских трав прекращен.
Развитие острого тубуло-интерстициального нефрита возможно при
различных инфекционных заболеваниях, например лептоспирозе, аденови-
русной инфекции, ВИЧ-инфекции, способной приводить к распространен-
ному некрозу эпителиоцитов почечных канальцев, а также гистоплазмозе ?
паразитарных инвазиях, таких как стронгилоидоз. Развитие острого тубуло-
интерстициального нефрита при инфекционных заболеваниях, как прави-
ло, сопровождается резким ухудшением почечной функции и сопряжено сс
значительным ухудшением общего прогноза.
Острый тубуло-интерстициальный нефрит наблюдают и при некоторых
системных заболеваниях, например болезни Шегрена. Быстрое ухудшение
функции почек у больных системной красной волчанкой также может быть
обусловлено острым тубуло-интерстициальным нефритом, иногда возни-
кающим при минимально выраженном вовлечении почечных клубочков.
Острый гранулематозный тубуло-интерстициальный нефрит развива-
ется при активном саркоидозе, как правило, характеризующемся множе-
ственными внелегочными проявлениями. Саркоидный гранулематознын
тубуло-интерстициальный нефрит — по-видимому, самая частая форма по-
ражения почек при саркоидозе — обнаруживается на аутопсии не менее чем
у 20% больных. В небольших по объему сериях биопсии почки, выполнен-
ной у пациентов, страдавших саркоидозом, частота обнаруженного пораже-
ния структур почечного тубуло-интерстиция достигала 35—50%. Саркоид-
Острый тубуло-интерстициальный нефрит
217
ный гранулематозный тубуло-интерстициальный нефрит иногда становится
первым проявлением саркоидоза. При этом функция почек может ухуд-
шаться очень быстро: уровень сывороточного креатинина иногда в течение
очень короткого периода времени может приближаться к величинам, позво-
ляющим диагностировать терминальную почечную недостаточность.
Острый тубуло-интерстициальный нефрит может быть частью паранео-
пластического синдрома, возникая при солидных опухолях, множественной
миеломе и неходжкинских лимфомах. Обусловленная тяжелым тубуло-
интерстициальным поражением острая почечная недостаточность иногда
предшествует первым специфическим проявлениям злокачественных опу-
холей, в первую очередь неходжкинских лимфом, часто локализующихся
вне лимфатических узлов н отличающихся малым размером опухолевого
очага.
В целом первый контакт с любым экзогенным фактором может сопрово-
ждаться развитием острого тубуло-интерстициального нефрита, в toiw чис-
ле протекающее ( существенным ухудшением функции почек. Так, описано
формирование острого тубуло-интерстициального нефрита и острой почеч
ной недостаточности после укуса насекомого, шершня (Vespa oriencalis).
Вместе с гем иногда причину острого тубуло-интерстициального нефрита
установить не удастся. Типичным примером идиопатическою варианта яв-
ляется так называемый ТИНУ-синдром — сочетание острого тубуло-
интерстициального нефрита с увеитом. Описаны редкие случаи развития
ТИНУ-синдрома у близнецов, хотя генетическая природа этого заболева
ния, как и других форм острого тубуло-интерстициального нефрита, пока
не расшифрована.
ПАТОГЕНЕЗ
В развитии острию тубуло-интерстициального нефрита могут прини
мать участие несколько механизмов, однако в зависимости от провоцирую-
щею фак юра один из них будет иметь ведущее значение (табл. 13.4). На-
ряду с собственно токсическим или иммуновоспалительным повреждением
структур почечною тубуло-интерстиция существенное значение в нараста-
ющем ухудшении функции ночек могут иметь расстройства внутрипочеч-
ной гемодинамики, приводящие к ишемии, а также обструкция просвета
почечных канальцев кристаллами, например, содержащими лекарственный
препарат или его метаболиты. Кроме того, при некоторых формах острого
губуао-интерстициального нефрита, в частности индуцированного ненар-
котическими анальгетиками или нестероидными противовоспалительными
препаратами, быстро развивающаяся недостаточность почечных проста-
218
Нефрология. Неотложные coctorhmi
гландинов приводит к стремительному развитию ишемии почечных пира-
мид с их последующим некрозом, а некротические массы в сочетании сс
сгустками крови могут обусловливать обструкцию мочеточников и появле-
нию олигоанурии.
Таблица 13 ~
Патогенез острого тубуло-интерстициального нефрита
Механизм нлруцмншя функции почек
Иидуцмроаанныйаариант ТИН
Синтез и фиксация антител к тубулярной ба
зальной мембране.
Инфильтрация Т-лимфоцитами.
Реализация реакций гиперчувствительности
с привлечением эозинофилов
Г ека рственный тубуло - интерсти циа л ьный
нефрит (например, обусловленный пени-
циллинами)
Обструкция просвета почечных канальцев
кристаллами, которая обычно сочетается с
другими механизмами поражения почек
Острый тубуло-интерстициальный нефрит
индуцированный фторхинолонами
Угнетение синтеза почечных простагланди-
нов с нарастающей ишемией тубуло-
интерстициальных структур.
Возможна ассоциация с «аллергическими»
механизмами, в том числе эозинофильной
инфильтрацией
Острый тубуло-интерстициальный нефри’
индуцированный НПВП и ненаркотическими
анальгетиками
Образование гранулем из воспалительных
клеток в почечном тубуло-интерстиции
Некоторые варианты лекарственного
тубуло-интерстициального нефрита
Характерно также для саркоидоза
Воспаление, вызванное воздействием на по-
чечный тубуло-интерстиции бактериальных
белков (например, белков внешней мембра-
ны — лептоспир);
Взаимодействие с Toli-like рецепторами с по-
следующей активацией ядерного фактора
транскрипции кВ (NF-кВ) и связанных с ним
провоспалительных хемокинов, а также
митоген-ассоциированных лротеинкиназ
характерно для большинства вариантов
ТИН
•ТИН - тубуло-интерстициальный нефрит.
Среди возможных звеньев патогенеза острого губуло-интерстициальнопг
нефрита, представленных в табл. 13.4, наиболее доступны для терапевтиче-
ского воздействия иммуновиспалительные, в том числе аллергические
Именно поэтому при большинстве форм этого заболевания, сопровождаю-
щихся острой почечной недостаточностью, приходится назначать глюко-
кортикостероиды, в том числе в высоких дозах.
Кроме того, следует иметь в виду возможность развития генерализован-
ных нарушений внутрипочечной гемодинамики, приобретающих особое
значение при остром тубуло-интерстициальном нефрите, индуцирование
Острый тубуло-интерстициальный нефрит
219
нестероидными противовоспалительными препаратами и ненаркотически-
ми анальгетиками, которые обусловзивают ишемию, в первую очередь по-
чечных канальцев, чувствительных к гипоперфузии в связи с особенностя-
ми их кровоснабжения. Тем не менее возможность коррекции ишемии
тубуло-интерстиция при остром тубуло-интерстициальном нефрите срав-
нительно невелика, поскольку терапевтические стратегии, приводящие к
снижению системного АД. могут усугублять канальцевую гипоперфузию.
По-видимому, в этом случае оправдано устранение избыточной активности
локально-почечных систем гемостаза. При остром тубуло-интерстициаль-
ном нефрите, обусловленном нестероидными противовоспалительными
препаратами и непаркотическими анальгетиками, необходимо также увели-
чение активности системы почечных простагландинов, возможно, достижи-
мое при инфузии их синтетических аналогов.
Независимо от особенностей повреждающих факторов, острый тубуло-
интерстициальный нефрит всегда сопровождается расстройством функции
почечных канальцев, в первую очередь транспортной, в связи с че.м у этих
пациентов развивается расстройство электролитного гомеостаза. Чаше
наблюдают гиперкалиемию, особенно типичную для острого тубуло-интер-
стициального нефрита, обусловленного нестероидными противовоспали-
тельными препаратами и ненаркотическими анальгетиками и способную
привести к угрожающим для жизни нарушениям сердечного ритма. Гипер-
натриемия может обусловливать дополнительную задержку жидкости.
Вместе с тем у части пациентов возможно формирование феномена «соль-
теряющей почки», сопровождающегося значительным увеличением почеч-
ных потерь иатрия и/или калия с закономерным снижением их концентра
иии в крови вплоть до развития лекарственного синдрома Барттсра. Также
могут развиваться гипомагниемия и гипокальциемия. Признаки нарушения
электролитного гомеостаза при остром тубуло-интерстициальном нефрите
зачастую приобретают ведущую роль среди клинических проявлений, ста-
новясь первоочередной мишенью для терапевтических воздействий (так.
гиперкалиемия обусловливает выполнение острого гемодиализа).
МОРФОЛОГИЯ
В зависимости от тех или иных этиологических факторов развития
острого тубуло-интерстициального нефрита его морфологические призна-
ки приобретают определенные особенности (табл. 13.5). Различаются как
состав клеточных инфильтратов, так и их расположение — они могут быть
диффузными или образовывать гранулемы. Эпителиоциты почечных ка-
нальцев, как правило, всегда атрофичны; на отдельных участках — некроти-
220
Нефрология. Неотложные состояния
зирошшы, что особенно типично для острого тубуло-интерстициальног
нефрита, индуцированного нестероидными противовоспалительными пре-
паратами и ненаркотическими анальгетиками. Возможны воспалительны-
изменения стенок артериол и венул, наличие тромбов в микроциркулятор-
ном русле. Почечные клубочки исходно бывают мало изменены, хотя инс
гда обнаруживают разрывы их базальной мембраны, коллапс капиллярных
петель.
Таблица 13 z
Особенности морфологической картины при различных вариантах
острого тубуло-интерстициального нефрита
Клинический вариант
Морфологич«скаякартина
ТИН, индуцированный лекар-
ствами (особенно антибиоти-
ками)
ТИН. индуцированный нестеро-
идными противовоспалитель-
ными препаратами / ненарко-
тическими анальгетиками
Системные заболевания (син-
дром Шегрена, системная крас-
ная волчанка)
Саркоидоз
Большое количество СОЗ-положительных Т-лимфоцитов
в составе клеточных инфильтратов; при остром ТИН*, ин
дуцированном -лактамными антибиотиками - CD4
положительных.
Эозинофилы в клеточном инфильтрате типичны для
острого «аллергического» ТИН, индуцированного анти-
бактериальными препаратами).
Возможны депозиты IgG и СЗ вдоль тубулярной базаль-
ной мембраны.
Эпителиоидно-клеточные гранулемы, расположенные
периваскулярно. наблюдают при некоторых вариантах
лекарственного ТИН. в том числе индуцированного анти
биотиками (ванкомицином), сульфаниламидами.
Сладж капилляров клубочка, клубочковые эндотелиоци-
ты экспрессируют молекулы адгезии ICAM 1 и VCAM-1
Инфильтраты из лимфоцитов.
Эозинофильные инфильтраты возможны, но обнаружи-
ваются далеко не всегда.
Как. правило, выявляют тубулярный некроз.
Эпителиоидно-клеточные гранулемы не характерны
В клеточном инфильтрате обнаруживают В-лимфоцитс
Вдоль тубулярной базальной мембраны - гранулярные
депозиты IgG и комплемента
В почечном тубуло-интерстиции наблюдают
эпителиоидно-клеточные гранулемы без казеозного -е
кроза
*ТИН — тубуло-интерстициальный нефрит.
Таким образом, острый тубуло-интерстициальный нефрит, развиваю-
щийся при воздействии лекарственных препаратов (р-лактамных антибип>
тиков, нестероидных противовоспалительных препаратов. лиурстикоБ я
др.), чаще всего имеет иммунную природу, и основную роль в его формиро-
вании играет клеточно-опосредованная гиперчувствительность. При гист>
логическом исследовании в почечном интерстиции обнаруживают отек •
Острый тубуло-интерстициальный нефрит
221
инфильтрацию моноиуклеарными клетками, в основном лимфоцитами и
макрофагами. Иногда выявляют инфильтрацию нейтрофилами и эозино-
филами, реже — плазматическими клетками и базофилами. При токсиче-
ском воздействии некоторых препаратов (например, метициллина, тиази-
довых диуретиков) в интерстиции образуются гранулемы, содержащие
гигантские многоядерные клетки. Почечные канальцы инфильтрированы
лимфоцитами; в них обнаруживают очаговый некроз и участки регенера-
ции. Клубочки сохранны, за исключением случаев острого тубуло-интерсти-
циального нефрита, вызванного нестероидными противовоспалительными
препаратами, при котором возможно одновременное поражение почечных
клубочков. Сосуды, как правило, не изменены. Иммуногистохимическое
исследование показало, что воспалительный инфильтрат представлен преи-
мущественно CD4+ Т-лимфоцитами. При иммуиофлюоресцентном и элект-
ронно-микроскопическом исследованиях отложения иммунных комплек-
сов не выявляются, что свидетельствует в пользу клеточно-опосредованного
иммунного ответа.
Некоторые группы лекарственных препаратов вызывают нс только вос-
паление в тубуло-интерстиции, но и некротические изменения канальцев
(тубулотоксичными являются аминогликозиды, амфотерицин В, цефало-
спорины/. Так. токсическое воздействие аминогликозидов обусловлено их
способностью связываться с клеточными мембранами эпителия канальцев
и нарушать их функцию. Патоморфологические исследования свидетель-
ствуют о том, что основной причиной нефротоксичности аминогликозидов
является некроз эпителия канальцев. Кроме того, показано, что гентами-
цин — препарат класса аминогликозидов — вызывает выраженную макро-
фагальную инфильтрацию, увеличение сывороточных уровней трансфор-
мирующего фактора роста ₽ (ТФРР). эндотелина-1 и ангиотензина II,
ускоряющих прогрессирование тубуло-интерстициального поражения.
Восстановление функции почек наблюдается у большинства пациентов и
происходит благодаря большим компенсаторным возможностям эпители-
альных клеток почечных канальцев, которые очень быстро начинают про-
лиферировать.
При поражении почек, вызванном применением ненаркотических аналь-
гетиков, вначале развивается некроз почечных сисочков, затем — корти-
кальный тубуло-интерстициальный нефрит. Повреждение почек обуслов-
лено комбинацией прямого токсического действия этих препаратов и
ишемического повреждения канальцев и сосудов. Макроскопически почки
выглядят нормальными или незначительно уменьшенными. В корковом ве-
ществе чередуются участки западения и выбухания. Участки западения воз-
никают в результате атрофии коркового вещества над некротизированными
сосочками. В сосочках наблюдаются разные стадии некроза, кальцифика-
222
Нефрология. Неотложные состояния
ции, фрагментации и отторжения. Микроскопически изменения в сосочках
представлены отдельными участками некроза, однако при тяжелых формах
заболевания сосочки некротизируются полностью и часто выглядят как
бесструктурные массы, в которых прослеживают контуры канальцев и фо-
кусы дистрофического обызвествления. Сегменты сосочков могут оттор-
гаться и выделяться с мочой. Изменение коркового вещества выражается
исчезновением и атрофией канальцев, интерстициальным фиброзом и вос-
палением. Эти процессы обусловлены главным образом обструктивной
атрофией, вызванной повреждением канальцев в сосочках.
Отдельные лекарственные препараты (фторхинолоны, сульфанилами-
ды, ацикловир, метотрексат) нерастворимы в моче и обладают способно-
стью преципитировать в почечных канальцах и вызывать их обструкцию, в
результате чего развивается острое повреждение канальцев. По некоторым
данным, ацикловир способен также вызывать острый интерстициальный
нефрит иммунной природы, при котором отмечают отек интерстиция, эози-
нофильную инфильтрацию, иногда — образование гранулем.
Иммунно-опосредованный острый тубуло-интерстициальный нефрит
может развиваться как почечное осложнение болезни и синдрома Шегрена.
системной красной волчанки. Изолированный острый тубуло-интерсти-
циальный нефрит без значительного поражения клубочков — редкое явле-
ние при системной красной волчанке. В биоптате почки при системном
красной волчанке обнаруживают диффузную инфильтрацию тубуло-
интерстиция мононуклеарными клетками. При иммунофлюореецентном
исследовании на базальной мембране канальцев выявляют отложения IgG.
СЗ и Clq. При электронно-микроскопическом исследовании электронно
плотные депозиты наблюдают также на тубулярной базальной мембране .
При саркоидозе наиболее частой формой поражения почек является
гранулематозный интерстициальный нефрит, в результате которого у боль-
ного может развиваться острая почечная недостаточность. Другие формы
поражения почек при саркоидозе формируются значительно реже. В центре
эпителиодно-клеточных гранулем (без казеозного некроза) появляются ак-
тивированные макрофаги, которые могут превращаться в эпителиодные и
гигантские многоядерные клетки, на периферии — CD4+ и в меиьшей сте-
пени CD8+ Т-лимфоциты. Пролиферация и привлечение из кровотока
моноцитов/макрофагов и лимфоцитов регулируется цитокинами, в том
числе интерлейкином-1 (ИЛ-1), ИЛ-2, интерфероном-у, хемотоксическим
моноцитарным фактором. В дальнейшем гранулемы фиброзируются, в них
обнаруживают фибробласты. Этот процесс также регулируется цитокина-
ми, в первую очередь трансформирующим фактором роста р Фибробласты
пролиферируют и синтезируют компоненты внеклеточного матрикса, что
приводит к развитию интерстициального фиброза. При гранулематозном
Острый тубуло-интерстициальный нефрит
223
интерстициальном нефрите может отмечаться атрофия канальцев Почеч
ныс клубочки и сосуды, как правило, не изменены (если только не замеще-
ны гранулемами). При иммунофлюореспентном исследовании отложения
IgG, IgA, IdM, фибриногена, СЗ, С4 и Clq не зафиксированы.
При остром тубуло-интерстициальном нефрите, возникающем при леп-
тоспирозе, клеточные инфильтраты представлены лимфоцитами, моноци-
тами, плазмоцитами и нейтрофилами. Почти всегда обнаруживается некроз
эпителиоцитов проксимальных канальцев. При сепсисе почечный тубуло-
интерстиций инфильтрирован преимущественно полиморфно-ядерными
лейкоцитами, на отдельных участках формирующими микроабсцсссы.
Детально уточнены морфологические особенности острого тубуло-
интерстициального нефрита с увеитом (синдром ТИНУ), для диагностики
которого почти всегда проводят биопсию почки. Патогенез синдрома
ТИНУ до конца не изучен, но определенную роль в его развитии отводят
Т-клеточио-опосредованному, а также антите тьиому (у пациентов с
ТИНУ увеличивается уровень IgG в крови) иммунному ответу. Некоторьг
ми исследователями обнаружены аутоантитела к клеткам почечных каналь-
цев, перекрестно реагирующие с увеальными клетками.
Обязательные компоненты синдрома ТИНУ — билатеральный увеит,
поражающий, как правило, переднюю камеру глаза, и острым тубуло-
интерстициальный нефрит. Почечный интерстиций отечен, инфильтриро-
ван лимфоцитами (преимущественно Т-лимфоцитами), плазматическими
клетками, эозинофилами. Развивается очаговая атрофия проксимальных
и дистальных канальцев, появляются разрывы базальной мембраны ка-
нальцев с инфильтрацией эпителиальной выстилки канальцев лимфоци-
тами и плазматическими клетками. Клубочки интактны, иногда обнару-
живают небольшую гиперклеточность клубочков. Доминирующими
клетками, инфильтрирующими интерстиции, являются CD4+ Т-лимфоциты
(хелперы), в меньшем количестве обнаруживают CD8+ Т-лимфоциты
(цитотоксические) и CD Ис клетки (моноциты/макрофаги). В отдельных
случаях наблюдают мелкие гранулемы, образованные эпителиоидными и
гигантскими миогоядерными клетками. При иммун©флюоресцентном ис-
следовании ни в почечных клубочках, ни в канальцах, ни в стенках сосу-
дов отложений IgG, А. М, СЗ компонента комплемента, фибриногена, как
правило, не обнаруживают. Под электронным микроскопом иммунные де-
позиты также не выявляются.
Относительно малое число длительно прослеженных случаев острого
тубуло-интерстициального нефрита, подтвержденного с помощью морфо-
ло! ического исследования полученной при биопсии ткани почек, затрудня-
ет выявление признаков, имеющих прогностическое значение. Тем не менее
.можно утверждать, что клеточная инфильтрация может быть полностью об-
224
Нефрология. Неотложные состоящее
ратимой, но по мере увеличения распространенности и выраженности тубу-
лярного некроза с последующим тубуло-интерстициальным фиброзом ве-
роятность нормализации функции почек существенно уменьшается.
КЛИНИЧЕСКАЯ КАРТИНА
Острый тубуло-интерстициальный нефрит всегда характеризуется раз-
личной степенью ухудшения фильтрационной функции почек — снижени е
СКФ и гиперкалиемией. Олигоанурия и анурия на первых этапах развития
болезни могут отсутствовать. Наряду с этим ухудшение концегп рационног
функции почек, наиболее надежным признаком когорого служит депрессия
относительной плотности мочи, может проявляться такж< преходящей полиу-
рией. Характерно нарушение электроли тного гомеостаза: появляются пщер-
или гипонатриемия, гипо- или чаще — гиперкалиемия, нередко становящаяся
основанием для проведения острого гемодиализа. Часть случаев острого
тубуло-интсрстиииального нефрита длительно остаются субклиническими.
Острый лекарственный тубуло-интерстициальный нефрит, в частности
индуцированный антибактериальными препаратами, нередко протекает с
системыми проявлениями, типичными для большинства лекарственных ре-
акций:
• лихорадкой;
• кожной сыпью (в том числе крапивницей);
• гиперэозинофилией;
• увеличением СОЭ.
Острый лекарственный тубуло-интерстициальный нефрит может также
быть ассоциирован с признаками лекарственного гепатита (среди которых
умеренное увеличение активности печеночных трансаминаз и ферменте®
холестаза) и тромбоцитопенией.
Для острого тубуло-интерстициального нефрита, индуцированного ле-
карственными препаратами, характерна микрогематурия. Возможно появ-
ление признаков синдрома Фанкони, таких как почечный канальцевый аци-
доз. сочетающийся с повышением экскреции некоторых аминокислот.
Острый тубуло-интерстициальный нефрит, причиной которого являют-
ся нестероидные противовоспалительные препараты, в том числе селектив-
ные ингибиторы ЦОГ-2 и нснаркотическис анальгетики, часто протекает
очень тяжело, с быстро нарастающими ухудшением функции почек и оли-
гоанурией. Типичный признак этого варианта острого лекарственного
тубуло-интерстициального нефрита, отличающий его от других форм
ТИН, — значительная протеинурия, нередко приводящая к формированию
нефротического синдрома. Макрогематурия указывает на развитие остропи
некроза почечных пирамид.
Острый тубуло-интерстициальный нефрит
22S
Острый тубуло-интерстициальный нефрит, возникающий у лиц, упо-
требляющих китайские травы, содержащие аристолохиевую кислоту, часто
не проявляется яркими клиническими симптомами Тем не менее, развитие
почечной недостаточности нередко приобретет быстро прогрессирующий
характер, практически не обратимый даже при отказе от их употребления.
Саркоидный гранулематозный тубуло-интерстициальный нефрш так-
же нередко прогекаст субклинически. Иногда регистрируют «следовую»
протеинурию, небольшие отеки конечностей, умеренное повышение сыво-
роточного креатинина. Артериальное давление часто остается нормальным.
Саркоидный тубуло-интерстициальный нефрит почти всегда сочетается с
другими внелегочными проявлениями хронического саркоидоза сарко-
идным поражением печени, селезенки, кожи, глаз, слюнных желез, а также
прогрессирующим течением процесса в легких. Для острой формы саркои-
доза - варианта Лефгрена (узловатая эритема, внутригрудная лимфадено-
патия, лихорадка) — развитие саркоидного тубуло-ингерстициального не-
фрита, напротив, не типично. Описаны единичные случаи развития острого
саркоидного тубуло-интерстициальиого нефрита в дебюте саркоидоза, при
отсутствии его легочных и внелегочных проявлений, при котором, как пра-
вило. констатируют ухудшение функции почек.
Синдром ТИНУ включает признаки острого тубуло-интерстпциального
нефрита (умеренную гиперкреатининемию, сочетающуюся со снижением
СКФ. «следовую» протеинурию, возможно — полиурию), увеит и систем-
ные признаки (лихорадку, увеличение СОЭ. анемию, потерю массы тела).
Единичные наблюдения демонстрируют возможность сочетания синдрома
ТИНУ ио специфическими серологическими феноменами, в частности
АНЦА и антителами к тубулярной базальной мембране, а также снижением
сывороточного уровня комплемента. Фактор, провоцирующий развитие
синдрома ТИНУ, как правило, выделить не удается.
Острый губуло-интерстициальный нефрит, таким образом, далеко не
всегда характеризуется яркими клиническими проявлениями. Тем не менее
за кажущейся бессимптомностью может скрываться выраженное почечное
поражение, опасное быстрым и нередко необратимым ухудшением функ-
ции почек.
ДИАГНОЗ
Анализ жалоб в диагностике острого тубуло-интерстициального нефри-
та оказывается, как правило, мало информативным. Тем нс менее пациент
может отмечать полиурию или олигоанурию, жажду, отеки конечностей,
слабость, зудящую кожную сыпь (при остром аллергическом тубуло-ин-
терстициальном нефрите, индуцированном лекарственными препаратами)»
в Нефрология
226
Нефрология. Неотложные состояние
Изменения мочи могут исчерпываться микрогематурией и снижением
относительной плотности мочи, подтверждаемым результатами пробы Зим-
ницкого. Протеинурия, как правило незначительная, и лишь в случае остро-
го тубуло-интерстициального нефрита, индуцированного несгероидными
противовоспалительными препаратами, экскреция белков с мочой может
достигать нефротических (> 3 г/сутки) величин. Пул белков, выявляемых в
моче при тубуло-интерстициальных поражениях, представлен преимуще-
ственно низкомолекулярными, для дифференциации которых необходимо
применение специальных лабораторных методов (табл. 13.6). Наряду с ка-
нальцевой протеинурией регистрируют также увеличение активности в
моче некоторых ферментов, свидетельствующих о повреждении различных
структур канальцевых эпителиоцитов (табл. 13.7).
Таблица 13 €
Нормальные значения мочевой экскреции низкомолекулярных белков
Белок । Нормальное значение мочевой экскреция*
1 Гликопротеин Тамма-Хорсфалла 5.1 -25,5
-микро гл обул ин 0,021 -0,142 -- .... J
IgG 0,35 - 2,70
Трансферрин 0,08 - 0,83
Ретинол-связывающий протеин 0,03-0,13
Лизоцим 0,002—0,120 !
* Все значения приведены в мг/r креатинина мочи, для лизоцима — в мг/дл.
Таблица 13.7
Мочевая экскреция ферментов — индикатор канальцевого повреждения
Структура канальцевого эпителиоцита Экспрессируемый фермеи.
Щеточная кайма 1 _ Аланин-аминотрансфераза
Щелочная фосфатаза |
Гамма-глутамилтрансгептидаза
Мальтаза
Цитозоль Лактат-дегидрогеназа
Малат-дегидрогеназа
Лизосомы N -ацетил - D- гл юкамин идаза
Кислая фосфатаза
, Митохондрии Глутамат-дег идрогеназа
Острый тубуло-интерстициальный нефрит
227
Всем больным острым тубуло-интерстициальным нефритом необходи-
мо проводить мониторинг показателей, характеризующих фильтрационную
функцию почек и электролитного гомеостаза:
• креатининсмии;
• СКФ, рассчитанной по формулам Cockroft-Gault, MDRD и/или оце-
ненной в пробе Реберга;
• калиемии:
• иатриемии;
• кальциемии;
• сывороточной концентрации мочевой кислоты.
Целесообразна также оценка суточной экскреции калия, натрия, каль-
ция и мочевой кислоты.
При остром тубуло-интерстициальном нефрите, развивающемся в рам-
ках системных заболеваний, необходима оценка соответствующих иммуно-
логических маркеров (антител к ДНК, LE-клеточного теста) и проведение
дополнительных визуализирующих методов обследования, например ком-
пьютерной томографии, показанной больным саркоидозом При впервые
выявленном остром тубуло-интерстициальном нефрите может быть не-
обходо определение серологических маркеров HBV-, HCV- и ВИЧ-ин-
фекции.
Биопсия почки нецелесообразна при остром тубуло-интерстициальном
нефрите очевидного, в первую очередь лекарственного, происхождения,
особенно тогда, когда устранение провоцирующего фактора привело к ре-
грессу признаков почечного поражения. Биопсию почки следует считать
показанной при:
• остром туб¥ло-интерстициальном нефрите неясного происхождения;
• быстро прогрессирующем ухудшении функции почек;
• сочетании острого тубуло-интерстициального нефрита с признаками
системных заболеваний.
При остром тубуло-интерстиииальиом нефрите всегда следует стре-
миться к выявлению возможных этиологических факторов. Установить
провоцирующие факторы нередко становится возможным уже на этапе де-
тального изучения анамнеза (исключением является синдром ТИНУ).
ЛЕЧЕНИЕ
Лечение острого тубуло-интерстициального нефрита подразумевает
обязательное устранение провоцирующего фактора, что нередко имеет ре-
шающее значение в достижении ремиссии почечного процесса, особенно
при большинстве лекарственных вариантов этого заболевания. Тем не ме-
228
Нефрология. Неотложные состояния
нее, при остром тубуло-интерстициальном нефрите потребность в быстром
купировании нарастающего ухудшения почечной функции зачастую быва-
ет очень острой, и с этой целью чаще всего приходится применять глюко-
кортикостероиды .
Возможные схемы лечения острого тубуло-интерстициального нефрита,
в том числе включающие применение глюкокортикостероидов, не были
объектом специальных контролируемых исследований. Вместе с тем было
продемонстрировано, что назначение преднизолона позволяет добиться
сравнительно быстрого прироста клиренса креатинина при саркоидном
тубуло-интерстициальном нефрите. При остром тубуло-интерстициальном
нефрите, индуцированном содержащейся в китайских травах аристолохие-
вой кислотой, глюкокортикостероиды, но данным ретроспективного анали-
за, позволяют снизить частоту терминальной почечной недостаточности
Их с успехом применяют также при синдроме ТИНУ. Напротив, при остром
тубуло-интерстициальном нефрите, индуцированном нестероидными про-
тивовоспалительными препаратами, глюкокортикостероиды малоэффек-
тивны.
В целом при остром тубуло-интерстициальном нефрите независимо от
его происхождения обоснованно назначение преднизолона в дозе 1 mi/кг
сутки per os (или эквивалентная доза внутривенно). Если удается достичь
улучшения функции почек в течение 7—10 дней, применение преднизоло-
на продолжают еще в течение 4—6 недель, затем дозу препарата постепен-
но уменьшают вплоть до полной отмены. Если же улучшения функции
почек не удается добиться даже в течение 2—3 недель лечения преднизо-
лоном, можно обсуждать назначение циклофосфамида (2 мг/кг/сутки).
ответ на терапию которым оценивают в течение 5—6 недель. Инфузию ци-
клофосфамида можно сочетать с плазмаферезом (10 сеансов в течение 2
недель).
Этиотропное лечение инфекционного тубуло-интерстициального не-
фрита может включать назначение антибактериальных, противовирусных и
противогрибковых препаратов, однако следует иметь в виду, что они могут
усугублять поражение почечного тубуло-интерстиция. Лечение острого па-
ранеопластического тубуло-интерстициального нефрита требует обязатель-
ного воздействия на очаг злокачественной опухоли, при сохранении и ли
прогрессировании которого все терапевтические вмешательства, направ-
ленные на отдельные звенья патогенеза тубуло-интерстициальной нефро-
патии. окажутся заведомо безуспешными.
При остром тубуло-интерстициальном нефрите необходимы тщатель-
ный мониторинг и своевременное устранение нарушений водно-этектро-
литного и кислотно-основного баланса. При нарастающей гиперкалиемии
может потребоваться проведение острого гемодиализа.
Острый тубуло-интерстициальный нефрит
229
ПРОГНОЗ
При своевременном устранении этиологических факторов прогноз боль-
шинства форм острого тубуло-интерстициального нефрита сравнительно
благоприятен Исключение составляют острый тубуло-интерстициальный
нефрит, индуцированный нестероидными противовоспалительными препа-
ратами или китайскими трава.ми. содержащими аристолохиевую кислоту, —
у большинства таких пациентов почечная недостаточность приобретает бы-
стро прогрессирующий и не сдерживаемый доступными в настоящее время
методами лечения характер. Кроме того, у лиц, употреблявших средства
традиционной китайской медицины, в состав которых вхолит аристолохие-
вая кислота, существенно возрастает риск развития злокачественных опу-
холей нижних мочевыводящих путей (мочевого пузыря, мочеиспускатель-
ного канала), сохраняющийся очень длительно даже после прекращения
приема соответствующего препарата. При некоторых заболеваниях, в част-
ности при злокачественных опухолях, сопровождающихся острым паранео-
пластическим тубуло-интерстициальным нефритом, и системных болезнях
(системной красной волчанке, болезни Шегрена) прогноз определяется не
только поражением почечного тубуло-интерстиция, но и поражением дру-
гих органов (легких, сердца).
ПЕРСПЕКТИВЫ
Повышение эффективности лечения и профилактики острого тубуло-
интерстициального нефрита во мноюм зависит от разработки новых стра-
тегий, позволяющих защищать почечный губуло-пнтерстиций от повреж-
дающих воздействий, в том числе за счет оптимизации внутрипочечной
гемодинамики.
При лечении острого тубуло-интерстициального нефрита, особенно при
резистентности пациентов к стандартной терапии глюкокортикостероида-
ми, определенные перспективы связывают с микофенолата мофетилом. ко-
торый, как известии но опыту ведения небольших групп больных, позволяет
добиться достоверного уменьшения креатининемии у большинства боль-
ных при длительном течении При остром саркоидном тубуло-интер-
стициальном нефрите, как и при других иммуновосналительных гра-
нулематозах, определенные перспективы в лечении связывают также с
антагонистами ФНО-а, в частности инфиликсимабом. Коррекции острой
недостаточности почечных простагландинов, играющей одну из главных
ролей в ухудшении функции почек при остром тубуло-интерстициальном
нефрите, индуцированном нестероидными противовоспалительными пре-
230
Нефрология. Неотложные соепямм
паратами, могут способствовать синтетические аналоги простагландинов,
однако опыт клинического применения этих препаратов при тубуло-
интерстициальных нефропатиях пока отсутствует.
Неотложные мероприятия
• Оценить состояние гемодинамических показателей (АД, ЧСС) и обе-
спечить возможность их мониторинга.
• Выполнить биохимическое исследование крови с оценкой сывороточ-
ной концентрации креатинина, калия, натрия, мочевой кислоты.
• Рассчитать СКФ по формуле Cockroft-Gault или MDRD.
• Начать измерение диуреза.
• Выполнить ЭКГ покоя (приближение высоты зубца Тк зубцу R — ве-
роятный признак гиперкалиемии).
• Выполнить общий анализ мочи и исследование мочи под микрос-
копом.
• При отсутствии противопоказаний выполнить инфузию 500—1 000 мг
преднизолона и/или назначить его per os (доза — 1 мг/кг массы тела).
• При калиемии > 6,5 мЭкв/л — обсудить выполнение экстренного ге-
модиализа.
Глава 14
УРАТНЫЙ ПОЧЕЧНЫЙ КРИЗ
Острая уратная нефропатия (уратный почечный криз) — острая по-
чечная недостаточность, развивающаяся вследствие одномоментной мас-
сивной обструкции почечных канальцев кристаллами солей мочевой кис-
лоты (уратами).
ЭПИДЕМИОЛОГИЯ
Точные данные, характеризующие распространенность острой уратной
нефропатии, в том числе о ее месте в структуре причин острой почечной не-
достаточности, в настоящее время отсутствуют. Тем не менее идентифици-
рованы группы пациентов, у которых частота острой уратной нефропатии
весьма велика. Так, ее развитие нередко возникает при массивном распаде
опухолевых клеток после химно- или лучевой терапин, особенно тогда, ког-
да масса неопластической ткани велика и характеризуется высокой интен-
сивностью пролиферации, например при лейкозах и лнмфомах. В практике
гематологических стационаров острая уратная нефропатия как компонент
синдрома лизиса опухоли (tumor lysis syndrome), индуцированного агрес-
сивной химио- или лучевой терапией, занимает одно из первых мест среди
других причин острой почечной недостаточности. И все же ее значение в
структуре причин резкого ухудшения почечной функции в популяции не
определено в связи с тем, что массивная обструкция почечных канальцев
уратами нередко остается нераспознанной
Распространенность острой уратной нефропатии возрастает в следую-
щих группах пациентов:
• у больных злокачественными опухолями (лейкозами, лимфомами),
особенно после химио- или лучевой терапии;
• у пациентов с метаболическим синдромом (абдоминальным ожирени-
ем, инсулинорезистентностью / сахарным диабетом II типа), артери-
альной гипертензией, гипертриглицеридемией;
• у пациентов, нуждающихся в постоянном приеме петлевых и/или тиа-
зидовых диуретиков, например страдающих хронической сердечной
недостаточ ностью;
232
Нефрология. Неотложные состою—
• у больных с установленным диагнозом суставной подагры и/или урат-
ной нефропатии, (хронический уратный тубуло-интерстициальный
нефрит, уратный нефролитиаз).
Риск острой уратной нефропатии велик также у лиц с семейной пред-
расположенностью к обменным нарушениям, суставной подагре и уратному
нефролитиазу. Продолжают уточнять географические и расовые различия в
эпидемиологии нарушений обмена мочевой кислоты: так, установлена зна-
чительная распространенность гиперурикемии у представителей желтой
расы, особенно проживающих в бассейне Тихого океана (на Тайване, на Фи-
липпинах).
ЭТИОЛОГИЯ
Основной причиной развития острой уратной нефропатии является вы-
раженная шперпродукция мочевой кислоты и ее солей, нередко сочетаю-
щаяся со снижением интенсивности их катаболизма (табл. 14.1). Тем не ме-
нее почти все факторы, провоцирующие гиперурикемию, сравнительно
редко приводят к одномоментной обструкции почечных канальцев уратами.
Исключением являются злокачественные опухоли, особенно упомянутые
лейкозы и лимфомы, в лечении которых используют агрессивные комбина-
ции химиопрепаратов или лучевые методы, а также резкая дегидратация, в
том числе обусловленная приемом больших доз диуретиков.
Факторы, предрасполагающие к гиперурикемии
и острой уратной нефропатии
Таблица 14 1
Группа факторов Фактор, предрасполагающий к гиперурикемии
Генетические • Синдром Lesh Nyhan; • синдром Дауна; • рецессивные формы уриказы, обусловливающие недоста- точность этого фермента
Внешнесредовые • Распад опухолевых тканей,- сопровождающийся интенсив ной пролиферацией (лейкозы и лимфомы, реже - солид ные опухоли), индуцированный химио- или лучевой терапи- ей или спонтанный, • резкая дегидратация, причиной которой могут служить. — прием больших доз тиазидовых или петлевых диуретиков. - интенсивное потоотделение (физический труд, пребыва- ние в условиях высокой температуры, посещение сауны / бани)
Метаболические • Гипотиреоз, • гипоксия с метаболическим ацидозом
Уратный почечный криз
233
ПАТОГЕНЕЗ
Избыточное образование уратов, сопровождающееся повышением экс-
креции их с мочой, кислая реакция мочн способствуют кристаллизации
уратов в просвете канальцев. Массивная обструкция почечных канальцев
уратами приводит к резкому снижению скорости клубочковой фильтра-
ции, нередко с развитием олигоанурии. Следствием прямого контакта ура-
тов с эпителиоцитами почечных канальцев является постепенно нарастаю-
щая атрофии последних, а также активация в тубуло-интерстициальном
пространстве экспрессии медиаторов вазоконстрикции (ангиотензина II,
эндотелина-1) с последующим персистирующим генерализованным спаз-
мом аффереитой и эфферентной артериол клубочка, приводящим к ише-
мии почечных канальцев Кроме тоги, кристаллы мочевой кислоты и ее со-
лей перегружают физиологические транспортные канальцевые системы,
что приводит к существенным нарушениям реабсорбции и экскреции элек-
тролитов и воды.
Как правило, при острой уратной нефропатии констатируют тенден-
цию к гипернатриемии, гиперкалиемии (которые нередки становятся само-
стоятельным показанием к экстренному началу процедуры гемодиализа) и
снижению клиренса осмотически свободной воды. Подъем АД, наблюдаю-
щийся при острой уратной нефропатии, с одной стороны, обус повлек
локально-почечной гиперпродукцией компонентов ренин-ангиотензин-
альдостероновои системы, а с другой — имеет натрии — объемзавиенмый
генез, частично связанный и с дисфункцией почечных канальцев — след-
ствием нх прямого повреждения кристаллами уратов.
Кроме того, действие солей мочевой кислоты на эпителиоциты прокси-
мальных и дистальных почечных канальцев не ограничивается только
индукцией их атрофии и некроза, но включает также привлечение клеток —
модуляторов процессов воспаления и фиброза и индукцию траисдиффе-
ренциацип непосредственно канальцевых эпителиоцитов в фиброласты.
Поэтому даже при успешном купировании острой уратной нефропатии
определенная часть почечной ткани подвергается фибротической транс-
формации, приводящей к формированию резидуальной почечной недоста-
точности.
МОРФОЛОГИЯ
Морфологические признаки острой уратной нефропатии в целом близ-
ки к таковым для других вариантов острой почечной недостаточности, раз-
витие которых обусловлено обструкцией почечных канальцев кристаллами.
234
Нефрология. Неотллжиые госгмят
Проксизмальные и дистальные почечные канальцы перерасти нуты, просвет
их резко расширен, местами обнаруживаются разрывы базальной мембра-
ны, нарушение целостности апикальной поверхности канальцевых эпитеж-
цитов и их некроз. В интерстициальном пространстве мыут обнаруживать-
ся инфильтраты, состоящие преимущественно из макрофагов, а такжг
фибробласты. Сосуды тубуло-ннтерстиция резко сужены. Почечные клу-
бочки исходно бывают мало измелены, но возможно повреждение m
базальной мебраны, склеивание капиллярных петель с последующим фор-
мированием гломерулосклероза. Может развиваться гиперплазия юкста-
гломерулярного аппарата, увеличение в его клетках числа гранул, содержа-
щих ренин.
Спсфицические иммуно! истохимические методы выявляют, как прав»
ло, диффузное увеличение количества медиаторов воспаления — макрофа-
гального воспалительного протеина типа 1-а (М1Р-1а), моноцитарного
хемотаксического протеина типа 1 (МСР-1), а также медиаторов вазокое-
стрикции (ангиотензина II, эндотелина-1). Следует подчеркнуть, что при
обычных методах фиксации почечной ткани (например, формалином) урат-
ные кристаллы вымываются, поэтому, чтобы их обнаружить в кач ттм
фиксатора, следует использовать этиловый спирт. У пациентов, у которьп
острая уратная нефропатия представляет собой одно из проявлений син-
дрома лизиса опухоли, особенно у страдающих неходжкинскими лимфома-
ми. часто обнаруживают инфильтрацию почечной ткани опухолевыми клет-
ками. Именно поэтому считается, что почки могут выступать в качестве
одного из депо пула клеток лимфомы.
КЛИНИЧЕСКАЯ КАРТИНА
Как правило, развитию ocrpoii уратной нефропатии предшествуют раз-
личные предрасполагающие обстоятельства: прием больших доз петлевыт
или тиазндовых диуретиков, сопровождающийся так называемым форсиро-
ванным диурезом, резкая дегидратация вследствие обильного потоотделе-
ния, обусловленного интенсивными анаэробными физическими нагрузка-
ми, посещением сауны / бани, употребление большого количества пищевых
продуктов, содержащих пуриновые основания (говядины, конины, барани-
ны, томатов, бобовых), прием некоторых лекарственных препаратов (несте-
роидных противовоспалительных средств).
Острая уратная нефропатия как ведущее проявление синдрома лизиса
опухоли часто возникает после очередного сеанса химио- и/или лучевой те-
рапии. особенно при злокачественных опухолях, которым свойственны
большая масса неопластической ткани и высокая интенсивность ее пролн-
Уратный почечный криз
235
ферации, таких, как лейкозы, низкодифференцированные неходжкинские
лимфомы. Одномоментный распад значительного числа опухолевых клеток
приводит к резкому росту сывороточной концентрации мочевой кислоты с
обструкцией ее солями просвета почечных канальцев. Параллельно могут
наблюдаться и другие последствия химио- / лучевой терапии — интоксика-
ционный синдром (слабость, лихорадка, боли в суставах), венозные тромбо-
зы и тромбоэмболии. Острая уратная нефропатия как составляющая син-
дрома лизиса опухоли всегда сочетается с выраженным расстройством
электролитного гомеостаза (гипернатриемией, гиперкалиемией).
Клинические проявления острой уратной нефропатии могут бурно де-
бютировать и быстро нарастать (табл. 14.2), при этом острая почечная не-
достаточность с олигоанурией сопровождается угрожающими жизни
осложнениями, в числе которых гиперкалиемия, некунируемый гиперто-
нический криз, левожелудочковая недостаточность. Возможно и рециди-
вирующее течение острой уратной нефропатии, типичное для конститу-
ционально обусловленного и сочетающегося с метаболическим синдромом
нарушения обмена мочевой кислоты. При таком варианте течения первый
эпизод острой мочекислой нефропатии может возникнуть в молодом воз-
расте еще при отсутствии стойкой гиперурикемии, но при уже имеющемся
стойком повышении экскреции с мочой мочевой кислоты. Последнее сви-
детельствует о ее гиперпродукции, во многом генетически детерминиро-
ванной, но становящейся особенно заметной под действием экзогенных
факторов, таких, как употребление пищевых продуктов, содержащих боль-
шое количество пуриновых оснований, алкогольных напитков, прием тиа-
зидовых и петлевых диуретиков, а также при формировании других
обменных нарушений (абдоминального ожирения, инсулинорезистент-
ности).
Под действием провоцирующих факторов (например, после дегидрата-
ции) отмечается тенденция к олигурии, моча приобретает бурый («толче-
ный кирпич») цвет, обусловленный наличием в ней большого количества
уратов. Возможен транзиторный подъем АД. После первых подобных эпи-
зодов диурез восстанавливается, цвет мочи нормализуется в течение 24 ча-
сов, и в связи с этим данный «стертый» вариант течения острой моче кислой
нефропатии, как правило, своевременно не распознают. Это приводит к на-
растанию нарушения обмена мочевой кислоты (гиперурикемии становится
стойкой) и развитию хронических форм уратной нефропатии, таких, как
хронический уратный тубуло-интерстициальный нефрит, уратный нефро-
литиаз. Необходимо подчеркнуть, что острая уратная нефропатия, как и
другие варианты подагрической почки, может дебютировать задолго до пер-
вой атаки суставной подагры.
236
Нефрология. Неотложные сектам—
Таблица М 2
Клинические и лабораторные проявления острой уратной нефропатии
- Тип проявлений Клиническое проявление (симптом)
Клинические • Олигоанурия (в период разрешения острой почечной недо статочности - полиурия), • бурый цвет мочи; • трудно купируемый подъем АД. • боли в поясничной области
Лабораторные • Большое количество уратов в моче • гиперурикозурия; • гиперурикемия; • гиперкреатининемия со снижением скорости клубочковой фильтрации; • гиперкалиемия; • гипернатриемия; • гиперфосфатемия; • гипокальциемия
ДИАГНОСТИКА
Диагностика острой уратной нефропатии обычно не вызывает затрудне-
ний при соответствующей «настроенности» врача и детальном изучении
анамнеза. Как правило, удается выявить какой-либо из провоцирующих
развитие острой уратной нефропатии факторов. К ним относятся:
• у больных злокачественными опухолями — предшествующий сеан
химио- и/или лучевой терапии (следует иметь в виду возможность
спонтанного развития синдрома лизиса опухоли);
• дегидратация ( форсированный» диурез после приема тиазидовых
или петлевых диуретиков, обильное потоотделение при интенсивных
анаэробных физических нагрузках, посещении сауны / бани);
• употребление большого количества пищевых продуктов, содержащих
пуриновые основания (говядина, конина, баранина, бобовые, томаты,
шпинат);
• алкогольный эксцесс (наиболее опасными считают пиво, особенно
темные сорта, и красное вино);
• прием нестероидных противовоспалительных препаратов / ненарко-
тических анальгетиков, особенно в больших дозах.
Необходимо выполнение общего анализа мочи, мониторинга показате-
лей биохимического анализа крови (урикемии, креатининемии, калиемии.
натриемии, фосфатемии и кальциемии) и определения расчетной скорости
клубочковой фильтрации. При проведении пробы Реберга у больных без
анурии может быть оценена суточная экскреция мочевой кислоты с мочой.
Уратный почечный криз
237
Характерных признаков острой уратной нефропатии, регистрируемых с
помощью визуализирующих методов обследования, не описано, хотя уль-
тразвуковое исследование почек и мочевыводящих путей необходимо для
исключения уратного нефролитиаза. Если наличие острой уратной нефро-
патии не вызывает сомнения и других причин острой почечной недостаточ-
ности не предполагают, то биопсия почки нецелесообразна.
ЛЕЧЕНИЕ
При острой уратной нефропатии необходимо добиться нормализации сы-
вороточной концентрации мочевой кислоты, в связи с чем пациентам показа-
но назначение ингибитора ксантиноксидазы — аллопуринола. Следует иметь
в виду, что применение аллопуринола может сопровождаться усилением об-
струкции почечных канальцев за счет преципитации в них предшественни-
ков мочевой кислоты — гипоксантина и ксантина. Назначение аллопуринола
должно осуществляться с осторожностью при выраженном снижении скоро-
сти клубочковой фильтрации (табл. 14.3). Примерно у 5% пациентов, кото-
рым назначают аллопуринол, возникают нежелательные явления — зудящая
кожная сыпь, фотосенсибилизация, диарея, головная боль, — становящиеся
причиной отмены препарата. У пациентов, которым аллопуринол из-за раз-
вития нежелательных явлении был отменен, а в последующем вновь назна-
чен, может развиваться системная лекарственная реакция, включающая
близкую к гектической лихорадку, эксфолиативный дерматит, лейкемоидную
реакцию, синдром печеночного цитолиза и нарастающую почечную недоста-
точность, а также органный васкулит (обусловленный продукцией ANCA,
исчезающих при своевременной отмене препарата).
Таблица 14.3
Расчет дозы аллопуринола в зависимости от величины
скорости клубочковой фильтрации
I Скорость клубочковой фильтрации, мл/мин Доэа аллопуринола, мг/сутки
— — —---------1------------------------ -------•-----—
> 100 мл/мин 80—100 мл/мин 300 мг/сутки и выше (при необходимости) Ь - - I» ! 250 мг/сутки
60-80 мл/мин 40—60 мл/мин 20—40 мл/мин 200 мг/сутки 150 мг/сутки 100 мг/сутки
10-20 мл/мин <10 мл/мин । 100 мг 1 раз/2 суток 100 мг 1 раз/3 суток
238
Нефрология. Неотложные состо*м
Хорошо известно, что значительному снижению частоты нежелатель-
ных явлений, вызванных приемом аллопуринола, способствует достаточная
гидратация организма. Кроме того, при отсутствии тенденции к дефицит)
объема циркулирующей крови и воды уменьшается вероятность развития
собственно острой уратной нефропатии, в том числе в рамках синдрома ли-
зиса опухоли. В связи с этим перед химиотерапией и в течение нескольких
суток после очередного ее сеанса целесообразно обильное питье в сочета-
нии с инфузиями физиологического или солевых растворов из расчета
2,5—3 л/м2 поверхности тела/сутки. (Следует помнить, что подобный ре-
жим гидратации может быть опасным в связи с риском перегрузки объемом
и развития отека легких у пациентов с легочной гипертензией и/или лево-
желудочковой сердечной недостаточностью любого происхождения.) Ин-
фузия натрия бикарбоната, направленная на увеличение pH крови у боль-
ных злокачественными опухолями, которым провидят химиотерапию,
обоснована ввиду ее способности увеличивать почечный клиренс мочевой
кислоты и предупреждать ацидоз, возникающий у них вследствие много-
кратной рвоты и диареи.
Альтернативой аллопуринолу, позволяющей уменьшить сывороточную
концентрацию мочевой кислоты, является ставшая доступной в последние
5—10 лет рекомбинантная уриказа (расбуриказа). Применение расбурнка-
зы сопряжено с меньшим числом нежелательных явлений, чем лечение ал-
лопуринолом. Как показали контролируемые исследования, включавшие
преимущественно пациентов со злокачественными опухолями крови и лим-
фатической системы и максимальным риском развития синдрома опухоле-
вого лизиса и острой уратной нефропатии, рекомбинантная уриказа приво-
дит к более быстрому снижению урикемии (в течение первых 4 часов после
первой инфузии — на 86%), чем аллопуринол, обусловливающий уменьше-
ние этого показателя за это же время лишь на 14%. Величина урикемии
которой удается достичь при использовании расбуриказы, почти в три раза
при применении аллопуринола. Установлено, что эффективность и безопас-
ность применения расбуриказы не зависят от степени ухудшения почечной
функции. Существенно затрудняет широкое распространение расбуриказы
в клинической практике необходимость исключительно парентерального
введения, пероральные формы в настоящее время еще не получены.
Острая уратная нефропатия, как правило, сопровождается гиперкалие-
мией. При ее развитии необходима инфузия 50 мл 50%-ного раствора глю-
козы и 15 единиц инсулина в течение 60 минут. Допустимо одновременное
применение петлевых диуретиков, хотя их использование при острой урат-
ной нефропатии опасно из-за возможного усугубления обструкции почеч-
ных канальцев уратами. Если величина сывороточной концентрации калия
превосходит 5 мЭкн/л, необходима инфузия 50%-ного раствора глюкозы и
Уратный почечный криз
239
15 единиц инсулина в сочетании с кальция глюконатом (10—30 мл 10%-
ного раствора медленно). При необходимости возможны повторные инфу-
зии растворов глюкозы и инсулина. При развитии олигоанурии, а также
при гиперкалиемии более 7,0 мЭкв/л, показано экстренное проведение ге-
модиализа.
ПРОГНОЗ
Прогноз при острой уратной нефропатии определяется в первую оче-
редь заболеванием, на фоне которого она развивается. Очевидно, что смерт-
ность наиболее велика при злокачественных опухолях, хотя синдром лизи-
са опухоли, возникший в процессе лечения гемобластозов или лимфом,
если не требует радикальной смены режима химио- или лучевой терапии и
не сопровождается необратимым ухудшением функции почек, то далеко не
всегда отрицательно влияниет на выживаемость. При развитии хрониче-
ской формы уратной нефропатии почечная недостаточность, как правило,
прогрессирует медленно, но существенно возрастает риск сердечно-
сосудистых осложнений.
ПЕРСПЕКТИВЫ
Перспективы в лечении и предупреждении острой уратной нефропатии
определяются разработкой новых селективных блокаторов синтеза мочевой
кислоты и методов аферезного лечения, позволяющих элиминировать из
плазмы крови избыток мочевой кислоты и ее солей.
Неотложные мероприятия
• Мониторинг диуреза, общего анализа мочи, показателей, характери-
зующих функцию почек (креатининемии, калиемии, скорости клу-
бочковой фильтрации), урикемии.
• По возможности — отмена петлевых и тиазидовых диуретиков.
• При калиемии, превышающей 6,5 мЭк/л, — экстренный гемодиализ.
• Купирование сопутствующего острой уратной нефропатии повыше-
ния АД.
Глава 15
ОСТРАЯ ПИГМЕНТНАЯ
НЕФРОПАТИЯ
Острая пигментная нефропатия — острая почечная недостаточность,
развивающаяся при повышении концентрации в крови и массивной экс-
креции с мочой миоглобина (миоглобинурииный нефроз) или гемоглоби-
на (гемоглобинурийный нефроз). Развитие острой почечной недостаточ-
ности при рабдомиолизе или гемолизе — одно из наиболее опасных,
прогностически неблагоприятных и трудно устранимых осложнений
ЭПИДЕМИОЛОГИЯ
Острая пигментная нефропатия не относится к числу частых причин
острой почечной недостаточности и в связи е этим часто даже не отмечается
в соответствующих регистрах. Тем не менее у определенных категорий
больных именно рабдомиолиз можег быть лидирующей причиной быстрого
ухудшения функции почек. Так, в специализированный гоксикологиче< кии
клинический центр в течение одного года госпитализируют более 180 паци-
ентов с рабдомиолизом, индуцированным лекарственными препаратами в
первую очередь, опиумом и его производными. У 1,1% из них выявляют ги-
перкалиемию, у 2,8% — креатинином и ю, превышающую 1.4 mi/дл В Воору-
женных силах США в течение 21 юда (с 1980 по 2001 годы) число госпита-
лизаций, обусловленных тепловым ударом, возросло почти в 8 раз (с 1,8 на
100 000 в 1980 до 14,5 на 100 000 в 2001 году). В 25% случаев теплового уда-
ра, потребовавших госпитализации, у пациентов был обнаружен рабдомио-
лиз. Хорошо известно драматическое увеличение частоты развития рабдо-
миолиза и связанной с ним острой почечной недостаточности во время
чрезвычайных ситуаций, в т ом числе техногенных катастроф, приводящих
к росту количества травм, сопровождающихся синдромом длительного раз-
давливания (краш-синдромом).
Миоглобинурия составляет более 25% всех случаев острой почечной не-
достаточности, возникающей после травм. Так. во время землетрясения в
Мармарисе (одном из прибрежных городов Турции), достигавшего 7,4 бал-
ла по шкале Рихтера, острая почечная недостаточность, обусловленная раб-
домиолизом, развилась у 12% из 5392 госпитализированных пострадавших.
Почти 3/4 из них потребовалось приведение острого гемодиализа.
Острая пигментная нефропатия
241
Увеличение частоты развития рабдомиолиза и его органных осложне-
ний, в том числе острой пигментной нефропатии, стало предметом активно-
го обсуждения в 1990-х годах. Это было связано с увеличением частоты на-
значения некоторых лекарственных препаратов, в том числе обладающих
выраженным антигинерлипидемическим действием и существенно снижа-
ющих риск сердечно-сосудистых осложнений — итибиторов ГМГ-КоА-
редуктазы (статинов). Чем не менее случаи рабдомиолиза, индуцированно-
го статинами, остаются чрезвычайно редкими и всегда связаны не столько с
самим фактом применения статинов, сколько с нерациональным сочетани-
ем их с другими препаратами (например, фибратами — противогрибковыми
препаратами) или несоблюдением режима их приема (употреблением в ло-
зах, превышающих средние терапевтические, сочетанием с алкогольными
напитками и грейпфрутовым соком) Так, анализ базы данных, в которую
вошли 32 255 человек, часть которых постоянно принимали статины в пе-
риод с 1997 по 2004 год, показал, что частота возникновения рабдомиолиза
статистически не различается у лиц, получающих и не получающих эти пре-
параты, составляя 0,2 случая на 1000 человеко-лет. Обобщение данных 19
контролируемых клинических исследований, в которых статины применя-
ли для снижения риска сердечно-сосудистых осложнений, также не выяви
ло повышения риска рабдомиолиза, связанного с использованием зтих ан
тигиперлипидемических препаратов.
Острую почечную недостаточность, связанную с гемоглобинурией, мож-
но иногда наблюдать при массивном гемолизе различного происхождения.
Подобные наблюдения в настоящее время встречаются казуистически редко.
ЭТИОЛОГИЯ
Этиология рабдомиолиза, осложняющегося острой почечной недоста-
точностью (миоглобинурийным нефрозом), разнообразна (табл. 15.1). Сво-
евременное выявление и устранение провоцирующих факторов необходи-
мы в целях профилактики миоглобинурийного нефроза. Так. в клиническом
центре Университета Johns Hopkins (США) с 1993 по 2001 год наблюдались
475 пациентов с рабдомиолизом. Самыми частыми его причинами были эк-
зогенные факторы: у 46% больных — лекарственные препараты (психотроп-
ные, препараты лития, статины, зидовудин, колхицин, анксиолитики — ин-
гибиторы обратного захвата серотонина), наркотики и алкоголь У 60%
больных рабдомиолиз был спровоцирован двумя и более факторами, у 7%
причину установить не удалось. Острая почечная недостаточность разви-
лась у 46% больных, 3,4% — погибли от непосредственных последствий раб-
домиолиза.
242
Нефрология Неотложные состояния
Таблица 15 '
Причины рабдомиолиза, осложняющегося
миоглобмнурийным нефрозом
Группа п ♦чин Неспецифические факторы, об- условливающие повреждение поперечно-полосатых мышц Причина • Чрезмерная физическая нагрузка (в том числе очень продолжительная, например, у бегунов на марафон- ские дистанции); • переохлаждение; • действие высоких температур и гипертермия, • ожог; - травма; • укус насекомых и змей; • длительное сдавление мягких тканей (в т.ч. при дли- тельном пребывании пациента в одном положении во время хирургических вмешательств); • травма электрическим током; • судороги
Лекарственные препараты • см. табл. 15.2
Инфекции • ВИЧ, • вирус Эпштейна—Барр; • вирус гриппа; • вирус Коксаки В; • легионелла; • сальмонелла; • Fransdseila tularensis i
Системные заболевания • Дерматомиозит / поли миозит (первичный и паоанео- пластический)
Метаболические и эндокрин- ные расстройства • Гипокалиемия (первичный гиперальдос^еронизм, первично-почечные потери калия — синдром Бартте- ра); • гипонатриемия; • гипокальциемия; • кетоацидоз (в т.ч. при сахарном диабете); • недостаточность карнитина; • гипотиреоз
Генетические детерминанты* • Недостаточность пальмитоил коеатининтрансферагь • недостаточность миофосфорилазы (болезнь MacArdle); • недостаточность ферментов дыхательной цепи мито хондрий
* Могут приобретать клиническое значение под действием экзогенных факторов, например
лекарственных препаратов или чрезмерной физической нагрузки
Лекарственные препараты остаются одной из ведущих причин рабдо-
миолиза, осложняющегося миоглобинурийным нефрозом, вероятность воз-
никновения которого особенно высока при нерациональном использовании
препаратов, в том числе назначении их в необоснованных сочетаниях, по-
тенцирующих повреждающее действие каждого из составляющих на
Острая пигментная нефропатия
243
поперечно-полосатую мускулатуру (табл. 15.2). Одним из основных меха-
низмов развития рабдомиолиза, индуцированного лекарствами, является
расстройство продукции необходимого для мышечного сокращения АТФ
или резкое невосполнимое увеличение потребности в нем. Активация
Na-K-АТФазы может происходить при увеличении концентрации в сарко-
лемме миоцита ионов натрия и калия, обусловленном увеличением их по-
ступления в клетку за счет активации фосфолипаз. Этот процесс является
высокоэнергозатратным и приводит к резкому увеличению потребления
АТФ, истощение запасов которого приводит к рабдомиолизу.
Таблица 15.2
Лекарства, вызывающие рабдомиолиз
с острой почечной недостаточностью
Группа лякярстминых пряпярвгов Названия препарата
Психотропные и антидепрессанты • Амитриптилин, • флуоксетин; • галоперидол; • препараты лития; • хлопромазин; • флуфеназин; • трифлуоперазин
Снотворные • Бензодиазепины; • диазепам; • нитразепам, • лоразепам, • триазолам; • барбитураты
Антигиперлипидемические препа- раты • Статины (ловастатин, симвастатин, правастатин) • фибраты (безафибрат, ципрофибрат, клофибрат)
Наркотические препараты • Героин; • кокаин; • амфетамин • метадон; • лсд
Другие препараты • Алкоголь; • противогрибковые препараты (амфотерицин В. флуконазол), • цитостатики (азатиоприн); • i естеооидные противовоспалительные препараты (парацетамол, салицилаты); • диуретики тиазидового ряда; • теофиллин; • пентамидин; • D-пеницилламин
244
Нефрология. Неотложные состоя—
Хорошо известно о случаях рабдомиолиза, развивающегося после упо-
требления больших доз алкоголя одномоментно или в период запоя: пре
этом дополнительным фактором, индуцирующим некроз поперечно-
полосатых мышц, может быть их раздавливание при длительном пребыва-
нии в одном положении во время алкогольного опянения. Миоглобинурий-
ный нефроз может сочетаться с поражением других органов-мишеней,
например острым алкогольным гепатитом.
Рабдомиолиз нередко возникает у лиц, употребляющих кокаин. Мио
глобинурийный нефроз составляет до 25% среди всех причин госпитализа-
ций в связи с острыми ситуациями, возникающими после приема кокаина.
Механизмы развития острого рабдомиолиза, индуцируемого кокаином,
включают прямое токсическое действие на миофиламенты, возможность
развития клон ико-тонических судорог, а также генерализованный спазм ар-
териол и микроциркуляторного русла с необратимой ишемией поперечно-
полосатых мышц.
Развитие рабдомиолиза и последующей острой почечной недостаточно-
сти возможно при различных вариантах нарушения электролитного гомео-
стаза (гипокальциемии, гипонатриемии, гипокалиемии), в том числе возни-
кающих при резкой дегидратации вследствие рвоты, диареи. Снижение
сывороточного уровня калия, которое может провоцироваться или усугу-
бляться, например, приемом больших доз тиазидовых или петлевых диуре-
тиков, в том числе при первичном гиперальдостеронизме и канальцевых
дисфункциях с первично-почечными потерями калия (синдром Барттера.
вариант Ги гельмана) может достаточно быстро приводить к массивному не-
крозу поперечно-полосатых мышц с миоглобинурийным некрозом.
Выраженный рабдомиолиз с миоглобинурийным нефрозом возможен
при вирусных (вирусы гриппа, простого герпеса, Коксаки В, Эпштейна-
Барр) и бактериальных инфекциях. Выраженный рабдомиолиз возможен
при. итионеллезе, в этом случае он может стать причиной смерти.
Развитие миоглобинурийного нефроза характерно для повреждения
мышц под воздействием чрезмерно высоких температур. Рабдомиолиз с по-
следующей острой почечной недостаточностью наблюдают также при пере-
охлаждении.
Рабдомиолиз может быть следствием чрезмерных и/или очень продол-
жительных физических нагрузок, приводящих к перерастяжению, разрыва
отдельных мышечных волокон, а также ишемическому их некрозу, обуслов-
ленному значительным несоответствием между резко возрастающей по-
требностью в кислороде и субстратах метаболизма и возможностями их
доставки. Мио1лобинурийный нефроз развивается также после травмати-
ческого повреждения поперечно-полосатых мышц, в частности, после ту-
пых травм (падений, побоев).
Острая пигментная нефропатия
245
Острая почечная недостаточность, обусловленная миоглобинурией,
может развиваться у больных дерматомиозитом / полимиозитом. Вместе
с тем частота обнаружения бессимптомной миоглобинурии при дермато-
миозите / полимиозите многократно превосходит отмечаемую при этом за-
болевании частоту развития острой почечной недостаточности.
1емоглобинурийный нефроз и последующая острая почечная недоста-
точность развиваются при отравлении различными гемолитическими яда-
ми. Кроме того, повышение содержания гемоглобина в моче, сопровождаю-
щееся ухудшением почечной функции, может развиваться у пациентов с
пароксизмальной ночной и холодовой гемоглобинурией.
Как правило, причину острой пигментной нефропатии установить уда-
ется. Вместе с тем само ее устранение, как правило, не приводит к регрессу
почечной недостаточности, достижение которого возможно только при при-
менении специальных патогенетически обоснованных методов течения.
ПАТОГЕНЕЗ
В развитии острого рабдомиолиза участвуют три основных механизма
(табл. 15.3). В зависимости от причины, провоцирующей начало заболева-
ния, один из них может приобретать ведущее патогенетическое значение.
Отек и воспаление мышц обусловливают формирование известного фено-
мена сдавления увеличившихся в объеме мышечных волокон в соответству-
ющих фасциально-клетчаточных пространствах (феномен «compartment»)»
который и приводит к дальнейшему усилению рабдомиолиза.
Механизмы развития острого рабдомиолиза
Таблица 15.3
Механихм причина, провоцирующая начало забомвампя
Прямое повреждение клеточных мембран • Раздавливание; • разрыв; • тупая травма, • действие токсинов
Гипоксия миоцитов, со- пряженная с дефицитом АТФ • Окклюзия сосудов; • резкий персистирующий вазоспазм, в том числе лекарствен- ный; • сдавление тканей
Нарушение электролит- ного гомеостаза в мио- цитах, связанное с рас- стройством Na* / К* - каналов • Гипокалиемия (при первичном гиперальдостеронизме ци функции канальцев с первично-почечной потерей калия, вследствие рвоты, диареи, при форсированном диурезе), • гипонатриемия (в том числе при снижении клиренса осмоти чески свободной воды)
246
Нефрология. Неотложные согтаи—
Образование в просвете канальцев миоглобиновых или гемоглобиновых
слепков приводит к прямому повреждению эпителиоцитов почечных ка-
нальцев. Токсическое действие гемоглобина и миоглобина на почечную
ткань резко возрастает в условиях гиповолемии и наблюдающихся при раб-
домиолизе метаболическом ацидозе и резком закислении мочи. Вступая в
реакцию с белком Тамма—Хорсфалла, миоглобин может образовывать не-
растворимые комплексы. Гемоглобин, попавший в первичную мочу может
также индуцировать повреждение канальцевых эпителиоцитов перскисямж
и свободными радикалами. Распространенность обструкции канальцев во
многом определяет степень ухудшения почечной функции и обратимость
почечной недостаточности.
МОРФОЛОГИЯ
Миоглобин и гемоглобин являются эндогенными токсинами, способны-
ми вызывать острый канальцевый некроз, если присутствуют в моче в боль-
ших концентрациях. Тем не менее более значительную роль в развитии не-
кроза канальцев играют ишемия и микроциркуляторные нарушения.
Известно, что миоглобин усиливает вазоконстрикцию, подавляя продух -
цию эндотелиального релаксирующего фактора.
Миоглобинурийнын и гемоглобинурийный острый канальцевый некроз
имеют гистологические черты, сходные с острым канальцевым некрозом
ишемического генеза. На ранних стадиях отмечают отек и некроз отдель-
ных эпителиальных клеток почечных канальцев. Эти единичные некроти-
зированные эпителиальные клетки слушиваются в просвет канальцев, что
приводит к оголению канальцевой базальной мембраны. Проксимальные
канальцы могут быть расширены, эпителий в них уплощен, щеточная каем-
ка разрушена. В просвете канальцев, особенно дистальных, и собиратель-
ных трубочек появляются гиалиновые, зернистые цилиндры. В дистальных
канальцах и собирательных трубочках обнаруживают также многочислен-
ные пигментные красно-коричневые цилиндры (гемоглобиновые, миоглод-
биновые). Интерстиции отечен; в vasa recta часто наблюдается скопление
лейкоцитов. Клубочки и сосуды почек остаются интактными. На более
поздних стадиях отмечают признаки регенерации: расширенные канальцы
выстланы уплощенным эпителием, ядра эпителиоцитов крупные, обнару-
живаются митозы. При гемоглобинурии в проксимальных канальцах обна-
руживают гемосидерин, при миоглобинурии в канальцах в составе зерни-
стых цилиндров с помощью иммуногистохимического исследования можно
выявить миоглобин.
Острая пигментная нефропатия
247
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина рабдомиолиза с миоглобинурииным нефрозом
включает собственно признаки поражения мышц, проявления почечного
поражения и неспецифические симптомы и синдромы, отражающие фор-
мирование системного воспалительного ответа и/или интоксикацию
(табл. 15.4). Следует иметь в виду, что выраженный рабдомиолиз, сопро-
вождающийся массивной миоглобинурией и ухудшением почечной функ-
ции, может иметь минимальные клинические проявления или не характе-
ризоваться ими вообще («амиопатический» полимиозит, часто бывающий
паранеопластическим), при этом сывороточная активность КФК может
достигать очень высоких значений. При некоторых лекарственных миопа-
тиях, особенно при миопатии, индуцированной статинами, в первую оче-
редь обнаруживаются признаки поражения проксимальных групп мышц
верхних конечностей. Специфические клинические признаки гемолиза не
описаны.
Таблица 15.4
Клинические признаки острой пигментной нефропатии
Группа признаков — Клини чаек ив признак — — '
Поражение мышц • Мышечная слабость (локальная, как правило, вовлекающая симметричные группы мышц, или распространенная); • болезненность мышц; • отек и уплотнение мышц
Поражение почек • олигоанурия; • темный цвет мочи
Неспецифические призна- ки • Желтушность кожных покровов и видимых слизистых (мо- жет наблюдаться при гемоглобинурийном нефрозе); • подъем температуры тела (возможен как при миоглобину рии, так и при массивном гемолизе с гемоглобинурией); • артралгии
ДИАГНОСТИКА
Диагностика острой пигментной нефропатии во многом основана на ре-
зультатах изучения анамнеза, почти всегда позволяющего установить при-
чину рабдомиолиза или гемолиза. Как правило, между действием провоци-
рующего фактора и развитием острой пигментной нефропатии проходит не
более 24—48 часов.
Наиболее достоверным признаком рабдомиолиза является увеличение
сывороточной активности КФК, которое наблюдается в течение первых
248
Нефрология. Неотложные согтом—
12 часов с момента начала некроза поперечно-полосатых мышц, достигает
максимума в течение первых трех суток и, если рабдомиолиз не продолжа-
ется, в течение последующих 2—3 суток начинает уменьшаться. Вероят-
ность острой почечной недостаточности максимальна при увеличении сы-
вороточной активности КФК до уровня, превышающего 20 норм (>5,ХЮ
МЕ/л). Повышение сывороточной активности КФК при рабдомиолизе со-
храняется дольше, чем увеличение сывороточной концентрации миоглоби-
на. Рост активности КФК в сыворотке крови дополняется увеличением сы-
вороточной активности ACT, АЛТ и ЛДГ; определение отдельных фракций
последней смысла не имеет. Для диагностики предполагаемого поврежде-
ния кардиомиоцитов (например, при болях за грудиной, указывающих на
возможный острый коронарный синдром) целесообразно оценивать плаз-
менную концентрацию тропонина Т или 1, не экспрессирующихся в
поперечно-полосатых мышцах.
Попадание в мочу миоглобина наблюдают, если его концентрация s
плазме крови превосходит 1,5 мг/дл. При концентрации миоглобина >
моче выше 100 мг/дл последняя приобретает темно-коричневый цвет. При
микроскопическом исследовании мочи в ней обнаруживают характерные
миоглобиновые или гемоглобиновые цилиндры. Протеинурия остается
умеренной.
Наряду с анемией достоверным признаком гемолиза служит повышение
сывороточной концентрации неконъюгированного билирубина. Активность
печеночных ферментов в сыворотке крови, как правило, не изменяется
При острой пигментной нефропатии признаки ухудшения фильтраци-
онной функции почек, такие, как гиперкреатининемия, снижение СКФ, бы-
стро дополняются угрожающим жизни повышением сывороточной концен-
трации калия. Гиперкальциемия быстро сменяется снижением сывороточной
концентрации кальция.
При предположении о токсическом (в том числе лекарственном) рабдо-
миолизе возможно выполнение соответствующих токсикологических ис-
следований. Идиопатический дерматомиозит/полимиозит подтверждает
наличие специфического сывороточного маркера — антисинтетазных (анти-
Jo) антител, отсутствующих при вторичных, в том числе паранеопластиче-
ском, вариантах этого заболевания.
ЛЕЧЕНИЕ
При острой пигментной нефропатии необходима регидратация с одно-
временным увеличением осмоляльности плазмы. С этой точки зрения воз-
можно применение коллоидных и кристаллоидных растворов, а также фи-
Острая пигментная нефропатия
249
энологического раствора. Если в течение 6 часов с момента начала
регидратации отмечена тенденция к полиурии, вероятность разрешения
острой почечной недостаточности существенно возрастает.
По мере регидратации возможно применение маннитола (однократная
внутривенная инфузия 12,5—25 г в течение 15—30 минут) и натрия бикар-
боната. Основная цель применения натрия бикарбоната — ощелачивание
мочи с уменьшением темпа образования миоглобиновых или гемоглобино-
вых цилиндров. Польза от применения маннитола, в том числе его способ-
ность тормозить нарастание почечной недостаточности, пока в контроли-
руемых исследованиях не доказана.
При развитии гиперкалиемии (> 6,5 мЭкв/л) выполняют экстренный
гемодиализ. Эффективность плазмафереза и гемофильтрации при острой
пигментной нефропатии достоверно не установлена; тем не менее в ряде
случаев (особенно при острых отравлениях с массивным гемолизом или
рабдомиолизом) эти методы могут оказаться полезными. При дерматомио-
зите/полимиозите целесообразна инфузия глюкокортикостероидов (напри
мер, преднизолона по 500 -1000 мг/сутки) в сочетании с цитостатиками
(циклофосфамидом, циклоспорином).
ПРОГНОЗ
Наиболее надежным маркером, позволяющим предсказать развитие
острой почечной недостаточности при рабдомиолизе, является сывороточ
ная активность КФК: риск ухудшения почечной функции максимален при
уровне КФК. превышающем 5000 МЕ/л. При рабдомиолизе острая почеч
ная недостаточность может стать необратимой. Ухудшение функции почек
при пароксизмальных гемоглобинуриях, как правило, носит преходящий
характер и прогностически сравнительно благоприятно.
ПЕРСПЕКТИВЫ
Перспективы в предупреждении острой пигментной нефропатии во
многом определяются совершенствованием подходов к раннему выявлению
причин рабдомиолиза и гемолиза, в том числе факторов риска возникнове-
ния нежелательных эффектов от применения лекарственных препаратов и
своевременному их устранению. Препараты с антиоксидантным действием,
с патофизиологических позиций способные уменьшать выраженность по-
чечного поражения при миоглобинурии и гемоглобинурии, пока не проде-
монстрировали своей эффективности в убедительных клинических иссле-
250
Нефрология. Неотложные состояния
дованиях. Возможна разработка селективных мембран или сорбционных
колонок, нейтрализующих миоглобин и гемоглобин, которые можно было
бы применять при плазмаферезе и гемосорбции.
Неотложные мероприятия
• Мониторинг сывороточной активности КФК, ACT, АЛТ, креатинине-
мии, СКФ, калиемии, натриемии, кальциемии, показателей, характе-
ризующих кислотно-основное состояние.
• Регидратация с помощью физиологического раствора и/или кол
ЛОЙДОВ.
• Инфузия натрия бикабоната (параллельно с регидратацией).
• Острый гемодиализ (при калиемии выше 6,5 мЭкв/л и/или ЭКГ-
признаках гиперкалиемии).
• Инфузия преднизолона в сверхвысоких дозах (только при миоглобину-
рийном нефрозе в рамках активного дерматомиозита / полимиозита).
Глава 16
ГЕМОРРАГИЧЕСКАЯ ЛИХОРАДКА
С ПОЧЕЧНЫМ СИНДРОМОМ
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — ви-
рус-индуцированное заболевание почек, характеризующееся нарастаю-
щей почечной недостаточностью, гематурией и возможными системными
геморрагическими проявлениями, такими, как кожная пурпура, носовые,
желудочно-кишечные, мато'шые кровотечения, ДВС-синдром.
ЭПИДЕМИОЛОГИЯ
На территории Российской Федерации ГЛПС длительно оставалась
природно-очаговым заболеванием, особенно часто встречавшимся в Ом-
ской, Оренбургской областях, Хабаровском крае, Башкирии, а также в По-
волжье и некоторых южных областях (Белгородской, Курской. Орловской).
Однако в настоящее время в нашей стране четко прослеживается общеми-
ровая тенденция к утрате ГЛПС эндемичности. Изменение климата и влаж-
ности в 1990-х годах привели к массовым миграциям грызунов-носителей, в
связи с чем вспышки и спорадические случаи этого заболевания в настоя-
щее время наблюдают почти повсеместно в европейской части Российской
Федерации, в том числе в Тульской, Калужской и Московской областях.
В связи с нередкими сегодня абортивными вариантами течения ГЛПС,
отличающимися отсутствием или минимальной выраженностью системно-
го геморрагического синдрома, умеренным ухудшением функции почек, не
сопровождающимся изменением диуреза, а также возможностью спонтан-
ного излечения, многие ее случаи, особенно единичные, остаются нераспо-
знанными, что затрудняет достоверную эпидемиологическую характери-
стику этой болезни.
Одна из первых вспышек ГЛПС была отмечена во время американо-
корейской войны в 1951 году в бассейне реки Hantaan (именно поэтому воз-
будитель ГЛПС получил потом название хантавирусов): более чем у 3000
американских военнослужащих развились фебрильная лихорадка, острая
почечная недостаточность, у части — геморрагический шок, 7% заболевших
погибли. В настоящее время в мире регистрируют более 200 000 случаев
хантавирусной ГЛПС ежегодно. В эндемических очагах заболеваемость до-
стигает 200 случаев на 100 000 человек, а серопозитивными оказываются до
252
Нефрология. Неотложные состояния
40% проживающих в них людей. Типичны два пика заболеваемости ГЛПС —
весенний и осенний.
Путь заражения ГЛПС — фекально-оральный, и в связи с этим увеличе-
ние заболеваемости отмечают во время массовых миграций населения, в
том числе во время локальных военных конфликтов, когда не соблюдаются
общепринятые гигиенические нормы. Так, в Боснии и Герцеговине с 1994 по
1995 год число заболевших ГЛПС возросло почти в 50 раз.
Наибольшему риску заражения ГЛПС подвержены лица, работающие в
сельской местности (сельскохозяйственные рабочие, охотники, особенно на
пушных зверей н крупных грызунов, солдаты, задействованные на сезонной
уборке урожая). Спорадические случаи ГЛПС нередки возникают и у го-
родских жителей, выезжающих за город и во время пребывания в сельских
домах и подсобных строениях контактирующих с грызунами-переносчиками
(рыжей полевкой) и/илн употребляющих пищевые продукты или воду,
контаминированную их экскрементами. Существуют несколько возможных
эпидемических источников ГЛПС:
• дикие животные (например, красная береговая полевка резервуар виру-
са Puumala в Центральной Европе), контакт с которыми человека относи-
тельно редок и всегда происходит в естественной среде их обитания;
• животные, обитающие в сельской местности, в том числе в населенных
пунктах (например, желтошейная мышь Apodemus flavicollis — разносчик
вируса Dobrava, распространенного на Балканах и в южной Европе);
• животные, обитающие в непосредственном контакте с человеком в
том числе в городах, и распространяющие вирус через контаминиро-
ванные мочу и фекалии (например, крыса Rattus norvegicus, распро-
страняющая вирус Seoul, особенно часто встречающийся в Азии).
Таким образом, ключевой особенностью современной эпидемиологии
ГЛПС можно считать увеличение распространенности и расширение ареала
с утратой типичной для этого заболевания прежде природной очаговости.
В связи с этим ГЛПС следует всегда учитывать при дифференциальном
тиагнозе впервые выявленной острой почечной недостаточности, особенно
тогда, когда она сочетается с гематурией, в том числе микрогематурией,
подъемом температуры тела, «островоспалительными > изменениями пока
зателей периферической крови, а также системным геморрагическим син-
дромом.
ЭТИОЛОГИЯ
Хантавирусы относятся к РНК-содержащему семейству Bunyaviridae.
но, в отличие от других его представителей, не передаются от человека к
человеку. Хантавирусы реплицируются в цитоплазме клеткн-хозянна Ви-
Геморрагическая лихорадка с почечным синдромом
253
русная частица состоит из сферической липидной оболочки, 4 вирусных
белков и 3 одноцепочечных ДНК-сегментов, кодирующих белок нуклеокап-
снда, поверхностные гликопротеиды Gf и G2, а также РНК-зависимую РНК-
полимеразу.
Хантавирусы условно подразделяют на вирусы Старого и Нового Света.
В зависимости от вида конкретного вируса клиническая картина заболева-
ния может различаться, но в целом она представлена тремя основными ва-
риантами — геморрагической лихорадкой с почечным синдромом, относи-
тельно доброкачественной по течению эпидемической нефропатией (ЭН) и
хантавирусным легочным синдромом (ХЛС).
Группа хантавирусов Старого Света представлена вирусами Hantaan,
Seoul, Amur, Tula и Dobraoa, вызывающими преимущественно ГЛПС, а так-
же одним из наиболее распространенных в Европе вирусом Puumala, обу-
словливающим развитие ЭН. С начала 1990-х годов, вслед за первым иден-
тифицированны м вирусом Sin Nombre, было открыто несколько хантав ирусов
Нового Света, большинство из которых вызывают ХЛС.
Различные хантавирусы имеют разные ареалы распространения и пере-
носятся разными видами животных (табл. 16.1).
Таблица 16.1
Хантавирусы, их ареалы, переносчики и вызываемые
ими заболевания
Серотип Хантавируса Природный резервуар (переносчик) Ареал распространения Вызываемое жабо левея ие
Хантавирусы Старого Света
Amur Корейская мышь- полевка (Apodemus peninsulae) Юго-Восточная Сибирь, северо-восточный и юго-восточный Китай, Корея, восточная Мон- голия, острова Сахалин и Хоккайдо ГЛПС
Dobrava Желтошейная мышь- полевка (Apodemus flavicollis) Англия и Уэльс, северо- западная Испания, Франция, южная Скан- динавия. европейская часть России, южная Италия, Балканы, Си- рия, Ливан и Израиль ГЛПС
Hantaan Полосатая мышь- полевка (Apodemus agrarius) Бассейн реки Амур (Ко- рея и Китай), Тайвань ГЛПС
254
Нефрология. Неотложные состояния
Продолжение табл. 16 1
Серотип Природный резервуар Хантавируса (переносчик) I - - т—— — Ареал । Вызываемое распространения тебе л- мние
Puumala Рыжая прибрежная по- левка (Clethrionomys giareolus) - Пояс от Франции и Скандинавии до озера Байкал, северная Испа- ния. северная Италия, западная Турция, север- ный Казахстан, Алтай- ские и Саянские горы. Великобритания и Ир- ландия ЭН
Seoul Крысы (Rattus norvegi cus, Rattus rattus) Повсеместно ГЛПС
Tuia Обыкновенная полевка (Microtus arvahs) Пояс от центральной и северной Испании до Черного моря, южный и северо-восточный Урал ГЛПС
Хантавирусы Нового Света
Andes Oran Длиннохвостая карли ковая рисовая крыса (Oligoryzomys longicaudatus) Северные, центральные и южные Анды на тер ритории Аргентины и Чили ХЛС
Bayou Болотная рисовая крыса (Oryzomys palustris) От юго-восточного Кан- заса до восточного Те- хаса, южный Нью- Джерси, островная Флорида ХЛС
Bermejo Карликовая рисовая крыса Чако (Oligoryzomys chacoensis) Западный Парагвай, юго-восточная Боливия, западная и центральная Бразилия, северная Ар гентина ХЛС
Chocklo Бурая карликовая рисо- вая крыса (Oligoryzomys chacoensis) Мексика Бразилия, Эк- вадор, Гвиана ХЛС
Laguna Negra Вечерняя мышь (Calomys laucha) Северная Аргентина и Уругвай, юго-восточная Боливия, западные Па рагвай и Бразилия ХЛС
Maciel Темная полевка (Necromys benefactus) Аргентина ХЛС
Sin Nombre Оленья мышь (Peromyscus manicuiatus) Аляска, северная Кана- да, большая часть США ХЛС
New York Белоногая мышь (Peromyscus feucopus) Канада, США, Мексика ХЛС
Геморрагическая лихорадка с почечным синдромом
255
ПАТОГЕНЕЗ
Имеются указания на то, что к ГЛПС, ЭН и ХЛС, индуцированным хан-
тавирусами, имеется наследственная предрасположенность, маркерами ко-
торой могут служить носительство HLA-B8, DRB1 *0301 и HLA-DQ2 алле-
лей главного комплекса гистосовместимости. Показано также, что наличие
аллеля HLA-B35 обусловливает более тяжелое течение ГЛПС. Тем не ме-
нее генетические детерминанты, очевидно, не играют решающей роли в раз-
витии органного поражения при хантавирусной инфекции, клинические
проявления которой часто формируются и у тех, у кого соответствующие
маркеры отсутствуют.
Хантавирусы проникают преимущественно в макрофаги и эндотелио-
циты преимущественно почечных и легочных сосудов. Проникновение хан-
тавируса в клетку-мишень осуществляется путем взаимодействия с распо-
ложенным на клеточной мембране ннтегрином aJS, с последующим
эндоцитозом. В цитоплазме активация вирусной РНК-зависимой РНК-
полимеразы обусловливает транскрипцию фрагментов вирусной РНК. Бел-
ки вирусного нуклеокапсида и м-РНК РНК-полимеразы транслируются на
свободных рибосомах, а м-РНК гликопротеидов — в эндоплазматических
ретикулумах. Окончательная подготовка глнкопротеидов G, и G2 заверша-
ется их гликозилированием в аппарате Гольджи. В цитоплазме формируют-
ся крупные тельца-включения, состоящие из нуклеокапсида, а сборка ви-
русных частиц происходит на мембранах аппарата Гольджи. Цитопатически.м
действием на клетки-мишени (эндотелиоииты, макрофаги) хантавирусы не
обладают. Тем не менее установлена возможность индукции ими клеточно-
го апоптоза (в том числе апоптоза эмбриональных почечных клеток), игра-
ющего, по-видимому, не последнюю роль в дальнейшем тканевом повреж-
дении.
Макрофаги, инфицированные хантавирусами, начинают увеличивать
продукцию интерферонов, однако темпы роста их секреции меньше, чем у
интактных клеток макрофагального ряда. В ткани, где присутствуют ханта-
вирусы, также быстро мигрируют NK-клетки (естественные киллеры). Кро-
ме того, хантавирусная инфекция всегда приводит к тканевой активации
мембран-атакуюшего комплекса комплемента (С5Ь-С9).
Инфицирование хантавирусами всегда сопровождается продукцией
специфических IgA, IgM и IgG; титры последних нарастают в дальнейшем в
фазу реконвалесценцнн. Наряду с этим уже в начале острой фазы хантави-
русной инфекции увеличивается продукция специфических IgE, приводя-
щая к увеличению экспрессии и секреции интерлейкина-lp и трансформи-
рующего фактора роста-p, обусловливающих неконтролируемый рост
проницаемости эндогелиоцитов.
256
Нефрология. Неотложные состояния
Острая фаза хантавирусной инфекции сопровождается гнперпродукци-
ей ряда тканьдеструктивных цитокинов и хемокннов, в том числе сс-фактора
некроза опухолей, концентрация которого коррелирует с тяжестью клини-
ческих проявлений. Некоторые воспалительные цитокины могут опреде-
ляться в моче. Воспалительные цитокины, хемокины, а также маркеры
острофазового ответа, очевидно, играют центральную роль в развитии эндо-
телиальной дисфункции, следствием которой является формирование ор-
ганного повреждения, реализуемого при резком увеличении объема внутри-
клеточной жидкости за счет проникновения в нее жидкой части плазмы, а
также нарастающих расстройств системного и тканевого гемостаза.
Таким образом, формирование и прогрессирование органных пораже-
ний определяется в первую очередь нарастающей дисфункцией эндотелио-
питов с резким увеличением проницаемости эндотелия и расстройством
систем гемостаза, нередко достигающим степени Д ВС-синдрома. Пропоте-
вание жидкой части плазмы в ткани-мишени и расстройство органной гемо-
динамики с образованием тромбов в микроциркуляторном русле и одновре-
менным формированием очагов кровоизлияний определяют формирование
недостаточности функций соответствующих органов — почек и легких.
МОРФОЛОГИЯ
При ГЛПС почки увеличены, под капсулой и в корковом веществе обна-
руживают кровоизлияния. Легкие отечны, в них также обнаруживаются
очаги кровоизлияний. Из-за отечной жидкости масса легких может в два
раза превышать нормальные значения. При развитии ДВС-синдрома крово-
излияния могут также быть обнаружены в коже и подкожно-жировой клет-
чатке, надпочечниках, головном мозге.
При микроскопическом исследовании ткани почек выявляют признаки
тубуло-интерстициального нефрита — инфильтраты из иммунокомпетент-
ных клеток, очаги кровоизлияний в интерстиций. Канальцевые эпителио-
циты и эндотелиоциты капилляров отечиы, многие интерстициальные ка-
пилляры спавшиеся, в их просвете могут обнаруживаться тромбы.
Изменения клубочков носят вторичный характер.
КЛИНИЧЕСКАЯ КАРТИНА
В зависимости от типа хантавируса заболевание может развиваться по
трем клиническим вариантам (табл. 16.2). ЭН нередко своевременно не рас-
познают; ГЛПС и ХЛС нередко становятся неотложным состоянием и мо-
гут быстро приводить к смерти.
Геморрагическая лихорадка с почечным синдромом
257
Таблица 16.2
Клинические варианты мантавирусной инфекции
Вариант ханта вирусной инфекции Клинические признаки
I Геморрагическая лихорад- ка с почечным синдромом Признаки почечного поражения • нарастающие гиперкреатининемия / снижение скорости клубочковой фильтрации. • олигоанурия. • гематурия, в т.ч. макрогематурия. • протеинурия (может достигать 3 г/сутки); • боли в пояснице (могут отражать кровоизлияние под почеч- ную капсулу); • гиперкалиемия; • гипонатриемия. Признаки геморрагического синдрома: • петехии на мягком небе (один из наиболее ранних призно ков, может опережать поражение почек); • геморрагическая кожная пурпура; • кровоизлияния в конъюктиву; • кровоизлияния в серозные полости и паренхиматозные ор ганы, • тромбоцитопения; • увеличение сывороточной концентрации D-димера. Общие признаки: • лихорадка; • покраснение лица и верхней половины гуловища; • артериальная гипотензия; • лейкоцитоз; • увеличение СОЭ, • боли в животе, • тошнота, рвота; • энцефалопатия (судороги, нарушение сознания)
Эндемическая нефропа- тия • Умеренное ухудшение фильтрационной функции почек; • микрогематурия; • умеренная протеинурия; • боли в пояснице; • транзиторная тромбоцитопения; • кожная геморрагическая сыпь
Хантавирусный легочный синдром • Дебкг с гриппоподобным синдромом (лихорадка, артрал- гии, катаральные явления, миалгии, головная боль). • нейтрофильный лейкоцитоз; • тромбоцитопения; • гемоконцентрация с подъемом гематокрита; • отек легких с возможным геморрагическим альвеолитом (респираторный дистресс-синдром); • артериальная гипотензия. • гемодинамическая (преренальная) острая почечная недо- статочность
9 Нефрология
258
Нефрология. Неотложные состояния
При ГЛПС инкубационный период составляет от 7 до 36 часов. В кли-
ническом течении выделяют 5 фаз, в каждой из которых ведущее значение
приобретают разные симптомы:
• фебрильная (3—4-й дни болезни);
• гипотензивная (на 3—6-й день с момента начала лихорадки);
• олигурическая (начиная с 8-го дня заболевания);
• фаза восстановления диуреза (начиная с 11-го дня болезни);
• фаза реконвалесценции (3—6 месяцев с момента начала забо лева-
ния).
ЭН начинается внезапно, однако нередко может быть практически бес-
симптомной, характеризуясь преимущественно лабораторными проявле-
ниями. Полиурию нередко отмечают уже на 3-й день болезни.
При ХЛС в течение 2—14 суток развиваются артериальная гипотензия и
некардиогенный отек легких. У выживших регресс органных поражений с
восстановлением функции происходит на 5—7-й день.
ДИАГНОСТИКА
В диагностике ГЛПС учитывают данные, полученные при изучении
анамнеза и анализе клинических проявлений. Подтверждают хантавмрус-
ную инфекцию обнаружением (методом ELISA) антител класса IgM, ука-
зывающих на остроту заболевания. Титр антител класса IgM максимален
между 8-м и 25-м днями заболевания. Следует иметь в виду, что используе-
мые для постановки реакции ELISA антитела к нуклеокапсиду вируса
Puumala могут вступать во взаимодействие с нуклеокапсидом вируса Han-
taan, а антитела к нуклеокапсиду вируса Hantaan не реагируют с нуклеокап-
сидом вируса Puumala. Высокоточными методами диагностики хантавирус-
ной инфекции являются иммунохроматография и полимеразная цепная
реакция, но они пока не нашли применения в широкой клинической прак-
тике.
ЛЕЧЕНИЕ
В большинстве случаев лечение ГЛПС ограничивается только симпто-
матическими и патогенетическими методами.
При развитии ДВС-синдрома используют свежезамороженную плазму,
при выраженной тромбоцитопеиин возможна трансфузия тромбоцитарной
массы. При развитии артериальной гипотензии целесообразна инфузия фи-
зиологического раствора, инфузия коллоидных и кристаллоидных раство-
ров — для коррекции гиповолемии, электролитных нарушений и артериаль-
ной гипотензии.
Геморрагическая лихорадка с почечным синдромом
259
При ГЛПС риск геморрагических осложнений и острой сердечной недо-
статочности, сопряженный с проведением острого гемодиализа, очень ве-
лик. Кроме того, гемодиализ малоэффективен для устранения проявлений
энцефалопатии и некардиогенного отека легких, в патогенезе которых веду-
щее значение имеет практически неустранимое с помощью аферезных и
диализных методов лечения расстройство органного кровообращения, свя-
занное в том числе с интенсивным тромбогенезом в микроциркуляторном
русле. При выраженной острой почечной недостаточности с установленной
гипергидратацией и кардиогенным отеком легкого возможно проведение
артериовенозной улы рафильтрации
При хантавирусных инфекциях уточняют показания и режимы приме-
нения противовирусных препаратов. Накоплен определенный опыт клини-
ческого применения рибавирина, назначение которого оправдано, по-
видимому, только в острую фазу заболевания, характеризующуюся активной
репликацией вируса Эффективность влияния рибавирина на основные
клинические проявления почечного поражения удалось подтвердить не во
всех клинических исследованиях. К тому же следует иметь в виду, что при-
менение рибавирина может приводить к мутациям хантавируса, в результа-
те которых эффективность этого препарата может быть утрачена, а вирус
может приобрести способность ускользать от иммунного ответа хозяина
Интерфероны при хантавирусной инфекции не эффективны. Эффек-
тивными могут оказаться некоторые биологические препараты, в частности
рекомбинантный интерлейкин-2, позволяющий добиться достоверно более
выраженного регресса креагннннемии, чем это наблюдается у пациентов, не
получающих данного препарата.
Таким образом, при ГЛПС, ЭН и ХЛС общие принципы лечения долж-
ны быть аналогичны используемым при других вирусных инфекциях, для
которых противовирусные препараты отсутствуют или малоэффективны.
Более обоснованными можно считать только симптоматические меры, на-
правленные на коррекцию метаболических и электролитных нарушений,
гемодинамических расстройств, а также Д ВС-синдрома.
ПРОГНОЗ
При ЭН острая почечная недостаточность н летальный исход наблюда-
ются не более чем у 1% пациентов. ХЛС приводит к смерти более чем у 50%
больных. Смертность прн ГЛПС, как правило, не превышает 15%.
Опыт длительного наблюдения за реконвалесцентами ГЛПС позволяет
утверждать, что у части этих пациентов формируются признаки хрониче-
ской болезни почек. Результаты сравнения переболевших с пациентами
260
Нефрология. Неотложные состояния
контрольной группы показало, что у лиц, перенесших ГЛПС, обнаружива-
ют более высокие значения альбуминурии и систолического АД, СКФ у
них чаще оказывается выше юш ниже нормального диапазона, и почти у
15% переболевших выявляют признаки канальцевой дисфункции. Следова-
тельно, ГЛПС может играть роль одной из эпидемически значимых причин
формирования хронической болезни почек в первую очередь в очагах хан-
тавирусной инфекции.
ПЕРСПЕКТИВЫ
Перспективы в лечении хантавирусной инфекции определяются разра-
боткой вакцин, в том числе получаемых из трансгенных животных и расте-
ний — продуцентов соответствующих антител. Так. в настоящее время в
Южной Корее доступна инактивированная формалином вакцина против
вируса Hantaan — коммерческое название Ifantavax. Наряду с новыми про-
1 и новируемыми препаратами для лечения хантавирусной инфекции могут
быть использованы и рекомбинантные нейтрализующие антитела. Кроме
того, для ГЛПС и ХЛС прогноз может быть улучшен в случае внедрения
новых патогенетических препаратов, разработанных для лечения ЛВС-
синдрома и респираторного дистресс-синдрома (например, рекомбинантно-
го легочного сурфактанта/ Необходимо также совершенствование проти-
воэпидемических мероприятий, в частности своевременной дератизации.
Неотложные мероприятия
• Оценивать в динамике креатининемию, СКФ, калиемию и натриемию.
• Периодически выполнять общий анализ мочи и количественную оцен-
ку гематурии.
• Периодически выполнять общий анализ крови с подг четом количе-
ства тромбоцитов.
• Проводить мониторинг АД, ЧСС и ЭКГ.
• Определить показатели коагулограммы н вести их мониторинг, иссле-
довать плазменную концентрацию D-димера.
• Проводить ультразвуковое исследование почек с целью обнаружения
их спонтанного разрыва.
• Проводить инфузию физиологического раствора, кристаллоидных и
коллоидных растворов с целью коррекции гиповолемии.
• При появлении признаков Д ВС-синдрома — осуществлять трансфу-
зии свежезамороженной плазмы.
Глава 17
ОСТРАЯ НЕФРОПАТИЯ. ВЫЗВАННАЯ
ПРИМЕНЕНИЕМ ИНГИБИТОРОВ
КАЛЬЦИНЕЙРИНА
Разработка и внедрение в клиническую практику ингибиторов киль-
цмнейрина — циклоспорина, FK506 (такролимуса) — позволило радикаль-
но изменить судьбу пациентов — реципиентов органных трансплантатов
(почки, сердца, печени), значительно увеличив продолжительность их
жизни во многом за счет снижения риска возникновения свойственных
другим цитостатикам нежелательных явлений и увеличения привержен-
ности длительному лечению. Кроме того, в течение последних 15 лет зна-
чительно расширились показания к назначению ишибиторов кальцинеири-
на как для лечения системных заболевании (системной красной волчанки,
ревматоидного артрита), так и для лечения хронических заболеваний по-
чек — стероид-резистентной формы болезни с минимальными изменения-
ми у взрослых, первичного фокально-сегментарного гломерулосклероза,
волчаночного нефрита.
Селективный механизм действия ингибиторов кальцинейрина, предо-
пределяющий значительно меньший, чем у ранее применявшихся цитоста-
тиков спектр возможных нежелательных явлений, заключается в специфи-
ческом и обратимом ингибировании GO- и G 1-фаз клеточного цикла
иммунокомпетентных Т-лимфоцитов, нарушении их дифференциации и
пролиферации с одновременным угнетением синтеза и высвобождения
интерлейкина-2. Циклоспорин А формирует комплекс с циклофилином.
Этот комплекс подавляет активность кальцинейрина, что приводит к нару-
шению дефосфорилирования и перемещения в ядро ядерного фактора ак-
тивированных Т-клеток, усиливающего транскрипцию и продукцию
интерлейкина-2 (ИЛ-2) и друшх цитокинов, стимулирующих рост и про-
лиферацию Т- и В-клеток. Таким образом, циклоспорин А ингибирует про-
дукцию ИЛ-2, что приводит к нарушению пролиферации и активации лим-
фоцитов.
Вместе с тем течение ингибиторами кальцинейрина удается осущест-
влять далеко не у всех пациентов (даже при наличии абсолютных показа-
ний) в связи с развитием некоторых нежелательных явлений, сопряженных
с их использованием, одним из наиболее тяжелых среди которых является
нефротоксическое поражение. (Острую и хроническую циклоспориновую
нефропатию удалось воспроизвести в эксперименте на различных живот-
262
Нефрология. Неотложные состояния
ных моделях.) Неблагоприятные почечные последствия иногда бывают за-
метны уже при первой попытке применения циклоспорина иди такролиму-
са и обусловливают отмену или существенное уменьшение дозы этих
препаратов как у реципиентов органных трансплантатов, в том числе по-
чечного, так и у пациентов, страдающих хроническими болезнями почек и/
или системными заболеваниями.
ЭПИДЕМИОЛОГИЯ
Точная распространенность острой циклоспориновой нефропатии не
установлена, одиако следует иметь в виду, что ее развитие вероятно у всех
больных, которым был впервые назначен циклоспорин. По-видимому, риск
острого поражения почек, индуцированного мш ибиторами кальцинейрнна,
несколько меньше у получающих такролимус (FK 506). Частота острой ци-
клоспориновой нефропатии, вероятно, несколько выше в некоторых груп-
пах риска.
Более четко охарактеризована эпидемиология хронической нефропа-
тии, связанной с приемом ингибиторов кальцинейрнна, далеко не всегда
являющейся производной острой нефротоксической реакции на эти препа-
раты. По некоторым данным, признаки почечного повреждения удается
выявить при биопсии почти у 70% реципиентов органных трансплантатов,
постоянно получающих циклоспорин в течение двух лет. Часть случаев
хронической циклоспориновой нефропатии остается вообще не диагности-
рованной в связи с тем, что морфологические ее признаки могут значитель-
но опережать появление клинических, в том числе ухудшение функции
почек.
ЭТИОЛОГИЯ
Несмотря на то что проявления острой циклоспориновой нефропатии
могут быть отмечены очень быстро после начала приема ингибиторов каль-
цинейрина, индивидуальная, в том числе генетическая, предрасположен-
ность, по-видимому, не играет существенной роли в ее развитии. Вероят-
ность развития нефротоксических эффектов после применения ингибиторов
кальцинейрнна возрастает по мере увеличения дозы (показано, что для раз-
вития хронической циклоспориновой нефропатии доза этого препарата
должна составлять не меиее 5 мг/кг/сутки)т а также при использовании
комбинации циклоспорина или гакролимуса с сиролимусом или эвероли-
мусом или нестероидными противовоспалительными препаратами.
Острая нефропатия, вызванная применением ингибиторов кальцинейрина
263
ПАТОГЕНЕЗ
Формирование острого почечного поражения, индуцированного инги-
биторами кальцинейрина, подразумевает участие нескольких взаимодопол-
няющих механизмов, значение каждого из которых у конкретного пациента
может различаться. Общепризнано, что первоочередными мишенями ток-
сического воздействия циклоспорина являются почечное микроциркуля-
торнос русло и структуры тубуло-интерстиция.
Генерализованная вазококонстрикция внутрипочечных артериол — одно
из первоочередных и наиболее клинически значимых последствии назначе-
ния ингибиторов кальцинейрина. При индуцированном этими препаратами
стойком артериолярном вазоспазме неизбежно ишемизируются почечные
канальцы: одним из наиболее ярких проявлении их дисфункции является
гиперкалиемия. Острая нефропатия характеризуется вазоконстрикцией
афферентных и, в меньшей степени, эфферентных артериол, вызванной на-
рушением баланса синтеза вазоактивных веществ. Значительная роль отво-
дится воздействию ангиотензина II, тромбоксана А2, эндотелина-1, а также
уменьшению действия вазодилататоров — простациклина и NO. Персисти-
рующая констрикция афферентной и эфферентной артериол почечного
клубочка обусловливает снижение СКФ, обеднение гломерулярного крово-
тока всегда приводит к дальнейшему усугублению гипоперфузии почечного
тубуло-интерстиция.
Патогенез острой нефропатии, индуцированной ингибиторами кальци-
нейрина, подразумевает вовлечение гломерулярных эндотелиоцитов с на-
рушением их функции. Одной из его составляющих является интенсивная
эндотелиальная продукция медиаторов вазоконстрикции (эндотелина-1,
ангиотензина II), усиливающих вазоспазм, почечное сосудистое сопротив-
ление и тканевую гипоксию. Так, на экспериментальной модели острой ци-
клоспориновой нефропатии было показано, что назначение антагониста
эндотелина-1 (босентана) и ингибитора АПФ (периндоприла) приводило к
увеличению почечного кровотока и снижению почечного сосудистого со-
противления, исходно неблагоприятно измененных под действием цикло-
спорина. Антагонист эндотелина-1 и ингибитор АПФ также обусловливали
достоверное увеличение диуреза.
Ухудшение внутрипочечной гемодинамики, развивающееся в условиях
индуцированной циклоспорином гиперпродукции ангиотензина П и
эндотелина-1, осуществляемой преимущественно гломерулярными эндоте-
лиоцитами, обусловлено в основном их констрикторным действием на при-
носящие артериолы почечного клубочка. Продемонстрировано, что под
действием циклоспорина экспрессия эндотелина-1 возрастает еще и в эпи-
телиоцитах проксимальных почечных канальцев. Внутрипочечная актива-
ция системы эндотелипов наблюдается также и под действием такролимуса,
264
Нефрология. Неотложные состояния
вызывающего генерализованную внутрипочечную вазоконстрикцию и сни-
жение скорости клубочковой фильтрации у спонтанных гипертензивных
крыс уже в течение первых двух недель применения. Протективный эффект
в отношении провоцируемых циклоспорином и такролимусом нарушений
внутрипочечной гемодинамики оказывают антагонисты эндотелина-1.
Ингибиторы кальцинейрнна активируют рецепторы ие юлько к пред-
ставителям семейства эндотелинов, ни и к другим медиаторам вазо-
констрикции, например аденозину, обусловливающему острый спазм
преимущественно выносящей клубочковой артериолы с последующим
усугублением внутри клубочковой гипертензии и дальнейшим обеднени-
ем тубуло-интерстициального кровотока. Установлено, что при активации
циклоспорином почечных адеиозиновых рецепторов развиваются рас-
стройства процесса эндотелии-зависимой вазодилатации В свою очередь,
индуцированные ингибиторами кальцинейрнна негативное влияние аде-
нозина на почечный кровоток и скорость клубочковой фильтрации могут
быть существенно уменьшены с помощью его фармакологических антаго-
нистов, в частности меги л ксантинов (эуфиллина, теофиллина).
Уже при острой циклоспориновой нефропатии ишемическое поврежде-
ние почечного тубуло-интерстиция и нарушение функции гломерулярных
эндотелиоцитов дополняются повреждающим действием супероксид-иона
и перекисей — так называемым оксидантным стрессом. Одновременно воз-
растает продукция медиаторов фиброгенеза (трансформирующего фактора
роста-p — TGF-p), фибронектина и коллагена I типа, а также медиаторов
эндотелий-зависимого звена гемостаза (ингибитора активатора плазмино-
гена типа 1 — PAI-1). Под действием циклоспорина гломерулярные эндоте-
лиопиты начинают продуцировать тромбоксан В2, и именно поэтому раз-
виваются не только персистирующая вазоконстрикция и дисфункция
гломерулярных эндотелиоцитов, но и почечная тромбсиическая микроан-
гиопатия, которая представляет собой самостоятельный механизм генера-
лизованного поражения микроциркуляторного сосудистого русла почек
центрального звена патогенеза острой циклоспориновой нефропатии. Под
действием ингибиторов кальцинейрнна возможно развитие гемолитико-
уремического синдрома с острой почечной недостаточностью.
Расстройство внутрипочечной гемодинамики, провоцируемое ингиби-
торами кальцинейрнна, нарастает также в связи с угнетением эндотелий-
зависимых систем вазодилатации. Показано, что усиление продукции
супероксид-ионов гломерулярными эндотел ионитам и. наблюдающееся при
назначении циклоспорина, сопровождается снижением активности эндоте-
лиальной NO-синтазы и продукции NO, что приводит к дальнейшему ухуд-
шению внутрипочечной гемодинамики н падению скорости клубочковой
фильтрации, частично устраняемым при инфузии экзогенных донаторов
NO, например Н-нитро-Ь-аргинин-метилэстера (L-NAME).
Острая нефропатия, вызванная применением ингибиторов кальцинейрина
265
Рост системного АД, наблюдающийся при острой циклоспориновой не-
фропатии, во многом обусловлен нарастающей задержкой натрия и воды,
определяющих натрий- объем-зависимый характер артериальной гипертен-
зии. Задержка натрия частично обусловлена нарушением функционирова-
ния соответствующих транспортных систем, связанным с ишемическим по-
вреждением канальцевых эпителиоцитов (этим же обстоятельством
объясняется типичный для острой циклоспориновой нефропатии подъем
сывороточной концентрации калия). Кроме того, установлено, что под
действием циклоспорина может увеличиваться экспрессия рецепторов к
альдостерону, а возможно, и синтез этого гормона.
Определенную роль в формировании острого почечного поражения, вы-
званного ингибиторами кальцинейрина, Moiyr играть провоцируемые эти-
ми препаратами обменные нарушения — дислипопротсидемия, гиперглике-
мия. несколько в большей степени присущая такролимусу, гиперурикемия
и гипергомоцистеииемия. Избыток мочевой кислоты и ее солей, а также го-
моцистеина окалывают непосредственное повреждающее действие на эпи-
телиоциты почечных канальцев.
Таким образом, острая циклоспориновая нефропатия предполагает уча-
стие двух взаимно дополняющих механизмов — генерализованного пораже-
ния почечного микроциркуляторного русла и повреждения почечных ка-
нальцев. При своевременной отмене этих препаратов прогрессирование
указанных процессов может быть приостановлено.
МОРФОЛОГИЯ
Острая циклоспориновая нефропатия может развиваться уже через не-
сколько часов после приема циклоспорина, но является обратимой — в от-
тичие от хронической циклоспориновой нефропатии, при которой развива-
ются структурные повреждения почечной ткани Морфологические
изменения при острой нефропатии, вызванной такролимусом, аналогичны
таковым при нефропатии, вызванной циклоспорином.
Гистологические исследования при острой циклоспориновой нефропа-
тии выявляют вакуолизацию клеток проксимальных канальцев, в которых
определяются гигантские митохондрии, крупные лизосомы и микрокальци-
фикаты. Электронно-микроскопические исследования показали, что вакуо-
лизация является результатом дилатации эндоплазматического ретикулу-
ма. Кроме того, могут наблюдаться дегенеративные изменения, некроз/
апоптоз отдельных гладкомышечных клеток артериол, отек »ндотелиаль-
ных клеток, утолщение интимы, гиалиноз, отложения мукоидного вещества
в стенках артериол. Все это приводит к значительному сужению просвета
артериол.
266
Нефрология. Неотложные состояния
Известны случаи развития тромботической микроангиопатии в резуль-
тате применения циклоспорина у пациентов после трансплантации почки.
Хотя механизм полностью не изучен, определенная роль отводится токси-
ческому воздействию препарата на эндотелиальные клетки. При гистологи-
ческом исследовании наблюдают признаки тромботической микроангиопа-
тии с тромбами, состоящими из тромбоцитов и фибрина, в капиллярах
клубочков и сосудах почек и небольшую воспалительную инфильтрацию.
Морфологически острую циклоспориновую нефропатию несложно
дифференцировать от хронической, приводящей к необратимом}' наруше-
нию почечной функции и характеризующейся тубуло-интерстициальным
фиброзом и специфической артериолопатией, отличительной чертой кото-
рой является присутствие в стенках артериол концентрически расположен-
ных депозитов на месте некротизированных гладкомышечных клеток. В на-
стоящее время типичная циклоспорин-ассоциированная артериолопатия
практически не встречается в связи с уменьшением применяемых доз пре-
парата. Чаще можно увидеть очаговый или диффузный гиалиноз стеиок со-
судов, мукоидное набухание интимы, что приводит к сужению просвета со-
суда. Тубуло-интерстициальный фиброз характеризуется наличием очагов
интерстициального фиброза в виде полосок и избыточным накоплением
внеклеточного матрикса (ВКМ). Также отмечается атрофия канальцев.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления острой циклоспориновой нефропатии вклю-
чают артериальную гипертензию и ухудшение фильтрационной функции
почек, дополняемое расстройством функции канальцев, что в свою очередь
обусловливает нарушение электролитного гомеостаза Кроме того, при
острой нефропатии, индуцированной ингибиторами кальцинейрина, .могут
наблюдаться соответствующие обменные нарушения (табл. 17.1).
Таблица 17’
Клинические проявления острой нефропатии,
обусловленной применением ингибиторов кальцинейрина
Тип нарушения Клини«искоа проявление и/мли^гокарак аристикл
Артериальная гипертензия - Натрий-объем-зависимый характер; резистентность к комбинированной антигипертензивной терапии
Ухудшение фильтрационной функции почек Снижение скорости клубочковой фильтрации и гиперкре атининемия. Очень быстрое ухудшение фильтрационной функции почек может указывать на индуцированный ин-м- биторами кальцинейрина гемолитико-уремический син- дром
Острее нефропатия, вызванная применением ингибиторов кальцинейрнна
267
Продолжение табл. 17.1
Тип нарушай» я К ла ническоа проявление и/или его характеристика
Канальцевая дисфункция Задержка натрия; гиперкалиемия, обусловленная нарушением экскреции натрия; почечные потери магния с гипомагниемией
Обменные нарушения Дислипопротеидемия; гиперурикемия с суставной, тофусной подагрой и усугу- бляющей почечную недостаточность обструкцией почеч- ных канальцев уратами, тощаковая гипергликемия; гипергомоцистеинемия
ДИАГНОСТИКА
Диагностика острой нефропатии, индуцированной ингибиторами каль-
цинейрина, основана на тщательном мониторинге показателей, характери-
зующих фильтрационную функцию почек (креатининемии расчетной ско-
рости клубочковой фильтрации), мониторинге сывороточной концентрации
калия и мочевой кислоты, сопоставлении данных анамнеза (продолжитель-
ности приема ингибиторов кальцинейрнна и их доз), а также клинических
(выраженности н темпа нарастания артериальной гипертенаии) и лабора-
торных (показателей, характеризующих обмен липопротеидов, гликемии,
урикемии) параметров. Для дифференциальной диагностики острой не-
фропатии. индуцированной ингибиторами кальцинейрнна, н острого оттор-
жения почечного трансплантата целесообразна биопсия почки. Следует
иметь в виду, что первые морфологические признаки острой индуцирован-
ной ингибиторами кальцинейрнна нефропатии появляются между 3-м и
12-м месяцами постоянного приема циклоспорина или такролимуса.
ЛЕЧЕНИЕ
Спефицические методы лечения острой нефропатии, индуцированной
ингибиторами кальцинейрнна, не разработаны. При появлении ее призна-
ков, как правило, приходится отменять циклоспорин или такролимус. По-
видимому, вероятность развития острой нефропатии при применении инги-
биторов кальцинейрина может быть уменьшена за счет минимизации числа
одновременно принимаемых пациентом лекарств, в том числе исключения
нестероидных противовоспалительных препаратов.
268
Нефрология. Неотложные состояния
Для лечения артериальной гипертензии, возникающей вследствие остро-
го нефротоксического действия ингибиторов кальцинейрина, наиболее обо-
снованно использовать дигидропиридиновые антагонисты кальция. В не-
больших клинических исследованиях с успехом применяли нифедипин.
В 2-летнем контролируемом исследовании показано, что применение дли-
тельно действующего дигидропиридинового антагониста кальция — лацвди-
пина — в большей степени позволяет сохранить функцию почек у пациентов,
постоянно принимающих циклоспорин. В настоящее время получен первый
положительный опыт применения при острой циклоспориновой нефропатии
карведилола, приводящего к снижению АД, улучшению внутрипочечной ге-
модинамики и уменьшению повреждения почечной ткани оксидантами.
Перспективными для изучения при острой циклоспориновой нефропа-
тии являются донаторы NO, в том числе пролонгированные нитраты, ме-
тилксангины и антагонисты эндотелина-1. Нуждается в дальнейшем уточ-
нении обоснованность назначения N-ацетил цистеина (показана его
способность улучшать клиренс креатинина и предупреждать появление вы
раженных морфологических признаков циклоспориновой нефротоксично-
сти), в том числе профилактического. Необходимо также дополнительное
исследование протекторов тканей от гипоксии, в том числе триметазидина,
показавшего высокую эффективность для сохранения почечной функции и
торможения процессирования почечного поражения, что было оценено
при морфологическом исследовании. При экспериментальной острой ише-
мической почечной недостаточности применение триметазидина позволяет
уменьшить активацию медиаторов перекисного окисления, клеточного и
митохондиального отека канальцевых эпителиоцитов; одновременно сни-
жается интенсивность инфильтрации почечной ткани воспалительными
клетками. Если сравнивать с животными, не получавшими лечения, то мож-
но сказать, что у особей, получавших триметазидин, после эпизода ишемии-
реперфузии происходит достоверное увеличение концентрации АТФ и
АДФ в почечной ткани. Кроме того, использование триметазидина при
острой ишемической почечной недостаточности приводит к уменьшению
креатининемии и повышению выживаемости животных.
При развитии угрожающей жизни гиперкалиемии (> 6,5 мЭкв/л) необ-
ходимо обсуждать выполнение экстренного гемодиализа Назначение глю-
кокортикостероидов при острой нефропатии, индуцированной ингибитора-
ми кальцинейрина, необоснованно. Польза от антигиперлипидемических
препаратов (статинов, фибратов) в данном случае не установлена, тем более
что их трудно сочетать с циклоспорином в связи с увеличением риска про-
вокации воспалительной миопатии и синдрома печеночного цитолиза Не
отработаны также терапевтические подходы к коррекции гиперурикемин н
гипергомоцистеинемии.
Острая нефропатия, вызванная применением ингибиторов кальцинейрина
269
ПРОГНОЗ
При своевременной отмене ингибиторов кальцинейрина провоз срав-
нительно благоприятен. Индуцированным ингибиторами кальцинейрина
гемолитико-уремический синдром нередко приводит к необратимому ухуд-
шению функции почек.
Неотложные мероприятия
• Отменить циклоспорин или такролимус.
• Обеспечить мониторинг АД и биохимических показателей крови (та-
ких, как креатининемия, калиемия, урикемия, гликемия), а также рас-
четной скорости клубочковой фильтрации.
• Для лечения артериальной гипертензии назначить антагонисты каль-
ция (при выраженном и иекупируемом подъеме АД — нифедипин н/
и ти короткодействующие — верапамил или дилтиазем, возможно при-
менять эти препараты в парентеральных формах; при отсутствии не-
обходимости в купировании гипертонического криза использовать
длительно действующие дигидропиридиновые).
• Возможно применять метилксантины (предпочтительнее — паренте-
рально), антагонисты альдостерона, пролонгированные нитраты, кар-
ведилол и триметазидин, однако польза от этих препаратов пока не
установлена.
Список
использованной литературы
1. Авдеев ВТ., Фомин В.В., Попова Е.Н. и др. Тубуло-интерстицальный
нефрит и фиброзирующий альвеолит, индуцированные сульфасалазином,
при язвенном колите. Тер. арх. 2006; 78(1): 77—79.
2. Алмазов ВЛ., Шляхто Е.В. Ленинградская блокадная гипертензия
Артериальная гипертензия. 1997; 3: 54—58.
3. Аникина Н.В., Гусева Н.Г., Мач Э.С. Нарушения микроциркуляции в
генезе склеродермической нефропатии. Тер. арх. 1986; 8: 62- 65.
4. Арабидзе Г.Г. Злокачественная артериальная гипертония. Кардиоло-
гия. 1985; 1: 5-11.
5. Бойцов С.А., Карпенко МА., Кучмин М.А. и др. Особенности клиниче-
ских проявлений артериальной гипертонии у жителей блокадного Ленин-
града (ретроспективный анализ архивных материалов). Тер. арх. 2000; 4-
54—58.
6. Варшавский ВЛ. Болезни почек, мочеточников, мочевого пузыря
В: Патология. Под ред. М.А. Пальцева, В.С. Паукова, Э.Г. Улумбекова —
М.: Гэотар-Медиа, 2002. С. 384—430.
7. Гусев Н.Г, Аникина Н.В., Щербаков А.Б. Применение каптоприла при
системной склеродермии. Тер. арх. 1992; 64(5): 100—102.
8. Гусева Н.Г. Системная склеродермия и псевдосклеродермические син-
дромы / Н.Г. Гусева. — М.: Медицина, 1993.
9. Гусева Н.Г. Системная склеродермия и псевдосклеродермические син-
дромы. — М.: Медицина, 1993.
10. Дударев М.В., Пименов Л.Т. Отдаленные исходы и формирование
хронической почечной недостаточности у перенесших геморрагическую ли
хорадку с почечным синдромом. Тер. арх. 2008; 6: 59—62.
11. Карпов ЮА., Мареев В.Ю., Чазова И.Е. Российские программы о цен
ки эффективности лечения фозиноприлом больных с артериальной гипер-
тонией и сердечной недостаточностью. Проект Три Ф (ФЛАГ. ФАСОН,
ФАГОТ). Сердечная недостаточность. 2003; 4(5): 2—6.
12. Кобалава ЖД.. Гудков К.М. Гипертонические кризы: существуют ли
реальные противоречия в классификации и лечении? Сердце. 2003; 2(3):
116-127.
Список использованной литературы
271
13. Козловская Л.В., Гордовская Н.Б., Малышко Е.Ю. и up. Клиническое
значение смешанной криоглобулинемии. Клин. мед. 2003; 4: 11—15.
14. КозловскаяЛ.В., Фомин В.В. Протеинурия и нефротический синдром.
Е.М. Шилов (ред.). Нефрология. Учебное пособие для послевузовского об-
разования. — М.: Гэотар-Медиа, 2007; 147—154.
15. Козловская НЛ. Нефропатия, ассоциированная с первичным анти-
фосфолипидным синдромом: клинико-морфологическая характеристика,
диагностика, лечение. Автореф. дисс. докт. мед. наук — М„ 2006.
16. Козловская НЛ. Тромбофилические состояния. Клии. фармакол. тер.
2003; 1:74-80.
17. Козловская НЛ., Боброва ЛА., Захарова Е.В. и др. Двусторонний сте-
ноз почечных артерий у больного первичным антифосфолипидным синдро-
мом, перенесшего гемолитико-уремический синдром (описание случая и
обзор литературы). Тер. арх. 2008; 6:69—73.
18. Козловская НЛ., Медведева ЕЮ., Мирошниченко И.Г., Качалов Ю.Р.
Тромбоз почечных вен при мебранозной нефропатии (обзор литературы и
описание случая). Тер. арх. 2000: 72(6): 71—73.
19. Козловская НЛ., Тареева И.Е., Камышева Е.С. и др. Поражение почек
при первичном антифосфолипидном синдроме. Тер. арх. 2001; 6: 25—31.
20. Козловская НЛ., Шахнова ЕА., Кушнир В.В., Шилов Е.М. Низкомоле-
кулярные гепарины в лечении АФС-нефропатии при первичном и вторич
ном антифосфолипидном синдроме. Тер. арх. 2004; 9:35—10.
21. Комитет экспертов РМОАГ/ ВНОК. Диагностика и лечение артери-
альной гипертензии Российские рекомендации (третий пересмотр). — М.,
2008.
22. Кутырина И.М., Клепиков П.В., Тареева И.Е. О роли рении-аигиотеи-
зииовой системы в патогенезе нефротического синдрома. Тер. арх. 1988;
6:32 -34.
23. Кутырина И. М., Мартынов С А., Швецов М.Ю. и др. Артериальная
гипертония при хроническом гломерулонефрите: частота выяв тения и эф-
фективность лечения. Тер. арх. 2004; 9: 10—15.
24. Кутырина И М, Швецов М.Ю., Мартынов С А. Ишемическая нефро-
патия. Нефрология и диализ. 2003; 5(1): 4 -8.
25. Лебедева М.В., Балкаров И.М., Шовская Т.Н. Острая уратная нефро-
патия—причина обратимой почечной недостаточности у молодого больно-
го. Тер. арх. 2006; 78(5): 69—71.
26. Метелева НА., Козловская Л.В. Поражение почек при антифосфоли-
пидном синдроме. Тер. арх. 2004; 9:91—96=
272
Нефрология. Неотложные состояния
27. Моисеев С.В., Фомин В.В. Нефрологические аспекты хронической
сердечной недостаточности. Тер. архив. 2003; 6:72—76.
28. Мухин НА. Снижение скорости клубочковой фильтрации—
общепопуляционный маркер неблагоприятного прогноза Тер. арх. 2007; 6:
5-10.
29. Мухин НА., Балкаров И.М. Подагрическая почка. В: Тареева И.Е.
(ред.) Нефрология: руководство для врачей. — М., 2000: 422—128.
30. Мухин НА., Балкаров И.М., Моисеев С.В и др. Хронические прогрес-
сирующие нефропатии и образ жизни современного человека. Тер. арх. 2004;
9: 5-10.
31. Мухин Н.А., Козловская Л.В., Малышко Е.Ю. и др. Криоглобулинеми-
ческий нефрит, ассоциированный с хронической инфекцией вируса гепати-
та С. Тер. арх. 2000; 6:1 —5.
32. Мухин И А., Козловская Л.В., Насонов Е.Л. и др. Клинические и наю-
генетические аспекты поражения почек, связанного с антителами к цито-
плазме нейтрофилов. Вести. РАМН. 1995; 5: 34—39
33. Мухин НА., Полянцева Л.Р., Хасабов Н.Н., Геворкян ГГ. Паранеопла-
стические реакции при злокачественных опухолях паренхимы ночек. Урол.
Нефрол. 1978; 4: 65— 67.
34. Мухин НА., Фомин В.В. Атеросклеротический стеноз почечных арте-
рий. Чазов Е.И., Кухарчук В.В., Бойцов С.А. (ред.) Руководство по атеро-
склерозу и ишемической болезни сердца. — М.: MediaMedita, 2007: 248 -
273.
35. Мухин НА., Фомин В.В. Отечный синдром: современное понимание
проблемы. Врач. 2008; 6: 7—12.
36. Мухин НА., Фомин В.В., Моисеев С.В. Эволюция представлений об
артериальной гипертонии в работах Е.М. Тареева. Тер. арх. 2006; 12: 9—15.
37. Мухин НА., ШоничевДТ., Балкаров И.М. и соавт. Формирование ар-
териальной ишертонии при уратном тубулоинтерстициальной поражении
почек. Тер. арх. 1999; 6: 12 -24.
38. Мясников А.Л. Гипертоническая болезнь и атеросклероз — М.: Мед-
гиз, 1965.
39. Нефрология. Под ред. Е.М. Шилова. — М.: ГЭОТАР-Медиа, 2007:306—
318.
40. Николаев А.Ю. Геморрагическая лихорадка с почечным синдромом.
В: Тареева И.Е. (ред.) Нефрология. Руководство для врачей. — М.: Медици
на, 2000: 572-577.
Список использованной литературы
273
41. ОССН ВНОК. Национальные рекомендации по диагностике и лече-
нию хронической сердечной недостаточности (второй пересмотр). Сердеч-
ная недостаточность. 2005; 2(36): 2-21.
42. Пальцев М.А., Серов В.В. Эндокринная система почек и нефрогенная
гипертензия. Тер. арх. 1987; 8: 110—113.
43. Полянцева Л.Р. Клиника и дифференциальный диагноз нефротиче-
ского криза. Тер. арх. 1985; 6: 46 -49.
44. Попова Е.Н., Фомин В.В., Пономарев А.Б., Кондарова О.В. Поражение
почек при саркоидозе. Тер. арх. 2006; 78(5): 82 - 86.
45. Рекомендации ВНОК по профилактике, диагностике и лечению арте-
риальной гипертонии (проект второго пересмотра). Кардиоваскулярная те-
рапия и профилатика. 2004; 3: 105—120.
46. CurtisJJ. Hypertension following kidney transplantation. Am. J. Kidney
Dis. 1994; 23: 471-475.
47. Самокишина НА., Козловская Н.Л., Шилов E.M. и op. Типы обостре-
ний волчаночного нефрита и их прогностическое значение. Тер. арх. 2008; 6:
10-14.
48. Семенкова Е.Н. Системные васкулиты. — М.. 1988.
49. Сиротин Б.З. Пути развития и особенности патологии почек при ге-
моррагической лихорадке. Тер. арх. 1981; 6: 64—67.
50. Сулимов В А., Удовиченко А.Е. Применение изоосмолярного контра-
ста для снижения частоты и клинического значения рентген-контрастной
нефропатии при сахарном диабете. Кардиология. 2008;48(5):51—55.
51. Сумароков А.В. Стенозирующий атеросклероз почечных артерий.
Сов. мед. 1952; 11:29-32.
52. Таранова М.В., Белокриницкая ОА., Козловская Л. В.. Мухин НА. «Ма-
ски» подострого инфекционного эндокардита. Тер. арх. 1999; 1: 47 -50.
53. Тареев Е.М. Гипертоническая болезнь. — М.: Медгиз, 1948.
54. Тареева И.Е., Полянцев Л.Р. Протеинурия и нефротический синдром
Тареева И.Е. (ред.) Нефрология. Руководство для врачей.—М.: Медицина,
2000: 124-131.
55. Тареева И.Е., Швецов М.Ю., Краснова Т.Н. и др. Артериальная гипер-
тония при волчаночном нефрите. Тер. арх. 1997; 6: 13—17.
56. Терещенко СП Гипертонические кризы: диагностика и лечение. В:
Чазов Е.И., Чазова И.Е. (ред.) Руководство по артериальной гипертонии. —
М.: МедиаМедика, 2005: 676 689.
274
Нефрологий Неотложные состояния
57. Томилина Н.А., Бирюкова Л.С., Егорова Е.Т. и др. Быстро прогресси-
рующий гломерулонефрит при АНЦА-ассоциированных васкулитах: тече-
ние, эффективность лечения, прогноз. Тер. арх. 2008; 6:15-24
58. Чазов Е И., Мухин НА., Жарова ЕА., Фомин В.В. Острая почечная не-
достаточность, обусловленная холестериновой эмболией внутрипочечных
артерий после коронароангиографии: успех лечения глкжокортикостерои
дами. Тер. арх. 2008; 8: 54—57.
59. Чазова И.Е., Фомин В.В. Резистентная артериальная гипертензия.
Тер. арх. 2008; 6: 80—85
60. Шальнова С А. Проблемы лечения артериальной гипертонии. Кар
диоваскул. терапия и профилактика. 2003; 3: 17—21.
61. Шилов Е.М., Козловская НЛ., Метелева НА. и др. Клинические про-
явления нефропатии, связанной с антифосфолмпидным синдромом, при
первичном антифосфолипидном синдроме. Тер. арх. 2003; 6: 22—27.
62. Шилов Е.М., Козловская НЛ., Метелева НА. и др. Клинические про-
явления нефропатии, связанной с антифосфолипидным синдромом, при
первичном антифосфолипидном синдроме. Тер. арх. 2003; 6: 22—27.
63. Шутов А.М., Савинова ГА., Киселев Л.И. и др. Применение рекомби
нантного интерлсйкина-2 при геморрагической лихорадке с почечным син
дромом. Клин. мед. 2002; 80(4): 54—57.
64. Щербак А.В., Балкаров И.М., Козловская Л.В. и др. Фибринолитиче-
ская активность мочи как показатель поражения почек при нарушении об-
мена мочевой кислоты. Тер. арх. 2001; 6: 34—37.
65. Aiyagari V., Deiben Е., Diringer M.N. Hypernatremia in the neurologic
intensive care unit: how high is too high? J. Crit. Care. 2006; 21(2): 163—172.
66. Alamartine E., PhayphetM., Thibaudin D. etal. Contrast medium—induced
acute renal failure and cholesterol embolism after radiological procedures:
incidence, risk factors,and compliance with recommendations. Eur. J. Intern
Med 2003;14: 426-431.
67. Alcazar J.M., Rodicio J.L. Ischemic nephropathy: clinical characteristics
and treatment. Am. J. Kidney Dis. 2000; 36(5): 883—893.
68. Alexopoulos E., Gionanlis L., Papayianni E. et al. Predictors of outcome in
idiopathic rapidly progressive glomerulonephritis (IRPGN). B.M.C. NephroL
2006; 7:16
69. Alpers Ch.E. In: Robbins and Cotran Pathologic basis of disease. Elsevier
Saunders, 7th ed., 2005. P. 955-1022.
70. AsgharM., Ahmed K., Shah S.S. et al. Renal vein thrombosis. Eur J. Vase.
Endovasc. Surg. 2007; 34(2): 217-223.
Слисок использованной литературы
275
71. Aspelin Р, Aubry Р, Fransson S.G. et al. Nephrotoxic effects in high-risk
patients undergoing angiography. N. Engl. J. Med. 2003; 348(6): 491—499.
72. Auchus R.A. Aldo is back: recent advances and unresolved controversies
in hyperaldosteronism. Curr. Opin. Nephrol. Hypertens. 2003; 12: 153—158.
73. Bader T., Benea G., Bonomo L. et al.; Investigators in the Abdominal
Computed Tomography: IOMERON 400 Versus VISIPAQUE 320 Enhancement
(ACTIVE) Study. The ACTIVE Trial; comparison of the effects on renal function
of iomeprol-400 and iodixanol-320 in patients with chronic kidney disease
undergoing abdominal computed tomography. Invest. Radiol. 2008; 43(3): 170—
178.
74. Bagshair S.M., Ghah WA. Acetylcysteine for prevention of contrast-
induced nephropathy after intravascular angiography: a systematic review and
meta-analysis. B.M.C Med. 2004; 2: 38.
IS. Bagshan S.M., Ghali WA. Theophylline for prevention of contrast-
induced nephropathy: a systematic review and meta-analysis. Arch. Intern. Med.
2005, 165(10): 1087-1093.
76. Beevers D.G., LipG.Y.H Hypertensive crisis. In: Crawford M.H., DiMarco
J.P, Paulus W.J. Cardiology. Mosby, 2nded., 2001: 545—552.
77. Bennett M., Dent C.L., Ma Q. et al. Urine NGAL predicts severity of acute
kidney injury aftercardiac surgery: a prospective study. Clin. J. Am. Soc. Nephrol.
2008; 3(3): 665-673.
78. Beukhof C.M., Hoorn EJ.f Lindemans J., Zietse R Novel risk factors for
hospital-acquired hyponatraemia: a matched case-control study. Clin. Endocrinol.
(Oxf.) 2007; 66(3): 367-372.
79. Borza D.B., Neilson E.G., Hudson B.G. Pathogenesis of Goodpasture
syndrome: a molecular perspective. Semin Nephrol. 2003; 23:522—531.
80. Boyden T.F., Gurm H.S. Does gadolinium—based angiography protect
against contrast-induced nephropathy?: a systematic review of the literature.
Catheter. Cardiovasc. Interv. 2008; 71(5): 687—693.
81. Braunwald E„ Pollack C.V. Jr. 2007 update to the ACC/AHA guidelines
for the management of patients with unstable angina and non-ST-segment
elevation myocardial infarction: implications for emergency department practice.
Ann. Emerg. Med. 2007: 51(5): 591-606.
82. Canavese С, Mereu M.C., Aime S. et al. Gadolinium-associated nephro-
genic systemic fibrosis: the need for nephrologists’ awareness. J. Nephrol. 2008;
21(3): 324-336.
83. Canet J J., CastaM J., Alvarez M. et al. Scleroderma renal crisis sine
scleroderma. Nephron. 2002; 90(1): 119—120.
276
Нефрология. Неотложные состояния
84. Cardenas A., Gines Р. Diiutional hyponatremia, hepatorenal syndrome
and liver transplantation. Gastroenterol. Hepatol. 2008; 31(1): 29—36.
85. Cattran D.C., Alexopoulos E., Heering P. et al. Cyclosporin in idiopathic
glomerular disease associated with the nephritic syndrome: workshop
recommendations. Kidney Int. 2007; 72(12): 1429—1447.
86. Chapman J.R., Nankivell B.J. Nephrotoxicity of ciciosporin A: short-term
gain, long-term pain? Nephrol. Dial. Transplant. 2006; 21: 2060- -2063.
87. Courouble P., Vanpee D., Delgrange E. etal. Hantavirus infections, clinical
presentation in the emergency room. Eur. J Emerg. Med. 2001; 8(1): 17—20.
88. Conic A., Schiller A., Volovat C. et al. Epidemiology of renal disease in
Romania: a 10 year review of two regional renal biopsy databases. Nephrol. Dial.
Transplant. 2006; 21(2): 419 424.
89. Cowie M.R., Komajda M, Murray—Thomas T. etal. Prevalence and impact
of worsening renal function in patients hospitalized with decompensated heart
failure: results of the prospective outcomes study in heart failure (POSH) Eur.
Heart J. 2006; 27(10): 1216-1222.
90. Damrnan K, Navis G., Voors A.A. et al. Worsening renal function and
prognosis in heart failure: systematic review and meta-analysis. J. Card. Fail.
2007; 13(8): 599-608.
91. De Broe M.E., Elseviers M.M., Bengtsson U. et al. Analgesic nephropathy.
Nephrol. Dial Transplant. 1996; 11: 2407—2408.
92. Decelle L., Cosyns J.P., Georges B. ei al. Acute interstitial nephritis after
cocaine sniffing. Clin. Nephrol. 2007; 67(2): 105—108.
93. Desch K., Motto D. Is there a shared pathophysiology for thrombotic
thrombocytopenic purpura and hemolytic-uremic syndrome? J. Am. Soc.
Nephrol. 2007; 18: 2457-2460.
94. Detrenis S., Meschi M., Musini S. et al. Lights and shadows on the
pathogenesis of contrast-induced nephropathy: state of the art // Nephrol. Dial-
Transplant 2005; 20: 1542-1550.
95. Erley C.M., Duda S.H., Rehfuss D. et al. Prevention of radiocontrast-
media—induced nephropathy in patients with pre-existing renal insufficiency by
hydration in combination with the adenosine antagonist theophylline. NephroL
Dial Transplant. 1999; 14(5): 1146-1149.
96. ESH—ESC Guidelines Committee 2007 guidelines for the management of
arterial hypertension. J. Hypertens. 2007; 25: 1105—1187.
97. Evans KJ., Greenberg A. Hyperkalemia: a review. J. Intensive Care Med.
2005; 20(5): 272-290.
Список использованной литературы
277
98. Fabnzi Е, Dixit V., Martin Р. Meta-analysis: terliprcssin therapy for the
hepatorenal syndrome. Aliment. Pharmacol. Ther. 2006; 24(6): 935—944.
QS. Fauldc M., Sobe D.t Kimmig P„ Scharninghausen J. Renal failure and
hantavirus infection in Europe. Nephrol. Dial. Transplant. 2000; 15: 751—753.
100. Feldstein C. Management of hypertensive crises. Am. J. Then 2007;
14(2): 135-139.
101. Fine MJ., Kapoor IV., Falanga V. Cholesterol crystal embolization: a
review of 221 cases in the English literature. Angiology. 1987; 38(10): 769-
784.
102. Fisher MA., Neilson E.G. Treatment of acute interstitial nephritis. Brady
H.R., Wilcox C.S. Therapy in nephrology and hypertension. 2nd ed. Saunders,
2003, 297-304.
103. French Cooperative Study Group for adult HUS. Adult hemolytic uremic
syndrome with renal microangiopathy. Outcome according to therapeutic
protocol in 53 cases. Ann. Med. Interne. 1992; 143: 27—32.
104 Fukumoto Y., Tsutsui H., Tsuchihashi M. Cholesterol Embolism Study
( CH EST) Investigators. Theincidence and risk factors < -f cholesterol embolization
syndrome, a complication of cardiac catheterization: a prospective study. J. Am.
Coll. Cardiol. 2003; 42(2): 211-216.
105. GinesP., Guevara M., Arroyo V., RodesJ. Hepatorenal syndrome Lancet
2003; 362:1819-1827.
106. Glassock RJ. Prophylactic anticoaguiation in nephrotic syndrome: a
clinical conundrum. J. Am. Soc. Nephrol. 2007; 18: 2221—2225.
107. Gleeson T.G., Bulugahapitiya S. Contrast—induced nephropathy. AJ.R.
2004; 183:1673-1689.
108. Gdbel U, Kettritz R., Schneider VV et al. The protean face of renal
sarcoidosis. //J. Am. Soc. NephroL 2001; 12: 616 -623.
109. Greaves M. Antiphospholipid syndrome and thrombosis. Lancet 1999;
353: 1348-1353.
110. Greenberg A. Diuretic complications. Am. J. Med. Sci. 2000; 319: 10-
24.
111. GucriniS., CavazzanaL, Venturelli C. etal. Renal involvement in systemic
sclerosis. G. Ital. Nefrol. 2007; 24(4): 295-310.
112. Halimi C., BonnardP, BernardB. etal. Effect of terlipressin (Glypressin)
on hepatorenal syndrome in cirrhotic patients: results of a multicentre pilot
study. Eur. J. Gastroenterol. Hepatol. 2002; 14: 153—158.
278
Нефрология. Неотложные состояния
ИЗ. Hedger N., Stevens J., Drey N. et al. Incidence and outcome of pauci-
immune rapidly progressive glomerulonephritis in Wessex, UK: a 10-year
retrospective study. Nephrol. Dial. Transplant. 2000; 15(10): 1593—1599.
114. House AA, Silva Oliveira S., Ronco C. Anri-inflammatory drugs and the
kidney. Ini. J. Artif, Organs 2007; 30(12): 1042-1046.
115. Huber IK, Schipek C.t Ilgmann K. et al. Effectiveness of theophylline
prophylaxis of renal impairment after coronary angiography in patients with
chronic renal insufficiency. Am. J. Cardiol. 2003; 91(10): 1157—1162.
116. Huerta—Alardin A.L., Varon J., Marik PE. Bench-to-bedside review
rhabdomyolysis-an overview to clinicians. Crit. Care. 2005; 9:158—169.
117. JoS.H., Youn TJ., Koo B.K. etal. Renal toxicity evaluation and comparison
between visipaque (iodixanol) and hexabnx (ioxaglate) in patients with rena]
insufficiency undergoing coronary angiography: the RECOVER study: a
randomized controlled trial. J. Am. Coll. Cardiol. 2006; 48(5): 924 -930.
118. Kidney Disease Outcome Quality Initiative. Clinical practice guidelines
for chronic kidney disease: evaluation, classification and stratification. Am. J.
Kidney Dis. 2002; 39 (Suppl. 2): SI—S246.
119. Kishore B., Thurlow V., Kessel B. Hypokalaeinic rhabdomyolysis. Ann.
Clin. Biochem. 2007:44 (Pt. 3): 308-311.
120. Kodner C.M., Kudrimoti A. Diagnosis and management of acute
interstitial nephritis. Am. Fam Physician. 2003; 67(12): 2527—2534.
121. Komers R., Anderson S., Epstein M. Renal and cardiovascular effects of
selective cyclooxygenase-2 inhibitors. Am. J. Kidney Dis. 2001; 38: 1145—1157
122. Korzets Z.t Plotkin E., Bernheim J., Zissin R. The clinical spectrum of acute
renal infarction. 1st. Med. Assoc. J. 2002; 4(10): 781—784
123 Kosch A., Kuwertz—Broking E., Heller C. et al. Renal venous thrombosis
in neonates: prothrombotic risk factors and long-term follow-up. Blood 2004
104: 1356-1360.
124. Kulzer P, Wanner Ch. Thrombotic microangiopathy: a challenge with
uncertain outcome. Nephrol. Dial Transplant. 1998; 13: 2154—2160
125. Lameire N.H. Contrast-induced nephropathy. Nephrol. Dial. Transplant
2006; 21 (Suppl.1): il 1—123.
126. Levy J.B., Pusey C.D. Crescentic glomerulonephritis. In: Brady H R~
Wilcox C.S. (ed.) Therapy in nephrology and hypertension., Saunders.. 2003.
177-195.
127. Li C., Lim S.W., Sun B.K. et al. Chronic cyclosporine nephrotoxicity: ne*
insights and preventive strategies //Yonsei Med. J. 2004; 45(6): 1004—1016.
Слисок использованной литературы
279
128. Liamis G., Tsimihodimos V., Doumas M et al. Clinical and laboratory
characteristics of hypernatraemia in an internal medicine clinic. Nephrol. Dial
Transplant. 2008; 23(1): 136-143.
129. Lima E.Q., Nogueira M.L. Viral hemorrhagic fever—induced acute kidney
injury. Semin. Nephrol. 2008; 28(4): 409—415.
130. Liu R., Nair D., Ix J. et al. N-acetylcysteine for the prevention of
contrast-induced nephropathy. A systematic review and meta-analysis. J. Gen.
Intern. Med. 2005; 20(2): 193-200.
131. Locatelli E, Rossi P Incidence and pathogenesis of tumor lysis syndrome.
Contrib. Nephrol 2005; 147:61—68.
132. Lopez-Gomez J.M.. Rivera F.; Spanish Registry of Glomerulonephritis.
Renal biopsy findings in acute renal failure in the cohort of patients in the
Spanish Registiy of Glomerulonephritis. Clin. J. Am. Soc. Nephrol. 2008; 3(3):
674-681.
133. Malinoski DJ., Slater M.S., Mullins RJ. Crush injuiy and rhabdomyolysis.
Crit. Care Clin. 2004; 20(1); 171-192.
134. Marenzi G., Assanelli E., Marana I. et al. N-acetylcysteine and contrast-
induced nephropathy in primary angioplasty. N. Engl. J Med. 2006; 354(26):
2773-2782.
135. Marik P.E., Varon J. Hypertensive crises: challenges and management.
Chest. 2007; 131: 1949-1962.
136. McCullough PA., Bertrand M.E., BrinkerJ A. et al. A meta-analysis of the
renal safety of isosmolar iodixanol compared with low-osmolar contrast media.
J. Am. Coll. Cardiol. 2006; 48(4): 692-699.
137. Meyrier A. Acute pyelonephritis. Rev Prat. 2003; 53(16): 1777—1784.
138. Modi K.S., Rao V.K. Atheroembolic renal disease. J. Am. Soc. Nephrol.
2001; 12: 1781-1787.
139. Morcos S.K., Thomsen H.S., Webb JA.W. and members of contrast media
safety committee of the European Society of Urogenital Radiology (ESUR).
Contrast media induced nephrotoxicity: a consensus report. Eur. Radiol. 1999; 9:
1602-1613
140. Moreau R., Durand E, Poynard T. et al. Terlipressin in patients with
cirrhosis and type 1 hepatorenal syndrome: A retrospective multicenter study.
Gastroenterology 2002, 122: 923—930.
141. Moreau R„ Lebrec D. Acute kidney injuiy: new concepts. Hepatorenal
syndrome: the role of vasopressors. Nephron Physiol. 2008; 109(4): p73—p79.
142. Moreillon P„ Que Y.~A. Infective endocarditis. Lancet 2004,363:139—
149.
280
Нефрология. Неотложные состояния
143. Morgan M.D., Harper L., Williams J., Savage C. Anti - neutrophil
cytoplasm-associated glomerulonephritis. J. Am. Soc. Nephrol. 2006; 17: 1224—
1234.
144. Muranyi W., Bahr U., Z.eierM., van der Woude FJ. Hantavirus infection.
J. Am. Soc. Nephrol. 2005; 16:3669—3779.
145. Orth S.R., Ritz E. The nephritic syndrome. N. Engl. J. Med. 1998; 338:
1202-1211.
146. Panichi V., Pasquanello A., Innocenti M. et al. The Pisa experience of
renal biopsies, 1977—2005. J. Nephrol. 2007; 20(3): 329—335.
147. Penn H., Howie A J., Kingdon E.J. Scleroderma renal crisis: patient
characteristics and long-term outcomes // Q. J. Med. 2007; 100: 485—194.
148. PoelsP., GabreelsF. Rhabdomyolysis: a review of literature. Chn. Neurol.
Neurosurg. 1995; 95:175—192.
149. Prakash J., Sen D., Kumar N.S. et al. Acute renal failure due to intrinsic
renal diseases: review of 1122 cases. Ren. Fail. 2003; 25(2): 225—233.
150. Rastegar A., Kashgarian M. The clinical spectrum of tubulointerstitial
nephritis // Kidney Int. 1998; 54: 313—327.
151. Remuzzi G., Perico N. Cyclosporine-induced renal dysfunction in
experimental animals and humans. Kidney Int 2007; 1995; 52: S70 S74
152. Remuzzi G., Ruggenenti P. The hemolytic uremic syndrome. Kidney Int.
1995; 48:2-19.
153. Rhew E.Y., Barr IV.C Scleroderma renal crisis: new insights and
developments. Curr. Rheumatol. Rep. 2004; 6(2): 129 -136.
154. Ribera Pibemat M., Bigata Viscasillas X., Fuentes Gonzalez MJ. et al.
Cholesterol embolism disease: study of 16 cases. Rev. Clin. Esp. 2000; 200(12).
659-663.
155. Robinson S., Nichols D., Macleod A., Duncan J. Acute renal artery
embolism: a case report and brief literature review. Ann. Vase. Surg. 2008; 22( 1)
145-147.
156. Ronco C. N-GAL: diagnosing AKI as soon as possible. Crit. Care. 2007
11(6): 173
157. Rossert J. Drug-induced acute interstitial nephritis. Kidney Int 2001:
60: 804- 817.
158. Ruggenenti P., Nons A., Remuzzi G. Thrombotic microangiopathy,
hemolytic uremic syndrome and thrombotic thrombocytopenic purpura Kidney
Int. 2001; 60: 831- 846.
159. Ruiz-del-Arbol L., Monescillo A.. Arocena C. etal. Circulatory function
and hepatorenal syndrome in cirrhosis. Hepatology 2005; 42: 439—447.
Список использованной литературы
281
160. Rundback J.H., Murphy Т.Р., Cooper С., Weintarub J.L. Chronic renal
ischemia: pathophysiological mechanisms of cardiovascular and renal
hypertension. J. Vase. Interv. Radiol. 2002; 13:1085—1092.
161. Russel T. Acute renal failure related to rhabdomyolysis: pathophysiology,
diagnosis, and collaborative management. Nephrol. Nurs. J. 2000; 27:567—577.
162. Rychlik I.,Jancovd E., Tesar V. et al. The Czech registry of renal biopsies.
Occurrence of renal diseases in the years 1994—2000. Nephrol. Dial. Transplant
2004; 19(12): 3040-3049.
163. Sadler J.E. Von Willebrand factor, AD AMTS 13, and thrombotic
thrombocytopenic purpura. Blood. 2008:112(1): 11-18.
164. Salama A.D.. Levy J.B., Lightstone L.t Pusey CD. Goodpasture's disease.
Lancet. 2001; 358: 917-920.
165. Schepke M Hepatorenal svndrome: current diagnostic and therapeutic
concepts. Nephrol. Dial. Transplant. 2007; 22 (Suppl. 8): 2—4.
166. Schrier R.W„ Fasset R.G. A critique of the overfill hypothesis nf sodium
and water retension in the nephritic syndrome. Kidney Int. 1998; 53: 111 1—
1147.
167. Schwarz A., Krause P.H., Kunzendorf V. et al The outcome of acute
interstitial nephritis: risk factors for the transition from acute to chronic
interstitial nephritis. Clin. Nephrol 2000; 54(3): 179—190.
168. Seyon RA., Jensen LA., Ferguson LA., Williams R.G. Efficacy of
N-acetylcysteine and hydration versus placebo and hydration in decreasing
contrast-induced renal dysfunction in patients undergoing coronary angiography
with or uithout concomitant percutaneous coronary intervention. Heart Lung.
2007: 36(3): 195-204.
169. Shibagaki K, Fujita T Thrombotic microangiopathy in malignant
hypertension and hemolytic uremic syndrome (HUS)/ thrombotic
thrombocytopenic purpura (TTP): can we differentiate one from the other?
Hypertens. Res. 2005; 28(1): 89—95.
170. Shyu K.G., Cheng J J., Kuan P. Acetylcysteine protects against acute
renal damage in patients with abnormal renal function undergoing a coronary
procedure. J. Am. Coll. Cardiol. 2002; 40(8): 1383—1388.
171. Sierra E, Suarez M., Rey M., Vela М.Е Systematic review: Proton pump
inhibitor-associated acute interstitial nephritis. Aliment. Pharmacol. Ther. 2007;
26(4): 545 -553
172. Solanki P., Chanda A., Garg R. et al. Beneficial effects of terlipressin in
hepatorenal syndrome: a prospective, randomized placcbo-controlled clinical
trial. J. Gastroenterol. Hepatol. 2003; 18: 152-156.
282
Нефрология. Неотложные состояния
173. Sood A., Midha V., Sood N. Myoglobinuria' a cause of acute renal failure
in alcoholic hepatitis. Am. J. Gastroenterol. 2000; 95(12): 3669—3670.
174. Spieker L.E., Ruschitzka ET., Luscher T.E, Noll G. The management of
hyperuricemia and gout in patients with heart failure. Eur. J. Heart Failure 2002:
4: 403-410.
175. Tefel M, van der Giet M., Schwarzfeld C. et al Prevention of radiographic-
contrast-agent-induced reductions in renal function by acetylcysteine. N. Engl.
J. Med. 2000; 2000; 343: 180-184.
176. Teixeira L.t ServettazA., MehrenbergerM. Scleroderma renal crisis. Presse
Med. 2006; 35 (12 Pt. 2): 1966-1974.
177. Terrell D.R., Williams L.A., \fesely S.K. et al. The incidence of thrombotic
thrombocytopenic purpura-heniolytic uremic syndrome: all patients, idiopathic
patients, and patients with severe AD AMTS-13 deficiency. J. Thromb. Haemost.
2005; 3:1432-1436.
178. The ESC Task Force. Guidelines for the diagnosis and treatment of
chronic heart failure: executive summary (update 2005): The Task Force for the
Diagnosis and Treatment of Chronic Heart Failure of the European Society of
Cardiology. Eur. Heart J. 2005; 26(11): 1115—1140.
179. Thomsen H.S., Marcos S.K., European Society of Urogenital Urology.
ESUR guidelines on contrast media. Abdom. Imaging 2006; 31(2): 131—140.
180. Tsai H.-M. The molecular biology of thrombotic microangiopathy.
Kidney Int. 2006; 70(1): 16-23 .
181. Turban 5., Thuluvath PJ., Atta M.G. Hepatorenal syndrome. World. J.
Gastroenterol. 2007; 13(30): 4046—4055.
182. Van Praet J.T., De Vriese A.S. Prevention of contrast-induced nephro-
pathy: a critical review. Curr. Opin. Nephrol. Hypertens. 2007; 16(4): 336—347.
183. Vanholder R., VanBiesen W.,LameireN. Sever M.S.\ International Society
of Nephrology/Renal Disaster Relief Task Force. The role of the International
Society of Nephrology/Renal Disaster Relief Task Force in the rescue of renal
disaster victims. Contrib. Nephrol. 2007; 156- 325—332.
184. Wadei H.M., Mai M.L., Ahsan N., Gonwa T.A. Hepatorenal syndrome
pathophysiology and management. Clin. J. Am. Soc. Nephrol. 2006; 1: 1066—
1079.
185. Ufeng Y., Cui Z., Fan M. Retrospective analysis on Chinese patients
diagnosed with acute renal failure hospitalized during the last decade (1994—
2003). Am. J. Nephrol. 2005; 25(5): 514-519.
186. Weisberg L.S. Management of severe hyperkalemia. Crit. Care Med.
2008; 36(12): 3246-3251.
Список использованной литературы
283
187. Witz М., Korztes Z. Renal vein occlusion: diagnosis and treatment.
I.M.AJ. 2007; 9: 402-405.
188. Wysokinski W.E., Gosk—Bierska 1., Greene E.L. et al. Clinical
characteristics and long-term follow-up of patients with renal vein thrombosis.
Am. J. Kidney Dis. 2008; 51(2): 224-232.
189. Yarlagadda S.G.t Perazella M.A. Drug—induced crystal nephropathy: an
update // Expert Opin. Drug Saf. 2008; 7(2): 147—158.
190. Zagler A., Azadpour M.t Mercado C. et al. N-acetylcysteine and contrast-
induced nephropathy: a meta-analysisof 13 randomized trials. Am. Heart J. 2006;
151(1): 140-145.
Wl.Zakarija A., Bennet C. Drug-induced thrombotic microangiopathy.
Semin. Thromb. Haemosi. 2005; 31(6): 681 690.
192. Zaki S.R., Greer P.W., Coffield L.M. et al. Hantavirus pulmonary
syndrome. Pathogenesis of an emerging infectious disease. Am. J. Pathol. 1995;
146: 552-579.
193. Zheng X.L., Sadler J.E. Pathogenesis of thrombotic microangiopathies.
Ann. Rev. Pathol. 2008; 3:249—277.
Учебное издание
ПРОФЕССИОНАЛЬНАЯ МЕДИЦИНА
НЕФРОЛОГИЯ
Неотложные состояния
Директор редакции И. Федосове
Ответственный редактор О. Шестова
Редактор И. Таранова
Художественный редактор М. Левыкин
Технический редактор Л. Зотова
Компьютерная верстка Н. Журавлева
Корректоре. Елетмна
ООО Издательство -Эксмо-
127299. Москва, ул. Клары Цеткин, д. 18/5. Тел. 411-68-88.956-38-21.
Home раде: www.ekemo.ru E-mail, tnfo9ekamo.ru
Подписано в печать09.10.2009.
Формат 70x100’/,,. Гарнитура-Петербург».
Печать офсетная. Бумага газ. Усл. печ. л. 23.22.
Тираж 1500* 500 эка. Заказ №7975
Отпечатано с готовых файлов заказчика в ОАО «ИПК
•Ульяновский Дом печати» 432980. г. Ульяновск, ул. Гончарова, 14
IS0N 976-5-699-29633-0
ISBN 078-5-699-39093-9
9,|785699' 390939 >