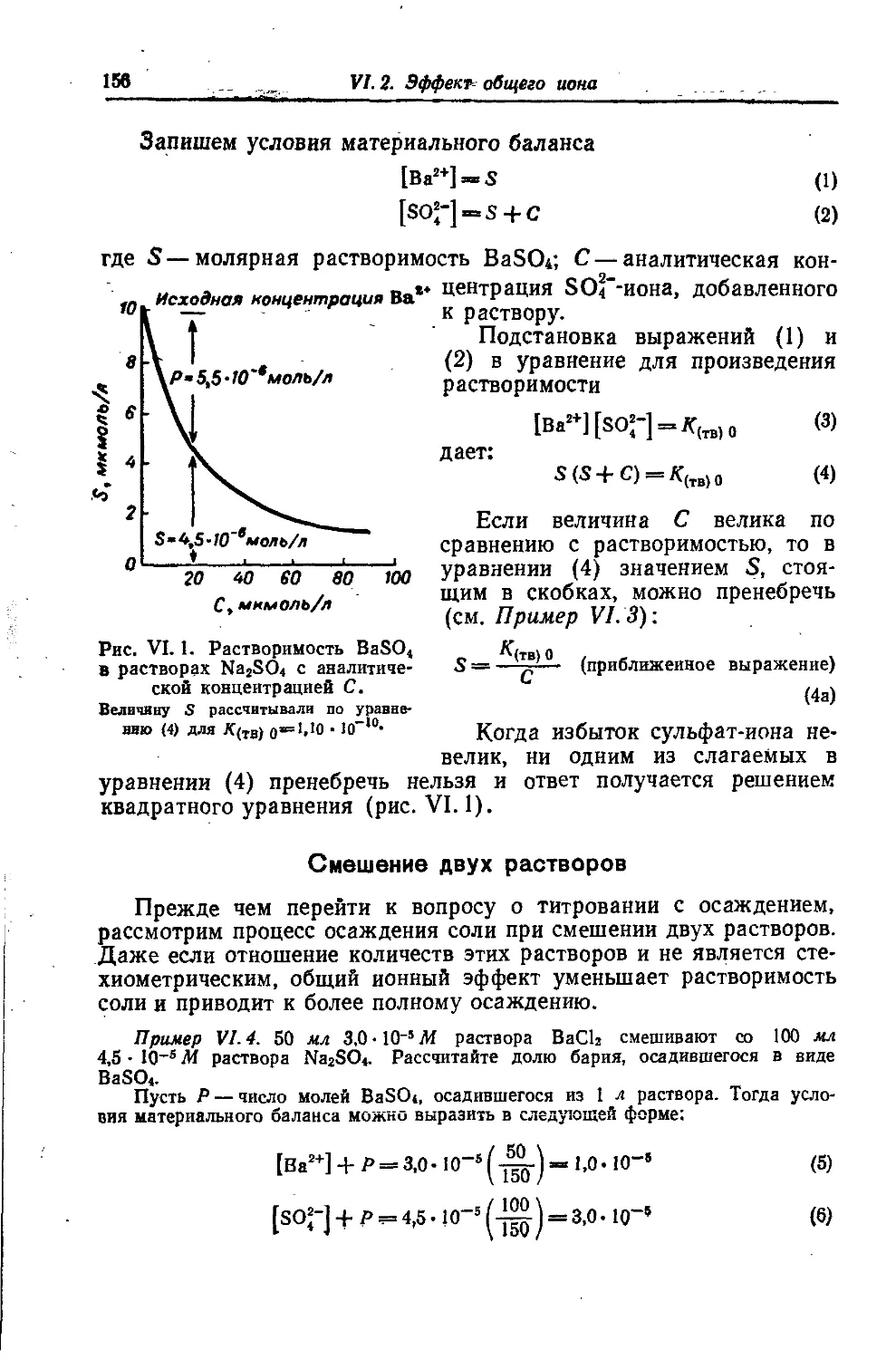
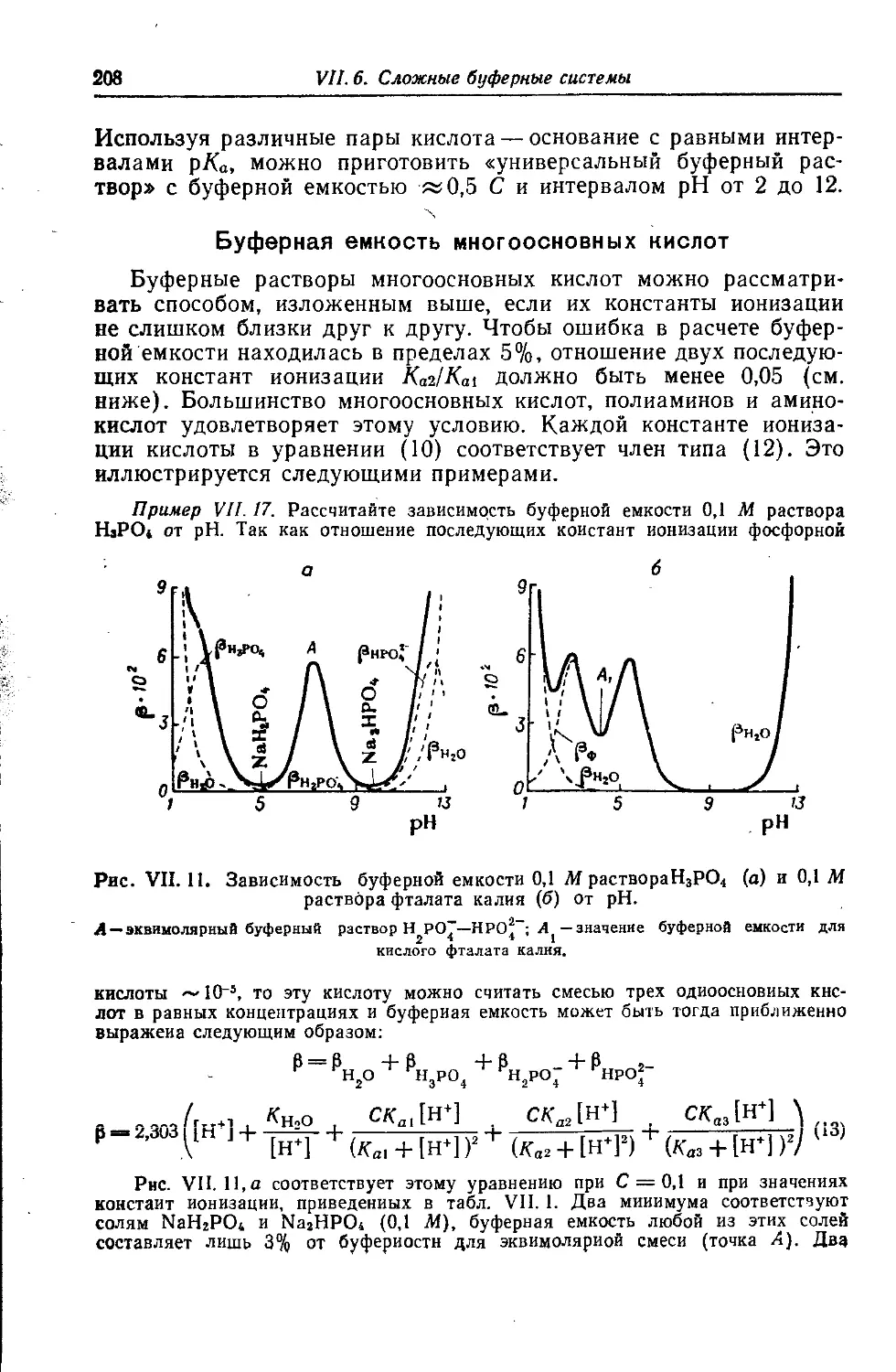
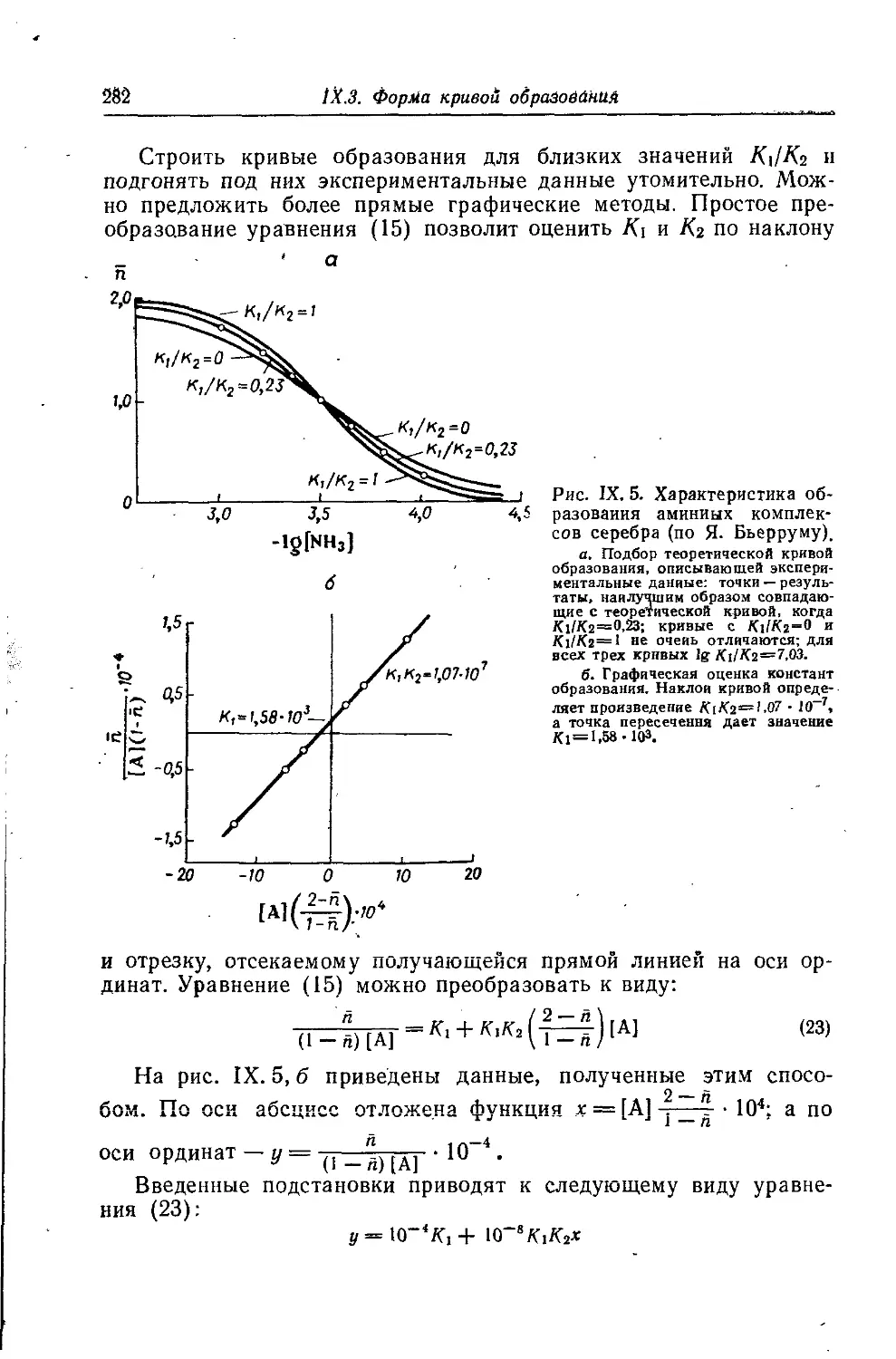
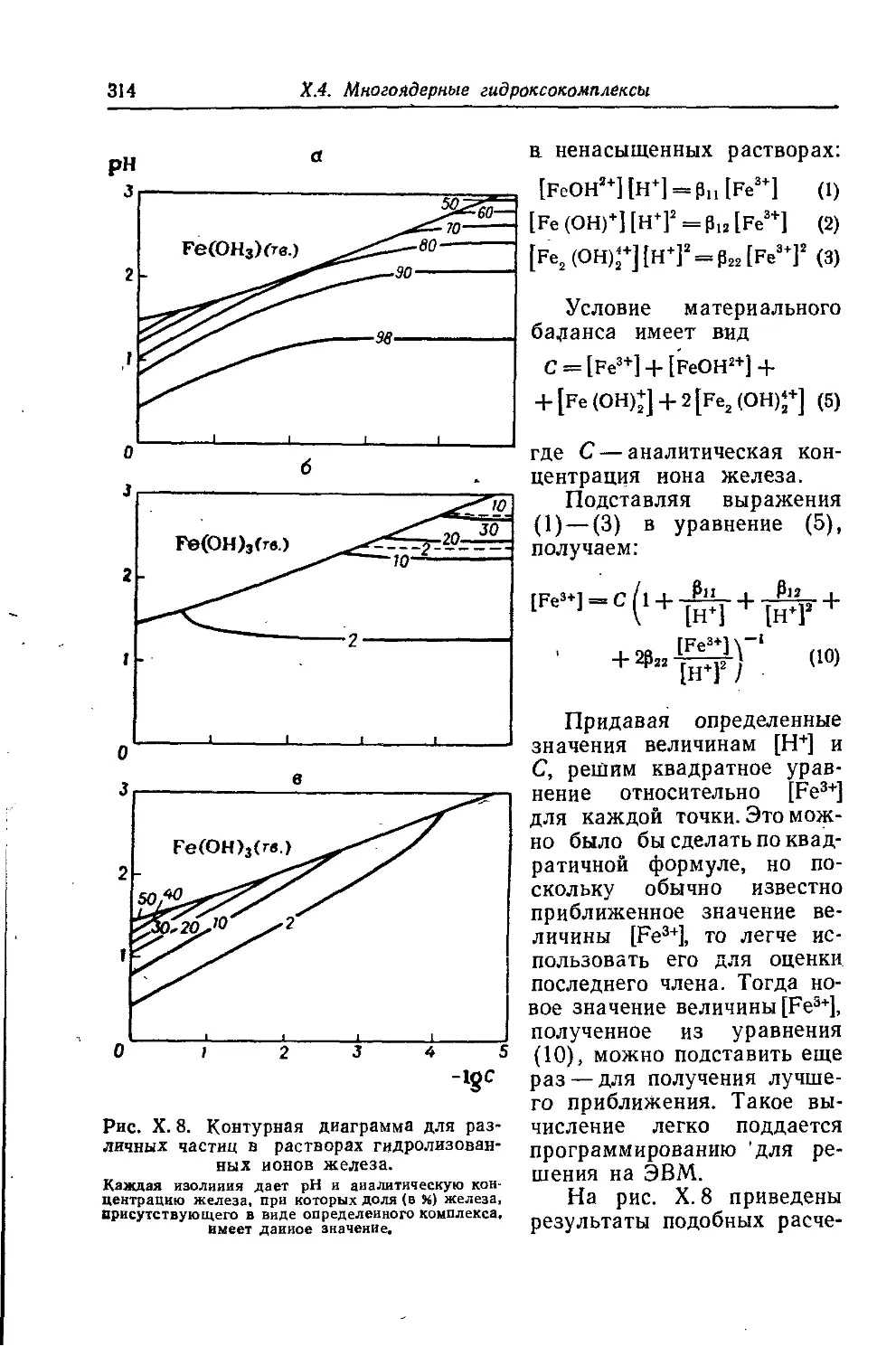
Автор: Батлер Дж.
Теги: химия учебник по химии издательство химия гетерогенные ионные равновесия
Год: 1973
Текст
I
ДЖ. Н. БАТЛЕРИОННЫЕ РАВНОВЕСИЯ(МАТЕМАТИЧЕСКОЕ ОПИСАНИЕ)Перевод с английского
В. А. Станкевича и С. П. Бардеевой
под редакцией канд. хим. наук
А. А. ПендинаЛЕНИНГРАД
ИЗДАТЕЛЬСТВО «ХИМИЯ>
Ленинградское отделение • 1973
УДК 541.I21/.I23Б 28Дж. Н. БатлерИонные равновесия. Пер. с англ., Изд-во «Химия»,
Л., 1973.Стр. 448, табл. 26, рис. 116, библиографических ссылок 29.Книга является практическим руководством по способам составления и
решения математических уравнений, описывающих ионные равновесия в раз*
личных системах (кислоты н основания, осадок — раствор, комплексные сое¬
динения, окислительно-восстановительные системы и т. д.).На многочисленных примерах автор объясняет особенности расчетов, в
которых используются различные допущения, позволяющие получать ответы
желаемой степени точности. Существенное внимание уделено графическим
методам решения уравнений. Книга содержит более 500 вопросов и развер¬
нутых ответов к ним.Достоинством книги является доступность изложения материала: она по¬
нятна читателю любой специальности, знакомому с общей химией и нача¬
лами алгебры.Книга может быть рекомендована в качестве справочного и методиче¬
ского пособия. Она будет особенно полезна студентам, аспирантам и работни¬
кам лабораторий, занимающихся химией, биологией, физикой.0254-115 22_73
050(01 )-73
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДАПредлагаемая вниманию читателей книга Джеймса Бат¬
лера, хотя и является учебным пособием, однако несомненно
может быть полезна широкому кругу химиков, которые имеют
дело с растворами электролитов. Это прежде всего относится
к химикам-аналитикам, поскольку описание ионных равнове¬
сий проведено в книге количественно, а разбираемые примеры
включают важные для аналитической химии реакции.К настоящему времени накоплен большой эксперименталь¬
ный материал по константам равновесия различных ионных
реакций, табулированный в справочной литературе. Однако
использование его ограничено в связи с тем, что системати¬
ческих руководств по расчетам ионных равновесий, изданных
на русском языке, нет. Такие фундаментальные и обстоя¬
тельные монографии, как «Определение констант устойчиво¬
сти и других констант равновесия в растворах» Ф. Россотти
и X. Россотти, «Константы нестойкости комплексных соеди¬
нений» К- Б. Яцимирского и В. П. Васильева, «Комплексооб-
разование в растворах» Г. J1. Шлефера, «Термодинамика
ионных процессов в растворах» Г. А. Крестова, посвящены
методам определения и расчета констант равновесия, а рас¬
чет ионного состава раствора по известным константам рав¬
новесия и аналитическим концентрациям компонентов рас¬
твора в них почти не рассматривается. При выборе условий
для осуществления тех или иных аналитических определений
именно расчет ионного состава раствора в процессе титрова¬
ния позволяет оценить пригодность и точность аналитиче¬
ского определения. Поэтому книга Дж. Батлера — это прежде
всего учебное пособие по физико-химическому обоснованию
аналитических определений в ионных растворах.
6Предисловие редактора переводаКнига обладает рядом несомненных достоинств. Так, ма¬
тематическое описание разнообразных видов химического
равновесия (кислотно-основное, комплексообразование, окис¬
лительно-восстановительное, растворимость ионных соедине¬
ний) проведено единообразно, а результаты представлены в
различных математических формах (аналитические решения,
диаграммы разного вида, номограммы).Высокий методический уровень изложения материала, мно¬
гочисленные и тщательно выбранные примеры и вопросы по¬
зволят широко использовать эту книгу при обучении студен¬
тов как высшей школы, так и техникумов. Большое внимание
автор уделяет оценкам систематической ошибки, возникаю¬
щей при аналитических определениях.Для исследователей, занимающихся изучением ионных
равновесий, эта книга может быть полезна на этапе проверки
корректности рассматриваемых наборов равновесий и их кон¬
стант в отношении экспериментальных данных.При подготовке издания переводчики и редактор стреми¬
лись по возможности точно передать английский текст.Однако в ряде случаев с целью повышения строгости из¬
ложения некоторые упрощающие вопрос формулировки из¬
менены.Существенно изменена дополнительная литература. Мы
сочли целесообразным оставить в русском издании ссылки
только на те книги из рекомендованных автором, которые
имеются на русском языке и дополнить литературу отече¬
ственными учебниками и монографиями.Главы I—VI переведены В. А. Станкевичем, а VII—XII —С. П. Бардеевой,А. Пендин
Г лава IНЕКОТОРЫЕ ОБЩИЕ ПОЛОЖЕНИЯ1.1. РАВНОВЕСНОЕ СОСТОЯНИЕЕсли смешение веществ вызывает химическое изменение в си¬
стеме, то говорят, что произошла химическая реакция. Относитель¬
но небольшое число реакций протекает так, что реагенты расхо¬
дуются полностью и остается только продукт реакции. Подобные
реакции используют в количественном анализе. Однако, при стро¬
гом подходе даже эти реакции нельзя рассматривать как проте¬
кающие действительно полностью. Это связано с тем, что про¬
дукты реакции могут реагировать между собой. Конкуренция
прямой и обратной реакций приводит к равновесному состоянию.
В этом состоянии исходные вещества присутствуют в конечных ко¬
личествах. Именно наличие равновесия является источником ошиб¬
ки в количественном анализе, что следует учитывать.По многим причинам в этой книге основное внимание уделено
лишь взаимодействию ионов в водных растворах. Во-первых, боль¬
шинство веществ, изучаемых в неорганической и аналитической
химии, в растворе существуют в виде ионов. Во-вторых, реакции
между ионами протекают практически мгновенно и равновесное
состояние достигается почти сразу же после смешения веществ.
Поэтому, между прочим, ионные равновесия изучены достаточно
полно и по ним накоплен большой экспериментальный материал.
В-третьих, известны простые, но убедительные теоретические прин¬
ципы, управляющие реакциями при равновесии. Используя эти
принципы, можно предсказывать результаты экспериментов —
вплоть до численной оценки их. Это тем более ценно, что некото¬
рые результаты, важные в неорганической и аналитической хи¬
мии, иногда трудно определить непосредственно.Признаки равновесного состоянияИсследуя равновесие, прежде всего сталкиваются с альтерна¬
тивой: достигнуто данное равновесие или нет. Существует очень
простой метод оценки наличия равновесия: не вмешиваются в те¬
чение прямой реакции до тех пор, пока не убеждаются, что в ней
не происходит более никаких изменений, а затем определяют
8/. 1. Равновесное состояниехимический состав системы. После этого позволяют течь обратной
реакции с соблюдением тех же условий, что и в случае прямой.
Если состав системы одинаков вне зависимости от направления
реакции, считают, что наступило равновесие.Может случиться так, что при обычных условиях смешивание
веществ не приведет к реакции или составы, получающиеся по
прямой и обратной реакциям, окажутся различными. Это указы¬
вает на то, что равновесное состояние не достигнуто.В органической химии зачастую незначительное отклонение от
условий проведения реакций вызывает изменение природы полу¬
чающихся продуктов; в большинстве таких случаев равновесие не
достигается. Значительно чаще в результате реакции получают
только те вещества, скорость образования которых намного пре¬
вышает скорость образования других веществ. И если имеется воз¬
можность определения всех образующихся при смешении реаген¬
тов веществ, то может оказаться, что существуют сотни путей, по
которым может пойти реакция; это очень осложняет химическое
изучение такого процесса.Для соединений с ковалентной связью характерны медленные
реакции и способы протекания их различны. Многие ионные реак¬
ции в растворе могут быть описаны простыми математическими со¬
отношениями, отражающими законы, которым подчиняются кон¬
центрации всех возможных типов частиц в равновесной смеси.
Иными словами, когда система находится в равновесии, можно
теоретически рассчитать концентрации всех веществ, присутствую¬
щих в растворе.Равновесие как результат протекания
противоположно направленных реакцийМатематический аппарат для расчетов ионных равновесий
прост. Хотя обилие различных типов частиц в растворе и делает
уравнения равновесий внешне громоздкими, для их решения не¬
обходимо лишь знание начала алгебры.Наиболее простое описание химического равновесия может
быть проведено с использованием представлений, что оно является
результатом протекания противоположно направленных реакций.
В этом случае система приближается к равновесному состоянию,
когда при взаимодействии реагентов получающиеся продукты на¬
чинают реагировать между собой,, превращаясь в исходные ве¬
щества. При равенстве скоростей прямой и обратной реакций на¬
ступает равновесие. Оно всегда является динамическим. Измене¬
ние концентрации веществ или температуры раствора приводит
к нарушению равновесия и, следовательно, вызывает химическую
реакцию, направленность которой зависит от соотношения скоро¬
стей прямой и обратной реакций в новых условиях.
Равновесие как результат протекания противоположно направл. реакций 9Рассмотрим хорошо изученную реакцию диссоциации уксусной
кислоты на ионы. Когда СНзСООН (НАс) растворяют в воде, то
высвобождаются ион водорода Н+ и ацетат-ион Ас-. Первый взаи¬
модействует с окружающими молекулами воды, давая гидратиро¬
ванный ион Н30+*. Диссоциация не протекает полностью, так как
одновременно с разрушением молекул кислоты происходит реком¬
бинация ионов Н+ и Ас-. В равновесном состоянии скорости диссо¬
циации и рекомбинации сбалансированы, а концентрации кислоты
и ионов не зависят от времени:Уксусная кислота + вода < ацетат-ион + гидратированный ион водорода
НАс + Н20 Ас- + Н30+I /Н I /° /Н+
н—с—+о; н—с—(Г +н—о(I \0—Н \н I 'О- жн нДиссоциация кислоты, как и установление равновесия, проте¬
кает практически мгновенно — спустя несколько микросекунд**
после внесения молекул уксусной кислоты в раствор.Измерение скорости вблизи равновесия в этом случае — очень
сложная проблема. Именно поэтому, несмотря на то, что эту ре¬
акцию изучают уже почти 70 лет, только совсем недавно Эйген
смог измерить скорости диссоциации уксусной кислоты и ассоциа¬
ции ацетат-ионов и ионов водорода. В мощном электрическом поле
степень диссоциации уксусной кислоты несколько больше, чем в от¬
сутствие его. Путем измерения электропроводности раствора (при
помощи осциллографа) определено, как быстро изменяется сте¬
пень диссоциации после мгновенного снятия электрического поля
(см. раздел II. 3, стр. 47).Рассмотрим гипотетический опыт, результаты которого можно
рассчитать из данных по измерению электропроводности:
100 мкмоль й* НАс мгновенно смешивают с 1 л чистой воды.На рис. 1.1, а концентрации [НАс], [Н+] и [Ас-] представлены
как функции времени, прошедшего с момента смешения. Концен¬
трация [НАс] уменьшается сначала быстро, затем медленно —
вплоть до некоторого постоянного значения: 66 мкмоль/л. За то же* По аналогии с иоиом аммоиия NH* ион НэО+называют гидронием или
оксонисм. Если факт гидратации ие имеет значения, пишут просто Н+ (см. раз¬
дел IV. 1, стр. 83).** 1 мксек = 10-в сек.3* Термин моль означает 6,0235• 1023 различных частиц (число Авогадро),
т. е. понятие относится и к 1 г-ат, и к 1 г-мол, и к 1 г-иону, и к 1 г-форм. e?Q\
1 цкмоль = 1Q“6 ноль.
101.1. Равновесное состояниевремя величина [Ас-] возрастает до 34 мкмоль/л. Эти конечные
значения концентраций являются равновесными для 10-4 М рас¬
твора НАс; они постоянны до тех пор, пока не изменится темпе¬
ратура или не будут добавлены ка¬
кие-либо вещества.На рис. 1.1,6 показано прибли¬
жение к равновесию для гипотетиче¬
ской обратной реакции: 100 мкмоль
NaAc мгновенно смешивают со
100 мкмоль НС1 и 1 л НгО (Na+
и С1" не принимают участия в ре¬
акции). Концентрация [Ас-] снача¬
ла уменьшается быстро, затем мед¬
ленно — вплоть до некоторого по¬
стоянного значения: 34 мкмоль] л.
За это время величина НАс возрас¬
тает до значения 66 мкмоль/л.Таким образом, равновесие в си¬
стеме устанавливается за несколь¬
ко микросекунд, а равновесные кон¬
центрации [Ас-] и [НАс] не зависят
от направления реакции, приводя¬
щей к нему.Следует отметить, что общая
концентрация ацетатных групп
(СН3СОО), равная сумме' [Ас-] и
[НАс], постоянна: 100 мкмоль/л; она
не зависит от степени завершенности реакции или ее направле¬
ния. Это свидетельствует о том, что ацетат-группа не разрушается
во время реакции.Сложные равновесияФундаментальное представление, что равновесие является след¬
ствием протекания двух противоположно направленных реакций,
к сожалению, не всегда правильно используют. Это представление
может быть строгд применено только к таким реакциям, как дис¬
социация уксусной кислоты, поскольку она протекает в одну ста¬
дию без образования каких-либо промежуточных продуктов. Мно¬
гие же простые реакции при детальном рассмотрении оказываются
сложными и в результате их протекания возможно образование не¬
скольких промежуточных продуктов. Поэтому равновесие в таких
реакциях не является следствием протекания только двух проти¬
воположно направленных реакций, а полное количественное опи¬
сание влияния изменения условий на равновесие возможно лишь
с учетом всех промежуточных веществ.Рие. I. 1. Зависимость изменения
концентраций иедиссоциироваи-
ной уксусной кислоты и ацетат-
иоиа от времени при различных
значениях их исходных концен¬
траций:а — [НАс] = 1,00 • 10~* М-, [Ас“]=0;
б —[Ас“] = [н+] = 1.00. 10-4 М- [НАс]=0.
Равновесные концентрации обозначены
пунктирными линиями.
Сложные равновесия11Например, при смешении сульфата меди с концентрированным
раствором аммиака возникает интенсивное сине-фиолетовое окра¬
шивание. Реакцию записывают, как правило, такCu2+ + 4NH3 5=± Cu(NH3)24+поскольку найдено, что большая часть ионов в растворе связана
с четырьмя молекулами аммиака.Однако детальное изучение этой реакции в условиях различной
концентрации аммиака показало, что существуют еще четыре типа
частиц. Все они содержат ион меди и различные количества моле¬
кул аммиака. Таким образом, указанная выше реакция " может
быть представлена как протекающая в пять стадий:CuNH*+Cu(NH3)’+Cu(NH3)r
Cu(NH3)J+Cu(NH3>5+В решетке таких солей, как Cu(NHs)4S04-5H20 присутствует
ион тетрааммиаката меди Си(ЫНз)4+. В растворе же некоторые из
указанных ионов могут терять молекулы аммиака, другие — при¬
соединять их. В результате все эти ионы в той или иной концентра¬
ции будут содержаться в растворе.Данные рентгенографического исследования кристаллов гидра¬
тированных солей меди (типа CuS04-5H20) показали, что с ионом
меди прочно связаны четыре молекулы воды. В растворе, однако,
как это следует из спектроскопических данных, к иону меди до¬
полнительно присоединяются еще две молекулы воды, но нахо¬
дятся они на несколько большем расстоянии. Взаимодействие иона
меди с аммиаком может быть лучше представлено как результат
замещения молекул воды молекулами аммиака:Cu(H20)g+ + NH3 Cu(NH3)(H20)*+ + H20Cu(NH3)(H20)=++NH3 ^ Cu(NH3)2(H20)f + H20Cu(NH3)2(H20)’++ NH3 Cu(NH3)3(H20)*++ H20Cu(NH3)3(H20)3+ + NH3 Cu(NH3)4(H20)*++ H20Cu(NH3)4(H20)j+ + NH3 Cu(NH3)5(H20)2++ H20Продукт замещения, включающий шесть молекул аммиака,
принципиально возможен, но он не обнаружен при исследованииCu2+ + NH3
CuNH*+ + NH3
Cu(NH3)*+ + NH3
Cu(NH3)3+ + NH3
Cu(NH3)f + NH3
12I. 2. Константа равновесияравновесий. Так, даже в наиболее концентрированных (из возмож¬
ных) растворах аммиака этот ион присутствует в столь малых
количествах, что определить его не удается.Присоединенные к ионам меди молекулы воды могут терять
ионы водорода; в результате в растворе появляются ионы типа
СиОН+ или Си2(ОН)2+Cu(H20)f ^=± Cu(H20)6(0H)++ Н+Н20 Н,0
Н2Оч | /ОН\ | /Н2°2Cu(H20)2+ + 2Н+ + 2Н20которые находятся в равновесии с аммиачными комплексами меди.Заметим, что молекулы воды обычно не указывают в форму¬
лах ионов.Аммиак может присоединять ион водорода; в результате по¬
лучается ион аммония (см. раздел V. 3, стр. 115):NH3 + H+ ^=± NHJКроме того, вода диссоциирует на ионы водорода и гидро¬
ксильные ионы:Н20 ^=± Н+ + ОН“Таким образом, полная картина взаимодействия иона меди
с аммиаком может быть представлена только при условии знания
многих равновесий в этой системе.Следует отметить, что многие положения, рассматриваемые
в дальнейшем, приложимы лишь к растворам с концентрацией ме¬
нее ~0,1 М. К концентрированным растворам, для которых спе¬
цифическое взаимодействие между ионами становится существен¬
ным, они неприменимы. Тем не менее, большинство практически
важных систем может быть рассмотрено с использованием общих
положений и методов.1.2. КОНСТАНТА РАВНОВЕСИЯКонстанта равновесия — основное понятие, позволяющее коли¬
чественно изучать равновесия. Гульдберг и Вагге (1865 г.) в своем
законе действия масс особо подчеркивали, что законы равнове¬
сия— количественные. Точная формулировка законов, управляю¬
щих равновесием, дана Вант Гоффом в 1877 г. В течение после¬
дующих тридцати лет Вант Гофф, Оствальд, Аррениус, Нернст и
Гиббс своими работами показали их применимость к различным
системам.
I. 2. Константа равновесия13Вернемся к диссоциации уксусной кислоты. Равновесные кон¬
центрации недиссоциированной кислоты, ацетат-ионов и водород¬
ных ионов измерены для различных условий (разная концентра¬
ция кислоты в воде; в воде с добавками соляной кислоты и аце¬
тата натрия) и приведены в табл. I. 1.Таблица 1.1Константа равновесия диссоциации уксусной кислоты при 25°ССредаКонцентрация *, Маналитиче¬
ская **[НАс][Ас~][Н+]2,9,0~57,1 •10_57,1 •10"6,61(Г3,4-10 43,4-10 48,7310 31,27 -10 11,27 -109,65104,5-104,5-109,01о_!1,0 -1(Г!1,7-1(Г57,010-3,0-10 ,4,4-10_5,010 45,0-10 11,8 -1<Г4,0106,0-101,3 *ю-59,0ю-;1,7-1(Г51,0 -10_!7,01014,4-10~3,0-10-5,010-1,8 •10~5,0-1(Г13,010 I8,0-10~7,0-1(Г1,0ю-42,0-ю~69,0 •10~4Уксусная кислота
в водеУксусная кислота
в воде с добав¬
кой ацетата на¬
трияУксусная кислота
в воде с добав¬
кой соляной кис¬
лоты1,00-10"
1,00-10'
1,00- 10'
1,00-10'1,00- 10 “
(общая
концен¬
трация)1,00- 10_3
(общая
концен¬
трация)1.741.751.85
2,101.891.89
1,80
1,951.891.89
1,801.86
1,80* Прямое определение всех концентраций экспериментально неосуществимо. На практи¬
ке величину [Н+] определяют потеициометрически, а остальные концентрации рассчитывают,
используя имеющиеся данные. Приведенные величины взяты из работы Harned, Mur¬
phy, J. Am. Chem. Soc., 53, 8(1931), но существенно упрощены (см. раздел II. 2). *** Аналитическая концентрация —общее число молей вещества в 1 л раствора. В КГ" М
растворе СН3СООН аналитическая концентрация Сцдс^ЬОО.Ю-4 М. Действительная кон¬центрация иедиссоциированиых молекул кислоты НАс равна 0,67-10
присутствует в виде ионов водорода и ацетат-ионов (см. рис. 1,1).М; остальная же часть‘ Концентрационная константа равновесия диссоциации уксусной
кислоты определяется уравнением:[н+][Ас“]Ка-[HAcJ(1)(концентрации выражены молярностью, М).Из данных табл. 1.1 следует, что величина Ка очень слабо за¬
висит от концентрации; она зависит от температуры раствора
(см. раздел II. 4, стр. 53) и практически не зависит от атмосфер¬
ного давления.Выражение для константы равновесия не содержит члена, зави¬
сящего от количества раствора. Только отношение числа ионов
141.3. Способы выражения константы равновесияданного вида к общему числу растворенных молекул, т. е. концен¬
трация ионов, существенно для описания равновесного состава
раствора.В случае чистой уксусной кислоты (см. табл. I. 1) величина Ка
увеличивается с ростом концентрации кислоты. Это является ре¬
зультатом прежде всего электростатического взаимодействия
ионов, отличного от их химического взаимодействия. До тех пор,
пока общая концентрация ионов в растворе ниже 10~3 М, значе¬
ния Ка, определяемые уравнением (1), отличаются друг от друга
не более чем на ±5%.Когда необходима большая точность или рассматриваются бо¬
лее концентрированные растворы, концентрации в уравнении (1)
должны быть заменены на активности (обозначены фигурными
скобками) *, которые учитывают взаимодействия между ионами:„о {н*} {Ас}{НАс} ()Константа равновесия, выраженная через активности веществ,
называется термодинамической константой равновесия. Ее опреде¬
ляют экстраполяцией концентрационной константы равновесия
к нулевой концентрации; в нашем примере с уксусной кислотой
оказывается, что /С? == (1,75 ± 0,02) - 10-5 при 25 °С.Отметим, что в первом приближении активность может быть
заменена молярной концентрацией.1.3. СПОСОБЫ ВЫРАЖЕНИЯ КОНСТАНТЫ РАВНОВЕСИЯОбщая формулировка закона равновесия может быть получена
из следующих соображений. Для реакцииаА + ЬВ ^=± сС + dD
при равновесии будет выполняться соотношение{А}* {В}* (1)где А, В, С, D — некоторые вещества; а, Ь, с, d — стехиометриче-
ские коэффициенты.Понятие активности в разных случаях рационально нормиро¬
вать следующим образом.I. Ионы и молекулы в разбавленном растворе — активность
численно приблизительно равна молярной концентрации (см. раз¬
дел II.2 и главу XII) и строго равны ей в бесконечно разбавлен¬
ном растворе.II. Растворитель в разбавленном растворе — активность равна
молярной доле растворителя и близка единице.* Более детально см. разделы II. 4 (стр. 49) н главу XII,
Ионное произведение воды15III. Чистые твердые или жидкие вещества, находящиеся в рав¬
новесии с раствором — активность равна единице.IV. Газы, находящиеся в равновесии с раствором — активность
равна парциальному давлению отдельного газа *.V. Смеси жидкостей — активность данного компонента прибли¬
зительно равна его молярной доле.Константа равновесия К0, выраженная через активности, зави¬
сит только от температуры и не зависит ни от давления **, ни от
состава системы. Закон равновесия получен в результате экспе¬
риментальных исследований в разбавленных растворах, хотя он
может быть выведен и теоретически из положений химической тер¬
модинамики.Рассмотрим несколько примеров приложения закона равнове¬
сия к ионным растворам.Ионное произведение водыОчень важное для растворов равновесие — диссоциация воды —
приводит к появлению водородных и гидроксильных ионов:Н20 + Н20 Н30+ + он-Эту реакцию обычно записывают в краткой форме:Н20 Н+ + ОН"Выражение для термодинамической константы равновесия име¬
ет вид:Поскольку активности ионов примерно равны их концентра¬
циям, а активность воды близка к единице, то обычно используют
приближенное выражение для константы равновесия:Кн2о = 1н+Нон“] (3)Константу КнгО называют ионным произведением воды.В очень концентрированных растворах или в присутствий дру¬
гих растворителей (например, спиртов) активность воды уже не
равна единице; поэтому необходимо пользоваться точным урав¬
нением (2), в котором активность воды приблизительно равна ее
молярной доле, а последняя меньше единицы. Таким образом, кон¬
центрации водородных и гидроксильных ионов в водно-спиртовых
смесях меньше, чем в чистой воде при тех же условиях.* Для газовых реакций при высоких давлениях активность не точно равна
парциальному давлению, но поправка на неидеальность газа обычно невелика.** Более строго — весьма слабо зависит от давления (Прим. ред.).
16I. 3. Способы выражения константы равновесияПроизведение растворимостиМатематическое выражение для произведения растворимости
подобно полученному для ионного произведения воды.Если ионная твердая соль и ее насыщенный раствор нахо¬
дятся в состоянии равновесия, то концентрации ионов подчи¬
няются закону равновесия, например, для хлорида серебра:AgClTB Ag+ + Cl-Поскольку мы имеем дело с чистой солью ее активность равна
единице, т. е.:C)o = (Ag+}{cr}Заменяя активности на концентрации, получаем:К (тв) о= lAg ] [Cl ]Константу /С(тв)о называют произведением растворимости.Эту формулу используют для приближенных вычислений, од¬
нако в случае точных расчетов при концентрациях больших 10~3 М
необходимо применять активности ионов.Константа ионизации слабой кислотыОбсуждая уксусную кислоту, мы уже на ее примере ознако¬
мились с ионизацией слабой кислоты.РеакциюНАс 4- Н20 5=± Ас-+Н30+
обычно условно записывают в краткой форме:НАс Ас" + Н+ЧТермодинамическая константа равновесия имеет вид:о {Н+} {Ас~}{НАс}В разбавленных растворах активности могут быть заменены
концентрациями:[н+] [Ас-] = Ка [НАс]Понятия константа ионизации и константа диссоциации обычно
взаимозаменимы, но в некоторых случаях желательно делать раз¬
личие: ионизация — это образование ионов; диссоциация — распад
На части,
Ступенчатые константы образования комплексных ионов 17Константа ионизации слабого основанияСлабое основание, например аммиак, может взаимодействовать
с водой. В случае аммиака при этом образуются ионы аммония и
гидроксильные ионы:NH3 + H20 NHJ + OH"В разбавленном растворе выражение для концентрационной
константы равновесия этой реакции приближенно имеет вид[NHt][OH-] = Kb [NH3]поскольку активности ионов и аммиака примерно равны их кон¬
центрациям, а активность воды как растворителя близка к еди¬
нице. Величину Кь называют константой диссоциации основания
NH4OH (см. раздел V. 3, стр. 116).Ступенчатые константы ионизации многоосновных кислотЕсли кислота может терять более одного иона водорода, в си¬
стеме устанавливается несколько равновесий, каждое из которых
описывается своей, независимой от других, константой равновесия.
Так, для фосфорной кислоты, диссоциирующей по трем ступеням,
для описания экспериментальных данных необходимы три незави¬
симых уравненияН3Р04 Н2Р07 + Н+; [н+1[Н2Р07] = Ка1[Н3Р04]н2Р07 нро24- + н+; [н+] [hpoj-] = ка2 [н2ро;]HPOJ- POJ" +Н+; [н+][РОГ] = К03[нРОГ](численный индекс у величины Ка указывает на заряд аниона,
образующегося при реакции). Как и ранее, в данном случае ак¬
тивности заменены на концентрации.Ступенчатые константы образования комплексных ионовРавновесия образования комплексных ионов и диссоциации
многоосновных кислот идентичны. Записываются они обычно так,
чтобы показать образование иона, а не его диссоциацию. Напри¬
мер, образование хлоридных комплексов кадмия может быть пред¬
ставлено уравнениями:Cd2+ + CF CdCl+; [CdCl+] = K, [Cd2+] [СГ]cdcr + cr CdCl?; [CdClj] = К2 [CdCl+] [СГ]CdClj + Cr ^ CdCIJ; [CdClj] = K3 [CdCl2] [СГ]CdClj СГ CdClf; [CdClf] = K4 [CdClj] [СГ]
181.3. Способы выражения константы равновесияЗдесь индексы у констант означают число ионов хлора в ком¬
плексном соединении, полученном по реакции. Как и ранее, актив¬
ности заменены концентрациями.Общие константы образованияДля расчетов ионных комплексных систем иногда удобно
использовать общие константы, являющиеся комбинациями сту¬
пенчатых констант образования. Однако для полного описания всех
равновесий число общих констант должно соответствовать числу
ступенчатых констант.Рассмотрим в качестве примера систему хлор — кадмий:Cd2++ СГ CdCl+; [сасг] = р, [Cd2+] [СГ]Cd2+ + 2СГ CdCl2; [CdCl2] = р2 [Cd2+] [СГ]2Cd2+ + 3C1" CdCl"; [CdClj] = p3[Cd3+] [СГ]3Cd2+ + 4СГ CdCl2-; [CdCl2-] = p4 [Cd2+] [Cl“]4Следует отметить, что:Pi —Kl, р2 — KlKii Рз = KlK2K3; ^4 = KlKiKiKiСущественно также следующее. В то время, как ступенчатые
уравнения, вероятно, представляют элементарные акты образова¬
ния комплексов, общие уравнения такого представления не дают;
они лишь в математической форме описывают соотношения между
элементарными актами.Иногда величину, обратную общей константе образования выс¬
шего комплекса, называют константой нестойкости последнего.
Для рассматриваемой системы:CdCl2- Cd2+ + 4СГ; [Cd2+] [СГ]4 = Кнест [CdCl2-]Константа нестойкости является характеристикой комплексо-
образования лишь в тех случаях, когда концентрации всех ком¬
плексов, кроме высшего, исчезающе малы, а это бывает редко.Образование комплексных ионов из твердых веществКогда металл образует соль, которая также плохо раство-
рается, как и соли комплексных ионов этого металла с тем же
анионом, равновесия часто описывают с помощью уравнений реак¬
ций образования различных комплексов из этой соли. Так, в си-
Вопросы19стеме хлор — серебро возможны следующие равновесия*:AgClTB z=+ Ag+ + СГ; [Ag+] [СГ] =/С(ТВ) О
AgClXB ч > AgCIeoflHl [AgCl] = ТС(тв) 1AgdTB + cr ^ AgCi;; [AgClj] = К(ТВ)2[СГ]AgCItB+2Cr AgCl2- [AgCl^] =/C(TB)3[dT
AgClTB + 3Cr AgCl3-; [AgClfJ = К(тв)4 [СГ]3Все приведенные выше равновесия возможны только при на¬
личии твердого хлорида серебра. Ступенчатые константы образо¬
вания или общие константы для хлоридных комплексов серебра
можно получить, комбинируя имеющиеся константы. Например:Кэ = К(тв) э/К(тв) 2', Рз == К (ТВ) з/К (ТВ) о! /Cl = /С(ТВ) l//C(TB) оВопросыНайдите выражения для констаиты равновесия следующих реакций, прибли¬
женно справедливые в случае разбавленных растворов.1. HCN Н+ + CN”.2. CH3NH2 + H20 CH3NHj + ОН-.3. BaS04(TB) 5=± Ba2++SO-4- Саз(р°4)2(1в) ЗСа2+ + 2Р03-.5. С02(р.р) + Н20 Н2СОэСО2 (г) + Н2О ч - н2со3Н2СОз +=£ Н+ + НС07
НС07 Н++СОз_.6. Hg2+-f СГ ^=± HgCl+HgCr + Cl- HgCl2
Hgci2 + cr 5=± HgC17HgC17 + Cl~ HgClJ-.7. CuClTB Cu+ + Cl"*-
CuClIB+cr ^=± CuClJ
CuClTB + 2СГ CuCl2-.8. N2H4 + H+ ^=± N2H+ВД+Н+ 5=± N2Hf.* Индекс «водн» у AgCl указывает на растворенные молекулы AgCl (для
отличия от твердой соли и от ионов в растворе).
20/. 4. Свободная энергия и константа равновесия9. +NH3CH2COOH +Ш3СН2СОСГ + Н++NH3CH2COO” NH2CH2COO' + Н+.10. Fe3+ + HF FeF2+ + H+FeF2+ + HF FeF++H+FeFj + HF FeF3 + h+.11. 2AgITB + 4P +=£ Ag/-.12. Th4+ + H3P04 ;p=± ThH2PO*+ + H+.13. 2H++ Ca4H(P04)3 • 3H20TB Z=± 4Ca2++ 3HP02-+ 3H20.14. Напишите общее уравнение образования и выражение для общей кон¬
станты образования каждого из четырех хлоридных комплексов ртути (см. Во¬
прос 6).15. Напишите выражение для константы нестойкости Ag(S203)2_ и соответ¬
ствующее ей уравнение реакции.1.4. СВОБОДНАЯ ЭНЕРГИЯ И КОНСТАНТА РАВНОВЕСИЯХотя выражение для константы равновесия можно рассматри¬
вать как полезное эмпирическое соотношение, однако более пол¬
ные сведения о равновесии может дать лишь термодинамика. Хими¬
ческая термодинамика изучает энергетические соотношения в си¬
стемах. Одно из наиболее важных ее применений — нахождение
законов, управляющих равновесием, и предсказание значений кон¬
стант равновесия.Вопросам химической термодинамики посвящено много книг.
Поэтому здесь приведены только те сведения, которые полезны
для расчета константы равновесия из табличных данных.Большинство данных по равновесию представлено через тер¬
модинамическую функцию, называемую свободной энергией
ГиббсаG — Н — TSгде Н — энтальпия; Т — температура (абсолютная); S — энтропия.Равновесие в системе при постоянных температуре и давлении
устанавливается тогда, когда свободная энергия минимальна. Из¬
менение этой функции, происходящее в системе в результате про¬
текания процесса при постоянных давлении и температуре, равно
взятой с обратным знаком максимальной работе, которую система
может произвести над окружающей средой, кроме работы рас¬
ширения.Свободную энергию 1 моль вещества можно выразить через
его активностьОа = °А + RT In {А} (1)
1.4. Свободная энергия и константа равновесия21где R — газовая постоянная [1,987 кал/(моль-град)]-, In {А} — лога¬
рифм активности вещества А.Постоянная величина СА является характеристикой вещества А
при данной температуре и называется стандартной свободной
энергией. Часто ее определяют как свободную энергию вещества
в некотором стандартном состоянии, когда {А} = 1. Однако необ¬
ходимо подчеркнуть, что величина G° зависит от выбора исследо¬
вателем стандартного состояния, для которого принято значение
активности, равное единице. Если активность вещества в разбав¬
ленном растворе приравнивают концентрации, то при различных
способах выражения последней стандартные состояния оказы¬
ваются неодинаковыми.Для реакцииаА+6В ^=± cC + dD (2)изменение свободной энергии в процессе превращения реагентов
с активностями {А} и {В} в продукты реакции с активностями
{С} и {D} равно:Д G = cGc + £fGD— aGA — 6GB (3)Используя уравнение (1), получаем{C}c{D}dAG = AG° + RT In {А}Я{В}Г (4)гдеAG =* cGq + cIGq — я(?д— bGQ (5)Величина AG° представляет собой константу, характеризующую
рассматриваемую реакцию при данной температуре, и называется
изменением стандартной свободной энергии рассматриваемой ре¬
акции.Не существует методов определения абсолютных значений
стандартной свободной энергии отдельных веществ; можно найти
лишь изменение величины AG при реакциях.Условные значения G° можно получить, однако, в предположе¬
нии, что стандартная свободная энергия простых веществ равна
нулю.Далее, предположение, что свободная энергия образования гид¬
ратированного иона водорода в водном растворе также равна
нулю, позволяет оценить значения свободной энергии образования
всех других ионов в водных растворах.Таким образом, стандартная свободная энергия всех веществ,
а также ионов, определяется как стандартная свободная энергия
реакций образования их из простых веществ или из гидратирован¬
ных ионов водорода:G° = AGf
22/. 4. Свободная энергия и константа равновесияЭти свободные энергии образования вычислены и табулирова¬
ны; их используют в уравнении (5) для вычисления стандартных
свободных энергий любых химических реакций.Связь констант равновесия со стандартной
свободной энергиейЕсли AG <С 0, то реакция протекает самопроизвольно в том
направлении, как она записана; при AG > 0 реакция самопроиз¬
вольно протекает в обратном направлении; если AG = 0, система
находится в равновесии. В последнем случае отношение активно¬
стей в уравнении (4) просто является выражением константы рав¬
новесия [см. уравнение (1), стр. 14]. Таким образом, при равнове¬
сии уравнение (4) принимает вид:AG° = — RT In К (6)Для комнатной температуры, переходя к десятичным логариф¬
мам, получаем следующее выражение для AG° (в ккал/моль):AG° = — 1,364 lg К (6а)Рассмотрим несколько примеров расчета константы равновесия
с использованием табличных величин термодинамических функций.Пример 1.1. Используя приведенные значения свободных энергий образова¬
ния при 25° С, рассчитайте константу ионизации Ка уксусной кислоты.Н+ Ас" НАс
AG°f, ккал/моль О* — 87,32 — 93,80Величина Ка является константой равновесия реакции:НАс Н+ + Ас~Используя уравнение (5), ьюжно найти величину AG°:AG° — G° + + G° _ — G° = 0 — 87,32 + 93,80 = 6,48 ккал/мольН Ас НАсПодставив это значение в уравнение (6а), получим:, „ 6,48 ,,г „ [Н+][Ас“] , п—5IgKo = “ W=_4’75; [НАс]"" = 1,78 *10Пример 1.2. Используя ' приведенные значения термодинамических функций
при 25° С, рассчитайте произведение растворимости хлорида серебра.AgCiTB Ag+ с гAGf, ккал/моль —26,224 18,430 —31,35По определению.
Связь констант равновесия со стандартной свободной энергией23Произведение растворимости /С(тв>о — это константа равновесия реакции'
AgClTB ~ Ag -f- Clдля которой:AG = G + + G —G° = 18,430 — 31,35 + 26,224 = 13,304 ккал/мольAg Cl AgClИспользуя уравнение (6a), получаем:lg К(tb) o = - =- 9,75; ° * [А§Ч [C1'1 = 1,78'10_ШВеличина свободной энергии образования помимо того, что по¬
зволяет в краткой форме характеризовать равновесия, имеет еще
одно достоинство: ее можно вычислить, используя данные по теп-
лотам образования, теплоемкости,
а также результаты спектроскопи¬
ческих исследований. Даже тогда,
когда указанных данных нет, мож¬
но, используя многочисленные эмпи¬
рические соотношения, оценить ве¬
личину свободной энергии, предска¬
зать возможность протекания реак¬
ции и приближенно рассчитать зна¬
чение константы равновесия.Поскольку величина свободной
энергии минимальна для равновес¬
ного состояния, с ее помощью лег¬
ко проверить равновесность си¬
стемы.Рассмотрим диссоциацикГ’уксус-
ной кислоты (100 мкмоль!л). На
рис. 1.2 свободная энергия отложе¬
на как функция концентрации [Ас-].Степень диссоциации при этом опре¬
деляется концентрацией [Ас-] при
условии, что [НАс] + [Ас-] = 100 мкмоль/л. Величина свободной
энергии для любой степени диссоциации отнесена к свободной
энергии раствора недиссоциированной кислоты, т. е. когда
[Ас-] = 0. Равновесие наступает при составе (а = 34%), кото¬
рому отвечает минимальное значение свободной энергии; послед¬
няя на 0,028 кал/моль ниже свободной энергии недиссоциирован¬
ной кислоты.Если указанный состав достигается с любой стороны, это зна¬
чит, что произошло уменьшение свободной энергии ровно иа столь¬
ко, сколько может быть получено в рассматриваемой химической
реакции.Смещение равновесия вызовет увеличение свободной энергии
системы, а для этого необходимо приложить внешнюю работу.Рнс. 1.2. Изменение свободной
энергии Гиббса при диссоциации
1,00 • 10-4 Л1 раствора СН3СООН-Левая часть кривой характеризует ра¬
створ недиссоциированной кислоты
(точка М — равновесный состав смеси,
соответствующий минимуму свободной
энергии:AG-—0,028 кал/моль, [Ас-] —34 и
(НАс]*=64 мкмоль!л); правая часть кри¬
вой характеризует раствор, содержащий
только ионы водорода и ацетат-ионы
(в точке N величина ЛО*0,ЮЗ кал!моль).
24I. 5. Электродные потенциалыВопросыИспользуя приведенные термодинамические данные, рассчитайте константы
равновесия следующих реакций.16. AgBrTB17 hso;18. РО’” + Н+19. н2ро; ^20. Н+ + CN“ВеществоГТ+ПВОДНAg+ .
AgBrTB
Br-. .
CN~ .
HCN .: Ag+ + Br-
H+ + S02“z=± hpo24-H+ + HPO2"HCN
AGf, ккал/моль018,430—22,930—24,57439,626,8ВеществоН2Р0ГHP04”роГ-hso;
so Г.AGf, ккал/моль
—271,3
-261,5
—245,1
—179,94
—177,34а 4 ъ—rfWWWWWY*-Iе ;1.5. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫОбратимые ячейки*Изменение свободной энергии реакции может быть определено
непосредственно, если она протекает в электрохимической ячейке.Однако измеренное значение напря¬
жения не будет соответствовать ве¬
личине свободной энергии реакции,
если в системе не установилось рав¬
новесие или реакция является не¬
обратимой.Если через систему протекает
заметный ток, то обратимость от¬
сутствует. По этой причине электро¬
движущую силу ячейки измеряют
потенциометрическим методом. Сущ¬
ность его состоит в том, что на ячей¬
ку подают разность потенциалов,
равную измеряемой, но противопо¬
ложную по знаку (рис. 1.3). Сколь¬
зящий контакт 1 перемещают по со¬
противлению 4 до тех пор, пока не
прекратится ток, о чем судят по гальванометру 2. В этот момент
отношение определяемой разности потенциалов Ех к известной Ев
равно отношению сопротивлений Rac и Rab■ Если сопротивление2Рис. 1.3. Схема потенциометри¬
ческой установки:/ — скользящий контакт; 2 —гальвано¬
метр; 3 —ячейка с неизвестным значе¬
нием Ех; 4 — сопротивление; 5 —батарея
с известным значением* В отечественной литературе принят термин гальванические элементы.
{Прим. ред.)
Некоторые условия относительно знаков э. д. с. ячеек25проволоки ab откалибровано, то отношение Rac и Яаь может быть
заменено отношением длин 1ас и 1аь■ Практически применяют на¬
бор калиброванных сопротивлений, а напряжение батареи калиб¬
руют по э. д. с. стандартного элемента.Если приложенное напряжение, несколько большее э. д. с.
ячейки, заставляет реакцию протекать в одном направлении, а
меньшее его значение — в противоположном, ячейка обратима.Практически измеряют ток, протекаю¬
щий через ячейку, как функцию приложен¬
ной разности потенциалов. Если на кривой
ток —напряжение вблизи точки нулевого
тока нет резкого изменения, то ячейку мож¬
но считать обратимой. Э. д. с. такой ячейки
соответствует величине свободной энергии
исследуемой реакции.Некоторые условия относительно
знаков э.д.с. ячеек и протекающих
в них реакцияхТипичной электрохимической ячейкой
является элемент Вестона, схема которого
приведена на рис. 1.4 (э. д. с. при 25 °С
равна 1,01807в). Его часто применяют для
определения стандартных потенциалов.Элемент Вестона может быть представлен
следующим образом:GCd (14% в Hg) | CdS04 (насыщ. р-р) | Hg2S04 (тв.) | Hg®где вертикальные линии означают границы раздела фаз.Э. д. с. элемента является величиной, не имеющей знака, но
условно принято считать ее знак таким, каков он у правого элек¬
трода на схеме. В данной книге использована форма записи элек¬
тродных реакций, принятая IUPAC в 1953 г. Согласно этой форме,
для приведенной схемы £ = +1,018 в; для схемы, написанной
в обратном порядке, Е = —1,018 в.На отрицательном электроде самопроизвольно разряжающейся
ячейки происходит окисление*, а на положительном электроде —
восстановление.* При электролизе, когда электрическую энергию прилагают извне, реакция
протекает в противоположном направлении и на этом электроде происходит
поглощение электронов, т. е. восстановление. Термины катод и аиод не всегда
точны; по этой причине мы их не применяем. Так, некоторые авторы определяют
катод как отрицательный электрод, другие — как положительный. При электро¬
лизе эти определения равнозначны, но в гальваническом элементе они взаимо¬
исключаемы, так как восстановление происходит на положительном электроде
самопроизвольно разряжающейся ячейки.Рис. 1.4. Схема насы¬
щенного элемента Вес¬
тона:1 — насыщенный раствор суль¬
фата кадмия; 2 — твердый
сульфат кадмия; 3 — амальга¬
ма кадмия (14?6 Cd); 4— паста
из ртути и сульфата ртути
(I); 5 — ртуть.
26/. 5. Электродные потенциалыТаким образом, в элементе Вестона протекают реакции:Cd ^z± Cd2+ + 2e-Hg2S04 + 2e~ 2Hg+S024-Суммарная реакция: Hg2S04 + Cd ^2Hg + Cd2+ + SO;;-Последовательность записи электрохимической реакции должна
соответствовать схеме элемента, так как от этого зависит знак
э.д. с. Для правильного написания реакции следует пользоваться
следующим правилом:в качестве исходного реагента реакции следует писать восста¬
новленную форму вещества левого электрода (Cd), а в качестве
продукта реакций — восстановленную форму вещества правого
электрода (Hg).Тогда, если электрохимическая ячейка представлена так, что
ее э. д. с. положительна (как в рассмотренном выше примере эле¬
мента Вестона), то реакция, записанная по указанному правилу,
протекает самопроизвольно.А что произойдет, если ячейка будет записана в обратном по¬
рядке©Hg | Hg2S04 (тв.) | CdS04 (насыщ. р-р) | Cd (14% в Hg)eт. е. ее э. д. с. будет отрицательна?Согласно вышеприведенному правилу реакция должна быть
записана следующим образом:2Hg + Cd2+ + SO2- Cd + Hg2S04Эта реакция самопроизвольно протекает справа налево.Таким образом, положительному значению э.д.с. отвечает са¬
мопроизвольная реакция, протекающая слева направо, отрица¬
тельному — самопроизвольная реакция, но протекающая справа
налево.Конечно, вне зависимости от записи ячейки в ней будет про¬
текать реакция, если эта ячейка является самопроизвольно раз¬
ряжающейся. Сопоставление направления реакции со знаком э.д.с.
необходимо лишь для правильного соотнесения величины э. д. с.
ячейки и свободной энергии реакции.Элементы с жидкостными соединениямиНемногие электроды с одним и тем же электролитом можно
сочетать друг с другом. Это ограничение обусловлено тем, что
в большинстве случаев вещества будут реагировать между собой.Типичным примером элемента с жидкостным соединением яв¬
ляется элемент Даниэля:eZn | Zn!+1 Cu2+1 Cu®4
Влияние концентрации на э. д. с.27По месту контакта жидкостей возникает потенциал потому, что
ионы различных типов или концентраций диффундируют через
границу раздела с неодинаковыми скоростями. Этот потенциал
(называемый диффузионным) может быть сведен к минимуму, если
использовать солевой мостик, соединяющий два полуэлемента.
Обычно в качестве электролита солевого мостика применяют кон¬
центрированный раствор инертной соли. Такой солью может быть
хлорид или нитрат калия, так как подвижности ионов К+, СГ и
NO3 почти одинаковы.Тем не менее, даже при наиболее благоприятных условиях диф¬
фузионный потенциал может составлять несколько милливольт,
что вносит неопределенность в термодинамические величины, вы¬
числяемые из данных по э. д. с.Свободная энергия реакцииПо определению (стр. 20), свободная энергия реакции равна
взятой с обратным знаком максимальной работе (за вычетом ра¬
боты расширения), которую может совершить система. В обрати¬
мой ячейке эта работа тратится на генерацию тока, а э. д. с. эле¬
мента является мерой изменения свободной энергии реакции. При
соблюдении условий записи ячейки, изложенных выше, э. д. с. об¬
ратимой ячейки Е связана с AG соотношениемД G=—nFE (1)где п — число электронов,'участвующих в реакции; F — число Фа¬
радея (96 500 к).Если э. д. с. выражена в вольтах, a AG в килокалориях, тоAG = — 23,06п£Когда Е > 0, электрохимическая реакция протекает самопроиз¬
вольно и AG < 0; это находится в согласии с высказанным ранее
положением (стр. 22).Влияние концентрации на э.д.с.В насыщенном элементе Вестона концентрации Cd2* и SOf-
постоянны, поскольку раствор насыщен CdS04. Вообще же, э.д.с.
элемента зависит от концентрации веществ в электролите. На¬
пример, если концентрация сульфата кадмия меньше насыщающей,
то £ > 1,018 в.Зависимость между концентрациями веществ и величиной э.д.с.
выражается уравнением Нернста, которое легко получить из урав¬
нения, описывающего изменение свободной энергии химическойреакции.
28I. 5. Электродные потенциалыИзменение свободной энергии превращения реагентов с актив¬
ностями {А} и {В} в продукты реакции с активностями {С} и {D}
описывается уравнением (4) (стр. 21):{С}с {D}dAG = AG° + /?r In(А}а {В}°Если это превращение сопоставить с реакцией, э.д.с. которой
равна Е, то, учитывая выражение (1), получаем уравнение Нерн-
ста *Е==Е._ж1пшщ (2)nF {А}° {В}®где£•— Д°°nFВеличину Е° называют стандартной э. д. с. ячейки и определяют
экстраполяцией данных э. д. с., измеренных при различных кон¬
центрациях электролита, к нулевой концентрации (см. раздел II. 4,
стр. 51).Как видно из уравнения (2), Е = Е°, когда активности реаген¬
тов и продуктов реакции равны единице. На практике, однако,
этим определением пользуются редко.Если концентрации веществ таковы, что реакция достигла рав¬
новесия, то AG = 0 и Е = 0 и:£° = -^'п * (3)Если Е выражено в вольтах, а температура равна 25 °С, то,
переходя к десятичным логарифмам, получаем следующие урав¬
нения:£ = £0. 0,05915 JCHDll
п {А}° {В}6lg/C= 16,9я£° (За)Рассмотрим в качестве примера элемент Даниэля
Zn | ZnJ+ | Солевой мостик | Си2+ | Сив котором протекает реакция:Zn + Cu2+ Zn2++CuУравнение Нернста для этого элемента имеет вид[Zn2+]Е = £° — 0,02957 lg[Cu2+]* Иногда это уравнение записывают с обратным соотношением активностей;
тогда знак перед логарифмическим членом меняется на противоположный.
Определение электродных потенциалов29если пренебречь диффузионным потенциалом и заменить актив¬
ности ионов их концентрациями.При условии [Zn2+] = [Си24-] = 0,01 М потенциометрические изме¬
рения дают: Е = Е° = 1,100 в.Если этот элемент замкнуть накоротко, то он будет разря¬
жаться и в конце концов наступит равновесное состояние, для ко¬
торого Е = 0. Используя уравнение Нернста (2а) и учитывая, что
Е° = 1,1 в, получаем при равновесии:jzn=372
g [Cu2+JДругими словами, при наступлении равновесия, реакция прак¬
тически протекла нацело и равновесные концентрации ионов сле¬
дующие:[Zn2+] = 0,02 М- [Си2+] = 1,25- Ю-39 МТакие же равновесные концентрации могут быть получены, если
кусочки цинка (взятые в избытке) поместить в 0,02 М раствор
сульфата меди.Следует отметить, что концентрация ионов меди очень мала —
в среднем один ион находится в объеме, равном объему Верхнего
озера *.Определение электродных потенциаловВместо того, чтобы приводить стандартные э. д. с. всех реакций,
удобнее табулировать стандартные электродные потенциалы (по
некоторой произвольной шкале), поскольку разность между этими
величинами для соответствующих электродов даст стандартнуюэ. д. с. любой реакции. Стандартный электродный потенциал опре¬
деляется как э. д. с. ячейки, в которой вторым электродом служит
стандартный водородный электрод**. При этом знак электродного
потенциала определяется знаком заряда электрода в такой ячейке.Знак электродного потенциала зависит от того, как записано
направление полуреакции: окисление или восстановление. Элек¬
тродные потенциалы равны восстановительным потенциалам при
соблюдении условий, о которых шла речь выше. Многие таблицы,
в том числе и важнейшая сводка Латимера s*, дают окислительные
потенциалы, значения которых равны восстановительным, но об-
ратны по знаку.* Имеется в виду одно из пяти озер в Северной Америке (Прим. перев.).** Водородный электрод состоит из платиновой пластины, поверхность кото¬
рой покрыта платиновой чернью. Через пластину барботирует водород. В таком
электроде парциальное давление водорода равно 1 атм, а активность ионов водо¬
рода в растворе — 1 М. В практике не только стандартный водородный элек¬
трод служит электродом сравнения. Последним могут быть и хлорсеребряный, и
каломельный, но калиброванные по стандартному водородному электроду.3* См. более новые сведения — Справочник химика, т. III, Изд. «Химия», 1965
(Прим. перев.).
30I. 5. Электродные потенциалыРассмотрим в качестве примера хлорсеребряный электрод.
Стандартный потенциал ячейкиGPt | Н2 (г.) | Н+СГ | AgCI (тв.) | Ag®равен 0,222 в. Это означает, что хлорсеребряный электрод поло¬
жителен, а самопроизвольно протекающая в нем реакция является
восстановительной:AgCI + е~ Ag + СГТаким образом, и электродный потенциал, и потенциал восста¬
новления AgCI равны 0,222 в.Если же полуреакция записана в обратном порядке, то ее по¬
тенциал равен —0,222 в и электрохимическим процессом является
окислениеAg + Cl" z=± AgCI +е~потенциал которого —0,222 в.Все электродные потенциалы определяют относительно стан¬
дартного водородного электрода, в котором протекает реакция:Н* + е <—- V2^2(r)Значение AG ее принято равным нулю, а это влечет за собой
равенство нулю и электродного потенциала.Последнее условие является добавлением к условию, принимаю¬
щему, что стандартная свободная энергия образования иона водо¬
рода в водном растворе равна нулю.Величины некоторых стандартных электродных потенциалов,
а также соответствующие им восстановительные реакции, приве¬
дены ниже*:Стандартный_ электродныйЭлектродная полуреакция потенциал.вLi+ + е~ \ LiTB —3,045Na+ + е~ т~Na-п, —2,714, Zn2+ + 2ё~ ZnTB : . . . —0,763Fe2+ + 2е~ FeTB —0,440Сг3+ + е~ Сг2+ -0,412Н* + 2е~ ?=> Н2(г) 0,000Stb + 2Н+ + 2е~ H2Sr 0,141Cui+ + е~ Cu+ 0,153AgClTB + e- AgTB + С Г 0,222Cu2+ + 2er CuTB 0,337^(TB) +2e~ 2r °>5355MnOJ + e~ MnOj" 0,564* Данные взяты из книги Латимера. Согласно рекомендациям IUPAK, знаки
изменены на противоположные, по сравнению с приводимыми Латимером, по-
скольку электродные реакции записаны в сторону восстановления.
Вычисление констант равновесия31СтандартныйэлектродныйЭлектродная полуреакция потенциал,вО, (г) + 2И++ 2е' Н20 0,682рез+ _)_ е- —>• ре2+ 0,771Hg2+ + 2е~ *z£ 2HgjK 0,789Ag+ + е~ < AgTB 0,7991Hg2+ + е~ +=+ '/2Hgs2+ 0,920Вг2 (Ж) + 2е~ 5Z± 2Вг- 1,0652Мп02(тв) + 4Н+ + 2е~ Мп2+ + 2Н20 1,23Сг20?"+14Н++6е" z=+ 2Сг3+ + 7Н20 1,33С12(г) + 2е' 5Z± 2С1- 1,3595Мп3+ + е~ х *• Мп2+ 1,51МпО; + 8Н++ 5е- Мп2+ + 4Н20 1,51H2Oj + 2Н+ + 2е~ 2Н20 1,77F2(r) + 2e- ^2F- 2,65Электродные потенциалы, измеренные в ячейках без жидкост¬
ных соединений, имеют правильность ±0,0001 в*. Большинство
же измерений проведено в элементах с жидкостными соединениями
и неопределенность, связанная с диффузионным потенциалом, огра¬
ничивает правильность пределами около ±0,01 в.Вычисление констант равновесия с использованием величин
стандартных электродных потенциаловИспользуя указанные выше закономерности и условия, можно
сформулировать следующие правила для вычисления констант
равновесия при наличии двух значений стандартных электродных
потенциалов.1. Записывают сбалансированное общее уравнение реакции
(иногда это легче сделать, комбинируя электродные реакции).2. Расчленяют уравнение на два уравнения, отвечающие двум
полуреакциям. Находят п — число электронов, участвующих в ре¬
акции.3. Находят стандартные электродные потенциалы (потенциалы
восстановления) для каждой полуреакции. (Потенциалы окисле¬
ния берут с обратным знаком.)4. Если полуреакция записана в сторону'восстановления (элек¬
троны слева), то ее потенциал является потенциалом электрода.
В случае записи процесса в сторону окисления (электроны справа)
для получения значения потенциала необходимо изменить знак на
противоположный._* Под правильностью будем понимать строгость выполнения для данной
ячейки соотношения Е = ДG/nF (в), где &G характеризует химическую реак¬
цию. (Прим, ред.)
32/. 5. Электродные потенциалы5. Суммируют потенциалы полуреакцией для получения стан¬
дартного потенциала реакции (£°).6. Вычисляют константу равновесия, используя уравнение
(За)*:Ig АГ= 16,9пЕ°Пример /. 3. Найдите константу равновесия реакции
Cu2+ + Zn Zn2+ + Cuпри 25 °С.Эту реакцию можно представить двумя полуреакциями:Полуреакция Электродный Потенциал4 потенциал, а полуреакции, вВосстановлениеCu2+ + 2е~ Си 0,337 0,337ОкислениеZn Zn2+ + 2е~ —0,763 0,763Обратите внимание, что вторая полуреакция является окислением и ее по¬
тенциал противоположен по знаку электродному потенциалу. Величина Е° равна
сумме потенциалов полуреакций:£° = 0,337 + 0,763= 1,1 вВ реакции принимают участие два электрона, т. е. п = 2. Подстановка най¬
денных величин в уравнение (За) дает:\gK — 16,9 • 2 • 1,1 = 37,2; К = 1,6 • 10*» —Следует отметить, что активности твердых металлов, поскольку они по¬
стоянны и равны единице, входят в выражение для константы в неявной форме.Пример 1.4. Найдите константу равновесия для реакции между Fe2+ и Сг202-.Полуреакцин и их потенциалы следующие: „ Электродный ПотенциалПолуреакция потенциал, в полуреакции, вОкислениеFe2+ Fe3+ + е~ 0,771 —0,771-ВосстановлениеСг202-+ 14Н++ 6е" ?=± 2Сг3+ + 7Н20 1,33 1,33Обратите внимание, что первая полуреакция является окислением и знак
ее потенциала противоположен знаку потенциала электрода.В реакции принимают участие шесть электронов, высвобождающиеся в пер¬
вой полуреакцин и поглощающиеся во второй:6Fe2+ + Cr202-+ 14Н+ 6Fe3+ + 2Cr3+ + 7HfO* Для температуры, отличной от 25 °С, применяют уравнение: lg К
= \6,QnE°^^Y~). Для 25 °С —обычной температуры, при которой произво;
электрохимические измерения, отношение 298/Г равно единице.
Вычисление констант равновесия88Потенциалы полуреакций являются свободными энергиями на одни переда¬
ваемый электрон; по этой причине их не умножают на число электронов, а
просто суммируют:Е° = -0,771 + 1,33 = 0,56 в
Используя уравнение (За), получаем:[Fe3+]6 [Сг3+]2lg /С = 16,9 • 6 - 0,56 = 56,8; /С = 6 - 10s6 =[Fe2+]6[Cr205-][H+]14Пример 1.5. Рассчитайте произведение растворимости хлорида серебра, ис¬
пользуя величины стандартных электродных потенциалов.РеакциюAgCITB Ag+ + С Г л
можно рассматривать как суммарную для следующих двух полуреакций.Полуреакция Электродный4 потенциал, вВосстановлениеAgClTB+e” ; AgTB + Cr 0,222ОкислениеAgTB ^ Ag+ -f е~ 0,799Используя уравнение (За), получаем:lg (тв) о = 16,9-1 (0,222 — 0,799) = —9,75
/С(тв)о = 1,78- 10-10 = [Ag+] [СГ]Результат тот же, что и в Примере I. 2 (стр. 22).Вычисление констант равновесия с использованием трех
или более величин стандартных электродных потенциаловЕсли рассматриваемую реакцию нельзя представить через две
табулированные полуреакции, то ее описывают посредством трех
или более полуреакций и поступают следующим образом:1. Записывают сбалансированное общее уравнение реакции.2. Расчленяют уравнение на несколько уравнений, соответствую*
щих полуреакциям, но так, чтобы электроны не входили в общее
уравнение.3. Если полуреакция записана в сторону восстановления, то
используют соответствующий ей потенциал, не меняя его знака.
В случае записи процесса в сторону окисления знак потенциала
изменяют.4. Умножают каждый из потенциалов полуреакции на число
электронов, передаваемых в ней.5. Суммируют найденные величины и для получения IgTC умно¬
жают сумму на множитель F/RT.Приведенный способ расчета константы равновесия можно при¬
менять и для случая, когда используют значения потенциалов
только двух полуреакций, но тогда появляется лишняя операция
умножения. В сущности мы это и делаем, когда вычисляем2 Зак. 345
34I. 5. Электродные потенциалысвободные энергии каждой из полуреакций, а затем суммируем их
для получения свободной энергии всей реакции.Пример 1.6. Рассчитайте константу равновесия окисления Сг2+ до Сг202-
перекисью водорода.Обратите внимание, что если бы мы сложили значения трех
потенциалов полуреакций и применили уравнение (За) с п — 8,
мы получили бы lg/C = 115, а это неверно.При ответе на вопросы используйте данные, приведенные на стр. 30. Не
забывайте также, что активности чистых твердых и жидких тел равны единице.21. Потенциал насыщенного элемента Бертона равен 1,018 в. С помощью
уравнения Нериста (2а) покажите, что, если концентрация сульфата кадмия
уменьшится, то потенциал увеличится. Каково будет значение потенциала, если
концентрация сульфата кадмия уменьшится на Ую по сравнению с насыщающей?422. Найдите константу равновесия реакции окнслеиия следующих ионов
перманганатом калия при условии, что МпО” восстанавливается до Мп2+:24. Рассчитайте константы равновесия следующих реакций, протекающих
с участием марганца (где необходимо, учитывайте ионы Н+ или молекулы Н20):ПолуреакцияЭлектродный
потенциал, вПотенциал
полуреакций, в2(Сгг+ J=± Сг3+ + вГ) ,2Сг3+ + 7НгО СГ202- + 14Н+ + 6е~4(Н202 + 2Н+ + 2е~ 2Н20)—0,411,331,770,41 0,82-1,33 -7,981,77 14,162Сг2+ + 4HsOj Сг2072-+ 6Н++ НаО7,00lg К = 16,9-7,00= 118,3; /f = 2,0*10U8 =' [Сг2+]2 [Н202]4ВопросыСГ; Сг3+; Мпг+ (до Mn02); Fe2+; Си (до Си21-); H2S (до S); Н202 и Hg2+23. Рассчитайте константу равновесия реакции:
Cu2++CuTB 2Си+Мп3+ Мп02(тв) + Мп2+MnO2- Mno; + MnOs(TB)Mn02(TB) Mn07 + Mni+'MnO2- + Мп2+ Мп,+25. Рассчитайте константы равновесия следующих реакций:
Вопросы3526. Рассчитайте произведение растворимости оксалата серебра, используя
величину электродного потенциала реакции:AgjCj04(TB) + 2е .< .** 2AgTB + С204 ; £'“ = 0,472 в27. Рассчитайте ионное произведение воды, если известен электродный по¬
тенциал в щелочном растворе:2Н20 + 2е~ ^ Н2(г)+20Н“; Е° = —0,828 в28. Рассчитайте полную константу образования комплекса Cd(CNJ^-, если
известны следующие электродные потенциалы:Cd*++2<r ^ CdTB; Е° = -0,403 в
Cd(CN)*-+ 2е“ ^ Cd„ + 4CN_; £° = -0,958в2* *
Глава II.ИЗМЕРЕНИЕ КОНСТАНТ РАВНОВЕСИЯ11.1. ПРЯМОЙ АНАЛИЗНаиболее очевидный метод определения констант равновесия
заключается в следующем: создают условия для нормального те¬
чения процесса — вплоть до достижения им равновесного состоя¬
ния, а затем анализируют получившийся раствор на присутствие
в нем всех возможных типов частиц; делают это, естественно, не
нарушая равновесного состояния.К сожалению, многие методы анализа основаны на взаимодей¬
ствии определяемых продуктов с некоторыми другими веществами,
а это нарушает равновесное состояние. Существуют, однако, ме¬
тоды, при помощи которых по крайней мере концентрации отдель¬
ных продуктов могут быть определены непосредственно без наруше¬
ния равновесия.Быстрые методы анализаОбычные аналитические методы определения равновесного со¬
става системы можно применять, когда время достижения системой
состояния равновесия во много раз больше времени проведения
анализа, т. е. изучаемая система достаточно инертна.В 1914 г. Нильс Бьеррум использовал прямой химический ана¬
лиз для определения констант равновесия в случае тиоцианатных
комплексов ионов трехвалентного хрома.• В равновесной смеси присутствовали ионы: Cr3+, CrSCN2+,
Cr(SCN)j, Cr(SCN)3, Cr(SCN);, Cr(SCN)|", Cr(SCN)j!' и SCN-.
Растворы, содержащие различные количества Сг3+ и SCN-, в те¬
чение нескольких дней выдерживали при 50 °С до тех пор, пока
не устанавливалось равновесие. Затем растворы быстро охлаж¬
дали до комнатной температуры и отдельные комплексы выделяли
методами осаждения и экстракции (см. схему). В каждом комп¬
лексе определяли общее содержание ионов хрома и тиоцианат-
ионов. Рассмотренный способ позволил найти и составы комплек¬
сов, и их концентрации.
Быстрые методы анализа37и—►и. Z
иС/о
38It. 1. Прямой анализНесмотря на сложность этой системы, Бьеррум смог найти ве¬
личины констант для всех шести комплексов, хорошо соглаСую-щиеся ПРИ различных "исходных кон-Спектрофотометрия (Многие системы достигают равно¬
весного состояния за очень малые про¬
межутки времени и разделение по ме¬
тоду Бьеррум а для них невозможно.
Так, при диссоциации уксусной кисло¬
ты равновесие устанавливается за не¬
сколько миллионных долей секунды
(см. стр. 10); это слишком малый от¬
резок времени для любых измерений
с использованием инструментальных
методов.Для определения типа частиц,
присутствующих в растворе, иногда
может быть использован спектро¬
фотометрический метод без нару¬
шения равновесного состояния си¬
стемы.Наибольшее затруднение в этом
методе возникает из-за того, что обыч¬
но абсорбционные спектры отдельных
ионов различаются не очень сильно и
поэтому концентрации их не могут
быть определены количественно. Тем
не менее, спектрофотометрическим ме¬
тодом в инфракрасной области спек¬
тра изучены комплексы серебра с ци¬
анид-ионом (рис. II. 1).Как видно из рис. П. 1, свободные
цианид-ионы и отдельные комплексы
имеют четко разделимые пики, высота
которых пропорциональна концентра¬
ции комплекса.Используя различные общие ко¬
личества серебра и цианида в раство¬
ре, можно, таким образом, определить
концентрации отдельных комплексов. Концентрацию свободного
иона серебра находят по разности.Константа равновесия, измеренная для различных количеств
серебра и цианида, лежит в пределах ошибки опыта.Ag(CN)j‘ А§(С!ЧДРис. II. 1. Инфракрасные аб¬
сорбционные спектры раство¬
ров, содержащих нитрат сере-
“бра и цианид калия в раз¬
личных соотношениях.
Цифры на кривых — отношение
[Ag+j/[CN“’J для каждого комплекса
[Jones, Penneman, J. Chem,
Phys.. 22. 965 (1954)].
Растворимость39Спектрофотометрические методы можно применять и для опре¬
деления концентрации частиц, находящихся в равновесии с погло¬
щающими частицами. В разд. V. 6 и XII. 4 приведены примеры
использования индикаторов для измерения концентрации ионов
водорода.РастворимостьПрямые методы анализа равновесий возможны и в тех слу¬
чаях, когда одним из реагентов является твердая соль. Если
между последней и раствором наступило равновесие, то в растворе
после отфильтровывания твердой соли концентрации ионов
остаются равновесными.О%XО)<//[ВгО}] ,л/мольРис. II. 2. Сопоставление вели¬
чин К(тв) о для AgBr03, найден¬
ных экспериментально (точки) и
теоретически.Прямая линия соответствует вели¬
чине K(jv) 0=6-5 • 1Д a m m е 11 е,
J. Chem. Ed., 33, 610 (1956)).Рис. Ы. 3. Растворимость S хло¬
ридов меди в соляной кислоте.Кривая рассчитана в предположе¬
нии, что К(ТЪ) 2—0,075, а Я(тВ) 3=
= 0,034 [М с С о п е 1 I, Davidson,
J. Am. Chem. Soc., 72, 3168 (1950)].Часто удается определить экспериментально концентрации од¬
ного нли нескольких ионов. Например, произведение растворимости
бромата серебра может быть определено путем насыщения им
раствора, содержащего различные количества бромата калия; по¬
сле отфильтровывания концентрацию Ag+ определяют титрованием
тиоцианатом калия (рис. II. 2).Теоретически можно предсказать, что концентрация [Ag+] дол¬
жна быть обратно пропорциональна концентрации [BrOJ]. Эта
зависимость описывается на рис. II. 2 прямой линией, проходящей
через начало координат; ее уравнение:6,5 • 10”'(тв)о[ВЮ7] [вго;]Найденные экспериментальные значения действительно ложатся
на прямую, проходящую через начало координат.
40II. I. Прямой анализПроблема усложняется, когда между катионом и анионом соли
образуются комплексы, как, например, в случае хлоридов меди.
Тогда обычно определяют растворимость соли в растворе, содер¬
жащем различные количества хлор-иона. Значения констант дис¬
социации комплексов для теоретической кривой, дающей наилуч-
ч шее совпадение с экспериментальной зависимостью, принимают за
экспериментальные константы. На рис. II. 3 сплошная линия —
теоретическая кривая для /QTB)2 = 0,075 и /С(Тв)з = 0,034, а точки —
экспериментальные данные (о расчете теоретической кривой см.
раздел VIII. 2).Когда один из ионов соли является слабой кислотой или осно¬
ванием, различная кислотность раствора влияет на концентрацию
этого иона в нем и, следовательно, на растворимость соли. Если
константа ионизации слабой' кислоты или основания может быть
определена независимо или возможны измерения в достаточно ши¬
рокой области значений pH, экспериментальные данные могут быть
хорошо согласованы с теоретической кривой (см. раздел VI. 6,
стр. 169), все это позволяет определить константы.Если слабая кислота или основание плохо растворимы, то кон¬
станты ионизации могут быть определены измерением их раство¬
римости в растворах с различным значением pH.Экстракция растворителемЭкстракция органическим растворителем возможна, если одно
из определяемых веществ существует в незаряженной молекуляр¬
ной форме. Описываемый метод основан на предположении, что
в органической фазе присутствуют только незаряженные моле¬
кулы, и равновесие между двумя фазами может быть использо¬
вано для расчета их концентрации в водной фазе.В качестве примера рассмотрим образование трииодид-иона:i2 + r ^ 17Водный раствор иодида калия и иода встряхивают с четырех¬
хлористым углеродом; при этом водная фаза содержит Ь, Г и
1з, а органическая — только Ь-Установившееся равновесие определяется относительными кон¬
центрациями иода в водной фазе и органической. Отношение кон¬
центраций постоянно; оно называется коэффициентом распределе¬
ния и может быть определено независимо с использованием рас¬
творов, содержащих иод и воду, но не содержащих иодид калия.После того, как в системе KI —12 установится равновесие,
органическую фазу отделяют от водной; титрование первой тио¬
сульфатом натрия дает концентрацию Ь- Концентрацию же свобод¬
ного Ь в водной фазе можно найти, используя коэффициент рас¬
пределения.\
Ионный обмен41Титрование водной фазы тиосульфатом натрия дает возмож¬
ность найти сумму [ 1а] и [13].Поскольку величина [12] вычислена из результатов титрования
органической фазы, концентрация [1з] может быть определена по
разности [I ] = [KI] — [1з], так как [KI] = [I ] + [b]- Таким обра¬
зом, концентрации всех трех типов частиц находят из результатов
двух титрований.В табл. II. 1 приведены некоторые данные по системе 12 —— I" — IJ. Величину константы равновесия вычисляли по формуле,, [*3М [Пдля разных концентраций [12] и [KI]; различия в значениях этой
величины не превышали 3%.Таблица II.1Характеристика равновесия для реакции 12 + Г ^=± IJ[М. Davies, Е. G w у n n е, J. Am. Chem. Soc., 74, 2748(1952)]м+м(ЬНО4К]Кз0,10108,1200,03954701,10,10020,9200,00660767,60,10000,4710,00348767,60,10000,1030,00078766,50,024827,7940,009271765,40,024825,2020,007068765,90,024820,8910,001595770,7Подобным образом исследовано равновесие реакции образова¬
ния аммиачных комплексов металлов. Из найденных величин дав¬
ления пара аммиака над растворами вычислена концентрация сво¬
бодного аммиака в растворе.Ионный обменИонообменные методы, в которых применяют иониты, сходны
с методами экстракции. Иониты являются синтетическими полиме¬
рами, содержащими функциональные кислотные или основные
группы; последние могут взаимодействовать с контактирующим
раствором; ионит при этом не растворяется. Так, катионит может
обменять ионы водорода на ионы металла из раствора, в резуль¬
тате чего устанавливается равновесие:Н+ (ионит) + Ме+ (раствор) 7 Ме+ (ионит) + Н+ (раствор)
42//. 2. Потенциометрические методыДля данного типа ионита отношение активности (концентра¬
ции) поглощенного иона к активности (концентрации) того же
иона в растворе является величиной постоянной *. Это отношение
по аналогии с экстракцией называют коэффициентом распреде¬
ления.Поскольку катиониты обменивают только положительные ионы
из раствора, а аннониты — отрицательные, ионообменные методы
применяют преимущественно для определения заряда комплексов,
содержащихся в растворе.Расчет констант равновесия из ионообменных данных заклю¬
чается в сопоставлении этих данных с теоретической кривой, по¬
лученной по известным величинам коэффициентов распределения.
Последние зависят главным образом от величины заряда иона,
а не от его природы.Ионообменные методы очень удобны для исследований равно¬
весий между сериями комплексов типа РЬ2+—РЬС1+—РЬСЬ—— РЬС1з—РЬС14_, так как заряды в данном случае изменяются
в достаточно широком интервале.Однако они непригодны для изучения серий комплексов, ли¬
ганды в которых не заряжены (например, Ag+, Ag(NH3)+»
Ag(NH3)2), ибо коэффициенты распределения всех этих ионов почти
одинаковы и эффект влияния концентрации аммиака практически
не наблюдаем.II. 2. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫДля определения констаит равновесия наиболее широко при¬
меняют методы, основанные на том, что э. д. с. обратимой электро¬
химической ячейки непосредственно связана с активностями ионов,
принимающих участие в реакции, уравнением Нернста [уравнение
(2), стр. 28].Например, э. д. с. ячейки, использованной Харнедом с сотруд¬
никами для определения констант диссоциации слабых кислот
(рис. II. 4)Pt | Н2 (г.) | НА, А", Н+, СГ | AgCI (тв.) | Agзависит от активностей {Н+} и {С1~} в электролите.Для общей реакции, протекающей в ячейкеAgCl(TB) + '/2Н2(г) ^ Ag + Н+ + СГ; £“ = 0,222 в
согласно уравнению Нернста, можно написать:Е = 0,222 - 0,05915 lg {Н+} {СГ}* Это определение справедливо в условиях постоянства кислотности рас¬
твора и преимущественного содержания нона водорода в ионите. (Прим. ред.)
Стеклянный электрод43Ионы водорода в растворе появляются только вследствие дис¬
социации слабой кислоты, и если поддерживать постоянной актив¬
ность иона хлора с помощью неизменной концентрации хлорида
калия, то изменение количества слабой кислоты и ее соли вызовет
изменение {Н+}, поскольку они связаны уравнением:{Н+} {А-} = Ка {НА}Естественно, это повлЬчет изменение э. д. с. ячейки.Э. 4д. с. рассматриваемой ячейки определяет активность иона
водорода, который появляется в результате диссоциации слабой
кислоты. Концентрации [НА] и [А-] на¬
ходят из известных количеств кисло¬
ты и соли, введенной в раствор. Та¬
ким образом, с учетом соответствую¬
щих поправок может быть вычислена
константа равновесия. В этой ячейке
водородный электрод обратим относи¬
тельно ионов водорода и является
«эталоном» для определения их актив¬
ности в растворе. Его поэтому назы¬
вают индикаторным электродом.Поскольку концентрация иона хло¬
ра фиксирована, потенциал хлорсе-
ребряного электрода не меняется; его
называют электродом сравнения.Техника измерения констант рав¬
новесия потенциометрическим мето¬
дом сводится к составлению электро¬
химической ячейки, в которой один
электрод является индикаторным — он
обратим по отношению к иону, участ¬
вующему в изучаемом равновесии, а
другой — электродом сравнения. Как
правило, невозможно составить цепьбез жидкостного соединения; поэтому основная неопределен¬
ность большинства исследований связана с возникновением диф¬
фузионного потенциала между раствором с электродом сравнения
и изучаемым раствором. Приведенная на рис. II. 4 ячейка хороша
именно отсутствием в ней жидкостного соединения.Рис. II. 4. Ячейка Харнеда для
определения константы дис¬
социации слабой кислоты:/ — платиновая пластина, покрытая
платиновой чернью; 2 — серебряная
пластина, покрытая хлоридом сере¬
бра; 3 —раствор известной концен¬
трации хлорида калия и изучаемой
кислоты.Стеклянный электродВодородный электрод H2(r.)|Pt служит стандартом для по¬
строения шкалы электродных потенциалов, но он легко выходит
hs строя в присутствии окислителей или ионов тяжелых метал¬
лов в растворе. Одним из наиболее распространенных и часто
44II. 2. Потенциометрические методыупотребляемых индикаторных электродов является стеклянный
электрод, который также обратим относительно иона водорода. По¬
скольку потенциал стеклянного электрода возникает в результате
перехода ионов водорода через тонкую стеклянную мембрану, а не
за счет окислительного процесса, постольку этот электрод нечув¬
ствителен к ионам металла, окисляющим агентам и т. д. Это позво¬
ляет применять его для измерения концентрации [Н+] почти в лю¬
бых системах. Стеклянный электрод является составной частью
различных рН-метров, нашедших широкое применение.На рис. II. 5 приведена ячейка
Ag | AgCi (тв.) | КС1. НАсСтеклян¬наямембранаИссле¬дуемыйрастворСол«вой I КС11 Hg2 С12 (тв.) | Hg
мостиксостоящая из двух электродов, которые помещены в разные стек¬
лянные трубки.Потенциалы каломельного (справа) и хлорсеребряного (слева)
электродов постоянны, поскольку неизменна концентрация хло¬
рида калия. Не меняется и концен¬
трация ионов водорода внутри стек¬
лянного шарика, так как постоянна
концентрация уксусной кислоты;
изменяется только концентрация
[Н+] в исследуемом растворе.Потенциал рассматриваемой
ячейки для очень широкой области
изменения [Н+] может быть найден
экспериментально по уравнениюЕ = 5° + 0,059 lg [н+]где Е° зависит не только от стан¬
дартных потенциалов и хлорсереб¬
ряного и каломельного электродов,
концентраций КС1 и НАс, но и от
потенциала ассиметрии. Последний
характеризует данную мембрану и
зависит от ее предыстории. Это
означает, что стеклянный электрод
в отличие от водородного не является абсолютным для измерения
концентрации [Н+]. Однако он может быть откалиброван по бу¬
ферному раствору, величина [Н+] которого известна.электродом для измерения pH:/ — паста Hg2Cl2 + Hg; 2—раствор хло¬
рида калия; 3 — капилляры: 4 — иссле¬
дуемый раствор; 5 —стеклянная мем¬
брана; 6 — раствор хлорида калия и
уксусной кислоты; 7 —серебро, покры¬
тое хлоридом серебра.Другие электродыДля исследования равновесий с участием ионов металла может
быть изготовлен индикаторный электрод из самого металла. Так,
для определения произведения растворимости солей серебра в ка¬
Эквивалентная электропроводность45честве индикаторного электрода используют серебряную прово¬
локу, которая погружена в насыщенный солью серебра раствор
с известной концентрацией аниона. Электрод сравнения соединяют
с раствором солевым мостиком. [Ср. с Примером 1.5 (стр. 33),
где величину /С(ТВ)о определяли в ячейке, содержащей AgTB и
AgCl-электрод.]Анионы могут быть определены в растворе, насыщенном солью
с тем же анионом; катионом в этом случае должен быть ион ме¬
талла, из которого сделан электрод. Например, хлорсеребряный
электрод применен для определения активности ионов хлора
в ячейке, приведенной на рис. II. 4 (стр. 43).Гидроксил-ионы можно определять при помощи стеклянного
электрода, так как произведение активностей Н+ и ОН- постоянно
из-за диссоциации воды.Потенциометрически могут быть определены отдельные кон¬
станты равновесия в случае диссоциации многоосновных кислот
или образования комплексных ионов. Титруя раствор, содержащий
один продукт реакции, раствором, содержащим другой в присут¬
ствии индикаторного электрода, обратимого относительно иона,
входящего по крайней мере в один из продуктов, можно найти
концентрацию этого иона при различных условиях.Диаграмму, на которой представлены экспериментальные дан¬
ные, сопоставляют с кривой, полученной расчетным способом. Те
значения констант, которые дают кривую, наилучшим образом
совпадающую с экспериментальной, и принимают за константы
равновесия.11.3. КОНДУКТОМЕТРИЧЕСКИЕ МЕТОДЫЛегкость, с которой ионный раствор проводит электрический
ток, зависит от концентрации ионов, присутствующих в растворе,
и в меньшей степени от природы ионов.Если в равновесии принимают участие частицы недиссоцииро-
ванного соединения или слаборастворимой соли, то электропровод¬
ность раствора характеризует общее число ионов в единице его
объема. В этих случаях для сравнительно простых систем измере¬
ния электропроводности могут дать все равновесные концентрации.С 1865 по 1910 гг. Кольрауш, Оствальд и Аррениус, применяя
кондуктометрический метод, определили ионное произведение воды,
константы диссоциации слабых кислот и оснований и произведения
растворимости солей. Многие из их измерений выполнены с уди¬
вительной точностью.Эквивалентная электропроводностьНаиболее важной характеристикой электропроводности является
эквивалентная электропроводность — понятие, содержание которого
может быть определено следующим образом.
II. 3. Кондуктометриче*кив методыВ ячейке конфигурации куба с высотой ребра 1 см и электро¬
дами площадью 1 см2, находящимися на расстоянии 1 см, удельная
электропроводность к (величина, обратная сопротивлению ячейки,
ом_1) раствора соли с молярной концентрацией С определяется
соотношениемАгС1000гдз Л — эквивалентная электропроводность, см2-ом~1-г^экв~1; z—
общее число положительных зарядов ионов одной формульнойединицы соли; гС — концентрация
раствора, г-э/св/л; 1000 — коэффи¬
циент для пересчета литров в ку¬
бические сантиметры.В период от 1869 до 1880 гг.
Кольрауш с сотрудниками в резуль¬
тате очень тщательных измерений
электропроводности многих водных
растворов различных веществ на¬
шел, что они принадлежат к двум
группам. К первой относятся силь¬
ные электролиты; эквивалентная
электропроводность их растворов
очень слабо зависит от концентра¬
ции. В качестве примера можно
Рис. II. 6. Зависимость эквива- привести соли — NaCl, KNO3,
лентиой электропроводности от NaCH3COO; кислоты — НС1, HN03;
концентраций сильного (КС1) и основания — КОН, NaOH. Вторуюслабого (СН3СООН) электроли- 1 ^тов (Nernst, Theoretical Chemi- ГРУППУ составляют слабые электро-
stry, N. Y., 1923). литы, у которых величина Л заметноменяется с изменением концентра¬
ции. Кислоты СНзСООН и HF — типичные примеры слабых элек¬
тролитов.Приведенные на рис. II. 6 данные для хлорида калия показы¬
вают, что величина Л почти не зависит от концентрации. Кривая,
проведенная по точкам, допускает экстраполяцию и может быть
описана уравнениемЛ = Л0 - Л/С = 130,2-79КС 'где Ао = 130,2 — эквивалентная электропроводность, экстраполи¬
рованная к бесконечному разбавлению (так называемая предель¬
ная эквивалентная электропроводность)-, А—эмпирическая по¬
стоянная.С другой стороны, эквивалентная электропроводность слабого
электролита — СНзСООН— мала при высоких концентрациях и
Законы Кольрауша и Оствальда47велика при низких. Это вызвано диссоциацией кислоты, опреде¬
ляемой равновесием:СН,СООН ^=± СН3СОСГ+Н+Независимость движения ионов (закон Кольрауша) /Для сильных электролитов экстраполированную величину Ло
можно рассматривать как сумму двух независимых слагаемых,
каждое из которых относится к одному иону. Это — закон незави¬
симости движения ионов (закон Кольрауша).Кольрауш показал, что значение Ло одного сильного электро¬
лита может быть почти точно вычислено из величины Ло для трех
других сильных электролитов. Так, для нитрата натрия измерен¬
ная величина Л0 равна 105,33, а вычисленная — 105,39:NaN03 = NaCl + KN03 — Ло, КС1== 108,99 + 126,50 — 130,10 = 105,'39Закон разведения ОствальдаЗакон Кольрауша использован Оствальдом для оценки экви¬
валентной электропроводности СНзСООН при бесконечном раз¬
ведении. Ацетат иатрия — сильный электролит и его эквивалентная
электропроводность при бесконечном разведении может быть
легко найдена экстраполяцией; она равна 87,4. Если эту величину
скомбинировать с подобными величинами для соляной кислоты и
хлорида натрия, то можно получить значение Л0 для НАс:Л0, НАс = Ло. NaAc + Ло, НС1 — Ло, NaCl = 87,4 + 379,4 ~ *09,0 = 357,8Отношение эквивалентных электропроводностей уксусной кис¬
лоты, соответствующих некоторой определенной концентрации и
концентрации, когда кислота диссоциирована полностью, является
степенью диссоциации:[Ас-] Л
° С “ Л„Зная концентрацию кислоты С и измеренную эквивалентную
электропроводность Л, можно легко найти величину [Ас-]:Если раствор состоит только из НАс и НгО, то одному иону
водорода соответствует один ацетат-ион *[н+] = [Ас1 = аС* Это соотношение справедливо лишь при условии пренебрежения диссо¬
циацией воды. При малых концентрациях уксусной кислоты уравнение электро-
нейтральиости имеет вид: [Н+] = [Ас"] + [ОН-]. (Прим. ред.)
48II. 3. Кондуктометрические методыи концентрация недиссоциированной кислоты определяется как
разность:[НАс] = С - [Ас-] = (1 - а) СВеличины, найденные экспериментально, подчиняются, как
установлено, условию равновесия:[Н+] [Ас~~] а2С Л2С~ „Ла [НАс] _ 1-а _Л0(Л0-Л)УравнениеКа-а2Сесть математическое выражение закона Оствальда. Кривая, при¬
веденная на рис. II. 6, рассчитана по этому уравнению.Определение растворимостиДля чистой воды, как и для уксусной кислоты, концентрации
водородных и гидроксильных ионов должны быть равны. Из¬
мерив удельную электропроводность допустимо чистой воды
(0,043 -ИН ом-'-см-1), Кольрауш определил ионное произведение
ее: Кнго = 1,17-10~14 при 25° С.Насыщенный раствор чистого сульфата бария в сверхчистой
воде имел удельную электропроводность 2,785-\0гь ом~х • см~1. Вы¬
читая электропроводность чистой воды и используя эквивалентные
электропроводности других солей бария и сульфат-иона, для на¬
хождения эквивалентной электропроводности BaS04 при беско¬
нечном разведении, Кольрауш сумел рассчитать концентрации
[Ва2+] и [SOf-] в насыщенном растворе; они оказались равными0,957-10-6М. Произведение растворимости сульфата бария, вы¬
численное с учетом этих величин, равно:К(тв) 0 = [Ваг+] [SOr] = 0,917 • 1<Г10Эта величина хорошо согласуется со значением, полученным
непосредственным измерением.Возникновение ионных парКондуктометрические измерения могут быть использованы для
изучения возникновения ионных пар в концентрированных рас¬
творах. Электростатическое взаимодействие между ионами разных
знаков является причиной их объединения в группы, а это влечет
за собой уменьшение скорости движения в электрическом поле.
Используя более точные теории электропроводности, учитывающие
вязкостное торможение молекул воды, можно определить кон¬
станту равновесия образования ионных пар.
Коэффициенты активности4911.4. НЕИДЕАЛЬНОСТЬ, ТЕМПЕРАТУРА И СОЛЕВОЙ ЭФФЕКТСогласно правилу произведения растворимости, растворимость
соли не должна зависеть от добавления другой соли, не имеющей
общих ионов с первой. Однако это не так. На рис. II. 7 приведена
зависимость растворимости иодата серебра от концентрации до¬
бавленных в раствор иодата и нитрата калия. Как и следовало
ожидать, растворимость AglOe существенно уменьшается при уве¬
личении концентрации КЮ3. Од¬
нако растворимость AgI03 в рас¬
творах KN03 возрастает, а не
остается постоянной при повыше¬
нии Ckno,- Это увеличение рас¬
творимости — результат влияния
межионных сил, возникающих
при добавлении в раствор посто¬
ронних ионов и действующих
даже в отсутствие химической
реакции между ионами нитрата
калия и иодата серебра.Коэффициенты активностиС учетом выше сказанного
правило произведения раствори¬
мости может быть записано в виде*<TB)0 = {Ag+} {107} == [Ag+] [lO~J y+y_ (1)где активности ионов серебра и
иодат-ионов равны их концентра¬
циям, умноженным на коэффициенты активности у+ и ■у— В очень
разбавленных растворах активность почти равняется концентра¬
ции, т. е. у становится равной единице *.Из-за невозможности изолировать индивидуальные ионы без
нарушения электронейтральности раствора экспериментально мож¬
но определить только произведение y+Y— Таким образом, коэф¬
фициенты активности солей в растворе даются (табулируются)
среднегеом етрическим и:Y± = yr'v7vl* Для обозначения коэффициентов активности, когда последним соответ¬
ствует концентрация, выраженная в молярностях, употребляют символ /; в слу¬
чае моляльиого способа выражения концентрации используют символ у- За
исключением очень концентрированных растворов, / «С, м ыопь/пРис. II. 7. Растворимость иодата
серебра в присутствии солей калия.
экспериментальные данные; ра¬
счет с использованием величины К(ТВ) q
для AgI03 [Kolthoff, Lingane,
J. Phys. Chem., 42, 133 (1938)1.
50//. 4, Неидеальность, температура и солевой эффектЭкспериментально найдено и теоретически обосновано, что ко¬
эффициент активности зависит от общей ионной силы I раствора:(2)где С,-— концентрация i-ro иона; — его заряд.Например, для простых солей типа KNO3 ионная сила равна
концентрации этих солей:I = 42 {[к+] • I2 + [N07](—I2)} = [к+] = [N07] = сДля смеси KN03 и AgI03 ионная сила равна сумме концентра¬
ций солей:_ 1 = 42 {[К+] + [N07{ + [Ag+I + [107]} = СКШз + САеЮзТаким образом, прибавляя различные количества нитрата ка¬
лия к насыщенным растворам иодата серебра, можно получать
желаемую ионную силу раствора.Коэффициенты активности и растворимостьКоэффициент активности y± может быть рассчитан следующим
образом. Экспериментальную кривую S = f(I), где 5 — раствори¬
мость (рис. II.8), экстраполируют к нулевой ионной силе, для ко¬
торой у± — I', это позволяет найти ве¬
личину растворимости для 1 = 0:0,200% 0,190о5*03 0,180
0,П01-Sam1,733- 10~*моль/л4 в 12
VT-10*0, моль/л)S о = 1,733 • 10-4МВычисленное из этой величины
■термодинамическое произведение рас¬
творимости, т. е. /С(тв)о в единицах ак¬
тивности, равно:K(tb)o = so = 3.00-10~‘m2Средний коэффициент активности
рассчитывают затем по уравнению (1)
для каждой концентрации из найден¬
ных величин растворимости S:Y± := Y+Y- =^(тв)0*(ТВ)0М[10П(3)Рис. II. 8. Экстраполяция ра¬
створимости к нулевой ионной
силе.Точки — экспериментальные данные
те же, что и иа рис. И. 7; прямая —
растворимость в чистой воде.На рис. II. 9, а эти коэффициенты активности отложены как
функция ионной силы. Найденные значения у± точно описываются
уравнением _1ЕУ± = -'/2 V1 W
Определение стандартного потенциала экстраполяцией 51которому соответствует прямая, проведенная через полученные та¬
ким образом величины lgy± (рис. 11.9,6).^ 61,ММОЛ»/Л VT(I, моль/л)Рис. II. 9. а. Значения коэффициентов активности AgI03 в сис¬
теме AgI03—KN03 (данные те же, что и на рис. II. 7); б. Сопо¬
ставление экспериментальных значений коэффициентов актив¬
ности (точки) с рассчитанными по предельному закону Дебаи —
Хюккели (прямая линия).Уравнение (4) теоретически предсказывается теорией Дебая —
Хюккеля (раздел XII. 2, стр. 365), только вместо коэффициента 0,5
должно быть 0,509 при 25° С.Определение стандартного потенциала экстраполяциейТак же как для получения термодинамической константы рав¬
новесия была произведена экстраполяция растворимости соли
к нулевой ионной силе, для получения стандартного потенциалаэ. д. с. ячейки должна, быть проведена экстраполяция к бесконеч¬
ному разбавлению.Рассмотрим ячейку (см. рис. II. 4), в которой электролитом
является соляная кислота:Pt | Н2 (г.) (1 атм) | НС1 | AgCi | AgУравнение Нернста для этой ячейки записывается следующим
образом:Е = Е° — 0,05915 lg {Н+} {СГ}Поскольку соляная кислота чистая, т. е.[Н+1 = [СГ] = СНС1постолькуЕ + 0,1183 Ig Chci = —^Р.1183 lg (5)Левая часть уравнения (5) содержит только известные вели¬
чины: Chci можно найти, поскольку известно количество НС1 в
растворе, а Е — измеряемая для этой концентрации э. д. с. ячейки.
52//. 4. Неидеальность, температура и солевой эффектЕсли электролит идеален, правая часть уравнения должна быть
постоянна и равна стандартному потенциалу. Однако, как следуетиз рис. II. 10, левая часть урав¬
нения (5) очень мало, но все же
зависит от величины Снсь Экс¬
траполяция к бесконечному раз¬
ведению (нулевой концентрации),
как это было сделано при опре¬
делении произведения раствори¬
мости (см. рис. II. 8), даст вели¬
чину Е°, так,как при этом у± =— 1; полученная таким образом
величина Е° равна 0,2224 в. Она
является стандартным электрод¬
ным потенциалом хлорсеребря-
ногО электрода и стандартным
потенциалом ячейки.0,237 г0,229 -iо0,227 -Оот*юсо0,225 -сГ+Uj0,22з[0,221Ус;НС1Рис. II. 10. Экстраполяция ~э. д. с.
ячейки к бесконечному разбавлению
с целью получения стандартного
потенциала хлорсеребряного элек¬
трода [Harned and Ehlers, J. Am.Chem. Soc., 54, 1350 (1932)].Потенциометрическое
измерение коэффициентов
активностиЯчейка, рассмотренная на
рис. II. 4, может быть применена
и для определения коэффициента активности НС1, поскольку вели¬
чина Е° найдена. Используя известное значение Е° и измеренноеС, моль/WOO г Н20Рис. II. 11. Коэффициенты активности соляной кислоты в кон¬
центрированных растворах при 25 °С (а) и сульфата цинка (б)
[Harned, Owen, Phys. Chem. of Electrol. Sol. (N. Y), 716,
564 (1958)]:/ — экспериментальная кривая; 2 —кривая, описываемая уравнением (4)—
уравнением предельного закона.значение Е в растворах данной концентрации Сна, можно вычис¬
лить коэффициент активности по уравнению (5):Е° — Е , _
Зависимость константы равновесия от температуры53Наиболее точные измерения коэффициента активности соляной
кислоты в воде и в смесях воды с другими растворителями выпол¬
нены для проверки различных теорий растворов электролитов
(рис. II. 11).Как следует из рис. II. 11, предельный закон Дебая—Хюккеля
[уравнение (4)] почти точен в разбавленных растворах; в более
концентрированных растворах коэффициент активности увеличи¬
вается и делается значительно большим единицы в очень концен¬
трированных растворах.Теории, учитывающие размеры ионов, позволяют предсказать
эту зависимость (раздел XII. 2, стр. 365).Для многовалентных ионов коэффициенты активности меньше,,
но они сильней зависят от концентрации — из-за образования ион¬
ных пар (раздел XII. 1, стр. 365) (рис. II. 12).Зависимость константы равновесия от температурыХотя большинство исследований ионных растворов выполнены
при хемпературах, близких к комнатной (25°С), интересно оце¬
нить эффект влияния температуры на эти равновесия.Произведение растворимости большинства солей равномерна
растет при увеличении температуры (рис. II. 12,а). Это согла¬
суется с данными о том, что диссоциация большинства кристаллов.Рис. 11.12. Зависимости произведения растворимости AgCi (a) [Owen,
Brinkley, J. Am. Chem Soc., 60, 2229 (1938)], иоиного произведения воды (б)
и константы ионизации СН3СООН (в) От температуры [Phys. Chem. of Ele-
ctrol. Sol., N. Y., 638, 755 (1958)].до образования гидратированных ионов требует затраты значи¬
тельной энергии, т. е. процесс растворения является эндотермиче¬
ским (протекает с поглощением тепла). Функция К(тВ)о = }(Т)
почти линейна и очень легко может быть интерполирована.
х Температурные зависимости ионного произведения воды
(рис. II. 12,6) и произведения растворимости хлорида серебра
идентичны, поскольку диссоциация воды на ионы также эндотер¬
мический процесс.Температурная зависимость констант ионизации слабых кислот
не столь проста, так как многим из них при комнатной температуре
54II. 5. Точность и правильность равновесных данныхприсущ переход от экзотермичности к эндотермичности процесса;
функция Ka = f(T) проходит через максимум (рис. II. 12,в).Вид температурной зависимости константы равновесия можно
предсказать, если есть необходимые термодинамические данные.
На практике графическая экстраполяция и интерполяция вели¬
чины К при температурах, близких к 25° С, может быть сделана
с точностью, достаточной для многих целей. Это возможно только
при наличии нескольких экспериментальных точек или по.анало¬
гии с подобными соединениями.Неводные растворыДобавление к воде растворителей, например спирта, может по¬
влиять на равновесие в растворе двояко. Во-первых, уменьшится
активность самой воды и, во-вторых, изменятся коэффициенты ак¬
тивности различных ионов, поскольку изменится диэлектрическая
проницаемость среды, в которой они находятся.Водно-спиртовые растворы представляют практический инте¬
рес, так как растворимость солей в них значительно меньше, чем
в чистой воде. Кроме того, они интересны и* в теоретическом ас¬
пекте, ибо позволяют контролировать изменение диэлектрической
проницаемости растворителя при проверке различных электроста¬
тических теорий ионного взаимодействий.Реакции в полностью неводнйх растворителях все чаще начи¬
нают применять в аналитических методах. Это связано с тем, что
титрование очень слабых кислот и оснований, невозможное в воде,
поскольку ее собственная диссоциация приводит к появлению Н+-
и ОН'-ионов в значительных концентрациях, делается очень про¬
стым в органических растворителях (этиленгликоль, метилизо-
бутилкетон, этанол), которые вряд ли вообще диссоциируют
(подробнее см. раздел XII. 4).11.5. ТОЧНОСТЬ И ПРАВИЛЬНОСТЬ РАВНОВЕСНЫХ ДАННЫХПрежде чем продолжать обсуждение методов расчета равно¬
весных концентраций с использованием найденных значений кон¬
стант равновесия, следует рассмотреть, какую точность и .правиль¬
ность можно ожидать от этих расчетов.Точность характеризует самосогласованность величины и за¬
висит только от случайных ошибок. Этот тип ошибки может быть
легко оценен повторением измерений и поэтому он не является
главным.Правильность характеризует отклонение от некоторой гипоте¬
тической «правильной величины» и зависит не только от случай¬
ных ошибок, но и от систематических. Последние появляются, ко¬
гда отсутствует возможность учета всех факторов, влияющих на
II. 5. Точность и правильность равновесных данных55конечный результат. Ойенка этих ошибок трудна, но может быть
в некоторой степени проведена сравнением результатов, получен¬
ных различными методами.Рассмотрим в качестве примера измерения константы равнове¬
сия ионного произведения воды, поскольку в этом случае суще¬
ственны и точность, и правильность эксперимента (табл. II. 2).Ионное пройзведение воды впервые определено Оствальдом
в 1893 г. грубыми потенциометрическими измерениями кислых и
основных растворов с использованием водородного электрода; оно
оказалось равным 10'12. Этим же методом Аррениус более тща¬
тельно определил, что /Сн2о = 1,26 • 10~и при 25 °С.В 1894 г. Кольрауш, используя сверхчистую воду, кондуктомет-
рически (раздел II. 3), нашел, чтоДн2о = 1,17 • 10“14 при 25°С; эта
величина хорошо согласуется со значением, полученным Арре¬
ниусом.Таблица II. 2
Величина ионного произведения воды ЯИг0 при 25^°С(J. Bjerrum.G. Schwarzenbach, L. S i 1 1 е n, Stability Constans,
parts I and II, spec. publ. nos 6 and 7 of Chem. Soc., L., Chem. Soc., 1958)АвторГодМетод*н2о-1°14Аррениус1893Потенциометрический1,26Кольрауш1894Кондуктометрический1,17Лундеи1907»1,04Канольт1907>0,81Лоренц и Ббхи1909Потенциометрический1,23Льюис н Рэндалл1923Термодинамический рас¬
чет с использованием
теплот реакций1,002Бьеррум1929Потенциометрический1,045Робертс1930»0,989Ньютон и Болингер1930>1,020Харнед и Хамер1933>1,008Наиболее точными и, возможно, правильными следует считать
данные Харнеда и Хамера (1933), которые использовали ячейку,
приведенную на рис. II. 4. Электролитом служила смесь хлорида
и гидроокиси калия, полностью ионизованных в растворе. Кон¬
центрации С1~- и ОН--ионов постоянны за счет введенных в рас¬
твор КС1 и КОН; в ячейке измеряли активность ионов водорода.
Используя ячейку без жидкостного соединения, авторы устранили
один из главных источников систематической ошибки, присущий
всем предыдущим работам. Данные, полученные для растворов
с различной ионной силой, были затем экстраполированы к / = 0;
56//. 5. Точность и правильность равновесных данныхэто позволило найти ионное произведение воды, выраженное через
активности (при 25°С):К°Пг0 = {н+} {ОН-} = (1,008 ± 0,001) • Ю~14Отметим, что немногие измерения выполнены с такой точ-
яостью. Так, данные о реакции образования 1з (см. табл. II. 1,
•стр. 41) имеют точность ±1%. Но даже измерения с такими пре¬
делами ошибки, как ±1%, относительно редки и требуют тща¬
тельного выполнения. Кроме того, система не должна быть слиш¬
ком сложной.Произведение растворимости хлорида серебра было предметом
измерений почти в двадцати работах, наиболее надежными дан¬
ными являются те, что получены потенциометрически и кондукто-
зиетрически: значения /QTB)o лежат в интервале (1,74 ■— 1,95) • 10~10,
т. е» правильность выполнения их примерно ±5%. Более новые
измерения, выполненные Гледхиллом в 1954 г., даютД-“тв)0 = {А8+}{СГ}= (1,78 ± 0,02) . Ю-10 (при 25 °С)т. е. имеют точность ±1%.Правильность измерений констант ионизации слабых одно¬
основных кислот и оснований колеблется обычно в пределах
±0,5 -=-10%, да и то для наиболее тщательных измерений. Пра¬
вильность в ± 1% может быть достигнута при измерении констант
ионизации многоосновных кислот, однако большинство из этих
констант измерено со значительно большими пределами ошибки.
Если величины констант близки, то ошибочность определения их
•отношения может быть связана с каждой из этих констант.Если система сложна из-за наличия в ней нескольких равнове-
•сий или трудности достижения истинного равновесия, ошибки мо¬
гут быть значительно большими. Например, произведения раство¬
римости сульфидов, определенные различными методами, могут
различаться на несколько порядков. Столь большие ошибки вы¬
званы чрезвычайно малыми значениями концентраций иона ме¬
талла, неопределенностью характера равновесия и природы реак¬
ций, протекающих в растворе.Сульфид серебра — одна из наиболее тщательно исследован¬
ных солей; но даже для нее недавно найденные потенциометриче¬
ски надежные .значения произведения растворимости имеют
точность ±20%. Ранее полученные величины различались при¬
мерно в 1000 000 раз.Константы образования комплексных ионов обычно измеряют
в растворе, содержащем большой избыток (до 4 моль/л) перхло¬
рата натрия, который обычно не принимает участия в реакции;'такой избыток необходим, чтобы изменения концентраций изу¬
чаемых ионов не влияли на ионную силу раствора. Указанный
Применение концентрационных констант равновесия 57прием позволяет изучать значительно более сложные системы.
Измеренные константы равновесия, хотя и являются концентра¬
ционными, не зависят от концентраций разных ионов, так как при
постоянной ионной силе в условиях избытка NaC104 коэффи¬
циенты активности постоянны.Экстраполяция к бесконечному разведению может служить ис¬
точником больших систематических ошибок. Экстраполировать же
в область умеренных концентраций, обычно применяемых в ана¬
литической химии, можно, поскольку это не приведет к ошибке,,
большей чем ±10% (раздел XII. 3).Константы образования комплексных ионов колеблются в до¬
статочно широких пределах правильности, зависящих от числа
равновесных состояний и тщательности выполнения измерений.
Если учтены все типы частиц, результаты измерений могут быть-
выполнены с ошибкой не более ±10%.Применение концентрационных констант равновесияВ типичных растворах, с которыми имеют дело в аналитической
химии, поправки на коэффициент активности составляют величину
порядка ±20% (см. рис. II. 11). Когда такие поправки вводят для
растворов с концентрацией менее 0,1 М, используя термодинами¬
ческие константы равновесия, правильность которых доходит до
±1%, то результаты расчета будут иметь правильность, доходя¬
щую до ±1%, при условии, что учтены все типы частиц (раз¬
дел XII. 3).Однако практически, прежде чем вводить поправки столь вы¬
сокой степени точности, обычно проводят грубый расчет в пред¬
положении, что активности равны концентрациям. Это необходимо
делать не только ддя того, чтобы решить, концентрации каких ти¬
пов частиц являются наибольшими, но и для оценки величины
ионной силы раствора, нужной для расчета коэффициентов ак¬
тивности.Применяя затем поправки на коэффициент активности, прово¬
дят пересчет констант равновесия для требуемой ионной силы.Для многих случаев, особенно в аналитической химии, пра¬
вильности «прикидочных» расчетов бывает достаточно.В примерах, приведенных в последующих главах, точность в
±5% выбирается как предельно допустимая для результатов рас¬
четов. Однако без поправок на коэффициент активности расчет не
будет иметь даже такой правильности. Но и с поправками столь
высокой степени точности результат расчета никогда не является
более правильным, чем используемые данные, и поэтому большин¬
ство экспериментальных данных имеет правильность, лежащую за
пределами ±5%.
Глава IIIМАТЕМАТИЧЕСКИЕ МЕТОДЫ,
ИСПОЛЬЗУЕМЫЕ ПРИ РАСЧЕТАХ РАВНОВЕСИЙIII. 1. НЕКОТОРЫЕ ОБЩИЕ ПОЛОЖЕНИЯВ этой и последующих главах равновесие рассматривается как
математическая проблема в том смысле, что для некоторой физи¬
ческой системы, содержащей в растворе определенные вещества,
необходимо найти концентрации всех видов ионов и молекул, ко¬
торые могут присутствовать в растворе. Для целей аналитической
химии необходимо иногда знание концентрации только одного
вида частиц, но в процессе ее определения и вычисления прихо¬
дится находить концентрации и всех других видов частиц.В настоящей главе приведен тот математический аппарат, ко¬
торый необходим при расчете равновесий. В последующих главах
содержатся примеры, приложения найденных приемов вычислений
к реальным системам.Путь решения проблемыСформулируем положения, необходимые для решения задачи.1. Должна быть выявлена природа всех частиц. Это сложная
экспериментальная и теоретическая задача; для большинства хи¬
мических систем природа частиц не вполне известна. В дальней¬
шем мы будем использовать те данные, достоверность которых в
настоящее время бесспорна.2. Должны быть найдены константы равновесия, связывающие
концентрации различных частиц. Эти константы обычно находят
одновременно с определением природы частиц в растворе. Для
простоты в дальнейшем (за исключением главы XII) будем счи¬
тать, что активности равны концентрациям.3. Должны быть выявлены все уравнения связи между неиз¬
вестными концентрациями, чтобы число уравнений равнялось
числу неизвестных. Следовательнр, необходимо учитывать уравне¬
ния материального баланса и электронейтральности.Во всех случаях, рассматриваемых в данной книге, неизвестны
концентрации различных частиц в растворе, а известны аналити¬
ческие * концентрации веществ, внесенных в растворы, и кон¬* См. сноску к табл. I. 1 (стр. 13).
Общие рекомендации59станты равновесия. Однако иногда неизвестна и аналитическая
концентрация, т. е. растворимость.Обратная задача — нахождение констант равновесия из экспе¬
риментальных данных — более чем сложна. (Кратко этот вопрос
рассмотрен в главе II, более полное изложение см. в конце этой
главы и в разделе IX. 3).4. Полученная система из п уравнений, содержащих п неизве¬
стных концентраций, должна быть решена для всех п концентра¬
ций. В большинстве случаев отыскание точного решения утоми¬
тельно и поэтому делают некоторые допущения. Последние долж¬
ны учитывать имеющиеся сведения о природе вещества: является
ли оно кислотой или основанием; какова его растворимость и т. д.Приближенные уравнения решать легче, чем точные.5. Для проверки полученные приближенные результаты под¬
ставляют в исходные точные уравнения. В тех случаях, когда ре¬
шения не удовлетворяются с точностью ±5%, делают новые до¬
пущения и отмскивают соответствующие им решения. Повторяют
подстановку; если и в этом варианте необходимая точность не до¬
стигается, необходимо еще более точное решение.6. Обычно одной из п неизвестных величин является концентра¬
ция ионов водорода или растворимость; именно эти величины бо¬
лее всего и необходимы для расчетов в аналитической химии.Общие рекомендацииПроблема отыскания неизвестных сложна. Она может быть
облегчена применением следующих четырех правил решения за¬
дачи, которые рекомендованы известным математиком Дж. Пойя:1. Необходимо четкое понимание сути проблемы
что неизвестно;что известно;какое условие соответствует этим неизвестным и известным?2. Необходим план решения
знакомы ли вы с подобными задачами;приходилось ли вам сталкиваться с такими же неизвестными;
можете ли вы решить часть задачи;можете ли вы решить данную задачу, но с несколько изме¬
ненными условиями;можно ли изменить известные или неизвестные величины
с целью большего совпадения, соответствия их?3. Проверьте план решения, каждую его стадию
необходима ли каждая стадия;можете ли вы доказать правильность каждой стадии?4. Проверьте решение
разумен ли результат;
60111. 2. Материальный балансесли проблема симметрична по отношению к одной из неиз¬
вестных величин, распространяется ли это свойство и на ре¬
шение;попадают ли численные ответы в те границы, которые опре¬
делены задачей;можно ли ответ, полученный для сложной задачи, распростра¬
нить на простую, известную задачу?III. 2. МАТЕРИАЛЬНЫЙ БАЛАНСУсловие материального баланса означает, что число атомов
данного типа должно быть неизменным во все время протекания
химических реакций в изолированной системе. В некоторых слу¬
чаях эквивалентом рассматриваемого условия может быть усло¬
вие неизменности числа групп, подобных SO^- или СООН~.В качестве примера рассмотрим насыщенный водный раствор
сульфата бария. Пусть 5 — молярная растворимость, т. е. число
молей BaS04, растворенных в 1 л раствора; тогда:S = [Ва2+]Это — условие материального баланса по барию. Оно, кроме
того, показывает, что растворенный барий присутствует в растворе
только в виде ионов Ва2+.Условие материального баланса цо сульфату имеет вид5 = [S0r] + [HS07]так как сульфатные группы присутствуют обычно в растворе
только в двух формах: SO\~ или HSO^.В водном насыщенном растворе хлорида ртути образуется
много комплексных ионов. По этой причине расчет для ртути сле¬
дует проводить по уравнению:S = [Hg2+J + [HgCl+] + [HgClJ + [HgCr] + [HgClf ] + [HgOH“] + [Hg(OH)2]Это уравнение содержит семь типов частиц, соответствующих
различным состояниям, в которых может находиться ртуть, если
в растворе присутствует хлор-ион.Каждую частицу следует учитывать столько раз, сколько она
содержит атомов или групп одного и того же типа. Например, рас¬
чет для хлора в случае растворов хлорида ртути надо вести по
уравнению:25 = [СГ] + [HgCl+] + 2 [HgCl 2] + 3 [HgC17] + 4 [HgCl=~]Следует отметить, ^то каждый моль HgCI2 при растворении
дает два хлор-иона; именно поэтому в левой части уравнения и
содержится множитель 2.
Протонное условие61Если существуют два вещества-источника происхождения ато¬
мов или групп одного и того же типа, оба они должны быть учтены
в уравнении материального баланса.Рассмотрим в качестве примера раствор, содержащий уксус¬
ную кислоту и ацетат натрия (аналитические концентрации — Сна
и СА, моль!л).Условие материального балансаСНа + са = [НАс] + [Ас-]показывает, что все ацетатные группы, присутствующие в растворе
за счет двух соединений, находятся как в форме иона Ас-, так
и в недиссоциированной форме — НАс.Заметим, что приведенное уравнение не является столь «же¬
стким», как условия [НАс] = Сна и [Ас-] = Сд, хотя последние
и допускают некоторую степень приближенности.Таким образом, если все возможные вещества-источники атома
или группы атомов и частицы, которые содержат рассматриваемые
атом или группу, учтены, условие материального баланса является
точным соотношением.Протонное условиеДля кислотно-основных систем, в которых ионы воды прини¬
мают участие в равновесии, необходимо иметь соотношение (на¬
зываемое протонным условием), учитывающее по крайней мере
один из ионов воды. Существуют четыре способа нахождения
этого соотношения: первые два основаны на использовании усло¬
вия материального баланса (по ионам водорода или гидроксил-
ионам), а другие два — на условии протонного баланса или элек¬
тронейтральности (см. раздел III. 3)".Условие материального баланса по ионам водорода не столь
просто, как, скажем, для случая бария или хлора, поскольку вода
присутствует в неограниченном избытке. Это ведет к необходи¬
мости иметь способ определения отдельно количеств ионов водо¬
рода, поступающих за счет ионизации воды и кислоты.Когда внешние источники гидроксил-ионов (например, NaOH
или NH3) отсутствуют, можно воспользоваться тем фактом, что
каждая ионизирующая молекула воды «поставляет» по одному
иону водорода и гидроксила. Например, для водных растворов
нацело диссоциированной соляной кислоты с концентрацией
С моль/л условие материального баланса по ионам водорода
имеет вид:[Н+] + [ОН-]Оно означает, что ионы водорода в растворе появились в ре¬
зультате диссоциации как кислоты, так и воды (один Н+ на каж¬
дый ОН-),
62///. 2. Материальный балансТочно так же, если нет внешних источников ионов водорода
(например, НС1 и СН3СООН), условие материального баланса
можно записывать по гидроксилЧюнам. Например, для растворов
нацело диссоциированного едкого натра (концентрация — С,
моль/л) имеем:[ОН-] = С + [н+]Иными словами, мы учли С моль ОН~-ионов, образованных
едким натром, и ОН~-ионы (один на каждый Н+-ион), возникшие
при диссоциации воды.При соблюдении указанных выше условий такой способ рас¬
чета может быть распространен на больший круг объектов. На¬
пример, в растворе, содержащем ионы ртути (II), возможны сле¬
дующие реакции с участием воды:Н20 Н+ + ОН~Hga+ + НаО Н+ + HgOH+Hgs+ + 2НгО 2Н+ + Hg(OH)2Условие материального баланса* по ионам водорода может
быть найдено из следующих соображений: на каждый ОН"-ион
образуется один Н+-ион—за счет диссоциации воды; на каждый
ион HgOH+ образуется один Н+-ион — по реакции ионов ртути (II)
с водой; наконец, на каждую молекулу Hg(OH)2 образуются два
Н+-иона — по реакции ионов ртути (II) с водой.Итак, протонное условие, например для растврррв нитратов
или хлоридов ртути (II), в которых образуется много комплексных
ионов, имеет вид:[Н+] = [ОН-] + [HgOH+] + 2 [Hg(OH)2]В тех случаях, когда система содержит соли слабых кислот или
оснований (см. разделы V. 4 и VII. 2), протонное условие проще
всего получается с использованием' свойства протона менять сво¬
его «хозяина» в растворе.Рассмотрим раствор цианида натрия. За «нулевой уровень про¬
тонов» должны быть выбраны те частицы, из которых может быть
«составлен» раствор: НгО и CN~ (Na+). Тогда другие частицы
раствора будут либо содержать избыток протонов, либо испыты¬
вать их дефицит. Подобная характеристика зависит от способа
образования этих частиц, а именно: за счет присоединения прото-
-нов к частицам нулевого уровня или, наоборот, вычитания.В растворе цианида натрия гидратированный ион НзО (кратко
Н+) образуется в результате присоединения протона к молекуле
воды, т. е. возникает частица с избытком протона. Гидроксил-ион
получается за счет отщепления протона от молекулы воды — воз¬
никает частица с дефицитом протона. Недиссоцийрующая частица
///. 3. Условие электронейтральности63HCN образуется за счет присоединения протона к CN~-HOHy, и
опять-таки создается избыток протона.Протонное условие может быть записано, если приравнять
концентрации частиц с избытком протонов к концентрациям час¬
тиц с его недостатком:[Н+] + [HCN] = [ОН-]Это же уравнение можно получить из условия материального
баланса по ОН'-ионам, образующимся по реакциям:H20+CN" HCN+ОН'Н20 Н+ + ОН“В более сложных случаях, например, для NaH2P04 или
(NH4hHP04, условие протонного материального баланса, исполь¬
зуемое для получения протонного условия, становится проще, хотя
и несколько более искусственным, чем простое условие материаль¬
ного баланса.111.3. УСЛОВИЕ ЭЛЕКТРОНЕЙТРАЛЬНОСТИДаже в случае относительно простых систем, подобных рас¬
смотренным выше, следует быть очень осторожным при выводе
протонного условий с использованием уравнений материального
баланса, включающего ионы растворителя. Вызвано это тем, что
очень легко не учесть возможность протекания реакции между
ионами и растворителем. .По этой причине зачастую предпочтительней использовать ус¬
ловие электронейтральности, суть которого состоит в том, что рас¬
твор, содержащий ионы, должен быть электронейтральным.Искомое соотношение определяют подсчетом общего числа по¬
ложительных зарядов (на единицу объема) и приравниванием по¬
следнего к общему числу отрицательных зарядов (в том же объ¬
еме). При этом должен быть учтен каждый ион в растворе — даже
тот, который не принимает участия в равновесии при данных
условиях.Полученное таким образом соотношение в сочетании с усло¬
вием материального баланса позволяет найти протонное условие.Рассмотрим раствор соляной кислоты (С, моль/л). Условие
электронейтральности имеет вид:[Н+] = [СГ] + [ОН"]Поскольку все С1~-ионы «происходят» из кислоты, условие ма¬
териального баланса по хлору очень просто:[СГ] = С
64III. 3. Условие электронейтральностиСовместное решение последних двух уравнений дает протонное
условие[Н+]=С + [ОН“]аналогичное полученному ранее, но с использованием условия ма¬
териального баланса по ионам водорода.Для раствора, содержащего С моль NaCN на 1 л раствора,
условие электронейтральности таково:[Н+] + [Na+] = [он~] + [CN~]Концентрация недиссоциированной кислоты (HCN) не вклю¬
чена в уравнение, так как молекулы кислоты не несут заряда.Условия материального баланса по Na+- и СМ--ионам:[Na+] = С; [HCN] + [CN-] = СПодстановка величин [Na+] и [CN~] в соотношение электроней¬
тральности дает протонное условие:[Н+] + [HCN] = [ОН-]Это условие идентично полученному из протонного условия и
условия материального баланса по Н+-ионам.В более сложных случаях необходимы некоторые алгебраиче¬
ские выкладки для получения протонного условия из условия
электронейтральности.Следует отметить, что применение условия электронейтраль¬
ности приводит, по-видимому, к более точному соотношению.Когда рассматривают только растворимость вещества или об¬
разование комплексных ионов, для получения результатов доста¬
точными являются данные по равновесию и материальному ба¬
лансу.Для кислотно-основных систем, в которых ионы растворителя
принимают участие в равновесии, необходимо одно из дополни¬
тельных уравнений — протонное условие или условие электроней¬
тральности.Для окислительно-восстановительной системы нужно еще одно
дополнительное уравнение, учитывающее баланс электронов. Оно
связывает концентрации окисленных и восстановительных частиц
(см. раздел XI. 1).ВопросыДля следующих систем выведите условия материального баланса и электро¬
нейтральности. Определите сначала непосредственно протонное условие или ус¬
ловие материального баланса по Н^-ионам, а затем проверьте подстановкой соот¬
ношений электронейтральиости в другие уравнения материальиого баланса.1. С моль КОН в 1 л Н20; диссоциирован нацело.2. С моль НС104 в 1 л Н20; диссоциирован нацело.3. Ci моль КОН и С2 моль HCI в 1 л Н20. Свяжите искомое решение с про¬
цессом нейтрализации кислоты основанием.
Вопросы654. С моль HCN в 1 л Н20; диссоциирована слабо.5. С] моль HCN и С2 моль NaCN в 1 л Н20; диссоциированы слабо.6. Cj моль HCN и С2 моль NaOH в 1 л Н20; диссоциированы слабо.7. С моль NH3 в 1 л Н20; раствор содержит NH4, NH3, Н+ и ОН-.8. Ci моль NH3 и С2 моль NH4CI в 1 л Н20; диссоциированы нацело.9. Вода насыщена С02; раствор содержит: С02, H2C03, Н+, HCOJ, СО2-,ОН".10. Раствор NaHC03; содержит: H2C03, С02, Na+, Н+, НСО", СО*-, ОН~.11. Ci моль NaHC03 и С2 моль Na2C03 в 1 л Н20; раствор содержит те же
ионы, что и в Вопросе 10.12. Раствор NH4CN; содержит NH3, HCN, NH*, Н+, CN", ОН".13. Раствор Pb (ОН)2; содержит: Pb(OH)2, Pb(OH)+, Pb2+, Pb202+, РЬ302+,
Pb4024+, Н+, НРЬ02, ОН-.14. Насыщенный раствор РЬ(ОН)2 в 0,1 М HCIO4; кислота диссоциирована
нацело; ионы С10~ не дают комплексов с РЬ2+.15. Насыщенный раствор РЬ(ОН)2 в 0,1 М КОН.16. Насыщенный раствор HgS в воде; содержит: Hg(OH)2, Hg(HS)2, H2S,
Hg2+, HgOH+, H+, s2~, HS-, hs22~ OH".17. Насыщенный раствор HgS в 0,1 M H2S; раствор содержит те же ионы,
что и в Вопросе 16.18. Насыщенный раствор HgS в 1,0 М HN03; ионы NOJ не дают ком¬
плексов с Hg2+.19. Насыщенный раствор HgS в 1,0 М КОН.20. Насыщенный раствор HgS в 0,05 М Na2S; сульфид натрия диссоциирован
нацело на Na+ и Sz~; другие частицы раствора те же, что и в Вопросе 16.21. Раствор Agl в воде; содержит: Agl, AgOH, Ag+, Ag2I+, Ag3I2+, Ag4I3+,
H+, Г, Agl~ Agl2-, Agl*-, Ag2Ij~, Ag3Ijj", Ag12I‘2“, OH".22. Насыщенный раствор Agl в 0,1 M AgN03; AgN03 диссоциирован на¬
цело; ионы NOJ не дают комплексов с Ag+.23. Насыщенный раствор Agl в 0,1 М KI; диссоциирован нацело.24. Насыщенный раствор Agl в 1,0 М НС1; диссоциирован нацело.25. Раствор получен смешением 500 мл 0,02 М AgN03 с 50t> мл 0,01 М
Na2S203; содержит: AgOH, Ag+, Na+, Н+, S20|", HS20~ AgS207, Ag(S203)2~,
OH".26. Раствор получен смешением 100 мл 0,001 М Na2S203 с 400 мл 0,01 М
NaCl и 500 мл 0,02 М AgN03. Р моль AgCl выпало в осадок; раствор (1 л)
содержит: AgCl, Ag2d+, Ag3Cl2+, Ag4Cl3+, AgClj, AgCl2", AgCl®", а также
все те частицы, что и в Вопросе 25.27. Избыток твердого MnS находится в 0,01 М NaOH. S моль MnS пере¬
шло в 1 л раствора, а Р моль Мп(ОН)2 выпало в осадок; раствор содержит:
H2S, Mn(OH)2, Mn(OH)+, Na+, Mn2\ Н+, S2~, MS", ОН-.28. Объем V 0,001 М NaOH добавлен к 100 мл раствора, содержащего0,001 М FeCl3 и 1 • 10-4 М НС1. Раствор содержит: FeCl3, HFeCU, Fe3+, FeCl2+,
FeClj, FeOH2+, Fe2 (X)H)f, H+, Na+, FeCl" СГ, OH-.29. Смешаны равные объемы 0,01 M CuS04 и 0,04 М NH4OH; раствор со¬
держит: NH3, Cu2+, CuNMf, Си (NH3)2+, Cu(NH3)2+, Cu(NH3)2+, Cu(NH3)2+,
CuOH+, Cu2 (OH)2+, NH+, H+, SO2-, ОН" (см. раздел 1. 1).3 Зак. 345
eeIII. 4. Решение уравненийIII. 4. РЕШЕНИЕ УРАВНЕНИЙУравнения многих неизвестных, как правило, вызывают за¬
труднения в тех случаях, когда одно неизвестное связано с хими¬
ческим равновесием. ПопУтка решить эти уравнения может при¬
вести к большой путанице, если не использовать некоторые систе¬
матические допущения.В этом и последующих разделах будет приведен общий метод,
позволяющий вводить те или иные допущения.Следует отметить, что точное решение системы уравнений дает
результат непосредственно, но бывает слишком громоздким.Систему из п независимых уравнений, связывающих п неизве¬
стных, решают, прибегая к следующим допущениям:1. Выбирают неизвестное (х{), которое в данной системе встре¬
чается реже всего.2. Находят все уравнения, которые содержат х*•. Если оно вхо¬
дит только в одно уравнение, то последнее исключают до оконча¬
тельного решения; с оставшимися п—1 уравнениями поступают
<гак, как указано в пункте 1.3. Решают одно уравнение для выражая последнее через
остальные неизвестные'.4. Подставляют найденное выражение для Xi во все уравнения,
где оно содержится. Это приводит к п — 1 уравнениям с п — 1 не¬
известными.К уравнению, найденному в пункте 3, которое позволяет найти
численное значение хи возвращаются в самом конце решений.5. Повторяют последовательность операций 1—4 до тех пор,
пока не останется одно уравнение с одним неизвестным. Решают
его и оставляют тот корень, который удовлетворяет Данным усло¬
виям *. Положительных действительных корней может быть не¬
сколько, но обычно только один из них дает положительные зна-
чёния для всех других неизвестных (см. разделы VIII.2 и VIII.6).6. После того, как последнее уравнение решено, его корень
подставляют в уравнение, найденное в пункте 3. Это позволяет
найти все другие неизвестные.7. Численные значения проверяют затем подстановкой в ис¬
ходные уравнения. Если они удовлетворяются, ответы верны.Слабая кислота (точное решение)Более детально этот вопрос будет рассмотрен в разделе V. 1,
здесь же основное внимание уделено математической стороне
вопроса.* Оставляют не отрицательное и не мнимое решения, поскольку концентра¬
ция физически ие может иметь таких значений.
Слабая кислота (точное решение)67В системе НА — НгО существуют два равновесия — диссоциа¬
ция воды[н+] [ОН-] = Кц2о Ши диссоциация слабой кислоты[н+][А-] = Д-а [НА] (2)Если в растворе присутствует кислота (С, моль/л), то условие
материального баланса по анионам А~ дает:С = [НА] + [А-] (3)Условие электронейтральности определяет величину [Н*]:[Н+] = [ОН-] + [А-] (4)Положим, что величины С, /Сн2о и К а известны, т. е. суще¬
ствуют четыре уравнения, связывающие четыре неизвестных: [Н+],
[ОН ], [НА] и [А ]. Ни одно из этих уравнений не может быть по¬
лучено комбинацией любых других, поэтому они независимы.
А что можно сказать относительно других уравнений?Протонное условие просто совпадает с уравнением (4) и, сле¬
довательно, не является независимым соотношением.Гидролиз аниона[А'] + Н20 ± [НА] + [ОН-]описывается выражением[ОН-] [НА] = Къ [А-]которое может быть получено, если уравнение (1) разделить на
уравнение’(2) и принять: Къ = Кн2о/Ка', т. е.-выражение для гидро¬
лиза не является независимым.Итак, можно утверждать, что задача вполне корректна, по¬
скольку имеется столько уравнений, сколько неизвестных. Однако
нет специальных указаний на то, в каком случае решение отсут¬
ствует.Решим эти уравнения. Какое неизвестнее содержится наимень¬
шее число раз: [Н+] встречается три раза; [А ] — три; [ОН~]—два
и [НА] — два. Исключим первым [ОН ]; решая уравнение (1) от¬
носительно [ОН ] и подставляя найденное выражение в уравнение
(4), исключим [ОН ] окончательно. В результате этих операций
получаем три уравнения с тремя неизвестными: [Н+], [А~] и [НА],
причем одно из этих уравнений является новым[н+1==ТнТ + [А~] (5)а два других — уравнения (2) и (3)3*
68III. 5. Приближенные уравненияОпределяя [НА] из уравнения (3) и подставляя найденное вы¬
ражение в уравнение (2), исключаем [НА]. Новое уравнение
имеет вид:[Н+] [А~] = Ка (С - [А-]) (6)Другим выражением, не содержащим [НА], является уравне¬
ние (5); решая его относительно [А-], получим:[А1 = [н+]--^||- (7)Подставляя уравнение (7) в уравнение (6), получаем выраже¬
ние, содержащее только [Н+][H*l([H*]--^)-S.(c —[Н'1 + ij^-) (8)которое является кубическим уравнением относительно [Н+]:[н+]3 + Ка [Н+]2 - (кН2о + СКа) [Н+] - КН20Ка =0 (9)Известные значения Ка, /Сню и С позволяют численно решить
уравнение (9) относительно [Н+] (см. раздел III. 7).Решая уравнение (1) подстановкой в него [Н+], находим вели¬
чину [ОН-]. Делая затем следующие подстановки, находим и [А-],
и [НА]. Окончательно проверяем найденные величины так, как это
указано в пункте 7.III. б. ПРИБЛИЖЕННЫЕ УРАВНЕНИЯТочность равновесных данных редко обеспечивает при расчетах
правильность, большую ±5%, поэтому возможно при решении си¬
стемы уравнений применять некоторые допущения. Последние су¬
щественно упрощают решение; правильность же результата сохра¬
няется в тех же пределах. Суть этих допущений зависит от при¬
роды веществ и их концентраций.Алгебраические соотношения могут быть получены в общей
форме, применимой ко многим системам (см. главу IX), но слож¬
ность их при первом ознакомлении затрудняет их понимание.В дальнейшем допущения сначала будут касаться природы ве¬
ществ, затем они будут распространены на условия изменения
аналитических концентраций — вне зависимости от того, в каких
случаях эти допущения приняты, а в каких — нет. Все рассмотре¬
ния проведены на примерах реальных соединений с учетом такого
числа видов частиц в растворе, которое известно в настоящее
время.
Слабая кислота (приближенное решение)69Слабая кислота (приближенное решение)В качестве иллюстрации того, чего мы достигаем, делая допу¬
щение, рассмотрим диссоциацию уксусной кислоты, концентрация
которой С = 0,01 моль/а; табличные данные: А'а == 1,8-10-5;
Лн2о = 1,0-Ю~14 (концентрацию в дальнейшем будем выражать
в моль/л).Задача состоит в отыскании решения, точность которого (отно¬
сительно точного уравнения) ±5%. Необходимые для решенияуравнения те же, что и приведенные ранее:1н+][ОН-] = Кн2о=1.0-Ю-14 (О[Н+] [А“] = Ка [НА] = 1,8 • 10~5 [НА] (2)[НА] + [А-] = С = 0,01 (3)[Н+] = [ОН-] + [А-] (4)Примем допущение: если то или иное слагаемое мало, им
можно пренебречь.Равновесные соотношения (1) и (2) не представляют интереса,
поскольку они являются не суммами, а произведениями членов.Условия (3) и (4) — суммы, по этой причине на них можно
проверить те или иные допущения. Так как мы рассматриваем
раствор кислоты, то [Н+] много больше [ОН ]; поэтому можно
пренебречь [ОН ] в уравнении (4) (первое допущение):[Н+] = [А'] (4а)Обратимся к уравнению (3). В данном случае ситуация слож¬
нее, существует возможность двух допущений:
либо кислота незначительно диссоциирует, т. е. [А-] < [НА], либо
кислота почти нацело диссоциирована и [НА] < [А-]. Воспользуемся
последним предположением и пренебрежем в уравнении (3) чле¬
ном [НА]:[А-] = 0,01 (За)Используя выражение (4а), получим условие[н+] = 0,01которое в сочетании с уравнением (2) дает:1,8 ■ 10—5 [НА] =(l,0-10-2)2; [НА] =5,55В результате сделанного допущения величина [НА] существен¬
но превышает [А ]! Иными словами, предположение о почти пол¬
ной диссоциации кислоты в корне неверно и уравнение (За) не¬
корректно. Теперь примем первое допущение, т. е. пренебрежем
величиной [А^] в уравнении (3):[НА] = 0,01(36)
70III. 5. Приближенные уравненияКомбинируя уравнения (36), (4а) и (2), получим:[Н+]2 = (1,8 • 10~5) (1,0 • 10-2) = 1,8 • 10-7; [н+] = 4,2 • 10-4Из уравнений (4а) и (1) находим:[А-] = 4,2-10-4[ОН-] = -■’°'10 И = 2,4 • 10“"4,2-10-4Полученные результаты могут быть проверены подстановкой
в исходные уравнения:(4,2 • 10“4) (2,4 • 10“") = 1,01 • 10-14 (1)
_ (4,2* 10”4)(4,2* 10—4) = (l,8» 10 s) (1,0• 10 2); 1,76- 10-7 = 1,80- 10-7 (2)
(1,0-10_2) + (4,2- 10-4)= 1,042- 10-2 (3)
(4,2 • 10~4) = (2,4 • 10_и) + (4,2 • 10~4) (4)Уравнения (1) и (2) удовлетворяются автоматически, по¬
скольку расчеты по ним произведены без всяких допущений (если
не считать округление ответов до двух значащих цифр после за¬
пятой) .Уравнение (3) удовлетворяется с точностью 4,2%, что является
результатом использования приближенного уравнения (36). Та-
каЯ" точность укладывается в принятый предел (±5%).Ошибка в решении уравнения (4) проистекает от использова¬
ния уравнения (4а); она составляет 10-18 и свидетельствует о бле¬
стяще сделанном допущении.Общие принципы приближенных решенийУспех в выборе корректных допущений в значительной сте¬
пени зависит от умелого предположения о величинах относитель¬
ных концентраций различных ионов в растворе. И в этом смысле
весьма хороши графические методы, обсуждаемые в последующих
главах.Итак, общие принципы приближенных решений таковы:1. Делают столько допущений, сколько возможно по числу урав¬
нений материального баланса и электронейтральности. Суть допу¬
щений состоит в том, что пренебрегают концентрациями тех или
иных частиц в уравнениях, в которых они являются слагаемыми.2. Решают систему приближенных уравнений.3. Проверяют соответствие полученных результатов сделанным
допущениям.
Вопросыл7!4. Если допущение неверно, принимают противоположное и по¬
вторяют решение с последующей проверкой его.5. Если ни одно из принятых допущений не дает ответа желае¬
мой точности, оставляют уравнение в его точной форме и решают
более сложную систему уравнений.6. Все допущения не должны давать ошибку более ±5%.ВопросыПринимая разумные допущения, решите следующие уравнения относительно
всех неизвестных. Проверьте, удовлетворяют лн найденные результаты точно¬
сти ±5%.30. Дано: [Н+], [ОН-] и [CN~] приблизительно равны 10-7 моль/л.[Н+] [CN-] = 4,8* Ю-10 [HCN][н+] [ОН-] = 1,0-[н+] = [CN“] + [ОН-][CN~] -f [HCN] = 1,0* 10~431. Даио: [ОН-] и [HCN] приблизительно равны 10-4 моль/л.[Н+] [CN“] = 4,8- 10“10 [HCN][н+] [ОН“] = 1,0 - ю-*4
[н+] + 1,0-10-2 = [ОН-] + [CN-][CN-] + [HCN] = 1,0> 10-232. Дано: [SO^~] < 10~5 моль/л.[Ba2+] [SO2-] = 1,0* I0-1°[Ba2+] = 1,0 • 10—2 + [SO2"]33. Дано: [Cl-] > 10-5 моль/л.[Ag+][cr]= 1,8- 10“10[Ag+] = 1,0 • 10~7 + [Cl-]34. Дано: [ОН-] н [НАс] равны приблизительно 10-s моль/л, a [Ag+] и
[Ac-] — примерно 0,05 моль/л.[Н+] [Ac-] = 1,8- 10~s [НАс][H+] [OH“] = 1,0 -10“14 ■*[Ag+] [Ac-] = 4,0 • 10“8
[H+] + [Ag+] = [OH-] + [Ac-][Ag+] = [Ac-] + [HAc]
72///. 6. Решение квадратных уравнени35. Дано: [Н2РС>7] «5-10 2 моль!л; [Н3Р04], [НРО2 ] и [Н+] значительно
меньше, а [ОН-] н [РО3-] существенно меньше всех других концентраций.[н+] [н2ро;] = 6,9 • 10-3 [ н3ро4][н+] [ИРО2-] = 6,2 • 10“8 [H2P07j
[Н+] [РО3-] = 4,7 • 1(Г13 [НРО2-][Н+] [ОН-] = 1,0- ю-14
[н+] + 5,0 • ю-2 = [он-] + [н2Р07] + 2 [НРО2-] + 3 [ро3-][н3ро4] + [н2ро;] + [нро4-] + [ро3-] = 5,0 • ю—236. Дано: [Н+] н [ОН-] несущественны по сравнению с другими концен¬
тр аДнями.[Н+] [CN-] = 4,8 • Ю~‘° [HCN][NH+] [ОН-] = 1,8- 10 S[NH3][н+][он-] = 1,о-ю_14[NHt] + [NH3]=0,10
[HCN] + [CN-] = 0,10
[H+] + [NHt] = [OHl + [CN-]37. Дано: [Cl“] значительно больше, чем все другие концентрации.[CdCl+] = 21 [Cd2+] [Cl-][CdCl2] =7,9 [CdCl+] [СГ][CdC17]= U3[cdci2][cr][CdClf-] = 0,35 fCdCI^] [СГ][СГ] + [CdCl+] + 2 [CdCl2] + 3 [CdCl-] + 4 [CdCl2-] = 1.00[Cd2+] + [CdCl+] + [CdCl2] + [CdCl^] + [CdCl2-] = 1,0 • 10~2III. 6. РЕШЕНИЕ КВАДРАТНЫХ УРАВНЕНИЙДаже тогда, когда введены все корректные допущения, может
случиться, что система уравнений приведет к квадратному, куби¬
ческому или иному уравнению высоких степеней. Если подобная
ситуация возникает на начальных стадиях, проще прибегнуть
к графическому расчету (см. разделы VI. 6 и VII. 7). Однако, если
только окончательное уравнение является высокостепенным, чис¬
ленные методы, естественно, легче и дают результаты любой же¬
лаемой степени точности.
Несостоятельность формулы, когда квадратный член мал73Квадратичная формулаУравнение второй степени может быть решено алгебраически.
Однако необдуманное использование квадратичной формулы ино¬
гда приводит к невразумительным и неточным результатам; по¬
этому данный способ решения не всегда наилучший.Рассмотрим общий способ решения и те допущения, которые
могут быть полезными.Квадратное уравнениеПростыми операциями преобразуем последнее уравнение:Извлекая квадратный корень из обеих частей равенства, по¬
лучим для х\Уравнение (2) дает общее решение уравнения второй степени
с одним неизвестным; его часто называют «квадратичной форму¬
лой». Для получения численного результата необходимо подста¬
вить правильные значения коэффициентов в уравнение (2). Воз¬
можны два решения. Однако только одно из них имеет физиче¬
ский смысл, поскольку все отрицательные и невещественные
решения должны быть отброшены. И даже когда оба корня поло¬
жительны, один из них обычно приводит к отрицательному значе¬
нию других неизвестных в системе уравнений, которые привели
в результате преобразований к квадратному уравнению.Несостоятельность формулы, когда квадратный член малЕсли в уравнениях (1) или (2) член 4ас < Ь2, возникают затруд¬
нения, которые хорошо видны из следующего примера.Согласно общим правилам (стр. 70), прежде чем применить
квадратичную формулу, разумней выяснить возможность прене¬
брежений одним из членов.ах2 + Ьх + с = 0(Оможет быть приведено к виду:Ь2 — 4 ас4 а2
74III. 6. Решение квадратных уравненийПример III. 1. Решите уравнение *: г2 + 345z — 563 = О-345 ± V 1,190• 106 +2,252- 103
2 = 2 - 345 ± V(1,190 + 0,023)- 1052 =2— 345 ± V 1,213- Ю52— 345 ± 348= — 346 или 2 = 1,5Приведенные расчеты выполнены на логарифмической линейке, дающей для
подобных измерений точность 0,1%. Однако для положительного результата эта
точность ~30%, поскольку он является разностью двух больших, почти равных
чисел.Как следует поступать в данном случае? Во-первых, можно воспользоваться
пятизначными таблицами логарифмов, но даже это не поможет, если член 4ас
достаточно мал. Тем не менее, воспользуемся этим. Рассмотрим предел, когда
4яс->0; с не может стремиться к нулю, поскольку уравнение при этом условии
не имеет вещественных корней. Если же а -*■ 0, то квадратный член существечно
меньше двух других членов, т. е. им можно пренебречь. Как правило, если 4ас
меньше Ьг менее чем на 5%, квадратным слагаемым можно пренебречь.Если 2 « 1,5, то z2 « 2, а два других слагаемых равны ~ 500. Пренебреже¬
ние величиной z2 дает небольшую ошибку. Приближенное решение таково:345г —563 = 0, т. е. 2=1,63Это значение г точнее, чем полученное с применением квадратичной формулы.Еще более точное значение величины г может быть получено путем итерации
(последовательных приближений). Введем поправку в приближенное уравнение,
используя значение г = 1,63:(1,63)2 + 345г-563 = 0
345г == 563 — 2,7 = 560,3
2=1,625Итак, пренебрежение слагаемым второй степени почти не сказывается на
ответе.Пример III. 2. Решите уравнение: S2 + 4,3- 10~3S — 1,6-10~10 = 0.Перепишем уравнение так, чтобы в левой части стояли члены, содержащие
неизвестное:S2 + 4,3-10 3S = 1,6 • 10~10Такой вид уравнения показывает, что величина S будет меньше корня любого
из следующих двух уравнений:S2 = 1,6- Ю~10 нлн 4,3-10_3S= 1,6-Ю-10Первое уравнение дает: S = 1,26-10~5; это решение не удовлетворяет точное
уравнение. Решением второго уравнения является: S = 3,7 • 10~8; оно удовлетво¬
ряет точное уравнение, поэтому и является его корнем.Как и ранее, S2 существенно меньше двух других слагаемых.* Мы не будем использовать букву х как символ неизвестного в тех случаях,
когда числа записаны в степенной форме: 1,19- 105. Кроме того, буквы-г, w и у
в данном разделе означают растворимость S и концентрации, например [Н+]
или [Cl'].
Вопросы751Зачастую, приближенный корень может быть найден, если в
уравнении будет опущен один из положительных членов (см. При¬
мер III. 2). Квадратичную формулу (2) следует применять с осто¬
рожностью в тех случаях, когда в уравнении (1) пренебрегают
членом ах2.Если 4ас меньше Ь2 менее чем на 5%, уравнение (2) приобре¬
тает следующий приближенный вид:X — — у (2а)Если Ь2 меньше 4ас менее чем на 5%, то в уравнении (2) опус¬
кают линейный член; в результате получают приближенное урав¬
нение: /х = ± V — с!а (26)Отметим, что по крайней мере один из членов уравнения (1)
должен быть отрицательным; в противном случае уравнение не
может быть удовлетворено положительным вещественным числом.
Как правило, с < 0.ВопросыНайдите положительный вещественный корень (с .точностью ±1%) для сле¬
дующих квадратных уравнений.38. AJz2 + 3,12 — 17 = 0.39. у2 - Щ + 32 = 0 (у « 1).40. 1,8- 10-4 [NH3]2 + 3,6- 10“8 [NH3] - 5,5- 10-и = 0.41. 1,0- 10-14 [ОН-]2 + 0,13 [ОН-] - 9,7 • 10-14 = 0.42. S(S — 6,5 • 10-4) + 4,7 • 10-8 = 0 (оба корня).43. 1,95 • 10~6 [СГ] (8,4 • 10~2 + [СГ] ) = 2,6 • Ю-10.44. 7,3 • 10-5 [СГ] (1 + 3,3 • 103 [СГ]) = 4,4 • 10-2.45. S2 — 8,8-10_35+ 1,75- 10—5 = 0 (оба корня).46. [Н+]2 - 4,9 • 104 [Н+] + 3,9-10-2 = 0 ( [Н+] < 1,0).47. S2 + 4,3 • 10~2S - 1,24 = 0.48. В следующей системе уравнений концентрации всех трех типов частиц
сравнимы. Решите эту систему точно, используи в конце квадратное уравнение.
Проверьте результаты подстановкой в исходные уравнения:[HgOH+] [Н+] = 2,0 • 10“4 [Hg2+]
[Н+] = 10,4 [HgOH+]
[Hg2+] + [HgOH+] = 9,76 • 10—3
76III. 7. Решение многочленных уравнений высоких степенейIII. 7. РЕШЕНИЕ МНОГОЧЛЕННЫХ УРАВНЕНИЙ
ВЫСОКИХ СТЕПЕНЕЙПереход к квадратичной формеНекоторые типы высокостепенных уравнений могут быть ре¬
шены как квадратные; однако для этого необходимы подходящие
подстановки.Пусть имеем уравнениех4 4- ах2 + 6 = 0которое может быть приведено к квадратному следующей подста¬
новкой: у — х2. Тогда:у2 + ay + 6 = 0Подобным же образом уравнениеz6 + аг3 + 6 = 0преобразуется ви)2 + aw + 6 = 0если w = z3.Однако приведенные уравнения и подстановки в них скорее
исключение, нежели правило.ГПриближенный метод НьютонаПриближенный метод Ньютона применяют для решения лю¬
бого уравнения с одним неизвестным, но особенно многочленных
уравнений высоких степеней.Прежде всего необходимо, чтобы был известен приближенный
корень; затем умелое применение формулы дает последовательно
все более лучший результат — вплоть до истинного корня.Существующая модификация Рафсона позволяет использовать
рассматриваемый метод для решения уравнений, в которых одна
из переменных не может быть выражена в явной форме через
другие переменные.Почти триста лет тому назад Исаак Ньютон предложил сле¬
дующий способ решения сложных уравнений, который, по сути
дела, является простейшим примером дифференциального исчис¬
ления.Рассмотрим кривую y = f(x), которая в области точки пересе¬
чения с абсциссой имеет плавный характер (рис. III. 1)*. Допус¬
тим, что хо приближенное значение истинного корня xf. Касатель¬
ная, проведенная к кривой в точке хо, имеет наклон, тангенс угла* Это означает, что f(x) должна иметь непрерывную, не стремящуюся к
нулю, первую производную в области между приближенным корнем х0 и истин¬
ным корнем хусловие \х — дг/1 |дг0 — Х]\ определяет границы области.
Отыскание приближенного корня77которого равен f'(xо), где dy/dx — f'(x) — первая производная
функции *. Касательная пересекает ось абсцисс в точке хй по¬
следняя ближе к xf, чем Хо. Посколь¬
ку f'{x о) — тангенс угла наклона,
справедливо равенство:Г (*о) =f (х0) — О*о— *1или■Хо —f(x о)
Г (Хо)(1)Численные значения f(xо) и f'(x0)
могут быть получены подстановкой
приближенного корня х0 в формулы
для f(x) и f'(x). Разделив f(x0) на
f'(xо) и вычитая результат деления
из *0, получаем лучшее приближе¬
ние — Х\.Подобные операции повторяют до тех пор, пока разница ме¬
жду двумя последовательными приближениями окажется меньше
допустимой максимальной ошибки (см. рис. III. 1).Рис. III. 1. Метод последова¬
тельных приближений для вы¬
числения истинного корня
уравнения f (х) = 0.Отыскание приближенного корняОбычно высокостепенное уравнение появляется только после
того, как исчерпываются все корректные допущения для данной
системы уравнений. Но именно к этой стадии уже становится яс¬
ным порядок величины корня (например, 10-4 или 10_6) и зачастую
этого достаточно.Можно, однако, иногда пренебречь одним или более слагаемым
и решить полученное квадратное уравнение; любой найденный та¬
ким образом ответ дает наименьшую величину f(xо), являющуюся
наилучшим приближением к корню.Третий способ, в большинстве случаев являющийся наиболее
удовлетворительным, состоит в графическом построении, допус¬
тим, шести точек величины f{x), диапазон значений которых до¬
статочно широк. Затем через эти точки проводят кривую до
пересечения с осью абсцисс. Безусловно, необходимо иметь и* Производную многочлена получают следующим образом: умножают ко¬
эффициент каждого слагаемого на степень соответствующего ему х, а степень
уменьшают на единицу.Еслиf (х) = апхп+ ап-,хп~' + + а,\Х + а0тоf = па„хп~' + (п — 1) an-ixn~2 + ... + а,
78111. 7. Решение многочленных уравнений высоких степенейположительное и отрицательное значения величины f(x), иначе
можно не получить хорошего приближения к корню.Отметим, что графическое построение позволяет судить, дей¬
ствительно ли кривая имеет плавный ход вблизи точки пересече¬
ния с осью абсцисс. Если существует максимум или минимум
вблизи приближенного корня (как правило, их не бывает), то это
Следует иметь в виду, поскольку дальнейшие приближения в по¬
добном случае могут и не дать сходимости.Следующие простые правила с самого начала позволяют ис¬
ключить неожиданные ситуации:1. Для существования положительного вещественного корня
необходимо, чтобы хоть один член многочлена /(х) был отрица¬
тельным, так как f(x) не может быть нулем, если величина х ве¬
щественна и положительна.2. Если лишь постоянный член многочлена отрицателен, суще¬
ствует только один положительный вещественный корень, причемфункция f(x) при положительном
значении х не имеет ни максиму¬
ма, ни минимума. В данном случае
f' (х) > 0 для всех положительных
вещественных х.Так как условием существова¬
ния максимума или минимума яв¬
ляется равенство f'(x) = 0, для по¬
ложительного вещественного х не
может быть экстремумов.Как правило, второе условие со¬
блюдается в уравнениях, получае¬
мых для равновесий, но иногда воз¬
можно существование двух или бо¬
лее отрицательных членов.Если же отрицательные члены в
многочлёнах f(x) отсутствуют, то
значит допущена ошибка при его
составлении.Рис. III. 2. Метод последователь¬
ных приближений при решении
уравнения f (х) = х3 + 5х2 +
+ 6,25л: — 45.Пример III. 3. С точностью 0,1% найдите корень следующего кубического
уравнения:/(*) = х3 + 5х2 + 6,25* - 45Частично эта функция представлена на рис. III. 2; ее производная такова:f'(x) = 3х2+10х + 6,25Для получения приближенного значения хо примем первые три члена [(х)
равными 45:х3 = 45; х — 3,6
5х2 = 45; х = 3,06,2а: = 45;* = 7,2
Подстановки, применяемые для устранения громоздкости вычислений 79Корень должен быть меньше любого из найденных значений; это позволяет
выбрать наименьшую величину: х0 = 3.Тогда} (Хо) = (3,0)3 + 5 (3,0)2 + 6,25 (3,0) - 45 = 27,0 + 45,0 + 18,8 - 45 = 45,8f (Хо) = 3 (3,0)2 + 10 (3,0) + 6,25 = 27,0 + 30,0 + 6,2 = 63,2
метод Ньютона дает:= *° “ Ты = 3,00 ~ = 3,00 ~ 0,72 “ 2,28Повторяя выкладки, получаем:f (*i) = 7,0; n*i) = 44,6; х2 == 2,12
f(x2) = 0,3; f' (x2) = 40,9; jc3 = 2,11Поскольку xs отличается от хг менее чем на 0,5%, дальнейшие приближения
не нужны.Итак, наилучшее приближение является истинным корнем, сходимость до¬
стигается быстро.Линия, проведенная на рис. III. 2, пересекает ось абсцисс в точке х = 2,12,
полученной в результате двух итераций величины х = 3,0.Подстановки, применяемые для устранения
громоздкости вычисленийКак правило, находимые при вычислениях неизвестные значи¬
тельно меньше единицы и имеют порядок 10~5—10~7. В подобных
случаях более удобно ввести величину z в качестве переменной
так, чтобы она, являясь в 10г‘ раз большей, чем неизвестная вели¬
чина в исходном уравнении, принадлежала численному интервалу
1 — 10. Это избавляет от появления многочисленных степенных
членов, а также уменьшает возможность возникновения ошибки.Пример III. 4. Для некоторой кислотно-основной системы найдено уравнение:
[ОН-]3+ 2,1-10-5[ОН"]2 + 6,0* Ю-,2[ОН-]- !,8-10“19 = 0Видно, что отношения коэффициента каждого предыдущего члена к коэффи¬
циенту каждого последующего члена равны 10е и 107 (1/Ю-5 = 105; 10~5/Ю~12 =
= 10т; 10-12/10-19 = 107). Таким образом, величина [ОН"] = 10~5—10~7.Прежде чем вводить степени при вычислениях, положим г = 107 [ОН*]; это
дает:г3 + 2 Юг2 + бООг — 180 = 0Если же у=106[ОН-], то:Юу3 + 210у2 + 60у - 1,8 = 0Любое из полученных уравнений проще исходного. Значение множителя
(10е или 107) выбирают так, чтобы, по возможности, получить коэффициенты,
мало отличающиеся от единицы; а это увеличивает вероятность того, что корень
будет находиться между 0,1 и 10.Применяя метод Ньютона для полученных ранее уравнений, находим:? = 3Г12; = 0,31:2
80III. 7. Решение многочленных уравнений высоких степенейЧеткий выбор множителя облегчает расчет, но не влияет на окончательный
ответ,, поскольку[ОН-] = 3,12-10-7Интегрирование высокостепенных уравненийВ Примере III. 1 наиболее точный корень квадратного уравне¬
ния получен путем пренебрежения малым членом второй степени
с использованием приближенного корня. Подобная же операция
может быть применена и к высокостепенным уравнениям, если
один или несколько членов достаточно малы.Однако итерирование очень медленная операция, и для полу¬
чения сходимости необходим такой же объем вычислений, что и
в методе Ньютона. Именно по этой причине последний предпоч¬
тительней.ВопросыПутем подходящей подстановки переведите данные уравнения в квадратные
и определите положительные вещественные корни.49. 9,3- 10-4 [Н+]4 + 3,7 • 10-2 [Н+]2 - 1,7 • 109 = 0.50. [Н+]4 + 2,2 • 10~э [Н+]2 - 1,3 • 10-7 = 0.51. [Г]6 + 4,4 • 10-7 [Г]3 - 8,7 • 10~14.= 0.52. [I-]6 — 3,2 • 10-2 [i-]3 + 1,9 * 10~14 = 0 (положительный корень меньше0,30).53. Зная, что приближенный корень уравнениял:3 + 170л:2 + 48,0л: - 1450 = 0х = 3, найдите корень, состоящий из трех значащих цифр (точность 0,1%).54. Приведите следующее выражение подстановкой х = 105 [Н+] к выраже¬
нию с простыми коэффициентами; найдите положительный вещественный корень
с двумя значащими цифрами:[Н+]4 + 2,4 • 10~5 [Н+]3 + 1,1 • 10~п [Н+]2 + 4,8 • 10-14 [Н+] - 6,7 • 10-21 =0Для следующих уравнений найдите наименьшие положительные веществен¬
ные корни с двумя значащими цифрами.55. 10-14 [Szi3 + 0,13 IS2-]2-9,7- 10~U = 0.56. 32 [СГ]4 -f 1,5 [СГ]2 + 3,1 [СГ] - 1,0 - 10_3 = 0.57. [Вг-]5 + 3,4 [Вг-]3- 4,3 [Вг-] - 320 = 0.58. [ОН-]4 + 2,1 • 10'4 [ОН-]3 - 2,4 • 10-16 = 0.59. [ОН-]3 = 1,2- 10"15 (2,0 - 2,5- 105 [ОН-] ).60. [Н+]3 (4,3 • Ю_8+ [Н+]2) = 7,2- 10_п [Н+]2 (1,00- 1,3- 10_14[Н+]).61. [Н+]5 + 3,7 • 10~20 [Н+]3 - 2,7 • 10~48 = 0.02. [NH3]3 - 4,1 • 10"7 [NH3] + 3,7 • IQ"11 = Q,
Другие логарифмические функции81III. 8. ЛОГАРИФМИЧЕСКИЕ ФУНКЦИИКак правило, при рассмотрении ионных растворов используют
логарифмические функции концентраций, особенно [Н+]. Тому есть
несколько причин.Во-первых, электрохимические потенциалы, посредством кото¬
рых экспериментально измеряют концентрации, связаны прямо
пропорционально именно с логарифмом концентрации (см. раз¬
делы I. 5 и II. 2).Во-вторых, на практике имеют дело с концентрациями, значе¬
ния которых лежат в интервале 10—10моль/л. Любое графиче¬
ское описание изменений их в логарифмической шкале проще для
отражения столь широкой области значений.В-третьих, зачастую логарифмическая шкала превращает (гра¬
фически) уравнение в прямую или почти прямую линию; это поз¬
воляет во многих случаях производить расчеты непосредственно
по графику (см. раздел V. 1).Определение pHПоскольку концентрации растворов обычно несколько меньше
1 моль/л, логарифм концентрации отрицательное число. Так как
удобней иметь дело с положительными числами от 1 до 10, кон¬
центрацию ионов водорода выражают посредством pH *. Эта ве¬
личина является отрицательным логарифмом активности ионов
водорода; для разбавленных растворов справедливо следующее
приближенное уравнение:pH = — lg [н+]Например, для раствора, в котором [Н*] = 1,0 • 10~5 моль/л, ве¬
личина pH = 5,0.Измерениям pH всегда сопутствуют некоторые ошибки, и точ¬
ность определения значений этой величины редко бывает более0,01; последнее соответствует 2% [Н+].Другие логарифмические функцииАналогично pH, символ «р» во всех других случаях означает
отрицательный логарифм той или иной величины; например:
рОН = —lg [ОН-]; р/Са = — lg/Ca; pAg = —lg [Ag+] и т. д.* Символ Рн для характеристики кислотности среды введен в 1909 г. дат¬
ским химиком С. П. Съёренсеном; из него и образовалось обозначение pH, кото¬
рое иногда называют водородным показателем.
82III. 8. Логарифмические функцииПереход от [Н+] к pHПереход от [Н+] к pH и наоборот часто служит источником
ошибок при вычислениях. Ниже приведены некоторые правила,
способствующие устранению подобных ошибок.Пример III. 5. Найдите pH .раствора, в котором [Н+] = 3,4 • Ю-4.ГН = -lg [Н+] = - lg (3,4 • 10-") = - lg 3,4 - lg 1<Г4 —- lg 3,4 - (-4) = 4 — lg 3,4 = 4,00 - 0,53 = 3,47Следует отметить, что 3,47 заключено между 3 и 4, а 3,4-10'4 —между 10_3
и 10-4. Столь простая качественная оценка позволит избежать ошибки в 100 раз,
которую обычно совершают при определении pH.Пример III. 6. Найдите [ОН-] в растворе, в котором рОН = 11,68.рОН = - lg [ОН-]; lg [ОН-] = - 11,68 = -12,00 + 0,32;ОН- = antilg (0,32) • 10~12 = 2,1 • 10-'2И снова, 11,68 заключено между 11 и 12, а [ОН“] — меж чу 10~и и 10“1а.Вопросы63. Найдите pH растворов, в которых [Н+] равна: а. 6,4 • 10~3; б. 1,3 • 107;в. 4,3-10~9; г. 9,2-10-*; д. 4,65; е. 7,7-Ю’10; ж. 2,3-Ю"2; з. 6,5-10-“; и. 9,1-10-”;
к. 4,35 • 10-s.64. Используя приводимые в таблицах величины р/С(тв) о» найдите вели¬
чины ЛГ(тв) о1 а. 10,43; б. 32,45; в. 41,3; г. 6,54.65. Используя приведенные величины lg^T(TB)o> найдите величины /С(ТВ) о-'а. — 8,24; б. — 4,03; в. — 14,92; г. — 7,46.66. Используя условие [Н+][ОН~] = 1,0 • 10~14, найдите соотношение между
pH и рОН.67. Ки Кг и т. д. — ступенчатые константы образования комплексного иона.
Общая константа образования fh = KiKzKsKi. Принимая, что логарифмы сту¬
пенчатых коистаит равны 3,62; 5,49; 0,35 й —0,78, найдите lg $4 н68. Очень важный комплексообразующий агент — этилендиаминтетрауксусная
кислота (ЭДТА или трилон Б) — способен к отщеплению четырех ноиов водо¬
рода. Ступенчатые константы диссоциации в данном случае таковы: p/Cai = l,99;
pKaZ = 2,67; р/(аЗ = 6,16; рКаЬ — 10,26. Найдите величины Ка1, Ка2 и т. д.,
а также общую константу диссоциации.> 69. Концентрация ионов водорода в растворе соли, образованной слабой
кислотой (константа ионизации Ка) и слабым основанием (константа ионизации
Кь), определяется уравнением: [Н+] = 1,00* \Q~7VКаКь- Выразите pH и рОН
как функции р/(а и рКь, используя соотношение, полученное в Вопросе 66 (см.
также раздел V. 9).70. Концентрация ионов водорода в буферном растворе, образованном слабой
кислотой (константа ионизации Ка) и ее солью (отношение кислоты и соли R),
определяется уравнением: [Н+] = KaR. Выразите pH и рОН как функцию рКа и
lg/?, используя соотношение, полученное в Вопросе 66 (см. также раздел V.7).
Глава IV
СИЛЬНЫЕ КИСЛОТЫ И ОСНОВАНИЯ
IV. 1. ИОНИЗАЦИЯ водыПри ионизации воды протон переходит от одной молекулы
воды к другой; результатом этого являются гидратация протона
и возникновение ОН~-иона:н2о + н2о н3о+ + но_Конечно, приведенная схема является упрощенной, но она под¬
черкивает тот факт, что ион водорода в водных растворах не суще¬
ствует в виде «голого» протона, а очень прочно связан с молекулой
воды. Энергия, необходимая для полной диссоциации Н30+ на Н20
и протон, примерно в три раза превышает энергию разрыва боль¬
шинства ковалентных связей.Молекула НзО+ претерпевает дальнейшую гидратацию вслед¬
ствие возникновения водородных связей между молекулой воды и
одним из водородов. В конечном счете присоединяются три моле¬
кулы Н20 и возникает так называемая первая гидратная оболочка
иона водорода:Н\ /Н
Онн\ А /н\н--0(WЭнергия водородной связи в первой гидратной оболочке состав¬
ляет примерно 1/10 от энергии обычных ковалентных связей, но
заметно больше энергии тех водородных связей, которые приводят
к агрегированию молекул воды. Эти агрегаты сохраняют целост¬
ность при комнатной температуре; поэтому наименьшей по раз¬
меру частицей, в форме которой существует гидратированный ион
водорода, является частица H^Ot- Значительно большее число мо¬
лекул воды присоединено менее сильными связями (вторая гидрат¬
ная оболочка). В момент замерзания размер этих агрегатов почти
равен размеру кристаллов льда.
84IV. 1. Ионизация водыИонное произведение водыДля целей данной книги несущественно, какое число молекул
воды связано с ионом в водных растворах. Поэтому для простоты
в дальнейшем все формулы будут записаны с наименьшим числом
молекул воды. С учетом этого ионизация воды кратко может быть
представлена в виде:Н20 Н+ + ОН"Константа равновесия этой реакции обсуждалась в разделахI. 3 и II. 5; при 25 °С[н+] [ОН-] = Ки20 = 1.00 • 10-14 (1)так как активность воды в разбавленных растворах очень близка
к единице.pH чистой водыКонцентрации Н+- и ОН'-ионов в чистой воде могут быть най¬
дены комбинированием выражений для константы равновесия и
условий материального баланса или электронейтральности.Условие материального баланса, состоящее в том, что при
ионизации воды образуются равные количества ионов ОН- и Н+,
" имеет вид:[Н+] = [ОН-] (2)Уравнение (2) может быть получено и из условия электроней¬
тральности: положительными в растворе являются только ионы
водорода, а отрицательными — гидроксильные. Требование элек¬
тронейтральности как раз и выражается равенством (2).Подставляя выражение (2) в уравнение (1), получаем:[Н+]2 = 1,00- 10~14; [Н+]= 1,00- 10-7
[ОН-]2 = 1,00- 10“ и; [ОН-] = 1,00-10-7Как правило, эти концентрации записывают в логарифмической
форме (см. раздел III. 8):pH = — lg [Н+] = 7,00; рОН = — lg [ОН-] = 7,00Итак, согласно уравнению (1), для водных растворов при 25°С
соблюдается равенство:pH + рОН = 14,00По кислотно-основной шкале водных растворов чистая вода ней¬
тральна. Если [Н+] > [ОН-], раствор является кислым; при [ОН-] >
> [Н*] раствор будет основным.Отметим, что если [Н+] становится меньше 10~7; то [ОН-] превы¬
шает 10-7, тем самым удовлетворяется равновесное соотношение (1).
Неводные растворы85НюКе приведены критерии оценки кислотности и щелочности вод¬
ных растворов:Кислый раствор Щелочной раствор[Н+] > [ОН~] (по определению) [ОН-] > [Н+] (по определению)[Н+]>10-7 [ОН-] > 10“7[ОН~]<Ю~7 [Н+]<10~7pH <7 pH >7рОН>7 рОН <7Неводные растворыДля неводных растворов необходимы более общие критерии
оценки кислотности среды. Одним из таких критериев может быть
величина ионизации растворителя. Например, в растворах жидкого
аммиака ионы образуются в результате перехода протона (как и
в случае воды):NH3 + NH3 NH++NHJДля этого процесса константа равновесия имеет вид:[nh+] [nh;] = кКислым раствором в жидком аммиаке будет тот, для кото¬
рого соблюдается условие [NHt] > fNHl]; если же [NH7] > [NHt]T
то раствор является основным.Вопросы1. На рис. II. 12, б приведены полученные Харнедом и Хамером величины
констант ионизации воды при различных температурах; так, при 0 °С Кцго=1.15ХЮ-15, а при 60°С /Сн2о = 9"6,10_14- Рассчитайте pH нейтральных рас¬
творов для каждой из этих температур. Почему при измерениях на рН-метре
веобходим контроль за температурой?2. Этанол (С2Н5ОН, сокращенно ЕЮН) диссоциирует по схеме:ЕЮН + ЕЮН ЕЮН+ + ЕКГ
Константа равновесия этой реакции при 25° С имеет значение:[еЮН2] [ЕЮ-] = 8 • ИГ20Вычислите концентрации каждого иоиа в чистом этаноле. Какие существуют
критерии (подобные тем, что приведены выше) для оценки реакции среды
растворов в этаноле?
86IV. 2. Расчет pH в растворах сильных кислот и основанийIV. 2. РАСЧЕТ pH В РАСТВОРАХ СИЛЬНЫХ КИСЛОТ
И ОСНОВАНИЙПонятия сильный и слабый обычно характеризуют степень дис¬
социации вещества на ионы в растворе. В разделе II. 3 даны опре¬
деления: сильный электролит это тот, который диссоциирован на¬
цело, а слабый — только частично.Содержание этих понятий несколько изменяется при обсужде¬
нии неводных растворов. Полная диссоциация водных растворов
НСЮ4 и НС1 обусловлена так называемым нивелирующим дейст¬
вием растворителя, каковым является вода из-за своей высокой
акцептирующей способности по отношению к протонам. Чистая
(ледяная) уксусная кислота не обладает столь высокими, как у
воды, акцептирующими свойствами и поэтому ей не свойственно
подобное нивелирующее действие. Так, и HCIO4, и НС1 — слабые
кислоты в растворах ледяной уксусной кислоты, но НСЮ4 более
диссоциирована, чем HCI. Именно поэтому НСЮ4 является по при¬
роде своей более сильной кислотой, чем НС1, хотя в водных рас¬
творах обе они диссоциированы нацело.Для целей математической классификации кислоты и основа¬
ния удобно разделить на две группы: сильные — диссоциированы
нацело; слабые — диссоциированы частично. Существует, безуслов¬
но, некоторая промежуточная область между нацело диссоцииро¬
ванными кислотами (HCI) и почти недиссоциированными (напри¬
мер, HCN). Кроме того, некоторые кислоты, например НЮ3, яв¬
ляются слабыми в концентрированных растворах и сильными в
разбавленных.Ниже приведены вещества, которые в растворах с концентра¬
цией менее 1 моль/л диссоциированы практически нацело; исклю¬
чение составляют HI03> Sr(OH)2, Ва(ОН)2 и. Т10Н — они диссо¬
циированы нацело в растворах с концентрацией, не превышающей
0,01 моль/л:Кислоты ОснованияНХ Н+ + X" МеОН Ме+ + ОН"HCI, HBr, HI, НСЮ4, НШ3, Ме(ОН)2 ^=± Ме2+ + 20Н-
H2S04, HSCN, HIO3 LiOH, NaOH, КОН, RbOH, CsOH,Sr(OH)2, Ba(OH)2, TlOHДаже в очень концентрированных растворах большинство из
приведенных веществ присутствует не в виде истинных ковалент¬
ных молекул, а скорее в виде ионных пар. Однако два отдельных
иона этих пар связаны сильнее друг с другом, чем можно было
бы ожидать из электростатических соображений.Образование ионных пар сказывается на величинах коэффици¬
ентов активности; они становятся меньше полученных путем рас¬
чета из простой теории электростатического взаимодействия точеч¬
ных зарядов (см. раздел XII.2).
Сильная кислота87Следует отметить, что H2S04 нацело диссоциирует только по
первой ступени (H2SO4 Н+ + HSOJ); ион HSO4 — относительно
слабая кислота с /Са=10-2.Соли, образованные по реакции между сильными кислотами и
основаниями (например, NaCl), в водных растворах диссоцииро¬
ваны нацело; реакция среды у них нейтральная. Соли слабых кис¬
лот и оснований диссоциированы нацело, но реакция среды у них
либо кислая, либо основная, поскольку ионы их являются либо кис¬
лотами, либо основаниями (см. раздел V. 4).Сильная кислотаПример IV. 1. Найдите pH 0,05 М раствора НС1.Помимо ионов, возникающих при диссоциации воды, в растворе присутствуют
ионы, внесенные при добавлении НС1.Первым соотношением между [Н+] и [ОН~] является ионное произведение
воды:[Н+][ОН“]= 1,00-10“14 (1)Второе соотношение — протонное условие; оио может быть получено для
ионов водорода из условия материального баланса с включением Н+-ионов как
воды, так и кислоты:[Н+] = [ОН-]+0,05 (2)Используя условия электроиейтральности[Н+] =[ОН"] + [СГ]
и материального баланса по С1~-ионам[СГ] = 0,05можно также получить уравнение (2).Уравнения (1) и (2) нетрудно решить точно, однако, сделаем возможные до¬
пущении. Поскольку раствор является кислым, [ОН'] С 10~7; поэтому в уравне¬
нии (2) величиной [ОН'] (по сравнению с 0,05) можно пренебречь:[Н+] = 0,05 (2а)Уравнение (2а) — приближенное. Для проверки правильности сделанного до¬
пущения вычислим [ОН~] по уравнению (1):[ОН-] = 1,00 ‘ Ш- ~ = 2,0 • 10“135,0 • 10“2Действительно, значение 2 ■ 10"13 пренебрежимо мало по сравнению с величи¬
ной 0,05. Итак:pH = — lg [Н+] = — lg (0,05) = 1,30Возможно, приведенный пример напоминает стрельбу из пушки
по воробьям, ио он необходим для понимания применения условий
материального баланса и электронейтральностц к простым си¬
стемам,
88IV. 2. Расчет pH в растворах сильных кислот и основанийСильное основаниеПример IV.2. Найдите pH и рОН 1,0*10-3 М раствора Ва(ОН)2.Как и ранее:иоииое произведение воды[н+] [ОН“]= 1,00-10”14 (1)условие электронейтральиости *[Н+] + 2 [Ва2+] = [ОН-]условие материального баланса по барию> [Ва2+]= 1,0-10_3Подстановка последнего уравнения в щэедпоследнее дает уравнение протон¬
ного условия:[Н+] + 2,0 • 10—3 = [ОН-] (2)Выражение (2) может быть получено и из условии материального баланса
по ОН~-ионам: каждая диссоциирующая молекула воды «дает» по одному иону
Н+ и ОН'; 1 моль Ва(ОН)г дает 2 моль ОН-. Сумма этих двух членов и опре¬
деляет [ОН-].Поскольку имеется избыток ОН'-ионов, раствор является основным —
[Н+] < 10~7. Последнее служит основанием для пренебрежения [Н+] по сравне¬
нию с 2,0-10~3 в уравнении (2). Приближенное уравнение имеет вид:[ОН-] = 2,0- 10-3 (2а)Подстановка уравнения (2а) в уравнение (1) дает: [Н+] = 5,0-10~12; эта вели¬
чина действительно пренебрежимо мала по сравнению с 2,0 • 10~3.Итак:pH = 11,30; рОН = 2,70; pH + рОН = 14,00Очень разбавленная сильная кислотаПример IV. 3. Найдите pH 1,0 • 10'7 М раствора HCIO4.Как и ранее:ионное произведение воды[Н+] [ОН-] =1,00.10“14 ч (1)условие материального баланса по водороду или комбинация уравнений
электронейтральности и материального баланса по перхлорат-ионам дает уравне¬
ние протонного условия[Н+] = [ОН-] + 1,00 -‘10~7 (2)Поскольку раствор очень разбавлен, величиной [ОН-] пренебречь (по сравне¬
нию с 1,00 • 10-7) нельзя, т. е. необходимо точное решение уравнений.Решение уравнения (2) относительно [ОН-] н подстановка результата в урав¬
нение (1) дает:[Н+]2- 1,00- 10_7[Н+]- 1,00- 10_и = 0Это выражение легко может быть решено по квадратичной формуле (см.
раздел III. 6):[Н+]= 1,62-10-7 нли [Н+] = — 0.6Ы0-7* Коэффициент 2 перед [Ваг+] обусловлен двухзарядностью последнего,
Общее соотношение для pH сильной кислоты89Физический смысл может иметь только положительный ответ, логарифм ко¬
торого дает:pH = 6,79Для проверки полученного результата найдем [ОН-], используя уравне¬
ние (1):[ОН'] = 6,18 • 10-5 = 0,62 • 10~7Подставляя эту величину [ОН’] в уравнение (2), убеждаемся в том, что оно
удовлетворяется:[Н+] = 0,62 • 10-7 + 1,00 • 10-7 = 1,62 • 10-7Последняя величина точно совпадает с положительным корнем квадратного
уравнения.Соль сильной кислоты и сильного основанияПример IV. 4. Найдите pH 0,02 М раствора Ba(NOsb-
Условие материального баланса по барию:[Ва2+] = 0,02 (3)Условие материального баланса по нитрату *:[NOJ] = 0,04 (4)Условие электронейтральности:2 [Ва2+] + [Н+] = [ОН-] + [NO“] (5)Подстановка уравнений (3) и (4) в уравнение (5) дает протонное условие:[Н+] = [ОН-] (2)Комбинируя уравнение (2) с уравнением ионного произведения воды[Н+] [ОН-] = 1,00 • 10“14 (1)получимpH => рОН = 7,00что свидетельствует о нейтральной реакции среды.Другой путь состоит в рассмотрении условия материального баланса по
ионам водорода — это непосредственно приводит к уравнению (2), поскольку
внешние источники Н+- и ОН'-ионов отсутствуют.Отметим, что катион и анион сильных кислот и основания, по существу,
инертны и не принимают участия в кислотно-основных реакциях.Общее соотношение для pH сильной кислотыМетодически полезно рассмотреть целиком вопрос взаимосвязи
pH раствора сильной кислоты и ее аналитической концентрации.
В растворах разумных концентраций (см. Пример IV. 1) [Н+]
почти точно равна аналитической концентрации кислоты. С другой* Условие (4) учитывает тот факт, что 1 моль Ва(ЫОз)2 дает 2 моль N0”
90IV. 2. Расчет pH в растворах Сильных кислот и основанийстороны, в предельно чистой воде, в которой вообще кислота отсут¬
ствует, [Н+] не меньше 10-7 моль/л. Значения pH внутри области
между этими крайними случаями могут быть определены по об¬
щему соотношению, которое легко вывести.Для нацело диссоциированной кислоты с аналитической кон¬
центрацией С необходимы два уравнения, позволяющие опреде¬
лить [Н+] и [ОН-]:ионное произведение воды[Н+][ОН-] = /Сн2о (•)протонное условие[Н+]-С + [ОН“] (2)Решая уравнение (2) относительно [ОН-] и подставляя полу¬
ченный результат в уравнение (1), получаем выражение[Н+] ([н+] — С) = /С н2оявляющееся квадратным уравнением относительно [Н+][Н+]2-С[Н+]-*н2О=0 (6)и линейным относительно С:c=[H+1“TTrf ^В пределе, когда [Н+] > [ОН-], второй член уравнения (7) про¬
падает:[Н+] = С (7а)Если же С < 10-7, можно пренебречь левой частью уравнения(7)[H+]2 = /CHso С7®)т. е. pH = 7,00.Графический способ решения уравнения (6), т. е. определение
всех [НЧ для некоторых заданных С (см. Пример IV. 3), очень уто¬
мителен. С другой стороны, графическое определение [Н+] по урав¬
нению (7) и последующее вычисление С просты; кривая в этом
случае та же, что и в первом (рис. IV. 1, табл. IV. 1).Рис. IV. 1 построен в логарифмической шкале, поскольку об¬
ласть изменения [Н+] простирается от I до 10~7 моль/л, а для С
диапазон еще больше. Отрицательная же абсцисса обусловлена
тем, что все числа, для которых взяты логарифмы, меньше еди¬
ницы.
Вопросы91Таблица IV.1Численное решение уравнения (7)[н+]Кн2оЛн+]СpH-lg С1 ,1(Г!з1 .00,0~10-1(Г1,0001,00010_510 д10~33,0003,00010_10 8ю-5в5,0005,0001(Г7100,99 • 10,6,0006,0045-10-72.10-4,8- 10-6,3006,3182-10,5-10~®1,5-10-6,6996,8241,5-10"!6.7-10 !0,83-10“6,8247,0801,10- 10,9,1 • 10“1,9-106,9587,7811,05-10 19,51-10 *9,9- 10~36,9808,0041,02- 10,9,8 • 10 *4,0 • 10-96,9928,3971,01 • ю-!9,9-10,2,0- 10“96,9968,69810~710-707,000ООУравнение (7а) удовлетворяется в области значений С от
10-6 моль/л и выше. По мере приближения [Н+] к значению
10-7 моль/л величина С становится сколь угодно малой.рн-lg СРис. IV. 1. Величина pH сильной
кислоты как функция концен¬
трации.В левой части диаграммы расположены
большие концентрации; в правой —ма¬
лые. Кислые растворы расположены
внизу диаграммы, а основные»наверху.С'Ю\моль/лРис. IV. 2. Величина pH сильной
кислоты как функция концентра¬
ции (очень разбавленные растворы).
Сплошная и прерывистая линии рассчи
таны по уравнениям (7) и (7а); в послед¬
нем случае ионизацией воды пренебре*
гаем.Рис. IV. 2 показывает ту же зависимость, что и рис. IV. 1, но
в обычной шкале.ВопросыВычислите pH и рОН в приведенных ниже растворах при 25° С. Подтвер¬
ждаются ли сделанные вами допущения?3. 0,05 мл 16 М HNOj смешано с 1 л Н20.
92/ V. 3. Титрование сильных кислот и оснований4. 0,03 М КОН.5. 4,5- 10-‘M Sr(OH)2.6. 0,100 мг ТЮН в 174 мл Н20.7. 4,0 • 10-* М LiOH.8. 1,4- 10’7 М Ва(ОН)2.9. 15 мл 1,3- 10-4 Af 8г(10з)г смешано с 12 мл 0,015 М НЮз.10. 150 мл 2,5 • 10~3 М NaCl смешано с 100 мл 5,0 • 10~8 М НС1.11. Вычислите концентрации различных ионов 0,010 М раствора этилата на¬
трия (Na+OEt~) в этаноле. Ионное произведение этанола (см. Вопрос 2, стр. 85):
[EtOHj] [ЕЮ-] = 8 • Ю-20.12. Выведите соотношение между pH и аналитической концентрацией силь¬
ного основания. Какие уравнения получатся в случаях предельно концентриро¬
ванных й очень разбавленных растворов?IV. 3. ТИТРОВАНИЕ СИЛЬНЫХ КИСЛОТ И ОСНОВАНИЙРеакция между сильными кислотами и основаниями сводится
к взаимодействиюН+ + ОН" ^=± Н20и подчиняется уравнению:[Н+][0Н"] = 1,00-10-14 (1)Существуют два не очень отличающихся подхода к проблеме
вычисления pH в процессе титрования. В первом (см. Пример
VI. 5) рассматривают идущую до конца стехиометрическую реак¬
цию, в результате которой получается раствор, представляющий
собой смесь соли с кислотой или основанием. Во втором способе
(см. Пример IV. 6) используют условия: электронейтральности по
всем ионам раствора и материального баланса по инертным
ионам — для контроля за количеством добавляемого титрующего
вещества.Пример IV. 5. Объем V 0,1 М раствора NaOH добавляют к 50 мл 0,1 М рас¬
твора НС1. Вычислите pH раствора как функцию V.Полная нейтрализация кислоты будет достигнута при добавлении 50 мл
(стехиометрическое количество) щелочи, но сам процесс нейтрализации может
быть разбит на следующие три стадии: V < 50; V — 50; V > 50 мл.1. V < 50 мл\ кислота присутствует в избытке, но часть ее — нейтрализован¬
ная — дала NaCl, который, как и НгО, не оказывает ощутимого влияния на pH.
Полагая, что количество кислоты не очень мало, получим: величина [№] при¬
мерно равна концентрации избыточной кислоты с учетом разбавления Исходное
число молей кислоты:(0,1 моль/л) (0,05 л) =50- 10-4 моль (а)Число добавленных молей NaOH (V, в мл):(0,1 моль/л) (V • 10—3 л) = 1,0 • 10~V моль (б)Число оставшихся непрореагировавших молей кислоты определяется раз¬
ностью выражений (а) и (б):(50 — V) • 10 ' моль(в)
iIV. 3. Титрование сильных кислот и оснований 93Концентрация кислоты, а следовательно, и приближенная величина [Н+] мо¬
жет быть иайдеиа делением выражения (в) иа общий объем—(У + 50)-10'3 лtH+3=§^y (О-1) (2)Если V ф 50, то [Н+] > 10_6; иными словами, сделанное допущение, что
[НС1] = [Н+], удачно. Расчеты по уравнен-ию (2) приведены в табл. IV. 2.Таблица IV.2Результаты расчзтов по уравнению (2)(до точки эквивалентности)V, мл50-1/, мл50+1/, мл[Н+].моль(лpH050500,1001,001040600,06671,182030700,04291,373020800,02501,604010900,01111,95455,0950,005262,28482,0980,002042,69491,0990,00101 ,3,0049,50,599,55,01 • 10 *3,3049,90,199,91,00-104,402. V = 50 мл; добавлено стехиометрическое количество щелочи; раствор со¬
держит 5,0 • 10~3 моль NaCl в 100 мл Н20 и является нейтральным, т. е. достиг¬
нута эквивалентная точка и pH = 7,00.3. V > 50 мл\ удобнее рассматривать раствор как смесь NaCl и NaOH. По¬
добно сделанному ранее можно показать, что:= (3)
Результаты расчетов по уравнению (3) приведены в табл. IV. 3.Таблица IV.3эезультаты расчетов по уравнению (3) (после точки эквивалентности)Вычисление pH проводили по формуле pH+ рОН= 14,00V, млV — 50, млК+ 50, мл[он~].МОЛЬ/ЛрОНpH50,10,1100,11,00-нг!4,0010,0050,50,5100,54,97- 10 ,3,3010,705111019,90-10 ,3,0011,005221021,96- 10 ’2,7111,295551054,76- 10 ,2,3211,686010ПО9,09- 10 ,2,0411,9670201201,67- 10 ,1,7812,2280301302,30 • 10 ,1,6412,3690401402,86 • 10 ,1,5412,46100501503,34-101,4812,52
94IV. 3. Титрование сильных кислот и основанийДанные табл. IV. 2 и IV. 3 приведены на рис. IV. 3. Обратите внимание, как
увеличивается pH: только на единицу — при добавлении 40 мл\ более чем на
единицу — при добавлении следующих 9 мл; на единицу — при следующих 0,9 мл
и на шесть единиц — при добавлении 0,2 мл. Это чрезвычайно быстрое изменениеpH происходит вблизи точки эквивалент-
рН ности; оно позволяет применять цветныеиндикаторы при кислотно-основном тит¬
ровании.„ Общее уравнение кривой
титрованияВысокие концентрации кисло¬
ты и основания позволяют пре¬
небречь величиной [ОН-] до точ¬
ки титрования, а величиной
[Н+]— после нее. Это означает,
что в наиболее интересной обла¬
сти, прилегающей к точке титро¬
вания, вычисления являются наи¬
менее точными. Попытаемся уста¬
новить точное уравнение кривой
титрования.Пусть сильную кислоту (скажем, НС1), объем которой Vo, а
концентрация С0, титруют сильным основанием (например, NaOH) ;
объем основания V, а концентрация — С. Запишем условия:
материального баланса^NaOH»млРис. IV. 3. Кривая титрования 50 мл
0,1 М раствора HCI 0,1 М раство¬
ром NaOH.Точки — значения, вычисленные в При¬
мере IV. 5 и представленные в табл. IV. 2
и IV. 3. Э. т. — эквивалентная точка.[СП = С°^°-.
' J V + Vo[Na+]CVV + V0
электронейтральности[H+] + [Na+] = [ОН-] + [СГ](4)(5)(6)Подстановка уравнений (4) и (5) в уравнение (6), а' также
ионное произведение воды дают:CV-C0V0*Н20V + V0[Н+][Н+](7)Поскольку С, С0 и Vn даны, уравнение (7) определяет [Н+] как
функцию V, т. е. это уравнение является точным.Более удобная форма уравнения получается, если уравнение
(7) выражают через титровальные доли. Точка эквивалентности
достигается, когда:СК = С070
Общее уравнение кривой титрования95Определим титровальную долю как отношение:В точке эквивалентности Ф = 1.Используя эту переменную, запишем уравнение кривой титро
вания:^н2оv + v0[Н+]-[Н+](9)Приближенное соотношение, примененное в Примере IV. 5, мо¬
жет быть получено из уравнения (9), если пренебречь в правой
части его либо первым, либо вто¬
рым слагаемым.До точки эквивалентности
[Н+] > [ОН-] иpHc„vn■ (1 — Ф) = [н+]V+V0(кислотное приближение) (9а)После точки эквивалентности
[ОН-] > [Н+] и(Ф-1): Kvv + v0ун2оРис. IV. 4. Сравнение точной и
приближенных кривых титро¬
вания 1,0 • 1СГ6 М раствора НС1
1,0* КГ4 М раствором NaOH:/, 3 — приближенные кривые титрования,
описываемые уравнениями (9а) и (96);
2 — точная кривая титрования, описывае¬
мая уравнением (9).[н+](основное приближение) (96)Отметим, что при С0 = 0,1, Vo== 50 мл и Ф = V/50, уравнения (9а)
и (96) превращаются соответствен¬
но в уравнения (2) и (3).Чтобы показать, в каких слу¬
чаях сделанные выше допущения не¬
состоятельны, рассмотрим титрова¬
ние очень разбавленной кислоты.Пример IV. 6. Рассчитайте кривую титрования раствора 1,0-Ю-* М НС1 рас¬
твором 1,0-10-4 М NaOH.Подобные титрования проводят с помощью микробюреток, так как объем
щелочи, необходимый для нейтрализации, составляет только 1% от общего объе¬
ма раствора. Последнее соответствует расчету, так как между значеняями Ф = 0
и Ф = 2ТТТ7=1'°1± 0,°1Полагая С0 — 1,0-10-8, величину Ф можно найтн как функцию [Н+] по урав¬
нениям (9), (9а) и (96) (рис. IV. 4). Обметим, что приближенные кривые 1 н 3
устремляются в бесконечность в эквивалентной точке, а точная кривая продол¬
жается за точку эквивалентности и дает значение pH = 7,00 прн Ф = 1.
IV. 4. Ошибка титрованияВопросыРассчитайте pH как функцию добавляемого объема V.13. 50 мл 0,01 М раствора КОН титруют 0,01 М раствором HNO3.14. 50 мл 1,0-10~4М раствора HN03 титруют 1,00 -10-2 Л1 раствором КОН.15. 100 мл 0,05М раствора Ва(ОН)2 титруют 0,1 М раствором НС1.16. Рассчитайте pH раствора, полученного смешением 32,5 мл 1,3 • 10_3 Л1
раствора НСЮ4 с 1,46 мл 2,5- 10~2 М раствора NaOH.17. Рассчитайте pH раствора, полученного смешением 12,6 мл 2,4 • 10-4 М
раствора КОН с 32,5 мл 1,0- 10М раствора НВг.18. Рассчитайте pH раствора, полученного смешением 96,3 мл 1,2 М раствора
ТЮН с 87,2 мл 0,980 М раствора HN03 и разбавленного до 750 мл.19. Выведите уравнение, подобное уравнению (9), используя титровальную
долю как функцию [Н+], для случая титрования сильного основания (Vo, Со)
сильной кислотой (V, С).20. Убедитесь, что эквивалентная точка при титровании любой сильной кис¬
лоты любым сильным основанием (или наоборот) всегда лежит при pH = 7,00
(в чистой воде) и не зависит от аналитических концентраций. В частности, если
из растворов не удалена полностью СОг, эквивалентная точка сдвинута в кислую
область.21. Покажите, что точка перегиба на кривой титрования наступает при экви-
валентной точке.IV. 4. ОШИБКА ТИТРОВАНИЯЭквивалентная точка и конечная точка
(точка конца титрования)Экспериментальное определение эквивалентной точки титрова¬
ния, которая соответствует точно стехиометрическим количествам
реагентов, — один из наиболее существенных вопросов объемного
анализа. Точка, определяемая экспериментально с использованием
цветных индикаторов, по появлению осадка или электрометрически,
называется конечной. Эквивалентная точка является теоретической,
а конечная — экспериментальным приближением к ней; последняя
поэтому зависит от метода определения. Разница между этими
двумя величинами дает ошибку титрования.Индикаторная конечная точкаВ случае простейшего титрования сильной кислоты сильным
основанием конечную точку наблюдают по изменению цвета инди¬
катора. Являясь органическими кислотами или основаниями, инди¬
каторы имеют окраску, характер которой зависит от степени про¬
тонирования (см. раздел V. 6).Изменение окраски не бывает резким и происходит в некоторой
области pH, что и служит одним из источников ошибки. Другая
причина ошибки проистекает от того, что цвет индикатора может
и не измениться при том значении pH, которое соответствует экви¬
валентной точке, Для рассматриваемого случая титрования экви¬
йотенциометричёские и конддктометрическ. конечн. точки титрован. 9?валентная точка лежит вблизи pH = 7,00*; ниже приведены инди¬
каторы, изменяющие окраску именно в этой области значений pH:Область pH конечной точки и
изменение окраски при
Индикатор переходе от кислой к щелоч-. ной реакциям средыМетиловый оранжевый . . . 3,1—3,5(красная — оранжевая)3.7-5,0
(красная — желтая)4,0—5,6
(желтая — голубая)4.4—6,2
(красная — желтая)5.2—6,8
(желтая — пурпурная)6.2-7,6
(желтая — голубая)6.4—8,0
(желтая — красная)6.8—8,0
(красная — желтая)7.3-8,7 ,(розовая — зеленая)8.4—10,0
(бесцветная — красная)Тимолфталеин 9,4—10,6(бесцветная — голубая)Приведенные выше значения областей изменения pH являются
результатом различных исследований по выбору наиболее вероят¬
ной конечной точки. Сопоставляя цвета используемого раствора и
стандартного образца индикатора, можно ограничить область0,5 единицами pH и меньше. Еще большего эффекта можно до¬
стичь, если смешать индикаторы дополнительных цветов. Так,
смесь фенолового красного и бромкрезолового зеленого в отноше¬
нии 2: 1 изменяет окраску от серо-зеленого до ярко-фиолетового
в области 0,2 единиц pH вблизи pH = 7,2.Потенциометрические и кондуктометрические
конечные точки титрованияПотенциометрический метод определения конечной точки, ле¬
жащий в основе автоматизации процесса титрования, является
одним из наиболее важных. Метод измерения электропроводности
(см. раздел II. 3) также позволяет определить конечную точку.Эквивалентная электропроводность Н-- и ОН~-ионов во много
раз превышает эту величину у других ионов. Поэтому по мере уда¬
ления ионов Н+ (за счет титрования NaOH) из раствора электро¬* Для растворов, содержащих растворенную СОг, значение pH меньше 7,00
(см. главу VII).а-Нафтилкрасный Бромкрезоловый- зеленый . .Метиловый красный Бромкрезоловый пурпурный .
Бромтимоловый голубой . . .Феноловый красный Нейтральный красный . . . .а-Нафтолфталеин Фенолфталеин 4 За к. 345
98tV. 4. Ошибка титрованияпроводность последнего уменьшается, проходя через минимум
вблизи эквивалентной точки, а когда появляется избыток NaOH,
она начинает расти.Вычисление ошибки титрованияОшибку титрования рассчитывают по тем же уравнениям, что
и кривую титрования. Если последняя вычислена, а pH конечной
точки известно, то необходимый для достижения конечной точки
объем титранта (Ук. т) может быть найден по кривой.Ошибка титрования выражается через разность между объе¬
мами реагента, соответствующими конечной (Кк. т) и эквивалент¬
ной (V') точкам, отнесенную к V':т^^=1-Положительное значение m означает, что конечная точка сле¬
дует из эквивалентной, т. е. VK- т > У, если т< О, то соотношение
объемов противоположное. Покажем это на примере титрования,
рассмотренного в предыдущем разделе.Пример IV. 7. Метиловый красный использовали как индикатор при титрова¬
нии 50 мл 0,1 М раствора НС1 0,1 М раствором NaOH. Какова будет ошибка ти¬
трования, если pH конечной точки принять равным 5,0?Кривая титрования для данного случая вычислена в Примере IV. 5. Экви¬
валентная точка наступит в тот момент, когда будет добавлено 50,00 мл NaOH;
в этой точке pH = 7,00. Индикатор указывает точку, в которой pH = 5,0; по¬
этому объем для конечной точки будет меньше,
чем для точки эквивалентности. На рис. IV. 5 при¬
ведена область кривой титрования вблизи эквива¬
лентной точки. Объем У„. т может быть вычислен
с использованием кислотного приближения [ураи-
нение (2), стр. 93]:50 мл, знаменатель равен при-Поскольку V
мерно 100 мл.V = 50,00 — 1,0 - 103 [Н+]Принимая, что [Н+] в конечной точке равно1,0 • 10-5, получаемт = 50,00 — 1,0 • 10~2 = 49,99 млЕсли пена деления бюретки ~0,02 мл, то несущественнаи ошибка при титро¬
вании проистекает от того, что индикатор изменяет окраску не точно в эквива¬
лентной точке. Ошибка титрования равнаFK. т — 50,0049,8 50,2УцаОН.млРис. IV. 5. Ошибка титрова¬
ния при использовании ме¬
тилового красного (см. При¬
мер IV. 7).50,00= — 0,02%0,02%.Таким образом, конечная точка будет достигнута ранее эквивалентной на
Общее уравнение ошибки титрования99Общее уравнение ошибки титрованияДля получения общего уравнения воспользуемся точным урав¬
нением кривой титрования:_^(ф_1)==.^0 _[н+]V +V0 [Н+]Объем, соответствующий эквивалентной точке, равен:V' = ^-V0Используя определения ошибки титрования и титровальной
доли, получаем:„ Ук.т-У' CVк.тV C0F01 — Фк_ т — 1Итак, уравнение (9) непосредственно определяет ошибку тит¬
рования, если pH конечной точки известен. Полагая, что FK, TmV',
находим:V а V0 СVK.T-Vo V'+Vo С+С0(допущение для конечной точки)Таким образом, уравнение (9) может быть приведено к более
удобной для расчетов ошибки титрования форме:Например, ответ в Примере IV. 7 может быть получен по урав¬
нению (10) подстановкой [Н+]к.т = 1,0-Ю-5 и С=С0 = 0,10; в
этом случае m — — 2,0-10-2 = — 0,02%.В более разбавленных растворах ошибка титрования стано¬
вится больше.Пример IV. 8. Желательно при титровании 1,0-10-4 М раствора НС11,0-10~4 М раствором NaOH получить т<0,1%. Внутри какой области pH
следует определять конечную точку?Полагая в уравнении (10) Фк. т — 1 = —1,0-10_3, а С — Со — 1,0-10~4, по¬
лучаем:— Нг° [Н+]К.Т 0,5-10-7[Н+]к.,Решая это квадратное уравнение по квадратичной формуле, имеем;[Н+]к. т= 1,28* 10“7; РНК. х = 6,89Проводя аналогичный расчет, но с Фк. т — 1 = 1,0 • 10-3, получаем:рНк. т == 7,11Итак, pH должно быть определено в области, отстоящей от эквивалентной
точка иа ±0,1; это можно сделать, применяя потенциометрический метод. Если же
100IV. 4. Ошибка титрованияСОг полностью удалена, т. е. эквивалентная точка лежит точно при 7,00, то из¬
мерении можно проводить на рН-метре нли со смешанным индикатором. Фено¬
ловый красный и бромкрезоловый зеленый, смешанные в определенной пропорции,
могут дать серый оттенок при изменении pH = 7,0 на 0,1.На практике, однако, титрование очень разбавленных растворов ведут кон-
дуктометрически для определения конечной точки. Этот метод не столь чувстви¬
телен к присутствию СОг, как потенциометрические или индикаторные измерения.Вопросы22. Метиловый красный изменяет свою окраску от красной к желтой при
изменении pH в интервале 4,4—6,2. Рассчитайте минимальную и максимальную
ошибки титрования в следующих реакциях:а. 50 мл 0,1 М HCi тнтруют 0,1 М раствором NaOH;б. 10 мл 0,05 М НС1 тнтруют 0,01 М раствором NaOH;в. 10 мл 0,05 М Ва(ОН)г тнтруют 0,01 М раствором НС1;г. 25 мл 2,0-10-4 М HSCN титруют 1,0-1 О*3 М раствором КОН.При условии, что цена деления бюретки равна 0,02 мл, в каком из процессов
применимо цветовое сравнение для уменьшения ошибки титрования?23. Рассчитайте величины pH прн титровании 25 мл 0,02 М раствора НС1
24,98 и 25,02 мл 0,02 М раствора NaOH. Какой индикатор из приведенных на
стр. 97 можно применить, если цена деления бюретки 0,02 мл?24. Для случая титрования сильной кислоты сильным основанием, когда ко¬
нечная точка принимается за pH, выведите алгебраическое выражение для
ошибки титрования, если растворы равных концентраций титруют при следующих
условиях:а. конечная точка наступает при pH > 7,85;б. конечная точка наступает при pH < 6,15.Учтите, что ошибка титрования не зависит от общего объема раствора, но
зависит от концентрации.25. В качестве индикатора при титровании 5,0 • 10~3 М раствора НС15,0 • 10*s М раствором NaOH применяют фенолфталеин. Конечная точка опреде¬
лена прн pH = 8,0. Если цена деления бюретки 0,02 мл, каков должен быть
объем образца, чтобы ошибка титрования не превышала ошибки отсчета добав¬
ленного объема щелочи?26. Существует формула для определения ошибки титрования сильной кис¬
лоты сильным основанием:200[Н+]К.Тя* = т; г %с0Однако эта формула справедлива при следующих условиях: концентрации
кислоты и щелочи должны быть одинаковыми; если рНк. * > 7,0, то вместо [ЬГ]
в формуле должно быть [ОН']-Какие допущения сделаны при выводе этой формулы?При каких условиях применение формулы нежелательно?
Глава V
СЛАБЫЕ ОДНООСНОВНЫЕ КИСЛОТЫ И ОСНОВАНИЯV.1. ИОНИЗАЦИЯ СЛАБОЙ КИСЛОТЫБольшинство кислот в водных растворах при обычных концен¬
трациях диссоциированы неполностью; такие кислоты называют
слабыми, противопоставляя их сильным, которые диссоциированы
нацело (см. стр. 86). Они называются одноосновными, если отще¬
пляют один ион водорода, а диссоциация их описывается следую¬
щими уравнениями: *[НА] [н+] + [А-][Н+] [А“] = Ка [НА] (1)Задача вычисления концентраций отдельных ионов в растворе
слабой одноосновной кислоты формально уже рассмотрена в раз¬
делах III. 4 и III. 5 при обсуждении метода решений систем урав¬
нений.Константы ионизацииКак следует из табл. V. 1 величины констант ионизации слабых
одноосновных кислот изменяются в очень широком интервале зна¬
чений.Кислоты, значения Ка которых больше 1,0, при концентрациях
меньших 0,1 М в водных растворах диссоциированы практически
нацело, т. е. ведут себя подобно сильным кислотам. «Пограничной»
между сильными и слабыми является йодная кислота, у которой
Ка = 0,16 (см. данные, приведенные на стр. 86).Кислоты с Ка < Ю-14 не диссоциированы вовсе при любых кон¬
центрациях, поскольку за счет ионизации воды появляется столько
же (или больше) ионов водорода, что и при ионизации кислоты.
Величина pH таких кислот очень незначительно отличается от 7,00.• В растворителях с высокими значениями диэлектрической проницаемости е
(иапример, вода) термины «диссоциация» и «ионизация» равнозначны. Если же
величина е мала (напрнмер, СНзСООН), ионные пары существуют наравне с
молекулами и большее значение приобретает диссоциация.
102V. 1. Ионизация слабой кислотыТаблица V.IНекоторые слабые одноосновные кислоты*НазваниеФормулаР«аЙоднаяНЮз1,6-10"’0,79Бисульфат-ионHS071,02-10~21,99ХлоруксуснаяС1СН2СООН1,36 -10“®2,87ФтористоводороднаяHF6,75 • 10~43,17АзотистаяHNO,5,1 - 10-43,29МуравьинаяНСООН1,77-10 ,3,75АзотистоводороднаяHN31,9-1014,72УксуснаяСН3СООН1,75-10 ‘4,75ПропионоваяСН3СН2СООН1,34-10”*4,87ХлорноватистаяНОС12,95- 10-87,53БромноватистаяНОВг2*М°Л8,60СинильнаяHCN4,8-10 °9,32ИодноватнстаяHOI5 • 1012,3* Величина KQ экстраполирована к нулевой ионной силе.Вычисление pH слабой кислотыОбратимся сначала к примеру, решенному в разделе III. 5, а
затем рассмотрим более полно диссоциирующую кислоту.Пример V. 1. Найдите концентрации всех типов частиц в 0,01 М растворе
СНзСООН (Ка = 1,75- 10-s).Запишем уравнения условий:равновесия[Н+] [Ас"]= 1,75- 10_s [НАс] (1)[Н+] [ОН-] =1,00-10“14 (2)протонное (из условия электронейтральиости):[Н+] = [Ас1 + [ОН~] (3)Так как аналитическая концентрация кислоты равна 0,01 моль/л, условие ма¬
териального баланса имеет вид:[НАс] + [Ас"] = 0,01 (4)Раствор является кислым, поэтому можно пренебречь [ОН-] по сравнению
с [Ас-]; уравнение (3) принимает вид:[Н+] = [Ас-] (За)Примем, что кислота диссоциирует в незначительной степени, т. е.
[Ас-] < [НАс]; тогда вместо уравнения (4) можно написать:[НАс] — 0,01 (4а)
Вычисление pH слабой кислоты103Подставляя выражения (За) и (4а) в уравнение (1), получаем:[Н+]2 = (1,75- 10-5) (1,0- Ю"2); [Н+] = 4,18 • 10-и; pH = 3,38
Уравнения (2) и (3) дают:[ОН-] = 2,39 • 10 11; [Ас-] = 4,18 - 10~4Подстановка полученных данных в уравнение (4) — для проверки его — по¬
казывает, что оно удовлетворяется в пределах &%:[НАс] + [Ас-] = 4,18- 10-4+ 1,00- 10~2= 1,04- 10-2Другие уравнения удовлетворяются (при округлении ошибок), поскольку они
использованы для получения решений.Пример V.2. Найдите концентрации всех типов частиц в 1,00 ■ 10_3 Л4 рас¬
творе HF (Ка = 6,75 • 10-4). ^Как и ранее:[н+] [F-] = 6,75 • 10~4 [HF] (1)[Н+][ОН-]= 1,00- 10-14 (2)Запишем уравнения условий:
электронейтральности[Н+] = [F-] + [ОН-] (3)материального баланса[HF] + [F-] = 1,00-10-3 (4)Принимая те же допущения, что и в Примере V.1, получаем[Н+] = [F-] (За)[HF] = 1,00-10-3 . (4а)откуда[Н+]2 = (б,75- 10~4) (1,00 • 10~3); [Н+] = 8,2-10-4
Уравнения (2) и (3) дают:[ОН~]= 1,22- 10_п; [F-] = 8,2 • 10—4Для проверки подставим найденные значения в уравнение (4):[F"] + [HF] = 8,2- 10-4+ 1,00- 10_3= 1,82- 10-3Найденный результат почти в два раза превышает точное условие материаль¬
ного баланса, что указывает на некорректность одного из сделанных допущений.
Действительно, величина [ОН-] пренебрежимо мала по сравнению с [F-] в урав¬
нении (3), т. е. уравнение (За) верно. Второе допущение — уравнение (4а) —надо
отбросить; тогда следует допустить полную диссоциацию, т. е.[H+] = [F"]= 1,00- 10“3
что в сочетании с уравнением (1) дает:[HF] = 1,48-10-3
Подстановка в уравнение (4) для проверки[F-] + [HF] = 2,48-10-3
Приводит к ответу, более чем в два раза превышающему точный.
104V. 1. Ионизация слабой кислотыИтак, ни одно из допущений — частичная илн полная диссоциация — не дает
верного результата, т. е. необходимо решение точного уравнения (4). Отметим,
что уравнение (За) справедливо даже тогда, когда (4а) не подтверждается.
Подстановка уравнений (За) и (4) в уравнение (1) дает выражение[Н+]2 = (б,75 • 10~4) (1,00* 10-3 — [Н+] )
решение которого (см. раздел III. 6) следующее:[Н+] = 5,5* 10“4; pH = 3,26
Уравнения (2), (3) н (1) дают:[ОН“] = 1,8-10~“; [F~] = 5,5 • 10 4; [HF] = 4,48 • 10-4
Проверка уравнения (4)[F-] + [HF] =5,5. 10-4 + 4,5-10-4 = 1,00- 10-3Доказывает правильность найденного решения.Итак, делая, казалось бы, разумные допущения, мы нашлн, что нн одно из
них не удовлетворяет точное уравнение. Тогда мы решали уравнения, не привле¬
кая никаких допущений относительно условия материального баланса [уравне¬
ние (4)]; пренебрежение же величиной [ОН"] в условии электронейтральности
[уравнение (3)] является корректным допущением *.Общее уравнение для pH слабой кислотыОстановимся на некоторых деталях поведения слабой одноос¬
новной кислоты НА, аналитическая концентрация которой С (см.
раздел III. 4).Необходимо рассмотреть четыре концентрации, связанные сле¬
дующими четырьмя соотношениями (величины Ка, Кн& и С из¬
вестны) :условие кислотной диссоциации[Н+] [А-] = Ка [НА] (1)ионное произведение воды[Н+][0Н‘] = /Снг0 (2)протонное условие, получаемое или из условия электроней¬
тральности, или из выражений материальных балансов
по Н+-ионам[Н+]«[А"] + [ОН-] (3)по анионам А*[НА] + [А-] = С (4)* В концентрированных растворах HF в 'Значительных количествах образует¬
ся ион HF~; в разбавленных же растворах его концентрация пренебрежимо мала.
Из равновесного соотношения [HF~] = 3,9 [F~] [hf] можно найти (для условий
Примера V.2), что [HF*J = 9,6* 10“7. Эта величина составляет менее 0,1% от
аналитической концентрации HF. Детальнее подобные вопросы рассмотрены I
разделе X. 1.
Общее уравнение для pH слабой кислоты105Соотношение (4) показывает, что вся кислота, внесенная в рас¬
твор, либо остается неионизованной, либо служит источником ани¬
онов.Учитывая последнее, наиболее перспективным является после¬
довательное исключение неизвестных — для того, чтобы опреде¬
лить величину [Н+], используя известные значения Ка, Кн2о и С
(как это сделано в разделе III.4). Там сначала была исключена
величина [ОН-], хотя проще было обойтись без [НА]. Ради разно¬
образия в данном случае исключим [НА].Во первых, решим уравнение (4) от¬
носительно [НА] и подставим ответ в урав¬
нение (1); это дает решение для [А-]:[А1 =СКа** + [Н+]Во-вторых, решим уравнение (2) от¬
носительно [ОН~] и подставим найден¬
ные значения [ОН-] и [А-] (см. выше) в
уравнение (3):[Н+]СКа'Н20Кв+[Н+] [Н+](точное выражениб)(5)Уравнение (5) легче решается графи¬
чески (рис. V. 1), если ему придана форма:+[н*]Ка([Н+]W3_\[hi;(точное выражение)Рис. V. 1. Зависимость изме¬
нения pH фтористоводород¬
ной (кривая 1), уксусной
(кривая 2) и синильной (кри¬
вая 3) кислот от концен¬
трации.
р/са: 1 — 9,32; 2- 4,75; 3-3,17.
В достаточно разбавленных ра»
створах (правая часть рисунка)
для всех слабых кислот pH =*7,00.Отметим, что для достаточно малых концентраций (большие
значения — lgC) величина pH равна 7,00 и не зависит от С (см.
рис. V. 1) Вызвано это тем, что Н+-ионы «поставляет» не кислота,
а вода. При высоких значениях С поставщиком Н+-ионов является
кислота и pH уменьшается.Если кислота диссоциирована нацело, то кривая имеет вид, как
на рис. IV. 1 (стр. 91); но поскольку диссоциация в более концен¬
трированных растворах меньше, величина pH изменяется не столь
быстро с изменением концентрации.Синильная кислота, константа ионизации которой чрезвычайно
мала, практически перестает «поставлять» в раствор ионы водо¬
рода, когда ее концентрация становится меньше 10-5М. Для уксус¬
ной и фтористоводородной кислот, обладающих достаточно высо¬
кими значениями констант ионизации, это наступает при концеЦ*
Трациях, не превышающих 10"8Л[,
106V. 1. Ионизация слабой кислотыПриближенные уравнения для pH слабой кислотыЛинейная часть кривой на рис. V. 1 указывает и на простейшие
приближенные формулы, описывающие pH в соответствующей этой
части области концентраций. Наиболее очевидным для достаточно
низких концентраций является пренебрежение величиной [А-] по
сравнению с [ОН-] в уравнении (3); это приводит к следующему
виду уравнения (5):Уравнение (5а) означает, что при достаточно малых концентра¬
циях любой кислоты величина pH постоянна и равна 7,00.Альтернативным допущением является то, что при высоких кон¬
центрациях в уравнении (3) можно пренебречь величиной [ОН-] по
сравнению с [А-] (это использовано в Примерах V. 1 и V. 2); тогда
уравнение (5) принимает вид:Уравнение (56) в большинстве элементарных учебников полу¬
чают путем «пренебрежения диссоциацией воды». В случае синиль¬
ной кислоты полученное уравнение (56) справедливо для концен¬
трационной области от I0-4 моль!л и выше, а для уксусной и фто¬
ристоводородной— от 10-в моль/л и выше.Два следующих допущения возможны, если пренебречь либо
[А-], либо [НА] в уравнении (4). Пренебрежение величиной [А-] по
сравнению с [НА^-означает то же, что и предположение о слабой
диссоциации кислоты; это приводит уравнение (56) к видукоторый в элементарных учебниках рекомендован для вычисления
pH слабой кислоты.Уравнение (5в) справедливо: для синильной кислоты при
С> 10"4 моль/л\ для уксусной — при С > !0-3 моль/л и фтористо¬
водородной— при С > 10-2 моль! л. Видно, что для СНзСООН в
этом случае концентрационный предел почти в два раза меньше
даваемого уравнением (56).Другим альтернативным допущением является пренебрежение
величиной [НА] по сравнению с [А-], что равносильно признанию[н+]2=к.— ЛН20[H+J = у/Сн2о (приближенное уравнение)(5а)Ка (приближенное выражение)(56) ■[Н+]==}^С/Са (приближенное выражение)(5в)
Приближенные уравнения для pH слабой кислоты107полной диссоциации кислоты. Это приводит уравнение (5fe) к
виду:[Н+] = С (приближенное выражение) (5г)Уравнение (5г) не выполняется ни для каких концентрацион¬
ных областей HCN; для СН3СООН — лишь в очень узкой области
вблизи 10~6 моль/л, а для HF—в интервале 10-4—10~6 моль/л.-igcРис. V. 2. Диаграмма, показывающая различные допущения в случае диссо¬
циации слабой кислоты (на примере СН3СООН).Прямые линии характеризуют простейшие допущения, описываемые уравнениями (5а), (5в) и
(5г). Области, в которых преимущественным является одно из пяти допущений, указаны в верх¬
ней части диаграммы; ломанными линиями обозначены соответствующие им интервалы кон¬
центраций.Простейшее допущение может быть получено, если число доминирующих частиц не более
двух. Если же число частиц равно трем, получаются более сложные выражения —уравне¬
ния (56) и (5д), которые применимы в переходных областях концентраций: С=Ка иС—10“7 моаь[л.Когда Ка ** 1СГ7, значение имеют все четыре типа частиц в области концентрации ~ 10~7 моль/л-,
в этом случае необходимо пользоваться точным уравнением (5).В концентрационной области, для которой уравнение (5г) спра¬
ведливо, кислоту можно рассматривать как полностью диссоции¬
рованную. Выражение для pH в области концентраций, близких
к 10-7 моль/л, рассмотрено в разделе IV. 2; в данном случае оно
108V. 2. Графические способы описанияполучается путем пренебрежения величиной НА по сравнению с
другими концентрациями:Уравнение (5д) справедливо только для интервала концентра¬
ций 10~6—10~8 моль/л.Конечно, возможны и иные допущения вместо приведенных, од¬
нако, следует помнить о тех основных особенностях поведения
слабых кислот, которые рассмотрены выше. В наглядной форме
обо всем сказанном можно судить по рис. V. 2.1. Оцените величину концентрации. Если она мало отличается
от 10-7, превалирующими являются величины [Н+] и [ОН-], а
pH « 7.2. Если С > 10-7, оцените величину Ка-3. Если Ка < 10-7, то кислота не является диссоциирующей на¬
цело; разумное допущение состоит в том, что [НА] > [А-]. Проверь¬
те это. В случае неудачи решайте точное уравнение.4. Если Ка > 10-7, сравните Ка и С.5. Если 10~7 С С С Ка, наиболее разумным является допуще¬
ние полной диссоциации. Проверьте это. В случае неудачи решайте
точное уравнение.6. Если С > Ка, то [Н+] > [ОН-]. Наиболее разумным является
допущение слабой диссоциации кислоты; превалирующей являет¬
ся величина [НА]. Проверьте это. В случае неудачи используйте
условие (точное) материального баланса.Вернемся к Примерам V. 1 и V. 2. В обоих случаях С > 10-7 и
Ка > 10-7. В Примере V. 1 С = 10-2, а Ка « Ю-5 и наиболее разум¬
ным было допущение слабой диссоциации. В Примере V.2 С «
т Ка ж 10_3; поэтому ни допущение слабой, ни допущение полной
диссоциации не дали разумных результатов; по этой причине и
было использовано точное условие материального баланса.Прежде чем приводить следующие числовые примеры, рассмо¬
трим два типа диаграмм, описывающих равновесия в случае кис¬
лотно-основной диссоциации, тем более, что они пригодятся нам
для более сложных систем. Первый тип нашел выражение в так
называемых распределительных диаграммах, очень похожих на
кривые титрования (см. раздел V. 8) и весьма полезных при рас¬
смотрении ступенчатых равновесий. Второй тип — концентрацион¬
но-логарифмическая диаграмма — очень удобен для приближен¬
ных расчетов.(5д)Рекомендации для выбора типа допущенийV.2. ГРАФИЧЕСКИЕ СПОСОБЫ ОПИСАНИЯ
Распределительная диаграмма109Распределительная диаграммаЕсли pH раствора известно, то концентрации всех типов частиц
могут быть легко рассчитаны. В частности, концентрации слабой
кислоты и ее аниона связаны
условием материального ба¬
ланса[НА] + [А-] = С (4)и выражением для константы
равновесия:[н+] [А-] = Ка [НА] (1}Решив уравнение (1) отно¬
сительно [НА] и подставив от¬
вет в уравнение (4), находимС = [А-] +[Н+] [А~]
КаРис. V. 3. Распределительная диаграм¬
ма для уксусной кислоты (Пример V. 1).
Кривая образования делит вертикальиыелииии
на части, равные: верхняя — величине адс; ниж¬
няя—величине а__.НАсЕ1 — точка Примера V. !•Доля аналитической концентрации, приходящаяся на анион,
называется степенью диссоциации кислоты:[А-КаК* + [Н+](6)Графическое построение функции ад = /(рН) дает кривую дис¬
социации.Доля аналитической концентрации, приходящаяся на недиссо-
циированную кислоту, называется степенью образования кислоты
из ионов:[НА] _ [н+]“на :/са + [н+](7)Откладывая ода как функцию pH, получим кривую образова¬
ния (рис. V. 3)*.Отметим, что условие материального баланса может быть за¬
писано в форме:а д + ана-В Примере V. 1 найдено, что для 0,01 М СНзСООН pH = 3,38,
[Ас-] = 4,18-10-4, т. е. аде = 0,04. Отметим (см. рис. V.3), что вер¬
тикальная линия для pH = 3,38 разделена на два отрезка: аде =.
= 0,04 и анАс — 0,96.* Если рис. V. 3 перевернуть, то получится кривая диссоциации.
110V. 2. Графические способы описанияАналогично при pH = 4,40 (достигнуто либо разбавлением,
либо нейтрализацией раствора основанием, т. е. когда [Н+] =
= 4,0-10-5, имеем из уравнения (6)1,75-10"-‘Ас-■ — 0,30; а нас — 1 “ аАс 0>701,75- 10“5 + 4,0- 10-5что также отображено на рис. V. 3.Для срединной точки М при условии, что [НА] = [А-], получаем
из уравнения (1):[Н+] = Ка (выражение для срединной точки)■IgCКонцентрационно-логарифмическая диаграммаВ подобных диаграммах логарифм концентраций всех типов
частиц откладывают как функцию pH (рис. V. 4).Для величины [Н+] прямая линия с наклоном —1 получается из
определения pH: lg[H+] = —pH, для величины [ОН-] прямая ли¬
ния, но с наклоном +1 получается
из выражения для ионного произве¬
дения воды:lg [ОН-] = рН-рКН2о
Комбинация условия материаль¬
ного баланса и выражения для кис¬
лотной константы диссоциации при¬
вела к уравнениям (6) и (7); по¬
следние можно привести к виду,
выражающему [А-] и [НА] как
функции [Н+]:СКаРис. V.4. Концентрационно-лога¬
рифмическая диаграмма для1,0-10-2М СНзСООН.[А-] =[НА].*а + [Н+]
С[Н+](6)(7)£3 —точка Примера V. 3; Р — точка си
стемы.Яа + [н+]На рис. V. 4 эти две функции
представлены двумя отрезками
прямой линии, соединенными короткой кривой. Точка системы Р
характеризует состояние, когда pH = рКа и концентрация равна
С; для рассматриваемого случая ей соответствуют: pH = 4,75 и
lg С = —2. Левее этой точки [Н+] > Ка и выражения (6) и (7)
(в логарифмической форме) превращаются в' следующие:lg[Al = igC — р/Са+рН (6а)lg [НА] = lg С (7а)Графически выражения (6а) и (7а) изображаются линией с
наклоном +1 и горизонтальной линией; обе они пересекаются в
точке системы.
Вычисления при помощи концентрационно-логарифмических диаграмм 111Правее точки системы Ка > [Н+] и выражения (6) и (7) приво¬
дятся к виду:lg Г А'] = lg С (66)lg [НА] = lg С + рКа - pH (76)Графически выражения (66) и (76) изображаются горизон¬
тальной линией и линией с наклоном —1; обе они также пересе¬
каются в точке системы.Вблизи точки системы величины Ка и [Н+] имеют примерно рав¬
ные значения.Кривые lg[HA] и lg[A-] пересекаются при [НА] = [А-] = 1/2С и
pH = рКа, точка пересечения лежит на 0,30 единиц ниже точки
системы.Построение концентрационно-логарифмической
диаграммыДля построения концентрационно-логарифмической диаграммы
(см. рис. V. 4) при значениях pH = р/С0 и концентрации С через
точку системы проводят горизонтальную линию и линии с накло¬
нами + 1 и —1. Соединяют соответствующие линии отрезками кри¬
вых, но так, чтобы они пересекались в точке, лежащей на 0,30 еди¬
ниц ниже точки системы.Линии для [Н+] и [ОН-] имеют наклоны +1 и —1 и пересе¬
каются при pH = 7,00 и концентрации 10-7 (случаи использования
подобных диаграмм приведены в Примерах V. 3 и V. 4).Отметим, что всякому изменению концентрации раствора соот¬
ветствует изменение положения кривых и для [НА], и для [А-] —
они смещаются вверх или вниз относительно исходного положения.
Кривые для [Н+] и [ОН-] при этом остаются на месте [ср. рис. V. 6
и V.9 (10-4 и 10-2 М HCN)].Вычисления при помощи концентрационно-логарифмических
диаграммПример V. 3. Найдите графически pH 1,0 • 10"* М раствора СЙзСООН (см.
Пример V. 1). Диаграмма (см. рис. V. 4) содержит все те сведения, которые дают
равновесные выражения (1) и (2) и условие материального баланса (4). Если мы
привлечем еще и протонное условие[Н+] = [Ас-] + [ОН-] (3)то задача может быть решена графически.Продолжая линию для [Н+] до пересечения с линией [Ас-], получим точку Е3,
где [ОН"] < 10~8. Этой величиной можно пренебречь. Таким образом, pH раство¬
ра определяется точкой пересечения Е3, которой соответствует условие:[н+] = [Ас-] (За)
112V. 2. Графические способы описанияДругие концентрации просто считываются с графика:
pH = 3,37 (точка пересечения Е3)
lg [Н+] — — 3,37 [Н+] = 4,26 • 10—4lg [Ас-] = - 3,37 [Ас-] = 4,26-10-4lg [НАс] = - 2,00 [НАс] = 1,00 • Ю-2
lg [ОН-] < - 9 [ОН-] < 10"9Полученные данные корректны с точностью до 5%, что следует из подста¬
новки их в уравнение (4)[НАс] + [Ас-] = 1,00 • 10"2 + 4,26 • 10-4 = 1,04 • 10-2н условие равновесия:[Н+] [Ас-] (4,26 • 10-4)2[НАс]1,00- 10“= 1,82* 10"-lg СОтлнчие величин 1,04• 10~2 и 1,82-ТО-5 от действительных 1,00• 10-2 и1,75 • 10-5 проистекает преимущественно от погрешностей построения диаграммы
В считывания с нее.Пример V.4. Найдите графически pH 10~3Л1 раствора HF (см. Пример V. 2).На диаграмму (рис. V. 5) нанесены
уравнения (1), (2) н (4), а протонное усло¬
вие имеет вид:[H+] = [F-] + [OH“]Продолжая линию для [Н+] вниз, полу¬
чаем, что точка пересечения ее с линией
[F-] появляется раньше точки пересечения
с линией [ОН-]. Это означает, что пересе¬
чение кривых для [Н+] и [F-] соответствует
условию (3). Точке Et отвечают данныеpHРис. V. 5. Концентрационно-ло¬
гарифмическая диаграмма для
1,0* 10-3 Af раствора HF.Ei — точка Примера V. 4.pH = 3,25
lg [F-] = - 3,25
lg [HF] = - 3,34[Н+] — 5,6 • 10“4
[Г-] = 5,6 • 10“4
[HF] =4,5-10-4которые совпадают с результатами, полу¬
ченными расчетом, с точностью до 5%.
Величина ошибки зависит от аккуратности
нанесения на диаграмму кривого участка
линии для [F-].Пример V.5. Найдите концентрации всех типов частиц в 1,00-10'*М растворе
HCN; Ка = 4,8 • 10-10.Необходимые для решения уравнения:[Н+] [CN-] = 4,8 - 10“10 [HCN]
[Н+] [ОН-] = 1,00-10“14[н+] = [сн-] + [он-][CN-]+[HCN] = 1,00- 1Q~4(1)(2)(3)№
Вопросы113Графическое решение (рис. V. 6) в данном случае будет не столь точным как,
для Примеров V. 3 и V. 4. Продолжая линию для [Н+] до пересечении с линией
дли [CN“], получим точку Еъ, которой со¬ответствуют:pH = 6,95
lg [CN~] = - 6,95
lg [HCN] = - 4,00
lg [ОН ] = - 7,35-lg С[H+] = 2,24 • Ю-7
[CN“] == 2,24* 10-7
[HCN] = 1,00- 10-4
[OH-] = 4,46- Ю-8Сравним графические данные с рас¬
четными. Пренебрегая [CN~] « 10-' по
сравнению с [HCN] = 10-4 в уравнении
(4) и используя уравнение (1), получим:[Н+] [CN-] = 4,8 • 10-14 (la)Определяя [CN-] из уравнения (1а),
а [ОН-] из уравнений (2) и (3), имеем:Гтт+1 4,8-10“14 , 1,00-10“14
1Н1 [H.j ■Рис. V. 6. Концентрацнонно-логариф¬мическая диаграмма для 1,0* 10‘
раствора HCN.£5 — точка Примера V.S.1-3М[Н+][Н+]2 = 5,8-10“14; [Н+] = 2,4" 10""Привлекая уравнения (1а), (2) и (4), получаем:[CN“] = 2,0 • 10-7; [ОН-] = 4,2* 10-8; [HCN] = 1,00* 10-4Подстановка этих данных в исходные уравнения показывает,
что все они удовлетворяются. В рассмотренном случае допущение
слабой диссоциации кислоты справедливо, а пренебрежение [ОН-]
неверно.Некоторое расхождение расчетных данных с графическими обу¬
словлено тем, что в уравнении (3) величина [ОН-] не пренебре¬
жимо мала по сравнению с [CN-]. Тем не менее, ошибка в опреде¬
лении [Н+] составляет ~10%; для многих задач это вполне допу¬
стимо.Наибольшая возможная в графическом методе ошибка появ¬
ляется в тех случаях, когда допущения в протонных условиях при¬
водят к совмещению линий для [А-] и [ОН-]. При этом величина
[Н+] в два раза меньше получаемой из точки пересечения; pH, на¬
ходимое графически, также на 0,30 единиц меньше. Когда линия
[ОН-] пересекается первой (как в случае 10-6 М HCN), то величина
pH всегда равняется 7,00. Если линии для [А-] и [ОН-] расположены
очень близко, графическое решение может дать полезные сведения
относительно значений концентраций, но точное решение получается
только расчетом.ВопросыДля следующих растворов найдите концентрации всех типов частиц и pH.
Подстановкой в точные уравнения проверьте корректность принятых допущений.
Попытайтесь использовать концентрационно-логарифмические диаграммы для
приближенных ответов: проверьте последние подстановкой в точные уравн?}1йЯ-
114V. 3. Ионизация слабого основания1. 5,3- 10-3Л1 раствор НАс; Ка — 1,75- ЮЛ2. 0,4 М раствор НАс.3. 0,1 М раствор HCN; Ка = 4,8-10-*°.4. 1,0 • Ю-о М раствор HF; Ка = 6,75 • 10-*.5. 1,0 • 10"® М раствор НАс.6. 1,0 • 10-в М раствор НОС1; Ка = 2,95 • 10'8.7. Высокая полярность молекулы HF делает ее степень ионизации весьма
чувствительной к присутствию других ионов в растворе. Так, константа иониза¬
ции HF при 25 °С в 0,5 М растворе NaClOi равна 1,23-10~3. Рассчитайте pH1,0 -10_3 Л1 раствора HF в 0,5 М растворе NaClOi; сравните полученный резуль¬
тат с найденным в Примере V. 2.8. Хотя НС1 и диссоциирована нацело в водных растворах, она почти пол¬
ностью ассоциирована в растворах чистой ледяной уксусной кислоты. Вызвано
это низкой диэлектрической проницаемостью последней и ее высокой кислот¬
ностью. Диссоциация с участием растворителя может быть представлена следую¬
щим уравнением:НС1 + НАс ^ Н2Ас+ + С1~Константа равновесия равиа 2,8 • 10-".Для процессаНАс + НАс ^ Н2Ас+ + Ас"иоиное произведение равно 3,6-10-15. Рассчитайте концентрации НС1, НгАс+ и
С1~ для 1,0-10~4 jW раствора НС1 в ледяной уксусной кислоте. Активность рас¬
творителя примите равной единице. <9. При 15 °С константа ионизации HF равна 7,9-10-*, а Яцго = 4,51 • 10“15.
Рассчитайте концентрации всех типов частиц и pH 2,0 • 10"* М раствора HF в
воде при этой температуре.10. Степень диссоциации оса водных растворов муравьиной кислоты НСООН
определена кондуктометрически Ауэрбахом и Цеглиным *. Рассчитайте концентра¬
ции всех частиц и константу диссоциации НСООН при условии, что ал =
= 0,348 для концентрации 1,028 • 10~3 моль/л. Постройте распределительную и
концентрационно-логарифмическую диаграммы (см. рис. V. 3 и V. 5).11. Выведите соотношение <ха = [А~]/С сначала через величину С, потом Ка
для водного раствора одноосновной кислоты, аналитическая концентрация кото¬
рой С, а pH < 6,00.12. Серная кислота диссоциирует нацело на Н+ и HSO^, если концентрация
ее в растворе меньше 1 моль/л; HSO” диссоциирует далее на Н+ и SO*- =
= 1,02 • 10“2). Рассчитайте pH растворов H2SO4 как функцию концентрации для
интервала 10~‘—10*® моль/л. Постройте зависимость типа рис. V. I. Учтите, что
уравнение (5) неприменимо к этой системе. Почему?V.3. ИОНИЗАЦИЯ СЛАБОГО ОСНОВАНИЯК растворимым слабым основаниям, присоединяющим только
один протон, применимы все математические выкладки, использо¬
ванные для описания поведения слабых одноосновных кислот.Так, аммиак при растворении в воде отнимает протон от моле¬
кулы воды, а сам превращается в NH^-hoh:NH3 + H20 ^ NH++OH"* ДцегЬзсЬ, Zeglin, Z. phys. Chem., 103, 191 (1923),
V. 3. Ионизация слабого основания115В некоторых книгах аммиак в водном растворе записывали в
виде NH4OH вместо NH3, стремясь подчеркнуть этим, что при дис¬
социации возникает ион NHt- В последние годы наблюдается
стремление к отказу от такой формы записи, но и сейчас многие
детали этого вопроса неясны.Наиболее интересные результаты для выяснения этого вопроса
дает определение скорости изотопного обмена в NHj-ионе, реги¬
стрируемой ЯМР-спектроскопией. На сегодняшний день наиболее
доказанным является тот факт, что такие молекулы, как NH4OH,
отсутствуют; в растворе скорее присутствуют гидратированные
по крайней мере тремя молекулами воды следующие частицы:н н н! I IН—0---Н—0--VЭнергия водородных связей (обозначены точками) составляет
-—- 4/го от энергии нормальной ковалентной связи. Действительно,
в «истинной» молекуле NH4OH аммиак был бы связан с единст¬
венной молекулой воды нормальной ковалентной связью, но этому
нет доказательств (см. выше).Присоединение иона водорода (от молекулы кислоты или дру¬
гой молекулы воды) в любое из положений, отмеченных звездоч¬
кой, влечет за собой сокращение расстояния (вдоль водородной
связи) между атомом азота и ближайшим к нему протоном. Ре¬
зультатом этого является возникновение иона аммония. Так, если
протон присоединяется в положение то возникает структура:н н н
I* I АН—N—Н- • -О—Н ■ • О—НI :Н НI „Не вдаваясь в характер ионизации аммиака, в дальнейшем его
водные растворы мы будем обозначать формулой NH3, не забывая,
однако, что несколько молекул воды нежестко соединены с моле¬
кулой NH3 и могут принимать участие в ионизационных процессах.Все сказанное выше можно отнести и к органическим аминам.
Например, пиридин показывает в воде слабоосновную реакцию;
116V. 3. Ионизация слабого основания .его ионизацию можно представить следующим образом:N + H20^~^NH+ + OH~Некоторые производные аммиака, обладающие свойствами сла¬
бых оснований, приведены в табл. V. 2.Т а б л и ц a V.2
Некоторые слабые одноосновные основанияНазваниеФормула**•P*6ДиметиламинNH(CH3)21,18 • 10“*2,93Метиламинnh2ch35,25-10“*3,28Этиламииnh2ch2ch34,7-10"43,33ТриметиламииN(CH3)38.Ы014,09АммиакNH3
HN CH1,78- 10 54,75Иыидазол1 IIHC^ /СН
N8,1 • I0-87,09ПиридииО»1,5-10"*8,82Анилинnh24,2-10“10938* Величина экстраполирована к нулевой ионной силе.Гидроокиси металлов либо диссоциированы нацело, либо обра¬
зуют комплексы с различным числом гидроксильных групп (см.
главы VIII и X).Ионизация слабого основания в общем виде может быть запи-,
сана в следующей форме:в + н20 ВН+ + ОН-; [BH+][OH-] = KfttB] (I)В уравнение (1) не включен растворитель — вода, поскольку ее
активность примерно равна, единице. Ионное произведение воды[Н+] [ОН-] = /Сн2ои условия электронейтральности[Н+] + [вн+] = [ОН-]материального баланса[ВН+] + [В] = С(2)(3)(4)
Аналогия между слабыми кислотами и основаниями117те соотношения, которые необходимы для установления связи
между четырьмя концентрациями — [В], [ВН+], [Н+] и [ОН-] и изве¬
стными значениями аналитической концентрации С и константой
ионизации Къ-Пример V. 6. Найдите концентрации всех типов частиц в 0,01 М растворе
аммиака; Кь = 1,78 • 10~5.Имеем четыре уравнения;[NH+] [ОН-] = 1,78 • 10-5 (1)[н+] [ОН-] = 1,00-10~14 (2)[H+] + [NH+] = [OHi (3)[NHJ] + [NH3] = 0,01 (4)Поскольку раствор является основным, величиной [Н+] по сравнению с [ОН']
в уравнении (3) можно пренебречь:[NHj] = [ОН-] (За)Возможным допущением для уравнения (4) является пренебрежение вели¬
чиной [NH*]:[NH3] = 0,01 (4а)Подставлия выражения (За) и (4а) в уравнение (1), получаем:[ОН-]г= (1,78- 10 5) (1,0 - 10—2)[ОН-] = 4,22 • 10—4
С учетом уравнений (2) и (3) находим:[Н+] = 2,37 ♦ 10_п; [NH+] = 4,22 • ИГ4Аналогия между слабыми кислотами и основаниямиПример V. 6 формально тот же, что и Пример V. /; различие
между ними лишь в том, что [НАс], [Ас-], [Н+] и [ОН-] заменены на
{NH3], [NHI], [ОН-] и [Н+].Это формальное сходство еще более наглядно, если сравнить
уравнения, управляющие равновесием:Слабая кислота Слабое основание[Н+] [А~] = Ка [НА] [ОН-] [ВН+] = Кь [В][н+][онГ=кНао [он-] [Н+] = Кн20[Н+] = [ОН-] + [А-] [ОН-] = [Н+] + [ВН+][НА] + [А-] = С [В] + [ВН+] = СПоскольку уравнения имеют одинаковый вид, решения их
имеют подобную форму. Точное решение в случае слабого
118V. 3. Ионизация слабого основанияоснования аналогично уравнению (5) раздела V. 1; это же отно¬
сится и к сделанным там допущениям.Распределительная диаграмма для аммиака приведена на
рис. V. 7. Так как Кь для NH3 то же, что и Ка для СН3СООН,
рис. V. 7 подобен рис. V. 3. Разница между ними лишь в том, что
pH заменено на рОН, НАс — на NH3, Ас- на NH4. Сказанное отно¬
сительно рис. V.7 и V. 3 справедливо и для рис. V. 8 и V. 4.Точка системы Р (рис. V. 8) соответствует условию рОН = р/С*,
т. е.pH = р/Сн2о — р Кьи для аммонияpH = 14,00 - 4,75 = 9,25При концентрации 10~2 моль/л точка системы Р расположена
так, что для [NHJ] кривая горизонтальна влево от нее и имеетрОНXZ3Рис. V. 7. Распределительная диаграмма Рис. V.8. Концентрационно-для аммиака.логарифмическая диаграмма
для 1,0*10"2М раствора ам¬
миака.£7 —точка Примера V. 7; Р —точка
системы.наклон —1 вправо от нее. Кривая для [NH3] имеет наклон +1
влево от точки Р и горизонтальна вправо от нее. Кривые для [Н+]
и ОН" расположены так же, как и ранее.Пример V. 7. Найдите графически pH 0,01 М раствора аммиака.Для решения можно использовать рис. V. 8, так как иа нем представлены
уравнения (1), (2) и (4). Уравнение (3) фиксирует точку, являющуюся решением
задачи:[OH"] = [NH4+] + [H+](3)Продолженная вниз линия для [ОН-] встретит линию для [NH^] значительно
раньше, чем для [Н+]. Точка пересечения линий [ОН'] h[nH*] и есть искомый
V. 4. Общее между кислотами и основаниями119ответ. Для этой точки:pH =10,62 [Н+] = 2,4-10"“lg [NHj] == - 3,38 [NH+] = 4,2 • 10-4lg [OH-] = - 3,38 [OH“] = 4,2 • 10-4lg [NH3] = - 2,00 [NH3] == 1,0 • 10—2Итак, величины, полученные графически, совпадают с рассчитанными в При¬
мере V. 6.ВопросыРассчитайте pH следующих растворов, используя, если это необходимо, кон¬
центрационно-логарифмическую диаграмму. Проверьте решения подстановкой в
исходные уравнения.13. 4,0 • 10~2 М раствор N(CH3)3; Кь — 8,1 * 10-5.14. 1,0 -10 3 М раствор пиридниа; Кь — 1,5 • 10“4.15. 1,0-Ю-3 М раствор NH(CH3)2; Кь = 1,18• Ю-3.16. 1,0-Ю-6 М раствор NH3; Кь = 1,78• 10-6.17. Решите точно четыре уравнения, управляющие ионизацией слабого осно¬
вания, чтобы найти уравнение, аналогичное уравнению (5) раздела V. 1. Построй¬
те для него диаграмму, подобную рис. V. 1, используя данные для NH2C2H5
(рКь = 3,33).18. Выведите пять приближенных уравнений для pH слабого основания как
функции аналитической концентрации, подобные уравнениям (5а) — (5д) разде¬
ла V. 1. В каком концентрационном интервале каждая из формул применима к
растворам NH2C2H5 (р/Сь = 3,33)?V.4. ОБЩЕЕ МЕЖДУ КИСЛОТАМИ И ОСНОВАНИЯМИВодный раствор соли сильного основания и слабой кислоты,
например NaCN, имеет основную реакцию. Это свойство связано
с явлением, называемым гидролизом *; однако равновесие в дан¬
ном случае носит тот же характер, что и для диссоциации слабой
кислоты.При растворении соли в воде анион «экстрагирует» протон из
воды; это приводит к образованию слабой кислоты и ОН"-иона;А- + Н20 НА + ОН"Анион ведет себя, как аммиак или пиридин, оттягивающие про¬
тон от воды. Другими словами, А- — слабое основание, отличаю¬
щееся от обычных слабых оснований только зарядом. Это обстоя¬
тельство приводит к определению кислот и оснований по Брён-
стеду — Лоури: кислота является донором протона, а основание —
акцептором. Отщепление протона от кислоты дает сопряженное ей
основание. Так, анион А" — основание, сопряженное со слабой* Термин гидролиз, означающий «расщепление водой», использован, чтоОы
подчеркнуть основные свойства подобных солей.
120V. 4. Общее между кислотами и основаниямикислотой НА; вода — с кислотой НзО+; ОН- — с кислотой НгО;
NH3 — с кислотой NHJ.При ионизации слабой кислоты протон переходит от нее к осно-ванию—воде: НА —> Н20. При ионизации воды одна из моле¬
кул ее ведет себя ка J кислота (является донором протона), а вто-н+ ^рая — как основание (акцептирует протон): Н20 —► Н30 . Веще¬
ства, проявляющие как кислотные, так и основные свойства, яв¬
ляются амфипротонными или амфолитами.Константы ионизации сопряженных кислот и основанийКонстанта основной ионизации (константа гидролиза) веще¬
ства А" связана простым соотношением с константой кислотной
ионизации вещества НА. Так как соответствующие константы
имеют вид„а- [НА] [ОН"} .. irHA [Н+] [А-]** [ХТ“ ' *“ —iifirТОА" [НА] г„+1гон1 ^HjO6 wmT[Hl[OH1=^fАналогичным образом для гидролиза соли слабого основания
и сильной кислоты, т. е. для ионизации слабой кислотывн+ + н2о в + н3о+можно получить:,ВН+_ *НгО** —£Г-Окончательно для кислоты и сопряженного с ней основания
имеем:*Л = *н2оКонцентрационно-логарифмическую диаграмму для аммиака
(см. рис. V. 8) можно использовать и для слабой кислоты NHJ*
чья кислотная константа ионизации имеет следующее значение:рД’о = 14,00 — 4,75 = 9,25Точка системы, таким образом, всегда может быть располо¬
жена, при pH = р/Са для кислотной формы рассматриваемой KHQ-
дртно-однрвной системы,
Вычисление pH растворов солей121Неводные растворыОпределение кислот и оснований, данные Брёнстедом — Лоури,
может быть распространено и на неводные растворители, содер¬
жащие водород. Так, в жидком аммиаке, ионизация растворителя
происходит в результате, перехода протона от одной молекулы NH3
к другой:NH3 + NH3 NH+ + NH;Сильным основанием в этом растворителе будет то, которое
нацело диссоциирует и дает NHJ-ионы, например, амид натрия.
Хлорид аммония — сильная кислота, а ацетат аммония — слабая,
подобная уксусной кислоте в водных растворах. Ацетат натрия —
слабое основание, так как при взаимодействии ацетат-иона с рас¬
творителемAc"+NH3 HAc+.NHJполучается амид-ион.Для неводных растворителей, не содержащих водород, приме¬
нимо определение, предложенное Льюисом. Льюисовской кислотой
является вещество, которое может принять электронную пару от
льюисовского основания, образуя ковалентную связь:BF3 + NH3 BF3-NH3Определение Льюиса незначительно отличается от определения
Брёнстеда — Лоури в случае обычных систем. Например, при об¬
разовании NHt-иона протон является льюисовской кислотой, при¬
нимающей неподеленную электронную пару от аммиака.Вычисление pH растворов солейПример У. 8. Рассчитайте концентрации всех типов частиц в 0,01 Af растворе
NaCN; для HCN Ка = 4,8 • Ю*10. -Существуют пять концентраций и пять уравнений, связывающих их:условия равновесий[Н+] [CN“] = 4,8 - (1)[н+] [ОН-] = 1,00 • 10-14 (2)условия электроиейтральности и материального баланса[Н+] + [Na+] = [ОН-] + [CN-] (3)[CN~] + [HCN] =* 0,01 (4)[Na+] = 0,01 (5)В случае гидролиза протоииое условие ие является уже условием электро¬
нейтральности. В рассматриваемом примере уравнение протонного условия может
быть получено суммированием уравнений (3) н (4); тогда с учетом уравнения (5)
получим:[Н+] + IHCN] — [ОН-] (6)
122V. 4. Общее между кислотами и основаниямиПоскольку раствор является основным, величина [Н+] пренебрежимо
мала, т. е.[HCN] = [ОН-] (6а)Дальнейшее допущение заключается в пренебрежении величиной [HCN] по
сравнению с [CN~] в уравнении (4):[CN“] = 0,01(4а)Полученные равенства наиболее просто могут быть использованы в выраже¬
нии для константы ионизации по CN'-иоиам; для этого разделим уравнение (2)
иа уравнение (1):jpCN-"■ь[ОН-] [HCN] 1,00-10“[CJT]4,8- 10“= 2,08-10'(7)Подстановка уравнений (4а) и (6а) в уравнение (7) дает:[ОН-]г = (2,08 • 10“5) (1,0 • 10-г) = 2,08 • Ю-7
[ОН-] =4,56-10-4
С учетом уравнений (2), (6) н (4) получаем:
[Н+] = 2,2 • 10-п; [HCN] = 4,56 • 10-4;
[CN-]= 1,0-Ю-*Найденные результаты удовлетворяют исход¬
ные точные уравнения с точностью до 5%.Приведенный пример подобен Примеру V.6,
в котором рассмотрен аммнак. Это обнаруживает¬
ся при сравнении результатов. Уравнение (7) яв¬
ляется выражением для Кь (константы основно¬
сти ионов CN-), а уравнение (6) — протонным
условием, как условие электронейтральности было
протонным условием в Примере V. 6.Графическое решение для 0,01 М раствора
HCN может быть проведено по концентрацнонио-
логарифмической диаграмме (рис. V. 9); уравне¬
ния (1), (2) н (4) одинаковы и для растворов HCN, н для растворов NaCN, по¬
этому они объединяются на диаграмме. Условие пересечения есть протонное
условие (6).Продолжая линию для [ОН~] вниз, мы дойдем до пересечения ее с линией
для [HCN] раньше, чем с линией для [Н+], так как [Н+] < [HCN]. Таким образом,
в точке пересечения А[ОН-] = [HCN]что дает:логарифмическая диаграм¬
ма для 1,0-10—2 Л1 раство-
рои HCN и NaCN.Be-точка Примера V, 8; Р—точ¬
ка системы.pH = 10,66
lg [HCN] = - 3,34
lg [ОН-] = - 3,34
lg [CN-] = - 2,00[H+] = 2,2 • 10—11
[HCN] = 4,6-10-4
[OH-] = 4,6-10-4
[CN-]*= 1,0 • 10-aЭтн результаты те же, что н полученные расчетом.
V.5. Смесь сильной и слабой кислот123ВопросыНайдите pH следующих растворов, используя при необходимости коицеитра-
циоино-логарифмическую диаграмму.Проверьте правильность найденных результатов подстановкой в точные урав¬
нении.19. 0,25 М раствор NaCN; для HCN Ка = 4,8- 10-10.20. 5,0 • 10-2 до раствор NaF; дли HF Ка — 6,75 • Ю'4.21. 1,0- 10_3Л1 раствор NaAc; для НАс Ка — 1,75- 10-5.22. 4,0- 10-8 М раствор NH4C1; для NH3/C*= 1,78 • 10“5.23. 1,0-10-1 М раствор NaHS04; для HSO; Ка = 1,02• 10-2.24. 1,0 • 10—1 М раствор Na2S04.25. Для какой области значений Ка и аналитической концентрации С раство¬
ров NaA справедливо следующее соотношение дли pH:(С [Н+] — Ян2о) [Н+] = КаКц20V.5. СМЕСЬ СИЛЬНОЙ И, СЛАБОЙ КИСЛОТДобавление сильной кислоты к слабой влечет за собой увели¬
чение [Н+], но не на столько, сколько получается при суммирова¬
нии аналитической концентрации сильной кислоты и концентрации
Н+-ионов, уже существовавшей в растворе слабой кислоты.Добавленный ион водорода сильной кислоты сдвигает равно¬
весиеНА Н+ + А"влево; в результате степень диссоциации слабой кислоты умень¬
шается.Если концентрация добавляемой сильной кислоты мала по
сравнению с концентрацией слабой кислоты (см. Пример V. 9), то
изменение pH не очень велико. В противном случае pH зависит от
концентрации сильной кислоты. Степень диссоциации слабой кис¬
лоты при этом мало зависит от изменения ее концентрации. Подоб¬
ная ситуация возникает, когда индикатор (слабая кислота) при¬
меняют при титровании сильной кислоты сильным основанием (см.
Пример V. 10).Присутствие сильной кислоты может быть учтено модифициро¬
ванным условием электронейтральности. Например, если НС1 до¬
бавлена к НА, уравнения (1), (2) и (4) раздела V. 1 не изменяют¬
ся, а уравнение (3) переходит в следующую форму:[н+] = [А“] + [ОН-] + [сГ]В данном случае необходимо использовать условие материаль¬
ного баланса по хлору[сг] = Счтобы учесть аналитическую концентрацию сильной кислоты.Сказанное выше может быть отнесено и к смеси сильного осно¬
вания и слабой кислоты.
124V. 5. Смесь сильной и слабой кислотПример V. 9. Найдите концентрации всех типов частиц в смеси растворов1,0 • 10-* М СНзСООН и 1,0 • 10-* М НС1.По сравнению с Примером V. 1 (стр. 102) присутствие сильной кислоты из*
меняет условия электронейтральности и материального балавса — появляется
новая частица С1_. Таким образом, имеется система из пяти уравнений с пятью
веизвестными:условия равновесий-[Н+] [Ас-] — 1,75-10“8 [НАс] (1)[Н*1 [ОН-] = 1,00 • 10"14 (2)условие электронейтральности[Н*] =» [Ас-] + [ОН-] + [СГ] (3)условия материального баланса[НАс] + [Ас-] = 1,00 •10“* ^ (4)[СГ]= 1,00- (5)Пренебрегая величиной [ОН-] в уравнении (3) и подставляя в последнее
уравнение (5) — для исключения [С1_], получаем[Н+] = [Ac-] -f-1,0* 10—4 (За)Полагая в уравиеиии (4) [НАс] 3> [Ас-], имеем:[НАс] = 1,00 «Ю-2 (4а)Подстановкой в уравнение (1) величии [Ас-] и [НАс] из уравнений (За) и
(4а) находим[Н+]([Н*] - 1,0* 10“4) — 1,75* 10“7[Н+] = 4,71 • 10“4Тогда из уравнений (2) и (3) получаем:[ОН-] = 2,12-10 [Ас-] = 3,71 • 10-4Проверка подстановкой в уравнения (3) в (4) показывает, что они удовлет¬
воряются в пределах 5%.Сравним найденные результаты с данными Примера V. 1:10-*М раствор НАс10 2 М раствор НАс+10 4 М
раствор НС1[н*].. . 4,18* 10“4А.О1*[он-].. . 2,39-1 о-112,12* игп'[Ас-].. . 4,18-10—4тО£СО[НАс] .. . 1,00*10“*1,00-10“2Добавление очень малых количеств НС1 повышает кислотность, но не адди¬
тивно. Увеличение [Н+] подавляет ионизацию НАс и величина [Ас-] уменьшается.При добавлении соляиой кислоты коицентрациоино-логарифмическая диа¬
грамма (см. рис. V. 4) становится сложнее для графического расчета. Условие
(За) ие может быть представлено как точка пересечения двух линий, поскольку
либо следует пренебречь одним из слагаемых, либо построить иовую линию:[н+] — 1,0.10“4
V. 6. Индикаторы как слабые кислоты125Эта линия не является прямой и ее построение требует значения нескольйих
точек.Если в уравнении (3) доминирующей является величина [Ас'], то ситуация
та же, что и в Примере V. 1; если же доминирует [С1'], pH определяется кон¬
центрацией НС1 (как в растворе сильной кислоты), а присутствие слабой кислоты
в этом случае ие оказывает влияния на pH.ВопросыНайдите концентрации всех типов частиц в следующих смесях. Проверьте
полученные ответы подстановкой в соответствующие исходные уравнения.
Сравните с концентрациями в растворах, содержащих только слабые кислоту
или основаняе.26. 1,0-10~2 моль HF +1,0-10~4 моль НС1 (в 1 л Н20); для HF Ка =
= 6,75 • 10-*.27. 1,0• 10-4 моль НАс + 1,0-Ю-2 моль НС1 (в 1 л Н20); дли НАс Ка —
= 1,75 • 10'5.28. 2,5-10-7 моль NH3 + 2,5 ■ 10~7 моль NaOH (в 1 л Н20); для NHj Кь =
= 1,78-10'5.29. С. Аррениус [Z. phys. Chem., 2, 284 (1888)] сформулировал следующее
правило относительно язокислотных растворов: если смешивают два раствора
с равными значениями pH, то pH смесей не изменяется н не зависит от состава
растворов за исключением тех случаев, когда образуются многоядерные комп¬
лексные соединения (см. разделы X. 1 и X. 3). Докажите это правило для смеси
сильной и слабой кислот.V.6. ИНДИКАТОРЫ КАК СЛАБЫЕ КИСЛОТЫВ разделе IV. 4 индикаторы определены как вещества, растворы
которых изменяют окраску в некоторой области значений pH. Рас¬
смотрим причину этого явления: ионизацию самого индикатора.Индикатор — это слабые кислота или основание, у которых
окраски кислотной и основной форм различны (см. стр. 97). На¬
пример, товарная форма метилового оранжевого является натрие¬
вой солью:п/СН3
■\-/~"\:Нз(обозначим кратко Naln). Основная форма этого индикатора —
In-, кислотная — Н1п:О СНз"О—S——N=N——N—Н+IО СИ,Процесс ионизации кратко может быть записан следующим об¬
разом:Н1п Н+ + 1п"(красная) (оранжевая)[Н+] [in-] =» 1,6 • 10“4 [HIn]
126V. 6. Индикаторы как слабые кислотыОбласть изменения окраски лежит в интервале pH от 3,2 до 4,5,
т. е. в интервале [Н+] от 6,3-10~4 до 3,2-10-3; для этого промежутка:[in ] _ 1,6-Ю 4 ^0>25 + 5 0[HInJ [Н+]Химическая природа индикаторов может быть различной. Рас¬
смотрим фенолфталеин, который в нормальной (кислотной) форме
бесцветен:/""Ч—ОН
/ ^(Н21п)|\0_онПотеря двух протонов приводит к красной форме, существую¬
щей в основных растворах:Г\-0cw=\ <’"'1Мс хО-°-о оЭти два протона теряются почти с одинаковой легкостью, так
что промежуточная форма Н1п_ присутствует только в очень ма¬
лой концентрации:Н21п Н+ + НГп" ^=± 2Н+ + In2-(бесцветная) ^ (окраска (красная)' практически
отсутствует)Область изменения окраски лежит в интервале pH от 8,4 до
10,0. В достаточно концентрированной щелочи к красной форме
присоединяется ОН-группа; в результате возникает другая бес¬
цветная форма:ОН/“Л.—г. , k (ГпОН3-)В случае фенолфталеина вторую бесцветную форму не исполь¬
зуют. Однако для некоторых других индикаторов подобного типа
V. б. Индикаторы как слабые кислоты127наличие трех стабильных форм различной окраски позволяет при¬
менять их в двух областях — в кислой и основной.Поскольку индикаторы сами являются кислотами или основа¬
ниями, их присутствие влияет на кислотность того раствора, в ко¬
торый они введены. Если содержание индикатора по отношению
к главному компоненту раствора слишком велико, то pH может
измениться существенно. Однако не это является основным источ¬
ником ошибки при кислотно-основных титрованиях. В ПримереV. 10, хотя концентрация индикатора и составляет 10% от концен¬
трации сильного основания, присутствие индикатора не оказывает
ощутимого влияния на pH раствора.Пример V. 10. Раствор 10-4 М NaOH становится 10~5 М раствором натриевой
соли метилового оранжевого; Ка = 1,6-10~4. Рассчитайте pH конечного раствора
(см. Пример V. 9).Запишем условия:равновесий[Н+] [in'] = 1,6 • 10“4 [HIn] (1)[Н+][01Г]=1,0.1(Ги (2)электронейтральиости[H+] + [Na+] = [OH~]+[ln-] (3)материального баланса[HIn] -f- [In-] = 1.0-10—5 (4)[Na+] = 1,0-10—4+ 1,0* 10—5 = 1,1 • 10“4 (5)Протоииое условие может быть получено, если из суммы уравнений (3) и(4) вычесть уравнение (5):[Н+] + [HIn] Н- 1,0 -10“4 = [ОН‘] (6)Основная константа ионизации Кь находится делением уравнения (2) на
уравнение (1) (при этом величина [Н+] исключается);[Н1п] [ОН-] = 6,3 • 10_u [In] (7)Так как раствор является основным, то пренебрегаем в уравнении (6) вели¬
чиной [Н+] по сравнению с другими слагаемыми[HIn] = [ОН"] — 1,0 • 10“4 (6а)а в уравнении (4) величиной [HIn] по сравнению с [in-]![In']=l,0*10~5 (4а)Аналогично можио пренебречь [HIn] в уравнении (6а):• [ОН‘]= 1,0-10-4, т. е. pH =10,0 (66)Итак, pH=10,0; эта величина соответствует чистому 10М раствору NaOH.
Отметим, что уравнение (7) дает[HIn] =6,3- 10-1а
V. 6. Индикаторы как слабые кислотыт. е. величина [Н1п] пренебрежимо мала по сравнению с [In-], как и было при¬
нято нами. Подстановка результатов в исходные уравнения показывает их удов¬
летворительность с точностью до 5%.Другой тип ошибки возникает, когда основной индикатор, до¬
бавленный к сильной кислоте, нейтрализует некоторое ее количе¬
ство. Заметная ошибка появляется в том случае, если концентра¬
ции индикатора и кислоты одного порядка.Ошибку, однако, .можно полностью избежать (даже в разбав¬
ленных растворах), если вводить индикатор непосредственно перед
pH конечной точки. Добиваются этого тем, что кислоту или осно¬
вание добавляют в-титруемую среду до введения в нее индикатора.
Тогда, хотя pH первоначально и изменяется под влиянием инди¬
катора, пропадающие ионы водорода будут восполняться в про¬
цессе титрования за счет диссоциации индикатора. 'Когда индикатор добавлен к раствору слабых основания или
кислоты, ситуация усложняется из-за возникновения в системе но¬
вых равновесий (см. раздел VII. 4). Но и в этом случае, если ин¬
дикатор введен до pH конечной точки, ошибки, вызванной его ней¬
трализацией, не возникает.Спектрофотометрическое измерение pHИзменение окраски индикатора может быть использовано для
Определения pH спектрофотометрическим методом, приближаю¬
щимся по точности к потенциометрическим методам (при условии
применения современных типов спектрофотометров).Для большинства индикаторов положение максимумов погло¬
щения основной и кислотной форм в шкале длин волн существенно
различно. Определяя спектр поглощения индикатора при различ¬
ных концентрациях в растворе сильной кислоты, можно найти за¬
висимость интенсивности поглощения от концентрации кислоты.
Подобную же зависимость устанавливают и для основания. Тогда,
если определены спектры для нескольких растворов с известными
значениями pH, рассчитывают величину рКа- Спектрофотометри-
руя содержащий индикатор раствор с неизвестным pH, находят
концентрации кислоты и основания по определенным выше спект¬
рам и спектрам поглощения стандартных растворов; величины pH
рассчитывают затем с привлечением константы ионизации (опре¬
деление коэффициентов активности см. главу XII).t Вопросы30. Сравните pH чистого раствора 1,0 -10-3 М НС1 и раствора с той же кон¬
центрацией кислоты, но содержащей 10~5 М, получившейся в» результате добав¬
ления натриевой соли метилового оранжевого; лв = 1,6-10~4. Каково отноше¬
ние оранжевой формы In- к красной Н1п-?31. Структуры бромтимоловога голубого и фенолфталеина подобны. Каждый
нз трех следующих растворов является 1,0 • 10"“ М по индикатору: а. чистая
вода; б. Ю 4 М НС1; в. 10'4 М NaOH,
V. 7. Буферные растворы129Рассчитайте конечные значения pH растворов н отношение желтой формы
H2I11 к голубой In2-. Учтите, что чистый индикатор имеет форму Н21п, а концен¬
трация промежуточной формы Н1п~ пренебрежимо мала. Найдите затем кон¬
станту равновесия прл условии, что концентрации желтой и голубой форм равны
прн pH = 6,8.32. Метиловый оранжевый использован при титровании 10~2 М раствора НС1
10~s М раствором NaOH. «Плохой» конечной точке соответствовало равенство
концентраций красной и оранжевой форм. Если индикатор введен в кислотной
форме, то какую концентрацию следует применять, чтобы ошибка, проистекаю¬
щая за счет нейтрализации индикатора, была полностью «погашена» ошибкой,
связанной с выбором «плохой» конечной точки.V.7. БУФЕРНЫЕ РАСТВОРЫВо многих химических операциях, особенно биохимических, же¬
лательно поддерживать pH раствора относительно постоянным на
протяжении реакции, в которой ионы водорода поглощаются или
выделяются. Этого достигают тем, что реакцию проводят в буфер¬
ном растворе — довольно концентрированном растворе слабой кис¬
лоты и сопряженного ей основания, участие которых в реакции
сводится лишь к выделению или поглощению иона водорода. Если
результатом реакции является образование Н+-ионов, то они реа¬
гируют с основанием, увеличивая тем самым количество сопряжен¬
ной кислоты; если же ионы водорода поглощаются в течение реак¬
ции, то количество их восполняется за счет диссоциации слабой
кислоты. Результирующий эффект препятствует изменению pH.Пример V. 11. Рассчитайте pH буферного раствора, состоящего нз 0,01 М
раствора СНзСООН и 0,01 М раствора CHjCOONa; Ка = 1,75 • 10-5.Запишем, как всегда, условия:равновесия[Н+] [Ас~]= 1,75 -10-5 [НАс] (1)[Н+][ОН'] = 1,00-10-14 (2)электроиейтр альности[Н+] + [Na+] - [ОН"] + [Ас“] (3)материального баланса[НАс] + [Ас-] = 0,02 (4)[Na+] = 0,01 (5)Протонное условие получается подстановкой уравнении (5) в выражение (3)
и суммированием результата с уравнением (4):[Н+] + [НАс] = [ОН-] + 0,01 (6)Поскольку раствор достаточно концентрирован, ыожно пренебречь величи¬
нами [Н+] и [ОН*] по сравнению с [НАс] и.[Ас]:[Ас“] = 0,01 (За)[НАс] = 0,01 (6а)5 За к. 345
130V. 7. Буферные растворыПодстановка соотношений (За) и (6а) в уравнение (1) дает:[Н+]= 1,75-10~5; pH = 4,75Отметим, что pH = 4,75 — срединная точка на распределительной диаграм¬
ме (см. рис. V. 3); в этой точке половина кислоты присутствует в виде НАс, а
другая половина — в виде Ас".Из уравнения (2) имеем:[ОН-] == 5,7 • Ю-10Подстановка найденных результатов в точные уравнения показывает, что
сделанные допущения удовлетворяют их с точностью до 5%.Пример V. 12. Рассчитайте pH, когда к 1 л буферного раствора Приме¬
ра V. 11 добавлено 1,0 • 10~3 моль раствора НС1.Условия равновесия н материального баланса в этом случае те же, что и
ранее, а в условие электронейтральности входит дополнительный член для
С1*-иона:[H+]+[Na+] = [OH-] + [Ac"] + [cr] (7)Условие материального баланса по хлору:[СГ] = 1,00-10~3 (8)Подставляя в уравнение (7) выражение (8) и пренебрегая величинами [Н+]
и [ОН-], получаем:[Ас“] =0,9-10“2 (7а)Это означает, что добавление кислоты уменьшило концентрацию ацетата нат¬
рия иа 10%. Отметим, что уравнение (6) перестает быть справедливым, так как
оно получено из уравнения (3). Новое протонное условие имеет вид:[Н+] + [НАс] = [ОН-] + 1,1 • 10“2 , (9)Полагая [Н+] и [ОН-] малыми, получаем:[НАс] = 1,1 • 10~2 (9а)Иными словами, концентрация уксусной кислоты увеличилась иа 10%. До¬
бавление 10~3 моль сильной кислоты <перевело» 10% соли в недиссоциирующую
кислоту.Подстановка условий (7а) и (9а) в уравнение (1) дает[Н+] = 2,14 • 10-5; pH = 4,67т. е. добавление сильной кислоты сместило pH иа 0,08 единиц. Те же количе¬
ства НС1, но введенные в чистую воду, изменяют pH на 4,00 единицы — от 7,00
до 3,00.Простая формула для pH буферных растворовПриведенные выше примеры показали, что в случае смеси сла¬
бой кислоты НА и ее соли NaA (концентрации их Сна и Сд) суще¬
ствуют пять уравнений с пятью неизвестными:[н+] [А-] = Ка [НА] (1)[Н+] [ОН-] = Кц2о (2)[H+] + ]Na+] = [OH-] + [A-] (3)[НА] + [А-] = Сна + Са <4>[Na+] = Сд (5)
Измерение констант ионизации131Подставляя уравнение (5) в (3) и суммируя результат с урав¬
нением (4), получаем протонное условие:[н+] + [НА] = СНА + [ОН"] (6)Очень простая формула для pH буферного раствора (уравне¬
ние Хендерсона) получается, если допустить, что величины [Н+] и
[ОН-] малы по сравнению с Сна и Сд. Тогда из уравнений (3) и (6)
имеем:[А“] = Са (За)[НА] = СНА (6а)Подстановка условий (За) и (6а) в уравнение (1) дает:[H+] = tfa-^- (10)АУравнение (10) не выполняется в тех случаях, когда кислота
является либо слишком сильной — нельзя пренебречь [Н+], либо
слишком слабой — нельзя пренебречь [ОН-] или когда слишком
малы аналитические концентрации.Как правило, растворы, применяемые на практике, отвечают
условиям, при которых выполняется уравнение (10). Буферная
система, выбранная так, что концентрации сопряженных кислоты
и основания равны, имеет pH « р/Са- Далее будет показано, что
это соотношение наиболее выгодно для поддержания pH таких
растворов постоянным.Подобным же образом можно получить выражение и для pH
смеси слабого основания В и его соли ВНС1, полагая величины
[Н+] и [ОН-] малыми по сравнению с аналитическими концентра¬
циями:[н‘1-Измерение констант ионизацииКонстанты ионизации кислот и оснований наиболее правильно
могут быть измерены в буферных растворах. Ячейка, рассмотрен¬
ная в разделе II. 2 (рис. II. 4), служит для наиболее тщательного
измерения pH, которое проводится в смеси сопряженных кислоты
и основания известного состава. В тех случаях, когда изучаемые
вещества нарушают работу водородного электрода, можно исполь¬
зовать стеклянный электрод. Применение солевого мостика в соче¬
тании с эмпирической стандартизацией по буферным растворам
с известным pH дают в данном случае достаточно точные резуль¬
таты.5*
132V. 7. Буферные растворыВеличины [Н+], Сна и Са известны; [0Н~] рассчитывают из ион¬
ного произведения воды [уравнение (2)], а [НА] — из уравнения
(6):[НА] * СНА + [ОН-] - [Н+] (6)Уравнения (3) и (5) совместно дают:[А-]=«Са—[он-] + [н+] (11)При наличии всех этих величин по уравнению (1) находим:
[н1(сА-[он-] + [н*1)СНА + [ОН-]-[Н+] ( }Для получения термодинамической константы необходимо вве¬
сти коэффициенты активности. Величину Ка следует экстраполи¬
ровать к нулевой ионной силе.Разбавленные буферные растворыУравнение (10) не выполняется, если величинами [Н+] или
[ОН-] нельзя пренебречь по сравнению с Сна и Сд. Кроме того, оно
указывает, что pH буферного раствора не зависит от концентра¬
ции последнего до тех пор, пока отношение сопряженных кислоты
и основания остается постоянным. Однако последнее справедливо
не для всех концентраций: когда Сна и Са равны нулю, pH = 7,00.Для применения уравнения (10) важно знать те пределы раз¬
бавления буферного раствора, за которыми оно перестает выпол¬
няться.Точное уравнение для [Н+] можно получить подстановкой урав¬
нения (2) в уравнение (12):[Hi (СА [Н+] - *На0 + [Hi2) - ^ (СНА [Н+1 + Кщо “ [Н+Р) (13)Уравнение (13)—кубическое относительно [Н+], но линейное
относительно аналитических концентраций. Чтобы найти зависи¬
мость pH от концентрации для некоторого данного закрепленного
отношения Сна/Са, решим уравнение (13) относительно СА:(kJ[h+] + 1) ([н+] -/CHa0/[H+])s (*„сНА/[н*1сд-1) <М)При условии, что величины [Н+] и Са рассчитаны, вид функции
(14) определяется легко. Следует отметить, что Сд > 0, если зна¬
чения [Н+] лежат между 10-7 (при более низком значении числи¬
тель отрицателен) и величиной, определяемой уравнением (10)
Буферная емкость(при более высоком значении знаменатель становится отрицатель¬
ным).Как следует из рис. V. 10, уравнение (10) выполняется в аце¬
татном буфере (Ка = 1,75-10-5; СНас/САс = 1) только тогда, когда
величина САс > 10-3 моль/л. Ниже этого значения величина [Н+]
уже не является пренебрежимо ма¬
лой. Если С ас < Ю'6 мол/л, то нельзя
пренебречь [ОН~].Интересно отметить, что если урав¬
нение (10) дает для буферного рас¬
твора pH = 7,00, то оно выполняется
для всех концентраций. Необходимым
условием корректного применения
уравнения (10) является по крайней
мере 20-ти кратное превышение кон¬
центрацией кислоты (основание) ве¬
личины Ка(Кь)- При меньшей концен¬
трации формула (10) дает результат,
отклоняющийся от обычного более
чем на 5%.Буферная емкостьВ Примере V. 12 показано, что бу¬
ферный раствор препятствует смеще¬
нию pH при добавлении сильной кис¬
лоты: введение 10 ~3моль/л сильной
кислоты изменило pH только на 0,08 единиц. Мера буферной спо¬
собности определяется количеством сильных кислоты или основа¬
ния, необходимым для изменения pH на данную величину. Чем
больше это количество, тем лучше буфер.Буферную емкость * удобно представить как производнуюДобавление dCb моль сильного основания к 1 л буферного
раствора увеличивает pH и аналитическую концентрацию основ¬
ного компонента (ацетата натрия) на dCb при одновременном рас¬
ходовании кислотного компонента (уксусной кислоты). Поскольку
добавление сильной кислоты производит обратный эффект, можно* Буферная емкость (buffer index) впервые использована Ваи Слайком[J. Biol. Chem., 52, 525 (1922)]. Иногда ее определяют как обратный наклон;последний термин имеет отношение К кривой титрования, наклон которой
rfpH/dCj.Рис. V. 10. Зависимость pH
эквимолярного буферного ра¬
створа СН3СООН—CH3COONa
от аналитической концентра¬
ции С:аЬ — участок кривой, описываемый
Примерами V. И и V. 12; пунктир,
ная прямая соответствует уравне¬
нию (10).
134V. 7. Буферные растворытакже выразить р через приращение концентрации Са добавляе¬
мой сильной кислоты;п dCaр—WTВ обоих случаях р > 0.Буферная емкость одноосновной кислоты и сопряженного с ней
основания имеет простой вид и может быть легко получена диф¬
ференцированием условия электронейтральности. Рассмотрим рас¬
твор, содержащий Сь моль NaOH, Са моль НС1 и С моль слабой
кислоты, присутствующей как в НА, так и в А" форме (т. е. ча¬
стично диссоциирующей).^Запишем условия:
равновесия[Н+] [А-] = Ка [НА] (1)[н+] [ОН-] = Ян2о (2)материального баланса[Na+] = С* (16)[С Г] = Са (17)[НА] + [А-] = С (18)электронейтральности[Н+] + [Na+] = [ОН-] + [СГ] + [А-] (19)Комбинация уравнений (I) и (18) дает:1А~'-ОТГ (20>Подставляя уравнения (2), (16), (17) и (20) в условие (19)
находим:c-c‘+w-[H4|+CTfer (21)Буферная емкость получается дифференцированием уравнения
(21), однако необходимо сначала выразить р как производную
по [Н+]. Так какpH lg [Н*1 -2555-1" 1н*1уравнение (15) может быть представлено следующим образом:Р = d ^ = — 2,303 [Н+] d~ ~ (22)dpH d [H ] dpH d[H+]Дифференцируя уравнение (21) по [H+], полагая Са — const и
учитывая уравнение (22), получаем:^ню . г„х1 . СКа[П']
Буферная емкость135Итак, зная pH, можно простой подстановкой в уравнение (23)
рассчитать буферную емкость раствора.В уравнении (23) первые два члена вызваны буферным дейст¬
вием воды, а третий член — буферным действием сопряженных
кислоты и основания.Аналогичное соотношение может быть получено для смеси сла¬
бого основания В и сопряженной ему кислоты ВН+, если Ка яв¬
ляется константой ионизации ВН+.Пример V. 13. Используя буферную емкость, рассчитайте pH, когда1,0 • 10~3 моль НС1 добавляют к 1 л буферного раствора, состав которого приве¬
ден в Примере V.11 (pH = 4,75, т. е. [Н+] = 1,75 • 10-5, общая концентрация
уксусной кислоты и ацетат-иона С = 2,0-10~2).Из уравнения (23) следует:Р = 2,303 (5,7 • Ю-10 + 1,75• 10~5 + 5.0* 10“3)= 1,15* 10“2Изменение pH находим из определения буферной емкостио dCa.р чщИспользуя вместо дифференциалов разности, получаем:Д С а 1,0-10-3АрН =1,15-10'= —0,086Таким образом, pH буферного раствора после добавления сильной кислоты
равенpH = 4,75 — 0,086 = 4,66что согласуется с результатом решения При¬
мера V. 11.Как следует из рис. V. 11, макси¬
мальному значению буферной емко¬
сти для 0,1 М ацетатного буферного
раствора соответствует pH = рКа == 4,75, т. е. условие [НАс] = [Ас-];
минимальное же значение величины р
получается отдельно для уксусной
кислоты (pH = 2,88) и для ацетата
натрия (pH = 8,88).Для получения раствора с pH <■< 2,88 надо добавить сильную кисло¬
ту; значительное возрастание величи¬
ны р в области pH = 2 (см. рис. V. 11)
означает увеличение концентрации сильной кислоты, необходимой
для достижения этой кислотности. Для получения раствора с
pH > 8,88 следует добавить сильное основание; этому соответствует
увеличение р в области pH = 12.Отметим, что раствор, содержащий только уксусную кислоту,
имеет ощутимую буферную способность (р=8,3 * 10-3), чего нельзяРис. V. 11. Занисимость буфер¬
ной емкости 0,1 М раствора
СН3СООН от pH.Точка А соответствует эквимо-
лярному буферному раствору
СНзСООН—CH3COONa; точки В н
С —0,1 М растворам СН3СООН и
CH3COONa.
136V. t. Буферные растворысказать о растворе, содержащем только ацетат натрия, для кото¬
рого р = 3,5 -10~5. Это означает, что в то время как грубое изме¬
рение pH 0,1 М раствора СН3СООН может дать величину, близ¬
кую к значению 2,88, подобные же измерения для раствора 0,1 М
CH3COONa могут привести к величине, значительно отличающейся
от pH = 8,88. В случае 0,1 М раствора СНзСОСЖа такое положе¬
ние возникает и при неполном удалении СО*Рассчитайте для следующих растворов pH и буферную емкость. Проверьте
допущения подстановкой в точные уравнения.33. 1,0-Ю'2 моль НАс и 2,0-10-* моль NaAc в 1 л Н20; Ка = 1,75• 10-5.34. 2,0-10-* моль KCN и 2,0-10-* моль HCN в 1 л Н20; Ка = 4,8 • 10-w.35. 1,0-10”* моль пиридина и 5,0-10-3 моль НС1 в 1 л Н20; Кь — 1,5 • 10"9.36. 1,0-10-» моль NHj и 2,0-10-» моль NH4C1 в 1 л Н20; Кь = 1,75-10-».37. Имидазольная группа является важной составной частью многих энзи¬
мов, катализирующих гидролитические реакции. vявляется слабым основанием (рКь = 7,09). Найдите соотношение основной и
кислотной форм, которым будет соответствовать pH = 7,00. Зависит ли это
значение pH от разведения смеси?38. Определенное , потенциометрически зиачение pH раствора, содержащего
в 100 мл Н20 2,20 г КЮЭ и 1,8 г НЮ», оказалось равным 1,32. Рассчитайте Ка
для НЮ», а также коэффициенты активности (используя уравнение Дэвиса,
стр. 373); найдите затем величину Ка, выраженную через активности.39. Покажите, что если величины [Н+] и [ОН*] пренебрежимо малы по срав¬
нению с аналитическими концентрациями слабой кислоты Сна и ее соли Са, бу¬
ферная емкость смеси имеет вид:40. Покажите, что уравнение (23) является выражением для буферной ем¬
кости раствора, содержащего слабое основание В и сопряженную ему кислоту
ВН+, при условии, что Ка — константа диссоциации ВН+.41. Выведите выражение для буферной емкости раствора, содержащего толь¬
ко сильную кислоту нли сильное основание. Покажите, что минимум величины р
соответствует pH чистой воды. Какова буферная емкость последней?42. Дифференцированием уравнения (23) покажите, что буферная емкость
максимальна, если концентрации сопряженных кислоты и основания равны. По¬
кажите, что величина р минимальна в растворе, содержащем только кислоту
или сопряженное ей основание. При каких ограничениях это положение справед¬
ливо?43. Дж. У. Дренэн [J. Chem. Ed., 32, 36 (1955)] предложил следующее урав¬
нение для вычислений pH буферных растворов:ВопросыИмидазолHN СН HN СН1Н+] - Ка СНАСа-7* Vе+УстЛа
V.8- Титрование слабой кислоты сильным основанием137В этом выражении: Сна — аналитическая концентрация слабой кислоты, кон¬
станта ионизации которой Ка, а СА — то же для сопряженного основания;
Кь = Кн2о /Ка — его константа ионизации.Можно ли эту формулу вывести строго? Какие необходимы допущения?
Постройте график, подобный рис. V. 10, и сравните их. Применима лн эта фор¬
мула для более широкого концентрационного интервала, чем дается уравнением
(10)? Используя эту формулу, постройте зависимость pH ацетатного буфера при
условии, что величина Сяа/(СНа + Са) расположена в интервале 0—1; примите,
что Сна + Са = const для 0,1 М. Сравните с величинами, вычисленными по
точному уравнению (14). В каких случаях предпочтительней по сравнению
с уравнением (10) применять формулу Дренэна?V.8. ТИТРОВАНИЕ СЛАБОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМДля построения кривой титрования слабой кислоты сильным
основанием используют те же уравнения, что и в случае сильных
кислот и оснований. Кривая титрования в рассматриваемом случае
до некоторой степени отличается от построенной для сильных кис-
лот и оснований (см. рис. IV. 3) и похожа на кривую, описываю*
щую диссоциацию (см. рис. V. 3).Титрование слабого основания сильной кислотой аналогично.Пример V. 14. V мл 0,1 М раствора NaOH добавляют к 50 мл 0,1 М рас¬
твора СНзСООН. Рассчитайте pH раствора как функцию V,Как всегда, запишем условия:
равновесия[Н+] [Ас-] = 1,75-Ю-5 [НАс] (1)[Н+] [ОН~] = 1,00 • 10—14 (2)электронейтральности[H+] + [Na+] = [OH']-i-[Ac1 (3)материального баланса[Ас~] + [НАс] (0,1) (4)[Ка+1“ТТ50 (0,1) (5)протонное [используя уравнения (3), (4) и (5)][Н+] -|- [НАс] = [ОН"] +^ (0,1) (6)Те или иные допущения зависят от добавленного количества NaOH. Исход¬
ное pH (V = 0) вычислим так же, как это сделано в разделе V. 1: пренебрежем
величинами [ОН"] и [Ас“] в уравнениях (3) н (4), соответственно, это дает
pH = 2,88 для раствора 0,1 М СНзСООН.Когда добавлено несколько миллиметров NaOH, величины [Na+] и [Ас-]
больше и [Н+] и [ОН-]; уравнения (3) и (5) дают[Ас-]=-~gg (0,1) (За)а уравнение (6) принимает вид:[ИЛе] = (°,1) (6а)
138V. 8. Титрование слабой кислоты сильным основаниемУравнение (6а) перестает выполняться, когда V » 50, так как [НАс] уже
не больше [ОН-]. Подставляя выражения (За) и (6а) в уравнение (1), получаем:[Н+] = —р—■ (l,75' 10-5) (7)Выражение (7) выполняется в области V от 5 до 49,9 мл.При достижении эквивалентной точки (F = 50 мл) pH = 8,72 (см. раз¬
дел V. 4), так как раствор представляет собой чистый ацетат натрия, концен¬
трация которого 0,05 М. За точкой эквивалентности ве¬
личина [ОН-] уже не пренебрежимо мала; величины же
[Н+] и [НАс] малы и уравнение (6) дает:1°н'1=тт1 (0-1} (6б)Полученные простые выражения удовлетворяются в
достаточно концентрированных растворах. Область их при¬
менения в более разбавленных растворах ограничена. Они
вовсе неприменимы при значительном разведении, посколь¬
ку ни [Н+], ни [ОН-] не являются столь малыми, что ими
можно пренебречь— вне зависимости от V.Полная кривая титрования (рис. V. 12) имеет несколь¬
ко отличительных особенностей по сравнению с кривой ти¬
трования сильных кислот и оснований (см. рис. IV. 3).
Во-первых, эквивалентная точка лежит при pH, отличном от7,00 поскольку ацетат-ион — слабое основание. Во-вторых,
за начальным участком возрастания кривой (У=0—10мл)
следует относительно плоский участок; такое пове¬
дение вызвано буферным действием смеси СНзСООН и
СНзСОО-, существующий до эквивалентной точки. После
нее кривая ймеет тот же вид, что и в случае сильнокислотного титрования, так
как и здесь, и там доминирующим являются ОН-ионьг.Полное уравнение кривой титрованияДопущения, применяемые ранее для качественного описания
кривой титрования, естественно, могут быть использованы и в дан¬
ном случае. Однако для определения ошибок титрования необхо¬
димо точно знать поведение кривой вблизи эквивалентной точки,
но именно в этой области принятые допущения теряют смысл. По¬
этому и появляется надобность в полном уравнении.Кривая титрования просто соотносится с кривой диссоциа¬
ции и очень хорошо ею аппроксимируется в области до точки
эквивалентности. Это соотношение очень легко может быть об¬
общено и на случай титрования многоосновных кислот (см.
главу VII).Если VQ мл слабой кислоты НА (концентрация С0) титруютV мл сильного основания (скажем, NaOH), концентрация кото¬
рого С, то используемые обычно условия имеют вид:РНРис. V. 12. Кривая
титровании слабой
кислоты (50 мл
0,1 М СН3СООН>
сильным осиова-
нием(0,1 М раствор
- NaOH).
Ошибки титрования139материального баланса[HAl + tA-]—^^- (8)[Na+] = v + ^ (9)электронейтральности[Na+] + [Н+] = [ОН-] + [А-] (10)Подстановка уравнения (9) в уравнение (10) дает:1А']-у + у, + [Н+] — [ОН~] (11)Степень диссоциации (см. раздел V. 2) и титровальная доля
(см. раздел IV. 3) определены как: _ .“а" [на]+\а“] (12) и ф==~с^7 (13)Подставляя условия (8) и (11) в выражение (12) и используя
соотношение (13), получаем уравне¬
ние для кривой титрования:ф = <*а + ([ОН] — [Н+]) (14)Если величины [Н+] и [ОН-] исче¬
зающе малы по сравнению с С0, то® аА Рис. V. 13. Сравнение кривыхтитрования (Ф) и диссоциа-
и кривые титрования и диссоциации ции (аА)идентичны.Сравнение обеих кривых приведено на рис. V. 13; кривая дис¬
социации имеет тот же вид, что и на рис. V. 3, а кривая титрования
соответствует кривой на рис. V. 12; правда, кривые повернуты так,
чтобы они накладывались одна на другую.Отметим, что сравниваемые кривые идентичны от точки, где
примерно 10% кислоты оттитровано, до эквивалентной точки. Раз¬
личия же существуют в начальной области (вызвано тем, что ве¬
личиной [Н+] нельзя пренебречь по сравнению с С) и после экви¬
валентной точки (нельзя пренебречь [ОН-] по сравнению с С0),Ошибки титрованияДля вычисления ошибок титрования уравнению (14) следуем
придать форму, пригодную вблизи эквивалентной точки.Степень диссоциации можно выразить следующим образом
(см. раздел V. 2)■*-МТ<г <■«
140V. 8. Титрование слабой кислоты сильным основаниема объемный фактор вблизи эквивалентной точки (см. раздел IV. 4)
может быть учтен, если в уравнении (13) величину Ф положить
равной 1:±±Хt = £°+£. (17)Подставляя уравнения (16) и (17) в выражение (14), полу¬
чаем:(ф - 1) Ка + Ф [Н+] = -■££- ( [ОН-] - [Н+] ).( [Н+] + Ка) (18)Поскольку мы рассматриваем область вблизи эквивалентной
точки, Ф[Н+] я* [Н+]. В большинстве практических случаев в конеч¬
ной точке [Н+] «С Ка (см. рис. V. 12); поэтому величиной [Н+] мож-
*но пренебречь по сравнению с Ка управой части уравнения (18).
Уравнение для вычисления ошибки титрования можно представить
в следующей удобной форме:, С° + С
m = Фк. т — 1С0С(,9)Первый член этого уравнения тот же, что и в уравнении (10)
раздела IV. 4 (стр. 99), описывающем титрование в системе силь¬
ная кислота — сильное основание. Второй член появился в резуль¬
тате буферного действия слабой кислоты в конечной точке.В случае титрования сильного основания слабой кислотой все
члены правой части уравнения (19) имеют противоположные
знаки.Пример V. 15. Рассчитайте ошибку титрования для Примера V. 14, если
конечная точка лежит при pH = 8,00 (эквивалентной точке соответствует
pH = 8,72).Подставляя Со = С = 0,1 и [Н+] = 1,00-10~8 в уравнение (19), находим:
m = Фк. т — 1 = 2,00 • 10~5 — 5,7 • Ю-4 = 5,5 • 10“4Следует отметить, что наибольший вклад вносит второй член уравнения (19).
Проведенное титрование очень точно, так как m = 0,05% меньше, чем ошибка
отсчета показаний бюретки (0,1%).Подобным же образом можно рассчитать m и для случая тит¬
рования слабого основания сильной кислотой:тдф _1^-С° + САн+1 *не_\ СпСДля определения величины m при титровании сильной кислоты
слабым основанием в правой части уравнения (20) все члены сле¬
дует брать с противоположными знаками.
Индекс крутизны.141Индекс крутизныВозможность проведения титрования определяют по так назы¬
ваемому индексу крутизны, который характеризует величину на¬
клона кривой титрования:(21).Большему наклону кривой титрования отвечает меньшая ошиб¬
ка титрования (для данной ошибки измерения pH).Каково же разумное значение этого индекса? Для наиболее рас¬
пространенных титрований, в которых используют бюретки ем¬
костью 50 мл и кислотно-основные индикаторы для нахождения
конечной точки, объем может быть оценен с точностью до 0,1%,
а pH — с точностью до единицы. Если индекс крутизны равен 103,
ошибка при определении pH в единицу дает ошибку в 0,1% —как
и при установлении объема.Таким образом, для титрования, когда т) >■ 103, точность опре¬
деляется правильностью отсчета показаний бюретки; если же т) <С
< 103, точность титрования зависит от правильности определения
конечной точки.Точность до 0,1 pH может быть достигнута при определении
конечной точки потенциометрически или спектрофотометрически
(с использованием окрашенного стандартного раствора индика¬
тора). Если Tj = 10, а pH определено с точностью до 0,1, то ошиб¬
ка титрования может составить 1%. Таким образом, для г) = 10
титрование непригодно в качестве аналитического метода опреде¬
лений.Нетрудно показать связь между буферной емкостью и индек¬
сом крутизны. Используя уравнения (9), (13) и (17), можно ана¬
литическую концентрацию добавляемого при титровании сильного
основания приближенно выразить следующим соотношением:Сь = —^°С ■ Фс„ + сщБуферная емкость определена как производная: dCb/dpH. По¬
этому, дифференцируя это соотношение и используя уравнение(21), получаем:Со С 1(22)Четкое выражение для индекса крутизны как функции [Н+] мо¬
жет быть получено дифференцированием уравнения (19).:
142V. 8. Титрование слабой кислоты сильным основаниемУравнение (23) может быть получено и из уравнений (22) и
(23) раздела V. 7 (см. стр. 134).Как следует из рис. V. 14, максимальное значение т] соответ¬
ствует эквивалентной точке. Одним из наиболее распространенных
способов определения конечной точки в потенциометрическом тит¬
ровании является выбор точки, характеризуемой максимальнымПодставляя уравнение (24) в уравнение (23), находим интере¬
сующее нас выражение для индекса крутизны в эквивалентной
точкекоторое одинаково хорошо выполняется при титровании и слабой
кислоты сильным основанием, и сильного основания слабой кис¬
лотой.Если эквивалентная точка лежит в более щелочной среде, чем
pH = 8, второй член правой части уравнения (24) пропадает. Это
приводит к простому выражению для [Н+]'Уравнение (27) очень полезно для многих случаев титрований.
Однако следует иметь в виду, что оно не выполняется, когда кис¬
лота является достаточно сильной и эквивалентная точка попадает
в область pH = 7—8.З.т.наклоном. Рис. V. 14 показывает, что
точке максимального наклона как
раз и соответствует эквивалентная
точка.Рис. V. 14. Зависимость ин¬
декса крутизны от pH при
титровании 0,1 М раствора
СНзСООН 0,1 М раствором
NaOH (см. Пример V. 14).3,0 8J5 S.0 9,5 Ю,0pHИндекс крутизны в эквивалентной
точке получается, если совместно ре¬
шить уравнения (23) и (19). Обозна¬
чим для первого из них величину [Н+]
эквивалентной точки через [Н+]'; тогда
в уравнении (19) величина [Н+]' соот¬
ветствует ф = 1, Итак, решение дает:(24)(25)(26)подстановка которого в уравнение (25) дает:(27)\t((f L, -'НгО /
Индекс крутизны143Из уравнений (20)—титрование слабого основания сильной
кислотой — индекс крутизны в эквивалентной точке имеет вид:Уравнение (28) одинаково хорошо применимо для титрования
как слабого основания сильной кислотой, так и сильной кислоты
слабым основанием. Кроме того, оно может быть использовано и
для определения индекса крутизны в первой эквивалентной точке
в случае титрования смеси слабой и сильной кислот сильным осно¬
ванием (см. Вопросы 52 и 63).Если эквивалентная точйа при титровании слабого основания
сильной кислотой попадает в область, более кислую, чем pH = 6,
выражение для величины ц' имеет вид:Последнее широко применяют для описания процессов титро¬
вания; однако оно неприменимо, когда основание является доста¬
точно сильным и эквивалентная точка попадает в область pH =Уравнения (25) и (28) выполняются и в случае титрования
сильной кислоты сильным основанием, и наоборот, это можно лег¬
ко показать, если положить в уравнениях (23) и (19) дробь [Н+]//Са
равной нулю. Так как при титровании сильной кислоты сильным
основанием всегда [Н+]' = 1,0-Ю-7, получим:Наличие атмосферной двуокиси углерода может сместить pH
эквивалентной точки при кислотно-основном титровании на 2 или
более единицы pH; поэтому в данном случае титрование с индика¬
торами обычно дает результаты, точность которых хуже 0,1%, если
концентрация меньше 10_3 М. Применение потенциометрии для опре¬
деления конечной точки и полное устранение влияния СОг позво¬
ляет проводить титрование с точностью до 1%, даже для раство¬
ров с концентрациями порядка 10~5 М. Однако для таких малых
концентраций более подходящей является кондуктометрия, по¬
скольку она менее чувствительна к присутствию СОг-Пример V. 16. Рассчитайте индекс крутизны в эквивалентной точке при
титровании 0,1 М раствора СНзСООН 0,1 М раствором NaOH (см. Пример 14).В этом случае pH = 8,72, т. е. [Н+]' = 1,90-10-9; С0 = С — 0,1. Подставляя
эти величины в уравнение (25), находим:г)'= 2,06* 103(29)= 6—7.(30)Так как г) > 103, точность титрования определяется правильностью отсчета
показаний бюретки, т. е. m « 0,1%-
144V. 8. Титрование слабой кислоты сильным основаниемОбратите внимание, что значение х\' соответствует максимуму на кривой
рис. V. 14.Приближенное значение индекса крутизны является прибли¬
женным ответом Примера V.15. Если в уравнении (21) вместо
дифференциалов принять конечные разности, то:Найденная величина ri = l,2-103 (pH = 8,25) несколько отли¬
чается от индекса крутизны в эквивалентной точке (pH =8,72).
Однако, как следует из рис. V. 14, она расположена в интервале
значений pH = 8,00—8,72, т. е. между конечной точкой (pH = 8,00)
и эквивалентной.Индекс крутизны, получаемый
из концентрационно-логарифмической диаграммыПростота выражений (25) и (28) позволяет применять концен¬
трационно-логарифмическую диаграмму для определения индекса
'-крутизны при титровании. В приближенных вычислениях можно
принять С0 = С, а 0,217 заменить на 0,20; такое упрощение дает:При титровании уксусной кислоты сильным основанием (см.
рис. V.4) эквивалентная точка является результатом пересечения
линий для [НАс] и [ОН-]; ей соответствует рОН'= 5,65; lgC0 =
= —2,00. Таким образом, из уравнения (25а): lgT)' = 2,65 или
ц' = 450. Итак, конечная точка является «хорошей»; точность тит¬
рования в 0,1% будет достигнута в том случае, если можно будет
измерить pH с точностью до 0,5 единицы.Если 0,01 М раствор CH3COONa титруется НС1, эквивалентная
точка является результатом пересечения линий для [Ас-] и [Н+]; ей
соответствует pH' = 3,37; lgrj' =0,37; ц' = 2,3. В этом случае ко¬
нечная точка является «плохой», и даже если pH может быть из¬
мерена с точностью в 0,1 единицы, ошибка титрования составитСформулируем теперь общее правило: если точка пересечения
на концентрационно-логарифмической диаграмме соответствует
эквивалентной точке титрования, то расстояние от этой точки до
горизонтальной основной линии для lgCo, уменьшенное на единицу
в логарифмической шкале дает логарифм индекса крутизны в эк¬
вивалентной точке. Это означает, что если пересечению соответ¬
ствуют четыре или более единиц (вниз от основной линии), то
т|';>103 и титрование возможно с ошибкой, меньшей 0,1%. Есл»ДФ 5,9 • 10“lg Ti' = lgC0 + pOH'-l
lgri' = lg Co+pH'-l(25a)(28a)5%.
Вопросы.145же пересечение лежит ниже основной линии менее, чем на две еди¬
ницы (г/ < 10), то даже наиболее точные методы определения ко¬
нечной точки не дадут ошибки титрования лучшей 1 %.44. Постройте кривую титрования (см. Пример V. 14) 50 мл 0,1 М рас¬
твора NHs 0,1 М раствором НС1; для NHj рКь — 4,75. Сравните с кривой обра¬
зования (рис. V. 7).45. Какой из приводимых ниже индикаторов наиболее пригоден для титро¬
вания 0,01 М раствора СНзСООН 0,01 М раствором NaOH:Обратите внимание на выбор области, в которой происходит изменение
окраски, и легкость визуального определения этого изменения. Рассчитайте воз¬
можную максимальную и минимальную ошибки титрования.46. Незадачливый студент решил, что муравьиная кислота (Ка=1,77 • 10~4)—
сильная кислота. У него был образец — 0,01 М раствора НСООН. Он заполнил
бюретку емкостью 50 мл 0,1 М раствором NaOH и воспользовался стандартным
раствором 0,1045 М кислоты. Затем аликвотную часть в 100 мл образца рас¬
твора неизвестной концентрации он оттитровал до pH = 7,00 (по рН-метру).
Так как он проявил особую заботу при стандартизации рН-метра по буферу
с pH == 7,00, то, вероятно, смог определить концентрацию иоиов водорода в ко¬
нечной точке с точностью до 0,2 единиц pH. Если точность отсчета показаний
бюретки составила 0,05 мл, какова общая ошибка (в %) при определении коли¬
чества муравьиной кислоты в образце? Как можно улучшить процесс титрова¬
ния? Какова возможная минимальная ошибка при наличии указанного оборудо¬
вания и стандартных растворов?47. Рассчитайте индекс крутизны в эквивалентной точке при титровании
0,1 М раствор HCN (Ка = 4,8-1Сг10) 0,1 М раствором NaOH. Определяется ли
-ошибка титрования отсчетом показаний бюретки или измерением pH? Сравните
с титрованием раствора NaCN раствором НС1.48. Рассчитайте индекс крутизны при титровании 0,01 М раствора NaHS04
0,1 М раствором NaOH; для HSOJ Ка = 1,00-10~*. Если ошибка титрования
должна быть меньше 0,1 %, внутри какой области следует определять pH?49. Выведите общее уравнение, подобное уравнению (14), для кривой титро-
вания слабого основания сильной кислотой. Покажите, что кривые диссоциации
и титрования почти одинаковы в области до точки эквивалентности. Используя
это, выведите соотношение для ошибки титрования [см. уравнение (20)]. Какова
должна быть ошибка, если при титровании 0,1 М раствора NHs 0,1 М раствором
НС1 конечную точку выбрать при pH = 5,00?50. Выведите соотношение, подобное уравнению (23), для индекса кру¬
тизны при титровании слабого основания сильной кислотой; из полученного
соотношения выведите уравнения (28) и (29).51. Покажите, что если Ка слабой кислоты меньше 10-7, титрование соли
слабой кислоты сильной кислотой более правильно, нежели титрование только
слабой кислоты сильным основанием.52. Смесь, содержащую 0,1 моль HCI и 0,1 моль СНзСООН в 1 л, титруют
0,1 М раствором NaOH- Рассчитайте кривую титрования, ио учтите, что В ДйННомВопросыОбласть изменения pH конечнойТетрабромфеиолфталеин .
jn-Крезоловый пурпурный
а-Нафтолфталеии . . . .
Крезоловый красный . .Фенолфталеин . . .
Тимоловый голубойточка и изменения окраскн8.4—10,0; бесцветная — красная8.0—9,6; желтая — голубая8.0—9,0; бесцветная — фиолетовая7.4—9,0; желтая — пурпурная7.3—8,7; розовая — зеленая7.3—8,8; желтая — розовая
146V. 9. Соль слабой кислоты и слабого основанияслучае существуют две эквивалентные точки для двух отдельных ступеней кри¬
вой. Выведите уравнение индекса крутизны в первой точке. Обратите внимание,
что уравнение (23) здесь неприменимо, так как первым допущением при его
выводе было то, что [Н+] < Ка. Индекс крутизны во второй точке дается урав¬
нением (25). Рассчитайте значение индекса крутизны в обеих точках и оцените
точность, которая возможна при титровании смесей сильной и слабой кислот.53. Для какого значения Ка существует минимальная ошибка титрования
при условии, что концентрации и сильной, и слабой кислот одинаковы? Какова
минимальная ошибка титрования в данном случае, если концентрации равны
0,1 М?V.9. СОЛЬ СЛАБОЙ КИСЛОТЫ И СЛАБОГО ОСНОВАНИЯСоли сильных кислот и сильных оснований имеют нейтральную
реакцию среды (см. раздел IV. 2). С другой стороны, в разделе V. 4
было показано, что раствор соли слабой кислоты и сильного
основания имеет щелочную реакцию, так как анион слабой кис¬
лоты реагирует с водой как основание (см. раздел IV. 2). Анало¬
гично соль слабого основания и сильной кислоты дает кислую ре¬
акцию.В растворе цианида аммония (HCN и NH3 — слабые кислота и
основание) и катион, и анион взаимодействуют с водой:NH+ + H20 +=£ NH, + H30+CN~ + H20 HCN + ОН"Величина pH такого раствора определяется соотношением
«сил» двух кислот: HCN и NHt.Хотя решение этой задачи связано, помимо диссоциации воды,
еще с двумя равновесиями и его следовало бы рассматривать сов¬
местно с вопросами поведения многоосновных кислот (см. главу
VII), есть все основания обратиться к нему здесь.Простая формула для pH соли слабой кислоты
и слабого основанияВеличина pH определяется простым соотношением, получаемым
при допущении, что концентрациями [Н+] и [ОН-] можно прене¬
бречь. Запишем условия:
равновесий[Н+] [А-] = Ка [НА] (1)[ВН+] [ОН-] = Кь [В] (2)[Н+][0Н"] = /Сн2О (3)материального баланса *[НА] + [А-] = С (4) [ВН+] + [В] = С (5)* С — аналитическая концентрация соли АВ.
Простая формула для pH соли слабой кислоты и слабого основания 147электронейтральности[Н+] + [вн+] = [ОН-] + [А-] (6)Комбинируя уравнения (6), (4) и (5), получаем протонное
условие:[Н+] + [НА] = [ОН-] + [В] (7)Если пренебречь величинами [Н+] и [ОН-] по сравнению с кон¬
центрациями других ионов, уравнения (6) и (7) принимают сле¬
дующий вид:[ВН+] = [А-] (6а)[В] = [НА] (7а)Перемножив уравнения (1) и (3) и поделив результат на урав¬
нение (2), получаем:*н2о*а . гн+]2 [А! [В]Кь [НА] [ВН+]Используя уравнение (6а) и (7а), имеем:[н+] = //Сн2оЗД <»>Уравнение (8) — предельное, справедливое при высоких кон¬
центрациях; концентрация же, при которой оно перестает выпол¬
няться, зависит от соотношения величин Ка и Кь• И только когда
Кь — Ка, величина pH не зависит от С. В этом случае pH = 7,00 и
безразлично, присутствует соль или нет. Подобная ситуация ха¬
рактерна для СН3СОО NH4:/(a = Кь = 1,75-10~5.Наиболее важный случай невыполнимости уравнения (8) воз¬
никает, когда и Ка, и Кь больше 10-7 и являются величинами того
же порядка, что и С. Тогда в уравнении (6), но не (7), величинами
[Н+] и [ОН-] можно пренебречь, что дает приближенное соотно¬
шение:г„л [KHi0Ka(Kb + C)y/t1 J I Кь(Ка+С) IПрименимость любого приближенного соотношения может
быть всегда проверена расчетом всех концентраций с последующей
подстановкой в точные уравнения условий равновесия, материаль¬
ного баланса и электронейтральности (см. Вопросы 65 и 66).Пример V. 17. Рассчитайте pH 0,10 М раствора NH4CN; Ка = 4,8- Ю-10;
Кь =.1,78-10-5.Подстановка в уравнение (8) дает:[Н+] = 5,2- 10 10; pH = 9,28Так как pH близко к рДо = 9,32 для HCN, и к рЛо = 9,25 для NH*, соль
NH4CN — очень хороший буфер. Буферная емкость ее примерно в два раза
выше, чем у эквимолярной буферной смеси NH3—NH* той же концентрации.
148V. 9. Соль слабой кислоты и слабого основанийДля проверки правильности допущений рассчитаем другие концентрации; из
уравнения (3):[ОН'] = 1,9-10“5Подставляя значение [Н+] в уравнение (1) и комбинируя результат с урав¬
нением (4), получаем[HCN] = 0,052и из уравнения (4);[CN~] = 0,048Подставляя значение [ОН-] в уравнение (2) и комбинируя результат с урав¬
нением (5), получаем:[Ш3] = 0,052[NHj} = 0,048Подстановка найденных величин в уравнения (6) и (7) показывает, что они
удовлетворяются с точностью до 0,05%.Титрование слабой кислоты слабым основаниемЕсли Vo мл слабой кислоты НА (концентрация С0) титруют
V мл слабого основания (концентрация С), то комбинация усло¬
вий материального баланса и электронейтральности даст уравне¬
ние кривой титрования:Перепишем уравнение в следующей форме:Приведенная на рис. V. 15 кривая титрования для случая, когда
С0 = С = 0,1 мало отличается от кривых, построенных для других
концентраций, если С0 > 10“2.В эквивалентной точке раствор идентичен раствору соли сла¬
бых кислоты и основания, и если раствор не очень разбавлен, ура¬
внение (8) позволяет вычислить pH. При допущении, что [Н+]</Св
и, тем более, [Н+] <С Кн2о1Ка, как это имеет место в эквивалентной
точке почти во всех случаях титрований, ошибка титрования [опи¬
сываемого уравнением (9)] может быть найдена по уравнению:Л , (С0+С\1 ^Н20 Гтт+1 \, ^н2о [н+]к.т“-ф-‘-1^^]1т;Рк7_[н1"’)+№С7—кГ (0)При титровании слабого основания слабой кислотой знаки пе¬
ред всеми слагаемыми в правой части уравнения должны быть
изменены на противоположные.Ф- 1
Концентрационно-логарифмические диаграммы 14$рнОтметим, что если Кь велико, то уравнение (10) превращается
в уравнение (19) раздела V. 8, описывающее титрование слабой
кислоты сильным основанием. Если же Ка велико, то уравнение
(10) превращается в уравнение (20) раз¬
дела V. 8 (но с противоположными знака¬
ми), описывающее титрование сильной кис¬
лоты слабым основанием. Если же и Ка, и
Кь велики, уравнение (10) соответствует
уравнению (10) раздела IV. 4, описываю¬
щему титрование сильной кислоты сильным
основанием.Дифференцируя уравнение (10) и под¬
ставляя в него числовые значения при Ф=1,
получаем выражение для индекса крутизны
в эквивалентной точке:(И)где [В]' — концентрация свободного основа¬
ния в эквивалентной точке.Уравнение (11) справедливо, если вели¬
чины [Н+] и [ОН-] пренебрежимо малы по
сравнению с [В] и [НА]; в этом случае, как
следует из уравнения (7), [В]' = [НА]'.Если уравнения (11) и (8) справедливы, можно найти простое
выражение для индекса крутизны непосредственно через констан¬
ты равновесия; из уравнений (1), (4), (7а) и (8) имеем:Рис. V. 15. Зависимость
титровальиой доли от pH
при титровании 0,1 М
раствора СНзСООН
0,1 М раствором амми¬
ака.[НА]' = [ВГ=С,Сс.+с’)(%го + (М«^)1/8н2оПодстановка найденного выражения в уравнение (11) даетгч,1-0’217{' + (:^гП (12)Поскольку уравнение (12) выведено из уравнений (11) и (8),
оно справедливо только если [Н+] и [ОН"] пренебрежимо малы в
уравнениях (6) и (7); оно не выполняется, если Ка и Кь велики, а
также, если раствор разбавлен.Концентрационно-логарифмические диаграммыПодобные диаграммы очень удобны для характеристики всего
процесса титрования слабой кислоты слабым основанием и опре¬
деления индекса крутизны.Рис. V. 16 является такой диаграммой для CH3COONH4; полу¬
чен он наложением диаграмм для СНзСООН и NH3.
150V. 9. Соль слабой кислоты и слабого основанияЗначение pH соли, т. е. pH в эквивалентной точке при титрова¬
нии уксусной кислоты аммиаком, найдено по уравнению (7), со¬
гласно которому:[НАс] = [NH3]Однако это справедливо при условии, что [Н+] и [ОН~] прене¬
брежимо малы в этой точке. Пересечение соответствующих линийпроисходит при pH = 7,00,
что и отмечено на рис. V. 16.Индекс крутизны в экви¬
валентной точке определяет¬
ся уравнением (11), кото¬
рое можно записать в лога¬
рифмической форме:
lg4'«=lgCe-lg[B]'-lВ точке пересечения
[В]' = [НА]'; эта точка — эк¬
вивалентная.При титровании 0,1 М
раствора СН3СООН 0,1 М
раствором NH3 пересечение
линий происходит на 2,30 логарифмических единиц ниже основ¬
ной линии С0, т. е. г\' = 20. Это означает, что соблюсти аккурат¬
ность при титровании в данном случае трудно. Однако, если ис¬
пользовать потенциометр, а конечную точку выбрать так, чтобы ей
соответствовал максимальный наклон, то ошибка при измерении
pH может быть снижена до 0,1 единицы; все эти меры дают точ¬
ность в определении объема ~ 0,5%, что вполне приемлемо.Если Ка или Кь слишком велики или раствор слишком разбав¬
лен, возможно, что величинами [Н+] и [ОН-] в уравнении (7) пре¬
небречь нельзя:[Н+] + [НА] = [В] + [ОН”] n (7)В этом случае точка пересечения двух кривых, соответствую¬
щих наибольшим слагаемым обеих частей уравнения (7), опреде¬
ляет pH раствора.Если сила кислоты или основания увеличивается, крутизна кри¬
вой титрования приближается к получаемой при титровании сла¬
бого основания сильной кислотой или слабой кислоты сильным
основанием; в этом случае пригодны выводы раздела V. 8. Пере¬
ходная точка появляется, когда два члена одной из частей урав¬
нения (7) являются величинами одного порядка. Условие для эк¬
вивалентной точки в этом случае изменяется от [В] = [НА] до
[В] = [Н+] или [ОН-] = [НА].Иногда логарифм индекса крутизны лишь на одну логарифми¬
ческую единицу меньше расстояния от точки пересечения до основ¬
ной линии.'1§С рНа для НАС[N(V] [Ас]Рка дуННь'[NH,’]«Ас,3.г.,рН*7,О0[МНЛЧнАс]'Рис. V. 16. Концентрационно-логарифмиче¬
ская диаграмма для 0,1 М раствора NH4Ac.
Вопросы151Итак, общее правило для титрования слабого или сильного
основания слабой или сильной кислотой (или наоборот) таково:
если точка пересечения, определяющая эквивалентную точку, бо¬
лее чем на четыре логарифмических единицы лежит ниже основ¬
ной линии (г\' > 103), ошибка титрования зависит от правильности
отсчета показаний бюретки и величина ее меньше 0,1%. Если же
точка пересечения отстоит от основной линии менее, чем на две
логарифмические единицы (т|' < 10), то даже наиболее совершен¬
ные методы определения конечной точки дадут при титровании
ошибку более 1%„ВопросыРассчитайте pH следующих растворов.54. 0,1 М раствор NH4F; для HF Ка = 6,75 • 10-"; для NH3 Кь = 1,78 • 10-*.55. 1,0- 10-5.М раствор NH4F.56. 0,1 моль по NH4Ac и 0,01 моль по НС1 (1л).57. 0,1 моль по NH4Ac и 0,01 моль по NaOH (1 л).58. 0,1 М раствор (NH4)2S04; для HS04~ Ка = 1,02 • 10-2. Сравните с pH
0,1 М раствора Na2S04 и 0,2 М раствора NH4N03.59.0,01 моль по СН2С1СООН (Ка = 1,36- Ю 3) и 0,1 моль по NH(CH3)2
(Кь = 1,18-10-3) (1 л).60. Постройте график зависимости pH от титровальной доли для титрования
0,1 М раствора NH3 0,1 М раствором СН2С1СООН. Какова ошибка титрования,
если конечная точка находится в пределах 0,2 единиц pH эквивалентной точки?61. Найдите ошибку титрования, если 50 мл 0,01 М раствора CH2CICOOH
титруют 0,01 М раствором NH(CH3)2, а pH в эквивалентной точке определяют
с точностью ±1 единица pH.62. Какова ошибка титрования, если 50 мл 0,2 М раствора NH3 титруют 0,2 М
раствором НАс, а pH конечной точки принимают за 7,25?63. Постройте график зависимости pH от титровальной доли для титрования0,1 М раствора H2S04 0,1 М раствором NHa. Чему будет равняться приближен¬
ный индекс крутизны для каждой эквивалентной точки? Какова ошибка титрова¬
ния в каждой эквивалентной точке, если pH измеряют с точностью ±0,1?64. Решите уравнение (1), используя при этом уравнение (6), но без всяких
допущений; затем найдите соотношение между С и [Н+] для соли слабой кислоты
и слабого основания. Постройте график pH = f(—lgC) для NH4CN. Проверьте
точку, найденную в Примере V. 17 и рассчитайте pH 1,0-10—0 М раствора NH4CN.
При какой минимальной концентрации пренебрежение величинами [Н+] и [ОН-]
дает ошибку более 5%?65. Гриффит [Trans. Farad. Soc., 17, 525 (1922)] вывел простую формулу
[уравнение (8)] дли pH соли слабых кислоты и основания указав: «Эта формула
требует некоторой модификации в крайне разбавленных растворах по той причи¬
не, что предположение о практически полной диссоциации слабых кислоты и ос¬
нования несостоятельно». Дайте критическую оценку этому заявлению.66. Кларк [Determination of Hydrogen Ions, Baltimore, 1922] вывел соотно¬
шение-Гн*1_ l/ *н2о*а(*ь + [ВН+])1 J V Kb (Ка + [A-] )для соли слабой кислоты и слабого основания. Он указал, что это приводит к
простому выражению [уравнение (8)] «... если Кь и Ка являются малыми вели¬
чинами по сравнению с [ВН+] и [А-], а раствор значительно разбавлен, но так, что
[ВН+] и [А-] приближенно равны концентрации соли С ..Выведите формулу
Кларка и укажите, при каких условиях она превращается в простое выражение.
Дайте критическую оценку уточнениям Кларка.
Глава VIОСАЖДЕНИЕ И ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИVI. 1. РАСТВОРИМОСТЬ ПРОСТЫХ ИОННЫХ СОЛЕЙ
В ЧИСТОЙ ВОДЕВ 1899 г. Нернст показал, что равновесие между твердой ион¬
ной солью и ее раствором в воде подчиняется выражению, назы¬
ваемому произведением растворимости. Рассмотрим в качестве
примера хлорид серебра, растворимость которого в воде невелика.
В процессе растворения первоначально образуются: катион Ag+
и анион С1~. Итак, для реакцииAgCITB ^ Ag+ + СГвыражение, описывающее равновесие, имеет вид[А8+][СГ] = ^(тв)огде величина К(тву> — константа произведения растворимости, или,
короче, произведение растворимости.В выражение для К(тв)о активность соли не входит, так как по¬
следняя является фазой постоянного состава, и поэтому ее актив¬
ность можно приравнять единице. Можно также сказать, что кон¬
центрация твердой соли постоянна и поэтому входит в константу
равновесия. Произведение растворимости — понятие, приложимое
только к насыщенным растворам.Если S моль AgCl растворяют в воде и при этом образуется 1 л
насыщенного раствора, условия -материального баланса по катио¬
нам и анионам имеют вид:[Ag+] = S и [СГ] = SПривлекая величину произведения растворимости, получаем:
[Ag+][cr] = S2 = tf(TB)0; S==/^7Таким образом, растворимость твердой соли в чистой .воде за¬
висит от величины произведения растворимости при условии, что
в растворе присутствуют только эти два иона. Подобная же форма
уравнений описывает растворимость BaS04 и любой другой соли,
два иона которой имеют одинаковые заряды.Если заряды ионов неодинаковы, то растворимость все равно
Зависит от произведения растворимости, хотя уравнения несколько
VI. 1. Растворимость простых ионных солей в чистой воде 153и усложняются. Так, для соли MezXv, дающей в водном растворе
только ионы Ме*'+ и X2-, реакцияMe^(TB) ^ гМеу+ + уХг~
описывается следующим выражением:[Же»*]г[хг-]У^К{ТВ)0Используя условия материального баланса по катиону и аниону[Ме»+] = zS и [Хг~] = ySокончательной подстановкой в выражения для произведения рас¬
творимости получаем:(zSf(yS)« = K{m) оПоследнее выражение может быть легко решено для S через
известные г, у и /Qtbjo-Только относительно небольшое число ионных солей подчи¬
няется столь простой модели, поскольку большинство из них обра¬
зует в водных растворах комплексные ионы. Кроме того, раство¬
римость многих солей столь велика, что их насыщенные растворы
являются очень концентрированными и поэтому необходимо при¬
бегать к использованию коэффициентов активности.Ниже приведены величины произведения растворимости при
25 °С некоторых солей, образующих только два иона в разбавлен¬
ных водных растворах:Ионы равных зарядовИоны неравных зарядовСольP^(tb) 0Т1С1 3,72AgBr03 4,28Hg2S046,17SrS04 6,55AgI03 7,52PbS04 7,80AgCl 9,75BaS04 9,96AgSCN 12,00AgBr 12,28Agl 16,08СольРК,(тв) ОAg2S04 4,80^52^2^4 » • • * 11,30BaF2 5,76Cu(I03)2 7,13MgF2 8,18SrF2 8,54CaF2 10,40Mg(OH)2 .... 10,74Pb(I03)2 12,59Hg2Cl2 ** .... 17,88Ce(I03)3 9,50La(I03)3 11,21* Величина 0 экстраполирована к нулевой ионной силе.** Hg|+ — единичный ион.Для приведенных выше солей рассмотренная модель дает точ¬
ное соотношение между растворимостью в чистой воде и произве*
дением растворимости. Рассмотрим несколько примеров,
154VI. 1. Растворимость простых ионных солей в чистой водеПример VI. 1. Рассчитайте произведение растворимости сульфата бария, если
его растворимость в чистой воде, измеренная кондуктометрически при 10 °С, рав¬
на 1,0-10'5 моль/л.Условия материального баланса[Ва2+] =1,00* 10-5; [SO®-] = 1,00 - 10-5Далее, подстановка в выражение дли произведения растворимости дает:/С(тв) о — fBa2+] [sorj = (1.00* Ю"5)2 — 1,00.10-10Найденное значение лишь незначительно отличается от приведенного на
предыдущей странице; в последнем случае другая температура и при расчетах
использованы коэффициенты активности.Пример VI. 2. Произведение растворимости CaF2 равно 4,0 • 10-11. Найдите
растворимость соли в чистой воде.Запишем уравнение реакцииCaF;(TB) ^ Са2+ + 2F-
в выражение для произведения растворимости:[Са2+] [F"]2 = 4,0-10-“Используя условия материального баланса[Ca2+]=S; [F~] = 2Sполучаем:S(2S)2 = 4S3 = 4,0.10-11; S=2,15-10“4 моль/л = 1,68* 10-2 г/лВеличина 1,68 • 10~2 г/л хорошо согласуется с найденной экспериментально
—1,6 ■ 10~2 г/л, даже без поправок на иоиную силу или гидролиз ионов.В о п р о с ыРассчитайте, используя данные, приведенные на стр. 153, молярную раство¬
римость следующих солей в чистой воде. Выразите ее в грамма^ на литр и
сравните с табличными величинами.1. AgCl.2. MgF2.3. Ag2S04.4. La (Юз)з-Используя величины молярной растворимости, рассчитайте для следующих
солей произведения растворимости.5. Т1С1; S = 1,4 • 10“2 моль/л.6. SrF2; 5 = 8,5 • 10“4 моль/л.7. Се(Ю3); S = 1,85» 10-3 моль/л.8. Ртуть (I) в растворе присутствует только в виде иона Hg2+; поэтому
выражение для произведения растворимости записывают, используя этот ион.
Найдите растворимость приведенных ниже солей (в г/л):а. Hg2S04; K(TB)0 = [Hg2+][SO2-];б. HgjCijj K(TB)0=[Hg22+][cr]2.9. Все гидроокиси металлов, за исключением Mg (ОН) г, либо образуют ком¬
плексные ионы, либо очень хорошо растворимы. Найдите pH насыщенного рас¬
VI. 2. Эффект общего иона153твора Mg (ОН) 2 и объясните, почему он может быть использован без последствий
для нейтрализации избыточной кислотности желудочного сока.Чему равен вес осадка (если он вообще образуется), получающегося при
смешении следующих растворов.10. 20 мл 5,0-10~8Л1 раствора КЮз и 5,0 мл 1,0-10_2Л1 раствора Pb(NOab.11. 1,00 мл l,0-10_3Af раствора NaCl и 1,00 мл 1,0-10_3ЛГ раствора TINO3.12. 1,00 мл 0,1 М раствора NaCl и 10,0 мл 0,01 М раствора AgN03.13. 40,7 мг KF(tb) взбалтывают с 50 мл 0,0070 М раствора СаС12.VI. 2. ЭШШЕКТ ОБЩЕГО ИОНАВ насыщенном растворе соли, подобной BaSC>4, концентрация
ионов определяется произведением растворимости[Ba2+][sor] = tf(TB)0даже тогда, когда в растворе присутствуют и другие соли.Если концентрация одного из ионов возрастает (в результате
добавления ВаСЬ или Na2SC>4), то концентрация другого иона дол¬
жна уменьшаться — иначе нарушится равновесие. Таким образом,
добавление общего иона уменьшает растворимость соли, если, од¬
нако, не происходит образования комплексных ионов в заметных
количествах.Пример VI. 3. Рассчитайте растворимость BaS04 в 1,0-10~2 М растворе ВаСЬ.Запишем выражения:произведения растворимости (при 25 °С)[Ва2+] [SO*-] = 1,1 - Ю-10материального баланса[Ваг+] = 5 + 1,0-Ю-2[sor ] = sПодстановка последних в первое уравнение дает:S(S+l,0-10-2)=l,bl0-I°Растворимость BaSO* в чистой воде ~ 10-5 л«оль/л (см. Пример VI. 1),
а в растворе ВаС12 даже меньше, так что можно пренебречь величиной S по
сравнению с 10'2 в полученном выше уравнении. Тогда5= 1,1 • 10-8и действительно пренебрежимо мала по сравнению с 10_а.Итак, присутствие общего иона существенно понижает растворимость.Рассмотрим теперь в общем виде проблему растворимости соли
в растворах, содержащих общий ион. В качестве примера восполь¬
зуемся BaSC>4, а общим ионом пусть будет SO^-hoh. Примем,
кроме того, что полученный результат применим лишь к солям, в
которых на один катион приходится один анион и в растворах их
комплексообразованием и гидролизом можно пренебречь.
156VI. 2. Эффект^ общего ионаЗапишем условия материального баланса[Ba2+]»S (1)[so’-]=s + c (2)где 5—молярная растворимость BaS04; С—аналитическая кон-, Bat* центрация ЭО^-иона, добавленного
к раствору.Подстановка выражений (1) и
(2) в уравнение для произведения
растворимости[Ba2+][sor] = tf(TB)0 Wдает:S (S + С) = /С(тв) о (4)fg Исходная концентрацияТ .[Р’5,5‘10 моль/лJS~\S- Ю~вноль/л15 40 60 80 100
С, ыкмоль/лРис. VI. 1. Растворимость BaS04
В растворах Na2S04 с аналитиче¬
ской концентрацией С.
Величину S рассчитывали по уравне-
вию (4) для К(ТВ) 0«= 1,10 • 10"*°-Если величина С велика по
сравнению с растворимостью, то в
уравнении (4) значением S, стоя¬
щим в скобках, можно пренебречь
(см. Пример VI. 3):К fan) 0 , .S = —~— (приближенное выражение)(4а)Когда избыток сульфат-иона не¬
велик, ни одним из слагаемых в
уравнении (4) пренебречь нельзя и ответ получается решением
квадратного уравнения (рис. VI. 1).Смешение двух растворовПрежде чем перейти к вопросу о титровании с осаждением,
рассмотрим процесс осаждения соли при смешении двух растворов.
Даже если отношение количеств этих растворов и не является сте-
хиометрическим, общий ионный эффект уменьшает растворимость
соли и приводит к более полному осаждению.Пример VI. 4. 50 мл 3,0 • 10~5 М раствора ВаСЬ смешивают со 100 мл4,5 • 10-s М раствора Na2SOi. Рассчитайте долю бария, осадившегося в виде
BaSC>4.Пусть Р — число молей BaSOt, осадившегося из I л раствора. Тогда усло-форме:[Ва2+] + Р == 3,0-10: 1,0 • Ю-5[SO4-] + Р - 4,5 • JO'5 (ig) = 3,0.10-(5)(6)
Концентрационно-логарифмические диаграммыIS7Уравнения (S) и (6) вместе с выражением для произведения растворимости[Ва2+] [SO*-] = 1,1 • 10—10 (3)составляют систему из трех уравнений с тремя неизвестными. Вычитая условие(5) из (6), исключаем Р[Ва2+] + 2,0 • Ю"5 = [SO2-] (7)а подставляя [SO2-] из уравнения (7) в (3), находим:[Ва2+]2 — 2,00-10-6 [Ва2+] - 1,1 • Ю-10 = 0
Решаем это квадратное уравнение[Ва2+] = 4,5 * 10—6и из уравнения. (5) получаем:Я = 5,5-10“*Поскольку общее количество [Ва2+] = 1,0-10-5 моль/л, то осадившаяся часть
его составляет 55%. Растворимость BaS04 лишь немногим больше 1,0-10~5; таким
образом, без добавления избытка сульфат-иона нельзя было бы достичь заметного
осаждения.Обсуждаемый вопрос близок к определению растворимости BaSOi в2,0-10_3 М растворе Na2S04 (см. рис. VI. 1). Эта концентрация — тот избыток
сульфат-иона сверх требуемого по реакции со всеми Ва2+-ионами, который при¬
водит к полному осаждению.Отметим, что если S исключается с помощью уравнений (1) и (2), а С =
= 2,0 • 10~5, то:[Ва2+] +. 2,0 • 10"5 = [SOJ-]Полученное выражение идентично уравнению (7). Итак, Р — разность между
общей концентрацией бария (1,0-10-5) и растворимостью S = [Ва2+] = 4,5- 10_в.
Поэтому уравнение (5) можно записать в форме:S + Я* 1,0-Ю"6В зависимости от постановки вопроса задача осаждения может быть решена
с использованием либо величин S, либо Р.Концентрационно-логарифмические диаграммыПриведенные в главе V диаграммы можно применять и при
обсуждении вопросов растворимости (рис. VI. 2). Так, выражение:
[Me2+][S04~] — Л(тв) о, записанное в логарифмической формеlg [Ме2+] =■= lg ^Г(тв) 0 + PS04 *описывается прямой линией с наклоном "+1 **.* Логарифмы величин [Ме2+] и [SO2-] взяты с противоположными знаками
(lg [Ме2+] и -Ig[S0f-] = pS04) для того, чтобы диаграммы, построенные
в этих координатах, имели тот же вид, что и диаграммы в главе V.** Для Ag2S04 наклон равен Y*: [Ag+]2 [S04-1 = /С(тв) о и lg[Ag+] == V*igV)» + 1/*pso4.
158* VI. 2. Эффект общего ионаКак следует из рис. VI. 2, последовательность уменьшения рас¬
творимости приведенных солей в чистой воде совпадает с последо¬
вательностью уменьшения величин /С(тв>о- Это — скорей исключе¬
ние, нежели правило, и обу-
[HgSlfsr*-] [ВаЧ словлено оно тем, что все
соли (аз исключением одной)
являются солями двухва¬
лентных металлов и их ионы
в растворе присутствуют в
простой форме.Растворимость соли в
сульфатных растворах на
рис. VI.2 приближенно дает¬
ся линиями произведений
растворимости, расположен¬
ными в левой нижней части
диаграммы; растворимость
же соли в растворах «иона
металла» приближенно опи¬
сывается теми же линиями,
но расположенными в пра¬
вой верхней части (см. При¬
меры VI. 6 и VI. 7).Графический метод дает
приближенные ответы, ког¬
да концентрация общего иона и растворимость в чистой воде поч¬
ти равны (см. Пример VI. 4); в этом случае необходимо приме¬
нять условие материального баланса.Максимальная ошибка (почти вдвое)
появляется тогда, когда С = S. Для
более низких концентраций прибли¬
женный результат совпадает с ре¬
зультатом, найденным для чистой
воды.Рассмотрим несколько примеров
(рис. VI. 3) графических расчетов,
хотя они и не проще численных.Пример VI. 5. Рассчитайте графически раство¬
римость BaS04 в чистой воде.Уравнение для линии [Ва2+] с накло¬
ном +1: lg [Ва2+] = —0,95 + pS04.Для линии [S042 ] наклон равен —1; эта линия проходит через начале коор
динат. В чистой воде [Ва2+] = [SO2-]; точка пересечения дает:pso*Рис. VI. 2. Концентрационно-логарисрмиче-
ская диаграмма для произведения раство¬
римости сульфатов некоторых металлов.Точки пересечения линий Me с Линней SO2- дают
значения растворимостей этих солей в чистой воде:
[Me2+]=[s02-j=s.Рис. VI. 3. Концентрационно-
логарифмическая диаграмма
для растворов BaS04.■ [Ва2-] = [SO2-] = 1,05 • 10-5 моль/лПример VI. 6. Рассчитайте графически растворимость BaSO* в 0,01 Ж рас¬
творе BaClj.
Вопросы159Пренебрежимо малая ошибка появляется, когда в условии материального
баланса[Ва2+] = 1,0* 10-2 + [SO2-]
пренебрегают членом [SO2-]. С учетом этого получаем:[Ва2*] = 1,0 • 10“2; lg [Ва2+] = 2,00 и pS04 = 7,96; т. е.S = [so2-] = 1,1 • 10-8 моль/л.Пример VI. 7. Рассчитайте графически растворимость BaS04 в 1,0 • 10~3 М
растворе Na2S04. Незначительная ошибка появляется, когда в точном условии
материального баланса[SOf-]= 1,0-10_3 + [Ва2+]
пренебрегают членом [Ва2+]. С учетом этого получаем:[SO2-] = 1,0- 10-3; pS04 = 3,00 и lg [Ва2+] = - 6,96; т. е.S = [Ва2+] = 1,1 • 10-7 моль!а.ВопросыИспользуя величины произведений растворимости, приведенные на стр. 153,
решите следующие вопросы.Рассчитайте растворимость:14. PbSOi в 0,05 М растворе РЬ(ЫОз)г.15. PbS04 в 1,0-10-4 Л1 растворе NaNOe.16. PbS04 в 1,0 • 10'3 М растворе Na2S04.17. PbS04 в чистой воде.18. MgF2 в 0,1 М растворе KF.19. MgF2 в 1,0- 10~4 М растворе Mg(NOa)2.20. Рассчитайте долю хлор-иона в 1,0-10~5Л1 растворе NaCl, которая может
быть осаждена при добавлении:а. стехиометрического количества 0,1 М раствора AgNOs равной концентрации;б. 10%-ного избытка того же раствора.21. Навеску 0,451 г AgCl перед прокаливанием и взвешиванием сначала про¬
мыли. Рассчитайте, какое количество навески будет потеряно, если промывание
ведут:а. 200 мл чистой воды;б. 150 мл 0,1 М раствора NH4C1, затем 50 мл Н20;в. 50 мл 0,001 М раствора AgNOs, затем 150 мл 0,01 М раствора HNOs.Рассчитайте вес осадка, образующегося при смешении следующих растворов:22. 25 мл 0,05 М раствора Sr(NOsh и 10 мл 0,15 М раствора Na2S04.23. 1,0 мл 0,10 М раствора AgNOs и 100 мл 0,005 М раствора НС1.24. 0,25 г KF и 250 мл 0,05 М раствора MgCU.25. Таллий следует осадить в виде хлорида. Какой объем 1,0 М раствора НС1
следует добавить к 10,0 мл раствора, содержащего 383 мг таллия, чтобы полнота
осаждения равнялась 99,5%?26. Рассчитайте растворимость Mg(OH)2 в НС1 с pH = 3,50. Каково значе¬
ние pH в насыщенном растворе?27. Рассчитайте количество 0,1 М раствора СНзСООН, необходимого для рас¬
творения 5,83 мг Mg(OH)2, а также pH насыщенного раствора.28. Рассчитайте количество 0,01 М раствора NaOH, необходимого для рас¬
творения 5,83 мг Mg(OH)2, полагая при этом, что комплексообразования не про¬
исходит.29. Рассчитайте растворимость Mg(OH)2 в 0,1 М растворе NH3.
160VI. 8. Разделение соединений осаждением30. Рассчитайте объем буферного раствора, содержащего 0,05 моль NHj и
0,05 моль NHiCl в 1 л, необходимого для растворения 5,83 мг Mg (ОН) г-31. К 10 мл раствора, являющегося 0,2 М по MgClz и 0,4 М по NH4C1, добав¬
лено 5,0 мл 1,0М раствора NH3. Какая часть магния осадится в виде Mg(OH)2?32. Дана ионная соль общего вида Ме2Х„, растворимость которой в чистой
воде So. Покажите, что растворимость S в растворе, содержащем NazX (анали¬
тическая концентрация С), всегда меньше или равна So для любых положитель¬
ных реальных значений С. Учтите, что раствор содержит только следующие иоиы:
Ме»+, X*-, Na+, Н+ 'н ОН'.VI.3. РАЗДЕЛЕНИЕ СОЕДИНЕНИЙ ОСАЖДЕНИЕМ\При дробном осаждении, одном из наиболее старых методов
аналитической химии, в систему вводят реагент, который осаж¬
дает большую часть какого-то одного иона металла, при этом
большая часть других ионов остается в растворе. Простые вычи¬
сления, базирующиеся на величинах констант равновесия, позво¬
ляют найти максимальную степень разделения, достигаемую в дан¬
ных условиях (см. Пример VI. 8).На практике, однако, расчеты иногда не оправдываются, так
как они не учитывают явления соосаждения. Это явление заклю¬
чается либо в механическом поглощении осадком некоторого коли¬
чества раствора, либо в адсорбции поверхностью осадка другого
иона, либо в образовании твердых растворов и т. д.Пример VI. 8. Раствор является 0,01 М по ВаС12 н 0,01 М по SrCl2; к нему
добавляют концентрированный раствор Na2S04. Какой иои осядет первым? Ка¬
кова будет его концентрация, когда начнет осаждаться второй иои?Величины произведений растворимости BaS04 н SrS04[Ваг+] [SO*-] = 1,1 • 10“10 (1)[Sr*+J [SO*-] = 2,8 • 10-*7 (2)справедливы при описании только таких растворов, которые находятся в равно¬
весии с соответствующими твердыми солями. Для, раствора, находящегося в
раниовесии с обеими твердыми солями дробьТК^Г"2'5'10' (3)показывает, что [Sr2+] [Ва2+] (в 2500 раз). Когда первые кристаллы SrS04 по¬
явятся в осадке, то, как следует из соотношения (3), [Ва2+] < 1,0 • 10~3 [Sr2+],
поскольку остальной барий уже осадился в форме BaS04. Если же SrSOt начи¬
нает осаждаться первым[Sr2+] = 0,010и из уравнения (3) имеем:[Ва2+] = 3,8* Ю1*"®Уравнение (3) справедливо, когда добавлено избыточное количество любого
сульфата, необходимое для начала осаждения Sr2+; состав раствора остается
неизменным, поскольку SrS04 и BaS04 осаждаются вместе. Оптимальное разде¬
ление наступает тогда, когда в систему вводят точное стехиометрическое количе-
VI. 4. Осадительное титрование161ство сульфата, необходимое для осаждения всего бария. Можно считать, что в
этот момент твердым является сульфат бария (конечно, следует учитывать со-
осаждение). Концентрации веществ в насыщенном растворе даны выше; только
~0,04% Ва2+ загрязняют раствор Sr2+. Если концентрация рассматриваемого рас¬
твора не будет увеличена, большей очистки этим методом получить нельзя.В весовом анализе этот метод разделения Sr2+ и Ва2+ неприменим, если ие
найден способ, предупреждающий соосаждение. Так, можно применять столь раз¬
бавленные растворы, что для SrS04 точка насыщения не будет достигнута никогда
(см. Вопрос 35), или воспользоваться другим осадителем. В качестве последнего
очеиь часто используют хромат; меняя кислотность среды и добавляя спирт, до¬
биваются еще большего различия величин растворимости хроматов бария и строн¬
ция. Ошибка в данном случае составляет ~0,5%. Однако на практике для столь
трудно разделимых ионов используют более специфические методы анализа, од¬
ним из которых является пламенная фотометрия.Используя данные, приведенные на стр. 153, решите следующие вопросы.33. Дан раствор 0,01 УН по NaCl и 1.0 - 10-3 А1 по NaBr; к нему добавляют
насыщенный раствор AgNOj. Хлорид или бромид натрия осядет первым? Какова
максимальная степень чистоты для раствора второго иона?34. 1,15 г PbS04 встряхивают с 100 мл 0,1 М раствора КЮз до достижения
равновесия. Какая часть PbS04 превратится в твердый РЬ(ЮзЬ?35. Дан раствор 0,01 М по ВаСЬ и 0,01 М по SrCU. Если 100 мл этого рас¬
твора смешать с 200 мл 0,01 М раствора ЫагБО^ какая часть каждого из ионов
выпадет в осадок?Многие ионы, образующие, нерастворимые соли, могут быть
определены титрованием, но при условии, что существует подхо¬
дящий метод установления эквивалентной точки. В данном случае
наиболее подходящей является потенциометрия, однако, не исклю¬
чено и использование индикаторов. Кривая зависимости концен¬
трации иона металла от объема добавленного титранта подобна
рассчитанной для титрования сильной кислоты сильным основа¬
нием (см. раздел IV. 3), поскольку форма математических уравне¬
ний и в том, и в этом случаях одинакова.Пример VI. 9. Концентрацию ионов серебра приближенно можно измерить
потенциометрически, используя серебряный электрод в качестве индикаторного
электрода. Эта концентрация может служить характеристикой достижения конеч¬
ной точки при титровании ионов С1”, Вг или I" нитратом серебра. 50 мл 0,1 М
раствора NaCl титруют 0,1 М раствором AgNOj. Рассчитайте [Ag*] как функцию
объема и постройте кривую титрования.Выражение для произведения растворимости:Условия материального баланса могут быть записаны через объем добавлен¬
ного нитрата серебра V и число молей AgCl, осаждающихся из 1 л раствора, —Р:ВопросыVI. 4. ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ[Ag+] [СГ]= 1,78. Ю-10(1)^+1 + Р=ТТ50-0*1(2)(3)в I». Ш
162VI. 4. Осадительное титрованиеДо точки эквивалентности раствор содержит избыток С1~-ионов; поэтому ве¬
личина [Ag+] пренебрежимо мала по сравнению и с [С1~], и с Р. Принимая это
допущение, можно уравнения (2) и (3) объединить; в результате получаем вы¬
ражение[СП = 4^. 0,150 + 7подстановка которого в уравнение (1) дает:
[Ag*] _ 50 + 7 . 17Я..Л-Э50-71,78*10 (приближенное выражение)(4)Вблизи эквивалентной точки концентрации [С1~] и [Ag+] малы, поэтому урав¬
нения должны быть решены точно. Вычитая уравнение (3) из уравнения (2) —
для исключения Р — и подставляя выраженную через урав¬
нение (1) величину [Ag+], находим:[Ag+] =1,78-10-ю 7-50[Ag+7 + 500,1 (точное выражение)(5)50 и второй член в уравне-80
V.M/7Рис. VI. 4. Кривая
титроиания 50 мл
0,1 М раствора
NaCl 0,1 М рас¬
твором AgN03.К. т.— конечная точка
титрования по Мору.В эквивалентной точке V ■
нии (5) пропадает, т. е.[Ag+] = 1,33- 10~5что соответствует концентрации чистого хлорида серебра
в чистой воде.После эквивалентной точки величина [С1_] становится
малой по сравнению с Р, поскольку присутствует избыток
Ag+. При допущении объединение уравнений (2) и (3)
дает:[Ag*] — у gQ 0,1 (приближенное выражение) (6)Уравнения (4), (5) и (6) использованы при построении рис. VI. 4. Обратите
внимание на то, что кривая титрования в области эквивалентной точки изменяет¬
ся очень круто. Это означает, что даже если потенциометрическая точность опре¬
деления [Ag+] составляет только 20% (0,1 единицу pAg), конечная точка опре¬
деляется хорошо в пределах точности любой используемой бюретки. Даже в
случае применения «грубых» индикаторных методов кривая титрования все равно
остается достаточно крутой. К таким методам относятся титрования по Мору
(см. Пример VI. 10) и Фольгарду (см. Вопрос 40).Ошибки титрованияТочное уравнение кривой титрования имеет тот же вид, что и
для случая титрования сильной кислоты сильным основанием. Так,
при титровании Vo мл NaCl (концентрация С0) V мл AgNOe (кон¬
центрация С) условия материальных балансов таковы:CV[СГ] + Р>С о7о[Ag+] + Р ■■7 + 70 “ l“6 J 1 ‘ 7 + 70Используя понятие титровальной доли — Ф = CV/CV0—и исклю¬
чая из условий материального баланса величину Р, получаем с уче-
Ошибки титрования 163том? выражения для произведения растворимости [Ag+][C1~] = /С(ТВ)о
уравнение кривой титрования:СЛ (ф-1)_|А»Ч-5& (7)V + v0 v J [AgУравнение (7) может быть использовано для расчетов ошибки
титрования. Вблизи эквивалентной точки разумно допустить, чтоV СV + Vo С + С0а это приводит к следующему выражению для ошибки титрования:с + С0 / /С (тв) о \Уравнения (7) и (8) применимы для солей, у которых заряды
катиона и аниона равны (Hg2S04, PbS04, AgSCN), а раствори¬
мость определяется только произведением растворимости. Любая
из указанных на стр. 153 солей подчиняется приведенным соотно¬
шениям, поскольку комплексообразование вблизи эквивалентной
точки для них пренебрежимо мало. В случае высоких концентра¬
ций галоген-ионов кривая титрования для галогенидов серебра
имеет несколько иной (по сравнению с другими солями) вид; вы¬
звано это тем, что часть галоген-ионов связывается в комплексы
и, например, величина [С1“] делается меньше аналитической кон¬
центрации хлорида.Для случая обратного титрования ионов Ag+ хлоридом знаки
слагаемых в правой части уравнений (7) и (8) меняются на проти¬
воположные:л , С0 + С ( /С(тв)о г,_л ^
фк-т~ 1 -~С^С~ 1"[АГ 1к.Т “ 1 S кт/Пример VI. 10. В методе определения хлоридов по Мору 50 мл 0,1 М раство¬
ра NaCl титруют 0,1 М раствором AgNC>3; в качестве индикатора добавляют 1 мл
0,1 М раствора К2СЮ4. Появление красного осадка Ag2Cr04 указывает на окон¬
чание титрования. Вычислите ошибку титрования.Произведение растворимости хромата серебра *:[Ag+]2 [СгО2-] = 1,1 • 10~12Если произведение растворимости Ag2Cr04 будет превышено, появится крас¬
ный осадок. Так как [СгО|~] = 1,0 • 10~3, конечная точка наступит, когда[Ag+]K. т = 3,3 • 10“5* Строго говоря, в расчеты необходимо включить и НСгО", и Сг202-. Хотя
пренебрежение последними и увеличивает ошибку не более чем в два раза, оно,
однако, существенно упрощает задачу (см. разделы VI. 6 и X. 3).6*
164VI. 4. Осадительное титрованиеЭто значение (pAg = 4,75) и значение эквивалентной точки (pAg = 4,88)
представлены на рнс. VI. 4: конечная точка достигается вскоре после эквивалент¬
ной.Для вычисления ошибки титрования положим: [Ag+]B. т = 3,3-10~5;
Со = С = 0,1; тогда уравнение (8) дает:Эта ошибка меньше полученной в результате небрежности отсчета показаний
бюретки. Итак, общая ошибка титрования 0,1%.В более разбавленных растворах ошибку можно уменьшить, если раствор
нитрата серебра стандартизировать по известному количеству (взвешенному)
хлорнда натрия. Это устраняет систематическую склонность к завышению зна¬
чений конечной точки.Эффект, который также оказывает существенное влияние в случае разбав¬
ленных растворов (мы не можем здесь рассмотреть его подробно), заключается
в том, что количество образованного Ag2Cr04 должно быть достаточно большим,
чтобы осаждение стало наблюдаемым. А это требует добавления некоторого из¬
бытка титранта против того количества его, которое соответствует рассчитанной
конечной точке.Если при титровании появляются несимметричные соли типа
Ag2S04 и Hg2Cl2, уравнение кривой титрования приобретает иной
вид. При условии, что вблизи эквивалентной точки не образуются
в заметных концентрациях комплексные соединения, ошибка тит¬
рования при взаимодействии ионов SO|- и Ag+ может быть опре¬
делена по уравнениюгде С — нормальность раствора сульфата.При титровании двухвалентного металла одновалентным анио-прежний вид, а уравнение ошибки титрования — следующий:В «симметричном» титровании точка максимального наклона
(т. м.н) совпадает с эквивалентной точкой. Это можно показать
дифференцированием уравнения (8)—для получения производной
dpAg/dtf), дающей наклон вблизи эквивалентной точки:Фк.т- 1=5,5-ИГ4Несимметричные" титрованияном, например Hg2+ и СГ, уравнение кривой титрования имеет(10)Точка максимального наклона
Точка максимального наклона165Точке максимального наклона отвечает условие равенства про¬
изводной нулю; дифференцируя приведенное выше уравнение, по¬
лучаем для этой точки выражение[Ag+]2 = /Г(тв)0которое является точным, соотношением для эквивалентной точки.
Иными словами, точки максимального наклона и эквивалентная
для симметричного титрования совпадают.Для несимметричного титрования рассматриваемые точки не
совпадают. Дифференцирование уравнения (9) дает:<^pAg л ^ СоС [ ' _ К(тв)о |dO С„ + С ([Ag+] + 4 [Ag*]2 )Точка максимального наклона может быть найдена дифферен¬
цированием уравнения (11) и приравниванием нулю полученного
результата; это дает:[Ag+]3 = 8/C(TB)o (12)Эквивалентной же точке, т. е. условию Ф = 1 для уравнения
(9), соответствует равенство:[Ag+]3 — 2/С(тв)о(12а)Как следует из рис. VI. 5, а, при титровании 0,5М раствора
сульфата 1,0 М раствором Ag+'Ионов точки максимального наклона9о.•нфРис. VI. 5. Наклон кривой титрования (а) и кривая титрования (б) 0,50 М ра¬
створа S04”-hohob 1,0 М раствором Ag+-HOHOB.При построении кривых в расчетах принято К(тв)0=1-65 ■ 10~5! С0=С=1,0.и эквивалентная не совпадают: для первой pAg = 1,30, для вто¬
рой pAg — 1,50. Объем титранта, соответствующий точке макси¬
мального наклона на 7,5% больше объема, отвечающего эквива¬
лентной точке. Принимая точку максимального наклона за конеч¬
ную, получаем ошибку в 7,5% •Как раз так и поступают в потенциометрическом титровании.
Для симметричного титрования это, по всей вероятности, наиболее
T6SVI. 4. Осадительное титрованиеточный метод определения конечной точки. В случае несимметрич¬
ного титрования такое предположение ведет к систематической
ошибке. Последнюю можно «скомпенсировать» расчетами по вы¬
шеприведенным уравнениям.Какая из точек (конечная или эквивалентная) наступает рань¬
ше, зависит от реагентов. Так, при титровании двухвалентного
иона одновалентным (SO4 и Ag+, рис. VI. 5, б) эквивалентная точ¬
ка появляется первой; при титровании же одновалентного иона
двухвалентным (СГ и Hg2+) первой является конечная точка.Ошибка титрования, появляющаяся за счет отождествления
конечной точки и точки максимального наклона, может быть опре¬
делена по выражению (13), которое получается при подстановке
условия максимального наклона (12) в уравнение (9):®к.,-1-±4-£гг£<а). <13>Положительный знак полагают при титровании двухвалентного
иона одновалентным, а отрицательный — в противоположном ва¬
рианте. Этим уточнением можно пренебречь, когда /С(Тв>о < 10~14;
однако это — редкий случай. Применяя условие (13), следует по¬
мнить, что /С(тв)о — концентрационная константа равновесия, т. е.
она выведена для ионной силы раствора при эквивалентной точке.Вопросы36. Рассчитайте ошибку титрования в Примере VI. 10 при условии, что крас¬
ное окрашивание ие станет видимым до тех пор, пока вес AgaCrOi не превысит
на 0,1% вес AgCl.37. В потенциометрии для определения конечной точки применяют ртутный
электрод. 25 мл 0,1 М раствора NazSOi титруют 0,1 М раствором Hg2(N03)2;
рассчитайте зависимость [Hg^J от добавленного объема и постройте кривую ти¬
трования. Какова ошибка титрования, если точность определения lg [Hg2+j с0*
ставляет 0,1? Для Hg2SO* величина /((tbjo = 6,8- 10~7.38. Выведите уравнения, подобные выражениям (9), (11) и (13) для ошибки
титрования иона SO*- ионом Ag*. Дано: 1,0 М раствор AgN03 для титрования
0,5 М раствора Na2SOi. Примем, что конечная точка является точкой максималь¬
ного наклона /С(тв>о = 1,6 • 10~5. Определите ошибку титрования. При условии,
что pAg может быть измерена с точностью 0,05, какова минимальная ошибка
титрования, если уточнение конечной точки проводить по уравнению (13)?39. Покажите, что ошибка титрования, проистекающая из отождествления
конечной точки и точки максимального наклона, может быть определена по урав¬
нению (13) для титрования иона С1~ ионом Hgj+. Рассчитайте эту ошибку для
0,1 М растворов СГ- и rig^-HOHOB; для Hg2Ci2 величина л<тв)о = 1,3- 10 13.40. В методе определения С1“-иона по Фольгарду известное количество стан¬
дартного раствора нитрата серебра добавляют к неизвестному раствору. После
отделения осадка AgCl избыток AgN03 оттитровывают KSCN. Конечную точку
обратного титрования определяют по индикатору—иону Fe3+, так как незначи¬
тельный избыток SCN'-иона образует с Fe3+ красные комплексы.
VI. 5. Сложности при расчетах растворимости16?В обычном варианте титрования на 20 мл 0,1 М раствора необходимо 30 мл
0,1 М раствора AgNOj; раствор некоторое время кипятят — для коагуляции AgCl,
а потом отфильтровывают и промывают осадок на фильтре 30 мл разбавленной
HN03; промывные воды соединяют с фильтратом. Затем к получившемуся рас¬
твору добавляют 1 мл 0,5 М раствора Ре(МОз)з и титруют 0,02 М раствором
KSCN до появления первой непропадающей красной окраски ([SCN~] = 10-5).Рассчитайте ошибки, получающиеся в результате промывки и введения инди¬
катора для определения конечной точки обратного титрования. Сравнимы ли этн
ошибки с теми, которые проистекают при определении объема, если наименьший
учитываемый объем равен 0,01 мл? Почему для точного ответа необходима от-,
мывка хлорида серебра перед проведением обратного титрования? Условия: ве¬
личина р/С<тв)о равна 9,75 для AgCl и 12,0 для AgSCN.41. Смесь хлорида, бромида и иодида потенциометрически может быть
успешно оттитрована нитратом серебра с использованием серебряного электрода.
Раствором 0,1 М AgN03 титруют смесь, содержащую: 0,1 моль С1“, 0,05 моль
Вг- и 0,2 моль 1' в 1 л. Рассчитайте [Ag+] как функцию добавленного объема и
постройте кривую титрования. Учтите, что AgBr начинает осаждаться до экви¬
валентной точки для Agl и на кривой в этом месте возникает разрыв. Подобный
же разрыв появляется в момент начала осаждения AgCl. Какова ошибка титро¬
вания, если за величину конечной точки принять значение, соответствующее этим
разрывам? Условия: величина р/С<тв>о равна 9,75, для AgCl, 12,28 для AgBr и
16,08 для Agl.VI. 5. СЛОЖНОСТИ ПРИ РАСЧЕТАХ РАСТВОРИМОСТИЧисло случаев, когда растворимость ионной соли может быть
рассчитана с привлечением только величины произведения рас¬
творимости, составляет лишь малую долю от встречающихся на
практике. Кроме того, растворимость зависит от многих других
факторов, которые следует учитывать при вычислениях.Одним из них является ионная сила раствора (см. раздел II. 4).
Добавление инертного растворителя (типа KN03) к насыщенному
раствору слаборастворимой соли (типа AgI03) незначительно уве¬
личивает растворимость последней (см. рис. II. 7, стр. 49). В раз¬
бавленных растворах (С<0,1М) этот эффект может быть легко
учтен использованием коэффициентов активности (см. главу XII).
Для растворов с С> 1,0 М теоретическое предсказание коэффици¬
ентов активности не так эффективно, особенно для смеси электро¬
литов. Именно по этой причине сначала необходимо эксперимен¬
тальное изучение концентрированной ионной солевой системы, что
позволит сделать какие-то количественные выводы относительно
растворимости.Даже в разбавленных растворах между ионами существуют
равновесия, отличные от равновесий, связанных с растворимостью.
А это означает, что растворимость определяется не только вели¬
чиной произведения растворимости, но и другими равновесными
факторами.Так, при взаимодействии катиона или аниона с водой возни¬
кают гидроксокомплексы или протонированные анионные частицы.
Обычно гидролиз аниона легко учитывается, поскольку константы
тVI. 6. Растворимость солей слабых одноосновных кислотдиссоциации большинства слабых кислот известны. Учесть влияние
гидролиза катионов трудней, ибо переходные металлы образуют
более сложные системы гидроксокомплексов и константы равнове¬
сий для таких систем либо очень приблизительны, либо неизвестны
вовсе. Анионный гидролиз более существен в кислых растворах,
а катионный — в основных. Но и тот и другой «выводят» ионы
соли из раствора и тем самым увеличивают растворимость соли по
сравнению с вычисленной из величины произведения раствори¬
мости.К тому же эффекту, приводит комплексообразование между
катионом и анионом соли, особенно в случае избытка одного из
ионов. Наиболее значителен он в растворах галогенидов серебра
и меди; образование же ионных пар происходит в растворах даже
таких солей, как СаИг и CaSCU.Кроме того, добавление других солей в качестве осадителей
или регуляторов pH может привести к комплексообразованию с
интересующим нас ионом. Это в свою очередь увеличивает раство¬
римость осаждаемой соли.Учет перечисленных побочных реакций возможен лишь при на¬
личии разнохарактерных сведений о равновесии и требует иногда
весьма сложных вычислений. Во многих случаях необходимые ве¬
личины можно найти в таблицах констант стойкости.VI. 6. РАСТВОРИМОСТЬ СОЛЕЙ СЛАБЫХ ОДНООСНОВНЫХ КИСЛОТВ качестве первого этапа рассмотрения сложных равновесий
при вычислениях обратимся к эффекту кислотности в случае рас¬
творимости солей слабых одноосновных кислот. При растворении
соли МеА в воде возникают ионы -МеА (тв.) Ме+ + А”и равновесие подчиняется условию произведения растворимости:[Ме+] [А-] = /С(Тв)оЕсли'А~— анион слабой кислоты, то он реагирует с образова¬
нием недиссоциирующей кислотыА" + Н+ ^=± НАи равновесие подчиняется уравнению для константы ионизации
слабой кислоты:[Hi [А'] = Ка [НА]По мере увеличения кислотности раствора все больше айионов
Превращаются в недиссоциирующую кислоту и растворимость соли
возрастает. Итак, соли слабых кислот более растворимы в кислых
растворах, нежели в нейтральных.
VI. 6. Растворимость солей слабых одноосновных кислот 169В табл. VI. 1 приведены многие соли из указанных на стр. 153,
потому что количество недиссоциирующей кислоты, образующейся
в нейтральных растворах, незначительно.Таблица VI. 1Произведения растворимости солей слабых одноосновных
кислот и константы ионизации последних*СольPK(tb)0PKa"СольPK(tb)0PKa "Равнозарядные ионыНеравнозарядные ионыAgAc 2,404,75Ag2S04 ....4,801,99TIN, 3,664,72BaF2 5,763,17CuCr04 5,446,55Pb(CH02)2 . . .6,703,75Hg2S04 6,171,99Cu(I03)2 ....7,130,79SrS04 6,551,99MgF2 8,183,17AgI03 7,520,79SrF2 8,543,17PbS04 7,801,99CaF2 10,403,17AgN3 8,544,72Ag2Cr04 ....11,956,50Hg2Cr04 ....8,706,50Tl2Cr04 ....12,016,50BaCr04 9,936,50Pb(I03)2 ....12,590,79BaS04 9,961,99Ce(I03)3 . . . .9,500,79PbCr04 13,756,50La(I03)3 • . • .11,210,79* Величины констаит экстраполированы к нулевой иоииой силе.** Величина ТС характеризует ионизацию групп: HSO” —для сульфатов; НСгО**—для
а 4 4хроматов. В концентрированных растворах следует учитывать димеризацию до Сг Оу“(см.раздел Х.З).Рассмотрим несколько примеров растворимости ацетатов сере¬
бра в растворах, содержащих различные количества сильной кис¬
лоты. Строгое рассмотрение требует учета эффекта ионной силы,
концентраций комплексов ацетата и гидроокиси серебра, а также
возможности осаждения окиси. Ради простоты, однако, все пере¬
численные факторы не будут учтены и вычисленная растворимость
окажется заниженной по сравнению с истинной.Пример VI. 11. Рассчитайте растворимость ацетата серебра в воде. Сравните
полученный результат с величиной растворамости, вычисленной в предположении
отсутствия гидролиза ацетат-ионов. Те же уравнения использованы и в Приме¬
ре VI. 12, где к воде добавлена азотная кислота; по этой причине в данном при¬
мере в уравнения включена величина [NO“], хотя она и равна 0.Запишем уравнения условий:равновесий[Н+] [Ас'] = 1,75 • 10~5 [НАс] (1)[Н+][ОН"]= 1,00- 1<Г14 (2)[ Ag+] [Ас“] = 4,00 • (3)
170VI. 6. Растворимость солей слабых одноосновных кислотэлектронейтральности и материальных балансов[Н+] + [Ag+] = [ОН-] + [Ас-] + [NOgJ (4)[Ag+] = S (5)[Ac-] + [НАс] = S (6)[N07] = С (7)В этих уравнениях: S—молярная растворимость ацетата серебра; С — ана¬
литическая концентрацяя НМОз- Протонное условие может быть получено комби¬
нацией приведенных соотношений. Так, если [Ag+] и [Ас] — две большие величи¬
ны— исключить из уравнения (4) подстановкой из уравнений (5), (6) и (7),
получим[Н+] + [НАс] = [ОН'] + С (8)Рассчитаем сначала растворимость AgAc в воде, пренебрегая гидролизом.
Если величина [НАс] пренебрежимо мала по сравнению с S, то уравнения (5)
и (6) дают:[Ag+] = [Ас-] = S
Сочетая это выражение с уравнением (3), имеем:S2 = 4,0-10 3; [Ag+] = [Ac"] = S = 6,3-10~2 (9)В чистой воде реакция ацетат-иона с водой приводит к защелачиванию рас¬
твора. Если величина [Н+] пренебрежимо мала по сравнению с [ОН-], а С = О,
то уравнение (8) принимает простой вид:[НАс] = [ОН-] (8а)Разделив уравнение (2) на (1) и подставив соотношение (8а), получаем:
[ОН-]2 = 5,7 -Ю-10 [Ас-]Используя уравнение (9), т. е. допущение, что [НАс] < [Ас-], имеем:[ОН-] = 6,0-10_6
Окончательно из уравнений (2) и (8а) находим:[Н+]= 1,6-10-9; pH = 8,78
[НАс] = 6,0- 10-6Следует отметить, что величины [РГ], [ОН-] и [НАс] пренебрежимо малы по
сравнению с S, а это указывает на удачно принятые допущения. Величина рас¬
творимости ацетата серебра в чистой воде не отличается от вычисленной с допу¬
щением отсутствия гидролиза *.Пример VI. 12. Рассчитайте растворимость СНзСООАд в 0,1 М растворе
HN03. В данном случае положение иное: поскольку раствор сильнокислотный,
величина [ОН-] пренебрежимо мала по сравнению [Н+]. Принимая это допущение
и подставляя уравнения (5) и (7) в уравнение (4), получаем:[Н+] + S = [Ас-] + 0,1 (4а)* Строгие расчеты (см. Вопрос 32, раздел VIII. 3, стр. 247) дают: S = 8,6Х
X Ю-2 моль/л и pH = 7,47. Различие величин растворимости вызвано, в первую
очередь, образованием уксусно-серебряных комплексов; различие же величин pH
обусловлено преимущественно осаждением 5,95 • Ю-5 моль Ag20 на 1 4,
VI. 6. Растворимость солей слабых одноосновных кислот171Комбинация уравнений (3) и (5) дает:S [Ас-] = 4,0 • 10“3 (10)Другими соотношениями, связывающими четыре неизвестных — [Н+], [Ас-],
[НАс] и S, — являются:[Н+] [Ас-] == 1,75- 10“6 [НАс] (1)[Ас-] + [НАс] = S (6)Совместное решение уравнений (1) и (6) позволяет исключить величину
[НАс]:[Н+] [Ас-] = 1,75 • 10-s (S - [Ac-]) (11)Итак, мы имеем три уравнения — (4а), (10) и (11) — с тремя неизвестными.
Решая уравнения (11) и (4а), исключаем величину [Н+], а подстановка резуль¬
тата в уравнение (10) дает:(1,75 • 10“5) ( —- — А + S = 4,0 * Ю -3- + 0,1\ 4,0 • 10 / 5(12)Полученное уравнение — кубическое относительно S. Наиболее простым ме¬
тодом решения в данном случае является применение разумных допущений. Если
растворимость CH3COOAg в азотной кислоте та же, что и в чистой воде, первый
член уравнения (12) равен нулю. Положим, что растворимость мала, и пренебре¬
жем ею в первом приближенииS=i^!+0,iоткудаS = 0,130Для получения лучшего решения воспользуемся сделанным допущением и
выразим численно малый член уравнения (12):5,5- 10~5 + S=* 4,0‘J0 3 +0,1Решение этого соотношения дает то же значение S:S = 0,130Итак, растворимость ацетата серебра в 0,1 М растворе HNOj примерно вдвое
превышает его растворимость в чистой воде. Поскольку значительная часть азот¬
ной кислоты реагирует с образованием недиссоцинрующей уксусной кислоты, pH
насыщенного раствора будет больше 1. Уравнения (10), (6) и (1) дают:[Ас-] = 3,08- 10“2
[НАс] = 0,130 - 0,031 = 0,099
[Н+] = 5,62 • 10~5; pH = 4,24
172VI. 6. Растворимость солей слабых одноосновных кислотОбщие соотношенияРассматриваемый нами вопрос о растворимости солей слабых
кислот является частью более общей проблемы. Для соли МеА, где
А" — анион слабой кислоты НА, существуют следующие равно¬
весия:[Н+] [А-] = Ка [НА] (1)[Н+][ОН1 = /Сн2о (2)[Ме+] [А~] —К(тв)о (3)Для растворимости соли МеА в растворах сильных кислот с
концентрацией С имеются условия:материальных балансов[Ме+] = S (5)[НА] + [А-] = S (6)Протонное[Н+] + [НА] = [ОН~1 + С (8)Комбинируя уравнения (3) и (5), находим:[А',—(10)Совместное решение уравнений (1), (б) и (10) дает:S2 = *( тв)о(1+-И) - (13)Соотношение (13) выражает растворимость соли МеА как
функцию [Н+]. Отметим, что, когда [Н+]//Са < 1 — случай растворов
малой кислотности и нерастворимых солей сильных кислот, рас¬
творимость не зависит от [Н+], т. е. гидролиза аниона как будто
нет.Уравнение (13) при /Qtbmj = 4,0-10~3 и Ка = 1,75-10-5 дает ли¬
нию насыщения S для ацетата серебра (рис. VI. 6).Если растворимость определена экспериментально в буферных
растворах с известным pH, уравнение SZ = /([H+]) (рис. VI. 7)
имеет вид прямой линии с наклоном К^В)о/Ка, Пересекающей орди¬
нату в точке /С(тв)о. Подобная серия опытов может быть использо¬
вана для определения /С(ТВ)о и Ка, если отсутствуют осложняющие
обстоятельства.Те же уравнения применимы для определения pH ненасыщен¬
ных растворов CH3COOAg в сильной кислоте с аналитической кон¬
центрацией соли S'. Уравнения (1), (6) и (8) дают:(14)
Общие соотношения173Поскольку не учтено произведение растворимости [уравнение
(3)], соотношение (14) пригодно как для насыщенных, так и для
ненасыщенных растворов.Реальные растворы с концентрацией S' могут быть приготов¬
лены для любого состава, расположенного выше линии S
(рис. VI. 6) (Sl^sS'), и семейство кривых S' для различных зна¬
чений С позволяет найти значение pH, обусловленного диссоциа¬
цией S' моль ацетата серебра в 1 л HN03 концентрации С. Инте¬
ресно, что S'-кривые похожи на кривые титрования. ДобавлениеРис. VI. 6. Растворимость ацетата
серебра в растворах с известйым pH.
Область осаждения ограничена линией рас¬
творимости S; ^'-кривые характеризуют pH
ненасыщенных растворов ацетата серебра
концентрации S' в сильной кислоте кон¬
центрации С; пересечение S'-кривых с ли¬
нией S определяет растворимость ацетата
в сильной кислоте концентрации С.Рис. VI. 7. Определение
величин К(тв) о и Каяз экс¬
периментально найденных
значений растворимости.твердого ацетата серебра к азотной кислоте нейтрализует ее так,
что S'-кривые могут характеризовать pH как функцию добавлен¬
ных количеств соли. Точка перегиба на кривых соответствует усло¬
вию S' — С, т. е. как бы является эквивалентной точкой титрова¬
ния.Пересечение линий S' и S определяет растворимость и pH на¬
сыщенных растворов для любого значения С. Так, пересечение
этих линий для С = 0 дает: S = 6,3-10-2 и pH = 8,78 (ответ на
Пример VI. 11). Отметим, что поскольку S-кривая почти горизон¬
тальна в этой области, величина растворимости будет подобна вы¬
численной в предположении отсутствия гидролиза. Пересечение
линий для С = 1 дает ответ на Пример VI. 12: S = 0,130 и
pH = 4,24.Совершенно необязательно, однако, строить S'- и S-кривые
для определения растворимости ацетата серебра в азотной кислоте
концентрации С. Достаточно решить уравнение (13) для [Н+], а за¬
тем подставить найденное значение в уравнение (14), полагая
174VI, 6. Растворимость солей слабых одноосновных кислотS' = 5. Так, можно найти зависимость S от С:п / с2 г \ ' ^Н2О^(тв)0 /1СЧ( ТВ)° Т^Г + Т “ Ка (S2 — /С(тв)о) ( 5)Уравнение (15) может быть получено и непосредственно — че¬
рез уравнения (1) и (8). Более удобное графическое построениеуравнения (15) достигается тем, что вы¬
бирают серию значений для 5 и С. На
рис. VI. 8 точки а и b соответствуют точ¬
кам пересечения S'- и 5-кривых на рис.VI. 6.Хотя график 52=/[Н+] является стро¬
го прямой линией, зависимость S2 —
= f(C) будет прямолинейной только для
S <; С, т. е. уравнение (8) аппроксими¬
руется условием С = [Н+]. Последнее,
однако, возможно, если Ка велико, а
Л^(тв)о мало. В противном случае прямая
искривляется и описывается уравнением(15). Действительно, как следует из рис.VI. 8, для больших значений С величи¬
ны S х С. Таким образом, при экспери¬
ментальном определении /С(Тв)о и Ка лучше измерять S в растворах
с известным pH, чем в растворах с известной величиной С силь¬
ной кислоты.Вывод уравнения (15) зависел от условия, что уравнение (13)
является линейным относительно [Н+]. В случаях многоосновных
кислот подобное уравнение является квадратным или кубическим
относительно [Н+] и метод пересечения кривых наиболее прост при
вычислениях 5 как функции С.ВопросыПри ответе на вопросы используйте данные табл. VI. I.42. Рассчитайте растворимость ацетата серебра в 1,0 • 10~2 М растворе НЫОз
н pH насыщенного раствора. Проверьте результат сравнением с данными
рис. VI. 6 и VI. 7.43. Рассчитайте растворимость фторида бария в чистой воде и pH насыщен¬
ного раствора. Сравните с растворимостью, рассчитанной с привлечением только
величины произведения растворимости. Совпадает ли найденный результат с дан-
иыми, приведенными на стр. 153.44. 10,0 мл 1,0-10~2Л1 раствора SrCb смешивают со 100 мл 0,1 М раствора
HF. Рассчитайте число осадившихся молей SrF2 и концентрацию ионов Sr2*+,
оставшихся в растворе. Какая часть осадка растворится при разведении раствора
до 1 л?45. Весовое определение свинца основано на осаждении формиата свиица
РЬ(СН02)2 с последующим прокаливанием его до окиси. Сколько миллилитров
1,0 М раствора НСООН следует добавить к 50 мл раствора, содержащего 215 мг
Pb2t, чтобы осаждение было 99,9%-ным?Рис. VI. 8. Растворимость
ацетата серебра в сильной
кислоте концентрации С.а и 6 —точки пересечения линии
насыщения (VI. 6) с S'-кривыми
для С=0,1 и С=0,01 моль!Л.
Вопросы17546. Рассчитайте растворимость Ag2CrOi в чистой воде и pH насыщенного
раствора. Для простоты пренебрегите величинами [AgOH], [Сг2072-] и [нСг207],
но не [нею;].47. При каком pH растворимости AgN3 и AgI03 одинаковы и чему они
равны?48. Какова ошибка при вычислениях растворимости BaS04 в 0,1 М растворе
HN03, если пренебречь величиной [HSO~]?49. Выведите общую формулу, связывающую растворимость соли^еАг сла¬
бой кислоты с Ка в растворе с заданным pH, через произведение растворимости
/С(тв)о этой соли. Равны ли растворимости РЬ(СН02)г и СиЮ3 при некотором
данном значении pH?50. При условии [Н+] < Ка через величины /С(Тв)о и Ка выведите формулу,
выражающую растворимость и pH насыщенного раствора соли МеА слабой кис¬
лоты НА в чистой воде.51. Если концентрация слабой кислоты в растворе С а = [НА] + [А*], а кон¬
центрация иона металла Сме = [Ме+], то для данного pH в насыщенном растворе
соли МеА, содержащем один из общих ионов, справедливо соотношение:
СлСме = К(тв)у. Величину К(тв)У называют условным произведением раствори¬
мости-, она является функцией pH. Выразите К(тв>у через K^tyi, Ка и [Н+].
Постройте кривую 7\(тВ)у =— f(pH) для CH3COOAg.52. Выведите точное уравнение для растворимости соли МеА2 в растворе
сильной кислоты, аналитическая концентрация которой С. Постройте кривую
S = f(C), как это сделано на рис. VI. 8 для РЬ(СНОг)г.
Глава VIIМНОГООСНОВНЫЕ КИСЛОТЫ
VII. 1. СТУПЕНЧАТАЯ ДИССОЦИАЦИЯДо сих пор мы детально рассматривали только те кислоты, ко¬
торые при ионизации образуют один ион водорода. Однако многие
кислоты образуют при ионизации два и более иона водорода; их
называют многоосновными кислотами. Поскольку отщепление од¬
ного иона водорода от молекулы кислоты описывается соответ¬
ствующим уравнением равновесия, то для многоосновной кислоты
всегда будет столько констант равновесия, сколько имеется атомов
Водорода, способных к ионизации. В табл. VII. 1 приведены кон¬
станты ионизации для некоторых многоосновных кислот; они зави¬
сят от структуры молекул, причем константа ионизации второго
атома водорода меньше или равна константе ионизации первого, и
лишь в очень редких случаях больше ее. Такого рода исключением
является гидратированный ион ртути Hg(H20)2+, рассматриваемый
в разделе VIII. 3.Фосфорная кислота Н3РО4 диссоциирует в три стадии; поэтому
существуют три константы ионизации, соответствующие следую¬
щим равновесиям:Н3Р04 Н2РО:+Н+ [Н+] [Н2Р07] = Ка1 [Н3Р04]н2ро: нро*- + н+ [н+] [hpoJ-] = ка2 [н2ро;]HPOf 5=? POJ- + H+ [Н+][Р034-] = Каз[НР0*-]Структура молекулы фосфорной кислотыОНIНО—Р=0IОН(мтпамтМVi4.ij.UwF/показывает, что удаление одного из протонов сообщает остатку
молекулы отрицательный заряд, распределенный поровну между
атомами кислорода. Это значит, что удаление второго протона
затруднено и еще более трудным оказывается удаление третьего
VII. 1. Ступенчатая диссоциация177Таблица VII. I
Константы ионизации многоосновных кислот*КислотаФормулаР*«РКа2РУгольнаяДвухосновные кислотысо2+н2о6,3510,25Сероводо¬H2S7,0012,92 роднаяСеленисто¬H2Se3,8911,00 __водород¬наяТиосернаяh2s2o30,601,72——ЩавелеваяО ОII IIНО—С—С—ОН1,254,28Виннаяо н ноно—с—с—с—с—он
1 13,044,37Сукциновая1 1
он оно оII II
но—с—сн2—сн2—с—он4,195,48Адипиноваяо оII IIНО—с—СН,—CHj—сн2—сн2—с—он4,425,41ФталеваяоПг"-°н2,952,235,417,21Ортофос-—с—он
IIОТрехосновные кислотын3ро412,32форнаяОртомышья-H3ASO42,226,9811,53ковая* Величины констант экстраполированы к нулевой ион рой силе.
178VII. 1. Ступенчатая диссоциацияПродолжениеКислотаФормулаРЯд2Р*йзр*«Четырехосновные кислотыПирофос-Н4Р2071,522,366,609,25форнаяо он оЛимоннаяII 1 IIНО—С—СН2—С—СНг—С—ОН2,944,145,8216,00|0=С—ОНЭтилёидиа-о о1,992,676,1619,26минтетра-II IIуксуснаяно—с—сн2 СН2—С—ОН(ЭДТ А)СН2—СН2—но—с—сн3 сн2—с—онII IIо опротона. Подтверждение этому мы находим в последовательном
увеличении констант ионизации:ptfai = 2,33; рКа2 = 7,21; рКвз = 12,32Величина каждой последующей константы составляет 1/100 000
от предыдущей. Эта закономерность является общей для тех кис¬
лородсодержащих кислот, у которых все ОН--группы связаны с
одним и тем же атомом.Если оба протона связаны с одним и тем же атомом, вторая
константа ионизации может составлять даже меньше, чем 1/100 000
от первой. Так, от молекулы воды второй протон вообще не отщеп¬
ляется; для селенида водорода отношение второй константы к пер¬
вой составляет 10-7, а для сероводорода — 10-6.Характерная особенность угольной кислоты состоит в том, что
лишь малая часть двуокиси углерода, растворенной в воде, суще¬
ствует в виде двухосновной кислоты Н2СОз- В разбавленных рас¬
творах равновесие гидратацииН^О + СОг ;Н2С03; К* = = 2,6'10-3устанавливается намного медленнее (0,1 сек) по сравнению с рав¬
новесием ионизации (10~в сек):[Н+][НС07]xfllн,со,НСО-HC03-+H+; Kl
СО,” + Н+; Каг-' [Н2С03][н+] [со*-]IHCO-J= 1,7-10-4= 5,6-10'
Распределительные диаграммы179По этой причине равновесие ионизации можно изучать методом
быстрой струи, не нарушая существенно равновесие гидратации, и
найти отдельные константы равновесия. Однако вследствие того,
что неравенство [Н2С03] < [С02] не зависит от концентрации и pH,
величиной [Н2С03] обычно пренебрегают в вычислениях. Первая
константа ионизации угольной кислоты, приведенная в табл. VII. 1,
для реакцииКонстанты ионизации для более сложных молекул, в которых
протондонорные группы обособлены, по величине намного ближе
друг к другу. Для молекул органических кислот с длинными угле¬
водородными цепочками между кислотными группами (например,
сукциновая и адипиновая кислоты) отношение двух соседних кон¬
стант составляет 1 : 10.В пирофосфорной кислотепервые два протона отщепляются от двух противоположных кон¬
цов молекулы; это сказывается на значениях констант ионизации:P^ai = 1.52; \sKa2 = 2,36; рКаз = 6,60; рКа* = 9,25Значения первой и второй констант близки, а третья составляет
1/10 000 от второй и близка ко второй константе ионизации фос¬
форной кислоты; третья и четвертая константы тоже близки друг
к другу по значению.Многоосновные кислоты в зависимости от pH могут существо¬
вать либо в виде недиссоциированной формы, либо в виде любой
анионной формы. Можно вычислить долю каждой частицы в рас¬
творе как функцию величины [Н+]; график этой зависимости дает
общую картину равновесия. Нижеследующие примеры, относя¬
щиеся к фосфорной кислоте, иллюстрируют три способа характе¬
ристики равновесий, в четвертом же используют концентрационно¬
логарифмическую диаграмму.Н20 + С02^ Н+ + НС07равна:ОН ОН0=Р—О—Р=0ОНРаспределительные диаграммыПример VII. 1. Рассчитайте доли фосфорной кислоты, присутствующей в виде
каждой из форм, в зависимости от pH.
180VII. I. Ступенчатая диссоциацияЗапишем уравнения условий:
равновесий[н+] [h2po;] = Ках [Н3Р04] (1)[н+] [hpoJ-J = ка2 [н2ро;] (2)[н1[роГ] = *аз[нР°Г] (3)материального баланса для фосфата-иона[н3ро4] + [н2ро;] + [нро42~] + [Р034“] = С (4)где С — аналитическая концентрация фосфорной кислоты.Доля кислоты, присутствующей в виде какой-то формы, является отношением
концентрации этой формы к аналитической концентрации; например, величина[Н3Р04]
а3 саналогична величине анл, введенной ранее для одноосновной кислоты.Индекс 3 указывает на число ионов водорода, связанных с молекулой. Для
нас удобнее вычислять величину, обратную а, так как именно она непосредствен¬
но связана с переменными, входящими в уравнение материального баланса (4):1 _ с _,, [и2ро1 , ГНР°Г] , tp°4~1 ...1 ~т~ ru ПП 1 I ГТ4 ПП 1 ‘ ru ПП 1«3 [Н3Р04] ^ [Н3Р04] ^ [Н3Р04] 1 [Н3Р04
Из уравнении (1) сразу же находим второй член правой части уравнения (5):1Н2Р0Г] *д. (6)[Н3Р04] [н+]Перемножая выражения (1) и (2), для исключения величины [Н,Р07], на¬
ходим третий член правой части уравнения (5):'.[HPOJ-] Ка1Ка2[Н3Р04] - [н+]2Перемножая выражения (1) — (3), определяем четвертый член:[Р04“] К а[К а2К аз
[H3P04] [ft]5
Подстановка выражений (6) — (8) в уравнение (5), дает[Н3Р04] Г, . Ка, , KaiKa2 , ка1кагказт1аз = ___ = р+Т_ + ___+ [н_з j (9)Объединяя. последовательно выражение (9) с выражениями (6) — (8),
получаем:_ [Н2Р0Г] Ка1(7)(8)
Распределительные диаграммы181Обратите внимание, что условие материального баланса (4) может быть за¬
писано следующим образом:cto Ч" Я1 + а.2 + аз = 1 (13)На рис. VII. 1 приведен гра¬
фик зависимости величины а от
pH, полученный при использовании
констант ионизации, взятых из
табл. VII. 1. Интересно, что в рас¬
творе присутствуют либо только
один сорт частиц фосфорной кис¬
лоты, либо два сорта каких-либо
частиц в сравнимых концентрациях,
в зависимости от интервала изме¬
нения pH, но ни в одном из интер¬
валов pH не находятся одновре¬
менно в заметных количествах ча¬
стицы трех типов. Последнее
обстоятельство удобно для вычис¬
лений, так как для любого значе¬
ния pH следует учитывать холько
два вида частиц, и математическое
решение задачи в данном случае
аналогично по степени трудности
случаю одноосновной кислоты.Пример VII. 2. Постройте рас¬
пределительную диаграмму для
фосфорной кислоты. Кривые
рис. VII. 1 аналогичны кривым рас¬
пределения для одноосновной кис¬
лоты (рис. V. 3) или для основа¬
ния с одним атомом водорода
(рис. V. 7). Приведенная на
рис. VII. 2 диаграмма дает еще
один способ воспроизведения этих
кривых. Первая кривая в левой
части диаграммы — это а3 — доля
фосфорной кислоты, присутствую¬
щая в виде молекул НзР04; сле¬
дующая за ней кривая а3 -f а2 —
доля кислоты в виде молекул
Н3РО* и ионов Н2РО~ и, наконец,
последняя кривая — а3 + а2 +Вертикальная линия, прове¬
денная для любого выбранного
значения pH, делится этими кри¬
выми на отрезки, пропорциональ¬
ные величинам а. Например, при
pH — 3 вертикаль делится первой
кривой на части, соответствующие
аз = 0,127 и а,2 — 0,873. Значения
(*i и «о при таком pH настолько
малы, что не могут быть опреде¬
лены из графика. Вертикальнаялиния, проведенная при pH = 7,21, делится второй кривой на два равных от¬
резка а2 = 0,500 и #i = 0,500. При этом отрезки аз и ао настолько малы, что ие
могут быть вычислены из графика.рнРис. VII. 1. Зависимость доли различно
протонированных фосфат-иоиов от pH.Рис. VII. 2. Распределительная диаграмма
для фосфорной кислоты.
182VII. I. Ступенчатая диссоциацияКаждая область на графике, таким образом, обозначена формулой преобла¬
дающего в ней иона, а часть вертикальной линии, лежащая в этой области, пред¬
ставляет долю этого иона в ней. Чем больше область, соответствующая данной
форме иона, тем более эта форма «стабильна» по отношению к диссоциации или
к ассоциации с протоном.Приведенные диаграммы в дальнейшем будут применяться для графической
иллюстрации равновесий различных частиц в системах с участием многоосновных
кислот и комплексных соединений.Пример VII. 3. Начертите кривую диссоциации фосфорной кислоты НзР04.
В разделе V. 8 была описана связь кривых диссоциации одноосновной кислоты и
титрования сильным основанием. Титрование многоосновной кислоты сильным
основанием будет рассмотрено в разделе VII. 3, а пока приведем вычисления, не¬
обходимые для изображения кривой диссоциации многоосновной кислоты.Пусть п — степень образования, или среднее число протонов, связанных с
ионом фосфата:В числителе учтена концентрация каждой частицы столько раз, сколько про¬
тонов с ней связано. В знаменателе стоит общая аналитическая концентрация.
Используя выражение (14), можно представить я в единицах а, определенных в
Примере VII. I:п = а1 + 2а2 + За3 (15)Кривая зависимости п от pH называется кривой образования-, впервые она
была использована Н. Бьеррумом в 1915 г. в работе, посвященной комплексам
тиоцианатов хрома (см. раздел II. 1). Поскольку математическое описание много¬
основных кислот совпадает с таковым для одноядерных комплексов, то кривую
образования для многоосновной кислоты можно рассчитать тем же способом.Однако при обсуждении титрования многоосновных кислот сильным основа¬
нием более полезными оказываются кривые зависимости величины 3 — п, т. е.
степени диссоциации или среднего числа протонов, потерянных молекулой НзР04,
от pH. Эти кривые называются кривыми диссоциации. В общем случае, если мно¬
гоосновная кислота теряет N протонов, то степень диссоциации равна N — п.Кривой образования для одноосновной кислоты в разделе V. 7 мы называли
кривую зависимости аНА от pH, поскольку осца—степень образования или сред¬
нее число протонов, связанных с анионом. Подобным образом кривую зависимо¬
сти величины аА = 1 — анд от pH рассматривали как кривую диссоциации, по¬
скольку аА—степень диссоциации или среднее число протонов, потерянное моле¬
кулой НА.Если известна зависимость а от pH, кривую диссоциации легко рассчитать.
Для любой трехосновной кислоты условие материального баланса записывается
следующим образом:Кривые диссоциации и образования(14)<*о + <*1 + «г + а3 = 1(13)Объединяя выражения (13) и (15), получаем3 — ti = За0 + 2ai + а2(16)
Вопросы]>183где доли а — выражаются как функции [Н*] уравнениями (9)—("12}. Аналогичное
соотношение выполняется и для двухосновных кислот:2 — h = 2(Xq + GEjНа рнс. VII. 3 представлена кривая диссоциации для фосфорной кислоты.
Кривая состоит из трех «ступеней», соответствующих трем последовательным ста¬
диям диссоциации. Интервалы pH, в которых п почти постоянно, попадают в
середины тех областей на рис. VII. 2, в которых кис¬
лота присутствует в виде отдельной формы. Однако
даже при п = 2,00, что соответствует раствору, со¬
держащему только NaH2P04, все же в растворе при¬
сутствуют ионы НРО2- и молекулы Н3РО4, как сле¬
дует из приводимого ниже Примера VII. 4.ВопросыПо мере необходимости используйте данные
табл. VII. 1.1. Выведите формулы зависимости доли каждой
частицы для двухосновной кислоты от [Н+]; типы ча¬
стиц: 1ЬЛ, НА- и А2-. Получите зависимости Я и2 — п от [Н+].2. Выведите формулы зависимости доли каждой частицы для четырехоснов¬
ной кислоты от [Н+]; типы частиц: Н4А, Н3А~, Н2А2~, НА3' и А*~ Выразите вели¬
чины п и 4 — п как функции долей а и [Н+].3. Постройте распределительную диаграмму и кривую образования для серо¬
водорода.4. Постройте распределительную диаграмму и кривую диссоциации для щаве¬
левой кислоты.5. Постройте распределительную диаграмму и кривую образования для пиро-
фосфорной кислоты.6. Постройте распределительную диаграмму и кривую диссоциации для ли¬
монной кислоты. Может ли в водном растворе в заметных количествах отщеп¬
ляться последний протон?7. Используя константы равновесия, приведенные в тексте, постройте кривые
зависимости доли каждой частицы от pH для угольной кислоты; типы частиц:
СОг (водная), Н2СОэ, НСО“ и СО2" (см. рис. VII. 1). Какие выводы следуют из
этой диаграммы относительно важности величины [Н2С03] в каждом из условий
материального баланса? Покажите, что использование приведенных в табл. VII. 1
значений Ка\ и Ка2 вносит, независимо от величины pH, ошибку менее 1% при
вычислении величин [НСО-] и [со,2-].8. При каком значении [Н*] для двухосновной кислоты Н2А [НА-] макси¬
мальна? При каком значении pH [Н2А] = [НА-]? При каком pH выполняется
равенство [НА"] = [А2-]?9. Когда углеводородная цепочка между двумя кислотными группами дикар-
боновых кислот удлиняется, отношение констант ионизации KadKai уменьшается
до предельного значения, равного 4. Докажите это, используя статистические
представления, что равновесия являются результатом равенства скоростей про¬
тивоположно направленных реакций.10. Найдите уравнения, связывающие величину [Н+] для четырехосновной
кислоты Н4А с константами ионизации, если [Н2А2~] максимальна. Какие необ¬
ходимы допущения для получения уравнения:3 плчЗ'2'СГ"о /0 I 5 9 13
pHРис. VII. 3. Кривая дис¬
социации фосфорной
кислоты.PH=i-(pKe! + p/ees)
184VII. 2. Соли многоосновных кислотVII. 2. СОЛИ МНОГООСНОВНЫХ КИСЛОТВычисление величины pH раствора, содержащего соль много¬
основной кислоты, сложнее чем определение долей кислоты, при¬
сутствующей в виде различных форм при данном pH, так как необ¬
ходимо принимать в расчет реакции взаимодействия анионов соли
с водой. В зависимости от значений констант ионизации и концен¬
трации соли pH раствора может изменяться от значения, при кото¬
ром концентрация аниона соли максимальна, до pH чистой воды.Промежуточные анионы многоосновных кислот — амфотерны,
т. е. могут вести себя и как кислоты, и как основания:НА" А2- + Н+; НА" + Н20 Н2А + ОН"Это значит, что растворы чистых NaHC03 или МаНгР04 Оудут
обладать буферными свойствами (см. раздел VII. 6).Для приближенных расчетов полезной оказывается распреде¬
лительная диаграмма (см. рис. VII.2), так как pH растворов
обычных концентраций близко к pH растворов, в которых концен¬
трация аниона^соли максимальна. Полезна и кривая диссоциации,
аналогичная изображенной на рис. VII. 3, так как pH раствора
уменьшается вблизи того уровня, когда п приобретает целочислен¬
ное значение, равное числу протонов, приходящихся на анион соли.Пример VII. 4. Вычислите pH 0,1 М раствора NaH2P04. Рис. VII. 2 показы-
' вает, что концентрация аниона Н2РО” максимальна при pH == 5, следовательно,
pH раствора будет находиться вблизи этого значения. Аналогично рис. VII. 3 сви¬
детельствует, что вблизи pH = 5 п = 2. Таким образом, могут быть сделаны сле¬
дующие допущения: [Н2РО“] и [Na+] велики для концентрации раствора
~0,1 моль/л; [HsPOJ и [НРО*“]— немного меньше, [Н+] — еще меньше, а
[ОН“] и [Р03~] пренебрежимо малы.Запишем уравиеиия условий:
равиовесий[Н+] [Н2РО“] = 5,9 • 10—3 [Н3Р04] (1)[Н+] [HPOf-] = 6,15 • 1(Г8 [Н2РО;] (2)[Н+] [Р03~] = 4,8 • КГ13 [НРО*~] (3)[Н+][ОН“] = 1,00-10-14 (4)электронейтральности[Н+] + [Na+] = [ОН~] + [Н2Р07] + 2 [НРО’"] + 3 [P03"j (5)материального баланса[н3ро4] + [н2ро;] + [нро42-] + [рог] = од (6)[Na+] — 0,1 (7)Этих соотношений вполне достаточно для нахождения едииствеииого реше-
рщ рднзко уравнением протонного условия удобнее пользоваться, чем урзе-
VII. 2. Соли многоосновных кислот185нением условия электронейтральностн. Заметим, что в уравнения (5)—(7) вхо¬
дит один член, приблизительно равный 0,1. Решим уравнение (6) относительно
[H2POj] и подставим полученное значение и выражение (7) в уравнение (5),
чтобы избавиться от громоздких членов:,[Н+] + [Н3Р04] = [ОН“] + [НРО*-] + 2 [РО3,-] (8)Выражение (8) и есть уравнение протонного условия.Можно получить уравнение (8) и прямым путем, учитывая стехиометрию
возможных реакций с водой; еще более наглядно оно получается следующим
образом: примем частицы Н20 н Na+H2PO“ за нулевой уровень протонов в рас¬
творе (см. стр. 62). Все частицы, содержащие протоны в избытке, должны быть
сбалансированы таковыми, но с недостатком протонов по отношению к тому же
нулевому уровню. В левой части уравнения (8) перечислены частицы с избыт¬
ком протонов: Н+ — протонированная форма Н20, и Н3РО4 — протонироваииая
форма Н2Р04“- Каждая нз этих частнц содержит один лишний протон сверх
нулевого уровня, поэтому н учитывается она лишь один раз. В правой части
уравнения (8) находятся частицы с недостатком протонов: ОН' — это НгО, ли¬
шенная протона; НРО*- — это Н2РО”, лишенный протона, а РО3- — Н2РО~,
но без двух протонов. Концентрация каждой частицы умножена на число про¬
тонов, которое необходимо, чтобы частица стала электронейтральной. В этом
случае составление уравнения протонного условия аналогично составлению урав¬
нения условия электронейтральности с той лишь разницей, что подсчет избытка
и недостатка электронов заменяется подсчетом избытка и недостатка про¬
тонов.Даже если н не пользоваться подобными рассуждениями, все равно при
решении подобных задач следует стремиться применять именно протонное усло¬
вие, иначе интересующие нас члены в уравнениях баланса будут пренебрежимо
малы по сравнению с достаточно большими членами — концентрациями частиц
соли.При учете ранее сделанных допущений, сразу получаем решение задачи.
Пренебрегая величинами [ОН-] и [Р04“] в уравнении (8), находим:[Н+] + [Н3Р04] = [НР04-] (8а)Пренебрежение в уравнении (6) всеми частицами, кроме НгРО- дает:[Н2Р07] = 0,1 (6а)Подставляя выражение (6а) в уравнение (1), а (9)—в (8а), получаем:[Н+] = 5,9-10-2 (9)[НР04“] ** 1.06 [Н3Р04] (10)Умножая уравнение (1) на (2) и подставляя полученный результат в выра¬
жение (10), находим:1,06[Н+]2 = 3,6• Ю-10; [Н+] — 1,85* 10~5; pH = 4,73
186VII. 2. Соли многоосновных кислотДля проверки правильности сделанных допущений вычислим концентрации
других частиц, подстановкой полученного значения [Н+] в соответствующие урав¬
нения[н2ро:] = о,1[Н3Р04] =3,1 • 10—4
[НР02-] = 3,3- 10~4
[рО*-] = 8,6- 10—12
[ОН-] = 5,4 • 10—10[из уравнения (6а)]
[из уравнения (9)]
[из уравнения (8а)]
[из уравнения (3)]
[из уравнения (4)]Отметим, что значения концентраций уменьшаются в том порядке, который
следует из рис. VII. 2, и что уравнения (1)—(8) удовлетворяются.с точностью
±5% при подстановке в них данных значений.-IgC Точки систем0rpl<al = 2,23 рКаГ7,2! рКау 12,32Концентрационно-логарифмические диаграммыПример VII. 5. Определите графически величину pH 0,1 М раствора NaH2P04.
Для вычислений, относящихся к многоосновным кислотам и их солям, может
быть применена диаграмма, подобная представленной на рис. V. 4. Такая диа¬
грамма для 0,1 М раствора фосфорной кислоты (или любой ее соли) изображена
на рис. VII. 4. По внешнему виду она похожа на несколько наложенных друг надруга диаграмм для одноосновных кислот.
Отметим, однако, что в области очень низ¬
ких концентраций (lg С 5 и ниже) ли¬
нии перестают быть прямыми с наклоном
±1, а происходит изгиб. Это приводит к но¬
вому линейному участку с наклоном +2
или —2.Верхнюю же часть диаграммы можно
построить точно так же, как и в случае
одноосновной кислоты. Точки системы рас-
полагаютси при заданных значениях кон¬
центраций (кислоты или соли) и при значе¬
ниях pH, равных рКаи рКа2 И рКоЗ- Из
этих точек вниз проведены линии с накло¬
ном ±1; они соединены с горизонтальной
линией плавными отрезками кривых, прохо¬
дящих на 0,3 логарифмических единиц
(IgC) ниже точек системы. Линии, соответ¬
ствующие [Н+] и [ОН-], имеют накло¬
ны —1 и +1 и пересекаются, как и ранее,
при pH = 7.Определяя величину pH для 0,1 М раствора NaH2P04, отметим, что усло¬
вия равновесий (1)—(4) и материального баланса (6) использованы при построе¬
нии диаграммы, а уравнения (5) и (8) на ней не отражены. Оказывается, решить
эту задачу удобнее всего, если прибегнуть к протонному условию:Рис. VII. 4. Концентрационно¬
логарифмическая диаграмма для
0,1 М раствора Н3Р04.Es, Ее, £7 —точки Примеров VII. 5,
VII. 6 и VII. 7.[Н+] + [Н3Р04] = [ОН j + [НРО;-] + 2 [po'-jI»)В области максимального значения величины [Н2Р07] все величины, стоящие
в левой части уравнения (частицы с избытком протонов) описываются прямыми
с отрицательным наклоном, а всем членам правой части (частицы с недостатком
протонов) соответствуют прямые с положительным наклоном. Положение наи¬
Концентрационно-логарифмические диаграммы187высшей точки пересечения прямых определяет условие приближенного выполне¬
ния уравнения (8). В данном примере это имеет место при [Н3Р04] = [НР04~] и
pH = 4,72.Пока величины [Н+] и [ОН-] пренебрежимо малы, pH раствора является
именно таким независимо от разбавления. Как мы видели в Примере VII. 4,
при концентрациях соли, соответствующих 0,1 М раствору, величина [Н+] не¬
сколько превышает 5% от величины [Н3Р04]. В более разбавленных растворах
величина [Н+] перестает быть пренебрежимо малой. При еще большей степени
разбавления NaH2P04 значение pH приближается к pH чистой воды. В этом
отношении раствор становится похожим на буферный раствор одноосновной кис¬
лоты (см. раздел V. 7) или на растворы солей слабых кислот и слабых оснований
(см. раздел V. 9).Пример VII. 6. Определите pH 0,1 М раствора Na2HP04. Используя рис. VII. 4,
можно выполнить вычисление графическим способом. На диаграмму нанесены
уравнения (1) — (4) и (6). Уравнение протонного условия получается комбиниро¬
ванием уравнений условий электронейтральности (с [Na+] = 0,2) и материаль¬
ного баланса или непосредственно при подсчете концентраций частиц с избытком
протонов (в левой части) и недостатка (в правой части) по отношению к нуле¬
вому уровню для Н20 и НРО2-:[н+] + 2 [Н3Р04] + [Н2РО;] = [ОН-] + [Р04“] (11)В области максимального значения величины [НР04-] члены, стоящие в ле¬
вой части этого уравнения, описываются на графике линиями с отрицательным
наклоном, а члены в правой части — линиями с положительным наклоном. Наи¬
высшая точка пересечения соответствует выполнению равенства [Н2РО^] = [РО|“]
и значению pH = 9,75 (см. рис. VII. 4). При этом значении pH имеемlg [Р04~] = -3,57; [РО*-] = 2,7 • 10"4lg [ОН-] = —4,25; [ОН-] = 5,6 • 10"5откуда следует, чтст величина [ОН'] составляет 20% от величины [Р04“|, и ею
вряд ли можно пренебречь.Теперь известны приближенные значения концентраций частиц; это
позволяет решить уравнения численно. Пренебрегая величинами [Н+] и [Н3РО4]
в уравнении (11), получаем:[Н2Р07] - [ОН"] + [Р034~] (11а)Условие материального баланса (6) в предположении, что величина [НР04“]
велика по сравнению с другими концентрациями, дает:[НР02-]=0,1 (66)Разделив выражение (3) на (4) и подставлия найденное значение [НР04-],
находим:[Р04“] = 4,8 [ОН-]Подстановка этой величины в выражение (11а) дает:[Н2Р07] = 5,8[0Н“] (12)Так как теперь величина [НР04“] известна и существует соотношение
между концентрациими других частиц и величиной [ОН-], можно получить
188VII. 2. Соли многоосновных кислотсоотношение, связывающее величины [НРО*-]. [Н2Р07[ н [ОН-]. Разделив
выражение (2) на (4), находим:[НРО*-] = 6,15 • 106 [Н2РО;] [ОН-] (13)Подстановка (66) н (12) в (13) дает[ОН-] = 5,3 • 10~5; pH == 9,72что очень близко к значению, полученному графически, несмотря на неудачное
приближение в графическом методе, состоящее в пренебрежении величиной
[ОН-]. Наибольшая ошибка в графическом методе возникает при совпадении
кривых [ОН-] и [РО3-]. и составляет 0,15 логарифмических единиц.Пример VII. 7. Определите pH 0,1 М раствора Na3P04. Уравнение протон¬
ного условия для раствора этой соли записывается следующим образом[н+] + 3 [Н3ро4] + 2 [Н2Р07] + [НРО*-] = [он-]н в области преобладания [РО®-] все члены, кроме [НРО*-], в левой части
пренебрежимо малы. В данном случае pH раствора определяется из условия
пересечения кривых (см. рнс. VII. 4):[HPOf-] = [ОН-]; pH = 12,60
Прн этом значении pH нз графика получаем:lg [ОН-] = — 1,40; [ОН-] = 4,0 • 10“*lg [НРО*-] = — 1.40; [НРО*-] = 4,0 • 10“*
lg [РО|“] = — 1,16; [РОГ] = 6,9 • 10-*lg [Н2РО;] = — 6,65; [Н2РО;] = 2,2 • 10"7Величины концентраций других частнц оказываются меньше 10 ®. Следо¬
вательно, сделанные нами допущения удачны. Обратите внимание, что Na3P04
почти такое же сильное основание, как н NaOH.ВопросыВычисления производите численно нлн графически в зависимости от того,
какой метод удобнее.11. Рассчитайте pH 0,1 М раствора Н3РО4.12. Рассчитайте pH 0,1 М раствора NaH2As04.• 13. Рассчитайте pH 0,001 М раствора NaH2P04 и сравните со значением pH,
полученном в Примере VII. 4.14. Рассчитайте аналитическую концентрацию Na2HP04, при которой выпол¬
няется равенство [ОН~] = [Р04-]- Найдите pH этого раствора численным и гра¬
фическим способами. Какова ошибка графического способа?15. Рассчитайте pH 0,1 М раствора NaHCOs и 0,1 М раствора Na2COa.16. Кислый фталат калия часто используют как стандарт при калибровке pH.
Рассчвтайте pH 0,1 М раствора этой соли.17. Рассчитайте pH и концентрации различных частиц в 0,01 М растворе
Н4Р2О7.18. Рассчитайте pH 0,1 М растворов лимонной кислоты и ее дву натриевой
соли.
Связь кривой титрования с кривой ионизации18919. При определенных условиях pH раствора NaHA определяется уравне¬
нием:(J(at и Кй2 — константы ионизации Н2А). Выведите это уравнение и укажитенеобходимые допущения.20. Выведите точное уравнение, связывающее величину [Н+] и аналитическую
концентрацию С соли NaHA, используя константу ионизации Н2А. Постройте
график зависимости pH растворов от —lg С. Сравните полученную кривую с кри¬
вой, приведенной на рис. V. 10. В каком интервале концентраций применима
формула предыдущей задачи?VII. 3. ТИТРОВАНИЕ МНОГООСНОВНОЙ КИСЛОТЫ
СИЛЬНЫМ ОСНОВАНИЕМВ разделе V. 8 было детально рассмотрено титрование одно¬
основной кислоты сильным основанием. Те же принципы приме¬
нимы и к титрованию многоосновных кислот. Кривая титрования
может быть рассчитана с помощью констант ионизации кислоты
прямым вычислением величины [Н+] для каждого добавленного
объема щелочи, но этот путь вычисления утомителен, особенно,
если константы ионизации близки.Связь кривой титрования с кривой ионизацииНамного легче и полезнее связать кривую титрования с кривой
диссоциации. Кривая диссоциации не зависит от концентрации
реагентов и легко может быть вычислена способом, описанным в
разделе VII. 1. Все выражения констант ионизации для многоос¬
новной кислоты и условие материального баланса для анионов
кислоты определяются кривой диссоциации. Соотношениями, кото¬
рые, кроме того, необходимы для однозначного определения си¬
стемы, являются: ионное произведение воды, условия электроней¬
тральности и материального баланса по Ыа+-ионам. Последние два
выражения для случая титрования Н3РО4 щелочью NaOH имеют
видгде Vo—исходный объем фосфорной кислоты концентрации Со;
V—добавленный объем NaOH концентрации С.Подставляя выражение (2) в (1) и разделив результат на ана¬
литическую концентрацию фосфата, равную C0Vo/(V -f V0), нахо¬
димpH=T(ptf01 + ptf02)[Na+] + [H+] = [ОН"] + [Н2Р07] + 2 [HPOf ] + 3 [РО*“](1)(2)С2 + 2а, + Зсг0 = Ф + ( [Н+] - [ОН-])Сок о(3)где Ф = CV/CQVо — титровальная доля.
190 VII. 3. Титрование многоосновной кислоты сильным основаниемИз уравнения (16) (см. стр. 182) имеем:а2 + 2at + За0 = 3 — п (4)Это дает соотношение между кривой диссоциации и кривой титро¬
вания:Ф = (3 — «) + ([OH-]-[Hi) (5)C-QKOВыражение (5) аналогично уравнению (14) раздела V. 8
(стр. 139), определяющему кривую титрования одноосновной кис¬
лоты, в котором ад или 1 — Я заменено на 3 — п.
Если известна зависимость п от [Н+], то для нахождения зави¬
симости Ф от [Н+], а следовательно, и кривой титрования можно
применить уравнение (5). Если исключить из рассмотрения высо¬
кие и низкие значения pH, второй член в выражении (5) будет
пренебрежимо мал, а кривая титрования идентична кривой диссо¬
циации. Чем более разбавленным становится раствор, тем уже
область, в которой эта идентичность сохраняется.Пример VII. 8. Определите pH как функцию Ф при титровании 0,1 М рас¬
твора Н3РО4 0,1 М раствором NaOH. В большей части области титрования(3 ^ pH 10) величины [Н+] и [ОН-] малы по срав¬
нению с величиной С = 0,1 и уравнение (5) превра¬
щается вФ = 3 — п (5а)т. е. кривые диссоциации и титрования совпадают.Однако в начале титрования (pH 3) величи¬
на [Н+] может быть оценена; поэтому следует учиты¬
вать еще одии член в уравнении. Так как V мал и
С = 0,1, можно приблизительно записать:Ф = 3 — п — 10 [Н+] (56)В коице титрования (pH ^ 10) становится за¬
метной величина [ОН-], а так как в этой точке V
приблизительно равио ЗУ0, тоф = 3 — п + 40 [ОН-] (5в)В Примере VII. 3 была рассчитана кривая диссоциации; с помощью урав¬
нений (5а), (56) и (5в) ее можно применить для построения кривой титрова¬
ния. На рис. VII. 5 изображены кривая титрования (сплошная линия) и кривая
диссоциации (пунктирная кривая). Первым двум точкам эквивалентности соот¬
ветствуют резкие изгибы на кривой титрования, но третьего перегиба, даже очень
слабого, не наблюдается, так как он должен был бы соответствовать значению
pH, которое имеют более щелочные растворы, чем титрующий раствор.Ошибка титрованияОшибка титрования для данной конечной точки может быть
легко определена по уравнению (5). В первой конечной точке
(НгРО4) — величина Ф близка к 1, и ошибка титрования опреде¬Рис. VII. 5. Сравнение
кривых титрования и дис¬
социации при титрова¬
нии 0,Ш раствора Н3Р04
0,1 М раствором NaOH.
Индекс крутизны, определяемый по концентрационно-логарифм. диаграмме 191ляется соотношением:Фк. т — 1 == (2а0 + cii — «з)к. т Н — f"rr~rf [Н+]к. (6)\ L* jk. т /Величины а могут быть оценены в конечной точке, если исполь¬
зовать уравнения (9) — (12) раздела VII. 1 или распределительные
диаграммы, приведенные на рис. VII. 1 или VII. 2.Во второй конечной точке, соответствующей НРО4-, величина
Ф близка к 2, и ошибка титрования определяется соотношением:С “I- 2 С / К \фк. т - 2 = (а0 - а, - 2а3)к. т + — ° Ь ;-|2° - - [Н+]к. т) (7)CqC \ [Н Jk. т /В третьей точке эквивалентности, соответствующей РО4-, за¬
метной точки перегиба не обнаруживается, и, следовательно, ее
нельзя использовать как конечную точку при практическом титро¬
вании.Уравнение (7) с противоположными знаками в правой части
определяет ошибку титрования в первой конечной точке при титро¬
вании РО4"- сильной кислотой, а уравнение (6) с противополож¬
ными знаками в правой части дает ошибку титрования во второй
конечной точке. Для третьей конечной точки (Н3Р04) заметного
перегиба нет и, следовательно, она не может быть использована в
практическом титровании.Индекс крутизны, определяемый
по концентрационно-логарифмической диаграммеРанее (см. раздел V. 8) было показано, что индекс крутизны
для титрования слабой кислоты НА концентрации С0 раствором
сильного основания той же молярности приблизительно опреде¬
ляется выражением:lgn' = lgC0-lg [ОН-]' — 1Величина 1 + lgr)/ — расстояние между основной линией и точ¬
кой пересечения прямых [ОН-] = [НА], которая определяет точку
эквивалентности.При титровании слабого основания В концентрации С0 раство¬
ром сильной кислоты той же молярности индекс крутизны опреде¬
ляется приближенным выражением:lgr,'=lgC0-lg[H+]'-lВеличина 1 -f- lg— расстояние между основной линией и точ¬
кой пересечения прямых [Н+] = [В], которая определяет точку
эквивалентности.
192 VtI.3. Титрование мнОгбосндвной кислоты сильным основаниемПри титровании слабой кислоты НА концентрации С0 раство¬
ром слабого основания той же молярности индекс крутизны опре¬
деляется приближенным выражением:lg Ч' = lg С0 — lg [В] - 1Величина 1 +lgr|' — расстояние между основной линией и точ¬
кой пересечения прямых [НА] = [В], которая определяет точку
эквивалентности.В разделе VII. 6 будет показано, что для промежуточной точки
эквивалентности титрования двухосновной кислоты НгА раствором
сильного основания индекс крутизны определяется следующим
приближенным выражением:Ign'-lg Co-lg [Н2А]'-1Величина — расстояние между основной линией и точкойпересечения прямых [НгА] = [А2-], которая определяет точку экви¬
валентности.Все типы точек эквивалентности, которые на практике встре¬
чаются в кислотно-основных титрованиях, могут быть представ¬
лены как точки пересечения на концентрационно-логарифмических
диаграммах. Индекс крутизны в каждом случае приблизительно
на единицу меньше, чем- расстояние от основной линии до точки
пересечения, определяющей точку эквивалентности. Таким обра¬
зом, полученное нами соотношение является общим и выполняется
при любых условиях, встречающихся в практике кислотно-основ-
ных титрований. Существуют следующие два правила.1. Если точка пересечения, которая определяет точку эквива¬
лентности, лежит ниже, чем на 4 единицы относительно основной
линии (т|'>103), то ошибка титрования определяется ошибкой
отсчета показаний бюретки и составляет ~0,1%.2. Если точка пересечения, которая определяет точку эквива¬
лентности, лежит ниже основной линии меньше, чем на 2 единицы
(т/< 10), тогда даже самые точные методы определения конечной
точки дадут ошибку титрования более 1%.Из рис. VII. 4 видно, что титрование до точек эквивалентности
НгР07 или HPOf может быть выполнено на практике только при
точном определении pH, так как для каждого из них точка пере¬
сечения попадает на 2,5 логарифмической единицы ниже основной
линии. Титрование НРО4- раствором сильного основания до ко¬
нечной точки, соответствующей РОГ. или титрование Н2РО4
раствором сильной кислоты до точки эквивалентности, соответст¬
вующей Н3РО4, невозможно, так как точки пересечения для этих
случаев попадают на 0,4 и 0,6 логарифмических единицы ниже
основной линии.
Вопросы193ВопросыИспользуйте константы ионизации, приведенные в табл. VII. 1.21. Покажите, что для двухосновной кислоты Н2А кривые диссоциации и
титрования раствором сильного основания связаны уравнением:Ф = 2-я + Уо + У ([ОН-]-[1Г])
со1' оКакое существует соотношение между кривой образования [h = f(pH)] и
кривой титрования А2- сильной кислотой? Выведите выражение для определения
ошибки титрования в каждой из возможных конечных точек.22. 0,01 М раствор СОг титруют 0,01 М раствором NaOH. Какова ошибка
титрования, если конечную точку НСО” выбирают при pH = 9,0; индикатором
является фенолфталеин?23.. Присутствие атмосферного СО2 вызывает смещение конечной точки при
титровании сильной кислоты сильным основанием в кислую сторону. Определите
pH в первой точке эквивалентности, при условии, что 1 л раствора, содержащего
0,01 моль НС1 и 0,0001 моль СОг титруют 0,01 М раствором NaOH. Сравните
индекс крутизны с тем, который существует для того же титрования в отсут¬
ствие СОг.24. 0,1 М раствор NazCOj титруют 0,1 М раствором НС1. Если фенолфта¬
леин используют для определения конечной точки НСО”, то pH в конечной
точке должен быть равен 9,0. Какова ошибка такого титрования? Если для
оценки конечной точки С02 (pH = 3,8) применить метиловый оранжевый, то
какова ошибка титрования, если СОг не улетучивается? Какова ошибка титрова¬
ния в конечной точке для СОг, если раствор прокипятить перед достижением ко¬
нечной точки, чтобы уменьшить концентрацию СОг в растворе до 0,0001 М?25. Рассчитайте кривую титрования, если смесь 0,1 М раствора ЫагСО> и
0,05 М раствора NaHCOa (по 100 мл каждого) титруют 0,1 М раствором НС1.
Чем эта кривая отличается от кривой титрования только ШгСОз с концентра¬
цией 0,075 М?26. Выведите соотношение между кривой образования [h = f(pH)] для трех¬
основной кислоты НзА и кривой титрования А3' сильной кислотой. Рассчитайте
кривую титрования, если 0,1 М раствор №зР04 титруют 0,1 М раствором НС1.27. Какова наиболее удачная конечная точка при индикаторном титровании
0,1 М раствора щавелевой кислоты 0,1 М раствором NaOH? Какой из индика¬
торов, перечисленных на стр. 97, будет наилучшим?28. Рассчитайте кривую титрования 0,0001 М раствора Н3РО4 0,0001 М рас¬
твором NaOH. Сравните с кривой рис. VII. 5. Внутри какого интервала должен
быть pH первой конечной точки, чтобы ошибка титрования была меньше 1%?29. В случае титрования двухосновной кислоты Н2А концентрации С (по¬
правка на разбавление концентрация равна °- ] сильным основанием' + 'О /в учебниках по аналитической химии часто приводят следующие формулы:
начало — pH = -j (рКа\ — lg С)
первая конечная точка — pH = -i- (pKai 4- рКаг)вторая конечная точка — pH = (р/Сн2о "Ь Р^а2 "Ь *£При каких допущениях выведены эти формулы? При титровании какого из
следующих соединений: СО2, H2S, щавелевая кислота, — удовлетворяются все ус-,
ловия?7 Зак. 345
194VII. 4. Смеси двух слабых одноосновных кислот30. Выведите формулы для трехосновной кислоты, аналогичные формулам
Вопроса 29. Вычислите pH в различных точках эквивалентности для титрования
Н3Р04 раствором NaOH (С = 0,1 М), используя полученные формулы, и срав¬
ните со значениями, вычисленными по рис. VII.5. Нарушаются ли какие-нибудь
допущения в каждой точке эквивалентности?VII.4. СМЕСИ ДВУХ СЛАБЫХ ОДНООСНОВНЫХ КИСЛОТЗадача определения pH двухосновной кислоты тесно связана
с подобной задачей для двух слабых одноосновных кислот одина¬
ковой концентрации, но с различными константами ионизации. Так
же, как для многоосновных кислот, можно применять концентра¬
ционно-логарифмические диаграммы для решения задач, относя¬
щихся к смеси слабых одноосновных кислот.Можно выделить два крайних случая. Во-первых, концентрации
слабых кислот одинаковы, а константы ионизации существенно
различны. В этом случае pH раствора определяется более сильнбй
кислотой. Во-вторых, две слабые кислоты имеют одинаковую силу,
но разнятся концентрациями; в данном случае pH раствора опре¬
деляется более концентрированной кислотой. Возможна и проме¬
жуточная ситуация: кислоты почти одинаковы и по силе и по кон¬
центрации. Эта задача сводится к решению уравнения более вы¬
сокой степени относительно [Н+].Все указанные варианты иллюстрируются примерами, приве¬
денными ниже. Подобные рассуждения применимы также и к сме¬
сям слабых одноосновных оснований и смесям одно- и двухоснов¬
ных кислот.Пример VII. 9. Определите pH смеси 0,1 М раствора НАс и 0,25 М HCN.Запишем уравнения условий:равновесий[Н+] [Ас-] = 1,75 • 10“5 [НАс][Н+] [CN-] = 4,8 • 10-‘° [HCN][Н+][ОН"]= 1,0* 10~14материального баланса[НАс] + [Ас“] = 0,10
[HCN] + [CN-] = 0,25Все эти соотношения отражены на рис. VII. 6, а.Кроме того, для решения необходимо условие электронейтральиости, которое
имеет вид:[Н+] = [Ас'] + [CN-] + [ОН-]Линия [Н+], идущая вниз, вначале пересекает линию [Ас-] в точке, где вели*
чинами [CN-] и [ОН-] можно пренебречь:[Н+] = [Ас-]; pH = 2,88
VII. 4. Смеси двух слабых одноосновных кислот195Значение pH точно такое же, что и для 0,10 М раствора чистой уксусной
кислоты. Диссоциация HCN почти полностью подавлена, так как при этом зна¬
чении pH выполняются соотношения:Ig [CN-] = — 7,07; [CN-] = 8,5 • 10“8При этом значении pH величина [ОН-] меньше 10-9, и, следовательно, лежнт
вне диаграммы.Пример VII. 10 Определите pH смеси 0,1 М раствора НАс и 0,0001 М рас¬
твора метилового оранжевого (Н1п). В каком соотношении находятся кислая
и основная формы индикатора?р р
О гГНДН/pHРис. VII. 6. Концентрационно-логариф¬
мические диаграммы для смесей:
а —0,1 М НАс и 0,25 М HCN; 6 — 0,1 М НАс
1,0 • Ю“4 М метилового оранжевого; в —0,1 м
НАс и 0,05 М НСООН.Точки систем: Р —0,10 М НАс, рКав4,75;[НСООН] Р9 —0.25М HCN, рКа=9,32; />,„-1.0 . 1<Г4 М
метиловый оранжевый, pfCa=3,8; Рц— 0,05 М
НСООН, рКа=3,75.£9, Ею, £11 (первое допущение) — точки При¬
меров VII. 9, VII. 10 и VII. II.Запишем уравнения условий:
равновесий[Н+] [Ас-] = 1,75 • 10-5 [HAcJ[Н+] [in-] = 1,6 • 10”4 [HIn][H+][OH-] = 1,0.10-14
материального баланса[НАс] + [Ас-] = 0,1 [HIn] + [Ih-] — 1,0 • 10-4Все эти соотношения отражены на рис. VII. 6, б.Кроме того, для решения необходимо условие электронейтральности:[Н+] = [Ас-] + [in-] + [ОН-]Линия, соответствующая [Н*], сначала пересекает линию [Ас-] там, где вели¬
чины [In'] и [ОН'] все еще пренебрежимо малы:[Н+] = [Ас-]; pH = 2,88
196VII. 4. Смеси двух слабых одноосновных кислотМы снова получили значение pH, совпадающее с pH 0,1 М раствора чистой
уксусной кислоты. При этом значении pH отношение концентраций кислой и ос¬
новной форм индикатора равно:[HIn] [Н+] 1,32-IQ"3[In'] К,п 1,6-10~4При этом значении pH величина [ОН] < 10-9 и лежит вне диаграммы.Пример VII. II. Определите pH смеси 0,1 М раствора НАс и 0,05 М раствора
НСООН.Запишем уравнения условий:
равновесий[Н+] [Ас-] = 1,75-10-5 [НАс] (1)[Н+] [НСОО-] = 1,77 • 10~4 [НСООН] (2)[Н+][ОН-] = 1,0-Ю-14 (3)материального баланса[НАс] + [Ас“] = 0,10 (4)[НСООН] + [НСОО'] = 0,05 (5)Все эти соотношения отражены на рис. VII, 6, s.Кроме того, для решения необходимо условие электронейтральности:[Н+] = [НСОО"] + [Ас-] + [ОН"] (6)Следуя вниз, линия, соответствующая [Н+], вначале пересекает линию
[НСОО]. Если мы пренебрежем двумя другими концентрациями в выражении
(6), это пересечение даст:[Н+] = [НСОО'] = 2,92 • 10_3; pH = 2,54
При этом значении pHlg [Ас-] = — 3,22; [Ас-] =6,0-10-4
Отношение концентраций формиат- и ацетат-ионов равно:[НСОО-[Ас“= 4,9Поэтому величиной [Ас-] в действительности вовсе нельзя пренебрегать. От¬
метим, однако, что [ОН~] < 10-9 и, следовательно, эта величина пренебрежимо
мала. ,Более точное значение pH может быть получено, если в уравнении (6) учесть
члены [НСОО'] и [Ас-]. Пренебрежение членом [ОН-] в уравнении (6) даст:[Н+] = [НСОО-] + [Ас-] (6а)Подставляя уравнение (4) в уравнение (1) и выражая [Ас-] через [Н+], по¬
лучаем:... _. 1,75- 10-6 „[Н+] + 1,75-10“5Подставляя уравнение (5) в уравнение (2) и выражая [НСОО"] через [Н+],
находим:[НСОО-] = 8,85-10 6[Н+]+1,77.10-
Полиамины197Подстановка уравнений (7) и (8) в уравнение (6а) дает:+1 3,85. 10—6 1,75- 1Q-6[Н+] + 1,77- КГ4 [Н+]+1,75-10“5Так как из рис. VII. 6, в следует, что величина [Н+]~ 0,003, то разумно
пренебречь дополнительными константами в знаменателе, которые составляют
менее 5% от величины [Н+]. При этих приближениях из выражения (9) следует,
что[н+]2= 10,60- 10-6; [Н+] =3,25 • 10~3; рН = 2,49Эти результаты близки к полученным графически, несмотря яа существенные
допущения в этих вычислениях.ВопросыИспользуйте константы из табл. V. 1, V. 2 и VII. 1 там, где это необходимо.31. Определите pH раствора 0,010 М по СНзСООН и 0,02 М по NH4CI.32. Определите pH 0,10 М раствора по HF и 0,01 М по NaHSO^33. Определите pH раствора 0,1 М по метиламину и 1 • 10~3 М по триметил-
амииу.34. Определите pH раствора 0,05 М по CHsCOONa и 0,10 М по NH3.35. Определите для фенолфталеина отношение бесцветной формы (Нг1п)
к красной (In2-) в растворе, 1 л которого содержит 1 • 10~s моль фенолфталеина
и 0,1 моль NH3. При pH = 9,2 концентрацией одноосновной формы Н1п_ можио
пренебречь и принять, что [Н21п] = [In2-].36. Определите pH раствора 0,1 М по НСООН и 1 • 10~3 М по СНзСООН.37. Определите pH раствора 0,1 М по ЫагСОз и 1 • 10~3 М по NH3.38. Определите pH раствора, 1 л которого содержит 0,1 моль НС1, 0,1 моль
NaHS04 и 0,1 моль СНзСООН.39. Рассчитайте кривую диссоциации для смеси, состав которой приведен в
Вопросе 38. Степень диссоциации этой смеси можно определить как сумму степе¬
ней диссоциации для каждой составляющей:а = аС1 + aSo4 + аАсПостройте зависимость а от pH.40. Сопоставьте кривую диссоциации в Вопросе 39 с кривой титрования
смеси кислот раствором сильного основания (0,1 М NaOH). Сколько отдельных
конечных точек можно определить с точностью, по меньшей мере, 1%, используя
индикаторный метод? Какие индикаторы будут подходящими?VH.5. ПОЛИАМИНЫ И АМИНОКИСЛОТЫ
ПолиаминыОрганические молекулы с двумя или более аминогруппами мо¬
жно использовать как буферные вещества и как лиганды для
ионов металла. Вычисления для растворов этих соединений раз¬
личной кислотности проводят точно таким же способом, что и в
случае многоосновных кислот. Единственное различие состоит в
том, что наибольшее количество протонов содержит не нейтраль¬
ная молекула, а катион. Рассмотрим, например, этилендиамин,
198VII. 5. Полиамины и аминокислотыТаблица VII.2Константы ионизации органических молекул с несколькими
кислотными или основными группамиФормулы, указывающие число способных к ионизации водородных атомов,
незаряженных и содержащих наибольшее число протонов форм, даны после
названия соединений. Константы ступенчатой ионизации форм, содержащих
наибольшее число протонов, экстраполированы к нулевой ионной силе.НазваниеНейтральная структураp *«1P*a2рКазГидразин (А, Н2А2+)nh2—nh20,277,24 Этилендиамин (А, Н2А2+)nh2ch2ch2nh26,859,93—1,2,3-Т риа минопропан
(А, Н3А3+)nh2ch2—сн—сн2 nh2
1nh23,727,959,59~8-Гидроксихинолин *
(НА, Н2А+)OH5,019,90Глицин (НА, Н2А+)NH2-CH2—COOH2,359,77——Серии (НА, Н2А+)HO—CN.!—CH—COOH
1nh22,209,25Аспарагиновая кислота
(Н2А, Н3А+)HOOC—CH2—CH—COOH
1nh22,083,949,98Цистеин (НА, НЭА2+)HS—CH2—CH—COOH
1nh2nh21,968,3610,28Цистии (Н2А, Н4А2+)1S—CH2—CH—COOH
i NH2
\ 1XCH2—CH—COOH
nh21,042,058,0010,25Аргинин (НА, Н3А2+) **CHj—NH—C=NHCH2(\сн2—CH—COOH
inh22,079,0812,48—* Ионизуется протон ОН-группы.
гппы vii? протона могут добавляться к группам NH2. один протон может теряться группой
1-UOH, JVH-группы не участвуют в кислотно-основных реакциях в водных растворах.
Аминокислоты199который может взаимодействовать с водой следующим образом:
NH2CH2CH2NH2 + Н20 NH2CH2CH2NH++ ОН"; КЬ1NH2CH2CH2NH++ Н20 +NH3CH2CH2NH3++ ОН-; КЬгВ таблицах часто приводят константы ионизации основания
(константы основности), соответствующие его реакции с водой.
Столь же ценными и полезными при вычислениях являются кон¬
станты ионизации по кислотному типу (константы кислотности)
для случая диссоциации форм, содержащих максимальное число
протонов:+NH3CH2CHsNH+ NH2CHjCH2NH^ + Н+; КаХNH2CH2CH2NH+ NH2CH2CH2NH2 + Н+; Ka2Эти константы простым образом связаны друг с другом посред¬
ством ионного произведения воды:KalKb2 = ^HsO^a2^bl = ^НгОПодобные же соотношения справедливы и для оснований, кото¬
рые могут присоединять 3 или 4 протона. В табл. VII. 2 приведены
константы ионизации по
кислотному типу для неко¬
торых органических основа¬
ний.Вычисления pH или свя¬
занных с ним величин про¬
водят точно так же, как и
в случае многоосновных
кислот и их солей. Распре¬
делительная диаграмма для
этилендиамина приведена
на рис. VII. 7. Она имеет
точно такой же вид, что и
диаграмма для двухоснов¬
ной кислоты. Анион протонированный одним протоном, существует
в заметной концентрации в интервале изменений pH от 8 до 12
и, следовательно, его концентрацией в вычислениях пренебрегать
нельзя.АминокислотыМногие органические молекулы, имеющие большое значение
в биологии, содержат и кислотную и основную группы. Одна из
наиболее простейших подобных молекул — глицин (аминоуксуснаяаpHРис. VII. 7. Распределительная диаграмма
для этилендиамина.
200VII. 5. Полиамины и аминокислотыкислота):И\ ? /0Н,N—С—СГ1 Ч0
нВ кислых растворах аминогруппа может присоединить протон
и образовать катион — кислотный ион глициния:+ н н„_и_<онА А ч°С другой стороны, в щелочных растворах карбоксильная груп¬
па теряет протон и образует анион — основной ион глицината:Н НI I /°
N—С—С
I I
н нБольшой дипольный момент этой молекулы в нейтральных рас¬
творах указывает на то, что большая часть нейтральных молекул
глицина существует не в форме первой из вышеприведенных струк¬
тур, а скорее в виде высокополярной формы:♦ н н
I I /°
н—N—с—сч;
I I \о
н нПодобную ионизованную «внутри» частицу называют «дипо-
лярным ионом» или «цвиттерионом» *. Установлено, что нейтраль¬
ная форма веществ, содержащих и кислые, и основные группы,
является, в основном, цвиттерионной.В современной литературе предпочитают способ табулирования
констант равновесия для аминокислот, заключающийся в написа¬
нии последовательного ряда констант ионизации форм, содержа¬
щих наибольшее количество протонов. Константы равновесия для
глицина, например, приводят в виде ступенчатых констант иониза¬
ции двухосновного кислого иона глициния. В табл. VII.2 приве¬
дены константы ионизации ряда важных аминокислот. Вычисления
pH и связанных с ним величин для растворов аминокислот прово¬
дят так же, как и для многоосновных кислот.Как следует из рис. VII. 8, а, для глицина характерен широкий
интервал изменения pH, в котором преобладающей формой яв¬* От немецкого zwitter, означающего гибрнд.
Аминокислоты2010,5/'/V+мн\\ NH,
\ iС|Нг \\ снгсоон N
1w +NH3— сн2— СОО' \сОО"1 t |Юlgc72pHляется цвиттерион. В кислых растворах глицин существует в фор¬
ме катиона и при пропускании электрического тока мигрирует к
катоду; в щелочных же рас¬
творах он существует в фор- а а
ме аниона и мигрирует к
аноду. Между этими край¬
ними значениями находится
значение pH, соответствую¬
щее так называемой «изо-
электрической точке». В по¬
следней количества катио¬
нов и анионов одинаковы,
и в электрическом поле гли¬
цин не перемещается *.Как видно из нижеследую¬
щих примеров, значение pH
раствора глицина в чистой
воде близко к pH изоэлек-
трической точки; для моле¬
кул с равными количествами
кислотных и основных групп
это значение близко к 7. Если
молекула содержит кислот¬
ных групп больше, чем ос¬
новных, изоэлектрическая
точка и pH раствора в чи¬
стой воде оказываются в об¬
ласти большей кислотности.Если же молекула содержит
больше основных, чем ки¬
слотных групп, изоэлектри¬
ческая точка и pH раствора
в чистой воде оказываются
в области большей основно¬
сти (см. Вопрос 50).Пример VII. 12. Рассчитайте pH 0,01 М раствора глицина в чистой воде.
Уравнения равновесий таковы:[Н+] [HG] = 4,5 • 10-3 [H2G+] (1)[Н+] [в-] = 1,7 • 10“10 [HG] (2)[Н+] [ОН-] = 1,0 • 10—14 (3)*) Более строго неподвижность в электрическом поле определяется усло¬
вием /k+cr. ' ~ческой точке Ск+/Сд_ = 1А-/1К+- Однако если /.рнРис. VII. 8. Распределительная (а) н кон¬
центрационно-логарифмическая (б) диа¬
грамма для глицина.Точки: / — изоэлектрическая, pH«=6,06; Р —значе¬
ние рН=6,14 для 0,01 М раствора глицина в чистой
воде £13 —точка Примера VII. 13 (изоэлектриче¬
ская точка).+ ~ гДе ^ — подвижность нона. Следовательно, в изоэлектри-/_+, что для больших
Кионов выполняется достаточно строго, то С . =* С . (Прим. ред.)
202Vll. 5. Полиамины и аминокислоты(нейтральная форма глицина обозначена сокращенно HQ, иона глициния —
H2G+, а иона глицината — G~).Уравнения условий материального баланса и электронейтральности для
глнцина таковы:[H2G+] + [HG] + [G~] =0,01 (4)[H+] + [H2G+] = [OH-] + [Gl (5)Подстановка выражений (1) —(3) в выражение (5) дает:
r„+1 , [Н+1 [HG] АГн2о , [HG] Ка2[н]+~^г"=_ет+_ет~fij+i2 _ ^н2о + Ка2 [HG]lH J 1 + [HQ]/tfe, (6)Обратите внимание (см. рис. VII. 8, б), что величины [H2G+] и [G-] прене¬
брежимо малы по сравнению с величиной [HG].При этом допущении выражение (4) сводится к такому:[HG] = 0,010 (4а)Подставив выражение (4а) в выражение (6), находим
[Н+] = 7,25 • 10-7; pH = 6,14Из выражений (1) и (2) следует:[H2G+]= 1,6- 10_e; [G~] = 2,35 • 10~бОбе этн величины, как н предполагалось, пренебрежимо малы по сравнению
с величиной [HG] = 0,01. Концентрационно-логарифмическая диаграмма в дан¬
ном примере неприменима, так как величиной [Н+] в выражении (5) нельзя пре¬
небречь по сравнению с величиной [Нгй*].Пример VII. 13. Рассчитайте pH глицина в изоэлектрической точке, в кото¬
рой количества анионов и катионов равны:[H2G+] = [О"] (7)Так как для достижения этой точки следует добавить кислоту или основание,
условие электронейтральности (5) более не является справедливым; оно заме¬
няется условием (7) существования изоэлектрической точки. Последнее соответ¬
ствует просто пересечению линий при pH = 6,06 (см. рис. VII, 8, б). Поскольку
[Н+] и [ОН'] не входят в условие существования изоэлектрической точки, ответ
не зависит от аналитической концентрации аминокислоты.Подобный же ответ можно получить и алгебраически. Перемножая выраже¬
ния (1) и (2), получим:[И*]2 = KaiKa2Используя выражение (7), находим:[Н+]2 = Ка\Ка2 (изоэлектрическая точка) (8)Выражение (8) не зависит от аналитической концентрации глицина в рас¬
творе; оно, являясь общим соотношением для любой аминокислоты с одной кис¬
лотной и одной основной группой, не выполняется для аминокислот других типов.Используя приведенные значения констант ионизации, получаем:[Н+] = 8,75 • Ю-7; pH = 6,00
Вопросы203Итак, значение pH в изоэлектрической точке не совпадает точно с pH рас¬
твора в чистой воде. Вообще говоря, чем больше концентрация раствора в чис¬
той воде, тем ближе pH к изоэлектрической точке. Когда раствор становится
более разбавленным, pH стремится к значению, равному 7.Ряд вычислений для молекул с большим числом кислотных или
основных групп выполнить можно, используя концентрационно-ло¬
гарифмические диаграммы. Их проводят точно так же, как и в слу¬
чае многоосновных кислот с точками систем, соответствующими
концентрациям вещества в растворе и при pH = р/Саь pH = рКа2
и т. д. В большинстве случаев pH вещества в чистой воде, pH в
изоэлектрической точке и pH растворов различных солей могут
быть определены по точке пересечения линий на диаграмме. В об¬
щем случае уравнения условий электронейтральности или протон¬
ного являются достаточными для отыскания точек пересечения.ВопросыИспользуйте, где необходимо, данные табл. VII. 2. В некоторых вычислениях
могут оказаться полезными концентрационно-логарифмические диаграммы.41. Рассчитайте концентрации различных частиц в растворе, 1 л которого
содержит 0,1 моль 'этилендиаминмоногидрохлорида (NH2CH2CH2NH3CI).42. Постройте кривую образования для этилендиамнна. Степень образования
п — это среднее число протонов, присоединенных к молекуле NH2CH2CH2NH2.43. Постройте кривую титрования 0,10 М раствора этиленднаминдигндрохло-
рида (NH3CH2CH2NH3C12) 0,1 М раствором NaOH.44. Постройте концентрационно-логарифмическую диаграмму для 0,01 М
раствора N2H4 и из нее найдите pH следующих растворов, в 1 л которых со¬
держится:а. 0,01 М N2H4;б. 0,01 моль N2H4 и 0,01 моль НС1;в. 0,01 моль N2H4 н 0,02 моль НС1.45. Постройте распределительную диаграмму и кривую образования для
1,2,3-триаминопропана.46. В качестве лиганда для металлических ионов в аналитической химии
часто применяют 8-гидроксихинолин, иногда называемый 8-хинолинол или
«оксин». Концентрация незаряженных молекул в насыщенном растворе этого
соединения (его собственная растворимость) равна 3,78 • 10_3 моль/л. Определите
зависимость растворимости 8-гидроксихинолнна и концентрации его анионной
формы от pH.47. Рассчитайте pH 0,01 М раствора серина в воде и сравните со значением
pH в изоэлектрической точке.48. Постройте распределительную диаграмму и кривую диссоциации для ци-
стеина. Укажите на графиках нзоэлектрическую точку.49. Постройте распределительную диаграмму и кривую образования для
димера цистина, указав на графике pH изоэлектрической точки.50. Аспарагиновая кислота имеет две кислотные и одну основную группы,
аргинин — одну кислотную и две основные. Вычислите pH 0,01 М раствора
каждой нз них в чистой воде и сравните с pH изоэлектрической точки. Почему
аспарагиновая кислота относится к «кислым», глицнн — к «нейтральным», а арги¬
нин — к «основным» аминокислотам.51. В литературе можно иайти константы ионизации аминокислот, выражен¬
ные классическим способом, когда константа ионизации кислоты приведена для
каждой группы СООН, а константа ионизации основания — для каждой группы
204VII. 5. Полиамины и аминокислотыNHj. Найдите связь этих констаит с константами ступенчатой ионизации форм
с наибольшим числом протонов, использованных в табл. VII. 2, для аминокислот,
у которых:а. одна группа СООН и одна группа NH2;б. две группы СООН и одна группа NH2;в. одна группа СООН и две. группы NH2.52. Когда впервые было установлено, что аминокислоты существуют как
цвиттерионы, Н. Бьеррум предложил представлять константы ионизации амино¬
кислот в цвиттерионнон форме, когда константы ионизации кислот даны для
групп NH+, а константы ионизации основания — для групп СОО“ — цвнттериона.
Сопоставьте эти константы с «классическими» (см. Вопрос 51) и с константами
ступенчатого образования кислоты, приведенными в табл. VII. 2, для соединения
с одной группой СООН и одной группой NH2. Цвиттерионные константы для
аспарагиновой кислоты таковы: pKai = 2,08; рКаг = 3,94; рКь — 4,02. Каким
уравнениям равновесия они соответствуют? Есть ли какая-нибудь неоднознач¬
ность в этой форме представления констант?В разделе V. 7 были описаны буферные растворы, состоящие из
одной одноосновной кислоты и сопряженного с ней основания.
Рассмотрим буферные растворы, состоящие из нескольких кислот¬
но-основных систем. Последние могут быть солями многоосновных
кислот или смесями одноосновных кислот и оснований.Вычисление pH многих подобных сложных систем существенно
упрощается при использовании концентрационно-логарифмических
диаграмм. Наклон кривой диссоциации многоосновной кислоты
связан простым соотношением с буферной емкостью смеси их со¬
лей. Выведем некоторые общие зависимости буферной емкости
смеси от pH, но вначале рассмотрим некоторые характерные при¬
меры.Пример VII. 14. Определите pH буферного раствора, полученного растворе¬
нием 0,10 моль NaH2P04 н 0,05 моль NaOH в воде с последующим разбавлением
до 1 л.Запишем уравнения условий (см. раздел V. 7):
равновесияVII. 6. СЛОЖНЫЕ БУФЕРНЫЕ СИСТЕМЫ[н+] [Н2Р07] = 5,9 • 10“3 [Н3Р04][н+] [hpoj-]=6,15 • ю-8 [н2ро;][н+] [РО®“] = 4,8. 10-13 [НРО*“][h+][oh-] = i,o-io-14(1)(2)(3)(4)электронейтр альностиматериального баланса[Н3Р04] + [Н2Р07] + [НРО*“] + [РО3-] = 0,10(6)(7)[Na+] = 0,10+ 0,05
VII. 6. Сложные буферные системы205Приведенных соотношений достаточно, чтобы найти ответ, однако уравнение
протонного условия упрощает решение задачи, так как приводит к исчезнове¬
нию некоторых больших членов в каждой части уравнения (5). Подставляя выра¬
жение (7) в выражение (5) и складывая с условием (6), мы получим уравнение
протонного условия, использующее Н20 и H2POJ как частицы нулевого уровня:[Н+] + [Н3Р04] + 0,05 = [ОН"] + }НР042-] + 2 [Р04“] (8)Так как часть нонов Н2РО^ в растворе реагирует с нонами ОН-, образуя
ионы HPOJ”, можно оценить pH, учитывая, что Н2РО^ и HPOJ являются до¬
минирующими частицами в области pH =7 (см. рис. VII. 2). Когда эти два
вида ионов преобладают, то Н3Р04 и ноны РО®- присутствуют в пренебрежимо
малых концентрациях. Таким образом, можно пренебречь всеми членами в вы¬
ражении (8), за нсключеинем [НР04-]:[НР04-] = 0,05 (8а)Комбинируя выражение (8а) с выражением (6) и пренебрегая [Н3Р04] и [Р04~],
находим:[Н2РО;] = 0,05 (9а)Подставляя выражение (8а) и (9а) в (2), получим:[Н+] = 6,15* Ю8; pH = 7,21Вычисленные с учетом полученной концентрации нона водорода все другие
концентрации малы по сравнению с величинами [НРОГ] н [н2Р07]. Этот ре¬
зультат мог быть получен и из кривой титрования. Прн титровании НзРСН ед¬
ким натром ИаНгРСи — первая точка эквивалентности и Ф = 1. Если добавить
половину эквивалентного количества сильного основания, то Ф = 1,5. Из
рис. VII. 5 видно, что это происходит прн pH = 7,21, что соответствует резуль¬
тату, полученному ранее.Концентрационно-логарифмическую диаграмму, подобную изображенной иа
рис. VII. 4, можно также использовать для этой задачи, но условие пересечения[нроГ]=[н2ро;]непосредственно под точкой системы прн pH = рЛГаг = 7,21, выполняется только
в случае, если добавлена точно половина эквивалентного количества сильного
основания, и поэтому в общем случае этот метод не всегда полезен.Пример VII. 15. Определите pH 0,1 М раствора (NH4)2HPOt. Эта задача
наиболее легко решается с применением концентрационно-логарифмической диа¬
граммы, так как состав раствора тот же, что н у простой соли. На рис. VII. 9
совмещены диаграммы для 0,1 М раствора НзР04 н 0,2 М раствора NHj. Они
построены с учетом всех условий равновесий н ■ материального баланса. Недо¬
стающим соотношением является уравнение протонного условия, которое может
быть получено нз уравнений электронейтральности и материального баланса или
же путем следующих рассуждений. Выбрав за нулевой уровень вещества, обра¬
зующие раствор —Н20, NH^ и НР04_, запишем частицы с избытком водорода
206VII. 6. Сложные буферные системыв левой, а с недостатком — в правой частях уравнения протонного условия:[Н+] + 2 [Н3Р04] + [H2PO;j = [ОН-] + [NH3] + [РОГ]Изучение диаграммы в той области ее (около pH = 8), где обе величины
[НР04~] и [NH]'] велики, показывает, что наибольшей в левой части протонного
условия является величина [н2ро;], а в правой — [NH3]. Тогда протонное усло¬
вие приблизительно выполняется, если:[H2PO~] = [NH3]; pH ==8,07При этом значении pH концентрациями других частиц в уравнении протон¬
ного условия можно пренебречь. Так как эта точка пересечения близка к точкам-10 с н3ро4 н*ро4- nh; нро*-S pKa( = 2,2J рКо2=7,2/ рКа=Э,25 рКа3-12,32Рис. VII. 9. Концентрационо-логарифмическая диа¬
грамма для 0,1 М раствора (NH4)2HP04.£15 —точка Примера VII. 15системы Н2Р04 и NH*, то раствор будет буферным. Его буферная емкость мо¬
жет быть вычислена непосредственно из соотношений, приводимых ниже при
известном значении pH (см. Вопрос 53).Зависимость буферной емкости от pHБуферная емкость смеси одноосновных кислот и оснований
связана с pH простой зависимостью. Полученный в разделе V. 7
результат легко обобщается для любого числа пар кислота — осно¬
вание.Если условие электронейтральности для смеси нескольких сла¬
бых кислот, например НА, НА' и НА", выразить через [Н+], исполь¬
зуя выражения для условий равновесия, и продифференцировать,
то получается аддитивное выражение для буферной емкости, каж-
Зависимость буферной емкости от pH207дый член которого относится к одной из составляющих смеси:Р = Рн20 + РнА + РнА' + РнА" + • • •
Рн20 = 2,303 ( [Н+] + [ОН-] ) = 2,303 ([Н+] +СКа [Н*]Рнд — 2,303{.Ка -Ь [Н+])2(10)(11)(12)р-1И Т. д.Кислоты могут быть нейтральными (например, уксусная), ка¬
тионы— типа NHJ, анионы — подобные НгР07. Рассмотрим фор¬
му этих уравнений для конкретной
смеси.Пример VII. 16. Рассчитайте буферную ем¬
кость 0,1 М раствора NH4COOCH3 в зависимо¬
сти от pH. Используя уравнения (10) — (12) с
С = 0,1 (рКа — 4,75 для уксусной кислоты
НА) и С = 0,1 (р/Со = 9,25 для иона аммиака
НА'), получаем зависимость, приведенную на
рис. VII. 10. Величина pH раствора ацетата
аммония в воде равна 7 и соответствует мини¬
муму, находящемуся в центре кривой (точ¬
ка С). Минимумы в левой части (pH = 2,88)
соответствуют чистой уксусной кислоте, а в
правой (pH = 11,12)—чистому аммиаку. Ма¬
ксимумы в левой (точка А) и правой (точка В)
частях диаграммы соответствуют эквимоляр-
ным НАс — Ас- и NH3 — NH| буферным рас¬
творам (pH = 4,75 и 9,25). При значениях pH
менее 2 или более 12, буферная емкость резко
увеличивается за счет буферного действия
воды.Рис. VII. 10. Буферная емкость
смеси 0,1 НАс и 0,1 М NH3
с добавкой достаточно силь¬
ных кислоты или основания
для получения желаемого зна¬
чения pH.Точки А, В и С — соответствуют
эквимолярным буферным раство¬
рам НАс —Ac”, NH3— NH*, а также
раствору NH4Ac.Кривые, соответствующие уравне¬
нию (12), всегда имеют одинаковую
колоколообразную форму и могут быть получены для любой кис¬
лотно-основной составляющей таким смещением кривой по оси pH,
4тобы максимум был при pH = р/Са. В точке максимума буферная
емкость составляет 0,575 от аналитической концентрации пары кис¬
лота— основание. Точки максимума и минимума соответствуют
точкам минимального или максимального наклона кривой титро¬
вания.Так как члены уравнения для любой из пар кислота — основа¬
ние независимы, в уравнение (10) без всяких трудностей можно
включить любое число одноосновных пар кислота — основание. Бу¬
ферная емкость для каждого компонента смеси может быть вычис¬
лена как функция pH, а общая величина емкости при любом pH
тогда будет равна сумме вкладов всех отдельных компонентов
208VII. 6. Сложные буферные системыИспользуя различные пары кислота — основание с равными интер¬
валами р/Са, можно приготовить «универсальный буферный рас¬
твор» с буферной емкостью «0,5 С и интервалом pH от 2 до 12.Буферная емкость многоосновных кислотБуферные растворы многоосновных кислот можно рассматри¬
вать способом, изложенным выше, если их константы ионизации
не слишком близки друг к другу. Чтобы ошибка в расчете буфер¬
ной емкости находилась в пределах 5%, отношение двух последую¬
щих констант ионизации KadKai должно быть менее 0,05 (см.
ниже). Большинство многоосновных кислот, полиаминов и амино¬
кислот удовлетворяет этому условию. Каждой константе иониза¬
ции кислоты в уравнении (10) соответствует член типа (12). Это
иллюстрируется следующими примерами.Пример VII. 17. Рассчитайте зависимость буферной емкости 0,1 М раствора
ШРО* от pH. Так как отношение последующих коистант ионизации фосфорнойРис. VII. 11. Зависимость буферной емкости 0,1 М раствораН3Р04 (а) и 0,1 М
раствора фталата калия (б) от pH.А — эквимолярный буферный раствор Н^РО”—НРО^-; —значение буферной емкости длякислого фталата калия.кислоты ~ 10-5, то эту кислоту можно считать смесью трех одиоосновиых кис¬
лот в равных концентрациях и буферная емкость может быть тогда приближенно
выражена следующим образом:I - р “ЬР “ЬР _“ЬР 2—Н2° Н3Р°4 Н2Р°4 НР°4 , . Кн»0■ *,зи3^1н j-+ с/сд,[н+1 . скд2[н+] . _CKaJt£]_)[Н+] ^ (Kai + [н+] )2 + (Ка2 + [Н+]2) + (Каз + [Н+] f)Рис. VII. 11, а соответствует этому уравнению при С = 0,1 и при значениях
констаит ионизации, приведенных в табл. VII. 1. Два минимума соответствуют
солям NaH2P04 и Na2HPC>4 (0,1 М), буферная емкость любой из этих солей
составляет лишь 3% от буфериостн для эквимоляриой смеси (точка /4). Двэ
IТочное выражение для буферной емкости двухосновной кислоты 209других максимума замаскированы буферной емкостью воды при больших и ма¬
лых pH. Кроме того, точка А соответствует примеру VII. 14; она находится
при pH — 7,21, а (3 = 5,75 • 10-2 моль/л.Пример VII. 18. Определите зависимость буферной емкости 0,1 М раствора
кислого фталата калия от pH. Величина pH 0,1 М раствора, вычисленная с по¬
мощью констант, приведенных в табл. VII. 1, равна 4,18 *. Так как отношение
констант ионизации равно 10~3, то фталевую кислоту можно рассматривать как
смесь двух одноосновных кнслот. Для этой системы из уравнений (10)—(12) сле¬
дует:*н2о , С/Са1[Н+] С/Са2[Н+]Р = 2,303 [Н+] +[н+] (ка1 + [Н+] )2 (Ка2 + [н+] )2где С = 0,1; pKai = 2,95 и рКаг = 5,41; приведенные данные достаточны для
построения рис. VII. 11,6.Так как константы ионизации в данном случае ближе, чем для фосфорной
кислоты, то буферная емкость для кислого фталата калия (точка Ai) состав¬
ляет ~40% от максимальных значений по обе стороны от минимума. Посколь¬
ку р увеличивается по мере добавления кислоты или основания, постольку кис¬
лый фталат калия эффективен в более широком интервале pH, чем эквнмоляр-
ная смесь одноосновной кислоты и основания, буферная емкость которой умень¬
шается при добавлении кислоты или основания.Точное выражение для буферной емкости
двухосновной кислотыЕсли рассматривать многоосновную кислоту как смесь одно¬
основных, когда константы ионизации близки, то вычисленная бу¬
ферная емкость окажется ошибочной. Точное уравнение, учиты¬
вающее вклад буферной емкости двухосновной кислоты, получит¬
ся, если определить зависимость Сь от [Н+] в растворе, содержа¬
щем двухосновную кислоту Н2А в смеси с сильными кислотой и
основанием. Дифференцирование этого выражения даетР — Рн2о + Рн2агде„О,™ Гтт+1 [Н+]2 + 4Ka2 [Н+] + KalKa*Рн2л - 2,303C/Cal [Н ] ([н+]Ч*а,[н+] + ада2)2Условие, при котором становится необходимым выражение
(14), можно оценить исходя из того, что для смеси двух однооснов¬
ных кислот с константами ионизации Kai и Ка2, вклад в величину
р, определяемой уравнениями (10) и (12), составляет:Й — 2303С/С fH+1 <’ + *«*/*«!> fH+12 + Wa* [H*l + (I + KgJKai) KalKa2{[Н+Г + (1 + KatlKal) Kai [H+] + K^KalY* Официальным британским стандартом pH и одним из рН-стандартов На¬
ционального Бюро Стандартов США является 0,05 М раствор кислого фталата
калня, pH которого равен 4,005 при 25 °С. Константы в табл. VII. 1 согласуются
с этим значением, если введены поправки на коэффициент активности (см. Прц-
Нер XII. 2, стр. 378).
210VII. 6. Сложные буферные системыУравнение (15) имеет ту же форму, что и уравнение (14), за
исключением множителя 1 + Каг/Ка!- Когда /Саг составляет меньше
5% от Каи этот множитель вносит ошибку менее 5%, и выражение
(10) дает практически те же значения р; что и уравнение (14).
В главе IX мы продолжим дальнейшее обсуждение общей формы
этих выражений.Существует всего несколько многоосновных кислот, которые
нельзя рассматривать как смеси одноосновных кислот. Например,
для перечисленных в табл. VII. 1 нужно использовать выражение
(14) вместо (12) только для винной, сукциновой и адипиновой кис¬
лот, а также для первых двух констант ионизации пирофосфорной
и лимонной кислот.Индекс крутизны при титровании многоосновной кислотыИндекс крутизны (наклон кривой титрования, см. раздел V. 8)
связан с буферной емкостью следующим образомПТ1 = -(16)pHРис. VII. 12. Индекс крутизны
при титровании фосфорной
кислоты.В и С— эквивалентные точки ионовНоР07 и HPOf2 4 4эквнмолярный
2-где С — аналитическая концентрация
буферного вещества. Таким образом,
если известен вид функции Р = / (pH),
то известен и вид функции =
= /(pH).В случае титрования фосфорной
кислоты (рис. VII. 12) два максиму¬
ма на кривой для величины ri соответ¬
ствуют двум минимумам на кривой
для р (см. рис. VII. 11,а); эти макси¬
мумы пригодны для применения точки
эквивалентности. Величина ri для точ¬
ки эквивалентности НРО4- (точка В)
несколько выше, чем для точки экви¬
валентности H2POJ (точка А). Индекс крутизны зависит от раз¬
бавления только в той степени, в которой буферная емкость воды
вносит вклад в общее значение р, так что рис. VII. 12 почти не ме¬
няется с изменением концентрации титруемой фосфорной кислоты
и вид его не зависит от разбавления в процессе титрования.Понятие индекса крутизны представляется наиболее полезным
в связи с концентрационно-логарифмической диаграммой, так как
величина т] для любой точки эквивалентности может быть прибли¬
женно получена из диаграммы. Ранее (раздел VII. 3) были приве¬
дены (без доказательства) правила для выполнения этого про¬
цесса. Теперь же покажем, что индекс крутизны первой точки э$»буферный раствор Н2РО~—НР04
Индекс крутизны при титровании многоосновной кислоты211Бивалентности при титровании двухосновной кислоты раствором
сильного основания выражается следующим приближенным соот¬
ношением:С0ц' = 0,1[Н2А]'(17)Р Ка?Точка эквивалентности получается при пересечении прямых
[Н2А] и [А2-] на диаграмме (рис. VII. 13), но при условии, что вели¬
чины [Н+] и [ОН-] пренебрежимо малы с
по сравнению с величиной [Н2А]'. (Если *
какой-либо из величин [Н+] или [ОН-]
нельзя пренебречь, то задача сводится к
определению точки эквивалентности си¬
стемы слабая кислота — сильное основа¬
ние или слабое основание — сильная кис¬
лота, решение которой приведено в раз¬
деле V. 8). Объединяя соотношение[н2а]' = [а2-]'с выражением для констант равновесия,
получим выражение для pH точки экви¬
валентности:[Н+Y — VKalKa(18)4 7 10 13
pHРис. VII. 13: Концентра¬
ционно-логарифмическая
диаграмма некоторой гипо¬
тетической двухосновной
кислоты со значениями
рКа\ = 5,00 и pKai = 10,00.Н2А=С; 1 — первая эквивалент¬ная точка.Подставляя выражение (18) в выра¬
жения для буферной емкости (10) и (12),
найдем, что если [Н+] и [ОН-] малы, то общая буферная емкость
определяется выражением:VXJK,Р = Рн2а + Р-- = 2-303 (2С)НА'(1 +VKa2lKaif(19)Индекс крутизны получается подстановкой уравнения (19) в
(16):0 + /*«/*„,)*ц' = 0,217-VKaJKai(20)Величина rj' не зависит от С, и, следовательно, от разбавления
в процессе титрования. Этого не наблюдается для тех точек экви¬
валентности, для которых используют пересечение линий [Н+] или
[ОН-].Если константа /Саг мала по сравнению с Каи что свойственно
любому титрованию (см. ниже), можно произвести ряд упроще¬
ний. Если отношение Каг/Кы < Ю~3, величины [Н2А] и [А2-] со¬
ставляют менее 3% от величины [НА'] в точке эквивалентности.
Если выражение (18) подставить в выражения равновесия с
212VII. 6. Сложные буферные системы[НА*]' = Со/2 (так как раствор разбавляется приблизительно вдвое
в процессе титрования), то получим, что:[Н2А]/ = [А2"]' = j С0 VКа2/Ка1 (21)Поскольку отношение KazlKai предполагается меньшим 10-3,
можно пренебречь вторым членом в числителе выражения (20), и,
подставляя (21), находим приближенное выражение:"'-«■'тетг (17)В логарифмической форме оно имеет вид:lgTi' = lgC0-lg[IW-l (22)Это показывает, что правила, установленные в разделе VII. 3,
приложимы не только к титрованию одноосновной кислоты основа¬
нием, но и к промежуточным точкам эквивалентности при титро¬
вании многоосновных кислот, если Ка различаются на 3 или более
единиц.Следует отметить, что если отношение констант KazlKai > 10"3,
то из выражения (21) следует, что [НгА]' > 0,015 С0, а из выраже¬
ния (17) —что г) < 6. Таким образом, когда условия этого вывода
нарушаются, индекс крутизны так мал, что точка эквивалентности
не является пригодной для практики конечной точкой.ВопросыОпределите pH и буферную емкость для следующих растворов. Используйте
по мере необходимости константы табл. V. 1, V. 2, VII. 1 и VII. 2. Для большин¬
ства вычислений pH можно использовать концентрационно-логарифмические диа¬
граммы. Для некоторых систем постройте кривую р = /(pH).53. 0,1 М раствор (NH4)2HP04.54. «Универсальный буферный раствор», состоящий из 0,1 М раствора
(NH4)2HP04 и 0,1 М раствора CHaCOONa.55. 0,2 М раствор NH4H2P04.56. 0,1 Af раствор кислого оксалата калия.57. 0,1 М раствор NH4CN.58. 0,1 Af раствор 1ЧН4НСОз.59. Раствор, 1 л которого содержит 0,1 моль СНзСООН и 0,05 моль NaCN.60. 0,05 М раствор оксалата аммония.61. 0,05 М раствор (NH4)2COs.62. 0,05 М раствор N2H5C1.63. Раствор, 1 л которого содержит 0,1 моль N2H4 и 0,1 моль МН4С1.64. Смесь 0,01 М глицина и 0,01 М имидазола. Эта смесь — грубая модель
буферного действия в биологических системах.• 65. Раствор, 1 л которого содержит 0,1 моль кислого тартрата калия я
0,025 моль NaOH.66. 0,1 М раствор лимонной кислоты.67. 0,1 М раствор цитрата аммония.68. 0,1 М раствор кислого цитрата натрия.69. Раствор, 1 л которого содержит 0,1 моль (№и)2СОз и 0,1 моль CHjNHa.
VI 1.7. Растворимость солей многоосновных кислот21370. Покажите, что составляющая буферной емкости пары одноосновная кис¬
лота— основание, определяемая уравнением (12), имеет максимум при pH = р/С„
и что максимальное значение (3 равно 0,575 С.71. Выведите уравнение (14) для составляющих буферной емкости двухос¬
новной кислоты. Покажите, что при Kai = ЬКаг, статистический предел вели¬
чины PHjA для длинноцепных дикарбоновых кислот имеет форму, одинаковую
с р для одноосновной кислоты концентрации 2С и эффективным значением Ка,
равным среднему геометрическому величин Каi и Каг-72. Покажите, что если Каi > 4Каг, центральный минимум на кривой буфер¬
ной емкости двухосновной кислоты достигается при [Н+] = У KaiKa2 ■73. Постройте график для величины р/С по уравнению (14) для двухосновной
кислоты при Kat — Kai. На этом же графике нанесите кривую P/С, удовлетво¬
ряющую уравнению (12), для случая одноосновной кислоты при том же значе¬
нии Ка- Сравните эти кривые.VII. 7. РАСТВОРИМОСТЬ СОЛЕЙ МНОГООСНОВНЫХ КИСЛОТРассмотрим растворимость солей многоосновных кислот, не
учитывая эффектов гидролиза (который может быть весьма суще¬
ственным) или комплексообразования. Это фактически ограничит
нас карбонатами и фосфатами щелочноземельных металлов, кото¬
рые, тем не менее, являются очень важными веществами. Кон¬
станты равновесия для ряда таких систем приведены ниже.Реакция * ig /СФосфорная кислота: p/Cai = 2,23; pi(a2 = 7,21; рКлз= 12,32MgNH4P04 (тв.) Mg2++NH++P03" -12,6Са8(Р04)2 (тв.) ЗСа2++2Р043_ -26,0CaHP04 (тв.) Саг++НР02_ -7,0СаНР04(Н2о)2 (тв.) jrt Ca2++HP0j-+2H20 -6,57Са5(Р04)30Н (тв.) 5Са2+ + ЗР03-+0Н~ -57,8Ca2++HPOf CaHP04 (aq) 2,70Са2++НгР07 5=± СаН2Р04 1,08Угольная кислота: pKai =6,35; рКа2— Ю,25MgC03(H20)3 (тв.) Mg2++C023-+3H20 -4,25Mg2++HC03 MgHCO+ 1,0СаС03 {ти., кальцит) 7~*~ Са2++С02_ —8,18СаС03 (тв., арагонит) 7~*~ Са2++С02- —8,04Ca2++HCOJ СаНС03 1,0SrC03 (тв.) Sr2++C02- -9,96ВаС03 (тв.) Ва2++С02~ -9,26• Значения всех констант получены экстраполяцией к нулевой ионной силе.
214VII. 7. Растворимость солей многоосновных кислотСущественное осложнение в этих системах связано с наличием
нескольких твердых фаз, отличающихся растворимостью. Так, для
фосфата кальция известна, по крайней мере, семь кристаллических
форм различного состава; четыре из них приведены выше, а две —
наименее растворимые — рассмотрены в Примере VII. 19. Карбо¬
нат кальция существует в виде кальцита и арагонита, раствори¬
мость которых различна. Соли магния и кальция образуют не¬
прочные комплексы с ионами НСОд и НР02-, и по этой причине
Примеры VI 1.20 и VII. 21 скорее относятся к ВаС03, чем к СаСОз.
Влияние образования этих комплексов на растворимость рассмат¬
ривается в ряде Вопросов.Пример VII. 19. Определите растворимость Са3(Р04); в чистой воде.Запишем упрощенные уравнения условий:
равновесийс условиями (7) и (8) дает уравнение протонного условия или более удобное
условие материального баланса по иону гидроксила:Так как первоначально присутствующей твердой фазой является Саз(Р04)2,
то уравнение (5) применимо к равновесию растворимости до тех пор, пока рас¬
твор достаточно щелочной. В более кислых растворах, вследствие более высокой
концентрации иона НР04~ в растворе, менее растворимой твердой фазой станет
СаНР04, и к равновесию растворимости будет применимо уравнение (6). Если
избыток Саз(Р04)2 поместить в кислый раствор, то некоторая часть соли перей¬
дет в СаНР04-Допустим сначала, что Са3(Р04)2—единственная твердая фаза, а Са2+
и Р04~—основные из присутствующих ионов. Запишем тогда в приближенном
виде условия материального баланса:(1)(2)(3)(4)(5)(6)[Н+] [P0f ] = 4,8 • 10"13 [НРО2-]
[Н+] [ОН-] = 1,0- 1<Г14[Са2+] [НР042-]=1,0.10-7(7)(8)[РОГ] + [НРОГ] + [Н2Р0;] + [Н3Р04] = 2SКомбинация условия электронейтральности2[Са2+] + [Н+] = [ОН'] + [Н2РО;] + 2[НР02-] + 3 [РО^][он-] = [Н+] + [НРО2-] + 2 [Н2Р07] + 3 [Н3Р04](9)[Са2+] = 35(7)(8а)
VII. 7. Растворимость солей многоосновных кислот215Используя выражение (5), получаем:S = 2,5 • 10~бПри указанных допущениях уравнение (9) упрощается до[Н+] = [ОН-] (9а)а уравнение (4) —до:[Н+] = 1,0-Ю7Подставляя значения [Н+] и [POJ-] в уравнение (3), получим[НР02-]= 1,04что абсурдно!Итак, допущение о преобладании иона [Р04~] среди всех ионов фосфата —
неверно.Поэтому, более разумно допустить, что в уравнениях (8) и (9) преобла¬
дает [НР04~], т. е;[Са2+] = 35 (7)[HP0*-] = 2S (86)[0Н-] = [НР02-] (96)Объединяя уравнения (3) — (5), получим соотношение между этими 4 неиз¬
вестными:[Са2+]3[НР02-]2 [ОН-]2 = 4,4 • Ю~30 (10)Подстановка уравнений (7), (86) и (96) в (10) дает:S = 2,7 • Ю-5что в 10 раз больше растворимости, вычисленной без учета гидролиза фосфат-
иона.Для проверки результата, вычислим концентрации других ионов:[Са2+] = 8,1 • Ю~5 [нз уравнения (7)][НРО2-] = 5,4 • 10-5 [из уравнения (86)][ОН-] = 5,4 • 10-5 [из уравнения (96)][Н+] = 1,8-Ю—10 [из уравнения (4)][РО3-] = 1,4 • Ю-7 [из уравнения (3)][Н2РО“] = 1,6-10-? [из уравнения (2)][Н3Р04] = 4,8 • Ю—13 [из уравнения (1)]Величины всех этих концентраций согласуются с предположением, что ион
[НР042-] — преобладающая фосфатная форма в растворе.Наконец, необходимо удостовериться, что фосфат СаНРО* не осаждается,
поскольку это приводит к нарушению условия материального баланса. Отметим
НТО[Ca2+][HP042-] = 4,4.1Q-
216VII. 7. Растворимость солей многоосновных кислота это значительно меньше 1 • 10~7, т. е. величины произведения растворимости,
которой достигнет произведение концентраций перед выпадением в осадок
СаНР04. Раствор должен быть значительно подкислен для того, чтобы осадки
Саз(Р04Ь и СаНР04 пришли в равновесие с раствором (см. Вопрос 76).Пренебрегая образованием в растворе комплекса СаНР04, мы вводим в вы¬
числения растворимости некоторую ошибку. Из коистанты равновесия реакции
образования этого комплекса, приведенной выше, находимчто составляет ~ 10% от величины растворимости. Поэтому концентрацию этого
комплекса следует включить в условие материального баланса, как в Вопро¬
се 74.Пример VII. 20. Рассчитайте растворимость ВаСОз в 0,01 М растворе
NaHCOs- Бикарбонат действует как буфер, фиксирующий концентрацию СОи, следовательно, растворимость ВаСОз.Запишем уравнения условий
равновесийПоследнее можно объединить с выражениями (14) и (15) для того, чтобы нс-Так как [НСО“] велика по сравнению с концентрациями других карбонатов
и величииой 5, то уравнение (15) может быть записано в приближенном виде:Подстановка уравнений (15а) в уравнения (И) и (12), а (14) и (18) в (13)
дает:[СаНР04] = 5 • 10* [Са2+] [HPOj-] = 2,2 • 10_в(И)(12)(13)(14)(14)(15)[Н+][ОН~] = 1,0.10~14'материального баланса[Ва2+] = Sэлектроиейтральностн, с учетом того, что [Na+] = 0,01[Н+] + 2 [Ва2+] + 0,01 = [ОН-] + 2 [COf-] + [НСО"]ключить большие величины(16)(15а)[С02] = 2,28 • 10+4 [Н+](17)(18)5 = 983 [Н+](19)
VII. 7. Растворимость солей многоосновных кислот217Итак:Подставляя уравнения (4), (14), (17)—(19) в уравнение (16), получаем
уравнение с единственной неизвестной [Н+]:[Н+] + 983 [Н+] + 2,28 • 10+4 [Н+] = —'+°- — + --’6' -IH J [Н J[Н+] = 4,90‘ 10—9S = 4,8-10_ei [из уравнения (19)][С02] = 1.1 • Ю~4 [из уравнения (17)][СОд“] = 1,1 • 10~4 [из уравнения (18)][НСО^"] = 0,98 • 10 2 [из уравнения (19)]Величина 0,98 • 10~2 лишь иа 2% отличается от значения [НСО“] = 1,00 • 10 2,
принятого в уравненяи (15а).Пример VII. 21 Рассчитайте растворимость ВаСОз в растворах НС1 и зави¬
симость pH насыщенных растворов от аналитической концентрации НС1 (С).
Условия равновесий те же, что и в Примере VII. 20, но используется другое ус¬
ловие материального баланса для карбоната, а условие электронейтральности
содержит [С1~]. Условие материального баланса имеет вид:[СО’-] + [НС07] + [С02] - S (20)Условие электронейтральности может быть объединено с уравнениями (14)
и (20). Используя соотношение [С1~] = С, для исключения [Ва2+] и [СО*-], полу¬
чаем:[Н+] + [НСО“] + 2 [С02] == [ОН~] + С (21)Выразим теперь все концентрации через две основные переменные — S и [Н*].
Подстановка уравнения (14) в уравнение (13) дает:[СОГ] = ^^ (22)Подставляя уравнение (22) в уравнение (12), а (23) в (11) получаем:(23)[НС07] = 9,8зЫ,7 [Hi
,\J21 — • К " Из уравнения (4) находим, что:[С02] = 2,23.Ю7Ш- (24)[ОН-] ■=-1,00-'10. М- (4)[н+]ение IS2 = 5,5 • КГ10 + 9,83 [Н+] + 2,23 • 107 [Н+]2 (25)Подстановка этих выражений в уравнение (20) дает некоторую функцию Su
связывающую S и [Н+]:
218VII. 7. Растворимость солей многоосновных кислотДругую функцию S2, связывающую S и [Н+], можно получить, если подста¬
вить все концентрации в уравнение (21):9,83 [Н+]2 (1 + 4,54 • 10+а [Н+] )
1,00-10-14 + С[Н+]-[Н+]2(26)Для любого значения аналитической концентрации НС1 (С) кривая зависи¬
мости Si от [Н+] пересечет кривую зависимости S2 от [Н+] в точке насыщения
и даст значения растворимости и pH насыщенного раствора (рис. VII, 14, а).-IgS-lg С-1§СРис. VII. 14. Растворимость ВаС03
в кислоте концентрации С:
а —общая диаграмма; б —диаграмма
для сильной кислоты; в —pH насыщен¬
ного раствора ВаСОз в сильной кислоте.
Рис. б не получены с использованием
значений точек пересечения рис, а,1 — растворимость, рассчитанная в'пред¬
положении отсутствия гидролиза карбо¬
ната, S=y"/C(TB) 0=2*34 " l0~5* Sj “ рн
насыщенных водных растворов ВаСОз;2 — растворимость в чистой воде,5,75 . юв; 3 — растворимость в НС1;
4 — pH насыщенного водного раствора
ВаСОя.Функция Si имеет простой физический смысл — растворимость ВаСОз в рас¬
творе данной кислотности, прн условии отсутствия внешнего источника карбо¬
ната. Отметим, что St не зависит от С. Функцию S2 не так просто интерпрети¬
ровать, поскольку она выбрана просто для удобства построения графика. В част¬
ности, S2 не является концентрацией ВаСОз в ненасыщенном растворе с некото¬
рой величиной pH, подобной S' в разделе VI. 6 (стр. 172). Можно подставить
S2 из уравнения (26) вместо Si в уравнение (25), с тем, чтобы получить урав¬
нение 6-й степени относительно [Н+], численное решение которого даст pH насы¬
щенного раствора, однако графическое решение, использующее пересечение кри¬
вых Si и S2, гораздо более удобно.Подобные расчеты применимы только до тех пор, пока вся образовавшаяся
С02 остается в растворе. Экспериментально этого можно достичь, если проводить
реакцию в запаянной ампуле без воздуха. В открытом же сосуде задача ста¬
Вопросы219новится неопределенной, так как парциальное давление С02 над раствором опре¬
деляет количество СОг в растворе[С02] = 3,43 • 10~2 Р Со2 (27)где Рсог— паРЦиальиое давление газообразного СОг над раствором; [СОг] —
концентрация растворенного СОг, моль/л. Потоки воздуха над сосудом, скорость
реакции, геометрия сосуда — все это влияет на Рсс,2. Истинное равновесие будет
достигнуто, когда Р СОг равно парциальному давлению С02 в атмосфере, состав¬
ляющему 10~3 атм. Удаление С02 из раствора увеличивает растворимость ВаСОз
в кислоте. В этом случае условие материального баланса имеет видs = [со,2-] + [нсо;] + 3,43 • Ю-2 рСОз + qгде Q — число молей С02, уходящих из 1 л раствора в условиях реакции.На практике проще насытить раствор С02 при данном парциальном давле¬
нии, например 1 атм. В этом случае растворимость ВаСОз в растворах, насыщен¬
ных С02, точно определена и условие материального баланса [уравнение (20)] уже
не выполняется, а заменяется равновесием растворимости С02 в воде [уравнение
(27)], с фиксированным значением ^сог’ Равным 1 атм. Последнее приводит
к фиксированному значению [С02] = 3,4 • 10~2; другие же концентрации могут
быть определены так, как это сделано в Примере VII. 20 (см. Bonpocpi 80 и 81).ВопросыПо мере необходимости используйте константы равновесия, приведенные на
стр. 213. В задачах, связанных с фосфатом кальция, для получения реальных
результатов следует учитывать наличие частнц CaHP04 (aq) и СаН2Р04.74. Рассчитайте растворимость Са3(Р04)2 в воде, учитывая концентрации
двух комплексов Ca(HP04) (aq) и СаН2РО*. Сравните с результатами При¬
мера VII. 19.75. В 1 л Н20 взбалтывают взятый в избытке СаНР04 (тв.). Рассчитайте
pH насыщенного раствора, число молей растворившего СаНР04 (тв.) и число
молей осадка Саз(Р04)2, если таковой образуется. Включите комплекс CaHPOs, (aq)
в условие материального баланса.76. Определите pH раствора, насыщенного поСаНР04 (тв.) иСаз(Р04)2 (тв.).77. В 1 л 1,0 -10-2 М раствора Na2HP04 взбалтывают Саз(Р04)2, взятый в
избытке. Рассчитайте число молей растворившегося Са3(Р04)2 и вновь образую¬
щегося осадка СаНР04 (тв.), если он образуется. В условие материального
баланса следует включить комплекс CaHP04 (aq).78. 3,1 г Са3(Р04)2 (тв.) следует растворить в 1 л разбавленной фосфорной
кислоты. Какое минимальное количество фосфорной кислоты необходимо для
этого?79. Осаждается ли какая-нибудь из двух кристаллических форм фосфата
кальция из насыщенного раствора Са3(Р04)2 в чистой воде? Можно ли осадить
их, изменяя pH раствора?80. Как упоминалось в Примере VII. 21, низкая растворимость С02 в воде
усложняет реальные вычисления растворимости карбонатов в кислых растворах.
Способ избежать этого — проведение реакции в атмосфере С02. Рассчитайте рас¬
творимость ВаСОз в водном растворе, насыщенном С02, в котором [С02] =
= 3,43 • 10'2 моль/л.81. Рассчитайте зависимость растворимости СаСОз (кальцита) в насыщен¬
ной С02 воде от парциального давления С02.Такие вычисления интересны с точки зрения интерпретации образования из¬
вестняковых пещер и характерных для них сталактитов и сталагмитов. Сильная
220VII. 7. Растворимость солей многоосновных кислотзависимость растворимости СаС03 от парциального давления СОа объясняет
медленность растворения известняка в дождевой воде; по мере же улетучивания
СОг карбонат кальция вновь выпадает в осадок.82. Рассчитайте растворимость СаСОз (кальцита) в чистой воде, используя
графический метод, указанный в Примере VII. 22.83. Рассчитайте концентрацию СаНСОд в насыщенном растворе СаСОз в
чистой воде.84. Рассчитайте растворимость СаСОз в 0,1 М растворе NaHC03, включая
реакцию образования СаНСО* в условия равновесия. Сравните со значением, вы¬
численным без учета [СаНСО,].85. Магний обычно определяют весовым путем, осаждая MgNHiPOifHjO)*
и прокаливая этот осадок до получения М{*2Рг07; последний затем взвешивают.
К 2 г (NH^HPOi добавлено 150 мл раствора, содержащего ~0,2 г MgO, рас¬
творенного в НС1 и нейтрализованного аммиаком до изменения цвета метилового
красного (pH = 5). Затем добавлен избыток ЫНз с тем, чтобы концентрация.
NHj стала ~0,5 моль. Рассчитайте приблизительно долю магния, не выпадаю¬
щего в осадок при этой процедуре.
Глава VIIIКОМПЛЕКСООБРАЗОВАНИЕ
(ВВЕДЕНИЕ В ТЕОРИЮ)VIII. 1. СТУПЕНЧАТОЕ КОМПЛЕКСООБРАЗОВАНИЕ В РАСТВОРЕЛюбые частицы в растворе, образованные из двух или не¬
скольких более простых частиц, которые также могут существо¬
вать независимо в растворе, называются комплексными. Ком¬
плексы обычно заряжены положительно или отрицательно, но
могут быть и в виде электронейтральной частицы (комплексные
соединения). Кислотно-основным системам присуще некоторое
своеобразие, поскольку комплексы в них образуются объедине¬
нием ионов водорода и центральной группы, подобной NH3 или
РС^.Математический аппарат, развитый в главах V и VII приме¬
нительно к кислотам и основаниям, может быть легко распростра¬
нен и на системы, в которых комплексы образуются путем объ¬
единения нейтральных или анионных групп с ионом металла. Ти¬
пичным представителем комплексов такого типа является ион
тетрамина меди Cu(NH3)*+.Оказалось, что комплексы ионов металлов, обнаруженные вна¬
чале в качестве «составляющих» в кристаллах некоторых солей
и являющиеся более устойчивыми, чем последние, могут суще¬
ствовать *как независимые частицы и в растворах. Способность
металлов к комплексообразованию в растворах изменяется в ши¬
роких пределах. Щелочные и щелочноземельные металлы обра¬
зуют очень слабые комплексы, которые правильнее называть
ионными парами, поскольку энергия связи аниона с катионом
лишь очень незначительно превышает энергию электростатиче¬
ского притяжения. Напротив, очень устойчивы аммиачные ком¬
плексы Со3+, изученные в 1893 г. Вернером. Аммиак, связанный
с кобальтом в комплексе Co(NH3)g+, почти не взаимодействует
ни с кипящей соляной, ни с концентрированной серной кислотами.В этой и следующей главах рассматриваются одноядерные
комплексы, состоящие из центрального иона металла и связанных
а ним нейтральных или анионных групп, называемых лигандами.
Число связанных с центральным ионом лигандов называется ко¬
ординационным. Координационное число и геометрия комплекса
зависят от электронной структуры центрального иона и лигандов.
222VIII. 1. Ступенчатое комплексообразование в раствореОбъяснение комплексообразования является трудной задачей, не
рассматриваемой в данной книге. Наиболее успешно химическую
связь в комплексных соединениях и их геометрическое строение
объясняет теория поля лигандов. Интересующиеся найдут обсуж¬
дение этих вопросов в специальной литературе.Строго говоря, большинство ионов металлов в растворе при¬
сутствует только в виде комплексов, так как всегда имеются мо¬
лекулы растворителя, прочно связанные с ионом. Методом диф-
фракции рентгеновских лучей было установлено существование
в кристаллах А1(Н20)б+, Си(Н20)4+ и подобных ионов.Если равновесие реакций обмена лигандов устанавливается
достаточно медленно, как, например, в случае Сг(Н20)^+ и
Co(NH3)5H203+, то число молекул в первой гидратной оболочке
может быть определено прямым химическим анализом. Исполь¬
зуя результаты спектроскопических исследований, теория поля ли¬
гандов предсказывает возможную природу гидратированных час¬
тиц в растворе. Так, хотя обычно ион меди в узлах кристалличе¬
ской решетки находится в виде иона Си(Н20)^+, доказано что
в растворе основной его формой является Си(Н20)|+, причем две
молекулы воды расположены на большем расстоянии, чем че¬
тыре другие. Недавние исследования методом изотопного разбав¬
ления также привели к получению сведений о степени гидратации
ионов в растворе.Приведенные примеры свидетельствуют о том, что комплексо-
образование в водном растворе происходит вследствие замещения
молекул воды-лигандов анионами или другими лигандами, о чем
уже упоминалось в главе I.Поскольку в водных растворах всегда имеется избыток воды,
а обычным потенциометрическим методом определения состава
ионных соединений в растворе нельзя выяснить количество моле¬
кул воды, присоединенных к иону, в формулах соединений в рас¬
творе принято опускать молекулы воды-лиганда.Например, мы пишем формулу гидратированного протона в
виде Н*-, гидратированного иона меди — Си2+, а комплекса
Cu(H20)4(NH3)|+ — в виде Cu(NH3)^+. Образование простейших
комплексных гидроокисей часто рассматривают как результат от¬
щепления протона от молекулы воды-лиганда:А1(Н20)^+ + Н20 А1(Н20)50Н2++ Н30+Запишем эту реакцию сокращенноА13+ + Н20 А1(ОН)2+ + Н+Иначе говоря, полагают, что гидроксокомплекс образуется из
иона металла и лиганда ОН-.
Вычисления при наличии ступенчатых равновесий223Вычисления при наличии ступенчатых равновесийРасчет равновесия с участием комплексов представляет часто
более трудную задачу, чем подобный же расчет для многооснов¬
ных кислот, из-за присутствия в заметных концентрациях не¬
скольких разнотипных частиц. Однако, если известен pH кислот¬
но-основной системы, то легко произвести расчет концентраций
и всех остальных существующих в растворе частиц; точно также,
если известна концентрация лиганда, то для одноядерного ком¬
плекса легко рассчитать и концентрации всех остальных частиц
в растворе. Как будет видно из последующих примеров, графиче¬
ские методы, используемые для кислотно-основных систем, при¬
менимы и к системам, содержащим комплексы.В табл. VIII. 1 приведены константы ступенчатого комплексо-
образования некоторых одноядерных комплексов, у которых ли-Таблица VIII.1Константы ступенчатого комплексообразования
одноядерных комплексов при 25 °С*(J. Bjerrum, G. Schwarzenfiach, L. Sillen, Stability Constants,
Parts I, II, Spec. Publ. № 6, 7, L., 1958).ЛигандЦентральныйионЛогарифм константы равновесияИоннаясила,MKiKiКзKiK5KeСГAg+2,851,870,320,860,2Cd2+1,320,900,09-0,454,5Hg2+6,746,480,851,000,5Pb2+0,880,61—0,40-0,151,0*»In3+1,420,811,00—0,21,0Fe3+0,620,11— 1,40— 1,921,0Fe2+0,360,04Вг*Ag+4,152,960,840,940,1Cd2+1,560,460,230,411,0Hg2+9,058,282,411,260,5ГCd2+2,080,872,091,594,5CN'Hg2+Cd2+12,875,4810,955,143,784,562,233,580,53,0Hg2+18,0016,703,832,980,13*SCN"Ag+4,593,701,771,204,0Ni2+1,180,460,171,0Cr3+3,11,71,00,3—0,7-1,650 °C4*S208'рез+1,962,02—0,41—0,14-1,57-1,511,8 5*Ag+8,824,640,6920 °C 4** Обозначения констант приведены в главе I. За исключением CN (рКц^=9,32^ вселиганды •—анионы сильных кислот. Среда, в которой проводили измерения, NaClCb.** Среда - КС1.
з* Среда — NaNC>3.4* Значения получены для разбавленного раствора, а затем эдстраполированы к нулевой
ионной силе.в* Среда —KNOa; значения сильно зависят от природы среды.
224VIII. I. Ступенчатое комплексообразование в растворегандами являются анионы сильных кислот. Хотя эти значения
согласованы друг с другом, но поскольку почти все они получены
при измерениях в среде с постоянной ионной силой, обычно в рас¬
творе перхлората натрия с концентрацией от 1 до 4 моль, то,
строго говоря, их нельзя применять в более разбавленных рас¬
творах. Однако для иллюстрации методов расчета будем считать,
-что эти концентрационные константы не зависят от ионной силы.
Подобные предварительные расчеты необходимы в любом случае
для оценки ионной силы равновесного раствора и расчета коэф¬
фициентов активности с целью получения значений концентра¬
ционных констант в случае реализуемой в данных условиях ион¬
ной силы (см. главу XII).Рассмотрим вначале расчет концентраций различных групп
комплексов в случае избытка лиганда.Пример VIII. I *. Рассчитайте концентрации всех частиц в растворе, содер¬
жащем 1,0 моль/л НС1 и 0,1 моль/л Cd(N03)2. Так как раствор кислый, для
упрощения расчета можно пренебречь гидролизом иона металла.Запишем уравнения условий:
равновесий[CdCl+] = 21 [Cd2+] [Cl-] (1)[CdCl2] = 7,9 [CdCI+] [CI-] - (2)[CdClj] = 1,23 [CdClj [СГ] (3)[CdClj-] = 0,35 [CdCl;] [Cl-] (4)материального баланса[СГ] + [CdCI+] + 2 [CdCl2] + 3 [CdCI~] + 4[CdClf] = 1,00 (5)[Cd2+] + [CdCl+] + [CdCl2] + [CdCljJ + [CdCl|“] =0,01 (6)В первом приближении можно допустить, что хлор в основном присутствует
в виде свободного С1~-иона; это разумно, так как аналитическая концентрация
его в 100 раз выше концентрации кадмия. Тогда уравнение (5) можно прибли¬
жение записать так:[СГ]= 1,00Используя это уравнение, получим при помощи констант равновесия отно¬шение концентраций различных частиц к [Cd2+]:[CdCl+] = 21 [Cd2+] [из уравнения (1)J (7)[CdCl2] = 165 [Cd2+] [из уравнений (7) и (2)] (8)[CdCl^] =■» 204 [Cd2+] [из уравнений (8) н (3)] (9)[CdClj-] = 71 [Cd2+] [из уравнений (9) и (4)] (10)* С. А. Щукарев и др., Уч. зап. ЛГУ., Сер. хим., JM° 15, 211, 17 (1957).
Некоторые авторитетные исследователи ничего не сообщают о существовании
группы CdClp см. Вопрос 4.
Вычисления при наличии ступенчатых равновесий228Подставляя уравнение (7) в уравнение (6) и решая последнее относительно
[Cd2+], получаем:[Cd2+] == 2,16 • 10"5Подставляя это значение обратно в уравнения (7)—(10), получим концентра¬
ции остальных групп:[CdCl+] = 4,55 • 10—4
[CdCl2] = 3,58 • 10-3
[cdd~] = 4,40- 10_3
[CdClf]= 1,54- 10"3Обратите внимание иа то, что хотя среди комплексов кадмия в растворе
содержится больше всего CdClJ, однако и других частиц не на много меньше.Для проверки справедливости использованных допущений применим уравне¬
ния материальных балансов. Уравнение (5) дает величину [С1~] = 0,972. Следо¬
вательно, допущение выполняется с точностью до 3%. Второе уравнение мате¬
риального баланса выполняется точно.Пример VIII. 2. Рассчитайте концентрации всех частиц в растворе, содержа¬
щем 0,01 'моль/л CdCl2. Предположим, что для предотвращения гидролиза в рас¬
твор добавлено значительное количество азотной кислоты. В данном случае
можно использовать уравнения (1)—(4) и (6), а условие материального баланса
для хлора имеет вид:[СГ] + [CdCl+] + 2 [CdCI2] + 3 [CdCi;] + 4 [CdCl2-] = 0,020 (11)В первом приближении примем, что комплексообразование незначительно и
уравнения материального баланса имеют вид:[Cd2+] = 0,01 (6а)[СГ] = 0,02 (11а)Подставляя эти значения в условия равновесия (1)—(4), как и прежде по¬
лучим следующие приближенные значения:[CdCl+] = 4,2-10 3; [CdCl2] =6,6* 10"4;[CdCl^] = 1,63 • 10"5; [CdCl2-] = 1,14 • 10“7Если теперь вновь рассмотреть уравнения материального баланса, то станет
видно, что пренебрегать [CdCl+], которая составляет 42% от [Cd2+], нельзя, тогда
как концентрации других комплексов кадмия составляют 5% или меиее от ана¬
литической концентрации. С учетом сказанного запишем уравнения (6а) и (11а),
включив в них член [CdCl+]:[Cd2+] + [CdCl+] = 0,01 (66)[СГ] + [CdCl-] = 0,02 (116)Итак, совместно с уравнением (1), мы получим три уравнения с тремя не¬
известными. Решая уравнение (1) относительно [CdCl+] и подставляя полученное
значение в уравнения материального баланса, получаем:' [СГ] + 21 [Cd2+] [СГ] == 2 • 10“ 2 (12)[Cd2+] + 21 [Cd2+] [СГ] = 1 • 10“* (13)б Зак. 345
226VIII. 1. Ступенчатое комплексообразование в раствореРешая теперь уравнение (12) относительно [Cd2+] и подставляя полученное
значение в уравнение (13) находим квадратное уравнение относительно [С1-]:Это уравнение легко решается по квадратичной формуле (см. раздел III. 6,
стр. 73). Отрицательный корень отбрасываем; а положительный равен:Из уравнения (12) имеем: [Cd2+] = 7,35-10_3.Концентрации всех остальных частиц получим, как и прежде, с помощью
условий равновесия (1)—(4):[CdCr] = 2,67 • 10_3; [CdCl2] = 3,65 • 10-i[CdClj] = 7,76 • 10 e; [CdCl*-] = 4,7 < 10“8Для оценки сделанного второго допущения проверим выполнение уравнений
материального баланса. При подстановке всех полученных значений в точное
уравнение (11) находим, что:[СГ] + [CdCl-] + 2 [CdCl2] + 3 [CdClj] + 4 [CdCl*-] =>=» 1,73 • 10~2 + 2,67 • 10~3 + 7,30-10~4 + 2,33 • 10-5 + 1,88 • 10-7 = 2,07 • 10~aЭта величина совпадает с истинной (2-10-2) с точностью не хуже 5%. Под¬
становка значений в .точное уравнение (6) дает величину 1 • 04 • 10т2, отличаю¬
щуюся от истинной (1 • 10'2) на 5%.Итак, первоначальное допущение, что основными частицами в растворе яв¬
ляются только Cd2+ и С1~, неверно. Учет же групп GdCl+ привел к решению,
удовлетворяющему точное уравнению с ошибкой до 5%.Пример VIII. 3. Рассчитайте долю кадмия в каждом из его комплексов с
С1_-иоиами как функцию [С1~]. Равновесие образования комплексных ионов мо¬
жет быть представлено теми же графическими методами, которые были исполь¬
зованы для многоосновных кислот (см. раздел VII. 2). В данном случае, однако,
основной переменной является не pH, а концентрация лиганда [СГ].Используемый здесь математический подход является обобщением подхода,
примененного в Примере VIII. 1. Перемножением констант ступенчатого компле-
ксообразования находим общие константы комплексообразовання:Если С — аналитическая концентрация кадмия, то уравнение материального ба
ланса для кадмия имеет вид:21 [СГ]2 + 0,79 [СГ] - 0,02 = 0[СГ] = 1,73 • 10“2Распределительные диаграммы(14)(15)(16)[Cd2+] + [CdCl+] + [CdCl2] + [CdC17] + [CdCl*-] = С(18)
Распределительные диаграммы227Подставляя в это уравнение значения констант комплексообразования, по¬
лучаем:tcd2+] (1 + Р, [СГ] + р2 [СГ]2 + Рз [СГ? + Р4 [СГ]4) = С (19)Теперь рассчитаем долю кадмия, присутствующего в виде каждой формы
частиц как функцию кЬнцентрации нона хлора:[Cd2+] 1а°~ С ~ 1 + Р, [СГ] + р2 [СГ]2 + Рз [сг]3 + р4 [сг]4 (20)a,=Jc^l==p,[cr]ao (21)а2 = -£^!=р2[сГ]2а0 (22)с— = Рз[сГ]3а0 (23),2-1= р4 [СГ]4 а0 (24)Найденные доли не зависят от общего количества кадмия в растворе, а за¬
висят только от [С1~].Напомним, что [С1‘] концентрация Ch-иона, а ие аналитическая концентрация
его в растворе, которая определяется вторым уравнением материального ба¬
ланса:[сг] + [CdCl+] + 2 [CdCl2] + 3 [CdC17] + i [CdCIf] — С, (25)Сравнение рис. VIII. 1 и VII. 1 показывает, что в системах с комплексными
ионами обнаруживается гораздо большее перекрытие областей существования
разных частиц, чем в системах многоосновных кислот.Ответ для Примера VIII. 1 можио найти непосредственно нз рис. VIII. 1.
Определяя соответствующие ординаты при [С1~] = 1,00 (рС1 = 0], находим долю
кадмия. Так как общая аналитическая концентрация кадмия в Примере VIII. 1
составляет 0,01 моль/л, то для получения истинных значений концентраций нужно
полученные значения долей умножить на эту величину:а0 = 0,2%; [Cd2+] = 2 • 10~5а, =4,6%; [CdCl+] = 4,6* 10-4«2 = 35,8%; [CdCl2] = 3,58 • 10—3а, = 44,0%; [CdCl,] = 4,40 • 10-3а4 = 15,4%; [CdClJ-] = 1,54- 10“3Найденные величины совпадают с результатами решения Примера VIII. I
Так как в Примере VIII. 2 неизвестно значение [С1~], то концентрации частим
нельзя определить непосредственно, но если [Cl~] ~ l(fJ или менее, то как видно
нз рис. VIII. 1, основными частицами, содержащими кадмий, будут Cd2* и CdCl*.8*
228VIII. /. Ступенчатое комплексообраэование в растворе1,0«о а,5о», 0,5О«2 0,5ОСг, 0,50а* 0,50Рис. VIII. 1. Доля ионов кадмия, присутствующих в форме каждойиз частиц.рС1Рис. VIII 2. Распределительная диаграмма для
Cd—С1-комплексов.рС1
Кривая образования229Можно строить такие кривые, используя и шкалу логарифмов концентраций,
но н данном случае отсутствует принципиальное преимущество этих диаграмм
для кислотно-основных систем — простота их построения, так как в системах из
комплексных ионов одновременно присутствует слишком много частиц, и полу¬
чаемые линии в интересующих нас областях не являются прямыми.Распределительная диаграмма (рис. VIII.2)—наиболее компактный способ
изображения доли иона металла, присутствующего в той или иной форме (см.
рис. VII. 2). Самая левая кривая —это а4 — доля кадмия, присутствующего в
виде CdCl2-; правее — а4 + а3 — доля кадмия в виде CdCl2- и CdCl^ и т. д.Вертикальная линия, проведенная для любого значения [С1~], рассекается
кривыми на отрезки, пропорциональные значениям долей. Например, прямая при
[С1] = 1,00 (рС1 = 0) пересекается первой кривой в точке с ординатой 15,4% г
это означает, что 15,4% Cd присутствует в внде CdCl2- и т. д.Итак, каждая область на рис. VIII. 2 является областью устойчивости одного
из комплексов. Комплекс тем менее устойчив, чем'уже область. Если эти кривые
нанесены на миллиметровой бумаге, то необходимые величины могут быть легко
найдены с помощью сантиметровой лннейки. При использовании диаграммы, по¬
добной рис. VIII. 2, равновесное состояние для систем с комплексными ионами
определяется намного проще, чем при помощи рис. VIII. 1.Кривая образованияПрцмер VIII. 4. Рассчитайте кривую образования в системе Cd—Cl.Кривые образования и диссоциации были использованы нами при рассмотре¬
нии равновесий в кислотно-основных системах. Впервые кривую образования при¬
менил в 1915 г. Н. Бьеррум в классическом исследовании тиоцианатных комплек¬
сов хрома. В случае изучения равновесия комплексообразования при помощиб-п = 2,5
|-рН>2,/6=рк, pH^V> = '.57,21= ркгп = 1рН = 12,33-рК'}лг JРис. VIII. 3. Кривые образования для систем:Cd — Ci (а) и фосфорная кислота (б),
п —среднее число иоиов С1~ и Н + , связанных с ионами Cd2+ и РО3-,потенциометрических методов экспериментальные результаты часто получаются
в внде кривой образования, для которой и подбирают теоретические константы.Степень образования, или лигандное число п — это среднее число лигандов,
связанных с ионом металла. Так, для системы Cd—ClС, - [СГ] [CdCl+] + 2 [CdCl2] + 3 [CdCl^] + 4 [CdCl*-](26)где С и Ci — аналитические концентрации кадмия и хлора, даваемые уравнением
материального баланса (25) через концентрации индивидуальных комплексов.
230VIII. I. Ступенчатое комплексообразование в раствореИспользуя уравнения (21)—(24), можно выразить п через доли о:
п = ai + 2а2 + За3 + 4а4(27)На рис. VIII. 3, а приведена зависимость Я от рС1 =—lg[Cl~J. Интересно
сравнить рис. VIII. 3, а и VIII. 3,6. Для фосфорной кислоты, константы образо¬
вания которой отличаются друг от друга значительно, на кривой образования
отчетливо видны ступеньки. Почти горизонтальные участки соответстиуют рас¬
творам кислых солей, а точки перегиба находятся в области полуцелых значе¬
ний Я при pH « рКа. Кривая для хлорида кадмия ни одной из этих особенностей
не обладает: константы образования настолько близки друг к другу, что сту¬
пеньки неразличимы. Семь точек перегиба, ожидаемых по аналогии с кривой для
фосфорной кислоты, сливаются в одну при Я = 2 (см. раздел IX. 3).Именно по причине «невыразительности» рассмотренных кри¬
вых во многих работах изучено суммарное равновесие образова¬
ния комплекса с наибольшим координационным числом у иона
металла. Часто в работах, особенно по качественному анализу,
приведены «константы нестойкости», табулированные по значе¬
ниям 1/р для комплексов с наибольшим координационным чис¬
лом, и только. Во многих случаях это явилось причиной ошибоч¬
ных выводов относительно растворов, содержащих комплексные
ионы. Даже в случае преобладания комплексов с наибольшим ко¬
ординационным числом следует рассчитывать и концентрации
других комплексов для того, чтобы определить, можно ли прене¬
бречь их концентрациями.Растворы „комплексных солей"Пример VIII. 5. Рассчитайте [С1~] и растворах CdCrNO", CdCl2 и K+CdCt“
в зависимости от аналитической концентрации соли.Отношение аналитических концентраций хлорида и кадмия в каждом из трех
случаев определяется формулой соли, а при наличии кривой образования, легкорассчитать нужные кривые. Перепишемуравнение (26):
[СГС-IgcРис. VIII. 4. Концентрация свобод¬
ных С1 -ионов как функция анали¬
тической концентрации С ионов Cd2+
в условиях фиксированных отноше¬
ний С,/С.£5 — точка Примера VIII. 5.Для упомянутых выше солей отно¬
шение CJC принимает значения 1, 2 и 3.
Для произвольно выбранных концентра¬
ций [С1~] рассчитываем Я и С. Затем от¬
кладываем значения [С1—] в зависимости
от —lgC (см. рис. VIII. 4).Пример VIII. 2 можно решить гра¬
фически (см. рис. VIII. 4), используя
кривую для CdCb(Ci/C = 2): при С —
= 1,0 • 10"2(—lg С = 2) величина JC1~]/C
равиа 1,68 или [Сг] = 1,68 - Ю'2. Исполь¬
зуя это значение, можно рассчитать чис¬
ленно или определить из рис. VIII. 1 или
VIII. 2 концентрации других частиц. Ре¬зультаты получаются те же, что и в Примере VIII. 2, в пределах точности гра¬
фика. В разделе IX. 4 будет показано, как то же вычисление проводят с помощью
номограммы.
1Вопросы231ВопросыПри решении используйте данные табл. VIII. 1.1. Рассчитайте концентрации всех частиц и степень образования п в кислых
растворах хлорида кадмия следующих концентраций:а. 5- 10-3М CdCh; б. 1,0 • 10~5 At CdCb; в. 0,1 М CdCb.2. Рассчитайте концентрации всех частиц и степень образования п в раство¬
ре, образованном при смешении 100 мл 0,025М раствора Cd(NOsh и 100 мл
0,005 М раствора НС1.3. 100 мл 0,02 М раствора NaCl добавляют к 100 мл 0,02 М раствора
Cd(NOj)2, слегка подкисленного азотной кислотой для предотвращения гидро¬
лиза. Рассчитайте степень образования п и долю кадмия, присутствующего в
форме каждого из комплексов. Обратите внимание, что концентрация стехиомет-
рического комплексного соединения CdCU не обязательно является наибольшей.4. Ван-дер-Зее и Доусон [J. Am. Chem. Soc., 75, 5659 (1953)] предположили,
что в растворах, содержащих ионы кадмия и хлора, присутствуют только ионы
Cd2+, CdCl+, CdCb и CdCl~. Они получили следующие значения констант:
/Ci = 34,6; Кг — 4,6 и К» — 1,23. Используя эти константы, рассчитайте кривую
зависимости степени образования п от рС1 н сравните ее с кривой, приведенной
на рис. VIII. 3,6. Экспериментальный метод, использованный этими исследовате¬
лями, был тот же, что и у С. А. Щукарева (1957 г.), с той лишь разницей, что
они не применяли его к столь высоким концентрациям хлора. Что позволяет сде¬
лать предположение об образовании комплекса CdCl2-?5. Рассчитайте концентрации всех частиц в следующих растворах комплексов
хлорида ртути (II), при условии, что длн предотвращения гидролиза иона Hg2+
добавлено достаточное количество кислоты:а. 1^0 • 10 3 моль Hg(N03)2 и 5* 10-2 моль НС1 в 1 л;6. 5,0- 10 2 моль Hg(N03)2 и 5,0- 10-4 моль НС1 в 1 л;в. 2,0- 10~2 М HgCl2_б. Начертите кривые, подобные кривым рис. VIII. 4, для хлоридных комплек¬
сов ртути(П) для CJC = 1, 2, 3 н 4. Используя полученные кривые, определите
степень образования п в нижеперечисленных системах и сравните ее с й для
стехиометрического соединения хлора и ртути. Учтите, что растворы являются
достаточно кислыми для предотвращения процесса гидролиза:а. 0,02 М HgCl2; б. 1,5-10-4 М HgCl2;в. 1 • 10-2 Af HgClN03; г. 5 • 10_3 М KHgCI3;д. 5- 10~2 М K2HgCl4; е. 0,10 М K2HgCl<;ж. 1 • Ю-5 М KHgCl3; з. 1,5 • 10“4 М HgClN03.7. В 1915 г. Нильс Бьеррум одним из первых выполнил систематическое ис¬
следование ступенчатого комплексообразования. Полученные им константы для
тиоцианатных комплексов хрома приведены в табл. VIII. 1. Рассчитайте зависи¬
мость доли хрома, присутствующего в форме каждого комплекса, от концентра¬
ции иона [SCN~] и начертите кривые распределения и кривую комплексообразо¬
вания.8. Из-за исключительной стойкости комплекса HgCl2 для определения хлора
применяют метод титрования нитратом ртути. Конечную точку находят, исполь¬
зуя иитропруссид натрия, образующий белый осадок при взаимодействии с ионом
ртути, причем произведение растворимости HgFe(CN)5NO равно 2,5 ■ 10~в. Опре¬
делите объем, при котором достигается конечная точка, и ошибку титрования,
если 100 мл 0,01 М раствора NaCl титруют 0,01 М раствором Hg(NOs)2 и кислом
растворе, коицеитрацин нитропруссида натрия в котором 0,003 М.9. Начертите для Вопроса 8 кривую титрования, т. е. кривую зависимости
—lg[Hg2+] от объема добавленного раствора нитрата ртути, пренебрегая
232VU1.2. Влияние комплексообразования на растворимость солейразбавлением (для облегчения вычислений). Обратите внимание, что указываемая
индикатором конечная точка близка к точке перегиба на этой кривой. Какие
еще из перечисленных в табл. VIII. 1 систем комплексов могут подойти для
подобного титрования?10. Объем V 1,0 М раствора НС1 добавлен к 100 мл 0,01 М раствора
Сс)(ЫОз)2. Рассчитайте зависимость —lg[Cd2+] от V, пренебрегая разбавлением.
Почему на кривой титрования отсутствуют отчетливые перегибы даже тогда, ко¬
гда образуются все четыре возможных комплекса? Сравните полученную кривую
титрования с кривой образования, приведенной на рис. VIII. 3,6.VIII. 2. ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ
НА РАСТВОРИМОСТЬ СОЛЕЙРастворимость многих солей в присутствии общего иона зна¬
чительно выше, чем следует из произведения растворимостей (см.
раздел VI..5). Обычно это обусловлено образованием комплексов
между анионом и катионом соли. В табл. VIII. 2 приведены кон¬
станты равновесия для ряда подобных систем.Т а б л и ц а VIII.2Константы равновесия комплексообразования из твердых солейЛигаядЦен¬тральныйионЛогарифм константы равновесия *Ионнаясила,М**К(тв) 0^(тв)0^(тв) 2^{тв)3К(тв) 4СГСи+-6,73(-5)— 1,12— 1,47—3* 4*Ag+—9,75-6,7—4,70-4,70-4,463*Т1+-3,04-3,15-3,74—4,70—4,0Hg2+— 13,79-7,05-0,570,281,280,5Вг-Ag+— 12,10—7,96-5,00— 4,153,220,1Hg2+-19,10— 10,05-1,770,641,900,5Ti+—4,81—4,48—4,62—5,10—5,804,0I*Ag+— 16,35-8,22-5,40—2,60— 1,964,0Hg2+-27,70-14,83—3,88—0,102,130,5Pb2+—8,15—6,23—4,47—4,65-3,853*CN"Cu+-19,49(-13)-4,230,362,063*Ag+— 15,92(-7)4,625,324,193*Hg2+—35,10— 17,10—0,403,436,410,1 5*SCN”Ag+— 11,97—7,22—3,74—2,52-2,33*СН3СОО'Ag-О ЛП—-1,67— 1,76—3** Константы равновесий для реакций типа:MeLn (TB) + ftLaq MeLn + fe, aqгде k — целочисленно и может иметь отрицательные значения вплоть до —л (случай произве
дения растворимости {Прим. ред.).Номенклатура констант равновесия рассмотрена в главе J. Значения величин в скобка*ориентировочные. Бее лиганды, кроме CH3COQ - и CN -ионов — анионы сильных кислот
(рКа Для СН3СООН 4,75, а для HCN—9,32)р Система комплексов иодида серебра включает
в себя многоядерные комплексы, данные о равновесиях которых приведены в табл. X.I.** Среда, в которой производили измерения, — NaClOiз* Величину/С{ТВ) о определяли в разбавленном растворе, а затем экстраполировали к ну¬
левой нонной силе.4* ^(тв) 2 и *(тв) 3 —ионная сила равна 0,1 М (раствор NaClO*).6* Среда — NaN03.
VIII.2. Влияние комплексообразования на растворимость солей233Часто концентрацией таких комплексов можно пренебречь в
растворах, не содержащих значительного избытка анионов, на¬
пример, для галогенидов таллия и, в меньшей степени, для гало-
генидов серебра. Однако если концентрации аниона высоки, рас¬
творимость может быть значительно большей, чем это следует из
произведения растворимости. Рассмотрим в качестве примера си¬
стему хлоридных комплексов меди(1), однако подобные же рас¬
суждения применимы для любой из систем табл. VIII. 2.Пример VIII. 6. Рассчитайте растворимость CuCl в 0,01 М растворе НС1. Для
насыщенного раствора CuCl характерны следующие равновесия:[Си+] [СГ] = 1,85 • 10~7 (1)[CuCl”] = 7,6 • 10-2 [СГ] (2)[CuCl2-] = 3,4 • 10-2 [СГ]2 (3)Если S моль CuCl растворены в 1 л раствора, то уравнения материального
баланса имеют следующий вид:S = [Cu+] + [CuC17]+[CuCl2-] (4)S + 1,0 • 10-2 = [СГ] + 2 [CuCi;] + 3 [.CuCl2-] (5)Таким образом, существуют 5 уравнений с 5 неизвестными. Если принять,
что растворимость мала по сравнению с аналитической концентрацией соляной
кислоты, тогда концентрация комплексов намного меньше [С1~] и уравнение (5)
принимает следующий вид:[СГ] = 1 • 10-2 (5а)Поскольку [С1_] известна, то теперь легко рассчитать и концентрации других
ионов:[Си+] = 1,85 • 10—5 [из уравнения (1)][CuCl2j = 7,6* 10“4 [из уравнения (2)][СиС12-] = 3,4-10_в [из уравнения (3)]S = 7,8*10'"4 [из уравнения (4)]Наконец, используя точное равенство (5), можно рассчитать и более точное
значение [С1~]: [С1~] = 9,93 ■ 10~3; оно совпадает с ранее принятым значением с
точностью до 1%-Пример VIII. 7. Рассчитайте растворимость CuCl в чистой воде*. Уравнения
(1)—(4) по-прежнему выполняются, а уравнение (5) следует заменить урав¬
нением:S=[cr]+2[CuClj]-+3[CuClf] (6)* Равновесие гидролиза для иона Си+ трудно измерить ввиду того, что этот
ион легко окисляется до Си2+. Поскольку для произведения растворимости Си20
надежные значения отсутствуют, в данном примере равновесия гидролиза
рассматривается,
234VIII.2. Влияние комплектовразования на растворимость солейПредполагая, что доминирующими частицами являются Си+ и С1~, получаем[Cu+] = S (4а)[cr] = S (6а)Подставляя эти значения в уравнение (1), получаем:S = 4,3 • 10'4
[CuClj] = 3,3* 10-5 [из уравнения (2)].[СиС1з~] = 6,3* 10-9 [из уравнения (3)]Проверяя расчеты обратной подстановкой, находим, что из-за пренебреже¬
ния [CuCl'j в уравнении (4) возникает ошибка, равная 8%, а из-за пренебреже¬
ния [CuCljJ в уравнении (6) ошибка составляет 14%. Эти ошибки очень велики.Произведем новый расчет, вводя [СиС1“] в уравнение материального балан¬
са. Тогда уравнения (4) и (6) принимают вид:S = [Cu+] + [CuCl~] (46)S = [СГ] + 2 [СиС1~] ' (66)Исключая S из уравнений (46) и (66) и подставляя в них: [Си+], выражен¬
ную через [СГ] из уравнения (1) и [СиС1~], выраженную через [С1 ] из уравне¬
ния (2), получаем:[СГ] ([СГ] + 7,6 • 10"2 [СГ] )= 1,85 • 10-;Решение последнего уравнения относительно [С1~] дает[СГ] = 4,15-10“*что немного меньше значения, полученного ранее.Теперь непосредственно рассчитаем концентрации всех других ионов:[Си+] = 4,45 • 10“4 [из уравнения (1)][CuClj] = 3,15- 10-5 [из уравнения (2)][CuCl2-] = 5,85 • 10-9 [из уравнения (3)]S = 4,77 • 10“4 [из уравнения (4)]Проверяя уравнение (6), получаем S = 4,78 • 10~4, что лежит в пределах
ошибки расчета, 4Обратите внимание, что это значение S иа 10% больше значения, получен¬
ного при использовании первого допущения, в котором концентрациями комплек¬
сов пренебрегали.Растворимость как функция концентрации лигандовПример VIII. 8. Рассчитайте растворимость CuCl в растворах соляной кис¬
лоты как функцию концентрации последней. Константы равновесия для систем,
подобных данной, получают при измерении растворимости солн в растворе, со¬
держащих лиганд, путем сопоставления теоретической кривой с эксперименталь¬
ными данными. Приведем расчет такой кривой.Уравнения (1)—(4) справедливы по-прежнему. Если концентрацию соляной
кислоты обозначить через С, то уравнение материального баланса имеет вид:C + S = [cr] + 2[CuCi;] + 3[CuCl^] (7)
Концентрационно-логарифмические диаграммы235Подстановка S из уравнения (4) дает:[Си+] + С = [СГ] + [СиС1~] + 2 [CuClf ]В результате подстановки выраженных через [СГ] величии [Си+] из урав¬
нения (1); [CuCl"] — из уравнения (2) и [CuCl, ] — из уравнения (3) находим
величину С.С = 1,076 [СГ] + 6,8 • 10“2[СГр - ~(8)С помощью тех же подстановок выразим
величину S через [С1“], используя уравне¬
ние (4):5 = 1’8^с‘-°1 7 + 7,6 • Ю- [СГ] ++ 3,4- 10~2 [СГ]2 (9)Придавая различные значения [С1~], начи¬
ная с [С1~] = 4,15 ■ 10"\ рассчитанной в При¬
мере VIII. 7 для случая С = 0, вычислим зна¬
чения С и S.Как следует из рис. VIII. 5 (кривая 1),
растворимость снижается, проходит через ми¬
нимум при С=1,5-10_3М н затем увеличи¬
вается. Минимальная растворимость, равная2,4 • 10"‘ моль/л, вдвое меньше растворимости
в чистой воде.На рис. VIII. 5 приведена также и растворимость, соответствующая произ¬
ведению растворимостей, в случае полного пренебрежения комплексами (кри¬
вая 2). Величина этой растворимости для любого значения С меньше, чем в
случае расчета ее из более близких к реальности уравнений. При стремлении С
к высоким значениям различие становится весьма значительным. Например, при
С = 0,01 мы получили в Примере VIII. 6 S = 7,8-10~‘. Если не включать в урав¬
нения материального баланса комплексы, то S = 1,85 • 10"5, что составляет меиее
3% от реального значения.Концентрационно-логарифмические диаграммыПример VIII. 9. Постройте диаграмму для системы комплексов CuCl. Си¬
стемы, дли которых комплексы образуются в насыщенных растворах, можно лег¬
ко представить в виде диаграммы, подобной таковой для кислотно-основных .си¬
стем.За основную переменную можно взять рС1 = —lg [Cl'], а все другие кон¬
центрации выразить через эту переменную в виде линейных уравнений:lg [Cu+] = —6,73 + рС1 [из уравнения (1)]lg[CuClj] = — 1,12—рС1 [из уравнения (2)]lg [CuCl^-] = — 1,47 - 2рС1 [из уравнении (3)]Эти линии проведены на рис. VIII. 6.Концентрация молекул CuCl в растворе, по-видимому, очень мала, и К{тъп
Для данной системы никогда не измеряли. Если бы она была известна, тоРис. VIII. 5. Растворимость
CuCl в растворах хлоридов,
аналитическая концентрация
которых С.1 и 2 —зависимости S*=sf (С), вычис¬
ленные с учетом и без учета ком¬
плексообразования.
236 VIII. 2. Влияние комплексообразования на растворимость солейгоризонтальную линию следовало бы провести следующим образом:lg[CuCl] = lg/C(TB)1Величину [CuCl] можно было бы не определять и пренебречь ею, если бы
она составляла меиее 10% от минимальной растворимости. Итак, примем, чтоКтв)1 г? Ю~5. Это значение представляется
разумным по аналогии с AgCl (см.
табл. VIII. 2); на рнс. VIII. 6 пунктиром
показана гипотетическая концентрация мо¬
лекул CuCl в растворе.Обычный расчет равновесий в подоб¬
ных случаях трудно производить непосред¬
ственно по диаграмме, так как задача обыч¬
но не сводится просто к нахождению усло¬
вий пересечения прямых, однако диаграм¬
ма помогает при выборе подходящих
допущений при проведении численных рас¬
четов. Пример VIII. 6 упрощается, если
учесть, что при [С1“] = 0,01, т. е. рС1 = 2,
ион [СиС1“] преобладает среди всех ча¬
стиц, содержащих медь. Это приводит к
замене уравнения (4) приближенным урав¬
нением:5 = [СиС1“]Из диаграммы находим
lg[CuClj“J = — 3,15 и [CuClj] = 8 • 10—4что близко к вычисленному значению.Для грубого расчета при решении При¬
мера VIII. 7 следует пренебречь концен¬
трациями всех комплексов. Отсюда получается простое условие пересечения пря¬
мых линий:S = [Си+] = [СГ]Это происходит при рС1 = 3,36; т. е. S = 4 • 10~4.Одиако из диаграммы видно, что при этом значении рС1 и [СиС1^]составляет
~ 10% от [Си2+] и [С1“], и, следовательно, этой величиной нельзя пренебрегать.
Величина [CuCI32~] очень мала (10~8) и ею можно полностью пренебречь. Это
приводит к уравнениям (46) и (66), из которых получаем требуемые численные
значения, как и во второй части Примера VIII. 7.Титрование ЛибихаВ качестве иллюстрации применения в аналитической химии
принципов, обсуждаемых в этом разделе, рассмотрим метод опре¬
деления цианида титрованием А^-ионом, предложенный впервые
в 1851 г. Либихом. Взаимодействие Ag+- и CN~-hohob приводит
к образованию серии комплексов, среди которых в разбавленных
растворах в основном преобладает ион Ag(CN)r. В конечной
точке, соответствующей стехиометрическому соединению Ag(CN)7>-igcpciРис. VIII. 6. Концентрационно-ло¬
гарифмическая диаграмма для
насыщенных растворов CuCl.
Горизонтальная линия (оценочная) — мак¬
симально возможная концентрация
молекул CuCl в растворе.£5 и Eg — точки Примеров VIII. 5 и
VII. 6.
Титрование Либиха837Ра9выпадает белый осадок AgCN (иногда его формула записывается
как Ag[Ag(CN)2]). Таким образом, рассматриваемая реакция как
бы обладает собственным внутренним индикатором.Титрование Либиха фактически уникально из-за совпадения
двух обстоятельств: высокой стойкости комплекса (lg Рг = 20,54)
и малой растворимости осадка (lgК. = —15,92). Ни одна из дру¬
гих систем, перечисленных в табл.VIII, 2, не может быть использована
для титрования этого типа, и до сих
пор метод Либиха является практи¬
чески наиболее важным методом
определения малых концентраций
цианида.Если к объему Vo раствора KCN
концентрации Со при титровании
добавить объем V мл раствора
AgNC>3 концентрации С, то условия
материального баланса будут иметь
вид:CV = (V + 70) ([Ag+] + Р + [Ag(CN)~] +
+ [Ag(CN)32-] + [Ag(CN)f] (10)
C0V0 = (7 + V0) ([CN-] + [HCN] + P ++ 2 [Ag(CN)j] + 3 [Ag(CN)32"] ++ 4[Ag(CN)3"] (II)Рис. VIII. 7. Титрование Лнбнха;
pAg = f (Ф) прн титровании 0,01 M
раствора CN- и 0,01 М раство¬
ром Ag+Перелом при Ф=0,9998 (/) означает по*
явление осадка AgCN: обычно его счи¬
тают конечной точкой титрования, так
как он почти совпадает с точкой экви¬
валентности для образования комплекса.
Точка перегиба при Ф=2(2) —точка
эквивалентности, соответствующая обра¬
зованию цианида серебра.Здесь Р — число молей AgCN, выпадающих в осадок из 1 л рас¬
твора.Точка эквивалентности, соответствующая образованию Ag(CN)7»
достигается при условии 2 CV = Со Ко, т. е. титровальная доля
составляет:. 2 CVФ-СЛ “2>Вторая точка эквивалентности наступает при Ф = 2, что соот¬
ветствует стехиометрическому соединению AgCN(TB.), но на прак¬
тике обычно используют только первую точку, так как для нее
существует внутренний индикатор.Кривую титрования, приведенную на рис. VIII. 7, удобно раз¬
делить на две части. До момента выпадения AgCN в осадок
(Р = 0) величиной [Ag+] можно пренебречь. В начале титрования
доминируют более высшие комплексы. В процессе титрования их
доля уменьшается, так что в конечной точке концентрацией их
можно пренебречь.
238VIU.2. Влияние комплексообразования на растворимость солейТаким образом, пренебрегая концентрацией высших комплек¬
сов и величиной Р и комбинируя уравнения (10)— (12), получаемгде Ка — константа ионизации HCN (р /Са = 9,32). Если нет
внешнего буферирующего агента, то [Н+] связана с CN- уравне¬
нием протонного условияи уравнением равновесия ионизации для HCN. Комбинируя их
получаем:При расчете [Ag+] учтем, что в уравнении (10) преобладающей
величиной является [Ag(CN)7]. Используя уравнения (10) и (12)
и суммарную константу образования Ag(CN)7 (lg & = 20,54), нахо¬
дим:Придавая [CN-] ряд различных значений, можно рассчитать:
по уравнению (14) — [Н+], по уравнению (13) — Ф; по уравнениюТаким образом, можно рассчитать кривую титрования в виде
функции pAg = f(0), вплоть до точки выпадения в осадок AgCN.
На; рис. VIII. 7 приведена кривая титрования для случая С =
= С0 = 0,01 М. В непосредственной близости к значению Ф = 1
начинает выпадать в осадок AgCN и эти уравнения больше не
применимы. В этой точке происходит резкое изменение наклона
кривой титрования. После выпадения в осадок AgCN единственно
существенными членами в уравнениях (10) и (11) становятся Р,тем исключения Р из уравнений (10) и (11) при помощи уравне¬
ния (12), константы образования К(Тв)2 и произведения раствори¬
мостей К( тв)0Ф(13)[н+] + [HCN] = [ОН~](14)(15)(15) — [Ag+J.[Ag+] и fAg(CN)7]. Уравнение кривой титрования получается пу-(16)ГДе lg К(тв) 2^(тв) о=П ,30.
Титрование Либиха239Придавая различные значения концентрации Ag\ можно рас¬
считать Ф. Как видно из рис. VIII. 7, между первой и второй точ¬
ками эквивалентности [Ag+] меняется незначительно. Вблизи
Ф = 2 большая часть комплекса переходит в твердое соединение
AgCN и происходит быстрое увеличение [Ag+], которое можно ис¬
пользовать в качестве конечной точки для потенциометрического
титрования.Ошибку титрования в первой конечной точке можно найти,
комбинируя уравнения (10) и (11) для исключения [Ag(CN)l]>
пренебрегая комплексами более высокого порядка, полагая Р = О
и используя произведение растворимостей /С<тВ)оФ- 1 =№)1Ы-М'^)} •»>где lg/C(TB)o = —15,92 и р Ка = 9,32.Пренебрегая в уравнении (11) всеми членами, кроме [Ag(CN)2]»
получаем:ГГ[CN~]=— ff^r-svv- (18)^(тв) 2\о + 2С)где lg /С(тв)2 = 4,62.Для того чтобы рассчитать для данного случая ошибку титро¬
вания, следует вычислить [CN-] по уравнению (18), [Н+] — по
уравнению (14) (или принять ее равной [Н+] в среде, используе¬
мой для забуферивания раствора), а затем рассчитать ошибку
по уравнению (17)-Для значений, использованных при построении рис. VIII. 7
(Со = С — 0,01), получаем:[CN-] = 8,0* 10—8 [из уравнения (18)][Н+] = 7,7 • 10—9 [из уравнения (14)]Ф — 1 = — 2,05" 10—4 [из уравнения (17)]Таким образом, конечная точка появляется на 0,02% ранее
точки эквивалентности, что сравнимо с ошибкой, возникающей
при измерениях объема. На практике ошибка титрования может
быть значительно больше из-за трудностей наблюдения за появле¬
нием конечной точки. Так, вблизи нее одна капля нитрата серебра
вызовет локальное выпадение осадка AgCN, с трудом растворяю¬
щегося лишь в концентрированных растворах. В более разбав¬
ленных же растворах должен быть добавлен заметный избыток
нитрата серебра, чтобы коллоидный осадок скоагулировал и стал
заметным. В очень разбавленных растворах начало образования
осадка AgCN можно обнаружить с большой точностью при до¬
240 VIII.2. Влияние комплексообразования на растворимость солейбавлении адсорбционного индикатора типа дифенилкарбазида.
В растворе индикатор имеет розовый цвет, но, сорбируясь по¬
верхностью коллоидных частиц осадка, становится фиолетовым.
Это изменение цвета заметно до начала опалесценции раствора.В модификации титрования Либиха, предложенной Денигом,
(см. Вопрос 73, стр. 262) для предотвращения выпадения в оса¬
док AgCN добавляют аммиак, индикатором же служит Agl. При
правильном подборе концентраций выпадение осадка может про¬
исходить сколь угодно близко к точке эквивалентности. При пере¬
мешивании раствора иодид серебра легко растворяется вновь, и
поэтому нет проблемы, подобной той, которая возникает при вы¬
падении осадка AgCN. Конечная точка в данном случае значи¬
тельно резче, и ошибка титрования столь же мала, как и рассчи¬
танная теоретически.ВопросыПри решении используйте данные табл. VIII. 2.11. Рассчитайте растворимость CuCl в 0,05 М НС1.12. Рассчитайте растворимость CuCl в 1,0 М НС1.13. Рассчитайте растворимость CuCl в 5,0- 10-4 М НС1.14. Рассчитайте кривую, подобную кривой, приведенной на рис. VII. 5, но
описывающую растворимость S хлорида серебра в растворе соляной кислоты,
аналитическая концентрация которой равна С. Сравните с величиной растворимо¬
сти, рассчитанной без учета комплексообразования. Простейшим способом реше¬
ния является задание серии различных значений [CI~J, использование их для рас¬
чета концентраций различных частиц, а затем расзет из уравнения материального
баланса величин С и S. Постройте зависимость S от С.15. Какая возникает ошибка (в %) в значении растворимости AgCi в чистой
воде при условии полного пренебрежения комплексообразованием? Какова ошиб¬
ка в случае учета [AgCi] и пренебрежения [AgCl“] и комплексами более высокого
порядка?16. Фторид кальция плохо растворим в воде. В растворе, кроме ионов Са2+
и F-, присутствуют водородсодержащие частицы HF и HFJ и нестойкие комп¬
лексы (ионные пары) —CaF+. Таким образом, существуют равновесия:CaF2(TB) Са2+ + 2F”; *(тв) „ = 4,0- ИГ11Са2+ + F_ CaF+; Кг = ЮН+ + F~ HF; ЛГ' = 1,5 • 103HF + F_ HF"; ЛГ'= 3,9Рассчитайте растворимость фторида кальция и концентрации всех частиц в
следующих растворах: а) чистая вода; б) 0,1 М HF.17. Хлорид таллия умеренно растворяется в воде и образует нейтральные
молекулы (ионные пары) и ионы в растворе. Используя константы, приведенные
в табл. VIII. 2, рассчитайте концентрации различных ионов в растворе 0,01 М
Т1С1. Выпадет ли хлорид таллия в осадок при добавлении к 1 л 0,01 моль
концентрированной соляной кислоты? Если выпадет,, то сколько молей из 1 л
раствора? Сколько молей соляной кислоты на 1 л следует добавить для получе¬
ния максимального количества осадка?
Вопросы241 , 18. Сульфат кальция образует в растворе непрочные ионные пары. Уравнения
равновесия имеют вид:CaS04 (тв) Са2+ + SOf": *(1В) о = 2-37 • КГ»Са2+ + SOf CaS04(aq); /С, = 204S042' + Н+ HSOJ; к', = 98Са2+ + ОН' СаОН+; к" = 25Рассчитайте растворимость сульфата кальция в чистой воде и концентрации
всех частиц. Если пренебречь концентрациями всех частиц, за исключением Са2+
и S04-, какова величина допускаемой при этом ошибки?19. Рассчитайте растворимость сульфата кальция в 0,1 М H2S04.20. Постройте концентрационно-логарифмическую диаграмму для системы
хлоридных комплексов серебра. Каково должно быть значение [С1~], чтобы кон¬
центрация одного из комплексов составляла бы более 10% от [Ag+]?21. Постройте концентрационно-логарифмическую диаграмму для системы
цианидных комплексов серебра. Собственную растворимость AgCN(/C(Te)i) ни¬
когда не измеряли. При условии, что [AgCN] должна составлять менее 10% от
минимальной растворимости (для того, чтобы цианид серебра нельзя было обна¬
ружить в растворе), каково должно быть максимальное значение Kitb)i? Срав¬
ните со значениями К(тв)1, приведенными в табл. VIII. 2 для AgCl, AgBr и Agl.22. Иодид ртути плохо растворим в чистой воде, но хорошо растворим в рас¬
творах иодида калия из-за образования очень стойких комплексов Hgl” и
Hglf. Рассчитайте растворимость иодида ртути в 0,05 М растворе KI и срав¬
ните ее с растворимостью в чистой воде. Определите, при какой аналитической
концентрации иодида калия растворимость Hgl2 минимальна. Что следует доба¬
вить для выпадения Hgrl2 в осадок — избыток нитрата ртути или иодида калия?23. Методика определения содержания иона ртути основана на образовании
иедиссоциированиых молекул Hgl2 и твердого иодида ртути при добавлении двух
эквивалентов 1~-иона. Пробу, содержащую иои ртути в растворе азотной кис¬
лоты, титруют иодидом калия, измеряя в процессе титрования электропроводность
раствора. Величины [Н+] и [NO“] практически неизменны и меняются лишь
вследствие разбавления, а [К+] постоянно увеличивается по мере добавления
титрующего раствора. Величина [Hg2+] уменьшается по мере образования комп¬
лексов с 1~-ионом. Величины [Hgl“] и [Hgl2-] увеличиваются после превышения
стехиометрической концентрации. Электропроводность раствора в первом при¬
ближении пропорциональна общей концентрации ионов, так как подвижности
всех ионов почти одинаковы.Таким образом, по мере выпадения в осадок Hgb электропроводность умень¬
шается, проходит через минимум и затем увеличивается по мере образования
комплексов. Определите объем V 0,1 М раствора KI, добавляемого к 100 мл рас¬
твора, 1 л которого содержит 0,01 моль Hg(N03)2 и 0,005 моль HN03, при кото¬
ром электропроводность минимальна. Определите ошибку титрования. Полная
картина задачи отчетливо видна из концентрационно-логарифмической диа¬
граммы.24. Предложенная методика определения иодида титрованием нитратом
ртути основана на выпадении в конечной точке красного осадка Hgl2. Если
100 мл 0,1 М раствора KI титруют 0,1 М раствором Hg(N03)2, какой объем
раствора следует добавить до появления красного осадка. Полезен ли этот ана¬
литический метод? Сравните результат с титрованием в Вопросе 23 к с титро¬
ванием Либиха.25. В титровании Либиха 0,1 М раствор KCN титруют 0,1 М раствором
AgNOa. Рассчитайте ошибку титрования, предполагая, что образуется только
242VIII.3. Гидролиз ионов металловкомплекс [Ag(CN)”]. Определите ошибку титрования в случае учета и комплек¬
сов более высокого порядка. Определите, какое разбавление допустимо при ус¬
ловии, что ошибка титрования не должна превышать 0,1%, если Со = С и pH
раствора при помощи буфера доводят до 9.VIII.3. ГИДРОЛИЗ ИОНОВ МЕТАЛЛОВРяд особенностей отличает гидролиз ионов металлов от гид¬
ролиза катионов типа аммония. Наиболее характерная из них
состоит в том, что промежуточные частицы могут быть относи¬
тельно нестойкими; в этом случае непригодны обычные допуще¬
ния, применяемые в случае ступенчатой диссоциации многооснов¬
ных кислот. Другой, усложняющий дело фактор состоит в том, что
гидроокиси или окиси многих металлов плохо растворимы, и вы¬
падение осадка в щелочных растворах происходит даже при низ¬
ких концентрациях ионов металлов. Однако наиболее неприятное
обстоятельство заключается в том, что ионы многих переходных
металлов образуют многоядерные гидроксокомплексы, содержа¬
щие несколько атомов металла, и уравнения, соответствующие
условиям равновесия, нелинейны относительно' аналитической кон¬
центрации иона металла. Все это усложняет математический под¬
ход к системам гидролизующихся ионов металлов.Т а б л и ц а VIII. 3Константы равновесия образования одноядерных
гидроксокомплексов *Цен¬траль¬ныйионЛогарифм константы равновесия *ТвердаяфазаК)KiКзК*К(тв)0К(тв)1Тв)2К(тв)3К(тв)4Hg2+10,3311,40 —25,30—15,02—3,62 HgOAg+2,301,72———7,73—5,43—3,71——Ag20Ni2+3,46,82,8—— 17,2—13,8—7,0—4,2—Ni(OH)2Fe2+5,7(3,4)(0,9)-0,4-15,1—9,4(-6)—5,1-5,5Fe(OH)2Co2+1,87,41,3——15,6—13,8-6,4—5,1—Со(ОН)2Mn2+3,4(3,4)(1.0)——12,8—9,4(-6)—5,0__Мп(ОН)2Zn2*4,15(6,0)(4,1)1,26— 17,15—13,0(7)—2,92—1,66Zn( ОН)2Cd2+4,164,230,69—0,32— 13,66—9,5—5,37—4,68—5,0Cd(OH)2Mg2+2,58———— 10,74—8,16———Mg(OH)2Ca2+1,51————5,26—3,75———Са(ОН)2Sr2+0,82Ba2+0,64Ti+0,85———————— • Все константы отнесены к нулевой нонной силе, кроме константы для Н(^2+, которая
измерена в 0.5 М NaClO.}. Значения в скобках получены путем ориентировочной оценки /С(ТВ)2
дл^ тех систем» в которых ее це измеряли»
VII 1.3. Гидролиз ионов металлов243Рассмотрим, тем не менее, вначале только те ионы металлов,
киторые образуют при гидролизе одноядерные гидроокиси. Весь¬
ма разумным является рассмотрение гидратированных ионов ме¬
таллов как кислот по Бренстеду, однако, мы будем рассматривать
гидролиз как комплексообразование, при котором ионы гидро¬
ксила являются замещающими лигандами. Такой подход обуслов¬
лен тем, что используемый математический аппарат значительно
ближе к применяемому при рассмотрении систем комплексных
ионов, чем к случаю систем многоосновных кислот. В табл. VIII. 3
приведены константы равновесия для ряда систем, содержащих
одноядерные гидроксокомплексы. Константы Ки К.2, Кз и К.4
наиболее полезны при рассмотрении тех растворов, в которых
гидроокиси или окиси металла не осаждаются. В насыщенных
же растворах гидроокисей или окисей более пригодны кон¬
станты К( тв)0> /С(тв)Ь К(тв)2, А(тп)3, К( тв)4! Кроме ТОГО, /С(тв)1 ==А(Т в)0 А 1 i А(тн)2 = А(тв)1 А'2 И Т. Д.Пример VIII. 10. Рассчитайте концентрации всех частиц в 1,0-Ю'4 М рас¬
творе Hg(N03)2, в котором pH = 3. Осаждается ли окись ртути? Разумнее всего
применить величины Ki н Кг, поскольку они не зависят от образования осадка:[Hg'OH+] = 2tO. 1010[Hg2+][OH~] (1)[Hg(OH)2] = 2,5. 10м [HgOH+][OH-] (2)Условие осаждения HgO наиболее легко определить из /С<Тв)2; оно проис¬
ходит при[Hg(OH)2]>2,4.10~4 (3)Если pH = 3, то [ОН-] = 1,0 • 10-11 и из уравнений (1) и (2) имеем:[HgOH+] = 0,20 [Hg*+] (4)[Hg(OH)?] = 0,50 [Hg2+] (5)Условие материального баланса для ртути дает третье соотношение между
этими тремя переменными:[Hg2+] + [HgOH+] + [Hg(OH)2] =1,0-10-4 (6)Подстановка уравнений (4) и (5) в выражение (6) дает уравнение, в кото¬
ром единственной переменной является [Hg2+]. Решая его, находим, что:[Hg2+] = 5,88* 10“5Подставляя это значение в уравнения (4) и (5), получим:[HgOH+] = 1,18 -10-5; [Hg(OH)2] = 2,94 ■ 10-5Таким образом, согласно уравнению (3), окись ртути в осадок не выпадет,
так как[Hg(OH)2]< 2,4* 10-4Распределительная диаграмма для гидроксокомплексов ртути (рис. VIII. 8, а)
рассчитана из условий равновесия (1) и (2) способом, описанным в Приме¬
ре VIII. 3. Эта диаграмма, однако, верна лишь для достаточно разбавленного
раствора, в котором окись ртути не выпадает в осадок.
244VIIJ.3. Гидролиз ионов металловПример VIII. И. Выпадение в осадок окиси ртути наблюдается при раство¬
рении азотнокислой ртути даже в весьма кислых растворах. Определите pH,pHРнРис* VIII. 8. Распределительная диаграмма для
гидроксокомплексов ртути:а — аналитическая концентрация ртутн менее 2,4*lO“’4Af и
^ окись ртути не осаждается; вертикальная лнння (рН^З)
делится на отрезки, пропорциональные доли ртути, суще¬
ствующей в форме каждой нз частиц;
б —аналитическая концентрация ртути равна 0,01 ЛГ; в ра*
створах с pH > 2,36 осаждается твердая окись ртути;Е\\ и Я13 — точки Примеров VIII. И и VIII, IS»В точке — насыщение и рН=*2,36.который предотвращает осаждение из 0,01 М раствора Hg(NOa)2. Условие насы¬
щения раствора окисью ртути лучше всего определяется из К(тв)г:lHg(OH)2] = 2,4 ■ 10—4Подставляя это значение [Hg(OH)2j в уравнения (1) и (2) или пользуясь
значениями К(тв>о и К(тв)1, взятыми непосредственно из табл. VIII. 3, получаем
соотношения[HgOH+] [ОН-] = 9,6 • 10-16[Hg2+] [ОН-]2 == 4,8 - 10“(7)(8)которые выполняются только в случае раствора, насыщенного HgO.Еще одним необходимым уравнением является уравнение материального
баланса для ртути:[Hg2+J + [HgOH+] + [Hg(OH)J - 1,0- ю-
Степень осаждения245Подставляя в него выражения (3), (7) и (8), получим уравнение, содержа¬
щее только одну неизвестную величину — [ОН-]:-i-M:.!?-18 -^.нг'-до.нг»[ОН-]2 ^ [ОН']
или9,76 • 10-3 [ОН-]2 — 9,6 • 10-18 [ОН-] — 4,8 • 10-26 = ОРешая его по квадратичной формуле, находим:[ОН-] = 2,26-10“12; pH = 2,36Таким образом, для предотвращения выпадения осадка необходима кон¬
центрация кислоты, почти равная концентрации нитрата ртути.Распределительные диаграммы
в случае образования осадкаПример VIII. 12. Постройте распределительную диаграмму для 0,01 М рас¬
твора Hg(N03)2, показывающую зависимости долей Hg2+, HgOH-, Hg(OH)2 и
HgO от pH. Растворы с pH < 2,36 не насыщены и диаграмма совпадает с тако¬
вой, приведенной иа рис. VIII. 8, а. Однако в более щелочных растворах окись
ртути выпадает в осадок и равновесие определяется уравнениями (3), (7) и (8).
Пользуясь ими, можно выразить доли различных частиц через величину [ОН-]:[Hg2+] 4,8-10-24
“°= 0,010 = ' |01Г]~ f“3 УРавнения (8>][HgOH+] 9,6 -Ю-14
= ' 0,010 = —он-] " [из уравнения (7)]«2 = = 2,4 ■ 10~2 [из уравнения (3)]Доля твердой окиси ртути находится по разности:«(тв) = 1 - («о + «! + «2)Рассмотренное приведено на рис. VIII. 8, б. Обратите внимание на резкое
изменение наклона кривых в точке, соответствующей выпадению осадка.Степень осажденияПример VIII. 13. Растворы нитрата ртути в воде являются весьма кислыми
из-за сильного гидролиза иона ртути. Рассчитайте pH раствора, полученного
растворением 1,0-10-2 моль Hg(NOj)2 в воде с последующим разбавлением
до 1 л.Как было показано в Примере VIII. 12, форма уравнений существенно за¬
висит от того, выпадает или нет осадок окиси ртути. Запишем уравнение мате¬
риального баланса через величину Р, где Р — число молей окиси ртути, осаж¬
дающейся из 1 л раствора;[Hg2+] + [HgOH+] + [Hg(OH),] + Р= 1,0* 10"2 (9)Если Р > 0, то раствор насыщен окисью ртути, и справедливы уравнения
(3), (7) и (8). Если Р — 0, то раствор неиасыщен, и выполняются уравнения
(1) и (2). Отрицательным Р быть не может.
246VIII.3. Гидролиз ионов металловЕсли уравнения, решаемые в предположении Р > 0, дают при проверке
Р < 0, то раствор на самом деле не насыщен, и уравнение даст правильное ре¬
шение в предположении Р = 0.Предположим, что Р > 0. Уравнения (3), (7)—(9) дают 4 соотношения
для 5 неизвестных. Пятое соотношение можно получить из условия электроней¬
тральности: '[Н+] + 2 [Hg2+] + [HgOH+] = [ОН-] + [NO-]Так как источником ионов нитрата является нитрат ртути, то [NO“] = 0,02.
Выражая с помощью ионного произведения воды [Н+] через [ОН-], получаем,
наконец, пятое соотношение:' 10*1 П*”14[ОН-J + 2 [Hg2+] + [HgOH+] = [ОН-] + 2,0-10~2 (10)Поскольку раствор, несомненно, должен быть кислым, можно пренебречь
[ОН-] в правой части уравнения (10), что поможет избавиться от члена третьей
степени в конечном уравнении. После подстановки [Hg2+] и [HgOH+] в уравнение
(10) из уравнений (7) и (8) и упрощений получаем квадратное уравнение отно¬
сительно [ОН*]2,0 • 10“2 [ОН-]2 - 1,096 • Ю-14 [ОН~] — 9,6 • 10-26 = Орешением которого является:[ОН-] = 2,47 • 10-12; pH = 2,39Теперь можно получить и концентрации других частиц:[Hg(OH)2] = 2,4* 10— 4 [из уравнения (3)][HgOH+] = 3,9-10“4 [из уравнения (8)][Hg2+] = 7,87 • 10-3 [из уравнения (8)]Р= 1,50* 10~3 [из уравнения (9)]Так как Р > 0, мы подошли к решению задачи правильно. В осадок выпа¬
дает ~15% ртути, а ~79% остается в виде негидролизованного иона Hg2+. Ре¬
зультаты этого примера приведены на рис. VIII. 8, б.\ ВопросыПри решении в случае необходимости используйте данные табл. VIII. 3.26. Рассчитайте pH и концентрации различных ртутьсодержащих частиц для
насыщенного раствора окиси ртути в чистой воде.27. Определите, при каком pH из 0,05 М раствора Hg(N03b выпадает в
осадок 99% ртути в виде окиси. Какова минимальная концентрация раствора
нитрата ртути, из которого может быть осаждено в виде окиси 99% ртути?28. Определите концентрацию HNO3, необходимую для растворения3,5 ■ 10~2 моль HgO в 1 л. Рассчитайте концентрации всех частиц в конечном
растворе.29. Рассчитайте концентрации всех частиц в растворе} а при образовании
осадка, и числа молей осаждающейся окиси ртути, если к 0,05 моль Hg(N03)i
и 0,05 моль HNOs добавляют воду до получения 1 л раствора.30. Раствор, содержащий 0,1 моль/л HNO3, насыщается окисью ртути. Опре¬
делите pH конечного раствора. Определите, осаждается ли и в каких количе¬
ствах окись ртути, если 100 мл этого раствора разбавить до 1 л. Определите pH
разбавленного раствора.
VIII. 4. Растворение осадка в комплексообразующем агенте 24731. Рассчитайте концентрации всех частиц в 1,0-10-4 М растворе Hg(N03)2-32. Рассчитайте растворимость ацетата серебра в чистой воде и количество
выпадающей в осадок окиси серебра (если осадок образуется), учитывая обра¬
зование комплексов ацетата серебра (см. табл. VIII. 2), а также AgOH и
Ag(OH)J. При каком pH начинается выпадение окиси серебра из насыщенного
раствора ацетата серебра при добавлении сильного основания?33. Гидроокись кальция хорошо растворима, но диссоциирует иеполиостью,
вследствие чего ее растворы весьма концентрированы по ионам СаОН+. Рассчи¬
тайте растворимость Са(ОН)2 в воде и концентрации всех частиц.34. Определите растворимость Са(ОН)2 в 0,05 М растворе NaOH. Сравните
ее с растворимостью, рассчитанной при условии пренебрежения [СаОН+].35. Окись серебра растворяется в растворах едкого натра вследствие образо¬
вания комплекса AgfOH)^ ■ Рассчитайте зависимость растворимости окиси се¬
ребра от аналитической концентрации едкого натра. Какова минимальная рас¬
творимость окиси серебра? Определите долю серебра, существующего в растворе
в виде AgOH в таких условиях, в которых растворимость окиси серебра мини¬
мальна.36. Найдите концентрации всех частиц в насыщенном растворе гидрата за¬
киси железа, pH которого 8,0.37. Определите концентрацию ионов Fe2+, pH раствора и растворимость
гидрата закиси железа в чистой воде.38. Рассчитайте объем раствора (в мл), 0,1 М NaOH, который следует доба¬
вить к 100 мл 1 • 10~3 М раствора Fe(N03)2 для того, чтобы начал выпадать
осадок.39. Вычислите растворимость Ni(OH)2 в 0,01 М растворе HN03.40. Вычислите растворимость Ni(OH)2 в 0,01 М растворе NaOH.41. Вычислите растворимость Ni(OH)2 в чистой воде.42. Определите число молей едкого натра, которое следует добавить к 1 л4,5 • 10~3 М раствора Ni(N03)2, чтобы образующийся осадок растворился вновь.43. Определите долю кадмия в виде каждого из комплексов и в виде твер¬
дого Cd(OH)2 в 0,01 М растворе Cd(N03)2 при изменении pH от 2 до 12. Ре¬
зультаты представьте на графике, как это сделано на рис. VIII. 8, б.VIII. 4. РАСТВОРЕНИЕ ОСАДКА В КОМПЛЕКСООБРАЗУЮЩЕМ
АГЕНТЕВ предыдущих разделах было рассмотрено влияние комплек¬
сообразования на растворимость, когда лигандом является анион
соли. Добавкой инородных лигандов осадок можно перевести в
раствор. В йтом случае нет нужды в привлечении каких-либо но¬
вых принципов, и вычисления можно проводить так же, как и в
двух предыдущих разделах. Если комплексы с инородными ли¬
гандами гораздо устойчивее комплексов с анионами соли, то кон¬
центрациями последних можно пренебречь, и уравнения мате¬
риального баланса существенно упрощаются. В качестве примера,
представляющего большую практическую важность, рассмотрим
растворимость бромида серебра в тиосульфате натрия. Этот про¬
цесс лежит в основе операции фиксирования фотоснимков в фото¬
графии, в результате которой с пленки удаляется бромид серебра,
не подвергшийся действию света.Пример VIII. 14. Определите растворимость AgBr в 0,01 М растворе Na2S20s.
Равновесие образования комплексов тиосульфата натрия характеризуется
248VIU.4. Растворение осадка в комплексообразующем агентеследующими уравнениями:[AgS,07] = 6,6.10s [Agl [s2032-][Ag (S203)*-] = 4,4 • 10* [AgS20-] [S20|~J
[Ag (S203)351 = 4-9 [Ag(S203)^] [S2Or](1)(2)(3)Приведенная на рис. VIII. 9 распределительная диаграмма для этих комп¬
лексов, показывает, что для каждого из них существует весьма широкая область,
в которой его концентрация является преобладающей.О 2 * 6 8 10 12-ig[s*orjРис. VIII. 9. Распределительная диаграмма для
тиосульфатных комплексов серебра.Произведение растворимости бромида серебра:[Ag+] [Вг“] = 7,9 -10~13 (4)При более строгом подходе следует рассмотреть и некоторые другие менее
важные равновесия, хотя концентрациями образующихся в них частиц в даль¬
нейшем можно пренебречь. Так, возможен гидролиз иона тиосульфата:[HS20~] = 52 [н+] [S2Og~] ' (5)Следует учитывать и гидролиз иона серебра:[AgOH] = 200 [Ag+] [ОН-] (6)Равновесия образования бромидных комплексов серебра в растворах, на¬
сыщенных AgBr, подчиняются следующим уравнениям:[AgBr] = 1,1 • 10—3 (7)[ AgBr2-] = 1,0 • 10- 5 [ В г~] (8)[AgBr2-] = 7,1 • 10~5 [Вг-]2 (9)[AgBr^J = 6,0-10-4[Br-]3 (Ю)
VItl.4. Растворение осадка в комплексообразующем агенте 249Запишем уравнения материального баланса:для серебраS = [Ag+] + [AgBr] + [AgBrjJ + [AgBrf] + [AgBr*‘] + [AgOHJ ++ [AgS2031 + lAg(S203)rJ + lAg(S203)51 (П)для бромаS = [Вг~] + [AgBr] + 2 [AgBr~] + 3 [AgBrf] + 4 [AgBrf] (12)для тиосульфата0,010 = [S2023-] + [HS2Oj] + [AgS20~] + 2 [Ag(S203)3“] + [Ag(S,0,)J-] (13)Для определения [H+] и [ОН-] необходимы еще два соотношения:уравнение протонного условия[ОН-] + [AgOH] = [н+] + [HS207] (14)и выражение для ионного произведения воды[Н+][ОН"]= 1,0- 10~14 (15)Итак, имеем 15 соотношений с 15 неизвестными. Решение задачи громоздко,
однако оно сильно упрощается, так как в соответствии с условиями задачи кон¬
центрациями многих комплексов можно пренебречь. Пробные расчеты показы¬
вают, что доминирующими частицами являются: S203-, Ag (S203)3- и Вг_; а если
всеми другими частицами в уравнениях материального баланса пренебречь, то
получим 3 уравнения:S=[Ag(S203)32-] (Па)S = [Вг~] (12а)0,01 = [s20;-] + 2 [Ag (S203)3-] (13а)Четвертое соотношение, необходимое для решения задачи, получается пере¬
множением уравнений (1), (2) и (4):lAS (S203)3-] [ВГ] = 23 [S20f]2 (16)Таким образом, задача упрощается и сводится к решению 4 уравнений
с 4 неизвестными. Подставляя уравнения (11а) и (12а) в выражения (13а) и(16), получим два уравнения с двумя неизвестными:0,01 = [S2C)f] + 2S (17)S2 = 23 [S202-]2 (18)Извлекая квадратный корень из уравнения (18) и подставляя результат
в уравнение (17), находим:S = 4,53 • 10-3Растворимость AgBr составляет несколько меньше половины концентрации
тиосульфата. Определим теперь концентрации различных частиц, чтобы прове¬
рить правильность наших предположений:[Ag(S203)3-] = 4,53.10-3 [из уравнения (Па)1
[Вг~] = 4,53-10—3 [из уравневия (12а)][S2Oj-] = 9,48 • 10~4 [из уравнения (18)]
260 Vlll.4. Растворение осадка в комплексообразующем агентеУравнение (13а) выполняется хорошо, так как оно использовалось в вычи¬
слениях без каких-либо допущений. Рассчитаем теперь концентрации других
частиц:[Ag+I = 1,74 -10 10 [из уравнения (4)][AgS20"] = 1,09* 10~4 [из уравнения (2)][Ag(S203)~5] = 2,10-10-5 [нз уравнения (3)]Концентрации бромндных комплексов серебра легко получаются из ранее
вычисленного значения [Вг-]:[AgBr] = 1,1 • 10-8 [нз уравнения (7)][AgBrjj = 4,53 • 10-8 [из уравнения (8)][AgBr3-] = 1,46 • 10-9 [из уравнения (9)][AgBr*-] = 5,58 • 10-и [из уравнения (10)]Значения [S203-] н [Ag+], полученные выше, используем в уравнениях (5)
и (6) для того, чтобы получить соотношения, выражающие [HS20“] и [AgOH]
через [Н+] и [ОН-]. Подставляя полученные значения в уравнение протонного
условия, получим соотношение, определяющее [Н+]:(1 + 3,48 • 10~8) 1-°-’ = [Н+] (1 + 4,93 • 10~2); [Н+] = 9,75 • 10-8
LH JИтак, раствор практически нейтрален, он содержит:[ОН-] = 1,025* 10“7 [нз уравнения (15)][HS20~] = 4,8 • 10-9 [из уравнения (5)][AgOH] = 3,57 • 10-15 [нз уравнения (6)]Для оценки правильности сделанных допущений проверим выполнение урав-
ненвй материального баланса. Уравнение протонного условия выполняется точ¬
но, так как оно использовалось без каких-либо допущений. Уравнение материаль¬
ного баланса для брома (12) выполняется с точностью до 1 -10-5; это свиде¬
тельствует о том, что единственной важной бромсодержащей частицей является
ион Вг-. Уравнение материального баланса для серебра (11) выполняется с точ¬
ностью ‘до 3%, а для тиосульфата — до 2%.Из этого примера следует важный вывод, что задача может быть решена
довольно легко, несмотря на большое количество частиц, присутствующих в рас¬
творе и большое число уравнений равновесия, поскольку концентрации многих
частиц пренебрежимо малы. Однако важно знать все существующие частицы и
для полной уверевности в разумности пренебрежения некоторыми из них необхо¬
димо рассчитывать концентрации всех частиц. Для данной задачи в более кон¬
центрированных растворах преобладающей будет частица Ag(S203)'-, а в разбав¬
ленных — AgSaOg, хотя важнейшим комплексом тиосульфата серебра является
Ag(S203)®~. Из-за малости [Ag+] можно всегда пренебречь бромнднымн комплек-
самв серебра и AgOH. Также можно пренебречь и гидролизом S202- при всех
концентрациях, кроме самых высоких, н даже в последних случаях он влияет
только на pH раствора, но не на растворимость AgBr.
VIII. 5. Равновесия процессов замещения одного лиганда на другой251В о п р о с ыПри необходимости используйте данные табл. VIII. 1, VIII. 2 и VIII. 3.44. Рассчитайте растворимость бромида серебра в 2,0 ■ 10~3 М растворе
Na2S20s.45. Рассчитайте растворимость S бромида серебра в растворах тиосульфата
иатрия с аналитической концентрацией С и постройте диаграмму S = f(C)
в области значений С от 0 до 2-10-5 моль/л. В этой области значений С един¬
ственным существенным комплексом является AgS2Og.46. Постройте диаграмму S/C = f(—lgC) в области значений С от 10-5
до 1 моль/л, учитывая все тиосульфатные комплексы серебра, но пренебрегая
бромидными комплексами.Простейший способ выполнения этого состоит в том, чтобы [Ag+] выра¬
зить как функцию [S2Ojj-], с С и S — как функции [Ag+] н [S2Oj-]. Придавая
[S2C>3_] ряд значений, вычислите lAg+], а затем С и 5; затем постройте гра¬
фик S/С = / (— lg С). Обратите внимание, что это отношение почти не зави¬
сит от С.47. Определите число молей бромида серебра, выпадающего в осадок, если
к 100 мл 0,02 М раствора №г520з, насыщенного AgBr, добавить 100 мл 0,02 М
раствора КВг.48. Фотографическая ванна для фиксажа содержит 750 мл 0,5 М раствора
ЫагБгОз. Определите количество пленок, которые можно отфиксировать в этой
ванне, если после проявления в фотопленке данного типа содержится 150 мг
AgBr. Почему обычно рекомендуют обрабатывать намного меньшее число
пленок?49. Сравните растворимость AgBr в ОД М растворе Na2S203 с его раствори¬
мостью в 0,1 М растворе КВг. Обратите внимание, что в растворе, содержащем
избыток бромида калия следует учитывать и бромидные комплексы серебра.50. Определите растворимость цианида серебра в 0,01 М растворе Na2S20s.
Сравните полученную величину с растворимостью AgCN в 0,01 М растворе NaCN.
(Гидролизом СМ“ пренебрегать нельзя.)51. Определите растворимость AgBr в 1,- 10~2 М растворе KCN. Сравните
полученную величину с растворимостью AgBr в 1,0 • 10~2 М растворе Na2S20j,
вычисленной в Примере VIII. 14. (Не пренебрегайте гидролизом CN~.)52. 1 л 0,01 М раствора Na2S203 насыщают AgCl. Если 10 .мл 0,1 М раствора
КВг добавить к этому раствору, то сколько молей AgBr выпадет в осадок? Раз¬
бавлением и концентрациями комплексов галогенндов серебра можно пренебречь.VIII. 5. РАВНОВЕСИЯ ПРОЦЕССОВ ЗАМЕЩЕНИЯ
ОДНОГО ЛИГАНДА НА ДРУГОЙВ предыдущем разделе был рассмотрен пример, в котором
ЭгОз-ион конкурировал с Вг_-ионом при образовании комплексов
с серебром, однако в этом случае мы пренебрегли бромидными
комплексами серебра по сравнению с его тиосульфатными ком¬
плексами. В этом и следующем разделах будет рассмотрено ком¬
плексообразование в щелочном растворе, где ОН--ион конкури¬
рует почти на равных условиях с такими лигандами как галоген-
и циан-ионы или аммиак.Концентрации обоих конкурирующих лигандов могут меняться
независимым образом, поэтому адекватное представление этих
систем требует трехмерного графика или карты горизонтальных
252 VIII.5. Равновесия процессов замещения одного лиганда на другойсечений для частиц, присутствующих в растворе. Сокращенный
вариант такого графика представляет диаграмма областей пре¬
обладания, которая показывает, какая из групп присутствует в
наибольшей концентрации для любого данного значения концен¬
траций обоих лигандов.Пример VIII. 15. Рассчитайте растворимость хлорида ртути в воде и концен¬
трации всех присутствующих в растворе частиц. Уравнения равновесия для комп¬
лексов хлорида ртути в растворах, насыщенных ее хлоридом, перечислены в
табл. VIII. 2:[Hg2+] [СГ]2 =■ 1,62 • 10~14
[HgCl+] [СГ] = 8,9 • 10—8
[HgCl2] = 0,27
[HgClj] = 1,9 [СГ]
[HgCi2-] = 19 [Cl-]2О)(2)(3)(4)(5)Данные рис. VIII. 10, а, рассчитанные также, как н в Примере VIII. 3, пока¬
зывают исключительно большую область устойчивости HgCb по сравнению
с HgCr и HgCl--IgCpCIРис. VIII. 10. Распределительная (а) и концентрационно-логарифмическая (б)
диаграммы для хлоридных комплексов ртути.Растворы: а —ненасыщенные и б —насыщенные.Диаграмма рис. VIII. 10, б вычислена также, как и в Примере VIII. 9. За
исключением областей очень больших или очень малых концентраций хлорида
KgC'a — доминирующая частица в растворе.Уравнения равновесия для гидроксокомплексов ртути даны в табл. VIII. 3.
Поскольку растворы не насыщены по окиси ртути, используем константы Ki и Кг'-[HgOH+] = 2,0 • 10'° [Hg2+] [ОН-]
[Hg(OH)2] = 2,5 • 10й [HgOH+] [ОН"](6)(7)
VU1.5. Равновесия процессов замещения одного лиганда на другой 253Когда [Hg(OH)z] превышает 2,4 • 10~‘ моль/л, окись ртути осаждается (см.
рис. VIII. 8, а).Так как мы имеем дело с кислотно-основной системой, следует привлечь
ионное произведение воды:[Н+][ОН']= 1,0-10~14 (8)Запишем уравнения условий материального баланса:
для ртутиS = [Hg2+] + {HgCll + [HgCl2] + [HgCl-] + [HgCl2'[ + [HgOH+] + [Hg(OH)2](9)для хлора2S = [сг] + [HgCl+] + 2 [HgCI2] + 3 [HgC17] + 4 [HgClf] (10)Уравнение протонного условия, получаемого из условия электронейтральности
и условий материального баланса для ртути и хлора или способом, описанным
в разделе III. 2, в конце концов сводится к виду:[Н+] = [ОН-] + [HgOH+] + 2 [Hg(OH)2] (11)Из рис. VIII. 10, б следует, что в уравнениях материального баланса (9) и
(10) можно пренебречь всеми членами, кроме [HgCl2], и что эти уравнения
[учитывая соотношение (3)] принимают вид:S = [HgCl2[ = 0,27 (9а)Для проверки сделанного допущения следует рассчитать концентрации ос¬
тальных частиц, а для этого необходимо знать основные переменные: [С1~] и
[ОН']. Так как концентрации всех других частиц намного меньше концентрации
[HgCU],-то в уравнение (10) лучше всего подставить значение S из уравнения
(9а). Тогда члены, содержащие [HgCl2], взаимно уничтожаются и мы приходим
к следующему уравнению:[Hg2+] + [HgCl+] + 2 [HgOir ] + 2 [Hg(OH)2] = [СГ] + [HgClj] + 2 [HgCl^](12)Уравнение (12), в котором отсутствует [Н+], также можно получить, исполь¬
зуя уравнение (11) и условие электронейтральности. Распределительные диа¬
граммы и некоторые предварительные вычисления показывают, что помимо HgCl2
важнейшими частицами в растворе являются: HgCl+, HgCl^, СГ, Н+ и Hg(OH}2.
Учитывая только эти частицы, получаем следующую приближенную форму урав¬
нения (12): 1[HgCl+] + 2 [Hg(OH)2] = [СГ] + [HgC17] (12а)Уравнение (11) переходит в уравнение[Н+] = 2 [Hg(OH)2] (11а)а уравнения равновесия (2) и (4) используем в том виде, как они записаны.
Пятое соотношение получим, комбинируя уравнения (6), (7) и (8V и исключая
из них [HgOH+] и [ОН']:[Hg(OH)2] [Н+]2 = 5,0 • 10“7 [Hg2+]Исключив из этого уравнения и из уравнения (1) [Hg2+], приходим к иско¬
мому соотношению:[Hg(OH2)] [Н+]2 [СГ]2 — 8,2 • 10“21 (13)
254 VI11.5. Равновесия процессов замещения одного лиганда на другойПодставляя уравнение (11а) в уравнение (13) для того, чтобы исключить [H+J,
получим:[Hg(OH)2]3 [СГ]2 = 2,05 • 10“ 21 (14)Подставляя [HgCl+] из уравнения (2) и [HgCl-] из уравнения (4) в выра¬
жение (12а), получим уравнение, связывающее [Hg(OH)2] с концентрацией [СГ]:,Hg(OH,,|- '•45'СГ[-»5-1°- (15)Подстановка уравнения (15) в выражение (14) дает уравнение шестой сте¬
пени относительно [С1 ]:(1,45 [СГ]2 — 4,45 • 10—8)3 = 2,05* 10-21 [СГ] (16)Последнее легко решается методом последовательных приближений. Прене¬
брегая каким-лвбо из членов в скобках, получаем явно неверное первое прибли¬
жение; пренебрежение же правой частью уравнения приводит к разумному пер¬
вому приближению:1,45 [СГ]2= 4,45 • 10-8; [СГ]= 1,75-Ю-4Используя эту величину [С1“] для оценки правой части уравнения (16), по¬
лучим второе приближение:1,45 [СГ]2 — 4,45 • 10-8 = 7,1 • 10-9; [СГ] = 1,89 • 10~4Так как третье приближение дает тот же результат, что и второе, то, оче¬
видно, эта величина является искомым корнем уравнения (16). После определе¬
ния [С1~] сразу можно произвести расчет концентраций всех остальных групп:[Hg(OH)2] = 3,85 • Ш—5[изуравнения(14)][Н+] = 7,70- 10—5[нзуравнения(11а)][ОН-] = 1,30- Ю~10[изуравнения(8)][HgOH+] = 1,18-10-6[нзуравнения(7)][Hg2+] = 4,55-10-7[изуравнения(6)][HgCl+] = 4,70- 10~*[изуравнения(2)][HgCI2] = 0,27[изуравнении(3)][HgClj] = 3,6-10~4[изуравнения(4)][HgCl2-] = 6,8 • 10-7[изуравнения(5)]значение 3,85 • 10~5 меньше,чем2,4 • 10"*, то окисьпадает в осадок. Уравнение (1) дает для [Hg2+] ту же самую величину, что и
уравнение (6). Все эти значения можио проверить, подставляя их в точные
уравнения материального баланса. Уравнения (9) и (10) выполняются с точ¬
ностью до 0,2%, уравнение (II)—до 3%, уравнение (2)—до 0,05%, это сви¬
детельствует о пригодности сделанных приближений.
Диаграммы области преобладания255Диаграммы области преобладанияПример VIII. 16. Постройте диаграмму области преобладания (рис. VIII. 11)
для насыщенного раствора хлорида ртути (II) с различными значениями [Н+]
и [С1-].Для раствора, насыщенного HgCl2, уравнения (1)—(5) связывают концен¬
трации комплексов с величиной [С1~]. В логарифмической форме, вводя обозна¬чение рС1 = — lg[Cl~], имеем:lg [hs+] = - 13,79 + 2рС1 (1)lg [HgCl+] = - 7,05 -j- pCl (2)lg [HgCl,] = - 0,57 (3)lg[HgC17] = 0,28-pCl (4)lg [HgClJ-] = 1,28 — 2pCl (5)Это — уравнения пяти прямых ли¬
ний на рис. VIII. 10, б. Концентрации
гидроксокомплексов зависят также от
[ОН-], а следовательно, и от pH. Комби¬
нируя выражения (1) и (6), (7) и (8),
получаем уравнения в логарифмической
форме:lg [HgOH+] = -17,49 + pH + 2рС1 (17)
lg [Hg(OH)2]=—20,09 + 2pH + 2рС1 (18)Обратите внимание, что окись ртути
осаждается тогда, когда lg[Hg(OH)2] =
= —3,62, так что это значение опреде¬
ляет границу диаграммы области преоб¬
ладания — прямую линию, уравнение ко¬
торой имеет вид:рС1 ,0гГнпп:игыпг-1-1pH + рС1 = 8,23(19)8 Ю
pHРис. VIII. 11. Диаграмма области
преобладания для растворов,
насыщенных HgCl2.Различные области диаграммы соответ¬
ствуют значениям pH и рС1, при которых
доминирующими являются те или иные
конкретные частицы. Справа от диагонали
раствор насыщен HgCl2 и HgO; части¬
ца HgCl~ никогда ие становится домини¬
рующей.На рис. VIII. 11 это — наклонная линия, пересекающая оси координат при
значениях рС1 и pH, равных 8,23. Так как сумма pH и рС1 ограничена и воз¬
можны лишь значения, меньшие или равные 8,23 из-за осаждения окиси ртути,
то приготовить раствор, насыщенный окисью ртути, pH и рС1 которого соответ¬
ствовали бы точке, лежащей ниже и правее этой линии, невозможно. Вместо
этого произойдет выделение окиси ртути из раствора.Какие же частицы являются доминирующими в растворах, которые можно
приготовить? ,Отношения концентрации хлоридиых комплексов зависят только от рС1 и,
следовательно, границы области их преобладания параллельны оси pH.
Рис. VIII. 10, б ясно показывает, какие частицы являются доминирующими: при
очень малых значеииих [С1~] (при больших рС1) — это Hg2+. Приравнивая друг
к другу уравнения (1) и (2), находим границу, для которой [Hg2+] = [HgCl+];
это pCl = 6,74. Граиицу, для которой [HgCl+] = [HgCl2], получаем, приравнивая
друг к другу выражения (2) и (3); это рС1 = 6,48.Как видно из рис. VIII. 10, б, величина [HgClj] будет преобладающей, если
рС1 лежит между указанными значениями. Поэтому область между горизонталь¬
ными линиями, соответствующими приведенным величинам, обозначена на
рис. VIII. 11 через [HgCl+], Из рис. VIII. 11 видно, что [HgCljj никогда не
256 VIH.5. Равновесия процессов замещения одного лиганда на другойстановится преобладающей, поэтому на нем отсутствует область преобладания
для этой частицы. Граница же соприкосновения областей преобладания HgCla и
HgCI^- проходит при pH = 0,93; последнее определено нз уравнений (3) и (5).
Пунктирные линии иа рис. VIII. 11 соответствуют значениям рС1, при которых
[HgCl2] = [HgCI-] и [HgCI-J = [Hgcir-J-Частица HgOH* также никогда не становится преобладающей, поскольку
для этого необходимо, чтобы [HgOH+] превышала фиксированное значение
[HgCl2]: lg [HgOH+] 3s -0,57.Согласно уравнению (17), для этого, в свою очередь, требуется соблюдение
следующего неравенства: pH + 2рС1 ^ 16,92. Эта область лежит полностью
справа от границы, соответствующей осаждению окиси ртути, и поэтому даииое
условие не может быть выполнено *. Максимальная величина [Hg(OH)2], опреде¬
ляемая выпадением окиси ртути в осадок и равная 2,4 • 10~4, никогда ие превы¬
шает [HgCl2] и поэтому никогда не становится преобладающей.На рис. VIII. 11 точкой отмечены значения pH и рС1 для иасыщеииого рас¬
твора HgCl2 в чистой воде, вычисленные иами в Примере VIII. 15. Обратите
внимание на близость этой точки к границе осаждения окиси ртути. Для полу¬
чения точек во всей области значений, лежащей выше границы осаждения к на¬
сыщенному раствору HgCl2, следует добавить кислоту, щелочь, Hg(NOsb или
NaCl. Подобная диаграмма для растворов хлоридов, насыщенных окисью ртути,
должна быть расположена ниже линии равновесия твердых HgO и HgCl2 с рас¬
твором (см. Вопрос 55).ВопросыПри необходимости используйте при решении данные табл. VIII. 1, VIII. 2
и VIII. 3.53. Определите концентрации всех частиц в 0,01 М растворе HgCl2. Выпадает
ли окись ртути в осадок? Сравните результат с таковым для 0,01 М раствора
Hg(NOab (см. раздел VIII. 3).54. 0,01 моль Hg(N03b нужно растворить в воде так, чтобы получился1 л раствора. Определите число молей хлорида натрия, которое можно добавить
для предотвращения осаждения окисн ртути.55. Постройте диаграмму области преобладания растворов, насыщенных
окисью ртути, с изменяющимися pH и рС1. Учтите, что граница осаждения
хлорида ртути совпадает с границей осаждения окиси ртути, проведенной на
рис. VIII. 11. Реальные растворы, насыщенные окисью ртути, ио ненасыщенные
хлоридом ее, лежат ниже этой границы. Наиболее простой способ построения —
вначале нанести границы, на которых каждая из величин [Hg2+], [HgCl+], [HgClJ
и [HgClJ~] достигает значений, равных концентрации насыщенного раствора[Hg(OH)2] = 2,4 • 10 4, затем провести горизонтальные линии, отделяющие раз¬
личные частицы, содержащие ион хлора. Покажите, что величина [HgOH+] ни¬
когда не становится превалирующей.56. Рассчитайте растворимость окиси р1ути в растворе, 1 л которого содер¬
жит 0,05 моль KI и 0,05 моль NaOH. Рассчитайте концентрации всех частиц
в насыщенном растворе н число молей иодида ртутн, выпадающих в осадок, если
последний действительно образуется.57. 500 мл 0,05 М. раствора K.I добавляют к 500 мл 0,05 М раствора HgCl2.
Рассчитайте число молей иодида ртути, выпадающих в осадок, если выпадение
действительно происходит, н концентрации всех частиц в растворе.* Внимательный читатель заметит, что линия pH + 2рС1 = 16,92 пересекает
границу выделения HgO — линию pH + рС1 = 8,23 при pH = 0,46 и рС1 = 8,69,
т. е. в точке, лежащей вне диаграммы, однако из уравнений (1), (17) и (18)
видно, что в этой точке [Hg2+] значительно больше, чем [HgOH+], Таким образом
[Hg2+] преобладает везде, где [HgOH+] превосходит [HgCl2],
Vlll. 6. Аминные комплексы25758. Гидроксокомплексы железа (II) значительно устойчивее его хлоридных
комплексов. Определите, при каком значении pH из 0,01 М раствора FeCU выпа¬
дет в осадок Fe(OH)2. Сравните с величиной pH, при которой происходит
выпадение осадка из 0,01 М раствора Fe(N03b-59. Рассчитайте растворимость гидрата окиси никеля в 0,1 М растворе
NaSCN. Сравните ее с растворимостью Ni(OH)2 в чистой воде и в 0,1 М NaOH.60. Постройте диаграмму области преобладания для насыщенного раствора
гидрата окиси кадмия с меняющимися pH и концентрацией хлорида; 5cdclj >
>■ 1 моль/л.61. Постройте диаграмму области преобладания для насыщенного раствора
AgBr с изменяющимся содержанием Вг~ и S20|_.62. Рассчитайте растворимость CuCN в 0,01 М растворе НС1.63. Рассчитайте растворимость CuCl в 0,01 М растворе KCN.64. Постройте диаграмму области преобладания для насыщенного раствора
CuCN с меняющимися концентрациями С1~ и CN-.VIII. 6. АМИННЫЕ КОМПЛЕКСЫИзучение аминов металлов — важный этап в развитии химии
комплексных соединений, весьма полезный для аналитической хи¬
мии. По этой причине, хотя расчеты для аминных комплексов
принципиально идентичны приведенным в йредыдущем разделе,
они будут рассмотрены в данном разделе.В расчетах приходится учитывать конкуренцию ионов ОН- и
молекул NH3 как лигандов, поскольку растворы, в которых обра¬
зуются аминные комплексы, обычно щелочные. Кроме того, вели-Таблица VIII.4Константы ступенчатого комплексообразования аминов металловЦентральный ионЛогарифм константы равновесия *X,*2*3*4K5КвAg+ 3,203,83Hg2+ 8,88,71,000,78——Zn2+ 2,372,442,502,15 —Mg2+ 0,23—0,15—0,42-0,7-0,95-1,3Cd2+ 2,652,101,440,93—0,32— 1.66Cu2+ 4,153,502,892,13-0,5-2,5Ni2+ 2,802,241,731,190,750,03Co2+ 2,111,631,050,760,18—0,62Co3+ 7,36,76,15,65,054,41* Данные для Mg2+ и Hg2+ получены при 23 °С в 2 М NH4NO3. Все другие данные полу¬
чены при 30 °С в 2 М NH4NO3. Константа диссоциации аммиака как основания:p/Cft t, °С Состав среды4,39 23 2 М NH4NO34,67 30 2 М NH4NO34.75 25(в последнем случае данные для разбавленной среды экстраполированы к нулевой ионной
силе).9 Зак. 345
258VIII. 6. Аминные комплексычины [0Н~] и [NH3] тесно связаны вследствие существования равно¬
весия диссоциации гидроокиси аммония. Важные результаты иссле¬
дования аминов металлов, проведенного Я. Бьеррумом, были полу¬
чены путем измерений pH раствора. Константы образования неко¬
торых аминов приведены в табл. VIII. 4.Известно, что при добавлении небольшого количества аммиака
в раствор, содержащий ион серебра, осаждается окись серебра, рас¬
творяющаяся, однако, в избытке
аммиака. С точки зрения матема¬
тики, эта система весьма сходна
с другими системами, в которых
достигается минимальная раство¬
римость, с рассмотренной в При¬
мере VIII. 8 системой, содержащей
CuCl.Для разнообразия рассмотрим,
однако, задачу об аминных ком¬
плексах серебра с несколько иных
позиций.Пример VIII. 17. Рассчитайте макси¬
мальное число молей аммиака, которые
можно добавить к 1 л 0,1 М раствора
AgNOs- до начала образования осадка
окиси серебра. Уравнения равновесия, соответствующие табл. VIII. 4, приведены
ниже *;[AgNH+]= 1,58- 10s [Ag+][NH3] (l)[ Ag(NH3)2+] = 6,75 • 103 [AgNH+] [NHJ (2)[AgOH] = 200 [Ag+][OH“] (3)[AgOH] = 3,7 • 10—6 (в насыщенном растворе Ag20) (4)[Ag(OH)-] = 52,5 [AgOH] [OH'] (5)[NH+] [OH-] = 2,14 • 10-5 [NH3] (6)Основная особенность диаграммы рис. VIII. 12 — очень узкая область устой¬
чивости AgNHj. Это в общем случае означает, что либо Ag+, либо Ag (NH,)*
являются преобладающими серебросодержащимв частицами. Пусть N — число
молей NHa, добавляемых к 1 л раствора. Пренебрегая эффектом разбавления
и используя уравнение (4), ваходим, что, осаждение окиси серебра начинается,
когда: [AgOH] = 3,7 • 10~в.Согласно уравнению (3), выпадение осадка происходит, как только[Ag+] [ОН-] = 1,85 • 10“8 (7)* Данные для равновесий (1), (2) и (6) получены в 2 М NH4NO3 при
30 °С, а для (3) — (5) при бесконечном разбавлении прв 25 °С. Для реального
расчета нужно вводить поправки на температуру и ионную силу, хотя в данном
случае они имеют тенденцию к взаимному элиминированию.«-1§[ХН,]Рис. VIII. 12. Распределительная
диаграмма для аминных комплек¬
сов серебра.Величина jAgNH* J всегда меньше, чем[Ag+] и [Ag(NH3)+].
VIII. 6. Аминные комплексы 259До тех пор, пока окись серебра не осаждается, уравнение "условия материаль¬
ного баланса для серебра имеет вид:0,10 = [Ag+] -f [AgNHj] + [Ag(NH3)j] -f [AgOH] -f [Ag(OH)“] (8)Уравнение условия материального баланса для аммиака:N = [NH3] + [NHJ] + [AgNHjj + 2 [Ag(NH3)+] (9)Уравнение материального баланса для ОН' или уравнение протонного усло¬
вия, которое также может быть получено комбинацией условия электронейтраль¬
ности и двух уравнений материального баланса, имеет вид:2[Ag(OH)7] + [AgOH] + [ОН"] = [Н+] + [NH+] (10)Вместе с уравнением для ионного произведения воды имеем 10 уравнений
с 10 неизвестными. Достаточно принять одно допущение, чтобы расчет значи¬
тельно упростился. Предполагая, что в уравнении (8) [Ag*] доминирует, полу¬
чаем:[Ag+] = 0,10 (8а)Подставляя уравнение (8а) в уравнение (7), получаем:[ОН-] = 1,85- 10-7Из выражения для ионного произведения воды и других уравнений сле¬
дует:[Н+] = 5,4 • 10“8
[AgOH] = 3,7 • 10_6 [из уравнения (4)][Ag(OH)~] = 3,6 • 10-и [из уравнения (5)][NH*] = 3,85 • 10~6 [из уравнения (10)][NH3] = 3,33 • 10~8 [из уравнения (6)][AgNHg] = 5,26 • 10-S . [из уравнения (1)][Ag(NH3)j] = 1,18 • 10—9 [из уравнения (2)]= 9,14 « 10 в [из уравнения (9)]Таким образом, для осаждения окиси серебра достаточно добавить очень не¬
большое количество аммиака. Уравнение (10) выполняется точно, так как оно
использовалось без каких-либо допущений; гочиое уравнение материального ба¬
ланса для серебра (8) выполняется с точностью до 0,01%, что свидетельствуето пригодности выбранного допущения.Пример VIII. 18. Если избыток аммиака добавить к раствору того же со¬
става, что и в Примере VIII. 17, то вследствие образования аминных комплек¬
сов серебра, осадок окиси серебра растворится вновь. Сколько молей аммиака
нужно добавить к 1 л 0,1 М раствора AgNOe, чтобы нацело растворить всю
окись серебра?Для растворения осадка нацело, очевидно, должны выполняться те же урав¬
нения, что и в предыдущем Примере VIII. 17, но в данном случае ввиду наличия
избытка добавленного аммиака преобладающим комплексом является уже
[Ag(NH3)*]. Используя это допущение, имеем:ч [Ag(NH3);l = °.l (86)9*
260VIII. 6. Аминные комплексыЦелесообразно также упростить и уравнение (10). Раствор будет щелочным,
так что величина [Н+] мала, однако не настолько, чтобы следовало учитывать
величину [Ag(OH)~]. Таким образом, получим, что приблизительно[AgOH] + [ОН-] - [NHJ] (106)Комбинируя уравнения (4) и (6) с уравнением (106), находим:[ОН-] (3,7 • 10-6 + [ОН-]) = 2,14 • 10“5 [NH3] (11)Перемножая уравнения (1) н (2) и подставляя значения [Ag+] и [Ag(NH3)*]
нз уравнений (7) и (86), получаем:[ОНГ= 1,97 [NH3]2 (12)Исключая величину [ОН'] нз уравнении (11) и (12), получим выражение,
позволяющее определить [NH3]:3,88 [NH3]3 + 7,3 • 10-6 [NH3] — 2,14 • 10~5 = 0Пренебрегая средним членом, находим:[NH3] = 1,8 • 10“2Используя это значение, находим, что средний член оказывается равным
1,3 • 10-8, т. е. составляет менее 1% от суммы двух других членов и что второе
приближение дает то же самое значение:[NH3] = 1,80.10~2Итак:[ОН~] = 6,39 • 10-4 [из уравнения (12)][AgOH] = 3,7 • 10~8 [из уравнения (4)][Ag(OH)~] = 1,24 • 10-7 [из уравнения (5)]Из выражения для ионного произведения воды находим, что:[Н"]= 1,6-10“иТаким образом:[NH*] = 6,43 • 10“4 [нз уравнения (10)][Ag+] = 2,90 • 10“5 [из уравнения (7)][AgNHj] =5 8,25 • 10-4 [из уравнения (1)][Ag(NH3)*j = 0,100 [нз уравнения (2)]N — 0,219 [нз уравнения (9)]Следовательно, количество аммиака, необходимое для повторного растворе¬
ния выпавшей в осадок окнси серебра, лишь ненамного больше удвоенной ана¬
литической концентрации серебра.Обратите внимание, что уравнение материального баланса (8) выполняется
с точностью до 1%, а уравнение протонного условия (10)—с точностью до
0,05%, следовательно, сделанное допущение вполне пригодно.
VIII. 6. Аминные комплексы261Пример VIII. 19. Рассчитайте максимальную аналитическую концентрацию
С иона серебра, которую можно получить в растворе аммиака данной аналитиче¬
ской концентрации N, ие вызывая осаждения окиси серебра. На рис. VIII. 13
представлены два интересных способа графического изображения зависимости
N от С.■1 дсОСРис. VIII. 13. Осаждение окиси серебра N моль аммиака из 1 л раствора
с аналитической концентрацией Ag-ионов С.а. Граница области осаждения окиси. Линию можио рассматривать как кривую раствори¬
мости (см. рис. VIII. 5), описывающую зависимость растворимости С окиси серебра в раствореаммиака от аналитической концентрации последнего N.б. Доля Ag+-noHa, осажденного в виде окиси. Сравните эту кривую с распределительна диа¬
граммой рис. VIII. 8, б; при значениях С <4 • 1(Г"4 моль!Л осадок» не образуется никогда.В этом примере мы кратко рассмотрим способ вычисления зависимости ве¬
личины С от N.Запишем уравнения условий материальных балансов:
для серебрас = [Ag+] + [AgNHj] + [Ag(NH3)+] + [AgOH] + [Ag(OH)+] (8)
для аммиакаN = [NH3] + [NHJ] + [AgNH+] + 2 [Ag(NH3)+] (9)Зависимость С от N можно получить, используя уравнение (7) и выражая
величину [ОН-] через [Ag+], Тогда из выражений (5) и (6) получим зависи¬
мость [Н+], [NH+] и fAg(OH)7] от [Ag+] и [ГШ3]. Подставляя эти величины
вместе с величиной [AgOH], определяемой из уравнения (4), в уравнение (10)
и решая его относительно [NH3], получим зависимость [NH3j от [Ag+J:г„„, 1,60.10-" , 3,20-10-.9 1П_10[Шз] [AfFF [Ajpi—4-67-10Таким образом, величина [Ag+] становится основной переменной. Для под*
счета величин С и N выбирают различные значения [Ag+] и для них вычисляют
концентрации различных комплексов, которые и подставляют затем в уравнения
(8) и (9).ВопросыПри решении задач используйте данные табл. VIII. 1 —VIII. 4.65. К 1 л 0,05 М раствора AgNOs добавляют концентрированный раствор
аммиака. Подсчитайте число молей последнего, необходимых для того, чтобы
началось осаждение окиси серебра, а также число молей аммиака, необходимых
для полного растворения всего осадка,
262VIII. 7. Растворимость сульфидов66. Рассчитайте растворимость хлорида серебра в 0,1 М растворе NHs.
Изменится ли ответ, если пренебречь гидролизом иона серебра?67. К 500 мл раствора, содержащего 0,05 моль ионов С1" и столько же Вг-,
добавляют 500 мл 0,1 М раствора AgNCh. Вычислите количество концентриро-
ваийого аммиака (в моль на 1 л раствора), которое следует добавить к раствору,
чтобы полностью растворить хлорид серебра. Определите, какая часть бромида
серебра при этом также переходит в раствор.68. Рассчитайте растворимость хлорида серебра в 0,01 М растворе NH4C1.
Сравните это значение с растворимостью хлорвда серебра в 0,01 М NaCl.69. Рассчитайте растворимость окиси серебра в 0,05 М растворе NH4NO3
и сравните с ее растворимостью в чистой воде.70. 500 мл 0,02 М раствора NH3 добавляют к 500 мл 0,01 М раствора
AgNOs. Происходит ли осаждение? Подсчитайте число молей окиси серебра, вы¬
падающих в осадок (см. рис. VIII. 13, а).71. Рассчитайте растворимость хлорида таллия в 0,1 М растворе NHs- Срав¬
ните полученный ответ с ответом на Вопрос 66.72. Постройте кривую зависимости максимально возможной аналитической
концентрации иоиа никеля в растворе с данной аналитической концентрацией
аммиака от концентрации последнего в виде графика, аналогичного рис. VIII. 13, а.73. В модифицированном Деиигом методе определения цианида титрованием
нитратом серебра (см. раздел VIII. 2 ) используют следующий способ получения
более резкой конечной точки: в качестве индикатора добавляют иодид калия,
а для предотвращения выпаденин цианида серебра в осадок — аммиак. Конечная
точка обнаруживается по появлению осадка Asl.а. К 100 мл раствора, содержащего 0,2 KCN, 0,01 KI и 0,2 моль/л NH3, до¬
бавляют 0,1 М раствор AgN03. Подсчитайте объем V этого раствора.б. Определите ошибку титрования.в. При каких концентрациях аммиака и иодида калия ошибка титрования
минимальна. Определите величину этой минимальной ошибки.74. Постройте диаграмму области преобладания для насыщенных растворов
окиси серебра с переменными pH и [NHs].75. Постройте диаграмму области преобладания для насыщенных растворов
хлорида серебра с переменными [С1-] и NH3 (см. также Вопрос II раздела X. 2,
при решении которого учитывается образование смешанных комплексов).76. Постройте диаграмму области преобладания для насыщенных растворов
Ni(OH)z с переменными значениями pH и [NH3].VIII.7. РАСТВОРИМОСТЬ СУЛЬФИДОВСульфиды металлов занимают центральное место в традицион¬
ной схеме качественного анализа. Поэтому в любом элементар¬
ном учебнике химии рассматривается влияние кислотности на их
растворимость. Однако по целому ряду причин такие упрощенные
рассмотрения не очень близки к действительности. Главная из
этих причин состоит в том, что при проведении качественного
анализа процесс выпадения сульфидов в осадок редко достигает
равновесия. В растворах из-за высокой концентрации соляной
кислоты образуются хлоридные комплексы, и концентрация сво-
оодного иона металла становится намного меньше его аналитиче™
ской концентрации. В щелочных растворах образование комплек¬
сов сульфидов и гидролиз ионов металла происходит особенно
сильно. Все это приводит к увеличению значений растворимости
сульфидов, иногда достигающих величин в 105 раз больших зна¬
Vtil. 7. Растворимость сульфидов263чений растворимости, рассчитанных без учета комплексообразо¬
вания.Поскольку равновесие между раствором и твердым сульфидом
достигается с трудом, измерение констант равновесия затруднено.
Поэтому обычно произведения растворимостей сульфидов металлов
вычисляют методом корреляций с величинами свободных энергий.
Даже равновесие диссоциации сероводорода настолько трудно из¬
мерить, что в литературе приводятся данные, расходящиеся в
100 раз. В табл. VIII. 5 приведены согласованные величины кон¬
стант диссоциации сероводорода и произведений растворимостей
для некоторых сульфидов. Образование сульфидных комплексов
исследовалось лишь для немногих систем и существуют определен¬
ные сомнения относительно значений этих констант. Тем не менее,
^ табл. VIII. 5 приведены константы устойчивости тех комплексов
сульфидов, которые были исследованы.Таблица VIII. 5Произведения растворимостей сульфидов и константы
образования комплексов сульфидовПроизведения растворимостей и константы образования в этой таблице
соответствуют следующим константам диссоциации для H2S : pKai *= 7,00;
P^a2 = 12,92.В воде, насыщенной H2S, при 1 атм [H2S] = 0,102 лолб/л.СульфидpK(tb) 0СульфидР^(тв) 0Ag2S 49,6ZnS (а, сфалерит) . .23,8Cu2S 48,0ZnS (В, вюрцит) . . .21,6T12S 20,3CoS 22,1HgS (черный) 51,8NiS FeS MnS (зеленый) ....20,717,312,6HgS (красный) ....
CuS52,435,126,6PbS MnS (розовый). . .9,6CdS 26,197SnS 25,012,7010,22РеакциикомплексообразованияAg+ + S2- AgS~ lg/C23,9
264Vlll. 7. Растворимость сульфидовХотя расчеты растворимости сульфидов не соответствуют ре¬
альным условиям качественного анализа, они представляют ин¬
тересный пример, в котором комбинируются уже рассмотренные
нами различные типы равновесий: диссоциация двухосновной кис¬
лоты H2S и образование хлоридных, гидроксильных и сульфид¬
ных комплексов ионов металлов.Сульфид ртути — классический пример нерастворимого в кис¬
лотах сульфида. Из следующего примера, в котором принято во
внимание как образование комплексов сульфидов и хлоридов, так
и влияние кислотности, видно, насколько данный сульфид действи¬
тельно нерастворим.Пример VIII. 20. Рассчитайте растворимость сульфида ртути в 0,1 М рас¬
творе НС1. Равновесие ионизации сероводорода описывается уравнениями:[Н+] [HS~] = 1,0 - 10~7 [H2S] (1)[Н+] [S2-] = 1,2 -10“13 (2)На рис. VIII. 14 приведена распределительная диаграмма для сероводорода,
из которой следует, что концентрация иона S2' становится ощутимой тольков сильно щелочных растворах.
В 0,1 М растворе значениями
[S2-] и [HS-] можно пренебречь
по сравнению с [H2S].В растворах, насыщенных
твердым сульфидом ртути (чер¬
ная форма), выполняются сле¬
дующие уравнения равновесия:[Hg2+] [S2-] = 1,6 -10—52 (3)[HgS-] = 0,58 [S2-] (4)[Hg(SH)2] == l,0-107[HgS*-][H+]2 (5)Три пунктирные линии на рис. VIII. 15 характеризуют значение [Hg(SH)2]
при различных значениях pH. Верхняя линия (pH = I) соответствует данному
примеру.Константы образования гидроксокомплексов ртути, приведенные в
табл. VIII. 3, имеют следующий вид:[HgOH+] = 2.0 • Ю10 [Hg2+] ГОН-] (6)[Hg(OH)2]=2,5- 10“ [HgOH+] [ОН-] (7)Как следует из рис. VJII. 8,6, при pH = 1 величины [Hg(OH)2] и [Hg(OH)+]
пренебрежимо малы по сравнению с [Hg2+].Константы образования хлоридных комплексов ртути, приведенные
с табл. VIII. 1, следующие:[HgCl+] = 5,5 • 10б [Hg2+] [СГ] (8)[HgCl2] = 3,0 • 106 [HgCl+] [СГ] (9)[HgCl-] = 7,08 [HgCl2] [СГ] (10)[HgCir] = 10,0 [HgCl-] [СГ] (11)Рис. VIII. 14. Распределительная диаграмма
для сероводорода.
VIII. 7. Растворимость сульфидов265Как следует из рис. VIII. 10, при [СГ] = 0,1 величинами [Hg2+] и [HgCl+]
можно пренебречь по сравнению с более сложными комплексами.Запишем уравнения условий материальных балансов:
для ртутиS = [Hg2+] + [HgSf] + [Hg(SH)2] + [HgOH+] + [Hg(OH)2] ++ [Hgcr] + [HgCl2] + [HgCl-] + [HgClJ-] (12)для серыs = [S2-] + [HSl + [H2S] + 2 [HgS22'] + 2[Hg(SH)2] (13)для хлора0,1 = [СГ] + [Hgcr] + 2 [HgCI2] + 3 [HgCl-] + 4 [HgClf] (14)Уравнение протонного условия получается комбинированием уравнений элек¬
тронейтральности с тремя уравнениями материального баланса:0,10 = [HgOH+] + 2 [Hg(OH)2] + [ОН“] == [н+] + [HSl + 2 [H2S] + 2 [Hg(SH)2] (15)Если в растворе присутствует так много различных частиц, то следует ввести
некоторые упрощения. Первое состоит в пренебрежении растворимостями и, сле--lg[S2]Рис. VIII. 15. Концентрационно-логарифмическая
диаграмма для насыщенных растворов HgS.довательно, концентрациями всех частиц, содержащих Hg и S, по сравнению
с аналитической концентрацией HCI:[СГ] = 0,10 (14а)[н+] = 0,10 (15а)Как уже упоминалось ранее, величины [Hg2+] и [HgCl+] пренебрежимо малы
по сравнению с соответствующими концентрациями более сложных хдоридных
комплексов, так что:S = [HgCl2] + [HgClj] + [HgCl2"] (12а)
266VIII. 7- Растворимость сульфидовПоскольку раствор кислый, величинами [HS~] и [S2~] можно пренебречь по
сравнению с [H2S]. Согласно уравнению (1) [HgS2-] будет равна половине вели¬
чины [S2~], и, следовательно, ею также можно пренебречь.Комбинируя уравнения (4), (5), (1) и (2), получимfHg{SH)2] =7,0 -10-14✓откуда следует, что в уравнении (13) этим членом тоже можно пренебречь. Итак
имеем: чS=[H2S] (13а)Подстаиляя уравнение (14а) в выражения (10) и (11), а затем в (12а),
находим:S= 2,416 [HgCl2] (16)Итак, имеем два уравнения (13а) и (16), связывающие величины S, [H2S]
и [HgCU]. Окончательное соотношение получается путем комбинации уравнений
(1), (2), (3), (8) и (9):[H2S] [HgCl,] = 2,2 • 10~19 [Н+]2 [СГ]2 (17)Подстановка уравнений (14а), (15а), (13а) и (16) в уравнение (17) даст:S = 7,15 • 10~12Это значение растворимости слишком мало для того, чтобы его можно
было измерить непосредственно. Сульфид ртути может растворяться в царской
водке, так как эта смесь азотной и соляной кислот окисляет сероводород в рас¬
творе до свободной серы, сдвигая, таким образом, равновесие растворимости.Произведение растворимости сульфида ртути измеряют потенциометрически
с помощью ртутного электрода. В растворе с известной концентрацией сероводо¬
рода (обычно насыщенном) и известной кислотностью концентрация сульфида
может быть рассчитана из уравнений равновесия (1) и (2). Электродвижущая
сила ячейки дает концентрацию свободного иона ртути. Из этих данных можно
вычислить произведение растворимости для сульфида ртути.Обычный расчет, приводимый в учебниках, в котором пренебрегают всеми
образующимися комплексами и рассматривают только равновесия (1)—(3), для
данной задачи далек от реальности, так как вычисленная растворимость S =
= 1,15-10~17 в 105 раз меньше, чем полученная выше величина.Найденное значение растворимости S позволяет рассчитать концентрации
всех других частиц:[из уравнения (14а)][из уравнения (15а)][из уравнения (13а)][из уравнения (1)][из уравнения (2)][из уравнения (3)][из уравнения (4)][из уравнения (5)]
j-из уравнения для #h2q][СГ]= 0,10[н+]= 0,10[H,S]= 7,15• 10-12[HS-]= 7,15• 10-18[S21= 8,6-10-30[Hg2+]= 1,86• 10~23[Hgsr]= 5,0-10“30[Hg(SH)2]= 5,0-10-25[он-]= 1,0-10-13
VIII. 7. Растворимость сульфидов26?[HgOH~] = 3,7 • 10~2в [из уравнения (6)][Hg(OH)2] = 9,3- 10~28 [из уравнения (7)][HgCl+] = 1,0- 10 17 [из уравнения (8)][HgCl2] =3,0-Ю-’2 [из уравнения (9) нли (16)][HgCl~] = 2,1 • 10—12 [из уравнения (10)][HgCl2-] = 2,1 • 10-12 ■ [из уравнения (И)]Обратите внимание на то, что концентрации многих из этнх частиц неве¬
роятно малы — меньше чем 1 ион на 106 л. В действительности равновесие по от¬
ношению к этим частицам никогда не достигается.Уравнение материального баланса (12) выполняется с точностью до 1%,
уравнение (13)—до одной миллионной части, уравнения (14) и (5)—до одной
десятимиллнардной части. Таким образом, принятые нами допущения очень
удачны.Пример VIII. 21. Рассчитайте растворимость сульфида ртутн в 0,1 М рас¬
творе Na2S. Образование сульфидных комплексов делает сульфид ртути рас¬
творимым в щелочных сульфидных растворах. Используем те же самые уравне¬
ния равновесия (1)—(7) с учетом образования сульфидных комплексов и
гидроксокомплексов ртути.Запишем уравнения условий материальных балансов:для ртутиs = [Hg2+] + [HgS2-] + [Hg(SH)2] + [HgOH+] + [Hg(OH) J (18)для серыS + 0,1 = [S2i + [HS-] + 2 [HgS*-] + 2 [Hg(SH)2] (19)Комбинируя уравнение электронейтральности с двумя вышеприведенными
уравнениями материального баланса, получим уравнение протонного условия:[HgOH+] + 2 [Hg(OH)2] + [ОН"] = [Н+] + [HSl + 2[H2S] + 2[Hg(SH)2] (20)Поскольку мы имеем дело с сильнощелочным раствором сульфида, то, как
видно из рис. VIII. 14, величина [H2S] пренебрежимо мала по сравнению с [HS~]
и [S2-]. Из рис. VIII. 15 следует, что величиной [Hg(SH)2] можно пренебречь по
сравнению с [HgS2-]. Гидроксокомплексы также можно не принимать в расчет,
поскольку [Hg2+] невероятно мала (10"50). Наконец, так как раствор щелочной,
то [Н+] можно пренебречь по сравнению с [ОН']. При этих допущениях мы полу¬
чаем приближенные соотношения:s = [HgS2_] (18а)S + 0,l = [S2-]+[HS-] + 2[HgS2-] (19а)[ОН'] = [HS~] (20а)Из уравнений (4) и (18а), (20а) и выражения для ионного произведения
воды, получаем:[S2-] = 1,73S (21)[HS'] = 0,38Sl/s (22)
268Vlll.7. Растворимость сульфидовПодставляя уравнения (18а), (21) и (22) в выражение (19а), получим
уравнение:2.73S + 0,38S1/2 — 0,1 = ОПрименяя подстановку х = S1/2, находим:S= 1,80- 1(Г2Это значение растворимости достаточно велико для того, чтобы можно было
качественно отделить сульфид ртути от других сульфидов путем его растворения
в сульфиде натрия.Вычислим концентрации всех других частиц:[из уравнения (18а)][из уравнения (21)][из уравнения (22)][из уравнения (20а)][из выражения для ^н2о][нз уравнения (1)][из уравнения (5)][из уравнения (3)][из уравнения (6)][из уравнения (7)]Заметьте, что уравнение (18) выполняется с точностью до 10-18, уравнение
(19) —до 0,1%, а уравнение (20) —до Ю-10. Как уже говорилось ранее, некото¬
рые из этих концентраций чрезвычайно малы и в действительности равновесие
по отношению к ионам Hg2+ никогда не достигается. Так, значение концентрации
10~45 моль/л равносильно тому, что в объеме раствора, равном объему всех океа¬
нов на земле, содержится только 1 ион.Nsr] =1,80• 10-2[s21 == 3,1 •10~2[HSl =5,1 •10~2[он-] =5,1-10-2[H+] =1,96• 10-13[H2S] =1,0 -10~7[Hg(SH)2] =6,9-10~21[Hg2-] =5,15• 10-S1[HgOH+] =5,3-10-43[Hg(OH)2] =6,7*I0~34ВопросыПо мере необходимости используйте данные, приведенные в табл. VIII. 1,
VIII. 3 и VIII. 5.Рассчитайте концентрации всех частиц с целью проверки правильности при¬
нятых допущений.77. Рассчитайте растворимость сульфида железа (II) в насыщенном (0,1 М)
растворе H2S.'78. Рассчитайте растворимость сульфида мышьяка в 0,1 М растворе Na2S.79. 1 л раствора содержит 110-2 моль Cd2+ и 1 ■ 10_г моль Zn2+ и насыщен
сероводородом. Определите значение pH, при котором возможно осаждение суль¬
фида кадмия и невозможно осаждение сульфида цинка. Какая доля кадмия
останется в растворе прн этом значении pH? Примите, что сульфид цннка выпа¬
дает в осадок в своей наименее растворимой форме (a-форме) и что анион кис¬
лоты не образует комплексов с ионами Zn2+ или Cd2+.80. 1 мл 0,15 М раствора Ni(N03h насыщается сероводородом. Вычислите
число молей сульфида никеля, выпадающих в осадок, долю никеля, оставшегося
в растворе и pH конечного раствора.
Вопросы26981. Постройте концентрационно-логарифмическую диаграмму, демонстрирую¬
щую зависимость концентрации свободного иона металла от pH в растворах,
насыщенных сероводородом, для следующих сульфидов: Ag2S, CuS, PbS, FeS,
MnS (розовый), Ge2Ss.82. Сульфид марганца (11) переходит в твердый Мп(ОН)2 в щелочных рас¬
творах. Избыток розового MnS находится в равновесии с 1 л 1 • 10“3 М рас¬
твора NaOH. Рассчитайте число молей образовавшегося Мп(ОН)г и число мо¬
лей Мп2+ в растворе.83. Постройте концентрационно-логарифмическую диаграмму, демонстрирую¬
щую зависимость концентраций [Hg2+], [HgS2-] и [Hg(SH)2] в растворе, насы¬
щенном HgS и H2S, от pH.84. Вычислите растворимость сульфида ртути в 0,1 М растворе НС1, насы¬
щенном сероводородом. Сравните полученное значение с вычисленным в При¬
мере VIII. 20.85. При каком значении pH растворимость сульфида ртути в насыщенном
растворе сероводорода минимальна? Считайте, что анион добавляемой кислоты
не образует комплексов с ионом Hg2+.86. Рассчитайте растворимость сульфида серебра в 0,1 М растворе HN03.87. Избыток хлорида серебра добавляют к 1 л 0,1 М раствора Na2S. Рас¬
считайте равновесные числа молей хлорида серебра, перешедших в сульфид се¬
ребра и в окись серебра, и аналитическую концентрацию серебра в растворе.88. Из учебника по качественному анализу выберите пример, относящийся
к равновесию сульфидов. Решите его настолько строго, насколько это возможно,
учитывая в уравнениях материального баланса все комплексы, которые могут об¬
разоваться при использовании обычной для качественного анализа процедуры.
Сравните полученный Вами ответ с ответом, приведенным в учебнике.
Глава IXМАТЕМАТИЧЕСКИЕ ПРИЕМЫ РАСЧЕТА РАВНОВЕСИЙНесмотря на огромное разнообразие рассмотренных химиче¬
ских соединений, все аналитические выражения, использованные
при решении уравнений равновесия, весьма однотипны. В этой
главе функции, применяющиеся при расчетах ионных равновесий,
будут рассмотрены скорее с математической, чем с химической
точки зрения.Обратимся вначале к общим выражениям для математических
функций, применяющихся в описании равновесия одноядерных
комплексов, и приведем некоторые интересные результаты для
случаев комплексообразования с участием одного или двух ли¬
гандов. Затем кратко обсудим задачу расчета констант равновесия
по экспериментальным данным, а в последнем разделе рассмотрим
способ упрощения вычислений — использование диаграмм или номо¬
грамм, и обсудим, какие типы функций могут быть представлены
таким образом.IX. 1. ОПРЕДЕЛЕНИЯПусть центральный атом или группа атомов Me присоединяют
максимум N лигандов А в случае образования комплексов МеА„,
где п = 1, 2, 3 ... N. Такой подход соответствует типам комплек¬
сов, перечисленных в табл. VIII. 1—VIII. 4, причем Me — ион ме¬
талла, А — лиганд (например, хлорид, цианид, гидроксил, аммо¬
ний). Он пригоден и для одноосновных и многоосновных кислот
и оснований, но в этом случае Me — наиболее основная форма,
а лиганд А — ион водорода.Константы ступенчатого комплексообразования соответствуют
следующим равновесиям:Me + А МеА [МеА] = Kt [Me] [AJ
Me А + A ^=± MeA2 [MeA2] — K3 [MeA] [A]MeA„_, + A ^ MeA„ [MeA„] = Kn [MeA„_,] [A1
Соотношения для растворимости271Для наших целей удобнее использовать общие константы об¬
разования, соответствующие следующим равновесиям:Ме+А МеА [МеА] = р, [Me] [А]Ме + 2А МеАг [МеА2] = р2 [Me] [А]*Ме + иА < t МеА„ [МеА„] =р„ [Me] [А]"Кроме того, р! = Кй р2 = К\К,2, ...; Р« = К\К2 • • ■ Кп■ Чтобы
в дальнейшем было удобно пользоваться знаком суммы, опреде¬
лим, что ро = Ко = 1.Итак, концентрацию любого из комплексов можно выразить
в виде зависимости от величин [Me] и [А], если использовать об¬
щие константы комплексообразования. Условие материального ба¬
ланса для Me запишется следующим образом *:JV NСМе = 2 [МеА*1 “ 2 Р» tMel [А]" (1)л=0 л=ОЗдесь Сме — аналитическая концентрация Me. Условие материаль¬
ного баланса для А имеет вид:N NСА = [А] + 2 п [МеА„] = [А] + [Me] [А]п (2)п*=0 п=0где С а — аналитическая концентрация А.Соотношения для растворимостиДля вычисления растворимости 5 соли МеА в присутствии из¬
бытка А запишемCMe=S и cA = S + C°где Сд—аналитическая концентрация лиганда А, добавленного
к раствору. Следует также ввести дополнительное условие равно¬
весия, определяющее растворимость; обычно им является уравне¬
ние произведения растворимости-[Me] [А] = /С(тв)0которое выполняется только в растворах, насыщенных твердым
МеА. Другая возможность — уравнение молекулярной раствори¬
мости[МеА] = /С(тв)1 /* Знак суммы, используемый здесь, означает, что все члены суммируютсяN2 [МеА„] = [Me] + [МеА] + [МеА2] + ... + [МеА„] + ... [МеА,]
272IX. I. Определениякоторое выполняется только в растворе, насыщенном твердым
МеА. Обе эти константы связаны соотношением:^<ТВ) 1 = *Л(ТВ) оОдно из условий растворимости можно использовать для ис¬
ключения величины [Me] из выражений (1) и (2), чтобы получить
параметрические уравнения, выражающие S и С\ через пере¬
менную [А] и константы равновесия. Применяя тв)о, получим из
уравнений (1) и (2)S = СМе = 2 Kin) 0р„ [А]»-' = 2 К(тв) „ [А]”-1и=0 №=О1VС^= СА - S = [А] + 2 (я - 1) К(тв)-« ’п=0где /С(тв)п = /((тв)орп — константа равновесия образования МеА„
из твердой соли МеА и «свободного» лиганда А:МеА (тв.) + (п - !) А МеА„, [MeAJ = К{тв) „ [А]”-1Метод параметрических уравнений был использован в разде¬
ле VIII. 2 для вычисления кривой растворимости хлорида меди
(рис. VIII. 6) и в разделе VIII. 6 для вычисления кривой раство¬
римости Ag20 в ЫНз (рис. VIII. 13); он может быть распростра¬
нен на твердые соли в форме МегА или МегАз.Распределительные диаграммыПо определению, функция распределения — это доля Me, при¬
сутствующего в виде определенного комплекса МеА„_ [МеА„] 0„ [Me] [А]"ап р м2 Р* [Ме] [А]*где k пробегает значения от 0 до N' его применяют при суммиро¬
вании в знаменателе вместо га, так как п — индекс лишь одного
члена суммы уравнения. Поскольку [Me] входит в каждый член и
в знаменателе, и в числителе, его можно сократить:= IV (3)2 Pft [А]*fe=oNЗаметьте, что 2 a«= 1-п=ОКривые распределения были использованы в главах VII и
VIII; там же для графического обсуждения равновесий были по¬
строены диаграммы ап = /(lg[A]).
Кривая образования273Кривая образованияСтепень образования по определению — это среднее число ли¬
гандов А, связанных с центральной группой Me:Г Г 41 2"Р»[Ме][А]" 2 "МАГA п=0 п=ОП~~ См ~ N — N2 р* tMei 2 Р* [А]*
ft=0 fc=0В главах VII и VIII была использована кривая образования,
и построены графики зависимости Я от lg[A] при обсуждении
титрования и комплексообразования.
При рассмотрении лишь одноядерных комплексов ап и п за¬
висят только от констант равновесия и величины [А]. При обра¬
зовании полиядерных комплексов ап и п становятся также и
функциями [Me], и их тогда труднее представить графически.Вопросы1. Используя параметрические уравнения для кривой растворимости соли
МеА, найдите формулу для определения величины [А] при минимальной раствори¬
мости. Для случая N = 2 найдите точные выражения для [A], S и С\ при ми¬
нимальной растворимости.2. Найдите параметрические уравнения для кривой растворимости соли МеВ,
находящейся в равновесии с раствором, содержащим лиганд А. Покажите, что
если А образует комплексы с Me, а В не образует их, то на кривой раствори¬
мости ие существует никакого минимума для Сд>0.3. Найдите параметрические уравнения для кривой растворимости твердой
соли Ме2А в растворе, содержащем лиганд А.п = 2 "“л (4)л=0IX. 2. ФОРМА КРИВОЙ РАСПРЕДЕЛЕНИЯНаклон кривой распределения, отражающей зависимость а„
от lg[A], равен 2,303 бп, где
= (б)
Параметр 6„ можно выразить как явную функцию [А], если
применить выражение (3) в форме:ап |>[А]* = Р„[А)П*=9
274IX.2. Форма кривой распределенияДифференцируя это выражение по [А], умножая на [А] и ис- ,
пользуя выражение (5), получим:N Nб„ 2 Р* ГА]* + 2 [А]* = «ft, [А]"fe=0 k—0Используя уравнения (3) и (4), ролучаем простое выражение:1 б„ = а„.(я — п) (6)Величина ап достигает максимума в точке, где наклон кривой
распределения равен 0. Так как ап Ф 0, 6П может быть равно 0,
только если п = п. Таким образом, максимальная концентрация
комплекса МеА„ достигается в том случае, когда среднее число
лигандов, связанных со всеми центральными группами, равно п.Комплексные соединения с одним лигандомКогда с Me связан только один лиганд, функции распределе¬
ния, согласно уравнению (3), имеют простой вид:1 Ki [А]а° 1 + к,[А1’а| 1+*,[А]Функции распределения зависят только от произведения
/Ci[A], и, следовательно, кривая распределения имеет одну и ту
же форму — независимо от величины Ки а изменение ее просто1§[А]Рис. IX. 1. Кривые распределения для одноядер¬
ных комплексов с одним лигандом.смещает кривую по оси [А], как это видно из рис. IX. 1. Величина
ао достигает максимума при п = 0, т. е. в том случае, когда с Me
'не связан ни один лиганд. Это происходит при [А] = 0 или
lg[A] = —оо. Величина ai достигает максимума при /1=1, т. е.
когда все ионы металла в растворе связаны в комплекс, это про¬
исходит при [А] = оо или 1g[AJ =-}-°ог
Комплексные соединения с двумя лигандами275Комплексные соединения с двумя лигандамиКогда максимальное число связанных с Me лигандов равно
двум, функции распределения, согласно уравнению (3), имеют бо¬
лее сложный вид:1ССо —CCi =
0*2 ==1 + /С, [А] + KiKt [А]2
К, [А]1 + К, [А] + К,К2 [А]2
KiKz [А]21 +К: [А] + /С,/С21А]217]Максимальные значения а0 и аг достигаются при п = О
([А] = 0) и п = 2 ([А] = оо). Вид зивисимостей а0 и а% от lg[A]
подобен кривым, приведенным на рис. IX. 1.1,00,5K,/K2 = 8J ч К,/К2 = 1,5-10*А§г5гО,- Hgr^\ \ К,/К2= 1,8к,/кг=о,овIlf'HgOH4-6-2 С2 4lg[Al^?1§К,К2Рис. IX. 2. Кривые распределения cii для проме¬
жуточного комплекса двухлигандной системы.
Кривые смешены так, чтобы все максимумы оказались иа
одной вертикали. Чем меньше отношение К\1К2* тем
меньше максимальное значение dj.График зависимости oci от lg [А] — эта кривая в форме коло¬
кола с максимумом при п= 1; [А] = {K\K2)~'h. Некоторые из
этих кривых приведены на рис. IX. 2. Чтобы облегчить сравнение
кривых, запишем уравнение для oci в форме:X 01 УкЖ + х + КкЖ X*где X—YKiK.2 [А].При этом шкалу lg [А] следует сместить так, чтобы все макси¬
мумы имели одну и ту же абсциссу. Отметим, что форма кривой
в этом случае зависит только от отношения констант ступенча¬
того комплексообразования. В точке максимума имеем:iBi, max . / ~ ~2 У KiiKi + 1
2761Х.З. Форма кривой образованияВ предельном случае, где Ki К2, почти все ионы металла
в растворе связаны в промежуточный комплекс МеА, когда [А] =
= (KiK2)~'k- В другом предельном случае, когда К.2^ Ки доля
МеА пренебрежимо мала при всех значениях [А].Для систем, в которых N > 2, кривые ао и а„ имеют S-образ¬
ную форму подобно кривым рис. IX. 1. Кривые промежуточных ап
имеют почти форму колокола подобно кривым рис. IX. 2. В общем
случае, однако, эти промежуточные кривые распределения не яв¬
ляются симметричными, а кривая ап не является зеркальным
отображением кривой ао-Вопросы4. Пусть только три комплекса MeAn-i, МеА„ и MeA„+i присутствуют
в заметных концентрациях в данном интервале значений [А]. Покажите, что
когда величина ап максимальна, то an-i = an+i-5. Покажите, что для системы с N = 2 максимальное значение ai дости¬
гается при [А] = (К1К2)6. Покажите, что для системы с N = 1 точка перегиба на кривых распре¬
деления или образования имеет место при [А] = ЦКи7. Для системы с N — 2 определите значения [А], соответствующие точкам
перегиба кривой зависимости ai от lg [А]. При каких условиях эти точки распо¬
ложены симметрично относительно максимума?8. Для системы с N — 3 ai и а2 имеют максимумы. Найдите уравнения,
определяющие [А] в обоих максимумах. Каким должно быть соотношение между
константами образования, чтобы кривые зависимости at и а2 от lg [А] были зер¬
кальным отображением?IX. 3. ФОРМА КРИВОЙ ОБРАЗОВАНИЯНаклон кривой образования, т. е. кривой зависимости п от
lg [А] равен 2,3036, где5 = TlW = {A1rfW {8)Дифференцируя уравнение (4) по [А], умножая на [А] и ис¬
пользуя выражение (5), получаем:N5=2^» (9)п=0Подстановка выражения (6) в уравнение (9) дает:N6=2 п(п — п)ап (Ю)л=ОСогласно уравнению (10), наклон кривой образования может
равняться 0 при целочисленных значениях п, но только если один
из комплексов доминирует. Однако обычно и другие комплексы
Точки перегиба277присутствуют в достаточной концентрации, что делает члены в
выражении (10) отличными от 0, и, следовательно, выражение для6 положительным.Связь буферной емкости с наклоном кривой образованияБуферная емкость определяет количество сильного основания,
необходимого для небольшого изменения величины pH:р- dCj,~dpHЕсли величины [Н+] и [ОН-] малы, по сравнению с аналитиче¬
ской концентрацией буферного вещества, то добавка dCb сильного
основания к раствору просто переведет dCb буферного вещества
в кислой форме в dCb буферного вещества в основной форме.
Пусть п — это среднее число протонов, связанных с наиболее
основной из форм буферного вещества. Тогда за лиганд А может
быть принят ион Н+, и pH = —lg [А]. Если аналитическая кон¬
центрация буферного вещества равна С, то, используя выражение(8), находим:Р = 2.303С6 (11)Формулы для буферной емкости, выведенные в разделе VII. 6,
это частные случаи уравнения (10). Например, при N = 1 выра¬
жение (10) при подстановке выражений (3) и (4) принимает вид:А —п К, [Л]( ")a‘ (1 4- Ki [А])2Используя выражение (11) и полагая [А] = [н+], Ki=Ka\
находимСКа [А]0са + [н+])2что идентично уравнению (12) раздела VII. 6 или уравнению (23)
раздела V. 7. Буферную емкость двухосновной кислоты, опреде¬
ляемую уравнением (14) (см. раздел VII. 6), можно таким же
способом получить из общего выражения (10), используя выра¬
жения (3), (4) и (11).Точки перегибаТочки перегиба на кривой образования появляются тогда,
когда наклон кривой экстремален, т. е. при условии:М = ° 02)din [А] 1 Jd[A]
2781Х.З. Форма кривой образованияДифференцируя уравнение (10) по [А] и умножая на [А], на¬
ходим:[А] Т[АГ + 2п rfW1А] “ S "2 ТЩп=0Подстановка в это уравнение членов из уравнений (5), (8),(9) и (12) дает условие появления точки перегиба:N2 n(n — 2fi)6n — 0
п=0Используя уравнение (6), получаем:N '2 п {п — 2п) (п — п) ап = 0 (13)n=Q tЕсли [А] = 0, то п = 0 и ао = 1, а все другие а„ = 0. В та¬
ком случае уравнение (13) всегда имеет тривиальное решение
при п = 0, но оно не представляет интереса.Когда [А] > 0, то по меньшей мере одно из ап Ф0, т. е. воз¬
можен, по крайней мере, еще один реальный положительный ко¬
рень уравнения (13). Тогда на кривой образования всегда будет
иметься хотя бы одна точка перегиба. Так как п — полином сте¬
пени N относительно [А], то могут существовать максимум 2N
положительных реальных корней уравнения (13). Один из этих
корней всегда тривиален при и = 0, поэтому кривая образования
может иметь 2N— 1 точек перегиба.Комплексы с одним и двумя лигандамиДля N — 1, п = ai и кривая образования такая же, как и кри¬
вая распределения на рис. IX. 1. На этой кривой перегиб проис¬
ходит в точке, для которой /Ci[A] = 1 при п = -^.' При N — 2 форма кривой образования имеет более интерес¬
ный вид. Из выражения (4) находим:it — d] + 2a2 (14)Подставляя ai и аг из выражения (7) в выражение (14), на¬
ходим:V Г А 1 _I_ Oir V Г А12«М l^J ~Г 1*\2 I'M /1С\п- 1 + К, [А] +/С,*, [А]2Используя подстановку Х = Vпреобразуем уравнение(15) к виду: Х+2}ЛК,/К, X2У К2/К1 + X + VK2/KI X2
Комплексы с одним и двумя лигандами279На рис. IX. 3 приведены кривые образования для тех же са¬
мых систем, что и на рис. IX. 2. Как и прежде, шкала lg [А] сме¬
щена для совмещения центральных точек перегиба.о 2 *lg[A]+ J 1§к,к2Рис. IX. 3. Кривые образования для двухлиганд-
ных систем.Точки перегиба обозначены кружками. Для системы
Ag+—S20|” и Hg2+—1“ кривая образования имеет триточки перегиба, причем центральная находится в точке
с наименьшим наклоном. С другой стороны, для системы
Hg2+—ОН” кривая образования имеет только одиу точку
перегиба там, где наклон кривой максимален.Уравнение (13), определяющее точки перегиба, является урав¬
нением четвертой степени относительно [А], но оно легко может
быть преобразовано к виду:(1 - п) [(1 - 2п) а, + 4 (2 - п) а2] = О(16)Подставляя уравнения (7) и (15) в уравнение (16), получим
условие существования точки перегиба, выраженное через [А]:Ki [А] (1 - KiK2 [A]2) (KiK2 [А]2 - /С, [А] + ВКг [А] + 1) = О(17)Нетривиальные корни этого уравнения — четвертого порядка,
следовательно, и точки перегиба находятся из следующих выра¬
жений:1(1). 1[А]'2',3) .(Ki-ВКг) ± V(Ki-4K2) (Kt - 16/Сг)
2/Ci/Cz(18)(19)Значения п, при которых появляются эти точки перегиба, на¬
ходятся подстановкой выражений (18) и (19) в уравнение (15):п/г(|) =(2,3) .1 (не зависит от Ki, Кг и [А])
3/С, - 1б/С2 12/С, — 8/С2 /С(-4/С2[А]<2'3)(20)
2801Х.З. Форма кривой образованияп2,01,020 40 ВО 80 100Первая точка перегиба существует всегда, две другие — только
при К1» 16/Сг, следовательно, только тогда выражение (19) по¬
лезно.В предельном случае, где К\^>,К2, вторая и третья точки пе¬
региба появляются при Я = 7г и п — 3/г и области диссоциации
сильно разделены. Этот вариант иллюстрируется кривой образо¬
вания для комплексов тиосульфата серебра при К\ — 1,5-104 К2,(см. рис. IX. 3). Вблизи Я = 1
на кривой образования имеет¬
ся ярко выраженная сту-
а пенька.По мере того, как значения
К\ и К2 сближаются, кривая
образования изменяет форму
таким образом, что точки пе¬
региба сдвигаются симметрич¬
но по направлению к значению
к,/к2 п — I. Такой промежуточныйРис. IX. 4. Положение точек перегиба случай иллюстрируется кри¬
на кривой образования для двухлиганд- вой образования для первых
ных комплексов. двух комплексов иодида рту-В пределе (пунктирные прямые /), когда „л„ К0Т0Г)ЬТХ {(. — ЯЯ/Соточки перегиба для максимальных 1 ’ UlupblA м о о \2-наклонов расположены симметрично при л=1/г В ТОМ Случае, К0ГДЗ К\ =и Я=з/2 — в области точек а и с кривой мак- л с is симальных наклонов аос. Для меньших зна- — 16/\2» ВС6 Три ТОЧКИ ПСрСГИ-чений KlIKi эти точки перегиба находятся бли- ga сливаются при П= 1. ТОГ-
же к центру кривой аЬс\ когда /Cl/A2 = 16> все. гтри точки перегиба сливаются при й=! (точ- да Же, КОГДЗ Al 1ОА2, ПОЯВ-ка Ь). Для значений К\1Кг > 16 кривая образо- яяртгя ТПпысП пгтня тпчкя ПРПР-
ваиия имеет только одну точку перегиба. iwidau идна luntvci ucjjcгиба при Я = 1 (см. на рис. IX. 3
кривую образования комплексов гидроокиси ртути, для которых
^ = 0,008tf2) •На рис. IX. 4 показано, каким образом точки перегиба сме¬
щаются при изменении отношения К1/К2■ Для К\ > 16/С2 в цент¬
ральной точке перегиба угловой коэффициент минимален, а в двух
других точках перегиба максимален.Особенно интересным, с точки зрения теории, представляется
случай, когда отношение KJK2 определяется статистически (см.
Вопрос 9, раздел VII. 1). Скорость образования МеА вдвое боль¬
ше, чем для МеА2, поскольку существуют два возможных поло¬
жения лиганда А относительно Me и лишь одно относительно
МеА. Скорость же распада МеА2 вдвое выше, чем для МеА, так
как из МсА2, каждый лиганд может диссоциировать, а из МеА —
лишь один, следовательно К\ — 4Яг-В этом особом случае выражение (15) принимает простой вид3 . ... *,-=4*, (21)1 + 2К3 [А] ’
Подбор- констант равновесия по кривой образования281и становится по форме очень похожим на запись гипотетической
одностадийной реакции в случае отсутствия промежуточного ком¬
плекса:«-rfw;[M'A1-° (22)Однако эти кривые образования отличаются шкалой абсцисс
и поэтому различимы.Подбор констант равновесия по кривой образованияВ связи с обсуждением формы кривой образования для двух-
лигандного комплекса рассмотрим задачу оценки констант рав¬
новесия К\ и /Сг по экспериментальным данным, представленным
в виде кривой образования. Произведение /Ci/Сг может быть легко
найдено по координате срединной точки на кривой образования
[уравнение (18)], отыскание же значений K1IK2 связано с подбо¬
ром таких значений, при которых теоретическая кривая наилуч¬
шим образом соответствует экспериментальной.Когда К\ ^ К2, из предельных выражений (19) и (20) следует,
что точки перегиба с максимальным наклоном появляются при
следующих условиях:* _ 1 г л l2 1п~~2’ [А]п = 7(Г:Иными словами, константы можно определить независимо, ис¬
пользуя просто ту точку, в которой кривая образования пересе¬
кает полуцелые значения п.Однако, когда Ki > ЮО/С2, точки перегиба начинают сме¬
щаться в сторону от полуцелых значений к центральному значе¬
нию п— 1 (см. рис. IX. 4). В этих случаях данные следует
«подгонять» под кривую другими способами.Когда К1/К2 мало, форма кривой образования лишь незначи¬
тельно изменяется при существенных изменениях KxtRi- Таким
образом, если даже для произведения /Ci/Сг можно получить точ¬
ное значение, отношение К1/К2 определяется с большими ошиб¬
ками.На рис. IX. 5, а точками отмечены данные Я. Бьеррума для
образования аминных комплексов серебра, там же приведены
три теоретические кривые, для которых /Ci/C2= 1,07-Ю7, но зна¬
чения К\1К,2 различны. Средняя кривая с KJK2 — 0,23 соответ¬
ствует константам, выбранным Я- Бьеррумом. Отметим, что менее
точные данные могли бы быть описаны и кривыми для /С1//С2 = 0
или 1.
2821Х.З. Форма кривой образованияСтроить кривые образования для близких значений K1IK2 и
подгонять под них экспериментальные данные утомительно. Мож¬
но предложить более прямые графические методы. Простое пре¬
образование уравнения (15) позволит оценить К\ и К.2 по наклонуРис. IX. 5. Характеристика об¬
разования аминиых комплек¬
сов серебра (по Я. Бьерруму).а. Подбор теоретической кривой
образования, описывающей экспери¬
ментальные данные: точки — резуль¬
таты, наилучшим образом совпадаю¬
щие с теоретической кривой, когда
Ki//C2~0,23; кривые с KilK2=Q и
JCi/fa—* не очень отличаются; для
всех трех кривых lg Ki/K2=7,03.б. Графическая оценка констант
образования. Наклон кривой опреде¬
ляет произведение Ki/С2=^ *07 • 10“7»
а точка пересечения дает значение1.58 • 103.■10и отрезку, отсекаемому получающейся прямой линиеи на оси ор¬
динат. Уравнение (15) можно преобразовать к виду:(i-я) [А]■ Ki + К1К2(т=тИ(23)На рис. IX. 5, б приведены данные, полученные этим спосо-2 fiтложена функция х == Г А1 -—г - 104: а по‘■■'J —пбом. По оси абсцисс от10-4оси ординат -у = —Введенные подстановки приводят к следующему виду уравне¬
ния (23):у = 10-4,+ Ю-'KiKiX
Подбор констант равновесия по кривой образования283Следовательно, все экспериментальные точки должны лежать
на прямой линии с угловым коэффициентом 10_s/Ci/C2, . отсекаю¬
щей на оси ординат отрезок 10-4/(i. Линия, проведенная через
экспериментальные точки на рис. IX. 5, б, дает /Ci = 1,58-103 и
К1К2— 1,07 -107. Ошибка в определении значений констант лежит
в пределах 5%, что соответствует максимальной точности изме¬
рений подобного типа.Вопросы9. Покажите, что если в растворе доминирует только комплекс МеА„, точка
перегиба кривой образования соответствует наклону кривой, равному нулю при
ii — п. /10. Покажите, что когда только два комплекса МеА„ и MeAn+i присут¬
ствуют в заметных концентрациях, точка перегиба, соответствующая максималь¬
ному наклону, лежит иа кривой образования при га = п + '/г. Найдите выраже¬
ние для б в этой точке.11. Покажите, что если концентрация комплекса МеА„ является домини¬
рующей, а концентрации MeA„-i и MeAn+i достаточно ощутимы, то точка пере¬
гиба, соответствующая минимальному наклону, лежит на кривой образования
при ii = п. Найдите выражение для б в этой точке.12. Для случая N — 4 определите условия, при которых имеется точка пере¬
гиба на кривой образования при п = 2.13. При четных значениях N центральная точка перегиба иа кривой образо¬
вания находится вблизи га = lUN. При каких условиях это значение будет хоро¬
шим приближением?14. Определите максимальное значение а.% для Кi = 4Kz и К\ = I6/C2, если
N = 2.15. Постройте кривые образования, отвечающие уравнениям (21) и (22), ис¬
пользуя соотношение Р2 = KtK2 = Начертите кривую зависимости п от
lg [А] + lg 2Кг так, чтобы центральные точки перегиба были совмещены. Какова
максимально допустимая ошибка в экспериментально получаемых значениях п,
позволяющая отличить две кривые?16. Из общих выражений для буферной емкости (10) и (11) получите для
нее формулу, применимую в случае двухосновных кислот. При каком значении
отношения К1/К2 два максимума на кривой для буферной емкости сольются в одни?17. Покажите, что если для двухосновной кислоты Ki Кг, то выражение
для буферной емкости сводится к сумме двух членов, относящихся к однооснов¬
ным кислотам.18. Преобразуйте уравнение (15) в уравнение прямой линии с угловым коэффи¬
циентом I/K2, отсекающей отрезок \/К\Кг- Какие функции следует принять за х и у?19. Данные Я. Бьеррума, полученные для амиииых комплексов ртути при
низких концентрациях аммиака, таковы:— lg [NH3] . . .9,23 8,96 8,63 8,535 8,34 8,09 7,33
ii 0,441 0,655 0,969 1,290 1,62 1,92 1,98Изобразите их графически, пользуясь уравнением (23), и проведите наиболее
подходящую прямую через эти точки. Исходя из углового коэффициента и от¬
резка, отсекаемого прямой на ординате, оцените Кг и Кг для диамиииых комп¬
лексов ртути.20. Для высоких концентраций аммиака Я- Бьеррум получил следующие дан¬
ные для аминиых комплексов ртути:- lg [NH3] . . . 2,604 1,941 1,522 1,120 0,807 0,477 0,195п2,017 2,173 2,238 2,638 3,132 3,502 3,656
284IX. 4. НомограммыОтыщите графический метод нахождения Кз и Ki, предполагая, что в интер¬
вале, к которому относятся данные Бьеррума, концентрацией ионов Hg2+ н
HgNHj+ можно пренебречь. Изобразите эти данные на графике и оцените Кз
и Ki.IX.4. НОМОГРАММЫВ случае многократного выполнения однотипных вычислений
полезно применить номограммы. В простейшем виде номограмма
состоит из трех шкал, соответствующих трем взаимосвязанным
переменным — q, г и s. Если значения любых двух переменных из¬
вестны, то прямая линия, проведенная через эти точки, пересечет
третью шкалу в точке с координатой, соответствующей искомому
значению третьей переменной. Используя несколько таких номо¬
грамм, можно изобразить некоторые функции четырех или пяти
переменных.Общие соотношенияУсловие, при выполнении которого три точки с координатами
(х\,у\), (х2, у2) и (лг3, Уз) окажутся на прямой линии в плоскости
ху, можно записать, используя определитель *:xi yi 1х2 у2 1 =0х3 у% 1Если функция, связывающая переменные q, г и s, такова, что
уравнение можно представить в видеXi (?) Ух (?) 1Х2 (г) у2 (г) 1=0Хз (s) Уз (s) 1то возможно и построение номограммы. Параметрические уравне¬
ния для различных шкал таковы:(7-шкала — х — хх (q)\ у=ух (<?);
г-шкала — х = х2 (г); у — у2 (г);
s-шкала — х = х3 (s); у = у3 (s);В нижеследующих примерах эти общие выражения будут при¬
менены в тех случаях, когда номография может оказаться полез¬
ной при вычислении ионного равновесия. Читатель может сам по¬
строить номограммы для собственных целей, используя эти при-
меОЫ кяк мпгтрли* Более простые тнпы номограмм можно строить и не используя определи¬
телей, однако метод, предложенный здесь, более общий и полезный. Свойства
определителей можно найти в любой книге по высшей математике, например:
0. И. Смирнов, Курс высшей математики, т. III, ч. 1, Изд. «Наука», 1967,
Две прямые и одна искривленная шкала285Параллельные прямые шкалыПример IX. I. Самые простые номограммы те, в которых все трн шкалы —
прямые линии, параллельные друг другу. Это означает, что параметрические
уравнения для шкал имеют постоянное значение х и переменное у. Определитель,
поэтому, должен иметь вид— a yi(q) 1О у2 (г) 1
+ а уз (s) 1= 0где а — расстояние между шкалами.Если раскрыть определитель, то получим следующее уравнение:У\ (?) — 2уг (г) + Уз (s) = 0При соответствующем выборе функций этот тип номограммы может быть
применен ко многим функциям трех переменных. Например, приведенное в раз¬
деле VII. 7 предельное выражение для pH одноосновного кислотно-основного бу¬
ферного раствора высокой концентрации запишется:[Н+] = Ка Sr-сьгде Са — аналитическая концентрация кислоты с константой ионизации Ка',
Сь — аналитическая концентрация сопряженного с ней основания.Логарифмируя это уравнение и изменяя знак иа противоположный, получаем
выражение:pH-ptfa+lg|^- = 0которое можно использовать для построения номограммы с параллельными шка¬
лами (рис. IX. 6), если положить:1/, = pH-1,6; 1/2 = -?Г РКа + °-4; 03-18-^-+. WАддитивные постоянные сокращаются и служат лишь для выбора положе¬
ния нуля шкал так, чтобы используемые области для всех трех шкал располага¬
лись удобно. Конечно, номограмма пригодна только тогда, когда справедлива
исходная формула, и ее нельзя применять для очень разбавленных буферных
растворов или для очень высоких н очень низких значений pH.Две прямые и одна искривленная шкалаПример IX. 2. Более сложное соотношение, которое можно представить в
виде номограммы, это уравнение, связывающее pH слабой кислоты с ее анали¬
тической концентрацией. Когда величиной [ОН-] можно пренебречь по сравнению
с [Н+], выполняется следующее уравнение (см. раздел V. 1) :[н+]2=*а(с-[н+])Это выражение с некоторым трудом можно преобразовать к внду опреде¬
лителя, каждая строка которого является функцией одной из трех переменных.
2861Х.4. Номограммы-5-4-3-2Рис. IX(г9-вт!400200100SO2010pH-5-452Са
1 Сь0,5-2т\*—00,2V0,050,020,010,005.6. Номограмма для определения pH одноосновного буферного
раствора.Использовано уравнение [Н
Две прямые и одна искривленная шкала28?Приведем одну из возможных форм записи:О С 1
1+1»[Н+]2 [Н+] 1— Ка 1 О= 0Чтобы привести этот определитель к виду, удобному для построения номо¬
граммы, разделим третью строку на Ка, сложим первый столбец с третьим и
разделим вторую строку на 1 + [Н+]2; это дает:0[н ♦]*С[н+]1+[н+]2 1 + [н+]2Ка1= 0Наконец, сместим нуль таким образом, чтобы используемые интервалы всех
трех шкал можно было пересечь прямой линией; этого можно добиться, прибав¬
ляя дважды первый столбец ко второму. Параметрические уравнения тогда
имеют вид:*1 = 0; У\ = С_ _ [Н+]2 . гг [Н+] + 2 [Н+]2
2 ^ . Г» * + 12 » У2—"1 + [н+]2 ~ 1 + [н+]2*3 = 1; уз = 2 —*\аНа рис. IX. 7 приведены эти шкалы. Хотя интервалы изменения каждой из
переменных примерно равны единице, номограмму можно использовать и для
других интервалов, так как, если все три переменные умножить на одну и ту же
постоянную, уравнения останутся неизменными. Например, уравнение(103 [Н+])2 = 103Ка (Ю3С — 103 [Н+])идентично исходному.Таким образом, йомограмма пригодна для любого кратного десяти интер¬
вала изменения переменных С, [Н+] и Ка, если [ОН-] пренебрежимо мала по
сравнению с величиной [Н+]. Для вычисления pH раствора слабой кислоты нахо¬
дят желаемые значения Ка и С. Прямая линия, проведенная через эти точки,
даст нужную величину pH в месте ее пересечения со шкалой [Н+].Пример IX. 3. Еще более сложным уравнением, которое можно использовать
как основу для построения номограммы, является соотношение, дающее pH раз¬
бавленного буферного раствора (см. раздел V. 7):где Са — аналитическая концентрация кислоты с константой ионизации Ка\ Сь —
аналитическая концентрация сопряженного с ней основания.
288IX.4. НомограммыРис. IX. 7. Номограмма для определения pH слабых одноосновных кислот.Использовано уравнение [H+] = Kfl(C—[Н ])•
Дее прямые и одна искривленная шкала28910 Зак. 34S
290IX. 4. НомограммыЕсли Ка и Kh2q известны, то имеем три переменных: [Н+], Сь и Са/С4.
Одна из возможных форм определителя для этого уравнения следующая:Здесь т — имеющий размерность множитель, приводящий к сокращению еднннц
коидентраднн. Различные значения т определяют различные интервалы концен¬
траций на шкалах номограмм.Чтобы привести этот определитель к обычной форме, сложим первый столбец
со вторым н третьим н умножим вторую строчку на миожнтель:Полученный таким образом определитель даст следующие параметрические
уравнения для шкал номограммы:Рис. IX. 8 построен с использованием этих уравнений прн т = 105 н Ка —
= 1,75 • 10"5. Полученная номограмма применима ограничено, так как она под¬
ходит только для буферного раствора уксусная кислота — ацетат с концентра¬
цией ~ 10~5 моль/л. Подобные номограммы можно построить, используя эти
же параметрические уравнения, и для других систем кислота—основание и
других интервалов изменения концентрации. Наиболее интересен интервал, полу¬
чаемый прн условии, что 1/т того же порядка, что и Ка.образования для хлорндных комплексов кадмия н показано, что существует про¬
стое соотношение, связывающее концентрацию свободных ионов хлорида с из¬
вестными величинами аналитической концентрации кадмия и хлорида. Эти соот¬
ношения удобно представить двумя различными номограммами.Первая номограмма (рис. IX. 9)—это просто несколько параллельно рас¬
положенных шкал, передающих зависимости п и различных долей а„ от основ-01 =0—1Многошкальные номограммыПример IX.4. В разделе VIII.! были рассчитаны кривые распределения и
Многошкальные номограммы291ной переменной [С1~]. Горизонтальная линия при любом данном значении одной
из этих величин пересекает шкалы всех других величин при соответствующих
значениях последних. Шкалы былн построены по кривым распределения и3.53.0V2.01.5V»ii0,50,30,20,10,050,020,0!0,0050,0020,010,05О,’ 0.20,3
0,4
«о 0,5
0,6
0,7
0£0,90,950,980,990,010,050,10,20,i0,4. 0,445-
махс, 0,40.30.20,10,05-0,020,010,0f0,050,10,20,30,445
0.5J —
мах0,50,40,30,2«г0,10,050,014-54«0, 45
0,48 _
мах
0,4544
. 42
0,050.0/Я7460.543424'0,05
0,01 -<*«-5- 2
/0,5b ft*
0,1-0J0S10[СГ]- 0,02-0,01
■ 0,0050,002
■0,001
- 0,0005- 0,0002■ 0,000)Рис. IX. 9. Параллельные шкалы, связывающие п н долю а хлорндных ком¬
плексов кадмня с концентрацией свободного СГ-нона.образования, вычисленным в разделе VIII. 1. Заметьте, что максимальные значения
ось ссг и аз имеют место при целочисленных значениях п.Вторая номограмма (рнс. IX. 10) связывает аналитические концентрации
кадмия Со и хлорида с концентрацией свободного нона хлора условием мате¬
риального баланса[СГ] + йСо = С,10*
292IX. 4. Номограммыгде п — функция [С1~], представленная шкалами на рис. IX. 9 нлн кривой обра¬
зования на рис. VIII. 3. Это уравнение легко можно привести к форме опреде¬
лителя0 тС\ 1
п т[СГ] 1 =01 —тС0 0 ,где т — имеющий размерность множитель, который приводит в соответствиеV0,20,3—Рис. IX. 10. Номограмма для определения концентрации свободного СГ-иона
в растворах с аналитическими концентрациями кадмня и хлора С0 н С,.интервалы изменения концентраций, попадающие на шкалы. Складывая первый
столбец со вторым н третьим н деля вторую строку на J -j- п, получим определи¬
Многошкальные номограммы293тель обычного для номограммы вида. Параметрические уравнения для шкал
имеют следующий вид:х, =0; yi= тСхп+т[СГ]Х2~Т+1'‘ У2~ 1 +п*з = 1; */з = 1 — «СоНа рис. IX. 10 шкалы, соответствующие этим уравнениям с m = 2,5, пере¬
крывают самый интересный интервал концентраций для комплексообразования.
Отметим, что линия 0,01 М раствора CdCl2, проведенная через Со = 0,01 и Ci =
= 0,02, пересечет шкалу [С1~] в точке 0,0173, что согласуется с численным ре¬
зультатом, полученным в Примере VIII. 2.Номограммы подобного вида можно строить для любых систем одноядерных
комплексов и для некоторых полиядерных систем. Мы снова прибегнем к по¬
мощи номограмм в главе XII, как к простому способу вычисления коэффициента
активности. Эти очень полезные номограммы находят широкое применение, огра¬
ниченное, однако, недостатком воображения и изобретательности исследователя.Вопросы21. Постройте номограмму для соотношения [Н+]2 = СКа-22. Постройте номограмму, подобную той, что изображена на рис. IX. 8, для
определения pH буферных растворов HSOJ —SO|~. Для HSOJ р^а=1,99 и,
следовательно, масштабный коэффициент m = 102 будет подходящим. Заметьте,
что выражения существенно упрощаются.23. В насыщенных растворах хлорида ртути (см. раздел VIII. 5) величина
[Hg2+] зависит от [Н+] и [С1~]. Постройте номограмму, выражающую это соот¬
ношение.24. В насыщенных растворах сульфида ртути (см. раздел VIII. 7) величина
[Hg(SH)2] зависит от [Н+] и [H2Sj. Постройте номограмму, выражающую это
соотношение.25. Постройте для систем аминов серебра (см. раздел VIII. 7) номограмму
зависимости концентрации всех частиц и доли серебра, выпадающего в осадок в
виде Ag20, от аналитической концентрации ионов серебра и аммиака.26. Если в Примере IX. 3 величины [Н+], Ка и Сь считать переменными,
тогда уравнение для построения номограммы нельзя привести к стандартной
форме. Покажите, однако, что если [Н+]/К„, [Н+] и Сь выбраны как три пере¬
менные, то можно получить стандартную форму. Постройте номограмму на этой
основе для интервала концентраций 10~3, в предположении, что Са = Сь.
Г лава XК0МПЛЕКС00БРА30ВАНИЕ
(Более сложные вопросы)За последнее десятилетие было выполнено огромное количе¬
ство исследований, посвященных ионным равновесиям в раство¬
рах. Детальное рассмотрение этих работ выходит за границы дан¬
ной книги, однако обсудим вкратце несколько систем, поведение
которых не укладывается в рамки математического описания од¬
ноядерных комплексов.Рассмотрение начнем с некоторых более сложных одноядер¬
ных систем, затем обсудим некоторые полиядерные системы, и, на¬
конец, дадим краткое описание равновесий хелатных комплексов
металлов, которые в последнее время приобрели чрезвычайное
значение в аналитической химии.Х.1. СРАВНЕНИЕ КАТИОНА И АНИОНА КАК ЛИГАНДОВ
Фтористый водородБольшинство кислот можно рассматривать как одноядерные
комплексы, в которых центральная группа*—это анион, а лиган¬
дом является ион водорода.
Одним существенным исклю¬
чением из этого положения яв¬
ляются растворы HF, для кото¬
рой характерно образование
иона HF2~ при высоких концен¬
трациях F'-иона. Если, однако,
полагать ион Н+ центральной
группой, а ион F" — лигандом,
то систему можно считать
двухлигандным одноядерным
комплексом.Как следует из рис. X. 1, в
рассматриваемой системе, в от¬
личие от обычных кислотно¬
основных систем, аргументом
является [F-], а не [Н+], причем [F-] можно в большинстве случаев
легко изменить, добавляя фторид или сильную кислоту. В раство-а-lg[FJРис. X. 1. Распределительная диаграмма
для плавиковой кислоты.Система описывается теми же способами, что
и одноядерные комплексы, если за лиганд
вместо иона Н* принять ион F”.
Фтористый водород295pax, содержащих только HF и воду, величина [F-] может изме¬
няться в ограниченном интервале путем изменения аналитической
концентрации HF.Пример Х.1. Рассчитайте pH растворов HF в зависимости от аналитической
концентрации С, значения которой находятся вблизи 1 моль/л. Сравните резуль¬
тат с таковым, полученным в прене¬
брежении величиной [HFj].Запишем уравнения условий:равновесия *[HF] = 8,5 • 102 [н+] [F-] (1)[HFj] = 6,9 [HF] [Fl (2)материального баланса[HF] + [F-] + 2 [HFj] = С (3)электронейтральности (в прене¬
брежении величиной [ОН-], посколь¬
ку растворы кислые)[H+] = [F-] + [HF-] (4)Подстановка уравнений (1), (2)
в уравнение (4) дает связь между
[Н+] и [F—]:гн+1 [FJ 1 J 1 — 5,86 - 103 [F-]2 уо>Подстановка уравнений (1), (2)
и (5) в (3) дает выражение, в кото¬
рое входит только величина [F-]:8,5 • 10J [F~]2 + 1,17- 104 JF-]3 =— (С — [F-]) (1 — 5,86 • 103 [F' ]2) (6)Положительные значения для [H+] и С можно получить только, если знаме¬
натель (5) положителен, т. е. (если [F-] < 1,31 • 10~2). Начиная с этого значения,
мы можем выбрать ряд уменьшающихся значений [F-] и использовать их для
вычисления [Н+] из уравнений (5) и С из уравнения (6). Тогда pH можно пред¬
ставить как функцию — lg С (рис. X. 2). На этом же рисунке показаны еще две
кривые: одиа (кривая 4) характеризует полностью диссоциирующую кислоту[Н+] = Сдругая (кривая 1) — простую одноосновную кислоту; кривая (/) получена пу¬
тем объединения выражений (1), (3) и (4) при пренебрежении величиной [HFj]:С — [Н+] = 8,5 • 102 [н+]2 ' (8)В растворах, более разбавленных, чем 0,05 моль1л, пренебрежение величиной
[HF“] разумно. В концентрированных же растворах величина [Н+] зависит
почти линейно от С, вместо того, чтобы изменяться пропорционально Скак* Константы измерены в 1 М растворе NaC104 при 20 °С. S. Ah г land,
R. Larson, К. Rogengren, Acta chem. Scand., 10, 705 (1956).pH-lg СРис. X. 2. Значения pH растворов пла¬
виковой кислоты концентрации С.
Кривая 3 учитывает все присутствующие ча¬
стицы и при концентрациях выше 10”1 М зна¬
чительно отклоняется от кривой 1, вычислен¬
ной: в пренебрежении [hF“J. При концентрацияхвыше 1 М HF ведет себя примерно как в 10 раз
разбавленная сильная кислота (кривая 2).
296Х.1. Сравнение катиона и аниона как лигандовэто следует из уравнения (8). Последнее легко проверяется. Поскольку величина
[нр;] преобладает по сравнению с величиной [F-], выражение (4) можно запи¬
сать так:[H+]=*[HF;J (4а)Используя это выражение, представим уравнение (3) в виде:• [HF] + 2 [Н+] = С (За)Подстановка уравнений (1) и (2) в (4а) дает:[F~]= 1,31 • 10~2Вводя это значение [F-] в уравнение (1) и подставляя полученное значение
в уравнение (За), получим:[Н+] = 7,63 • 10-2С (9)Это подтверждает, ?то при высоких концентрациях HF ведет себя почти как
сильная кислота, но более низкой концентрации; такое поведение наблюдается
при С = 1 М (см. рис. X. 2) и выше.Таблица Х.1*Равновесия в насыщенных растворах иодида серебра **(тв)0={А8+]ГГ] = 4,45.10-17Частицы, принимающие участиеКонцентрации 3* различных частиц
в насыщенных растворах Aglв равновесиях и уравнения равновесий **в чистой
водев 1 М
растворе
KIв 1 М
растворе
AgNO,Растворимость:Agl — аналитическая1,27-ю-31,83-10-24,20-ю-3[Ag+]6,7 •10-94,7 • 10~179,83-10-1[Г]6,7 •ю-99,4 .10“'4,53-ю-17[Agl]6,0 •ю-96,0 -10-96,0 •10“9[As1!]= 4,0- 10~e[Г]2,7 •10“143,75- 10_в[Agl3]2-= 2,5- 10~3[I"]22,2 -10_3[AglJ2-= 1,1-10~2[I-]49,2 • 10_3[Agjrj. 1 c f= l yU ' i \J[Г]41,17- 10-3[Ag3r]= 2,0 • Ю-3[I-J51,5 *10-3[Ag12lHl= 4,0- I0_ein121,9 -10“6[Ag2I+]= 1,0- 10-6[Ag+]6,7-ю~159,83-10" 7[Ag3I2+]= 7,1 • 10-4[Ag+]26,86-ю-4r « .3+1LaS44 j— 3,7 • i(T3Г it . +13i^g j3,52 •ю-3* Константы вычислены по результатам измерений растворимости в 4 М растворе NaClO*
ври 25 °С; J. Leden, Acta chem. Scand., 10 , 535, 540, 812 (I9§6).** Возможно существование н других комплексов ориентировочного состава
** Концентрации, меньшие ДО**20, не приведены.
Иодид серебра297Иодид серебраПеремена ролей катиона и аниона, характерная для плавико¬
вой кислоты, происходит и в галогенидных комплексах серебра,6-1§СРис. X. 3. Концентрационно-логарифмические
диаграммы для зависимости концентраций раз¬
личных частиц от величин [I-] (а) и [Ag+] (б)
в насыщенных растворах Agl.образующихся в концентрированных растворах нитрата серебра
с участием нескольких ионов серебра и одного галоген-иона.
В табл. X. 1 приведены константы равновесия “образования
298Х.2. Комплексы с разнородными лигандамиразличных комплексов, которые существуют в равновесии с твердым
иодидом серебра в растворах с избытком ионов иода или серебра.Приведенные на рис. X. 3 диаграммы показывают, что ком¬
плексы с избытком иода над серебром преобладают при концент¬
рациях иона иода, больших, чем 10~3, и включают также неко¬
торые полиядерные группы при самых высоких концентрациях
1~-иона.При концентрациях же [Ag'*'], больших 2-10~3, преобладают
комплексы, содержащие большее число Ag*, чем 1_-ионов, а поли¬
ядерные комплексы не образуются.ВопросыИспользуйте константы, приведенные в Примере X. 1 н табл. X. 1 и VIII. 2
(стр. 232)._ 1. Найдите концентрации всех частиц в 1,0 М растворе HF.2. Найдите растворимость CaF2 в 1,0 М растворе HF, используя константы
для CaF2: рК<тв)о = 10,5 и р/((тв)1 = 10,0.3. Найдите растворимость Agl в 0,5 М растворе KI.4. Найдите растворимость Agl в 0,5 М растворе AgN03.5. В насыщенных растворах AgCl в AgNOj следует учитывать равновесия:[AgCl] = 2,2-10-7
[Ag2Cl+] = 2,7.10-5[Ag+][Ag3Cl2+] = 5,0 • 10“5 [Ag+]2Используя константу К<тв)о = 3,8 • 10~10, измеренную в 0,2 М растворе
NaC104, вычислите растворимость AgCl в 0,2 М растворе AgNC>3.6. Постройте концентрационно-логарифмическую диаграмму для насыщенных
растворов AgCl, содержащих избыток Ag*-HOHOB, и проведите кривую зависи¬
мости растворимости AgCl от [Ag+].7. В насыщенных растворах AgBr в AgNOs следует учитывать равновесия:[Ag+] [Вг—] = 7,8 • 10—13
[AgBr] = 1,1 • 10-8
[Ag2Br+] = 3,9-10—3 [Ag+][Ag3Br2+] = 7,8.lO-5 [Ag]2
[Ag4Br3+] = 1.8 -10-“ [Ag+]3Постройте концентрационно-логарифмическую диаграмму для этой системы
и определите максимальную растворимость AgBr. Какова необходимая для до¬
стижения минимальной растворимости аналитическая концентрация иона се¬
ребра?Х.2. КОМПЛЕКСЫ С РАЗНОРОДНЫМИ ЛИГАНДАМИВ растворах, содержащих ионы металла и два других типа
частиц, которые образуют с первыми комплексы сравнимой устой¬
чивости, могут образоваться в заметных концентрациях и ком¬
плексы с двумя разнородными лигандами. Поскольку измерения
Галоген-аммиачные комплексы серебра299констант равновесия для таких смешанных комплексов труднее,
чем для простых одноядерных, тщательно исследованы были только
несколько таких систем.Галоген-аммиачные комплексы серебраХорошо известно, что галогениды серебра частично раство¬
ряются в аммиаке, так как образование комплексов AgNH3 и
Ag(NH3)2 изменяет равновесие растворимости за счет введения
свободных Ag+-HOHOB в упомянутые комплексы. Галогениды се¬
ребра растворимы также и в концентрированных галогенсодер¬
жащих растворах из-за образования комплексов типа AgX„. Когда
концентрации и NHj, и Вг” в растворах, насыщенных AgBr, ве¬
лики, то образуются в заметных количествах комплексы, содер¬
жащие оба лиганда. Подобная ситуация наблюдается для раство¬
ров, содержащих NH3 и С1~, насыщенных AgCl.В табл. X. 2 приведены константы для аммонийно-бромидных
и аммонийно-хлоридных комплексов серебра. Константы ^С(Тв)тпТаблица Х.2Смешанные галоген-аммиачные комплексы серебра (Х = С1, Вг)*AgX (тв.) + mNH3 + (п - 1)Х~ Ag(NHa)m X^"-1»
[Ag(NH3)mX-("-"] = /С(ТВ)т„ [NH.f [XT'1Хлоридные комплексыБромндные комплексыт<NH3>п(СГ)—lg К(тв) тпт(NHg)п(Вг“)—lg К(тв) тп009,420012,11016,60017,96024,70025,0034,40034,15043,52043,22105,76108,39113,40114,35122,82124,1013?133,70201,95204,582 '12,30214,3722?224,30* Константы On для хлоридиых комплексов серебра заимствованы у: J. Leden,
Svensk. Kem. Tidskr., 64, 249 (1952) и E. Berne, J. Leden, ibid.. 65, 88 (1953), а для бро-
мидных комплексов серебра у: Е. В е г n е. J. Leden. Naturiorsch., 8а, 719 (1953), намере¬
ния при 25 С в 0,1 М растворе NaC104.Константы К(ТВ) ]д вычислены из данных для К(ТВ) 20 н ^2 для Ag(NH3)^, измеренныхЯ. Вьеррумом (Metal Amnune Format, p. 134) при 30 °C в 0,5 Af растворе NH4NO3. Все другие
константы взяты у: J. L е d е n, G. Bersion, Acta chem. Stand., 15, 607 (1961),
300X. 2. Комплексы с разнородными лигандамихарактеризуют равновесия образования комплексов Ag(NH3)mBrn
или Ag(NH3)mCln из твердых AgBr или AgCl и необходимых ко¬
личеств лигандов. Например, образованию Ag(NH3)Br2 соответ¬
ствует равновесие:AgBr (тв.) + NH3 + Вг“ Z=± Ag(NH3)Br;[Ag(NH3)Brj] = K(TB)12[NH3][Br-]^(ТВ) 12 = —Равновесия сохраняются до тех пор, пока растворы остаются
насыщенными. Константы же равновесия в ненасыщенных раство¬
рах могут быть получены делением соответствующих величин на
произведение растворимости.Для описания систем со смешанными комплексами можно ис¬
пользовать простую концентрационно-логарифмическую диаграм¬
му, но при условии, что концентрация одного из лигандов по¬
стоянна (рис. Х.4).Ион Ag(NH3)2 в большинстве случаев является доминирующим
серебросодержащим ионом, но при высоких значениях величины
[Вг~] следует учитывать смешанные комплексы, даже несмотря на
то, что концентрация ни одного из них не превалирует над AgBrt"
(рис. Х.4, а).В отсутствие избытка Вг~-иона растворимость AgBr в 1,0 М
растворе NH3 определяется приближенным условием материаль¬
ного баланса:S = [Br1 = [Ag(NH3)+]Это условие соответствует отмеченному на рис. X. 4, а пересе¬
чению двух линий приlg [Вг“] = — 2,28
откуда получаем следующие выражения:S = 5,2- Ю_3
[Вг“] = 5,2 • !0—3
rAg(NH3)t] = 5,2 • 10“3
[AgNH3Br] =4,45- 10—5
[Ag(NH3)2Br]-= 4,25 • 10“5Малые концентрации двух последних частиц повышают рас¬
творимость менее, чем на 2%. Все другие вероятные частицы на¬
ходятся в пренебрежимо малой концентрации.Добавка нитрата серебра или бромида калия к насыщенному
раствору AgBr в аммиаке уменьшает растворимость. Добавка
же большого избытка КВг снова увеличивает ее из-за образо¬
вания AgBrij- и других комплексов, содержащих избыток Вг~- над
Галоген-аммиачные комплексы серебра301[AgNHjBrJ'JBrJ'J№]
JAjCNHjVBr;]^[AgBrj][AgNHjBr]-lg[NH3]Рис. X. 4. Концентрационно-логарифмические диа¬
граммы для зависимости концентраций различных
частиц от [Вг~] (а) и [NH3] (б) в растворах, насы¬
щенных AgBr.Величины [NH3] (а) и [Вг~] (б) постоянны и равны
1,0 М.Доминирующими являются частицы jAgBr^~j и [Ag (NHa)j j(a).
Смешанные комплексы становятся ощутимыми при высоких
концентрациях Вг”-иона (а) и NH3 (б).
302X. 2. Комплексы с разнородными лигандамиАд+-ионами. На большей части рис. Х.4,б преобладает AgBrr, а
растворимость AgBr не зависит от величины [NH3], но при высоких
концентрациях аммиака смешанные комплексы становятся доми¬
нирующими и преобладают величины [AgNHaBrl"] и [Ag(NH3)2Br2].Диаграмма области преобладанияМожно изобразить целую серию концентрационно-логарифмиче¬
ских диаграмм при различных фиксированных значениях [NH3] и
[Вг_], но полную картину системы легче всего получить из диа¬
граммы области преобладания. Чтобы проследить связь междуРис. X. 5. Диаграмма области преобладания для растворов, насыщенных AgBr:а — общий вид; б — область высоких концентраций, где важны смешанные комплексы.
Смешанный комплекс (AgNH3>Br преобладает при условии [NH3] я* [Вг~].этими двумя типами диаграмм, представим трехмерную диаграм¬
му, где концентрация каждой из частиц представлена поверх¬
ностью. На такой диаграмме две горизонтальные оси соответ¬
ствуют —lg[NH3] и —lg [Вг-], а на вертикальной — отложен лога¬
рифм концентрации данных частиц. Рис. X. 4, а и X. 4, б являются
вертикальными сечениями этой трехмерной диаграммы плоско¬
стями, параллельными одной из горизонтальных осей, а линии
пересечения поверхностей являются линиями концентраций.Рис. X. 5,а — вид сверху на эту трехмерную диаграмму. На
нем видны границы между теми поверхностями, которые оказа-ЯПЛ1. rtooanvi; 1-Т о ПТ1Л Y ^ Л ттотгл ^гпаттшштттта тюлЛпо\т/дттчл
•iijriv^u auiiw^Aj • ни j./nv_. 1 v. Kjy kj дини j uw«fin nwniivw uowpumvnnv; iunобласти диаграммы, в которой оба лиганда имеют высокие кон¬
центрации.Для выявления доминирующих частиц можно построить подоб¬
ную диаграмму, вычерчивая несколько концентрационно-логариф¬
мических диаграмм (вертикальные сечения 3-мерной диаграммы).
Смешанные бромид-иодидные комплексы ртути303Уравнения прямых линий, разделяющих различные области,
получают, приравнивая выражения для концентраций двух сосед¬
них частиц.Некоторые частицы никогда не становятся доминирующими.AgNHe находится в заметной, концентрации около границы
между Ag+ и Ag(NH3)2. AgBr!" начинает играть заметную роль
вблизи границы между AgBr~ и AgBr^-, a AgNF^Brj вблизи гра¬
ницы между Ag(NH)2 и AgBr*”.При высоких концентрациях Вг--иона серебро имеет координа¬
ционное число 4; при более же низких концентрациях его коорди¬
национное число обычно равно 2. Даже при самых больших из
достигаемых экспериментально концентрациях аммиака серебро не
может координировать более двух молекул аммиака, но Ag(NH3)j
может присоединить две молекулы лиганда Вг" прежде, чем Вг"
начнет замещать NH3.Смешанные бромид-иодидные комплексы ртутиЕще одна детально изученная система со смешанными ком¬
плексами— ионы ртути Hg2+ с Вг-- и 1--ионами (табл. X. 3). При
любом постоянном значении концентрации одного из лигандов
можно построить распределительную диаграмму, которая покажет
изменение состава раствора при изменении концентрации второго
лиганда (Вопрос 13).Таблица X. 3
Смешанные бромид-иодидные комплексы ртути*Hg2+ + шВг" + пГ ^ HgBrmI-(m+n-2)
[HgBrmI-(m+n-2>] = pm„ [Hg2+] [Вг-]"1 [Г]"тп(вг)п(г)lg $mnm(Бг-)п(•-)$mn0001328,590112,872016,880223,822122,740327,492227,190429,863019,15108,943124,231120,894020,901225,70* Все значения получены при измерении в 0,5 М растворе NaC10< при 25 °С [Y. Marcus,
Acta chem. Scand., 11, 329, 599. 610, 811 (1957)).Полное описание системы, однако, можно получить, вычерчи¬
вая диаграмму области преобладания (рис. X. 6). Чтобы получить
304X. 2. Комплексы с разнородными лигандамиграницы между областями преобладания в виде прямых линий
следует приравнять концентрации пары частиц. В большинстве до¬
ступных областей координационное число ртути равно 2, 3 или 4.
Только при очень низких концентрациях обоих лигандов стано¬
вятся преобладающими ионы HgBr+, Hgl+ или Hg2+. Конечно,Рис. X. 6. Диаграмма областей преобладания для растворов^
содержащих ионы ртути, брома и иода.Каждый из возможных комплексов становится преобладающим для не¬
которых значений [Вг“] и [l“].существует возможность гидролиза, приводящего к образованию
HgOH+ и Hg(OH)2, но влияние третьей переменной, pH, может
быть подавлено, если поддерживать раствор достаточно кислым.Смешанные протонные комплексыДругой тип смешанного комплекса образуется з том случае,
если лиганд помимо иона металла может присоединить один или
больше протонов. Так, в растворах фосфата кальция (см. раздел
VII. 7), кроме ионов Са2+ и различных ионов фосфатов, обнару¬
жены комплексы СаНР04 и СаНгРО^ (более детальное рассмот-ПРНМР ППИИР ГГРНП R ПЯЧЛРГТР Y М
г -* г **“ “ ГВ основных растворах частицы воды, включенные в комплекс,
могут терять протоны, образуя смешанные комплексы. Например,
ион двуххлористого комплекса Сг3+ может гидролизоваться[СгС12(Н20)]+ ^ СгС12ОН + Н+; К = 3,2 • 10_6
X. 3. Гомоядерные кислотные системы305а ион тетрааммина Со3+ гидролизуется по стадиям:[Co(NH3)4(H20)2]3+ z=£ [Co(NH3)4(H20)OH]2 + Н+
tCo(NH3)4(H20)OH]2+ ^=± [Co(NH3)4(OH)2]++ Н+/С = 1,1 ■ 10 8
/С = 8.9-10-9При расчетах подобных систем следует учитывать эти смешан¬
ные комплексы. Довольно много комплексов указанного типа было
найдено для многовалентных ионов металлов, обычно их приводят
в таблицах констант устойчивости.ВопросыИспользуйте по мере необходимости таблицы X. 2 и X. 3.8. Из рис. X. 4, а видно, что при добавлении иона Вг" к насыщенному рас¬
твору AgBr в 1,0 М NH3 растворимость уменьшается, проходит через минимум и
затем увеличивается. Определите минимальную величину растворимости и ана¬
литическую концентрацию Вг"-иона, необходимую для достижения этого мини¬
мума. Сравните эту величину с тем значением, которое вычислено без учета
смешанных комплексов.9. Постройте концентрационно-логарифмическую диаграмму для насыщен¬
ного раствора AgBr в 0,1 М растворе NH3 с различными [Вг-]. Какова мини¬
мальная растворимость AgBr, достигаемая при добавлении Вг~-нона к насы¬
щенному раствору AgBr в O'1 М NH3?10. Постройте концентрационно-логарифмическую диаграмму для насыщен¬
ного раствора AgCl в 0,1 М NH3 с различным [С1“]. Найдите по диаграмме
зависимость растворимости AgCl от аналитической концентрации С1~-иона, добав¬
ленного к насыщенному раствору AgCl в 0,1 М ЫНз-11. Постройте диаграмму области преобладания для насыщенного раствора
AgCl в растворах, содержащих NHs н С1~.12. Рассчитайте концентрации всех частиц в растворе, если концентрации
свободных ионов следующие: [Hg2+] = Ю'18; [Вг-] = 10'2; [I-] = 10~5 моль/л.Какие аналитические концентрации Hg(NOs)2, КВг и KI необходимы для
приготовления такого раствора? Выпадает ли что-нибудь в осадок?13. Постройте распределительную диаграмму для бромид-иодидных ком¬
плексов ртути в интервале изменения [Вг-] от 10“* до 10~4 для постоянного зна¬
чения [I-], равного 10-е. Используйте рис. X. 6 для определения тех комплексов,
концентрации которых заметны.Х.З. ГОМОЯДЕРНЫЕ КИСЛОТНЫЕ СИСТЕМЫГомоядерные комплексы, являясь специфическим классом по-
-лиядерных комплексов, можно разделить на содержащие: один
атом металла и некоторое определенное число атомов металла.
В каждой группе могут быть комплексы с различным числом ли¬
гандов, однако заметных количеств комплексов, содержащих раз¬
личное число атомов металла, нет. Хотя подобные системы слож¬
нее простых одноядерных, между ними существует определенное
сходство, а описание их проще, чем для многоядерных систем, в
которых комплексы могут содержать любое число атомов металла
и лигандов.
306Х.З. Гомоядер'ные кислотные системыХромат-бихроматные системыВероятно, самой известной гомоядерной системой является си¬
стема хромат — бихромат. Равновесие между одноядерными
(CrOij-, HCrOJ, Н2СГО4) и двухъядерными (СггО?-, НСггО”) части¬
цами устанавливается быстро (табл. X. 4).Таблица Х.4Системы гомоядерных кислот *Равновесияlg кХроматыCroj~+H+ z=± нею;6,50HCrOj+H+ H2CrO(-0,082НСЮ7 ^=± Cr202-+H201,52CraO"-+H+ ^=± HCr2C>70,07МолибдатыМо02“+н+ HMoo;4,087MoO*“+8H+ Mo70“7+4H2057,7mo7o«7 + h+ HMo7o=;4,33HMo7Oj4+H+ i=± H2Mo704273,7Ванадаты (pH меняется от 0 до 5)10VOj+8H2O ^ HjV|0O2“+I4H+-6,75H,VI0O£ HV10O=-+H+—3,6hv10o£ ^ v10o«-+H+-5,8* L. G. S i 11 е п, Quart Revs, 13. 146 (1959).В щелочных растворах преобладающим является ион СгОГ»
но при увеличении кислотности становятся заметными и концент¬
рации других частиц. В сильнокислых растворах преобладают
двухъядерные частицы при высоких концентрациях хромата и од¬
ноядерные— при низких.Пример Х.2. Вычислите концентрации всех частиц в 0,1 .М растворе би¬
хромата.Запишем уравиеиня условий равновесий:[НСгОГ] = 3,16 • 10е [Н+] [СЮ?-] (1)[Н2Сг04] = 0,83 [Н+] [НСгО;] (2)[Сг2072_]=33[НСг07]2 (3)[нсг2о;] =1,17 [н+] [сгао72-] (4)[Н+][ОН-]= 1,0*10~и (5)
Хромат-бихроматные системы307материального баланса для хромат-иона[СгО*-] + [НСгО;] + [Н2Сг04] + 2 [Сг202"] + 2[НСг207] =0,20 (6)протонного (получаемого из условий материального баланса и электроней¬
тральности)[н+] + [нсг2о;] + [Н2Сг04]=[ОН-] + [СгО*“] (7)Итак, получено 7 уравнений с 7 неизвестными.Самое простое допущение — пренебрежение в условии материального ба¬
ланса (6) всеми ионами, кроме [Сг202-]:[Сг2072-]=0,1 (6а)Получаемая из уравнения (3) величина[нею;] =0,057в 2 раза меньше, чем [Сг202-]; естественно, что ею в уравнении (6) пренебречь
нельзя. Поэтому следует в условие материального баланса включить второй член:[НСгО;] + 2 [Сг202-] = 0,2 (66)Подставляя значение [CrjO2-] из уравнения (3), получаем квадратное урав¬
нение:66 [него;]2 + [нею;] - 0,2=о[НСгО^] = 4,8 • 10-2Из уравнения (3) получаем значение[Сг202-] = 7,6 • Ю—2которое удовлетворяет выражение (66).Для вычисления других концентраций необходима величина [Н+], которую
можно получить из протонного условия (7): зная величины [НСгО“] и [Сг202-],
можно выразить концентрации других частиц через [Н+] и подставить их в урав¬
нение (7); это приводит к квадратному уравнеиню, решением которого явлнется:[Н+] = 1,16-10-4Таким образом:[Сг02-]= 1,30* 10-4 [из уравнения (1)][Н2Сг04] = 4,65 • 10-в [из уравнения (2)][НСг207] — 1,03-10_6 [из уравнения (4)][ОН-] = 8,6- 10-п [из уравнения (5)]Уравнение (6) удовлетворяется с точностью до 1%, а (7) —до 0,1%'.
303X. 3. Гомоядерные кислотные системыДля полиядерных систем те графические методы, которые были
использованы для представления равновесий в одноядерных си¬
стемах, менее удобны, так как а зависит от концентрации и ли¬
ганда, и центральной группы.
В сильно разбавленных раство¬
рах, однако, полиядерными час¬
тицами можно пренебречь при
всех значениях pH, и распреде¬
лительную диаграмму можно ис¬
пользовать для описания равнове¬
сий одноядерных частиц. Как сле¬
дует из рис. X. 7, во всей рассмат¬
риваемой области количество
двухъядерных частиц пренебре¬
жимо мало. Последние следует
учитывать, если их концентрации
достигают примерно 5% от ана¬
литической концентрации. Для
растворов более кислых, чем
рН=5, преобладающей одноядерной частицей является НСгОГ; сле¬
довательно, двухъядерные частицы необходимо учитывать, когда:2 [Сг2072~] > 0,05 [НСгО;] = 0;05С
Из уравнения (3) следует, что это выполняется при условии:С >7,6-10-4арнРис. Х.7. Распределительная диа¬
грамма для растворов хромата,
аналитическая концентрация кото¬
рого менее 10~4 МИтак, пока концентрации растворов хроматов <10~4М, двухъ¬
ядерными комплексами можно пренебречь.Другие гомоядерные комплексыКонстанты равновесия для изученных детально систем молиб-
датов и ванадатов приведены в табл. Х.4. Вычисления для них
похожи на вычисления для систем хроматов, но несколько услож¬
нены из-за более высоких показателей степени в выражениях рав¬
новесия.В кислых растворах молибдатов умеренных концентраций пре¬
обладают три нолиядерные частицы, и равновесие можно рассмат¬
ривать с помощью тех же методов, что и для одноядерных ком¬
плексов, если считать лигандом Н+, а центральной группой
- М07О2®.Подобным образом в не очень кислых растворах ванадатов
умеренной концентрации преобладают полиядерные частицы; и в
Вопросы309этом случае можно использовать одноядерный подход, если счи¬
тать, что Н+ — лиганд, а УюОЕв — центральная группа. В щелочных
растворах ванадата преобладают различные типы полиядерных
комплексов. Вблизи pH = 7 равновесие устанавливается медленно
и измерения выполнять трудно.Изучение некоторых систем полиядерных кислот, например си¬
ликатов, осложнено трудностью достижения равновесия между
компонентами различной степени полимеризации. В общем случае
реакции отщепления и присоединения протона протекают быстро,
однако реакции полимеризации могут быть очень медленными.Одной из крайностей являются фосфаты. Превращение Н3РО4
в Н4Р2О7 возможно только при довольно высоких температурах;
следовательно, Н3РО4 можно принимать за полностью одноядер¬
ную систему, а Н4Р2О7 при комнатной температуре — как пол¬
ностью самостоятельную одноядерную систему. Другой крайний
случай — три системы, рассмотренные в этом разделе, в которых
равновесия между моноядерными и полиядерными частицами до¬
стигаются за доли секунды.Если равновесие реакции полимеризации достигается в течение
часа или даже более, то можно получить невоспроизводимые «рав¬
новесные» результаты, и для полного понимания системы тре¬
буется очень внимательное и детальное исследование.ВопросыИспользуйте по мере необходимости данные табл. X. 4.14. Найдите концентрации всех частиц в растворе, 1 л которого содержит
0,1 моль HNOa и 0,2 моль КгСг04.15. Рассчитайте растворимость AgaCrOi в 0,1 М растворе HNO3; р/С<тв>о =
= 11,95.16. Насколько концентрированным может быть раствор СгО|~-иона, в ко¬
тором с помощью буфера поддерживается pH = 7, прежде чем аналитическая
концентрация двухъядерных частиц превысит 5%?17. Определите концентрацию всех частиц в растворе, 1 л которого содер¬
жит 0,05 моль М0О3 и 0,10 моль HNO3.18. Какая наибольшая аналитическая концентрация молибдена будет до¬
стигнута в растворе молибдата, в котором с помощью буфера поддерживается
pH = 7,00, перед тем, как количество полиядерных частиц составит 5% от об¬
щего количества?19. Определите концентрации всех комплексов в растворе, 1 л которого
содержит 0,01 моль V2O5 и 0,05 моль HNO3.20. Постройте распределительную диаграмму для 0,1 М растворов молибдата
в интервале pH от 0 до 6, показывающую долю каждой из трех полиядерных
частиц. Рассчитайте концентрации моиоядерных частиц при pH = 5 и покажите,
что ими можно пренебречь.21. Постройте распределительную диаграмму для 0,1 М раствора ваиадата
в интервале изменения pH от 2 до 6, показывающую доли каждой из трех пол.и-
ядерных частиц. Рассчитайте концентрацию VO* при pH = 2 и покажите, что'
она пренебрежимо мала.
310X. 4. Многоядерные гидроксокомплексыХ.4. МНОГОЯДЕРНЫЕ ГИДРОКСОКОМПЛЕКСЫКак уже говорилось в разделе VIII.3, при обсуждении гидро¬
лиза ионов металлов, многие гидроксокомплексы последних яв¬
ляются многоядерными. Эти системы стали расшифровывать, а ча¬
стицы в них — идентифицировать только в последние 15 лет. Боль¬
шая часть ранних работ, посвященных гидролизу ионов металлов,
оказалась неверной либо из-за ошибочных предположений о су¬
ществовании одноядерных комплексов в условиях, в которых на
самом деле преобладают многоядерные комплексы, либо непра¬
вильного описания состава последних.Силлён и его сотрудники первыми выполнили точное потен¬
циометрическое изучение этих систем в среде с постоянной ионной
силой. Проведя исследования в широком интервале изменения pH
и концентраций ионов металлов, они смогли определить состав
главных комплексов и константы равновесия их образования.Т а б л и ц а Х.5Многоядерные гидроксокомплексы *Равновесияlg/CFe3++H20
FeOH2+
2Fe3++2HaO
Fe(OH)3(TB.)+3H+ЧнгоЖелезо (III)
t FeOH2++H+Fe(OH)++H+Fe2(OH);++2H+Fe3++3H20Be2++2H20 ;
2Be2++H20 .
"2++3H20Бериллий (II)± Be(OH)2(aq)+2H+
± Be2OH3++H+
3Bez++3H20 Z=± Ве3(ОН)з++ЗН+
Ве(ОН)2(тв.)+2Н+ 5=± Be2++2H20Олово (II)Г SnOH++H+=± Sn2(OH)2++2H+
r* Sn,(OH)2++4H+
Sn2++H20Sn2++HaO
2Sn2++2H20 ;
3Sn2++4H20 ;
SnO(TB.)+2H+Висмут (III)Bi3++HsO 7—* BiOH2*+H*
6Bi3++12H20 Bie(OH)“++12H+
V2Bi203(TB.)+3H+ ^=± Bi3++1‘/2H20—3,05—3,26-2,913,96-10,9-3,24—8,66>6,8-3,9-4,45-6,772,860,3311,6* Значения измерены в 3M растворе NaCl04 прн 25 °С [L. G. S 111 ё п. Quart Revs, 13.
146 (1959). См. так же: J. В j е г г u m a. oth.. Stability Constants, Parts I, II, Spec. Publ.,
tk 6, 7, U Chem. Soc., 19581.
Гидроксокомплексы железа311В табл. X. 5 приведены константы равновесия для 4 простых
систем, в которых были найдены многоядерные гидроксокомплек-
сы. В этих системах для полного их описания необходимо рас¬
сматривать лишь 2 или 3 типа частиц. Изучены и некоторые дру¬
гие системы, но они, как правило, более сложны.Для многоядерных комплексов среднее число п лигандов, свя¬
занных с атомом металла, и другие относящиеся к ним функции
зависят не только от концентрации лиганда, но и от концентрации
металла. Этот эффект дает прямой метод идентификации много¬
ядерных комплексов, если могут быть построены кривые образо¬
вания для ряда меняющихся в широком диапазоне аналитиче¬
ских концентраций. Поскольку в этих исследованиях требуется из¬
менение концентрации в широких пределах, существенно сохранить
постоянной ионную силу раствора, чтобы поддерживать постоян¬
ным коэффициент активности, а это позволит применять выраже¬
ния, описывающие равновесия через концентрации. Однако даже
при таком упрощении задача нахождения констант по серии кри¬
вых образования трудноразрешима, и графические методы обычно
должны дополняться расчетами на ЭВМ.Гидроксокомплексы железаГидролиз иона железа очень важен при изучении коррозии и
в аналитической химии железа, но только в 1953 г. было показано,
что в растворе существует двухъядерный комплекс Fe2(OH)2+.
Его структура, вероятно, включает в себя мостики гидроксилов,
соединяющих два иона железа:Н(H20)4Fe^ ^Fe(H20)401нКак следует из Примера Х.З, этот комплекс — самый важный
продукт гидролиза иона железа в растворах умеренных концент¬
раций.Пример X. 3. Определите концентрации всех частиц в растворе, 1 л кото¬
рого содержит 0,1 моль Fe(N03)2 и 0,01 моль HN03.Запишем уравнения условий:равновесия[FeOH2+] [Н+] = 8,9 • 10-4 [Fe3+] (1)[Fe(OH)+] [Н+]2 = 4,9 • ГО"7 [Fe3+] (2)fFe2(OH)24+] [Н+]2 = 1,23 • 10-3 [Fe3+f (3)[Fe3+] = 9,1 • 103 [Н+]3 [в присутствии Fe(OH)3 (tb.)J (4)
312Х.4. Многоядерные гидроксокомплексыматериального баланса по железу[Fe3+] + [FeOH2+] + [Fe(OH)*] + 2 [Fe2(OH)<+] = 0,1 (5)протонного (получается из условий материального баланса и электроней-
тральиости)[Н+] = [ОН“] + 0,01 + [FeOH2+] + 2 [Fe(OH)+] + 2 [Fe2(OH)24+] (6)Поскольку раствор должен быть кислым, постольку в выражении (6) можио
пренебречь величиной [ОН ].Самое простое допущение состоит в том, что в выражении (5) преобладает
[Fe3+]:[Fe3+] = 0,1 (5а)С помощью этого значения из уравнений (1) — (3) могут быть иайдеиы за¬
висимости концентраций других частиц от [Н+]. Подстановка этих зависимостей
в уравнение (6) дает уравнениеГтт+1 nm , 8,9-Ю-5 9,8-ИГ7 2,46- 10"5являющееся кубическим относительно [Н+]:[Н+]3- 1,0- 10-2[Н+]2-8,9. 10-5 [Н+] — 2,55 • 10“5 = 0Следующие пренебрежения дают:
третьим и четвертым членами — [Н+] = 1,0- 10-2
вторым и четвертым членами — [Н+] = 0,94 • 10-2
вторым и третьим членами —[Н+] = 2,94- 10-2.Таким образом, все члены — величины одного порядка, и ни одним из них
нельзя пренебречь. Однако теперь найдено, что [Н+] — величина порядка 10~2;
метод Ньютона дает истинное значение:[Н+] = 3,43 • 10-2Коль скоро величина [Н+] становится известной, можно вычислять и концен¬
трации остальных компонентов:[Fe(OH)2+] = 2,60 • 10—3 [из уравнения (1)][Fe(OFf)2] = 4,16 • 10-5 [из уравнения (2)][Fea (ОН),4-] = 1,05-10-2 [из уравнения (3)]Обратите внимание, что двухъядерный гидроксокомплекс составляет 10% кон¬
центрации свободного иона железа и, следовательно, им нельзя пренебречь. Для
получения правильного ответа необходимо дальнейшее уточнение.Если требуется более точное решение, нужно вычислить исправленное зна¬
чение [Fe3+] из уравнения (5); это дает:[Fe3+] =7,64 • 10“2.Используя эту величину, следует еще раз рассчитать [Н+] и другие концен¬
трации. Одна итерация дает значения с точностью до 5%.
Контурные диаграммы313Более интересный метод состоит в том, чтобы написать два уравнения, свя¬
зывающие [Fe3+] н [Н+], пренебрегая [ОН-] и [FefOH)^], которые, как мы виднм,
малы, и решить эти уравнения совместно. Подставляя уравнения (1), (3) в (5)
и (6), находим:-4 [Fe3+] „,е ,„-з [Ре3*]2[Fe3+] = 0,10 — 8,9 • 10~4 2-46*Ю Ю[Н+] = 0,010 + 8,9 • 10“4 + 2,46 • ID"3 -^рг WДеление уравнения (7) на (8) приводит к выражению, содержащему только
отношение R = [Fe3+]/[H+J:R3 + 1,36/?2 + 4.43Я - 40,7 = 0Последнее можно решить относительно R. Используя ориентировочное ре¬
шение, полученное выше, можно получить приближенное начальное значение
R = 3; и, применяя затем метод Ньютона, нетрудно отыскать точное значение
корня:R = = 2,68 (9)[Н+]Теперь легко вычислить все остальные концентрации:[Н+] = 3,0* 10—2 [из уравнения (8)][Fe3+] = 8,0 • Ю-2 [из уравнения (9)][FeOHz+] = 2,4-10_3 [нз уравнения (1)][Fe(OH)j] = 4,4• 10~5 [нз уравнения (2)][Fe2 (ОН)2+] = 8,85-10-3 [из уравнения (3)]Отметим, что уравнения (5) и (6) удовлетворяются с точностью до 1%.
Кроме того, Fe(OH)3 (тв.) не выпадает в осадок. Последнее возможно — соглас¬
но уравнению (4) — если выполняется условие:[Fe3+]>9,1-103[H+]3Но из проведенных выше расчетов следует, что[Fe3+] = 2,96. 103 [Н+]3а эта величина слишком мала для образования осадка.Возможность приведенного выше решения уравнений (7) и (8) зависит от
специфической формы уравнений. Если бы величина [Fe(OH)*] не была пре¬
небрежимо малой, то комбинированное уравнение не было бы функцией толь¬
ко R. Стоит поискать упрощающие вычисления способы, подобные этому, однако
они не всегда возможны.Контурные диаграммыОбщее решение задачи гидролиза иона железа легче всего
можно получить итерационным методом. Обозначая константы
равновесия символом pmn, запишем следующие условия равновесия
314Х.4. Многолдерные гидроксокомплексырн-lg СРис. X. 8. Контурная диаграмма для раз¬
личных частиц в растворах гидролизован¬
ных ионов железа.Каждая изолиния дает pH и аналитическую кон¬
центрацию железа, при которых доля (в %) железа,
присутствующего в виде определенного комплекса,
имеет данное значение,а ненасыщенных растворах:
[FeOH2+][H+] = p„[Fe3+] (1)
[Fe(OH)+][H+]2=p12[Fe3+] (2)
[Fe2 (OH)f ] [H+]2 = p22 [Fe3+f (3)Условие материального
баланса имеет видс = [Fe3+] + [FeOH2+] ++ [Fe(OH)+] + 2[Fe2(OH)42+] (5)где С — аналитическая кон¬
центрация иона железа.Подставляя выражения
(1)—(3) в уравнение (5),
получаем:1Р'И1-с(, + #1 + 1ЙТ+' +2p”W) * (10)Придавая определенные
значения величинам [Н+] и
С, решим квадратное урав¬
нение относительно [Fe3+]
для каждой точки. Это мож¬
но было бы сделать по квад¬
ратичной формуле, но по¬
скольку обычно известно
приближенное значение ве¬
личины [Fe3+], то легче ис¬
пользовать его для оценки
последнего члена. Тогда но¬
вое значение величины [Fe3+],
полученное из уравнения
(10), можно подставить еще
раз — для получения лучше¬
го приближения. Такое вы¬
числение легко поддается
программированию ’для ре¬
шения на ЭВМ.На рис. X. 8 приведены
результаты подобных расче-
Кбнтдрные диаграммы315тов; они представлены в виде контурных диаграмм, на которых
кривые постоянного содержания (в %) железа в определенных
частицах изображены как функции pH и lgC.На рис. X. 8, а изображены изолинии постоянной доли общего
количества иона железа, присутствующего в виде свободного иона
Fe3+. В очень кислых растворах pH = 0 и гидроксокомплексов
почти не образуется, а 99% железа присутствует в виде свободного
иона Fe3+. При фиксированном значении pH доля железа, присут¬
ствующего в виде Fe3+, уменьшается при увеличении аналитиче¬
ской концентрации железа из-за образования двухъядерного ком¬
плекса. Если бы образовывались только одноядерные комплексы,
тогда изменение аналитической концентрации железа не оказало
бы никакого влияния на долю железа, присутствующего в виде
свободного иона Fe3+.Рис. X. 8,б показывает доли железа, присутствующего в виде
одноядерных комплексов FeOH2+ и Fe(OH)2 (—). При высоких кон¬
центрациях доли их несущественны; однако она становится значи¬
тельной при низких концентрациях железа и высоких значениях
pH. Напротив, доля двухъядерного комплекса РегСОН)^ значив
тельна при высоких концентрациях (рис. X.8,в).При вычислениях следует учитывать, что в некоторых опреде¬
ленных условиях в осадок выпадает Fe(OH)3, это, согласно усло¬
вию равновесия растворимости (4), происходит при:[Fe3+] = К(тв) [Н+]3 (4)Подставляя последнее в уравнение (10), получим соотношение
между [Н+] и СС = К(ТВ)[Н+] (2*(тв)р22 [Н+]3 + [Н+]2 + р„ [Н+] + р„) (II)которое является уравнением границы осаждения, изображенной
на диаграмме изолинии рис. X. 8.Выше этой границы Fe(OH)3 выпадает в осадок, уравнение
(10) более не удовлетворяется, а вместо этого величины [Fe3+] и
[Н+] становятся связанными соотношением (4). В присутствии
осадка аналитическая концентрация С не входит в расчеты, и вы¬
ражение (4) можно объединить непосредственно с уравнениями
(1) — (3), для того чтобы получить выражения зависимостей кон¬
центраций различных комплексов только от pH:[FeOH2+] = f5ntf(TB)[H+]2 (12)[Fe(OH)+] = p,2K(TB)[H+] (13)[Fe2(OH)24+] = P22/C2TB)[H+]4 (14)
316Х.4. Многоядерные гидроксокомплексы6pHРис. X. 9. Распределительные диаграммы,
характеризующие долю железа, присут¬
ствующего в виде определенных частиц,
в зависимости от pH для трех значений
аналитической концентрации.Кривые распределения имеют излом при том зна¬
чении pH, прн котором Fe(OH)3 выпадает в осадок
(см. рис. VIII. 10).А — начало границы осаждения.Рас п редел ител ь н ые
диаграммыНа рис. X. 9 показан иной
способ графического пред¬
ставления равновесных кон¬
центраций, где приведен ряд
диаграмм распределения для
трех различных аналитиче¬
ских концентраций иона же¬
леза. Для ненасыщенных
растворов (низкое pH) кри¬
вые получены по уравнени¬
ям (1)—(3) и (10) или взя¬
ты из диаграмм изолиний
на рис. X. 8. Для насыщен¬
ных растворов (высокое
pH) кривые вычислены по
уравнениям (4), (12) — (14).
Хотя вычисления для мно¬
гоядерных комплексов в не¬
насыщенных растворах су¬
щественно труднее, чем для
одноядерных, приводимые
диаграммы являются удоб¬
ными.Отметим, что при всех
концентрациях ионы Fe3+ яв¬
ляются преобладающими.
При концентрациях 10 ~4М
заметна доля одноядер¬
ных гидроксокомплексовFeOH2+ и Fe(OH)2, а приконцентрации 1 М — только
двухъядерного комплексаFe2(OH)|+.Осаждение Fe(OH)3 при¬
водит к излому на кривых
распределения. При изме¬
нении pH менее чем на 1,
от значения, соответствую¬
щего этой точке, в осадок
выпадает 99% железа.
Другие системы317Кривые образованияКривые образования, изображенные на рис. X. 10, тесно свя¬
заны с распределительными диаграммами. Среднее число гидро¬
ксильных групп, связанных с ионом
железа, определяется формулой:[FeOH2+] + 2[Fe(OH)+] + [Fe2(OH)f]
й_ g Если использовать уравнения(1), (2), (3) и (5), это выражение
примет вид:- Рм [Н+] + 2р1г + р22 [Fe3+][Н+]2 + Р„ [Н+] + Р,2 + 2р22 [Fe3+]Отметим, что в растворах, бо¬
лее разбавленных, чем 10~4М, где
величина [Fe2(OH)^+] пренебрежимо
мала, п является функцией только
[Н+], и, следовательно, не изме¬
няется при изменении аналитиче¬
ской концентрации железа. Эта пре¬
дельная кривая известна под на¬
званием «одноядерного барьера» (mononuclear wall). Для более
высоких концентраций при увеличении аналитической концентра¬
ции железа кривая образования смещается в сторону более низ¬
ких значений pH. Кривые на рис. X. 10 не закончены — они обо¬
рваны в точке, где начинается осаждение Fe(OH)3.Другие системыРасчеты для других многоядерных систем могут быть выпол¬
нены теми же способами; однако, как правило, они утомительны.
Если для какой-либо системы необходимы многочисленные вычис¬
ления, то, вероятно, самый легкий способ — построить серию диа¬
грамм, подобных приведенным на рис. X. 8 и X. 9 с применением
ЭВМ. В случае немногочисленных расчетов можно поступать так,
как было сделано в Примере X. 3, используя метод Ньютона.ВопросыПо мере необходимости используйте коистанты, приведенные в табл. X. 5.22. Определите значение pH, при котором из 0,5 М растворов нитрата же¬
леза начинает осаждаться Fe(OH)3.23. Рассчитайте концентрации всех частиц в растворе, 1 л которого содержит0,5 моль Fe(NOa)s и 0,5 моль HNOj.прнРис. X. 10. Кривые образования
для гидроксокомплексов железа.Для концентраций менее 10-4 М все кри-
вые совпадают и дают «одноядерный
барьер* А. Зависимость формы и поло¬
жения кривой образования от аналити¬
ческой концентрации нона металла ха¬
рактерна для тех систем, в которых су¬
щественную роль играют многоядериые
комплексы.
•318Х.5. Хелаты24. Постройте распределительную диаграмму и крнную образования длн
растворов, содержащих 10~8 моль!л' железа. Сравнимы лн они с кривыми для
С = 10~4, приведенными в этой главе (см. рис. X. 9 и X. 10).25. Рассчитайте концентрации всех частиц в растворе с pH = 5, содержа¬
щем 10_3 моль!л Be(NOs)a.26. Рассчитайте концентрации всех частиц в растворе с pH = 2,5, содержа¬
щем Ю~2 моль!л Sn(NOs)2.27. При каком значении pH выпадает в осадок SnO из раствора, содержа¬
щего 10~! моль!л Sn(NOsb?28. Рассчитайте концентрации всех частиц в растворе с pH — 1,5, содержа¬
щем 10~3 моль!л Bi(NOs)s.29. При каком значении pH из раствора, содержащего 10_3 моль/л Bi (ГчГОз)з,
выпадет в осадок Bi2Oj?В состав полиаминов и аминокислот входят функциональные
группы, являющиеся хорошими донорами электронов; они могут
образовать координационные связи с ионами металлов, давая тем
самым комплексы. Комплекс, образованный присоединением не¬
скольких групп одного и того же лиганда к одному и тому же
атому металла, получил название хелата *. Хелаты обычно го¬
раздо стабильнее комплексов, образованных из отдельных ли¬
гандов. Например, гексамин никеля(II) менее стабилен, чем три-
этилендиамин никеля (II):Частично это различие в стабильности объясняется просто кон¬
центрационным эффектом, обусловленным тем обстоятельством,
что, когда одна «клешнях- бидентатного лиганда присоединяется
к иону металла, другая «клешня» находится рядом, и, следова¬
тельно, вероятность образования его координационной связи уве¬
личивается. Однако, несмотря на концентрационный эффект, по¬
вышенная устойчивость хелатных комплексов обусловлена образо¬
ванием пятичленных хелатных колец.* Термин «хелат» происходит от греческого слова, означающего «клешня
краба». Хелатные агенты называются бндентатнымн («дважды-цапнутый»), если
они могут занять два координационных места у металла, трехдентатнымн, если
три и т. д.X. 5. ХЕЛАТЫNH-
Комплексы ЭДТА319Комплексы ЭДТАНаиболее важными практически применяемыми хелатообра-
зующими агентами являются те, которые полностью соответствуют
условиям координации, присущим данному иону металла, и обра¬
зуют с последним комплекс в отношении 1:1. Возможно, наиболее
широко исследованным и используемым соединением из всех хелато-
образующих агентов является этилендиамин [(N.N.N'.N'J-TeTpa-
уксусная кислота], сокращенно называемая ЭДТА *:НООС—СН2ч /СН2—СООН)n—СН2—СН2—НООС—СН/ \сн2—СООНЭДТА является четырехосновной кислотой; предельная основ¬
ная форма ее может образовывать связи, в которых принимают
участие четыре атома кислорода и два азота. При этом возникают
шесть координационных связей с ионом металла и образуются ста¬
бильные пятичленные хелатные кольца:Большинство ионов металлов с максимальным координацион¬
ным числом 6 образуют с ЭДТА очень стабильные комплексы.
В табл. X. 6 приведены константы равновесия образования* Используют следующие торговые названия двуиатриевой соли ЭДТА —
калсол, хелатои, комплексон III, имииол Д, иерванаид, нуллапон, секвестрин,
идранол III, титравер, трилон Б, версен.
320X 5. Хелатыкомплексов ЭДТА (1:1) с некоторыми ионами металлов (всего же
исследовано 45 систем). Рассматриваемые комплексы настолько
стабильны, что при соответствующих условиях избыток ЭДТА, по
существу, удаляет из раствора все «свободные» ионы металла. Та¬
кие реакции лежат в основе комплексометрических титрований
(см. раздел X. 6).Т а б л и ц а Х.6Комплексы ЭДТА с ионами металлов*Ион*MeYte^MeHY■й ^MeOHYPMe(OH)2Y.Ва2+7,764,57Са2+10,703,07Cd2+16,59Со2+16,21Fe2+14,332,79- Fe3+25,11,3621,4944,90Hg2+21,803,0623,11Mg2+8,693,85Mn2+13,58Ni2+18,56Pb2+18,3Sr2+8,633,93Zn2+16,26* Константы равновесия:[MeY|=KMeY lMel IY][МеНУ]=ЯМену lMeY] [H+J
[MeOHY|=KMeOHY lMeYl ЮН-]
rMe(OH)2YJ-PMe(OH)2Y (MeYlЗначения получены измерением в 0.1 М растворе КС1 при 20 °С (для Hg2+ измерения
проведены в 0.1 М растворе KNO3 при 20 °С).Для кислотной диссоциации ЭДТА [Hn Y] =■ Pn(Y] [Н+]: lg Pi = 10,26; lg Зг—16,.42; lg Рз —
■=19,09; lg04«=21,O8.Различные хелатообразующие агенты, дающие комплексы раз¬
личной стабильности, можно применять как буферные вещества
для иона металла (металлобуферы), поддерживающие концентра¬
цию свободного иона в растворе около некоторого наперед задан¬
ного небольшого значения. Последние можно несколько изменять,
меняя pH раствора; это позволяет точно подобрать концентрацию
свободных ионов металла такой, какая необходима для предот¬
вращения осаждения одного из металлов, не мешая осаждению
другого. Например, количественный анализ титана в присутствии
железа затруднен. ЭДТА связывает железо в комплекс значи¬
тельно сильнее, и титан может быть осажден из раствора, содер¬
жащего ЭДТА, в виде Ti(OH)4 без образования осадка Fe(OH)3.
Многоядерй-ые зселйтЫ§21Нерастворимые хелатыХелатообразующие агенты часто дают с металлами нераство¬
римые нейтральные комплексы и, таким образом, являются хоро¬
шими осадителями. Так, широко известно осаждение никеля ди-
метилглиоксимом:.НчО ХочСН3—C=N.)N=C—CH,NiСН3—C=N' ' N=C—СН3О\н-'-Из-за наличия прочных внутримолекулярных водородных свя¬
зей между частицами диметилглиоксима образуется исключитель¬
но только комплекс с отношением 1 :2. Другим важным осадите-
лем является 8-гидроксихинолин, иногда называемый «оксин», об¬
разующий нерастворимые хелаты Me (Ох) 2 и Ме(Ох)з с 30
различными ионами металлов; комплекс Me (Ох) 2 имеет струк¬
туру:Равновесие растворимости этих комплексов изучено недоста¬
точно. Даже если нейтральные комплексы частично растворимы в
воде, они обычно значительно более растворимы в неполярных
растворителях, таких, как бензол или эфир и их можно экстраги¬
ровать из водных растворов. Хелаты часто сильно окрашены; это
используют во многих спектрофотометрических аналитических ме¬
тодиках.Многоядерные хелатыБольшинство хелатов является одноядерными и обнаружение
в качестве преобладающей частицы многоядерного хелата необыч¬
но. Примером многоядерного хелатного кольца является комплекс11 Зак. 345
322Х.5. Хелатыэтилендиамина с серебром:/NH2—Ag—NH2N^СН2 + СН2I Iсн2 сн2\nH2—Ag— NH2/Из-за того, что серебро имеет только две координационные ва¬
лентности, расположенные под углом 180°, молекула его хелатного
комплекса с одной молекулой этилендиамина является очень на¬
пряженной, а это приводит к нестабильности комплекса. При объ¬
единении же двух молекул этилендиамина с двумя ионами се¬
ребра, как показано выше, деформация в комплексе исчезает.Влияние кислотности на хелатообразованиеОсновной фактор, воздействующий на хелатообразование —
кислотность растворов. Хелатообразующими агентами являются
многоосновные кислоты и обычно только нацело продиссоцииро-
вавшая частица кислоты образует комплексы с ионом металла,
а это означает, что хелатные комплексы наиболее стабильны в
щелочных растворах. Иногда образуются частично присоединив¬
шие протон комплексы в виде MeHY или гидролизованные ком¬
плексы в форме MeOHY, но они обычно менее стабильны, чем про¬
стые хелатные MeY комплексы 1:1.В сильнощелочных растворах большинство металлов осаж¬
дается в виде гидроокисей; поэтому буферную среду подбирают
так, чтобы она действовала как дополнительный комплексообра¬
зующий агент, предотвращающий выпадение гидроокиси в осадок.
Обычно применяют аммиачные, фосфатные и цитратные буферные
растворы. Это приводит к появлению дополнительных равновесий
и к необходимости учета их при расчетах.Частицы, принимающие участие в равновесии хелатных ком¬
плексов, могут, поэтому, включать не только комплекс — ион ме¬
талла и лиганд — но и все недиссоциированные кислотные формы
лигандов, кислые или гидролизованные гидроксокомплексы ионов
металлов и аммиачные комплексы (или комплексы с другими бу¬
ферными веществами). Задачу обычно облегчает то, что в присут¬
ствии хелатообразующего агента концентрация свободного иона
металла очень низка и, следовательно, концентрации любых мно¬
гоядерных частиц будут пренебрежимо малы.Условные константы устойчивостиЕсли система содержит только одноядерные комплексы, расчет
равновесий может быть формально упрощен введением условной
константы стабильности. Допустим, что в растворе существуют
Условные константы устойчивости323три типа частиц, из которых первый — это все частицы, содержа¬
щие ион металла, но не содержащие лиганда; сумма их концент¬
раций такова:[Me]' = [Me] + [MeNH3] + [Me(NH3)2] + ... + [MeOH] + [Me(OH)2] + ...(для простоты заряды частиц опущены).Второй тип частиц включает только те, которые содержат ли¬
ганд; сумма их концентраций:[Y'] = [Y] + [HY] + [H2Y]+ ...К третьему типу частиц относятся комплексы 1:1; их сумма:
[MeY]' = [MeY] + [MeHY] + ... + [MeOHY] + ...Если существенны концентрации других комплексов с иным от¬
ношением металла к комплексообразователю (этого обычно не бы¬
вает в случае ЭДТА), то эффективные концентрации [MeY2]' и
[MeYJ' могут быть определены аналогично.При учете соответствующих выражений условий равновесия
концентрации интересующих нас частиц могут быть вынесены за
скобки:[Ме]' = ЛМе [Me][Y]' = [Y][MeY]' = ^MeY [MeY]Коэффициенты* определяются выражениями^Me=1 + P<1NH3>[NH3] + P2NH3)[NH3]2+ ••• + Р(10Н) [ОН-] + •••Лу = 1 + РУ [Н+] + р(2У) [Н+]2 + ...АчеУ= 1 + ^МеНу[Н+] + ••• + ^MeOHY (0Н 1+ •••где p^NHs> — общие константы образования для аммиачных ком¬
плексов металла;Рп°Ш — общие константы образования для. одноядерных ком¬
плексов гидроокиси металла;* Дж. Шварценбах, который ввел этот прием, использовал символ ан
для Лу и рА для Аш. А. Рингбом, иапнсавший несколько важных статей по
комплексометрическому анализу, использовал символы aL {Н) для Лу и
aMe(NH3) + aMe(OH) Для ^Ме. Мы произвольно изменили обозначения, во избе¬
жание неудобств, вызванных тем, что индекс ап был использован для обозна¬
чения доли, присутствующей в виде данного комплекса, и рп для обозначения
общей константы образования этого комплекса.11*
324X. 5. ХелатыP«Y) — °бщие константы образования для протонных комплек¬
сов комплексообразователя;/Смену — константа образования MeHY из MeY и Н+; ./Смеону — константа образования MeOHY из MeY и ОН-.Коэффициенты Аме, Ау и АмеУ полезны только в том случае,
если они не зависят от аналитических концентраций Me и Y, т. е.
если [Me] очень мала (например, в конечной точке комплексомет¬
рического титрования или в присутствии нерастворимого хелата).
При этом [NH3] будет намного больше, чем концентрации комплек¬
сов аммиака с Me, так что [NH3] и, следовательно, все три коэф¬
фициента будут зависеть только от фиксированной аналитической
концентрации буферного вещества и pH.Выражение для концентрационной константы равновесия обра¬
зования комплекса MeY имеет вид[MeY] = К [Me] [Y]но для практических вычислений, особенно при титрованиях, более
полезно выражение для условной константы равновесия:[MeY]' = К’ [Me]' [Y]'Условная константа К' связана с концентрационной констан¬
той К через определенные выше коэффициенты:Она не зависит от аналитических концентраций Me и Y, но за¬
висит от pH и концентрации присутствующего буферного веще¬
ства. Для данной системы величину К' можно вычислить из изве¬
стных зависимостей констант равновесия от pH и использовать
график зависимости К' = f(pH) для определения оптимальных
условий титрования, осаждения или экстракции.Если образуется несколько комплексов MeY, MeY2 и МеУз,
условные константы устойчивости (3,, $'2 и (З3 можно определить
аналогичным образом.Условные константы устойчивости применяют не только в слу¬
чае хелатов. Так, многие решенные ранее задачи, которые вклю¬
чали большое число равновесий, можно формально упростить вве¬
дением соответствующим образом определенных условных кон¬
стант устойчивости.Пример Х.4. Определите условные константы образования для ком¬
плекса Mg2+ с ЭДТА в зависимости от pH в присутствии от 0,1 М буферного
раствора NH3—NH*. Условия равновесия, приведенные в табл. VIII. 3, VIII. 4
Условные константы устойчивости325и X. 6, таковы:[HY3-=1,8210'° [Y-4] [H+](1)[h2y2~=2,62• ioie [y-4] [h+]2(2)[H3Y“=1,23• io19[y-4][h+]3(3)[H4Y=1,20• 1021 [Y-4] [h+]4(4)[MgY2-=4,89T+jsGO0(5)[MgHY~=7,07•103[MgY2-][H+](6)[H+] [MgOH+=3,8010~12 [Mg2+](7)[MgNHf=1,70[Mg2+] [NH3](8)[Mg(NH3)2+-1,20[Mg2+] [NH3]2O)[Mg(NH3)f;=0,457 [Mg2+] [NH3]3(10)[Mg(NH3)f=0,09[Mg2+] [NH3]4(П)[Mg(NH3)f=0,010 [Mg2+] [NH3]5(12)[Mg(NH3)=+=5,0-10-4 [Mg2+] [NH3]6(13)[NHt=1,78•109[H+][NH3)(14)Поскольку концентрация свободного иона металла в присутствии комплексо-
образователя очень мала, постольку естественно предположить, что пренебрежи¬
мо малое количество ЫНз связано в ком¬
плексы с Mg. Это позволяет записать сле¬
дующее уравнение условия материального
баланса для NH3:[NH3] + [NH+] = 0,lОбъединяя это выражение с уравне
нием (14), получим обычную функцию рас¬
пределения для одноосновной кислоты0,1[NH3+ 1,78- 109 [Н+](15)pHРис. X. 11.Буферная емкость
аммиачных буферных растворов
(кривая 1) и воды (2).приведенную на рис. V. 7.Буферная емкость аммиачного буфера
(рис. X. 11) существенна лишь в интер¬
вале pH, близких к рКа для NHj, т. е. в интервале pH = 8— И, так что мы
ограничимся вычислениями в этом интервале.Множитель, дающий кажущуюся концентрацию иона металла,-получается из
условий равновесия (7)—(13) и из выражения для ЛмеЛМе=1 + 1.70 [NH3]+ 1,20 [NH3]2 + ... +3,80-10'[Н+](16)в котором [NH3] зависит от [Н+] в соответствии с уравнением (15). Так как
[NHs] не может превосходить аналитическую концентрацию аммиака, т. е. 0,1,
326X. 5. Хелатычлены, учитывающие аммиачные комплексы Mg, более высокого порядка, меньше
10"*, и следовательно, в выражении (16) оии пренебрежимо малы. На рис. X. 12, аpHрнРис. X. 12. Множители ЛМе (а) и Лу (б), характеризующие кажущиеся кон¬
центрации Mg2+-HOHOB и ЭДТА, в зависимости от pH.Кривые / и 2 относятся к 0,1 М аммиачному буферному раствору н раствору, не содержащему
буферного вещества (раствор NaOH).приведена зависимость А ме от pH. Кривая 2, полученная при допущении, что
[NHj] = 0 в уравнении (16), показывает, что при высоких значениях pH вели¬
чина А ме в основном определяется обра¬
зованием гидроксокомплексов Mg.Множитель, определяющий кажу¬
щуюся концентрацию комплексообразо-
вателя, получается из условий равнове¬
сия (1) — (4) и определения Л у:Ar= 1 + 1,82- Ю10[Н+] ++ 2,62- 101в[Н+]2+ ... (17)Другие члены в интервале pH от 8
до 11 меньше 10_б. Эта зависимость изо¬
бражена на рис. X. 12,6.Множитель, определяющий кажу¬
щуюся концентрацию комплекса MeY,
получается из условия равновесия (6) н
из определения А меу:РНРис. X. 13. Услонная константа обра¬
зования комплекса Mg — ЭДТА в за¬
висимости от pH.Кривые / и 2 относятся к 0,1 М аммиачному
буферному раствору н к раствору, не содер¬
жащему буферного вещества (растворы
NaOH).К — линия константы образования.1MeY '1 +7,07- 103[Н+] (18)Этот множитель равен 1000 в интер¬
вале изменения pH от 8 до 11.
образования MeY получается сочетаниемУсловная константа равновесия
выражений (5), (16)—(18):,*' = 4,89.10»(ЛМеУ/ЛМеЛу) (19)Как следует из рис. X. 13, буферный раствор аммиака (кривая 1) оказывает
сравнительно небольшое влияние на К', так как комплексы Mg2+ с NH3 мало
устойчивы по сравнению с комплексами Mg2* с, ЭДТА и с ОН*. При низких зна¬
чениях pH К' возрастает с увеличением pH, н основном из-за роста доли ЭДТА,
Буферные ho иону меЫлла растворы327участвующей в комплексообразовании. Прв pH = 10,5 почти вся ЭДТА присут¬
ствует в нацело продиссоциировавшей форме. При pH = 11 К' начинает умень¬
шаться из-за того, что все большее количество Mg2+ переходит в гидроксоком-
плекс.Буферные по иону металла растворыПример Х.5. Раствор содержит 10~* моль Mg2+ и 2 - 10'2 моль ЭДТА; до¬
бавка 0,1 М раствора аммиака до pH *= 10,0 делает его буферным. Определите
концентрацию свободного иона Mg2+ при равновесии.Вычисление упрощается почти так же, как и в случае одноосновной кислоты,
если используют условные константы. Рис. X. 13 позволяет определить условную
константу устойчивости при pH = 10; она равна:[MeY]' = 1,45 • 10» [Me]' [Y]' (20)Условии материального баланса имеют вид:[Y]' + [MeY]' = 2,0 • 10-2 (21)[Me]' -f [MeY]' = 1,0-10-2 (22)Добавление избытка ЭДТА делает величину [Me] столь малой, что ею мож¬
но пренебречь в уравнении (22):[MeY]' = 1,0- 10~2 (22а)Вычитая уравнение (22) нз уравнения (21) и пренебрегая [Me]', получим:[Y]' = 1,0* 10-2 (21а)Подстановка последнего в уравнение (20) дает:[Me]' = 6,9 • 10—9При pH = 10 величина Аме = 1,19 (см. рис. X. 12, п), таким образом[Mg2+]=J^L = 5,8. 10~9MeОстальные 10~* моль Mg связаны в комплексы.Итак, избыток ЭДТА явился причиной фиксации концентрации свободных
Mg2+-HOHOB. Если в раствор добавить больше Mg2+-HOHOB, то они свяжутся в
комплекс, и концентрация свободных ионов изменится незначительно. Эта ситуа¬
ция аналогична возникающей и случае кислотно-осиовиого буферного раствора;
поэтому растворы, содержащие избыток комплексообразователя, известны под
названием буферных по иону металла растворов.ВопросыКонстанты равновесия для ЭДТА и ее комплексов приведены в табл. X. 6,
а константы устойчивости одноядерных гидроксокомплексов и аммиачных ком¬
плексов в табл. VIII. 3 и VIII. 4.30. Условная константа устойчивости комплекса Mg2* с ЭДТА при pH = 9
в 0,1 М буферном растворе аммиака равиа 2,4 • 107. Определите долю Mg*+, при¬
сутствующего в виде комплекса с ЭДТА в растворе, полученном смешением
100 мл буферного раствора 0,01 М Mg2+ со 100 мл 0,01 М раствора ЭДТА.31. Условная коистаита устойчивости комплекса барня с ЭДТА при pH = 10
равиа 2 • 107. Определите растворимость сульфата бария (рК(тв)о = 10,00) в
3,01 М растворе ЭДТА, являющимся буферным при pH = 10.
328X. 5. Хелаты32. Алый комплекс никеля с диметилглиоксимом (№Аг) растворим в кисло¬
тах вследствие образования недиссоциированного диметилглиоксима НА. Учиты¬
вая равновесия: lg*НА (тв.) ^=± HA(aq)HA(aq) ^=± Н+ + А”NiA2 (тв.) f NiA2 (aq)Ni2+ + 2А~ NIA2 (aq)— 2,26
—10,67
— 6,00
17,83рассчитайте растворимость комплекса в небуферном растворе в зависимости от
pH. Насколько кислым может быть 0,1 М раствор никеля, чтобы из него можно
было осадить 99,9% никеля?33. Обычно комплекс никеля с диметилглиоксимом осаждают из .раствора
аммиака. Условное произведение растворимости определяется выражением<B = [Ni2+ПА']'2где[Ni2+]/ = [Ni2+] + [NiNH32+]+ ... +[NiOH+]+ ...,[А“]'=[А"] + [НА]Рассчитайте условное произведение растворимости в 0,1 М буферном рас¬
творе аммиака как функцию pH. При каком pH произведение растворимости
минимально.34. Рассчитайте условную константу устойчивости комплекса Mg2+ с эрио-
. хромом черным Т (H3L) (индикатором, используемым при комплексометрическихтитрованиях некоторых ионов металлов) в 0,1 М аммиачном буферном растворе
в интервале изменения pH от 8 до 11. Констаита устойчивости комплекса[MgL-] = 1,0* 107 [Mg2+] [L3-]Константы устойчивости для различных ступеней кислотной диссоциации
следующие:[HL2-] = 3,5- 10й [Н+] [L3i; [H2L~] = 7,0- 1017 [Н+]2 [L3~]35. Рассчитайте условную константу устойчивости комплекса Zn2+ с ЭДТА
в небуферных растворах в интервале pH от 4 до 12. При каком pH значение К'
максимально?36. Рассчитайте условную константу устойчивости для комплекса Zn2+ с
ЭДТА в 0,1 М аммиачно-аммонийном буферном растворе (NH3 — NH*) при
изменеинн pH от 4 до 12. При каком значении pH значение К' максимально?37. Ниже приведены уравнения равновесий образования комплексов этилен-
диамнна (En—NH2CH2CH2NH2) с ионом серебра:[AgEn+] =5,0- 104 [Ag+] [En][AgEtij] = 1,0- 103 [AgEn+] [En][AgHEn2+] = 224 [Ag+] [HEn+][Ag2En2+] = 57,5 [Ag*] [AgEn+][Ag2En2+]= 1,70- 1013 [Ag+]2 [En]2
[HEn+] = 1,07 • 1010 [H+] [En][H2En2+] = 1,66 • 107 [H+] [HEn+]
X. 6. Комплексометрические титрования329Рассчитайте концентрации всех частиц в растворе, 1 л которого содержит
ОД моль этилеидиамина и 6,01 моль серебра. Распределительная диаграмма для
этилендиамина приведена на рис. VIII. 9.Х.6. КОМПЛЕКСОМЕТРИЧЕСКИЕ ТИТРОВАНИЯИз-за высокой стабильности хелатных комплексов титрование
ионов металла комплексообразователями может быть очень точ¬
ным методом анализа. Вычисление теоретических кривых титро¬
вания с использованием условных констант устойчивости подобно
другим расчетам процессов титрования, обсужденным в предыду¬
щих главах.ЭДТА обычно применяют в виде двунатриевой соли ЫагНгУ,
при взаимодействии которой с ионом металла высвобождаются
ионы водорода:Ме2+ + H2Y2~ MeY2- + 2Н+Если титрование проводят в небуферном растворе, то кислот¬
ность последнего увеличивается при добавлении ЭДТА, что вызы¬
вает весьма сильное смещение равновесия вблизи конечной точки
влево, и, следовательно, приводит к плохо выраженной конечной
точке. Поэтому в точных комплексометрических титрованиях очень
существенную роль играет буферность раствора.Рассмотрим общие уравнения кривой комплексометрического
титрования. Выражение для условного равновесия имеет вид[MeY]' = К' [Me]' [Y]' (1)где величины со штрихом включают все комплексы, которые мо¬
гут быть в растворе (см. раздел X. 5). Если Vo мл раствора, со¬
держащего ионы металла концентрации С0, титруют V мл ком-
плексообразователя концентрации С, условия материального ба¬
ланса имеют вид:[Me]' + [MeY]' = (2)[Y]' + [MeY]' = vCJYo (3)Исключая [MeY]' из уравнений (2) и (3), получаем уравнение
кривой титрованияФ- 1=1-±^([У]'-[Ме]') (4)Ьоу огде Ф = CV/C0V0 — титровальная доля.До точки эквивалентности величиной [Y]' в уравнениях (3) и (4)
можно пренебречь; полученные приближенные выражения можно
объединить с уравнением (1):Ф = 1--^У^[Ме]'; Ф<1ь0к 0[5J
330Х.6. Комплексометрические титрованияПосле точки эквивалентности величина [Me]' в выражениях(2) и (4) становится пренебрежимо малой; полученные прибли¬
женные выражения можно объединить с (1):ф=о1 + К' [Me]' : Ф>1 (6)Вблизи точки эквивалентности объемный фактор можно упро¬
щенно записать следующим образом:У0 + У __ С + С0\Т П v 'В области, достаточно близкой к точке эквивалентности, [MeY]'
велика по сравнению и с [Me]', и с [Y]', т. е.VWt—ggc (8)Комбинируя уравнения (7) и (8) с уравнениями (1) и (4), по¬
лучаем уравнение для кривой титрования вблизи точки эквива¬
лентности; следовательно, ошибка титрования имеет вид:<9)где [Ме]к.т — общая концентрация всех комплексов Me за исклю¬
чением комплексов с Y в выбранной конечной точке титрования.В точке эквивалентности * [Me]' может быть получена, если
положить в уравнении (9) Фк. т = 1:[Me]' = VС0С//Г (С0 + С) (в точке эквивалентности) (10)Дифференцируя уравнение (9) и применяя уравнение (10), мо¬
жно получить выражение для индекса крутизны в точке эквива¬
лентности:Т) = = 0.217 у К'С.СНСо + С) (1!)Для индекса крутизны, большего 103, в случае, когда С0 =
*= С = 0,01, К' должно быть больше 5-109. Если же К' меньше 5-105,
индекс крутизны будет меньше 10, и титрование практически невоз¬
можно.* При обсуждении кислотно-осиовиых титрований мы употребляли штрих
для обозначения концентрации в точке эквивалентности, ио в этой главе мы
используем штрих, чтобы указать эффективную концентрацию, используемую
в выражении для условного равновесия. Здесь мы не используем никакого спе¬
циального символа для точки эквивалентности
Индикаторы для ионов металлов331Пример X.6 (рис. X. 14). Рассчитайте кривую титрования, когда 50 мл
10-2 М раствора Mg2+ в 0,1 М буферном растворе аммиака с pH = 10 титруют
10-2 М растиором ЭДТА. Из рис. X. 13
следует, что К' = 1,44 • 108. При этом значе¬
нии К' и Со = 0,01 уравнения (5), (6) и
(9) описываются кривой, приведенной на
рис. X. 14. Индекс крутизны в точке экви¬
валентности, согласно ураинению (11), ра¬
вен 180; это означает, что pMg должно
быть определено в пределах 0,18, чтобы
ошибка титрования была менее 0,1%.Индикаторы для ионов металловКонечную точку в комплексо¬
метрическом титровании можно оп¬
ределять множеством различных
способов. Однако самый простой иобщий — использование в качестве индикатора для ионов металлов
сильно окрашенного хелата, константа устойчивости которогоподходит для того, чтобы указать
желаемую конечную точку.
Эриохром черный Т
ОН онРис. X. 14. Кривая титрования
для Примера X. 6., N=N , ;-SOaHN02обычный индикатор, используемый
при титрованиях с ЭДТА. Этот кра¬
ситель образует с рядом ионов ме¬
таллов красный хелатный комплекс
(MeL-), который четко контрасти¬
рует с голубым цветом свободного
красителя (HL2-) в интервале из¬
менения pH от 6 до 12. Если кон¬
центрация индикатора мала по
сравнению с ЭДТА, его равновесие
полностью контролируется равнове¬
сием металлического иона с ЭДТА.
Самая малая ошибка титрования
появляется в том случае, когда 1//Cin для индикатора будет почти
равна [Ме]' в точке -эквивалентности. В этом случае в точке экви¬
валентности должны существовать равные количества свободного
индикатора и его комплекса.Пример X. 7. Эриохром черней Т используют в качестве индикатора при
титровании магния ЭДТА, рассчитанном в Примере X. 6. Определите ошибкуРис. X. 15. Условная константа об-
разоиания комплекса Mg — Эрио¬
хром черный Т (кривая 1) и зна¬
чения [Mg2+]' в точках эквииа-
лентности при титровании ио¬
на Mg2+ с аналитическими кон¬
центрациями С — 5,0"10_3 (кри-
иая 2) и С — 1,0- 10-2 (кривая 3)
10-2 М растиором ЭДТА.
Оптимальное значение pH для титрова¬
ния близко к точке, в которой кривые
пересекаются.
332Х.6. Комплексометрические титрованиятитрования, если за конечную принимается точка, в которой половина индика¬
тора превращена из HL2' в MgL~.График для условной константы устойчивости комплекса Mg с эриохромом
черным Т приведен на рис. X. 15. При pH = 10 выражение для условного равно¬
весия имеет вид:[MgL~]' = 2,3 • 105 [Mg2+]' т = 4,35 • 10-вВ конечной точке [MgL-]'= [L]' и [Mg2+]' т = 4,35 • 10-в. Из уравнения
(9) для С = 0,01; Со = 0,01; К' — 1,44 • 108 вычислено, что ошибка титрования
составляет:Фкт — 1 = 1,6 * 10“3 -8,7- 10-4 =7,3- 10-4что меньше, чем ошибка отсчета по бюретке.Если цвет индикатора не будет точно подогнан к цвету стандарта, то
[Ме2+]к т может отличаться в 10 раз для различных наблюдателей, что означает,
что наиболее вероятная ошибка титрования будет ~0,5—1%.Выбор оптимальных условий титрованияКонцентрация ионов металла, при которой индикатор изменяет
цвет, приблизительно обратно пропорциональна условной константе
устойчивости индикатора и ее можно изменять, меняя pH. Опти¬
мальное значение pH титрования — это обычно компромиссное
значение между наибольшей условной константой образования
комплекса металл — ЭДТА и подходящей условной константой
для индикатора.Способ выбора оптимальных условий титрования магния ЭДТА
с использованием эриохрома черного Т как индикатора показан
на рис. X. 15. В добавление к условной константе устойчивости
индикатора (кривая /) приведены и концентрации «свободного»
магния в точках эквивалентности (пунктирные кривые). В При¬
мере Х.6 величина С = 5,0-10~3 и значение [Mg2+]K.T описывается
кривой 2. Эта кривая пересекает сплошную кривую при pH = 9,8,
давая оптимальные условия для этого частного случая титрова¬
ния. В более концентрированных растворах (кривая 3) оптималь¬
ное pH ниже.Компромиссное условие определяют, проводя некоторую стан¬
дартную операцию. Допустим, что точная концентрация образца
неизвестна, но известно, что она находится в интервале между
5-10~3 и 10~2 моль/л; кроме того, раствор является буферным и
его pH = 10. В процессе титрования высвобождаются ионы водо¬
рода; т. е. к моменту достижения точки эквивалентности pH ока¬
жется в интервале 9—9,5, иными словами, будут достигнуты почти
оптимальные условия.Если pH падает слишком сильно, условная константа устойчи¬
вости для комплексов Mg с ЭДТА уменьшается, и кривая титро¬
вания (рис. X. 14) становится более плоской, что затрудняет опре¬
деление конечной точки. Это осложнение не возникает в системе,
буферность которой выбрана правильно.
Вопросы333Если исходное pH слишком велико, то магний может выпасть
в осадок в виде гидроокиси. При pH = 10 максимальная концентра¬
ция Mg, которая может существовать в 0,1 М буферном растворе
аммиака без выпадения Mg(OH)2 в осадок, — меньше 10~2 моль/л.
Гидроокись магния может выпасть в осадок во время подбора
pH. В этом случае достижение равновесия в течение титрования
может оказаться затрудненным из-за медленного растворения вы¬
падающего вначале осадка. Существенно, чтобы весь осадок был
вновь растворен до достижения конечной точки; в противном слу¬
чае будет получен ошибочный результат.Вопросы38. 50 мл 1,0 ■ 10-2 М буферного (pH = 8) раствора Mg2+ оттитровано
10"2 М раствором ЭДТА. Рассчитайте зависимость [Mg2+] от V и сравните с при¬
веденной на рис. X. 14. Какова ошибка титрования, если за конечную прини¬
мается точка, в которой 50% индикатора связано в комплекс с Mg? При pH =
= 8 К' для комплекса Mg с ЭДТА равна 4,4- 10е, a Kjn для комплекса Mg
с эриохромом черным Т равна 2,8 • 103.39. Какая максимальная концентрация Mg возможна в 0,1 М буферном
растворе аммиака при pH = 10 при условии, что Mg(OH)2 не выпадает в оса¬
док? При ирнной силе, соответствующей 0,1 М раствору, р/(<тв)о для Mg (ОН) 2
равно 10,15.40. Каково должно быть максимальное значение pH, при котором 1,0-10~2М
раствор Mg может быть оттитрован ЭДТА в 0,1 М буферном растворе аммиа¬
ка так, чтобы в точке эквивалентности не было твердой фазы Mg(0H)2? По¬
чему будет трудно получить точные результаты вблизи этой точки? Примите,
что условная константа для комплекса Mg с ЭДТА равна 2,0-10s и более или
менее независима от pH в интервале pH от 10,5 до 11,5.41. Постройте диаграмму области преобладания, показывающую, какие ча¬
стицы эриохрома черного Т преобладают при различных значениях pH и
—lg [Mg2+]T. 8. Покажите на диаграмме границу, отделяющую ту обл_асть, где
в точке эквивалентности присутствует осадок Mg(OH)2. Частицы H2L и MgL
красного цвета, HL2~ — голубого, L3'— оранжевого. В каком интервале изме¬
нения pH этот индикатор полезен для титрования Mg? Константы устойчивости
этих комплексов следующие:[MgL-] = 1,0- Ю7 [Mg2+] [L3-][HL2-] = 3,5 • 1011 [H+][L3i
[H2L“] = 7,0 • 1017 [H+]2 [L3“]42. Ион железа можно оттитровать ЭДТА, используя в качестве индикатора
тиоцианат. Можно считать, что конечная точка, в которой исчезает глубокий
красный цвет комплексов тиоцианата железа, появляется при [FeSCN2+] = 10~s.
Вычислите условную константу образования комплекса иона железа с ЭДТА в
интервале pH от 0 до 3. Определите оптимальное pH для титрования 1,0-10-2 М
раствора Fe3+ раствором ЭДТА такой же концентрации с помощью 10~2 М рас¬
твора тиоцианата в качестве индикатора. Константа образования для FeSCN2+
равна приблизительно 5 • 102. Константы гидролиза Fe3+ приведены в табл. X. 5.
Так как величина [Fe3+] в конечной точке мала, двухъядериым гидроксокомплек-
сом можно пренебречь.
Глава XIОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РАВНОВЕСИЯXI. 1. ОБЩИЕ ПОЛОЖЕНИЯКонцепция окисления-восстановления — фундаментальное пред¬
ставление описательной неорганической химии, но ее трудно вы-
разщъ количественно без привлечения произвольно введенных
ограничений. Окисление часто определяют как потерю электронов,
например при превращении металла в ион:Ag(TB.) Ag+ + е~В большинстве систем, однако, элемент, который окисляется,
не может быть определен так легко. При электролитическом окис¬
лении иона цианидаCN- + H20 CNO- + 2Н+ + 2е“кто может сказать, какой из атомов — углерод, азот, водород или
кислород — теряет два электрона?Степень окисленияОбычный способ решения указанного вопроса состоит в том,
что элёктроны, распределенные между двумя атомами, произ¬
вольно относят к более электроотрицательному из них, или делят
поровну, если оба атома, между которыми распределены элек¬
троны, одинаковы. Формальный заряд приходящийся на атом,
после проведения такого распределения, называют степенью окис¬
ления атома. И в этом плане окисление определяют как увеличе¬
ние степени окисления, а восстановление — как ее уменьшение.
Так, при окислении цианид-иона степень окисления углерода из¬
меняется от +2 до +4, азота — остается равным —3, кислорода
—2, водорода (-1.Согласно данному определению, диссоциация воды на ионы не
сопровождается ни окислением, ни восстановлениемН20 Н+ + ОН~поскольку степень окисления кислорода остается равной —2, а во¬
дорода— + 1. Однако в действительности разрыв ковалентной
Сравнение процессов окисления — восстановления и комплексообразования 335связи между водородом и кислородом увеличивает электронную
плотность на атоме кислорода и уменьшает ее на атоме водорода.
Если окисление строго определить как потерю электронов, то во¬
дород частично окисляется, а кислород — частично восстанавли¬
вается.Сравнение процессов окисления—восстановления
и комплексообразованияВведенное понятие степени окисления позволяет все химиче¬
ские реакции разделить на два класса: идущие с изменением и без
изменения ее. Кислотно-основные реакции и реакции образования
комплексных -ионов не приводят к изменению степени окисления,
хотя электронная плотность на различных атомах в процессе ре¬
акции, естественно, изменяется. Указанные реакции протекают в
растворе обычно очень быстро и за редким исключением (напри¬
мер, образование многоядерных соединений) равновесия дости¬
гаются за время, необходимое для смешения растворов.Хотя многие окислительно-восстановительные реакции проте¬
кают в растворах быстро, существует гораздо больше таких реак¬
ций, которые идут медленно или совсем не идут. Например, пер¬
хлорат-ион является очень сильным окислителем и если бы рав¬
новесие достигалось быстро, то он не мог бы сосуществовать в
растворах с такими ионами, как Fe2+, Сг2+ или Мп2+. Однако ре¬
акция идет настолько медленно, что растворы, содержащие ионы
Сг2* и СЮ*, стабильны в течение месяцев. Если бы окислительно¬
восстановительное равновесие в таких растворах достигалось, то
на 1 л раствора перхлората приходилось бы менее одного иона Сг2+.Перманганат калия можно использовать как окислитель в вод¬
ных растворах только из-за малой скорости его взаимодействия
с водой. Если бы равновесие достигалось быстро, то перманганат
окислил воду до кислорода, а сам восстановился до Мп02. Кон¬
станта равновесия реакции4МпО; + 4Н+ 4Мп02 (тв.) + 302 (г.) + 2Н20вычисленная с использованием величины стандартного электрод¬
ного потенциала (см. раздел 1.5), такова:[Н+]4[мп07]4== Ю-68-1^В растворе перманганата калия при давлении воздуха 1 атм
величина Ро2 ** 0,2 атм; [Н+] « 10“6 моль/л; следовательно, равно¬
весная концентрация иона перманганата [МпОГ] = 10~"'6, т. е.
чрезвычайно мала.
336XI.1. Общие положенияОднако 0,1 М растворы перманганата устойчивы в течение не¬
скольких дней и лишь затем начинают медленно разлагаться. Ка¬
тализатором разложения является Мп02, поэтому, если в рас¬
твор попадают органические вещества, даже в следовых концент¬
рациях, то взаимодействие их с МпОГ дает МпОг и скорость раз¬
ложения перманганата значительно возрастает. По этой причине
стандартные растворы перманганата для объемного анализа же¬
лательно готовить на очень чистой воде.Константы равновесия окислительно-восстановительных
реакцийКонстанты равновесия окислительно-восстановительных реак¬
ций могут быть найдены из величин стандартных электродных по¬
тенциалов (см. раздел 1.5). В некоторых случаях чрезвычайно
высокие или низкие значения разности электродных потенциалов
рассматриваемых двух полуреакций указывают на завершенность
реакции. В таких случаях изменение концентрации реагентов в
104 раза (что обычно бывает на практике) оказывает малое влия¬
ние на степень завершенности реакции.Таким образом, судить о возможности протекания реакции
можно по знаку разности потенциалов полуреакций: если она по¬
ложительна, то реакция идет. Вычисления равновесий, однако,
никогда не могут указать на скорость реакции, и в действитель¬
ности скорость может быть столь малой, что реакцией можно пре¬
небречь.Потенциалы большого числа неорганических и ряда органиче¬
ских систем можно найти в книгах Латимера и Кларка.Баланс электроновНезависимые условия равновесия, реакций комплексообразова¬
ния и кислотной диссоциации, материального баланса и электро-
нсйтральности не обеспечивают достаточного числа уравнений
связи для полного описания равновесия окисления-восстановле¬
ния, поэтому еще одно необходимое условие — учет числа поте¬
рянных и приобретенных электронов — условие баланса элек¬
тронов.В системе, где существенно лишь одно равновесие, уравнение
баланса электронов может быть найдено из стехиометрического
уравнения реакции. В более сложных системах, однако, исполь¬
зуют более общий подход, аналогичный составлению уравнений
условия материального баланса. Например, в растворе, насыщен¬
ном Мп02 при pH = 1, можно обнаружить: Мп2+, Мп3+, МпОГ>
МпО|~ и Мп07, которые соответствуют следующим степеням
Баланс электронов337окисления Мп: 2, 3, 5, 6 и 7. Более низкие степени окисления об¬
разуются за счет потери электронов при образовании частиц с бо¬
лее высокой степенью окисления:Мп02 + 4Н+ + 2е~ Мп2+ + 2Н20Мп02 + 4Н+ + е~ Мп3+ + 2Н20Мп02 + Н20 МпО~ + 2Н+ + е~МпОг + 2НгО МпО2- + 4Н+ + 2е~Мп02 + 2Н20 МпО“ + 4Н+ + Зе-При образовании ионов Мп2+ и Мп3+ высвобождаются два и
один электрон. При образовании МпОГ теряется один электрон,
а для МпО?~ — два электрона; для МпОГ — три электрона. Если
общее число высвобожденных электронов равно общему числу
потерянных, можно записать2 [Мп2+1 + [Мп3+] = [Мп07] + 2 [МпО2- ] + 3 [Мп04“]что и является условием баланса электронов.Пример XI. 1. Рассчитайте равновесные концентрации, получающиеся после
смешения равных объемов 0,01 М раствора Hg(N03b и Fe(N03)2. Поскольку
раствор является достаточно кислым, гидролиз отсутствует. Используя данные,
приведенные на стр. 30, для стандартных потенциалов (в в)Fe3+ + е~ Fe2+ Е° = 0,7712Hg2+ + 2е~ Hg2+ £■'’ = 0,920можно вычислить константу равновесия реакцииHg2+ + Fe2+ ^ 72Hg2+ + Fe3+как описано в разделе I. 5lg К = (16,9) (1) (0,920 - 0,771) = 2,52что приводит к следующему выражению для окислительно-восстаиовительиого
равновесия:[Fe3+] [Hgfp = 330 [Hg2+] [Fe2+] (1)Запишем уравнения условия материального баланса:[Fe2+] + [Fe3+] = 5,0 • 10_3 (2)[Hg2+] + 2 [Hg2+] = 5,0-10~3 (3)Условие электронейтральности не содержит никаких необходимых сведений,
поскольку включает в себя не имеющую отношения к задаче величину [Н+]. Итак,
существует 3 уравнения с четырьмя неизвестными. Четвертое уравнение полу¬
чается из уравнения условия баланса электронов:
338XI. I. Общие положенияПри образовании каждого нона Hg2+ высвобождаются два электрона, а
при образовании иона Fe3+ теряется один. Требование баланса электронов та¬
ково, что все электроны, потерянные одним ионом, должны быть приобретены
другим.Отметим, что уравнение (4) могло быть получено и нз стехиометрии реак¬
ции, для которой составляется баланс электронов.Поскольку четвертое условие найдено, задача решается легко. Подставляя
уравнение (4) в уравнение (3) и вычитая последнее из уравнения (2), полу¬
чаем:[Fe2+] = [Hg2+] = 5,0 • 10-3 - [Fe3+] (5)Подстановка уравнений (4) и (5) в (1) дает:[Fe3+]V! = 468 (5,0 • 10~3 — [Fe3+])2Последнее решается методом последовательных приближений:[Fe3+] = 4,23 • 10—3Из уравнений (4) и (5) находим:[Hgf] = 2,lbl0“3[Fe2+] = 7,7 • 10-4; [Hg2+] = 7,7 • 10-4 •Выражение (1) справедливо с точностью 0,5%.ВопросыДля вычисления искомых констант равновесия используйте следующие зна¬
чения электродных потенциалов:Полуреакция Е°, вFe3+ + е~ Fe2+ 0,771Hg2+ + 2e" 2Hg^.) 0,789.Ag+ + e~ < Ag (тв.) 0,799Hg2+ + e" 72Hg22+ 0,920Кроме того, поскольку растворы являются достаточно кислыми, гидролиз
любого нона отсутствует.1. Рассчитайте равновесные концентрации в растворе, образовавшемся после
смешения 100 мл 0,01 М раствора Hg2(N03)2 с 100 мл 0,01 М раствора
Fe(N03)3.2. 0,01 М раствор Hg(N03)2 приводят в контакт с жидкой ртутью. Най¬
дите концентрации ионов Hg2+ и Hg|+ в растворе при равновесии.3. Покажите, что в Примере XI. I жидкая ртуть не выделяется.4. Рассчитайте равновесные концентрации реагентов, образующихся в ре¬
зультате контакта жидкой ртути с 0,01 М раствором Fe(N03)3.5. Рассчитайте равновесные концентрации в растворе и число молей выде¬
ляющейся ртути в расчете на 1 л раствора, когда 10 мл 0,1 М раствора
Hg(N03/2 смешивают с 90 мл 0,1 А! раствора F6(N0j)a.6. 0,01 М раствор AgNOs находится в контакте с жидкой ртутью. Опреде¬
лите равновесные [Ag*], [Hg+] и [Hg2+] и число молей серебра, выпавшего
в осадок, в расчете на 1 л раствора.7. Потенциалы различных полуреакций для марганца приведены в табл. XI. 1
(стр. 343). Рассчитайте конпентрацни всех ионов в насыщенном растворе МпОа
при pH = 1.
Активность как функция потенциала339XI. 2. ГРАФИЧЕСКИЕ СПОСОБЫ ОПИСАНИЯКомбинирование полуреакцийРавновесия окислительно-восстановительных процессов обыч¬
но описывают с помощью стандартных электродных потенциалов.
Например, окисление железа можно представить следующими по-
луреакциями *:Fe2+ + 2е~ < Fe (тв.); £°0 = — 0,440e (1)Fe3+ + е~ Fe2+; £°2 = 0,771а (2)Полуреакции (1) и (2) могут быть скомбинированы следующим
образом:Fe3+ + Зе~ Fe (тв.) (3)Стандартная свободная энергия полуреакции ** (3) получается
при сложении стандартных свободных энергий полуреакций (1) и
(2). Стандартная свободная энергия пропорциональна потенциалу,
умноженному на число переданных электронов, т. е.ЗЕ30 — 2Е°20 + Е32’ Е1о = — °>036вОбратите внимание, что £з0 не является суммой Е°20 и Е°32.Активность как функция потенциалаПотенциал инертного, например, платинового электрода, по¬
груженного в раствор, измеренный (или пересчитанный) относи¬
тельно стандартного водородного электрода, — главная церемен-
ная в окислительно-восстановительной системе, также как pH —
главная переменная в кислотно-основной системе. При равновесии
все окислительно-восстановительные пары имеют один и тот же
потенциал Е, и уравнение Нернста (см. раздел 1.5) дает соотно¬
шение между Е и концентрациями различных ионов в растворе.
Для некоторой полуреакцииаА + пе~ ЬВуравнение Нернста имеет вид:£— е° Ю- in«/■ {А}«* Индекс у стандартного потенциала указывает на обе степени окисления
элемента, участвующего в полуреакции.** Стандартная свободная энергия полуреакции — это чисто формальное по¬
нятие, так как свободная энергия электрона экспериментально неизмерима. Что¬
бы быть точными, мы должны говорить о свободной энергии только полных
электрохимических ячеек. Однако свободную энергию ячейки, одним из электро¬
дов которой является стандартный водородный электрод, можно формально
рассматривать как свободную энергию полуреакции.
340XI. 2. Графические способы описанияПри 25 °СЕ = Е°0,06 ,g {В}»{А}а0,06 в; более точноегде приблизительно принято, что 2,303 RT/F ■
значение 0,05915 в.Так, в присутствии твердого железа потенциал инертного элек¬
трода в растворе, содержащем ионы Fe2+ и Fe3+, зависит от ак¬
тивностей обоих ионов. Используя
уравнение Нернста для полуреак¬
ции (1), получим:Е = — 0,440 + 0,03 lg {Fe3+}
а из полуреакции (3) находим:Е = - 0,036 + 0,02 lg {Fe3+}Активности, большие 1, на прак¬
тике, вообще говоря, не достигают¬
ся, поэтому на рис. XI. 1 эти части
линий показаны пунктиром. Актив¬
ность металлического железа всег¬
да 1, так как это — чистая твердая
фаза. Активность иона Fe2+ намно¬
го больше, чем активность Fe3+ в
любой достижимой области кон¬
центраций. Это указывает на то,
что в присутствии твердого железа ион Fe2+ будет преобладать
среди окисленных форм железа.Диаграммы логарифмов отношения активностейЧасто, однако, мы имеем дело с растворами, содержащими
ионы Fe2+ и Fe3+, но в отсутствие твердого железа. В подобном
случае более удобно иметь дело с отношением активностей час¬
тиц различных степеней окисления к активности иона Fe2+. Урав¬
нение Нернста для полуреакции (1) имеет вид{Fe (тв.)}Рис. XI. 1. Зависимости актив¬
ности ионов Fe (II) и Fe (III) от
потенциала системы в присут¬
ствии твердого железа.В левой части рисунка находятся сильно
восстановленные растворы, в правой —
сильно окисленные.Е ~ — 0,440 — 0,03 lg-{Fe2+}в него включена активность твердого железа, хотя она и равна 1.
Из полуреакции (2) следует:{Fe3'1'}Е = 0,771 + 0,06 lg{Fe2+}Кривые, соответствующие этим уравнениям, приведены на
рис. XI. 2. Так как активность твердого железа равна 1, а актив¬
Концентрационно-логарифмические диаграммы341ность иона Fe2+ не может быть больше 1, отношение {Fe(TB.)}/{Fe2+}
не может быть меньше 1, поэтому часть линии на рис. XI. 2 изоб¬
ражена пунктиром. Конечно, {Fe2+}/{Fe2+} = 1 независимо от по¬
тенциала, и горизонтальная линия служит просто для напомина¬
ния, что изображено отношение к {Fe2+}.Области потенциала, в которых преобладает какая-либо из
форм, легко проследить по рис. XI. 2: в области восстановления
(низкие значения Е) преобладает Fe; когда степень окисления уве¬
личивается (увеличивается Е), преобладает Fe2+, и в конечном
итоге в условиях сильного окисления — ион Fe3+.и.ооооиРис. XI. 2. Зависимость отношений Рис. XI. 3. Зависимость активностей
активностей различных частиц же- Fe(TB.), Fe (II) и Fe (III) в 0,1 М
леза от потенциала. растворе от потенциала.Отметим, что при Е = 0, характеризующем окислительную спо¬
собность иона водорода при его активности, равной 1, преобла¬
дает ион Fe2+, так что железо должно растворяться в сильных
кислотах типа HCI, выделяя водород и образуя почти исключи¬
тельно Fe2+. В более сильно окисляющих кислотах типа HNO3 об¬
разуется Fe3+ и выделяются N0 или N02.Концентрационно-логарифмические диаграммыТретий способ графического описания (рис. XI.3) аналогичен
концентрационно-логарифмическим диаграммам, используемым
для кислотно-основных систем. При этом аналитическая концент¬
рация железа в растворе имеет определенное значение. Рассмот¬
рим раствор, содержащий 0,1 моль)л Fe3+ и достаточное количе¬
ство кислоты для предотвращения ■ гидролиза. Этот раствор полу¬
чается в условиях, соответствующих правой части рис. XI. 3, при
потенциале ~1,0в. Если добавить восстановитель или произвести
в системе электрохимическое восстановление, потенциал умень¬
шается, а концентрация Fe2+ увеличивается.
342XI. 2. Графические способы описанияТак как аналитическая концентрация железа равна 0,1 моль/л,
можно записать уравнение материального баланса следующим об¬
разом:[Fe2+] + [Fe3+] = 0,1
• Уравнение Нернста применительно к полуреакции (2)£ = 0,771— 0,061е|Щ-Если принять активности равными концентрациям и скомбини¬
ровать результат с уравнением материального баланса, то полу¬
чаемВ-0,771— 0,06 lg0,,!!,p]„|ИЛИ0,1 — fFe3+l
Е = 0,771 - 0,06 lg ’‘[РеЦ "Эти два уравнения описывают кривые рис. XI. 3, выполняются
они до образования осадка железа в системе.Кривые, соответствующие [Fe2+] и [Fe3+], пересекаются там, где
концентрации этих ионов равны:[Fe2+] = [Fe3+] = 0,05 моль/л £ = £°2 = 0,771 вТочка Р, в которой E — Eh, называется точкой системы — по
аналогии с точкой, в которой pH = р/Са для кислотно-основной
системы. Раствор с потенциалом, близким к потенциалу точки
системы, содержит сравнимые концентрации Fe2+ и Fe3+; его
свойства аналогичны свойствам кислотно-основного буфера. До¬
бавление небольшого количества окислителя вызовет переход
Fe2+->Fe3+ и лишь незначительно изменит потенциал раствора.Таким образом, раствор, содержащий и окисленную, и восста¬
новленную формы одного и того же вещества, является потенцио-
статическим буфером *; его действие таково, что он стремится со¬
хранить потенциал постоянным.В сильно восстановительных средах осаждается металлическое
железо; уравнение материального баланса в этом случае более
не соблюдается и потенциал определяется уравнением Нернста
для полуреакции (1):Е = 0,440 - 0,03 lg [Fe2+]Точка перехода соответствует [Fe2+] = 0,1, т. е. Е = —0,47 б.Системы, зависящие от pHДо сих пор мы полагали, что растворы железа являются на¬
столько кислыми, что в растворе не происходит никакого гидро¬
лиза ионов и, следовательно, характер диаграммы не зависит от* Иногда называют окислительно-восстановительный буфер (Прим. ред.).
Диаграммы логарифма отношений активностей при постоянном аначен. pH 343pH. Образование гидроксокомплексов не изменит стандартных
потенциалов, но введет новые члены в уравнения материального
баланса, изменяя форму кривых концентрация — потенциал. А это
приведет к тому, что наблюдаемый потенциал в данной системе
станет зависимым от pH (см. раздел XI. 3).Даже если никакие гидроксокомплексы и не образуются, во
многих полуреакциях принимают участие ионы водорода или гидр¬
оксильные ионы, и для них потенциал должен зависеть от кислот¬
ности раствора и от концентрации других частиц.Для систем, в которых равновесие зависит от потенциала и
кислотности, можно использовать диаграммы, подобные приведен¬
ной на рис. XI. 2 при фиксированных значениях pH. Общее описа¬
ние системы можно получить, построив диаграмму областей пре¬
обладания, приняв за независимые переменные pH и потенциал.
Диаграммы pH — потенциал широко применяют при обсуждении
явлений, типа коррозии и электролиза.В качестве системы, иллюстрирующей зависимость от pH, рас¬
смотрим различные окисленные состояния марганца. Полуреакции,
приводящие к образованию различных его соединений, приведены
в табл. XI. 1.Т а б л и ц a XI.1Потенциалы образования различных окисленных состояний марганцаДанные получены комбинацией величин из книги Латимера и констант
устойчивости гидроксокомплексов Мп (II), приведенных в табл. VIII.3.Степеньокисле¬нияПолуреакцияЯ°. во+2+2+2+2+2+3+3+5+6+7Мп02(тв.)+4Н++4е-Мп02(тв.)+4Н++2е-Мп02(тв.)+ЗН++2е'Мп02(тв.)+2Н++2е'Мп02(тв.)+2Н++2<ГМп02(тв.)+Н++Н20+2е"Мп02(тв.)+4Н++е-Мп02(тв.)+Н++Н20+в'Мп02(тв.)+Н20Мп02(тв.)+2Н20Мп02(тв.)+2Н20Мп(тв.)+2Н200,205Мп2++2Н201,23Мп0Н++Н200,91-Мп(ОН)2(тв.)0,77Mn(OH)2(aq)0,60Мп(ОН)3"0,20Мп3++2Н200,95Мп(ОН)3(тв.)0,59Мп03-+2Н++е‘-2,5МпОГ+4Н++2е--2,26Мп04“+4Н++Зе--1,695Диаграммы логарифма отношений активностей
при постоянном значении pH -Линии на рис. XI. 4 получены по уравнению Нернста, решае¬
мому для каждой из полуреакций, приведенной в табл. XI. I.
Пунктирные линии указывают гипотетические отношения активно¬
стей тех твердых соединений, которые не могут существовать в
344XI. 2. Графические способы описанияравновесии с водными растворами при pH = 0. В восстанови¬
тельной среде (низкий потенциал) преобладает Мп2+. В более0 0,4 0,8 1,2 1,6 2,0 2,4Рис. XI. 4. Растворы марганца при pH == 0 (а) и
рН= 14 (б).Диаграмма зависимости логарифма отношений активности каждой
возможной формы существования марганца к активности твер¬
дой фазы МпОг от потенциала в растворах с [Н+]=[ОН”’] == 1 а моль!л.окислительной среде образуется твердое соединение Мп02. В на¬
сыщенных растворах Мп02 около Е — 1,5в в малых концентра¬
циях присутствуют Мп2+, Мп3+ и MnOJ. В еще более окислитель¬
ной среде преобладает МпО^.
Диаграммы pH — потенциал345Стандартный потенциал окисления воды равен 1,23 в, но реак¬
ция является очень медленной, поэтому и вода не окисляется в
1 М кислом растворе с заметной скоростью, до тех пор, пока по¬
тенциал не станет выше 1,7 в. Разность этих потенциалов зависит
от электрода, на котором происходит окисление (в некоторой сте¬
пени от присутствия других соединений в растворе) и известна под
названием «кислородного перенапряжения». Кислородное перена¬
пряжение на большинстве электродов—~0,5е. Растворы пер¬
манганата в 1М кислоте имеют окислительный потенциал -— 1,7 в
и влияние перенапряжения в отсутствие какого-либо электрода
вообще выражается в том, что раствор перманганата распадается
очень медленно.Как следует из рис. XI. 4, б в щелочных растворах с низкой
окислительной способностью марганец существует главным обра¬
зом как твердая фаза Мп(ОН)2 с небольшими количествами Мп2+,
МпОН+, Мп(ОН)2 и Мп(ОН)з в растворе. Гидроокись марганца
Мп(ОН)3 (тв.) может быть гидратированной формой минерала
манганита (Мп203-Н20), но значения потенциала, приведенные в
табл. XI. 1, указывают, что она метастабильна и диспропорциони-
рует на Мп02 и Мп(ОН)2.В растворах, насыщенных твердым Мп02, обнаружены Мп2+ и
МпОН+, а также частицы Мп(ОН)2, Мп(ОН)з, МпОз> Мп04- и
MnOJ. В сильно окисляющих растворах из Мп02 возникают МпОГ
и МпС>4. Когда в концентрированной щелочи перманганат вос¬
станавливается, то осаждается Мп02; цвет раствора при этом ме¬
няется от фиолетового до зеленого (цвет MnOf- — манганат-иона),
а затем до голубого (цветМпОз — гипоманганит-иона); и, наконец,
раствор становится бесцветным, так как равновесная концентрация
марганца в насыщенных растворах Мп02 вблизи нулевого потен¬
циала— ~10'I4Af. Обычный метод приготовления перманганата
калия — это окисление воздухом Мп02 в расплавленной гидро¬
окиси калия. Полученная масса состоит в основном из К2МПО4,
но если растворить в воде, М11О4- диспропорционирует на М11О4
и МпОг.Перманганат значительно более стабилен в щелочных, чем в
кислых растворах. Если принять перенапряжение кислорода близ¬
ким к 0,5 в, вода не будет окисляться до кислорода при pH = 14
до тех пор, пока Е не достигнет примерно 0,9 в, тогда как MnOI
преобладает при Е выше 0,6 в.Диаграммы pH—потенциалДиаграммы, подобные тем, что приведены на рис. XI. 4, можно
построить для различных значений pH. Их можно рассматривать
как вертикальные сечения трехмерных концентрационно-логариф¬
346XI. 2. Графические способы описаниямических диаграмм. На рис. XI. 5 приведен вид этой диаграммы
сверху; на ней изображены только те области, в которых преоб-
' ладают те или иные соединения и, таким образом, она является
диаграммой области преобладания. Границы областей построены
для аналитической концентрации I М; в более разбавленных рас¬
творах они несколько изменятся. Пунктирной линией окруженаобласть значений pH и по-
рН тёнциала, которые могутбыть достигнуты в разумнр
концентрированных водных
растворах, в предположе¬
нии, что величины кислород¬
ного и водородного перена¬
пряжений ~0,5в. Отметим,
что ион Мп2+ может быть
восстановлен до металла
только при том условии, что
водородное перенапряжение
крайне велико. Металличе¬
ский марганец можно полу¬
чить электролитическим вос¬
становлением концентриро¬
ванного электролита: суль¬
фат аммония — сульфат
марганца при pH = 5.В щелочных растворах
с низкой окислительной спо¬
собностью преобладает твер¬
дый Мп(ОН)г, а в кислых растворах — Мп2+. В наибольшей кон¬
центрации МпОН+ появляется вблизи границы между Мп2+ и
Мп(ОН)2(тв.). Содержание Mn(OH)2(aq.) ограничено концентра¬
циями, меньшими 10-6М, вследствие его осаждения. Содержание
Мп(ОН)з становится заметным только в очень щелочных рас¬
творах. ^В растворах с умеренной окислительной способностью при всех
значениях pH преобладает Мп02 (тв.), но в сильных щелочах
можно получить МпО^-, а в концентрированных кислотах — Мп3+.
Частицы МпОз никогда не являются доминирующими, а их об¬
разование наиболее ощутимо вблизи границы между Мп04- и
МпОз-В сильных окислителях преобладающим является МпОТ.Если рассмотренные диаграммы могут быть построены, то они
дадут полное представление об окислительно-восстановительной
системе (если требуется лишь полуколичественный результат).
В большинстве же случаев расчеты с помощью диаграмм трудны,f.flРис. XI. 5. Диаграммы областей преобла¬
дания яля дяаграмма pH—потенциал для
марганца, изображающая области, в кото¬
рых доминируют различные содержащие
марганец частицы.Область, ограниченная пунктиром, достижима
в водных растворах.
Вопросы347так как уравнения материального баланса и баланса электронов
обычно не могут быть выражены в результате простого пересече¬
ния двух линий.Вопросы8. Постройте диаграммы, подобные приведенным на рис. XI. 2 и XI. 3, для
меди, изобразив на ней линии Си (тв.), Си+ и Сиг+. Используйте данные, приве¬
денные на стр. 30.9. Постройте диаграмму, подобную приведенной на рис. XI. 2, для ртути,
изобразив на ней линии Hg(I), Hg2+ и Hg2+. Используйте данные, приведенные
на стр. 30.10. Постройте диаграмму, подобную приведенной на рнс. XI. 4, а, для мар¬
ганца при pH = 7. Используйте данные табл. XI. 1.И. Потенциалы (в в) различных степеней окисления ванадия следующие:у2+ v (тв.) + 2е~ £° = — 1,20V3+ V2+ + е~ Е° = — 0,255V02+ + 2Н+ + е~ ^=± V3+ + H20 Е° = 0,337VOj + 2Н+ + е~ V02+ + H20 Е° = 1,000Постройте диаграмму, подобную приведенной на рис. XI. 4, а, для ванадия
при pH = 0.12. Постройте диаграмму pH — потенциал, показывающую области преобла¬
дания частиц различных степеней окисления ванадия.13. Постройте диаграмму pH — потенциал, показывающую области преобла¬
дания частиц различных степеней окисления хрома. Используйте даииые, приве¬
денные на стр. 30.14. Потенциалы (в в) различных степеней окисления азота следующие:N2Hj + ЗН+ + 2е~ *2NH3OH+ + Н+ + 2<Г ^N2 (г.) + 2Н20 + 4Н+ + ^3N2 (г.) + 2Н+ + 2е~ +H2N202 + 2Н+ + 2е~ «2NO (г.) + 2Н+ + 2е~ ^HN02 + Н+ + е~ ^N204 (г.) + 2Н+ + 2е~ i
2NO~ + 4Н+ + 2е~ +Многие нз этнх соединений в водных растворах могут терять ионы водо¬
рода. Константы ионизации кислот следующие:2NH+Е° = 1,27n2h+ + h2o£°=* 1,422NH3OH+frjОII1002NH3Г = -3,1N2 (г.) + 2H. ОЕ° = 2,65H2N202Е° = 0,71NO (г.) + Н20Е° = 0,992HN02чIIоN204 (г.) + 2Н20Е° = 0,80NH+ р/Са = 9,25
ВД Р*а = 7,94
Р/Са = 0,27
NH3OH+ рЛГа = 5,98HN3 рКа = 4,72H2N202 рКа = 7,05hn2o; р/са== li.oHN02 рКа = 3,29Постройте диаграмму pH — потенциал, показывающую области преобла¬
дания различных соединений.
348 XI. 3. Влияние комплексообразов. на окислительно-восстановительн. равное.XI. 3. ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ
НА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РАВНОВЕСИЯВлияние ионной силыУравнение Нернста выполняется точно только в том случае,
когда активности действительно реализующихся в растворе час¬
тиц, принимающих участие в полуреакции, входят в логарифми¬
ческий член уравнения. Термодинамический стандартный потен¬
циал, который связан со стандартной свободной энергией реакции,
должен быть получен при обычном выборе стандартного состоя¬
ния экстраполяцией измеренных потенциалов к нулевой ионной
силе. Однако подобно тому, как были использованы концентра¬
ционные константы равновесия в средах с постоянной ионной си¬
лой, можно применять и стандартные потенциалы, измеренные для
данной ионной силы, в комбинации с концентрациями частиц, ко¬
торые участвуют в полуреакции. В этом случае уравнение Нерн¬
ста все еще будет выполняться.Формальные потенциалыДля применения изложенных выше соображений можно опре¬
делить формальный потенциал* для данной полуреакции и затем
применять его вместе с аналитической концентрацией частиц каж¬
дой из степеней окисления. Эта концентрация включает помимо
концентраций веществ, действительно участвующих в полуреакции,
и концентрации всех комплексов, присутствующих в растворе.
Формальный потенциал будет зависеть не только от ионной силы
среды, но и от концентраций присутствующих лигандов.Если образуются только одноядерные комплексы, формальный
потенциал не должен зависеть от аналитической концентрации
элемента, принимающего участие в полуреакции. Измерение фор¬
мального потенциала требует измерения потенциала ячейки, в ко¬
торой могут изменяться аналитические концентрации частиц двух
интересующих нас ступеней окисления. Тогда постоянный член в
уравнении Нернста — формальный потенциал. Если известны кон¬
станты образования всех важных комплексов, тогда можно вы¬
числить стандартный потенциал. Если можно оценить коэффи¬
циенты активности, то можно вычислить и стандартный потенциал
при нулевой ионной силе. Тогда формальный потенциал аналоги¬
чен условным константам равновесия, рассмотренным в разделах
v с у аи И Л.. \j.* Е. X. Свифт, который ввел термин формальный потенциал, использовал
его в описанном выше смысле. Другие авторы применяли этот термин для стан¬
дартного потенциала при конечной ионной силе. Мы ввели различие между по¬
правками на ионную силу и эффектом комплексообразования, используя различ¬
ные термины.
Формальные потенциалы349Пример XI. 2. Формальный потенциал пары Ce(III)—Ce(IV) в 1 М рас¬
творе H2SOt равен 1,44 в. Рассчитайте стандартный потенциал пары в некомплек¬
сообразующей среде с ионной силой, соответствующей 1 М H2SO4. Используем
следующие константы равновесия комплексообразования, определенные в среде
с ионной силой 1 М:Аналитические концентрации церия в двух стадиях окисления следующие*:Так как раствор сильнокислый, мы пренебрегли гидроксокомплексами, для
которых равновесные данные пока еще не определены достаточно надежно.Измеренный потенциал, естественно, один и тот же, независимо от того,
выражен он через концентрации веществ, действительно участвующих в полу¬
реакции, илн через аналитические концентрации:Используя константы устойчивости, приведенные выше, можно выразить
аналитические концентрации через концентрации реально реализуемых частиц
и концентрацию сульфат-иона. Подставляя уравнения (1)—(3) в (8), получаем:Сш = [Се3+] (1 + 42,5 [SO2-] + 2,18 [SOf]2 + 1 20- 103 [SO2-]3 (11)
CIV = [Ce4+] (l + 3,9 • 104 [SO2'] + 8,7 • 107 [SO2"]2 + 1,95 • 10'° [SO2']3) (12)В 1,0 Af растворе H2SOt уравнение протонного условия, еслн пренебречь
[ОН-], следующее:* Поскольку мы пользуемся формальным потенциалом, то концентрации яв¬
ляются суммами концентраций всех комплексов и свободных ионов. Поэтому
вместо [Се3+], строго говоря, следует всегда писать:(1)(2)(3)(4)(5)(6)
(7)С,,, - [Се3+] + [CeSOt] + [Ce(S04);] + [Ce(S04)3-]
CIV = [Ce4+] + [CeSOf] + [Ce (S04)2] + [Ce(S04)2-](8)(9)c= 1,44-0,06^ T\rIV(10)(13)а уравнение материального баланса для сульфата:(14)Cce(ni)=lCe3+] + [CeS04+]+ ...
350 XI. 3. Влияние комплексообразов. на окислительно-восстановительн. равное.Комбинируя уравнения (7), (13) и (14), получаем:1,0 - [SOf ] = 12 [SO’"] (1,0 -f [SO2-]) [S042“] = 0,071Подстановка этого значения в уравнение (11) и (12) дает:Сш = 5,55 [Се3+]С1у = 7,42- 10° [Се4+]Так как комплексы одноядерные, то аналитически концентрации прямо про¬
порциональны истинным концентрациям. Это условие должно быть выполнено,
чтобы формальный потенциал не зависел от аналитических концентраций. Под¬
ставляя эти значения в уравнение (10), получаем: Е° = 1,80 в, т. е. ион
Ce(IV) гораздо более сильный окислитель в некомплексообразующей среде.
Термодинамический стандартный потенциал должен быть больше это» величины,
так как при данной ионной силе коэффициент активности иона Ceiv меньше,
чем СеньФормальный потенциал в 1 М растворе НСЮ4 должен быть близок к вы¬
численному выше значению; в действительности, он оказался равным 1,7 в. Рас¬
хождение можно частично объяснить тем фактом, что коэффициент активности
многозарядных ионов типа Се3+ и Се4+ значительно сильнее зависит от ионной
силы и природы ионной среды, чем для одновалентных ионов, и отчасти труд¬
ностью достижения истинного равновесия в растворах, содержащих такой силь¬
ный окислитель, как Се4+.Равновесие в системе ртуть—ионы ртути Hg (I) и Hg (II)Поскольку значения окислительных потенциалов Hg(>K.) —
Hg(I) и Hg(}K.) — Hg(II) очень близки, постольку равновесие
между этими ионами легко смещается в случае комплексообразо¬
вания. В отсутствие лигандов равновесиеHg (II) + Hg (ж.) Hg2(I)сдвинуто вправо, добавление же хлорида в систему существенно
сдвигает равновесие влево. Причина этого смещения — большая
устойчивость хлоридных комплексов Hg(II) по сравнению с тако¬
выми для Hg(I). Равновесие Hg(«i.) — Hg(I)—Hg (II) очень
важно из-за того, что каломельный электрод (Hg2Cl2) широко
применяют в качестве электрода сравнения в потенциометрических
измерениях. Каломельный электрод состоит из смеси Hg(>K.)—
Hg2Cl2, находящейся в контакте с раствором постоянной концент¬
рации хлорида (обычно с насыщенным или с 1 Л1 раствором КС1).
Вследствие простого влияния общего иона концентрация жидкой
ртути очень мала при таких высоких концентрациях иона хлора.
Но из-за большой устойчивости хлоридных комплексов Hg(II)
концентрация растворенной ртути в каломельном электроде может
достигать ~ 10_3 моль/л.
Равновесие в системе ртуть—ионы ртути Hg(t) и Hg(ll)351Пример XI. I. Рассчитайте общую концентрацию растворенной ртути в кало¬
мельном электроде с 1 М раствором КС1. Соответствующие равновесия, измерен¬
ные прн ионной силе 0,5 М, следующие:[Hg2+] [СГ]2 = 1,32 * 10—17(15)[Hgf]=l30[Hg2+](16)[HgCl+] = 5,5.10е [Hg24'] [СГ](17)[HgCl2] » 1,65.1013 [Hg2+] [СГ]2(18)[HgCIJ] = 1,17- 1014 [Hg2+] [СГ]3(19)[HgClf] = 1.17 • Ю'5 [Hg2+] [cr]4(20)[Hg2CI+] = 20[Hg2+J[cr](21)[H+] [HgOH+] = 2,0 • 10"4 [Hg2+](22)[H+]2 [Hg(OH)2] = 5,0 • 10-7 [Hg2+](23)[H+][Hg2OH+]= 1,0. 10~5[Hg2+](24)[н+][0н-]=1,0.10_м(25)Приближенное уравнение материального баланса по СГ-ионам, при их
большом избытке, имеет вид:[СГ] =1,0 (26)Уравнение протонного условия[Н+] = [ОН~] + [Hg2OH+] + [HgOH+] + 2 [Hg(OH)2] (27)и уравнение материального баланса по ртути дают общую концентрацию ра¬
створенной ртути:CHg = 2 [Hg2+] + 2 [Hg2Cl+] + 2 [Hg2OH+] + [Hg2+] + [HgCl+] + [HgCIJ ++ [«gCl^J + [HgClf] + [HgOH+] + [Hg(OH) j (28)Подстановка уравнения (26) в (15) дает[Hg|+]= 1,32-10~17И[Hg2+] = 1,02 • 10”18 [из уравнения (16)][HgCl+] = 5,6> 10-13 [из уравнения (17)]£HgCl2] = 1,62* 10 6 [из уравнения (18)][HgCI~] = 1,19 ■ 10-5 [из уравнения (19)][HgCl*-] -1,19-10-* [из уравнения (20)][Hg2Cl+] = 2,6• 10 ** [нз уравнения (21)]
352 XI. 3. Влияние комплексообразов. на окислительно-восстановительн. равное.Используя полученные выше значения [Hg2+] и [Hg2+] и подставляя урав¬
нение (22) в (25) н (27), находим:[Н+]2= 1,0-10_14^1+1,02- 10““'[Н+] )[н+] = 1,0.10~7[HgOH+] = 2,0 • 10“16 [из уравнения (22)][Hg(OH)2] = 5,0 • 10~12 [из уравнения (23)][Hg2OH+] = 1,3 • 10-15 [из уравнения (24)][ОН-] = 1,0 • 10~7 [из уравнения (25)]Отметим, что уравнение (27) выполняется с точностью до 10-4.Наконец, общая концентрация растворенной ртутн, вычисленная нз урав¬
нения (28), равна:CHg = 1.33 • 10—4Итак, практически вся ртуть в растворе находится в форме хлоридных
комплексов Hg(II), а не в виде комплексов Hg(I).В о п р о с ы15. Определите концентрации всех нонов в растворе, насыщенном однохло¬
ристой ртутью н ртутью. Прн нонной силе, равной 0, константы равновесия
имеют следующий вид:[Hg2+] [СГ]2= 1,33- 10~'8[Hg2+]=130[Hg2+][Н+] [HgOH+] = 8,1 • 10-4 [Hg2+][Н+]2 [Hg(OH)2] = 2,24 • 10“6 [Hg2+][H+][Hg2OH+] = 4,0-10-5[Hg2+][HgCl+] = 2,18- 107 [Hg2+][cr][HgCl2] = l,82.1014[Hg2+] [СГ]3[HgCl"] = 9,5 [HgCl2][Cl-][HgCI7]=120 [Hgci2][cr]2[Hg2d+] = 20[Hg2+][cr]Сравните результаты ваших вычислений с результатами Драя и Гледхила
[Trans. Faraday Soc., 51, 1119 (1955)], полученными измерением электропровод¬
ности, pH и концентрации растворенной ртути в насыщенных растворах одно-
хлоркстои ртути.*[Н+] == 8,17 • 10~б
[СГ] == 8,40 • 10~6
[Hg(OH)2] = 4,03. 10“*[HgCl2] = 3,3 • 10-6
XI. 4. Окислительно-восстановительное титрование35316. Найдите концентрации всех частиц в растворе, насыщенном одиохло-
ристой медью и металлической медью. Потенциалы (в в) в системе:Си2+ + 2е~ Си (тв.) Е° = 0,337Си2+ + е“ Си+ Е° = 0,153Константы комплексообразования для Си (I) с С1~-иономIgf (тв) о=== 6,73; lg/f(TB)i— М2; Ig/CtTBjs^—1-47
н для Си (И) с тем же лигандом:Ki = 1,30; Kt = 0,2317. Рассчитайте формальный потенциал реакцииCu(II) + СГ + е~ CuCl (тв.)в 1 М растворе НС1.18. Металлическая медь контактирует с раствором, 1 л которого содержит
0,1 моль Си2+ и 0,1 моль С1_. Рассчитайте равновесные концентрации всех частиц
в растворе? Осаждается ли однохлористая медь?19. Постройте диаграмму области преобладания, считая потенциал и
—lg [С1_] независимыми переменными; укажите в области преобладания различ¬
ные частицы, содержащие медь.20. Используя константы, приведенные в Примере XI. 3, постройте диаграмму
области преобладания, выбрав в качестве переменных потенциал и —lg [Cl-];
укажите области преобладания различных частиц, содержащих ртуть. Считайте,
что в растворе присутствует достаточное количество кислоты для предотвраще¬
ния гидролиза.21. Рассчитайте формальный потенциал для пары Со3* — Со2* в 1М рас¬
творе NH3. Потенциал в отсутствие комплексообразования:Со3+ + е~ Со2+ Е° = 1,842 вКонстанты аммиачных комплексов Со2+ и Со3+, а также аммиака приведены
в табл. VIII. 4.22. Найдите аналитические концентрации Со(П) н Со(Ш) в растворе, 1 л
которого содержит 0,01 моль Co(NOa)2 и 1 моль NHj в присутствии воздуха
(Р0 = 0,2 атм). Потенциал восстановления воды:Н20 + V* 02 (г.) + 2е~ ^ 20Н" £° = 0,401 вIXI.4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕТитрования, основанные на реакциях окисления-восстановле¬
ния, являются одним из наиболее точных методов анализа. Конеч¬
ную точку можно установить визуально, как и при кислотно-ос¬
новном и осадительном титрованиях, однако потенциометрические
методы ее определения более удобны.В качестве окислителя очень часто используют перманганат,
поскольку он действует как «самоиндикатор»: титрование проводят
до тех пор, пока фиолетовый цвет Мп07 не станет устойчивым.
При титрованиях другими окислителями или восстановителями
применяют и окислительно-восстановительные индикаторы. Ими
могут быть, например, органический краситель типа метиленового12 Зак. 345
354Х1.4. Окислительно-восстановительное титрованиеголубого или ферроина. Окисленная и восстановленная формы
последнего окрашены в разный цвет, а равновесие окисления-
восстановления наступает быстро.При рассмотрении кислотно-основных титрований была де¬
тально обсуждена проблема определения ошибки титрования в
случае использования индикатора; по существу, эта проблема свя¬
зана с формой кривой титрования. Если кривая титрования изве¬
стна, то разность потенциалов между конечной и эквивалентной
точками может быть сведена к разности объемов, и таким обра¬
зом определена ошибка (в %) титрования. Для потенциометри¬
ческих титрований желательно знать приблизительно такое значе¬
ние потенциала, при котором достигается эквивалентная точка,
чтобы получить точные результаты с наименьшими усилиями’.Расчет нривых титрованияРассчитаем две кривые титрования: перяая описывает титрова¬
ние раствора, содержащего Fe(II), раствором, содержащим
Ce(IV), вторая кривая относится к титрованию в системе Fe(II) —
бихромат. Титрование Fe(II)—Ce(IV) является симметричным,
поскольку от восстановителя к окислителю переходит один элек¬
трон; во второй случае титрование несимметрично из-за много-
электронного обмена.При симметричном титровании точка эквивалентности распо¬
лагается посередине кривой титрования, а потенциал, ей соответ¬
ствующий, не зависит от аналитических концентраций реагентов.
В реакции Fe(II)—бихромат точка эквивалентности ближе к ве¬
личине стандартного потенциала пары бихромат — Сг(Ш) и ее
точное местоположение зависит от pH и аналитических концен¬
траций реагентов.Титрование Fe (II) — Се (IV)Пример XI. 4. Рассчитайте кривую зависимости потенциала от добавляемого
объема для титрования 50 мл 0,1 М раствора Fe(II) 0,1 М раствором Ce(IV) в1 М растворе H2SO4.В 1 М растворе кислоты формальный потенциал пары Ce(lII)—Ce(IV) равен
1,44 в, а формальный потенциал для пары Fe(II)—Fe(III) равен 0,68 в. Равно¬
весный потенциал, указываемый инертным электродом, определяется любой из
пар *;1,44-0.06 Ig-j^j- (1)£ = 0,68-0,06 (2)* См. примечание на стр. 349,
Титрование Fe((I) — Ce(IV) 355Уравнения условий материального баланса и баланса электронов имеют вид:
[Fe«]+[Fe^] = 0,10T^ (3)[Се3+] + [Се4*] = 0,10 (4)[Fe3t] = [Се3+] (5)Уравнения (1)—(5) позволяют определить зависимость Е от V.Так как точное решение достаточно громоздко, проведем его в три этапа,
приближенно полагая, что реакцияFe2+ + Ce4+ Fe3++ Се3+протекает нацело. Такое допущение разумно, поскольку константа равновесия
(вычисленная из величины формального потенциала) равна 7,1 • 1012.Перед точкой эквивалентности все добавленные ноны Ce(IV) немедленно
восстанавливаются и в уравнении (4) можно пренебречь величиной [Се4+]. Ком¬
бинируя уравнения (4) и (5), получаем:[Fe3+] = [Се4+] = 0>10-y-qjgQ- (6)Подстановка уравнения (6) в (3) при¬
водит к выражению1ре’*'-0’101т7 <7>уравнений (6) и (7) в (2) дает выражениеЕ = 0,68 - 0,06 lg 50 ~ У- (8)которое применяли при расчете участка
кривой титрования до точки / {рис. XI. 6).Потенциал точки, в которой раствор отти¬
трован наполовину (V = 25 мл), является
формальным потенциалом пары Fe(II) ——Fe(III).Эта область аналогична буферной об¬
ласти при титровании слабой кислоты.В растворе, содержащем сравнимые кон¬
центрации окисленной н восстановленной
форм одного и того же соединения, проявляется потенциостатический буферный
эффект, выражающийся в поддержании постоянного потенциала при добавлении
окислителя или восстановителя. Обратите внимание, что согласно уравнению (8)
при V = 0 Е — —оо. Однако практически при V = 0 величина Е имеет некото¬
рое конечное, но невоспроизводимое значение — из-за присутствия следов Fe*+,
которые всегда есть в растворах Fe2+.В точке эквивалентности 2 V = 50; объединяя уравнения (3)—(5), можно
получить:[Fe3*] = [Се3+] (5)[Fe2+] = [Се4*] (9)Суммирование уравнений (1) и (2) дает2Е' = 1,44 + 0,68 - 0,06 lg [g!!] jpff j
где E' — потенциал в точке эквивалентности.Рис. XI. 6. Зависимость потен¬
циала платинового электрода
относительно стандартного водо¬
родного эйектрода от объема при
титровании 50 мл 0,1 М раство¬
ра Fe (II) 0,1 М раствором Се (IV).12*
356XI.4. Окислительно-восстановительное титрованиеИспользуя уравнения (5) и (9), находим, что логарифмический член равен
нулю, т. е. Е' = 1,06 в.За точкой эквивалентности все ионы Fe2+ превращаются в Fe3+ и в уравне¬
нии (3) можно пренебречь членом [Fez+], Объединяя уравнения (3) и (5), полу¬
чаем:[Се^-ОЛО-р^д- (10)Подстановка уравнения (10) в (4), а (10) и (11) в (1), дает:[Се4+] = 0Л0-£-=§- (И)Е= 1,44- 0,06 lg -yZTso (12)Участок 1—3 кривой титрования вычислен по уравнению (12). Отметим, что
формальный потенциал пары Ce(III)—Ce(IV) достигается, когда V = 100 мл
(точка 3).vПотенциал точки эквивалентности для симметричных
титрованийИз общих соображений легко показать, что если одинаковое
число электронов переносится обеими окислительно-восстанови¬
тельными системами, то потенциал точки эквивалентности яв¬
ляется средним из формальных потенциалов для обеих систем:E' = 4E°ox + E°rei)Доказательство этого математически идентично вычислению
потенциала точки эквивалентности в Примере XI. 4. При этом ис¬
пользованы два существенных предположения: в полуреакциях не
участвуют ионы Н+ и раствор окислителя содержит только окис¬
ленную форму, а раствор восстановителя — только восстановлен¬
ную. Участие в одной из полуреакций иона Н+ приводит к появле¬
нию добавочного члена, учитывающего pH. Если раствор окисли¬
теля содержит сколько-нибудь своей восстановленной формы, или
наоборот, то потенциал точки эквивалентности несколько сме¬
щается.Для упрощения вычислений сделано предположение, что реак¬
ция, лежащая в основе титрования, завершается полностью. Если
разность окислительных потенциалов реагирующих систем мала
или определенный интерес представляет область вблизи точки
эквивалентности, уравнения нужно решать точно.Для симметричного титрования, подобно рассмотренному в
Примере XI.4, это не очень трудно и результат аналогичен полу¬
ченному при титровании сильной кислотой и сильной щелочью
(см. главу IV). Приближенные кривые, описываемые уравнениями
(8) и (12), асимптотически приближаются к вертикалям вблизи
точки эквивалентности; однако точное уравнение непрерывно и
Титрование Fe(II) — бихромат357имеет точку перегиба в точке эквивалентности. Обычный способ
определения конечной точки в потенциометрическом титровании
основывается на том факте, что для нее наклон кривой титрова¬
ния максимален. Это дает очень хорошее приближение к точке
эквивалентности даже в разбавленных растворах или когда раз¬
ность потенциалов между парами окислителя и восстановителя
мала.Титрование Fe (II) — бихроматПример XI. 5. Рассчитайте кривую зависимости потенциала от объема, до¬
бавляемого при титровании 50 мл 0,1 М раствора Fe2+ 0,1 н. раствором Сг20,_
в 0,1 М растворе H2SO4.Формальный потенциал пары Сг(Ш) —бихромат в серной кислоте точно не¬
известен, но, вероятно, он близок к 1,33 в — значению стандартного потенциала,
приведенному Латимером. Формальный потенциал пары Fe(II)—Fe(III) равен
0,68 в. Потенциал в равновесии определяется уравнением для пары:гр.З+12Е = 1,33 — 0,01 lg 7 1 ,rJ (13)[сг20Г][н+]14fFe2+lЕ = 0,68 - 0,06 Ig-jp^rj- (2)Так как эквивалент Сг20,- составляет 'U моля, то уравнение условия ма¬
териального баланса для хрома имеет вид:з[Сг3+] + б[Сг2ОГ] = 0,1 (14)При образовании каждой частицы Fe(III) высвобождается 1 электрон, а на
образование каждой частицы Сг (III) затрачивается 3 электрона, поэтому для
железа имеем:уравнение условия материального баланса[Fe2+] + [Fe3+] = 0,1 (3)уравнение условия баланса электронов[Fe3+] = 3 [Сг3+] (15)Как и ранее, можно упростить вычисления, полагая,, что окисление частицы
Fe(II) завершается полностью. Так как константа равновесия реакции6Fe2++ Cr2Of“ + 14Н+ 5=± 6Fe3+ + 2Сг3+ + 7Н20равна 6 • 105в (см. Пример 1.4, стр. 32), это допущение разумно.До точки эквивалентности весь бихромат восстанавливается мгновенно до
Сг(Ш), следовательно, величиной [Сг202-] в выражении (14) можно пре¬
небречь. Объединяя это выражение с (15) и (3), находим:л, V
358Х1.4. Окислительно-восстановительное титрованиеПодставляя найденные выражения в уравнение (2), получим тот же резуль¬
тат, что и в Примере XI. 4кп VЕ = 0,68 — 0,06 lg ——р— (8)Таким образом, часть кривой титрования до точки 1 на рис. XI. 7 совпадает
с кривой, приведенной иа рис. XI. 6.В точке эквивалентности V = 50 мл; объединив выражения (14), (15) и (3),
получаем:[Fe3+] = 3 [Сг3+] (15)[Fe2+] = 6[Cr2072-] (16)Умиожая выражение (13) на (6) и прибавляя к результату уравнение (2),
имеем:rf’,3+12 гре2+17*- (6) (1.33) + 0,68 - 0,06 lg [сг^г] и г.-L-. {17)Подстановкой уравнений (15) и (16) и уравнение (17), находим
Е' = 1,24 - 0,085 lg (J- [Fe3+]'j - 0,118 pHгде [Fe3+]' — концентрация Fe(III) в точке эквивалентности.Концентрация ионов водорода в 1М растворе H2SO.i рассчитана в При¬
мере XI. 2; оиа равна 1,07 моль/л; 0,23 моль!л ионов Н+, израсходованных иареакцию, мало изменяют это значение — из-за
буферного действия HSO“. Положив [Fe3+]' =
= 0,05 и pH = 0,03, получаем: Е' = 1,23 в.Это. значение намного ближе к формаль¬
ному потенциалу пары Сг(Ш)—бихромат,
чем к формальному потенциалу пары Fe(II) —
—Fe(III).После достижения точки эквивалентности
все ионы Fe2+ израсходованы и в выраже¬
нии (3) величиной [Fe2+J можно пренебречь.
Зто позволяет объединить выражения (3), (14)
и (15):3 [Сг3+] = 0,1 у 50 ; б[Сг202 ] = 0,ly _j_50Подстановка полученных выражений в
уравнение (13) дает:£= 1,30 + 0,01 lg (72 — 2500) (18)В выражении (18) величина [Н+] приня¬
та, как и ранее, равной 1,07, а все постоян¬
ные члены объединены с формальным потен¬
циалом. Уравнение (18) использовано для по¬
строения кривой на рис. XI. 7 от точки 2 до
точки 3.Зависимость потенциала точки эквивалентности от аналитической концен¬
трации очень слаба, а от pH очень сильна. Изменение pH иа единицу меняет
потенциал в точке экиивалентности иа 0,12 в. Конечно, изменение кислотности и
аналитической концентрации бихромата подействует на формальный потенциал
пары хром—бихромат, так как доли Cr(VI) и Сг(Ш), связанные в других со¬
единениях (например, HCrOJ, CrO2-, СгОН2+), изменится. Пока раствор яв¬Рис. XI. 7. Зависимость потен¬
циала платинового электрода
относительно стандартного во¬
дородного электрода от объе¬
ма при титровании 50 мл 0,1 М
раствора Fe (II) 0,1 н. раство¬
ром Сг20^“.
Ступенчатое окисление и восстановление359ляется достаточно кислым, что препятствует гидролизу иона Fe3\ формальный
потенциал пары Fe(II)—Fe(III) почти не зависит от pH и аналитической кон¬
центрации железа, так как сульфатные комплексы этих ионов относительно не¬
прочные и одноядерные.Потенциал точки эквивалентности для
несимметричных титрованийВ общем случае для несимметричного титрования, в котором
m электронов переносятся окисляющим агентом, а п — восстанав¬
ливающим, потенциал точки эквивалентности приближенно опре¬
деляется уравнением:£ ' лm + пЕсли в полуреакциях участвуют и ионы водорода, то может
появиться добавочный член, зависящий от pH; кроме того, если
один из реагентов — полиядерный комплекс, например бихромат,
то может быть и член, зависящий от аналитической концентрации.
Как и при симметричном титровании, присутствие некоторого
количества восстановленной формы окислителя или окисленной
формы восстановителя слегка смещает потенциал точки эквива¬
лентности.Решение точного уравнения для несимметричного титрования
показывает, что точка перегиба несколько ближе к центру кривой
титрования, чем точка эквивалентности. Однако для большинства
титрований это неважно. Ошибка, возникающая при выборе ко¬
нечной точки в точке максимального наклона, примерно та же,
что и при вычислении потенциала точки эквивалентности из при¬
близительных значений формального потенциала.Таким .образом, метод определения максимального наклона
кривой титрования достаточен, хотя и неточен, как для симмет¬
ричного, так и для несимметричного титрования.Ступенчатое окисление и восстановлениеВ некоторых системах окисление можно проводить в несколько
стадий; кривая титрования в этих случаях подобна полученной
при титровании многоосновной кислоты сильным основанием. Ва-
надий(П) может быть окислен перманганатом до ванадия(У) в
три стадии; на кривой титрования появятся три четко выраженных
ступеньки, разделенные тремя точками эквивалентности.Пример XI. 6. Определите потенциалы точек эквивалентности при титрова¬
нии 50 мл 0,1 Af раствора V2+ 0,1 н. раствором МпО^-
360XI.4. Окислительно-восстановительное титрованиеПолуреакции и их стандартные потенциалы (в в) следующие:V3+ + е~ V2+ Е° = — 0,255V02+ + 2Н+ + е~ V3+ + H20 Е° = 0,337VOj + 2Н+ -f- е~ V02+ + Н20 Е°= 1,000МпОТ + 8Н+ + 5е~Mn2+ + 4Н,0Е =1,51Для простоты примем формальные потенциалы равными этим значениям. За¬
пишем уравнение условия баланса электронов, необходимое для получения усло¬
вий достижения точки эквивалентности:5 [Mn2+] = [V3+] + 2 [V02+] + 3 [VO+] (19)Уравнения условий материального ба¬
ланса:5 [Мп2+] + 5 [Мп07] = 0[V2+] + [V3+] + [V02+] + [VO+] =50= 0,1V + 50(20)(21)где у — объем добавленного перманганата.На первой стадии титрования (рис. XI. 8)
V2+ окисляется до V3+, и на полпути к пер¬
вой точке эквивалентности потенциал ра¬
вен стандартному потенциалу первой ва¬
надиевой пары.После достижения первой точки экви¬
валентности V3+ окисляется до VO24-, т. е.
избытка ионов MnOJ иет. В первой точке
эквивалентности (V = 50 мл) преобладаю¬
щими являются ионы V3+ и Мп2+, а ионов
V2+ и VO24- значительно меньше. Уравне¬
ния условий материального баланса (20) и (21), если не учитывать величины
[VO+j и [Мп07], дадут:[V2+] + [V3+] + [V02+] = 5 [Мп2+]Объединяя это выражение с условием баланса электронов (19) и пренебре¬
гая величиной [VOj], получаем условие существования точки эквивалентности:[vo2+] = [v2+]Рис. XI. 8. Зависимость потен¬
циала платинового электрода
относительно стандартного водо¬
родного электрода при титрова¬
нии 50 мл 0,1 М раствора V2* 0,1 и.
раствором Мп07-Уравнения Нернста для первых двух пар ванадня следующие:[V2+]Е = — 0,255 — 0,06 lg
Е = 0,337 — 0,06 lg[V3+][V3+][vo2+][h+]2(22)(23)(24)
Ступенчатое окисление и восстановление361Складывая уравнения (23) и (24) и применяя уравнение (22), находим вы¬
ражение для потенциала в первой точке эквивалентности:Е' = 0,041 — 0,06 pHОтметим, что результаты будут те же, если V2+ титровать V02+ или любым
другим окислителем с потенциалом выше 0,337 в. Потенциал пары перманганата
ие выявляется, так как концентрацией перманганата после точки эквивалентности
еще можно пренебречь.На второй стадии титрования V3+ окисляется до V02+, но виовь после
достижения точки эквивалентности ион МпО“ отсутствует, так как расходуется
на образование VO*. Во второй точке эквивалентности (V = 100 мл) преоб¬
ладают ионы V02+ и Мп2+, a V3+ и VO* присутствуют в меньших количествах.
Условия материального баланса (20) и (21), если ие учитывать величину [V2+]
и [МпО~], таковы:2 [V3+] + 2 [V02+] + 2 [VO+] = 5 [Mn2+]Объединяя это выражение с уравнением условия баланса электронов (19),
получаем:[V0+] = [V3+] (25)Уравнения Нернста для второй и третьей пары ванадия следующие:[V3+lЕ = 0.337 0,06 lg (24)£- ..000 -,.,6 le-[v^;;if <*»Складывая уравнения (24) и (26) и используя уравнение (25), получим ве¬
личину потенциала во второй точке эквивалентности:Е' = 0,668 — 0,03 pH■ Любой окислитель с потенциалом > 1,00 в дал бы тот же потенциал в точке
эквивалентности.На конечной стадии титрования, когда V02+ окислеи до VOJ, после до¬
стижения точки эквивалентности появляется МпО~, так как окислять уже не¬
чего. В третьей точке эквивалентности (V = 150 мл) преобладают ионы VOj
и Мп2+, а ионы V02+ и МпО” присутствуют в меньших количествах. Еслипренебречь величинами [V2+] и [V3+], то условия материального баланса (20)
и (21) дают:3 [ V02+] + 3 [VOt] = 5 [Мп2+] + 5 [МпО;]Объединяя это выражение с уравнением баланса электронов (19) и прене¬
брегая величиной [V3+], находим:5 [MnO;] = [V02+] (27)Само же уравнение материального баланса, если пренебречь [V02+] и
[МпО;], по сравнению с большими концентрациями, определяет:5 [Мп2+] = 3 J VOjj (28)
362XI.4. Окислительно-восстановительное титрованиеУравнения Нернста для двух пар на этой стадии следующие:[vo2+lЕ = 1,000 - 0,06 lg г 1 ‘ (26)[VO*] [Н ]Я = 1,51 - lg ■ (29)5 [Мп07] [Н+]8 _Складыиая уравнение (26) с выражением (29), умноженным на 5, и исполь¬
зуя уравнения (27) и (28), получаем:£' = 1,40 -0,10 pHПриведенная на рис. XI. 8 кривая титрования может быть использована для
определения стандартных потенциалов.Титрование смесейТо обстоятельство, что потенциометрическое окислительно-вос-
становительное титрование позволяет определять каждый из ком¬
понентов смеси, может быть использовано для быстрого рядового
анализа сплавов. Удобное эмпирическое правило состоит в том,
что достаточно четко выраженную конечную точку можно наблю-'
дать, если потенциалы окислителя и восстановителя отличаются
более чем на 0,3 в. В некоторых вариантах, однако, удовлетвори¬
тельные титрования могут быть выполнены, когда разность потен¬
циалов меньше 0,3 в и особенно в случаях симметричного титро¬
вания и условиях выбора конечной точки при максимальном на¬
клоне кривой титрования.Часто, однако, кажущееся возможным титрование невыпол¬
нимо на практике, так как реакция, ■ на которой оно основано,
очень медленная. Только одни вычисления равновесия не могут
ответить на вопрос, какие из реакций составляют основу наилуч-
шего метода определения, поскольку они могут лишь ответить на
вопрос, какие реакции следует испытать.Вопросы23. Рассчитайте кривую титрования 50 мл 0,1 М раствора Fe2+ 0,1 н. раство¬
ром Мп07 в 1,0 Л! растворе HiSO» в области от 49,8 до 50,2 мл. Формальные
потенциалы (в в) :Fe3+ + е~ Fe2+ £° = 0,68МпО; + 8Н+ + 5е~ Mn2+ + 4HiO £° = 1,51Определите ошибку титрования, если конечной точке (первое появление
окраски перманганата) соответствует [МпО~] = 10—5 М.24. Рассчитайте кривую титрования 50 мл 0,1 М раствора Sn4+ 0,1 М рас¬
твором Сг2+ в 1,0 М растворе НС1. Формальные потенциалы (в в):Сг3+ + е~ Сг2+ Е° = — 0,38
Вопросы36325. Рассчитайте кривую титрования 50 мл 0,1 М раствора Си2’ в 6 М рас¬
творе НС1 ибнами Сг2+. Формальные потенциалы (в в):Си (II) и Си (I) означают суммы всех комплексов двух- и одновалентной
меди.26. Рассчитайте кривую титрования 50 мл ОД М V2+ 0,1 М раствором -Се4+
в 1,0 М растворе H2SO4; сравните ее с приведенной на рис. XI. 8.27. Рассчитайте потенциал в точке эквивалентности при титровании смеси
50 мл 0,1 М раствора Fe2+ и 50 мл 0,1 М раствора Fe3+ 0,1 М раствором Се4+
в 1,0 М растворе H2SO4. Отметьте, что этот потенциал не равен среднему фор¬
мальных потенциалов пар Fe(II) —Fe(III) и Ce(III)—Ce(IV).28. Рассчитайте потенциал в точке эквивалентности при титровании 50 мл
0,1 М раствора Fe(II) раствором, 1 л которого содержит 0,1 моль Ce(IV) и0,1 моль Ce(III) в 1,0 М растворе H2SO4. Обратите внимание, что он не равен
среднему формальных потенциалов.29. Рассчитайте кривую титрования 50 мл 0,1 М раствора I" 0,1 М раство¬
ром Се(IV); Формальные потенциалы (в в):Константа комплексообразования для IJ равна 790; растворимость Ь (тв.)
в воде 1,33-Ш'3 моль/л. Обратите внимание, что при указанных аналитических
концентрациях Ь выпадет в осадок до достижения точки эквивалентности. От¬
метьте, что потенциал точки эквивалентности не является средним формальных
потенциалов обеих пар.Си (II) + е~Си (I) + е~
Сг3+ + е~ ,Си (I) Е° = 0,45Си (тв.) Е° == 0,00
Сг2+ £° = —0,38Се4+ + е~ Се3+ £°=1,6112(тв.) + 2е" 2Г £° = 0,535
Глава XIIПОПРАВКИ НА НЕИДЕАЛЬНОСТЬХотя поправки на неидеальность и коэффициенты активности
вкратце были рассмотрены в главе II, однако в последующих главах
мы ими не пользовались. Объясняется это тем, что математические ме¬
тоды сочетания равновесных концентрационных соотношений и урав¬
нений материального баланса остаются одинаковыми- —независимо
от численной величины константы равновесия; введение же коэффи¬
циентов активности просто изменяет значение концентрационной
константы равновесия, если изменяется ионная сила.В случае приближенных расчетов этими поправками можно
пренебречь и принять, что концентрационная константа равнове¬
сия не зависит от ионной силы раствора. Для более точных рас¬
четов, однако, желательно вводить поправки везде, где это воз¬
можно. В разбавленных растворах коэффициенты активности зависят
только от ионной силы раствора и заряда ионов. В более концентри¬
рованных растворах коэффициент активности зависит от природы
ионов в растворе и предельные формулы оказываются неверными.Теория достаточно точно предсказывает значения коэффициен¬
тов активности при ионных силах менее 0,1 М. Если участвуют
только ионы с зарядом ±1, то коэффициенты активности можно
оценить с точностью до 3%, используя лишь величину ионной
силы. Если ввести подгоночный параметр, характерный для каж¬
дого иона, то величину коэффициента активности можно оценить
уже с точностью до 1%. Для ионов с более высоким зарядом воз¬
можны почти такие же хорошие результаты, если известны кон¬
станты равновесия ассоциации ионов и они учтены, наряду с Дру¬
гими константами, при решении задачи.При более высоких ионных силах величины коэффициентов ак¬
тивности могут изменяться в широком интервале; в этом случае
следует использовать экспериментальные значения средних коэф¬
фициентов активности. Последние табулированы для большин¬
ства 1 — 1- и 1—2-валентных электролитов, но коэффициент актив¬
ности иона в смеси электролитов может сильно отличаться от
среднего коэффициента активности в растворе одного электро¬
лита. В случае электролитов молярности, большей 1, ошибки, воз¬
никающие при оценке коэффициентов активности, обычно имеют
порядок самих значений коэффициентов активности; в этом случае
XII.1. Ионные взаимодействия365точнее и гораздо легче предположить, что концентрационная кон¬
станта равновесия (обычно измеряемая в интервале 1—4 М рас¬
твора NaClOi не зависит от ионной силы. Результаты, получен¬
ные в этом приближении, приводят не более чем к двукратным
ошибкам, если в расчет принимаются все равновесия, включая и
образование ионных пар.XII. 1. ИОННЫЕ ВЗАИМОДЕЙСТВИЯВ растворе, содержащем ионы, взаимодействие между части¬
цами растворенного вещества простирается на гораздо большие
расстояния, чем в растворе, содержащем нейтральные молекулы.
Следствием этого является то, что отклонения от идеальных зако¬
нов, которые предполагают независимость поведения частиц в
растворе друг от друга, наблюдаются в ионных растворах при го¬
раздо более низких концентрациях, чем в молекулярных раство¬
рах. В растворе сильного 1-электролита (например, NaCl) откло¬
нения от термодинамических законов идеальных растворов пре¬
вышают 5% уже при концентрациях ~0,002М, в то время как
в растворах, содержащих только нейтральные молекулы (напри¬
мер, этиловый спирт, ацетон), эти отклонения не превышают 5%
вплоть до концентраций ~ 1 М.Облегчает задачу теории то, что дальние электростатические
ионные взаимодействия в растворах зависят только от заряда
ионов и не зависят от их природы. Предполагая, что ионы являют¬
ся точечными зарядами в непрерывной среде с диэлектрической
постоянной, такой как у воды, Дебай и Хюккель получили теоре¬
тическое выражение для коэффициента активности иона в разбав¬
ленных растворах [см. раздел XII. 2, уравнение (5)]. Для раство¬
ров электролитов многочисленные измерения были выполнены не
только в воде, но и в других растворителях с иными диэлектриче¬
скими постоянными и при различных- температурах. В каждом
случае соотношение Дебая — Хюккеля выполняется, когда раствор
достаточно разбавлен. Дальние взаимодействия являются в основ¬
ном электростатическим притяжением противоположно заряжен¬
ных ионов и, следовательно, в разбавленных растворах активность
иона меньше, чем его концентрация.В более концентрированных растворах, однако, коэффициент
активности может проходить через минимум, а затем увеличи¬
ваться. Причиной этого могут быть как силы отталкивания между
одноименно заряженными ионами, так и то, что молекулы воды
первой гидратной оболочки существенно увеличивают эффектив¬
ный размер иона. Когда концентрация достигает значений, при
которых почти вся вода в растворе связана ионом,: коэффициент
активности может стать огромным. В растворе, содержащем
20 моль LiBr в 1000 г НЮ, коэффициент активности соли равен 485!
Зёб XII. I. Ионные взаимодействияОбразование ионных парКонечно, в таких концентрированных растворах ионы нельзя
уподобить точечным зарядам. Противоположно заряженные ионы
объединяются в пары, последние притягивают другие ионы и в ре¬
зультате образуются более сложные агрегаты из ионов; такая ас¬
социация есть результат уравновешивания сил отталкивания.
Вследствие этого коэффициент активности данного нона в концен-.трированных растворах за¬
висит от концентрации и
природы каждого иона дру¬
гого сорта в растворе.Для растворов, содержа¬
щих многозарядные ионы,
в которых происходит зна¬
чительное образование ион¬
ных пар, были предложены
многочисленные теоретиче¬
ские выражения для истин¬
но ионного коэффициента
активности и вычислены кон¬
станты равновесия ассо¬
циации ионов, с тем, чтобы
с их помощью описать остав¬
шуюся необъясненной со¬
ставляющую наблюдающе¬
гося отклонения от идеаль¬
ности. Это — хороший спо¬
соб представления отклоне¬
ний от идеальности в слу¬
чае, когда получающаяся константа ассоциации в разумной сте¬
пени не зависит от ионной силы.Приведенные на рис. XII. 1 данные ложатся на кривую 2, рас¬
положенную ниже теоретической кривой 1. Однако разумные до¬
пущения об образовании ионных пар могут привести к частичному
совпадению кривых. Кривая 2 была вычислена с учетом уравнения
равновесия:{ZnS04} 240 {Zn2+} {SO*-}Образование ионных пар происходит гораздо интенсивнее в
растворах с низкой диэлектрической постоянной (например, чис¬
тая уксусная кислота) и равновесные константы образования пар
в таких растворах могут быть очень большими. Основываясь толь¬
ко на потенциометрических измерениях, нельзя провести четкую
границу между ионной парой и ковалентным комплексом — для
этого необходимы еще другие доказательства. Например, полезныРис. XII. 1. Ассоциация иоиов в растворах.
Кривая 1 — теоретическая, основанная на теории
Дебая — Хюккеля для 2—-2-валентного электролита.
Точки — экспериментально определенные коэффи¬
циенты активности ZnS04. Если принять равно¬
весную константу образования для ассоциации
вонов равной 240, то расчетная кривая совпадает
с экспериментальной (2) вплоть до концентраций
2,5 т.
Различные концентрационные шкалы867кондуктометрические измерения, однако самые точные данные
дает спектрометрия. Ионы, ассоциированные в пары, имеют почти
те же инфракрасные или рамановские спектры, что и сольватиро-
ванные ионы в растворе, но спектры ковалентных комплексов
резко отличны от них. В расчетах равновесий обычно нет необхо¬
димости проводить различия между ионными парами и ковалент¬
ными комплексами. Это различие становится важным в оптиче¬
ских исследованиях, например, при спектрофотометрическом
определении pH.Коэффициенты активности отдельных ионовВ вычислениях, приведенных в этой главе, мы будем использо¬
вать уравнения для коэффициентов активности отдельных ионов
так, как будто бы их можно измерять. В принципе, если бы можно
было представить такой процесс, который позволил бы «извлечь»
некоторое число ионов из раствора, не нарушая его электроней¬
тральности, то можно было бы измерить коэффициент активности
отдельного иона.В действительности же можно измерить комбинацию коэффи¬
циентов активности, которая соответствует коэффициенту актив¬
ности индивидуального электролита. Например, в ячейкеPt | Н2 (г.) | Н+; СГ | AgCi (тв.) [ Agизмеренный потенциал дает сведения о произведении коэффици¬
ентов активности Н+ и С1-, но не о каждом из них в отдельности*.Если попытаться измерить отношения коэффициентов актив¬
ности отдельного иона при двух различных концентрациях, ис¬
пользуя две полуячейки с различной концентрацией, но одним и
тем же электродом, то оказывается, что возникает неопределен¬
ность, обусловленная градиентом потенциала в переходной обла¬
сти между растворами. Величина последнего — того же порядка,
что и ожидаемая разность потенциалов, обусловленная различием
коэффициентов активности.Однако, хотя коэффициенты активности отдельных ионов сами
по себе неизмеримы, в практических задачах они встречаются в
таких комбинациях, для которых эти определения возможны.XII. 2. ТЕОРЕТИЧЕСКИЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВАКТИВНОСТИРазличные концентрационные шкалыДля точного изучения растворов применяют три шкалы концент¬
раций: молярные доли, молярности и моляльности, а коэффициенты* Столь же надежно могут быть определены и отношения коэффициентов
активностей, но только одноименных ионов. (Прим. ред.)
368XII.2. Теоретические уравнения для коэффициентов активностиактивности можно рассчитывать, используя любую из них. В раз¬
бавленных водных растворах молярные доли используют редко;
чаще — моляльность (моли на 1000 г растворителя) и молярность
(моли на 1 л раствора).Каждый способ выражения состава имеет свои преимущества.
Для объемного анализа молярность предпочтительнее, так как
растворы можно приготовить, растворяя взвешенное количество
твердого вещества в воде и разбавляя до нужного объема. Для
точных термодинамических вычислений, однако, предпочтительнее
моляльность, поскольку она является отношением весов и не зави¬
сит от температуры и плотности раствора.Различие между молярностью и моляльностью в разбавленных
водных растворах мало — по сравнению с неопределенностью, воз¬
никающей при измерении констант равновесия или при оценке
коэффициентов активности. Поэтому и константы равновесия и
коэффициенты активности, вычисленные в любой из шкал, взаи¬
мозаменяемы. Например, различие между двумя шкалами кон¬
центраций следующее: 1 пг раствора NaCl содержит в 1000 г Н20
58,5 г NaCl; его плотность 1,0377 г/мл, а объем 1020 мл. В 1 л та¬
кого раствора содержится 0,980 моль NaCl. Коэффициент актив¬
ности NaCl в шкале моляльностей равен 0,658 и 0,670' в шкале
молярностей.При отсутствии экспериментальных величин коэффициент ак¬
тивности для рассматриваемого раствора можно оценить теорети¬
чески — он окажется равным 0,6—0,7 и с большей точностью
расчет провести невозможно. Ошибка, обусловленная оценкой ко¬
эффициента активности (15%), намного больше, чем ошибка, воз¬
никающая при применении неверной шкалы (2%).Теория Дебая — ХюккеляВсе теоретические выражения для коэффициентов активности
ионов основываются на выводах теории Дебая — Хюккеля. Основ¬
ная посылка этой теории состоит в том, что ионы можно предста¬
вить как точечные заряды в непрерывной среде с диэлектрической
постоянной, равной постоянной растворителя. Исходя из этого,
С некоторыми трудностями можно применить законы электроста¬
тики и термодинамики для получения предельного закона Дебая —
Хюккеля. Он справедлив в сильно разбавленных растворах для
любого полностью диссоциированного электролита и утверждает,
что для среднего коэффициента активности бинарного электро¬
лита с ионами зарядов г+ и 2_. Справедливо следующее выра¬
жение:— lg Y± = Az+z_ VI(1)
Теория Дебая—Хюккеля369Здесь /— ионная сила, равная полусумме концентраций каж¬
дого иона в растворе, умноженных на квадрат его заряда:(2)Константа А зависит от абсолютной температуры Т и диэлек¬
трической постоянной растворителя е:А = 1,825- 106 (еГ)—3/2Для водных растворов * при 25° С А = 0,509.Теория Дебая — Хюккеля позволяет также записать выраже¬
ние для коэффициента активности отдельного иона заряда z в
сильно разбавленных растворах:- lg y = Az2 VT (3)Хотя это выражение и нельзя проверить, но оно допустимо, так
как дает корректное значение для среднего коэффициента актив¬
ности:- 'В V± - * VT - Лг+z- VT (4)Сравнение с экспериментальными данными показывает, что
предельный закон выполняется при ионных силах менее 0,001 М.
При более высоких концентрациях коэффициенты активности,
предсказанные предельным законом, меньше экспериментально из¬
меренных.Намного более усложненный подход, основанный на тех же
предположениях о непрерывной диэлектрической среде и точечных
зарядах, но использующий в приближенном уравнении еще один
член разложения в ряд, дает расширенный закон Дебая — Хюк¬
келя. Для бинарного электролитаVT- Ig Y = Az z_ -==- (5)+ 1-f BaV Iи для отдельного ионаVI— lgY=/4z2 —. (6)1 +BaVT* Принятое значение диэлектрической постоянной для воды (78,54) дает
А = 0,5085, но недавние измерения с применением новой техники свидетель¬
ствуют о том, что диэлектрическая постоянная воды равна 78,30, а А =0,5115.
Так как почти все исследователи употребляли А — 0,5085, мы также приняли
это значение с целью согласования результатов. В монографии Робинсона и
Стокса использовано более высркое значение, которое дает у в моляльных еди¬
ницах. Для молярной шкалы А — 0,5092, т. е. различие пренебрежимо мало.
370Х/1.2. Теоретические уравнения для коэффициентов активностигде а — поправонный коэффициент, А (в первом приближении он
соответствует эффективному размеру гидратированного иона);
В — функция абсолютной температуры Т и диэлектрической по¬
стоянной е; при 25°С в воде: В *= 50,3(е7’)"'Л = 0,328.Кьелланд оценил значение параметра а для 130 ионов
(табл. XII. 1). В табл. XII.2 приведены значения коэффициентов
активности при разных ионных силах, вычисленных по уравнению
(6). Для температур, отличных от 25° С, или растворителей с дру¬
гим значением диэлектрической постоянной, следует использовать
другие значения А и В, однако' величина а существенно не ме¬
няется.rtРис. XII. 2. Расширенное уравнение Дебая — Хюк-
келя.Кривые рассчитаны по уравнению (5) для п=5, а=6 и
• а=7 А. Кружки, соответствующие экспериментальным
данным’эначеиий коэффициентов активности для HCI, на¬
ходятся внутри областей. Предельный закон (а=0 А)[уравнение (1)] гораздо хуже описывает эксперименталь¬
ные данные.Кривые, вычисленные по уравнению (5) для трех различных
значений а, приведены на рис. XII. 2. Экспериментальные данные
для среднего коэффициента активности НС1 изображены круж¬
ками. Если а — б А, ошибка, возникающая при вычислении по
уравнению (5), меньше, чем 1% для ионных сил <0,2 т. Значе¬
ние а = 6 А — среднее из тех, которые приведены в табл. XII. 1
для Н+ (9А) и С1" (ЗА). Предельный закон [уравнение (1)] соот¬
ветствует этим данным очень плохо, что приводит к ошибке 10%
при вычислении для ионных сил 0,1 г.Для оценки неизвестных коэффициентов активности Гюнтель-
берг предложил выбрать а, равное 3 А; это приводит к:- lg Y± = Az+z_ (7)'
Теория Дебая—Хюккеля371Таблица XII.1Значения параметра аДанные: J. К i е 1 1 a n d, J. Am. Chem. Soc., 59, 1675 (1937).ИоныОднозарядныеН+(С6Н5)2СНСОО- (C5H7)4N+OC6H2(NOa)7, (c3h7)3nh+, СН3ОС6Н4СОО-Li\ СвН6СОО-, СвН4ОНСОО-, С6Н4С1СОО-, с6н6сн2соо-
СН2СНСН2СОО-, (сн3)2сснсоо-, (c2h6)4n+, (c3h7)2nh+СНС12СОО", CCl3COO“, (c2he)3nh+, (c3h7)nh+Na+, CdCl+, C102,I0“ HCO-H2PO-HSO- H2AsO"
C0(NH3)4(N02)+ CH3COO- CH2ClCOO- (ch3)4n\(c2hs)2nh+ nh2ch2coo- +nh3ch2cooh, (ch3)3nh+,
c2hsnh+OH~, F~, CNS”, CNO", HS-, CIO" CIO" BrOJ, I0~MnO" к+, с Г, Вг", Г, CN", N02, NO", Rb+NH+ Tl+, Ag+, HCOO- H2(citrate)“ CH3NH+,(CH3)2NH2ДвухзарядныеMg2+, Be2+(CH2)6(COO)2~, (CH2)6(C00)2-, (конго красный)2-
Ca2+, Cu2+, Zn2+, Sn2+, Mn2+, Fe2+, Ni2+, Co2+,c6h4(coo)2- н2с(сн2соо)22- (CH2CH2COO)2'Sr2+, Ba2+, Ra2+, Cd2+, Hg2+, S2-, S2-, WO2-, Pb2+, CO2-,SO*', Mo04~, Co(NH3)ECl2+, Fe(CN)6N02“, H2C(C00)2-,
(CH2C00)2-, (CHOHCOO)2-, (COO)2-, H (цитрат)2-Hg2+, SO2-, S202-, S202-, SeO2-, CrO2", HPO2-, S202"
ТрехзарядныеAl3+, Fe3+, Cr3+, Sc3+, Y3+, La3+, In3+, Ce3+, Pr3\ Nd3+, Sm3+
Со(ЭДТА)|+Цнтрат<-3>РОГ, Fe(CN)3-, Cr(NH3)3+, Co(NH3)3+, C0(NH3)6H203+
372.XI1.2. Теоретические уравнения для коэффициентов активностиПродолжениеИоныЧетырехзарядные
Th4+, Zn4+, Се<\ Sn4+
Co(S203)(CN)r
Fe(CN)rПятизарядныеCo(S203)2(CN)r1165T а б л и ц a XII.2Коэффициенты активности отдельных ионов,
вычисленные из расширенного уравнения Дебая— Хюккеля
(вода, 26 °С)Ионная силаа0,0010,00250,0050,010,0250,050,1Одиозарядные90,9670,9500,9330,9140,880,860,8380,9660,9490,9310,9120,880,850,8270,9650,9480,9300,9090,8750,8450,8160,9650,9480,9290,9070,870,8350,8050,9640,9470,9280,9040,8650,830,7940,9640,9470,9270,9010,8550,8150,7730,9640,9450,9250,8990,850,8050,755Двухзарядные80,8720,8130,7550,690,5950,520,4570,8720,8120,7530,6850,580,500,425fi0.8700.8090,7490,6750,570,4850,40550,8680,8050,7440,670,5550,4650,3840,8670,8030,7400,6600,5450,4450,355Трехзарядные90,7380,6320,540,4450,3250,2450,1860,7310,6200,520,4150,280,1950,1350,7280,6160,510,4050,270,180,115л**0,7250,612П.5050,3950,250,160,095Четырехзарядные110,5880,4550,350,2550,1550,1060,5750,430,3150,210,1050,05550,570,4250,310,200,100,0480,0650,0270,021
Эмпирические выражения373Уравнение (7) дает слишком малые значения для многих
электролитов. Лучший результат можно получить, если выбрать
из табл. XII. 1 значение а для иона того же заряда и сходного по
химической природе.Так как с увеличением коэффициента а возрастает значение
коэффициента активности, Гуггенгейм предложил выбрать для а
постоянное значение, равное ЗА, а для лучшей аппроксимации
данных добавить линейный член, приводящий к другому уравне¬
нию с одним параметромкоторое намного проще для интерполяции или экстраполяции из¬
меренных значений у±, чем уравнение (5).Используя значение b для ряда 1—1-валентных и 1—2-валент¬
ных электролитов, Дэвис предложил уравнениеМногие авторы предпочитали применять для оценки коэффи¬
циентов активности отдельных ионов уравнение (10), а не данные
табл. XII. 1 и XII. 2.На рис. XII. 3 коэффициенты активности, вычисленные по урав¬
нению Гюнтельберга (7) и уравнению Дэвиса (9), сравниваются
с экспериментальными данными для НС1, HNO3, NaC104 и КС1.
Значения, предсказанные уравнением Гюнтельберга, слишком низ¬
ки, но значения по уравнению Дэвиса разумно оценивают коэф¬
фициенты активности. При ионной силе 0,1 М ошибка меньше 3%,
а при ионной силе 0,5 М — меньше 8%.Уравнение Дэвиса очень удобно для быстрого вычисления; на
рис. XII. 4 приведена номограмма, использующая уравнение (10).
Уравнение Дэвиса предсказывает минимум для у при 0,8М, так
что для ионных сил в интервале между 0,5 и 1,5 М в качестве гру¬
бого приближения можно принять значение коэффициента актив¬
ности для 0,5М. Тем не менее, специфические взаимодействия ме¬
жду ионами делают эту оценку очень ненадежной.Эмпирические выражениякоторое для отдельных ионов принимает вид:(10)
374 XII. 2. Теоретические уравнения для коэффициентов активности,При концентрациях выше 0,1 М соотношения Дебая — Хюккеля
[уравнение (5)] или Гуггенгейма [уравнение (8)] гораздо хуже
описывают экспериментальные данные. Более точное соответствие
с этими данными может быть достигнуто, если применить уравнение7+Рис. XII. 3. Сравнение различных эмпирических
выражений для коэффициента активности с экспе¬
риментальными данными для НС1 (□), НЖ)3 (+),NaClO^A) и КС1 (О).Предельный закон Дебая — Хюккеля [уравнение (1)] плохо
соответствует Данным; кривая же уравнения Гюнтель-
берга (7) лежит ниже всех экспериментальных данных;
уравнение Дэвиса (9) соответствует экспериментальным
результатам весьма точно.с несколькими поправочными параметрами. В одном из возмож¬
ных уравнений добавлено несколько членов к соотношению Гуг¬
генгейма: _lg v± = — Az+z_ ^ ^yj + Ы + cl2 + dP + ...Чем больше применено поправочных параметров, тем более
точные данные могут быть получены, но значения, приданные па¬
раметрам, менее значимы. По этой причине многие авторы пред¬
почитают непосредственно табулировать экспериментальные ре¬
зультаты для ионных сил выше 0,1 М.Использование перхлората натрия для
поддержания постоянной ионной силыИзмерения в растворах смесей электролитов указывают, что
коэффициент активности катиона определяется в первую очередь
природой анионов в растворе и мало зависит от природы других
Использование перхлората натрия для поддержания постоян. ионной силы 375катионов. На этом основано применение среды с постоянной ион¬
ной силой при определении констант образования комплексов.
Пока в растворе концентрация ЫаСЮд больше концентрации лю-Ю'ю* ю~3о
X
. 250,010,020,05Vг0-2as-lg y«<V>09 z-■4• •2J0,010,050,100,200,30
0,40
0,SO0,600,700,800,900,35Рис. XII. 4. Номограмма для вычислений коэффициентов активности поуравнению Дэвиса (10).Приблизительные предельные ошибки для 1—1-валентных электролитов:±1% ниже /=0,05; ±3% прн /=0,1; ±10$б при /—0,5.бого другого электролита, коэффициент активности одновалент¬
ного катиона будет таким же, как и у его перхлоратной соли, а
коэффициент активности одновалентного аниона будет тем же,
что и для его натриевой соли.
376 XII.2. Теоретические уравнения для коэффициентов активностиМногозарядные ионы образуют слабые перхлоратные комплек¬
сы (это было показано на примере равновесия Hgf+—Hg2+), но
в концентрированном растворе перхлората нельзя различить с по¬
мощью потенциометрических измерений или измерений раствори¬
мости перхлоратные лиганды и лиганды воды *. Как видно из
рис. XII. 3, уравнение Дэвиса хорошо описывает данные о среднем
коэффициенте активности перхлората натрия, так что значения
коэффициентов активности в растворах NaC104 должны достаточно
хорошо оцениваться по уравнению Дэвиса.Коэффициенты активности незаряженных молекулПри концентрациях, меньших 0,1 М, активность незаряженных
частиц в растворе отличается от концентрации на величину ~1%
И, следовательно, коэффициент активности незаряженной моле¬
кулы при расчетах равновесия можно принять равным 1.Для незаряженных молекул с концентрацией, меньшей 0,5 М,
в растворах с ионной силой до 5М выполняется уравнение:
\gy0 = kl. Коэффициенты активности незаряженных молекул обы¬
чно больше 1. Коэффициент высаливания 0,1 для малых мо¬
лекул, но он больше для больших органических молекул (напри¬
мер, углеводы и протеины). Некоторые незаряженные молекулы
(например, HCN) всаливаются (k отрицательно) и имеют коэф¬
фициенты активности, немного меньшие 1.Вопросы1. Рассчитайте средний коэффициент активности 0,1 М раствора NaN03, ис¬
пользуя данные табл. XII. 2, предельный закон Дебая — Хюккеля [уравнение (1)],
уравнение Гюнтельберга (7) и уравнение Дэвиса (9). Сравните с найденным
экспериментально значением 0,762.2. Рассчитайте средний коэффициент активности 0,1 М раствора MgCh, ис¬
пользуя различные методы, описанные в книге. Сравните с экспериментальным
значением 0,528.3. Покажите, что если для вычисления коэффициентов активности применено
уравнение Дэвиса, то значение pH кислоты HAZ+ определяется следующим вы¬
ражением:PH = Р*2 + lg + (2, - 1) (0,509) (_£Z__0,2/)где p/C® — константа ионизации кислоты при 25 °С и бесконечном разбавлении.4. Выведите уравнение для константы ионизации Ка NH* по кислотному
типу, учитывая, что рЛГ„ = 9,245. а коэффициент активности аммиака в воде при
25 °С определяется выражением:*£ Vnh3 ~ 0.12/* Доказательство справедливости положения о электрохимической неразли¬
чимости лигандов можно найти в работе А. А. Пендина и И. Н. Кузнецовой
Шести. ЛГУ, № 16, 32 (1971)].
XII. 3. Использование коэффициентов активности при расчете равновесий 3775. Выведите уравнение зависимости общей константы образования ком¬
плекса M(NH3)* от ионной силы.6. Покажите, что константа образования К(тв)2 комплексного иона MC1J из
твердой соли MCI почти не зависит от ионной силы.7. Пользуясь методикой, описанной в разделе IX. 4, постройте номограмму
для уравнения Дэвиса (рис. XII. 4).XII. 3. ИСПОЛЬЗОВАНИЕ КОЭФФИЦИЕНТОВ АКТИВНОСТИ
ПРИ РАСЧЕТЕ РАВНОВЕСИЙХотя экспериментальные данные для средних коэффициентов
активности можно скомбинировать так, чтобы получить значения
равновесных концентрационных констант в сложных смесях элек¬
тролитов, в большинстве случаев получаемая точность не оправ¬
дывает громоздких вычислений. В рассматриваемых ниже приме¬
рах коэффициенты активности вычислялись либо с помощью рас¬
ширенного уравнения Дебая — Хюккеля (см. табл. XII. 1 и XII. 2),
либо уравнения Дэвиса. Каждый из примеров выбран так, чтобы
вычисленное значение можно было бы сравнить с эксперимен¬
тально измеренным. Кроме того, рассматриваются простые си¬
стемы, для которых были определены константы равновесия. Если
в значениях констант равновесия имеется значительная неопреде¬
ленность или если для некоторых комплексов они неизвестны, то
обычно нет необходимости в расчетах поправки на коэффициенты
активности.Пример XII. 1. При изготовлении стандартного буферного раствора 0,025 моль
КН2Р04 и 0,025 моль Na2HP04 растворяют в воде, затем раствор разбавляют
до 1 л. Рассчитайте pH раствора, приняв для фосфорной кислоты при нулевой
ионной силе рКф-— 7,198 . Равнонесие описывается выражением:[Н+][НРОГ]тн+Унро2- = 6,34. 10-“[H2P07]yh pQ_ (1)4 2 4Если пренебречь значениями [Н+], [ОН-], [Н3Р04] и [Р04-], то уравнение
условия материального баланса может быть приближенно записано в виде:[HPOJ-] = [Н2РО;] = 0,0250 (2)Ионная сила раствора/ = Чг ([К+] + [Na+] + [Н2Р07] + 4 [HPOf] ) = 0,100 (3)Из табл. XII. 1 следует, что для Н2Р07 н НР04“ а = 4, а нз табл. XII.2
находим:Y =0,77; Y 2 =0,355
ирсг НРО*R. G, Bates, S. F. Ас гее, J. Res. Natl Bur. Stand., 30, 129 (1943).
378 XIIЯ. Использование коэффициентов активности при расчете равновесийПодставляя эти значения вместе, с уравнением (2) в выражение (1), по¬
лучим:YH+ [Н+] = 1,37 • 10 7; pH = -lgvH+[H+] = 6,862Значение pH этого буферного раствора, принятое Национальным бюро стан¬
дартов США, равно 6,86 ± 0,005.Таким образом, мы рассчитали правильное значение pH в пределах ошибки
эксперимента.Ошибки, обусловленные пренебрежением некоторыми другими частицами в
уравнении материального баланса, очень малы. Используя константы равновесия
из табл. VII. 1, приблизительно получаем:[Н+]= 1,4-10“7 [ОН-] = 7,О.Ю-8[НэР04] = 5,0 • 10-7 [РО®-] = 8,3 • 10-8Пренебрежение величинами этих концентраций в уравнении (2) приводит к пре¬
небрежимо малой ошибке в 0,002%.Пример XII. 2. Рассчитайте pH стандартного буферного раствора, содержа¬
щего 0,05 моль!л кислого фталата калия (^КНА), используи наиболее достоверные
среди известных значения констант ионизации фталевой кислоты *К°, = 1,123 -10-3; = 3,906 • 10“®где верхний индекс 0 введен для различения констаит, полученных путем экстра¬
поляции к нулевой ионной силе, от концентрационных констант при конечной
ионной силе.Для вычисления коэффициентов активности нужно знать ионную силу; по¬
этому выполним предварительные вычисления, предполагая, что константы рав¬
новесия не зависят от ионной силы.Запишем уравнения условийравновесия[Н+] [НА-] = Kai [Н2А] (1)[н+] [А2-] = K'ai [НА“] (2)материального баланса[Н2А] + [НА-] + [А2"] = С = 0,0500 (3)Уравнение протонного условия получается из уравнений условий материаль¬
ного баланса и электронейтральностн:[Н+] + [Н2А] = [А2~] + [ОН~] ‘ (4)Поскольку раствор кислый, то величиной [ОН'] в выражении (4) можно пре¬
небречь.В уравнении (3) член [НА'] является доминирующим. Учитывая эти допу¬
щения и комбинируя выражения (1)—(4), получаем:М'-тй&г ®Принимая КаХ — K°i и /Са2 = для С = 0,05из уравнения (5) находим:[Н+] = 6,55* 10-5* W. J. Hamer et al„ J. Res. Natl Bur. Stand., 35, 381, 539 (1945).
XII. 3. Использование коэффициентов активности при расчете равновесий 379Из выражений (1) и (2), принимая [НА-] = 0,05, имеем:[Н2А] — 2,91 • 10 3; [А2-] = 2,98-10“3Из выражения (3) получаем более точное значение для [НА-]:[НА-] = 4,41 • 10 *Теперь вычислим ионную силу:/ = i/a ( [К+] + [НА-] + 4 [А2-] ) = 5,30-10~!Найденная величина ионной силы позволяет рассчитать и коэффициенты
активности по уравнению Дэвиса (10)V^HA-^0’812'’ V- О’441Так как частица НгА электроиейтральиа, можно принять ее коэффициент
активности равным 1. Тогда концентрационные константы равновесия равны:Vh2a= Ь™4 -Ю"3 „VH+ НА”^2 = <2v-Hf- = 8.85-10-6YH"YA2-Подставляя этн значения в выражение (5), получим:[Н+] = 1,208- 10-4; pH = — lg у . [Н+] = 4,008нБританский стандарт, по которому устанавливается шкала pH — это 0,05 М
раствор кислого фталата калия; для этого раствора справедливым считается
уравнение:pH-4,000 + .,, (-til)’где t — температура, °С.При 25 °С pH = 4,005, что очень хорошо согласуется с вычисленным нами
значением.Ощутимое влияние на ответ оказывает только выбор значения YA2_; таккомбинация всех вышеприведенных уравнений дает следующее уравнение, опре¬
деляющее pH:РН =■ — ValS [zf0 TfO*'al*'a2Другие коэффициенты активности входят в малый поправочный член Kai/C.
Если использовать расширенное уравнение Дебая — Хюккеля, приняв а = 6,
В соответствии с табл. XII. 1, то получим:Ya2_ = 0,478; pH = 4,025Этот результат ие слишком хорошо согласуется с нашим, однако он еще
находится в пределах ошибки большинства экспериментальных измерений.Пример XII. 3. Рассчитайте произведение растворимости хлорида серебра в
растворах индифферентной соли с концентрациями от 0 до 5 М, предполагая,
что коэффициенты активности удовлетворяют уравнению Дэвиса. Наилучшее
значение константы при бесконечном разбавлении рЛ"^ 0 = 9,749 .* В. В. О w е п, J. Am. Chem. Soc., 60, 2229, 2233 (1938).
380 XII.3. Использование коэффициентов активности при расчете равновесийКонцентрационная константа равновесия связана с термодинамической кон¬
стантой через коэффициент активности:*?тв) 0= [Ag+] [СГ] y2± = tf(TB, oY±Коэффициенты активности можно оценить по уравнению Дэвиса:-|„1-ода(7^т-ци)и, следовательнорЯ(гв) о = 9,749 - 1,018 - -у= -0,2/Л1 + VIКривая на рис. XII. 5 соответствует этому уравнению. На том же рисунке
приведены результаты экспериментов рэда авторов. Вероятно, результаты Ле-дена в растворах NaC104 и
NH4CIO4 наиболее надежны. Вы¬
вод, который следует из этих дан¬
ных, состоит в том, что ошибка при
вычислении произведения раство¬
римости, вследствие применения
уравнения Дэвиса, вероятно, не
больше ошибки, вызываемой спе¬
цифическими эффектами среды и
экспериментальными ошибками.Пример XII. 4. Рассчитайте
растворимость AgCl в 0,1 М рас¬
творе КС]. Константы образования
различных хлоридных комплексов
серебра, измеренные в 0,2 М рас¬
творе NaC104, следующие:к{тв) 0 = 3,80. Ю-10;^С(тв) ] = 2,5 *10 ;я (тв) 2 = 2,о- ю-5;*(тв) 3 = 4,0.1 о-5;/С(ТВ) 4 = 3,0-10"4Для того чтобы ввести в эти значения поправку на ионную силу, равную
0,1 М, вычислим сначала коэффициенты активности по уравнению Дэвиса:Заряд иона 0,1 М 0,2М1 0,772 0,7282 0,360 0,2803 0,097 0,058. Затем приравняем выражения для термодинамических констант равновесия
для двух ионных сил:*?т», о = [Agl [СГ] YAg+Ycr = К(тв)0Y1К(тв) о (0.772)2 = (3,80 • Ю-10) (0.728)2 = 3,38 • Ю-10* Е. В е г п е, I. Leden, Svensk Кега. Tidskr., 65, 88 (1953).Рис. XII. 5. Зависимость произведений
растворимости хлорида серебра от ионной
силы в растворах NaC104 (О), NH4C104
и HN03, KN03, NaN03, NaC104 (+). (Дан¬
ные заимствованы у I. L е d е п a. oth.,
Svensk kem. Tidskr., 64, 249 (1952); 65, 88
(1953); Acta Chem. Scand., 15, 1141 (1961).
XII. 3. Использование коэффициентов активности при расчете равновесий 381Так как логарифм коэффициента активности незаряженной молекулы AgCi
должен линейно зависеть от ионной силы, можно провести экстраполяцию, ис¬
пользуя значение Кцв)1 = 1,00- 10'7, полученное для 5 М раствора NaC104.Зная /(<„,, для ионных сил 0,2 и 5 М, вычислим значение коэффициента
высаливания AgCi:Полученное значение вполне разумно.Величину /С(тв)1 для ионной силы 0,1 М можно вычислить, испвльзуя k:ptf(TB) 1 - (0,083) (0,1) = 6,60 - (0,083) (0,2) = 6,59AT(tb)i= 2,56 - 10“7Она почти такая же, как и для I — 0,2 М.Величина К(тв)2 не должна зависеть от ионной силы растворатак как коэффициенты активности двух одинаковозаряженных ионов почти рав¬
ны. Никакого наблюдаемого различия в обнаружено не было при изме¬
нении ионной силы среды от 0,2 до 5,0 М NaCI04.Величина К(тв)з зависит от ионной силы; ее можно найти с помощью ко¬
эффициентов активности, табулированных ранее:Подобным же образом вычислим К(твц, используя ' коэффициенты актив¬
ности:Растворимость AgCi получаем из уравнения условия материального ба¬
ланса для серебра:Полагая [С1 ] = 0,1 и используя вычисленные выше значения для констант
I = 0,1, получаем:S — 3,38 • 10~s + 2,56 • 10~7 + 2,00 • 10~в + 3,50 • 10“7 + 2,14 • 10"7 = 2,82 • 10-вS = 2,82 • 10-8Р^(тв) 1 Р*(тв>1 Yo Р^(тв) 1 ^7,00 - 5,0й = 6,60 - 0,2*; k = 0,083ходим:3,50 -10-5s = [Ag+] + [AgCi] + [AgClj] + [AgClJ-] + [AgCir]После подстановки условий равновесия находим:
382 XII. 3. Использование коэффициентов активности при расчете равновесийЭта величина в точности согласуется с измерениями Пинкуса и Тиммер-
манса *, которые получили значение растворимости 2,82 • 10_6 моль!л в 0,1 М рас¬
творе КС1. Данные для НС1, LiCl, NaCl немного различаются, хотя по нашим
расчетам они должны быть одинаковыми. Средние коэффициенты активности
этих электролитов могут быть скоррелированы с растворимостью AgCl в них:S-106, МОЛЬ/Л у±КС1 2,82 0,770 LiCl 2,90 0,790НС1 3,02 0,796 NaCl 2,92 0,778Корреляция хороша для всех веществ, кроме NaCl. Возможно, эти данные
отражают специфическое ионное взаимодействие, но, вероятно, они просто от¬
ражают экспериментальную ошибку.Другое измерение растворимости хлорида серебра в 0,1 М NaCl было сде¬
лано Джонтом и Мартином **, которые получили 3,15 • 10'“ моль/л. Они, однако,
отделяли твердую соль от раствора центрифугированием, и все твердые части¬
цы, не осевшие на дно пробирки, анализнровалн совместно с растворенным хло¬
ридом серебра. Это объясняет некоторую завышенность их данных по сравне¬
нию с вычисленными нами или найденными Пинкусом и Тиммермансом.Пример XII. 5. Рассчитайте формальный потенциал полуреакции
Fe(CN)“3 + е~ Fe(CN)J~в 0,1 М растворе НС1.Стандартный потенциал при бесконечном разбанлении равен 0,356 в. Ион
ферроцианида образует протонированные формы:[HFe(CN)3e-] у3 = 1,48. 104 [Н+] [Fe(CN)g-] YH+Y4
[H2Fe(CN)82-] V2 = 1,0* 102 [H+] [HFe (CN63“)] YH+Y3Феррицианид-ион не образует устойчивых кислых комплексов. Формальный
потенциал Еф определяет^ через аналитические концентрации, но стандартный
потенциал Е°—через активности. Уравнение Нернста в любой форме должно
дать один и тот же измеряемый потенциал:В - 4 - 0,05915 le lFe,CN>i~l+ fT(CN>-4 + tH-Ff(£N>n _4 [Fe(CPirIrFe(CN)f] y4
= 0,356 - 0,05915 lg -j 5-4-i-[Fe(CN)r]v3Если подставить равновесные константы образования кислотных комплексов,
то получим:El = 0,356 + 0,05915 lg (-25- + 1,48 • 104 [Н+] у + 1,48 • 108 [Н+]2 у2 ^)* \ V4 н п У2 /Из табл. XII. 1 следует, что для Fe(CN)j~ а = 4, для Fe(CN)g~ а = 5 идля Н* а = 9. Принимая для кислых комплексов а = 4, получим из табл. XII. 2
для ионной силы 0,1 Af следующие величины:Y2 •= 0,355; Y3 = 0,095
Y4*= 0,021; Yh+ = 0.83I * 1 Г1Полагая [Н+] = 0,1 и используя эти значения коэффициентов активности,
получим: о
Еф — 0,569* A. Pinkus, А. М. Timmermans, Bull. Soc. chim. Belg., 46,46 (1937/.** J. H. Jonte, D. S. Martin, J. Am. Chem. Soc., 74, 2052 (1952).
Вопросы383Эта величина может быть сравнена со значением 0,56, измеренным эксперимен¬
тально в 0,1 М НС1 *. Влияние коэффициента активности в этом случае, как и
во многих других, относительно мало по сравнению с влиянием комплексообра¬
зования.Хотя рассмотренные примеры были выбраны ввиду хорошего
согласия э-кспериментальных и вычисленных данных, они хорошо
иллюстрируют и то, что при соответствующих обстоятельствах
можно предсказать значения pH, растворимости и электродных
потенциалов так же точно, как и измерить их экспериментально.Вопросы8. Рассчитайте pH буферного раствора, приготовленного смешением 50 мл0,1 М раствора КН2РО4 и 29,1 мл 0,1 М раствора NaOH с последующим разбав¬
лением до 100 мл.9. Рассчитайте pH буферного раствора, приготовленного смешением 50 мл0,1 М раствора кислого фталата калия и 22,3 мл 0,1 М раствора НС1 с после¬
дующим разбавлением до 100 мл.10. Рассчитайте растворимость AgCl в 0,1 М растворе NaCIOj.11. Рассчитайте растиоримость AgCl в 0,05 М растворе КС1.12. Рассчитайте формальный потенциал пары ферроцианид — феррицианид
в буферном растворе, содержащем 0,05 моль/л СНзСООН и 0,05 моль/л
CHjCOONa. Для СНзСООН при бесконечном разбавлении Ка — 1,754 • 10~5.13. Рассчитайте растворимость AgBr в растворе 3,02 М аммиака при 25 °С,
используя нижеприведенные константы для нулевой ионной силы:[AgNHj] = 2,06 • 103[ Ag+][NH3][Ag(NH3)+]= 1,70- 107[Ag+][NH3]2[AgOH] = 2,0 • 102[ Ag+][OH~J[NH+J[OH"j = 1,77 • 10~5[NH3][Ag+][Br~] = 4,57 • Ю-13[AgBr] = 1,095- 10~8[AgBrj] = 1,00 • 10~5 [Bri; [AgBr^] = 4,46 • 10"5 [Вг“Г[AgBr3-] = 2,5 • 10—4 [Br-]3.В 1 M растворе NH4CIO4, насыщенном AgBr:[AgNH3Br] = 4,5 • 10~5 [NH3][AgNHgBrjj = 8 - lO-5 [NH3][Br“][AgNH3Br2-] = 2,0 - lO"4 [NH3] [Br-]2
[ Ag(NH3)2Br] = 4,3 • 10-=[NH3]2
[Ag(NH3)2Br2] = 5,0 • 10-5[NH3]2[Br']'-Используйте значения коэффициентов высаливания, равные 0,12 для NHs
и 0,08 для AgBr. Посмотрите, для какого равновесия важно знать точные зна¬
чения констант.14. Рассчитайте растворимость AgBr в растворе, содержащем 3,58 маль/л
NH3, 0,5 моль/л NHtBr и 0,5 моль/л NH4CIO4.15. Нэр и Нэнколлас (J. Chem. Soc., 1958, 4144) измерили потенциал ячейки
Pt I Н2 (г.) | HCI (/и,), H2S04 (m2) I AgCl | Ag* I. M. Kolthof {, W. J. Tomsicek, J. Phys. Chem., 39, 955 (1935).
384ХНА. Шкала pH и ее расширениестандартный потенциал которой Е° = 0,22239 в при 25 °С. Если ыоляльность НС1
т1 = 5,7665 • 10~3, а моляльность H2SO4 т2 = 10,1000 • 10~3, измеряемый потен¬
циал ячейки равен 0,46218 в. Пользуясь для вычисления коэффициента актив¬
ности уравнением Дэвиса, найдите термодинамическую константу равновесияРеаКЦИИ: изо; ^ Н+ + sOf-Если измеренные потенциалы определены с точностью до 3-10~5 в, а моляльно-
сти — до ± 1 ■ 10_6, то какова ошибка определения константы равновесия (в %)?
Константы, определенные для различных растворов, разнятся на ±4%. Чему
приписать остальную часть ошибки?16. В главе IV мы полагали коэффициенты активности равными 1. Однако,
на самом деле следует использовать следующие выражения:РН = — lg [Н+] y_|_ и [Н+][0Н-Ь+у_ = *н2ОЛ^огде Nh2o — доля воды от общего числа присутствующих молей.Более строгое рассмотрение по сравнению с таковым в главе IV состоит в
том, что коэффициенты активности всех одновалентных ионов находятся в одной
и той же функциональной зависимости от иониой силы (у+ = у~). Покажите, что
в рамках этого допущения добавка соли сильной кислоты и сильного основания
к чистой воде не изменит pH более, чем иа 0,01 до тех пор, пока концентрация
соли ие достигнет 1 моль/л.XII. 4. ШКАЛА pH И ЕЕ РАСШИРЕНИЕВведенная ранее величина pH была определена как отрица¬
тельный логарифм активности иона водорода, причем активность
водорода была принята равной его концентрации. Во всех слу¬
чаях, кроме примеров раздела XII. 3, с успехом использовалось
приблизительное соотношение: pH = —lg[H+].Для расчета pH из измеренных констант равновесия знание
точных значений коэффициента активности водородного иона не¬
обязательно, так как этот коэффициент всегда присутствует в ком¬
бинации с концентрацией иона водорода:pH = — lg {Н+} = — lg [Н+] yh+Если приходится иметь дело со сложными системами, то удоб¬
нее пользоваться значениями Yh+> взятыми из табл. XII. 1 или по¬
лученными по уравнению Дэвиса, предполагая, что конечный
результат будет не очень зависеть от выбранного значения.Как было показано в примере XII. 2, концентрация иона водо¬
рода входит и в условие равновесия в комбинации с коэффициен¬
том активности и в условие материального баланса, где она обыч¬
но является небольшим поправочным членом к аналитическим
концентрациям. Когда вычисляют pH, точное значение [Н+], при¬
меняемое для введения этих малых поправок, не слишком важно,
и можно использовать любое разумное значение для Yh+- В усло¬
вие равновесия коэффициент активности иона водорода вводят
тогда, когда вычисляют концентрационную константу, но он ста¬
новится не нужным при вычислении pH с помощью [Н+]. Однако
Потенциометрические измерения pH385не все коэффициенты активности, применяемые для получения
концентрационных констант, исчезают, и очень часто ответ зависит
от значения, выбранного для этих коэффициентов.Потенциометрические измерения pHВеличину pH обычно измеряют либо потенциометрически, либо
спектрофотометрически. Потенциометрические методы — самые лег¬
кие, а рН-метр очень прост в обращении.Однако не всегда легко установить, насколько точно эти потен¬
циалы соответствуют активности иона водорода в растворе.Измерения стандартных буферных растворов производили в
ячейках без переноса (без жидкостного контакта между полуэле-
ментами), подобных следующим:Pt !Н2 (г.) |Н+, К+, НА, А'СГ |AgCI (тв.) ! AgСогласно уравнению Нернста, потенциал этой ячейки опреде*
ляется:Е = Е° - 0,05915 lg [Н+] [СГ] vH+YcrpH —18 [Н*1 V - fiffir + >« 1°!-} + ’« VОпределение pH из этих значений потенциала требует оценки
коэффициента активности иона хлора. Некоторые исследователи
для оценки Ycr предпочитают использовать теоретическое выра¬
жение для коэффициента активности отдельного иона. Другие же
применяют экспериментально определенные средние коэффициен¬
ты активности для некоторых стандартных электролитов, обычно
НС1 или КС1. Для растворов с ионной силой, меньшей 0,1 М,
ошибка эксперимента — величина того же порядка, или большая,
чем различия, обусловленные различием методики оценки Ycr-
Последнее означает, что pH стандартного буферного раствора
можно определить достоверно, если раствор не слишком концен¬
трированный.Поскольку pH некоторых стандартных буферных растворов
определены, можно определить эмпирическую шкалу pH, если
стандартизовать рН-метр по одному или нескольким стандартным
буферным растворам. В этом случае зависимость pH от измерен¬
ного потенциала определяется следующим выражением:рн-рН„+-|^ (25.С)где Е — потенциал, измеренный в неизвестном растворе; Ест —
потенциал, измеренный в стандартном буферном растворе
с pH = рНст-До тех пор, пока исследуемый раствор сходен по составу с бу¬
ферным раствором, использованным для стандартизации, это эмпи¬13 Зак. 345
386XII.4. Шкала pH и ее расширениерическое значение pH довольно хорошо соответствует теоретиче¬
скому значению последнего. Однако для измерений, выполненных
при резко отличных ионных силах, в очень кислых или щелочных
"средах, в неводных растворителях или в коллоидных смесях, та¬
ких как кровь или почва, можно ожидать лишь грубой качествен¬
ной корреляции с теоретическим значением pH.Во многих случаях единственное, что необходимо — это воспро¬
изводимое указание на кислотность среды. Примером может слу¬
жить титрование кислот и оснований в неводных растворах, кото¬
рое с помощью стеклянного электрода, как индикатора конечной
точки выполняется вполне успешно. Однако теоретические расчеты
подобных кривых титрования по константам равновесия или вы¬
числение констант равновесия по таким кривым очень сложно.
Это требует не только знания того, насколько стеклянный элек¬
трод чувствителен к присутствию различных частиц в неводных
растворах, но и учета весьма большого контактного потенциала
жидкостного перехода между стандартным электродом (насыщен¬
ный раствор КС1 в воде) и неводным раствором.Спектрофотометрическое измерение pHЗадолго до появления потенциометрических методов для изме¬
рения pH применили индикаторы. Современные спектрофотометри¬
ческие методы позволяют измерять pH с помощью индикаторов
столь же точно, как и потенциометрические, а в некоторых слу¬
чаях они оказываются и более полезными. Если спектр поглоще¬
ния индикатора определен для сильнокислого и сильнощелочного
растворов, величину поглощения при данной длине волны кислой
или основной формой индикатора можно связать с их концентра¬
циями. При наличии соответствующей калибровочной кривой в
любом растворе можно определить соотношение концентраций
кислой и основной форм. Используя растворы с известным pH,
можно вычислить константы ионизации для индикатора.Например, если индикатор — основание В, которое присоеди¬
няя протон, образует ВН+, то константа ионизации ВН+ может
быть вычислена из известного значения pH раствора и измерен¬
ного отношения [В] к [ВН+]:к° №1 Vyb
Л“~ [вн*] VBH+о [В] v„Р^о = pH — lg lg •[ВН*] YBH+Экспериментально можно измерить первые два члена при не¬
скольких ионных силах и результат проэкстраполировать к бес¬
конечному разбавлению, а можно и теоретически рассчитать ко¬
эффициенты активности.
Функция кислотности Гамметта387Если Ка для данного индикатора известна, то измеренные
отношения [В] к [ЪН1 позволяют определить pH с помощью со¬
отношения:В YBРН = рКд + lg[ВН+]+ lg-VBH+Точные значения получаются при ионных силах до 0,1 М, но
если ионная сила больше, неопределенность в оценке коэффици¬
ентов активности становится значительной.Функция кислотности ГамметтаПри высоких концентрациях измерениями с помощью индика¬
тора можно воспользоваться для определения новой шкалы кис¬
лотности, которая расширяет шкалу pH за ее обычные пределы.
Гаммет определил функцию кис¬
лотности h0 по соотношению:о [ВН+][В]г YH+Yn: [н ] -Ji_L'BhPиндекс «о» указывает на то, что ин¬
дикатором является нейтральное
основание. Логарифмическая функ¬
ция кислотности Гамметта, соответ¬
ствующая pH, имеет вид:#0 = -lg ho0,4 0,8 1,2Аполитическая концентра *
цир НС1, моль/лРис. XII. 6. Три варианта измере¬
ния кислотности растворов HCI. 5Активность ионов водорода меньше
концентрации кислоты, тогда как функ¬
ция кислотности Гамметта больше кон¬
центрации кислоты. При нулевой ионной
силе все три измерения кислотности
приближаются к одному и тому же зна¬
чению.Теория Дебая—Хюккеля пред¬
сказывает, что отношение коэффи¬
циентов активности . однозарядных
ионов, таких как Н+ и ВН+, должно
быть независимым от диэлектриче¬
ской постоянной и ионной силы
раствора. Можно ожидать, поэтому, -что функция h0 будет приблизительно равной [Н+] в разбавленных
растворах. В более концентрированных растворах эффект высали¬
вания будет увеличивать ув, и, следовательно, отношение h0 к [Н+]
должно возрастать при увеличении ионной силы.Для растворов HGf на рис. XII. 6 показано сравнение аналити¬
ческой концентрации и активности ионов водорода и функции кис¬
лотности Гамметта. Отметьте, что hJC увеличивается почти
линейно с концентрацией и равно приблизительно 1,6 при концен¬
трации 1 М. Хотя это означает, что коэффициент высаливания для
такой большой молекулы, как индикатор, не очень велик, вполне
возможно, что отношение Уц*[Ут* также возрастает по мере13*
388XII.4. Шкала pH и ее расширениеувеличения ионной силы. При значениях ионной силы, меньших
0,5 М, метод индикатора (h0) дает лучшую оценку концентрации
иона водорода, чем потенциометрические измерения ({Н+}), но при
концентрациях ~ 1 М верно обратное.Полезность функции кислотности Гамметта состоит в том, что
Но — это свойство раствора. Оно фактически в большинстве слу¬
чаев не зависит от индикаторов, используемых для его измерения,
при условии однако, что они являются незаряженными основа¬
ниями, которые не участвуют ни в каких других реакциях, кроме
присоединения одного протона. Функция Н0 не зависит от состава
растворителя, пока диэлектрическая постоянная растворителя до¬
статочно велика, чтобы препятствовать образованию в значитель¬
ных количествах ионных пар. Н0 определяет тенденцию раствора
передавать протон нейтральному основанию. Было обнаружено,
что в сильнокислых растворах скорости реакций, катализуемых
кислотой, намного лучше коррелируют с Я0, чем с pH или с анали¬
тической концентрацией кислоты.Выбирая подходящий ряд индикаторов с постепенно увеличи¬
вающейся величиной Ка, можно измерить Н0 в сильно концентри¬
рованных или даже неводных растворах. Применяют следующий
метод: несколько индикаторов с Ка, лежащими в интервале
между 10_3 и 10-1, используют для установления шкалы Я0, так как
их значения Ка могут быть получены экстраполяцией к бесконеч¬
ному разбавлению. Эти значения принимают почти независящими
от растворителя или кислоты, применяющихся при их измерении
(табл. XII.3). В качестве эталонного индикатора для шкалы Н0
(примем /г-нитроанилин); его К°а (среднее значение из всех экспе¬
риментально измеренных) соответствует рКд = 0,99.Таблица XII.3
Изменение для незаряженных индикаторовМ. A. Paul, F. A. Long, Chem. Revs, 57, 1 (1957).КислотаРастворительиндикатораrt-нитроанилино-нитроанилии4-хлор-2-нитроанилинНС!H200.98—1.03-0,29-1,03HN03H201,03-0,32— J ,09НСЮ4H200,97—0,31—1,03h2so4H20-0,25—0,97h3po4H20-0,22-1,01HFH20-0,27-1,03C6H5S03HHCOOH-1,06h2so4СНзСООН-1,03
Функция кислотности Гамметта389Затем, используя растворы с известной Н0, проводят измере¬
ния для других индикаторов с более высокими значениями Ка- Их,
наоборот, используют для расширения Я0-шкалы, и в растворах
с еще более высокой кислотностью могут быть проведены измере¬
ния с индикаторами с еще более высокими Ка• Используя большое
число индикаторов со значительным перекрытием областей пере¬
хода, Гамметт и его последователи
смогли расширить шкалу Н0 вплоть до
h0 = 1013. Некоторые из использован¬
ных индикаторов перечислены в табл.XII. 4 вместе с общепринятыми для
них значениями рКа-На рис. XII. 7 кислотность раство¬
ров серной кислоты показана вплоть
до точки, в которой в растворе не ос¬
тается свободной воды. Концентрация
иона водорода была получена измере¬
ниями по спектрам Рамана концентра¬
ций HS07 и SO Г в растворах. Вели¬
чина [НзО+] достигает максимума по¬
рядка 10 моль/л, а затем резко сни¬
жается, как только достигается 100%-
ная концентрация H2SO4. В растворах
серной кислоты, содержащих избыток
S03, [Н30+] пренебрежимо мала.С другой стороны, функция кислотности Гамметта достигает
огромных значений в концентрированных растворах серной кис¬
лоты. Для 100%-ной H2SO4, когда вся вода уже израсходована,Таблица XII. 4Индикаторы для установления шкалы Н0М. S. Paul, F. A. Long, Chem. Revs, 57, 1 (1957).ИндикаторИндикатор<Аминоазобензол 2,77N.N-Ди метил-2,4,6-три-л-Нитроаиилин ....... 2,50нитроанилин -4,81Бензоазодифениламин . .1,42Бензальацетофенон . .-5,73гс-Нитроанилин (эталонный(5-Бензоилнафталин . .-6,04стандарт) 0,99гс-Беизоилдифенил . . .-6,31о-Нитроанилин -0,296-Бром-2,4-динитроани¬-6,714-Хлор-2-нитроанилин . . .— 1,03лин п-Нитродифениламии . . .—2,48Антрахинон -8,272,4-Дихлор-6-нитроанилин .-3,322,4,6-Тринитроанилин-9,41га-Нитроазобензол ....-3,47«-Нитротолуол ....-10,462,6-Динитро-4-метиланилин-4,44Нитробензол -11,382,4-Динитроанилин ....-4,532,4-Динитротолуол . . .-12,78SO3, моль/лРис. XII. 7. Кислотность кон¬
центрированных растворов
H2S04, определяемая по кон¬
центрации иона водорода и по
функции кислотности Гамметта-
390XII. 4. Шкала pH и ее расширениевеличина Я0 увеличивается ступенчато и кривая подобна кривой
титрования. Это показывает, что серная кислота — намного более
сильный донор протонов, чем НзО+. При автоионизации H2SO4 об¬
разуется ион H3SOt, который является самым сильным из изве¬
стных доноров протонов.Другие функции, характеризующие кислотностьХотя оказалось, что шкала кислотности Я0 Гамметта, исполь¬
зующая незаряженные основные индикаторы, — наиболее полезное
расширение шкалы pH, это не означает, что она единственно воз¬
можная. Гамметт также определил возможность установления
Я+-шкалы, применяя катионный основной индикатор, или Я_-
шкалы, применяя анионный основной индикатор. Величины Я+ и
Я_ должны характеризовать тенденцию раствора передавать про¬
тон катионному и анионному основаниям. Ни одна из этих шкал
не оказалась такой удачной, как Я0, поскольку не было достаточ¬
ного количества индикаторов таких типов для однозначного опре¬
деления шкал. В некоторых недавних исследованиях предполага¬
лось, что в сильнощелочной среде Я_ может оказаться лучшей
функцией кислотности, чем Я0, для расширения шкалы pH.Другая шкала кислотности /0 была определена по аналогии
со шкалой pH, но с использованием спиртов (вторичных основа¬
ний) вместо аминов, кетонов или нитросоединений (оснований
Брёнстеда). В растворах, содержащих мало воды, два типа инди¬
каторов реагируют различным образом. Вторичное основание об¬
разует при ионизации воду:ROH + Н+ = R+ + Н20; К = Кь
а основание Брёнстеда воды не образует:В + Н+ = ВН+; К=1/*ГаФункция кислотности /о определяется следующим образом:[ROH]Jo = — Р Кь + !g ■[R+]Найдено, что катализируемые кислотами реакции вторичных
оснований лучше коррелируют с /0, чем с Я0, хотя различие стано¬
вится важным только в почти безводных растворах.Теоретическое предсказание значений Я0 или других способов
расширения шкалы pH непросто, однако полезность этих шкал
при описании поведения кислот и оснований в концентрированны^
растворах не следует отвергать.
ОТВЕТЫ НА ВОПРОСЫНиже приведены ответы на вопросы. Вопросы без ответов — это либо раз¬
новидности тех, для которых уже даны ответы или требующие построения
диаграмм, подобных приведенным в тексте. Некоторые вопросы — развитие
материала текста, и для них даны очень подробные ответы. Для других дан
наикратчайший из возможных ответов.Г л ав а I1. [н+] [CN~] = Ка [HCN].2. [CH3NH+] [ОН-] = Кь [CHsNH2].3. [Ba2+][sor] = /C(TB)0.4. [Са2+]3[РОГ]2 = К(ТВ)о-б. [Н2С03] = К [СО,]; [Н2С03] = КрРсо',[н+] [нсо~] = Ка\ [Н2С03]; [нЧ[сог] = ка2[нсо;].6. [Hgci+] = ic, [Hg2+]fcr]; [Hgcij = /С2 [Hgcr][cr];[HgCl,] = K3 [HgCl J [сг]; [HgCl*-] = [HgClj] [СГ].7. [Cu+] [СГ] = *(tbJJ); [CuClJ] = KiTB) о [СГ];[cuci2-] = /c(TB)0[cr]2.8. [N2HJ] = , [N2H4] [Hi; [N2H2+] = K2 [N2Hs+] [Н].9. [+NH3CH2COCT] [H+] = Kai [+NH3CH2COOH];[nh2ch2coct] [H+] = Ka2 [+NH3CH2COO"].10. [FeF2+] [H+] = Kl [Fe3+] [HF]; [FeF2] [H+] = K2 [FeF2+] [HF];[FeF3] [H+] = Ks [FeF2] [HF].П. [Ag2lJ-] = К [I-]4.12. [ThH2P02+] [H+] = К [Th4+] [H3P04]. . -13. [Ca2+]4 [НРО2-]3 К [H+]2.14. [HgCl+] = p, [Hg2+][cr]; [HgCl2] =p2 [Hg2+] [Cl-]*;[HgClj] = p3 [Hg2+] [СГ]3; [HgCl2'] = P4 [Hg2+] [СГ]*.
392Ответы на вопросы. Глава /.15. Ag(S10,)J" Ag++2S20f; [Ag+] [S20rf = Wt [АВ (82°з)Г1-16. [Ag+] [Br-] = 1,56-10~12.17. [н+] [so2~] = 1,25 • io~2 [hso;].18- [HPOf] = 1,1 • 1012 [H+] [P034-].19. [h+] [hpo2-] = 6,75 • io~8 [h2po;].20. [HCN] = 2,3* 109 [H+] [CN-]. ,21. E = E° — y (0,05915) lg [Cd2+] [SO2-].Уменьшение [Cd2+] и [SO2-] делает логарифмический член более отрица¬
тельным; иными словами, второй член уравнения становитси более поло¬
жительным, увеличивая Е до 1,077 в.22. [Мп2+]г Я5с,2 = 2,5 • 1025 [МпО;]2 [н+]1в [СГ]'°;[Мп2+] [Сг3*]5 = 10162 [МпО;] [Н+]8 [Сг2+]5;[H+f = 2,5 • 1047 [МпО;]2 [Мп2+]э;[Mn2+] [Fe3+]5 = 3,2 • 1062 [Мп07] [Н+]8 [Fe2+]5;[Мп2+] [Cu2+]5 = 10198 [Мпо;]2 [н+]16;[Mn2+]2 = 10232 [Мп04-]2 [Н+]6
[Мл2+]2 Р5ог = Ю140[МпО7]2 [H+F [Н202]5;[мп2+]2 [Hg2+],0= ю98 fMno;]2 [н+]1в [Hg2+]5.23. [Cu+]2 = 6,15* 10-7 [Си2+].24. [Mn2+] [Н+]4 = 2,9 • 109 [Мп3+]2;[МпО;]2 = 3,2 ■ 105? [MnOf]3 [Н+]4;[МпО~]2 [Мп2+]3 = 5 • 10"48 [Н+]4;[Mn3+]4 = 10-86 [МпО2-] [Н+]8 [Мп2+]3.25. [Си2+] [Г] = 2,9 • 10е [Си+];[Си+] [Г] = 0,56;[Hg2+] — 1»65 • 10г [Hg2+];26. [Ag+]2 [С202-] = 8,9 • 10-12.27. [Н+] [ОН'] = 1,0-Ю-'4.28. [cd(CN)4-] = 5,75 • 1018 [Cd2+][CN~]\
Ответы на вопросы. Глава III.393Глава III1. Условия материальных балансов:по К+ - [К+] = С; по ОН" - [ОН-] = С + [Н+]Условие электронейтральности:[к+] + [н+] = [он-].2. Условия материальных балансов:по С107 - [сю;] = С; по Н+ - [Н+] = С + [ОН-]Условие электронейтральности:[н+]=[сю7] + [он-]3. Условия материальных балансов:по К+-[К+] = С,; по сТ- - [СГ] = С2; по Н+ - [н+] = С2 - С, + [ОН-].
Условие электронейтральности:[к+] + [н+] = [сг] + [он-]4. Условие материального баланса:по CN” - [CN“] + [HCN] = С
Условие электронейтральности:[н+] = [он-] + [сгг].5. Условия материальных балансов:по Na+ — [Na+] = С2; по CN” — [CN-] + [HCN] = С, - С2;
по ОН” — [ОН-] + С, = [Н+] + [HCN] (не очевидно).Условие электронейтральности:[Na+] + [Н+] = [ОН-] + [CN-].6. Условия материальных балансов:по Na+ - [Na+] = С2; по CN- - [CN-] + [HCN] = С,.Условие электронейтральности:[Na+] + [Н+] = [CN-] + [ОН-].7. Условие материального балансапо NH3 - [NH3] + [NHt] = С.Условие электронейтральности:[NHt] + [H+] = [OH-].8. Условие материальных балансов:по СГ - [СГ] = С2; по NH3 - [NH3] + [NHj] = С, + С2.Условие электронейтральности:[NH+J + [Н+] = [ОН-] + [СГ].
394Ответы на вопросы. Глава III.9. Условие материального балансапо С02 - [С02] + [H2cos] + [НСО-] + [СО*-] = С.Условие электронейтральности:[Н+] - [НСО7] + 2 [СОд-] + [ОН-].10. Условия материальных балансов:по Na+ - [Na+] = С; по С02 - [С02] + [Н2С03] + [НСО7] + [С032“] = С.
Условие электронейтральности:[Н+] + [Na+] = [НСО7] + 2 [СО2"] + [ОН-].11. Условия материальных балансов:по Na+-[Na+] = C, + 2C2;
по С02 - [С02] + [Н2С03] + [НСО7] + [СО2-] = С, - С2.Условие электронейтральности:[Н+] + [Na+] = [НСО7] + 2 [СО,2”] + [ОН-].12. Условия материальных балансов:по NHS - [NH3] + [NH+] = С; по CN- - [CN-] + [HCN] = С.Условие электронейтральностя:[Н+] + [NH+] = [CN“] + [ОН-].13. Условие материального баланса[РЬ(ОН)2] + [РЬОН+] + [РЬ2+] ++ [НРЮ7] + 2 [РЬ202+] + 3 [РЬ302+] + 4 [РЬ40*+] = С.Условие электронейтральности:[Н+] + [РЬОН+] + 2 [РЬ2+] + 2 [РЬгО^] ++ 2 [РЬ302+] + 4 [РЬ402+] = [ОН-] + [HPbOj].14. Условия материальных балансов:по CIO7 — [СЮ7] — 0,1; по РЬ — то же, что и в Вопросе 13.Условие электронейтральиости: то же, что и в Вопросе 13, только к пра¬
вой части добавляется член [С107].15. Условия материальных балансов:по К+ — [К+] = 0,1; по РЬ — то же, что и в Вопросе 13.Условие электронейтральиости: то же, что и в Вопросе 13, только к левой
части добавляется член [К+].16. Условия материальных балансов:по Hg - [Hg2+] + [HgOH+] + [Hg(OH)2] + [Hg(SH)2] + [HgS2"] = C.
no S - [S2-] + [hS“] + [H2S] + 2 [Hg(SH)s] + 2 [HgS2"] + [H2S] = C.
Ответы на вопросы. Глава III.39$Условие электронейтральности:[Н+] + 2 [Hg2+] + [HgOH+] = [ОН"] + 2 [S~] + [HS“] + 2 [HgS2-].17. Условия материальных балансов — те же, что н в Вопросе 16, только
для S к правой части добавляется член 0,1.Условие электронейтральности: то же, что и в Вопросе 16.18. Условия материальных балансов:по N0“— [N03] = 1,0; по Hg и S — те же, что и в Вопросе 16.Условие электронейтральности: то же, что и в Вопросе 16, только к пра¬
вой части добавляется член [NOj].19. Условии материальных балансов:по К+ — [К+] = 1,0; по Hg и S — те же, что и в Вопросе 16.Условие электронейтральности:то же, что и в Вопросе 16, только к левой части добавляется член [К+] •20. Условия материальных балансов:по Na+ — [Na+] =0,1 по Hg и S: те же, что и в Вопросе 16, только к пра¬
вой части добавляется член 0,05.Условие электронейтральности: то же, что и в Вопросе 16, только к ле¬
вой части добавляется член [Na+].21. Условия материальных балансов:по Ag - [Ag+] + [Ag I] + [Ag OH] + 2 [Ag2I+] + [Ag I2“] + 3 [Ag3I2+] ++ [Ag I32"] + 4 [Ag4I3+] + [Ag IJ-] + 2 [Ag2I4-] + 3 [Ag3Ij-] + 12 [Ag12l'42"J = S;
no I - [Г] + [Agl] + [Ag2I+] + 2 [Agi;] + [Ag3I2+] ++ 3 [Aglf] + [Ag4I3+] + 4 [Agl3'] + 6 [Ag2I4-] ++ 8[Ag3ir] + 24[Ag12I-12] = S;
no OH - [OH-] + [AgOH] = [H+].Условие электронейтральностн:[Н+] + [Ag+] + [Ag2I+] + 2 [Ag3I2+] + 3 [Ag4I3+] == [OH-] + [I-] + [Agl“] + 2 [Agl2-] + 3 [Agl4] + 4 [Ag.I4'] + 5 [Ag3l'“] ++ 12[Ag12I'42-].22. Условия материальных балансов:no NO" - [NOj] =0,1;по Ag — то же, что и в Вопросе 21, только к правой части добавляется
член 0,1;;по I- — то же, что и в Вопросе 21.Условие электронейтральности: то же, что и в Вопросе 21, только к правой
части добавляется член [NO,].23. Условия материальных балансов:, по К+—[К+3 = 0,1; по Ag — то же, что и в Вопросе 21; по I — то же, что
и в Вопросе 21, только к правой части добавляется член 0,1.Условие электронейтральности: то же, что и в Вопросе 21, только к левой
части добавляется член [К+].
396Ответы на вопросы. Глава ///.24. Условия материальных балансов: по Ag — то же, что и в Вопросе 21;
по I — то же, что и в Вопросе 21, только к правой части добавляется член 0,1;
по Н+ — [Н+] = [AgOH] + [ОН-] + 1,0.Условие э^ектронейтральности: то же, что и в Вопросе 21.25. Условия материальных балансов:по Ag - [Ag+] + [AgOH] + [Ag (S203)*-] + [AgS.O",] - 0,010;no Na+ - [Na+] = 0,01;
no S2Oj - [S2Og~] + [AgS207] + 2 [Ag (S203)3-] + [HS207] = 0,005;no OH“ - [OH“] + [AgOH] = [H+] + [HS207],Условие электронейтральности:[H+] + [Na+] + [Ag+] = [OH~] + 2 [S20|“J + [HS207] ++ [AgS207]+3[Ag(S203)^].26. Условия материальных балансов:no Na — [Na+] = 4,2 • 10-3;no S2Oj~—то же, что и в Вопросе 25;по СГ - [СГ] + Р + [AgCi] + [Ag2Cl+] + [Ag3Cl2+] + [Ag4Cl3+] ++ 2 [AgCl^] + 3 [AgClj-] + 4 [AgCl4] = 4,0 • 10~3;
no Ag - [Ag+] + P + [AgCi] + [AgCi;] + [AgCi*"] + [AgCi3"] ++ 2 [Ag2Cl+] + 3 [Ag3Cl2+] + [Ag4Cl3+] + [AgOH] ++ [AgS207] + [Ag(S203)32-] = 0,010;
no N03 — [NO^] = 0,01;
по он" - [он-] + [AgOH] = [h+] + [hs2o;].Условие электроиейтральиости:[H+] + [Ag+] + [Na+] + [AgjCli + 2 [Ag3Cl2+] + 3 [Ag4Cl3+] == [ОН"] + [СГ] + [NO7] + 2 [S202"] + [HS.OJ] + [AgS207] ++ 3 [ Ag (S203)3-j + [AgCljJ + 2 [AgClj-] + 3 [AgCl3"j.27. Условия материальных балансов:по Mn - [Мп2+] + [МпОН+] + [Мп(ОН)2] + Р = S;
по Na — [Na+]=0,01;
по S - [S2i + [HS~] + [H2S] = S;
no H+ - [Na+] + [H+] + [HS“] + 2 [H2S] == [MnOH+] + 2 [Мп(ОН)2] + 2P + [OH-].Условие электронейтральности:[H+] + 2 [Мп2+] + [МпОН+] + [Na+] = [ОН‘] + [HS~] + 2 [S2'].
Ответы на вопросы. Глава III.39728. Условия матеряальных балансов:по Fe - [Fe3+] + [FeCl2+] + [FeCl+] + [FeCl3] + [FeClj] ++ [HFeCl4] + [FeOH2+] + 2 [Fe2(OH)*+] = 0,1/(100 + V);
еслн Fe(OH)3 осаждается, то к левой части уравнения добавляется член Р;
по С1 - [СГ] + [FeCl2+] + 2 [FeCI+] + 3 [FeCl3] + 4 [FeCi;] ++ 4 [HFeCl,] = 0,11/(100 + V)\no Na - [Na+] = 10-3 V/(J00 + V)• Условие электронейтральиости:[Na+] + [H+] + 3 [Fe3+] + 2 [FeCI2+] + [FeClJ] + 2 [FeOH2+] + 4 [Fe2 (OH)*-] == [OH-] + [СГ] + [FeCi;].29. Условия материальных балансов:по Си - [Си2+] + [CuNH2+] + [Cu(NH3)2+] + [Cu(NH3)2+] + [Cu(NH3)f ] ++ [Cu(NH3)2+] + [CuOH+] + 2 [Cu2(OH)2+] = 0,005;
nb S04 — [SO2-] = 0,05;
no NH3 - [NH3] + [NH+] + [CuNHf] + 2 [Cu(NH3)2+] ++ 3 [Cu(CH3)32+] + 4 [Cu(NH3)2+] + 5 [Cu(NH3)2+] = 0,020;
no OH - [NHJ] + [H+] = [OH-] + [CuOH+] + 2 [Cu(OH)2+].Условие электронейтральностн;2 [Cu2+] + 2 [Cu(NH3)2+] + 2 [Cu(NH3)2+] + 2 [Cu(NH3)2+] + 2 [Cu(NH3)2+] ++ 2[Cu(NH3)‘+] + [CuOH+] + 2[Cu2(OH)2+] + [NHj] + [H+] = [OH-] + 2 [SO2-].30. Пренебрегите членом [CN-] н последнем уравнении (см. Пример V.5,
стр. 112): . , ■[Н+] = 2,4-10-7 [HCN] = 1,00 • 10—4[CN-] = 2,0- 10-7 [ОН-] = 4,2 • 10-831. Скомбинируйте последние два уравнения для получения протонного ус¬
ловия:[Н+] + [HCN] = [ОН-]Пренебрегите членом [Н+] в этом условии и [HCN] в последнем уравнении
(см. Пример V. 8, стр. 121):[ОН-] = 4,56 • 10-4 [HCN] = 4,56 • 10—4[Н+] = 2,2 • 10“11 [CN-]= 1,0- 10-232. Пренебрегите членом [SO2-] во втором уравненнн (см. Пример VI. 3,
стр. 155):[Ва2+] = 1,0- 10-2 [S02-] = l,0-10_8
398Ответы на вопросы. Глава III.33. Пренебрегите членом 1,0-10~7 во втором уравнении. Второе приближение
даст:[Ag+] = 1,34* 10“5 [СГ] = 1,33-10“534. Скомбинируйте последние два уравнения для получения протонного ус¬
ловии:[Н+] + [НАс] = [ОН-]Пренебрегите членом [Н+] в этом условии и [НАс] в последнем соотношений
(см. Пример VI. II, стр. 169):[Ag+] = [Ас-] = 6,3 • 10“* [Н+] = 1,6 • 10“"[ОН-] = 6,0 • 10“б [НАс] = 6,0 -'10_в35. Скомбинируйте последние два уравнения для получения протонного усло¬
вия:[Н+] + [Н3Р04] = [ОН-] + [НРО*-] + 2 [Р034-]Пренебрегите членами 40Н~] и [РО|—] и в этом условии и всемн чле¬
нами, кроме [HjPOj], в последнем уравнении (см. Пример VII. 4, стр. 184):[Н2Р07] = 5,0-10-2 [Н+] = 1,94 -10“5[НРО*-] = 1,60-10“4 [ОН-] = 5,2-10“10[Н3Р04] =1,40- 10“4 [РО3-] = 3,9-10“1236. Пренебрегите членами [Н+] и [ОН-] в последнем уравнении. Скомбини¬
руйте полученное выражение с двумя условиями материального баланса, чтобы
получить [HCN] = [ЫНз] (см. Пример V. 17, стр. 147):[HCN] = 0,052 [NH+] = 0,048[NH3] = 0,052 [ОН-] = 1,9 • 10“5[CN-] = 0,048 [Н+] = 5,2> 10“’°37. Пренебрегите всеми членами, кроме [С1~], в пятом уравнении. Решите
первые четыре уравнения относительно [Cd2+], подставьте полученное значение
в последнее уравнение, чтобы выразить в явной форме [Cd2+] (см. Пример
VIII. 1, стр. 224):[С1-] = 1,00 [CdCl2] = 3,58 • 10“3[Cd2+] = 2,16* I0“5 [CdClj] = 4,40-10“3
[CdCl+] = 4,55 • 10“4 [CdClj-] = 1,54 • 10-338. Используйте квадратичную формулу; z = 1,60.39. Примите, что у2 = 1; тогда у = 1,03.40. Пренебрегите квадратичным членом для получения значения: [NH3] =
= 1,53 • 10_6. Используйте это выражение для оценки квадратичного члена во
втором приближении [NH3] = 1,52 • 10~6.41. Пренебрегите квадратным членом:[ОН-] = 7,46 • 10~13.
Ответы на вопросы. Глава III39942. Используйте квадратичную формулу:Sj = 5,67 • 10 4; Sj = 8,3* 10“5.43. Используйте формулу решения квадратного уравнения:[СГ] = 1,57 - 10—3.44. Пренебрегите линейным членом; [С1_] = 0,427.45. Используйте квадратичную формулу:S, = 5,74 • 10-3; S2 = 3,06 • 10-3.46. Пренебрегите квадратным членом: [Н+] = 7,96■ 10-7.47. Используйте квадратичную формулу: S = 1,09.48. Скомбинируйте уравнения таким образом, чтобы получить квадратное
уравнение:5,20- 104 [HgOH+]2 + [HgOH+] = 9,76-10_3.Используйте квадратичную формулу (см. Пример VIII. II, стр. 244):[HgOH+] = 4,23-10-4; [Н+] = 4,40* 10_3;[Hg2+] = 9,34-10_3. '49. Пусть у = [Н+]2. Пренебрегите членом у2 для получения:у = 4,6 • 10—8; тогда [Н+] = 2,15 • 10-4.50. Пусть у = [Н+]2. Пренебрегите членом у = 3,6 ■ 10-4; тогда
[Н+] = 1,9 • ю-2.51. Пусть у — [Г]3. Используйте квадратичную формулу для получения
у = 1,48-10~7; тогда [Г] = 5,30-10~3.52. Пусть у — [Г]3. Пренебрегите квадратным членом для получения у —
= 5,94-10"13; тогда [Г] = 8,4-ЮЛ53. Используя метод Ньютона, находим, что прн Хо = 3, х — 2,76.54. Пренебрегите всеми членами, кроме линейных и постоянных; тогда
[Н+] = 1,40 10-7.55. Пренебрегите кубическим членом; тогда [S2~] = 8,63• 10-7.56. Пренебрегите членом квадратным и четвертой степени; тогда [С1~] =
= 3,22 10-4.57. Напишите несколько целых значений для члена [Вг-]. Применяя метод
Ньютона к решению задачи, находим: при [Вг_]0 = 3,00 [Вг~] = 3,00.58. Применяя метод Ньютона прн [ОН"]0 = Ю~4, находим [ОН-] = 9,3- ЮЛ59. Применяя метод Ньютона при [ОН~]о = Ю-5, находим [ОН"] = 6,90-Ю-6.60. Пренебрегите членом 1,3-10~14 [Ht] по сравнению с 1,00. Применяя метод
Ньютона для [Н+]0 = 2,7- Ю-10, находим [Н*] = 2,84- Ю-10.61. Используя метод Ньютона с [Н+]о = 2,7-Ю-10, находим: [Н+] = 2,84-Ю~10.62. Самый простой метод решения — построить график. Функция обнаружи¬
вает минимум прн [NH3] = 3,7 • 10-4 и имеет два реальных корня при: [NH3] =
= 5,8-10-4 и [NH3] = 9,2-Ю-5.63. а. 2,19; б. 6,89; в. 8,37; г. 0,04; д. —0,67; е. 9,11; ж. 1,64; з. 13,19; и. 14,04;
к. 4,36.64. а. 3,7-10 "; б. 3,55-Ю-33; в. 5,0-Ю-"2; г. 2,9-Ю’7.65. а. 5,75-10-»; б. 9,3- Ю 5; в. 1,20-Ю'16; г. 3,46.10-'.66- pH + рОН = 14,00.
400Ответы на вопросы. Глава IV.67. Ig р4 = 8,68; р4 = 4,78-108.68. Kai = 1,02-10-2; Kai = 2,13-10-3; /Саз = 6,90-IO"7; Ка< = 5,5-10-"; общая
константа диссоциации 1/|34 = 8,3-10~22.69. pH = 7,00 + Чг(рКа - рКь); рОН = 7,00— Чг(рК„ — рКь).70. pH = рЯ„ — lg R; рОН = 14,00 - рКа + Ig R-Г лава IV1.pH =7,47 и рН>= 6,51.2.|ЕЮН+] = 2,83-Ю-10;[ею-] = 2;[ЕЮН+]>[ЕЮ“]— кислота;[ЕЮ";3.pH = 3,10рОН =10,90.4.рОН= 1,52рН =12,48.5.рОН = 3,05Рн =10,95.6.рОН = 5,59Рн =8,41.7.рОН = 6,91рН =7,09.8.рОН = 6,50pH =7,50.9.ООCNIIXр.рОН =(1,8210.pH = 6,96рОН =7,04.И."га1оXW +II00о-18[ЕЮ~] == 0,010.12.Общее соотношение:[Н+]Кривые имеют тот же вид, что и приведенные иа рис. IV. 1 и IV. 2, если
[Н+] заменить на Г ОН-] =13. До точки эквивалентности можно пренебречь членом [Н+]:2 0-10~14
ф=1—(у+so) ■ -После точки эквивалентности можно пренебречь членом [ОН-]:
ф = I + 2 (V + 50) [Н+]14. Так как раствор КОН в 100 раз концентрированнее раствора HNO3, раз¬
бавление ничтожно. Тогда уравнение (9) принимает вид:ф = ,+7ЙТ_104[н+]15 До точки эквивалентности член [Н+] пренебрежимо мал и выполняется
соотношение:10-'5Ф=1-(^ + юо)^
Ответы на вопросы. Глава IV.401После точки эквивалентности можно пренебречь членом [ОН-]:ф = 1 +0,1 (V + 100) [н+]16. pH = 3,77.17. pH = 5,30.18. pH = 1,40.19. Замените член 1н+] в уравнении (9) на член [ОН-]:■ C-V°- (Ф - 1) = [Н+] -V + F0 [Н+]20. Когда в уравнении (9) Ф = 1, то [Н.+] = /Сн^О независимо от С„. Если
р*н = 14,00, то в точке эквивалентности pH = 7,00.21. Точке перегиба соответствует условие:*2ф =0dpHИз определения pH имеем:аФ =-2,303 [Н+] аФДифференцируя уравнение (9), получаем:
d® / V + V.rfpH ’ d [Н+][ение (9), получаем:rfpHВновь дифференцируя и полагая результат равным 0, получаем:dpH= 0Это выражение выполняется при [Н+]2 = /СНго, чт0 является условием до-
етижения точки эквивалентности при Ф = 1 в уравнении (9).22. Из уравнения (10) имеем:«шах = -4,0-10~5-+^6-"*п,1п = — 6,14 • 10—70,02Ошибка бюретки те — ± у.Для Ва(ОН)2 Со = 2(0,05) =0,1. Полученные выражения позволяют найти:а. «max = 0,08%; /лтт = —0,001%; те = ±0,04%; соответствие окраски
растворов необязательно.б. «шах = —0,5%; тт1п = —0,007%; те — ±0,04%; соответствие окраски
растворов облегчает решение задачи.в. /Лшах = +0,4%; wmin =+0,007%; тв = ±0,02%; соответствие окраски
растворов облегчает решение задачи.Г. Шшах =—24%; тш1„ = —0,4%; те — ±0,016%; соответствие окраски
растворов необходимо, если применяется индикатор; для определения конечной
точки лучше использовать другие методы.
402Ответы на вопросы. Глава IV.23. Для объемов 24,98 и 25,02 pH равны 5,10 и 8,90. Подходит любой инди¬
катор, pH которого попадает в этот интервал. Можно применять бромкрезоловый
пурпурный, бромтимоловый голубой, феноловый красный, нейтральный красный
и а-нафтолфталеин.24. а. Пренебрегая членом [Н+] по сравнению с [ОН"], находим по уравне¬
нию (10):Ф 1 - 2Кн*°Ж7б. Пренебрегая членом [ОН'] по сравнению с членом [Н+], находим по урав¬
нению (10):и ф . 2[Н+]к.тm — Фк. т 1 т; •Со25. Объем образца должен быть больше 8 мл.26. Из уравнения (10) при С = С0 находим:ш = 100 (Фк, т-1) = -^( rj”2°- - [Н+1к. т)Cq \ [Н Jk. т /Формула, приведенная в вопросе, получена при пренебрежении любым из
членов в скобках. Это приближение не выполняется в важной области измене¬
ния pH от 6,15 до 7,85.Глава V1. [НАс] =5,0-10-3 [Ас-] = 2,96- 10—4[Н+] = 2,96-10~4 [ОН-] = 3,38 • 10—11
pH =3,532. [НАс] = 0,40 [Ас-] = 2,64-10”3[Н+] = 2,64-10~3 [ОН-] = 3,79-10-1*
pH = 2,583. [HCN] = 0,10 [CN-] = 6,9- 10-e[Н+] = 6,9- 10~6 [ОН-] = 1,45-10-9
pH = 5,164. [HF]= 1,48-10“9 [F-] =1,0-10—®[н+] = 1,0-10—6 [он-] = 1,0-10~8
pH = 6,005. [НАс] = 5,2 • 10~s [Ас-] = 9,5 • 10~т[Н+] = 9,6 • Ю-7 [OH-] = 1,04 - 10-8pH =6,026. Используйте уравнение (5) (стр. 105), полагая: С = 1,0 • 10_6; Ка —
= 2,95* 10“8. Решение его графическим способом или по методу Ньютона при
условии, что [Н+]0 = 2- 10-7 дает:[HOC1] = 8,64 • 10“7 [ОСГ] = 1,36- 10-7[Н+]= 1,89-I0-7 [ОН-] = 5,30-10“*
pH = 6.72
Ответы на вопросы. Глава V.4037. [HF] = 3,5 • 10-4 [F~] = 6,5 • 10-4[Н+] = 6,5-10“4 [ОН'] = 1,54-10-11
pH =3,198. [НС1] = 1,0-10~4 [СГ] = 5,3-10-7
[Н2Ас+] = 5,3-10“7 [Ас ] = 6,8 • 10-99. [HF] = 3,5* 10~6 [F-] =1,65* 10“4[Н+] = 1,65-10~4 [ОН'] = 2,72-10“11
pH = 3,7810. Ка = 1,91 * Ю'4.11. Если пренебречь членом [ОН'] в условии электронейтральиости, то
получим:С“А = Ка(! ~“а)12. Условие электронейтральиости[Н+] = [ОН'] + [HS07] + 2 [so 1~]
и поэтому уравнение (5) можно заменить выражениемС~Г' и)и+я.которое дает возможность построить график.Использование этого значения Ка при концентрациях, больших ОД М, при¬
водит к ошибочным результатам вследствие больших отклонений от идеальности
в концентрированных растворах серной кислоты. В разделе XII. 4 обсуждена
кислотность концентрированной серной кислоты. Растворы серной кислоты уме¬
ренных концентраций детально обсуждаются С. Н. В rub acker, J. Chem. Е due.,34, 325 (1957).13. [В] = 3,82-10-2 [BH+] = 1,76* 10—3
[H+] = 5,7 • 10“12 [ОН-] = 1,76 • 10-3pH = 11,2514. [В] =1,0* 10-3 [ВН+]= 1,22* 10-e
[H+] = 8,2 • lO-9 [OH'] = 1,22 • 10~epH = 8,0915. [B] = 3,6.10-4 [BH+] = 6,5 • 10-4[H+]= 1,54-10“" [OH-] = 6,5* 10-4pH = 10,8116. [B] = 5,6* 10-e [BH+]=l,0.10_e[h+]=i,o.io-8 [oH-] = i,o.io_epH = 8,0017. В уравнении (5) (стр. 105) замените [Н+] на [ОН'], а Ко на Кь:
404Ответы на вопросы. Глава V.18. В уравнениях (5) раздела V. 1 замените [Н+] на [ОН-], а Ка на Кь',
С < 10~8 (5а); С лежит между 10~5 и 10~2 (56); С > 10~2 (5в); С между Ю-8
и 10~5 (5г); С между 10-8 и 10~6 (5е).19.[CN“] =0,25[HCN]= 2,28• 10~3[ОН-]-2,28• ю_3[н+]= 4,4-10~12рН =11,3620.[Fl =5,0-10~2[HF]= 8,6-Ю-7[н+] =1,15• 10~8[ОН-]= 8,7-10-7рн =7,9421.[НАс] =7,6-10~7[АС]= 1,0-10~3[н+] =1,30• 10-8[ОН-]= 7,7-10-7рН =7,8922.[NHtl =3,4-10-в[NH3]= 6,5-10-7[H+] =2,9-10~9[ОН-]= 3,4-10_6рН =8,5323.[sor] =2,72• ю-2[hsoj]= 7,28• 10~2[H+] =2,72• 10-2[ОН-]= 3,68• ю-13рн =1,5624.[sorb0,1[HS07]:= 2,96• кг7[н+] =3,02-■ 10-8[он-] == 3,28 •10-7рН =7,5225. Это уравнение можно решить, если в условии материального баланса
по водороду пренебречь [Н+] по сравнению с [НА]. Чтобы это предположение
выполнялось, необходимо, чтобы С > 10 6, а Ка < 0.05С.26. [HF] = 7,70 • 10~3 [F-] = 2,23 • 10“3
[Н+] = 2,33 • 10~3 [ОН-] = 4,3 • 10~12pH = 2,6327. [НАс] = 1,0 • 10—4 [Ас"]= 1,75-10-7[Н+]= 1,0- 10-2 [ОН-] = 1,0-10“12
pH = 2,0028. [NH+] = 2,43 • 10-7 [NH3] = 7,00 • 10~9[Н+]= 1,95-10~8 [ОН-] = 5,12 • 10-7
pH — 7,7!29. Для раствора сильной кислоты с аналитической концентрацией Сi урав¬
нение (7) (стр. 90) дает:Cj = [Н+] _ КнгО
1 J 1Н+]
Ответы на вопросы. Глава V.405Для раствора слабой кислоты с аналитической концентрацией С2 уравне¬
ние (5) (стр. 105) дает:Для смеси Fi мл сильной кислоты с аналитической концентрацией Ct и
V2 мл слабой кислоты с аналитической концентрацией С2 общее уравнение
получается из условий материального баланса и электронейтральности:Гн+1 = ( ClFl ^ \ ( Ка \V^ + fJ [v^vJyiH+l + Ka) [н+1Подставьте С] и С2 из приведенных выше уравнений и заметьте, что по¬
лучается тождество.30. pH = 3,000 только для НС1. Если добавить к НС1 индикатор, то pH =
= 3,004.31. Отметьте, что [Н+]2 [in2-] = Ка [Н21п]; следовательно, Ка = 2,5 • 10-14 .а. pH = 6,10 [H2In]/[ln2-] = 2,5 (желто-зеленый)б. pH = 4,00 [H2In]/[ln2-] = 4,0 • 10+5 (желтый)в. pH = 9,90 [Н21п]/[1п2-] == 6,4* 10 8 (голубой)32. Конечной точке соответствует равенство [Н+] = 1,6-10-4. Согласно уравне¬
нию (10) раздела IV. 4 (стр. 99), ошибка титрования составляет—32%. Для ком¬
пенсации этой ошибки исходный раствор НС1 в кислотной форме индикатора
должен быть 6,4-10~4. Тот факт, что это строго выполняется, может быть под¬
твержден, если использовать уравнение титрования смеси слабой и сильной кис¬
лот сильным основанием (См. Вопрос 52).33. pH = 5,06 Р = 1,54-10-234. pH = 9,32 Р = 2,3-10-235. pH = 5,17 Р = 5,77 • 10-336. Пренебрегая в условиях материального баланса и электронейтральности
членом [Н+], получим:Кь 1Н+1 (Сь [Н+] — КН2о) = КН2о (Свн + [Н+] + Кн2о)Решение этого квадратного уравнения дает pH = 8,62. Из уравнения (23)
Р = 2,05-10"5.37. [В]/[ВН+] = 1,23. Разбавление не влияет на буферную емкость, но ме¬
няет pH.38. CHjq3 = 0,102; С10з = 0,103. Подстановка в уравнение (11) и прене¬
брежение членом [ОН-] дает Ка = 0,134. Так как концентрации высоки, поправки
на коэффициент активности велики, но имеют тенденцию к уменьшению. Ис-
пользуя' уравнение Дэвиса (см. раздел XII. 2), находим, что у± = 0,745 при
ионной силе 0,15 М. ПосколькуpH = — lg [Н+] и [Н+] [Ю-] vi = К°а [НЮ3]величину К^ можио вычислить методом последовательных приближений; онаоказывается равной 0,160, что согласуется со значением, приведенным в
табл. V. 1.39. Подстановка уравнения (10) в (23), при условии С = Сна + Са, при¬
водит к тому, что первые два члена в уравнении (23) пренебрежимо малы, если
малы [Н+] и [ОН-].
406Ответы на вопросы. Глава V.40. Замените [Н+] на [ОН-], а Ка на Кь в уравнении (23). Отметьте, что та. Гтт+1 Кц 0 Кн оже форма получится, если [Н J = -—^ и Ка = —■ЮН J Кь41. Пренебрежение в уравненнн (23) последним членом дает:р = 2,303 + [Н+])Для чистой воды Р = 4,6-10-7.42. Максимуму нлн минимуму на кривой буферной емкости соответствует
условиеdP г , <*Р— — 2,3031^1-^-0Дифференцирование уравнения (23) дает для [Н+] в точках максимума илн
минимума:ска [н+г (ка - [н+]) = (ка + [н+])3 (*н2о - [н+])2 (1)а. Из уравнения (14) при Са = Сна = '/г'С выражение для [Н+] эквнмо-
лярного буферного раствораС [Н+] (Ка - [Н+]} = - 2 (ка + [Н+]) (Кщо - [Н+]2)становится похожим на выражение (1), только если члены [Н+] и [ОН-] прене¬
брежимо малы по сравнению с С, так что [Н+] « Ка, а правая часть почти
равна 0.б. Из уравнения (14) прн Са = 0 и С на = С, величина [Н+] для чистой
слабой кислоты запишется следующим образом:С 1Н+] Ка = (Ка + [Н+]) (Кщб - [Н^Это выражение совпадает с выражением (1), если [Н+] > Ка-в. Из выражения (14) прн Са = С и Сна = 0, выражение для pH чистой
соли принимает внд:с [Н+]2 = (ка + [н+]) (*Нго - 1н+]г)Оио совпадает с иыражением (1), если [Н+] < Ка-43. Формула Дренена получается, если в уравнении (12) для оценки членов
[Н+] и [ОН-] воспользоваться предельными соотношениями для области высоких
концентраций. Это выражение удобнее (10), если Са/Сь очень велико или очень
мало, но в общем случае оно неприменимо к разбавленным растворам н его
нельзя вывести достаточно строго.44. Если в уравнении (14) [Н+] заменить иа [ОН'], а Ка на Кь, то получимф “ “вн*+ (1н*1 - 1он_1 *гдеКьвн+ [ОН-] + КьКривая титрования — это зависимость pH от Ф, кривая образования — это
зависимость ®вн+ от pH.
Ответы на вопросы. Глава V.40745. Точке эквивалентности соответствует pH = 8,23. Лучшим индикатором
будет тетрабромфенолфталеин, который меняет свой цвет в интервале изменения
pH от 8,0 до 9,0. При pH = 8,0 ошибка титрования составляет — 0,04%, а при
pH = 9,0 1-0,2%. Ошибка показаний бюретки для образца объемом 50 мл со¬
ставляет ±0,04%, так что даже если совпадение цвета с требуемым и не выпол¬
няется достаточно тщательно, все равно ошибка титрования может быть столь
же малой, как и ошибка показаний бюреткн.46. Точке эквивалентности соответствует pH = 7,88, а не pH = 7,00. Макси¬
мальная ошибка титрования (—0,09%) появляется, если конечную точку пола¬
гать существующей при pH = 6,8. Когда в конечной точке добавляется только10 мл, ошибка показаний бюретки составит ±0,5%. Ошибка, возникающая при
использовании пипетки, составляет ±0,05%. Так как общая ошибка при этом
лежит в пределах — 0,6+ 0,4%, основной источник ошибки — бюретка. Ошибку
показаний бюретки можно снизить до 0,04%, если применить образец такого
объема или титрованный раствор такой концентрации, чтобы использовать все
содержимое (50 мл) бюретки. Индекс крутизны в точке эквивалентности равен
2,89 ■ 103, и ошибка в определении pH в 0,2 даст ошибку в определении объема
в 0,007%. Ошибка при использовании пипетки составляет 0,05%, а концентра-
■ция стандартного раствора известна с точностью 0,1%. Тогда минимальная
ошибка будет составлять ±0,2%, обусловленная, главным образом, неопреде¬
ленностью в концентрации стандартного раствора:47. Индекс крутизны для титрования 0,1 М раствора HCN 0,1 М раствором
NaOH равен 10,6; ошибка титрования определяется точностью определения pH.
Чтобы получить ошибку титрования равной 0,1%, pH должно быть определено
с точностью до 0,1 единицы, а это чрезвычайно трудно.Индекс крутизны для титрования 0,1 М раствора NaCN 0,1 М раство¬
ром НС1 равен 2,2 ■ 103; ошибка титрования определяется ошибкой показаний
бюретки.48. Индекс крутизны равен 4,85-104. Чтобы ошибка титрования была менее0,1%, pH следует определять в пределах 3 единиц вблизи от точки эквивалент¬
ности. Поскольку интервал изменения pH настолько велик, следует использо¬
вать уравнение (19). (Если принять, что ДрН =* dpH, то индекс крутизны дал
бы ДрН = 48,5, что абсурдно.)49. Уравнение, аналогичное уравнению (14), имеет вид;ф= У + И0/г„+1 *н2о\ . *ЛН+]C0v0 V [H+W /сН2о + /сй[н+] ,Уравнение (20) получается из вышеприведенного, если считать, что
Кь [Н+] > /СНг0, аФ»), Ошибка титрования при титровании 0,1 М раствора
NHa 0,1 М раствором НС1 с pH = 5,00 в конечной точке составит +0,014%.50. Дифференцирование уравнения (20) даетПолагая в уравнении (20) Ф = 1, имеем;^нго со+с Ан+к _Кь [н+]' с„с I1 J [H+]'jПодстановка этого выражения в вышенаписаниое даст уравнение (28). Если
член Кн2о/[Н+]' пренебрежимо мал По сравнению с [Н+], получаем уравне¬
ние (29).
408Ответы на вопросы. Глава V.51. Если предположить, что [Н+]' мало по сравнению с Ю-7, то из уравнения
(27) можно получить следующее выражение для индекса крутизны при титро¬
вании слабой кислоты сильным основанием:„ _по,7/ С0С Ка \Чш
41 0,217 (с„ +С КН2о JПодобным же образом, полагая, что [Н^ велико по сравнению с !0~7, из
уравнения (29) получаем значение ^ для титрования соли слабой кислоты силь¬
ной кислотой:'ь-ы'Аътс-к ГКогда Ка — Ю~7, оба выражения становятся одинаковыми:ч~6’3’1°-‘(с£гсГЕсли Ка > 10‘7, то г)2 > "Ль и титрование соли слабой кислоты сильной
кислотой точнее, чем титрование самой слабой кислоты сильным основанием.52. Для случая титрования раствора объемом Vo, 1 л которого содержит Со
коль слабой кислоты и Ci моль сильной кислоты, раствором объема V, содержа¬
щим сильное основание концентрации С, кривая титрования определяется усло¬
виями материального баланса и электронейтральности:Ка ) С,У0] Ч~ Ка / F + VoПервой точке эквивалентности соответствует равенство: CV = V0, а вто¬
рой— CV = С0П. Пользуясь приведенным уравнением, можно начертить кривую
титрования. Вплоть до первой точки эквивалентности [Н+] велика по сравнению
с Ка- Между первой и второй точками кривая титрования может быть прибли¬
женно заменена кривой диссоциации слабой кислоты. После достижения второй
точки эквивалентности Ка становится больше [Н+]. Для эквимолярного раствора
НС1—НАс наблюдаются две отчетливые ступеньки.Если положить Ф = CV/CiVo и считать [Н+] значительно большим Ка, то
ошибка титрования в первой точке эквивалентности определится выражением:\С, (н*1/ \ с,с IДифференцирование и оценка в точке эквивалентности дает индекс кру¬
тизныгде [H+] = [C0CKa/(Ci + C)]\Отметьте, что эта точка эквивалентности совпадает с точкой эквивалентности
при титровании соли слабой кислоты сильным основанием [уравнение (28)], и,
следовательно, индекс крутизны тот же.Для тех цифр, которые приведены в Вопросе, получаем:[Н*]' = 9,35 • 10-4; 4' = 11,6Иными словами, конечная точка является плохой. Во второй точке эквива¬
лентности т]' = 2,0-103, как в Вопросе 16, т. е. конечная точка достаточно рез¬
кая. [Отметим по поводу Вопроса 32 (стр. 129) следующее: требуемая концен-CVv + v0+ [Н+]Кн8о[Н+\v + v0J\[Н+
Ответы на вопросы. Глава V.409трация индикатора равна С0, концентрации растворов сильной кислоты и силь¬
ного основания равны Cj = С = 10-3. Конечной точке соответствует [Н+] = Ка-
Согласно уравнению для точки эквивалентности, приведенному выше,
Со = 4Ка = 6,4 • 10-4].53. Минимальная ошибка титрования в обеих точках эквивалентности появ¬
ляется тогда, когда индекс крутизны в этих точках одинаков. Пользуясь выше¬
приведенным соотношением и уравнением (29), находим, что при Со = С] мини¬
мальная ошибка титрования наступает при Ка — 10'7, а значение т)' таково:•п' = 0 217 ( -~°С 11 °’217 (С0 +С КН2оЕсли Со = С = 0,1, то величина г\' в обеих точках эквивалентности равна1,5-10-3; т. е. точное титрование возможно, если Ка ни слишком велико, ни
слишком мало, по сравнению с величиной 10“7.54. Используйте выражение (8); pH = 6,21.55. Уравнение (8) неприменимо. Пренебрегите величиной [HF] по сравнению
с [Н+], но не пренебрегайте ни членом [NH3], ни членом [ОН-]; итак:[Н+] = 1,25-10-7 [ОН-] = 8,0- 10-8
[NH+] = 1,0 -10-5 [F-] = 1,0 • 10~5[NH3] = 4,50 • 10-8 [HF] = 1,85 • 10-9
pH =6,9056. Уравнение (8) неприменимо, так как условия материального баланса и
электронейтральиости иные:[Н+] = 1,94- 10-в [ОН-] = 5,15-Ю~9[NH+] = 0,1 [Ас-] ==0,09[НАс] = 0,010 [NH3] =2,90- 10-spH = 5,7157. Уравнение (8) неприменимо, так как условия материального баланса и
электронейтральности другие; итак:[н+] = 5,05 • 10-9 [ОН-] = 1,98 • 10"“[NH+] = 0,09 [Ас-] = 0,1[НАс] = 2,88-10-5 [NH3] = 0,01
pH = 8,3058. Уравнение (8) неприменимо, так как величиной [Н+] нельзя пренебречь
по сравнению с величиной [HSOj]; итак[Н+] =3,22 • 10“8 [ОН-] = 3,10-10-9[NH* ] = 0,1 [S0f] = 0,2[NH3] == 3,48- 10—5 [HSO7] = 3,16 - 10_spH = 5,49Обратите внимание, что уравнение (8) дает pH = 5,62. Для 0,1 М раствора
Na2S04 pH = 7,48. Для 0,2 М раствора NH4NO3 pH = 4,97.
410Ответы на вопросы. Глава V.59. Уравнение (8) неприменимо, так как условия материального баланса
другие, итак:[Н+] = 1,64 • 10~12 [ОН-] = 6,1 -10-3
[ВН+] = 1,61 • 10~2 [В] = 8,39-10-2[А~]= 1,00-10~2 [НА] = 1,21-10-“pH = 11,7960. До достижения точки эквивалентности [Н+] мала по сравнению с [ОН-]
и Ка, т. е.ф кь[ Н+] /V + VBV [Н+] I*н2о + *б[Н+1 V CaV0Вблизи точки эквивалентности:со + с/гт,+1 *н2о\ . *н2оф-1С0С \ [н+] ) Ка *Лн+]и Кь, т. еПосле достижения точки эквивалентности [ОН-] мала по сравнеиию с [Н+]В точке эквивалентности[Н+] = 8,62 • 10“7- [ОН"]=1,16-Ю-8
[ВН+] = 5,0* 10“2 [А-] = 5,0* 10"2[В] = 3,26* 10~5 [НА] = 3,17 -10—5pH = 6,06Из уравнений (11) или (12) следует, что индекс крутизны равеи 3,4-102.
Если ошибка в определении pH составляет 0,2 единицы, то ошибка титрования
будет равна 0,059%, т. е. она меньше ошибки показаний бюретки. Если же ко¬
нечную точку взять при pH = 6,26, а ие при pH = 6,06, то вышеприведенное
уравнение кривой титрования даст Ф—1=—6,2-Ю-4, или 0,062%.61. В точке эквивалентности [Н+] = 1,06-10~7 и [В] = 4,0-10-7. Одно из урав¬
нений (11) или (12) дает индекс крутизны, равный 2,7-Ю3. Если ошибка опреде¬
ления составит ±1, то ошибка титрования будет ±0,04%. Более точное значение
можио получить, пользуясь уравнением кривой титрования.62. Пользуясь уравнением кривой титрования, получаем ошибку титрова¬
ния —0,68%.63. Сравните с Вопросом 52, в котором рассмотрено титрование смеси силь¬
ной и слабой кислот сильным основанием.Для случая титрования раствора объемом Va, содержащего Со моль/л сла¬
бой кислоты и Ci моль/л сильной кислоты, раствором объемом V, содержащим
слабое основание концентрации С, кривая титрования определяется условиями
материального баланса и электроиейтральности:
Ответы на вопросы. Глава V.411Для случая титрования 0,1 М раствора H2S04 0,1 М раствором NH3 С0 =
Cj = С = 0,1; 1,02-10—3 н Кь *= 1,78 • 10-5. От начала титрования нвплоть до второй точки эквивалентности величина Кц20/[Н*] пренебрежимо
мала по сравнению с [Н+], а Кц2о мал° па сравнению с Кь [Н+].Полагая Ф = CVjCaVа< для этой области кривой имеем:Ка Гтт+1 V + VФ= 1 + т-:,- [Н+][н+] + Ка C0V0Вблизи ‘второй точки эквивалентности н далее [Н+] пренебрежимо мало по
сравнению с Ка, тогда:o,—*iMr\2 + lv + v.*н,о + кД"*1 / V с,у,Пользуясь ответом на Вопрос 52, можно вычислить индекс крутизны в пер¬
вой точке эквивалентности. Когда Ф = 1, [Н+]' = 1,80-10-2 н в первой точке эк¬
вивалентности pH = 1,75, а показатель резкости запишется следующим обра¬
зом:Г)' = 0,217 С'С = 0,6С. + С [Н ]Это говорит о том, что первая точка эквивалентности не может быть прак¬
тической конечной точкой. Во второй точке эквивалентностиФ = 2; [Н+]" = 3,3- !0_б; [В]" = 5,3• 10_б(сравните с Вопросом 58).Согласно уравнению (11), т^' = 1,4-103, а это дает хорошую конечную точ¬
ку. Обратите внимание на то, что уравнение (12) дает индекс крутизны, равный
9,2 -102, что близко к вышеуказанному значению, ио все же заметно отлично от
него.64. Точное решение уравнения дает:*Лн+] Ка*JH+] + *h2o *а + [Н+]/ [Н+]а ЛН20-[HiВыражение (8), характеризующее предельное приближение в области высо¬
ких концентраций, дает для С значение менее 10~5 М. Для 1,0-10~6 М раствора
NH4CN pH = 7,96.65. Получение уравнения (8) было основано на допущении, что обе вели¬
чины [Н+] и IOH'] пренебрежимо малы в уравнениях (6) и (7). Если и Ка, и Кь
значительно больше 10~7, то величины [НА] и [В] могут быть очень малы, даже
если С значительно: тогда не будет выполняться условие, принятое при выводе
условия (7). Наоборот, если и Ка и Кь значительно менее 10~7, обе величины
[А"] н [ВН+] могут быть очень малыми, даже если С велико, и тогда не выпол¬
няется условие, при котором было выведено уравнение (6). Гриффит не делает
различия между этими двумя случаями. Поэтому будет неправильно буквально
принимать его качественное заявление.66. Если в выражении (6), но не в (7), пренебречь величинами [Н+] и [ОН-],
то получим соотношение Кларка. Оно оказывается полезным, когда величины Ка
н Кь того же порядка, что и концентрация (см. Вопрос 59). Оно было бы ещеполезным, если бы и [ВН*1, и [А-] по порядку величины совпадали бы
412Ответы на вопросы. Глава VI.с С. Оно переходит в выражение (8), когда величины Ка и Кь становятся ма¬
лыми по сравнению с С. Качественное высказывание Кларка ошибочно, так как
оно приводит к тому, что формула оказывается точнее в более разбавленных
растворах. В действительности же точность формулы выше в более концентри¬
рованных растворах, так как [Н+] и [ОН-] меньше [ВН+] и [А-].Глава VI1. 5 = 1,33-10—5 моль!л.2. S == 1,18 * 10 3 моль/л.3. 5 = 1,58* 10г моль/л.4. S = 6,9- 10-4 моль/л.5. АГ(тв)о=1.96-10_4.6. /С(тв)о = 2,46* 10_э-7. /С(тв)0 = 3,18 *8. а. 5 = 0,395 г/л; б. 5 = 3,26-10“* г/л (см. раздел XI. 3).9. pH = 8,5210. 27,2 мг.11. Осадок не образуется.12. 14,3 мг.13. 26,4 мг.14. 5 = 3,16-10-7 моль!л.15. S= 1,26- 10-4 моль/л.16. 5= 1,56- 10~5 моль!л.17. S = 1,26 - 10~4 моль!л.18. S = 6,6- 10-7 моль{л.19. Решение уравненияS3+ 1,0 • 10_4S2 — 1,65- 10-'° = 0дает:S = 5,17 -10 4 моль/л20. а. 97,5%; б. 99,5%.21. а. 0,085; б. 0,021%; в. 0,063%.22. 0,229 г.23. 14,3 мг.24. 0,525 г.25. 6,35 мл.26. Решение уравнения[ОН-]3 + 3,16 • 10-4 [ОН-]2 - 3,64 • 10~!! = 0дает:[ОН] = 2,53- 10~4, т. е. pH = 10,40; 5 = 2,84-10~4 моль/л.27. Пренебрежение [Н+] и [НАс] в условиях материального баланса и элек¬
тронейтральности дает:pH = 9,72; S = 5,05-1Q'2 моль/л; требуемый объем 1,98 мл.
Ответы на вопросы. Глава VI.41328. S = 1,82 • 10-7 моль!л; требуемый объем 550 л.29. S = 1,02-10-5 моль/а.30. Решение уравнения[ОН-]3 - 1,78 • 10~5 [ОН-]2 - 7,28 • 10_ш [ОН~] - 1,30 • 10~14 = 0дает [ОН'] = 4,26-10~5; S = 1,00 • 10~2; требуемый объем 10,0 мл.31. 72%.32. Условия материальных балансов в чистой воде и растворе Na*X дают:*(ra)0 = ss+W(zS)z (г/S + С)у = К(тв)оТарш образом, S*+yzzy'J = Sz+yzzyy плюс другие положительные члены,
содержащие С. Следовательно, для любого положительного реального зна¬
чения СS0>S33. Первым выпадает в осадок бромнд. В момент начала осаждения хлорид
серебра [Вг~] = 3,0-10'5 М. Максимально достижимая чистота хлорида 99,7%.34. Весь PbS04 переходит в РЬ(Юз)г.35. Стронций совсем не выпадает в осадок, а бария выпадает 99,83%.36. 0,055%.37. Для построения кривой титрования используйте уравнение (7), в кото¬
ром [Ag+] замените на [Hg2*]. В случае определения значения lg [Hgj+] с точ¬
ностью 0,1 единицы ошибка титрования составит 0,78%.38. Согласно уравнению (13), ошибка титрования составит 7,5%. Если pAg
определено с точностью 0,05 единиц, минимальная ошибка титрования соста¬
вит 2,3%.39. 0,015%.40. Ошибка, вызванная вымыванием, составит —0,02%. Ошибка титрования
+0,009%. Ошибка определения объема: первой пипеткой — 0,05%, второй —0,03%, бюреткой — 0,02%, общая—±0,10%. Таким образом, ошибка титрования
в основном определяется ошибкой нахождения объема. Необходимо устранить
из раствора AgCl, так как AgSCN менее растворимо, а в присутствии избытка
ионов SCN" часть AgCl будет переходить в AgSCN, что вызовет увеличение
ошибки титрования. В случае грубого титрования хлорид серебра можно не
устранять из раствора AgCl.41. В начале pAg = 15,08. Вплоть до первой конечной точки при V = 2Vo
кривая титрования определяется уравнением:[Ag*]-8,3.10-(^±^-)Первая конечная точка наступает при pAg = 10,50, когда начинает оса¬
ждаться AgBr, а не в точке эквивалентности (pAg = 8,04). Ошибка титрования
составляет — 0,007%. На практике эта первая ступенька не очень резкая, ввиду
процессов соосаждения и адсорбции.При изменении V от 2Vo до 2,5V0 кривая титрования определяется уравне¬
нием:[Д,-]_Ь24.,0-(1^Г)
414Ответы на вопросы. Глава VII.Вторая конечная точка наступает при pAg = 8,20, когда начинает оса¬
ждаться AgCi, а не в точке эквивалентности (pAg = 6,14). Ошибка титрования
составляет —0,3%.Остальная часть кривой титрования описывается уравнением:Последняя конечная точка считается- расположенной в том месте, где наклон
кривой титрования максимален, т. е. при V = 3,5V0. Ошибка титрования зави¬
сит от аккуратности определения pAg, но может быть достаточно легко умень¬шена до ±0,1%.42. pH = 5,53 S = 6,9 • 10”2 моль/л.43. pH = 7,36 S = 3,52 • 10~3 моль/л.44. [Sr2+] = 6,60-10-5 М\ 9,28• 10~5 моль SrF2 осаждаются (92,8%).45. V = 8,10 мл.46. pH = 9,23 S = 2,94 • 10~3 моль/л.47. pH = 3,75 S = 1,73 • 10~4 моль/л.48. Ошибка определения S составляет 0,001 %.49. Из условий материального баланса и электроиейтральности получаем:Формиат свинца всегда растворим более иодата меди для любого положи¬
тельного значения [Н+].50. Если величина [Н+] мала по сравнению с Ка< то [НА] мало по срав¬
нению с [А ] и*а*н2о*«+*$>.Затем вычислим С из выражения:Последнее позволяет построить зависимость S = f (С).Глава VII1. Способом, аналогичным описанному в тексте, можно вывести;[H*jа — 2аг2 — а = 2а0 + а4
Ответы на вопросы. Глава Vtt.4152. Способом, аналогичным описанному, можно вывести соотношения:я == 4а4 + Заз + 2а2 + а4 — я = 4а0 + 3а1 + 2а2 + а33. Используйте уравнения, выведенные в Вопросе 1. Начертите зависимость
<Хо, ai и а2 от pH и постройте функцию п = / (pH) (см. рис. VIII. 14, стр. 264).4. Используйте уравнения, полученные в Вопросе 1. Постройте зависимости
(Хо, ai и а2 от pH и 2 — п от pH.5. Используйте уравнения, выведенные в Вопросе 2. Постройте зависимости
«о, ось а2, аз и а4 от pH и п от pH.6. Используйте уравнения, выведенные в Вопросе 2. Постройте зависимости
во, ось а2. «з и а, от pH и 4 — Я от, pH.При pH = 14,0 ао = 0,01, поэтому последний протон лимонной кислоты
в водных растворах не может быть удален на значительное расстояние.7. Доли присутствующих в растворе групп, вычисленные для различных pH,
приведены ниже:Так как величина [Н2С03] всегда составляет 0,3% от величины [СОг], то,
очевидно, в любом уравнении условия материального баланса ею можно прене¬
бречь. Обратите внимание, что соотношение выполняется с точностью до 0,3%;
Лш — KaiK независимо от того, дает ли величина [С02] количество свободного
С02 или общее количество С02 и Н2С03.8. Величина [НА~] максимальна при pH = ’/2 (рКщ + рКаг);9. Скорость образования НА" в два раза выше скорости образования Н2А,так как для Н+ на А2~ существует два возможных положения, а на НА- только
одно. Скорость разложения Н2А вдвое превышает скорость разложения НА',гак как два иона Н+ могут диссоциировать из Н^А, а из НА~ — только один.ДолиЧастицырН = 3 pH = 7 pH = 10С02 . .
Н2С03нсо; .0,997 0,192 1,61 • 10~42,79 • 10~3 5,39- 10-4 4,51-10-7
4,19 -10~4 0,808 0,6762,01 -10“11 3,88-10"" 0,322[Н2А] = [НА'] при pH = pKai
[НА-] = [А2-] при pH = рКа2
416Ответы на вопросы. Глава VII.Поскольк) скорость разложения Н2Аа1 скорость образования Н2А
_ скорость разложения НА~
аг скорость образования НАто: Ка\ = 4Ка2.10. Как будет доказано в разделе IX. 2, стр. 275 или как можно видеть, если
продифференцировать выражение для [Н2А2~], максимальному значению [Н2А2~]
соответствует п = 2. Для четырехосновной кислоты это условие сводится к сле¬
дующему:2а4 а3 = а; 2cto
Если а4 и а0 малы, то получаем данное выражение.11. [Н+] = 2,15-10~2 [Н2Р07] = 2,15 -10-2
[Н3Р04] = 7,85 • 10~2 pH =1,6712. [Н+] = 2,44 • 10~5 [H2AsO;] = 0,10
[H3As04] = 4,07 • 10~4 [HAs04“] = 4,31 • Ю~*pH = 4,6113. [Н+] = 7,25 • 10~e fH2P07] = 1,0 • Ю-3
[H3P04] = 1,23 • 10~e [HPO2-] = 8,48 • 10~epH = 5,14. 14. Аналитическая концентрация Na2HP04 в растворе, где [ОН~] = [Р04“]
составляет 2.08-10“2 моль/л. В графическом методе можно воспользоваться про¬
тонным условием[н2ро7] = [он-] + [роГ]пренебрегая одним из членов в правой части выражения. Это дает для заданной
аналитической концентрации pH = 9,78. Если учитывать оба члена, то pH = 9,61.
Разница составляет 0,15 единиц pH, или 14% [Н+], что и является максимальной
ошибкой графического метода.15. pH 0,1 М раствора NaHC03 равно 8,30, а 0,1 М раствора Na2C03 11,37.16. См. Примеры VII. IS и XII. 2; pH = 4,18.17 Решрние кубического уравнениядает:[Н+] + 3,02 • 10~2 [Н+]2 - 2,89 ■ 10_3 [Н+] - 1,31 • 10~5 = 0[Н+] = 4,34 • 10~2 [ОН-] == 2,3-10—13[Н4Р207] = 5,67 • !0~2 [Н3Р20;] = .3,94 • !0~2[Н2Р2072-] = 3,96 • 10"3 [НР203-] = 2,28 • 10-7
[Р204“] «= 2,94 • 10“15 pH = 1,3618. pH кислоты 1,99, а соли 4,98.
Ответы на вопросы. Глава VII.41719. Для раствора NaHA условие материального баланса по водороду имеетвид:[Н+] + [Н,А] = [А2"] + [ОН']Если разность [ОН+] —[ОН-] пренебрежимо мала по сравнению с [Н2А] или
[А2-], то: [Н2А] = [А2-]. Это дает: [Н+]2 = KaiKa2, т. е. искомую формулу.20. Из условия материального баланса по водороду и условия равновесия
имеем^1 + = ^нгО + Каг [НА ]Если в условии материального баланса преобладает член [НА'], что характерно
для случая Kai > Ю3/Со2, то:[н+]2 (l[НА'] = С и [Н+]2fHlo+^a*C1 + с/ка1Точное решение имеет вид:([Hi2 + ка] [н*] + ка1ка2)(кН2о - [Hi2)[н+] ( [Н+]2 - KalKai)21. При титровании А2" сильной кислотой кривая титрования описывается
уравнением:ф = Я + VnV^-C0v0В первой точке эквивалентности
®к. т -■ 1 = (<*о — о2)к, т Ч"То же самое выражение для первой точки эквивалентности только с противо¬
положными знаками у членов, стоящих в правой части, пригодно и для титро¬
вания А2' сильным основанием.Во второй точке эквивалентности при титровании Н2А сильным основанием:Фк. Т - 1 (а, + 2а2)к. т + ~ [Н'к т )рой точке эквивалентности при титровании А2' сильной кислото?Ф,. t - 1 _ - („, + 2«„)к, , + (-^£) ([H*k , -22. Используйте уравнения, полученные в Вопросе 21. В точке эквивалент-
кюсти^ pH = 8,40, а в конечной точке pH = 9,00. Ошибка титрования равна23. См. ответ на Вопрос 52 (стр. 408). Для титрования Vo мл раствора 1 л
которого содержит Со моль слабой двухосновной кислоты Н2А и Ci моль силь¬
ной кислоты, раствором объемом V мл, содержащим сильное основание в кон¬
центрации С моль/л, кривая титрования определяется условиями материального
баланса и электронейтральностиCV I Гп+1 ^н2° f C°V° ™ ■ ' • ClV°+!н 1 - TFT+7Т?; (2“"+a'»+где «1 и oti выражены, как функции [Н+] соотношениями, полученными в
вопросе 1.14 Зак. 345
418Ответы нй вопросы. Глава VII.Первая точка эквивалентности поянляется при CV = CiVo, а вторая при
CV = C0V0. Для рассматриваемой смеси эти объемы отличаются друг от друга
только на 1%.Первая точка эквивалентности является корректной для случая титрования
сильной кислоты и появляется при pH 10~4 М раствора СОг; pH = 5,19.В первой точке эквивалентности индекс крутизны приблизительно опреде-С С 1ляется выражением (см. Вопрос 52) т)'=0,217 т^~Т~г ' Tu+i7- Для этого титрованияCi+c, [Н I[Н+]' = 6,45-10'®; Ci = С = 10“2 т) = 168. Для титрования в отсутствие СОг
индекс т) = 1,1 • 104.Таким образом, наличие даже незначительного количества СОг при титро¬
вании сильной кислоты сильным основанием существенно снижает его точность... 24. Используйте уравнения, полученные в Вопросе 21. Если pH первой ко¬
нечной точки принять равным 9,0, то ошибка титрования составит — 5,1% (см.
Вопрос 22). Если принять pH второй конечной точки равным 3,8, то ошибка ти¬
трования будет равна +0,18%, если при этом не улетучивается С02.Кипячение раствора для снижения концентрации растворенного С02 до
10~* М приводит к тому, что точка эквивалентности появляется при pH = 5,2, а
не 3,67, соответствующем 0,1 М раствору СОг. Когда индекс крутизны опреде¬
ляется уравнением, приведенным в Вопросе 23, тогда для непрокипячеиного рас¬
твора ои равен 51, а для прокипяченного 1,7-103. В зависимости от того, на¬
сколько близко ко второй конечной точке оттитрован образец, будет изменяться
и концентрация С02 в прокипяченном растворе, и, следовательно, будет сильно
меняться и индекс крутизны. Чем более щелочным является раствор в конечной
точке, тем четче конечная точка. В качестве индикатора метиловый красный сле¬
дует предпочесть метиловому оранжевому, поскольку pH конечной точки для
прокипяченного раствора равен 5. Если индикатором для прокипяченного раствора
служит метиловый оранжевый, то ошибка титрования 0,1 М растворов составит
от 0,1 до 0,2%. , 725. Если раствор, 1 л которого содержит 0,05 моль Na2COs и 0,025 моль
NaHC03 титруют 0,1 М раствором НС1, то первая точка эквивалентности появ¬
ляется прн V = 0,5 Vo, а вторая — при V = 1,25 Vo. Из условий материального
баланса и электронейтральности получаем уравнение кривой титрования:°-12570 , г„+1 *Н2о . 0,075V0 , . _ 0,10У- + [Hi = + .f- ■ в- [а, + 2g„] + -V + V0 [Hi V + Vo V + Voгде cti- и oco определены как функции [H+] уравнениями в Вопросе 1.Уравнение кривой титрования 0,075 М Na2C03 отличается только тем, что
вместо 0,125 Vo в первом члене стоит величина 0,150 V.26. Используя уравнениеФ = й ([Hi-[ОН-])V о^Ои кривую образования (рис. VII. 3), получаем уравнение крирой титрования..27. В первой точке эквивалентности индекс крутизны равен 6,2; это плохо.
Во второй точке эквивалентности он равен 2,3-103, что вполне пригодно. Во
второй точке эквивалентности pH = 8,64; так что хорошим индикатором будет
тимоловый голубой. Где это необходимо, концентрации принимали равными
0,1 М.28. Вблизи первой точки эквиаалентности из уравнения (6) имеем:Ф- 1=2а0 + а,-а3 + 2.104([0н1-[н1)Значение pH в первой точке эквивалентности pH = 5,76, а ие 4,72, как в
предельном случае для высоких концентраций. Так как и «о и аз малы по срав-
л.Ответы на вопросы. Глава VII.419нению с cti, тоф _ 1 = а, — 2 • 104 [Н+] = 1,0 • 10-2Подстановка <Xi в виде функции [Н+] приводит к квадратному уравнению1,17 • 102 [Н+]2 + 6,60- КГ5 [Н+] - 3,60 • Ю-10 = 0из которого получаем pH = 5,83.Таким образом, если ошибка в определении объема составляет 1%, то раз¬
личие в значениях pH всего лишь 0,07 единиц; этой точности достичь трудно, но
возможно.Используя понятие индекса крутизны, равного в первой эквивалентной точке
5,8, находим ошибку в определении pH. Она составляет 0,06 единиц при ошибке
определения объема в 1%.Поскольку [Н+] много больше [Н3РО4], предельное выражение для индекса
крутизны в области высоких концентраций, согласно которому последний равен63, является некорректным. Это становится очевидным из концентрационно-лога¬
рифмической диаграммы.29. В начале титрования раствор — это чистая кислота Н2А. Пренебрегая
членами [А2] и [ОН'] и принимая, что [НА] мало по сравнению с [Н2А], получаем:[Н+]2 = KajCВ первой точке эквивалентности раствор — чистая соль NaHA. Пренебрегая
членами [Н+] и- [ОН-] и предполагая, что [Н2А] и [А2-] малы по сравнению
[НА-], получаем:[Н+ f = KaiKa2Во второй точке эквивалентности раствор — чистая соль Na2A. Пренебрегая чле¬
нами [Н+] и [Н2А] и предполагая, что [НА'] мало по сравнению [А2-], получаем*аЛ0Н12 = *„2ОС
Из всех трех перечисленных соединений только С02 удовлетворяет всем
условиям. Для щавелевой кислоты уравнение для pH в начале не выполняется,
так как [НА-] не мало по сравнению с [Н2А]. Для H2S уравнение для pH не вы¬
полняется во второй точке эквивалентности, так как член [НА-] не мал по срав¬
нению с [А2-].30. В начале титрования справедливо выражение:pH=l(pKal-lgC)Согласно этому выражению при С = 0,1 величина pH = 1,61. Сравните это
значение со значением, вычисленным строго, равным 1,67. Член [Н2РО^] не мал
по сравнению с членом [Н3РО4].В первой точке эквивалентности выполняется соотношениеpH = (P^ai + РКаг)которое дает значение pH = 4,72. Сравните с вычисленным строго значением,
равным 4,72.Во второй точке эквивалентностиРн = -i- (РК«2 + РК«з)т. е. pH = 9,76. Сравните с вычисленным строго значением равным 9,76.В третьей точке эквивалентностиpH = !(ptfe3 + ptfH3o+lgC)14*
420Ответы на вопросы. Глава VII.Согласно этому выражению при С = 0,025 величина pH = 12,36. Сравните
с вычисленным строго значением, равным 12,16. Член [НРО2-] не мал по срав¬
нению с членом [РО3-]31. [н+] = 4,ю • 10~4 [Ас-] = 4,10- Ю-4
[НАс] = 9,59 • 10-3 [NH3] = 2,74 • 10“8
[NH+] = 0,02 [ОН-] = 2,44* 10"11pH = 3,3932. [Н+] = 1,08* 10”2 [ОН-] = 9,25-10"13
[F-] = 5,86 ■ 10_3 [HF] = 9,41 -Ю-2[HSO;] = 5,15 • 10_3 [SO2-] = 4,85 • 10_3
pH =1,9733. [ОН-] = 7,0* Ю-3 [Н+]= 1,43-10-12
[CH3NH2] = 9,3 • 10“2 [CH3NHg] = 7,0* Ю_э
[(CH3)3N] = 9,88. lO-4 [(CH3)3NH3] = 1,14 ■ 10-5pH = 11,8534. , [ОН~] = 1,ЗЗ.Ю_3 [NH+] = 1,33.10-3[NH3] = 1,0* 10 1 [H+] = 7,5* 10~12[Ac-] = 5,0- 10-2 [HAc] = 2,14 • 10-8
pH= 11,1235. Выражение равновесия для индикатора имеет вид:[Н+]2 [In2-] = 3,97-10-'9
В 0,1М растворе NH3 величина [Н+] =7,5* 10“12 (см. Вопрос 34) и1,42. 10“[Н21п] , /)0_ )п—4[In2]36. [Н+] =5,2- 10~2 [НОх-] = 5,2 • 10—2
[Н2Ох] = 4,8-10-2 [Ох2-] = 5,2.10-5[НАс] = 1,0 • 10_3 [Ас-] = 3,4 • 10~7
pH = 1,2837. [Н+] = 2,42-10“12 [СО2] =9,57 • 10-2
[НСО~] = 4,14 • 10~3 [NH3] = 9,96 * Ю-4[С02] = 2,24 • 10“8 [NH+] = 4,28 • 10_в[ОН~] = 4,14 • 10—3pH = 11,62
Ответы на вопросы. Глава VII. 42138. [Н+] = 1,09-10"1 [Ас-] = 1,60-10-6
[SOf ] = 8,64 • 10-3 [НАс] = 1,00 • 10" ■1[HSOj] = 9,14 • 10-2pH = 0.9639. Используя условия материального баланса, получаем:а = 1 1,02 -10~2 1,75-10~5а [Н+] + 1,02 * 10“2 [Н+] + 1,75 • 10-540. Для случая титрования раствора, представляющего собой смесь V0 мл
раствором сильного основания концентрации 0,1М и объемом V мл, имеем:0 = a+10-V-tVa ([ОН~] — [Н+] )
у огде а определяется из ответа на Вопрос 39, аф = V/Va. Используя индикаторы,
можно определить с точностью до 1% только конечную точку (V = 3Vo).
В точке эквивалентности pH = 8,58, и тимоловый голубой вполне подходит в ка¬
честве индикатора.41. pH = 8,19.42. Кривая образования определяется уравнением:___ [Н*](2[Н*] + ДГа1)[Н+Г + Kai [Н+] + KaiKa243. Кривая титрования определяется уравнением:ф = 2 - я -f -ДУ- ([ОН~] - [Н+])^ 0 V' о44. а. pH = 9,97; б. pH = 4,97 [обратите внимание на то, что pH не равноY (ркй1 + рКа2)]; в. pH = 2,01.45. Используйте уравнения (9) — (12) (стр. 180) для вычисления зависимо¬
стей а3, а2, cti и а0 от pH. Кривая образования п определяется уравнением (15)
(стр. 182).46. Используя условия материального баланса и равновесия, получаем вы¬
ражение для растворимости:S = 3,87 • 102 [Н+] + 3,78-10~s + 4,76- 10_13/[H+] [В~] = 4,76- 10-13/[Н+)47. В чистой воде pH = 5,83, а в изоэлектрической — pH = 5,72.48. Вычисление зависимостей а3, а2, си и ао от pH для цистеина (Н2А) про¬
водите по уравнениям (9) — (12) (стр. 180). Кривая диссоциации 3 — п опреде¬
ляется уравнением (16) (стр. 182).В изоэлектрической точке должно выполняться условие:[Н3А+] = [НА“] + 2 [А2~], т. е. pH = 5,1749. Для цистина (Н2В) используйте уравнения, полученные в Вопросе 2.В изоэлектрической точке должно выполняться условие2 [Н4В2+] + [Н3В+] = [НВ“] + 2 [В2-]т. е. pH = 5,03.
422Ответы на вопросы. Глава VII.50. Для аргинина (НА) в изоэлектрической точке должно выполняться усло¬
вие2[НэА2+] + [н2А+] = [А-]т. е. pH = 10,78; в чистой воде pH = 10,48.Для аспарагиновой кислоты (Н2А) в изоэлектрической точке должно вы¬
полняться условие[Н3А+] = [НА-] + 2 [А2-]т. е. pH = 3,01; в чистой воде pH = 3,14.Отметьте, что аспарагиновая кислота дает кислый раствор, глицин — почти
нейтральный, аргинин — основной.51. Обозначим «классические» константы штрихами.а. < = /Са2; K'b = KHi0/Kal 'б- *«1 = Ка2 ~ КцЗ’ ~ ^Н2о/^а1в. *'а = Ка3; К'ы=КН201Ка1; = КН^К52. Обозначим константы цвиттерионов двумя штрихами. Для аминокис¬
лоты с одной кислотной и одной основной группой:К = Ко1 = Кщо1К'ъ’ К'ь - *Н2о/* а2 = *Н,о/<Для аспарагиновой кислоты данные константы соответствуют следующим:<2=^2;Пока используемая система достаточно четко определена, нет никакой неодно¬
значности в результатах, только большая путаница.53. pH = 8,08 (см. Пример VII. 15); 0 = 1,61 - НИ.54. pH = 8,08; 0 = ^бЫО'1.55. См. Пример VII. 4. Протонное условие приблизительно запишется так:[Н3Р04] = [НРО*-]; pH = 4,73; Р = 3,04 ■ 10-356. Протонное условие приблизительно запишется так[Н+] + [Н2Ох] р= [Ох2-]pH ==2,86; Р = 1,67 • 10“2.57. См. Пример V. 17, pH = 0,28; Р = 1,15-1058., Протонное условие приблизительно запишется так[C02] = [NH3]pH = 7,73; Р = 1,6Ы0-2.59. Протонное услоиие н условие электронейтральности приводят к выра-
женйю:[НАс] = [Ас-] = 0,05pH = 4,75; 8 = 5,75-10~2.60. Протонное условие приблизительно запишется так[NH3] == [НОх-]pH = 6,61; ft = 1,04 • Ю-3,
Ответы на вопросы. Глава VII.42361. Протонное условие приблизительно запишется так:[HC03-] = [NH3]pH = 9,16; р = 5,03 • 10~2.62. Протонное условие приблизительно запишется так:[h+] + [N2H’+] = [N2H4]рН = 4,64: Э = 1,15* 10 4 (см. Вопрос 44).63. Протонное условие приблизительно запишется так[вн+]=[g-]pH = 8,60; р = 6,88 • 10“г.64. Протонное условие приблизительно запишется таю[BH+] = [G-]pH = 8,34; 0=1,59-10-3.65. Протонное условие и условие электронейтральностн приводят к выра¬
жениям:[А2-] = 0,025 + [Н2А]; [НА-] = 0,075 -2 [Н2А]pH = 4,06; р = 7,12* 10 2 [(из уравнения (14>] и р = 6,92* 10 2 [из уравнений
(10), (11) и (12)].66. См. Вопрос 18. Протонное условие приблизительно запишется так:[Н+] = [Н3А~] + [н2А2“]pH =1,99; р = 4,69 • 10-2.67. См. Вопрос 18. Протонное условие приблизительно запишется так:2 [Н4А] + [Н3А'] = [НА3"]pH = 4,98; р = 5,28-10“2.68. Протонное условие приблизительно запишется так:[Н<А] = [Н2А2~]pH = 3,54; 0 = 7,92-10-2.69. Протонное условие приблизительно запишется так:[hcoj] + [ch3nh+] = [nh3]Решение кубического уравнения2 [Н+]3 + 7,48 • 10—11 [Н+]2 - 4,20-Ю'20[Н+]- 1,18-10-з9 = 0дает: рН = 9,85 и 0 = 1,47 • 10-1.70. См. Вопрос 42 главы V. Продифференцируйте уравнение (12) и покажите,
что когда dp/rf[H+] = 0, то [Н+] = Ка. Подстановка этого значения [Н+]
в уравнение (12) дает 0 = 0,575 С.71. Когда Ка\ — 4/СЯ2 уравнение (14) преобразуется:_ 2,303 С Ка, [Н+][Н+]2 + Каг [Н+] + KaiKai
424Ответы на вопросы. Глава VII.Пусть Ка = (Ка\Каг) Чг. тогда получаем:2,303 (2С) АГ0[Н+]Р ([н+] + *а)272. Продифференцируйте уравнение (14) по [Н+] и примите dfild [Н+] = 0.
Окончательное выражение будет уравнением четвертой степени» которое можно
разложить на множители:([н+] - KhKlz) + ([Н+]2 - Ка1Ка2)(8Ка2 - ка1) [н+] = оЭто уравнение удовлетворяется для любых значений констант, если выпол¬
няется' соотношение: [Н+]2 = KaiKa2. Когда Kai > 8Каг существуют два других
корня (см. раздел. IX. 3). Точки перегиба на кривой образования соответствуют
минимуму или максимуму на кривой для буферной емкости.73. Уравнение (14) при Кщ = Каг дает:Р.-2,303^,[Н*Ь1Н*1' + 4К‘'ЛН*1 + ''*'с ' ° (|н*]’ + /г„,1н*] + ку’А из уравнения (12) находим:— = 2,303 Каг [Н+] -С ’ ([Н+] + KaiYОба эти соотношения имеют максимум при [Н+] = Kai- Максимальное зна¬
чение первого равно 1,53, а второго — 0,575. Таким образом, двухосновная кис¬
лота вдвое лучший буфер, чем одноосновная кислота той же концентрации.74. S = 2,8-10~5 моль/л.75. S = 2,66-10*« моль/л.76. Для растворов, насыщенных Саз(Р04)г и СаНР04 условия материального
баланса необходимы только для вычисления растворимости. Условие электроней¬
тральности, два произведения растворимости, ионное произведение воды и вто¬
рая и третья констаиты ионизации для фосфорной кислоты дают 6 уравнений
с 6 неизвестными:[Са2+], [Н+], |Н2Р0;|,[НР042~], [Р0®“] и [ОН-]. Членом [Н3Р04]
пренебрежем. Члены [Н+] и [Са2+] наиболее легко исключить из условий равно¬
весия, и, если членами [Н+], [ОН-] и [Р04~] пренебречь в условии электроией-
тральности, то имеем три уравнения для трех неизвестных:[нро42-] ( [н2ро;| + 2 [НРО2-]) = 2,0 - ю-7
[Н2Р07] [РО®-] = 7,75 • 10“в [HPOf]2
[РО*-]2 = 1,0- 10-s [НРО2-]3Их можно объединить таким образом, чтобы получить уравнение только по од¬
ной неизвестной —[НРО2-]:(1,0 • 10“7 - [НРО2-]2)2 = 1,50- 10“в [HPOf]3Приравнивай член в скобке нулю, получим первый корень. Второе приближение
дает:[НРО2-] = 3,04 • 10“4 . [Р043~]= 1,68-10-8[Н2РО;] = 4,27 - 10“* [н+] = 8,65 • 10"*pH = 8,06
Ответы на вопросы. Глава VIII.42577. СаНРС>4 не выпадает в осадок. Растворимость Са3(Р04)2 составляет
1,28-10-6 моль/л; pH = 9,52.78. Если принять ратворимость Са3(Р04)2 равной 1,0-10~2 моль/л, то нз вы-fжжений для произведения растворимости и условий материального баланса
Р03~] = 1.92- Ю-9. Если считать твердой фазой соединение Са3(Р04)2, то усло¬
вия электронейтральности и материального баланса дают для аналитической кон¬
центрации Н3РО4 значение С = 2,63-10~3. Однако в насыщенном растворе
[НРО2-] = 1.95 • 10-4, а это приводит к тому, что произведение растворимости
для СаНР04 превышено. В результате твердой фазой будет не Са3(Р04)2, а
СаНР04. Если растворимость последнего равна 1,0-10-2 моль/л, величина
[нроГ] должна равняться 1,0-ЮЛ Тогда из условий материального баланса
и электронейтральности, составленных вновь по этим данным, находим аналити¬
ческую концентрацию Н3Р04, которая обеспечит растворение соли; она равна
4,22-10-®.79. СаНР04 всегда менее растворим, чем СаНР04(Н20)j, независимо от
pH в разбавленных растворах. В концентрированных растворах коэффициенты
активности изменяют константы равновесия настолько, что гидрат может выкри¬
сталлизоваться. Из насыщенного раствора Саз(Р04)2 в чистой воде Са5(Р04)30Н
осаждается, если достигается равновесие.80. Если [СОг] = 3,43-10~2 моль/л, то условие материального баланса для
С02 непригодно. Условия электронейтральности, равновесий и материального ба¬
ланса для Ва2+ дают S = 3,35-10_3 моль/л.81. Если в условии электронейтральности пренебречь всеми членами, кроме
[Са2+], [НСО-] и [СО2-], то получим:РС02 = 1,0- 109 [Н+]г ( [Н+] + 1,12 • 10-1Т'/2S = 7,7 ([Н+] + 1,12. Ю-10)+1/2 + 1,18 • 102 [Н+]Пусть [Н+] > 1,6-10'10— это соответствует pH насыщенного СаС03 водного
раствора (см. Вопрос 82). Итак, можно вычислить значения РСОг и S и по¬
строить график. Для очень малых значений РС02следует использовать приближе¬
ния, сделанные выше, и более точные уравнения, в которых присутствуют члены
[Н+] и [ОН1.82. S = 1,6-10-4 моль/л; pH = 9,8.83. [CaHCOj] = 1,9 • 10~7.84. Пренебрежение комплексообразования дает S =1,86-10'®, а учет —
3,72-10-6.85. Доля Mg, остающегося в растворе (не выпавшего в осадок), 10-5 %.Глава VIII1. a. [Cd2+] =4,18-10-3 [СГ] = 9,21 - 10“3[CdCl+] = 8,1 • 10-4 [CdCl2] = 5,90 -10-5[CdCl^j = 6,69 -10“7 [CdCl2-] =2,15- Ю"9
h = 0,1586. [Cd2+] = 1,0 -10“5 [Cl-] = 2,0 • 10~s[CdCl+] = 4,2-10'9 [CdCl2] = 6,65 • 10-13[CdCl-] = 1,64 -10“17 [CdCl2] = 1,15* 10—2*ii = 4.2-10-4
426Ответы на вопросы. Глава VIII.в. [Cd2+] = 2,40 • 10-г [СГ] ==8,7 • 10“2[CdCl+] = 4,38 • 10-2 [CdCl2] = 3,00 • 10-2
[CdClj] = 3,21.10-3 [CdCl2-] = 7,95 • 10-5
n= 1,132. [Cd2+]= 1,20-10-2 [Cl-] =2,02- JO-3
[CdCl+] = 5,10 • 10~4 [CdCl2] =8,12 • 10_*[CdClj ] = 2,02 • 10~8 [CdClf] = 1,43-10-11n = 3,84 • I0~23. См. Пример VIII. 2.4. Для [Cl-] = 1,0, по данным Ван-дер-Зее и Доусона, величина Я равна
2,41, а по данным Щукарева, 2,70. Таким образом, различная интерпретация вы¬
зывает в определении п ошибку в 10%. Можно принять по аналогии с CdBr2- и
CdlJ-, что CdCl^- присутствует в растворе в более высокой концентрации.5. См. Примеры VIII. I и VIII. 2.6. См. Пример VIII- 5. _7. См. Примеры VI3 и VIII. 4.8. Если использовать условия электронейтральности и равновесий, можно
получить уравнение кривой титрования в форме:(2F - 100) = 100 (100 + V) [HgCl2] X\./7П7ГГп , ,,, гп-12 3,31 .10~~7 1,2» IQ-13\X (7,07 [С1 ] + 141 [Cl ] JC1-J JВ точке эквивалентности V = 50 мл; для него [HgCl2] = 3,3- 10-s М, а
[С1~] = 2,2■ 10-4 М. В конечной точке [Hg2+] = 8,3-10-7 М, а [С1~] = 1,55-10-5 М.
Считая [HgCb] = 3,3-10-3 М, можно вычислить объем в конечной точке по при¬
веденному уравнению: Ук-т =49,5 мл; ошибка титрования равна —1%.9. Еслн Ф=-^-я, то зависимость кривой титрования от рС1 совпадает скривой образования. Отметьте, что [Hg2+] = «оС, где С — аналитическая концен¬
трация ртути, с поправкой на разбавление. Начертите график зависимости Ф отpHg.10. Кривая титрования совпадает с кривой образования, если Ф = п. В Этом
случае ступенчатые равновесия настолько близки, что точки перегиба сливаются
(см. раздел IX. 3).11. S = 3,58-10~3 моль/л.12. S = 9,2-10-3 моль/л.13. S = 2,75-10-4 моль/л.14. Постройте кривую, используя следующие уравнения:s=/с(тв) о I [сг] + л:(ТВ), + к{п) 2 [сг] + *(TB) 3 [сг]2 + к (тв) 4 [сг]3С = (1 + К (ТВ) 2) [СГ] + 2/С(тв) з [СГ]2 + 3/С (Тв) ЫСГ]3 - tf(TB) о/[СГ]15. Если пренебречь всеми комплексами, ошибка в определении S составит
Если учитывать [AgCi], ошибка в определении 5 составит 0,002%.
Ответы на вопросы. Глава VIII.42716. а. [Са2+] = 2,15-10“4 [F-] = 4,30 • 10“4[CaF+] = 9,25 ■ 10“7 [Н+] =7,8 -10“8[HF] = 5,0 -10“8 [HFj] = 8,4* 10“11[ОН-] = 1,28-10“7S = 2,15 • 10“46. [F_] = 6,7 - ГО-3 [H+] = 8,9* 10—3[HF] = 9,0 • 10—2 [HF;] = 2,4 • 10_3
[Са2+] = 8,9-10~7 [CaF+] = 6,0 • 10-8
S = 9,5 • 10“717. [Т1+]= 1,0-10-2 [СГ] = 1,0- Ю-2'[Т1С1] = 7,75 • 10-5 * [T1C1J] = 1,82 -10-7[Т1С12-] = 2,18* 10“8Если добавить 0,01 моль НС1, никаких осадков из раствора ие выпадет. Мак¬
симально большое осаждение происходит при минимальной растворимости или
при частичном соблюдении условии: [Т1+] = [TlClj]. Это происходит при до¬
бавлении 2,2 моль НС1.18. [Са2+] = 4,86 • 10—3 [SO2-] = 4,86 ■ 10“3[CaS04] = 4,84 • 10~3 [HSO^] = 1,40 • 10'8[Н+] = 8,72 ■ 10~8 [ОН-] = 1,15-Ю-7
[СаОН+]= 1,40-Ю-8S = 9,70 • 10“3Если пренебречь величиной [CaSOJ, то ошибка в определении величины S
достигнет самой величины.19. S = 7,60-Ю-3 моль/л.20. Когда [AgCi;] = 0,l [Ag+], то [СГ] = 1,38-10“3.21. См. Пример VIII. 9. lg K(tb)i меньше — 6,65. По аналогии с галогенидами
серебра можно предположить, что /((тин будет ~ 10~7—10~8, что является вполне
подходящим. Таким образом, в условиях материального баланса всегда можно
пренебречь величиной [AgCN].22. S = 1,62 • 10~2 моль/л. Минимальная растворимость достигается при кон¬
центрации KI, равной 0. Satin = 1,32 -10~4 моль/л.23. Электропроводность пропорциональна величине:I К 1 125 10—2 1 ^~20 I J1200jW(*(TB)3+l)]'/»1200 + ’ + 1200 + I К-20 JПолагая dL/dV = 0, находим, что проводимость минимальна при V — 20=*
= 2,3-Ю*11. При этом ошибка титрования составит 10~12, что пренебрежимо мало
по сравнению с ошибками при определении объемов. В очень разбавленных рас¬
творах могут .выполняться кондуктометрические титрования, подобные приведен¬
ному.
428-Ответы на вопросы. Глава VIII.24. Если в условиях материального баланса и электронейтральности прене¬
бречь членами [Hg2+], [Hgl+], [Н+] и [ОН'], то получим два уравнения, связываю¬
щие V и [I*] при насыщении:100 - 2V = 10 (100 + V) ([Г] + К(тв) з [Г] + 2К(ТВ)«(П2)
V = 10 (100 + V) (К(тв) 2 + К(тв) з [Г] + /С(тв) 4 [Г]2)Если на одном графике начертить обе эти кривые, то они пересекутся приV = 24,0; [I-] = 9,6-10-®. Это титрование непригодно в качестве аналитического
метода, поскольку конечная точка появляется при V = 24,0, а эквивалентная —
при V = 50,0. Конечная точка, к тому же очень чувствительна к разбавлению.25. Если предположить, что единственным комплексом в растворе является
Ag(CN)“, то вычисленная ошибка титрования составит —7,35-ЮЛ Если учесть
комплексы более высокого порядка, то это значение изменится лишь в четвертом
значащем знаке. Если растворы более разбавлены, чем до 2,0 • 10~4 М, ошибка
титрования превысит 0,1%. Для нахождения конечной точки в таких разбавлен¬
ных растворах, нужен адсорбционный индикатор.26. [Н+] = 9,55 • 10-з [ОН'] = 1,045-10-7[Hg(OH)2] = 2,40 • 10-4 [HgOH+] = 9,13 • 10-9[Hg2+] = 4,38 -10—12pH = 7,0227. pH = 3,19. Самым разбавленным раствором, из которого можно осадить
99% HgO, будет 2,4-Ю-2 М раствор.28. С = 7,73-Ю'2 М.29. HgO не осаждается.[Hg(OH)2] = 1,0 • 10-5[Hg1+] = 4,98 • 10-2 [HgOH+] = 2,0 • Ю-4
[Н+] = 4,98 • 10~"2 [ОН~] = 2,01 • 10-1330. Если 0,1 М раствор HNOa насытить HgO, окончательное значение pH
будет 2,02. Аналитическая концентрация Hg в растворе составит 4,56-10^ моль/л.
Если этот раствор разбавить в 10 раз, общая концентрация Hg, включая и то ко¬
личество Hg, которое выпадает в виде осадка HgO, составит 4,56-Ю-3 моль/л;5,6-10~* моль HgO выпадает в осадок из 1 л раствора; разбавленный раствор
имеет pH = 2,57.' 31. Пренебрегите в условии электронейтральностн только членом [ОН-].
Из условий равновесия, материального баланса и электронейтральности по¬
лучите кубическое уравнение:1,0-1018 [ОН-]3 - 4,8 • 107 [ОН-]2 - 2,0 -10-4 [ОН'] - 1,0-10-14 = 0
Решите его, используя метод Ньютона:[ОН“] = 5,53-10“11 [Н+] = 1,81 • 10“4[Hg2+] = 5,74 • 10~e [HgOH+] = 6,36 • 10-в
fHg(OH)2] = 8,77 • 10~5 HgO не осаждается
Ответы на вопросы. Глава VIII.42932. См. Пример VI. II (стр. 169). Растворимость CH3COOAg в чистой воде
8,6» 10—2 моль; 5,95" 10~5 моль Ag20 выпадут в осадок из 1 л раствора. В на¬
сыщенном растворе pH = 7,47 и:[Ag+] = 6,31 • I0-2 [Ас~] = 6,31 • 10—2[AgAc] = 2,14* 10-2 [AgAcj] = 1,09* 10"3[AgOH] = 3,71 • 10-в [ ОН"] = 2,95 • 10-7[Н+] = 3,40-10“8 [НАс] = 1,23.10-"[Ag(OH)“] = 5,75* 10-мОкись серебра будет осаждаться из раствора, более щелочного, чем рас¬
твор с pH = 7,46.33. * [Са2+] = 9,10* 10-3 [СаОН+] = 7,24 • 10—8[ОН-] = 2,46» 10-2 [Н+] = 4,06- 10—13S = 1,63 • 10-2 моль!л pH = 12,3934. Пренебрегите [Н+] в условии электронейтральности. Из условий равно-
весии, материального баланса и электронейтральности получите кубическое
уравнение:[ОН-]3 — 5,0 • 10~2 [ОН-]2 — 1,78 • 10-4 [ОН-] - 1,0- 10_5=0Решите его, используя метод Ньютона:[ОН-] = 5,67 • 10-2 [Са2+] = 1,71 • 10“3
[СаОН+] = 3,14 • 10-s S = 4,85* 10~3 моль/лЕсли пренебречь членом [СаОН+], то третий член в кубическом уравнении
пропадает, и растворимость оказывается равной приблизительно 1,9* 10-3, что
существенно меньше приведенной выше.44. S = 9,13" 10—4 моль/л.45. Пусть К (тв) о — произведение растворимости AgBr; К(щ i — концен¬
трация молекул AgBr в насыщенном растворе; 0] — константа образования
AgSjO-. Тогда условия раиновесия и материального баланса дадут:с = [(s - к(2тв), - к(тв) о] [ Pik(tb) 0 + S - К(щ 1 ]Придадим S ряд значений и вычислим значения С. Зависимость S от
С — почти прямая линия. Когда С = Ю-6, S = 9,8 • Ю_б моль!л.46. Пусть ЛГ(тв) о — произведение растворимости AgBr; К(щ i — концен¬
трация молекул AgBr в насыщенном растворе; рь р2 и р3 — константы образо¬
вания трех комплексов тиосульфата серебра. Придавая [S202-] ряд значений,
из условия материального баланса вычислим S:(S - К(тв) О2 = ТВ) оО + Р, К°з1 + [s2°r]2 + Рз [s2o2-]3)
430Ответы на вопросы. Глава VIII.Зная S, вычислим С из условия материального баланса по тиосульфату1В области изменения С от 0,005 до 0,20 находим, что S/С = 0,453 неза¬
висимо от изменения С. Когда С = 10 5, S/С = 0,98.47. Полагая, что в условиях материального баланса преобладают члены
[Br-], [Ag(S203)^—] и [S203-], получим уравнениерешение которого дает; Р = 6,35 • 10”4 моль/а. Из 200 мл раствора выпадут
в осадок 1,27 * 10 4 моль.48. В 750 мл 0,5 М раствора Na2S203 растворяется 0,170 моль или 32 г
AgBr. Это соответствует 213 пленкам. Обычное число — это 30, так кЖк скорость
растворения AgBr по мере расхода тиосульфата уменьшается.53. См. Пример VII. 13, относящийся к подобной же ситуации, но в отсут¬
ствие Ch-ионов. В тех случаях, когда HgO или HgCl2 не осаждается, следует
использовать не константы растворимости /С(тв)п, а константы полного образо¬
вания р„. Для данной задачи наряду с условиями равновесий следует применять
условия материального баланса[HgOH+] и [Hg2+]. Затем решите квадратное уравнение относительно [С1 ]2,26 • 109 [СГ]2 + 7,48 • 102 [СГ] - 9,57 • 10_3 = 0Итак, в 1 л раствора следует внести 1,77 * 10 2 моль NaCl. В насыщенном
растворе.'с = [s2032-] + s *(™;°в) 1 Р, [S А] + 2Р2 [s2o3212 + зр3 fs2or]391Р2 + 0,115P — 1,09-10_4=0IHgCl2] = 1,0-10~2 [Н+] = 2 [Hg(OH)2]
[СГ] + [HgClj] = [HgCl*] + 2 [Hg (OH)Jдля получения следующих значений неизвестных:[HgOH+] = 4,10 • 10“7 [Hg(OH)2] = 2,26 • 10-s ‘Таким образом, HgO не осаждается.54. Положите [Hg(OH)2] = 2,4 • 10—4 и вычислите значения [Н+], [ОН-],[Hg(OH)2] = 2,4 • 10-" [HgCl+] = 1,42 • 10“3[Н+] = 5,32 • 10“4 [HgCl2] = 8,16 -10“3[ОН~]= 1,88- 10-п [HgClj] = 1,10 -10“7[Hg2+]= 1,36- 10~4 [HgCl2-] = 2,09-10-12[HgOH+] = 5,10 • 10~e [СГ] = 1,90 • 10"®
Ответы на вопросы. Глава VIII.43155. См. нижнюю часть рисунка. На линии, соответствующей осаждению HgCU,
pH + рС1 = 8,23, а на линии, характеризующей равенство [HgCl2] = [Hg(OH)2],
pH + pCl == 9,76.56. Используйте приближенные
выражения для условий материаль¬
ного баланса0,05 = [Г] + 2 [Hgl2] + 3 [HgljJ ++ 4[HgI42-]o,io = [OH-] + [r] + [Hgi-] == 2[HgI2-] .и произведение растворимости для
HgO и константы полного образова¬
ния комплексов иодида ртути для
получения трех уравнений для трех
неизвестных [Hg2+], [ОН-] и [I-]. Ре¬
шение их методом последовательных
приближений дает растворимость,
равную 1,35-10~2 люль/л; 6-10-5 моль Hgl2 осаждаются из 1 л раствора. В на¬
сыщенном растворе:pH[он-] = 7,3-10-2
[Hg2+] = 9,0 • 10-24
[HgOH+] = l,3-10-14
[Hg(OH)2] = 2,4 • 10~4
[Г ] == 5,7 • 10_357. В предположении, что реакцияHgCl2 + 2Г ^[Hgl+] = 3,8 • 10“13
[Hgl2] = 1,32-10"4
[Нё1Г]=6,7.10-3
[Hgl|-J = 6,4-10-3Hgl2 + 2СГидет до конца, нйходим: 1,24*10"* моль1л Hgl2 выпадают в осадок. Применяя
к уравнениям[СГ] = 0,025 - [HgClj] - 2 [HgCl2-]
[HgCl2] = 0,125 - [HgCl-] - [HgCl2-]метод последовательных приближений, получим концентрации в насыщенном
растворе:-127[СГ] = 2,26 • 10-2
[HgCI2] = 1,05- 10—2
[Hg2+j = 1,24- 10
[HgCl+]= 1,54- 10
[HgClj] = 1,68-10-3
[HgCl2-] = 3,80 • 10~4
[OH_]= 1,17- lO"8
[Hg(OH)2] = 8,50- 1Q—7[F] = 1,27 - 10-8
[HgI+] = 1,16* 10~7
[Hgl2] = 1,32 • 10-4[Hgi7] = l.oi.r1[Hgl42-] = 2,18.10-14
[H+] = 8,56 • 10“7
[HgOH+] = 2,90 • 1Q~10
432Ответы на вопросы. Глава IX.-2-265. Осаждение начнется при /V = 6,0-10'e люль/л; растворение же осадка
начнется при N = 0,112 моль/л.66. S = 1,38-10~3 моль/л. Если гидролиз Ag’ не учитывать, то ошибка при
определении растворимости составит только 2-10~5 от этого значения.67. Для полного растворения AgCi необходимо 3,63 моль/л раствора ам¬
миака. В этом растворе [Вг-] = 2,24-10-4, поэтому, только 0,45% AgBr раство¬
рится.68. Растворимость AgCi и в NaCl, и в NH4C1 равна 4,20-10-7 моль/л. В рас¬
творе NH4C1 образование аммиачных комплексов увеличивает растворимость
только на 0,01%.69. Напишите условия материального баланса, электронейтральности, равно¬
весий для получения следующих уравнений:[ОН-]2 (1 + 5,62 • 10* [NH+] + 6,23 • 107 [NH+]2) = 1,85 • 10-8
[ОН-] (5,62 • 104 [NH+] + 1,25 • 108 [Ш^]2) = 5,0 • 10~2 - 2,64 [NH+]Постройте соответствующие этим уравнениям кривые на одном графике:
точка пересечения кривых дает:[ОН"]= 1,59.10_6 [NH+] = 1,04-10[NH3] =9,30- 10~4 [Ag+]= 1,16-10[AgNHj] = 1,71 - 10“2 [Ag(NH3)+] = 1,07 • 10“2[AgOH] = 3,7-10~6 [Ag(OH)-] = 3,1 • 10-10Растворимость Ag20 в 0,05 M растворе NH4N03 равна 1,98-Ю-2 люль/л;
растворимость Ag20 в чистой воде равна 7,5-10-5 моль/л.70. Графический способ решения по кривым Примера VIII. 19 является са¬
мым простым. Рис. VIII. 13, а показывает, что при С = 5-10-9 я N = ЫО-2 Ag20
осаждается. Для насыщенного раствора с N — 1 ■ 10~2 С — 4,08-10-3. Разница ме¬
жду ними 4,6-10-4 равна количеству выпавшего в осадок серебра.77. [Н+] =7,78-10-5; [NS~] = 1,29-10"4; [ОН~]= 1,28-10-10; [S2-] = 1,98-10"13
[Fe2+] = 2,52-10-5; [FeOH+] = 1,61-10-»S = 2,52 • 10“5 моль/л78. [AsS-] = 1,04 • 10~2 [S2-] = 1,08 ■ 10“8
[ОН-] = 9,50 • 10~4 [HS-] = 9,45 • 10—4[H+]= 1,05 - 10~“ [HAsS2] =5,46« 10-10
S = 5,2 • 10-3 моль/л79. Для предотвращения осаждения ZnS необходимо, чтобы [Н+] = 2,74 М.
В гаком растворе [Cd2*] = 5,0-10~5, т. е. 0,5% кадмия останется не выпавшим
в осадок.80. [Н+] = 0,185 [HS-] = 5,40 • 10—8
[Ni2+] = 5,72 • 10-2 Р — 9,28 • 10—2Из 1 мл раствора выпадет в осадок 9,28-10~5 моль NiS.Глава IX1. Для минимальной растворимости dS/d[A] = 0; это приводит к условию
Ответы на вопросы. Глава IX.433которое можно решить относительно [А]. Подстановка результата в соответ¬
ствующие выражения даст S и Сд в минимуме.Для N — 2 имеем просто[А] = »2 («- 1)Г1/2S = *(тв) 0 [h in - Щ42 + К(тв) , + *<тв) , [Р, (я -
С°А = (1 + К(п) 2) [Р2 (п - I- к{п) „ [Р2 (п - 1)]1/22. Если К(тв)о произведение растворимости соли МеВ, а ря— константа
полного комплексообразования для МеА„, то# wS2 = *<тв) о S Р» f А1"; СА = [■Щ S *Р» [А]" - Sм=0 п=0Обратите внимание, что dS/d[A] > 0 для всех значений [А] > 0, которые поло¬
жительны.3. Если Kiтв)о — произведение растворимости соли МсаА, а {5„ — константа
полного комплексообразования МеАп, то5=2p^(tI)o[a]'1"1/2п=0Сд = [А] + S (п - 1) p^'l) 0 [А]п~'!2п=О4. Когда ап максимально, то п=п. Из определения я имеем соотиошеняе:ГД12 _ Ря-1 1
1 W Ря+i КпКп+1В точке, где ап максимально:-™-Ит&г)Г5. Наклон кривой распределения равен:\ . Kj [А] (1 — К,К; [А]2)1 (1+К, [А] + /С,КПА]2)2Положив его равным нулю, имеем: [A]max = (KiK2)~>l26. Точка перегиба имеет место при:db0 2К\ [А]2 - К, [А] (1 + К, [А]) п
d [А] (1 + Ki [А] )3
Это дает [А)п = I//Ci-7. Уравнение кривой распределения можно записать следующим образом:XК+ Х +КХ2
Здесь К = (АУЛ",)1,2 и X = [AJ (KxKt)4\
434Ответы на вопросы. Глава IX.Наклон кривой распределения равен:КХ(\-Х2)1 {К + X + КХ2)2Максимуму кривой соответствует X = I.Точки перегиба наступают при условии d6i/dX = 0, т. е.*з + х = К (X* - 6Х2 + 1)Если одна точка перегиба наступает при Xi, то симметричная ей точка
будет расположена при Х2 = 1 jXu также удовлетворяющем условию ее суще¬
ствования.8. Максимальные значений cii и а2 достигают при п — 1 и п — 2, т. е. при:К1К2 [А]2 + 2/С,/Сг/Сз [А]3 = 1
К1К2К3 [А]3 = I + /Ci [А]Если кривые aj и а2 являются зеркальным отображением одиа другой, то
кривая (ai + a2) должна быть симметричной относительно точки, где ai = о-ъ
Максимум и минимум на кривой (ai + a2) появляются при 61 + б2 = 0, г. е.
при1 + 2К2 [А] = К1К2К3 [А]2 (2 + /С2 [А])Одиако ai = a2) когда /С2[А] = 1. Центральный максимум или минимум
совпадает с этой точкой только в том случае, когда /С1/С3 = /С2; если же это
последнее действительно выполняется, то ai и являются зеркальными.9. Для поставленных условий в уравнении (13) исчезнут все члены кроме
одного — для п:п (п— 2п) (п — п) ап = ОЭто соотношение выполняется, когда п = п. Но в этой точке наклон кривой,
согласно уравнению (10), равен 0, если пренебречь всеми другими комплексами.10. Для поставленных условий:ап + а„+1 = 1 л = я + а„+1если п = п + У2, то ап = an+i = ’/2-'Уравнение (13) даст нам условие существования точек перегиба'п{п — 2л) (п — п) ап + (п + 1) (п + 1 — 2п) (п + 1 — п) an+i == 0крторое выполняется при п = п + V2 и я„ = п.--. \Для тех же самых значений уравнение (10) дает б = lU.При этих же предположениях точки перегиба в п — п и й = я+1 дадут6 = 0, так что вышеприведенная точка перегиба соответствует максимальному
наклону.И. Для поставленных условий, уравнение (13)' даст соотношение, которое
удовлетворяется при п = п (см. доказательство в Вопросе 4)\ это же соответ¬
ствует ctn-i = Оп+1- Из выражейия (10), учитывая ответ на Вопрос 4, находим:в~2““«-2[2+ЫЬг)Т12. Для N = 4 уравнение (13) даст точку перегиба при п — 2, цо только
если =_a3. В общем случае, однако, при п = 2:+ 2ctg = a3 + 2a*
Ответы на вопросы. Глава IX.435Во многих случаях ао и а4 будут малыми, и центральная точка перегиба
расположится близко к п — 2. В частности, когда ао = «4, точка перегиба будет
всегда находиться при п = 2. Это накладывает на константы образования сле¬
дующее требование: К1К4 = КгКз-13. Согласно уравнению (13), при п = точка перегиба расположитсяпри:N^ п (п - N) ^ п — Y N j а„ =» Огс=0Если доминирующим является комплекс с n = 'hN, то это соотношение вы¬
полняется приблизительно, а ошибка будет порядка разности а1(,2у_2 — ay2N+2
которая обычно очень мала.14. Когда К\ = 4Дг, максимальное значение ai — '/г- Когда Ki = 16К2, мак¬
симальным значением aj будет 2/з-15. Если положить X = [А] (К.\Кг)'/2, тогда уравнение (21) сведется к:2ХЕсли положить X = [А] тогда уравнение (22) запишется следующим
образом:2р
п~ 1+Х2Разница между этими выражениями будет максимальна при условии, что
(1 + Х2)2 = 2Х (1 + Х)2т. е. когда X — 0,31 или X = 3,2. Максимальная разность между значениями п
составляет 0,3, что намного больше обычных ошибок эксперимента.16. См. уравнение (14) раздела VII.6. Обратите внимание, что Ка\ — К^1
и Ка2 = КJ"1. Оба максимума совмещаются, когда Ki = 16/f2 нли Kai = 16ЛГл2.17. См. уравнения (14) и (15) раздела VII. 6.18. Используйте зависимости:S,-(f->)[Al- , *-(l-l)[A]19. iCi = 6,3 - 10s; К2 = 5,0 • 10*.20. Используйте уравнение (23), в котором п замените на (п — 2). Зависи¬
мости имеют вид:п — 2 4 — п ,, „У = ~(3~—~ге)'[А] * X = T=R tA]Если данные нанести на график, получим /С3= 10 н К^= 6.21. Удобная (но не единственная) форма записи следующая:*1=0 «/,=—IgC
х2 = Ч г Уг = pH
*з = 1 Уз — рКа22. Используйте Пример IX. 3, пренебрегая величиной Kh2o/[H+3 по сра¬
внению с [Н+].
436Ответы на вопросы. Глава X.26. Одна из возможных форм записи следующая:Xi = 0 У! ="^'Лн+] . ЛЛ„*1 *шо\ [н+]1mCbх3 = 1 ys — —Глава X1. [Н+] = 8,22- 10~2 [F“] = 1,20- Ю~2
[HF] = 8,38 • 10~1 [HF7] = 6,95 • 10-22. S = 3,03-10~7 моль/л.3. [Г] = 0,492 5 = 2,27 • 10_3 моль/л4. [Ag+] = 0,498 S = 6,35-10“4 моль!лб. 5=7,62* Ю-6 моль!л.8. Минимальная растворимость равна 2,43 • 10-4; ей соответствует [Вг-] =
= 0,271, т. е. при аналитической концентрации Вг~-иона 0,271 моль[л.12. [Hg2+] = 1,0- 10--18 [Hgl+] = 7,40 • 10“11[Hgl2] = 6,6 • 10~5 [Hglj] = 3,09 • 10_e '[Hgl2-] = 7,25 • 10-9 [HgBr+] = 8,70 • 10-12[HgBrI] = 7,75 • 10~5 [HgBrlj] = 5,0 • 10[HgBrl2-] = 3.89 • 10~7 [HgBr2l-] = 5,50 • 10[HgBr2I2-]= 1,55- 10-5 [HgBr7]= iv41 • 10[HgBr3I2-] = 1,77 - 10-5 [HgBr2-] = 7,95 • 10_eCHg = 3,07 • 10~“ C, = 4,34 ■ 10"* СВг = 3,96- 10-4Величины [Hgl2] и [HgBr2| слишком малы, чтобы мог выпасть какой-нибудь
осадок.14. Если пренебречь величинами [Н2Сг04] и [НСг.От], то условия равно¬
весия и материального баланса сведутся к двум уравнениям:6,6 • 10й [Н+]2 [CrO^]2 + (1 + 3,16 • 106 [Н+] ) [CrOf ] = 0,20
[CrOj-] = 0,1 + [Н+]Полагая, что [Н+] мала по сравнению с 0,1, так как равновесие реакциин+ + сю2- нею;значительно смещено вправо, получаем:6,6- Ю12 [Н+]2 + 3,16 • 105[н+]- 0,1 =0—5,-5—5
Ответы на вопросы. Глава X.437Это приводит к следующим результатам:« [н+] = 1,01 -10—7 [СгО|—] = 0,10[нею;] = 3,20 • 10“2 [Сг20=-] = 3,38.10
[HjCrOJ = 2,69 • 10-9 [HCrs07] = 3,92 • 10-215. Из условий равновесия, материального баланса, электронейтральности,
если пренебречь всеми членами, кроме [НСгО“] и [Сг202-], получим уравнения:s = [нею;] + 66 [нею;]2S2 = [нею;] = 8,84 • 10~8 (1 + 10S)Нанесите обе эти кривые на один график и тогда точки пересечения дадут
следующие результаты:[Cr20f] = 4,5 • Ш-4 [нею;] = 3,7 • ю-3
[нсг207] = 5,0 • 10_s [Н+] =9,5-10~2[CrOj-] = 1,2 • 10-8 [Н2Сг04] = 2,9 • 10~4S = 4,8 * 10 3 моль)л
1) для С = 0,5; pH =R3 + 1,36#2 + 204# — 204 = 022. Решите уравнение (11) для С — 0,5; pH =1,50.23. Решение уравнениядаетR = [Fe3+]/[H+] = 0,99Равновесные концентрации равны:[Fe2+] = 4,97 • 10—1 [Н+] = 5,03 • 10“'[FeOH2+] = 8,8 • 10—4 [Fe2(OH)4+] = 1,20-10-3
[Fe(OH)2] = 9,63* 10-724. Пренебрегите двухъядерным комплексом. При pH = 3,78 и й = 1,69
Fe[OH]3 выпадает в осадок.30. 99,71% магния присутствуют в виде комплексов ЭДТА.31. S = 3,58-10'3 моль/л.32. Из условий материального баланса для никеля и условий равновесия
получаем:о_,л , 1.50- 10-24 (, , 2,5. 10-" , 1,58* 10~18 , 1,0.10~29\
S 1,0-10 + - TFJ- - + ■ ■ [н+]2- - + - JЕсли НА не выпадает в осадок, условие материального баланса по А и усло¬
вие равновесия дают выражение:2S = 2,0 • 10"® + [А“] (1 + 4,67 • Ю10 [Н+])Самый простой способ получения зависимости S от pH — это построение
семейства кривых S = /(pH) для различных значений [А-], используя приведен¬
438Ответы на вопросы. Глава XI.ные выше уравнения, с последующим определением координат точек пересечения
двух кривых для одного и того же значения [А-]. (См. Пример VII. 21, стр. 217).Когда [Н+] ^ 5,04-10~3, твердая фаза НА выпадает в осадок. Тогда условие
материального баланса по А заменяется соотношением равновесия[Н+][А‘]= 1,18* 10-13которое можно подставить в первое уравнение и получить:S = 1,08 • 102 [Н+]2 + 2,7 • 10~и [Н+] + 1,0- 10~в + 1 ’°8.' ^ -IH JПоследнее выражение позволяет найти вид функции S = /(pH). Для того
чтобы из 0,1 М раствора осадилось 99,9% никеля, величина S должна быть ме¬
нее 10~4, а [Н*] — менее 3,44-10'5 и более 1,57-10~14.33. В 0,1 М растворе аммнакаTNH 1 О.Ю 3 1 + 1,78 - 109 [Н+]Условная константа равновесия определяется соотношением:К'тв = 1,50 • 10~24 (1 + 4,67 • Ю!0 [Hi)2 (l + 6,31 • 102 [NH3] +-f 1,10-105 [NH3]2 + 5,9- 10e [NH3]3 + 9,1 • 107 [NH3]4 ++ 5,13-10® [NH3]5 + 5,50- 10» [NH3]8)Минимум наблюдается при pH = 10.34. См. рис. X. 15, стр. 331.37. См. G. Schwarzenbach et al., Helv. chim. acta, 35, 2337 (1952).38. Ошибка титрования равна —7,2%.39. Чтобы предотвратить выпадение в осадок Mg(OH)2, аналитическая кон¬
центрация магния должна быть меньше 8,42-10~3.40. В точке эквивалентности, согласно уравнению (10), [Mg2*)' = 5,0-10~6. Из
рнс. X. 12, а следует, что значения Лмв лежат в интервале от 1,2 до 2,0, т. е.
А ме « 1,5. Тогда [Mg2+] = 7,5 - 10_в. Выражения для произведения растворимости
дает для pH значение меньше 11,5.Глава XI1. Уравнение условия баланса электронов имеет вид:[Fe2+] = [Hg2+]Полагая, что равновесие реакции сдвинуто значительно влево, и применяя
метод последовательных приближений к окончательным уравнениям, получаем:[Hg2+] = 2,04 • 10~* [Fe2i = 2,04-10-4[Fe3+] = 4,80 ■ 10—3 [Hg2+] = 4,90* 10-82. См. Вопрос 25 в разделе I. 5, стр. 34. Условие электронейтральиости[Hg2+] + [Hg2+] = 0,01дает следующие результаты:[Hg2+1 = 6,02 • 10~5 [Hg2+J = 1,00 • 10-2
Ответы на вопросы. Главц, XI.4393. Для осаждения жидкой ртути необходимо, чтобы отношение [Hg2+j/[Hg2+]
было больше 165. Согласно ответу на Вопрос 1, это отношение равно 24; т. е.
металлическая ртуть не осаждается.' 4. Объединяя уравнение условия электронейтральности2[Hgf] + 2[Hg2+] = [Fe2+]
с уравнениями условий равновесия и материального баланса, получаем:[Hg2+] (1,0 • 10~2 - 332 [Hg2+])2 = 7,28 • 107 [Hg2+]4
Последнее можно решить методом последовательных приближений:[Hg2+] = 2,66 • 10—5 [Fe2+] = 8,84* 10~3
[Hgf] = 4,40 • 10_3 [Fe3+] = 1,17- 10_315. [Н+] = 8,55* 10—6 [СГ] = 8,55 • 10_6[Hg2+]= 1,82-10-8 [Hg2+] = 1,40- Ю-10
[HgOH+] = l,33-10-8 [Hg(OH)2] =4,30- 10"6
[Hg2OH+] = 8,50 • 10-8 [ОН-] = 1,17 - 10~9[HgCl+] = 2,61 • 10-8 [HgCl2] = 1,86 • 10“'[HgCl'] = 1,51 • 10“10 [HgCl2-J = l,63-10-u
[Hg2Cl+] = 3,1 • 10-1216. Условие электронейтральности имеет вид:S = [Cu+] + [CuCl~] + [CuClg-] + 2 [Cu2+] + 2 [СиСГ] + 2 [CuCl2]Из этого условия, а также условия материального баланса по хлору,
условия равновесия (см. Вопрос 23 раздела 1.5) получаем уравнение6,8 • 10~2 [СГ]4 + 1,076 [СГ]3 — 1,31 • 10_6 [СГ] - 1,125-10~7 = 0
которое дает:[СГ] = 4,80* 10-3 [Си+] = 3,88- 10~s[CuCl;] = 3,65 • 10-4 [CuCl2-] = 8,07 • 10~7
[Cu2+] = 2,48- 10-3 [CuCl+] = 2,35 • 10“4[CuCI2] = 1,91 -10“6 S = 5,80 • 10—317. Уравнение Нернста для написанной реакции имеет вид;Е = 0,348 + 0,06 lg [СГ] Сигде C„ = [Cu2+] + tCuCl+]+tCuCl2]Формальный потенциал равен 0,348 в. 118. В предположении осаждения CuCl условия равновесий и материального
баланса по хлору дают:0,102 [СГ]3 + 1,152 [СГ]2 - 0,10 [СГ] + 1,13- 10-6 =0
440Ответы на вопросы. Глава XII.Если из 1 л раствора выпадает в осадок Р моль CuCl, то условие электро¬
нейтральности приводит к следующему:[Си+] + Р + [CuClj] + [CuCl2-] + 2 [Cu2+] + 2 [СиСГ] + 2[CuCi2] = 0,20
Таким образом[СГ] = 8,60 • 10“2 [Си+] = 2,16- 10“6[CuClj] = 6,54 • 10-3 [CuClj-] = 2,52 • Ю"4
[Cu2+] = 7,60 • 10_e [CuCl+] = 1,31 • 10-5
[CuClj] = 1,91 • 10"e P= 1,93-10_121. Формальный потенциалравен 0,117 в.22. Используя значение формального потенциала, найденное в Вопросе 21,
получаем: Ссоци) = 1,0-10-2 моль/л, a Cco(ii) = 6,25■ 10~9 моль/л.23. В точке эквивалентности Е — 1,38 в. В конечной точке Ек.т = 1,47 в.
Ошибка титрования равна +0,1%.24. В точке эквивалентности потенциал равен —0,03 в.25. В первой точке эквивалентности потенциал равеи 0,22, а во второй—0,19 в.26. В первой точке эквивалентности потенциал равен 0,043, во второй 0,669,
в третьей—1,22 в. Кривая идентична кривой, приведенной на рис. XI. 8 кроме
той ее части, которая расположена за третьей точкой эквивалентности.27. Условие баланса электронов имеет вид:[^"l-tcn + o.lTrlWУчитывая Пример XI. 4, находим, что в точке эквивалентности
[Fe2+]' — [Cl4+]'; [Fe3+]' = 2 [С13+]'н, следовательно, £' = 1,069 в.28. Условие баланса электронов имеет вид:[Се3+] = [Fe3+I + 0,10Учитывая Пример XI. 4, находим, что в точке эквивалентности
[Ре2+Г = fCe4+j'; [Се3*]' = 2 [Fe3+]'и, следовательно, Е' = 1,051 в.29. Полное описание задачи дано в книге J. J. L i п g а п е, Electroanalyt.
Chem. Когда 10% иона иода оттитровано, Е = 0,619 в; /2 выпадает в осадок,
когда титровальная доля равна 0,654; точке эквивалентности отвечает Е' —
= 1,113 в.г- „ YIII JI а а а А!!1. Значения у±: из табл. XII. 1 и XII. 2 — 0,762; из уравнений (1)—0,690;
из уравнения (7) — 0,754; из уравнения (9) — 0,772.2. Для 0,1 М раствора MgCb I = 0,3 моль/л. Из табл. XII. 1 и уравнения
(6) Y+ = 0,348, Y-= 0,659 и у± = 0,533; из уравнения (1)—0,276; из уравне¬
ния (7) — 0,436; из уравнения (9) — 0,565-
Ответы на вопросы. Глава XII.4413. Для рассматриваемого варианта выполняются соотношенияpH = — lg YH + [Н+][Н+] [A<*-'>+] YhYa - К°а fHA2+l Vha
Ig Yz+ ?= lg Yz- = г2 lg Y+
позволяющие получить требуемое уравнение.4. Поскольку Yh+ — Ynh+> рКа = 9,245+ 0,121.45. Предположим, что v,. + = V +> и> следовательноу Me Me(NH3)+igPa = lg Й + 0,12«/6. К,тн>2 не зависит от ионной силы, если y-,- — Yив;<6 С1 МеС127. Рис. XII. 4 получен на основании следующих уравнений и выбранной
единицы длины —5 см:*,=0 у, = — lg (“JT77 - 0-2/j
= j If,-I + lg 2-0,1458
*9=1 Уз = 2 + lg (— lg у)8. pH = 7,00.9. pH = 3,00.10. S = 1,73» 10-s моль/л.11. S = l,36»10~6 моль/л.12. £ф = 0,397s.13. Для рассматриваемого случая I = 1,58- 10-а моль/л, вычисленная раство¬
римость 1,0Ы0“2 моль/л; измерения дают S = 1,16* 10-2 моль/л.14. Измеренвая S равна 2,59-10~3 моль/л.15. Измеренная величина Ка равна 1,12-10~2.Ошибка в определевии Ка, предсказанная из значений ошибок в отдельных
измерениях, составляет ~1,5%. Большая ошибка (4%), наблюдаемая в действи¬
тельности, обусловлена в основном допущением, что yh+ — YC1- — Yflso_ и чтоу 2_ определяется уравнением Дэвиса.
s°416. Если присутствует только соль сильной кислоты и сильного основания,
то [Н+] — [ОН-]. Если коэффициенты активности равны, тоpH = — 1 lg кНг0 ~ у lg Мщ0В чистой воде коэффициенты активности и молярная доля воды равны 1,т. е.pH = -llgKHsoВ растворе, содержащем 1 моль соли и 100 г (55,6 моль) Н20, молярная
доля воды равна 0,983. Ошибка в определении pH составляет;- j lg 0,983 — 0,004
ЛИТЕРАТУРАГлава IЛ. П о л и н г, Общая химия, Изд. «Мир», 1964.С. А. Щ у к а р е в, Неорганическая химия, Изд. «Высшая школа», 1970.Глава IIР. А. Р о б и а с о н, Р. Г. Стокс, Растворы электролитов, ИЛ, 1963.Ф. Россотти, X. Россотти, Определение констант устойчивости и дру¬
гих констант равновесия в растворах, Изд. «Мир», 1965.Г. Л. Ш л е ф е р, Комплексообразоваиие в растворах, Изд. «Химия», 1964.
Г. Хариед, Б. Оуэн, Физическая химия растворов электролитов, ИЛ.
1952.Г л а в а IIIДж. Поя, Математическое открытие, Изд. «Наука», 1970. Справочник хи¬
мика, т. I, Изд. «Химия», 1965.Г л а в а IVА. Альберт, Е. Сержей т, Константы ионизации кислот и оснований.
Изд. «Химия», 1964.Р. Бейтс, Определение pH. Теория и практика, Изд. «Химия», 1972.К- Швабе, Техника определения pH, ИЛ, 1962.И. М. Кольтгоф, В. А. Стеигер, Объемный анализ, Госхимиздат, 1950.
Теоретическое и практическое руководство к лабораторным работам по фи¬
зической химии, ч. 2, Изд. ЛГУ, 1967.Глава VИ. М. Кольтгоф, Е. В. С ей дел л, Количественный анализ, Госхимиз¬
дат, 1964.Н. А. Измайлов, Электрохимия растворов, Изд. «Химия», 1966.Н. А. Т а и а и а е в, Дробный анализ, Госхимиздат, 1950.Г. Шарло, Методы аналитической химии, Изд. «Химия», 1969.Глава У1М. И. У с а н о в и ч. Исследования в области теорий растворов и теории кис¬
лот и оснований, Изд. «Наука», 1970.Глааа VIIX. Т. С. Бриттен, Водородные иоиы, Химтеорет, 1936.
Литература443Глава VIIIА. А. Гринберг, Введение в химию комплексных соединений, Изд. «Хи¬
мия», 1971.А. К. Бабко, М. И. Ш т о к а л о, Металл-индикаторный метод изучения
комплексов в растворе, Изд. «Наукова Думка», 1969.Д. Б ей л ар, Химия координационных соединений, ИЛ, 1960.Я. Б ь е р р у м, Образование аминов металлов в водных растворах, ИЛ,
1961.К. Б. Яцимирский, В. П. Васильев, Константы нестойкости комплекс¬
ных соединений, Изд. АН СССР, 1959.Глава XН. М. Дятлова, В. Я. Темкина, М. Д. К о л п а к о в а, Комплексоны,
Изд. «Химия», 1970.Р. П р и ш и б л, Комплексоны в химическом анализе, ИЛ, 1960.Г. Шварценбах, Г. Флашка, Комплексонометрическое титрование, Изд.
«Химия», 1970.Глава XIМ. С. Захарьевский, Оксредметрия, Изд. «Химия», 1967.A. Берка, Я- В л т е р и н, Я. Зыка, Новые редокс-методы в аналитической
химии, Изд. «Химия», 1968.М. Ф. С т а щ у к, Проблемы окислительно-восстановительного потенциала в
геологии, Изд. «Недра», 1968.B. Л. Л а т и м е р, Окислительные состояния элементов и их потенциалы в
растворах, ИЛ, 1954.Глава XIIСм. главу И.
ОГЛАВЛЕНИЕПредисловие редактора перевода 5Глава!
Некоторые общие положения1.1. Равновесное состояние 71.2. Константа равновесия 121.3. Способы выражения константы равновесия 14I. 4. Свободная энергия и константа равновесия 201.5. Электродные потенциалы 24Глава II
Измерение констант равновесияII. 1. Прямой анализ 36II. 2. Потенциометрические методы . 42II. 3. Кондуктометрические методы 45II. 4. Неидеальность, температура и солевой эффект 49II. 5. Точность и правильность равновесных данных 54Глава III
Математические методы, используемые
при расчетах равновесийIII. 1. Некоторые общие положения 58III. 2. Материальный баланс 60III. 3. Условие электронсйтральности 63III. 4. Решение уравнений 66III. 5. Приближенные уравнения 68III. 6. Решение квадратных уравнений 72III. 7. Решение многочленных уравнений высоких сгепеней .... 76III. 8. Логарифмические функции 81Глава IV
Сильные кислоты и основанияIV. 1. Ионизация воды 83IV. 2. Расчет pH в растворах сильных кислот и оснований .... 86IV. 3. Титрование сильных кислот и оснований 92IV. 4. Ошибка титрования 96
Оглавление445Глава V
Слабые одноосновные кислоты и основанияV. 1. Ионизация слабой кислоты 101V. 2. Графические способы описания 108V. 3. Ионизация слабого основания 114V. 4. Общее между кислотами и основаниями 119V. 5. Смесь сильной и слабой кислот 123V. 6. Индикаторы как слабые кислоты 125V. 7. Буферные растворы 129V. 8. Титрование слабой кислоты сильным основанием 137V. 9. Соль слабой кислоты и слабого основания 146Глава VI
Осаждение и произведение растворимостиVI. 1. Растворимость простых ионных солей в чистой воде .... 152VI. 2. Эффект общего иона 155VI. 3. Разделение соединений осаждением 160VI. 4. Осадительное титрование 161VI. 5. Сложности при расчетах растворимости 167VI. 6. Растворимость солей слабых одноосновных кислот 168Глава VII
Многоосновные кислотыVII. 1. Ступенчатая диссоциация 176VII. 2. Соли многоосновных кислот 184VII. 3. Титрование многоосновной кислоты сильными основаниями . 189VII. 4. Смеси двух слабых одноосновных кислот 194VII. 5. Полиамины и аминокислоты 197VII. 6. Сложные буферные системы . 204VII. 7. Растворимость солей многоосновных кислот 213Глава VIII
Комплексообразование (введение в теорию)VIII. 1. Ступенчатое комплексообразование в растворе 221VIII. 2. Влияние комплексообразования на растворимость солей . . . 232VIII. 3. Гидролиз ионов металлов . ... 242VIII. 4. Растворение осадка в комплексообразующем агенте .... 247VIII. 5. Равновесия процессов замещения одного лйГанда на другой 251VIII. 6. Аминные комплексы 257VIII. 7. Растворимость сульфидов . 262Г лава IX
Математические приемы расчета равновесийIX. 1. Определения . 270IX. 2. Форма кривой распределения 273IX. 3. Форма кривой образования 276IX. 4. Номограммы 284
446ОглавлениеГлава X
Комплексообразование (более сложные вопросы)X. 1. Сравнение катиона и аниона как лигандов 295X. 2. Комплексы с разнородными лигандами 298X. 3. Гомоядерные кислотные системы 305X. 4. Многоядерные гидроксокомплексы . 310X. 5. Хелаты 318X. 6. Комплексометрические титрования 329Г лава XI
Окислительно-восстановительные равновесияXI. 1. Общие положения 335XI. 2. Графические способы описания 339XI. 3. Влияние комплексообразования на окислительно-восстанови¬
тельные равновесия 348XI. 4. Окислительно-восстановительное титрование 353Г л а в а XII
Поправки на неидеальностьXII. 1. Ионные взаимодействия 366XII. 2. Теоретические уравнения для коэффициентов активности . . 367XII. 3. Использование коэффициентов активности при расчете равно-^весий 377XII. 4. Шкала pH и ее расширейне 384Ответы на вопросы 391Литература 442
Дж. Н. Батлер
ИОННЫЕ РАВНОВЕСИЯ(математическое описание)с. 448Редакторы: JI. Ф. Травииа, В. А. Станкевич
Технический редактор Ф. Т. Черкасская
Переплет художника А. П. Рыбакова
Корректор Л. А. ЛюбовичСдано в набор 2/Х 1972 г. Подписано к печати 20/11 1973 г. Формат
бОХЭО'Лб. Бумага типогр. № 2. Уел. печ. л. 28,0. Уч.-нзд. л. 28,42.
Тираж 6500 экз. Изд. № 152. Заказ 345. Цена 2 р. 12 к.* * *Ленинград. 1911Е6. Издательство «Химия», Ленинградское ’
отделение, Д-186, Невский пр., 28
• * *Ордена Трудового Красного Знамени
Ленинградская типография № 2 им. Евгении Соколовой
«Союзполиграфпрома» при Государственном комитете
Совета Министров СССР по делам издательств, полиграфии и книжной
торговли г. Ленинград, Л-52, Измайловский проспект, 294