Автор: Безбородов А.Μ.
Теги: общая микробиология биохимия микробные метаболиты ингибиторы ферментов
Год: 1986
Текст
АКАДЕМИЯ НАУК СССР
ОРДЕНА ЛЕНИНА ИНСТИТУТ БИОХИМИИ им. А.Н. БАХА
A. Μ. Безбородов
МИКРОБНЫЕ МЕТАБОЛИТЫ —
ингибиторы ферментов
Ответственный редактор член-корреспондент АН СССР B.Л. КРЕТОВИЧ
МОСКВА
«НАУКА»
1986
УДК 579.22
Безбородов А.Μ. Микробные метаболиты — ингибиторы ферментов. Μ.: Наука, 1986. 96 с.
В книге содержатся основные сведения о синтезируемых микроорганизмами ингибиторах ферментов. Рассматриваются ингибиторы, имеющие белковую природу, пептиды, депсипептиды, олигосахариды специфической структуры и другие соединения, обладающие ингибиторной активностью. Приводятся данные о физико-химических свойствах, специфичности, механизмах взаимодействия с ферментами, методах выделения и очистки. Основное внимание отводится ингибиторам гидролитических ферментов. Обсуждается вопрос о функции ингибиторов в культурах микроорганизмов, синтезирующих ингибиторы, в частности их регуляторной роли.
Книга рассчитана на биохимиков и микробиологов.
Ил. 10. Табл. 25. Библиогр. на 9 с.
Рецензенты:
Л.Г. ЛОГИНОВА, В.В. МОСОЛОВ
Алексей Михайлович Безбородов
МИКРОБНЫЕ МЕТАБОЛИТЫ-ИНГИБИТОРЫ ФЕРМЕНТОВ
Утверждено к печати
ордена Ленина Институтом биохимии им. А.Н. Баха
Редактор Н.С. Палева. Редактор издательства Г.П. Панова
Художник Μ.Л. Храмцов. Художественный редактор И.Ю. Нестерова
Технические редакторы И.И. Джиоева, Г.А. Фетисова
Корректор Н.Ю. Кулагина
ИБ№ 31362
Подписано к печати 24.02.86. Т-00249. Формат 60×90 1/16
Бумага офсетная № 2. Гарнитура Литературная (фотонабор)
Печать офсетная. Усл.печ.л. 6,0. Усл.кр.-отт. 6,2.Уч.-изд.л. 7,8
Тираж 2250 экз. Тип. зак. 1053, Цена 80 коп.
Ордена Трудового Красного Знамени издательство ”Наука”
117864 ГСП-7, Москва В-485, Профсоюзная ул., д. 90
Ордена Трудового Красного Знамени 1-я типография издательства ”Наука” 199034, Ленинград В-34, 9-я линия, 12
Б
2001040000-156
239-86-11
042(02)-86
© Издательство «Наука», 1986 г.
ВВЕДЕНИЕ
Природные ингибиторы ферментов, являющиеся продуктами микробного метаболизма, привлекают в последние годы внимание широкого круга исследователей. Свидетельством тому могут служить многочисленные публикации последних лет. По химической природе различаются две группы ингибиторов: одна — высокомолекулярные соединения, включающая белки, крупные пептиды и гл и ко протеиды, другая — низкомолекулярные соединения различного строения, в частности олигопептиды. К числу ингибиторов могут быть, несомненно, отнесены антибиотики. В этой книге приведены данные лишь о некоторых пептидных антибиотиках, сведения о которых могут представлять интерес при сопоставлении с пептидами — ингибиторами протеаз.
Изучение специфических белковых ингибиторов ферментов, помимо конкретных частных задач, связанных с исследованием данной функции, представляет интерес для решения вопросов более общего характера. К их числу могут быть отнесены исследования белок-белкового взаимодействия: ингибитор — фермент, системы, отличающейся от фермент-субстратного взаимодействия отсутствием каталитической активности, что особенно интересно для ингибиторов протеолитических ферментов. Высокая степень специфичности может служить основанием для использования ингибиторов при получении очищенных ферментов методом аффинной хроматографии, а также инструментом для изучения активных центров и структурной гомологии. Применение специфических ингибиторов может оказаться весьма полезным в энзимологии, когда минимальные количества сопутствующих ферментов влияют на ход эксперимента. Специфические ингибиторы являются удобными тестами для анализа биохимических функций ферментов в клетке.
Высокомолекулярные ингибиторы белковой природы представляют собой одну из систем регуляции активности ферментов микробной клетки. Вероятно, это одна из универсальных оперативных систем контроля, поскольку образование и разрушение комплекса in vitro происходят в условиях, отвечающих физиологическим, имеющим место в клетке. В частности, область pH, в которой проявляется оптимум активности ингибиторов, близка к внутриклеточным значениям pH. Кроме того, эта система выгодна своей экономичностью: реагирующие компоненты после распада комплекса фермент— ингибитор вновь приобретают свои исходные конформации.
Одной из функций ингибиторов, вероятно, является защита клетки от действия собственных гидролаз. В частности, предполагается, что локализованный на внутренней стороне клеточных мембран ингибитор рибонуклеазы Bac. subtilis препятствует обратному поступлению фермента из среды в клетку.
Не менее важной функцией следует считать участие ингибиторов в процессах дифференцировки. Известно, что биохимическая, или метаболическая, дифференцировка находит различные формы своего проявления.
3
Одной из таких форм может быть активирование или угнетение находящихся в клетке ферментов. Реализация этого процесса может осуществляться через образование и распад комплексов фермент—ингибитор или инактивацию ингибиторов.
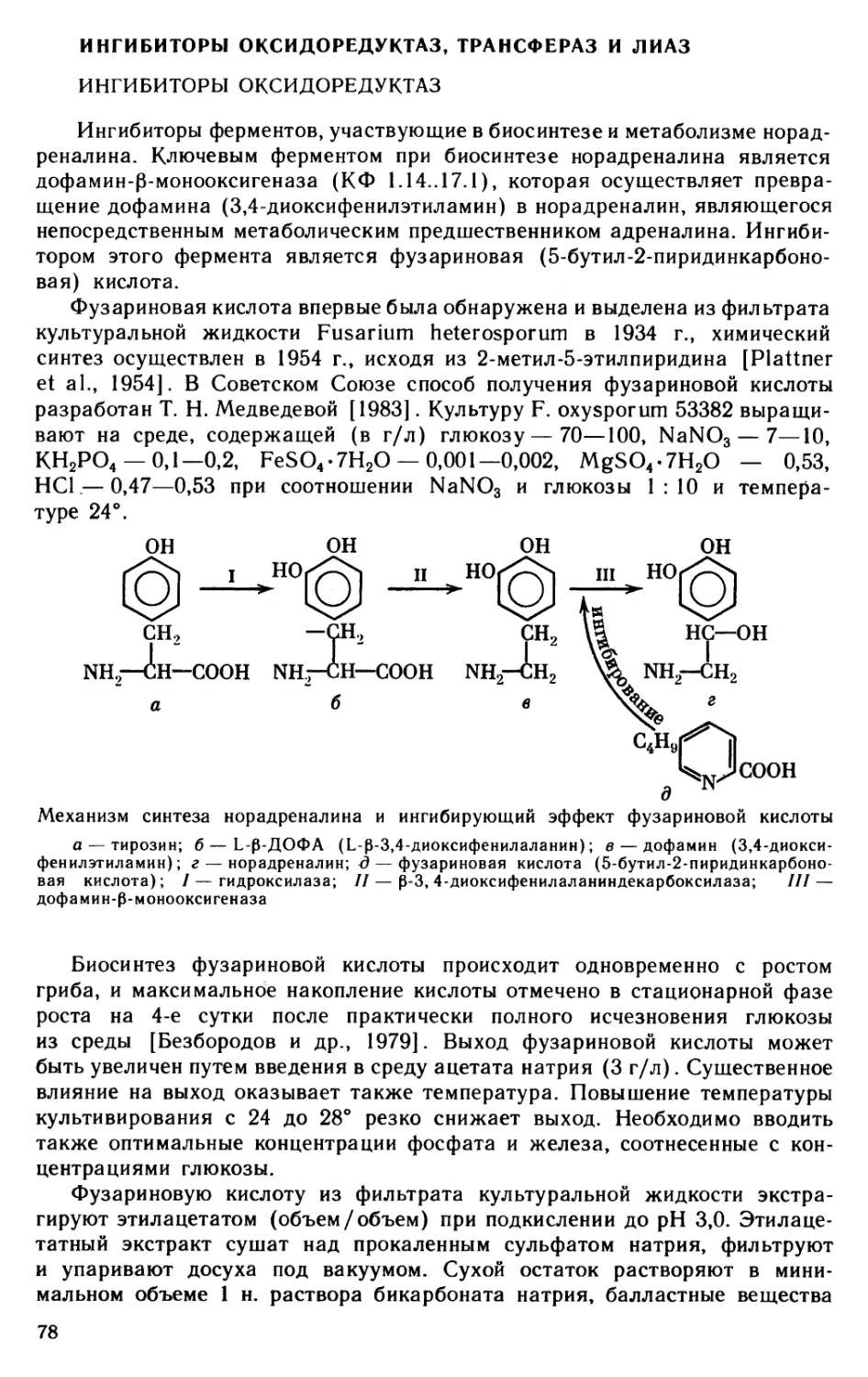
Низкомолекулярные ингибиторы получены по отношению к различным ферментам: представителям классов оксидоредуктаз, трансфераз, гидролаз и лиаз. В большинстве случаев их поиск был обусловлен практической необходимостью, в частности, как возможных медицинских препаратов. В настоящее время наибольшее количество ингибиторов получено против ферментов, относящихся к классу гидролаз. Практически все известные ингибиторы белковой природы действуют на гидролитические ферменты. История открытия и получения ингибиторов наложила отпечаток на характер изложения и расположения материала: не всюду соблюдается порядок, предусмотренный классификацией ферментов, в частности, в материале, касающемся ингибитора АТРазы и PHK-полимеразы; не равноценны по объему и информации различные главы. К сожалению, не все ферменты — объекты действия ингибиторов — точно названы и не всегда приведены их классификационные шифры, так как сохранены названия, используемые в оригинале цитированных работ.
Автор надеется, что вслед за обзором В. В. Мосолова [1983], где изложены основные сведения о белках — ингибиторах ферментов высших растений, окажется полезным обзор современного состояния вопроса об ингибиторах-продуктах микробного синтеза.
ВЫСОКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ
ИНГИБИТОРЫ ГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ, ДЕЙСТВУЮЩИХ НА ЭФИРНЫЕ СВЯЗИ
ИНГИБИТОРЫ ЛИПАЗЫ И ФОСФОЛИПАЗЫ
В ходе фракционирования, выделения и очистки внутриклеточной липазы гриба Rhizopus microsporus был установлен факт увеличения суммарной активности по сравнению с исходной, содержащейся в пробе. После введения мочевины в надосадочную жидкость гомогената мицелия липолитическая активность гомогената повысилась. К. Даврановым и Μ. Μ. Рахимовым [1981] было обнаружено, что в культуре присутствуют пять молекулярных форм липазы, различающихся по составу субъединиц. Все молекулярные формы представляют собой, олигомерные белки с молекулярной массой 28 · 103 (1), 39 · 103 (2), 43 · 103 (3), 65 · 103 (4), 67 · 103 (5), состоящие из двух субъединиц А и В в различных комбинациях: А + В (1), 2А+В (2), А + 2В (3), 4А+В (4), ЗА + 2В (5).
Для выделения и последующей характеристики ингибитора, ответственного, как предполагалось, за отмеченные факты, мицелий отделяли от культуральной жидкости и использовали для дальнейшей работы. Мицелий механически разрушали на холоду и затем проводили экстракцию 0,005 М фосфатным буфером, pH 7,8. Супернатант отделяли центрифугированием. Осадок трижды промывали тем же буфером. Все супернатанты объединяли, после чего белки, содержащиеся в них, осаждали четырьмя объемами изопропанола при 4°. В осадок выпадали липазы и их ингибитор. Осадок растворяли в 0,1 М фосфатном буфере, pH 7,4. Раствор фракционировали на колонке с сефадексом G-75, уравновешенным тем же буфером. Были идентифицированы фракции, обладающие ингибирующей активностью по отношению к препаратам липазы грубой очистки, полученной из той же культуры. Эти фракции подвергали дальнейшей очистке на ДЭАЭ-целлюлозе, уравновешенной 0,1 М фосфатным буфером, pH 7,8. Элюцию белков вначале осуществляли исходным буфером, а затем линейным градиентом NaCl (от 0 до 1,0 М) в 0,1 М фосфатном буфере, pH 7,8. Заключительным этапом очистки являлась гель-хроматография на сефадексе G-75, уравновешенном 0,1 М фосфатным буфером, pH 7,8. В итоге выход ингибитора по активности составил 69%, степень очистки—158 раз; удельная активность ингибитора—59 ед./мг белка. Гомогенность полученного белка доказана методами диск-электрофореза в 7 %-ном ПААГ, ультрацентрифугированием, а также определением N-концевых аминокислот. Ингибитор по своей природе является белком с молекулярной массой 24 000 по данным гель-хрома- тографии на сефадексе G-100, 22000±2000 при ультрацентрифугировании, 25 000±2,5000 при диск-электрофорезе (7,5 %-ный ПААГ). Оптимум pH 6,8—7,0, температурный оптимум 32°. УФ-спектр: max 278 нм, min 253 нм, Dmax/Dmin 2,96. Аминокислотный состав ингибитора следующий (моль/моль белка): Лиз — 10, Гис — 2, Арг — 4, Асп (асн) — 20, Тре — 14, Сер — 20,
5
Глу (Глн) — 16, Про — 2, Ала — 12, Гли — 14, Цис — 4, Вал — 10, Мет — 2, Иле — 8, Лей — 8, Тир — 6, Фер — 8, Три — 4. N-концевая аминокислота — лейцин, C-концевая — глицин [Давранов и др., 1983].
Число субъединиц ингибитора определяли, анализируя диссоциацию полученных веществ в растворах мочевины и ДДС-Na. Были идентифицированы две идентичные субъединицы с молекулярной массой 12 000. Полученные в результате диссоциации мономеры ингибирующей активностью не обладали. Как было отмечено выше, исследуемый микроорганизм способен синтезировать несколько молекулярных форм липазы. Активность ингибитора относительно различных форм липазы проявлялась неодинаково: угнетение активности липазы формы 1 составляло 8%, формы 2 — 30%, формы 3 — 37 %, формы 4 — 10%, формы 5 — 23 %. Наличие олигомерной структуры у липолитических ферментов с различными субъединицами не дает возможности для прогнозов о механизмах взаимодействия между ферментом и ингибитором. Имеется достаточно больше оснований для предположений об изменении четвертичной структуры фермента под влиянием ингибитора, чем о конформационном изменении субъединиц, как это имеет место в случае протомеров.
Ингибитор фосфолипазы Aj (КФ 3.1.1.32) в культуре Bac. subtilis был найден в результате работы с одним из мутантных штаммов, имеющим дефект в строении цитоплазматической мембраны [Kennedy et al., 1974; Krag, Lennarz, 1975]. При получении протопластов исходного штамма и мутанта были замечены различия в фосфолипазной активности, связанной с мембранами. Изучение причин этого явления показало, что исходный штамм содержит ингибитор фосфолипазы АР
Для выделения ингибитора клетки подвергали разрушению на прессе Френча и полученный экстракт разделяли на мембранную фракцию и фракцию надосадочной жидкости. Количественные отношения между ингибирующей активностью в осадке и растворе зависят от буфера, который использовался для работы.
Другим способом, показывающим одновременно локализацию ингибитора, был метод с использованием лизоцима. Клетки исходной культуры суспендировали в изотоническом буфере, содержащем 0,015 М MgCl2, и обрабатывали лизоцимом для получения протопластов. Культуры Bac.
subtilis после выращивания отмывали, получали в виде осадка и затем помещали в буферный раствор, содержащий 0,05 М фосфат натрия pH 7,0, к которому добавляли сахарозу и MgCl2 в конечных концентрациях 0,6 и 0,015 М соответственно. Для получения протопластов клетки ресуспен- дировали в 5 мл буфера, содержащего 25 мг лизоцима, и помещали в термостат на каталку (температура 30°, время 30 мин). Протопласты были отделены центрифугированием от компонентов разрушенных клеточных стенок. Одновременно отделялась периплазматическая фракция, в которую переходили вещества, локализованные между клеточной стенкой и цитоплазматической мембраной (SJ. Периплазматическую фракцию центрифугировали, в результате чего получали осадок (PJ и растворимую фракцию (S2). Протопласты были изолированы при инкубации в гипотоническом растворе. Лизаты после центрифугирования также давали две фракции. Растворимая фракция представляла собой содержимое цитоплазмы (S3), осадок содержал мембраны (Р2). При фракционирований подобным образом от 10 до 30 % общей активности ингибитора были идентифицированы 6
в растворимых фракциях надосадочных жидкостей, причем преимущественно в периплазматической фракции (Si и S2) (схема 1).
Для выделения и очистки ингибитора использовали надосадочную жидкость гомогената клеток Bac. subtilis 168. Фракция надосадочной жидкости наносилась на колонку с ДЭАЭ-целлюлозой (табл. 1). После заключительного этапа на гидроксилапатите степень очистки достигала 2000, а выход — Ю %.
При определении молекулярной массы ингибитора методом гель-хрома- тографии на биогеле Р-60 была установлена величина 28 000—32 000, методом электрофореза в ПААГ в присутствии мочевины и ДДС-Na — 36 000—37 000.
Ингибитор сохраняет не менее 80 % своей активности после тепловой обработки (100°, 5 мин), воздействия 4 М раствора мочевины, 1 %-ного раствора ДДС-Na, понижения pH ниже 4,0. Однако ингибитор чувствителен к трипсину.
Ингибитор проявляет высокий уровень специфичности по отношению к фосфолипазе Aj из данного штамма Bac. subtilis. В частности, ингибитор угнетает мембраносвязанную фосфолипазу АР Возможно, что in vivo все фосфолипазные ингибиторы связаны с цитоплазматической мембраной и что разрушение клеток на прессе или осмотический шок механически солюбилизируют часть белков-ингибиторов. Локализация ингибитора в пери- плазматическом пространстве или наличие той или иной формы связи с цитоплазматической мембраной могут косвенно свидетельствовать о функции ингибитора. В данной культуре, в исходном штамме, ингибитор может служить защитой для липидов цитоплазматической мембраны от гидролиза внеклеточной фосфолипазой в процессе ее секреции. Подтверждением может служить опыт, в котором ингибитор фосфолипазы Aj был добавлен к протопластам, полученным из исходного штамма и мутанта. Введение ингибитора приводило к стабилизации протопластов, предотвращало лизис. Отмечались лишь различия в необходимых количествах ингибитора для исходного штамма и мутанта.
7
Таблица 1
Очистка ингибитора фосфолипазы A1 из Bac. subtilis Krag, Lennarz, 1975
Этап очистки
Удельная активность, ед./мг белка
Степень очистки
Выход, %
Супернатант
71
1
100
ДЭАЭ-целлюлоза (элюция исходным буфером)
903
13
33
ДЭАЭ-целлюлоза (градиентная элюция)
14708
207
17
Гидроксилапатит (градиентная элюция)
I
168000
2360
10
II
145000
2044
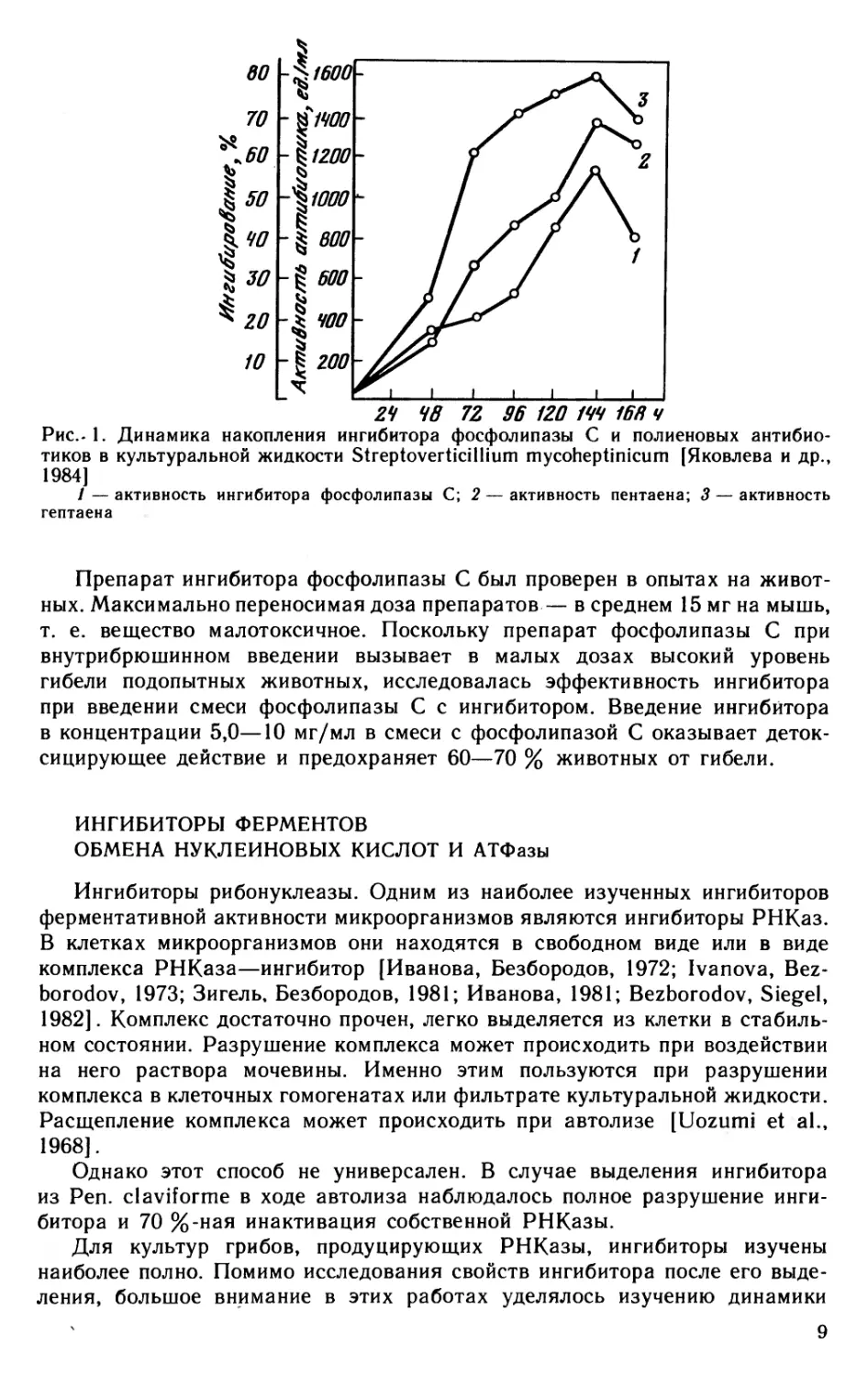
Фосфолипаза C является одним из факторов патогенности ряда возбудителей заболеваний человека и животных. Высокое содержание этого фермента обнаружено в патогенной анаэробной культуре Clostridium рег- fringens, найден он также у ряда стафилококков, грибов, актиномицетов. Природный ингибитор фосфолипазы C был идентифицирован в культуре Streptoverticillium mycoheptinicum — продуценте антибиотика микогептина [Яковлева и др., 1984]. Ингибитор, содержащийся в фильтрате культуральной жидкости, на 50—70 % угнетает активность фосфолипазы C из С1. perfringens. Максимум его активности в культуре совпадает с максимумами активности двух полиеновых антибиотиков — пентаенового и гептаенового (рис. 1). Поэтому после отделения мицелия, который содержит антибиотики, фильтрат культуральной жидкости используется для выделения и очистки ингибитора. В ходе фракционирования возникает необходимость возможно раньше освободиться от присутствующих в растворе протеолитических ферментов (которые обладают способностью инактивировать фосфолипазу), а также пигментов.
Схема выделения ингибитора включает следующие основные этапы:
1) депигментация нативного раствора на анионите ФАФ имеющем коэффициент набухания 4,2, подкисление раствора до pH 5,3—5,5 и прогревание его в течение 30 мин при 50—55° для термокоагуляции протеиназы;
2) высаливание сульфатом аммония (60% насыщения); 3) отделение осадка; 4) ультра- и диафильтрация надосадочной жидкости через ацетилцеллюлозные мембраны УАМ-100 Μ. Последние обладают удовлетворительной скоростью фильтрации (1,0 · 10~1 2 мл/мин · см2 · атм) и задерживают ингибитор на 90—95 %, не вызывая его инактивации. Концентрирование происходит в 6—8 раз. Ингибитор не инактивируется и при сублимационной сушке. Для полной очистки ингибитора необходимо дополнительно проводить гель-хроматографию на сефадексе G-50 «fine» или изоэлектрическое фокусирование в градиенте плотности сахарозы. В данном случае в препарате обнаруживаются две молекулярные формы ингибитора, имеющие ИЭТ 8,15 и 8,50. Обе формы являются веществами пептидной природы с молекулярными массами 3500—4000.
1 ФАФ — продукт сополиконденсации хлористого триметилфеноксиэтиламмония с фенолом и формальдегидом.
8
Рис. l. Динамика накопления ингибитора фосфолипазы C и полиеновых антибиотиков в культуральной жидкости Streptoverticillium mycoheptinicum [Яковлева и др., 1984]
1 — активность ингибитора фосфолипазы C; 2 — активность пентаена; 3 — активность гептаена
Препарат ингибитора фосфолипазы C был проверен в опытах на животных. Максимально переносимая доза препаратов — в среднем 15 мг на мышь, т. е. вещество малотоксичное. Поскольку препарат фосфолипазы C при внутрибрюшинном введении вызывает в малых дозах высокий уровень гибели подопытных животных, исследовалась эффективность ингибитора при введении смеси фосфолипазы C с ингибитором. Введение ингибитора в концентрации 5,0—10 мг/мл в смеси с фосфолипазой С оказывает детоксицирующее действие и предохраняет 60—70 % животных от гибели.
ИНГИБИТОРЫ ФЕРМЕНТОВ
ОБМЕНА НУКЛЕИНОВЫХ КИСЛОТ И АТФазы
Ингибиторы рибонуклеазы. Одним из наиболее изученных ингибиторов ферментативной активности микроорганизмов являются ингибиторы РНКаз. В клетках микроорганизмов они находятся в свободном виде или в виде комплекса РНКаза—ингибитор [Иванова, Безбородов, 1972; Ivanova, Bezborodov, 1973; Зигель, Безбородов, 1981; Иванова, 1981; Bezborodov, Siegel, 1982]. Комплекс достаточно прочен, легко выделяется из клетки в стабильном состоянии. Разрушение комплекса может происходить при воздействии на него раствора мочевины. Именно этим пользуются при разрушении комплекса в клеточных гомогенатах или фильтрате культуральной жидкости. Расщепление комплекса может происходить при автолизе [Uozumi et al., 1968].
Однако этот способ не универсален. В случае выделения ингибитора из Pen. claviforme в ходе автолиза наблюдалось полное разрушение ингибитора и 70 %-ная инактивация собственной РНКазы.
Для культур грибов, продуцирующих РНКазы, ингибиторы изучены наиболее полно. Помимо исследования свойств ингибитора после его выделения, большое внимание в этих работах уделялось изучению динамики
9
Рис. 2. Динамика изменений активности свободной РНКазы (1), свободного ингибитора (2) и связанной РНКазы (3) в процессе роста гриба Asp. clavatus 1816, вес сухого мицелия (4) [Ivanova, Bezborodov, 1973]
1, 2, 3 — в ед./мг веса сухого мицелия; 4 — в г/100 мл
активности ингибитора при сопоставлении с активностью РНКазы по ходу роста культуры. В культуре Asp. clavatus определены соотношения активностей в мицелии (рис. 2). К 17 ч культивирования отмечается низкий уровень активности РНКазы и ее ингибиторов. В латентной форме фермент отсутствует и обнаруживается только к 24 ч. К 40 ч происходит возрастание как активности РНКазы, так и ингибитора, причем 40 % общей РНКазной активности содержится в неактивном комплексе. Стационарная фаза роста характеризуется понижением удельного уровня содержания связанной РНКазы при общей высокой активности свободной РНКазы и свободного ингибитора. К концу стационарной фазы комплекс РНКазы с ингибитором разрушается, активность свободных фермента и ингибитора возрастает [Иванова, Безбородов, 1972; Ivanova, Bezborodov, 1973].
Свободный ингибитор и свободная РНКаза в культуре Pen. claviforme достигали максимума своего содержания к концу вторых суток, примерно в середине экспоненциальной фазы роста [Иванова, 1981]. В культуре Pen. brevi-compactum с интервалом в 12 ч определяли активности РНКазы в фильтрате культуральной жидкости и бесклеточном гомогенате при pH 5,0 и 7,7, ингибитора и латентной РНКазы (по акивации фермента в присутствии мочевины), количество биомассы и pH [Зигель, Безбородов, 1981]. Максимальное накопление вне- и внутриклеточных РНКаз наблюдалось к концу первых суток культивирования, причем преобладала активность ферментов, действующих в кислой области pH. Ингибитор и комплекс РНКаза—ингибитор появлялись к концу первых суток. Ингибирующая активность увеличивалась до начала стационарной фазы роста, пройдя максимум при 48 ч, затем она постепенно снижалась (рис. 3). Таким образом, намечаются некоторые общие черты в характере динамики изменения величин ферментативной активности и ингибиторов РНКазы для Asp. clavatus, Pen. claviforme и Pen. brevi-compactum. Следует также отметить сдвиг по времени максимумов активностей ингибиторов и ферментов. Близкие к отмеченным выше закономерности наблюдались в культуре Asp. oryzae [Uozumi et al.,
1969]. Высокая активность фермента отмечалась в ранний период роста, затем она понижалась и вновь возрастала в стационарной фазе. Периоду уменьшения нуклеазной активности соответствовало резкое увеличение внутриклеточной активности ингибитора, а повышение нуклеазной активности в стационарной фазе сопровождалось инактивацией ингибитора, что авторы связывают с автолизом.
10
Рис. 3. Изменение активности вне- и внутриклеточных РНКаз, ингибитора и комплекса РНКаза—ингибитор в процессе роста Pen. brevi-compactum [Зигель, Безбородов, 1981]
1 — биомасса (абсолютно сухая на 100 мл среды); 2 — РНКаза внеклеточная, pH 5,0 ед./г биомассы; 3 — РНКаза внеклеточная, pH 7,7 ед./г биомассы; 4 — РНКаза внутриклеточная, pH 5,0 ед./г биомассы; 5 — РНКаза внутриклеточная, pH 7,7 ед./г биомассы; 6 — комплекс РНКаза—ингибитор, pH 5,0 ед./г биомассы; 7 — ингибитор, pH 7,7, ингибитор ед./г биомассы
Для характеристики белковых ингибиторов существенно важным является их специфичность. Известные в настоящее время ингибиторы из грибов проявляют исключительно высокую специфичность. Активность внутриклеточных ингибиторов из Asp. clavatus 1816 и Pen. claviforme проявлялась только в отношении двух внутриклеточных и одной внеклеточной РНКазы, выделенных из той же культуры. Ни внеклеточная РНКаза из Act. levoris 2789, ни панкреатическая, ни РНКаза из плаценты человека не ингибировались указанным продуктом [Иванова, Безбородов, 1972; Ivanova, Bezborodov, 1973; Иванова, 1981]. Аналогичные данные были получены для ингибитора нуклеазы О (КФ 3.1.4.9) из Asp. oryzae. Ингибитор и фермент были получены из одного и того же организма [Uozumi et al., 1976]. Ингибитор был выделен из биомассы и очищен в 160 000 раз. С нуклеазой О он образует стабильный комплекс с молекулярной массой 73 000 (Мг фермента 46 000, Мг ингибитора 22 000). Отмечается очень высокая степень сродства между ингибитором и ферментом (Ä\ = 3,2 X 10“12 М). Добавление химотрипсина к комплексу ведет к разрушению ингибитора, освободившаяся нуклеаза О вновь способна связываться со свободным ингибитором. Ингибитор не угнетает активности нуклеазы Sh РНКаз Т, и Т2 и панкреатической РНКазы.
Столь же высокое сродство ингибитор—фермент отмечается в культуре Pen. brevi-compactum [Зигель, Безбородов, 1981]. Полученные в ходе выделения и очистки комплекс кислая РНКаза—ингибитор имеет молекулярную массу 41 000, а комплекс щелочная РНКаза — ингибитор — 24 000. Исходя из данных о молекулярных массах РНКаз, молекулярная масса ингибитора лежит, очевидно, в пределах 7000—13 000. Отсутствие гомогенного препарата ингибитора привело к необходимости вести определение специфичности образования комплекса фермент—ингибитор посредством
11
Рис. 4. Определение pH-оптимума РНКаз и ингибитора [Зигель, Безбородов, 1981]
1 — кислая РНКаза; 2 — щелочная РНКаза; 3 — ингибитор
анализа и сопоставления активностей при различных значениях pH. При этом предполагалось, что в функционирующей клетке изменение pH (возможно, локальное) существенно влияет на состояние комплекса. Кислая РНКаза в комплексе с ингибитором проявляла максимальную активность при pH 6,0. Щелочная РНКаза в комплексе имела максимум активности при pH 7,0—8,0. Ход кривых, изображенных на рис. 4, и совпадение максимальной величины активности при одинаковом значении pH для ингибитора и щелочной РНКазы говорят о том, что именно их связывание в комплекс носит специфичный характер. Аналогичный пример описан для ингибитора РНКазы Bac. subtilis [Smeaton, Elliott, 1967].
Среди известных в настоящее время белковых ингибиторов РНКаз ингибитор панкреатической РНКазы из Neurospora crassa является единственным неспецифическим [Argykaris-Vomvoyannis, Vomvoyanni, 1971]. Высокий уровень специфичности ингибиторов, вероятно, заставляет с осторожностью относиться к данным о полном отсутствии ингибитора в той или иной культуре. Возможно, что для положительного ответа не был подобран соответствующий тест.
Выделение ингибиторов РНКазы из надосадочной жидкости гомогенатов мицелия Asp. clavatus и Pen. claviforme осуществляли путем применения широко распространенных методов гель-хроматографии и ионообменной хроматографии. Впоследствии введением стадии аффинной хроматографии на сефарозе 4В с ковалентно связанной РНКазой очистка была существенно упрощена [Иванова, 1981]. В результате одной стадии очистки на колонке с иммобилизованным ферментом удалось уменьшить в 100 раз содержание балластных белков и получить препарат ингибитора, в значительной степени свободный от РНКазы.
Из бактериальных культур для выделения ингибитора использовали Bac. subtilis [Smeaton et al., 1965; Smeaton, Elliott, 1967] и Bac. amilo- liquefaciens H2 [Hartley et al., 1972]. Ингибитор из Bac. subtilis не столь обстоятельно охарактеризован, как ингибитор из Bac. amyloliquefaciens Н2, однако у Bac. subtilis была изучена динамика изменения активности по ходу культивирования и локализации. Ингибирующая активность в гомогенатах клеток возрастала параллельно с выделением РНКазы в среду и достигала максимума к концу первых суток культивирования. Ингибитор локализован на внутренней стороне цитоплазматической мембраны [Smeaton, Elliott, 1967]. В тех же исследованиях было установлено, что синтез РНКазы и данного ингибитора не находится под контролем одного гена. Однако в свете более современных представлений это положение не имеет строгих доказательств. Нельзя также безоговорочно принять предположение авторов
12
Таблица 2
Аминокислотный состав ингибитора из клеток и внеклеточной рибонуклеазы (количество остатков на молекулу белка) Bac. amyloliquefaciens H2
Аминокислота
Ингибитор
РНКаза
Аспарагин
7
15
Аспарагиновая кислота
Треонин
4
9
Серин
5
9
Глутамин
17
7
Глутаминовая кислота
Пролин
3
3
Глицин
5
10
Аланин
6
8
Цистин 1/2
0
0
Валин
5
4
Изолейцин
6
8
Метионин
0
0
Лейцин
13
7
Тирозин
3
7
Фенилаланин
2
4
Лизин
6
8
Гистидин
1
2
Аргинин
3
6
Триптофан
3
3
Всего
89
110
о функции ингибитора как агента, предохраняющего клетку от обратного поступления выделенной РНКазы.
В культуре Bac. amyloliquefaciens ингибитор локализован внутри клетки. Ингибитор извлекали из замороженных клеток, предварительно отмытых ацетоном и 1 М уксусной кислотой. Экстракцию ингибитора проводили 1 М раствором ацетата аммония. После подкисления экстракта до pH 2,0 ингибитор выпадал в осадок, который хранили в холодильнике без заметной потери его активности в течение нескольких месяцев. Очистка ингибитора включала хроматографию на ДЭАЭ-целлюлозе, хроматографию на агарозе, к которой ковалентно присоединена внеклеточная РНКаза Bac. amyloliquefaciens Н2, повторную хроматографию на ДЭАЭ-целлюлозе и гель-фильтрацию на сефадексе G-75. Природа взаимодействия ингибитора с РНКазой, вероятно, имеет нековалентный характер. Сравнивая аминокислотный состав ингибитора [Hartley, Rogerson, 1972] и фермента [Hartley et al., 1972], приведенный в табл. 2, можно предположить, что часть молекулы ингибитора образует комплементарную площадку с молекулой РНКазы, возможно, вблизи активного центра, поскольку потеря активности РНКазы после удаления нескольких аминокислот с C-конца ее молекулы совпадает с утратой способности фермента образовывать комплекс с ингибитором [Hartley,
1970].
Внутриклеточный ингибитор РНКазы был также выделен из мицелия актиномицета Streptomyces aureofaciens ВМ-К путем осаждения сульфатом аммония, хроматографией на сефадексе G-75, хроматографией и рехроматографией на ДЭАЭ-сефадексе А-25 [Mucha et al., 1983]. В отличие от многих других ингибиторов ферментов данный ингибитор угнетает синте-
13
Таблица 3
Свойства и характеристика ингибиторов рибонуклеаз белковой породы, выделенных из микроорганизмов
Источник ингибитора
Ингибируемый фермент
Молекулярная масса
ИЭТ
Оптимум pH
Действие протеаз
Термостабильность
1
2
3
4
5
6
7
Bac. subtilis
Внеклеточная РНКаза Bac. subtilis
12500
—
8,0
Инактивируется проназой, пепсином, устойчив к трипсину и химотрипсину
Термолабилен
Bac. amyloliquefaciens (клетки)
Внеклеточная РНКаза Bac. amyloliquefaciens
10212
—
—
—
—
Asp. oryzae
Нуклеаза O
22000
4,09
7,8
Инактивируется химотрипсином и проназой
Термостабилен (100° 10 мин)
N. crassa
Внутриклеточная РНКаза N. crassa Панкреатическая РНКаза
—
—
—
—
—
Asp. clavatus 1816
Внутри- и внеклеточная РНКазы Asp. clavatus
13000
7,8
Инактивируется протеазами Asp. clavatus 1816
Термостабилен (80- 100° при pH 3,5)
Pen. brevi- compactum
Щелочная внутриклеточная РНКаза Pen. brevi-compactum
7000- 13000
7,5
—
—
зируемую тем же продуцентом гуанилспецифичную РНКазу Sa. Ингибитор не действует на другие гуанилспецифичные РНКазы из Pen. claviforme, Pen. brevi-compactum, Pen. chrysogenum, Asp. clavatus, Asp. pallidus, Asp. oryzae и Bac. intermedius. Почти в равной мере с РНКазой Sa он угнетал РНКазу неидентифицированной специфичности из Str. rimosus [Mucha et al., 1983а].
Выделенное вещество дает характерный для белков УФ-спектр, не диализуется через фильтр UM-2 («Amicon»), весьма термолабилен, теряет активность через 20 мин при 38° в растворе при нейтральном pH.
Основные сведения об ингибиторах РНКаз суммированы в табл. 3. Для внутриклеточного ингибитора Bac. amyloliquefaciens, действующего на внеклеточную РНКазу, приведен аминокислотный состав в сопоставлении с внеклеточной РНКазой (см. табл. 2). В молекулах ингибитора и фермента отсутствуют серосодержащие аминокислоты. Молекулы ингибитора, по- видимому, менее компактны, чем молекулы фермента, поскольку при гель-
14
Рис. 5. Влияние температуры на активность ингибитора рибонуклеазы из мицелия Asp. clavatus при различных значениях pH (в % к активности при 30°, принятой за 100%) [Ivanova, Bezborodov, 1973]
1 — при pH 3,5; 2 — pH 6,0; 3 — pH 8,0
фильтрации на сефадексе G-75 ингибитор элюировался в меньшем объеме по сравнению с внеклеточной РНКазой, несмотря на более высокую молекулярную массу фермента (13 200 по сравнению с 10 212 для ингибитора) .
Некоторые ингибиторы РНКаз отличаются термостабильностью. Для ингибитора из Asp. clavatus стабильность была проверена при различных значениях pH (рис. 5). Наибольшая неустойчивость к нагреванию отмечалась при 40-60° в кислой и нейтральной областях pH. При 80-100° в кислой области pH активность ингибитора оставалась на уровне контроля, а в нейтральной — несколько понижалась, составляя 70-80 % от исходной активности. Для культуры Asp. clavatus схема выделения ингибитора из надосадочной жидкости сведена в табл. 4
Ингибитор 3': 5'-циклонуклеотид-фосфодиэстеразы. Из клеток Е. coli выделен термостабильный белок-ингибитор, угнетающий активность 3':5'- циклонуклеотид-фосфодиэстеразы из печени быка. Белок проявляет активность в присутствии кальмодулина и Са2+, образуя комплекс. Очищенный белок-ингибитор не обладает фосфодиэстеразной активностью, однако не исключается, что он является каким-то иным Са2+-кальмодулинзависимым ферментом [Iwasa et al., 1981].
Ингибитор дезоксирибонуклеазы. В настоящее время из микроорганизмов выделен и более или менее удовлетворительно охарактеризован лишь один ингибитор белковой природы из Act. levoris [Баскакова и др., 1972]. Для нескольких культур микроорганизмов имеются косвенные доказательства присутствия белковых ингибиторов. К ним относятся дрожжи Sacch. сеге- visiae, бактерии Bac. subtilis, Bac. amylozyma и ряд других. Эти данные приведены в обзоре Г. С. Ивановой и Р. А. Саймановой [1974].
Предпосылкой к выделению ингибитора из гомогената мицелия Act. levoris 2789 послужило наблюдение о понижении ферментативной активности внеклеточной ДНКазы в случае нарушения целостности клеток. Ингибитор был выделен из мицелия в виде хроматографически гомогенного препарата с молекулярной массой 22 000, установленной методом гельфильтрации. Его белковая природа была доказана после обработки протеазами. Белок имеет слабоосновные свойства с ИЭТ, расположенной в интервале pH 7,8—8,2. В отличие от некоторых других ингибиторов белковой природы данное вещество термолабильно. Для него характерна высокая специфичность. Культура, продуцирующая ингибитор, синтезирует по крайней мере две внеклеточные ДНКазы [Безбородов и др., 1968]. Ингибитор активен только в отношении одной из них.
15
Таблица 4
Выделение ингибитора РНКазы из надосадочной жидкости гомогенного мицелия Asp. clavatus [Ivanova, Bezborodov, 1973]
Этап выделения
Объем, мл
Ингибитор, ед./мл
A280
Удельная активность ингибитора, ед./A280
Всего единиц
Выход, %
Надосадочная жидкость гомогената мицелия
320
2,0
6,25
0,3
640
100
Осадок при 70% насыщения сульфатом аммония
20
10,7
4,2
2,4
200
46
Диализат
41
11,25
2,1
5,5
460
72
Объединенные активные фракции после ДЭАЭ-целлюлозы
43
3,5
0,2
17,0
160
25
Ингибиторы эндодезоксирибонуклеаз. Известно, что система рестрикционных эндонуклеаз выполняет функцию защиты клетки хозяина от атаки бактериофагов. Белковый ингибитор эндодезоксирибонуклеазы BamNx (КФ 3.1.23.67), относящийся к рестриктазам типа II, выделен после заражения культуры Bac. amyloliquefaciens штамм N бактериофагом ф NR2rH [Makino et al., 1979]. Для получения ингибитора культуру заражали бактериофагом и культивировали при 37° на качалке. Индуцированные клетки собирали через 15 мин после заражения и хранили при —20°. Затем клетки подвергали оттаиванию и суспендировали в 20 мМ трис-НС1-буфере, pH 7,5, содержащем 5 мМ MgCl2, 0,2 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, после чего озвучивали в течение 15 мин в ледяной бане. Остатки клеток удаляли центрифугированием при 80 000 g в течение 90 мин при 4°. В надосадочную жидкость добавляли 5 %-ный раствор сульфата стрептомицина до конечной концентрации 1 %. Полученную суспензию подвергали центрифугированию, а супернатант диализовали при 4° против 20 мМ трис-НС1-буфера, описанного выше. Осадок, который появлялся в ходе диализа, удаляли низкоскоростным центрифугированием. Супернатант, полученный в результате этой операции, представлял собой грубый экстракт и использовался для работы. Была доказана специфичность ингибирующего эффекта экстракта относительно рестриктазы BamNx. Аналогичную систему имеют бактериофаги ТЗ и Т7, которые защищают свою ДНК от эндонуклеазы хозяина — культуры Е. coli [Spoerel et al., 1979]. Однако в данном случае активность ингибитора проявляется по отношению к рестриктазе, относящейся к типу I. Бактериофаги ТЗ и Т7 защищают свою ДНК от рестрикции направленным синтезом антирестрикционных белков. Эти белки являются первыми детектируемыми продуктами фагового генома, образованными после инфекции.
Эффект угнетения активности эндонуклеазы может быть получен не только за счет связывания ингибитора с ферментом. Так, из индуцируемого лизогена бактериофага Mu-Ι частично очищен высокомолекулярный ингибитор эндонуклеаз, специфичных к двунитевым ДНК. Присутствие ингибитора в бесклеточных экстрактах зависит от индукции профага Ми. Характерной особенностью ингибитора является его способность связываться с дву-
16
нитевой ДНК, но не с ферментом. Связываясь с линейной двунитевой ДНК фага Mu-1, Р22 и φΧ 174 атЗ, ингибитор защищает ее от деградации нуклеазой гесВС и λ-эндонуклеазой, что свидетельствует об отсутствии специфичности. Однонитевая ДНК не защищается ингибитором от деградации нуклеазой гесВС и эндонуклеазой. Из препарата ингибитора выделен белок, который связывается с линейной, но не связывается с кольцевой двунитевой ДНК. Не связывается белок также с кольцевыми и линейными формами однонитевой ДНК [Williams, Radding, 1981].
Ингибитор PHK-полимеразы (РНК-нуклеотидилтрансфераза; КФ 2.7. 7.6). Ингибитор был получен из клеток Е. coli К-12 штамм W3110 [Crimaldi, Ihler, 1976]. Процедура выделения ингибитора многоэтапная, требующая проведения ряда тонких биохимических операций. Выделяют ингибитор из гомогената замороженных клеток путем осаждения сульфатом аммония, сорбцией на ДЭАЭ-целлюлозе, рехроматографией, если в белке присутствуют следы нуклеиновых кислот, освобождением от РНК-полимеразы и последующей хроматографической очисткой ингибитора. Все операции проводятся в условиях, обеспечивающих стабильность выделяемого белка, при низких температурах, в специфичных буферных системах.
Выделенный ингибиторный белок представляет собой полипептид с молекулярной массой 70 000. Ингибитор не узнает специфического участка на ДНК-матрице. Фактически ингибитор регулирует количество синтезированной РНК вне зависимости от транскрибируемой последовательности.
Ингибиторы АТФазы. Из клеток Sacch. cerevisiae [Ehner, Maier, 1977] и Candida utilis CBS [Satre et al., 1975] получены близкие по физиологическим свойствам термостабильные белки, угнетающие активность митохондриальной АТФазы, которые имеют близкие величины молекулярных масс (7400 и 7500 соответственно) и состоят из 64 и 66—67 остатков аминокислот соответственно. Для ингибиторов из Sacch. cerevisiae и С. utilis (в скобках) содержится следующее количество остатков аминокислот: Лиз —8 (10), Гис — 1 (1), Арг —7 (3), Асп — 5 (8), Тре — 4 (5), Сер— 6 (3), Глу— 14 (13), Про —0 (1), Гли —4 (3), Ала — 1 (6), 1/2 Цис— 0 (0), Вал — 2 (1), Мет — 1 (0), Иле — 2 (2), Лей — 4 (7>, Тир — 0 (1—2), Фен — 5 (2), Трп—0 (не определено).
Ингибитор из Sacch. cerevisiae имеет основную природу, ИЭТ — 9,05. Очищенный ингибитор чувствителен к трипсину и дрожжевым эндопротеиназам А и В, однако устойчив к дрожжевой экзопротеиназе С. Радио- иммунологическими методами и путем использования специфических антибиотиков показано, что ингибитор синтезируется на рибосомах, расположенных в цитоплазме. Его накопление, очевидно, связано с образованием митохондриального комплекса.
Ингибитор проявляет высокую субстратную специфичность и практически не угнетает активность других функционально близких митохондриальных ферментов. Кроме того, ингибитор не проявляет гистоноподобной активности, так как не угнетает ДНК-зависимую PHK-полимеразу из Е. coli. Его основная функция — регуляция окислительного фосфорилирования.
Белковый ингибитор из Sacch. cerevisiae или С. utilis в количестве 1 мг способен вызвать угнетение активности 60—80 ед. митохондриальной АТФазы. ИЭТ белка из клеток С. utilis равна 5,6.
Схема выделения и очистки ингибитора митохондриальной АТФ-азы из С. utilis приведена в табл. 5. Было отмечено, что активность ингибитора
17
Таблица 5
Сводная таблица выделения и очистки ингибитора митохондриальной АТФазы из Candida utilis [Satre et al., 1975]
Этап очистки
Общий белок, мг
Общая активность, ед.
Удельная активность, ед./мл
Выход, %
Митохондрии
4940
—
—
—
Щелочной экстракт
1180
5040
4,3
100
Осадок после насыщения сульфатом аммония
238
6240
26
124
Осадок после трихлоруксусной кислоты
64
3245
51
65
ДЭАЭ-целлюлоза
3,9
1940
500
39
Изоэлектрическое фокусирование
1,6
974
630
19
в митохондриях С. utilis зависит от среды, где проводилось культивирование. Использование глюкозы вместо глицерина в качестве единственного источника углерода вызывало 4-кратное понижение активности. Вероятными могут быть два толкования этого факта. Первое — репрессирующее действие глюкозы на синтез ингибитора. Второе — включение ингибитора во внутреннюю мембрану митохондрий. При росте на среде, содержащей глицерин, из 1 мг митохондриальных белков можно получить около 1 ед. ингибитора АТФазы. Сравнительная оценка специфичности и активности ингибиторов АТФазы из С. utilis и сердца быка показала, что ингибитор из С. utilis в 7 раз активнее по отношению к собственной АТФазе из митохондрий, чем к АТФазе из сердца быка. Ингибирование более эффективно в кислой области pH [Klein et al., 1977].
Следует отметить еще один белок, который выполняет ингибирующую функцию относительно АТФазы и представляет собой одну из субъединиц АТФазы Fj из Е. coli [Läget, Smith, 1979].
ИНГИБИТОРЫ ГИДРОЛАЗ, ОСУЩЕСТВЛЯЮЩИХ РАЗРЫВ ГЛИКОЗИДНЫХ СВЯЗЕЙ
ИНГИБИТОРЫ АМИЛОЛИТИЧЕСКИХ ФЕРМЕНТОВ
Ингибиторы α-амилазы Ное-467. Культура Str. tendae 4158 является продуцентом двух ингибиторов α-амилазы Ное-467А и Hoe-467S поли- пептидной природы, отличающихся, в частности, Леконцевыми аминокислотами. Первый из названных ингибиторов содержит аспарагиновую кислоту, второй — серин, что нашло отражение в буквенных индексах. Методом ионообменной хроматографии на ДЭАЭ-целлюлозе и КМ-целлюлозе был получен гомогенный белковый ингибитор Ное-467А. Классическими методами установлена его первичная структура:
18
60 70
Гли—Асп—Гли—Тир—Иле—Гли—Сер—Гис—Гли—Гис—Ала—Арг—Тир—Лей—
Ала—Арг—Цис—Лей.
Молекула белка состоит из 74 аминокислотных остатков и не содержит Фен и Мет. Существенный вклад в формирование структуры вносят две дисульфидные связи Цис-11—Цис-27 и Цис-45—Цис-73, одна из которых совершенно необходима для проявления биологической активности [Ascha- uer et al., 1981; Vértesy et al., 1982]. Ингибитор необратимо взаимодействует с ферментом, 1 моль ингибитора связывает 1 моль фермента. Ингибитор обладает высокой специфичностью: только α-амилаза млекопитающих угнетается необратимо. Не обнаружено активности по отношению к ферментам бактерий или грибов. Поскольку ингибитор действует на а-амилазу продуцента, предполагается, что Ное-467 осуществляет регуляторную функцию у Str. tendae 4158. Ингибирующее действие препарата было продемонстрировано in vivo на животных при кормлении их крахмалом. Это привело к заключению, что он может найти применение при лечении диабета и ожирения [Vértesy et al., 1982].
Ингибитор α-амилазы Al-3688. В фильтрате культуральной жидкости Str. aureofaciens DSM 2790 обнаружен полипептид, угнетающий активность α-амилаз животного происхождения [Вертеси, Трипиер, 1984]. Ингибитор получил наименование А1-3688. Вещество было выделено путем сорбции на полистирольной неионной смоле Р-20 при pH 5,0 с последующей элюцией системой вода—изопропанол (4 : 1), хроматографией на ДЭАЭ-сефадексе, pH 7,0, при градиентной элюции NaCl. После обессоливания на сефадексе G-50 и ультрафильтрации удельная активность продукта составляла 1,5 Х1014 ед/мг, ИЭТ — 4,2. Полипептид состоит из 36 аминокислотных остатков: Ала — Тре — Гли — Сер — Про — Ала — Про — Асп — Цис — Вал — Глу — Сер — Фен — Глн — Сер — Трп — Арг — Тир — Тре — Асп — Вал — Арг — Асн — Гли — Цис — Сер — Асп — Ала — Вал — Тре — Вал — Вал — Вал — Глу — Тир — Глу. Между Цис-9 и Цис-25 имеется дисульфидная связь, вследствие чего образуется кольцо из 17 остатков, содержащее активный участок: Глн-14—Тир-18. Это кольцо включает в себя структуру, отвечающую представлениям о наличии двойного изгиба α-спирали. Предполагается, что он также может найти применение при лечении ожирения.
Ингибитор α-амилазы Paim (pig pancreatic α-amylase inhibitor of microbes). Продуцентом ингибитора α-амилазы является Str. corchorusii [Murao, Ouchi et al., 1983]. Выделение ингибитора осуществляют из 32-часовой культуры из среды, содержащей глюкозу и соевый экстракт. Процедура очистки ингибитора достаточно длительная и трудоемкая. Из фильтрата культуральной жидкости ингибитор осаждают сульфатом аммония при 80 %-ном насыщении, осадок растворяют в фосфатном буфере, pH 7,0. Далее уксусной кислотой понижают pH до 4,0 и осадок удаляют, а надосадочную жидкость диализуют против фосфатного буфера, pH 6,0. Диализат подвергают хроматографии на ДЭАЭ-целлюлозе и элюируют, применяя линейный градиент концентрации NaCl (0—0,5 М). В результате этой стадии очистки получены две фракции, обладающие ингибирующей активностью, названные Paim I и Paim II. Дальнейшие этапы очистки для обеих фракций были практически идентичны. После диализа против 19
фосфатного буфера, pH 6,0, диализат был помещен на ТЭАЭ-целлюлоз у. После элюции линейным градиентом NaCl (0—0,5 М) активная фракция подвергалась хроматографии на сефадексе G-75. Дальнейшие этапы очистки проходили на SP-сефадексе G-50 и с помощью гидрофобной хроматографии на октил-сефарозе GL-4B, уравновешенной ацетатным буфером, pH 4,0, содержащим 1 М NaCl, элюция раствором NaCl.
Ингибитор Paim I после описанных этапов очистки при электрофорезе в ПААГ при pH 2,3 и 9,5 давал одну четко окрашенную полосу, ингибитор Paim II, помимо одной основной полосы, давал несколько минорных компонентов. Молекулярные массы Paim I и Paim II — 4300 и 4800, ИЭТ — 4,2—4,0 соответственно. Оба ингибитора содержат много остатков Ала, не содержат Лиз, Иле и Фен, не являются гликопротеидами.
На α-амилазы из различных объектов они действуют избирательно, что может служить косвенным доказательством их различного строения. Они проявляют активность относительно α-амилазы поджелудочной железы свиньи, собаки, менее активны относительно тех же ферментов коровы и лошади и не действуют на α-амилазы поджелудочной железы, слюны и мочи человека, некоторых растений и микроорганизмов.
Ингибитор α-амилазы животного происхождения получен из Str. gri- seosporus YM-25 [Murao et al., 1980; Goto et al., 1980, 1983]. Поскольку он был выделен в опытах с α-амилазой из поджелудочной железы борова, ингибитор получил сокращенное название Haim (hog pancreatic α-amylase inhibitor of microbes). Ингибитор содержится в суточном фильтрате культуральной жидкости. Выделение ингибитора происходит в результате ряда обычных при фракционировании белков операций: насыщение фильтрата культуральной жидкости сульфатом аммония (80 %) с последующим диализом и хроматографией на колонках с ДЭАЭ- и ТЭАЭ-целлюлозой. Ингибирующую активность идентифицировали в двух фракциях. Каждую из них подвергали рехроматографии на ТЭАЭ-целлюлозе, далее — на сефадексе G-50. Удельная активность, за единицу которой было принято количество ингибитора, необходимое для снижения амилазной активности на 50 %, для Haim 1 после всех стадий очистки составляла 4650 ед/мг, для Haim II — 4800 ед/мг. После доказательства гомогенности обеих фракций были установлены молекулярные массы (8500 для обоих белков) и ИЭТ белков для Haim I — 4,0, для Haim II — 3,8. Аминокислотный анализ дал также близкие результаты (число остатков на моль): Асп (Асн) — 11, Тре — 8, Сер — 4, Глу (Глн) — 1, Про — 4, Гли — 8, Ала — 9, Цис — 2, Вал — 8, Иле — 3, Тир — 4, Фен — 3, Гис — 1, Арг — 3, Трп — 1. Мет и Лиз в состав молекул не входили. Различались Haim I и Haim II по количеству остатков Лей: ингибитор Haim I содержит 3, Haim II — 4 остатка. Оба белка имеют идентичные УФ-спектры, не содержат в своем составе углеводов, проявляют высокие термо-« и pH-стабильность. При экспозиции в течение 10 мин при 100° в широком интервале pH (от 2,5 до 7,9) не теряют ингибирующие активности.
Ингибиторы имеют ярко выраженную специфичность по отношению к гликозидазам животных. Они в одинаковой мере угнетают активность α-амилаз поджелудочной железы и крови свиньи, слюны, сока поджелудочной железы и мочи человека, поджелудочных желез лошади, коровы и кошки (при pH 7,0) и не угнетают активность така-амилазы А, солода, глюкоамилазы Rhizopus niveus, пуллуланазы Aerobacter aerogenes, декстра20
назы Penicillium sp. (при pH 5,5), ß-амилазы пшеницы и батата (при pH 5,0) и целлюлазы Trichoderma sp. (при pH 4,5).
Кроме актиномицетов, продуцентом внеклеточного ингибитора амилазы является культура гриба Cladosporium herbarum F-828. Ингибитор был очищен в 81 раз после фракционирования на ДЭАЭ-целлюлозе, сефадексе G-75, ДЭАЭ-сефацеле и биогеле. Р-100. По данным гель-хроматографии на биогеле Р-100, его молекулярная масса около 18 000. Очищенный ингибитор является гликопротеидом, содержащим 10 % углеводов. Белковая часть молекулы ингибитора состоит из следующих аминокислот (число остатков на моль): Асп (Асн) — 16, Тре — 13, Сер — 15, Глу (Глн) — 16, Гли — 19, Ала — 14, Цис — 1, Вал — 10, Мет — 1, Иле — 7, «Лей — 9, Ти — 8, Фен — 9, Лиз — 7, Гис — 3, Арг — 2, Трп — 3.
Одна молекула ингибитора взаимодействует с одной молекулой фермента. Кинетические исследования показали, что ингибитор действует неконкурентно, имея = (2,3—4,8) · Ю-10 Μ. Ингибирующая активность сохраняется в интервале pH 5—12 при 4°. Ингибитор специфически угнетает α-амилазы животных: поджелудочных желез свиньи и человека, а также слюны человека. Не действует на α-амилазы бактерий и грибов, в частности Bac. licheniformis, Bac. subtilis и Asp. oryzae. Не действует на ß-амилазу, глюкоамилазу, α-глюкозидазу, пуллуланазу [Saito, 1982].
ИНГИБИТОРЫ ПРОЧИХ ГЛИКОЗИДАЗ
Ингибитор эндодекстраназы был обнаружен в фильтрате культуральной жидкости глубинной культуры одного из мутантных штаммов Streptococcus [Hamelik, McGabe, 1982]. Ингибитор был выделен путем аффинной хроматографии. При действии трипсина, проназы Е и папаина активность ингибитора пропадала, что послужило основанием для заключения о его белковой природе. Ингибитор термостабилен, не теряет активность при нагревании в течение 15 мин при 100°. Характерной особенностью является специфичность ингибитора. Он проявляет высокий уровень активности по отношению к собственной декстраназе, но не действует на декстраназы Penicillium sp. Наличие ингибитора искажает данные об активности декстраназы в культуре, т. е. в присутствии ингибитора декстраназная активность не обнаруживается. Именно наличием ингибитора авторы объясняют наблюдаемые модуляции величины декстраназной активности по ходу культивирования.
Ингибитор лизоцима был получен после обследования в опытах in vitro более 40 культур актиномицетов. Объектом исследования служил фильтрат культуральной жидкости. На этом уровне было показано, что подавляющее большинство культур содержит ингибитор. Полученный из Act. herbescens 4 препарат не был гомогенным белком, проявлял термостабильность. Уровень угнетения активности зависел от природы используемого буфера. Так, при pH 7,5 активность лизоцима в 0,1 М боратном, 0,05 М трис-HCl- и 0,05 М фосфатном буферных растворах подавлялась соответственно на 98, 50 и 5 %. При анализе надосадочной жидкости клеточного гомогената 2—5-суточной культуры Act. herbescens 4 был обнаружен ингибитор лизоцима. Предварительные опыты показали, что внеклеточный ингибитор отличается по некоторым свойствам от внутриклеточного. Оба ингибитора имеют белковую природу [Безбородов и др., 1975].
21
Гомогенный высокомолекулярный ингибитор НАД+ нуклеозидазы (НАДаза; КФ 3.2.2.5) выделен из Bac. subtilis [Everse et al., 1980]. Известно, что большинство микробных НАДаз являются термостабильными белками. Они присутствуют в клетках в неактивной форме в комплексе с термолабильным ингибитором. При нагревании клеточного гомогената в кипящей водяной бане происходит активация фермента. Очистка ингибитора проводится путем последовательного двукратного фракционирования клеточного гомогената на сефадексе G-75 и ДЭАЭ-сефадексе. Ингибитор, как и фермент, является гликопротеидом, содержащим 72,7 % углеводов. Молекулярная масса ингибитора — 26 200, комплекса с ферментом — 52 700.
Нейраминин — ингибитор нейраминидаз вирусного происхождения — выделен из фильтрата культуральной жидкости Str. sp. N 289 [Kunio et al., 1977]. Вещество представляет собой гликопротеид, содержащий 88% нейтральных сахаров и 12 % аминокислот. Очевидно, что к числу ингибиторов белковой природы он может быть отнесен условно. Молекулярная масса электрофоретически гомогенного препарата равна примерно 100 000. Нейраминидазная активность сохраняется после 10-минутного прогрева при 100°, не меняется после инкубации с трипсином, пепсином, протеазой Str. griseus, папаином, α-химотрипсином, но заметно снижается после обработки NaJO4.
Ингибитор эффективно ингибирует нейраминидазу вируса гриппа и вируса ложной чумы кур, но не действует на нейраминидазы Cl. perfringes и Vibrio cholerae. Во всех случаях имеет место конкурентное ингибирование нейраминидаз, насыщение происходит при очень низкой концентрации ингибитора независимо от типа и концентрации субстрата.
ИНГИБИТОРЫ ПЕПТИДГИДРОЛАЗ
ОБЩИЕ ПРЕДСТАВЛЕНИЯ
ОБ ИНГИБИТОРАХ БЕЛКОВОЙ ПРИРОДЫ
Основные представления о механизмах действия ингибиторов получены на примерах с ингибиторами протеолитических ферментов, полученных из высших растений или животных. Исключение составляет ингибитор S-S1, полученный из актиномицета, информация о свойствах и механизме действия которого сопоставима с ингибиторами из высших растений.
Представление о реактивных центрах ингибиторов было сформулировано в работах Ласковского [Finkenstadt, Laskowski, 1965; Ozawa, Laskowski, 1966]. Реактивный центр ингибитора определяется как часть молекулы белка, которая вступает в контакт с активным центром фермента при формировании комплекса фермент—ингибитор. Наиболее изучен механизм взаимодействия ингибиторов протеиназ. Их взаимодействие с ферментом осуществляется реактивным центром и напоминает взаимодействие с субстратом. Аминокислотная последовательность в области реактивного центра ингибитора по аналогии с последовательностью в молекуле любого белкового субстрата обозначается следующим образом:
Рх ·· Р,-Р3-Р2-Рх-±—Р\-Р'2-Р^Р'А ... Р'х
При контакте ингибитора с ферментом происходит разрыв одной пептидной связи. Как показано выше, эта связь имеет обозначение —Рх——Р\—. Анализ аминокислотных последовательностей в реактивных центрах инги22
биторов высших растений и микроорганизмов показал, что реактивные центры содержат пептидные связи Арг—X или Лиз—X. При этом остатки Арг или Лиз занимают положение Исходя из этого, белковые ингибиторы трипсина обычно относят к типу «аргининовых» или «лизиновых». Разрыв пептидной связи в реактивном центре ингибитора является обратимым процессом.
Модификации в реактивном центре сделаны преимущественно на ингибиторах из высших растений, в частности на так называемом соевом ингибиторе Кунитца [Kowalski et al., 1974]. Было показано, что замена Арг-63 на Лиз-63 в положении Р{ не влияла на активность. В случае замены того же остатка Арг-63 на Трп-63 менялась специфичность ингибитора. До модификации ингибитор проявлял высокий уровень активности по отношению к трипсину и низкий к химотрипсину. После модификации ингибитор приобретал свойства специфического ингибитора химотрипсина. Замена Арг-63 на Фен-63 не привела к потере способности ингибировать трипсин.
Гидролиз пептидной связи в реактивных участках ингибиторов не происходит до полного завершения. При нейтральном значении pH константа равновесия между модифицированным ингибитором (с гидролизованной пептидной связью в реактивном участке) и немодифицированным ингибитором (пептидная связь в реактивном участке интактна) близка к единице.
Детальному изучению подвергался вопрос о специфичности разрыва пептидной связи в реактивном участке ингибитора. Для доказательства обычно приводят следующие экспериментальные факты [Laskowski, Kato, 1980].
1. Специфическое замещение или удаление вновь образованного C-кон- цевого остатка (PJ в активном модифицированном ингибиторе делает его неактивным.
2. Специфическое ацилирование вновь образованной в результате гидролиза концевой аминогруппы (PJ предотвращает возврат ингибитора из модифицированного в исходное, немодифицированное, состояние и делает его тем самым неактивным.
3. При диссоциации фермент-ингибиторного комплекса, включающего модифицированный ингибитор, кинетическими методами показано, что продуктами реакции являются немодифицированный ингибитор в преобладающем и модифицированный в крайне незначительном количестве.
Механизм фермент-ингибиторного взаимодействия, представленный в обобщенном виде, включает только те промежуточные продукты, реальное существование которых было доказано [Laskowski, Kato, 1980]:
Е + I--L^C^-X^-LX^E + /х,
где Е — фермент; I и Iх — ингибиторы, немодифицированный и модифицированный соответственно; L и Lx— слабо связанный нековалентными связями быстро диссоциирующий комплекс Е с / и Iх соответственно; X — промежуточный продукт реакций в реакции Е + /х, имеющий относительно долгий период существования; С — стабильный фермент-ингибиторный комплекс.
Предполагается, что при наличии более тонких и точных методических приемов анализа промежуточных продуктов их число может возрастать.
Показано, что реактивный центр ингибитора взаимодействует с активным центром фермента подобно субстрату. Наблюдается контакт небольшого участка фермента и ингибитора с образованием многочисленных ван-дер- 23
ваальсовых взаимодействий, гидрофобных связей и солевых мостиков. При образовании комплекса происходят небольшие конформационные изменения, хотя преобладают взаимодействия по типу ключ—замок. Конформационная адаптация ингибитора предположительно имеет место на этапе L-+C, согласно приведенной выше схеме.
Многие ингибиторы имеют дисульфидные мостики. Обычно они окружают реактивный центр. Наличие такой дисульфидной «петли» вокруг реактивного центра обеспечивает связь между двумя пептидными цепями, образующимися вследствие гидролиза пептидной связи в реактивном центре. Однако такое положение не может быть постулировано как обязательное. Сильное нековалентное связывание может заменить дисульфидную связь при стабилизации фрагментов.
Локализацию реактивных центров определяют обычно методом ограниченного протеолиза каталитическими количествами фермента в кислой области pH (2,5—4,5), а затем, после восстановления дисульфидных связей и алкилирования, разделяют образовавшиеся фрагменты [Rouleau, Lamy, 1975; Ozawa, Laskowski, 1966].
Известны ингибиторы, обладающие способностью подавлять активность нескольких различных ферментов. При этом предполагаются три возможных типа взаимодействия: 1) связывание различных ферментов с неперекры- вающимися участками молекулы ингибитора, так называемые двуглавые и многоглавые ингибиторы; 2) связывание ферментов хотя и с различными, но перекрывающимися участками; 3) взаимодействие различных участков ферментов с одним и тем же реактивным центром в белковом ингибиторе.
Наиболее интересен и наиболее изучен первый из названных типов взаимодействия. Впервые такие ингибиторы были выделены из растений семейства бобовых. Это двуглавый ингибитор Боумана—Бирка из сои, ингибитор из нута, ингибиторы из фасоли, ингибиторы DE-3 и DE-4 из южно-африканского бобового растения. Все эти ингибиторы имеют весьма близкую первичную структуру и локализацию реактивных центров [Joubert et al., 1979]. Обычно двуглавые ингибиторы имеют различные аминокислотные остатки в положении реактивных центров. Очевидно, что наличие двух реактивных центров ингибитора не вызывает конкуренции ферментов за него. При этом может происходить одновременное связывание двух ферментов в случае двуглавых и большего количества в случае многоглавых ингибиторов.
ИНГИБИТОР ЩЕЛОЧНОЙ ПРОТЕИНАЗЫ
S-Sl STREPTOMYCES ALBOGRISEOLUS
Ингибитор щелочной протеиназы S-Sl (Streptomyces-subtilisin inhibitor) выделен из фильтрата культуральной жидкости Str. albogriseolus S-3253 [Murao, Sato, 1972]. Ингибитор получен при одно- или двухступенчатом выращивании продуцента при 45° на среде следующего состава (в %): полипептон — 4,0; крахмал — 2,0; дрожжевой экстракт — 0,1; NaCl — 0,1; К2НРО4 —0,1; MgSO4 · 7Н2О — 0,5, pH 7,0 [Murao et al., 1972]. Многие источники углеводов заменяли крахмал при биосинтезе ингибитора без существенного изменения уровня активности. Из источников азота лучшим был полипептон. Минеральные источники азота не обеспечивали синтез ингибитора. Ингибитор был выделен из фильтрата культуральной жидкости
24
Таблица 6
Сводная таблица выделения и очистки ингибитора S-SI из Str. albogriseolus S-3253 [Sato, Murao, 1973]
Стадия
Общая активность, ед.
Удельная активность, ед./A280
Выход, %
Культивирование
Фильтрат культуральной жидкости
342∙103
2,56
100
(NH4)2SO4
Осаждение
Диализ
Диализат
325∙103
8,3
95
Хроматография на ДЭАЭ-целлюлозе
Неочищенная фракция (из активной зоны)
272∙103
41,3
79
Подкисление до pH 4,5
A-фракция
152∙103
85,5
46
Трехкратная
перекристаллизация
Кристаллы S-SI
474∙102
87,5
13
высаливанием сульфатом аммония, хроматографией на ДЭАЭ-целлюлозе (табл. 6). Из фракции А были получены кристаллы двух типов: игольчатые и ромбические [Sato, Murao, 1973]. Для получения игольчатых кристаллов лиофилизированную А-фракцию (250 мг) растворяли в 50 мл 0,01 М боратного буфера, pH 7,2, слегка подкисляли на холоду 0,02 н. НС1 до pH 5,0, после чего ее оставляли на ночь при комнатной температуре. Для получения ромбических кристаллов применяли другой способ. Лиофилизированную А-фракцию (100 мг) суспендировали в 5 мл дистиллированной воды, доводили pH до 7,5 0,3 %-ным водным раствором аммиака до полного растворения осадка. Раствор ингибитора насыщали раствором сульфата аммония, добавляя последний по капле при одновременном перемешивании. После появления легкой мути прекращали добавление сульфата аммония. Раствор оставляли стоять при комнатной температуре. На дне сосуда через некоторое время возникали кристаллы ромбической формы. Полученные результаты, как считают авторы, дают основание утверждать, что кристаллы игольчатой формы формировались, когда в ингибиторном белке S-SI были свободными несколько карбоксильных групп. Ромбические кристаллы формируются тогда, когда образуются аммонийные соли [Sato, Murao, 1973].
Ингибитор S-S1 обладает специфичностью действия относительно щелочных протеиназ. При pH 9,5 он интенсивно угнетает активность субти- лизина BPN', щелочных протеиназ Bac. subtilis SO4, Bac. subtilis var. amylosacchariticus, Streptomyces sp. и Cehpalosporium sp. Не проявляет активности при pH 7,0 по отношению к трипсину, α-химотрипсину, папаину, фицину, нейтральной протеиназе Ps. aeruginosa, пепсину при pH 1,6, кислым протеазам Rhodotorula glutinis, Cladosporium sp. при pH 2,5. Высокий
25
Первичная структура ингибиторов протеиназ S-SI из Str. albogriseolus (1) и плазминострептина (2) [Mitsui et al., 1979]
Ала-Цис- Ал а-Ци с-
уровень специфичности к субтилизину BPN' обнаружен в опытах, где вместо субтилизина в качестве субстрата использовали тиолсубтилизин, полученный путем химического замещения Сер-221 на Цис-221 [Fujiwara et al., 1977]. Ингибитор конкурентно угнетает этеролитическую активность тиолсубтилизина по отношению к n-нитрофенилацетату. При pH 7,5 Ki = = 1,3∙10-5 Μ. Сравнительное изучение Kd при разных значениях pH комплексов ингибитор—субтилизин и ингибитор—тиолсубтилизин показало, что замена Сер на Цис приводит к понижению сродства к ингибитору примерно на 6—7 ккал/моль.
Ингибитор S-SI один из первых белковых ингибиторов протеиназ, для которых установлена первичная структура и выявлены некоторые детали о локализации центра связывания [Ikenaka et al., 1974]. Ингибитор содержит 113 аминокислотных остатков. Исходя из этого, молекулярная масса белковой молекулы составляет 11 483. Млекулярная масса по результатам физико-химических методов анализа составляет 27 000 [Ikenaka et al., 1974] и 23 000 [Sato, Murao, 1974]. Последнее позволяет предполагать, что в растворах ингибитор находится в виде димера. Белок содержит два дисульфидных мостика. Один из них между Цис-35 и Цис-50, другой — между Цис-71 и Цис-101. Около 90 % остатков Ала, 80 % Лей, 90 % Тре 26
и 75 % Про найдены в N-концевой части молекулы белка. Другая часть молекулы более богата остатками ароматических кислот, основных, дикарбоновых и их амидов. Такой характер расположения аминокислотных остатков может оказывать существенное влияние при формировании третичной структуры белка.
Взаимодействие S-SI с субтилизином BPN' изучено с точки зрения стехиометрии связывания их молекул [Inouye et al., 1977]. Показано, что две субъединицы молекул ингибитора (молекулярная масса 23 000) связывают и ингибируют две молекулы субтилизина BPN' (молекулярная масса 56 000). Предполагается, что взаимодействие между ингибитором и субтилизином BPN' — типичный пример специфического узнавания между белками. Взаимодействуя с субтилизином BPN', S-SI имеет /(^ 10“9 при pH 8,5. Значение уменьшается со снижением pH; при pH 7,0 ее величина составляет 7 · 10“11 Μ. При взаимодействии с α-химотрипсином быка Ki = 3 · 10-6 Μ.
Из температурной зависимости были определены термодинамические параметры связывания S-SI с субтилизином BPN' при pH 7,0 и 25°: ΔΟ° = —53,3 кДж · моль-1, ΔΑ0 = 17,5 кДж · моль-1, Δ5° = 237 Дж · град-1. Считают, что связывание ингибитора с субтилизином ΒΡΝ' представляет собой процесс с «управляемой энтропией» [Hiromi et al., 1980].
С помощью метода остановленного потока установлено, что ингибитор взаимодействует с субтилизином еще до или во время образования комплекса фермент—субстрат.
Комплекс S-SI с субтилизином BPN' был получен путем гель-хромато- графии на сефадексе G-100 в виде ромбических кристаллов [Sato, Murao, 1974]. Молекулярная масса комплекса — 78 000, ИЭТ соответствовала pH 5,5. Одна субъединица S-SI соединялась с одной молекулой субтилизина BPN'.
Исследование кристаллической структуры S-SI [Mitsui et al., 1979] показало, что каждая субъединица димерного ингибитора имеет 5 анти- параллельных участков ß-структуры и две короткие α-спирали. Контакт между субъединицами ингибитора осуществляется за счет взаимодействия ß-структурных участков субъединиц, напоминая подобное взаимодействие субъединиц у конканавалина А. Активный центр S-SI находится на поверхности молекулы белка. Структура активного центра выражена последовательностью Вал-69—Мет-70—Цис-71—Про-72—Мет-73—Вал-74 (см. рис. 6) При ингибировании субтилизина расщепляемой является связь Мет-73— Вал-74 [Omichi et al., 1980]. Конформация участка молекулы белка, расположенного вокруг этой связи, отличается повышенной жесткостью.
Для получения протеаз высокой степени очистки, ингибитор был иммобилизован на бромциан-сефарозе [Sato et al., 1975]. Преимущество данного носителя в том, что свободные аминогруппы ингибитора не принимают участия в реакциях ингибирования, связывание происходит именно по аминогруппам молекулы S-SI. Стабильность ингибитора при иммобилизации не снижалась. Иммобилизованный ингибитор применялся для очистки щелочной протеиназы Bac. subtilis SO4 из фильтрата культуральной жидкости, а также α-химотрипсина, хотя ингибитор не проявлял по отношению к нему специфической ингибирующей активности [Sato, Murao, 1973]. В качестве диссоциирующего агента с большим успехом использовался ДДС-Na.
27
Анализ результатов взаимодействия между детергентами и белками может представлять интерес как для теории, так и для практики. В частности, изучение свойств S-SI привело к анализу взаимодействия ДДС-Na с субстратом и ингибитором [Inouye et al., 1979]. Было отмечено, что диссоциация димера S-SI на субъединицы в присутствии низких концентраций детергента ведет к заметной потере ингибирующей активности по отношению к суб- тилизину BPN'. Взаимодействие ДДС-Na и S-SI вызывает конформационное изменение белка за счет связывания ДДС-Na с остатком Трп. В результате ингибирующая активность S-SI по отношению к субтилизину BPN' снижается в 2 раза. Наличие ДДС-Na в системе вызывает диссоциацию ингибитора на субъединицы, как сказано выше, и, вероятно, денатурацию. По- видимому, ДДС-Na действует не только на структуру субстрата и ингибитора, но и на связывание n-нитрофенилацетата с активным центром фермента. Сложность в поиске ответа обусловлена, в частности, тем, что субъединицы ингибитора идентичны.
Для молекул S-SI получены спектры лазерного (488 нм) комбинационного рассеяния в Н2О и Д2О [Harada et al., 1982]. Идентифицировано следующее положение полос: для амида III (Н2О) — 1236 и 1248 см“1; амида III' (Д2О) —933 и 965 см“1; амида I (Н2О) — 1665 см“1; амида I' (Д2О) — 1662 см“1, что свидетельствует о наличии антипараллельной ß-структуры (складчатый слой) и конформации неупорядоченного клубка в молекуле S-SI. Положение полосы S—S-связи (510 см-1) позволяет приписать всем четырем СаСр—SS—СрСа-группам димерной молекулы S-SI гош—гош—гош-конформацию. Согласно анализу спектра комбинационного рассеяния в области 750—650 см-1 (колебания С—S-связей), Са-, Ср- или C?S—CS-группа остатка Мет может принимать в растворе различные конформации (гош—гош, транс—гош и гош—транс). Ни один из остатков Тир молекулы (дублет при 855 и 840 см“1) не образует специфичных водородных связей с другими остатками аминокислот белка. Единственный остаток Трп (Трп-86) субъединицы S-SI находится в гидрофобном окружении. Обнаружено, что в молекуле ингибитора содержатся четыре—шесть анионов SÓf“, характеризующихся полосой спектра комбинационного рассеяния при 981 см“1.
ИНГИБИТОРЫ ЩЕЛОЧНОЙ ПРОТЕИНАЗЫ ГРУППЫ АР-1
Из фильтрата культуральной жидкости Str. pseudogriseolus No КТо-332 получен ингибитор щелочной протеиназы AP-Ι (alkaline protease inhibitor). Культуру выращивали на среде, содержащей (в %) глюкозу— 2,0, растворимый крахмал — 3,0, соевую муку — 1,0, кукурузный экстракт — 1,0, полипептон — 0,5, NaCl — 0,3, СаСО3 — 0,5, pH 7,0. Культивирование проводили в течение 30—40 ч при 42° [Uyeda et al., 1976]. Выделение и очистку осуществляли путем использования традиционных приемов для препаративного получения белков: осаждением сульфатом аммония (50 % насыщения) с последующим диализом и хроматографией на ДЭАЭ-целлюлозе. После элюции активные фракции вновь осаждали сульфатом аммония, растворяли осадок в боратном буфере, pH 7,5, содержащем 0,1 М КС1, и затем проводили диализ против того же буфера в течение двух дней при 4°. Если диализ был заменен гель-хроматографией на сефадексе G-100, то активные фракции вновь переосаждали сульфатом аммония и после диализа раствор
28
Таблица 7
Действие ингибитора AP-I на различные протеазы [Uyeda et al., 1976]
Протеаза
pH
Ингибирующий эффект
Щелочная протеаза из такадиастазы
9,5
+
Субтилизин BPN'
9,5
+
Субтилизин «Carlsberg»
9,5
+
Щелочная протеаза (Nagase)
9,5
+
Проназа As
9,5
+
Щелочная протеаза из Cephalosporium sp.
9,5
+
Трипсин
7,0
—
α-Химотрипсин
7,0
—
Пепсин
2,0
—
Примечание. (+) — угнетение более 90% активности; (—) — угнетение менее 10 % активности.
Таблица 8
Сравнение API-2b и API-2c с другими ингибиторами протеаз (Suzuki et al., 1978]
Характеристика
API-2b
API-2c
API
S-SI
Плазминострептин
Молекулярная масса (гельфильтрация)
36000
32000
27500
27000
26000
Подвижность (диск-электрофорез)
0,79
0,83
0,65
0,66
—
ИЭТ
E1 см1%
<4,0
<4,0
4,0
4,3
6,3
Аминокислоты
N-концевая
Ала-(Про)
Асп-(Сер)
Асп
Асп-(Ала)
Гли-(Лей)
C-концевая
Фен
Фен
Фен
Фен
Фен
Число остатков
117
111
115
113
109
Изолейцин
1
1
0
0
0
Цистин 1/2
4
4
4
4
4
Примечание. Аминокислоты в скобках показывают второй аминокислотный остаток от N-конца.
подвергали лиофилизации. Из лиофилизированного препарата после его растворения в 0,01 М боратном буфере, pH 7,5, и подкисления 0,02 н. HCl до pH 4,8 на холоду выделялись игольчатые кристаллы, если раствор сохранялся в течение ночи при комнатной температуре. Результаты испытаний на специфичность показали, что ингибитор (100 мкг в каждом опыте) угнетает микробные щелочные протеазы, но не действует на протеазы из животных тканей: трипсин, α-химотрипсин, пепсин (табл. 7).
Физико-химические свойства AP-Ι наряду со свойствами других близких ингибиторов представлены в табл. 8, а аминокислотный состав — в табл. 9.
Белок AP-Ι в боратном буфере, pH 7,5, в присутствии 0,1 М КС1 при 37° образовывал комплекс с субтилизином BPN' [Uyeda et al., 1976]. Как показали исследования фракций, полученных на колонке с сефадексом G-100, имеются два типа комплексов. Они различаются по молекулярным массам (83 000 и 56 000), а также по остаточной ингибирующей активности. Первый
29
Таблица 9
Аминокислотный состав ингибиторов некоторых протеиназ на актиномицетов
Аминокислота
Количество остатков аминокислоты, моль/моль
ИТ-AjI [Черменский и др., 1979]
S-SI [Ikenaka et al., 1974]
Плазминострептин [Kaki- numa et al., 1978]
API-2b API-2c AP-I [Suzuki et al., 1978]
S-MPI [Murao et al., 1978]
Триптофан
1
1
1
1
1
1
0
Лизин
2
2
3
1
1
2
5
Гистидин
3
2
2
2
2
2
1
Аргинин
5
4
5
4
4
4
8
Аспарагиновая кислота
8
9a
10в
9
9
9
6
Треонин
9
8
11
8
8
8
13
Серин
9
9
5
10
9
9
11
Глутаминовая кислота
9
6б
7г
8
8
6
5
Пролин
7
8
5
9
8
8
5
Глицин
13
11
11
11
10
12
17
Аланин
15
18
15
18
16
19
17
Полуцистин
4
4
4
4
4
4
4
Валин
12
13
13
13
13
12
10
Метионин
1
3
2
3
3
3
1
Изолейцин
3
0
0
1
1
0
1
Лейцин
7
9
7
10
10
9
8
Тирозин
3
3
3
3
3
3
4
Фенилаланин
3
3
5
2
2
3
3
Сумма
114
113
109
117
111
115
119
Молекулярная масса
11712
11483
11402
11872
11162
11831
11950
Примечание. а — три из них Асн; б — один из них Глн; в — пять из них Асн; г — три из них Гл.
полностью утратил ингибирующую активность, второй сохранил 50 %-ную активность. Анализ показал, что комплекс с молекулярной массой 83 000 преставляет собой димер ингибитора с двумя молями фермента, а с молекулярной массой 56 000 — димер ингибитора с одним молем фермента. По- видимому, формирование комплекса с молекулярной массой 83 000 проходит через этап образования комплекса с молекулярной массой 56 000. Иными словами, сначала один моль фермента соединяется с димером ингибитора, а затем к этому промежуточному комплексу присоединяется еще один моль фермента.
Близким по свойствам к ингибитору AP-Ι является ингибитор API-2b. Ингибитор содержится в фильтрате культуральной жидкости Str. griseoin- carnatus штамм No КТо-250 [Uyeda et al., 1978]. Культуру выращивали на среде, содержащей (в %) глюкозу — 2,0, пептон — 2,0, дрожжевой экстракт—0,1 NaCl —0,1, К2НРО4 —0,1, MgSO4-7Н2О — 0,05, pH 7,0, при температуре 28°. Помимо ингибитора API-2b, в культуральной жидкости в течение четырех суток было отмечено присутствие еще двух, получивших названия АР1-2а и API-2c. Первым к концу первых суток обнаруживается API-2b, исчезающий к 96 ч, затем к 43 ч появляются АР1-2а и API-2c. Поэтому выделение и очистку API-2b проводят из суточной культуры, когда нет сопутствующих ингибиторов, согласно схеме 2.
30
Полученный белок был стабилен в интервале pH 5—11 при 37° в течение 20 ч. После прогрева при 100° API-2b сохранял свою активность в интервале pH 6—8. По специфичности относительно различных протеиназ API-2b
практически аналогичен AP-Ι, он проявляет сильный ингибирующий эффект на микробные щелочные протеиназы, но не угнетает сериновые протеазы из животных тканей.
Ингибитор API-2c был выделен из того же организма, что и API-2b, однако из 3-суточной культуры [Suzuki et al., 1978]. Сводная схема очистки с количественными показателями по стадиям дана в табл. 10. Наличие гомогенных белков трех близких по свойствам ингибиторов позволило сопоставить их некоторые характеристики (см. табл. 8 и 9). Данные аминокислотного анализа показали наличие остатков Иле в молекулах API-2b
и API-2c. У названных ингибиторов содержится по одному остатку Лиз в отличие от AP-Ι (два остатка) и по восемь остатков Глу (у АР-1 — шесть). Все они имеют фенилаланин на C-конце молекулы. N-концевые аминокислоты одинаковы у AP-Ι и API-2c, ими является аспарагиновая кислота. Исходя из данных величины молекулярной массы, все пять ингибиторов, приведенные в табл. 8, существуют в виде димеров.
Для ингибиторов API-2b и API-2c установлена частичная первичная структура [Suzuki et al., 1981]. Ингибитор API-2c лишен с N-конца шести аминокислотных остатков с последовательностью Ала—Про—Сер—Лей—
Частичная аминокислотная последовательность ингибиторов щелочной протеазы API-2b и API-2c [Suzuki et al., 1981]
x — реактивный аминокислотный остаток
31
Таблица 10
Сводная схема очистки ингибитора API-2c из фильтрата культуральной жидкости Str. griseoincarnatus штамм No КТо-250 [Suzuki et al., 1978]
Этап очистки
Общая активность, ед.
Удельная активность, ед./A280
Выход, %
Фильтрат культуральной жидкости
316000
5,6
100
Диализат
226000
301,7
71,8
Неочищенный раствор (после хроматографии на колонке с
ДЭАЭ-целлюлозой)
173000
496,5
54,7
Активная фракция (после фильтрации на сефадексе G-100)
138000
691,3
43,8
Очищенный белок API-2c
110000
776,4
35,0
Гли—Ала. В остальной части молекулы API-2b и API-2c полностью идентичны. Молекула ингибитора API-2c образуется из молекулы ингибитора API-2b благодаря активности внеклеточной щелочной протеиназы, содержащейся в культуральной жидкости продуцента ингибиторов [Uyeda et al., 1979].
Для идентификации реактивных участков в молекулах ингибиторов API-2b и API-2c оба вещества были подвергнуты химической модификации. Для модификации остатков Лиз применяли 2, 4, 6-тринитробензосульфонат; Арг — 1, 2-циклогександион, Мет — монойодацетат. Модификация остатков Лиз и Арг не влияла на ингибирующую активность API-2b и API-2c. Карбоксилирование остатков Мет вызывало понижение ингибирующей активности, в чем они сходны с ингибиторами AP-Ι и S-SI. Ингибирующая активность понижалась, в частности, по отношению к субтилизину BPN'. При образовании комплекса ингибитора API-2c с субтилизином BPN' происходит гидролиз ингибитора до низкомолекулярных продуктов, однако последние удерживаются вместе дисульфидной связью. Разрыв происходит по связи Мет—Иле, являющейся таким образом реактивным центром [Uyeda et al., 1980]. Ингибитор щелочных протеаз S-SI имеет Мет—Вал в качестве реактивного центра. После получения информации о первичной структуре ингибиторов API-2b и API-2c было показано, что аминокислотная последовательность вокруг реактивного центра подобна таковой ингибитора S-SI. Как сказано выше, на месте Вал в S-SI в молекулах ингибиторов API-2b и API-2c расположен Иле, что является единственным исключением.
С помощью гель-фильтрации на сефадексе G-100 выделен фермент- ингибирующий комплекс. Молекулярная масса гомогенного комплекса составляет 86 000. Как предполагают, комплекс состоит из двух молекул субтилизина и двух идентичных субъединиц API-2c. Комплекс, по-видимому, активен лишь в димерном состоянии. При диализе комплекса против 0,05 н. HCl при 4° происходит постепенное освобождение ингибитора. Электрофоретическая подвижность нативного ингибитора и ингибитора, освобождающегося из комплекса, значительно отличается. Полагают, что изменение электрофоретической подвижности ингибитора после взаимодействия с субтилизином обусловлено разрывом пептидной связи в области взаимодействия API-2c с ферментом [Suzuki et al., 1980].
32
ПЛАЗМИНОСТРЕПТИН
Плазминострептин выделен из фильтрата культуральной жидкости Str. antifibrinoliticus IFO 13298 при выращивании актиномицета на среде, содержащей (в %) глюкозу—1,0, пептон—1,0, мясной экстракт — 0,7, NaCl — 0,3, К2НРО4 — 0,2, pH 7,0, при 28° в течение трех суток [Kakinuma et al., 1978]. В результате приведенных в табл. 11 операций был получен гомогенный белок с ИЭТ 6,3. По данным электрофореза в ПААГ с ДДС-Na, ингибитор присутствует в природных условиях в виде димера. С субстратами ингибирования, в частности с плазмином или трипсином, образует комплекс в стехиометрическом отношении 1:1. Ковалентные связи при этом не образуются. По-видимому, взаимодействие плазминострептина и протеиназ происходит за счет связей электростатической или гидрофобной природы. Доказательством тому служат две полосы (ингибитора и фермента) при электрофорезе в ПААГ в присутствии ДДС-Na. Ингибитор оказался достаточно устойчивым при нагревании. Он нагревался в различных буферных системах при pH 3—11 в течение 10 мин при 100°. После охлаждения определялась остаточная активность. В интервале pH от 3 до 9 потеря активности практически не отмечалась. Однако при pH 11 она была потеряна полностью.
Ингибитор способен угнетать активность плазмина, трипсина и микробных щелочных протеиназ, таких, как субтилизин. Причем сильно угнетает как фибринолитическую, так и этеролитическую активность трипсина. Не действует на некоторые сериновые протеиназы (тромбин, калликреин, химотрипсин и эластазу), металлопротеиназы (карбоксипептидазы А и В, лейцинаминопептидазу, термолизин) и тиоловые протеиназы (бромелаин, папаин, фицин).
Плазминострептин является одним из немногих белковых ингибиторов микробного происхождения, для которого установлена первичная структура [Sugino et al., 1978а] и детально исследована молекула с точки зрения функциональной значимости ее структуры в акте взаимодействия с субстратом [Sugino et al., 1978].
Молекула плазминострептина претерпевает определенные изменения, когда подвергается химической модификации специфическими реагентами на определенные аминокислотные остатки или ферментативной модификации, например трипсином. Химическая модификация аминогрупп 2, 4, 6-три- нитробензолсульфонатом или о-метилизомочевиной полностью снимает его ингибирующую активность по отношению к трипсину и плазмину. Однако это дает только предварительный результат при ответе на вопрос о реактивном центре молекулы ингибитора. В данном случае подобный эффект может свидетельствовать о присутствии по крайней мере одного остатка Лиз в этом участке. На этом основании плазминострептин отнесен к типу лизиновых ингибиторов. Инкубация трипсина с ингибитором при pH 3,5 ведет к модификации плазминострептина. Восстановление и S-карбоксиметилирование модифицированного трипсином плазминострептина привели к образованию двух фрагментов. Анализ концевых групп полученных фрагментов показал, что трипсин расщепляет только одну связь в молекуле ингибитора Лиз-60— Глу-70. Аналогичные результаты были получены при модификации суб- тилизином. Таким образом, реактивным центром в молекуле плазминострептина при ингибировании трипсина и субтилизина является Лиз-69— Глу-70. Производные плазминострептина, лишенные шести аминокислотных
33
Таблица 11
Этапы очистки плазминострептина из фильтрата культуральной жидкости Str. antifibrinolyticus [Kakinuma et al., 1978]
Этап очистки
Объем, мл
Общий белок, мг
Общая активность, ед. (×103)
Степень очистки
Выход, %
Фильтрат культуральной жидкости
70000
313000
587,5
1
100
Осаждение сульфатом аммония
2400
8300
500,0
32,1
85
Элюат после первой колонки с ДЭАЭ-целлюлозой
1200
5600
425,0
40,5
72
Элюат после второй колонки с ДЭАЭ-целлюлозой
160
3000
240,0
42,7
41
Кристаллический препарат
1300
163,8
44,6
28
Таблица 12
Сравнение плазминострептина, S-SI и других ингибиторов протеиназ по их аминокислотной последовательности вокруг активного участка
Источник происхождения
Ингибитор или источник его выделения
Аминокислотная последовательность вокруг реактивного участка
Р4
P3P2
P1
P1'
P2'
P3'
P4'
Микроорганизмы
Плазминострептин
-Ала
-Цис
-Тре
-Лиз
-Глу
-Фен
-Асп
-Про
S-SI
-Мет
-Цис
-Про
-Мет
-Вал
-Тир
-Асп
-Про
Растения
Соевые бобы
-Ала
-Цис
-Тре
-Лиз
-Сер
-Асп
-Про
-Про
Лимская фасоль
-Лей
-Сер
-Тре
-Лиз
-Сер
-Иле
-Про
-Про
Нут бараний
-Вал
-Цис
-Тре
-Лиз
-Сер
-Иле
-Про
-Про
Животные
Яйца перепелки
-Лей
-Цис
-Тре
-Лиз
-Асп
-Фен
-Сер
-Фен
Поджелудочная железа быка
-Гли
-Цис
Про
-Арг
-Иле
-Тир
-Асп
-Про
свиньи
-Гли
-Цис
-Про
-Лиз
-Иле
-Тир
-Асп
-Про
овцы
-Гли
-Цис
-Про
-Арг
-Иле
-Тир
-Асп
-Про
человека
-Ала
-Цис
-Про
-Арг
-Лей
-Гис
-Глн
-Про
остатков в C-концевой области, теряли свою активность, очевидно, вследствие невозможности сохранить необходимую для проявления активности третичную структуру. Плазминострептин, подобно соевому ингибитору Ку- нитца трипсина, является одноглавым ингибитором.
Молекула белка состоит из 109 остатков, имеет молекулярную массу 11 395, содержит две дисульфидные связи. Почти все остатки Ала, Лей и Тре расположены в N-концевой половине молекулы, в то время как большинство ароматических аминокислот — в C-концевой.
34
Полная первичная структура плазминострептина очень сходна с таковой у ингибитора S-SI (см. с. 26). Они имеют почти 70% гомологичных последовательностей, несмотря на различия в спектрах ингибирования. В табл. 12 приведены данные о ближайшем окружении реактивного центра ингибиторов микробного происхождения плазминострептина и S-SI и ингибиторов из животных и растительных тканей. Многие протеиназные ингибиторы имеют сходную с плазминострептином аминокислотную последовательность вокруг реактивного центра (Р}—Р'{). Почти все ингибиторы имеют Цис 1/2 в Р3 и Про в Р4. Треонин или пролин, ароматическая аминокислота и аспарагиновая кислота или аспарагин встречаются довольно часто в Р2, Р2 и Р3 соответственно. Гомологичные аминокислотные последовательности вокруг реактивных центров ингибиторов из микроорганизмов, растений и животных заставляют нас предполагать, что структуры вокруг реактивного центра весьма существенны для проявления ингибирующей активности и что, возможно, они сохранились в ходе эволюции.
В отличие от плазминострептина ингибитор S-SI содержит 113 аминокислотных остатков, а в его реактивный участок входят Мет-73—Вал-74. Предполагается, что именно структура реактивных центров этих ингибиторов определяет их различную субстратную специфичность.
ИНГИБИТОР ПРОТЕИНАЗ ИТ-AjI ИЗ ACTINOMYCES JANTHINUS
В ходе работы по поиску продуцентов ингибиторов трипсина А. Μ. Безбородовым с соавт. [1977] было обследовано большое число культур актиномицетов, относящихся к глобиспориновой, синей, фиолетовой, желтой, белой, бурой, зеленой таксономическим группам. Среди культур глобиспориновой, желтой, белой и бурой групп не было найдено ни одной с выраженной ингибирующей активностью. Все высокоактивные в отношении трипсина культуры принадлежали к фиолетовой группе актиномицетов. Высокоактивных продуцентов ингибиторов химотрипсина найдено не было.
Антитрипсиновая активность проявляется в культуральной жидкости уже на первые сутки роста культуры (рис. 6). Наиболее интенсивно активность возрастает между первыми и вторыми сутками, когда культура переходит из логарифмической в стационарную фазу роста. Максимальная ингибирующая активность приходится на третьи сутки роста актиномицета. В период автолиза культуры ингибирующая активность сохраняется примерно на одном уровне.
Физиологические опыты по изучению влияния компонентов среды на синтез ингибиторов протеаз были предприняты относительно Act. janthi- nus 118 [Безбородов и др., 1977], Str. albogriseolus S-3253 [Murao et al., 1972].
В опытах по изучению влияния некоторых источников азота на ингибиторную активность фильтрата культуральной жидкости Act. janthinus 118 за основу была принята среда, содержащая (в г/л) пептон — 5,0, глюкозу — 10,0, NaCl — 5,0, перевар Хоттингера — 30 мл. Пептон и перевар Хоттингера в эквивалентных по азоту количествах заменялись другими источниками. Из испытанных веществ только кислотный или панкреатический гидролизат казеина наряду с переваром Хоттингера давал величину активности, одинаковую с контролем. При использовании соевой или гороховой муки ингибитор трипсина вообще не был идентифицирован в культуральной жидкости.
35
Рис. 6. Биосинтез ингибитора трипсина в культуральной жидкости Act. janthinus 118 [Безбородов и др., 1977]
Состав среды: перевар Хоттингера — 30 мл; пептон — 5 г/л; глюкоза — 10,0 г/л; NaCl — 5,0 г/л, pH 6,8—7,2; 1 — биомасса; 2 — ингибирование активности трипсина; 3 — pH
Подобные результаты получены Мурао с соавт. [Murao et al., 1972], показавшими, что на среде с казеином содержание ингибитора микробных щелочных протеаз, образуемого Str. albogriseolus S-3235, во много раз меньше, чем на средах с полипептоном, смесью аминокислот и мясным экстрактом. Ингибитор трипсина был выделен из фильтрата трехсуточной культуральной жидкости Act. janthinus 118 [Андреева и др., 1978]. Продуцент выращивали на среде указанного выше состава. Очистка препарата состояла из нескольких стадий: осаждение сульфатом аммония, хроматография на ДЭАЭ- целлюлозе и QAE-сефадексе, кристаллизация. Результаты, полученные при хроматографии на ДЭАЭ-целлюлозе, показали наличие в культуральной жидкости Act. janthinus 118 по крайней мере двух ингибиторов, обозначенных ИТ-AjI и HT-Aj2. Суммарная активность первой фракции была существенно выше второй. Поэтому вторая фракция HT-Aj2 фактически в дальнейшем не использовалась, за исключением определения ее молекулярной массы, которая составляет около 60 000. Схема очистки ингибиторов трипсина из культуральной жидкости Act. janthinus 118 приведена в табл. 13.
Ингибитор ИТ-AjI получен в виде белковых кристаллов методом равновесного диализа в микродиффузионных ячейках [Dattagupta et al., 1975] или в диализных мешочках для равновесного диализа против 0,02 М ацетатного буфера, pH 5,6—5,8, при 4°. В течение кристаллизации буфер меняли 3—4 раза. Через 5—6 сут появились мелкие игольчатые кристаллы ингибитора, часто соединенные в пучки. Кристаллы отделяли от маточного раствора фильтрованием через стеклянный фильтр № 4, промывали на фильтре 0,02 М ацетатным буфером, pH 5,6, и растворяли в небольшом объеме 0,5 М трис- НС1-буфера, pH 8,5, содержащем 0,5 М NaCl. Полученный раствор HT-AjI с оптической плотностью 2,5—5,0 ед/мл использовали для перекристаллизации.
Большинство известных в настоящее время белковых ингибиторов протеолитических ферментов микробного происхождения довольно устойчивы к действию таких денатурирующих агентов, как pH и температура.
Ингибитор трипсина ИТ-AjI из Act. janthinus 118 при выдерживании в буферных растворах при pH 2,0— 11,9 в течение 24 ч практически полностью сохраняет исходную активность в интервале pH 6,0—11,0 при 4 и 20ό. При 60°
36
Таблица 13
Очистка ингибиторов трипсина из культуральной жидкости Act. janthinus 118 [Андреева и др., 1978]
Этап очистки
Объем, мл
Количество оптических единиц
Количество ингибиторных единиц
Удельная активность ед./A280
Степень очистки
Выход, %
Фильтрат культуральной жидкости
4000
36 000
55400
1,54
1
100
Осаждение сульфатом аммония и диализ
105
1 653
43200
27
17,5
78,5
Хроматография на ДЭАЭ-целлюлозе
ингибитор трипсина I
270
124,2
11 840
95,3
62
21,4
ингибитор трипсина II
430
410
8460
20,6
13,4
15,2
Дальнейшая очистка ингибитора трипсина I хроматография на QAE-сефа- дексе
160
50,4
6 700
133
86,5
12,1
двухкратная кристаллизация
10
36,6
5,860
160
104
10,6
и pH 5,8; 7,4 и 9,4 ингибитор полностью сохраняет свою активность в течение часа. При 100° стабильность существенно зависит от pH. Ингибитор более стабилен в слабокислой области pH, чем в нейтральной или щелочной [Андреева, Черменский, 1979].
Очевидно, что термостабильность существенно зависит от природы буфера, в котором находится белок в ходе опыта. Кроме того, говоря о термостабильности, следует помнить, что многие денатурированные нагреванием белки могут частично восстанавливать свою конформацию в ранее существующую активную форму при охлаждении растворов. Возможно, что в той или иной мере такая реактивация имела место и в ходе изложенных выше экспериментов.
Данные о специфичности ИТ-AjI приводятся в табл. 14. Они свидетельствуют о том, что ИТ-AjI подавляет активность трипсина, фибринолизина и ряд протеиназ микробного происхождения: проназу, террилитин и суб- тилизин. Практически не угнетает активность химотрипсина, папаина и тромбина. По специфичности ИТ-AjI наиболее близок к плазминострептину из Str. antifibrinolyticus. Близкий к ИТ-AjI по ряду физико-химических свойств ингибитор S-SI из фильтрата культуральной жидкости Str. albogri- seolus также подавляет активность субтилизина, но в отличие от ИТ-AjI инактивирует химотрипсин и практически не влияет на активность трипсина.
Связывание ИТ-AjI с трипсином и субтилизином происходит при молярном соотношении 1:1. Такое же соотношение было установлено для плазминострептина при ингибировании им фибринолизина и трипсина. Характерной особенностью молекулы ингибитора является преобладание в éro составе кислых аминокислот над основными, причем на 17 остатков дикарбоновых аминокислот приходятся только две амидные группы. Эти данные
37
Таблица 14
Специфичность ингибитора ИТ-AjI из Act. janthinus 118 [Андреева, Черменский, 1979]
Фермент, 100 мкг
Субстрат
Количество ингибитора, вызывающее 50%-ное снижение активности фермента, мкг
Трипсин
Казеин
29,5
ТАМЭ
22,0
Фибринолизин
Казеин
1,8
Химотрипсин
»
>500
Папаин
»
>500
Тромбин
Фибриноген
Не ингибирует
Проназа
Казеин
115
Террилитин
»
2
Субтилизин
»
18
ААЛПНА
45
Примечание. ТАМЭ — метиловый эфир N-n-толуол—сульфонил-L-аргинина; ААЛПНА — н-нитроанилидкарбобензокси-L-аланил-L-аланил-L-лейцин
Таблица 15
Влияние модификаций на ингибирующую активность ИТ-AjI [Черменский и др., 1979]
Реагент
Модифицированные остатки аминокислот
Модификация, %
Остаточная ингибирующая активность, %
антитрипсиновая
антисубтилизиновая
2,4,6-Тринитробензолсульфонат
Лиз
100
0
100
Малеиновый ангидрид
Лиз
—
6
100
1,2-Циклогександион
Арг
60
80
100
Фенилглиоксаль
Арг
60
70
100
Тетранитрометан
Тир
100
50
50
Йодацетат
Мет
100
100
100
коррелируют с положением ИЭТ белка в слабокислой области pH. Подтверждением этого является понижение растворимости ИТ-AjI и его способность к кристаллизации в интервале pH 6,0—5,0 [Андреева и др., 1978].
Сравнение аминокислотного состава ингибиторов ИТ-AjI, S-SI, плазминострептина, AP-Ι, API-2b и API-2c (см. табл. 9) показало, что для них характерно наличие двух дисульфидных связей и одинаковое количество остатков Трп и Тир. Близко или также одинаково содержание остатков Лиз, Гис и Арг. Все сравниваемые белки имеют преобладающее количество кислых аминокислот над основными. Отличительной особенностью ИТ-AjI является наличие в его составе трех остатков Иле; в молекулах S-SI,плазминострептина и AP-Ι изолейцин отсутствует. Обращает на себя внимание также содержание в составе ИТ-AjI только одного остатка Мет, другие ингибиторы содержат два-три остатка этой аминокислоты.
Химическая модификация некоторых аминокислотных остатков (табл. 15) показала вклад соответствующих аминокислот в механизм ингибирования. На основании анализа хода реакции с 2, 4, 6-тринитробензолсульфонатом Д. Н. Черменский с соавт. [1979] предполагают, что ИТ-AjI имеет два контактных участка: антитрипсиновый активный центр, содержащий остаток
38
Рис. 7. Титрование трипсина (1, 3) и субтилизина (2, 4) ингибитором (1, 2) и комплексами ИТ-AjI с субтилизином (4) и ИТ-AjI с трипсином (3) [Черменский и др., 1979]
Лиз, и антисубтилизиновый центр, содержащий какую-то другую аминокислоту. Модификация остатков Арг незначительно влияет на антитрипсино- вую активность ИТ-AjI и совершенно не затрагивает его антисубтилизино- вую активность. Последующие детальные эксперименты показали, что Арг- не входит в состав активных центров ИТ-AjI. Не входит в субтилизиновый контактный участок и Мет. Субтилизин предпочтительно гидролизует связи, образованные карбоксильными группами Лей, Фен, Тир [Мосолов, 1971]. Исходя из субстратной специфичности фермента, Д. Н. Черменский и соавт. [1979] предположили, что одна из названных аминокислот находится в активных центрах ингибиторов субтилизина. Обработка ИТ-AjI тетранитрометаном привела к избирательному нитрованию всех трех остатков Тир в белке и вызвала 50 %-ное снижение антитрипсиновой и антисуб- тилизиновой активности (см. табл. 15). Не исключено, что остаток Тир располагается в непосредственной близости от контактного участка в молекуле ингибитора, как это было показано для S-SI [Aoshima, 1976]. Однако авторы не делают каких-либо окончательных выводов относительно функциональной роли остатков Тир в активном центре ИТ-AjI. Они указывают также на то, что введение нитрогрупп в молекулу белка может приводить к перестройке системы водородных связей или электростатических взаимодействий в участках структуры, сопряженных с активным центром ингибитора.
На рис. 7, /, 2 приведены результаты титрования протеаз (трипсина и субтилизина) ингибитором. Из представленных данных видно, что ингибитор не имеет особого предпочтения к трипсину или субтилизину. Это подтверждается и близостью величин Kd комплексов обеих протеаз с ИТ-AjI (χ. = 1θ-8—10“'° Μ).
Фермент-ингибиторный комплекс связывается с другой протеазой хуже, чем свободный ингибитор (рис. 7, Зу 4). Эти данные в совокупности с результатами химической модификации говорят о том, что ингибитор ИТ-AjI имеет, вероятно, два разных контактных участка: один — ответственный за взаимодействие с трипсином, второй — с субтилизином.
Д'. Н. Черменский с соавт. [1979] предлагают две не исключающие друг друга схемы контакта ингибитора с протеиназами. В момент контакта с одной из протеиназ второй активный центр блокируется, если оба центра сопряжены и частично перекрываются. Некоторая потеря антитрипсиновой и антисубтилизиновой активности при модификации остатков Тир может 39
говорить в пользу стерической близости обоих реактивных центров. Возможно и другое предположение. Молекула ИТ-AjI имеет всего две дисульфидные связи и может обладать «рыхлой» структурой. При контакте с протеином происходит конформационная перестройка молекулы ингибитора. Эта перестройка может маскировать второй активный центр, затрудняя процесс комплексообразования с другой протеиназой.
ИНГИБИТОР МЕТАЛЛОПРОТЕИНАЗ S-MPI
Ингибитор металлопротеиназ S-MPI выделен из фильтрата культуральной жидкости Str. nigrescens ТК-23 после выращивания продуцента в течение 35—40 ч. Среда для культивирования состояла (в %) из полипептона — 3,0, глюкозы — 1,0, мясного экстракта — 1,0, NaCl — 0,1, К2НРО4 — 0,1, MgSO4 · пН2О — 0,0001, pH 7,0 [Murao et al., 1978]. Исходным материалом для выделения и очистки служил фильтрат культуральной жидкости, доведенный уксусной кислотой до pH 4,0. Очистка включала процедуру концентрирования, диализ против 0,02 М ацетатного буфера, pH 4,0, КМ-сефадекс С-50 (pH 4,0), КМ-сефадекс С-50 (pH 8,0) и сефадекс G-50 (pH 8,0). Выход при очистке составил 30 %. Из 1 л культуральной жидкости получали 10—13 мг гомогенного по данным электрофореза в ПААГ белка. В дальнейшем схема очистки была несколько упрощена [Oda et al., 1979]. Начальные этапы очистки заменены сорбцией на амберлите IRC-50 в статических условиях. Изучение белка показало, что он имеет ИЭТ при pH 10,3. Термостабильность определяли путем нагревания при 100° в течение 5 мин в различных буферных системах с pH 1,5—12,0. Остаточную активность определяли после охлаждения. В интервале pH между 2,0 и 7,0 потеря активности была менее 20 %. При pH 10,0 ингибирующая активность полностью не идентифицировалась. Аминокислотный состав приведен в табл. 9. Общее число остатков 119, величина молекулярной массы, рассчитанная по аминокислотным остаткам, равна 11950. Характерно отсутствие Трп и высокое содержание гидрофобных аминокислот в составе молекулы. Имеются две дисульфидные связи на молекулу. Вещество не является гликопротеидом. Ингибитор проявляет специфическую активность относительно металлопротеиназ. Наиболее сильный комплекс с низкой величиной Kd ингибитор образует с термолизином, протеиназой из Ps. aeruginosa IFO 3455 и Bac. sub- tilis YT 25. С металлопротеиназами из Bac. amyloliquefaciens и Bac. subtilis var. amylosacchariticus ингибитор образует хорошо диссоциирующие комплексы, которые не обладают сильным ингибирующим эффектом. Не угнетает сериновые протеиназы (трипсин, α-химотрипсин, панкреатическую эластазу, субтилизин BPN'), тиоловые протеиназы (папаин, фицин), кислые протеиназы (пепсин, протеиназу из Rhodotorula glutinus). Поданным Ода и соавт. [Oda et al., 1979], ингибитор взаимодействует с ферментами при молярном отношении 1:1,о чем свидетельствуют данные молекулярной массы комплекса и титрования ингибитора с ферментом.
40
ИНГИБИТОРЫ ПРОТЕИНАЗ ИЗ ДРОЖЖЕЙ
Ингибиторы протеиназ из дрожжей в течение почти 10 лет изучаются в Биохимическом институте Фрайбургского университета под руководством проф. X. Хольцера [Holzer, 1975]. Дрожжи, возможно, являются одним из наиболее интересных объектов для демонстрации доказательства контроля внутриклеточного протеолиза ингибиторами протеиназ. Были выделены три группы ингибиторов соответственно имеющимся в клетках протеиназам А и В и карбоксипептидазе Y.
Ингибиторы протеиназы А (КФ 3.4.23.8) были выделены из пекарских дрожжей путем осаждения трихлоруксусной кислотой, фракционированием этанолом, хроматографией на SP-сефадексе С-25, QAE-сефадексе А-25 и препаративным диск-электрофорезом. Как показано в табл. 16, ингибиторы протеиназы А проявляются в трех различных «пиках» элюатов SP-сефадекса. Фракции, соответствующие пикам 2 и 3, были в дальнейшем очищены до гомогенного состояния по данным диск-электрофореза в присутствии ДДС-Na. Полученные препараты, названные и I3 соответственно, проявляли характерные свойства полипептидов и не содержали ни углеводов, ни нуклеиновых кислот. По данным электрофореза в ПААГ с ДДС-Na молекулярная масса обоих ингибиторов была одинакова и составляла 6100. Однако ингибиторы отличались по их ИЭТ: 5,7 для и 6,3 для I3. При гель-фильтрации на сефадексе молекулярная масса I3 составила 23 000. Молекулярная масса комплекса I3 с протеиназой А оказалась равной 48 000, при этом протеиназа А имела молекулярную массу 42 000. Исходя из приведенных здесь величин молекулярных масс, следует, что ингибитор I3 состоит из четырех субъединиц, т. е. существует в виде тетрамера. В присутствии протеиназы А тетрамер диссоциирует, и одна субъединица ингибитора взаимодействует с одной молекулой протеиназы А. Аналогичные данные были получены для другого ингибитора [Saheki et al., 1974]. Для ингибитора I3 определена первичная структура [Biedermann et al., 1980]: Ац—Мет—Асн—Тре—Асп—Глн—Глн—Лиз—Вал—Сер—Глу—Иле—Фен— Глн—Сер—Сер—Лиз—Глу—Лиз—Лей—Глн—Гли—Асп—Ала—Лиз—Вал— Вал—Сер—Асп—Ала—Фен—Лиз—Лиз—Мет—Ала—Сер—Глн—Асп—Лиз— Асп—Гли—Лиз—Тре—Асп—Ала—Асп—Глу—Сер—Глу—Лиз—Гис—Асн— Тир—Глн—Глу—Глн—Тир—Асн—Лиз—Лей—Лиз—Гли—Ала—Гли—Гис— Лиз—Лиз—Глу.
Ингибиторы имеют ярко выраженную специфичность по. отношению к протеиназе А и не угнетают протеиназу В, карбоксипептидазу Y и пепсин. Инактивирует ингибиторы и I3 только протеиназа В, но не А и не карбоксипептидаза Y. Области pH, в которых работают ингибиторы, подтверждают точку зрения, что они могут иметь физиологическое значение. Это же подтверждает их высокая специфичность. Например, не происходит угнетения активности пепсина, хотя кислая дрожжевая протеиназа А инактивируется. Ингибиторы протеиназы В (КФ 3.4.22.9) первоначально идентифицированы в экстрактах из пекарских дрожжей путем титрования с ферментом [Ferguson et al., 1973]. Два из них (1^ и I®) были очищены почти в 300 раз по схеме, близкой к приведенной выше для ингибиторов протеиназы А [Betz et al., 1974]. Количественное отношение Ιθ и Ιθ в клетках равняется 1 : 3. Углеводы и нуклеиновые кислоты в очищенных препаратах ингибиторов не обнаружены. Оба ингибитора являются термостабильными полипептидами, имеющими ИЭТ 8,0 для I® и 7,0 для I®. Помимо пекарских
41
Таблица 16
Очистка протеиназы A из пекарских дрожжей [Holzer, 1975]
Этап очистки
Общее количество, ед.
Удельная активность, ед.
Степень очистки
Экстракт, полученный при нагревании клеток
241000
18,2
1
Осадок после трихлоруксусной кислоты
145000
11,0
0,6
Фракционирование этанолом
256000
50,6
2,8
SP-Сефадекс G-25 первый «пик» (I1A)
4270
16,4
0,9
второй «пик» (I2A)
11100
107
5,9
третий «пик» (I3A)
59000
209
12
Дальнейшая очистка I2A
QAE-сефадекс A-25
10100
1140
63
Препаративный диск-электрофорез
1860
930
52
Дальнейшая очистка I3A
QAE-сефадекс A-25
29800
1500
83
Препаративный диск-электрофорез
3770
1780
98
дрожжей, ингибиторы протеиназы В были идентифицированы в культурах Sacch. carlsbergensis NCYC 74 и Sacch. cerevisiae X 2180 [Betz, 19751. В первой из названных культур был обнаружен только if, во второй — if. Синтез ингибиторов, по-видимому, подвержен катаболитной репрессии. Клетки, растущие в среде, содержащей глюкозу, имели высокие уровни содержания ингибиторов только в стационарной фазе роста. В то время, как в среде, содержащей ацетат, большая активность проявлялась и в экспоненциальной фазе роста [Betz, 19751.
Третий ингибитор протеиназы В (if) был выделен из культуры Sacch. carlsbergensis [Matern et al., 1979]. Он доведен до гомогенного состояния по данным диск-электрофореза в присутствии ДДС-Na. При очистке if были использованы осаждение полиэтиленимином, фракционирование ацетоном, хроматография на ДЭАЭ-сефадексе А-25, хроматография на гидро- ксилапатите, гель-хроматография на сефадексе G-75 и хроматография на ω-аминогексил-сефарозе. Белок был очищен в 460 раз с незначительным выходом (2 %). Ингибитор отличается по физическим, химическим и антигенным свойствам от If и If. ИЭТ равна 4,6. Комплекс протеиназы В с if стабилен при 25° в области pH 5—10. if не проявлял иммунологических перекрестных реакций с if и if. Протеиназа А, карбоксипептидаза У из дрожжей, трипсин из поджелудочной железы быка инактивировали If.
Молярное отношение if к if в цитоплазме равно 5:1. Для if и if из пекарских дрожжей изучена первичная структура [Maier et al., 1979, 1979а, b]. Оба ингибитора состоят из 74 аминокислотных остатков. В их молекулах отсутствуют остатки Цис, а также Мет, Арг и Трп. Это первые ингибиторы с установленной первичной структурой, в которых отсутствуют дисульфидные связи. Отсутствие Трп является общим для большинства ингибиторов протеиназ, изолированных от других источников. Последовательность аминокислот в If с N-конца установлена до 42 остатка. Сравнение аминокислотной последовательности If и If позволило обнаружить следующие различия: Лей-32 и Глу-34 в молекуле If изменены на Вал-32 и Лиз-34
42
Частичная аминокислотная последовательность ингибитора I1B в сравнении с полной аминокислотной последовательностью ингибитора I2B [Maier et al., 1979a]
в молекуле I1B. Деградация I1B и I2B с помощью карбоксипептидаз А и Υ обнаружила идентичность C-концевых областей молекул обоих ингибиторов. Аминокислотный состав двух молекул лишь незначительно отличается по содержанию Глу, Лиз, Вал и Лей по 0,7—0,9 остатка в расчете на молекулу (табл. 17). Замена Лиз на Глу в положении 34, очевидно, ведет к различиям в ИЭТ белков. Это согласуется с экспериментами, проведенными по модификации единичного остатка Тир-41 в I2B путем нитрования, в результате чего ИЭТ понижается с 7,1 до 6,6 [Bunning et al., 1977]. Отмеченные выше замещения в положениях 32 и 34 вызваны изменениями в генетическом материале, кодирующем данные белки. Замещение Вал на Лей связано с изменением в первом нуклеотиде соответствующего кодона Г на Ц или Г на У. Второе замещение в положении 34 связано с заменой А на Г в первом нуклеотиде кодона. Показано, что I1B и I2B — это изоингибиторы, так как кодируются разными генами.
Оба ингибитора являются единичными полипептидными цепями. Они содержат большое число полярных остатков, индекс полярности составляет 58 %. Присутствие большого числа заряженных аминокислотных остатков создает возможность сильного ионного взаимодействия с протеиназой В, чем, вероятно, объясняется прочная связь с ферментом. Нативные ингибиторы протеиназы В крайне восприимчивы к протеолитической атаке. Эта уязвимость может быть объяснена особенностями третичной структуры, у которой отсутствует стабилизация дисульфидными связями [Maier et al., 1979а, b]. В противоположность данным ингибиторам ингибиторы трипсина из других организмов очень устойчивы к воздействию протеаз именно благодаря наличию дисульфидных связей [Мосолов, 1982]. 1^ и Ιθ полностью инактивируются при действии карбоксипептидазы А из поджелудочной железы быка. Этот факт, видимо, может свидетельствовать, что C-концевые
43
Таблица 17
Аминокислотный состав ингибиторов протеиназ из дрожжей [Maier et al., 1979b; Matern et al., 1979]
Аминокислота
I1B
I2B
I3B
(остатков на молекулу)
Аспарагин/аспарагиновая кислота
11,9
11,8
15
Треонин
5,0
5,1
5
Серин
2,2
2,0
13
Глутамин/глутаминовая кислота
6,6
7,3
12
Пролин
2,2
2,1
3
Глицин
3,3
3,1
7
Аланин
2,1
2,1
6
Цистеин
<0,2
<0,2
1
Валин
8,8
7,9
7
Метионин
<0,2
<0,2
1
Изолейцин
5,6
5,4
7
Лейцин
5,0
5,7
9
Тирозин
1,0
0,9
5
Фенилаланин
3,0
3,0
2
Лизин
11,4
10,7
8
Гистидин
6,0
6,0
2
Аргинин
<0,2
<0,2
2
Триптофан
<0,2
<0,2
0
8466
8480
10515
группы необходимы для механизма угнетения. Детальное изучение инактивации [В карбоксипептидазой А показало, что связь между Тре-73 и Гис-72 в C-концевом участке ответственна за потерю активности. Кроме C-концевой области ответственность за ингибирующую активность распространяется и на центральную часть молекулы. В опытах с модификацией Тир-41 Ιθ в результате нитрования образуется 3-нитротирозин-41-12· Результатом модификации явилось, в частности, повышение константы ассоциации Ιθ на один порядок от 3,9 · 109 М-1 до 3,2 · 108 М-1 [Bunning et al., 1977].
Молекула Ιθ состоит из 105 остатков аминокислот (см. табл. 17). В составе молекулы I® отсутствует Трп, содержится только один остаток Цис на молекулу, следовательно, нет дисульфидного мостика. В этом отношении он похож на I? и 1®. Отсутствие дисульфидных связей ставит интересную проблему о механизмах ингибирования, так как у ряда других ингибиторов дисульфидные связи локализованы в участках, ответственных за взаимодействие с субстратом ингибирования. Ингибитор характеризуется большим числом полярных остатков; индекс полярности составляет 55 %. Известно, что большинство растворимых белков имеет данный индекс в пределах 47±6 %.
Существование ингибитора карбоксипептидазы Υ, названной также протеиназой С, было показано несколькими исследователями [Hayashi et al., 1979, 1972; Hayashi, Hata, 1972; Lenney, Dalbec, 1969; Lenney, 1973]. Матерн с соавт. [Matern et al., 1974] показали, что ингибитор карбоксипептидазы У может быть отделен от комплекса с ферментом фракционированием ацетоном при возможно низких температурах. Полная схема очистки дана в табл. 18. Была достигнута почти 900-кратная степень очистки до получения гомогенного, по данным диск-электрофорез а, материала. Молекулярная масса при определении методом гель-фильтрации на сефадексе равнялась 25 000.
44
Таблица 18
Очистка ингибитора карбоксипептидазы Y из неочищенного экстракта пекарских дрожжей [Matern et al., 1974J
Этап очистки
Объем, мл
Общее количество, ед
Общий белок, мг
Удельная активность, ед.
Выход, %
Степень очистки
Неочищенный экстракт
1200
1700
33 400
0,051
100
1
Осаждение протаминсульфатом
1150
1700
36 000
0,049
100
1
Фракционирование ацетоном
44
3130
4 006
0,789
184
15,5
Кислотная обработка (0,1 М HCl до pH 3,5)
140
2420
1 640
4,48
142
29
ДЭАЭ-сефадекс A-50
35,5
420
15
27,6
24,7
540
Гидроксиапатит
31
268
6,8
39,2
15,7
770
Сефадекс G-75
2,6
71
1,6
45,5
4,2
890
В отличие от неочищенного препарата, который проявлял отсутствие термостабильности [Lenney, 1973], гомогенный белок Iе терял только 11 % ингибиторной активности после 5-минутного кипячения при 100° [Matern et al., 1974]. Как было установлено, причина нестабильности неочищенных препаратов связана с присутствием в препарате протеаз А и В, разрушающих ингибитор Iе. Ингибитор подвержен действию протеиназ А и В, он высокоспецифичен относительно карбоксипептидазы из пекарских дрожжей.
Биохимическое значение и функция ингибиторов протеиназ дрожжей определяются в первую очередь их специфичностью относительно различных каталитически активных белков, продуцируемых клеткой одновременно с ингибитором. В данном случае if и if ингибируют только протеиназу А и не действуют на протеиназу В, карбоксипептидазу Y или пепсин. I® и Ιθ угнетают только протеиназу В и не действуют на протеиназу А, карбоксипептидазу или трипсин. Iе угнетает только карбоксипептидазу Υ и не ингибирует дрожжевые протеиназы А и В и панкреатические карбоксипептидазы А и В свиньи. В опытах Хольцера [Holzer, 1974], проведенных in vitro с протеиназами дрожжей, было установлено, что они ответственны за деградацию фруктозодифосфатазы, малатдегидрогеназы, изоцитратлиазы, ФЕП-карбоксикиназы, глутаминсинтетазы, триптофансинтазы, треониндегидрогеназы и т. д. Предполагается, что эти эффекты могут быть экстраполированы на интактные дрожжевые клетки и, следовательно, ингибиторы протеиназ могут осуществлять свою регулирующую функцию. Как было показано в достаточно убедительных экспериментах, одна из протеиназ, осуществляя так называемый ограниченный протеолиз, активирует присутствующую в клетке в неактивной форме хитинсинтазу. В данном случае таким ферментом служит протеиназа В. Ингибитор протеиназы В контролирует процесс in vitro [Betz et al., 1974; Cabib, Ulane, 1973; Hasilik, Holzer, 1973; Ulane, Cabib, 1974].
Интересной особенностью трех групп ингибиторов является их различная чувствительность к гидролитической инактивации дрожжевыми протеиназами. Протеиназа А инактивирует ингибитор протеиназы В, протеиназа В инактивирует ингибитор протеиназы А и обе протеиназы А и В инактивируют ингибитор С. Карбоксипептидаза Y не инактивирует ни один ингибитор.
45
Рис. 8. Автокаталитический цикл активации ингибированных дрожжевых протеиназ A, B и C (карбоксипептидазы Y) следовыми количествами активных протеиназ B и A [Holzer, 1975]
Рис. 9. Каскадный механизм активации хитинсинтазы [Holzer, 1975] π — осмотический эффект
Эта характерная чувствительность к протеолизу распространяется и на ингибиторы, связанные с соответствующими протеиназами. Поэтому, как показано схематически на рис. 8, следовые количества свободной протеиназы А будут активировать комплекс протеиназа В—1В, гидролизуя 1в. Активированная протеиназа В в свою очередь будет освобождать более активную связанную с 1А протеиназу А.
Высокий уровень специфичности ингибиторов протеиназ подтверждает мысль, что они могут играть важную роль в круговороте клеточных белков in vivo [Lenney, 1975]. Экспериментально показано, что карбоксипептидаза У в экстрактах пекарских дрожжей содержится в основном в неактивной форме [Fischer, Holzer, 1980]. Карбоксипептидаза была получена в неактивной форме, ее молекулярная масса при гель-фильтрации на сефадексе G-100 составила 88 000. Электрофорез в ПААГ в присутствии ДДС-Na показал, что неактивный фермент состоит из двух полипептидов, имеющих молекулярные массы 60 000 и 30 000. Был сделан вывод о том, что неактивный фермент представляет собой комплекс активного фермента с его белковым ингибитором. Такой комплекс стабилен в интервале pH 5—9 и диссоциирует с образованием активного фермента при pH ниже 5,0. Активация неактивного комплекса наблюдалась при его обработке протеиназами А и В. Причем активирующее действие протеиназы В по крайней мере на порядок выше, чем протеиназы А. Как сказано выше, активация происходит за счет специфического ферментативного гидролиза ингибитора. Проведенные ранее исследования [Hayashi et al., 1972; Hayashi, Hata, 1972] с неактивной формой карбоксипептидазы Y дали несколько иные величины молекулярной массы: длй неактивного комплекса 60 000 и для ингибитора предположительно 19 000. Ингибитор Iе авторы осторожно называют субъединицей катионной природы.
Функция ингибиторов обусловлена и их локализацией в клетках. Протеиназы в дрожжевых клетках находятся в вакуолях [Matile, Wieken, 1967], а их ингибиторы — в цитозоле [Matern et al., 1974]. При такой
46
Таблица 19
Действие ингибитора на активность инактивазы I и II [Ferguson et al., 1973]
Фермент и ингибитор
Активность триптофансинтазы
ед.
%
Триптофансинтаза (ТС)
3,54
100
ТС + инактиваза I
0,64
18
ТС + инактиваза I + ингибитор
3,58
101
ТС + инактиваза II
2,60
74
ТС + инактиваза II + ингибитор
3,64
103
ситуации функции ингибиторов, возможно, сводятся к контролю проявления нежелательной активности протеиназ вне вакуолей. Эта функция может быть особенно важна, когда протеиназы, синтезированные в области эндоплазматического ретикулума, транспортируются в вакуоли. В этой ситуации, возможно, происходит перенос комплекса, который распадается на каком-то пограничном участке. Выше была отмечена функция протеиназы В в активации хитосинтазы. Детали показаны на рис. 9. Происходит автокаталитическая активация ингибированных протеиназ А и В неизвестным сигналом X. При этом освобождаются следы активной протеиназы А. Далее имеет место каскадный механизм активации, широко распространенный в биологических системах.
Очень важным является вопрос о количественных соотношениях в клетках между различными протеиназами и их ингибиторами. Мутант Sacch. cerevi- siae, полученный при помощи этилметансульфоната, имел нарушенную регуляцию синтеза ингибитора протеиназы А [Beck, Fink, 1980]. В исходном штамме наблюдается избыток ингибитора по сравнению с протеиназой А, тогда как мутант содержит в 2,5 раза больше протеиназы А, чем ингибитора, и ее избыток не приводит к нарушению скорости деградации белка.
Генетический анализ культуры показал, что ингибитор и протеиназа кодируются различными генами [Beck, Fink, 1980]. Регуляция синтеза ингибитора протеиназы А и В различаются.
В заключение следует привести более ранние работы, связанные с обнаруженными в культуре Sacch. cerevisiae двумя белками, инактивирующими триптофансинтазу. Белки были очищены в 1200 и 1900 раз и получили соответственно названия «инактиваза I» и «инактиваза II» [Kastsunuma et al., 1972]. Дальнейшие исследования показали, что ответственными за инактивацию белков являются протеиназы [Tsai et al., 1973]. Однако одновременно с протеазами клетка содержит специфический ингибитор, образующий неактивный комплекс с протеазой. Уровень активностей протеазы и ингибитора в клетках существенно зависит от состава среды для культивирования. Ингибитор представляет собой термостабильный белок, поэтому на первом этапе очистки удалось применить тепловую обработку. Белок не был получен в гомогенном виде. Активная фракция, обладающая ингибирующим действием, имеет молекулярную массу около 10 000. Помимо устойчивости к нагреванию, белок устойчив при обработке трихлоруксусной кислотой. Защитное действие ингибитора от разрушения триптофансинтазы инактивазами I и II показано в табл. 19 [Ferguson et al., 1973]. Помимо триптофансинтазы Sacch. cerevisiae, ингибитор защищает от разрушения триптофансинтазу N. crassa.
47
ИНГИБИТОРЫ ПРОТЕИНАЗ ИЗ ГРИБОВ
Грибы в качестве источника ингибиторов протеиназ изучены в меньшей степени, чем актиномицеты, а выделенные из них ингибиторные белки не имеют обстоятельной характеристики, подобно белкам из актиномицетов. Наиболее изучены изоингибиторы из N. crassa tryp-3 мутант td20i [Siepen et al., 1975; Yu et al., 1974, 1976], ингибитор из N. crassa 74A [Lampkin et al., 1976], а также препарат ингибитора щелочной протеиназы и папаина из Asp. oryzae [Matsushima, 1979].
Ингибиторы из N. crassa идентифицированы при исследовании причин нестабильности триптофансинтазы в данной культуре [Yu et al., 1976]. Было показано, что разрушение триптофансинтазы происходит за счет активности одной из эндогенных протеаз. При инактивации протеазы внутриклеточным ингибитором разрушения фермента не происходило. Ингибиторы получены из лиофилизированного мицелия буферной экстракцией (фосфатный буфер, pH 6,2, встряхивание в течение 40 мин при 4°). Комплекс протеаза—ингибитор разрушали путем нагревания в водяной бане при 90° в течение 5 мин. При такой обработке денатурации подвергается фермент, а ингибитор сохраняет нативную структуру. Денатурированный белок легко удаляется центрифугированием. После лиофилизации или упаривания в роторном испарителе концентрированный раствор, содержащий ингибиторы, пропускали через колонку с сефадексом G-75. После ДЭАЭ-целлюлозы были обнаружены два «пика», проявляющие ингибирующую активность. Препаративно были получены четыре ингибитора с различными молекулярными массами: А-1 и А-2 —10 000, А-3 — 5 000 и В — 24 000. Предположительно, только А-3 является гомогенным при гелевом диск- электрофорезе. В качестве N-концевой аминокислоты идентифицирован лизин.
Полученные препараты ингибиторов различаются по своим свойствам относительно субстратов ингибирования. Фракции А-2, А-3 и В взаимодействуют преимущественно со щелочными протеазами, в то время как ингибитор А-1 более специфичен для кислых протеаз. Следует также отметить, что, хотя ингибитор А-3 проявляет сильный защитный эффект относительно протеолитической инактивации триптофансинтазы, он ведет себя как слабый ингибитор при гидролизе казеина протеазами. Помимо того что ингибитор А-3 активен в защите от протеолиза триптофансинтазы, в условиях in vitro он предохраняет от протеолиза алкогольдегидрогеназу.
Вопрос о молярном соотношении реагирующих компонентов ингибитора и протеазы I из N. crassa был решен эмпирически путем подбора их концентраций, вызывающих полное угнетение активности. Компоненты выдерживали в 0,1 М фосфатном буфере при pH 8,0 в течение 3 ч при 4° [Yu et al., 1974]. Реконструированный комплекс был выделен и имел молекулярную массу 35 000. Молекулярная масса протеазы I равна 24 000, ингибитора А-2 — 10 000. Полученные данные подтвердили предположение, что имеет место молярное отношение составляющих компонентов, равное 1:1.
Из культуры N. crassa штамм 74А ингибитор протеазы выделен при изучении протеолитической инактивации некоторых ферментов метаболизма ароматических аминокислот [Lampkin et al., 1976]. К числу чувствительных к протеазам ферментов были отнесены хоризматсинтаза, антранилатсинтаза, кинурениназа, дегидрохинатсинтаза и шикиматкиназа. Выделение и очистка
48
Таблица 20
Схема очистки ингибитора протеиназы из Asp. oryzae N 26
Этап очистки
Общая активность, ед.
Удельная активность, ед./мг белка
Выход, %
Экстракт из мицелия после кислотной обработки
1316
2,1
100
Сефадекс G-100
1134
47,3
86,2
ДЭАЭ-сефадекс A-50 (1-я стадия)
415
180
31,5
ДЭАЭ-сефадекс A-50 (2-я стадия)
250
192
19,0
Сефадекс G-100
147
210
11,2
ингибитора проводились путем фракционирования сульфатом аммония и гель-фильтрацией на колонке с биогелем А-50. Ингибитор не угнетает некоторые коммерческие препараты протеаз, например трипсин, химотрипсин, проназу, субтилизин и папаин. Более того, он сам разрушается под действием трипсина и субтилизина. Как и большинство ингибиторов протеаз, он термостабилен. В градиенте концентрации сахарозы имеет константу седиментации ~ 3S. В опытах in vitro, поставленных с ингибитором и названными ферментами, было показано, что ингибитор способен предохранять их в разной степени от инактивации.
Ингибитор из мицелия Asp. oryzae был выделен по схеме, суммированной в табл. 20. Была достигнута 100-кратная очистка при выходе И %. Гомогенность белка не доказана. Препарат ингибитора активен относительно щелочных протеиназ различных грибов: Asp. oryzae, Asp. sojae, Asp. melleus, Pen. chrysogenum, Pen. carylophiloides, N. sitophila, Cephalosporium sp., Scopulariopsis brevicaulus, Trichoderma koningi, Tritirachium album. Препарат также ингибирует активность папаина, но не ингибирует пепсин, трипсин, α-химотрипсин, кислую протеазу и нейтральную протеазу II Asp. oryzae и щелочные протеиназы бактерий Bac. subtilis, Bac. subtilis var. amylosacchariticus, Serrata marcescens; проназу P из актиномицетов Str. griseus, Str. reches, var. proteolyticus, Str. lipmanii, Str. cellulosae и дрожжевую из Candida lypolytica. Спектр специфичности послужил автору основой для утверждения, что подобный ингибитор ранее описан не был [Matsushima, 1979].
ВНУТРИКЛЕТОЧНЫЕ ИНГИБИТОРЫ ПРОТЕАЗ
ИЗ СПОРОВЫХ БАКТЕРИАЛЬНЫХ КУЛЬТУР
Ингибиторы из Bac. subtilis и Bac. megaterium — единственные, полученные из бактериальных клеток. Как и многие известные ингибиторы протеаз белковой природы, они имеют относительно небольшую молекулярную массу, термостабильны, устойчивы к воздействию трихлоруксусной кислоты. Эти свойства используются при их фракционировании и очистке.
Для выделения ингибитора из Bac. subtilis замороженные клетки суспендировали в 0,2 М трис-НС1-буфере pH 7,3 и при 4° обрабатывали ультразвуком, затем в течение получаса центрифугировали при 27 000 д. Надосадочную жидкость нагревали в водяной бане в течение 5 мин, после чего охлаждали 49
на льду. В более поздних экспериментах клеточную суспензию нагревали без озвучивания. В этом случае водную суспензию отмытых клеток в трис- HCl-буфере нагревали в водяной бане в течение 20 мин при 90—95°, а затем замораживали во льду. На втором этапе проводили концентрирование раствора посредством ультрафильтрации через мембрану «Диафло» UM-10 в атмосфере азота. Концентрат смешивали с ДЭАЭ-сефадексом А-25, уравновешивали 0,2 М трис-буфером, pH 7,3. Суспензию встряхивали в течение 2 ч при 4°, затем центрифугировали. Ингибитор находился в надосадочной жидкости. Последнюю вновь подвергали концентрированию через ту же систему ультрафильтрации. Концентрат помещали на колонку с ДЭАЭ-сефадексом А-25 (25x41 см), уравновешенную 0,2 М трис-НС1- буфером, pH 7,3. Элюцию проводили тем же буфером. Дальнейшее осаждение осуществляли трихлоруксусной кислотой. После встряхивания в течение 5 мин при 4° суспензию центрифугировали при 27 000 g в течение 15 мин. Осадок, содержащий 20 % ингибирующей активности, отбрасывался. Надосадочную жидкость обрабатывали 100 %-ной ледяной трихлоруксусной кислотой до конечного ее содержания, равного 10 %. После повторного центрифугирования осадок растворялся в ЮмМ растворе трис-НС1-буфера, pH доводили 1 н. КОН до 9,0. Раствор диализовали в течение ночи при 4° против того же буфера. Для дальнейшей очистки вновь был использован ДЭАЭ-сефадекс А-25, уравновешенный 10 мМ трис-НС1-буфером, pH 9,0. После ступенчатой элюции была выделена активная фракция, подвергнутая диализу и лиофилизации. Заключительным этапом очистки была фильтрация лиофилизированного порошка через биогель Р60, уравновешенного 0,1 М трис-НС1-буфером, pH 7,3. Активные фракции подвергали в течение ночи диализу против 10 мМ трис-НС1-буфера, pH 7,3, и лиофилизировали. В итоге ингибитор был очищен в 640 раз по сравнению с исходным экстрактом; выход по активности — 16 %.
Выделенный гомогенный белок имел молекулярную массу 15 500± 1 000 по данным электрофореза в ПААГ с ДДС-Na и гель-фильтрации на биогеле РЗО. Ингибитор проявляет специфичность относительно внутриклеточных сериновых протеаз, проявляя как протеолитическую, так и эстеразную активность, однако не угнетает активность внеклеточных протеаз Bac. subtilis типа субтилизина [Millet, Gregoire, 1979].
Физиологическая функция ингибиторов Bac. subtilis до настоящего времени не установлена, а имеющаяся точка зрения не имеет надежного экспериментального обоснования. Она исходит из трех основных функций внутриклеточных протеаз, которые имеют место в процессе споруляции: 1) посттрансляционная модификация предсуществующих ферментов вегетативных клеток; 2) процессинг белка, покрывающего спору; 3) обращение белков. Если действительно внутриклеточные протеазы выполняют перечисленные выше функции, то они могут регулироваться данными ингибиторами белковой природы. Косвенным тому подтверждением могут служить величины активностей протеаз и их ингибиторов в динамике роста культуры и спорообразования. В частности, ингибирующая активность в культуре Bac. subtilis снижается при споруляции, когда необходима модификация белков для формирования спор.
50
ИНГИБИТОР ТРИПСИНА
В КУЛЬТУРЕ STREPTOMYCES GRISEUS CAL.
Продуцент ингибитора трипсина Str. griseus Cal. был выделен в числе других продуцентов из почвы в районе Калькутты [Mukherjee, Thangamani, 1981]. Из фильтрата культуральной жидкости после его прогревания при pH 2,0 и удаления осадка, диализа против воды и насыщения диализата сульфатом аммония были выделены три фракции, обладающих ингибирующей активностью. Одна из них формировалась при 0—30 %-ном насыщении сульфатом аммония, вторая — при 30—60 %-ном насыщении, третья представляла собой концентрат диализата. Каждая из фракций проявляла различную активность по отношению к трипсину, химотрипсину и папаину. Первые две фракции хорошо разделялись на сефадексе G-100, образуя два пика (ТЫ и TI-2). Оба ингибитора разрушались и теряли активность при обработке пепсином при pH-2,0. TI-2 угнетает ферментативный гидролиз как низкомолекулярных, так и высокомолекулярных субстратов: казеина и этилового эфира N-бензоил-L-аргинина, что может свидетельствовать о его взаимодействии с активным центром фермента. Ингибиторы TI-1 и TI-2 имеют белковую природу.
При фракционировании подкисленного до pH 2,5 диализата на Дауэксах и последующей хроматографии на сефадексе G-15 были получены два ингибитора ΤΙ-За и TI-Зв пептидной природы. В отличие от TI-1 и TI-2, угнетающих активность трипсина, химотрипсина и папаина, ингибиторы ΤΙ-За и TI-Зв активность химотрипсина не угнетают.
Пептидные ингибиторы не являются продуктами ферментативного гидролиза белков, что показано при изучении синтеза ингибиторов продуцентом на различных средах для культивирования и последующего разделения активных фракций [Mukherjee et al., 1982].
Детальное исследование процесса формирования ингибитора TI-2 на различных средах, содержащих белки, показало, что аминокислотный состав ингибитора зависит от присутствующих в среде азотсодержащих компонентов, хотя существенных различий между ними нет. Определено содержание аминокислотных остатков в молекулах метаболита, выделенного при культивировании на среде, содержащей мясной экстракт в сочетании с пептоном, и на среде с желатиной (показано в скобках): Лиз — 3(3), Гис—1(1), Арг — 3(4), Опр —6(7), Асп —5(5), Тре —2(1), Сер —3(3), Глу— 12(12), Гли — 18(20), Про —6(6), Ала —8(7), Вал— 3(3), Мет — 1(1), Иле — 3(3), Лей — 3(3), Фен — 1(2). Общее число аминокислотных остатков— 77(80), молекулярная масса 5026 (4 818), в молекуле отсутствуют Тир, Трп, Цис [Mukherjee, 1983].
Идентичный ингибитору TI-2 продукт был получен при ферментативном гидролизе желатины внеклеточной протеазой Str. griseus. Этот факт позволил автору сделать заключение о том, что TI-2 не секретируется продуцентом, а представляет собой продукт гидролиза субстрата, обладающий ингибирующей активностью [Mukherjee, 1983].
51
НИЗКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ ФЕРМЕНТОВ
ИНГИБИТОРЫ ГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ
ИНГИБИТОРЫ ФЕРМЕНТОВ, ДЕЙСТВУЮЩИХ НА ЭФИРНЫЕ СВЯЗИ
Ингибитор эстеразы, активный против липазы поджелудочной железы свиньи, получен из мицелия Str. lavendulae MD-4-C-1 при выращивании в течение 2—3 дней на среде, содержащей (в %) глицерин—1,5, муку хлопковых зерен—1,5%, NaCl—0,5, L-аспарагин — 0,2, pH 7,0 [Ume- zawa, Aoyagi et al., 1978]. Экстракция из мицелия осуществляется метанолом или этанолом, затем после упаривания вещество переводится в бутилацетат. После упаривания бутил ацетатного экстракта проводится фракционирование на силикагеле в системе хлороформ: метанол =80 : 1. Активные фракции переносятся на сефадекс LH-20 в метаноле. Дальнейшее разделение вновь происходит на силикагеле с использованием этилацетата. Чистое вещество представляет собой 5(№-ацетил-L-аспарагинилокси)-2-гексил-З-окси-лак- тон 7,10-гексадиеновой кислоты. Оно получило название эстерастатин. Ингибитор действует по конкурентному типу. Ингибирующий эффект (1С50, т. е. концентрация вещества, необходимая для снижения активности фермента на 50 %) выражается в следующих величинах: относительно п-нитро- фенилацетата и л-нитрофенилбутирата — 0,002 мг/мл, п-нитрофениллаурата — 0,125 мг/мл.
Функцию ингибитора некоторых эстераз, в частности эстерастатина, Умезава и др. [Umezawa, Aoyagi et al., 1978] видят в регуляции иммунного ответа организма. Ими было установлено, что заметные количества эстераз различной специфичности локализованы на поверхности мембран различных клеток животных. При введении внутрибрюшинно не менее 62 мг эстерастатина на 1 мышь происходит подавление образования антител. Авторы обобщают этот факт, считая, что вещества, которые угнетают активность ферментов, расположенных на поверхностях клеток, сами связываются с поверхностью клеток и оказывают влияние на иммунный ответ организма в целом.
Ингибитор щелочной фосфатазы получен из фильтрата культуральной
52
жидкости Act.fulvoviridis var. acarbodicus [Aoyagi, Yamamoto et al., 1978]. В состав среды входили (в %) соевая мука— 1,5, NaCl — 0,3, MgSO4X 7Н2О — 0,1, К2НРО4 — 0,1 и микроэлементы (Cu2+, Fe2+, Mn2+, Zn2+), pH 7,2. Максимум накопления ингибитора отмечался на 2—3-и сутки при выращивании в ферментере. Выделение ингибитора осуществлялось по схеме 3.
По химической природе вещество является 4-формил-З-окси-фенилглици- ном [Yamamoto et al., 1978] и получило название «форфеницин». Обнаружен сильный ингибиторный эффект против щелочной фосфатазы из кишечника цыпленка и слабый против щелочной фосфатазы из кишечника и печени теленка и Е. coli. Тип ингибирования неконкурентный, в опытах с п-нитро- фенилфосфатом /fť = 1,64 · 10~7 Μ. Вещество низкотоксичное, при дозе 125 мг/кг гибели мышей не наблюдается. Подобно эстерастатину, оказывает регуляторный эффект на функцию иммунной системы. Форфеницин вызывает возрастание числа клеток, образующих антитела.
В исследованиях И.-Μ. В. Горбачевой и др. [1983] проводился поиск ингибиторов по отношению к собственным фосфомоноэстеразам. Была проверена способность различных видов грибов Aspergillus и Penicillium выделять внеклеточные фосфомоноэстеразы при глубинном культивировании на комплексной среде. Показано, что исследованные культуры (более 50 штаммов)
53
продуцируют как кислую, так и щелочную фосфомоноэстеразу, однако образование кислой фосфомоноэстеразы намного превосходит секрецию щелочной. Инкубация культуральной жидкости и бесклеточных экстрактов с мочевиной в большинстве случаев приводила к снижению активности кислой и щелочной фосфомоноэстераз. При исследовании действия бесклеточных экстрактов на внеклеточные кислые фосфомоноэстеразы у большинства культур обнаружена способность ингибировать активность этих фермен- ментов.
Различные культуры грибов отличаются по степени ингибирования и по отношению к фосфомоноэстеразам из разных источников. Бесклеточный экстракт мицелия Asp. giganteus полностью ингибировал активность трех кислых фосфомоноэстераз Asp. clavatus 22, Pen. verricosum var. cyclopium 686 и препарата кислой фосфатазы «Worthington».
Около 1200 культур актиномицетов проверены в поисках продуцентов ингибиторов 3': 5'-циклонуклеотид-фосфодиэстеразы (КФ 3.1.4.17), полученной из селезенки кролика. Выделен штамм MD611-С6, близкий по систематическому положению к Str. mobaraensis. При культивировании в течение 3 сут на качалках при 27° на среде, содержащей (в %) крахмал — 2, глюкозу — 2, соевую муку — 2, дрожжевой экстракт — 0,5, NaCl — 0,25 и раствор микроэлементов, ингибитор накапливался в культуральной жидкости. Для его выделения фильтрат культуральной жидкости смешивают с равным объемом бутилацетата при pH 2,0 и экстракт упаривают до сиропообразной концентрации. Последующие операции по очистке осуществляют на силикагеле с использованием хлороформа. Из активных фракций после их концентрирования ведут кристаллизацию из смеси хлороформ— метанол, с добавлением гексана. Выделенное вещество ретикулол представляет собой 6, 8-диокси-7-метокси-3-метил-изокумарин [Furutani et al., 1977].
Ингибитор действует по неконкурентному типу ингибирования, /(4 = 38х ХЮ-6 Μ. 1С50 = 4,1 · 10-5 М относительно фосфодиэстеразы.
Два других ингибитора (PDE-I и PDE-II) получены из фильтрата культуральной жидкости актиномицета, близкого к Str. griseoflavus [Eno- moto et al., 1978].
Условия культивирования практически не отличаются от условий, при которых получен ретикулол. Процесс выделения также начинается с экстракции при pH 2,0 «-бутанолом или бутилацетатом и последующей хроматографии экстракта на силикагеле и сефадексе LH-20. PDE-I и PDE-II более активны, чем ретикулол, при воздействии на одни и те же препараты ферментов. Так как при внутрибрюшинном введении мышам дозы 200 мг/кг токсический эффект не отмечался, PDE-I и PDE-II считаются низкотоксичными веществами.
54
Из клеток Monascus purpureus после 2-дневного культивирования выделен ингибитор нуклеазы, получивший сокращенное название «NMP-ингиби- тор» [Saruno et al., 1981]. После культивирования в течение 6 дней ингибитор в результате автолиза клеток поступает в культуральную жидкость. В результате очистки путем гель-хроматографии на сефадексе G-25, биогеле Р-2 и ДЭАЭ-сефадексе А-25 получен электрофоретически гомогенный препарат с молекулярной массой 2500 (по данным гель-хроматографии на сефадексе G-75). Вещество дает положительные реакции с нингидрином и антроновым реактивом. Ингибитор проявляет активность относительно двух нуклеаз — МР и Р1, синтезируемых Monascus purpurescens, если в качестве субстрата использовать РНК или денатурированную нагреванием ДНК. NMP-ингибитор действует по принципу неконкурентного торможения.
ИНГИБИТОРЫ ГЛИКОЗИДАЗ
Ингибиторы амилолитических ферментов. Ингибитор амилазы получен из культуральной жидкости продуцента пуллуланазы Str. flavochromogenes [Ueda et al., 1973, 1976, 1978; Koba et al., 1976]. Существенно лучший выход ингибитора был получен при использовании растворимого крахмала по сравнению с мальтозой или глюкозой в качестве источников углерода. В присутствии следов глюкозы ингибирующую активность не удавалось идентифицировать в среде. Предполагается, что ингибитор в этом случае не синтезировался.
Применяя классические методы препаративного разделения продуктов метаболизма микроорганизмов, было выделено 4 фракции ингибиторов (А, В, В' и С), гомогенных по данным хроматографии и электрофореза на бумаге. В процентах от исходной активности выход ингибитора А составляет 3,7, В и В' — 20,0, С — 36,0. Отличаются они по удельной активности по отношению к α-амилазе: для А — 18 800, В — 45 700, С — 59 000 ингибирующих единиц на 1 мг глюкозы. Данные, приведенные в схеме 4 получения ингибиторов α-амилазы, свидетельствуют о различных физико- химических свойствах этих веществ. По данным электрофореза, ингибитор С имеет более основной характер, далее следуют В и А. Молекулярная масса ингибитора С близка к 14 000, ингибитор А имеет молекулярную массу немногим больше, а В — в пределах от 3500 до 4000. В известных пределах ингибиторы устойчивы к нагреванию. Для денатурации соединений, близких по свойствам к ингибиторам, допустим прогрев системы в кипящей водяной бане в течение 3 мин. Молекулы ингибиторов содержат в своем составе как аминокислоты, так и углеводы, преимущественно D-глюкозу. Однако по соотношению аминокислот и углеводов в молекулах ингибиторы отличаются друг от друга. Для ингибитора А отношение аминокислот к нейтральным сахарам (в молях лейцина к молям глюкозы) составляет 0,09, для В — 2,77, для С — 0,58.
Неочищенный первичный экстракт фильтрата культуральной жидкости вызывал угнетение активности α-амилазы животного и бактериального происхождения (1,4-а-глюкан-глюканогидролаза, КФ 3.2.1.1), глюкоамилазы грибов (1,4-а-О-глюкан-глюкогидролаза, КФ 3.2.1.3), но не действовал на пуллуланазу (пуллулан-6-гидролаза, КФ 3.2.1.41), ß-амилазу растений (1,4-а-О-глюкан-мальтогидролаза, КФ 3.2.1.2). Дальнейшие исследования смеси ингибиторов В, В' и С по отношению к различным гидролазам
55
и фосфорилазам показали, что происходит угнетение активности мышечной и картофельной фосфорилаз, грибной и дрожжевой a-D-глюкозидаз (a-D-глюкозид-глюкогидролаза КФ 3.2.1.20) и цикломальтодекстрин-глю- кано-трансферазы (КФ 2.4.1.19). Система оказалась неактивной по отношению к Q-ферменту (1,4-а-О-глюкан-ветвящий фермент, КФ 2.4.1.18) и декстрансахаразы (КФ 2.4.1.5).
Гомогенные фракции ингибитора А и В вызывают почти полное угнетение активности мышечной фосфорилазы а, фракции В и С — слабый эффект. При действии на дрожжевую a-D-глюкозидазу фракции В и А увеличивают мальтазную активность, а фракции В' и С угнетают. Как полагают авторы [Ueda et al., 1978], при взаимодействии ингибитора и фракций А и В происходит инактивирование ингибитора, но не освобождением молекулы D-глюкозы из гликопептида, как это справедливо можно предполагать.
В последующих исследованиях ингибиторов в той же культуре Str. flavochromogenes было найдено 14 низкомолекулярных соединений [Tajiri et al., 1983]. Выделены они были из фильтрата культуральной жидкости с помощью классических методов фракционирования микробных метаболитов: адсорбционной хроматографии на активированном угле, ионообменной хроматографии на дауэксах и амберлитах, электрофореза, жидкостной хроматографии высокого давления, гель-фильтрации на сефадексах G-10 и G-15. Все ингибиторы имеют по одному атому азота и содержат по 1—4 остатка глюкозы в молекуле. Расчетные величины молекулярных масс находятся в пределах 483—1083 (табл. 21). Ранее предполагалось, что ингибиторы, продуцируемые этой культурой, являются гликопептидами. В цитируемой работе такое утверждение отсутствует. Сами авторы называют две возможные причины несовпадения результатов: недостаточность, неэффективность очистки или
56
Таблица 21
Брутто-формулы и молекулярные массы ингибиторов α-амилазы из Str. flavochromogenes [Tajiri et al., 1983 J
Ингибитор
Брутто-формула
Молекулярная масса
рассчитанная по брутто-формуле
по данным гель- хроматографии на G-15
Al-A1
C38H69NO34
1083
1300
Al-A2
C37H65NO31
1019
1100
Al-B1
C36H66NO3l
1008
1050
Al-B2
C36H69NO31
1011
900
Al-B3
C31H56NO26
858
800
Al-B4
C32H58NO26
872
600
AL-B5
C26H48NO21
710
600
Al-D
C19H35NOl6
533
310
Al-H1
C18H39NO17
553
580
Al-H2
C19H36NO14
502
550
Al-H3
C19H33NO13
483
500
изменчивость, нестабильность продуцента, который утратил способность синтезировать ингибиторы гликопептидной природы. Такой вариант вполне возможен, поскольку выделенные ранее вещества не были способны гидролизоваться ß-амилазой, за исключением ингибитора АР Из полученных в данной работе ингибиторов гидролизу ß-амилазой подвергались вещества А1-Аь А1-Вь А1-В2, А1-В4.
Ингибиторный эффект может быть обусловлен числом остатков глюкозы в молекуле, а также характером их связи между собой и другими структурными особенностями молекул. Природа азотсодержащего компонента достоверно не определена.
Все 14 соединений угнетают глюкоамилазу из Rhizopus sp. без существенных различий в уровне активностей, ингибируют α-амилазу поджелудочной железы свиньи. Однако с большим эффектом действуют ингибиторы, имеющие более высокую молекулярную массу. Мышечную фосфорилазу а угнетают только ингибиторы группы А : А1-А', Al-Aj, и А1-А2. Дрожжевую α-глюкозидазу угнетают ингибиторы С, D, Е, Нн Н2 и Н3, обладающие относительно небольшой молекулярной массой. Все ингибиторы незначительно угнетают активность сахаразы. Других представителей аналогичной природы среди ингибиторов ферментов не описано.
Трестатины — ингибиторы а-амилазы — выделены из фильтрата культуральной жидкости Str. dimorphogenes nov., sp. NR-320-OM7HB [Yokose et al., 1983]. Культуру выращивали на среде, содержащей (в %) картофельный крахмал — 2, глюкозу — 2, соевую муку — 2, дрожжевой экстракт — 0,5, NaCl — 0,25, СаСО3 — 0,32 и соли цинка, меди, марганца в следовых количествах, pH 7,0, в течение 43 ч в ферментере при 27°. Типичная культуральная жидкость имела 3,1 · 104 ингибиторные единицы в 1 мл. Фильтрат культуральной жидкости сорбировали на активированном угле и вели элюцию 50 %-ным водным ацетоном при pH 2,0. Дальнейшие этапы очистки осуществляли на Дауэксе-50 (Н+) с элюцией 1 н. NH4OH, затем использовали Дауэкс-1 и Дауэкс-50 (NH^). Завершалось фракционирование сорбцией на Амберлите-С0-50 (H+/NH^) и элюцией водой. В итоге 57
были получены три фракции А, В и С. Все они сильно угнетают а-амилазу поджелудочной железы свиньи (ID50 для А, В и С — 8,1 · 10~9, 6,1Х Х10~7, 8,8· 10-9 М соответственно), α-амилазу Asp. oryzae (1Г>50 для А — 1,1 · 10-6, В — 3,1 · 10~5, С — 1,3 · 10-6 М соответственно) и а-амилазу Bac. subtilis (ID50 для А — 2,1 · 10~5, В — 5,4 · 10“5, С — 1,8 · 10"6 М соответственно). Все три вещества, проявляют ингибирующий эффект относительно экзо-1,4-а-D-глюкозидазы (глюкоамилазы) Asp. niger, но неактивны относительно ß-амилазы из батата, сахаразы и мальтазы из дрожжей, ß-глюкозидазы сладкого миндаля. При приеме перорально 500 мг/кг симптомы токсичности у мышей не возникали. Авторы считают, что препарат эффективен при лечении диабета и ожирения.
Установлена структура трестатинов А, В и С. Для них характерно наличие остатка трегалозы в нередуцирующей части молекулы и псевдоолигосахарида — дегидроолигобиозамина.
Ингибирующую активность по отношению к α-амилазе проявили антибио- тики-олигосахариды олигостатины [Itoh et al., 1981; Omoto et al., 1981]. Олигостатины выделены из фильтрата культуральной жидкости Str. myxo- genes nov. sp. SF-1130 при выращивании продуцента в 300-литровЫх ферментерах в течение 66 ч при 28°. Среда содержала (в %) мальтозный сироп — 5,0, соевую муку — 2,5, зародыши пшеницы — 1,0, NaCl — 0,25, pH 7,0 перед стерилизацией. Фильтрат культуральной жидкости был пропущен через Дауэкс-50 Wx2 (Н + ). Для удаления нейтральных олигосахаридов, таких, как мальтотриоза или пентаозы, колонка промывалась раствором NaHCO3. Олигостатины элюировались с колонки 0,1 н. NaOH. Фракции, проявляющие биологическую активность, были собраны и пропущены через активированный уголь. После отмывки водой олигостатины были элюированы 35 %-ным эталоном и упарены под вакуумом. Дальнейшее фракционирование осуществляли согласно схеме 5.
Преобладающим в количественном отношении было вещество С.
Олигостатины представляют собой бесцветные порошки, имеющие точки плавления 185, 190 и 195°, молекулярные массы 825, 987 и 1149 и число остатков глюкозы в молекуле 3, 4 и 5 для С, D и Е соответственно. Олигостатины D и Е — псевдо-, пента-, гекса- и гептаолигосахариды с азотсодержащей гликозидной связью.
58
Олигостатины проявляют антибиотическую активность относительно грамотрицательных микроорганизмов: Е. coli, Shigella sonnei, Proteus vulgaris, Salmonella typhi, Klebsiella pneumonia. Наиболее активен олигостатин Е. Олигостатины наиболее активны по отношению к а-амилазам животных. Так, величины Ю50 для С, D и Е против α-амилазы поджелудочной железы свиньи составляют 2,9; 0,09 и 0,12 мкг/мл; против а-амилазы слюны человека — 7,8; 0,16 и 0,18 мкг/мл соответственно. Олигостатины практически неактивны по отношению к α-амилазам Bac. subtilis, Bac. lique- faciens, Asp. oryzae, не действуют на α-глюкозидазу пекарских дрожжей и инвертазу Sacch. cerevisiae. Ингибиторы проявляют сравнительно высокую активность относительно глюкоамилазы Rhizopus niveus.
Ингибирующий эффект по отношению к α-амилазе находится в прямой зависимости от числа остатков глюкозы в молекуле. Присутствие глюкозного остатка в молекуле олигоетатина Е в нередуцирующей части молекулы ведет к понижению активности относительно глюкоамилазы.
В поисках ингибитора α-амилазы Мурао и др. [Murao et al., 1977] проверили около 2000 штаммов бактерий и 1500 актиномицетов. Отбор проводили на среде, содержащей (в %) растворимый крахмал — 0,5, глюкозу — 1,0, мясной экстракт — 0,5, полипептон — 0,5, NaCl — 0,3, pH 7,0. Микроорганизмы культивировали в течение 3—4 дней при 30°. Ингибирующую активность определяли в надосадочной жидкости после центрифугирования. В результате был отобран актиномицет Str. diastaticus, подвид
59
amylostaticus, синтезирующий ингибитор S-AI. Для синтеза ингибитора в состав среды необходимо вводить крахмал (лучше кукурузный) или амилопектин. Моно- и дисахариды не могут заменить крахмал. В качестве источников азота необходимы органические соединения, в частности содержащиеся в экстракте из соевых бобов. Минеральные соли признаны непригодными. Максимум активности наблюдается в стационарной фазе роста после истощения углеводов в среде. Фильтрат культуральной жидкости проявляет ингибирующее действие на α-амилазу и глюкоамилазу и не действует на ß-амилазу и пуллуланазу. По данным гель-хроматографии на сефадексе G-25, молекулярная масса ингибитора — 1500.
Молекула содержит один атом азота, при гидролизе ß-амилазой образуются две молекулы мальтозы. Пять остатков глюкозы соединены между собой а-1,4-связями. Показано, что каталитический участок связывания бактериальной α-амилазы с ингибитором расположен между шестым и седьмым остатками олигомера, считая с нередуцирующего конца [Murao, Ohy- ama, 1979].
Ингибиторы α-амилазы и сахароза-α-D-глюкогидролазы (сахараза, КФ 3.2.1.48) синтезируются различными штаммами Actinoplanes: SE 50, SE 82 и SB 18 [Schmidt et al., 1977]. При смешанном росте этих штаммов происходил синтез ингибиторов, строение и субстратная специфичность которых зависели от условий культивирования и источников углерода. В присутствии глюкозы или мальтозы преобладающим был синтез ингибиторов ферментов, расщепляющих дисахариды. В присутствии крахмала наблюдался синтез ингибитора α-амилазы. Ингибитор, получивший для обозначения символ BAYg 5421, действует по конкурентному типу и при использовании сахарозы имеет равную 2,6 · 10-7. Его полная структура не установлена. Вещество предложено авторами как возможное антидиабетическое средство и для лечения полноты [Schmidt et al., 1977].
Ингибиторы ß-амилазы образуют многие виды рода Streptomyces. Один из них, Streptomyces sp. N 54, синтезирует внеклеточный ингибитор на среде, содержащей растворимый крахмал и дезоксинойиримицин [Arai et al., 1983]. Последнее соединение выделено ранее из фильтрата культуральной жидкости Str. lavendulae subsp. trehalostaticus [Murao, Miyata, 1980]. Показано, что оно является ингибитором трегалазы. Фракционирование и выделение химически чистого продукта осуществляли путем хроматографии на колонке с Дayэκcoм-50W в Н +-форме. После отмывания колонки водой, ингибитор элюировали 0,5 н. раствором аммиака. Активированные фракции собирали и упаривали под вакуумом, затем растворяли в воде и сорбировали на активированном угле. Ингибитор элюировали 3 %-ным н-бутанолом, вновь упаривали, растворяли в воде и наносили на колонку с биогелем Р-2. Окончательную очистку осуществляли путем препаративной бумажной хро60
матографии на Ватмане 3 ММ в системе н-бутанол:пиридин:вода (6:4:3). Ингибитор представляет собой бесцветный аморфный порошок, имеющий температуру плавления 120°, брутто-формулу C12H23NO9.
ИК-спектр свидетельствует о наличии гидроксильных групп и иминогруппы. Молекулярная масса ингибитора около 300 по результатам анализа на биогеле Р-2. На основании данных газожидкостной хроматографии сделано заключение, что он состоит из эквимолекулярных количеств глюкозы и дезоксинойиримицина и, возможно, является гликозил-дезоксинойиримици- ном. Авторы предполагают, что в процессе культивирования продуцента образуются продукты трансгликозилирования между растворимым крахмалом или продуктами его деградации и дезоксинойиримицином типа (глю- коза)я · дезоксинойиримицин. При помощи α-амилазы, глюкоамилазы, гликозидазы и фосфорилазы такие продукты были получены. Они обладали ингибиторными свойствами, и их ингибирующее действие зависело от числа остатков глюкозы.
Ингибитор угнетает активность ß-амилазы батата на 70 %, соевых бобов на 84 %, солода на 32 %, ячменя на 33 %, Bac. polymyxa на 82 %, Bac. megaterium на 66 %, Bac. circulans на 75 %. Практически не действует на большинство изученных α-амилаз микробного и животного происхождения, за исключением кислотостабильной α-амилазы из Asp. niger и Bac.
subtilis saccharifying.
Из неидентифицированного штамма актиномицета получен ноджирими- цин, действующий на ферменты, участвующие в гидролизе углеводов [Niwa et al., 1970]. Его структура: 5-амино-5-дезокси-О-глюкопираноза. Действует по конкурентному типу ингибирования на эмульсин из абрикоса, Kt = 5,5x X 10“6 М (эмульсин, ферментный препарат, гидролизующий ß-глюкозидные связи). Ингибирует такадиастазу и глюкоамилазу Rhizopus niveus. Характерной особенностью ингибитора является более сильный эффект на ферменты, гидролизующие а- или ß-1,4-связи гликозидов или гликозидных цепей, чем на ферменты, которые освобождают ди- или олигосахариды из 1,4-полимеров глюкозы. Ноджиримицин проявляет значительный ингибирующий эффект на гйдролиз фенил-а-И-глюкозида такадиастазой и глюкоамилазой.
Из культуральной жидкости Streptomyces sp. N 280 выделены четыре различных ингибитора (А, В, В' и С) карбогидраз и мышечной фосфорилазы a [Nakano et al., 1981]. Под действием внеклеточных карбогидраз продуцента из ингибитора А образуются две формы ингибиторов — AI-Aj и А1-А2, имеющие молекулярные массы в пределах 1300—1500. Содержание азота в них составляет 1,3 %. Отношение общего содержания сахаров к восстанавливающим группам для Aj и А2 равно соответственно 6,8:1 и 6,2:1. По химической природе AI-A! и А1-А2 являются олигосахаридами с одной свободной аминогруппой.
Ингибитор AI-Aj более эффективно ингибирует фосфорилазу а и амилазу поджелудочной железы, ингибитор AL-A2 — грибную глюкоамилазу и сахаразу.
При ферментативной модификации ингибитора AI-A! ß-амилазой происходит отщепление мальтозы, при этом ингибитор теряет способность угнетать активность фосфорилазы а, но сохраняет активность относительно глюкоамилазы и сахаразы. Предполагается, что только нативная исходная первичная структура ингибитора обеспечивает его активность относительно 61
фосфорилазы а. На ингибитор А1-А2 ß-амилаза не действует. Амилаза поджелудочной железы расщепляет AI-Aj и в несколько меньшей степени А1-А2, при этом они теряют способность ингибировать фосфорилазу а и амилазу поджелудочной железы, однако способность ингибировать глюкоамилазу и сахаразу увеличивается.
Трансформация ингибитора в культуральной жидкости происходит также при росте микроорганизма за счет активности внеклеточной ß-амилазы. В ходе гидролиза освобождается преимущественно мальтоза. Модификация ингибитора α-амилазой не изменяет его ингибирующей активности по отношению к глюкоамилазе, но активность полностью пропадает по отношению к мышечной фосфорилазе a [Chaen, Ueda, 1979].
Другой ингибитор амилолитических ферментов получен из фильтрата культуральной жидкости Str. diastaticus subsp. amylostaticus № 2476 [Fukuhara et al., 1982а]. Суммарный препарат ингибитора был расфрак- ционирован классическими методами ионообменной и бумажной хроматографии, в результате чего получены три фракции — F-la, F-lb и F-2, каждая из которых в свою очередь содержала несколько компонентов. Фракция F-la содержала четыре вещества, выделенных бумажной хроматографией, фракция F-lb — пять веществ.
Субстратами для изучения ингибирующего эффекта служили бактериальные а-амилазы, α-амилаза поджелудочной железы свиньи, така-амилаза А, глюкоамилаза Rhizopus nigricans. Было четко показано, что каждое соединение отличается величиной ингибирующей активности. Во фракции F-la найдены два азотсодержащих вещества — Хи XG, имеющих соответственно следующие брутто-формулы: C13H2NO7 и C19H3NOi3.
ИНГИБИТОРЫ НЕЙРАМИНИДАЗЫ
Одной из гликозидаз, являющейся, как полагают, одним из ферментов патогенности, может быть названа нейраминидаза (КФ 3.2.1.18). Фермент освобождает N-ацетилнейраминовую кислоту, Ν-0-диацетилнейраминовую, N-гликолилнейраминовую и т. п. из глюкоконъюгатов. В научной литературе фермент часто встречается под названием «сиалидаза» или «ацетилнейра- минил гидролаза». При поиске ингибитора нейраминидазы обычно в качестве тестов используют патогенные или условно патогенные микроорганизмы или вирусы, синтезирующие фермент.
При использовании вируса инфлюэнцы как теста, синтезирующего нейраминидазу, ингибитор был найден в фильтрате культуральной жидкости Str. pseudoverticillus var. panosialinus [Aoyagi et al., 1971; Umezawam, Aoyagi et al., 1974]. В состав среды для культивирования входили следующие компоненты (в %): глюкоза— 1,0, крахмал — 1,0, соевая мука — 1,5, КН2РО4 — 0,1, MgSO4 · 7Н2О — 0,1, NaCl — 0,3 и раствор микроэлементов. Максимум ингибирующей активности отмечался на 4—7-е сутки. Вещество экстрагировали из фильтрата культуральной жидкости н-бутанолом. Незначительное количество вещества, содержащегося в мицелии, извлекали метанолом. В дальнейшем экстрагированные метанолом продукты переводили в н-бутанол и с использованием хроматографических методов получали чистые вещества. Соединения, обладающие ингибирующей активностью — три производные 5-алкилбензол-1,3-дисульфата: 5-изо-пентадецилбензил- 1,3-дисульфат (Rj), 5-н-пентадецилбензил-1,3-дисульфат (R2) и 5-изогекса- 62
децилбензил-1,3-дисульфат (R3) [Kumagai et al., 1971]. Все они получили обобщенное название «паносиалины». Все три вещества обладают примерно одинаковой ингибирующей активностью : ID50 по отношению к нейраминидазе составляет 9 · 10“6 М, кислой фосфатазе — 3,8 · 10~5, полигалактуроназе — 3,9 · 10~5 Μ.
Паносиалин в низких концентрациях угнетает активность нейраминидазы вирусов, кислую фосфатазу, полигалактуроназу. Это вещество не обладает ингибирующей активностью по отношению к грамотрицательным, слабо угнетает Грамположительные микроогранизмы, имеет низкую токсичность. Паносиалин ингибировал NWS-штамм вируса инфлюэнцы при их совместном интерцеребральном введении.
Паносиалин относится к числу соединений, имеющих характер анионных детергентов. Детергенты, как правило, не обладают выраженной специфичностью относительно определенных ферментов. Их взаимодействие с различными ферментными белками зависит в основном от ИЭТ белков и ионного окружения.
Необходимо отметить, что паносиалин не единственный микробный метаболит-детергент. Микробные клетки содержат довольно много различных соединений, обладающих свойствами детергентов. К их числу могут быть отнесены, например, некоторые полисахариды, белки и нуклеиновые кислоты. Вероятно, в определенных условиях в клетке они могут выполнять функции регуляторов ферментативных реакций.
3. А. Стрельцовой и соавт. [1975] в опытах по изучению влияния различных полианионов на параметры катализируемого химотрипсином гидролиза этилового эфира N-ацетил-L-тирозина было показано, что взаимодействие полианионов с α-химотрипсином вызывает эффекты, которые могут быть полностью объяснены изменением констант ионизации ионогенных групп фермента, участвующих в каталитической реакции. Исследования комплексов поликислот и полиоснований показали, что образование надмолекулярных структур сопровождается значительными конформационными изменениями макромолекул [Кольцова и др., 1971]. Одним из таких примеров может быть ингибирование PHK-полимеразы E.coli полиадениловой кислотой [De Robertis et al., 1972], другим — угнетение ДНК-полимеразной α-актив- ности поли-дГ, поли-дЦ и поли-дЦ—олиго-дГ. Кинетические исследования показали, что каждое из названных соединений связывается с идентичными участками фермента [Oguro et al., 1982].
Другой ингибитор нейраминидазы — систатин, продуцируемый Str. verticil lus var. quintum, — был найден при использовании в качестве теста Clostridium perfringens [Umezawa, Aoyagi et al., 1974]. Продуцент культивировали на среде, содержащей (в %) крахмал — 1,0, глюкозу — 1,0, мясной экстракт — 0,75, полипептон — 0,75, NaCl — 0,3, MgSO4 · 7Н2О — 0,1 и раствор микроэлементов. После выращивания в течение 3 сут и очистки филь63
трата культуральной жидкости методами молекулярной и ионообменной хроматографии (силикагель, амберлит, Дауэкс-SOW X2, авицел) получены два вещества — систатин А и В. Систатин В имеет более широкий спектр, чем систатин А, действует по конкурентному типу ингибирования при исполь-
зовании в качестве субстрата сиалолактозы, угнетает активность препаратов нейраминидазы (сиалидазы) из Cl. perfringens (Kj= 1,7 · 10“ jM), ряда актиномицетов и тканей органов крысы. Не действует на препараты сиалидазы из вируса гриппа и Vibrio cholera. Систатин В угнетает также ß-глю- куронидазу и М-ацетил-р-0-глюкозаминидазу, на которые систатин А не действует.
ИНГИБИТОРЫ ß-ГАЛАКТОЗИДАЗЫ,
ЦЕЛЛОБИАЗЫ И ЦЕЛЛЮЛАЗЫ
Пиридинолол — ингибитор ß-галактозидазы, полученной из печени быка. Ингибитор выделен из фильтрата культуральной жидкости Str. alboverti- cillus MD 401-C5 [Kumagai et al., 1976]. Его структура: 1- [ 1 (R), 2-диокси- этил]-Зоксиметил-9Н-пиридо [3, 4, b]-индол.
Пиридинолол угнетает ß-галактозидазу только в кислой среде, в нейтральной проявляет незначительную активность: при pH 4,2 при концентрации ингибитора 10“3М доля угнетения составляет 85 %, при 10“5 М — 60 %, при pH 7,0 — 23 и 10 % соответственно. Пиридинолол угнетает ß-галактозидазу по неконкурентному типу ингибирования (Ať = 2 · 10“6 М). Не угнетает ß-галактозидазную активность препаратов, полученных из печени свиньи и крысы, почек быка и свиньи, яичника свиньи, сердца быка, плаценты человека. Пиридинолол угнетает также ß-глюкозидазу, но не нейраминидазу, a-D-маннозидазу или М-ацетил^-глюкозаминидазу.
Пара-оксифенилацетальдоксим (НРААО) получен из фильтрата культуральной жидкости Str. nigellus MD 824-CG-2 [Hazato et al., 1979]. Организм выращивали на среде, содержащей (в %) глицерин — 1,5, муку хлопковых зерен— 1,5, NaCl—0,3, L-аспарагин — 0,2, pH 7,2, в течение 48 ч при 27°. После сорбции на активированном угле, элюции метанолом активную фракцию подвергали дальнейшему разделению на силикагеле в си64
стеме хлороформ: метанол (80:1). Процедуру очистки завершали хроматографией на сефадексе LH-20 и кристаллизацией из хлороформа.
НРААО угнетает ß-галактозидазу из печени быка, ß-глюкозидазу, ß-фу- козидазу при pH 6,0—8,0, не действует на нейраминидазу. Вещество имеет низкую токсичность: при внутрибрюшинном введении 500 мг/кг гибели мышей не отмечается.
Ингибитор и его аналоги получены методом химического синтеза. Syn- форма более активна, чем anti-форма, против ß-галактозидазы из печени быка. Для проявления ингибирующей активности необходимо наличие оксим- ной группировки в молекуле НРААО.
Изофлавоноиды, обладающие ингибирующей активностью, получены из штамма, близкого к Str. xanthophaeus MD 865-СЗ [Aoyagi, Hazato et al., 1975]. Наиболее активными по отношению к ß-галактозидазе и ß-фукозидазе, полученных из различных органов быка и свиньи и почки крысы, являются соединения II, Ш-2, Ш-3 и IV-2.
R1
R2
R3
II
O-рмн'
H
O-рмн
Ш-1
OH
OH
OH
Ш-2
O-рмн
H
OH
Ш-3
O-рмн
OH
O-рмн
IV-1
OH
H
OH
IV-2
O-рмн
OH
OH
При сравнении величин ID50 по отношению к активности ß-галактозидазе из печени быка при pH 4,2 наибольшей активностью обладает НРААО (0,06 мкг/мл), далее — пиридинолол (2,0 мкг/мл) и наконец — изофлавоноид Ш-2 (14 мкг/мл). При pH 7,0 НРААО имеет активность 0,015, Ш-2 — 3,6 и пиридинолол — более 250 мкг/мл.
Ингибитор ß-D-глюкозидазы Asp. niger выделен из коммерческого дрожжевого экстракта „Difco“ [Woodward et al., 1983]. Степень ингибирования зависит от концентрации дрожжевого экстракта и возрастает с увеличением pH. Вещество лабильно к нагреванию, нестабильно при кислых значениях pH (5,0). Ингибирующая активность не пропадала после обработки трипсином при pH 7,0 или кислой протеазой при pH 5,0. Входящие в состав дрожжевого экстракта тиамин, никотиновая кислота, пиридоксин, пантотеновая кислота, биотин, холинхлорид, аскорбиновая кислота, мио-инозит, каза- миновые кислоты не вызывали угнетения активности ß-D-глюкозидазы. Ингибирующий эффект не связан с ионами металлов, так как добавление ЭДТА к дрожжевому экстракту не снимало угнетение активности. Ингибитор не связывается с ДЭАЭ-сефарозой. При гель-фильтрации не сефадексе G-100 он элюируется во фракции с молекулярной массой меньше 4000. Ингибирование, вызванное полученным веществом, было неконкурентным. Химическая природа вещества не установлена. Возможно, что речь идет о каком-то суммарном или кооперативном эффекте нескольких соединений, содержащихся 65
в дрожжевом экстракте. Ингибитор целлюлазы неидентифицированной природы выделен из поверхностной культуры Asp. terreus на пшеничных отрубях [Sinha et al., 1981]. Выделенное путем экстракции цитратным буфером (pH 4,8) вещество имеет молекулярную массу около 1200, не подвергается гидролизу трипсином; на 100 % угнетает гидролиз целлюлазой хлопка, на 56,2 % — фильтровальной бумаги, на 71,4 % — КМ-целлюлозы. В равной мере, как целлюлазу собственного продуцента, угнетает целлюлазы из Asp. niger и Trichoderma viridae, а также ферментный препарат „Onozuka“ 3S. Поскольку при росте гриба на микрокристаллической целлюлозе ингибитор не был идентифицирован, высказывается предположение, что специфические соединения, присутствующие в отрубях, индуцируют синтез ингибитора грибом или ингибитор может быть продуктом деградации субстрата независимо от гриба.
ИНГИБИТОРЫ ПЕПТИДГИДРОЛАЗ
Аминопептидаза А (КФ 3.4.11.7) представляет собой экзопептидазу, отщепляющую с N-конца остаток аспарагиновой или глутаминовой кислот (L-a-аспартил-пептид + Н2О = L-аспарагиновая кислота + пептид). Ингибитор аминопептидазы А, выделенной из сыворотки крови человека, получен из культуры Str. sp. ME 98-МЗ [Aoyagi et al., 1978] путем ионообменной хроматографии на амберлитах, дауэксах, ДЭАЭ-сефадексе А-25 с молекулярной хроматографией на заключительном этапе. Выделенное вещество является (2S, 3R) -амино-2-окси-5-метилгексаноил-L-валил-L-валил-L-ас- парагиновой кислотой и получило название «амастатин». Ингибитор, помимо аминопептидазы А, действует на лейцинаминопептидазу и практически неактивен относительно аминопептидазы В, трипсина, папаина, химотрипсина, эластазы, пепсина, термолизина.
Аминопептидаза В (КФ 3.4.11.6) представляет собой экзопептидазу, отщепляющую с N-конца остаток аргинина или лизина (L-аргинил-пептид+ + Н2О-L-аргинин + пептид). Фермент для поиска ингибитора был выделен из печени крысы. Ингибитор был обнаружен и выделен из фильтрата культуральной жидкости Str. olivoreticuli MD 976-С7 [Umezawa, Aoyagi et al., 1976]. Культуру выращивали в течение 2—3 сут на среде, содержащей (в %) мальтозу— 1,5, дрожжевой экстракт — 0,3, N-Z-амин—1,0, NaCl — 0,3, pH 7,4. Из фильтрата культуральной жидкости вещество сорбировали на активированном угле или на амберлите XAD, далее после элюции 80 %-ным метанолом экстрагировали к-бутанолом, промывали экстракт дистиллированной водой, концентрировали, переводили в 0,2 М пиридин-ацетатный буфер и заключительные стадии проводили на Дауэксе-50х8 и силикагеле
66
в системе ацетат : «-бутанол : уксусная кислота : вода (12 : 4 : 1 : 1). Выделенное вещество представляет собой [ (2S, ЗИ)-3-амино-2-окси-4-фенилбута- ноил-]-L-лейцин [Suda et al., 1976]. Оно получило название «бестатин».
Бестатин, помимо аминопептидазы В, ингибирует лейцинаминопептидазу, не угнетает аминопептидазу А, трипсин, химотрипсин, эластазу, папаин, пепсин или термолизин. При замене L-лейцина на D-лейцин в молекуле бе- статина ингибирующая активность понижается в 340 раз. Изучение механизма взаимодействия ингибитора с ферментом методом ядерного магнитного резонанса показало, что взаимодействуют гидроксильная группа ингибитора и ион металла фермента. В случае лейцинаминопептидазы в реакцию вступает ион Zn2+ [Ricci et al., 1982]. Бестатин обладает низкой токсичностью, в дозе 300 мг/кг гибели мышей не вызывает.
Ингибиторы сериновых и тиоловых протеаз. Ингибиторы протеаз, синтезируемые актиномицетами, основу структуры которых составляет трипептид L-лейцил-L-лейцил-аргиналь, получили название «лейпептины».
Пептид имеет N-ацильную связь у первого лейцина. Заместителями обычно служат пропионил или ацетил. В ряде случаев L-лейцин может быть замещен L-изолейцином или L-валином. Альдегидная группировка у ингибитора сериновых протеиназ была впервые обнаружена у лейпептина [Maeda et al., 1971]. Описаны 42 культуры, содержащие внеклеточный лейпептин. Среди них различные штаммы, относящиеся к видам Str. roseus, Str. roseo- chromogenes, Str. chartreusis, Str. albireticuli, Str. thiolutens, Str. lavendulae, Str. noboritoensis и др. Одним из наиболее активных продуцентов лейпептина является Str. roseus МА 839-AL Актиномицет выращивали в лабораторных условиях на качалках на среде следующего состава (в %): глюкоза— 1,0, крахмал — 1,0, пептон — 2,0, NaCl — 0,5, pH 7,0. Максимум ингибирующей активности в фильтрате культуральной жидкости наблюдали в период между 48 и 72 ч. При выращивании в 2000-литровом ферментере концентрацию глюкозы увеличивали вдвое и вводили 0,2 % КН2РО4.
67
Таблица 22
Распределение изотопной метки в молекуле лейпептина (в %)
Радиоактивный предшественник молекулы
CH3Co—
Лей
Остаток аргиналя
Гуанидиновая группировка
Орниталь
CH314COONa
93,6
6,4
0
L-[U-14C]-Лей
3,2
87,9
1,9
L-[Гуанидо-14C]-Арг
26,8
5,2
66,4
1,6
L-[U-14C]-Арг
34,6
6,9
7,0
51,5
Лейпептин из фильтрата культуральной жидкости сорбировали на активированном угле и элюировали метанолом при pH 2,0. Однако более эффективное выделение лейпептина из фильтрата культуральной жидкости осуществлялось на ионообменных смолах. На первом этапе выделения фильтрат культуральной жидкости пропускали через колонку с макропористой карбоксильной смолой «Lewatit CNP» (Na+50 %, Н+50%) при pH 6,0. Элюцию проводили 1 н. HCl в 80 %-ном метаноле. Активный элюат упаривали под вакуумом, получая буро-коричневый порошок, который экстрагировали к-бутанолом, и бутанольный экстракт вновь упаривали под вакуумом. Полученный пигментированный порошок растворяли в воде и обесцвечивали в колонке с Дауэксом 1-Х2 в С1 “-форме, колонку промывали водой и водный раствор, содержащий лейпептин, лиофилизировали. ID50 полученного белого порошка по отношению к плазмину равна 10 мкг/мл [Umezawa, 1972].
Для оценки возможных метаболических предшественников молекулы лейпептина мицелий продуцента инкубировали на качалке при 27° на синтетической среде, содержащей лейцин, аргинин и глюкозу. В среду вводили аминокислоты, содержащие радиоактивные изотопы, и изучали включение метки в молекулу лейпептина. Хорошими предшественниками лейпептина оказались лейцин и аргинин, за ними следовали изолейцин и [1-14С] ацетат натрия. Почти равноценным был вклад [U-14C] Арг и [Гуанидо-14С] Арг. Плохо включался в молекулу аргинина орнитин (табл. 22).
Меченые а цетил-лейцин и ацетил-лейцил-лейцин плохо включались в молекулу как предшественники. Вероятно, они подвергались интенсивному разрушению ацилазами и пептидазами продуцента [Hori et al., 1978].
Фермент, который конденсирует ацетил-L-лейцил-L-лейцин и L-аргинин в ацетил-L-лейцил-лейцин-L-аргинин (лейпептин-кислота) был частично очищен из клеточного экстракта Str. roseus МА 839-Al [Suzukake et al., 1979]. Молекулярная масса фермента 260 000, оптимум действия pH равен 9,5 в глициновом буфете и 9,0 в трис-НС1-буфере. Для проявления активности необходимо присутствие АТФ. Активность фермента угнетается ЭДТА, пирофосфатом или D-этилмалеинимидом.
Фермент катализирует также другие реакции, которые ведут к образованию молекулы лейпептин-кислоты: Ац-L-Лей+L-Лей-^Ац-L-Лей-L-Лей Ац-L-Лей-}-L-Лей-|-L-Арг—>-Ац-L-Лей-L-Лей-L-Арг (лейпептинкислота).
Фермент не способен осуществлять реакции:
L-Лей+L-Арг-*> (L-Лей) i_2-L-Арг и
Ац-L-Лей+L-Арг*>Ац-L-Лей-L-Арг.
68
Таблица 23
Выделение лейпептин-кислота-синтетазы из мицелия [Suzukake et al., 1979]
Этап выделения фермента
Общий белок, мг
Единицы активности (×108)
Степень очистки
Надосадочная жидкость гомогената мицелия (10 000g)
498,2 (100%)
1,265 (100%)
1
Высаливание сульфатом аммония (20-40%)
150,1 (30,1%)
1,319 (104,3%)
4,4
Сефадекс G-200
66,0 (13,3%)
1,925 (152,1%)
14,6
ДЭАЭ-целлюлоза
3,8 (0,76%)
604 (47,8%)
19,7
В ходе синтеза происходит обмен АТФ—ФФН с Ац-L-Лей, Ац-L-Лей-L- -Лей или L-Лей, но не с Ац или Арг.
Фермент получил название «лейпептин-кислота-синтетаза».
Для получения фермента мицелий дважды отмывали в трис-буфере, pH 8,2, содержащем 5 мМ 2-меркаптоэтанола. После разрушения мицелия посредством френч-пресса для выделения фермента использовали надосадочную жидкость, которую хранили при температуре ниже 0°. Схема очистки приведена в табл. 23.
Фермент, осуществляющий ацилирование L-лейцина, лейцин ацилтранс- фераза выделен и очищен из гомогената мицелия продуцента Str. roseus МА 839-Al [Suzukake, Hayashi et al., 1980]. Фермент не имеет строгой специфичности относительно как доноров ацильной группы, так и акцепторов, хотя уровень активности отличается в зависимости от соединения, вступающего в реакцию. При ацилировании L-лейцина 14С-ацетил-КоА и 14С-про- пионил-КоА радиоактивность ацетил-L-лейцина была в 10 раз выше. В случае различных доноров для 14С-ацетил-КоА, если активность включения «метки» в ацетил-L-лейцин принять за 100 %, для L-лейцина она составит 12 % и далее соответственно для L-валина — 50%, L-фенилаланина—179%, D-фенилаланина — 18 %, DL-метионина — 118 %, L-гистидина — 7 %, L- глутаминовой кислоты — 0, L-Лей-L-Лей — 246 %, L-Лей-L-Лей — 393 %, L-Лей-L-Лей-L-Лей — 191 %.
Молекулярная масса фермента 27 000, он активируется ионами Fe2+ и ингибируется п-хлормеркурибензоатом, N-этилмалеинимидом, а также ионами Mg2+ и Mn2+.
Для доказательства участия плазмиды в синтезе лейпептина продуцент Str. roseus МА 839-Al был обработан акрифлавином. Был получен мутант, не способный к синтезу лейпептина. В дальнейшем плазмида путем конъюгации была перенесена из продуцирующего в непродуцирующий лейпептин. При этом у последнего штамма способность к синтезу лейпептина была восстановлена. Какой конкретно вклад в механизм синтеза молекулы лейпептина вносит плазмида, не установлено [Umezawa, Okami, Hotta, 1978]. Обработанный акрифлавином мутант, не синтезирующий лейпептин, способность к синтезу лейцин ацилтрансферазы не утратил.
Функция лейпептина в продуцирующих клетках, видимо, не связана с угнетением активности собственных внутриклеточных протеиназ, так как в клетке содержится лейпептин-кислота, не обладающая ингибирующей активностью. Количественное соотношение между содержанием лейпептин- кислоты в клетке и среде составляет 5 : 1; то же соотношение для лейпептина
69
Таблица 24
Концентрации лейпептина, вызывающие угнетение активности протеиназ на различных субстратах
Фермент
Субстрат
Лейпептин, мкг/мл
Тромбокиназа
Плазма
15
Тромбин
ТАМЭ
10000
БАЭЭ
12000
Плазмин
Фибриноген
8
Фибрин
6
Казеин
16
ТАМЭ
85
Трипсин
Казеин
2
Гемоглобин
3,6
БАА
0,1
ТАМЭ
65
БАЭЭ
80
Папаин
Казеин
0,5
Гемоглобин
0,15
БАА
0,05
Каликреин
БАЭЭ
75
α-Химотрипсин
Казеин
>500
АТЭЭ
>2500
Примечание. ТАМЭ — метиловый эфир N-n-толуол-сульфонил-L-аргинина; БАЭЭ — этиловый эфир N-бензоил-L-аргинина; БАА — N-бензоил-L-аргининамид; АТЭЭ — этиловый эфир N-ацетил-L-тирозина.
равно 1 : 250. В гомогенате мицелия продуцента идентифицирован лабильный фермент, который восстанавливает кислотную группу в альдегидную, после чего образовавшийся лейпептин выходит из клетки в среду [Suzukake, Takada, Hoři, 1980; Umezawa, Okami, Hoffa, 1978].
Лейпептин сильно угнетает активность тромбокиназы, плазмина при гидролизе фибрина и фибриногена, трипсина при его действии на казеин, гемоглобин и N-бензоил-L-аргининамид · НС1 (БАА), проявляет высокую активность по отношению к папаину, когда субстратами служат казеин, гемоглобин и БАА. Незначительный эффект лейпептин оказывает на тромбин и α-химотрипсин (табл. 24).
Приведенные данные свидетельствуют о том, что лейпептин более активно угнетает протеолитическую активность плазмина, трипсина и папаина, чем их эстеразное действие" на синтетические субстраты.
Для оценки вклада альдегидной группы лейпептина в эффект ингибирования протеолитической активности получено дибутилацетатпроизводное ингибитора [Aoyagi et al., 1969]. Практически все реакции, которые сильно угнетаются лейпептином, не подвергались действию дибутилацетата лейпептина. Аналогичный результат получен в опытах при использовании окисленного производного лейпептина в виде кислоты или восстановленного до диги- дролейпептина, где в качестве фермента применяли плазмин, а субстратом служил фибриноген, а также при гидролизе казеина папаином.
Ингибирующая активность лейпептина зависит также от оптической формы, в которой находится аргинин в составе молекулы. Наличие D-арги- наля вместо его L-изомера ведет к увеличению Ю50 при гидролизе фибриногена плазмином от 4,5 до 70 мкг/мл, при гидролизе казеина и гемоглобина папаином, а также казеина трипсином Ю50 увеличивалась 70
в 10 раз [Umezawa, 1972]. Меньшее влияние на ингибирующую активность оказывает замена лейцина близкими по структуре аминокислотами, например валином и изолейцином [Maeda et al., 1971].
Ниже приведены данные по изменению ID50 (в мкг/мл) при ингибировании плазмина лейпептином и другими близкими по структуре пептидами (субстрат фибриноген), где Ац — ацетил, Пр — пропионил, Аргал — аргиналь:
N-Ац-Аргал
>333
Пр-Лей-Лей-Аргал
8
Ац-Лей-Аргал
8
Ац-Иле-Лей-Аргал
2
Пр-Лей-Аргал
8
Ац-Вал-Лей-Аргал
2
Ац-Иле-Аргал
33
Ац-Иле-Иле-Аргал
35
Ац-Лей-Лей-Аргал
9
Ац-Иле-Вал-Аргал
314
Изучение кинетических характеристик действия трипсина на синтетические субстраты показало, что имеет место конкурентное ингибирование при эстеразных реакциях (метиловый эфир N-n-толуол сульфоил-L-аргинина и этиловый эфир N-бензоил-L-аргинина) с/<, = 3,4 · 10~7и 1,3 · 10~7М соответственно. Неконкурентное ингибирование имеет место при гидролизе пептидной связи в реакции с N-бензоил-L-аргинин-п-нитроанилидом (/Q = = 3,8 · IO“7 М).
Лейпептин обладает невысокой токсичностью. LD50 в опытах на крысах равна 125 мг/кг при внутривенном введении и более 4 г/кг при приеме перорально, для кроликов эти дозы составляют 35 мг/кг и более 1,5 г/кг соответственно. Лейпептин при оценке его с точки зрения возможного терапевтического агента рассматривается как средство для лечения панкреатита и ожогов [Umezawa, 1972].
Другой ингибитор пептидной природы — антипаин — идентифицирован в фильтрате культуральной жидкости некоторых актиномицетов, в частности Str. michiganensis КС 84-AG13, Str. mauvecolor, Str. yokosukanensis MC 829-AS1 [Suda et al., 1972]. В состав среды для культивирования и синтеза антипаина входят следующие компоненты (в %): глюкоза — 2,0, NZ-амин — — 1,0, дрожжевой экстракт — 0,2, NaCl — 0,3, MgSO4 · 7Н2О — 1,0, К2НРО4 — 0,1 и раствор микроэлементов, содержащий сульфаты меди, железа, марганца и цинка, pH 7,2.
Из фильтрата культуральной жидкости антипаин извлекают «-бутанолом, после чего бутанольный экстракт упаривают под вакуумом. Дальнейшей операцией может быть сорбция на активированном угле с последующей элюцией 0,05 н. НС1 в 80 %-ном метаноле. Элюат помещают на КМ-сефадекс G-25 при градиентной элюции формиатом аммония от 0,01 до 1 Μ. Завершает выделение антипаина хроматография на окиси алюминия с использованием метанола в качестве элюента или ионообменная хроматография на катионите и элюция 0,01 н. НС1. По химической природе антипаин представляет собой тетрапептид — карбо-L-фенилаланил-L-аргинил-L-валил-L-аргиналь [Umezawa et al., 1972].
71
Таблица 25
Действие лейпептина, антипаина, химостатина и пепстатина на различные протеазы [Umezawa, 1972]
Фермент
Субстрат
ID50, мкг/мл
Лейпептин
Антипаин
Химостатин
Пепстатин
Тромбокиназа
Плазма
15
20
>250
>250
Тромбин
ТАМЭ
10000
>250
>250
>250
Плазмин
Фибриноген
8
93
>250
>250
Трипсин
Казеин
2
0,26
>250
>250
Папаин
»
0,5
0,16
7,5
>250
Каликреин
БАЭЭ
75
>250
>250
>250
α-Химотрипсин
Казеин
>500
>250
0,15
>250
Пепсин
»
>500
>250
>250
0,01
»
Гемоглобин
>500
>250
>250
0,0031
Проктаза A
Казеин
>250
>250
>250
>250
Проктаза B
»
>250
190
26,5
0,0072
Катепсин A
КБТГ
1,680
—
62,5
>125
Катепсин B
БАА
0,44
—
2,6
>125
Катепсин
Гемоглобин
109
—
49,0
0,011
β-, γ-, δ-Химотрипсин
Казеин
>500
>250
0,15
>250
Примечание. КБГТ — карбобензокси-L-глутамил-L-тирозин; остальные обозначения см. табл. 24.
В виде дигидрохлорида он имеет точку плавления 170—177°, растворим в воде, метаноле или диметилсульфоксиде; хуже растворим в этаноле, пропаноле или н-бутаноле; нерастворим в бензоле, гексане, петролейном эфире, этиловом эфире и хлороформе.
Антипаин как ингибитор проявляет высокий уровень специфичности относительно папаина и трипсина (табл. 25). При внутрибрюшинной инъекции мышам 1 г/кг и внутривенной 125 мг/кг антипаина гибель мышей не отмечалась. Доза 250 мг/кг при внутривенном введении приводила к гибели всех подопытных мышей.
Специфический ингибитор α-, β-, γ-, δ-химотрипсинов — химостатин — выделен из нескольких штаммов актиномицетов, в частности Str. hygrosco- picus MC 521-C8 и Str. lavendulae MC 524-C1 [Umezawa et al., 1970]. Ингибитор содержится как в фильтрате культуральной жидкости, так и в мицелии. Из мицелия его экстрагируют метанолом, из фильтрата — «-бутанолом. Дальнейшая очистка после упаривания под вакуумом осуществляется путем обработки сиропа этилацетатом, хроматографией на силикагеле, в системе к-бутанол:вода (9:1) и последующей депигментации на аниОно- обменниках, например Дауэксе 1 (С1 “-форма). Перекристаллизацию проводят из метанола. Структурная формула химостатина не установлена. По данным ИК-спектра, вещество представляет собой пептид: С — 57,95; Н — 7,19; N — 15,13; О— 17,11. Аминокислотный анализ показал наличие в составе молекулы валина, изолейцина, лейцина, аргинина и фенилаланина. При введении 500 мг/кг внутрибрюшинно или перорально мышам токсический эффект отсутствует.
Ингибитор эластазы, выделенный из Str. griseoruber MD 469-CG8, получил название «эластатинал» [Umezawa et al., 1973]. Ингибитор накапливается через 38—48 ч культивирования в ферментере на среде, содержащей (в %) глюкозу — 3,0, соевую муку — 2,0, NaCl — 0,3, NH4C1 —
72
0,25, СаСО3 — 0,6, pH 7,2. Из фильтрата культуральной жидкости вещество выделяли сорбцией на активированный уголь с последующей элюцией 50 %-ным ацетоном. Активный элюат был упарен под вакуумом и далее пропущен через колонку с Дауэксом 1 Х2 в ацетатной форме. Вытекающие из колонки активные фракции и вода, используемая для промывки колонки, смешивались и подкислялись до pH 3,1 муравьиной кислотой. Полученный раствор наносили на колонку с SP-сефадексом С-25, уравновешанным 50 мМ пиридин—формиатным буфером, pH 4,1. Активные фракции были собраны и упарены под вакуумом. Повторная хроматография на SP-сефадексе С-25 привела к получению очищенного от примесей эластатиналя. По химической природе ингибитор представляет собой N-(S)-/-карбоксиазопептил карба- моил-2-имино-гексагидро-4(Б)-пиримидил-(Б) -глицил-(S)-глутаминил- (S) - -аланинал. Характерно, что с N-конца молекулы расположен остаток — аминокислота в виде своего альдегидного производного, как это имеет место у некоторых других пептидных ингибиторов протеаз, например лейпептинов. Ингибитор весьма специфичен относительно эластазы (ID50 = 1,8 мкг/мл). Для трипсина, плазмина, папаина, химотрипсина, термолизина и пепсина эта величина больше 250 мкг/мл.
Ингибитор папаина E-64 [Hanada et al., 1978] выделен из фильтрата культуральной жидкости гриба Asp. japonicus TPR-64.
Ингибитор проявляет высокую активность только относительно тиоловых протеиназ, вступая во взаимодействие своей эпоксидной группировкой с сульфгидрильной группой фермента. Лактатдегидрогеназа, в состав которой также входит SH-группа, с ингибитором не реагирует. Низкую активность проявляет ингибитор относительно трипсина, α-химотрипсина, пепсина, плазмина, эластазы, дрожжевой кислой протеиназы. Наивысшую активность ингибитор показывает, когда субстратом для папаина служит БАА. Ингибитор после экстракции его метанолом сорбируют на активированном угле, далее на Амберлите CG-50 (в Н+-форме), затем на фосфоцеллюлозе и завершает очистку фракционирование на сефадексе G-25.
Ингибитор эластазы гранулоцитов человека — эласнин — выделен из фильтрата культуральной жидкости Str. noboritoensis [Omura et al., 1978,
73
Рис. 10. Биосинтез пепстатина Act. longisporus-flavus MC 144-Cl [Umezawa, 1972]
Состав среды (в %): крахмал — 1,0; глюкоза — 1,0; мясной экстракт — 0,75; полипептон — 0,75; NaCl— 0,3; MgSO4∙7Н2О — 0,1; раствор сернокислых солей Cu2+, Fe2+, Mn2+, Zn2+; 1 — пепстатин; 2 — pH; 3 — глюкоза
1979]. Среда для биосинтеза ингибитора содержала (в %) глюкозу — 2,0, соевую муку — 2,0, NaCI —0,1, pH 7,0. Активное вещество экстрагировали этилацетатом с последующим фракционированием на силикагеле. Ингибитор рассматривался как потенциальный терапевтический агент при лечении заболеваний, связанных с повышенной активностью ферментов, вызывающих деструктивные изменения тканей организма человека, в частности при панкреатитах. Полагают, что он может контролировать развитие некоторых патологических процессов, например эмфизему легких, острый артрит и т. п. [Omura et al., 1978, 1979]. Ингибитор обладает низкой токсичностью и высокой специфичностью относительно эластазы гранулоцитов (IDso=l,3 мкг/мл). Он проявляет невысокую активность относительно эластазы поджелудочной железы, трипсина, α-химотрипсина, термолизина и папаина. Поликетидная структура ингибитора формируется из 12 остатков «активного ацетата».
Ингибиторы карбоксильных протеаз. Пепстатин — ингибитор кислых протеаз — выделен из фильтратов культуральных жидкостей нескольких видов актиномицетов: Actinomyces longisporusflavus, Str. testaceus, Str. argen- teolus, Str. argenteolus var. toyonakensis, Str. naniwaensis. Пропись среды, динамика накопления ингибитора, изменения pH и расхода глюкозы представлены на рис. 10. Максимум содержания ингибитора приходится на 70—80 ч. Перед максимумом содержания пепстатина отмечается падение 74
величины pH, глюкоза практически полностью отсутствует в среде. Из фильтрата культуральной жидкости пепстатин может быть экстрагирован н-бутанолом, сконцентрирован в вакууме и концентрат обесцвечен на активированном угле. Кристаллизацию проводят из метанола. В случае экстракции пеп- статина из мицелия применяют метанол. После экстракции метанольный раствор пропускают через колонку с силикагелем в системе н-бутанол: уксусная кислота : вода : бутилацетат (4:1:1:4). Пепстатин растворяется в метаноле, этаноле, уксусной кислоте, пиридине, диметилсульфоксиде. Практически нерастворим в этилацетате, этиловом эфире, бензоле, хлороформе и воде. По химической природе он представляет собой ацил-L-валил-L-валил- -4-ами но-3-окси-6-метил гептаноил-L-аланил-4-амино-3-окси-6-метил гептановую кислоту. В качестве ацильного радикала обнаружены ацетил-, изовалерил-, «-капроил- или изокапроил-заместители.
В определенных условиях культивирования (см. рис. 10) в ферментере при аэрации и перемешивании в наибольшем количестве происходит синтез изовалерилпроизводного [Umezawa et al., 1970; Morishima et al., 1970; Fuka- mura et al., 1971].
Пепстатин активно ингибирует кислые протеазы: пепсин, пептидазу А из Aspergillus sp., реннин из грибов рода Мисог, протеазы из Rhodotorula sp. и Saccharomyces sp., но не действует на протеазы, имеющие тиоловые группы, — папаин и фицин, протеазы, имеющие серин в активном центре, — трипсин и химотрипсин, металлопротеазы из Pseudomonas и Streptomyces. Для проявления ингибирующей активности карбоксильная группа не является необходимой* так как при ее замещении и образовании метилового, этилового, n-бромфенацитинового эфиров, как и солей натрия, магния и кальция, она практически не меняется. Дегидроацетилпепстатин, в котором гидроксильная группа концевой аминокислоты в пепстатине была дегидратирована, а другая гидроксильная группа — ацетилирована, показывал только одну сотую от исходной величины активности пепстатина.
75
Кроме пепстатина, в культуре Str. testaceus найдены его аналоги — пепстанон и оксипепстатин [Umezawa, 1982]. Пепстанон содержит меньше на один углеродный атом с C-конца, т. е. лишен карбоксильной группы. В молекуле оксипепстатина вместо L-аланина находится L-серин. Пепстатин, пепстанон и оксипепстатин в равной мере проявляют ингибирующую активность относительно пепсина и катепсина D. Пепстатин более активен против реннина. Активность пепстатина по отношению к реннину возрастает с увеличением числа углеродных атомов в алифатической части молекулы. Как и при проявлении ингибирующей функции пепстатина, карбоксильная группа оксипепстатина не принимает участия в связывании с пепсином.
Биосинтез молекулы пепстатина осуществляется так же, как и молекулы лейпептина, на мультифункциональной ферментной системе. Способность к биосинтезу пепстатина пропадает у продуцента после его обработки акрифлавином. Высказывается предположение, что для синтеза необходима информация, закодированная в плазмиде.
Оценку пепстатина с точки зрения возможности его применения в медицине проводили с изовалерилпепстатином. Препарат оказался малотоксичным. При введении перорально LD50 составляет 2 г/кг. Клиницисты полагают, что пепстатин можно использовать в качестве ингибитора для выяснения роли пепсина в патогенезе язвенных заболеваний желудка и двенадцатиперстной кишки [Umezawa, 1972].
Ингибиторы металлопротеиназ. Из различных видов актиномицетов выделен ингибитор термолизина — фосфорамидон, в частности из Str. tana- shiensis [Suda et al., 1973]. Ингибитор избирательно угнетает термолизин и близкие к нему ферменты. По структуре он отличается от других подобных ингибиторов наличием углевода — рамнозы: Ы-(а^-рамнопиранозилокси- гидроксифосфинил) ^-лейцил^-триптофан.
Ингибитор металлопротеиназ — талопептин — получен из фильтрата культуральной жидкости Str. mouzunensis МК-23 [Fukuhara, Katsura, Murao, 1982]. Активное вещество получено при помощи сорбции на активированном угле, экстракции «-бутанолом, хроматографии на ДЭАЭ-сефадексе А-25, активированном угле и сефадексе G-10. По химической природе он является 6-дезокси-а^-талопиранозилоксифосфо^-лейцил-к-триптофаном. Ингибитор стабилен при pH>7,5 в течение >60 мин при 100°. В кислой среде быстро разлагается.
Ингибитор специфичен относительно термолизина. Характер взаимодействия термолизина и талопептина определяли путем измерения скорости ингибирования ферментативной активности и спектров абсорбции и флуорес- 76
ценции комплекса [Kitagishi, Hiromi, 1983]. Взаимодействие фермента с ингибитором сопровождается возрастанием флуоресценции при возбуждении при 280 и 295 нм. Характеристика дифференциального абсорбционного спектра свидетельствует о том, что при связывании фермента и ингибитора изменяется микроокружение остатков триптофана в молекулах фермента или ингибитора, а возможно, и в обеих молекулах. определяли в области pH от 5 до 9 относительно 3-(2-фурилакрилоил)-глицил-L-лейцин амида в качестве субстрата. Константу диссоциации комплекса определяли методом флуорометрического титрования фермента ингибитором. Обе константы расположены в зоне pH от 6,0 до 8,5. По-видимому, по крайней мере две способные к ионизации группы, находящиеся в протонированной форме, необходимы для связи между термолизином и талопептином. Процесс связывания является эндотермическим (Н° = —12 ккал/моль).
Кинетические исследования механизма связывания термолизина с талопептином, проведенные методом остановленной струи, показали, что имеет место двустадийный механизм связывания. Сначала происходит быстрая бимолекулярная стадия, за которой следует медленная мономолекулярная [Kitagishi, Hiromi, 1983].
Специфический ингибитор металлопротеиназ Asp. oryzae — FMPI (fungal metalloproteinase inhibitor) — получен из фильтрата культуральной жидкости Str. rishiriensis NK-122 [Murao et al., 1982]. Вещество, обладающее ингибирующим эффектом, накапливается к концу первых суток культивирования при 25° (до 100 мг/л) на среде, содержащей (в %) мясной экстракт— 1, полипептон — 1, NaCl — 0,3, pH 7,0. Глюкоза, растворимый крахмал и глицерин не угнетают синтез FMPI. Ингибитор очищен в 10 000 раз с помощью хроматографии на Дауэксе 1X2 (ОН~-форма), окиси алюминия, амберлите XAD-2, целлюлофайне GC-12 и сефадексе LH-20 [Kasai et al., 1982] FMPI ингибирует только металлопротеиназы, но не действует на сериновые, тиоловые и карбоксипротеиназы А и В, а также аминопептидазу. Характерной особенностью ингибитора является его нестабильность при pH < 11 при комнатной температуре.
Ингибитор содержит в своем составе L-фенилаланин, L-аргинин и остаток фосфорной кислоты. Предположительно он имеет следующую структуру.
77
ИНГИБИТОРЫ ОКСИДОРЕДУКТАЗ, ТРАНСФЕРАЗ И ЛИАЗ
ИНГИБИТОРЫ ОКСИДОРЕДУКТАЗ
Ингибиторы ферментов, участвующие в биосинтезе и метаболизме норадреналина. Ключевым ферментом при биосинтезе норадреналина является дофамин-р-монооксигеназа (КФ 1.14..17.1), которая осуществляет превращение дофамина (3,4-диоксифенилэтиламин) в норадреналин, являющегося непосредственным метаболическим предшественником адреналина. Ингибитором этого фермента является фузариновая (5-бутил-2-пиридинкарбоно- вая) кислота.
Фузариновая кислота впервые была обнаружена и выделена из фильтрата культуральной жидкости Fusarium heterosporum в 1934 г., химический синтез осуществлен в 1954 г., исходя из 2-метил-5-этилпиридина [Plattner et al., 1954]. В Советском Союзе способ получения фузариновой кислоты разработан Т. Н. Медведевой [1983]. Культуру F. oxysporum 53382 выращивают на среде, содержащей (в г/л) глюкозу— 70—100, NaNO3 — 7—10, КН2РО4 — 0,1— 0,2, FeSO4*7H2O — 0,001—0,002, MgSO4-7H2O — 0,53, HCL— 0,47—0,53 при соотношении NaNO3 и глюкозы 1 : 10 и температуре 24°.
Механизм синтеза норадреналина и ингибирующий эффект фузариновой кислоты
а — тирозин; б — L-β-ДОФА (L-β-3,4-диоксифенилаланин); в — дофамин (3,4-диоксифенилэтиламин); г — норадреналин; д — фузариновая кислота (5-бутил-2-пиридинкарбоновая кислота); I — гидроксилаза; II — β-3,4-диоксифенилаланиндекарбоксилаза; III — дофамин-β-монооксигеназа
Биосинтез фузариновой кислоты происходит одновременно с ростом гриба, и максимальное накопление кислоты отмечено в стационарной фазе роста на 4-е сутки после практически полного исчезновения глюкозы из среды [Безбородов и др., 1979]. Выход фузариновой кислоты может быть увеличен путем введения в среду ацетата натрия (3 г/л). Существенное влияние на выход оказывает также температура. Повышение температуры культивирования с 24 до 28° резко снижает выход. Необходимо вводить также оптимальные концентрации фосфата и железа, соотнесенные с концентрациями глюкозы.
Фузариновую кислоту из фильтрата культуральной жидкости экстрагируют этилацетатом (объем/объем) при подкислении до pH 3,0. Этилацетатный экстракт сушат над прокаленным сульфатом натрия, фильтруют и упаривают досуха под вакуумом. Сухой остаток растворяют в минимальном объеме 1 н. раствора бикарбоната натрия, балластные вещества
78
экстрагируют небольшим количеством диэтилового эфира и отбрасывают, а водную фазу подкисляют соляной кислотой до pH 3,0 и проводят непрерывную экстракцию хлористым метиленом в течение 24 ч. Экстракт упаривают досуха под вакуумом. Сухой остаток дважды перекристаллизовывают из гексана.
Изучен механизм биогенеза молекулы фузариновой кислоты, являющейся гетероциклическим соединением, имеющим в своем составе пиридиновое кольцо. Синтез пиридинового кольца микроорганизмами может осуществляться различными путями. Добсон и др. [Dobson et al., 1967] при использовании меченого ацетата предложили схему биогенеза молекулы фузариновой кислоты из пяти «ацетатных единиц» и аммиака, т. е., точнее, из одной молекулы ацетил-КоА и четырех молекул малонил-КоА. Согласно другой теории [Destay et al., 1968], в экспериментах с [1-13С] ацетатом, [2-13С] ацетатом и [4-13В] аспартатом, используя метод !Н-ЯМР, было доказано, что С2, СЗ, С4 и С7 атомы молекулы фузариновой кислоты происходят из ацетата через аспартат или родственное четырехуглеродное соединение, в то время как С5, С6, С8, С9, СЮ и СН происходят непосредственно из двухуглеродного соединения.
Ингибирующий эффект фузариновой кислоты относительно дофамин-ß- монооксигеназы высокоспецифичен: ее концентрация, вызывающая 50 %-ное угнетение активности, составляет 3,0 · 10“8 М, в то время как для каталазы она равна 1,0 · 10-2 М, для монофенолмонооксигеназы, тирозин-2-моно- оксигеназы, альдегиддегидрогеназы, монофенолмонооксигеназы— 1,0 X Х10“4 Μ. Сравнение фузариновой кислоты с другими известными ингибиторами дофамин-р-монооксигеназы, как с синтетическими, такими, как бензилоксиамин, диэтилдитиокарбамат, фенилэтилтиокарбамат, так и с природным — допастином, показывает, что фузариновая кислота и ее галогенопроизводные обладают ингибирующей активностью на два порядка выше, чем перечисленные выше ингибиторы. Специфичность ингибирования, поводимому, может быть объяснена введением объемного заместителя в положение 5 пиридинового кольца. Замещение водорода на галоген в положении 3'- или 4'-бутильной группы фузариновой кислоты дает более сильнодействующие производные: 5-(3', 4'-дибром) -бутилпиридинкарбоновую и 5-(4'- бром)бутилпиридинкарбоновую кислоты.
Дофамин-р-монооксигеназа в присутствии ДОФА и ионов Са2+ вызывает изменение проводимости мембран, вследствие чего ему отводят роль нейромедиатора [Kafka et al., 1976]. Если такая функция фермента подтвердится, то фузариновая кислота может оказаться одним из регуляторов этого процесса.
На основе фузариновой кислоты методом химического синтеза получено ее производное—гидрохлорид ß-(N, М-диэтиламино)этиламид 5-к-бутил- 2-пиридинкарбоновой кислоты [Медведева и др., 1978]. Это соединение 79
обладает противоаритмической активностью, предупреждает смертельную фибрилляцию желудочков, развивающуюся вследствие интоксикации хлоридом кальция, уменьшает кардиотоксическое и аритмогенное действие токсических доз строфантина.
Другой ингибитор дофамин-р-монооксигеназы, выделенный из Pseudomonas sp., —допастин [Umezawa, 1982] —также обладает гипотензивным эффектом в опытах на крысах.
Ингибитор тирозин-3-монооксигеназы, найденный в культуре гриба Oudemasiella radicata [Umezawa, 1982], получивший название «оуденон», имеет низкую, токсичность и незначительный гипотензивный эффект в опытах на крысах.
Ингибитор З-окси-З-метилглутарил-КоА-редуктазы (НАДФН). Поиск ингибиторов З-окси-З-метилглутарил-КоА-редуктазы (КФ 1.1.1.34) был обусловлен задачей найти природное соединение, способное вызвать угнетение синтеза холестерина в организме высших животных [Endo, Kuroda, Tsujta, 1976]. Известно, что этот фермент лимитирует синтез холестерина, катализирует реакцию синтеза З-окси-З-метилглутарил-КоА из мевалонат-КоА с участием НАДФ. Именно З-окси-З-метилглутарил-КоА-редуктаза является основной мишенью при изучении проблемы снижения уровня холестерина у человека.
Ингибитор синтеза холестерина выделен из фильтрата культуральной жидкости Pen. citrinum 18767. Культура росла в аэробных условиях в течение 4 сут на среде, содержащей (в %) солодовый экстракт — 3, глюкозу — 2, пептон — 0,1. После концентрирования под вакуумом проводили экстракцию этилацетатом в кислой среде (pH 4,0). Этилацетатный экстракт концентрировался под вакуумом и фракционирование осуществляли на силикагеле и в органических растворителях различной полярности. В результате выделены три соединения, обозначенные как ML-236A, ML-236B и ML-236C. Все они угнетают активность З-окси-З-метилглутарин-КоА-редуктазы и снижают содержание холестерина в крови. Наибольший интерес представляет, видимо, вещество ML-236B. При анализе содержания холестерина в сыворотке после введения 20 мг/кг перорально крысам через 3 ч количество холестерина понижалось на 26— 30 % по сравнению с контролем. Острый токсический эффект наблюдается при дозе 500 мг/кг. При использовании соединений ML-236A и ML-236C снижение уровня холестерина происходило 80
на 14—21 % [Endo et al., 1976]. Подобный эффект отмечался не только в опытах на крысах. Он был получен при клинических испытаниях, а также в опытах на собаках и обезьянах. Подтверждением тому, что речь идет об угнетении синтеза, а не о разрушении синтезированного холестерина, служит отсутствие эффекта в хронических опытах.
В острых опытах на культурах клеток с использованием меченых ацетата и мевалоната также наблюдался сильный ингибирующий эффект ML-236B, оцениваемый по синтезу холестерина.
Кислотные формы ML-236A и ML-236B, полученные путем гидролиза, обладают более сильной ингибирующей активностью, чем соответствующие лактонные формы. Обе формы ML-236В более активны, чем такие же формы ML-236A. Ki= 0,22 и 0,01 мкМ соответственно для натриевых солей ML- 236А и ML-236B, тип действия — конкурентный.
Соединение ML-236B идентично ранее выделенному антифунгальному веществу из Pen. brevi-compactum, названному компактином.
Метилированное производное компактина 6-метил-МL-236В (6-метилком- пактин) найдено в культуре Asp. terreus АТСС 20542 и получило название «мевинолин» [Alberts et al., 1980]. Культуру выращивали в течение 4—6 сут при 28° на среде, содержащей (в 1 л) декстрозу — 45 г, пептонизированное молоко — 24 г, дрожжевой экстракт — 2,5 г, полиэтиленгликоль (Р 2000) — 2,5 мл, pH 7,4. Выделение из фильтрата культуральной жидкости осуществляли по сходной с выделением ML-236B методике с применением экстракции этилацетатом в кислой среде с фракционированием на силикагеле, используя различные органические растворители.
Химическая структура мевинолина установлена, он представляет собой 1,2,6,7,8,8а-гексагидро-р-6-диокси-2,6-диметил-8- (2-метил-1 -оксобутоксил) - 1-нафталин-6-лактон гептановой кислоты. Ее кислотная форма, названная мевинолиновой кислотой, проявляет более сильный ингибирующий эффект, чем мевинолин, по отношению к З-окси-З-метилглутарид-КоА-редук- тазы, = 0,6 мМ.
Существенный вклад в увеличение ингибирующей активности дает метильная группа в положении 6, что заметно при сравнении структуры мевинолина и ингибитора ML-236B. При пероральном введении крысам мевинолинат натрия при низких концентрациях оказался активным ингибитором синтеза холестерина. Доза, вызывающая 50 %-ное угнетение синтеза, составляла 46 мг/кг. Близкие результаты получены в опытах на собаках.
Как видно из приведенных формул соединений, угнетающих синтез холестерина, все они относятся к группе лактонов гексагидронафталина, имеющих различные заместители, причем открытые кислотные формы более активны.
ИНГИБИТОРЫ ТРАНСФЕРАЗ
Ингибитор аспартатаминотрансферазы (КФ 2.6.1.1) синтезируется культурой Str. sumanensis nov. sp. NK-23 [Murao, Nishino, 1983]. При выращивании на среде, содержащей (в %) глюкозу — 2,0, мясной экстракт — 1,0, полипептон — 1,0, NaCl — 0,25, pH 7,2, ингибитор накапливался вне клеток через 60—64 ч. После удаления мицелия в фильтрат культуральной жидкости при кислом значении pH добавляли активированный уголь, 81
на котором сорбция ингибитора не происходила. Несорбированную фракцию упаривали до состояния сиропа под вакуумом и растворяли в минимальном количестве воды. После добавления метанола до конечной концентрации 70 об.% осадок удаляли центрифугированием. Активное начало содержалось в осадке, полученном после добавления метанола к супернатанту до концентрации 80 об.%. Осадок растворяли в воде и далее вели фракционирование на колонке с Дауэксом-50Ш X 4 (в Н+-форме) и десорбировали 2,8 %-ным водным раствором аммиака. Активная фракция была перенесена на колонку с Дауэксом 1X4 (в ОН“-форме), предварительно уравновешенным 50 мМ буфером ΝΗ4ΟΗ—NH4C1, pH 10,0. Ингибитор был элюирован линейным градиентом NH4Cl (0,05—1 М). Окончательную очистку активного вещества проводили на активированном угле при элюции водой и последующем обессоливании путем гель-фильтрации. Кристаллизацию ингибитора проводили из водного метанола. Полученное вещество, названное «гостадин», представляет собой 5-амино-2-карбокси-4-оксо- 1,4,5,6-тетрагидропиридин-З-ацетат [Murao, Nishino et al., 1981].
Препарат был испытан на фермент, выделенный из сердца свиньи. Он проявлял активность, угнетая аланинаминотрансферазу (КФ 2.6.1.2), не действовал на глутаматдегидрогеназу из печени свиньи и глутамат- синтазу из мозга овцы.
При изучении влияния компонентов среды на синтез гостатина [Murao, Nishina, 1983] показано, что только глюкоза в 3—5 %-ной концентрации обеспечивает удовлетворительную активность. Не рекомендуется использовать глицерин, растворимый крахмал, ацетат и цитрат в качестве источников углерода. Только азот органических соединений пригоден в качестве азотсодержащего компонента среды. Исходя из структуры, полагали, что аланин и глутаминовая кислота могут быть прямыми метаболическими предшественниками гостатина. Однако они не стимулировали увеличение выхода и не включались в молекулу ингибитора.
Ингибитор неспецифической N-метилтрансферазы. Соединение, угнетающее N-метилирование триптамина препаратом метилтрансферазы из легких кролика, было найдено в фильтрате культуральной жидкости Actinomyces MD 736-С5 [Kumada et al., 1974]. По химической природе оно является 1 - [2- (3,4,5,6-тетрагидропиридил) ] -1,3-пентадиеном.
Установлены величины А. с триптамином (2,4 · 10“5 М) и S-аденозил- метионином (3,0 · 10“5 М). Активность катехол-О-метилтрансферазы не ингибирует. Имеет высокую токсичность (LD50 = 5,9 мг/кг).
82
ИНГИБИТОРЫ ЛИАЗ
Специфический ингибитор гистидинкарбоксилазы (КФ 4.1.1.22) был найден в культуре Pyricularia штамм Fe-178 [Umezawa, Shibamoto et al., 1974].
Ингибитор содержится в мицелии и фильтрате культуральной жидкости.
Из мицелия вещество экстрагируется метанолом, из фильтрата культуральной жидкости —бутилацетатом при pH 2,0. После перевода продукта из кислой среды в водную щелочную и вновь в кислую органическую дальнейшее фракционирование проводили на силикагеле и окончательно выделяли чистое вещество на сефадексе LH-20. Чистое вещество, обладающее ингибирующим эффектом, получило название «леканоровая кислота».
Леканоровая кислота и ее аналог, содержащий пептидную связь: N-(2-4-диоксибензоил) -4-аминосалициловая кислота
Леканоровая кислота является конкурентным ингибитором в опытах с гистидином (Ki = 6,9 · 10”7 М) и неконкурентным — с пиридоксальфосфатом (Ki =1,1 · Ю~5 М). Леканоровая кислота эффективна только в опытах in vitro, при введении в организм животного происходит гидролиз ее эфирной связи, она разрушается и теряет активность. Декарбоксилазу ароматических аминокислот леканоровая кислота не угнетает. Аналог лека- норовой кислоты, содержащий пептидную связь, — N- (2,4-диоксибензоил) - 4-аминосалициловая кислота — имеет Ki = 3,3 · 10“8 М в опытах с гистидином, т. е. является более эффективным.
Ингибиторы глиоксилазной системы. Глиоксилазная система состоит из двух ферментов: глиоксилазы I (КФ 4.4.1.5) и глиоксилазы II (КФ 3.1 '2.6). Первый фермент относится к классу лиаз и имеет несколько названий: лактоил-глутатионлиаза, метилглиоксилаза, альдокетомутаза. Этот фермент осуществляет следующую реакцию: S-D-лактоил-глутатион = глутатион + + метилглиоксаль. Второй фермент принадлежит к классу гидролаз. Другое его название — «оксиацилглутатионгидролаза». Под его воздействием происходит гидролиз S-2-оксиацилглутатиона до глутатиона и 2-оксикислоты. Один из метаболитов функционирующей глиоксилазной системы — метилглиоксаль, широко распространен в клетках, реагирует с сульфгидрильной группой восстановленного глутатиона и может играть роль в регуляции роста клеток.
Известно также, что α-кетоальдегиды, включая метилглиоксаль, обладают канцеростатической активностью, в частности сильно угнетают рост асцитной карциномы, опухоли молочной железы, аденокарциномы, лейкоза, лимфокарциномы и саркомы мышей. Однако α-кетоальдегиды, в частности метилглиоксаль, легко превращаются в соответствующие неактивные а-окси- кислоты за счет активности глиоксилазной системы в клетках организма.
83
Таким образом, метилглиоксаль вступает в следующую систему реакций:
Основываясь на наблюдениях, что глутатион необходим для клеточного деления и что опухолевые клетки дефицитны по метилглиоксалю, было постулировано [Egyod, Szent-Györgyi, 1966], что глиоксилазная система, участвующая в регуляции роста и деления клеток, зависит от концентрации метилглиоксаля. В связи с этим Сент-Дьердь и Эгед предложили гипотезу, согласно которой повышенная глиоксилазная активность может вызвать неконтролируемый рост клеток. Отсюда следует, что задержать рост может ингибитор глиоксилазной системы; это позволит сохранить определенный уровень метилглиоксаля в клетках. При поиске ингибиторов было обследовано 449 культур бактерий, 390 дрожжей, 639 грибов, в частности 339 базидиомицетов. Субстратом при поиске ингибитора был супернатант гомогената печени крысы. При культивировании на среде, содержащей (в %) глюкозу — 4,0, полипептон — 0,5, дрожжевой экстракт — 0,3, КН2РО4 — 0,3, MgSO4 · 7Н2О— 0,1, при температуре 26—30° на 4— 6-е сутки после полной утилизации глюкозы в фильтрате культуральной жидкости и в биомассе одного из базидиальных грибов, штамма К 1001, отмечается ингибирующая активность [Kurasawa, Takeuchi, Umezawa, 1975]. Из фильтрата культуральной жидкости вещество экстрагировали бутилацитатом при pH 2,0, из мицелия — метанолом. После упаривания и подкисления из метанола вещество также переводили в бутилацетат. Дальнейшие операции по очистке проводили при помощи органических растворителей. Выделенное вещество (Глио-I) представляло собой 3'-4'-диоксиметил-5'-окси-6'-(3-метил-2-бутецил) -фенил-2,4-диокси-6-метил- бензоат [Kurasawa, Naganawa et al., 1975]. Вещество обладает низкой токсичностью (125 мг/кг мыши при внутрибрюшинном введении в 20 %-ном ди мети л сульфокси де), угнетает рост клеток саркомы Иосиды крысы в культуре тканей. Существенным недостатком с точки зрения перспектив практического использования является легкая гидролизуемость эфирной связи в опытах in vivo. Вследствие этого ингибирующий эффект отсутствует.
Другой ингибитор был выделен и очищен из культуры, близкой к Str. griseosporus [Takeuchi et al., 1975]. Ингибитор угнетает обе глиоксилазы. В опытах in vitro проявляет сильное угнетение роста клеток HeLa асцитной карциномы Эрлиха и саркомы Иосиды крысы. Вещество получило название Глио-П. Его структура — (4R, 5R, 6Р)-2-кротонилоксиметил-4,5,6-триокси- циклогекс-2-енон. Предложен механизм ингибирования глиоксилаз этим веществом, в системе участвуют соединения с сульфгидрильной группой, в частности глутатион.
Механизм ингибирования глиоксилаз ингибитором Глио-II
84
ИНГИБИТОРЫ ПЕПТИДНОЙ ПРИРОДЫ, ОТНОСЯЩИЕСЯ К АНТИБИОТИКАМ
К числу пептидов, являющихся ингибиторами ферментативных реакций, следует отнести также вещества, принадлежащие к антибиотикам. Они были первоначально идентифицированы как ингибиторы роста микроорганизмов, а позже был установлен механизм их действия [Korzybski et al., 1978].
Тормозит синтез белков боттромицин Л2, связываясь с 50S субчастицами рибосом и угнетая реакцию транспептидации, т. е. образование пептидной связи в белке. Боттромицин А2 является одним из пяти структурно близких пептидных соединений, состоит из р-метил-L-фенилаланина, L-ß-ß-диметил- α-аминомасляной кислоты, L-валина, цис-З-метил-L-пролина, ß-2-тиазолил- ß-аланина, глицина и А’-изокапроновой кислоты.
Негамицин синтезируют несколько штаммов Str. purpeofuscus. Антибиотик выделен из фильтрата культуральной жидкости ионообменными методами. Негамицин является специфическим ингибитором синтеза белков в культуре Е. coli К-12, угнетая инициацию образования пептидной цепи. Негамицин имеет следующую структуру.
Ингибитором транслокации является антибиотик сиомицин А, выделенный из мицелия Str. sioyaensis. Антибиотик взаимодействует с 50S субчастицами рибосом и влияет на реакцию гидролиза ГТФ 50S субчастицами, которая осуществляется в 70S рибосомах с участием эукариотического G-фактора элонгации (EF-G-фактора). Сиомицин А угнетает эту реакцию, подавляя образование комплекса EF-G-фактора—ГТФ.
Ниже приведена структура сиомицина А, где ОХ — 4-(а-оксиэтил)- 8-оксихинальдиновая кислота, ДеАла — дегидроаланин, АцТЗ — 2-(1'-ами- ноацетонил)-тиазоло-4-карбоновая кислота:
Полипептидом основного характера является антибиотик эдеин, синтезируемый Bac. brevis Vm 4. Антибиотик содержит два родственных основных компонента — эдеин А и эдеин В, которые, вероятно, имеют сходный механизм действия. Исследовался преимущественно эдеин А. В интактных клетках Е. coli эдеин сильно подавляет синтез ДНК, стимулирует синтез РНК и не влияет на синтез белка. По-видимому, антибиотики действуют 85
на фермент ДНК-полимеразу, поскольку с ДНК in vitro эдеин не связывается. Кроме того, эдеин может действовать как специфический ингибитор инициации полипептидной цепи in vitro, хотя неизвестно, имеет ли какое-либо значение этот эффект для биологической активности антибиотика.
Из других соединений, имеющих пептидную природу и также осуществляющих угнетение синтеза белка на различных этапах транскрипции и трансляции, следует назвать стафиломицин (вирджиниамицин), годида- мицин, спорангиомицин, мультиомицин, которые, однако, не получили распространения и не приобрели практического значения.
На основании анализа структуры антибиотиков и структуры молекул, являющихся их мишенью, было высказано предположение о характере их взаимодействия и дан прогноз о свойствах полипептидов, которые могут рассматриваться как потенциальные ингибиторы. Отмечается, что взаимодействие между ферментом и ингибитором полипептидной природы в основном происходит в результате гидрофобных и ван-дер-ваальсовых взаимодействий, особенно если ингибиторы богаты неполярными аминокислотами. Применительно к изученным антибиотикам пептидной природы считается, что большое количество низкоэнергетических взаимодействий может быть столь же эффективно для связывания ингибитора с мишенью, как и присутствие единственного ацилирующего или алкилирующего центра. В этом случае молекула должна быть достаточно большой, чтобы обеспечить необходимые множественные взаимодействия, и, кроме того, пептид должен сохранять жесткую конформацию для достижения очень точного наложения взаимодействующих атомов. Это в свою очередь приводит к образованию внутри самого полипептидного антибиотика большого количества связей такого же типа, как и связи между ингибитором и мишенью. Свойства полипептидных антибиотиков, исследованных до сих пор, свидетельствуют о том, что эффективные молекулы такого типа должны содержать по меньшей мере 10 аминокислотных остатков, чтобы иметь достаточное количество потенциальных реакционноспособных групп; они должны иметь также достаточную жесткость конформации, чтобы точно связаться с мишенью [Gale et al., 1972]. Изложенная выше точка зрения не может быть признана универсальной для всех ныне известных ингибиторов полипептидной природы. В частности, есть примеры, когда стойкий ингибирующий эффект имеют соединения с числом аминокислотных остатков менее 10.
ЗАКЛЮЧЕНИЕ
Большая разнообразная по структуре и функциям группа биологически активных соединений, ингибиторов ферментных реакций, очевидно, далеко не исчерпывается представленными здесь соединениями. Можно ожидать, что будут найдены ингибиторы ферментов, относящихся к классам изомераз и лигаз. При изучении ингибирующей активности микробных метаболитов наметились два направления поисков, обусловленных поставленными задачами. В одном из них в качестве субстратов ингибирования используются ферменты, синтезированные самой клеткой одновременно с ингибитором, в другом — широко распространенные коммерческие ферментные препараты — представители различных классов и групп ферментов. Вероятно, правомочны оба подхода в зависимости от поставленной цели. С точки зрения анализа физиологической функции большой интерес представляют работы, где субстратом служит один из ферментов продуцента ингибитора. Однако для оценки механизма воздействия весьма полезным бывает субстрат с известной первичной структурой. При характеристике специфичности ингибитора обычно стараются использовать максимально возможное число имеющихся различных по структуре субстратов. В наших работах [Безборо- дрв, 1978; Bezborodov, 1980], в работах Холцера и сотр. [Holzer, 1975] поиск ингибиторов ферментов среди микробных метаболитов основан на концепции одновременного присутствия в культуре ингибиторов и ингибируемых ферментов.
Из представленных материалов видно, что ингибиторы имеют внутри- и внеклеточную локализацию и в опытах in vitro обладают четко выраженным ингибирующим эффектом относительно определенных ферментов. Неоднозначен пока ответ на вопрос о функциях ингибиторов в клетках даже относительно ингибиторов протеаз, для которых выполнены наиболее обстоятельные исследования. Во-первых, нет надежных доказательств локализации ингибиторов в клетке. Во-вторых, появляются данные, свидетельствующие о достаточно продолжительном времени существования индивидуальных белков клетки. В-третьих, вероятно, для эукариотических клеток можно принять гипотезу о лизосомном расщеплении внутриклеточных белков, которая в последнее время получила экспериментальное подтверждение [Dean, 1980].
Низкомолекулярные ингибиторы представлены разными классами химических соединений. Выделить какую-либо характерную особенность в их структуре не представляется возможным. Привлекают внимание данные об ингибиторах-олигосахаридах. Характер их взаимодействия с ферментом остается открытым.
Надо полагать, что многие из поставленных здесь вопросов получат разрешение в ближайшие годы.
ЛИТЕРАТУРА
Андреева Н. А., Черменский Д. И., Безбородов А. Μ. Очистка внеклеточного ингибитора трипсина из Actinomyces janthinus 118. — Прикл. биохимия и микробиология, 1978, т. 4, № 1, с. 25—31.
Андреева И. А., Черменский Д. И. Стабильность и специфичность внеклеточного белкового ингибитора трипсина из Act. janthinus 118. — Биохимия, 1979, т. 44, № 5, с. 838—843.
Баскакова А. А., Балдина А. В., Безбородов А. Μ. Белковый ингибитор внеклеточной ДНКазы Act. levoris 2789. — Микробиология, 1972, т. 41, № 1,
с. 77—82.
Безбородов А. Μ. Биосинтез микроорганизмами ингибиторов ферментов белковой природы. — Прикл. биохимия и микробиология, 1978, т. 14, № 1, с. 5—10.
Безбородов А. Μ., Андреева Н. А., Черменский Д. И. Ингибиторы лизоцима из культур актиномицетов. — В кн.: V съезд Всесоюз. микробйол. о-ва. Секция: Физиология микробов и техническая микробиология. Ереван, 1975, с. 13.
Безбородов А. Μ., Андреева И. А., Черменский Д. И., Петрова Η. Т. Поиск актиномицетов — продуцентов ингибиторов протеолитических ферментов. — Микробиология, 1977, т. 46, № 2, с. 232— 238.
Безбородов А. Μ., Баскакова А. А., Балдина А. В. Выделение и очистка внеклеточной дезоксирибонуклеазы Actinomyces levoris 2789. — Прикл. биохимия и микробиология, 1968, т. 4, № 3, с. 295— 301.
Безбородов А. Μ., Медведева Т. Н., Дислер Е. И. и др. Влияние некоторых факторов на образование фузариновой кислоты Fusarium oxysporium 53382. — Прикл. биохимия и микробиология, 1979,
т. 15, № 1, с. 40—43.
Вертеси Л. Ф., Трипиер Д. Является ли активным участком пептидных ингибиторов α-амилазы пентапептид, входящий в состав кольца? Выделение и установление структуры нового ингибитора амилазы AI-3688, гомологичного тенда- мистату. — В кн.: Тез. докл. 16-й конф. ФЕБО. Μ., 1984, с. 322.
Горбачева И.-Μ. В., Кебекбаева КМ. Безбородов А. Μ. Отбор культур микро- 88 скопических грибов, синтезирующих ингибиторы фосфомоноэстераз. — Микробиология, 1983, т. 52, вып. 5, с. 755—УбО.
Давранов К., Ахмедова 3. Р., Безбородов А. Μ. Выделение ингибитора липаз из гриба Rhizopus microsporus. — Химия природ, соединений, 1983, № 3,
с. 373—375.
Давранов К., Рахимов Μ. Μ. Природа множественных форм липазы Rhizopus microsporus. — Биохимия, 1981, т. 46, № 2, с. 250—255.
Зигель Μ., Безбородов А. Μ. Внутриклеточные рибонуклеазы Penicillium Ьге- vi-compactum и их природные ингибиторы. — Прикл. биохимия и микробиология, 1981, т. 17, № 2, с. 203—209.
Иванова Г. С. Сравнительное исследование внутриклеточных и внеклеточных рибонуклеаз грибов Aspergillus clavatus и Penicillium claviforme: Автореф. дис.. . .д-ра биол. наук. Пущино: ИБФМ, 1981. 35 с.
Иванова Г. С., Безбородов А. Μ. Специфический ингибитор рибонуклеазы Act. clavatus 1816. — Микробиология, 1972,
т. 41, № 2, с. 224—230.
Иванова Г. С., Сайманова Р. А. Ингибиторы нуклеаз микроорганизмов. — В кн.: Нуклеазы микроорганизмов. Μ.: Наука, 1974, с. 282—289.
Кольцова С. В., Гликина Μ. В., Илларионова И. Г., Самсонов Г. В. Образование водорастворимых молекулярных комплексов в системе трипсин —полиметакриловая кислота. — Молекуляр. биология, 1971, т. 5, вып. 2, с. 225—231.
Медведева Т. Н. Микробиологическое получение фузариновой кислоты и синтез ее производных: Автореф. дис. . . . канд. биол. наук. Μ.: Моск, технол. ин-т пищ. пром-сти, 1983. 15 с.
Медведева Т. И., Безбородов А. Μ., Желудкова Μ. Д., Жданова Η. Ф., Кудрин А. И. Синтез и фармакологическая активность фузариновой кислоты и ее производных. — Хим.-фармацевт, журн., 1978, т. 12, № 5, с. 66—69.
Мосолов В. В. Протеолитические ферменты. М,: Наука, 1971. 250 с.
Мосолов В. В. Природные ингибиторы протеолитических ферментов. — Успехи биол. химии, 1982, т. 22, с. 100—118.
Мосолов В. В. Белковые ингибиторы как регуляторы процессов протеолиза: Баховское чтение. Μ.: Наука, 1983. 40 с.
Стрельцова 3. А., Браудо Е. Е., Тол- стогузов В. Б. Исследование влияния полианионов на каталитические свойства а-химотрипсина. — Биоорган. химия, 1975, т. 1, № 2, с. 267—272.
Черменский Д. Н., Грищенко В. Μ., Андреева Н. А. Аминокислотный состав и химическая модификация функциональных групп ингибитора протеаз (ИТ-AjI) из Actinomyces janthinius 118. — Биохимия, 1979, т. 44, № 11, с. 1981 — 1987.
Яковлева Е. П., Рожанская Т. И., Левит Ж. Д. и др. Ингибитор фосфолипазы C из Streptoverticillium mycohepti- nicum. — Прикл. биохимия и микробиология, 1984, т. 20, № 3, с. 349—354.
Alberts A. №., Chen Kuron G. et al. Mevinolin: A highly potent competitive inhibitor of hydroxymethylglutaril-coenzy- me A reductase and a cholesterol-lowering agent. — Proc. Nat. Acad. Sei. US, 1980, vol. 77, N 7, p. 3957—3961.
Aoshima H. Inactivation of Strepto- myces subtilizin inhibitor by chemical modification. — Biochim. et biophys. acta, 1976, vol. 453, p. 139—150.
Aoyagi T., Hazato T., Kumagai Μ. et al. Isoflavone rhamunoside, inhibitors of ß-galactosidase produced by Actino- mycetes. — J. Antibiot., 1975, vol. 28, N 12, p. 1006—1008.
Aoyagi T., Miyata S., Nanbo Μ. et al. Biological activities of leupeptins. — J. Antibiot., 1969, vol. 22, N 4, . 558—568.
Aoyagi T., Tobe H., Kojima F et al. Amastatin, an inhibitor of aminopeptidase A, produced by Actinomycetes. — J. Antibiot., 1978, vol. 31, N 6, p. 636—638.
Aoyagi T., Yagisawa Μ., Kumagai Μ. et al. An enzyme inhibitor, panosialin, produced by Streptomyces. — J. Antibiot., 1971, vol. 24, N 12, p. 860—869.
Aoyagi T., Yamamoto T., Kojiri K. et al. Forphenicine, an inhibitor of alkaline phosphatase produced by Actinomycetes. — J. Antibiot., 1978, vol. 31, N 3, p. 244—246.
Aral Μ., Sumida Μ., Nakatani S., Murao S. A novel ß-amylase inhibitor. — Arg. and Biol. Chem., 1983, vol. 47, N 1, p. 183—185.
Argi/rafo’s-Vomvoyannis Μ., Vom- voyanni V. Time dependent increase of ribonuclease activity in Neurospora cras- sa. — In: 7th meet. FEBS. Varna, 1971, p. 131, ref. 263.
Aschauer H., Vértesy L., Braunit- zer G. Die Sequenz des a-Amylaseinhibi- tors Hoe-467A (a-Amylaseinaktivator Hoe-467A) aus Streptomyces tendae 4158. — Hoppe-Seylers Ztschr. physiol. Chem., 1981, Bd. 362, N 4, S. 465—467.
Beck /., Finn G., Wolf D. H. The intracellular proteinases and their inhibitors in yeast: A mutant with altered regulation of proteinase a inhibitor activity. — J. Biol. Chem., 1980, vol. 255, N 10, p. 4821—4828.
Betz H. Levels and turnover of the proteinase В inhibitors in yeast. — Biochim. et biophys. acta, 1975, vol. 404, p. 142—151.
Betz H., Hinze H., Holzer H. Isolation and properties of two inhibitors of proteinase В from the yeast. — J. Biol. Chem., 1974, vol. 249, N 14, p. 4515—4521.
Bezborodov A. Μ. Specific proteins of microorganisms as regulators of enzyme activity. — Actinomycetes and related organisms, 1980, vol. 15, N 4, p. 178—191.
Bezborodov A. Μ., Andreeva N. A., Chermensky D. N. Protein inhibitors from actinomycetes. — In: Fifth Intern, ferment. symp. Abstr. B., 1976, p. 238.
Bezborodov A. Μ., Siegel Μ. Intracellular ribonucleases from Penicillium brevi- compactum and their natural inhibitors. — In: Metabolism' and enzymology of nucleic acids, Br., 1982, vol. 4, p. 97—110.
Biedermann K-, Montali U., Martin B. et al. The amino acid sequence of proteinase a inhibitor 3 from baker's yeast. — Carlsberg. Res. Commun., 1980, vol. 45, N 4, p. 225—235.
Blobel G., Walter P., Chung Nan Chang et al. Translocation of proteins across membranes: The signal hypothesis and beyond. — In: Secretory mechanisms. Soc. for exp. biol. symp. Cambridge: Univ, press, 1979, p. 9—36.
Banning P., Holzer H. Nature occu- rence and chemical modification of pro^ teinase В inhibitors from yeast. — J. Biol. Chem., 1977, vol. 252, N 15, p. 5316—5323.
Cabib E., Ulané R. Chitin synthetase activating factor from yeast a protease. — Biochem. and Biophys. Res. Communs, 1973, vol. 50, p. 186—191.
Chaen H., Ueda S. Enzymatic modification of amylase inhibitor produced by Streptomyces sp. N 280. — Agr. and Biol. Chem., 1979, vol. 43, N 11, p. 2265—2272.
Crimaldi A., Ihler G. Isolation and properties of an inhibitor of E. coli RNA polimerase. — Europ. J. Biochem., 1976, vol. 71, p. 201—206.
Dattagupta J. K-, Fujiwara T., Grishin E. V. et al. Crystallization of the fungal enzyme proteinase К and amino acid composition. — J. Mol. Biol., 1975, vol. 97, N 2, p. 267—271.
89
Dean R. T. Lysosomes and protein degradation. — In: Protein degradation health and disease. Amsterdam etc., 1980, p. 139—149.
De Robertis E. Μ., Ezcurra P. Μ., Judewicz N. D. et al. Inhibitor of E. coli RNA polymerase by polyadenylic acid. — FEBS Lett., 1972, vol. 25, N 1, p. 175—178.
Destay D., Mclnnes A. G.,Smith D. G., Vining L. C. Use of 13C in biosynthesis studies: Incorporation of isotopically labeled acetate and aspartate into fusaric acid. — Canad. J. Biochem., 1968, vol. 46, p. 1293—1300.
Dobson T. A., Destay D., Brewer D., Vining L. C. Biosynthesis of fusaric acid in cultures of Fusarium oxysporum schlecht. — Canad. J. Biochem., 1967, vol. 45, p. 809—823.
Ehner E., Maier K. L. A protein inhibitor of mitochondrial adenosine triphosphatase (FJ from Saccharomyces cerevisiae. — J. Biol. Chem., 1977, vol. 252, p. 671—676.
Egyod L. G., Szent-Gyorgyi A. Cell division, SH-ketoaldehydes and cancer. — Proc. Nat. Acad. Sei. US, 1966, vol. 55, p. 388—393.
Endo A., Kuroda Μ., Tsujta Y. ML- 236A, ML-236B and ML-236C, new inhibitors of cholesterogenesis produced by Penicillium citrinum. — J. Antibiot., 1976, vol. 29, N 12, p. 1346—1348.
Enomoto J., Furutani J., Naganawa H. et al. Isolation and characterization of PDE-I and II the inhibitors of cyctic ade- nosine-3',5'-monophosphate phosphodiesterase. — Agr. and Biol. Chem., 1978, vol. 42, N 7, p. 1331 — 1336.
Everse K. E., Everse J., Simeral L. S. Bacillus subtilis NADase and its specific protein inhibitor. — In: Methods in enzymology. N. Y. etc., 1980, vol. 66. Vitamins and coenzymes, pt E, p. 137—144.
Ferguson A. R., Katsunuma T., Betz H., Holzer H. Purification and properties of an inhibitor of the tryptophan- synthase-inactivating enzymes in yeast. — Europ. J. Biochem., 1973, vol. 32, p. 444— 450.
Finkenstadt W. R., Laskowski Μ. Peptide bond cleavage in trypsintrypsin inhibitor complex formation. — J. Biol. Chem., 1965, vol. 240, p. C962.
Fischer E. P., Holzer H. Interaction of proteinases and their inhibitors from yeast: Activation of carboxypeptidase Y. — Biochim. et biophys. acta, 1980, vol. 615, N 1, p. 187—198.
Fujiwara K., Inoye K-, Tonomura B. et al. Interaction of thiolsubtilisin with Streptomyces subtilisin inhibitor, SSL — J. Biochem., 1977, vol. 82, N 1, p. 125—130. 90
Fukamura Μ., Satoi S., Kuwana N., Murao S. Structure elucidation of new pepsin inhibitor (S-PI). — Agr. and Biol. Chem., 1971, vol. 35, N 12, p. 1310—1312.
Fukuhara K., Katsura Μ., Murao S. Purification and some properties of talo- peptin ^VIK-I), a novel proteinase inhibitor produced by Streptomyces mozumensis MK-23. — Agr. and Biol. Chem., 1982, vol. 46, N 6, p. 1707—1710.
Fukuhara K., Mural H., Murao S. Amylostatins, other amylase inhibitors produced by Streptomyces diaststicus subsp: Amylostaticus N 2476. — Agr. and Biol. Chem., 1982, vol. 46, N 8, p. 2021 — 2030.
Furutani Y., Shimada Μ., Hamada Μ. et al. Reticulol, an inhibitor of cyclic nucleotide phosphodiesterases. — Agr. and Biol. Chem., 1977, vol. 41, N 6, p. 989—993.
Gale E. F., Cundliffe E., Reynolds P. E. et al. The molecular basis of antibiotic action. N. Y. etc.: Wiley, 1972. 572 p.
Glaser Ch. B., Chamorro Μ., Crowley R. et al. The isolation of alpha-1-protease inhibitor by unique procedure for industrial application. — Anal. Biochem., 1982, vol. 124, N 2, p. 364—371.
Goto A., Matsui Y., Ohyama K. et al. Purification and characterization of an α-amylase inhibitor (Haim) produced by Streptomyces griseosporeus YM-25. — Agr. and Biol. Chem., 1983, vol. 47, N 1, p. 83—88.
Goto A., Matsui Y., Ohyama K-, Murao S. Hog pancreatic α-amylase inhibitor (Haim) from Streptomyces griseosporeus. — J. Jap. Soc. Starch. Sci.„ 1980, vol. 27, N 2, p. 91—96.
Hamelik R. Μ., McGabe Μ. Μ. An endodextranase inhibitor from bath cultures of Streptococcus mutant. — Biochem. and Biophys. Res. Communs, 1982, vol. 106, N 3, p. 875—880.
Hanada K-, Tamai Μ., Yamagishi Μ. et al. Isolation and characterization of E-64, a new thiol protease inhibitor. — Agr. and Biol. Chem., 1978, vol. 42, N 3, p. 523—528.
Harada I., Takeuchi H., Tasumi Μ. et al. Raman spectroscopic study of Streptomyces subtilisin inhititor. — J. Raman Spectrosc., 1982, vol. 13, N 3, p. 276— 279.
Hartley R. W. Derivates of Bacillus amyloliquefaciens ribonuclease (barnase) isolated after limited digestion by carboxypeptidase A and B. — Biochem. and Biophys. Res. Communs, 1970, vol. 40, N 2, p. 263—270.
Hartley R. W., Rogerson D. L. Pro-
duction and purification of the extracellular rubonuclease of Bac. amyloliquefa- ciens (barnase) and its intracellular inhibitor (Barstar). I. Barnase. — Prep. Bio- chem., 1972, vol. 2, p. 229—242.
Hartley R. W., Rogerson D. L., Smeaton I. R. Production and purification of the extracellular ribonuclease of Bac.
amyloliquefaciens (Barnase) and its intracellular inhibitor (Barstar). II. Barstar. — Prep. Biochem., 1972, vol. 2, p. 243—250.
Hasilik A., Holzer A. Participation of the tryptophan synthase inactivating system from yeast in the activation of chitin synthase. — Biochem. and Biophys. Res. Communs, 1973, vol. 53, N 3, p. 552—559.
Hayashi R., Hata T. Yeast pro-proteinase C. Pt IV. Activation by yeast proteinase A and activation mechanism. — Agr. and Biol. Chem., 1972, vol. 36, N 4, p. 630—638.
Hayashi R., Minami Y., Nata T. Yeast pro-proteinase C. Pt III. The activation by protein denaturants. — Agr. and Biol. Chem., 1972, vol. 36, N 4, p. 621—629.
Hayashi R., Oka Y., Hata T.Yeast proproteinase C. Pt II. Isolation and some physicochemical properties. — Agr. and Biol. Chem., 1969, vol. 33, N 2, p. 196— 206.
Hazato T., Kumagai Μ., Naganawa H. et al. p-Hydroxyphenylacetaldoxime, an inhibitor of ß-galactosidase, produced by Actinomycetes.—J. Antibiot., 1979, vol. 32, N 1, p. 91—92.
Hiromi K., Inoye K., Uehara Y., Tono- mura B. Static and kinetic studies of the interaction between a proteinase ^ubtili- sin BPN') and a protein proteinase inhibitor (Streptomyces subtilisin inhibitor, SSI).— Stud, biophys., 1980, vol. 81, N 2/3, p. 115—116.
Holzer H. Regulatory role of proteinases and proteinase inhibitors in yeast. — In: Proc. 9th FEBS meet. Bp.,
1974, p. 87.
Holzer H. Chemistry and biology of macromolecular inhibitors from yeast activity on proteinases A and В and carboxypeptidase Y. — Adv. Enzyme RegiL,
1975, vol. 13, p. 125—134.
Hori Μ., Hemmi H., Suzukake K-, Hayashi H. Biosynthesis of leupeptine. — J. Antibiot., 1978, vol. 31, N 1, p. 95—98.
Hussian Μ., Ozawa Y., Ichihara S., Mizushima S. Signal peptide digestion in Escherichia coli: Effect of protease inhibitors on hydrolysis of the cleaved signal peptide of the major outermembrane lipoprotein. — Europ. I. (Y) Biochim., 1982, vol. 129, N 1, p. 233—239.
Ikenaka T., Odani S., Sakai Μ. et al. Amino acid sequence of an alkaline proteinase inhibitor (Streptomyces subtilisin inhibitors) from Streptomyces albo-griseo- lus S-3253. — J. Biochem., 1974, vol. 76, N 7, p. 1191 — 1209.
Inouye K., Tonomura B., Hiromi K. The effect of sodium dodecyl sulfate on the structure and function of a protein proteinase inhibitor, Streptomyces subtilisin inhibitor. — Arch. Biochem. and Biophys., 1979, vol. 192, N 1, p. 260—269.
Inouye K., Tonomura B., Hiromi K. et al. The stoichiometry of inhibition and binding of a protein proteinase inhibitor from Streptomyces (Streptomyces subtilisin inhibitor) against subtilisin BRN — J. Biochem., 1977, vol. 82, N 4, p. 961 — 967.
Ito K. Protease inhibitors inhibit production of protein I of the outer membrane in Escherichia coli. — Biochem. and Biophys. Res. Communs, 1978, vol. 82, N 1, p. 99—107.
Itoh J., Omoto S., Shomura T. ét al. Oligostatins, new antibiotics with amylase inhibitory activity. I. Production, isolation and characterization. — J. Antibiot., 1981, vol. 34, N 11, p. 1424—1428.
Ivanova G. S., Bezborodov A. Μ. Natural regulation of intracellular ribonuclease activity of Aspergillus clavatus. — Folia microbiol., 1973, vol. 18, N 2, p. 212—222.
Iwasa J., Jonemitsu K., Matsui К. et al. A headstable inhibitor protein for bovine brain cyclic nucleotide phosphodiesterase from E. coli. — FEBS Lett., 1981, vol. 129, N 2, p. 311—314.
Joubert J., Kruger H., Townshend G. S., Botes D. P. Purification, some properties and the complete primary structures of two protease inhibitors (DE-3 and DE-4) from Macrotyloma axillare seed. — Europ. J. Biochem., 1979, vol. 97, p. 85—91.
Kafka Μ. S., Blumenthal R., Walker G. A. Dopamine-ß-hydroxylase induced conductance changes in bimolecular lipid membrans in the presence of Dopamine and Calcium. — Biophys. J., 1976, vol. 16, N 2, pt 2, p. 112a.
Kakinuma A., Sugino H., Moriya H., Isono Μ. Plasminostreptin, a protein proteinase inhibitor produced by Streptomyces antifibrinolyticus. I. Isolation and characterization. — J. Biol. Chem., 1978, vol. 253, N 5, p. 1529—1537.
Kasai N., Fukuhara K·, Murao S. Purification and some properties of FMPI, a novel/metallo-proteinase inhibitor produced by Streptomyces reshiriensis NK- 91
122. — Agr. and Biol. Chem., 1982, vol. 46, N 12, p. 2979—2985.
Katsunuma T., Schott E., Elsässer S., Holzer H. Purification and properties of tryptophan-synthase-inactiving enzymes from yeast. — Europ. J. Biochem., 1972, vol. 27, p. 520—526.
Kennedy Μ., Krag S., Lennarz W. Localization of phospholipase and its inhibitor in Bacillus subtilis. — Fed. Proc.,
1974, vol. 33, p. 1469.
Katagishi K., Hiromi K. Kinetics of binding between thermolysin and Streptomyces metalloprotease inhibitor, talopeptin 04K-I). — J. Biochem., 1983, vol. 93, N 1, p. 55—59.
Klar A. J. S., Halvorson H. 0. Proteinase activites of Sacharomyces cerevisiae during sporulation. — J. Bacteriol.,
1975, vol. 124, N 2, p. 863—869.
Klein G., Satre Μ., Vignais P. Natural protein ATPase inhibitor from Candida utilis mitochondria: Binding properties of the radiolabelled inhibitor. — FEBS Lett., 1977, vol. 84, N 1, p. 129—134. '
Koba У., Najima Μ., Ueda S. Further purification of amylase inhibitor produces by Streptomyces sp. — Agr. and Biöl. Chem., 1976, vol. 40, p. 1167—1173.
Korzybski T., Kowszyk-Gindifer Z., Kurylowicz W. Antibiotics, origin, nature and properties. Wash. (D. C.): Amer. Soc. Microbiol., 1978, Vol. 1—3. 2270 p.
Kowalski D., Leary T. R., McKee R. E. et al. Replacement, insertions and modifications of amino acid resudies in the reactive site of soybean trypsin inhibitor (Kunitz). — In: Bayer-Symp. V “Proteinase inhibitors“. B. etc.: Springer, 1974, p. 311—323.
Krag S., Lennarz W. Purification and characterization of an inhibitor of the phospholipase Aj in Bacillus subtilis. — J. Biol. Chem., 1975, vol. 250, N 8, p. 2813— 2822.
Kumada Y., Naganawa H., Hamada Μ. et al. 1 - [2- 0, 4, 5, 6) tetrahydpo- pyridyl)]-1,3-pentadiene an N-methyl- transferase inhibitor produced by actinomycetes. — J. Antibiot., 1974, vol. 27, N 9. p. 726—728.
Kumagai Μ., Aoyagi T., Umezawa H. Inhibitory activity of pyridindolol on ß-galactosidase. — J. Antibiot., 1976, vol. 29, N 7, p. 696—703.
Kumagai Μ., Sahara Y., Aoyagi T., Umezawa H. An enzyme inhibitor panosialin, produced by Streptomyces. — J. Antibiot., 1971, vol. 24, N 5, p. 870— 875.
Kunio O., Wenlii L., Ko A., Kenji S. Нейрамин — специфический ингибитор нейраминидаз вирусного происхождения, образуемый Streptomyces sr. — Хакко то тайяс, Amino Acid and Nucl. Acid, 1977, N 35, p. 76—90 Щит. по: РЖ Биол. химия, 4X35, 1978).
Kurasawa S., Naganawa Н., Takeuchi T., Umezawa H. The structure of MS-3: A glyoxylase I inhibitor produced by a mushroom. — Agr. and Biol. Chem., 1975, vol. 39, N 10, p. 2009—2014.
Kurasawa S., Takeuchi T., Umezawa H. Studies on glyoxalase inhibitor isolation of a new active agent, MS-3 from a mushroom culture. — Agr. and Biol. Chem., 1975, vol. 39, N 10, p. 2003— 2008.
Läget P., Smith J. B, Inhibitory properties of endogenous subunit ε in the E. coli Fj ATPase. — Arch. Biochem. and Biophys., 1979, vol. 197, N 1, p. 83—89.
Lampkin S. L., Cole K. W., Vitto A., Gaertner F. H. The protease problem in Neurospora. — Arch. Biochem. and Biophys., 1976, vol. 177, p. 561—565.
Laskowski Μ., Kato I. Protein inhibitors of proteinases. — Annu. Rev. Biochem., 1980, vol. 49, p. 593—626.
Lenney J. F. Three yeast proteins which inhibit three yeast proteases. — Fed. Proc., 1973, vol. 32, p. 659, abstr.
Lenney J. F. Three yeast proteins that specifically inhibit yeast proteases A, В and C.—J. Bacteriol., 1975, vol. 122, N 3, p. 1265—1273.
Lenney J. F., Dalbec J. Μ. Yeast proteinase B: Identification of the inactive form as an enzyme-inhibitor complex. — Arch. Biochem. and Biophys., 1969, vol. 129, p. 407—409.
Maeda K., Kawamura K., Kondo S. et al. The structure and activity of leupep- tins and related analogs. — J. Antibiot., 1971, vol. 24, N 3, p. 402—404.
Maier K-, Müller H., Holzer H. Purification and molecular characterization of two inhibitors of yeast proteinases B. — J. Biol. Chem., 1979, vol. 254, N 17, p. 8491—8497.
Maier K., Muller H., Tesch R. et al. Primary structure of yeast proteinases В inhibitor 2.—J. Biol. Chem., 1979a, vol. 254, N 24, p. 12555—12561.
Maier K-, Muller H., Tesch R. et al. Amino acid sequence of yeast proteinase В inhibitor 1 comparison with inhibitor 2. — Biochem. and Biophys. Res. Communs, 1979b, vol. 91, N 4, p. 1390—1398. .
Maki no O., Hawamura F., Saito H., Ikeda Y. Inactivation of the restriction endonuclease Bam Nx after infection with phage 0 N R2. — Nature, 1979, vol. 277, p. 64—66.
92
Matern H., Hoffmann Μ., Holzer H. Isolation and characterization of the carboxypeptidase Y inhibitor from yeast. — Proc. Nat. Acad. Sei. US, 1974, vol. 71, N 12, p. 4874—4878.
Matern H., Weiser U., Holzer H. Isolation, characterization and localization of the proteinase В inhibitor If from Saccharomyces carlsbergensis. — Europ. J. Biochem., 1979, vol. 101, N 2, p. 325— 332.
Mattle Ph., Wiemken A. The vacuole as the lysosome of the yeast cell. — Arch. J. Microbiol., 1967, vol. 56, p. 148—155.
Matsushima Kin-ichi. A note on a novel fungal alkaline proteinase inhibitor from Aspergillus oryzae. — Biochem. and Biophys. Res., Communs, 1979, vol. 90, N 4, p. 1142—1146.
Meyn Μ. S., Rossman T., Troll W. A protease inhibitor blocks SOS function on Escherichia coli: Antipain prevents λ repressor inactivation, ultraviolet mutagenesis and filamentous growth. — Proc. Nat. Acad. Sei. US, 1977, vol. 74, N 3, p. 1152—1156.
Millet K. J., Gregoire J. Characterization of an inhibitor of the intracellular protease from Bacillus subtilis. — Biochemie, 1979, vol. 61, N 3, p. 385—391.
Mitsui Y., Saton Y., Watenabe Y.f litaka Y. Crystal structure of a bacterial protein proteinase inhibitor (Streptomyces subtilisin inhibitor) at 2,6 A resolution. — J. Mol. Biol., 1979, vol. 131, p. 697—724.
Moris hi ma H., Takita T., Aoyagi T. et al. The structure of pepstatin. — J. Antibiot., 1970, vol. 23, N 2, p. 263—265.
Mucha J., Zelinkova E., Zelinka J. Ribonuclease inhibitor from Streptomyces aureofaciens. I. Purification and properties. — Biologia D (CSSR), 1983, vol. 38, N 12, p. 1177—1184.
Mucha J., Zelinkova E., Zelinka J. et al. Ribonuclease inhibitor from Streptomyces aureofaciens. II. Specificity. — Biologia D (CSSR), 1983a, vol. 38, N 12, p. 1185-1188.
Mukherjee Μ. Studies on T 1—2 trypsin inhibitor of Streptomyces griseus. — Canad. J. Biochem. and Cell Biol., 1983, vol. 61, N 11, p. 1228—1232.
Mukherjee Μ., Mukherjee K., Thanga- mani A. Trypsin inhibitor of Streptomyces griseus grown in a carbon nutrition medium. — Folia microbiol., 1982, vol. 27, N 6, p. 468-470.
Makherjee Μ., Thangamani A. Studies on trypsin inhibitors of Streptomyces griseus Cal. — Ind. J. Biochem. and Biophys., 1981, vol. 18, N 6, p. 437—439.
Murao S., Goto A., Matsui J., Ohyama K. New proteinous inhibitor (Haim) of animal α-amylase from Streptomyces griseosporus YM-25. — Agr. and Biol. Chem., 1980, vol. 44, N 7, p. 1679—1681.
Murao S., Kasai N., Kimura Y., Oda K. Isolation of metallo-proteinase inhibitor (FMPI) producing microorganism.— Agr. and Biol. Chem., 1982, vol. 46, N 11, p. 2697—2703.
Murao S., Miyata S. Isolation and characterisation of a new trehalose inhibitor, S-GI. — Agr. and Biol. Chem., 1980, vol. 44, N 1, p. 219—221.
Murao S., Nishina T. Isolation and identification of aspartate aminotransferase inhibitor producing microorganism. — Agr. and Biol. Chem., 1983, vol. 47, N 7, p. 1531 — 1535.
Murao S., Nishino T., Katayma N., Nagano H. New aspartate aminotransferase inhibitor (gostatin) produced by Streptomyces sumanensis nov. sp. NK- 23. — Agr. and Biol. Chem., 1981, vol. 45, N 4, p. 1039—1041.
Murao S., Oda K-, Koyama T. New metallo proteinase inhibitor produced by Streptomyces nigrescens TK-23: S-MPI. — Agr. and Biol. Chem., 1978, vol. 42, N 4, p. 899—900.
Murao S., Ohyama K. Chemical structure of an Amylase inhibitor S-AI. — Agr. and Biol. Chem., 1979, vol. 43, N 3, p. 679—681.
Murao S., Ohyama K-, Ogura S. Isolation of amylase inhibitor-producing microorganism. — Agr. and Biol. Chem., 1977, vol. 4L N 6, p. 919—924.
Murao S., Oouchi N., Goto A., Aral Μ. New proteinaceous α-amylase inhibitor (Paim) from Streptomyces corchorusii. — Agr. and Biol. Chem., 1983, vol. 47, N 2, p. 453—454.
Murao S., Sato S. S-SI, a new alkaline protease inhibitor from Streptomyces albo- griseolus S-3253. — Agr. and Biol. Chem., 1972, vol. 36, N 1, p. 160—163.
Murao S., Sato S., Muto N. Isolation of alkaline protease inhibitor producing microorganism. — Agr. and Biol. Chem., 1972, vol. 36, N 10, p. 1737—1744.
Nakano H., Tajiri T., Koba V., UedaS. Some properties of amylase inhibitor A produced by Streptomyces sp. N 280. — Agr. and BioL Chem., 1981, vol. 45, N 5, p. 1053—1060.
Niwa T., Inouye S., Tsuruoka T. et al. «Nojirimycin» as a potent inhibitor of glucosidase. — Agr. and Biol. Chem., 1970. vol. 34, N 6, p. 966—968.
Oda K-, Koyama T., Murao S. Purification and properties of a proteinaceous metallo-proteinase inhibitor from Strepto- 93
myces nigrescens TK-23. — Biochim. et biophys. acta. 1979. vol. 571, p. 147—156.
Oguro Μ., Nagano H. Inhibition of eukaryotic DNA polymeraseby polydeoxy- nucleotides. — J. Biochem., 1982, vol. 92, N 2, p. 599—602.
Omichi A., Nagara N., Ikenaka T. On the reactive site of Streptomyces subtilisin inhibitor. — J. Biochem., 1980, vol. 87, N 2, p. 483—489.
Omoto S., Itoh J., Ogino H. et al. Oligostatins, new antibiotics with amylase inhibitory activity. II. Structure of oligostatins C, D and E. — J. Antibiot,, 1981, vol. 34, N 11, p. 1429—1433.
Omura S., Nakagawa A., Ohno H. Structure of elasnin, a novel elastase inhibitor. — J. Amer. Chem. Soc., 1979, vol. 101, N 15, p. 4386—4388.
Omura S., Ohno H., Saheki T. et al. Elastin, a new human granulocite elastase inhibitor produced by a strain of Streptomyces. — Biochem. and Biophys. Res. Communs, 1978, vol. 83, N 2, p. 704— 709.
Ozawa K., Laskowski Μ. The reactive site of trypsin inhibitors. — J. Biol. Chem., 1966, vol. 241, p. 3955—3961.
Plattner P. A., Keller W., Boiler A. Konstitution und Synthese der Fusarium- säure: Synthese von 5-ätyl- und 5-n-hexyl- pyridin-2-carbonsäure. — Helv. chim. acta, 1954, vol. 37, p. 1379—1392.
Ricci J. S., Bousvaros A., Taylor A. Crystal and molecular structure of besta- tin and its implications regarding substrate binding to the active site of leucine aminopeptidase. — J. Org. Chem., 1982, vól. 47, N 16, p. 3063-3065.
Roulearu Μ., Lamy F. Purification and characterization of a trypsin inhibitor from Solanum tuberosum. — Canad. J. Biochem., 1975, vol. 53, p. 958—971.
Saheki T., Matsuda Y., Holzer H. Purification and characterization of macromolecular inhibitors of proteinase A from yeast. — Europ. J. Biochem., 1974, vol. 47, p. 325—332.
Saito N. a-Amylase inhibitor from fungus Cladosporium herbarum F-828. — J. Biol. Chem., 1982, vol. 257, N 6, p. 3120—3125.
Saruno R., Setoyama T., Nakashima C. et al. Purification and some properties of nuclease inhibitor from Monascus purpureus. — Agr. and Biol. Chem., 1981, vol. 45, N 1, p. 133—139.
Sato S., Kimura T., Murao S. Preparation of immobilized protease inhibitor (S-SI) and application to enzyme purification. — Agr. and Biol. Chem., 1975, vol. 39, N 2, p. 415—422.
Sato S., Murao S. Isolation and crystallization of microbial alkaline protease inhibitor S-SI.— Agr. and Biol. Chem., 1973, vol. 37, N 5, p. 1067—1074.
Sato S., Murao S. Complex formation of microbial alkaline protess inhibitor ß- SI) with subtilisin BPN' and its properties. — Arg. and Biol. Chem., 1974, vol. 38, N 11, p. 2227—2233.
Satre Μ., Jerphanion Μ. B., Huet L, Vignais P. V. ATPase inhibitor from yeast mitochondria: Purification and properties. — Biochem. et biophys. acta, 1975, vol. 387, p. 241—255.
Schmidt D. D., Frommer W., Junge B. et al. a-glucosidase inhibitors. — Naturwissenschaften, 1977, Bd. 64, H. 10, S. 535—536.
Siepen D., Yu P. H., Kula Μ. R. Proteolytic enzymes of Neurospora cras- sa. — Europ. J. Biochem., 1975, vol. 56, p. 271—281.
Sinha S. N., Ghosh B. L., Chosh S. N. Detection of cellular inhibitor in the wheat bran culture of Asp. terreus. — Canad. J. Microbiol., 1981, vol. 27, N 12, p. 1334— 1340.
Smeaton J. R., Elliott W. H. Isolation and properties of a specific bacterial e ribonuclease inhibitor. — Biochim. et biophys. acta, 1967, vol. 145, p. 547—560.
Smeaton J. R., Elliott W. H., Coleman G. An inhibitor in Bacillus subtilis of its extracellular ribonuclease. — Biochem. and Biophys. Res. Communs, 1965, vol. 18, N 1, p. 36—38.
Spoerel N., Herrlich P., Bickle T. A. A novel bacteriophage defence mechanisms: The antirestriction protein. — Nature, 1979, vol. 278, p. 30—34.
Suda H., Aoyagi T., Hamada Μ. et al. Antipain, a new protease inhibitor isolated from actinomycetes. — J. Antibiot., 1972, vol. 25, N 2, p. 263—266.
Suda H., Aoyagi T., Takeuchi T., Umezawa H. A thermolysin inhibitor produced by actinomycetes: Phosphorami- don. — J. Antibiot. 1973, vol. 26, N 10, p. 621—623.
Suda H., Takita T., Aoyagi T., Umezawa H. The structure of bestatin. — J. Antibiot., 1976, vol. 29, N 1, p. 100—101.
Sugino H., Kakinuma A., Iwanaga S. Plasminostreptin, a protein proteinase inhibitor produced by Streptomyces antifi- brinolyticus. III. Elucidation of the primary structure. — J. Biol. Chem., 1978a, vol. 253, N 5, p. 1546—1555.
Sugino H., Nakagawa S., Kakinuma A. Plasminostreptin, a protein proteinase inhibitor produced by Streptomyces antifibrinolyticus. II. Determination 94
of the reactive site for proteinase. — J. Biol. Chem., 1978, vol. 253, N 5, p. 1538—1545.
Suzukake K-, Fujiyama T., Hayashi H., Hori Μ. Biosynthesis of leupep- tin. II. Purification and properties of leu- peptin acid synthetase. — J. Antibiot., 1979, vol. 32, N 5, p. 523—530.
Suzukake K., Hayashi H., Hori Μ., Umezawa H. Biosynthesis of leupeptine. III. Isolation and properties of an enzyme synthezing acetyl-L-leucine. — J. Antibiot., 1980, vol. 33, N 8, p. 857—862.
Suzukake K-, Takada Μ., Hori Μ. Biosynthesis of leupeptine. IV. Is protein turnover in leupeptin producer cells affected by leupeptin? — J. Antibiot., 1980, vol. 33, N 10, p. 1171 — 1176.
Suzuki K., Uyeda Μ., Shibata Μ. API-2c a new alkaline protease inhibitor produced by Str. griseoincarnatus strain NO KTo-250. — Agr. and Biol. Chem., 1978, vol. 42, N 8, p. 1539—1543.
Suzuki K., Uyeda Μ., Shibata Μ. Formation and dissociation of complex between alkaline protease inhibitor (API- 2c) and subtilisin BPN'. — Agr. and Biol. Chem., 1980, vol. 44, N 11, p. 2549— 2553.
Suzuki K., Uyeda Μ., Shibata Μ. Partial amino acid sequence of an alkaline protease inhibitor: APL-2 (b and c).— Agr. and Biol. Chem., 1981, vol. 45, N 3, p. 629—634.
Tajiri T., Koba Y., Ueda S. Amylase inhibitors produced by Streptomyces N 280. — Agr. and Biol. Chem., 1983, vol. 47, N 4, p. 671—679.
Takeuchi T., Chimura H., Hamada Μ., Umezawa H. A glyoxalase I inhibitor of a new structural type produced by Streptomyces.— J. Antibiot., 1975, vol. 28, p. 737—742.
Tsai H., Tsai H. J., Yu R. H. Effects of yeast proteinase and its inhibitor on the inactivation of tryptophan synthase from Saccharomyces cerevisiae and Neurospora crassa. — Europ. J. Biochem., 1973, vol. 40, p. 225—232.
Ueda S., Koba Y. Some properties of amylase inhibitor produced by Streptomyces sp. N 280. — Agr. and Biol., Chem., 1973, vol. 37, p. 2025—2030.
Ueda S., Koba Y., Chaen H. Action of amylase inhibitors produced by Streptomyces sp. on some carbohydrate hydrolases and phosphorylases. — Carbohyd. Res., 1978, vol. 61, p. 253—264.
Ueda S., Koba Y., Najima Μ. Production and properties of amylase inhibitor. — In: V Intern, ferment, symp. Abstr. B., 1976, p. 237.
Ulané R. E., Cabib E. The activating system of chitin synthetase from Saccharomyces cerevisiae: Purification and properties of an inhibitor of the activating factor. — J. Biol. Chem., 1974, vol. 249, p. 3418—3422.
Umezawa H. Enzyme inhibitors of microbial. origin. Tokyo: Univ, press, 1972, 212 p.
Umezawa H. Low-molecular-weight enzyme inhibitors of microbial origin. — Annu. Rev. Microbiol., 1982, vol. 36, p. 75—99.
Umezawa H., Aoyagi T., Hazato T. et al. Esterastin, an inhibitor of esterase, produced by actinomycetes. — J. Antibiot., 1978, vol. 31, N 6, p. 639—648.
Umezawa H., Aoyagi T., Komiyama T. et al. Purification and characterization of a sialidase inhibitor sistatin, produced by streptomyces. — J. Antibiot., 1974, vol. 27, N 12, p. 963—969.
Umezawa H., Aoyagi T., MorishimaH. et al. Chymostatin, a new chymotrypsin inhibitor produced by actinomycetes. — J. Antibiot., 1970a, vol. 23, N 3, p. 425— 427.
Umezawa H., Aoyagi T., MorishimaH. et al. Pepstatin, a new pepsin inhibitor produced by actinomycetes. — J. Antibiot., 1970b, vol. 23, N 2, p. 259—262.
Umezawa H., Aoyagi T., Okura A. et al. Elastational, a new elastase inhibitor produced by actinomycetes. — J. Antibiot., 1973, vol. 26, N 12, p. 787— 789.
Umezawa H., Aoyagi T., Suda H. et al. Bestatin, an inhibitor of aminopeptidase B, produced by actinomycetes. —
J. Antibiot., 1976, vol. 29, N 1, p. 97—99.
Umezawa H., Okami Y., Hotta K. Transfer of the leupeptin-producing ability of the strain, Streptomyces roseus MA 839-Al, by conjugation. — J. Antibiot., 1978, vol. 31, N 1, p. 99—102.
Umezawa H., Shibamoto N., Naganawa H. et al. Isolation of lecanoric acid, an inhibitor of histidine decarboxylase from a fungus. — J. Antibiot., 1974, vol. 27, N 8, p. 587—596.
Umezawa H., Tatsuta K-, Fujimoto
K. et al. Structure of antipain, a new Sakaguchi positive product of streptomyces. — J. Antibiot., 1972, vol. 25, N 2, p. 267—272.
Uozumi T., Ishino К., Beppu T., Arima K. Purification and properties of the nuclease inhibitor of the Aspergillus oryzae and kinetics of the its interaction with cristalline nuclease O. — J. Biol. Chem., 1976, vol. 251, N 9, p. 2808—2813.
Uozumi T., Tamura G., Arima K.
95
Studies on the autolysis of Asp. oryzae. IV. Presence of ribonuclease inhibitor in the mycelia. — Agr. and Biol. Chem., 1968, vol. 32, p. 969—973.
Uozumi T., Tamura G., Arima K. Studies on the autolysis of Asp. oryzae VII and VIII: Purification and properties of an interacellular nuclease inhibitor. — Agr. and Biol. Chem., 1969, vol. 33, p. 636—641.
Uyeda Μ., Suzuki K. Reactive site of API-2c an alkaline protease inhibitor subtilisin BPN'. — Agr. and Biol. Chem., 1980, vol. 44, N 3, p. 699—700.
Uyeda Μ., Suzuki K., Shibata Μ. Complex formation of alkaline protease inhitibor (AP-I) with subtilisin BPN' and its properties. — Arg. and Biol. Chem., 1976, vol. 40, N 8, p. 1479—1483.
Uyeda Μ., Suzuki K-, Sugiyama Μ., Shibata Μ. Purification and properties of API-2b->API-2c converting protease from streptomyces griseoincarnatus strain NO KTo-250, an API-2 producer. — Agr. and Biol. Chem., 1979, vol. 43, N 9, p. 1849—1854.
Uyeda Μ., Suzuki K-, Ume moto Y. et al. Some properties of an alkaline protease inhibitor, AP-I, and its effected on a-chymotrypsin and trypsin. — Agr. and Biol. Chem., 1977, vol. 41, N 4, p. 703—704.
Uyeda Μ., Suzuki K., Uwatoko H., Shibata Μ. API-2b, a new alkaline protease^ inhibitor produced by streptomyces griseonicarnatus strain NO KTo-250. — Agr. and Biol. Chem., 1978, vol. 42, N 1, p. 49—54.
Uyeda Μ., Yoshida S., Suzuki K., Shibata Μ. Isolation of an alkaline protease inhibitor, AP-I produced by streptomyces pseudogriseolus strain NO KTo-332. — Agr. and Biol. Chem., 1976, vol. 40, N 6, p. 1237—1238.
Vértesy L., Oeding V., Bender R. et al. Chemistry and biochemistry of a new type α-amylase-inactivator HOE 467 from Streptomyces tendae. — In: 13th Intern, symp. chem. nat. prod., Pretoria, 2— 6 Aug., 1982, Abstr. S. I., 1982, p. L 17 (Цит. по: РЖ Биохимия микроорганизмов и вирусов, 10 Ц274, 1983).
Williams J. G. К., Radding С. Μ. Partial purification and properties of an exonuclease inhibitor induced by bacteriophage Mu-1. — J. Virol., 1981, vol. 39, N 2, p. 548—558.
Woodward K. E., Lee J., Zachry G. S. The inhibition of ß-D-glucosidase (Aspergillus niger) by a factor in commercial yeast extract. — Biotechnol. Lett., 1983, vol. 5, N 7, p. 469—474.
Yamamoto T., Kojiki K-, Naga- nawa H. et al. The structure of forpheni- cine. — J. Antibiot., 1978, vol. 31, N 5, p. 483—484.
Yokose K-, Ogawa K-, Sano T. et al. New α-amylase inhibitor trestatins. I. Isolation, characterization and biological activities of trestatins A, В and C. — J. Antibiot., 1983, vol. 36, N 9, p. 1157— 1165.
Yokose K-, Ogawa K-, Suzuki Y. et al. New α-amylase inhibitor, trestatin. II. Structure determination of trestatins A‘, В and C. — J. Antibiot., 1983, vol. 36, N 9, p. 1166—1175.
Yu P. H., Kula Μ. R., Tsai H. Isolation of specific protease inhibitors from Neurospora crassa. — Canad. J. Biochem., 1976, vol. 54, p. 699—703.
Yu P. H., Siepen D., Kula Μ. R., Tsai H. On the stoichimetry and reversibility of interaction between Neurospora crassa protease I and its inhibitor. — FEBS Lett., 1974, vol. 42, N 2, p. 227— 230.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 3
ВЫСОКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ 5
Ингибиторы гидролитических ферментов, действующих на эфирные связи 5
Ингибиторы липазы и фосфолипазы 5
Ингибиторы ферментов обмена нуклеиновых кислот и АТФазы 9
Ингибиторы гидролаз, осуществляющих разрыв гликозидных связей ... 18
Ингибиторы амилолитических ферментов 18
Ингибиторы прочих гликозидаз 21
Ингибиторы пептидгидролаз 22
Общие представления об ингибиторах белковой природы 22
Ингибитор щелочной протеиназы S-SI из Streptomyces albogriseo- lus 24
Ингибиторы щелочной протеиназы группы АР-1 28
Плазминострептин 33
Ингибитор протеиназ ИТ-Aj 1 из Actinomyces janthinus 35
Ингибитор металлопротеиназ S-MPI 40
Ингибиторы протеиназ из дрожжей 41
Ингибиторы протеиназ из грибов 48
Внутриклеточные ингибиторы протеаз из споровых бактериальных культур 49
Ингибитор трипсина в культуре Streptomyces griseus Cal 51
НИЗКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ ФЕРМЕНТОВ 52
Ингибиторы гидролитических ферментов 52
Ингибиторы ферментов, действующих на эфирные связи 52
Ингибиторы гликозидаз 55
Ингибиторы нейраминидазы 62
Ингибиторы ß-галактозидазы, целлобиазы и целлюлазы 64
Ингибиторы пептидгидролаз 66
Ингибиторы оксидоредуктаз, трансфераз и лиаз 78
Ингибиторы оксидоредуктаз 78
Ингибиторы трансфераз 81
Ингибиторы лиаз 83
Ингибиторы пептидной природы, относящиеся к антибиотикам 85
ЗАКЛЮЧЕНИЕ 87
ЛИТЕРАТУРА 88