Текст
А.РЕФ0РМАТСК1Й
еП FY ГЯ H [А ЦОГУ Я О
u|ji апуі л с? и г\ еіл
Памятникъ Лавуазье въ Париж?.
Сооружен* па средства, собраппыя по междупародпой подггаск?.
НЕОРГАНИЧЕСКАЯ
химія.
(НАЧАЛЬНЫЙ КУРСЪ.)
Седьмое, исправленное и дополненное, нзданіе.
Съ 7 портретами и 103 рисунками.
^Д. ^ЕФОРМАТСКАГО.
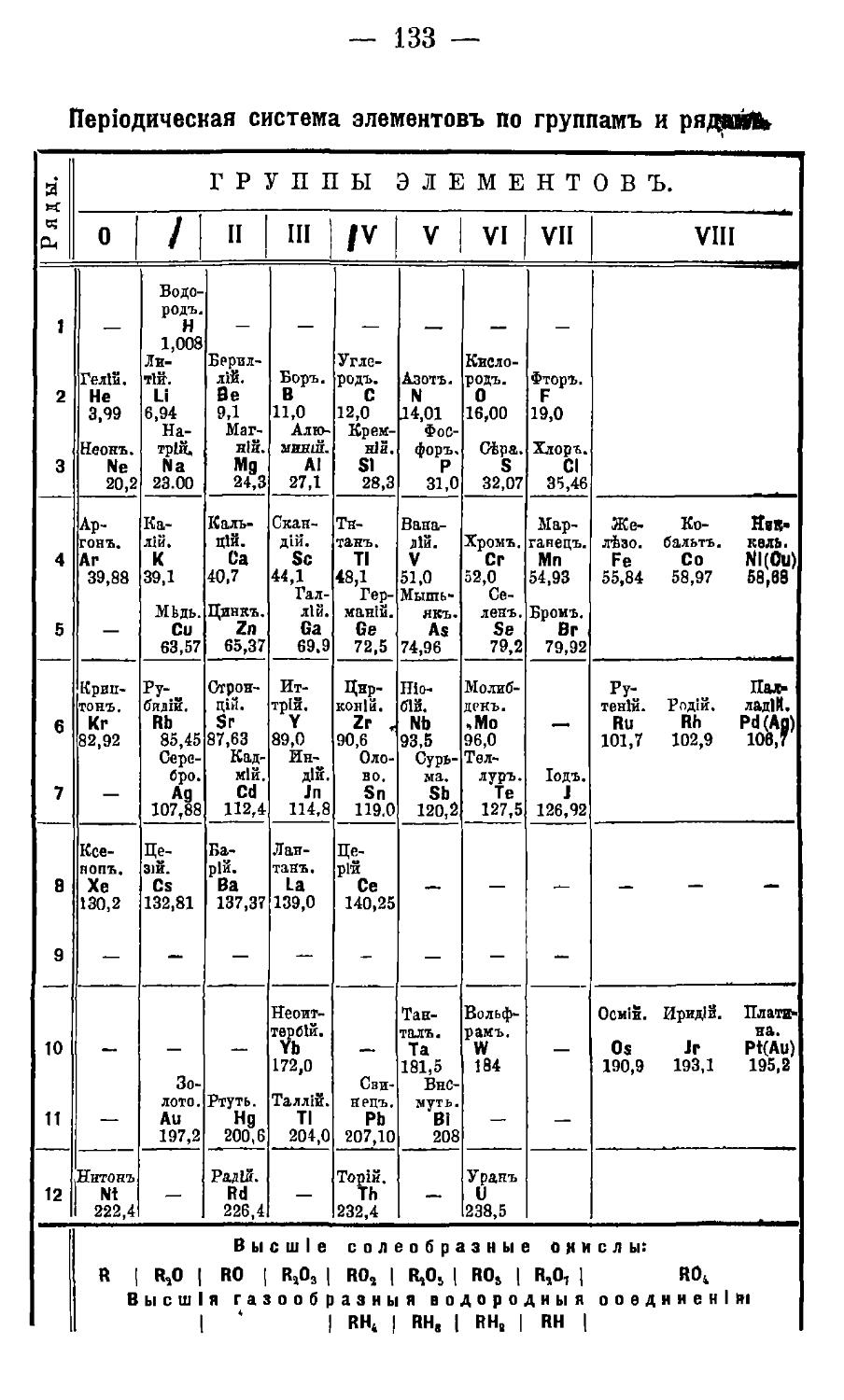
Періодичесная система элементовъ.
3
1
2
3
4
j
' е'
7
і 8
1 9
10
1"
і12
1
ГРУППЫ ЭЛЕМЕНТОВЪ.
0
НеЗ w
Ne20,j
I | II
HI ,00b
us,w
Na23)00
i А.г39,8э К39„0
' Cu63,s
[Кг82,„
Agl07lM
Xq130,j Csl32lgl
— J Aul97,a
M222 4
1 R
-
ы с и
*R*0
[СШіЯ
Be9„
Mg24,M
C»40,„
ZnBS.,,
Srt?,»
Cdll2,0
Bal37,r
Hg200ie
Rd226,i
л i e
RO
raso
III
A127.I
BeU„
V89,0
InlUn
Lal34,0
T1204,o
С О Л
1
IV
С121(Я
S128,j
V
N14ID1
P31.W
VI 1 VII [ VIII
оіеФ00
832l0i
TU8., j V61,» OrW*
Ge72,s 4s7*,ge Se79,s
Zr90„
ЗпПЧ.о
SblSO,,
Cel40,„ -
i
Pb207„u
Th232,i
e о 0
RO»
RH*
Ta.181,!
BI208,u
Mo96lD
Tel27,,
-
wm,e
- 1 Ui 238,4
раз
R»0«
ЕОДОі
К Ы
RO»
іОДНЬ
RH*
CIS*,,,
Мп54,и
Br79„
J1S6,,,
-
э о к
RIO'
ія сое
Fc&5,«i Co58)fI Кі5В>в/Си)
RulQl„Rhl02>l1>dlOGJ,>AE^
- — -
Osl90„ Irl93llPtl95,b(Ab/
и с л ы:
so*
Москва.—1912.
^л
"р
-t *"ч
_45tWl/l„
< И, <' vTO Ц-НТС к
< **вг*г*ч окал моолото*"^* (
' » Аііушии*
ч_
Типоі'рафія Т-ва И. Д. Сытина, Пятницкая ул., свой домъ,
МОСКВА.-1912.
II
О Г Л А В Л Е H I E.
Стр.
ОБЩАЯ ЧАСТЬ.
1. Мат?рія и энергія 1
2. Физическія изм?ненія 2
3. Химическія изм?ненія 3
4. Матерія. Т?ла простыя и сложныя 11
5. Перечень лростыхъ т?лъ 15
6. Элементы 17
7. Законъ сохранения вещества 18
8. Краткій очеркъ исторіи химіи 23
9. Энергія. Законъ сохраненія энергіи 31
10. Химическая энергія 34
11. Химическая активность —
12. Условія д?йствія химической энергіи 35
13- Химическая энергія и теплота 38
14. Термохимія 39
15. Главн?йшее направленіе д?йствія химической
энергіи 43
16. Обратимыя и необратимыя реакціи 44
17. Законъ д?йствующихъ массъ 47
18. Важн?йшіе законы, по которымъ химическіе элементы
соединяются для образованія сложныхъ т?лъ ... 50
I. Законъ постоянства состава —
II. Законъ кратныхъ отношеній 51
III. Законъ паевъ , 52
19. Атомистическая гипотеза 53
20. Согласованіе предыдущихъ законовъ съ
атомистической гипотезой 55
21. Физическія состоянія т?дъ ' 57
22. Химическіе знаки эіементовъ. Формулы и уравненія. 61
23. Основные законы газоваго состоянія т?лъ 63
24. Законъ Авогадро-Жерара 72
25. Законы Гей-Люссака относительно объемныхъ
отношеній соединяющихся и получающихся веществъ
въ газообразномъ состояніи 74
26. Ояред?леніе в?са частицъ 78
27. Частицы лростыхъ т?лъ 79
28. Состояніе атомовъ (m statu nascendi) въ моментъ вы-
д?ленія S3
',
_ IV _
Стр.
29. М = 2D 84
30. Опред?леніе плотности пара -86
31. Кріоскопическій методъ 93
32. Методы опред?ленія атомныхъ в?совъ элементовъ . 97
33. Законъ Дюлонга и Пти 100
34. Количественное значеніе химическихъ знаковъ . . . 104
35. Валентность (атомность) элементовъ. Типы формъ
соединеній 107
36. Краткія положенія теоріи строенія 113
Періодическій законъ 116
37. Элементы и т?ла природы —
38. Первая классификация элементовъ —
I. Металлы ¦—
II. Металлоиды 118
39. Условность д?ленія элементовъ на металлы и
металлоиды 120
40. Тріады Деберейнера 121
41. Классификация Дюма 122
42. Д. И. Мендел?евъ. Принципъ классификаціи .... 123
43. Элементы и ихъ атомные в?са 124
44. Періодическій законъ 130
45. Періодическая система химическихъ элементовъ . . 131
Періодическая система элементовъ по группамъ и рядамъ . 133
46. Періодическій законъ относится къ элементамъ . . . 134
47. Периодичность валентности —
48. Металлы и металлоиды въ періодической систем? . . 135
49. Изм?ненія въ рядахъ 136
50. Изм?ненія въ группахъ 138
52. Прим?ръ опред?ленія свойствъ элемента по м?сту
его въ періодической систем? 140
53. Опред?леніе атомнаго в?са элемента по его свой-
ствамъ 141
54. Изм?няемость физическихъ свойствъ простыхъ т?лъ. 143
55. Значеніе періодическаго закона 144
56. Приложеніе періодическаго закона къ предсказаніямъ
неизв?стныхъ элементовъ 146
спеціалыіая часть.
Водородъ II 151
Металлоиды и ихъ соедипенія съ водоро-
домъ ...... 167
Галоиды (VII группа; —
Хлоръ 169
Бромъ 176
іодъ 179
Фторъ 181
Соединенія галоидовъ съ водородомъ 184
Фтороводородъ —
Хлороводородъ 186
Бромоводородъ 192
іодоводородъ 194
— у —
Стр.
Группа кислорода (VI группа) "196
Кислородъ 198
Озоиъ 209
Соединенія кислорода съ водородомъ 213
Вода —
Сила кислотъ и основаній 236
Перекись водорода 238
С?ра. . . . 241
С?роводородъ 245
Группа азота (У группа) 250
Азотъ 252
Воздухъ 255
Аргонъ 266
Аналоги аргона 267
Фосфоръ 270
Мышьякъ ". 274
Сурьма 275
Бодородныя соединенія металлоидовъ группы азота . • ¦ ¦ 276
Амміакъ ¦ . . . . 277
Соединение фосфора съ водородомъ 285
Мышьяковистый водородъ 287
Сурьмянистый водородъ 2й$
Группа углерода (IV группа) 290
Углеродъ 291
КремніЙ 297
Соединенія металлоидовъ группы углерода съ водородомъ . 298
Соединенія углерода съ водородомъ 299
I. Метанъ —
II. Этиленъ 300
III. Ацетиленъ —
Кремнистый водородъ ¦ . . . . 301
ГорЬніе. Пламя 303
Соединенія металлоидовъ между собою 307
Кислородный, с?рнистыя и галоидныя соединены* группы
углерода 310
Углекислый газъ —
Окись углерода 316
Кремнеземъ 319
С?роуглеродъ 324
С?рнистый кремній 325
Галоидныя соединенія кремнія - • ¦ • —
Синеродистыя соединенія 326
Карборундъ 327
Кислородный, с?рнистыя и галоидныя соединенія
металлоидовъ группы азота (V) 328
Кислородный соединенія азота 330
Азотная кислота 332
Азотный ангидридъ .... 338
Азотноватая окись —
Азотистый ангидридъ 340
Азотистая кислота 341
- VI —
Стр.
Окись азота 341
Закись азота 344
Соединеніе азота съ галоидами 346
Кислородный соединенія фосфора 347
Фосфорный ангидридъ —
Фосфорная кислота (орто) 349
Пирофосфорная кислота 350
Меіафосфорпая кислота —
Фосфористый ангидридъ 351
Фоооористая кислота 352
Фосфорноватистая кислота 353
Кислородный соединенія мышьяка . , —
Мышьяковистый ангидридъ 354
Мышьяковая кислота 355
Кислородный соединенія сурьмы 356
Окись сурьмы —
С?рнистыя соединенія эдсментовъ V группы 358
Галоидныя соединенія фосфора 359
Галоидныя соединенія мышьяка 360
Галоидныя соединенія сурьмы 361
Кислородный, с?рнистыа и галоидныя соединенія группы
кислорода 362
С?рнистый ангидридъ —
С?рныЙ ангидридъ ¦ 367
С?рная кислота 368
Пирос?рная кислота 376
Галоидныя соединенія с?ры 378
Кислородныя соединенія группы галоидовъ 379
Кислородный соединенія хлора —
Кислородныя соединенія іода 383
Боръ 384
МЕТАЛЛЫ.
Физическія свойства металловъ 889
Таблица I. Атомные объемы элементовъ въ твердомъ со-
стояніи 391
Таблица II. Температуры плавленія элементовъ . . . 392
Отношеніе металловъ къ другнмъ элементамъ 394
Сплавы 395
Металлы въ природ?. Способы получения металловъ . . 396
СоедЕіненія металловъ 399
1. Окислы —
П. Гидраты окисловъ 400
ИГ. С?рнистыя соединенія 402
IX. Галоидныя соединенія 403
X. Соли —
Д?йствіе электрическаго тока на соли 409
Законы электролиза 410
„Спектральный анализъ 411
— VII —
Стр.
Первая группа .416
Щелочные металлы —
Патрій 417
Калій 425
Литій, рубидіЙ и цезій 431
Аммоній —
Реакціи металдовъ 1 группы 433
Металлы второй группы 434
Первая подгруппа второй группы —
Щелочно-земельные металлы —
БалъцШ 436
СтронцШ 445
Барій —
Радіоактивные элементы 446
Реакціи, служащія для открытія солей кальція, стронція
и оарія 457
Вторая подгруппа второй группы 458
Магній 460
Цинкъ 463
Кадмій 465
Ртуть —
Третьягруппа 469
Алюминій * 471
Металлы четвертой группы 479
Олово 480
Свинецъ 484
Металлы пятой группы 489
Висмутъ 490
Металлы шестой группы, . •. 492
Хромъ 493
Седьмая группа 497
Марганец'ь —
Восьмая группа 504
Подгруппа жел?за 509
Жел?зо 510
Никкелъ 521
Кобальть 522
М?дь, серебро и золото 523
М?дь 524
Серебро 527
Золото ?«м
Платина 534
— VIII —
Стр.
ПРИЛОЖЕНЫ.
Электронная теорія строенія матеріи 539
Растворимость основаній и солей въ вод? при 18° . . . 542
Упругость воднаго пара въ мюшшетрахъ ртутнаго столба
от% 15Д° до 25,3° Ц 543
Процентное содержаніе амміака въ растворахъ различ-
наго уд?льнаго в?са 544
Процентное содержаніе хлористаго водорода въ
растворахъ различнаго уд?льнаго в?са —
Процентное содержаніе S03 и H2S04 въ растворахъ
различнаго уд?льнаго в?са 545
Процентное содержаніе азотной кислоты въ растворахъ
различнаго уд?лыіаго в?са 547
Русскія и метрическія м?ры —
В?сы 548
Списокъ аипаратовъ, необходимыхъ для начальныхъ за-
нятій по химіи 550
Списокъ веществъ, необходимыхъ для начальныхъ заня-
тій по химіи 554
Приготовленіе растворовъ важн?йшихъ реактивовъ . . 559
Рекомендуемый книги по химіи (теоретической и
неорганической) на русскомъ язык? 562
Именной указатель 571
Предметный указатель 573
ОТЪ АВТОРА.
Предисловіе къ 1-му изданію.
Предлагаемый начальный курсъ химіи составился изъ
лекцій 1), читанныхъ авторомъ въ н?сколькихъ высшигь
учебяыхъ заведеніяхъ Москвы.
Къ числу н?которыхъ особенностей курса относится,
между прочимъ, группировка какъ теоретическаго, такъ
и фактическаго матеріала.
Вся теоретическая часть, включая сюда и періоди-
ческій закоиъ съ періодической системой^ вынесена въ
курс? во введеніе. Намъ всегда казалось, что, признавая
за періодической системой высокія научныя заслуги,
различные авторы руководствъ по неорганической химіи
мало д?нили ея педагогической Значеніе въ д?л? бол?е
связнаго и легкаго усво?яія химическаго матеріала. А
между т?мъ это значеніе очень существенно, въ чемъ мы
уб?дились въ теченіе десятил?тняго педагогическаго
опыта. Связанные періодической системой во единую
неразрывную ц?пь; химическіе элементы сразу нріобр?-
таютъ въ глазахъ изучаюгцаго большій интересъ и проще
укладываются въ его памяти.
Чрезвычайно легко, усваиваемая по систем? валентность
іілементовъ упрощаетъ запоминаніе состава сложныхъ
веществъ при выраженіи его химическими формулами, а
чрезъ ¦ это упрощается и ум?нь? выражать химическія
пр?вращенія химическими уравнениями, т.-е., другими
словами, скор?е вырабатывается ум?нье химически мыслить.
і) Въ пер в о начально мъ вид? этотъ курсъ быдъ изданъ моими
бывшими учениками, студентами Императорского Техническая
училища, Б. С. Швоцовымъ и Г. М. Чиликинымъ. Пользуюсь случаемъ.
еще разъ принести имъ мою искреннюю благодарность.
— X —
Конечно, излагая п?ріодич?скій законъ и періодическую
систему въ самомъ начал? курса, мы отнюдь не претен-
дуемъ на вполн? точное усвоеніе ихъ начинающими
изучать химію: оно, по существу д?ла, невозможно б?зъ
знаніа фактическаго мат?ріала. Зд?сь важно, чтобы была
воспринята основная идея системы, а детали ея и
фактическое обоснованіе, трактуемый на протяжении всего
курса, усвоятся постепенно.
Въ группировке фактическаго матеріала въ куров
пресл?довались дв? ц?ли. Во-первыхъ, мы старались не
загромождать внимація приступающего къ изучеяію химіи
сообщеніемъ сразу большого количества разнообразныхъ
фактовъ, которые, часто сами по с?б? очень интересные,
иногда могутъ затушевывать иллюстрируемое ими то или
иное положеніе. Обогатиться фактическими матеріаломъ
всякій мож?тъ впосл?дствіи—изъ другихъ, бол?е полныхъ
руководствъ. Во-вторыхъ, съ д?лью обобщить свойства
однородныхъ соединений, напр.: водородныхъ соединеній
металлоидовъ. ихъ кислородныхъ соединеній и др. эле-
ментовъ каждой группы, и ч?резъ это р?зче выдвинуть
сходство и различіе ихъ самихъ, мы въ первой части
курса, т.-?. у металлоидовъ, расположили однородный со-
единенія въ отд?льныя главы. Въ групп? леталловъ мы
распределили весь матеріалъ по самымъ металлам*!»;
вопросы же о сходств? и разлнчін ихъ разобраны во
введеніяхъ въ каждой групн?.
Зат?иъ въ курс?, въ качеств? приложеній, пом?-
щены какъ списки аппаратовъ и вещест^ъ, необходи-
мыхъ для начальныхъ занятій по химіи, такъ и
указатель книгъ но теоретической и неорганической химіи на
русскомъ язык?. Это сд?лано въ отв?тъ на т?
многочисленный просьбы, съ которыми обыкновенно въ начал?
каждаго учебнаго года къ намъ обращаются наши новые
слушатели. А. Реформашскій.
Москва,
4902 года 20 октября.
Д. И. Мендел?евъ.
(і 20 января 1907 г.)
Дмитрій Ивановичъ Мендел?евъ родился 26 января
1834 г. въ г. Тобольск?, гд? отецъ Д. И. былъ директо-
ромъ гимназіи. И. И. былъ семнадцатымъ и посл?днимъ
ребенкомъ въ семь? Мендел?евыхъ. Едва Д. И. минуло
10 л?тъ, какъ отецъ его умеръ, и воспитаніе мальчика-
Мендел?ева всед?ло перешло въ руки его матери Маріи
Дмитріевны, урожденной Корнильевой, женщины
выдающегося ума. Основнымъ воспитательнымъ принципомъ
ея было, свободное пробужденіе и разни ті? природныхъ
дарованій и систематическое пріученіе къ труду.
Гимназическіе годы Д. И. прошли въ Тобольск?; въ
гимназію онъ былъ отданъ семи л?тъ; зд?сь скоро
обозначилась у Д. И. особенная любовь къ математик?,
физик? и исторіи. Курсъ гиыдозіи Д. И. окоичилъ въ
1849 г. Внимательная мать и тогда ясно уже оц?нила начи-
навшійся вырисовываться самобытный независимый харак-
теръ своего сына и его любовь къ изсл?дованію неизв?ст-
ііаго и р?шила направить Д. И. по научному руслу.
Съ этой д?лыо 15-л?тняго Д. И. мать везетъ сначала
вь Москву, а черезъ годъ—въ Петербургъ, гд? и пом?-
щаетъ сына въ Педагогическій институтъ по физико-
математическому факультету. Главными учителями Д. И.
въ институт? были: Воскресенскій — по химіи, Л?нцъ-
по физик?, Куторга — по минералогіи, Саввичъ — по
астрономіи, Рупрехтъ—по ботаник?; БраиДъ—по зоологіи.
Эти известные ученые какъ нельзя бол?е
способствовали Д. И. въ изученіи научныхъ дисциплинъ и
облегчили путь къ развитію выдающихся дарованій своего
ученика. И неудивительно, что Д. И., будучи еще сту-
дентомъ, напечаталъ н?сколько работъ аналитическаго
характера и написалъ статью „Объ изоморфизм?".
— XII —
На протяженіи институскихъ л?ть Д. И. скончалась
его мать. „Можно думать,—говорить біографъ Д. И.,—
что зав?ты матери 1), всосанные въ плоть и кровь съ
самаго ранняго д?тства, онред?лили въ сильной м?р?
весь характеръ далыі?йшей д?ятельности Мендел?ева,
включая и отношенія къ различнымъ техническямъ,
экономя ческимъ и общественнымъ явленіямъ". Мы не со-
мн?ваемся, что съ чувствомъ глубокаго уваженія будутъ
вспоминать эту р?дкую мать, воспитавшую міроеого уче-
наго, вс? т?, кому дороги интересы науки.
Курсъ института оконченъ. Всл?дствіе пошатнувша-
гося здоровья (у Д. И, появилось кровохарканье), Д. И.,
по сов?ту докторовъ, у?зжаетъ изъ Петербурга на югъ
и зд?сь поступаетъ въ качеств? преподавателя сначала
въ симферопольскую гимназію, а потомъ — въ одесскую.
Въ 1856 году Д. И. возвратился въ Петербургъ и
приступилъ въ качеств? приватъ-доцента университета къ
чтенію лекцій по органической и теоретической химіи.
За это же время Д. И. усп?лъ, во-первыхъ, написать и
защитить диссертацію „Объ уд?льныхъ объемахъ" на
степень магистра химіи и физики; а во-вторыхъ, напе-
чаталъ статьи: „Объ энантилово-с?рнистой кислот?" и
„О различіи реакцій зам?щенія, соединенія л разло-
женія".
і) Памяти ?я Д. И. посвятилъ свой капитальный трудъ—«Изсл?до-
вані? водныхъ растворовъ по уд?льному в?су»—въ сл?дующихъ стро-
кахъ: <Это изсл?дованіе посвящается памяти матери ея поол?дышемъ.
Она могла его возрастить только своимъ трудомъ, ведя заводское д?ло;
воспитывала прим?ромъ, исправляла любовью и, чтобы отдать наук?,
вывезла изъ Сибири, тратя посл?днія средства и силы. Умирая зав?-
щала: изб?гать латынскаго самооболыденія, настаивать вътруд?, а не
въ словахъ, и терп?ливо искать божескую или научную правду, ибо
понимала, сколь часто діалектика обманываетъ, сколь многое еще
должно узнать и какъ при помощи науки безъ насилія, любовно, но
твердо устраняются предразсудки, неправда и ошибки, а достигаются
охрана добытой истины, свобода дальн?йшаго развитія, общее благо
и внутреннее благополучіе. Зав?ты матери считаетъ священными
Д. И. М?ндел?евъ. Октябрь, 1887 г.».
XIII —
Такимъ образомъ въ двадцать три года Д. И. былъ
уже магистромъ и началъ пренодаваніе въ университет?.
Съ 1859 г. по 1861 г. Д. И. былъ за границей — въ
Гейделъберг? и зд?сь работалъ въ своей небольшой ла-
бораторіи надъ вопросомъ о капиллярности жидкостей;
за это же время папечаталъ „О раствореніи жидкостей"
и „О температур? абсолютнаго кип?нія"; въ
университет? онъ только слушалъ лекціи.
Въ 1861 г. Д. И. возвратился въ Петербургъ ненова
приступилъ къ чтенію лекціи въ университет?. Вскор?
онъ напечаталъ и свой „Курсъ органической химіи".
Этотъ курсъ проф. А. М. Бутлеровъ охарактеризовалъ сл?-
дующими словами: „Это единственный и отличный русскій
оригинальный учебникъ органической химіи, еще не
распространенный въ Западной Европ?, безъ сомн?нія,
только потому, что для пего не нашлось переводчика".
Въ 1863 г. Д. И. былъ опред?ленъ профессоромъ
Технологическаго института и зд?сь занялся изученіемъ
различныхъ техническихъ вопросовъ; главнымъ образомъ,
касающихся нефти и сельскаго хозяйства, и изданіемъ
техническихъ руководства „Выросши около стекляннаго
завода,—пишетъД, И. въ своихъ „Зав?тныхъ мысляхъ",—¦
который вела моя мать, т?мъ содержавшая д?тей,
оставшихся на ея рукахъ сызмала, пригляд?лся я къ
заводскому Д?лу И ЛрИВЫКЪ ПОНИМатЬ, ЧТО ОНО ОТНОСИТСЯ КТэ
числу народныхъ кормильцевъ, даже при сибирскомъ
простор?. Поэтому, отдавшись такой отвлеченной и
реальной наук?, какова химія, я смолоду интересовался
фабрично-заводскими предпріятіями".., Интересъ къ техни-
ческимъ вопросамъ, какъ увидимъ, никогда не покидалъ
Д. И., и съ особенной интенсивностью онъ выдвинулся
въ посл?днія 10—15 л?тъ его жиз.яи.
Въ 1865 году Д. И. особенно много работалъ надъ
изел?дованіями растворовъ спирта но уд?льному в?су;
эту работу въ сл?дующемъ году онъ представилъ и
защитилъ въ качеств? диссертаціи на степень доктора
— XIY —
химіи. Въ 1867 году Д. И. былъ избранъ профессоромъ
Спб. университета по ка?едр? химіи и оставался тако-
вымъ до 1890 г.
Въ этотъ періодъ мы и видимъ удивительно широкій
размахъ его разнообразной научной д?ятельности. Мы
не будемъ перечислять вс?хъ его многочисленныхъ работъ
(числомъ около 140), укажемъ лишь н?сколько главн?й-
шихъ: „Объ упругости газовъ"; „Нефтяная
промышленность въ с?веро-американскомъ штат? Пенсильваніи и
на Кавказ?"; посл?дняя работа бдаа соединена съ
неоднократными по?здками въ Пенсильванію и на Кав-
казъ—м?сторожденіе нефти"; „О сопротивленіи жидкостей
и воздухоилаваніи"; въ 1887 году, во время полнаго сол-
нечнаго затменія, Д. И. поднимался на аэростат? въ
Клину для соотв?тственныхъ наблюденій; „Изсл?дованіе
водныхъ растворовъ по уд?льному в?су".
Въ 1888 году онъ изучалъ на м?ст? экономическія
условія донецкой каменноугольной области и напеча-
талъ „Міровое значеніе каменнаго угля и Донецкаго
бассейна".
На н?которое время Д. И. увлекся спиритическими
явленіями и напечаталъ объемистое сочиненіе: „Матеріалы
для сужденія о спиритизм?".
Но въ указанномъ перечн? работъ мы еще не
упомянули самаго крупнаго, скажемъ, геніальнаго труда
Д. И., —труда, который и сд?лалъ его міровымъ уче-
яьшъ,—труда, который изв?стенъ иодъ именемъ „Періо-
дическаго закона химическихъ элементовъ", конкретнымъ
выраженіемъ котораго явились изданный въ 1868—J 870 го-
дахъ „Основы химіи"-—настольная книга каждаго химика
переведенная на англіискій (два изданія) и н?медкій
языки; вышло 8 изданій на русскомъ язык?.
Періодическій законъ справедливо называютъ самьтмъ
широкимъ обобщеніемъ въ области естествознанія въ
XIX в?к?. Изложенію и уясненію этого закона и
посвящено наше настоящее руководство.
_ ХУ —
Въ 1889 году научная міровая слава Д. И. особенно
была подчеркнута англійскими учеными: Д. И. — первый
изъ русскихъ ученыхъ—получилъ очень лестное пригла-
шеніе прочитать въ ма? 1889 года дв? лекціи: одну въ
Лондонскомъ Королевскомъ институт?, а другую — въ
память Фарадея въ Великобританскомъ Химическомъ
Обществ?. Эти лекціи (первая на тему: „Попытка
приложения къ химіи одного изъ началъ естественной филосо-
фіи Ньютона", шорая: „Періодическая законность хими-
ческихъ эл?ментовъ") были высокимъ научнымъ тріум-
фомъ и самого Д. И., а въ лиц? его и вообще русскаго
генія. Д. И. вручена была особая фарадеевская медаль и
подарены на память отъ обоихъ обществъ драгоц?нныя
вазы изъ алюминія и золота.
Съ 1890 года Д. И. прекратилъ свою профессорскую
д?ятельность въ Спб. университет?, а всю свою дальн?йшую
д?ятелъность сосредоточилъ, главнымъ образомъ, на раз-
личныхъ экономическихъ и государственныхъ вопросахъ.
Сначала мы видимъ его чл?номъ сов?та торговли и
мануфактуръ: зд?сь онъ принимаетъ самое д?ятельное
участіе въ выработк? и систематическомъ проведеніи
покровительственная для русской обрабатывающей
промышленности тарифа и публикуетъ сочиненіе „Толковый
тарифъ 1890 г.".
Въ то же время Военное и Морское Министерства
поручаютъ Д. И. разработку вопроса о лучшемъ тип?
бездымнаго пороха; съ 1891 г. Д. И. назначается кон-
сультантомъ при управленіи Морскимъ Министерствомъ
по пороховымъ вопросамъ.
Съ 1893 г. при Министерств? Финансовъ учреждается
„Главная палата м?ръ и в?совъ", и Д. И. опред?ляется въ
ггей „ученымъ-хранителемъ м?ръ и в?совъ". Зд?сь онъ из-
даетъ журналъ „ Временникъ", въ которомъ публикуются вс?
изм?рительныя изсл?дованія, производимыя въ палат?.
Параллельно Д. JL съ болыпимъ интересомъ
относился къ міру художественному и въ 1894 году былъ
_ хуі —
избрана д?йствительнымъ членомъ Императорской Ака-
деміи художествъ.
Въ то же время Д. И. продолжаетъ разработку раз-
личныхъ водросовъ техники, сельскаго хозяйства и др.
и излагаете свои мысли въ статьяхъ, изданныхъ потомъ
подъ именемъ „Зав?тныя мысли Д. И. Мендел?ева". Въ
1906 году онъ по т?мъ же государственной важности
вопросамъ печатаетъ этюдъ „Къ познанію Россіи"; трудъ
этотъ вышелъ уже четвертымъ изданіемъ.
Одновременно Д. И. редактируетъ химико-техническій
и фабричпо-заводскій отд?лъ „Энциклопедическаго
словаря" Брокгауза и Ефрона и проч. и проч.
До конца дней своихъ Д. И. неустанно отзывался на
всякое бол?е или мен?е серьезное явленіе общественной
жизни и во всемъ высказывалъ свое авторитетное слово.
Лебедиными п?снями Д. И. въ химическомъ напра-
вленіи были въ 1903 году, во-первыхъ,
глубоко-интересная его статья въ „В?стник? и библіотек?
самообразования"—„Попытка химическаго нониманія мірового э?ира"
и, во-вторыхъ, 8-е изданіе „Основъ химіи".—Общая сумма
книгъ, брошюръ и зам?токъ, иапечатаниыхъ Д. И., пре-
вышаетъ 350.
20 января 1907 г. Д. И. скончался отъ восналенія
легкихъ.
Въ нашемъ краткомъ біографическомъ очерк? покой-
наго мы остановились лишь на выдающихся моментахъ
въ его жизни и д?ятельности. Достаточно и приведеннаго,
чтобы сказать, что міровой ученый, какимъ по сравед-
ливости является Д. И., своими работами, а среди нихъ
въ особенности своимъ „періодическимъ закономъ", соз-
далъ себ? „памятникъ нерукотворный".
Д. И. горячо в?рилъ, что „пос?въ научный взойдетъ
для жатвы народной". Будемъ же и мы верить въ ско-
р?йшее осуществленіе этой его зав?тной мечты...
А. Реформапьстй.
ОБЩАЯ ЧАСТЬ.
§ 1. Матерія и эн?ргія, Химія есть одна изъ есте-
ственныхъ наукъ; сл?довательно, предметомъ ея изученія
служить природа. Подъ именемъ природы обыкновенно
разум?ютъ сумму двухъ слагаемыхъ: матеріи и ?нергіи*
Матеріей называютъ все то, что им?етъ в?съ, инердію
и протяженіе, т,-е. занимаетъ опред?ленное пространство;
а энергіей — способность совершать работу. Матерія съ
присущей ей энергіей обыкновенно мыслится какъ вн?ш-
нгй мгръ по отношенію къ познающему ихъ, такъ
называемому внутреннему міру.
Матерія познается лишь благодаря присущей ей
способности возд?йствовать или непосредственно на органы
чувствъ, или на нихъ же чрезъ посредство различныхъ
аппаратовъ. Механическое возд?йствіе (раздраженіе) на
тотъ или иной органъ чувствъ субъективируется зат?мъ
какъ опред?ленное ощущеніе, а посл?днее
объективируется въ качеств? „вн?шняго" міра. Безъ указаннаго
возд?йствія матерія для насъ не существуетъ, короче,
мы не знаемъ матеріи безъ энергіи1).
Познанія наши о вн?шнемъ мір? очень далеки отъ
совершенства, и это прежде всего зависитъ отъ несовершенствъ
познающихъ его органовъ чувствъ: они могутъ
воспринимать лишь только н?которыя раздраженія, а не вс?.
Отм?тимъ сейчасъ же то общее, что, вн? всякаго
сомн?нія, принадлежитъ матеріи и энергіи. Какое бы
міровоззр?ніе ни лежало въ основ? нашихъ отношеній
къ природ?, сущность того, что называютъ міровой
*) Въ посл?днее время усиленно разрабатывается мысль о тожде-
ств? матеріи и энергіи: та и другая сливаются въ понятіи «электронъ».
Неорганическая хдмія. 1
— ft
жизнью, выразится понятіемъ изм?неніе (или, что то же,
явленге). Вс? міровоззр?нія сходятся въ одномъ: то, что
составляетъ природу, т.-е. и матерія и эиергія, каждый
мигъ изм?няется. Процессъ изм?ненія происходить
безостановочно. Справедливо сказалъ знаменитый француз-
скій химикъ Жераръ (Gerhardt), что „въ природ? н?тъ
настоящего, а лишь прошедшее". См?на такихъ изм?не-
ній и составляетъ т. н. жизнь природы.
Изученіемъ жизни природы занимаются прежде всего
дв? основныя науки—физика и химія. Он? очень близко
соприкасаются между собою въ своихъ изсл?дованіяхъ и
часто даже сливаются (отсюда понятно существование
отд?ла, называемаго „Физической химіей"). Т?мъ не ме-
н?е, все-таки можно показать, что эти науки изсл?дуютъ
различный стороны указанныхъ изм?неній.
§ 2. Физическія изш?ненія. Вс? изм?ненія (или явле-
иія) можно, хотя и не р?зко, разбить на дв? категоріи:
I. Къ первой категоріи принадлежать изм?ненія
временный, который прекращаются съ устраненіемъ
вызвавшей ихъ причины: матерія при такихъ изм?ьненгяхъ
не м?няетъ своего состава. Такія явленія называются
физическими, и ихъ изучаетъ физика. Сюда, наприм?ръ,
относятся вс?мъ изв?стныя явленія механическаго дви-
женія, звука, теплоты, электричества.
Прим?ры бол?е сложные:
а) При достаточномъ нагр?ваніи вода обращается въ
паръ, а при охлажденіи до 0° она превращается въ
ледъ. Паръ и ледъ, повидимому, представляютъ суще-
ственныя изм?ненія воды. Но стоитъ только обратно
охладить паръ (иначе, отнять приданную теплоту) или
нагр?ть ледъ (иначе, придать отнятую теплоту), и
получится вода съ первоначальными свойствами.
Вторичнымъ охлажденіемъ инагр?ваніемъ лишь
устраняется д?йствіе первыхъ причинъ, вызвавшихъ указанный
изм?ненія. Сл?довательно, приведенныя изм?ненія были
чисто физическими.
3 —
b) Если внести платиновую пластинку въ пламя св?чи
или бунзеновской гор?лки, она раскалится до яркаго
св?ченія. Однако посл? удаленія причины св?ченія, т.-е.
посл?того, какъ пластинка будетъ удалена изъ пламени,—
она остьшетъ и явится со своими прежними свойствами;
составь пластинки при этомъ не изм?нится. Сл?дова-
тельно, и зд?сь изм?неніе было только физическое.
§ 3. Химичеекія изм?ненія. П. Ко второй категоріи
изм?~неній относятся такія, которыя касаются состава
вещества, т.-е. изм?ненія глубокія: они не прекращаются
съ устраненіемъ причины, вызвавшей ихъ, и матергя
при такихъ изм?неніяхъ изм?няетъ свой составь*),
пріобр?тая вм?ст? съ т?мъ новыя свойства. При-
м?ры лучше всего пояснять характеръ такихъ изм?неній.
a) М?дная пластинка при накаливаніи въ пламени
бунзеновской гор?лки вскор? изм?няетъ свой видъ: она
черн?етъ отъ образованія новаго т?ла, такъ называемой
черной окиси м?ди2). По прекращеніи нагр?ванія черное
вещество останется; значить, м?дь изм?нилась не временно.
b) Если см?шать мелко истолченныя жел?зныя опилки
съ желтымъ порошкомъ с?рнаго цв?та, то см?сь
принимаешь с?рый цв?тъ — средній между цв?тами ея состав-
ныхъ частей. Но ни жел?зо, ни с?ра не потеряютъ при
этомъ своихъ свойствъ, что легко вид?ть прежде всего
подъ микроскопомъ.
Полученную см?сь легко и разд?лить, напр., при
помощи магнита, который притягиваетъ жел?зо, а с?ры не
притягиваетъ, или д?йствіемъ на см?сь жидкости,
называемой с?роуглеродомъ: с?ра въ немъ растворится, а
жел?зо не растворится.—Подобныя см?си, неоднородняя
и физически, принято называть гетерогенными^ въ отли-
!) Въ дальн?йш?мъ буд?тъ указано, что химическое изм?н?ніе
можетъ происходить не только при изм?н?ніи состава, но и при изм?-
неніи соотношенія («стро?нія») между входящими въ составъ слагаемыми.
2) Съ этимъ явдені?мъ всякій давно знакомъ по почерн?нію м?д-
ной самоварной крышки.
1*
_ 4 —
чіе отъ однородныхъ см?с?й, напр., газовыхъ, называе-
мыхъ гомогенными.
Описанное явленіе станетъ совершенно инымъ, если
немного нодогр?ть указанную см?сь1): вскор? наступить
настолькб большое выд?леніе тепла, что вся см?сь сама
собой постепенно раскалится, и въ рсзультат? получится
новое т?ло съ новыми свойствами, такъ называемое с?р-
нистое жел?зо, изъ котораго жел?зо уже не вытягивается
магнитомъ, и с?ра не переходить въ с?роуглеродъ; это
новое т?ло подъ микроскопомъ показываетъ однородное
строеніе. При д?йствіи с?рной (или какой-либо другой)
кислоты оно выд?ляетъ непріятно пахнущій газъ—с?ро-
водородъ (а жел?зо и с?ра въ отд?льности при д?йствіи
с?рной кислоты не даютъ с?роводорода). Очевидно, что
с?ра и жел?зо р?зко изм?нили свои свойства, образо-
вавъ однородное во вс?хъ частяхъ, бол?е сложное по
составу т?ло, ч?мъ они сами.
Подобно жел?зу, и многіе другіе металлы легко обра-
зуютъ съ с?рой новыя т?ла, напр., ртуть даже при
простомъ стираніи съ с?рой, безъ нагр?ванія, даетъ
черное вещество—с?рнистую ртуть.
с) Если къ н?сколькимъ кристалламъ іода, положен-
нымъ въ колбу, бросить кусокъ желтаго фосфора, то
эти т?ла быстро вступаютъ во взаимод?йствіе между
собою съ выд?леніемъ тепла и св?та и образуютъ новое
однородное т?ло — іодистый фосфоръ, въ которомъ уже
н?тъ іода и фосфора въ первоначальномъ ихъ вид?.
Зд?сь не надо и подогр?вать, такъ какъ и безъ этого
при образованіи новаго т?ла выд?ляется большое
количество теплоты.
і) Жел?зныя опилки для этого опыта надо ям?ть тонко
измельченными, сухими, нержавыми и лучше еще передъ опытомъ промыть
ихъ сухимъ э?иромъ. Для опыта сл?дуетъ взять ж?л?зо и с?ру по
в?су на 7 частей перваго 4 части второй. Опытъ хорошо идетъ въ
обыкновенной пробирк? изъ тугоплавкаго стекла. А такъ какъ
пробирка при этомъ опыт? часто лопается, то въ видахъ
предосторожности подъ нее сл?дуетъ поставить жел?зную сковородку.
— 5 —
d) Металлическій магній при накаливаніи въ пламени
загорается съ осл?пительнымъ св?томъ и превращается
въ б?лый порошокъ, въ такъ называемую жженую маг-
незію (соединеніе магнія съ кислородомъ). Въ б?ломъ
порошк? магнезіи, конечно, н?тъ ничего по виду похо-
жаго на магній, и вновь получить его отсюда не легко,
хотя и возможно. Сл?довательно, въ жженой магнезіи
магній глубоко нзм?нилъ свои свойства. Во время процесса
изм?ненія магнія выд?ляется очень много тепла и св?та.
e) Б?лый кусокъ негашеной извести при обливаніи
его водой очень быстро изм?няется: онъ разсыпается и
нагр?вается при этомъ до такой степени, что часть воды
переходить въ паръ; если при этомъ на известь
положить кусочекъ пироксилиновой ваты, то она вспыхнеть.
Въ конц?-концовъ вся негашеная известь превращается
въ гашеную, или въ такъ называемую известку — т?ло
съ новыми свойствами. Опять при этомъ наблюдается
выд?леніе тепла и изм?неніе состава и свойствъ.
f) Если взять два цилиндра, наполненные двумя
прозрачными, безцв?тными газами: одинъ—хлористымъ водо-
родомъ1), а другой амміакомъ (газъ, обусловливающій
запахъ нашатырнаго спирта), и привести ихъ въ сопри-
косновеніе между собою, тотчасъ же появляется облако
б?лаго дыма, который ос?даетъ на ст?нкахъ цилиндра
въ вид? б?лаго порошка. Газы — хлористый водородъ и
амміакъ—соединились между собою, образовавъ твердое
т?ло — нашатырь, съ совершенно новыми свойствами;
при этомъ соединеніи также выд?ляется тепло, отчего
цилиндры разогр?ваются.
Во вс?хъ этихъ изм?неніяхъ общая картина состояла
въ сл?дующемъ: взятые матеріалы слагались, или, какъ
выражаются химики, соединялись въ однородное, бол?е
сложное т?ло со свойствами, не похожими на свойства
взятыхъ матеріаловъ; при чемъ каждое соединеніе со-
і) Этотъ газъ, будучи раствор?нъ въ вод?, даетъ соляную
кислоту; см. группу галоидовъ (189 стр.).
_ 6 —
провождалось выд?леніемъ теплоты, очевидно, до начала
процесса скрывавшейся во взятыхъ матеріалахъ только
въ иной форм?.
1) Всякое глубокое изм?нені? т?лъ въхиміи называется
реакціей. Въ частности — приведенный изм?ненія были
'реащгями соединены: при нихъ всегда изъ двухъ или
болыпаго числа т?лъ получается одно или н?сколько,
но всегда меньшее число т?лъ.
2) Существуютъ глубокія изм?ненія матеріи и
противоположная характера, т.-е. когда сложное однородное
т?ло распадается, или разлагается, на свои разнородный
составныя части: такія реакціи называются реапціями
разложенья.
Прим?ры:
а) Если опустить электроды электрической батареи
въ сосудъ съ водой,
подкисленной слабой с?рной кислотой*),
и собрать въ отд?льные
цилиндры появляющееся на обо-
ихъ электродахъ пузырьки га-
зовъ (рис. 1), то въ одномъ
изъ цилиндровъ—въ томъ,
который былъ на катод?, —
соберется вдвое бол?е газа,
ч?мъ въ другомъ. Легко
обнаружить и разницу въ свой-
ствахъ полученныхъ газовъ:
тотъ, который выд?ляется на
катод?, обладаетъ способно-
т> п 1 тт <<„ 0„™ ¦ стыо гор?ть, тогда какъ дру-
Рис. 1. Приооръ для разлож?нія г ' rJ
воды. гой (на анод?) самъ не го-
ритъ, но поддерживаетъ гор?-
ні? другихъ т?лъ. Первый изъ нихъ называется водоро-
домъ, а второй—кислородомъ.
*) Объяснение причины подбавки къ вод? с?рной кислоты будегь
дано въ дальн?йш?мъ излож?ніи (см. главу о «Вод?ч 220 стр.).
— 7 —
Если бы взв?сить воду въ сосуд? до опыта и поол?
него, то можно было бы уб?диться, что за время опыта
в?съ воды уменьшился и притомъ на столько, сколько
в?сятъ въ сумм? полученные газы. Сл?довательно, эти
газы, д?йствит?льно, явились т?ми веществами, на кото-
рыя разложилась вода.
b) Разложеніе воды легко произвести и другимъпутемъ.
Если бросить въ воду кусочекъ металла калія, то онъ
будетъ разлагать ее, выд?ляя часть ея водорода, и
соединяться съ остающейся ея частью, образуя ?дкую щелочь.
При этой реакціи водородъ воспламеняется отъ выд?ля-
югдейся при реакціи теплоты. Образованіе же ?дкой щелочи
обнаруживается прибавленіемъ краснаго лакмуса (краска)—
вещества, принимающая отъ щелочей синій цв?тъ.
c) Если насыпать сахаръ въ пробирку и нагр?вать
посл?днюю, то сахаръ начнетъ сначала желт?ть, зат?мъ
бур?ть и, наконецъ, черн?ть, а па холодныхъ частяхъ
пробирки появляется вода; при дальн?йшемъ нагр?ваніи
въ пробирк? останется чистый уголь, а вода испарится.
На основаніи этого опыта можно сказать, что сахаръ
разложился и далъ уголь и воду а).
d) То же самое разложеніе можно произвести съ по-
мощію с?рной кислоты — вещества, жадно поглощающаго
воду. Для этого надо взять густой сахарный сиропъ,
налить его немного въ большой цилиндръ и прибавить туда
купороснаго масла. Тотчасъ же, особенно скоро при по-
м?шиваніи,' начнется вспучиваніе и почерн?ніе вещества:
ij іірод?ссъ разложенія сахара взятъ зд?сь безъ подробностей, и
изъ того, что сахаръ разлагается въ нашемъ опыт? на уголь и воду,
нельзя заключать, что онъ состоитъ изъ угля и воды; изъ дальн?й-
шаго выяснится, что составными частями сахара являются элементы:
углеродъ, водородъ и кислородъ, которые по выд?л?ніи и образуютъ
уголь и воду. Вообще необходимо зам?тить, что у всякой химической
реакціи им?ются не только начало и конецъ, но и промежуточный
стадіи, а потому образованіе при реакціи какого-нибудь вещества въ
болыпинств? случаевъ является, по выраженію Шенбейна, «какъ бы
заключительной сценой многоактной химической драмы».
_ 8 —
образуется очень большое количество угля, который бу-
детъ вываливаться изъ цилиндра, если досл?дній не
особенно великъ, а вода частью удержится купороснымъ
масломъ, частью же улетитъ въ вид? пара отъ проис-
шедшаго при реакціи повыгаенія температуры.
е) Порошокъ красной окиси ртути при нагр?ваніи
его въ реторт? (рис. 2) разлагается на металлическую
ртуть, которая частію ос?даетъ въ вид? зеркала на хо-
Рис. 2. Разлож?ні? окиси ртути. А — реторта съ окисью ртути;
В — ртуть, выд?лившаяся изъ окиси ртути; С — ванна съ водой;
D — цилиндръ съ собирающимся кислородомъ.
лодныхъ частяхъ регорты, а частію собирается въ пріем-
ник? Д и на газъ кислородъ, который обнаруживается
т?мъ, что въ немъ легко воспламеняется тл?ющая
лучинка. Его можно собрать въ цилиндръ D, опрокинутый
въ воду, какъ показано на рис. 2.
f) Въ подобномъ же прибор? (или, проще, въ про-
бирк?) можно легко разложить при нагр?ваніи, напр.,
бертоллетову соль на сл?дующія составныя части: на
газъ кислородъ и на б?лое вещество (хлористый калій),
которое останется въ нрибор?
— 9 —
Въ этой второй серіи опытовъ везд? брался сложный
матеріалъ, который разлагался на бол?е простыя состав-
ныя части. Вообще зд?сь изъ меныпаго числа веществъ
получалось большее число ихъ.
3) Наконецъ есть третья и посл?дняя категорія глу-
бокихъ изм?неній, — когда въ сложномъ матеріал? одна
составная часть зам?няется какой-нибудь другой. Это
реакцги обм?на (или перем?щенія): число веществъ
зд?сь до и посл? изм?ненія всегда одно и то же а).
Прим?ры:
a) Въ синій растворъ м?днаго купороса опускается
жел?зяая пластинка (жел?зный ножъ). Спустя н?которое
время растворъ д?лается бл?дно-зеленымъ, а опущенная
пластинка покрывается краснымъ слоемъ чистой
металлической м?ди, которую съ пластинки легко снять. Это
явленіе объясняется т?мъ, что жел?зо выт?сняетъ м?дь
изъ м?днаго купороса, и само становится на ея м?сто,
а м?дь осаждается на оставшейся части жел?за.
b) Если насыпать въ фарфоровую,, ступочку немного
порошка нашатыря, полученнаго нами при одномъ изъ
прежнихъ опытовъ (см. on. f, стр. 5), и прибавить туда
гашеной извести—т?ла, уже немного знакомаго (см. реакц.
соед., оп. е), а зат?мъ см?сь растереть пестикомъ, тот-
часъ же появляется характерный ?дкій запахъ амміака,
который, очевидно/выт?сняется изъ нашатыря—его со-
единенія съ хлористымъ водородомъ.
Подобныя глубокія превращенія, совершающіяся въ
природ?, въ большинств? случаевъ очень сложны, но вс?
они сводятся лишь къ указанньшъ тремъ типамъ и чаще
всего представляютъ одновременную комбинацію и соеди-
неній, и разложеній, и перем?щеній.
Химическія явленія составляютъ основу жизни
природы: они (вм?ст? съ физическими) дали нашей планет?
!") Въ этомъ тр?ть?мъ тип? изм?неній т?лъ въ сущности им??тся
соедин?ні? первыхъ двухъ типовъ, т.-е. разложенія веществъ на
составная части и соединены посл?днихъ въ новыхъ комбинадіяхъ.
— 10 -
тотъ видъ и составь, который она им?етъ; они же
подготовили то, что мы называемъ почвой; путемъ химиче-
скихъ изм?неній мертвыя вещества почвы превращаются
въ ткани растеній, а чрезъ нихъ—и въ ткани животныхъ;
путемъ ^химическихъ изм?неній поддерживается жизнь
вс?хъ брганизмовъ; хямтескія же изм?ненія сопрово-
ждаютъ организмы и посл? ихъ смерти. Такъ
многочисленны химическіе процессы въ природ?! Но, какъ
сказано выше, все ихъ разнообразіе укладывается въ три
типа:
1) реакціи соединенія;
2) реакціи разложения;
3) реакціи обм?на.
Изученіе этлхъ изм?неяій въ однородныхъ веществахъ,
въ связи съ ихъ составомъ, и составляетъ задачу шміи1).
!) Въ посл?дн?е вр?мя'въ химич?скій обиходъ вош?лъ новый т?р-
минъ — «разаъ, съ помощью котораго, какъ увиднмъ ниже, можно
н?сколько точн?е спред?лить задачу химія. Фазой яазываютъ опре-
д?іенно? состояні? т?ла: такъ, напр., когда въ сосуд? им?ются
жидкая вода и ея паръ, то говорятъ: данная система состоитъ изъ двухъ
фазъ — фазы жидкой и фазы газообразной. Т? системы, въ
которыхъ каждая фаза ц?ликомъ можетъ быть переведена въ любую
другую (во взятомъ лрим?р?—вода въ паръ и паръ въ воду), называются
системами, образованными однимъ независимымъ сдагаемымъ; т? же
системы (напр., вода, въ которой растворенъ сахаръ), въ которыхъ
н?которыя изъ фазъ другъ въ друга (вода въ сахаръ и обратно) не
пр?вратимы, называются системами изъ двухъ или бодыпаго числа
независимых* слага?мыхъ. Съ изложенной точки зр?нія задача химги
состоитъ въ изсл?дованіи т?хъ системъ, въ которыхъ им?ются два
или большее число я?зависимыхъ слагаемыхъ; физика же изсл?ду?тъ
превращения въ системахъ изъ одного н?зависимаго слагаемаго, т.-е.
въ сист?махъ, гд? каждая фаза пр?дставля?тъ лишь различное
состояні? одного и того же вещества (мат?ріала).
При превращеніяхъ независимыя слагаемая могутъ при опред?лен-
ныхъ в?совыхъ отяошеніяхъ давать однородным, иначе — гомогенных
системы (напр., жел?зо и с?ра, взятия въ отношеніи 7:4,
соединяются и даютъ гомогенную систему—с?рнистое жел?зо), которыя и
называются химическими соединепгямц.
— 11 —
Методы, которыми пользуется химія въ изученіи
природы, суть наблюденіе и опытъ, т.-е. искусственное
воспроизведете того или иного явленія съ ц?лью выяс-
ненія причины его и подробнаго теченія его. Опытъ
производится или путемъ анализа, т.-е. путемъ разложения
сложнаго на прост?йшія слагаемыя, или путемъ синтеза,
т.-е. путемъ образованія сложнаго вещества изъ бол??
простыхъ слагаемыхъ, а въ конц?-концовъ, изъ элемен-
товъ.
§ 4. Матерія. Т?ла простая и сложныя. При хи-
мическихъ изм?неніяхъ происходятъ одновременно изм?-
иенія въ состав? вещества и изм?ненгя въ эиергіи ее-
щеспьва. Очень важно сейчасъ же разр?шить вопросъ:
конечны или безконечны эти изм?ненія?
Что касается матеріи, то характеръ ея превращеній
проще выясняется, напр., на сл?дующихъ опытахъ.
Если въ тугоплавкой трубк? Ь (рис. 3), им?ющей
посредине расширеніе и заткнутой съ одного конца
пробкой, нагр?ть, предварительно хорошо., высушенный, ми-
нералъ малахитъ г), то, спустя н?которое время, онъ
начинаетъ разлагаться (на что указываетъ переходъ его
цв?та изъ зеленаго въ черный) на бол?е простыя по
составу вещества: воду, которая будетъ появляться сначала
въ вид? росы, а потомъ и въ вид? капель на холодныхъ
частяхъ трубки, и на углекислый газъ, который пойдетъ
чрезъ газоотводную трубку въ цилиндръ В съ водой, на-
стоенной предварительно на известк?: углекислый газъ
мутитъ такую воду, такъ что по помутн?нію известковой
*) Малахитъ, природный зеленый камень, взятъ лишь потому, что
съ нимъ очень легко и показательно идетъ опытъ. Вм?сто природ-
наго малахита можно взять тождественную съ нимъ по составу
продажную углем?дную соль. Посл?днюю легко получить и самому
экспериментатору: стоитъ только къ водному раствору м?днаго (иначе си-
няго) купороса прилить водный же растворъ соды; при этомъ
получится зеленый ооадокъ, который сл?дуетъ отфильтровать, промыть
водою и высушить.
— 12
Рис. 3. Раздозкені? малахита.
воды можно сл?дить и за
выд?леніемъ его. Когда
весь малахитъ
разложится, на что укажетъ намъ
прекращеніе образованія
б?лаго осадка, дающаго
муть, то на его м?ст?
останется черная масса
такъ наз. окиси м?ди.
Описанный ояытъ, сл?-
довательно, даетъ право
заключить, что малахитъ
при разложений даетъ
воду, углекислый газъ и
окись м?ди.
Эти продукты разложеиія малахита, въ свою очередь,
можно также разложить на еще бол?е простые матеріалы.
Сложность воды была уже показана въ одномъ изъ преж-
нихъ опытовъ (см. реак. разл., стр. 6).
Сложность углекислаго газа и окиси м?ди легко
доказать сл?дующими опытами.
Простымъ нагр?ваніемъ разложить эти вещества
неудобно, и для того, чтобы показать ихъ сложность,
приходится приб?гнуть къ реакціямъ выт?сиенія или обм?на.
Опытъ показалъ, что въ окиси м?ди есть кислородъ,
который можетъ быть отнять у посл?дней водородомъ. Это
производится въ сл?дующемъ прибор? (рис. 4). Въ ша-
рик? d находится окись м?ди, водородъ получается въ
колб? а (при д?йствіи на цинкъ с?рной кислоты) и
высушивается въ трубк? с, наполненной хлористьшъ каль-
ціемъ—веществомъ, поглощагощимъ воду. Проходя надъ
шарикомъ d, подогр?ваемымъг) бунзеновской гор?лкой
или пламенемъ спиртовой лампы, водородъ соединяется
*) Подогр?ваніе можно начинать лишь тогда, когда изъ прибора
выт?сн?нъ весь возлухъ, иначе можетъ произойти взрывъ (см.
«Водородъ»).
— 13 —
съ кислородомъ окиси м?ди, образуя воду, которая ча-
стію въ вид? пара и выд?ляется изъ трубочки, а частію,
если трубка не очень нагр?та, осаждается въ вид? ка-
пелекъ на холодныхъ частяхъ трубки; въ щарик? же
остается красная металлическая м?дь. Такимъ образомъ
этотъ опытъ уб?ждаетъ, что окись м?ди разлагается на
м?дь и кислородъ.
Рис. 4. Рааюжені? окиси м?ди водородомъ.
Для доказательства сложности углекислаго газа можно
воспользоваться сл?д. приборомъ (рис. 5). Въ двугорлой
склянк? (при д?йствіи соляной кислоты на м?лъ или
мраморъ) получается углекислый газъ: сначала онъ
направляется въ сос?дній цилиндръ, гд?. съ ц?лыо осуше-
нія, промывается чрезъ с?рную кислоту, а зат?мъ идетъ
въ сухую трубку съ шарикомъ, въ который кладется или
кусочекъ металла калія, или порошокъ металла магнія;
трубка съ шарикомъ заканчивается трубочкой, согнутой
подъ прямымъ угломъ и опущенной въ стаканчикъ со
ртутью: посл?дняя препятствуетъ вхожденію въ приборъ
наружнаго воздуха. Тотъ же воздухъ, который им?ется
въ прибор?, предварительно выт?сняется продолжитель-
нымъ пропусканіемъ чрезъ приборъ углеікислаго газа.
Зат?мъ шарикъ съ каліемъ или магніемъ нагр?вается:
_ 14
происходить Энергичное сгораніе металла на счетъ
кислорода, находившаяся въ углекисломъ газ?, и образуется
такимъ образомъ б?лое кислородное соединение того или
другого металла. Но зд?сь же окажется еще уголь,
видимый*' простымъ глазомъ; посл?дніі входилъ' также въ
составь углекислаго газа.
Такимъ образомъ углекислый газъ разлагается на
уголь и кислородъ.
Полученные при раздоженіи малахита м?дъ,
кислородъ, водородъ и углеродъ при современныхъ методахъ
Рис. 5. Разложение углекислаго газа.
уже не могутъ быть разложены. Такія вещества, который
не удалось до сихъ поръ разложить на разнородныя со-
ставныя части, называготъ простыми1), а вещества, раз-
лагаемыя на разнородныя составныя части,—сложными.
Какое бы сложное вещество ни подвергалось разло-
женію, въ конц?-коицовъ, всегда получатся подобныя
і) Сл?довательно, въ яаучномь понятіи «простое т?ло> им?ется
въ виду не абсолютная неразложимость вещества, а лишь
неразложимость для даннаго времени при иы?ющихся въ настоящее время
методахъ разлозвенія. Въ исторіи химіи имеется не мало нрим?ровъ,
когда т?ла, считавшаяся первоначально простыми, впосл?дствіи
оказывались сложными; нри усовершенствованіи м?годовъ они были
разложены па простЪишія составныя части.
— 15 -
неразложимый простыл т?ла: ихъ наука не ум?етъ и
составить изъ чего-нибудь. Такихъ простыхъ т?лъ
насчитывается въ настоящее время около 80.
Сл?довательно, подъ именемъ матеріи въ природ? раз-
ум?ются два ряда т?лъ: т?ла простыл и т?ьла сложный.
§ 5. Вотъ перечень простыхъ т?лъ:
Азотъ N . .
Алюмиігій Аі
Аргонъ At .
Барій Ва. .
Бериллій(Глицій
Боръ В . . .
Бромъ Вг . .
Ванадій Vd. .
Висмутъ Ві. .
Водородъ Н. ,
Вольфрамъ W.
Гадолиній Gd .
Галлій Ga . .
Гелій Не, . .
Германій Ge .
Диспрозій Ly.
Жел?зо Ге
Золото Аи
Индій In.
Иридій іг
Иттрій V.
іодъ J . .
Кадмій Cd
Калій К .
Кальцій Са .
Кислородъ О
Кобальтъ Со
Кремній Si .
Криптонъ Кг
Ксенонъ Хе
14,01
27,1
39,88
137,37
)Ве 9,1
11,0
79,92
51,0
. 208,0
1,008
184,0
157,3
69,9
3,99
72,5
162,5
55,84
197,2
114,8
193,1
89,0
126,92
112,40
39,10
40,07
16,00
58,97
28,3
82,92
130,2
Лантанъ La .
Литій Li. . .
Лутедій Lu. .
Магній Mg . .
Марганецъ Ми
Молибденъ Мо
Мышьякъ As
М?дь Си. .
Натрій Na .
Неодимъ Nd
Беоиттербіи Y
Неонъ Ne .
Никке'ль Ш.
Ніобій Nb .
Нитонъ Nt .
Олово Sn. .
Осмій Os. .
Палладій Pd
Платина Pt.
Празеодимъ Рг
Радій Ra. .
Родій Rh. .
Ртуть Hg*. .
Рубидій Rb.
Рутеній Ru.
Самарій Sa .
Свинедъ РЬ.
Селенъ Se .
Серебро Ag.
Скандій Sc .
139,0
6,94
174,0
24,32
54,93
96,0
74,96
63,57
23,00
144,3
172,0
20,2
58,68
93,5
222,4
119,0
190,9
106,7
195,2
140,6
226,4
102,9
200,6
85,45
101,7
150,4
207,10
79,2
107,88
44,1
— 16 —
Стронцій Sr
Сурьма Sb
С?ра S .
Таллій Tl.
Тантадъ Та
Теллуръ Те
Тербій ТЬ.
Титанъ Ті
Topi* Th.
Тулій Ти.
Углеродъ С
4 Надо зам?тить,
часто встр?чаются
Уранъ Иг.
Фосфоръ Р
Фторъ F .
Хлоръ С1.
Хромъ Сг
Цезій Cs.
Церій Се.
Ципкъ Zu
Цирконій Zr
Эвропій Ей.
Эрбій Ег. .
87,63
120,2
32,07
204,0
181,5
127,5
159,2
48,1
232,4
168,5
12,00
что далеко но вс? они
. 238,5
. 31,04
. 19,0
. 35,46
. 52,0
. 132,81
. 140,25
. 65,37
. 90,6
. 152,0
. 167,7 3)
одинаково
і) Въ эгомъ перечн? н? упомянуты н?которыя простыл т?ла, такъ
какъ они мало еще изсл?дованы; числа означаютъ паи (см. 18 §).
2) Воть приблизительное процентное содержание въ изсл?дован-
ной части земного шара н?которыхъ, наибол?е часто встр?чающихся,
просгыхъ т?лъ:
Въ океан.
Въ земной
кор?: въ
Кисдородъ .... 47,29
Кр?мяіи 27,21
Алюминій .... 7,81
Жел?зо 5,46
Кальціи 3,77
Магнія 2,63
НатрШ 2,36
"/о-
Калій . . .
Водородъ .
Тятанъ . .
Углеродъ .
Хлоръ. . .
Бромъ. . .
Фосфоръ .
Марганецъ
Сіра . . .
БарШ . .' .
Азотъ. . .
Хромъ. . .
въ о/0.
85,79
0,05
0,14
1,14
0,04
10,67
Въ атмо-
сфер?:
23,00
0,002
2,07 \
0,008/
0?09
Среднее:
въ о/0.
49,98-0
25,30—Si
7,26—А1
5,08-Fe
3,51—Са
2,50-Mg
2,28—Na
2,23—К
0,34-Н
0,30—Ті
0,21—С
{о,15~
2,40
0,21
0,33
0,22
0,01
0,10
0,08
0,03
0,03
0,01
100,00 ~100,00 100,00 100,00
01,Вт
77
0,09-Р
0,07—Мп
0,04—S
0,03—Ва
0,02—N
0,01—Сг
- 17 -
1. Распространеші?йшіи въ природ? просгыя тізла
суть; водородъ, углеродъ, азотъ, кислрродъ, нагрій,магній,
алюминій, кремній, фосфоръ, с?ра, хлоръ, кальдій и
жел?зо.
2. Въ природ? не очень распространены, но хорошо
изв?стяы по прим?н?нію въ общ?житіи или вь техник?;
литій, боръ, фторъ, хромъ, марганецъ, кобальтъ, никкель,
м?дь, цинкъ, мышьякъ, бромъ, строндій, серебро, кадмій,
олово, ,сурьма, іодъ, барій, платина, золото7 ртуть, сви-
нецъ, висмутъ и уранъ.
Приведемъ н?сколько прим?ровъ состава изв?стн?л-
шихъ т?лъ природы:
a) въ составъ тканей растительныхъ и животныхъ
организмовъ преимущественно входятъ: углеродъ, кисло-
родъ, водородъ, азотъ3 с?ра, фосфоръ, кальцій и жел?зо;
b) вода состоитъ изъ водорода и кислорода;
c) глина—изъ алюминія, кремнія и кислорода;
(1) песокъ—изъ кремнія и кислорода;
e) поваренная соль—изъ натрія и хлора;
f) сахаръ — изъ углерода, водорода и кислорода
и т. д.
§ 6. Элементы. Отъ понятія о простыхъ т?лахъ
надо отличать понятіе объ элементахъ. Это отличіе по-
нятн?е будетъ на прим?р?. Вс?мъ изв?стны уголь,
графить и алмазъ: они суть простыл т?ла, отличающіяся
другъ отъ друга по свойствамъ и ыогущія быть
превращенными одно въ другое; во вс?хъ этихъ трехъ тізлахъ
находится одинъ и тотъ же матеріалъ — элемеитъ
углеродъ; этотъ элементъ находится и въ томъ углекисломъ
газ?. который получается при гор?ніи угля на воздух?
и который выд?ляется при нагр?ваніи малахита (см. 11 сгр.)
и во вс?хъ углеродистыхъ (органическихъ) веществахъ.
Сами простыя т?ла являются, сл?довательно,
образованными изъ того или иного элемента. Элементы гь сушь
основные виды матеріи: ихъ сложеніемъ составлена вся
Нг оргатпчеекая химія 2
18
видимая природа. Простое т?ло содержите всегда одинъ
элементъ, а сложное—не мен?е двухъ элементовъ а).
'Понятія о химическихъ элементахъ и о простыхъ и
сложпыхъ т?лахъ лежатъ въ основ? химическихъ знаній.
Элем.еіи*ы составляютъ крайній пред?лъ нашихъ
химическихъ познаній о матеріи.
Итакъ, разнообразіе состава т?лъ природы зависитъ
отъ разнообразія комбинацій. между элементами. Ясно
теперь, что на вопросъ (см. § 4): конечны или безкон?чны
превращения матеріи, сл?дуетъ отв?тить, что превращенія
эти для нашего времени конечны: они им?ютъ пред?лъ,
каковымъ и являются элементы.
§ 7. Законъ еохран?нія вещества. Еще въ конд?
XVTlI в,(въ 1770г. )французскій химикъ Лавуазье (Lavoisier)
ввелъ въ химическій обиходъ основной законъ, касающійся
характера превращеиій матеріи,—законъ, изв?стный подъ
имеаемъ закона сохраненья вещества (или матеріи).
Законъ этотъ гласить, что матерія во время реакціи
не исчезаешь и не творится, а лишь только видоизм?-
няется, всегда оставаясь матеріею; или то же самое можно
сказать въ сл?дующихъ словахъ: при химическихъ пре-
вращеніяхъ в?съ веществъ, вступающихъ въ реакцію, всегда
равенъ в?су веществъ,получающихсявърезультат?реакціи,
или—что тоже—общій в?съ участвующихъ веществънеизм?-
няется, а сл?довательно, общая масса2) ихъ сохраняется3)
*) Понятія объ «элементахъ и простыхъ т?лахъ» станетъ ясн?е
посл? ознакомл?нія съ частицами и атомами. До самаго посл?дняго
времени существенно характеряымъ для элементовъ свойствомъ
считалась ихъ непревращаемость другъ въ друга; но опыты Рамсая надъ
превращеніями раді?вой эманадіи (см. § 193) говорить за возможность
взаимныхъ пренращенш элемоытарныхъ видовъ матеріи.
2) Масса т?ла пропорціональна в?су.
3) Сл?дующая бол?е общая формулировка учитываетъ всякія
перем?щенія матеріи: <каждьш разъ, когда масса даннаго т?ла изм?-
ня?тся (увеличивается или уменьшается), то масса одного или н?-
сколькихъ окружающихъ т?лъ пр?терп?ваетъ одновременное изм?ио-
иіе, равное по величин?, но противнаго знака (уменьшается или
увеличивается)».
— 19 —
Этому закону, съ перваго взгляда, какъ будто иро-
тивор?читъ ежедневный опытъ: дрова въ печи сгораютъ
съ очень малымъ остаткомъ золы; уголь, керосинъ и
св?ча сгораютъ почти безъ остатка. Но это противор?чіе
лишь кажущееся. Вотъ опыть*, показывающіе, что при
гор?ніи вещество горящихъ т?лъ не уничтожается, а
лишь химически (по составу) изм?няется.
Въ большую совершенно сухую колбу
(рис. 6) на проволок? опускается горящая
св?ча. Она немного погоритъ и въ колб?,
но скоро погаснетъ; при этомъ на ст?нкахъ
колбы легко можно зам?тить появившуюся
во время гор?нія росу: это сгустившійся
водяной паръ—продуктъ гор?нія. Если
вынуть изъ колбы св?чу, влить туда
известковой воды и хорошенько взболтать, то вода рис 6( г*0.
СИЛЬНО ПОМУТН??ТЪ. ЭТО ПОМуТн?ніе ПрС- Р*ні? св?чи
TIT» Т?П TTOTR
исходить отъ д?йствія на известковую воду
углекислаго газа. Итакъ, опытъ указываетъ,
что св?ча при гор?ніи не исчезаетъ безсл?дно, а обра-
зуетъ воду и углекислый газъ.
Доказательство будетъ еще ясн?е, если опытъ
поставить такъ, чтобы св?ча гор?ла на в?сахъ, и чтобы
водяной паръ и углекислый газъ улавливались. Для этого
стоить взять обыкновенное ламповое стекло и прив?сить
его къ коромыслу в?совъ; въ верхнюю часть стекла
положить ?дкое кали и хлористый кальцій 1), засунувъ
предварительно въ стекло м?дную с?тку; въ нижнее
отверстіе сл?дуетъ вставить на продырявленной пробк?
св?чу, какъ показано на рис. 7. В?сы уравнов?шиваютъ,
и св?чу зажигаютъ. При гор?ніи отъ пагр?ванія въ
стеклЬ образуется снизу вверхъ тяга; благодаря этой
тяг?, образовавшіеся водяной паръ и углекислый газъ
пройдутъ чрезъ ?дкое кали и хлористый кальцій и въ
*) ?дкое кали способно ноглощать углекислый газъ, а хлористый
кальцій—воду.
2*
— 20 —
Рис. 7. Гор?ні? св?чи на в?сахъ.
нихъ поглотятся. В?сы при гор?ніи постепенно выйдутъ
изъ положенія равнов?сія: чашка в?совъ, на которой
горитъ св?ча, начнетъ перетягивать, не смотря на сгора-
ніе св?чи и видимое уничтоженіе матеріала. Очевидно,
при гор?ніи и при видимомъ, якобы, исчезновении ма-
теріи, посл?дняя не только не исчезаетъ, но даже еще
увеличивается въ в?с?: уловленные въ ламповомъ стекл?
вода и углекислый газъ оказались бол?е тяжелыми, ч?мъ
давшая ихъ матерія свЬчи.
Чтобы р вшить вопросъ, откуда же взялся прив?съ,
надо ближе присмотр?ться къ двумъ посл?днимъ опы-
тамъ. Въ первомъ изъ нихъ (рис. 6) св?ча, гор?вшая
въ замкнутом^ пространств?, скоро гасла, а во второмъ
(рис. 7) св?ча гор?ла въ открытомъ стекл? (пробка
была продырявлена) и не гасла; если здесь также
закрыть стекло, то св?ча быстро погаснетъ, какъ и въ
первомъ случа?. Выводъ отсюда одинъ: во второмъ опыт?
воздухъ свободно притекалъ къ горящей св?ч?, а въ
— 21 -
первомъ притокъ его былъ затрудн?нъ. Д?йствит?льно,
.ід?сь и кроется причина различія опытовъ. Доказать,
что воздухъ д?йствительно виноватъ въ лолученномъ
нрив?с?, можно на сл?дующемъ опытЬ (рис. 8).
Пусть св?ча будетъ гор?ть въ замкнутой колб?, въ
которую положены предварительно поглотители: угле-
кислаго газа — ?дкое кали, воды — хлористый кальцій ])>
колба затыкается пробкою съ проходящими чрезъ нее
проволокой, на конецъ которой прикр?плена горящая
св?ча, и согнутой подъ >гломъ трубкой; на а рубку на-
д?вается каучуковая трубочка съ зажимомъ, а въ
каучуковую трубочку вставляется еще трубка, которая и
опускается въ стаканъ съ подкрашенной водой. Зажженная
св?ча, какъ это было и раньше, н?которое время горитъ, а
зат?мъ гаснетъ. Причина этого не можетъ заключаться
ни въ углекисломъ газ?, выд?лившемся нри гор?ніи,
потому что онъ поглощается ?дкимъ кали, ни въ вод?,
которая поглощена хлористымъ кальціемъ. Остается
обратиться къ воздуху, какъ къ t участцику въ опыт?, и
узнать, ц?лъ ли онъ. Съ этой
ц?лію, по охлаждеиіи колбы, сл?-
дуетъ открыть зажимъ на
каучуковой трубк?: жидкость изъ
стакана сейчасъ же поднимается по
трубк? и входитъ въ колбу.
Отсюда естественное заключеніе:
изъ воздуха колбы что-то исчезло.
Въ оставшемся воздух? уже
ничто не горитъ, — онъ не спосо- с
бенъ поддержать гор?ні?. Сл?-
довательно, въ воздух? есть та- fa^latotoSpy"
кая составная часть, которая кой колб?. а) Кусочки ?д-
пожать поддерживать гор?ніе, и ^»» ^ZTZ
во время ГОр?нія она соединяется жимъ;с)подкраіпеннаявода.
*) Практически очень удобно брать такъ называемую натронную
известь.
1 ' iLJ i_j
съ горящимъ т?ломъ, входя вь составъ продуктовъ го-
р?нія — воды и углекислаго газа — и д?лая ихъ бол?е
тяжелыми, ч?мъ сгор?вгаіи матеріалъ.
Эта же составная часть воздуха, называемая кислоро-
домъ, можетъ быть выд?лена обратно изъ углекислаго
газа и воды при ихъ разложении (см. опыты разложенія
воды и малахита).
Итакъ, причина, увеличивающая в?съ продуктовъ
гор?вія,—кислородъ воздуха.
При вс?хъ случаяхъ видимаго исчезновенія матеріи
при химическихъ превращеніяхъ, обыкновенно, какъ и
въ случа? гор?нія, вм?ст? съ изм?неніемъ состава про-
исходитъ и переходъ веществъ изъ видимыхъ жидкаго
или твердаго состояній въ невидимое, газообразное. 06-
щій же в?съ веществъ, участвовавшихь въ превращении
до и посл? него, всегда остается неизм?ннымъ.
Сл?дуісщій простенькій'опытъ также подтвердить
сказанное. Поставимъ на одну чашку в?совъ два стаканчика,
изъ которьгхъ въ одномъ находится купоросное масло, а въ
другомъ растворенный въ вод? свинцовый сахаръ. Уравно-
в?сивъ гирьками чашки в?совъ, выльемъ содержимое
одного сгаканчика въ другой и пустой стаканчикъ опять
поставимъ на чашку в?совъ: результатомъ см?шенія
жидкостей 'будетъ образованіе б?лаго твердаго вещества, т.-е.
изм?неніе состава вещестнъ, а между т?мъ равнов?сіе ча-
шокъ в?совъ останется неизм?ннымъ, т.-е. такимъ же, ка-
ішмъ оно было и до происшедшая химическая превращения.
Это - то правило, подтвержденное и подтверждамое
тысячами наблюдений, и обобщено въ приведенный за-
конъ сохраненья вещества, называемый также закономъ
в?чности матеріи. Этотъ же законъ можно
распространить на всю природу и формулировать его такъ;
количество матеріи въ природ? неизм?пно, всегда одно и
то же было и есть. Конечно, посл?днее утверждение
является уже н?скоіько гипотетичнымъ, такъ какъ не
можетъ быть пров?рено на опыт?.
— 23 —
Какъ ни простъ законъ неуничтожаемое™ матеріи, а
на точное обоснованіе его потребовалось не мало сто-
л?тій. Теперь этотъ законъ вн? всякихъ сомн?ній. Онъ
лежитъч въ основ? пониманія всего совершающагося съ
матеріей. Мало того, этотъ законъ даетъ въ руки изсл?-
дователя и в?рный контроль правильности изсл?дованій:
изсл?дователь всегда долженъ помнить, что в?съ взятыхъ
веществъ точно долженъ быть равенъ в?су полученныхъ
веществъ; разъ такого равенства н?тъ, самое изсл?дова-
ніе или неполно, или неправильно :).
§ 8. Краткій очеркъ исторіи химіи. Начало химіи
теряется въ глубокой древности. Зачатки химическихъ
наблюденій и открытій находятся уже у одного изъ пер-
выхъ культурныхъ народовъ, о которомъ дошли до насъ
св?д?нія,—у египтянъ. Они сначала извлекали изъ земли
только' самородные металлы; зат?мъ научились
обрабатывать руды, д?лать сплавы и выучились даже окрашивать
стекла и придавать имъ чрезъ окраску видъ драгод?нныхъ
камней. Но опыты эти были случайны, сд?ланы паугадъ
и вызваны были большею частью коммерческими д?лями.
Первыя попытки сгруппировать факты и осв?тить
ихъ пониманіемъ причинной связи находятся у грековъ.
!) Самъ Лавуазье выразилъ законъ сохраненія вещества въ
сл?дующихъ словахъ: «Мы можемъ признать за аксіому, что при вс?хъ
пр?вращеніяхъ, какъ искусственныхъ, такъ и природныхъ, ничто не
создается вновь: одно и то же количество матеріи существуетъ до
опыта и посл? него. На этомъ принцип? покоится возможность ка-
кихъ бы то ни было химическихъ опытовъ, и мы принуждены,
благодаря ему, всегда ожидать настоящаго тождества, или равенства, между
сущностями т?лъ изучаемыхъ и т?хъ, которыя могутъ быть извлечены
ихъ анализомъ>. Зам?тимъ, между прочимъ, что нашъ русскій ученый
М. В. Ломоносовъ этотъ же законъ формулировалъ еще раньше
Лавуазье, но не сум?лъ придать ему надлежащего значенія. Въ 1760 г.
въ овоемъ «Разсужденіи о твердости и жидкости т?лъ> Ломоносовъ
выразилъ эту мысль въ сл?дующихъ словахъ: «Вс? перем?ны, въ
натур? сдучающіяся, такого суть состоянія, что сколько чего у одного
т?ла отнимется, столько присовокупится къ другому. Такъ, ежели
гд? убудетъ н?сколько матеріи, то умножится въ другомъ м?ст?».
— 24 -
Рр?ки настойчиво старались разр?шить самые основные
вопросы: что такое видимый міръ, откуда онъ произо-
шелъ, и изъ чего состоять вс? т?ла въ природ?.
Первые греческіе философы учили, что начало, или
основа вещей, едина, чю міръ полонъ видоизм?неніями
одной и той же основы, или субстанціи. Такъ, ?алесъ
училъ, что все сущее произошло изъ воды: если вода
сгустится, она д?лается землею, а если испарятся, то
становится воздухомъ. Въ VI в?к? ученіе ?алеса см?-
няется учепіемъ сначала Анаксимандра, по которому все
происходить изъ хаотическаго „безпред?льнаго", а по-
томъ—Анаксимена, реализовавшаго ото „безпред?льное",
какъ „воздухъ": изъ воздуха путемъ сгущенія и разр?женія
его все происходить.
Гераклитъ признавалъ, что начало всему огонь; по
Гераклиту „все течешь и ничто не пребываетъ;
абсолютное начало природы есть в?чно живой огонь, то угаса-
ющій въ другія косныя стихіи, то вновь пожирающій ихъ
въ себ?, переходящій отъ себя къ своей
противоположности и отъ своей противоположности возвращающійся
къ себ?. Въ этой борьб?—внутреннее согласіе, въ этомъ
в?чномъ движеніи и жизни—слово, „Логосъміровой тайны,
в?чный законъ Космоса". Зд?сь впервые отм?чена энергія.
Идутъ конецъ V в?ка и начало IV в., и мы видимъ
еще бол?е оригинальное т?ченіе, представителями кото-
раго являются Левкиппъ и его товарищъ Демокритъ—
первые ировозв?стники чистаго матеріализма: по ученію
ихъ, въ основ? всего сущаго лежать дв? сущности:
атомы безконечно малые, безусловно плотные и
твердые, безцв?тные и нед?лимы?, и пустота. Основные
пункты ихъ ученія таковы: 1) Изъ ничего ничто
произойти не можеть; ничто существующее не можетъ быть
уничтожено, и всякое изм?нелі? состоитъ лишь въ
соединении и разд?леніи. 2) Ничто не случайно: па все
есть причина и необходимость. 3) Кром? атомовъ, все
остальное есть только сужденіе, а не существованіе.
Лавуазье (Antoine Laurent Lavoisier).
1743—1794.
— 27 —
4) Атомы, безконечные по числу и по форм?, своимъ дви-
женіемъ, столкновеніемъ и возникающимъ отъ того круго-
вращеніемъ образуютъ видимый міръ. 5) Различіе пред-
м?товъ зависить только отъ различія числа, формы и
порядка атомовъ, изъ которыхъ они образованы, но не
отъ качеспьвеннаго различія атомовъ, д?йствующихъ другъ
на друга только давленіемъ и ударами. 6) Духъ, какъ и
огонь, состоитъ изъ мелкихъ, круглыхъ, гладкихъ, наи-
бол?е легко подвкжныхъ и легко всюду проникающихъ
атомовъ, движеніе которыхъ составляетъ явленіе жизни.
Интересное, оригинальное ученіе, но неясное, а потому и
непонятное! Зд?сь матерія и эн?ргія все еще слились въ
одно, до разд?ленія ихъ ждать еще долго—до XVII в?ка.
Атомы Демокрита были мысленною и абсолютною гранью
механической д?лимости вещества *), что, зам?тимъ,
зд?сь же, совершенно отлично отъ современнаго
представления объ атомахъ.
У посл?дующихъ философовъ видно стремленіе
поставить въ основу существующая н?сколько началъ.
Такъ, по Эмпедоклу, происхожденіе и уничтоженіе
вещей происходить путемъ сложенія и'разложенія в?чныхъ
качественно неизм?нныхъ элементовъ, а именно—воздуха,
воды, земли и огня: они сначала были соединены
любовью въ блаженномъ единств? божественной сферы, а
зат?мъ раздроблены роковой враждой. Въ міровомъ
процессе они вновь соединяются любовью. Чрезвычайно
интересны и сл?дующія положенія Эмпедокла: „Изъ ничего не
возникаегъ ничего; ничего изъ того, что существуетъ, не
можетъ быть уничтожено. Всякая перем?на въ природ? не
что иное, какъ соединеніе и разд?леніе частей. Сущность
природы заключается въ в?чномъ круговорот?".
Впосл?дствіи, мы увидимъ, эти положенія будутъ
основными въ д?л? міропониманія.
]) Популярное изложеніе этого ученія далъ Титъ Лукрецш Каръ
въ его <De гегитп naturae». Русскш переводъ этого сочиненія подъ
заглавіемъ «О природ? вещей» сд?ланъ И. Рачинскимъ. Ц. 2 р. 50 к.
— 28
Особепнймъ внимані?мъ пользовалось учоніе
Аристотеля (въ IV в. до Р. Хр.), который училъ, что все
видимое состоитъ изъ четырехъ началъ или элементовъ:
воздуха, воды: земли и огня; цосл?дннэ находятся въ
зависимости отъ пятаго (quinta essentia)—эвира, наполня-
ющаго и оживляющаго природу. Сл?ду?тъ зам?тить, что
въ своихъ элементахъ Аристотель (а равно и
вышеупомянутые философы) скор?е вид?лъ носителей важн?йншхъ,
легко узнаваемыхъ, свойствъ т?лъ природы, ч?мъ д?йстви-
тельныхъ слага?мыхъ ихъ; въ качеств? такихъ свойствъ
Аристотель и выбралъ: сухость и влажность, холодъ и
тепло; разнообразі? т?лъ въ природ?, по Аристотелю, за-
виситъ отъ различныхъ степеней развитія этихъ свойствъ.
Ученіе Аристотеля съ теченіемъ времени перестало
удовлетворять мыслителей и главнымъ образомъ—въ силу
его м?тафизическаго характера. На м?сто осяовныхъ
Аристотелевскихъ элементовъ были постепенно
поставлены другі?, а именно: ртуть, въ которой вид?ли
начало металлических^ свойствъ, с?ра, олицетворявшая
способность гор?ть, вода, обозначавшая растворимость
т?лъ, соль—способность вызывать вкусовое ощущенье, и,
наконецъ, земля, какъ элементъ, обозначавши
устойчивость т?лъ къ д?йствію воды и огня. По тогдашнему
ученію, матерія сама по себ? представлялась
индифферентной, а указанные элементы-свойства можно или
придавать ей, или отнимать отъ нея.
Вс? средніе в?ка и яроходятъ въ попыткахъ
доказать эту мысль опытнымъ путемъ. Этотъ періодъ въ
химіи называется алхимгіческимъ. Алхимики затратили
неимов?рныя усилія на выд?леніе упомянутой основной
индифферентной матеріи и на изобр?теніе способовъ
превращать одни т?ла въ другія путемъ приданія или отня-
тія осиовныхъ свойствъ элементовъ. Особенно много труда
было затрачено на стремленіе превратить дешевые
металлы въ драгоц?нно? золото. Но попытки эти не ув?н-
чались желанньшъ усп?хомъ. Правда, он? и не пропали.
— 29 -
Въ указанныхъ поискахъ химики того времени
(алхимики) постепенно накопили тотъ фактический матеріалъ,
изъ котораго выросла современная химія.
Въ XVII в?к? лучшіе умы, наконецъ, пришли къ
уб?жденію, что еще рано разсуждать о причйнахъ вс?хъ
причинъ, рано говорить объ единой индифферентной ма-
теріи, а надо прежде изучить ближайшія причины,
ближайшія составныя части — элементы, на которые можно
разд?лить сложное т?ло (Бойль—Boyle—1617—1691). На
м?сто прежнихъ элементовь, являвшихся носителями из-
в?стныхъ свойствъ, Робертъ Бойль впервые поставилъ
элементы, какъ составныя матергальныя части т?лъ природы.
Но прошло еще д?лое стол?тіе, ц?лый такъ
называемый флогистичешй періодъ, преяде ч?мъ
народилась современная химія. Флогистическій періодъ названъ
такъ отъ теоріи флогистона, характеризующей его. Бе-
херъ (Becher) и Сталь (Stahl), предложившіе эту теорію,
утверждали, что все т?ла, который могутъ гор?ть,
состоять изъ особеннаго огневого вещества — флогистона
и изъ другого элемента, им?ющаго особыя свойства для
каждаго вещества. Когда вещество (напр., металлъ) го-
ритъ, оно теряетъ свой флогистонъ и потому переходитъ
въ негорючее землистое вещество. Веществу негорючему
можно вновь придать флогистонъ, паприм?ръ, накаливая
его съ очень богатымъ флогистономъ углемъ: уголь при
гор?ніи выд?ляетъ свой флогистонъ и отдаетъ его
землистому веществу, которое переходитъ въ металлъ *). При-
знанію этой теоріи не пом?шалъ и тотъ, давно, еще съ
VIII в?ка, изв?стный фактъ, что при гор?ніи тЬла
увеличиваются въ в?с?, а не уменьшаются, какъ можно
было бы ожидать въ виду происходящей при гор?ніи
потери флогистона. Однако зд?сь усматривали не проти-
вор?чіе, а, наоборотъ, поддержку данной теоріи.
Флогистонъ легче воздуха, по словамъ Сталя, и потому, соеди-
г) Зд?сь разум?лись реакціи возстановленія, т.-е. отяятіе углемъ
кислорода изъ окисловъ металловъ.
- 30 —
няясь съ т?ломъ, уменьшает* его в?съ; следовательно,
т?ло, потерявшее флогистон*, должно быть тяжел?е. Въ
этой теоріи еще отсутствует* правильное понятіе о „ма-
теріи" и объ „энергіи".
26 августа 1743 года въ Париж? родился Лавуазье,
которому суждено было реформировать всю
существовавшую тогда химію и стать отцом* современной нам*
химіи.
Как* строго систематически изсл?дователь, Лавуазье,
прежде всего твердо устанавливает* самый метод* изсл?-
дованія: он* ставит* себ? въ обязанность изучать не
только качественную сторону явленія, но непрем?нно и
количественную. Как* основной контроль вс?хъ
химических* изсл?дованій, позволяющей д?лать т? или иные
выводы, он* вводит* 1) в?сы. Постоянно пров?ряя свои
опыты взв?шиваніемъ, он* опред?ляет* состав* воды, из-
сл?дует* воздух*, пров?ряетъ различные алхимическіе
опыты, изсл?дуетъ гор?ніе и точно доказывает*, что
т?ла при гор?ніи увеличиваются въ в?с? на столько, на
сколько теряет* въ в?с? тот* воздух*, въ котором*
происходит* гор?ніе, т.-е. доказывает*, что при гор?ніи
кислород* воздуха присоединяется к* горящему т?лу, и
что въ этомъ-то продесс? и заключается гор?ніе, а не
въ выход? из* т?ла какого-то флогистона. Лавуазье
принадлежит* высокая честь расчлен?нія понятій „матерія"
и „энергія". Разлагая сложныя т?ла на бол?е простая,
Лавуазье вполн? точно установил* понятіе объ
элементах*. И, наконец*, систематически пользуясь въ своих*
изсл?дованіяхъ в?сами, Лавуазье неоспоримо доказал*,
что матерія при превращениях* не творится и не
исчезает*, а лишь видоизменяется, т.-е., другими словами,
*) М. В. Ломояосовъ еще раньше Лавуазье высЕазалъ мысль
о необходимости количественныхъ изысканіи и тогда же вполн?
правильно истолковалъ процессъ гор?кія, какъ соединеніе горящаго т?ла
съ «тяжелыми частицами воздуха?. Но голосъ русскаго ученаго не
былъ услышанъ другими учеными.
— 31 —
Лавуазье этимъ самымъ утвердилъ въ наук? законъ, каса-
ющійся матеріи—законъ неуничтожаемости вещества.
Съ этого момента начинается современная химія*
§ 9. Энергія. Законъ сохраненія энергіи. Какъ
изв?стно, способность т?ла или группы т?лъ
совершать работу называютъ энергіею 1). Матерія безъ энергіи
въ представленіи огромнаго большинства людей
немыслима. Самое познаніе природы сводится на констатирова-
ніе въ т?лахъ энергіи, ея прибыли или ея убыли. О ко-
личеств? производительной энергіи въ данномъ т?л? при
данныхъ условіяхь судятъ но количеству работы, кито-
рое т?ло въ состояніи совершить; узнать же все
количество энергіи, запасенной въ т?л?, невозможно. Изуче-
ніе энергіи показало, что существуетъ ц?лый рядъ раз-
личныхъ ея формъ, или видовъ. Вс? эти виды разд?ля-
ются обыкновенно на дв? группы: энергія быва?тъ
кинетическая (явная), или энергія движенія 2), и
потенциальная (скрытая), или энергія положенія3).
Къ кинетической энергіи относятся:
1) Энергія движенія т?ла, какъ д?лаго, наприм?ръ:
движеніе пули, воды, энергія в?тра; сюда же относится
и звуковая энергія.
2) Энергія тепловая.
3) Лучистая энергія (напр., св?тъ).
4) Энергія (электрическаго) тока.
Къ потенціальной энергіи относятся:
1) Энергія тягот?нія.
і) Оствальдъ опред?ля?тъ энергію такъ: «Энергія есть работа и
все то, что можетъ быть получено изъ работы или превращено въ
работу*.
2) Кинетическая энергія находится въ зависимости отъ массы и
скорости и изм?ряется живой силой т?ла, равной -^- MV*, гд? М—
масса т?ла, а V—его скорость.
3) Потенціальная энергія т?ла изм?ряется той работой, которую
произвела бы сила, отъ которой она зависитъ, если бы т?ло
уступило д?Йствію этой силы.
— 32 —
2) Энергія упругоизм?н?ннаго т?ла.
3) Энергія электростатическая.
4) Энергія химическая (о ней см. ниже).
Въ физик? доказывается, что кинетическая энергія
легко можетъ переходить въ потенціальную и обратно,—
это во-первыхъ; а во-вторыхъ, что энергія одного вида
можетъ переходить въ энергію другого вида, наприм?ръ,
механическая энергія легко переходитъ въ тепловую,
электрическую и обратно и т. д. Чрезвычайно
характерно для этихъ переходовъ то, что называется
эквивалентностью.
Эквивалентными количествами энергіи различная
вида называютъ количества численно равный, т.-е. могу-
щія произвести одинаковую работу.
Итакъ, энергія одного вида можетъ перейти въ
эквивалентное количество энергіи другого вида.
Изученіе превращепій энергіи показало сл?дующее:
какое бы явленіе или процессъ мы ни взяли, какимъ бы
превращеиісмъ ни подвергалась въ немъ энергія, всегда
оказывается, что сумма ея во вс?хъ тЬлахъ, участвовав-
шихъ въ этихъ превращеніяхъ до процесса, посл? про-
десса и въ любой моментъ процесса остается всегда
постоянною. Другими словами, нельзя ни создать ни
уничтожить энергіи; на всякое количество возникающей
энергіи одновременно исчезаеть эквивалентное количество
другой энергіи, и, наоборотъ, никакое количество энергіи
не исчезаетъ безъ того, чтобы одновременно не возникло
эквивалентная количества какой-нибудь другой ея формы.
Эготъ-то фактъ и обобщается во второмъ1) основномъ
закон? современная остоствознанія — закон? сохраненья
энергіи, который можно формулировать сл?дующимъ
образомъ:
Полная энергія какой-либо материальной системы
есть величина, которая не моэюетъ быть ни увели-
М Первый— законъ сохраненія вещества (см. стр. 18).
— 33 —
чена ни уменьшена какимъ-нибудь д?йствіемъ между
частями системы, хотя она можетг быть обращена
въ любую изъ т?хъ формъ, какія мооюетъ принимать
энергія. (Р. Майеръ (1842 г.), Гельмгольтцъ (1847)).
Отсюда съ большой в?роятностыо можно заключить,
что количество энергіи, запасенное въ природ?, всегда
постоянно.
Всл?дствіе легкаго перехода и притомъ эквивалент-
наго, одного вида энергіи въ другой и изм?ренге
любого вида энергіи можно произвести въ какихъ угодно
единицахъ видовъ энергіи. Наибольшую склонность вс?
виды энергіи им?ютъ къ переходу въ тепловую. Едини- |
цей изм?ренія тепловой энергіи служить калорія, т.-е. і
количество теплоты, которое способно повысить темпе- ¦
ратуру единицы массы воды (1 грамма = малая калорія, >'
1 килограмма (1.000 граммъ)—большая калорія) съ 0° до *
1° Ц. Отсюда понятно, что количество теплоты изм?-
ряется в?сомъ воды и повышеніемъ ея температуры:
число калорій находятъ, умножая в?съ воды въ граммахъ
на число градусовъ Цельсія, выражающее повышеніе
температуры. Такъ, если 1.500 граммовъ воды нагр?лись
на 3° Цельсія, то количество малыхъ калорій к
поглощенной теплоты равно 1.500X3 = 4.500, а болыпихъ
К—4,5 :). Многочисленные опыты показали, что 1 К
(одна большая калорія) даетъ 426 килограммометровъ
работы и, наоборотъ, 426 килограммометровъ
затраченной работы даютъ, превращаясь въ тепло, всегда 1 К2).
Величина 426 килограммометровъ называется меха*
ническимъ дквивалентомъ теплоты.
!) Большую калорію принято обозначать большой буквой К,
малую—малой к.
2) Работа т?ла (А), какъ изв?стно, прямо пропорціональна в?су
т?ла (w) и высот? его поднятія (h), или, что то же, пропорціональна
ихъ произвед?нію (A —wh), а сл?довательно, легко изм?ряется грам-
мометрами.
Неорганическая химія. 3
— 34 -
§ 10. Химическая энергія. Въ качеств? спутниковъ
химическаго взаимод?йствія въ большинств? случаевъ
наблюдается выд?леніе то тепла, то св?та (то и другое,
наприм?ръ, при реакціяхъ гор?нія), то электричества
(напримізръ, въ гальваническихъ эдементахъ), то
совершается механическая работа (наприм?ръ, при утилизадіи
взрывчатыхъ веществъ). Вс? эти виды энергіи, по закону
сохранепія энергіи, могутъ образоваться лишь всл?дстві?
перехода какого-либо другого вида энергіи, присущаго
т?ламъ. Этотъ видъ энергіи, обнаруживающійся лишь
при химическихъ превращеніяхъ, и носить названіе
химической энергіи. Химическая энергія есть энергія по-
тенціальная: до наступленія реакціи она скрыта въ ве-
ществ? и обнаруживается лишь въ моментъ реакдіи.
Въ химическую энергію могутъ переходить и другіе
виды энергіи. Такъ, наприм?ръ, при нагр?ваніи окиси
ртути (стр. 8) тепловая энергія ею поглощается и
переходить въ химическую энергію ртути и кислорода. Фото-
графическій иродессъ даетъ прим?ръ перехода лучистой
энергіи въ химическую (см. серебро въ отд?л? о метал-
лахъ).
Возможность такихъ взаимныхъ переходовъ между
химической энергіей и другими видами энергіи указываетъ,
что химическая энергія не составляетъ исключенія
сравнительно съ этими посл?дними, а находится въ т?сной
связи съ ними, подчиняясь, какъ и он?, основному
закону сохраненія энергіи.
Итакъ, элементы заряжены химической энергіей,
при чемъ количество ея у различный, элементовъ
различно; при химическихъ превращеніяхъ этотъ запасъ
энергіи въ т?лахъ непрем?нно изм?няется. Съ этой точки
зр?нія вещества являются машинами для преобразованія
энергіи.
§ 11. Химическая активность. Вс? т?ла обладаютъ
химической энергіей; но, во-первыхъ, далеко не вс? они
могутъ вступать между собою во взаимод?йствіе, а во-
— 35 —
вторыхъ, и т?, которыя могутъ взаимод?иствовать, напр.,
соединяться, соединяются не съ одинаковой легкостью
въ разныхъ случаяхъ.
Далее и у одного и того же элемента химическая
энергія не всегда одинаково проявляется, напр., хлоръ
очень энергично соединяется съ металлами и очень слабо
соединяется съ не-металлами, а съ фторомъ даже со-
вс?мъ не соединяется. Въ различныхъ сложныхъ т?лахъ
составныя части удерживаются въ соединеніи также не
съ одинаковой прочностью.
Алхимики думали, что соединяются только такія т?ла,
между которыми существуете что-нибудь общее,
родственное, а потому и ту силу, которая соединяетъ
вещества и удерживаетъ ихъ въ соединеніи, назвали „срод-
ствомъ". Названіе это осталось и до сихъ поръ, хотя съ
нимъ уже соединяюсь совершенно противоположное
представление; оказалось, что въ болыпинств? случаевъ наи-
бол?е энергично соединяются между собою т?ла
несходным, несродныя 1).
§ 12. Уеловія д?йствія химической энергіи.
Сущность химической энергіи остается неразгаданной. Долгое
время пытались отожествить химическую энергію съ
другими видами энергіи: то, наприм?ръ, съ силой всемір-
наго тягот?нія (для котораго качество матеріи
безразлично, тогда какъ для химической энергіи оно весьма
важно), то съ обыкновеннымъ сц?пленіемъ т?лъ (но при
сц?пленіи н?тъ химическаго изм?ненія, а только прили-
паніе веществъ другъ къ другу), то съ электрической
энергіей и т. д. Потомъ отказались отъ этихъ попытокъ.
Большинство ученыхъ до посл?дняго времени признавали
химическую энергію своеобразной, особымъ видомъ
энергіи. Нов?йшее „электронное" уч?ніе вновь пытается свя-
7 ,
і) Строго говоря, понятіе <Химическо? сродство» нисколько не
уясня?тъ существа вопроса о направлении д?йствія химической
энергіи: на вопросъ о причин? химической активности веществъ въ
наук? отв?та пока еще опред?д?инаго н?тъ.
3*
— 36 —
зать химическую энергію и ея активность съ
электрическими зарядами электроновъ.
Особенно важно отм?тить тотъ современный взглядъ
на д?йствіе химической энергін между веществами, что
оно завйситъ не только отъ природы реагирующихъ
вещество^ но и отъ другихъ факторовъ, какъ химическихъ,
такъ и физическихъ.
Главн?йшее условіе для проявления химической энер-
гіи составляешь непосредственное соприкосновение ве-
ществъ, т.-е. химическая энергія д?ьйствуетъ лить на
весьма малыхъ разспгояпіяхъ. Отсюда все, что
способствуем наитвснЬйшему сближенію веществъ, — все это
благопріятствуетъ и проявленію химической энергіи.
Такъ, наприм?ръ, жидкое и газообразное состояніе
(въ особенности жидкое), какъ позволяющія наибол?е
близкое см?шеніе веществъ, наибол?е благоприятны для
проявленія химической энерпи. Между твердыми
веществами химическая энергія такъ же можетъ проявиться,
напр., при сдавливаніи ихъ или при растираніи (ири-
м?ры: стирані? порошковъ с?ры и ртути, нашатыря и
гашеной извести, см. стр. 4 и 9, перем?шивані?
порошковъ сулемы и іодистаго калія); но вообще между
сухими твердыми веществами реакціи идутъ очень трудно,
присутствіе же влаги (часто самое ничтожное)
значительно облегчаетъ взаимод?йствіе.
Возд?йствіемъ другихъ видовъ энерпи, напр.,
теплоты, электричества, св?та и др., также можно
возбудить работу химической энергіи.
Тепловое возд?йствіе (нагр?ваніе) прим?няется при
химическихъ работахъ чаще всего. Теплотой пользуются
и для соединеній и для разложеній веществъ. Повыше-
ніемъ температуры стараются достичь опредвленнаго
внутримолекулярная движенія (оно в?дь и характеризуется
температурой): при очень яизкихъ температурахъ, даже
бурныя (при обыкновенныхъ условіяхъ) реакціи часто не
происходить; въ свою очередь, реакціи нейдутъ и при
— 37 —
очень высокихъ температурахъ, когда им?ющее
образоваться сложное тЬло вновь можетъ разложиться на состав-
ныя части. Поэтому необходимо всегда помнить, что т?
или иныя химическія превращенія возможны лишь только
въ опред?ленныхъ для каждаго случая температурныхъ
пред?лахъ.
Галь?аническій шокъ можетъ вызвать образованіе
новыхъ веществъ; напр., подъ его вліяніемъ легко
образуется изъ кислорода озонъ (см. главу объ озон?); очень
многія сложныя т?ла токомъ разлагаются на составныя
части, напр., поваренная соль разлагается на свои
составныя части—на металлъ натрій и на хлоръ,
Св?тъ можетъ вызывать иногда соединеніе веществъ,
напр., хлора и водорода, а иногда—разложеніе сложныхъ
т?лъ, напр., соединеній серебра (см. главу о серебр?).
Къ числу условій, ускоряющихь д?йствіе химической
эн?ргіи, сл?дуетъ отнести еще одно, а именно присут-
ствіе такъ называемыхъ катализашоровь 1), т.-е.
веществъ, которыя ускоряютъ теченіе химическихъ процес-
совъ, а сами во время реакдіи или вовсе не изм?няются,
или изм?няются лишь временно, такъ что къ концу ре-
акціи и качественно и количественно вновь являются въ
первоначальномъ вид?. Интересно отм?тить, что во вс?хъ
такихъ случаяхъ очень малое количество катализатора
можетъ провести реакцію между очень большими, часто
неограниченно большими количествами веществъ. Ката-
лизашорь не создаешь реакціщ а только ускоряешь ее.
Въ дальн?йшемъ изложеніи фактической части
подобные случаи встр?тятся не разъ, напр., соединеніе
водорода съ кислородомъ въ присутствіи губчатой платины,
полученіе кислорода изъ бертоллетовой соли въ
присутствіи перекиси марганца, или полученіе с?рнаго
ангидрида при участіи мелко раздробленной платины; многія
!) Катализаторами эти вещества назвалъ Берцеліусъ; а Мит-
черлихъ назвалъ ихъ контактными. Самые процессы поэтому назы-
ваютъ каталитическими или контактными.
- 38 -
реакдіи въ асивыхъ организмахъ — этого же порядка,
напр., переходъ крахмала въ сахаръ подъ вліяніемъ
слюны (точн?е—птіалина) и др. 1).
Очень важное значеніе для опред?леннаго налравле-
нія хода хлмическаго язм?ненія играютъ массы изм?-
пяющихся веществъ, о ч?мъ буд?тъ сказано дал??
(см. § 17).
§ 13. Химическая энергія и теплота. Химическая
эн?ргія, какъ сказано въ § 10, можетъ превращаться въ
другія формы энергіи. Всего легче это превращеше
совершается въ теплоту. Большинство реакцій образованія
сложныхъ т?лъ изъ элементовъ идетъ съ выд?леніемъ
тепла, и такія реакцій называются экзотермическими;
напр., сюда относятся всЬ реакдіи гор?нія т?лъ.
Понятно, что образовавшіяся при такихъ условіяхъ
сложный т?ла обладаютъ меньшей энергіей, ч?мъ т?ла, въ
нихъ вошедшія.
Бываетъ, однако, и обратный случай, когда сложное
т?ло обладаетъ большимъ запасомъ энергіи сравнительно
съ образовавшими его т?лами. Посл?днее возможно лишь
въ томъ случа?, когда реакція образованія сложнаго
вещества сопровождается поглощеніемъ тепла извн?; такія
реакцій называются эндотермическими.
Въ виду сказаннаго, сл?дить за судьбой химической
энергіи въ т?лахъ всего проще путемъ измвренія
теплоты, выд?ляющейся при химическихъ реакціяхъ 2).
і) Кром? каталитич?скаго вліянія в?гдествъ, современная хішія
отм?тила еще такъ называемую химическую инЬупцгю, состоящую
въ томъ, что иногда два нереагирующихъ вещества можно заставить
реагировать между собою введ?ніемъ къ нимъ третьяго вещества,
могущаго реагировать съ однимъ изъ двухъ яервыхъ.
з) А также: по скорости реащій: тамъ, гд? происходитъ
сравнительно большая потеря химической энергіи, р?акцш (при прочихъ
равныхъ условіяхъ) протекаютъ быстро; когда же эта потеря мала,
то нревращепі? ид?тъ медленн?е; и по величины электродвижущей
сгьлы шока гальваническаго элемента, составленная изъ вещества
- 39 -
Изм?реніе это да?тъ возможность, во-первыхъ, судить о
томъ, на сколько уменьшается или увеличивается запасъ
химической энергіи при образованіи сложиаго т?ла; а
во-вторыхъ, оно даетъ ключъ для р?шенія вопроса объ
источникахъ и запасахъ свободной энергіи, которую
бываешь необходимо утилизировать въ т?хъ или иныхъ
случаяхъ техники и житейской практики для совершенія
той или иной работы.
Важность посл?дняго будетъ вполн? понятна, если
вспомнить, что вс? источники энергіи, прим?няемой въ
техник? и житейской практик?, въ сущности химическаго
происхожденія: химическій процессъ гор?нія обыкновенно
служитъ такимъ источникомъ. Наконецъ и самая жизнь
организмовъ сводится къ накопленію и проявленію
энергіи чрезъ посредство химическихъ превращеній.
/\ .14. Термохимия. Тотъ отд?лъ химіи, который
занимается изм?реніемъ количества теплоты, выд?ляющейся
или поглощающейся при химическихъ реакціяхъ,
называется термохимгей. Количество '"теплоты выражается,
какъ было сказано выше (стр. 33), въ калоріяхъ. Самыя
опр?д?ленія ведутся въ приборахъ, называемыхъ
калориметрами 1).
Въ качеств? образчика одинъ изъ калориметровъ
изображ?нъ на рис. 9. Существенную часть этого
прибора составляетъ (по Б?ртло) внутренній платиновый
цилиндрическій сосудъ, вм?щающій въ себ? 1.000 грам-
данной р?акціи, т.-е.- при условіи, когда полезная или свободная
химическая энергія превращается не въ теплоту, а въ электрическую
энергію.
!) Тепловой эффектъ обыкновенно указывается для молекуляр-
ныхъ количествъ (грамм-молекулъ) взаимодействующие веществъ, такъ
какъ только такія количества сравнимы между собою. Сл?довательно,
когда говорятъ, наприм?ръ, что теплота образованія воды равна 69 К.,
то это значитъ, что 69 К. выд?ляется при образованіи молекулы
воды (т.-е. при соединены 2 гр. водорода съ 16 гр. кислорода); вода
зд?сь разум??тся жидкая, т.-е. сюда включена и та теплота
(равная 9.6 К.), которая выд?ля?тся при лереход? вара въ жидкость.
40
мовъ воды: сосудъ этотъ иногда закрывается крышкой,
чрезъ которую проходить точный и чувствительный тер-
мометръ, съ д?леніемъ на сотыя доли градуса. Внутри
этого сосуда, если возможно, то въ самой вод?, или въ
сосуд? изъ стекла, лучше изъ платины
(калориметрическая бомба Бертло, рис. 10), заставляюсь происходить
Рис. 9, Калорим?тръ.
химическую реакцію и нзм?ряютъ температуру воды
калориметра. Чтобы изб?жать потери теплоты, платиновый
сосудъ окружаютъ двумя металлическими оболочками.
Самъ сосудъ и первая оболочка установлены на про-
бочкахъ. Зат?мъ им?ется еще вн?шняя оболочка.
Промежуток между оболочками наполненъ водой, которая
для равном?рнаго распред?ленія въ ней температуры пе-
рем?птивается м?шалкой; изм?яенія ея температуры все
время изм?ряются чувствительнымъ термометромъ. Сна-
— 41 —
ружи весь приборъ закрыть войлокомъ. Опыты съ кало-
риметромъ стараются производить въ комнат? съ
постоянной температурой.
Итакъ, главная задача термохиміи состоите въ
установке соотношенія между химической энергіей, теплотой
и вн?шней работоспособностью при химическихъ превра-
щеніяхъ 1). Весь запасъ энергіи, присущей веществу, какъ
Рис. 10. Калориметрическая бомба Бертло.
сказано и выше, опред?лить невозможно, такъ какъ его
невозможно извлечь изъ вещества.
Самымъ основнымъ закономъ термохиміи является за-
конъ Гесса (въ 1840 г. въ Петербург?), изв?стный подъ
именемъ принципа начальнаго и конечнаго состошія
и формулирующейся сл?дующимъ образомъ:
і) Полезная энергія, которая получается при химической ре-
акціи и которая можетъ быть превращена въ другой видъ энергіи,
называется свободной энергіей р?акціи.
- 42 -
Если система т?лъ, простыхъ или слооюныхъ, взя-
тыхъ въ опред?ленныхъ условгяхъ, испытываешь рядъ
изм?нент физичеекихъ или химгічестіхъ, безъ участгя
?н?гинихъ силъ, то количество теплоты, выд?ляемой
или поглощаемой при этихг изм?неніяхъ, зависишь
только отъ начальнаго и конечнаго состоянья системы;
оно будетъ одно и то же, каковы бы ни были
промежуточных состоянія. Значить, при термохимическомъ
изученіи химическаго превращения не важно, чрезъ какія
стадіи шло это превращение, а важно то, изъ какихъ
веществъ исходили и къ какимъ пришли. Прямымъ
сл?дствіемъ приведенного принципа является следующее
положеніе:
Для разложенья сложнаго т?ла необходимо
затратить такое же количество теплотыі которое выд?-
лилось при его образованы. Доказать это легко; пусть
изъ т?лъ А и В образуется соединеніе АВ, зат?мъ пусть
т?ло АВ разлагается на составныя части А и В; общій
тепловой эффекта долженъ быть равенъ нулю, такъ какъ
начальное и конечное состояніе т?лъ одно и то же, а
потому, если при образованіи соединенія выд?лилось
опред?ленное количество теплоты, то при разложеніи
такое же количество теплоты должно было поглотиться.
Этотъ законъ, какъ нетрудно вид?ть, представляетъ
одно изъ частныхъ приложешй общаго закона сохраиенія
энергія.
Изъ сказаннаго легко понять, что ч?мъ больше
выд?лилось теплоты при образованіи даннаго сложнаго т?ла,
т?мъ трудн?е его разложить, т.-е. т?мъ прочн?е будутъ
связаны его составныя части, т?мь соединеніе будетъ
устойчив?е. Наоборотъ, если тепла при реакціи
выд?лилось мало, то соединеніе будетъ непрочно, оно легко
будетъ разлагаться. Эндотермическія соединенія, конечно,
будутъ особенно неустойчивы и чрезвычайно легко
будутъ разлагаться (напр., сюда относятся взрывчатыя
вещества). Соединенія, образующія пашу землю, напримвръ:
— 43 —
вещества, слагающія гранитныя породы (полевые шпаты,
кварцъ и слюда), образовались съ выд?леніемъ очень
большого количества тепла, а потому они и очень прочны;
а красный порошокъ окиси ртути при образованіи вы-
д?ляетъ сравнительно мало тепла, а потому и разлагается
сравнительно легко.
Химическія силы въ жизни природы играютъ важную
роль: он? обусловливаю™ образовані? и существованіе
сложныхъ т?лъ, безъ которыхъ немыслима жизнь природы
какъ мертвой, такъ въ особенности и живой.)
§ 15. Главн?йшее направленіе д?йствія
химической энергіи. Французскій химикъ Бертло (Berthelot)
старался закр?пить за тепловымъ эффектомъ при хими-
ческихъ реакціяхъ еще одно очень важное значеніе, а
именно: онъ вид?лъ въ пемъ м?ру той силы, которая
ведетъ реакцію между реагирующими веществами и съ
этой точки зр?нія формулировалъ сл?дующій свой
основной законъ направленія химическихъ превращеній:
Всякое химическое преврйщеніе, способное
происходишь безъ д?йствія вн?шней энергіи, стремится
произвести такую систему т?лъ, которая образуется съ
наибольшимъ выд?леніемъ теплоты, т.-е. если, напр.,
т?лу А представляется возможность соединиться съ т?лами
В, С, D и др., то оно соединится съ т?мъ изъ нихъ,
съ которымъ при реакціи можетъ выд?литься наибольшее
количество теплоты.
А такъ какъ между теплотой и работой существуешь
эквивалентное соотношеніе, то наибольшее количество
теплоты можетъ выд?литься только при томъ условіи,
если совершится наибольшая работа. На этомъ основапіи
приведенный принципъ и носитъ названіе принципа
максимума работы.
Принципъ этотъ, д?йствительно, приложимъ къ очень
большому количеству химическихъ превращеній, особенно
такъ называемыхъ необратимыхъ, но далеко не ко вс?мъ,
а потому и не можетъ считаться общимъ закономъ природы.
— 44 —
Уже начиная съ того, что принципъ этотъ во всей
теоретической строгости невозможно практически
проконтролировать, потому что свободная энергія, изм?ряемая
произведенной работой вообще не эквивалентна т?шгот?,
выд?ляіощейся при реакціи (второй законъ термодинамики).
Кром? того, невозможно химическій процесеъ изолировать
отъ такой, напр., вн?шней процессу энергіи, какъ
тепловая, всегда присущей т?ламъ. А между т?мъ химич?скія
реакціи, напр., при выеокихъ температурагь вдуть какъ
разъ обратно принципу наибольшей работы: очень многія
со?диненія при выеокихъ температурахъ распадаются на
свои составныя части съ поглощеніемъ тепла; а при
низкихъ температурахъ этого не бываетъ.
Зат?мъ вс? эндотермическіл реакціи, протекающая
при нормальной температур?, также противор?чатъ
указанному положенію Бертло.
§ 16. Обратимыя и необратившя реакціи. Прин-
ципъ максимума работы требуетъ, чтобы реакціи между
веществами шли до конца и давали бы только такія хи-
мическія системы, при образованы которыхъ выд?лилось
наибольшее количество тепла. Этому требованию
принципа противор?читъ ц?лый рядъ такъ называемыхъ обра-
шимыхъ р?акцій, т -е. до конца не доходящихъ; доходя-
щія же до конца реакціи называются необратимыми1).
Обратимость реакціи состоитъ въ томъ, что если
вещества, напр., А и В, вступая въ обмвнное разложеніе, мо-
гутъ дать С и D, то эти посл?днія, въ свою очередь,
обратно могутъ дать первоначальный твла А и В и
обратно. Для обратимости реакціи, конечно, необходимо,
что бы продукты реакціи не уходили изъ сферы ихъ
взаимод?йствія. Пред?лъ, съ котораго начинается обрат-
1) Въ настоящее время есть основаше думать, что въ принцип?
вс? процессы обратимы; только современные химическі? методы изед?-
дованія иди не всегда позволяютъ подыскать надлежащія условія для
обратимости процесса, или обратимость трудно констатируется всл?д-
стві? очень малой скорости ея теченія.
Дальтонъ (John Dalton).
1766 — 1844.
— 47 —
ная реакція различныхъ веществъ, различены онъ зави-
ситъ отъ природы и относительныхъ количествъ реаги-
рующихъ веществъ, а также отъ температуры и давленія.
При обратимыхъ процессахъ одновременно сущесгву-
етъ н?сколько химическихъ системъ (во взятомъ прим?р?:
А, В, С и D); количество же т?хъ и иныхъ формъ и
зависитъ, какъ сказано, отъ природы и массы реагиру-
ющихъ веществъ, отъ давленія и температуры.
Когда скорости прямого процесса и противоположнаго
ему становятся равными, наступаешь то, что называютъ
химическимъ равнов?сгемъ. Понятно, что это не состоя-
ніе покоя, а выражені? движеній прямого и обратнаго
при равныхъ скоростяхъ, почему самое отношеніе между
количествами веществъ каждой формы и остается неиз-
м?ннымъ. Химическое равнов?сі? справедливо называютъ
модвижнымъ равнов?сіемъ,
Для выраженія обратимыхъ реакцій принятъ зна-
чокъі^; взятый прим?ръ сл?дуетъ написать такъ;
A + B±z;C + D2).
§ 17. Законъ д?йствующихъ шассъ. Еще въ начал?
девятнадцатая стол?тія Бертолле выск&залъ положеніе,
состоящее въ томъ, что на ходъ химическаго процесса
оказываютъ вліяніе не только качества веществъ и
температура, но и относительное количество веществъ,
участвующихъ въ процесс?. Трудами многихъ ученыхъ,
а въ особенности Гульдберга и Вааге, положеніе
Бертолле въ настоящее время стало основнымъ закономъ,
изв?стнымъ подъ названіемъ закона д?йствующихъ массъ.
По этому закону химическое д?йствге при постоянной
температур? пропорцгонально д?йствующей масс?,
т.-е. количеству вещества въ единиц? объема (концентра-
ція); а если въ реакцій принимаетъ участіе н?сколько
веществъ, то она пропорціональна произведенію д?й-
ствующихъ массъ каждаго изъ нихъ.
2) Такое уравнение, конечно, уже не выражаетъ равенства:
количества вещества въ об?ихъ частяхъ уравн?нія не равны.
— 48 —
По м?р? того, какъ массы веществъ, р?агирующихъ
другъ на друга, постепенно убываютъ, а вновь образо-
вавшіеся продукты накопляются, процессъ превращенія
замедляется и зат?мъ прекращается; образуюддіяся при
реакціи ¦ вещества, если они остаются въ ближайшемъ
соприкосновеніи другъ съ другомъ, по м?р? накошг?нія
ихъ, могутъ реагировать между собою въ обратномъ
направленіи, образуя вновь исходныя вещества: получается
обратимая реакція1). Если же продукты реакціи
разобщаются, напр., если одинъ изъ продуктовъ газообразенъ
и улетаетъ изъ сосуда, или одипъ изъ продуктовъ вы-
падаетъ въ вид? осадка, то реакція точетъ только въ
одномъ прямомъ ноправленіи и является необратимой,
идущей до конца.
Во взятомъ примьр? Л -f- В ^z; C-\-D скорость обра-
зованія веществъ С и D въ каждый данный моментъ
будетъ, следовательно, пропорціональна существующимъ
концентраціямъ веществъ А и В. Для момента времени
t она будетъ = &. [Л7] . [і?], если [А1] и [В'] будутъ
выражать концентраціи веществъ А и В для времени t.
Скорость обратнаго превращенія веществъ О и D въ
і и Б для того же времени будетъ = # . [С] . [17],
при чемъ [С] и [В1] здесь будутъ концентрациями ве-
1) Съ точки зрЬнія кинетическаго воззр?нія на строені? вещества
можно объяснить этого фактъ сд?дующимъ образомъ: всякое
химическое превращені? требуетъ столкновенія молекулъ веществъ; когда
въ данномъ объ?м? мол?кулъ много, столкновения бываютъ бол?е
частыми (а это и бываетъ по отношенію къ прямому процессу — въ
начал? реакціи), и реакція идетъ быстро; при уменьшеніи числа
модекулъ встр?чи и столкновенія ихъ становятся все бол?е и болЬе
р?дкими и скорость процесса въ прямомъ направленіи все бол?е и
бол?е замедляется. По м?р? же увеличенія числа молекулъ
продуктовъ реакціи прямого направленія, вознякаютъ все бол?е и бол?е
благопріятныя условія для бол?? частыхъ ихъ столкновение, и
процессъ все быстр?е и быстр?е идетъ въ обратномъ направленіи. Въ
конц?-концовъ, скорости этихъ лротивоположныхъ направленіи
процесса станутъ равными, и наступитъ уже состояние равнов?сія.
— 49 —
ществъ С и D для времени t; h и К — коэффиціенты
пропорціональности. При момент? равнов?сія будемъ
им?ть:
к. [Af] . [Б'] = к'[С] . [D'];
[А'], [В], [С] и [D'] суть концентраціи А, В, С и D для
состоянія равнов?сія. Посл?дне? уравненіе можно пред-
ставить въ сл?д. вид?: )^А—~г~ = уг ==К
LG J ¦ \Р \ к
Это и есть прост?йшее ?ыраоюеніе закона д?йству-
ющихг массъ. Изъ него видно, что при изм?неніи
концентраціи одного изъ взятыхъ веществъ непрем?нно
произойдешь изм?неніе концентраціи и другихъ веществъ, а
сл?довательно, опред?лится и то направленіе, въ кото-
ромъ изм?нится составъ см?си. Вообще можно сказать
такъ: нарушеніе равнов?сія увеличеніемъ или уменыпе-
ні?мъ концентраціи веществъ, участвующихъ въ реакціи,
вызываеть ту реакцію, при которой концентраціи этихъ
веществъ соотв?тственно уменьшаются или возрастаготъ.
К называютъ постоянной равнов?сія; она им?етъ
опред?ленную величину для каждаго даннаго процесса и
изм?няется отъ вн?шнихъ условій (каковы—давленіе и
температура)1).
*) Сл?дующій, наибол?? общій законъ, указывающей направленіе
въ превращ?ніяхъ обратимыхъ матеріальныхъ сист?мъ при изм?неніи
одного изъ условій равнов?сія, данъ въ 1884 г. Ле-Шателье: «всякое
измгьненге любого фактора равновгьсгя униваріантной (системы съ
одной степенью свободы; а степень свободы есть число п?рем?нныхъ
факторовъ равнов?сія) системы влечешь за собою преврагценіе въ
ней, которое стремится вызвать въ этомъ факторгъ изм?неніе
противоположное по знаку тому, которое ему сообщено». Такъ,
всякое возвыш?ніе температуры вызываешь въ равнов?снои систем?
превращені? (плавленіе, испареніе), которое идетъ съ поглощеніемъ
теплоты и, идя само по себ?, вызываетъ понижені? температуры.
Такимъ образомъ равнов?сныя системы им?ютъ стремлені? возста-
новлять нарушенный условія равнов?сія, почему законъ Л?-Шатель?
и былъ названъ «закономъ консервативности физико - химическихъ
системъ*.
Неорганическая хиыія. *
— 50 —
Важн?йшіе законы, по ноторымъ химичесніе
элементы соединяются для образования сложныхъ т?лъ.
§ 18. Законы. Химическіе элементы соединяются въ
сложныя т?ла по опред?леннымъ законамъ. Законы эти
суть: 1) законъ постоянсШа состава, 2) законъ нрат-
ныхъ отношеніи и Ъ)ъешш.№&евг.
I. Законъ постоянства состава утверждаетъ тотъ,
н? им?ющій исключений, фактъ, что всякія т?ла
химически соедгтяюшбя между собою всегда въ строго опре-
д?ленпыхъ (а не въ произвольныхь) ошношенгяхъ по
в?еу, которыя зависятъ лишь отъ природы
соединяющихся веществъ и не зависятъ отъ условій, при кото-
рыхъ происходить соединеніе. Такимъ образомъ, во вся-
комъ химичесномъ соединены элементы, его образующіе,
находятся всегда въ строго опред?ленномъ гюстоянномъ
в?совомъ отношеніи и, сл?довательно, м?нять составь
сложнаго вещества по произволу нельзя: этимъ
химическое соединеніе и отличается отъ механическихъ см?-
сей, въ образовании которыхъ химическая энергія не
участвуетъ, и въ которыхъ в?совыя пропорцш могутъ
быть совершенно произвольны1). Такъ, наприм?ръ, с?ру
съ ж?л?зомъ можно смвшать въ какихъ угодно пропор-
ціяхъ, но соединить ихъ для образованія с?рнистаго же-
л?за можно лишь въ опред?ленномъ и именно въ слЬду-
ющемъ отношеніи: на 7 в?с. частей жел?за 4 в?с. части
с?ры. Для образованія воды требуется всегда на 1 в?с.
часть водорода 8 в?с. частей кислорода; для образованія
поваренной соли, состоящей изъ натрія и хлора—на
23 в?с. части перваго 35,5 в?с. частей второго и т. д.
Если бы которой-нибудь составной части былъ взятъ из-
*) Надо зам?тить, что различш между механическими см?сяаш и
химическими соединениями до некоторой* степени условно; существуютъ
и переходный между ними ступени (см. дальше «растворю и «сплавы»).
— 51 —
бытокъ против ь указанныхъ количеств ь, то этотъ избы-
токъ не вошелъ бы въ соединеніе, а остался бы свобод-
нымъ. Отсюда сл?дуетъ, во-первыхъ, что какимъ бы спо-
собомъ мы ни получили данное сложное т?ло, всегда въ
составь его, на опред?ленное количество одной
составной части, входитъ опред?ленно? же количество другой,
и, во-вторыхъ, что каждое химическое соединеніе во
вс?хъ своихъ частяхъ всегда обладаешь однимъ и т?мъ
же составомъ и одними и т?ми же свойствами, т.-е.
химическое соединеніе однородно.
Пр?вращенія такихъ однородныхъ веществъ, пред-
ставляющихъ во вс?хъ частяхъ одинаковый химическія
свойства, и являются для химіи ближайшимъ предметомъ
изученія.
IL Законъ кратныхъ отношеній. Не всегда, однако,
два элемента образуютъ между собою только одно
соединеніе; иногда они образуютъ н?сколько соединений,
отличающихся одно отъ другого отношеніемъ в?совыхъ
количествъ составныхъ частей и^ конечно,
различающихся по ихъ свойствамъ. Напр., кислородъ съ водо-
родомъ соединяется не только въ отношеній 1 :8, какъ
въ вод?, но и въ отношеній 1: 16, какъ въ перекиси
водорода; азотъ съ кислородомъ можетъ соединяться въ
сл?дующихъ пяти отношеніяхъ: 14 : 8, 14 :16, 14 : 24,
14:32, 14:40; числа 8, 16, 24, 32 и 40, выражающія
относительныя количества кислорода, соединяющагося съ
однимъ и тЬмъ же количествомъ азота, какъ видно,
кратны 8, а сл?довательно, ихъ отноіпенія выражаются
простыми числами: 1:2:3:4:5.
Совершенно т? же простота и кратность
характеризуют подобныя же соединенія и другихъ элементовъ
между собою. Этотъ фактъ и выражаетъ собою второй
вышеуказанный законъ кратныхъ отношеній, впервые
установленный Дальтономъ (Dalton). Законъ этотъ
обыкновенно формулируется въ общей форм? такъ: если два
вещества А и В образуютъ между собою н?сколько
4*
— 52 —
химическихъ соединены различимо количественнаго
состава, то въ этихъ соединенгяхъ на одно и то же
??совое количество одной составной части (А)
приходятся такія количества другой (В), который кратны
наименьшему изъ нихъ: отношенья этихъ количеств^
выражаются ц?лыми и обыкновенно малыми числами.
III. Законъ паевъ. Въ связи съ приведенными
законами стоить еще третій законъ опред?ленныхъ
химическихъ отношеній—законъ паевъ, установленный Рих-
тероиъ (Richter). Его можно формулировать сл?дующимъ
образомъ: если н?который в?съ т?ла С соединяется
съ в?сомъ а т?ла А и съ в?сомъ Ь т?ла В, то
взаимное соединеніе т?ла А и В и происходить въ ко-
личествахъ а и b (или въ количествахъ имь кратныхъ).
Наприм?ръ, съ 70,9 в?с. частями газа хлора могутъ
соединяться 32,06 в?с. части с?ры или 56 в?с. частей
жел?за; сл?довательно, по закону паевъ, желЬзо и с?ра
соединяются между собою въ отношеній на 56 в?с.
частей жел?за 32,06 в?с. части с?ры. Такь, дЬйсгвительно,
и происходить соединеніе жел?за и с?ры.
Собственно вс? эти законы сводятся кь сл?дующему
основному положенію: для каоюдаго элемента чисто
опытнымъ путемъ можно найти числол выраоюающее
массу, которою онъ вступаешь въ соединеніе. Эта масса
называется паемъ, или пайнымъ в?сомъ, или, наконецъ,
соединительнымъ в?сомъ.
Элементы соединяются не всегда пай на пай: иногда
одинъ пай одного элемента соединяется съ двумя, тремя
и бол?е паями другого элемента; вообще, отнош?нія
паевъ соединяющихся элементовъ могутъ быть
разнообразны, но самый пай для каждаго элемента есть
всегда величина постоянная, и, сл?довательно,
количество элемента, вступающее въ соединеніе, всегда бу-
детъ равно или кратно паю 2).
1) Паи элементовъ приведены на стр. 15 и 16 при пер?чн? про-
стыхъ т?дъ. О томъ, какъ опред?ляются и чисдепно выражаются паи
- 53 —
§ 19. Атомистическая гипотеза. Указавъ законъ
кратныхъ отношеній, Дальтонъ далъ объясненіе его въ
такъ называемой атомистической гипотез? строенія
вещества, которая съ т?хъ поръ является основньшъ
фундаментомъ для всего естествознанія.
Сущность этой гипотезы сводится къ сл?дующему
положенію: всякое вещество состоишь изъ мелъчайшихъ
частичекъ (массъ), который не дробятся ни при-ка-
комъ изъ изв?стныхъ до сихъ поръ превращены
вещества.
Эти недробимыя, нед?лимыя частички матеріи названы
атомами (атоцос—нед?лимый), откуда произошло и на-
званіе гипотезы.
Атомы одного и того же элемента совершенно
одинаковы какъ по количеству матеріи, въ нихъ
заключающейся, т.-е. по в?су, такъ и по свойствамъ, т.-е. по
количеству и качеству присущей имъ энергіп. Атомы же
различныхъ элементовъ различны и по в?су и по
свойствамъ. Отсюда понятно, что рааличяыхъ атомовъ въ при-
род? существуетъ столько же, сколько элементовъ, т.-е.
около 80.
Атомы, по излагаемому ученію, не наполняютъ сплошь
пространства занимаемаго т?ломъ, а отстоятъ другъ отъ
друга на н?которыхъ, хотя и ничтожно малыхъ, раз-
стояніяхъ; они не находятся въ поко?, а въ постоянномъ
движеніи, т.-е. имъ присущъ опред?ленный запасъ энергіи.
Однородные и разнородные атомы могутъ соединяться
между собою: сложеніемъ однородныхъ атомовъ
образуются простыя т?ла, а сложеніемъ атомовъ разнородныхъ—
сложныя т?ла. Атомы подъ вліяніемъ химической
энергіи соединяются въ одно ц?лое, которое принято
называть частицей или молекулой.
элементовъ, см. § 32.—Законъ паевъ приложимъ и къ сложнымъ ве-
ществамъ: пай сложнаго вещества равенъ сумм? паевъ элементовъ
его еоставллющихъ. Сложныя вещества вступаютъ въ реакцію въ
отношеніяхъ ихъ па?въ или въ отношеніяхъ чиселъ кратныхъ паямъ.
— 54 —
Надо строго различать поиятія атомъ и частица, а
потому мы еще разъ точно опред?димь ихъ: атомъ есть
мал?йшее количество матеріи элемента^ входящее въ
составь частицъ т?ла и не изм?няющее своего в?са
н? при іатьхъ изв?стныхъг) до настоящаго времени
шмическшъ превращепіяхъ, т.-е. нед?лимое (индиви-
думъ); частица есть мал?йшее количество вещества,
съ котораго оно начинаетъ существовать, пат
таковое, т.-е. съ опред?леиными химическими свойствами;
напр., частица с?рнистаго жел?за состоитъ изъ одного
атома жел?за и одного атома с?ры, частица поваренной
соли—изъ одного атома натрія и одного атома хлора,
частица воды—изъ двухъ атомовъ водорода и одного
атома кислорода. Такимъ образомъ частица—это мелъ-
чайшій физичеекгйинди?идуумъ, ведущій самостоятельное
существованіе2). Каждое однородное химическое соеди-
неніе состоитъ изъ тождественныхъ частицъ.
Частицу можно разд?лить еще только на атомы, со-
ставляющіе ее, но съ этимъ д?леніемъ прекратить свое
существованіе и первоначальный индивидуумъ. Сложныя
т?ла вступаютъ въ химическое взаимод?йствіе своими
частицами.
Однородные атомы въ болышшетвв нростыхъ т?лъ,
сц?пляясь между собою въ группы, образуютъ тоже ча-
1) Сд?доватедьно, ва атомами утверждается не абсолютная нед?-
лимоеть, а лишь относительная, обоснованная исключительно на фак-
тахъ; подъ атолной массой элемента разумтъется его наименьшая
реагирующая масса.—Факты посл?дняго времени (см. «радіоактив-
ныя вещества> § 193) для своего объяснения требуютъ допущенія
д?лнмости атомовъ на электроны или корпускулы; допущение это,
какъ сказано, съ современной точки зр?нія предвид?лось, и оно
нисколько п? кол?блетъ атомистическаго нр?дставленія при уясненш
строенія вещества: атомъ есть определенный индтидумг, съ его
раснадомъ уничтожается и его индивидуальность, а вэам?нъ возни-
каетъ другая индивидуальность.
2) Разм?ры частицъ, а т?мъ бол?е атомовъ, чрезвычайно малы:
полагаютъ, что разм?ры молекулъ въ поп?речник? могутъ им?ть огъ
1,0 до 0,8 микрона; а микронъ есть 0^001 миллиметра.
— 55 —
стицы,. подобныя частицамъ сложныхъ т?лъ, но.съ той
разницей, что въ частицахъ простыхъ т?лъ они
однородны, а въ частицахъ сложныхъ т?лъ—разнородны.
Отсюда понятно, что атомистическое учекіе,
представляя всю матерію въ природ? состоящею изъ атомовъ,
поставило въ зависимость отъ нихъ к вс? свойства ма-
теріи, вс? ея превращенія; характеръ и число
соединяющихся въ частицы атомовъ, а также ихъ взаимное
расположеніе въ пространств? опред?ляютъ формы и
свойства образованныхъ изъ нихъ частицъ, составля-
ющихъ т?ла природы; вс? изм?ненія въ посл?днихъ, т.-е.
вс? явленія въ нрирод?, сводятся по этому ученію къ
изм?ненію въ комбинаціяхъ атомовъ, къ ихъ перем?ще-
нію и къ изм?ненію той энергіи, которая имъ присуща.
§ 20. Согласование предыдущихъ законовъ съ
атомистической гипотезой. Дальтонъ въ атомистиче-
скомъ представленіи строеяія вещества далъ полное
объясненіе вышеприведенныхъ законовъ соединеній эле-
ментовъ. . ¦ а
Въ основ? этого представленія лежитъ неизм?нный
по в?су атомъ: его передвиженіями навстр?чу другимъ
атомамъ совершаются вс? химическія превращенія, а въ
томъ числ? и образованіе сложныхъ т?лъ.
Атомы при этихъ передвиженіяхъ нед?лимы, сл?до-
вательно, они только ц?лыми своими массами и могутъ
соединяться, т.-е. одинъ атомъ (или н?сколько ихъ)
какого-нибудь элемента можетъ соединиться съ однимъ,
двумя, тремя и бол?е атомами другого элемента; тутъ
дробности быть не можетъ; не можетъ соединяться ни
і/2 атома, ни а/3, ни аДз ни какая ДРУгая дробная его
часть. Вс? комбинаціи могутъ выражаться только
ц?лыми числами... а этотъ фактъ и обобщенъ въ закон?
крашныхъ отиошент и въ закон? паевъ: пай, такимъ
образомъ, выражаетъ атомную массу.
Атомы, соединяясь химически, образуютъ орред?лен-
ную по в?су и свойствамъ частицу т?ла, такъ какъ вно-
— 56 —
сятъ въ нее съ собою опред?ленную массу, заряженную
опред?ленной энергіей* Конечно, вс? частицы одного и
тогожетвла совершенно тожественны; иначе т?ло было бы
неоднороднымъ, въ разныхъ своихъ частяхъ облада-
ющимъ различными свойствами, а химическія соединенія
всегда однородны. Отсюда понятно, что всякое химическое
соединеніе всегда должно им?ть постоянный составь
(одну и ту же частицу) и всегда должно обладать строго
определенными свойствами.
Наконецъ и самый основной законъ химіи — законъ
неуничтожаемости вещества—находится въ полномъ
согласіи съ излагаемымъ ученіемъ. Въ самомъ д?л?,
если атомъ при химическихъ превращеніяхъ есть всегда
неизм?нное ц?лое> то въ реакціяхъ онъ и можетъ лишь
перем?щаться, а не уничтожаться: нельзя ни создать
новаго атома, ни уничтожить существующаго.
Такъ просто и легко атомистическое ученіе
согласуется съ основными химическими законами. Надо
добавить, что этому ученію не противор?читъ ни одинъ до
сихъ поръ изв?стный фактъ. Этого мало. Атомистическая
гипотеза чрезвычайно облегчила познаніе сокровенныхъ
тайнъ црироды: она не только позволила заглянуть, такъ
сказать, внутрь вещества, позволила понять невидимое,
объяснить многое до того времени непонятное, но и пред-
вид?ть еще неизв?стное и т?мъ обусловила тотъ великій
научный прогрессъ, свид?телемъ котораго является все
XIX стол?тіе. А потому неудивительно, что
атомистическая гипотеза въ настоящее время лежитъ въ основа-
ніи господствующаго міровоззр?нія.
Йтакъ, химія сводить всю жизнь природы на живнь
атомовъ, которые то соединяются (реакціи соединения],
то разъединяются (реакціи разлооюенгя), а иногда одни
атомы выт?сняютъ иэъ частицъ другіе атомы и
становятся на ихъ м?сто (реакціи обм?па). Эти типичныя
химическія реакціи и обнимаютъ вс? химическія явленія
въ природ?. Химическое соединеніе образуется тогда
- 57 —
когда опред?ленное число атомовъ одного элемента
соединяется съ опред?іеннымъ же числомъ атомовъ
другого элемента, формируя новую частицу съ новыми
свойствами.
§ 21. Физическія состоянія т?лъ. По
вышеизложенному представленію матерія, въ какомъ бы она со-
стояніи ни находилась, состоитъ изъ молекулъ, въ свою
очередь, составленныхъ изъ атомовъ. Какъ частицы, такъ
равно и атомы въ нигь находятся въ постоянномъ дви-
женіи; различныя физическія состоянія т?лъ ставятся въ
зависимость отъ того движенія, въ которомъ находятся
ихъ частицы. Самое малое движеніе обусловливаетъ
твердое состояніе веществъ: въ твердыхъ т?лахъ
частицы, составляющія ахъ, наибол?? т?сно сближены
между собою. Наблюдать молекулярное движеніе въ
твердыхъ т?лахъ хотя и трудно, но возможно, наприм?ръ, на
испареніи льда (ледъ им?етъ опрсд?ленную, вполн?
изм?римую упругость пара), на выд?леніи запаховъ
твердыми пахучими веществами ил», наприм?ръ, на та-
кихъ фактахъ: волокнистое сложеніе жел?за рельсовъ
или осей отъ продолжительна™ сотрясенія переходитъ
въ зернистое, почему жел?зо д?лается хрупкимъ и легко
ломается; стекло, многія порошкообразный т?ла при
долгомъ храненіи д?лаюгся кристаллическими. Спрингъ
показалъ, что частицы твердыхъ т?лъ не только могутъ
диффундировать, но и реагировать; такъ, наприм?ръ,
легко реагируютъ между собою подъ давленіемъ м?дь и
с?ра, образуя с?рнистую м?дь; также реагируютъ твер-
дыя м?дь и сулема, при чемъ изъ посл?дней входящій
въ ея составъ хлоръ частью отнимается м?дью; сулема
очень хорошо реагируетъ съ іодистымъ каліемъ, м?няясь
составными частями, при простомъ стираніи или даже
встряхиваніи см?си этихъ порошковъ и т. д. Въ этихъ
опытахъ Спринга движутся не только частицы, но и
атомы, такъ какъ въ результат? им?ется химическое
перем?щеніе атомовъ изъ одн?хъ частицъ въ другія.
- 58 —
Жидкое сосюяш? т?ла характеризуется большимъ
движеніемъ частицъ х): самый переходъ твердаго состоянія
въ жидкое совершается, какъ изв?стно, при повышеніи
температуры, т.-е., другими словами, при увеличеніи
скорости частичнаго движенія. Въ отличіе отъ скром-
наго движенія твердыхъ молекулъ—въ предЬлахъ очень
малаго пространства, молекулы жидкихъ т?лъ не со-
храняютъ постояннаго равнов?сія, а, скользя одна около
другой и не выходя изъ сферы притяженія своихъ же
частицъ, быстро перемещаются въ пред?лахъ всей массы
т?ла.
Сл?дуетъ, однако, зам?тить, что молекулы въ т?-
лахъ движутся не съ одинаковой скоростью: одн?
быстрЬе, другія медленн?е, и ч?мъ выше температура,
т?мъ, конечно, быстр?е движеніе молекулъ.
На поверхности жидкости молекулы, движущіяся съ
наибольшей скоростью, могутъ преодолеть притяженіе
своихъ молекулъ и уйти совс?мъ изь сферы ихъ
вліянія; эіимъ и объясняется испареніе и кипЬніе
жидкостей.
На ряду съ температурой очень важное вліяніе на
состояніе жидкосгей оказываетъ давленіе: увеличеніе его
затрудняетъ, а уменьшеніе облегчаетъ передвиженіе
молекулъ, а, сл?довательно, и переходъ жидкостей въ паръ.
Движеніе молекулъ вь жидкостяхъ легко вид?ть, на-
прим?ръ, на явленіяхъ дмффузіи, т.-е. на свойств?
жидкостей проникать одна въ другую въ спокойномъ состоя-
*) Еще въ 1827 г. Броунъ показалъ, что очень мелкш матеріадь-
яыя частицы, попавішя въ жидкость, н? остаются въ поко?, а
находятся въ постоянномъ движ?нш: и ч?мъ частицы мельче, т?мъ
движутся он? быстр??. Движеніе это названо Броуиовымъ Его хорошо
можно наблюдать въ ультрамикроскопе надъ суспендированными
веществами Броуново движеніе вызывается толчками движущихся
молекулъ жидкости. Эренгафтъ въ 1907 г. нашелъ, что Броуново
движете еще бол?е зам?тяо въ томъ случа?, когда мелкія частички взв?-
шены въ газахъ.
- 59 —
ніи, независимо отъ уд?льнаго в?са. Наприм?ръ, если
налить на дно стакана сахарнаго сиропа или соленой
воды, а сверху осторожно налить слой чистой воды и
оставить въ полномъ поко?, то черезъ н?которое время
и сахаръ и соль проникнуть въ чистую воду.
Такъ же уб?дительны и показательны сл?дующіе
опыты съ проникновеніемъ жидкостей чрезъ перегородки,
какъ, наприм?ръ, чрезъ пергамента, коллодій и н?кото-
рыя другія. Опытъ съ проникновеніемъ жидкостей чрезъ
пергаментъ описанъ дал?е (см. діализъ въ глав? о
кремневой кислот?). Опыты съ коллодіевыми м?шочками
ставятся сл?дующимъ образомъ х):
а) Въ м?шочекъ иаливаютъ водный растворъ хлорнаго
жел?за и вносятъ его въ стаканъ съ воднымъ растворомъ
таннина; быстро растворъ таннина начнетъ черн?ть, такъ
какъ хлорное жел?зо будетъ реагировать съ танниномъ,
а между т?мъ въ самомъ м?шочк? ничего чернаго не
будетъ: останется та же бл?дно-желтая окраска,
которая принадлежите слабому раствору хлорнаго жел?за.
Очевидно, частицы хлорнаго жел?за проникли чрезъ
ст?нки м?шочка и прореагировали съ танниномъ,
частицы же таннина не могутъ проникнуть внутрь
м?шочка.
Ь) Въ другой м?шочекъ наливается крахмальный
клейстеръ; такой м?шочекъ вносится въ красно-бурый
растворъ іода въ вод? (или лучше въ раствор? іодистаго
калія). Зд?сь картина будетъ обратная: частицы іода
*) Коллодіевы м?шочки приготовляются такъ: немного продажнаго
ко лло дія вливаютъ въ пр о бирку и вр ащаю тъ посл?днюю до т?хъ
поръ, пока вся пробирка внутри смочится коллодійнымъ растворомъ;
посл? этого даютъ кодлодійной жидкости (э?иру) испариться и зат?мъ,
наливъ осторожно въ пробирку воды, захватываюсь концы коллодіевой
пленки у отверстія пробирки и вынимаютъ коллодіевый м?шочекъ.
Въ него вставляютъ стеклянную трубку и притягиваютъ м?шочекъ
къ трубк? ниткой. Черезъ трубку можно вводить въ м?шочекъ
различные вещества.
— 60 —
войдутъ въ м?шочекъ и зд?сь, прореагировавъ съ крах-
маломъ, дадутъ вещество синяго цвЬта: все въ м?шочк?
посин?етъ, а дв?тъ раствора іода не изм?нится; значитъ?
частицы крахмала не могутъ пройти чрезъ коллодіевы
ст?нки/
Вообще, надо сказать, что въ большинств? случаевъ
вещества, которыя могутъ кристаллизоваться (въ приве-
денныхъ прим?рахъ—іодъ и хлорное
жел?зо)—кристаллоиды^ какъ ихъ называютъ, чрезъ подобныя перепонки
проходятъ, а вещества не кристаллизующіяся (въ
прим?рахъ —крахмалъ и таннинъ), или, что то же, коллоиды
(т.-е. подобныя клею), не проходятъ.
Газообразное состояніе характеризуется очень
большой скоростью движенія частицъ, — настолько большой,
что частицы лишь на очень короткое время, при столк-
новеніяхъ, попадаютъ подъ взаимное вліяніе: сталкиваясь
другъ съ другомъ и м?няя каждый разъ свое направленіе,
газовыя частицы летятъ дальше, стремясь занять
возможно большій объемъ, пока не встр?тится преграда
въ вид? какой-нибудь оболочки или ст?нокъ сосуда, въ
которыя обыкновенно и заключаютъ газы, если желаютъ
ихъ сохранить. Частицы газовъ, сталкиваясь между
собою въ невообразимомъ хаос?, ударяются о преграду
(наприм?ръ, о стЬнки сосуда) и создаютъ то, что
называютъ давленіемъ газа. Благодаря этой способности бы-
страго передвиженія, газовыя частицы выполняютъ всякій
объемъ съ одинаковой во вс?хъ точкахъ плотностью,
если только не имеется какого - либо внЪшняго пре-
пятствія.
Въ очень большой скорости передвиженія газовыхъ
часгицъ можно уб?диться на скорости распространенія
наприм?ръ, пахучихъ газовъ, а также на диффузіи газовъ
чрезъ преграды (см., напр., опытъ диффузіи водорода,
описанный на 161 стр. при „Водород?").
Опыты эти, между прочимъ, дали возможность
установить сл?дующее правило: скорость движенія частицъ
— 61 —
различныхъ газо?ъ обратно пропорцгональна кориямъ
н?адратныхъ изъ шъ плотностей. Наприм?ръ,
плотности водорода и кислорода относятся, какъ 1 : 16, а
сл?довательно, скорости движенія ихъ молекулъ относятся
j/T : |/і6, или какъ 1 : 4.
Если видимыя состоянія т?лъ, согласно изложенному,
зависятъ отъ относительнаго положенія (движенія) частицъ,
а посл?днее обусловливается, помимо природы вещества,
существующими температурой и давленіемъ, то, конечно,
данный видъ вещества всегда условный и можетъ быть
изм?ненъ въ другой при соотв?тствующихъ изм?неніяхъ
температуры и давленія; короче, каждое вещество при
подходящихъ условіяхъ температуры и давленія можно
им?ть въ любомъ состояніи.
§ 22. Химическіе знаки элементов?». Формулы и
уравненія. Для выраженія состава т?лъ и для выраженія
ихъ превращеній химія выработала свой особый языкъ.
принципъ котораго состоитъ въ сл?дующемъ: условилисьг)
обозначать атомы различныхъ э^ментОвъ начальными
буквами ихъ латинскихъ названій. Такъ, наприм?ръ, атомъ
водорода обозначается Н (Hydrogenium); атомъ
кислорода—О (Oxygenium) и т. д. (см. вышеприведенную
таблицу элементовъ и ихъ знаковъ на стр. 15). Если н?-
сколько элементовъ начинаются съ одной и той же буквы,
то въ обозначеніи элемента къ первой букв?
прибавляется одна изъ посд?дующихъ. Такъ, наприм?ръ, азотъ
(Nitrogenium) обозначается буквою N, а металлъ натрій—
Na (Natrium). Углеродъ обозначается буквою С (Carbo),
м?дь—Сп (Cuprum), хлоръ—С1 (СЫог) и т. д.
Для обозначенія состава какого - нибудь соединенія
(точн?е, частицы его) пишутся рядомъ знаки элементовъ,
его составляющихъ. Такі, поваренная соль (каждая
частица ея) состоитъ изъ элементовъ хлора и натрія и
*) Первоначальная выработка химическаго языка принадлежите
Берц?ліусу (Berzelius).
- 62 —
обозначается NaCl; хлористый водородъ (частица его)
состоитъ изъ хлора и водорода и обозначается HCL Если
въ составъ какого-нибудь соединения входятъ н?сколько
атомовъ, какого-нибудь элемента, то соотв?тствующая
цифра пишется справа и внизу (иногда, очень р?дко,
вверху) отъ знака этого элемента; наприм?ръ, составъ
воды (частицы), содержащей 2 атома водорода и одинъ
атомъ кислород а, выразится—Н30. Подобныя обозначенія
состава оложныхъ т?лъ называются формулами этихъ
т?лъ. Формула амміака, наприм?ръ, будетъ NH3: она
ноказываетъ намъ, что каждая частица амміака состоитъ
изъ одного атома азота и трехъ атомовъ водорода. На-
конецъ, если нужно обозначить не одну, а н?сколько
частицъ, то цифра, выражающая число частицъ, ставится
сл?ва отъ соотв?тствующей формулы, служа ея множите-
лемъ. Наприм?ръ, 2Н20 обозначаетъ 2 частицы воды,
ЗНС1 обозначаетъ В частицы хлористаго водорода.
Для выраженія химическимъ языкомъ химнческнхъ
превращеній поступають сл?дующимъ образомъ: пишутъ
формулы частицъ т?лъ, вступающихъ въ реакцію, и соеди-
няютъ ихъ знакомъ -\-; зат?мъ пишутъ формулы частицъ
т?лъ, полученныхъ посл? реакціи и также соединяютъ
ихъ знакомъ -f-, Такъ какъ формулы выражаютъ в?совыя
количества (объ этомъ см. ниже), и такъ какъ вещество
при реакціяхъ не творится и не уничтожается, то сумма
в?совъ т?лъ, взятыхъ въ реакцію, равна сумм? в?совъ
т?лъ, полученныхъ посл? реакціи. Поэтому между об?ими
группами фориулъ ставится знакъ равенства.
Прим?ры н?которыхъ уравненій:
Соединеніе с?ры съ жел?зомъ для образованія с?р-
нистаго жел?за:
Fe + S = FeS.
Разложеніе воды:
— 63 —
Разлоясеніе малахита:
CuC03. Cu(OH)2 = 2CuO -f H20 + С02.
J
Выт?сненіе м?ди жел?зомъ изъ раствора м?днаго
купороса:
CuS04 + Fe = FeS04 + Си.
Надо зам?тить, что большинство химическихъ урав-
неній выражаютъ лишь идеальные (а не д?йствительные—
во вс?хъ подробностяхъ) процессы, потому что
большинство превращеній просл?жено въ зависимости отъ
наличныхъ условій далеко неполно—въ виду очень боль-
шихъ экспериментальныхъ затрудненій. Химическое пре-
вращеніе р?дко идетъ только въ одномъ направленіи и
р?дко — непосредственно въ направленіи, указуемомъ
уравненіемъ, а чаще—или въ н?сколькихъ направленіяхъ,
или посл?довательно чрезъ рядъ посредствующихъ си-
стемъ.
§ 23. Основные законы газоваго состоянія т?лъ.
Такъ какъ по атомистическому- представленію химическія
превращенія совершаются въ часшицахъ между атомами,
то является необходимость научиться опред?лять какъ
в?са частицъ, такъ в?са и атомовъ, чтобы им?ть
возможность сл?дить не только за качественной стороной
реакціи, но и за количественной. Всего проще эти опре-
д?ленія разработаны для т?хъ случаевъ, когда вещество
можетъ находиться въ газообразномъ состояніи.
Два закона управляютъ газообразнымъ состояніемъ
т?лъ: первый изъ нихъ разсматриваетъ зависимость объема
газа отъ изм?ненія давленія, а второй — отъ изм?ненія
температуры.
1. Законъ Бойля (Boyle) и Маріошта (Mariotf). Если
температура газа остается постоянной, то объемъ газа
изм?няется, по закону Бойля-Маріотта, обратно пропор-
цгонально изм?ненію давленія, т.-е., напр., если объемъ
взятаго газа былъ равенъ одному литру, то при увели-
ченіи давленія вдвое этотъ объемъ уменьшится вдвое,
— 64 —
значить, будетъ равенъ половин? литра, а при
увеличении давленія въ четыре раза онъ будетъ равенъ j литра
и т. д. Понятно, что плотность газа при указанныхъ
изм?неніяхъ будетъ увеличиваться. Вообще, если объемъ
газа при дайленіи pQ былъ vQ, а потомъ съ изм?неніемъ
давленія до р изм?нился до v, то
или, взявъ произведенья крайнихъ и среднихъ:
v*Po = VP,
получимъ другое выражеяіе того же закона: произведете
изъ объема газа на давленіе при пеизм?нной темпера-
тур? для одного и тоіо же количества всякаго газа
есть величина постоянная (vp = const.).
2. Законъ Гей-Люссака (Gay-Lussac). Если давленіе
остается постояянымъ, то объемъ газа изм?няется, по
закону Гей-Люссака, прямо пропорціоналъно изм?ненію
температурь^ а именно при повышеніи температуры
на 1° Д". объемъ газа увеличивается на 1)ш (на 0,003665)
того объема, который данный газъ занималъ при 0Q.
Пусть объемъ газа при 0° былъ v0, а объемъ газа
при/0 — vv При повышеніи температуры на 1° Ц. объемъ
v0 увеличится на г/273 vQ и станетъ v0-\-^j2nvQi а при
*) Отсюда сл?дуетъ, что и, вообще, какой бы го ни было объемъ v
находящейся подъ одинаковымъ съ объемомъ vt давлені?мъ pf будучи
подвергнуть давленію р%, переходить въ новый объемъ г2 по пропорщи
Рч
v t^=j?a Р> откуда v2 = v~.
Р
Съ помощью этого уравненія можно переводить объемъ газа отъ
одного давленія къ другому. Наприм?ръ, какой объемъ займутъ 6 ли-
тровъ воздуха, изч?р?нныхъ при 720 мм. давленія, если посл?днее
опустится до 700 мм? Зд?сь ttj—искомый объемъ при 700 мм., v—объемъ
при 720 мм, т.-е = б, р = 720, р2 = 700 Сл?довательно,
720
{'2^6*Ш^6'17 ЛИТрОВЪ
— 65 —
повыш?ніи температуры на і° объемъ v0 увеличится на
VmXK* или на "273^°' И станетъ ^o + ij^oi" сл?до-
вательно, можно написать: vt=.vQ-\-—-v0,
или, вынося vQ за скобки и обозначая постоянный коэф-
фиціентъ 1/2П греческой буквою а:
Такъ обыкновенно и выражаютъ законъ Гей-Лтос-
сака г).
Изъ этого уравненія, конечно, легко опред?ляется и vQ:
і) Если ж? при температурныхъ изм?н?ніяхъ объемъ газа
оставить н?изм?няющимся, то п?рем?ннои величиной явится давленіе:
оно буд?тъ прямо пропорціонально изм?н?ніямъ температуры, и при
повышеніи температуры на 1° Ц. 'Ъно будетъ увеличиваться на
і/273 (=0,003665) того давленія, которымъ газъ при томъ же самомъ
объем? обладалъ бы при температур? (Ж Отсюда, обозначая черезъ
Pq давленіе и vQ—объемъ газа при 0°, при № и пр?жнемъ объем? v0
буд?мъ им?ть давленіе р равнымъ:
Р =Ро + 273 ' Ро~^° і1 + 273/ =jPe (1 + а^'
Такимъ образомъ давленіе газа при постоянномъ объем?
возрастаем съ новышеніемъ температуры въ такой же степени, въ какой
возрастаетъ объемъ, если нагр?вать газъ при постоянномъ давл?ніи,
или коэффщіентъ упругости (т.-е. приращені? давленія при нагр?-
ваніи на 1°) въ газахъ равенъ коэффициенту расширенія (т.-е. лрира-
щенію объема при нагр?ваніи на Щ.
2) Если объемъ щ* взятый при 0% нагр?ть на іД то получится
новый объемъ v0t, который по предыдущему буд?тъ равенъ v0 (1 -f- а^)>
a Vq отсюда =.. и т. д. для всякой температуры. Комбинируя
уравненія относительно vt и vt, т.-е.
1) «* = ^о (1 + О и 2) vti = we (I + ok),
Неорганическая химія. 5
— 66 —
( Предыдущіе законы даютъ возможность выразить со-
стояні? газа при одновременныхъ изм?неніяхъ и
температуры и давленія.
Обозначимъ объемъ газа при 0° и 760 мм. давленія
(эти услсМя принято называть „нормальными") черезъ VQy
объемъ газа при t° и давленіи 760—-черезъ Vv а объемъ
при температур? і° и давленіи р—черезъ Vp.
Сл?довательно, взяты сл?дующія положенія:
J. 0° —760 мн.—Г0.
2. і°~ 760 мм. — Vt.
3. і°— j> w&,— Vp.
При переход? газа, взятаго при 0° къ температуре і°
а давленіе осталось неизм?нившимся) объемъ Vt будетъ
по закону Гей-Люссака равенъ V0(l-\-a>i):
Vt = Va{\+af) .-(1)
Соотношеніе газовыхъ объемовъ при условіяхъ неиз-
м?няющейся температуры і°, но при изм?нившемся
давленіи изъ 760 мм. въ р мм. выразится по закону Бойля-
Маріотта такъ:
Fp.p=Ft.760 (2)
получаемъ изъ 1): vQ =s= z / ¦ , а вставляя это выражені? v0 въ-урав
1 -f- etc
н?ніе 2), им?емъ:
+
Пользуясь посл?днимъ уравнені?мъ, можно переводить
любой объемъ газа отъ одной температуры къ другой; напр., какой
объемъ займутъ 6 литровъ водорода, взяіаго при 180, если на-
гр?ть его до 1000? Зд?сь vH — искомый объемъ при 100°, vt —
объемъ при 180, т.-?г 6, *1==1000, *== 180, а = */и»» или 0>003665.
Сл?довательно:
1 + 0,003665 . 100
1 + 0,003665 . 18
vt = 6 ' і і птъаак iq — 7>6д литровъ.
Жераръ (Charles Frederic Gerhard!).
1816—1856.
^*
- 69 —
Выражая во второмъ уравненіи множитель Vt его зна-
ченіемъ изъ уравненія (1), т.-?. черезъ VQ {l-\-af), no-
лучаемъ
Vp.p=ro(l+at).l№) (3)
і) Если вообще надо вычислить, какимъ будетъ объемъ vb если
для объема v при давленіи р и т?мператур? t° изменить давлені? до рх
а температуру до t, то разсуждаютъ такъ:
Р
1) по Бойлю-Маріотту: «j ¦= и ¦ — (см. прим?ч. на стр. 64).
Рі
1 -4- at
2) по Г?й - Люссаку: v^—v ¦ 1 * (см. прим?ч. на стр. 65),
1 4- аи р
отсюда: v± = v • ~—р • ~ •
1 + at рх
Напр., какой объемъ займутъ 250 к. с. водорода, взятаго при 28°
н 743 мм. давленія, если температуру понизить до 10о, а давл?ні? —
до 720 мм.?
ЗдЬсь « = 250 к. с, р = 743 мм., * == 28«, j»t = 720, tt = 10« и
о . окл 1+0,003665 . 10 743
yj —искомый объемъ. Получаемъ vt=2oO • fT"Q~QA3e65 .' 28 " 720 ~
— 242,56 к. с.
1 + а^і Р х
Изъ уравненія vx — v • ¦ — можно вывести еще сл?д. два
уравненія:
-ч<іЧС^р+-і"1)
По 1-му уравнению вычисляется давленіе, которому надо
подвергнуть газъ, занимающій объемъ v при р и t°, чтобы онъ при tx занялъ
объемъ v$ напр., какому давленію надо подвергнуть 50 литровъ
воздуха, изм?реннаго при 22° и 753 мм., чтобы онъ при 0° занялъ объемъ
въ 30 литровъ?
Зд?сь v = 50, t = 220, р = 750, vx = 300 и іх = 00;
__ 50 (1 + 0,003665 • 0)
Л= 7бЭ * 30(1+0,003665^ 22) = Ш »' = 1'528 а™'
По 2-му уравненію вычисляютъ температуру, подъ вліяніемъ ко*
торой газъ, занимающій при Р и давленіи р объемъ v, займетъ при
давленіи рх объемъ vv Напр., взято 100 литровъ водорода, изм?рен*
— 70 —
а К° — (1 -|- а0. 760
Будемъ изм?нять уравненіе (3), подставивъ вм?сто а
ея величину;
Jj> = Fo(l + 2Уз0 • 760 = У0(Щ^) • 760;
наго при 200 и 650 мм. До какой температуры сл?дуетъ нагр?ть газъ,
чтобы при 760 мм. онъ занядъ объемъ, равный 180 литрамъ?
Зд?сь: v = 100, * = 20, р = 650, vt = 180, р1 = 760.
' *1==273 • (||^Ш[1+а003665 ' 2°1-1) = 343».
Или: на сколько градусовъ надо нагр?ть газъ, изм?ренный при 0е»
чтобы онъ при томъ же давленіи занялъ двойной объемъ?
Зд?сь: v — 1, t = 0, р =р\ = 1, «х = 2:
«і = 273 (т-^-т [1 + 0,003665 . 0] - і\ = 273 (2 — 1) = 2730.
і) По этому уравненію д?лаютъ приведеніе газовыхъ объемовъ
къ нормальной темлератур? и нормальному дав лент. Напр., привести
250 к. с. водорода, взятаго при 28° и 743 мм. къ нормальному давле-
нію и къ нормальной температур?.
Зд?сь ^ = 250 к. с, р = 7іЗ, t = 28<>:
250 ¦ 743
^ — (1+0,003665 • 28) . 760 *° К- С"
Легко, конечно, р?шить и обратную задачу, т.-?. перейти отъ
объема, взятаго при нормальныхъ условіяхъ давленія и температуры,
къ объему при другяхъ условіяхъ.
Если ^(і+У76о-
»>^=^1+af>-760.
р
Наприм?ръ, привести 221,56 к. с. водорода при 0*> и 760 мм. къ
280 и 743 мм.
991 «я (1+0.003665.28) ¦ 760
vf — 221,56 ч — '- = 250 к. с.
— It —
но 273 -f-1 есть абсолютная температура*) газа; её
обыкновенно обозначаюсь черезъ I, и тогда предыдущее
уравненіе примета сл?дующій видъ:
р F 273
— )
или, обозначая постоянный коэффиціентъ ° —
буквою і?, нолучимъ уравненіе въ окончательной форм?:
Гр-р = ВТ.
Полученное выражение есть уравненіе Елапейрона
(Clapeyron); оно, какъ видно, представляетъ собою
выводу изъ законовъ Бойля-Маріотта и Гей-Люссака. J
( Однако при опытной пров?рк? приведенныхъ
законовъ выяснилось, что это уравненіе выражаетъ состояніе
лишь идеальнаго газа2).уПри низкихъ температурахъ и
большихъ давленіяхъ вс? газы бол?е или мен?е
отклоняются отъ законовъ Бойля-Маріотта' и Гей-Люссакал а
сл?довательно, и уравненіе Клапейрона не вполн? точно.
Причину этого явленія объяснилъ ванъ-деръ-Ваальсъ
(van-der-Waals), который указалъ на то, что, во-первыхъ,
въ уравненіи Клапейрона совершенно игнорировано
взаимное притяженіе частицъ другъ къ другу: съ уменьше-
ніемъ объема оно ощутительно увеличивается и ведетъ
1) Абсолютная температура отсчитывается отъ абсолютнаго нуля,
который л?житъ на 273° ниже обычнаго 0*> Ц. Это ясно изъ того,
что при пониженіи температуры отъ 0*> Ц. на каждый градусъ про-
изойд?тъ сокращеніе объема на „=^ часть его; сл?доват?льно, черезъ
2730 сокращеніе будетъ равно ™Х273=::1» т*"е* эт0 будетъ
нулевой объемъ.
2) Поэтому и законы Бойля - Маріотта и Г?й - Люссака должны
быть названы лишь предгьльпыми законами, къ которъшъ
действительный явленія только приближаются, но которыхъ вполн? никогда
н? достигаютъ.
— 72 —
за собою уменьшені? давленія, оказываемаго газовыми
частицами на ст?нку преграды. А во-вторыхъ. въ объем?
Vp им?ется въ виду величина большая д?йетвительной,
потому что весь объемъ газа состоитъ изъ объема моле-
кулъ, его' составляющихъ, и изъ объема промежутковъ,
между ними заключающихся; изм?няться же могутъ
только промежутки, пространство между молекулами, а
объемъ самихъ молекулъ остается неизм?ннымъ. Ол?дова-
тельно, свободный для движенія молекулъ объемъ меньше,
ч?мъ разум?ющійся въ уравненіи. А въ зависимости отъ
этого удары часгицъ въ ст?нку будутъ чаще, т.-е. да-
вленіе, испытываемое ею, будетъ больше того, которое
им?ется въ уравненіи Клапейрона. Основываясь на тео-
ретическяхъ соображеніяхъ, ванъ-деръ-Ваальсъ
предложи лъ сл?дующую формулу:
гд? о есть часть несжимаемаго пространства, а —- — вы-
раженіе въ единицахъ давленія, присущаго молекуламъ
сц?пленія, обратно пропорціональнаго квадрату объема.
Указанныя отклоненія при изм?иеніяхъ газовыхъ объе-
мовъ сказываются т?мъ слаб?е, ч?мъ мен?е давленіе и
ч?мъ выше температура газа.
§ 24. Законъ Авогадро-Жерара. Приведеннымъ за-
конамъ Бойля-Маріотта и Гей-Люссака подчиняются какъ
простые, такъ и сложные газы, т.-е. независимо отъ ихъ
химической природы; сл?довательно, и причины этихъ
законностей не химическаго характера. Для объясненія
этой однородности газовъ въ начал? прошлаго стол?тія
(1811 г.) итальянскій ученый Авогадро (Avogadro) и
почти одновременно съ нимъ французскій ученый Амперъ
(Ampere) предложили гипотезу, по которой равные
объемы различныхг газовъ wpu одинаковой температур?
и одинаковомъ давлены содержать одинаковое число
— 73 —
молекулъ [частицъ]а), или, что то же: равное число ка-
кихъ бы то ни было молекулъ при одинаковыхъ давленіи
и температур? занимаютъ равные объемы, очевидно,
потому, что среднее разстояніе между молекулами всякихъ
газовъ въ указанныхъ условіяхъ одинаково.
Но какъ Авогадро, такъ и Амперъ им?ли въ виду,
главнымъ образзмъ, физическую сторону этого закона, а
потому для химіи онъ долгое время им?лъ очень мало
значенія. Большинство химиковъ даже не обратило на
него вниманія. Только въ 40-хъ годахъ прошлаго стол?-
тія, благодаря Шарлю Жерару, законъ Авогадро сталъ,
д?йствительно, чрезвычайно важнымъ закономъ въ
современной химіи.
Законъ этотъ справедливо можетъ быть названъ j?aKo-.
номъ Авогадро-Жерара.
Законъ Авогадро-Жерара можно вывести изъ
кинетической теоріи газовъ сл?дующимъ путемъ. Возьмемъ два
различные газа; если М и Ж—массы ихъ отд?льныхъ
частицъ, V и 7'—ихъ соответственный скорости, N и
N'—число частицъ въ единиц? объема, тогда давленія
этихъ газовъ р и р* будутъ находиться между собою въ
такомъ отношеніи:
1 1 v NMV2
p:p' = ±NMV>^N'M'V», или ^_^_(1)2).
і) Самъ Авогадро разум?лъ не молекулы, а атомы: поправка
была внесена поздн?е.
2) По кинетической теоріи газовъ молекулы газообразнаго
вещества находятся въ прямолинейномъ поступательномъ движеніи; встр?-
чаясь между собою, он? отталкиваются подобно эластичнымъ шарамъ,
но ничего не теряютъ въ своей скорости. Съ повышеніемъ
температуры скорость этого движенія увеличивается. Съ точки зр?нія этой
теоріи давленіе, производимое газомъ на поверхность вм?щающихъ его
сосудовъ, пр?дставляетъ собою результатъ ударовъ, непрерывно на-
носимыхъ этой поверхности молекулами газа. Для уравнов?ш?нія этой
совокупности ударовъ молекулъ и приходится прим?нять давленіе извн?.
Сл?довательно, давленіе газа на преграду зависитъ какъ отъ числа
молекулъ, такъ и отъ массы и скорости каждой изъ нихъ. По кине-
— 74 —
Если давленія этихъ двухъ газовъ будутъ одинаковы,
т.-?. р—р', то
и NMY*=*N'MT* -. - (2)
Если температуры газовъ будутъ одинаковы, то и
пропорціональныя абсолютнымъ темнературамъ живыя
силы ихъ частицъ —^— и —^— будутъ также равны
между собою, или
Ж72 = Ж* Г2 (3)
Разд?ляя почленно уравненіе (2) на (3), получимъ
N=N't
т.-е. при одинаковыхъ давленіи и температур? въ рав-
ныхъ объемахъ вс?хъ газовъ заключается одинаковое
число частицъ.
§ 25. Законы Гей-Люесака относительно объем-
ныхъ отношеній соединяющихся и получающихся
веществъ въ газообразномъ еостояніи. Изложенный
законъ Авогадро-Жерара прежде всего очень просто и
ясно объясыилъ сл?дующіе чисто опытные законы Гей-
Лю ссака, установленные въ 1808 году. Гей-Люссакъ,
изучая относительныя величины объемовъ, въ которыхъ
газы, и простые и сложные, химически соединяются между
собою, установилъ, что эти величины или одинаковы,
или находятся въ простыхъ кратныхъ отношеніяхъ.
Этотъ первый законъ Гей-Люссака можно
формулировать такъ: Количество т?лъ, вступающие въ
химическое взйимод?йст?ге, занимаешь, при одинаковыхъ
физическихъ условіяхъ, въ газообразномъ или парообраз-
номъ еостояніи равные или кратные между собою
объемы.
тической теоріи давленіе — р въ единиц? объема, гд? находится N
частицъ съ массою М и со скоростью движенія V каждая, выражается
сл?дующимъ уравненіемъ:
р = ~ NMV*.
Гей-Люссакъ (Joseph Louis Gay-Lussac),
1778—1850.
— 77 —
Второй законъ Гей-Люссака касается относительной
величины объема въ газообразномъ состояніи
образующаяся сложнаго вещества. Законъ этотъ сл?дующій:
Объемъ образующегося т?ла въ газообразномъ или паро-
образномъ состояніи всегда находится въ простомъ
кратномъ отношены къ объему каждой изъ составныхъ
частей его2).
Вотъ н?сколько прим?ровъ: при образовали хлори-
стаго водорода входятъ въ реакцію 1 об. водорода съ
1 об. хлора и получается 2 об. хлористаго водорода;
при образованіи воды—1 об. кислорода съ 2 об.
водорода и получается 2 об. водяного пара и т. д.
Законы Гей-Люссака въ настоящее время пров?рены
на весьма большомъ числ? случаевъ и найдены вполн?
правильными.
Очевидно, что т? относительныя в?совыя количества,
въ которыхъ т?ла соединяются между собою и продукты
реакціи, занимаютъ въ парообразномъ состояніи соизм?-
римые объемы. А если принять в? вниманіе, что
реакціи веществъ идутъ между ихъ частицами и въ
результате реакцій получаются также частицы, то, по закону
Авогадро-Жерара, относительный числа объемо?ъ при
химическихъ реакцгяхъ выражаютъ относительныя
числа частицъ, участвующихъ въ реакціи, гь частицъу
получающихся въ результат? реакціи.
Общая формулировка законовъ Гей-Люссака такова:
реакціи газообразныхъ и парообразныхъ т?лъ всегда
происходятъ меоюду соизм?римыми ихъ объемами.
Законы Гей-Люссака совершенно напоминаютъ законъ
кратныхъ отношеній, управляющій в?совыми отношеніями
соединяющихся элементовъ. Для объясненія посл?дняго
взятъ атомъу какъ химическій, въ в?с? неизм?няемый,
*) Объемные законы Гей-Люссака вм?ст? съ законами кратныхъ
отношеній и паевъ часто называютъ стехіометричеепчми законами,
т,-е. количественными законами.
— 78 —
индивидуумъ; зд?сь же—при объемныхъ отношеніяхъ—
объясненіе найдено въ частиц?, какъ реагирующемъ инди-
видуум?, при однихъ и т?хъ же условіяхъ им?ющемъ
всегда одинъ и тотъ же объемъ, независимо отъ
природы вещества.
§ 26. Опред?леніе в?са чаетицъ. Пользуясь зако-
номъ Авогадро-Жерара, можно опред?лять
относительный1) в?съ чаетицъ какъ простыть, такъ и сложныхъ
т?лъ. Въ самомъ д?л?, если равное количество чаетицъ
какого угодпо газа—простого (наприм?ръ: водорода,
кислорода, азота и др.) или сложнаго (иодяного пара, угле-
кислаго газа, амміака и др.)—при одинаковыхъ условіяхъ
температуры и давленія занимаютъ равные объемы, то
относительный в?съ чаетицъ долженъ равняться
относительному в?су равныхъ объемовъ газовъ. В?са
чаетицъ обычно сравниваются съ в?сомъ частицы
водорода. Ясн?е это будетъ на прим?р?. Литръ кислорода
в?ситъ въ 162) разъ бол?е литра водорода, конечно, при
одинаковыхъ условіяхъ температуры и давленія; въ томъ
и другомъ литр? количество чаетицъ одинаково. Сл?до-
вательно, каждая частица кислорода въ 16 разъ тяжел?е
частицы водорода. Частица азота при такомъ же опре-
д?леніи оказывается въ 14 разъ тяжел?е частицы
водорода.
Отнонгені? же между в?сомъ даннаго вещества и
между в?сомъ равнаго объема какого-нибудь другого
вещества, принятаго за единицу сравненія (обыкновенно
воды, а для газовъ—воздуха или водорода) при
одинаковыхъ условіяхъ давленія и температуры, какъ изв?стно,
называется относительнымъ—уд?льнымъ в?сомъ. Отсюда
уд?льный в?съ, или выражающаяся т?мъ же числомъ
!) Для опред?ленія абсолютнаго в?са чаетицъ м?тодовъ н?
им?ется.
3) Въ прим?разсь большею частью взяты цифры округленные, т.-е,
не вполн? точныя.
— 79 —
плотность1) газа по отношенію къ водороду, показы-
ваетъ, во сколько разъ частица этого газа тяжел?е
частицы водорода.
За основную же в?совую единицу сравненія съ
давнихъ поръ принимается в?съ одного атома
водорода2).
§ 27. Частицы простыхъ т?лъ. Докажемъ теперь,
что если принять в?съ одного атома водорода за
единицу, то в?съ частицы водорода всего проще выражается
числомъ 2, т.-е. что она состоитъ изъ 2-хъ атомовъ.
Существуешь соединеніе, называемое хлористымъ водо-
родомъ—НС1.
Опытъ показываетъ, что, во-1-хъ, для полученія этого
соединеиія всегда надо брать равные объемы водорода и
хлора, а во-2-хъ, что результатомъ соединенія равныхъ
объемовъ водорода и хлора всегда получается хлористаго
водорода вдвое большій объемъ, ч?мъ объемъ каждой
составной части.
і) Плотностью называется количество газа въ ?диниц? объема,
т.-?. она изм?ряется в?сомъ единицы объема.
2) Эта основная единица принципіально признается и въ
настоящее время, хотя въ то же время съ 1898 г., по пр?дложенію
специальной комиссіи, избранной сов?томъ Берлинскаго химическаго общества
и состоявшей изъ Г. Ландольта, В. Оствальда и К. З?йберта, и
принято: основатель для вычислеиія атомныхъ вгьсовъ долженъ
служить в?съ кислорода, принимаемый за 16,000: атомные втъса
другихъ элементовъ долэюны быть вычислены изъ опред?ленныхъ
непосредственно или посредственно огпношеній, въ которыхъ эти
элементы соединяются съ кислородомъ. Атомный в?съ водорода при
этомъ съ единицы изм?няется въ 1,008.
Такая поправка им??тъ наибол?? существенное значеніе при
аналитическихъ работахъ; на понимание же теоретич?скихъ положеній
она не им?етъ никакого вліянія, а потому для простоты въ -настоящемъ
курс? (во введеніи) и удерживается прежняя водородная единица.
Атомные ж? в?са взяты съ поправкой на 1912 г. (см. стр. 15 и 16).
Огчетъ упомянутой комиссіи съ изложеніемъ мотивовъ поправки
нап?чатанъ въ «Berl. Berlichte», 31, 2761, а въ русскомъ перевод?
напечатанъ въ «Журнад? Русскаго Физико-Химнческаго Общества»
31 (И), 12.
— 80 —
Изобразись это въ сл?дующемъ вид?:
Хлорист. вод.
В?съ въ граммахъ. . 1 35,45 36,45
Объемъ въ литрахъ. 11,2 11*2 22,4
Конечно, мы не знаемъ, сколько частицъ
заключается во взятыхъ объемахъ, но это и не важно. Опытъ
говоритъ только, что объемы водорода и хлора равны, а
объемъ получающагося при этомъ хлористаго водорода—
вдвое больше; сл?довательно, по закону Авогадро-Жерара,
водорода и хлора берется равное число частицъ, а
получается хлористаго водорода вдвое большее число
частицъ.
Въ частиц? хлористаго водорода не можетъ быть ме-
н?е одного атома водорода и одного атома хлора. А что
же разум?ть подъ частицами водорода и хлора? Пред?лъ
д?лимости простыхъ т?лъ есть атомъ. Можетъ-быть, этотъ
атомъ и есть частица въ этихъ простыхъ т?лахъ?
Если такъ, то пусть во взятомъ объем? водорода бу-
детъ 1.000 атомовъ і), тогда и въ объем? хлора будетъ
1.000 атомовъ. Въ такомъ случа? реакцію надо понять
такъ:
1.000 Н
+
1.000 С1
1
то-?сть 1.000 атомовъ водорода и J.000 атомовъ хлора
соединяются и даютъ 1.000 частицъ хлористаго водорода.
Но въ такомъ случа?, по закону Авогадро-Жерара, эти
частицы хлористаго водорода должны были бы занимать
объемъ, равный объему водорода или, что то же, равный
объему хлора.
А между т?мъ опытъ указываетъ, что объемъ
хлористаго водорода вдвое больше, а сл?довательно, въ
1 объем? его находится только 500 частицъ. Но посл?д-
няго не можетъ бытъ: хлористый водородъ—газъ, также
*) Конечно, ихъ н?лзм?римо больше, но величина цифры зд?сь
роли не играетъ.
Водор.
+
Хлоръ.
— 81 —
отыосящійся къ изм?неніямъ давл?нія и температурь*,
какъ водородъ и хлоръ; сл?довательно, и для него
обязателен законъ Авогадро-Жерара. Очевидно, въ приве-
д?нномъ разсужденіи гд?-нибудь допущена ошибка.
Чтобы устранить эту ошибку, представимъ себ?, что
и въ водород? и въ хлор? отд?льные атомы сц?пляются
по два, и каждый такой двойной атомъ является
частицею, тогда во взятыхъ объемахъ водорода и хлора бу-
детъ уже по 500 частицъ, и символическое изображеніе
приметь такой видъ:
500Н2
+ 500CL = 500НС1 f 500HC1
Зд?сь уже все согласно съ закономъ
Авогадро-Жерара. Отсюда сл?дуетъ, что реакція соединенія хлора
съ водородомъ идетъ въ 2 фазы: первая фаза состоитъ
въ распадеиіи двойныхъ атомовъ (частицъ простыхъ т?лъ)
водорода и хлора на отд?льные атомы, а вторая—въ со-
единеніи разнородныхъ атомовъ въ частицу сложнаго
т?ла—хлористаго водорода.
Изсл?дованіе вс?хъ другихъ изв?стныхъводородистыхъ
со?диненій показало, что н?тъ такого, въ которомъ
водорода находилось бы мен?е, ч?мъ въ хлористомъ
водород?, а потому мы можемъ, пока не будетъ доказано
противное, принять это количество за нед?лимое, или,
что то же, за атомъ; а тогда частица водорода, сл?до-
вательно, состоитъ изъ двухъ атомовъ, и если в?съ
атома водорода принять =1, то в?съ частицы
водорода =2.
Прим?ровъ, подобныхъ приведенному, много, но вс?
они понимаются просто при допущеніи существованія
элементарныхъ атомовъ въ вид? т?хъ или иныхъ ком-
плексовъ, или иначе—частицъ.
Съ принятіемъ частицы водорода, какъ состоящей изъ
двухъ атомовъ, приходится допустить, что и н?которыя
другія простая т?ла им?ютъ частицу, составленную тоже
Неорганическая химія. 6
— 82 —
изъ 2-хъ атомовъ, напр., хлоръ, кислородъ и др. Но есть
простыя т?ла и сь бол?е сложными частицами: напри-
м?ръ, у фосфора и мышьяка въ парахъ (при н?высо-
кихъ температурахъ) частицы сложены изъ 4-хъ атомовъ.
Иногда у* простыхъ т?лъ сложность частицы бываетъ
неодинакова при различйыхъ условіяхъ: наприм?ръ, у т?хъ
же фосфора и мышьяка при бол?е высокихъ
температурахъ частицы д?лаются мен?е сложными, а именно при
1.700° у фосфора он? состоять уже изъ 3-хъ атомовъ,
а у мышьяка около 1.400° - изъ 2-хъ атомовь; у с?ры
только выше 800° частица состоитъ изъ 2-хъ атомовъ,
а при лизшихъ температурахъ сложность частицы
возрастаешь до 8 атомовъ. Самъ кислородъ, частица котораго
состоитъ изъ 2-хъ атомовъ, можетъ быть переведенъ въ
другое видоизм?неніе—озонъ, у котораго частица равна
тремъ атомамъ. Молекулы, напр., металловъ: калія, на-
трія, цинка, кадмія, ртути и н?которыхъ другихъ въ
парахъ при высокой температур?, содержать по одному
атому.
Конечно, въ зависимости оть состава частицы изм?-
няются и свойства т?ла: такь, кислородъ и озонъ
различаются другъ отъ друга по свойствамъ; существуетъ два
различныхъ по свойствамъ фосфора: безцв?тный (его
обыкновенно зовутъ—желтый фосфоръ)—сильно
энергичный, и красный—мало энергичный; у мышьяка и с?ры
изв?стно также по н?скольку видоизм?неній.
Такія видоизм?ненія простыхъ т?лъ, которыя зави-
сятъ отъ неодинаковой величины частицы, называются
обыкновенно аллотропическими видоизм?неніямиа). Яркіе
прим?ры подобныхъ видоизм?неній являетъ углеродъ,
который изв?стенъ въ вид? обыкновеннаго аморфнаго
угля, графита и алмаза.
*) Вопросъ о лричинахъ, вызывающихъ аллотропно, нельзя
считать вполн? выясненнымъ; совершенно, напр., н? выяснено, какова
группировка атомовъ въ частицахъ простыхъ т?лъ и какъ она вліяетъ
на свойства частицъ и массъ.
— 83 —
§ 28. Соетояніе атомовъ (in statu nascendi) въ
моментъ выд?ленія. Въ существовали частицъ элемен-
товъ можно отчасти уб?диться и на сл?дующемъ изв?ст-
номъ факт?: вс? элементы въ моментъ ихъ выд?ленія (in
statu nascendi) изъ соединеній д?йствуютъ бол?е
энергично, нежели т? же элементы, побывшіе въ свобод-
номъ состояніи.
Наприм?ръ, если изъ баллона, въ которомъ собранъ
заран?е кислородъ, пропускать его въ хлористый водо-
родъ, то никакого изм?ненія въ хлористомъ водород? не
будетъ; сл?довательно, кислородъ не д?йствуетъ на
хлористый водородъ. Другое будетъ, если д?йствовать на
хлористый зье водородъ кислородомъ въ тотъ моментъ,
какъ онъ только что выд?ляется изъ какого-нибудь со-
единенія: при этихъ условіяхъ онъ сейчасъ же отнимаетъ
у хлористаго водорода водородъ, а хлоръ, легко
ощутимый по желто-зеленому дв?ту и удушливому запаху,
будетъ выд?ляться свободнымъ.
Подобныхъ прим?ровъ изв?стно много. Н?которые
химики причину этого различнаго д?йствія объясняютъ
такъ: когда элементъ собранъ заран?е, то его атомы
усп?ли уже сц?питьея въ частицы, при чемъ на это
сц?пленіе они затратили изв?стную часть присущей имъ
энергіи, и сами, сл?довательно, стали мен?е энергичными;
при реагированіи частицъ часть энергіи идетъ на рас-
щепленіе ихъ на атомы. Въ моментъ же выд?ленія изъ
соединеній атомы, не усп?въ сц?питься въ частицы,
сл?довательно, не усп?въ истратить нисколько изъ
своего запаса энергіи, гораздо сильн?е д?йствуютъ на им?-
ющееся на ихъ пути вещество.—Правда, существуетъ
и другое объясненіе этого факта: наибольшую энергію
элементовъ въ моментъ ихъ выд?ленія объясняютъ ихъ
сгущенностью въ этомъ состояніи, т.-е. съ точки зр?яія
закона д?йствующихъ массъ.
Итакъ, явленія аллотропіи, а, можетъ-быть, отчасти и
соетояніе элементовъ въ моментъ ихъ выд?ленія под-
6*
— 84 —
тверждаютъ существованіе частицъ въ эл?ментахъ. Эти
частицы равнообъемны съ частицами сложныхъ веществъ.
§ 29. M = 2D. Теперь будетъ уже легко опред?лить
в?съ частдцы и по отношенію къ в?су атома водорода.
Плотность вещества по отношенію къ водороду показы-
ваетъ намъ, во сколько разъ частица его шяжел?е
частицы водорода. Частица же водорода, какъ состоящая
изъ двухъ атомовъ, в?ситъ 2. Отсюда, если удвоить
плотность даннаго газа по водороду, получится в?съ частицы
газа, выраженный въ в?с? атома водорода.
Возьмемъ равные объемы изсл?дуемаго газа и
водорода V и V. Обозначимъ массу и плотность испытуе-
маго газа черезъ іий, а водорода — черезъ Ш ж d\
ИзвЬстно, что объемъ газа прямо пропорцгоналенъ масс?
и обратно пропорцгоналенъ плотности^ откуда им?емъ:
но по условно:
отсюда:
~d~~ d'*
В?съ массы даннаго объема газа составляется изъ
суммы вЬсовъ отд?льныхъ частицъ, его слагающихъ.
Пусть т будетъ вЬсъ частицы даннаго газа, а N—число
ихъ въ данномъ объем?, ml—в?съ частицы водорода, а
Лт/—число ихъ.
Отсюда M^JSTm, MJ — N'ni\ Зам?няя Ж" и Ж' въ
вышеприведенномъ уравненіи величинами Nm и N'm\
будемъ им?ть:
Nm N'ni
— 85 — ч
при равенств? объемовъ N=^N' (fco закону Авогадро);
сл?довательно, и
т пі
Но т'—масса частицы водорода—равна 2 (принимая
массу атома водорода за 1), a d'—плотность водорода=1.
Сл?довательно,
m
d~^
откуда
m = 2d*),
т.-е. в?съ частицы вещества равенъ удвоенной
плотности его пара, опред?ленной по отнотеиію пъ
водороду.
*J Къ уравн?нію т —2с? можно прійти также сл?дующимъ пу-
темъ: пусть т, т', w2... будутъ в?са частицъ различныхъ т?іъ, а
ду d!, d2 —ихъ плотности и v, v', щ. •.—объемы этихъ частицъ въ
газообразномъ состояніи; соотношения межДу массою, плотностью и
ооъемомъ можно выразить такъ: v = -4, v ^—,, v^^ — ... Если
d d d%
. m mr Шъ
и=г> =d«=. .,, то — = -=;:=: ~=..., т.-е. отнош?ні? массъ къ
d df d2
плотности есть н?которая постоянная величина; обозначимъ ее че-
резъ А. Значеніе этой А, конечно, условно и зависитъ отъ ?диняцъ,
избранныхъ для выраженія частичныхъ в?совъ и плотностей. В?съ
частицъ равенъ сумм? в?совъ атомовъ, е? составляющихъ; для сра-
вн?нія атомныхъ в?совъ, какъ уже было сказано въ текст?, прини-
маютъ кислородный атомъ=16, а водородный—1,008 (т.-е.=почти 1);
для выраженія же плотностей газовъ и паровъ принимаютъ за еди-
пицу сравненія плотность водорода. Отсюда для нахожденія
постоянной величины А сл?дуетъ определить только в?съ частицы какого-
нибудь со?диненія и его плотность но водороду. Пусть такимъ соеди-
неніемъ будетъ вода. Изъ опытовъ можно определить, что наим?н-
шая реагирующая ея масса (т.-е. частица) ш есть 18, плотность
водяного пара по водороду d = 9, сл?д., -= — —- = 2; сл?д.3 постоянная
О/ У
А = 2, или -= = 2, откуда т = 2d.
— 86 —
Эта формула позволяетъ очень легко вычислить в?съ
частицы. На практик? плотность паровъ или газовъ
опред?ляютъ обыкновенно по отношенію къ воздуху.
Перевести эту посл?днюю на плотность по водороду очень
легко, а именно—помножая первую на 14,435, такъ какъ
водородъ легче воздуха въ 14,435; полученную такимъ
образомъ плотность умножаютъ на 2 и получаютъ в?съ
частицы, показывающій, во сколько разъ частица
вещества тяжел?е одного атома водорода.
Количество граммовъ элемента или сложнаго соеди-
н?нія,, равное в?су атома, называется граммъ-атомомь, а
количество граммовъ, равное в?су частицы (молекулы),
называется граммъ-молекулой. Такъ, граммъ-атомъ
водорода есть 1 граммъ водорода (точн?е 1,008 гр.), а граммъ-
молекула водорода есть не что иное, какъ 2 грамма(2,016 гр.
съ поправкой) водорода. При 0° и 760 мм. давл?нія эта
граммъ-молекула водорода занимаетъ объемъ въ 22,4 литра.
А такъ какъ, по закону Авогадро-Жерара, молекулы
вс?хъ т?лъ въ газообразномъ состояніи при одинаковыхъ
условіяхъ температуры и давленія занимаютъ одиаъ и
тотъ же объемъ, то и граммъ-молекула всякаго газа
при 0° и 760 мм. давленія занимаетъ 22,4 литра, и, на-
оборотъ, взявъ 22,4 литра (при 0° и 760 мм.) любого
газообразнаго вещества и взв?сивъ ихъ, им?емъ граммъ-
молекулу, т.-е. знаемъ относительный молекулярный в?съ
вещества. Объемъ 22,4 литра называется граммъ-моле-
кулярнымъ объемомъ, или просто молекулярнымг объ-
емомъ.
§ 30. Опред?л?ніе плотности пара. Итакъ, для
опред?ленія в?са частицы какого бы то ни было
вещества необходимо знать плотность его пара по водороду
Зам?тимъ, что если принимать атомную массу водорода равной
н? 1, а 1,008, то для в?са частицы воды величину 18 надо исправить
на 18,016, и уравнені? m — 2d надо изм?нить на m — 2,Q\.§d и
прочитать такъ: в?съ частицы вещества почти рав?нъ удвоенной
плотности его пара, опред?деиной по водороду.
— 87 —
(1 литръ водорода при 0° и 760 мм. в?ситъ 0,09 или,
точн?е, 0,0899578) или по воздуху (1 литръ воздуха
при 0° и 760 мм. в?ситъ 1,29306), Чтобы опред?лить
плотность, надо знать в?съ вещества, его объемъ въ
состояніи газа, давлені? и температуру, при которыхъ
этотъ объемъ изм?ренъ.
Существуете н?сколько методовъ для опред?ленія
плотности пара. Вотъ важнЬйшіе изъ нихъ:
а) МетодгРенъо (Regnault)—
пригодный для веществъ газо-
образныхъ при обыкновенной
тедш?ратур?. Онъ состоитъ въ
томъ, что стеклянный сосудъ,
емкость и в?съ котораго опре-
д?ляются заран?е, взв?шиваютъ
сначала съ воздухомъ, а потомъ,
выкачавъ воздухъ, съ изсл?ду?-
мымъ газомъ, конечно, при одина-
ковыхъ условіяхъ температуры
и давленія. Такъ опред?ляются
в?са равныхъ объемовъ испы-
туемаго газа и воздуха; отношеніе Рдс п. Опред?лені?
плотности пара по Дюма,
этихъ величинъ и дастъ плот- F л
ность.
/ Ъ) Методъ Дюма. (Dumas.) Въ стеклянный сосудъ
фис. 11), в?съ и емкость котораго изв?стны, вливаютъ
небольшое количество испытуемой жидкости и нагр?ва*
ютъ въ бан? (водяной или масляной) съ т?мъ расчетомъ,
чтобы температура бани была на н?сколько градусовъ
выше температуры кип?нія вещества и чтобы она не
изм?нялась въ теченіе опыта. Когда вся жидкость
превратится въ паръ, который выт?снитъ весь воздухъ изъ
сосуда, посл?дній запаиваютъ и взв?шиваютъ. Такимъ
образомъ и зд?сь изв?стны: в?съ вещества, объемъ его
пара, температура бани (а сл?довательно, и пара) и да-
, вленіе атмосферы и т? же данаыя относительно воздуха.
— 88 —
Этоть методъ прим?-
няется большею частью къ
невысоко кипящимъ жид-
костямъ.
с) Методъ Виктора
Мейера (Victor Меуег)(пред-
ставляющій видоизм?нені?
метода Гофмана) состоитъ
въ слідующемъ;
Длинная стеклянная
трубка (рис. 12),
расширенная внизу, вм?стимостыо
около 100 куб. сант., по-
м?щается въ широкой, снизу
запаянной муфт?, на дно
которой иаливаютъ какой-
нибудь высоко кипящей
жидкости; точка кип?нія
этой жидкости должна
быть, но крайней м?р? на
30° выше точки кип?нія
изсл?дуемаго вещества.
Трубка закрывается сверху
пробкой d; отъ верхней
части этой трубки отходить
боковая а; она погружена
въ воду, какъ это
представлено нарисунк?.Въ
верхнюю часть внутренней
трубки, отд?ленную отъ
остальной трубки или краномъ
Рис. 12. Приборъ В. Мейера или, какъ на рисунк?,
для олр?д?ленія плотности пара. цалочкой, прикр?пленной
каучукомъ, вносится въ
ампульк? (въ маленькой пробирочк? съ пробкой) отв?шен-
но? количество испытуемаго вещества. При кипяченш жид-
— 89 —
кости въ муфт? воздухъ вътрубк? расширится и всл?дстві?
этого изъ трубки а будетъ выходить пузырьками. Когда
температура станетъ постоянной, т.-е. когда пузырьки изъ
трубки перестанутъ выд?ляться, надъ концомъ отводной
трубки а ставятъ изм?рительную трубку, наполненную
водой; зат?мъ открываютъ кранъ или отодвигаютъ
поперечную палочку, при чемъ ампулька съ веществомъ па-
даетъ внизъ, и кранъ опять быстро запираютъ. Вещество
выходить изъ ампульки и переходитъ въ ларъ, который
выт?сняетъ равный ему объемъ воздуха, наполнявшаго
внутреннюю трубку; воздухъ этотъ выт?сняется въ изм?-
рительную трубку, и объемъ его можетъ быть изм?ренъ.
Число кубическихъ сантиметровъ воздуха, перешедшихъ
въ изм?рительную трубку, равно объему пара вещества
и притомъ объему пара при наблюдаемомъ во время
опыта атмосферномъ давленіи съ присоединеніемъ давле-
нія водяного пара и при комнатной температур?, такъ
какъ воздухъ, проходя чрезъ воду, охладился; давленіе
водяного пара находятъ въ справо^ныхъ таблицахъ и
вычитаютъ изъ общаго давленія.
Узнавъ, такимъ образомъ, объемъ, занимаемый па-
ромъ опред?леннаго количества вещества, можно легко
вычислить в?съ одного литра пара вещества при 0° и
760 мм. давленія. Наприм?ръ, пусть взято было въ ам-
пульку 0,184 гр. жидкости и парами ея было выт?снено
37,5 к. с. влажнаго воздуха, изм?реннаго въ трубк? при
14° и 752 мм. давленія. Для вычисленія плотности пара
разсуждаютъ такъ: общее давленіе воздуха и водяного
пара при 14° = 752мм.; а давленіе одного водяного пара
при 14°= 12 мм.; сл?д., на долю воздуха приходится
752—12 = 740 мм.; сл?д., 0,184 гр. жидкости при 14°
и 740 мм. давленія занимали объемъ 37,5 к. с. Какой же
объемъ они займутъ при 0° и 760 мм.? По формул?
(см. стр. 70) v»= * или= і— =
7Ы)(1 + аО 760(1+_LXq
— 90 —
__ vtF vtp ¦273
760 /273+*\ 760.(273 + 0'
подставляя вмЬсто
273 /
vt— 37,5, вм?ио P— 740 и t — 14, им?емъ: v0 =
37,5X740X273 0K __ .
= ~760(273 + l!T E- C,; K' C' еСТЬ Ъ?МЪ
испарившагося вещества при 0° и 760 мм.; в?съ
1 к. с. = ~?— = 0,0053, а в?съ 1 литра (1.000 к. с) =
= 5,3. Чтобы получить плотность по водороду, стоить
только 5,3 разд?лить на в?съ 1 литра водорода, т.-е. на
0,08987, и получится 59.
Въ общемъ формула, по которой зд?сь вычисляютъ
плотность пара (D), выражается такъ:
P(l+gfl.760
v. 0,00008987 (Я—*)'
гд? Р — в?съ взятой жидкости, а — коэффиціеніъ рас-
ширенія газовъ, равный-^=^, или 0,00367, і —
температура изм?ренія объема пара; 760—норм, давлеше,
v—наблюденный объемъ воздуха, равный объему пара,
0,00008987—в?съ 1 к. с. водорода, Н—наблюденное
давленіе, h—упругость водяного пара при температур?
водяной ванныг).
*) Формула эта получается сл?дующимъ пут?мъ* по уравнению
(см. стр. 65)
и vt (Н — h) — vQ (l + ot)760, откуда
- t>,(H-h)
(1 + at) . 760 *
P __ P __ P (1 + at) 760
^o~ tf|(H-h) ~ vt(E~b) "'
(1 + ctf)760
а выражая плотность по отношений къ водороду =
_ Р (1 + at). 760
— у,. 0,0000899578 (Н — h) '
vQ —
— 91 —
Описанный методъ прим?нимъ только для т?хъ ве-
ществъ, которыя могутъ безъ разложенія переходить въ
парообразное состояніе. Большинство газовъ и паровъ
таково, что ихъ плотность всегда постоянна, независимо
отъ обычныхъ температурь и давленій, которымъ
подвергается вещество. Сюда относятся вс? т? вещества,
которыя въ изв?стныхъ границахъ температуры и давле-
нія сл?дуютъ законамъ Бойля-Маріотта и Гей-Люссака.
Но есть и исключенія1). Существуютъ вещества какъ
простыя, такъ и сложный, плотность которыхъ изм?-
няется съ перем?ною температуры и давленія и
обыкновенно въ такомъ порядк?: при низкой температур?,
различной для различныхъ веществъ, сущ?ствуетъ
максимальная плотность, которая съ повышеніемъ температуры
уменьшается до изв?стнаго минимума. Къ такимъ веще-
ствамъ относятся, между прочимъ, вс? т? элементы, у
которыхъ наблюдается аллотропія (см. стр. 82); напр.,
с?ра, у которой плотность паровъ вблизи точки кип?нія
(около 500°) почти вчетверо ~ больіне, ч?мъ вблизи
1.000°, гд? устанавливается минимумъ,не изм?няющійся
до 1.700°.
Объясненіе такихъ пенормальиыхъ плотностей лезкитъ
въ изм?неніи молекулярнаго в?са частицы: если М—21),
то ясно, что съ изм?неніемъ D должно м?няться и М.
В?съ же молекулъ слагается изъ в?совъ атомовъ, вхо-
дящихъ въ нихъ. Сл?довательно, при изм?неніи моле-
кулярныхъ в?совъ изм?няется въ частицахъ количество
атомовъ: количество ихъ уменьшается, и частица
упрощается.
Количество атомовъ въ молекул? элемента опред?-
ляется при д?леніи молекулярнаго в?са на атомный в?съ
элемента. Напр., для с?ры около 500° D = 96, сл?д.,
M = 2D = 2X96 = 192; а 192:32 (ат. в?съ с?ры) = 6;
значить молекула с?ры около 500° состоитъ изъ 6 ато-
*) О молекулахъ, состоящихъ лишь изъ одного атома, см. стр. 82,
- 92 —
мовъ; а около 1.000° плотность паровъ с?ры равна 32;
сл?д., по M = 2D, М = 64, а 64 : 32 = 2, т.-е. частица
состоить изъ двухъ атомовъ.
Указанная ненормальность свойственна и сложнымъ
т?ламъ. Прост?йіпимъ прим?ромъ сложныхь т?лъ, им?-
ющихъ ненормальную (не отв?чающую теоретической)
плотность, может ь служить нашатырь (хлористый аммоній),
который легко получается соединеніемъ амміака и хло-
ристаго водорода (см. стр. 5). Плотность нашатыря была
найдена равной 1,01, тогда какъ, теоретически
вычисленная, она равна 1,849. На основаніи меньшей
плотности надо думать, что и частица нашатыря въ парахъ
становится иной. И д?йствительно, теперь доказано (см.
§ 98), что нашатырь въ газообразномъ состояніи
распадается въ значительной своей части на свои слагаемый—
амміакъ и хлористый водородъ. Всл?детвіе этого
разложения количество частицъ въ объем?, конечно,
удваивается, а также увеличивается и объемъ вдвое, такъ
какъ каждая частица нашатыря (NH4C1) при распаденіи
даетъ одну частицу хлористаго водорода (НС1) и одну
частицу амміака (NH3). Такъ какъ объемъ увеличивается
вдвое, то плотность и становится вдвое меньшей. Правда,
опытъ даетъ величину плотности не точно вдвое
меньшую, а н?сколько большую. Это объясняется т?мъ, что
разложеяіе происходитъ неполное: н?которое количество
частицъ нашатыря остается неразложеннымъ (обратимая
реакція). При охлажденіи паровъ нашатыря получившіяся
частицы амміака и хлористаго водорода вновь
соединяются и вновь получается нашатырь. Подобное разложе-
ніе частицъ называется диссоціаціеи1).
*) Зам?тимъ, что диссоцгацгя возможна не только для вещества
въ газообразномъ состояніи йодъ вліяніемъ изменяющейся
температуры, но и для вещества въ растворенномъ состояніи подъ вліяніемъ
различнаго разведенія (см. дал?е «Электролитическая диссоціація»,
§ 82).
— 93 —
Встр?чающіяся при опытахъ слишкомъ болыпія,
сравнительно съ теоретическими, плотности объясняются
уменыпеніемъ количества частидъ въ объем?, происхо-
дящемъ всл?дствіе соединенія двухъ или большаго числа
частицъ въ одну; при этомъ, конечно, уменьшается со-
отв?тственно и объемъ. Такое усложненіе частицъ*
называется полимеризаціей. )
§ 31. Кріоекопическій методъ. Для веществъ, не
могущихъ сравнительно легко превращаться въ паръ, но
легко растворимыхъ въ какомъ-нибудь растворител?, су-
ществуетъ другой способъ опред?ленія в?са молекулы,
называемый кріоскопическимъ, который состоитъ въ сл?-
дующемъ. Изв?стно, что каждая жидкость характеризуется
опред?ленными температурами замерзанія и кип?нія.
Если же въ этой жидкости растворить какое-нибудь
вещество, химически невзаимод?йствующее съ раствори-
телемъ, то упругость пара раствора, всл?дствіе притя-
женія молекулъ растворителя частицами раствореннаго
вещества, будетъ ниже упругости пара самого
растворителя, а потому температура замерзанія раствора
понизится, а температура кип?нія его повысится х). Величина
этого поииженгя (депрессія) и повышенгя въ разведен-
ныхъ растворахъ для одного и того же т?ла пропор-
цгональна концентраціи .раствора, а для различныхъ
т?лъ при одной и той же концентраціи въ одномъ и
шомъ оке растворител? обратно пропорціональна мо-
лепулярнымъ в?самъ этихъ т?лъ. Сл?довательно, изм?-
ненія температуръ замерзанія и кип?нія зависятъ отъ
числа химическихъ частицъ вещества въ единиц? в?са
растворителя, а не отъ природы вещества. Такъ, если
въ 1 килограмм? воды растворить граммъ-молекулу
сахара (С12Н22011 = 342 гр.), или граммъ-молекулу спирта
*) Кип?ніе жидкостей возможно лишь тогда, когда упругость пара
ихъ буд?тъ въ состояніи преодол?ть давл?ні? воздуха, Зам?рзаніе
раствора мож?тъ совершиться лишь тогда; когда упругость его пара
будетъ равна упругости пара твердаго растворителя.
— 94 -
(С2Н60 = 46 гр.), или граммъ-молекулу другого какого
вещества, то везд? пониженіе температуры замерзанія
раствора будетъ равно — 1,8°; при раствореніи двухъ
граммъ-мол^кулъ оно будетъ равно 3,6° 1).
Одред?ленія величинъ пониженія температуры
замерзанія и повышенія температуры кип?нія, произведенныя
при разныхъ концентраціяхъ для разныхъ т?лъ, можно,
на основаніи первой половины правила, привести къ
какой-нибудь одной концентрации, напр., къ 1%-й (1 гр.
вещества въ 100 гр. растворителя). Тогда произведете
этой депрессіи (Е) на молекулярный вЬсъ (М) для одного
и того же растворителя будетъ величина (А) постоянная,
А
то-есть МЕ = А, откуда М=тт- Величину А находятъ
опытнымъ путемъ, опред?ляя Е для т?лъ съ изв?стнымъ
уже молекулярнымъ візсомъ. Для воды молекулярное
пониженіе = 18,6, для бензола = 50, для уксусной
кислоты = 38,6 и т. д., молекулярное повышеніе для воды =
= 5,2, для уксусной кислоты = 25,3.
Молекулярнымъ пониженіемъ или повышеніемъ
называюсь произведенія изъ пониженія (или повышенія)
температуры замерзанія (или кипЬнія), произведеннаго
однимъ граммомъ вещества, растворенпаго въ 100 грам-
махъ растворителя, на молекулярный в?съ растворен-
наго т?ла.
Правило депрессіи можно окончательно формулировать
такъ:
Молекулярное пониженіе (или повышеніе)
температуры замерзанія (или кип?нія) раствора одинаково
!) Зам?тимъ, что указанное пониженіе покажутъ лишь т?
вещества, которыя не разлагаются гальваническимъ токомъ; вс? ж? раз-
лагаемыя токомъ вещества дадутъ большее понижете, напр., граммъ-
молекула NaCl дастъ двойное пониженіе, т.-?.—3,6. Объясненіе этого
факта дежитъ на диссоціащи посл?днихъ в?щ?ствъ при раствореніи
(см. дал?? § 82).
— 95 —
для вс?хь т?лъ, растворенныхъ въ одиомъ и томъ же
количеств? даннаго растворителя а).
Для произвольныхъ конд?нтрацій в?съ молекулы
определяется по сл?дующей формул?:
М-А ё-100 ,
М-А (t--t').G
гд? А — молекулярное повышение (или пониженіе) для
даннаго растворителя, g — в?съ въ граммахъ растворен-
наго вещества, t — температура замерзанія растворителя
(или температура кип?нія раствора), tr—температура
замерзанія раствора (или температура кип?нія
растворителя), G—в?съ въ граммахъ растворителя 2).
На рис. 13 изображенъ приборъ Бекмана, въ кото-
ромъ удобно опред?лить пониженіе температуры
замерзанія раствора. Приборъ состоитъ изъ пробирки А съ
!) Это же правило иногда формулируюсь такъ:
эквимолекулярные растворы, т.-е. такіе^ въ которыхъ содержатся в?еовыя
количества растворенныхг веществг, пропорціЬнальныя ихъ частич-
нымъ вуьсамъ, замерзаютъ при одинаковой температургъ. Исклю-
чені? изъ этого правила представляютъ электролиты, т.-?. вещества,
проводящія электрически! токъ: это, главнымъ образомъ, сильныя
кислоты, сильныя основанія и соли (см. главу о вод?); въ водныхъ
растворахъ они диссоціируютъ.
2) Эта формула можетъ быть выведена сл?дующимъ образомъ:
пусть N частицъ вещества растворены въ G граммахъ растворителя;
въ 1 гр. растворителя ихъ будетъ —, а въ 100 гр. растворителя (кон-
. , N.100 л . ,. .,, А N.100
ц?нтращя) = —^—. Отсюда депр?ссія (t — t') = А . —~— ... (1).
Въ нашемъ случа?, когда взято g граммовъ вещества, число частицъ
(У
(N) въ нихъ выразится черезъ ^ . Вставляя это значеніе N въ 1-е
уравненіе, им?емъ:
c-o-^biS «•
Опр?д?ляя изъ 2-го уравненія М, получаемъ:
— 96 —
боковымъ тубусомъ А';
пробирка А вставлена
въ другую бол?е
широкую пробирку В,
служащую муфтой для первой;
весь этоть приборчикъ
вставляется въ нійрокій
стаканъ С, служащій хо-
лодильникомъ; въ него
пом?щаютъ или воду,
или воду со льдомъ, или
снЬгъ съ солью, или др.
охладительныя см?си.
Температура въ стака-
н? С должна быть на
2° — 3° ниже
температуры замерзанія
растворителя. Въ пробирк? А
отв?шивають (съ
точностью до 0,01 гр.) около
15 гр. чистаго
растворителя и вставляюіъ
въ нее на лробк?
чувствительный термометръ
(обыкновенно съ
произвольною шкалой, раз-
д?ленной на 0,01°) и м?-
шалку; пробирку А вста-
Рис. 13. Приборъ Вешана для шіре- вляютъ на пробкЬ вь
д?ленія понижешя точки замерзанія. муфту В И ОпускаЮТЪ
въ стаканъ С; при по-
стоянномъ пом?шиваніи наблюдаютъ моментъ появленія
кристалловъ растворителя. Обыкновенно вначал?
растворитель переохлаждается, почему съ появленіемъ
кристалловъ температура быстро повышается и, наконедъ,
— 97 —
устанавливается; это и есть температура замерзанія
растворителя.
Не разбирая прибора, а лишь оттаявъ растворитель,
вводятъ чрезъ тубусъ А' въ пробирку А точно отв?шен-
ное количество (отъ 0,03 до 0,1 гр.) испытуемаго
вещества; когда оно растворится, растворъ при пом?шиваніи
замораживаютъ и наблюдаютъ, по вышесказанному,
температуру замерзанія. Посл?днее число градусовъ вычи-
таютъ изъ перваго и узнаютъ наблюденное пониженіе, а
зат?мъ вычисляютъ молекулярный в?съ по
вышеприведенной формул?.
Опытъ обыкновенно повторяютъ, прибавляя къ
раствору еще новое количество вещества, сл?довательно,
увеличивая концентраций. Надо зам?тить, что опыты эти
ведутся со слабыми растворами, т.-е. въ сред?, гд?
частицы раствореннаго вещества разс?яны въ большой
масс? частицъ растворителя (см. § 82).
§ 32. Методы опред?ленія атомныхъ в?совъ
элементовъ. Подъ „атомнымъ в?сомъ" элемента (или
атомомъ), какъ выше было указано, разум?ется то
наименьшее (оно и будетъ нед?лимымъ) количество его,
которое встр?чается въ частицахъ химическихъ соединеній.
Опред?леніе абсолютныхъ величинъ этихъ наименыпихъ
количествъ невозможно; возможно опред?леніе лишь
относительное, т.-е. относительно какой - либо условной
единицы. Въ качеств? посл?дней, какъ сказано въ
прим?чаніи къ § 26-му, сначала избранъ былъ атомъ
водорода, какъ самаго легкаго изъ элементовъ; въ
настоящее же время принимается за основную единицу
атомъ кислорода, равный 16, а по отношенію къ по-
сл?дн?му атомъ водорода выразится величиной 1,008,
т.-е. величиной, очень близкой къ единиц?. Принци-
піально атомъ водорода и остается условной единицей
сравненія, но при точныхъ вычисленіяхъ равной не 1,
а 1,008. Опред?лить, во сколько разъ большая масса
какого-нибудь элемента, ч?мъ одна в?совая часть водо-
7
Неорганическая химія. <
- 98 —
рода, является наименьшей въ частицахь Хймичесішхъ
соединена, и, значить, опред?лить атомный вЬсъ (или
атомную массу) элемента.
Длярпред?ленія этой наименьшей (атомной) массы
элемента надо проанализировать вс? соединены его и
въ каждой частиц? (граммъ-молекул?) посл?днихг
опред?лить эту массу (граммъ-атомг), зная, что
она можешь встр?титъся или какъ таковая (граммъ-
атомг), или по закону кратныхг отногиеній, въ ц?ъ-
лое число разъ большая, Вотъ прим?ры такихъ
вычислений.
Пусть требуется опред?лить атомный в?съ кислорода.
Возьмемъ для анализа лишь н?сколько *) его соединеній,
а именно: воду (Н20), углекислый газъ (С02), сЬрный анги-
дридъ (S03), спиртъ (С2Н60), уксусную кислоту (С2Н402);
вычислимъ въ нихъ количество кислорода. Для этого опы-
гомъ сначала опред?лимъ, вь какихъ в?совыхъ отноше-
шяхъ соединяются между собою элементы для образованія
каждаго взятаго т?ла.
Въ составъ воды, какъ показываетъ опытъ, входятъ
водородъ и кислородъ и всегда въ такомъ отношеніи: на
1 в?совую часть водорода—8 2) в?совыхъ частей
кислорода. Чтобы узнать, каковы эти части по в?су въ частиц?
воды, надо опред?лить в?съ посл?дней: плотность воды
по водороду равна 9, сл?довательно, в?съ частицы воды
(M=2d) равенъ 18.
Теперь сл?дуетъ перевести на какія - нибудь м?ры,
наприм?ръ, на граммы, и разсуждать такъ: если бы, д?й-
ствительно, 1 гр. водорода соединялся съ 8 гр. кислорода,
то частица воды в?сила бы 9, а она вЬситъ 18;
сл?довательно, водородъ и кислородъ входятъ въ болыпемъ
*) Прі?мъ вычисленія, прим?ненный зд?сь, конечно, прим?нимъ
ко вс?мъ другимъ соединеніямъ.
2) Во вс?хъ ирим?рныхъ вычисленіяхъ, какъ зд?сь, такъ и дал?е
цифры будутъ браться округленный
— 99 —
количеств?; чтобы р?шить, въ какомъ же именно, надо
составить дв? пропорціи: 1) относительно водорода:
9: 1 = 18:,г,
для 9 требуется 1
а •}•) 1 о j5 х
откуда х = 2;
2) относительно кислорода:
для 9 — 8 1
, 18-У}9:8=18:У>
откуда у =16. Сл?довательно, въ частицу воды
кислорода входить 16.
Разберемъ составь углекислаго газа, состоящаго изо,
углерода и кислорода: опытъ указываетъ, что в?совыя
отношенія ихъ выражаются числами 3 : 8; плотность
углекислаго газа по водороду = 22; сл?довательно, в?съ
частицы =44; составляемъ пропорціи:
1) на 11 ч. требуется 8 ч. кислорода!
44 х М1:8 = 44:я?,
я ^" я я я » J
откуда х = 33;
2) на 11 ч. требуется 3 ч. углерода
я 44 „ „ і/
11:3=44:$/,
откуда 2/ = 12.
Подобнымъ же образомъ легко вычислить, что въ
частиц? с?рнаго ангидрида кислорода—48, спирта— 16,
уксусной кислоты — 32. Однимъ словомъ, какія бы
кислородныя соединенія ни брали, кислорода всегда въ
частиц? будетъ или 16, или масса, кратная 16, и ни
въ одномъ изъ соединеній не встретится кислорода
мен?е 16.
Сл?довательно, факты подтверждаютъ, что самое
малое количество кислорода, входящее въ частицу
соединеній (а это и есть атомъ) в?ситъ въ 16 разъ больше
атома водорода, принятого за единицу. Это и есть обычный
7*
100 —
фактич?скій путь для опред?ленія атомныхъ в?совъ
элементовъ х).
Итакъ, в?съ атома даннаго простого ттьла равепъ
в?су {отнесенному къ в?су атома водорода, условно
принятому за 1 или точтье за 1,008) того нагтенъ-
шаго количества этого т?ло^ которое находится въ
частицахъ его соединены,
§ 33. Законъ Дюлонга и Пти. Для трудно летучихъ
элементовъ, каковы, напрюі?ръ, серебро, м?дь и др.,
атомный в?съ можетъ быть найденъ при опред?леніи
частичнаго в?са ихъ летучихъ соединеній съ элементами,
атомный в?съ которыхъ уже изв?стенъ.
Влрочемъ, для такихъ элементовъ прим?нимъ еще
сл?дующій бол?е простой методъ, основанный на закои?
теплоемкостей 2) элементовъ.
Дюлонгъ (Dulong) и Пти (Petit), изсл?дуя теплоемкости
т?лъ въ твердомъ состояніи, нашли, что въ ряду
элементовъ он? совершенно правильно уменьшаются съ
увёличеніемъ атомныхъ в?совъ, и формулировали это въ
сл?дующемъ закон?: теплоемкости простыхь т?лъ
обратно пропорціоиальны ихъ атомнымъ в?самъ, или,
что то же, произведете теплоемкости на атомный
в?съ есть величина почти постоянная', она колеблется
у большинства элементовъ (см. таблицу) въ пред?лахъ
5,8—6,8 ,,и въ среднемъ, сл?довательно, равна 6Д3).
х) Надъ опред?л?ні?мъ атомныхъ в?совъ элементовъ особенно
много работали вначал? Берцеліусъ, а поздн?? Стасъ; опыты лосл?д-
няго являются выдающимися по ихъ тщательной постааовк?.
2) Теплоемкостью называется количество теплоты, потребное для
повышенія температуры единицы массы (1 грамма) вещества на 1° Ц.
Теплоемкость воды принимается за единицу.
3) У углерода, бора я бериллія теплоемкость значительно
отклоняется отъ 6,3; она н?сколько меньше нормы и у с?ры, фосфора,
кр?мнія, алюминія и германія. При высокихъ темлературахъ эти откло-
ненія бол?? или м?н?? сглаживаются. Вообще надо зам?тить, что
теплоемкость есть величина сложная, содержащая не только прира-
щ?ніе эн?ргіи вещества съ п?рем?ною его температуры, но также
— 101 —
Элементъ.
<У
ф
эй .
§^
и
о о
"'я у
а
g S
Прим?чанія.
Водородъ . .
Литій ....
Бериллій . .
Боръ . . . .
Угле- (Аморф-
I ный .
родъ. ^Алмазъ.
Азотъ
Натрій .
Магній .
Алюминій
Кремній .
Фосфоръ
С?ра .
Калій .
Кальціи
Скандій
Хромъ
Марганецъ
Жел?зо .
Кобальтъ
Никкель
М?дь .
Цинкъ
ГалдіЯ
4 Г?рманій
6
0,941
0,408
0,254
0,174
0Д43
0,43
0,293
0,250
0,214
0,165
0Д89
_0,178
0,166
ОД 70
ОД 53
0,121
0,122
0,114
0,107
0,108
0,095
0,094
0,079
0,077
1,01
7,03
ЭД
11
12,00
31,0
32,06
39,15
40,0
44,1
52,1
55,0
56,0
59,0
58,7
63,6
65,4
70
72
6
6,6
3,7
2,8
2Д
1,7
14,0
23,05
24,36
27,1
28,4
6
6,7
6,1
5,8
4,6
5,9
5,7
6,0
6,8
6,7
6,3
6,7
6,4
6,3
6,4
6,0
6Д
5,5
5,6
въ жидкомъ состоянии
при 2570 уд?льная
теплота = 0,58, поэтому
произведете = 5,2.
аморфный — при 4000.
уд?льная теплота = 0,58.
произведете = 6,4.
выше 9000 уд. теплота —
= 0,459, произведете,
сл?д. = 5,5.
въ жидкомъ состояніи.
Кристаллическій; выше
2000 уд. теплота = 0,204;
произведете = 5,8.
желтый; уд. теплота крас-
наго=0,1698,произвед.=
= 5,24.
ромбическая
- 102 —
Эл?ментъ.
_у
Мышьякъ . .
Селенъ . . .
Бромъ . .
Цирконій . .
Молибденъ
Рутетй . . .
Родій , . . .
Падладій .
Серебро . .
Кадмій . . .
Индій ....
Олово . . .
Сурьма . . .
Т?ллуръ . .
іодъ ....
Лантанъ . .
Церій ....
Вольфрамъ .
Осмій ....
Иридій . . .
Платина . .
Золото . . .
Ртуть ....
Таллій . . .
Свкнецъ . .
Висмутъ . .
Торій ....
Уранъ. . . .
Теплоемкость.
0,082
0,080
0,084
0,066
0,072
0,061
0,058
0,059
0,057
0,054
0,057
0,054
0,051
0,047
0,054
0,045
0,045
0,033
0,031
0,032
0,032
0,032
0,032
0,033
0,031
0,030
0,027
0,027
Атомный
в?съ А.
75
79
79,96
90,7
96,0
101,7
103,0
106
107,93
112,4
114
118,5
120
127
126,85
138,0
140
184
191
193,0
194,8
197,2
200,3
204,1
206,9
208,5
232,5
239,5
Произведете
AXQ.
6,9
6,3
6,7
6,0
6,9
6,3
6,0
6,3
6,1
6,0
6,5
6,5
6,1
6,0
6,8
6,2
6,3
6,1
5,9
6,1
6,2
6,3
6,4
6,7
6,4
6,2
6,2
6,5
Прим?чанія.
кристаллическш
тоже
твердый
твердая
- 103 -
Приведенный наблюденія Дюлонга и Пти, сл?дова-
¦іельно, указываютъ, что если будутъ взяты атомныя
количества простыхъ т?лъ, то для приведенія ихъ въ
определенное тепловое состояніе нужно употребить
одинаковую работу, или, что то же, массы элементовъ, пропор-
ціональныя атомнымъ в?самъ, то-есть содержания одно
и то же количество атомовъ, при одинаковыхъ условіяхъ
должны им?ть, и д?йствительно им?ютъ, почти одну и
ту же теплоемкость; короче, теплоемкость атомовъ вс?хъ
простыхъ т?лъ почти одна и та же, или: равныя
количества теплоты способны поднять температуру атомныхъ
в?совъ вс?хъ олементовъ на одно и то же число
граду совъ.
Сл?довательно, въ общей формул? лютъ законъ
выразится такъ;
а отсюда легко определяется А — атомный в?съ:
л _ '*'
Q
Такимъ образомъ, опр?д?ляя изъ опыта теплоемкость
элемента и разд?ляя на нее указанное число 6,3, полу-
чаютъ очень близкую къ истинной величину в?са атома
изсл?дуемаго т?ла; окончательная же установка этой ве-
вн?шнюю работу расширенія и внутреннюю работу, совершающуюся
между атомами въ частицахъ, а потому въ величин? теплоемкости и
нельзя ожидать простоты отношенія къ составу. Не надо забывать,
что теплоемкость аависитъ отъ плотности, температуры и состоянія
т?ла: 1) все, что увеличиваете плотность твердаго или жидкаго т?да
уменьшаешь его теплоемкость; 2) съ повышеніемъ температуры тепло- '
емкость возрастаетъ (въ пред?лахъ 0Q— 100<> изм?нені? теплоемкости
очень незначительно); 3) газы имвютъ наибольшую теплоемкость, въ
частности—водородъ изъ вс?хъ изв?стныхъ т?лъ природы обладаете
наибольшею теплоемкостью—почти въ 3*/2 раза большею, ч?мъ
теплоемкость воды, которая, въ свою очередь, какъ изв?стно, им?етъ
самую большую теплоемкость среди жидкихъ и твердыхъ т?лъ.
%
— 104 —
личины можетъ быть произведена при изученіи в?сового
состава соединеній этого т?ла съ другими элементами,
какъ это было выяснено выше. )
§ 34. Количественное знаЗеніе химичеекихъ зна-
ковъ. Такъ какъ им?ется полная возможность знать
в?съ (хотя бы и относительный) атомовъ и частицъ, то
и самые химическіе знаки получили не только
качественное, но и количественное значеніе. А именно,
начальными буквами латинскихъ названій элементовъ условились
обозначать массы, отв?чающія массамъ ихъ атомовъ
(граммъ-атомы); такъ, О обозначаетъ не только кисло-
родъ, но именно массу атома (граммъ-атомъ) кислорода,
которая по в?су въ 16 разъ больше, нежели масса атома
водорода, а Н, сл?довательно, обозначаетъ массу атома
(граммъ-атомъ) водорода, условно принятую за единицу
изм?ренія атомныхъ в?совъ.
Въ сложныхъ т?лахъ формула обозначаетъ массу
частицы т?ла, которая по в?су равна сумм? в?совъ
атомовъ, въ нее входящихъ (граммъ-молекула).
Прим?ры формулъ сложныхъ т?лъ:
Частица—граммъ-молекула. В?съ.
Формула воды . . . Н20(Н2 = 2, 0=16) = 18
„ хлористаго
водорода .... НС1(Н = 1, С1 = 35,5) = 36,5
Формула поваренной
соли NaCl(Na = 23, CI = 35,5)= 58,5
Формулауглекислаго
газа С02(С=12, 02 = 2Х16)= 44
Формула болотнаго
газа СН4(С=12, Н4 = 4) = 16
Формула спирта . . С2НеО(С2= 12 X 2 = 24, Н6 =
= 6, 0=16)= 46
„
обыкновенная сахара . . . С12НмОп(С12=12Х 12,Наа =
= 22)0П = 16Х П)= 342.
— 105 —
В?са частицъ получены сложеиіемъ в?совъ атомовъ,
составляющихъ ихъ.
Такъ какъ химическіе знаки выражаютъ опред?лен-
ныя в?совыя количества, то очень легко отъ в?ьса
частицы перейти къ опред?ленію процентнаго
содержанья составныхъ частей ея. Возьмемъ прим?ръ: частица
воды — Н20(18) составлена изъ Н2(2) и 0(16); разсужда-
емъ дал?е такъ: если въ 18 в?с. частяхъ воды водорода
содержится 2 в?сов. части, то въ 100 в?сов. частяхъ
ихъ—х, откуда (18 : 100 = 2 :х) х — 11,11 °/0 водорода;
для кислорода пропорція будетъ такова: 18 : 100 — 16 : у,
откуда 2/ = 88,89%.
Выведемъ еще %-й составъ для виннаго спирта С2Н60
съ частичнымъ в?сомъ 46:
a) для углерода: 46 : 100 = 24 : ж; я? = 52,18°/0С-
b) для водорода: 46:100= 6:у, г/ = 13,04%Н.
c) для кислорода: 46 : 100= 16 :*; #=34,78%0.
Итакъ, зная формулу вещества, легко вычислить %-е
содержаніе составныхъ частей его.
Покажемъ теперь обратный переходъ—отъ процент-
наго состава къ формул? соединенгя.
При анализ? химическихъ соединеній получаютъ дан-
ныя, изъ которыхъ легко вычисляется %-е содержаніе
составныхъ частей; а опред?ляя плотность пара
вещества, легко по формул? (M=2d) вычислить в?съ
частицы; этихъ данныхъ вполн? достаточно для вывода
формулы.
{ Пусть произведенъ анализъ спирта и получены въ
% сл?дующія числа:
С = 52,18%
Н= 13,04%
0 = 34,78%;
плотность пара спирта по водороду равна 23; сл?дова-
тельно, в?съ частицы спирта равенъ 46. Дал?е, если
— 106 —
въ 100 в?сов. частяхъ спирта содержится 52Д8 частей
углерода, то въ 46=#, откуда 46:100=д?:52,18; #=24;
то же самое им?емъ: для водорода 46 :100 —у : 13,04,
откуда 2/ = 6^h для кислорода: 46:100 = ^:34,78, откуда
#=16; х-\-у -\-2 = 24 -}-6 -)-16 = 46; сл?довательно,
вычисленіе сд?лано в?рно. Чтобы узнать, сколько же
атомовъ каждаго элемента въ частиц? спирта, надо
указанный в?совыя части разд?лить на соотв?тственные
атомные в?са: J
углерода =24 : 12 = 2 \
водорода = 6 : 1 = 6/ сл?довательно, формула спирта
кислорода =16:16 = 1 ) С2Н60.
Для воды анализъ даетъ: водорода = 11,1 і%> кисло-
рода^ВвЗЭ, d=9; сл?довательно, М=18; вычисляя:
а) 18:100=^:11,11 и 18:100=^:88,89, им?емъ а?=2,
у = 16; д?ля на атомные в?са (2:1 = 2 и 16 : 16= 1),
получаемъ формулу воды — Н20.
Г Зная молекулярный в?съ вещества, легко вычислить
??съ 1 литра его въ состояніи газа: такъ какъ M = 2D,
ТЧ М 4 1
откуда D = -o-, и такъ какъ в?съ 1 литра водорода
при 00 и 760 мм. давленія в?ситъ 0,08987, то в?съ
1 литра газа = ^-Х 0,08987. *
Химическія уравненія выражають также не только
качественную, но и количественную сторону; такъ,
Н2-)-0 = Н20 сл?дуетъ читать, что 2 в?совыхъ частя
(напр., 2 гр.) водорода, соединяясь съ 16 в?с. частями '
(16 гр.) кислорода, даютъ 18 в?с. частей (18 гр.) воды;
или CuS04-f-Fe==FeS04-fCii значитъ: 56 в?с. частей
жед?за (напр., 56 гр.) выт?сняютъ изъ 159 в?с. частей
(159 гр.) м?днаго купороса 63 в?с. части (63 гр.) м?ди
и т. д. Отсюда ясно, что изъ химпческихъ уравненій
всегда можно разсчитать одну и ту же реакдію и на
- 107 -
другія количества, наприм?ръ: если 56 гр. жел?за вы-
т?сняютъ 63 гр. м?ди, то 100 гр. жел?за выт?сняють
х гр. м?ди, откуда #=112,5 гр.
Иногда въ реакдіи принимаешь участіе не одна
частица вещества, а дв? и бол?е: это обозначаготъ боль-
шою цифрой, поставленною передъ частицей; наприм?ръ,
полученіе хлористаго водорода выразится такъ:
2NaCl -f H2SO± = Na^SO^ -f 2HCI
2 X 58,5 -f 98 =142 + 2 X 36,5.
Итакъ, благодаря атомистическому ученію,
положенному въ основу химическихъ представлены, химія обла-
даетъ прекрасною системой условныхъ знаковъ; каждая
формула, каждое уравненіе при краткости и наглядности
своей вполн? выражаютъ и качественную и
количественную стороны реакцій. Сл?дуетъ прибавить къ этому,
что такая система знаковъ принята вс?ми народами и,
сл?довательно, подобно цифрами, является языкомъ обще-
челов?ческймъ и т?мь упрощаетъ международное
научное общеніе.
Можно было бы, пожалуй, сд?лать этому языку одинъ
существенный упр?къ, а именно, что онъ ничего не
говорить о превращеніи энергіи при реакціяхъ; но упрекъ
этотъ относится не\ къ нему, а къ атомистическому
ученію, вызвавшему его и ничего не сказавшему
относительно этой стороны реакцій. Посл?дняя, какъ выше
было сказано, и до сихъ поръ является еще
сравнительно мало разработанною.
§ 35. Валентность (атомность) эленентовъ. Типы
формъ соединеній. Атомъ каждаго элемента можетъ
соединяться съ -атомами другихъ элементовъ, но далеко
не во всякихъ количественныхъ отношеніяхъ, и факты
указываютъ, что зд?сь существуютъ довольно узкі? пре-
д?лы. Вотъ н?сколько прим?ровъ:
— 108 —
1 атомъ хлора можетъ соед. только съ 1 атомомъ водорода
1 „ кислорода „ „ ,. „ 2 атомами „
1 „ азота „ „ „ „ 3 „ „
і „ углерода „ ., „ 4 „
Подобное же различіе въ способности удерживать при
себ? неодинаковое количество другихъ атомовъ
наблюдается во всемъ ряду элементовъ. Но формъ различныгь
комбинацій оказывается очень немного; такъ, по отноше-
нію къ водороду, вс? типичный комбинацій и
ограничиваются вышеуказанными формами, то-есть:
RHj ИН2ч RH3, RH4)
(R зд?сь обозначаетъ атомъ элемента, соединяющагося
съ водородомъ.)
Наибол?е разнообразными являются комбинацій эле-
ментовъ съ кислородомъ, но и он? исчерпываются сл?-
дующими главными восемью формами:
R20, R202 (или RO), R203, R204 (или R02), R20B. R206
(или R03), R207 и R208 (или R04).
Способность атома элемента присоединять къ
себ? то или иное количество атомовъ другихъ элемен-
товъ называется валентностью или атомностью.
Свойство валентность по своей сущности остается
пока еще неизвЬстнымъ *). Валентность является свой-
*) Въ посл?днее время усиленно развивается такъ называемая
электронная теорія, по которой атомъ представляется слозкеннымъ
изъ опред?л?ннаго количества быстро движущихся электроновъ или,
что то же, атомовъ электричества подожительныхъ и отрицательных*;
масса отрицательна™ электрона равна Vi70o Дол? массы атома водорода,
а масса положительна™ электрона почти равняется масс? атома
водорода. Ч?мъ больше атомный в?съ элемента, т?мъ въ его атом? больше
электроновъ. По этой теоріи силы, свяэывающія электроны въ атомы,
а равно и атомы въ частицы суть электрич?скія силы положительныхъ
— 109
ствомъ м?няющимся, во-первыхъ, въ зависимости отъ
природы присоединяющаяся элемента, а во-вторыхъ, и
по отношенію къ одному и тому же элементу—отъ т?хъ
условій, при которыхъ происходить взаимод?йствіе; на-
прим?ръ, въ ран?е упомянутыхъ прим?рахъ азотъ мо-
жетъ съ кислородомъ образовать, по закону кратныхъ
отногаеній, сл?дующія комбинаціи: N205, N204, N203>
N202 и N20; по отношенію къ хлору, наприм?ръ, фос-
форъ образуете или РС15 или РС13 и т. д. Впрочемъ,
разнообразіе комбинаціи, вызываемыхъ валентностью,
какъ упомянуто выше, очень невелико: до сихъ поръ
преимущественно изв?стны комбинаціи, образующаяся
или по типу водородистыхъ соединеній, т.-е., главпымъ
образомъ, въ пред?лахъ RH —RH4, или по типу кисло-
родныхъ, т.-е. въ пред?лахъ R20 — К04. J
Для показанія м?ры валентности элемента избрана
единица сравненія, и именно опять атомъ водорода;
атомъ водорода принимается одноатомнымъ, потому что
н?изв?стно такого элемента, котораго потребовалось бы
бол?е одного атома для зам?щенія одного атома
водорода или для соединенія съ нимъ. Сколько атомовъ
водорода можетъ присоединить къ себ? или зам?стить со-
и отрицатедьныхъ электроновъ. Въ центр? атома находится комплексъ
положительныхъ электроновъ, а на вн?шнихъ концентрическихъ поверх-
ностяхъ этого комплекса располагаются отрицательные электроны.
Система атома — эд?ктр о нейтральна: количество подожительныхъ
электроновъ уравнов?шивается количествомъ отрицатедьныхъ
электроновъ. Атомы могутъ иди терять (металлы) отрицательные
электроны и д?латься посл? этого электроположительными, или пріобр?-
тать (металлоиды) добавочные отрицательные электроны и д?даться
всл?дстві? этого электроотрицательными. Противоположно заряжен-
ныя массы будутъ соединяться между собою, при чемъ эти
вступающая между собою въ соединені? массы должны им?ть одинаковое
количество противоположныхъ зарядовъ. Съ точки зр?нія
электронной теоріи валентность, какъ видно изъ предыдущаго, определяется
количествомъ потерянныхъ или пргобргьтенныхъ атомомъ
электроновъ.
- ПО -
бою атомъ элемента, столько валентпымъ онъ и
называется; такъ, относительно водорода, наприм?ръ, С1—
одновалентенъ (НС1), кислородъ — двухвалентенъ (Н20),
азотъ—трехвалентенъ (H3N) и углеродъ — четырехвален-
тенъ (СН4)'. Если элемента съ водородомъ не соединяется,
то его валентность изм?ряготъ количествомъ
присоединяющихся атомовъ другихъ элементовъ, валентность кото-
рыхъ изв?стна. Итакъ, валентность среди элементовъ
можетъ м?няться въ вр?д?лахъ 1—8.
( Хотя валентность для одного и того же элемента не-
р?дко быва?тъ величиной перем?нной, но оказывается,
лишь въ изв?стныхъ пред?лахъ: для каждаго элемента
всегда существу?тъ изв?стный maximum валентности,
опред?ляющій различный комбинаціи этого элемента съ
другими. По этому maximum'y валентности вс? элементы
и могутъ быть разд?лены на 8 группы одновалентные,
двухвалентные, трехвалентные и т. д. |
Валентность обусловливаетъ не только формы соеДи-
неній атомовъ, но она же управляетъ и реакціями обм?на
или зам?щенія одного элемента другимъ: только при
равномь количесте? валентностей можетъ
происходить обм?нъ* Такъ, въ частиц? воды—Н20 легко можно
зам?нить водородъ металломъ натріемъ; но зам?на эта
можетъ происходить только при сл?дующемъ условіи:
каждыя 23 в?совыя части натрія (23 ат. в?съ Na) изъ
каждыхъ 18 в?совыхъ частей воды выт?снятъ 1 в?совую
часть водорода (1—ат. в?съ Н), т.-е., другими словами,
каждый атомъ натрія межетъ выт?снить только одинъ
атомъ водорода: Н20 -(- Na = NaOH -j- Н, или Н20 +
-}-Na2 = Na20 -\~ Н2; атомъ же, наприм?ръ, кальція
(40 ві,с. ч.) выт?снитъ два атома водорода (2 в?с. части):
Н20-[-Са = СаО -\-Н2. Натрій, сл?довательно, элементъ
одновалентный, а кальцій—двухвалентный.
Количества элементовъ, могущія зам?нять другъ друга
въ соединеніяхъ, называются эквивалентными. Эквива-
иентомъ обыкновенно принято называть количество эле-
А. М. Бутлеров'і,
1828—1886.
— ИЗ —
мента, могущее соединяться съ 1 вісовою частью
водорода (или, что то же, съ 8 в?с. ч. кислорода) или за-
м?щать ее, потому эквивалент одновалентныхь эле-
ментовъ равенъ ихъ атомному в?су, а эквивалент**
многовалентныхъ элементовъ равенъ гьхъ атомному
в?су, д?ленному на валентность.
Валентность, обусловливая формы соединеній атомовъ,
этимъ самымъ р?зко вліяетъ и на свойства образующего
соединенія; факты, подтверждающее это, будутъ
приведены дал?е.
Валентность въ исторіи развитія ученій о веществ?
сыграла еще сл?дующую важную роль: она позволила
научной мысли проникнуть внутрь частицъ химическихъ
соединеній и узнать, вь какомъ отношеніи находятся въ
частицахъ атомы, позволила разсуждать, какъ говорятъ,
о строение частгщы.
Въ развитіи ученія о стро?ніи частицъ химическихъ
соединеній участвовали, главнымъ образомъ, англичанин ь
Куперъ, н?мецъ Кекуле и руссюй химикъ Бутлеровъ.
1J36. Краткія положенія теоріи строенія. Сь
точки зрйія валентности атомы въ частицахъ
представляются взаимод?йствующими своими валентностями, при
чемъ каждая отд?льная валентность одного атома можетъ
взаимод?йствовать лишь съ одной валентностью другого
атома (одна съ двумя или съ^тремя не можетъ"
взаимод?йствовать); этимъ взаимод?йствіемъ (сд?пленіемъ) атомы
и удерживаются въ частиц?, обусловливая ея ц?лостность,
какъ опред?леннаго индивидуума. Им?я въ виду
сказанное, возьмемъ, наприм?ръ, соединеніе, изв?стное иодъ
именемъ древеснаго или метиловаго спирта, формула
котораго СН40, и посмотримъ, въ какомъ отношеніи
находятся атомы въ частиц? этого соединенія. Углеродъ—
четырехвалентный элеменіъ, т.-е. максимальное
количество атомовъ одновалеитнаго элемента, которое онъ
можетъ присоединить къ себ?, равно 4 (существуешь, на-
нримЬръ, соединешо CHJ. Между т?мъ въ частиц Ь
Неорганическая хпчія. "
— 114 -
древеснаго спирта съ углероднымъ атомомъ соединены
4 атома водорода и 1 атомъ кислорода, т.-е. четыре
валентности углерода связываютъ четыре валентности
водорода и р?—кислорода, всего шесть валентностей. Для
объяснен^ этого противор?чія можно представить 3 атома
водорода непосредственно присоединенными къ атому
углерода, посл? чего у углерода остается еще одна
свободная валентность, которая должна удержать одинъ
атомъ кислорода и одинъ атомъ водорода, т.-е. всего
3 валентности. Это можетъ произойти только такимъ
образфмъ: кислородъ одною валентностью соединяется съ
углероднымъ атомомъ, а другою, остающеюся свободною,
валентностью дрисоединяетъ къ себ? четвертый атомъ
водорода. Другого соотношенія атомовъ въ частиц?,
чтобы соблюдалось при этомъ правило валентности,
придумать невозможно. Условились валентности элемента
(или, какъ иногда говорятъ, единицы сродства)
изображать черточками подобно тому, какъ силы въ механик?.
Н
I
Тогда формула соединенія CHt выразится такъ: Н — С — И,
Н
а древеснаго спирта сл?дующимъ образомъ:
Н
Н—С—О—Н
Н
Эта формула, такъ называемая формула сшроенгя,
установлена на основаніи сл?дующихъ главЕі?йшихъ
фактовъ:
1) Если под?йствовать на древесный спиртъ метал-
ломъ натріемъ, то будетъ выд?ляться водородъ. Будемъ
бросать натрій до т?хъ поръ, пока не прекратится вы-
д?леніе водорода, Если теперь проанализировать полу-
^ - 115 —
ченное вещество, то окажется, что его составь
выразится формулою CH3ONa. Реакд'ія изобразится сл?ду-
ющимъ уравненіемъ:
СН3ОН -f Na == CH3ONa -f H.
Въ погіученномъ веществ? атомъ натрія всталъ на
м?сто одного атома водорода, и сколько бы еще не
вводили натрія, дальн?йшаго зам?щенія водорода на натрій
не произойдете Это показываетъ, что одинъ изъ ато-
мовъ водорода, входящаго въ составъ древеснаго спирта,
ч?мъ-то отличается отъ остальныхъ 3-хъ. Изъ
приведенной формулы видно, что 1 атомъ водорода соеднненъ съ
атомомъ кислорода, тогда какъ остальные 3
присоединены непосредственно къ углероду.
2) Зат?мъ можно доказать въ древесномъ спирт?
присутствіе группы—ОН, такъ называемаго гидроксила,
или воднаго остатка. Под?йствуемъ на древесный спиртъ
соляной кислотой. Тогда получится соединеніе,
называемое хлористымъ метиломъ, въ к-оторомъ хлоръ зам?нилъ
гидроксильную группу:
СН3ОН 4- НС1 = СН8С1 + Н20.
Под?йствовавъ на хлористый метилъ избыткомъ воды,
можно вызвать обратную реакцію—выт?сненіе хлора гидро-
ксильной группой:-
СН3С1 + НОН = СН3ОН -f НС1.
Изъ приведеннаго прим?ра видно, что атомы въ ча-
стиц? химическаго соединенія д?йствительно находятся
въ опред?ленномъ соотношеніи и взаимно влгяютъ другъ
па друга: отъ различнаго соотношенія изм?няется такъ
или иначе и самый характеръ элемента въ частиц?
химическаго соединенія. Теорія строенія и даетъ
возможность, какъ сказано выше, уразум?ть соотношенія ато-
мовъ въ частиц?.
ь*
— 116 —
Въ последнее время т?орія етроенія, выражающая
только взаимныя отношенія между атомами, входящими
въ составь частицы, испытала дальн?йшее развитіе и
дала начало стереошміи, пытающейся опред?лить взаим-
ное полоошеніе атомо?ъ ?ъ пространств?.
Періодическій законъ.
§ 37. Элементы и т?ла природы. Подчиняясь
химической энергіи и въ зависимости отъ валентности,
а равно и отъ многихъ другихъ условій, различные
элементы соединяются другъ съ другомъ въ опред?ленныхъ
количествахъ, тратя на такое соединеніе различное въ
различныхъ случаяхъ количество присущей имъ энергіи,
и чрезъ это образуютъ вс? разнообразн?йшія по составу
и свойствамъ т?ла мертвой и живой природы.
Отсюда понятно, что вс? т?ла природы своими
свойствами вполн? должны быть обязаны свойствамъ обра-
зующихъ ихъ элементовъ. Чтобы понять жизнь природы,
протекающую между сложными т?лами, прежде всего
надо изучить элементы, слагающіе ихъ,—понять, ч?мъ
одни элементы отличны отъ другихъ, или въ чемъ одни
элементы сходны съ другими, вообще понять связь и,
различіе между самыми элементами. Вопросъ этотъ
сливается, очевидно, съ вопросомъ о классификации
элементовъ.
§ 38. Первая классификация элементовъ. Впервые
вс? элементы по сходству признаковъ были разд?лены
на дв? болынихъ группы: на металлы и неметаллы,
или металлоиды.
Начиная съ 1811 года, Берцеліусъ (Berzeliusj
достаточно точно опред?лилъ эти группы; съ н?которою
условностью это д?леніе принимается и теперь.
I. Металлы. Къ металламъ обыкновенно относятъ
вс? т? элементы, которые съ физической стороны
характеризуются непрозрачностью въ твердомъ и жидкомъ
— 117 -
воетоляілхъ, особеннымъ м?талздческямъ блвекомъ3 хв-
рош?ю тепло: и электропроводностью,
электроположительностью1), т.-е. свойствомъ, при выд?леніи изъ соеди-
неній токомъ, отлагаться на^ отрицательномъ полюс?; а
съ химической — т?мъ, что, во-п?рщлхъ, съ водородомъ
не даютъ прочныхъ летучихъ соединеній; во-вторыхъ, съ
кислородомъ вс? соединяются и даютъ окислы,
называемые основными; окислы, соединяясь съ водою, образу-
тотъ гидраты окисловъ основного характера (основангя),
т.-е. по свойствамъ противоположная каслотнымъ ги-
дратамъ, образуемыми неметаллами, или металлоидами,
Наприм?ръ, металлъ натрій (Na) им?етъ окиселъ Na20,
который, соединяясь съ водой, даетъ гидратъ: Na20-f-
+НяО = Na2H202 или = 2NaOH; металлъ кальцій (Са)
даетъ окиселъ СаО и гидратъ окисла Са(ОН)2 [СаО -{-
-|-Н20 = Са(ОН)2] и т. д. Характерн?йшимъ свойствомъ
основаній является ихъ способность соединяться съ
кислотами, а для большинства гидратовъ окисловъ ме-
талловъ еще характерно и то, что водородъ ихъ не мо-
жетъ зам?щаться на металлъ.
Изъ наибол?е распространенныхъ и изв?стныхъ эле"
ментовъ къ металламъ относятся сл?дующіе:
Натрій Na Марганецъ Мп
Калій К Кобальтъ Со
Кальцій ч Са Никкель Ш
Стронцій Sr Олово Sn
Барій Ва Свинецъ РЬ
Магній Mg М?дь Си
Цинкъ. Zn Серебро Ag
Алюминій А1 Золото Аи
Хромъ Сг Платина Pt
Жел?зо Fe Ртуть Hg
!) По электронной" т?оріи металлы характеризуются т?мъ, что
ихъ атомы способны терять то или иное количество отрицательных!»
электрояовъ.
— 118 —
II. Металлоиды. Къ металлоидамъ относятся вс?
т? элементы, которые вышеупомянутыхъ свойствъ не
им?готъ; они лишены_металлическаго блеска, теплоту и
электричество проводить^ плохо, они
электроотрицательны т)7 "химически они характеризуются способностью
легко давать съ водородомъ прочныя летучія соединенія;
съ кислородомъ вс? (кром? фтора) даютъ окислы, но
^уже кислотные (кислые), т.-е. которые, растворяясь въ
*вод?, сообщаютъ ей кислый вкусъ, потому что съ водою
образуютъ кислые гидраты, иначе называемые кислотами;
характерн?йшими свойствами кислотъ являются два: во-
первыхъ, ихъ способность соединяться съ основаніями,
и, во-вторыхъ, способность зам?щать свой водородг на
металлы съ образованіемъ солей; солью въ химіи и
называется всякое соединеніе, которое можно разсма-
тривать происшедшимъ изъ кислоты чрезъ зам?ну ея
водорода на металлъ. Возьмемъ прим?ръ: с?ра им?етъ
окиселъ S03, который, соединяясь съ водою, даетъ
гидратъ, изв?стный подъ именемъ с?рпой кислоты,
S03 + H20 = H2S04.
Чтобы вид?ть легкую зам?щаемость въ H2S04
водорода металломъ, стоитъ взять металлъ, наприм?ръ, же-
л?зо, и облить его с?рною кислотой: жел?зо быстро
покроется пузырьками газа, которые скоро будутъ выд?-
ляться изъ жидкости; при изсл?дованіи газъ этотъ
оказывается водородомъ, выт?сняемымъ жел?зомъ изъ
H2S04 по сл?дующему уравнение: Fe-f-H2S04 = FeS04-|-
-j-H2. Если выждать время, когда уже пузырьки больше
выд?ляться не будутъ, и изсл?довать жидкость, то въ
ней не будетъ больше H2S04, а вм?сто нея—соединеніе
(соль) FeS04, называемое жел?знымъ купоросомъ, и вода,
і) По электронной т?оріи металлоиды характеризуются т?мъ,что
ихъ атомы способны присоединять къ себ? то или иное количество
отрицательныхъ электроновъ.
— Ш —
которая была вм?ст? съ HgSO^,1) и въ которой <$?eS04
теперь растворено.
Къ металлоидамъ относятся сл?дующіе элементы:
Фторъ F Теллуръ Те
Хлоръ С1 Азотъ N
Бромъ Вг Фосфоръ Р
іодъ J Мышьякъ As
Кислородъ О Сурьма Sb
С?ра S Углеродъ С
Селенъ Se Кремній Si
Основные и кислотные гидраты, растворимые въ вод?,
обладаютъ способностью различно изм?нять дв?тъ н?ко-
торыхъ красящихъ веществъ. Особеннаго вниманія
заслуживаем въ этомъ случа? лакмусъ2) — синяя краска,
извлекаемая изъ лишаевъ; она даетъ сити насгоЁ съ
водой. Кислотные гидраты д?лаютъ синій настой лакмуса
краснымъ, а основные этотъ красный цв?тъ изм?няютъ
і) Чистую безводную с?рную кислоту при такихъ реакціяхъ
обыкновенно не берутъ.
2) Лакмусъ им??тся въ продаж? въ виде синихъ комковъ. Для
приготовл?нія лакмусовой настойки продажный лакмусъ измельчаютъ
въ тонкій порошокъ и н?сколько разъ промываютъ холодной водой,
чтобы отмыть легко растворимыя лрим?си. Промытый водою лакмусъ
для большей чистоты иногда еще промываютъ б?зводнымъ виннымъ
спиртомъ. Посл? такой очистки лакмусъ обливаютъ 6-ю частями воды,
нагр?ваютъ и оставляютъ стоять на н?сколько часовъ въ поко? въ
тепломъ м?ст?. Посл? этого фильтруютъ, и фильтратъ (т.-е. растворъ,
прошедшій чрезъ фильтръ") д?лятъ на дв? равныхъ части: въ одну изъ
нихъ осторожно, по каплямъ, прибавляюсь разведенной азотной
кислоты столько, чтобы жидкость стала'красной, и тогда эту часть лри-
ливаютъ къ другой части лакмусоваго раствора; см?сь принимаетъ
фіол?товый цв?тъ. Этотъ растворъ сохраняюсь въ склянкахъ, заткну-
тыхъ ватой. Приготовленный растворъ отъ кислотъ красн?етъ, а отъ
основаніЙ син?етъ. Для удобства часто прим?няютъ, вм?сто самого*
раствора, лакмусовую бумагу, которая готовится такъ; пропускнную
бумагу пропитываютъ лакмусовымъ настосмъ, или фіолетовымъ или
— 120 —
въ синій- Нейтральнымъ цв?томъ между синимъ и крас-
нымъ является фголетовый.
Существуютъ еще окислы промеоісуточпые (или
„амфотериые"), т.-е. такіе, которые могутъ реагировать
и съ основаніями и съ кислотами.
§ 39. Условность д?ленія элементовъ на металлы
и металлоиды. Д?лені? элементовъ на металлы и
металлоиды условно; оно не можетъ быть проведено строго:
среди элементовъ существуютъ такіе, въ которыхъ
наблюдается см?шеніе свойствъ металлическихъ и метал-
лоидныхъ, наприм?ръ, у олова, сурьмы и др.
/Д?лепіе это и слишкомъ ужъ широко. Скоро какъ
между металлоидами, такъ и между металлами усмотр?ны
были бол?е близкія соотноіпенія, и именно со стороны
чиселъ, выражающихъ атомные в?са элементовъ1).]
краснымъ, о лриготовленіи которыхъ было сказано выше, высуши-
ваютъ; такія бумажки вполн? аам?няютъ лакмусовый настой.
Иногда прим?няются бумажки ж?лтаго цв?та, окраш?нныя на-
стоемъ куркумоваго корня въ спирт?: он? отъ кислотъ не изм?-
няются, а отъ основашй бур?ютъ.
йзъ искусственные красокъ часто въ подобяыхъ случаяхъ
употребляется краска фенолфталеипъ: это—б?лыё порошокъ; его при-
м?няютъ обыкновенно раствореннымъ въ спирт?. Безцв?тныЙ спирто-
вый растворъ фенолфталеина отъ прибавления щелочей д?лается ма-
линовымъ, а отъ кислотъ малиновая окраска пропадаетъ, и растворъ
вновь д?лается безцв?тньшъ.
*) Въ первоначальной исторіи вопроса о систематик? элементовъ
немаловажную роль сыгралъ также изоморфизлъ— понятіе, введенное
въ химш (1820 г.) Митчерлихомъ (Mitscherlich). Изоморфными т?-
лами называютъ такія, которыя, при одинаковомъ числ? атомовъ въ
частицахъ, представляютъ сходство въ химическихъ реакціяхъ,
близость въ свойствахъ и одинаковую или чрезвычайно близкую
кристаллическую форму; въ нихъ входятъ часто н?которые общіе
элементы, изъ чего заключаютъ, что и остальные элементы, входящіе въ
частицу, представляютъ сходство. Короче говоря, по сходству кри-
стадлическихъ формъ соедин?ній можно заключать о сходств?
частичного состава ихъ и о сходств? элементовъ, составляющихъ
изоморфный т?да. Прим?ромъ могутъ служить различные квасцы: KAlSuOg.
Д2Н20, 4aAlS208.12Н20, KCrS908 .12Н20 и др.. кристаллизующееся
- 121 —
( § 40. Тріады Деб?рейн?ра. Однимъ изъ первыхъ\)
(въ 1829 г.), обратившихъ вниманіе на числа, выра-
жающія атомные в?са, былъ Деберейн?ръ (Doebereiner).
Онъ подм?тилъ среди элементовъ такія группы,
состояния изъ 3-хъ сходныхъ по свойствамъ элементовъ, у
которыхъ атомный в?съ одного является среднимъ ари?-
метическимъ изъ суммы атомныхъ в?совъ двухъ другихъ
элементовъ, и но свойствамъ этотъ элементъ является
таквгмъ же среднимъ.
Ирим?ры:
„ .„ 6,94 + 39,10 очпо
Натрій •= — ~ —= 23,02.
Ат. вЬса.
Литій. . . . 6,94
Разность. . 16,06
Натрій. . . . 23,00
Разность. . 16,10
Калій. . . . 39,10
С?ра .... 32,07'
Разность. . 47,13^
Селенъ . . . 79,2 \п 32,07+127,5 _Q 7Q
г> Ао п >Селенъ = —'—± ^- = 79,78
Разность. , 48,3 [ 2
Теллуръ. . . 127,5 )
въ формахъ правильной системы. Ц?нность этого основанія для су-
жд?нія объ аналогіяхъ понизилась съ открытіемъ самимъ же Митчер-
лихомъ явленія диморфизма, состоящаго въ томъ, что одно и то ж?
вещество можетъ кристаллизоваться въ разныхъ формахъ, напри-
м?ръ, с?ра кристаллизуется въ ромбической и одноклином?рной си-
ст?махъ. Кром? того, нер?дко можно встр?тить и соединения
совершенно различнаго состава, но кристаллизующаяся въ одинаковыхъ
формахъ.
*) Первый (1815 г.), искавшій законност?й въ соотяош?ніи
атомныхъ в?совъ элементовъ, былъ Проутъ (Prout); онъ обратилъ
вниманіе, что при принятіи атомнаго в?са водорода за 1 атомные в?са вс?хъ
другихъ элементовъ выражаются ц?лыми числами. Отсюда Проутъ
гд?далъ выводъ: водородъ и есть та первичная матерія, изъ которой
образовались вс? другіе элементы. Впосл?дствіи была доказана оши-
— 122 -
Деберейн?ръ полагалъ, что эти соотяошеяія могутъ
послужить основаніемъ для систематической группировки
элементовъ.
Самъ Деберейнеръ установилъ н?сколько такихъ трой-
ныхъ груйгь, назвавъ игь тріадами.
Деберейнеръ также отм?тилъ, что элементы, близкіе
другъ другу по физическимъ и химическимъ свойствамъ
(напр., металлы Ге, Ni и Со), им?ютъ почти одинъ и
тотъ же атомный в?съ.
Идея Деберейнера внесла большое оживленіе въ об-
сужденіе вопроса о систематик? элементовъ.
§ '41. Классификація Дюма. Изъ посл?дующихъ си-
стематиковъ всего бол?е посчастливилось французскому
химику Дюма (Dumas). Онъ очень удачно разгрушгиро-
валъ вс? металлоиды на шесть группъ (1—водородъ;
2—F, С1, Вг, и J; 3—0, S, Se; 4—X, Р и As; 5—С, Si
и 6—В), которыя съ небольшими изм?неніями приняты
и въ настоящее время.
При группировк? металловъ встр?тились затруднения,
вызванныя, во-1-хъ, т?мъ, что аналогіи металловъ часто
не р?зки, а во-2-хъ, что въ н?которыхъ металлахъ
зам?чалась двойственность характера, такъ что они
являлись какъ бы переходами отъ одной группы къ другой.
Эти промежуточные члены тогда только затрудняли
классификацию, стремившуюся установить лишь отд?ль-
ныя группы. Т?мъ не мен?е и среди металловъ было
установлено н?сколько группъ1).
Такъ понемногу сортировались элементы: гд? не
хватало простоты соотношеній въ атомныхъ в?сахъ, і^амъ
бочность основного полож?нія Ироута: атомные в?са элементовъ въ
болыпинств? случаевъ не выражаются ц?лъши числами по отношенію
къ водороду, принятому за единицу.
9 Бол?е подробную классификацию вс?хъ элементовъ на осно-
ваніи аналогіи въ ихъ химическихъ свойствахъ дадъ Емединъ (Gmeliu)
въ 1843 г. Позднве — въ шестидесятыхъ годахъ много поработали
надъ вопросомъ о классификации элементовъ de Chanconrtois, Ne-w-
lands и L. Meyer.
— 123 —
обращались къ аналогіи въ пр?вращеніяхъ, и наоборотъ;
такимъ образомъ явилось много аналогичныхъ группъ
элементовъ. А между т?мъ группировка эта далеко не
удовлетворяла химиковъ. Уже цомимо того, что н?кото-
рыя группы были составлены довольно искусственно,
недоставало самаго главнаго: группы эти стояли большею
частью особнякомъ, безъ всякой связи другъ съ другомъ;
короче, между группами, а сл?довательно, и между
элементами не было общаго связующаго начала, которое бы
обняло вс? аналогіи и связало бы вс? группы въ
единое ц?лое, гд? отд?льные элементы явились бы лишь
звеньями этого ц?лаго. J
§ 42. Д. И. Мендел?евъ. Принципъ класеификаціи.
Такъ д?ло обстояло до 1869 года, когда нашему
соотечественнику Д. И. Мендел?еву выпало на долю указать
и причину неудачи предыдущихъ класеификаціи и тотъ
общій принципъ, который долженъ быть положенъ въ
основу понимания соотношеній вс?хь свойствъ элементовъ
и ихъ соединеній.
Недостаточность предыдущихъ класеификаціи таилась
въ томъ, что за основаніе брались сравнительно частные
признаки элементовъ, а отсюда и класеификаціи
являлись, такъ сказать, частными, не обнимающими всего
ряда элементовъ со вс?ми ихъ особенностями. За
основаніе для широкой класеификаціи надо брать самое
важное, самое постоянное въ элементахъ.
Что же надо считать самыагъ важнымъ и неизм?н-
нымъ въ элементахъ?
„У элементовъ,—говоритъ Д. И, Мендел?евъ,—есть
точное изм?римое и никакому сомн?нію не подлежащее
то свойство, которое выражается въ ихъ атомномъ в?с?.
Величина его показываетъ относительную массу атома,
или, если изб?жать понятія объ атом?, величина его
показываетъ отношеніе между массами, составляющими хи-
мическіе самостоятельные индивидуумы или элементы.
А по смыслу вс?хъ дочныхъ 'св?д?ній объ явленіяхъ
— 124 —
природы, масса вещества есть именно такое свойство
его, отъ котораго должны находиться въ зависимости
вс? остальныя свойства, потому что вс? они опред?-
ляются подобными же условіями или такими же силами,
какія д?йстЬуютъ въ в?с? т?ла; онъ ж? прямо пропор-
ціоналенъ масс? вещества. Поэтому ближе или естествен-
н?е всего искать зависимости между свойствами и сход-
ствомъ элементовъ, съ одной стороны, и атомными ихъ
в?сами—съ другой" 1).
Итакъ, масса атома, или, что то же, атомный в?съ,—
вотъ что самое незыблемое и (по закону сохраненія
массъ) неуничтожаемое у элементовъ и
индивидуализирующее ихъ> а потому изъ массы атомовъ всего есте-
ственн?е и исходить для выяспенія соотношеній между
элементами, а следовательно, и для уразум?нія
естественной ихъ группировки.
„Такова основная мысль, заставившая расположить
вс? элементы по величин? ихъ атомнаго в?са".
§ 43. Элементы и ихъ атомные в?еа. Чтобы
выяснить соотношенія атомныхъ в?совъ со свойствами
элементовъ, приведемъ сл?д. таблицу Д. И. Мендел?ева, въ
которой вс? элементы расположены по степени возраста-
нія атомнаго в?са и характеризованы со стороны ихъ
свойствъ (см. стр. 125—129).
При разсматриваніи этого ряда элементовъг)
нетрудно вид?ть, что величина атомныхъ в?совъ въ болыпин-
ств? случаевъ изм?няется не р?зко, а постепенно; а вм?-
*) сСущность понятш, вызывающихъ періодическіи
законъ,—говорить Д. И. Мендел?евъ,— кроется въ общемъ фйзико-химическомъ на-
чал? соотв?тствія, превращаемости и эквивалентности силъ природы.
Отъ массы вещества находятся въ прямой зависимости тягот?ні?, при-
тяжені? на близкихъ разстояніяхъ и много иныхъ явленій. Нельзя
же думать, что химическія силы не зависятъ'отъ массы. Зависимость
оказывается потому, что свойства простыхъ и сложныхъ т?лъ опре-
д?ляются массами атомовъ, ихъ обраэующйхъ».
*) Ниже приведенная таблица взята въ тоиъ вид?, какъ ои&
напечатана въ 8-мъ изданіи «Основъ химіи» Д. И. Мендел?ева.
— 125 —
<
Э
н
о
о
Н
«а
о 3
ф
о
W
>о
ч
5
I
. и
н
Я
8
"В
g 9
11
о
о
О
Си С4 w
і і
о 2 ' і
чк се а
И
о
СО
в о о* о" о о о
ЮОООШОО
союооиюн
HCJMC-NNW
»-( (N
ft'
О
ю
ем
в в в с-« о с о
ОЗОЛУтНИО
t>coO ,__
1 ++ Н- I I I
+
:++
к
еЭ
S
м
гН
01
а
я
а
ю -^ (Л
Я
а
<М Ю т* CD СО СМ С—
і-Н
•
ев
а
*-н
і-і г-*
*
X
ев
а
я (3
а а
(М т-1
^ Л
(в
а
сЗ
а
СП
о
о
СЛ ^ D- ^
юсоюотнмн
О •-* СМ »—і 1—і гН г-і
00-* О
05 1ХГ1Й (МОК
нГ* Г* #*» "I **ч •*• *о
Оі-і<М«ММн
С) .-і О
И И и4 М м О fc О Рч
о ев ^о^ ч 21
pf
Й
со
о
*« -а
•-» Jz; ^
-гНо
со о о о о о
— „Ч.'Т.гнСЧ -Ф СО ОТ
^•¦^•t-СЭіН Нг-іг-1Н
II II II II II 1! II II И
Н 3 m * Еа
из
И
г—I
о
Ю СО »о
<М СМ СМ (М ОЭ СО СО
II II 11 II II I! II II
& ? ? < 1Я 0< СЯ CJ
о»
сЗ
«> .М
PQ 00 Си
О
слей
СО
126 —
о
о
О.
Й
&.S
ft
" eg
^
^ я
ю .
п
11
о
о
о
о в
о с
CD
о* в о
ООО
^ v ~ _ Ю О Ю — . .
СОМОЮООЮ^^ССО4*
cq счі гн і—11-
о © о о о о о
О^ОіОООО
ЮЮнсОООн
OS О CJ
о
С-
+ +
м
03
8
+
а
¦1—1
a
c^co^c^co^ot^c^w с^сч со
т со со со оэ t^t^t^co^co^c^a^r-Tco4 со'со со
>cj< са і—(г-н нгч нінсд
a
a
«J
s
t- СО с-.
СО t^ in
сююш co^tf^r^io^a^cp^t^oq^r-^c^-^ со со *-*
сГ т-Г сД4 со* *гі" со" t^ с*^ со" со* ее? с-Г ю" iff и? ¦*$ со"
-4
в*
и
Я
ч
со
аз
Я
%
о
о
о ш і і і
М
5.Я
PQ ft
gw
tf
ft 15
»
\
<3
О ЬН
».
1A
О
у
m
со
,_, r-t гн i-^-d^r^O^C^6*" с*- ^"^.С^іД О « 0^
сГсГт^со им ід ісГсі ел со *п о фГю*сГсГ
II !1 II
3
cdP5
*a Ом
127 —
3
Q
О
cd
& я
а,
ф
и
©
8
*Q W
іЯ
§
о
о
О
&
н
н
о
53
1 л __4
О
О W
1 "111
и х %
Е-"
W
О
г
©
to
о
Ed
о
о ф і і :
о
о
53S
W .
8W
РЭ Р-
ОНИ)
Й
a
о
о
о S*
О) О
со о
со
+
оо о
оо о
О ю о
s-
о
о
см
S, о-. 6
о о в & =>
О О О О о О СО
ОООЮ^ім^
OOCD05 3JCOH
INCMH
max.
об" со" етГсГ со ** со
т-Г n" ее4 ^t>* со"
4*1°° 4to ^ эт
CSKN Н О
со t^ с-
и
[? с/1 рн S3 ?j S
со
ко
И
¦а, О
t-l
ее
Рч
СО
РЗ
со
© 0
ЬО
СО
»s
.-Ч
00
ю"с—"оГо1-^ to оъ г"і со co't^'frj'^ d
QOODGOOlOJOSCSOOOO-H'HrH
тЗ
о
128
ев
оЗ
О*
да
К
да
5
S3
S3
=3
И
t4
та
о
о
О
»
еЗ
о о в
(М -М О
СО <Л vft
СМ -чр -*
О
=3
S
в о
Г- О
СМ С*- «v. О
г-
о
со
оо о to
rH CM CN
<0 <Х> СО --<
ю те см n
К
се
со
QC ОТ
со" со -^
о- с4- „
•Si
г*.
сЗ
\о ьз і-н ~ _
аз
0^«
~ Tig и
аз
Я
Н
a
о
еЗ
Й es **
со
со s
щ
С/3
О О t~
CI CM W
hjS
00
CM
от ^
52" h-" Ob О
со со со ^
IIII
4Э _«
S3
О й «5 й И
^tjToco со-^
Л-1-н ни *-і *-(
«Q
5
— 129 —
н
Я
о
о
ев
а
ш
га
о й
>га
и га
№
Я
я
•а
га к
н в
га
га
ев
О
о
О
Я
и
н
о
I
о
5*^
Рч . _г *"• ~—
О) Р,г^ О ^
о
ф
о
яО ^
і
я
да
Я
И
О)
из
ч
CD
а?
Я
га
о
ев ,га
га
if»
и
я
о
о в о
о о о ^С0С5
о ю а» а; м со
Ь- тр СО (N СО СЧ
+
4
с*-
о
о
О
хо О <?^
<хГсо~сГо ю t^ со
см
см
со
і і :
о а> і t »•
га и Рнф ч о
° g «
*о *^ ^>
а и: а
Я о н
ш
in ^tj^co to go co^cq^
<n ем і-Гсэ' co"r-T*-< cjT
CM <N С] ,-i i-< .—i гч
1-< t-^
t-Tco"
С*-. О-
-га J4
И
а
еЧ
ш
го
ЛЬ!
эл
ж С*-
?со
ОСО
>га ¦-*
га ^
ві
аз я
се
Е-
-J-J СО
• сии
г га
.13
Ид
«1
О
• t—(
я ¦
К СО
Щ СМ
3 S
еа
о
ft
Рч
се
5
аз
«=:
го
аз
Я
га
о
»«ч
га
со
а;
со
=з ьо-
ра .„
И
OJ —I -і-і
О
00
о
см
&
о
га
S
о
о
>га
га
Я
&
м
о
W
ы см
Зсм
III
о
!¦&
О (S.j
РчРчИ
рц
о
со со
1111
Неорганическая химія.
9
— 130 —
ст? съ изм?неніемъ атомныхъ в?совъ также изменяются
и другія свойства.
При изученіи физическихъ, а главнымъ образомъ, хн-
мическихъ;'свойствъ р?зко выступаетъ одна и та же
правильность; а именно: вс? свойства элементовъ и ихъ
соединены изм?няются въ зависимости отъ изм?неній
атомныхъ в?совъ. Это и былъ первый выводъ, сд?лан-
ный Мендел?евымъ.
§ 44. Періодическій законъ. При бол?е подробному
изученіи соотношеній между изм?неніями атомныхъ
в?совъ и изм?неніями свойствъ элементовъ Мендел?евъ
выяснилъ, что свойства изм?няются не такъ, какъ
атомные вЬса, т.-е. не возрастаютъ непрерывно отъ перваго
элемента къ посл?днему, а посл? н?котораго возрастанія
вновь убываютъ, зат?мъ опять растутъ до п?котораго
максимума и вновь уменьшаются и т. д. во всемъ ряду
элементовъ. Эти максимумы и минимумы изм?неній довольна
правильно являются чрезъ опред?ленные промежутки, чрезъ
определенные періоды, или, какъ обыкновенно говорятъ
въ такихъ случаяхъ, изм?ненія совершаются пергоди-
чески, т.-е. подобные элементы появляются всегда чрезъ
определенные промежутки. Для прим?ра пока укажемъ
вскользь на періодическую см?ну металловъ и металлои-
довъ.
Отсюда и законъ Д. И. Меидел?ева называется перго-
дическимъ закономъ.
Д. И. Мендел?евъ въ окончательномъ вид? формули-
ровалъ періодическій законъ такъ: „свойства простыхъ
т?лъ, также формы и свойства соединеній элементовъ,
находятся въ періодической зависимости (или, выражаясь
алгебраически, образуютъ періодическую функцію) отъ вели*
чины атомныхъ в?совъ элементовъ"1).
і) Въ 8 изд. «Основъ химіи», въ прим?ч. на стр. 467, Д. И. М?ы-
дел??въ объясняетъ, на основаніи чего, исходя изъ какой мысли*
131
§ 45. Періодичеекая система химическихъ
элементовъ* Указавъ на періодичность въ изм?неніяхъ
свойствъ элементовь, Д. И. Менделвевъ придалъ имъ и
соотв?тствующее расаоложеніе: онъ разм?стилъ ихъ въ
горизонтальный рядъ по величин? атомнаго в?са и при
этомъ элементы, въ которыхъ свойства повторяются, под-
ігисалъ подъ т?ми, къ которымъ они всего ближе под-
ходятъ, такъ что образовались, кром? горизонтальныхъ
рядовъ, еще вертикальный группы, заключаются ближай-
шія по сходству въ свойствахъ аналоги, Отъ такого рас-
положенія и получилась такъ называемая періодичеекая
система химическихъ элементовь (см. стр. 133).
найденъ былъ имъ и упорно защищаемъ перюдическій законь; вогь
часть этого отв?та:
...<ГГосвятивъ свои силы изученпо вещества, я вижу въ немъ два
такихъ признака: массу, занимающую пространство и проявляющуюся
въ притяж?ши, а ясн?е или реальн?е всего въ в?с?, и
индивидуальность, выраженную въ химическихъ превращеніяхъ, а ясн?е всего
формулированную въ представлении о химическихъ элементахъ. Когда
думаешь о вещесгв?, помимо всякаго представленія о матеріальныхь
атомахъ, нельзя, для меня, изб?жать двухъ вопросовъ, сколько и
какого дано вещества, чему и соотв?тствуютъ понятія—массы и
химическихъ элементовъ. Исторія же науки, касающейся вещества, т.-е
химш, приводитъ волей или неволей къ требовашю признашя не только
в?чности массы вещества, но и къ в?чности химическихъ элементовъ.
Поэтому невольно зарождается мысль о томъ, что между массою и
химическими элементами необходимо должна быть связь, а такъ какь
масса вещества, хотя и не абсолютная, а лишь относительная, выра-
лсается окончательно въ вид? атомовь, то надо искать фуякщояаль-
наго соотв?тствія между индивидуальными свойствами элементовъ и
ихъ атомными в?сами. Искать же чего-либо, хотя бы грибовъ или
какую-либо зивисимость, нельзя иначе, какъ смотря и пробуя. Вотъ
я и сталъ подбирать, написавъ на отд?льныхъ карточкахъ элементы
сь ихъ атомными ввсами и коренными свойствами, сходные элементы
и близкіе атомные в?са, что быстро и привело къ тому заключенно,
что свойства элементовъ стоятъ въ перюдической зависимости отъ
ихъ атомнаго в?са, при чемъ, сомн?ваясь во многихъ неясностяхъ, я
ни на минуту не сомя?вался въ общности сд?ланнаго вывода, такъ
какъ случайности допустить было невозможно».
9*
- 132 —
Какъ видно изъ таблицы, вс? элементы, способные
къ соединеніямъ, расположились въ 8 вертикальныхъ
группъ, первая же сл?ва группа—„нулевая"1)
составилась изъ элементовъ, ни съ ч?мъ не соединяющихся;
яря укаранномъ располож?ніи получилось 12 горизон-
тальныхі рядовъ.
Въ вертикальныхъ группахъ элементы четныхъ рядовъ
отд?лены оть элементовъ нечетныхъ рядовъ въ отд?ль-
ные столбики на томъ основаніи, что четнорядные
элементы показываютъ наибол?е сходства съ четнорядными
же, а нечетнорядные—съ нечетнорядными: отсюда полный
пері<)дъ взм?неній въ свойствахъ завершается въ 2 ря-
дахъ—ч?тномъ и нечетномъ; такі? два сос?днихъ ряда,
четный и слЬдующій за нимъ нечетный, и составляютъ,
по Мендел?еву, одипъ пергодъ: всего же періодовъ, сл?-
довательно, шесть. Последнее ясно видно изъ таблицы.
Единственный элементъ 1-го ряда—водородъ, и
элементы 2-го ряда, Li, Be, В, С, N, О и F, обладагощіе
наименьшими атомными в?сами, хотя въ общихъ глав-
н?йіпихъ свойствахъ и сходны съ своими аналогами,
подписанными подъ ними, но во многомъ и отличаются отъ
нихъ; ихъ Мендел?евъ предложилъ назвать типическими,
т.-е. обладающими наибол?е рЬзко выраженнымъ инди-
видуальнымъ характеромъ.
Что касается девяти вертикальныхъ группъ, то он?,
согласно самому способу расположенія элементовъ,
явились содержащими наибол?е сходные между собою
элементы, такъ называемыя естественным семейства.
Черточки въ таблиц? показываютъ, что вь этихъ м?-
стахъ не хватаетъ элементовъ; обыкновенно между
ближайшими къ пустымъ м?стамъ элементами существуетъ
скачокъ въ атомномъ в?с?, а съ нимъ и большое раз-
личіе въ свойствахъ.
1) О «нулевой» групп? подробн?е будетъ сказано дад?е при опи-
саніи свойствъ аргона; она установлена была гораздо поздн?е, лишь
въ 1900 году.
— 133 —
Періодическая система элементовъ по группамъ и рядшЙЬ
Ряды.
1
2
3
4
5
в
7
8
9
10
11
12
ГРУППЫ ЭЛЕМЕНТОВЪ.
0
Гели.
Не
3,99
Неонъ.
Ne
20,2
Ар-
гонъ.
Аг
39,88
—
Крип-
го нъ.
Кг
82,92
—_
Ксе-
нопъ.
Хе
130,2
—
—
—
Ннтонь
Nt
222,4
/
Водо-
родъ.
Н
1,008
іи-
тШ.
Li
6,94
На-
ТріЙ,
Na
23.00
Ка-
лій.
К
39,1
МЬдь.
Си
63,57
Ру-
бндін.
Rb
85,45
Серебро.
Ад
107т88
Це-
31Й.
Cs
132,81
—
—
Золото.
Аи
197,2
—
II
Бррил-
лій.
Be
9,1
Маг-
нін.
Mq
24,3
іСаль-
цЙ.
Са
40,7
Цянкъ.
Zn
65,37
Строн-
ціЙ.
Sr
87,63
Кад-
мій.
Cd
112,4
Ба-
рій.
Ва
137,37
—
—
Ртуть.
Нд
200,6
Радій.
Rd
226,4
III
Боръ.
В
11,0
Алю-
агянш.
AI
27,1
Скан-
Дій.
Sc
44,1
Гал-
лій.
Ga
69,9
Ит-
трій.
Y
89,0
Ин-
дій.
Jn
114,8
Яан-
танъ.
La
139,0
—
Неоит-
т?рбШ.
Yb
172,0
Таллій.
TI
204,0
—
/V
Угле-
родъ.
С
12,0
Крем-
ніа.
SI
28,3
Ти-
танъ.
TI
48,1
Гер-
маніи.
Ge
72,5
Цир-
коній.
Zp ,
90,6 ^
Олово.
Sn
119.0
Це-
рій
Се
140,25
-
—
Сви-
нецъ.
РЬ
207,10
Торій.
Th
232,4
V
Азоть.
N
.14,01
Фос-
форъ.
р
31,0
Вана-
ліи.
V
51,0
Мыть-
якъ.
As
74,96
Шо-
бій.
No
93,5
Сурьма.
Sb
120,2
—
Тан-
талъ.
Та
181,5
Вис-
муть.
Ві
208
—
VI
Кпсло-
родъ.
0
16,00
Gfepa.
S
32,07
Хромъ.
Сг
52,0
Се-
ленъ.
Se
79,2
Молиб-
ДРНЪ.
,Мо
96,0
Тел-
луръ.
Те
127,5
—
Вольф-
рамъ.
W
184
—
Уранг
и
238,5
В ы с ш1е солеобразныс
R ( R,0 | RO | R,03 I RO> | R,Ob | ROs |
Высшія газообразны я водоро
1
RH4 |
RH„ I
RHB |
VII
Фторъ.
F
19,0
Хлор-ь.
CI
35,46
Map-
га нецъ.
Мп
54,93
Бромъ.
Вг
79,92
—.
іодъ.
J
126,92
—
—
—
Же-
л?зо.
Fe
55,84
Ру-
тепій.
Ru
101,7
Осміи.
Os
190,9
! окислы:
RA 1
VIII
Ко-
бальть.
Со
58,97
Рпдій.
Rh
102,9
Йридіи.
Jr
193,1
R04
д н ы я соединен!
RH |
Няя-
к?ль.
NI(Ou)
58Г?Э
Пал-
ладіН.
да
Платина.
Pt(Au)
195,2
tit
— 134 —
§ 46. Періодическій законъ относится къ
элементами Авторъ періоднческой системы подчеркивает^
что „періодическій законъ относится къ элементамъг),
такъ какъ яць свойственъ атомный в?съ", а не къ про-
стымъ т?лаьіъ, которымъ, какъ и сложнымъ т?ламъ,
свойсгвенъ частичный в?съ. Отсюда періодическую
зависимость свойствъ отъ атомнаго в?са и надо прежде всего
искать въ химическихъ своиствахъ элементовъ, а не въ
физическихъ. Посл?днія „опред?ляются преимущественно
свойствами частицг и только посредственно зависятъ
отъ свойствъ атомовъ, образующихъ частицы", т.-е. въ
физическихъ изм?неніяхъ зависимость отъ атомнаго в?са
уже сложн??. На этомъ основаніи мы прежде всего и
главнымъ образомъ остановимся надъ изсл?дованіемъ
того, какъ выразила періодическая система изм?ненія въ
химическихъ своиствахъ. Изм?ненія эти надо разсматри-
вать какъ въ группахъ, такъ и въ рядахъ, т.-е. и въ
вертикальномъ и горизонтальномъ 'направленіяхъ:
атомный в?съ, согласно расположенію, растетъ въ группахъ
сверху внизъ, а въ рядахъ—сл?ва направо; параллельно
этимъ же направленіямъ должны изм?няться и
свойства.
Первое, что въ періодической систем? останавливаетъ
вниманіе, это—восемь вертикальныхъ группъ, въ кото-
рыхъ расположились вс? д?ятельные элементы.
§ 47. Періодичность валентности. Что же значитъ
это число 8? Почему періодичность выразилась именно
этою цифрою, а не другой? Вотъ вопросъ, прежде всего
требующій разъясненія.
*) «Простое т?ло есть н?что матеріально?; это—металлъ или
метадлондъ, обладающих данными физическими свойствами. Понятію
простого т?ла отв?ча?тъ молекула»... < Элементы суть матеріальныя
составныя части простыхъ и химическихъ сложныхъ т?лъ, который
обусловливают ихъ физическое и химическое отношение... Это не
конкретное т?ло, а в?сомое вещество съ суммою свойствъ> (Мен-
дел?евъ).
— 135 —
Самымъ важнымъ изъ химическихъ свойствъ
элементовъ, безспорно является ихъ валентность,
обусловливающая опред?ленныя формы соединеній. Хотя
валентность и различна у различныхъ элементовъ, но разно-
образіе ея невелико;, она варіируетъ въ нред?лахъ 1—8,
т.-е. одновалентные и восьмивалентные элементы
являются пред?лами этихъ варіацій. Отсюда и основныхъ
формъ соединеній атомовъ въ частицы существуетъ только
восемь. Формы эти въ вид? окисловъ и приведены выше
(на 108 стр.).
Разсматривая элементы каждой изъ восьми группъ
періодической системы, можно вид?ть, что въ каждую
группу попали элементы одной и той же валентности,
сл?довательно, вообще образующіе одинаковый формы
соединеній. Отсюда попятно, что 8 группъ періодической
системы образовались не случайно, а именно отв?тили
8-ми главнымъ типамъ соединеній.
Это и показано въ систем?; внизу каждой группы
поставленъ характерный для нея окиселъ, выражающій
вм?ст? съ т?мъ максимальную валентность элементовъ
группы.
Разсматривая эти окислы, мы видимъ, что они сто-
ятъ въ строгомъ порядк? увеличивающейся валентности
отъ R20 до R04; сл?довательно, элементы д?йствительно
распред?лились по строгой систем?. Валентность элемента
по кислороду опред?ляется номеромъ группы, въ
которой онъ стоитъ.
Итакъ, 8 группъ періодической системы вполн?
отв?тили 8-ми главнымъ типамъ соединеній или, что
то же, валентности элементовъ.
§ 48. Металлы и металлоиды въ періодической
систем?. Начиная съ 4-й группы, подъ группами
поставлены еще тииическія для группъ водородистая со-
единенія: RH4, RH3, RH2 и RH, съ ц?лыо показать, что
и по отношение къ водороду элементы также
распред?лились совершенно систематично. Надъ первыми тремя
— 136 —
группами и иадъ 8-ю группой водородныхъ соединеній
не поставлено по той причин?, что элементы этихъ
группъ или вовсе не образуютъ съ водородомъ
соединеній, или эти соединеяія очень непрочны и нехарактерны,
тогда ка&?ь водородистыя соединенія 4, 5, 6 и 7 группъ
довольно5 прочны и характерны для элементовъ этихъ
группъ.
Отношеніе элементовъ къ водороду есть одно изъ хаг
рактерн?йшихъ хими^іескихъ основаній для д?ленія
элементовъ на металлы и металлоиды. Сл?довательно, въ
періодической систем? само собою произошло и
правильное разд?леніе элементовъ на металлы и металлоиды,
или иначе разд?леніе элементовъ по ихъ
электрохимическому характеру. И д?йствительно, въ 1, 2, 3 и 8 груп-
пахъ находятся металлы, а въ 4, 5, 6 и Ч^преиму-
щественно металлоиды.
§ 49. Изм?ненія въ рядахъ. При бол?е тщатель-
номъ изученіи металлических^ (основныхъ) и метал-
лоидныхъ (кислотныооъ) свойствъ элементовъ зам?чается,
что т? и другія по своей сил? далеко не одинаковы у
различныхъ элементовъ, и это вполн? выражается въ
періодической систем?: въ начал? періодовъ, то-есть,
главнымъ образомъ, зъ 1-й и 2-й группахъ, стоятъ
элементы, дающіе наибол?е сильные основные окислы,—
окислы наибол?е энергичныхъ металловъ, наприм?ръ,
К, Na, Са, Sr, Ва и другихъ: въ конц? же періодовъ,
т.-е. главнымъ образомъ, въ 6 и 7 группахъ, находятся
элементы, дающіе найбол?е сильные кислотные окислы,—
окислы нанбол?е энергичиыхъ металлоидовъ, наприм?ръ,
S, CI, Br, J. Въ среднихъ же группахъ, т.-е. въ 3, 4,
стоятъ элементы, такъ сказать, переходные: самые
элементы не энергичны, и вс? свойства ихъ не р?зки: въ
3-й групп? стоятъ слабые металлы, а въ 4-й тоже мало-
д?ятельные, но уже металлоиды. Сл?довательно, въ одномъ
и тсмъ же горизонталыюмъ ряду, наприм?ръ, хотя бы
во 2-мъ отъ Li къ F, им?ется постепенный переходъ
— 137 —
отъ энергичнаго металла Li чрезъ Be и В къ слабому
металлоиду С и къ бол?е и бол?е энергичнымъ метал-
лоидамъ N, О и, наконецъ, къ самому типичному
металлоиду F; въ 3-мъ ряду отъ энергичнаго металла Na и
чрезъ металлы бол?е слабые Mg и А1—къ мало
энергичному металлоиду Si и къ бол?е энергичнымъ Р и S и,
наконецъ, къ очень характерному металлоиду 01 и т. д.
То же самое видно изъ формъ окисловъ, свойствея-
ныхъ группамъ. Укажемъ главн?йшія свойства (основность
и кислотность) типичныхъ окисловъ:
R90 — (гидратъ ROH) — главнымъ образомъ, основной
окиселъ; элементы, образующіе этоть окиселъ,
суть металлы; исключенія есть, но
немногочисленны.
RO — [гидратъ R(OH)2] — также почти исключительно
(R202) основной окиселъ; только основныя свойства его
слаб?е, ч?мъ у типа R20; элементы съ окисломъ
R0 суть металлы.
й203—[гидратъ R(OH)3]—этотъ окиселъ бываетъ слабо-
осно?нымъ и слабокислотнымъ\ поэтому н?кото-
рые окислы этого типа называются
промежуточными.
R02 — [гидратъ R(0H)4 или R(0H)4 — Н20 = RO(OH)2] —
(R204) чаще всего этотъ окиселъ слабокислотенъ, какъ
р?дкое исключеніе—онъ им?етъ слабыя основныя
свойства, среди окислов ь этого типа им?ется много
промежуточныхъ.
Щ05~[гидрать В(ОН)Б —Н20 = ЩОН)з, или—2Н20 —
= R02(OH)]—пгьслотнаго характера.
R03 — [гидратъ R(OH)6—2Н20 = R02(OH)2]—кжлояшагя
(R206) характера; основныя свойства у типа R03 (а равно
и у типа R205) очень р?дки и очень слабо
развиты.
R207—[гидратъ R(OH)7 —ЗН20 = R03(OE)]-^ кислотнаго
характера.
— 138 —
R04 — типъ кгсслотнаго окисла, очень р?дко встр?ча-
(R208) ющійся: такой окиселъ изв?стенъ лишь у элемен-
товъ осмія и рутенія.
Положеиіе элементовъ въ четномъ или нечетномъ ряду
также отзывается на свойствахъ ихъ: четнорядиые
элементы группы являются бол?е основными, а нечетно-
рядные—бол?е кислотными.
Восьмая группа является также переходною, но уже
между 7-ю и 1-ю группами, связуя четный и нечетный
ряды одного и того же періода; но въ 8-й групп? недо-
стаетъ многихъ элементовъ, а потому далеко не вс? пе-
ріоды • им?тотъ этотъ переходъ.
§ 50,. Изм?ненід въ группахъ. Вліяніе атомнаго
в?са сказывается не только въ горизонтальныхъ рядахъ,
но и въ вертикальныхъ группахъ.
Въ каждую вертикальную группу попали элементы,
сходные между собою; въ зависимости же отъ величины
атомнаго в?са у нихъ есть и отличія, а именно: въ одной
и той оюе групп? съ увеличенгемъ атомнаго в?са
усиливаются основныя (металлическгя) свойства, на-
прим?ръ, К—бол?е энергичный металлъ, ч?мъ Na; Ва—
бол?е, ч?мъ Са, и т. д. Даже въ чисто кислотныхъ
группахъ наибол?е тяжелые элементы (въ 5-й—Ві, въ 6-й—U)
являются преимущественно основными. Правда, въ
этихъ случаяхъ они обыкновенно образуютъ наибол?е
прочныя формы соединеній уже отъ другого окисла—
низшаго, ч?мъ показанный надъ группой, т.-е. проявляюсь
не maximum своей валентности, а только часть ея (Ві203
и U02 вм. Ві205 и U03).
Изъ всего только что сказаинаго можно вывести
действительное подтверждение, что періодическая система
вполн? обняла важн?йшія варіаціи главныгь свойствъ
элементовъ. Теперь достаточно сказать, что такой-то
элемента находится въ такой-то групп? и въ такомъ-то ряду,
чтобы сразу опред?лить, какой его окиселъ, а сл?дова-
— 139 —
телыю, какова его валентность, и каковъ онъ съ точки
зр?нія основности или кислотности, т.-е. общій характеръ
элемента.
Изъ періодической системы легко вид?ть и причину
невозможности р?зко расчленить элементы на металлы и
металлоиды. Причина въ томъ, что атомный в?съ, отъ
котораго зависитъ положеніе элементовъ въ систем?, въ
большинств? случаевъ м?няется не р?зкими скачками, а
довольно постепенно.
Обобщая вышеизложенное относительно основного и
кислотнаго характеровъ элементовъ, надобно сказать, что
они опред?ляются: а) формою окисла (или, что то же,
группой); Ь) ч?тнымъ или нечетнымъ рядомъ, въ кото-
ромъ находится элементъ, и с) в?сомъ его атома: пизшгй
окиселг, четный рядъ и при одиомъ и томъ же окисл?
наибольшій атомный в?съ—вотъ наилучшія условгя
для проявлеигя основности; выстгй окисслъ, нечетный
рядъ и малый атомный в?съ, наоборотг, обусловлгь-
ваютъ высокія шслотныя свойства; среднія положенгя
являются переходными, связующими, со свойствами
ослабленными, металлическими или металлоидными,
смотря по групть и по ряду.
§ 51. Въ общемъ при взгляд? на періодическую
систему мы им?емъ, сл?довательно, такую картину: въ пер-
вомъ сл?ва столбц? (нулевая группа) находится группа
химически нед?ятельныхъ элементовъ; дал?е въ 1, 2 и
3-й группахъ помещаются металлы со сл?дующими отли-
чіямя: въ 1-й гр.—одновалентные, р?зко основные, такъ
называемые „щелочные" металлы, во 2-й
гр.—двухвалентные, тоже сильно (но въ меньшей степени, ч?мъ въ
1-й гр.) основные „щелочно-земельные" металлы и
металлы магніевой подгруппы, а въ 3-й гр. окиси трехва-
лентныхъ металловъ им?ютъ уже слабыя основныя
свойства, 4-я, 5-я, 6-я и 7-я группы содержатъ элементы,
окислы которыхъ почти исключительно кислотнаго ха-
— ио —
рактера и опять-таки со сл?дующей носл?довательностыо;
элементы 4-й гр.—четырехвалентны, слабокислотнаго
характера; въ 5-й и 6-й групдахъ эти валентность и
кислотность постепенно возрастаютъ, и, наконецъ, въ
7-й гр. элементы семивалентны, и кислотныя свойства
проявляются наибол?е р?зко; во вс?хъ посл?днихъ че-
тырехъ группахъ (4, 5, 6 и 7-и) кислотныя свойства
уменьшаются по м?р? увеличенія атомнаго в?са (т.-е.
сверху внизъ). О нереходномъ значеніи 8-й гр. было
сказано выше. /
Валентность, какъ зам?чено, правильно возрастаетъ
отъ ігй группы къ 8-й, что и выражено въ систем?
формами окисловъ, начиная съ R20 для одновалентныхъ эле-
ментовъ и кончая К04 (или R208)—для элементовъ восьми-
валентныхъ. Начиная съ 4-й гр., т.-е, съ первой группы,
заключающей въ себ? металлоиды, отм?чена еще
валентность ихъ по водороду. Сл?дуетъ обратить ввиманіе, что
только въ 4-гр. она равна валентности по кислороду,
т.-е. равна четыремъ, а дал?е она понижается: въ 5-й
групп? по водороду элементы уже трехвалентны, въ
6-й групп?—двухвалентны, а въ 7-й
групп?—одновалентны. Значитъ элементы 4, 5, 6 и 7 гр. способны
присоединять къ себ? т?мъ бол?е кислородпыхъ ато-
мовъ, ч?мъ мен?е могутъ удерживать водородныхъ
атомовъ; сумма же валентностей по кислороду и
водороду въ каждой групп? всегда равна восьми.
Итакъ, періодическая система, охвативъ существенный
стороны элементовъ, указала каждому изъ нихъ м?сто въ
опред?ленной вертикальной групп? и въ опред?ленномъ
горизонтальномъ ряду; м?сто это точно указывается
величиною атомнаго в?са и опред?ляетъ свойства элемента:
§ 52. Прим?ръ опред?ленія свойствъ элемента
по м?ету его въ періодической сиетем?. Пусть
атомный в?съ элемента равеиъ 27,1; въ періодической систем?
ему можетъ быть отведено единственное м?сто между
Mg(24,32) и Si(28,3), т.-е. въ 3 гр. между В и Sc. Какія
— 141 —
же его свойства? Свойства, конечно, будутъ средними
между Mg и Si и между В и Sc. Уже изъ того, что эл?-
ментъ этотъ находится въ 3-й групп?, сл?дуетъ, что
окиселъ его есть R203, т.-е. элементъ этотъ 3-валентенъ.
Третья группа (окиселъ R203 тожъ) является переходной
отъ металловъ къ металлоидамъ; а такъ какъ во 2-й гр.
стоящій Mg есть металлъ, а въ 4-й Si—слабый метал-
лоидъ, то всего в?роятн?е, что описываемый элементъ
будетъ также металлъ, но уступающій въ энергіи Mg.
Посл?дне? точн?е опред?лится, если принять во вниманіе
чрезвычайно слабыя основныя свойства В и вполн? ясныя,
хотя и не очень сильныя, основныя свойства Sc. Итакъ,
изсл?дуемый элементъ—металлъ, а это значить, что съ
водородомъ онъ или совершенно не соединится или дастъ
очень непрочное соединеніе; окиселъ его, какъ окиселъ
переходной группы, долженъ быть слабоосновной; сл?до-
вательно, и соли нашего металла сравнительно мало прочны,
и т?мъ мен?е прочны, ч?мъ слаб?е металлоидный
окиселъ, съ нймъ реагирующій, и т, д. Все это совершенно
согласно съ д?йствительностыо: таковъ именно металлъ
AL Физическія свойства его, какъ видно будетъ дальше,
тоже опред?ляются какъ приблизительно среднее изъ 4-хъ
рядовъ стоящихъ элементовъ.
Итакъ, одно знаніе м?ста элемента въ періодической
систем? опред?ляемаго величиною атомнаго в?са, даетъ
возможность предсказать его свойства; это—фактъ
огромной важности,—фактъ, позволяющій предугадать неизв?ст-
ное, а потому о немъ еще будетъ р?чь впереди.
§ 53. Опред?леніе атомнаго в?еа элемента по его
свойствамъ. Если по атомному в?су можно поставить
элементъ въ опред?ленную группу и въ опред?леяный
рядъ системы и т?мъ определить его свойства, то и, на-
оборотъ, зная свойства элемента, можно опред?лить
его атомный ??ег.
Въ самомъ д?л?, пусть относительно того же А1, о
которомъ только что говорилось, будутъ изв?стны его
— 142 —
свойства, а н?изв?стенъ его атомный в?съ. Наприм?ръ,
если съ водородомъ онъ не соединяете», то очень в?-
роятно, что онъ—металлъ; если его соли непрочны, то
это металлъ не энергичный; если его высшій окиселъ
R203, то ёто металлъ 3-й гр., а потому и энергія его,
какъ металла переходной группы, слаба. Такъ опред?ли-
лось положеніе въ групп?. Теперь какъ опред?литъ рядъ?
Изучая свойства даннаго элемента и его соединеній, пу-
темъ сравненія нетрудно будетъ увид?ть, что окиселъ Sc
будетъ бол?е, а окиселъ В мен?е основпымъ, нежели его
окиседъ; отсюда прямой выводъ, что м?сто этого элемента
въ 3-мъ ряду, между Mg и Si. Разъ такъ, то нетрудно
онред?лить и его атомный в?съ: онъ долженъ быть между
24.32 (Mg) и 28,3 (Si) и между 11 (В) и 44,1 (Sc), т.-е.
24,32 + 28,3 + 11 + 44,1 107,5 „ „п/пг поч
около— ! ^ ! - = ~~ = лриб.27 (26,93),
что и д?йствительно в?рно.
Такимъ образомъ, періодическая система даетъ новый
способъ опред?ленія атомныхъ в?совъ элемеппьовъ.
Стоить вспомнить, съ какими трудностями сопряжены
такія опред?ленія, чтобы вполн? од?нить эту важную
заслугу періодической системы.
При первоначальной установк? системы Д. И. Мен-
дел?еву пришлось исправить атомные в?са н?сколькихъ
элеменговъ (напр., индія1), урана, торіи, титана и др.),
!) Съ подробными разеужденіями относительно такихъ поправокъ
интересующіеся могутъ познакомиться, наприм?ръ, на образчик?,
изложенномъ въ «Основахъ химіи> Д. И. Мендел?ева, стр. 466>
прим?ч. 15. Серіозность поправокъ видна изъ сл?дующей таблицы:
Ат. в. до исправленія .
Ат. в. исправленный . •
J и
75.4
113
и
120
240
Th
118
236
т,
52
48
— 143 -
такъ какъ при ран?е указанныхъ величинахъ одни изъ
нихъ попадалг въ группы несходныхъ съ ними
элементовъ, а для другихъ и вовсе не находилось м?стъ въ
систем?. Поздн?йшія изсл?дованія лишь вполн?
подтвердили эти поправки.
§ 54. Изм?няемоеть физическихъ свойствъ про-
стыхъ т?лъ. Физическія свойства, какъ было зам?чено.
опред?ляются преимущественно свойствами частицъ
элемента и, следовательно, стоятъ не въ простой
зависимости отъ атомныхъ величинъ. Но такъ какъ частицы
слагаются изъ атомовъ, то все-таки качество и
количество атомовъ элементовъ должно им?ть вліяніе и на
нихъ. Зависимость эта, д?йствительно, существуетъ, а
именно: всякое бол?е или мен?е хорошо изученное и
сравниваемое въ ряду простыхъ т?лъ физическое
свойство изм?няется періодически> проходя чрезг изв?ст-
ныв maximum*ы и minimum'ы, mo-есть то возрастая,
то убывая.
Для прим?ра укажемъ на, изм?няемость магпитныхъ
свойствъ простыхъ т?лъ въ связи съ ихъ положеніемъ
въ періодической систем?: простая т?ла четныхг ря-
довъ относятся къ числу магпитныхъ (парамагнитныхъ);
простыя же т?ла нечетныхъ рядовъ діамагнитны. На
прилагаемомъ графическомъ изображеніи Лотара Мейера
ясно видна періодическая зависимость атомныхъ объ-
емовъ и температуръ плавленія простыхъ т?лъ отъ
ихъ атомныхъ в?совъ: по горизонтальной линіи (абсцисса)
зд?сь нанесены атомные в?са, а по вертикальной
(ордината)—атомные, объемы и температуры плавленія.
Жирная линія, изображающая ходъ изм?неній атомныхъ объ-
емовъ, представляетъ рядъ постоянно увеличивающихся
волнообразныхъ загзаговъ: въ начал? каждаго періода
атомный объемъ им?етъ максимальную величину, въ сре-
дин? большого періода (у элементовъ восьмой группы)
досгигаетъ минимума, зат?мъ снова увеличивается.
Такова же по виду и тонкая линія, изображающая ходъ
_ 144 —
изм?неній въ температурахъ плавленія: на восходящихъ
отр?зкахъ кривой располагаются газообразные и легко-
нлавкіе элементы, на нисходящихъ—трудно плавящіеся
элементы.
|/§ 55. Значеніе періодическаго закона. Наиваж-
н?йшая^заслуга періодическаго закона состоитъ въ томъ,
что онъ упазалъ то незыблемое, основное, что евязуетг
вс? элементы, а именно массу ихъ атомовъ.
По періодическому закону, вс? свойства элементовъ
завиеятъ отъ массы ихъ атомовъ: съ перем?ною массы
должны м?няться и свойства, и, конечно, ч?мъ ближе
массы по в?су, т?мъ сходн?е должны быть элементы, и
наоборотъ. Съ возрастаніемъ массъ не все время въ
одномъ и томъ же направленіи изм?няются свойства: пе~
ріодически, чрезъ опред?леиные промежутки, свойства
повторяются, или, иначе, зависимость свойствъ элемен-
товъ отъ массы ихъ атомовъ періодическая.
Наибол?е важное посл? атомной массы въ элемен-
тахъ, что періодически изм?няется,—это ихъ способность
образовать т? или иныя формы соединеній, т.-е. ихъ
валентность. Она періодически изм?няется отъ 1 къ 8 и
распред?ляетъ вс? д?ятелыш? элементы въ 8 групяъ.
Можно сказать, что атомный в?съ и валентность—вотъ
два главн?йшихъ фактора, создающге ту или иную
физіономію элемептовъ; въ нихъ лежитъ самая
существенная причина сходствъ и различій въ элементахъ.
Сл?доватсльно, періодическій законъ не только вс?
элементы связалъ въ одинъ стройный рядъ, но и объясыилъ
вс? групповыя аналогіи и связь группъ, т.-е. сд?лалъ
понятиымъ ходъ изм?неній въ свойствахъ элементовъ и
ихъ соединеній.
А разъ все явилось объединеннымъ и стройпымъ
д?лымъ, то и каждая частность получила бол?е широкій
общій смыслъ: изсл?дованіе любого звена въ ц?пи стало
какъ бы изсл?дованіемъ д?лой ц?пи.
Графическое изображена періодической зависимости атомныхъ объемов»
и температуръ плавленія простыхъ г&лъ отъ ихъ атомныхъ в?соаъ,
1 id w м « * и w 4о м т А «и 1» г» ui і« w я* иг* уг эхо т «
Рис. 14. Жирная лйнія обозначаетъ атомпы? объемы,
тонкая—температуры (абсолютный) плавленія. Ординаты атомвыхъ объежжъ
умножены на 4,—температуръ плавленія разд?дены на, 7. Точяа, обозна-
Имфшмш хщ. чен*ая * лежитъ на 66 д?лешй вьше. щ
-- 146 —
Ьъ только что указанны хъ заслугахъ періодическій
законъ явился прежде всего выраженіемъ фактовъ въ
обобщенномъ вид?. Но въ этомъ еще только половина
его значенія. I
§ 56. рриложеніе періодическаго закона къ пред-
сказанію неизв?стныхъ элементовъ. Для общихъ
законовъ мало одного выраженія или знанія фактовъ,
необходимо обладаніе ими даже и въ томъ случа?, когда
еще они не добыты, неизвестны, т.-е. истинный законъ,
выразивъ факты, долженъ быть способенъ на основаніи
изв?стнаго предсказать неизв?стное. Въ этой возможности
и лейсигь самая высокая заслуга законовъ и
доказательство ихъ правдивости.
Въ самомъ д?л?, выше уже было сказано, какъ
періодическій законъ даетъ возможность по свойствамъ
опред?лять и пров?рять атомные в?са мало изсл?дован-
пыхъ, но изв?стныхъ элементовъ, для которыхъ прямыя
опред?ленія почему-либо затруднены.
„Такъ истинный законъ природы предупреждаете
фактъ, угадываетъ число, даетъ обладаніе природою,
заставляем улучшать методы наблюденія и т. п.". Этими
словами заключаете Д. И. Мендел?евъ г) рубрику объ
исправлены атомныхъ в?совъ на основаніи
періодическаго закона.
До періодическаго закона ничто, кром? прямого опыта,
не указывало впередъ на необходимость существованія
какихъ-нибудь еще неизв?стныхъ элементовъ и, конечно,
т?мъ бол?е на свойства неизв?стныхъ элементовъ и
ихъ соединеній. Благодаря періодическому закону, д?ло
изм?нилось: пе видя и не изсл?дуя ничего въ лаборато-
ріи, оказалось возможнымъ не только предсказать суще-
ствованіе неизв?стныхъ элементовъ, но и точно описать
ихъ свойства и ихъ соединенія.
Выше было вскользь упомянуто, что, когда
устанавливалась періодическая система, число незанятыхъ м?стъ
*) «Основы химіи»; 466 стр., 15 прим?чаніе.
— 147 —
въ ней было бол?е. ч?мъ теперь. Такъ, въ 4 горизэн-
тальномъ ряду, въ 3 гр., между Са и Ті недоставало
одного элемента, а въ 5 ряду не хватало двухъ элемен-
товъ—одного въ 3-й гр., а другого въ 4-й гр.
Д. И, Мендел?евъ, указывая на эти проб?лы (въ
1871 г.), предсказалъ существованіе недостающихъ трехъ
элементовъ и теоретически вывелъ всЬ ихъ свойства,
совершенно справедливо полагая, что они суть средніе
между ближайшими сос?дними элементами: для 1-го,
который онъ тогда назвалъ эка-боромъ 5)—между Са, Ті, В
и V, для второго—эка-алюминія—между Zn и As, А1 и
In, и для третьяго эка-силиція—между Zn, As, Si, и Sn.
Недолго заставили себя ждать и оправданія такихъ
предсказаній. Прошло всего четыре года носл? предска-
занія, а именно въ 1875 году, во Франціи, Лекокъ де-
Буабодранъ (Lecoq de Boisbaudran) открылъ въ цинковой
обманк? новый элементъ галлш, оказавіпійся по вс?мъ
свойствамъ совершенно тождественнымъ 2) съ эка-алюми-
ніемъ Мендел?ева. Въ 1879 году Нильсонэмъ (Nilson),
въ Швеціи, между церитовыми* металлами былъ открыть
элементъ скандій, тождественный съ эка-боромъ, и, на-
конецъ, въ 1886 году Винклеромъ (Winkler), въ Герма-
ніи, въ саксонскомъ минерал? аргиродит? пайдемъ былъ
и третій предсказанный элементъ — эка-силицій, назван-
ный германіемъ.
*) Неизв?стные элементы М?ндел?евъ прелложилъ назвать по
имени предш?ствующаго изв?стнаго элемента той же группы съ
предварительной приставкой «эка», что значить по-санскритски одинъ,
2) Въ первомъ своемъ сообщеніи о галлі? Лекокъ де-Буабодранъ
описалъ физическія свойства его самого и свойства н?которыхъ его
соединеній отлично отъ предсказаній Менд?л?ова. Но посл?дтй вы-
сказалъ ув?ренность, что разногласі? зд?сь получалось оттого, что
изел?дователь не довелъ очистку новаго элемента до надлежащей
степени. И д?йствителыю, когда, посл? этого указанія Мендел?ева,
Лекокъ де-Буабодранъ очистилъ галлій надлежащимъ образомъ, то
вс? его свойства оказались точно совпавшими со свойствами,
предсказанными Меядел?евымъ.
10*
— 148 -
Чтобы им?ть представление относительно точности
предсказаній, приведемъ хоть одинъ прим?ръ:
Въ 1871 году Д. И. Мен-
дел?евъ (Ж. Р. X. О., стр.
50) писалъ: эка - силицій
долженъ обладать атомнымъ
в?сомъ Es—72, потому что
за нимъ сл?дуетъ As — 75.
По свойствамъ средній
между кремніемъ и оловомъ.
Довольно легко возстано-
вляется изъ Е=>02 и K2EsT6.
Уд?льный в?съ около 5,5.
Это будетъ плавкійметаллъ,
способный въ сильномъ
жару улетучиваться и
окислиться. Атомный объемъ
его долженъ быть лишь
немного больше 13.
Es02 долженъ быть съ
уд?льнымъ в?сомъ близ-
кимъ къ 4,7.
EsCl4 долженъ
разлагаться водой какъ SiCl4 и
SnCl4; уд?льный в?съ его
будетъ около 1;9. Точка
кип?нія близка къ 90°.
Въ 1886 году Винклеръ
(Вері. Вег. 19, Ref. 652) о
свойствахъ германія гово-
ритъ сл?дующее: металли-
ческій германій получается
возстановленіемъ окиси во-
дородомъ или крахмаломъ
и сплавленіемъ получаема-
го с?рнаго порошка подъ
бурою. Плавится около 900°
и немного выше
улетучивается. Уд?лышй в?съ
5,469 при 20,4°, атомный
в?съ 72,32. Атомный
объемъ его равенъ 13,1.
Ge02 получается гор?-
ніемъ или окисленіемъ
азотного кислотою металла;
уд?льный в?съ Ge02 4,703
при 18°.
GeCl4 образуетъ безцв?т-
ную жидкость уд?льнаго
в?са 1,887 при 18°,
которая кипитъ при 86°.
Какъ видно, предсказанное вполн? совпало съ д?й-
ствительнымъ. Самъ Д. И. Мендел?евъ опред?ляетъ
значеніе періодическаго закона въ сл?дующихъ словахъ:
„Періодическій законъ,—говоритъ Д. И. Мейдел?евъ,—
не только обнялъ взаимныя отношенія элементовъ и вы-
разилъ ихъ сходство, но и придалъ н?которуЮ
законченность ученію о формахъ соединеній, образуемыхъ
элементами, позволилъ вид?ть правильность въ изм?иеніи
— 149 —
веякихъ химическихъ и физическихъ свойства простыхъ
и сложныхъ т?лъ и далъ возможность предугадать
свойства еще опытомъ не изученныхъ простыхъ и сложныхъ
т?лъ; а потому подготовляетъ почву для построения
атомной и частичной механики" *),
Познакомившись съ содержаніемъ и значеніемъ періо-
дическаго закона, мы въ прав? спросить себя: все ли
ясно въ этомъ закон? природы, все ли онъ сказалъ изъ
того, что невольно запрашиваетъ нашъ умъ? Къ сожа-
л?нію, далеко не все!
Подведя химическія явленія въ зависимость отъ массъ,
онъ блестяще уясиилъ законом?рносшь въ этой
зависимости, но онъ ничего не сказалъ, почему такъ или иначе
вліяютъ различный массы, т.-е. не далъ настоящего по-
ниманія внутренней связи между массами и свойствами.
Указавши, что зависимость зд?сь не прямая, а періо-
дическая, онъ не объяснилъ, почему она именно періо-
дическая.
Чрезвычайно характерно, между *прочимъ, для періо-
дичности въ данномъ случа? то, что она ид?тъ не
непрерывно (какъ въ другихъ случаяхъ, гд? какая-нибудь
переменная изм?няется непрерывно, другая же
возрастаете и убываетъ періодически), а разрывно; при этомъ
одинаковые скачки или разности между массами не всегда
влекутъ за собою одинаковые результаты въ изм?неніяхъ
свойствъ.
Вс? эги вопросы существенные, основные, а на нихъ-то
и не находится отв?та въ періодическомъ закон?.
Д. И. Мендел?евъ на вс? эти запросы отв?чаетъ такъ:
„Что же касается до отсутствія какого-либо объясне-
нія сущности разсматриваемаго закона, то причину тому
должно искать прежде всего въ отсутствіи точнаго для
него выраженія. Онъ рисуется нын? въ вид? новой,
!) «Основы химіи», 475 стр.—На построеніи химіи на основа-
ніяхъ механики, какъ изв?стно, еще въ первой половин? XVIII в?ка
уб?жденно настаивалъ М. В. Ломоносовъ.
— 150 —
отчасти только раскрытой, глубокой тайны природы, въ
которой намъ дана возможность постигать законы, но
очень мало возможности постигать истинную причину
этихъ законовъ. Такъ, законъ тягот?нія изв?стенъ уже
два стол?тія, но вс? попытки его объясненія — донын?
мало удачны. Эти тайны природы составляютъ высшій
интересе точныхъ наукъ, кладутъ на нихъ особый отде-
чатокъ и д?лаютъ изученіе естествознанія, въ отличіе
отъ классическаго пріема знаній, залогомъ ум?нія
сочетать и подчинять реально-понятное съ идеально-в?чнымъ
и общимъ, а потому и кажущимся недонятяымъ. Сло-
вомъ, широкая приложимость періодическаго закона при
отсутствіи пониманія его причины есть одинъ изъ
указателей того, что онъ очень новъ и глубоко проникаетъ
ьъ природу химическихъ явленій, и я, какъ русскій,
горжусь т?мъ, что участвовать въ его установленіи" 1).
і) Безупречна ли періодическая система въ расположеніи элемен-
товъ? Н?тъ; въ ней есть н?коіорыя непосл?довательности, которыя
должнаго объясненія пока не им?ютъ. Въ качеств? прим?ровъ можно
указать на подоженія теллура и іода — во-п?рвыхъ, кобальта и
Кинкеля—во-вторыхъ, аргона и калія—въ-тр?тьихъ. Что касается теллура
и іода, кобальта и никкеля, то надо думать, что ихъ атомные в?са
еще не вполн? точно опред?лены. Объ атомныхъ в?сахъ никкеля
и кобальта самъ Мендел?евъ д?лаетъ сл?дующее зам?чаніе: «Для
Дті находится атомный в?съ 58,7, но такъ какъ этотъ металлъ, судя
по свойствамъ, долженъ сл?довать за кобальтомъ =: 59, то у него
д ^лжно ждать атомнаго в?са не меньшаго, а большаго, ч?мъ для Со,
а потому для Со и Ni при дальн?йшихъ изсл?дованіяхъ можно ждать
н?котораго (небольшого) изм?ненія атомнаго в?са>. Аргонъ (ат. в.
Г9,88) неправильно стоить передъ К (ат. в. 39,10). А. Горбовъ
кХимическі? элементы»... стр. 40і) по этому поводу высказыва?тъ
сл?дующіЯу заслуживающія вниманія, соображенія: «Несмотря на то
ч'ю Ramsay высказался не только за элементарную натуру аргона,
но и за элементарность всей группы инертныхъ газовъ и пом?стилъ
ихъ (въ 1901 г.) въ періодической систем? между галоидами и
щелочными металлами, съ ч?мъ впосл?дствіи согласился и Мендел?евъ,—
я думаю, что въ настоящее время, въ виду наблюденій Ramsay съ
Soddy и Ramsay'fl съ Сатегоп'омъ надъ превращеніемъ гелія въ
неонъ и аргонъ, вопросъ этотъ требуетъ пересмотра. Если даже счи-
СПЕЩАЛЬНАЯ ЧАСТЬ.
Водородъ, Н.
м
Атомн. в?съ Н = 1,008; молекул, в?съ Н = 2,016; уд, в?съ
(воздуха — 1) 0,06956; уд. в?съ (Н = 1)= 1; в?съ 1 литра при 00 и 760 мм.
давл?нія = 0,08987 гр.; крит. темп. — 234°; темп, кип. — 252,7; темп,
плав.— "258; въ 100 об. воды при Ш расгв. 1,9 об. водорода. Открыть
въ XVI в. ГГарацельсомъ; выд?ленъ въ 1766 г. Кавендидіемъ.
§ 57. Водородъ въ свобоц-
номъ состояніи встр?чается въ
природ? очень р?дко; такъ,
онъ находится въ фотосфер?
солнца, обусловливая такъ
называемые протуберансы; на
земл? свободнымъ онъ
находится въ небольшихъ количе-
ствахъ въ воздух? (около'
0,0033°/0) и въ вулканиче-
скихъ газахъ; входитъ также
въ составъ газовъ, выходя-
щихъ изъ буровыхъ скважинъ
вм?ст? съ нефтью, а иногда
образуется при гніеніи безъ
доступа воздуха водородъ со-
держащихъ веществъ. Зато въ
соединеніяхъ онъ очень
распространен^ такъ, въ вод?
онъ составляетъ а/э часть ея
в?са; зат?мъ входитъ въ со-
Рис. 15. Аппаратъ Гофмана
для разложенія воды.
тать гелій за особый элементъ, то нельзя, не отбрасывая
общепринятая опред?ленія элемента и не зам?няя его новымъ опред?леніемъ,
признать за элементы неонъ и аргонъ: ихъ можно только считать иди
— 152 -
ставъ веществъ, образующихъ организмы какъ живот-
ныхъ (80°/0), такъ и растеній (90°/0)э и веществъ, соста-
вляющихъ нефть; констатярованъ и въ н?которыгь ме-
теоритахъ.
Полуценіе: 1. Вода, какъ широко распространенный
и дешевіш матеріалъ, казалось бы. могла служить источ-
никомъ для полученія водорода. Изъ воды водородъ можно
получить: а) путемъ ея электролиза, при чемъ водородъ
выд?ляется на отрицательномъ полюс? (рис. 15); Ь)д?й-
ствіемъ на нее металловъ калія, натрія, кальдія и др.
особыми состояніями г?лія, или же продуктами со?диненія его *съ
какими-нибудь элементами, или же, наконецъ, результатами двойного
обм?на гедія тоже съ другими элементами, при чемъ Ramsay и
Cameron подозр?ваютъ учасгіе м?ди въ процесс? образования неона и
аргона. Съ своей стороны, я обращаю вниманіе на ускользнувшее
повидимому, отъ другихъ обстоятельство, что такъ называемые
атомные в?са гелія, неона и аргона, а именно: 3,99; 20,08 и 40,24, можно
считать, въ пред?лахъ ошибокъ опыта, кратными другъ отъ друга;
во всякомъ случа? эта кратность несомн?нна для неона съ аргономъ,
и едва ли ихъ отношеніе можно приравнять, напр., отношенію атом-
ныхъ в?совъ кислорода съ с?рой (гд? кратность то же какъ будто
им?ется), потому что при громадномъ числ? наблюд?ній, лроизведен-
ныхъ надъ посл?дними т?лами, въ высшей степени мало в?роятія
допустить, что они могутъ превращаться другъ въ друга, но что
случайно необходимый для этого контактный агентъ еще не найденъ.
Если ж? аргонъ полимеръ гелія, или хотя бы неона, то вопросъ о
несогласіи цифръ 40,24 и 39,15 съ періодическимъ закояомъ отпа-
даетъ вполн?, потому что аргонъ не можетъ тогда им?ть м?ста въ
таблиц? олементовъ». Во всякомъ случа?, на что уже обращалъ
вниманіе Ріссіпі, величины: 3,99; 20,08; 40,24, а равно граммъ-молеку-
лярны? в?са криптона и ксенона, съ химической точки зр?нія, не
могутъ считаться атомными вшами гелія, неона, аргона, криптона
и ксенона, такъ какъ, по опред?ленію, атомный в?съ есть
наименьшей в?съ, съ которымъ данный элем?нтъ входитъ въ составь
химически сложныхъ молекулъ, а никакихъ химич?скихъ соединеній для
этихъ гаэообразныхъ т?лъ пока не получено». <
Есть и другія — бол?? мелкія несовершенства въ періодической
систем?, напр., положені? Аи и Си въ 1 тр., РЬ — въ 4-ой, а не во
2-ой гр., Ві— въ 5-ой, а не въ 3-й тр.; но о характ?р? этихъ эле-
ментовъ буд?тъ сказано въ соотв?тственныхъ главахъ.
— 153 —
Посл?дняя р?акція выражается сл?дующимъ уравне-
ніемъ:
Н,0+К=КОД + Н1).
Выд?ляющійся при этомъ водородъ можно собрать,
если производить опытъ сл?дующимъ образомъ:
стеклянный цилиндръ, наполненный водой, опрокидываютъ въ
ванну съ водой, и подъ цилиндръ щипцами съ чашечками
на концахъ подводятъ кусочекъ (не крупн?? горошины)
К или Na (рис. 16); при раскрываніи щипцовъ кусочекъ
металла (какъ бол?е легкій, ч?мъ вода) быстро всплываетъ
въ верхъ цилиндра и зд?сь реагируетъ, выд?ляя изъ
воды Н, а посл?дній, накопляясь, выт?сняетъ изъ
цилиндра ту воду, которая не усп?ла прореагировать. Вм?-
сто самыхъ металловъ К и Na 2) можно брать ихъ сплавы
со ртутью (такіе сплавы называются амальгамами); тогда
разложеніе идетъ медленн?е и бол?е безопасно
относительно иногда бывающихъ при этой реакціи взрывовъ;
ртуть при этомъ не участвуете въ реакціи, а выд?ляется
въ свободномъ вид?.
с) Другіе металлы могутъ также служить для получе-
нія водорода изъ воды. Наприм?ръ, магній разлагаетъ
воду при температур? ея кип?нія: жел?зо начинаетъ
разлагать воду лишь при температур? краснаго кале-
нія. На рисунк? 17 изображенъ приборъ, въ которомъ
легко показать посл?дній опытъ: въ реторточк? а
образуется при кипячеиіи воды водяной паръ, который за-
т?мъ пропускается чрезъ раскаленную докрасна
фарфоровую трубку съ жел?зными стружками; образующійся
і) Точн?е: 2Н20 + 2К = 2КОН + Н3, такъ какъ молекула
водорода содержись два атома.
2) Еще б?зопасн?е и удобн?е производить подобный опытъ съ
м?таллическимъ кальціемъ: посл?дній сильно понизился въ своей ц?н?
(100 гр. стоятъ 2*/2 марки), а потому и стадъ доступенъ для ц?лей
эксперимента. '
- 154 —
V.
(по уравкенію: 3Fe + 4Н20 = Fe304 +• 4Н2) водородь
собирается вь дилиндр?.
Уголь (коксъ) при высокой температур? (около 100°)
также мо^етъ разлагать воду, выд?ляя водородъ и
другое газообразное вещество — оаись углерода —по сл?ду-
ющему уравненію:
C-f H20 = 2H-f СО;
см?сь посл?днихъ двухъ газовъ называется водянымъ
іазомъ. Водяной газъ при гор?ніи развиваетъ большое
Рис. 16. Получоню іюдорода при разложенш воды
калі?мъ или натріемъ.
количество тепла и потому прим?няется въ техник? для
нагр?ванія.
Но вс? предыдущіе способы полученія водорода изъ
воды или дороги, или сложны по обстановк?, или же,
наконецъ, даютъ нечистый водородъ.
— 155 —
2. Наибол?е удобнымъ и обычнымъ способомъ добы-
ванія водорода служить д?йспьсіе металло?ъ па
кислоты 1). Наприм?ръ:
Zn + H2S04 = ZnS04 -f Н2,
или
Fe + H2S04-=FeS04 + H2.
Эта реакція ведется или въ прибор?, изображенномъ
на рис. 18, понятномъ безъ описанія, или въ такъ
называемом!, аппарат? Киппа, изображенномъ на рис. 19.
Рис. 17. Разложеніе воды ж?л?зомъ.
( Ириборъ этотъ состоитъ изъ трехъ стеклянныхъ ша-
ровъ: два нижніе Ъ и d соединяются пер?хватомъ, тре-
тій—верхній е при помощи длинной трубки вставляется
плотно въ горло средняго шара, у котораго есть другое
боковое отверстіе с, служащее для накладыванія кусковъ
цинка 2) и для выхода развивающагося въ аппарат? газа.
!) При д?йствіи щелочей на н?которые металлы, какъ, напр., на Za
А1, Sn и др., также получается водородъ по уравненію, напр., для
цинка и ?дкаго калія: Zn -)- 2КОН = Zd(OK)2 + 2Н.
2j Если въ р?акцію взять чистый цинкъ, то реагировані? его,
скоро останавливается, такъ какъ поверхность чистаго металла
покрывается слоемъ мелкихъ пузырьковъ водорода, образующихъ какъ
бы пленку, не допускающую дальн?йшаго д?йствія кислоты; для устра-
ненія этого неудобства вводятъ въ сферу реакціи какой-нибудь дру-
— 156 —
Необходимая для реакдіи кислота (для этой д?ли 1 объ-
емъ кр?пкой H2S04 разводятъ 3—5 объемами воды)
приливается чрезъ верхнее горло третьяго шара. При нали-
ваніи кислоты необходимо, конечно, открыть кранъ около с
для чыхоДа воздуха. Когда кислота наполнить нижній
шаръ d и достигнешь до цинка, во второмъ шар? Ъ
начинается выше написанная реакція сь выд?леніемъ газо-
образнаго водорода; который можетъ выйти только
через ь трубку въ горл?. Если выходное отверстіе, регули-
Рис. 18. Получені? водорода изъ Рис. 19. Апяаратъ Кшіпа для
Zn и H2S04. полученія водорода.
руемое краномъ, закрыть, то внутри Шара Ь отъ выд?-
ляющагося водорода развивается давленіе, которое д?й-
ствуетъ на жидкость и отт?сняетъ ее внизъ, а она, не
им?я другого выхода, поднимается въ верхній шаръ.
Такимъ образомъ цинкъ иерестаетъ соприкасаться съ
гой металлъ (напр., платину), который игралъ бы по отногаенію къ
цинку роль катода: тогда образуется галъваническій элементъ, и
пузырьки водорода будутъ собираться на катод?-платинь1, и цинкъ бу-
детъ доступеяъ д?йствіго кислоты.
— 157 —
кислотой, и выд?леніе водорода прекращается.
Полученный такимъ путемъ водородъ а) не совс?мъ чистъ,
благодаря прим?сямъ 2), находившимся въ цинк?, жел?з? и с?р-
ной кислот?, и парамъ воды, которые онъ механически
увлекаетъ съ собою. Чтобы очистить водородъ отъ при-
м?сей, надо пропустить его чрезъ рядъ поглотительныхъ
приборовъ, подобныхъ нарисованному (а) при ашіарат?.
Рис. 20. Склянка Вульфа. Рис. 21. Склянка Др?кселя.
§ 58. Приборы. Для осушенія газъ обыкновенно про-
пускаютъ чрезъ дву- или трехгорлую склянку Вульфа
(рис. 20) или чрезъ склянку Дрекселя (Drechsel) (рис. 21),
*) Первыя порціи водорода, выходящаго изъ аппарата, бываютъ
смвшаны съ воздухомъ, а потому для изсл?дованія ихъ брать не сл?-
дуетъ: при зажиганіи такой см?си происходитъ взрывъ. Уб?диться,
что идетъ чистый водородъ, можно сл?дующимъ пріемомъ: приготовить
въ ч&шечкЪ мыльную воду и пустить въ нее водородъ; зат?мъ, отойдя
съ чашечкой отъ аппарата, къ полученному небольшому пузырьку
поднести горящую лучинку; если въ мыльномъ пузырьк? будетъ см?сь
воздуха съ водородомъ, то произойдетъ слабый взрывъ, если же въ
пузырьк?—чистый водородъ, то гор?ніе произойдетъ безъ взрыва.
2) Въ качеств? прим?с?й бываютъ; мышьяковистый водородъ,
фосфористый водородъ, окислы азота, с?рнистый газъ и с?роводородъ.
Для очищенія отъ этихъ прим?сей водородъ пропускаютъ чрезъ
растворы; КМп04, КОН, Pb(N03)2, AgK03, H2S04 и др.
— 158 —
на дно которыхъ налито кр?пкой с?рной кислоты.
Осушаемый газъ пропускается чрезъ трубку, доходящую до
дна склянки, промывается въ кислот? и осушенный
выходить чрезъ трубку, оканчивающуюся у самой пробки.
Иногда газъ для осушенія же пропускаюсь чрезъ U-об-
разную трубку, наполненную хлористымъ кальціемъ. Для
сохраненія сухой газъ собираютъ въ опрокинутомъ ци-
яиндр?.надъ ртутью. Если же не требуется сухого газа,
то его собираютъ надъ водой — въ газометрах*.
Газометръ (рис. 22)
состоитъ изъ стекляннаго
сосуда с, который иы?етъ
2 тубуса вверху и одинъ
внизу. Во вс? три тубуса
вставляются плотно при-
шлйфованныя части: въ
средній, верхній тубусъ —
воронка съ краномъ и
съ трубкой, доходящей
почти до дна сосуда, въ
боковой верхній, — тоже
трубка съ краномъ, а въ
нижній—пробка. Прежде
ч?мъ наполнять газомъ,
сперва наливаютъ
газометръ водою чрезъ
воронку, для чего должны
быть открыты оба верхніе крана, а нижнее отверстіе,
наоборотъ, закрыто пробкой, Когда вода выт?снитъ весь
воздухъ, наполнивши нижній сосудъ доверху, закрываюсь
оба крана. Для наполненія газомъ открываюсь нижнее
отверстіе и вставляюсь чрезъ него конецъ трубки,
приводящей газъ. Наполненіе производится настолько, чтобы
внизу оставался слой воды (на уровн? нижняго тубуса),
отд?ляющій газъ внутри сосуда отъ воздуха. Если закрыть
нижнее отверстіе, то получится герметически закрытый
Рис. 22. Стеклянный газометръ.
— 159 —
сосудъ съ газомъ, который такимъ образомъ и можно
сохранять. Для выпусканія этого газа наливаютъ воды
въ воронку и, открывая кранъ посл?дней, т?мъ сообща-
ютъ ему давленіе, равное атмосферному, плюсъ давленіе
столба воды. Сжатый такимъ образомъ газъ внутри
газометра, при открываніи другого крана, будетъ выходить
подъ давленіемъ.
Въ технип? большое количество водорода получается
въ качеств? побочнаго продукта при электрическомъ спо-
соб? полученія КОИ изъ воднаго раствора хлористаго
калія. Такой водородъ поступаетъ въ продажу въ сталь-
ныхъ бомбахъ, гд? онъ находится подъ давл?ніемъ въ
100 атмосферъ.)
§ 59. Физи'ческія свойства водорода. Водородъ есть
безцв?тный газъ безъ запаха и вкуса. Онъ очень легокъ,
въ 14,435 разъ легче воздуха. 1 литръ его при 0° и
760 мм. давленія в?ситъ 0,08987 гр.; уд?льн. в?съ по
отношенію къ воздуху —0,06956. 1 гр. водорода при 0°
и 760 мм. давленія занимаетъ 11,2 куб. сантимегровъ.
Какъ самый легкій газъ,'водородъ принимается за
единицу для уд?льнаго в?са
газовъ. Въ легкости водорода
можно уб?диться какъ взв?-
шиваиіемъ его на в?сахъ2),
такъ и на малыхъ пузырькахъ,
наполненныхъ водородомъ:
посл?дні? въ силу легкости
водорода летятъ кверху. Поль- Рис. 23. Переливаніе водорода.
зуясь легкостью водорода,
можно переливать его въ перевернутый кверху дномъ
сосудъ, какъ это показано на рис. 23.
і) Этотъ оііыгь производится такъ: къ одному плечу коромысла
чувствительныхъ в?совъ прикр?пляютъ перевернутый кверху дномъ
стаканъ и уравнов?шиваютъ его в?съ какимъ-нибудь грузомъ; зат?мъ
впускаютъ въ стаканъ водородъ, при чемъ сейчасъ же равнов?сіе
нарушается: при замЬн? воздуха стакана водородомъ в?съ стакана
меньшается.
— 160 —
Водородъ лучше другихъ газовъ подчиняется законамъ
Бойля-Маріотта и Гей-Люссака и очень трудно сгущается.
Только въ 1878 году Пикте (Pictet) и Кальете (Cailletet)
удалось сгустить его въ жидкость при совм?стномъ д?й-
ствіи охлажденія и сильнаго давленія. Но эти ученые не
могли получить водорода въ вид? постоянной жидкости,
а вид?ли жидкій водородъ только въ вид? струи,
вырывающейся изъ крана и сейчасъ же испаряющейся.
Въ 1898 г. Дыоаръ (Dewar) получилъ жидкій
водородъ въ болыпомъ количеств?, пользуясь низкою
температурой а), легко достигаемой предварительнымъ сдавли-
ваніемъ газа и посл?дующимъ его расширеніемъ;
критическая температура водорода лежитъ при — 234,5°;
критическое давленіе около 15 атмосферъ.
Жидкій водородъ представляетъ безцв?тную легкую
жидкость уд?льнаго в?са (по отношенію къ вод? 0,07 и
кипитъ подъ атмосфернымъ давленіемъ при—252,7°, при—
'258° водородъ замерзаетъ 2); уд?л. в?съ твердаго водо-
рода = 0,0763.
Водородъ наимен?е плотный изъ вс?хъ изв?стныхъ
газовъ. Плотность его принята за единицу. (Малую
плотность водорода можно показать на сл?дующемъ опыт?.
Еакъ изв?стно, скорости диффузіи газовъ обратно про-
порціональни корнлмъ нвадратнымъ изъ гтъ
плотностей (законъ Грема (Graham); см. 60 стр.). Водородъ же
*) Дьюаръ предварительно при помощи быстро испарявшагося
жидкаго воздуха охладилъ водородъ ниже критической его
температуры. Критической температурой газа называютъ ту особую для
каждаго вещества температуру, выше которой онъ ни при какомъ
давленіи не превращается въ жидкое состояні?.
2) Самая низкая температура, которой удалось достигнуть, равна
—271,50. Сравнительно небольшія низкія температуры въ лабораторной
практик? достигаются такъ наз. охладительными см?сями: такъ,
см?сь 3 частей сн?га съ 1 ч. поваренной соли даетъ охлаждені?
до—210, а см?сь изъ 10 ч. кристаллическаго хлористаго кальція
(СаС12. 6Н20) и 7 ч. сн?га показываетъ—55"; сильное охлажденіе
получается также при раствореніи NH4N03 или KCNS въ вод?.
— 161 —
въ 14,435 разъ мен?е плотенъ, ч?мъ" воздухъ; поэтому
онъ будеть диффундировать въ j/14,435, т.-е. почти въ
4 раза скор?е, ч?мъ воздухъ. Опытъ ведутъ такимъ об-
разомъ: пористый цилиндръ (рис. 24),
соединенный при помощи трубки а
съ сосудомъ, наполнениымъ
подкрашенною водой, накрываютъ стеклян-
нымъ стаканомъ Ъ и подъ стаканъ
подводятъ струю водорода. Благодаря
способности водорода прюникать
чрезъ пористую ст?нку сосуда
скор?е, ч?мъ воздухъ можетъ выходить
обратно, газовое давл?ніе внутри
пористаго цилиндра настолько
увеличивается, что вода начинаешь
выбрасываться съ силой, наподобіо
фонтана. Снявши съ цилиндра
стеклянный стаканъ, мы получимъ
вокругъ пористаго сосуда
обыкновенную воздушную атмосферу, въ
которую начнетъ выделяться водо-
родъ изъ цилиндра. Это обусловитъ
въ немъ разр?женіе настолько
сильное, что чрезъ выходное отверстіе
прибора начнетъ всасываться
воздухъ. Над?вая вновь стаканъ на
цилиндръ и приводя опять водо-
родъ, мы увидимъ повтореніе фон- Рис* 24, ДиФФУзія вод°-
тана.
Легкость диффузіи водорода можно также вид?ть на
прибор? Анзеля, служащемъ для открытія въ рудникахъ
газовъ, такъ же легко диффундирующихъ, какъ и водо-
родъ. Приборъ этотъ состоитъ (рис. 25) изъ чашки а,
покрытой пористою крышкой, и изъ стекляннаю
баллона Ъ. Чашка а и баллонъ Ъ соединены между собою
трубкой (она внутри подставки) и наполнены ртутью,
Неорганическая химія, 11
— 162 —
которая, однако, наполняете ихъ не доверху. Въ баллонъ
пропущена и гла, которая немного не касается уровня
ртути. Игла соединена съ однимъ электродомъ батареи,
ея другой электродъ пропущенъ въ с. Въ ц?пь введенъ
электриёескій звонокъ. Въ обычныхъ условіяхъ д?пь
разомкнута, и звонокъ не звонитъ. Но если приборъ
ввести въ атмосферу газа легче диффундирующаго, ч?мъ
воздухъ (напримЪръ, направить на пористую крышку
струю водорода), то давленіе внутри чашки а повышается,
всл?дствіе чего уровень ртути въ баллон? Ъ повышается
и приходить въ соприкосновеніе съ иглой: ц?пь
замыкается, является токъ, и звонокъ начинаетъ звонить,
предупреждая о грозящей рудокопамъ опасности, j
Изъ другихъ физическихъ свойствъ водорода важно
отм?тить его большую
тепло- и
электропроводность, что
характерно для металловъ.
Водородъ мало рас-
творимъ вь вод? а);
100 объемовъ воды
при 0° и 760 мм. рас-
творяютъ 2,15 объема
водорода.
Рис. 25. Приборъ Анзеля. § 60. ХИМИЧ?СШЯ
свойства водорода.
Изъ химическихъ свойствъ водорода прежде всего сл?-
дуетъ отм?тить его индифферентность при обыкновенной
температур?: при этомъ условіи онъ р?дко вступаетъ въ
реакціи, а если и реагируетъ, то очень слабо; только
съ фторомъ реакція идетъ энергично. При повышенной
температур?, а также при увеличенномъ давленіи, при
д?йствіи св?та, равно какъ и въ моментъ своего выд?-
*) Сл?дуетъ зам?тить, что, вообще, вс? трудно сжимаемые газы
отличаются малой растворимостью въ вод?.
— 163 —
ч
л?нія или въ присугствіи катализаторовъ (наприм?ръ,
губчатой платины), водородъ реагируетъ очень энергично.
Водородъ_ моясетъ гор?ть, то-есть способенъ
соединяться съ кислородомъ съ образованіемъ воды 2):
H2-fO = H20.
Гор?ніе водорода совершается только нри
предварительно мъ повыіпеніи (600°) температуры (поднесеніе
горящей спички къ водороду); при реакціи гор?нія водорода
выд?ляется большое количество
теплоты— около 2.500 — 2.800° 2).
При повышенной же температур?
(или въ моментъ выд?ленія)
водородъ часто способенъ отнимать
кислородъ даже отъ соединеній,
въ чемъ можно было уб?диться,
наприм?ръ, при опыт? разложенія
малахита (см. стр. 13): отъ чернаго
порошка окиси м?ди (СиО) водородъ
отнималъ кислородъ, образуя воду
и выд?ляя свободную м?дь по сл?-
дующему уравненію:
CuO + H2 = H20 + Cu.
Такое д?йствіе водорода на окислы металловъ
называется реакціей возстаповлепія*
(Въ атмосфер? водорода большинство т?лъ не горыть,
в? чемъ можно уб?диться на сл?дующемъ опыт?: въ ци-
линдръ (рис. 26), наполненный водородомъ и
перевернутый дномъ кверху, вводятъ зажженную св?чу: водородъ
у отверстія загорается, а св?чка въ цилиндр? гаснетъ.
Рис. 26. Потуханіе
св?чки въ атмосфер?
водорода.
і) Отсюда названіе—водородъ.
2) Пламя горящаго водорода бл?дное, несв?тящееся; для подуч?*
нія этого пламени надо водородъ выпускать чрезъ платиновый нако-
кечкикъ, такъ какъ при вшіусканіи чрезъ стеклянную трубку
получается пламя желтое отъ присутствія въ немъ паровъ натрія,
находящаяся въ стекл?.
И*
— 164 —
Въ томъ, что водородъ при гор?ніи (точн?е — при
соединеніи съ кислородомъ) образуетъ воду, уб?ждаются
въ сл?дующемъ опыт? (рис. 27). Сухой водородъ
заставляют^ сгорать подъ воронкой с, соединенной трубкой d
съ U-образною трубкой е; воронка быстро покрывается
мелкими каплями воды; если при помощи воздушнаго
Рис. 27. Образованіе воды при гор?ніи водорода.
насоса просасывать чр?зъ приборъ воздухъ, то пары бу-
дутъ увлекаться токомъ воздуха, и вода соберется въ
U-образной трубк?. /
Кром? кислорода, водородъ легче всего соединяется
съ металлоидами, напр., съ хлоромъ, с?рой и др.
Водородъ способенъ 1) поглощаться н?которыми ме-
(галлами, особенно палладіемъ (до 900 объемовъ) и
платиной (лучше—губчатой); водородъ удерживается
металлами лишь при обыкновенной температур?, а при по-
*) Способность металдовъ поглощать водородъ называется
окклюзгей.
— 165 —
вышеніи ея вновь выд?ляется. Такія соединенія подобны
сплавамъ.
/ На посл?днемъ свойств? основано устройство водо-
pd-днаго огнива Деберейнера (Doebereiner). Приборъ этотъ
(рис. 28) состоитъ изъ стекляннаго сосуда с, закрытаго
крышкою, въ которой при-
кр?пленъ другой стеклянный
сосудъ &, им?ющій форму без-
доннаго графина; этотъ
сосудъ закрытъ пробкой, въ
которой находится узкая трубка,
снабженная краномъ; въ со-
суд? пов?шенъ на проволок?
кусокъ цинка. Наливши въ
сосудъ с с?рной кислоты, см?-
шанной съ водою, опускаютъ
въ него сосудъ і, при чемъ
посредствомъ ручки с
открываюсь кранъ, чтобы вышелъ воз-'
духъ, и тогда сосудъ Ъ съ цин-
комъ погрузится въ жидкость.
При этомъ, какъ изв?стно,
начыетъ выд?ляться водородъ и выт?снитъ жидкость изъ
сосуда J вь с, такъ что черезъ н?сколько времени цинкъ
будетъ находиться вн? жидкости, и потому отд?леніе
водорода прекратится. Если теперь открыть кранъ, то
струя водорода будегъ выходить и ударять на губчатую
платину, пом?щенную въ неболыпомъ, съ одной стороны
открытомъ, цилиндр? /*; губчатая платина, сгущая въ
своихъ порахъ водородъ, раскаляется и зажигаетъ его.
По м?р? того, какь водородъ вытекаетъ изъ крана,
жидкость въ сосуд? Ъ поднимается, отчего цинкъ будетъ
опять находиться въ ней, и водородъ опять будетъ отд?-
ляться. Водородъ, направляемый на губчатую платину,
не долженъ быть см?шанъ съ воздухомъ, иначе
образуется гремучій газъ, который при прикосновеніи къ
Рис. 28. Огниво
Деберейнера.
— 166 —
платин?, воспламеняется со взрывомъ. Поэтому прежде
нужно выпускать газъ изъ сосуда Ь, закрывши /*, напри-
м?ръ, листомъ бумаги, и выпускать до т?хъ поръ, пока
сосудъ6;весь не наполнится водою; потомъ надо
закрыть кранъ и подождать, пока въ сосуд? наберется
уже въ достаточномъ количеств? чистый водородъ.
Платина въ данномъ случа? играетъ роль катализатора.)
Въ реакдіяхъ обм?ннаго разложенія водородъ изъ
соедин?ній выт?сняется многими металлами; въ свою
очередь и самъ онъ, какъ было упомянуто выше (на стр. 13),
также способенъ зам?нять н?которые металлы (напрн-
м?ръ, при д?йствіи Н на СиО).
Въ виду того, что водородъ а) хорошо проводитъ
теплоту и электричество, Ь) соединяется легче и прочн??
съ металлоидами, с) при реакдіяхъ обм?на чаще играетъ
роль металла, d) при электролиз? отлагается на отрица-
тельномъ полюс? и е) съ металлами даетъ соединенія,
подобный сплавамъ, — онъ долженъ быть поставленъ
ближе къ групп? металловъ3), такъ какъ для нихъ
именно и характерны указанный свойства.
Итакъ, водородъ можетъ быть узнанъ по его малой
плотности, по его горючести и по образованію при го-
р?ніи воды.
Прим?няется водородъ для ц?лей возстановленія, для
полученія высокой температуры (при гор?ніи), а также
въ виду его малой плотности, для наполненія воздушныхъ
шаровъ.
Задачи: 1) Сколько надо Zn и H3S04 для полученія 17 гр,
водорода, и какой объемъ займетъ выд?ленный
водородъ лри 0° и 760 мм.?
2) Сколько водорода (по в?су и объему) выд?лится изъ
100 гр. H2S04, и сколько для этого потребуется
цинка?
*) ЖидкШ и твердый водородъ, а также водородъ органическихъ
соединенш не им?етъ металлическихъ свойствъ.
— 167 ~
Металлоиды и ихъ соединенія съ водородомъ.
Галоиды х) (VII группа).
§ 61. Самые энергичные металлоиды находятся въ
седьмой групп? періодическои системы; это будутъ: фторъ(?),
хлоръ (С1), бромъ (Вг) и іодъ (J), называемые галоидами.
Элементы эти очень сходны между собой: въ природ?
они находятся ночт^ всегда вм?ст? и въ одинаковый
соединеніяхъ; въ своб^дномъ состоянш получаются оди-_
ЩЩВ]ШЗ^Ш&№&Ш&* Физическія и химическія свойства
ихъ самихъ и ихъ соединёніи'измЬняются параллельно
съ изм?неніемъ атомнаго в?са. Фторъ, атомный в?съ
которагб р-аШіъь 19Д*^естЬігачтігіэтаЦв?тный газъ, немного
тяжел?е воздуха и трудно' сгущается въ жидкость; хлоръ,_
съ атомнымъ в?сомъ 35,46,—газъ желто-зеленаго цв?та,
въ 2,45 раза тяжел?? воздуха, сравнительно" "легко
сгущается въ жидкость; бррьц>, им?ющій атомный в?съ
79,92, —жидкость красно-бураго цв?та, легко испаря- і
ющаяся, J^JoEh, съ атомнымъ в?сомъ 126,92, предста- '
вляетъ собою твердое т?ло с?ро-чернаго цв?та, дающее
при нагр?ваніи фіолетовые пары.
Изм?неніе физическихъ свойствъ эл?м?нтовъ ясн??
буд?тъ видно изъ сл?дующей таблицы.
Ат. в?съ. Уд. в. Т. кип. Т. плав. Физ. сост.
F 19,0 1,14 жидк. яря 0» as, — J 870 —2230 слегка желт, газъ
С1 35,46 1,33 с « _ 33,6»—1020 Желт.-зел. газъ.
Вг 79,92 ЗД87 * « -f 63°— 7,3« красно - бурая
жидкость.
J 126,92 4,97 тверд, при 17*» -+- 1840 -|_ Ц40 с?ро-черное тв.
вещ. съ металл.
_^_______— блескомъ 2).
і) Эти элементы легко образуютъ соли непосредственнымъ соеди-
неніемъ съ металлами, почему ихъ и называютъ солеродами или
галоидами (отъ греч. слова hals—солъ).
2) При изсл?дованіи паровъ галоидовъ при помощи спектральнаго
прибора можно вид?ть, чт0 полосы сиектра при переход? отъ F mj
п?рем?щаются въ сторону фюлетовой части спектра.
— 168 —
Изъ таблицы видно, что съ увеличеніемъ атомнаго
^?са происходитъ ""уплотненіе матеріи,""растетъ, конечно,
н тотдностіГперехода изъ одного состоянія въ другое
'•(т.-е. повышаются темп?ра^щ^^плашенія-д-вил?нія); па-
раілельно~оттГфТорТкъ "іоду сгущается и цв?тъ галоидовъ.
Обращаютъ на себя вниманіе интервалы между
атомными в?сами сос?днихъ галоидовъ; въ круглыхъ едини-
цахъ они будутъ между F и С1^= 16, между С1 и Вг = 44
и между Вг и J — 47; подобную же картину мы встрв-
тимъ и въ другихъ группахъ періодической системы.
Съ химической гторттипг}] гпттшгАутт, мйтя-длодд**»
соединяясь съ водородомъ, даютъ газообразныя соединс-
нія формулы RH, въ водныхъ растворахъ обладающія
кислотными свойствами; изъ формулы RH видно, что~~по
от^шенно""къ"нодороду вс? галоиды одновалентны; съ
металлами галоиды образуюсь соли, іГ(Ттему--в--«взвггаы
галоидами или галогенами {солеродами).
Энергія галоидовъ къ водороду (а равно и ко вс?мъ
металламъ) съ увеличеніемъ атомнаго в?са уменьшается,
такъ что въ болыпинств? случаевъ каждый посл?дующій
членъ этой группы можетъ быть выт?сненъ изъ своихъ
соединеній предыдущимъ; отношеніе же къ металлоидамъ,
какъ увидимъ дал?е, буд?тъ обратньшъ.
Такъ какъ подобное изм?неніе въ энергіи металлои-
довъ повторяется и въ сл?дующихъ группахъ, то можно
сейчасъ же установить сл?дующее правило:
Съ увеличеніемъ атомнаго в?са (атомной массы)
энергія металлоидныхъ элементовъ ш металлажъ^въ
одной и той же групп?) уменьшается: элементы
становятся все мен?е и мен?е д?ятельными, какъ
металлоиды, и приближаются по т?мъ или инымъ
\ свойствамъ къ металламъ.
— 169 —
Хлоръ CI1). J**-*
Атомный в?съ CI = 35,46. Молекул, в?съ С]2 —70,92, при темлера-
тур? б?лаго каленія 2) молекул, в?съ меньше. Темп, кип?нія—33,6°.
Темп, плавленія—102°. Уд. в?съ жидкаго хлора при 0° (вода=1)—1,33.
Плотность (возд. = Ь)=^ 2,45. Литръ газообр. хлора — 3,220 гр. Въ
большинств? соединеній одновалент?нъ, иногда же пятя или семи-
валентенъ. Открытъ впервые Шееле въ 1774 г.
§ 62. Хлоръ, по причин? своего большого сродства
къ другимъ элем?нтамъ, въ свободномъ вид? въ природ?
но встр?чается, но въ соединеніяхъ онъ довольно
распространен^ особенно въ вид? поваренной соли—соеди-
п?нія хлора съ металломъ натріемъ (NaCl)3).
Хлористый натрій (NaCl) добывается въ большомъ
количеств? изъ морской воды, изъ самосадочныхъ озеръ,
гд? онъ выпадаетъ изъ насыщенныхъ растворовъ въ вид?
такъ называемой самосадочной соли (въ Россіи—Элтон-
ско? и Баскунчакско? озера): иногда же NaCl образуетъ
д?лые пласты такъ называемой каменной соли: огромныя
залежи ея находятся, паприм?ръ, около Велички въ Га-
лиціи, близъ Стассфурта въ Г?рманіи и въ Россіи въ
Оренбургской губерніи, около Илецкой Защиты.
Полученіе. Для лолученія свободнаго хлора можно
воспользоваться поваренною солью. Въ лабораторіяхъ
обыкновенно изъ NaCl сначала получаютъ (НС1)
хлористый водородъ. Эта реакція совершается при д?йствіи
с?рной кислоты (H2S04) на NaCl по следующему уравненію,
NaCl ~^~ H2S04 = Na2S04 +- НС1>
~) При частномъ описаніи галоидовъ фторъ, какъ элемента
малодоступный и сравнительно мен?е изученный, пом?щенъ въ конц?
группы.
2) Б?лое калені? наступаетъ около 1.30О0 —1.500°; желтое —
около 1.1000, темно-красное—7000 и красное—525<>.
3) Кром? поваренной соли (NaCl), въ природ? довольно часто
встр?чаются еще сл?дующія соединенія хлора: сильвшъ (КСП, кар-
иалитъ (KCI. MgCl3. 6Н20), тахгидридъ (СаС12. 2MgCl2. 12Н20) и др.
— 170 -
Д?йствуя на хлороводородъ кислородомъ (въ момента
выд?ленія), отнимаюсь отъ него водородъ и
освобождают/в хлоръ. ^ля этого на растворъ НС1 въ вод?,
называемый соляною кислотой, д?йствуютъ веществами,
легко отдающими кислородъ. Къ такимъ веществамъ
принадлежитъ перекись марганца, формула которой Мп02
(черный порошокъ). Если перекись марганца облить
соляною кислотой, то д?йствительно кислородъ первой
отнимаетъ водородъ посл?дней, образуя дв? частицы
воды; но освободившіеся при этомъ хлоръ и марганецъ
сейчзсъ же взаимод?йствуютъ, и получается четырехъ-хло-
ристый марганецъ:
Мп02 + 4HCU- МпС14 + 2Н20.
МпС14 легко разлагается при нагр?ваніи, выд?ляя
половину хлора по сл?дующему уравненію:
MnCl4 = MnCJ2 + Cl2.
Вм?сто готовой соляной кислоты обыкновенно берутъ
см?сь, изъ которой она готовится, именно — поваренную
соль NaCl и с?рную кислоту—H2S04. Въ колбу (рис. 29)
пом?щаютъ см?сь NaCl (2 ч.), H2S04 (2 ч.) и Мп02 (1 ч.,
и слегка подогр?ваютъ, при этомъ выд?ляется хлоръ1).
і) При производств? опыта полученія хлора сл?дуетъ поступать
такъ: въ колбу (рис. 29) надо влить 28 в?с. частей кр?пкой с?рной
кислоты, предварительно разведенной 15 в?с. ч. воды; когда эта см?сь
охладится до комнатной температуры, въ нее вносятъ см?сь изъ
10 в?с. ч. измельченной въ крупный порошокъ перекиси марганца и
22 в?с. ч. поваренной соли; заткнувъ колбу пробкой съ изогнутой
воронкой и газоотводной трубкой, соединенной съ промывной
склянкой и съ сосудами—пріемниками хлора (какъ показано на рис.), на-
гр?ваютъ ее на водяной бан? или осторожно на песчаной ско-
вородк?.
Пробки, входящія -въ лриборъ, сл?дуетъ предварительно
пропитать лараффиномъ, чтобы н? разъ?дались хлоромъ; каучукъ для смычки
сл?дуетъ брать черный, не вулканизированный.
Вс? опыты съ хлоромъ должны производиться въ вытяжномъ
шкапу.
— 171 —
Рис. 29. Приборъ для получ?нія хлора.
Реакція идетъ въ три фазы: сначала получается НС1
д?йствіемъ с?рной кислоты на поваренную соль:
1) 2NaCl-f H2S04 = Na8SO, + 2HCl.
Зат?мъ с?рная кислота, разлагая MnOg4 выд?ляетъ
кислородъ:
2) MnO24-H2SO4 = MnSO, + H20 + O.
Кислородъ же отъ НС1 отнимаетъ водородъ, и выд?-
ляется хлоръ:
з) 2на + о = нао + сіа,
Въ общемъ видЬ это выразится такъ:
2NaCl-f2H2S04+Mn02=Na2S04-f-MnS04 + 2H20 + Cl21).
Реакція эта прим?нима н? только для полученія хлора, но также
брома и іода. Если вм?сто поваренной соли взять бромистый или
іодистый натрій (ХаВг или NaJ), то и получится Вг или J, на-
прим?ръ:
2tfaBr(J) + 2H2S04 + Mn02 = На^Од + MnS04 + 2H20 -f Br2(J2).
!) Вм?сто Мп02 можно брать въ реакцію хромовый ангидридъ
(получается изъ К2Сга07 и H2S04; см. при хром?): Сг03 + 6HC1 =
— 172 —
р Современная техника разработала
і также методъ непосредственнаго вы-
\ д?ленія хлора изъ NaCl (или лучше
ч изъ КСГ) при д?йствіи на водный его
м расгворъ электрическаго тока: хлоръ
.< tr выд?ляется при этомъ на анод? (см.
Рис. 30. Аппарат ь для полученія хлора изъ б?лильной извести.
Хлоръ можно получать также и изъ б?лильной
извести д?йствіемъ на нее НС1.
СаС130 + 2НС1 = СаС12 -f Н20 + 2С1.
Для этой реакціи б?лильную известь см?шиваютъ
съ г/4 частью по в?су жженаго гипса, прессуютъ, р?-
жутъ на кубики и сушатъ при обычной температур?.
Кубики б?лильной извести пом?щаютъ въ Кипповскій
аппарать (рис. 30) и обливають НС1, при чемъ
выд?ляется хлоръ.
Хлоръ, какь газъ бол?е тяжелый, нежели воздухъ,
можно собирать въ прямо поставленный сухой сосудъ;
—СгС13 + ЗН20 + 3CI; промежуточнымъ продуктомъ при этой реакціи
является Сг02С12. Практически также очень удобно получать хлоръ
изъ КМп04 и HC1: KMn04 -f 8НС1 = 4Н20 + МпС12 + КС1 + 501;
HCI для этой реакціи берется въ разведенш 1:1.
— 173 —
по цв?іу хлора можно сл?дить за наполненіемъ сосуда1).
Надъ водой хлоръ собирать нельзя, такъ какъ онъ рас-
творимъ въ ней; нельзя собирать его и надъ ртутью,
потому что съ ней онъ образуетъ соединеніе. Для очи-
щенія хлоръ промываютъ, пропуская его чрезъ воду
(чтобы удержать увлекаемый НС1), и если надо им?ть
сухой хлоръ, сушатъ его, пропуская чрезъ с?рную
кислоту.
§ 63. Физическія свойства. Хлоръ — желто-зеленый
(отсюда и его названіе: ХХсорос — желто-зеленый) газъ съ
удушливымъ запахомъ; вдыханіе его вызываетъ кашель
и воспаленіе дыхательныхъ путей. Онъ въ 2,45 раза тя-
жел?е воздуха. При 0° и 37 атмосферахъ давленія или
при обыкновенномъ давленіи и при температур?—33,60°
онъ можетъ быть сгущенъ въ жидкость желтаго цв?та,
съ уд. в. 1,56; при бол?е низкой температур? хлоръ затвер-.
д?ваетъ въ сн?говидную массу, плавящуюся при—102°;
критич. темп, хлора 146°2). Хлоръ растворяется въ
вод? (1 объемъ воды при 17е растворяетъ 2,37 объема
хлора). Водный растворъ хлора носить названіе хлорной
водыв); при охлаждены насыщенной хлоромъ воды до 0°
выд?ляются кристаллы гидрата хлора С12.8Н20, при
нагрЬваніи легко распадающагося на хлоръ и воду.
Хлорная вода при д?йствіи св?та разлагается по сл?дующему
уравненію:
H20 + Cl2 = 2HCl-fO.
§ 64. Химическія свойства. По химическимъ свой-
ствамъ хлоръ принадлежитъ къ металлоидадгь^Еакъ какъ
*) Желто-зеленый цв?тъ хлора ясн?е видимъ, если пом?стить за
стекляннымъ сосудомъ, въ который хлоръ собирается, б?луго бумагу
наполненные хлоромъ сосуды закрываютъ стеклянной
пришлифованной пробкой, смазанной вазелиномъ.
2) Жидкій хлоръ находится въ продаж? въ стальныхъ бомбахъ.
3) Въ разбавленной хлорной вод?} какъ показали изсл?дованія
находятся въ равнов?сіи сл?дующія четыре вещества:
С12 + Н20 t~ НС1 +НСЮ.
- 174 -
легко соединяется съ водородомъ, а сл?довательно, и съ
другими металлами, образуя црочныя соединенія; при
эл?ктролиз? соедин?ній хлора посл?дній отлагается на
положительномъ полюс?, что доказываетъ его
электроотрицательно сть; приреакціяхъ обм?ннаго разложенія хлоръ
обыкновенно м?няется м?стами съ металлоидами, напр.,
онъ можетъ выт?сниться изъ соединеній кислородомъ.
Со многими т-Ьлами хлоръ
соединяется съ выд?леніемъ
большого количества тепла
и св?та; такъ, иаприм?ръ,
калій, натрій, м?дь, сурьма,
фосфоръ и др. сгораютъ въ
атмосфер? хлора (рис. 31).
Даже благородные металлы,
вообще очень слабо
реагирующее, отъ д?йствія хлора
переходятъ въ хлористыя
соединенія; такъ, напр.,
золото растворяется въ
хлорной вод?. переходя въ
хлорное золото. На воздух?
хлоръ не горитъ, но слосо-
бенъ поддерживать гор?ні?;
св?ча или водородъ,
зажженные на воздух?, горятъ
въ хлор? съ выд?леніемъ б?лаго дыма.
Особенно энергично хлоръ соединяется съ водородомъ.
При гор?ніи водорода въ хлор? (рис. 32) образуется
хлористый водородъ НС]. Иосл?дніе два опыта производить
сл?д. образомъ.
а) Получаютъ водородъ въ колб? при д?иствіи H2S04
на Zn; когда выт?снится изъ прибора воздухъ, выходя-
щій водородъ зажигаютъ и. зажженный вводятъ въ прямо
поставленный цилиндръ съ хлородгь: гор?ніе водорода
продолжается и въ атмосфер? хлора.
Рис. 31. Опытъ гор?нія сурьмы
въ хлор?: колбочка съ
порошкообразной сурьмой соединяется
каучуковой трубкой съ склянкой;
наполненной хлоромъ; натрій,
фосфоръ и др. сл?ду?тъ вносить въ
сосуды съ хлоромъ въ жед?зныхъ
ложечкахъ съ длинной ручкой.
— 175 —
Ъ) Баполняютъ цилиндръ водородомъ; опрокинувъ
цилиндръ дномъ кверху, зажигаютъ водородъ и затвмъ
вводятъ въ этотъ цилиндръ трубку, приводящую хлоръ:
посл?дній, загор?вшись у отверстія цилиндра, продол-
жаетъ гор?ть и въ самомъ цилиндр?.
Соединеніе хлора съ водородомъ легко происходитъ
при д?йствіи прямыхъ солнечныхъ лучей или при св?т?
хлора въ водо-
Рис. 32. Гор?ніе водорода въ хлор?. род?.
горящаго магнія; соединеніе сопровождается въ этихъ
усдовіяхъ сильнымъ взрывомъ; при соединенія хлора съ
водородомъ выд?ляется 36,8 К тепла; на разс?янномъ
св?т? соединеніе это происходитъ медленно, безъ взрыва.
На органическія соединенія г) хлоръ д?йствуетъ раз-
рушающимъ образомъ, отнимая отъ нихъ водородъ; при
этомъ иногда углеродъ выд?ляется въ свободномъ состоя-
!) Органическими соединениями называются углеродъ
содержания соединенія.
— 176 —
ніи 2). Краски обезцв?чиваются имъ, но только въ при-
сутртвіи влаги, при этомъ хлоръ соединяется съ водоро-
домъ воды и освобождаетъ кислородъ (Н20 -}- С12 =
= 2НС1 —^ О), который, являясь въ моментъ выд?ленія
собственна и производить обезцв?чиваніе, изм?няя со-
ставъ красящаго вещества. Излишекъ хлора при б?леиіи
вредить, такъ какъ хлоръ можетъ д?йствовать разруша-
ющимъ образомъ на самыя ткани. Кром? того, хлоръ
употребляютъ, какъ дезинфекціонное (обеззараживающее)
средство.
Прим?неніе хлора разнообразно: онъ прим?няется для
ц?лей окисленія, для приготовлеиія многихъ хлоръ содер-
жащихъ веществъ, для ц?лей б?ленія и обеззараживания;
при посредств? его золото извлекается изъ рудъ и т. д. 2).
^\у/ Б р о м ъ, Вг.
Атом, в?съ Вг =^79,92. Мол?к. в?съ Вг2= 159,84. Уд. в?съ при н?-
высокихъ температурахъ (возд. =1)=534. Уд. в?съ жидкаго Вг при 00
(пода = 1) = 3,187. Темп. кип. 63,05, темп, шгавл. — 7,6.
§ 65. Полученіе. Бромъ, подобно хлору, въ природ?
свободнымъ не встр?ча?тся, а только въ соединеніи съ
металлами и, главнымъ образомъ, съ натріемъ; но бро-
мистыхъ соединении въ лрирод? меньше, ч?мъ хлори-
* стыхъ. Въ вид? бромистаго натра (NaBr) его добываютъ
изъ маточныхъ растворовъ морской воды (NaBr есть и
въ н?которыхъ минеральныхъ источникахъ и южныхъ
озерахъ), получаемыхъ посл? удалевія поваренной соли.
*) Сказанное легко показать, напр., на гор?ніи св?чи въ хлор?
или, еще лучше, на гор?ніи скипидара въ хлор?; носл?дній опытъ
удается лучше всего въ сл?д. форм?: сухимъ скипидаромъ смачиваютъ
полоску пропускной бумаги и вносятъ ее въ склянку съ хло-
ромъ, при этомъ происходитъ воспламененіе и выд?леніе сажи (мелко
раздробленна™ угля), стодбомъ вырывающейся изъ сосуда. Гор?ніе
скипидара можно выразить сл?дующимъ уравіеніемъ: С1оН1в'Т-16С1=
= 16НС1 + С10.
*) Надо зам?титъ, что хлоръ въ сухомъ вид? не реагируегь.
— 177 —
Въ свободномъ вид? бромъ получаютъ, подобно хлору,
по сл?дующей реакціи г):
2NaBr -f 2H2S04 + Mn02 = Na2S04 + MnS04 + 2H80 -f
+ Br2.
Реакція ведется въ прибор?, указанномъ на
рису нк? 34.
Физичвскін свойства. Бромъ при обыкновенной тем-
ператур? представляетъ красно-бурую жидкость уд?льнаго
Рис. 34. Праборь для полученія брома»
в?са 3,187 (при 0°). При охлажденіи до—7° застываетъ въ
кристаллическую массу, при обыкновенной температур?
быстро испаряется, распространяя сильный удушливый
запахъ (Ppcojxo; — зловонный), похожій на запахъ хлора;
і) Много брома находится въ поверхностныхъ слояхъ Стассфурт-
скихъ залежей: соли этихъ слоевъ растворяются въ вод?, большая
часть воды зат?мъ выпаривается, при чемъ ыногія соли выпадаютъ
изъ раствора; остающійся же «маточный разсолъа, содержащей, между
прочимъ, MgBr2, подвергается д?йствію хлора, отчего и выд?ляется
бромъ: MgBr2 + С12 — MgCI2 + Вг2.
Неорганическая хпмія. 1 ^
— 178 —
будучи нагр?тъ до 63°, превращается въ краснобурый
паръ. Въ вод? бромъ значительно растворяется (100
частей воды при 20° раствор? 3,5 частей брома),
образуя бромную воду красно-бураго цв?та. При охлажденіи
раствора1 брома до 2° выд?ляются кристаллы гидрата
брома, состава Вг2 . 10Н2О. Лучше растворяется бромъ
въ спирт?, хлороформ?, с?роуглерод? и въ раствор?
бромистаго калія, Хлороформъ и с?роуглеродъ при
взбалтываніи извлекаютъ бромъ изъ воднаго раствора,
окрашиваясь въ красный цв?тъ, ч?мъ и пользуются для
откр.ытія незначительныхъ сл?довъ брома.
Химическія свойства. По химическимъ свойствамъ
бромъ, подобно хлору, принадлежите къ металлоидамъ,
но онъ обладаетъ меньшей энергіей по отношение къ
водороду и къ металламъ, ч?мъ хлоръ; онъ выт?сняется
посл?днимъ изъ соединеній, иаприм?ръ:
NaBr+Cl = NaCl + Br.
Этой реакціей иногда пользуются для полученія брома.
Подобно хлору, бромъ нс горючъ; въ немъ же и?ко-
торыя вещества могутъ загораться, наприм?ръ, фосфоръ.
Съ металлами бромъ соединяется энергично: такъ, на-
прим?ръ, калій, натрій, алюминій и н?которые другіе
металлы горятъ въ парахъ ¦ брома; мен?е энергичные
металлы (м?дь, ртуть, серебро) соединяются съ нимъ
мен?е энергично; съ водородомъ бромъ соединяется уже
при неболыпомъ нагр?ваніи. Влажный бромъ (или
бромная вода) прим?няется, подобно влажному хлору, какъ
окислитель *).
!) Въ виду ядовитости брома вс? опыты съ нимъ надо
производить въ вытяжномъ шкапу и съ большой осторожностью; на когк?
бромъ вызываетъ долго незаживающіе ожоги; вдыханіе болыцихъ ко-
личествъ брома визываетъ насморкъ, кашель, головокруженіе, крово-
теченіе изъ носа и головную боль; въ качеств? нротивоядш
рекомендуется вдыханіе паровъ амміака или паровъ спирта.
— 179 —
Вообще бромъ въ своихъ р?акціяхъ показываетъ
полную аналогію съ хлоромъ, уступая ему лишь въ энергіи
своего д?йствія, а сл?довательно, и въ прочности обра-
лованныхъ имъ соединеній.
Практически бромъ прим?няется въ вид? своихъ
соединеній въ м?дицин?, въ фотографіи, въ красильномъ
д?л? (напр., краска эозипъ) и друг.
I о д ъ, J.
Лтом. в?съ J ™ 126,92. Молек. в?съ J2 —253,84. Уд. в?съ тв?рдаго
J при 170 (вода = 1) — 4,97. Плотность (воздухъ = 1) = 8,65 — при
среднихъ температурахъ. Темп. кип. 183,05. Темп, плавл. 161,1.
§ 66. Полученге. іодъ встр?чается въ соединеній съ
натріемъ или съ магніемъ въ минеральныхъ источникахъ,
въ соляныхъ озерахъ и въ морской вод?, но въ еще
мен?е значительныхъ количествахъ, ч?мъ бромъ. Поэтому
іодистый натръ добывается не изъ маточныхъ раство-
ровъ, а изъ золы морскихъ водорослей (fucus, laminaria
и др.), который обладаютъ способностью скоплять въ
себ? іодистыя соединенія, вбирая ихъ изъ морской воды;
іодъ также выд?ляютъ изъ маточныхъ разсоловъ при
выд?леніи чиліиской селитры (NaNOa) 1). Въ свободномъ
вид? іодъ получаютъ, подобно хлору и брому,
обрабатывая іодистый натръ (NaJ) с?рной кислотой въ при-
сутствіи перекиси марганца:
2NaJ -f 2H2S04 -f Mn08 = Na2S04 + MnS04 + 2H20 + J2;
или выт?сняютъ іодъ изъ соединеній хлоромъ.
Для очищенія отъ прим?сей іодъ въ присутствіи
іодистаго калія переводятъ въ паръ и при охлажденіи
посл?дняго получаютъ его въ вид? пластинчатыхъ
кристалловъ с?ро - чернаго цв?та съ металлическимъ
блескомъ.
*) іодъ входить въ составь сложнаго органич?скаго (т.-е. угле-
родъ содержащаго) соединенія, находящагося въ щитовидной желез?
людей и млекопитающихъ животныхъ.
12*
— 180 —
Физическія свойства, іодъ почти въ 5 разъ тяжел?е
воды; при обыкновенной температур? испаряется,
распространяя ?дкій запахъ, напоминающій запахъ хлора;
при 161,Д° плавится, а при 183,05° превращается въ пары
фіол?тойаго цв?та. При высокихъ т?мпературахъ (около
1500°) плотность паровъ іода уменьшается вдвое: его
молекула при этомъ вм?сто двухъ атомовъ содержитъ
лишь одинъ атомъ. Въ вод? мало растворяется (і : 5.000),
сообщая ей красно-бурое окрашиваніе. Въ спирт?
растворяется хорошо: 10°/0-ный спиртовый растворъ іода
употребляется въ медицин? подъ названіемъ іодной
тинктуры; такъ же хорошо растворяется іодъ въ растворахъ
іодистыхъ металловъ, напр., въ раствор? іодистаго калія.
Лучшими растворителями іода (какъ и брома) служатъ
хлороформъ и с?роуглеродъ, которые, извлекая іодъ изъ
водныхъ растворовъ, окрашиваются въ фіолетовый цв?тъ,
что позволяетъ открывать іодъ въ незначительныхъ ко-
личествахъ: еще бол?е чувствительнымъ реактивомъ
служить крахмальный клейстеръ, дающій съ іодомъ темно-
синее окрашиваніе, пропадающее при нагр?ваніи, а при
охлажденіи вновь появляющееся 2).
Хгтическід свойства. Подобно хлору и брому, іодъ
прямо соединяется со многими т?лами при обыкновенной
температур?. Фосфоръ загорается при соприкосновеніи
9 Для того, чтобы р?зч? вид?ть это на олыт?, поступают!, такъ:
въ пробирку наливаютъ крахмадьнаго клейстера и каплю іодной воды,
получается темно-синяя окраска; зат?мъ пробирку нагр?ваютъ почти
до кип?нія жидкости, и синее окрашиваніе изм?няется на
слабо-буроватое; посл? этого нагр?тая пробирка охлаждается не сразу, а лишь
дно пробирки опускается въ холодную воду; синее окрашиваніе,
конечно, появляется только въ этой охлажденной части, а по м?р?
охлажденія остальной массы оно двигается снизу вверхъ. Интересно
отм?тить, что окраска іодныхъ растворовъ въ разныхъ растворит?-
лнхъ различна: такъ, въ спирт? и э?ир? она бурая, а въ с?роугле-
род? и хлороформ?—фіолетовая, близко напоминающая пары іода.
Причина этого явленія кроется, в?роятно, не въ одинаковости
отношения іода къ различнымъ растворителямъ.
— 181
съ іодомъ; мЬдь, серебро п ргуть соединяются съ нимъ
мен?е энергично, но безъ участія посторонней теплоты.
Хлоромъ и бромомъ іодъ выт?сняется изъ соединеній съ
металлами и съ водородомъ, напр.:
NaJ -f Cl(Br) = NaCl(Br) + J.
_JLjj?- .спадидірнія Г;ъ...лод.0?одомъ іодъ требуетъ болыпаго
ищі?вадіяг-ч^н-г -бр-емъ. "~
Будучи металлоидомъ и, сл?довательно, электроотря-
цательнымъ, іодъ при электролиз? іодистыхъ соединеній
выд?ляется на положительномъ полюс?.
іодъ часто прим?няется для прижиганія, раздраженія
кожи; а соединенія іода съ металлами часто прим?няютъ
для внутренняго употребленія, какъ ц?лебныя вещества.
Итакъ, хлоръ, бромъ и іодъ, д?йствительно, им?ютъ
много сходнаго какъ по м?сту и форм? нахожденія въ
природ? и по способу полученія ихъ въ свободномъ '
вид?, такъ и, въ особенности, по химическимъ свой-
ствамъ; это — однохарактерные металлоиды, только съ
различнымъ запасомъ энергіи: съ повышеніемъ атомнаго
в?са посл?дняя къ водороду и къ металламъ уменьшается,
а сл?довательно, и энергія реагированія съ металлами
понижается.
Фторъ1), F.
Атом, в?съ F —19,0. Молекул, в?съ F2=38,0. Плотность (воздухъ=
= 1) = 1,26. Теми. кип. ок.— 1870. Темп, плав. —223<>.
§ 67. Получение. Фторъ, какъ чрезвычайно
энергичный элем?нтъ, находится въ природ? обыкновенно въ
вид? очень прочныхъ соединеній. /Чаще всего онъ встр?-
чается въ вид? фтористаго кальція—CaF2, минерала,
і) Фторъ происходитъ отъ греческаго слова (рторюс, что зна
читъ—разрушительный.
— 182 —
извЬстнаго подъ названіемъ плавиковаго шпата :) и въ
вид? кріолита (6NaF . А12Р^Г~найд"енъ ??кже, напр., въ
зол? злаковъ; входить въ составъ зубовъ, особенно
зубной эмали, животныхъ и челов?ка.
Въ евободномъ состояніи фторъ впервые былъ полу-
ченъ Муассаномъ (Moissan) въ 1886 году разложеніемъ
лсидкаго фтористаго водорода (въ присутствіи фтористаго
калія) сильнымъ элекірическимъ токомъ въ сосудахъ,
сд?ланныхъ изъ иридистой платины — сплава, наиболее
сопротивляющаяся д?йствію фтора, при низкой темпе-
Рис. 35. Приборъ для подученія фтора.
ратур? 2). Приборъ состоитъ изъ U-образной платиновой
трубки, пом?щенной въ стаканъ съ охлаждающимъ ве-
ществомъ. Трубка им?етъ дв? боковыя трубочки для
вывода продуктовъ электролиза; сверху оба кол?на плотно
закрываются пробками изъ плавиковаго шпата, чрезъ ко-
!) Небольшія количества фтористаго кальція находятся въ эмали
зубовъ, въ костяхъ, въ крови, въ молок?, въ зодт. раст?ній и т. п.
2) Поздн?е было указано, что вм?сто дорогой иридистой платины
можно брать м?дь, которая покрывается слоемъ CuFg, защищающим*
ее отъ дальн?йшаго дЬйствія фтора.
— 183 —
торыя проходятъ массивные электроды изъ иридистой
платины (рис. 35); на катод? получается водородъ, а на
анод?—фторъ.
Физическія свойства. Въ указанномъ прибор* Муас-
санъ получилъ фторъ въ вид? газа непріятнаго запаха,
похожаго на запахъ хлора. Въ толстыхъ слояхъ фторъ
обладаетъ слабымъ зеленовато-желтьшъ цв?томъ, напо-
минающимъ цв?тъ хлора въ слабой только степени; при
сильномъ охлажденіи (до—187°) сгущается въ жидкость
уд?льнаго в?са 1,26; а при охлажденіи жидкимъ водо-
родомъ фторъ затверд?ваетъ въ б?лую массу,
плавящуюся при—223°.
Химическія свойства. Фторъ—самый сильный изъ
металлоидовъ элементъ; съ водородомъ онъ соединяется
въ темнот? и безъ нагр?ванія со взрывомъ, даже
твердый фторъ и съ жидкимъ" водородомъ соединяется со
взрывомъ. іодъ, с?ра, фосфоръ, мелко раздробленная
сурьма, уголь, мышьякъ, кристаллическій кремній и друг.
сгорають въ стру? фтора; металлы соединяются съ нимъ
при соприкосновеніи, выд?ляя очень много тепла; даже
золото и платина изм?няются фторомъ. Только кисло-
родъ, азотъ и хлоръ, повидимому, не даютъ съ фторомъ
соединеній. Фторъ энергичн?е хлора: посл?дній выт?с-
няется фторомъ изъ соединеній:
Воду фторъ разлагаетъ на холоду, выд?ляя кислородъ:
H20 + Fa = 2HF + 0.
Кислородъ, выдЬляющійся при этой реакціи,
оказывается сильно озонированнымъ.
Органическія соединенія разрушаются фторомъ; ски-
пидаръ, керосинъ, спиртъ и т. п. воспламеняются при
соприкосновеніи съ нимъ; фторъ разъ?даетъ стекло.
Задача: 1) Разсчитать количество матеріаловъ) необходимых^
для лолученія 100 гр. хлора, брома, іода и фтора.
2) Какой объемъ будутъ занимать при 0" и 760 мм.
100 гр. хлора?
— 184 —
Соединенія галоидовъ съ водородомъ.
§ 68. Галоиды, соединяясь съ водородомъ, даютъ
газообразная соединенія формулы RH, въ водныхъ рас-
творахъ о^ладающія кыслотнымъ характеромъ, Наибол?е
энергично съ водородомъ соединяется и образуетъ
наибол?е прочное водородное соединені? фторъ; отъ фтора
къ іоду, т.-е. съ увеличеніемъ атомнаго в?са, какъ энер-
гія реагированія галоидовъ съ водородомъ, такъ,
конечно, и нрочность водородныхъ соединеній уменьшается,
что видно изъ сл?дующей таблицы;
H-j-F = HF +36,8 К
H + Cl = HCl-f-22,0 К разлаг. при 1.300°
Н + Вг=НВг+13,5 к я „ 8000
H + J =HJ — 0,8 К около 200°.
Наоборотъ, сродство галоидовъ къ металлоидамъ ра-
стетъ съ увеличеніемъ атомнаго в?са.
Фтороводородъ, FH.
Молек. в?съ "FH при высокой температур? = 20. Уд. в?съ въ жид-
комъ состояши=0,9879 при 15°. Температура кип?нія-|~ 19,50.
Температура плаввдгія — 92;5<>. Процентный составъ HF : F = 95,05%
Н = 4,950/0.
§ 69. Полученіе. Фтороводородъ получается д?йстві-
емъ кр?якой с?рной кислоты на измельченный въ поро-
шокъ фтористый кальцій:
GaF3 + H2S04 = CaS04 + 2FH.
Реакція эта ведется въ платиновыхъ или свинцовыхъ
сосудахъ (рис. 36); фарфоръ и стекло разъ?даются фто-
ристымъ водородомъ, а потому и не могутъ быть зд?сь
прим?няемы.
Свойства. Это—безцв?тный газъ, дымящійся на воз-
дух?. При охлажденіи можетъ быть сгущенъ въ жид-
— 185 —
кость, кипящую—19,4° и затверд?вающую при—102° въ
прозрачную кристаллическую массу; хорошо растворимъ
въ вод?; водный раетворъ, называемый плавиковой кис-
лошой, разъ?даетъ стеклянныеа), фарфоровые сосуды;
сохраняется онъ въ платиновыхъ и гутталерчевыхъ
сосудахъ, на которые не д?йствуетъ; довольно хорошо
противостоять ей также воскъ, смола, параффинъ. Изъ
металловъ только золото, платина и свинедъ не изм?-
няются плавиковой кислотой. На кож? она производить
бол?зненные ожоги, трудно заживающіе; пары плавиковой
кислоты очень вредны.
На свойств? фторово-
дорода разъ?дать стекло
основано гравированіе на
стекл?. Для этого стекло
покрываютъ тонкимъ сло-
емъ воска, на который FH
не д?йствуетъ, какимъ-ни- „ OQ ^ ,
* J ' Рис. 36. Приборъ для полученія
будь остреемъ обнажаютъ ^фтористаго водорода,
т? м?ста, которыя нужно
выгравировать, и пом?щаютъ надъ сосудомъ, въ кото-
ромъ получается фтороводородъ. Этотъ посл?дній
разъ?даетъ только м?ста, свободныя отъ слоя воска,
оставляя нетронутыми м?ста, покрытыя воскомъ; при д?й-
ствіи на стекло газообразнымъ HF получаютъ матовый
рисунокъ; для полученія же прозрачнаго рисунка д?й-
ствуютъ воднымъ растворомъ HF. Продажный водный
растворъ плавиковой кислоты обыкновенно содержитъ
38°/0 посл?дней и отв?чаетъ гидрату HF. 2Н20.
Въ химическомъ отношеніи эта кислота является
бол?е слабой, нежели другія галоидоводородныя кис-
!) Въ составъ обычнаго стекла (см. при м?талл? кальцШ вхо-
дятъ CaSi03 и JSTa2Si03; реакцію между ними и FH можно выразить
сл?д. уравн?ніями: CaSi08 + 6HF == SiF4 + CaFa + ЗНяО; Na,2Si03 -f
+ 6HF = 3SiF4 + 2N"aF + 3H20. Образованіемъ газообразнаго SiF4
и объясняется разъ?даніе плавиковой кислотой стекла.
— 186 —
слоты1). Растворимый соли плавиковой кислоты прим?-
няются въ качеств? асецтшшвъ,
Хлороводородъ, НС1.
Молекул, в?съ НС1 = 36,46. Плотность (воэд. = 1)= 1,2612. Темп.
кип?нія =— 83,7<>. Температура плавл?нія = —111,1®. В?съ 1 литра
при 00 и 760 мм. = 1,6533. Уд. в?съ жидкаго НС1 (вода = 1) — 1,27.
Процентный составъ НС1 : С1 = 97,24о/0; Н=:2,7бо/0.
§ 70. Полученіе. Хлоръ, какъ сказано выше, спосо-
бенъ непосредственно соединяться съ водородомъ: если
см?сь равныхъ объемовъ хлора и водорода подвергнуть
д?йствію _прямыхъ солнечныхъ лучей, то происходить
взрывъ, при чемъ хлоръ и водородъ, соединяясь, дають
безцв?тный газъ — хлористый водородь—въ количеств?
двухъ_объемовъ^ Точно такъ же дЬйствуютъ и
искусственные источники св?та, богатые химически д?йствующими
лучами, наприм?ръ, св?тъ горящаго магнія; при раз-
с?янномъ солнечномъ св?т? происходить медленное и
постепенное соединеніе хлора и водорода.
Хлористый водородъ получаютъ обыкновенно д?й-
ствіемъ кр?пкой с?рной кислоты, постепенно чрезъ
воронку съ краномъ приливаемой къ хлористому натрію 2):
NaC14-HaS04 = NaHS04+HCl, или
2NaCl -f H2S04 = Na2S04 + 2HC1.
!) Въ дальн?йшемъ (см. въ глав? «Вода» § 83) будетъ выяснено,
что сила водныхъ кислотъ определяется степенью ихъ
электролитической диссоціаціи на іопы: ч?мъ посд?дняя больше, т?мъ сильн?е
кислота; maximum силы будетъ при полной диссоціаціи. Плавиковая
кислота мало диссоціируетъ, а потому и не является сильной. Кром?
того, молекула флористаго водорода оказывается при обыкновенныхъ
условіяхъ, какъ показываетъ плотность его пара, полимеризована
(ассоціирована) изъ двухъ молекулъ, т.-е. им?етъ формулу H2F2;
диссоціируетъ она на KF -f- B.F только выше 300,
2) Выт?сненіе кислотъ изъ солей другими кислотами (особенно
часто—с?рной кислотой, какъ сильной и мало летучей)—это реакція
часто прим?няемая для полученія кислотъ изъ ихъ солей.
— 187 —
Ряс. 37. ііолучені? хлористаго водорода.
Эта реакція обратима; но въ опыт? она становится
необратимой, потому что НС1, какъ газъ, уходить изъ
сферы реакціи>
Колба, въ которой ведется эта реакція, ставится на
песчаную сковородку и слабо подогр?вается; получающійся
въ колб? (рис. 37) газъ высушиваютъ пролусканіемъ
чрезъ склянку, содержащую пемзу, смоченную с?рной
кислотой, и собираютъ надъ ртутью или въ прямо
поставленный сосудъ:), хотя посл?дній пріемъ хуже, по-
і) На заводахъ соляную кислоту добываютъ также при д?йствіи
с?рной кислоты на поваренную соль — въ стеклянныхъ ретортахъ
или въ чугунныхъ щглиндрахъ, изъ которыхъ хлористый водородъ
идетъ въ рядъ глиняныхъ трехгорлыхъ баллоновъ, наполненныхъ до
половины водой. Продажная соляная кислота (acidum muriaticum или
hydrochloricum crudum) обыкновенно содержиіъ хлористаго водорода
около 33 — 35,5%; она обыкновенно нечиста и въ качеств? прим?-
сей содержитъ: с?рнистую и с?рную кислоты, хлоръ, хлорное жел?зо
и соединенія мышьяка (изъ H2SO4). Изъ воднаго раствора
хлористый водородъ легко выт?сняется кр?нкой HaS04; для этой ц?ли въ
колбу, наполненную концентрированной с?рной кислотой и
заткнутую пробкой съ проходящими чрезъ нее воронкой съ краномъ и
газоотводной трубкой, прибавляютъ (чрезъ воронку) по маленышмъ
каплямъ соляную кислоту: с?рная кислота отнимаетъ воду, и HCI
выд?ляется свободнымъ.
— 188 —
тому что Щюристый водородъ немного тяжел?е
воздуха.
Физическгя свойства. Хлористый водородъ—безцв?т-
ный газъ, немного тяжел?е воздуха, съ удушливымъ за-
пахомъ, 'Дымящій на воздух?, всл?дствіе соединенія съ
влагой иосл?дняго; яри температур? 10° и 40 атмосфе-
рагь давленія онъ сгущается въ жидкость, кипящую
при—83,7°, которая при еильномъ охлажденіи (около
— 111,1°) застываетъ
въ бездв?тную
кристаллическую массу.
Уд?льный в?съ по от-
ношенію къ водороду
—18,23, по отношение
къ воздуху —1,2696.
1 литръ НС1 при 0° и
760мм.в?ситъ 1,6533.
Критическая
температура НС1—52,3°,
критическое давленіе—86
атмосферъ.
Хлористый
водородъ весьма легко рас-
Рис. 38. Поглощение хлороводорода творимъ въ вод?. При
водой. обыкновенной темп?-
ратур? (15°) 1 объ?мъ
воды растворя?тъ 450 объемовъ хлороводорода, а при 0°—
до 503 объемовъ. Такая легкая растворимость газа можетъ
быть показана на сл?дующемъ опыт?. Если сухую склянку
(рис. 38) наполнить сухимъ хлороводородомъ, заткнуть
ее пробкой, въ которую вставлена запаянная съ одного
конца трубка, зат?мъ погрузить трубку въ воду и подъ
водой отломить запаянный конедъ ея, то вода быстро
войдетъ въ склянку и тамъ будетъ бить фонтаномъ;
первый капли воды, которыя попадутъ въ склянку, погло-
щаютъ весь хлороводородъ, всл?дствіе чего тамъ обра-
— 189 —
зуется сильное разр?женіе; въ это разр?женное
пространство атмосфернымъ давленіемъ будетъ вгоняться вода съ
такою силой, что получается явленіе быощаго фонтана.
Если воду въ нижнемъ сосуд? подкрасить синимъ лак-
мусомъ, то она, переходя въ верхній сосудъ, изм?няетъ
свой цв?тъ въ красный, что указываетъ на кислотный
свойства получающагося раствора.
Рис. 39. Приборъ для полученія соляной кислоты.
Растворъ хлористаго водорода въ яод?ліазываетая.іі0-
ляной кислотой. Кислота эта получается пропускаиіемъ
хлороводорода чрезъ рядъ сосудовъ, наполненныхъ водой
(рис. 39).
Растворимость хлороводорода въ вод? им?етъ изв?ст-
ный пред?лъ: такъ, 50°/0-ный растворъ уже дымить на
воздух?, что обусловливается вновь выд?леніемъ изъ
раствора газа, который съ водянымъ ларомъ воздуха рбра-
зуетъ жидкость въ вид? тумана. Выд?леніе это тбмъ
значительн?е, ч?мъ выше температура, но весь хлорово-
дородъ нагр?ваніемъ изъ раствора выд?ленъ быть не мо-
жетъ, такъ какъ при 110° перегоняется жидкость, содер-
— 190 —
жащая 20% хлороводорода; составь такой кислоты съ
20% НС1 отв?чаетъ формул? HCl.eiy)1).
Хгтическія свойства. Растворъ хлороводорода есть
кислота; ^сл?довательно, водородъ въ немъ можетъ быть
Рис. 40. Раздожені? НС1 Рис. 41. Анализъ НС1 при помощи
токомъ. амальгамы натрія.
зам?щ?нъ на металлъ. Если д?йствовать соляной
кислотой на металлы, исключая золото, платину и н?которые
другіе, то металлъ растворяется, выд?ляется водородъ и
образуется соль; напр., Zn+2H01 = H24-ZnC]2. Соляная
кислота есть одна изъ самыхть _сильныхъ__кислотъ. Ждд-
кій безводный хлористый водородъ не обнаруживаем кис-
лотныхъ свойствъ и не проводить электрическаго тока;—
!) Изъ насыщеннаго воднаго раствора НС1 при — 22° выпадаетъ
гидратъ НС1 . 2Н20; при —18° онъ уже распадается.
— 191 —
очевидно, что при раствореніи въ вод? хлористый водо-
родъ переходить въ другое состояніе 2).
Р?шить вопросъ о количест?ениомь состав? хлоро-
водорода можно двумя способами; анализомъ— разложе-
ніемъ вещества на составныя части, и синтезомъ — сло-
женіемъ его изъ элементовъ,
Разложеніе хлороводорода производятъ электрическимъ
токомъ въ прибор? съ угольными электродами (рис. 40).
Для опыта берутъ кр?пкую соляную кислоту. При начал?
опыта зам?чается выд?леніе газа только на одномъ элек-
трод? (катод?); зд?сь вьід?ляется водородъ. На анод? же
получается желто-зеленое окрапшваніе, потому что выд?-
ляющійся хлоръ растворяется въ соляной кислот?. Посл?
того, какъ посл?дняя насытится хлоромъ (требуется около
1 часа) и посл?дній начнетъ собираться надъ жидкостью,
сл?дуетъ выпустить изъ прибора газы, и тогда уже, вновь
закрывъ краны, если изм?рять объемы выд?ляющихся
газовъ, то въ обоихъ кол?иахъ прибора они будутъ
равны. ;
Разложеніе хлористаго водорода можно произвести
также отнятіемъ хлора металломъ натріемъ. Для этого
берутъ длинную U-образную трубку (рис. 41) и напол-
няютъ одно кол?но ея, снабженное на конц? краномъ,
сухимъ хлороводородомъ. Ртуть служитъ для разобщенія
газа отъ воздуха. Въ другое открытое кол?но приливаютъ
амальгаму, натрія (сплавъ натрія со ртутью) до самаго
верха, трубку встряхиваютъ для лучшаго соприкосновенія
газа съ металломъ, при этомъ натрій вступаетъ въ
соединение съ хлоромъ'и выт?сняетъ водородъ, который,
по приведеніи его къ первоначальному давленію, займетъ
половину прежняго объема газа. Сл?довательно, НС1
получается соединеніемъ равныхъ объемовъ водорода и хлора.
Но въ равныхъ объемахъ заключается по равному коли-
*) О «состояніи веществъ въ водныхъ растворахъ> см. § 82 на
стр. 228—236.
— 192 —
честву частицъ, а потому при реакціи частица хлора
реагируетъ съ частицей водорода:
CI2-f H, = 2HCL
Мож^о пров?рить эту формулу опред?леніемъ
плотности хлористаго водорода; она равна 18,225, сл?дова-
тельно, частичный в?съ хлористаго водорода долженъ
равняться 18,225 X 2 = 36,45; въ 36,45 в?совыхъ частяхъ
долженъ быть minimum одинъ атомъ хлора, атомный в?съ
котораго 35,46, а одна вЬсовая часть (1,00), конечно,
приходится на долю водорода. Это отв?чаетъ фор-
мул? НС1.
Соляная кислота употребляется для добыванія хлора
и различныхъ хлористыхъ соединений.
Соляная кислота находится въ желудк? челов?ка и
животныхъ (0,1—0,2%) и играетъ зд?сь важную роль
въ процесс? пищеваренія.
Бромоводородъ, НВг.
Молек. в?съ НВг = 80,92. Абсолюты, в?съ 1 литра при 0& и
760 мм. = 3,6167 гр. Плотность (вовдухъ = 1) = 2,79. Процентный
составъ НВг : Вг = 98,76%; Н = 1,24<у0,
§ 71. Полученіе. Бромъ, обладающій меньшей энер-
гіей, ч?мъ хлоръ, соединяется съ водородомъ только при
нагр?ваніи.
Бромистый водородъ, какъ и хлористый, можетъ быть
получ?нъ д?йствіемъ с?рной кислоты на бромистый натрій:
2BrNa 4- H2S04 = Na2S04 -f 2HBr.
С?рную кислоту при этомъ надо брать разбавленную,
такъ какъ кр?пкая бромоводородъ разрушаетъ:
2НВг + H2S04 = H2S03 + Н20 -|- Вг2.
Бромоводородъ можетъ быть полученъ также
д?йствіемъ воды на трехбромистый фосфоръ:
РВг3 + ЗН20 = Н3Р03 + ЗНВг.
— 193 —
Реакцію эту ведутъ сл?д. образомъ: въ колбу (рис. 42
насыпаютъ красяаго фосфора (1 ч.), обливаютъ его
водой (2 ч.) и осторожно чрезъ воронку съ краномъ
прибавляюсь брома (10 ч.); первыя капли брома реагируютъ
со вспышкой; выд?ляющійся НВг пропускаюсь чрезъ
U-образную трубку съ краснымъ фосфоромъ для того,
чтобы удержать улетучивающіеся пары брома.
Рис. 42. Приборъ для полученія бромистаго водорода.
Свойства. Бромистый водородъ представляетъ без-
дв?тиый газъ, дымящій на воздух?, при охлажденіи до—73°
сгущается въ жидкость, затверд?вающую при—88,5° въ
прозрачную массу; растворимъ въ вод? лучше НС1: такъ,
1 объемъ воды при 10° растворяетъ 600 объемовъ газа.
Насыщенный растворъ дымитъ на воздух? отъ выд?ленія
газа, которое увеличивается при повышеніи температуры.
При 125° перегоняется жидкость, содержащая 48% бромо-
водорода, состава НВг.5Н20, уд. в. 1,49 при 14°; изъ
насыщеннаго раствора при охлажденіи вынадаетъ гидратъ
НВг.2Н20. По хчмическимъ свойствамъ бромоводородъ
вполн? подобенъ хлороводороду, т.-е, водный растворъ
его есть сильная кислота, образующая соли; только соли
ея легче (ч?мъ соли НС1) разлагаются и бромъ изъ
Неорганическая химія. 1«
— 194 —
нихъ можетъ выт?сняться хлоромъ; сухой НВг, подобно
сухому НС1, кислотными свойствами не облада?тъ.
іодоводородъ, Ш.
Молек. в?съ JH = 127,92. Плотность (возд. — 1) = 4,4. Процентный
составъ: J^99,210/0; Н^0,79о/0.
§ 72. Лолучеиіе. іодъ соединяется съ водородомъ
очень трудно (при 520° соединяется ок. 76% см?си), при
чемъ часть подучившагося іодоводорода вновь разлагается
при условіяхъ образованія; следовательно, реакція
обратима, т.-е. H2-f-J2^2HJ. Всл?дствіе своей малой
прочности іодоводородъ еще легче разлагается (окисляется)
с?рной кислотой, ч?мъ бромоводородъ, поэтому его по-
лучаютъ не д?йствіемъ H2S04 на NaJ1), какъ бы сл?до-
вало по аналогіи съ полученіемъ НС1 и НВг, а разло-
женіемъ трехъіодистаго фосфора2) водой:
PJ3 + ЗН20 = Н3Р03 + 3HJ.
Свойства, іодистый водородъ—безцв?тный газъ удуш-
ливаго запаха, дымящій на воздух?, при охлажденіи
до — 34° превращается въ жидкость, затв?рд?вагощую
при 51°. іодоводородъ хорошо растворимъ въ вод?: при
10° одинъ объемъ воды растворяетъ 450 объемовъ HJ.
Насыщенный растворъ дымитъ; при 127° перегоняется
растворъ, содержаний 57°/0 іодоводорода (HJ. 5Н20)
съ уд. в. 1,67.HJ — очень непрочное соединеніе, разла-
!) При д?йствіи H2S04 на KaJ реакція идетъ по сл?д. уравне-
ніямъ: 1) 2NaJ + H2S04 = IS'a2S044-2HJ и 2) H8S04 + 8HJ=H8S +
+ 4Н20 + 4J2.
2) PJ9 получается прямымъ соедин?ніемъ фосфора съ іодомъ: для
этого въ колбу пом?щаютъ 13 ч. сухого іода и бросаютъ туда 1 ч.
жедтаго фосфора; реакція идетъ съ восяламененіемъ; когда масса
остыяетъ, чрезъ воронку съ краномъ постепенно прибавляютъ въ
колбу воду, и выд?ляется HJ.
— 195 —
гаотся при нагрЬваніи кислородомъ воздуха, ко горый
отпимаетъ у HJ водородъ и выдЬляетъ свободный іодъ
но уравненію:
2Щ + 0 —h2o + J2;
растворъ іодоводорода, сначала безп,в?тный, даже при
отояніи на св?ту разлагается, окрашиваясь іодомъ.
Благодаря такой легкой разлагаемости съ выд?леніемъ сво-
(іоднаго іода своимъ освобождающимся водородомъ HJ
д?йству?тъ, какъ очень энергичный возстаиовителъ.
По химическимъ свойствамъ водный растворъ JH—
кислота, хотя и очень слабая: соли ея еще мен?е
устойчивы, ч?мъ соли бромистоводородной кислоты; изъ солей
іодъ можетъ выд?ляться и хлоромъ и бромомъ; сухой HJ
кислотныхъ свойствъ не им?етъ.
Итакъ, вс? галоиды съ водородомъ соединяются: F
даже въ темнот?, С1—при д?йствіи солнечныхъ лучей,
Вг—при слабомъ нагр?ваніи, J — при бол?е высокомъ
пагр?ваніи и даютъ галоидоводородныя соединенія типа
RH. Вс? они получаются также д?йствіемъ кислотъ
(H2S04 или Н3Р04) на соединенія галоидовъ съ
металлами (CaF2, NaCl, NaBr, NaJ), или (HBr и HJ)—при
д?йствіи воды на соединенія съ фосфоромъ (РВг3 и PJ3).
'Вс? галоидоводороды суть газы, дымящіе на воздух?,
хорошо растворимые въ вод? и образующіе кислоты;
сл?довательно, водородъ въ этихъ кислотахъ способенъ
зам?щаться на металлъ, при чемъ образуются соли. Сила
кислотъ НС1, НВг и HJ очень большая, a HF—малая.
Прочность галоидоводородовъ (а также и прочность ихъ
солей) уменьшается отъ F къ J, т.-е. съ увеличеніемъ
атомнаго в?са галоидовъ.
Для сравненія физическихъ свойствъ галоидоводород-
ныхъ соединеній приводимъ нижесл?дующую таблицу:
13*
— 196 —
tJ
HF
-92,3
+19,5
?
HC1
—111,3
—83,1
+52,3
HBr
—86,13
—68,1
+91,3
HJ
—51,3
—36,7
+ 150,7
Задачи: 1) Сколько надо по объему хлора для выт?сненія 80 гр.
брома и 100 гр. іода?
2) Сколько по в?су и по объему потребуется хлора для
соединения съ 100 гр. водорода и сколько по в?су и
по объему получится хлористаго водорода?
3) Написать формулу вещества, состоящего изъ 39;39°/0
Na и 60,61% CL
4) Опред?лить плотность НС1.
5) Узнать в?съ 1 литра НС1 яри 760 мм.
Группа кислорода (VI группа).
73. Къ этой групп? принадл&катъ сл?дующіе
металлоидные элементы: кислородъ, с?ра, селенъ и теллуръ.
Подобно тому, какъ въ групп? галоидовъ фторъ стоить
н?сколько особнякомъ, такъ и зд?сь кислородъ бол?е
отличается отъ с?ры, селена и теллура, ч?мъ эти по-
сл?дніе между собою. Зд?сь, какъ и въ групп?
галоидовъ, выступаетъ зависимость своиствъ этихъ элементовъ
отъ ихъ атомнаго в?са, что можно вид?ть изъ сл?ду-
тощей таблицы:
Ат. в. Уд. в. Темп. кип. Темп, плавл. Физич. состояніе.
1,13 —1820 — 2330 Безцв?тный газъ
(въ длинномъ сло?
слабо-голубой).
2,06 +4480 +1140,5 Тв. ж?лто? т?ло.
4,27 + 6800 + 2170 Тв. красно - бурое
т?ло.
6,23 около 1,3900 4500 Тв. синеватое, съ
металл, бл?скомъ
т?ло.
Кислородъ. 16
С?ра. .
Селенъ.
32,07
79,2
Телллуръ. . 127,5
— 197 —
Изъ таблицы видно, что и въ групп? кислорода съ
увеличеніемъ атомнаго в?садцшіщхощгь_щ»сл?дователь-
«ог~уплотненіе вещества и, конечно, большая и большая
трудготггепі^р^ад^ твердаго состданія въ
жидкое jaJSgb жидкаго въ"Тазообразное. Рапида между
атомными в?сами О и S"^TB7,"tt",MeJKAy атомными в?сами
S и Se, а также Se и Те = ок. 47. Энергія элем?нтовъ
этой группы къ водороду и^^і^алла^сьладж?^дмень-
шается оть О къ Те, какъ это было и въ ць^галаддавъ;
къ"" м?таллбидамъ—обратно'.'
Интересно отм?тить аиалогію въ физическихъ свой-
ствахъ, наприм?ръ, въ цв?т? у элементовъ этой группы
и у элементовъ группы галоидовъ. Тамъ фторъ — почти
безцв?тный газъ, зд?сь кислородъ, стоящій въ томъ же~
ряду, — безц??тныи газъ; тамъ хлоръ — желто-зеленый
газъ; гщс^^^^^Жёлікое твердое т?ло; тамъ бромъ —
красно-бурая жидкость" зд?сь у селена также им?ется
одно видоизм?неніе^^асщ-бі/дагб) щтта\ наконець и
іодь и теллуръ оба суть твердыя т?ла съ металличе-
скимъ блескомъ. Вс? эти элементы им?ютъ по н?скольку
аллотрЬЪичбскжхъ видоизм?н?ній.
Водородныя соединения элементовъ группы кислорода
им?ютъ общую формулу RH2. Въ сл?дующей таблиц?
приведены теплоты образованія и температуры разложе-
нія водородистыхъ соединеній, а также ихъ уд?льные
в?са въ жидкомъ состояніи, ихь температуры кип?нія и
плавленія.
Теплоты образов.
На + 0 гг=Н20 +56,8 К
Нй + S = H2S + 4,6 К
Н2 + Se = IIaSe — 24,5 К
На + Те = НаТе—35,2 К
Изъ таблицы видно, что зд?сь, какъ это было и
у галоидовъ, теплота образованія, а также и прочность
водородистыхъ соединеній падаютъ съ увеличеніемъ атом-
Темп.
разлож?шя.
+ 1.0000
+ 4000
+ 2500
обыкнов. темп.
Уд. в.
жидкихъ.
1,0
0,86
2,12
2,57
Темп.
кип.
1000
— 600
— 420
— 00
Темп.
плавл.
00
— 830
— 640
— 480
— 198 —
наго в?са^длементовъ. Энергія элементовъ группы кисло-
-^"ода слаб?е энергіи галоидныхъ элементовъ, а потому
они встр?чаются на земл? и въ свободномъ вид?.
Кислородъ *), О.
Ат. в?съ 0 = 16. Молекул, в?съ 02 = 32. Уд. в?съ (Н = 1)= 15,88.
Плотность (воздухъ — 1)— 1,10535. Абсолютный в?съ 1 литра при 0°
и 760 мм. ;= 1,4292 гр. Открыть въ 1774 г. Пристде?мъ и
одновременно Шеел?.
§ 74. Кислородъ — самый распространенный элем?нтъ
на земл? какъ въ свободномъ состояніи, такъ и въ вид?
со?диненій съ другими элементами. Въ свободномъ
состояніи онъ встр?ча?тся въ воздух? (около 23% по в^су
и 21% по объему); изъ соединеній его въ наибольшемъ
количеств? им??тся въ природ? вода, въ которой
кислорода % ч. по в?су. Кром? того, кислородъ встр?ча?тся
во вс?хъ животныхъ (около 20% ихъ в?са) и раститель-
ныхъ (около 40%) организмахъ, а также въ болыиинств?
веществъ, составляющихъ земную кору, гд? на долю
кислорода приходится въ среднемъ около 47%; такъ,
наприм?ръ, въ песк? его 53%) въ глин? до 35% и т. д.
Вообще природа очень богата кислородомъ. Въ
последнее время указано присутствіе кислорода на солнц?.
¦ Получете: а) Такъ какъ громадное количество
кислорода находится въ воздух?, то предложено было много
способовъ извлекать его оттуда.
Изъ этихъ способовъ наибол?е удаченъ по иде? спо-
собъ Буссенго, который состоитъ въ сл?дующемъ: если
нагр?вать окись барія (ВаО) при доступ? воздуха до
500° Ц., то она присоединяем къ себ? атомъ кислорода
и переходить въ перекись барія (Ва02):
ВаО + 0 = Ва02;
при дальн?йшемъ нагр?ваніи до 800° Ц. .перекись барія
снова разлагается на кислородъ и окись барія. Такимъ
і) Отъ греческихъ словъ—dEos—кислота и y^vofiac—произвожу.
— 199 —
образомъ въ результате получается первоначально
взятый продуктъ — окись барія, которую опять можно
пустить въ д?ло: 2Ва02 ^ 2ВаО-|-02.
b) Изъ воды кислородъ можетъ быть полученъ раз-
ложеніемъ ея помощью гальваническаго тока (см. стр. 6,
реакція разложенія, on. а).
c) При нагр?ваніи н?которыхъ окисловъ также легко
выд?ляется кислородъ; особенно же легко, наприм?ръ,
Рлс. 43. Получені? кислорода.
при нагр?ваніи окиси ртути: HgO = Hg-(-0 (см. стр. 8,
реакція разложенія, оп. е).
/d) Изъ перекиси натрія (Na202) при д?йствіи воды,
лучше-—въ присутствіи Со203, играющаго роль
катализатора: 2Na202 + 2H20 = 4NaOH-J-02. /
е) Но самымъ удобнымъ способомъ полученія
кислорода служитъ разложеиіе бертоллетовой соли, для чего
се нагр?ваютъ въ реторт? (рис. 43) или колб?, а выд?-
— 200 —
ляющійся газъ промываютъ отъ С02, S02 и др. дрим?-
сей чрезъ растворъ NaOH и собираютъ въ газометр?:
KC103 = KCb{-(V).
Раздоженіе бертоллетовой соли 'идетъ быстр?е, если
къ ней прибавить немного перекиси марганца 3); надо
только остерегаться, чтобы перекись марганца не
содержала горючихъ прим?сей, иначе очень легко можетъ
произойти взрывъ 3). Перекись марганца при ;>томъ не
изм?няется, хотя при бол?е высокой температур? она и
сама можетъ выд?лять кислородъ; д?йствіе перекиси
марганца въ данномъ случа? каталитическое.
f Т) Такъ же легко и просто получается кислородъ при
д?йствіи разведенной с?рной кислоты (1 ч. H2S04 на
4 ч. Б30) на КМп04; реакція идетъ по сл?дующему
уравнеиію: 2КМп04 -f H3S04 = K2S04 + 2Mn02 -f H20 +
-[-30 (изъ 10 гр. КМт\04 и 40—50 к. с. разведенной
і) Разложеніе КСЮ3 собственно совершается въ дв? фазы:
сначала при слабому нагр?ваніи КСЮ3 (хлорноватокаліевая соль)
разлагается съ выд?леніемъ кислорода и образовакіемъ хлористаго калія
(КС1) и хлорнокаліевой соли (КСЮ4): 2КСЮ8==КС1 + Оа + КС104»
а зат?мъ (при бол?? высокой температур?) уже разлагается и
КС104 : КС104 = KCI + 202.
з) Опытъ полученія кислорода ведется такъ: б?ртоллетову соль
растираютъ въ тонкій порошокъ и перем?шиваютъ въ фарфоровой
или стеклянной чашк? съ і/4 по в?су частью Мд02, предварительно
прокаленной-, такую см?сь насыпаютъ въ реторту и нагр?ваютъ;
быстроту выд?ленія кислорода регудируютъ усиленіемъ или ослабле-
ніемъ нагр?ванія; промываютъ кислородъ чрезъ водный растворъ
NaOH (1 ч. NaOH въ 3 ч. воды), сушатъ чрезъ с?рную кислоту или
чрезъ хлористый кальцій. 100 гр. КСЮ3 выд?ляютъ 39,15 гр.
кислорода (около 30 дитровъ). Собираютъ кислородъ или надъ ртутью,
или надъ водой (если не требуется сухой кислородъ), или, наконецъ,
въ прямо поставленный сосудъ, такъ какъ кислородъ немного тяже-
л?е воздуха.
3) Для того, чтобы быть ув?реннымъ въ чистот? Мп02, передъ
опытомъ ее сл?дуетъ тщательно прокалить. При полученіи кислорода
сл?дуетъ брать Мп02 вдвое (или даже вчетверо) меньше по в?су,
ч?мъ КСЮ3.
— 201 —
с Ьрной кислоты получается н?сколько бол?е одного
литра кислорода). ]
Для техническихъ ц?лейа) кислородъ (температура
]сип.—182,5°) получается изъ жидкаго воздуха (см. § 90
главу „Воздухъ") путемъ испаренія легче улетающаго
азота (—194°); такой кислородъ накачивается въ сталь-
цыя бомбы подъ давленіемъ 100 атмосферъ и въ такомъ
лид? поступаетъ въ продажу.
Физическгя свойства. Кислородъ — безцв?тный, въ
длинномъ сло? — голубой2) газъ, безъ запаха и вкуса,
какъ атмосферный воздухъ. Плотность его по отношенію
къ воздуху — 1,10535, а по отношенію къ водороду—
15,88. 1 литръ кислорода при 0° и 760 мм. давленія
в?ситъ 1,4292 гр. Въ вод? кислородъ растворимъ, хотя
и въ неболыпомъ количеств?, а именно: 100 объемовъ
воды при 0° Ц. растворяютъ 4,89, а при 15° Ц.—всего
2,9 объема кислорода; лучше растворимъ онъ въ спирт?
(280 к. с. въ 1 литр?). Точка кип?нія кислорода =
—182,5° при 760 мм. давленія; критическая температура
его 118°, критическое давленіе 50 атмосферъ. Жидкій
кислородъ сильно магнитенъ; уд?льный в?съ его = 0,6
(Н20=1). Въ жидкомъ водород? кислородъ при — 233°
затверд?ваетъ въ голубого дв?та ледяную массу.
Химгічеснія свойства. Изъ химическихъ свойствъ
прежде всего надо отм?тить его большую энергію къ
соединенно со вс?ми элементами, за исключеиіемъ фтора
и благородныхъ газовъ, т.-е. аргона, гелія, криптона,
неона и ксенона. Въ болыпинств? случаевъ это
соединение происходитъ непосредственно и во многпхъ слу-
чаяхъ при обыкновенной температур? 3). Наприм?ръ,
і) При помощи машины Линде (см. гл. о «Воздух?») можно
получить кислородъ прямо изъ воздуха.
2) Голубымъ цв?томъ кислорода объясняется голубой цв?тъ неба.
3) Бол?? трудно кислородъ соединяется съ галоидами (С1, Вг и J)
и съ благородными металлами (Au, Pt, Ag), Легкостью соединенія
кислорода съ т?лами объясняется присутствіе большого количества
кислорода въ т?лахъ природы.
— 202 —
фосфоръ легко соединяется съ кислородомъ; жел?зо при
обыкновенной температур? ржав?етъ на влажномъ воз-
дух?, а ржавленіе и состоитъ въ соединеніи жел?за съ
кислородомъ воздуха. Очень часто соединеніе т?ла съ
кислородомъ сопровождается выд?леніемъ тепла, св?та и
пламени. Такія т?ла, какъ фосфоръ, с?ра, уголь и др.,
горятъ въ кислород?, образуя окислы Р205, S02, С02;
металлы съ кислородомъ также образуютъ окислы.
Каждое горючее т?ло им?етъ свою температуру восгіламе-
ненія, т.-е. температуру, при которой оно иачинаетъ
соединяться съ кислородомъ съ образованіемъ пламени.
Въ большинств? случаевъ для начала гор?нія
обыкновенно необходимо повысить температуру горючаго т?ла;
а какъ только гор?ніе началось, накаливанія уже не
нужно, такъ какъ реакдія будетъ поддерживаться той
теплотой, которая выд?ляется при соединеніи кислорода
съ горящимъ т?ломъ.
Чтобъ показать, какъ энергично происходитъ гор?ніе въ
чистомъ кислород?, воспользуемся сл?дующими опытами:
1. Въ банку, наполненную кислородомъ, опустимъ на
проволок? раскаленный уголь: быстро начинается
сильное раскаливаніе, и уголь, соединяясь съ кислородомъ,
сгораетъ въ углекислый газъ (С02). Что д?йствительно
углекислый газъ образуется, въ этомъ можно уб?диться
по помутн?нію известковой воды, влитой въ банку. Если
вм?сто известковой воды въ банку прилить
растворенную въ вод? синюю лакмусовую краску, то она отъ
углекислаго газа стан?тъ красной; если же, наконецъ,
прилить простой воды и взболтать тщательно, чтобы
углекислый газъ растворился въ вод?, то вода пріобр?-
тетъ кисловатый вкусъ; С02 — окиселъ кислотный, такъ
какъ съ водою образуетъ кислоту (Н2С03).
2. Если въ банку съ кислородомъ опустить кусочекъ
горящей с?ры, положивъ ее въ жел?зную чашечку съ
припаянной длинной проволокой (рис. 44), то с?ра уси
ленно будетъ сгорать фіолетовымъ пламенемъ, образуя
— 203 —
іакъ называемый с?рнистыЁ ангидридъ (S02), тоже оки-
селъ—кислотный. Посл?дній также, растворяясь въ вод?,
иридаетъ ей кислый вкусъ (образуетъ кислоту) и также
синій цв?тъ лакмуса изм?нита въ красный.
3. Фосфоръ при совершенно подобномъ же (только
.іажечь его надо въ самой банк? прикосновеніемъ
раскаленной палочкой) опыт?1) (рис. 45) дастъ фосфорный
ангддридь (Р205) въ виД? бвлаго дыма, съ водою обра-
Рис. 44. Горът? Рис. 45. Горвте Рис 46. Горъте
с?ры, натрія фосфора жел?за
въ кислород?. въ кислород?. въ кислород?.
зующій кислую жицкость г(кислоту), измЬняющую синій
цв?тъ лакмуса вь красный.
Уголь, с?ра и фосфоръ взяты зд?сь, какъ
представители металлоидовъ. Подобно имъ^д^другіе металлоиды,
соединяясь съ кибЖтрбдомъ, дають кисло/тные~б^жлы]
такъ какъ эти окислы, (ВрисОединяззг^оду, образуютъ
кислогныя жидкости (гидраты) или иначе—кщдшиы, ве-
щества кислыя на вкусъ, изм?няющія синій цв?іъ лак-
' N
!) Фосфоръ обыкновенно хранится въ вод?; для опыта сл?дуетъ
подъ водой ж? осторожно отр?зать маленькш кусочекъ, быстро
обтереть его пропускной бумагой и, положивъ въ жел?зную ложку сь
длинной ручкой, внести въ банку съ кислородомъ; банку во время
гор?нш нельзя затыкать пробкой, иначе отъ расширенія и разогр?-
ванія можетъ разорвать банку или выбросить пробку вм?ст? съ
ложечкой и ея содержимымъ
— 204 —
муса въ красный и способныя зам?нять свой водородъ
на металлы (см. стр. 118).
4. Если сжечь въ кислород? металлъ натрій, поло-
живъ кусоч?къ его также» въ желвзную (лучше въ
известковую) ^жечку и предварительно расплавивъ и воспла-
менивъ его на гор?лк?, то натрій быстро сгораетъ съ
желтымъ пламенемъ, образуя окись натрія (Na20),
которая при раетвореніи въ вод? даетъ уже не кислую, а
щелочную жидкость (NaOH): она, обратно лредыдущимъ
окиеламъ, будетъ изм?нять красный цв?тъ лакмуса въ
синій. Самый окиселъ натрія и называютъ щелочнымъ
или основнымъ.
\ Вс? металлы, подобно натрію, образуютъ также
основные окислы, даюші? съ водою основные ггсдраты,
которые у большинства металловъ неспособны зам?нять
свой водородъ на металлы (см. стр. 117).
( 5. Если въ банку съ кислородомъ ввести жел?зную
пружину съ привязаннымъ къ ней кусочкомъ трута или
пробки и передъ введеніемъ въ банку зажечь трутъ, то
посл? того, какъ трутъ сгоритъ въ кислород?,
загорится пружина, образуя жел?зную окалину (Fe304)
(рис. 46). J
( 6. Гораздо ярче и энергичн?е горитъ бъ кислород?
д лента магнія (предварительно зажженная), образуя магне-
fylbO зію (MgO); ярко горитъ въ кислород? также цинкъ. }
f-^uw*^**^ Съ водородомъ кислородъ быстро соединяется при
if.*,» »'& сл?дующихъ условіяхъ: или при нагр?ваніи до 700°а),
^ л ,*, v или .при д?йствіи губчатой платины (водородное огниво),
или подъ вліяніемъ электрическихъ искръ. Результатомъ
этого соединепія является вода. См?сь двухъ объемом»
водо?од^^_адяаід5--ойъема. кидларода, называется грему-
чимъі(шшь.і такъ какъ при д?йствіи электрической
*) Ниже 700° соединеніе водорода съ кислородомъ тоже
возможно, но только медленное, и ч?мъ ниже температура, т?мъ медлен-
н?е идетъ реакція.
— 205 —
искры или при поднесеніи пламени взрываетъ а). Гремучій
газъ легко получается разложеніемъ воды электрическимъ
токомъ въ прибор?, изображ?нномъ на рис. 47. При-
Рис. 47. Приборъ для полученія гремучаго газа.
боръ наполняютъ водой и пропускаютъ чрезъ нее
электрически токъ; полученные при разложеніи воды водо-
Рис. 48. Кранъ Даніеля.
і) Громкій взрывъ объясняется т?мъ, что образующійся при ре-
акціи водяной паръ при высокой температур? гор?нія занима-етъ
гораздо болытй объемъ, ч?мъ см?сь взятыхъ газовъ, а потому и вы-
т?сняетъ сильнымъ толчкомъ находящійся прредъ нимъ воздухъ.
— 206
родъ и кислородъ см?шиваются между собой и чрезъ
узкую трубку выходятъ наружу.
Сжигать гремучій газъ всего безопасн?е въ такъ
называемом^ кран? Даніеля (см. рис. 48): кислородъ впу-
скаютъ $о внутреннюю трубку крана, а водородъ—въ
наружную. Пламя,
получающееся при сгораніи грему-
чаго газа, облад&етъ
настолько высокой
температурой, что въ пемъ
плавится даже платина; если
вставить въ это пламя ку-
сокъ извести, то (рис. 49)
онъ сильно раскаляется и
начинаетъ испускать осл?-
пительный, такъ
называемый Друммтдовъ св?тъ.
§ 75. Гор?ніе. Гор?-
ніемъ называется всякая
реакція, которая
сопровождается выд?леніемъ
тепла и св?та. Пламя обра-
зуютъ раскаленные газы,
развивающіеся при гор?ніи,
или раскаленныя твердыя
частицы; отъ количества
посл?днихъ зависитъ и
яркость пламени. Прим?ръ Друммондова св?та
подтверждаете это *).
Рис. 49. Приборъ для получения
Друммондова св?та.
1) Этотъ вопросъ будетъ подробнее изложенъ дальше—при угле-
род?. Бод?е яркое гор?ніе веществъ въ чистомъ кисдород?, ч?мъ въ
воздух?, объясняется сл?дующимъ: теплота, выд?ляющаяся при гор?-
ніи въ кисдород?, идетъ на раскаливані? газообразныхъ продуктовъ
гор?нія, и ч?мъ больше ея выд?ля?тся, т?мъ сильн?е раскаливанів,
т?мъ ярче св?ченіе; при гор?ніи же въ воздух? теплота гор?нія
расходуется еще на нагр?ваніе азота и др. составныхъ частей воз-
— 207 —
Такъ какъ большинство соединена! съ кислородомъ
совершается съ выд?л?ніемъ тепла (экзотермически) и
св?та, то понятіе о гор?ніи часто пріурочиваютъ
исключительно къ реакціямъ соединенія т?лъ съ кислородомъ;
но это неправильно. Гор?ніе можетъ явиться при всякой
реакціи, если только она идетъ съ выд?леніемъ такого
большого количества тепла, чтобы раскалить продукты
гор?нія до состоянія св?ченія. Изъ опред?ленія гор?нія
видно, что это понятіе относительное; если т?ло А го-
ритъ въ т?л? В, то и т?ло В горитъ въ т?л? А. Такъ,
иаприм?ръ, св?тилышй газъ *
горитъ въ кислород?: но
если атмосфера будетъ
состоять изъ свЬтильнаго газа,
а по газопроводной трубк?
будетъ течь кислородъ, то ¦ і
кислородъ будетъ гор?ть въ
св?тильномъ газ?. Рис. 50
показываетъ гор?ніе кисло- *
рода въ атмосфер? св?тиль-
наго газа. Явлені? протекаете
такъ же, какъ и при гор?ніи
хлора въ водород?, и наобо-
ротъ. &.
Т?ла могутъ соединяться
СЪ кислородомъ и безъ ВЫ- Рис. 50. Гор?ніе кислорода
д?ленія св?та: это въ т?хъ слу- въ св?тильномъ газ?.
чаяхъ, когда реакція
соединенія идетъ медленно, и развиваемое въ единицу времени
количество теплоты бываетъ недостаточно для раскали-
духа; сл?д., на нагр?ваніе самихъ-то продуктовъ гор?нія приходится
меньшее количество теплоты, а потому и гор?ніе въ воздух? идетъ
мен?е энергично. Если уменьшить теплоту настолько, что сос?днія
части горючаго т?ла не будутъ накаливаться до температуры гор?-
нія, то посл?днее прекращается. На этомъ, между прочимъ, основаны
такіе житейскіе пріемы, какъ задуваніе св?чи, гашеніе пожара водою.
— 208 —
ванія продуктовъ гор?нія до св?тимости, или тогда, когда
развиваемая теплота передается хорошимъ проводникамъ
тепла, напр., металламъ, и разс?ивается. Къ процессамъ
медленнаго гор?нія относятся, наприм?ръ, ржавленіе же-
л?за, аг'также гніеніе, тл?ніе, окисаніе.
Очень важный процессъ медленнаго гор?нія происходить
въ животныхъ организмахъ, это—дыханіе2). Пища,
принимаемая въ организмъ, подвергается сначала ц?лому
ряду механическнхъ и химическихъ превращеній въ про-
цесс? пищеваренія, а зат?мъ н?которыя получившіяся при
этомъ вещества, сд?лавшись составными частями т?ла,
соединяются при акт? дыханія съ кислородомъ
экзотермически: эта-то реакція и даетъ теплоту, которая необходима
для жизни организма. Вдыхаемый воздухъ содержите по
объему: 20,95% кислорода, 79^02% азота и 0,03% углекис-
лаго газа, водяные пары и др. составныя части.
Выдыхаемый воздухъ содержите по объему: 16,033% кислорода
(убыль почти 5%), 79,02% азота (безъ изм?ненія), около
4,38% углекислаго газа (въ 100 разъ больше сравнительно
съ вдыхаемымъ воздухомъ). почти насыщенъ водяными
парами (прибыль воды) и да. Такимъ образомъ, дыханіе
есть гор?ніе, но гор?ніе медленное, совершающееся безъ
выд?леніе св?та и сопровождающееся сравнительно не-
большимъ выд?леніемъ тепла въ единицу времени. Пре-
кращеніе дыханія вызываетъ смерть организма, потому
что съ этимъ актомъ прекращаются т? химическіе
процессы, которые давали энергію для работы организма.
Вс? виды соединенія т?лъ съ кислородомъ
обобщаются однимъ поняті?мъ— окисленіе.
Значеніе кислорода въ жизни природы, какъ видно
изъ предыдущаго, чрезвычайно важно: 1)
онъ—необходимый элементъ при жизпениомъ акт? —дыханіи; 2) при
реакціи соединенія т?лъ съ яимъ (при гор?ніи дерева,
і) Еще Лавуазье опред?лилъ, что дыханіе есть медленное
гор?ніе.
— 209 —
угля, нефти и др.) добывается необходимая въ общежи-
ччи тепловая энергія; 3) благодаря д?йствію кислорода,
сгниваютъ и истл?ваютъ отжившіе животные и расти-
тельные организмы (т.-е. трупы животныхъ, деревья,
растенія, органическія вещества почвы и т. д.)*), при
чемъ ихь составныя части—сложныя
вещества—превращаются въ прост?шпія; а посл?днія вновь вступаютъ въ
общій круговоротъ матеріи въ природ?.
О з о н ъ, 03.
Молек. в?съ 03 — 48. * Уд. в?съ (Н = 1) — 24. Плотность (воз-
духъ = 1) = 1,66. Темп, кил?нія — 1190.
§ 76. Полученіе. Кром? своего обыкновенная состоя-
лія, кислородъ встр?чается еще-лъ^вид? особаго паху-
чаго видоизм?ненія— озона.^отъ осв?жающій пріятный
-запахъ, который ощущается въ воздух? посл? грозы,
принадлежитъ озону.
Озонъ можетъ быть получёнъ изъ кислорода, напр.,
при медленномъ окисленіи фосфора или скипидара, при
д?йствіи H2S04 на хамелеонъ .(KMnOj; особенно же
хорошо— подъ вліяніемъ тихаго разряда электричества на
кислородъ. Ни при одномъ изъ способовъ не достигается
лолнаго превращенія кислорода въ озонъ3 а превращается
не бол?е 5—6°/0, такъ какъ эта реакція обратима.
Въ лабораторіяхъ озонъ получаютъ чаще всего въ
такъ называемомъ озонатор? Сименса. Этотъ приборъ
(рис. 51) состоитъ изъ двухъ трубокъ, вложенныхъ одна
въ другую; наружная трубка, обложенная снаружи
оловянной фольгой, на одномъ конц? суживается въ
трубочку е, на которую над?вается форштоссъ; внутренняя
і) Когда желаютъ сохранить на продолжительное время
питательный органическія вещества, ихъ закупориваютъ въ банки или
коробки, изъ которыхъ удаляютъ воздухъ (приготовленіе консервовъ);
при этомъ уничтожаются и т? микроорганизмы, которые участвуютъ
въ процесс? разрушенія веществъ.
Неорганическая хвмія. 14
— 210 —
трубка выложена оловянной фольгой съ внутренней
стороны; кон?цъ с внутренней трубки задаянъ, а у конца Ь
ея фольга соединена съ индукщонной спиралью; съ по-
сл?дней соединена и наружная фольга наружной трубки.
При тако&ъ условіи токъ разряжается тихимъ разрядомъ,
безъ искръ.
Если чр?зъ боковую трубку d въ пространство между
обложенными фольгой* трубками направить струю сухого
кислорода, то чрезъ конецъ е трубки будетъ выходить
уже частью озонированный кислородъ. Посл?днее легко-
обнаружить, потому что уже ничтожное количество озона,
Рис. 51. Озонаторъ Сименса.
во і-хъ, ощутимо по запаху, во 2-хъ, вызываетъ поси-
н?ні? іодо-крахмальной бумажки (объясненіе этой реакдіи
см. на 212 стр.).
Фтическія свойства. Озонъ — газъ, обладающій ха-
рактернымъ запахомъ; въ толстыхъ слояхъ онъ синяго
цв?та. При давленіи въ 150 атмосферъ и при очень
низкой температур? озонъ переходитъ въ жидкость инди-
гово-синяго цв?та. При обычныхъ усдовіяхъ озонъ дсь
вольно постояненъ, но при нагр?ваніи онъ переходитъ
въ кислородъ; при этомъ объемъ озона увеличивается9
а плотность его уменьшается въ 1,5 раза.
Плотность озона по отношенію къ водороду = 24;
¦сл?довательно, частичный в?съ озона = 48 (m = 2d)7 и
— 211 —
частица его состоять изъ трехъ атомовъ (03); этимъ онъ
и отличается отъ кислорода, у котораго частица состоитъ
изъ двухъ атомовъ (02).
Уменьшеніе объема и увеличеніе плотности въ 1,5
раза при переход? кислорода въ озонъ, а равно и
увеличеніе объема и уменьшеніе плотности въ 1,5 раза при
переход? озона въ кислородъ можно схематически
пояснить такъ:
1 объемъ
кислорода 00
1 объемъ
кислорода 00
1 объемъ
кислорода 00
или 302 = 203,
злачитъ, изъ трехъ объемовъ кислорода образуется 2
объема озона/^а,""прй""5?ратноУ'р^акЬТи^- изъ 2-хъ
объемовъ озона образуется 3 объема кислорода.
Подобное явленіе, когда одинъ и тотъ же элемента
образуетъ н?сколько видоизм?иеній (простыхъ т?лъ),
называется аллотропгей; оно и объясняется т?мъ, что
частицы элемента въ разныхъ видоизм?неніяхъ состоять
изъ различнаго количества атомовъ (см. стр. 82). Озонъ
растворимъ въ вод? лучше, ч?мъ кислородъ. \
Химическгя свойства. Изъ химическихъ свойствъ
озона особенно зам?чательна его способность окислять;
при обыкновенной температур? въ этомъ отношеніи озонъ
превосходитъ кислородъ: вс? органическія вещества имъ
разрушаются, краски обезцв?чиваются; фосфоръ и с?ра
окисляются имъ въ кислоты; амміакъ (NH3) переходитъ
въ азотную (HN03) и азотистую (HN02) кислоты; серебро
и свинецъ образуютъ перекиси и т. д.
Для обнаруженія озона пользуются іодо-крахмальной
бумажкой, т.-е. бумажкой, пропитанной растворомт^
14*
=
000
000
1 объемъ озона.
1 объемъ озона.
— 212 —
іодистаго калія и крахмадьнымъ клейстеромъ./ Озонъ въ
присутствіи воды выд?ляетъ іодъ изъ іодистаго калія:
03 + 2KJ + H20 = 0B + 2KOH + J2,
а выд?давшійся іодъ съ крахмаломъ даетъ соединеніе
синяго Дв?та.
Характерна для озона и сл?д. реакція: св?жеочищен-
ная серебряная пластинка отъ озона черн?етъ,
образуется перекись серебра Ag202. Эта посл?дняя реакція
позволяетъ отличить озонъ отъ очень сходной съ пимъ
перекиси водорода (см. дал?е).
Озонъ есть соединеніе эндотермическое, образованное
съ погдощеніемъ энергіи извнЬ:
02 + 0 = 03 —32,4 К.
При разрушеніи онъ выд?ляетъ все затраченное на
его образованіе тепло, ч?мъ и объясняется его ббльшая
энергія сравнительно съ кислородомъЛ
Озонъ всегда находится въ бодьшемъ или меньш?мъ
количеств? въ воздух?; но въ виду того, что онъ
расходуется, энергически д?йствуя'на органическія т?ла, а
также и на низшіе организмы, количество его не везд?
одинаково: въ воздух? полей и л?совъ (особенно хвой--
ныхъ), его больше, ч?мъ вблизи жилищъ. Убивая
микроорганизмы, озонъ является дезикфекціоннымъ средствомъ.
Продолжительное вдыханіе чистаго озона вызываетъ вос-
паденіе дыхательиыхъ путей.
Въ техиик? озонъ широко прим?няется для б?ленія
тканей, страусовыхъ перьевъ, воска, сахара, для очистки
питьевой воды, для осмоленія маселъ и т. д.
Задачи: 1) Сколько надо взять бертоллетовой соли, чтобы
получить 16 гр. кислорода?
2) Сколько по в?су и по объему выд?лится кислорода
изъ 10 гр. бертоллетовой соли?
3) Если атомный в?съ кислорода = 16 гр., а плотность
озона = 24, то какъ узнать, изъ сколькихъ атомовъ
кислорода состоять частица озона?
— 213 —
Ссединенія кислорода съ водородомъ.
Вода, Н20. §[?> '
Молекул, в?съ Н20 = 18,02. Уд?л. в?съ Н20 при 00^=0,99987, при
40 г= 1. Абсол. в?съ 1 литра вод. пара при 0° и 760 мм. = 0,8059; при
1000 и 760 мм.=0,590 гр. Процентный составъ воды по в?су: 0=88,89о/0,
Н:=11,Ш/0. Темпер. замерзанія^Оо. Темпер. кип?нія=100° при 760 мм.
§ 77. Вода есть самое распространенное въ природ?
соединеніе кислорода. Жидкая вода покрываетъ около 4/5
земной поверхности; много воды находится въ вид? пара
въ атмосфер? и въ вид? льда въ полярныхъ странахъ и
на вершинахъ высокихъ горъ; въ животныхъ организмахъ
воды находится до 80%, а въ растительныхъ—до 90%.
Въ природ? вода никогда не встр?чается совершенно
чистой, а всегда содержитъ въ раствор? различныя прн-
м?си какъ твердыя, такъ и газообразныя.
Самая чистая природная вода — дождевая, но и она
содержитъ растворенные газц (около 3%)—азотъ, кисло-
родъ и углекислый газъ и н?которыя соли (амміачныя
соли азотистой и азотной кислотъ, образующіяся въ воз-
дух? во время грозы); кромЬ того, при своемъ паденіи
она увлекаетъ съ собою въ значительномъ количеств?
пыль и микроорганизмы, носящіеся въ воздух?.
Воды источнжовг образуются изъ дождевой воды.
Просачиваясь чрезъ почву, дождевая вода растворяетъ
н?которыя вещества почвы: отъ разнообразія ночвъ
зависишь и разнообразіе и количество прим?сей къ вод?
источниковъ. Особенно часто и въ наибольшемъ
количеств? въ вод? находятся соли Са(НС03)2, NaCl и CaS04,
а въ меныпихъ количествахъ—Na2S04, MgS04, Fe(HC03)2
и др. Источники, содержание въ раствор? ц?лебныя
вещества, называются минеральными. Составъ минераль-
ныхъ водъ очень разнообразенъ какъ по количеству, такъ
и по качеству расхворенныхъ веществъ. Существуютъ,
наприм?ръ, воды жел7ьзистыя (въ нихъ содержатся
— 214 —
соединенія жел?за), с?рныя (т.-е. содержащія въ себ?
соединенія о?ры) и др.
Ключевая вода, кром? твердыхъ составныхъ частей
(солей), содержитъ обыкновенно еще газы, наприм?ръ.,
часто угдекислый газъ. Благодаря содержанііо посл?дняго
вода можетъ растворять и такія вещества, которыя въ
чистой вод? нерастворимы, наприм?ръ, СаС03, MgC03
и др. При стояніи такой воды на воздух?, лучше при
повышенной температур? (наприм?ръ, при кицяченіи),
углекирлый газъ улетучивается изъ воды, а соли (СаС03,
MgC03 и др.) выпадаютъ, образуя муть или осадокъ. По
этой именно причин? и образуются накипи въ самова-
рахъ, котлахъ и вообще тамъ, гд? происходить кипяче-
ні? воды 3).
Вода, содержащая много Са(НС03)2, Mg(HC03)2, а также
CaS04 и др., называется жесткой водой: она плохо мы-
литъ, плохо развариваетъ плоды и овощи и даетъ много
накили въ сосудахъ. Накипи, образующіяся въ котлахъ
или самоварахъ, требуютъ болыпаго прогр?ванія ст?нокъ
сосуда, а сл?довательно, требуютъ большаго расхода
топлива. Дабы устранить нежелательную жесткость воды,
предложено было н?сколько способовъ, изъ коихъ пока
шире прим?няетея такой: къ такой вод? прибавляютъ
извести, которая соединяется съ углекислымъ газомъ
воды, образуя нерастворимый въ вод? СаС03, который и
осаждается на дно сосуда, съ нимъ же осаждаются и
т? СаС03 и MgC03, которыя были раньше въ раствор?,
*) Для иллюстрацш этого явленія можно произвести сл?д. опытъ:
въ стаканъ наливается известковая вода, и въ нее пропускается
углекислый газъ; сейчасъ же известковая вода мутится отъ образующаяся
углекислаго кальція [Са (ОН)2 -f- С02 = СаС03 -f- K<fi]> въ В(>Д? не~
растворимаго; при дальн?йшемъ пропусканіи С03 образовавшаяся муть
дсчеза.етъ и получается прозрачная жидкость. Если теперь нагр?ть
оту жидкость, то изъ нея выд?лится н?которое количество С02, и муть
(соль) вновь появляется.
— 215 —
т.-е. пока въ вод? находился углекислый газъ. Для
т?хъ же ц?лей служитъ прибавленіе къ вод? соды 2).
Вода, содержащая мало (около 0,01—0,03°/0)
твердыхъ растворенныхъ прим?сей, называется мягкой.
Р?чная вода содержитъ въ себ? въ 100.000 ч. отъ
10 до 50 частей твердыхъ солей, и преимущественно
солей кальція (СаС03, CaS04), а также солей магнія и др.
Въ ней также содержатся и газы; отъ 40 до 50 к. с. на
1.000 к. с. воды.
Морская вода по жесткости во много разъ
превосходить р?чныя воды: въ ней количество солей въ среднемъ
достигаетъ прим?рно до 3,5°/0, и главная масса
приходится зд?сь на поваренную соль (NaCl) около 2,5—3°/0-
Колодезная вода находится въ зависимости отъ почвы.
Въ колодезной вод? могутъ быть прим?шаны органиче-
скія вещества, амміакъ и др. очень вредныя прим?си.
Всего опасн?е мелкіе колодцы, вода которыхъ можетъ
заражаться загрязненной почвенной водой.
Чистой водой въ природ? называютъ такую, которая,
во-1-хъ, не содержитъ мути, во-2-хъ, содержитъ
небольшое количество твердыхъ солей (не бол?е 300 миллигр.
солей и не бол?е 100 миллигр. органическихъ остатковъ
на 1 литръ воды) и, въ-3-хъ, им?етъ осв?жающій вкусъ 2)
л не обладаетъ запахомъ.
Въ воздух? вода находится въ вид? водяного пара,
принимающего различныя формы: облаковъ, тумана, росы,
инея, сн?га и т. п.
Кром? указанныхъ видовъ, вода въ природ?
составляете необходимую принадлежность какъ растительныхъ,
такъ и животныхъ организмовъ.
!) Въ посл?дні? года для очистки воды разрабатывается новый
методъ—фильтрація воды черезъ цеолитовый минералъ; результаты
лрим?ненія этого метода очень хорошіе.
2) Вкусъ воды въ значительной степени зависитъ отъ
растворенныхъ въ ней газовъ; при кипяченіи воды газы улетаютъ, поэтому
прокипяченная (отварная) вода им?етъ иной вкусъ, ч?мъ св?жая. При-
сутстві? газовъ въ вод? питьевой физіологически необходимо.
— 216 —
Зат?мъ вода пропитываетъ всю твердую часть земной
коры и зд?сь находится, сл?довательно, при химическихъ
соединеніяхъ; отяошені? ея зд?сь различно.
Иногда она только механически притягивается т?лами,
напр., всегда сгущается на поверхности (адсорбція) твер-
дыхъ rfcjrd, и въ такомъ случа? называется
гигроскопической) удаляется она изъ т?ла при 100°; химизма зд?сь
н?тъ.
Очень часто вода принимаетъ участіе въ сложеніи
кристалловъ, при чемъ участіе это настолько необходимо,
что кристаллы разрушаются при выд?леніи изъ нихъ
воды. Такая вода носитъ названіе крисшаллизаціонной.
Кристаллизаціонная вода связана съ т?ломъ бол?е прочно,
ч?мъ гигроскопическая, и выд?ляется г) при темпе-
ратур?, часто очень значительно превышающей 100°.
Наприм?ръ, посл?дняя частица кристаллизадіонной воды
м?дпаго купороса (CuS04 . 5Н20) выд?ляется только
около 220°.
Иногда вода, вступая въ химическое соедииеніе,
расщепляется на свои элементы (Н20 —О -j-H-f-H),
которые въ такомъ случа? и входятъ, какъ составныя части
химическаго соединенія, и, конечно, удерживаются въ
п?мъ бол?е или мен?е прочно. Наирим?ръ, К20 4-Н20 —-
^2КОН; CaO -f Н20 = Оа(ОН)3; S03 4-H20 = H2S04.
Такая вода, входящая въ самый составъ химическаго
соединенія, называется конституціопной.
Чтобы очистить природную воду отъ прим?сей, меха-
~ нически взв?шенныхъ, напр., отъ ила, глины, песка
и т. п., ее фильтруютъ, т.-е. пропускаютъ чрезъ поры
какого-нибудь вещества—бумаги, песка, угля, пористаго
камня и т. п.
Но чтобы очистить воду отъ прим?сей, расш?орен-
ныхъ въ ней, ее подвергаютъ перегонк?, т.-е. превра-
*) Улетучиваніе кристаллизаціонной воды изъ кристалловъ при
обыкновенныхъ усдовіяхъ называется вывтътриваніемъ.
— 217 —
іцаютъ въ паръ, который дал?е пропускаютъ чрезъ
холодильнику и полученную въ холодильник? воду соби-
раютъ въ какой-нибудь пріемникъ. Такая перегнанная
вода называется дистиллированной водой. Перегонку
производить въ аппарат?, изображенномъ на рис. 52,
въ такъ называемомъ перегонномъ куб?. Вс? твердыя
вещества, растворенныявъвод?, посл? перегонки остаются
въ перегонномъ куб?; газы же выд?ляются раньше, ч?мъ
вода будегъ перегоняться. Для полнаго очищенія воды
Рис. 52. Перегонный кубъ.
отъ растворениыхъ вь ней газовъ и твердыхъ веществъ
одной перегонки не достаточно: ее повторяютъ н?сколько
разъ и лучше въ прибор? изъ платины, какъ металла,
не изм?няющагося во время опыта.
§ 78. Физическія свойства чистой воды. Чистая вода
въ тонкомъ сло? безцв?тная, а въ толстомъ—зеленовато-
юлубая, безъ запаха и вкуса. При 0° вода затверд?ваетъ,
образуя твердую кристаллическую массу—ледъ; кристаллы
льда им?ютъ различное сложеніе, что видно на прила-
гаемомъ рисунк? (рис. 53); ихъ легко наблюдать зимой
на оконныхъ стеклахъ. При 100° Ц. (при 760 мм. давле-
— 218 —
лія) она превращается въ паръ 1). При 4° Ц. она им?-
етъ наибольшую плотность и наименыній объемъ: и выше
и ниже этой температуры она расширяется. При пере-
ход? воды въ ледъ объемъ ея увеличивается
приблизительно на 9%, уд?льный в?съ при этомъ, конечно,
уменьшается: по этой-то причин? ледъ плаваетъ на
поверхности воды2). Скрытая теплота плавленія льда =
= 79К., а скрытая теплота парообразования = 536К,
Рис. 53. Кристаллы льда.
1 объемъ воды при 100°, переходя въ паръ, увеличиваетъ
свой объемъ въ 1.696 разъ. Плотность паровъ по отно-
шепіго къ воздуху— 0,62, а къ водороду = 9.
Теплоемкость воды больше теплоемкости вс?хъ другихъ
жидкостей, почему горячую воду и ея пары часто прим?няютъ
для нагр?ванія, а холодной водой заливаютъ пожары.
*) Чтобы показать, какъ вліяетъ давленіе на темп, кип?нія воды*
лриведемъ сд?дующую табличку:
при давленіи въ 1 атм. вода кипить при 3000
» » » lVa > » » > 111,7»
» > » 2 » » > » 120,60
» » 2V» » * » 127,8»
> » » 3 » » » з> 133,9°
2) Температура нижнихъ слоевъ воды (въ не очень м?лкихъ бас-
сейнахъ) обыкновенно не бываетъ ниже 4°: при 4*> вода наибол?е
тяжела, она опускается вішзъ и всд?дствіе плохой теплопроводности
вышележащихъ слоевъ дал?е не охлаждается. Поэтому большіе бас-
-сейны (р?ки, моря) зимою не пром?рзаютъ до дна, и водная жизнь
не прекращается.
— 219 —
Гиоиства воды во многихъ случаяхъ принимаются за
одпницу сравиенія.
Выше было указано, что вода при 100° (при 760 мм.
дмнленія) кипитъ. Если же воду нагр?вать до 950° —
1.000°, то она разлагается на свои составныя части —
ішдородъ и кислородъ:
н2о=н2 + о.
Но при неяосредственномъ нагр?ваніи водяного пара
.пюго разложенія зам?тить нельзя, потому что при доста-
Рис. 54. Раздож?ніе воды д?йствіемъ нагр?ванія но способу
Сентъ - Клера Девилдя.
точномъ охлажденіи (около 700°—800°) водородъ вновь
соединится съ кислородомъ, образуя воду. Такое разло-
жеяіе (подъ вліяніемъ теплоты), при которомъ
получаются продукты, способные (при пониженіи температуры)
соединяться вновь и давать первоначальное т?ло, какъ
было указано на стр. 92, называется джсоціаціей.
( Для показанія диссоціаціи воды Сентъ-Клеръ Девилль
предложилъ сл?дующій опытъ (рис 54). Глиняную
пористую трубку вставляютъ въ бол?е широкую
фарфоровую и накаливаю гъ въ печи доб?ла. Во внутреннюю
трубку (по трубочк? д) пропускаютъ водяной паръ,
который при высокой температур? разлагается на водородъ
и кислородъ. Водородъ, какъ бол?е легкій газъ, скор?е
— 220 —
кислорода диффундируетъ чрезъ пористую ст?нку, и
потому по охлажденіи см?си, находящейся во вн?шней и
во внутренней трубкахъ, въ первой изъ нихъ останется
свободный водородъ, а во второй—кислородъ. йхъ можно
собрать въ цилиндръ е, какъ это показано на рисунк?.
Дисссіщація совершается всегда постепенно, а не сразу.
Кинетическое представленіе о газахъ легко объясняетъ
это: какъ скорость движенія частицъ газа не одинакова,
такъ не одинакова и скорость движенія атомовъ въ раз-
ныхъ частицахъ; та и другая пропорціональны
абсолютной температур?Л
§ 79. Составь воды. Уже изъ опыта диссоціаціи ясно,
что вода состоитъ изъ двухъ составныхъ частей—изъ
водорода и кислорода. Водорода въ вод? по объему вдвое
бол?е, нежели кислорода; по в?су же водорода почти
въ восемь разъ меньше, нежели кислорода. Это
доказывается сл?дующими опытами.
Объемный анализъ воды производится д?йствіемъ на
воду электрическаго тока, при чемъ на катод?
получаются два объема водорода, а на анод?—одинъ объемъ
кислорода (рис. 15 на стр. 151).
Надо зам?тнть, что вода чистая является чрезвычайно
слабымъ электролитомъ: для электролиза воды
прибавляюсь къ ней какого-нибудь электролита, напр., H2S04.
С?рная кислота въ водномъ раствор? подъ вліяніемъ
тока выд?ляетъ на отрицательномъ электрод? водородъ
/Н2), а на положительномъ—группу S04, которая сей-
часъ же разлагается на S03-|-0, почему съ электрода
выд?ляется кислородъ, a S03 съ водою даетъ опять
H2S04. Такимъ образомъ, выразивъ этотъ процессъ въ
уравненіяхъ:
1) H8S04 = H8 + S04,
2) S04 = S03 + 0,
3) S03 + H20 = H2S04,
можно вид?ть, почему H2S04 въ опыт? остается какъ бы
— 221 —
ым і» изм?ненія, а процесеъ идетъ такъ, ,какъ будто,
рп.шігается сама вода1).
Синтезъ воды, соединенный съ измЬреніемъ объемовъ,
производится сл?дующимъ образомъ. См?сь изъ 2 объ-
Рис. 55. Приборъ для синтеза воды съ язм?реніемъ
объема образовавшаяся водяного пара.
омовъ водорода и 1 объема кислорода вводится въ
.шдіометрическую трубку, которая предварительно
наполняется ртутью. Закрытое кол?но этой трубки (рис. 55)
окружаютъ бол?е широкой трубкой Е, чрезъ которую
1) Въ 1.000.000 литровъ воды диссоцшрована на іоны (см. дал?е)
приблизительно лишь граммъ-молекула.
— 222 —
процускаютъ иаръ, нагр?ваемой въ колб? F жидкости,
кипящей выше воды (для того, чтобы вода получилась
въ газообразномъ состояніи), наприм., амиловаго спирта,
точка кдл?нія котораго 132°. Паръ сгущается въ
другой колб?, охлаждаемой въ сосуд? Н. Когда впущенный
гр?мучій газъ приметь температуру окружающаго его
пара, тогда приводятъ ртуть въ обоихъ кол?нахъ U-об-
разной трубки къ одному уровню, передвигая для этого
сообщающейся съ ними ртутный резервуаръ М. Зат?мъ
отм?чаютъ объемъ, занимаемый гр?мучимъ газомь, и подъ
уменьшеннымъ давленіемъ (понижая уровень ртути въ
запаянномъ кол?н?) пропускаютъ электрическую искру
межцу электродами, проведенными въ трубку въ верхней
ея части. Подъ вліяні?мъ искры кислородъ соединяется
съ водородомъ, образуя воду. Зат?мъ приводятъ ртуть
въ обоихъ кол?нахъ снова къ одному уровню (то-есть
къ первоначальному давленію) и изм?ряютъ полученный
объемъ водяного пара. Онъ равенъ 2/з прежняго объема
см?си водорода съ кислородомъ. Стало-быть, два объема
водорода, соединяясь съ однимъ объемомъ кислорода,
даютъ два объема воды:
2Н2 + 02 = 2Н20
2 об. или 2 мол.-)- 1 об. или 1 мод. = 2 об. или 2 мол.
Если бы былъ избытокъ одного изъ газовъ, то остав-
шійся не соединеннымъ объемъ избыточнаго газа можно
изм?рить сл?дующимъ образомъ: охладить U-образную
трубку до обыкновенной температуры (тогда вода перей-
детъ въ жидкое состояніе) и изм?рить оставшійся объемъ
газа, а зат?мъ, принимая во вниманіе упругость
водяного пара, перевести полученный объемъ на объемъ при
132° (по формул? Г е й-Л во с с а к а).
В?совой анализъ воды производятъ сл?дующимъ
образомъ. Получаютъ въ склянк? А (рис. 56) водородъ
д?йствіемъ H2S04 на Zn и осушаютъ его, пропуская
чрезъ склянку В съ H2S04 и рядъ трубокъ С, D и Е
— 223 -
Рис. 56. Весовой аналнэъ воды.
съ СаС12. Въ шарик? F находится черная окись м?ди
(СпО). При нагр?ваніи этого шарика водородъ отнимаетъ
кислородъ отъ окиси м?ди, образуя воду, которая
сгущается въ шарик? G и окончательно улавливается въ
хлорокальціевой трубк? Н. Приборы F, G и Н взв?ши-
ваются до и посл? опыта. Прив?съ G и Н даетъ
количество образованной воды, а убыль въ в?с? F —
количество затраченнаго кислорода. Разница въ в?сахъ воды
и кислорода даетъ в?съ водорода. Этимъ путемъ носл?
многократныхъ пров?рокъ найдено, что 100 частей воды
содержатъ 11,11 частей по в?су водорода и 88,89 частей
кислорода, или на 1 в. ч. водорода приходится 7,94 в?-
совыхъ частей кислорода а).
Изъ плотности водяного пара, равной 9, заключаемъ,
что частичный в?съ воды равенъ 18. Изъ этого выте-
каетъ, что частица воды состоитъ изъ 1 атома кислорода
(ат. в. = 16) и двухъ атомовъ водорода (18— 16 = 2),
что вполн? соотв?тствуетъ объемнымъ отношешямъ.
*) Въ случаяхъ, когда не требуется особой точности это отно-
шеніе принимаютъ какъ 1:8.
— 224 —
§ 80. По хгсмическимь свойствамъ вода является
окисломъ водорода и окисломъ индифферентньшъ, такъ
какъ можетъ соединиться и съ окислами основными и
съ окислами кислотными, напр.:
1) СаО+Н20 = Са(ОН)2,
2) S03 + Н20 == S09(OH)2,
При химическихъ превращеніяхъ вода играетъ очень
важную роль: достаточно указать, что очень большое
число химическихъ реакдій идетъ или въ водныхъ раство-
рахъ, или въ присутствіи хотя бы небольшого количества
воды. Вода непосредственно соединяется со многими т?-
лаыи. При высокихъ темнературахъ вода можетъ служить
окислителемъ для веществъ, легко окисляющихся.
§ 81. Растворы. Вода—самый обыкновенный
растворитель для очень большого числа различныхъ т?лъ — и
твердыхъ, и жидкихъ, и газообразныхъ. Подъ растворомъ
разум?ется совершенно однородная (гомогенная) система
изъ двухъ или болынаго количества веществъ. Этой
однородностью растворы отличаются отъ суспенсій, т.-е.
когда одно вещество взв?шено въ другомъ въ вид? ли
ясновидимыхъ отд?льныхъ частичекъ вещества, въ вид?
ли эмульсіи; типичнымъ прим?ромъ эмульсій можетъ
служить молоко. Иногда въ эмульсіяхъ растворимое
вещество такъ тонко распылено, что оно лри стояніи не
ос?даетъ и при фильтрованіи на фильтр? не застре-
ваетъ; т?мъ не мен?е .такая см?сь или мутна или
оналесцируетъ.
Растворы могутъ быть не только жидкіе, но и
твердые] прим?ромъ посл?днихъ можетъ сложить
обыкновенное стекло, представляющее см?сь различныхъ солей
кремневой кислоты.
Чтобы узнать, растворяется ли данное вещество въ
вод?, взболтанную см?сь фильтруютъ, берутъ каплю
раствора на часовое стекло и выпариваютъ: присутствіе
твердаго остатка на стекл? свид?тельствуетъ о раство-
— 225 —
римости вещества въ растворител? г). Если нужно узнать
степень растворимости вещества, то берутъ опред?лен-
ный объемъ раствора, осторожно испаряютъ
растворитель и остатокъ взв?шиваютъ. Количество вещества
раствореннаго въ опред?ленномъ количеств?
растворителя, выражаетъ концентрацгю раствора. Наибольшее
количество даннаго вещества, могущее при обыкновен-
ныхъ условіяхъ раствориться въ 100 в?совыхъ частяхъ
растворителя, называется коэффиціентомъ
растворимости этого т?ла при данныхъ условіяхъ. Растворъ,
содержаний въ литр? растворителя граммжвивалентъ
вещества, называется нормальнымъ растворомъ.
Эквивалентный в?съ вещества есть такое его количество,
которое требуется для обм?ннаго превращенія съ однимъ
еквивалентомъ элемента: такъ, напр., граммъ-молекула
соляной кислоты (36,5) есть и ея эквивалента; для с?рной
кислоты H2S04 (98 гр.), содержащей два атома водорода,
эквивалентомъ является половина граммъ-молекулы, т.-е.
49 гр. для ГеС13 (162,5), гд?* Fe—трехъэквивалентно,
эквивалентомъ будетъ 54,16 гр. Смотря по надобности,
готовятъ растворы полунормальные (половина граммъ-
эквивалента вещества на 1 литръ растворителя), деци-
нормалыгые (у^граммъ-эквивалента 1, сентинормальные
("Топ гРаммъ-эквивалента ) и т. д. Существуетъ еще
выраженіе—-молярные растворы, когда въ одномъ литр?
растворителя растворена граммъ-молекула вещества.
*) Необходимо различать растворимость «практическую», т.-е.
сравнительно легко констатируемую при обычныхъ изсл?дованіяхъ,
и растворимость «абсолютную»: практически нер?дко многія
вещества называются нерастворимыми, но на самомъ д?л? они
растворяются, но лишь въ самыхъ незначительныхъ количествахъ, и, пови-
цимому, совершенно нерастворимыхъ въ вод? веществъ н?тъ.
Неорганическая химія. 15
— 226 —
Коэффиціентъ растворимости твердыхъ т?лъ
обыкновенно увеличивается съ повышеніемъ температуры г), и
есть для каждой данной температуры и для даннаго т?ла
величина постоянная. Растворы, содержание это
наибольшее количество вещества, которое соотв?тствуетъ
данной температур?, называются насыщенными, въ отли-
чіе отъ ненасыщенныхъ, когда количество раствореннаго
вещества меньше требуемаго для насыщенности.
При осторожномъ охлажденіи насыщенныхъ при
повышенной температур? растворовъ иногда кристаллы не
выд?ляются: такіе растворы называются пересыщенными.
Правда, изъ нересыщенныхъ растворовъ очень легко
выд?ляется часть раствореннаго вещества. Явленіе
пересыщенія хорошо воспроизводится, наприм?ръ, съ
глауберовой солью (Na2S04 . 10Н2О): растворяютъ при
кипяченіи десятиводную кристаллическую глауберову
соль въ вод? до насыщенія, растворъ сливаютъ съ не-
растворившейся соли и еще кипятятъ; еще во время
кип?нія затыкаютъ колбу ватой для изолированія
раствора отъ твердыхъ прим?сей воздуха; по охлажденіи и
получается пересыщенный растворъ. Если въ такой
растворъ внести еще кристалликъ глауберовой соли, то
растворъ быстро начинаетъ выд?лять кристаллы состава
Na2S04 . 10Н2О.
Пересыщенные растворы образуются большею частью
такими солями, которыя могутъ давать съ водою н?-
сколько различныхъ по составу соединение, такъ наз.
кристаллогидратовъ. Напр., с?рнокислый натръ даетъ
или Na2S04 . 10Н2О. или Na2S04 . 7Н20. Каждое изъ та-
кихъ соединеній им?етъ свою растворимость; въ водномъ
раствор? эти различный соединенія могутъ существовать
одновременно. Въ нашемъ прим?р? въ раствор? могутъ
і) Существуютъ и такія т?ла, растворимость которыхъ съ
повышеніемъ температуры уменьшается (напр., гипсъ). и такія,
растворимость которыхъ мало зависитъ отъ температуры (напр.,
поваренная соль).
— 227 —
быть оба кристаллогидрата, по отношений къ которымъ
растворъ не будетъ пересыщеннымъ (онъ былъ бы пере-
г.ыщенъ» если бы растворяемое вещество не м?няло въ
раствор? своего состава). Кристаллогидраты непрочны,
а потому и требуются особыя предосторожности при
ириготовленіи и сохраненіи ихъ. Брошенный въ такую
систему кристалликъ съ опред?леннымъ и достаточно
устойчивьшъ химическимъ составомъ (въ прим?р?
]S:a2S04 . 10Н2О) вызываетъ въ раствор? переходъ
вещества въ устойчивую форму (въ прим?р?—въ Na2S04.
. 10Н2О), по отношенію къ которому растворъ д?лается
пересыщеннымъ, и тогда это устойчивое соединеніе
выпадаетъ изъ раствора обыкновенно съ выд?леніемъ
тепла, такъ какъ находившаяся въ жидкомъ вид? соль
переходитъ въ твердое состояніе а).
Мыогія жидкости также растворяются въ вод?; но
въ случа? жидкостей повышепіе температуры часто
ум?нъша?тъ ихъ растворимость.
При раствореніи въ вод? твердыхъ т?лъ и жидкихъ
часто происходитъ повышеніе (напр., при раствореніи
МаОН или H2S04) или пониженіе (напр., при раствореніи
NaCl, KN03 и др. многихъ солей) температуры, иногда—
уменыненіе объема и всегда изм?няются температуры
кип?нія и замерзанія растворовъ сравнительно съ
таковыми же у чистаго растворителя (см. 93 стр.).
Основываясь какъ на этихъ признакахъ, такъ и на н?которыхъ
другихъ, нужно признать, что при явленіяхъ растворенія
происходитъ не механическое только см?шеніе, но и
химическое взаимод?йствіе между растворителемъ и раство-
реннымъ т?ломъ.
Что касается растворимости газовъ въ вод?, то она
зависитъ отъ природы газовъ, отъ температуры и давле-
!) Съ точки зр?нія теоріи «электролитической диссоціаціи» (см.
дал?е) «всякій насыщенный растворъ какой-нибудь соли становится
пересыщеннымъ относительно этой соли, разъ только въ раствор?
увеличивается концевтрація одного изъ ея іоновъ>.
15*
— 228 —
иія. Газы, иаибол?е легко сгущающееся въ жидкость,
бол?е растворимы, наприм?ръ, кислородъ бол?е раство-
римъ въ вод?, ч?мъ водородъ. Растворимость газа
уменьшается съ повышеніемъ температуры. Зависимость
растворимости газовъ отъ давленія формулирована Генри Даль-
тономъ въ сл?дующихъ законахъ:
1) в?съ газа, растворимаго въ 1 литр? воды, пропор-
ціоналенъ давленію, которое газъ производить на
жидкость, когда она насыщена;
2) когда н?сколько газовъ растворяются совм?стно
въ вод?, то каждый газъ растворяется такъ, какъ будто
бы онъ былъ одинъ, и пропорціонально той дол?
давленія, какая принадлежать ему въ см?си. Этотъ законъ
называется закономъ парцгальнаго давленія.
§ 82. Состоянье веществъ въ растворахъ. На воду
нельзя смотр?ть, какъ на вполн? безразличное вещество:
ея присутствіе глубоко вліяетъ на свойства веществъ и
на ихъ превращенія. Существуютъ сл?дующія дв? теоріи
относительно состоянія веществъ въ растворахъ:
1. Гидрашная теорія утверждаетъ, что въ
растворахъ (зд?сь разум?ются сравнительно кр?пкіе растворы)
растворенныя вещества находятся въ форм? гидратовъ
въ состояніи диссоціаціи, т.,-е. молекулы раствореннаго
вещества соединены съ опред?ленньшъ въ каждомъ дан-
номъ случа? количествомъ молекулъ воды, но соединенія
эти настолько непрочны, что при своемъ образованіи они
частью уже и распадаются, такъ что и соединенія и
продукты, на которые они распадаются, находятся вм?ст?
въ жидкомъ вид?3).
1) «Представление о растворахъ, какъ о жидкихъ диссоціирован-
ныхъ опред?денныхъ химическихъ соединеніяхъ, опирается на то:
1) что существующая н?которыя, несомн?нно, опред?ленныя, твердыя,
кристаллическія соединенія (напр., H2S04 . НаО или НС1 . 2Н20, или
СаС12. 6Н20 и т. п.) плавятся при н?которомъ повышеніи температуры
и тогда образуютъ настоящі? растворы; 2) что сплавы м?талловъ въ
жидкомъ вид? суть настоящіе растворы, а при охлажденіи они даютъ
— 229 -
2. Теоргя электролитической диссоціаціи. Въ осно-
шшіи этой теоріи лежитъ законъ Вантъ-Гоффа, каса-
инцШся состоянія твердыхъ веществъ, растворенныхъ (въ
глабыхъ растворахъ) въ жидкостяхъ. Прежде ч?мъ
формулировать этотъ законъ, необходимо выяснить понятіе
объ осмотическомъ да?леніи. При раствореніи твердаго
т?ла въ вод? видимо происходить сл?дующее: твердое
тііло, занимающее сравнительно небольшой объемъ,
попадая въ среду растворителя, им?ющаго объемъ большій,
равном?рно распред?ля?тся въ этомъ болыпемъ объем?*
частицы твердаго т?ла, до растворенія т?сно связанныя
между собою, бол?е или мен?е освобождаются отъ взаим-
паго вліянія и, какъ при испареніи, отходятъ другъ отъ
друга, равном?рно распред?ляясь въ гораздо.большемъ
пространств? растворителя. Въ правдивости такого пред-
ставленія легко уб?ждаютъ насъ, напр., явленія диффузіи.
Изв?стно, что если на растворъ, напр., сахара въ
вод?, осторожно налить слой чистой воды, то, хотя бы
мы оставили эту см?сь въ совершеннймъ поко?, сей-
часъ же частицы сахара начнутъ перем?щаться
(диффундировать) въ чистую воду снизу вверхъ. Это перем?щеніе
прекратится лишь тогда, когда частицы сахара вполн?
равном?рно расположатся во всей жидкости, или, какъ
часто совершенно явств?нныя опред?ленныя кристаллическія со?ди-
ненія; 3) что между растворителемъ и раствореннымъ т?ломъ, во
множеств? случаевъ, образуются, несомн?нно, многія опред?ленныя
соединенія, чему прим?ромъ служатъ соединенія съ
кристаллизационной водою; 4) что фязическія свойства растворовъ, а особенно уд?ль-
ный в?съ ихъ (свойство очень точно наблюдаемое), изм?няются съ
перем?ною состава именно такъ, какъ того требуетъ образованіе
между водою и раствореннымъ въ ней т?ломъ одного или н?сколько
опред?ленныхъ, но диссоціирующихъ соединеній. Такъ, напр.,
прибавляя къ дымящей с?рной кислот? воды, зам?ча?тся уменьшені?
плотности, пока не достигается опред?ленный составъ H3S04 или
S03 + H20, а зат?мъ уд. в?съ возрастаете хотя потомъ опять при
дальн?йшемъ разбавленіи водою падаетъ> (Мендел?евъ. «Основы
химіи>, 8 изд., 46 стр.).
_ 230 —
говорить, когда концентрация раствора буд?тъ повсюду
одинакова. Отсюда видно, что растворенное вещество,
аналогично газамъ, стремится занять возможно болыпій
объемъ и распред?литься въ немъ равном?рно, производя
при этбмъ давленіе на окружающую среду. Это — такъ
называемая упругость расшвореиія. Эта сила равном?р-
наго распред?ленія возникаетъ всякій разъ, какъ только
между двумя растворами возникаетъ разница
концентр ацій.
Если между слоемъ чистой воды и растворомъ сахара
пом?стить такъ наз. полупроницаемую перегородку,
которая свободно пропускала бы воду и не пропускала бы
раствореннаго въ ней сахара, то понятно, что сахаръ
станетъ оказывать н?которое давленіе на эту перегородку,
препятствующую его перем?щеніго въ чистую воду.
Давленіе это называется осмотическимъ давленіемъ.
Опытъ, свид?тельствующій о существованіи такого
давленія и позволяющій изм?рять его, можетъ быть по-
ставленъ въ сл?д. форм?. Берутъ глиняный пористый
сосудъ, въ отверстіе котораго на пробк? вставлена
вертикальная трубка, и погружаютъ его сначала въ растворъ
жел?зистосинероднстаго калія, а зат?мъ въ растворъ
м?днаго купороса; при этомъ въ порахъ сосуда
образуется въ силу обм?ннаго разложенія м?дная соль же-
л?зистосинеродистой кислоты въ вид? студенистой пленки
(Traube, Pfeffer); эта пленка полупроницаема, т.-е.
можетъ пропускать чрезъ себя воду, но не пропускаете
сахара. Въ приготовленный такимъ образомъ сосудъ на-
ливаютъ растворъ сахара и погружаютъ его въ чистую
воду. На пленку, какъ выяснено выше, сейчасъ же
начинается осмотическое давленіе; но пленка, заключенная
въ прочной глиняной ст?нк?, податься въ силу давленія
не можетъ, а потому (въ силу принципа д?йствія и
противод?йствія) является сила, стремящаяся отодвинуть
отъ перепонки самый растворъ; другими словами, чистая
вода устремляется въ сосудъ съ растворомъ, что и за-
— 231 —
м?тпо будетъ по поднятію жидкости въ вертикальной
трубк?. Поднятіе это окончится тогда, когда
гидростатическое давленіе будетъ равно притоку воды, т.-?. когда
установится равнов?сіе. Ясно, что гидростатическое да-
илепі? въ этотъ моментъ будетъ равно осмотическому и
но первому, сл?довательно, можетъ быть изм?рено и
второе. Для раствора 1 в?с. ч. сахара въ 100 в?с. ч.
поды при обыкновенной температур? осмотическое давле-
ліе достигаете 2/3 атмосферы, а для раствора 2 ч. сахара
въ 100 ч. воды оно равно іу2 атмосферъ. Изъ прим?ра
видно, что осмотическое давленіе можетъ быть точно
изм?рено1).
Указанное свойство растворенныхъ веществъ, конечно,
сближаетъ ихъ съ газами, молекулы которыхъ также
стремятся занять болыпій объемъ и ударами своихъ ча-
стицъ о преграду (полупроницаемую пленку) вызываютъ
давленіе 2).
Такое сближеніе растворовъ съ газами стало ясн?е,
когда, благодаря трудамъ Пфефера и др., были изучены
законы изм?ненія осмотического давленія. Законы эти
сл?дующіе: 1) осмотическое давленіе при постоянной
температурь прямо пропорцгонально концентраціи
(аналогія съ закономъ Войля-Маріотта) и при постоян-
номъ объем? прямо пропорцгонально температур?, —
оно возрастаешь на 1/273 своей величины съ повыше-
ніемь температуры на 2° Ц. (аналогія съ закономъ
Гей-Люссака). Это для одного и того же вещества. А
для растворовъ различныхъ веществъ установленъ сл?д.
*) Полупроницаемыми ст?нками оказываются, напр., ст?нки расти-
тельныхъ кл?точекъ: он? легко проницаемы для воды и вполн?
непроницаемы для многихъ растворенныхъ въ ней веществъ,
содержащихся въ кл?точпомъ сок? (напр., для глюкозы); отсюда законы осмо-
тическаго давленія очень важны и для пониманія жизни кл?токъ въ
частности и организмовъ вообще.
2) По другому воззр?нію осмотическое давленіе вызывается т?мъ
сродствомъ, которое им?ютъ частицы раствореннаго т?ла къ части-
цамъ растворителя.
— 232
законъ: при одинаковой концентрацги и равномъ объ-
ем? осмотическое да?леніе обратно пропорціональпо
молекулярнымъ в?самъ, или: эквимолекулярные'1)
растворы любыхъ веществъ въ одинаковъш количествахъ
растворителя показываешь одинаковое осмотическое
давленіе *(аналогія съ закономъ Авогадро-Жерара).
Итакъ, растворенный т?ла находятся въ растворител?
въ состояніи разс?янія, аналогичномъ газовому 2).
Вс? эти аналогіи разведенныхъ растворовъ съ газами
и позволили Ванть-Гоффу формулировать его закояъ:
въ слабыхъ растворахъ вещества производить въ форм?
осмотическаго давленія то же да?леніе, какое оть
производили бы въ газообразномъ состояніи при томъ
же объем? и при той оюе температур?.
Приравнявъ состояні? веществъ въ растворахъ къ
газовому состоянію, Вантъ-Гоффъ связалъ съ осмотич?-
скимъ давленіемъ понижеяіе температуры замерзанія
растворителя и повышені? температуры его кип?нія,
вызываемыя раствореннымъ т?ломъ, и такимъ образомъ
объяснилъ еще ран?е установленные Раулемъ методы
опред?ленія молекулярнаго в?са по изм?ненію
температуры замерзанія и кип?нія растворителя (см. стр. 93).
Правила Рауля можно теперь объединить въ одно поло-
женіе, а именно: при растворенги ?квимолекулярныхъ
количества (т.-е. количествъ, отвЬчающихъ молекуляр-
нымъ в?самъ) самыхъ разнообразныхъ веществъ въ одномъ
и томъ же растворител? появляются растворы съ
одинаковыми осмотическими давленіями.
J) Эквимолекулярными растворами называются такіе, когда въ
равныхъ объемахъ растворовъ находится одинаковое количество мо-
лекулъ.
2) Конечно, въ растаорител?—жидкости, гд? молекулы сближены
между собою т?сн??, нежели въ газахъ, молекулы раствореннаго
вещества не могутъ передвигаться также свободно, какъ въ газахъ,
поэтому кинетическая картина въ жидкихъ растворахъ гораздо сдож-
н?? нежели въ газахъ.
— 233 —
На основаніи закона Вантъ-Гоффа, къ разведеннымъ
1>астворамъ должно быть также приложимо и уравненіе
Клапейрона, т.-?. VpP = RT (см. стр. 71). Приложимость
:)та была вполн? доказана, но вмвст? съ т?мъ было
установлено, что растворы сильныхъ кислотъ, сильныхъ
основаніи, солей и вообще, какъ оказалось, электро-
лито?ъ (т.-е. в?ществъ, которыя въ раствор? проводятъ
электричество) показываютъ отклоненіе; посл?днее т?мъ
сшгьн?е, ч?мъ вещества лучше проводятъ электрическій
токъ1). Для такихъ растворовъ уравпеніе PV = RT
приходится изм?пить на g)P = aRT, гд? і указываетъ на при-1?2^ и
сутстві? въ раствор? большаго числа молекулъ, ч?мъ
указываетъ концентрадія ?). j
По аналогіи съ газами,-^ которыхъ анормальная
плотность объясняется диссоціированіемъ молекулъ, и для
растворовъ естественно было предположить диссоціацію
молекулъ растворекныхъ т?лъ; а такъ какъ вс? такія
т?ла, какъ было уже сказано, были электролитами, то
и теорія, поясняющая ихъ соотояні? въ разведенныхъ
растворахъ, названа теоргей электролитической диссо-
ціаціи3). Предложена она была впервые Арреніусомъ.
/ Сущность этой теоріи сводится къ утвержденію, что
электролиты въ разведенныхъ растворахъ им?ютъ или
!) Напротивъ, т? растворы, въ которыхъ осмотическое давленіе,
понижені? температуры замерзанія и аовышені? температуры кип?нія
нормальны, тока не проводятъ.
2) Точн?о: коэффнціентъ і пр?дставляетъ собою отношені? общаго
числа н?диссоціированныхъ молекулъ и іоновъ, имеющихся въ
раствор?, къ числу первыхъ, только взятыхъ въ растворъ, частидъ дан-
наго хичическаго соединенія.
3) Въ противоположность диссоціаціи существу?тъ для н?кото-
рыхъ в?ществъ ассоціація (уплотн?ні? н?сколькихъ молекулъ въ одну)
молекулъ, какъ это, напр., было указано для фтористоводородной
кислоты. Къ веществамъ съ ассоциированными молекулами относится
и вода (а также спирты, органич?скія кислоты). И зам?чательно, что
диссоціаторами являются именно жидкости съ ассоціированными
молекулами.
— 234 —
вс? молекулы или часть ихъ распавшимися
(диссонировавшими) на т? составныя части, которыя при электро-
лиз? движутсяг) по направленію къ электродамъ и та-
кимъ образомъ переносятъ съ собою электричество при
прохождеиій тока чрезъ растворъ; такая диссодіація
происходить при самомъ раствореніи; д?йствіе же электри-
ческаго тока на эти продукты диссоціаціи, названные
гонами, состоитъ лишь въ перем?щеніи ихъ въ двухъ
противоположныхъ направленіяхъ къ электродамъ. Напр..
частицы хлористаго натрія NaCl при раствореніи его въ
вод? постепенно распадаются на іонъ—Na и іонъ—С1:
ч?мъ- больше приливается воды, т?мъ больше количество
частицъ NaCl распадается на іоны. \
Диссодіація, по Арреніусу, увеличивается до опред?-
леннаго maximum'a по м?р? разбавленія; степень диссо -
ціаціич т.-е. отношеніе числа частицъ диссоціированныхъ
къ общему числу вс?хъ частицъ даннаго соеднненія,
находящихся въ раствор?, опред?ляется по
электропроводности. Степень электролитической диссоціаціи зависитъ
отъ природы раствореннаго т?ла, отъ природы
растворителя и, какъ сказано, отъ количества посл?дняго.
Электропроводность обыкновенно растетъ по м?р? разве-
денія раствора, т.-е. по м?р? увеличенія количества
!) Перем?щенів іоновъ можно наблюдать, напр., на сл?д. опыт?:
въ U-образную стеклянную трубку наливается растворъ H2S04; въ
одно изъ кол?нъ трубки догружается амальгамированная цинковая
пластинка, соединенная съ положительнымъ подюсомъ источника
электрическаго тока, и такимъ образомъ служащая въ опыт? ано-
домъ; въ другое кол?но вводятъ платиновую пластинку, соединяющую
съ отрицательнымъ полюсомъ. Пока токъ н? замкнутъ, если и про-
исходитъ выд?дені? Н, то на Zn, а вокругъ Pt изм?неній" не видно.
Стоитъ только замкнуть ц?пь, какъ въ тотъ же момеятъ начнется»
выд?л?ні? пузырьковъ на Pt, т.-е. на катод?. іонъ Н въ раствор?
былъ заряженъ положительнымъ зарядомъ, при замыканіи тока
отрицательные заряды катода н?йтрализуютъ положительные заряды
Н—іона, и тогда образовавшаяся нейтральный частицы водорода вы-
д?ляются въ свободномъ состояніи.
— 235 —
диссоціированныхъ молекулъ (иначе—числа іоновъ). Ясно,
что пред?льная электропроводность совпадаетъ съ момен-
томъ полнаго распада раствореннаго вещества на іоны.
іонами могутъ быть не только отд?льные атомы, но и
д?лыя группы ихъ, наприм?ръ, у H2S04 іонами являются
Н и HS04 (а иногда—Н, Н, и SOJ, у КОН—іоны К и ОН.
іоны—по излагаемой теоріи—совершенно отличаются
по свойствамъ отъ свободныхъ атомовъ: они всегда
им?ютъ одни и т? же свойства, независимо отъ другого
іона, съ которымъ они являются. Такъ, іонъ Н у H2S04
(и у кислотъ вообще) совершенно отличенъ отъ обыкно-
веннаго газообразнаго водорода: посл?дній трудно раство-
римъ въ вод?, а водородъ-іонъ изв?степъ только въ
раствор?, у кислотъ іонъ-водородъ всегда им?етъ т?
свойства, которыя характеризуют кислоты, тогда какъ
газообразный водородъ ни одного изъ этихъ свойствъ не
им?етъ, точно такъ же, напр., іонъ-натрій въ NaCl на
воду не д?йствуетъ, а металлъ' натрій воду разлагаетъ;
іонъ-хлоръ въ NaCl не им?етъ „ни цв?та, ни запаха, ни
б?лящихъ свойствъ обыкновеннаго хлора и изв?стенъ
только въ раствор?. іоны, отлагающіеся при электршиз?
на отрицательномъ электрод? (напр., Н, металлическіе
іоны солей), являются носителями положительна™
электричества и называются капьіонами, а іоны, отлагающіеся
на положительномъ электрод? (металлоидные іоны),
являются носителями отрицательнаго электричества и
называются аніонами. іоны существуютъ только въ раство-
рахъ, а сл?д., какъ только іоны отлагаются на электрод?,
они уже перестаютъ быть іонами; до момента отложенія
они обладаютъ электрическимъ зарядомъ, а при отложе-
ніи на электрод? этотъ зарядъ уходитъ изъ іоновъ,
распространяясь по металлическому проводнику. Въ раствор?
электролита сумма вс?хъ положительныхъ зарядовъ
равняется сумм? вс?хъ отрицательныхъ зарядовъ, такъ что
самъ растворъ является электрически нейтральнымъ. При
пропусканіи тока электроды при достаточной величин?
— 236 —
электровозбудительной силы получаютъ количество энер-
гіи, необходимое для того, чтобы со свободныхъ іоновъ
снять заряды противоположныхъ знаковъ, при чемъ іоны
въ этотъ моментъ и превращаются въ состояніе атомовъ.
Если элоктрическій зарядъ іона-водорода принять за
единицу, то атомность другихъ іоновъ, съ точки зр?нія
излагаемой теоріи, будетъ выражаться числомъ,
указывающими относительную величину электрическаго заряда
въ этихъ іонахъ1). Вс? одноатомные іоны несутъ
одинаковый зарядъ, двуатомные—вдвое большій и т. д. Напр.,
KCI^K + Ci, CuSO^Cu + S04, FeClari+Fe +3C1.
Вс? химическія р?акціи въ растворахъ, по этой теоріи,
происходятъ между іонами.
§ 83. Сила кислотъ и основаній. Выше (см. §§ 69,
70 и 72) сд?лано было указаніе, что галоидоводородныя
кислоты (а зд?сь добавимъ, и кислоты вообще, а также
и осиованія) различаются по своей сил?. Оствальду
удалось указать причину этой различной силы кислотъ и
основаній въ связи съ ихъ способностью претерп?вать
въ растворахъ электролитическую диссоціацію.
Что касается кислопьъ, то он? въ растворахъ всегда
диссоціируютъ съ образованіемъ положительно заряжен-
наго катіона Н; отсюда вс? спеціальныя для кислотъ
свойства и должны быть сведены къ д?йствію этого водо-
роднаго іона.
Основанья въ растворахъ всегда диссоціируютъ съ
образованіемъ отрицательно заряженнаго іона—(ОН), на-
і) Единица количества электричества есть кулонъ. Чтобы выд?-
лился 1 гр. водорода, надо, чтобы прошло электричества 96.540 куло-
новъ; другими словами: 1 гр. Н даетъ электрическую массу—96.540 ку-
лонамъ, что эквивалентно, напр., 103 гр. Ag, или --— — -л- —48.
Отсюда для переноса единицы электрической массы необходимо
9бк ГР- Н' ИИ эШб ГР- Ag И Т- Д-
— 237 —
лыиаемаго гидроксиломъ, а потому и спеціальныя реакціи
основаній должны быть сведены къ д?йствію гидроксиль-
наго іона.
Если сравнивать между собою эквивалентные растворы
различныхъ кислотъ, то сила каждой изъ нихъ будетъ
т?мъ больше, ч?мъ больше будетъ у нея въ раствор?
содержаться водородныхъ іоновъ. У основаній тотъ же
нопросъ разр?шится въ зависимости отъ числа гидро-
ксильныхъ іоновъ.
Вообще сила кислотъ или основаній опред?ляется
степенью ихъ электролитической диссоціаціи (Оствальдъ
lOstwald]).
Обращаясь къ вышеразобраннымъ галоидоводороднымъ
кислотамъ, сл?дуетъ указать, что соляная кислота уже
при ум?ренныхъ разведеніяхъ довольно близка къ maxi-
mum'y своей диссоціаціи и потому является одной изъ
самыхъ сильныхъ кислотъ; бромисто- и іодисто-водород-
ныя кислоты въ этомъ отношеніи близки къ соляной1),
а фтористоводородная кислота' диссоціируетъ въ
значительно меньшей степени, а потому и уступаете своимъ
аналогамъ въ сил?.
Съ точки зр?нія изложенной теоріи разберемъ хотя
бы одинъ прим?ръ реакцій въ водныхъ растворахъ, напр.,
реакщю между КОН и HCI. КОН въ водномъ раствор?
диссоціируетъ на іоны—К (положительный) и ОН
(отрицательный); НС1 диссоціируетъ на іоны—Н
(положительный) и С1 (отрицательный). При см?шеніи растворовъ
КОН и НС1, сл?довательно, получаются четыре іона: К,
ОН, Н и С1; іоны Н и ОН могутъ образовать при соединеніи
і) Кром? галоидоводородныхъ кислотъ, къ сгільнымъ кислотамъ
(сильнымъ электролитамъ) относятся еще: азотная, хлорноватая и с?р-
ная кислоты; къ среднимъ: фосфорная, с?рнистая, уксусная кислоты;
къ слабымъ: угольная, синильная, кремневая и борная кислоты, а также
свроводородъ. Основанія сильиыя: гидраты окисей щелочныхъ и ще-
лочноземельныхъ металловъ; среднгя: амміакъ, гидрокиси серебра и
магнія; слабыя\ гидрокиси тяжедыхъ металловъ.
— 238 —
почти не диссоціирующую молекулу Н20; они ее и обра-
зуютъ, а К и С1 остаются іонамя. Реакдія между КОН
и НС1 есть не что иное, какъ нейтрализація; посл?дняя,
такимъ образомь, состоитъ въ соединеніи іоновъ Н и ОН
въ молейулу Н20.
При выт?сненіи одной (слабой) кислоты другой
(сильной) ходъ превращенія понимается такъ: возьмемъ нри-
м?ръ выт?сненія С2Н402 изъ NaC2H302 соляной кислотой
(HCI). При см?шеніи въ раствор? буд?тъ четыре іона:
Н, CI, Na и С2Н302; С2Н30.2 съ Н образуютъ мало
диссодіирующую молекулу С2Н402, аіоны Na и С1 останутся.
Перекись водорода, Н202.
Молекулярный в?съ Н202 —34,02. Уд?льный в?съ — 1,50 (вода=:1).
Процентный составъ: О =: 94,12%, Н=г5,88<>/0.
§ 84. Кром? воды, существуетъ другое соедин?ніе
кислорода съ водородомъ, называемое переписью
водорода, тогда какъ вода является окисью его.
Перекись водорода въ природ? встр?чается въ незна-
чительныхъ количествахъ, напр., въ дождевой вод?, въ
сн?г?, а сл?д., и въ воздух?1); искусственно получается
д?йствіемъ сильно раз)$ро1ш#)ныхъ охлажденныхъ кис-
лотъ на перекись барія (или перекись натрія Na202),
наприм?ръ:
ВаО, + H2S04 = BaS04 + Н202,
Na262 + 2НС1 = 2NaGl + Н202,
J) Перекись водорода образуется также при медлекномъ окисле-
ніи фосфора (вм?ст? съ озономъ), лри гор?ніи водорода. При взбал-
тываніи съ водой и кислорюдомъ или воздухомъ цинковыхъ стружекъ
образуется Н202; многіе металлы, напр., м?дь, свинецъ, жед?зо и др.,
образуютъ Н202 при взбалтываніи съ воздухомъ и разведенной с?р-
ной кислотой. Въ посл?днихъ случаяхъ везд? выд?ляющійся водородъ
соединяется съ кислородомъ й образуетъ Н202- Предполагают^ что
во вс?хъ случаяхъ окисленія въ присутствіи воды (а безъ нея эти
процессы иди вовсе не идутъ, или идутъ очень медленно) сначала
образуется перекись водорода, которая, выд?ляя кислородъ, и
производить уже окислені?.
— 239 —
Нерастворимый въ вод? с?рнокислый барій можетъ
быть легко удаленъ фильтрованіемъ, и тогда получится
растворъ перекиси водорода въ вод?. Чистая перекись
водорода отд?ляется отъ воды испареніемъ посл?дней
подъ уменыпеннымъ давленіемъ; нечистая Н202 легко
разлагается на воду и кислородъ.
Перекись водорода представляетъ собою очень
неустойчивую безцв?тную сиропообразную жидкость съ жгу-
чимъ металлическимъ вкусомъ; она въ 1,5 раза тяжел?е
воды; при давленіи 26 мм. перекись водорода кипитъ
при 69°. Являясь довольно непрочиымъ соединеніемъ, она
легко (особенно—на св?ту и при нагр?ваніи) распадается
(иногда со взрывомъ) на воду и кислородъ, а потому и
прим?няется, какъ хорошій окислитель*); пористыя и
порошкообразныя вещества (напр., порошки серебра,
золота, платины, перекиси марганца) и даже стекло уско-
ряіотъ (каталитически) разложеніе Н2Оа съ выд?леніемъ
кислорода. По реакціямъ перекись водорода близко под-
ходитъ къ озону, гд? д?йствуіощимъ начались является
также кислородъ въ моментъ выд?ленія. Перекись
водорода, подобно озону, является соединеніемъ также
эндотермическими Въ присутствіи сл?довъ кислотъ Н202
д?лается бол?е устойчивой; отъ щелочей же и многихъ
солей продессъ разложенія Н202 ускоряется. Водный
растворъ Н202, содержаний ея 95—96%? ПРИ охлажде-
ніи до—80° выд?ляетъ безцв?тные кристаллы твердой
Н208 плав, при—2°. Водный растворъ Н202 обладаетъ
свойствами слабой кислоты: она мало распадается на
іоны; реагируетъ съ основаніями, напр., Sr(OH)2-J-H202=
= 2H20 + Sr02.
Самою чувствительною реакціей на перекись водорода
является см?сь двухромокислаго калія съ с?рною кисло-
*) Въ виду легкаго разложенія перекиси водорода, ее не сл?-
ду?тъ хранить въ плотно заткнутыхъ сосудахъ, иначе ихъ можетъ
разорвать.
240 —
той, которая, будучи прилита къ раствору перекиси
водорода, даетъ синее окрашиваніе (образуется надхромовая
кислота = НСг04): посл?диее становится ясн?е, если
вести реакцію въ присутствіи э?ира1).
Перекись водорода разлагаетъ, подобно озону, іоди-
стый калій, на т?л? производить б?лыя пятна,
разрушая животныя ткани. Она широко прим?няется для ц?-
лей б?ленія, напр., шелка, перьевъ, волосъ, губокъ, для
оживлеяія красокъ2) старыхъ масляныхъ картинъ и для
ц?лей дезинфекціи.
Кром? реакцій окисленія, для перекиси водорода
изв?стны также и реакцій возстановленія. Такъ, напр.',
окись серебра Ag20 раскисляется перекисью водорода въ
металлическое серебро, при чемъ самая перекись
водорода переходитъ въ воду: Ag20-f H202=Ag2-|-H20-{-02.
Это объясняется т?мъ, что кислородные атомы (отъ Ag20
и отъ Н202) сц?пляются легче въ частицу (02) мекду
собою, ч?мъ кислородъ съ серебромъ.
Задачи: 1) Сколько по в?су и объему можно получить кислорода
изъ 1 литра воды?
2) Сколько потребуется хлора для отнятія отъ 10 к. с.
воды вс?го водорода?
3) Сколько надо взять перекиси водорода, чтобы ею
окислить въ воду водородъ одного литра хлористаго
водорода?
*) Хорошей реакдіей на НаОа является также сл?дующая: без-
цв?тный растворъ титановой кислоты въ кр?пкой с?рной кислот?
окрашивается перекисью водорода въ оранжево-красный цв?тъ; отъ
мад?йшихъ сд?довъ Н202 цв?тъ ре актив а—лимонно-жедтый.
2) Потемн?ніе старыхъ картинъ, между прочимъ, зависитъ отъ
перехода б?лой свинцовой краски въ черный с?рнистый свинецъ
(PbS); Н202 переводитъ черный PbS въ б?лый PbS04.
— 241 —
С?ра, S. jO^'
Атомный в?съ S = 32,07. Мол. в?съ S8 — 256,56, а при высокой тем-
иоратур? S2 = 64,14. Температура кип?нія = 448,4°. Темпер, плавле-
и\и -1140. Уд?льныя в?съ (вода^і)—1,957 (аморфн.) до 2.045 (ромб.)
§ 85. Получете. С?ра въ свободномъ вид? встр?-
чаотся въ вулканическихъ м?стностяхъ, гд? иногда
образуете большія залежи, наприм?ръ, въ Сициліи: зд?сь
иЬра залегаетъ въ вид? жилъ, прослоекъ или
вкрапленной въ пласты известняковъ, мергелей, гипса и др.;
отсюда она преимущественно и вывозится въ Европу.
Новыя богатыя залежи открыты въ Калифорніи, близъ
устья р?ки Колорадо. Въ вид? соединены съ металлами
она очень распространена въ природ?, образуя гипсъ
(CaS04 . 2Н20) ангидридъ (CaSOJ и колчеданы, обманки,
блески (напр., FeS3—жел?зный колчеданъ,
PbS—свинцовый блескъ, ZnS—цинковая обманка), то-есть с?рно-
кислыя и с?рнистыя соединенія. Богатыя залежи с?ры
находятся у насъ на Кавказ?, въ Дагестан?, въ Приви-
слинскомъ кра?, а также въ н?которыхъ м?стахъ по бе-
регамъ Волги, напр., въ Казанской губерніи Сюкеевское
м?сторожденіе. С?ра также входитъ въ составъ б?лко-
выхъ веществъ, въ составъ горчицы и т. д.
Свободная с?ра получается выплавкой самородной с?ры
въ такъ назыв. калъкаронахъ, т.-е. болынихъ крытыхъ
углубленіяхъ; необходимая теплота для выплавки
достигается сжиганіемъ части самой же с?ры._С?ра^
полученная выплавкой, называется комовою_. Комовую с?ру очи-
щаютъ или литруютъ, подвергая перегонк? въ чугун-
ныхъ сосудахъ (С) и сгущая пары въ особыхъ камерахъ (А)
(фиг. 57). При этомъ. на ст?нкахзь камеры ос?даетъ мел-
кій порошокъ с?рнаго цв?та>_ъ> на дн?, посл? того, какъ
камера разогр?ется, скопляется расплавленная с?ра (&);
посл?днюю выпускаютъ чрезъ отверстіе (О) и отливаютъ
Неорганическая хаиія, 16
— 242 —
во влажныхъ деревяиныхъ формахъ въ палочки, получая
такимъ образомъ черенковую с?ру1)-
Видоизм?ненгя Ъ?ры. СЩТ встр?чается, подобно
своему арьлогу кислороду (см. озонъ), въ н?сколькихъ
аллотролйчепшхъ изч?неніяхъ. Наибол?е часто встр?-
чается cfepa кристаллическая, а именно, октаэдрическая
или ромбическая, то-есть кристаллизованная въ окта-
Рис. 57. Аппаратъ для перегонки с?ры.
эдрахъ ромбической системы. Уд?льный в?съ такой с?ры
2,05—2,07, ея темп, плавл. 114,5°.
ДалЪе сл?дуетъ призматическая или моноклиноэдри-
ческая с?ра, образующаяся при медленномъ охлажденіи
расплавленной с?ры. Дня полученія такого видоизм?не-
*) Въ н?которыхъ м?стахъ, напр., въ Привислияскомъ кра?, с?ру
изъ ігородъ изві?каютъ с?роуглеродомъ (CS2 — жидкость,
растворяющая с?ру).
— 243 —
tiiu поступаютъ сл?дующимъ образомъ. Расплавленную
иъ глиняномъ тигл? с?ру медленно охлаждаютъ до т?хъ
иоръ, пока поверхность ея затверд?етъ; тогда кору про-
(шнаютъ и выливаютъ находящуюся внутри еще жидкую
часть с?ры. На ст?нкахъ сосуда остаются длинныя и тон-
ісія иглы призматической с?ры. При стояніи
призматическая с?ра переходить въ октаэдрическую. Ея уд?льный
н?съ 1,96—1,98, темп. плав. 120°.
Кром? кристаллическихъ видоизм?неній, с?ра обра-
¦іуетъ еще н?сколько аморфныхъ модификашй. Такъ,
мягкая пластическая с?ра получается выливаніемъ
расплавленной и нагр?той немного выше 300° с?ры тонкой
струей въ холодную воду. Это видоизм?неніе при стояніи
также переходитъ въ октаэдрическую с?ру. Если
пластическую с?ру растворять въ с?роуглерод? (CS2)t то при
этомъ часть ея останется нерастворенной въ вид? такъ
называемой аморфной нерастворимой с?ры.
Аморфная растворимая с?ра получается при обра-
ботк? н?которыхъ многос?рнисрыхъ металловъ соляной
кислотой, наприм?ръ:
CaS2 + 2НС1 = СаС12 + H2S + S. ;
Существованіе вс?хъ этихъ видоизм?неній с?ры, по
всей в?роятности, объясняется различнымъ количествомъ
атомовъ въ ихъ частицахъ. Это предположеніе
подтверждается изсл?дованіемъ плотности паровъ с?ры при раз-
личныхъ температурахъ. Такъ, только при температур?
выше 1.000° плотность с?ры = 32, что (по M = 2d) со-
отв?тствуетъ молекул? S2; при 500° d=96, что соотв?т-
ствуетъ молекул? S6 (96X2:32 = 6); а при
обыкновенной температур?, когда с?ра находится въ твердомъ со-
стояніи, надо ожидать еще большей сложности частицы.
Опред?леніе молекулярнаго в?са с?ры въ бензольномъ
раствор? кріоскопическимъ методомъ указало, что при
этихъ условіяхъ молекула с?ры состоитъ изъ 8
атомовъ (S8).
16'
— 244 —
Свойства с?ры н?сколько изм?няются въ
зависимости оттого, какое видоизм?неніе разсматривать.
Вс? видоизм?ненія с?ры суть безъ исключенія
твердый т?ла по большей части желтаго цв?та, за исключе-
ніемъ б&лаго порошкообразна™ с?рнаго молока 1). При
111°—120° с?ра плавится въ желтоватую жидкость,
которая при дальн?йшемъ нагр?ваніи бур?етъ, а около
250° вновь загуст?ваетъ настолько, что не выливается
изъ сосуда. Выше 300° она снова становится жидкой и
при 448,4° кипитъ, образуя пары оранжеваго цв?та. При
охлажденіи указанный явленія повторяются въ обратпомъ
порядк?. Уд?льный в?съ с?ры колеблется отъ 1,957 до
2,045, въ среднемъ около 2. С?ра въ вод? нерастворима,
трудно растворима въ спирт? и э?ир? и довольно хорошо
растворяется въ углеводородагь и э?ирныхъ маслахъ.
Лучщими растворителями для с?ры являются анилинъ,
хлористая с?ра и с?роуглеродъ (CS2), изъ которыхъ она
выд?ля?тся въ вид? октаэдрическаго видоизм?ненія. По-
сл?дпій, однако, растворяетъ не всіз модификаціи с?ры
(аморфная нерастворимая с?ра).
По химическимъ свойствамъ с?ра представляетъ
полную аналогію съ кислородомъ. Подобно посл?днему, она
соединяется почти со вс?ми элементами — и
металлическими и металлоидными; со многими металлами она
соединяется непосредственно, образуя с?рнистыя соединенія.
Реакція эта, какъ и у кислорода, часто сопровождается
гор?ніемъ; напр., м?дная пластинка, внесенная въ пары
с?ры, горитъ съ раскаливаніемъ; о ход? соединенія с?ры
съ жел?зомъ говорилось на 3 стр.
Полученныя с?рнистыя соединенія им?ютъ составъ,
сходный съ составомъ окисловъ, только вм?сто
кислорода въ нихъ стоитъ с?ра. Напр.:
!) Так? называется очень тонкій порошокъ с?ры, въ вид? кото-
раго она выявляется изъ своихъ соединеній, находящихся въ водномъ
раствор?.
— 245 —
I) Вода H20; 4) Углекислый газъ С02;
с?роводородъ H2S. с?роуглеродъ CS2.
\і) ГидратъокисикаліяКОН; 5) Углекислый калійК2С03;
сульфгидратъкаліяКЭН. тіоуглекислый калій
:і) Окись барія BaO; K2CS3.
с?рнистый барій BaS.
Съ кислородомъ с?ра соединяется при 260°,
загораясь при этомъ синимъ пламенемъ и образуя с?рнистый
газъ S02.
Прим?ненге с?ры. С?ру употребляютъ для
производства с?рной кислоты, для приготовленія пороха, взрыв-
чатыхъ веществъ, с?рныхъ спичекъ, для окуриванія
хмеля, вина, для осыпанія виноградниковъ (во время бо-
л?зни винограда), для приготовленія с?рнистой кислоты,
с?рпистаго углерода, для приготовленія с?рнистыхъ ме-
талловъ, для вулканизадіи каучука и гуттаперчи и т. п.
С?роводородъ, H2S.
Молек. в?съ H2S = 34,15. Уд. в. (Н = 1) = 17,15. Плотность (возд.~
= 1) — 1,19. Тема. еил?нія = —61,8°. Темя. ллав. = — 8Q0.
Процентный составь: S= 94,08% Н —5,92<>/0.
§ 86. Полученіе. С?ра соединяется непосредственно
со многими металлами, давая с?рнистыя соединения; въ
томъ числ? она соединяется и съ водородомъ, образуя
соединенія H2S (аналогично Н20); соединеніе это и
называется с?роводородомъ а).
С?роводородъ въ свободномъ состояніи встр?чается
въ вулканическихъ газахъ и въ минеральныхъ водахъ,
наприм?ръ, въ Россіи~въ Сергіевск? (Самарской губ.),
Пятигорск? и въ Старой Русс?. Онъ образуется также
при гніеніи б?лковыхъ веществъ. Получить его можно
*) H2S не единственное соединеніе водорода и с?ры; въ настоя-
щемъ курс? разсматриваются только наибол?е важныя и устойчивыя
соединенія.
— 246 —
или прямымъ соединеніемъ, пропуская водородъ падъ
расплавленной с?рой, или, лучше, разложеніемъ с?рни-
стыхъ металловъ кислотами, наприм?ръ, разложеніемъ
с?рнистаго жел?за с?рной кислотой:
* FeS+H2S04 = FeS04 + H2S.
Этой реакціей пользуются для полученія с?роводорода
въ болыпихъ кодичествахъ, при чемъ разлодаені? про-
изводятъ въ аппарат? Киппа (см, рис. 19). Получаемый
такимъ образомъ с?роводородъ содержитъ н?которыя
прим?си.
Указанная реакція совершенно аналогична д?йствію
кислотъ на соединенія металловъ съ кислородомъ, только
тамъ получаются соль и вода, а зд?сь — соль и
с?роводородъ:
Г?О + H2S04 = FeS04 -f- Н20,
FeS + H2S04 = FeS04 + H2S.
Физичеснія свойства. С?роводородъ—безцв?тный газъ
съ запахомъ гнилыхъ яицъ. Плотность его 17,15 (Н = 1).
При — 61,8° и атмосферномъ давленіи или при давленіи
16 атмосферъ и при обыкновенной температур? сгущается
въ прозрачную безцв?тную жидкость, затверд?вающую
при — 86° въ б?лую кристаллическую массу. Одинъ
объемъ воды при 0° растворяетъ 4 объема
с?роводорода. Этотъ растворъ, называемый с?роводородной
водой, со временемъ мутится, потому что с?роводородъ
при д?йствіи кислорода воздуха разлагается на с?ру
и воду:
H2S + 0 = H20 + S.
При вдыханіи с?роводородъ д?йствуетъ ядовито; луч-
шимъ противоядіемъ служитъ, вдыханіе воздуха,
содержащая небольшое количество хлора.
Химическія свойства. С?роводородъ горитъ на воз-
дуХ? синеватымъ пламенемъ, при чемъ образуются вода
и с?рнистый газъ S02:
H2S + 30 = H20 + S02;
— 247 —
для гор?нія, сл?довательно, требуется 3 объема
кислорода на 1 объемъ с?роводорода. Если въ пламя с?ро-
водорода внести какой-нибудь холодный предметъ, на-
прим?ръ, фарфоровую крышечку, то на ней образуется
налетъ с?ры, такъ какъ всл?дстві? пониженія
температуры продолжа?тъ гор?ть только водородъ.
То же происходить и при недостатк? кислорода:
H2S + 0 = H20+S.
Температура гор?нія H2S равна, приблизительно, 310°.
Обладая большимъ сродствомъ къ кислороду, с?роводо-
родъ отнимаетъ его отъ многихъ соединеній и является,
такимъ образомъ, возстано?ителемъ. Такъ, марганцовая,
хромовая и азотная кислоты переводятся имъ въ низшія
степени окисленія; наприм?ръ:
"2CrOB + 3H8S = Cr,Oa + 3H80 + 3S.
С?роводородъ въ водномъ расхвор? реагируетъ, какъ
слабая г) двуосновная кислота; с?рнистые металлы, явля-
ющіеся солями с?роводородной кислоты H2S 2), легко
разлагаются другими кислотами 3). С?роводородъ — газъ
ядовитый для высшихъ организмовъ; н?которые tee низ-
!) Въ водномъ децинормальномъ раствор? только 0,07*>/0 H2S
диссоціируетъ на іоны Н и HS. Сухой H2S кислыхъ свойствъ не
им?етъ.
2) Ср?днія с?рнистыя соли называются просто с?рнистыми соеди-
неніями, а кислыя—сульфгидратами. Подобно соотв?тствующимъ окис-
ламъ (см. кислородъ), с?рнистыя соединенія элем?нтовъ обладаютъ
или слабымъ щелочнымъ характеромъ или слабо-кислотнымъ;
с?рнистыя соединенія противоположнаго характера могутъ соединяться
между собою и давать соли, въ которыхъ вм?сто кислорода стоить
с?ра; напр.: KgS + CS2 = K2CS3, аналогично: К20 + С02^=К2С03.
3) При пропусканіи H2S въ концентрированную H2S04 происхо-
дитъ возстановденіе по уравненію:
H2S + H2S04 = S + 2ЩО + SOa,
— 248 —
шіе организмы въ присутствии H2S могутъ жить, напр.,
микроорганизмы, вызывающе гніеніе.
Составъ с?роводорода можно вывести изъ его
плотности по водороду, которая=17; сл?ловательно,
молекула еш = 34 (M = 2d). Атомный в?съ с?ры 32; отсюда
легко вид?ть, что она можетъ находиться въ с?роводород?
только въ количеств? одного атома; дв? же в?совыхъ
части остаются для водорода, который сл?довательно,
и входитъ въ количеств? 2 атомовъ. Отсюда формула
с?роводорода—H2S.
С?роводородъ нашедъ с?б? важное прим?нені? въ
аналитической химіи, гд? вс? металлы разд?лены на группы по различнымъ
отношеніямъ ихъ с?рнистыхъ соединеній къ растворителямъ. Такъ,
с?рнистыя соединенія 1-й (К, Na и NH4) и 2-й (Са, Sr, Ba и Mg)
аналитическихъ группъ металловъ растворимы въ вод?; с?рнистыя
соединенія 3-й гр. (А1, Сг, Fe, Zh, Mn, Ni и Со) нерастворимы въ
вод? и многос?рнистомъ аммоніи ([NH^S^), но растворяются въ сла-
быхъ кислотахъ, всл?дстві? этого с?рнистые металлы 3-й гр. оса-
ждаютъ д?йствіемъ с?рнистаго аммонія. С?рнистыя соединенія 4-й гр.
(Ag, Hg, Си, Pb, Hg, Ві и Cd) не растворяются въ вод?, въ слабыхъ
кислотахъ и въ многос?рнистомъ аммоніи, а потому осаждаются изъ
растворовъ с?роводородомъ. С?рнистыя соединенія 5-й гр. (As, Sb и
Sn) отличаются растворимостью въ многос?рнистомъ аммоніи.
С?рнистыя соединенія иногда могутъ образоваться и
при непосредственномъ д?йствіи с?роводорода на
металлы; такъ, напр., серебро черн?етъ отъ с?роводорода
всл?дствіе образованія чернаго с?рнистаго серебра,
Съ металлами с?ра обыкновенно двувалентна, а по
отяошенію къ металлоидамъ валентность с?ры
повышается, доходя до шестивалентности, напр. въ S03—с?р-
номъ ангидрид?.
С?роводородъ—спутяикъ всего живого: онъ является
однимъ изъ продуктовъ разложенія пищевыхъ веществъ;
противный запахъ помойныхъ и клозетныхъ ямъ обязанъ,
между прочимъ, и с?роводороду. ¦ ¦
— 249 —
§ 87. Сл?дующіе аналоги с?ры суть селенъ и
теллуръ, отв?чагощіе брому и іоду — аналогамъ хлора въ
VII гр. Это довольно р?дкіе элементы, иногда
сопровождающее с?ру въ лрирод?.
Селенъ (химическій знакъ Se и атомный в?съ 79,2)
получается возстановленіемъ изъ кислороднаго соединенія
Se02 и, подобно с?р?, образуетъ н?сколько аллотропи-
ческихъ видоизм?неній, Главн?йшія изъ нихъ: аморфное—
краснаго дв?та, растворимое въ CS2, и кристаллическое—
чернаго цв?та съ металлическимъ блескомъ,
нерастворимое въ CS2. Селенъ плавится при 217° и кипитъ при
680°, превращаясь въ темно-желтый паръ.
Электропроводность металлическаго селена зависитъ отъ степени его
осв?щенія: поэтому селенъ прим?няется для устройства
фотометровъ и фотофоновъ.
Теллуръ (химическій знакъ Те, атомный в?съ 127,5)
иногда встр?чается въ самородномъ состояніи, или же
получается, подобно селену, возстановленіемъ своего
окисла. Онъ также встр?чается въ вид? аморфнаго
и кристаллическаго видоизм?неній съ металлическимъ
блескомъ. Сплавленный онъ им?етъ б?лый дв?тъ съ
серебристымъ блескомъ. Теллуръ плавится около
452° и кипитъ около 1.400°, образуя золотисто-желтый
паръ.
Какъ селенъ, такъ и теллуръ на воздух? при нагр?-
ваніи загораются, образуя удушливые ангидриды Se02
и Те02. Соединяются съ водородомъ и съ металлами
также аналогично с?р?.
Селенистый (SeH2) и теллуристый (ТеН2) водороды
получаются, подобно с?роводороду, или прямымъ соеди-
неніемъ элементовъ, или д?йствіемъ НС1 на соотв?тству-
ющіе селенистые и теллуристые металлы:
FeSe + 2 HCl = FeCl2-f SeH2,
ZnTe + 2 HCl = ZnCl24-TeH2.
— 250 —
Подобно с?роводороду, ТеН2 и SeH2 суть б?зцв?тные,
ядовитые газы слабокислаго характера съ отвратитель-
иымъ запахомъ.
Итакъ, элементы О, S, Se и Те, д?йствительно,
представляють группу очень сходныхъ между собою
элементовъ: ихъ водородистая соединяя образуются
по формул? RH2; кром? Н20, вс? водородиетыя ихъ
соединенія суть слабыя двуосновныя кислоты, соли ко-
торыхъ легко разлагаются вс?ми другими кислотами.
Кислотность водородистыхъ соединеній, равно какъ и
сродство самыхъ элементовъ къ Н, убываетъ отъ S къ Те:
сл?довательнО) какъ и въ групп? галоидовъ, металлоид-
ность зд?сь падаетъ съ увеличеніемъ атомнаго в?са.—
Аналогія этихъ элементовъ, дакъ увидимъ, полная и въ
соединеніяхъ съ другими элементами.
Задачи: 1) Какой объемъ воздуха н?обходимъ для сжиганія 1 гр.
чистой с?ры?
2) Разочитать количество матеріаловъ, необходимыхъ
для полученія 17 гр. с?роводорода.
3) Сколько по объему получится с?роводорода изъ 32 гр.
с?ры?
Группа азота (V группа).
§ 88. Къ металлоидамъ пятой группы системы
элементовъ принадлежать: азотъ—N, фосфоръ—Р, мышьякъ—
As и сурьма — Sb. Какъ и въ предыдущихъ 6-й и 7-й
группахъ, съ увеличеніемъ атомнаго в?са зд?сь зам?-
чается параллельное увеличение уд?льнаго в?са, повы-
шеніе температуръ плавленія и кип?нія — это съ
физической стороны; съ химической же—ослабленіе металло-
идныхъ и усиленіе металлическихъ свойствъ. Сл?дующая
таблица подтверждаетъ сказанное:
— 251 —
At. Уд?льный At. Температуры Физическое
в?съ. в?съ. объемъ. плавлеяія кип?нія. состояніе.
N 14,01 0,885 (возд.=1) 15,82 — 213° —195» безцв?тныйгазъ.
Р 31,04 1,83 — 2,34 13,25 +44,1° +2870 желтое или
красное твердое т?ло.
As 74,96 5,73 13,09 возгоняется-(-180** твердое т?ло тем-
но-с?раго цв?та
съ металличе-
скимъ блескомъ.
Sb 120,2 6,8 17,71 +629,50+1,3000 твердое т?ло с?-
ровато - б?лаго
дв?та съ метал-
лическимъ
блескомъ.
Разность между атомными в?сами N и Р = 17, между
Р и As = 44, между As и Sb = 45, т.-е. зд?сь почти
та же картина, которая была и въ групіг? галоидовъ.
Съ водородомъ металлоиды этой группы даютъ газо-
образныя соединенія, отв?чающія формул? RH3. Теплоты
образованія ж температуры разложенія этихъ соеднненій
видны изъ следующей таблицы:
Темп, разлож.
N + H3 = NH3 +12,2 К, 500°
Р + Н3 = РН3 4-11,6°К, —
As-j-H3 = AsH3 —36,7 К, 2300
Sb-fH3 = SbH3 — 84,5 К. 250°
Ол?довательно, какъ сродство къ водороду, такъ и
прочность водородистыхъ соединеній съ увеличеніемъ
атомнаго в?са элемента убываютъ. Сродство же по отно-
шеиію къ металлоидамъ (напр., къ галоидамъ), какъ
увидимъ ниже, съ увеличеніемъ атомнаго в?са
возрастаете.
Наибольшее сходство между собою показываютъ Р, As
rf^Sb; азотъ же, какъ наибол?е легкій (подобно F и О),
н?сколько уклоняется отъ нихъ.
/
— 252 — > ,
А з о т ъ, N. j\jy
Атом. в. N = 14,01. Мол?к. в. К2 = 28,02. Плот. (воэд. = 1)= 0,969.
Уд. в. жидкаго N при—194<> (вода = 1) = 0,885. Абсолютный в?съ:
1 литръ при 00 и 760 мм. = 1,2505 гр.
§ 89. Азотъ въ природ? чрезвычайно распространены
онъ составляешь около 4/5 (по объему) воздуха, входить
въ составь такъ называемыхъ селитръ (напр., КК03
и NaN03), т.-е. солей азотной кислоты (HN03). Кром?
того, азотъ является постоянной составной частью б?лко-
выхъ веществъ растительныхъ и животныхъ организмовъ:
протоплазма кл?токъ, зародыши и с?мена растеній
содержать азотистыя соединенія, а ткани животныхъ уже
почти исключительно состоятъ изъ б?лковыхъ (азотъ
содержапщхъ) веществъ. Въ воздух? азотъ подъ влія-
ніемь атмосфернаго электричества можетъ переходить въ
азотно и азотисто-амміачныя соли NH4N03 и NH4N02,
который и увлекаются атмосферными осадками (дождь,
сн?гъ и др.) въ почву, откуда азоть переходить въ
растенія, а изъ растеній—въ животныхъ. Только н?кото-
рыя растенія изъ семейства мотыльковыхъ (горохъ, лу-
пинъ, клеверъ и др.) при участіи микроорганизмовъ,
развивающихся на ихъ корняхъ и вырабатывающихъ
вещества, способный соединяться съ азотомъ, усваиваютъ
азотъ изъ воздуха. Вс? же остальныя растенія
усваиваютъ азотъ чрезъ впитываніе въ себя солей азотной
кислоты (селитры). Животныя же получаютъ азотъ
исключительно чрезъ растительную (или животную) пищу.
Атмосферный азотъ, сл?довательно, является глав-
нымъ запаснымъ источникомъ всего азота, необходимаго
для растительной и животной жизни. Обратное поступле-
ніе азота въ воздухъ идетъ при разложеніи продуктовъ
жизнед?ятельности организмовъ и остатковъ отжившихъ
растеній и животныхъ подъ вліяніемъ микроорганизмовъ.
Этимъ процессомъ и сохраняется общее равнов?сіе въ
круговорот? азота въ природ?.
— 253 —
Содержаніе опред?леннаго количества азотистыхъ со-
единеній въ почв? есть необходимое условіе для произ-
растанія, наприм?ръ, хл?бныхъ злаковъ. Для лучшей
урожайности необходимо возвращать азотъ почв? въ
вид? азотистыхъ удобреній.
Лолученіе. 'Азотъ, правда, нечистый, можетъ быть
полученъ изъ воздуха, такъ какъ кислородъ легко
можетъ быть удаленъ оттуда. Опытъ ведется такимъ обра-
зомъ: въ чашечку, плавающую на вод?, кладутъ кусо-
чекъ фосфора и покрываютъ стекляннымъ колоколомъ;
чрезъ отверстіе, закрывающееся пробкой, прикоснове-
ніемъ нагр?той проволоки зажигаютъ фосфоръ, который
и соединяется съ кислородомъ, а азотъ (а равно и
углекислый газъ, водяные пары и др. составиыя части
воздуха) остается свободнымъ. Если посл? опыта
содержимое колокола привести къ первоначальной температур?,
то вода въ немъ поднимется и займетъ
приблизительно одну пятую часть его (рис. 58).
Дляудалеиія
кислорода изъ воздуха
можно воспользоваться
и и?которыми
металлами, напр., м?дыо,
которая въ накален-
номъ состояніи легко
соединяется съ
кислородомъ, образуя
нелетучій окиселъ
СиО.
Чистый азотъ
полу чаютъ, нагр ? в ая
азотистокислый аммо-
ній NH4N02, который при этомъ распадается на азотъ
и воду (рис. 59):
Рис. 58. Гор?ніе фосфора подъ
колоколомъ для изсл?дованія состава
воздуха.
NH4NOa = N2-f2HaO.
— 254 —
Рис. 59. Полученіе чистаго азота изъ азотистоаммо
нШной соли*).
Физическія свойства. Азотъ представляете собою
безцв?тный газъ безъ запаха и вкуса. Плотность его но
воздуху = 0,969, а по водороду — 14,01. При пониженіи
температуры до—146° и при увеличеніи давленія до 35
атмосферъ азотъ переходить въ прозрачную жидкость,
кипящую при—194° и застывающую при—214° въ сн?-
гообразную массу, критич. темп.—146°. Уд?льный в?съ
жидкаго азота 0,885. Въ вод? азотъ растворяется мало;
100 объемовъ воды растворяютъ 1,6 объема азота; въ
спирт? азотъ растворяется лучше.
Химическія свойства. По аналогіи съ кислородомъ
и хлоромъ, отъ азота можно было бы ожидать большой
энергіи, но на самомъ д?л? это элементъ въ обычныхъ
условіяхъ не д?ятельный: при обыкновенной темпера-
тур? онъ не соединяется ни съ однимъ элемеятомъ, онъ
*) Вм?сто N'HjNOg можно брать см?сь кр?пкихъ водныхъ рас-
творовъ KN02 и №Н4С1, которые сначала лутемъ обм?на даютъ
NHaTO2 и КС1, а потомъ чрезъ разложеніе образовавшейся NH|NOa
получается азотъ; нагр?вані? при опыт? должно быть несильное,
иначе разложеніе пойдетъ очень бурно.—Азотъ можно получить при
пропускали Ш13 надъ раскаленной СиО, или при пропускайте NO
надъ раскаленной м?дыо.
— 255 —
не горитъ и не поддерживаетъ гор?нія и дыханія. Прямо
онъ соединяется только съ магніемъ (Mg3N2), баріемъ,
строндіемъ, кальціемъ (Ca3N2), литіемъ (Li3N), бо-
ромъ (BN), титаномъ, кремніемъ (Si2N3) и н?которымй
другими и то только при высокой температур? (красное
кал?ніе). Съ кислородомъ, какъ сказано выше,
соединяется лишь при д?йствіи электрической искры; подъ
вліяніемъ перем?нныхъ токовъ высокаго напряженія
азотъ горитъ, образуя пламя. Животныя, пом?щенныя
въ атмосферу азота, умираютъ, но не отъ ядовитости
азота, а отъ отсутствія кислорода.
Индиферентность азота объясняется прочностью его
молекулы (N2). Интересно отм?тить, что, несмотря на
указанную химическую нед?ятельность азота, соединенія
его очень многочисленны и способны къ разнообразнымъ
превращеніямъ.
Въ обыкновенномъ воздух? азотъ является, такъ
сказать, растворителемъ кислорода; онъ разр?жа?тъ кисло-
родъ. Если бы воздухъ состоялъ изъ чистаго кислорода,
то всякія явленія гор?нія, а также и жизненные
процессы (и прежде всего дыханіе) совершались бы гораздо
быстр?е, что, очевидно, не въ ц?ляхъ природы. До
посл?дняго времени азотъ воздуха принимали за
совершенно чистый азотъ; но теперь стало изв?стнымъ, что
къ воздушному азоту прим?шаны еще другіе газы, изъ
коихъ главнымъ (около 1°/0) является аргонъ.
Воздухъ.
Уд. в. (Н — 1) = 14,44. Темп. кип. (начало) = — 193°. Абсол. в?съ
1 литръ при 0° и 760 мм. = 1,294. Процентный составь: а) по объему
N = 78,13o/0, О"20,900/0, Аг = 0,940/0, СО2 = 0,03°/0; 6) по в?су:
^ = 75,55%, О = 23,10о/0, Аг = 1,30»/0, С02 = О;О50/0.
§ 90. Атмосферный воздухъ есть см?сь приблизительно
21% кислорода и 78°/0 азота по объему или 23%
кислорода и 75.5% азота по в?су. Кром? того, въ составъ
- 256 —
воздуха входить около 0,03% по в^су углекислаго газа
и изм?нчивое содержаніе влаги, озона, перекиси
водорода и н?которыхъ солей (преимущественно азотисто- и
азотно-ариачной), а также пыль и микроорганизмы. За
посл?дніе годы въ воздух? открытъ аргонъ (около 1%
по в?су), водородъ (ок. 0,0033%) и ц?лый рядъ новыхъ
газовъ (неонъ, криптонъ, ксенонъ и гелій), которые
находятся въ очень маломъ количеств? и еще не вполн?
изсл?дованы. Составь воздуха остается лостояяньшъ,
потому что, хотя, съ одной стороны, въ природ? суще-
ствуютъ процессы, поглощающіе кислородъ и выд?ля-
ющіе углекислый газъ (гор?ніе, дыханіе животныхъ и ра-
стеній, вулканическая д?ятелыюсть); съ другой стороны,
существуютъ и прямо противоположные имъ процессы,
то-есть поглощающіе углекислый газъ и выд?ляющіе
кислородъ (разложеніе С02 растеніями при участіи
хлорофилла и подъ вліяніемъ солнечной энергіи), и эти
процессы взаимно уравнов?шиваются; по крайней м?р?,
изсл?дованія за посл?днія сто л?тъ не обнаружили
никакого изм?ненія въ состав? воздуха. Иостоянныя
воздушный теченія обусловливаюсь постоянное перем?ши-
ваніе воздушныхъ массъ, а сл?д., и однородность состава
атмосфер наго* воздуха.
Рис. 60. Приборъ для анализа воздуха.
— 257 —
Самый анализъ воздуха производится въ аппарат?,
илображенномъ на рис. 60. А — аппаратъ, наполненный
II2S04 для поглощенія Н20 изъ воздуха; В и 6'—трубки
<"[, КОН, назначенный для поглощенія С02; аЪ—трубка,
наполненная м?дньши стружками, которыя при накали-
наніи поглотятъ весь кислородъ воздуха, и, накояецъ,
V—баллонъ, гд? соберется оставшійся непоглощенный
азотъ. Изъ баллона до опыта выкачи-ваготъ весь воздухъ,
к вс? приборы взв?шиваютъ. Зат?мъ открываютъ краны
Рис. 61. Опытъ Лавуазье.
V и и баллона, всл?дствіе чего туда направляется
медленный токъ воздуха, теряющаго по дорог? одну изъ своихъ
составныхъ частей за другой. Когда весь баллонъ
наполняется азотомъ, опытъ прекращаютъ и приборы еще разъ
взв?шиваютъ. Прибыль въ в?с? укажотъ на в?съ погло-
щенйыхъ С02, Н20, О и N. Въ такой форм? анализъ
былъ впервые произведеиъ Дюма и Буссенго (Bussin-
gault).
Впервые анализъ воздуха былъ произведеиъ Лавуазье.
Это былъ одинъ изъ первыхъ опытовъ, гд? было при-
м?нено точное и систематическое взв?шиваніе вс?хъ ве-
ществъ, участвовавшихъ въ реакціи, и продуктовъ
реакціи.
, Лавуазье производилъ этотъ опытъ въ сл?дующей
форм? (см. рис. 61). Онъ налилъ въ стеклянную реторту
Неорганическая химія. 17
— 258 —
Л 4 унца чистой ртути. Горло В реторты изгибалось и
было погружено въ сосудъ RS, также наполненный
ртутью. Выдающійся конецъ Е реторты былъ покрытъ
стекляннымъ колпакомъ FG. Зат?мъ былъ опред?ленъ
в?съ pTjytn и объемъ воздуха, оставшагося въ прибор?,
то-есть въ верхнихъ частяхъ реторты и подъ колпакомъ.
Посл? того Лавуазье нагр?валъ въ теченіе 12 сутокъ
реторту со ртутью при температур?, близкой къ кип?нію
Рис. 62. Опр?д?л?ні? кислорода въ впздух?.
этой посл?дней. Ртуть при этомъ покрылась краснымъ
налетомъ (это была окись ртути HgO).
По истеченіи 12 дней Лавуазье охладилъ приборъ и
зам?тилъ, что объемъ воздуха уменьшился (изъ 50 куб.
дюймовъ остались только 42). Оставшійся воздухъ поте-
рялъ способность поддерживать гор?ніе, между т?мъ какъ
полученный налетъ на ртути (красная окись ртути) при
накаливаніи выд?лялъ газъ, поддерживающій гор?ніе
гораздо энергичн?е, нежели обыкновенный воздухъ. Кром?
того, прим?няя в?сы, Лавуазье нашелъ, что на сколько
воздухъ уменьшился ъъ в?с?, на столько в?съ ртути
увеличился.
— 259 —
Изъ этого опыта Лавуазье вывелъ заключеніе, что
иоздухъ не есть элемента, какъ думали раньше, а есть
тЬло сложное, состоящее изъ двухъ газовъ, изъ кото-
рыхъ одинъ поддерживаетъ гор?ніе, а другой—н?тъ.
1)тотъ же опытъ послужилъ ему однимъ изъ основаній
к'ь укр?пленію закона сохраненія матеріи.
Опред?леніе кислорода въ воздух? удобно
производить при обыкновенной температуре въ сл?дующ?мъ
прибор? (рис. 62). Въ стеклянный сосудъ А, называемый
газовой пипеткой, накладывается тонкими палочками
желтый фосфоръ, который зат?мъ покрывается водою.
Сосудъ А соединяется съ одной стороны тонкой
трубочкой а съ шарообразнымъ расширеніемъ сосуда, куда
можетъ уходить вода изъ пом?щенія А, а съ другой
стороны— съ двумя бюретками, изъ которыхъ одна (В) раз-
д?лена на кубическіе сантиметры, а другая (D) безъ
д?леній.
Опытъ д?лается такъ: сначала бюретки разъединяюсь
отъ сосуда А и наполняюсь вдъ водой; зат?мъ, опуская
внизъ бюретку D, набираютъ въ бюретку В опред?лен-
иое количество кубическихъ сантиметровъ воздуха,
подлежащего изсл?довапію, и зажимаютъ наверху бюретки
зажимъ. Посл? этого соединяюсь черезъ каучуковую
трубку бюретку В съ сосудомъ А и, открывъ зажимъ,
иерекачиваютъ (поднимая бюретку D) весь воздухъ въ
сосудъ А, и нажимъ вновь запираюсь. Фосфоръ въ со-
суд? А тотчасъ же начинаетъ окисляться на счетъ
кислорода воздуха (въ темнот? видно при этомъ св?ченіе
фосфора); процессъ поглощенія кислорода фосфоромъ
заканчивается очень быстро (въ темнот? конецъ окис-
л?пія легко узнается по исчезанію св?ченія фосфора).
Тогда вновь выкачиваюсь воздухъ изъ сосуда А въ
бюретку Д и убыль взятаго воздуха укажетъ на
количество бывшаго въ воздух? кислорода, у
Свойства воздуха. Воздухъ есть газъ, безцв?тный въ
тонкихъ слояхъ, но въ большихъ массахъ окрашенный
17*
— 260 -
въ голубой цв?тъ; онъ не им?етъ запаха и вкуса.
Плотность его—14,44 по отношенію къ водороду; при опре-
д?леніи плотностей газовъ плотность воздуха (состоящаго
только изъ кислорода, азота и аргона и лишеннаго влаги,
пыли и «проч. прим?сей) принимается за единицу сра-
вненія. 1 литръ указаннаго воздуха при 0° и 760 мм.
давленія в?ситъ 1.294 гр. (въ СПБ); в?съ, какъ изв?стно,
м?няется въ зависимости отъ географическаго положенія
м?ста, гд? производится изм?реніе.
Воздухъ не есть химическое соедииеніе, и потому о
растворимости его, какъ д?лаго, наприм?ръ, въ вод?,
нельзя говорить, такъ какъ каждая составная часть его
растворяется, при вс?хъ прочихъ равныхъ условіяхъ, въ
зависимости отъ своего парціальнаго (частнаго) давленія
(законъ Генри-Дальтона). Что воздухъ есть см?сь, а
не химическое со?дин?ніе, на это указываютъ еще и
сл?дующія данныя:
a) Элементы въ немъ см?шаны не въ атомныхъ отно-
шеніяхъ, что обязательно при химическихъ соединеніяхъ.
b) При искусственномъ приготовленіи воздуха изъ эле-
мейтовъ не происходитъ ни выд?ленія ни коглощенія
тепла (а изм?неніе это обязательно при всякой
химической реакціи), т.-е. въ этомъ случа?, очевидно,
внутреннее состояніе газовъ не изм?няется, сл?довательно,
происходитъ только продессъ см?шенія.
При давленіи 3.9 атмосферъ и температур? ниже—140°
(критич. температура воздуха) воздухъ сгущается въ
жидкость, кипящую подъ давленіемъ одной атмосферы
при—193°.
Впервые воздухъ быль сгущенъ Пикте и Кальете.
Въ значительныхъ количествахъ жидкій воздухъ былъ
полученъ Вроблевскимъ и Олыпевскимъ въ 1883 году.
Въ настоящее время, благодаря машин? Линде, можно
заводскимъ путемъ готовить жидкій воздухъ. /Способъ
Линде основанъ на томъ приндип?, что при расширении
сильно сжатаго газа до бол?е низкаго давленія происхо-
— 261 —
дитъ сильное охлажденіе, могущее достигать г[4° на
каждую атмосферу уничтоженнаго давленія. Рис. 63
представляешь схематически чертежъ аппарата Линде:
воздухъ сжимается насосомъ Р до 220 атм., въ резервуар?
W онъ охлаждается впачал? до обычной температуры,
т.-е. приблизительно до+ 20° (трубка L служить для
ігриведенія холодной воды, а К—для отвода ея). Зат?мъ
онъ идетъ по трубк? ВС въ узкую трубку, діаметромъ
въ 3 сантиметра, CD, изогнутую зм?евикомъ и лежащую
внутри широкой трубки (.F), въ 6 сантиметровъ
діаметромъ (на черт. 63 узкая трубка обозначена пунктиромъ).
По узкой трубк?, длиной въ н?сколько десятковъ ме-
тровъ, воздухъ доходить до крана U, чрезъ который
поступаете въ сосудъ 21, гд? давленіе всего 20 атм.
Всл?дствіе нроисходящаго расширенія онъ охлаждается
градусовъ на 50, т.-е. до 30°: этотъ холодный воздухъ
идетъ изъ сосуда Т по широкой трубк? F и охлаждаетъ
встр?чный токъ воздуха, идущій по узкой трубк? DC,
такъ что сл?дующій разъ въ Т расширяется воздухъ,
уже охлажденный ниже 0°, и ч температура достигаетъ
до—50°—60°; сл?дующій разъ-будетъ уже—100° и ниже,
потомъ еще ниже и вскор? достигаютъ температуры
ниже—180°, при которой воздухъ иодъ давленіемъ 20 атм.
уже сжимается. Воздухъ изъ ihhpqkoh трубки F постоянно
засасывается насосой? G и поступаетъ чрезъ Н въ резер-
вуаръ W. Кранъ'Л приводитъ св?жій воздухъ къ на-
сосу. Изъ ( сосуд'а ГЛ жидкій -воздухъ выпускается чрезъ
крапъ V. \
ЖидКій^воздух-? получается въ вид? мутной Жидкости,
такъ какъ "-въ !немъ плаваіЬтъ частицы твердой
углекислоты, льда" 'И- другихъ прим?сей. Профильтрованный
чрезъ бумажный филътръ,' онъ представляетъ уже
прозрачную 'жидкость. Сохраняютъ жидкій воздухъ въ стек*
лянныхъ 'сосудахъ *съ двойными, внутри высеребренными,
ст?нками, пространство между которыми лишено воздуха,
Жидкій воздухъ можно свободно переливать при обыкно-
— 262 —
венной температур?: первыя порціи, попадая въ сосудъ,
быстро испаряются и этимь такъ охлаждаютъ сосудъ,
что послЬдующія порціи сохраняются совершенно
спокойно; оц? испаряются медленно. Жидкій воздухъ, по-
Рис. 63. Машина Линде.
м?щенный въ жидкій водородъ, засшваетъ въ твердое
т?ло.
Уд?лышй в?съ жидкаго воздуха=0,93. Если
медленно испарять жидкій воздухъ, чо сначала будетъ
улетучиваться ниже кипящій азотъ (т. к.—194°), зат?мъ аргонъ
(т. к. — 185°), и жидкость будетъ все бол?е и бол?е
обогащаться кислородомъ, кипящимъ при—182,5°.
(На отомъ основанъ предложенный Линде способъ
полученія кислорода прямо изъ воздуха. Съ этой ц?лыо
аппаратъ н?сколько видоизм?ненъ (рис. 64). Сжатый
воздухъ идетъ по двумъ трубкамъ с и й, который опять
соединяются въ Ъл зат?мъ проходитъ по спирали S,
расположенной въ широкомъ сосуд?, и, проходя черезь
кранъ rv поступаеіъ въ тотъ же сосудъ, гд? часть ею
— 263 —
(преимущественно кислородъ)
сгущается, другая же часть (глав-
аымъ образомъ, азотъ) идетъ по
вн?шней трубк? N для охлажде-
нія навстр?чу идущему по
тонкой спирали воздуху и выходить
чрезъ отверстіе п. Находящійся
въ пшрокомъ сосуд? жидкій воз-
духъ, нагр?ваясь отъ проходя-
щаго по спирали 8 сжатаго
воздуха, частью испаряется, при
чемъ испаряется
преимущественно азотъ. Съ помощью винта г2
можно понижать уровень
жидкости и, такимъ образомъ.
регулируя всегда притокъ тепла отъ
спирали S, получать бол?е или
мен?е чистый кислородъ.
Выпущенный чрезъ кранъ г2 жидкій
КИСЛОРОДЪ ПрОХОДИТЪ ВЪ ШИро- Рис. 64. Приборъ Линде
кую трубку О, гд? испаряется для поилуъчевн^ **слоРода
и зат?мъ выпускается чрезъ
отверстіе О. Регулируя краны с и
й, можно достичь того, что изъ 2\г и О будутъ
выходить азотъ и кислородъ одинаковой температуры. Въ та-
комъ аппарат? съ помощью 1 лошадиной силы въ
1 часъ можно разд?лить 5 кубическихъ метровъ
воздуха на кислородъ и азотъ.)
Въ жидкомъ воздух? оч&іь легко замерзаютъ: вода,
спиртъ, э?иръ, ртуть, обычные газы, напр., С02, H2S,
С1, ацетиленъ (С2Н2) и др., превращаясь въ твердыя
т?ла. Охлажденныя до такой низкой температуры, многія
т?ла совершенно изм?няютъ свои свойства. Напр., Zn
или каучукъ д?лаются хрупкими и отъ удара молоткомъ
разлетаются на мелкіе куски. Замороженная каучуковая
трубка, изогнутая въ вид? петли, сохраняете эту форму
— 264 —
даже тогда, когда къ ея другому концу прив?слть гирю.
При температур? жидкаго воздуха совершенно
прекращается множество химическихъ реакцій, напр., H2S04
перестаетЪіД?йствовать на Zn и на щелочи. Многія т?ла
пріобр?таАотъ способность фосфоресцировать.
Изученіе жидкаго остатка посл? испаренія азота
позволило открыть ц?лый рядъ уже упомянутыхъ новыхъ
газовъ, напр., неонъ, гелій и др.
Кром? кислорода и азота, въ воздух? находятся
углекислый газъ и водяные пары.
Количество оодяныссь паровя въ воздух? зависитъ отъ
температуры и другихъ условій. Обнаружить присутстві?
водяныхъ паровъ въ воздух? можно такъ: понизить
температуру воздуха внесеніемъ въ него холоднаго т?ла,
тогда часть паровъ воды выд?лится на т?л? въ вид?
капель, или можно пропустить опред?ленный объемъ
воздуха чрезъ с?рную кислоту, которая поглотитъ всю
воду, и по увеличенію въ в?с? с?рной кислоты можно
судить иО количеств? водяныхъ паровъ въ данномъ объем?
воздуха.
Присутстві? углекислаго газа можно вид?ть изъ того,
что известковая вода при стояніи въ открытомъ сосуд?
д?лается мутной, всл?дствіе образованія б?лаго порошка
углекислаго кальція.
Количество углекислаго газа опред?ляется при про-
пусканіи опред?леннаго объема воздуха въ известковую
воду, и тогда по в?су образовавшаяся осадка судятъ о
количеств? С02, или пропускаютъ опред?ленный объемъ
воздуха чрезъ взв?шенную трубочку съ ?дкямъ кали,
которое тоже поглощаетъ С02, и опять по прив?су
опред?ляютъ его количество.
Содержаніе С02 въ воздух? колеблется около 0,03°/0 —
0,04°/0 по объему; С03 является продуктомъ гор?нія я
дыханія. Высшій пред?лъ его содержанія, однако, не
превосходитъ 0,5°/0. Взрослый челов?къ днемъ и въ
состояніи покоя сжигаетъ при дыханіи около 12 гр. угле-
— 265 —
рода въ част», что даетъ 94 гр. углекислаго газа или
22 литра; въ сутки онъ выдыхаетъ около 2,5 фунтовъ
(или 1.040 литровъ) углекислаго газа. Для очищенія
воздуха жилыхъ пом?щеній необходима вентиляція. II о-
сл?дняя и совершается всегда чрезъ окна, двери и ст?ны,
а также, конечно, и чрезъ форточки, вентиляторы и др.
Кром? газообразныхъ т?лъ, въ низшихъ слояхъ
воздуха постоянно носятся различный твердый т?ла въ вид?
ныли. Пыль составляютъ, во-первыхъ, различныя мине-
ральныя соли, напр., азотнокислый и азотистокислый
аммоній, поваренная соль, глауберова соль, кремнеземъ,
гипсъ, окись жел?за и др., а во-вторыхъ, различныя
органическія и организованныя т?ла (микроорганизмы,
бактеріи, споры и пр.); посл?днія, по изсл?дованіямъ Па-
стера, могутъ вызывать процессы гніенія, броженія, пл?с-
нев?нія. Процессы эти им?ютъ громадное значеніе для
вс?хъ растительныхъ и животныхъ организмовъ; мертвые
организмы, подвергаясь гніенію, доставляютъ вещества,
необходимыя для питанія раст*епій; гніеніе и броженіе
суть т? процессы, посредствомъ которыхъ природа унич-
тожаетъ растительные и животные отбросы, превращая
ихъ вновь въ вещества, пригодныя для питанія растеній,
а черезъ эти посл?днія и животныхъ. Отсюда видна
важность этихъ процессовъ: безъ нихъ въ природ?
накопилось бы огромное количество отбросовъ, и жизнь стала бы
невозможной.
Въ воздух? носятся также различные бол?знетворные
микроорганизмы, которые, попадая въ кровь, вызываютъ
различныя забол?ванія, напр., холеру, чуму, тифъ и т. п.
Наблюденія, сд?ланныя въ окрестностяхъ Парижа,
показали, что число бактеріи въ воздух? подвергается значи-
тельнымъ колебаніямъ: наприм?ръ, въ 1 кубическомъ
метр? воздуха оно — зимой — 433, весной — 633, л?-
томъ—825, осенью—1,083. Въ жилыхъ пом?щеніяхъ ихъ
больше, а дальше отъ жилья ихъ меньше. Чище всего
воздухъ высокихъ горъ. Въ воздух? одной изъ улицъ
— 266 —
Парижа въ 1 кубичсскомъ метр? насчитано бактерій 3.480,
въ воздухЬ новыхъ домовъ — 4.500, старыхъ—36.000,
госпиталей—79.000. Посл? дождя воздухъ чище, потому
что доящ>, проходя чрезъ воздухъ, увлекаетъ съ собою
бактерій.' Для того, чтобы обезвредить воздухъ,
содержащей заразные микроорганизмы, его дезгьнфицируютъ,
т.-е. вводить въ воздухъ такія вещества, которыя уби-
ваютъ бактерій (напр., хлоръ, с?рнистый газъ).
А р г о н ъ, Аг.
Атом, в?съ Аг = 39,88. Молек. в. —39,88. Уд. в. (Н= 1) = 19,957,
(возд. = 1) = 1,38. Темп, кип. —I860, Темп, плавл. = — 189,5».
§ 91. Полученіе. Англійскіе ученые Рэлей и Рамзай,
изсл?дуя въ 1894 году азотъ, полученный изъ воздуха,
и азотъ, полученный изъ соединеній (напр., изъ NH4N02),
нашли, что плотность перваго всегда больше плотности
второго: 1 литръ азота, полученнаго изъ NH4N02 в?силъ
1,2505 гр., а 1 литръ азота, полученнаго изъ воздуха, в?-
ситъ 1,2572 гр. Рэлей и Рамзай предположили, что разница
въ в?с? зависитъ отъ прим?си къ азоту воздуха какого-то
бол?е тяжелаго газа. Чтобы выд?лить этотъ посл?дній,
они заставили проходить воздухъ, предварительно
лишенный воды и углекислоты, чрезъ нагр?тый порошокъ
магнія—вещества, соединяющаяся съ кислородомъ и азо-
томъ (рис. 65)1). Пропустивъ воздухъ чрезъ указанный
приборъ н?сколько разъ, они получили н?которое
количество безцв?тнаго газа. Дальн?йшія изсл?дованія
показали, что газъ этотъ обладаетъ крайнею инертностью,
а потому его и назвали аргономъ (нед?ятельнымъ). До
сихъ поръ не удалось получить ни одного характерная
соединенія для аргона.
і) Къ магнію рекомендуется прибавлять металлическаго литія,
жадно поглощающаго азотъ.
— 267 —
Рис. 65. Приборъ для полученія аргона; въ склянк? К находится
?дкое кали для поглощ?нія С02, въ U-образной трубк? t—натронная
известь тоже для поглощенія С02; въ склянк? $ налита H2S04 и въ
трубку Р положенъ ?%0$ •— оба для поглощенія воды; въ трубк? v
накаливается магній, со?диняющійся съ кислородомъ и азотомъ.
Свойства. Въ воздух? аргона находится 0.63% по
объему или 0,9% по в?су. Аргонъ— безцвЬтный газъ!
плотность его 19,957 (Н = 1); 1 литръ его (при 0° и
760 мм. давленія) в?ситъ 1,7818 гр.
При охлажденіи до—128,6° и давленія 38 атмосферъ
аргонъ удалось сгустить въ безцв?тную жидкость, уд.
в?са 1,5, кипящую при—186° и замерзающую при—189,5°.
Аргонъ почти въ 2,5 раза растворим?е азота; аргонъ
обладаетъ характернымъ спектромъ1).
Съ химической стороны аргонъ, какъ уже сказано,
характеризуется, какъ совершенно мертвый газъ, т.-е. ни
съ ч?мъ не реагирующій.
Аналоги аргона.
§ 92. Аргонъ, выд?ленный изъ воздуха и пом?щенный
въ лшдкій воздухъ, испаряющійся подъ уменыпеннымъ
і) По Круксу и др. для аргоннаго спектра характерны дв? крас-
ныя лиши съ длинами волнъ 707 и 696 милліонпыхъ долей
миллиметра.
— 268 —
давлені?мъ (т.-е. при температур? около—200°),
превращается въ жидкость. Если этотъ жидкій аргонъ испарять
подъ обыкновеннымъ давленіемъ (760 мм.), то часть его
улетучивдется ран?е—185°. Въ этой летучей до—185°
части аргона открыты были Рамзаемъ, Траверсомъ и др.
четыре новыхъ элементарныхъ газа: гелій (Не), неонъ
(Ne), кргттонъ (Кг) и ксенонъ (Хе). Количество ихъ
въ сумм? мен?е 0,2%. Аргонъ и его аналоги найдены
также въ н?которыхъ (особенно скандинавскихъ) мине-
ралахъ, напр., въ уранит?, клевеит?-и др.; въ этихъ
минералахъ указанные элементы находятся въ довольно
прочномъ состояніи: выд?ляготся они только при силь-
номъ накаливаніи этихъ мин?раловъ съ с?рного
кислотою.
Первый изъ этихъ элементовъ—гелій, задолго раньше
(въ 1868 г. Локъеромъ) открытъ былъ въ фотосфер?
солнца; впосл?дствік Рамзай выд?лилъ его изъ разныхъ
минераловъ, напр., изъ клевеита, уранита и др., а также
изъ н?которыхъ минеральныхъ источниковъ; это очень
легкій газъ, очень трудно сгущающійся; въ жидкомъ
состояніи получилъ его профессоръ Каммерлингъ-Оннесъ
(10 ііоля—нов. стиля—1908 г.): жидкій гелій кипитъ подъ
давленіемъ одной атмосферы при—268,5° Ц., или 4,5 по
абсолютной шкал?. Физическія свойства другихъ
элементовъ приведены ниже въ таблиц?.
Чрезвычайно интересное открытіе сд?лано было
Рамзаемъ и Содди, а именно: газообразное вещество — эма-
нація (см. дал?е „Радіоактивныя вещества"), выд?ля-
ющ?еся изъ бромистаго радія, постепенно превращается
въ гелій; та же эманація, но растворяемая въ вод?,
превращается почти исключительно въ неонъ; а въ раство-
рахъ азотном?дной соли подъ вліяиіемъ эманаціи
образуется аргонъ, при чемъ гелія зд?сь уже вовсе не
образуется, неона же—только, быть-можетъ, сл?ды.
Если эманацію считать д?йствйтельнымъ элементомъ
(а таковымъ ее и считаготъ), то данный фактъ чрезвы-
— 269 —
чайно важенъ, какъ первый наблюденный случай превра-
щеиія одного элементарнаго вещества въ другое1).
Вс? эти четыре вещества — безцв?тные безъ запаха
газы съ своеобразными спектрами. Въ химическомъ отно-
шеніи они, подобно аргону, совершенно нед?ятелъны; они
до сихъ поръ ни съ ч?мъ не соединены. При сопоста-
вленіи ихъ свойствъ нетрудно усмотр?ть такую же по-
сл?довательность въ ход? изм?неній, какая наблюдается
въ элементахъ, принадлежащихъ къ одной и той же
групп? періодической системы.
Не
т
Аг
Кг
Хе
Ат. в.
3,99
20,2
39,88
82,92
130,2
Шотн.
(н=і).
1,99
10,1
19,94
41,46
65,1
Темп. кип.
—268,5°
—243°
-186,1°
— 151,7°
—109,1°
Темп. плав.
—271,5°
—252,6°
—187,90
-169,0°
-140,0°
Приблизит.
содержаніевъ
100 об. возд.
/1-000.000
/40-000
/100
/l-000-OOO
/70'000-000
Атомные в?са ихъ находятся между атомными в?сами
элем?нтовъ (галоидовъ) 7-й гр. и элементовъ (шелочныхъ
металловъ) 1-й гр.
7 гр.
—
F 19,0
С1 35,46
Вг 79,92
J 126,92
Аргоновая гр.
Не 3,99
Ne 20,2
Аг 39,88
Кг 82,92
Хе 130,2
Li
Na
К
Rb
Cs
1 гр.
6,94
23,05
39,10
85,45
132,81
Въ виду сказаннаго, по предложенію Рамзая (1900 г.),
аргонъ и его аналоги объединены въ группу. А такъ
какъ вс? они характеризуются неспособностью вступать
въ химическія соединенія, то и группа названа „нулевой"
]) См, также прим?чаніе на 144—146 стр. Тамъ же и о положе-
піи аргона въ періодической систем?.
— 270 —
группой, при которой нельзя поставить никаяихъ типи
ческихъ формъ соединеній, каковыя обязательны для
вс?хъ другихъ группъ; подъ этой группой въ періоди-
ческой таблиц? и стоить лишь одиноііій R.
Ф о е ф о ръ, Р.
Ат. в. ^31,04. Мод. в. Р4 = 124,16. Уд. в. (вода = 1) = 1,83 при 10°
(для желтаго) 2,11 (для краснаго) и 2,34 (для металлическаго).
§ 93. Фосфоръ встр?ча?тся въ природ? только въ
соединеніяхъ и преимущественно въ соединеній съ каль-
ціемъ, въ вид? залежей такъ называемыхъ фо^форитовъ
[Са3(Р04)2], апатитовъ [ЗСа3(Р04)2] + CaF2(Cl2)j и др.; въ
вид? фосфорно-кальціевой соли онъ находится также
въ мускульной жидкости, въ моч?3) и въ коСтяхъ жи-
вотныхъ (до 60%), откуда его, главньшъ образомъ, и до-
бываютъ; фосфоръ является составной частью лецитина—
сложнаго органическаго вещества, находящаяся въ мозгу
и нервахъ; протоплазма кл?токъ заключаетъ въ себ?
фосфоръ содержащія вещества.
Полученіе. Для полученія фосфора костяную золу2)
обыкновенно обрабатываютъ с?рною кислотой на холоду,
при чемъ получаются нерастворимый въ вод? гипсъ
(CaS04) и переходящая въ растворъ соль состава
СаН4(Р04)2—кислая фосфорно-кислая соль:
Са3(Р04)2 -f 2H2S04 = 2CaS04 -f CaH4(P04)2;
полученную соль выпариваютъ и накаливаютъ; при на-
каливаніи она распадается и даетъ воду и среднюю
кальціеву соль метафосфорной кислоты:
СаН,(Р04)2 = 2Н20 + Са(Р03)2.
і) Въ первый разъ фосфоръ и былъ открыть алхимшсомъ Бранд-
томъ (въ 1669 г.) при перегонк? сухого остатка мочи.
2) Костяная зола состоитъ изъ Са3(Р04)2 (84,39*/оЪ Mg3(P04)2
(2-150/0), СаСО. (9,42»/0) и CaF, (4,05<у0),
— 271 —
Е)ту посл?днюю перем?шиваютъ съ угл?мъ и накалива-
ютъ, при чемъ выд?ляется свободный фосфоръ:
ЗСа(Р03)2 + ЮС = Са3(Р04)2 + 10СО -f 4Р.
Такъ какъ фосфоръ легко окисляется въ воздух?, то
приборы, въ которыхъ окисляется фосфоръ, наполняютъ
углекислымъ газомъ, а пары фосфора сгущаются подъ
водой1).
Для очищенія отъ прим?сей полученный фосфоръ
вторично перегоняютъ изъ чугунныхъ ретортъ и
сплавленный подъ водою отливаютъ въ палочки. Еще лучше
можно очищать фосфоръ при перегонк? его съ водяньшъ
паромъ.
Физическгя свойства. Фосфоръ изв?стенъ въ н?-
сколькихъ аллотропическихъ изм?неніяхъ. Фосфоръ,
называемый обыкновенным^, представляетъ собой твердое
т?ло: св?жеполученный онъ прозраченъ, мягокъ, какъ
воскъ, и слабожелтоватъ (почти безцв?тенъ), но съ те-
ченіемъ времени онъ становится непрозрачнымъ и сильно
желтымъ.
Плавится обыкновенный фосфоръ при 44°, при 60°
загорается въ воздух?, а при 287° въ атмосфер? не
соединяющаяся съ фосфоромъ газа превращается въ
паръ. Уд?льный в?съ его = 1,83. Онъ легко
растворяется въ с?роуглерод? CS2; изъ этого раствора
выд?ляется въ вид? кристалловъ и поэтому называется кри-
сталлическимъ; въ вод? нерастворимъ; сильно ядовитъ.
Въ мелко раздробленномъ состояніи фосфоръ загораетзя
при обыкновенной температур? 1).
*) Въ настоящее время, благодаря прим?ненію электрической
энергіи для полученія высокихъ температурь, фосфоръ добываютъ при
плавленіи смЬси Са3(Р04)2 съ пескомъ (Si02) и углемъ:
Са3(Р04)2 + 3Si02 + 5С = 3CaSi03 + 5СО + 2Р.
і) Показать это на опыт? можно такъ: растворить въ CS2
немного фосфора и такимъ растворомъ облить полоску пропускной
бумаги; захвативши лосл?днюю щипцами, подержать немного на воз-
— 272 —
Если желтый фосфоръ нагр?вать до температуры 260
въ закрытомъ сосуд? безъ доступа воздуха, то
получается другое видоизм?неніе фосфора, такъ называемый
красный фосфоръ1). Это красноватый порошокъ уд?ль-
наго в?са=**=2,11 съ температурой воспламененія 260°.
При 290° онъ, не плавясь, превращается въ пары, а
сгущаясь даетъ вновь желтый фосфоръ. Красный
фосфоръ не растворяется въ с?роуглерод? и не ядовитъ;
мало энергиченъ, не самовозгорается.
Плотность пара фосфора показываетъ, что при раз-
иыхъ температурахъ частица его состоитъ изъ разнаго
числа атомовъ: такъ, при температурахъ до 1.000° она
состоитъ изъ четырехъ атомовъ; такъ какъ плотность
паровъ = 62; сл?довательно, M = 2D —2 X 62 = 124, а
124:31 (атомный в?съ форфора) —4; а при 1700°—изъ
3 атомовъ (D—16,5). Кріоскопическимъ методомъ
найдено, что при обыкновенной температур? молекула
фосфора содержать 4 атома.
Существованіе двухъ видоизм?неній фосфора и
обусловливается, в?роятно, различнымъ числомъ атомовъ въ
частицахъ ж?лтаго и краснаго фосфора. Въ пользу этого
пололсенія говорить тотъ фактъ. что желтый фосфоръ,
переходя въ красный, выд?ляетъ 19 К теплоты.
Существуетъ еще третье видоизм?н?ні? фосфора—
металличесній фосфоръ, получающійся при нагр?ваніи
краснаго фосфора въ запаянной трубк? до 530°;
получается онъ въ вид? иглъ съ металлическимъ блескомъ,
уд. в. 2,28 2).
дух?, при чемъ CS2 быстро улетаетъ, а фосфоръ сейчаоъ же
загорается, отчего вся бумажка вспыхиваетъ.
!) Желтый фосфоръ, сохраняющійся подъ водою на св?ту,
постепенно съ поверхности переходитъ въ красный фосфоръ. 'Въ
присутствии іода это превраіценіе ускоряется и заканчивается безъ
повышения температуры.
2) Изв?стно еще видоизм^неніе — ярко-красный фосфоръ,
получающійся при кипяченіи раствора фосфора въ тр?хбромистомъ фос-
— 273 —
Химическія свойства. Фосфоръ является элементомъ
очень энергичнымъ: со многими простыми т?лами онъ
соединяется непосредственно и съ выд?леніемъ большого
количества тепла. Особенно энергично фосфоръ
соединяется съ кислородомъ; въ темнот? при медленномъ
окисленіи фосфора на воздух? происходитъ ясно
видимое св?ченіе; окисленіе фосфора сопровождается появле-
ніемъ запаха, !!напоминающаго озонный запахъ, такъ какъ
при этомъ окисленіи часть кислорода переходить въ
озонъ. Сохрагіяютъ фосфоръ подъ водой.
Фосфоръ можно соединить съ кислородомъ также и
подъ водой. Если расплавить въ пробирномъ цилиндрик?
подъ водой кусочекъ фосфора и при помощи стеклянной
трубки приводить къ нему кислородъ изъ газометра, то
происходить яркія вспышкиа). Фосфоръ, такимъ обра-
зомъ, мож?тъ служить въ качеств? энергичнаго возстано-
вителя.
Кром? кислорода (и озона), особенно энергично онъ
реагируетъ, напр., съ галоидами, с?рой и съ многими
металлами; при нагр?ваніи фосфоръ д?йствуетъ даже на
платину.
Красный фосфоръ уступаешь по энергіи желтому и
можетъ сохраняться на воздух? безъ изм?неній: онъ
загорается только въ присутствіи богатыхъ кислородомъ
веществъ, напр., см?сь его съ бертоллетовою солью
воспламеняется со взрывомъ отъ удара.
Фосфоръ нашелъ себ? прим?нені? въ приготовленіи
спичекъ. Такъ называемый шведскія или безопасныя
спички приготовляются сл?дующимъ образомъ: красный
фосфоръ съ битымъ стекломъ и с?рыистой сурьмой
наносить на боковыя бумажки коробки, а головку спички
фор? въ вид? мелкаго аморфнаго порошка. Онъ неядовитъ, н? изм?-
няется на воздух?, цо въ общемъ реагируетъ энергичн?е, ч?мъ
красный фосфоръ.
і) Опытъ подробно описанъ дал?е, — при кислородныхъ соедине-
ніяхъ фосфора.
Неорганическая химія. J-"
- 274 —
покрываютъ см?сыо бертоллетовой соли, перекиси свинца
и с?рнистой сурьмы.
Фосфоръ можеть соединяться и съ другими
металлоидами и съ металлами.
Желтей фосфоръ очень ядовиты доза около 0,1 гр.
является уже смертельной для взрослаго челов?ка.
М ы ш ь я к ъ, As.
Атомн. в. As =74,96. Модек. в?съ As^=229;84. Уд. в?с* = 5,73 при 140.
§ 94 Полученіе. Мышьякъ сравнительно р?дко встр?-
чается въ природ? въ свободномъ состоявши, чаще же
въ соединеніяхъ съ с?рой, образуя минералы реальгаръ
As4S4 и аурипигменіъ (As2S3), и въ соединеніяхъ съ
металлами (жел?зомъ, м?дыо, кабальтомъ, никелемъ и др.).
Въ свободномъ вид? мышьякъ получается при
накаливании безъ доступа воздуха мышьяковистэго колчедана
(FeAsS), а также мышьяковистаго ангидрида As203 съ
угл?мъ, который отнимаетъ отъ соедип?нія кислородъ,
свободный же мышьякъ возгоняется:
2As203 -f ЗС = ЗС02 + 2As2.
Свойства. Мышьякъ изввстенъ въ трех^ аллоіропи-
ческихъ видоизм?непіяхъ. Одно, къ которому
принадлежите и самородный мышьякъ, представляете собою
с?ровато-б?лую кристаллическую массу съ металлическимъ
блескомъ. Это видоизмЬненіе называется кргішалличе-
скимъ; получается оно и при возгонк? мышьяка,
отличается хрупкостью и легко измельчается въ порошокъ;
уд?льный ввсъ его = 5,73. Другое видоизм?нвніе мышьяка
получается при разложеніи мышьяковистаго водорода въ
вид? чернаго малоблестящаго аморфна^го вещества, уд?ль-
наго в?са 4,71; при нагр?ваніи до 360° оігь переходитъ
въ к?исталлпческій, выд?ляя теплоту. Есть еще желтое
видоизм?нені?-мышьяка, образующееся при быстромъ и
сильномъ охлажденіи паровъ мышьяка; по свойствамъ
- 275 -
оно напоминаетъ желтый фосфоръ, растворимо въ CS2,
легко окисляется на воздух? со св?ченіемъ, им?етъ
чесночный запахъ. При 360° оно переходить въ
обыкновенный кристаллическій мышьякъ.
Плотность пара при температур? 360° показываетъ,
что частица мышьяка состоитъ изъ 4 атомовъ, но при
температур? б?лаго каленія частица диссоціируетъ и
содержитъ 2 атома.
При темно-красномъ каленіи безъ доступа кислорода
мышьякъ, не д?лаясь жидкимъ, прямо превращается въ
пары. Пары мышьяка желтоватаго цв?та, съ чесночнымъ
запахомъ, ядовиты.
По химическймъ свойствамъ мышьякъ — металлоидъ
мало энергичный; поэтому въ природ? онъ^и можетъ
нЭходитГсяПвъ~свободномъ состояніи; на сухомъ воздух?
не изм?няется, но, нагр?тый до 180°, загорается,
превращаясь въ мышьяковистый ангидридъ As.,03; во влаж-
номъ воздух? окисленіе идетъ и при обыкновенной,
температур?. Соединяется онъ какъ съ металлами, такъ
и съ металлоидами, что указываетъ на его переходныя
свойства. По металлическому блеску, по способности
проводить теплоту и электричество металлическій
мышьякъ бол?е походить на металлъ. Мышьякъ не
растворяется ни въ НС1, ни въ H2S04; азотная же кислота
окисляетъ его въ мышьяковую кислоту.
Сурьма, Sb.
Атомп. в?съ Sb = 120,2. Уд. в?съ (вода=1)=6,7. Темп. плавл.=630<>.
§ 95. Сурьма еще мен?е энергичный, какъ
металлоидный, элементъ, ч?мъ мышьякъ. .
Въ природ? встр?чается какъ въ свободномъ вид?,
такъ и въ вид? соединеній съ кислородомъ—Sb203 и
с?рой—Sb2S3 (сурьмяный блескъ) и почти всегда
сопровождаете мышьякъ.
18*
— 276 —
Въ чистомъ вид? сурьма, какъ и мышьякъ, можетъ
быть получена накаливаніемъ окиси сурьмы Sb203 съ
углемъ, при чемъ сурьма выплавляется:
2Sb203 -f-3C = 3C02 + 2Sb2.
По физическимъ свойствамъ сурьма очень близко
подходить къ металламъ: обладаетъ металлическимъ бле-
скомъ, кристалличиа, хрупка, легко измельчается въ по-
рошокъ. Плавится при 630°, а при 1450° кипитъ. Уд?ль-
ный в?съ ея —6,7. Сурьма изв?стна въ н?сколькихъ
аллотропическихъ видоизм?неніяхъ.
Но химическимъ свойствамъ сурьма, какъ сказано,
является мен?е энергичной, ч?мъ мышьякъ. Правда, съ
кислородомъ, хлоромъ и бромомъ она реагируетъ еще
очень энергично. Высшіе кислородные окислы, а также
газообразное соединеніе сурьмы съ водородомъ
заставляют^ причислить ее къ металлоидамъ, а между т?мъ со-
единенія ея съ галоидами, съ с?рой, и низшіе
кислородные окислы характеризуют сурьму, какъ металлъ.
Отсюда сурьму правильн?е сл?дуетъ назвать металл о-
металлоіьдомъ.
Сурьма въ кислотахъ растворяется.
Въ техник? сурьма прим?няется въ сплавахъ съ
другими металлами: сплавамъ она сообщаетъ блескъ,
твердость и хрупкость. Сплавъ изъ свинца (50%), сурьмы
(25%) и олова (25%) служить для отливки шрифта и
называется типографскимъ металломъ.
Водородныя соединенія металлоидовъ группы азота.
§ 96. Въ глав? о соединеніяхъ водорода съ галоидами
(VII гр.) было показано, что они составлены по типу RH
и по химическимъ свойствамъ явились сильными
кислотами. Водородныя соединенія элементовъ группы кисло-
— 277 —
рода (VI группы) образованы до тяну ЕН2; кислотныя
свойства, подобно галоидоводородамъ, сохранились и
зд?сь (кром? Н20), но уже въ очень ослабленной
степени.— Элементы группы азота (V гр.) даютъ съ
водородомъ соединенія типа ЕН3, отъ которыхъ, по
сравнению съ прежними группами, едва ли ужъ можно ожидать
хоть какой-нибудь кислотности. И въ самомъ д?л?, со-
единеніе азота съ водородомъ — амміакъ NH3—обладаешь
вполн? основнымъ характеромъ: съ кислотами онъ
образуешь соли, при чемъ роль металла играетъ группа аммо-
нія NH4; на лакмусовую бумажку реагируетъ, какъ
щелочь; фосфористый водородъ (РН3) обладаетъ также
основными свойствами, а мышьяковистый (AsH3) и
сурьмянистый (SbH3) водороды нейтральны.
Вс? упомянутыя соединенія элементовъ группы азота
съ Н газообразны. Выше было указано, что сродство къ
водороду въ этой групп?, какъ и въ предыдущихъ,
быстро уменьшается съ увеличеніемъ атомнаго в?са
элементовъ: у азота и фосфора -эти соединенія экзотер-
мичны, а у мышьяка и сурьмы сильно эндотермичиы,
ч?мъ и объясняется ихъ легкая разлагаемость.
Амміакъ, NH3. \ 'VJ ^/
> s
Мод?к. в?съ ОТГ3 = 17,29. Темпер, пдавл. = — 77*. Уд. в?съ жидкаго
КН3 при 00 (вода = 1)^0,6233. Плотн. газ. NH3 (возд. = 1) = 0,589.
Абсол. в?съ: 1 л. NH3 при 0° и 760 мм. = 0,772 гр. Процентный
состава а) по в?су: N=82,25o/0, Н=17?75о/0; Ь) по объему: 100 куб. с.
NH3 даютъ 150 куб. с. Н и 50 куб. с. N.
§ 97. ііолученіе. Амміакъ образуется при гніеніи азо-
тистыхъ веществъ, а потому какъ въ свободномъ состоя-
ніи, такъ и въ соединеніяхъ находится вьвоздух?, почв?
и въ водахъ, покрывающихъ земную поверхность. Азотъ
сь водородомъ можетъ прямо соединяться только при
д?йствіи электрическихъ искръ, при чемъ реакція эта
— 278 —
является обратимой1); она идетъ по уравнение: N2-|-
~j-3H2;^; 2NH3; какъ видно изъ уравненія при полномъ
свершеніи реакціи изъ 4-хъ взятыхъ объемовъ см?си
получаются то«ігько 2 объема амміака; при разложеніи
амміака, конечно, произойдетъ увеличеніе объема въ
два раза.
¦ Въ болыпомъ колич?ств? амміакъ образуется при
накаливаніи каменнаго угля и скопляется при газовомъ
производств? въ газовой вод? 2). Для полученія чистаго
амміака берутъ обыкновенно хлористый аммоній
(нашатырь) и- слегка нагр?ваютъ его съ двойнымъ по в?су
количеством, гашеной извести Са(ОН)2:
2NH4C1-f Са(ОН)2 = СаС12 + 2Н20 -f 2NH3.
Для сушенія употребляютъ обыкновенную негашеную
известь или ?дкій натръ, или ?дко? кали, но не с?рную
кислоту, такъ какъ она соединяется съ амміакомъ, давая
с?рнокислый аммоній:
H2S04 + 2NH8 = (NH4)8804;
и не СаС)2, съ которымъ NH3 также можетъ соединяться.
Всл?дствіе большой растворимости амміака въ вод?
его собираютъ надъ ртутью или, пользуясь
легкостью его, въ сосудъ, перевернутый дномъ кверху (см.
рис. 66)3).
і) Равнов?сіе устанавливается, когда 0,02 общаго объема см?си
газовъ азота и водорода (взятыхъ въ отношеніи 1 : 3) оказывается
въ вид? NH3, а 0,98 — въ вид? свободныхъ элементовъ. Если обра-
зующійся Ші3 удалять изъ см?си (напр., д?йствіемъ какой-нибудь
кислоты), то реакцію можно довести до конца.
2) Свободнаго амміака въ газовой вод? немного, а
преимущественно тамъ находятся амміачныя соли (напр., (NH4)2C03, (NH4)2S,
JS"HiCN", (NH4)aSO| и др.); газовая вода на заводахъ нагр?ваніемъ съ
известью перерабатывается или на нашатырный спиртъ или на
амміачныя соли.
3) Очень быстро можно получать сухой КН3, если къ твердому
КОН приливать по каплямъ кр?пкій водный растворъ амміака. Въ
нродаас? им?ется жидкій амміакъ въ стальныхъ бомбахъ.
— 279 ~
Фгізическія свойства. Амміакъ 2) — безцв?тный газъ
съ острымъ раздражающимъ слизистыя оболочки запа-
хомъ, почти вдвое легче воздуха: уд?льный в?съ его по
отношенію къ водороду = 8,53, по отношенію къ воз-
духу = 0,589.
Рис. 66. Поіученіе амміака.
При охлажденіи до—33,5° и при обыкновенное да-
вденіи или давленіи въ 9 атмосферъ и обыкновенной
т?мператур? амміакъ переходитъ въ жидкость, кипящую
при — 33,5° и застывающую при — 75°, въ безцв?тную
кристаллическую массу J Амміакъ очень хорошо раство-
римъ въ вод?; растворъ этотъ носитъ названіе нашатыр-
паго спирта; одинъ объемъ воды при обыкновенной
температур? растворяетъ 750 об. газа, а при 0° — до
] .500 объемовъ.
і) Названіе амміака произошло отъ храма Юпитера Аммона (въ
Ливійской пустын?), около котораго въ давнія времена добывался
хлористый аммоній (N"H4C] — SaJ ammoniacum) сжиганіемъ сухого
ворблюжьяго помета,
— 280 -
Растворимость амміака въ вод? можетъ быть показана
на сл?дующемъ опыт? (рис. 67): сосудъ А наполняется
сухимъ амміакомъ и
плотно закрывается
пробкой, чрезъ
которую проходитъ трубка
I, запаянная на конц?
вн? сосуда; если, пе-
ревернувъ вверхъ
дномъ сосудъ -4,
опустить его трубку въ
воду сосуда В и
щипцами р отломить
запаянный конецъ
трубки, то вода изъ
сосуда В быстро
поднимается въ сосудъ А
и зд?сь начинаете бить
въ вид? фонтана, потому что первыя капли воды, по-
павшія въ сосудъ А, поглотятъ весь амміакъ: образуется
пустота, въ которую атмосферное давленіе съ силой и
вгоняетъ воду. При этомъ, если воду въ сосуд? В
подкрасить краснымъ лакмусомъ, то красный цв?тъ воды
изм?няется въ синій, а это указываетъ, что водный рас-
творъ NH3 им??тъ щелочныя свойства. Реакдія взаимо-
дЬйствія NH3 съ Н30 можетъ быть выражена въ слЬду-
ющемъ уравненіи:
NH8 + H80 = NH4OH.
Хгштескія свойства. Амміакъ въ присутствии воды
обладаетъ основными свойствами: соединяясь съ
кислотами, онъ образуетъ соли, въ которыхъ роль металла
играетъ сложная группа NH^1), не полученная въ свобод-
Рис. 67. Погдощ?ніе амміака водою.
*) Ш14—одновалентный положительный іонъ вс?хъ аммоніевыхъ
соединеній.
— 281 —
номъ состояніи. Напр., NH34-HC1=
= NH4C1; NHa + HN08 = NH4N08;
2NHs + HaS04 = (NH4)2S04. Метал-
лическія свойства группы аммонія
доказываете также существованіе
ея сплава со ртутью, называемаго
амальгамой (амальгамами
называются вообще вс? сплавы металловъ
со ртутью). Если къ амальгам?
натрія, приготовляемой внесеніемъ
натрія въ ртуть, прилить кр?пкаго
раствора хлористаго аммонія
(нашатыря), то натрій амальгамы съ хло-
ромъ нашатыря дастъ хлористый
натрій, а аммоній со ртутью обра-
зуетъ объемистую жирную наощупь
массу амальгамы аммонія:
Hg -f N Н4С1 = NaCl + NH4Hg.
Рис. 68. Гор?ніе амміака.
Амальгама эта очень непрочна
и разлагается на ртуть, амміакъ и водородъ.
Амміакъ способ?нъ гор?ть въ кислород?. Въ колб? А
(рис. 68) нагр?ваютъ кр?пкій растворъ амміака въ вод?.
Амміакъ, выд?ляющійся по труб? а, попадаетъ въ
широкое ламповое стекло Б, вь которое по трубк? Ъ
пропускается кислородъ. При этомъ гор?ніи получаются
вода и азотъ:
2NH8 + 0==3H,0 + 2N.
Въ почв? амміакъ можетъ окисляться кислородомъ
воздуха при сод?йствіи бактерій съ образованіемъ
азотной кислоты (HN03).—Магній сгораетъ въ NH3 съ
образованіемъ Mg3N2. При пропусканіи NH3 надъ нагр?тымъ
К (или Na) получается NH2K:2K + 2NH8 = 2NHaK+Ha;
NH2K (амидъ калія) не им?етъ характера соли; это —
твердое вещество металлическаго вида.
282
г
Составь амміака. Плотность амміака по отношенію
къ водороду—8,5; сл?довательно, в?съ частицы — 17.
Такъ какъ атомный в?съ азота—14, то въ частиц?
амміака его не можетъ быть бол?е одного атома, а осталь-
ныя три й?совыя части приходятся на водородъ. Такимъ
образомъ формула амміака—NH3.
Къ этой же формул? приводитъ и объемный анализъ,
основанный на д?йствіи
амміака на газообразный
хлоръ. Въ трубку съ кра-
номъ, разд?ленную на
три части равной емкости
(рис. 69), вводится хлоръ,
и туда же чрезъ кранъ
приливаютъ избытокъ
кр?пкаго воднаго
амміака. Происходитъ
энергичная реакція,
сопровождающаяся появленіемъ
пламени и образованіемъ
б?лыхъ тяжелыхъ паровъ
нашатыря. Реакція ид?тъ
сл?дующимъ образомъ:
сначала амміакъ реаги-
руетъ съ хлоромъ:
Л1-.
ішгііпгтп
Рис. 69, Объемный анализъ амміака.
NH3 + С1а = ЗНС1 + N,
а зат?мъ избытокъ амміака соединяется съ
образовавшейся соляной кислотой:
NH8 + HC1 = NH4C1.
г
Нашатырь NH4C1 растворяется въ вод?, а въ трубк?
остается только одно газообразное вещество—азотъ.
Чтобы опред?лить его объемъ, трубку ^оединяютъ
при помощи сифона съ сосудомъ, наполне*/нымъ под-
— 283 —
кисленной водой, которая и буд?тъ втягиваться, пока
данленіе внутри трубки не буд?тъ равно атмосферному.
Для приведенія къ одинаковой темп?ратур? трубка по-
м?щается въ цилиндръ съ водой той же температуры,
при которой производилось наполненіе хлоромъ. При
итомъ оказывается, что азотъ занимаетъ лишь г/3 часть
изятаго первоначально объема хлора.
Такъ какъ хлоръ соединяется съ водородомъ въ рав-
ііыхъ объемахъ, то изъ этого сл?дуетъ, что и объемъ
водорода долженъ быть втрое больше объема азота.
Наконецъ если черезъ сухой амміакъ въ эвдіометр?
пропускать рядъ электрическихъ искръ, то оиъ
разлагается на азотъ и водородъ, при чемъ взятый объемъ
газа увеличивается вдвое, что и отв?чаетъ уравненію:
2NH3= N2 + ЗН2
2 об. = 1 об.-f Зоб.
Въ продажу амміакъ поступаешь или водный, 24°—25°
Боме (уд. в. 0,91—0,903), содержащие амміака 26—28°/0,
или безводный—въ жел?зныхъ цилиндрахъ, и зд?сь онъ
почти химически чистый.
§ 98. Аммгачныя соли получаются, какъ сказано
выше, прямымъ соединеиіемъ амміака (газообразнаго или
воднаго) съ кислотами. Почти вс? он? хорошо
растворимы въ вод?, при нагр?ваніи легко улетучиваются, дис-
соціируя предварительно на NH3 и кислоту.
} На рис. 70 изображенъ приборъ, въ которомъ легко
показать диссодіадію, напр., NH4C1: чрезъ трубку Свхо-
дитъ по трубкамъ а и Ъ сухой воздухъ въ широкую
трубку Л; въ посл?дней находятся азбестовая пробка и
кусочекъ хлористаго аммонія; выходить воздухъ чрезъ
трубки d и Ъ\ соединенный съ пробирками, въ которыхъ
положены влажныя лакмусовыя бумажки—въ а' красныя,
а въ V синяя. При подогр?ваніи нашатыря происходить
его разложеніе на NH3 и НС1: первый, какъ бол?е лбг-
— 284 —
кій, быстро продиффундируетъ чрезъ азбестовую пробку
и окрасить красную лакмусовую бумажку въ синій цв?тъ,
а НС1 пойдетъ въ V и синюю бумажку сд?лаетъ красной. 1
Щелочи (NaOH, КОН, Са(ОН)2 и др.) легко выт?с-
няютъ NH3 изъ солей: этой реакціей пользуются для
открытія солей аммонія. Для той же ц?ли служить ре-
активъ Несслера1): если амміака много, то этотъ реактивъ
Рис. 70. Диссоціадія хлористаго аммонія.
даетъ красно-бурый осадокъ; если же амміака мало, то
получается только оранжевое окрашиваніе.
§ 99. Кром? амміака, азотъ съ водородомъ образуете
еще сл?дующія соединенія:
і) Реактивъ Несслера готовится такъ: 50 гр. KJ растворяютъ
въ 50 гр. горячей воды, приливаютъ къ нимъ 20 — 25 гр. кр?пкаго
горячаго раствора HgClg до т?хъ поръ, пока образующиеся осадокъ
іодной ртути не буд?тъ бол?е растворяться. Зат?мъ жидкости* филь-
труютъ и прибавляютъ къ фильтрату 150 гр. КОН, раствореннаго въ
300 к. с. воды, и 5 гр. сулемы въ раствор?; профильтровавъ,
прозрачный растворъ сохраняютъ въ закупоренной склянк?. Реакція
реактива Нессл?ра съ амміакомъ идетъ по сл?дующему уравненію:
Ш2 + 2[HgJ2 + 2KJ] + ЗКОН = 7KJ + 2Н20 + О < 5jj > NH*T.
- 285 —
1) іидразинъ—N2H4, безцв?тная жидкость, кипящая
при 113,5° и затверд?вающая при 1,4°; съ водою даетъ
основной гидратъ, а съ кислотами — соли; это сильный
восстановитель.
2) Азотистоводородпая кислота — N3H, безцв?тная
жидкость, кипящая при 37° съ очень непріятнымъ за-
пахомъ; это — взрывчатое вещество, въ растворахъ бо-
л?е постоянно; по химическимъ свойствамъ
N3H—сильная одноосновная кислота, н?сколько аналогичная га«
лоидоводороднымъ кислотамъ: соли ея очень взрывчаты.
Соединенія фосфора съ водородомъ: РН3, Р2Н4 и Р4Н2. >
і
Мол. в?съ РН3 = 34,03. Плотн. (возд. = 1) = 1,178. о/0-ый составъ: I
Р = 91Д20/0; Н = 8;80/0. Мол. в?съ Р2Н4^ 64,04. Уд. вЬсъ при
160 = 1,016. о/0_ый сост.: Р = 93,90/0, Н = 6Д0/0.
§ 100. Фосфоръ съ водородомъ даетъ три соединенія;
газообразный фосфористый водородъ—РН3, жидкій
фосфористый водородъ — Р2Н4 и твердый фосфористый
водородъ—Р4Н2. Изъ нихъ типичное и самое
прочное—первое, т.-е. РН3.
Газообразный фосфористый водородъ (РН3) можетъ
быть полученъ при д?йствіи на фосфоръ водородомъ въ
моментъ выд?ленія. Обыкновенно же получается нагр?-
ваніемъ желтаго фосфора съ кр?пкимъ растворомъ ?дкаго
кали или ?дкаго натра:
4Р -f 3NaOH л- ЗН20 = РН3 + 3P02H2Na
(Фосфорноватистонатро-
вая соль).
Опытъ ведутъ въ прибор?, изображенномъ на рис. 71.
Колбу а при этомъ насколько возможно наполняютъ
кр?пкимъ (1 ; 2) растворомъ ?дкаго натра; открытый
конецъ газоотводной трубки погружаюсь въ теплую воду,
— 286 —
чтобы увлекаемый парами фосфоръ не засаривалт> трубки.
Выд?ляющіеся пузырьки газа загораюіся на воздух?,
образуя б?лыя дымныя кольца. Самъ газообразный
фосфористый водородъ не загорается на воздухЬ, но къ нему
обыкновенно бываетъ прим?шано н?когорое количество
Рис. 71. Получені? фосфористаго водорода.
жздкаго фосфористаго водорода (Р2Н4), который,
воспламенясь самъ, воспламеняете и газообразный.
Точно такъ же РН3 можетъ быть полученъ при д?й-
ствіи соляной кислоты на фосфористый кальцій:
Са3Р2 + 6НС1 = ЗСаС12 -f 2PH3.
Свойства. Газообразный фосфористый (водородъ—это
безцв?тный газъ, непріятнаго запаха гнилой рыбы, н?-
сколько растворимъ въ спирт?; плотность его —17:
следовательно, частичный вЬсь = 34, а составъ—РН3. Онъ
— 287 —
ластываетъ при—133,5° и кипитъ при—85°,
воспламеняется при 100°. При нагр?ваніи и д?йствіи электриче-
скихъ искръ онъ разлагается на фосфоръ и водородъ;
на воздух? горитъ яркимъ шгамепемъ, выд?ляя б?лые
нары фосфорнаго ангидрида:
2РНа + 402--=ЗНяО+Р20Б-
См?шанный съ хлоромъ, онъ сильно взрываетъ,
образуя треххлористый фосфоръ и хлористый водородъ:
РН8 + ЗС18 = РС1а + ЗНС1.
Газообразный фосфористый водородъ, подобно амміаку,
соединявіся съ кислотами, образуя соли, при чемъ роль
металла играетъ группа фосфонія РН4. Щелочныя
свойства РН3 очень слабы, почему, соли его легко
разлагаются; РН3—хорошій возстановитель.
Газообразный фосфористый водородъ очень ядовитъ.
Жидкій фосфористый водородъ (Р2Н4) есть безцв?т-
ная жидкость, кипящая при * 57°, сильно преломляетъ
св?тъ; на воздух? загорается самъ собою, образуя
фосфорный ангидридъ и воду; легко разлагается на
газообразный и твердый фосфористый водородъ (Р4Н2).
Посл?дпій представляетъ собою желтый порошокъ, заго-
рающійся при 160° и отъ удара.
Въ природ?—при гніеніи содержащихъ фосфоръ орга-
ническихъ остатковъ—также образуются водородистыя
соединенія фосфора; ихъ воспламеняемостью объясняется
явленіе блуэюдающихъ огней, которые зам?чаются на
болотахъ и кладбищахъ.
Мышьяковистый водородъ, AsH3.
Молек. в?съ AsH3 = 78,03. Плотн. (возд. = 1) = 2,69. о/0-Ыц сост.:
As = 96,13%. Н=г:3?87.
§ 101. Мышьяковистый водородъ можетъ быть по-
лученъ д?йствіемъ водорода въ моментъ выд?леиія на
- 288 —
какое-нибудь мышьяковистое соединеніе, наприм?ръ, на
мышьяковистый ангидридъ:
As203 + 6Н2 = 2AsH3 + ЗЫ20.
Мышьяковистый водородъ—безцв?тный газъ, чесноч-
нато запаха, очень ядовитъ; плотность его по
водороду = 39; сл?довательно, в?съ молекулы = 78, что и
указываешь на формулу AsH3. При сильномъ охлажденіи
можетъ быть сгущенъ въ жидкость, кипящую при 55°
и затв?рд?вающую въ кристаллическую массу,
плавящуюся при—110°. Соединеніе это очень непрочное и при
д?йствіи тепла или электрическихъ искръ разлагается на
As и Н8; на воздух? горитъ синеватымъ пламенемъ,
образуя воду и мышьяковистый ангидридъ:
2AsH3 -f 302 = As203 + 4Н20.
По химическимъ свойствамъ мышьяковистый водородъ
отличается отъ NH3 и РН3 т?мъ, что онъ не соединяется
съ кислотами,—другими словами, не обладаешь
основными свойствами; онъ нейтраленъ.
Свойство водорода въ момеитъ его выд?ленія давать
съ мышьяковистыми соединеніями мышьяковистый
водородъ и непрочность посл?дияго позволяютъ открывать
мал?йшіе сл?ды мышьяка сл?дующимъ образомъ:
Для этого пользуются приборомъ Марша. Въ склянк? d
(рис. 72) д?йствіемъ с?рной кислоты на зерненый цинкъ
выд?ляется водородъ^ Чрезъ трубку съ воронкой вли-
ваютъ растворъ испытуемаго мышьяковистаго соединенія.
Выд?ляющійся газъ, см?сь водорода съ мышьяковистьшъ
водородомъ, высушивается въ трубк? с съ хлористымъ
кальціемъ и проводится чрезъ стеклянную трубку d,
оттянутую м?стами. Если зажечь водородъ, то въ присут-
ствіи AsH3 онъ горитъ синеватымъ пламенемъ, выд?ляя
б?лые пары (As203); если въ это пламя ввести холодный
предмета, то онъ покрывается пятнами не усп?вающаго
сгорать металлическаго мышьяка. Если стеклянную трубку
— 289 —
Рис. 72. Приборъ Марша для получения мышьяковистаго водорода.
d накаливать, то мышьяковистый водородъ разлагается,
и въ оттянутой части трубки отлагается мышьятсъ въ
вид? металлическаго налета, образующего зеркальную
поверхность, легко перем?щающагося съ м?ста на м?сто
отъ нагр?ванія, и растворимаго (всл?дствіе окисленія) въ
хлорноватистомъ натр? (NaOCl).
Сурьмянистый водородъ, SbH3.
Мол.в?съ SbH3—123,22. о/0-ный составъ: Sb = 97,55<>/0, Н = 2,45о/0.
§ 102. Сурьмянистый водородъ получается т?мъ же
способомъ, какъ и мышьяковистый (т.-е. при д?йствіи
водорода въ моментъ выд?ленія на соединения сурьмы),
и представляетъ съ нимъ большое сходство: на воздух?
въ см?си съ водородомъ сгораетъ бл?дно-голубоватьшъ
пламенемъ въ окись сурьмы (Sb203) и воду, а при нака-
ливаніи разлагается на элементы (Sb и Н). Зеркало
Неорганическая хинія. 19
— 290 —
сурьмы, получаемое въ прибор? Марша, отличается отъ
мышьяковистаго бол?е чернымъ цв?томъ, бол?е трудною
летучестью и нерастворимостью въ хлорноватистонатріе-
вой соли (NaOCl). Химически SbH3 нейтралеиъ.
г
Задачи: 1) Сколько надо взять воздуха, чтобы изъ его азота
получить 17 гр. амміака?
2) Сколько надо взять гашеной извести для иолученія
амміака изъ 63,5 гр. нашатыря?
3) Скблько мышьяка и сурьмы получится изъ одного
литра AsH3 и 1 литра SbH3?
Группа углерода (IV группа).
§ 103. Къ групп? углерода (IV) принадлежать
элементы: углеродъ (С), кремній (Si), германій (Ge) олово
(Sn) и свинецъ (РЬ). Настоящее металлоиды изъ нихъ
только два первые, т,-е. углеродъ и кремній. Четвертая
группа является посл?дпей металлоидной группой, сл?-
довательно, самой слабой въ отношеніи металлоидное™,
а потому и неудивительно, что число металлоидовъ зд?сь
сократилось до двухъ, количество же металловъ возросло
до трехъ (Ge, Sn и РЬ). Вс? элементы 4-й группы им?-
ютъ то общее свойство, что они въ тахітиш'?
четырехвалентны по кислороду, т.-е. высшая форма окисла ихъ
Е02; характерно также и то, что вс? они, кром? крем-
нія, им?ютъ еще окиселъ формулы RO, т.-е. являются
въ этомъ окисл? только двухвалентными. Кислородный со-
единенія типа R02 вс? слабокислотны; кислота, ему
отв?чающая, им?етъ формулу H2R03[R(OH)4—Н20].
Съ водородомъ углеродъ и кремній даютъ типичныя
соединенія RH4, т.-е. по водороду они тоже
четырехвалентны. Эти водородный соединенія по своимъ химиче-
скимъ свойствамъ нейтральны.
Изъ нижесл?дующей таблички видно, что, подобно
предыдущимъ группамъ, и зд?сь параллельно изм?неніямъ
атомнаго в?са изм?няются свойства элементов!».
— 291 —
Ат. в. Уд. в. Темп. ил. Физическое состояние.
/ Аморф. до 2,35
С 12 1 Графитъ 1,8—2,25 ок. 2.700°? твердое т?ло чернаго цв?та
\ Алмазъ 3—3,5
уі 28,3 2,49 ок. 1.300°? или аморфный или
кристаллически! съ металлическимъ
блескомъ»
Ge 72,5 5,47 при 30° ок. 900° с?роватоб?лый м?таллъ.
Sn 119 7,29 233° серебристый »
РЬ 207,10 11,39 334° синеватос?рый >
Разности между атомными в?сами сос?днихъ элемен-
товъ т? же, что и въ предыдущихъ группахъ: между
С и Si= 16, между Si и Ge = 44, между Ge и Sn —46,
а между Sn и РЬ = 88 (т.-е. 44X2).
Съ повышеніемъ атомнаго в?са элементы становятся
все плотн?е и плотн?е, по вн?шнему виду—все бол?е и
бол?е металлическими.
Съ химической стороны съ увеличені?мъ атомнаго
в?са и зд?сь падаетъ у элементовъ сродство къ
металлами а къ металлоидамъ повышается.
Углеродъ и кремній ]) играютъ въ жизни природы
очень важную роль. Эти два элемента какъ бы под?лили
всю природу между собою: въ мертвой неорганизованной
природ? царитъ кремній, безъ углерода же немыслимъ
никакой живой организмъ: вс? растительные и животные
организмы, какъ бы они малы или велики ни были,
обязательно содержатъ въ себ? углеродистый соединенія.
Углеродъ, С.
^»*
Атомн. в. С = 12. Изв?стны три главныхъ видоизм^ненія: алмазъ,
графитъ и аморфн. уголь.
§ 104. Углеродъ очень распространен!, въ природ?
какъ въ свободномъ состояніи—въ вид? разнообразныхъ
формъ аморфнаго угля, графита и алмаза, такъ и въ
*) Держась принятаго плана, мы пока разсмотримъ только
металлоиды, т.-?. углеродъ и кремній, a Ge, Sn и РЬ будутъ разсмотр?ны
при м?таллахъ.
19*
— 292 —
вид? со?дшгеній, какъ, наприм?ръ, въ со?дин?ніи съ
водородомъ онъ образуетъ рядъ в?ществъ, составляющихъ
нефть; въ соединенш съ кислородомъ—углекислый газъ,
находящейся въ воздух? и входящій въ составь многихъ
горныхъ^ породъ, наприм?ръ, м?ла, мрамора, известня-
ковъ и проч. Ткани растеній и животныхъ состоятъ изъ
углеродистыхъ соединеніи. Доказать это легко: стоитъ
только нагр?ть любую ткань до высокой температуры,
какъ она обуглится.
Если жечь дерево при н?достаточномъ приток?
кислорода воздуха, то получается аморфный уголь. Въ при-
род? происходить постепенно подобный же процессъ из-
м?ненія растительныхъ организмовъ и приводитъ къ
образованно залежей торфа, бурыхъ углей, каменныхъ углей
и антрацита. Остатки деревьевъ, в?тви, листья, падая
на дно водныхъ бассейновъ, подвергаются процессу гніе-
нія въ отсутствіи воздуха и слеживаются въ плотную
массу, въ которой иногда ясно зам?тяы остатки растеній.
Эта масса, высушенная, а иногда и спрессованная,
употребляется какъ топливо, подъ названіемъ торфа (сод.
С около 60%)- Дальн?йшее уплотненіе древесной массы,
сопровождаемое дальн?йшимъ разложеніемъ
органический, веществъ, даетъ бурый уголь (сод. С. около 67%).
Каменный уголь (существуетъ много сортовъ его)
есть тоже изм?нившіяся растенія, но еще бол?е давняго
происхожденія, ч?мъ бурый уголь; содержаніе С
колеблется въ каменныхъ угляхъ около 85°/о- Наибол?е же
чистый изъ ископаемыхъ углей—антрацитпь—содержитъ
С до 94—95% и бол?е і).
Самый чистый аморфный уголь есть сажа; въ техник?
она получается обугливаніемъ смолъ и скипидара: если
растворить какую-нибудь смолу въ скипидар? и зажечь
*) Вотъ сравнительная табличка состава кл?тчатки и различ-
ныхъ стадій ея разложеяія, при которомъ выд?ляются С02 и СН4, а
остающаяся масса становится все бол?е богатой углеродомъ и все
бол?е б?дной водородомъ и кислородомъ:
— 293 —
этотъ растворъ подъ колоколомъ, то выд?ля?тся
При прокаливаніи каменнаго угля без'ъ доступа воздуха *)
получается коксъ. Въ Россіи залежами каменнаго угля
богатъ Донецкій бассейнъ. Наибол?е богата имъ Англія,
Графить есть особое видоизм?неніе углерода, среднее
между аморфнымъ углемъ и кристаллическимъ алмазомъ.
Въ вид? залежей онъ встр?чается и въ Россіи, напри-
м?ръ, въ Алтайскихъ горахъ; онъ встр?чается въ самыхъ
древнихъ породахъ, найденъ и въ метеоритахъ 2). Гра-
фитъ представляетъ собою черное, иногда
кристаллическое вещество съ металлическимъ блескомъ, неплавкое
и нелетучее, стальнос?раго дв?та; легко проводитъ
теплоту и электричество. Графитъ мягокъ, оставляетъ на
бумаг? черту, почему и употребляется для изготовленія
карандашей3). Слоемъ графита покрываютъ жел?зные
сосуды для предохраненія ихъ отъ ржавленія.
Уд?льный в?съ его м?няется отъ 1,8 до 2,25. При
силъномъ накаливаніи въ кислород? онъ сгораетъ, обра-
Кд?тчатка . . .
Торфъ
Бурый уголь . .
Каменный уголь .
Алтрацитъ . . .
Древесный уголь.
Углерода.
45,0
60,0
70,0
82,0
94,0
95,0
Процентный
Водорода.
6,0
5,9
5,8
5,8
3,4
1,7
Кислорода.
48,0
32,0
24,0
12,0
3,0
3,4
зоставъ:
Золы.
1,5
5—20
3—30
1—15
1,5
4,0
Теплота го-
р?нія одного
грамма въ
Воды, калоріяхъ.
18—20 2700
20—30 3500
15 до 6000
4 » 8000
2 » 8000
6,5 » 8080
*) Такой процессъ и производится въ огромныхъ разм?рахъ при
добываніи св?тильнаго газа.
2) Въ настоящее время графитъ получается и искусственно—при
пропусканіи сильнаго перем?ннаго тока чрезъ з?рненый антрацитъ.
3) Для приготовленія карандашей растираютъ графитъ въ тонкій
порошокъ и прибавляютъ какихъ-нибудь связывающихъ веществъ,
напр., глины; зат?мъ придаютъ форму палочекъ и слегка обжигаютъ;
отъ количества прибавленкаго цемента зависать твердость
карандашей. Подобнымъ же образомъ, т.-е. изъ графита и цемента, д?лаются
огнеупорные плавильные тигли.
— 294 —
зуя С02. Графить, равно какъ и аморфный уголь, не-
растворимъ въ обычныхъ растворителяхъ
Графить получается и изъ обыкновенная угля: если
накаливагь жел?зо съ углемъ, то уголь въ жел?з?
растворяется и получается то, что зовуіъ чугуномъ. При обра-
ботк? же чугуна соляной кислотой уголь, не соединенный
съ жел?зомъ химически, выпадаетъ въ вид? ірафита.
Алмазъ — это также углеродъ, только въ кристалли-
ческомъ состояніи, съ уд. в 3—3,5. Въ природЬ онъ
найденъ въ розсыпяхъ на остров? Борнео, въ Бразиліи,
въ Остъ-Индіи, Трансвааль и др. Онъ облада?тъ силь-
нымъ блескомъ и лучепреломленіемъ Превосходить всЬ
т?ла своею твердостью. Въ кислородЬ при сильномъ
накаливанш сюраетъ въ углекислоту (С02); такъ какъ
другихъ продуктовъ при гор?ши алмаза не получается,
то несомн?нно, что онъ есть чистый углеродъ
Алмазъ, подобно графиту, нерастворимъ въ обычныхъ
растворителяхъ. Шлифованные алмазы называются
брильянтами.
(Въ посл?дніе годы были попытки искусственна! о по-
лученія алмазовъ. Французскій химикъ Муассанъ въ своей
Рис 73 Продольный разр?зъ печи Муассана.
электрической печи (см. рис. 73—74), температура въ
которой доходить до 3.500°, расплавлялъ жел?зо и раство-
рялъ въ немъ уголь. Зат?мъ расплавленная масса
подвергалась быстрому охлажденпо въ холодной вод?. Посл?
обработки чугуна царской водкой уголь выпадалъ въ
вид? меткихъ кр\пинокъ, обладавгпихь свойствами алмаза
- 295
Печь Муассана состоитъ изъ двухъ огнеупорныхъ
известковыхъ кирпичей: въ нижнемъ кирпич? им?ется
углубленіе, въ которое ставится графитовый тигель съ
испытуемымъ веществомъ, а верхній кирпичъ служить
крышкой. Къ углубленію проведены угольные электроды.
Все это можно вид?ть на рис. 73, представляющемъ
разр?зъ печи.
Когда электроды сближены, появляется сильный св?тъ
и пламя (рис. 74).
Рис. 74. П?чь Муассана въ д?йствіи.
Изъ предыдущаго видно, что какъ аморфный уголь.
такъ и графитъ и алмазъ суть видоизм?ненія одного и
того же элемента — углерода. Въ самомъ д?л?, вс? они
могутъ быть превращены другъ въ друга, вс? они при
сгораніи даютъ одно и то же вещество — углекислый
газъ (С02). Сл?довательно, это суть аллотропическія
видоизм?ненія углерода. Причину ихъ различія, по аналогіи
съ ран?е встр?тившимися намъ подобными же явлениями
(у О, S. Р и др.), можно объяснить различнымъ числомъ
атомовъ, образующихъ ихъ частицы. ОпредЬленіе точнаго
— 296 —
числа атомовъ въ частиц? угля пока невозможно; в?-
роятно, оно довольно велико. Есть данныя, указывающая,
что оно не мен?е 12 атомовъ. Потому-то, конечно, уголь
яри своем;* маломъ атомномъ в?с? и оказывается твер-
дымъ, очень устойчивымъ веществомъ, нерастворимымъ
въ обычныхъ растворителяхъ.1
Свойства. Уголь при обыкновенныхъ условіяхъ
соединяется только съ фторомъ. Взаимод?йствіе угля съ
другими элементами можно вызвать лишь при повыщеніи
температуры: при накаливаніи на воздух? онъ образуетъ
съ кислородомъ соединеніе С02, неправильно называемое
угольной кислотой. При повышенной температур? уголь
можетъ отнимать кислородъ даже отъ соединеній („воз-
становлять"), почему и прим?няется въ металлургіи для
выплавки металловъ изъ окисловъ. При температур?
вольтовой дуги уголь съ металлами соединяется, образуя
такъ называемые карбиды, наприм?ръ, карбидъ кальція
(СаС2)а) и др.; въ этихъ условіяхъ онъ соединяется и съ
водородомъ, образуя ацетиленъ (СаНа). Въ паръ уголь
былъ обращенъ только въ печи Муассана.
Индифферентность его, в?роятно, также объясняется большой
сложностью частицы.
Значеніе угля въ жизни природы велико: имъ
пользуются (при гор?ніи) для полученія тепловой энергіи.
Посл? солнца уголь—самый важный источникъ теплоты.
Онъ представляетъ складъ солнечной энергіи. При
помощи угля жел?зо превращается въ чугунъ и сталь (см.
при жел?з?). Углемъ же пользуются, какъ упомянуто
выше, при выплавк? многихъ металловъ изъ рудъ.
Уголь въ вид? сажи прим?няется для приготовленія
черной краски, ваксы и др. Газовый уголь (коксъ),
благодаря своей электропроводности, прим?няется въ техник?.
Древесный уголь идетъ для приготовленія чернаго по-
*) СаС2 можно получить при сжяганіи стружекъ кальція на угл?
часть кальція при этомъ сгораетъ, часть ж? соединяется съ углемъ:
Ca-f 2C = CaC2.
— 297 —
роха. Костяной уголь, получаемый обжиганіемъ костей
безъ доступа воздуха и посл?дующей обработкой соляной
кислотой для удаленія солей фосфорной и угольной
кислотъ, дрим?яяется въ водяныхъ фильтрахъ, такъ какъ
онъ хорошо поглощаетъ (адсорбція) красящія вещества,
пахучіе газы и вредныя соли свинца; на сахарныхъ
заводахъ онъ прим?няется для обезцв?чиванія
сахарныхъ растворовъ. Прим?ненія графита и алмаза изв?стны
вс?мъ.
К р е га н і й, Si. I
Атомн. в?съ Si —28,3. Уд.в?съ (вода^ 1) = 2,39. Те|ш. плавл. 1.200°.
§ 105. Какъ углеродъ есть главная составная часть
растительныхъ и животныхъ веществъ, такъ кремній
является составной частью большинства, зтлмстыхъ и
въ особенности горыыхъ образованій земной коры, на-
прим?ръ, гранитныхъ породъ. Кремній находится въ при-
род? только въ вид? соединений, наприм?ръ, съ кисло-
родомъ, образуя кварцъ, горный хрусталь, опалъ,
кремень и обыкновенный песокъ; а въ особенности онъ
распространенъ въ вид? такъ называемыхъ силикатовъ г).
Въ чистомъ вид? кремній получается при накалива-
ніи см?си м?лкоистертаго песка (Si02) съ порошкомъ
металлическаго магнія:
SiO, + 2Mg = 2MgO-f Si.
Полученную массу обрабатываютъ соляною кислотой,
которая растворяетъ магнезію MgO, а кремній остается
въ вид? бураго аморфнаго порошка.
Кром? аморфнаго кремнія, изв?стенъ еще пристал-
лическгй: если аморфный кремній растворить въ рас-
і) Силикатами называются соли кремневой кислоты.
— 298 —
плавленномъ цинк? и зат?мъ охлажденную массу
обработать соляной кислотой, то и получится кристаллическій
кремній въ вид? с?ростальныхъ, сильно блестящихъ
кристалловъ, уд?льнаго в?са 2,49. Аморфный кремній
при силіномъ накаливаніи горитъ въ воздух?, образуя
кремневый ангидридъ (Si02); кристаллическій же въ
этихъ условіяхъ не горитъ,
Кремній при обыкновенной температур? соединяется
только съ фторомъ, а при повышенной температур? онъ
соединяется и съ хлоромъ, и съ бромомъ, и съ азотомъ,
и съ н?которыми металлами; существуете соедииеніе и
съ углеродомъ (см. дал?е „Карборундъ"). Изъ кислотъ
на него д?йствуетъ только см?сь плавиковой съ азотной.
Въ кр?пкихъ растворахъ ?дкаго кали или натра кремній
растворяется съ выд?леніемъ водорода:
Si + 2КОН + Н20 = K2Si03 + 2Н2.
Аморфный кремній вообще отличается большей
энергіей, ч?мт, кристаллическій. . s
Соединен» металлоидовъ группы углерода съ водо-
родомъ.
§ 106. Углеродъ и кремній даютъ съ водородомъ
соединенія типа RH4.
Углеродъ съ водородомъ, кром? отв?чающаго этой
формул? метана СЫ4, образуетъ еще очень много дру-
гихъ соединеній, называемыхъ углеводородами; посл?днія
ближе разсматриваются въ органической химіи. Прямое
соединеніе углерода съ водородомъ возможно только при
д?йствіи вольтовой дуги, при чемъ получается ацети-
ленъ.
Кремній непосредственно съ водородомъ не
соединяется.
— 299 —
Соединенія углерода съ водородомъ*
I. М е т а н ъ, СН4.
Мол?к в?съ СНі = 16,03. Плотн. (возд. — 1) = 0,559. о/0-ый составъ
С = 74,870/0. Н = 25,13%.
§ 107. Иолученіе. Метанъ въ природ? образуется при
гніеніи органическихъ веществъ безъ доступа воздуха,
наприм?ръ, на дн? болотъ (отчего онъ и называется „бо-
лотньшъ" газомъ). Онъ находится въ большихъ количе-
ствахъ въ м?стностяхъ, богатыхъ залежами каменнаго
угля („рудничный газъ") и нефти, гд? выходитъ на
поверхность земли и можетъ быть зажженъ. Искусственно
онъ получается вм?ст? съ другими углеводородами при
добываніи св?тильнаго газа, т.-е. при накаливаніи
каменнаго угля безъ доступа воздуха (метана отъ 30
ДО 40%). *
Чистый СН4 получаютъ 2), дакаливая см?сь уксусно-
натріевой соли и ?дкаго натра:
C2H302Na -f NaOH = Na2C03 + СН4.
Свойства. Метанъ — безцв?тный газъ безъ запаха и
вкуса, въ вод? нерастворимъ; зажженный на воздух? онъ
сгораетъ въ углекислоту и воду: СН4 -\- 202 = С02 -f-
-|-2Н20. См?сь его съ воздухомъ взрываетъ, почему при-
еутствіе его въ каменноугольныхъ копяхъ крайне опасно.
Плотность его (Н —1) = 8; сл?д., мол. в?съ СН4(М =
= 2d)=16, откуда легко вывести составъ СН4. Метанъ
не способенъ къ реакдіямъ соединенія, а только къ
реакціямъ зам?щенія, т.-е. водородные атомы его можно
*) Бертло получидъ СН4 при пропусканіи см?си с?роводорода и
паровъ с?роуглерода (CSa) чрезъ раскаленную м?дь: 2H2S -+- CS2 +
+ 4Cu — CH4 4~ 4CuS. Этотъ синтезъ интер?сенъ т?мъ, что можно
исходить изъ элементовъ (Н, S, С и Си) и получить сначала прямымъ
соединеніемъ H2S и CS9 и зат?мъ вести вышеуказанную реакцію.
— 300 —
зам?нить атомами другихъ элементовъ, напр., галоидовъ.
Метанъ не им?етъ ни основныхъ ни кислотныхъ свойствъ;
онъ нейтраленъ.
II. 3 т и л е н ъ, С2Н4.
Молекул, в?съ С2Н4 —28,03. Плотн. (возд.— 1) = 0,976. «/„-ъгё
составь: С = 85,63о/0; Н = Н,37«/0.
§ 108. ііолученіе. Этиленъ находится въ св?тильномъ
п*з?. Въ чистомъ вид? онъ получается отнятіемъ
элементовъ воды отъ виннаго спирта при д?йствіи на него
кр?пкой с?рной кислоты:
СяНвО-Н80 = С8Н4.
Свойства. Этиленъ — безцв?тный газъ, обладающій
слабымъ э?ирнымъ запахомъ; зажженный на воздух? онъ
горитъ св?тящмся. пдамехшмъ по сл?д. -уравненію;
С2Н4 + 302 = 2С02 -f 2Н20; съ воздухомъ образуешь
взрывчатую см?сь.
При 0° и 45 атмосферахъ давленія этиленъ сгущается
въ прозрачную жидкость, кипящую подъ обыкновеннымъ
давленіемъ при—103°, а при уменьшенномъ при—150°.
Употребляется для охлажденія при сжиженіи газовъ.
Этиленъ можетъ прямо соединяться съ двумя атомами
галоидовъ, напр., съ двумя атомами брома даетъ
бромистый этиленъ:
СаН4 + 2Вг=СяН4Вгг
III. Ацетилен ъ, С2Н2.
Молек. в?съ С2Н2 = 26,02. Плотн. (возд. = 1) = 0,92. %-ый состав*
С = 92,31°/0; Н^7,690/0.
§ 109. Получете. Ацетиленъ можетъ быть полученъ
прямымъ соединеніемъ углерода съ водородомъ при
образовали вольтовой дуги въ атмосфер? водорода. Онъ
получается также при неполномъ сгораніи св?тильнаго газа.
- 301 -
Въ болыпихъ количествахъ его получаютъ при д?й-
ствіи воды на кальцій-карбидъ СаС2:
СаС2 + 2Н20 = Са(ОН)2.+ С2Н2.
Реакдія идетъ съ выд?леніемъ тепла очень бурно, а
потому вести ее сл?дуетъ при охлажденіи.
Свойства. Ацетиленъ—безцв?тный газъ съ характер-
нымъ запахомъ св?тильнаго газа. Можетъ быть сгущенъ
при 0° и 21,5 атмосферахъ давленія въ безцв?тную
жидкость уд?льнаго в?са 0,45. На воздух? горитъ сильно
коптящимъ св?тлымъ пламенемъ: С2Н2 -\- 50 = 2С02 -f-
-f- Н20; съ кислородомъ образуетъ взрывчатую см?сь.
Употребляется для осв?щенія.
Одна часть ацетилена можетъ присоединить одну или
Дв? частицы галоида:
С2Н2+- Вг2 = С2Н2Вг2.
С2Н2 + 2Вг2 = С2Н2Вг4.
Ацетиленъ съ солями закиси м?ди и окиси серебра
образуетъ осадки: съ м?дью—красный, а съ серебромъ—
желтоватый. Ацетиленистая м?дь и ацетиленистое
серебро разлагаются при удар? со взрывомъ; при д?йствіи
же на нихъ кислотъ вновь выд?ляется ацетиленъ.
Кремнистый водородъ, SiH4.
Молек. в?съ SiH4—32,33. о/0-ыи составь Si — 87,55о/0; Н=12,45<у0.
§ ПО. Аналогично метану (СН4), кремній съ водо-
родомъ образуетъ SiH4. Получается онъ при д?йствіи
соляной кислоты на сплавъ кремнія съ магні?мъ;
SiMg2 -f 4НС1 = 2MgCl2 + SiH4;
это—безцв?тный газъ, воспламеняющійся х) на воздух? и
сгорающій въ кремневый ангидридъ и воду:
SiH4 + 202 = Si02 + 2H20.
J) SiH$ воспламеняется, благодаря прим?си къ нему жидкаго SiaHe.
- 302 -
По химическимъ свойствамъ SiH4 н?йтраленъ,
подобно СН4.
Кремнистымъ водородомъ заканчивается описаніе
вс?хъ главн?йшихъ водородныхъ соединеній металлоидовъ.
Для сравненія приведемъ ихъ въ сл?д, таблиц?:
Водородныя соединенія металлоидовъ:
Химич. св. ¦
Формулы
Химич. ев
сн4
— 1620
Нейтр.
SiH4
?
Нейтр.
¦
__
NH3
— 38,50
Щелочи.
РН3
— 850
Щелочи.
AsH3
— 54,80
Нейтр.
SbH3
— 170
Н?йтр.
он2
4-ЮОО
Нейтр.
SH2
— 61,60
Кислотн.
SeH2
— 420
Кислотн.
ТеН2
?
Кислотн.
FH
+ 19,50
Кислотн.
СШ
— 83,10
Кислотн.
ВгН
— 68,10
Кислотн.
JH
— 36,7о
Кислотн.
— 303 —
Гор?ніе. Пламя.
§ 111. Всякое химическое соединеніе, сопровождаемое
выд?леніемъ тепла и св?та, называется гор?ніезяъ. Одни
т?ла при гор?ніи даютъ яркое св?тящееся пламя, дру-
гія—совс?мъ безцв?тное. Пламя св?чи (рис» 75), им?ющее
форму конуса, состоитъ изъ трехъ частей: внутренняго
темнаго конуса аа', зат?мъ самой св?тлой части пламени
efg и снаружи вновь темнаго конуса bed. Если внести быстро
въ пламя спичку такъ, чтобы головка ея
находилась во внутреннемъ темномъ конус? аа!,
то спичка загорится въ той своей части,
которая находится во вн?шнемъ темномъ
конус? bed) головка же спички не будетъ
гор?ть. Сл?довательно, въ наружной,
соприкасающейся съ воздухомъ, части
пламени существуетъ наибол?е высокая
температура, во внутреннемъ же конус?
температура низка. Можно положить во внутреннюю
часть пламени порохъ, и онъ не будетъ „
, ^ J Рис. 75. Строе-
воспламеняться 2). ніе пламени.
Если внести во внутреннюю темную часть
аа' пламени св?чи трубочку, то по ней начнут^
подниматься пары, которые можно зажечь на другомъ конд?
трубки. Это показываетъ, что во внутренней темной части
пламени находится обращенное въ парообразное состояніе
вещество св?чи. Изсл?дуемъ теперь самую св?тлую часть
пламени. Внесемъ въ нее какой-нибудь б?лый холодный
предметы фарфоровую крышечку, листъ б?лой бумаги
!) Приблизительная средняя температура пламени различныхъ
гор?локъ:
Обыкновенная спиртовая лампа 900°—1000°
Газовая гор?лка съ безцв?тнымъ пламенемъ 1200*>—13000
Паяльная газовая гор?лка 1500°—1600*>
— 304 —
и т. п.; тотчасъ фарфоровая крышка покрывается нале-
томъ сажи. Значить, вещество св?чи зд?сь находится
уже разложившимся на составныя части. Въ самой
вн?шней части пламени вещество св?чи, перем?шиваясь
насколько^зозможно съ кислородомъ воздуха, соединяется
съ нимъ, т.-е. горитъ выд?ляя тепло. Подъ вліяніемъ
этой теплоты вещество св?чи расплавляется, поднимается
по св?тильн?, превращается въ паръ, подвигаясь все
ближе и ближе къ наружной поверхности пламени,
подвергаясь большему д?йствію тепла, разлагается, при
этомъ твердая составныя части раскаляются и
начинаюсь св?титься, и, наконецъ, во вн?шней части пламени
происходить полное соединеніе вещества св?чи съ
кислородомъ воздуха.
Что св?чені? зависитъ отъ присутствія въ пламени
твердыхъ веществъ, можетъ быть доказано также и т?мъ,
что гор?ніе, наприм?ръ, фосфора въ кислород?
сопровождается осл?пительнымъ св?томъ,такъ какъ образующееся
при этомъ вещество, фосфорный ангидридъ, Р205, —
твердое т?ло, а при гор?ніи водорода въ кислород? пламя
безцв?тно, хотя температура пламени и выше, но водо-
родъ, кислородъ и вода при этой температур?
газообразны. Можно и пламя водорода сд?лать св?тящимся
посредствомъ такъ наз. карбурнрованія. Для этого струю
водорода, прежде ч?мъ зажечь, пропускаюсь сквозь
пары, напр., бензола С6Н6. Бензолъ, увлекаемый водоро-
домъ, при гор?ніи разлагается на составныя части, и
выд?ляющійся углеродъ, раскаляясь, начинаетъ св?титься.
Св?тильный газъ горитъ св?тящимъ и коптящимъ
пламенемъ, что въ болынинств? случаевъ неудобно въ
лабораторіяхъ. Но, вводя въ св?тящееся пламя избытокъ
воздуха или кислорода въ количеств?, требуемомъ для
сожиганія всего углерода, получаютъ несв?тящееся
пламя, обладающее гораздо высшей температурой, всл?д-
ствіе большей полноты химическаго соединенія. На этомъ
- 305 —
основано устройство газовой гор?лки Бунзена *),
употребляемой въ лабораторіяхъ для нагр?ванія и накаливаиія.
Св?тилышй газъ, выходящій изъ тонкаго отверстія г
(рис. 76), см?шивается въ привицченной трубк? f съ
Рис. 76. Бунзеновская гор?лка.
воздухомъ, входящимъ въ нее чрезъ боковыя отверстія п, и
горитъ надъ верхнимъ отверстіемъ гор?лки бл?днымъ
пламепемъ. Закрывая отверстія п клапаномъ а, умень-
*) Въ гор?лк? Ауэра накаливается въ пламени газа
конусовидная с?тка (чулокъ), которая приготовляется такъ: тонкая тюлевая
ткань пропитывается растворомъ азотнокислыхъ солей церія и торія
и обжигается на гор?лк?, при чемъ ткань сгораетъ, а зола (окислы
церія и торія) образуетъ с?тку.
Неорганическая химія. 20
— 306 —
шаютъ притокъ воздуха и получаютъ св?тящ?еся
коптящее пламя. Бл?дное пламя, заключая избытокъ
кислорода, д?йствуетъ окисляющимъ образомъ и называется
окислительнымг. Св?тящееся же пламя, заключая въ
себ? частички раскал?ннаго угля, д?йствуетъ возстано-
влякодимъ образомъ, потому что накаленный уголь им?-
етъ способность отнимать киелородъ отъ многихъ соеди-
неній; такое пламя называется ?озстановительпымъ.
Для т?хъ же самыхъ ц?леи прим?няется и
обыкновенная паяльная трубка.
Какъ уже было указано, газы, входящіе въ составъ
св?тильнаго газа, могутъ съ воздухомъ образовать взрыв-
чатыя см?си, что д?лаетъ опаснымъ присутствіе ихъ
въ атмосфер? каменноугольныхъ копей. Для изб?жанія
взрывовъ въ копяхъ употребляютъ предохранительную
лампу Дэви. Устройство ея будетъ понятно изъ сл?ду-
ющаго. Изв?стцо, что для гор?вія вещества необходима
опред?ленная температура, пониженіе ея прекращаешь
гор?ніе. Если, напр., надъ отверсті?мъ
газовой гор?лки, изъ которой выте-
каетъ газъ, держать металлическую
с?тку, зажигая газъ надъ с?ткой, то
с?тка настолько много поглощаетъ
тепла, что процеесъ гор?нія подъ
с?ткой становится невозможиымъ.
Поднимая с?тку, можно вполн? снимать
Рис. 77. Пламя, и тушить пламя (рис. 77). На этомъ
снятое съ гор?лки , тг ^
с?ткоё. принцил? устроена и лампа Дэви. Она
состоитъ изъ обыкновенной масляной
лампы, пламя которой окружено цилиндромъ изъ
металлической с?тки (рис. 78 и 79). Если такую лампу внести
во взрывчатую см?сь или горючій газъ, то газъ, прони-
кающій въ цилиндръ, сгораетъ внутри его съ
небольшими взрывами, которые тушатъ лампу. Пламя изъ
лампы не передается чрезъ с?тку наружу, такъ что
окружающая лампу взрывчатая см?сь не воспламеняется.
— 307 —
Рис. 78. Рис. 79.
Лампа Дэви.
Соединенія металлоидовъ между собою.
§ 112. Первое м?сто среди соединеній металлоидовъ
между собою по важности занимають соединенія сь
кислородомъ. Элементы въ настоящемъ случа? будутъ
расположены также въ порядкЬ возрастающей
валентности, но теперь уже но отношенію къ металлоидамъ,
въ частности — по отношенію къ кислороду. Порядокъ
этоть будетъ какъ разь обратный предыдущему, т.-е.
придется итти отъ 4-и группы къ 7-й.
Чтобы въ дальн?йшемъ изложеніи не было неясностей
относительно общаго характера соединеній металлоидовъ
съ металлоидами, необходимо здесь точно установить его.
Окислы. Металлоиды съ кислородомъ образуютъ сл?-
дующіе типичные окислы: въ 4-й групн? R02 (и RO),
къ 5-й—В205 (и К203), въ 6-й—Е03 (и К02), въ 7-й—
R207 и др. Какъ видно изъ формъ окисловъ, поставлен-
ныхъ въ скобки, металлоиды, кром? высшихъ окисловъ,
характеризующихъ ихъ высшую валентность, могутъ обра-
20*
— 308 -
зовать и низшіе окислы, въ которыхъ проявляется не
вся валентность *).
Вс? окислы металлоидовъ, за немногими исключе-
ніями, кислотнаго (или, что то же, акгидриднаго)
характера, т.-е. съ водою даютъ кислоты 2), такъ:
въ 4-й групп? R02 + H20 = H2R03
„ 5-й „ R205 + 3H20 = 2H3R04 и R203 -f
4- 3H20 = 2H3R03
„ 6-й „ R03 + Ho0 = H,R04 и R02 + H20 =
= H2R03
„ 7-й „ R207 + H20==2HR04 и др.
Когда одшъ и тоть otce металлоидъ даетъ н?-
сколько окгісловь, то окиселъ, высшій по содерэюаиію
кислорода, обладаешь бол?е кислошнымг характеромь,
mo-есть съ водою даешь бол?е сильную кислоту 3),
ч?мъ низшгй.
!) Интересно отм?тить, что въ типичиыхъ окислахъ каждой
группы валентность чаще всего м?няется изъ четной въ четную же
(напр., R02 и RO, R03 и R02), а изъ нечетной—въ нечетную (напр.,
R205 и R203).
2) Иногда высшія кислоты теряютъ часть своей воды и даютъ
такъ называемый ангидрокислоты (тоже ангидрогидраты), наприм?ръ:
Н3Р04 — Н20 = ЯР03. или 2НаР04 —Н2О^Н4Р207 и т. д.
3) По теоріи электролитической диссоціаціи такая кислота им?етъ
бол?е высокую степень диссоціаціи или, иначе, даетъ большее
количество водородныхъ іоновъ, такъ характерныхъ для кислотъ. Одно-
основныя кислоты всегда диссоціируютъ по одному типу: выд?ляютъ
въ вид? іона свой единственный водородъ. У двуосноішыхъ кислотъ
возможны два распаденія: напр.? возьмемъ двуосновную—с?рную
кислоту H2S04: сначала она диссоціируетъ, какъ одноосновная на іоны:
II и IIS04, а зат?мъ уже іонъ IIS04 вновь диссоцшруетъ на іоны Н
и SO4. Если кислота слабая, то первая стадія диссоціаніи
преобладает^ а вторая наступаетъ лишь въ слабой степени; при сильныхъ
же кислотахъ вторая стадія диссоціаціи (т.'-е. освобожденіе и второго
водороднаго іона) идетъ легко. Растворъ кислой соли слабой
двуосновной кислоты им?етъ поэтому (т.-е. въ силу незначительности
второй стадіи) слабокислую реакцію, близкую къ нейтральной соли.
— 309 —
Кислоты. Кислотой называется такое водородъ
содержащее соединеніе, которое можешь обм?пивать
свой водородъ на металлъ съ образованіемъ соли. Такъ
какъ водородъ есть элемеитъ до н?которой степени ме-
таллическаго характера, то и самыя кислоты можно
разсматривать какъ соли водорода. По числу атомовъ
водорода (водородныхъ іоновъ), которое кислота можетъ
зам?нить на металлъ, кислоты д?лятся на одноосновный,
двуосновныя, трехосновный и т. д. Если кислота зам?-
иила весь свой водородъ на металлъ, то полученная соль
называется среднею, напр., NaCl, Na2S04. Если же на
металлъ въ кислот? зам?щены не вс? атомы водорода,
то полученная соль называется кислою, напр., NaHS04.
Если разсматриваемая кислота трех- или бол?е основна,
то кислыя соли могутъ быть различны: однометалли-
честя, двуметаллическая и т. д. Напр., фосфорная
кислота (Н3Р04) им??тъ дв? кислыя соли: Na2HP04
и NaH2P04.
При составленіи формулъ солей надо всегда им?^ь въ
виду валентность металла: число, выражающее
валентность металла, всегда указываешь на число атомовъ
водорода^ которые можно зам?нить одпимъ атомомъ
металла.
С?рнистыя соединения м?таллоидовъ внолн? анало- •
гичны и по составу и по свойствамъ кислороднымъ
соединеніямъ, такъ, наприм?ръ, въ 4-й групп? они
образуются по типу RS2, въ 5-й — K2S5 и R2S3 и т. д.
Многимъ изъ иихъ отв?чаготъ такъ называемыя сульфо-
кислоты, наприм?ръ: R2S5-|~ 3H2S---2H3I1S4.
Галоидныя соединенія металлоидовъ обыкновенно
непрочны: они легко разлагаются водой, при чемъ весь
галоидъ (или часть его) съ водородомъ воды выд?ляется
Растворъ же кислой соли сильной двуосновной кислоты (съ сильно
развитой второй стадіей — іонизаціей второго водорода) относится,
главнымъ образомъ, какъ растворъ кислоты; подобяымъ же образомъ
д?ло идегъ и при кислотахъ высшей основности.
— 310 —
въ вид? галоидоводородныхъ соединеній, а металлоидъ
образуетъ кислоту, наирим?ръ: РС13 -|- ЗН20 = ЗНС1 -f-
+ H3POs.
Кислородный, с?рнистыя и галоидныя соединенія
группы углерода.
§ 113. Высшій окиселъ этой группы им?етъ формулу
Е03: онъ обладаетъ кислотнымъ характ?ромъ, то-есть,
соединяясь съ водою, образуетъ кислоту:
R02 + H20 = H2R03.
Полученная кислота двуосновна и очень неустойчива,
такъ что у углерода даже не существуетъ въ свободномъ
состояніи, а изв?стна только въ вид? солей.
Другой окиселъ этой группы существуетъ только у
углерода, им?етъ формулу RO и обладаетъ безразличнымъ
характеромъ.
Углекислый газъ, С02.
Молек. в. С02~ 44. Уд. в. (Н = 1) = 22. Плотн. (возд. = 1) = 1,529.
Темпер, нлавл. ~ — 57°. Темпер, кип. = — 790. Крит. темп. =-f- 31°;
крит. давх —72,9 атом. о/0-ыи составъ О—72/710/0; С = 27,29о/0.
§ 114. Углекислый газъ г) въ свободномъ состояніи
встр?чается въ воздух? въ количеств? около 0,03%?
откуда и усваивается зелеными частями растеши, гд?
при участіи хлорофилла и солнечной энергіи разлагается
на кислородъ и углеродъ. Углекислый газъ попадаетъ въ
воздухъ, какъ продуктъ, образующійся при дыхаиіи 2),
*) Иначе его же называютъ «угольный ангидридъ», «углекислота»
и «-двуокись углерода>.
2) Суточное выд?леніе углекислаго газа челов?комъ въ ср?днемъ
равно 900 гр.: днемъ — около 525 гр. и ночью—около 375. Различі?
дневного выд?денія отъ ночного объясняется различіемъ въ работ?,
совершаемой организмомъ; всякая работа увеличиваетъ обм?нъ ма-
— 311 —
гор?ніи, гніеніи и тл?ніи углеродистыхъ веществъ.
Углекислый газъ въ н?которыхь м?стахъ выд?ляется изъ
трещинъ земли, особенно въ вулканическихъ м?стностяхъ
(„Собачья пещера" около Неаполя, „Долина смерти" на
остров? Яв?) *). Онъ входить также въ составъ многихъ
естественныхъ водъ, наприм?ръ, Нарзана на Кавказ?).
Но гораздо большее количество углекислаго газа
находится въ природ? не въ свободномъ, а въ связанномъ
вид?, въ вид? солей угольной кислоты (Н2С03), ангид-
ридъ которой онъ и пред став ляетъ:
Н2С03-Н20^гС02;
наибол?е распространены въ природ? сл?дующія соли
угольной кислоты: СаС03—углекислый кальдій (известь,
мраморъ, м?лъ), MgC03 (магнезитъ), MgC03. CaC03
(доломить и др.; нер?дко эти соли слагаютъ ц?лыя горныя
породы.
Углекислый газъ играетъ важную роль въ жизни
природы. Только благодаря процессу образованія С02 угле-
родъ совершаетъ свой круговоротъ въ природ?. Круго-
воротъ состоитъ въ сл?дующемъ: зеленыя части растеній
при помощи солнечной энергіи разлагаютъ углекислоту
воздуха2), усваиваютъ углеродъ и выд?ляютъ обратно
въ атмосферу кислородъ. Углеродъ въ растеніяхъ
переходить въ различный органическія соединенія, которыя
идутъ въ пищу и служатъ единст?еннымг источникомъ
поступленія необходимыхъ углеродистыхъ веществъ въ
организмъ животныхъ и челов?ка. Наконецъ ткани че-
лов?ка и животныхъ (а также и растеній) въ акт? ды-
теріи; иропорціонально количеству сгор?вшаго въ организм? углерода
развиваются и силы, необходимый для различныхъ отправлении
организма. За-м?тимъ, что въ 900 гр. углекислаго газа самого углерода
содержится 245,45 гр.; эта убыль должна пополняться принятіемъ пищи.
!) Такихъ м?стъ много и у насъ на Кавказ?.
2) 6С02 + 5Н20 = С6Н10О5 + 602 — 671.000 калорій.
— 312 —
ханія окисляются кислородомъ воздуха, результатомъ чего
обратно выд?ляется С02 въ воздухъ.
При образованіи С02 изъ С и О выд?ляется 96,96 К!
тепло это, являющееся результатом^ окисленія углерода
тканей,;Л даетъ организму необходимую ему „животную"
теплоту. При процессе разложения С02 въ растеніягь
солнечная энергія восполняетъ эту потерянную при
образованіи С02 теплоту, которая и превращается въ
химическую энергію выд?ляющихся изъ С02 углерода и кисло*
рода. Углеродъ опять идетъ на образованіе соединеній и
на гор?ніе и опять выд?ляетъ свою энергію въ форм?
тепла и св?та и т. д. Такимъ образомъ углеродъ и С02
суть т? посредники, при помощи которыхъ солнечная
энергія утилизируется какъ въ организмахъ, такъ и
вообще въ жизни природы ]). Превращеніе солнечной энер-
гіи въ химическую и посл?дней въ другіе виды энергіи
и составляетъ основу жизни всякаго организма.
Получение. Углекислый газъ прямо образуется при
гор?ніи угля или углеродъ содержащихъ веществъ въ
достаточномъ количестве воздуха:
с + о„=со2.
Получать его удоби?о всего въ аппарат? Киппа
д?йствіемъ соляной (или какой-нибудь другой, нанри-
м?ръ, уксусной, с?рной) кислоты на мраморъ2).
СаС03 -j- 2HC1 = СаС12 + Н2С03;
но выд?ляющаяся угольная кислота тотчасъ же
разлагается съ выд?леніемъ угольнаго ангидрида и воды:
н2со3=н2о + со2.
!) Конечно, здЬсь утилизируется и запасъ эн?ргіи кислорода,
соединяющагося съ углеродомъ.
2) Технически изъ СаС03 выд?ляютъ СО« при накаливанш: СаС03=
г=СаО + С02.
— 313 -
Высушиваютъ С02, пропуская его чрезъ H2S04; co-
бираютъ въ прямо поставленные сосуды.
Свойства. С02—безцв?тный газъ, въ полтора раза
тяжел?е воздуха (плотность его по водороду = 22, откуда
частичный в?съ=44), слегка кисловатаго вкуса.
Пользуясь болышшъ уд?льнымъ в?сомъ С02, его можно
переливать изъ одного сосуда въ другой, подобно жидкостямъ.
С02 довольно легко растворяется въ вод?: въ 1 объем?
посл?дней при 0° растворяется 1,8 об. С02. Съ по-
вышеніемъ температуры растворимость С02 значительно
уменьшается; съ повышеніемъ же давленія растворимость
углекислаго газа, конечно, увеличивается. Посл?днимъ
обстоятельствомъ и пользуются при изготовленіи ши.
пучихъ водъ и искусственныхъ шипучихъ винъ.
С02—одинъ изъ наибол?е легко сгущаемыхъ газовъ.
Жидкій С02 кипитъ при—79° подъ обыкновеннымъ давле-
ніемъ. Выше+ 31° (критическая температура) С02 уже
не можетъ существовать въ жидкомъ вид?. Жидкій С02
хранится въ особо устроенные для этой ц?ли бомбахъ
(см. рис. 80) и представляетъ изъ себя безцв?тную
жидкость. Испаряясь въ воздух?, жидкій С02 охлаждается
настолько, что остающаяся часть его застываетъ въ
рыхлую сн?гообразную массу, которая возгоняется, не
плавясь. Твердый С02 тяжел?е воды: уд?льный в?съ
его = 1,2. Твердый углекислый газъ им?етъ очень
низкую температуру, такъ что въ немъ легко мерзнутъ вода,
ртуть и др. жидкости. Твердый С02 довольно долго
сохраняется на воздух?, потому что для превращенія въ
газъ тр?буетъ много тепла. Въ твердомъ вид? С02 можно
безопасно взять па руку, такъ какъ къ рук? опъ не
прикоснется: слой газа будетъ отд?лять его отъ руки.
Но если такой кусокъ сжать въ рук?, то
произойдешь сильное отмораживаніе, сходное съ ожогомъ. Если
см?шать твердый С02 съ э?иромъ, то- получится
кашеобразная масса съ ещё бол?е низкой температурой
(до-80°).
— 314 —
Углекислый газъ не горитъ и гор?нія (а также и ды-
\ашя) не поддерживаетъ: горяпця т?ла (хотя и не вс?),
внесенныя въ атмосферу углекислаго газа, гаснуть1);
исключеніе составляет ь магній: зажженный въ воздух?,
онъ продаіжаетъ гор?ть въ С02, а также калій и натрій,
Рис. 80. Бомба для храненія жидкаго СОг и
жидкихъ или сдавленныхъ газовъ вообще.
которые горятъ при нагр?ваніи въ сухомъ углекисломъ
газ?. Животныя въ атмосфер? его умираютъ.
По химическимъ свойствамъ С02 есть кислотный оки-
селъ, съ водою дающій кислоту С02 + Н20 = Н2С03*
Получающаяся угольная кислота—очень непрочное
соединеніе и уже при обыкновенной температур?, какъ
сказано выше, распадается на С02 и Н20. Угольная
і) Конечно—потому что С и О прочно соединены въ С02.
- 315 —
кислота очень слабая: водный растворъ ея окрашиваетъ
лакмусъ не въ чистый красный, а въ виннокрасный
цв?тъ. Она существуетъ только въ водныхъ растворахъ,
и выд?лить ее въ чистомъ вид? до сихъ поръ не
удалось. Но соли угольной кислоты, сравнительно съ самой
кислотой,—довольно прочныя соединенія, и в?которыя
не распадаются даже при очень высокой температур?;
большинство же ихъ при накаливании распадается на С02
и окись металла, наприм?ръ: СаС03 = С02 -|-СаО. Такъ
какъ Н2С03—очень слабая (слабо диссоціирующая)
кислота, то она выт?сняется изъ своихъ соединеній почти
вс?ми другими кислотами, наприм?ръ:
Na2C03 + H2S04 = N&2S04 + Н30 + С02.
Н20О3-—кислота двуосновная (аніоны ея НС03 и С03).
а потому она образуетъ 2 ряда солей:
МНС03—кислыя соли*),
М2С03—среднія соли.
Большая часть солей угольной кислоты въ вод?
нерастворима. Напр., СаС03 выд?ляется въ вид? осадка
при д?йствіи С02 на известковую воду, потому что онъ
нерастворимъ въ вод?. Легко растворяются въ вод? лишь
соли щелочныхъ металловъ (1-я гр.), при чемъ ихъ
растворы показываютъ щелочную реакцію; это по теоріи
электролитической диссоціаціи объясняется такъ: Н2С03—
кислота слабая, слабо іонизируетъ даже въ первой ста-
діи, т.-е. на Н и НС03; а вторая стадія, т.-е. распаденіе
НС03 на іоны Н и С03, въ большинств? случаевъ бы-
ваетъ незам?тно мала; получившійся іонъ С03 съ водою
вновь даетъ іонъ НС03 по уравнению: Н20 -f- С03 =
— НС03-|-ОН, т.-е. освобождая при этомъ іонъ гидро-
ксилъ (ОН), которому свойственна основная реакція.
§ 115. Гидролизг. Выше былъ разсмотр?нъ частный
случай сл?дующаго общаго правила: если соль образо-
!) Подъ М зд?сь разум??тся атомъ одноатомнаго металла.
— 316 —
ваш слабой кислотой и силънымъ основаніемъ, то въ
водномъ раствор? она (соль) показываешь щелочную
реакцію. По теоріи электролитической диссодіаціи, какъ
сказано въ глав? о вод?, слабой кислотой называется
такая, диссЪціація которой на водородный іоиъ (катіонъ)
и сооти?тствующій апіоиъ мала. При водныхъ раство-
рахъ, кром? іоновъ соли, им?ются, хотя и въ очень
небо льшомъ количеств? (вода диссодіируетъ очень мало),
іоны воды—Н и ОН; іонъ воды Н соединяется съ аніо-
нами соли, и освобождается основной гидрокоильный
(ОН) іонъ, который реагируетъ щелочно; соединиться
съ катіоиомъ ОН онъ не можетъ, потому что тогда
получится гидратъ основного окисла, который самъ явится
сильно диссоціированнымъ электролитомъ. Описанное
явленіе получило названіе гидролиза, т.-е. разложенія при
д?йствіи воды.
Гидролизъ им?етъ м?сто и при обратномъ сочетаніи,
т.-е. когда им?ется водный растворъ соли, образованной
слабымъ основаніемъ и сильной кислотой; но только
тогда, конечно, будутъ накопляться водородные іоны, и
реащгя воднаго раствора будетъ кислая.
Когда же соли образуются и слабыми кислотами и
слабыми основаніями, то гидролизъ проходитъ обыкновенно
сполна (напр., при АЛ2 (С03)3); реакдія раствора зд?сь за-
виситъ отъ того, основаніе или кислота растворим?е и
сильн?е; напр., (NH4)?S реагируетъ щелочно.
Окись углерода, СО.
Молекул, в?съ СО — 28. Плотность (воздухъ — 1) — 0,9674. Темп." ¦
кип. — 1930; темп, замерз. — 199°. о/0-нын составъ: С — 42,87%;
0 = 57,130/0-
§ 116. Полученіе. При гор?ніи угля въ ирисутствіи
недостаточна™ количества кислорода вм?сто угольнаго
ангидрида образуется окись углерода:
С + О^СО.
— 317
Въ см?си съ водородомъ она получается при про-
пускапіи паровъ Н20 надъ раскаленнымъ углемъ:
н2о +- с = н2 -f со
(такъ называемый водяной газъ, см. стр. 154).
Если пропускать С02 надъ раскаленными углями, то
также получается СО : С02 +C^zt2CO (реакція обратимая);
этотъ случай им?етъ м?сто, паприм?ръ, при окончаніи
топки печей, когда С02 проходитъ чрезъ большую
поверхность раскаленныхъ углей: синеватое пламя
указываете на сгорающую при этомъ окись углерода1).
Въ чистомъ вид? СО получается д?йствіемъ H2S04
на муравьиную кислоту Н2С02:
Н,СОа = Н20 + СО,
или же при д?йствіи H2S04 на щавелевую кислоту2):
Н2С204 — НвО + СО + С02.
Въ посл?днемъ случа? СО получается въ см?си съ
С02, отъ которой мож?тъ быть отд?ленъ пропусканіемъ
чрезъ ?дкое кали, такъ какъ посл?днее поглощаетъ С02
и не поглощаетъ СО.
Свойства. Окись углерода— безцв?тный, не им?ющій
запаха газъ. При вдыханіи д?йствуетъ вредно на орга-
низмъ, вызывая явл?нія угара* 11А°/0 въ воздух? СО
достаточно для отравленія челов?ка3). Плотность СО по
1) Этимъ пользуются при металлургическихъ процессахъ (см. при
м?таллахъ), а также при отопл?ніи посредствомъ генераторовъ, т.-е.
особыхъ печей, въ которыхъ образующейся при гор?ніи С02
превращается въ СО; лосл?дній дал?е идетъ въ качеств? топлива съ очень
высокой (около 1800°) температурой сгоранія.
2) H2S04 въ обоихъ случаяхъ'служить для отнятія Н20.
3) Ядовитость СО объясняется т?мъ, что она соединяется съ
г?моглобиномъ—красящимъ веществомъ красныхъ кровяныхъ шари-
ковъ въ твердое вещество, неспособное поглощать кислорода. А ге-
моглобинъ крови и есть поглотитель кислорода: съ нимъ кислородъ и
разносится по всему т?лу, окисляя различный тканн и т?мъ
поддерживая жизнедеятельность. Отсюда угаръ равносил?нъ удуш?нію.
— 318 —
водороду =14. Окись углерода чрезвычайно трудно
сгущается въ жидкость. При нормальномъ давленіи она ки-
питъ при— 190°, а при — 211° переходитъ въ твердое
т?ло; критич. темп,—139,5°, крит. давл. 35,5 атм.
По шмическимъ свойствамъ окись углерода есть
индиферентный окиселъ, не обладающей ни кислотными
ни щелочными свойствами.
Въ превращеніяхъ вс? свойства СО зависятъ отъ
того, что СО—непред?льное соединеніе, т.-е. отъ того,
что въ СО углеродъ сохранилъ еще дв? валентности
неизрасходованными, потому-то реакдіи соединенія для СО
и являются характерными.
СО можетъ гор?ть, соединяясь съ кислородомъ (влаж-
нымъ) воздуха и образуя С02:
2СО + 02 = 2С02,
т.-е. два объема СО, соединяясь съ однимъ объемомъ 02,
даютъ два объема С02, при чемъ выд?ляется 67,67 ед.
тепла.
Окись углерода—хороши возстановитель (особенно при
высокой температур?), т.-е. она легко отнимаетъ кисло-
родъ отъ многихъ металлическихъ окисловъ, наприм?ръ,
отъ Fe203:
Fe303 + ЗСО = ЗС02 + Fe2.
См?сь СО съ О взрываетъ при д?йствіи электриче-
скихъ искръ.
Окись углерода" можетъ соединяться подъ вліяніемъ
прямого солнечнаго св?та съ хлоромъ въ радныхъ объ-
f емахъ и давать т. наз. фосгепъ. СОС12 по сл?д. уравне-
нію: СО-{-С12 —СОС12. Фосгенъ — б?зцв?тная жидкость,
| уд. в?са 1,43 при 0°, кипящая при -f- 8°. Водою фосгенъ
разлагается на хлористый водородъ и углекислый газъ:
COCl2-f-H20=2HCl-[-C02. Съ с?рой при высокой
температур? СО даетъ COS — с?роокись углерода.
Непосредственно СО соединяется съ н?которыми металлами, напр.,
— 319 —
съ никк?л?мъ, ж?л?зомъ и др., образуя карбонилы, напр.,
Ni(C0)4.
Итакъ, углеродъ им?етъ два окисла, изъ коихъ С02—
кислотный, дающій съ водою кислоту Н2С03, а СО
безразличный. Это первый случай изъ того общаго правила^
по которому кислотный свойства окисла т?мъ силь-
н?е, ч?мъ больше въ немъ содероісится кислорода.
Въ водородныхъ соединеніяхъ металлоидовъ д?ло
обстоять какъ разъ наоборотъ: тамъ кислотныя свойства
уменьшаются по м?р? увеличенія количества
водородныхъ атомовъ (СШ, SH2, NH3, CH4).
Въ 1906 г. при д?йствіи Р205 на малоновый э?иръ
(СН2<^ рП2' 2 5) получена еще недокись углерода,
С302—весьма неустойчивая жидкость, кипящая съ разло-
женіемъ при-(-7° я кристаллизующаяся при—107°.,
і I ,
Кремнеземъ, Si02. { J
Мол?к. в?съ SiO2 = 60;3. Уд. в?съ (вода = 1) = 2,6 (горный
хрусталь), 2,3 — 2,4 (тридимитъ), 2,2 (аморфн. песокъ). %-ый составъ:
Si=^47;O10/o; О = 52,990/0.
§ 117. Полученіе. У аналога углерода, кремнія суще-
ствуетъ соединеніе съ кислородомъ — Si02 а), такъ наз.
кремневый аптдридъ или кремнеземъ. Si02 очень
широко распространенъ въ природ? какъ въ свободномъ
вид?, наприм?ръ, въ вид? кварца, горнаго хрусталя,
аметиста, окрашеннаго марганцемъ въ фіолетовый цв?тъ,
дымчатаго топаза, окрашеннаго смолистыми веществами
въ темный цв?тъ, песка2), кремня, опала, агата, халце-
*) Въ посл?днее время при возстановленіи кремневой кислоты въ
электрической печи получено соединеніе SiO—коричневый порошокъ,
уд. в. 2,24, растворимый въ HF и въ щелочахъ.
2) Песокъ является продуктомъ разрушенія (сначала м?ханиче-
скаго, а потомъ химическаго) горныхъ породъ, а потому часто и со-
ч
— 320 —
дона, такъ и въ вид? солей отв?чающей ему кремневой
кислоты H2Si03 (полевые шпаты и вообще такъ
называемые силикаты, прост?йшимъ представителемъ кото-
рыхъ служить глина).
КремнЬземъ находится, наприм?ръ, въ растительномъ
царств?—во вн?шнемъ покров? соломы, тростника, хвоща
и др.; изъ кремнезема же состоятъ пандыри микроско-
пическихъ яизшихъ животныхъ и растеній (инфузоріи,
Diatomeae), остатки которыхъ составляютъ такъ
называемую инфузорную землю, встр?чающуюся, наприм?ръ,
у насъ на Кавказ?, около Ахалцыха.
Наибол?е чистымъ кремнеземомъ въ природ? является
горный хрусталь; искусственно же Si02 можетъ быть по-
лученъ при сжиганіи кремня въ кислород?, или при
прокаливаніи кремневой кислоты.
Свойства. Но вн?шнему виду Si02 представляетъ
собою твердое т?ло, являющееся какъ въ кристаллическому
такъ и въ аморфномъ видоизм?неніяхъ. Это очень
твердое вещество, плавящееся при 1800° въ прозрачное
стекло и даже улетучивающееся въ электрической печи:),
Въ вод? и обычныхъ кислотахъ кремнеземъ нераство-
римъ, но довольно легко растворяется при кипяченіи
или при сплавл?ніи) съ ?дкими щелочами:
Si02 -+- 2KOH = Н20 4- K2Si03.
держитъ въ качеств? прим?сей посторонняя минеральныя части; эти
посторонняя лрим?си придаютъ, между прочимъ, песку и различную
окраску: такъ, желтый цв?тъ песка зависитъ отъ прим?сей къ нему
соедин?нія жел?за. Наибол?е чистый песокъ носитъ названіе кварца.
Пески образовывались во вс? эпохи жизни земли; наибол?е др?вніе
изъ нихъ, находящееся лодъ давленіемъ поздн?е образовавшихся пла-
стовъ, часто являются въ уплотненномъ вид? и образуютъ
каменистый породы, называемый песчаниками.
*) Въ посл?днее время изъ такого сплавленнаго кварца начали
выд?лывать посуду для научныхъ опытовъ: посуда эта легко выдержи-
ваетъ высокую температуру, а также очень стойка при перем?нахъ
температуры.
— 321 —
При этомъ образуются соотвЬтствующш соли
кремневой кислоты. Такимъ образомъ Si02 является ангидри-
домъ кремневой кислоты. При сплавленіи Si02 вступаетъ
въ реакцію сь безводными окислами, съ солями, образуя
соли кремніевыхъ кислотъ.
§ 118. Ёремпекислопга1)^ H2Si03, отв?чающая Si02,
аналогична угольной кислот? Н2С03. Въ свободномъ вид?
она (въ смЬси съ другими кремневыми кислотами) мо-
жетъ быть получена разложеніемъ соляной кислотой ея
калійныхъ или натронныхъ солей, изв?стныхъ подь на-
званіемъ растворимаго или фуксова стекла2).
При этой реакщи кремневая кислота обыкновенно
получается въ вид? б?лаго творожистаго сгугтка, нерас-
творимаго въ водЬ и кислотахъ. При осторожномъ вли-
ваніи раствора кремнекислой соли въ слабую соляную
кислоту, образующаяся кремневая кислота не выпадаетъ
изъ раствора, а остается тамъ вм?ст? съ КС13) въ
коллоидальномъ состояніи.
і) Полный гидратъ, отв?чающій Si02, есть Si(OH)4; онъ неизв?-
стенъ въ свободномъ состояніи. При отщепленш одной частицы воды
получается. Si(OH)4 — Н20 —SiO(OH)2— это первый ангидрогидратъ;
заі?мъ изв?стны и другі? ангидрогидраты, назыв. полшремневыми
кислотами, образованные по общему типу mSi(OH)4—пН20, напр., отъ
2Si(OH)4 изв?стны H6Si207, H4Si206) H2Si205. Соли этихъ ангидроги-
дратовъ широко распространены въ природ? и изв?стны подъ име-
немъ силшатовъ. Напр, отъ ортокре мневой кислоты (HjSiOj)
силикаты* цирконъ (ZrSiOj), гранатъ (Ca3Fe'"(Si04)3)» сдюда (KELjA^SiO)^»
каолинъ (H2AI2(Si04)2), отъ метакремпевой кислоты (H2Si03)
силикаты: волластонитъ (CaSi03b беридлъ (Ве3А12(8іОз")б) и Др I отъ ди-
кремневой кислоты (H6Si207) силикатъ серпентинъ (Mg3Si207); отъ
тржремневой кислоты (H4Si208) силикатъ ортоклазъ (KAISi^Og).
2) Растворимое стекло въ техник? готовится д?йствіемъ ?дкихъ
щелочей (NaOH или КОН) въ паровомъ котл? на трепелъ или
инфузорную землю, которая сод?ржитъ въ себ? много аморфнаго
кремнезема. Такое стекло прим?няется въ красильномъ, бумажномъ и мыло-
вар?нномъ производствахъ, а также для приданія кр?пости и лоска
штукатурк? и разнымъ цементамъ.
^) Растворимый кремнеземъ есть и въ природныхъ водахъ;
особенно много его содержать горячее источники, изъ которыхъ осо-
ооргаыическая химш 21
— 322 —
Для выд?ленія кремневой кислоты изъ эгой смЬси
пользуются т?мъ, что КС1 есть кристаллоидг, т.-е.
вещество кристаллическое, легко проникающее черезъ жи-
вотныя илр растительныя перепонки, а кремЕіевая
кислота — коллоидг, вещество аморфное, не обладающее
этими свойствами, и производятъ ихъ разд?леніе, или
діализъ, въ приборе, изображенномъ на рис. 81, такъ
иазываемомъ діализатор?. Опъ состоять изь сосуда,
съ одного конца открытаго, а съ другого плотно затя-
Рис 81 Діализаторъ.
нутаго растительным ь пергаментомъ (растительный пер-
гаментъ получаютъ д?йствіемъ крепкой H2S04 на непро-
клеенную бумагу) и иогруженнаго во внЬшній стаканъ
съ чистою водой. КС1 будетъ проходить чрезъ
перегородку изъ внутренняго стакана во ви?шній до тЬхъ
поръ, пока концентрація растворовъ по обЬ стороны ея
не сд?лается одинаковой. МЬняя несколько разъ воцу
бенно прим?чательны гейзеры Исландш и С.-Ам?риканскаго нащональ-
наго парка. Такая вода можетъ пропитывать разные предметы, напр.,
части растеній, ^ри чемъ кремнеземъ отлагается внутри ихъ и
сохраняете такимъ образомъ, форму предметовъ, переводя ихъ въ
окаментълое состояніе. Растворимая кремневая кислота называется
гидрозолелъ, а нерастворимая—гидрогелеліъ. Гидрозоль собственно—
общее названіе всякихъ растворовъ (точнее—псевдорастворовъ) кол-
лоидовъ, а гидрогель — общее названіе студней или сгустковъ
коллоид овъ,
— 323 —
иъ наружномъ сосудЬ, можно достигнуть довольно пол-
наго разд?л?нія КС1 и H2Si03 3).
Растворы кремнекислоты не им?ютъ вкуса, но пока-
зываютъ слабо кислую реакцію, окрашивая синюю ламу-
оовуго бумажку въ красный дв?тъ. Растворы эти очень
непостоянны и легко выдізляютъ кремнекислоту въ не-
растворимомъ состояніи отъ д?йствія кислотъ (даже С02)
или при нагрізваніи; въ посл?днемъ случа? H2Si03, въ
конц?-концовъ, теряетъ Н20 и переходить въ Si02.
Природныя соли H2Si03 не обладаютъ такой простой
формулой, какую мы придаемъ кремнекислот?: он? отв?-
чаютъ различнымъ поликремневымъ кислотамъ.
Обычныя видоизм?ненія Si02, находящаяся въ
природ Ь, представляютъ частицу, сильно полимеризованную,
оттого-то Si02 и разнится сильно по физическимъ свой-
ствамъ отъ своего ближайшаго аналога С02. Сл?дова-
тельно, правильн?е выражать природныя видоизм?ненія
Si02 формулой (Si02)n: число частицъ уплотнившихся
пока неопред?ленио. При образовали и уплотненіи
Si02 выд?ляется 211,1К, этимъ и объясняется
чрезвычайная прочность видоизм?неиій Si02. Соли кремневой
кислоты прим?пяются широко въ т?хник?, паприм?ръ, при
приготовленіи стекла, фарфора, фаянса, огнеупорныхъ
материалов ь и проч.
!) Нов?йшія изсл?дованія показываютъ, что многіе коллоиды мо-
гутъ переходить въ кристаллическое состояніе, а многія кристалли-
ческія вещества могутъ давать коллоидальные растворы; поэтому
теперь говорятъ не о коллоидальныхъ или кристаллическихъ в?ще-
ствахъ, а о коллоидальность и кристаллическомъ состояніи вещества.—
Способность веществъ проникать черезъ данную перепопку, какъ
оказывается, зависит* не отъ кристаллической природы, а отъ
общихъ свойствъ вещества и отъ свойствъ перепонки, такъ что
иногда черезъ перепонку проходятъ одни кристаллоиды, или одни
коллоиды, а друпе задерживаются; бываютъ, накояецъ, и такіе
случаи, когда черезъ перепонки проходятъ коллоиды, а кристаллоиды не
проходятъ,
21-
— 324 —
Изъ другихъ соединеній группы углерода съ
металлоидами интересны галоидныя и с?рнистыя соединенія
углерода съ азотомъ и др.; галоидныя соединенія
обыкновенно разсматриваются въ отд?л? органической химіи;
зд?сь лишь за^м?тимъ, что углеродъ прямо соединяется
только съ фто^омъ, а кремній—и съ другими галоидами.
С?роуглеродъ, CS2.
Молек. в?съ CS2 = 76,14. Уд. в?съ (вода= 1) = 1,272 при 0». Темп.
плавл. =— ИЗО. Темя, кип. = + 46<>. Плотя, пара (возд. = 1) — 2,633.
о/о-ый составъ: С = 15;770/0; S—84;23<V0.
§ 119. CS2 получается пропускані?мъ иаровъ с?ры
надъ раскаленнымъ углемъ:
C-f 2S = CS2;
онъ образуетъ тяжелую (уд?лъный в?съ = 1,272)
жидкость, сильно преломляющую св?тъ и въ неочищенаомъ
вид? очень плохо пахнущую3); CS2 кипитъ при-{-46°.
Онъ является хорошимъ растворителемъ для с?ры,
фосфора, галоидовъ и многихъ органическихъ веществъ
(напр., жировъ, маселъ). Его иногда прим?няютъ, напри-
м?ръ, для извлеченія маселъ изъ с?мянъ. CS2 горючъ;
см?сь его съ кислородомъ при воспламененіи взрываетъ
Подобно тому, какъ С02 отв?чаетъ угольная кислота
Н2Ш3, такъ CS2 отв?чаетъ (CS2-f H2S) тіоугольная
кислота H2CS3—красно-бурое маслообразное вещество, мало
устойчивое.
CS2 ядовитъ, а потому имъ пользуются, наприм?ръ,
для истребленія грызуновъ. CS2 также задерживаетъ
гніеніе и броженіе, почему и является хорошимъ консер-
вирующимъ средствомъ 2).
і) Очищаютъ CS2 взбалтываніемъ съ металлическою ртутью и за-
т?мъ перегонкой.
, 2) Въ продаже CS2 называется: Carbonicum sulfuratum или Schewe-
felkohlenstoff, или Alkohol Sulfuris.
— 325 —
С?рнистый крешгій, SiS2.
Молекул. вЬсъ = 92,52.
§ 120. SiS2 получается изъ Si03 зам?щеніемъ въ н?мъ кислорода
с?рой при нропусканіи паровъ CS2 надъ раскаленной см?сью SiOa
съ угдемъ:
CS2 + Si02 + С = 2CO -f SiS2.
S1S2 есіь твердое т?ло, им?ющее видъ длинныхъ шелковистыхъ иглъ
Водой онъ разлагается съ выд?леніемъ Si02 и H2S-
SiS2 + 2Н20 = Si02 + 2H2S.
Галоидный соединенія кремнія.
§ 121. ФТОРИСТЫЙ КреМніЙ, SiF4 (иол. в?съ = 104,4; пл.
(возд. = 1) = 357; % составь: Si = 27,16% F = 72,84%), образуется
при д?йствіи фтористаго водорода на кремнеземъ или
кремнекислыя соединенія;
Si02 -f 2H2F2 = 2H20 -f SiF4*).
Фтористый кремній—безцв?тяый газъ съ острымъ за-
пахомъ, на воздухе дымитъ всл?дствіе реакціи съ водой,
поглощающей его съ выд?леніемъ кремнекислоты:
SiF4 + 3H80 = 2F2H8 + H2Si08.
Разложеніе это идетъ, однако, не до конца:
параллельно образуется еще такъ называемая кремпефтористо-
водородная кислота по сл?дующему уравненію: SiF4 +
4- 2HF-=H2SiF6. Об? реакціи должны быть выражены
однимъ уравненіемъ:
3SiF4 + ЗН20 = H2Si03 -f 2H2SiF6.
SiF4 трудно сгущается въ жидкость, кипящую при
—170° и застывающую при—140°.
Хлористый кремній, SiCl4 (мол. в?съ =і70,2),
получается при накаливаніи см?си кремнезема съ углемъ въ
*) Этой реакці?й объясняется разъвданіе стекла при д?йствіи па
него НЕ1.
— 326 —
ток? хлора: Si02 + 2C-|-2C12 = SiCl4-[-2CO; представля-
етъ летучую жидкость, кипящую лри—59,57°, съ уд?ль-
пымъ в?сомъ 1,52.
Синеродистыя соединения,
§ 122. Синеродомъ или гианомъ называютъ группу
CN, играющую роль одноатомнаго радикала. Въ
свободному состояніи существуешь въ вид? газа соединеніе
(CN)2, называемое синеродомъ или дидіаномъ*). По хи-
мическимъ реакціямъ группа CN напоминаетъ галоиды;
діанъ горючъ 2).
Изъ синеродистыхъ соединеній наибол?е важна HCN—
синильная кислота и ея соль KCN—діанистый калій.
Ціанистый калій (KCN) получается въ техник? при
накадиваніи желтой кровяной соли.
K4Fe(CN)6 ») = 4KCN + FeC2 -f N2.
KCN—б?лая кристаллическая масса, расплывающаяся
на воздух? и обладающая горько-миндальнымъ запахомъ:
посл?дній, в?роятно, является потому, что С02 воздуха
разлагаетъ KCN по следующему уравненію:
2KCN + Н20 + С02 = 2HCN + К2С03;
а соединеніе HCN, называемое синильной кислотой > въ
неочищенномъ вид? и им?етъ запахъ горькихъ мин-
далей.
KCN хорошо растворяется въ вод? и им?етъ
щелочную реакдію. Онъ сильно ядовитъ, потому что, какъ уже
1) (CN)a легко получается при нагр?ваніи синеродистой ртути:
HgC2N2 = Hg + (CN),.
2) У кремнія съ азотомъ есть соединеніе состава Si2Ng, б?ло?
аморфное вещество, получаемое при нагр?ваніи кремнія въ атмо-
ефер? азота.
3) K4Fe(CX)fi см. въ глав? о металлахъ при жел?з?, § 215.
— 327 —
было сказано, легко разлагается оіъ С02 съ выд?леніемъ
самаго сильнаго яда—HCN.
KCN прим?няется въ большомъ количеств? для галь-
ваническаго серебренія и золоченія, для извлеченія
золота и серебра изъ рудъ (подробности при указаиныхъ
металл ахъ).
При сплавленіи съ с?рой KCN образуете
KCNS—роданистый калій; это лучшій реактивъ для открытія
солей окиси жел?за (см. при металлахъ).
HCN—синильная кислота, легко можетъ быть
получена при д?йствіи кислотъ на KCN, наприм?ръ: KCN -f-
-f-HCl = KCl-f-HCN. Удобн?е его получать прямо изъ
желтой кровяной соли (изъ которой получается и KCN)
при д?йствіи на нее слабой с?рной кислотой.
Чистая HCN—безцв?тная жидкость, кипящая при 26°
и замерзающая при—14°. HCN есть самый сильный ядъ,
д?йствующій мгновенно: 0,05 гр. достаточно, чтобы
"умертвить челов?ка. Противоядіемъ служитъ перекись
водорода (Н202). Кислота эта очень* слабая, и соли ея мо-
гутъ разлагаться даже слабой угольной кислотой; поэтому
ціанистые металлы обыкновенно пахнутъ синильной кщ-
лотой.
Карборундъ, CSi.
Мол. в. CSi = 40,3. Уд. в. = 3,22 при 150. о/0-ый составъ: Si = 70,27o/0; '
С = 29,73%.
§ 123. Карборундъ, CSi, т.-е. соединеніе углерода
съ кремніемъ, получается при накаливаніи см?си угля и
кремнезема въ вольтовой дуг?:
Si02 + ЗС = CSi + 2CO.
Карборундъ получается обыкновенно въ вид? изумруд-
но-зеленыхъ кристалловъ. Кристаллы эти по твердости
почти не уступаюсь алмазу, почему и прим?няются для
шлифованія. Карборундъ, хотя и съ трудомъ, можетъ
гор?ть; на воздух? онъ не окисляется. Вода и кислоты
— 328 -
не д?йствуютъ на карборундъ, щелочи же его раство-
ряютъ.
Въ посл?дн?е время Мауссаномъ и другими получены
соедин?нія, углерода съ металлами, такъ называемые
карбиды. О карбид? кальція СаС2 было упомянуто при аце-
тилен? (см. стр, 300).
Задачи: 1) Написать формулу соединенія, им?ющаго сл?д. о/0-ый
составь С=750/0 и Н— 25<>/0.
2) Сколько надо взять мрамора, чтобы полученной изъ
него С02 наполнить баллонъ въ 22,4 литра?
3) Челов?къ выд?ляетъ въ т?ченіе сутокъ 900 гр. С02;
вычислить: а) количество углерода, слшгаемаго при
дыханіи, Ъ) объемъ воздуха, необходимый для этого
сжиганія.
4) Сколько кислорода находится въ 5 фунтахъ (1 кило-
граммъ —2*/2 Ф-) песка?
Кислородный, с?рнистыя и галоидныя соединенія
металлоидовъ группы азота (V).
§ 124. Элементы группы азота—N, Р, As и Sb—по
отношенію къ водороду трехвалентны и образуютъ съ
нимъ наибол?е характерный соединенія по типу КН3; по
отношенію же къ металлоидамъ (О, S, галлоидамъ и др.)
они обыкновенно проявляюсь двоякую валентность: или
пятивалентны или трехвалентны. Въ первомъ случа? они
образуютъ соединенія по типачь: К205, R2S5 и RX5 *), а
во второмъ: Е203, R2S3 и й-^з1)-
Въ соединеніяхъ высшей валентности, т.-е. когда
элементы пятивалентны, проявляется наибольшая металлоид-
ность (кислотность), въ соединеніяхъ же трехвалентнаго
типа—меньшая, это во-первыхъ.
Во-вторыхъ, съ увеличеніемъ атомнаго в?са (т.-е. отъ
N къ Sb) и зд?сь металлоидность элементовъ падаетъ, а
соединенія съ металлоидами д?лаются бол?е и бол?е
і) Подъ X разум?ется атомъ галоиднаго элемента.
— 329 —
прочными; особенно р?зко сказывается это на соедине-
ніяхъ съ галоидами; у N галоидныя соединенія наиме-
п?? прочны, а у Sb—наибол?е прочны.
Кислоты въ этой групп? образуются какъ отъ типа
R205, такъ и отъ типа R203 (кром? Sb203), такъ что у
каждаго элемента существуетъ по н?скольку кислотъ.
Типу R205 отв?чаетъ главный типъ кислоты съ ЗН20,
то-есть R205-)-3H20 = 2H3R04; но и кром? этого типа,
отъ R205 производятся кислоты съ одной или двумя
частицами воды:
1) R205-f H20 = 2HR03;
2) R205 + 2H20 = H4R207.
Перваго типа (H3R04) кислоты называются съ
приставкой ортОу второго (HR03)—мепга и третьяго (H4R207)—
пиро.
Только азотъ представляетъ исключеніе: онъ не даетъ
ни орпго, ни тшрокислотъ, а лишь одну—метакислоту
(HN03).
Типу R203 отв?чаетъ кислота съ ЗН20, т.-е. R203-f-
-j- 3H20 ===== 2H3R03, и только у азота по исключенію:
N203 + H20 = 2HN02.
Въ названіяхъ кислоты отъ разныхъ окисловъ отли-
чаютъ по окончаніямъ прилагательныгь, т.-е. отъ R205
кислоты им?ютъ окоычаніе: ая (азотная, фосфорная,
мышьяковая, сурьмяная), а отъ R203—истая (азотистая,
фосфористая, мышьяковистая).
Галоидныя соединенія въ этой групп? вообще мало
прочны; обыкновенно легко разлагаются водой, при чемъ
галоидъ съ водородомъ воды образуетъ галоидоводород-
ное соединеніе, а элементъ, соединенный съ галоидомъ,
при разложеніи даетъ кислоту, наприм?ръ: RX3 -j-3H20 =
= 3HX + H3R03.
;\; Кислородный соединенія азота.
§ 12&. Азотъ съ кислородомъ даетъ пять окисловъ;
тремъ изъ нихъ соотв?тствуютъ кислоты:
N205—азотный ангидридъ—безцв?тпые кристаллы,
N204 или 2Ю2—двуокись азота—желтоватая жидкость и
бурый газъ,
N203—азотистый ангидридъ—бурый газъ,
NgOg* или N0—окись азота—безцв?тный газъ,
N20—закись азота—безцв?тный газъ.
JNT205, N203 и N20, соединяясь съ водой, образуюсь
кислоты: первый — азотную HN03 (N205-f-H20==2HN03),
второй — азотистую HN02 (N203 + H80 = 2HN02) и
третій—азотноватистую HNO (N2O + H20 = 2HNO).
Окиселъ N204 (или N02) съ водой даетъ дв?
кислоты—азотную и азотистую: N204 + H20 = HN03 + HN02;
отсюда и самый окиселъ можно разсыатривать, какъ
продукта сочетанія окисловъ—N205 и N203 (N205 H—N203=
=2N204). Окиселъ N202 или N0 съ водой не соединяется
и кислоты не даетъ, а потому и должеыъ быть названъ
индиферентнымъ.
Рис. 82. Соединеніе азота съ кислородомъ подъ вліяяівмъ
электрической искры.
— 331 —
Несмотря на такое обиліе соединеній азота съ
кислородомъ, лрямое ихъ соединеыіе затруднено. Оно возможно
лишь при д?йствіи электрическихъ искръ на ом?сь азота
и кислорода. Такой опытъ можетъ быть произведенъ въ
форм?, показанной на рис. 82: на цилиндр? А надъ
ртутью собраны газы азотъ и кислородъ; пропуская
чрезъ эту см?сь рядъ электрическихъ искръ, и можно
вызвать соединеыіе азота съ кислородомъ: получается КО,
которое съ кислородомъ воздуха легко даетъ N02; N02
съ водой даетъ см?сь
НЖ)3 и HN02 (см. да- в
л?е).
Подобный же опытъ
можно произвести еще
въ сл?д. форм?: если въ
большую колбу (рис. 83)
черезъ боковыя отверстія
ввести электроды, какъ
показано на рисунк?, со-
?динивъ ихъ съ сильной
спиралью Румкорфа, и
пропускать черезъ нахо-
дящійся въ колб? воз-
духъ (въ немъ есть и
N и О) рядъ сильныхъ
электрическихъ лскръ,
то между электродами
будетъ желтоватое пламя горящаго въ кислород? азота.
Воздухъ въ колб? бур?етъ отъ образующихся окисловъ
азота.
Такъ какъ вс? кислородный соединенія азота
получаются изъ азотной кислоты и ея солей, то ее и сл?ду-
етъ разсмотр?ть прежде всего.
Рис. 83. Соедин?ніе азота съ
кислородомъ.
— 332
Азотная кислота, HN03.
Молек.в. HJV08= 63,01. Уд. в.— 1,56 при ОК Теш. шавл.= —41,2»
Темп, кип = 860 при 760 мм оДрый составъ; О = 76,13<Y0; К= 22,270/о;
Н=1,60о/0.
§ 126. Азотная кислота въ природ? находится не въ
свободномъ видЬ, а въ вид? солей (селитръ), которыя
образуются при гніеніи азотястыхъ веществъ въ присут-
ствіи оснований и при участіи микроорганизмовъ; такъ,
игв?стны болыпія залежи чиліиойой сглитры — аготкока-
тріев<?й соли—NaN03. КромЬ того, азотная кислота была
находима въ незначительныхъ количествахъ въ вид? аммо-
ніевой соли въ дождевой водЬ, гдЬ присутствіе ея
объясняется дЬйствіемъ воздушнаго электричества на азотъ,
кислородъ и водяные пары воздуха.
Иолученіе. Азотная кислота въ свободномъ вид? мо-
жетъ быть получена дізйствіемъ на ея соли cfepnoio
кислотой. Если, наприм?ръ, чилійскую селитру (5 ч.)
обработать въ реторт? (рис. 84) крЬпкой сЬрной мсло-
Рис. 84. Полученіе азотной кислоты.
— 333 —
той (3 ч.) при слабомъ (но .не ниже 86° темп, кип?нія
HNOa) нагр?вакіи, то получатся кислая с?рнонатріевая
соль и азотная кислота, которая, испаряясь, будетъ
сгущаться въ охлаждаемомъ пріемник?:
NaN03 + H2S04 = NaHS04 + HN03.
Безъ нагр?ваніЯ) т.-е. когда HN03 не будетъ
удаляться изъ сферы реакціи, реакція сд?лается
обратимой.
Если взять кислоты вдвое меньше, то иолучимъ
среднюю с?рнонатріеву соль: 2NaNOa -(- H2S04 — Na2S04 -f-
-|-2HN03; но реакція при этомъ идетъ гораздо трудн?е
и требуетъ бол?е высокой температуры, при которой
часть азотной кислоты разлагается по сл?д. уравненію:
2НШ3 = 2Ж>2 + 0 + Н20,
и кислота окрашивается двуокисью азота въ бурый
цв?тъ.
При этой же реакціи легко приготовить такъ
называемую дымящую азотную кислоту (красную), т,-е.
содержащую въ раствор? значительное количество
азотноватой окиси (N204). Для этого во время перегонки въ
реторту со см?сью NaNOg -f- H2S04 прибавляютъ немного
крахмала, который и переводитъ часть азотной кислоты
въ азотноватую окись. Дымящая азотная кислота д?й-
ствуетъ наибол?е энергично, наприм?ръ, органическія
вещества въ ней воспламеняются. Перегонку азотной
кислоты обыкновенно ведутъ подъ уменыненнымъ давле-
ніемъ: тогда кип?ніе совершается, конечно, при низшей
температур? и съ гораздо меныпимъ разложеніемъ.
Заводскій способъ лолученія азотной кислоты предста-
вленъ на рис. 85: цилиндрическая чугунная реторта а
вмазывается въ печь, наполняется NaN03 и H2S04 и
закрывается крышкой; посл?дняя замазывается глиною съ
гипсомъ. Изъ реторты пары HN03 выходятъ чрезъ отвод-
334 —
Рис. 85. Заводскій способъ полученія азотной кислоты.
пую трубку и идутъ въ рядъ глиияныхъ кувшиновъ-прі-
емниковъ J?, соединениыхъ между собою трубками, гд?
и сгущаются въ жидкость. Несгустившіеся окислы азота
проходятъ въ башню D и зд?сь поглощаются водой,
стекающей по кирпичамъ, положеннымъ въ кл?тку.
Разбавленная азотная кислота, стекающая на дно башни,
перетекаетъ въ сосуды С. Наибол?е чистая HN03
находится въ среднихъ кувшинахъ В; въ кувшинахъ, бли-
жайшнхъ къ ретортЬ, содержится механически увлекаемая
с?рная кислота, а въ кувшинахъ, ближайіпихъ къ башн?
D, прим?шиваетея хлористый водородъ, такъ какъ къ
селитр?, обыкновенно, прим?шена NaCI.
Биркеландъ (Вігкеіаш)) и Эйде (Eyde) выработали
методъ полученія HN03 изъ азота воздуха д?йствіемъ
на него электрической св?товой дуги, пом?щенной между
полюсами весьма сильнаго электромагнита; при такихъ
условіяхъ св?товая дуга при перем?нномъ ток?
принимаете форму плаченнаго диска съ діаметромъ до 2-хъ
метровъ; такой дискъ заключенъ въ коробку, чрезъ
которую прогоняется быстрый токъ воздуха и около 2% N
превращается въ N0; последняя съ О воздуха
переходить въ N02, a N02 съ Н20, соединяясь, даетъ:
2Х0Я -f Н20 = IJN03 4- HN02.
— 335 —
Въ настоящее время по указанному методу работаетъ
большой заводъ въ Норвегіи въ Nottodden^ близъ Хри-
стіаніи х).
Свойства. Азотная кислота представля?тъ безцв?тную
жидкость, довольно подвижную, слабо дымящую на воз-
дух?, уд?льнаго в?са при 0°=1,56, кипящую при 86°,
а при—41,2° застывающую въ кристаллическую массу.
Азотная кислота растворяется въ вод? во вс?хъ отноше-
піяхъ, при чемъ 68°/0-ьій растворъ, отв?чающій формул?
2HN03.3H20, кипитъ при 120,5° и перегоняется безъ
изм?н?нія; такой составъ обыкновенно и им?етъ
продажная (концентрированная) азотная кислота2). Мзъ
продажной HN03 можно легко получить кр?пкую: для этого
надо прибавить къ ней воду отнимающаго вещества,
наприм?ръ, H2S04, и перегнать; при 86° будетъ перего-
і) Въ вид? лекціоннаго опыта можно будетъ показать образова-
ніе HN"03 сл?д. образомъ: берутъ большую колбу, заткнутую
пробкой, черезъ которую пропущены дв? трубки—одна до дна колбы, а
другая оканчивается около пробки. Закр?пивъ колбу (лучше кругло-
допную) въ штатив?, пропускаютъ ч?резъ длинную трубку (доходящую
до дна) воду изъ водопроводнаго крана, всл?дствіе чего колба во
время опыта остается холодной. Если подъ колбой зажечь гор?лку,
то на поверхности колбы будутъ осаждаться капельки воды (про-
дуктъ гор?нія), содержащія азотную кислоту; капельки, накопляясь,
будутъ стекать съ колбы и ихъ можно собрать въ фарфоровую чашку.
Прилитый къ этимъ каплямъ растворъ дифениламина (рсактивъ на
HN03) въ с?рной кислот? дастъ синее окрашиваніе. (Сообщилъ С. Ф.
Нагибинъ).
2) Продажная азотная кислота (Acidum nitricum 65—68о/0)
обыкновенно им?етъ уд. в. отъ 1,3325 (36° Б.) до 1,410 (41<> Б.) и
содержись большею частью сл?д. прим?си: хлоръ, с?рную кислоту,
окислы азота (N"203 и N02), часто соедин?нія жел?за и др. соли. Отъ
H2S04 освобождаютъ азотную кислоту прибавленіемъ селитры (KN03)
и перегонкой: съ первой порціей перегона уходятъ и вс? летучія
прим?си. Въ общежитіи азотную кислоту часто называютъ кр?пкой
водкой или селитряной кислотой.—Acidum nitricum fumans-дымящая
азотная кислота; красно-бурая жидкость, выд?ляющая желто-красные
пары, уд. в. 1,485—1,500. содержитъ не мен?е 86<>/0 азотной.кислоты;
очень сильный окислитель.
— 336 —
няться безводная HN03. На воздух?, а особенно на сол-
нечномъ св?т?, азотная кислота частью разлагается,
окрашиваясь выд?ляющеюся двуокисью азота въ бурый
дв?тъ. Разложеніе это идетъ, какъ сказано выше, по
уравненш' 2HN03 = 2N02 -j- О -f- Н20. Окислы азота йзъ
азотной кислоты легко удаляются при продуваніи чрезъ
носл?днюю воздуха, лучше—при нагр?ваніи.
Въ химическомъ отношеніи азотная кислота — очень
сильная одноосновная кислота (въ водномъ раствор?
почти сполна распадается на іоны); она растворяетъ вс?
металлы, за исключеніемъ золота и платины. Азотная
кислота д?йствуетъ, какъ сильный окислитель. Реакція
съ металлами идетъ такимъ образомъ, что сначала
образуется окиселъ металла, который (кром? окисловъ олова
и сурьмы) реагируетъ дал?е съ избыткомъ кислоты; часть
кислоты при отомъ раскисляется, выд?ляя воду и окислы
азота, наприм?ръ:
2Fe + 2HN03 = Fe203 + H20 + 2NO,
Fe208 -f 6HN08 = 2Fe(]S03)3 «f 3H20.
Для м?ди эта реакція выразится такъ:
1) 3Cu + 2HN08 = 3CnO + 2NO + H80,
2) 3CuO + 6HN08 = 3Cu(N03)84-3H80;
иди, суммируя эти два уравненія: 3Cu + 8HN03 =
= ЗСи(Ж)3)2 + 4Н20 + 2NCP).
Органическія красящія вещества быстро обезцв?чи-
ваются азотной кислотой. На кож? азотная кислота
оставляетъ желтыя пятна, а кр?пкая кислота сильно
разъ?да?тъ кожу. Н?которые металлоиды (напр., с?ра,
фосфоръ и др.) переводятся ею въ соотв?тствующія
кислоты. Д?йствуя окисляющимъ образомъ, азотная кислота
сама раскисляется, переходя въ низшіе окислы азота.
і) Вообще при д?йствіи металдовъ на HN"03 водородъ ея н? вы-
д?ляется овободнымъ, а идетъ на возстановденіе HN03, чаще до
окисловъ N0 или N20, или же иногда—до КН3.
— 337 —
Иногда азотная кислота раскисляется даже до амміака.
Такъ, если на слабую азотную кислоту (5 — 6°/0)
Действовать металлическимъ цинкомъ, то цинкъ растворяется,
а выд?ляющійся вОдородъ д?йствуетъ въ моментъ выд?-
ленія на избытокъ 'азотной кислоты, переводя ее въ ам-
міакъ; поэтому въ раствор?, кром? азотноцинковой соли,
находится еще азотноаммоніева соль:
1) 4Zn+8HN08=4Zn(NO8)2 + 4Hj),
2) HN08 + 4H8 = NH8 + 3H20,
В) NH8 + HN08 = NH4N08J
или, выражая все это въ общемъ уравненіи, им?емъ:
4Zn + lOHNOg = 4Zn(N08)a + 3H20 + NH4NOs-
Если см?шать одну часть кр?пкой азотной кислоты
съ тремя частями соляной кислоты, то получается такъ
называемая царская водка, растворяющая платину и
золото, которыя даютъ при этомъ хлорные металлы, такъ
какъ азотная кислота окисляетъ водородъ соляной
кислоты, и д?йствующимъ веществомъ при этомъ является
хлоръ, что видно изъ сл?дующаго уравненія:
HN08+3HC1=C12+N0C1 (хлористый нитрозилъ) -f 2Н20.
Вс? соли азотной кислоты 3) растворимы въ вод? и
разлагаются при накаливаніи съ выд?леніемъ кислорода,
напр., KN08=KN02+0, или Cu(N08)2=CuO+2N02+0.
Азотная кислота им?етъ широкое прим?пеніе:нвиі]).,
при производств? с?рной кислоты, анилиновыхъ красокъ,
нитроглицерина (динамита), пироксилина, бездымнаго
пороха, для очистки (травленія) металлическихъ вещей, для
гравированія на металл?, для приготовленія азотнокис-
лыхъ солей и проч.
*) Только н?которыя основныя соли, напр., у висмута (см. дал?е
висмутъ) очень трудно растворимы.
Неорганическая зшмія. 22
— 338 —
Азотный ангидридъ, N205.
Мол. в. Na03 = 108,02. Темп, плавл. = + 30°. Темп, кии?нія = 45°.
о/і-ыМ состав-ь: О = 74,0іо/0; К == 25,99%.
§ 127. Йолученіе, Азотный ангидридъ получается
отнятіемъ воды отъ кр?пкой азотной кислоты посред-
ствомъ фосфорнаго ангидрида при охлажденіи:
2HN03 + P206 = 2HP03 + N205-
^20g — кристаллическое вещество, плавящееся при
30° и кипящее около 50; онъ легко разлагается на
двуокись азота и кислородъ; разложеніе можетъ
происходить со взрывомъ даже подъ вліяніемъ св?та. Жадно
поглощая воду, N205 образуетъ азотную кислоту:
Na06-f H20 = 2HNOa.
Азотный ангидридъ—очень сильный окислитель; при
окисленіи разлагается по уравненію: 2N205 = 4N02-f-02.
Азотноватая окись, N02 и N204.
Мол. в. NOa = 46,01; Х204 —92,02. Темпер, плавл. = — 90. Темпер,
кип. = + 220. о/0-ый составъ: О =г69,50о/0; N = 30,50о/0.
§ 128. Полученіе. Азотноватая окись можетъ быть
получена накаливаніемъ сухой азотносвшщовой соли (ри-
сунокъ 86): въ реторт? остается окись свинца, а бурые
пары азотноватой окиси охлаждаются въ пріемник? въ
св?тло-желтую жидкость. Реакція идетъ сл?дующимъ
образомъ:
Pb(N03)2 = 2N02 -f PbO -f О.
N02 получается такъ же легко прямымъ соединеніемъ
окиси азота (NO) съ кислородомъ.
Азотноватая окись им?етъ два видоизм?неяія, отв?-
чающія формуламъ N204 и N02, на что указываетъ плот-
— 339 —
Рис. 86. Подуч?ні? азотноватой окиси.
ность этихъ соединении При бол?е низкихъ температу-
рахъ сущ?ствуетъ преимущественно N204, которая съ
повышеніемъ температуры перехрдитъ въ 2^N02. Зд?сь
происходить диссодіація вещества.
Свойства. Четырехокись азота представляетъ собою
желтоватую жидкость, кипящую при 22° и застывающую
въ б?лую кристаллическую массу при—9°. При повыше-
ніи температуры четырехокись азота окрашивается все
бол?е и бол?е въ темно-бурый цв?тъ. Это объясняется
разложеніемъ четырехокиси на двуокись азота, которая
бураго цв?та.
При см?шенщ съ водой жидкая азотноватая окись
образуетъ азотную и азотистую кислоты:
N204 + Н20 = HN03 + HN02.
Всл?дствіе этого жидкую четырехокись можно разсма-
тривать какъ ангидридъ, см?шанный изъ азотнаго и
азотистаго ангидридовъ:
NA + NA-2N204.
22*
— 340 —
Азотноватая окись обладаетъ сильпо окислительными
свойствами: она энергично разрушаете органическія
вещества.
Азотистый ангидридъ, N2031).
Мол. в?съ К203^ 76,08. о/0-ыи составь: О = 63;100/0; N = 36,900/0
§ 129. Лолученге. Азотистый ангидридъ, правда,
нечистый, получается при перегонк? HN03 съ мышьякови-
стымъ ангидридомъ; точно такъ же онъ получается про-
пусканіемъ окиси азота въ жидкій азотноватый ангидридъ,
охлаждаемый до—21°.
N204 + 2NO = 2N203.
Свойства. Это темно-синяя жидкость, кипящая при
3,5° и въ присутствіи сл?довъ влаги легко разлагающаяся
на составляющее его окислы; сухой же N203 не распаг
дается. При д?йствіи на него воды, охлажденной до 0°,
получается растворъ азотистой кислоты:
Na03 + H20 = 2HNOa.
При попыткахъ выд?лить изъ водныхъ растворовъ
свободную HN02 всегда наблюдаютъ разложеніе ея на
воду и ангидридъ:
2HN02 = H20 + N203,
а посл?дній распадается на N0 и Ж)2:
Na08=NO + NOr
*) Есть указанія, что молекула чистаго азотистаго ангидрида,
в?роятно, выражается удвоенной формулой; т.-е. Х|08 (аналогично
Р4Ов и AS406).
- 341 —
Азотиетая кислота, HNOa.
Мол. в?съ HN02 = 47,01. о/0-ый составъ: 0 = 68,01%; N = 29,850/0;
Н = 2Д40/0.
§ 130. Азотистая кислота въ свободномъ состояніи
неизв?стна: изв?стны лишь ея соли, которыя могутъ быть
получены прокаливаніемъ соотв?тствующихъ азотнокис-
лыхъ солей съ веществами, отнимающими кислородъ,
наприм?ръ, со свинцомъ, который переходитъ при этомъ
въ окись свинца:
KN03 + Pb == ЮЮ2 -f PbO.
Сильный кислоты разлагаютъ азотистыя соли съ вы-
д?леніемъ бурыхъ паровъ, состоящихъ изъ окиси и
двуокиси азота.
Изъ іодистыхъ металловъ азотистая кислота (растворъ
азотистокислой соли, подкисленный с?рной кислотой:
KNOa + H2S04 = HN08 + KHS04) выд?ляетъ іодъ:
KN02 + H2S04 + KJ = J + N0+K2S04 + H20,
или HN02 + HJ = H20 + J + NO.
Сильноокисляющими веществами азотистая кислота
окисляется въ азотную кислоту.
Окись азота, N0.
Мол. в. N0 = 30,04. Темп. плавл. =— 1500. Темп, кип. — — 142,40
при 757,2 мм. Критич. темп. — 93,50. Уд. в?съ жидкой N0 (при критич.
темп. — 93,50) = 1,039. Плотя, газообразной КО (возд. ="і) = 1,039.
о/0-ыи составъ: 0 = 53,26о/0; N = 46,740/0.
§ 131. Полученіе. Окись азота получается при д?й-
ствіи азотной кислоты (уд. в. 1,2) на н?которые металлы,
наприм?ръ, на м?дь, серебро, ртуть (рисунокъ 87).
Реакция идетъ по уравненію:
ЗСи + 8НЖ)8 = 3Cu(N03)244H20+2NO l).
]) Объясн?ніе этого ураваенія приведено на стр. 336.
— 342
Рис. 87. Полученіе окиси азота.
Свойства. Окись азота — безцв?тный газъ, быстро
бур?кщій на воздух?, такъ какъ обладаете
способностью, соединяясь
съ кислородомъ,
переходить въ бурую
двуокись азота. На сл?-
дующ?мъ опыт? можно
показать этотъ пере-
ходъ окиси азота (N0)
въ двуокись азота:
верхній сосудъ (рис. 88)
наполня ю т ъ окисью
азота и закрываютъ
плотно пробкой, въ
которую проходять
дв? трубки—одна
прямая А, опущенная
вя?шшшъ концомъ въ
стаканъ съ водой, а другая ?, согнутая подъ угломъ.
Если чрезъ трубку В впустить немного кислорода, газъ
въ верхнемъ сосуд? побур?етъ, т.-е. часть N0 перейдете
въ N02; вода по трубк? А поднимется въ верхній сосудъ
и растворить N02, а остатокъ газа опять станете без-
цв?тнымъ. Приводя достаточное количество кислорода
къ N0, можно легко перевести всю ее въ N02; вода же,
растворяя посл?днюю, заполнить весь верхній сосудъ;
въ водномъ раствор? нетрудно доказать присутствие кис-
лотъ—HN08 и HN02.
Окись азота можетъ сгущаться въ жидкость, кипящую
при—154°. На воздух? легко окисляется; въ вод? мало
растворима; растворяется же въ раствор? жел?знаго
купороса, окрашивая его въ бурый пв?тъ, при этомъ
образуется непрочное соединеніе состава (FeS04)2NO.
Окись азота способна поддерживать гор?ніе н?которыхъ
т?лъ, и именно т?хъ, при гор?ніи которыхъ выд?ляется
много теплоты, необходимой для разложенія N0. Такъ,
— 343 —
зажженный фосфоръ продолжаетъ гор?ть въ окиси азота
яркимъ пламенемь, тогда какъ зажженная с?ра или
тл?ющій уголь, развивающіе при гор?ніи мало тепла, въ
ней потухаютъ.
Рис. 88. П?реходъ N0 въ NOa.
Если вь цилиндръ, наполненный окисью азота, влить
несколько капель с?рнистаго углерода (CS2) и поджечь,
то см?сь паровъ с?роуглерода и окиси азота сгораетъ
яркимъ синимъ пламенемь, богатымъ химически д?й-
?твующими лучами.
— 344 —
Закись азота, N20.
Мол. в. N20 — 44,02. Темп, кип. — — 87<>. Уд. в. жидк. NaO= 0,9369
при 00- 0/о-ый составь: N = 63,710/0; 0 = 36,290/в-
§ 132. Полученіе. Закись азота получается накалива-
ніемъ сухой азотно-аммонійной соли MI4N03 (рис. 89):
NH4N03 = 2H20 + NzO.
Свойсупва. Закись азота представляеть собою без-
цв?тный газъ съ сладйоватымъ вкусомъ и слабымъ запа-
Рис. 89. Полученіе закиси азота.
хомъ, въ 1,5 раза тяжел?е воздуха. Въ холодной вод?
хорошо растворима (1 об. воды при 0° растворяетъ
1,305 об. N20), а потому собираютъ ее надъ теплой
водой. При охлажденіи до—87° или при давленіи въ 30 атмо-
сферъ при 0° закись азота сгущается въ прозрачную
жидкость, которая, испаряясь на воздух?, охлаждается
до—100° и застываетъ въ кристаллическую массу,
плавящуюся при—102°.
Закись азота лучше поддерживаетъ гор?ніе, ч?мъ
окись азота, хотя и содержитъ меньше кислорода: такъ,
тл?ющая лучинка въ ней вспыхиваетъ и горитъ какъ въ *><
кислород?. Это объясняется т?мъ, что кислородъ закиси
— 345 —
слабо соединенъ съ азотомъ, и потому для разложенія
требуется невысокая температура. Калій, натрій и жел?зо
горятъ въ N20 при нагр?ваніи..
При разложеніи закиси азота оказывается, что выд?-
лившійся азотъ занимаетъ такой же объемъ, какъ и
взятая окись азота: 2 об. азота -)-1 об. кислорода = 2 об.
¦ закиси азота.
При вдыханіи закись азота производить опьян?ніе и,
након?цъ, безчувственность, почему и называется „весе-
лящимъ газомъ"; прим?няется вм?сто хлороформа
зубными врачами и акушерами при операціяхъ.
Азотноватистая кислота, HN"0. Соли ея получаются при д?й-
ствіи амальгамы натрія на соли азотной или азотистой кислотъ, напр.:
2N'aN08 + 8Na + 4H30 = 2№aN'0 + 3XaOH, или 2\аЖ)2 + 4N& +
4- 2Н20 = 2№аіМ"0 + 4N"aOH. Самая азотноватистая кислота
приготовлена д?йствіемъ соляной кислоты па серебряную соль
азотноватистой кислоты; въ свободномъ состояніи она представляетъ б?лое
кристаллическое вещество, легко разлагающееся со взрывомъ. Водный
растворъ ея н?сколько прочн?е, но все-таки скоро выд?ляетъ N30—
ангидридъ азотноватистой кислоты.
Вс? окислы азота суть эндотермическія соединенія,
т.-е. образуются съ поглощеніемъ тепла:
N20 = —1,77К; N0= —21,5К;
Na08 = —32,2K; N204 = —5,2K; N205 = —1,2К.
Эндотермическое происхожденіе окисловъ азота объ-
ясняетъ и ихъ непрочность и ихъ большую энергію въ
рсакціяхъ.
§ 133. Существуешь еще соединеніс азота, называемое
гидроксиламиномг NH2OH. Онъ получается при д?йсгвіи
водорода въ момептъ выд?лепія на окись азота:
N0-|-3H = NHa0H.
Свойства. Свободный
гидроксиламинъ—кристаллическое т?ло, плавящееся при 33° и легко разлагающееся;
— 346 —
онъ жадно соединяется съ водой. Водный растворъ гидро-
ксиламина облада?тъ щелочными свойствами: съ
кислотами онъ, подобно амміаку, образуетъ соли, наприм?ръ,
NH2OH . HCJ. (ХН2ОН)2. H3S04, являясь слабымъ
одновалентными основаніемъ; соли гидроксиламина д?йствуютъ,
какъ сильные возстаиовители,
Соединенія азота съ галоидами.
§ 184, Съ галоидами азотъ даетъ соединенія:
NC13 — хлористый азотъ,
NBr3—бромистый азотъ,
ЖЫ2—іодиетый азотъ.
Хлористый азотъ получается д?йствіемъ хлора на
кр?пкій растворъ хлористаго аммояія (NH4C1 + 6C1 =
=NC13 -\- 4HCI), или при д?йствіи электрическаго тока
на NH4C1, въ вид? тяжелой маслянистой жидкости (уд.
в?съ 1,65), сильно взрывающей даже при легкомъ сопри-
косновеніи со многими т?лами.
іодиетый азотъ, NHJ2 получается въ вид? мелкаго
чернаго порошка, если къ кр?пкому раствору іода въ
водномъ раствор? іодистаго калія или въ спирт?
приливать избытокъ амміака. Высушенный черный поропіокъ
взрыва?тъ даже отъ мал?йшаго къ нему прикосновения1).
1) Чтобы показать это на опыт?, сл?дуетъ, приливши къ
раствору іода нашатырнаго спирта, вылить осахокъ съ жидкостью на
фидьтръ и, когда жидкость стечетъ, разорвать фидьтръ, пока онъ
еще мокрый, ла мелкі? кусочки. Когда кусочки фильтра съ іодистызгъ
азотомъ высохнуть, стоитъ только дотронуться до нихъ лучинкой или
гусиныиъ п?ромъ, какъ посд?дуютъ сильные взрывы, сопровождаемые
выд?леніемъ фіолетовыхъ паровъ іода.—Изв?стны соединения іода съ
азотомъ и другого состава? напр., NJg
— 347 —
Кислородный соединенія фосфора.
§ 135. Фосфоръ очень энергично соединяется съ кисло-
родомъ съ выд?леніемъ большого количества тепла и
св?та. Фосфоръ можетъ гор?ть въ кислород? даже подъ
водой: посл?днюю надо только подогр?ть до плавленія
фосфора. Гор?ніе это легко идегъ въ прибор?, показан-
номъ на рис. 90: въ пробирку, укр?пленную въ штатив?,
кладутъ кусочекъ фосфора и туда же вливаютъ до
половины пробирки воды; пробирку опускаютъ въ стаканъ
съ водой и нагр?вають; когда фосфоръ расплавится,
иропускаютъ изъ газометра слабую струю кислорода, и
фосфоръ вспыхиваетъ. При этомъ образуются окислы
фосфора: при избытк? кислорода—фосфорный ангидридъ
Р205, а при недостатк? его — фосфористый ангидридъ
Р406. Оба окисла, соединяясь съ водой, образуютъ
кислоты, л
Фосфорный ангидридъ. Р205.
Мол. в?съ РаОв = 142. о/0-ый составъ: Р = 43,68о/0; 0 = 56,32о/0.
§ 136. Получете. Фосфорный ангидридъ получается
при сжиганіи фосфора въ чашечк?, прив?шенной къ
стеклянной трубк? аЪ (рис. 91), въ баллон? А, чрезъ
который просасываютъ требуемый сухой воздухъ при
помощи аспиратора; воздухъ предварительно высушиваютъ
въ трубкв С съ хлористымъ кальціемъ. По м?р? сгора-
нія фосфора, чрезъ трубку аЪ бросаютъ новыя
количества его. Образующейся ангидридъ собирается частью въ
баллон?, частью въ пріемник?.
Свойства. Фосфорный ангидридъ1) представляетъ
собою б?лую хлопьевидную массу; онъ жадно соединяется
і) Плотность паровъ фосфорнаго ангидрида при краснокалиль-
номъ жар? отв?чаетъ формул? (P2O5V
— 348 -
съ водой, потому и употребляется въ лабораторіяхъ какъ
лучшее высушивающее вещество. Растворяясь въ вод?,
онъ образуетъ съ ней сначала м?тафосфорную кислоту:
Р20Б + НаО = 2НРОа,
которая при стояніи съ водой переходить постепенно въ
ортофосфорную кислоту Н3Р04.
Рис. 90. Гор?ні? фосфора подъ водой.
Фосфорный аыгидридъ, присоединяя 3 частицы воды
(а это происходить или при нагр?ваніи Р205 съ Н20
или при долгомъ стояніи НРОа съ Н20), образуютъ
ортофосфорную кислоту:
Р205 + ЗН20 = 2Н3Р04.
— 349 —
Посл?днця при накаливаніи можетъ терять часть воды
и переходить или въ пирофосфорную:
2Н8Р04 —H20 = H4Pa07J
или въ метафосфорную:
Н3Р04 — Н20 = НР03.
Рис. 91. Полученіе фосфорнаго ангидрида.
Фосфорная кислота (орто), Н3Р04.
Мол. в?съ Н3Р04 = 98,03. Темп. плавл.= 38,6°» Уд. в?съ сплавленной
кислоты =1,88 при 180. о/о-ый составъ: О == 65,28<>/D. Р = 31,84о/в,
Н = 3;О8о/0.
§ 137. Фосфорная кислота находится въ природ? въ
вид? ея кальціевыхъ солей, образуя фосфориты и
апатиты; фосфорнокальціевая соль является также главною
составною частью костей.
Полученіе. Фосфорная кислота получается окислені-
емъ фосфора азотной кислотой.
ЗР -J- 5HN03 + 2Н20 = ЗН3Р04 + 5NO.
— 350 —
Чаще всего она получается д?йствіемъ сЬрной
кислоты на фосфорнокальціевую соль (на костяную золу),
при этомъ фосфорная кислота остается въ раствор?, а
с?рнокислый кальцій выпадаетъ въ осадокъ:
Са3(Р04)2 -f 3H2S04= 2Н3Р04 -f 3CaS04.
Свойства. Фосфорная кислота представляетъ собою
б?лое кристаллическое вещество, притягивающее влагу
и потому расплывающееся на воздух?; плавится при 38,6°.
Фосфорная кислота трехосновна. Съ металлами она обра-
зуетъ три рода солей: кислоты, получающіяся зам?ще-
ніемъ одного изъ двухъ атомовъ водорода, и среднюю,
когда зам?щены вс? три водорода. Наприм?ръ: NaH2P04,
йа2НР04, Na3P04, или СаН4(Р04)2, Са2Н2(Р04)2, Са3(Р04)2.
Среднія соли ортофосфорной кислоты нерастворимы въ
вод?, за исключеніемъ солей щелочныхъ металловъ (К, Na
и NH4). Съ азотносеребряною солью фосфорная кислота
даетъ желтый осадокъ—отличіе отъ остальныхъ фосфор-
ныхъ кислотъ, дающихъ б?лые осадки. Фосфорная
кислота сильная (юны, главньшъ образомъ, Н и Н2Р04), но
слаб??, напр., соляной, с?рной и азотной: посл?дними
она выт?сняется изъ солей.
Пирофоефорная кислота, Н4Р207.
§ 138. Полученге, Пирофоефорная кислота получается при на-
гр?ваніи ортофосфорной кислоты до 250°: 2НаР04 — Н20 = H4P20-j.
Соли нирофосфорной кислоты получаются прокаливаніемъ двуме-
таллическихъ солеи ортофосфорной кислоты: 2NaaHP04 — Н20 =
= Ха4Р207.
Свойства. Пирофоефорная кислота — б?лая кристаллическая
масса, легко растворимая въ вод?. Она четырехосновна; яри нагр?-
ваніи съ содой пер?ходитъ въ ортофосфорную кислоту.
Метафосфорная кислота, НР03 *).
§ 139. Полученіе. Получается изъ фосфорной кислоты при на-
гр?ваніи ея до 300°, или при раствореніи Р205 въ холодное вод?.
*) Сущ?ствуютъ различный м?тафосфорныя кислоты, отличающіяся,
в?роятно, величиной молекулы: общій составь ихъ надо выразить фор-
— 351 —
Свойства. Метафосфорная кислота—б?лая стекловидная масса,
расплывающаяся навоэдух?. Метафосфорная кислота даегь съ азотно-
с?р?бряною солью б?лый осадокъ, подобно пирофосфорной кислот?,
но отличается отъ посл?дней т?мъ, что евертываетъ бгьлокъ* Этимъ
объясняется ядовитость фосфора, каторый, попадая въ организмъ,
окисляется въ Р205; фосфорный же ангидридъ, растворяясь въ вод?,
образуетъ метафосфорную кислоту, свертывающую б?локъ крови,
всл?дствів чего останавливается движеніе крови въ сосудахъ. Водный
растворъ метафосфорной кислоты при обыкновенной температур?
постепенно, а при нагр?ваніи—быстро, переходитъ въ ортофосфорную
кислоту: HP03-f Н20~Н3Р04.
Фосфористый ангидридъ, (Рй03) ^406.
Молек. в?съ Р406 = 220. Темп, плавл. = + 22,5°. Темп. кип. = 173°,
%-ый составъ; Р=г 59,38%, О^43,61о/0.
§ 140. Полученіе. Фосфористый ангидридъ получается
при медленномъ окисл?ніи фосфора при обыкновенной
температур? и при гор?ніи его при недостаточному при-
ток? воздуха. На рис. 92 представлено полученіе фосфо-
ристаго ангидрида: палочки фосфора кладутъ въ стеклян-
ныя трубочки; посл?д-
нія растіолагаютъ на
воронк? подъ стек-
ляннымъ колоколомъ.,
При такихъ условіяхъ
фосфоръ медленно
окисляется и
переходитъ въ Р406.
Свойства.
Фосфористый ангидридъ —
б?лое воскообразное
вещество, плавящееся Рис. 92. Полученіе фосфористаго ангид-
при 22,50 и кипящее Рида и Ф°сФ°рист0Й кислоты-
при 173°; онъ легко
окисляется на воздух? въ фосфорный ангидридъ; медленно
растворяясь въ холодной вод?, онъ хотя и образуетъ
мулой (ЫР08)п, гд? п есть ц?ло? число; вопросъ зтотъ еще мало
разъясненъ.
'ч*'
— 352 —
фосфористую кислоту, но въ очень небольшомъ коли
честв?:
P40G + 6H20 = 4H3P(V).
Опред?леніе плотности пара фосфористаго ангидрида
показываетъ, что составь частицы его выражается
формулой Р406.
При нагр?ваніи до 440° Р406 разлагается на красный
фосфоръ и двуокись фосфора Р204 (аналогъ N204).
Фосфористая кислота, Н3Р03.
Мол. в?съ Н3Р03 = 82,03, о/о-ый составь: 0=58,51%, Р = 37,8Ю/0,
Н = 3,680/0.
§ 141. Фосфористая кислота обыкновенно получается
разложеніемъ треххлористаго фосфора водой:
РС13 4- ЗН20 = ЗНС1 -f Н3Р03;
кром? того, какъ уже сказано, она образуется при окис-
леніи фосфора на влажномъ воздух?.
Свойства. Фосфористая кислота—безцв?тная твердая
масса, плавящаяся при 70,1°, очень гигроскопичная,
легко растворимая въ вод?; на воздух? легко окисляется,
переходя въ фосфорную, и поэтому обладаетъ возстано-
вительными свойствами; н?которы? металлы возстановля-
ются ею изъ растворовъ ихъ солей. Фосфористая
кислота двуосновна.
§ 1і2.{Строеніе кислотъ фосфора. Несмотря на то,
что фосфористая кислота содержитъ 3 атома водорода,
она двухосновна, т.-е. только два водорода могутъ быть
зам?щены на металлъ. Это, по теоріи строенія, объясняется
т?мъ, что въ кислородныхъ кислотахъ металлами зам?-
щается только водородъ, им?ющійся въ вид? гидроксиль-
ной группы. Фосфорная кислота содержитъ ихъ три,
і) Реакція между водой и РдОв — сложная: въ результат?
получается н?сколько фосфорныхъ кислотъ.
— 353 —
фосфористая—два, а фосфорноватистая — только одинъ
гидроксилъ, что изображается сл?дующими формулами:
Н8Р04=Р0(ОН)в; Н8Р08=НРО(ОН)2; Н8Р02=Н2РО(ОН).
Строеніе фосфорныхъ кислотъ на основаніи пятива-
лентности фосфора въ бол?е подробномъ вид? можно
изобразить сл?дующимъ образомъ:
Н3Р04
/ОН
0 = Р(-ОН
\ОН
НРО,
р|-о-
Чо
-н
*
н4р2о
Рк-О-
\°-
vo-
Р^-О-
^0
\
-Н
-н
-Н
-н
н2 =
н,ро,
/ОН
0 = Р<-ОН
\он
Н3Р02
он
V
= Р = 0
Фосфорноватистая кислота, Н3Р02. і
§ U3. (Молек. в?съ Н3Р03 = 66,03, %-ъгй составь: О = 48,45<>/о,
Р-=46397о/о, Н —4,58*>/0). Она можетъ быть получена изъ ея
натронной соли, а посл?дняя получается въ качеств? побочнаго продукта
при полученіи фосфористаго водорода (РН3) д?йстві?мъ ?дкаго натра
на фосфоръ (см. стр. 285). Это б?здв?тная густая жидкость, легко
окисляющаяся въ фосфорную кислоту, а потому она—энергичный воз-
становитель. Фосфорноватистая кислота одноосновна х).
Кислородныя соединенія мышьяка.
§ 144. Мышьякъ образуешь съ кислородомъ
мышьяковый ангидридъ—As205 и мышьяковистый—As203. Оба
соединенія съ водой образуютъ (очень слабыя) кислоты;
сл?довательно, оба окисла кислотны. Въ кислородныхъ
соединеніяхъ фосфора было отм?чено, что низшіе окислы
і) Существуешь еще фосфорноватая кислота Н4Р206, по свой-
свамъ близкая къ фосфористой кислот?.
Неорганическая химія. 23
— 354 —
легко переходили въ высшіе; у мышьяка же этотъ пере-
ходъ совершается трудн?е. Очевидно, большой атомный
в?съ мышьяка сильно ослабилъ его кислотныя свойства,
а потому и способность образовать высшій (а сл?дова-
тельно, и найбол?? кислотный) окиселъ зд?сь
затруднена.
Мышьяковистый ангидридъ, (As203) As406.
Мол?к. в?съ Asa03=198. Уд. в?съ отъ 3,69 до 3,74. %-ый составъ:
As = 75,780/0. О = 24.22<>/0.
§ 145. Цолученіе и свойства. Мышьяковистый
ангидридъ встр?чается въ природ? подъ названіемъ б?лаго
мышьяка. Онъ получается въ вид? б?лаго порошка
также при возгонк? мышьяковистыхъ рудъ. Для очищенія
его вторично возгоняютъ, и тогда онъ получается въ
вид? аморфной, прозрачной, стекловидной массы.
Стекловидный мышьякъ при стояніи мало-по-малу
кристаллизуется и переходитъ въ фарфоровидное изм?неніе,
отличающееся меныпимъ уд?льнымъ в?сомъ. Въ вод? As203
плохо растворимъ. Растворъ им?етъ сладковатый вкусъ
и слабокислую реакцію. As203 уже хорошо растворимъ
въ соляной кислот?, что ясно указываешь на его
слабокислотный характеръ. На организмъ д?йствуетъ очень
ядовитоа). Водородомъ въ моментъ выд?ленія
мышьяковистый ангидридъ возстановляется въ мышьяковистый
водородъ, а углемъ возстановляется въ свободный
мышьякъ; окисляющими веществами переводится въ
мышьяковую кислоту. Опред?іеніе плотности пара мышьяко-
вистаго ангидрида до 800° показываетъ, что ему сл?-
дуетъ придать удвоенную формулу, т.-е. Ag406, а при
1800°—As203; кріоскопическое опред?леніе (въ иитро-
бензол?) дало As406.
*) При отравленіи мышьякомъ противояді?мъ можетъ служить
св?жеосажденная водная окись ж?л?за} съ которой мышьяковистая
кислота да?тъ нерастворимое соединеніе.
— 355 —
Мышьяковистому ангидриду соотв?тствуетъ
мышьяковистая кислота—H3As03, неизв?стная въ свободномъ
состояніи. Соли ея получаются, наприм?ръ, при д?й-
ствіи на As203 щелочей: As203 -f- 6КОН = 2К2 As03 +
-[- ЗН20; мышьяковистая кислота образуетъ среднія трех-
металлическія соли, которыя могутъ быть прим?нены въ
качеств? раскислителей, при чемъ сами они окисляются
въ мышьяковыя соли1). Мышьяковистая кислота
относится къ очень слабымъ кислотамъ.
Мышьяковая кислота, H3As04.
Мол. в. HgAs04 = 142,03. о/0-ый составь: As — 52,83%, 0 = 45,040/0,
Н = 2,180/0.
§ 146. Полученге и свойства. Мышьяковая кислота
получается окиолені?мъ мышьяка азотного кислотою: это
б?лая кристаллическая масса, расплывающаяся на воз-
дух? и легко растворяющаяся въ вод?. Растворъ им?етъ
сильно кислую реакцію. Мышьяковая кислота трехосновна
и съ металлами, подобно фосфорной кислот?, образуетъ
три ряда солей. При нагр?ваніи она, теряя воду, пере-
ходитъ сначала въ пиромышьяковую кислоту:
2H3As04 — H20 = H4As207,
а зат?мъ—въ метамышьяковую:
H3As04 — HaO = HAsOa.
Кислоты эти, растворяясь въ вод?, переходятъ вновь
въ ортомышьяковую кислоту. Мышьяковая кислота по
сил? немного уступаетъ фосфорной кислот?.
При полной потер? воды мышьяковая кислота
переходить въ мышьяковый ангидридг (As205)n (мол. в. As2Ojj—
= 230; уд- в. = 3,734; %-ый составъ: As = 65,24%, О = 34775<>/0).
J) М?дная соль CuHAsOg, обладающая н?жнымъ зеленымъ цв?-
томъ, употребляется иногда въ кач?ств? краски.
23*
- 356 —
Это б?лая стекловидная масса, легко распадающаяся при
накаливании на мышьяковистый ангидридъ и кислородъ:
As205 = As203 + 02.
*
Молекулярный в?съ мышьяковаго ангидрида неизв?-
стенъ.
Мышьяковая кислота и мышьяковый ангидридъ
употребляются, какъ окислители.
Кислородный соединенія сурьмы.
§ 147. Въ кислородныхъ соединеніяхъ сурьмы особенно
ясно обнаруживается см?шанный металлоидный и металли-
ческій характеръ сурьмы. Высшій окиселъ сурьмы Sb2Os—
окиселъ вполн? кислотный, который съ водой даетъ
слабую кислоту. Сл?довательно, зд?сь сурьма является
металлоидомъ. Низшій же окиселъ Sb203 кислоты не
даетъ, а съ водою образуетъ основной гидратъ, дающій съ
кислотами соли (правда, соединяющійся и съ основаніями),
почему и называется окисью сурьмы, а но ангидридомъ;
такимъ образомъ, зд?сь проявляется металлическій
характеръ сурьмы. Существуешь и окиселъ съ формулой
Sb204.
Окись сурьмы, Sb203.
Мол. в. Sba03-=288. »/0-ый составъ: Sb = 83,38%, О^16,620/0.
§ 148. Полученге и свойства. Sb203—б?лый поро-
шокъ, получается или окисленіемъ сурьмы на воздух?
при нагр?ваніи, или же при д?йствіи на нее слабой
азотной кислотой.
Съ водой Sb203 прямо не соединяется; нерастворима
она въ с?рной и въ азотной кислотахъ; растворима же
въ кр?пкой соляной кислот? и въ щелочахъ. При
нагр?ваніи на воздух? Sb203 переходитъ въ Sb204.
— 357 —
(Гидрата окиси сурьмы Sb(OH)3 получается при д?й-
ствіи ?дкаго кали или натра на растворъ треххлористой
сурьмы (SbCl3) въ соляной кислот?. Онъ растворяется въ
кислотахъ, образуя соли, что указываешь на его основныя
свойства; но въ то же время онъ растворяется и въ
избытк? ?дкой щелочи, образуя соли сурьмянистой
кислоты, наприм?ръ, NaSb02 (Sb[OH]3 — Н20 = HSb02);
сл?довательно, гидратъ обладаетъ также отчасти и
слабокислотными свойствами.?
§ 149. Сурьмяная (правильн?е—метасурьмяная)
кислота HSb03. Кислота H3Sb04, соотв?тствующая орто-
фосфорной кислот?, повидимому, существуетъ, но очень
непостоянна. Бол?е изсл?дованы лишь соли пиросурьмя-
ной кислоты (H4Sb207) и сурьмяной или, в?рн?е, мета-
сурьмяной кислоты HSb03. Сурьмяная кислота получается
нагр?ваніемъ сурьмы съ кр?пкой азотной кислотой въ
вид? б?лаго порошка, нерастворимаго въ вод? и азотной
кислот?. Соли сурьмяной кислоты большею частью
нерастворимы въ вод?.
Кислая калійная соль пиросурьмяной кислоты
употребляется въ аналитической химіи для открытія натрія.
Сурьмяный ангидридъ. Sb205. (Молек. в?съ sb2O3 = 320;
о/гый составь: Sb = 75,070/0, 0 = 24, 93<>,0).
Получается слабымъ накаливаніемъ сурьмяной кислоты
въ вид? желтой аморфной массы, растворимой въ
соляной кислот?. Молекулярный в?съ его не опред?ленъ.
/ § 150. Галоидапгидриды. Кислоты группы азота мо-
гутъ зам?щать одинъ или бол?? своихъ водныхъ остат-
ковъ на галоидъ; при такомъ зам?щеніи и получаются
галоидангидриды кислотъ.
Напр., N02.OH(HN03) отв?чаетъ N02C1—хлористый
нитроилъ,
N0 . OH(HN02) я NO C1—хлористый
нитрозилъ
РО . (ОН)3(Н3Р04) ,г Р0С1а—хлорокись
фосфора
— 358 —
и т. д. Вс? галоидангидриды легко разлагаются водой
на галоидоводородную кислоту и на кислоту
участвующая металлоида, напр.:
N02C1 + Н20= НС1 + НХ08 ,
или POCJ3 + 3H20 = 3HCl + H3P04. '
С?рниетыя еоединенія элементовъ У группы.
§ 151. Азоть не образуетъ характерныхъ
устойчивые соединеній съ с?рой.
Фосфоръ (красный), нагр?тый при высокой темпера-
тур? съ с?рой, даетъ, смотря по количеству посл?дней,
различныя по составу еоединенія, среди которы'хъ выд?-
лены: P2S3, P2S5 и др., P2S3—желтыя ромбнческіД призмы,
плав, при 167° и кип. при 380°. P2S5—желтое кристалли-
чаеят ъащ&ътаа, шш^. щш. 274.° — ?T(j° vl usmsunpe беаъ
разложенія при 518°.
Оба указанный еоединенія разлагаются водой съ вы-
діреніемъ с?роводорода и образованіемъ фосфорныхъ.
кислотъ, напр., P2S5-(-8H20 = 5H2S + 2Н3Р04,
Мышьякъ съ с?рой даетъ, главяымъ образо**ъ>
еоединенія, отв?чающія по составу кислороднымъ соединеніямъ:
трехс?рнистый мышьякъ As2S3 и пятис?рнистый мышьякъ
As2S5; кром? нихъ существуетъ еще As2S2 (реа^ьгаръ).
Трехс?рнистый мышьякъ, As2S3 (мол. в. As2S3~246>18)>
встр?чается въ природ? въ вид? минерала аурииигмента;
получается онъ въ вид? лимонно-желтаго осадка- при
пропускали с?рнистаго водорода чрезъ растворъ хлористаго
мышьяка: 2AsCl3 + 3H2S = As2S3 + 6НС1.
Пятис?рнистый мышьякъ, As2S5 (мол. в. As2$5 = 310>3)>
получается въ вид? желтаго аморфнаго осадка при
пропускали с?роводорода чрезъ растворъ мышьяковой
кислоты или ея солей: 2H3As04-j-5H2S^ As2S5-f-8H20.
Пятис?рнистый мышьякъ растворяется въ с?рнистыхъ
щелочахъ, образуя сульфосоли (As2S5 + 3(NH4)2S ==
#
— 359
— 2 (NH4)3AsS4), по составу аналогичный солямъ соотв?т-
ственныхъ кислородныхъ кислотъ, наприм?ръ, H3AsS4
соотв?тствуетъ H3As04.
Сурьма образуетъ съ с?рой трехс?рнистую сурьму
Sb2S3 и пятис?рнистую сурьму Sb2S5.
Трехс?риистая сурьма, Sb2S3 (мол. в. Sbas3= ззбдв;
уд. в. (вода = 1) = 4,7; %-ый составъ: Sb = 71,460/O, S = 28,54°/о)»
находится въ природ? въ вид? темно-с?рой массы, из-
в?стяой подъ названіемъ сурьмяного блеска. Искусственно
получается она при д?йствіи с?роводорода на растворъ
соли окиси сурьмы въ вид? оранжеваго порошка; въ
кр?пкой соляной кислот? растворяется при нагр?ваніи:
Sb2S3 + 6НС1 = 2SbCl3 + 3H2S i).
Пятис?рнистая сурьма, Sb2S5 (мол. в?съ Sb2s5~ 400,3
о/о-ый составъ: Sb = 59;99о/0, S = 40,010/0), получается пропуска*
ніемъ с?роводорода въ растворъ солей сурьмяной кислоты
въ вид? оранжеваго осадка.
Sb2S5 образуетъ также сульфосоли отъ сульфосурьмя-
ной кислоты H3SbS4.
Галоидныя соединенія фосфора.
§ 152. Фосфоръ прямо соединяется съ галоидами,
образуя соединенія, отв?чающія формуламъ: РХ3 и РХ5,
гд? X есть какой-нибудь изъ галоидовъ—CI, Br или J.
ТреХХЛОриСШЫй фосфоръ, РС13 (мол. в. PCI3=z 137,35; уд.
в?съ (вода = 1) = 1,613 при 0°; пдотн. (возд. = 1) = 4,742; о/0-ый
составъ: сі = 77,4іо/0, р = 22,59о/0), образуется прямымъ соеди-
неніемъ хлора съ фосфоромъ при избытк? посл?дняго въ
вид? безцв?тной жидкости остраго запаха, кипящей при
76°. Водой легко разлагается на хлористый врдородъ и
фосфористую кислоту.
РС13 + ЗН20 — Р(ОН)3 + ЗНС1,
і) Красныя каучуковыя изд?лія окрашены красной аморфной
трехс?рнистой сурьмой.
— 360 —
сл?довательно, РСі3 можетъ служить воду отяимающимъ
веществомъ.
ПятиХЛОрисШЫй фосфоръ, РС15 (мол. в. РС15 = 208,25;
о/о-ыи составъ: СЬ=?5,110/0, Р=14;890/0), получается пропуска-
ніемъ струи хлора чрезъ жидкій треххлористый фосфоръ
въ вид? твердаго кристаллическаго вещества желтоватаго
дв?та; легко диссоціируетъ на РС13 и С12; на воздух?
дымитъ, при недостатк? воды разлагается ею па хлор-
окись фосфора РОС13 и хлористый водородъ:
РС1Б+НяО = 2НС1 + РОС18;
при избытк? же воды получаются хлористый водородъ и
фосфорная кислота:
РС16 + 4Н20 = Н3Р04 + 5НС1.
Сл?довательно, оба галоидныя соединенія фосфора
водой очень легко разлагаются, въ конц?-коіщовъ, на НС1
и кислоты Н3Р03 или Н3Р04, т.-е. по этой реакдіи они
вполн? аналогичны галоидангидридамъ кислотъ.
Соединенія фосфора съ другими галоидами во мно-
гомъ аналогичны хлористымъ соединеніямъ; получаются
также н?досредств?ннымъ соединеніемъ элементовъ.
Галоидныя соединенія мышьяка.
§ 153. Хлористый мышьякъ, AsCl3. (Мод. в. AsC]y =
—181,35; уд. в.=2,205 при 00; темп, плавд.= —18»; темп. кип.—130,2<>.
плотн. (возд. = 1) = 6,3; о/0-ыи составъ: As = 41,39%. С1 = 58,61<>/0);
Хлористый мышьякъ можетъ быть полученъ или пря-
мымъ д?йствіемъ хлора на мышьякъ или растворені?мъ
мышьяковистаго ангидрида въ соляной кислот?:
As203 + 6HC1 = 2AsCla + 3H20.
AsCl3—безцв?тная маслянистая жидкость, дымящая на
воздух?; въ неболыномъ количеств? воды растворяеіся,
избыткомъ же воды, подобно галоидангидридамъ, разла-
— 361 —
гается на хлористый водородъ и мышьяковистый аиги-
дридъ. Хлористый мышьякъ очень ядовитъ.
Соединеніе AsCl5 получается при д?йствіи хлора на
AsCl3 при 30°. Соединеніе это очень непрочно.
Галоидныя соединенія сурьмы.
§ 154. Сурьма, подобно фосфору, съ хлоромъ образу-
етъ тр?ххлористую сурьму SbCl3 и пятихлористую SbCl5.
Треххлористан сурьма, SbCl3 ( мол. в. SbC]3 — 226,35
%-ый составъ Sb = 53,12%, 01 — 46,88о/0)? получается раство-
реніемъ окиси сурьмы Sb208 въ кр?пкой соляной кис-
лот?; представляетъ безцв?тную кристаллическую массу,
плавящуюся при 73° и кипящую при 223,5°. Въ
подкисленной соляной кислотой вод? растворяется, избыткомъ
же воды разлагается, при чемъ выд?ляется хлорокись
сурьмы, SbOCl, въ вид? б?лаго осадка:
SbCl3 + Н20 = 2НС1 + SbOCl.
Зд?сь, очевидно, хлоръ прочн?е связанъ съ Sb, а
потому полнаго разложенія, какъ это было у фосфора и
мышьяка, не наблюдается. (Полной аналогіи съ галоид-
ангидридами зд?сь уже н?тъ.)
ЛятШЛОристая Сурьма, $ЬС\5. (Мол. в. SLC]5™297,25;
о/0-ый составъ: Sb=40,46<>/0, С1=59,54о/0). Пятихлористая сурьма
получается прямымъ соединеніемъ сурьмы съ хлоромъ, а
также насыщеніемъ расплавленной трехлористой сурьмы
хлоромъ. Это желтая жидкость, при—6° застывающая въ
кристаллическую массу; на воздух? она сильно дымитъ
и избыткомъ воды разлагается на пиросурьмянную
кислоту и хлористый водородъ (зд?сь опять полная анало-
гія съ галоидангидридами). Въ общемъ SbCl& по свой-
ствамъ напоминаетъ РС15, только обладаетъ н?сколько
большею устойчивостью*
— 362 —
Задачи: 1) Сколько надо воздуха для сжиганія 10 гр. фосфора,
10 гр. мышьяка и 10 гр. сурьмы?
2) Разсчитать, сколько свободнаго хлора получится при
д?йствіи царской водки, если для получ?нія
необходимой для этого азотной кислоты взято 100 гр. КаЖ)^
3) Сколько надо взять азотной кислоты, чтобы сжечь
50 гр. угля?
Кислородный, с?рнистыя и галоидныя соединены
группы кислорода.
§ 155. Соединенія кислорода съ металлоидами 4-й и
5-й группъ уже разсмотр?ны; соединенія же селена и
теллура во всемъ аналогичны соедин?ніямъ с?ры;
соединенія с?ры съ элементами 4-й и 5-й группъ также
разсмотр?ны при соотв?тствующихъ группахъ и, сл?дова-
тельно, остается разсмотр?ть зд?сь только соединенія
с?ры съ кислородомъ и съ галоидами.
С?ра съ кислородомъ образуетъ 2 главныхъ окисла:
S02—с?рнистый ангидридъ и S03—с?рный ангидридъ1),
которые оба кислотны, такъ какъ съ водою даютъ
кислоты, а именно:
S02-|-H20 = H2S03 (с?рнистая кислота),
S03 4-H20 = H2S04 (с?рная кислота).
С?рниетый ангидридъ, S02.
ЗЙол. в. S02 — 64,06. Уд. в. жидкаго S02 при—20° (вода —1) = 1,49.
Уд. в. газообразнаго S02(H = 1) = 32,22. Плотность (возд. == 1) — 2,26
при С*. Темп, плавл. = — 760. Темп. кип. =— 8"; критич. темп. + 156*>.
о/о-ый составъ: S = 50,05 о/0, О = 49,95<>/0.
§ 156. Получепье. S02 получается при непосред-
ственномъ соединеніи с?ры 2) съ кислородомъ при
і) йзв?стны еще окислы S20 и S2C>7 — тоже ангидриднаго
характера.
2) Вм?сто свободной с?ры можно брать с?рнистые металлы
(колчеданы); они также при сжиганіы даютъ SOg.
— 363 —
ея гор?ніи на воздух? или, еще лучше, въ кисло-
род?:
S + 20 = 802!),
при чемъ 32 ч. твердой с?ры, соединяясь съ 32 ч.
кислорода, т.-е. образуя S02, развиваютъ 7іК тепла; сл?-
довательно, S02—очень прочное соединение.
Его можно получить въ чистомъ вид? разрушеніемъ
солей отв?чающей ему с?рнистой кислоты H2S03 бол?е
сильными кислотами, наприм?ръ:
Na2S03 + H2S04 = Na2S04 + H2S03;
выд?ляющаяся при этой реакдіи с?рнистая
кислота—соединеніе крайне непрочное—уже при обыкновенной тем-
ператур? распадается на ангидридъ и воду:
H2S03 = H20 + S02.
Наконецъ с?рнистый ангидридъ получается при д?й-
ствіи м?ди на с?рнуто кислоту (приборъ такой же, какъ
на рис, 87)2):
1) H2S04 + Cu = CuO-f-H2S03,
2) H2S03 = H20 + S02.
Образовавшаяся CuO реагируетъ съ другой частицей
H2S04 и даетъ CuS04 по уравненію:
3) CuO + H2S04 = CuS04-fH20.
і; Изъ уравненія видно, что объемъ получающагося S02 (1
молекула) равенъ объему вошедшаго въ его составъ кислорода (1
молекула). Вм?ст? съ S02 при гор?ніи с?ры,образуется и небольшое
количество S03.
2) На 1 в?с. часть м?дныхъ стружекъ берутъ 3—4 в?с. части
кр?пкои с?рной кислоты и в?дутъ р?акцію при нагр?ваніи.
— 364 —
Сл?довательно, въ общемъ, д?йствіе H2S04 на Си
можно выразить такъ:
Си + 2H2S04 = CuS04 -f 2Н20 -f S02*).
Уголь и, с?ра д?йствуютъ на H2S04 подобнымъ же
образомъ: f
С + 2H2S04 = 2S02 + СО, + 2Н20; S ~f 2H2S04 —
==SSOa + 2HaO.
Физическія свойства. S02—безцв?тный газъ,
значительно тяжел?е воздуха (уд?льный в?съ = 2,26 при 0и)
съ очень удушливымъ запахомъ; критич. темп. 156°.
При—10° онъ сгущается въ бездв?тную прозрачную
жидкость, застывающую при—76° въ б?зцв?тную
кристаллическую массу. При испареніи жидкаго S02 такъ сильно
понижается температура, что очень легко замерзаютъ,
напр., вода, ртуть и др. S02 очень хорошо растворяется
въ вод?: 1 объемъ посл?дней при 20° растворяетъ 40
объ?мовъ S02, а при 0°—80 объемовъ. При кипяченіи
S02 сполна выд?ля?тся изъ воднаго раствора.
По химическимъ свойствамъ S02 есть кислотный оки-
селъ. Отв?чающая ему двуосновная с?рнистая кислота
H2S03 изв?стна только въ водномъ раствор? и въ вид?
солей (среднихъ и кяслыхъ), а въ свободномъ состояніи
она, подобно угольной кислот?, съ которой им??тъ
сходную формулу, распадается на ангидридъ и воду:
ы2со3=н2о + щ>,
H2S03 = H20 + S02.
С?рнистая кислота относится къ числу очень сла-
быхъ кислотъ.
С?рнистый ангидридъ не горитъ и не поддерживаетъ
гор?нія2). Онъ обезцв?чиваетъ растительныя и животныя
Ц При этой р?акціи получается и небольшое количество другихъ
соединеяіи, напр., Си$.
*) S02 и H^SOg, какъ видно изъ ихъ свойствъ, во многомъ на-
поминаютъ С02 и ИаСОз; соли с?рнистой кислоты весьма сходны съ
солями угольной кислоты.
— 365 —
краски и потому прим?няется для б?ленія (напр., соломы,
шерсти, шелка). При этомъ онъ, в?роятно, вступаетъ въ
непрочное соединеніе съ красящими веществами, изъ
котораго вновь выд?ляется при д?йствіи бол?е сильныхъ
кислотъ, такъ какъ эти посл?днія возстановляютъ преж-
ній дв?тъ соединенія. А потому посл? обезцв?чиванія S02
матеріалъ, для удаленія образовавшагося соединенія,
тщательно промываютъ водой. Другое прим?неніе S02 на-
шелъ себ? для дезин-
фекціи (окуриваніе с?-
рой). Онъ вреденъ для
животныхъ и растеній.
С?рнистый ангидридъ
и с?рнистая кислота
способны, окисляясь1),
переходить въ с?рный
ангидридъ и с?рную
кислоту, почему и
производить ?озвтаио?ителъное
д?йствіе на кислородъ
содержащія соединенія2).
Съ другой стороны, есть
случаи, когда S02 д?й-
ствуетъ и какъ
окислитель, напр., окисляющимъ образомъ онъ д?йствуетъ на
с?роводородъ, окисляя водородъ его:
S02 + 2H2S = 2H20 + S3.
Этотъ опытъ легко воспроизводится въ сл?дующемъ
прибор? (рис. 03): въ сосудъ А чрезъ верхнюю трубку
изъ колбочки В впускаютъ S02, а чрезъ нижнюю трубку
изъ сосуда С—с?рнистый водородъ; реакція между S02
Рис. 93. Д?йствіе с?рнистаго
ангидрида на с?роводородъ.
!) Прибавденіе сахара или глицерина (отрицательные
катализаторы) уменьшаетъ скорость окисленія.
2) Реакція съ Ш03 лротека?тъ по сл?дующ?му уравненпо 2HJ034-
+ 5H2S09 = 5H2S04 + Н20 + J„.
— 366 —
и H2S наступаетъ очень скоро; реакція идетъ быстр?е,
если колба А будетъ сырая: ст?нки колбы А
покрываются желтымъ налетомъ с?ры; непрореагировавшіе газы
отводятся въ^тягу по трубк? D.
Эта реакція можетъ объяснить происхожденіе
самородной с?ры изъ ея кислородныхъ соединеній.
Галоиды окисляютъ водный растворъ S02 (с?рнистую
кислоту) въ с?рную кислоту, напр.: S02 + 2Н20 ~|- С12=
= H2S04 + 2HCL
§ 157. С?рно?атистая кислота. Близко къ с?рнистой
кислот?,стоитъ с?рноватистая кислота H2S203, т.-е. со-
единеніе с?рнистой (H2S03) кислоты съ с?рой (S). Она
въ свободномъ вид? не получена, а изв?стна лишь въ
слабыхъ водныхъ растворахъ, а главнымъ образомъ, въ
вид? солей. При попыткахъ выд?лить изъ посл?днихъ
самую кислоту вм?сто нея всегда получаютъ Н20, S02
и S; ходъ этого превращенія сл?дующій:
1) Na2S203 + 2HC1 = 2NaCl + H2S203,
2) H2S203 = S + S02 + H20,
Изъ солей наибольшее прим?неніе им?етъ натронная
соль Na2S203. 5Н20, изв?стиая подъ именемъ
гипосульфита. Получается она при нагр?ваніи раствора с?рнисто-
кислаго натра (Na2S03) съ с?рой:
NaaSO, + S = NattSa08.
Это вещество безцв?тное кристаллическое, легко
растворимое въ вод?. Оно прим?няется въ фотографіи для
удаленія съ пластинокъ серебряныхъ солей, не изм?нен-
ныхъ д?йствіемъ св?та: AgCl-f Na2S203 = AgNaS203+
+ NaCl.
Кром? того, гипосульфитъ прим?няется, какъ анти-
хлоръ, т.-е. какъ вещество, препятствующее
разрушительному д?йствію хлора: при д?йствіи хлора на с?рноватисто-
— 367 -
кислый натръ реакція идетъ по сл?дующему уравненію:
Na8Sa08 -f- С12 + Н20 = Na2S04 + 2HC1 + S.
іодъ съ Na2S203 реагируетъ иначе: 2Na2S203-f-J2 =
= Na2S406 + 2NaJ.
С?рный ангидридъ, S03.
Мол. в?съ S03 = 80,06. Уд. в?съ = 1,9546. Темп, плавл. — 14,8». Темп.
' кип. :=46,2о. о/0-ый составь: S = 40,05o/0, О = 59,95о/0.
§ 158. Лолученіе и свойства. Непосредственное со-
единеніе S02 съ кислородомъ идетъ очень медленно.
Гораздо легче и скор?е это соединеніе происходить подъ
Ряс. 94. Получение с?рнаго ангидрида.
вліяніемъ губчатой платины или платинированнаго азбе-
ста или окиси жел?за (катализаторы), при повышенной
температур? (рис. 94). Для этого сухую см?сь S02 съ О
(можно и съ воздухомъ) пропускаютъ чрезъ стеклянную
трубку С, гд? пом?щается платинированный азбестъ1).
г
!) Платинированный азбестъ готовится такъ: рыхлый азбестъ
смачиваютъ крвпкимъ растворомъ хлорной платины и высушиваютъ;
368 —
Трубку нагр?ваютъ около 450°, а полученный S03 соби-
раютъ въ колб?, служащей пріемникомъ, гд? онъ и
осаждается на ст?нкахъ въ вид? длинныхъ шелковистыхъ
иглъ б?лаго цв?та.
Надо зйм?тить, что реакція* S02-[-0^z?:SOg обратима,
и обратимости въ особенности благопріятствуетъ высокая
температура, которой и приходится изб?гать при про-
изводств? S03.
Химически чистый с?рный ангидридъ — безцв?тная
легкоподвижная жидкость, кипящая при 46°, а при 14,8°
застывающая въ кристаллы, похожіе на ледъ.
Твердымъ же при обыкновенныхъ условіяхъ с?рный
ангидридъ д?лается (полимеризуется) отъ присутствія
влаги, съ которой часть его даетъ H2S04. Въ вид?
шелковистой б?лой массы, похожей на азбестъ, S03 и
находится въ продали.
S03 — кислотный окиселъ: растворяясь въ вод?, онъ
выд?ляетъ очень много теп на и образуетъ с?рнуто
кислоту:
S03 + Н20 = H2S04 -f 39,1К.
Поэтому S03 сильно дымитъ во влаэкномъ воздух?.
S03 энергично соединяется съ окислами м?талловъ и
образуетъ съ ними соли с?рной кислоты. При 400° S03
диссодіируетъ на S024~0-
С?рная кислота, H2S04.
Мол. в?съ H2SOi = 98,08. Уд. в?съ —1,854. Темп, плавл. — + 10,5».
Темп. кип.=330в о 0.Hg составь: О=65,25<>/0. S=32,7O°/0, H=2,O50/0.
§ 159. Лолученіе. Вь техник? с?рная кислота
получается по двумъ способамъ: I) по камерному и II) по
контактному.
зат?мъ его погружаютъ въ растворъ хлористаго аммонія (образуется
хлороплатинатъ аммонія—(ХН4)2 PtC)e), опять высушиваютъ и прока-
ливаютъ, при чемъ хлороплатинатъ разлагается съ образованіемъ на
волокнахъ азбеста рыхлаго порошка платины.
— 369 —
I. Камерный продессъ сводится къ сл?дующимъ
химическимъ операдіямъ: а) къ полученію S02, b) къ
окисленію S02 въ S03 при помощи азотной кислоты въ
ирисутствіи воды и с) къ окисленію образующихся при
предыдущей операціи иизшихъ окисловъ азота кислоро-
домъ воздуха. Детали этого химическаго процесса до
сихъ поръ еще не вполн? разъяснены.
Важн?йшія химическія реакціи при камерномъ
процессе сл?дующія:
1) S02 получается или сжиганіемъ с?ры или обжи-
ганіемъ жел?знаго колчедана FeS2 (пиритъ); с?ра даетъ
бол?е чистую кислоту, ч?мъ пиритъ.
2) Полученный S02 окисляется въ ирисутствіи воды
азотной кислотой въ с?рную кислоту:
3S02 -f 2H20 -f 2HN03 = 3H2S04 -f 2NO.
/ Образующаяся при этомъ окись азота N0 кислоро-
домъ воздуха и водой можетъ вновь окисляться въ азот.
ную кислоту:
2N0 -f 30 + Н20 = 2HN03.
3) Окись азота легко окисляется и въ другомъ на-
правленіи, а именно, въ двуокись азота Ж)2:
Ж) + 0=Ж)я.
A N02 обладаетъ окислительными свойствами и
можетъ S02 также окислять въ S03, сама раскисляясь
обратно въ N0:
S02 + N02 = S03 + N0,
S03 + H20 = H2S04.
4) При д?йствіи азотной кислоты на S02 въ отсутствіи
воды можетъ получаться твердое кристаллическое соеди-
ггеніе — нитрозилъ-с?рная кислота $02( q-^q < или
S04HN0 (такъ наз. камерные кристаллы).
Неорганическая хвыія. 24
— 370 —
Шстрозилг-с?рная кислота также можетъ получаться
и при совм?стномъ д?йствіи S02,NO,N02, или N203,
кислорода и воды:
2S02 -f ftb + N08 + 02 + H20 = 2S08^o"
Отъ д?йствія же воды иитрозилъ-с?рная кислота
распадается на с?рную кислоту и азотистую кислоту;
посл?дняя, какъ неустойчивое соединеиіе, разлагается
на NO, Ш2 и Н20:
&SOa\ONO + 2Н20 ^ 2H2S04 + 2HN03,
2HN02 = N203(NO -J- N02) + H20.
Главную роль, какъ видно изъ предыдущая, зд?сь
играютъ въ первой стадіи азотная кислота, а въ посл?-
дующихъ—окислы азота, которые, сами окисляясь кисло-
родомъ воздуха, отдаютъ его S02, т.-е. служагь какъ бы
переносителями кислорода.
Отсюда теоретически сл?довало бы предположить,
что при достаточномъ доступ? кислорода и воды опре-
д?лешіымъ количествомъ азотной кислоты (раскислоніомъ
которой получаются окислы азота) возможно переводить
неограниченный количества S02 въ с?рную кислоту. На
практик? это предположеніе оказывается нев?рнымъ,
такъ какъ н?которая часть окисловъ азота возстано-
вляется с?риистымъ газомъ (S02) дал?е—до закиси азота
или даже до свободнаго азота, которые яри данномъ
процесс? уже не могутъ вновь соединиться съ кислоро-
домъ; кром? того, часть окисловъ азота уносится изъ
камеръ вм?ст? съ воздухомъ въ вытяжную трубу. Въ виду
всего этого во время производства всегда приходится
понемногу добавлять азотной кислоты.
Камерное полученіе с?рной кислоты можно
воспроизвести въ сл?дующемъ прибор? (рис. 95). Въ колб? а по
лучается с?рнистый ангидридъ д?йствіемъ H2S04 на Си
— 371 —
(см. стр. 363); а въ колб? Ь получается окись азота
д?йствіемъ азотной кислоты на м?дь (см. стр. -3&3-);
колба с содержитъ кипящую воду, пары которой
одновременно съ S02 и N0 входятъ въ баллонъ А, гд?, встр?-
чая О воздуха, входящаго по трубк? d, образуютъ H2S04.
Этотъ способъ приготовл?нія сЬрной кислоты былъ
впервые прим?ненъ въ Англіи (вь 1740 г.) и потому
называется англіискимъ; а такъ какь въ техник? его произ-
Рис. 95. Получені? с?рной кислоты.
водятъ въ громадныхъ выложенныхъ свинцомъ камерахъ,
то его называютъ также камернымъ.
На заводахъ камерный процессъ ведется сл?дующимъ
образомъ,
Бъ печи А (рис. 96) сжиганіемъ с?ры (или колчеда-
новъ) получается нечистый S02, который въ см?си съ
воздухомъ въ горячемъ состояніи идетъ въ башню Гло-
вера 6г", наполненную кусками кирпича и кокса,
которые сверху смачиваютъ дождемъ азотная кислота и с?р-
ная кислота (нитрозилъ-с?рная кислота): въ яосл?дней
растворены окислы азота (съ башни Гей- Люссака —
см. дальше). Окислы азота, при им?ющейся зд?сь высо-
24*
Рис. 90. Заводски! способъ полученія с?рной кислоты.
кой температур? (около 300°), выд?ляются изъ H2S04
и идутъ вм?ст? съ S02 и съ HN03 въ камеры; туда лее
идетъ и освободившаяся H2S04. Изъ башни Глов?ра S02
вм?ст? съ окислами азота идетъ въ камеры 1, 2 и 3,
куда по особымъ трубамъ впускается и водяной паръ.
Въ камерахъ и происходить вышеописанный процеесъ
окисленія S02 въ S03, образованіе нитрозилъ - с?рной
кислоты и разложеніе ея водою. Изъ посл?дней камеры
избытокъ введеннаго воздуха, а также и механически
уносимые имъ окислы азота пропускаются чрезъ башню
Гей-Жжсака G, наполненную коксомъ, который
сманивается сверху с?рной кислотой, льющейся, сл?довательно,
навстр?чу" газамъ.
Назначеніе башни Гей-Лшсака состоитъ въ томъ,
чтобы удержать важные для процесса окислы азота раство-
реніемъ ихъ въ с?рной кислот? !), которою смоченъ на-
. „ДГ*
J) Если среди газовъ есть Лт02? то и она даетъ съ H2S04 нитрозилъ-
с?рную кислоту и азотную кислоту: 2K02+HaS01=S02^ +ГОЮ3;
— 373 —
ходящійся въ башы? коксъ. Эта сврная кислота,
поглотившая окислы азота, и перекачивается на башню Гло-
вера, о чемъ упомянуто было выше.у
При правильномъ ход? камернаго процесса получаютъ
изъ 100 в?совыхъ частей с?ры отъ 290 до 300 частеи
с?рной кислоты вы?сто возможныхъ по теоріи 306 частей.
Производство ведется непрерывно.
При камерномъ процесс? получается водная H2S04,
содержащая около 64% с?рной кислоты1). Для удаленія
изъ нея воды приб?гаютъ къ выпариванію въ свиицо-
выхъ сосудахъ, на которые не слишкомъ кр?пкая
кислота не д?йствуетъ. Въ этихъ сосудахъ содержаніе H2S04
доводятъ до 77°/0, посл? чего она начинаетъ
значительно разъ?дать свинцовые сосуды, и выпариваніе до-
канчиваютъ въ стеклянныхъ, фарфоровыхъ или, всего
лучше, въ платиновыхъ сосудахъ. Къ посл?днимъ,
несмотря на ихъ дороговизну, приб?гаютъ потому, что
стеклянные и фарфоровые сосуды часто бьются.
Полученная такимъ образомъ кислота представляется въ вид?
тяжелой (уд?льный в?съ= 1,847) маслообразной
жидкости и называется купоросиымъ масломъ2) (95%); или
сырой ажлійской кислотой.
Для полученія бол?е кр?пкой кислоты полученную
камерную кислоту перегоняютъ; перегнанная кислота со-
HNOg, въ свею очередь, съ H^SO^ тоже дастъ нитрозилъ-с?рную
кислоту: НЩ, 4- HaS04 = S02/q^0+H20 + О. Сл?довагельно, H2S04
улавливаетъ вс? окислы азота и азотную кислоту.
і) Крпм? воды, къ такой с?рной кислот? прим?шаны соединенія
мышьяка, сурьмы, селена, свинца, с?рнистая кислота, окислы азота,
органическія вещества и др. Прим?си эти встр?чаются и въ про-
дажномъ кулоросномъ масл?.
2) Въ прежнее время оно получалось при накаливаніи жел?знаго
купороса (FeSOji), окислившагося на воздух?: 2FeS04 + О ^nFe2S2Ov„
который при накаливаніи разлагался по следующему уравненію:
Fe2S20g ~ Fe203-f 3S03; S03 растворялся въ вод? и получалась
Н^О*. А неокиелнвшійся жел?зный купоросъ разлагается по уравпе-
нію; 2FeS04 — Fe203 + S02 + S03.
— 374 —
держитъ около 98,5% H2S04 и 1,5% воды, им?еть
уд. в. 1,842 при 15°, кипить при 338°. Безводную H2S04
получаютъ насыщеніемъ 98,5°/0-й кислоты с?рнымъ анги-
дридомъ, который въ ней хорошо растворяется,
II. Контактный способъ полученія с?рной кислоты,
0 которомъ кратко было уже упомянуто при полученіи
с?рнаго ангидрида (367 стр.), распадается на четыре
операціи: 1) полученіе S02 и приготовленіе см?си его
съ воздухомъ, 2) очищеніе этой см?си, 3) образованіе S03
и 4) приготовленіе H2S04 раствореніемъ S03 въ вод?.
1) S02 получается такъ же, какъ и при камерномъ
процесс?, и см?шивается съ воздухомъ въ такомъ отно-
ш?ніи, чтобы кислорода приходилось 3 объема (это отв?-
чаетъ 15 объемамъ воздуха) на 2 объема S02 (а по
теоріи надо: 2S02-|- Оа = 2S03, т.-е. на два объема S02
1 об. кислорода).
2) Контактная масса (платинированный азбестъ) только
тогда сохраняетъ въ теченіе долгаго времени свое д?й-
ствіе, когда газы совершенно чисты, т.-е. состоятъ только
изъ см?си S02 и воздуха. А потому приготовленная
см?сь тщательно очищается отъ пыли, которая,
покрывая контактную массу, д?лаетъ ее инертной, и, особенно,
отъ мышьяковистыхъ соединеній (они бываютъ въ S02,
особенно при полученіи его изъ пиритовъ), которыхъ
даже мал?йшіе сл?ды вредно д?йствуютъ на контактную
массу.
3) Соединение S02 съ кислородомъ въ присутствіи
контактной массы ведутъ при температур? около 400°.
При этомъ принимается во вниманіе, во-первыхъ, что
реакція S02-f-O^S03 обратимая, [и, во-вторыхъ, что
теплота образованія S03 довольно значительная, а именно:
SOa4-O = SO3-f22600K. Около 400° преимущественно
идетъ окисленіе S02 въ S03; при дальн?йшемъ повыше-
ніи температуры этотъ процессъ замедляется, а при 1000°
с?рный ангидридъ уже сполна диссоціируетъ на S02 и О,
а сл?довательно, образованіе его прекращается. Въ виду
— 375 —
этого, начавъ р?акдію соединенія S02 съ О при 400°, бо
время процесса необходимо приборъ охлаждать г).
4) Раствореніе S03 въ вод? идетъ очень бурно, и S03
при этомъ сильно дымитъ. Предпочитаютъ поэтому
лучше сначала растворять S03 въ 97—98%-й с?рной
кислот?, а этотъ растворъ зат?мъ уже и разводятъ
водой до желательной концентраціи.
Свойства с?рнон кислоты. Чистая с?рная кислота
(моногидратъ H2S04) при обыкновенной температур? пред-
ставляетъ маслянистую жидкость съ уд. в. при 15° =
1,85; при низкой температур? она затверд?ваетъ, а при
—|— 10° плавится; кипитъ при 330°. При п?р?гонк? дис-
соціируетъ па S03 и Н20.
Она жадно соединяется съ водою и при этомъ вы-
д?ляетъ очень большое количество тепла2). Благодаря
атому свойству, она часто прим?няется какъ водуотни-
мающее средство. При соединеніи съ водою Н2ЙО^даетъ
рядъ гидратовъ. H2S04—двуосновная очень сильная (т.-е.
при сравнительно слабомъ разбавлеіііи водой она почти
сполна диссоціируетъ на іоны—Н и HS04) кислота,
энергично д?йствующая на большинство металловъ и
образующая два типа солей — кислыя (бисульфаты) и среднія
*) При 400° въ со?динені? съ кислородомъ входитъ S02 до
98—99о/0, при 7000—около 60°/0, а при 9000 соединенія совс?мъ не
происходить.
2) Интересно зам?тить, что при см?ш?піи с?рной кислоты со
льдомъ получается охлажденіе: если кр?пкую с?рнуго кислоту
разбавить і/2 объемомъ воды, и такой растворъ (1 ч. раствора), охладивъ
до 0°? см?шать со льдомъ (2 ч.), то охлажденіе получится до—33°,
Различіе въ тепловыхъ эффектахъ при см?шеніи жидкой воды и льда
съ H2SO4 объясняется такъ: ледъ подъ вліяні?мъ тепла, выд?ляемаго
при см?шеніи съ H2S05; плавится и на ото плавленіе затрачиваотъ
гораздо больше тепла, ч?мъ его можетъ вьтд?литься при взаимод?й-
ствіи воды съ H2S04; при см?шеніи же воды съ H2S04 такого
поглощения тепла не требуется, и тепло выд?ляется.
Зам?тим-і, что при см?шеніи с?рной кислоты съ водой всегда
надо счърную кислоту лить въ воду, а не обратно, иначе можетъ
произойти разбрызгиваніе жидкости.
- 376 -
(сульфаты), наприм?ръ, Na2S04 — с?рнокислый натрій я
NaHS04 — кислый с?рнокислый натрій. Надо зам?тить,
что при д?йствіи H2S04 на одни металлы (напр., Zn см.
при водород?) выд?ляется водородъ, а на другі? — S02
(напр., Си — см. при с?рнистомъ ангидрид?). С?рная
кислота можетъ действовать и окисляющимъ образомъ.
Благодаря своей очень малой летучести, с?рная
кислота широко прим?няется для полученія (выт?сненія)
многихъ другихъ кислотъ (напр., НС1, HN03, H2S и др.)
изъ ихъ солей.
Главная масса с?рной кислоты идетъ въ вид?
камерной (50—55°Б., т.-е. 62,5%—70,32%) для производства
сульфатовъ (с?рнокислыхъ солей металловъ), суперфосфа-
товъ, различыыхъ кислотъ (напр., HN03, НС1 и др.),
соды по методу Леблана; бол?е кр?пкая с?рная кислота—
для изготовленія динамита, пироксилина, коллодія, искус-
ственнаго шелка, нитробензола, для сульфированія, для
обмыливанія жировъ и т. д. Изъ сказаннаго видно,
какое широкое нрим?неніе іш?етъ с?рная кислота—этотъ
важн?йшій изъ химическихъ продуктовъ \).
Пирое?рная киелота, H2S207.
Молек. в?съ H3S20-j = 178,14.
§ 160. Пиросуърная (иначе дымящая) или нордіаузен-
ская кислота получается при раствореніи с?рнаго
ангидрида въ с?рной кислот?:
II2S04 + S03 = H2S207.
і) Въ продаж? отличаютъ:
a) Acidum sulfuricum crudum (anglicum) съ уд. в. 1,830;
содержитъ 91—92о/0 H2S04.
a) Ac. sulf. purum (rectificatum) съ уд. в. 1,836 —1,840;
содержи™ 93,86—95,60/q H.2S04.
c) Ac. sulf. finnans—дымящая: содержитъ 10 — 20<*Д S03.
d) Ac. snlf. dilutum—растворъ 1 ч. H2S04 въ 5 v. воды; уд. в.
1,110—1,114, содержитъ 15,6—16,30/0 H8SOt.
— 377 —
Это кристаллическое вещество, плавящееся при 36°,
уд. в. 1,85—1,9.
Иирос?рную кислоту можно раз&ліатривать, какъ
неполный ангидридъ (ангидрогидратъ) с?рной кислоты:
2H2S04 — H30 = H2S207.
Изв?стны и соли пирос?рной кислоты: он?
получаются при сильномъ нагр?ваніи кислыхъ с?рнокислыхъ
солей, напр., 2NaHS04:~rNa2S207 + Ы20; при растворе-
ніи въ вод? пирос?рныя соли обратно переходятъ въ
кислыя соли с?рной кислоты. Какъ сама кислота, такъ
и ея соли при нагр?ваніи разлагаются съ выд?леніемъ
с?рнаго ангидрида.
§ 161. С?ра образуетъ еще ц?лый рядъ кислотъ,
изв?стныхъ подъ общимъ именемъ полтпіоиовыхъ
кислотъ. Сюда относятся:
H2S206—дитіоновая кислота,
H2S306—тритіоновая „кислота,
H2S406—тетратіоновая кислота и
Н28506-^пентатіоновая кислота.
Кислоты эти —¦ разлагающіяся вещества, изв?стныя
лишь въ слабыхъ водныхъ растворахъ въ вид? солей.
Образуются он? одновременно, если пропускать въ
воду поперем?нво S02 и H2S, напр.,
HaS + 3SOa = HaS4Oe
2H2S + 6S02 = H2S306 + H2S506 и т. д.
Существуете еще падс?рная кислота (H2S208),
получающаяся при электролиз? охлажденной 50% с?рной
кислоты. Она изв?стна лишь въ очень разбавленныхъ
растворахъ.
Надс?рной кислотЬ отв?чаетъ ангидридъ S207—
перекись с?ры, получатощійся при д?йствіи тихаго разряда
на см?сь с?рнистаго ангидрида съ кислородомъ, или
— 378 —
при д?йствіи H202naH2S04: 2H2S04 + H202^H2S208+
+ 2H20.
Галоидныя соединенія с?ры.
§ 162. Изъ галоидныхъ соединеній с?ры мы и зд?сь
разсмотримъ только хлористая, такъ какъ бромистый и
іодистыя соединенія во многомъ понторяютъ ихъ свойства.
Съ хлоромъ с?ра образуетъ два соединенія: S2C12 и
SC14, изъ которыхъ только первое отличается н?которымъ
постоянствомъ.
Однохлорисшая с?ра, S2C12 (мол. в?с. s2Ci2 -= 135,92),
получается при пропусканіи струи сухого хлора чрезъ
расплавленную с?ру и собирается въ охлаждасмомъ
пріемник?. Хлористая с?ра представляетъ красновато-
желтую жидкость остраго запаха, кипящую при -(-138°;
уд?льный в?съ при 0°= 1,68. Плотность пара 67, что
соотв?тствуетъ частичной формул? S2C12 = 134. Она
сильно дымитъ во влажномъ воздух? и разлагается на
S02, HG1 и S:2S2C12 + 2H20 = S02 + 4HC1 + 3S. Одно-
хлористая с?ра легко растворяетъ с?ру (до 66%) и
Употребляется для вулкапизаціи каучука.
Четырехъ-хлористая с?ра, SC14 (мол. в. 8014 — 173,86),
существуетъ только ниже 0°. Получается насыщеніемъ
однохлористой с?ры хлоромъ при—30°. Диссоціируетъ
на S2C12 и хлоръ1).
Селенъ и шеллуръ въ своихъ кислородныхъ и галоид-
ньтхъ соединеніяхъ аналогичны соединеніямъ с?ры.
Задачи: 1) Вычислить, сколько потребуется воздуха и азотной
кислоты для получ?нія с?рной кислоты изъ 100 гр.
с?ры.
2) Сколько получится м?днаго купороса при лолучрніи
5 литровъ с?рнистаго газа?
і) Изв?стно н?сколько хлор ангидр идо въ с?рной кислоты: 1) хло-
¦росульфоноеая кислота, S02(0H)C1, получающаяся при д?йствіи РС15
— 379 —
Кислородный соединенія группы галоидовъ.
§ 163. У фтора до сихъ поръ не получено соединенія
съ кислородомъ. Хлоръ, бромъ и іодъ образуютъ съ
кислородомъ соединенія, отличающіяся очень малой
устойчивостью. Большинство изъ нихъ соединяется съ водою
и даетъ одноосновныя кислоты.
Высшій окиселъ этой группы R207 даетъ одноосновную
кислоту HR04 : R207 -f H20 = 2HR04.
Дал?е сл?дуютъ кислотные же окислы: R205(HR03),
R203(HR02) и R20(HRO); въ скобкахъ написаны отв?-
чакодія имъ кислоты. Зат?мъ у этой группы есть одинъ
см?шанный окиселъ R204 = 2R02, съ водою дающій дв?
кислоты:
2R02 -j- Н20 == HR03 + HR02.
Далеко не вс? эти окислы изв?стны въ свободномъ
вид?. Многі? изъ нихъ изв?стны только въ соляхъ отв?-
чающихъ имъ кислотъ.
Нислородныя соединенія хлора.
§ 164. Непосредственно хлоръ съ кислородомъ не
соединяется; косвеннымъ же путемъ получены н?которые
окислы, Изъ вс?хъ пяти возможныхъ окисловъ этой
группы у хлора въ свободномъ вид? изв?стны только
три: С120—хлорноватистый ангидридъ, см?шанный
окиселъ С1204 = 2С102—хлорноватая окись и высшій
окиселъ хлорный ангидридъ С1207.
Вс? эти окислы эндотершічпы, легко распадаются
иногда со взрывомъ на С1 и О.
Хлорноватистый ангидридъ, С120(мол. в?съ сі20=8б,9),
получается при д?йствіи сухого хлора на сухую окись
ртути:
HgO + 2С]2 = %С12 + CJ20.
на H2SO4 или при д?иствіи НС1 на S03; 2) хлористый сульфурилъ,
S02C]2, получающіися при д?йствіи НС1 на SO2 и др. Оба хлоранги-
дрида жидки, легко разлагаются водой на НС1 и H2S04.
— 380 —
С120—желто-бурый газъ, съ запахомъ, напоминающимъ
запахъ хлора, сгущатощійся въ темно-бурую жидкость,
кипящую при-{-5°. При механическихъ сотрясеніяхъ жид-
кій С120 вЗрываетъ, разлагаясь на элементы.
Въ вод? С120 сильно растворяется: 1 объемъ воды
поглощаетъ при 0° около 200 объемовъ С120, образуя
растворъ хлорноватистой кислоты, НС]О:
С1аО + Н20 = 2ПСЮ-
При внес?ніи окиси ртути въ хлорную воду также
получается растворъ хлорноватистой кислоты: HgO-f-
-f 2С12 + Н20 = HgCl2 -f- 2HC10.
Онъ же получается при д?йствіи кислотъ на соли
хлорноватистой кислоты, напр. КСЮ -\- HN03 ^ НСЮ -f-
+ KNO,.
Въ безводиомъ состояніи НСЮ не получена *); н?ко-
торымъ постоянствомъ обладаютъ только ея слабые
растворы и соли. Составь кислоты опред?ленъ по составу
г ея солей.
НСЮ—кислота; она вм?ст? съ т?мъ сильный
окислитель: при окисленіи она разлагается на кислородъ и
соляную кислоту:
2НС10=2НС1 +Оа.
При д?йствіи соляной кислоты на хлорноватистую
кислоту выд?ляется изъ об?ихъ кислотъ хлоръ; НСЮ +
+ НС1 = С1а + НаО.
При д?йствіи концентрированныхъ кислотъ НСЮ
распадается по сл?д. уравненію:
ЗНСЮ = НС103 +2НС1.
і) Вообще, ч?мъ слаб?е кислота, т?мъ мен?е прочна связь между
?я ангидридомъ и водой, и, сл?доватедыіо, т?мъ дегче она
распадается на свои компоненты—ангидридъ и воду. Соединеніе же слабой
кислоты съ сильной щелочью можетъ дать довольно устойчивое
соединеніе.
— 381 —
Соли хлорноватистой кислоты реагируютъ одинаково
съ хлорноватистою кислотой, такъ какъ посл?днюю он?
легко выд?ляютъ при д?йствіи даже очень слабыхъ кис-
лотъ, напр., С02 воздуха.
Натронная соль ея получается при д?йствіи хлора на
слабый растворъ ?дкаго натра па холоду:
2NaOH -f С1а = NaCl -f NaCIO -f Н20.
По тому же методу получается кальціева соль:
2Са(ОН)2 + 2С12 = СаС12 + Са(ОС1)2 + 2Н20,
или: Cl2 -j- Са(ОН)2 = CaCl(OCl) +НаО. )
у
Растворъ натронной соли въ вод? въ см?си съ NaCl
носитъ пазваніе оюавелевой воды1) и употребляется въ
кач?ств? б?лилыіаго вещества (напр., при стирк? б?лья),
потому что обладаетъ, благодаря легкому выд?ленію
хлора, б?лящими свойствами.
Са(ОС1)2 + СаС12 (или 2СаОС12) называется б?лильною
известью—опять благодаря той же способности выд?-
лять хлоръ2); употребляется она также и для дезин-
фекціи.
Щелочныя соли хлорноватой кислоты, НС103,
получаются3), подобно солямъ хлорноватистой кислоты, про-
пусканіамъ хлора въ кр?пкій растворъ щелочи и при
нагр?ваиіи:
6КОН + ЗС12 — 5КС1 + КСЮа + ЗН20. '
Ц Жавелевая вода (eau de Javell)—вода изъ Javelle, м?стечка
близъ Парижа, гд? ее впервые начали фабриковать.
2) Выд?левіе хлора изъ б?лильной извести идетъ легко подъ
вліяні?мъ кислотъ; напр., при д?йствіи I^SOj им?емъ: 1) Са(СЮ)2 ¦+-
+ II2S04 = CaS04 + 2НС10; 2) СаС12 + H2S04 = CaS04 + 211С1;
3) НСЮ + ИС1 = Н20 + CIa.
3) Современная техника выработала м?тодъ полученія хлорнова-
тистыхъ и хлорноватыхъ солей путемъ электролиза (см. при метал-
лахъ 1-й группы).
— 382 -
Такъ приготовляется бершоллето?а солъ,т.-е. хлорно-
ватокислый калій. Бертоллетова соль легко отдаетъ свой
кислородъ другимъ веществамъ и употребляется для по-
лученія кислорода, приготовленія взрывчатыхъ веществъ
и бенгальсккхъ огней. Отв?чающая бертоллетовой соли
хлорноватая кислота, подобно хлорноватистой кислот?,
въ безводномъ состояніи не получена, а изв?стна только
въ вид? слабыхъ водныхъ растворовъ; д?йствуетъ она
какъ сильный окислитель.
Ангидрида хлорноватой кислоты неизв?стно; при
разложении аде посл?дней (при д?йствіи кр?пкой с?рной
кислотой на КС103) взам?нъ ангидрида выд?ляется газъ съ
желто-бурымъ цв?томъ и характернымъ
запахомъ—хлорноватая окись, СЮ2:
ЗНСЮд = Н20 + ИС104 + 2СЮ2.
Хлорноватая окись при—10° переходить въ жидкость,
застывающую при—79° въ оранжевокрасную
кристаллическую массу. При раствореніи въ вод? С102 да?тъ 2
кислоты: хлорноватую и хлористую:
2сю2 + а, о = нсіо3 + нсю2.
С102 очень сильно взрываетъ при сотрясеніи или при
пагр?ваніи.
Наибол?е прочной кислородной кислотой хлора
является хлорная кислота, НСЮ4, соли которой
образуются при осторожномъ прокаливаніи хлорноватокислыхъ
солей:
2КС103 = КС1 + 02 + КСЮ4.
Самая кислота получается при д?йствіи H2S04 на
КСЮ4.
2КСЮ4 -f H2S04 = K2S04 + 2НС104.
Безводная НСЮ4 получается при пер?гонк? ея
водныхъ растворовъ съ с?рной кислотой. Это безцв?тная
— 383 —
дымящая жидкость съ уд?льнымъ в?сомъ= 1,764,
кипящая при 110°, д?йствуетъ какъ сильный окислитель.—
С1207 получается при д?йствіи Р205 на холоду на
НСЮ4 : 2НС104 -f Р205 = 2НР03 -f С1207; при слабомъ на-
гр?ваніи С1207 отгоняется въ вид? безцв?тной жидкости,
кип. при 82°; при пагр?вапіи взрываетъ.
§ 165. Кислородным соединения брома. Ни одного изъ
соединений брома съ кислородомъ въ свободномъ состояніи съ достаточной
точностью не изсл?довано. Соли же отв?чающихъ имъ кисдотъ,
бромноватястой и бромноватой, и сами кислоты получаются
аналогично соотв?тствующимъ соединеніямъ хлора.
Кислородныя соединенія іода.
§ 166. У іода изв?стенъ только окиселъ і2Оъ—годно-
?ашый ангидридъ, который (а равно и его соединенія)
отличается значительной прочностью.
іодъ при д?йствіи на кр?пкій и горячій растворъ
КОН, подобно хлору и брому, даетъ KJ03:
6КОЫ -f 3J2 = 5KJ -f 3H20 -f KJ03.
Свободная іодновашая кислота получается при
д?йствіи кислотъ на іодноватыя соли, а также окисленіемъ
іода азотной кислотой; 3J + 5HN03 = 3HJ03 -f- 5NO -|-
-(-IlgO.HJOg—кристаллическая масса, начинающая
разлагаться при 130°2). При нагр?ваніи распадается на
ангидридъ и воду:
2HJ03 = H20+J205.
J205—б?лое кристаллическое вещество, распадающееся
при 300° на іодъ и кислородъ.
*) NaJOa + О -f NaOH + Н20 = Ка2Н^ Ов.
- 384 —
іодная кислота, HJ04, получается при д?йствіи іода
на хлорную кислоту:
нсю44 j = Hjo4-f сі.
і
Гидратъ іодной кислоты HJ04~)-2H20 представляетъ
бвлую кристаллическую массу, плавящуюся и
разлагающуюся при 140°:
2HJ0, = H20 + O, + JaOB.
Соль NaJ04 встр?частся вь качеств? прим?си къ
чилійской селитр?1).
\ .у/ Б о р ъ, В.
\ < ( Атомн. в. Б = 11. Уд. в. кристал. В = 2,68, аморфнаго В — 2,45.
\ /
§ 167. Къ элементамъ съ металлоиднымъ характеромъ
относится еще боръ, стоящій совершенно особнякомъ
въ 3-й групп?. Въ немъ свойства металлоида очень слабо
выражены; въ то же время есть и свойства металличе-
скія, но и посл?днія выражены тоже крайне нер?зко.
Таковой характеръ обыкновенно присущъ элементамъ
переходным^ какимъ и является боръ, пом?щающійся въ
посл?дней (3-ей) чисто металлической групп? и, сл?до-
ват?льно, предваряющей первую слабо металлоидную (4-ю)
группу. Въ бор? свойства металла свелись почти къ
нулю, но и свойства металлоида еще не выразились бо-
л?е или мен?е ясно. Зд?сь происходить, такъ сказать,
переходъ одного (металлическаго) зигзага періоднческой
кривой въ другой (металлоидный).
Рядъ бора начинается литіемъ (1-я группа), дающимъ
сильное основаніе; во 2-й групп? этого ряда* стоить бе-
*) Существуют^ и соединенія н?которыхъ галоидовъ между
собою, напр., ЛС1, JC13; вс? они малоустойчивы; свойства ихъ
обыкновенно отв?чаютъ свойствамъ соединившихся гадоидовъ; этого и надо
было ожидать при соединеніи подобныхъ другъ другу элементовъ.
— 386 —
риллій, образующій слабое основаніе; за берилліемъ сл?-
дуетъ боръ (3-я группа), а за боромъ первый металло-
идъ 4-й группы—углеродъ.
Въ свободномъ состояніи (а равно и въ соединеніяхъ,
боръ, съ одной стороны, показываетъ сходство съ угле-
родомъ и кремніемъ (4-я группа), а съ
другой—приближается къ металламъ—бериллію (2-я группа) и алюми-
нію (3-я группа).
Химическій характеръ бора всего видн?е въ его
единственномъ окисл? В203. Эта окись бора, или
борный ангидридъ, им??тъ преимущественно кислотный
характеръ: образуетъ борную кислоту П3В03,
окрашивающую синюю лакмусовую бумажку, подобно кислотамъ,
въ красный цв?тъ, но на куркумовую бумажку, д?йству-
ющую подобно щелочамъ, то-есть окрашивающую въ
красно-бурый цв?тъ. Солей отъ этой борной кислоты не-
изв?стно. В203 можетъ реагировать съ кислотами;
следовательно, въ немъ есть и основныя свойства.
Наибол?е прочными солями, у бора являются соли
тетраборной кислоты, наприм?ръ, Na2B407—бура.
Боръ въ природ? встр?чается въ вид? сассолина—
борной кислоты [В(ОН)3], буры (Na2B407.10Н2О), боро-
кальцита (кальціевой соли тетраборной кислоты —
СаВ407.4Н20) и колеманита (Са2В6Оп . 5И20).
Свободный боръ получается при возстановленіи бор-
наго ангидрида натріемъ или магніемъ при нагр?ваніи. »\
Боръ при этомъ получается въ вид? аморфнаго зелено- ":
вато-бураго порошка уд?льнаго в?са 2,45. При сплавле-
ніи же В203 съ аллюмняіемъ получается боръ въ кри-'
сталлическомъ вид? похожемъ на алмазъ.
При накаливаніи на воздух? боръ воспламеняется при
300° и сгорастъ яркимъ пламенемъ въ В203. При
накаливаніи боръ соединяется съ азотомъ съ образованіемъ
BN—б?лаго твердаго вещества; въ хлор? боръ также
сгораетъ, образуя ВСі3—безцв/?тную, кипящую при 18°
жидкость; она дымитъ въ воздух?, водою разлагается
Неорганическая химія. ^
— 3Sfi —
на HC1 и борную кислоту (аналогія съ галоидаигидри-
дами). Со сплавленнымъ КОН боръ реагируетъ по сл?д.
уравггепію:
2В -f 6КОН == 2К8В08 + ЗН2.
Съ водородомъ боръ даетъ газообразное горючее со-
одинені? ВН3.
Верная кислота, Н3В03, встречается, главнымъ обра-
аомъ. въ Тоскан? (въ Италіи), гд? она съ парами воды
выд?ляется изъ трещинъ земли; пары ути п?р?водятъ въ
бассейны сь водой; вода зат?мъ испаряется, и борная
кислота выпадаетъ въ вид? блестящихъ чешуекъ, жир-
лыхъ лаощупь. Н3В03 растворима въ вод?; уд?л. в?съ
J ,4347; 1 часть ея растворяется при Ь9° въ 25,66 ча-
стяхъ воды, а при 100°—въ 2,97 ч. воды. Сниріовый
раствор ь ея горитъ зелеиымъ пламеиемъ. Соли Н3В03
иеизв?стиы. Н3В03—кислота очень слабая. При нагр?-
ваніи борная кислота теряетъ воду и переходить посл?-
довательно въ метаборную НВ02 (Н3В03 — 1120 = НВ02),
пироборную (или тетраборпую) Н2В407 (4Н3В03—5Н20=
= Н2В407) и, наконецъ, при иолномъ выд?леніи воды—
въ борный ангидридъ, В203—прозрачную стекловидную
массу (2Н3ВОя — ЗНяО = Ва03).
В203 въ расплавлешюмъ состояніи можетъ растворять
въ себ? различныя окрашенныя вещества (наприм?ръ,
окислы металловъ) и даетъ цв?тныя стекла, ч?мъ не-
р?дко пользуются при химическомъ анализ? веществъ.
Бура, Na2B407, .находится въ природ? въ Тибет?,
'гд? изв?стпа подъ именемъ типкала. Искусственно
получается при насыщеніи содой борной кислоты (или
борацита): 4Н3В03 + Na2C03 = Na2B407 + C02 -{- 6Н20.
Бура—б?лое кристаллическое вещество; при сплавленіи,
подобно борному ангидриду, она также способна
растворять окислы металловъ, а потому и прим?няется при
спаиваніи металловъ, а также для полученія окрашен-
пыхъ стеколъ при анализ?; въ первомъ случа? окислив-
- 387 —
шіеся концы металлическихъ вещей и очищаются
сплавленной бурой отъ покрывающихъ ихъ окисловъ.
Бура, равно какъ и борная кислота, прим?няется
такъ же, какъ антисептики, то-есть какъ вещества, уби-
вающія бактерій и задерживающія гніеніе.
При нагр?ваніи см?си В203 съ углемъ въ ток? хлора
подобно тому, какъ это было при креиніи, получается
хлористый боръ, ВС13 — жидкость, кипящая при 17и,
уд. в. 1,35; водою онъ разлагается, подобно галоидангидри-
дамъ, по сл?д. уравненію: ВС13 + ЗН20==Н3ВОз + ЗНС1.
Изв?стны еще бромистый боръ и фтористый боръ:
они также галоидангидриднаго характера. А следовательно,
боръ въ этихъ соединен!яхъ—металлоидъ.
25*
М Е Т R Л Л Ы.
§ 168. Къ металламъ принадлежать элементы, характе-
ризующіеся съ вн?шней стороны особенпымъ металличе-
скимъ видомъ1), хорошей тепло- и электропроводностью
и своей электроположительностью. Въ компактной масс?
и въ порошкахъ они темные, кром? магяія и аллюминія;
вс? они серебристые съ различной степенью яркости,
только золото (желтое) и м?дь (красная) окрашены. Если
расплавить металлы и зат?мъ медленно охлаждать ихъ,
то обыкновенно наступаетъ кристаллизация, и почти вс?
металлы кристаллизуются въ правильной систем?; сурьма
и висмутъ кристаллизуются въ гексагональной систем?,
а олово—въ квадратной. Металлоиды же обычно въ
правильной систем? не кристаллизуются. Съ химической
стороны это элементы основного характера, то-есть та-
кіе, которыхъ окислы (по крайней м?р?, низшіе) и ихъ
гидраты даютъ съ кислотами соли. Галоидный соедине-
нія у большинства металловъ водою или мало или со-
вс?мъ не гидролизуются, тогда какъ для галоидныхъ со-
единеній металлоидовъ гидролизъ обязателен^ Но р?з-
каго разграничснія между металлами и металлоидами
н?тъ, и нер?дко одинъ и тотъ же элементъ можетъ быть
въ однихъ соединеніяхъ металломъ, а въ другихъ"—ме-
таллоидомъ, смотря по тому, какую валентность онъ
проявить. Для того, чтобы элеметъ былъ металломъ,
наилучшими условіями являются: низкая валентность (не
*) Моталлическій блескъ металлы (кром? Mg н А1) сохраняютъ
только въ компактныхъ массахъ; а въ порошкахъ большинство
металловъ черны; Mg и Лі и въ порошкахъ им?ютъ металлическій видъ
— 389 —
выше 3-хъ), положеніе въ четномъ ряду періодической
системы и при одной и той же валентности большой
атомный в?съ (см. стр. 139).
Физическія свойства металловъ.
§ 169. За исключеніемъ единственная газообразнаго
элемента, по свойствамъ стоящаго во многихъ случаяхъ
ближе къметалламъ—водорода, и единственна™ жидкаго—
ртути, вс? металлы суть твердыя т?ла, отличающіяся
другъ отъ друга прежде всего по удЬльному в?су; уд?ль-
ный в?съ ихъ колеблется отъ 0,59 (Li) до 22,5 (Os).
По уд?льному в?су металлы разд?ляются на дв?
группы на металлы, уд?лыіый в?съ которыхъ меньше 5,
называемые легкими, и на тяжелые металлы съ уд?ль-
нымъ в?сомъ больше 5.
Группа I—легкіе металлы.
Атомн. в?съ. Уд?льн. в?съ. Ат. об. Ч.
Литій Li
«Калій К
Ыатрій Na
Рубидій Rb
Кальцій Са
Магній Mg
Алюмнпій А1
Барій Ва
(А).
6,94
39,10
23,00
85,45
40,07
24,32
27,10
137,37
(d).
0,59
0,86
0,97
1,52
1,57
1,74
2,60
3,76
(4)
12
45
24
57
26
14
11
36
і) Атомный объемъ есть частное, получающееся отъ д?ленія
атомнаго в?са на уд?льный в?съ: онъ указываетъ 'на ср?дній объемъ
того пространства, которое является сферой д?йствія атома; въ эле-
ментахъ съ болыпимъ атомнымъ объ?момъ атомы расположены на
бол?е далскомъ разстояніи другъ отъ друга? нежели въ элементахъ
съ малымъ атомнымъ объемомъ.
— 390 —
Трупа Н—тяжелые металлы.
Атомн. в?съ. Уд?льн. в?оъ. Ат. об.
(A). (d). (4)
Ципкъ Zn 65,37 7,1 9
Олово Sn 119,0 ' 7,2 26
Жел?зо Ге 55,84 7,8 7
М?дь Сп 63,57 8,8 7
Серебро Ag 107,88 10,5 11
Свинецъ РЬ 207,10 11,3 18
Ртуть Hg 200,6 13,6 15
Золото Аи 197,20 19,3 10
Платина Pt 195,2 21,4 9
Осмій Os 195,2 22,5 8,5
Легкіе металлы носятъ названіе „неблагородныхъ",
тяжелые—„полублагородныхъ" и, наконецъ, самые
тяжелые—они же и наимен?е д?ятельные въ химическомъ
отношеніи, наприм?ръ, золото, серебро, платина—наз.
„благородными"1). Въ связи съ атомиымъ объемомъ
находится и способность т?ла вступать въ химическія
реакціи: такъ, металлы первой группы—Li, К, Na, Kb
и Cs, металлы второй группы—Са, Sr и Ва, элементы
неметаллическіе шестой группы—О, S, Se и Те или
седьмой группы—F, 01, Вг и J, обладаютъ наиболыпимъ
атомнымъ объемомъ, они же наибол?е д?ятельны и въ
химическихъ превращеніяхъ.
Въ т?сной связи съ приведенными въ таблицахъ
тремя величинами (т.-е. атомнымъ в?сомъ, уд?льнымъ
в?сомъ и зависящимъ отъ нихъ атомнымъ объемомъ)
находятся и многія другія свойства элементовъ, какъ физи-
ческія, такъ и химическія. Изъ таблицъ I и II, напр.,
J) Кром? величины уд. в?са. для «благородныхъ> металловъ прежде
всего характерна ихъ очень трудная окисляемость.
— 39] —
ьЯ
CQ
О
И
w
ч
съ
3
И
>>
СЦ
Рн
¦F
»—<
^
И-4
»—*
N4
ИЧ
О
itfKd
1 *?
1 о"
fe
1 ^
1 ю
о
[ "
1 со
ее
г-н
?
1 *?
О
«о
**~
м^
1 »n 'Я
1 if$CO
т-Н
Д.^н «е
t^te
1 с4-
CD
нмео
ее
ее
<л
to
о
а
CD
fe
Л
CD
^
г~
т-Н
г^СО
О
Ч1
со
1—1
ее СП
>
со
«!"-<
СС CD
ъ
г-н
г-т-1
2 «в
CJ
со
4
оз
пЗ
О
еч
Г-
^
о-
5-
^
¦** ю
О)
-CJ
Рч
об
й
СО
Й
сэ
1ГЭ
1
—и
т-Н
т-Н «
1 ^
1 г-
СО
й
со4
г-.т—<
Й
СО
ю
г-н
|Х
Сі
СО
COQ
СО
в*
о
л^
ё
ts;
СО I—
1
1
1
і
1
1
1
1
1
1
Г-Н
СМ
ф
а
1
1
іэ
см
еа
t-H
1
1
¦Л
со"
со
о"
от
О
с*-
И
00 СП
00
)-Н
СО
о
j
1
1
ер
1 СЛ
?
^
SCO
г-»
о.-
еЗ
Н
00
1—(
рц
1
с*
С-
г—1
н
¦*
тИ
т—<
1
гн
о
1—1
3
<5
1
!
Оі-н
см
т-Н
Еэ
1
о»
О
СМ
і
1
1
1
С1
г-н
t 9
3
с?
о
Я
ев
а,
о
CD
ч
о
о
о
• г-Ч
и
о
га
¦^
о
1—1
О)
и
к
и;
те <0 эт
О о И
3 —
о
... , о
N
« « *¦*
м
я!
а.
Ю
О °
ея О
Рн п
ей
Рн
W
Й g
О
Й
Таблица II. Температуры плавленія элементовъ.
3
ГРУППЫ ЭЛЕМЕНТОВЪ.
О
I
II
III
іу:
V
VI
VII
VIII
Не?
NV-250"
Н—-J570
Li I860
Na 980
Be 9000
Mg 6630
В 13000?
AI 6570
С 26000
Si 13U00?
N-2030
P 44°
0—2300
S 1140
F-2100
CI-750
4
5
Ar-1900
К 62,50
Cu 10540
Cd 7G00
Ztt 4200
Sc 1200»?
Ga 30o?
Ti 25000?
Go УО00
V 16800?
As 5000
Cr 15050?
So 2170
Mn 12450?
Br-7o
Fe 1600 Co 15230 Ni 148R
Кг—100?
Rb 390
Ag 9620
Sr 6000
Cd 3220
Y 1000»?
In 1760
Zr 15000
Su 2410
Nb 19500
Sb 6300
Mo 22000
To 4460
J-114»
Ru 2000»? Rh 19000? Pd 1535.
8
9
Xe?
Cs 270
Ba 8500
La 8100
Co 6230
10
11
Aa 10930
Hg—390
Tl 3040
Pb 3280
Та 22500
Bi 269»
W 2600»
Os 27000 Ir 2020° Pt 1720
12
Rd?
Ok. 7000
Th 3040 -
U 21000?
R
R20
Высші? солеобразные окислы:
RO [ R208 | ROa | R205 | R03 | R207
Высшія -газообразныя водородпыя соединенія
I RH4 I RH3 I RH2 I BH I
UOj
— 393 —
видно, что элементы, обладающіе малымъ атомнымъ в?-
сомъ и большимъ атомнымъ объемомъ, бол?е легкоплавки,
ч?мъ элементы съ малымъ атомнымъ объемомъ.
Электропроводность металловъ уменьшается отъ Ag въ
сл?д. порядк?: Ag, Си, Аи, А1, Mg, Na, Zn, Cd, Ca, К,
Co, Sn, Fe, Ni, Pt, Pd, As, Sb, Hg, Bi. Есла принять
электропроводность Hg за 1, то таковая для Ag = 57 —
— 63,8, а Ві = 0,8 — 0,867 при комнатной температур?.
Относительно способности элементовъ вступать въ хи-
мическія реакціи, какъ уже сказано, существуешь сл?д.
зависимость: наибол?е легко проявляютъ химическую
энергію и даютъ наибол?е прочныя соединонія элементы
съ наибольшимъ атомнымъ объемомъ, наприм?ръ,
щелочные металлы 1-й группы (К, Na и др.), щелочно-зе-
. мельные 2-й группы (Ca, Sr, Ва). Это же относятся и
къ металлоидамъ; наприм?ръ, элементы группы
кислорода (6-й) и группы галлоидовъ (7-й) им?ютъ наиболь-
шіе атомные объемы и наибольшую энергію къ
реагированию.
Въ техническомъ отношеніи им?ютъ знач?ніе сл?-
дующія свойства металловъ: ковкость, тягучесть и вяз-
« кость.
Ковкостью называется способность металловъ
расплющиваться въ полосы или листы подъ ударами молота. У
различныхъ металловъ ковкость очень разнообразна: одни,
какъ золото1), могутъ расплющиваться въ чрезвычайно
тонкіе листы, другіе, какъ, наприм?ръ, висмутъ, марга-
нецъ,—хрупки.
Тягучесть, т.-е. способность металловъ вытягиваться
въ проволоку, также различна у разныхъ металловъ.
Золото является и по тягучести первымъ; за вимъ идутъ:
серебро, ялатяна, алюминій, жел?зо, м?дь и др.
і) Золото можно расплющивать въ столь тонкіе листочки, что они
проов?чиваютъ: бол?? 10.000 такихъ листочковъ попдетъ въ слой
толщиною въ 1 мм.
394 —
Вязкость металдовъ, то-есть способность
противостоять разрыву, м?ряется наименынимъ грузомъ, подъ
д?йствіемъ котораго разрывается проволока, сд?ланнаія
изъ даннаго, металла и им?ющая 2 мм. въ діаметр?; же-
л?зная проволока наибол?е вязка, за ней по вязкости
сл?дуготъ: м?дная, оловянная, свинцовая и др.
Отношеніе металдовъ нъ другимъ элементамъ.
§ 170. Металлы обладаютъ способностью вступать въ
соединенія какъ съ металлоидами, такъ и между собою.
Соединенія съ метатлоидами наибол?е характерны и
постоянны, что и попятно: зд?сь соединяются элементы
противоположная характера, а сл?довательно, химическая
энергія (лучше д?йствующая по противоположности)
д?йствуетъ наибол?о сильно: ч?мъ р?зче
противоположность между соединяющимися металломъ и металлоидомъ,
т?мъ легче вознпкаетъ и энергичн?е протекаетъ между
ними реакція и т?мъ прочп?е получающееся соединеніе.
Характеръ получающихся соединений зависитъ, конечно,
отъ характера соединившихся элементовъ и отъ формы
(или типа) ихъ соединенія. Наиважн?йшими соединеніями
зд?сь будутъ: окислы, гидраты окисло?ъ, с?рнистыя
соединенія, галоидным соединенія и соли нислотг1).
Ч?мъ меньше различія между соединяющимися
элементами (наприм?ръ, слабый металлъ и слабый металло-
идъ| т?мъ трудн?е они реагируютъ и даютъ мало прочныя
и нехарактерныя соединенія; элементы при этомъ мало
тратятъ своей энергіи; сл?довательно, слабо изм?няются
въ свойствахъ, и получающееся соединеніе часто обла-
даетъ т?ми же свойствами, какими обладаютъ
образовавшее его элементы.
!) Большинство соединеній металловъ суть іоногены, т.-е.
электролитически диссоціирующія на іоны: металлъ въ нихъ за
небольшими исключеніями (а именно—когда онъ является частью сложнаго
іона) является катіономъ и им?етъ всегда одни и т? же свойства
независимо отъ аніона, ч?мъ и пользуются въ аналитическое химіи.
— 395 —
Типичными въ этомъ отношеніи являются соединенія
металловъ съ металлами, паз. сплавами, а если металлы
сплавляются со ртутью—амальгамами. Подобныя соеди-
ненія составляютъ промежуточную стадію между
механическими см?сями и химическими соединеніями.
Сплавы.
§ 171. При сплавленіи металловъ происходить
обыкновенно раствореніе одного металла въдругомъ; приохлажде-
ніи сшгавъ застываетъ вновь въ твердое тЬло, и такимъ
образомъ получается „твердый растворъ"; но при н?ко-
торыхъ металлахъ посл? сплавленія выд?ляются опред?-
ленныя химическія соединенія металловъ между собою въ
атомныхъ отношеніяхъ, при чемъ, конечно, свойства
соединившихся металловъ изм?няются; наприм?ръ, ZnPt,
ZngHg, Cu3Sn. Такія химическія соединенія металловъ
другъ съ другомъ могутъ, въ свою очередь, представлять
твердые растворы въ какомъ-либо металл?. Чаще всего
сплавы представляютъ твердые металлическіе растворы
опред?ленныхъ хымическихъ соединены металловъ.
Изъ этого опред?ленія понятно, что въ сплавахъ, съ
одной стороны, встр?чаются т? же свойства, что и въ
сплавленныхъ металлахъ, и параллельно—н?которыя
новый свойства: Такъ, иногда при образованы енлавовъ
происходить уменыпеніе объема (наприм?ръ, при спла-
вленіи Си съ Sn, Си съ Zn и др.), въ иныхъ увеличеніе
(наприм?ръ: Ag съ Си, РЬ съ Ag) объема, а параллельно
въ первомъ случа? — повышеніе уд?льнаго в?са, а во-
второмъ—пониженіе его, сравнительно съ уд?льнымъ в?-
сомъ сплавленныхъ металловъ. При образованіи сплавовъ
происходитъ или выд?леніе (А1 -f Си или Ag -f- Sn) или
поглощение (Sn —Hg или Pb-j-Sn) тепла, т.-е. какъ и
при химическихъ соединеніяхъ.
Температура плавленія сплава обыкновенно ниже
гемпературъ плавленія взятыхъ металловъ. Такъ, напри-
~ 396 —
м?ръ, сплавъ калія (плав. 62°) и натрія (плав. 96°) въ
эквивалентныхъ количествахъ плавится при 8°; сплавъ
изъ 1 ч, свинца (плав. 326°), 1 ч. олова (плав. 231°),
2 ч. висмута (плав. 260°) плав, при 90°, а сплавъ изъ
8 ч. свинца, 4 ч. олова, 15 ч. висмута и 3 ч. кадмія
(пл. 315°) плав, немного выше 60°, тогда какъ каждый
металлъ въ отд?льности плавится гораздо выше
температуры сплава.
Твердость сплавовъ въ болыпинств? случаевъ бод?е
твердости металловъ, входящихъ въ составь сплава.
Этимъ -пользуются въ техпик?: такіе металлы, какъ
золото, серебро, въ чистомъ состояніи очень мягки,— они
скоро бы и стирались; сплавленные же съ м?дыо они
д?лаются значительно тверже. Поэтому монеты и драго-
ц?нныя вещи и д?лаются не изъ чистыхъ золота и
серебра, а изъ ихъ сплавовъ съ м?дыо.
Ковкость и вязкость металловъ, а равно
теплопроводность и электропроводность, въ силавахъ понижаются.
Цв?тъ сплавовъ часто сильно отличается отъ цв?та
металловъ, ихъ составляющихъ; такь, золото красн?етъ
отъ прибавки м?ди, сплавъ алюминія съ м?дыо им?етъ
дв?тъ Золота и т. д. г).
Металлы въ природ?. Способы полученія металловъ.
§ 172. Металлы, мало энергичные и съ трудомъ
соединяющіеся съ другими элементами, находятся въ
природ? по большей части въ свободном^ состояніи.
Такихъ металловъ немного; сюда относятся благородные
J) Составь н?которыхъ сплавовъ: 1) Латунь— обыкновенная со-
стоитъ изъ 1 ч. Zn и 2 ч. Си; видоизм?нет? латуни—томпакъ—тоже
изъ м?ди и цинка, но лосл?іняго меньше (ок. 1&%)- 2) Бронза изъ
Си (.отъ 70 до 9О0/О Си) и Sn. 3)" Алюминіева бронза—изъ AL и Си.
Новое серебро (нейзильберъ, арг?нтанъ, м?льхіоръ)—изъ Си, Zn я
$\. Нрипои~изъ Си (2 ч.) и РЬ (1 ч.).
— 397 —
металлы: золото, серебро, платина, а также отчасти ртуть
и м?дь.
Другіе металлы встречаются въ соединеніяхъ — чаще
съ кислородомъ (окислы), съ с?рой и въ вид? солей.
Природный соединенія металловъ называются рудами.
Самородные металлы (An, Ag, Pt, Си, Hg, Ві) отд?-
ляются отъ прим?сей обыкновенно механическими
приемами, наприм?ръ, отмываніемъ водой; или ихъ извлека-
ютъ спедіальными растворителями, напр., растворомъ
KCN извлекаютъ золото изъ розсыпей.
Изъ соединеній металлы выд?ляются сл?дугощими,
наибол?е типичными способами:
1) Возстаповленгемъ изъ окисловъ. Возстановленіе
производить или углемъ или водородомъ при
повышенной температур?. Способъ возстановленія углемъ
употребляется обыкновенно при получеши металла въ болыпомъ
количеств?. Добываніе, наприм?ръ, жел?за и м?ди идетъ
такимъ образомъ:
2Fe203 -f ЗС= 4Fe + ЗСОа,
2СиО+- С = 2Са+ С02.
Возстаиовляющимъ образомъ также д?йствуетъ окись
углерода (СО), наприм?ръ: ZnO-f-CO = Zn-(-COa.
Возстановленіе водородомъ мы вид?ли, наприм?ръ,
при анализ? малахита, гд? СиО -|- Н2 — Ы20 -j- Си
(стр. 13).
Для возстановленія жел?за, хрома, марганца и н?ко-
торыхъ другихъ металловъ изъ ихъ окисловъ прим?ненъ
алюминій. Для этого см?шиваютъ норошокъ алюминія
съ окисью хрома Сг203 (жел?за и др.), пом?щаютъ въ
тигель изъ огнеупорнаго матеріала и поджигаютъ массу1)
при помощи зажженной ленты магнія; при этомъ
алюминій сгораетъ на счетъ кислорода окисла, выд?ляя
!) Эта см?сь получила назваыі? «терыитъ».
— 398 —
огромное количество тепла; металлъ же получается въ
свободномъ состояніи:
Сг203 + 2А1 = А12Оа-|-Сг2.
2) Д?йемвіемъ на галогсдныя соединенія
металлическими каліемъ или натріемъ, которые и выт?сняютъ
металлы изъ галоидныхъ соединеній.
Наприм?ръ:
AlCL4-3Na==3NaCl-|-Al.
/
v 3} Отнятіемъ с?ры отъ с?рнистыхъ соединеній.
Для этого д?йствуютъ или: а) металломъ, им?ющимъ
большее сродство къ с?р?, ч?мъ металлъ, соединенный
съ ней.
Наприм?ръ:
PbS-j-Fe^FeS + Pb.
b) Или с?рнистое соединеніе прокаливается, и с?ра
при этомъ сгораетъ. Такъ добывается, наприм?ръ, ртуть
изъ с?рнистаго ея соединенія:
HgS-|-Oa^Hg + SOr
c) Иногда с?рнистыя соединенія при осторожномъ про-
каливаніи при доступ? воздуха переходятъ въ с?рно-
кислыя соединенія; изъ с?рнокислой же соли добываемый
металлъ выд?ляется бол?е сильнымъ металломъ.
Наприм?ръ, при накаливаніи с?рнистой м?ди получается:
CuS-{-202 = CuS04,
м?дь же выд?ляется жел?зомъ:
CuS04-pFe = FeS04 -f Си.
d) Нер?дко при сгораніи с?ры на воздух?
соединенный съ ней металлъ переходить въ окиселъ. Въ этомъ
случа? съ окисломъ надо поступать такъ, какъ указано
— 399 ---
выше, т.-е. возстановитьх его или углемъ, или вадоро-
домъ, или алюминіемъ. )
4) Д?йсш?іемг электрическаго тока. Тяжелые
металлы получаются при пропусканіи тока въ водный рас-
творъ ихъ солей, легкіе же — въ расплавленныя,
преимущественно, хлористыя ихъ соли. Анодомъ при этомъ
служить уголь, а катодомъ—жел?зная проволока.
Металлы при электролиз? изъ соединеній отлагаются
па отридателыюмъ полгос?.
Соединенія металловъ.
I. Окислы.
§ 173. Окислами называются соединенія эл?ментовъ
съ кислородомъ.
1) Металлы, за исключепіемъ благородгшхъ, довольно
легко непосредственно соединяется съ кислородомъ,
образуя окислы. Энергичные металлы, наприм?ръ, К, Na, Ca,
Sr и др., образуютъ окислы уже при обыкновенной темпе-
ратур?; мен?е же энергичные требуютъ предваритель-
наго иагр?ванія, различнаго при различныхъ металлахъ.
Наприм?ръ, магній при накаливаніи загорается и даетъ
MgO; при полученіи окиси цинка (динковыхъ б?лилъ)
пары цинка приходятъ въ соприкосновеніе съ воздухомъ,
и цинкъ сгораетъ въ ZnO—окись цинка.
2) Кром? того, окислы могутъ быть получены про-
каливаніемъ гидратовъ окисловъ:
Cu(0H)2 = CuO + H2O.
3) Наконецъ окислы получаются также прокалива-
ніемъ легко разлагающихся солей н?которыхъ кисло-
родныхъ кислотъ, главнымъ образомъ, азотной и угольной:
Pb(N03)2 = РЬО -j- 2N02 -f О,
СаС03 = Са0 4-С02.'
— 400 —
Окислы щелочныхъ металловъ (К, Ма и др.) и- щ?-
лочно-земельныхъ (Са, Sr и Ва) растворимы въ вод?;
окислы же осталышхъ металловъ не растворяются въ
вод?.
Растврреніе окисловъ сопровождается дереходомъ ихъ
въ гидраты окисловъ.
Большинство металловъ им?етъ по н?скольку окисловъ,
которые различаются въ названіяхъ: недокись, закись,
окись, перекись. Окиси и закиси обыкновенно съ
кислотами даютъ соотв?тственныя соли и называются соле-
образными окислами; химическіи характеръ ихъ, сл?д.,
основной. Такіе окислы бываютъ преимущественно только
трехъ типовъ: R20, RO и R203. Иногда высшіе окислы
металловъ им?готъ кислошный характеръ, и тогда они съ
водою образуютъ кислоты. Окислы, не дающіе пи солей
ни кислотъ, называются безразличными; таковы, напри-
м?ръ, перекиси металловъ.
Большинство окисловъ представляетъ соединенія по-
стоянныя: они не разлагаются при повышеніи температуры.
Только окислы мало энергичныхъ металловъ при нагр?-
ваніи разлагаются (наприм?ръ, Ag20, HgO) на металлъ
и кислородъ,
П. Гидраты окисловъ.
§ 174. Гидраты окисловъ можно разсматривать какъ
воду, у которой водородъ зам?неаъ металломъ, или какъ
соедипеніе окисловъ съ водой. Они получаются:
1) Д?йствіемъ энергичныхъ металловъ на воду, на-
прим?ръ, К и Na; гидраты окисловъ щелочныхъ
металловъ получаются зд?сь при обыкновенной темгератур?,
и реакція идетъ очень энергично; такъ, наприм?ръ,
Na-f H20 = NaOH + H.
2) Соединеніемъ воды съ окисломъ металла:
NaaO + HsO = 2NaOH.
BaO-f Н20 = Ва(ОН)2.
— 401 —
3) Гидраты тяжелыхъ металловъ получаются д?й-
ствіемъ ?дкгіхъ щелочей на распгворимыя въ вод? ихъ
соли:
ZnS04 -|- 2NaOH = Zn(OH)8 -\- Na2S04.
Окислы ртути и серебра при обыкновенныхъ усло-
віяхъ не им?югпъ гидратовъ, а потому при д?иствіи
?дкихъ щелочей на ихъ соли образуются окислы:
2AgN08 + 2КОН — Ag20 -f H20 + 2KNOa,
HgCl2 + 2NaOH = HgO -f H20 -f 2NaCl."
Многіе гидраты окисловъ при повышенной темпера-
турЬ разлагаются съ выд?леніемь воды и съ образованіемъ
окисла, наприм?ръ:
Cu(OH)2=:CaO-f Н20.
Только гидраты окисловъ щелочныхъ и щелочно-зе-
мельныхъ металловъ очень стойки при повышенной темпе-
ратур?; гидраты же окисловъ тяжелыхъ металловъ
разлагаются на окиселъ и воду, часто даже при незяачитель-
номъ пагр?ваніи. .'
Растворимость въ вод? у гидратовъ окисловъ такая
же, какъ и у окисловъ; только гидраты окисловъ
щелочныхъ (К, Na и др.) металловъ растворимы въ вод?
хорошо, гидраты окисловъ щелочно-земельныхъ (Са, Sr,
На) также еще растворяются въ вод?, но уже гораздо
хуже гидратовъ окисловъ щелочныхъ; гидраты же
окисловъ вс?хъ другихъ металловъ въ вод?
нерастворимы.
Какъ видно изъ формулъ гидратовъ окисловъ, вс?
они характеризуются присутствіемъ группы (ОН), такъ
наз. воднаго остатка (или гидроксила): количество
группъ (ОН) въ полномъ гидрат? всегда равно
валентности металла, иапрпм?ръ, К'(ОН), Са"(ОП)2, АГ"(Т)Н)3
и т. д.
Неоргапическая хпмія. 2о
— 402 —
III. С?рнистыя соединенія.
§ 175., С?рнистыя соединенія по составу въ больший-
ств? слуЧаевъ аналогичны окисламъ (S и 0 суть
элементы одной и той же 6-й группы період. сист.).
Наприм?ръ:
Окись калія К20. С?рнистый калій K2S.
Окись м?ди СиО. С?рнистая м?дь CuS.
И методы полученія с?рнистыхъ соединеній им?ютъ
общее съ методами полученія окисловъ: 1) подобно обра-
зовапію посл?днихъ, многіе металлы прямо
соединяются съ с?рой, наприм?ръ, м?дь (Си), жел?зо (Те):
Cu + S = CuS; Fe + S = FeS.
Вс? с?рнистыя соединенія можно разсматривать какъ
соли H2S, который, какъ изв?стно, есть кислота. 2) Отсюда
понятенъ и второй методъ полученія с?рнистыхъ соеди-
неній — при д?йсшвги с?роводорода (или его аммоній-
ной соли (NH4)2S) на растворы солей металловъ,
наприм?ръ:
CuS04 + H2S — CuS + H2S04. ... (1)
ZnS04-j-(NH4)2S = ZnS + (NH4)2S04. . (2)
{
х Осажденіе с?роводородомъ сопровождается, какъ видно
изъ уравненія (1), образованіемъ побочнаго продукта —
кислоты. Н?которые с?рнистые металлы въ этой кислот?
могутъ растворяться; въ такихъ случаяхъ (наприм?ръ,
уравненіе (2) с?роводородъ и зам?няется с?рнистымъ аммо-
ніемъ, при чемъ зд?сь побочнъшъ продуктомъ является
уже не кислота, а ея аммонійная соль. )
Полученіе с?рнистыхъ соединеній по второму методу
неприложимо только кь металламъ: щелочпымъ — К, Na
и щелочно-земедьнымъ— Са, Sr и Ва, а также и Mg.
С?рнистыя соединенія этихъ 6-ти металловъ получаются
— 403 -
при возстановленіи углемъ ихъ с?рнокислыхъ солей,
наприм?ръ:
BaSO,-f 4C = BaS + 4CO.
С?рнистыя соединенія большинства металловъ
нерастворимы въ вод?; растворимы они лишь только у выше-
написанныхъ металловъ: К, Na, Ca, Sr, Ba и Mg.
IV. Галоидныя соединенія.
§ 176. Галоидныя соединенія можно разсматривать
какъ продукты непоср?дственнаго соединенія металловъ
съ галоидами, или какъ соли галоидоводородиыхъ кис-
лотъ. Отсюда понягны и два метода нолученія ихъ:
1) При прямомъ соединены металловъ съ галоидами.
Этимъ методомъ можно получить галоидное соединеніе
какого угодно металла.
2) При д?йствт галоидоводородиыхъ кислотъ или
на свободные металлы^ или на ихъ окислы, гидраты
окисловъ, с?риистыя соединенія, или, наконецъ, на
углекислый соли металловъ. (Подробн?е объ этомъ
общемъ метод? полученія солей будетъ сказано при со-
ляхъ.) Галоидныя соединенія металловъ большею частью
растворимы въ вод? (исключеяія: Hg, Pb, Ag, Си) и
водою у большинства при обыкновенной температур? не
разлагаются. Последнее свойство р?зко отличаетъ ихъ
отъ галоидныхъ соединеній металлоидовъ, которыя водою
легко разлагаются. Хлористыя соединенія металловъ
отличаются большею прочностью, нежели бромистыя и іоди-
стыя.
Y. Соли.
§ 177. Соли можно разсматривать, какь производныя
кислотъ, въ которыхъ водородъ зам?ненъ на металлъ 1)-
Типовъ солей бываетъ четыре:
*") Оъ точки зр?нія теоріи электролитической диссоціаціи прив?-
денныя опред?л?нія солей выражаются такъ:
Солями называются такія соединенія, одинъ изъ іоновъ о бмЬн-
наго разложенія которыхъ есть осіатокъ кислоты, а другой—оста-
26*
— 404 —
1) Среднія — когда весь водородъ кислоты зам?неиъ
на металлъ, наприм?ръ: КС1, K2S04, Na2C03.
2) Кислый—когда только часть водорода зам?нена на
металлъ, наприм?ръ, KHS04, NaHC03; сл?довательио,
зд?сь не вся кислота нейтрализована металломъ. Эти соли
наибол?е свойственны энергичнымъ металламъ.
3) Основныя—когда не все основаніе нейтрализовано
кислотой, или, точн?е, когда въ соли остатковъ кислоты
мен?е, ч?мъ могло бы быть, наприм?ръ, Pb(OH)N03.
(а могло бы быть Pb[N03]2) или Bi(OH)2N03 (а могло бы
быть Bi[N03]3). Основныя соли образуются
преимущественно мало энергичными металлами.
4) Двойных— когда молекула образуется чрезъ соеди-
неиіе двухъ молекулъ солей, паприм?ръ, KCL MgCl2,
A12(S04)3 • K2S04 . 24Н80 i).
токъ основанія. При этомъ подъ кислотой разум?ютъ такое со?динс-
ні?, у котораго одинъ изъ іоновъ обм?ннаго разложенія есть
водородъ; а подъ основатель—такое соединеніе, у котораго однимъ изъ
іоновъ обм?ннаго разложенія является водный остатокъ, или гидро-
ксилъ (ОН). Основность кислотъ определяется колич?ствомъ водород- *
ныхъ іоновъ, атомность основанш—количествомъ гядроксильныхъ
іоновъ. Остаткомъ кислоты называется все то, что связано въ
кислот? съ водороднымъ іономъ, а остаткомъ основанъй—то, что
связано съ гидроксильнымъ іономъ. Средними солями называются
соли, въ молекул? которыхъ н?тъ ни водородныхъ ни гидроксильныхъ
іоновъ. Кислыми солями называются соединенія, въ которыхъ одинъ
изъ іоновъ есть остатокъ основанія, а другіе іоны —- остатокъ
(остатки) кислоты и іонъ (іоны) водорода. Основными солями наз.
соединенія, въ которыхъ одинъ изъ іоновъ есть остатокъ основанія, а
другіе іоны—остатокъ (остатки) кислоты и гидроксилъ (гидроксилы).
Двойныя соли, т.-е. состоящія изъ двухъ молекулъ солей, въ вод-
ныхъ растворахъ отчасти или ц?ликомъ распадаются на т?
слагаемые, изъ которыхъ он? составлены.
*) Еще отдичаютъ комплексных соли. Отличіе ихъ отъ двой-
ныхъ солей сл?дующее: если при соединеніи двухъ солей между собою
въ водкомъ раствор? іоны остаются прежніе, т.-е. какіе были у
солей до соединенія, то это будутъ двойныя соли (напр., квасцы); если
же лосл? соединенія двухъ солей въ водныхъ растворахъ сложная
— 405 —
Методы полученія солей:
1) При д?йствіи кислоты па ліеталлъ, наприм?ръ:
Zn 4- H2S04 = ZnS04 + Hg.
2) При д?йствіи кислоты па окиселъ металла или
на его гидратъ, наприм?ръ:
CuO + H2S04 = CuS04 + H20,
Cu(OH)2 + H2S04 = CuS04 -f 2Н20.
3) При д?йствіи солей на соли обм?ннымъ разложе-
ніемъ, наприм?ръ:
ВаС12 -f Na2S04 = BaS04 -f 2NaCl.
4) При д?йсгвіа мен?е летучей кислоты на соль
другой какой-нибудь кислоты^ бол?е летучей.
Посл?днія дв? реакціи протекаютъ до конца (сполна)
лишь въ томъ случа?, если какой-нибудь изг продуктовъ
реакціи можешь удалиться изг сферы реакціи или въ
вид? газа (наприм?ръ, СаС03 -J- H2S04 = CaS04 -\- С02 -f-
-f-H30) или въ вид? выпадающаго нераст?оримаго
осадка (наприм?ръ: BaCl2 + HaS04 = BaSO4 + 2HCl).
{ § 178. Приведенное правило им?етъ широкое прим?-
неніе въ химическихъ реакціяхъ и изв?стно подъ име-
немъ закона двойныхъ разложепій, установленнаго Бер-
толле. Его формулируютъ еще такъ: два т?ла, заклю-
чающія элементы MX и NY (наприм?ръ, дв? соли или
соль и кислота), будучи приведены во взаимное прикосно-
веніе., образуютъ чрезъ двойное разлоэюеніе т?ла NX
и MY, но образованіе новыхъ т?лъ не доходить до
конца, если ни одно изъ присутствующихь т?лъ не
удалится изъ круга взаимод?йствія (см. 44 стр.).
Отсюда, если взять растворы двухъ солей, иаприм?ръ,
NaCl и KN03, и см?шать ихъ въ эквивалентныхъ коли-
соль даетъ другіе iohuj то она будетъ комплексной, напр., соль K4Fe(CN)fi
(о ней см. при ж?л?з?).
— 406 —
чествахъ, то только часть частидъ NaCl перейдетъ въ
NaN03 по уравпепіго:
NaCl -J- KN03 = NaN03 -{- KCI;
но KCI можетъ опять вступить во взаимод?йствіе съ
NaN08 и дать NaN03+ KC1 = KN03 +NaCl, т.-е.
первоначальные продукты, потому что во взятомъ прим?р?
ни одииъ изъ продуктовъ реакціи не удаляется изъ
сферы реакдіи. Во взятомъ прим?р? образуются въ
раствор? 4 соли: NaCl, NaN03, KCI и KN03; реакція
все время идетъ и въ ту и въ другую сторону; между
д?йствующими веществами устанавливается „подвижное-
равнов?сіе" 7 т.-е. такое состояніе, при которомъ въ
единицу времени каждаго изъ д?йствующихъ веществъ
столько же образуется, сколько и разлагается а).
Количество каждой соли въ такомъ раствор? зависитъ отъ
массы и природы ея, отъ температуры и давлеиія. )
§ 179. Растворимость и прочность разлитых^
солей:
1) Азотнокислыя соли (среднія) вс?хъ металловъ
растворимы въ вод?. При накаливаніи вс? он?
разлагаются съ образованіемъ окисловъ, наприм?ръ, Pb(N03)2=
= PbO + 2N02-j-0.
і) Съ точки зр?нія теоріи электролитической диссоціаціи ходъ
реакцій обм?ннаго раздож?нія въ водныхъ растворахъ представляется
сл?дующимъ: вода, какъ растворитель,- стремится разложить
растворенное вещество на іоны, а само растворенное вещество стремится
противод?йствовать этой іонизаціи, т.-е. изм?нить свой составь такъ,
чтобы образовать устойчивый молекулы, которыя бы не диссоціиро-
вали на іоны (напр., образовать нерастворимый въ вод? вещества,
лначе осадки). Сл?довательно, сама-то реакція сводится къ
образованно устойчивыхъ противъ іонизирующаго д?йствія воды молекулъ, и
идетъ она до т?хъ поръ, пока не наступить равнов?сі? между диссо-
ціирующей силой воды и силой сопротивления вещества этой
диссоціаціи. Если въ результат? обм?нной реакцій получится вещество—не
эл?ктролитъ, то реакція идетъ до конца; реакція, сл?довательно, идетъ
въ сторону образованія наимеи?е диссоціирующихъ соединений.
s" -'''¦¦* I I t 1 I -I I I I I I I I I .1, J C
V fff Ж 30° 40' JO9 €0° 70° 80° SO" №°€.
2) С?рнокислыя соли у большинства металловъ
также растворимы; нерастворимы лишь BaS04, SrS04,
и PbS04; CaS04 немного растворимъ; эти соли
нерастворимы и въ кислотахъ; въ спирт? также нерастворимы,
кром? Fe2(S04)3-. С?рнокислыя соли многихъ металловъ
при накаливаніи обыкновенно не разрушаются.
— 408 —
3) Углекислый соли, за исключеніемъ К2С03 и Na2C03,
нерастворимы въ вод?, нерастворимы и въ спирт?, но
хорошо растворимы въ кислотахъ или, в?рн?е,
разлагаются кислотами съ выд?леніемъ С02 и образованіемъ
соли д?йсгвуфщей кислоты. При накаливаніи многія
довольно легко выд?ляютъ С02, а металлъ остается въ
вид? окисла, наприм?ръ:
СаС03 = С02 + СаО.
4) Кремнекислый соли также только у К я Na
растворимы въ вод?, вс? же прочія нерастворимы;
обыкновенно он? нерастворимы и въ кислотахъ. При накалива-
ніи не разрушаются.
5) Фосфорнокислый соли растворимы только у К и
Na, прочія нерастворимы въ вод?, но растворимы въ
кислотахъ. При накаливаніи въ большинстве случаевъ
не разрушаются.
6) О галоидиыхъ соляхъ сказано выше (см.
галоидный соедиы?нія).
Въ глав? о „вод?" было уже сказано, что, собственно,
каждое твердое вещество можетъ растворяться въ вод?;
но степень растворимости, зависящая отъ природы
вещества, а также отъ температуры и давленія, очень
различна у различныхъ веществъ. Иногда она бываетъ такъ
ничтожна, что для учета ея не находится методовъ о такихъ
веществахъ и говорятъ какъ о нерастворимыхъ. Таблицу
растворимости осиованій и солей см. въ приложеніяхъ (въ
конц? книги). Зд?сь же нриведемъ лишь н?сколько ири-
м?ровъ разнообразія растворимости н?которыхъ солей въ
зависимости отъ температуры.
Если температуры изобразить въ вид? абсцяссъ, а
количества соли, растворяіоіціяся въ 100 в?совыхъ ча-
стяхъ воды,—въ вид? ординатъ, то получатся „кривыя
растворимости", изображенныя на таблиц? (см. 407 стр.).
Какъ видно изъ таблицы, у KN03, напр., съ повы-
шеиіемъ температуры растворимость сильно возрастаетъ,
— 409 —
а у NaCl она очень мало изм?няется, у Na2S04 повы-
шеніе растворимости идетъ только до н?котораго пред?ла,
съ котораго начинается паденіе и т. д.
О состояніи солей въ водны^ь р^створахъ см. § 82.
Д?йствіе электрическаго тока.
§ 180. Въ § 82 было указано, что соли (а равно
основанія и кислоты) являются электролитами или
проводниками „второго класса"1). Проводя токъ, растворы
соли отлагаютъ свои іоиы въ свободномъ вид? на электро-
дахъ: съ іонами и движется электричество въ электро-
литахъ. іонное распаденіе (электролитическая диссоціа-
ція) солей совершается при акт? растворенія соли. Это
распаденіе можетъ быть и не полнымъ, т.-е. на ряду съ
молекулами электролктически-диссощированныші могутъ
находиться въ раствор? молекулы и недиссоціированныя
(электрически-нейтральныя): растворъ обладаетъ т?мъ
большей проводимостью и т?мъ меньшимъ сопротивле-
ніемъ, ч?мъ больше молекулъ раствореннаго вещества
диссоціировано электролитически. Въ результат?
электролиза іоны около электродовъ теряютъ свои электрическіе
заряды и превращаются въ обыкновенный простыя т?ла.
Посл?днія и отлагаются на электродахъ, при чемъ на
отрицательномъ полюс? (на катод?) всегда выд?ляется
металлъ, а на положительномъ (на анад?) — металлоидъ
(напр., при электролиз? СиС12: на катод? — Си, а на
анод?—С12), или металлоидная группа (напр., при
электролиз? соли CuS04: на катод? — Си, а на анод? — S04).
Однако полученные продукты электролиза нер?дко не
могутъ существовать, какъ таковые, и тогда происходит!.
і) Проводниками сперваго класса» являются металлы: прохожде-
ні? электричества чрезъ нихъ не сопровождается п?реносомъ матерін
(іоновъ), а последнее обязательно для проводниковъ «второго класса».
- 410 —
дальн?йшее ихъ изм?неніе. Напр., при электролиз?
поваренной соли NaCl выд?лившійся на катод? Na (металлъ
натрій) сейчасъ же д?йствуетъ на воду по уравненію:
Na-j-H20=NaObT-|-H, а потому съ катода выд?ляется
водородъ (Й) и около катода въ раствор? находится NaOH;
при вышеприведенномъ электролиз? CuS04
выявляющаяся на анод? группа S04 не можетъ существовать, а
распадается на S03-f-0, при чемъ кислородъ (0)
выд?ляется съ анода, a S03 съ водою около анода образуетъ
с?рную кислоту (S03-[-H80 = H2S04)1).
Законы электролиза.
§ 181. Фарадей, изучая явленія электролиза, устано-
вилъ два сл?дующіе закона, названные его именемъ:
1) Количество разлагаемаго вещества пропорціо-
нально полному количеству проходимаго электричества,
2) При одномъ и томъ эісе количеств?
электричества, прошедшемъ чрезъ разные электролиты, в?совыя
количества разложенныхъ электролитовъ мропорціо-
пальни химическимъ экви?алентамъ этихъ веществь
(или иначе: освобождаются химически эквивалентный
количества различныхг іоновъ)2).
Эквивалентный количества металловъ равны
количествам^ выражаемымъ ихъ атомными в?сами, д?ленными
на валентность, или, что то же, такія количества элемен-
товъ, который способны зам?щать одну в?совую часть
(одинъ атомъ) водорода или соединяться съ одной в?со-
вой частью (однимъ атомомъ) водорода.
*) Напомнимъ, что, кром? электролитической диссоціадіи, соли въ
водныхъ растворахъ могутъ испытывать еще «гидролитическую диссо-
ціацію? (см. § 115).
2) Такимъ образомъ движеніе электричества въ электролитахъ
сводится къ передвиженію іоновъ въ противоположныхъ направленіяхъ<
при чемъ каждый одноатомный катіонъ (напр., К, N& и др.) несетъ
съ собою къ катоду одинаковое количество положительна™ эл?ктри-
411 —
Спектральный анализъ.
§ 182. Обычный б?лый св?товой лучъ состоять изъ
чрезвычайно большого количества прост?йшихъ цв?тныхъ
лучей (или длинъ волнъ), на которые и можетъ быть
разложенъ при пропускали чрезъ призму. Лучи различ-
ныхъ дн?товъ, слагающее сложный б?лый цв?тъ, при
прохождении чрезъ призму испытываютъ различное
отклонена и, располагаясь въ опред?ленныхъ м?стахъ экрана,
даютъ то, что изв?стно иодъ именемъ непрерывная или
сплошного спектра.
Раскаленаыя твердый гь оюидкія т?ла посылаютъ изъ
себя лучи всевозможныхъ цв?товъ и даютъ
вышеуказанный сплошной спекшръ; при этомъ спектры отъ различ-
ныхъ т?лъ могутъ разниться только въ яркости.
чества, а одноатомный аніонъ (напр., С1, Вг, Х03 и др.) несетъ къ
аноду одинаковое количество отрицательнаго электричества.
Двухатомные катіоны (напр., Са, Zn, Си и др.) несутъ двойной зарядъ,
трехатомные (AI, Сг и др.), втрое больгаій зарядъ и т. д.; то же д?-
лаютъ двухатомные аніоны (напр., $0{), т.-е. несутъ двойной зарядъ
отрицательнаго электричества сравнительно съ одноатомнымъ аніо-
номъ. Такимъ образомъ электрическш зарядъ іона одноатомнаго
(какого бы то ни было элемента или сложнаго т?ла) есть величина
всегда постоянная и неизм?нная; онъ, такъ сказать, является ато-
момъ электричества (какъ положительнаго, такъ и отрицательнаго).
Впервые идея о сущесгвованіи атомовъ электричества дана была
Гельмгольцемъ.
«Законы Фарадея,—говорить Гельмгольцъ,—указываютх, что че-
резъ всякое поперечное с?ченіе электролита происходятъ всегда экви-
валентныя другъ другу электрическое и химическое двшкенія.
Постоянно одно и то же опр?д?ленное количество положительна™ и
отрицательнаго электричества передвигается съ каждымъ одноатомнымъ
іономъ, или съ каждымъ эквивалентомъ многоатомнаго іона, и
неразлучно сопровождаетъ его во вс?хъ п?редвиженіяхъ, совершаемыхъ
имъ черезъ жидкость. Это количество мы можемъ назвать электри-
ческимъ зарядомъ гона». Этотъ электрическш зарядъ іона на совре-
менномъ язык? и есть атомъ электричества. Атомъ отрицательнаго
электричества получилъ названіе электрона.
— 412 —
Совершенно иную картину даютъ раскаленные пары;
они даютъ спектры прерывные, т.-е. состояние только
изъ н?которыхъ цв?гныхъ полосъ, строго опред?л?нныхъ
для каждаго испареннаго вещества, разд?ленныхъ
темными промежутками. Такъ, teanp., пламя паровъ натрія
даетъ желтую линію, литія — красную и оранжевую ли-
ніи, калія—красную и синюю линіи и т. д. При этомъ
линіи каждаго элемента занимаютъ въ спектр? строго
опред?ленныя м?ста. Отсюда, если опред?ленный
прерывный спектръ всегда отв?чаетъ опред?ленному
веществу, то, конечно, возможно по спектру узнать
вещество.
При изсл?дованіи спектровъ см?сей получаютъ отъ
каждаго см?шаннаго вещества ему принадлежащей спектръ.
Таково основаніе, на которомъ впервые спектральный
методъ введенъ былъ, какъ методъ анализа веществъ,
Кирхгофомъ и Бунзеномъ. Если къ сказанному
прибавить, что для полученія спектра нужны ничтожныя доли
вещества, то важность спектральнаго метода еще
станешь ясн?е; такъ, наприм?ръ, олллпоо миллиграмма на-
трія уже даетъ возможность обнаружить его спектраль-
нымъ путемъА
Для изсл?дованія спектровъ въ лабораторіяхъ
употребляется спектральный приборъ сл?дующаго устройства
(рис. 97). Въ средин? его находится трехгранная призма
Р изъ свинцоваго стекла (флинтгласа). Трубка Л,
называемая коллиматоромь, им?етъ на удаленномъ отъ
призмы конц? подвижную вертикальную щель, передъ
которой ставится св?тящееся т?ло или пламя, Пронина-
ющіе черезъ щель лучи, проходя чрезъ собирательный
стекла, находящіеся въ трубк? А, получаютъ
параллельное направленіе и падаютъ на призму Р. Преломленные
призмою лучи, т.-е. спектръ, рассматриваются чрезъ
зрительную трубку -В, называемую опулярною.^ля опре-
д?ленія относительнаго положенія спектральньгхъ линій
- 413 —
служитъ трубка С, им?ющая на горизонтальноЁ щели
стеклянную прозрачную шкалу. Если осв?щать шкалу
св?тящимся пламенемъ, то д?ленія ея отражаются
поверхностью призмы и при надлежащемъ положеніи трубки
О проникаютъ въ зрительную трубку В, такъ что одно-
Рис, 97. Спектроскопъ,
временно въ ней видны изсл?дуемый снектръ и д?ленія
шкалы.
Чтобы им?ть возможность разсматривать и сличать
одновременно два спектра, передъ одной половиною
(верхнею или нижнею) щели трубки А прикр?плена
трехгранная прямоугольная призма, отражающая лучи второго
бокового пламени и направляющая ихъ чрезъ трубку А
на призму Р. Такимъ образомъ въ зрительной трубк? В
представляются два горизонтальныхъ спектра, одинъ надъ
другимъ, а между ними д?ленія шкалы. Способъ этотъ
прийг?няется часто для сличенія спектровъ разныхъ т?лт,
съ солнечнымъ спектромъ.)
— 414 —
Для полученія спектровъ м?талловъ обыкновенно вно-
сятъ въ пламя бунзеновской гор?лки ихъ летучія соеди-
ненія, который при накаливаніи и разлагаются съ выд?-
леніемъ самого металла. Трудноплавкіе металлы иногда
переводятся въ паръ въ пламени гремучаго газа или же
при помощи вольтовой дуги, образуемой между
электродами сд?данными изъ даннаго тугоплавкаго металла. По-
сл?днимъ способомъ могутъ быть изсл?дованы вс?
металлы; при температур? вольтовой дуги вс? металлы
плавятся и испаряются, давая окрашенное ихъ парами
пламя, которое и разсматривается въ спектроскопъ.
Спектры элементарныхъ газовъ всего удобн?е
наблюдаются, если пропускать разряды Румкорфовой спирали
чрезъ такъ наз. Гэйслеровы трубки съ газами.
Спектральнымъ методомъ открыты сл?дующіе
элементы: цезій, рубидій, таллій, ипдій, галлій, скандій и гелій.
§ 183. Кром? вышеописанныхъ прямыхъ св?тлыхъ
спектровъ, существуютъ еще темные спектры поглощенія.
Изв?стно, что каждый раскаленный газъ поглощаетъ
т? лучи, которые онъ самъ можетъ посылать. Отсюда,'
если на пути луча, дающаго непрерывный спектръ, по-
ставленъ какой-нибудь раскаленный газъ, то спектръ д?-
лается прерывнымъ, т.-е. на немъ появляются темныя
линіи (лиши поглощенія), а именно на тЬхъ м?стахъ,
гдЬ были бы св?тлыя, если бы спектръ получался только
отъ одного раскаленнаго газа. Такъ, наприм?ръ, при
пропусканіи б?лаго св?та, дающаго непрерывный спектръ,
чрезъ желтое пламя паровъ натрія, видна въ радужномъ
сп?ктр? б?лаго луча темная линія, какъ разъ на м?ст?
желтой линіи натрія, о которой упоминалось выше.
Получаемые такимъ образомъ спектры съ темными
линіями и называются спектрами поглощенія или
обращенными спектрами.
Сл?довательно, изучая обращенные спектры, можно
узнать составъ той среды, чрезъ которую лучъ прошелъ
на своемъ пути.
— 415 —
Фактъ обращенныхъ спектровъ сд?лалъ для спектраль-
наго метода доступной новую высоко интересную область —
это изученіе химическаго состава солнца и небесныхъ
св?тилъ.
Т? же обращенные спектры выяснили и причину такъ
наз. Фрауэнгоферовыхъ линій въ солн?чномъ спектр?.
Появленіе этихъ темныхъ линій объясняется т?мъ, что
св?тъ, посылаемый солнечнымъ ядромъ, проходить чрезъ
раскаленную газовую оболочку—солнечную хромосферу,
которая въ зависимости отъ своего состава и поглоща?тъ
опред?ленныя линій спектра. Такихъ линій въ солнеч-
номъ спектр? очень много: по нимъ судятъ такимъ обра-
зомъ о состав? самого солнца. Это изученіе показало
присутствіе на солнц? сл?дующихъ элементовъ: зкел?за,
натрія, калія, магнія, кальція, стронція> барія, хрома,
марганца, никкеля, кобальта, м?ди, цинка, свинца,
водорода и гелія.
Подобнымъ же образомъ изсл?дуется составь и дру-
гихъ небесныхъ св?тилъ.
Первая группа.
Щелочные металлы.
§ 184. Къ первой групп? періодической системы
принадлежать пять одновалентныхъ энергичныхъ металловъ,
а именно:
Литій Li
Натрій Na
Калій К
Рубидій Rb
Цезій Gs.
Вс? они носятъ пазваніе щелочныхъ металловъ; они
образуютъ самыя сильныя основанія, называемыя ?дкимп
щелочами.
Щелочные металлы показываютъ правильное изм?не-
иіе свойствъ съ увеличеніемъ атомнаго в?са:
1л1)
N&
К
Rb
Cs
Атомные
в?са = А.
6,94
23,00
39 ДО
85,45
132,81
Уд?дьные
в?са=<3.
0,59
0,97
0,862
1,53
1,87
Атомные
объемы = — •
а
1J,9
23,7
45,4
56,1
71,9
Температуры
• плавленія.
186°
95,6°
62,5°
38,5°
26,5°
Температуры
кип?нія.
выше 1400°
7420
66?о
—
270°
j) Литій по н?которымъ свойствамъ (ослабленная основность,
меньшая растворимость солей, напр., (1л2С03) является элементомъ,
переходнымъ ко второй групп?, и ближе стоитъ къ магнію.
— 417 —
Изъ этой таблицы видно, что съ увелич?ніемъ атом-
наго в?са уд?льные в?са и атомные объемы
(относительные объемы атомовъ) увеличиваются, а точки пла-
вленія и кип?нія понижаются.
Въ отнош?ніи химическихъ свойствъ, какъ сказано,
вс? эти элементы—одновалентные и самые энергичные
металлы: они легко окисляются, разлагаютъ воду при
обыкновенной т?мператур? и образуютъ сильный основа-
зіія (?дкія щелочи), съ кислотами дающія прочныя соли,
хорошо растворимый въ вод?У-съ увеличеніемъ атомнаго
вЬса зам?чается ув?личоніе химической активности (по-
вышеніе металлическихъ свойствъ).
Общая формула окисла этихъ одіювалентныхъ метал-
ловъ—R20, гидрата окиси ROH. Какъ окиселъ и гидратъ
ихъ, такъ и большинство солей этой группы хорошо
растворимы въ вод?. Общая формула с?рнистыхъ соеди-
пеній—R2S или KHS; хлористыхъ—RCi; азотнокислыхъ—
КЩ,; углекислыхъ—R2COg и RHC03 и т. д. Съ азотомъ
извъстны соедиііенія по типу M3N, напр., Na3N, K3N, LisN.
Натрій, Na. ^ v^
Атомный Bfecb~23j00. Уд. в. (вода— 1) —0,97. Темп, плавл. — 95,6**.
Въ соединеніяхъ одновалентенъ.
§ 185. Натрій широко распространенъ въ природ? въ
ішд? хлористаго натрія (NaCl), который находится въ
морской вод? и образу?тъ залежи ^каменной щм?_ во
многихъ м?стахъ земли (напр., въ Россіи, въ Гермапіи—
въ Стассфурт?, въ Галиціи и т. д.). Кром? того, *натріи
входитъ въ сосгавъ многихъ силикатовъ, зилійской^ со-_
литры (NaN03), кріолита и др. Вообще солями натрія
минеральная природа очень богата; почвой он? не
задерживаются (тогда какъ соли калія почвой прочно
удерживаются), а свободно фильтруются; по этой при-
чин? и въ растеніяхъ находятся преимущественно соли
калія, солей же натрія гораздо меньше, и морская вода
поэтому же богаче солями натрія, ч?мъ солями калія.
Неорганическая химія. **
— 418 —
Металлическііі натргй былъ нолученъ въ J 807 году
аиглшскимъ химикомъ Д.жи при электролил? расплавлен-
наго ?дкаго натра. Въ техники опъ получается иакали-
ваніемъ см?си сухой соды съ ,углемъ, или см?си ?дкаго
натра съ углеродистымь жел?зомъ.
l}Jfa2C03-|-2C = Na&H ЗСО.
2) MB.OH-pF^^S^^^Fe-] СО + С02 + 311.
Л въ посл?дпее время патрій нолучаготъ электроли-
зомъ расплавленнаго NaCl (или NaOH) въ жел?зныхъ
сосудахъ, разд?ляя электроды діафрашого, иначе реакція
пойдетъ обратно:
2NaCI-_2Na f- Cl21>
Натрііі плавится при 95,0° и кипитъ при 742°. При
обыкновенной температур? оиъ очень ыягокъ и легко
р?жется пожомъ 2). На св?жемъ разр?з? онъ серсбристо-
б?лаго цв?та съ металлическимъ блескоыъ, быстро
тускіі?ющимъ на воздух?, благодаря образованно описи
натрія, Na20, быстро переходящей въ гидраты, NaOH;
для предохранеіші отъ окисл?пія патрій сохраняется въ
керосші? или въ нефти. При медлеиномъ окислоліи па
воздух? образуетъ недокись натрія Na40.
і) Для получения нободьтаихъ количествъ натрія существуете, сл?д.
способъ: перекись натрія |\гао03] см?шивается съ др?веспымъ углемъ,
коксомъ или графитомъ и слабо (300- 4000) нагр?вается въ закры-
томъ тягл?. Реакція идетъ съ такимъ сильным* разогр?вапіемъ, что
большая часть натрія перегоняется и осЬдаетъ на крышк? и
верхней части тигля: ЗКа2Ой -(¦" 2С = 2Лга2С03 -\~ 2Na.
Если зам?нить уголь карбидомъ, то реакція идеть еще эиергич-
я?е (почти со взрывомъ), а потому вести ее сл?дуетъ съ небольшими
количествами: 7Ка202 + 2CaCg = 2СаО + 4\'а2С03 + 6Ха.
2) ігд?льный в?съ паровъ Na по отношению къ Н — 12,75, сл?д.,
молекулярный в?съ (М — 2D) —23,5: т.-е. почти равенъ атомному
в?су (23). Другими словами, частица натрія въ парахъ состоитъ изъ
одного атома. Раньше было уже зам?чено, что и частицы многихъ
другихъ металловъ (К, Zn, Cd, Пщ) въ парахъ тоже состоятъ лзъ
одного атома.
— 419
При д?йствіи на воду иатрій легко выд?ляетъ
водородъ, самъ переходя въ гидроокись:
2IJ/JJ 2Na = 2NaOH-j-II2;
водородъ при отомъ не загорается ^ Съ галоидами иатрій
роагируетъ энергично.
Гидрать описи патрія, NaOH, или іьдній^натръ
получается при кипячеиіи раствора Na2C03 съ гашеной
ішестыо:
NaaC()3 -f Са(ОП)2 = 2ХаОИ -]- СаС03;
лрл этомъ СаС03, какь нерастворимый ві> водь,
осаждается, a JfaOH остается въ раствор?.
Полученный растворъ ?дкаго натра сливаютъ съ осадка
углекальціевой соли, выпариваютъ досуха, плавятъ и
выливаетъ въ жсл?зныя формы2).
Въ настоящее время ?дкіё патръ получаютъ ири д?й-
сгвіи электричсскаго тока на водный растворъ поварен-
нон соли (NaClj: па анод? при отомъ пыд?ляется хлоръ,
а на катод?—иатрій, который съ водою даетт, NaOFT и
водородъ. Чтобы хлоръ съ анода не еталъ реагировать
съ NaOH (отчего могли бы образоваться: NaCl, NaCIO и
NaC103), электроды разд?ляютъ діафрагмой — пористой
перегородкой изь глипистаго известняка. При лтой ре-
акціи, какъ видно, получается и хлоръ.
ТіДкій патръ—б?лая твердая масса, очень легко
растворимая вь вод?. Иа воздух? онъ расплывается,
поглощая воду и углекислоту: iNaOH-J-CO^ = Na2C03 -\- На().
Въ хиыическомъ отношеніи NaOH — типичное сильное
основаніе (въ водныхъ растворахъ сильно распадается на
*) Если б?гающш по вод? к>сочекъ натрія задержать, положивъ
ішдъ него, напр., фильтровальную бумагу или кусокъ льда, то выд?-
дягощійея водородъ загорается.
2) При получении NaOH нельзя употреблять фарфоровой или
стеклянной посуды, потому что и та и другая Ьдкимъ натромъ рйзъ-
?даются.
27*
— 420 —
свои іоны—Na и ОН): различный кислоты легко даютъ
съ нимъ прочный соли. При д?йствіи нейтральпыхъ солей
другихь металдовъ NaOH вступаетъ въ обм?нное разло-
женіе и даетъ гидраты окисей этихъ металловъ, а самъ
переходить въ соль той кислоты, соль которой
участвовала въ реакціи, напр.:
CuS<\ + 2NaOH = Cu(OH)2 -f Xa2S04.
Въ техник? ?дкіи натръ им?етъ широкое прим?неніе для
приготовления стекла, мыла и т. д.
Перекись напгрія (Na202) получается при пролуска-
ніи сухого, лишеннаго С02; воздуха надъ нагрвтымъ ме-
таллическимъ натрі?мъ; представляетъ б?лый порошокъ,
расплывающійся на воздух?. Въ вод? растворяется съ
образованіемъ ?дкаго натра и съ выд?леніелгь кислорода:
Ата202 -|-H20 = 2NaOH -|-0. При д?йствіи слабыхъ кис-
лотъ выд?ля?тъ перекись водорода; носл?дняя по
отношению къ Na202 является кислотой. Na202 прим?няется
какъ сильный окислитель и для д?лей б?лонія шелка,
шерсти и проч. См?сь Na202 съ органическими
веществами отъ капли воды взрываетъ.
Хлористый патріи или поваренная соль, NaCl,
находится въ морской вод?, въ вод? соляиых'Ь озеръ и
исіочниковъ1) и образуешь громадный залежи каменной
соли въ Стассфурт? близъ Магдебурга, въ Величк? въ
Галидіи и въ Илецкой Защит? близъ Оренбурга.
Добывается хлористый натрій изъ морской воды сл?дующимъ
образомъ: во время прилива морскую воду впускаютъ въ
спеціально для этой ц?ли предназначенныя ямы и
оставляюсь ее тамъ испаряться подъ вліяніемъ солнечной
теплоты. Посл? достаточнаго испаренія осаждается
довольно чистая соль, которую выгр?баютъ лопатами. Исиа-
*) Въ 100 частяхъ морской воды содержится jVaCJ:
въ Мертвомъ мор? . . . 22,0
въ Средиземномъ мор? . . 3,8
въ Атлантическому океан?. 3,6
— 421 —
ренте иногда уекоряютъ, подвергая растворъ градирова-
пію въ градирпяхъ—высокихъ сооруженіяхъ изъ хвороста:
сверху на висящій хворостъ льютъ соляной растворъ,
который; благодаря большой поверхности испар?нія,
испаряется быстр?е. Въ холодныхъ странахъ для этой же
ц?ли пользуются холодомъ; при замерзаніи воды выд?-
ляется почти чистый ледъ, соль же остается въ раствор?;
посл?дній выпариватотъ и добыватотъ такимъ образомъ
хлористый натрій.
Каменную соль добыватотъ прямо выломкою въ шах-
тахъ.
Химически чистый хлористый натрій получается при
пропусканіи HCL въ насыщенный растворъ поваренной
соли, такъ какъ въ соляной кислот? онъ мен?е раство-
римъ, ч?мъ въ вод?.
Хлористый натрій кристаллизуется безъ кристаллияа-
діонной воды въ кубахъ правильной системы. При на-
каливаніи кристаллы растрескиваются, всл?дствіе выд?-
ленія механически включенной воды. Кооффиціентъ
растворимости NaCL при 0° = 36, а при 100°= 39;
насыщенный растворъ содержитъ около 26°/0 соли; плавится
при 7750.
Поваренная соль употребляется въ пищуг) и для ц?-
лей консервированія; изъ нея готовить NaOH, Na2C03,
Na2S04, НС1 и др.
Азотнокислый натрій или натронная селитра,,
NaN03, по свойствамъ похожа на калійную селитру, но
отличается отъ нея большей гигроскопичностью
(всл?дствіе этого не можетъ быть употреблена для приготовле-
иія пороха). Болыпія залежи ея находятся вь Чили и
Неру, отчего NaN03 иногда называется чилійской
селитрой. Плавится она при 318°. Применяется для добы-
ванія азотной кислоты и калійной селитры (см. KN03).
*) Продажная поваренная соль (JVatrium chloratum) содержитъ
въ себ? лрим?си магніевыхъ солей MgC]2, MgSOj и др., отчего она
«а воздух? рыр??тъ и на вкусъ горьковата,
*
— 422 —
Азотнокислый патръ вь бодыпихъ количсствахъ лрлыЬ-
няется также въ качеств? удобрснія. Эго самое важное
вещество для азогистаго питапія растеиій.
С?рнотіслыи натрій или глауберова1) соль, Na2S04,
въ природе встр?чается въ вид? минерала тенардита
(около Мадрида) и вь пЬкоторыхъ источникагь, напри-
м?ръ, въ карлсбадской вод?. Фабричный сиособъ полу-
ченія ея состоить въ д?йствіи с?рной кислоты на
поваренную соль (напр., при производств? НС1, Na2C03).
Na2S04 кристаллизуется въ большихъ призмахъ моио-
клиническоіі системы съ 10 частицами
кристаллизационной воды; растворимость ея при разныхъ темиературахъ
очень различна: гшсъ, 1G0 ч. воды при 0° растворяютъ
12 частей, а при 33°—223 части Na,S04. 10Н2О.
При 33° образуется досятиводиый гидрата, имьющій
наибольшую растворимость: онь можетъ при нагр?ваніи
плавиться въ своей кристаллизаціонной вод? и легко
даетъ пересыщенный растворъ. При охлажд?ніи такого
пересыщеннаго раствора до Г)° появляются кристаллы
семпводнаго гидрата Na2S04.7H2O. Выше 33°
глауберова соль частью теряетъ воду и превращается въ см?сь
гидрата съ безводной солью. На воздух? прозрачные
кристаллы Na,2S04. 10Н2О постепенно теряютъ воду (вы-
в?триваются) и превращаются въ б?лый порошокъ.
Глауберова соль употребляется какъ слабительное
средство, а вь тохник?—для нолучеиія стокла и, глав-
иымъ образомъ, для получения соды но методу Лоблана.
С?рнистоктлый натрій, Xa2S03. 7Н20, получается
при д?йствіи S02 на NaOH. Прим?няется какъ
проявитель, въ фотографіи: онъ является возггановителемъ,
окисляясь самъ въ Na2S04.
С?рповапыісууьокислый mwy>m~Na2S203(cM. стр. 366).
і) Названіе это дано по имени врача и химика Глаубера,
который первый стадъ прим?нять эту соль, какъ л?карство, хорошо д?й-
ствующее на пищеварительный процеесъ. Она составляетъ главную
часть карлсбадской воды. Составъ глауберовой соли—iNagSOj. 10Н2О.
- 423 -
Уиекіьслый напьріп, или сода. Na2C03, им?егь очень
широкое прюі?неніе въ промышленности.
Въ природ? сода найдена въ готовоыъ вид? въ Мс-
ксик? близъ Калифорнскаго залива, въ Египт? н въ н?ко-
торыхъ м?стносгяхъ въ Азіи.
Въ техник? прим?няются 2 способа для полученія
соды; снособъ Леблана и амміачпый снособъ Сольвея.
Способъ Леблана распадается на 2 операціи: 1)
превращение поваренной соли (исходный продуктъ) въ
глауберову соль (сульфать), при чемъ побочнымъ продуктомъ
является соляная кислота:
2NaCl -[- HaS04-- - Na2S04 -, 2НС1,
и 2) провращеніо глауберовой соли въ соду. Это послЬд
нее производится вь пламеиныхъ нечахъ, вь которыхъ
накаливают ь см?сь глауберовой соли (1 ч.), каыеинаго
угля (9,5 ч) и мЬ.іа (I ч.); реакш'и проходить чорезъ
сл?д. фазы:
1) Na2S04-| 4С Na2S |-4C0;
2) Na3S-[-Car03 = CaS-['Na2C03.
Получаемый въ содовой ночи такь называемы/!
содовый плавь выщелачиваютъ водой, при чемъ полушоть
растворъ соды и содовые остатки, состоящіе, главнымъ
образомъ, изъ трудно растворимой см?си сЬрнистаго
кальція (OaS) съ СаО. Растворъ соды вьшариваютъ въ
лселЬзныхъ сосудахъ, и выд?лепную соду очищаютъ
сначала нрокалнваніемъ, а потомъ перекристаллизаціей.
Недостатки этого способа состоять въ томъ, что получается
нечистая сода, и въ томъ, что получается не им?ющіы
выгоднаго прим?ненія побочный продукть—CaS.
Амміачпый способъ раціональн?е (п дешевле и
продуктъ чище) предыдущаго и потому выт?сняетъ его. Оігь
состоитъ въ томъ, чго насыщенный растворъ поваренной
соли насыщаютъ подъ давленіемъ амміакомъ и угле-
кислымъ газомъ. При .зтомъ осалсдается трудно раствори-
424 —
мая кислая угленатровая соль, а пооочнымъ продуктомъ
является нашатырь. Реакція идетъ въ дв? фазы:
1) NH3 + H20 + C02 = NH4HC03;
2) NaCl + NH4HC08 = NH4Cl + NaHC08.
Полученную въ осадк? кислую угленатровую соль
отдбляіотъ отъ раствора нашатыря и зат?мъ прокалива-
ютъ, при чемъ она, теряя воду и углекислоту,
переходить въ соду.
2NaHC03 == №цС03 + II20 + GO,.
Углекислый газъ собираютъ и пускаютъ въ оборотъ;
изъ нашатыря д?йствіемъ гашеной извести вновь выт?с-
ияется амміакъ, который опять идетъ въ д?ло:
2NH4C1 -f Са(ОН)8 = СаС12 + 2NH8 + 2Н20.
Сл?довательно, при этомъ способ? побочные продукты
не теряются.
Сода кристаллизуется въ вид? большихъ моноклино-
эдрич?скихъ призмъ съ 10 частицами воды; изв?стны и
другіе гидраты соды.
Растворъ соды им?етъ щелочной вкусъ и щелочную
р?акцію (гидролизъ). Растворимость соды м?няется съ
температурой; при 33,5° она наибольшая (100 ч. воды
растворяютъ 59 ч. соды).
Безводная сода на воздух? поглощаетъ влагу;
плавится она при 850° и улетучивается немного при б?-
ломъ каленіи.
Прим?няется сода чрезвычайно широко: въ мылова-
ренномъ производств? (твердое мыло), въ стеклянномъ
(обыкновенное стекло), писчебумажномъ (при кипячсиіи
тряпокъ вм. съ известью), при б?леніи хлопчатобумаж-
ныхъ и льняныхъ изд?лій (ткани вываривають сначала
нередъ б?л?віемъ вь содовомъ щелок?); изъ соды
готовятся другія натронныя соединенія, напр., NaOH; въ до-
машнемъ обиход? сода идетъ при сгирк? б?лья, при
чистк? посуды отъ жира и т. д.
— 425 -
Кислый углекислый натрій, NaHC03 (или
двууглекислая сода), получается въ вид? кристаллическаго
вещества или по методу Сольвея или при д?йствіи угле-
кислаго газа на насыщенный растворъ соды (Na2COa).
Прим?няется въ медицин? для приготовленія шипу-
чихъ порошковъ и шипучихъ напитковъ.
Кремнекислый натрій, Na2Si03—натровое
растворимое стекло 1) получается при сплавленіи кварцеваго
песка съ NaOH (или съ Na2SO^ -f~ 4С). Онъ широко при-
м?пяется для приготовленія стеколъ, несгораемыхъ
тканей, для закр?плеяія красокъ и т. п.
К а л і й, К.
А томя. в?съ = 39,10. Уд. в?съ ~ 0,862 при 15°. Темп. гтлавл.=62,50*
Въ соединеніяхъ одновалентенъ.
§ 186. Въ природ? главн?йшими соединениями, въ
составь которыхъ входить калій, являются силикаты:
между ними наибол?е распространены полевой тпатъ
(AlSi08) и слюда, которые вм?ст? съ кварцеыъ слага-
ютъ грапитныя породы. При выв?триваніи отихъ породъ
калійныя соединенія переходятъ въ почву и всасываются
растеиіями. Кром? того, хлористый калій (КС1) входить
въ составь морской воды, а также образуетъ
значительный залежи въ Стассфурт? близь Магдебурга (минералъ
силъвинъ)\ входить въ составь минераловъ: карналита
(MgCl2. КС1. 6Н20) каинита (K2S04 . MgS04 . MgCl, .
. 6НаО) и др.
Мемал^тческій калій до посл?дняго времени
получался пакаливаиіемъ см?си поташа и угля:
К2С()3 +2С-= Ка 1-ИСО.
і) Ст?кломъ онъ называется потому, что, высыхая на воздух?,
даетъ стекловидную массу.
- 426 -
Въ настоящее время техника начала прим?нять для
иолученія метал лическаго калія (аналогично натрію)
электролизъ его соединеній,—это методъ, которьшъ въ
1807 г, калій былъ полученъ впервые Дови (электроли-
зомъ расплавлениаго ?дкаго калія).
Металлическіи калій па св?жемъ разр?зЬ им??тъ
серебристый блескъ. При обыкновенной температур? онъ,
подобно натрію, мягокъ и легко р?жется ножомъ. Онъ
плавится при 62,5°, кинитъ при 667° и при краснока-
лильномъ жар? превращается въ зеленоватый паръ.
Калій легко окисляется на воздух?, почему и
сохраняется въ хорошо закрывающихся сосудахъ подъ нефтью.
Зам?чателыю, что въ совершенно сухомъ состояніи
калій не окисляется, а въ присутствіи нпчтожнаго
количества воды (катализъ) реакдіа окнеленія идеть очень
быстро. Воду онъ разлагаетъ съ выдЬлеиіемъ водорода и
образованіемъ ?дкаго кали:
к + н2о = ксш-|-іі.
При разложеніи 1120 каліомъ выд?ляется такъ шюго
тепла, что водородъ самъ загорается и горитъ фіолето-
вымъ пламенемъ; окраска принадлежит!» парамъ калія.
Съ галоидами и сЬройкалій соединяется непосредственно
и также съ выд?леніемъ большого количества теплоты.
Окись калія, К2(), получается при пакаливанш калія
бъ сухомъ воздух?1). Она нредставляетъ б?лую массу,
жадно притягивающую воду и образующую при этомъ
гидратъ окиси калія.
Ггьдратъ окгьегь калія, КОН, обыкновенно получался
д?йствіемъ гашеной извести на потаить (К2С03):
KgCOg + Са(ОГ1)2 = 2КОН -]- СаСОа.
Л При этой реакдіи образуется и церектег. калія. т.-с.
аналогично тому, к \&ъ это было при натріЬ.
— 427 —
Въ посл?днее время КОН (подобно NaOH. см, при
п?мъ) начали получать при д?йствіи электрическаго тока
па растворъ хлористаго калія:
2КС1 ~|~ 2Н20 = 2КОН + Н2 -f С18.
Ъдкое кали б?лое кристаллическое вещество, легко
плавящееся, а при высокой темііератур?
улетучивающееся безъ выд?ленія воды. На воздух? КОН
расплывается, поглощая воду и углекислоту и превращаясь въ
погашъ (К2С03). Въ вод? и спирт? КОН легко раство-
римъ. КОН есть типъ силышхъ основаіші; пъ его
водномъ раствор? лакмусъ д?лается сипимъ, а фенол-
фталеинъ—красиымъ. Въ раствор? КОН сильно іонизи-
ровано. Всв кислоты оно нейтрализуетъ съ образованіемъ
среднихъ солей. При д?йствіи на соли тяжелыхъ метал-
ловъ даетъ гидраты окисей. Изъ аммонійныхъ солеи вы-
д?ляетъ NH3. Растворъ ?дкаго кали въ вод? разъ?даетъ
органическія вещества и потому не можстъ быть проц?-
живаемъ чрезъ фильтровальную бумагу. Стекло
растворяется въ ?дкомъ кали. Жиры имъ обмыливаются.
Растворъ КОП сильно разъ?даетъ кожу, при чемъ всл?д-
ствіе гидролиза б?лковыхъ и других ь веществъ
получается липкая масса. Въ техник? КОМ идетъ на изго-
товленіе мягкаго мыла.
(\ Галоидный соли калія въ чпетояъ шід? получаются
при ирямомъ соединеніи калія съ галоидами или при
раотвореніи ?дкаго кали или поташа въ галоидоводород-
ныхъ кислот,ахъ; въ см?си съ другими солями
(хлорноватистыми и хлорноватыми) он? пол} чаются при д?йствіи
галоидовъ на 1?Ш1 (см. ниже). Ои? вс? легко
растворимы въ вод?, кристаллизуются въ правильной систем?
и им?ютъ соленый вкусъ.
Хлористый налігі въ природ? встр?чается въ вид?
минерала сильвина; кристаллизуется въ прозрачных^ kv-
бахъ, уд. в?са 1,84, Плавится при 730° и улетучивается
— 428 —
при силыюмъ накаливаніи. При 0° коэффиціечтъ
растворимости его = 25,5, а при 100°—57.
Бромистый налги (КВг) и іодистый калгй (KJ) суть
твердыя б?лыя кристаллическія вещества, хорошо
растворимый въ вод?. Прим?няются въ качеств? л?карствъ.
KJ при д?йствіи О воздуха и С02 разлагается съ выд?-
леніемъ свободнаго J, отчего растворъ сильно
окрашивается.
Хлорноватотліева соль, КСЮ3 5) (бертоллетова соль
или хлорноватокислый калій), получается при пропуска-
ніи хлора въ кр?икій нагр?тый растворъ ?дкаго кали:
6КОН -f ЗС12 = 5КС1 + КСЮ3 4- ЗНаО.
При охлажд?ніи выд?ляется трудно растворимая
бертоллетова соль. Хлорноватокаліева соль кристаллизуется
изъ горячаго раствора блестящими пластинками моно-
клиноэдрической системы. Трудно растворима въ вод?.
(При 75 коэфф. раств. = 6.) Плавится около 35°.
Въ настоящее время КСЮ3 готовятъ электролитически—
изъ природнаго КС1 въ щелочномъ раствор?, не разд?-
ляя электродовъ, при чемъ выд?ляюшійся хлоръ реаги-
руетъ съ КОН по вышеприведенному уравпенію и даетъ
ксю8.
Бертоллетова соль прим?няется для полученія
кислорода, при приготовлении бенгальскихъ огней, взрывча-
тыхъ см?сей и какъ сильно окисляющее средство, напр.,
при нриготовленіи красокъ2). При д?йствіи соляной
кислоты КСЮ3 выд?ляетъ много хлора по уравпенію: КС103 +
f 6НС1 = КС1 -f ЗН80 -ЬЗСі,.
*) КСЮ3 въ продаж? называется по-латыни Каішп rhlorirum,
а по-н?мецки — KaUumchlorat; KC1 —по-латыни — Kah'um chloratwm,
а тго-н?мецки Каіігіт vMorid.
2) KCIOg съ углемъ, фосфоромъ, с?рой и н?которыми с?рни-
стыми металлами взрыва?тъ отъ удара, а потому ихъ никогда нельзя
растирать вм?ст?. При нагр?ваніи большихъ количествъ КСЮ3 раз-
ложеніе ея нер?дко сопровождается взрывомъ.
— 429 —
Хлорно?атистокаліе?а соль, КС10 (хлорноватисто-
кислый калій), получается при пропускали хлора въ
холодный и слабый растворъ ?дкаго кали:
2КОН + С12 -= КС14- КСЮ -f Н20.
Растворъ им?етъ запахъ хлора и обладаетъ б?ля-
шими свойствами (жавелевая вода).
Азотнокислый калій, KN03? или селитра, встр?-,
чается въ природ? въ свободномъ состояніи. Она
образуется пщ окисленіи азотъ содержащихъ органических/
веществъ при свободномъ доступ? воздуха и воды и подъ
вліяніемъ особыхъ микроорганизмовъ (Bacillus nitrificaus).
Искусственно она получается въ такъ называемыхъ
селитряиицахь, гд? иавозъ и разные оібросы съ
древесной золой и известью подвергають въ рыхлыхъ к^-
чахъ д?йствію воздуха въ теченіе 2—3 л?тъ. Образовав-
шіяся азотиокислыя соли калія выщелачиваютъ водой.
KN03 приготовляють также изъ чилійской селитры
(NaN03) при д?йствіи на нее КС1 при кипяченіи, по
уравненію:
NaN03 -f KCl -= KN03 + NaCl.
Реакція зд?сь совершается до конца, потому что
растворимость NaCl мала и почти одинакова, какъ при
обыкновенной температурь, такъ и при кипяченіи, a KN03
въ горячей вод? растворимъ гораздо бол?е, ч?мъ въ
холодной, а потому при охлажденіи горячаго раствора
KN03 выкристаллизовывается. Селитра кристаллизуется
большими шестигранными призмами ромбической системы.
При 0° коэффидіентъ растворимости ея=1,3, а при
100° = 24,7. Селитра плавится около 340° и при даль-
н?йшемъ нагр?ваніи разлагается на азотистокислый калій
и кислородъ:
KN0^=KNOa + O.
Селитра прим?няется въ громадныхъ количествахъ для
дьлей окисленія, для удобренія, при соленіи мяса вм?стіі
съ поваренною солью и для производства пороха.
— 430 —
ііорохъ представляет ь механическую см?сь 75°/0 (въ
среднемъ) селитры, 10% сЬры, 14° 0 угля и 1% воды.
Разложеніс пороха при сгораніи сопровождается образо-
вапіемъ свободдыхъ: азота, углекислаго газа, с?рнистаго
калія и др.
Д?йсгвіе пороха основано на быстромъ образовали
газовъ (азота и углекислаго газа) при значительномъ вы-
д?леиіи тепла, отчего объемъ ихъ бол?е ч?мъ въ 1.000
'разъ прсвышаетъ объемъ пороха1).
KN03 при пакаливаніи съ окисляющими веществами
(обыкновенно со свинцомъ) переходить въ азотистока-
лгеву соль, KN02: ото соль малопостоянная: въ водномъ
раствор? им?етъ щелочную реакдіго (гидролизъ).
Углекислый калШ, К2С03) пли поташъ (Pottasclie),
получается изъ золы растеній2), для чего посл?днюю
выщелачиваютъ водой и изъ полученнаго раствора
выкристаллизовываюсь сырой ноташъ. Для очищенія его еще
разъ перекристаллизовываютъ, прокаливаютъ и раство-
ряютъ въ небольшомъ количеств? воды; самъ К2С03
растворяется въ вод? очень легко, а прим?си не
растворяются; растворъ сливаютъ съ осадка и вьшариваютъ.
Въ посл?дпее время доташъ стали получать искусственно
изъ хлористаго калія аналогично получешю соды (см. при
натрі?). К2С03—білый порошокъ, расплывающійся на
воздух?; оиъ плавится, не разлагаясь, при 838°. Въ вод?
хорошо растворимъ; при 20° коэфф. растворимости —94.
Изъ воды поташъ кристаллизуется вь вид? К2С03. ЗН20,
сильно расплывается. Водный растворъ поташа, вс-л?д-
ствіе гидролиза, им?етъ щелочную реакдіго. Въ спирт?
поташъ иерастворимъ. Прим?няется для приготовленія
богемскаго п хрустального стекла и зеленаго мыла.
J) Главная реакція при гор?ніи порога выражается такъ:
2KN03 | ЗС + S = K2S + ЗС02 + Щ.
2) Технически К2С03 готовятъ, между прочимъ, изъ досд?дней,
такъ называемой «черной» патоки свеклосахарныхъ заводовъ ея об-
угливані?мъ и выщелачиваніемъ золы водой.
— 431 —
Кремнекислый калій, KaSi()3, или растворимое 3.':
стекло, получается при растворсніи кремнезема въ 1>д-
комъ или углекисломъ каліи при ихъ сплавленіи:
Si02 -f 2КОЯ - - KaSi03 + Но0, ;
Si()2 -!-KaCOs = K2Si034- <Ч\. !
Оно преде гавлясть изъ себя аморфную стекловидную
массу, растворимую въ вод?. ііріш?ішпея тамъ же, гд?
п Na2SK)3 (см. стр. 425).
Литій, рубидій и цезій.
§ 187. Къ щелочнымъ металламъ относятся еще литій, рубидій и
дозій; изъ нихъ наименьшимъ атомнымъ в?сомъ обладаетъ литій
(Li =6,94); дал?е идутъ рубидій (Ш> = 85.45 и цезій (08 = 132,81).
Рубидій и цезій локазываютъ полную аналогію свойствъ съ каліемъ,
являясь только бод?е энергичными, нежели калій. Они были открыты
въ 1860 году Бунзеномъ и Кирхгофомъ при помощи спектральнаго
анализа.
Литій, наоборотъ, бол?е близокъ къ элементамъ сл?дующеЙ
второй группы. Тань, напр., углекислая и фосфорнокислая соли его трудно
растворимы, подобно соотв?тствующимъ.солядгь магнія, стронція, каль-
ція и барія. Соединоиія литія находятся въ зол? табака, чая, кофе,
свекловицы и др.
V
УЛ Аммоній, NH4.
§ 188. Солгі стмонія (см. амміакъ, стр. 283).
Большое сходство съ металлами первой группы им?отъ
одновалентная группа „аммоиій" (NH4) (іонъ—NH4). Металли-
ческій характеръ-.аммонія подтверждается существовані-
емъ амальгамы аммонія, получаемой обм?ниымъ разло-
*женіемъ амальгамы натрія съ хлористымъ аммоніемъ:
Hg.Na |-NH4CU NaCl-fHg.NH4.
Амальгама аммонія образуетъ рыхлую объемистую
массу, разлагающуюся на ртуть, амміакъ н водородъ:
Hg.NHt = NHa-j-H+IIg.
- 432 ~
Растворяясь въ вод?, амміакъ образуетъ щелочную
жидкость—шдратъ окиси аммонія, въ общежитіи из-
в?стный подъ именемъ нашапьырнаго спирта:
NH8 + Hs0 = NH40H. _Ц^ JT { ь ,^
Эго — вещество слабоосновного характера: степени !
іонизаціи его мол?кулъ мала.
Соли аммонія получаются при прямомъ соедипеніи
амыіака сь соотв?тствующими кислотами, наприм?ръ,
хлористый амчоній получается при д?йствіи амміака на
соляную кислоту:
XHS -j-HCl = NH4CI.
Соли аммонія—б?лыя кристаллическія^жщсства,
довольно хорошо растворимыя въ вод?ГТГн? напоминаютъ
по свойствамъ соли калія и иатрія. Отличительное
свойство ихъ—летучесть^ которая объясняется легкой дис-
содіаці?й ихь солеіі при сравнительно невысокой темпе-
ратур?, паирим?ръ:
NH4C1 = NH3 -f НС1,
a NH3 и НС1 при поииженіи температуры снова
соединяются между собою, образуя нашатырь (олытъ см.
стр. 284).
Изь соедилепій аммонія им?ютъ приктическое нрим?-
иеиіе нашатырный слиртъ и углекислый аммопій1)
(нюхательный порошокъ) — прим?няются какъ л?карства;
иосл?диій употребляется также при печеніи rfccra вм?сто
дрожжей; амміакъ идетъ при содовомъ производсгв?;
KH4N03 въ см?си съ углемъ прим?няется въ качеств?
пороха, а также для ц?лей охлажденія, такъ какъ при
расгвореніи въ вод? (3 ч. соли на 2 ч. воды) даетъ по-
ниженіе температуры на 25—27°. Хлористый аммопій—
*) Продажный углекислый аммоній содержитъ иъ себ? см?сь киг-
лаго углекислаго аммошя (J4H4HCO3) сь карбаминовоаммонійной
солью (NH2C02NH4).
— 433 —
въ красильномъ д?л? и при ситцепечатаніиа) и проч.;
с?рнистый аммоній, получаемый при пропускали H2S въ
нашатырный сяиртъ, въ лабораторіягь прим?няется при
анализ? для выд?ленія н?которыхъ металловъ изъ см?сей.
Реакціи металловъ первой группы.
§ 189. Металлы первое группы характеризуются сл?дующими
реакциями.
ііатрш: 1) соли ?го окрашиваютъ пламя въ желтый цв?тъ;
2) съ пиросурьмянокаліевой солью въ нейтральномъ раствор?
даютъ б?дый кристаллическій осадокъ пиросурьмянокислаго натрія
(Na2H2Sb207):
K2H2Sba07 + 2ХаС1 = Na2H2Sb207 + 2КС1.
Еалііл: 1) соли калія окрашиваютъ пламя въ фіол?товый цв?тъ;
2) съ кислымъ виннокислымъ натріемъ въ нейтральномъ раствор?
даютъ б?лый кристаллическій осадокъ кислой калійной
виннокаменной соли:
К01 + C4HsNa06 = С4Н506К + NaCl.
?) съ хлорной платиной (PtCU даютъ желтый хлороплатинатъ,
(K2PtCI6):
2KCI-(-PtCl4 = K2PtC]e.
Соли аммонія даютъ такія же реакціи, какъ и соли калія, и по
тому для открытія калія он? должны быть удалены прокаливаніемъ.
Соли аммонія, кром? того, характеризуются сл?дующими ре-
акціями: 1) при накаливании улетаютъ въ вид? б?лаго дыма;
2) ?дкія щелочи выд?ляютъ изъ солей аммонія амміакъ:
КОН + NH4C1 = КС1 + Н20 + NH3;
3) реактивъ Несслера (K2HgJ4 + КОН) даетъ оранжевый осадокъ,
или — при маломъ количеств? амміачныхъ соединеній — оранжевое
окрашивапіе.
і) Хлористый аммоній прим?яя?тся еще при спаиваніи металловъ:
зд?сь при нагр?ваніи изъ него освобождаются амміакъ и хлористый
водородъ; посл?дній удаляетъ (растворяетъ) съ поверхностей
металловъ образовавшееся и\ъ окислы и чрезъ это даетъ возможность
жидкому металлу, которымъ паяютъ, смочить и соединить поверхности
спаива?мыхъ кусковъ металла.
Неорганическая химія. 28
— 434 —
Металлы второй группы.
§ 190. Ко второй групп? принадлежать двувалентные
металлы, высшій окнселъ которыхъ им??тъ формулу RO.
Они д?4ятся на дв? подгруппы: къ первой подгрупп?
относятся такъ называемые щелочно-земельные металлы,
стояще въ четныхъ рядахъ періодической системы эле-
ментовъ: кальдій Са, стронцій Sr и барій Ва; ко второй
подгругш?, называемой магніевом, принадлежать металлы,
стоящіе въ нечетныхъ рядахъ періодической системы:
магній Mg, цинкъ Zn, кадмій Cd и ртуть Hg.
Металлы первой подгруппы принадлежать къ легкимъ
и по сил? своей основности (металличности)
приближаются къ металламъ первой группы, а металлы второй
подгруппы, за исключеніемъ магнія, являются уже
тяжелыми; основныя свойства ихъ гораздо слаб?е предыду-
щихъ. Бериллій и магній, какъ легкіе металлы, гго своимъ
свойствамъ ближе стоять къ щелочно-земельнымъ
металламъ и являются элементами, связующими эти двЬ
подгруппы. Металлы каждой подгруппы проявлякпъ между
собою полную аналогію въ свойствахъ.
Первая подгруппа второй группы,
Щелочно-земельные металлы.
§ 191. Къ этой подгрупп? принадлежать металлы:
калъцій (Са), стронцій (Sr), барій (Ва) и можетъ быть
радги. Свое названіе щелочно-земельныхъ они получили,
во-1-хъ, потому, что, будучи уд?льно легкими, химически
очень энергичными, они сами, а равно и ихъ окислы и
гидраты окисловь, близко напоминаютъ щелочные
металлы первой группы сь ихъ окислами и гидратами окис-
ловъ, а во-2-хъ, потому, чтд вь природ? ихъ
соединена (вмЬст? съ другими) образуютъ массу землщ и
потому, что ихъ окиси (RO) им?готъ землистый видь.
Сходство со щелочными металлами выражается въ
сл?дующемъ:
— 435
і) Самые металлы мягки, уд?льно легки,
химически сильно энергичны, оттого въ природ? и не
находятся свободными; они легко окисляются на воздух?,
почему должны быть сохраняемы подъ жидкостью, не
содержащей кислорода, наприм?ръ, подъ нефтью; они раз-
лагаютъ воду при обыкновенной температур?; съ
металлоидами (наприм?ръ, съ галоидами кислородомъ, с?рой)
соединяются непосредственно съ большимъ выд?леніемъ
тепла, давая прочныя соединенія. Они двухвалентны.
2) Ихъ окислы (а также с?рнистыя и галоидныя
соединенія) образуются непосредственньшъ соединеніемъ ме-
талловъ съ О (S или галоидами) и растворимы въ вод?.
3) Гидраты окисловг (R[OH]2) образуются прямымъ
соединеніемъ окисловъ съ водою; они растворимы въ
вод?, хотя и не одинаково легко. Эти водные растворы
являются сильно-щелочными, т.-е. они очень легко реаги-
руютъ съ кислотами, образуя прочныя соли. Въ водныхъ
растворахъ гидраты окисловъ сильно іонизованы.
Растворимость гидратовъ, а съ нею и щелочность (основность)
растутъ съ увеличеніемъ атомнаго в?са, какъ это было
и у металловъ первой группы.
Отсюда Ва(ОН)2 бол?е растворимъ и основенъ, нежели
Са(ОН)2, и Sr(OH)2 занимаетъ среднее мЬсто между ними.
Прочность какъ окисловъ, такъ и ихъ гидратовъ почти
такова же (т.-е. очень велика), какъ и прочность
окисловъ и гидратовъ первой группы.
4) Солю кальція, строндія и барія большею частью
очень прочны, какъ эго было и у щелочныхъ металловъ.
Но въ соляхъ есть и большая разница по сравненію съ
солями металловъ первой группы.
Тамъ соли, за очень малыми исключениями, были
хорошо растворимы въ вод?, зд?сь же многія соли
нерастворимы въ вод?; главн?йшія изъ посл?днихъ: углекислым
(RC03), кремнекислый (RSi03), фосфорнокислый (Ra[POJ2)
и с?рнокгсслыя (RS04). Правда, нерастворимость солей
зд?сь неодинакова: она увеличивается съ увеличеніемъ
28
- 436 —
атомнаго в?са металловъ, т.-е. соли барія отличаются
наименьшей, а соли кальція—наибольшей растворимостью;
соли стронція им?ютъ среднюю между ними
растворимость. Соли, образованный сильными кислотами, какъ это
было и у металловъ первой группы, не гидролизуются.
Въ природ? эти металлы встр?чаются
преимущественно въ вид? углекислыхъ (СаС03, SrC03 и ВаС03) и
с?рнокислыхъ (CaS04, SrS04 и BaS04) солей.
Итакъ, щелочно-земелыше металлы лишь немного
уступаюсь въ своей энергіи щелочнымъ металламъ; ихъ
энергія растетъ съ увеличеніемъ атомнаго в?са, или—
можно и такъ сказать — съ увеличеніемъ атомнаго
объема; посл?днее будетъ видно изъ сл?дующей таблицы
физическихъ свойствъ щелочно-земелышхъ металловъ:
Ат. в?съ. Уд. в?съ. Ат. объемъ. Темп, плавлен.
Са 40,07 1,85 26 ' 800°
Sr 87,63 2,50 35 600° (?)
Ва 137,37 3,75 36 (?)
Наибол?е распространены въ природ? соеданенія
кальція.
К а л ь ц і й, Са.
Атомный в?съ = 40,09» Уд?льный в?съ = 1,85. Въ со?диненіяхъ двух-
валентенъ.
§ 192. Кальцій въ природ? находится только въ вид?
соединеній и принадлежитъ къ числу наибол?е распро-
страненныхъ металловъ. Въ вид? углекислой соли (СаС03)
онъ образуегъ залежи известняковг, м?ла и мрамора,
а также находится въ природныхъ водахъ, содержащихъ
въ своемъ раствор? углекислый газъ; въ вид? этихъ
растворовъ СаС03 попадаетъ въ организмы растеній и
животныхъ и таиъ идетъ на образованіе твердыхъ частей:
въ соединеній съ MgC03 известняки образуютъ породу
доломитовъ; въ вид? с?рнокислой соли Са образуетъ
— 437 -
гипсъ и ангидритъ. Кром? того, изв?стны залежи пла-
вжоваго шпата (CaF?); фосфориты и апатиты
состоятъ, главньшъ образомъ, изъ фосфорнокислой соли
кальдія (Са3[Р04]2). Кости животныхъ состоятъ по
преимуществу изъ фосфорной соли кальція; раковины слиз-
няковъ преимущественно состоятъ изъ СаС03.
Въ свободиомъ вид? кальцій получается разложеніемъ
хлористаго кальція электрическимъ токомъ или при д?й-
ствіи натрія на CaJ2. Кальцій—б?лый блестящій тягучій
металлъ, плавящійся въ безвоздушномъ пространств? при
760°. Въ сухомъ воздух? онъ не изм?няется, во влаж-
номъ же быстро окисляется. При накаливаніи онъ сго-
раетъ яркимъ желтымъ пламенемъ въ окись; воду разла-
гаетъ довольно медленно.
Окись кальція, СаО. Окись кальція или (негашеная)
известь получается прокаливаніемъ углекислой (СаС03—
= С02 -(- СаО 3) дли азотнокислой соли кальція. Это б?-
лое аморфное вещество, плавящееся только при темпера-
тур? вольтовой дуги (около 3000°) и застывающее при
!)' Разложение СаС03 начинается съ 450" н идетъ т?мъ быстр?е,
ч?мъ выше температура. Накаливані? СаС03 надо веста въ
открытость сосуд?, иначе разложеніе не дойдетъ до конца. Оно остановится,
когда выд?лившійся углекислые газъ будетъ представлять наибольшее
диссоціаціонное давленіе, отв?чающе? данной т?мператур?. Если да-
вленіе увеличится прибавкой газа, отъ далыі?йшаго разложенія
начнется вновь соединеніе продуктовъ разложенія и образованіе исход-
наго вещества: СаО + С02 — СаСОд. Реакція разложенія СаС03 лр?д-
ставляетъ прим?ръ диссоцгацги теердаго тг&ла и можетъ быть
изображена 'такъ:
СаС03^Са0 + С02)
т.-е. это и значитъ, что реакція въ одно и то же время можетъ
совершаться въ двухъ противоположныхъ направленіяхъ. Такое
разложеніе вполн? похоже на испареніе жидкости: если паръ не удаляется,
его давленіе при данной температур? достигаешь своего maximum'a, и
испареніе прекращается, такъ какъ съ этого момента, сколько па-
ровъ прибавится, столько же ихъ сгустится; между изм?няющимся
веществомъ и продуктами изм?ненія устанавливается «подвижное
равнов?сіе».
438 —
охлажденіи въ' кристаллическую массу. Въ пламени гре-
мучаго газа известь, накаляясь, испускаетъ сильный
св?тъ, такъ называемый Друммондовъ св?тъ (см. стр. 206).
Съ водой она соединяется съ выд?леніемъ тепла,
образуя гидратъ окиси кальція Са(ОН)2:
СаО + Н20==Са(ОН)2,
паз. гашеной или ?дкой известью; на воздух? окись
кальція притягиваетъ углекислый газъ и переходить въ
углекислый калыцй:
СаО + С08=СаСОв.
Гидратъ описи кальція, Са(ОН)2. Гидратъ окиси
кальція (гашеная известь) получается прямымъ соедине-
ніемъ окиси съ водой, происходящимъ съ большимъ
выд?леніемъ тепла; процессъ этотъ называется гашеніемъ
извести. Гашеная известь — б?лый рыхлый порошокъ,
очень мало растворимый въ вод?, при чемъ
растворимость его съ повышсніемъ температуры воды уменьшается.
Растворъ носитъ названіе известковой воды, которая
обладаетъ свойствами сильной щелочи. На воздух?
известковая вода притягиваетъ углекислый газъ и мутится,
выд?ляя углекислый кальцій. При сильномъ накаливаніи
гидратъ распадается на окись и воду:
Са(ОН)8 = СаО + Н20.
Гашеная известь употребляется для полученія ?дкихъ
кали, натра, амміака, б?лильной извести, стекла и т. д.
Кром? того, она прим?няется въ качеств? цемента при
постройкахъ зданій въ вид? т?стообразной см?си ея съ
пескомъ и водой. Затв?рд?ваніе ?я обусловливается вы-
д?лепіемъ воды и поглощеніемъ углекислаго газа.
Са(ОН)2 + С02 = СаС03 + Н20.
Выд?ляющаяся ііри этомъ вода и д?лаетъ „новыя
постройки сырыми.
— 439 —
Песокъ прибавляется для того, чтобы масса при вы-
сыханіи не трескалась, а также для приданія ей н?кото-
рой пористости, которая позволяла бы углекислому газу
проникать во внутреннія части известки.
Съ теченіемъ времени между известью и пескомъ также
происходить реакція по уравнение: Са(ОН)2 ~\- Si02 =
= CaSi03-|-Н20; образованіемъ CaSi03 объясняется
наибольшая прочность старыхъ построекъ.
Известь въ см?си съ различными глинами даетъ
различные цементы, наприм?ръ, портландскій цементъ, ро-
манскій цементъ и др. а).
Въ лабораторной практик? часто прим?няется такъ
наз. патронная известь; эта известь (СаО),
погашенная растворомъ NaOH, представляетъ механическую см?сь
Са(ОН)2 и NaOH; употребляется какъ лучшій
поглотитель С02.
Хлористый кальцій, СаС12. Хлористый кальцій мо-
жетъ быть полученъ нейтрализаціей соляной кислоты
?дкою известью, а также прямымъ соединеніемъ кальція
съ хлоромъ; обыкновенно же является побочнымъ про-
дуктомъ при полученіи соды, амміака, хлора. Хлористый
кальцій—кристаллическое вещество (СаС12 . 6Н20)2), легко
растворяющееся въ вод?, на воздух? расплывается,
притягивая влагу; растворимъ въ спирт?; при нагр?ваніи до
200° теряетъ свою кристаллизаціонную воду и
обращается въ пористую массу, жадно соединяющуюся съ
водой, почему и употребляется для высушиванія га-
зовъ (исключеніе составляетъ амміакъ, дающій соединеніе
СаС12. 8NH3).
і) Составь портландскаго цемента: SiO2(22,40/o), CaO(62,80/0),
MgO(l,8o/0), А120^22,6%1? Fe203(l,2%l, FeO(0,6»/0}, МпО(0,б*/о),
К20 + ZVa2O(6,7<y0), SO3(O;20/0); Н20(7)бо/о); составь ромакскаго
цемента: SiOa(28,8o/0;, СаО(58,4°/о)> MgO(5,00/fl), А1яО8(6,4<у0, Fe2O3(4,80/0).
2) Кристаллически! СаС12 . 6H20 растворяется въ вод? съ сильнымъ
понижені?мъ томпературы: при см?шеніи СаС12 . 6Н2О со сн?гомь
температура падаетъ почти до—550 (см. 160 стр.).
— 440 —
Фтористый кальцій, CaF2. Фтористый кальцій встр?-
чается въ природ? подъ названіемъ плавиковаго шпата;
находится также въ зол? растеній, въ костяхъ и въ эмали
зубовъ. Получается онъ въ вид? студенистаго осадка
при см?шеггіи хлористаго кальція и фтористаго натрія.
Въ вод?" нерастворимъ. С?рною кислотой разлагается съ
выд?леніемъ фтороводорода. Легкоплавкая см?сь его съ
типсомъ служить поливою для жел?зныхъ сосудовъ.
Б?лильная известь, Б?лильной извести прйписы-
ваютъ формулу CaCLO (Са<^ . Получается она
Ч)— С1/
пропусканіемъ хлора черезъ гидратъ окиси кальція:
1) 2Са(ОН)2 + 2С12 = [Са(СЮ)2 + СаСЩ + 2Н20,
2) [Са(ОС1)2 + СаС12] = Са2С1402 — 2СаС120.
Это б?лый порошокъ съ запахомъ хлора. Въ вод?
легко растворяется. При накаливаніи какъ кр?пкій рас-
творъ, такъ и твердая б?лильная известь выд?ляютъ
кислородъ. На воздух? при д?йствіи св?та, теплоты, а
также и угл?кислаго газа разлагается съ выд?леніемъ
хлорноватистой кислоты и хлора. Кислотами разлагается
съ выд?леніемъ хлора (СаС120 -f* H2S04 = CaS04 -f- H204~
-f Cl2), почему и употребляется какъ б?лящее, а также
' и обеззараживающее средство.
С?рнокислыгі кальцій, CaS04. С?рнокислый кальцій
находится въ природ? въ вид? ангидрида—безводнаго
с?рнокислаго кальція (кристаллизуется въ ромбической
систем?) и гипса, формула котораго CaS04. 2И20
(кристаллизуется въ моноклинической систем?). Въ вод? эта
соль трудно растворима (около 2 гр. въ одномъ литр?),
въ спирт? не растворяется вовсе. При обжиганіи гипсъ
теряетъ одну молекулу воды и переходитъ въ жоке-
ный гипсъ, или алебаспьръ, обладаетъ способностью
образовывать при см?шеніи съ водой т?сто, которое
постепенно затверд?ваетъ, при чемъ вода вновь присоеди-
_ 441 —
няется къ CaS04. Благодаря этому свойству, гипсъ на-
шелъ себ? прим?неніе для отливки алебастровыхъ или
гипсовыхъ бюстовъ и фигуръ. Посл? нагр?ванія выше
160° гипсъ теряетъ способность соединяться съ водой.
Самородная с?ра въ природ?, главнымъ образомъ,
произошла изъ гипса. Порода, въ которой встр?чается
самородная с?ра, частью состоитъ изъ гипса и известняка,
пропитаннаго органическими веществами (напр., асфаль-
томъ—на правомъ берегу Волги въ Тетюшскомъ у?зд?,
Казанской губ.) а), которыя возстановляютъ гипсъ.
Кром? того, возстановленіе гипса происходить также
благодаря сп?ціальнымъ бактеріямъ, которыя потребляютъ
с?ру для превращенія ея впосл?дствіи и въ H2S04;
количество свободной с?ры въ ихъ кл?ткахъ доходитъ до
25% в?са т?ла этихъ бактерій.
Фосфорнокислый кальцій. Кальцій съ фосфорной
кислотой образуетъ три соли: одну среднюю и дв? кис-
лыя. Средняя или трехкалъціева соль встр?чается въ
природ? въ кристаллическомъ вид? въ соединеніи
съ фтористымъ кальціемъ, образуя такъ называемые
апатиты [(Р04)2Са3]3. CaF2; въ аморфномъ состояніи
въ см?си съ другими веществами образуетъ фосфориты
и остеолиты. Костяная зола состоитъ, главнымъ
образомъ, изъ этой соли. Средняя фосфорнокальціева соль
нерастворима въ вод?, но растворяется въ слабыхъ кис-
лотахъ и въ расгворахъ н?которыхъ солей. Въ Россіи
фосфоритами богаты Курская, Орловская, Волынская и
Костромская губерніи; фосфориты, размолотые въ муку,
прим?няются въ качеств? удобренія. Подъ именемъ
суперфосфата, лрим?няемаго тоже для удобренія, разум?ютъ
кислую фосфорнокальціеву соль, состава СаН4(Р04)2,
получаемую при д?йствіи с?рной кислоты на Са3(Р04)2
(см. фосфоръ, стр. 270). Эта соль въ вод? растворима.
і) Находящиеся зд?сь гипсъ, между прочимъ, похожъ на мраморъ
и очень противостоить д?йствію кислотъ.
— 442 —
Углекислый кальцій, СаС03. Углекислый кальцій очень
распространен* въ природ?. Въкристаллическомъ вид? онъ
образует* известковый шпатъ, исландскій шпатъ, мра-
моръ, въ мелкозернистом* — известняки, а въ аморф-
номъ—м?*ЛЪ) состоящій изъ микроскопических* скорлуп*
ископаемых* раковин*. Искусственно может* быть
подучен* д?йствіемъ углекислыхъ щелочей на растворы
солей кальція нъ вид? аморфнаго осадка, который при
стояніи под* водой переходит* в* кристаллическій:
СаС12 + Na2C03 = СаСОа -f 2N&C1.
Улекислый кальцій нерастворим* въ чистой вод?, но
растворяется въ вод?, содержащей углекислоту, при чем*
образуется двууглекислый кальцій СаН2(С03)2 или СаСОэ.
. Н2С03? изв?стный только въ раствор?; при выд?леніи
изъ раствора, или при нагр?ваніи онъ разлагается на
СаС03, Н20 и С02; при выд?леніи же углекислаго газа
углекислый кальцій выпадаетъ въ осадокъ, ч?мъ и
объясняется образованіе известковых* накипей, туфов*,
сталактитов*, сталагмитов* и т. п. При накаливавши
углекислый кальцій разлагается на СаО и С02.
Кремнекислый кальцій^ CaSi03, въ природ? встр?-
чается въ вид? минерала валластонита; прим?няется
для приготовленія многих* сортов* стекла.
Стекло. Стекло есть см?сь („твердый раствор*")
силикатов* (то-есть солей кремневой кислоты H2SiOs)
кальція и натрія или калія, получаемая спдавленіемъ
кварцеваго песка (Si02) с* углекислым* кальціемъ и с*
?дкимъ или углекислым* каліемъ или ?дким* и
углекислым* натріемъ при температур? около 1200°:
Na2(K2)C03 -f Si02 = Na2(K2)Si03-f С02 и CaC03 -lr Si02=
= CaSi08-f CO,.
При употреблении калійныхъ солей вм?сто
натронных* получают* стекло бемское, бол?е тугоплавкое и
бол?е способное противостоять химическим* реагентам*.
— 443 —
Изъ натроваго стекла изготовляютъ оконныя стекла,
обычную посуду и пр. Каліево стекло употребляется для
изготовленія химической посуды. Вода, хотя и слабо,
д?йствуетъ на стекло, выв?тривая его, отчего стекла не-
р?дко ирризируютъ.
Изготовлепіе стекла а) ведется сл?дующимъ образомъ:
кварцевый песокъ (Si02), углекислый калій или натрій
и углекислый кальдій см?шиваются въ опред?ленныхъ
в?совыхъ пропорціяхъ, пом?щаются въ огнеупорныхъ
тигляхъ и накаливаются до плавленія при высокой темпе-
Рис. 98. Печь съ тиглями для варки стеклянной массы.
ратур? въ спедіальныхъ печахъ (рис. 98). Иосл? того,
какъ произошло сплавленіе (образованіе силикатовъ взя-
тыхъ металловъ), жидкую массу или отливаютъ въ формы
или производясь выд?лку стеклянной посуды выдуваніемъ.
Для выдуванія захватываютъ изъ тигля жел?зной
трубкой (дудка) н?которое количество стеклянной массы и
выдуваютъ или цилиндрической или шарообразной формы
фигуры, которыя зат?мъ пом?щаютъ въ соотв?тственныя
формы, гд? и придаютъ окончательную форму; отломивъ
дудку съ кускомъ прилегающаго стекла, верхушки сосуда
прид?лываютъ отд?льно. Посл?довательныя стадіи вы-
!) Въ настоящее время (какъ сказано на стр. 320) и изъ чи-
стаго кремнезема д?лается лабораторная посуда; кремнеземъ
плавится при те'мператур? гор?нія гремучаго газа; расплавленный
кремнеземъ представляетъ безцв?тную, вязкую жидкость, подобную
обыкновенному расплавленному стеклу.
— 444 —
д?лки бутылки представлены на рис. 99. Приготовленная-
стеклянная посуда зат?мъ медленно охлаждается, иначе
при быстромъ охлажденіи получается отъ неравном?рнаго
во время охлажденія наружныхъ и внутреннихъ слоевъ
стекла внутреннее напряженіе, и такое стекло очень
легко трескается; характерный прим?ръ этого
представляюсь такъ называемыя „батавскія слезки".
Хрустальное стекло и флинтгласъ содержитъ вм?сто
кремнекислаго кальція кремнекислый свинецъ. Это стекло
Рис. 99. Поол?довательныя стадіи выдуванія бутылки.
легкоплавко и сравнительно мягко, поэтому оно идетъ
на выд?лку хрусталя, оптическихъ стеколъ, зеркалъ въ
физическихъ приборахъ и проч.
Зеленое стекло получается изъ сырыхъ нечистыхъ
матеріаловъ; цв?тъ его обусловливается прим?сью
закиси жел?за: цв?тъ этотъ можетъ быть уничтоженъ при-
бавленіемъ къ сплавляемой см?си окислителей, напри-
м?ръ, перекиси марганца (Мп02) или б?лаго мышьяка
(As203).
Для окраски стеколъ прибавляюсь къ стеклу метал-
лическихъ окисловъ: окиси хрома и окиси м?ди — для
зеленыхъ стеколъ, окиси кобальта — для синихъ, закиси
м?ди—для ярко-красныхъ, перекиси марганца—для фіолег>
— 445 —
товыхъ, оловяннаго камня или костяной золы — для мо-
лочнаго стекла и т. д.
Карбидъ кальція, СаСг Карбидъ кальція получатотъ
при накаливаніи въ электрической печи см?си извести
съ углемъ; см?сь плавится, выд?ляя окись углерода, а
кальцій соединяется съ углеродомъ:
СаО + ЗС = СаС2 + СО.
Карбидъ кальція (продажный) представляетъ собою
с?рую аморфную массу, но въ чистомъ вид? онъ
образуешь золотистые непрозрачные кристаллы; легко
разлагается водой съ образованіемъ ацетилена:
СаС2 4- 2Н20 = С2Н2 + Са(ОН)2.
Кальцій-цганъ-амидъ^ CaCN2, получается при
пропускали тока азота надъ нагр?тымъ карбидомъ кальція:
СаС2 -[- N2 = CaCN2 -f- С. Кальцій-ціанъ-амидъ идетъ для
удобренія полей; въ почв?, вероятно, происходите сл?ду-
ющая реакція: CaCN2 -f- ЗН20 = 2К"Нд-[-СаСОз. Указанная
реакція важна т?мъ, что воздушный азотъ ею вводится
въ общій круговоротъ азота въ природ?.
С т р о н ц і й, Sr.
At. в. =z 87,63. Уд. в. — 2,5. Въ соединеніяхъ двухвалент?нъ.
Б а р і й, Ва.
Ат. в. = 137,37. Уд. в =3,8. Въ соединеніяхъ двухвалент?нъ.
§ 193. Какъ самые металлы стронцій и барій, такъ
и ихъ соединенія очень близки по свойствамъ къ кальцію
и его соедииеніямъ. Въ природ? стронцій находится въ
вид? стронціанита (SrC03) и целестина (SrSOJ, a
барій—въ вид? витерита (ВаС03) и тнжелаго шпата
(BaS04). Въ свободномъ состояніи эти металлы
получаются электролизомъ ихъ хлористыхъ соединеній. Оба
они мягки, желтоваты, уд?льно легки; химически очень
— 446 —
энергичны: они окисляются на воздух?, легко разлага-
ютъ воду.
Ихъ солеобразовательные окислы образованы по тилу
Ж), т.-е. §гО, ВаО 1): получаются они при прокаливаніи
азотнокислыхъ солей. Жадно соединяясь съ водою, они
даютъ растворимые въ вод? гидраты окисловъ Sr(OH)2
и Ва(ОН)2. Растворимость этихъ гидратовъ увеличивается
съ увеличеніемъ атомнаго в?са металловъ. Гидраты
Sr(OH)2 и Ва(ОН)2 сильно осяовны, т.-е. они
соединяются съ кислотами (даже съ С02 воздуха) и образуютъ
соли.,
Соли стронція и барія какъ по способамъ ихъ полу,
ченія, такъ и по главн?йшимъ свойствамъ вполн?
аналогичны солямъ кальція.
Соли стронція окрашиваютъ пламя въ ярко-красный
дв?тъ; прим?няются [Sr(N03)2] въ пиротехник? для по-
лученія красныхъ огней.
Соли барія [Ba(NOa)2] прим'?няются для полученія зе-
леныхъ огней.
BaS04 (тяжелый шпатъ) прим?няется въ качеств?
б?лой краски подъ названіемъ „постоянныхъ" б?лилъ.
С?рнисты? барій и стронцій обладаютъ способностью
фосфоресцировать, т.-е. выставленные сначала на св?тъ,
а потомъ внесенные въ темноту, остаются и зд?сь св?-
тящимися.
Радіоактивные элементы. Честь открытія явленія
радіоактивности принадлежите Беккерелю, который (въ
1896 г.) нашелъ, что урановая смоляная руда испускаете
особые невидимые лучи, распространяющіеся
прямолинейно, д?йствующіе на фотографическую пластинку даже
сквозь непрозрачную обертку изъ черной бумаги, не
преломляющееся, не отражающееся и не поляризующіеся;
проходя черезъ газы, они д?лаютъ ихъ проводниками
і) Вс? щелочноземельные металлы образуютъ еще перекиси типа
R02. О переписи барія Ва02 (см. 238 стр.).
— 447 —
электричества. Супруги Кюри доказали, что радіоактив-
ность урановой руды зависитъ отъ присутствія въ ней
минимальныхъ г) количествъ новыхъ элементовъ, изъ
коихъ лучше всего изученъ радій (аналогъ барія).
Г-жа Кюри и Debierne въ 1910 г. получили и
свободный радій при электролиз? хлористаго радія, при
чемъ катодомъ была ртуть, а аыодомъ—иридистая платина,
При электролиз? получалась жидкая амальгама. Посл?
отгонки ртути изъ амальгамы въ атмосфер? чистаго
водорода выше 700° оставался жидкій металлъ, который
авторы и характеризуют какъ металлическій радій.
Радій — блестящій металлъ б?лаго дв?та съ темп. пл.
около 700°; радіоактивенъ; легко окисляется на воздух?
и черн?етъ, в?роятно, отъ образования соединенія съ
азотомъ. Воду энергично разлагаетъ. Въ соляной кис-
лот? легко растворяется. Вообще радій по свойствамъ
близко напоминаетъ барій.
Г-жа Кюри опред?лила атомный в?съ радія посред-
ствомъ осажденія хлора изъ опред?леннаго по в?су
количества хлористаго соединенія азотнокислымъ серебромъ
и опред?леиія в?са полученнато хлористаго серебра
Атоагный в?еъ радія по нов?йшимъ опред?леніямъ г-жи
Кюри равенъ 226,45, Такой большой атомный в?съ ста-
витъ радій въ періодической систем? въ 12-й рядъ, гд?
стоять торій (232) и уранъ (238,5). Интересно отм?тить,
что эти три элемента, обладающіе радиоактивностью, им?-
ютъ наибольшее изъ вс?хъ элементовъ атомные в?са.
Спектръ радія своеобразеиъ. Вс? соли радія (особенно
бромистый радій) св?тятся и вызываютъ флюоресценцію
во многихъ веществахъ, напр., въ платиносинеродистомъ
баріи (BaPfcCy4), въ с?рнистомъ цинк?, алмаз? и др.
*) Изъ двухъ тоннъ (122 пуда) руды получается н?сиолько со-
тыхъ грамма хлористаго радія; отсюда понятно, что извдеч?ні? радія
стоить большого труда и крупныхъ издержекъ, а потому и стоимость
радія превышаешь въ н?сколько тысячъ разъ стоимость равнаго в?са
золота.
— 448 —
Лучи радія оказались неоднородными: различаютъ а-лучи,
[S-лучи и у"лУчиі отличающіеся другъ отъ друга большей
или меньшей способностью проникать чрезъ различный
вещества и .по д?йствію на нихъ магнитнаго поля.
а-лучи йредставляютъ потокъ корпускулъ (частицъ),
заряженныхъ положительнымъ эл?ктричествомъ и обла-
дающихъ массой того же порядка, какъ и атомныя
массы другихъ элементовъ. Так,амъ образомъ а-лучи
обязаны своимъ существованіемъ особому газу,
сгущающемуся при низкой температур?.
[S-лучи обладаютъ большей способностью
проникновения, т.-е. способностью проникать черезъ т?ла, не
поглощаясь; такъ, они проходятъ черезъ стекло я черезъ
тонкія металлическія пластинки. Скорость ихъ
передвиженья близка къ скорости св?та, тогда какъ таковая для
а-лучей мен?е, ч?мъ 0,1 скорости св?та. По своимъ
свойствамъ [і-лучи всего ближе напоминаютъ катодные
лучи и представляютъ потокъ частицъ (электроновъ),
заряженныхъ отрицательнымъ электричествомъ; масса та-
кихъ электроновъ приблизительно въ 1000 разъ меньше
массы атома водорода.
а и [3~лучи, какъ и сл?довало ожидать, испытываютъ
отклоыеніе въ магнитномъ пол?.
у-лучи, въ противоположность а и [і-лучамъ, въ
магнитномъ пол? никакого отклоненія не испытываютъ;
способность проникновенія ихъ черезъ различный т?ла
очень велика, у-лучи распространяются со скоростями
большими, ч?мъ катодные лучи; они тождественны съ
рентгеновскими лучами и, „почти несомн?нно, являются
особаго рода возмущеізіями э?ира и до изв?стной
степени аналогичны св?товымъ и тепловымъ лучамъ"
(Рамзай) 1).
*) Пользуясь св?іимостью с?рнистаго цинка яодъ вліяніемъ со-
единешй радія, Круксъ устроилъ сл?дующій приборъ: небольшой ку-
сочекъ соли радія помещается на разстояніи доли миллиметра передъ
— 449 —
Кром? радія, радіоактивными элементами являются еще
уранъ, торіи, полоній (близкій по свойствамъ къ висмуту)
и актиній (близкій къ церію и торію).
Химическія д?йствія, вызываемый солями радія: 1) изъ
водныхъ растворовъ ихъ выд?ляется см?сь водорода и
кислорода (гремучій газъ); 2) изъ іодоформа (CHJ3)
выд?ляется свободный іодъ; 3) желтый фосфоръ
превращается въ красный; С09 распадается на С и О; 4) NH3
распадается на N и Н; 5) стекло окрашивается въ
коричневый цв?тъ; 6) КС1 и NaCl окрашиваются въ синій
цв?тъ; 7) зеленые листья растеній д?лаются желтыми; ,
¦8) с?мена теряютъ свою всхожесть; 9) изл?чиваются н?-
которыя иакожныя бол?зни и т. д.
Очень важное свойство радіевыхъ соединеній еще
выражается въ томъ, что вс? вещества подъ вліяніемъ ихъ
д?лаіртся радіоактивными („наведенная радіоактивность").
Объясненіе этой наведенной радіоактивности дано было
Рутерфордомъ, который показалъ, что соли радія (а равно
торія и актинія) выд?ляютъ такъ называемую эмапацію—
газообразное вещество, подчиняющееся закону Бойля,
сгущающееся при—65° въ флуоресцирующую жидкость,
застывающую при—71° въ твердую непрозрачную массу;
на эманацію не д?йствуютъ никакіе реактивы. По своей
полной химической нед?ятельности эманація является
аналогомъ эл?ментовъ нулевой группы. Спектръ ея на-
поминаетъ по характеру спектръ газовъ аргоновой группы
и содержитъ, главнымъ образомъ, зеленыя линіи.
Сначала Debierne, а потомъ Ramsay и Gray,
пользуясь микров?сами изъ кварца (съ чувствительностью до
1/500,000 миллиграмма), опред?лили/ плотность эманаціи,
пластинкой, покрытой сЬрнистымъ цинкомъ. Глядя на нее сквозь
увеличительное стекло, въ темной комнат? можно увид?ть блестящее мер"
цаиі?. Полагаютъ, что это м?рцаніе производится непосредственнымъ
раскалываніемъ одного изъ мельчайшихъ кристалловъ с?рнистаго
цинка подъ вліяніемъ бомбардировки корнускулъ а-лучей, ударяющихъ
эъ с?рнистнй цинкъ.
Неорганическая химія. &У
— 450 —
равную II 1,5, что соотв?тствуетъ молекулярному вЬсу
223. Но въ виду того, что эманадія по ея инертности
должна быть отнесена къ газамъ нулевой группы t
молекула которыхъ всегда состоять только изъ одного атома,
атомный'в?съ ея признается близкимъ къ 223. Съ та-
кимъ атомнымъ в?сомъ эманадія должна быть
поставлена въ 12 рядъ леріодической системы. Рамзай пред-
ложилъ для пея и названіе иитонъ еъ химическимъ
знакомь Nt. Отсюда 12-й рядъ будетъ сл?дующій:
Группы.
fc9
CU
см
1—1
0.
Нитонъ.
АЪ=223.
1-Й
* г1
Радій.
i?a=226,4
—
Торій,
Th -^232.4.
"к*-
Ураыъ.
Г=238,5
'г-
1—*
Образованіе нитона изъ радія сопровождается выд?-
леніемъ а-частидъ, который, по дальн?йшимъ изсл?дова-
ніямъ, оказались атомами гелія, заряженными положи-
тельнымъ электричеством^. Рутерфордъ и Содди первую-
фазу нревращенія радія представляютъ себ? такъ:
Ra = Nt+He, т.-е. 226, 4 — 4 = 222,4. На этомъ
основами атомный в?съ нитона долженъ быть равенъ 222,4.
Какъ видно, совпадете этого предположена съ выше-
приведенішмъ опред?леніемъ атомнаго й?с'а Nt почти
идеальное.
Наведенная радіоактивность объясняется, по Рутер-
форду, т?мъ, что когда эманадія приходить въ сопри-
косновеніе съ т?лами, къ ихъ поверхности (легче—если
таковая наэлектризована отрицательно) лристаютъ
положительно наэлектризованный частички. Посл?днія могутъ
растворяться въ н?которыхъ кислотахъ; но испареніи
такихъ растворовъ получается радіоактивный остатокъ.
— 451 —
Зам?тимъ, что д?йствія эманацій оказались независящими
отъ температуры: они были одинаковы и при красноагь
каленіи и при температур? жидкаго воздуха; сл?дова-
тельно, радіоактивные процессы кореннымъ образомъ
отличаются отъ обычныхъ физическихъ и химическихъ
явленій, обыкновенно зависимыхъ отъ температуры.
Эманація не получается ностояшюй: она испытываетъ
нре.вращенія вь силу того, что излучаетъ а-лучи: по
м?р? излученія а-частицъ интенсивность эманаціи
уменьшается, при чемъ, как'ь показали опыты (электрическія
изм?ренія), количество превращающейся эманацій въ
каждый моментъ нропорціоналыю ея наличной масс?.
Этому закону сл?дуетъ уменьшение активности и вс?хъ
другихъ радіоактивныхъ т?лъ, но скорость изм?пенія бу-
детъ различна; а отсюда различна и длительность суще-
ствованія элемента. Самое изм?неніе активности
понимается какъ процессъ распада атомовъ, выбрасывающихъ
а-частицы. По м?р? этого излученія получающіеся
остатки, конечно, отличаются и отъ началыіаго
препарата и другь отъ друга, въ конц?-кондовъ, получается
неактивный продуктъ. Такимъ образомъ
последовательная эволгоція радія можетъ быть представлена въ сл?ду-
ющемъ вдд? (см. таб. на стр. 452):
Въ высшей степени интересны превращены
эманацій вь другіе элементы. Вотъ что лишетъ по этому
вопросу Рамзай отъ 18 іюля 1907 года:
„Въ 1903 году Содди и я показали, что при само-
произволъномъ изм?непіи эманацірг радія образуется гелій;
это наблюдете было подтверждено Индриксоножъ, Дебіер-
номъ, Гизелемъ, Кюри и Дыоаромъ, Гимштедтонъ и Г.
Мейеромъ. Дебіернъ показалъ, что хлористый и
фтористый актиній тоже даготъ начало геліго. Я также открылъ
.однажды гелій въ газахъ, постоянно выд?ляеашхъ рас-
творомъ азотно-торіевой соли и над?гось скоро
подтвердить это наблюдете.
29*
— 452 —
Другія свойства радіоакт.
продуктов^
ф
>-» 'Я
& S
1 S
а?
Родъ испу-
скаемыхъ
частицъ.
Время лоло-
виннаго
разрушения
Элементы.
OS
э
лк -
сЗ-<*
Й«Г
.л
а*
дэ ...
ОР -Г-
Я о
о ч
ей х
>~.
(Я
и:
1
г(
2000 л?тъ.
5 со
о <м
CJ СЯ
З 1)
?-« о
? га
S ¦
сЗ сЗ
_ Е-
ГО tT
^- ко
g." J
& . В"
я с ~
с: 6
is!
•—' to
tf
3,86 дней.
'5" ^
ев И
tC О ?;—»
Ш ?
Образуетъ налетъ на поверхности
твордыхъ т?л-ь, особенно на катод?
иъ олек. пол?; растворимъ въ
кислотахъ.
Ч
О
Н о
§2
L
1У
3 минуты.
Растворимъ въ кислотахъ;
увлекается изъ раствора съ баріемъ.
s
||
gcD
&*
>>
Н
О
>>
о5_
26,7 минуты.
а.
Растворимъ въ кислотахъ;
выделяется изъ раствора на м?ди и
на никкел?.
Улетучивается выше
1100°.
р
19,5 минутъ.
•г*
О
га вч
=3
Рч
— 453 —
Другія свойства радіоакт.
продукт овъ.
Температура сгущенія
и улетучиванія.
Родъ испу-
скаемыхъ
частицъ.
Время поло-
виннаго раз-
рушенія.
Элементы.
]
1
оэ-
2,5 минуты.
О
зя =*->
я
PU
3 е
* и
Я к В
л о 5
4 я к
я я
° ? °
дНЯ
и S jf
^ I S
5 » 8
Я й ft
ft й
S °
Я д
н
о .~
сЗ еР
я
Улетучивается ниже
1000°.
Не даетъ
лучей.
15 л?тъ.
Радій D.
1
Растворимъ въ горячей уксусной
кислот?; мен?е благороденъ, ч?мъ
Ra — Ft.
Улетучивается при
краен, кал.
Но даеть
лучей.
с*..
'ч:
сЗ
О.
Мен?е бдагороденъ, нежели JRa F;
по реакціи аналогиченъ Вг,
Еще не улетучивается
при 1000°.
СО-
4,8 дня.
эя ;7і—у
"и:
0<
.- X
гР Я
я >¦
ЕЙ" ft»
&:
л я
к ~
щ я
ft* .
я >^ Й
и s **
° я ?
ffl e g
05 «3 й
»РЧ Я
я
К я
О о
ft Н-
о о
ей К
ч и
w 3
о
о
Улетучивается при
1000°.
с*
143 дня.
о
ч
о
я
ЭЯ
о,
— 454 —
„Когда эмаиація находится въ соприкосновенна сь
водой и въ ней растворена, то образующійся инертный газ ь
состоитъ, главнымъ образомъ, изъ неона; гелія въ н?мь
можно было открыть только сл?ды.
„Если йам?нить воду насыщеннымъ растворомъ о?рно-
м?дной соли, то гелія не образуется; главнымъ нродук-
томъ является аргонъ, быть-мож?тъ, содержащій сл?ды
неона, такъ какъ, повидимому, налицо были наибол?е
яркід изъ его линій. Остатокъ носл? удаленія м?да изъ
раствора показывалъ спектры натрія и кальдія;
наблюдена была и красная линія литія, но она была очень
слаба1). Иосл?днее наблюдете было повторено четыре
раза, два раза съ с?рном?дною и два раза съ азотном?д-
ною солью; были приняты всевозможный
предосторожности; подобные отимъ остатки отъ азотносвинцовой соли
и отъ воды не дали указанія на содержите въ нихъ литія;
литій также не былъ открыть въ раствор? азотном?дной
соли, обработаныомъ, какъ и прочіе, съ тою лишь
разницей, что онъ не былъ подвергнуть д?йсгвію эманаціи.
„Эти зам?чательные результаты могутъ быть,
повидимому, объяснены сл?дующимъ образомъ.
„Всл?дствіе нед?ятелыюсти „эманаціи раділ"
представляется в?роятяымъ, что она принадлежи™ къ групп?
гелія. При ея самопроизволыюмъ изм?неніи она выд?-
ляетъ относительно громадное количество энергіи. Смотря
по обстоятельствам^ энергія эта превращается различ-
нымъ образомъ. Въ случа? чистой эманаціи или см?-
шанной съ кислородомъ и водородомъ часть ся
„разлагается" или „дезинтегрируется" на счетъ энергіи,
выд?ленной другой частью. Полученное газообразное
вещество въ этомъ случа? оказывается геліемъ. Если рас-
нред?леніе энергіи изм?няется всл?дствіе присутствія
воды, то „разложенная" часть эманаціи даетъ начало
неону; если „разложеніе" происходить въ присутствіи
!) Г-жа Кюри, повторяя опыты Рамзая относительно дЬйсгвія
эманаціи на м?дцыя соли, литія не нашла.
— 455 —
-сЬрном?дной соли, то получается аргонъ. Подобно этому
м?дь при д?йствіи эманаціи „распадается" съ образова-
міемъ лерваго члена группы, именно литія. Невозможно
доказать образования натрія или калія, такъ какъ они
входятъ въ составь стеклянной посуды, заключающей
растворъ; но по аналогіи съ „продуктами разложенія"
эманаціи они также могутъ быть продуктами „распаде-
нія" м?ди.
„Полный отчетъ о настоящихъ изсл?дованіяхъ будетъ
¦вскор? сообщенъ Химическому обществу" 3).
Вильямъ Рамзаи.
Впосл?дствіи Рутефордъ доказалъ, что часть радія,
^переходящая въ гелій, есть излучаемыя имъ а-частицы2).
і) Поздн?е Рамзай изучалъ д?йствіе эманаціи радія на соедине-
«ія н?которыхъ элементовъ 4-й группы п?ріодической системы—кр?м-
яія, титана, цирконія, торія,—и наблюдалъ постоянное выд?лені? СОа
(углеродъ, какъ изв?стно, является первымъ, самымъ легкимъ, пред-
ставител?мъ 4-й группы). Конечно, и эти опыты требуютъ еще
подробной пров?рки.
2) Рутефордъ и Гейгеръ прим?нили сл?дующій зам?чательный
лріемъ для подсчета а-частицъ, яспускаемыхъ опред?леннымъ коли-
чествомъ радіоактивнаго вещества. Они заставляли общій потокъ
а-частицъ проходить сначала черезъ длинную трубку съ разр?жен-
ньшъ воздухомъ, а зат?мъ черезъ узкое окошечко въ непроницаемой
¦ст?нк?; при этомъ ддя упрощ?нія отсчета отбиралась лишь н?кото-
рая, но опред?ленная, малая часть а-частицъ; зат?мъ а-частицы
попадали въ іонизаціонный аппаратъ—въ замкнутое пространство,
заключенное между двумя проводниками. Одинъ изъ этихъ проводпи-
іковъ былъ соединенъ съ отрицат?льнымъ полгасомъ батареи высо-
каго напряженія (а положительный полюсъ батареи былъ соединенъ
<уь землей), а другой—съ эдектрометромъ. Каждая а-частица,
проходившая черезъ окошечко, вызывала кратковременную іонизацію газа
въ аппарат? и отклоненіе электрометра. Число такихъ отклоненш
(отъ 3 до 5 въ минуту) указывало на число а-частицъ, пролетавшихъ
передъ глазами наблюдателя. Эти опыты показали, что одинъ милли-
граммъ чистаго радія въ теченіе одной секунды выбрасываетъ около
34.000,000 а-частицъ. Интересно отм?тить, что Регеяеръ
аналогичные результаты въ р?шеніи этого вопроса получилъ, пользуясь со-
— 456 —
Соли радія все время испускаютъ огромныя количе^
ства энергіи, которая проявляется въ вид? тепловой и
лучистой: такъ, 1 гр. бромистаго радія въ 1 часъ, па
Рунге и Прехту, выд?ляетъ почти 110 калорій, т.-е. такое-
количество теплоты, которое способно 1,10 гр. воды на-
гр?ть до 100°. Происхожденіе этой энергіи остается до-
сигь поръ не совс?мъ выясненнымъ. Предполагают^ что
причина этого кроется, в?роятно, въ превращеніи ка-
ждаго атома радія: въ атом? происходитъ какъ бы
взрывъ, при чемъ отъ атома отд?ляются а-частицы, обла*
дающія огромньшъ запасомъ кинетической энергіи; оста-
токъ же, потерявшій огромное количество энергіи, даетъ
начало новому атому съ новыми свойствами. Сл?дова-
тельно, въ радіоактивныхъ веществахъ им?ется случай
необычайной концентраціи энергіи.
Изложенный открытія радіоактивныхъ веществъ, ихъ
эманаціи и превращеніи ея им?ютъ чрезвычайно важное
вершенно другимъ нріемомъ, а именно: онъ считалъ въ т?мнот? числа
мерцаній, вызываемыхъ а-лучами, падающими изъ радіоактивнаго
аппарата на экранъ изъ с?рнистаго цинка. Каждая блестящая зв?з-
дочка, появляющаяся на темномъ фон? экрана, по Регенеру, отв?ча-
?тъ удару одной а-частицы. Вс? эти удивительныя изсл?дованія,
помимо ихъ непосредственна™ интереса, явились въ то же время не-
опровержимъшъ доказательствомъ правильности атомно - модекуляр-
наго представленія о постро?ніи вещества. Вотъ что говоритъ въ
предисловіи къ посл?днему изданію своихъ «Основъ физической хи-
міи» знаменитый В. Оствальдъ, въ 90-хъ годахъ р?зко выступившій
противъ атомистической теоріи: «Я уб?дился, что мы недавно
получили экспериментальный доказательства прерывной или зернистой
природы вещества, тщетно искавшаяся атомистической гипотезой въ
лродолжені? стол?тій или даже тысячел?тій. Изолирование и подсчетъ
числа іоновъ въ газахъ, ув?нчавшіеся лолнымъ усп?хомъ, продолжн-
тельныя и превосход(и>ци)ныя работы J. J. Thomson'a, а также
совпадете Броуновскато движенія съ требованіями кинетической теоріи,
обнаруженное ц?лымъ рядомъ изсл?дователей, полн?е всего Реггіп'омъ,
даютъ теперь даже осторожному ученому'право говорить объ экспе-
риментальномъ доказательств? атомистическаго строенія веществъ,
заполняющихъ пространство».
— 457 —
значепіе. Въ самомъ явленіи радіоактивности, повидимому,
мы им?емъ д?ло съ посл?довательнымъ раснадомъ самихъ
атомовъ: элементы—уранъ, торій и радій распадаются па
бол?е легкіе атомы, а они, въ конц?-концовъ, даютъ одни
изъ самыхъ легкихъ атомовъ—атомы гелія. Этотъ
распадъ сопровождается выд?леніемъ огромяаго количества
энергіи, а она производить распадъ такихъ нерадіоактив-
ныхъ элементовъ, какъ м?дь. Распадъ этотъ происходить
такъ медленно, что не удалось еще констатировать его
по уменыненію въ в?с? солей радія. Происходящее при
этомъ превращеніе одного элементариаго вещества въ
другое, если даже взять только наибол?е доказанное
превращеніе эманаціи въ гелій,—фактъ, воочію
подтверждающей возможность превращенія различныхъ элементар-
ныхъ видовъ матеріи другъ въ друга, а сл?довательно,
и ихъ взаимное матеріальное родство, такъ ясно
вытекающее изъ періодической системы элементовъ и
единство ихъ происхожденія.
Реакціи, елужаідія для открытія еолей кальція,
стронція и барія.
§ 194. Мальцій. 1. Углекислыя и фосфорнокислыя щелочи оса-
ждаютъ изъ солей кальція б?лые осадки углекислаго и фосфорнокис-
лаго кальція, растворимые въ кислотахъ:
CaCJ2 + Ка2С03 = СаС03 + 2J№aCl,
СаС12 + Na2HP04 = Са1іР04 + 2NaCl.
2. Щавелевокислый аммоній да?тъ б?лый кристаллически* оса-
докъ щавелевокислаго кальція, растворимаго въ кислотахъ, кром?
уксусной:
CaCI2 -j- (ХН|)аСаОі = СаСаО? + 2NH4CI.
Эта р?акція очень характерна для солей кальція, но въ отсут-
ствіи солей барія- и стронція, къ которымъ она также относится.
3. Соли кальція окрашиваютъ пламя въ оранжевый цв?тъ.
Стронцій. 1. Реакціи съ Ха2С03 и Na2HP04—какъ и у кальція.
2. H.2S04 и ея растворимыя соли осаждаютъ SrSO^ въ вид? б?-
лаго, н?растворимаго въ кислотахъ, осадка:
Sr(N03)2 + H2S04 = SrS04 + 2HNOs.
— 458 —
3. Хромокислое кали K2CrOj осаждаютъ бл?дно-жедтый осадокъ
SrCrOs, растворимый въ уксусной кислот?:
Sr(N03)3 + КйСг04 = SrCr04 -j- 2КШ3.
4. Растврргь CaSOi осаждаетъ соли стронція: Sr(N"03)2 + CaSOs—
= Ca(N03)2-4:SrSOI.
, 5. Соли стронція окрашиваютъ пламя въ кармиігово-красныйцв?тъ.
Барій. 1. IS"a2C03 и Ка^НРОд—какъ у Са и Sr.
2. H2SOi и ея растворимыя соли осаждаютъ (какъ и у Sr) б?-
лый осадокъ BaSO.i, нерастворимый въ кислотахъ:
ВаС!2 + H2S04 == BaS04 + 2HC1.
3. КдСрОд и К2Сг207 даютъ бл?дно-желтый осадокъ ВаСг04,
нерастворимый въ уксусной кислот? (отличіе отъ SrCrOj):
ВаС12 + ICjCc04 = ВаСг04 + 2KGI.
4. Растворъ SrSO| осаждаетъ соли барія: SrS04 + ВаС1а —
— SrC]2 + BaS04.
5. Соля барія окрашиваютъ пламя въ зеленый пв?тъ.
Вторая подгруппа второй группы.
§ 195. Къ этой подгрупп? принадлежать: магній Mg.
цинкъ Zn, кадмій Cd и ртуть Hg1). Магній, динкъ и
кадмій проявляюсь въ свонхъ свойствахъ наибольшую
аналогію; ртуть лее, отличаясь очепь большимъ атомнымъ
в?сомъ и отстоя отъ кадмія черезъ два ряда, въ кото-
рыхъ соотв?тствеяные элементы неизв?стны, им?етъ уже
много отличительныхъ свойствъ.
Наибол?е легкій нзъ этихъ металловъ — магній, въ
то же время им?етъ сходство съ металломъ кальціемъ.
Общее у металловъ Mg, Zn, Cd и Hg сл?дующее:
вс? они двувалентны, т.-е. высшій окиселъ ихъ RO, а
гилратъ окиси Н(ОН)2; вс? они образуютъ мен?е энер-
1) Сюда же относится р?дкій м?таллъ берилліи, Be, съ ат. в. 9,1;
двувалентенъ; основность сравнительно слабая; растворы солей его
им?ютъ кислую реакцію; въ лрирод? входить въ составъ силиката
берилла. По положенію въ систем? анадогиченъ литію въ первой
групп?.
— 459 —
глчныя основанія, нежели щелочно-земельяые металлы:
это проявляется въ томъ, что, во-первыхъ, сами металлы
при обыкновенной температур? на воздух? почти не
окисляются и воды при обыкновенной температур? не
разлагаютъ; во-вторыхъ, ихъ окислы и гидраты въ вод?
нерастворимы, и, въ-третьихъ, соли гораздо меы?е прочны,-»
нежели соли щелочно-земельныхъметалловъ; нерастворимы
въ вод? сл?д. соли: углекислыя, фосфорнокислый и,
кром? магнія, с?рнистыя; с?рнокислыя соли, въ отличіе
отъ щелочноземельныхъ с?рнокислыхъ солей, хорошо
растворимы въ вод?.
Отличіе Mg, Zn, Cd и Hg другъ отъ друга находится
въ т?сной связи съ уд?льнымъ и атомнымъ в?сомъ этихъ
металловъ: магній принадлежите къ легкимъ металламъ
и съ малымъ атомнымъ в?сомъ, а потому онъ бол?е
онергиченъ, нелсели остальные металлы; по своей энергіи
и по прочности соединеній магній близко наноминаетъ
кальдій. Въ природ?, подобно посл?днему, магній
преимущественно встр?чается въ вид? MgC03 и MgSO+ и часто
съ солями кальція образуетъ однородный породы, напри-
м?ръ, доломитъ—MgC03. СаС03: MgS, подобно CaS, pac-
творимъ въ вод?. Вообще можно сказать—магній является
переходнымъ (промежуточиымъ) элементомъ между Ва,
Sr и Са, съ одной стороны, и Zn, Cd и Hg—съ другой.
Въ Zn и Cd, какъ уд?льно тяжелыхъ и о б лада-
ющихъ сравнительно большой атомной массой, энергія
р?зко падаетъ, что проявляется въ сл?дующемъ: 1) для
соединенія съ кислородомъ и для разложенія ими воды
требуется высокая температура; 2) окислы, гидраты оки-
словъ и соли при накаливаніи разлагаются. Особенно
отличается этими свойствами самый тяжелый—и атомно и
уд?льно—ргуть.
Ртуть отличается отъ Mg, Zn, Cd еще и въ томъ
отношеніи, что тогда, какъ они образуютъ по одному
сол?образователыюму окислу RO, т.-е. всегда двувалентны,
ртуть способна быть двувалентной, т.-е. давать окисолъ
— 460 —
НО и огв?чающія ему соли, и одновалентной—съ окис-
ломъ тина R20 и съ отв?чающими ему солями. Окисныя
соединенія типа RO сходны съ соединениями дияка и
кадмія, закисныя—типа R20—съ одновалентными соедп-
неиіями м?ди и серебра. Mg, Zn, Cd легко образуютъ
двойныя и основныя соли; посл?днія составляютъ
принадлежность вс?хъ слабо металлическихъ олементовъ.
Изм?непія въ свойствахъ Be, >1Mg, Zn, Cd и Eg видны
изъ нижесл?дующей таблицы:
Ат. в.
Бериллій, Вет 9,1
Магній, Mg, 24,32
Цинкъ, Zn, 65,37
Кадмій, Cd, 112,40
Ртуть, Hg, 200,6
Уд. в.
1,64
1,74
7.15
8,60
13,60
Атомн.
объемъ.
5,5
14
9,20
13
14,10
Темп.
плавл.
900°
668°
420°
322"
—89°
Темп.
кип?нія.
—
>Zp
950°
720°
360°
Магній, Mg.
Атомный вЬсъ —24,32. Уд?льнъш в?съ = 1,74. Темп, плавленія=663°.
Вь соединеніяхъ двувалентеиъ.
§ 196. Магній очень распространен въ природ?: въ
вид? углекислой соли онъ составляете магнезитъ (MgG03),
,въ см?си съ углекислымъ кальціемъ образуетъ залежи
доломита (MgC03. СаС03); съ КС1 образуетъ карнал-
литъ (MgCl2. KCl-f-6H20); большинство силикатовъ со-
держитъ магній, напр., талькъ (Mg3H2Si4012), оливинъ
(Mg. Fe)2Si04, жировякъ, серпентинъ (Mg3H4Si209), каи-
яитъ (MgS04. MgCI2. K2S04. 6Н20) и др.; растворимыя
соли магнія встр?чаются въ природпыхъ водахъ.
Въ чистомъ вид? Mg получается элсктролизомъ снла-
влепнаго хлористаго магнія MgCl2 или карналлита (MgO
еще прочна и углемъ не возстаповляется).
Магній—твердый серебристо-б?лый металлъ съ силь-
иымъ блескомъ, уд?льно легкій; въ сухомъ воздух? не
изм?няется, а во влажномъ постепенно тускн?етъ, покры-
- 461 -
ваясь слоемъ водной окиси; при накаливаніи сгораетъ
въ MgO съ яркимъ св?томъ й). Онъ очень ковокъ, тя-
гучъ и можетъ быть вытягива?мъ въ проволоку и ленту.
Воду начипаетъ разлагать только при кипячепіи. Въ
кислотахъ легко растворяется; щелочи па него не д?й-
ствуютъ. Магній можетъ служить ;ліергичньшъ возстаио-
вптелемъ.
Окись магнія, или магнезія, MgO, получается сжига-
иіемъ -магнія или прокаливаніемъ угл?кислаго магнія:
MgC03 = MgO-)-C02; это б?лый, очень легкій, аморфный
объемистый порошокъ, зам?чательный по -своей
огнеупорности; въ медидии? изв?степъ подъ имопемъ жженой
магпезіи.
Рмдратъ окиси магнія, Mg(OH)2, вынадаетъ въ вид?
б?лаго студепистаго осадка при д?йствіи ?дкихъ
щелочей на растворимыя соли магнія: MgCl2 -f- 2NaOH =
= Mg(OH)2 -|- 2NaCl; почти перастворимъ въ вод?; въ
1
раств?ръ переходить около гидрата, но и такой
оииии
растворъ уже реагируетъ щелочно. Mg(Ori)2 —слабое
основаніе.
При прокаливаніи гидратъ окиси магнія разлагается
на окись и воду:
Mg(OH)a = H20<frMgO.
Хлористый магній, MgCl2, находится въ морской вод?; /
двойная соль его съхлористымъ каліемъ MgCl2. КС1. 6П20
образуетъ минералъ карналлитъ; чистый MgCl2 предста-
вляетъ б?льте, очень гигроскопичные кристаллы съ 6 ч.
кристаллизационной воды.
ij Св?томъ магнія нер?дко пользуются для возОужденія химиче-
скихъ реакціЙ, наприм?ръ, при фотографировании иди при опыт? со-
едииснія хлора съ водородомъ. При прокаливаніи магнія въ ограни-
ченномъ объ?м? воздуха, кром? окиси магнія, образуется еще
азотистый магній Mg3N2—вещество желтовато-зеленаго цв?та. Присут.
ствіе посл?дняго доказывается выд?л?ніемъ амміака при кипяченіи
(продукта гор?нія Mg съ водою.
— 462 —
Вода при кипяченіи разлагаеть MgCl2 на окись маг-
нія и хлористый водородъ по уравненію;
MgCl2 -f Н20 = 2НС1 + MgO.
Этотъ фдктъ указывасгь на ослабленную основность
гидрокиси магиія.—MgCl2 легко образу?тъ двойныя соли.
С?рнокислый магнігі, MgSOt, образуетъ зпачитедь-
ныя залежи въ вид? минерала кизерита MgS04. Н20;
встр?чается въ морской вод? и л?которыхъ источня-
кахъ; обыкновенно кристаллизуется съ 7 частицами воды
(MgS04. 7Н20); всл?дствіе горькаго вкуса называется
юрькою или англіискою солью; прим?няется, какъ
слабительное средство; она входитъ въ составь горькихъ
минеральныхъ водъ, напр., воды Гуиіяди Яносъ въ.
Венгріи.
Углекислый магній, MgC037 встречается въ природ?
въ вид? магнезита. Въ соединении съ углекальдіевою
солью онъ образуетъ доломить. Изъ водныхъ растворовъ
магніевыхъ солей при д?йствіи углекислыхъ щелочей вы-
падаетъ б?лый осадокъ основной углекислой соли магиія:
' 2MgCl2-{~2Na2C03-f-H20=MgC03. Mg(OH)2-fCOa+4NaCL
Основная соль углекислаго магиія иредставляетъ
собой б?лый объемистый порошокъ, употребляемый въ
медицин? въ качеств? слабой щелочи подъ назвапіемъ
б?лой магнезіи (Magnesia alba).
Реащія па магній. Магній открываютъ, пользуясь его
способностью давать двойную фосфорноаммоніевомагніеву соль въ вид? б?-
лаго кристаллическаго осадка при д?йствіи фосфорнонатрі?вой соли
на соль магяія въ присутствіи амміака и хлористаго аммонія*):
MgCJ8 + Ш3 + Ка2НР04 = MgNH4P04 + 2NaCI.
i) Хлористый аммоній приливается для растворенія гидрата окис*
магнія, который частью осаждается при приливаніи амміака.
Важна зд?сь и реакдія образованія иерастворимаго въ вод?, но
растворимаго въ хлористомъ аммоній гидрата окиси магяія:
1) MgCIa = 2NaOH = Mg(OH)2 + 2XaCl,
2) Mg(OH)2 + ЗШ5С1 = MgCi2. XH4C1 + 2NH3 + 2H30.
— 463 —
Ц и н к ъ, Zn.
Атомный в?съ = 65,37. Уд?льный в?съ = 7,15. Темп, плавд. =433°.
Въ соединеніяхъ двувалентенъ.
§ 197. Цинкъ встр?чается въ природ? въ вид?
углекислой соли — благородпаго галмея (ZnC03) и въ вид?
с?рвистаго цинка—цинковой обманки (ZnS). Въ Россіи
галмей им?ется въ Привислинскомъ кра?. Въ свобод-
помъ вид? цинкъ получается прокаливаніемъ ZnS, при
чемъ получаются ZnO и S02; ZnO зат?мъ возстано-
вляется углемъ, и полученный цинкъ перегоняется1).
Ото—металлъ серебристо-б?лаго цв?та, хрупкій при
обыкновенной температур?, тягучій и ковкій при 100—150°;
при 200° цинкъ опять д?лается хрупкимъ и легко
толчется въ порошокъ. При 433° онъ плавится и при 920°
кипитъ. На воздух? при накаливавіи сгораеть яркимъ
св?томъ; во влажномъ воздухь медленно покрывается
тонкимъ слоемъ основной соли, предохраняющей
металлъ отъ дальн?йшаго изм?ненія. Въ кислотахъ
растворяется съ выд?леніемъ водорода.
Въ ?дкихъ щелочахъ цинкъ также растворяется (при
нагр?ваніи), выд?ляя водородъ,—фактъ, характерный для
цинка, металла съ пониженной энергіей 2):
Zn -- 2NaOII = Zn(ONa), -f Нэ.
Какъ трудно окисляющійся металлъ цинкъ
употребляется въ качеств? матеріала для выд?лки домашней
утвари (ведра, лейки, ванны и проч.), для архитектур-
ныхъ украшеній, для гальванизащи жел?за п какъ ма-
теріалъ для сплавовъ, наприм?ръ, для приготовленія
*) Тонкій с?ръш порошокъ, лолучаюшшся попутно при лерегояк?
цинка, изв?ст?нъ подъ именемъ цинковой пыли; посл?дняя, кром?
самаго цинка, содержитъ еще окись цшпса. Цинковая пыль разла-
гаетъ воду.
2) Такимъ образомъ Zn является не только катіономъ, какъ въ
¦ZnS04, ZnCl2 и др., но и частью аніона, какъ въ Ха^. 2в02(цинкатъ)-
— 464 —
латуни и томпака (Cu~j-Zn), нейзильбера (Сa 4-M-)-Zii)
и друг.
Окись цинка, ZnO, получается или сожиганіемъ
самого цинка въ стру? воздуха или прокаливаніемъ
углекислой солб цинка, въ вид? б?лаго порошка безъ запаха
и вкуса при нагр?ваніи желт?ющаго; употребляется какъ
весьма прочная бълая краска—ципковыя б?лила.
Гидратъ окиси цинка, Zn(OH)2, получается въ вид?
студенистой б?лой массы при д?йствіи ?дкихъ щелочей
на растворы солей цинка: въ избытк? ?дкихъ щелочей
растворяется, образуя цитаты:
1) ZnSO4 + 2NaOH = Zn(0H)a+NasSO4,
2) Zn(OH)2 + 2NaOH--=Zn(ONa)2 -f 2H20;
растворені? гидратовъ металловъ въ ?дкихъ гцелочахъ—
явленіе сравнительно р?дкое; оно присуще только слабо-
основнымъ металл амъ.
Хлористый цижъ} ZnCL,, получается раствореніемъ
цинка въ соляной кислот?. Это —б?лая, расплывающаяся
па воздух? масса, кипящая при 680°; служитъ для про-
питыванія дерева (напр., жел?знодорожпыхъ шпалъ),
чтобы предохранить его отъ гніенія; на органическія
вещества д?ствуетъ разъ?дающимъ образомъ.
Сернокислый адиккг, ZnS04. 7Н20,—б?зцв?тная
кристаллическая масса, прим?няется какъ прим?сь къ мас-
лянымъ краскамъ для ускоренія ихъ высыханія, а также
въ медицин? (цинковыя капли для глазъ). Получается
при обжиганіи цинковой обманки (ZnS); называется ции-
ковымъ (или б?лымъ) купоросомъ 1).
Углекислый цинкъ, ZnC03, находится въ природ?,
образуя галмей.
С?рнистый цижъ> ZnS, находится въ природ? въ
вид? цинковой обманки; въ вид? б?лаго осадка полу-
*) Иодъ имонемъ купоросовъ разум?готся вообще с?риоішслыя
соли общей формулы RSOi,7H20 (гд? R можетъ быть, кром? Zn, Fe
(закись), СО, Ni и др.).
— 465 —
чается д?йствіемъ с?рнистыхъ щелочей на растворы
цинковыхъ солей:
ZnS04+(NHJ2S = ZnS + NH4)aS04;
нерастворимъ въ вод? и уксусной кислот?, растворяется
въ слабыхъ мянеральныхъ кислогахъ,
Реащіи па циикъ. Нерастворимостью с?рнистаго цинка въ
уксусной кисдот? пользуются для открытія и отд?ленія цинка отъ другихъ
металловъ; характерна также растворимость гидрата окиси цинка
[Zn(OH)2] въ ?дкихъ щелочахъ (образованіе цинката).
К а д м і й, Cd.
At. в. = 112,40. Уд. в. = 8,00. Темп. плавл. = 320; тем. кип. 7700. въ
соединеніяхъ двувалентенъ.
§ 198. Кадлгій встречается всегда вм?ст? съ цинкомъ
и въ аналогичныхъ съ нимъ соединеніяхъ. Это—ковкій,
тягучій металлъ, бол?е летучій, ч?мъ цинкъ. Свойства
соединеній кадмія сходны со свойствами подобныхъ же
соединеній цинка. Прим?няется въ сплавахъ, особенно
плавящихся при низкой температур?, напр., въ сплав?
Вуда (4 ч. Bi-f-2 ч. РЬ + 1 ч. Sn + 1 ч. Cd). С?рни-
стый кадмій употребляется какъ желтая краска.
Для открытія кадмія прим?няется осажденіе его с?роводородомъ
CdS04 + H2S = CdS (желтый осадокъ) + II2S04.
Ртуть, Hg. Л flu I
At. в. = 200,6. Уд. в. = 13,60 при 0». Темп, плавл. = — 39,50. Въ
соединеніяхъ дву- и одновалентна.
§ 199. Сравнительно небольшое количество ртути
находится въ природ? въ свободномъ состояніи
вкрапленной въ горныя породы; главнымъ же образомъ, она
запасена въ вид? с?рнистой ртути—киновари. Важн?йшія
м?ста ея нахожденія — въ Испаніи, Калифорніи, Австріи
и въ Россіи; въ посл?дней она находится въ Екатерино-
славской губерніи, Бахмутскомъ у?зд? и въ Дагестан?
— 466 —
около Киринска. Въ металлическомъ вид? ртуть полу-
чаютъ обжиганіемъ киновари, при чемъ с?ра окисляется
въ S02, а ртуть перегоняется въ особые пріемники:
HgS + 02-:Hg + S02.
Ртуть *г) — единственный жидкій при обыкновенной
температур? металлъ, затверд?ваетъ при — 39,5°, а ки-
питъ при 360°, испаряется же и при обыкновенной
температур?; уд?льный в?съ очень большой = 13,602). Въ
парахъ молекула ртути состоитъ изъ одного атома. Пары
ртути ядовиты. На воздух? ртуть не окисляется.
Соляной кислотой ртуть не изм?няется, въ с?риой кислот?
растворяется при нагр?ваніи, въ азотной же растворяется
легко; водорода изъ кислотъ не выд?ляетъ. Ртуть легко
соединяется съ галоидами и съ с?рой.
Съ металлами ртуть образуетъ сплавы, называемые
амальгамами.
Амальгамы — ото настоящіе растворы, изъ которыхъ
во многихъ случаяхъ удается выд?лить опред?ленныя
кристаллическія соединеяія ртути съ растворешшмъ въ
ней металломъ.
Амальгамы прим?няются въ химической практик? въ
т?хъ случаяхъ, когда желаютъ ум?рить скорость реакціи
даннаго металла; напр., амальгама К или Na разлагаетъ
воду или спиртъ гораздо медленн?е, ч?мъ самые металлы;
цинкъ гальваническихъ элементовъ амальгамируютъ съ
ц?лыо бол?е медленнаго его растворенія въ кислотахъ;
амальгамаціей иногда пользуются для извлечения метал-
ловъ (напр., серебра, золота; см. эти металлы).
і) Ртуть очищается или перегонкой или вливані?мъ ртути
тонкой струей въ высокій сосудъ съ с?рной кислотой, или азотной
кислотой и посл?дующимъ промываніемъ водой и высушиваніемъ:- при-
м?си сполна растворяются въ кислотахъ, ртуть же проходитъ, почти
не растворяясь.
2) При пропусканіи электрическаго тока сильнаго напряжения
чрезъ очень разведенный растворъ азотнокислой соли окиси ртути
получается коричневаго цв?та растворъ, въ которомъ содержится
ртуть въ коллоидальномъ состоянии.
— 467 —
Ртуть даетъ два ряда соединеній: закисныя, - гд?
ртуть одноатомна, и окисныя, гд? она двуатомна. Окис-
ныя соединенія получаются въ т?хъ случаяхъ, когда
соединяющееся со ртутью вещество находится въ избыт-
к?, закисныя же, наоборотъ, при избытк? ртути.
Соединенія закиси ртути:
Закись ртути, Hg20 — черный по"рошокъ, очень
легко разлагается на ртуть и окись ртути. Получается
при д?йствіи ?дкихъ щелочей на соли закиси ртути.
2HgN03 -f 2NaOH = Hg20 -f 2NaN03.+ IT20.
Какъ окисныя, такъ и закисныя соединенія ртути
гидратовъ окисловь при обычныхъ условіяхъ не даютъ;
очевидно, они очень легко распадаются на окиселъ и
воду:
1) Hg(OH), = HgO +11,0,
2) 2HgOH = Hg20 + H20.
Хлористая ртуть или каломель, HgCl —вещество,
въ вод? нерастворимое, получается въ вид? б?лаго
аморфнаго осадка при д?йствіи соляной кислоты на
азотнокислую закись ртути HgN03 + HC1 = HgCl -f- HN03.
Каломель получается также при нагр?ваніи сухой сулемы
(HgCl2) со ртутью: HgCl2 -f Hg = 2HgCI. Если каломель
облить амміакомъ, то она черн?етъ всл?дствіе образо-
ванія хлористаго меркуръ-аммонія; это соединеніе можно
разсматривать какъ нашатырь, два атома водорода ко-
тораго зам?щены одноатомной ртутью:
2HgCl -f 2NH8 = NH4C1 + NH2HgaCl.
Опред?леыіе плотности пара показало, что молекула
каломели удвоенная, т.-е. Hg2Cl2.
Каломель прим?няется въ медицин? въ качеств?
антисептика.
Азотнокислая закись ртути, HgN03, получается
при д?йствіи разведенной азотной кислоты на избытокъ
30*
— 468 —
ртути. Въ вод? растворима. Въ раствор? медленно
окисляется въ соль окиси: металлическая ртуть,
прибавленная къ раствору, препятствуете окисленію.
Соедгтенія окиси ртути:
Окись ртути, HgO, получается при нагр?валіи
ртути въ присутствіи воздуха при температур?, близкой
къ температур?* кип?нія ртути или при осторожномъ про-
каливаніи азотнокислой окиси ртути: Hg(N03)2 = HgO-[-
-J-2NO -f- О. Она представляетъ вещество красиаго цв?та.
При д?йствіи щелочей на соли окиси ртути она выпа-
даетъ въ вид? желтаго аморфнаго осадка: HgCl2 ~\~
~\- 2NaOH=HgO + 2NaCl + H20. При накаливаніи окись
ртути разлагается на ртуть и кислородъ. Окись ртути
сыграла важную роль въ установлении закона неуничто-
жаемости матеріи (см. опытъ Лавуазье, стр. 257).
Хлорная ртуть или сулема*), HgCl2, получается
или при расгвореніи ртути въ царской водк? или при
возгонк? см?си с?рнокислой ртути съ поваренной солью:
HgS04 -}- 2NaCl = Na2S04 -f HgCla.
Сулема представляетъ б?лое кристаллическое вещество,
растворимое (1 ч. сулемы въ 15 ч. Н20) въ вод?. Д?й-
ствіемъ возстановляющихъ веществъ переводится въ
каломель и даже въ металлическую ртуть.
Такъ, наприм?ръ, д?йствуетъ хлористое олово, SnCl2:
1) 2HgCl2 + SnCl2 = 2HgCl-f SnCl4,
2) 2HgCl + SnCl2 = Hg2 + SnCl4.
Сулема — сильный ядъ 2): она свертываетъ б?локъ,
который, въ свою очередь, и служитъ лучшимъ противо-
ядіемъ при отравленіяхъ сулемой. Водный растворъ ея
(2 ч. на 1000 ч. воды) прим?няется для дезинфекціи.
1) Названіе сулема произведено отъ sublimire (возгоняться).
2) Интересно зам?тить, что ядовитое д?йствіе сулемы
увеличивается съ увелич?ніемъ іонизаціи.
— 469 —
Двуіодистая ртуть, HgJ2, получается при д?йствіи
KJ на растворы солей окиси ртути въ вид? краснаго
осадка, растворимаго въ избытк? реактива: HgCl2-|-2KJ=
= HgJ2 ~\- 2КС1; а также можно ее получить прямымъ
растираніемъ ртути и іода въ отношеніи 4: 5 по в?су.
При нагр?ваніи до 126° красная HgJ2 д?лается желтой,
а желтый цв Ьтъ при охлажденіи вновь легко
превращается въ красный.
Азотнокислая окись ртути, Hg(N03)2, получается
при раствореніи ртути въ избытк? азотной кислоты.
С?рнистая ртуть, HgS, образуетъ природную
киноварь, вещество краснаго цв?та. Искусственно с?рнистая
ртуть получается или прямымъ соединеніемъ ртути и
с?ры или осажденіемъ с ізроводородомъ изъ растворовъ
солей окиси ртути въ вид? чернаго аморфнаго осадка,
который при накаливаніи безъ доступа воздуха
переходить въ киноварь; подъ вліяніемъ св?та красная
киноварь черн?етъ. Киноварь употребляется въ качеств?
краски (напр., при приготовленіи сургуча).
Ріакцги на ртуть. Для заменой ртути характерны:
образование окисла чернаго цв?та при д?йствіи ?дкой щелочи, образование
б?лаго нерастворимаго осадка хлористой ртути HgCI при д?йствіи
НС1, образованіе іодистой ртути зеленовато-бураго цв?та при
д?йствіи KJ и образованіе чернаго осадка отъ амміака.
У окисной ртути окис?лъ желтовато-оранжеваго цв?та; SnCIa да-
етъ б?лый осадокъ HgCl, возстановляющійся при избытк? реактива
до металлической ртути; іодистый калій даетъ карминово-краеный
осадокъ іодной ртути, растворимый въ избытк? реактива; амміакъ даетъ
б?лый осадокъ (NH2HgN03); с?рнистая ртуть (HgS) нерастворима въ
азотной кислот?. Ртуть изъ солей легко выт?сняется м?дью, цинкомъ
и пр. металлами. Соли ртути при накаливаніи съ содой выд?ляютъ
свободную ртуть.
Третья группа.
§ 200. Къ третьей групп? періодической системы
элемеитовъ принадлежать изъ распространенныхъ элемен-
товъ: боръ В = 11,0 и алюмингй А1 = 27,1, а изъ р?д-
— 470 —
кихъ: скапдт Sc = 44,1, иттргй Y — 89; ланшанъ
La— 139,0; галлш Ga=69,9; индій In = 114,8; таллт
Т1 = 204,0. Посл?дніи три (Ga, 1л и Т1) съ алюминіемъ
во глав? образуютъ подгруппу земельиыхъ металловъ, а
остальные носятъ названіе металловъ р?дкихъ земель г).
Въ отношеніи металличности 3-я группа далеко
уступаете 1 и 2 группамъ. Этого, конечно, и надо было
ожидать, такъ какъ 3-я группа является после дней чисто
металлической (если не считать бора — промежуточна™
въ ней элемента) группой. Еще шагъ вправо періодиче-
ской системы, и начинается ужо область типичныхъ
металлоидовъ, каковыми являются С и Si въ 4 групп?.
При характеристике наибол?е въ природ? расдростра-
пеннаго металла этой группы — алюминія — будетъ
указано, въ чемъ проявилась его пониженная металличность
(растворимость самаго металла, его окисла и гидрата
окисла въ вдело чахъ, разлагаемость водою его галоид-
ныхъ соединеяій, легкая разлагаемость водой солеи со
слабыми кислотами, наприм?ръ, с?рнистаго и углекис-
лаго алюминія—будутъ наибол?е характерные факты въ
этомъ направленіи).
Взаимпыя отнош?нія элементовъ этой группы т? же,
что и въ предыдугцихъ, а именно, съ повышеніемъ атом-
наго в?са возрастаетъ металличность элементовъ, при
чемъ уд?льно тяжелые элементы (съ малымъ атомнымъ
объемомъ) мен?е д?ятельны, ч?мъ элементы легкіе (съ
большимъ атомнымъ объемомъ). Общій у вс?хъ
металловъ группы окиселъ им?етъ форму Е203, а гидрать
R(OIl)3, стало-быть, эти металлы трехвалентны. Самый
л?гкій элементъ этой группы—боръ—им?етъ уже слабо
выраженныя металлоидный свойства (борная кислота,
ВН3—газъ), и потому онъ раземотр?нъ при металлоидахъ.
Алюминій обладаетъ бол?е р?зко выраженными металли-
1) Итт?рбій, причиедявтійся раньше къ 3-й групп?, разлож?нъ
на два элементарныхъ вещества—неоиттербій (ат. в. 172) и лютецій
(ат. в. 174).
- 471 —
чоскими свойствами, но, какъ элементъ переходный, въ
н?которыхъ случаяхъ реагируетъ и какъ металлоидъ.
Ат. в?съ. Уд. в?съ Ат. объемъ. Темп, плавл.
В 11,0 2,5 4,4 1300°
А1 27,1 2,6 11,0 657°
Ga 69,9 5,9 11,7 30°
la 114,8 7,4 14 176°
Tl 204,0 11,8 17 304°
А л ю и и н і ft, Al. / / С
Атомный в?съ =27,1. Уд. в?съ = 2,6. Темп, плавл. — 6570. Въ со-
единеніяхъ трехвадентенъ.
§ 201. Алюминій очень распространенъ въ природ?
(его приблизительно около 8°/0» см. 16 стр.), главнымъ
образомъ, въ вид? силикатовъ, т.-е. кремнекислыхъ со-
единеній; сюда относятся: глина (А1203. 2Si02. 2Н20),
полевошпатовые минералы (К20 . А1203. 6Si02 — орто-
клазъ, Na20 . А1203 . 6Si02—альбитъ, СаО.А1203 . 2Si02—
анортить и др.), слюда и др.; также встр?чается въ
природ? окись алюмшіія (А1203) въ вид? минераловъ:
корунда, сапфира, рубина, наждака; или водная окись
его, образуя минералы: дгаспоръ [А1202(ОН)2], бокситъ
[А120(ОН)4], гидраргиллитъ [А12(ОН)6].
До посл?дняго времени алюминій получался въ ме-
таллическомъ вид? д?йствіемъ Na на хлористый алюминій:
AlCl, + 3Na = 3NaC14-AL
Интересно сопоставить ц?ны на алюминій: въ 1855 г.
1 кгр. алюминія стоилъ 2.400 марокъ, а въ 1898 году
2:/2 марки. Удешевленіе вызвано т?мъ, что въ посл?днее
время для полученія алюминія прим?ненъ
электролитический методъ. Сущность его состоитъ въ сл?дующ?иъ:
/ Въ жел?зный ящикъ съ угольной^ набойкой (рис. 100)
внутри нагружается см?сь кріолита A1F3. 3NaF и А1203
(изъ боксита, т.-е. водной окиси алюминія) и засыпается
- 472 —
солью, а зат?мъ пропускается очонь сильный
электрический токъ, при чемъ угольная набойка ящика служить
катодомъ (а), а опущенные въ ящикъ угольные сгержни—
аподомъ (Ь). Сначала отъ д?йствія сильнаго тока
происходить пЪвышеніе температуры, отчего смЬсь въ ящик?
плавится; зат?мъ соединенія алюминія разлагаются, и
саыъ алюмипій выд?ляется на катод?, т.-е. на дн? ящика
Рис. 100. Полученіе алюминія.
(с), откуда и выпускается чрезъ отверстіе (d). Въ Швей-
даріи (въ Нейгаузен?) треб}іощіяся для этого процесса
динамо-машины приводятся въ движеніе силою Рейнскаго
водопада; силою же водопадовъ пользуются и въ Аме-
риюЦ
Алюминій— металлъ оловянно-б?лаго цв?та, плавя-
щійся около 657°, очень ковкій и тягучій; уд?льный
в?съ его—2,6. Онъ легко плющится въ тонкіе листочки
и вытягивается въ проволоку. Спаиванію не поддается,
трудно полируется, что и затрудня?тъ его широкое при-
м?неніе въ т?хник?.
— 473 —
На воздух? дри обыкновенной температур? онъ не
иам?ня?тся2); даже и при накаливаніи онъ изм?няется
лишь взятый въ тонкихъ листочкахъ или въ вид? тон-
каго порояіка; въ посл?днемъ случа? онъ сгораетъ яр-
кимъ б?лымъ св?томъ въ свой окис?лъ А1203. Въ амаль-
гамированномъ вид? (амальгамируется онъ легко втира-
ніемъ какой-нибудь ртутной соли на поверхности металла)
онъ очень легко окисляется и разлага?тъ воду при
обыкновенной темнератур?. Алюминій растворяется хорошо
лишь въ соляной кислот?; слабая с?рная д?йствуетъ на
него плохо, а азотная кислота почти совершенно не
д?йствуетъ. Изъ сказаннаго видно, что свободный
алюминій—мало энергичный металлъ.
Очень важно отм?тить, что алюминій растворимъ въ
?дкихъ щелочахъ: А1 + ЗКОН = А1(ОК)а -f ЗН. Этотъ
фактъ, какъ упомянуто выше, указываетъ на слабую
металличность алюминія; настоящіе энергичные металлы
въ щелочахъ не растворяются.
При очень высокой температур? алюминій соединяется
съ кислородомъ и даетъ свой единственный солеобразо-
вательный окиселъ А1203, при чемъ эта реакція
сопровождается выд?леиіемъ большого количества тепла:
2А12-{-1Ю2 = 2А12Оз = 785,2К, т.-е. на каждую молекулу
А1203 выд?ляется 392,6К. Поэтому алюминій и прим?-
няется какъ возстановитель (см. стр. 397): только для
начала реакціи требуется высокая температура 2).
і) Впрочемъ, надо зам?тить, что алюминій быстро тускн??тъ на
воздух?, такъ какъ покрывается едва зам?тяымъ и прочно сидящимъ
сдоемъ своего окисла.
2) Возстановленіе металловъ изъ окисловъ алкшиніемъ
разработано Гольдшмитомъ: обыкновенно порошкообразный окиселъ металла
(напр., Сг203) см?шивается въ опред?ленныхъ отношеніяхъ съ алюши-
ніевымъ порошкомъ; въ эту см?сь («т?рмитъ*) вставляется поглубже
ленточка магнія (иногда къ ней еще присо?диняютъ шарикъ изъ см?си
алюминія и перекиси барія, чтобы скор?? началась реакція) и
зажигается: теплотою, выделяющейся при гор?ніи магнія, и вызываютъ
реакцію возстановленія сопровождающуюся очень сильнымъ повыш?-
ніемъ температуры въ короткое время.
— 474 —
Малый уд?льный в?съ, стойкость по отношенію къ
кислороду (т.-е. трудная окисляемость) и кислотамъ
давали поводъ думать, что этотъ металлъ при удешевленіи
его стоимости выт?снитъ собою въ практическихъ при-
м?нейіяхъ вс? металлы; но на д?л? алюминій не оправ-
далъ этихъ надеждъ; онъ оказался слишкомъ мягкимъ,
трудно спаивающимся; растворимость его въ щелочахъ и
растворахъ н?которыхъ содей также оказалась неблаго-
пріятной. Поэтому-то алюминій на рынк? пока и
служить какъ матеріалъ для вещей домашняго обихода, без-
д?лушекъ и т. д. Современная техника стремится
сгладить эти недостатки алюминія, приготовляя изъ него
сплавы съ другими металлами. Изъ силавовъ наибол?е
изв?стны: алюминіева бронза (5—12% А1) — золотисто-
желтаго цв?та, прим?няется, нанрим?ръ, для выд?лки
коромысловь химическихъ в?совъ и вообще для физи-
ческихъ приборовъ, какъ трудно изм?няющійся отъ
химическихъ реактивовъ сплавъ; ферро-алюминій (А1 -f-
-j—Fe)—сплавъ, прим?няющійся при отливк? стали: при-
бавленіе его, а также и самаго алюминія (около 0,1%))
предупреждаете образованіе пузырей въ литой стали.
Существуетъ также сплавъ алюминія съ магніемъ,
называемый магналіемг (6—30% Mg), отличающійся
легкостью, твердостью и стойкостью въ химическомъ отно-
шеніи; онъ, повидимому, сыграетъ большую роль въ
д?л? утилизаціи ц?нныхъ свойствъ алюминія.
Амальгама алюминія получается при дЬйствіи на
алюминій (лучше въ вид? опилокъ) 72~%"мъ растворомъ
сулемы; амальгама алюминія энергично разлагаетъ воду
при обыкновенной температур? съ выд?леніемъ водорода
и образованіемъ гидрата окиси алюминія.
Въ соединеніяхъ алюминій всегда трехатоменъ,
образуя А1203,А1(ОН)3 и соли по типу А1Х3.
Окись алюмгтгя (глиноземъ), А1203, встр?чается
въ природ? въ вид? драгоц?нныхъ камней, какъ-то ру-
— 475 —
бина1), сапфира2) и корунда*). Нечистая А1203
называется наждакомЪу употребляется для шлифовки. Въ
лабораторіяхъ А1203 получается прокаливаніемъ гидрата
окиси алюминія А1(ОН)3.
2А1(ОН)а=А12Оа + 2Н20.
А1203 плавится въ пламени гремучаго газа (т.-е. около
2000°). '
Гидратъ окиси алюминія, А1(0Н)3, получается д?й-
ствіемъ іцелочей—лучше воднаго амміака—на раствори-
міля соли алюминія:
Al2(SOJ3+ 6Ш4ОН = 2А1(ОН)3+ 3(NH4)2S04.
Осаждающійся гидратъ им??тъ видъ безцв?тяой сту-
денеобразной массы и изв?стенъ въ двухъ видоизм?ие-
ніяхъ: одно растворимо въ вод? (гидрозоль)] а другое—
нерастворимо (гидрогель); гидрозоль очень неустойчивъ
и легко переходить въ гидрогель. Гидратъ окиси
алюминія относится къ сильнымъ кислотамъ какъ основаніе,
а къ сильнымъ основаніямъ—какъ кислота; такъ, онъ
растворяется въ кислотахъ (реагируетъ какъ щелочь) съ
образованіемъ солей, наприм?ръ:
А1(0Н)3 + ЗИС1/= А1С13 + ЗНяО,
и въ ?дкихъ щелочахъ, образуя такъ называемые
алюминаты (реагируетъ, сл?д., какъ кислота):
А1(ОН3) + 3NaOH = Al(ONa)3 -f- 3H20.
*) Красный цв?тъ рубина зависитъ отъ прим?си сл?довъ хромо-
выхъ соединении.
2) Сити цв?тъ сапфира зависитъ отъ прим?си со?диненій
кобальта.
3) Бурымъ цв?томъ корупдъ и паждакъ обязаны прим?си
соединений окиси жел?за.
- 476 -
Въ этой реакціи выстуааетъ отчасти уже
металлоидный характеръ алюминія. Алюминаты очень непрочны:
разлагаются слабыми кислотами, даже угольной.
А1(ОН)3 со многими красками образуетъ окрашенный
соединенія, такъ называемые лаки, почему и применяется
въ качеств? протравы въ красильномъ д?л?.
Хлористый алюминЫ, А1С13. Безводный хлористый
алюминій получается лучше всего прямыми д?йствіемъ
хлора на нагр?тый металлическій алюминій; раньше его
получали при накаливаніи см?си А1203 и угля въ стру?
хлора:
А1203 + 6С1 -f ЗС = 2А1С13 -f ЗСО.
Раствореніемъ А1203 въ HCI получается водный
хлористый алюминій А12С16.12Н20. Прокаливаніемъ посл?д-
няго соединения нельзя получить безводнаго А1С13, потому
что оно разлагается на А1а03 и НС1. Подобное разложе-
ніе характеризуетъ слабыя основныя свойства окиси
алюминія.
С?рнокислый алюминій) A12(S04)3. 18H20,
получается при д?йствіи с?рной кислоты на глияоземъ. Онъ
образуетъ съ с?рнокислыми щелочами двойныя соли,
называемый квасцами, кристаллизующіяся съ 12
частицами воды:
AlK(S04)a. 12Н20.
Растворъ квасцовъ им?етъ вяжущій вкусъ и кислую
реакцію. При нагр?ваніи квасцы т?ряютъ кристаллиза-
ціонную воду и даютъ оюженые квасцы.
Квасцы бываютъ разнообразнаго состава: вм?сто
алюминія могутъ становиться сл?дующіе трехатомные
металлы: Cr, Fe и иногда Мн, а вм?сто К—другіе
щелочные металлы и аммоній (NH4).
Силгтаты алюминія встр?чаются въ значительныхъ
количествахъ въ природ? вм?ст? съ силикатами другихъ
элементовъ. Наибол?е обыкновенный силикатъ алюми-
— 477 —
пія—полевой шпатъ—им?етъ составь K2O.Al203.6Si02.
Въ природ? такіе сложные силикаты !), подъ вліяніемъ
воды и С02 воздуха, выв?триваются, то-есть постепенно
разлагаются на песокъ, глину и др.
Глина, наибол?е чистое видоизм?неніе которой
называется каолиномг, есть водный силикатъ алюминія —
состава А1203. 2Si02. 2Н20. Въ природ? глина
образуется, какъ сказано выше, выв?триваніемъ полевого
шпата подъ вліяніемъ, главнымъ образомъ, воды и
углекислоты; реакція идетъ по сл?д. уравненію:
2(KAlSi,Ofl) + 2Н20 + С02 = К2С03 + 4Si02 +
полевой шпатъ поташъ песокъ
+ Al203.2Si02.2H20.
глина
Поташъ, песокъ и глина уносятся текучими водами, изъ
которыхъ при тихомъ теченіи воды первымъ осаждается
песокъ, какъ наибол?е тяжелый, зат?мъ осаждается см?сь
песка и глины и, наконецъ, самая глина. Такъ
образуются разрушеніемъ горныхъ породъ почвы: песчаная,
супесчаная и глинистая. Поташъ, какъ хорошо
растворимый въ вод?, уносится дальше всего, а изъ воды
зат?мъ поглощается растеніями.
Залежи чистой глины, каолина, довольно р?дки 2);
обыкновенно же глина окрашена прим?сями въ разные
цв?та, чаще соединеніями жел?за въ бурый цв?тъ.
Чистый каолинъ прим?няется для приготовленія фарфо-
Г) Силикаты, по современнымъ воззр?ніямъ, и составляли перво-
зданныя породы: подъ вліяніемъ воды, изм?няющейся температуры и
движеній воздуха породы эти сначала механически размельчались и
чрезъ это д?лались бол?? пригодными для химическихъ превращеній
Первымъ химнческимъ д?ятелемъ была, в?роятно, углекислота: она
при бол?е низкихъ температурахъ выт?сняла изъ силикатовъ
кремневую кислоту, сама образуя углекислыя соли щелочныхъ и щелочно-
земельныхъ металловъ.
2) Въ Россіи лучшимъ жаолиномъ считается Глуховскій
(Черниговской губ,), а также Херсонскій и Волынскій.
— 478 —
ровой и фаянсовой1) посуды, а нечистая глина — для
выд?лки простой глиняной посуды, кирпичей и цементовъ-
Глина, см?шанная съ водой, пластична, т.-е. ей можно
придать любую фо^му; при высушиваніи вода теряется,
и глина становится твердой, но можетъ вновь
присоединить воду и вновь стать мягкой; посл? же прокаливанія
при высокой температур? глина теряетъ способность
присоединять воду и д?латься пластичной. При раство-
реніи въ H2S04 глина даетъ A12(S04)3.
Соли окиси алюминія, образованныя слабыми
кислотами, наприм?ръ, угольной, хлорноватистой, чрезвычайно
неустойчивы: оп? легко разлагаются водой. Окись
алюминія легко образуетъ двойныя и основныя соли, что
очень характерно для нея, какъ слабаго основанія.
Ультрамаринъ въ природ? находится въ вид?
минерала lapis lazuli (лазуревый камень). Искусственно
приготовляется прокаливаніемъ см?си глины, с?рнокислаго
натрія и угля или глины, углекислаго натрія и с?ры.
Ультрамаринъ обыкновенно рассматривается, какъ соеди-
неніе натріево-алюминіева силиката съ многос?рнистыми
соединеніями натрія.
Ультрамаринъ—великол?пная синяя краска.
Реакціи на алюмингй. Алюминій открывается по осазкденію его
гидрокиси с?рнистьшъ аммоні?мъ или угл?кисдымъ баріемъ; также по
растворенію гидрата въ ?дкихъ щелочахъ, откуда онъ вновь выд?-
ля?тся при приливаніи раствора NH4C1; также характерна для него
нерастворимая основная уксуснокислая соль б?лаго цв?та.
і) Фаянсовыя изд?лія им?ютъ внутреннюю массу пористую и
лишь съ поверхности покрыты глазурью изъ л?гкоплавкихъ силика-
товъ; у фарфоро?ыхъ же изд?ліи вс? поры заполнены сплавленнымъ
силикатомъ, для чего, къ глин? и прибавляютъ полевого шпата и
кварца.
— 479 —
Металлы четвертой группы,
§ 202. Металлы четвертой группы д?лятся на две
подгруппы: къ первой принадлежать металлы четныхъ
рядовъ: титанъ Ті = 48,1; цирконій Zr = 90,6; церій
Се — 140,25; торій Th = 232,4; ко второй — металлы
нечетныхъ рядовъ: германій Ge —72,5; олово Sn= 119,0;
свинецъ РЬ = 207,10.
Металлы первой подгруппы образуютъ соединенія
преимущественно по типу R02, сл?довательно, кислотнаго
характера, сходный съ соединениями углерода и кремнія:
кислотность ихъ попрежнему убываетъ съ увеличеніемъ
атомнаго вііса, такъ что наибол?е тяжелые —церій и
торій — почти настоящіе металлы. Элементы этой
подгруппы сравнительно р?дки, а потому они и не будутъ
подлежать разсмотр?нію ]).
Элементы второй подгруппы являются переходными
между нечетно-рядными элементами 3 и 5 группъ. Они
функціонируютъ съ различнымъ количествомъ
валентности, что видно прежде всего изъ ихъ окисловъ. Вс? они
образуютъ по два окисла: высшій R02, гд? элементы
проявляюсь свою максимальную валентность, и низшій—Ж),
гд? элементы двувалентны. Высшіе окислы этихъ мбтал-
ловъ Ge02, Sn02 и РЬ02 им?ютъ кислотный характеръ,
или, что то же, являются ангидридами соотв?тствуюгцихъ
кислотъ, при чемъ кислотныя свойства ихъ съ
увеличеніемъ атомнаго в?са металловъ уменьшаются. Въ низ-
шихъ окислахъ, образованныхъ по типу 2-й группы
RO — GeO, SnO и РЬО, проявляется вполн? металличе-
скій (основной) характеръ этихъ металловъ, аналогично
*) Соединенія церія и торія служатъ для пронитыванія ткани, изъ
которой д?лаются колпачки для «Ауэровскихъ> гор?локъ: при прока-
ливаніи эти соединенія переходятъ въ окиси; въ несв?тящемся
пламени газа эти окиси сильно накаливаются и испускаютъ
интенсивный св?тъ.
— 480 —
металламъ 2-й группы, при чемъ основность по общему
закону возрастать съ увеличеніемъ атомнаго в?са; за
это же говорить и увеличеніе атомнаго объема, что видно
изъ сл?дующей таблицы.
Ат. в. Уд. в. Ат. об. Темп, плавя. Темп. кип.
Германій, Ge. . . 72,5 5,47 13,2 9000 _
Олово, Sn . . . . 119,0 7,0 16 2410 около 1.5000
Свинецъ, РЬ. . . 207,10 11,39 18 328° > 1.6000
Итакъ, упомянутые элементы съ химической точки
зр?нія должны быть названы металло-металлоидами: ни
въ томъ ни въ другомъ направлеиіи они большой энер-
гіи не проявляютъ. У свинца, конечно, преобладают/в
металлическія свойства надъ металлоидными. Наибол?е
распространены въ природ? олово и свинецъ. Германій
былъ съ точностью предсказанъ Д. И. Мендел?евымъ
въ 1870 г. и въ 1886 г. открыть Винклеромъ въ мине-
рал? аргиродит? (см. стр. 147).
Олово, Sn.
Атомный в?съ —119. Уд?льный в?съ —7,29. Темп, ллавл. = 241 *>. Въ
соединеніяхъ или четырехвалентно іш?4'дв]'.хвалентяо.
§ 203. Олово находится въ природ? въ вид? двуокиси
Sn02—оловяпиаго камня, изъ котораго, носл? выжига-
нія прим?шанныхъ с?ры и мышьяка, и получается въ
чистомъ вид? возстановленіемъ углемъ:
Sn02 + 2C — Sn+2CO.
Оловянный камень встр?чается на Зондскихъ остро-
вахъ (о. Банка), въ Корнваллис?, въ Саксоніи, въ^Фин-
ляндіи (Питкарянты).
Олово изв?стно въ двухъ изхм?неніяхъ: первое —
обыкновенное съ уд. в. 7,29, второе—с?рый
кристаллически порошокъ съ уд. в. 5,8; первое видоизм?неніе стойко
выше 20°, а второе ниже 20°.
— 481 —
Обыкновенное олово—б?лый металлъ, им?ющій
кристаллическое строеніе, тягучъ и ковокъ, легко плющится
въ тонкіе листы (оловянная фольга ,или станіоль), при
200° олово д?лается хрупкимъ. Плавится при 233°,
улетучивается между 1.450° и 1.600°, олово очень тягуче,
легко прокатывается въ листы, а при 100° вытягивается
въ проволоку. При обыкыов?нныгь условіяхъ на воздух?
олово не окисляется, почему и употребляется для луже-
нія м?ди, жел?за (вылуженное жел?зо называется оюестпью)
и для различныхъ приборовъ л). При накаливаніи на
воздух? олово сгораетъ въ Sn02. Въ соляной кислот? олово
растворяется съ выд?л?ніемъ водорода и съ образова-
ніемъ SnCl2.
Sn + 2HCy= SnCy- H2;
въ кр?пкой с?рной растворяется при кипяченіи съ вы-
д?леніемъ с?рнистаго газа; разбавленная азотная кислота
окисляетъ олово въ метаоловянную кислоту, безводная
же азотная кислота на олово не д?йствуетъ. Олово
растворяется въ горячихъ ?дкихъ щ?лочахъ, образуя оловянно-
кислыя соли и выд?ляя водородъ:
Sn -+- 2KOH -f H20 = K2Sn03 -f 2И2;
это характерное свойство олова, какъ металло-металлоида.
Олово образуетъ два окисла: SnO—закись олова и Sn02—
окись олова, или, точп??, ангидридъ оловянной кислоты.
Соединенгя закиси олова. Закись олова, SnO,
получается при прокаливаніи гидрата Sn(OH)2 въ атмосфер?
углекислаго газа, въ вид? чернаго порошка, сгорающаго
на воздух? въ окись олова Sn02; закись олова обладаетъ
слабыми основными свойствами.
і) Домашнюю металлическую (напрпм?ръ, м?дную) посуду лудятъ
т.-е. покрываютъ оловомъ для того, чтобы въ пищу не попадали
ядовитый соединения м?ди.
Жесть приготовляютъ, погружая чистые жедЪзпые листы въ
расплавленное олово.
Неорганическая химія. 31
- 48Й -
Гйдрйтъ заЫсй олова, Sn(OH)2, получается вь вид?
б?лаго осадка йри д?йетвіи амміайа или соды на растворъ
Двухлб^стаго олова:
SpCl2 + 2КН4ОН = Si (QH)2 + 2Ш4С1.
Гидрата зайй'си олова раотворимъ въ Ьдкихъ щело-
чвхь съ образованіемъ emaunamat Sn(QH)2-j-2KOH =
= Sn(OK)2 -j- 2И20; растворимъ онъ и вь кислотахъ. Эти
реакдіи указываюсь, что Sn(OH)^ одновременно обладаетъ
и основным и кислотнымъ характеромъ. На этомъ осно-
вавіи самая закись олова можетъ быть названа проме-
жуточнымъ окисломъ.
Двухлористое олово. SnCl2. 2Н20, получаемся расгво-
реніечъ олова вь боляйо? кислот?. кристаллизуется съ
двумя частицами воды. Растворъ на воздух? окисляется
и мутится, выдЬляя основную соль1): 3SnCl2 -}- Н20-(-
-j- 0 = SuCl4-f- 2Sn(Ol4)Cl. Двухлористое олово —сильный
возстановитель: изъ соединеній ртути и серебра оно вы-
,д?ляетъ металлы, напр : HgCl2 -f- SnCl2 =- Hg -f- SnCl4;
соли окиси жел?за и м?ди возстановляютсгі ею въ соли
закиси. Оно подъ названіемъ „оловянной соли"
употребляется кавд шротрара #ъ красйльномъ д?л?. Какъ
возстановитель, SnCl2 прим?няегся для полученія кассіева
.nyphypa (см. зблото).
С?рниспіое оЛо?о, SnS, выд?ляется в? вйд? *гбмнобураго
осадка іГри д-Ьйствіи сероводорода на двухлористое олово:
SnCla + H2S = SnS + 2HCl. SnS растворяется Въ с?рни-
стыхъ іцелочахъ въ присутствіи оізры, образуя сульфосол:й;
SnS; f- S-j-Na2S = Na2SnS3;
вь кислогахъ растворяется съ выд?лбніёМъ с?роводорода.
Соедипенія оловянной кислоты. Двуокись олова
(оловянный ангидридь). Sh02, всірЬчабтся въ іфирод?
*) Для ^страненія окисленія обыкновенно прибавляюсь въ кисльій
растворъ SnCJa немного металлическаго олова, Моторов и возстано-
вляетъ обратно со?диненія окиси.
— 483 —
иодъ названіемъ оловяннаго камня; искусственно
получается въ вид? б?лаго аморфнаго порошка прокалйва-
піемъ оловянной кислоты. Въ кислотахъ Sn02 ие
растворяется. При сплавленіи съ ?дкими щелочами образуегъ
соли оловянной кислоты.
Оловянная кислота существуем въ двухъ видо-
изм?неніяхъ:
1) Обыкновенная оловянная кислоша, H2Sn031
получается въ вид? б?лаго аморфнаго осадка при д?йствіи
амміака на растворъ хлорнаго олова:
SnCl4 + 4NH4OH = SnO(OH)2 + 4NH4C1 -f H20.
Растворяется въ кислотахъ и ?дкихъ щелочахъ; въ
посл?днемъ случа? образуетъ растворимыя соли
оловянной кислоты, наприм?ръ, Na2Sn03.
2) Метаоловянная кислота получается въ вид?
бЬлаго порошка при нагр?ваніи олова съ азотного
кислотою:
Sn + 4HN03 = H2Sn03 + 4N02 -f H20;
нерастворима въ кислотахъ и труднорастворима въ
щелочахъ. Метаоловянную кислоту считаютъ гидратомъ
полимера окиси олова (Sn02)5.
Хлорное олово, SnCl4, получается при пропусканіи
хлора чрезъ двухлористое олово или при нрямомъ
соединении олова съ хлоромъ. Безводное хлорное олово
представляетъ бездв?тную густую жидкость, сильно
дымящую на воздух?, кипящую при 114°. При д?иствіи
воды SnCl4 реагируетъ, какъ хлорангидридъ, т.-е.
распадается на хлористый водородъ и на гидратъ окиси олова
Sn(OH)4, который легко выд?ляетъ одну молекулу Н20
и переходитъ въ оловянную кислоту -н SnCl4 -j- 4Н2 О =
= 4HCl + Sn(OH)4; Sn(OH)4 — H20 = H2Sn03. Если воды
мало, то SnCl4 переходитъ въ полутвердую
кристаллическую массу состава SnCl4 . ЗН20, такъ называемое
оловянное масло.
31
— 484 —
Двус?рнистое олово, SnS2, получается прокалива-
ніемъ см?си оловянныхъ оиилокъ, с?ры и нашатыря въ
вид? блестящихъ желтыхъ чешуекъ, такъ называемаго
муссивнаго или сусальнаго золота 5). Оно получается
въ вид? желтаго осадка также при пропусканы с?рово-
дорода чрезъ раствора хлорнаго олова; растворяясь въ
щелочахъ, образуетъ сульфосоли, изъ которыхъ вновь
выд?ляется кислотами:
Na3SnS3 4- 2НС1 = SnS2 + H2S -f 2NaCl.
Олово им?етъ широкое прим?неніе въ сплавахъ:
припай состоитъ изъ олова (1 ч.) и свинца (1 ч.); бри-
танскгй мегпаллъ— изъ олова и сурьмы, бронза — изъ
олова и м?ди. Оловянная амальгама служить для наве-
денія зеркалъ.
Реащья на олово. Для олова характерно выладеніе въ кисломъ
раствор? отъ д?йствія H2S желтаго осадка SnS2, растворимаго въ
(NH4)2S съ образованіемъ сульфосоли (NH4)2SnS3.
Свинецъ, РЬ.
Атомный в?съ = 207,10. Уд?льный в?съ = 11,39. Темп, пдавд. = 326°.
Въ соединеніяхъ четыревалентснъ и двувалентенъ.
§ 204. Свинецъ находится въ природ? въ вид?
свинцоваго блеска, PbS.
Эта руда встр?чается въ Россіи — на Алта?, въ
Забайкальской области, въ С. Америк?, Испаши,
Германии и др.
Въ металличесвомъ вид б свинецъ получается или
накаливаніомъ свинцоваго блеска съ жел?зомъ, при чемъ
с?ра переходитъ къ даел?зу:
PbS + Fe = FeS + Pb;
і) Благодаря способности распределяться очень тонкимъ слоемъ
на поверхности т?лъ, сусальное золото употребляется для подд?ль-
ной позолоты дерева, гипса, картона и др. SnS2 укр?пляютъ на
поверхности предмета б?дкомъ и покрываютъ лакомъ. Въ посл?дне?
время сусальное золото за-м?ияютъ бронзозымъ порошкоыъ
(измельченная бронза).
— 485 -
или обжиганіемъ руды на воздух?, при чемъ с?ра
удаляется въ вид? с?рнистаго ангидрида. При этомъ обжи-
ганіе не доводятъ до конца, а останавливаются на
образованы окиси свинца и с?рнокислаго свинца, которые
при накаливаніи безъ доступа воздуха реагируютъ съ
неизм?нившимся с?рнистымъ свинцомъ по уравненіямъ:
PbS-|-2PbO = 3Pb-|-S02.
PbS + PbS04 = 2Pb -|- 2S02.
Свинецъ—синеватос?рый, мягкій и тягучій металлъ,
плавится при 326°; на св?ж?мъ разр?з? блеститъ, но
скоро тускн?етъ: это объясняется окисленіемъ свинца и
одновременнымъ переходомъ образовавшейся окиси въ
основную углекислую соль, подъ вліяніемъ С02 и Н20
воздуха. Въ соляной и с?рной кислотахъ почти не
растворяется, такъ какъ образующееся съ поверхности РЬСі
и PbS04, какъ нерастворимые въ вод?, облекаютъ въ
вид? пленки остальную массу свинца и ле даютъ
происходить дальн?йшей реакціи; въ азотной же кислот?
растворяется легко; такъ же хорошо растворяется
свинецъ въ уксусной кислот?. Совершенно чистая вода д?й-
ствуетъ на свинецъ: д?йствуетъ на него собственно кисло-
родъ воздуха въ присутствіи воды, давая окись свинца,
Съ водою, переходящую въ и?сколько растворимый ги-
дратъ окиси свинца; обыкновенная же природная вода,
содержащая въ себ? соли с?рной кислоты, отчасти
соляной кислоты и углекислый газъ, д?йствуетъ на свинецъ
иначе: при д?йствіи указанныхъ веществъ свинецъ съ
поверхности переходитъ въ соли, которыя, какъ
нерастворимый въ вод?, покрываютъ свинецъ плотнымъ сло-
емъ и т?мъ предохраняютъ его отъ дальн?йшаго изм?-
ненія. Изъ растворовъ свинецъ выд?ляется многими
металлами, нанрим?ръ, цинкомъ (Сатурново дерево). Вс?
соединенія свинца ядовиты.
Свинецъ образуетъ сл?дующіе главн?йшіе окислы:
окись РЬО (глетъ и массикотъ) и перекись РЬ02; сурикъ
— 486 —
Pb304 разсматриваютъ, какъ см?шанный окиселъ—окиси
съ перекисью 2РЬО-(-РЬ02.
Окись свинца, или глеть, РЬО, получается обжи-
ганіемъ свинца на воздух? въ вид? красновато-желтой
массы. Обладаете основными (и вь слабой степени
кислотными) свойствами, во влажномъ воздухЬ, притягивая
углекислоту, переходите въ углекислую соль. При бол?е
энергичномъ нагр?ваніи получается окись свинца желтаго
цв?та, называемаго массикотпомъ. Сь льнянымь масломъ.
окись свинца даетъ олифу. Соли окиси свинца въ н?-
которой степени гидролизуются водою, но меньше ч?мъ
соли олова.
Гидратъ описи свинца, РЬ(ОН)2, осаждается въ видЬ
б?лаго объемистаго осадка изъ растворовъ свинцовыхъ
солей: Pb(N03)2 + 2NaOH = Pb(OH)2-f 2NaN03; растворимъ
въ избытк? ?дкихъ щелочей, немного растворимъ въ вод?.
Сурцкъ, РЬ304, получается накаливаніемъ окиси
свинца (массикота) до 300°; при бол?е высокихъ темпе-
ратурахъ сурикъ разлагается на окись свинца (РЬО) и
кислородъ; 2РЬ304 — 6РЬО -f 02. Сурикъ—ярко-красный
порошокъ; при см?щеніи съ масломъ употребляется какъ
краевая краска, которая применяется спеціально для
жел?зныхъ иредметовъ. При д?йствіи HN03 даетъ
РЬ(Ж)3)2 и свободную РЬ02:
Pb304 + 4HN03 = 2Pb(N03)2 -j РЬ02 + 2Н20,
что и указываете на сурикъ, какъ на см?шанный
окиселъ: Pb09 + 2PbO = Pbs04.
Перекись дёинца, РЬ02 (аягидридъ свинцовой
кислоты), какъ сказано выше, получается при д?йствіи
азотной кислоты на сурикъ въ вид? черно-бураго порошка,
нерастворимаго въ азотной кислотЬ.
При ііагр?ваніи съ сЬрной кислотой перекись свинца
выд?ляетъ кислородъ:
¦ PlbOj-f H2SQft = PbS04 + HaO + 0.
. — ,487 — '
Перекись, свинца ,¦ широко.;, прдм?даетед. къ .дцяеств?
ОКИОЛИТ?ЛЯ;..--.:-.. ¦/,[( -¦' t :¦;.-:;.!¦ о і іллч v. \\ к ; г- ¦¦! !¦¦-¦ = і.і і;і.:і ;¦ г-,ч
: Подобнои;йиО$#.; перекись - с»дадаі::обладает^.,.і хо;т# $
очень; слабыми,,! кислотными ¦ свойс^т-вами: ..при - :нагр?ваніц
съ КОН.образуетъ соль ;К'8РЪ%'::^C*W <евдащава#/--дисг
Л?Та /H^PbQgi Неизвестна. л /¦;< Л"Л; ¦•>¦>¦¦¦>/ л , '1;! / ¦¦¦W;>;•¦,> ..;*•
'. * Въ сврихъ еоляхъ ^винещъі двувалентен^, ;r;;\vr,; 1^-
/ Хлористый свинецъ, РЬС12, получается въ<вид? б?-
лаго осадка д?йсшемъ соляной; -кислоде:, -на растворимы я
соли ; свинца;' въ холодной/ вод?: :немного. рартворяетс^
въ горячей лже, растворяется усволйа: лл у-л,;і >>u^л/
іодистый свипецъ, TbJp, п'Олучаібтъ ' д?и'ствіемі' 'КЗ
-; Л' (.¦i'j.: .'л ,!'; .л ;і"-г/:!'і'.-'Т "¦'¦ >¦ ¦''<:¦'' л' ,¦ " "!-л>Л' л'і .:"Л'>м
на растворимую соль свинка: ; ,.
;':?;' ¦¦ : , ' У ¦¦ .'¦' ¦¦' ,' '¦ 'і . ¦¦ ' ¦•' I' }.У-'-'і ¦'¦ : !! ¦'''(¦" :'¦¦¦"¦'<¦¦ ; ¦ ' : ,'j ; >' Л ( 'г ¦ 'У
РЬ(Ш3)2+2Ю=РЫН-2К^Оз; ,;¦¦,-.,;:¦!.,,,,;.: .
прбдс^авііяе^ъ • вейфс^йЬ1' йсёлтйго цв?ти, нерастворимое въ
яШЬДнФй; йіэ'' :раств'ОряЮі3316бСйів'ь:Горячей вод?^ из^-ТО1
рячаго раствора выпадаетъ въ вид? блес^Щйхі^&еятъіх?
чёнгуейй;1 изЪ'ра'сть-бра въ 'сгаб'Ой іуіШусвой;'КГС:іОт?!вы-
падкёті въ йрй'край'ййхъ1 Ш*шетыхъ; №&№к&ж -и-'ч
' ! ОгьрноШсяыЯ 'Свййёщ, РЬ$04, йш?сіеШ ]поХь-^'яа,-'
званіемй'-сШпЩОвШб' ку'пдроЩ 'вШ&даетъ-^Ш^йд?-^?-^
лаго кристаллическаго, нерастворимаго въ ?ЬЙ?у!Ьб&дЁа
йрй; д?йствій'б?рнОі ййсло№:;йа!Ч(іолй!іс'вйнца'.; В?'-.'кон-
гіёнТрироМіШй fH^S04!1 ;:нёМя6гограст?Морййъ,-!'Wtiu[fflto№
раствора онъ вьііВДаё?'Б Йрй ^йвёйешЙ!,ЙВдЬйі'"
Углекислый свинецъ, РЬС03, встр?чается въ природ?
въ вид? б?л'діі- * Ьішш0#<М рудъі) ¦При''j 'д&йствіи угле-
кислыхъ щелочей на растворимыя соли свинца выпадаетъ
оЫдМаА >?(#гі*ёШ*^Ав^!' ^
з^а унотребля^т&я йаійъР-гірЗДйа^А^тЭДіШ
оМйчаёШтев^^
йСгб?г;;ё# 'п'олу'чеяія іэсйЬвййй:"М;Д?'йсі?і^уг!а?екйсл1йі^!*г&1(й
йам:06й6ййую^:;'уйсуйЁОЙйййуй-.1- с(ШіУісеійнЬЭД !:!tf о лу чаевую
раствЬреіп^йъ'і:^Ж^'а-:вЪ': уЁсусн'ай/*йисЙЬ??1
- 488 —
По голландскому способу сворпутые свинцовые листы
вставляются въ глиняные горшки съ уксусной кислотой,
и посл?дніе пом?щатотся на продолжительное время въ
гніющій на^озъ. Подъ вліяніемъ уксусной кислоты и
воздуха свйецъ превращается при этомъ мало-по-малу
въ основную уксусносвинцовую соль, которая съ
угольной кислотой, медленно выд?ляемой навозомъ, и обра-
зуетъ б?лила.
По и?мецкому способу въ камеры со свинцовыми
листами проводятъ пары уксусной кислоты съ воздухомъ
и углекислымъ газомъ, лолучаемымъ сжиганіемъ угля.
По французскому способу растворяютъ глетъ въ
уксусной кислот?, сливаютъ отстоенный растворъ съ
нерастворившихся частей и пропускаютъ въ пего
углекислый газъ, получаемый прокаливаніемъ м?ла; б?лила
выпадаготъ въ осадокъ.
По англійскому способу углекислый газъ проводятъ
чрезъ слой глета, смоченнаго растворомъ уксусиокислаго
свинца (катализъ).
Свинцовыя б?лила скоро черн?ютъ отъ с?роводо-
рода—этого обычнаго спутника всего живого (РЬС03 -\~
-}- H2S = PbS -)- Н20 -f- С02), всл?дстві? чего ихъ не-
р?дко зам?няютъ цинковыми (ZnO) или баріевыми б?ли-
лами (BaS04).
Для оживленія почерн?вшихъ свинцовыхъ б?лилъ
прим?няютъ д?йствіе перекиси водорода, при чемъ
образуется безцв?тный с?рнокислый свинецъ:
PbS + 4Н202 == PbS04 + 4Н20.
Уксуснокжлыйсвинецъ^вшяцовыЁ са,ха>фъ),РЬ(С2Нъ02)2-
.ЗН20, получается при раствореніи окиси свинца въ
уксусной кислот?. Эта соль широко прим?няется въ кра-
сильномъ д?л? (для приготовл?нія уксусноалюмииіевой
соли—протрава), а также для приготовленія свинцовыхъ
б?лилъ и хромовой желти. Въ уксуснокисломъ свинц?
— 489 —
хорошо растворяется окись свинца, при этомъ образуются
огповныя свинцовыя соли, изв?стныя подъ общимъ на-
звані?мъ свинцоваго уксуса (напр., Pb(C2H302)2 .Pb(OH)2).
С?рнисшый свинецъ, PbS, образуетъ въ природ?
свинцовый блескъ; искусственно получается д?йстві?мъ
с?роводорода на соли свинца въ вид? чернаго осадка,
нерастворимаго въ слабыхъ кислотахъ.
Еще важна соль хромовой кислоты—РЬСг04;
получается при д?йствіи К2Сг04 на растворимыя соли свинца
въ вид? желтаго осадка; прим?няется подъ названіемъ
„хромовой желти" (или желтаго крона) въ качеств?
желтой краски, РЬСг04 прим?няется и какъ хорошій
окислитель./
Важн?йшіе сплавы, въ которые входятъ свинецъ —
припой (РЬ -|- Sn), шгтографскій металлъ, изъ котораго
д?лается шрифтъ (РЬ -|- Sb); свинецъ въ см?шеніи съ
другими металлами служить также для отливки пуль и
дроби (РЬ (-0,02— 0,35% As).
Реащъи свинца. Для открытія свинца важны б?лые осадки PbS04
и РЬС12, получаемые при д?йствіи H2SOi и НС1, и черный осадокъ
PbS—при д?йствіи H2S. Особенно характеренъ іодистыЙ свинецъ
PbJ2, получаемый при д?йствіи KJ и изъ горячаго раствора кристал-
лизующійся въ вид? прекрасныхъ золотистаго цв?та чешуекъ.
Металлы пятой группы.
§ 205. Высшіе члены этой группы — азотъ и фос-
форъ—уже настоящіе металлоиды. Сл?дующіе за ними
мышьякь и сурьма — элементы переходнаго характера,
при чемъ низшій окиселъ сурьмы Sb203 проявляётъ
металлическія свойства (см. стр. 356). Наконецъ самый
тяжелый элеменгъ этой группы—оисмутъ Ві— 208,0—-
обладаетъ уже ясно выраженными металлическими
свойствами. Правда, какъ элементъ 5-й группы, висмутъ
образуетъ высшій окиселъ по типу этой группы (Е205), то-
есть Ві205, который является очень слабымъ кислотнымъ
— 490 —
окисломв. Но въ вид? пятивалентного элемента висмуть
только и фигурируете въ удомянутомъ окисл?; да и
самъ окиселъ, подобно лерекцсямъ, легко зыд?ляетъ два
атома кислорода и переходить въ низшій одиселъ Ві203,
гд? висмутъ трехвалентен^. Наибол?е изученные соеди-
ненія и отв?чаютъ этому окислу, то-есть трехвалентному
висмуту. Въ окисль1 Ві2Ов висмутъ является слабометал^
лическимъ эл^ментомъ, дающимъ слабое осцованіе, близко
напоминающее основания 3-й группы. Вообще въ этой
грудц? триокиси и гидрокиси слабр основны, и яхъ
.соли легко гидролизуются.
Другая подгруппа этой группы оодержитъ р?дкіе
элементы: ванадій Ud=s51,0, ніобій Nb = 93,5, празеодимъ
Рг= 140,6 и танталь Та =181,5,
Висмутъ, Ві.
Атомный вісъ = 208,0. Уд вісъ — 9,80. Темпер, плавл. =± 270*>. Въ
соединеншхъ преимущестренно трехвалентенъ, р?дко пятивалеятенъ.
§ 206. Висмутъ встр?частся въ природ? въ самород-
номъ сосгояніи, а также и въ вид? висмутовой охры,
Ві203, и тсмутовто- блеска, Bi2S3. Изъ этихъ рудъ
висмутъ получается прокаливаніемъ съ углемъ, жел?зомъ
и плавнемъ въ болыдихъ тцгляхъ. »
Металлическій висмутъ представляетъ красновато-бЬ-
лый ^еталлъ уд?льнаго в?са 9,80. Онъ—кристаілическаго
сложенія, очень хрупокъ, плавится при 270° ц
возгоняется при б?док^лилыюмъ жарі>. Црд затверд?ванш
расплавленный висмутъ расширяется; кристаллизуемся вь
гексагональныхь ромбоэдоахъ, аналогично мышьяку и
судьм?, Л^чшій растворитель для висмута—др?пка^г
азотная кислота На воздухt видмутъ де окцодется; дцшь
прц наваливаиіи переходить въ Ві2Оа, Висмутъ
непосредственно соединяется съ іалордами; растворяется только
вь гшгной кислогЬ.
— 491 —
Окись висмута, Ві203 ]), образуется при сгораніи
висмута и при прокаливаніи азотновисмутовоіі соли;
Ві203—желтоватый порошокъ ^д?льнаго в?са 8,2,
нерастворимый въ вод? и ?дкихъ щелочахъ, а растворяющійся
лишь вь кислотахъ. Очень слабое осиованіе; соли его
очень легко подвергаются гидролизу и образуюсь основ-
иыя соли, трудно растворимый въ вод?.
Гыдратъ окиси висмута^ Ві(ОН)3, получается въ
вид? б?лой аморфной массы при д?йствіи ?дкигъ
щелочей на растворимыя соли висмута:
Bi(N03)3 -f ЗКаОН = Bi(OH)3 -f 3NaN03.
Химическій характеръ Ві(ОН)3 исключительно основной.
Соли висмута отв?чаіотъ окиси висмута Ві>03, то-
есть висмутъ въ нихъ трехвалентенъ. Онъ обладаеть
большею склонностью давать основныя соли при д?йствіи
воды, наприм?ръ, хлористый висмутъ, ВіС13 — б?лая
кристаллическая масс?а, получаемая при' раствореніи Ві
въ царской водк?, избыткомъ воды разлагается съ выд?-
леніемъ б?лаго осадка—хлорокиси висмута:
ВіС13 + Н20 = ВіОСі + 2НС1 2).
Азотповисмутовая соль, Bi(N03)3, получается при
раствореніи висмута въ азотной кислот?. Избыткомъ воды
разлагается съ выд?леніемъ основныхъ солей, наприм?ръ,
(N03)2Bi(OH) и N03Bi(OH)2; посл?днія соли прим?няются
въ медицин? подъ назвапіемъ Magisterium Bismathi, a
также въ качеств? туалетныхъ б?лилъ.
С?рнистьш висмутъ, Bi2S3, встр?чается, как,ъ
сказано выше, въ природв въ вид? висмутоваго блеска, а
і) Высшш окисел!. Ві205 —оранжевый порошокъ; ему отвЬчаегй
висмутовая кислота НВ1О3 Изв?стны также окислы ВіО и ВЮ2.
2) Эта реакція обратима: избытокъ HCI вновь растворйеть ВіОСГ;
переводя ее въ ВіС13.
— 492 —
также получается въ вид? чернаго порошка при д?й-
ствіи с?роводорода на растворы солей висмута:
2Bi(N03)3 + 3H2S = Bi2S3 + 6HN03.
Сплавы'висмута отличаются низкой точкой плавле-
нія: наприм?ръ, сплавъ Вуда (4 ч. висмута, 2 ч. свинца,
1 ч. олова и 1 ч. кадмія) плавится при 75°, сплавъ
Розе (2 ч. Ві, 1 ч. РЬ, 1 ч. Sn) плавится при 60,5°,
сплавъ Ньютона (8 ч. Ві, 5 ч. РЬ3 3 ч Sn) плавится
при 94,5°. Такіе сплавы прим?няются въ качеств? про-
бокъ въ предохранительныхъ клапанахъ — въ паровыхъ
котлахъ, вь водопроводныхъ трубахъ и т. д.
Реакціи на висмугпъ. Характерными реакдіями являются: разло-
ж?ні? водою солей висмута и возстановлепіе ихъ щеючнымъ рас-
творомъ SnC]2, при чемъ выд?ляется черный осадокъ металлическаго
висмута.
Металлы шестой группы.
§ 207. Элементы нечетныхъ рядовъ шестой группы и
кислородъ электроотрицательны съ ясно выраженными
металлоидными свойствами; элементы же четныхъ рядовъ
им?ютъ и металлическія свойства, сохраняя металлоид-
пость лишь въ высшихъ степеняхъ окисленія. Къ четяо-
ряднымъ элементамъ 6-й группы принадлежать: хромъ
Сг = 52,0, молибденъ Мо=96,0, вольфрамъ W= 184,0
и уранъ Ur = 238,5. Въ высшихъ своихъ окислахъ они,
подобно с?р?, шестивалентны. Окислы эти Сг03, Мо03,
W03, UrOa, соединяясь съ водой, образуютъ кислоты:
Н2Сг04, Н2Мо04, H2W04 и Н2ТМ)4, соли которыхъ
изоморфны съ соотв?тствующими солями с?рной кислоты.
Кром? высшихъ кислотныхъ окисловъ, металлы шестой
группы образуютъ низшіе окислы формулы Е02, гд? они
четырехвалентны.
Для %хрома, кром? Сг03, существуютъ еще окислы
Сг203 и СгО. Въ первомъ, называемомъ окисью хрома,
— 493 —
онъ трехвалентенъ и аналогиченъ алюминію — элементу
IJ-й группы, а во второмъ (закись хрома)— двухвалентенъ;
СгО и его соли легко окисляются, переходя въ окисныя
со?динепія: окисленіе совершается такъ быстро, что очень
трудно готовить соединенія закиси хрома въ чистомъ
вид?:
Сг
Мо
W
Ur
Ат. в?съ.
'52,0
96,0
184,0
238,5
Уд.
в?съ.
6,7
8,6
16,6
18,7
Ат. объемъ.
7,7
11,0
11,09
12,8
Темп, пдавл.
ок. 1505°
ок. 2000°
ок. 2600°
ок. 2400°
X р о м ъ, Сг.
Атомный в?съ = 52. Уд. в?съ — 6,7. Темп, плавл. около 15050. Въ
соединеніяхъ преимущественно шестивалент?нъ и тр?хвалент?нъ.
§ 208. Хромъ встр?чается въ природ? въ вид? хро-
мистаю оісел?зняка, Fe(Cr02)2, изъ котораго получаются
почти вс? соединенія хрома. Руда эта находится въ боль-
шомъ количеств!; на Урал?. Ее тщательно измельчаютъ
и прокаливаютъ съ щелочами, при чемъ образуются соли
хромовой кислоты, которыя зат?мъ извлекаются водой,
Въ свободномъ состояніи хромъ получается возстановле-
ніемъ окиси хрома алюминіемъ (по Гольдшмиту); онъ
представляетъ собою очень твердый кристаллическій ме-
таллъ съ Чзеребристымъ металлическимъ блескомъ; на
воздух? окисляется лишь при накаливаніи, въ кислород?
горитъ; растворяется въ разведенныхъ соляной и с?рной
кислотахъ съ выд?леніемъ водорода; отъ азотной
кислоты не изм?няется. Въ чистомъ вид? хромъ прим?-
няется пока только какъ прим?сь къ стали, которой онъ
придаетъ твердость.
Соединенія окиси хрома. Окись хрома, Сг203,
получается въ вид? темно-зеленаго порошка при накаливаніи
гидрата окиси хрома: 2Сг(ОН)3 == Сг203-(- 2Н20; сильно
накаленная С^03 нерастворима ни въ кислотахъ ни въ
— 494 —
щелочахъ; она даетъ соединенія съ окислами н?кото-
рыхъ металлов^"; Сг203. 2Н20 обладаетъ ярко-зеленымъ
цв?томъ.
Гидрапгь описи хрома, 0г(ОН)3, получается въ вид?
студенистаго с?раго осадка ари д?йствіи ?дкихъ щелочей
и амміака на растворы солей окиси хрома; въ избытк?
?дкихъ щелочей, подобно гидрату алюминія, растворяется
съ образованіемъ хромата; при раствореніи въ кислотахъ
образуетъ соотв?гствующія соли. Сл?довательно, Сг(ОН)3
при своей основности (слабой) обладаетъ и
слабокислотными свойствами. Сг203—очень слабый основной окиселъ:
онъ можетъ образовать прочныя соли лишь съ сильными
кислотами; соли, образованные слабыми кислотами, легко
разлагаются водой.
Хлорный хромъ, СгС13, получается въ вид? фіолето-
выхъ пластинокъ при накаливаніи окиси хрома съ углемъ
въ стру? сухого хлора (ср. А1С13 на стр. 476). Изъ вод-
наго раствора кристаллизуется водный хлорный хромъ въ
вид? зеленыхъ расплывающихся на воздух? кристалловъ.
С?рнопыслый хромъ, Cr2(S04)3, получается растворе-
ніемъ гидрата окиси хрома въ с?рной кислот?. Съ с?р-
нокислыми солями щ?лочныхъ металловъ онъ образуетъ
хромовые квасцы (ср. алюминіевы квасцы на стр. 476).
Хромовокаліевы квасцы^ Cr2(S04)3 . K2S04 . 24Н20
или KCr(S04)2.12Н20> получаются пропусканіемъ с?рни-
стаго газа въ растворъ двухррмокаліевой -сиййРсъ с?рной
кислотой:
К2СЮ7 + 3S02 4- H2S04 = Cra(SOJa. K2S04 + Н20.
Вс? соли окиси хрома изв?стны въ двухъ видоизмб-
неніяхъ: растворяясь wi ЪоД?, он? даютъ или фіолето-
вые или зеленые рас$вфы. Изъ с^еглетовь^хъ р-абтворовъ
соли вщ?ляш;(?$.-въ вид?-крийалловъ, изъ зеленыхъ же
при идпа/еніи 'вь/падаютъ въ вид? аморфной массы.
При нагр?ваніи фіолетовый растворъ переходить въ
зеленый. Зеленый растворъ при стояніи вновь перехо-
— 495 —
дптъ въ фіолетовый. Явленіе перем?ны цв?товъ въ со-
ляхъ окиси хрома остается невыясн?ннымъ; правда, сб
точки зр?нія электролитической диссоціацік стараются
объяснить это явленіе, предполагая различную іопизацію
для различныхъ по дв?ту модификацій.
Окись хрома съ слабыми кислотами—угольной, с?р-
нистой—и съ с?рнистымъ водородомъ въ прцсутствіж
воды солей не образуетъ, такъ какъ соли эти всл?дствіе
своей непрочности въ моментъ образованія разлагаются
водой (полный гядролизъ). Вообще хромъ въ окисл?
Сг203 ж его производныхъ вполн? воспроизводитъ
свойства окиси алкшинія и его производныхъ.'
Соединенія хромовой кислоты. Высшій окиселъ
хрома — хромовый ангидршдъ, Сг03, им?етъ кислотныя
свойства. Кислоты, отв?чающей этому окислу, въ сво-
бодномъ вид? не получено, такъ какъ она, подобно
угольной кислот?, очень легко распадается на ангидридъ и
воду; но изъ многочисленныхъ солей ея видно,, что
кислота эта по составу й свойств&йъ аналогична с?рпой
кислоі?: она двуосновиа и им?етъ формулу Н2Сг04 2).
Хромовыя соли, присоединяя хромовый ангидридъ, обра-
зуютъ поли&ромовыя соли, отв?чающія полихромйвымъ
кислотамъ, наприм?ръ, хромокаліева соль, К2Сг04,
присоединяя хромовый ангидридъ Сг03, перех(?дитъ вь дву-
хромовокаліеву соль, К2Сг207.
Хромовый ангидрцдъ, Сг03, получается въ вид?
красныхъ кристалловъ при д?йствіи кр?пкой с?рной
кислоты на концентрированный растворъ двухромовокислаго
кали:
K2Cr207 + H2S04=2Cr03 + K2S04 + H20.
г) Анйідогія Н2СгОа съ E^SOj, дродолжается' и въ производныхъ
подобно, напр., S02C12, существуешь Сг02С12 (Сг02/ ttq, Сг02/ «, I—
красная жидкость, кипящая при 118°; получается при нагр?ваніи
см?си: K2Gr207-4-2NaC14-H2S04* Водою Cr02CJ2» подобно вс?ыъ хлор-
ангидридамъ, разлагается по уравнению: Cr02CI*j -*!- 2НаО == 2IIC1 -|-
+Н2СЮ4.
— 496 —
Хромовый ангидридъ д?йствуетъ, какъ сильный
окислитель: органическія вещества разрушаются имъ; при
д?йствіи с?рной кислоты онъ разлагается съ выд?леніемъ
кислорода и образованіемъ соли окиси хрома. При на-
гр?ваніи съ соляной кислотой выд?ляетъ хлоръ; с?рово-
дородомъ и с?рнистьшъ газомъ возстаиовляется въ окись
хрома, при нагр?ваніи разлагается на окись хрома и кис-
лородъ г).
Двухромовопапьріева соль, Na2Cr207, получается при
сплавленіи хромистаго жел?зняка съ содой и известью:
представляетъ собою красное кристаллическое вещество,
служить исходнымъ маторіаломъ для получения другихъ
хромовокислыхъ солей.
Хромовокислый калій, К2Сг04, представляетъ собою
желтое кристаллическое вещество, получается прилива-
ніемъ ?дкаго кали къ двухромовокислому калію до т&хъ
поръ, пока красный растворъ не перейдетъ въ желтый:
K2Cr,07-f 2КОН = 2К2СЮ4 + Н20.
Двухромовокислый калій, К2Сг207 (хромпикъ),
получается изъ двухромовокислаго натра путемъ двойного
обм?на съ хлористымъ каліемъ:
Na2Cr207 -f 2KC1 == K2Cr207 -f- 2NaCI.
Изъ раствора онъ выд?ляется вь вид? красныхъ кри-
сталловъ.
Реакціей К2Сг207 съ H2S04 пользуются въ лаборато-
ріяхъ при процессахъ окисленія:
K2Cr207 + 4H2S04 = Cr2(S04)3K2SO4 [или: 2KCr(S04)2] +
-f 4H20-f 30.
4) При д?йствіи Н202 на СгОз получается надхромовьш
ангидридъ, в?роятно, им?ющій формулу Сг207, аналогично надс?рному
ангидриду (см. стр. 377), образующій надхромовую каслопьу, Н2Сг308.
- 497 —
При д?йствіи па К2Сг207 концентрированной соляной
кислоты выд?ляется хлоръ:
К2Сг207 + 14НС1 = 2КС1 + 2СгС18 + 7Н20 + ЗС12.
Хромовокислые барій, стронцій и свинедъ нераство"
римы въ вод? а). Вс? соли хромовой кислоты ядовиты.
Вь т?хник? им?етъ широкое прим?неніе средняя
свинцовая соль хромовой кислоты—РЬСг04 (желтый кронъ) и
основная соль РЬСг04. РЬО (красный кропъ); Сг03 при-
м?няется въ гальваническихъ элем?нтахъ и какъ
окислитель; Сг203 употребляется или безводной для окраши-
ванія стеколъ и фарфора, или водной Сг03. 2Н20 подъ
им?н?мъ Гюйнешовой зелени въ качеств? зеленой краски
для обоевъ и для ситцевъ. Самый хромъ прим?няется
въ качеств? прим?си (ок. 3°/0) къ стали: посл?дией хромъ
придаетъ высокую степень твердости.
Рсакціи на хромъ. Хромъ открывается въ вид? сод?й тяж?лыхъ
металловъ хромовой кислоты, характеризующихся своимъ желтымъ
цв?томъ и нерастворимостью въ вод?, напр., PbCrOj. Bclv соедине-
нія хрома даготъ съ бурою зеленое вещество—боратъ хрома.
Седьмая группа.
Марганецъ, Мв.
Атомный в?съ=54,93. Уд. в?съ = 7,5. Темп, пдавл. — 1,245°. Въ со-
единеніяхъ чаще всего двувалентонъ и семивалентенъ.
§ 209. Седьмая группа періодической системы
заключаешь въ с?б'із наиболее энергичные металлоиды, — это
галоиды (F, С1, Вг и J). Въ эту же группу попалъ одішъ
эломентъ, стоящій въ четномъ ряду между хромомъ
*) Хромовая кислота и ея соли сильно разъЬдаютъ кожу и
вызывают^ бол?зненше нарывы, а потому при работахъ съ
хромовокислыми соединениями слЬдуетъ соблюдать осторожность. При толче-
ніи двухромовокислыхъ солей н? сл?дуетъ вдыхать пыли: лучше всего
толченіе производить въ закрытомъ сосуд?.
Неорганическая хлмія. о2
— 498 —
(6-я группа) и жел?зомъ (8-я группа), который къ
галоидамъ не относится и который разсматривается
обыкновенно среди металловъ; ото элемонтъ
маргапецъ Мп.
Поло^еніе марганца въ 7-й групп? вполн? аналогично
положенно хрома въ 6-й групп?.
Марган?цъ по своей высшей валентности таковъ же,
какъ и галоиды, а именно, въ своемъ высшемъ окисл? онъ,
подобно галоидамъ, семивалентенъ: его окиселъ—Мп207,
т.-е. образованъ по типу 7-й группы — R2Or Въ этомъ-
окисл? (наз. марганцовый ангидридъ) марганедъ, подобно
галоидамъ, металлоиденъ: окиселъ Мп207, соединяясь съ
водой, даетъ марганцовую кислоту, НМп04(Мп207 ¦*-(-
-|-Н20 = 2НМп04), вполн? аналогичную хлорной кислот?
ИСЮ4; об? эти кислоты одноосновны, об? .растворимы
въ вод?, об? летучи, об? сильно окисляютъ; сходны и
кристаллическія формы солей этихъ кислотъ. Итакъ, въ
окисл? Мп207 маргапецъ является металлоидомъ 7-й
группы.
Но у марганца, подобно вс?мъ другимъ высоковалеит-
нымъ элементамъ, есть тенденція образовать и другія
производный, въ которыхъ опъ яроявляетъ не всю свою
валентность, а только часть ея. Съ этииъ явленіемъ
приходится встречаться, начиная съ 4-й группы (если но
считать единственная металла 2-й группы—ртути: HgO
и Hg20), и зам?чательно, что ч?мъ выше максимальная
валентность элемента, т?мъ больше разнообразія онъ
нроявляетъ въ своихъ окислахъ, т.-е. въ своей
валентности.
Маргапецъ, стоя сейчасъ же за хромомъ, въ
проявлении низшей валентности какъ бы подражаетъ ему. И въ
самомъ д?л?, подобно Сг03, маргапецъ им?етъ
производный отъ окисла Мп03, наз. марганцовистымъ ангидргь-
домъ: существуетъ этому окислу отвечающая двуосновная
кислота марганцовистая, H2MnOlt(MaO3-j-H20=^=H2MnO4),
аналогичная хромовой кислот? П2Сг04 (конечно, и с?р-
— 499 —
ной: S03 -f-H20 = H2S04). Сл?довательно, n въ этомъ
окисл? маргац?цъ им?етъ металлоидный характеръ.
Подобно зке хрому, марганецъ образуетъ окиселъ по
типу 3-й группы R203—окиселъ Мп203, окись маргшща—
но свойствамъ аналогичный Сг203 (а конечно, и А1203).
]3ъ этомъ окисл? марганецъ, сл?дователыю, трехвалеіг-
тенъ и, какъ само собой понятно, является осповиымъ
(металлическимъ) элементомъ; но основность его очень
слаба, чего и надо било ожидать, разъ элемента
воспроизводить 3-ю группу; слабая основность и зд?сь
проявляется въ непрочности солей, въ особенности солей со
слабыми кислотами (срав. А1203 и Сг2Оа).
Дал?е марганецъ образуетъ еще окиселъ по типу
двувалентныхъ металловъ, т.-е. но типу 2-ц группы—RO,
окиселъ МпО — закись марганца, и въ немъ является
основнымъ (металлическимъ) элементомъ, близко напо*
минающимъ магдій (MgO): соли, отв?чающія этому окислу,
бол?е прочны, нежели соли отъ предыдущего окисла
Мп203. Сл?дователыю, въ окисл? МпО марганец ь является
довольно энергичньшъ металломъ.
Накоиецъ у марганца есть еще окиселъ — по типу
4-й ур. R02—Мп02, перекись марганца съ очень
слабокислотными свойствами (аналогично РЬ02), граничащими
съ безразличностью; кислоты, отв?чающей Мп02, не-
изв?стно.
Существующій еще окиселъ Мп304 является несамо-
стоятельнымъ; онъ представляетъ сочетаніе закиси
марганца съ окисью марганца: МпО -{- Мп203 = Мп304;' на
это указываетъ реакція Мп304 съ кислотами: цолучаются
соли закиси и окиси марганца.
Итакъ, самостоятельныхъ, паибол?е характерпыхъ, окис-
ловъ у марганца пять: два кислотныхъ, два основныхъ
и одинъ настолько слабокислотенъ, что граничить съ
безразличностью:
1) Мп207 — марганцовый ангидридъ, кислотный
окиселъ, образующей марганцовую кислоту, НМи04;
'32"
— 500 ~
2) МлОа—марганцовистый апгидридъ, кислотный оки-
селъ, образующей марганцовистую кислоту, Н2Мп04;
3) Мп02—перекись марганца, окис?лъ почти
безразличный, но, точн?е, очень слабокислотный;
4) Mn2Oj — окись марганца, очень слабое основапіе,
дающее соли по типу 3-атомиыхъ металловъ 3-й
грунпы;
5) МпО—закись марганца, сравнительно сильное осно-
ваніе, напоминающее окись магнія MgO.
Интересно зам?тить сл?дующее:
a) Вс? окислы марганца, нагр?тые съ кислотами,
даютъ соли, отв?чающія низшему окислу—закиси
марганца, МпО; значить, отв?чающія ему соединенія наибо-
л?е устойчивы.
b) Вс? мзшіе окислы марганца, въ присутствіи
щелочей, отъ д?йствія окислителей (наприм?ръ, КСЮ3,
KN03) мог уть окисляться и переходить въ высшіе
окислы.
c) Высшіе окислы марганца, наоборотъ, въ
особенности хорошо въ присутствіи киелотъ, могутъ
раскисляться и переходить въ низшія степени окисленія, а
именно, въ копц?-копдовъ, въ МпО — закись марганца-
Отсюда высшіо окислы марганца, ихъ кислоты и соли
кислотъ прии?пяютей въ качеств? окислителей (напр.,
хотя бы при полученіи хлора изъ НС1; см. хлоръ).
Объединяя все вышесказанное о марганц?, приходится
назвать его металло-мепіаллоидомъ.
Въ природ? марган?цъ встр?чается въ вид? минера-
ловъ: пиролюзита, Мп02, гаусманита, Мп304, браунпта,
Мп203, марганцоваго шпата, МпС03, и н?которыхъ дру-
гихъ. Металлическііі марганецъ получается возстановле-
ніемъ его кислородныхъ рудъ при иакалігвапіи съ углемъ
или, лучше, съ алюмипіемъ. Это твердый и хрупкій мс-
таллъ красноваточ'?раго цв?та, уд. в?са 7,5. Онъ
плавится около 1.245°. Въ кислотахъ растворяется съ обра-
зованіемъ солей закиси марганца. Окисляется па воздух?
— 501 —
очень трудно. Применяется маргалецъ, какъ полезная
пріш?сь къ чугуну.
Закись марганца, МпО, получается накаливаніемъ
углемарганцовистой соли, МпС03 (марганцовый шпатъ).
Это—зеленый норошокъ, легко окисляющійся на воздух?
нь бурую закисъ-окисъ марганца, Мгь04.
Гидратъ закиси марганца^ Mti(OH)2, получается по
обниму методу—д?йствіемъ ?дкихъ щелочей на
растворимый соли закиси марганца. Онъ б?лаго цв?та, но отъ
кислорода воздуха быстро окисляется и при этомъ бу-
р?етъ, переходя въ гидратъ оклей марганца; подобно
гидрату окиси магнія, онъ растворяется въ соляхъ
аммонія.
Соли закиси марганца отличаются отъ другихъ солей
марганца евоимъ постоянствомъ: он? бл?дно-розоваго
цв?та; растворы ихъ въ вод? почти безцв?тны.
Вс? он? могутъ быть получены при д?йствіи соотв?т-
ственныхъ кислотъ на перекись марганца—Мп02,
Хлористый марганецъ, МпС12, красталлизуется изъ
воднаго раствора съ 4Н20 въ розовыхъ таблицахъ. Въ
техник? МпС12 получается какъ побочный продуктъ при
полученіи хлора (см. хлоръ, стр. 170).
С?рнистый маргаиецъ, MnS, — единственное с?рни-
стое соединепіе т?леснаго цв?та. Получается при д?й-
ствіи (NH4)2S на растворимыя соли марганца:
MnCl2 -f (NH4)2S = MnS -f 2NH4C1.
Окись марганца^ Mn203, образуетъ минералъ брау-
нить въ вид? темно-бурыхъ квадратныхъ кристалловъ,
уд. в?са 4,75. Это слабо основной окиселъ, дающій соли
только съ сильными кислотами; соли эти непрочны и,
отдавая кислородъ, легко переходятъ въ соли закиси
марганца.
Гидратъ окиси маргангщ встр?чается въ природ?
въ вид? минерала манганита. Раствореяіемъ его въ
— 502 -
кислотахъ получаютъ малоустойчитшя соли окисп
марганца.
Закись-окись марганца, Мп304 или МпО. Мп203, встр?-
чается -яъ природ? въ вид? минерала гаусманита\ съ
кислотами даетъ преимущественно соли закиси марганца
съ ирим?сью солей окиси марганца, что устанавливаете
его см?шанный составь.'
Перекись марганца, Мп02, встр?чается въ природ?
въ вид? минерала пиролюзита (это главная руда
марганца), представляющаго очень темныя, ,почти черныя,
ромбическія призмы, съ металлическнмъ блескомъ; уд.
в?са 5,03. Мп02—исходный продуктъ для получспія дру-
гихъ соединений марганца. При накаливапіи выд?ляетъ
часть своего кислорода и раскисляется въ закись
марганца. Съ НС1 она выд?ляетъ хдоръ (ем. хлоръ, стр. 170)
съ H2S04 выд?ляетъ кислородъ: .
Мп02 -f H2S04 = MnS04 -f Н20 -f О.
Съ основными окислами можетъ давать соединепія,
хотя очень непрочныя, наприм?ръ, Мп02. СаО=СаМп03—
въ этомъ и сказывается слабокислотный характеръ Мп02.
При окисленіи переходитъ въ высшіе окислы марганца.
Въ техник? перекись марганца употребляется для
получения галоидовъ (С1, Вг и J) и кислорода, какъ
окислитель въ -стеклянномъ производств?, въ гончарномъ
производств? для полученія бурыхъ и фіолетовыхъ цвь-
товъ и, наконецъ, въ гальваническихъ элементахъ.
Марганцовистокислый калій, К2Мп04, представляетъ
изъ себд соль марганцовистой кислоты Н2Мп04, отв?ча-
ющей марганцовистому ангидриду Мп03, которые
неизвестны въ свободномъ состояиіи. К2Мп04 долучаехся сила-
вленіемъ какихъ-іщбудь окисловъ марганца (обыкновенно
Мп02) съ ?дкимъ или угдекислымъ кали въ присутствіи
окислителей (бертоллетовой соли или селитры) въ вид?
. аморфной темно-зеленой массы, напр.:
'¦ МпОа (-2КОН-1-0 = К2Міі04+наО.
— 503 —
Въ присутствіи кислотъ (даже угольной) К2Мп04
окисляется и переходить въ марганцовокислый калій КМп04,
при чемь первоначальный зеленый цвЬтъ раствора
переходить въ малиновый:
ЗК2Мп04 + 2С02 + Н20 = 2КМп04+Мп08. Н20+2К2С03.
Благодаря такой легкой перем?п? зеленаго дв?та въ
малиновый, К2Мп04 получилъ пазваніе минерального
хамелеона]).
Марганцовокислый калій, КМп04, образуетъ темно-
малиновыя ромбическія призмы, изоморфный съ КС104, и
получайся изъ K2MnQ4, какъ только что описано. Это
очень сильный окислитель, д?йствующій разрушительно
на органическія вещества, благодаря чему онъ и прим?-
ияется для дизенфекціи; при этомъ КМп04 самъ
раскисляется до перекиси марганца, который выд?ляется въ
вид? бураго гидрата Ми02. НгО = Мп03Нг:
2КМп04 + ЗН20 = 2НаМпОв -f 2КОН -f О,
а выд?ляющійся кислородъ и д?йствуетъ окисляющимъ
образомъ. Въ присутствіи кислотъ КМп04 окисляетъ еще
энергичи?е, ч?мъ въ присутствіи щелочей, напр.:
2КМп04 -f 3H2S04 = K2S04 4- 2MnS04 -f 3H80 + 50.
Реакдіи окисленія КМп04 могутъ быть просл?жены
до конца, такъ какъ, пока идетъ окисленіе, КМп04 д?-
лается безцв?тнымъ, и первая капля его раствора, посл?
того, какъ все вещество будетъ окислено, видна по не-
исчезающему розовому окрашиванію раствора: поэтому
опред?ленный (титрованный) растворъ КМп04 и
употребляется для количествениыхъ опред?леній, напр., для
опред?ленія органическнхъ веществъ въ вод?, жел?за въ
чугун? и* стали и проч.
*) Въ настоящее время минера лышмъ тамелеономъ называется
КМа04.
— 504 —
Свободная марганцовая кислота, ИМп04, получаотся
при д?йствіи с?рпой кислоты па ся баритовую соль:
Ва(Ми04)2 -f H2S04 = BaS04 + 2HMn04.
Она изв?стна только въ водномъ раствор? и является
кислотой сильной.
Марганцовый аитд$идъу Мп207, получается въ вид?
очень летучей темно-зеленой жидкости, при д?йствіи
кр?пкой с?рной кислоты на сухой КМн()4. Онъ легко
превращается въ красно-фіол?товый паръ, а посл?дній
отъ незналительныхъ причинъ разлагается со. взрывомъ
на кислородъ и перекись марганца.
Реакцги на марганецъ. Для открытія марганца характерны: с?р-
пистое соедин?ніе MnS—'т?л?снаго цв?та и соли марганцовой
кислоты—малиноваго цв?та. Посд?днія получаются сл?дугощимъ обра-
зомъ: берутъ въ пробирку перекиси свинца РЬ02 или сурика, прили-
ваютъ кр?пкой НДт03 и нагр?ваюгъ до кип?нія; эат?мъ приливаютъ
туда н?сколько капель какой-нибудь соли марганца, ыосл?дняя тот-
часъ окисляется до марганцовой кислоты, что и узнается по
интенсивному малиновому окрашнванію.
Восьмая группа.
§ 210. Въ соотавъ 8-й группы входятъ сл?дующіе
металлы: жел?зо (Fe), никкель (Ш) и кобальтъ (Со); ру-
теній (Ru), родій (Rh) и палладій (Pd); осмій (Os), ирп-
дій (Jr) и платина (Pt), а также м?дь (Си), серебро (Ag)
и золото (Аи), хотя посл?дніе три металла могутъ быть
поставлены и въ 1-го группу.
Основываясь на положеніяхъ періодическаго закона,
можно предвид?ть, что посл? атомнаго в?са эти металлы
прежде всего объединялись въ одну группу, своей
одинаковой высшей валентностью. Элементы 8-й группы,
действительно, могутъ — хотя и очень р?дко и *въ мало
устойчивомъ вид?—проявлять свою 8-валентную природу:
типъ окисла для этой группы долженъ им?ть формулу Е04;
оуществоваиіс такого окисла до сихъ поръ было конста-
- 505 —
тировано только у двугь металловъ—у рутенія (Ва04) и
у осмія (Os04); у вс?хъ же прочихь металловъ 8-й груипы
окисловъ такого типа не получено.
Что металлы 8-й группы очень рвдко и съ трудомъ
проявляють свою 8-валентяуго природу,—въ этомъ ничего
новаго н?тъ: и -раньш^ начиная съ 4-й группы, встр?ча-
лись подобные же факты: ч?мъ выше становилась
валентность злеиентовъ, т?мъ р?же и т?мъ трудн?е
элементы проявляли ее; гораздо чаще и легче такі? элементы
проявляли меньшую валентность, оставляя часть ея въ
потенціальномъ (скрытомъ) состояніи, и ч?мъ выше была
максимальная валентность (напр., N, Сг, Мп, галоиды и
другіе), т?^ъ больше формъ съ низшей валентностью
образовали эти элементы. Въ 8-й групп? это
разнообразие формъ, гд? элементы фигурируют ь съ низкой
валентностью, также большое. Конечно, свойства этихъ элемен-
товъ находятся въ зависимости отъ т?хъ типовъ
валентности, въ которыхъ они будутъ образовывать т? или
иныя соединения: ч?мъ ниже будетъ проявляющаяся
валентность, т?мъ элементъ будетъ все бол?е и бол?е
основньгаъ, а высшая валентность (4, 5, 6, Т и 8 еди-
ницъ валентности) всегда будетъ характеризовать
соединение съ кислотными (металлоидными) свойствами.
Въ 8-й групп? указанные элементы можно по
ближайшему ихъ сходству подразд?лить на 3 подгруппы:
" 1) Fe, Со, № (и Си),
2) Ни, Rh, Pd (и Ag),
3) Os, Jr, Pt (и An).
Fe
Xi
Co
Ru
lih
Pd
At. в?съ.
55,84
58,68
58,97
101,70
102,9
106,7
J'Д.- в?съ.
7,8
8,7
8,6
12,2
12.6
11,9
At. объемъ.
7,2
6,7
6,9
8,3
8,4
9,0
Темп, пла
1.600°
1.481°
1.528°
ок. 2.000°
ок. 1.900°
1535°
— 500 -
At. В'іісь. • Уд. пЬсъ. Ат. объсмъ. Темп, плаплснія.
Os 190,9 22,4 8,4 2.700°
Jr 193,1 22,38 8,6 2.020°
Pt 195v2 21,45 9Д 1.720°
Въ каждой изтэ этихъ подгруппъ замечается сл?ду-
ющая правильность въ напдсанномъ порядк? въ каждой
строк?: каждый изъ иосл?дугощихъ металловъ все труд-
и?е и трудн?о проявляетъ высшую валентность, а, на-
оборотъ, соединенія все низшей и низшей валентности
становятся характерн?е и прочн?е, т.-е., другими
словами, элементы в? каждой строк? отъ л?вой руки къ
правой становятся все бол?е и бол?е основными. Такъ,
напр., жел?зо им?етъ три ряда соединений, отв?чагощихъ
окисламъ; Fe03, Fe203 и FeG; соединенія перваго оікисла,
гд? Fe 6-валентно, непрочны: изв?стна, наприм?ръ, же-
л?знокаліева соль K2Fe04, и та легко разлагается;
соединенія, отв?чающія Fe203,— окисныя соли, наибол?е
постоянны и типичны для жел?за, нежели отв?чающія
окислу FeO—соли закиси жел?за; сл?дователыю, жел?за
всего устойчив?е даетъ соединенія, когда оно
трехвалентно. Для кобальта уже устойчив?е соли закиси
кобальта, отв?чающія окислу СоО, гд?, сл?довательно, ко-
бальтъ двувалентенъ; въ то же время у кобальта все-таки
есть, хотя и мен?е устойчивыя, соли окиси кобальта
Со203, гд? кобальтъ .трехвалентенъ. Никкель, хотя
им?етъ и закись №0 и окись Ni203, но отъ посл?дпяго
окисла солей совс?мъ уже не образуется, и никкель фи-
гурируетъ въ соляхъ, сл?довательно, только двувалент-
иымъ. М?дь лее, не гім?я окисла Си203, можетъ
образовать соли окиси м?ди СиО, гд? она двувалентна, и еще
соли закиси м?ди Си20, гд? она уже одновалентна. -
Подобнымъ же образомъ д?ло обстоять и въ двухъ
другихъ строкахъ.
На основаніи восьмивалентности элемептовъ 8-й группы
можно ожидать; что эти элементы металлоидны. Во такъ
— 507 —
какъ эта восъмивалентнооть очень трудно проявляется, а
элементы преимущественно выступаютъ сь меньшей
валентностью (главнымъ образомъ, какъ 3-хъ, 2-хъ и даже
одновалентные), то и характеръ отихъ эл?ментовъ изм?-
няется въ металлическій; эта металличность (основность)
у элементовъ 8-й группы не высока: всЬ они даютъ слаг
быя (конечно, въ различной степени) основанія, а при
высокой валентности проявляютъ и слабокислотпыя
свойства.
Иоложеніе 8-й группы въ періодической систем?
переходное (промежуточное); ея элементы находятся въ
срединЬ большихъ періодовъ и связываютъ четные и
нечетньй) ряды.
Чтобы понять эту роль элементовъ 8-й группы, слЬ-
дуетъ вспомнить, что свойства д?ятельныхъ элементовъ
последовательно изменяются въ горизонтальпыхъ рядахъ,
и что черезъ 7 элементовъ на 8-мъ начинается повторе-
піе. свойствъ (періодичность) перваго цикла изм?ненін.
Но, какъ и было это указано на 138-й страниц?, это
повторение гораздо точн?е, ближе воспроизводится, если
сравнивать черезъ рядъ. Другими словами, полный циклъ
изм?неній свойствъ элементовъ завершается въ двухъ
рядахъ—четномъ и нечетномъ; отсюда элементы четныхъ
рядовъ им?тотъ наибольшее сходство между собою; а
элементы нечстныхъ рядовъ — между собою; нечетноряд-
ные элементы хоть въ общемъ и повторяютъ свойства
четнорядныхъ, но въ ослабленной степени.
Элементы 8-й группы Fe, Со, Ni и Си связываютъ
ряды 4 и 5; Ru, Rh, Pd и kg—ряды 6 п 7; Os, Jr, Ft
и Au—ряды 10 и 11. Тамъ, гд? въ 8-й ірупп? не имЬ?тся
такихъ переходиьдхъ элементовъ, зам?чается р?зкій ска-
чокъ въ измЬненівс свойствъ элементовъ, наприм?ръ, пе-
реходъ отъ сильно энергичнаго металлоида фтора (2-го
ряда) къ сильно энергичному металлу—натрію (3-го ряда).
Теперь ясно и то, въ чемъ эта переходность должна
выразиться; отъ 1-й группы къ 7-й съ увеличеніемъ ва-
— 508 -
лентности происходить понижеиіе основности и все
большое и большее развитіе металлоидныхъ свойствъ; посл?д-
нее достигаете своего высшаго развитія въ 7-й групп?
Отсюда, чтрбы вернуться къ 1-й групп?, иеобходимъ
рядъ элементовъ, въ которыхъ, наоборотъ, уменьшались
бы металлоидный свойства и все бол?е и бол?е
развивались бы свойства металлическія, а это возможно съ
шшиэкеніемь валентности въ элементахъ. Именно это-то
т.-е. постепенное затрудненіе къ проявлению высшей
валентности и легкость образованія и устойчивость формъ
соединены все съ низшей и низшей валентностью, и
характерны въ рядахъ эл?м?птовъ 8-й группы.
М?дъ, серебро и золото заканчивают указанный
переходъ; они проявляютъ себя въ соединеніяхъ и
одновалентными, следовательно, но справедливости они
ставятся и въ 8-й групп? и въ 1-й групп? періодической
системы. Наглядн?е положеніе этихъ металловъ
выступить, если вс? ряды элементовъ написать на безконеч-
ной лент?, обернутой спиралью вокругъ цилиндра: Си
Связываютъ Ni, Zn, Ag—Pd и Cd, a Au—Pt и Hg, т.-е.
посл?дніо элементы 8-й группы съ н?четнорядньши
металлами 2-й группы. А такъ какъ этотъ переходъ отъ
8-й группы ко 2-й н? можетъ быть инымъ, какъ черезъ
1-ю группу, то въ этихъ 3-хъ металлахъ, Си, Ag и Au,
мы и встр?чаемъ н?которыя свойства, принадлежащія
элементамъ 1-й группы, наприм?ръ, указанную
одновалентность и связанное съ ней сходство атомнаго
состава соединеній.
Но при существовали указаннаго сходства между
элементами 1-й группы и металлами Си, Ag и Au им?ется
и значительное различіе. Оно ясно видно уже изъ того,
что щелочные металлы принадлежать къ числу
элементовъ, чрезвычайно легко соединяющихся съ кислородомъ,
разлагающимъ воду при обыкновенной температур?, и
являющихся вообще самыми энергичными металлическими
элементами, тогда какъ серебро и золото, а отчасти и
- 509 —
міздь трудно окисляются, воды не разлагаютъ не только
при обыкновенной температур?, но даже и при довольно
возвышенной; только изъ немногихъ кислотъ выт?сняютъ
они водородъ (золото ни въ одной кислот?
нерастворимо); окислы ихъ мало энергичны и легко возстано-
вляются я проч. Эта разница въ свойствахъ находится
въ т?сномъ соотношеніи съ разницей въ плотностяхъ
сравниваемыхъ металловъ. Металлы 1-й группы нринадле-
жатъ къ числу легчайшихъ, а Си, Ag и Аи — къ числу
тяжел?йшихъ; атомные объемы первыхъ велики, а вто-
рыхъ—малы.
Ат. в?съ. Уд. в?съ. Ат. объемъ. Тема, плавденія.
Си 63,57 " 8,9 7,2 1.054°
Ag 107,88 10,5 10,3 962°
Аи 197,20 19,3 10 1.093°
Въ заключеніо необходимо оговориться, что еще
далеко не вс? вопросы, связанные съ 8-ю группою, выр?-
шены вполи? ясно съ точки зр?нія періодической системы.
Подгруппа жел?за.
§ 21J. Эта подгруппа содерлснтъ въ себ? алименты:
жел?зо (Fe), кобальтъ (Со) и ннккель (Ni) съ очень
близкими атомными в?сами и съ многими общими свойствами.
Они составляюсь переходъ отъ марганца къ м?ди и да-
л?е къ цинку.
Жол?зо, какъ сказано выше, образуетъ три ряда
соединеній, отв?чающихъ окисламъ: FeOs, Fe203 и FeO;
высшій окис?лъ обладаетъ кислотнымъ характеромъ: ему
отв?чаетъ жел?зпая кислота, H2Fe04 — Fe03 -|- Н20.
Для кобальта и никкеля додобиыхъ соединеній
неизвестно.
Соедипопія окиси жел?за сходны съ подобными же
соединеніями хрома и алюшінія. Это иаибол?о постоянный
изъ соединеній жсл?за. Соединеній окиси кобальта нено-
1
— 510 —
стояішы, а ііикксль вовсе не образуетъ окисныхъ
солей.
Закисныя соединенія непостоянны у жслЬза и
постоянны у кобальта и никкеля.
Вс? эти металлы с?раіго цв?та и трудно плавятся; у
вс?хъ иіъ незначительные атомные объемы; въ раска-
ленномъ состояніи они сильно пропускаютъ водородъ
(особенно Fe, а изъ другой подгруппы—Pt), а при
обыкновенной темпераТур? сгущаютъ его; съ KCN даютъ
комплексный соединенія; соли ихъ всЬ окрашены. Эта
характеристика относится и къ другимъ элементамъ
ЦАсьмой группы.
Ж ел ? з о, Fe.
Атомный в?съ — 55,85. Уд. в?съ = 7,8. Темпер, плавл. = ок. 1.000°.
Въ сосдин?ніяхъ преимущественно трехвалентно и двувалентно.
§ 212. Ж?лЬзо очень распространено въ природ?, но
въ самородномъ состояніи встр?чается только, напри-
м?ръ, въ мстеоритахъ и н?которыхъ лавахъ. Существуете
предположение, что внутренность земного шара содержитъ
жсл?зо 2). Соединенія жел?за находятся въ гемоглобип?
крови и, песомп?нпо, играютъ зд?сь очень важную роль.
Важд?йшія жел?зныя руды:
1) Магнитный жел?знякъ (Feg04). Это самая
богатая по содержанію зкел?за руда (до 72°/0 Fe); она
наиболее распространена въ с?верныхъ странахъ: въ Россіи
на Урал? изъ него сложены гора Благодать, Магнитная
гора и др.; им?ются богатыя залежи въ Капад?, Соеди-
ненныхъ Штатахъ, въ Швеціи и Норвегіи.
*) Интересно отм?тить, чю распред?леніе элементовъ въ земл?
таково: на поверхности ея преобладаютъ легкіе элементы, какъ Н,
С, N, О, Na, Mg, Al, Si, Р, S, С1, К, Са, но направленно же къ
центру находятся бол?е тяжелые элементы, и плотность породъ глу-
бинъ больше, ч?мъ плотность породъ на поверхности. Такое распре-
д?лоніе, надо предположить, произошло еще въ тотъ періодъ, когда
вся масса земли была вь вид/L паронъ.
— 511 -
2) Красная жел?зная руда (красный жел?знякъ)
(Ке203) (до 69°/о Fe). Эта руда извЬстна въ п?сколькихъ
ішдоизм?неніяхъ. наприм?ръ, въ вид? жел?знаго блеска-^
кристаллич?скаго (въ Россіи — Кривой Рогъ на гранид?
^Екатеринославской и Херсонской губерній), о/сел?зногі
елюдкщ также гематита у охры (мумія) и др.
3) Вурый эісел?знякъ—водная окись жел?за и
4) Жел?зный шпатъ (FeC03);- посл?днія дв? руды
встр?чаются или въ вид? залежей или въ вид? широко
распространенные прим?сей къ другимъ нородамъ.
Кром? тбго, очень распространено С?рнисто? жел?зо—
а/дел?зный колчеданъ, FeS2 (пиритъ), непригодный для
выплавки жел?за.
Химичесщі чистое жел?зо получаютъ или д?йстві?мъ
гальваническаго тока на 'ж?л?зныя соли, • наприм?ръ,
FeS04, или накаливаніемъ окиси лсел?за въ стру?
водорода:
Fo203 -f ЗНа == 2Fe + ЗНаО.
Чистое желЬзо ич?стъ серебристоб?лый цвЬтъ и уд,
и?съ—7,8; оно плавится около 1,600° и улетучивается
въ электрической печи. При высокой температур?
желЬзо, прежде чЬмъ еще расплавиться, дЬлается мягкимъ
и ковкимъ. ііодъ вліяиіемъ магнита жел?зо
намагничивается, но сейчасъ же т?ря?тъ магнитяоеть по удаленіи
магнита, придагощаго ему это свойство. Своиствомъ
удерживать магнетизмъ обладаете сталь.
Непосредственнаго прим?ненія чистое жел?зо не
им?егьа); въ техник? прим?няются различные сплавы
его съ углеродомъ (отъ 0,5 до 5°/0), содержащіе въ не-
большомъ количествЬ и другія прим?си, наприм?ръ,
*) Чистое желЬзо такъ трудно плавится, что изъ него не отли*
вататъ вещей; нагр?тое оно легко вытягивается; плющится и гнется;
чугунъ ж? не гнется, а ломается; сталь занимаетъ въ этомъ отноше-
піи среднее м?ето между жел?зомъ и чугуномъ: если сталь сильно
нагр?тая быстро охлаждена (закаленная сталь), то она будетъ очень
ткгрдн, \рунка и уируга; если ж о охлажденіс произведено медленно,
— 512 —
крсмній, марганецъ, с?ру, фосфоръ и т. д. Прим?сь
углерода сильно понижаетъ температуру плавленія и
ковкость жел?за и повышаетъ твердость его.
Если содержание углерода въ жел?з? колеблется отъ
2,3 до іМ%» т0 TaK0* яродуктъ называется чугуномг.
Углеродъ чугуна частью химически связанъ съ жел?-
зомъ, а частью см?шанъ съ нимъ механически (находится
въ вид? графита). Если большая часть углерода,
находящаяся въ чугун?, вступила въ химическое соединеніе
съ жел?зомъ, то такой чугунъ называется б?лътъ. Онъ
получается при быстромъ охлажденіи сплавл?ннаго
чугуна. Б?лый чугунъ твердъ, им?етъ волокнистое или
крупнозернистое строеніе; уд. в?съ его = 7,1 — 7,9.
Температура плавленія = 1.050°—1.200°. Б?лый чугунъ
не годится для литья и идетъ для дальн?йшей
переработки въ сталь и жел?зо.
При медленномъ охлажденіи сплавленнаго чугуна
получается с?рый чугунъ, углеродъ котораго находится
по преимуществу въ вид? графита, располагающаяся
между частицами жел?за; онъ придаетъ излому такого
чугуна с?рый видъ. Онъ мен?е твердъ и хрупокъ, ч?мъ
б?лый чугунъ; им?етъ мелкозернистое строеніе, уд?лышй
в?съ его = 6,6 — 7,3, температура плавленія= 1.100°—-
1.300°. С?рый чугунъ прим?няется для литья и для даль-
п?йшсй переработки въ сталь и жел?зо.
Если въ сплав? жел?за съ углеродомъ гюсл?дняго
заключается меньше 0,5°/0, то продуктъ называется
ковтмъ жел?зомъ. Ковкое жел?зо тягуче, не очень
твердо; еще до начала плавленія (приблизительно около
600°) оно д?лается мягкимъ, доступнымъ для ковки,
прокатки и прессованія; при температур? ярко-краснаго
каленія жел?зныя массы можно „сваривать", т.-е.
соединять сдавливапіемъ.
то сталь (отпущенная сталь) будетъ мягка и гибка, какъ жел-ьзо. М?-
няя. условія нагр?ванія и охлажденія, можно получать сталь разной
степени твердости.
— 513 -
При содержат"и въ жел?з? угля оть 0,5% ДО 2,30/0
получается сталь. Углеродъ въ стали соединень съ же-
лЬзомъ химически. Сталь плавится около 1.400°. Если
сталь приготовлена медлепнымъ охлажденіемь, то она
сравнительно мягка и можетъ коваться. Сталь же, на-
гр?тая до краснаго каленія и быстро охлажденная, очень
тверда и хрупка. Въ зависимости отъ продолжительности
и температуры нагр?ванія и отъ быстроты охлажденія
стали можно придавать различная степени твердости.
§ 213. Металлургія жел?за. Жел?зо получается
возстановленіемъ углемъ и СО его кислородныхъ рудъ, при
этомъ жел?зо сплавляется съ избыткомъ угля, и
получается чугунъ, который зат?мъ перерабатывается на
сталь и жел?зо.
Выплавка чугуна совершается въ такъ называемыхъ
доменпыхъ печахъ, или просто домнахъ, д?йствующихъ
непрерывно въ теч?ніе н?сколькихъ л?тъ г). Высота ихъ
приблизительно равна отъ 15 до 30 метровъ (рис. 101).
Въ доменную печь сверху насыпаютъ перем?нными
слоями уголь и предварительно прокаленную,
разрыхленную руду, а снизу вдуваютъ воздухъ посредствомъ воздухо-
дувныхъ машинъ. Зажженный уголь (обыкновенно коксъ)
при этомъ слльно разгорается и возстановляетъ жел?зо
изъ его окисла, а самъ превращается въ окись углерода
или въ углекислый газь; С02, соприкасаясь съ раскален-
нымъ углемъ, переходить въ СО, а последняя служить
также хорошимъ возстановителемъ жел?зпой руды. Воз-
етановленное жел?зо сплавляется съ углемъ въ чугунъ и,
расплавившись, стекаетъ внизъ печи, гд? и скопляется;
по м?р? накопленія жидкій чугунъ выпускается, а сверху
все время засыпагатъ послойно руду и уголь. Прим?си,
находившіяся вь руд?, сплавляются съ нарочно
прибавляемыми плавнями и въ вид? легкоплавкаго шлака
*) Въ последнее время все болЬе и бол?е прим?няется выплавка
чугуна въ электрическихъ печахъ.
Псоргапичсская химія. зо
— 514 -
скопляются иадъ чугуиомъ, предохраняя»его поверхность
отъ окисленія. Плавнями чаще всего служатъ известняки
или песокъ.
Получаемый изъ доменной печи чугунъ обыкновенно
содержать углеродъ, кремній, cfcpy, фосфоръ, марганецъ
Рис. 101. Доменная печь.
и др. Онъ или прямо идетъ для отливки чугунныхъ
вещей, или подвергаегся дальн?йшей переработк? на сталь
и жел?зо. Для переработки чугуна на сталь и жел?зо
применяются нисколько способовъ, въ основаніи кого-
рыхъ лежитъ удаленіе большей части углерода и дру-
гихъ прим?сей, преимущественно кремнія и фосфора.
1) Но кричному способу обыкновенно б?лый ч)гунъ
плавятъ въ открытыхъ, такъ называемыхъ пргічныхъ
горпахъ, при чемъ въ нихъ вдувается воздухъ, и угле-
— 515 —
родъ сгорасть. Полученная крица затЬмъ проковывается
молотами. Кричный способъ сравнительно дорогъ;
кричное жел?зо и сталь обладаютъ обыкновенно хорошими
качествами.
2) При пудлингованы тотъ лее процеесъ ведутъ въ
плам?нныхъ печахъ, постоянно перем?шивая
расплавленный чугунъ или отъ руки (pudling), или м?шалками,
или вращ?ніемъ всей
печи.
3) Въ настоящее
время литая сталь и
литое жел?зо получаются,
главнымъ образомъ, пу-
темъ такъ называемого
бессемеровапія, т.-е. по
способу, впервые
изобретенному Бессемеромъ (въ
185G г.). При бессеме-
роваиіи въ
расплавленный чугунъ
(непосредственно получаемый изъ Ш^ШШШ^<шш^тщщщ^ш
доменпыхъ печей, или же Рис. 102. Бессемеровская реторта.
во вновь расплавленный
вдуваютъ подъ сшгышмъ давленіемъ воздухъ, который
окисляетъ углеродъ, а такясе и н?которыя прим?си, какъ
кремній и марганецъ. Требуемая высокая температура
зд?сь получается при гор?ніи подм?сей къ жел?зу,
наприм?ръ, кремнія, марганца и др. Продуваиіе воздуха
продолжаютъ или почти до полнаго сгоранія углерода
(для полученія ковкаго жел?за, которое посл?дующимъ
прибавленіемъ угля или чугуна съ опред?ленньшъ со-
держаніемъ жел?за можно вновь переработать на сталь),
или же его останавливают/в какъ разъ въ тотъ моментъ,
когда сгоритъ столько углерода, что должна получиться
сталь.
— 51fi —
Бессемеровская реторты (рис. 102), въ которьтхъ ;
происходить указанный процессъ, по предложение
Томаса и Джильхриста, изнутри обмазываются веществами
основного характера: см?сыо MgO . СаО, получаемой про-
каливаніемъ доломита MgC03.CaC03; эти-то вещества и
удерживатотъ прим?си кислотнаго характера, какъ окислы
фосфора, с?рьі и др. *). Процессъ бессемерованія идетъ
очень быстро; такъ, напр., Ij тонпъ чугуна бессемеру-
ются не бол?е 10—20 минуть, тогда какъ кричный спо-
собъ потребовалъ бы въ этомъ случа? около трехъ не-
д?ль, а-пудлингованіе—около трехъ дней. Изъ реторты
сталь разливается по формамъ.
Широко прим?няется приготовленіе стали также по
способу Сименса-Мартена, а именно — раствореніемъ
лсел?знаго лома въ расплавлениомъ чугун?. Операдія
ведется въ особо устроенпыхъ Сименсъ-Мартеновскихъ
печахъ—съ иодомъ тоже изъ основныхъ веществъ.
Такъ какъ природныя соединения жол?за всегда
содержать н?которыя прим?си, то не лишне указать, какъ
вліяютъ эти прим?си на свойства добываемыхъ иро-
дуктовъ.
Фосфоръ увеличиваете твердость, но еще бол?е
увеличиваем хрупкость. Это очень вредная прим?сь: ея
нельзя допустить бол?е 0,1% въ жел?з?.
С?ра также вредна и по т?мъ же причинамъ, что и
фосфоръ. Ея нельзя допускать бол?е 0,2°/0.
Еремній въ количеств? не бол?е 0,15% безвредепъ,
но при большомъ содержаніи д?лаетъ жел?зо хрупкимъ;
одновременное присутствіе марганца уничтожаете это
свойство кремнія и допускаетъ его присутствіе даже въ
1) Получагощійся при этомъ шдакъ содеряштъ довольно много
фосфорной кислоты и употребляется подъ именемъ «Томасова шлака»
въ качеств? сельско-хозяйственнаго удобренія. Онъ содержитъ въ себ?
также избытокъ извести и поэтому во влажномъ воздух? легко
распадается въ тонкій порошокъ, довольно хорошо разлагающійся водой
и углекислотой.
— 517 —
количеств'!} 0,5%. У кремнія особенно драгод?нио
свойство заполнять пустоты при отливк?. Прибавка
небольшого количества (около 0,1°/0) алгомипія также
предупреждаете образованіе пузырей при лить? стали.
Хромъ и волъфрамъ сильно увеличивают^ твердость
стали.
Изъ сплавовъ жел?за въ техник? прим?шиотъ ферро-
манганъ— сплавъ жел?за съ 10—20°/0 марганца, и фер-
росилицт—еилавъ жсл?за съ 10—11°/0 кремнія.
§ 214. Химическія свойства, Въ сухомъ воздух?
желіш не изменяется, но во влажномъ ржав?етъ,
покрываясь бурымъ слоемъ своихъ окисловъ 1)\ въ атмосфер?
кислорода при накаливаніи оно сгораетъ, превращаясь
въ окись желЬза Fe203. При накаливаніи въ воздухЬ
жел?зо окисляется въ окалину (Fe304) и ыожетъ
разлагать воду; оно легко соединяется съ
металлоидами; напр,, съ с?рой, фосфоромъ,- мышьякомъ,
галоидами и др.
Въ кислотахъ, даже самыхъ слабыхъ, жел?зо
растворяется съ выд?леиіемъ водорода и съ образованіемъ соли
закиси, за исключепіемъ азотной кислоты (см. 336 стр.);
кр?пкія H2S04 н HN03 почти не д?йствуютъ па
жел?зо.
Жел?зо, какъ металлъ, образуешь два типа солей,
отв?чающихъ закиси жел?за FoO и окиси жел?за
Fe203. Кром? того, изв?стиы соли желЬзпой кислоты
H2Fe04.
Соединены закиси жел?за. Закись жел?за, FeO,
получается возстановленіемъ окиси жел?за угл?мъ или
окисью углерода и представляетъ черный легко окисля-
ющійся порошокъ.
Тидрашь закиси жел?за осаждается ?дкими
щелочами изъ солей закиси жел?за въ вид? б?лаго осадка,
быстро сначала зелен?ющаго, а зат?мъ бур?ющаго на
^) Полированное жедЬзо рясеш?етъ трудн?е нелолированнаго.
— 518 —
воздух? всл?дствіе окисленія кислородомъ воздуха въ
гидратъ окиси жел?за: '
1) FeS04 + 2NaOH-=Fe(OH)2 + Na2S04;
2) >?Fe(OH)2 -J- О -f H20 = 2Fe(OH)3.
Сернокислая закись жел?за, FeS04. 7Н20 (жел?з-
ный купорось), кристаллизуется большими зелеными
моноклиноэдрическими призмами и легко растворяется
въ вод?. Жел?зный купоросъ кристаллизуется съ 7
частицами воды; онъ добывается какъ побочный продуктъ,
при получеши квасцовъ изъ глинистыхъ слаицевъ.
Жел?зпый купорось им?етъ обширное техническое
прим?нені?: такъ, онъ употребляется для приготовлеиія
чернилъ, въ красильномъ д?л?, при приготовленіи норд-
гаузенской с?рной кислоты, въ фотографіи въ качеств?
возстановителя, въ качеств? дезинфекціоипаго вещества
(онъ поглощаеть амміакъ и с?роводородъ) и т. д.
На воздух? FeS04 очень легко окисляется, переходя
въ с?рнокислую окись жел?за.
Углежел?зистая соль, FeC03, находится въ природ?
въ вид? жел?знаго шпата. Она немного растворима въ
вод?, содержащей углекислый газъ; этимъ и объясняется
ирисутствіе FeC03 въ жел?зистыхъ водахъ.
С?рнисшое жел?зо получается сплавленіемъ жел?за
съ с?рой или д?йствіемъ (NH4)2S па растворъ
какой-нибудь жел?зной соли въ вид? чернаго осадка:
FeS04 + (NH4)2S = FeS + (NH4)2S04.
Соединенія окиси жел?за* Окись оюел?за, Fe2Os,
встр?чается въ природ? въ вид? жел?знаго блеска,
образуя ромбическія призмы темно-с?раго цв?та. Въ аморф-
номъ вид? она образуетъ красный жел?знякъ и т. д.
Искусственно получается какъ побочный продуктъ, при
производств? нордгаузенской с?рной кислоты или прока-
ливаніемъ гидрата окиси жел?за:
2Fo(OH)3 — 3H2O^Fe203;
— 519 —
подъ именемъ мумш или колькотара прим?няется какъ
красная краска, преимущественно для окраски кровель.
По химическому характеру это слабое основаніе,
напоминающее А1203 (3-я гр.); но соли ея все-таки устойчи-
в?е солей закиси.
Запись-опись жел?за, Fe304 = Fe203 . FeO, образуетъ
магнитный жел?знякъ, встр?чающійся въ вид?
правильные октаэдровъ синевато-черйаго дв?та. Она же
получается при накаливаніи жел?за и называется
окалиной,
Гидратъ описи жел?за, Fe(OH)3, получается д?й-
ствіемъ растворимыхъ щелочей на соли окиси жел?за
въ вид? красно-бураго аморфиаго осадка а):
FeCl3 -f 3NaOH = 3NaCJ -}-Fe(OH)3.
Вь ярирод? встречается въ вид? бураго жел?зняка.
При д?йствіи кислотъ на окись жел?за или на ея
гидрата получаются соли окиси жел?за; он? же получаются
при окисленіи солей закиси жел?за.
Хлорное о/сел?зо, FeCl3, получается иагр?ваиі?мъ
жел?за въ стру? хлора въ вид? зеленовато-бурыхъ шести-
грайныхъ чешуекъ съ металлическимъ блескомъ.
Возгоняется оно при 100°, но закинаетъ только при 280°;
при 400° плотность пара его отв?чаетъ частиц? Fs2C]6,
которая вполн? диссоціируетъ на FeCl3 только при 750°.
Изъ водныхъ растворовъ FeCl3 кристаллизуется съ 6
частицами воды (FeCl3. 6Н20).
FeCl3 въ медицин? прим?няется, какъ
кровоостанавливающее средство.
Соли жел?зной кислоты получаются при сплавле-
ніи жел?зныхъ опилокъ съ селитрою, наприм?ръ, изв?стна
*) Изв?стенъ и растворимый Fe(OH)3, получаемый при діализ?
раствора его въ раствор?' FeCI3: въ діализаторЬ остается водный
растворъ Fe(OH)3, легко выпадающій въ осадокъ отъ д?йствія не-
болышиъ количествъ кислоты или щелочи.
— 520 —
соль K2Fg04—очень непрочная, Свободная жел?зиая
кислота (H2Fe04) и ея ангидридъ (Fo03) не получены.
§ 215, Синеродистый соединенія оіселіъза. Жел?зо
съ ціаномъ образу?тъ рядъ комплексныхъ соединепій,
изъ которыхъ наибол?е важны:
Жел?зиспгосинеродистый палій. K4Fe(CN)6, или
K^FeCy6 (желтая кровяная соль), получается при дЬй-
ствіи избытка KCN на растворъ заменой соли жол?за,
а въ техник? — прокаливаніемъ животиыхъ отбросовъ
(крови, рога, кожи и т. д.) съ поташомъ и экел?зоыъ и
носл?дующимъ выщелачиваніемъ водой. K4FeCy6
кристаллизуется съ ЗН20 въ болыпихъ желтыхъ призмахъ
квадратной системы; это — калійная соль жел?зистосинеро-
дистоводородной кислоты (H4FeCy6). При д?йствіи
слабой H2S04 на K4Fe(CN)6 выд?ляется ИСК
Берлинская лазурь, Fe4(FeCy6)3, есть соль окиси жо-
лЬза и жел?зиетосинеродистоводородной кислоты; она
выд?ляется въ вид? синяго осадка, нерастворимаго въ
кислотахъ при д?йствіи K4Fe(CN)6 на соли окиси же-
л?за:
4FeCl3 + 3K4FeCy6 = Fe4(FeCy6)3 + 12KCL
Берлинская лазурь прим?ня?тся какъ синяя краска.
Въ жел?зистосииеродистомъ каліи жел?зо двувалентно
(закисное); но и окисиое (трехвалентное) жел?зо можетъ
образовать подобное же соединение K3Fe(CN)6, изв?стноо
подъ имен?мъ красной кровяной соли. K3Fe(CN)6
получается при д?йствіи хлора на K3Fe(CN)6:
K4Fe(CN)6 + С1 = КС1 -f KsFe(CN)e.
K3Fe(CN)6 съ солями закиси жел?за образуетъ сити
осадокъ турнбуллевой сини, Fe3(FeCNc)2:
3FeS04 + 2K3FeCNG = Fe8(FeCNe)2 -f 3K3S04.
Реащш па оюелпзо. Окисное желЬзо открываютъ при помощи
желтой кровяной соли (берлинская лазурь), § эдкленод—при домощи
красной кровяной соли (турнбудлева синь).
- 521 —
Очень чувствителышмъ реактивомъ на соли окиси жел?за является
роданистый калій IvCXS, производящей въ соляхъ окиси жел?за
интенсивное кровянокрасно? окрашиваніе, всл?дствіе образованія рода-
иоваго жел?за Fe(CNS)3.
Никкель, №.
Атомный віісъ—58,08. Уд. в?съ=8Д Темп, плавл. около 1.481°. Въ
соедин?ніяхъ преимущественно двувалентенъ.
§ 216. Никкель встр?чается въ природ? въ вид?
купфертткеля №As, ншкелеваго блеска NiAs. NiS и
гарніерита (2(Ni, Mg)Si40]3 . 2Н20); никкел?выя руды
всегда содержать прим?сь соединеній кобальта. Для по-
лученія чистаго никкеля накаливаютъ его соль
щавелевой или угольной кислоты въ стру? водорода.
Никкель им?етъ серебристо-б?лый цв?тъ, металли-
ческій блескъ и очень тягучъ; уд?льный в?съ его = 8,8,
температура плавленія 1.481°; № им?етъ слабо магнит-
ныя свойства. Онъ растворяется легко въ азотной
кислого, трудн?е въ с?рной и соляной и образуетъ
исключительно соли закиси; вс? он? зеленаго цв?та, а въ
безводномъ состояніи — желтаго.
Запись ниппеля, NiO, получается прокаливаніемъ ея
гидрата въ вид? с?раго порошка.
Ггьдратъ закиси ниппеля, Ni(OH)2, выд?ляется ?д-
кими щелочами нзъ растворовъ солей никкеля въ вид?
зеленаго осадка.
С?рпокислый никкель, NiS04.7H20, — зеленыя ром-
бическія призмы; изоморфенъ съ соотв?тствующими
солями металловъ магніевой группы. Двойная соль NiS04.
. (NH4)2S04 . Н20 прим?няется для никкелированія,
Никкель лрим?няется въ сплавахъ, такъ, напр., мель-
хіоръ содержать м?дь, цинкъ и никкель; ч?мъ больше
никкеля въ сплав?: т?мъ б?л?е его цв?тъ, т?мъ сплавь
кр?пч?, тягуч?е и лучше полируется. Никкель, благодаря
своей трудной окисляемости и блестящему серебристому
виду, широко прим?няется для выд?лки различной по-
— 522 —
суды и для покрыгія (никкслировашя) другихъ ые-
талловъ.
Кобальтъ, Со.
Люмн. в?съ = 58,97. Уд. в?съ = 8,9. Темп, плавл. = 1.528». Въ соеди-
неніяхъ чаще всего двувалентенъ и трехвалентенъ.
§ 217. Кобальтъ встречается въ природ? вь вид?
гипейсоваго кобальта CoAs2 и въ видЬ кобальтоваго
блеска CoAs2.CoS2. Вс? кобальтовый руды обыкновенно
содержать большое или меньшее количество соодиионій
никкеля,
Металлическій кобальтъ получается накаливаиіемъ
закиси кобальта съ углемъ, или, по методу Гольдшмита,
при возстановленіи алгоминіемъ. Онъ им?етъ розовый
цв?тъ; плавится при 1.528°; уд. в?съ его = 8,9. Кобальтъ
слабо магнитенъ. Въ киолотахъ соляной и с?рпой онъ
растворяется медленно — съ образованіемъ солей закиси
кобальта; въ азотной Кислот? растворепіе идетъ легко.
Закисныя соли кобальта въ безводномъ состояніи им?ютъ
синій, а въ водномъ—розовый цв?тъ.
Закись кобальта, СоО, получается въ вид? зелено-
нато-с?раго осадка ири иакаливаіііи его гидрата.
Гмдратъ закиси кобальта, Со(ОН)3, осаждается
?дкими щелочами изь горячихъ растворовъ солен
кобальта въ вид? красііоватаго осадка; изъ холодныхъ
растворовъ выкадаютъ основный соли синяго цв?та.
Хлористый кобальтъ, СоС12, получается растворе-
ніемъ Со(ОН)2 въ соляной кислот?. Кристаллизуется въ
вйд? розовыхъ моноклиноэдрическихъ призмъ' состава
СоС12.6Н20. При нагр?ваніи до 140° получается безвод-"
нйй хлористый кобальтъ синяго цв?та, жадно притяги-
вающій влагу воздуха и переходящій при этомъ въ
красный цв?тъ. Прим?няется какъ симпатическія
чернила 1).
*) Ткань, пропитанная растворомъ кобальтовой соли, м?няотъ
свой цв?тъ въ зависимости отъ количества влаги въ воздух?; въ су-
— 523 —
С?рішспьый кобалътъ, CoS, осаждается при дЬйсгвіи
(NH4)2S на соли кобальта въ вид? ч?рнаго осадка.
Кобальтовый ультрамарину или синь Тэтра,
получается ігрокаливаніемъ осадка, выд?ляемаго содой изъ
кобальтовой соли, съ алюминіевыми квасцами и им?етъ
формулу СоА1204. Эта краска синяго цв?та, не
воспроизводящаяся фотографически, прим?няется въ
акварельной и масляной живописи 1).
Изъ солей окиси кобальта удомянемъ о двойной
азотистокислой соли окиси кобальта гь калія:
2[Co.(N02)3.3KN02].3H20;
она выд?ляется въ вид? желтаго кристаллическаго осадка,
если къ раствору соли закиси кобальта, подкисленному
уксусной кислотой, прибавить азотистокаліевой соли:
СоС1я 4- 5KN03 + 2HN02 = Co(N02)3 - 3KN02 -f 2KCI +
+ NO + Il20.
Эта реакція очень характерна дтя открытая кобальта
при анализ?.
М?дь, серебро и золото.
§ 218. М?дь, серебро и золото, какь }шо сказано,
сосгавляютъ переходъ оіъ элементов^ восьмой группы,
а именно оть никкеля, палладія и платины, къ элемен-
тамъ второй группы: кь цинку, кадмію и ртути. Такое
промежуточное иолозкеніо2) этихъ металловь проявляется
какъ въ физическомъ, такъ и въ химическомъ
характере ихъ.
хомъ воздух? цв?тъ синій, во влажномъ—бл?дно-розовый;
промежуточный сгадін характеризуются фиолетовыми отт?кками. Такую ткань
употребляютъ въ кач?ств? грубаго гигроскопа.
!) При сплавл?ніи стекла съ солями кобальта получается темно-
синее стекло (кремнекобальтовая соль); измельченное въ тонкій по-
рошокъ, такое стекло служитъ въ качеств? синей краски подъ на-
званіемъ «шмальты» или «кобальта».
2) Положеше Qu, Ag ц Au въ первой груші? еще недостаточно
обосновано.
— 524 -
Cu, Ag и An находятся въ такомъ же положенш
относительно иатрія, въ какомъ Zn, Cd и Hg
относительно Mg; они, подобно натріто, даюгъ соедин?нія, въ
которыхъ являются одновалентными и которыя сходны
между собою, Серебро въ соединеніяхъ преимущественно
одновалентно. М?дъ, кром? соединеній, въ которыхъ она
одновалентна и которыя называются закисными, даетъ
еще окисныя соединенія, наибол?е дрочныя, гд?
проявляется ея двувалентный характеръ. Золото въ
соединеніяхъ или одновалентно (закисныя соединенія), или
трехвалентно (окисныя соединенія).
Си, Ag и Аи—металлы мало энергичные; выт?сняются
изъ соединеній большинствомъ металловъ, въ природ?
находятся не только въ соединеніяхъ, но и свободными.
Окиси и гидрокиси ихъ, за исключеніемъ Ag20, слабо-
основны; галоидиыя соли ихъ, исключая AgCl, легко
гидролизуются и превращаются въ основныя соли. Вообще
надо зам?тить, что эти металлы им?ютъ сходство съ
металлами разныхъ группъ — въ зависимости отъ того,
какую валентность они проявляють.
М ? д ь, Си.
Аюмный ііЬсъ — 63,57. Уд. в?с* = 8,9. Темп. плавл.= 1.054°. Въ сс-
единеніяхъ двувалентна и одновалентна.
§ 219. М?дь находится въ природ? или въ свобод-
помъ вид? — самородная м?дь (особенно много ея въ
С. Америк? близъ озера Верхняго), или въ вид?
соединеній: Си20 — красная м?дная руда, Cu2S — м?дный
блескъ, CuFeS2 — міъдный колчедане и въ вид? основ-
ныхъ углекислыхъ солей: малахитъ [СиС03. Си(ОН2] и
м?дная лазурь [2СиС03. Си(ОН)2]. Въ Россіи м?дныя
руды встр?чаются на Кавказ? и въ Сибири. Въ свобод-
номъ вид? м?дь можетъ быть получена возстановленіемъ
углемъ красной руды (или обожженнаго колчедана) при
накаливапш; но въ посл?даес время для добывапія м?ди
изъ рудъ стали употреблять электролизъ; электролизу
подвергатотъ растворъ м?днаго купороса CuS04,
подкисленный с?рной кислотой.
Свойства. М?дь—металлъ краснаго дв?та, тягучій и
мягкій, такъ что плющится въ тонкіо листочки и
вытягивается въ топкія проволоки; уд?льный в?съ = 8,9,
плавится при 1.054° и улетучивается въ пламени гре-
мучаго газа; м?дъ — лучшій проводникъ эл?ктрическаго
тока, почему и прим?няется для электрическихъ прово-
довъ. Въ сухомъ воздух? м?дь не изм?няется, но во
влажномъ, притягивая углекислоту, покрываетъ зеленымъ
слоемъ основной углекислой соли; при накаливаніи на
воздух? покрывается слоемъ окиси м?ди, называемой
м?дпой окалиной; въ с?рной (съ выд?леніемъ S02) и
азотной (съ выд?леяі?мъ N0) кислотахъ растворяется
при нагр?ваніи, соляной кислотой но изм?няется; въ
амміак? растворяется, предварительно окисляясь, и даеть
синій растворъ, называемый реактивомъ Швейцера
(растворитель кл?тчатки).
М?дь широко прим?няется въ сплавахъ: латуни и
томпака (Cu-f-Zn), разныхъ сортовъ бронзъ (Cu-j-Sn и
др.), нейзильбера, мельхіора (Cu-j-Zn-fNi и т> ц>. м^д.
ная монета содержитъ 5% цинка. Кремнистая бронза
(не бол?е 5% кр?мнія) употребляется для телефонныхъ
и воздушныхъ электрическихъ проводовъ.
М?дь образуетъ два ряда соединеній: закисныя и
окисныя. Въ закисныхъ соединеніяхъ она одновалентна,
а въ окисныхъ — двувалентна. Закисныя — галоидныя и
діанистыя со?диненія легко получаются изъ окисныхъ;
они безцв?тны и въ вод? нерастворимы.
Закись м?ьдгс, Си20, находится въ природ? въ вид?
красной м?дной руды; искусственно получается въ вид?
краснаго кристаллическаго порошка возстаиовленіемъ
солей окиси м?ди; въ амміак? легко растворяется;
окисляясь, переходитъ въ окись м?ди. Хлористая (CuCl) и
- 52fi —
іодистая (CuJ) мЬдь нерастворимы въ водЬ. Растворъ
CuCl въ соляной кислотЬ поглощаетъ окись углерода:
при этомъ образуется соединеніе, которому предположи-
телъно д^ютъ формулу CuCl, СО, 2Н20.
Окись м?ди, СиО, можетъ быть получена или нагр?-
ваніемъ гидрата окиси м?ди [Си(ОН)2 = СиО -f- Н20],
или же накаливаніемъ м?дныхъ опилокъ на воздух?;
представляешь, собою черный порошокъ. При накалива-
ніи съ органическими т?лами она окисляетъ ихъ угле-
родъ въ углекислоту, а водородъ — въ воду, при чемъ
сама раскисляется въ металлическую м?дь.
Гидратг окиси м?дге, Си(ОН)2, получается въ вид h
голубого осадка д?йствіемъ ?дкихъ щелочей на соли
окиси мЬди:
CuS04 4- 2NaOH = Cu(OH)8 -f Na2S04.
Опъ легко, даже при нагрЬвапіи подъ водою, выд?-
ляеть частицу воды и переходитъ въ окись. Въ амміакЬ
гидратъ окиси растворяется съ голубымъ цв?томъ;
растворъ обладаетъ способностью растворять кл?тчатку.
Си(ОН)2—основаніе слабое; соли его легко подвергаются
іидролизу.
С?унокислая м?дь, CuS04 . 5Н20 (м?дный ісупоросъ),
получается по общимъ способамъ полученія солей. Она
образу?тъ синіе кристаллы, которые при накаливаніи,
всл?дствіе потери воды, становятся грязно-б?лыми; при
соединеніи съ водой сипій дв?тъ вновь появляется.
Наибольшее прим?неніе м?дный купорось им?етъ въ галь-
ванопластик? для полученія' чистой м?ди и для приго-
товленія м?дныхъ соединеніи.
Углекислая м?дь. Средней углекислой соли мЬди
СиС03 неизв?стно; при д?йствіи же углекислыхъ
щелочей на соли м?ди получается основная соль
CuC03 .Cu(OH)2j которая въ природ? образуетъ минералъ
малахить.
—-527 -
Мышьяковистая м?дь, CuHAs03, изв?стная подъ
именемъ зелени Шееле, прежде прим?нялась, какъ
зеленая краска г) (см. стр. 355).
С?рнисшая м?дь, CuS, находится въ природ? въ
вид? темно-синихъ кристалловъ; въ вид? чернаго осадка
получается д?йствіемъ с?роводорода на растворы солей
мЬди: CuS04 + H2S = CuS-)-H2S04. На воздух? она легко
окисляется, переходя въ с?рном?дную соль; водородомъ
при накаливаніи возстановляется въ полус?рнистую
м?дь, Cu2S.
Рсапціи на лгъдь. Отъ другихъ металловъ мЬдь отличается, во-
первыхъ, т?мъ, что в?дныя соли ея сяняго или зеленаго пвЬта, а
безводныя — бЬлаго; во-вторыхъ, вс? соли м?ди растворяются въ
амыіакЬ, образуя лазурево-синіе растворы, и, въ-третьихъ, соли м?ди
окрашивают* шгамя вь зеленый цв?гь.
Серебро, Ag.
Атомный ввсъ — 107,88. Уд. в?съ = 10,5. Теми, плавл. — 960. Въ со-
единепіяхъ одновалентно.
§ 220. Серрбро находится въ лриродЬ какъ въ сво-
бодномъ вид?, такъ и въ вид? многихъ рудныхъ собди-
неній, изъ коихъ наибол?е распространенъ серебряный
блескъ, Ag2S; онъ же почти всегда сопровождаетъ
свинцовый блескъ, PbS. Главный м?сторожденія серебряныхъ
рудъ въ Америк?, Саксоніи и въ РЬссіи—въ Алтайскихъ
горахъ и въ Нерчинск?.
Для полученія серебра изъ см?сей нер?дко ярим?ия-
ютъ ртуть, которая извлекаетъ серебро, образуя съ нимъ
амальгаму; изъ амальгамы же ртуть удаляется нагр?ва-
і) Еще сл?дующія соли м?ди прим?няются въ качеств? красокъ,
напр., бременская зелень состоитъ, главнымъ образомъ, изъ гидрата
окиси м?ди; брауншвейгекая зелень — основная углекислая соль,
СиСОз- Си(ОН)2; швейнфуртская зелень—двойное соединеніе уксуено-
и мышьяковисто-кислой м?ди; ярь-мгьдянка—основная уксусная соль,
2Си(С2Н302)2. Си(01Г)2.
— 528 —
нісмъ. С?рцистыя руды накаливаются въ присутствіи
кислорода воздуха, при чемъ с?рнистое серебро переходить
въ с?рнокислое, откуда выд?ляется металлическою м?дыо.
Обыкновенно серебро содержитъ прим?си другихъ метал-
ловъ. Чтобы выд?лить серебро совершенно чистымъ, его
растворяютъ въ азотной кислот? и осаждаютъ изъ
раствора соляной кислотой хлористое серебро, которое за-
т?мъ возстановляютъ сплав леніемъ съ содою въ тигд?
2AgCl -f Na2C03 = 2Ag -f 2NaCl + С02 -f О.
Серебро—б?лый, блестящій, мягкій металлъ, уд?л.
в?са= Ю;5; кристаллизуется въ правильпыхъ октаэдрахъ,
плавится при 960° и превращается въ пламени гремучаго
газа въ сипій паръ.
Серебро принадлежать къ благородными металлами,
для которыхъ отличительнымъ свойствомъ служить
трудная окисляемость. И д?йствителыю, серебро не
окисляется на воздух? ни на холоду ни при накаливаніи;
только при д?йствіи озона покрывается слоемъ черной
перекиси серебра. Расплавленное серебро поглоща?тъ
кислородъ (до 22 объемовъ), но при застываніи вновь
выд?ляетъ его. Серебро черн?етъ отъ с?роводорода,
покрываясь слоемъ с?рнистаго серебра. Съ галоидами
серебро легко соединяется. Въ с?рной кислот? растворяется
при кипяченіи (съ выд?леніемъ S02), а въ азотной
растворяется на холоду. Соляная кислота не растворяетъ
серебра; щелочи также не д?йствуютъ на серебро. Со-
единенія серебра сильно ядовиты.
Серебро « употребляется преимущественно въ вид?
сплава съ м?дыо (самое серебро слишкомъ мягко), при
этомъ число золотниковъ чистаго серебра, заключающихся
въ фунт? сплава, называется пробою. Серебряный изд?-
лія большею частью 84-й пробы, т.-е. въ 96 золотни-
кахъ сплава содержится 84 золотника серебра и 12
золотниковъ м?ди. Русскій серебряный рубль 86,4-й пробы,
т.-е. содержитъ 90% серебра, а разм?нная мелкая мо-
— 529 —
нета 48-й пробы, т.-?. содержитъ 50% серебра.
„Оксидированное" серебро получается при погруженіи сере-
бряныхъ предм?товъ въ раствор? гидрос?рнистаго калія,
при чемъ на поверхности предмета образуется тонкій
слой с?рнистаго серебра.
Кэри Ли, при возстановленіи лимоннокислаго серебра
жел?зяымъ купоросомъ, получилъ серебро въ аморфномъ
состояніи; такое серебро растворяется въ вод?.
Растворимое серебро есть аллотропическое видоизм?н?ніе
обыкновенная серебра. Растворъ серебра им?етъ или
красный или фіолетовый цв?тъ и обладаетъ такими же
свойствами, какъ растворы коллоидовъ. Приготовлено еще
н?сколько аллотропическихъ вилоизм?н?ній серебра, на-
прим?ръ, серебро, похожее видомъ на золото,
сине-зеленое серебро и др. Чистый коллоидальный растворъ
серебра можно получить такъ же, если пропускать между
серебряными проволоками подъ водой сильный электри-
ческій токъ: серебро катода при этихъ условіяхъ
уносится въ растворъ 3).
Окись серебра, Ag20, получается въ вид? темнаго
аморфнаго осадка, почти совершенно нерастворимаго въ
вод?, д?йствіемъ ?дкихъ щелочей на растворъ азотно-
кислаго серебра:
1) AgN03 + NaOH==AgOH--f-NaN08,
2) 2Ag(OH) —H20 = Ag20, т.-е.
въ данномъ случа? долженъ былъ бы получиться гидратъ
окиси серебра, но онъ настолько непроченъ, что тотчасъ
при образованіи распадается на окись серебра и воду.
Влажная окись серебра д?йству?тъ подобно гидрату. Хотя
Ag20 въ вод? почти нерастворима, т?мъ не мен?е вода
все-таки пріобр?таетъ щелочную реакцію; въ этомъ
усматривается сходство со щелочными гидратами первой
1) Подобнымъ же образомъ при электродахъ изъ золота и
платины были получены нхъ каллоидальные растворы.
Неорганическая химіл. 34
- 530 —
группы; окись серебра — вещество сильно основного
характера.
Хлористое серебро, AgCl, въ неболыпомъ количеств?
находится въ природ?; получается д?йствіемъ соляной
кислоты на'растворъ азотно-серебряной соли:
AgN03 + HC1 = AgGl + HN03.
Хлористое серебро выпада?тъ при этомъ въ вид?
б?лаго творожистаго осадка, нерастворимаго въ вод?, но
растворяющагося въ амміак? (AgCl. 3NH3). Б?лый дв?тъ
осадка подъ д?йствіемъ св?та переходить въ фіол?товый 2).
Азотнокислое серебро, AgN03, получаютъ растворе-
иіемъ серебра въ слабой азотной кислот?. Соль эта легко
растворима въ вод?; при д?йствіи солнечнаго св?та и
органическихъ веществъ изъ нея возстановляется
металлическое серебро, всл?дствіе чего AgN03 употребляется
для прижигакія ранъ. Называютъ его также лятшсомъ
lapis infemalis—адскій камень).
Синеродистое серебро, AgCN, выд?ляется изъ
раствора при д?йствіи на азотнокислое серебро ціанистымъ
каліемъ:
AgN03 -f KCN = KN03 -f AgCN;
при избытк? ціанистаго калія AgCN растворяется,
переходя въ комплексную соль K.Ag(GN)2. Посл?дняя соль
употребляется для гальваническаго серебренія другихъ ме-
талловъ.
С?рнистое серебро, Ag2S, находится въ природ? въ
вид? серебрянаго блеска; искусственно получается въ
вид? чернаго осадка при д?йствіи H2S на AgN03:
2AgN03 4- H2S = AgaS + 2HN03.
i) Изъ хлористаго серебра легко возстановляется металлическое
серебро: для этого къ AgCl приливаютъ кислоты и туда же пом?ща-
ютъ палочку цинка: 2AgCl + Zn =. 2Ag + ZnCl2; отъ ZuCl2 серебро
освобождается промываніемъ водою. Бромистое и іодистое серебро
нерастворимы въ вод?, желгаго цв?та.
— 531 —
Реакціи на серебро. Серебро характеризуется своею
способностью давать нерастворимое въ вод?, но растворяющееся въ ам-
міак?, хлористое серебро, что позволяетъ отличать его отъ другихъ
металловъ.
. Хлористое, бромистое и іодистое серебро, благодаря
своей способности* изм?нягься отъ д?йствія св?та, при-
м?няется въ фотографіи. Чтобы получить изображеніе
какого-нибудь предмета, стеклянную пластинку,
покрытую слоемъ желатины, содержащей въ себ? галоидосе-
ребряную (чаще бромистую) соль, подвергаютъ д?йствію
лучей (экепонированію), лроходящихъ чрезъ линзу и даю-
щигь изображеніе на пластянк?. Время экспонированія
должно быть настолько непродолжительно, чтобы
изображеніе это не было зам?тно для глаза, а проявлялось
только дотомъ, при погруженіи пластинки вь растворъ
возстановиг?ля, яаприм?ръ, сернокислой закиси жел?за,
пирогаллола и др. Этими возобновляющими веществами
выд?лается въ изм?нившихся отъ д?йствія св?та частяхъ
желатиннаго слоя металлическое серебро, и притомъ въ
большемъ или меныпемъ количестве, въ зависимости отъ
количества под?йствовавшихъ св?товыхъ лучей снимае-
маго предмета. Такимъ образомъ полученное въ камер?
изображеніе проявляется, т.-е. становится видимымъ.
Посл? проявления пластинку фиксируютъ, для чего ее
опускаютъ въ растворъ с?рноватистонатріевой соли, въ
которомъ неизм?нившееся галоидное серебро растворяется
и получается такъ называемый пегативъ, т.-е. обратное
изображеніе, на которомъ бол?е св?тльшъ частямъ
сфотографированная предмета отв?чаютъ бол?е темныя м?-
ста на пластинк?, и наоборотъ.
Чтобы получить позитивЪу т.-е. изображеніе, въ
которомъ бы св?тлымъ частямъ предмета соотв?тствовали
св?тлыя, а темнымъ—темныя, негативъ кодируютъ: кла-
дутъ ого на св?точувствительную бумагу, покрытию тоже
34*
— 532 —
солями серебра, и подвергаютъ ее д?йствію св?та, за-
т?мъ опять бумагу проявляюсь и закр?пляють на ней
изображеніе.
Золото, Ли.
'Атомный в?съ= 197,2. Уд. в?съ ~ 19.3. Темп, плавл. = 1.0930. Въ
соединеншхъ одно адеми? и трехвалентно.
§ 221. Золото находится въ природ? почти
исключительно въ самородномъ состояпіи въ вид? такъ
называемых^ розсыпей. Такія розсыпи находятся въ Калифор-
ніи, въ Австраліи, Южной Африк? (Трансваал?), на Урал?,
въ Сибири и другихъ м?стахъ. Сл?ды золота найдены въ
морской вод?. Добывается золото изъ розсыпей промыва-
ніемъ текучей водой, при чемъ легкія частицы песка и
горныхъ породъ уносятся, а крупинки золота, всл?дствіе
большого уд?льнаго в?са, остаются на м?ст?. Въ н?ко-
торыхъ м?стахъ, гд? золото встр?чается въ тонко раз-
дробленномъ состояніи, прим?нятотъ методъ амальгамаціи,
т.-е. извлеченія золота ртутью.
Нер?дко приб?гаютъ къ извлеченію золота изъ
розсыпей растворомъ KCN, въ которомъ золото растворяется,
образуя двойную соль AuCN. KCN : 2Au + 4KCN -f Н20 +
-|-0 = 2AuCN. KCN-J--2KOH; изъ этой соли выд?ляютъ
золото, быт?сігяя его цинкомъ или электролитическимъ
путемъ.
Самородное золото почти всегда содержитъ прим?си
другихъ металловъ — Ag, Pb, Си и др.; для очищенія,
его обрабатывают азотной или с?рной кислотами, кото-
рыя, растворяя прим?си, не д?йствуютъ на золото.
Золото—м?таллъ, мягкій, какъ свинецъ, ярко-желтаго
цв?та, очень ковкій, такъ что можетъ быть выковываемъ
въ топкі? листочки, просв?чивающіе зеленымъ св?томъ.
Уд?льный в?съ = 19,3; темп, плавл. = 1.093. Съ кисло-
родомъ золото не соединяется даже при накаливаніи;
растворяется оно только въ царской водк?, въ хлорной
— 533 —
вод? и вообще въ жидкосіяхъ, выд?ляющихъ свободный
хлоръ, и въ раствор? ціанистаго калія; а изъ растворовъ
солей легко выд?ляется различными возстановителями,
наприм?ръ, жел?знымъ купоросомъ, щавелевой кислотой
и др. Золото, выд?ляющееся изъ растворовъ его солей,
представляетъ очень тонкій порошокъ, въ проходящемъ
св?т? синяго цв?та, а въ отраженномъ — бураго; если
берутся очень разведенные растворы солей, то получаются
пурпурно-красные растворы коллоидальнаго золота. Рас-
творъ коллоидальнаго золота въ оловянной кислот?
(получается при возстановленіи солей золота д?йствіемъ SnCl2),
изв?стный подъ именемъ кассіева пурпура] употребляется
въ качеств? краски при фарфоровомъ производств?.
Золото всл?дствіе своей мягкости употребляется
преимущественно въ вид? сплавовъ; сплавъ его съ м?дью
им?етъ красноватый отт?нокъ, а сплавъ съ серебромъ—
желтый. Золото идетъ на приготовленіе монета и раз-
личнаго рода украшеній. Русскія золотыя монеты
содержать въ фунт? сплава около 86 золотниковъ золота;
украш?нія же бываютъ большею частью 56 пробы.
Зигмонди получилъ золото въ растворенномъ
состояли, возстановляя АиС13 муравьинымъ альдегидомъ. По
Бредигу, растворъ металлическаго золота можно получить
при образованіи вольтовой дуги между золотыми
электродами подъ водою; получается растворъ синевато-краснаго
цв?та. Этимъ же методомъ получены подобные же
растворы для серебра, ртути, платины и н?которыхъ другихъ
металловъ.
Золото въ своихъ соединеиіяхъ или одновалентно—и
тогда образуетъ соли закиси отъ слабо основного окисла
Аи20, или же трехвалентно, образуя соединенія окиси—
отъ окиси Аи203. Въ окисныхъ соединеиіяхъ золота
проявляется кислотный характерт>; такъ, напримВръ,
гидратъ окиси золота Аи(ОН)3 образуетъ съ основаніямн
соли, почему и называется золотой кислотогі.
— 534 —
Двойная солЪ) AuCN.KCN, нрич?няется для гальяа-
ническаго золоч?нія.
Хлорное золото, АиС13, получается раствор?ні?мъ
золота въ царской водк?. Изъ раствора оно
кристаллизуется въ вид? красно-бурыхъ кристалловъ,
расплывающихся на воздух?; при нагр?ваніи распадается на хлоръ
и золото.
Платина, Pt.
Атомный в?съ = 195,0. Уд. в?съ = 21.45. Темп, плавл. = 1.7200. Въ
соединеніяхъ двувалентна и четырехвалентна.
§ 222. Платина находится въ природ? въ самород-
номъ состояніи вм?ст? съ другими металлами
платиновой группы, образуя такъ называемую платиновую руду,
которой главныя залежи находятся на Урал?.
Платиновая руда въ вид? зеренъ добывается изъ роз-
сыпей промываніемъ, подобно золоту. Для разд?ленія ме-
талловъ поступают^ сл?дующимъ образомъ. Сначала руду
обрабатывают разведенной царской водкой, при чемъ въ
растворъ переходить золото; зат?мъ раствор?ні?мъ въ
кр?пкой царской водк? выд?ляготъ платину, палладій,
родій и рутеній и часть иридія; нераствор?нньши остаются
осмій и иридіи. Изъ раствора д?йствіемъ нашатыря вы-
д?ляютъ двойныя соли хлорной платины и хлорнаго ири-
ддя съ хлористымъ аммоніемъ. Отфильтрованный и
прокаленный осадокъ идетъ на под?лки подъ названіемъ
иридистой платины.
Платина 1) — металлъ с?ровато-б?лаго цв?та, очень
ковкій и тягучій, плавящійся около 1.770°. Въ сплавл?н-
номъ состояніи она, подобно серебру, поглоща?тъ кисло-
родъ, который при охлажденіи вновь выд?ляется;
платиновая чернь и губчатая платина сгущаютъ на своей по-
л) Въ Роосіи переработкой платины въ изд?ліл занимаются
«Платиновый заводь Кольб? и Линдфорсъ» и Т?нтелевскШ эаводъ въ
Петербурге,
— 535 -
верхности кислородъ, а также и водородъ и при
обыкновенной температур?. Платина растворяется только въ
царской водк? и то медленно. Уд?льный в?съ = 21,45.
Всл?дствіе своей тугоплавкости и способности
противостоять химическимъ реагеитамъ платина употребляется
для изготовленія химической посуды. Наибольшей
стойкостью отличается иридистая платина а).
Платина образуетъ соединенія закиси, въ которьтхъ
она является двувалентной — отъ окисла РЮ, и
соединенія окиси, гд? проявляется ея четырехвалентность — отъ
окисла Pt02; въ первыхъ соединеніяхъ платина обнару-
живаетъ бол?? основной характеръ, а во вторыхъ—бол??
кислотный.
Хлорная платина, PtCl4, получается раствореніемъ
платины въ царской водк?. Съ хлористыми щелочами
образуетъ такъ наз. хлороплатинаты, которые разсма-
триваютъ какъ соли платинохлористоеодородной
кислоты, HaPtCl6:
PtCl4 ^2KCl = K2PtCl6.
Хлороплатинаты калія и аммонія нерастворимы въ
вод?, чЬмъ и пользуются для открытія платины 2).
Если къ раствору хлорной платины прилить NaOH и
зат?мъ изСштокъ уксусной кислоты, то выд?ляется красно-
бурый осадокъ гидрата окиси платины Pt(0H)4
PtCi4 -f 4NaOH = 4NaCl -f Pt(OH)4,
который также называется платиновом кислотою, такъ
кайъ растворяется въ щелочахъ, образуя съ ними соли.
1) Платина изм?нлется при красномъ каленіи отъ фосфора, отъ
сплавленныхъ^?дкихъ щелочей; при продолжительномъ нагр?ваніи съ
углемъ платина растворяетъ его и д?ла?тся хрупкой.
9) Платина, подобно Fe, СО и Ni, способна образовать сложный
ціаннстыя соединенія; напр., при д?йствіи,* раствора KGN на PtCI2
получается K2Pt(CN)4. ЗН20. Соль барія BaPt(CN")4. Н20, нанесенная
а экрань, служить обыкновенно для обнаруживания р?нтгеновскихъ
ей. такъ какъ подъ вліянічкъ ихъ флюоресцируетъ.
— 536 —
Правда, этотъ гидратъ растворимъ и въ сильныхъ кисло-
тахъ, очевидно, въ немъ есть и основные свойства. Сл?-
довательно, гидрату окиси платины принадлежать смь-
шанный характ?ръ.
Большинство платиновыхъ соединеній при накалива-
нш разлагается, выд?ляющаяся при этомъ платина
имЬетъ видъ губки и называется губчатой платиной.
Губчатая платина обнаруживаем сильныя каталитическія
свойства, т.-е. ускоряетъ теченіе многихъ реакцій (см.,
напр., коніактный методъ полученія с?рнаго ангидрида—
367 стр., или водородное огниво—165 стр.). Наибол?е
юнко раздробленная платина получается, по методу Бре-
диіа, распыленіемъ ея подъ водой сь помощью
вольтовой дуги; при этомь образуется темно-бурый
коллоидальный растворъ платины. Изь такихъ расгворовъ платина
легко осаждается отъ прибавленія солей. Распыленная по
Бредигу платина обладаетъ хорошими каіалитическими
свойствами, во многихъ отношеніяхъ напоминающими
д?йствіе органическихъ ферментовъ. Каталитическое д?й-
ствіе платины, какъ и у растворовь органическихъ
ферментов^ 'при храненіи уменьшается; уменьшеніе идеіъ
бы^р?О. при ійаір?ваніи или при прибавленіи н?кото-
рыхъ: ь?щбсТ'йъ'^'ОсоШнно ядовитыхь; напр., сулемы,
синильной кислоткг;
ПРИЛ0ЖЕН1Я
Электронная теорія строенія матеріи.
Въ 1897 году Вильямсъ Круксъ предложилъ сл?ду-
тощую гипотезу, объясняющую сущность лучей, исходя-
щигъ отъ катода („катодныхъ" лучей), если электрическій
токъ проходить чрезъ разр?женный воздухъ или какой
другой газъ: катодные лучи пр?дставляютъ не
волнообразное двяжете э?ира, а „лучистую агат?рію", состоящую
изъ чрезвычайно маленькихъ матеріалъныхъ чаьтицъ,
гораздо меньшихъ по величин?, ч?мъ атомы. Джозефъ-
Джонъ Томсонъ въ 1894 году доказалъ, что скорость
катодныхъ лучей значительно отличается отъ скорости
св?та; Перр?нъ показалъ, что катодные лучи несутъ съ
собою отрицательное электричество. Эти и другіе факты
подтверждали гипотезу Крукса. Въ настоящее время и
принимаютъ, что мельчайшія частицы, изь которыхъ
состоять катодные лучи, суть атомы отрицательна™
электричества; по предложению Стони они названы „электронами".
Въ изложеніи Томсона, автора выдающихся работъ но
вопросу о природ? катодныхъ лучей, электронная теорія
строенія атомовъ выражается въ сл?дующемъ вид?;
электрически нейтральный атомъ состоитъ ийъ большого
количества электроновъ, пропорціональнаго в?су атома;
электроны им?тотъ большой зарядъ отрицательнаго электрп-
чества. А такъ какъ атомъ электрически нейтрал?ігь, го
приходится признать, что въ атом? заключается сов?р
птенно такое же количество положительнаго электрич?
— 540 -
ства, какое въ электронахъ атома—отрицательнаго.
Положительное электричество, по Томсону, распред?лено
внутри шарообразной оболочки, ограничивающей
поверхность атомам Электроны совершаютъ въ атом? круго-
образныя движенія вокругъ центра атома; всл?дствіе
же развивающейся при такомъ движеніи центроб?ж-
ной силы электроны отбрасываются въ наружные слои
атома.
Кром? того, они подвергаются и взаимному отталки-
ванію ихъ отрицательныхъ зарядовъ и притяженію со
стороны подожительнаго заряда сферы атома. Величина
электрона не превышаеть 3/1700 доли массы атома водорода.
Сходство въ свойствахъ элементовъ одной и той же
группы періодической системы, по Томсону, объясняется
т?мъ, что внутренніе концентрическіе ряды электроновъ
у этихъ элементовъ тождественны, но каждый посл?дую-
щій элементъ данной группы им?етъ одинъ лишиій концен-
трическій рядъ электроновъ по сравненію съ предшо-
ствующимъ элементомъ. Въ каждомъ ряду періодической
системы сл?ва направо, какъ изв?стно, атомный
в?съ увеличивается, т.-е. увеличивается количество
электроновъ, отчего системы д?лаются бол?е и бол?е
прочными: въ первыхъ группахъ системы элементы мо-
гутъ легко отдавать одинъ, два и бол?е электроновъ, и
тогда остатокъ является электроположительнымъ (метал"
ломъ); ч?мъ выше номеръ группы, тЬмъ элементы труд-
н?е отдаютъ свои электроны, а напротивъ, они полу-
чаютъ способность присоединять къ себ? лишніе
электроны, отъ чего получаются электроотрицательные
системы (металлоиды). Количество оторвавшихся (у метал-
ловъ) или присоединившихся (у металлоидовъ)
электроновъ опред?ляетъ валентность элементовъ.
Электронная теорія довольно легко объясняетъ явле-
иія радіоактивности. Причина радіоактивности кроется
въ томъ, что некоторое чрезвычайно малое число ато-
мовъ претерп?ваеть раздроблеиіе; небольшая, отд?ля-
— 541 —
ющаяся отъ нихъ, часть устремляется съ огромной
скоростью, составляющей около одной десятой скорости
св?та, въ пространство, давая явлеиіе радіоактивности.
Эти отрывающіяся части, однакоже, такъ малы, что учетъ
ихъ л?житъ за нред?лами опыта: по вычисленіямъ Содди,
1 граммъ радія потеряетъ 0,01 миллиграмма въ течете
одного года, или 1 миллиграммъ въ теченіе 100 л?тъ э).
*) ГГодробн?е съ электроннымъ ученіемъ можно познакомиться
въ сл?дугощихъ книгахъ на русскомъ язык?: Арр?ніусъ, «Теоріи хя-
міиз»; Лоджъ, «Современные взгляды на матерію>, а, также Ветгемъ,
«Современное развитіе физики», Томсонъ, «Корпускулярная теорія
вещества», Эйхенвальдъ, «Электрпчество> и др.
— 542 -
Растворимость 3) основаній и солей въ вод? при 18°.
С1
Вг
J
Р
N0a
С10э
ВгО,
JOs
ОН
SOi
Сг04
С904
со8
к
32,95
3,9
65,86
4,6
137,5
6,0
92,56
12,4
30,34
2,6
6,6
0,52
6,38
0,38
7,62
0,35
142,9
18
И,11
0,62
63,1
2,7
30,27
1,8
108,0
5,9
JVa
35,86
5,42
88,76
6,9
177,9
8,1
4,44
1,06
83,97
7,4
97,16
6,4
36,67
2,2
8,33
0,4
116.4
21
16,83
1Д5
61,21
3,30
3,34
0,24
19,39
1,8
Li
0*
—ч
77,79
13,3
168,7
12,6
161,5
8Х5
0,27
0,11
71,43
7,3
31,34
1,53
152,5
8,20
80,43
3,84
12,04
5,0
35,64
2,8
111,6
6,5
7,22
0,69
1,3
0,17
Ag
0,0316
0,0410
0,041
0,066
0,063
0,071
195,4
13,5
213,4
8,4
12,25
0,6
0,59
0,025
0,004
0,0314
0,01
0,001
0,55
0,020
0,0025
0,0315
0,0035
0,032
0,003
0,031
Tl
0,3
0,013
0,04
0,0215
0,006
0,0317
72,05
3
8,91
0,35
3,69
0,13
0,30
0,009
0,059
0,0216
40,04
1,76
4,74
0,09
0,006
0,031
1,48
0,030
4,95
0,10
Ва
37,24
1,7
103,6
2,9
201,4
3,8
0,16
0,0292
8,74
0,33
35,42
1,1
0,8
0,02
0,05
0,001
3,7
0,22
0,0323
0,0410
0,0338
0,0415
0,0086
0,0338
0,0023
0,0311
Sr
51,09
3,0
96,52
3,4
169,2
3,9
0,012
0,001
66,27
2,7
174,9
4,6
30,0
0,9
0,25
0,0257
0,77
0,063
0,011
0,036
0,12
0,006
0,0046
0,0326
0,0011
0,0+7
Са
73,19
5,4
143,3
5,2
200
4,8
0,0016
0,032
121,8
5,2
179,3
5,3
85,17
2,3
0,25
0,007
0,17
0,02
0,20
0,015
0,4
0,03
0,0356
0,0*43
0,0013
0,0313
Mg
55,81
5,1
103,1
4,6
148,2
4,1
0,0076
0,0214
74,31
4,0
126,4
4,7
42,86
1.5
6,87
0,26
0,001
0,032
35,43
2,8
73,0
4,3
0,03
0,0027
ОД
0,10
Zn
203,9
9,2
478,2
9,8
419
6,9
0,005
0,035
117,8
4,7
183,9
5,3
58,43
1,8
0,83
0,02
0,035
0,045
53,12
3,1
0,036
0,044
0,004?
0,033?
Pb
1,49
0,05
0,598
0,02
0,08
0,022
0,07
0,003
51,66
1,4
150,6
3,16
1,3
0,03
0,002
0,043
0,01
0,031
0,004*
0,0313
0,0-12
0,065
0,0315
0,055
0,031
0,043
*¦) Въ приведенной таблип? въ каждом* ісвадрат? стоять два числа, показывающая
растворимость соединения, апіопъ котораго поставлена въ в?ртикальномъ направлении, а
катіонъ—въ горизонтальномъ. Въ тьхъ случаягъ, когда соль образуешь гидраты, то
растворимость показана устойчиваго при 18° гидрата. Верхнее въ каждомъ квадрат? число
показываетъ количество граммовъ безводной соли, растворяющейся въ 100 к. с. воды;
нижнее же число показываетъ молярную растворимость, т.-е. число молей въ литр? насы-
щеываго раствора.
— 543 —
Упругость водяного пара въ миялишетрахъ ртут-
наго столба отъ 15,2° до 25,3° Ц.
ОД.
+15,2
15,3
15,4
15,5
15,6
15,7
15,8
15,9
16,0
16,1
16,2
16,3
16,4
16,5
16,6
16,7
16,8
16,9
17,0
17,1
17,2
17,3
17,4
17,5
17,6
17,7
Упругость
мм.
12,864
12,947
13,029
13,112
13,197
13,281
13,366
13,451
13,536
13,623
13,710
13,797
13,885
13,972
14,062
14,151
14,241
14,331
14,421
14,513
14,605
14,697
14,790
14,882
14,997
15,072 ;
0Ц.
+ 17,8
17,9
18,0
18,1
18,2
18,3
18,4
18,5
18,6
18,7
18,8
18,9
19,0
19,1
19,2
19,3
19,4
19,5
19,6
19,7
19,8
19,9
20,0
20,1
20,2
20,3
Упругость
мм.
15,167
15,262
15,357
15,454
15,552
15,650
15,747
15,845
15,945
16,045
16,145
16,246
16,346
16,449
16,552
16,655
16,758
16,861
16,967
17,073
17,179
17,285
17,391
17,500
17,608
17,717
t
0Ц.
+20,4
20,5
20,6
20,7
20,8
20,9
21,0
21Д
21,2
21,3
21,4
21,5
21,6
21,7
21,8
21,9
22,0
22,1
22,2
22,3
22,4
22,5
22,6
22,7
22,8
22,9
Упругость
мм.
17,826
17,935
18,047.
18,169^
18,271 f
18,383~
18,495
18,610
18,724
18,839
18,954
19,069
19,187
19,305
19,423
19,541
19,659
19,780
19,901
20,022
20,143
20,265
20,389
20,514
20,639
20,763
ОЦ.
+23,0
23,1
1 23,2
Р"23,3
[«2Э,4
23,5
23,6
23,7
23,8
23,9
24,0
24Д
24,2
24,3
24,4
24,5
24,6
24,7
24,8
24,9
25,0
25Д
25,2
25,3
Упругость
мм.
20,888
21,016
21,144
21,272
21,400
21,528
21,659
21,790
21,921
22,053
22,184
22,319
22,453
22,588
22,723
22,858
22,996
23,135
23,273
23,411
23,550
23,692
23,834
23,976
—[544 -
Процентное содержаніе амміака въ растворахъ
различнаго уд?льнаго в?еа.
ч н
Уд?
в?съ
1,000
0,993
0,986
0,979
0,972
0,966
0,959
0,952
0,946
0,940
о
ей о
? W
10
11
12
13,
і. .^Ы
^/t.
1J
17
18
19
ід?ржа-
мміака.
0
1,6
3,3
5,0
6,6
8,2
10,1
12,0
13,6
15,4
ч g<
0,933
0,927
0,921
0,915
0,909
0,903
0,898
0,892
0,886
адусы
омэ.
& w
20
21
22
23
24
25
26
27
28
erf СЗ
1 а
8 *
о"- Я
17,5
19,4
21,3
23,4
25,6
27,8
29,8
32,4
35,2
Процентное содержаніе хлористаго водорода въ
растворахъ различнаго уд?льнаго в?еа.
я о,
Й К
Р,
. га
1,000
1,005
1,010
1,015
1,020
1,025
1,030
1,035
1,040
1,045
1,050
1,055
1,060
1,065
1,070
Градусы
Бомэ.
0,0
0,7
М
2,1
2,7
3,4
4Д
4,7
5,4
6,0
6,7
7,4
8,0
8.07
9А
Процентное
содержаніе
СШ.
0,16
1,15
2.14
3,12
4,13
5,15
6,15
7,15
8,16
9,16
10,17
11,18
12,19
13,19
14,17
И сц
н к
р*
га
1,075
1,080
1,085
1,090
1,095
1Д00
1,105
1,110
1,115
1,120
1,125
1,130
1,135
1,140
1,1425
Градусы
Бомэ.
10,0
10,6
11,2
11,9
12,4
13,0
13,6
14,2
14,9
15,4
16,0
16,5
17,1
17,7
18,0
Процентное
содержаніе
СШ.
15,16
16,15
17,13
18,11
'19,06
20,01
20.97
21,92
22,86
23,82
24,78
25,75
26,70
27,66
28,14
і ^
« о,
Sag
Я Я
га
и м
га
1,145
1,150
1,155
1,160
1,165
1,170
1,175
1,180
1Д85
1,190
1,195
1,200
18,3
18,8
19,3
19,8
20,3
20,9
21,4
22,0
22,5
23,0
23,5
24,0
Процентное
содержаніе
СШ.
28,61
29,57
30,55
31,52
32,49
33,46
34,42
35,39
36,31
37,23
38,16
39,11
— 545 —
Процентное содержані? S03 и H2S04 въ растворахъ
различнаго уд?льнаго в?са.
я ?*
О 1 _ F
<-< Я
Ра
и в
О,
С *
ш ?
и
«
1,000
1,010
1,020
1,030
1,040
1,050
1,060
1,070
1,080
1,090
1,100
1,110
1,120
1,130
1,140
1,150
1,160
1,170
1,180
1,190
1,200
1,210
1,220
1,230
1,240
1,250
1,260
Градусы
Боыэ.
0
1,4
2,7
4,1
5,4
6,7
8,0
9,4
10,6
11,9
13,0
14,2
15,4
16,5
17,7
18,8
19,8
20,9
22,0
23,0
24,0
25,0
26,0
26,9
27,9
28,8
29,7
100 в?с. частей
содержать хтшч.
ЧИСТОЙ КИСЛОТЫ
въ о/0.
SO,.
0,07
1,28
2,47
3,67
4,87
6,02
7,16
8,32
9,47
10,60
11,71
12,82
13,89
14,95
16,01
17,07
18,11
19,16
20,21
21,26
22,30
23,33
24,36
25,39
26,35
27,29
28,22
H2S04.
0,09
1,57
3,03
4,49
5,96
7,37
8,77
10,19
11,60
12,99
14,35
15,71
17,01
18,31
19,61
20,91
22,19
23,47
24,76
26,04
27,32
28,58
29,84
31,11
32,28
33,43 '
34,57
«3. 1„ Ч
™ S* Й
1-4 Г* g
»!
я
Ю О
ю
>> °
1,270
1,280
1,290
1,300
1,310
1,320
1,330
1,340
1,350
1,360
1,370
1,380
1,390
1,400
1,410
1,420
1,430
1,440
1,450
1,460
1,470
1,480
1,490
1,500
1,510
1,520
1,530
Градусы
Бомэ.
30,6
31,5
32,4
33,3
34,2
35,0
35,8
36,6
37,4
38,2
39,0
39,8
40,5
41,2
' 42,0
42,7
43,4
44,1
44,8
45,4
46,1
46,8
47,4
48,1
48,7
49,4
50,0
100 в?(
;. частей
содержать химлч.
чистой кислоты
въ о/0.
so3.
29,15
30,10
31,04
31,99
32,94
33,88
34,80
35,71
36,58
37,45
38,32
39,18
40,05
40,91
41,76
42,57
43,36
44,14
44,92
45,69
46,45
47,21
47,95
48,73
49,51
50,28
51,04
H2S04
35,71
36,87
38,03
39,19
40,35
41,50
42,66
43,74
44,82
45,88
46,94
48,00
49,06
50,11
51,15
52,15
53,11
54,07
55,03
55,97
56,90
57,83
58,74
59,70
60,65
61,59
62,53
Неорганическая химіл. 35
— 546 —
и р.
а и
? ¦
1,540
1,550
1,560
1,570
1,580
1,590
1,600
1,610
1,620
1,630
1,640
1,650
1,660
1,670
1,680
1,690
1,700
1,710
1,720
1,730
1,740
1,750
а
р
Ш а
50,6
51,2
51,8
52,4
53,0
53,6
54,1
54,7
55,2
55.8
56,3
56,9
57,4
57,9
58,4
58,9
59,5
60,0
60,4
60,9
61,4
61,8
100 нъс
, частей
содержать химич.
чистой кислоты
въ о/0.
SOg.
51,78
52,46
53,12
53,80
54,46
55,18
55,93
56,68
57,40
58,09
58,77
59,45
60,11
60,S2
61,57
62,29
63,00
63,70
64,43
65,14
65,86
66,58
) HaSO|.
63,43
64,26
65,08
65,90
66,71
67,59
68,51
69,43
70,31
71,16
71,99
72,82
73,64
74,51
75,42
76,30
77,17
73,04
78,92
79,80
80,68
Sl,50
» a,
»Л Si lJ
n
" 2
n
« Б
1,760
3,770
1,780
1,790
1,800
1,810
1,820
1,822
1,824
1,826
1,828
1,830
1,832
1,834
1.836
1,838
1,840
1,8410
1,8415
1,8400
1,8390
Градусы
Бомэ.
62,3
62,8
63,2
63,7
64,2
64.6
65,0
65,1
65,2
65,3
65,4
—
—
—
—
65,8
65,9
—
—
—
—
100 в?с
:. частей
содержат* химия.
чистой кислоты
въ %.
so3.
67,30
68,02
68,98
69,96
70,94
72,08
73,51
73,80
74,12
74,49
74,86
75,19
75,53
75,96
76,57
77,23
78,04
79,19
80,16
80,98
81,39
H2S04.
82.44
83,32
84,50
85,70
86,90
88,30
90,05
90,40
90,80
91,25
91,70
92,10
92,52
93,05
93,80
94,60
95,60
97,00
98,20
99,20
99,70
При опред?деніи содоржанія с?рной кислоты въ растворахъ по
уд?льному в?су данная таблица даетъ точные результаты только для
ыюлн? чистое кислоты; для растворовъ не вполн? чистой кислоты
полученный числа» будутъ только приблизительный. Еслиопред?пені? уд?ль-
наго в?са произведено при т?лшератур? выше или ниже 15°, то нужно
для каждаго градуса выше иди ниже 15° прибавить и отнять;
0,0006 прл хяслотЬ уд?льи. в?са до 1,170
0,0007 ". отъ 1,170 до 1,450
0,0008 » 1,450 » 1,580
0,0009 ¦ . . » 1,580 » 1,750
0,0010 » 1,750 » 1,840
547
Процентное содержані?' азотной киелоты въ рас-
творахъ различнаго уд?лънаго в?еа.
*а
Я О,
— О.
И t:
& ч
• «
14 в
1,000
1,025
1,050
1,075
1,100
1,125
1,150
1,175
1,200
2,225
1,250
1,275
Градусы
Бомэ.
0
3,4
7,7
10,0
13,0
16,0
18,8
21,4
24,0
26,4:
28,8
31,1
Процентное
сод?ржаніе
шо3.
одо
4,60
8,99
13,15
17,11
21,00
24,84
28,63
32,36
36,03
39,82
43,64
н
Я р,
м1 р.
и к
S. к
" g
К с:
1,300
1,325
1,350
1,375
1,400
1,425
1,450
1,475
1,500
1,510
1,520
Градусы
Бомэ.
33,3
35,4
37,4
39,4
41,2
43,1
44,8
46,4
48,1
48,7
49,4
Процентное
содержані?
Ш03.
47,49
51,53
55,79
60,30
65,30
70,98
77,28
84,45
94,09
98,10
99,67
Присутствіе въ азотной кислот? другихъ окисловъ азота (КдОзДОа^
изм?няетъ зам?тно уд?льный в?съ водныхъ растворовъ азотной
кислоты, а потому процентное сод?ржані? (НКОз) въ водныхъ раство-
рахъ азотной кислоты, содержащей окислы азота, не можеіъ быть
определено точно на основаніи вышеприведенной таблицы.
Русскія и метрическія м?ры.
Русскія м?ры:
Пудъ
Фуятъ
Золотникъ
Доля
Верста
Сажень
Вершокъ
Футъ
Дюймъ >
Квад. верста
Десятина
Куб. сажень
Четверть
Четверикъ
Ведро
Винн. бутыл.
Метрическія:
=16,380496 яндогр.
=0,40951241 »
=4,2657543 грамм
=44,434940миллягр.
=1066,80 н?трамъ.
=2,13360 »
=44,4500 миллимет.
=0,304800 метра.
=25,4000 миллимет.
=1,13806 кв. килом.
=1,09254 гектар амъ.
=9,71268 куб. метр.
=20,991 гектолитр.
-26,239 литрамъ.
=12,299
=--0,76871 литра.
Метрическія:
Метр, тонна -
Килограммъ
Граммъ
Миллиграммъ
Километръ
Метръ
Сантиметръ :
Метръ
»
Квадр. килом.:
Г?ктаръ :
Кубич. метр,
(стеръ):
Гектолитръ
ДиТрЪ :
Гектолитръ
Литръ
Русскія м?ры:
=61,048211 пудамъ
=2,4419284 фунт.
=0,23442513 золот.
=0,022505 доли.
=0,937383 версты.
=1,40607 аршин.
=0,224972 вершка.
=3,28084 фута.
=39,3701 дюймовъ.
:0,878687 кв. вер.
:0,915299 десятин.
=2,77987 куб. арш.
=0,47639 четверти.
=0,30489 гарнца.
=8,1305 ведрамъ.
=1,3009 винн. бут.
35*
- 548 —
В ? е ы.
Химическіе в?сы (рис. 103) представляютъ собою
равнопл?чій рычагъ съ подв?шенными къ нему двумя
металлическими чашками. Для того, чтобы в?сы были
чувствительны къ неболыпимъ изм?неніямъ въ в?с?, т.-е.
чтобы треніе между частями в?совъ было возможно малое,
д?лаютъ центральную ось коромысла изъ агата или твер-
Рис. 103. Химическіе в?сы.
Дой стали въ вид? тонкаго острія; послЬднее покоится
на гладкой иодставк? изъ твсрдаго камня. Таковы же и
оси, на которыхъ висятъ чашки; он? также л?жатъ на
твердыхъ гладкихъ поверхяостяхъ. Эти три оси
параллельны другъ другу и лежатъ въ одной плоскости.
Когда взв?шиваніе окончено, коромысло и чашки
посредствомь особаго приспособленія (для „арретирова-
нія") приподнимаются надъ подставками: для этого
осторожно поворачиваюіъ вправо головку рычага,
проходящего въ подставк? в?совь. Грузы на чашки в?совъ по-
м?щаются только тогда, когда в?сьт арретированы. Спу-
— 549 —
скается коромысло на подставки осторожнымъ медлен-
нымъ вращеніемъ головки рычага вл?во; при этомъ, какъ
только обозначается направленіе, въ которомъ наклоняется
коромысло, сейчасъ же опять медленно арретируютъ в?сы
и, сообразно наблюденному наклону, прибавляютъ или
убавляютъ количество разнов?сокъ. Такое обращепіе съ
в?сами на дольше сохранитъ ц?лостность осей и под-
ставокъ.
Химическіе в?сы даже средняго достоинства еще мо-
гутъ показывать 0,0001 гр.
Такъ какъ очень маленькіе разнов?сы неудобны для
манипулированія, то у в?совъ д?лается еще сл?дующее
приспособленіе: правая половина коромысла отъ средины
до конца разд?лена на 10 равныхъ частей; на эти д?-
ленія можно пом?щать особой рукояткой разнов?съ въ
0,01 гр., называемый „рейтеромъ" и сд?ланный изъ
платиновой проводом. Разнов?съ, изв?стао, д??-
ствуетъ пропорціонально разстоянію отъ оси колебанія,
такъ что каждое д?леніе коромысла соотв?тству?тъ одному
миллиграмму. Такимъ образомъ при взв?шиваніи ц?лые
граммы, ихъ десятый и сотыя доли опр?д?ляются
положенными разнов?сами, а тысячныя и десятитысячный
доли грамма — рейтеромъ, который передвигается сл?ва
направо до полнаго равнов?сія.
Наступленіе равнов?сія наблюдаютъ по колебаніямъ
стр?лки, связанной съ коромысломъ; колебанія стр?лки
отсчитываются по шкал?, прикр?пленной къ в?самъ
сзади стр?лки. Равнов?сіе будетъ тогда, когда стр?лка
будетъ колебаться на одинаковое число д?леній отъ
средней на шкал? линіи.
В?сы должны стоять неподвижно и вполя?
горизонтально.
Передъ каждымъ взв?шиваніемъ необходимо пров?-
рять, сохраняютъ ли сами в?сы положеніе равнов?сія.
Разнов?сы никогда не сл?дуетъ брать руками, а
захватывать ихъ пинцетомъ.
— 550 —
Списокъ аппаратовъ, необходимыхъ для
начальны» занятій по химіи.
я
я
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
НАЗВАНШ ПРЕДМЕТОВЪ.
о
в
ч
о
[Химнческіе в?сы (нагрузка 50 гр.,
чувствительность 1—0,5миллигр.)]2)
[Разнов?сы къ нимъ никкел.]
В?сы Роберваля до 1 килогр
Разнов?сы къ нимъ до 50 гр. обыкн.
[Барометръ-анероидъ]
Сииртовыя лампы стекл
Паяльная трубка обыкнов
[Бензиновая лампа Бартеля]
Термометръ Ц. отъ 0° до 360° норм.
стекла
Ареометры для кислотъ но Бомэ . . .
[Водяная баня м?дная]
[Воздушная баня жел?зная]
Жел?зный котелокъ
Жел?зный штативъ безъ колецъ и за-
жимовъ
[Жел?зный штативъ съ
принадлежностями]
Жел?зный треножнякъ
Жел?зные треугольники
Стоим. *)
Руб.
24
3
5
1
6
2
1
3
5
1
4
і) Ц?ны взяты изъ прейсъ-кураитовъ московскихь фирмъ.
а) Предметы, поставленные въ скобкахъ [ ], могуть быть пріобр?-
тены во вторую очередь*
551 —
18 Железные треугольники съ глиняными
муфтами . . .
19 Жел?зная сковородка
20 Тигельные щипцы
21 Ножъ для р?занія пробокъ
22 Напильники: 1 трехгранный и 2 круг-
лыхь разныхъ разм?ровъ
23 Ножницы
24 М?хи
25 [Пр?ссъ для пробокъ]
26 Сверла для пробокъ въ 6 штукъ . . .
27 Пинц?тъ м?дный
28 Деревянный штативъ для 12 проби-
рокъ
29 Жел?зныя ложки съ длинной
проволочной ручкой
30 Зажимы для часовыхь стеколъ ....
31 п Моровскіе
32 М?дная с?тка квадратная
33 Проволока жел?зная:
34 „ м?дная
35 „ алюминіевая
36 Щеточки для чистки нробирокъ . . .
37 Роговая ложка
38 Каучуковыя трубки 3 разм?ровъ по
1 аршину
39 Фильтровальная бумага
41) Лакмусовая бумага красная
41 ., ., синяя."
552 —
НДЗВАН1Я ПРЕДМЕТОВ!».
_
о
g
о
аэ
v
о
Стоим.
Руб.
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
Пробирокъ обыкновенныхъ
Воронокъ б?лаго стекла разы, разм?ровъ
Воронокъ съ длинной трубкой (25—35
к. с.)
Воронка д? лительная открытая, съ
длинной трубкой въ 30 гр .
Колбы плоскодонныя—по 50 гр. . .
я юо „ . .
п 500 „ . .
„і.ооо „ . .
Реторты изъ тугоплавкаго стекла въ
іоо гр. . . . :
Часовыхъ стеколъ . . . *
Двугорлыя Вулъфовы склянки по 500 гр.
Гн?здо стакановЪ'ВЪ 8 штукъ« /. . .
Цилиндръ простой въ 500 к. с. . . .
я для собиранія газовъ въ
100 к. с *
Цилиндръ для собиранія газовъ въ
300 к. с
Палочки и трубочки стекл. разныхъ
діаметровъ
Трубочки изъ тугоплавкаго стекла съ
шариками
Хлорокальціевы трубки прямыя. . . .
п „ U-образныя. .
Стеклянный шпатель
Цилиндръ м?рный въ 500 к. с. . . .
Колба м?рная въ 1 литръ
50
5
ч
1
10
10
'5
2
3
2 п
2*
1
1
1
1
Зф.
2
1
1
1
— 553 —
&
Ъ
НАЗВАШЯ ПРЕДМЕТОВЪ.
1
5
64
65
66
67
68
69
70
71
72
78
74
75
76
77
78
79
80
81
82
Кюретки Мора по 50 к. с
Пипетки въ 10 к. с
Эвдіометрическая трубка 50 к. с. съ
д?леніями г/10
Фарфоровые тигли № 00
Фарфоровыя чашки въ 110 к. с. . . .
Ступка фарфоровая
Фарфоровый шпатель
Холодильникъ Либиха
[Стеклянная ванна]
[Газометръ Берцеліуса съ 2 кранами
въ 4 литра]
[Эксикаторъ]
[Аппаратъ Киппа]
[Дефлегматоръ]
Нокровныя для цилиндровъ стекла *).
Банокъ простыхъ по 100 гр
„ съ притертыми пробками по 50 гр.
Реактивныхъ склянокъ въ 250 к. с. .
Итого въ первую
очередь на сумму. . .
3
10
5
20
Всего
і) Для соединения отд?льныхъ частей нриборовъ нер?дко
употребляется мастика, которая приготовляется сл?дующимъ образоиъ:
сшгавляютъ (по в?су) 100 частей к&нвфола и 2Ь частей воска и къ
сплавленной масс? прибавляютъ 40 частей прокаленной дтуміи. Талая
мастика хорошо пристаетъ къ стеклу, дереву и м?тадламъ.
— 554
Спиеокъ вещеетвъ, необходимыхъ для яачальныхъ
занатій по химіи 1).
названія веществъ.
С?рная кислота (crudum)
я „ (purum) .
Соляная ., (crudum)
(purum) .
Азотная „ (crudum)
(purum) .
Уксусная ,, (ледяная)
Борная я
Виннокаменная кислота .
Бромъ
іодъ
С?ра (въ яалочкахъ). . .
„ (с?рный цв?тъ). . .
Фосфоръ желтый
„ красный . . . .
Сурьма металлическая . .
„ хлористая
Калій хлористый
„ хлорноватый....
„ азотнокислый . . .
„ углекислый . . . .
Количество въ
граэшахъ.
3 кг р.
і „
2 „
1 „
1 „
1 „
250 гр.
200 „
100 „
100 „
25 „
500 „
250 „
100 „
100 „
250 „
100 в
500 „
500 „
500 „
500 ..
Стоимость
въ
рубдяхъ.
0,39
0,45
0,28
0,50
0,48
0,52
0,25
0,16
0,30
0,65
0,53
0,12
0,08
0,47
0,62
0,63
0,60
0,35
0,58
0,41
0,54
і) Поименованный вещества требуются не одновременно, а
потому и закупка ихъ можетъ быть сд?лана но частямъ.
Ц?ны поставлены беаъ посуды, стоимость коей около 7—8 р.
- 555 -
названія веществъ,
Количество въ
граммахъ.
Стоимость
въ
рубляхъ.
Калій бромистый
іодистый
двухромоішслый
марганцовокислый , .
хромокислый
роданистый
?дкій
металлическій
кремнекислый 10°/0-ый ....
Натрій хлористый
„ с?рнокислый
„ с?рноватистый
„ азотнокислый
азотистокислый
фосфорнокислый
углекислый
двууглекислый
уксуснокислый
мышьяковистокислый
мышьяковокислый
?дкій
металлическій
Аммоній хлористый
с?рнокислый ,
азотнокислый
щавелевокислый ,
углекислый .
гидратъ (нашатырный спиртъ)
25°/о
50 гр.
50 „
1 кгр.
250 гр.
250 „
50 „
250 „
10 „
150 „
500 „
250 „
250 в
250 „
50 „
250 „
1 кгр.
500 гр.
250 „
250 „
100 „
100 „
50 „
250 „
250 „
250 „
100 „
250 я
500 „
- 556 -
тіазванія веществъ.
Количество въ
граммахъ,
Стоимость
въ
рубляхъ.
Кальцій гидратъ
„ хлористый (сухой)
,. карбидъ
Стронцій азотнокислый
Барій хлористый
,, азотнокислый
„ перекись
Магній хлористый
„ м?таллическій лентой
„ „ порошкомъ . .
Цинкъ с?рнокислый
„ металлическій въ зернахъ . .
палочкахъ.
Кадмій с?рнокислый
Ртуть хлорная (HgCl2)
„ азотнокислая (закись)
„ окись
., металлическая
Алюминій квасцы
„ металлическій (проволока)
, (жесть). . .
); „ порошокъ .
Олово двухлористое
„ четыреххлористое
„ металлическое
Свинецъ уксуснокислый
„ азотнокислый ..,,,...
перекись
500 гр.
250 я
250 я
100 я
250 я
250 „
50 я
250 „
25 „
25 я
250 я
500 „
500 я
25 я
200 „
50 „
100 я
500 „
250 я
25 „
25 я
100 я
100 я
100 я
50 я
250 я
250 я
50 щ
557
названія веществъ.
Количество въ
граммахъ,
Стоимость
рубляхъ.
Висмутъ азотнокислый
Хромовые квасцы
Хромовая кислота
Марганецъ хлористый *. . .
л перекись
Жел?зо хлорное (FeCla)
я с?рнокислое (купоросъ). . .
„ металлическое въ порошк? .
Желтая кровяная соль
Красная „ „
Кобальть азотнокислый
„ хлористый
Никкель хлористый
Серебро азотнокислое
М?дь с?рнокислая
„ окись
„ металлическая (стружки) . . .
Платина' въ проволок?
и ЖсСТЬ
С?рный э?иръ
Винный спиртъ 95°/0
Скипидаръ русскій. ;
Азбостъ
С?роуглеродъ
Гумми-арабикъ . . .
Индиго
Ваз?линъ . . .
50 гр
250
50
50
500
100
250
100
50
50
25
25
50
25
500
100
100
0,25
0,25
250
1 бут.
100 гр
100 „
250 „
100 „
100 .
0,65
0,15
0,30
0,13
0,16
0,13
0,08
0,17
0,23
0,23
0,30
0,21
0,25
0,90
0,50
0,45
0,57
0,75
0,75
0,30
1,05
0,20
0,20
0,20
0,30
1,10
0,10
- 558
НАЗВАНЫ ВЕЩЕСТВЪ.
Количество въ
граммахъ.
Стоимость
въ
рубляхъ.
Ф?нолфталеинъ
Лакмусъ
Бура
Параффинъ
Всего на сумму. .
25 гр.
100 „
250 „
0,50
0,20
0,06
0,25
44,17і)
1) Ц?ны матеріаламъ въ зависимости отъ рынка могугъ изм?-
няться въ ту и другую сторону
559 —
Приготовл?ніе растворовъ важн?йшихг
реактивовъ.
1. С?рная кислота 1 ч. на 5 ч. воды.
2. Соляная „ 1 ч., уд. в. 1,19, на 3 ч. воды.
3. Азотная „ 1 ч., уд. в. 1,2, на 2 ч.
4. Уксусная „ 1 ч. на 10 ч. воды.
5. Щавелевая „ 1 ч. на 9 ч. „
6. Випнокам. „ 1 ч. на 10 ч. и
7. Царская водка на 3 ч. кр?пкой НС1 1 ч. конц.
HNO,.
8. С?роводородная вода — готовится насыщенный
растворъ.
9. Бромная вода
10. іодная я насыщенные растворы.
11. Хлорная „
12. Амміакг, уд- в. 0,925, разбавляется равнымъ
объемомъ воды (отв?чаетъ 10°/0 NH3).
13. Натрій ?дкіи 1 ч. на 10 ч. воды.
14. ,, углекислый 1 ч. на 5 ч. воды.
15. „ фосфорнокислый 1 ч. на 10 ч. воды.
16. ., уксуснокислый 1 ч. на 4 ч. воды.
17. я с?рнокислый 1 ч. на 5 ч. воды.
18. „ с?рноватистокислый 1 ч. на 20 ч. в.
19. „ азотистокислып 1 ч. на 2 ч. воды.
20. „ с?рнокислый 1 ч. на 10 ч. воды.
21. Еалій двухромокислый 1 ч. на 10 ч. воды.
22. „ хромошслый 1 ч. на 10 ч. воды.
23. „ желуьзистосинеродистьш 1 ч. на 12 ч. в.
24. „ жел?зоеиперодіьетый 1 ч. на 12 ч. в.
25. „ іодистый 1 ч. на 10 ч. воды.
26. „ роданистый 1 ч. на 10 ч. воды.
27. „ хлористый 1 ч. на 20 ч. воды.
28. ,, ?дкгй 1 ч. на 10 ч. воды.
— 560 —
29. Еалій азотнокислый 1 ч. па 10 ч. в.
30. Аммоній хлористый 1 ч. на 9 ч. в.
31. „ углекислый 1 ч. на 3 ч. в. съ приба-
вленіемъ 1 ч; амміака, уд. в. 0,96.
32. Аммоній с?рнокислый 1 ч. на 4 ч. в.
33. „ щавелевокислый 1 ч. на 20 ч. в.
34. „ с?рнистый: амміакъ насыщается с?-
роводородомъ и прибавляется еще равный объемъ
амміака.
35. Известковая вода готовится настаиваніемъ воды
на избытк? гашеной извести.
36. Хлористый кальцій 1 ч. на 10 ч. в.
37. Азотнокислый стронцій 1 ч. на 10 ч.
38. С?рнокислый кальцій 1 настаиваютъ воду на
39. ., стронцій) избытк? солей.
40. Азотнокислый баргй 1 ч. на 10 ч. воды.
41. Хлористый барій 1 ч. на 20 ч. в.
42. С?рнокислый магній 1 ч. на 10 ч. в.
43. в цинкъ 1 ч. на 10 ч. в.
44. „ кадмгй 1 ч. на 10 ч. в.
45. Азотнокислая закись ртути 1 ч. на 20 ч. воды
съ прибавленіемъ металлической ртути.
46. Хлорная ртуть 1 ч. на 20 ч. в.
47. Алюмингевы квасцы 1 ч. на 10 ч. в.
48. Хромовые квасцы 1 ч. на 10 ч. в.
49. Двухлористое олово 1 ч. на J 5 ч. в.
50. Четырехлористое олово 1 ч. на 10 ч. в.
51. Уксуснокислый свинецъ 1 ч. на 10 ч. в.
52. Азотнокислый висмутъ 1 ч. на 20 ч. в. съ
прибавленіемъ кр?пкой HNOg.
53. Хлористый марганецъ 1 ч. на 10 ч. в.
54. Жел?зный купорось 1 ч. на 10 ч. в.
55. Хлорное оюел?зо 1 ч. на 10 ч. в.
56. Азотнокислый кобальтъ 1 ч. на 20 ч. в.
57. Азотнокислый никкель 1 ч. на 20 ч. в.
— 561 —
58. С?рнокислая м?дь 1 ч. на 10 ч. в.
59. Азотнокислое серебро 1 ч. на 20 ч. в
60. Хлорная платина 1 ч. на 20 ч. в.
61. Хлористое золото 1 ч. на 30 ч. в.
62. Баритовая вода 1 ч. гидрата окиси барія
20 ч. в.
63. Фенолфталеинъ 1 ч. растворяютъ ъъ 100
спирта.
64. Ниросуръмяный калій 1 ч. на 200 ч. в.
65. Индиго 1 ч. на 100 ч. в.
Неорганическая хииія
36
Рекомендуемый книги по химіи (теоретической и
неорганической) на русскомъ язык?.
I. Самыя элементарныя св?д?нія по химіи
можно получить и з ъ с л ? д у то щ и х ъ к н и ж е к ъ:
1. Роско. Химія. Спб., 1890. Ц. 40 к.
2. Бутлеровъ. Основныя поыятія химіи. Спб., 1885.
Ц. 40 к.
3. Реформатскій, А. Химія и жизнь природы. М.,
1903. Ц. 20 к.
4. Павловъ. Общепонятный бес?ды о химическихъ
явленіяхъ. Изд. 2-е. М., 1900. Ц. 25 к.
5. Мюрь, //. Химія огня. М., 1899. Ц. 85 к.
6. Кимжтсг, Л. Химія жизни и здоровья. М., 1899.
Ц. 85 к.
7. Лассаръ-Конъ. Химія въ обыденной жизни. Спб.,
1897. Д. 1 р.
8. Фарадей, М. Исторія св?чки. Спб., 1893. Ц. 75 к.
9. Лъюзъ. Воздухъ и вода. Спб., 1898 г.
10. іірясловъ. Вода и ея значеніе въ природ?. М.,
1904. Д. 50 к.
11. РеформатскЫ. Гор?піе. М., 1904. Д. 10 к.
12. Шарвгьнъ. Использованіе азота воздуха. М.3 1909.
Д. 15 к.
13. Варгинъ. Основныя св?д?нія по химіи. Спб.,
1912. Д. 30 к.
II. Самые краткіе курсы химіи въ
элемента р н о м ъ изложеніи сл?дующіе:
1. Яковлевъ. Учебникъ химіи1). Спб., 1903. Д. 40 к.
і) Этотъ курсъ читался въ классахъ для рабочихъ на Шлиссель-
бургскомъ тракт?.
— 563 —
2. Богдановская, В?ра. Начальный учебникъ химіи.
Сдб. Ц. 35 к.
3. Рамзаіі. Краткій учебникъ неорганической и
физической химіи. М., 1898. Ц. 1 р. 25 к.
4. Григоръевъ* Краткій курсъ химіи. Спб., 1901.
Д. 80 к.
5. Арендтъ. Основныя на'чала химіи и минералогіи.
Спб., 1904. Ц. 2 р. 50 к.
6. Оствалъдг. Школа химіи. Вып. I. M., 1904.
Д. 1 р. 25 к. Вып. II. Одесса, 1905. Д. 1 р.
Т. Аренсъ. Химія обыденной жизни. Спб., 1904.
8. Лассаръ-Еопъ. Введете въ химію. М., 1907.
Д. 1 р. 20 к.
9. Кукулеско. Элементарный курсъ химіи. Кіевъ,
1909. Д. 80 к.
10. Ипатьееъ и Сапожннковъ. Краткій курсъ химіи.
Спб., 1909. Ц. 1 р. 25 к.
11. Созоповг и Верховскт. Элементарный курсъ
химіи. Спб., 1911. Д. 1 р. 50 к.
12. Iluca/ржевскій. Первое знакомство съ химіей.
¦ Кіевъ. Д. 80 к.
111. Бол?е подробное ознакомленіе съ
основами химіи можно получить изъ сл?ду-
ющихъ книгъ:
1. Еукъ. Новая химія. М., 1897. Д. 1 р. 75 к.
2. Сборникг статей въ помощь самообразование м.
3-й вып. 2-е изд. М., 1900. Д. 1 р. 20 к.
3. Физжо - математическій ежегодпжъх). № J —
1900. Д. 2 р. 95 к. и № 2—1902. Д. 2 р. 50 к.
4. Вюрцъ. Атомическая теорія. Кіевъ, 1882 г.
5. Оствальдъ, В. Основанія теоретической химіи.
М., 1902. Д. 2 р. 70 к.
і) Изданіемъ «Сборника» и ^Ежегодника» зав?дуетъ А. Рефор-
матскій.
36*
— 564 —
6. Мегсерь, Ж. Основанія теоретической химіи. Спб.,
J 894. Ц. 2 р.
7. Нернетъ, Б. Теоретическая химія. Спб., 1904.
Ц. 4 р.
8. Вантъ - Гоффъ. Восемь лекцій по физической
химія. Рига, 1903. Ц. 80 к.
9. Вантъ - Гоффъ, Зависимости между физич. и
химич. свойствами и составомъ. Спб., 1893. Ц. 1 р. 20 к.
10. Круксъ. О происхождении химическихъ элементовъ.
М., 1902." Ц. 50 к.
11. ФлавицкШ. Очеркъ развитія знаяія о химическихъ
олементахъ. Казань, 1894. Ц. 40 к.
12. Бутлеровъ. Химическое строеніе и теорія зам?-
щенія. Спб., 1885. Ц. 50 к.
13. Бекето?ъ. Основные начала термохиміи. Ц. 25 к.
14. Янъ. Основанія термохиміи. Спб., 1893.
15. Ванъ-Девеитеръ. Краткій курсъ физической химіи.
М.5 1902. Ц. 80 к.
16. Каблуковъ, И. Основныя начала физической химіи.
Вып. I. М., 1900. Ц. 1 р. 50 к. Вып. И. М., 1902.
Ц. 1 р. 50 к.
17. Люпке. Основанія электрохиміи. Спб., 1897.
Д. 1 р. 50 к.
18. Арреиіусъ. Современная теорія состава электро-
литическихъ растворовъ. Спб., 1890.
19. Хрущевъ. Введете въ изученіе химическихъ рав-
нов?сій.
20. Гулъдбёргъ и Вате. Изсл?дованіе силъ химиче-
скаго сродства.
21. Вантъ-Тоффъ, Химическое равнов?сіе. М., 1902.
Ц. 40 к.
22. Рейхлеръ. Физико-химическія теоріи. Спб., 1903.
Д. 2 р. 50 к.
23. Рудольфи. Общая и физическая химія. Кіевъ,
1902. Ц. 60 к.
24. Осштльдъ. Катализъ. М., 1904. Ц. 30 к.
— 565 —
25. Вантъ-Гоффъ. О теоріи раетворовъ. Рига, 1903.
Ц. 50 к.
26. Тапатаръ и Гершковичъ. Теорія раетворовъ.
Одесса, 1895.
27. Гофманъ. Радій й его лучи. Спб., 1903.-Ц. 70 к.
28. Гизель. О радіоактивныхъ веществахъ. М., 1903.
Ц. 35 к.
29. Сколодвская-Еюри. Радій и радіоактивность. М.,
1905. II. 1 р.
30. Соддм. Радіоактивность. Спб., 1905. Ц. 2 р.
31. Штаркъ. Диссоціація и превращеніе химическихъ.
атомовъ. Спб , 1904. Ц. 50 к.
32. Д. Мендел?евъ. Два лондонекихъ чтенія. Спб.,
1895. Ц. 50 к.
33. Сапожников^. Общая теоретическая химія. Спб.,
1906. Ц. 2 р. 50 к.
34. Арреніусъ. Теоріи химіи. Спб., 1907. Ц. 1 р. 50 к.
35. Н. Морозовъ. Періодическія системы строеиія
вещества. М., 1907. Ц. 3 р.
36. Н. Морозовъ. Д. й. Меяделвевъ и значеніе его пе-
ріодическои системы для химіи будущаго. М., 1907. Ц. 75 к.
37. Оствалъдъ. Важн?йшія свойства коллоиднаго со-
стояпія матеріи. Спб., 1910. Ц. 40 к.
38. Вепыемъ. Современное развитіе физики. Одесса,
1908. Ц. 2 р.
39. Томсонъ. Корпускулярная теорія вещества. Одесса,
1900. Ц. 1 р. 20 к.
40. Жебонъ. Эволюція матеріи. Спб., 1909. Ц. 1 р. 50 к.
41. Губкина. Воспоминания о Д. И. Меядел?ев?.
Спб., 1908. Ц. 2 р.
42. Арреніусъ. Образованіе міровъ. Одесса, 1908.
Ц. 1 р. 75 <к.
43. Рамзай. Благородные и радіоактивные газы.
Одесса, 1909. Ц. 25 к.
44. Еаблуко?ъ. Нов?йщія теоріи строенія атомовъ.
М., 1908. Ц. 30 к.
— 566 —
45. Же-Бланъ. Учебникъ электрохиміи. М., 1908. Ц.
2 р. 50 к.
46. Оствалъдъ. Основы физической химіи.
47. Итоги науки. Изд. Т-ва „Міръ". М., 1911.
48. Новыя идеи въ физик?. Сборникъ Л» 1, Л» 2
и № 3. Спб., 1911.
IV. а") Курсы неорганической химіи по
объему близкіе къ нашему курсу:
1. МотъшщЫШ. Начальный курсъ химіи. 8-е изд.
Спб., 1904. Ц. 1 р. 50 к.
2. Ремсет. Вв?деніе къ изученію химіи.
Неорганическая химія. 2-е изд. М., 1906. Ц. 1 р. 75 к.
3. Еаблуковъ, И. Основный начала неорганической
аиміи. 4-е изд. М., 1908. Ц. 1 р. 50 к.
4. Ипатьевъ и Сапожнгіковъ. Курсъ ноорг. химіи.
Спб., 1902. Ц. 1 р. 90 к.
5. Сперапстй- Краткій курсъ химіи. 2-е изд. М.,
1908. Ц. 1 р. 25 к.
6. Дементьев*- Начальный курсъ химіи. Кіевъ, 1907.
И- 1 р. 80 к.
7. Еуриловъ. Учебникъ химіи. Екаторипославъ, 1909.
Ц. 3 р. .
8. Рамзагі. ііов?йіная химія. М., 1909. Ц. 2 р.
Ъ. Оотдалъдъ- Втедайа въ адутеьта тажл. Шътаъ.
1910. Ц. 1 р. 80 к.
10. Осиповъ. Л?кціи неорганической химіи. Харьковь.
1911. Ц. 2 р.
Ъ) Курсы б о л ? е обширные:
1. Флавицкіё- Общая или неорганическая химія.
3-е изд. Казань, 1907. Ц. 2 р. 50 к.
2. ГоллемапЪ- Учебникъ неорганической химіи. Спи.,
1905. Ц. 3 р. 60 к.
— 567 —
3. Горбова, Химическіе элементы и ихъ дрост?йшія
соединенія. Ч. I. Металлоиды. Спб., 1909.
4. Смитъ. Введеніе въ неорганическую химіто.
Одесса, 1911. Ц. 3 р. 50 к.
с) Самые полные курсы.
1. Мепделіьевъ, Д. Основы химіи. 8-е изд. Спб.,
1907. Ц. 5 р.
2. Оствальдъ. Основы неорганической химіи. М..
1902. Ц. 4 р.
V, Книги но исторіи химіи:
L Поповъ. Краткій очеркъ исторіи развитія
основной химической проблемы. М., 1904.
2. Са?чежовг. Исторія химіи.
3. Меншуткит, П. Очеркь развитія химическихъ
воззр?ній. Спб., 1888. Ц. 2 р.
4. Вюрцъ. Исторія химическихъ воззр?ній отъ
Лавуазье до нашихъ дней. Ц. 1 р.
5. Мейеръ, 9. Исторія химіи. Спб., 1899. Ц. 4 р.
6. Оствшъдъ. Путеводныя нити. М., 1908. Ц. 1 р.
40 к.
7. Морозову И. Вь поискахъ философокаго камня.
Спб., 1909. Ц. 2 р.
8. Ломоносовские сборнгькъ. Матеріалы для исторіи
развитія химіи въ Россіи. М., 1901. Ц. 2 р. 50 к.
9. Этельгардшъ. Лавуазье, его жизнь и научная
д?ятельность. Спб., 189L Ц. 25 к..
10. Жеишуткинъ, Б. Н. Ломоносовъ, какъ физике-
химикъ. Къ исторіи химіи въ Россіи. „Жур. Русск.
Физико-Химич. Общ.", 1904. Вып. 6—9.
11. Меншуткинъ Б. Н. М. В. Ломоносовъ. Спб.,
1911. Ц. 75 к.
— 568 —
12. Рамсей В. Оствальдъ. Изъ исторіи химіи. Спб.,.
1909. Ц. 75 к.
13. Оствальдъ. Великіе люди. Спб., 1910. Ц. 2 р.
50 к.
14. Ломопосовскій сборнжъ. Изданіе Академіи Наукъ.
Спб., 1911. Ц. 2 р.
VI. Книги, нолезныя при пр актическихъ.
занятіяхъ по химіи:
1. Федо. Химикъ-любитель. Спб., 1898. Ц. 1 р.
2. Жальчевскіе и Якобсонъ. Рядъ прост?йшихъ опы-
товъ для начальнаго обученія. Спб., 1901. Ц. 30 к.
3. Жуко?скій. Пособіе къ практическимъ занятіямъ.
по неорганической химіи. М., 1909. Ц. 65 к.
4. Еоноваловъ. Практическія занятія по общей
химіи. Кіевъ, 1906. Ц. 50 к.
5. Рамзай. Эксперимептальныя основанія
теоретической химіи для начинающихъ. М., 1887. Ц. 75 к.
6. Коренблитъ* Химическіе реактивы, ихъ приго-
товленіе, свойства, испытаніе и употр?бл?ніе. 2-е изд.
М., 1902. Ц. 2 р. 50 к.
7; Дъяконовъ и Лермоито?ъ. Руководство къ обра-
ботк? стекла на паяльномъ стол? Спб., 1902. Ц. 1 р.
8. Аббегъ и Герцъ. Практическая занятія по химіи.
Спб., 1905. Ц. 1 р. 25 к.
9. Эрдманъ, Руководство къ приготовлению и изсл?-
дованію химич. препаратовъ. М., 1899. Ц. 80 к.
10/ Вепдеръ. Приготовленіе и испытаніе неоргани-
ческихъ препаратовъ. М., 1904. Ц. 3 р.
11. Даммеръ. Доступные опыты по химіи. Спб., 1904.
Ц. 1 р.
' 12. Abraham: Сборникъ* элементарныхъ опытовъ па
физик?. Одесса, 1905. -Ц. 1 р. 50 к.
13. Сміьтъ. Введепіе въ химію. Руководство къ
практическимъ занятіямъ. М., 1905. Ц. 75 к.
— 569 —
14. Сапожншовъ. Практическая занятія,
параллельный курсу неорганической химіи. Спб., 1910. Ц. 85 к.
15. Постшковъ. Систематически курсъ практиче-
скихъ работь по. общей химіи. М., 1907.
16. Ипатьевъ. Руководство для практическихъ
занятой по химіи. Спб., 1905. Ц. 90 к.
17. Шейдъ. Химическіе опыты для юношества. Одесса,
1907. Ц, 1 р. 20 к.
18. С, Созоновъ u jB. Верховскій. Первыя работы по
химіи. Спб., 1908. Ц..85 к.
19. Михайленко, Я* Руководство къ практическимъ
занятіямъ по элементарному курсу химіи. Кіевъ, 1907.
Ц. 90 к.
20. Верховскій. Вытяжные шкапы. М., 1908. Ц. 50 к.
21. Верховскій. Техника постановки- химическихъ
опытовъ. Спб., 1911. Ц. 3 р. 50 к.
22. Бильцъ. Экспериментальное введете въ
неорганическую химію. Спб., 1912. Ц. 1 р. 25 к.
23. Захаро?г. Руководство къ первопачальнымъ
практическимъ занятіямъ по химіи. М., 1912. Ц. 60 к.
Именной указатель.
Авогадро, Г2, 232.
Лнаксим?нъ, 24.
Аиэсль, 162.
Амперъ, 72.
Аристотель, 28.
Лрреніуст», 233.
Луеръ, 305, 479.
Б?кксрель, 446.
Бекманъ, 96.
Бертло, 43, 2S9.
Бертолле, 47, 405.
Берц?ліусъ, 37, 61, ПО, ПО.
Бесс?меръ, 515.
Б?херъ, 29.
Бирк?лаидъ. 334.
Бойлъ, 20, 63, 160, 231.
Врандтъ, 270.
Бунзенъ, 305, 412, 431.
Бусс?нго, 198, 257.
Бутлеровъ, 111, 113.
Ваагс, 47.
Вантъ-Гоффъ, 229.
Ванъ-деръ-Ваальсъ, 72.
Вынклеръ, 147, 480.
Вроблевскш, 260.
Вудъ, 465.
Вульфъ, 157.
Дальтонъ, 42, 51, 54, 55.
Даніель, 205.
Деберейнеръ, 121, 165.
Демокрить, 24.
Джильхристъ, 516.
Дрексель, 157.
Друммондъ, 206.
Дэви, 306, 418, 426.
Дюлопгь, 100.
Дюма, 87, 122, 257.
Дьгоаръ, 160.
Жераръ, 2, 67, 73, 78, 232.
З?йбертъ, 79.
Зигмонди, 533.
Нальете, 160, 260.
Каммерлингъ-Оннесъ, 268.
Кекуде, 113.
Кирхгофъ, 412, 431.
Киппъ, 156.
Клапейронъ, 71.
Круксъ, 267, 539.
Куперъ, 113.
Кэри Ли, 329.
Кюри, 447.
Лавуазье, 18, 23, 30, 20S, 257.
Ландольтъ, 79.
Лобланъ, 423.
Лекокъ де-Баубодранъ, 147.
Линде, 201, 260, 262, 263.
Ломоносову 23.
Маріоттъ, 63, 160, 231.
Маршъ, 289.
Мейеръ, Викторъ, 88.
Мендел?евъ, XI, 123-150,228,480.
Гсіі-Люссакъ, 63,74,160,231,372.
Генри-Дальтонъ, 228, 200.
Гераклитъ, 24.
Гессъ, 41.
Глауберъ, 226, 422.
Глов?ръ, 371.
Гольдшмидтъ, 473.
Гофманъ, 88, 151.
Гр?мъ, 160.
Гульдбсргъ, 47.
Митчврлихъ, 37, 120.
Муассанъ, 182, 294, 327.
Несслеръ, 284, 433.
Нильсонъ, 147.
Ольшевскій, 26Й.
Оствальдъ, 236.
Пастеръ, 265.
Пикте, 160, 260.
Проутъ, 121.
Пти, 100.
Пфефферъ, 230.
Рамсей, 266, 268.
Рауль, 232.
Реньо, 87.
Радей, 266.
Сентъ-Клеръ Девилль, 219.
Сименсъ, 516.
— 572 —
Сименсъ-Мартенъ, 516,
Содди, 268, 451.
Сольвей, 423.
Спрингъ, 57.
Сталь, 29.
Стасъ, 100.
Стони, 539.
Тенаръ, 523.
Томасъ, 516.
Томсонъ, 539.
Траверсъ, 268.
Траубе, 230.
Фарадей, 410.
Фрауонгоферъ, 415.
Швейцеръ, 525.
Шееле, 169, 527.
Эйде, 334.
Оалесъ, 24.
Предметный
Абсолютная температура, 71.
Агатъ, 319.
Азбестъ платинированный, 367.
Азотистая кислота, 330, 341.
Азотистоводородная кислота, 285.
Азотистый ангидридъ, 340,
Азотпая кислота, 332.
» > дымящая, 333.
Азотноватая окись, 338.
Азотноватистая кислота, 345.
Азотновясмутовая соль, 491.
Азотъ, 252.
> бромистый ) о,?
> іодистыи (
> двуокись, 338.
» закись, 344.
» окись, 341,
» хлористый, 346.
Азотный ангидридъ, 338.
Алебастръ, 440.
Аллотропія, 82, 211, 243, 272,
295, 529, 533.
Алмазъ, 294.
Алхимія, 28.
Алюминаты, 475.
Алюминіева бронза, 474.
Алюминіевы квасцы, 476.
» силикіты, 476.
Алюминій, 471.
л окись, 474.
> с?рнокислый, 476.
> хлористый, 476.
Альбитъ, 471.
Амальгамы, 281, 395, 474.
Амальгамація, 527.
Аметистъ, 319.
Амміакъ, 277.
Амміачный способъ, 423.
Амміачныя соли. 283.
Аммоній, 280, 431.
указатель.
Аммоній азотистокислый\ 253.
> азотнокислый, 344.
» карбаминовый, 432.
» с?рнистый, 433.
» углекислый, 432.
> хлористый, 432.
Аммоніевая амальгама, 281.
Ампулька, 88.
Анализъ воды в?совой, 222.
» » объемный, 220.
» воздуха, 257.
Аягядрогидраты, 308.
Ангидр окисло ты, 308.
Ангидриды, 308.
Ангидритъ, 437.
Англійская соль, 462.
Аніонъ, 235.
Анортитъ^ 471.
Антихлоръ, 366.
Антрацитъ, 292.
Апатиты, 437.
Аргонъ, 266.
Атомистическая гипотеза, 53.
Атомы, 52.
Атомные в?са, 15, 52, 97, 100,
124, 141.
Атомные объемы, 145.
Атомная теплоемкость, 100.
Атомность, 107, 109, 134.
Аурипигаентъ, 274.
Ацетиленъ, 300.
Барій, 445.
» окись, 446.
» перекись, 238, 446.
> с?рнокислый, 446.
» углекислый, 446.
Башня Гей Люссака, 372.
» Гловера. 371.
Ватавскія слезки, 444.
Бериллш, 458.
Берлинская лазурь, 520.
Бертолдетова соль, 199, 382, 428
Кесеемерованіе, 515.
Бессемеровскія реторты, 515.
Блескъ висмутовый, 490.
» жел?§ный, 511.
» м?дный, 524.
> никкелевый, 521.
» свинцовый, 484.
> серебряный, 527.
Бокситъ, 471.
Болотный газъ, 299.
Борокадьцитъ, 385.
Бористый водородъ, 386.
Борная кислота, 386.
Борный' ангидридъ, 386.
Боръ, 384, 469.
> хлористый, 387.
Браунитъ, 500.
Брильянтъ, 294.
Бриганскій металль, 484.
Бромная вода, 178.
Вромоводородъ, 192.
Бромъ, 176.
Бронза, 396.
> алюминіева, 396.
Бура, 386.
Бурый ж?л?знякъ, 511.
Б?леніе, 176, 365, 381, 440.
Б?лила баритовыя, 446.
» свинцовыя, 487.
> туалетный, 491.
з> цинковыя, 464.
В?лильдая известь, 172, 381, 440
Валентность, 107, 109, 134.
Ванадій, 400.
Веседящій газъ,
Висмутовая кислота, 491.
> охра, 490.
Висыутъ, 490.
у азотнокислый, 491.
» гидратъ окиси, 491.
» окись, 491.
* с?рнистый, 491.
» хлористый, 491.
» хлорокись, 491.
Висмутовый ангидридъ, 491.
> блескъ, 490.
Витеритъ, 445.
Вода, 213.
> гигроскопическая, 216.
> дистиллированная, 217.
574 —
Вода конституционная, 216.
» кристаллизационная. 216.
Водка царская, 337.
Водородное огниво, 165.
Водородъ, 151.
Водяной газъ, 317.
Водный остатокъ, 236, 401.
Воздухъ, 255.
Возстановленіе, 195, 347.
, Волластолитъ, 442.
Вольфрамъ, 492.
Вулканизація каучука, 378.
В?сы, 548.
Вязкость металлов^, 394.
Газовая вода, 278.
Гадометръ, 158.
Газы, 63-78.
> высупшваніе, 157.
» диффузія, 161.
> сгущеніе, 260.
Галлій, 147.
Галоиды, 167.
Галоидангидриды, 357.
Галоидныя соединения металлои-
довъ, 309.
Галоидныя соединения металловь,
403.
Галоидо-водородныя кислоты, 184.
Гальванопластика, 521-
Гарніеритъ, 521,
Галмей, 463.
Гаусманинъ, 500.
Гелій, 268.^
Гематитъ, 511.
Генераторы, 317.
Германій, 147.
Гигроскопич?скія т?ла, 216, 421.
Гидразинъ, 285.
Гндраргиллитъ, 471.
Гидратная теорія, 228.
Гидраты, 117, 118.
> окисловъ, 400.
» основные, 400.
» с?риой кислоты, 374.
» хлористаго водорода, 190.
Гидратъ брома, 178.
» хлора, 173.
Гидрогель, 322.
Гидрозоль, 322.
Гидроксилъ, 237.
Гидроксиламинъ, 345.
Гидролизъ, 315.
Гипосульфитъ, 3G6.
— 5
Гипсъ, 440.
Глауберова соль, 226.
Глетъ, 486.
Глина, 471, 477.
Гор?лка Бунзена, 305.
» Ауэра, 305.
Гор?ніе, 206, 303.
Горькая соль, 462.
Градирня, 421.
Граммъ-атомъ, 104.
Граммометръ, 33.
Граммъ-молекула, 98,
Графитъ, 293.
Группа азота, 250, 330.
» кислорода, 196.
» углерода, 290, 310.
» 8-я, 504.
» 1-я, 416.
> 2-я, 434.
» 3-я, 471.
Гремучій газъ, 204.
ГюЙнетовая зелень, 497.
Давленіе осмотическое, 229.
» парщальное, 228.
Двойныя соли, 404.
Двуокись азота, 338.
» хлора, 382.
Двууглекислый натръ, 425.
Двухр омов о кислый калій, 496.
Двухромовонатріева соль, 496.
Депрессія, 93.
Диморфизмъ, 121.
Диссоціація, 219, 229.
» твердаго т?ла, 437.
» электролитическая,
227, 22^.
Дитіоновая кислота, 377.
Диффузія, 58.
» газовъ, 161.
Діализаторъ, 322.
Діализъ, 322.
Діасдор'ь, 471,
Долошитъ, 436, 460.
Доменная печь, 514.
Друммондовъ св?тъ, 206.
Дыханіе, 208, 317.
Ециница атомнаго в?са, 97.
» плотности, 85.
> тепла, 33.
Жавелевая вода, 381.
Жел??истосинеродист. калій, 520.
Жел?зносинеродистый калій, 520.
Жел?зная кислота, 5] 9.
з> красная руда, 511.
» слюдки, 511.
Жел?зный блескъ, 518»
» купоросъ, 511.
> шпатъ, 511.
Жел?знякъ бурый, 511.
> красный, 511.
» магнитный, 510.
Жел?зо, 510.
» закись, 517.
» гидратъ закиси, 517.
» с?рнистое, 518.
¦> хлорное, 5.
Жесть, 481.
Жидкій воздухъ, 260.
Жидкое состояніе т?лъ,
Жировикъ, 460.
Закиси, 400.
Закись азота, 344.
Законъ Авогадро-Жерара,72, 232.
> Бойля и Марютта, 63, 231.
> Вантъ-Гоффа, 232.
> Генри-Дальтона, 228, 260.
> Гей-Люссака, 64, 231.
» Гесса, 41.
» депрессіи (Рауля), 933 232.
» диффузіи, 161.
> д?йствующихъ массъ, 47.
> Дюлонга и Пти, 100.
> кратныхъ отношеній, 51.
> паевъ, 52.
> п?ріодичности, 116.
» постоянныхъ отношен., 50.
> сохраненія вещества, 18.
> 5 энергіи, 31.
» Фарадея, 410.
Зелень бременская, 527.
» брауншв?йгская, 527.
» Гюйнетова, 497.
» Шееле, 527.
» швейнфуртская, 527.
ЗАіото, 532.
> синеродистое, 532,
» хлорное, 534.
Золотая кислота, 534.
Золоченіе, 534.
Известка, 437.
Известковая вода, 438.
Известковый шпатъ, 442.
Известняки, 436.
— 576 -
Известь, 437.
> б?лильная, 381, 440.
> натронная, 439.
Изоморфизмъ, 120.
Индій, 470.
Иридій, 504.
Иридистая платина; 535.
Исторіи химіи, 23.
Иттербій, 470.
Иттрій, 470.
іодъ, 179.
іодистый азотъ, 346.
> водородъ, 194.
> фосфоній, 287.
іодная кислота, 383.
іодокрахмалвная бумажка, 211.
іоны, 234, 316, 406, 409.
Кадмій, 465.
» с?рнистый, 465.
Каинитъ, 425, 460.
Калій, 425.
> азотистый, 430.
> азотнокислый, 429.
» бромистый, 428.
» іодистый, 428.
> кремнекислый, 431.
> окись, 426*
> синеродистый, 326. *
» углекислый, 430.
> хлористый, 427.
> хлорноватистокислый,4,429.
> хлорнокислый, 428.
» хлорноватокислый, 428-
> ціанистый, 326.
> ?дкій, 426.
Каліева селитра, 429,
Каломель, 467.
Калориметръ, 40.
Калориметрическая бомба Берт-
ло. 41.
Калорія, 33.
Калькароны, 241.
Кальцій, 436.
> кремнекислый, 442.
> окись, 437.
> гидратъ окиси, 438.
> с?рнокислый, 440.
> с?рнистый, 423.
> углекислый, 442-
> углеродистый, 445.
> фосфорнокислый, 441.
> фтористый, 440.
Кальцій хлористый, 439.
> ціанамидъ, 445.
Каменная соль, 169.
Каменный уголь, 292.
Камерный процессъ, 371.
Камерные кристаллы, 369.
Каолинъ, 477.
Карандаши, 293.
Карбаминовая кислота, 432.
Карбиды, 328.
Карбидъ кальція, 301.
> кремнія, 327.
Карборундъ, 327.
Карналлитъ, 425, 460.
Кассіевъ пурпуръ, 533.
Катализаторы, 37.
Каталитическія реакщи, 37.
Катіонъ, 235.
Кварцъ, 319.
Квасцы алюминіевы, 476.
> жел?зные. 476,
» хромовые, 494.
Кизеритъ, 462.
Кинетическая теорія, 73.
> энергія, 31.
Киноварь, 465.
Кислородъ, 198.
Кислоты, 236, 309.
> двуосновныя. 309.
> одноосновныя, 309.
Кислая соль, 404.
Книги, 562—569.
Кобальтовый ультрамаринъ, 523.
» блескъ, 522.
Кобальтъ, 522.
т> закись, 522.
» гидратъ закиси, 522.
> двойная азотисто -
кислая соль окиси, 523.
^ с?рнистый, 523.
» хлористый, 522.
> шпейсовый, 522.
Ковкость м?талловъ, 393.
Коллиматоръ. 412.
Коллоиды, 322.
Колчеданъ жел?зный, 511.
> м?дный, 524.
Колькотаръ (мумія), 511.
Комплексныя соли, 404.
Контактный методъ, 374.
Контактныя вещества, 37.
Корундъ, 471, 475.
Кремень, 319.
Кремнекислота, 321.
- 577 —
Кремневый ангидридъ, 319-
Кремнеземт, 319.
Кремнефтористоводородная
кислота, 325.
Кремній, 297.
г водородистый, 301.
> фтористый, 325.
Криптонъ, 268.
Кристаллизаціонная вода, 216.
Кристаллогидратъ, 226.
Кристаллоиды, 322.
Критическая температура, 160.
Кричный способъ, 514.
Кричный горнъ, 514.
Крица? 535.
Кріолитъ,^ 471.
Кріоскопическій методъ, 93—97.
Кронъ желтый, 497.
з- красный, 497.
Кр?пкая водка, 335.
Ксенояъ, 268.
Кулоросы, 464.
Купорось жел?зный, 518.
» м?дный, 526.
т> цинковый, 461.
¦» свинцовый, 487.
Купоросное масло, 373.
Купферниккель, 521.
Лазурь берлинская, 520.
> м?дная, 524.
Лаки, 476.
Лампа Дпви, 307.
Лантанъ, 470.
Латунь, 396.
Леблановскій процеесъ, 423. »
Легкіе металлы, 389.
Ледъ, 57, 218.
Литій, 431.
Луженіе, 481.
Лютеціи, 470.
Ляписъ, 530.
Магній, 460.
Магнезигъ, 460.
Магнезія, 461.
> б?лая, 462.
Магніева подгруппа, 458.
Магній, 460.
> окись, 461.
*• гидратъ окиси, 461.
» с?рнокислый, 462.
» углекислый, 462.
Маггій фосфорнокислый, 462.
з> хлористый, 461.
Магнитный жел?знякъ, 510.
Малахитъ, 11, 524, 526.
Манганитъ, 501.
Марганецъ, 497.
» закись, 501.
» гидратъ закиси, 501.
» окись, 501.
-> гидратъ окиси, 501,
* перекись, 502.
> с?рнистый, 501.
» хлористый, 501.
Марганцовистый ангидридъ, 502.
Марганцовистая кислота, 502.
Марганцовая кислота, 504.
Марганцовистокислый калій, 502.
Марганцовокислый калін, 503.
Марганцовый ангидридъ, 504.
> гапатъ, 500.
Массикотъ, 486.
Мастика, 553.
Матерія, 1, 11.
іуіельхіоръ, 525,
Метакислоты, 329.
Металлоиды, 118, 167.
Металлы, 117, 388.
» багородные, 390.
» земельные, 470.
^ легкіе, 389.
> тяжелые, 390.
•> щелочные, 416.
>> щелочно-земельные, 434.
Метанъ, 299.
Метаоловянная кислота, 483.
Метасурьмяная кислота, 357.
Метафосфорпая кислота, 350.
Молекулы, см. частицы.
Молнбденъ. 492.
Монеты, 528, 533.
Мраморъ, 312, 442.
Мумія, 511.
Мышьякь, 274.
» б?лый, 354.
» водородистый, 287.
» с?рнистый, 358.
Мышьяковая кислота, 355.
Мышьяковистый ангидридъ, 351.
> водородъ, 287.
Мышьяковый ангидридъ, 355.
» колчеданъ, 274.
М?дь, 524.
> закись, 525.
> мышьяковистая, 527.
Неорганическая хямія.
37
— 578 —
М?дь окись, 526.
» гндратъ окиси, 520.
» подус?рнистая, 527.
> самородная, 524.
» сплавы, 5?5.
» с?рнистаіі, 527.
•» с?рнокислая, 526.
а углекислая, 526.
М?дная лазурь, 524.
з> красная руда, 524.
М?дный колчеданъ, 524.
» купоросъ, 526.
М?лъ, 311, 442.
М?ры, 547.
Накинь, 214, 442.
Наждакъ, 471, 475.
Нашатырь, 5, 9.
Нашатырный спиртъ, 0.
НатрШ, 417.
ъ азотпокислый, 421.
» борнокислый, 386.
> кислый углекислый, 423.
> кремнекислый, 423.
> окись, 418.
j- перекись, 420.
» с?рнистокислый, 421.
» с?рноватистокислый. 421.
Натрій с?рнокислый, 426, 421.
» углекислый, 422.
5 хлористый, 420.
Натръ ?дкій, 419,
Негативъ, 531.
Недокиси, 400.
Иейзильберъ, 464.
Пеоиттербій, 4-і7.
Неонъ, 268.
Никкелевый блескъ, 521.
Ннккель, 521.
> закись, 521.
з> гидратъ закиси, 521.
> окись, 506.
> с?рнокислый, 521.
Ниток1*, 450.
Нитрозилс?рная кислота, 369.
Нигрозидъ хлористый, 357,
Нитроилъ хлористый, 357.
Ніобій, 490.
Нордгаузенская кислота, 376.
Обманка цинковая, 463.
Обм?нныя разложенія, 9, 405.
Обратимыя реакціи, 44, 405.
Огниво водородное, 165.
Озоиаторъ, 210.
Озон*, 209.
Окалина жел?зная, 519.
» м?дная, 525.
Окисл?ыіе, 208.
Окислы, 117, 118, 307, 399.
» металловъ, 399.
» солеобразующіе, 400.
Окись, 400.
> азота, 341.
> углерода, 316.
Окклюзія, 164.
Оливинъ, 460.
Олифа, 486.
Олово, 480.
> двуокись, 482.
» закись, 481.
» гидратъ закиси, 482.
с?рнистое, 482.
» двус?рнисто?, 484.
» двухлористое, 482.
» хлорное, 483.
Оловянная кислота, 483.
s соль, 482.
> фольга, 484.
Одовяннонатріевая соль, 481.
Оловянный ангидридъ, 482.
» камень, 483.
Опадъ, 319.
Органическія соединенія, 175.
Ортокислоты, 329.
Ортоклазъ, 471.
Ортофосфорная кислота, 349.
Осмій, 504.
Осміевый ангидридъ, 505.
Осмотическое давленіе, 229.
Основания, 117, 236, 400.
Основная соль, 404.
Основность кислоты, 309.
Основные гидраты, 117, 400.
Остеодиты, 441.
Охладительный см?си, 160.
Охра, 511.
Паи, см. атомы, 15, 52.
Палладій, 504.
Пентатіоновая кислота, 377.
Перегонный кубъ, 217.
Перекиси, 400.
Перекись водорода, 238.
» барія, 446.
т> марганца, 200, 502.
» свинца, 486.
Періодическая система, 131.
— 579 —
Періодическій законъ, 116, 130.
Періодичность атомности, 134.
Песокъ, 319.
Пирокислоты, 329.
Пиролюзитъ, 500, 502.
Пирос?рная кислота, 376.
Лирофосфорная кислота, 350.
Плавиковая кислота, 184.
Плавиковый шпатъ, 437.
Плавни, 513.
Гіламя, 206, 303.
Платина, 534.
» губчатая, 536.
» гидратъ окиси, 535.
» иридистая, 535.
» хлорная, 535.
Платиновая кислота, 535.
» РУДа? 534.
Илатинохлористоводородная
кислота, 535.
Плотность дара, 86.
Поваренная соль, 169, 420.
Лозитивъ, 531.
Полевой шпатъ, 425, 471.
Поликремневыя кислоты, 321.
Полимеризація, 93, 323.
Политіоновыя кислоты, 377.
Полулроницаемыя ст?нки, 230.
Порохъ, 430.
Лоташъ, 430.
Погенціальная энергія, 31.
Правило наиболылаго выд?ленія
тепла, 43.
Иразеодимій, 490.
Предохранительная лампа, 306.
Приборъ Киппа, 156.
Приложенія, 537—569.
Прнготовленіе растворовъ, 559.
Припой, 489.
Проводники, 409.
Проба, 528.
Процентный составъ, 105.
Проявленіе, 531.
Пудлингованіе, 515.
Пятихлористая сурьма, 361.
Яятихлористый фосфоръ, 360.
Равнов?сі? подвижное, 47, 406.
» химическое, 47, 406.
Радіоактивныя вещества,446 457.
Радій, 447.
» хлористый, 447.
Растворимое или фуксово стекло,
421, 423.
Растворимость, 225, 406.
Растворы, 224.
» нормальные, 225.
> твердые, 224.
Реактивъ Несслера, 284, 433.
Реакція, 6.
Реакціи воз становления, 163.
j обм?на, 9.
з* обратимыя, 44, 405.
» разложенія, 6.
¦р соединенія, 6.
Реальгаръ, 274.
Роданистый калій, 327, 521.
Розсыпи, 532, 534.
1 Родій, 504.
Ртуть, 465.
» азотнокислая, 467.
» закись, 467.
> іодистая, 469.
> двуіодистая, 469.
» окись, 468.
> с?рнистая, 469.
» хлористая, 467.
» хлорная, 468.
Руды, 397.
Рубидій, 431.
Рубинъ, 475.
Рутеній, 504.
Сажа, 292.
Сатурново дерево, 485.
Сапфиръ, 471, 475.
Свнн?цъ, 484.
з. двуокись, 486.
» іодистый, 487.
» окись, 486.
» гидратъ окиси, 486.
> перекись, 486.
> с?рнистый, 489.
» с?рнокислый, 487.
» углекислый, 487.
» уксуснокислый, 488.
> хлористый, 487.
Свинцовая кислота, 487.
Свинцовый блескъ, 484.
Свинцовыя б?лила, 487.
Свинцовый купорось, 487.
Св?тильиый газъ, 300.
Сгущ?ні? газовъ, 260.
Селенъ, 249.
Селенистый ангидридъ, 249.
> водородъ, 249.
Селитра каліева, 420.
» чилійская, 421.
37н
580 —
Селитряница, 429.
Селитряная кислота, 335.
Серебро, 527.
ч азотнокислое, 530.
-¦> окись, 529.
-¦> растворимое, Ь29.
> синеродистое, 530.
> с?рнистое, 530.
» хлористое, 530,
Серебреніе, 530.
Серебряный блескъ, 527.
С?рпентлнъ, 460.
Сила кислотъ, 236.
Сила основаній, 236.
Силикаты, 321, 425, 471.
Сильвинъ, 425.
Сямпатическія чернила, 522.
Синеродистыя соедин?нія, 326.
Синеродистый водородъ, 326.
Синеродистый калій, 326.
Синеродъ или ціанъ, 326.
Синильная кислота, 326.
Синтезъ воды, 221.
Синь Тэнара, 523.
Скандій 147, 470.
Слюда, 425, 471.
Сода, 423.
Содовые остатки, 423.
Содовый плавъ, 423.
Соединения экзотермическая, 38.
> эндотермическія, 38.
Соединительный в?съ, 52.
Солеобразовательные окислы 400.
Соли, 403.
-> двойныя, 404.
» кислыя, 404.
» среднія, 404.
> основныя, 404.
Соляная кислота, 189.
Соль англійская, 462.
Состояніе выд?ленія, 83.
Спектральный анализъ, 411."
Спектроскопъ, 413.
Спектръ, 411.
» поглощенія, 414.
» прерывный, 412.
» сплошной, 411.
Слиртъ нашатырный, 9t 279,
432.
Списокъ аппаратов^, 55Q.
> веществъ, 554.
Спички, 273,
> шведскія, 279.
Сплавы, 395.
Сплавъ Вуда, 492.
•> Ньютона, 492.
> Розе, 492.
Сродство химическое, 35.
Сталагмиты, 442.
Сталактиты, 442.
Сталь, 513.
Станнантъ, 482.
Станіоль, 481.
Стассфуртскія соли, 425.
Стекло, 442.
> зеленое, 414.
> растворимое, 321, 444.
> хрустальное, 444.
'Степень диссоціаціи, 234.
Стереохимія, 116.
Склянки Вульфа, 157.
» Дрекселя, 157.
Строиціанитъ, 445.
Стронцій, 445.
» азотнокислый, 446.
> с?рнокислый, 446.
» углекислый, 446.
Строеніе химическое, 113.
Сулема, 468.
Сульфатъ, 422.
Сульфогидраты, 347.
Сульфокиелоты, 309.
» мышьяка, 358.
j олова, 484.
Сульфурилъ хлористый, 379.
Суперфосфатъ, 441.
Сурикъ, 486.
Сурьма, 275.
? окись, 356.
сірнистая, 359.
•> хлористая, 361.
Сурьмяная кислота, 357.
Сурьмянистый водородъ, 289.
Сурьмяный ангидрігдъ, 357.
» блескъ, 275.
Сусальное золото, 484.
С?ра, 241.
ъ однохлористая, 378.
» четырехъ-хлористая, 378.
•* октаэдрическая, 242.
» призматическая, 242.
> пластическая, 243.
С?рпая кислота, 368.
> > дымящая, 370.
С?рнистая кислота, 364.
С?рнистый кремній, 325.
» ангидридъ, 362.
> водородъ, 345.
— 581 —
С?рнистыя со?дипснія, 214, 309,
402.
С?роуглеродъ. 325.
С?рноватистая кислота, 366.
С?рное молоко, 244.
С?рный ангидридъ, 367.
С?роводородъ, 345.
Таблицы, 542—547.
Таліій, 470.
Талькъ, 460.
Танталъ, 490.
Тахгидридъ, 469.
Твердое состояніе т?лъ, 57.
Теллуръ, 249.
Теллуристый водородъ, 249.
Тенардитъ, 422.
Тоорія гидратяая, 228.
з> растворовъ, 229.
» строенія, 113.
Теплоемкость. 100.
Термохимія, 39.
Т?граборная кислота, 386.
Тегратіояовая кислота, 377.
Тянкалъ, 386.
Типографскій металлъ, 276. 489.
Типы соединений, 108.
Титанъ, 479.
Тіоугольная кислота, 324.
Томасовъ шлакъ, 516.
Томпакъ, 464, 525.
Топазъ, 319.
Торій, 479.
Торфъ, 292.
Тріады Деберепнера, 121.
Тритіоновая кислота, 377.
Турнбуллева синь, 520.
Туфы, 442.
Тяжелые металлы, 390.
Тяжелый шпатъ, 445.
Тягучесть металловъ, 393.
Угаръ, 317.
Углеводороды, 299.
Углекислый газъ, 310.
Углеводородистый кальцій, 301.
» кремній, 327.
Углеродъ, 291.
Уголь, 291.
» каменный, 292.
Угольная кислота, 314.
Угольный ангидридъ, 310.
Уд?льные в?са металловъ, 125,
389.
Уд?льные объемы, 12ц, 145, 391.
Ультрамаринъ, 478.
Уравненіе газовъ, 69.
» химическое, 62, 107.
» Клапейрона. 71.
Уранъ, 492.
Фаза, 10.
Фарфоровая глина, 477.
Фарфоръ, 478.
Фаянсъ, 478.
Ферроманганъ, 517.
Ферроалюминій, 474.
Ферросилиции 517.
Физика, 2.
Фиксированіе, 531.
Флинтгласъ, 444.
Флогистопъ, 29.
Формулы химичеокія, 61, 106.
Формула ванъ-деръ-Ваальса, 71.
s строенія, 113.
Фосг?нъ, 318.
Фосфоній, 287.
Фосфорноаммоніевомагніевая
соль., 462.
Фосфоръ, 270.
> водородистый, 285.
> красный, 272.
» моталлическій, 272.
-> хлористый, 359.
Фосфориты, 437, 441.
Фосфористая кислота, 352.
Фосфористый ангидридъ, 351.
¦ » водородъ, 285.
Фосфорная кислота, 349.
Фосфорноватистая кислота, 353.
Фосфорный ангидридъ, 347.
Фотографированіе, 531.
Фрауэкгоферовы лиши, 415.
Фтористый кальцій, 184, 444.
» водородъ, 184.
» кремній, 325.
Ф)ксово стекло, 321, 444.
Халлсдонъ, 319.
Хамелеонъ, 200.
Химическая энергія, 34.
Химическіе знаки, 61, 106.
Химическія реакціи, 6.
» уравненіе^ 62. 107.
Химическое сродство. 35.
Химія, 1.
Хлора гидратъ, 173.
» двуокись, 382.
— 582 —
Хлор ангидриды, 357.
Хлористая с?ра, 378.
Хлористый азотъ, 346.
> кремній, 325.
> мышьякъ, 360.
> фосфоръ,''359.
Хлороводородъ, 186.
Хлорная вода, 173.
Хлорная известь, 381.
> кислота, 382.
Хлорноватая окись, 382.
» кислота, 381.
Хлорноватистый ангидридъ, 379.
Хлорноватистая кислота, 380.
Хлорокись висмута, 491.
> сурьмы, 361.
» фосфора, 357.
Хлороплатинаты, 433, 535.
Хлоросульфоновая кислота, 378.
ХлорофоріМъ, 178, 180.
Хлоръ, 169.
Холодильникъ, 217.
Хромъ, 493.
* окись, 493.
» гидратъ окиси, 494.
> с?рнокислый, 494.
з> хлорный, 494.
Хромовая желть, 489.
Хромовокаліевы квасцы, 494.
Хромовокислый барій, 497.
э стронцій, 497.
з> свинецъ, 497.
> калій, 496.
Хромовый ангидридъ, 495.
Хромовистый ж?л?знякъ, 493.
Хромпикъ, 496.
Хромосфера солнца, 415.
Хрусталь горный, 319.
Хрустальное стекло, 444.
Царская водка, 337.
Цезій, 431.
Целестинъ, 445,
Цоментъ воздушный, 438.
» гидравлически!, 438.
> портландскШ, 439.
Церій, 479.
Динкъ, 463.
Цанка окись, 464.
» гидратъ окиси, 464.
» с?рнистый, 464.
» с?рнокислый, 464.
> углекислый, 464.
з* хлористый, 464.
Цинкаты, 463.
Цинковыя б?лила, 464.
Цинковая обманка, 463.
Цинковый (б?лыи) купоросъ, 464.
Цирконій, 479.
Ціанъ, 326.
Ціанистьгй кал'щ 327.
Частицы, 54, 78—86, 104.
Черенковая с?ра, 242.
Чернила симпатическія, 522.
Четырехокись азота, 338.
Четыр?хъ-хлористая платина, 535.
Ч?тырехъ-хлористо? олово, 483.
Чилійская селитра, 421.
Чугунъ, 512.
Шпатъ известковый, 442,
» плавиковый, 184, 446.
» полевой, 425, 471.
» тяжелый, 445.
Шпейсовый кобальтъ, 522.
Щелочи, 417.
Щелочяо-зем?льные металлы, 434.
Щелочные металлы, 416.
"Ьдкія щелочи, 417.
'Вдкій натръ, 419.
?дкій калій, 427.
Экаалюминій, 147.
Экаборъ, 147.
Экасилицш, 147.
Эквивалеитъ тепла, 33.
Эквиваленты, 110.
Эквимолекулярные растворы, 95,
232.
Экзотермическія реакціи, 38.
Экспонированіе, 531.
Электрическая печь, 294, 295.
Электролизъ солей, 409.
» воды, 6, 151.
Электролитическая диссоціація.
229—236.
Электролиты, 234, 409.
Эл?ктронъ, 54, 108, 539.
Элементы, 17, 120.
Эаганація, 44.9.
Эндотермическія реакціи, 38.
Эн?ргія, 31.
> химическая. 34.
Этиленъ, 300.
Явл?нія физическія, 2.
> химич?скія, 3.
Ярь-м?дянка, 527.
ИМЕЮТСЯ ВЪ ПРОДАЖЕ ВО ВС?ХЪ КНИЖН. МАГАЗИНДХЪ.
і) СБОРНИКЪ СТАТЕЙ ВЪ ПОМОЩЬ СДМООБРДЗОВДШЮ
по математик?, физик?. химіи и астрономіи, составлен, кружкомъ
преподавателей.
2-е вновь переработ, изд. въ 4-хъ вып. Ц. кажд. вып. 1 р, 20 коп.
2) ФИЗИИО-МАТЕГИАТИЧЕСКіЙ ЕЖЕГОДНИКЪ,
посвященный вопросамъ математики, физики, химіи и астрояомш.
.V 1-й 1900 г. съ 128 риг. и 8 таблицами. Ц. 2 р 95 коп.
№ 2-й 1902 г. съ 142 рис. Ц. 2 р. 50 коп.
Изданіе Кружка авторовъ: «Сборникь въ помощь самообраоованію».
Изданіями завідуетъ приватъ-доцентъ Императорскаго Московскаго
Университета А. Рефорлатсюй.
Складь изданій: Москва, Леонтьевскій пер.; д. 24, магазинъ
„Д?тское Воспитаніе".
в, #ИМ1Я и ЖИЗНЬ ПРИРОДЫ.
А. Реформатского. М., 1903 г. Д. 20 коп.
4) Г О Р Ъ Н I E.
А. Рефор иатскаго. М., 1904 г. Ц. 10 коп.
5) ОРГАНИЧЕСКАЯ ХИМ1Я.
(Краткіи начальный курсъ.) Съ приложеніемъ практичеоки^съ заня-
тіи по органической химіи. ?> изд. А. Геформатсшіго М., 1912 г.
Ц- 1 руб.
ві Одноатомныв непред?льные спирты жирнаго ряда.
Сигаъ щт ш С Л*-Ж
А. Реформатспаго М., 1908 г. Д. 2 р.
7) НЕОРГАНИЧЕСКАЯ ХИМ1Я.
(Начальный курсъ.) 7-е изданіе. Съ 7 портретами и 103 рисунками.
А. Реформатспаго, Москва, 1912 г. Д. въ переплет? 2 р. 25 коп.
Складъ изданія въ книжныхъ магазинахъ Т-ва И. Д.
Сытина. Выписывающіе изъ склада за пересылку не
платятъ.
ОПЕЧАТКИ.
Стран.
119
167
233
238
371
433
456
480
481
493
532
Строка.
1
2
11
16
2
17
6
13
14
1
6
сверху
снизу
сверху
снизу
сверху
>
снизу
>
сверху
снизу
сверху
Напечатано:
Ее 80ц
къ
У Р
раздробленныхъ
стр. 363
{Pt Сі)
превосходительный
ихъ
+2HCk=SnCl+
Cr&z
одноатомно
СлуьЬ-уетъ:
Fe SOg
къ J
PV
разбавленныхъ.
стр. 336
(Pt Ck)
превосходный
или
+2ЯС7=5иС/9+
о-А
одновалентно