Text
К. В. Вацуро
Г. Л. Мищенко
ИМЕННЫЕ РЕАКЦИИ
В ОРГАНИЧЕСКОЙ
ХИМИИ
СПРАВОЧНИК
МОСКВА
ИЗДАТЕЛЬСТВО «ХИМИЯ* 1976
547
В22
УДК 547: 001.815@83)
Вацуро К. В., Мищенко Г. Л.
В 22 Именные реакции в органической химии. М.,
«Химия», 1976.
528 стр ., список литературы более 3200 ссылок.
Справочник содержит описание более 750 реакций, исполь-
используемых в качестве методов "синтеза, в том числе реакций, от-
открытых или разработанных русскими и советскими химиками.
В описание каждой реакции входят: типовая схема, вклю-
включающая механизм и основные условия проведения реакции,
сведения о границах применимости, модификациях и практи-
практическом использовании реакции, а также краткая библио-
библиография.
Справочник снабжен именным указателем и указателем
типов реакций, что позволяет использовать его и как пособие
для выбора метода синтеза.
Книга предназначается для широкого круга специалистов,
работающих в области органической химии, может быть по-
полезна аспирантам, студентам химических вузов и химических
факультетов университетов.
20504-037
050@1)-76
-37-76
547
Редакторы Пастушенко М. Н., Гостеева Г. Н.
Художник Бекетов Е. В.
Художественный редактор Носов Н. В.
Технический редактор С к и т и н а В. М.
Корректор Хрипунова М. С.
Т 20202. Сдано в наб. 7/VI 1976 г. Подп. к печ. 25/Х 1976 г. Формат
бумаги бОХЭО'Ае. Бумага тип. № 2. Усл. печ. л. 33. Уч.-изд. л. 39,34.
Тираж 11.000 экз. Заказ 684. Изд. № 326. Цена 2 р. 21 к.
Издательство «Химия». 107076. Москва, ул. Стромынка, д. 13, корп. 2.
Московская типография № 11 Союзполиграфпрома при Государственном
комитете Совета Министров СССР по делам издательств, полиграфии
и книжной торговли. Москва, П3105, Нагатинская ул., д. 1.
ПРЕДИСЛОВИЕ
Уже более ста лет в органической химии широко используются реакции,
получившие названия по фамилии химиков, открывших или детально изучивших
эти реакции. Такие именные названия составляют значительную часть термино-
терминологии органических реакций, их насчитывается более 1000. Наименование реак-
реакций по фамилиям химиков обусловлено не только уважением и признатель-
признательностью к ним, но и прежде всего отсутствием номенклатуры реакций. Такой
способ давал бы возможность коротко определить смысл происходящего превра-
превращения (например, превращение карбоновой кислоты в ее ближайший высший
гомолог через стадии получения хлораигидрида и диазокетона — реакция
Арндта — Айстерта).
Использование именных названий осложняется явлением синонимии, т. е. од-
одна и та же реакция имеет различные названия, например: реакция Арбузова,
перегруппировка Арбузова, реакция Арбузова — Михаэлиса, реакция Михаэли-
са — Арбузова; реакция Кейзона, реакция Гилмена — Нелсона; реакция Дакина,
реакция Дэкина, реакция Дейкина.
Кроме того, с именами некоторых химиков связано несколько удобных и
достаточно широко используемых методов органического синтеза (омонимия
названий): например, существует 11 реакций, носящих имя Фишера, 7 — Кляйзе-
на, 7 — Байера, 4 — Гофмана, 3 — Чичибабина и т. д.
Существенным недостатком именных названий является их крайне малая
информативность; они, по существу, представляют собой тривиальные названия
реакций. Это создало необходимость появления справочных изданий, в которых
приведены описания именных реакций. Такими изданиями являются:
Wagner К. G. Autoren-Namen als chemische Begriffe. Weinheim, Verlag Chemie,
1951 A05 реакций); Gowan I. E., Wheeler T. S. Name Index of Organic Reactions.
London, Longmans Green and Co. Ltd., 1960 G40 реакций и модификаций);
Krauch H., Кию W. Reaktionen der Organischen Chemie. Heidelberg, A. Hflthig
Werlag, 1969 (около 450 реакций); Surrey A. R. Name Reactions in Organic Che-
Chemistry. New York, London, Academic Press, 1961 A00 реакций); Denney R. S.
Named organic reactions, New York, Plenum Press, 1969 G0 реакций).
На русском языке имеется лишь одно специальное издание: Серрей А. Спра-
Справочник по органическим реакциям. Пер. с аигл. Под ред. Н. С. Вульфсоиа.
Москва, Госхимиздат, 1962.
В «Краткой химической энциклопедии» (М, 1961 г.) также имеются описа-
описания 125 имеииых реакций, из которых 25 принадлежат русским химикам.
Настоящий справочник содержит описания 755 имеииых реакций, 92 их имеи-
имеииых модификаций, а также 35 имеииых методов, тесно связанных с известными
именными реакциями. Таким образом, ои дает возможность получения инфор-
информации о 880 реакциях, имеющих именные названия. Справочник включает опи-
описания реакций, упоминающихся в химической литературе после 1950 года,
и ие содержит, за редким исключением, аналитических реакций и синтезов от-
отдельных соединений. В справочнике впервые представлены описания 180 имен-
именных реакций (в том числе 27, открытых отечественными учеными), не входивших
ни в одно из специальных справочиых издаиий.
СТРУКТУРА СПРАВОЧНИКА
Реакции расположены в алфавитном порядке фамилий авторов в русской
транскрипции* рядом в скобках указаны фамилии в оригинальном иаписаиии,
для однофамильцев приведены их инициалы. Синонимия названий отражена
в подстрочных примечаниях. Описание каждой реакции содержит: краткую
формулировку химического смысла реакции с указанием названия
процесса, классов исходных и конечных соединений; уравнение реакции в виде
типовой схемы, включающей, как правило, механизм и основные условия ее про-
проведения; определение реакционной способности веществ и факторов, на нее
влияющих; границы применимости реакции и примеры, иллюстрирующие расши-
расширение этих границ; описание побочных реакций; пути использования реакции
и преимущества данного метода по сравнению с аналогичными; модификации;
отсылки к химически однотипным реакциям, к реакциям, приводящим к анало-
аналогичным соединениям или дающим другие продукты при изменении условий про-
проведения и др.**; краткую библиографию со ссылками на первую авторскую
публикацию, на статью, в которой данная реакция имеет именное название, на
обзоры и основные работы последних лет.
ДОПУЩЕНИЯ И УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
— такое написание соединения в типовой схеме означает уча-
участие в реакции как иекоидеисироваииой, так и коиденсироваиной систем;
— подобное изображение соединений означает, что заместитель
может находиться в любом положении кольца;
реагент — над стрелкой в уравиеиии реакции;
катализатор — в квадратиых скобках под стрелкой в уравиеиии реакции;
¦Транскрипции приведены в соответствии с «Русско-аигло-иемецким сло-
словарем названий органических реакций», М., ВИНИТИ, 1975. 187 с.
¦¦Наиболее полно подобные связи имеииых реакций с другими именными
реакциями, а также с реакциями, имеющими специальные названия, отражены
в книге: Тезаурус органических реакций. М., ВИНИТИ, 1975.
растворитель — в круглых скобках под стрелкой в уравнении реакции;
*• ** и т. д. — при записи реагента, растворителя, катализатора указывает,
что для этой цели используются и другие вещества, перечень которых приводится
под типовой схемой;
гипотетические и промежуточные продукты, а также ста-
стадии, отражающие механизм реакции, заключены в квадратные скобки.
Если условия проведения реакции в типовой схеме и приводимом примере
совпадают, то соответствующая запись в примере отсутствует.
Библиографическое описание книг, монографий, сборников, часто встречаю-
встречающихся в приводимой литературе, сокращено в соответствии с приведенным
ниже «списком сокращений».
Мы сердечно благодарим К. И. Карелину, О. А. Ключникову, Т. К. Назаро-
Назарову и Т. Б. Сахарову за помощь в работе иад рукописью, а также приносим
благодарность проф. А. Н. Косту за прочтение части описаний справочника
и ценные замечания. Мы будем очень признательны читателям за критические
указания и обсуждение.
Авторы
СПИСОК СОКРАЩЕНИЙ
Вейганд-Хильгетаг — Вейганд-Хильгетаг. Методы эксперимента в органической
химии. Пер. с нем. Под ред. Н. Н. Суворова. М., «Химия», 1968. 944 с.
Ингольд — Ингольд К. Механизм реакций и строение органических соединений.
Пер с англ. Под ред. И. Л. Кнунянца и Я. Ф. Комиссарова. М., Издатинлит,
1959. 673 с.
Мюллер — Мюллер Е. Новые воззрения в органической химии. Пер. с нем. Под
ред. А. Н. Несмеянова. М., Издатинлит, 1960. 680 с.
ОР — Органические реакции. Сб. 1—14. Пер. с англ. Под ред. К. А. Кочешкова
и И. Ф. Луценко. М., Издатинлит, 1948—1967.
РИМИОС — Реакции и методы исследования органических соединений. Т. 1—22.
Под ред. В. М. Родионова, Б. А. Казанского, И. Л. Кнунянца, М. М. Шемя-
Шемякина, Н. Н. Мельникова. М., «Химия», 1954—1971.
СОП — Синтезы органических препаратов. Т. 1—4. Пер. с англ. Под ред.
Б. А. Казанского. М., Издатинлит, 1949—1953.
Физер—Фиэер Л., Физер М. Реагенты для органического синтеза. Т.)—5. Пер.
с англ. Под ред. И. Л. Кнунянца и Р. Г. Костяновского. М., «Мир»,
1970—1971.
Фьюзон — Фьюзон Р. Реакции органических соединений. Пер. с англ. Под ред.
И. Ф. Луценко. М., «Мир», 1966.
Эльдерфильд — Гетероциклические соединения. Под ред. Р. Эльдерфильда.
Т. 1—8. Пер. с англ. Под ред. Ю. К. Юрьева. М., Издатинлит, 1953—1969.
Gilman — Organic Chemistry. An advanced treatise. Ed. Henry Gilman. New
York —London, Wiley —Chapman, 1950—1953.
Houben-Weyl — Houben /., Weyl Th. Methoden der organischen Chemie. 4. Aufl.
Bd. 1—15. Stuttgart, Thieme, 1952—1974.
OR —Organic reactions. Ed. R. Adams. V. 1—21. New York. Wiley; London,
Chapman and Hall, 1942—1974.
OS — Organic Syntheses. An annual publications of satisfactory methods for the
preparation of organic chemicals. Ed. R. Adams. V. 1—53. New York, Wiley;
London, Chapman and Hall, 1921—1973.
Rodd — Chemistry of carbon compounds. A modern comprehensive treatise. Ed.
E. H. Rodd. V. 1—5. Amsterdam, Elsevier publ. Co., 1951—1962.
1. АБРАМОВ
Получение О,0-диалкил-а-оксиалкилфосфонатов присоединением диалкил-
фосфитов к альдегидам или кетонам в присутствии алкоголятов щелочных ме-
металлов:
(ROJP-H-
II
О
)С=О
~ то °с
>-
[C2H5ONa]»
(ROJp+ \:=o
ONa
(ROJP-C/
I! |\
О ONa
H2O; Hf
(ROJP-C(
I! |\
о он
B0-90%)
CH3ONa, CH3OLi, без катализатора
В реакцию вступают алифатические, алициклические и ароматические карбо-
карбонильные соединения; наличие в них электроноакцепториых групп способствует
реакции. Аналогичным образом в присутствии (CaHeJsN фосфорилируются сахара.
Метод используется в промышленности для синтеза широко известного ин-
инсектицида — хлорофоса:
СС13-СНО + НР(ОСН3J
I!
О
СС13—СН—Р(ОСН3J
он о
См. также Конант (№ 316).
Абрамов В. С, ДАН СССР, 1950, т. 73, с. 487.
Абрамов В. С, Семенова Н. А., ЖОХ, 1958, т. 28, с. 3056.
Paulsen H., Greve W., Kohne H., «Tetrahedron Letters», 1971, p. 2109.
Нифантьев Э. Е. Химия фосфороргаиических соединений. М., Изд. МГУ,
I У / 1 ( С. &Qj.
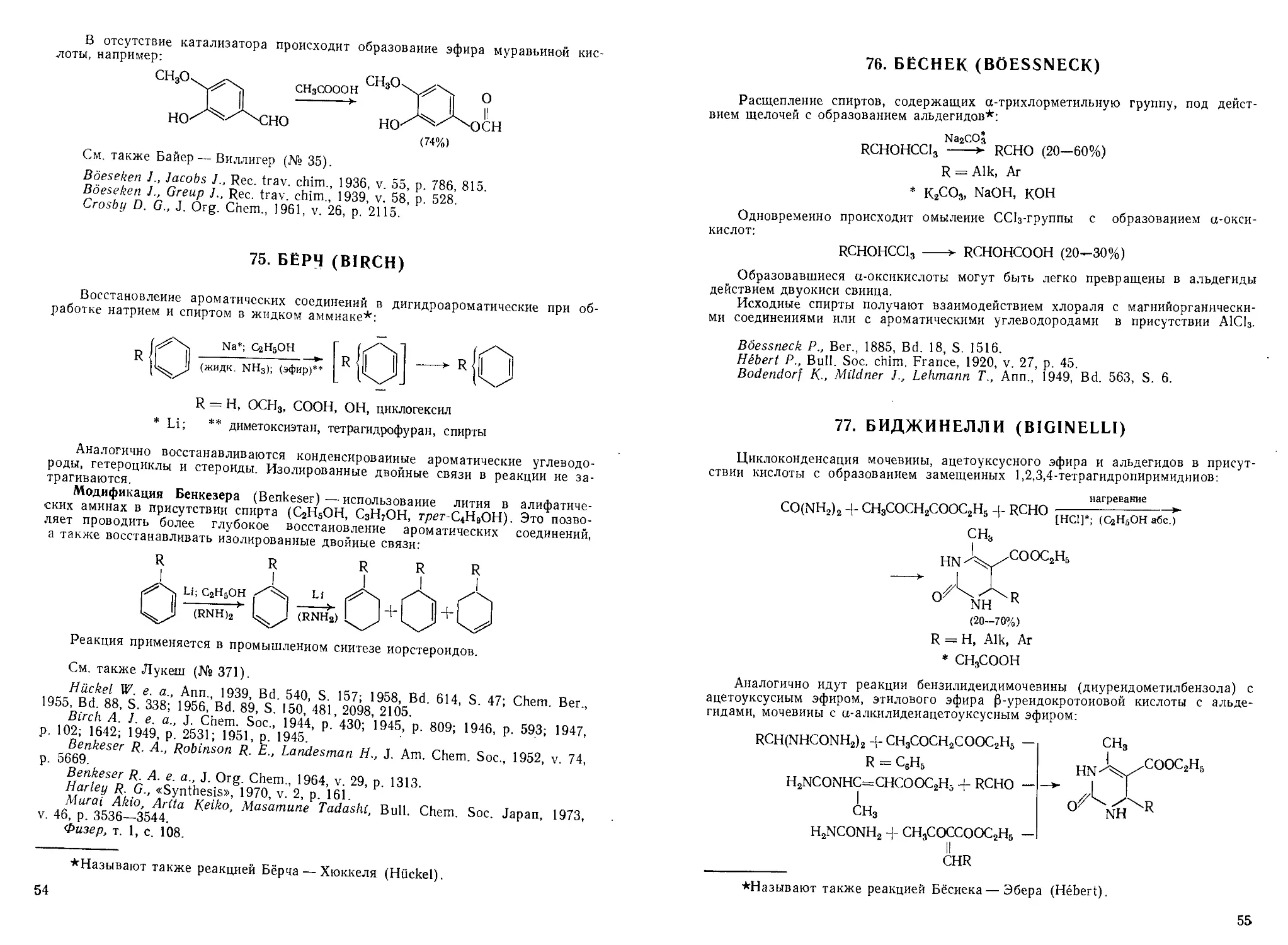
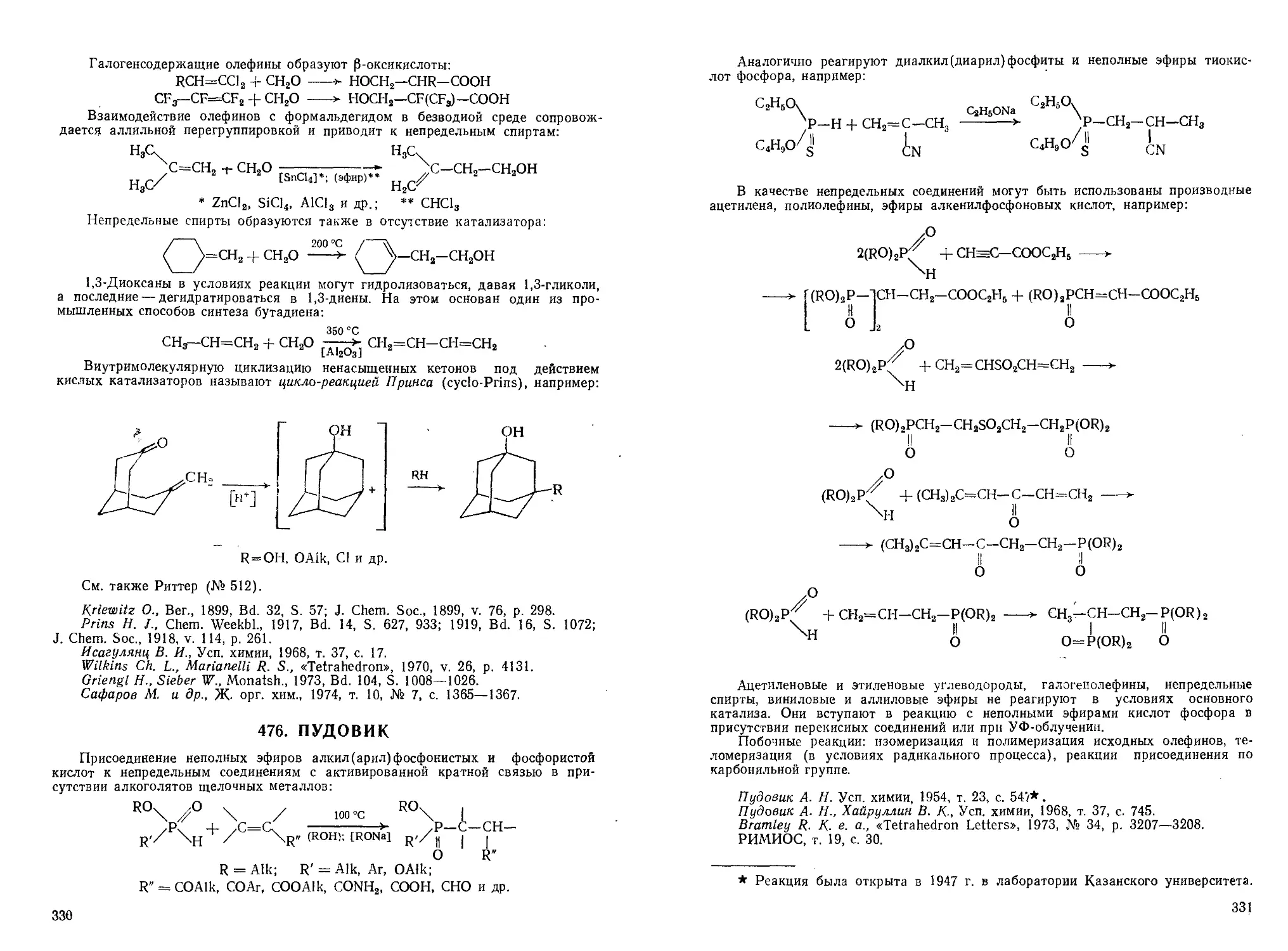
2. АДАМС (ADAMS)
Декарбоксилирование 3-карбоксикумаринов и их производных в кумарииы
под действием бисульфита натрия:
;о
1. NaHSO3
2. NaOH (конц.)*; нагревание
R = Н, ОН, A Ik, OAlk, CeH5
* H2SO4(kohu.)
Достоинство метода — возможность проведения декарбоксилирования без
разрушения цикла; выходы кумаринов значительно выше, чем при использовании
других методов. В реакцию вступают и конденсированные производные 3-карб-
3-карбоксикумаринов.
Adams R., Mathieu I., J. Am. Chem. Soc, 1948, v. 70, p. 2120.
Adams R., Backstahler T. E., J. Am. Chem. Soc, 1952, v. 74, p. 5346.
Cramer F., Windel H., Chem. Ber., 1956, Bd. 89, S. 354.
3. АДКИНС—ПИТЕРСОН (ADKINS—PETERSON)
Окисление метанола в формальдегид кислородом воздуха в присутствии
окисиых катализаторов:
Ог; 250—400 °G
ШзШ |Fe2O3] ? Ш*°
(90-95%)
Формальдегид получается практически без примеси метанола.
См. также Муро — Мииьонак (Л» 410).
Adkins H., Peterson W. R., J. Am. Chem. Soc, 1931, v. 53, p. 1512.
Ullmanns F. Encyklopadie der technischen Chemie. 3. Aufl. Bd. 6. Miinchen —
Berlin, Urban u. Schwarzenberg, 1955, S. 662.
4. АЗИНГЕР (ASINGER)
Межмолекуляриая циклизация кетонов под действием серы и аммиака с об-
образованием замещенных А3-тиазолинов:
—С—С7
II |N
О Н
-с-с(
II I
о н
S; NH3; 20 °С
(С6Нв)«
S
D0-90%)
сн—
* СН3ОН, C6H5N, HCON(CH3J
В реакцию вступают различные алифатические, алициклические и гетероцик-
гетероциклические кетоны, имеющие в а-положении к карбонильной группе хотя бы один
атом водорода. Альдегиды также вступают в эту реакцию, но выход Д3-тиазоли-
нов очень низок (<10%).
Аналогично идет реакция при взаимодействии кетонов с а-меркаптокетонами
или меркаптоальдегидами, например:
СН
СН3—С—СН—СН3 + С2Н6—С—СН3
I! I II
О SH О
мн
3,
/
СН3—
снз
Арилметилкетоны в обычных условиях образуют Д3-тиазолииы с низкими
выходами, а при большом избытке серы дают А3-имидазолии-5-тиоиы:
S; NH3
' ' " (90%)
2СвН6-С-СН3
II
О
(СН3ОН)
S=
Asinger F., Angew. Chem., 1956, Bd. 68, S. 377, 413.
Lyle R. E., Munk R., Lodd L, J. Org. Chem., 1965, v. 30, p. 293.
Asinger F., Offermanns H., Angew. Chem., 1967, Bd. 79, S. 953.
5. АЙНХОРН (EINHORN)
Ацилирование спиртов или фенолов хлорангидридами кислот в избытке
пиридина с образованием сложных эфиров:
C5H5N + ROH
ROH + R'COCl > [QHN-COR' ОТ] v R'COOR
Ацилируемое вещество растворяют в 5—10-кратиом избытке C5H5N, охлаж-
охлаждают, постепенно добавляют R'COCl, выдерживают несколько часов и разбав-
разбавляют водой или кислотой.
Для ацилирования аминов используют также хлорангидриды, получаемые
непосредственно в реакционной смеси из R'COOH и SOCb. Иногда вместо пири-
пиридина применяют Другие третичные амины, например (СгН5)зМ и (C2HsJNCeHs.
Этот метод, являющийся модификацией реакции Шоттена — Баумана (см.
№ 719), находит широкое применение благодаря мягким условиям проведения
и высокой ацилирующей способности пиридиниевой соли.
См. также Дорнов — Тайдель (№ 257), Четтэуэй (№ 695).
Einhorn A., Hollandt F., Ann., 1898, Bd. 301, S. 95.
Mills J. A., J. Chem. Soc, 1951, p. 2332.
Sitter H., Zutter H., Widler H., Ann., 1952, Bd. 576, S. 223.
6. АЙНХОРН (EINHORN)
Лмидометилирование ароматических соединений конденсацией их с N-оксиме-
тиламидами под действием сильных кислот*:
конц. H2SO| Н2О- н+
ArH + RCONHCH2OH у- ArCH2NHCOR >¦ ArCH2NH2
E0-90%)
R = Alk, CH2C1, CC13, CeH6 и др.
* НС1 в СН3ОН, BF3, H3PO4
¦Называют также реакцией Черняка — Айнхорна.
Аналогичным амидометилирующим действием обладают диоксиметильиые
производные карбамида, амида янтарной кислоты и т. п.
Амидометилироваиию подвергаются ароматические соедниеиия ряда бензола,
нафталина, антрацена, гетероциклические соединения, амины, амиды и вещества
с активированной СНг-группой, например:
H2NCOCeH6 + Г
X
CONHCH,OH
ОН
о
so2
\
N-CH2OH
со
со
^CONHCHjNHCOCf
^-OH
SO2
0
CO
CO
hsc/
H6
-NH
-NH
СН2(СООСНзJ +
,N-CH2OH
^N-CH2CH(COOCHs)a
(85%)
Исходные N-метилоламиды получают оксиметилироваиием амидов формаль-
формальдегидом в присутствии оснований:
RCONH2 + CH2O
[К2СО3]*; (Н2О)
NaOH, (C2H6)aN
*¦ RCONHCH,OH
Einhorn A., Ann., 1905, Bd. 343, S. 207.
Hellmann H., Angew. Chem., 1957, Bd. 69, S. 463.
Zaugg H. E. e. a., J. Org. Chem., 1969, v. 34, p. 14.
OP, т. 14, с 12.
7. АЙНХОРН - БРУННЕР (EINHORN - BRUNNER)
Получение 1,2,4-триазолов циклокоиденсацией диациламииор с моиозамещеи-
ными гидразинами или семикарбазидом:
/R"
R'CONHCOR" + RNHNH2
[C5H5NHC1]*
NR
R = H, CHa, NH2CO, CeH6; R' = H, CH3, NH2;
R" = H, C2H6, OH, NH2, C6H6CH2
* CH3COOH, кислый буферный раствор
Применение сильных кислот в качестве катализаторов вызывает понижение
выхода. Если R'^=R", то образуется смесь изомеров. Вместо диациламииов мож-
10
но использовать производные, в которых один или два карбоиильиых атома кис-
кислорода замещены иа имииогруппу или серу, например:
N
NH
N
NHCONH,
C6H6-<^ >
NH
/SH
HOCeH4NH—C-NH-C—NH2 + H,NNH2
II II
NH NH
C6H6CONH-C-NH2 + H2NNH2 —
II
N-CN
H2N-C-NH—C—SH + C6H6NHNH2
II II
s s
C6H6—C—N=C=S + H2NNH2
II
О
Einhorn A. e. a., Ann., 1905, Bd. 343, S. 229.
Brunner K-, Ber., 1914, Bd. 47, S. 2671; Monatsh., 1915, Bd. 36, S. 509.
Potts К. Т., Chem. Rev., 1961, v. 61, p. 103.
Эльдерфильд, т. 7, с. 333.
N-CeH6
/SH
•N
8. АЙСЛЕБ (EISLEB)
Амииоалкилироваиие соединений, содержащих активированный атом водоро-
водорода, действием третичных хлоралкиламииов в присутствии амидов натрия или
калия:
I NaNH2; нагревание |
-С-Н + C1(CH2),,NR2 ^^ * -C-(CH2)nNR2
я = 2,3
NR2 = N(CH3J. N(C2H6J, пиперидил, морфолил
* С6Н6СНа
В реакцию гладко вступают соединения типа беизилцнаиида, иидеи, флуо-
рен и т. п. В случае дезоксибензоинов образуется смесь продуктов О- и С-амиио-
алкилироваиия:
АгС—СН2Аг' v АгС-СНАг' + Аг-С=СНАг'
II И I I
О О CH2CH2NR2 OCH2CH2NR2
Пиррол, иидол, карбазол и акридон алкилируются по атому азота, на-
например: '
-СН,
NH
V
-сн,
NCH2CH2N(C2H6J
11
Аминоалкилироваиие соединениями типа [3-хлорэтилового эфира приводит
к циклическим продуктам:
С6Н5Ч С1СН2СН1Ч NaNH2 СвН5ч / \
>сн2 + >y —>¦ V ;y
NC' C1CH2OV NC/ \—/
Y = O, S, NSO2C6H5
Реакция идет значительно легче при использовании полярных апротонных
растворителей (диметилформамид, диметилсульфоксид).
См. также Маниих (№ 384).
Eisleb О., Вег., 1941, Bd. 74, S. 1433.
Dewar M. 1. S., J. Chem. Soc, 1944, p. 619.
Stoll W. G., Frey G., Morel С J. Helv. chim. acta., 1950, v. 33, p. 1208.
Sperber N.. Fricano R., Papa D., J. Am. Chem. Soc, 1950, v. 72, p. 3068.
Kretz E., Mutter J. H., Schlitter E., Helv. chim. acta, 1952, v. 35, p. 520.
Rice L. M., Hertz E., Freed M., J. Med. Chem., 1964, v. 7, p. 313.
9. АКАБОРИ (AKABORI)
Восстановление а-аминокислот или их эфиров в аминоальдегиды действием
амальгамы натрия в спирте в присутствии минеральной кислоты:
-СН-СООС2Н6
NH2
NaHg; HC1; -20 °С
—сн-сно
NH2
Н2О
Продукты реакции весьма реакционноспособны и широко применяются в ор-
органическом синтезе, например для получения гетероциклических соединений:
2C4HeCHCHO + H2NCN
NH.
рН 5
С4Н9-С=
N
=СН конц. НС1; нагревание
N
Н2С
I I
С4Н9-СО NH2
С4Нв-С=СН
" N N
НС С
II I
С4Н9-С NH
См. также Мак-Фейдиен — Стивене (№ 381), Сабатье —Мэль (№ 532).
Akabori S., J. Chem. Soc. Japan, 1931, v. 52, p. 844; С A.,- 1932, v. 26,
p. 5076.
Akabori S., Ber., 1933, Bd. 66, S. 151.
Lawson A., J. Chem. Soc, 1956, p. 307.
12
10. АКАБОРИ (AKABORI)
Получение аминоспиртов альдольной конденсацией аминокислот с аромати-
ароматическими альдегидами и последующим декарбоксилированием*!
нагревание
RCHCOOH + АгСНО ^-> ArCH-CHR
-со2
NHR'
ОН NHR'
В случае R'=H процесс сопровождается образованием ArCHaNH2 и RCHO.
Аминокислоты с третичной аминогруппой, с аминогруппой у ароматического яд-
ядра, а также с ацилированнои аминогруппой в реакцию не вступают.
См. также Эрленмейер— Фрюштюк (№ 741).
Akabori S., Momotani К., J. Chem. Soc. Japan, 1943, v. 64, p. 608; С A., 1947,
v. 41, p. 3774.
Dose K., Chem. Ber., 1957, Bd. 90, S. 1251.
Беликов В. М. и др., Изв. АН СССР. ОХН, 1969, с. 2536.
И. АЛГАР — ФЛИНН — ОЯМАДА
(ALGAR - FLYNN - OYAMADA)
Получение флавонолов окислительной циклизацией 2'-оксихалконов под дей-
действием перекиси водорода в щелочной среде:
—
R
R
.им
Н2О2; NaOK
^С-С=СНАг (В°ДНЫе С2Нб°Н
U'
0
Cl j-
Ц/кссГ^
/Ar"
хон
u
= Н, ОН, СН3, ОСН.; R'=H
0-20 °C
или СНзОН)
О
, осн.
^Ar
--он
Исходными веществами могут служить дифлаваноны, полиметоксифлаваио-
ны, а-фурфурилиден-о-оксиацетофеноны, а-циннамилиден-о-оксиацетофеноиы,
глюкозидохалконы. В реакцию вступают также вииилогн халконов, например:
СО-СН=СН-СН=СНС6Н5
сн=снс,н.
¦Называют также реакцией Акабори — Момотанн (Momotani).
13
В случае 2'-окси-6'-метоксихалконов продуктами реакции являются 2-арил-
кумаран-3-оны, а при R' = CH3— З-окси-3-метилфлаваноны, например:
СН3О
он
сн3
I
-со—с=снсвн5
Реакция служит одним из основных методов сиитеза флавоноидов. Побочные
реакции: расщепление исходных веществ.
Исходные 2'-оксихалконы обычно получают конденсацией 2-оксиацетофено-
иов с соответствующими ароматическими альдегидами под действием NaOH в
водном этаноле.
См. также Ауверс (№ 27), Бейкер — Оллис (№ 55), Костанецкий (№ 326).
Algar ]., Flynn J. P., Proc. Roy. Irish. Acad., 1934, v. 42B, p. 1; С A., 1935,
v. 29, p. 161.
Oyamada Т., J. Chem. Soc. Japan, 1934, v. 55, p. 1256; С A., 1935, v. 29,
p. 4358.
Dean F. M., Verapong Polimuang, J. Chem. Soc, 1965, p. 3978.
Smith M. A., Neumann R. M., Webb R. A., J. Heterocyclic. Chem., 1968, v. 5,
p. 425.
Cullen W. P., Donnelly D. M. X., Keenan A. K-, J. Chem. Soc, Ser. C, 1971,
p. 2848.
Gormley Т. Т., O'Sullivan W. ]., «Tetrahedron», 1973, v. 29, № 2, p. 369—373.
Эльдерфильд, v. 2, p. 188.
12. АЛЛЕН (ALLEN)
Получение оксимов эфиров диалкилфосфорных кислот из триалкилфосфитов
и а-галогеннитросоединений:
—40— +50 "С
2(ROKP + R'R"CXNO2 ' >- (ROJP-ON=CR'R" B0-60%)
О
R = СН3, С,,Н6; R' = Н, СН3, CF3, Cl, F; R" = СН3, Cl, COOAlk;
X = Cl, Br
Одновременно происходит окисление триалкилфосфита до триалкилфосфата.
Аналогично протекает реакция триалкилфосфитов, диалкилгалоген- и алкил-
дигалогенфосфитов с а-галогеннитрозоалканами, например:
C2H6OPRR' + R"R'"CC1NO
С2Н6О-Р
II
О
R
ON=CR"R"
R, R'=OC2H6, Cl; R" = CF3, CF2NO2; R" = CF3, F, Cl
14
В реакцию вступают также циклические эфиры фосфористой кислоты:
О | О F
' \ -40 СС —С/ \ | > о °С
Vf + CCIjFNO *• [ у?—ON=CC1F »-
О' ~|^О С1
\ I I
—v ;с—с—о-р=о
/| I I
Cl ON=CC1F
Преимуществом применения нитрозосоединений является отсутствие побоч-
побочной реакции окисления.
Образующиеся фосфорилированные оксимы являются азотистыми аналогами
еиолфосфатов — продуктов реакции Перкова (см. Перков, № 449).
См. также Арбузов (№ 22).
Allen J. F., J. Am. Chem. Soc, 1957, v. 79, p. 3071.
Мартынов И. В., Кругляк Ю. Л., Перевезенцева Н. Ф., ЖОХ, 1967, т. 37,
с. If25, ИЗО, 1132.
Малекин С. И., Якутии В. И., Сокольский М. А., ЖОХ, 1972, т. 42, с. 807.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачиика. М„ «Химия», 1972, с. 390.
13. АМАДОРИ (AMADORI)
Перегруппировка N-арилгликозиламинов в 1-амино-1-дезоксикетозы в при-
присутствии слабых кислот:
R
Аг
J—СН-
|
н—с—он
I
снон
|
о
CH-N<
II
С—ОН
снон
CH2-N
С=О
СНОН
I
-Аг
При нагревании в спирте перегруппировка проходит очень быстро. У N-ал-
килгликозиламинов перегруппировка не наблюдается.
Перегруппировка используется в промышленности как одна из стадий сиите-
сиитеза рибофлавина.
При действии NH3 или RNH2 на кетозы наблюдается ретро-перегруппировка
Амадори* с образованием 2-амино-2-дезоксиальдоз:
СН2ОН СНО
! RNH2 I
С=О >- CHNHR
СНОН
СНОН
¦ Ретро-перегруппировку Амадори иногда называют перегруппировкой
Хайиса (Heyns).
15
Amadori M., Atti Accad. naz. Lincei, 1925, v. 2, p. 337; 1929, v. 9, p. 68, 226;
1931, v. 13, p. 72, 195.
Heyns К., Meinecke K.-H., Chem. Ber., 1953, Bd. 86, S. 1453.
Michell F., Duong J., «Tetrahedron Letters», 1962, p. 21.
Heyns К, Beilfuss W., Chem. Ber., 1973, Bd. 106, № 8, p. 2680—2692, 2693—
2709
Вигдорчик М. М. и др., ЖОХ, 1974, т. 10, № 6, с. 1256—1262.
Hodge J. Е., Adv. in Carbohydrate Chem., 1955, v. 10, p. 165.
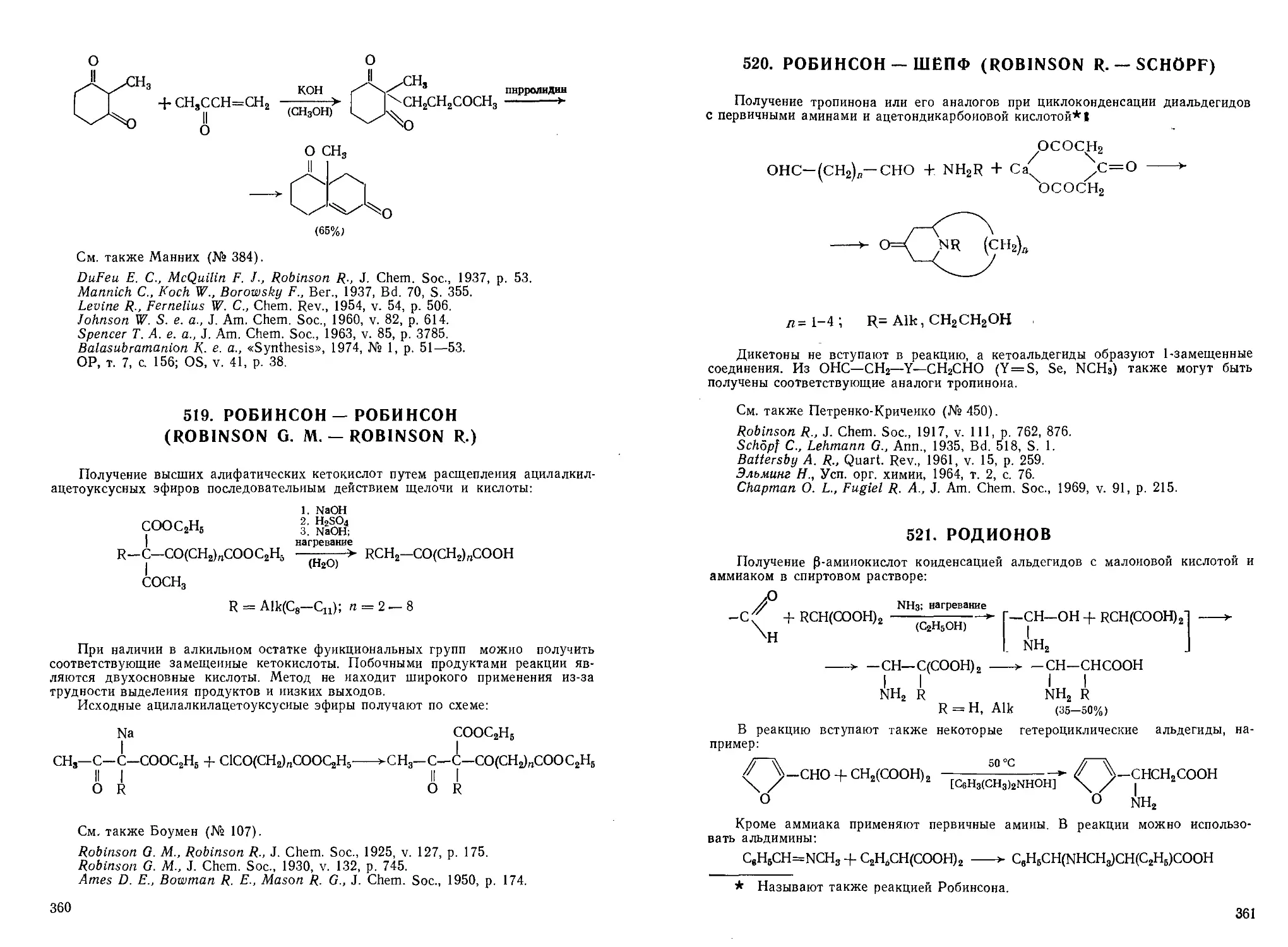
14. АНДЖЕЛИ —РИМИНИ (ANGELI — RIMINI)
Образование гидроксамовых кислот из альдегидов при действии бензолсуль-
фогидроксамовой кислоты:
но~
C6H5SO(OH)NOH >- NOH + CeH6SO2H
RCHO + NOH
RC<
OH"
NO
H
= Alk, Ar
/OH
RC/
NOH
В качестве источника нитроксила используют также натриевую соль нитро-
гидроксиламина.
Y-Оксиальдегиды, а также некоторые ароматические альдегиды
[o-O2NCeH4CHO, o-OHCCeH4CHO, n -(CH3JNCeH4CHO] не вступают в эту
реакцию.
Реакцию используют для качественного определения альдегидной группы,
поскольку гидроксамовые кислоты дают с FeCl3 интенсивное красное окраши-
окрашивание.
Angeli A., Gazz. chim. ital., 1896, v. 26, pt. II, p. 17.
Angeli A., Angelica E., Gazz. chim. ital., 1904, v. 34, pt. I, p. 50.
Yale H. L, Chem. Rev., 1943, v. 33, p. 228.
Власов В. М., Захарова О. В., Ж, орг. хим., 1974, т. 10, с. 66—71.
Houben-Weyl, 1953, Bd. 2, S. 437.
15. АНДО (ANDO)
Получение замещенных миндальных кислот из ароматических углеводородов
и эфиров мезоксалевой кислоты под действием хлорного олова с последующим
омылением и декарбоксилированием:
SnCl4
СО(СООС2Н5J
1. кон
.^ .С(СООС2Н5J 2. на; ХНСООН
-^\/ I нагревание i?
,XJ
он
он
F0-70%)
R = Н, СН3, СН2СвН5, СН(С„Н5J
16
Аналогично реагируют о- и гс-ксилолы, углеводороды ряда нафталина и аи-
трацен.
Ando Т., J. Chem. Soc. Japan, 1935, v. 56, p. 745; С. А., 1935, v. 29, p. 7960.
Riensomer J. e. a., J. Am. Chem. Soc, 1942, v. 64, p. 2080.
СОП, т. З, с 195.
16. АНДРУСОВ (ANDRUSSOW)
Получение синильной кислоты окислением смеси метана с аммиаком кисло-
кислородом воздуха на платиновом катализаторе:
О2; -1000 "С
СН4 + NH3 „.„ 1 HCN
[Pt]*
* Сплав Pt—Rh
(85%)
Реакцию следует рассматривать как частный случай реакции окислительного
аммонолиза. Она проводится в крайне жестких условиях и по характеру пре-
превращения исходных веществ может быть отнесена к процессам глубокой окис-
окислительной деструкции органических соединений. Реакция осуществляется в про-
промышленном масштабе.
Andrussow L., Ber., 1927, Bd. 60, S. 2005; Angew. Chem., 1935, Bd. 48,
S. 593.
Ullmann F., Encyklopadie der technischen Chemie. 3. Aufl. Bd. 5. Munchen —
Berlin, Urban u. Schwarzenberg, 1954, S. 635.
17. АНРИ (HENRY)
Получение иитроспиртов альдольной конденсацией альдегидов с нитропара-
фииами:
RCH—NO2 + R'CHO
H NO2 ОН
* K2CO3, Na2CO3, NaHCOg, RONa, RNH2, Ca(OHJ,
ZnCl2 (для ароматических альдегидов)
Аналогично можно получить двух- и трехатомные нитроспирты.
См. также Камле (№ 283), Соуден— Фишер (№ 551).
Henry L, С. г., 1895, v. 120, р. 1265.
Hass H. В., Riley E. F., Chem. Rev., 1943, v. 32, p. 406.
Lichtenthaler F. W., Angew. Chem., 1964, Bd. 76, S. 84.
Новиков С. С. и др. Химия алифатических и алициклических иитросоедине-
ний. М., «Химия», 1974, с. 37.
2—684
17
18. АНРИ (HENRY)
Получение а-галогенэфиров действием галогеноводородов иа эквимольную
смесь альдегида и спирта*:
НХ*; -5 - о -С
RCHO + R'OH >- fRCHOR'"! v RCHOR'
->• fRCHOR'"|
U. J
X
G0%—колич.)
= H,Alk;
R'=Alk; X = C1, Br,
'* SOC12
В реакции используют ароматические, алифатические (в том числе ненасы-
ненасыщенные и многоатомные) спирты, а также спирты, которые содержат различные
функциональные заместители, инертные по отношению к галогеноводороду. Ке-
тоны реагируют подобно альдегидам, однако образующиеся галогенэфиры очень
нестойки.
Реакция с фенолом протекает аномально:
,ОН °
сн2о +
Ч
Ч
о
Основные побочные реакции—образование ацеталей, дегидрогалогенирова-
ние и полимеризация.
В случае ненасыщенных альдегидов одновременно происходит присоединение
НХ по двойной связи, например:
НС1
СН2=СН—СНО + СН3ОН *- СН3СНС1—СН(С1)ОСН3
Henry L, Bull. Acad. Roy. Belg., 1893, v. 25, p. 439.
Blair С M., Henze H. R., J. Am. Cliem. Soc, 1932, v. 54, p. 399.
Поконова Ю. В. Галоидэфиры. М.-Л., «Химия», 1966, с. 19, 93. СОП, т 1,
с. 278.
19. АНШЮЦ (ANSCHUTZ)
Получение антрацена конденсацией ароматических углеводородов с алкил-
полигалогеиидами в присутствии хлористого алюминия:
18
При R=C2H5 гомологи антрацена ие образуются.
Существуют и другие реакции получения антрацена, носящие это же имя:
R
<У
снх
[АКЗД
X = Cl, Br
¦Называют также реакцией Анри — Литтершайда (Litterscheid).
См. также Фридель — Крафтс (№ 627).
Anschutz R., Angelbis A., Ber., 1884, Bd. 17, S. 165.
Anschutz R., Ann., 1886, Bd. 235, S. 305.
Sisido K. e. a., J. Org. Chem., 1961, v. 26, p. 1368.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер.
с англ. М., Издатинлит, 1949, с. 125.
20. АНШЮЦ (ANSCHUTZ)
Получение замещенных 4-окснкумаринов конденсацией о-ацетоксибензоилхло-
рида с натриевыми производными а-алкилацетоуксусных эфнров и последующим
кислотным гидролизом:
ОСОСН
нагревание
R = Н, СН3, СН2С6Н5
Аналогично реагируют натриевые производные малонового и циануксусного
эфиров.
См. также Пехман (№ 453).
Anschutz R., Ber., 1903, Bd. 36, S. 463; Ann., 1909, Bd. 367, S. 169, 219.
Heilbron I. M., Hill D. W., J. Chem. Soc, 1927, p. 1705.
Эльдерфильд, т. 2, с. 138.
21. АППЕЛЬ — РОБИНСОН (APPEL — ROBINSON)
Получение цианидина окислением тетраметилового эфира катехина бромом
с последующим деметилированием под действием йодистого водорода:
ОСН3
СН;
о
осн.
19
ОСН
—[' у—Wbn3 [P KpacH.j
но
Реакцию проводят в техническом диоксаие. При использовании чистого ди-
оксаиа необходима добавка перекиси беизоила. чистого ди
Appel H. Robinson R., J. Chem. Soc, 1935, р 426.
v 46 J5й К" Seskadri T- R' Subrafnanian P., Proc. Indian Acad. Scl., 1957,
Эльдерфильд, т. 2, с. 217.
R'O4
\ нагревание
)p-OR' + R-X — >
R'CK
22. АРБУЗОВ А. Е.
триалкилфосфитов в фосфоиаты при реакции с алкилга-
-OR'1 _ R'O4
R J X" ~*
rR<\
X = Cl, Br, I
4 /
PX
/ \
(-90%)
РазиообРазиые галогеипроизводные: первичные алкил-
srar г-жа - a
•Называют также реакцией Арбузова - Михаэлиса (Michaelis).
20
уменьшается в ряду I > Вг > С1, а также с увеличением длины цепи R.
У несимметричных триалкилфосфитов отщепляется, как правило, радикал с мень-
меньшим числом углеродных атомов.
К аналогичной перегруппировке способны также другие соединения, содер-
содержащие группы NPOR', например, R'P@R'J и RJPOR', а также тиопроизвод-
ные с группой NPSR', кроме P(SR'b. Взаимодействие P(OR'K с а-галогенке-
тоиами течет аномально (см. Перков, № 449).
Перегруппировка носит общий характер и может быть определена как пре-
превращение эфиров кислот трехвалеитиого фосфора в производные пятивалентного
фосфора, происходящее под действием электрофильиых реагентов и сопровож-
сопровождающееся образованием новой связи Р—Э (Э = С, N, О, S, Si и др.), например:
70—100 °С
P(OC2H5K + BrSi(C2H6K >¦ (C2H5KSi-P(O)(OC2H5J
(-25%)
Реакция широко применяется для получения инсектицидов, лекарственных
веществ и других физиологически активных фосфороргаиических соединений.
См. также Аллеи (№ 12), Милобендзкнй — Шульгин (№ 400), Михаэлис —
Беккер (№ 404), Райдои (№ 488).
Michaelis A., Kaehne R., Ber., 1898, Bd. 31, S. 1048.
Арбузов А. Е., ЖРФХО, 1906, т. 38, с. 687.
Burt D. W., Simpson P., J. Chem. Soc, 1969, Ser. C, p. 2273.
Рафиков С. Р., Челнокова Г. Н., Джилкибаева Г. М., Труды Института хим.
наук АН Каз. ССР, т. 23, с. 80.
Arbuzov В. A., Z. Chem., 1974, Bd. 14, S. 41—49.
Кирби А., Уоррен С. Органическая химия фосфора. Пер. с аигл. Под ред.
А. Н. Пудовика. М., «Мир», 1971, с. 44.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачника. М., «Химия», 1972, с. 382.
OR, v. 6, р. 276.
РИМИОС, т. 3, с. 7.
23. АРБУЗОВ А. Е. — АРБУЗОВ Б. А.
Образование триарилметильиых радикалов из триарилбромметаиа при дей-
действии диэтилфосфита натрия:
(C2H5OJPONa; нагревание
АгзСВг —— Аг3С
(эфир)
C0-80%)
Реакцию проводят в атмосфере азота.
Аналогичным образом получены свободные радикалы из бром- и хлорпроиз-
водиых арилксаитила и арилзамещеииого циклопеитадиеиа.
Триарилхлорметаиы реагируют с диэтилфосфитами по Михаэлису — Беккеру
(см. № 404) с образованием соответствующих О,О-диэтилтриарилметилфосфо-
натов.
См. также Гомберг (№ 204).
Арбузов А. Е., Арбузов Б. Л., ЖРФХО, 4929, т. 61, с. 1923.
Реутов О. А. Теоретические осиовы оргаиической химии. М, Изд. МГУ, 1964,
с. 344.
РИМИОС, т. 15, с. 56.
21
24. АРЕНС—ВАН ДОРП (ARENS — VAN DORP)
Получение а,р-иепредельиых альдегидов взаимодействием кетонов или аль-
альдегидов с этоксиэтииилмагнийбромидом, селективным гидрированием образовав-
образовавшихся этоксиэтииилкарбинолов и последующим гидролизом*:
\
:с=о + BrMgc==c—осан6
\
:с-с=с-ос,ня
\ Н2О;
\:-сн=сн-ос2н5
он
[Pd/BaSO4]*; (CH3OH)
)с=сн-сно
(-50%)
* Pd/CaCO3 в пиридине, Pd—СаСО3—РЬО (катализатор Линдлара)
В реакцию вступают алифатические, жнрноароматические и алициклические
кетоны. Весьма успешной оказалась замена этоксиэтинилмагнийбромида на
этоксиацетилеиид лития, получаемый по схеме:
С1СН=СН-ОС2Н6
LiNH2
(жидк. NH3)
f Li-feC-OC2H6
Исходя из соответствующих тиоэфиров, можно получать тиоальдегиды, на-
например:
о
+ Li-C=C-SC2H5
сн—сн
Метод позволяет удлинять углеродную цепь исходного карбонильного соеди-
соединения на два атома углерода и находит применение для получения альдегидов,
используемых в синтезе каротинондов.
См. также Джонс —Уидон (№ 249), Инхоффен (№ 274), Неф (№ 424).
Van Dorp D. A., Arens J. F., Nature (London), 1947, v. 160, p. 189.
Преображенский Н. А., Шокина В. В., ЖОХ, 1953, т. 23, с. 710.
Isler О. е. a., Helv. chim. acta, 1956, v. 39, p. 259.
Арене Д. Ф. В кн.: «Успехи органической химнн». Т. 2. Пер. с англ. Под ред.
И. Л. Кнунянца. М., «Мир», 1964, с. 113.
Физер, т. 4, с. 269, 273.
25. АРНДТ —АЙСТЕРТ (ARNDT — EISTERT)
Превращение карбоновой кислоты в ее ближайший высший 'гомолог взаи-
взаимодействием хлорангидрида с диазометаном, перегруппировкой образовавшегося
диазокетона под действием окиси серебра в кетен и превращением последнего
¦Реакция была открыта Н. А. Преображенским и В. В. Шокиной см ЖОХ
1945, т. -№, с. 65. '
22
в кислоту или ее производное*:
RCOC1 + CH2N2(-^
RCOCHN2
R'OH
> [RCH=C=O]
60—100 СС
NH3
>
R'NHjj
Н2О
RCH2COOR'
RCH2CONH2
RCH.CONHR'
RCH2COOH
R = Alk, Ar, цикло-АШ
* CeH6; ** мелкодисперсные Ag, Pt, Си, УФ-облучение, без катализатора
Выходы кислот или их производных составляют 50—80%.
Кроме диазометана могут быть использованы другие алифатические диазо-
соединения, например:
—COBr + N2CHCOOCH3
О
/~\-СН(СООСН3J
о
Побочный процесс—образование хлорметилкетонов:
НС1
RCOCHN2 > RCOCH2C1
Реакция находит применение в различных областях органического синтеза
благодаря возможности использования хлорангидридов кислот, содержащих
практически любые заместители (кроме фенольного гидроксила).
Модификация Ньюмеиа—Била (Newman — Beal)—использование триэтил-
амина для связывания НС1, выделяющегося при образовании диазокетоиа, и
применение C6H5COOAg в (C2H5KN в качестве катализатора перегруппировки.
Это позволяет сократить расход диазометана и получать продукты с более высо-
высокими выходами благодаря протеканию реакции в гомогенной среде.
Модификация Уайлдса (Wilds) — применение высококипящих спиртов (бен-
зилового, н-октилового) в качестве растворителей при разложении диазокетонов;
присутствие катализатора не обязательно. Метод позволяет использовать высшие
диазоалканы, например:
n-ClC6H4-C-CN2
О CH3
160 °С
; [C6H5N(CH3J]
га-С1С6Н4-СН-СОСН2СвН6
I И
сн3 о
См. также Вольф (№ 176), Килиани — Фишер (№292), Ниренштайи
(№ 427), Хюниг (№ 681).
Arndt F., Eistert В., Par tale W., Вег., 1927, Bd. 60, S. 1364; 1928, Bd. 61,
S. 1949; 1935, Bd. 68, S. 200, 212; 1936, Bd. 69, S. 1805.
Eistert В., Ber., 1933, Bd. 68, S. 208; Angew. Chem., 1941, Bd. 54, S. 127.
Кнунянц И. Л., Гамбарян Н. П., Рохлин Е. М., Усп. хим., 1958, т. 27, с. 1383.
Wilds A. L, J. Am. Chem. Soc, 1962, v. 84, p. 1503.
Аветисян А. А-, Акопян К- Г., Дангян М. Т., «Химия гетероциклических со-
соединений», 1973, № 12, с. 1604—1607.
Мюллер, с. 360, 591; ОР, т. 1, с. 53.
¦Стадия превращения диазокетона в кетен имеет самостоятельное значение
и называется «перегруппировкой Вольфа» (см. № 176).
23
26. АТЕРТОН —ТОДД (ATHERTON — TODD)
Получение диалкиламндофосфатов фосфорилированием аминов дналкилфос-
фнтами в присутствии четыреххлористого углерода и оснований*:
RR'NH + (R"OJP-H
CCil; -20 °G
—*¦ (R"OJP-NRR'+ CHC13
[(C2H5KN]*
и и
О О
R = H,Alk,Ar; R' = H, Alk; R" = Alk, Ar
* C2C16, C2C16H, CCl3Br; ** 2,6-днметилпнпериднн, Na2CO3
Аналогичным фосфорилнрующим действием обладают эфиры алкилфосфо-
нистых кислот, амиды фосфористой кислоты и др., например:
-NH2 + H-
/ОСН2С„Н6 /—\ /ОСН2СвН6
ii
Н2С NH-f H-P[N(CH3J]2 —
СН2 О
(C2H5JNH + (C2H6OJP-NHC6H6
(95%)
Н2С N-P[N(CH3J]2
СН2 О
G5%)
-> (C2H6OJP-N(C2H5J
II
NC6H6
Подобно аминам фосфорилируются различные спирты с образованием соот-
соответствующих эфиров, например:
ызо-С3Н7ОН + Н—P(CH2CH2CNJ
II
О
n-O2NC6H4OH + И-Р(ОС2Н6J
II
О
(QH9JNCH2CH2OH + H-P(CH2CH2CNJ
II
О
изо-С3Н7О—P(CH2CH2CNJ
II
О
n-O2NC6H4O-P(OC2H6J
II
О
(QH9JNCH2CH2O-P(CH2CH2CN) 2
I!
О
Реакция является одним из наиболее удобных методов синтеза амидов
и несимметричных эфиров кислот пятивалентного фосфора.
Atherton F. R., Openshaw И. Т., Todd A. R., J. Chem. Soc, 1945, p. 382, 660.
Atherton F. R., Howard H. F., Todd A. R., J. Chem. Soc, 1948, p 1106.
Нифантьев Э. Е., ЖОХ, 1971, т. 41, № 9, с. 2011; 1974, т. 44, № 1, с. 108.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачника. М., «Химия», 1972, с. 381, 453.
¦Называют также реакцией Атертона.
24
27. АУВЕРС (AUWERS)
Получение флавонолов из 2-бензнлиденкумаранонов бромированием с после-
последующим дегидробромированием под действием щелочи:
со
Вг2
>=СНС6Н6 > R
(СНЫ)
О
\ yCHBrC6H6 NaOH; нагревание
(Н2О)
ОН
R = СН3, ОСН3> С1
Наличие заместителя в орто- илн пара-положеннях к кислороду гетероцикла
облегчает реакцию; в случае лета-замещенных основным продуктом реакции яв-
является 2-бензонлкумаранон-З. Аналогичное расширение кольца претерпевают
н соответствующие днхлориды, но с меньшими выходами.
См. также Алгар — Флинн — Оямада (№ 11).
Auwers К., Мйпег К, Вег., 1908, Bd. 41, S. 4233.
Эльдерфильд, т. 2, с. 187.
28. АУВЕРС (AUWERS)
Термическая перегруппировка 1-алкилиден-4-днхлорметил-4-метилциклогекса-
диенов-2,5 в 1-дихлоралкил-4-метилбензолы:
Н3С СНС12
V л'
R"
R'
160—175 °С
RCH RCHCHC12
R, R', R", R'" = Н, СН3
Аналогичное превращение происходит в ряду производных нафталина.
В случае циклогексадиенов с аллильиыми заместителями перегруппировка
не идет.
Auwers К., Ann., 1907, Bd. 352, S. 219, 272.
Fuson R. С, Miller Т. G., J. Org. Chem., 1952, v. 17, p. 316.
29. АХМАД — СТРОНГ (AHMAD — STRONG)
Получение непредельных карбоновых кислот взаимодействием ацетиленида
натрия с дигалогеналканами, превращением образовавшихся галогенидов в ни-
нитрилы, затем в ацетиленкарбоновые кислоты и частичным каталитическим гндри-
25
рованием последних:
> RC=C(CH2)«CN
н2о
NaNH2
(NHS)
RC=C(CH2)nCOOH
н2
[Ni-Ренея]
KCN
RCH=CH(CH2)nCOOH
D0-60%)
R = H, Alk (C<9); л = 3 — 9; X = I, Br
При гидрировании получаются ^ис-соединения, которые могут быть превра-
превращены в транс-изомеры нагреванием с селеном.
Ahmad K-, Bumpus F. M., Strong F. M., J. Am. Chem. Soc, 1948, v. 70,
p. 3391.
Ahmad K-, Strong F. M., J. Am. Chem. Soc, 1948, v. 70, p. 1699.
Gensler W. J., Chem. Rev., 1957, v. 57, p. 214.
Howton D. R., Stein R., J. Lipid Res., 1969, v. 10, № 6, p. 631.
30. БАЙЕР (BAEYER)
Конденсация фенола, анизола или диметиланилина с альдегидами в присут-
присутствии кислот с образованием соединений ряда диарилметана:
R'CHO •
нагревание
[Н+]
R'CH
CHR'
Ан
R = ОН, ОСН3, N(CH3J; R' = Н, Alk, C,;H5
Конденсация происходит, как правило, в пара-положение к заместителю R.
Аналогично реагируют альдегиды, содержащие функциональные заместители
[Cl, NO2, N(CH3Jh т. п.].
Образующиеся продукты легко вступают в реакцию поликондеисации между
собой, с фенолом или его метилольным производным. Этот процесс легко оста-
остановить на любой стадии роста макромолекулы, регулируя условия (рН и темпе-
температуру). Реакция широко используется в промышленности для получения фено-
ло-формальдегидных смол.
См. также Бекеланд — Ледерер — Манассе (№ 57).
Ваеуег А., Вег., 1872, Bd. 5, S. 25, 280, 1094.
Kammerer H., Angew. Chem., 1958, Bd. 70, S. 390.
Foster H. M., Hein D. W., J. Org. Chem., 1961, v. 26, p. 2539.
Schneel #., Krimm H., Angew. Chem., 1963, Bd. 75, S. 662.
Hultzsch K. Chemie der Phenolharze. Berlin, Springer, 1950. 193S.
26
31. БАЙЕР (BAEYER)
Превращение солей пирилия в пиридины под действием карбоната аммония
в воде:
R" R"
(NH4JCO5
->¦
+0
А"
¦R'
R"
R
N
(колич.)
R, R', R" = H, Alk, Ar; R"'= Н, Alk, OCH3) NHCH3, Ar;
А=СЮГ, BF7, НаГ
* NH3 в С2Н5ОН или mpem-C4H9OH
При реакции солей пирилия с первичными аминами образуются соответст-
соответствующие N-замещенные пирндиниевые соли. Реакцию можно использовать и для
синтеза других ароматических азотсодержащих гетероциклов:
*См. также Клаусон —Каас (№ 294), Юрьев (№ 745).
Ваеуег А., Вег., 1910, Bd. 43, S. 2337.
Balaban А. Т., Nenitzescu С. D., Ann., 1959, Bd. 625, S. 74.
Dimroth K., Angew. Chem., 1960, Bd. 72, S. 331.
Дорофеенко Г. Н., Садекова Е. И., Кузнецов Е. В. Препаративная химия
пирилиевых солей. Ростов. Изд. Ростовского университета, 1972, с. 127.
Эльдерфильд, т. 1, с. 367.
32. БАЙЕР (BAEYER)
Циклизация N-галогенацетилмочевин в гидантоины под действием аммиака:
OC-NR'
хн2с/ \со—, 4/>=о
HlCjR NR
R, R' = Н, Alk, Ar
* Кипячение в спиртовом растворе
27
Аналогично циклизуются моно- и дизамещенные производные галогенаце-
тилтиомочевины. Реакция представляет скорее исторический, чем практический
интерес, так как выходы гидантоинов незначительны.
См. также Бухерер — Берге (№ 130), Габриель (№ 184), Липп (№ 366).
Baeyer A., Ann., 1864, Bd. 130, S. 129.
Eberly F. A , Dains F. В., J Am. Chem. Soc, 1937, v. 58, p. 2544.
Ware E., Chem. Rev., 1950, v. 46, p. 403.
33. БАЙЕР (BAEYER)
Получение оксиидолов из о-нитрофенилуксусных кислот восстановлением
оловом в соляной кислоте с последующей циклизацией:
=0
NH
R = H, CH3, NH2) Br
* Zn-fH2SO4, Zn-f СН/ЮОН, Fe-fCH3COOH, SnCl2, FeSO4 + NH4OH
В качестве побочного продукта образуется 1,2-диоксиндол. Метод не приме-
применим для получения N-алкилоксиндолов.
Аналогично конденсацией о-нитрофенилуксусной кислоты с ароматическими
альдегидами получают 3-арилиденоксиндолы:
гилр
СНАг
СН2СООН
+ АгСНО
NO2
СНАг
II
ССООН
=0
CeH5, CeH4Cl, CeH4NO2
NH
См. также Бруннер (№ 115), Бешан (№ 72), Зинин (№ 267), Пшорр — Хоппе
(№ 484), Хинсберг (№ 664), Штолле (№ 728).
Baeyer А., Вег., 1878, Bd. 11, S. 582.
Жунгиету Г. И. Оксиндол и его производные. Кишинев, «Штиинца», 1973,
с. 50.
Эльдерфильд, т. 3, с. 99.
34. БАЙЕР (BAEYER)
Получение индола из о-нитрокоричной кислоты действием порошка железа
в щелочной среде*:
хн_снсоон
>
NH
N02
CH=CHCOOH
NHOH
-СООН
NH
¦Называют также реакцией Байера — Эммерлинга (Emmerling).
28
Метод не имеет практического применения вследствие низких выходов
индола.
См. также Неницеску (№ 421), Райссерт (№ 491).
Baeyer A., Emmerling А., Вег., 1869, Bd. 2, S. 679.
Beilstein F., Kuhlberg A., Ann., 1872, Bd. 163, S. 141.
Эльдерфильд, т. З, с. 27.
35. БАЙЕР-ВИЛЛИГЕР (BAEYER — VILLIGER)
Окисление альдегидов и кетонов действием надкислот с образованием соот-
соответственно кислот н сложных эфиров:
-C-R
II
О
R'COOOH*
(CHCI3)**
—С—OR
Ah
-C-OR
II
О
R = Н, Alk
* Н2О2, H2SO5; ** инертный растворитель
В реакцию вступают алифатические, алициклические и ароматические кар-
карбонильные соединения. При окислении метилалкилкетонов всегда образуются
эфиры уксусной кислоты, например:
сн,со—.
GF3COOOH
сн,соо
E3%)
Легкость миграции радикала R возрастает в ряду: первичный < вторич-
вторичный < третичный. Электронодонорные заместители в ароматическом ядре об-
облегчают миграцию, тогда как электроноакцепторные — затрудняют..
Циклические кетоны окисляются в лактоны, а в присутствии спирта — в эфи-
эфиры ш-оксикислот. Из а-дикетонов получаются ангидриды кислот, а из а,|3-ие-
предельных кетонов — эфиры енолов.
См. также Бёзекен—Баллио (№ 74), Морленд (№ 408).
Baeyer A., Villiger V., Вег., 1899, Bd. 32, S. 3625; 1900, Bd. 33, S. 858.
Holker I.S.E., Yones W. R., Ramm P. J., Chem. Comm., 1965, p. 435.
Tardella P. A., Dl Maio G., «Tetrahedron», 1967, v. 23, p. 2285.
Ogata Yoshiro, Sawaki Yasuhiko, J. Am. Chem. Soc, 1972, v. 94, p. 4189.
DeBoer A., Ellwanger R. E., J. Org. Chem., 1974, v. 39, p. 77—83.
Фьюзон, с. 187; OP, т. 9, с. 82.
36. БАЙЕР—ДРЕВСЕН (BAEYER — DREWSEN)
Получение индиго при действии водного раствора щелочи на продукты кон-
конденсации о-нитробензальдегидов с ацетоном*:
CHO
+ CH3COCH3
¦Называют также реакцией Байера.
!СН2СОСН3
29
R = H, CHS> OCH3, OH, Br, CN
Вместо ацетона можно использовать пировиноградную кислоту или ацеталь-
дегид. Наличие в нитробензальдегидах гидроксильных групп в мета- или пара-
положениях затрудняет, а присутствие метоксигрупп — облегчает образование
индиго.
Ограничением метода является малая доступность исходных альдегидов, ко-
которые получают окислением о-ннтротолуолов двуокисью марганца в серной
кислоте.
См. также Хойман (№ 669).
Bayer A., Drewsen V., Ber., 1882, Bd. 15, S. 2856.
Hinkel L. E., Ayling E. E., Morgan W.. #., J. Chem. Soc., 1932, p. 985.
Венкатараман К. Химия синтетических красителей. Т. 2. Пер. с англ. Под
ред. Н. С. Вульфсоиа. Л., Госхимиздат, 1957, с. 1156.
37. БАЙЕР —ДРЕВСЕН (BAEYER — DREWSEN)
Циклизация метил-о-нитростнрилкетонов при восстановлении их оловом в
соляной кислоте с образованием хинолинов:
R = Н, СН8
При восстановлении о-нитробензилиденпировиноградной кислоты образуется
4-окснхинальднновая кислота.
См. также Кэмпс (№ 348).
Bayer A., Drewsen V., Ber, 1882, Bd. 15, S. 2682.
Manske R. #., Chem. Rev., 1942, v. 30, p. 130.
Эльдерфильд, т. 4, с. 54.
30
38. БАЛЬЗОН (BALSOHN)
Алкилирование ароматических соединений олефинами в присутствии кислых
катализаторов:
0-ю °с
ArH+-CH=CH- -^rf Аг-СН-СН—
F0-75%)
Ar = C6H4R, где R = H, Alk, ОН, NH2, OCH3> COOH, NO2 и др.
* H2SO4> BF3, AICI3, FeCl3
В реакцию вступают разнообразные олефины; присоединение идет по пра-
правилу Марковникова. Изомеризации олефинов не происходит. Побочные процес-
процессы— полиалкилирование ароматических соединений н расщепление олефинов.
Реакция используется в промышленности, в основном, для синтеза алкил-
и полиалкилбензолов.
См. также Эйкман (№ 734), Фридель — Крафтс (№ 627).
Balsohn M., Bull. Soc. chim. France, 1879, v. 31, p. 539.
Simons J. #., Archer S., J. Am. Chem. Soc, 1938, v. 60, p. 986; 1939, v. 61,
p. 1521, 1821.
Calcott W. S., Tinker J. M., Weinmayr V., J. Am. Chem. Soc., 1939, p. 61,
p. 1010.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер с англ.
М., Издатинлит, 1949, с. 462.
39. БАМБЕРГЕР (BAMBERGER)
Перегруппировка арилнитраминов в о-нитроанилины под действием кислот:
NR
HCI*;
~20°C
(HoO)**
R
NHR'
NO,
.nhr'
->R
NHRr
NO2
R- H, CH3. NO2,Cl,Br; Rr= H,CH3
* H2SO4, HCOOH, CH3COOH, C6H5SO3H
** C2H5OH, CH3COOH, (C2H5JO
Наряду с о-нитроанилином образуется небольшое количество пара-изомера.
См. также Бамбергер (№ 40), Гофман — Марциус (№ 214), Фишер — Хепп
(№ 615), Фрис (№ 630), Четтэуэй (№ 696).
31
Bamberger E., Landsteiner K-, Ber., 1893, Bd. 26, S. 482.
Hughes E. D., Ingold С. К-, Quart. Rev. Chem. Soc. London, 1952, v. 6,
p. 48.
Ингольд К-, с 502.
40. БАМБЕРГЕР (BAMBERGER)
Перегруппировка арилгндроксиламинов в га-аминофенолы в присутствии ми-
минеральных кислот:
NHOH
Н ОН
Чаще всего используют разбавленную серную кислоту. При замене воды дру-
другими нуклеофильными реагентами образуются соответствующие паро-замещен-
ные анилины:
HY
C6H5NHOH >¦ n-YC6H4NH2
Y=-OCH3, OC2H6, Cl, NHC6H6, C6H4OH-n, NH2
Если napa-положеиие занято, то перегруппировка не происходит, а образу-
образуются хииолы:
J~\-
NHOH
,=О
См также Бамбергер (№ 39), Гофман — Марциус (№ 214), Фишер — Хепп
(№ 615), Фрис (№ 630), Четтэуэй (№ 696).
Bamberger Е., Вег., 1894, Bd. 27, S. 1347, 1548; Ann., 1921, Bd: 424, S. 233,
294; 1925, Bd. 441, S. 297.
Hughes E. D., Ingold С. К., Quart. Rev. Chem. Soc. London, 1952, v. 6,
p. 45.
Ингольд К-, с, 500.
32
41. БАМБЕРГЕР (BAMBERGER)
Циклизация 1,5-диарилформазанов в бенз-1,2,4-триазины под действием
кислот:
R
N-NHAr
II
,CR'
H2SO4; -100
(СН3СООН)
N=N
C0-80%)
R = H, CH3, Br, OCH3; R' = H, CH3, C6H6> COCH3, CH2C6H6;
Аг = С6Н6>
, С6Н„Вг, С6Ц,ОСН3
При R = ra-OCH3 циклизация проходит с низким выходом, при R'
циклизация облегчается. Побочный процесс — образование феиазинов.
Исходные 1,5-диарилформазаны получают из соответствующих солей диазо-
иия и фенилгидразоиов:
NaOH
Ar'N2Cl -f R'CH=N-NHAr *¦ Ar'N=N-С=N-NHAr
A-
См. также Бишлер (№ 81).
Bamberger E., Wheelwright E., Ber., 1892, Bd. 25, S. 3201.
Bamberger E., Padova R., Ormerod E., Ann., 1925, Bd. 446, S. 260.
Abramovitch R. A., Schofield K-, J. Chem. Soc, 1955, p. 2327.
Erickson J. G. In: Chemistry of Heterocyclic Compounds. V. 10. London, In-
terscience publ., 1950, p. 100.
42. БАМБЕРГЕР —ХЕЙ (BAMBERGER — HEY)
Синтез биарилов из ароматических аминов через стадии ацетилнровання,
иитрозироваиия ацетиламина и взаимодействия нитрозоацетиламина с избытком
ароматического соединения:
ArNH2
СНзСЮОН
N2O3
ArNCOCH3
NO
—Njs; -СНзСОО'
Аг'Н
>¦ [Ar-] *- Ar—Ar'
Ar = C6H4R, где R = H, Cl, Br, OAlk, CN,
Ar' = C6H4R', где R' = H, CH3, NO2, COOCH3, OAlk
* NOC1 + CH2COONa
Используемый углеводород должен находиться в жидком состоянии, так как
применение растворителя (ССЦ, СНСЬ) приводит к значительному понижению
выходов.
3—684
33
Особое значение эта реакция имеет для получения несимметричных биари-
лов, а также полиарилов, например:
С8Н6
I II
N0 0
2С6Нв
CH3C-N—
II I
О N0
Побочные реакции — образование линейных полиарилов и восстановление
N (N0) СОСНз-группы:
ArN(NO)COCH3
Ar'H
ArH + СН3СООАг'
См. также Гомберг — Бахман — Хей (№ 206).
Bamberger E., Вег., 1897, Bd. 30, S. 366.
Grieve W. S. M., Hey D. H., J. Chem. Soc, 1934, p. 1797.
Huisgen R., Ann., 1951, Bd. 574, S. 184.
Angood D. R., Williams G. H. W., Chem. Rev., 1957, v. 57, p. 129.
OP, т. 2, с 244.
43. БАРБЬЕ— ВИЛАНД (BARBIER — WIELAND)
Превращение карбоновой кислоты в ее ближайший низший гомолог взаимо-
взаимодействием эфира кислоты с реактивом Гриньяра, дегидратацией образовавшегося
третичного спирта в олефин и его окислительным расщеплением под действием
хромового ангидрида* -.
RCH2COOC2H5 + R'MgBr
RCH2-CR?
нагревание
ОН
СгО3
RCOOH
(СН3СООН)
A0-40%)
R' = С6Н5 (обычно), Alk
Реакция применима к алифатическим, жирноароматическим и алицикличе-
ским кислотам, содержащим «-метиленовую группу. Очень хорошие результаты
(особенно в случае сложных молекул) дает окислительное расщепление
RCH = C(C6H5J действием NaIO4 в присутствии RuO(.
Третичные спирты (при R' = Alk) могут быть прямо окислены хромовым
ангидридом в кислоты. Побочным процессом в этом случае является образова-
образование кетона RCH2COR'. Последний становится главным продуктом, если исходная
кислота содержит а-СН-группу.
Метод нашел широкое применение для исследования строения и синтеза
веществ в химии природных соединений.
См. также Галлахер — Холландер (№ 187), Крафт (№ 334), Мишер (№ 407).
Wieland П., Вег., 1912, Bd. 45, S. 484.
*Наэывают также реакцией Барбье — Локкена (Locquin) — Виланда.
34
Barbier P., Locquin R., С. г., 1913, v. 156, р. 1443.
Sarel S., Yanuka Y., J. Org. Chem., 1959, v. 24, p. 2018.
Fetizon M., Golfier M., Rassat А., С. г., 1961, v. 252, p. 139.
Pattison F. L. M., Buchanan R. L, Biochem. J., 1964, v. 92, p. 10.
Фиэер, т. З, с. 90.
44. БАРДЖЕЛЛИНИ (BARGELLINI)
Получение кумаринов из о-оксиарилкетонов при нагревании их о натриевой
солью фенилуксусной кислоты в присутствии уксусного ангидрида:
R
нагревание
QH.CHoCOONa
R — СН3, С6Н5
Аналогично протекает реакция с ангидридами кислот, имеющими а-метнлс-
новую группу. При этом наряду с кумаринами образуются и хромоны, являю-
являющиеся основными продуктами реакции Костанецкого — Робинсона (см. № 327):
XOR
:h.r'
Выходы кумаринов повышаются, если в реакцию вводят ангидриды и соли
высших карбоновых кислот.
См. также Перкин (№ 446), Пехман (№ 453).
Bargellini G., Gazz. chim. ital., 1925, v. 55, p. 945.
Эльдерфильд, т. 2, с. 136.
45. БАРДЖЕР (BARGER)
_ Получение пирокатехина и его производных из метилендиоксисоединений
действием РС15 с последующим гидролизом:
Н2О; НО"
35
Burger G., J. Chem. Soc, 1908, p. 93, 563.
Baker W., Godsell J. A., McOmie J. F. W., J. Chem. Soc, 1953, p. 4058.
46. БАРДХАН-СЕНГУПТА (BARDHAN - SENGUPTA)
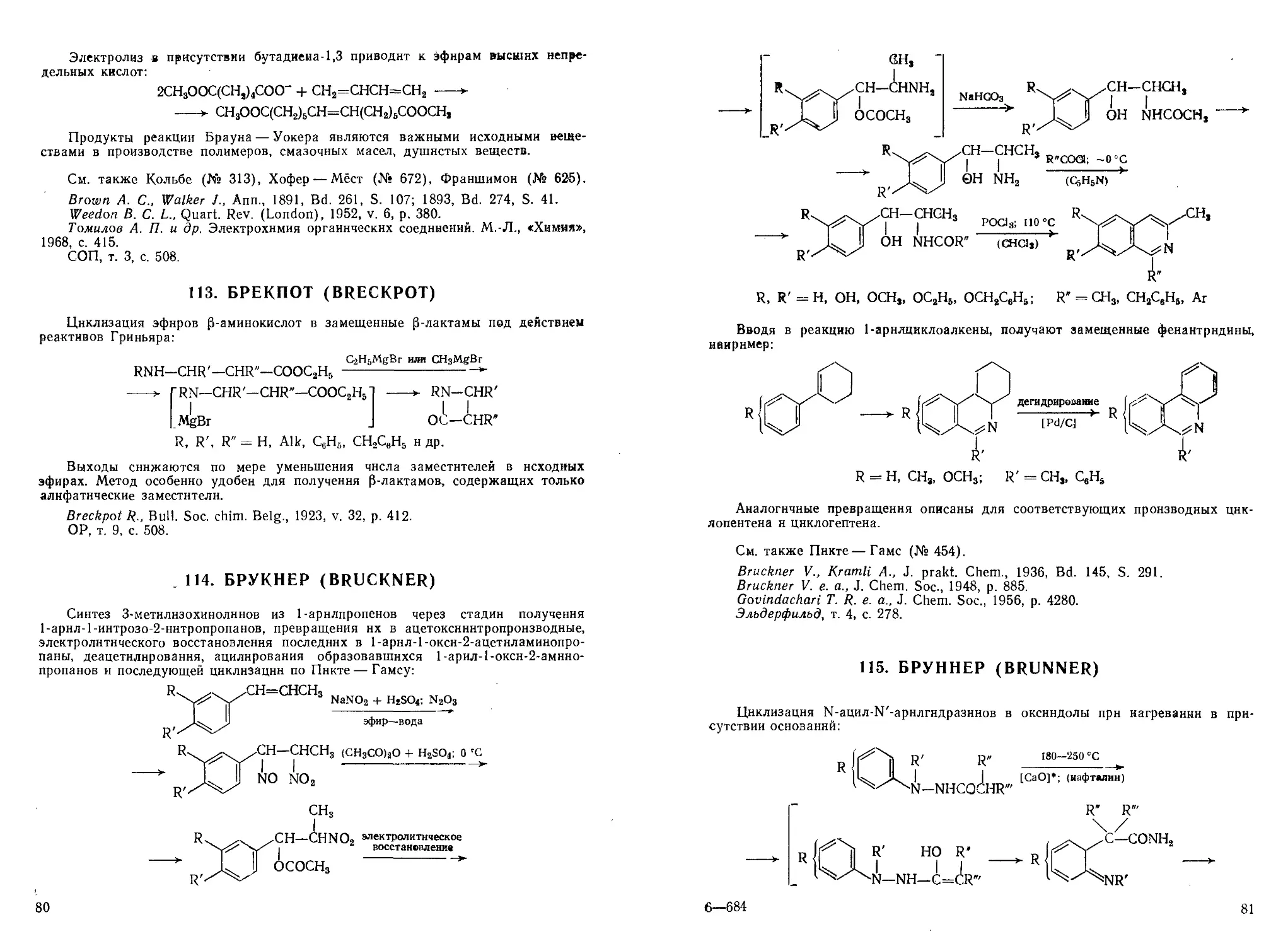
Получение фенантренов циклодегидратацией 2-(Р-арилэтил)-циклогексано-
лов-2 под действием Р2О5 в вакууме с последующим дегидрированием селеном:
Se; -300 °С
R, R' = Н, СН3, ОСН3, ызо-С3Н7
* HF (безводн.)
Аналогично реагируют соответствующие циклопеитанолы с образованием
полициклических систем, родственных стероидам:
СН2—СН2—
НО СНз
Исходные спирты получают по схеме:
СН2СН2Вг
К; нагревание
(СбН6)
СООС2Н6
ОН
Метод аналогичен реакции Боджерта — Кука (см. № 92) и отличается спо-
способами получения исходных соединений и их дегидратации.
36
См. также Хейуорт (№ 646).
Bardhan J. С, Sengupta S. С, J. Chem. Soc, 1932, p. 2520, 2798.
Renfrow W. B. e. a., J. Am. Chem. Soc, 1951, v. 73, p. 317.
Физер Л., Физер М. Химия природных соединений фенантренового ряда.
Пер. с англ. Под ред. В. М. Родионова. М.-Л., Госхимиздат, 1953, с. 91.
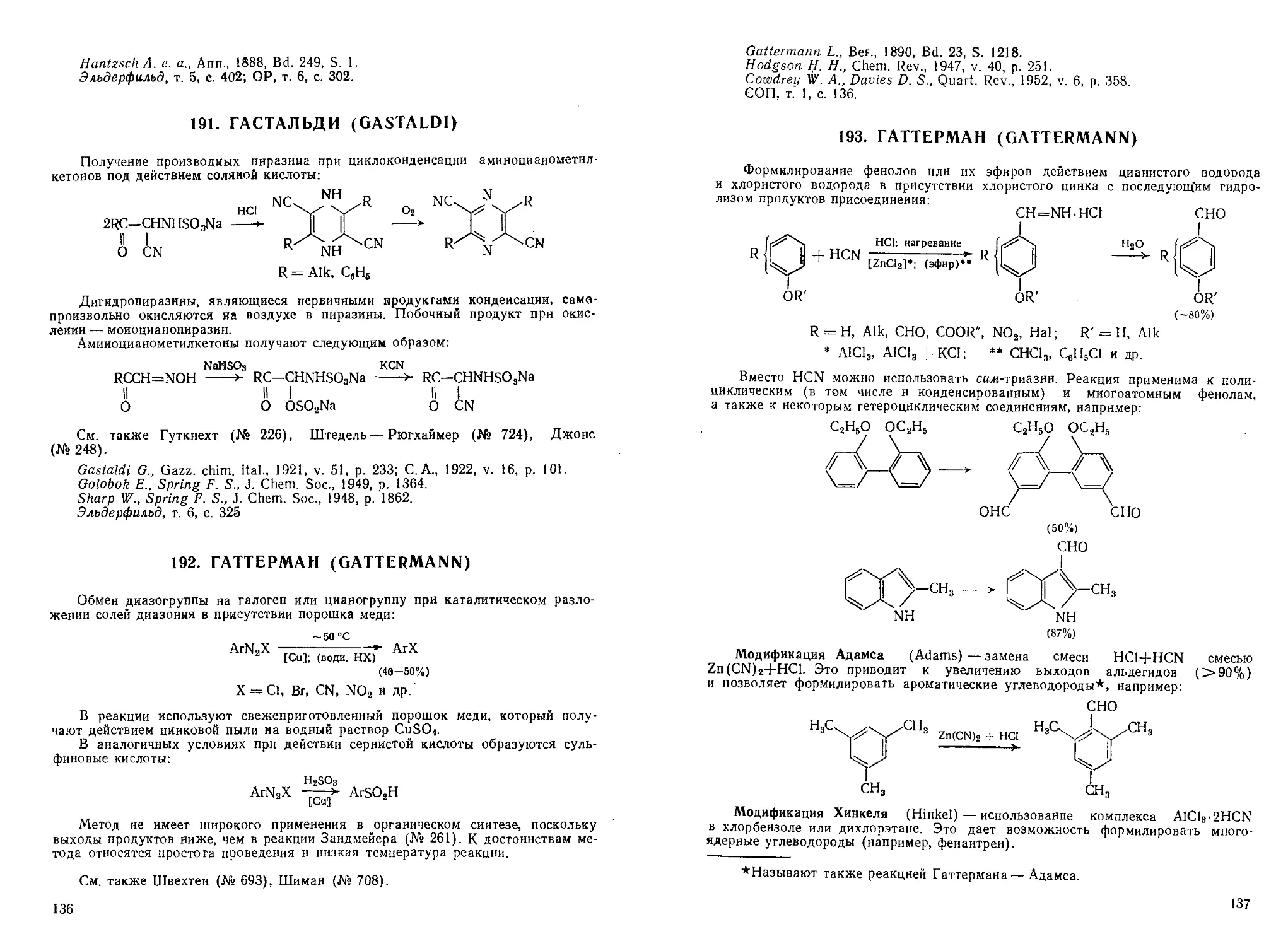
47. БАРТ (BART)
Получение ариларсиновых кислот взаимодействием арилдиазосоедииеиий со
щелочными солями мышьяковистой кислоты в присутствии катализаторов*:
; охлаждение
D0-60%)
* Ag, Ni, Co, соли Си, Ni> Co; ** щелочной буфер
В качестве побочных продуктов образуются вторичные ариларсииовые кис-
кислоты и триариларсиноксиды.
При замене арсенита натрия солями ариларсинистой кислоты получают ди-
ариларсиновые кислоты:
ArN2Cl + ArAs(ONaJ > (ArJAsOONa
Модификация Шмидта (Schmidt H.)—проведение реакции в нейтральной
среде без катализатора.
Модификации Старки (Starkey)—применение борфторидов диазония, кото-
которые менее склонны к разложению и образованию побочных продуктов.
См. также Бешан (№ 71), Зандеймер (№ 261), Розенмунд (№ 522), Шеллер
(№ 704), Шерлин —Браз (№ 705).
Bart U., нем. пат. 250264 A910); Chem. Zbl., 1912, Bd. 2, S. 882; Ann., 1922,
Bd. 429, S. 55.
Cowdrey W. A., Dames D. S., Quart. Rev. Chem. Soc. London, 1952, v. 6,
p. 363, 364.
Фрейдлина Р. Х. Синтетические методы в области металлоорганических со-
соединений мышьяка. Под ред. А. Н. Несмеянова. М.-Л., Изд. АН СССР, 1945,
с. 63.
СОП, т. 2, с. 501, с. 378; ОР, т. 2, с. 449.
48. БАРТОН (BARTON)
Фотохимическая перегруппировка нитритов в нитрозосоединения путем вну-
внутримолекулярного обмена нитрозогруппы на водород, связанный с у
атомом, с последующей изомеризацией в оксимы или димеризацией:
ONO
/IV; -10 °С
(С6На или СбНбСНз)
¦Вариант реакции Барта для получения арилстибиновых кислот называют
также реакцией Барта — Шмидта (Bart—Schmidt H.):
SbCl3
ArNjCl >¦ ArSbO(OH)a
37
но
f -NO
В реакцию вступают алифатические, жирноароматические и алициклические
соединения, а также соединения, содержащие различные функциональные груп-
группы (Hal, OR и т. п.):
Г N0 1
Av I
С6Н5-(СН2LОШ > [_СвН5—CH(CH2JCH2OHj2
(-35%)
)„—СН2 hv
|
,—C
CH2—CHONO
«=1—4
Реакция находит применение в химии стероидов, так как позволяет вводить
функциональные группы в неактивные места молекулы.
Barton D. H. R. e. a., J. Am. Chem. Soc, 1960, v. 82, p. 2640.
Barton D. H. R. e. a., J. Am. Chem. Soc, 1961, v. 83, p. 4076.
Siginome H., Sato N., Masamune Т., «Tetrahedron Letters», 1969, v. 35,
p. 3353.
Jones J., Careth Le., Marples Brian A., J. Chem. Soc. Perkin Trans., I, 1973,
№ 11, p. 1143.
Akhtar M., Advances in Photochemistry. V. 2. New York — London, Interscien-
ce publ., 1964, p. 263.
Kan R. 0. Organic Photochemistry. New York, McGraw-Hill, 1966, p. 233.
49. БАУДИШ (BAUDISCH)
Окислительное нитрозироваиие ароматических соединений в о-нитрозофенолы
действием гидроксиламииа в присутствии окислителя и солей меди:
NH2OH
[Си2+]*; (СНЬСОСН, рН 4.2)
R
_
R = Alk, CeH5> CH2C6H5, Hal, NO2
* Соли Hg, Fe2+, Ni
NO
ОН
Нитрозироваиие осуществляется под действием иитрозил-радикала («NOH),
который образуется при окислении NH2OH кислородом воздуха или перекисью
водорода. Соли тяжелых металлов стабилизируют радикал и препятствуют обра-
образованию я-интрозофенолов.
38
Baudisch О., Naturwiss., 1939, Bd. 27, S. 768.
Cronheim G., J. Org. Chem., 1947, v. 12, p. 1,7, 20.
Maruyama K-, Tanimoto 1., Goto R., J. Org. Chem., 1967, v. 32, p. 2516.
Tanimoto I., Bull. chem. Soc. Japan, 1970, v. 43, p. 1182.
Maruyama K., Tanimoto I., Bull. chem. Soc. Japan, 1971, v. 44, p. 3120.
50. БАУМАН —ФРОММ (BAUMANN — FROMM)
Получение 2,5-дифенилтиофена из коричной кислоты или стирола и серы:
2C6H5CH=CHR
S; нагревание
С6Н5-<^ \-С
R = Н, СООН
Побочный продукт — 2,4-диарилтиофен.
Аналогично из стильбена можно получить тетрафенилтиофеи:
2С6Н5СН=СНС6Н5
С6Н5
См. также Боджерт — Эррера (№ 93), Фольхард — Эрдман (№ 620).
Ваитапп Е., Fromm Е., Вег., 1895, Bd. 28, S. 890.
Demerseman P. e. a., J. Chem. Soc, 1954, p. 2720.
Эльдерфильд, т. 1, с. 188.
51. БАУМГАРТЕН (BAUMGARTEN)
Получение а-аминокетоиов из вторичных ^^дихлораминов последователь-
последовательным действием метилата натрия и хлористого водорода:
ОСН3 О
CH3ONa; нагревание | НСГ II
ArfCH' ^^ " АЛ—СН2 (цзо,СзН70н> ArC-CH2NH2.HC.
NC12 NH
C0-80%)
Ar = C6H4R, где R = CH3, C6H5, OCH3, NO2, Cl, Br
Аналогично получают а-амииокетоны из некоторых алифатических и али-
циклических N.N-дихлорамииов.
N,N-Диxлopaмииы образуются при действии грег-бутилгипохлорита на соот-
соответствующие амииы:
трет-
(СвН6)
0—5 °С
¦- АгСНСНз
NC1.
NH2
См. также Небер (№ 417).
Baumgarten H. E., Bower F. A., J. Am. Chem. Soc, 1954, v. 76, p. 4561.
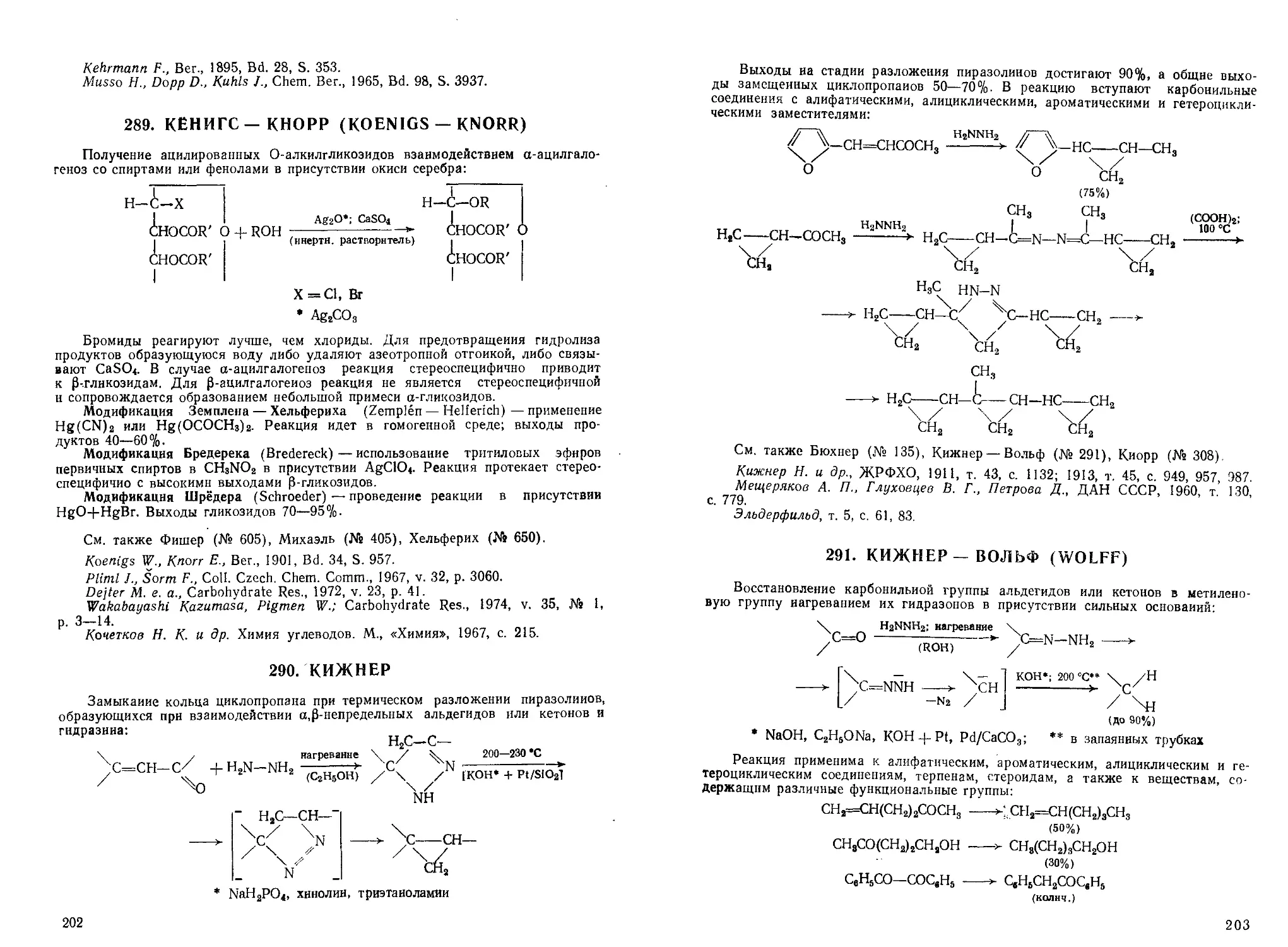
Baumgarten H. E., Petersen J. M., J. Am. Chem. Soc, 1960, v. 82, p. 459.
39
Alt G. H., Knowles W. S., J. Org. Chem., I960, v. 25, p. 2047.
СОП, т. 12, с 171;
Физер, т. 1, с. 172; т. 2, с. 257.
52. БЕАЛЬ — СОММЛЕ (BEHAL — SOMMELET)
Перегруппировка р-оксиалкилметиловых эфиров в альдегиды в присутствии
карбоиовых кислот:
нагревание
R,CCH,OCH3 7^—-> RgCHCHO
ОН
[(СООНЫ*
R = Alk, C,H5
• НСООН
E0-60%)
Исходные Р-оксиэфиры получают действием реактива Гриньяра на эфиры
метоксиуксусной кислоты:
СН3ООССН2ОСН3 + RMgX —-*¦ R2CCH2OCH3
ИР он
См. также Сериии (№ 538)
Behal M. M. A., Sommelet M., Bull. Soc. chim. France, 1904, v. 31, p. 300.
Houben-Weyl, Bd. 7/1, S. 104, 233.
53. БЕДУКЯН (BEDOUKIAN)
Получение а-галогенкетонов и а-галогенальдегидов через стадии енолацета-
тов, последующего их галогенирования, алкоголиза и гидролиза:
(СН3СОJО; нагревание
-СН=С-
Х2; 0-10 °С
(ССЦ)
О ОСОСНз
| ROH- 10—15 °С | _ НС1; нагревание
-СН—С— ОСОСН3 >¦ -СН—С(
А 1 1
_сн-с-
I U .
X О
A5-70%)
:(ORJ
R = CH3, C2H5; X=C1, Вг
* СН3СООК (в случае альдегидов)
Останавливая реакцию на стадии алкоголиза, получают ацетали с выходом
~70%. Иодацетали можно получить взаимодействием енолацетатов с хлористым
иодом:
IC1 + конц. НО; < 5 °С Q2H5OH; 10 °С
СН2=СНОСОСН3 ecu *" 1СН2СНСЮСОСН3 >¦
>- 1СН2СН(ОС2Н5J
(85%)
40
См. также Хелль — Фольхард — Зелинский (№ 649), Фрич — Клинг (№ 633).
Bedoukian P. Z., J. Am. Chem. Soc, 1944, v. 66, p. 651.
РИМИОС, т. 14, с. 335.
Физер, т. 2, с. 29; т. 3, с. 349.
54. БЕЙКЕР — ВЕНКАТАРАМАН (BAKER — VENKATARAMAN)
Перегруппировка 2-бензоилоксиарилметилкетонов в 2-оксиароилбензоилмета-
ны под действием оснований:
к
ОСОС6Н5
>. п
1*; (внертн. растворитель)
R = Alk, ОН, OAlk
* К2СО3, NaNH2, Na, NaOH
Реакцию можно рассматривать как внутримолекулярную сложноэфирную
конденсацию (см. Кляйзен, № 301). При R = NO2 перегруппировка не происхо-
происходит. Кроме бензоатов в реакции используют также сложные эфиры анисовой, ве-
ратровой, а- и р-нафтойных кислот.
Существенное препаративное значение реакции обусловлено легкостью цик-
циклизации получаемых продуктов в хромоны:
(-д. СНзСООнТ
См. также Фрис (№ 630).
Baker W., J. Chem. Soc, 1933, p. 1381; 1934, p. 1953.
Mahal H. S., Venkataraman K., J. Chem. Soc, 1934, p. 1767; 1935, p. 868.
Lewine R., Fernelius W. C, Chem. Rev., 1954, v. 54, p. 493.
Rahman W., Nasitn К- Т., J. Org. Chem., 1962, v. 27, p. 4215.
Rao A. V. R., Telang S. A., Nair P. M., Indian J. Chem., 1964, v. 2, p. 431.
Hautoville M., Chadenson M., Chorin J., Ст., Ser. C, 1974, v. 278, p. 471—473.
55. БЕЙКЕР-ОЛЛИС (BAKER - OLLIS)
Получение изофлавонов взаимодействием арилметил-о-оксиарилкетонов с
этоксиоксалилхлоридом в пиридине с последующим гидролизом и декарбоксили-
рованием:
CIOCCOOCjHb
СОСООС2Н5
CO
OH
К
41
со
Ar
СО
Н2О; нагревание
Ar
О
E9-80%)
R = OH, OAlk
Метод особенно удобен для получения полноксизвмещенных и частично
алкоксилированных изофлавонов. Таким образом был получен ряд природных
изофлавонов (ф-бантигенин, генистеин, биоханнн и т. п.).
См. также Алгар — Флинн — Оямада (№ 11).
Baker W., Ollis W. D. e. a., Nature (London), 1952, v. 169, p. 706.
Baker W. e. a., J. Chem. Soc, 1953, p. 1852.
Warburton W. K., Quart. Rev., 1954, v. 8, p. 79.
56. БЕЙЛИ (BAILEY)
Получение пептидов аминолизом N-карбоксиангидридов аминокислот эфи-
рами аминокислот в присутствии оснований с последующим декарбоксилирова-
иием:
RCH-CO
. >
NH-CO
H2NCHCOOC2H5
(CHCls)*
-35 °C
> (C2H5KN+ "OOCNHCHCO—NHCHCOOC2H5 *•
i A-
v H2NCHCO-NHCHCOOC2Hj
I I
R R'
* CH3N(C8H17J; ** CH3COOC2H5
Реакция позволяет осуществить ступенчатый контролируемый синтез пепти-
пептидов с определенной последовательностью аминокислот.
Модификацией метода является проведение реакции в водном растворе
(рН 10,2) при 0°С. Это позволяет использовать свободные аминокислоты и на-
наращивать пептидную цепь без выделения промежуточных продуктов.
Исходные N-карбоксиангидриды аминокислот получают либо из хлорангид-
ридов N-карбобензоксиаминокислот, либо непосредственной реакцией аминокис-
аминокислот с фосгеном.
См. также Бергман (№ 59), Фишер (№ 609).
Bailey I. L, Nature, 1949, v. 164, p. 889.
Bailey J. L., J. Chem. Soc, 1950, p. 3461.
Химия биологически активных природных соединений. Под ред. Н. А. Пре-
Преображенского и Р. П. Евстигнеевой. М., «Химия», 1970, с. 114.
Denkawalter R. G. e. a., J. Org. Chem., 1967, v. 32, p. 3415.
42
57. БЕКЕЛАНД — ЛЕДЕРЕР — МАНАССЕ
(BAEKELAND — LEDERER — MANASSE)
Промышленный метод получения феноло-формальдегидных смол поликоиден-
сацией фенола с избытком формальдегида*:
ОН ОН ОН
I I
нагревание ^\_СН,—(Г\—СН,
СН2
нагревание;
давление
СН2ОН СН2ОН
он он он
нон,с
В процессе конденсации вначале образуются фенолоспирты, затем терморе-
актнвный низкомолекулярный полимер — резол, растворимый в органических
растворителях. Дальнейшей термической конденсацией получается пластичный
полимер сетчатой структуры—резитол, нагреванием которого до 150 °С получают
твердый термостойкий и нерастворимый полимер — резит.
В присутствии кислот прн соотношении фенола и формальдегида 7 : 6 полу-
получают новолаки — полимеры, не содержащие свободных НОСН2-групп. Новолаки
можно перевести в резол нагреванием с формальдегидом.
Резолы перед последующими стадиями в производстве пластмасс обычно
смешивают с наполнителями.
См. также Байер (№ 30).
Lederer L, J. prakt. Chem., 1894, Bd. 50, S. 223.
Manasse O., Ber., 1894, Bd. 27, S. 2409.
Baekeland L. H., Chem. Ztg., 1909, Bd. 33, S. 317; Ind. Eng. Chem., 1909, v. 1,
p. 149; 1925, v. 17, p. 225.
Schnell #., Krimm #., Angew. Chem., 1963, Bd. 75, S. 662.
Houben-Weyl, Bd. 14/2, S. 193.
58. БЕКМАН (BECKMANN)
Перегруппировка оксимов в амиды кислот под действием кислых агентов:
R—С—R' h»soj
N_OH <эфир)**>
*Называют также Бекеланд-процессом.
43
+
> R—N=C—R'
+но-
*• R-N=C-R' >- R'CNHR
I II
ОН О
R = H, Alk, Ar
* Кислоты Льюиса, Р2О5, Ni-Ренея, полифосфорная кислота,
CH3COOH + (CH3COLO + HC1 (бекмановская смесь);
** Инертные растворители, CH3NO2, H2O, С2Н5ОН, СС14, пиридин
В реакцию вступают оксимы алифатических, ароматических, гетероцикличе-
гетероциклических и смешанных кетонов. Аналогично перегруппировываются простые и слож-
сложные эфиры оксимов*, например:
на
Ш3-С-Аг >¦ СНз-С—N—Аг
И I
О Аг'
NO2
Аг'
= _/ V
-NO.
NO,
Оксимы, легко изомеризующиеся под влиянием кислот, дают смесь изомер-
изомерных амидов. Сильнополяриые растворители и увеличение кислотности среды
способствуют реакции.
Реакция стереоспецифична: мигрирует радикал, находящийся в акги-поло-
жении к ОН-группе. Оптическая активность мигрирующего асимметрического
атома сохраняется.
Некоторые кетоксимы расщепляются с образованием нитрилов**, например:
CeH6SO2CI
C,.H6CN + С6Н5СООН
HON О
^NOH
NOH
=0
NH
РС15
(эфир)
NC—(CH2L—CHO
F8%)
CN NC4
i— CO—h
Это особенно характерно для оксимов а-оксикетоиов:
RCH-CR' >¦ RCHO + R'CN
ОН NOH
¦Перегруппировка соединений типа RR'C = NOR" называется также пере-
перегруппировкой Бекмана — Чепмена.
**Такое расщепление называют также перегруппировкой Бекмана второго
рода, перегруппировкой Вернера (Werner) или фрагментацией Бекмана.
44
Из альдоксимов обычно также образуются нитрилы:
RCH=NOH 5- RCN
Реакция Бекмана часто используется для установления строения кетонов.
Границы препаративных возможностей определяются лишь доступностью соот-
соответствующего кетона.
Промышленное применение перегруппировка оксимов находит в синтезе
капролактама:
°
конц. HaSO4; 140 °
_J
/ \
(до 90%)
См также Землер — Вольф — Шрётер (№ 265), Курциус (№ 345), Лоссен
(№ 369), Небер (№ 417), Тиман (№ 565), Чепмеи (№ 694).
Beckmann E., Вег., 1886, Bd. 19, S. 988; 1887, Bd. 20, S. 1507.
Винник М. И., Зарахаш Н. Г., Усп. химии, 1967, т. 36, с. 167.
Jackson В. Н., J. Org. Chem., 1970, v. 35, № 4, p. 875.
McCullough J. D. e. a., J. Am. Chem. Soc, 1972, v. 94, p. 874.
Савва А., Мартынов В. Ф., ЖОХ, 1974, т. 44, № 7, с. 1655—1656.
ОР, т. 11, с. 7; РИМИОС, т. 3, с. 139.
59. БЕРГМАН (BERGMANN)
Получение пептидов аминолизом азлактонов аминокислотами или их
эфирами:
О
Ч -20 °С I
\_r j_ H2NCHC00H >¦ RC—NH-C—C-NHCHCOOH
v I (C2H5OH)* и I II I
R' О О R'
* Без растворителя, Н2О, (СН3JСО (водн.), эфир, СН8СООН
В реакции могут использоваться азлактоны, полученные из дипептидов с за-
защищенными аминогруппами.
Исходные азлактоны легко получаются дегидратацией соответствующих
N-ацилированных аминокислот. Если эту реакцию вести в присутствии альдегида,
то образующиеся непредельные соединения после амииолиза дают начало пепти-
пептидам, содержащим ненасыщенные аминокислоты:
О
(СН3СОJО "^1^ \ H2NCHRCOOH
RCONHCH2COOH + R'CHO >¦ | >-R *-
>- RCONH—C-CO-NHCHCOOH
II I
CHR' R
Существенный недостаток метода: быстрая рацемизация вследствие таутоме-
ризации азлактонов. Азлактоиы, полученные из аминокислот с третичной
NH2-rpynnofi, устойчивы к рацемизации.
См. также Бейли (№ 56), Фишер (№ 609), Эрленмейер — Фрюштюк (№ 741)'.
45
Bergmann M., Stern F., Witte C, Ann., 1926, Bd. 449, S 277
Pfleger P., Pelz J., Chem. Ber., 1957, Bd. 90, S. 1489.
Шредер Э., Любке К. Пептиды. Т. 1. Пер. с англ. Под ред. М. М. Шемякина
и Ю. А. Овчинникова. М., «Мир», 1967, с 169
ОР, т 3, с. 204.
60. БЕРГМАН (BERGMANN)
Циклизация N-галогенациламинокислот с одновременным дегалогеиирова-
нием при нагревании с уксусным ангидридом в пиридине с образованием азлак-
тонов:
г. О
С6Н5СН2-СН—СООН (СН3СОJО; нагревание V \
NHCOCXRR' <™,* * 1 ^>-CHRR'
L6H5—HL
D0-80%)
R = H, C6H5, Cl; R'=H,C1; X = Cl, I
* 2,6-Лутидин
В случае R = R'=C1 происходит замена на водород только одного атома
хлора.
В реакцию вступает также у-бромкротоноилфенилалании:
С6Н5СН2-СН-СООН ЧХ \
I > Т >-сн=снсн3
NH-CO-CH=CHCH2Br г „ ^Ч
См. также Эрлеимейер — Плёхль (№ 740).
Bergman M., Stern F., Ann., 1926, Bd. 448, -S. 20.
Sheehan /., Duggins W. E., J. Am. Chem. Soc, 1950, v. 72 p 2475
РИМИОС, т. 9, с 169.
61. БЕРГМАН (BERGMANN)
Определение С-концевой аминокислоты в пептидах через соответствующие
альдегиды, полученные превращением пептида в азид, затем в карбобеизоксипро-
изводное с последующим гидрированием и гидролизом (карбобензокси-метод):
CO-NH—CHR
I-
СООН
CH2N2
••-CO-NH-CHR
1. N2H4
2. HNO2
соосн.
нагревание С3Н5СН2ОН
CO-NH-CHR >¦ CO-NH-CHR >
CON,
• --CO-NH-CHR
NHCOOCH2C6H5
!. Н2
2. Н2О
NCO
СО—NH2 + RCHO
46
Мягкий гидролиз позволяет сохранить пептидные связи. Процесс можно по-
повторять, последовательно определяя С-концевые аминокислоты.
См. также Шлак — Кумпф (№ 711), Эдман (№ 733) Курциус (№ 345).
Bergmann M., Science, 1934, v. 79, p. 439.
Bergmann M., Zervas L., J. Biol. Chem., 1936, v. 113, p. 341.
Кнунянц И. Л., Первова Е. #•, Усп. химии, 1955, т. 24, с. 666.
Sprlngall H. D The Structural Chemistry of Proteins. London, Butterworth,
1954, p. 321.
62. БЕРГМАН —ЗЕРВАС (BERGMANN — ZERVAS)
Защита аминогруппы в аминокислотах взаимодействием с бейэиловым эфи-
эфиром хлоругольной кислоты (карбобензоксилироваиие) *: •
NaOH*; 0—20 СС
СвН5СН2ОСОС1 + H2NCHCOOR' (НаО) ~" ceH5CH2OCONHCHCOOR'
R R
* СНС13 + (C2H5KN, CH3COOC2H5 + MgO, CHCI3 + Н2О + Na2CO3
Этот способ защиты находит широкое применение в пептидном синтезе по
следующим причинам:
1) легкость образования карбобензоксипроизводных;
2) практически универсальная применимость для большинства методов пеп-
гидиого синтеза;
3) малая склонность соответствующих производных к рацемизации;
4) мягкие условия снятия защиты (каталитическое гидрирование, действие
НВг в ледяной СН3СООН и т. п.).
См. также Виланд (№ 164), Лихошерстов (№ 367), Меррифилд (№ 398),
Шихаи—Франк (№710).
Bergmann М. е. а., Вег., 1932, Bd. 65, S. 1192; 1933, Bd. 66, S. 1288.
Bergmann M., Zervas L, Ross W., J. Biol. Chem., 1935, v. 3, p. 245.
Springall H. D., Law H. D., Quart. Rev. (London), 1956, v. 10, p. 234.
Буассона Р. А., Усп. орг. химии, 1966, т. 3, с. 162.
Шредер Э., Любке К. Пептиды. Т. 1. Пер. с англ. Под ред. М. М. Шемякина
и Ю. А. Овчинникова. М.,«Мир», 1967, с. 169.
Фиэер Л, Фиэер М. Органическая химия. Т. 2. М., «Химия», 1969, с. 675.
63. БЕРГМАН — ШОТТЕ (BERGMANN — SCHOTTE)
Гидроксилироваиие гликалей действием надбензойиой кислоты с образова-
образованием смеси эпимерных Сахаров:
О
СН CjH5coooh
СН
(Н2О)
О
НСЧ
)О
о
I
снон
I
н—с—он
+о
I
снон
I
но-с—н
При проведении реакции в метаиоле образуются соответствующие метилгли-
козиды. Соотношение эпимеров зависит от исходных гликалей. Так, в случае
*Называют также реакцией Бергмана.
47
глюкаля или рамналя образуется только один эпимер: манноза или рамноза, а из
галакталя получена смесь талозы и галактозы. Реакция применима также к
большому числу дисахаридов.
См. также Майлас (№ 377).
Bergmann M., Schotle Н., Вег., 1921, Bd. 54, S. 440, 1564.
Levene P. A., Tipson R. S., J. Biol. Chem., 1931, v. 93, p. 631.
Haskins W. Т., Hann R. M., Hadson С S., J. Am. Chem. Soc, 1942, v. 64,
p. 1289.
Evans W. L, Reynolds D. D., Talley E. A., Adv. in Carbohydrate Chem., 1951,
v. 6, p. 55.
64. БЕРЕНД —РОЗЕН (BEHREND — ROOSEN)
Получение пуринов циклокоидеисацией изодиалуровой кислоты и мочевины
под действием серной кислоты:
О
О
+ H2NCONHR
H2SOJ
NR
NR
/
-ОН
NR N
R = H, CH3
* HC1 (конц.)
При действии иа изодиалуровую кислоту М,м'-диметилмочевииы образуется
7,9-диметилмочевая кислота:
он
он
он
NCH,
+ CO(NHCHaJ
N
ОН
Реакция представляет в основном исторический интерес, так как является
одиим из первых способов синтеза мочевой кислоты.
См. также Траубе (№ 576), Фишер (№ 613).
Behrend R., Roosen О., Вег., 1888, Bd. 21, S. 999.
Эльдерфильд, т. 8, с. 155.
65. БЕРНТСЕН (BERNTHSEN)
Получение акридинов конденсацией диариламииов с карбоновыми кислота-
кислотами в присутствии хлористого циика и последующей циклизацией:
200—300 °С
NH
48
R = Н, Alk, Ar, CH2Ar
В реакцию вступают также двухосновные кислоты: фталевая, янтарная.
Из триариламинов (в присутствии полифосфорной кислоты) образуются соли
9-арилакридиния.
См. также Ульман—Фетвадян (№ 585).
Bernthsen A., Ann., 1878, Bd. 192, S. 1; 1884, Bd. 224, S. 1.
Ардашев Б. И., Минкин В. И., Усп. химии, 1959, т. 28, с. 227.
Staskum В., J. Org. Chem., 1964, v. 29, p. 2856.
Thu-Cuc Т., Вии-Hoi N. P., Xuong N. D., J. Chem. Soc, Ser. C, 1966, p. 87.
Эльдерфильд, т. 4, с. 380.
66. БЕРТИ (BERTI)
Получение олефинов перегонкой в вакууме метилалкилсульфитов*:
—С—С—О—S—ОСН3
I I II
О
200—260 °С; вакуум
/ \
E0-95%)
В реакцию вступают метилсульфиты алифатических и алициклических спир-
спиртов; независимо от исходной цис- или тракс-коифигурации происходит как цис-,
так и гракс-элимииироваиие.
При наличии ароматического заместителя в метилсульфитах алициклических
спиртов преимущественно образуются олефины, в которых связь С = С сопряже-
сопряжена с ароматическим кольцом. В этом случае выходы изомеров зависят от конфи-
конфигурации заместителей в исходном сульфите. Так, для ^ис-изомера выходы 1-фе-
1-фенил- и З-феиилциклогексенов-1 составляют соответственно 78 и 22%, для транс-
изомера — 65 и 35%:
OSOOCH3
Добавка силиконового масла при перегонке способствует ч«с-элимиииро-
ванию: выход 1-феиилциклогексена повышается до 93% (при гракс-коифигура-
ции исходного сульфита).
См. также Чугаев (№ 700).
Berti G., J. Am. Chem. Soc, 1954, v. 76, p. 1213.
¦Называют также методом дегидратации спиртов,
4-684
49
McNamara L. S., Price С. С, J. Org. Chem., 1962, v. 27, p. 1230.
Бюллер К-, Пирсон Д. Органические синтезы. Ч. 1. Пер. с аигл. М., «Мир»,
1973, с. 107.
67. БЕРТЛО (BERTHELOT)
Циклотримеризация ацетилена в беизол при пропускании через раскаленные
трубки:
СН 500 °С
3|
Беизол образуется с низким выходом; побочными продуктами являются ме-
метан, иафталии и смолы. Метод ие находит практического применения; имеются
другие, более эффективные методы получения ароматических углеводородов.
Реакция представляет лишь исторический интерес, так как является первым при-
примером превращения алифатического соедииения в ароматическое.
См. также Реппе (№ 505).
Berthelot M., С. г., 1868, v. 67, р. 233, 1182.
Raphael R. A. Acetylenic Compounds in Organic Synthesis. London, Butten-
worths scientific publ., 1955, p. 65.
Rodd, v. ЗА, р. 66.
68. БЕРТРАМ— ВАЛЬБАУМ (BERTRAM — WALBAUM)
Получение эфиров иэобориеола при действии на камфен органических кис-
кислот в присутствии серной кислоты:
Н3С СН3
СН3
+ RCOOH
\
[h2so4]
OCOR
СН,
сня
Присоединение по С = С-связн сопровождается камфеновой перегруппиров-
перегруппировкой (см. Вагнер — Меервейн, № 140). Аналогичные процессы происходят в слу-
случае а-пииена и других непредельных терпеновых соединений.
Bertram J., Walbaum H., J. prakt. Chem., 1894, Bd. 49, S. 1.
Toshio Funahashi, J. Sci. Hiroshima Univ., 1955, Ser. A, v. 18, p. 497.
Krieger H., Suomen Kemistilehti, 1962, Ser. B, v. 35, p. 71; С A., 1962, v. 57,
№ 14959.
Paasivizta J., Suomen Kemistilehti, 1963, Ser. B, v. 36, p. 156; С A., 1963,
v. 59, № 15189.
50
69. БЕРТРАН (BERTRAND)
Микробиологическое окисление полиолов в кетозы
Acetobacter:
СН2ОН
бактериями рода
Н—С—ОН
н—с—он
СН2ОН
с=о
н—с—он
I
Эти бактерии избирательно окисляют соседний с первичной спиртовой груп-
группой гидроксил, который входит в состав а-гликольной группировки, имеющей
?>-эригро-коифигурацию.
Этот достаточно общий и удобный метод широко используется в промыш-
промышленности, например в синтезе L-аскорбииовой кислоты для превращения D-cop-
бита в L-сорбозу:
СН2ОН
—он
но-
СН2ОН
:=о
но—
-он
-он
СН-ОН
но-
—он
сн„он
Bert rand G., С. г., 1898, v. 126, p. 762; Ann., 1904, Bd. 3, S. 181.
Sowden J. C. In: The Carbohydrates. Ed. W. Pigman. New York, Acad. press,
1957, p. 98.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 248.
70. БЕТТИ (BETTI)
Амииобеизилироваиие фенолов конденсацией их с первичными ароматически-
ароматическими аминами и беизальдегидом:
сн
+ С„Н5СНО + ArNH2
СН—NHAr
ОН
В реакцию-вступают и другие, ароматические альдегиды, а также некоторые
вторичные амииы, например пиперидин, диэтиламии. Вместо альдегида и амииа
можно использовать осиоваиия Шиффа.
Реакция применима к разнообразным фенолам (особенно к Р-иафтолам), в
том числе к гетероциклическим соединениям, например:
Ar'CHO + ArNH2
Аг'
I
ArNHCH
ОН
D0-85%)
N
Ar, Аг' = CeH3) C6H4Alk, C6H4NO2, C6H4OCH3, C6H4C1, С„Н4СООН и др.
4*
51
См. также Манних (№ 384), Дёбиер (№ 245).
Betti M., Gazz. chim. ital., 1900, v. 30, pt. II, p. 301; 1906, v. 36, pt. II,
p. 392.
Phillips J. P. e. a., J. Org. Chem., 1954, v. 19, p. 907; 1956, v. 21, p. 692.
Moerle H., Miller Ch., Wendisch D., Chem. Ber., 1974, Bd. 107, № 8, S. 2675—
2682.
Эльдерфильд, т. 4, с. 103.
71. БЕШАН (ВЁСНАМР)
Получение яара-замещеииых ариларсииовых кислот нагреванием аромати-
ароматических амииов или фенолов с мышьяковой кислотой:
R'
H3AsO4; 100-150 °С
R
I
= NH2, ОН, ОСН3;
R'
AsO(OHJ
B0-60%)
R' = Н, СН3, ОСН3, NO2> C6HS
Наличие в орго-положеиии метильиых групп заметно снижает выход, заме-
заместители в хега-положеиии не оказывают влияния. Из производных нафталина
в реакцию вступает только а-иафтиламии. Вследствие легкой окисляемости ами-
иофенолы и многоатомные фенолы за исключением резорцина не образуют
ариларсиновых кислот. N-Алкил- и Ы,Ы-диалкиламииы ие вступают в реакцию.
В качестве побочных продуктов образуются о-ариларсииовые кислоты.
См. также Барт (№ 47), Розеимунд (№ 522), Шеллер (№ 704).
Bechamp А. ]., С. г., 1863, v. 56, р. 1172.
СОП, т. 1, с. 55, 283; ОР, т. 2, с. 461.
72. БЕШАН (ВЁСНАМР)
Восстановление интрогруппы в ароматических соединениях в аминогруппу
при обработке железными стружками в разбавлеииых кислотах:
Fe*; HC1**; нагревание
(води. СаН5ОН)^
* Соли Fe2+; ** CH3COOH, H2SO4, HCOOH
Реакцию можно проводить также в растворах электролитов (FeCl2, NH4C1,
СаС12 и др.). Активность электролитов падает в ряду NH4C1 > FeCl2 >
> FeSO,.,
Реакция может быть использована для восстановления алифатических и ге-
гетероциклических иитросоедииеиий, например:
NH3
NH2
Cl
Fe; CH3COOH
Cl
N
G8%)
52
Метод широко применяется в промышленности.
См. также Зииин (№ 267), Байер (№ 33).
Bechamp A. J., Ann. chim. phys., 1854, [3], v. 42, p. 186; Ann., 1854, Bd. 92,
S. 401.
Лукашевич В. О., Усп. химии, 1948, т. 17, с. 692.
Werner J., Ind. Eng. Chem., 1951, v. 43, p. 1917; 1953, v. 45, p. 1912; 1955,
v. 47, p. 1840.
Sakae Yagi, Terukatsu Miyachi, Chia Yon Yen, Bull. Chem. Soc. Japan, 1956,.
v. 29, p. 194.
Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей,
Изд. 4-е. М., Госхимиздат, 1955, с. 234.
73. БЕЗЕКЕН (BOESEKEN)
Определение конфигурации аиомериого центра в альдозах по их способно-
способности к образованию сильиокислого комплекса с борной кислотой:
О
Н—С—ОН Н3ВО3
н—с—он
Н—С—Оч ,0—С—Н
>( I
4>-с-н
НС
I
н—с—
н+
Чис-а-Гликоли образуют с Н3ВО3 лабильный комплекс, являющийся значи-
значительно более сильной кислотой, чем сама Н3ВО3. Таким образом, по изменению
электропроводности смеси растворов сахара и НзВОз можно судить об относи-
относительном расположении оксигрупп при атомах С-1 и С-2.
Способность к образованию эфиров борной кислоты используют при разде-
разделении Сахаров методом распределительной хроматографии и электрофореза иа
бумаге, методом иоиообмеииой хроматографии иа смолах и угле.
Boeseken J., Ber., 1913, Bd. 46, S. 2612; Adv. in Carbohydrate Chem., 1949,
v. 4, p. 189.
Weigel H., Adv. in Carbohydrate Chem., 1963, v. 18, p. 61.
74. БЕЗЕКЕН — БАЛЛИО (BOESEKEN — BALLIO)
Получение арилацетатов из ароматических альдегидов под действием иад-
уксусной кислоты в присутствии я-толуолсульфокислоты:
АгСНО
СНзСОООН; 30-50 "С
[n-CH3C6H4SO3HT"~
Аг = С6Н4ОА1к
АгОСОСН,
Метод применим только для альдегидов, содержащих алкоксигруппы. Ана-
Аналогично реагируют диалкоксибензальдегиды, например:
О
О
сно
о
ОСОСНо
В отсутствие катализатора происходит образование эфира муравьиной кис-
кислоты, например:
снзсооон
СН*°
О
G4%)
См. также Байер — Виллигер (№ 35).
Boeseken J., Jacobs J., Rec. trav. chim., 1936, v. 55, p. 786, 815.
Boeseken J., Greup J., Rec. trav chim., 1939, v. 58, p. 528.
Crosby D. G., J. Org. Chem., 1961, v. 26, p. 2115.
75. БЁРЧ (BIRCH)
Восстановление ароматических соединений в дигидроароматические при об-
обработке натрием и спиртом в жидком аммиаке*:
Na»; C2H5OH
(жидк. NH3); (эфир)*
R = Н, ОСН3, СООН, ОН, циклогексил
* Li; ** диметоксиэтан, тетрагидрофуран, спирты
Аналогично восстанавливаются конденсированные ароматические углеводо-
углеводороды, гетероциклы и стероиды. Изолированные двойные связи в реакции ие за-
затрагиваются.
Модификация Бенкезера (Benkeser)—использование лития в алифатиче-
алифатических аминах в присутствии спирта (С2Н5ОН, С3Н7ОН, грег-С4Н9ОН). Это позво-
позволяет проводить более глубокое восстановление ароматических соединений,
а также восстанавливать изолированные двойиые связи:
R
R
L!
Li; C2H5OH
(RNHJ
„ -4*" "V>
Реакция применяется в промышленном синтезе иорстероидов.
См. также Лукеш (№ 371).
Huckel W. e. a., Ann. 1939, Bd 540, S. 157; 1958, Bd. 614, S. 47; Chem. Ber.,
1955, Bd. 88, S. 338; 1956, Bd. 89, S. 150, 481, 2098, 2105.
Birch A. J. e. a., J. Chem. Soc, 1944, p. 430; 1945, p. 809; 1946, p. 593; 1947,
p. 102; 1642; 1949, p. 2531; 1951, p. 1945.
Benkeser R. A., Robinson R. E., Landesman H., J. Am. Chem. Soc, 1952, v. 74,
p. 5669.
Benkeser R. A. e. a., J. Org. Chem., 1964, v. 29, p. 1313.
Harley R. G., «Synthesis», 1970, v. 2, p. 161.
Murai Akio, Arita Keiko, Masamune Tadashi, Bull. Chem. Soc. Japan, 1973,
v. 46, p. 3536—3544.
Физер, т. 1, с. 108.
54
*Называют также реакцией Бёрча — Хюккеля (Hiickel).
76. БЕСНЕК (BOESSNECK)
Расщепление спиртов, содержащих а-трихлорметильную группу, под дейст-
действием щелочей с образованием альдегидов*:
NajCOj
RCHOHCCI3 >• RCHO B0-60%)
R = Alk, Ar
* K2CO3, NaOH, КОН
Одновременно происходит омыление СС13-группы с образованием а-окси-
кислот:
RCHOHCC13 *¦ RCHOHCOOH B0—30%)
Образовавшиеся а-оксикислоты могут быть легко превращены в альдегиды
действием двуокиси свинца.
Исходные спирты получают взаимодействием хлораля с магнийорганически-
ми соединениями или с ароматическими углеводородами в присутствии А1С1з.
Boessneck P., Ber., 1885, Bd. 18, S. 1516.
Hebert P., Bull. Soc. chim. France, 1920, v. 27, p. 45.
Bodendorf K., Mildner J., Lehmann Т., Ann., 1949, Bd. 563, S. 6.
77. БИДЖИНЕЛЛИ (BIGINELLI)
Циклоконденсация мочевины, ацетоуксусного эфира и альдегидов в присут-
присутствии кислоты с образованием замещенных 1,2,3,4-тетрагидропиримидниов:
CO(NH2J + СН3СОСН2СООС2Н6 + RCHO
нагревание
сн3
[НС!]*; (С2Н5ОНабс.)
соос,н,
NH
B0-70%)
R = H, Alk, Ar
* CH3COOH
Аналогично идут реакции бензилидеидимочевины (диуреидометилбензола) с
ацетоуксусиым эфиром, этилового эфира Р-уреидокротоиовой кислоты с альде-
альдегидами, мочевины с а-алкилидеиацетоуксусным эфиром:
RCH(NHCONH2J + СН3СОСН2СООС2Н5 —
R = С6Н5
H2NCONHC=CHCOOC2H5 + RCHO —
СН3
H2NCONH2 + CH3COCCOOC2H6 -
II
CHR
СН,
HN
\
СООС2Н6
NH
*Называют также реакцией Бёсиека — Эбера (Hebert).
55
Замена мочевины на О-алкилизомочевииу или феиилсемикарбазид приводит
к получению соответственно 2-алкокси- или 1-аиилидопиримидииов.
Побочная реакция — образоваиие производиых пиридииа.
См. также Ремфри — Халл (№ 501).
Biginelli P., Вег., 1891, Bd. 24, S. 1317.
Folkers К., Johnson Т. В., J. Am. Chem., Soc, 1933, v. 55, p. 1140, 2886, 3361,
3784.
Sweet E., Fissekis J. D., J. Am. Chem. Soc, 1973, v. 95, № 26, p. 8741—8749.
Эльдерфильд, т. 6, с. 198.
78. БИРКЕНБАХ— ГУБО — УОТЕРС
(BIRCKENBACH — GOUBEAU — WATERS)
Прямое галогеиироваиие ароматических соединений катионом галогена:
Х+; 20-100 °С
АгН >- АгХ
F0-80%)
Ar = CeH4R, где R = Н, СН3, Cl, Br, NO2, СООН и др; X = Br, I
В реакцию вступают также полизамещеииые бензолы и производные наф-
нафталина.
Катион галогена получают различными методами:
1) взаимодействием галогена с водой в присутствии солей серебра или рту-
ртути (для связывания аниона Х~) и сильной кислоты:
НОХ + Н+ т—* [Н2ОХ]+ т—*- Х+ + Н2О
2) взаимодействием галогена с перхлоратом серебра:
Х2 + AgC104
3) взаимодействием иода с трифторацетатом серебра:
I2 + CF3COOAg -^ I+ -OOCCF3 + Agl
Способ 2 особенно удобен при Х = Вг. Иодирование с использованием иода
и трифторацетата серебра дает лучшие результаты вследствие гомогенности
реакционной смеси и легкости разделения продуктов реакции.
См. также Лихошерстов (№ 367).
Birckenbach L, Goubeau J., Ber., 1932, Bd. 65, S. 395; 1933, Bd. 66, S. 1280.
' Derbyshire D. #., Waters W. A., J. Chem. Soc, 1950, p. 564, 573, 3694.
Janssen D. E., Allen J., J. Org. Chem., 1955, v. 20, p. 1328.
Вейганд-Хильгетаг, с. 140, 141, 145.
79. БИЧЕМ (ВЕЕСНАМ)
Расщепление хлораигидридов N-тозилзамещеииых а-амииокислот под дейст-
действием водной щелочи с образованием кетоиов:
56
I
R = Н, СН3; R' = Alk
(Н2О)
RCOR'
Азиды N-тозил-а-аминокнслот подвергаются аналогичному распаду. N-To-
зилглицилхлорид в этих условиях не расщепляется. Бикарбонат натрия не вы-
вызывает расщепления, а под действием аммиака происходит превращение хлоран-
гидридов в амиды.
См. также Штреккер (№ 730).
Beecham A. F., Chem. Ind., 1955, v. 36, p. 1120; J. Am. Chem. Soc, 1957, v. 79,
p. 3257, 3262.
Lempert-Sreter M., Lempert K-, Acta Chim. Hungar., 1959, v. 21, p. 89.
OP, т. 12, с 177.
80. БИШЛЕР (BISCHLER)
Получение замещенных хииазолииов циклоконденсацией аиилидов алифати-
алифатических карбоиовых кислот с аммиаком:
COR"
¦NHCOR'
NH3; 100—170 °С
fCH3COONH4l*; (C2H5OH)"
R = H, Alk, Cl, CN, NO2; R'= H, Alk; R" = H, Alk, CeHs
* CH3COONa; ** без растворителя
Выходы близки к количественным. Аналогичную циклокоидеисацию претер-
претерпевают анилиды дикарбоновых кислот, например:
O,N
NH3
(колнч.)
Аиалогичио реагируют замещеииые N-карбоксиантраииловые (изатовые) кис-
кислоты и их нитрилы.
Достоинство метода — доступность исходных соединений.
См. также Нимеитовский (№ 425).
Bischler А., Вег., 1891, Bd. 24, S. 506.
Schofield К. е. a., J. Chem. Soc, 1952, p. 1924, 1927; 1954, p. 4043.
Albert A., Hampton A., J. Chem. Soc, 1954, p. 505.
Эльдерфильд, т. 6, с. 271.
57
81. БИШЛЕР (BISCHLER)
Получение 3-замещенных бенз-1,2,4-триазииов восстановлением о-нитрофе-
нилгидразидов амальгамой натрия с последующей циклизацией под действием
кислот и окислением феррицианидом калия:
R
NH
¦NO,
Na/Hg*
NHNHCOR'
HCl; нагревание
(C2H5OH + CH3COOH)
N
NH
NH
K3Fe(CN)e
N
A0-20%)
R = H, Br, NH2; R' = H, CH3, CeH5
* H2 над Pd/C; ** CeH5NO2
Побочный процесс—образование беизимидазолов.
См. также Бамбергер (№ 41).
Bischler А., Вег., 1889, Bd. 22, S. 2801.
Hempel A., J. prakt. Chem,. 1890, Bd. 41, S. 161.
Abramovitch R. A., Schofield K-, J. Chem. Soc, 1955, p. 2327.
Erickson J. G. In: Chemistry of Heterocyclyc Compounds. Ed. A. Weissberger.
V. 10. London, Interscience publ., 1956, p. 93.
82. БИШЛЕР —МЁЛАУ (BISCHLER —MOHLAU)
Конденсация а-галогенкетонов с ароматическими аминами с последующей
:изацией в индолы пол действием киглпт*-
циклизацией в индолы под действием
RC—CHR' + R"
II I
О X
COR HX; нагревание
/CHR' [
NH
¦-R'
R, R'=Alk, CCH5, C6H4CH3-n, QH4OCH3-n;
R" = CH3> C2H5, OCH3) COOCH3; X = Cl, Br
^Называют также реакцией Бишлера.
58
Вместо а-галогенкетонов используют также а-окси- или а-ариламинокетоны
Несимметричные кетоны дают смесь двух изомерных индолов, например:
CeH5CH2-C-CHC6H5 -
II I
О NHC6H5
CCH5
1—СН2С6Н5
NH
C2%)
NH2
СН2С6Н5
>-с6н5
NH
A8%)
Из фенацилбромида и его замещенных получены только 2-арилиндолы. Из
а-ариламиноциклогексанонов образуются тетрагидрокарбазолы (катализатор
MgCb).
См. также Неницеску (№ 420), Райссерт (№ 491), Фишер (№ 611), Япп —
Мюррей (№ 755).
Mohlau R., Вег., 1881, Bd. 14, S. 171; 1882, Bd. 15, S. 2480.
Bischler A. e. a., Ber., 1892, Bd. 25, S. 2860; 1893, Bd. 26, S. 1336.
Teuber H J., Schnee K., Chem. Ber., 1958, Bd. 91, S. 2089.
Campaigne E., Lake R., J. Org. Chem., 1959, v. 24, p. 478.
LeRoi Nelson K-, Robertson J. C, Duvall J. J., J. Am. Chem. Soc, 1964, v. 86,
p. 684.
Sundberg R. J. The Chemistry of-Indoles. New York, Acad. Press, 1970.
p. 164.
Эльдерфильд, т. З, с. 17.
83. БИШЛЕР—НАПИРАЛЬСКИЙ (BISCHLER—NAPIERALSKI)
Циклодегидратация N-ацил-Р-арилэтиламинов (в том числе и конденсиро-
конденсированных) с образованием изохинолинов под действием дегидратирующих агентов
с последующим дегидрированием:
РОС1*; нагревание
(СНС1з)« "*¦
COR'
[Pel]*" 14/4^ N
R' R'
(80%)
R = H, OAik, Aik; R'=Alk, Ar
* P2O5, PCI5, ZnCi2, полифосфорная кислота; ** C6H5NO2, инертные
растворители;
PdCl2, (CH3COOJHg, [Pt], KMnO4
Реакции способствует наличие электроиодонориых заместителей в аромати-
ароматическом ядре.
Способ может быть использован для получения других соединений с азот-
азотсодержащими шестичлеииыми гетероциклическими сЖтемами (феиаитридииы,
пиридины и др.), например:
СН2
/ ^ ~нс„нв
2
Н2С СН=СНС6Н5 РОС13; нагревание
н2с
сосн.
(СвН0)
N сь
Реакция находит широкое применение в синтезе алкалоидов.
См. также Боббитт (№ 91), Пикте—Гаме (№ 454), Пикте — Хуберт
{№ 455), Пикте — Шпенглер (№ 456), Помераиц—Фрич (№ 469).
Bischler A., Napieralski В., Бег., 1893, Bd. 26, S. 1903.
Fujisawa Т., Sugasawa S., «Tetrahedron», 1959, v. 7, p. 185.
Schmutz J. e. a., Helv. chim. acta, 1967, v. 50, p. 245.
Teitel S., Brossi A., Schenker F., J. Heterocyclic Chem., 1968, v. 5, p. 825.
Gal J. e. a., J. Org. Chem., 1974, v. 39, № 3, p. 418—421.
Эльдерфильд, т. 4, с. 265.
84. БЛАН (BLANC)
Циклизация 1,4- и 1,5-дикарбоновых кислот в кетоиы под действием уксус-
уксусного ангидрида:
(СНг),,— СН2СООН (СН3СОJО; -250 «С (СН2)„—СН2
СН2СООН
п = 2,3
СН2-
-С=О
Разветвление углеродной цепи, особенно наличие гемииальиых СНз-групп,
способствует циклизации. При п=4 реакция проходит с малыми выходами, при
я>4 образуются межмолекуляриые ангидриды.
Кислоты с п = 0, 1, а также соединения типа R2C(COOHJ в указанных усло-
условиях превращаются в ангидриды (в соответствии с правилом Блаиа):
СО
RCH-COOH
I
СН2-СООН
R
СО
Правило Блана: под действием уксусного ангидрида 1,4- и 1,5-дикарбоновые
кислоты превращаются в кетоиы, а 1,2- и 1,3-дикарбоиовые кислоты — в ангид-
ангидриды, например:
Правило Блаиа часто используют при установлении строения терпенов
и стероидов.
См. также Ружичка (№ 526).
Blanc G., С. г., 1907, v. 144, р. 1356; Bull. Soc. chim. France, 1908, v. 3,
p. 778.
Bachmann E., Deno N. C, J. Am. Chem. Soc, 1949, v. 71, p. 3540.
Фьюзон с. 584; Gilman, v. 1, p. 80.
85. БЛАН (BLANC)
Хлорметилироваиие ароматических соединений действием формальдегида
и хлористого водорода в присутствии катализаторов*:
АгН + СН2О
НС1
[ZnCl2]
¦> АгСН2С1
(80—90%)
Ar = QH4R, где R = H, Alk, OH, OAlk, COAlk, COOAlk, Ar
* H2SO4, H3PO4, A1C13, SnCl4
Электроиодоиориые заместители способствуют реакции.
Вместо СН2О + НС1 можно использовать СН2(ОСН3J+НС1 или СН3ОСН2С1.
Кроме СНаО возможно применение других альдегидов (СН3СНО, С2Н5СНО,
С8Н7СНО), например:
СН3О
СН3СНО; НС1
СН3О
СНС1
сн,
E0%)
Аналогично хлорметилируются конденсированные ароматические углеводоро-
углеводороды и гетероциклы, например:
Основная побочная реакция — образование производных диарилметана.
Реакция Блаиа позволяет получать также бромметильиые производные аро-
ароматических соединений. Иодметилироваиие осуществляется лишь в исключитель-
исключительных случаях.
Blanc G,, Bull. Soc. chim. France, 1923, v. 33, p. 313.
Abramo J. G., Chapin E. C, J. Org. Chem., 1961, v. 26, p. 2671.
Houben-Weyl, Bd. 5/3, S. 1001.
OP, т. 1, с 84.
*Называют также реакцией Блаиа — Келе (Quelet).
61
86. БЛОМКВИСТ (BLOMQUIST)
Синтез макроциклических кетонов внутримолекулярной конденсацией алифа-
алифатических дикетенов, полученных дегидрохлорированием хлорангидридов дикар-
боновых кислот:
(СН2)П—СН2СОС1 (CaHstaN; нагревание (СНо)п—СН=С=О КОН; нагревание
СН,СОС1
СН=(
(эфир абс.) СН=С=О
(СН2)„-СН2
сн2—с=о
[С2Н5ОН аСс.]
В реакцию вступают также хлорангидриды непредельных кислот:
СН-(СН2)?Ч
С1СО(СН2OСН=СН(СН2OСОС1
СН-(СН2)/
C3%)
Побочные продукты: линейные полимеры типа
НООС (СН2) „ [СО (СН2) п] jcCOOH
и дикетоны (в результате межмолекулярной конденсации). Последняя реакция
подавляется при проведении процесса в условиях сильного разбавления.
См. также Ружичка (№ 526).
Blomquisi А. Т., Spencer R. D., J. Am. Chem. Soc, 1947, v. 69, p. 472; 1948,
v. 70, p. 30, 34.
Физер Л., Физер М. Органическая химия. Изд. 2-е. Т. 2. Пер. с англ. Под
pea. H. С. Вульфсона. М., «Химия», 1970, с. 82.
Rodd, v. 2, р. 272.
87. БЛЭЗ (BLAISE)
Получение кетонов из галогенангидридов кис-лот н цннкорганических соеди-
соединений:
RCOX + R'ZnX
X = I, Cl, F; I
нагревание
(бензол + эфир) V RC°R
= Alk, Ar; R' = Alk
Реакционная способность галогенангидридов уменьшается в ряду:
RCOI > RCOC1 > RCOF
Выходы кетонов из галогенангидридов алифатических кислот составляют
70—90%, а из галогенангидридов ароматических кнслот— ~60%.
Наиболее важное использование реакции — получение эфиров кетокислот нз
хлорангидридов эфиров двухосновных кислот, например:
С2Н5ООС(СН2LСОС1 + Zn(CH3J
С2Н5ООС(СН2LСОСН3
(80-95%)
Сложноэфирная группа сохраняется благодаря малой реакционной способ-
способности карбонильных групп по отношению к RZnX (в отличие от RMgX).
62
Модификация Блэза—Мэра (Blaise— Maire) — получение а,|3-иепредельных
кетонов из хлораигидридов E-оксикарбоновых кислот:
—СН—С—СООН
Ан '
-СН—С-СОС1
RZnCI; нагревание
(эфир + бензол)
сн,соо
—СН—С
:—cor
20%-ная H2SO4 или 2 н. НС1; нагревание
-СН=С—COR
сн3со6
См. также Гилмен — Нелсон (№ 200), Оддо (№ 433).
Blaise Е. ?., Maire M., С. г., 1907, v. 145, р. 73.
Blaise E. ?., Kohler A., Bull. Soc. chim. France, 1910, v. 7, p. 215.
Cason J., Chem. Rev., 1947, v. 40, p. 17.
Klein H., Neff H., Angew. Chem., 1956, Bd. 68, S. 681.
OP, т. 8, с 44.
88. БЛЭЗ (BLAISE)
Получение |3-кетоэфиров из эфиров а-бромкарбоновых кислот и нитрилов
под действием металлического цинка с последующим щелочным гидролизом:
Zn; нагревание
R'R"C—COOC2H5 + RCN
(ннертн. растворитель)
Вг
R'R"C-COOC2H5
ZnBr
RCN
30%-ный р-р КОН*
(ВД *"
» R'R"C-COOC2H5
RC=NZnBr
v R'R"C-COOC2H5
COR
R = Alk, Ar; R\ R" = Alk
* H2SO4
Циклические нитрилы, содержащие заместители в положении 2, не вступают
в реакцию.
См. также Реформатский (№ 507).
Blaise Е. Е., С. г., 1901, v. 132, р. 478.
Cason J., Rinehart К- L., Thornton S. D., J. Org. Chem., 1953, v. 18, p. 1594.
Lapin H., Arsenijevic V., Horeau A., Bull. Soc. chim. France, 1960, p. 1700.
89. БЛЭЗ (BLAISE)
Циклизация 2,6-дикетонов с образованием циклогексенонов под действием
хлористого водорода:
HCI; 0 "С
RCOCH2CH2-CH-COCH3 »
^(СзНв)
:оос2н5
R = сн3) с2н5
(-60%)
63
2,7-Дикетоиы в этих условиях циклизуются с образованием семичлеииого
цикла, а 2,5-дикетоиы образуют производные фураиа, например:
СООН
CH3COCH2CHCOCHS
СООС2Н5
Blaise Е. ?., Bull. Soc. chim. France, 1908, v. 3, p. 413.
Henecka H., Ber., 1948, Bd. 81, S. 179.
Dann O., Dister H., Merkel H., Ber., 1952, Bd. 85, S. 457.
lager H., Keymer R., Arch. Pharm., 1960, v. 293, p. 896.
90. БЛЭЗ —ГЕРЕН (BLAISE — GUERIN)
Получение альдегидов термическим декарбоиилироваиием о-оксикарбоиовых
кислот в присутствии двуокиси углерода*:
-200 °С*
RCH-COOH >- RCHO
Ан
R = Alk
* H2SO4 (конц.) при ~30 °С
При декарбоиилироваиии алифатических кислот, содержащих пять и более
атомов углерода, выходы достигают 90%- В случае оксикислот с третичной
ОН-группой образуются кетоны, например:
ОН
НООССН
I конц. H2SO4; 30 °С
-С-СН.СООН *¦ НООССН2-С-СН2СООН
ООН
о
(97%)
а-Ацетокси- и а-алкоксикарбоновые кислоты декарбоиилируются более глад-
гладко, чем соответствующие а-оксикислоты.
Реакция дает возможность получить из карбоиовой кислоты альдегид, со-
содержащий иа одни атом углерода меньше, чем исходная кислота:
RCH2COOH
RCH,COCI
RCHBrCOCI
RCHOHCOOH
RCHO
См. также Руфф— Фентон (№ 530).
Blaise Е. Е., С. г., 1904, v. 138, р. 697.
Le Sueur H. R., J. Chem. Soc, 1904, v. 85, p. 827.
Blaise E. E., Guerin E., Ber. Schimmel u. Co., AG., Miltitz, Bez. Leipzig, 1929,
Bd. 11, S. 17.
Davies R. R., Hodgson H. H., J. Soc. Chem., Ind., 1943, v. 62, p. 128.
*Называют также реакцией Блэза и Блэза — Ле Сюэра (Le Sueur).
64
91. БОББИТ (BOBBIT)
Получение 4-замещенных изохинолинов циклокоидеисацией замещеииых
бензиламипоацеталей с ароматическими альдегидами под, действием соляной
кислоты:
СН(ОС2Н5J
сн,
I ff \ НС!; нагреванне
+ НС-/ VR' -
R
ч.
С
>Но
NH
(QsH5OH
E0-80%)
R = ОН, ОСН3; R', R" = Н, ОСН3
Преимуществом метода является возможность получения 4-замещеииых
изохинолинов, недоступных при использовании других методов (см., например,
Померанц— Фрич, № 469).
См. также Бишлер — Напиральскнй (№ 83).
Bobbit J. M., Winter D. P., Kiely J. M., J. Org. Chem., 1965, v. 30, p. 2459.
Gensler W. J., Shamasundar К. Т., Marbury S., J. Org. Chem., 1968, v 33,
p. 2861.
Bobbit J. M., Moore Т. Е., J. Org. Chem., 1968, v. 33, p. 2958.
92. БОДЖЕРТ— КУК (BOGERT —COOK)
Получение октагидрофеиантреиов дегидратацией 1-([5-феиилэтил)-циклогек-
санолов-1 под действием серной кислоты с последующей циклизацией:
ОН
/Ч^л 50%-ная HgSO^(~*~^~) конц'H2SOV Г^^}
R R R
R = Н, СН3, OCHS
• 12; ** А1С13
Аналогично протекает циклодегидратаиия соответствующих циклопеитаио-
лов, например:
ОН
5—684
65
Побочнымн продуктамн реакции являются спираны.
Исходные спирты получают из цнклогексанолов действием магнийорганиче-
скнх соединений:
О
СН2СН2СоН5
«
+ C6H5CH2CH2MgBr
Метод аналогичен методу Бардхана — Сенгупты (№ 46), но находит более
широкое применение вследствие большей доступности исходных продуктов.
См. также Дарзан (№ 230), Хейуорт (№ 646).
Bogert М. Т., «Science», 1933, v. 77, p. 289.
Cook J. W., Hewett С L, J. Chem. Soc, 1933, p. 1098.
Bergman E., Chem. Rev., 1941, v. 29, p. 535.
Schmidt C, Thazhuthavectil J., Can. J. Chem., 1973, v. 51, № 21, p. 3620—3625.
Физер Л., Физер М. Химия природных соединений фенантренового ряда.
Пер. с англ. Под ред. В. М. Родионова. М.-Л., Госхнмиздат, 1953, с. 93.
93. БОДЖЕРТ —ЭРРЕРА (BOGERT —HERRERA)
Получение 2,4-днарнлтиофенов взаимодействием аннлов арилметилкетонов
с серой*:
S; -200 °С
2Аг—С—СН3
N-C6H5 S
C0%)
Аг = С6Н5, о- или я-СН3С6Н4
Побочный процесс — образование 2,5-изомеров, например:
S
С6Н5—С—СН3
II
NC6H5
С6Н5—С—СН3
II
S
нс-сн
SH
\
с-свн5
HS SH S
Аналогично при взаимодействии анилов с селеном получают соответствую-
соответствующие селенофены. Селен обладает меньшей дегидрирующей способностью, поэто-
поэтому 2,5-днарнлзамещенные изомеры не образуются.
См. также Бауман — Фромм (№ 50), Фольхард — Эрдман (№ 620).
Bogert M. Т., Herrera P. P., J. Am. Chem. Soc, 1923, v. 45, p. 238.
Demerseman P. e. a., J. Chem. Soc, 1954, p. 2720.
^Называют также реакцией Бож.жерта.
66
94. БОДРУ (BODROUX)
Получение замещенных амидов кислот из сложных эфиров и ариламиномаг-
нийгалогенидов:
/R"
OMgX
/ - нагревание I HC1
RCOOR' + ArNx > R-C-NR"Ar ——*¦ RCONR"Ar
\Mgx (эфир) I (H2O)
OK
(-80%)
R = Alk, Ar; R" = H, CH3, C6H5
Аналогично р-аминокнслоты образуют N-метнланилиды, карбазолиды, ии-
долнды.
См. также Вильгеродт—Киндлер (№ 165).
Bodroux F-, Bull. Soc. chim. France, 1905, v. 33, p. 831; 1906, v. 35, p. 519;
1907, v. 1, p. 912; С. г., 1904, v. 138, p. 1427; 1905, v. 140, p. 1108; 1906, v. 142,
p. 401.
Kuhn R., Morris C, Ber., 1937, Bd. 70, S. 853.
Bassett H. L, Thomas С R., J. Chem. Soc, 1954, p. 1188.
Вепганд-Хильгетаг, с 457.
95. БОДРУ—ЧИЧИБАБИН (BODROUX)
Получение алифатических и ароматических альдегидов взаимодействием
магннйорганическнх соединений с ортомуравьнным эфиром и последующим гид-
гидролизом образовавшегося ацеталя:
RMgX + CH(OR'K
1. Нагревание
2. НС1; охлаждение
(эфир)
RCH(OR'J
н+
X = Вг, I; R = Alk, Аг; R' = СН3, С2Н5
- RCHO
D0-80%)
В реакцию вступают также реактивы Иоцнча и другие непредельные маг-
ннйорганическне производные:
BrMgC=C-Cs5CMgBr + СН(ОС2К,K у (С2Н5ОJСН-С=С—С=С-СН(ОС2Н6)г
(-60%)
В более жестких условиях возможно замещение двух или трех алкоксиль-
ных групп ортомуравьиного эфира с образованием соответственно простых эфи-
рон или углеводородов.
Реакция находит препаративное применение для формилироваиия различных
ароматических и гетероароматнческнх соединений.
См. также Буво (№ Ц7).
Чичибабин А. Е., ЖРФХО, 1903, т. 35, с. 1284.
Bodroux F., С. г., 1904, v. 138, р. 92.
Pasternak Y., Traynard J. С, Bull. Soc. chim. France, 1966, p. 365.
Методы элементоорганической химии. Магний, бериллий, кальций, стронций,
барий. Под ред. А. Н. Несмеянова и К. А. Кочешкова. М., Изд. АН СССР,
1963, с. 336.
67
96. БОИЛЭНД —СИМС (BOYLAND — SIMS)
. v, ^Окцсление ароматических аминов в о-аминофеиолы персульфатом калия в
щелочной среде:
~ R.N-OSOoH'
KjS2O8; КОН; -20 °С
*¦
(водн. СН3СОСН3)
NR,
OSO3H
конц. НС1; 100 °С
R = Н, Alk
D0-55%)
В реакцию вступают первичные, вторичные и третичные ароматические ами-
амины, в том числе и конденсированные системы. Если оба орто-положения заняты,
образуются я-амииофенолы. Аналогично реагируют аминопиридииы и индолы.
Побочные процессы: образование иитросоединений, азо- и азоксипроизвод-
иых и полимерного продукта — гуминовой кислоты.
Реакция помимо препаративного значения представляет большой интерес
вследствие ее аналогии с процессами биологического окисления.
См. также Эльбе (№ 735), Бон — Шмидт (№ 98), Дейкин (№ 237).
Boyland Е., Manson D., Sims P., J. Chem. Soc, 1953, p. 3623.
Boyland E., Sims P., J. Chem. Soc, 1958, p. 4198.
Behrman E. J., Edwards I. O. In: Progress in physical organic chemistry. V. 4.
Eds. A. Streitwieser, R. W. Taft. New York, Wiley, 1967, p. 97.
Behrman E. ]., J. Am. Chem., Soc, 1967, v. 89, p. 2424.
97. БОЛ Л — ГУД ВИН — МОРТОН
(BALL — GOODWIN — MORTON)
Окисление первичных или вторичных а,[5-иепредельиых спиртов в
а,[5-иепредельные альдегиды или кетоны двуокисью марганца:
С=С СН
I I I
ОН
MnOs; ~20°C
(петролейный эфир)*
-*¦ —с=с-с-
о
D0-90%)
* СН2С12) СС1„ (СНзJСО, С6Н6, бензин
В реакции используют активную форму МпОз, приготовленную из водных
растворов эквивалентных количеств MnSO4 и КМпО4-
I I I
Фрагмент —С = С—С—ОН может являться частью циклической системы
ароматических, гетероциклических или стероидных соединений, например:
СН2ОН СНО
НСк X /СН2ОН НО^ X ^СН.ОН
N-HC1
N
6*
Аналогично окисляются соответствующие ацетиленовые спирты:
Н3С СН3 Н3С СН,
, он
1 .
\с=с-снсн3
Метод используют для избирательного окисления полифуикциоиальных со-
соединений.
См. также Пфицнер — Моффэтт (№ 482).
Ball S., Goodwin Т. W., Morton R. A., Biochem. J., 1948, v. 42. p. 516.
Evans R. AT, Quart. Rev., 1959, v. 13, p. 61.
Вепганд-Хильгетаг, с. 308; Физер, т. 5, с. 266; т. 2, с. 219.
98. БОН — ШМИДТ (BOHN — SCHMIDT R. Е.)
Введение оксигрупп в оксиантрахинон действием олеума в присутствии
ртути:
О ОН О ОН
II
о он о он
* MnO2, PbO2, H3As04, H2SO4B00 — 300 °С), нитрозилсерная кислота; ** Se
Аналогично окисляется нитроаитрахинои. Реакцию обычно применяют для
получения производных аитрахинона, содержащих четыре — шесть оксигрупп, но
можно получать и менее гидроксилированные продукты. Чтобы остановить про-
процесс на нужной стадии, окисление проводят в присутствии Н3ВОз. Побочные
реакции: сульфирование, образование эфиров серной кислоты.
Метод позволяет получать ряд важных продуктов, используемых как про-
протравные красители и полупродукты для синтеза кубовых и суспензионных кра-
красителей.
См. также Бойлэнд—Симе (№ 96), Дейкнн (№ 237), Эльбе (№ 735).
Bohn R., нем. пат. 46654 A889).
Schmidt R. Е., нем. пат. 60855 A891). -
Winklery L, Jenny W., Helv. chim. acta, 1965, p. 48, p. 119.
Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей.
Изд. 4-е. М., Госхимиздат, 1955, с. 599.
99. БОННЕР (BONNER)
Получение ацилгалогеноз из алкилтиоглнкозидов действием брома или хло-
хлора в инертном растворителе:
H-C-SR
Н-С-ОСОСН
О
(СНС13 или СН2С12)
= С2Н,, С6Н4; X =
Н—С-Х
Н—С—i
I
С1, Вг
ОСОСН,
О
69'
Реакция протекает стереоспецифично, не сопровождается аиомериаацней и
позволяет получать некоторые труднодоступные ацилгалогеиозы.
См. также Паску (№ 440), Земплен — Коритник (№ 266).
Воппег №. A., J. Am. Chem. Soc, 1948, v. 70, p. 3491.
Weygand F., Ziemann H., Ann., 1962, Bd. 657, S. 179.
Wolfrom M. L, Groebke W., J. Org. Chem., 1963, v. 28, p. 2986, 2992.
100. БОРОДИН-ХУНСДИККЕР (HUNSDIECKER)
Декарбоксилирование серебряных солей карбоионых кислот под действием
галогенов в безводном органическом растворителе с образованием соответствую-
соответствующих алкилгалогенидов
;*•
RCOOAg
[RCOO- + Х- -
- RCOOX
R-
->• RX
F5-80%)
X = Br, Cl, I
В реакцию вступают алифатические, алициклические, ароматические и гете-
гетероциклические соединения. Наиболее легко реагируют соли алифатических кар-
боновых кислот, причем выходы уменьшаются в следующем ряду заместите-
заместителей R: первичный > вторичный > третичный. Непредельные кислоты, за ис-
исключением фенилпропиоловой кислоты, в этих условиях не декарбоксилнруются.
а-Кетокислоты в этих условиях образуют галогенаигндриды, а а-окси- и
а-аминокнслоты — соответственно кетоиы и альдегиды:
С6Н5—C==C-COOAg
RCOCOOAg
R2C(OH)COOAg
х2
R2C(NHs)COOAg
R2C(NH2)X
> С„Н6-С==С1
(94%)
RCOX
-> R2CO
н2о
RCHO
В случае ароматических карбоновых кислот реакция облегчается при нали-
наличии электроноакцепторных заместителей в ароматическом ядре.
Реакцию можно проводить с солями других металлов (калия, ртути, тал-
лня), не выделяя их из реакционной смеси:
Н,С СН-СООН
1_м2
Br2; HgO
—*
Н2С СНВг
D6%)
(CF^CHCOOK
ВГ2
(CF^CHBr
G8%)
Метод используют главным образом в алифатическом ряду, в частности для
получения эфиров ш-галогенкарбоновых кислот.
¦Называют также реакцией Бородина.
70
См. также Симониии (№541).
Borodin A., Ann., 1861, Bd. 119, S. 121.
Hunsdiecker H., Hunsdiecker C, Ber., 1942, Bd. 75, S. 291.
Grewe R., Vangermain E., Chem. Ber., 1965, Bd. 98, S 104.
Davis J. A. e. a., J. Org. Chem., 1965, v. 30, p. 415.
Дяткин Б. Л. и др., Журн. ВХО им. Д. И. Менделеева, 1965 т 10 с 469
Cason J., J. Org. Chem., 1972, v. 37, p. 669.
Ando Teiichi e. a., Chem. Letters, 1973 -№ 10, p 1133—1136
OP, т. 9, c. 445.
101. БОРШЕ—БЕРКУТ (BORSCHE — BERKHOUT)
Межмолекулярная конденсация фенолов и альдегидов под действием кислот
с образованием 1,3-бенздиоксанов:
R'
R
H2SO4 или НС1
2R'CHO )- R
О
ОН
О
R'
R = Н, СН3, СООН, NO2, С!, NH2, SO3H; R' = Н, CCI3, CHCI2, CH3
Направление реакции зависит от соотношения реагирующих веществ При
значительном избытке альдегида образуется соединение I, прн избытке феио-
ла — соединение II:
О О
|
сн
ОО
R R
i и
Заместители, находящиеся в орто-положенни к оксигруппе затрудняют ре-
реакцию, лета-заместителн не оказывают влияния.
Borsche W., Berkhout H., Ann., 1904, Bd. 330, S 91
Эльдерфильд, т. 6, с. 53.
102. БОРШЕ-ДРЕКСЕЛЬ (BORSCHE - DRECHSEL)
Циклизация арилгидразонов циклогексанона в тетрагидрокарбазолы при на-
нагревании с разбавленной серной кислотой*:
нагревание
D' >- р
NH-tf
R = Н, CHj, NO*, СООН; R' = Н, СН,
* СН^СООН(лед.), ZnCIs
¦Называют также реакцией Борше.
71
Процесс аналогичен получению нндолов по Фишеру (см. № 611). По упро-
упрощенной методике реакцию проводят без выделения арнлгндразонов, нагревая
циклогексанон с раствором арнлгидразина в спирте в присутствии кислоты.
При R нли R't^H образуется смесь изомерных тетрагндрокарбазолов, на-
например:
NH—N
O.N
Препаративное значение метода обусловлено легкостью дегидрогенизации
продуктов в соответствующне карбазолы с выходами до ' "'
хлоранил*; нагревание
(ксилол)
• Коричная кислота + Pd-чернь; РЬО
См. также Бухерер (№ 128), Гребе —Ульман (№ 216).
Drechsel Е., J. prakt. Chem., 1888, Bd. 38, S. 69.
Borsche W., Feise M., Ber., 1904, Bd. 140, S. 378.
Campbell N.. Barclay В. М., Chem. Rev., 1947, v. 40, p. 361.
Pausacker K. H., Schubert С L, «Nature» (London), 1949, v. 103, p. 289, 602,
Робинсон Б., Усп. химии, 1971, т. 40, с. 1434.
Эльдерфильд, т. 3, с. 236.
103. БОРШЕ — КЕННЕР (BORSCHE — KENNER)
Получение тетрагндрофенантрндннов цнклоконденсацней 2-оксиметилцнкла-
гексанона с первичными ароматическими аминами:
SnCl|; нагревание
R = Н, Alk; R' = H, Alk, OAlk, С!, NO2
• Без конденсирующего агента; ** циклогексанон
Аналогичные результаты получены при взаимодействии аминов с замещен-
замещенными 2-ацетнлцнклогексанонамн в присутствии концентрированной H2SO4. Не-
Недостатком этого варианта являются низкие выходы продуктов и жесткие требо-
требования к соблюдению температурного режима. •
См. также Дёбнер — Миллер (№ 246), Комб (№ 315), Пикте —Хуберт
(№ 455).
72
Borsche ЯГ., Ann., 1910, Bd. 377, S. 70.
Kenner L, Ritchie W. H., Statham F. S., J. Chem. Soc, 1937, p. 1169.
Hollingsworth L., Petrov V., J. Chem. Soc, 1948, p.'1537.
Эльдерфильд, т. 4, с. 451.
104. БОРШЕ- КЕЛЬШ (BORSCHE - KOELSCH)
Синтез 4-окснцнннолинов циклизацией дназонневых солей, полученных из
0-амнноацетофенолов:
COCH2R'
¦N.C1
нагревание
ОН
N
E8-90%)
R = Н, СН3, С2Н5, OCHSl На!, CN, NO2; R' = Н, СН,, С,НВ, С1, Вт
Наличие электроноакцепторных заместителей в орто- нлн яара-положеннях
к амнногруппе ускоряет цнклнзацню.
См. также Видман — Штёрмер (№ !6!), Рихтер (№ 514).
Borsche W., Herbert A., Ann., 1941, Bd. 546, S. 293.
Koelsch С. F., J. Org. Chem., 1943, v. 8, p. 295'
Эльдерфильд, т. 6, с. 121; OP, т. 10, с. 15, 29.
105. БОТТ (ВОТТ)
Получение замещенных уксусных кислот из соединений, способных к обра-
образованию ионов карбоння (олефннов, вторичных и третичных спиртов илн эфи-
ров), и 1,1,-дихлорэтилена под действием серной кислоты и трехфторнстого бора
с последующим гидролизом:
\:
\
в-Ю0%-ная H2SO4; 5-15 °С
соон
НаО \
73
Примеры:
СН2СООН
G 9%)
(СН3KС— СН2СООВ
(СН3K С-ОН —
(СН3)з С—С1 —
(СН3KС-ООССН3—
Очень легко получаются также адамантилуксусные кислоты:
СН2СООН
R"
(80-95%)
Я= Вг, ОН,ОСОСН3; R', R"Я"= Н, СН3
См. также Кох —Хааф (№ 331), Риттер (№ 512).
Bott К., Angew. Chem., 1965, Bd. 77, S. 967.
Boti К., Hellmann H., Angew. Chem., 1966, Bd. 78, S. 932.
Rober D. I. e. a., «Tetrahedron», 1971, v. 27, p. 3.
!06. БОУЛТОН — КАТРИЦКИИ (BOULTON — KATRITZKY)
Перегруппировка 5-замещенных 4-нитробензфуроксанов в 7-замещенные:
|O—N=O
O*-N
R = Aik, C6H5, CI
*С1СН,СНС12, без растворителя
74
Перегруппировка медленно происходит уже при ~20*С. Электронодоиор-
ные заместители заметно облегчают и ускоряют реакцию. В редких случаях про-
протекает ретроперегруппировка:
O—N О N0,
C,H,NHs.
Boulton A. ]., Katritzky A. R., Rev. Chim. (Romania), 1962, v. 7, p. 691.
Ghosh P. В., J. Chem. Soc., Ser. B, 1968, p. 334.
107. БОУМЕН (BOWMAN)
Получение кетонов ацилированнем бензиловых эфиров алкилмалоновых кис-
кислот с последующим гндрогенолязом и декарбоксилированием:
Na; CeH5CHaOH
Na; RX
RCH(COOCHaCeHBJ
ReH(COOCaH5)a
Na; R'COX
RC(COOCH2C6H5J
COR'
На
[Pd/C]
iOR'
R = Alk, C6HB) CH2C6H4, CHa-
нагревание
RC(COOH)a > RCHaCOR'
COR' D5-90%)
R' = H, Ak, C6HB
На стадии ацилирования можно использовать ангидриды кислот.
При наличии групп, не устойчивых к гндрогенолизу, последний можно ис-
исключить, подвергая расщеплению соответствующие тетрагидропкраииловые
эфнры:
RCH(COOHJ
\:
IH+]
-*• RCH
coo-<f \
Na; R'COCl; -40'С
(С6Нв)
RC
R'OC
С ОО-.
о-
иагревание
[СНзСООН];
¦¦ RCHaCOR'
Реакцию используют для получения высших алифатических кетонов, дикето-
нов, кетоспиртов, ацилоинов, кетокислот, E-кетоэфиров и |3-кетонитрилов.
Модификация Фонкеиа — Джоисона (Fonken — Johnson W. S.) — получение
кетонов из грег-бутиловых эфнров алкилмалоновых кислот с использованием
я-СНзСвН45ОзН на стадии декарбоксилнрования:
RC[COOC(CH3Kb
R'
нагревание
[л-СНзСеЩЗОзН]"
RCH2COR'
См. также Робинсон — Робинсон (№ 519).
Bowman R. E., «Nature» (London), 1948, v. 162, p. 111.
Ames D E., Bowman R. E., Mason R. G., J. Chem. Soc, 1950, p. 174.
Bowman R. E., Fordham W. D., J. Chem . Soc, 1951, p. 2753, 2758; 1952,
p. 3945.
Fonken G. S., Johnson W. S., J. Am. Chem. Soc, 1952, v. 74, p. 831.
Williams K. I. H. e. a., J. Am. Chem. Soc, 1960, v. 82, p. 3982.
108. БРАУН (BROWN С. А.)
Каталитическое восстановление двойной углерод-углеродной связи дейст-
действием боргидрида натрия в присутствии свежевосстановленной платины (катали-
(катализатор Брауна — Брауна):
\
г*'
NaBH4; 25 СС \ /
_ ^_ \р гу
[Pt]; (CjH5OH) / I | \
н н
(КрЛИЧ.)
Двойная связь восстанавливается избирательно, функциональные группы не
затрагиваются. Аналогично гидрируется С^С-связь. Катализатор Брауна —
Брауна, приготовляемый восстановлением H2PtCle боргидридом натрия непо-
непосредственно в реакционной смесн, значительно активнее катализатора Адамса
(РЮ2-Н2О).
Реакция может быть использована для количественного определения олефи-
нов (с точностью более 1%).
См. также Сабатье — Сандеран (№ 533), Швенк—Папа (№ 702).
Brown С. A., J. Am. Chem. Soc, 1969, v. 91, p. 5901.
Brown H. C, Brown С A., J. Am. Chem. Soc, 1962, v. 84, p. 1495, 2827, 2829;
J. Org. Chem., 1966, v. 31, p. 3989.
Brown H. C, Min-Hon Rei, J. Org. Chem., 1966, v. 31, p. 1090.
109. БРАУН (BROWN H. C.)
Присоединение комплексных боргидридов или диборана по кратным связям
(С = С, С = О, С = С, C = N, C = N) в мягких условиях с расщеплением связи
В—Н (гидроборирование):
\ / / ~25 °С \ I /
чх н—в —*- хсн—с—w
\ (эфир)* / , \
/с=с\
о-в7"
* Диглим, тетрагидрофуран
Гидроборирование является процессом г^ис-присоедииеиия с наименее стери-
чески затрудненной стороны, в основном, против правила Марковникова:
в2н6
RCH=CH2 >- (RCH2CH2)SB
B2He
BНз)аС=СНСН3 >- [(СНзJСНСН(СН3)]2ВН
76
Гидроборирование С4Н9СН =^СНСНз приводит к смеси (~1:1) изомерных
алкилборанов. При повышении температуры наблюдается миграция атома бора ,
в терминальное положение.
Выходы продуктов существенно зависят от природы гидроборирующего
агента. Так, при гидроборировании гептина-1 действием NaBH4 выход продукта
реакции составляет 12%, а при использовании ди-вго/г-изоамилборана (ДИАБ)
выход количественный:
ДИАБ
С6Н11СН=СН-В[СН(СН3)СН(СН3J]2
Применение ДИАБ часто позволяет осуществить избирательное гидробори-
гидроборирование. Так, в случае стирола, где возможно образование двух продуктов гид-
роборирования
С6Н5СН=СН2
C6HSCH2CH2—
СН,
С,Н6СН—W
выходы (в %) составляют:
Реагент
В2Нв
ДИАБ
Соединение
I
80
98
П
20
2
Реакция Брауна получила широкое распространение:
1) гидроборирование с последующим окислением Н2Ог в щелочном раство-
растворе — метод г<цс-гидратации :
\
нв.
\c_c-
/| I
Н
Н2О2
(водн. NaOH)
СН2=С-С=СН2
HSC СН3
XG-C—О
НОСН2СН—СНСН2ОН
I I
HSC CH3
F6%)
/\ |\
н он
(ДО 90%)
2) гидроборирование с последующим протонированием — метод восстановле-
восстановления кратных связей:
V_c/
_c
\
X
¦Называют также методом Брауна —Сабба Pao (Subba Rao).
77
Варьируя условия проведения реакцнй, можно проводить избирательное вос-
восстановление:
СН,СОО
ОСОСН,
сн,он
3) гидроборирование с последующей обработкой щелочным раствором
AgNO3 используют как способ образования новой С—С-связи:
\
2 4-U
/ |
—с—
2 \A_U-
/ | |
—с
/\
b
\ (водн. NaOH)
I |
—С
/\
|
с—
/\
Brown Н. С, Subba Rao В. S., J. Am. Chem. Soc, 1959, v. 81, p. 6423.
Krubiner A. M. e. a., J. Org. Chem., 1968, v. 33, p. 1715.
Brown H. С Hydroboration. New York, Benjamin, 1962 290 p.
Filby W. G., Gunther K., J. Labolled Сотр., 1973, v. 9, Xs 2, p. 321—324.
Физер, т. 1, с. 262; OP, т. 13, с. 7.
ПО. БРАУН (BRAUN)
Расщепление С—N-связи в алифатических аминах взаимодействием их с
бензоилхлоридом и реакцией получающихся при этом бензамидов с пятихлорн-
стым или пятибромистым фосфором с образованием алкилгалогенидов:
РХ6; 100—150 'С
RR'NH + С,Н6СОС1 > RR'N-COC6H6 *¦
>¦ RR'N—СХ2—C,HS » RX + R'X + CeH6CN
R = Alk; R' = H,Alk; X = Cl, Br
В реакцию вступают первичные и вторичные, в том числе и циклические,
амины, например:
' \
Br(CH2NBr
Превращение не сопровождается изомеризацией алкильного радикала.
В случае оптически активных соединений реакция протекает с сохранением кон-
конфигурации.
См. также Гофман (№ 208).
Braun I. von, Вег., 1904, Bd. 37, S. 2678, 2812, 3210, 3583.
Vaughan W. R., Carlson R. D., J. Am. Chem. Soc., 1962, v. 84, p. 769.
Blum J., Fischer A., «Tetrahedron Letters», 1970, p. 1963.
Левкоева Е. И., Яхонтов Л. Н., Усп. хим., 1972, т. 41, с. 1337.
Phillips В. А. е. a., «Tetrahedron», 1973, № 20, р. 3309—3327.
Houben-Weyl, v. 5/4, p. 451; v. 5/3, p. 921.
111. БРАУН (BRAUN)
Расщепление третичных аминов бромистым цианом с образованием циан-
цианамидов н алкилбромидов:
R2NR' + BrCN
R2N—CN Br
R'
(инертн. растворитель)
RR'N—CN + RBr
_ нагревание
. R2N-CN + R'Br
Соотношение продуктов определяется прочностью связей радикалов R и R'
с азотом. Отщепляется, как правило, радикал с наиболее короткой углеродной
цепью. Прочность С—N-связи увеличивается в ряду:
СН3СН=СНСН2 < СвН6СН2 < СН3 < С2Н6 < н-С3Н, <
< С4Н9 < С6НЬ
При наличии у атома азота двух фенильных групп реакция не идет. В слу-
случае N-бензилпнрролидина н N-бензилпиперидина реакция проходит с сохране-
сохранением цикла, тогда как остальные N-алкилзамещенные циклические амины рас-
расщепляются с раскрытием цикла.
Реакцию используют при установлении строения алкалоидов.
См. также Полоновскнй (№ 468).
Braun I. von, Вег., 1900, Bd. 33, S. 1438; 1907, Bd. 40, S. 3914; 1911, Bd. 44,
S. 1252.
Houben-Weyl, v. 5/4, p. 151; v. 8, p. 118, 124, 174.
СОП, т. 4, с 308; OP, т. 7, с. 260.
112. БРАУН —УОКЕР (BROWN А. С. — WALKER)
Анодная конденсация щелочных солей моноэфиров дикарбоновых кислот
с образованием эфиров высших дикарбоновых кислот* :
2ROOC(CH2)nCH2COO-
[2ROOC(CH2)nCH2COO-
¦ > 2ROOC(CH2)nCH2] *¦ ROOC(CH2)nCH2-CH,(CH2)nCOOR
R = Alk; n = 0—15
* H2O, водн. C2H6OH
Выходы эфиров наиболее высоки E0—70%) при п = 3—6. Заместители
в а-положении затрудняют реакцию. Наличие С = С-связей, не сопряженных с
СО-группой, не препятствует процессу. Выходы продуктов зависят от плотности
тока, рН раствора, температуры и наличия посторонних ионов.
*Называют также реакцией Крума Брауна — Уокера.
79
Электролиз в присутствии бутадиена-1,3 приводит к эфнрам высших непре-
непредельных кислот:
2СН3ООС(СН,LСОСГ + СН2=СНСН=СН2 *¦
>¦ СН3ООС(СН2NСН=СН(СН2NСООСН,
Продукты реакции Брауна — Уокера являются важными исходными веще-
веществами в производстве полимеров, смазочных масел, душистых веществ.
См. также Кольбе (№ 313), Хофер — Мест (№ 672), Франшимон (№ 625).
Brown А. С, Walker L, Ann., 1891, Bd. 261, S. 107; 1893, Bd. 274, S. 41.
Weedon В. С L., Quart. Rev. (London), 1952, v. 6, p. 380.
Томилов А. П. и др. Электрохимия органических соединений. М.-Л., «Химия»,
1968, с. 415.
СОП, т. 3, с. 508.
113. БРЕКПОТ (BRECKPOT)
Циклизация эфнров Р-аминокислот в замещенные (J-лактамы под действием
реактивов Гриньяра:
RNH-CHR'—CHR"—СООСаН5
или CH3MgBr
RN-CHR'-CHR"—СООС2Н6"| *¦ RN-CHR'
MgBr J OC-CHR'
R, R', R" = H, Alk, QH5, CH2CBH6 н др.
Выходы снижаются по мере уменьшения числа заместителей в исходных
эфирах. Метод особенно удобен для получения E-лактамов, содержащих только
алифатические заместители.
Breckpot R., Bull. Soc. chim. Belg., 1923, v. 32, p. 412.
OP, т. 9, с 508.
. 114. БРУКНЕР (BRUCKNER)
Синтез 3-метнлнзохинолннов из 1-арнлпропенов через стадии получения
1-арнл-1-интрозо-2-ннтропропанов, превращения нх в ацетокснннтропронзводные,
электролитического восстановления последних в 1-арнл-1-оксн-2-ацетнламинопро-
паны, деацетнлнровання, ацилнрования образовавшихся 1-арил-1-оксн-2-амнно-
пропанов и последующей циклизации по Пикте — Гамсу:
R
R'
R
R'
R
R'
СН=СНСН3
NaNO2 + HjSO4; N2O3
эфир~вода
¦СН—СНСН3 (СН3СОJО +
NO NO2
СН3
СН— CHNO2 электролитическое
¦у | восстановление
У ОСОСНз "
; 0 'С
80
GH, "
i—CHNH,
OCOCH3
R
NaHC3O3
R
R'
CH—CHCH,
0H NH2
СН—СНСН,
ОН NHCOCH,
R'
•f-CHGH3 Poga; ,„¦
OH NHCOR" (сна,)
R"COQ1; ~0°C
(C5H5N)
R, R' =H, OH, OCH,, OC2H6, OCHaCeHs; R* = CH3, CH2CeHS( Ar
Вводя в реакцию 1-арнлциклоалкены, получают замещенные фенантрнднны,
например:
R = Н, СН„ ОСН3; R' = СН„ CeHs
Аналогичные превращения описаны для соответствующих производных цнк-
лопентена и цнклогептена.
См. также Пнкте— Гаме (№ 454).
Bruckner V., Kramli A., J. prakt. Chem., 1936, Bd. 145, S. 291.
Bruckner V. e. a., J. Chem. Soc, 1948, p. 885.
Govindachari T. R. e. a., J. Chem. Soc, 1956, p. 4280.
Эльдерфильд, т. 4, с. 278.
115. БРУННЕР (BRUNNER)
Циклизация М-ацил-№-арнлгндразннов в окенндолы прн нагревании в при-
присутствии оснований:
?» 180—250 °С
I [СаО]'; (нафтышн)
•N-NHCOCHR"
R' HO R'
R" R'"
C—CONH2
6—684
81
R" R"'
R = H, Alk, OAlk; R' = H, CH3;
=0
NR'
C0-75%)
R", R" = H, Alk, C,H,
• NaNHa, CaH2, C2H6ONa, Na; ** хннолин, без растворителя
Предполагаемый механизм реакции аналогичен механизму циклизации арнл-
гндразонов в нндолы (см. Фншер, № 611). При R'=H выходы окснндолов вы-
выше, чем прн R'=CH3.
Реакцию обычно используют для получения 3-замещенных окснндолов.
См. также Байер (№ 33), Хннсберг (№ 664), Штолле (№ 728).
Вгиппег К., Monatsh., 1896, Bd. 17, S. 267; 1932, Bd. 61, S. 15.
Sundberg R. J. The Chemistry of Indoles. London — New York, Acad. press,
1970, p. 362.
Жунгиету Г. И. Окснндол и его производные. Кишинев, «Штиннда»,
1973, с. 62.
Эльдерфильд, т. 3, с. 104.
116. БРЭДШЕР (BRADSHER)
Цнклодегндратация днарнлкетонов, содержащих арнлметнленовую группу
в орто-положеннн к карбоннлу, в присутствии кислых катализаторов с образова-
образованием конденсированных ароматнческнх снстем:
E0-90%)
А12О3, H2SO4
Реакция облегчается, когда R — электронодонорный заместитель.
82
В аналогичную реакцию вступают жирноароматнческие кетоны и альдеги-
альдегиды, например:
ОНС—СНСН3 7 3
/~\_/~\ нагревание ^
/ \ / [НВг + СН3СООН] \ / \
(93%)
СН, /ОН
/ нагреваиае
/СН
сосн,
[НВг + СНзСООН]
Метод позволяет также получать конденсированные полнцнклнческие систе-
системы, содержащие гетероцнклы:
Преимущества метода по сравнению с реакциями Эльбса (№ 736) и Пшор-
ра (№ 483) — отсутствие молекулярных перегруппировок н высокие выходы.
Bradsher С. К., J. Am. Chem. Soc, 1940, v. 62, p. 486; Chem. Rev., 1946, v. 38,
p. 447.
Saraf С D., Vingiello F. A., Synthesis, 1970, p. 655.
Ahmed M. e. a., J. Chem. Soc, Ser. D, 1970, p. 1094.
Ahmed M. e. a., J. Chem. Soc, Perkin Trans. 1, 1973, № 10, p. 1099—1103.
Ashby J., Ayad M., Meth-Cohr O., J. Chem. Soc, Perkin Trans. 1, 1973, № 10,
p 1104—1107.
117. БУВО (BOUVEAULT)
Получение альдегидов из дизамещенных формамндов и реактивов Гриньяра:
R = Alk, Ar;
HCONR'R" + RMgBr *¦ RCHO
(эфир)
D0-80%)
NR'R" = NAlk2> N(CeH6J> NAlkCeH6, пнперидил
Незамещенные формамиды не вступают в реакцию. Побочные процессы: об-
образование третичных аминов и углеводородов (особенно при использовании
дналкилформамидов). Количество побочных продуктов уменьшается по мере
увеличения цепи R' и R".
83
См. также Бодру — Чичибабин (№ 95).
Bouveault L, С. г., 1903, v. 137, р. 987; Bull. Soc. chim. France, 1904, v. 31,
p. 1306, 1322.
Smith L. I. e. a., J. Org. Chem., 1941, v. 6, p. 437.
Методы элементоорганической химии. Магний, бериллий, кальций, стронций,
барий Под ред. А. Н. Несмеянова и К- А. Кочешкова. М., Изд. АН СССР,
1963, с. 286.
118. БУВО (BOUVEAULT)
Гидролиз амидов в карбоновые кислоты под действием азотистой кислоты:
^/f NaNO2; ~ О °С
"\NH (конц. H2SO4)
XN=NOH
60—80 CC
>-
Реакция позволяет с хорошими выходами переводить в кислоты разнооб-
разнообразные амиды и особенно удобна в случае пространственно затрудненных труд-
трудно гидролизующихся амидов. Ограничением метода является иитрозирующее
действие азотистой кислоты.
См. также Циглер (№ 686).
Bouveault L, Bull. Soc. chim. France, 1893, v. 9, p. 368; Ber., 1893, Bd. 26,
S. R773.
Kezdy F. J., Jaz I., Bruylants A., Bull. Soc. chim. Belg., 1958, v. 67, p. 687.
Houben-Weyl, v. 8, p. 432.
119. БУВО—БЛАН (BOUVEAULT—BLANC)
Восстановление эфиров алифатических карбоновых кислот до первичных
спиртов действием металлического натрия в этиловом (или бутиловом) спирте:
Na; нагревание
RCOOR' , , ?, RCH2OH
(абс. С2Н6ОН)
C0-80%)
Эфиры ароматических кислот восстанавливаются с низкими выходами. Зна-
Значительно лучшие результаты получают, действуя на эфиры натрием в спир-
спиртовом растворе фенола при 160—190 °С с оптимальным соотношением
ArCOOR': С6Н5ОН : Na = 1 : 6 : 8.
Свизь С = С, не сопряженная с COOR'-группой, обычно не затрагивается.
В отсутствие спирта образуются симметричные ацилоины:
Na; нагревание Na
RCOOR' »- RCO—COR *¦ RCO—CH(OH)R
Модификация Хэисли (Hansley) — использование эквимольных количеств
вторичного спирта и натрия в инертном растворителе, что позволяет восстанав-
восстанавливать RCOOR' с выходами 80—95%. Метод особенно удобен для получения
ненасыщенных спиртов из ненасыщенных эфиров.
См. также Буво — Локкен (№ 120).
Bouveault L, Blanc G., С. г., 1903, v. 136, p. 1676; Bull. soe. chim. France, 1906,
v. 35, p. 629. .
Hansley V. L, Ind. Eng. Chem., 1947, v. 39, p. 55.
84
Enz W., Helv. chim. Acta, 1961,. v. 44, p. 206.
Дзиркал В. Труды Научно-исследовательского института химических реак-
реактивов и особо чистых химических веществ. Вып. 17. М., ИРЕА, 1939, с 21.
СОП, т. 4, с. 406; Фьюзон, с. 487.
120. БУВО —ЛОККЕН (BOUVEAULT —LOCQUIN)
Восстановление эфиров алифатических карбоновых кислот в а-оксикетоиы
(ацилоины) под действием металлического натрия в инертном растворителе
(ацилоиновая конденсация):
2RCOOR'
R'O OR'
RC-CR
ONa
NaO
RC—CR
I! II
О О
Na; нагревание
*•
(ннертн. растворитель)
2Na
RC=CR
I I
NaO ONa
H2O
RC-CHR
II I
о он
B0-80%)
R = Alk, С(СНзK; R' = CH3, C2H6
В реакцию вступают также эфиры ненасыщенных карбоновых кислот. Эфи-
Эфиры дикарбоновых кислот образуют циклические ацилоины (см. Хэисли — Пре-
лог — Штолль, № 680). Побочный процесс — образование а-дикетоиов.
См. также Кляйзен (№ 301), Буво — Блан (№ 119).
Bouveault L, Locquin R., С. г., 1905, v. 140, p. 1593.
Lynn J. W., English J., J. Am. Chem. Soc, 1951, v. 73, p. 4284.
СОП, т. 2, с 140; OP, т. 4, с. 215.
121. БУВО —ЛОККЕН (BOUVEAULT—LOCQUIN)
Превращение а-изоиитрозоэфиров в а-кетоэфиры под действием иитрозил-
серной кислоты:
ONOSO3Hy
R—С—COOC2HS >¦ f R—С— СООС2Н6] » R—С—COOC2HS
NOH
|_O~-N—NO
R = «зо-СзН7, циклогексил
О
Исходные изонитрозоэфиры получают из эфиров алкилацетоуксусной или
алкилмалоновой кислоты действием алкилнитрита в растворе этилата натрия.
а-Изонитрозоэфиры легко расщепляются также под действием избытка
формальдегида в спиртовом растворе НС1. В этом случае выходы а-кетоэфиров
составляют 30—80%-
Bouveault L, Locquin R., С. г., 1902, v. 135, p. 179.
Hall N., Hynes I. E., Lapworth A., J. Chem. Soc, 1915, v. 107, p. 132.
Fischer R., Wieland Th., Chem. Ber., 1960, Bd. 93, S. 1387.
122. БУГО (BOUGAULT)
Конденсация эфиров р-арилпропиоиовой кислоты с диэтилоксалатом и по-
последующая циклизация образовавшихся а-кетоэфиров под действием концентри-
концентрированной серной кислоты:
CHjCHjCOOCjHj COOC,Hj
СООС,Н,
R
R'
о
I
.C
COOC,H,
R'
R"
\r rnnr н кввц' HjSO4
\C-COOC4H5 %
HO
_СООС,Н5
COOC,H,
R, R'( R" = H, OCH,
* Полифосфорная кислота
Реакция может быть использована также для синтеза шести- и семичленных
циклов, например:
СН3О
сн3.
СН3О
СН,0
(СН2K-СНСООС,Н6
сосоос,н,
0< >О
о
Bougault L, С. г., 1915, v. 159, р. 745.
Auwers К., Moller К., J. prakt. Chem., 1925, Bd. 109, S. 124.
Fieser L. ?., Hershberg E. В., J. Am. Chem. Soc, 1935, v. 57, p. 1508, 1851.
Horning E. C, Koo J., J. Am. Chem. Soc, 1951, v. 73, p. 5826.
123. БУРД (BOORD)
Получение олефинов из альдегидов через стадии превращения их в а-хлор-
алкилэтиловые эфиры, бромирования, замещения одного атома брома на ал-
кильный радикал и последующего элиминирования брома и этоксигруппы под
действием цинковой пыли:
HCI; CjHbOH; -5 "С Brj; 0 "С R'MffBr
RCH,—СНО •- RCH2-CHC1 >¦ RCH—СНВг ——*-
| || (»Фир)
|
О
RCH-CHR'
I I
Вг
Zn-пыль; магревание
(С4Н9ОН); [ZnCIj]
6с,н»
R = Н, Alk; R' = Alk
|
Вг
RCH=CHR'
Вместо альдегидов могут быть использованы алкилвиииловые эфиры, что
позволяет сократить число стадий и повысить выход олефинов:
Br2 R'MgX Zn-пыль
RCH,=CHOR" >¦ RCH-CHOR" >- RCH—CHOR" »¦ RCH=CHR'
Вг Вг
Br
R" = Alk
Образование олефинов путем элиминирования брома и этоксигруппы дает
возможность получать соединения без примеси изомеров в отличие от способов,
включающих дегалогенирование. Метод позволяет получать также тризамещеи-
ные олефины, если на последней стадии цинковую пыль заменить едким кали,
вызывающим элиминирование НВг, а затем снова провести бромирование и все
указанные выше стадии:
КОН Вг2 /R'
RCH—CH
ОС2Н5
RCH=CR'
OC,H6
RCH—CR'R
Вг О
Zn-пыль
>-
RCH—С
Br OC,HS
RCH=CR'R"
R'MgBr
Swollen L. С, Board С. Е., J. Am. Chem. Soc, 1930, v. 52, p. 651; 1931, v. 53,
p. 1501; 1933, v. 55, p. 3293.
Boord С E., J. Org. Chem., 1952, v. 17, p. 807.
Sundler S. R., Kara W. Organic functional group preparations. New York —
London, Acad. press, 1968, p. 44.
124. БУТЛЕРОВ
Получение Сахаров из формальдегида под действием щелочей:
СН2О
СН2О + СН,0
Са(ОН)»; -20 °С
(HjO)
¦¦ сн,он-сно
с,н10о5
* Гидроокиси щелочноземельных металлов, свинца, олова
В результате реакции получается смесь Сахаров («формоза»). Процесс иро-
исходит ступенчато и является автокаталитическим. Реакция инициируется до-
добавкой гликолевого альдегида или диоксиацетона, а также УФ-светом.
См. также Исбелл — Шаффер (№ 277), Толлеис (№ 573).
8?
Butlerow A., Ann., 1861, Bd. 120, S. 295.
Langenbeck W. e. a., J. prakt. Chem., 1956, Bd. 3, S. 196.
Уокер Д. Ф. Формальдегид. Пер. с англ. М., Гоехнмиздат, 1957, с. 188.
125. БУТЛЕРОВ
Получение третичных спиртов действием диалкилцинка иа хлор ангидриды
алифатических кислот в атмосфере двуокиси углерода:
о-с «22п
RCOCl + 2R^Zn » [RR'C(Cl)OZnR' >- RR^COZnR'] v RRiCOH
R = Alk; R'=CH,,C2H6
Реакция протекает гладко только с диметил- н диэтилцииком. При увели-
увеличении радикалов R и R' основной реакцией становится образование вторичных
спиртов.
При введении, в реакцию хлорангидридов галогензамещенных карбоновых
кислот не удается получить соответствующие третичные спирты, так как проис-
происходит замещение галогена алкильным остатком.
См. также Вагиер (№ 138), Зайцев (№ 259).
Бутлеров А. М. Избранные работы. М.-Л., Изд. АН СССР, 1951, с. 119, 163,
208, 627.
Методы элементоорганической химии. Цинк, кадмий. Под ред. А. Н. Не-
Несмеянова и К. А. Кочешкова. М., «Наука», 1964, с. 57.
126. БУТЛЕРОВ —ЛЬВОВ
Получение тетраалкнлметанов из триалкнлгалогенметанов н диалкилцннка:
1. —ю— +з°с
2. разб. НО*
R/~"Y 1 п'7« %-¦ о /™"Т)'
3\-.Л -р I\2^I1 I\qVj1^
(инерт. растворитель)**
C0-60%)
X = С1, Вг, 1; R' = С,Н6> СНз
* H2SO4; ** CHjCOOCHs
В реакцию вступают галогенпроизводные алифатического и алицнклического
рядов; выходы уменьшаются в ряду С1 > Вг > I.
Аналогично алкилируются н некоторые другие хлорпроиззодиые, например:
СН2С1-ОСН3 + (C2H5)sZn » С2Н5СН2-ОСН3
(колич.)
Побочная реакция — образование непредельных углеводородов.
Использование высших диалкнлцннков не дает хороших результатов вслед-
вследствие протекания побочной реакции:
R2Zn + R3CX v RZnX + RH + RJCH
В этом случае успешно используют смесь ноднстого этнла с цинком и RBr,
в результате чего получают смесь тетраалкилметанов, например:
(СНзKСС1 + С4Н9Вг + С2Н51
Zn
(СНзKС-С2Н5 + (СН,KС-С4Н,
Львов М. Д., ЖРФХО, 1870, т. 2, с. 176.
Либерман А. Л. и др., ДАН СССР, 1943, т. 40, с. 79.
88
Левина Р. Я-, Шушерина Н. П., Уси. хнмни, 1955, т. 24, с. 181.
Методы элементоорганической хнмин. Цннк, кадмий. Под ред. А. Н. Не-
Несмеянова и К- А. Кочешкова. М., «Наука», 1964, с. 48.
127. БУТЛЕРОВ —ЭЛЬТЕКОВ
Присоединение алкнлгалогенндов к олефинам в присутствии окисей или хло-
хлоридов тяжелых металлов:
<о°с
[ZnCI2]*
V=C
I +/1 х- i I
R-C-C ,-R-C— C-X
I \ II
C0-60%)
X = Cl, Br, I .
* ZnO, MgO, PbO, A1C13, FeCl3, HgCl2 и др.
В реакцию вступают алкилгалогениды с числом углеродных атомов больше
двух, галогенциклоалканы, галогенолефины, а-галогенэфиры, эфиры а-галоген-
кнслот, алкилполигалогениды. В качестве олефиновой компоненты используют
также диены и галоген- и полнгалогенолефины :
СС14 + CF2=CF2
СС12=СС1СС1Л + СНС1=СНС1
CC13-CF2-CF2C1
[AlClg]
(88%)
СС12=СС1СС12СНС1СНС12
(85%)
Побочные процессы: днспропорцноиирование исходного RX, изомеризация
конечных продуктов, отщепление НХ от исходных и конечных соединений н др.
Хлор- н нодметаны присоединяются к олефинам лишь при высокой темпе-
температуре, но затем происходит отщепление НХ с образованием смеси олефинов**:
(СН3JС=СНСН3 + СН3С1
(СНзJСС1-СН(СН3J -
220 °С
[РЬО или СаО]
(СН,JС=С(СНзJ + СН2=С(СН3)СН(СНзJ
Модификации Караша (Kharasch) — присоединение полигалогеналканов к
олефинам под действием перекисей (цепная реакция с участием свободных ради-
радикалов):
СС14 + RCH=CH2
RCHC1-CH2-CC13
[R'COOOOCR']
Присоединение RCOC1 к олефинам см. Кондаков (№ 317).
Эльтеков А., ЖРФХО, 1878, т. 10, с. 86.
Бутлеров А., ЖРФХО, 1878, т. 10, с. 90.
Prins Н. !., J. prakt. Chem., 1914, Bd. 89, S. 414.
Kharasch M. S. e. a., J. Am. Chem. Soc, 1945, v. 67, p. 1626.
РИМИОС, т. 2, с 7.
¦Присоединение СНХ3 нлн СХ4 (X=C1, F) к полнгалогенолефинам в
присутствии А1С13 называют также реакцией Принса (Priris).
**Эту реакцию называют «метилированием олефинов по Эльтекову».
128. БУХЕРЕР (BUCHERER)
Получение бензкарбазолов нагреванием нафтолов и фенилгидразина с би-
бисульфитом натрия:
CeH5NHNHe
NH2 H2N
SO3Na
Исходя из соответствующих нафтиламинов (см. Бухерер, К* 129), можно
получить те же бензкарбазолы. Производные (З-ряда образуют сразу соединения
типа II, которые при гидролизе дают 3,4-бензкарбазолы. Производные а-ряда
первоначально образуют соединения типа I, которые под действием минеральных
кислот превращаются в соответствующие соединения типа II и затем в 1,2-бенз-
карбазолы.
Аналогично фенилгидразииу реагируют я-толил-, а- и E-иафтил-, а также
N.N-дизамещенные гидразины, например:
NaHSOs
J
I
SOsNa
jl HO3S'
R = СНз, C2Hj, C4H1
См. также Борше — Дрексель (№ 102), Гребе — Ульмаи (№ 216).
Bucherer И. Т., Seyde F., J. prakt. Chem., 1908, Bd. 77, S. 403.
Rieche A., Seeboth H., Ann., 1960, Bd. 638, S. 81.
Seeboth H., Becker В., Ann. Chem., 1966, Bd. 693, S. 201.
OP, т. 1, с 144.
90
129. БУХЕРЕР (BUCHERER)
Обратимый обмен гидроксила и аминогруппы в ряду производных нафтали-
нафталина под действием водных растворов бисульфитов*;
О
NaHSOJ; NH3; 130-160 °С
- R
NH
SO3NH«
NH2
SO3NH«
NaHSO3
,4.
Выходы близки к количественным. Характер и положение заместителя R
мало влияют на ход реакции, а- и р-Нафтолы, имеющие SOSH- или СООН-груи-
пы в орто- или лега-положениях, в реакцию не вступают. Очень высокой реак-
реакционной способностью обладает оксигруппа в а-нафтол-4-сульфокислотах. В ря-
ряду производных бензола в реакцию вступают лишь резорцин и его гомологи.
В хинолинах и изохинолинах обмениваются лишь группы, находящиеся в бен-
бензольном кольце.
Аналогичным путем, но в более жестких условиях можно заместить гидр-
оксил иа AlkNH- или Alk2N-rpynnbi.
Реакция широко применяется в синтезе промежуточных продуктов и краси-
красителей.
Lepetit R., Bull. Soc. ind. Mulhouse, 1903, v. 73, p. 326.
Bucherer H. Т., J. prakt. Chem., 1904, Bd. [2]69, S. 49.
Rieche A., Seeboth H., Angew. Chem., 1958, Bd. 70, S. 52, 312; Ann., I960,
Bd. 638, S. 101; Ann., 1964, Bd. 671, S. 77.
Allan Z., Podstata J., Vrda Z., «Tetrahedron Letters», 1969, p. 4855.
Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей.
М., Госхимиздат, 1955, с. 405.
ОР, т. 1, с. 134.
130. БУХЕРЕР—БЕРГС (BUCHERER — BERGS)
Получение гидантоинов последовательным взаимодействием альдегидов или
кетонов с синильной кислотой и карбонатом аммония:
\ нагревание
, =0 + HCN ТТГ^Г
/ (води. СгН6ОН)
;c-cn
|
NH-COOH
C-CN
СО2
• CH3CONH2
¦Называют также реакцией Бухерера — Лепти (Lepetit).
91
Кетоиы реагируют очень легко и гладко, альдегиды — несколько труднее.
Вместо альдегидов удобно использовать их бисульфитиые производные. HCN
часто заменяют KCN или NaCN.
Гидантоины могут быть использованы для идентификации карбонильных
соединений, для получения веществ, обладающих антикоивульсивным действием,
а также для синтеза а-аминокислот (с лучшими выходами, чем при получении
их гидролизом циаигидринов).
2,4-Дитиогидаитоины могут быть получены обработкой кетонов NH4CN
и CSu илн реакцией аминонитрнлов с CS2.
См. также Урех (№ 589), Байер (№ 32).
Bergs H., нем. пат. 566094 A929); С. А., 1933, v. 27, № 1001.
Bucherer Н. Т. е. a., J. prakt. Chem., 1934, Bd. 140, S. 69, 129, 151, 291.
Ware E., Chem. Rev., 1950, y. 46, p. 422.
Shirai Tadashi, Takei Yukio, Оки госей кагаку кёкайси, 1971, v. 29, № 12,
p. 1135.
Maki Yoshifumi, Masugi Takasi, Chem. Pharm. Bull., 1973, v. 21, p. 685—691.
131. БЭДДЛИ (BADDELEY)
Изомеризация 2,5-диалкилацетофенонов в 3,5- н 3,4-диалкилацетофеноны
в присутствии хлористого алюминия:
сосн,
R = СН3, С2Н6; R' = Н, СН3, С,Н5
Реакция в основном приводит к образованию соединения I. Общий выход
изомеров ~70%. При R'=H получаются 4-алкилацетофеноны с выходами
~85%. Аналогично изомеризуются и другие жирноаооматические кетоны.
Baddeley G., J. Chem. Soc, 1944, p. 232.
Pearson D. E., Bruton J. D., J. Org. Chem., 1954, v. 19, p. 957.
132. БЭЛЛИ — ШОЛЛЬ (BALLY — SCHOLL)
Получение бензантронов циклокоиденсацией антронов с а,|3-непредельиыми
альдегидами ной нагревании с серной кислотой*:
ч
R + R'CH=C-CHO
H2SOi; 80-100 "С
¦Называют также реакцией Бэллм.
92
о о
R = Н, СН„ ОН; R' = Н, СН„ CeH6; R" = Н, СН3, С2Н6, СвН6
Аналогично реагируют глицерин и его р-алкил(арил)-а,у-диэтиловые эфиры,
которые под действием H2SO4 превращаются в а,р-непредельные альдегиды.
Антроны получают восстановлением антрахинонов действием железа
в H2SO4.
Метод применяется для промышленного получения беизантрона действием
H2SO4 и порошка железа на смесь аитрахиноиа и глицерина (в одну стадию).
См. также Скрауп (№ 543).
Bally О., Вег., 1905, Bd. 38, S. 194.
Bally О., Scholl R., Вег., 1911, Bd. 44, S. 1656.
Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей.
М., Госхимиздат, 1955, с. 724.
Rodd, v. 3, р. 1496; СОП, т. 2, с. 81.
133. БЭМФОРД—СТИВЕНС (BAMFORD — STEVENS)
Разложение тозилгидразонов алифатических кетонов под действием основа-
оснований с образованием диазоалканов или олефинов:
:=N—'NSO2CeH4CH3-rc
NC—C—N= NSO2CeH4CH,-n]
/I I
R
NC-C=N=N
* CH,ONa, NaH, NaNH,; ** (СН,ОН)„ C,H,N
93
При R = H всегда получаются олефины, в остальных случаях — диазоалка-
иы, например:
C,H6CH2-C(CH,)=N-NHTs >¦ С,Н6СН=СНСН3
(80%)
„NNHTs
-СН2С,Н6
NCOCH,
-СН2С,Н6 + (
NCOCH,
NCOCH,
ArC=N-NHTs » ArC=N=N
R = H, Alk
R
C0-60%)
C=NNHTs
Тозилгндразоны а,C-непредельных альдегидов в этих условиях дают цикло
пропены:
(CH3JC=C(CH3)CH=NNHTs » (СН3JС С-СН,
СН
Из тозилгндразонов циклических а-днкетонов получают соответствующие
ацетиленовые углеводороды:
(CH3)n-C=NNHTs NaOH (СН2)„-С
СН2 C=NNHTs Сода. сн3он) ^ 1
D0-55%)
л = 5, 9, 12
На основе реакции Бэмфорда — Стнвенса разработан метод синтеза оле-
финов действием алкиллития в эфире нли гексане на тозилгндразоны, имеющие
ot-метильную илн а-метиленовую группы, например:
н,с сн,
Н8С.
См. также Коуп (№ 330).
Bamford W. R., Stevens T. S., J. Chem. Soc, 1952, p. 4735.
Far пит D. G., J. Org. Chem., 1963, v. 28, p. 870.
Nickon A., Werstink N. H., J. Am. Chem.Soc, 1966, v. 88, p. 4543.
Ege G., Jooss G., Chem. Ber., 1973, Bd. 106, № 5, S. 1678—1687.
Chapleo Ch. В., Dreiding A. S., Helv. chim. acta, 1974, v. 53, № 3, p. 873—887;
№ 5, p. 1259—1265.
Физер, т. З, с. 357; т. 5, с. 423.
94
134. БЭРРИ (BARRY)
Избирательное расщепление олиго- илн полисахаридов
периодатом н последующим действием феннлгндразнна:
путем окисления
СН2ОН
Jо го
но
NaIO4
ОНС'
СН2ОН
ОНС
он
,CH=NNHC6H5
C=NNHC6H5
+ С—NNHC6H5
СН2ОН
C6HSNHNH2
(СН3СООН)
В результате окисления периодатом образуются полиальдегиды, дающие
с фенилгидразином феннлгидразоны. Феннлгидразин расщепляет не только аце-
тальные связи, но затрагивает н часть гликозидных. Сохраняются лишь такие
глнкозидные связи, наличие которых не препятствует образованию озазонов из
окисленных участков молекулы.
Недостатки метода обусловлены тем, что реакция полиальдегнда с
PhNHNHj не является количественной; кроме того, смесь озазонов очень трудно
разделима.
Реакцию используют при изучении строения олиго- и полисахаридов.
См. также Малапрейд (№ 382), Смит (№ 547), Фишер (№ 606).
Ватту V. С, Nature, 1943, v. 152, p. 537.
Barry К. С, Mitchell P. W. D., J. Chem. Soc, 1954, p. 4020.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 451, 502.
135. БЮХНЕР (BUCHNER)
Присоединение алифатических дназосоединеннй к олефииам (или ацетиле-
ацетиленам) с образованием замещенных пиразолинов (или пиразолов) с последующим
превращением в производные циклопропана:
/ \
+ RCH=N=N
RH
C N
N
\
С С нагревание \ /
'\ i\ •- ;с—с(
RC NH / \ / \
Л/ CHR
95
Аиалогично реагируют а,р-иепредельние кетоиы, эфиры непредельных кис-
кислот, арилзамещениые олефины, например:
с-соосн3
ИГ +
С—COOCHj
+N=N
N С—СООСН3
N— С-СООСН3
(келнч.)
Аналогично олефииам реагирует беизол:
нагревание
>1,CHCOOR
-COOR
нагревание
[Cu2Br2]
CHjCOOR
-COOR
В случае а,|3-непредельиых кетонов или эфиров R''CH-группа присоединяет-
присоединяется к Р-углеродному атому. Сопряженные диены присоединяют диазосоединения
в положение 1,2.
См. также Пехман (№ 452), Пфау — Платнер (№ 480), Кижнер (№ 290).
Buchner Е., Curtius Th., Вег., 1885, Bd. 18, S. 2377.
Huisgen R., Angew. Chem., 1963, Bd. 75, S. 614.
Мййет E. e. a., Ann., 1964, Bd. 675, S. 63.
Эйстерт Б. В кн.: Новые методы препаративной органической химии. Пер.
с англ. Под ред. А. Н. Курсанова. М., Издатинлит, 1950, с. 91.
OR, v. 18, р. 217.
136. БЮХНЕР—КУРЦИУС —ШЛОТТЕРБЕК
(BUCHNER — CURTIUS — SCHLOTTERBECK)
Метилеиироваиие альдегидов диазометаном с образованием метилкетонов,
а-окисей и альдегидов, содержащих на одну СНг-группу больше, чем исходный
альдегид:
RCHO + CH,N2
Г О"
I +
Lrchch2n=n —>-
(ииертн. растворитель)•
О~ 1 ,-- RCOCHj
I +
RCHCH,
r_HC СН,
RCH,CHO
Вода, спирты, формамид
96
В реакцию вступают алифатические, ароматические и гетероциклические
альдегиды. Направление реакции зависит от характера R, часто образуется
смесь всех трех продуктов. Образованию а-окисей способствует наличие элек-
троноакцепторных заместителей. Действие последних заметно ослабляется мети-
леновой группой, стоящей рядом с альдегидной, что приводит к образованию
кетонов:
ecu—сно —>- са,-нс—сн2
V
0-O2NQH4CHO
o-O2NQH4-HC СН2 + o-O2NC6H4COCH3
o-O2NC6H4CHXHO
О
F5%) A6%)
>- o-O2NC6H4CH2COCH3
В присутствии электронодонорных заместителей образуются метилкетоны
пли альдегиды; направление реакции существенно зависит от условий ее про-
проведения, например:
О
О
О
•сно
фир)
(эфир + СН3ОН)
•сосн,
:н,сно
Аналогично альдегидам реагируют кетоны, в основном с образованием
а-окисей. В случае алициклических кетонов основной реакцией является расши-
расширение кольца, например:
п
.СН,
F3%) A5%)
Диазоалканы и диазоуксусный эфир реагируют подобно диазометану:
CH3CHN2 >- С6Н6СОС2Н6
(94%)
:—СНО + CH3CHN2
о'
С6Н6СНО + NaCHCOOC,H5
о
(колпч )
С6Н6СОСН2СООС2Н6
В случае а,|3-непредельных альдегидов и кетонов происходит присоедине-
присоединение диазометана к С = С-связи с образованием пиразолинов (см. Бюхнер,
№ 135), а а-дикарбонильные соединения превращаются в циклические простые
диэфнры:
О
х/ \ л'
-С-С- + R'R"CN2
О О
О
•R"
7-684
Buchner ?., Curtius Т., Вег., 1885, Bd. 18, S. 2373.
Schlotterbeck F., Ber., 1907, Bd. 40, S. 479; 1909, Bd. 42, S. 2559.
Eistert В., Langbein A., Ann., 1964, Bd. 678, S. 78.
OP, т. 8, с 469, 474.
137. ВАГНЕР Е. Е.
Окисление олефинов в ч«с-а-гликоли действием перманганата калия в ще-
щелочной среде (гндроксилирование):
КМпО4; 5 °С
(водн. р-р NaOH или NajCOe)
но он
Реакцию часто проводят в водных органических растворителях (ацетоне,
этаноле, метилциклогексане). Гндроксилированию подвергаются разнообразные
этиленовые соединения, в том числе циклоолефины, сахара, терпены, стероиды,
например:
V
СН3
—СНо
сн3
он
но
СН3
D5%)
Ненасыщенные альдегиды окисляют преимущественно в виде ацеталей:
СН2=СНСН(ОС2Н5J v СН2(ОН)СН(ОН)СН(ОС2Н6J
F7%)
Прн окислении дненов с изолированными двойными связями образуются
дигликолн.
Метод широко применяется при изучении строения различных соединении,
а также для качественного определения непредельных кислот.
См. также Вудвард (№ 179), Криге (№ 339), Майлас (№ 377), Хилдич
(№ 661).
Вагнер Е. Е., ЖРФХО, 1888, т. 20, с. 72.
Ladbury I. W., Cullis С. F., Chem. Rev., 1958, v. 58, p. 403.
Леффлер М., В кн.: Успехи органической химии. Т. 1. Пер. с англ. Под
ред. И. Л. Кнунянца. М., Издатинлит, 1963, с. 116.
Реутов О. А. Теоретические основы органической химии. Изд. МГУ, 1964,
с. 253.
138. ВАГНЕР Е. Е.
Получение вторичных спиртов взаимодействием альдегидов и диалкилцинка
с последующим гидролизом:
RCHO +
0-20'С
[RR'CHQZnR'J >¦
= Alk, Ar; R'=CH3> C2H5
RR'CHOH
(до 90%)
98
В реакцию вступают также непредельные альдегиды. При использовании
высших цинкдиалкилов наряду со вторичными спиртами образуются первичные.
В некоторых случаях аналогичные результаты дает и диэтилцинк:
Cl— «f X>—CHO + (C2H5JZn
С1—
.—СН.ОН
См. также Бутлеров (№ 125), Гриньяр (№ 219), Зайцев (№ 259), Шоры-
гкн—Ванклин (№718).
Вагнер Е. Е., ЖРФХО, 1876, т. 8, с. 33; 1884, т. 16, с. 283.
Методы элементоорганическои химии. Цинк, кадмии. Под ред. А. Н. Не-
Несмеянова. М., «Наука», 1964, с. 52.
139. ВАГНЕР (WAGNER G. Н.)
Гидроснлнлпрование олефинов хлорсиланамп, содержащими связь Si—H,
в присутствии платиновых катализаторов под давлением:
+ RSiHCl2
100—300 "С
ЧСН— С— SiCUR
1аГ; (изо-С3Н;ОН)
I
R=C1, Alk, Ar
* K2PiCl4, 1% Pt/C
В реакцию вступают олефины н их производные, диены, ацетилен, на-
например:
СН2=СНС(СНз)=СН2 + CH3SiHCl2 >- CH3CH=C(CH3)CH2SiCl2CH3
CH2=CHCH2NO2 + CH3SiHCl2 > O2N(CH2KSiCl2CH3
CH2=CHCH2CN + SiHCi3 > NC(CH2KSiCl3 + NCCH2CH(CH3)SiCl3
CH=CH + SiHCl, >¦ CH2=CHSiCl3
Наличие у двойной связи атома галогена понижает выход, а удаление
электроотрицательных групп от двойной связи, наоборот, увеличивает выход
продукта.
Wagner G. Н., Вайсу D. L, Pihes A. N.. Ind. Eng. Chem., 1953 v 45
p. 367.
Speier G. L, Webster G. A., J. Am. Chem. Soc, 1957, v. 79, p. 974.
Stork G., Colvin E., J. Am. Chem. Soc, 1971, v. 93, p. 2080.
Методы элементоорганическои химии. Кремний. Под ред. А. Н. Несмеянова
и К. А. Кочешкова. М., «Наука», 1968, с. 115.
140. ВАГНЕР Е. Е. -МЕЕР8ЕЙН (MEERWEIN)
Изомеризация углеродного скелета молекул циклических соединений в про-
процессе реакций нуклеофильного замещения, присоединения или элиминирования,
сопровождающаяся миграцией алкнльной или арильной группы к соседнему
атому С — катионному центру (камфеновая перегруппировка первого рода):
7* 96
—C-C—Y
50—150 °С
[НС1]*; (С2Н5ОН)«*
X—:к
_ R
г
?\
R
;с-с(
,с=с-
R
R = H, Alk, Ar; Y~ = гидрокснльная группа нли анион сильной кислоты;
Z~ = аниои растворителя
* Кислоты Льюиса; ** жидкий SO2, CH3NO2 и Другие полярные растворители
Оба атома С могут быть первичными, вторичными или третичными.
Процесс происходит в растворах и расплавах, при нагревании или на холо-
холоду и часто приводит к расширению или сужению циклов. Скорость перегруппи-
перегруппировки пропорциональна иоинзующей способности растворителя.
Реакция особенно характерна для бициклических терпенов:
н3с.
н,с.
СН3
н3с
Прегруппировка в ряду алициклов протекает аналогично:
Реакция принадлежит к типу ретропинаколнновых перегруппировок.
См. также Бертрам — Вальбаум (№ 68), Намёткин (№ 416).
Вагнер Е. Е., ЖРФХО, 1899, т. 31, с. 680.
Meerwein H. e. a., Ann., 1914, Bd. 405, S. 129; 1918, Bd. 417, S. 225; 1923,
Bd. 435, S. 174; 1927, Bd. 453, S. 16; J. prakt. Chem., 1922, Bd. 104, S. 289.
Popp F. D., McEwen W. E., Chem. Rev., 1958, v. 58, p. 375.
Banthorpe D. V., Whittaker D., Quart. Rev. (London), 1966, v. 20, p. 373.
Johnson С. К., Collins С. J., J. Am. Chem. Soc, 1974, v. 96, p. 2514—2523.
Бобылева А. А. и др. Ж. орг. хим., 1974, т. 10, № 9, с. 1885—1892.
Темникова Т. И. Курс теоретических основ органической химии Л «Хи-
«Химия», 1968, с. 637.
Ингольд, с. 390.
141. ВАГНЕР-ЯУРЕГГ (WAGNER-JAUREGG)
1,4-Присоединение малеинового ангидрида к 1,1-диарнлэтиленам и после-
последующая ароматизация образовавшихся аддуктов в 1-арилнафталнны под дей-
действием дегидрирующих агентов:
.CHR
'" + 2
нагревание
(ксилол)
HI'1
(СН3СООН)
ООН
о
Я,ъ',ц"= н,сн3, осн3, f, ci; r"= н, ci,Вг
При Я. - С1, Вг-нагревание в вакууме; СиСОц в кипящем хинолине
101
При R=OCH3 присоединение маленнового ангидрида идет с большей скэ-
ростью.
1 -Фенил- 1-нафтилэтилен реагирует аналогично, образуя с выходом 16%
аддукт, который может быть превращен в 1,1-динафтйл.
См. также Дильс — Альдер (№ 254).
Wagner-]auregg Т., Вег., 1930, Bd. 63, S. 3213; Ann., 1931, Bd. 491, S. 1.
Bergmann F., Szmuszkowicz L, Fawaz G., J. Am. Chem. Soc, 1947, v. 69,
p. 1773.
Bergmann F., Szmuszkowicz J., J. Am. Chem. Soc, 1947, v. 69, p. 1777, 1779.
OP, т. 4, с 35.
142. ВАЙДЕНХАГЕН (WEIDENHAGEN)
Получение 2-замещенных бензимидазолов циклоконденсацией о-фениленди-
аминов с альдегидами в присутствии ацетата меди:
NH
нагревание ^ \
+ RCH0 [СШОСООЦ,]; (Н2ОГ*
• CtH6OH, води. С2Н5ОН
В реакцию вступают алифатические, алициклические, ароматические и гете-
гетероциклические альдегиды. В случае формальдегида при проведении реакции в
кислой среде образуется 1-метилбензимидазол. Аналогично о-фенилендиамннам
реагируют гетероциклические диамины, например 5,6-диаминохинолин и 3,4-ди-
аминопиридин.
См. также Баллах (№ 144), Дебу (№ 235), Филлипс — Ладенбург (№ 601).
Weidenhagen R., Вег., 1936, Bd. 69, S. 2263.
Hofmann К., Imidazole and its derivatives. Pt. 1, New York — London, Inter-
science publ., 1953, p. 269.
Эльдерфильд, т. 5, с. 223.
143. БАЛЛАХ (WALLACH)
Получение вторичных или третичных аминов восстановительным аминирова-
иием альдегидов или кетонов под действием первичных или вторичных аминов
и муравьиной кислоты*:
/
N'
\
=O
N-H + НСООН
нагревание
В реакцию вступают алифатические, алициклические, жирноароматические,
ароматические и гетероциклические альдегиды и кетоны. Реакция широко при-
применяется в органическом синтезе, поскольку позволяет сохранить имеющиеся в
исходных соединениях группы, легко подвергающиеся восстановлению (например,
С=С, NO2, CN).
¦Реакцию можно рассматривать как вариант реакции Лёйкарта, поэтому
ее называют также реакцией Лёйкарта — Валлаха.
См. также Деккер — Форстер (№ 239), Лёйкарт (№ 361), Миньонак
(№ 415), Эшвайлер — Кларк (№ 744).
Wallach О., Ann., 1949, Bd. 343, S. 54.
Staple E., Wagner E. C, J. Org. Chem., 1949, v. 14, p. 559.
de Benneville P. L, Macartney J. #., J. Am. Chem. Soc, 1950, v. 72, p. 3073.
Baltzly R., Kauder O., J. Org. Chem., 1951, v. 16, p. 173.
144. БАЛЛАХ (WALLACH)
Циклизация N.N'-диалкиламидов щавелевой кислоты с одновременным хло-
хлорированием под действием пятихлористого фосфора, приводящая к 5-хлорзаме-
щенным имидазолам:
СО— NH—CH2R PCU; нагрегание
| „С]
СО—NH—CH2R
NCH,R
R = Н, СН3
Если R — алкильный радикал, содержащий более двух атомов углерода,
циклизация не происходит или идет с очень низким выходом. Вместо пятихло-
пятихлористого фосфора можно использовать пятибромистый фосфор.
См. также Вайденхаген (№ 142), Дебу (№ 235), Воль —Марквальд
(№ 174).
Wallach О., Ann., 1876, Bd. 184, S. 33.
Hofmann К. Imidazole and its derivatives. Pt. 1, New York —London, Inter-
science publ.. 1953, p. 119.
Эльдерфильд, т. 5, с. 173.
145. БАЛЛАХ (WALLACH)
Перегруппировка азоксибензолов в я-оксиазобензолы под действием серной
кислоты при нагревании:
H_/~\-N=N-^\
\ / I \ / [конц.
R ° R'
Хлорсульфоновая кислота при 0°С.
R'
Электронодонорные заместители, а также заместители, вызывающие стери-
ческие затруднения, препятствуют реакции. Побочный процесс — образование
opro-изомера; эта реакция становится преобладающей при действии (СНзСОJО
(~250°С) или при УФ-облучении:
N=N
О
ftv
R' —-> R
НО
N=N
R'
102
103
Wallach О., Belli L., Ber., 1880, Bd. 13, S. 525.
Bigelow H. E., Chem. Rev., 1931, v. 9, p. 139.
Шемякин М. М. и др., ЖОХ, 1958, т. 28, с. 1708.
Chi Sun Hahn e. a., J. Am. Chem. Soc, 1967, v. 89, p. 4975.
Hendley E. C, Deiffey D., J. Org. Chem., 1970, v. 35, p. 3579.
Cox R. A., J. Am. Chem. Soc, 1974, v. 96, p. 1059—1063.
Dolenko A., Buncel E., Can. J. Chem., 1974, v, 52, p. 623—629.
146. БАЛЛАХ (WALLACH)
Сужение циклогексаиового кольца в циклопеитановое при обработке ди-
бромцнклогексанона щелочью*:
Аналогичную перегруппировку претерпевают некоторые дибромкетоны тер-
пенового ряда.
1-Оксицнклопентан-1-карбоновая кислота легко подвергается окислительно-
окислительному декарбоксилированию под действием двуокиси свинца:
=0
См. также Фаворский (№ 593), Перкнн (№ 448).
Wallach О., Nachr. Gess. Wiss. Gottingen, Math.-Physik. Kl., 1915, S. 244;
Chem. Zbl., 1916, Bd. 1, S. 365; Ann., 1918, Bd. 414, S. 296.
OP, т. 11, с 287.
147. BAH СЛАЙК (VAN SLYKE)
Определение аминогруппы в алифатических аминах взаимодействием их с
азотистой кислотой:
NaNO2
Метод используется для количественного определения аминогруппы (по
объему выделившегося азота) в алифатических первичных аминах, аминокис-
аминокислотах, пептидах, белках. Вторичные амииы в условиях реакции превращаются
в нитрозамины, третичные — в соли.
См. также Гофман (№ 211), Уайт (№ 578).
Van Slyke D. D., Ber., 1910, Bd. 43, S. 3170; J. Biol. Chem., 1910, v. 9, p. 189;
1915, v. 22, p. 281.
Houben-Weyl, v. 2, p. 674, 689; Gilman, v. 2, p. 1091.
¦Реакцию называют также «расщеплением по Валлаху».
104
148. ВАРРЕНТРАПП (VARRENTRAPP)
Расщепление высших непредельных кислот (типа олеиновой кислоты) при
сплавлении со щелочью:
NaOH или КОН; 300-320 °С
RCH=CH—(СН2)„—СООН *¦
R(CH2)nCH=CHCOO"
СН3СОО-
E0-70%)
В процессе реакции происходит ступенчатый сдвиг С = С-связи, приводящий
к а,Р-непредельнон кислоте, которая и претерпевает расщепление с образова-
образованием уксусной кислоты и насыщенной кислоты, содержащей на два атома угле-
углерода меньше, чем исходная кислота.
Модификацией данного метода является получение двухосновных кислот
непродолжительным сплавлением со щелочью и последующим озонированием.
См. также Галлахер — Холландер (№ 187).
Varrentrapp F., Ann., 1840, Bd. 35, S. 196.
Luttringhaus A., Reif W., Ann., 1958, Bd. 618, S. 221.
Ackmann R. G. e. a., Can. J. Chem., 1961, v. 39, p. 1730.
Ansell M. F., Radziwill A. N., Weedon В. С L, J. Chem. Soc, Ser. C, 1971,
p. 1851.
149. BEEPMAH (WEERMAN)
Укорочение углеродной цепи моносахаридов на одно звено при действии
гипобромита или гипохлорита натрия на амиды альдоновых кислот:
У/
о
с
Н— С—ОН
NaOX
(водн. NaOH)
" N=C=O"
Н-С-ОН
_|
(-50%)
Х = С1, Вт
Реакция является общей для амидов ct-оксикарбоиовых кислот, например:
CeH5CH(OH)CONH2 > С6Н5СНО
Аналогично идет превращение амидов а,Р-непредельных кислот:
ArCH=CHCONH2 г АгСН,СНО
Процесс протекает подобно превращению амидов в амииы по Гофману
(см. № 210).
См. также Воль (№ 172), Руфф — Фентон (№ 172), Шпенглер — Пфаннеи-
штиль (№ 720).
Weertnan R. A., Rec. trav. chim., 1918, v. 37, p. 16.
Mason С D., Nord F. F., J. Org. Chem., 1951, v. 16, p. 1869.
Arcus С L, Prydal B. S., J. Chem. Soc, 1954, p. 4018.
O'Colla P. S., O'Donnell J. J., Mullag J. A., Proc Chem. Soc, 1961, p. 300.
105
150. BEEPMAH (WEERMAN)
Образование индола из эфпров о-нитростирилкарбаминовой кислоты восста-
восстановлением в соответствующие о-аминосоединения с последующей циклизацией
под действием КОН:
CH=CHNHCOOR
N02
Fe-порошок (^
[CH3COOH] L
XCH=CHOH"
^.CH=CHNHCOOR
-"^NH2
NH
KOH
(H2O)
R = CH3, C2HS
Аналогично протекает превращение о-нитрофенилуксусного альдегида:
ХН2СНО .- /СН2СНО
NH
Вследствие низких выходов метод не находит практического применения.
См. также Неницеску (№ 421), Райссерт (№ 491).
Weerman R. A.. Rec. trav. chim., 1910, v. 29, p. 18; Ann., 1913, Bd. 401, S. 1.
Эльдерфильд, т. З, с. 27.
151. ВЕЛЬДЕ (WELDE)
Получеиие алкилдиксантогенатов из симметричных дигалогеналканов и ал-
килксантогената натрия:
X(CH2)nX + 2NaSC(S)OR
40—50 е С
(абс. спирт или ацетон)
*¦ RO(S)CS—(СН2)Л—SC(S)OR
D0-90%)
= uso-CSHU, C6HSCH2; Х = С1, Br; n = 2,3,4
При повышении температуры идет побочная реакция:
S
4>=S-f CS(ORJ
S
CH2SC(S)OR
CH2SC(S)OR
Welde H., J. prakt. Chem., 1877, Bd. 15, S. 43.
Lefort D., Hugel G., Bull. Soc. chira. France, 1952, p. 172.
106
152. BEPHEP (WERNER)
Получение арилнзотиоцианатов из симметричных диарилтиомочевин дейст-
действием уксусного ангидрида:
нагревание
(ArNHJCS + (СН,СОJО »¦ ArN=C.=S
(80%—К9ЛНЧ.)
Аг = CeH6> CeH4F, CeH4Aik, GeH,OAlk
Аналогично получают изомерные ксилилизотиоцианаты. :
См. также Калуца-(№ 281).
Werner E. A., J. Chem. Soc, 1891, v. 59, p. 396.
Вии-Hoi N. P., Xuong N. D., Nam N. H., J. Chem. Soc, 1955, p. 1573.
153. ВЕССЕЛИ (WESSELY)
Окисление замещенных фенолов с одновременным ацетоксилированием под
действием насыщенного раствора тетраацетата свинца:
РЬ(ОСОСН3L
(СН3СООН)»
R"
ОРЬ(ОСОСНзK"
i
R
R'
О
О
О
с
U" II D
CHSCOO R'
R"
¦CH3COO/I |J
R'
R
R = CHS, CeHs, Cl, Br, OCOCH3, CHO, GN, COOAlk;
R', R" = H, CH3, CeH6) Br
* QHe
В зависимости от характера заместителей образуется смесь с разным соот-
соотношением о- и л-хинолацетатов, но как правило с преобладанием орто-изоме-
ров. Побочные процессы — образование хинолдиацетатов н п-хинонов.
Аналогично реагируют нафтолы. В случае 3,5-дизамещенных фенолов ско-
скорость реакции определяется характером заместителя и убывает в ряду:
СН3О > СН3 > Cl > NO2
См. также Тойбер (№ 572).
Wessely F. e. a., Monatsh., 1950, Bd. 81, S. 811
Wessely F., Swoboda J., Guth V., Monatsh., 1964, Bd. 95, S 649
Bubb W. A., Sternbell S., «Tetrahedron Letters», 1970, p. 4499.
Oxydation in Organic Chemistry. Part A. Ed. К. В. Wieberg. New York — Lon-
London, Acad. press, 1965, p. 288.
107
154. ВЕССЕЛИ-М03ЕР (WESSELY — MOSER)
Миграция оксигруипы в флавоноидах при действии иодистоводородной
кислоты:
OR" ОН
1 ° R^A/°H
R"O О ОН
R" = H, Alk
* H2SO4
В реакцию вступают флавоны (R=Ar, R' = H), флавонолы (R = Ar,
R' = OH), изофлавоны (R=H, R' = Ar), хромоны (R=Alk, R' = H), хромонолы
(R = Alk, R' = OH), а также производные ксантона, например:
ОН
ОН О
он о
он о
осн.
он
Wessely F., Moser G. H., Monatsh., 1930, Bd. 56, S. 97.
Donnelly D. M. X. e. a., Chem. Ind., 1958, p. 892.
Seshadri T. R., «Tetrahedron», 1959, v. 6, p. 169.
Franck В., Baumann G., Chem. Ber., 1963, Bd. 96, S. 3209.
Molho D., Gerphagnon M. C, Bull. Soc. chim. France, 1963, p. 607.
De Mayo P. Molecular Rearrangements. New York — London, Interscience,
1963, p. 652.
155. ВЕСТЕРБЕРГ (VESTERBERG)
Дегидрирование производных циклогексена нагреванием с серой с образо-
образованием ароматического кольца:
R
S; 230—240 "С
R
В реакцию вступают также различные конденсированные полицикличеекие
соединения, содержащие циклогексеновое кольцо.
По сравнению с дегидрированием селеном (см. Дильс, № 253) метод дает
более низкие выходы продуктов. Реакция используется для установления строе-
строения высокомолекулярных алициклических соединений, в частности, политер-
политерпенов.
См. также Зелинский (№ 263).
Vesterberg А., Вег., 1903, Bd. 36, S. 4200.
Ruzicka L., Helv. chim. acta, 1922, v. 5. p. 345.
СОП, т. З, с 440.
156. ВЕСТФДЛЕН—ЛЕТРЕ (WESTPHALEN — LETTRE)
Миграция метальной группы от С-10 к С-5 при дегидратации 5-а-оксисте-
роидов под действием уксусного ангидрида в присутствии серной кислоты*:
Н3С
(СН3СОJО
Н3С
F0-70%)
?= сосн3, сн3, н; r=ococh3, он, f
* KHSO4, HF
При дегидратации образуются Д9- или Д8-производные. Перегруппировка
приводит к 5р*-соединениям и осуществляется лишь при наличии р-заместителя
С-6. Миграция метильной группы происходит также при дегидрохлорировании
5-хлорпроизводных. Перегруппировка соединений, не имеющих 5а-оксигрупп,
сопровождается перемещением С = С-связи, например, Д4-производное превра-
превращается в Д9-производное.
Westphalen Т., Вег., 1915, Bd. 48, S. 1064.
Elles В., Petrov V. L, J. Chem. Soc, 1952, p. 2246.
Fetizon M., Foy P., Coll. Czech. Chem. Comm., 1970, v. 35, p. 440. .
Marples B. A., O'Callaghan B. M., Scottow J. L, J. Chem. Soc, Perkin Trans.,
1974, v. 1, №9, p. 1026—1028.
Физер Л., Физер М. Стероиды. Пер. с англ. Под ред. Н. Н. Суворова
и И. В. Торгова. М., «Мир», 1964, с. 202, 938.
157. ВЕТТШТАЙН (WETTSTEIN)
Окисление Д5-Зр-оксистероидов в Д4'6-3-кетостероиды действием бензохинона
и алкоголята алюминия** :
¦Называют также перегруппировкой Вестфалена — Петрова.
¦'•'Называют также реакцией Ветштайна — Оппенауэра.
109
н,с
но
(ROKAl;
нагревание
(С6Н5 СНз)
н,с
На С
о
(ROJA1—О
н
о
Н3С
-С3Н7, С(СН3K, С6Н5
Повышенная реакционная способность атомов водорода в положении 7
приводит к тому, что помимо обычного окисления оксигруппы в условиях реак-
реакции Оппенауэра (см. № 435) происходит перемещение С = С-связи и дегидри-
дегидрирование с образованием Д4'6-3-кетостероидов. Насыщенные стероидные спирты
в этих условиях дают нормальные продукты окисления по Оппенауэру.
Wettstein A., Helv. chim. acta, 1940, v. 23, p. 388.
Mandell L, J. Am. Chem. Soc, 1956, v. 78, p. 3199.
OP, т. 6, с 256.
158. ВЁЛЕР (WOHLER)
Превращение цианата аммония в мочевину при нагревании в водном
р; :творе:
NH4OCN
NH4NC=O
[NH3+O=C=NH]
H-NCONH»
Процесс обратим. Равновесная смесь содержит -~95% мочевины.
Реакция является первым примером синтеза органического соединения из
неорганического и позволяет получать производные мочевины:
aNH2 O=C=NH
COOH
NHCONH2
СООН
C©
H2NCH,COOH
CH,COOH
|
nhco;<;i2
.NH
Аналогична можно получать тиомочевину и ее производные:
NH4SCN * H2NCSNH2
RNH2 + R'SCN v RNHCSNHR'
Реакция Базарова. Промышленный способ получения мочевины из двуокиси
углерода и аммиака:
160—200 °С; 100—400 кгс/см2
H2NCOONH4
H2NCONH2 + Н2О
Wohler F., Pogg. Ann., 1828, v. 12, p. 253.
Bazaroff A. I.. J. prakt. Chem., 1870, Bd. I, S. 283.
Jannelli L, Gazz. chim. ital., 1958, v. 88, p. 443.
Кучерявый В. И и др., ЖПХ, 1972, т. 45, с. 76.
Г орловский Д. М. и др., ЖПХ, 1974, т. 47, с. 229—230.
СОП, т. 2, с. 93.
159. ВИБО —APEHC (WIBAUT — ARENS)
Получение 7"алкилпиРиДинов действием на пиридин ангидридов карбоно-
вых кислот и цинковой пыли с последующим восстановлением цинком в соответ-
соответствующей карбоновой кислоте:
А Zn-пыль*; 30 °С
44 N + (RCOJO »- RCON
RCO—
N—COR *-
Zn; нагревание ft й.
^-°ОД (нсоон, ] RCH2-Qn
C0-60%)
R = Alk
* Fe-порошок
Реакция, по-видимому, идет через стадию образования нон-радикалов.
Выход алкилпиридинов уменьшается с возрастанием R. В случае а-заме-
щенных пиридинов алкилирование проходит с очень низкими выходами или ие
идет совсем.
Wibaut J. P., Arens J. F., Rec. trav. chim., 1941, v. 60, p. 1-19; 1942, v. 61,
p. 59.
Solomon W., J. Chem. Soc, 1946, p. 934.
Wibaut J. P., van der Vennen D., Rec. trav. chim., 1947, v. 66, p. 236.
Kutney I. P., Tabata Т., Can. J. Chem., 1963, v. 41, p. 695.
Казаринова Н. Ф., Бабин Е. П., Соломко К. А., ЖПХ, 1963, т. 36, с. 649.
Шейнкман А. К., Суминов А. К-, Кост А. Н., Усп. химии, 1973, т. 42, с. 1415.
160. ВИДЕКВИСТ (WIDEQVIST)
Межмолекулярная конденсация кетонов или альдегидов с динитрнлом бром-
малоновой кислоты под действием йодистого калня и последующая циклизация
в тетрацианоциклопропаны:
KI
RR'CO + 2BrCH(CNJ •- RR'C C(CN
v " (водн. GaH5OH)* ч / ч
C(CNh
R, R' = H, Alk, Ar (ie-90%)
* H2O, тетрагидрофуран
111
В реакцию вступают также циклические кетоиы (Cs—Сю). Из ароматиче-
ароматических альдегидов и этилового эфира бромциануксусной кислоты аналогично полу-
получают замещенные циклопропаны:
NC4 CN
ArCHO + BrCHCOOC2H6 >- ,С Сч
I (ТГФ'' с2н6оос/ \ / Чоос2н5
CN СНАг
C0-85%)
Аг = СвН„ С6Н4С1, С6Н4ОСН3, C6H4NO2
В качестве побочных продуктов при этом образуются (с выходом 10—30%)
RC6H4CH=C(CN)COOC2H5.
Widegvist S., Ark. Kemi, 1945, v. 20B, № 4, p. 8.
Hast H., Freedman F., J. Org. Chem., 1963, v. 28, p. 1220.
Вульфсон Н. С, Журина Ф. Г., Сенявина Л. Б., ДАН СССР, 1964, т. 157,
с. 603.
Журина Ф. Г., Вульфсон Н. С, Ж- орг. хим., 1967. т. 3, р. 504.
161. ВИДМАН — ШТЁРМЕР (WIDMAN — STOERMER)
Циклизация диазотированных аминоарилэтиленов в циннолииы:
R
N—N X"
I II
:N
N
G0-90%)
R = СН3, C6HS, QH^OCHg-w, пнридил, хинолил; R'= Н, СН3, Аг
Если R—Н, a R'—электроиоакцепторный заместитель, реакция не идет.
См. также Рихтер (№ 514), Борше—Келыл (№ 104), Небер — Боссель
(№418).
Widman О., Вег., 1884, Bd. 17, S. 722; 1909, Bd. 42, S. 4216.
Stoermer R., Fincke H., Ber., 1909, Bd. 42, S. 3115.
Leonard N. J., Chem. Rev., 1945, v. 37, p. 270.
Эльдерфильа. т. 6, с 138.
162. ВИЛАНД (WIELAND H.)
Термическая перегруппировка триарилметоксильчых радикт юв в ароксиди-
арилметильные:
Аг3СООСАг3
Ar3CONO2 —
нагревание
(ксилол)
Аг2СОАг
По легкость миграции арильные остатки можно расположить в следующий
ряд: л-ннтрофенил, л-бифенил, а-нафтил, фенил, толил.
См. также Уррн— Караш (№ 591).
Wieland Н., Вег., 1911, Bd. 44, S. 2550.
Kharasch M. S. е. a., J. Org. Chem., 1951, v. 16, p. 1458.
Benkeser R. A., Schroeder W., J. Am. Chem. Sot, 1958, v. 80, p. 3314.
163. ВИЛАНД (WIELAND H.)
Тритилирование ароматических соединений действием трифенилметильного
радикала в присутствии перекиси бензоила:
C(CeHsK
(С6Н6СООJ
B0-30%)
R = H, СН3, С1, СООС2Н5, NO2
Продукт реакции образуется вследствие рекомбинации соответствующих
радикалов:
(С6Н6KС + (С6Н5СООJ >- С6Н5СООС(С6Н5K + СвН5СОО-
С6Н5СОО- + АгН > Аг- + С6Н5СООН
Аг- + -С(С6Н5K ^ АгС(С6Н5K
Анилин тритилируется в яара-положение. Нитробензол в реакцию не всту-
вступает. Вместо трифенилметильного радикала можно использовать три(я-толил)-
метильный радикал.
Триарилметильные радикалы получают из соответствующих хлоридов дейст-
действием серебра в хлорбензоле.
См. также Хельферих (№ 651).
Wieland H., Meyer A., Ann., 1942, Bd. 551, S. 249.
Hammond G. S., Rudesill J. Т., Modic F. J., J. Am. Chem. Soc, 1951, v. 73,
p. 3929.
Benkeser R. A., Gosnell R. В., J. Am. Chem. Soc, 1956, v. 78, p. 4914.
Benkeser R. A., Gosnell R. В., Schroeder W., J. Am. Chem. Soc, 1957, v. 79,
p. 2339.
164. ВИЛАНД (WIELAND TH.)
Получение пептидов ацилированнем солей или эфиров аминокислот смешан-
смешанными ангидридами N-защищенных аминокислот с моноэфирами угольной кисло-
кислоты (метод смешанных ангидридов):
ZNHCH—С—О—COR + H2NCHCOOAlk
| [] у I (диоксаи)- | |,
R' О О R" R' О
R = C2H5, ызо-С4Н9; Z = С6Н5СН2ОСО
* Тетрагидрофуран, толуол, хлороформ, этилацетат
ZNHCH—С—NHCHCOOAlk
R'
Существенный недостаток—возможность рацемизации в процессе получе-
получения смешанных ангидридов. Последняя может быть уменьшена при использова-
использовании в качестве растворителя тетрагидрофурана.
8—684
Исходные смешанные ангидриды обычно получают взаимодействием N-за-
щнщенных аминокислот с эфнрамн хлоругольной кислоты в присутствии три-
этиламнна:
ZNHCHCOOH + C1COR
I II
R' О
¦>¦ ZNHCH-C-O-COR
I И И
R' О О
При этом иногда наблюдаются побочные реакции: ©бразованне ацнлнмидов,
уретанов.
См. также Бергман — Зервас (№ 62), Шихан — Франк (№ 710).
Wieland Т. е. a., Angew. Chem., 1951, Bd. 63, S. 7.
Шредер Э., Любке К. Пептиды. Т. 1. Пер. с англ. Под ред. М. М. Шемяки-
Шемякина и Ю. А. Овчинникова. М., «Мир», 1967, с. 128.
Вейганд-Хильгетаг, с. 449.
165. ВИЛЬГЕРОДТ (WILLGERODT)
Получение амидов кислот нагреванием жирноароматических кетонов с вод-
водными растворами полисульфида аммония в запаянных трубках*:
гСН3 (мн4JЗх 150-200 °С !s?^ /-(CH2)n+1CONHj
(Н2О)*
R = Н, Alk, OAlk, Hal
* Дноксан (водн.)
При гс = 0 выходы амидов составляют 50—8О°/о, по мере возрастания п вы-
выходы уменьшаются.
В реакцию вступают также олефины, амины, ацетилены, спирты, альдегиды,
производные альдегидов н кетонов (оксимы и т. п.), алкнлированные аромати-
ароматические, конденсированные полнциклическне н гетероциклические соединения:
С6Н5СН=СН2 ¦ > C6H5CH2CONH2 F4%)
С6Н5С=СН >- C6H5CH2CONH2 (80%)
С6Н5СН2СНО ^ C6H5CH2CONH2 E0%)
N
N
Для алифатических кетонов реакция также идет, но с низкнмн выходами.
Основной побочный продукт—аммониевая соль кислоты.
Реакцию используют для синтеза кислот из доступных арнлалкнлкетонов,
получаемых по реакции <Т"ииделя — Крафтса (№ 627)
Модификация Киндл^ра (Kindler) — использование смеси серы с амином
вместо (NH4JSi (позволяет проводить реакцию в открытом сосуде). Образую-
Образующиеся тиоамиды подвергают затем восстановлению нли гндролнзу:
н2о
нагревание; >
•- RCH2C—NR^ -
н2
RCH2COOH
RCH2CH2NR2'
¦Называют также реакцией Внльгеродта — Киндлера (Kindler).
114
Фсобвнно легко (при комнатной температуре) реагируют енамины:
s
О г
CeH5CH»-C-N:
(диметнлформамнд)
Модификация Швейка (Schwenk) — использование морфолина в качестве
амина. Особенно успешно применяется для ароматических кетонов, содержащих
ннтро-, амино- или алкоксигруппы:
S; морфолин
й-СН3ОСН4СОСН3 >- й-СН3ОС6Н4СН2СООН
E0%)
„снхоон
СОСНд
S; морфолнн
(S0?/e)
См. также Азннгер (№ 4), Бодру (№ 94).
Willgerodt С, Вег., 1887, Bd. 20, S. 2467; 1888, Bd. 21, S. 534.
Kindler К., Ann., 1923, Bd. 431, S. 193, 222; Archiv Pharm., 1927, Bd. 265,
S. 389.
Hurd R. N., DeLa Mater G., Chem. Rev., 1961, v. 61, p. 52.
Mayer R., Wehl L, Angew. Chem., 1964, Bd. 76, S. 861.
Asinger F., Offermanus H., Angew. Chem., 1967, Bd. 79, S. 953.
Asinger F Saus A., Michel E., Monatsh., 1968, Bd. 99, S. 1436.
Schneller S. W., Int. J. Sulfur Chem., 1973, v. 8, № 3, p. 485—503.
OP, т. З, с 88.
166. ВИЛЬСМАЙЕР (VILSMEIER)
Формилнрованне ароматических соединений действием М,М-днзамещенннх
формамидов и хлорокиси фосфора :
АгН +
роен
NRR'
)-NRR'
Н'
СГ
(ннерти. раетворитель)
^ Ar—CH—NRR'
С1
R = Alk;
* СОС1г, SOC12, ZnCl2, (CH3CO)sO
Формилирующнм агентом является комплекс формамидов с РОС13, обра-
образующийся в процессе реакции. Обычно используют дкиетилформамид, фенил-
метилформамнд нли N-формилпнперидин.
¦Называют также реакцией Вильсмаиера — Хаака (Наак).
В реакцию вступают разнообразные ароматические и гетероциклические со-
соединения, а также олефнны с активированным ct-водородным атомом, например:
=снсно
С(С6Н5J С(С6Н5J
Модификации метода
1. Добавление в реакционную смесь гидросульфнда натрия на стадии обра-
образования комплекса позволяет проводить тноформнлирование, например:
\_сн3—v[ у V-CH3
I
(-80%) CH=S
2. Формилирование действием диметилформамида н хлористого бензоила
успешно применяется в случае соединении, чувствительных к кислотам, на-
например:
Н$С СН3 Н3С
ч ,-CHj-
NH
Н,С
сн, н3с
СН„
ОНС-/ \-СН2-/~\-СНО
т nh
См. также Гаттерман — Кох (№ 195), Рнхе (№ 513).
Vilsmeier A., Haack А., Вег., 1927, Bd. 60, S. 121.
Grundmann С, Dean J. M., Angew. Chem., 1965, Bd. 77, S. 966.
Jutz C, Muller W., Muller E., Ber., 1966, Bd. 99, S. 2479.
Seshadri S., Sardessai M. S., Betrabet Ashok M., Indian J Chem 1969 v 7
p. 662
Kir a M. A., Nofal Z. M., Gadolla K- Z., «Tetrahedron Letters», 1970 v. 48
p. 4215.
Kiyomi Kirkugawa, Ichino M., J. Org. Chem., 1972, v. 37, p. 284.
Власов В. М., Захарова О. В., Ж. орг. хим., 1974, т. 10, с. 66—71.
Вейганд-Хильгетаг, с. 798.
167. ВИТТИГ (WITTIG)
Перегруппировка простых эфиров в спирты под действием феннллнтия*:
н2о
н
)C
L
C-OR
"С—OR
-О"
\
Li
R
Х-ОН
R
Na в жидком NH3; CH3ONa в СН3ОН при 70 °С, KNH2 в жидком NH3
*Впервые перегруппировку простых эфнров в спирты обнаружил П. П. Шо-
рыгнн:
Na; Ю0°С
(С6Н5СН2JО > С6Н5СН(ОН)СН2С6Н5
116
В реакцию вступают беизиловые, бензгидриловые и другие эфиры, содер-
содержащие ароматические заместители, например:
Н
НО
Способность простых эфнров к перегруппировке убывает в следующем ряду
заместителей R:
СН2СН=СН2, СН2С6Н5 > СН3, QA, C6H4NO2-n,
> С6Н5, С6Н4СН3-л, С6Н4С1-л
В случае оптически активного соединения перегруппировка сопровождается
рацемизацией.
См. также Лютрингхаус (№ 373).
Schorigin P., Вег., 1925, Bd. 58, S. 2031.
Wittig G. e. a., Ann., 1942, Bd. 550, S. 260; 1947, Bd. 557, S. 205; 1949, Bd. 562,
S. 192.
Wittig G., Angew. Chem., 1954, Bd. 66, S. 10.
Kobrich G., Angew. Chem., 1962, Bd. 74, S. 460.
Устышок Ю. А., Перевалова Э. Г., Несмеянов А. Н., Изв. АН СССР, ОХН,
1964, с. 62.
Pedde G. I. D., Ward I. E. H., J. Organometal. Chem., 1968, v. 14, p. 131.
Rautenstrauch V., Chem. Comra., 1970, p. 4.
Hisano Т., Yabuta Yuko, Chem. Pharm. Bull., 1974, v. 22, p. 316—326.
Eisch J. J. e. a., J. Organometal Chem., 1974, v. 63, p. 289—301.
168. ВИТТИГ (WITTIG)
Получение олефинов нз карбонильных соединений и алкилиденфосфораиов,
приготовленных дегндрогалогеиированием четвертичных солей фосфония под
действием оснований (олефннирование):
\
С=О; нагревание
R'R"CH— PR3 X"
R'R"C-PR3 -
i-o-
5U*
(эфнр)
7^ R'R"C=PR3
R'R"C-PR3
U
R'R"C=q -f R3PO
R = Alk, Ar, C6H5 (наиболее часто); R', R" = H, Alk, Ar, COOC2H5> OAlk и др.
* C4H9Li, CH3Li, mpem-C4H9OK. NaNH2; C2H5ONa и др;
** C2H5OH, (CH^SO, тетрагидрофуран
Стабильные фосфораны образуют преимущественно гракс-олефииы, тогда
как нестабильные — смесь цис- н транс-изомеров. В присутствии оснований
Льюнса (например, аминов) н при проведении реакции в полярном апротоином
растворителе возможен стереоспецнфический синтез ^ыс-олефинов. При R=Alk
реакция проходит легче, чем при R=Ar; введение электроиодонорных замести-
заместителей в ароматическое ядро еще более снижает реакционную способность фос-
форанов. Аналогичный эффект наблюдается, если R' (или R") является электро-
иоакцепторным заместителем. При R = R'=R"=Ar реакция не идет.
117
В реакцию вступают разнообразные альдегиды, кетоны, тиокетоны, форм-
амиды и кетены, причем альдегиды более реакционноспособны, чем кетоны.
Примеры:
(С„Н6KР=СН2 +
=0
=сн2
D0%)
(СвН5)зР=СН(СН2),СН=Р(СвН6)з + Г
Ч/Ч
сно
(С„Н6KР=СН2 + (QH6JC=S
(C6H6),P=CR'R" + (С6Н5JС=С=О
СНО
(QH6Jc=ch2
(X
-140 "С
(C,H5JC=C=CR'R"
Достоинства метода: образование олефинов со строго определенным поло-
положением С=С-связн н сравнительно мягкие условия проведения реакции.
Реакция находит широкое применение в химии природных соединений для
синтеза стероидов н каротинондов, соединений ряда витаминов А и D3.
Существует множество вариантов реакции Виттига (см., например, Хорнер
№ 671). Так, например, использование фосфоранов, полученных на основе
я-днфенилфосфннобензойной кислоты или гексаметнлтрнамидофосфита, позволяет
легко разделить образующуюся смесь олефнна н фосфинокснда:
С„Н5СН2Вг + CH3ONa
[(CH3JN]3P — > [(СНзJЫ]3Р-СН2С6Н5 Вг~ »-
[(CH3JN]3P=CHC,H5
C6H6CH=CHCeH5 + [(CH3KN]3PO
G5%) (растворим в воде)
Wittig G., Rieber M., Ann., 1949, Bd. 562, S. 187.
DeSilva S., Snieckus V., Can. J. Chem., 1974, v. 52, № 8, Pt. 1, p. 1294—
1306.
Триппет С. В кн.: Успехи органической химии. Т. 1. Пер. с англ. Под ред.
И. Л. Кнуняица. М., Издатиилит, 1963, с. 94.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачннка. М, «Химия», 1972, с. 330.
ОР, т. 14, с. 287.
Физер, т. 5, с. 78, 88, 289, 292, 305, 546.
169. ВИТТИГ (WITTIG)
Получение фенантренов восстановлением эфиров замещенных 2,2'-дифенил-
дикарбоновых кислот, превращением образующихся при этом глнколей в дибро-
миды, затем в циклические четвертичные соли аммония и перегруппировкой соли
в производное днгндрофенантрена с последующим исчерпывающим метилиро-
метилированием:
R'OOC COOR'
118
R R
R R
4N(CHSJ
R = Н, СН,
* NaNH2 в жидком NH,
Последними стадиями этого многостадийного синтеза являются перегруппи-
перегруппировка Стнвенса (см. № 554) и расщепление четвертичных аммониевых солей пе
Гофману (см. № 208). Каждая нз стадий проходит с выходами —80—90%.
См. также Пшорр (№ 483).
Wittig G., Zimmermann H., Chem. Ber., 1953, Bd. 86, S. 629.
Wittig G., Angew. Chem., 1954, Bd. 66, S. 15.
Мюллер, с. 532.
170. ВИТТИГ (WITTIG)
Получение литийорганических соединений из различных галогенпроизводных
действием алкиллития (литий-галогенный обмен)* :
I
—С—X + RLi
-70 — —20 °С |
: *¦ —С—Li
(инертн. растворитель) .
R = Alk, C6H6; X = Br, 1
Активность литниорганнческнх соединений уменьшается в ряду:
к-С4Н9, к-С3Н7 > С2Н5 > С6Н5 » СН3
Наиболее широко применяется «-CiHgLi как легкодоступный и весьма ста-
стабильный реагент, обладающий высокой реакционной способностью. Легкость
обмена пропорциональна степени поляризации галогена. В качестве галогенпро-
изводных обычно применяют бромиды, что связано с легкостью их получения,
хотя при использовании нодндов выходы выше.
В реакцию вступают алифатические, ароматические и гетероциклические га-
логенпроизводные. Дигалогениды обменивают как один, так и оба атома гало-
галогена, например:
СН,(Х
2С6Н5П
СНЯО
Li
осн.
Li
¦Одновременно и независимо эту реакцию открыл Гнлмен (Gilman).
119
Реакция обратима. Положение равновесия зависит от электроотрицательно-
электроотрицательности радикалов при атомах галогена н лнтия, нанрниер:
+ QH5Li
+ QH.Li
E0%)
Побочные реакции: конденсация н обмен водорода на литнй, например:
QH»L1
Li,N
Ш,0
СН3О
Y
Вг
Реакция широко применяется для получения лнтийорганнческих соединений,
особенно соединений ароматического и гетероциклического рядов, которые не-
невозможно получнть прямым металлированием.
Wittig G. е. а., Вег., 1938, Bd. 71, S. 1903.
Gilman H. e. a., J. Am. Chem. Soc, 1939, v. 61 p. 106, 1371.
OR, v. 6, p. 340.
171. ВИХТЕРЛЕ (WICHTERLE)
Получение бицнклнческих кетонов конденсацией циклических кетонов с
1,3-днхлор-1{ис-бутеном-2 и последующей циклизацией под действием сериой
кислоты:
С,С„!СН=ССН1
Cl
н2сн=ссн, н*о"<;
I
С1
сн3—с-
E0-65%)
R= CH3, COOC2H5; л= 3-5,8,10
J20
При R = H н л =1,2 циклизация проходит с участием метильион группы
боковой цепи:
E0-70%)
Аналогично циклизуются непредельные алифатические кетоны, например:
СН3С=СНСН2СНСОСН3
Cl СООС2Н5
СН
Wichierle О., Prochazka J., Hofmann J., Coll. Czech. Chem. Comm., 1948, v. 13,
p. 300.
James A., Marshall J. A., Schaeffer D. J., J. Org. Chem., 1965, v. 30, p. 3642.
Kobayashi Makato, Matsumoto Takeshi, Chem. Letters, 1973, № 9, p. 957—960.
OR, v. 16, p. 55.
172. ВОЛЬ (WOHL)
Укорочение углеродной цепи моносахаридов на одно звено действием на
окснмы альдоз уксусным ангидридом и последующей обработкой образующихся
нитрилов аммиачной окисью серебра:
СНО CH=NOH CN
| NH2OH I
;нон —*- снон
(СН3СОJО; CH3COONa
(C5H5N) ~*"
СНОН
:нон
снососн3
снососн.
Ag2O
(NH4OH)
CH(NHCOCH3J
НОН
(Н2О)
СНО
i
C0-40%)
Реакция представляет собой процесс, обратный циангндринному синтезу
Кнлиани — Фишера (см. № 292).
Модификация Земплена (Zemplen) — одностадийное расщепление ацетили-
рованных нитрилов обработкой метилатом натрия:
CN СНО
I CH3ONa или (СН3ОJВа |
снососн; (СНзОН + снс1з)-снон
Реакцию успешно применяют в ряду дисахаридов, так как при этом не про-
происходит гидролиза гликозндной связи. Эту модификацию используют также как
метод снятия ацетильной защиты в сахарах. При проведении процесса в абсо-
абсолютном метаноле достаточно каталитических количеств алкоголята.
121
Модификация Вейганда — Лёвенфельда (Weygand — Loewenfeld) — расщеп-
расщепление оксимов альдоз действием 1,3-динитро-4-фторбензола:
CH=NOH
СНОН
СНОН
(-66%)
См. также Веерман (№ 149), Мак-Доналд — Фишер (№ 379), Руфф — Фен-
тон (№ 530).
Wohl А., Вег., 1893, Bd. 26, S. 730; 1897, Bd. 30, S. 3101; 1899, Bd. 32,
S. 3666.
Zemplen G., Ber., 1926, Bd. 59, S. 1254, 2402.
Isbell H. S., Frush H. L, J. Am. Chem. Soc, 1949, v. 71, p. 1579.
Allerton R., Overend W. G., J. Chem. Soc, 1952, p. 35.
Bincley W. W., «Tetrahedron Letters», 1970, p. 3439.
Deulofeu V., Adv. in Carbohydrate Chem., 1949, v. 4, p. 119, 129.
173. ВОЛЬ — АУЭ (WOHL — AUE)
Получение N-окисей 3,8-дизамещеиных феназннов межмолекулярной кон-
конденсацией яара-замещенных анилинов с л-нитробензолами под действием ще-
щелочей:
NH
"8
R'
N.OH или К
(с6н6)
R, R' = H, Cl, OCH8
Реакция орго-замещенных анилинов и нитробензолов приводит к 1,6-диза-
мещенным феназинам:
NO2 H2N
122
C
Wohl A., Aue VP., Вег., 1901, Bd. 34, S. 2442.
Pachter I. J., Kloctzel M. C, i. Am. Chem. Soc, 1951, v. 73, p. 4958; 1952
v. 74, p. 971.
Joshioka I., Ashikawa R., Pharra. Bull. (Tokyo), 1957, v. 5, p. 81; С A., 1957,
v. 51, № 17933.
Paul D. В., Austr: J. Chem., 1972, № 10, p. 2283—2288.
174. ЗОЛЬ — МАРКВАЛЬД (WOHL — MARCKWALD)
Получение имидазолов окислением продуктов ¦ конденсации а-аминокетонов
(или а-аминоальдегидов) с изотиоцианатами:
RC—CHR + R'NCS
I
нагревание
Y__. м
N
>R-/ VSH
HNO3
NR'
„_// Л
6 NH2
R = H, Alk, Ar; R' = Alk, Ar
Аналогично реагируют аминоацетали:
NR'
H2NCH2CH(OC2H6J + CH3NCS *¦ CH3NHCNHCH8CH(OC2H6J
S NCH,
Ограничением метода является малая доступность а-аминокетонов.
См. также Баллах (№ 144), Дебу (№ 235).
Wohl A., Marckwald W., Вег., 1889, Bd. 22, S. 568, 1353.
Burtles R., Pyman F. L, Roylance ]., J. Chem. Soc, 1925, p. 581.
Hofmann K: Imidazole and its derivatives. Part 1. New York — London, Inter-
science publ., 1953, p. 77, 88.
Эльдерфильд, т. 5, с 174.
175. ВОЛЬ —ЦИГЛЕР (WOHL — ZIEGLER)
Бромированне олефинов в ¦у-положение действием N-бромамидов (аллильное
бромнрование):
ХС=С—С—Н + Br—N—СО—
нагревание
(ииерти. растворитель) /
С=С—С—Вг
Реакция протекает по свободнорадикальному механизму. В качестве бро-
мирующего агента обычно используют N-бромсукцинимид (Циглер; выход
60—80%), а также N-бромацетамид (Воль), N-бромфталимид, N-бромамиды пер-
фторированных янтарной и глутаровой кислот, 3-бром-5,5-диметилгидантоин.
В реакцию вступают разнообразные олефины, а,|3-непредельные кетоны,
эфиры, нитрилы, лактоны, циклические кетоны. Метиленовая группа бромирует-
ся легче, чем метальная. Олефнны с третичным атомом углерода в у-положении,
производные ацетилена н непредельные сульфоны в реакцию не вступают.
Действием N-бромсукциннмнда в присутствии солей металлов (А1С1з, FeCls,
ZnCl2) можно ввести бром в ароматическое ядро, а в присутствии перекиси
беизоила — бромнровать соединения е третичным атомом углерода, сопряжен-
12*
иые диены, а также боковые цепи ароматических и гетероциклических соедине-
соединений, например:
СН„СН=СНСООСН,
ВгСН2СН=СНСООСН,
(86%)
Побочные процессы: аллнльная перегруппировка и присоединение брома по
С = С-связн. Реакция находит широкое применение, в частности в химии сте-
стероидов.
Попытки осуществить хлорирование олефинов N-хлорсукцннимидом оказа-
оказались безуспешными, но Быу-Хой (Buu-Hoi) обнаружил, что N-хлорсукциннмид
может быть использован для хлорирования алифатических соединений в присут-
присутствии перекиси бензонла:
RH 4- О=/
С1—
=0
нагревание
1(СвН5СООJ]; (СС14)
RC1
C0-60%)
В реакцию вступают алканы, циклоалканы, кетоны, сложные эфиры, на-
например:
CHgCHs—COOCgHs >• CHsCHCl-COOCaHs
D0%)
WohlA., Ber., 1919, Bd. 52, S. 51.
Ziegler K- e. a., Ann., 1942, Bd. 551, S. 80.
Buu-Hoi N. P., Demerseman P., J. Org. Chem., 1953, v. 18, p. 649.
Dauben H. J., McCoy L. L, J. Org. Chem., 1959, v. 24, p. 1577; J. Am. Chem.
Sot, 1959, v. 81, p. 5404.
Loeffler A. e. a., He!v. chim. acta, 1970, v. 53, p. 383.
РИМИОС, т. 4, с 287; Вейганд-Хильгетаг, с. 136.
СОП, т. 10, с. 12; Физер, т. 1, с. 125, 134; т. 5, с. 44, 47.
176. ВОЛЬФ (WOLFF)
Перегруппировка дназокетонов в кетены при нагревании в присутствии ка-
катализатора *:
+ — нагревание
R—С—C=N=N
о
LCeHeOOOAgl»
R—С—CR'
II
О
R—С=С=О
R'
(ДО 90%)
R = Alk, Аг; R' = Н, Аг
* А8А Си, Ag, Pt, Ni-Ренея, R3N, без катализатора
•Называют также реакцией Вольфа — Шрётера (Schroeter).
124
Перегруппировка оптически активных диазокетонов происходит с сохране-
сохранением конфигурации.
Реакция имеет большое препаративное значение, так как неустойчивые ке-
кетены могут быть легко переведены в карбоновые кислоты или их производные:
RCH=C=O —!
н2о
R'OH
R'NH2
RCH2COOH
RCH2COOR'
RCH.CONHR'
Модификация Хориера (Ногпег) — разложение диазокетоиов в водном ди-
оксане при 0 °С под действием УФ-облучения.
См. также Арндт — Айстерт (№ 25), Зюс (№ 271).
Wolff L., Ann., 1912, Bd. 394, S. 25.
Schroeter G., Ber., 1909, Bd. 42, S. 2336; 1916, Bd. 49, S. 2704.
Homer L, Spietschka E., Ann., 1951, Bd. 573, S. 17.
Wilds A. L. e. a., J. Am. Chem. Soc, 1962, v. 84, p. 1503.
Родина Л. Л., Коробщина И. К., Усп. химии, 1967, т. 36, с. 611.
Allinger N. L., Walter Th. J., Newton M. G., J. Am. Chem. Soc, 1974, v. 96,
№ 14, p. 4588—4597.
De Mayo P., Molecular Rearrangements. New York — London, Interscience
publ., 1963, p. 558.
Вейганд-Хильгетаг, с. 882.
177. ВОЛЬФЕНШТАЙН — БЕТЕРС
(WOLFFENSTEIN — BOTERS)
Окислительное нитрование бензола в оксиннтросоединения действием азотной
кислоты в присутствии солей ртути:
ОН
50%-ная HNOJ; 30 °С
[Hg(NQsJ] ^.
NO,
NO,
ОН
60%-ная HNO»; 160 °С
[Hg(NO3J] ~~*"
N02
* Высшие окислы азота
126
Окислительное нитрование идет лишь при наличии в азотной кислоте окис-
окислов азота. Предполагаемый механизм процесса включает образование феинл-
меркурнитрата:
HgNO;
NHOH
NO2
и т. д.
Под действием НМОз, свободной от окислов азота, происходит расщепле-
расщепление фенилмеркурнитрата с выделением бензола.
Окислительному нитрованию подвергаются также некоторые производные
бензола, например:
Побочными продуктами являются нитробензолы.
См. также Фреденхаген (№ 626).
Boters О., Wolffenstein R., пат. США 923761 A909); С. А., 1909, v. 3, № 2227;
Вег.. 1913, Bd. 46, S. 576.
Захаров А. И., Ж. хим. пром., 1927, т. 4, с. 960; 1928, т. 5, с. 26; 1929, т. 6,
с. 698; 1931, т. 8, с. 30.
РИМИОС, т. 7, с. 223.
178. ВРЕДЕ (WREDE)
Образование 2,5-днметнлоксазолов нз а-амннокнслот действием уксусного
ангидрида и ацетата натрия с последующей циклизацией под действием пятихло-
ристого фосфора:
CH3COONa; (CH3GOJO; нагревание (СНзСОJ®
RCHCOOH *• fRCHCOOH >¦
МН,
NHCOCH,
126
RCHCOCH3
NHCOCH
(-15%)
R = Н, Alk
Метод представляет собой сочетание двух реакций: получение а-ациламиио-
кетонов по Дейкнну — Уэсту (№ 238) и синтез оксазолов по Робинсону — Габ-
Габриелю (№ 517). Вследствие низких выходов метод не находит практического
применения.
Wrede F., Feuerriegel G., Z. physiol. Chem., 1932, Bd. 205, S. 198.
Wiley R. H., Chem. Rev., 1945, v. 37, № 408.
Lowe C, Ridley D. D., J. Chem. Soc, Perkin Trans. 1, 1973, № 18, p. 2024.
Эльдерфильд, т. 5, с. 245.
179. ВУДВАРД (WOODWARD)
Окисление олефннов в ^ис-глнколн действием иода и ацетата серебра в вод-
водной уксусной кислоте с последующим гидролизом образовавшихся ^ис-оксиаце-
татов:
V
2; CH3COOAg; ~ 100 °С
«.
(води. СН3СООН);
С—I
-ососн»
Чл 1
L
с—оч +
С—О-'
н2©
Vex
с—о^
С—ОСОСН3
с—он
(СН3СОСН3)
Voh
с-он
* кон в ен,он
В безводной среде происходит гракс-гндроксилнрование. Метод эффективен
для гндроксилнрования олефинов с длинной цепью.
См. также Вагнер (№ 137), Криге (№ 339), Майлас (№ 377).
Woodward R. В., пат. США 2687435 A954).
Woodward R. В., Bruthcher F. V., J. Am. Chem. Soc, 1958, v. 80, p. 209.
Battersby A. R., Quart. Rev., 1961, v. 15, p. 284.
Ганстон Ф. Д. В кн.: Успехи органической химии. Т. 1. Пер. с аигл. Под
ред. И. Л. Киуияица. М., Издатннлит, 1963, с. 130.
127
180. ВЫШНЕГРАДСКИЙ —ЛАДЕНБУРГ (LADENBURG)
Восстановление пнрнднна н его производных в соответствующие пипериди-
пиперидины действием металлического натрия в абсолютном спирте:
R
Na*
14
N
(абс. СгН5ОН)**
R
NH
R = Н, Alk, COOH, NH2
* Сплав Na и К B%); ** С4Н9ОН
Аналогично восстанавливается пиридиновое кольцо хннолнна и его произ-
производных. При восстановлении 2-аминопиридина происходит раскрытие кольца с
образованием пентаметнленднамнна.
Этот способ применяется и для восстановления других классов органических
соединений, например сложных эфиров в спирты (см. Буво—Блан, № 119)
н алифатических нитрилов в первичные амины:
RCH2CN > RCH2CH2NH2
E0-60%)
R = Alk, Ar
Ароматические нитрилы и алифатические нитрилы с CN-группой у вторич-
вторичного атома углерода реагируют с отщеплением HCN и образованием углеводо-
углеводорода. В некоторых случаях образование амина сопровождается алкоксилирова-
ннем нлн переалкоксилнрованнем, например:
NCCH2CH2ZCH2CH2CN
Na
(QH9OH)
z = o, s
Na
QH9OCH2CH2CH2NH2
CH3OCH2CH2CN "„" > QH9OCH2CH2CH2NH2
(C4H9OH)
См. также Лукеш (№ 371).
Ladenburg A., Ber., 1884, Bd. 17, S. 156.
Вышнеградский A. #., ЖРФХО, 1889, т. 12, ч. 2, с. 16.
Кост А. Н., Терентьев А. П., ЖОХ, 1947, т. 17, с. 105.
Кост А. Н., Яшунский В. Г., ЖОХ, 1953, т. 23, с. 230.
181. ВЮЙТС (WUYTS)
Получение ароматических альдегидов из ароматических днтнокнслот дейст-
действием 1Ч,Ы-метнлфеннлгндразина с последующим гидролизом:
ArCSSH -f H2NN
ArCSNHN
ArCHO
(80—95%)
Ar = C6H5, C6H4CH3, C6H4Br
50 СС
128
Аналогично реагируют днтнокислоты ряда нафталина. Вместо N-метил-
N'-фенилгидразнна можно использовать семнкарбазнд или гндрокснламнн. Али-
Алифатические днтиокнслоты в условиях реакции превращаются в нитрилы.
См. также Мак-Фейднен — Стнвенс (№ 381).
Wuyts H., Goldstein M., Bull. Soc. chim. Belg., 1931, v. 40, p. 497.
Wuyts H., Berman A., Lacourt A., Bull. Soc. chim. Belg., 1931, v. 40, p. 665.
Wuyts H., Koeck H., Bull. Soc. chim. Belg., 1932, v. 41, p. 196.
Smith L. I., Nichols J'., J. Org. Chem., 1941, v. 6, p. 489.
182. ВЮРЦ (WURTZ)
Получение углеводородов конденсацией алкнлгалогенндов при действии ме-
металлического натрия:
Na*
2RX . > R-R
(эфир)**
(ДО 80%)
X = Br, I
* Li, К; ** (С4Н9JО
Реакция особенно хорошо идет с высшими первичными алкнлгалогенидами.
Алкнлиоднды реагируют лучше, чем хлориды. При использовании смеси алкил-
галогенндов образуется сложная смесь углеводородов. В случае оптически ак-
активного алкнлгалогеннда реакция идет с сохранением конфигурации. Основные
побочные процессы: образование олефинов и RH.
По типу реакции Вюрца происходит образование элементоорганнческих ео-
еднненнй, например:
СН2=СНС1
SiCl4
SiCl4
н-С4Н9С1
Si(C4H9-«)
Используются различные модификации реакции. Так, применение тетрафе-
ннлэтилена в качестве переносчнка натрия позволило увеличить выходы угле-
углеводородов и расширить границы метода. Использование тетрагндрофурана в ка-
качестве растворителя позволяет получать продукты с высокими выходами при
—80 "С.
Реакция Вюрца—Гриньяра* — образование углеводородов при взаимодей-
взаимодействии алкил(арнл)галогенндов с реактивами Грнньяра:
RX -f R'MgX —-> R-R'
Этот процесс, происходящий обычно в большей нлн меньшей степени яри
получении реактивов Грнньяра, катализируется солями кобальта и может быть
кспользован в препаративных целях, например:
с6н5вг + с6н5м§вг i-?5> с6н5-с6н5
(86%)
См. также Вюрц—Фнттнг (№ 183), Ульман (№ 583), Уррн — Караш
Wurtz A., Ann. chim. phys., 1855, v. 44, p. 275; Ann., 1855, Bd. 96, S. 364.
Bert, С. г., 1928, v. 186, p. 587.
Касухш Л. Ф., Грагеров И. П., Ж- орг. хим., 1971, т. 7, с. 2009.
Физер, т. 5, с. 414; Фьюзон, с. 544.
¦Называют также реакцией Губена (Houben).
9—684
129
183. ВЮРЦ—ФИТТИГ (WURTZ — FITTIG)
Получение жнрноароматнческнх углеводородов конденсацией арнлгалогенн-
дов с алкилгалогенндамн под действием металлического натрия:
ArX + RX
Na; нагревание
(инертн. растворитель)
Ar—R
C0-60%)
Обычно применяют алкилбромнды, реже ноднды н очень редко хлориды.
Легче всего реагируют первичные алкнлгалогеннды, труднее—вторичные, а тре-
третичные [кроме (СвН5)зСХ] не вступают в реакцию. Вместо RX могут быть ис-
использованы R2SO4, например:
Побочные процессы: образование Аг—Ar, R—R, RH и олефннов.
Метод может быть использован для синтеза элементоорганнческих соедине-
соединений, например:
4 п-СН3С6Н4С1 + SiCl4
(n-CH3C6H4LSi
Модификация Виттига—Витта (Wittig — Witt)—использование фенил-
лития вместо натрия при конденсации галогенпронзводных жнриоароматических
углеводородов. Метод дает возможность получать макроцнклическне соединения:
Н*Вг
СН,Вг
См. также Вюрц (№ 182), Ульмаи (№ 583).
Wurtz A., Ann. chim. phys., 1855, v. 44, p. 275; Ann., 1855, Bd. 96, S. 364.
Fittig R., Tollens В., Ann., 1864, Bd. 131, S. 303.
Bergmann E. D., Pelchowicz Z., J. Am. Chem. Soc, 1953, v. 75, p. 4281.
LeGoff E., Ulrich S. E., Denney D. В., J. Am. Chem. Soc, 1958, v. 80, p. 622.
Gusten H., Homer L, Angew. Chem., 1962, Bd. 74, S. 586.
Eaborn C, Walton D. R. M., J. Organometal. Chem., 1965, v. 3, p. 168.
Cullen W. R., Adv. in Organomet. Chem., 1966, v. 4, p. 149.
Касухин Л. Ф., Граверов И. П., Ж- орг. хим., 1971, т. 7, с. 2009.
СОП, т. 3, с. 126.
120
184. ГАБРИЕЛЬ (GABRIEL)
Циклизация р-галогеналкнламннов в производные азнрнднна под действием
щелочи*:
КОН*
RCH-CHR >¦ RHC-
CHR
X NHR' NR'
R = H, Alk, С6Н6; R'= Н, Alk, С6Н6, SO2Ar; X = С1, Вг
* Ag2O, NaOH
е-Хлорамиламнны, вполне устойчивые в виде гндрохлоридов, при нейтрали-
»ацнн превращаются в пиперидины. Аналогично получают н другие замещенные
циклические имины, например:
C6H5CH2NHCH2—С—СНСН2СН2Вг
II I
О C,HR
NCH2CeH6
См. также Хох —Кэмпбелл (№ 673), Байер (№ 32), Лнпп (№ 366), Уэн-
кер (№592).
Gabriel S., Ber., 1888, Bd. 21, S. 1049.
Marckwald W. e. a., Ber., 1899, Bd. 32, S. 2036; 1900, Bd. 33, S. 764.
Гембицкий П. А., Жук Д. С, Каргин В. А. Химия этнленнмина. М., «Нау-
«Наука», 1966, с. 5.
Эльдерфильд, т. 1, с. 51, 500.
185. ГАБРИЕЛЬ (GABRIEL) .
Перегруппировка N-карбалкокснметнл- н N-фенацнлфталнмндов в замещен-
замещенные 1,4-диоксннзохннолнны под действием алкоголята натрия**:
ОН
СО - - - ¦
\ R'ONa
j;nch2cor —*-
OH
R = OR', n-C6H4R" (R" = H, CH3, OCH3, Cl, Br, NO2); R' = CH3, CgHB
Аналогично (N-нзатнннл)-уксусный эфнр перегруппировывается в производ-
производное 3,4-диоксихннолнна:
О ОН
"
NCH2COOC,HR
N
¦Называют также реакцией Габриеля — Марквальда (Marckwald).
**Называют также реакцией Габриеля—Кольмана (Colman).
131
Предполагают, что в процессе реакции происходит раскрытие нмндного
кольца н перегруппировка нмнд-аннона в карбанион с последующей внутримо-
внутримолекулярной конденсацией по Днкману (см. 251).
Исходные соединения получают алкилнрованнем фталнмнда калня эфнрамн
галогенкарбоновых кнслот или фенацилгалогенндамн.
Gabriel S., Colman L, Вег., 1900, Bd. 33, S. 980, 996, 2630; 1902, Bd. 35,
S. 2421.
Allen С F. H., Chem. Rev., 1950, v. 47, p. 284.
Hill J. H. M., J. Org. Chem., 1965, v. 30, p. 620.
Henecka H. Chemie der Beta-Dicarbonylverbindungen. Berlin, Springer, 1950,
S. 150, 154.
186. ГАБРИЕЛЬ (GABRIEL)
Получение первичных алифатических аминов из алкнлгалогенндов взаимо-
взаимодействием с фталнмндом калня и последующим гидролизом образовавшихся
N-замещенных фталнмндов:
RX-
Ч
со
со
100-180 СС
ч
со
СО
НС1 или H2SO4; 280 °С
(ДО 90%)
X = CI, Br, I
В случае малой реакционной способности алкнлгалогеннда лучшие резуль-
результаты получают при использовании растворителей (ацетон, формамнд, диметнл-
формамнд, ацетамнд). Для синтеза низших жирных аминов вместо алкнлгало-
алкнлгалогенндов удобно использовать соответствующие эфнры я-толуолсульфокнслоты.
Реакция применяется для синтеза первичных аминов, амниогалогенндов,
амнносинртов, амннотнолов, амнноннтрнлов, амнноальдегидов н аминокислот.
Модификация Инга—Мапске (Ing — Manske)—расщепление N-замещепно-
го фталнмнда гндразингндратом. Это существенно повышает выход амнна и
имеет особенное значение в синтезе аминов, содержащих группы, чувствительные
к гидролизу:
C-NHR
H2NNH2H2O ^\/ 4N Pa=>6. HC1
:nr *- I i »- rnh2 +
Ч/Ч /NH
CO CO
ч
CO
СО
См. также Делепин (№ 241), Сервисен (№ 539).
Gabriel S., Вег., 1887, Bd. 20, S. 2224.
Ing H. R., Manske R. H. F., J. Chem. Soc, 1926, p. 2348.
Sakellarios E. J., Helv. chim. acta, 1946, v. 29, p. 1675.
Gibson M. S., Bradshaw R. W., Angew. Chem., 1968, Bd. 80, S. 986.
Hendrickson J. В., Bergeron R., «Tetrahedron Letters», 1973, № 39, p. 3839—
3842.
Губен И. Методы органнческой хнмнн. Пер. с нем. Под ред. А. Я. Берлина
и др. Т. 4. М„ Госхнмнздат, 1949, с 461.
Вейганд-Хильгетаг, с. 414.
132
187. ГАЛЛАХЕР —ХОЛЛАНДЕР
(GALLAGHER — HOLLANDER)
Уменьшение длины углеродной цепн карбоновых кнслот на два атома угле-
углерода через стадии получения хлорангндрнда, превращения его в дназокетон, за-
затем в а-хлоркетон, восстановления, бромнровання н дегндробромнровання с по-
последующим окислительным расщеплением полученного непредельного кетона
действием хромового ангидрида, например:
RCH,CH2COOH
SOClo
RCH2CH,COC1
CH2N2; в "С
(эфир)
-*¦
на
RCH2CH2COCHN2 —^ RCH2CH2COCH2Cl
Br2
Zn
-*¦
RCH2CH,COCH,
RCH=CHCOCH3
RCH2CHBrCOCH3
CrO3
(CH3COOH)
коллидин
RCOOH
Метод не находит широкого применения из-за многостадийное™ н низкого
выхода конечного продукта.
См. также Барбье —Виланд (№ 43), Крафт (№ 334), Мишер (№ 407).
Hollander V. P., Gallagher Т. F., J. Biol. Chem., 1946, v. 162, p. 549.
Физер JI., Физер М. Химия природных соединений фенантренового ряда.
Пер. с англ. Под ред. В. М. Родионова. М.-Л., Госхнмнэдат, 1953, с. 379.
188. ГАНЧ (HANTZSCH)
Получение замещенных пирндннов циклоконденсацией эфнров р-кетокнелот
с альдегидами и аммиаком с последующим окислением образовавшихся дигнд-
ропнрндннов:
2RCCH2COOC2H5 + R'CHO
У
NH3; нагревание
(С2Н5ОН или СН3ОН)
О
сгн6оос
RC=CHCOOC2H5 + RC—ССООС2Н5
I И II
NH2 О CHR'
с2н6оо
о зо%)
= Alk, C6H6; R'=H, Alk, C6H6
133
Аналогично реагируют р-дикетоны. При ином соотношении реагентов
A моль Р-дикарбоиильиого соединения и 2 моль альдегида) получают пириди-
ны, минуя стадию окисления:
CH2R
СН3ССН2СООС8Н5 -f 2RCHaCHO
й
О
NHg
С2Н6ООС
H,G
N
B0—30%)
Вместо ацетоуксусного эфира и аммиака можно применять р-аминокротоно-
вын эфир*, в качестве карбонильной компоненты — Р-хлорвииилкетоны:
СН3С=СНСООС2Н5
I
NH2
RCCH=CHC1
II
О
N
Модификация Кнёвенагеля (Knoevenagel)—конденсация р-кетоэфиров с
альдегидами и последующая обработка гидроксиламином:
NH2OH; 120 °С
СН8ССН2СООС8Н6 + С,Н6СНО >¦ С6Н6СН ГСНСОСНЛ
О [COOC2H6J2
(Н2О)
N
См. также Гаттерман — Скнта (№ 196), Гуарескн — Торп (№ 224), Мейер —
Мор (№ 393), Петренко— Кричеико (№ 450), Чичибабин (№ 698).
Hantzsch A., Ann., 1882, Bd. 215, № 1, S. 72; Вег., 1885, Bd. 18, S. 1744;
1886, Bd. 19, S. 289.
Loev В., Snader К. М., J. Org. Chem., 1965, v. 30, p. 1914.
Norcross B. E., Clement G., Weinstein M., J. Chem. Educ, 1969, v. 46,
p. 694.
Pyridine and its Derivatives. Ed. E. Klingsberg. V. 1. New York, Interscience,
1960, p. 500.
Кочетков Н. K-, Усп. химии, 1955, т. 24, с. 47.
Эльдерфильд, т. 1, с. 356.
189. ГАНЧ (HANTZSCH)
Замыкание пиррольного кольца при конденсации ацетоуксусного эфира,
а-хлоркетонов и аммиака (или аминов):
С2Н6ООС-СН2 CH2CI NH3 ГС8Н5ООС-СН СН2СП нагревание
I + I >¦ И + I I *-
СН3-С=О COR L СН,—С—NH2 COR
СООС2Н6
*Этот вариант реакции называют также синтезом Ганча — Бейера (Beyer).
134
Вариантом этой реакции является реакция Файста — Бенарн (см. № 597),
приводящая к производным фурана.
См. также Кнорр (№ 310), Пааль —Кнорр (№ 439).
Hanlzsch А., Вег., 1890, Bd. 23, S. 1474.
Agosta W. С, J. Org. Chem., 1961, v. 26, p. 1724.
Roomi M. W., MacDonald S. F., Can. J. Chem., 1970, v. 48, p. 1689.
Эльдерфильд, т. 1, с. 104, 224.
190. ГАНЧ (HANTZSCH)
Получение тназолов взаимодействием а-галогенкетонов или а-галогенальде-
гндов с тноамидамн:
R'\
R'CO нагревание R'CO NH-HX V~N
[ +R"CSNH2 — >- I !| v R-</
(инертн.
растворитель)
RO N
рнг C
\
ч
R, R' =H, Alk, Ar; R" = H, NH2> NHR, NR2, Ar, OAlk; X = Cl, Br
* H2O, води. С2Н5ОН
В реакцию вступают и соответствующие производные гетероциклических
соединений.
В качестве карбонильного соединения применяют также а-диазокетоны,
а-галогенкнслоты, смесь кетонов с SOjClj или Ь, ацеталн а-галогенальдегидов.
Вместо тноамнда можно использовать смесь амида с P2S5, а также соли и эфн-
ры дитнокарбамнновой кислоты:
На
С1СН2СОСН3 + CH3CONH2
P2S5; нагревание
(C6HG) '
С,Н5СОСН3 + H2NCSNH,
I2; 100 °С
СН3СОСН2С1 + H2NCSONH4
С6Н6СОСН2С1 + H2NCSSNH4
(изо-С3Н7ОН)
(-90%)
135
HantzschA. e. a., Ann., 1888, Bd. 249, S. 1.
Эльдерфильд, т. 5, с. 402; OP, т. 6, с. 302.
191. ГАСТАЛЬДИ (GASTALDI)
Получение производных пнразнна при циклоконденсации аминоцианометнл-
кетонов под действием соляной кислоты:
NH
2RC-CHNHSO3Na
11 I
О CN
на
МГ
NH
R = Alk, C,H4
NO
N
Дигидропиразнны, являющиеся первичными продуктами конденсации, само-
самопроизвольно окисляются на воздухе в пиразины. Побочный продукт при окис-
окислении — моиоцианопиразин.
Амииоцианометилкетоны получают следующим образом:
NaHSOs KCN
RCCH=NOH >¦ RC-CHNHSO3Na >
О
О OSO.Na
RC—CHNHSO3Na
11 1
О CN
См. также Гуткнехт (№ 226), Штедель — Рюгхаймер (№ 724), Джонс
(№ 248).
Gastaldi G., Gazz. chim. ital., 1921, v. 51, p. 233; С A., 1922, v. 16, p. 101.
Golobok E., Spring F. S., J. Chem. Soc, 1949, p. 1364.
Sharp W., Spring F. S., J. Chem. Soc, 1948, p. 1862.
Эльдерфильд, т. 6, с. 325
192. ГАТТЕРМАН (GATTERMANN)
Обмен диазогруппы на галоген или цианогруппу при каталитическом разло-
разложении солей диазоння в присутствии порошка меди:
ArN2X
-50 °с
[Си]; (води. НХ)
АгХ
D0-50%)
Х = С1, Br, CN, NO2 и др.
В реакции используют свежеприготовленный порошок меди, который полу-
получают действием цинковой пыли на водный раствор C11SO4.
В аналогичных условиях при действии сернистой кислоты образуются суль-
финовые кислоты:
H2SO3
ArN2X —-»- ArSO2H
L^UJ
Метод не имеет широкого применения в органическом синтезе, поскольку
выходы продуктов ниже, чем в реакции Зандмейера (№ 261). К достоинствам ме-
метода относятся простота проведения н низкая температура реакции.
См. также Швехтен (№ 693), Шиман (№ 708).
136
Gattermann L, Вег., 1890, Bd. 23, S. 1218.
Hodgson H. H., Chem. Rev., 1947, v. 40, p. 251.
Cowdrey W. A., Davies D. S., Quart. Rev., 1952, v. 6, p. 358.
СОП, т. 1, с 136.
193. ГАТТЕРМАН (GATTERMANN)
Формилированне фенолов или их эфиров действием цианистого водорода
и хлористого водорода в присутствии хлористого цинка с последующим гидро-
гидролизом продуктов присоединения:
CH=NH-HCt CHO
НС1; нагревание
[ZnCl2]*; (эфнрТ*
Н2О
OR'
(-80%)
R = Н, Alk, CHO, COOR", NO2, Hal; R' = Н, Alk
* AlClg, A1C13+KC!; ** СНС13> С6Н5С1 и др.
Вместо HCN можно использовать сиж-триазнн. Реакция применима к поли-
полициклическим (в том числе н конденсированным) и многоатомным фенолам,
а также к некоторым гетероциклическим соединениям, например:
С2Н6О ОС2Н5 С2Н5О ОС2Н5
ОНС
сно
)-сн3
NH
Модификация Адамса (Adams) — замена смеси HC1+HCN смесью
Zn(CNJ+HCl. Это приводит к увеличению выходов альдегидов (>90%)
и позволяет формилировать ароматические углеводороды*, например:
СНО
zn(CNJ + на
у.
сн3
Модификация Хинкеля (Hinkel) — использование комплекса A1C13-2HCN
в хлорбензоле или дихлорэтане. Это дает возможность формилировать много-
многоядерные углеводороды (например, фенантрен).
¦Называют также реакцней Гаттермана — Адамса.
137
Модификация Шаха — Лайвалла (Shah — Laiwalla)
изводных резорцина в условиях модификации Адамса:
ОН ОН
- формилирование про-
•СНО
Zn(CNK + НС1
-ОН ~у ^ОН
COR COR
R = Alk, OAlk, CeH6
См. также Гаттерман — Кох (№ 195), Губен —Фишер (№ 225), Раймер —
Тиман (№ 490), Фишер —Цервек (№ 616), Хеш (№ 658).
Gatterman L. е. а., Вег., 1898, Bd. 31, S. 1149, 1765, 1770; 1899, Bd. 32, S. 278,
284, 289; Ann., 1907, Bd. 357, S. 313.
Hinkel L. E. e. a., J. Chem. Soc, 1936, p. 339.
Shah R. C, Laiwalla M. C, J. Chem. Soc, 1938, p. 1828.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер.
с англ. М., Издатинлит, 1949, с. 569.
Физер, т. 4, с. 187; т. 5, с. 430; РИМИОС, т. 7, с. 307; ОР, т. 9, с. 45.
194. ГАТТЕРМАН — КАНЦЛЕР (GATTERMANN — CANTZLER)
Получение арилизоцианатов действием циаиата калия в присутствии порош-
порошка меди на соли арилдиазония:
КОСЫ
ArN2Cl — >- ArNCO
[Cu-порвшок]
Ar = CeH6, CeH4CH3, С„Н4ОСН3, С„Н4Вг
Аналогично реагирует 1,3,5-триметилфенилдиазоний. Реакция не имеет боль-
большого препаративного значения вследствие низких выходов.
См. также Зандмейер (№ 261).
Gattermann L., Ber., 1890, Bd. 23, S. 1225.
Gattermann L., Cantzler A., Ber., 1892, Bd. 25, S. 1086.
Cowdrey W. A., Davies D. S., Quart. Rev., 1952, v. 6, p. 363.
Houben-Weyl, 1952, Bd. 8, S. 127.
195. ГАТТЕРМАН - КОХ (GATTERMANN - KOCH)
Формилирование ароматических углеводородов действием окиси углерода
и хлористого водорода в присутствии кислот Льюиса:
АгН
СО + НС1 (или НВг); 35—50 СС
[А1С!3]ф; *
[АгН + НСОС1-А1С13]
Ar = CeH4Alk, СвН4С1, СвН6
> АгСНО
D0-60%)
* А1Вг3, АП3, FeCl3, BF3; ** C6H6NO2, без растворителя
В реакцию вступают также конденсированные полициклические углеводоро-
углеводороды, полиалкилбензолы, фенолы не реагируют. Катализаторы обычно активируют
138
добавками Cu3Xj, NiCb, TiCU и т. п. При проведении реакции под давлением
C0—90 кгс/см2, 25—60 °С) без применения активаторов выходы альдегидов до-
достигают 90%. В ароматическое ядро вступает лишь одна формильная группа,
почти исключительно в яара-положение к имеющемуся заместителю. Побочные
процессы: миграция алкильных групп, дезалкилирование.
Реакция является важным техническим методом получения ароматических
альдегидов.
См. также Вильсмайер (№ 166), Гаттерман (№ 193), Раймер — Тиман
(№490), Рихе (№513).
Gattermann L, Koch J. A., Ber., 1897, Bd. 30, S. 1622.
Dilke M. H., Eley D. ?>., J. Chem. Soc, 1949, p. 2601, 2613.
Bruce J. M., Sutcliffe F. K., J. Chem. Soc, 1956, p. 3824.
Вейганд-Хильгетаг, с. 776; РИМИОС, т. 7, с. 277; OP, т. 5, с. 271.
196. ГАТТЕРМАН - СКИТА (GATTERMANN - SKUA)
Получение производных пиридина циклоконденсацией натриймалонового
эфира с дихлорметиламином:
2NaCH(COORJ + H2NCHC12
НО
N
-COOR
ОН
Синтез можно рассматривать как вариант реакции Ганча (см. № 188).
Продукты реакции легко теряют карбалкоксигруппы с образованием 2,6-диокси-
пиридина, который применяют для синтеза красителей.
См. также Редделин (№ 499).
Gattermann L, Skita A., Ber., 1916, Bd. 49, S. 494.
Hollins С. The synthesis of nitrogen ring compounds. London, Bonn, 1924,
p. 201, 227.
197. ГЕЙЛЕТ— ИЛИОН (GALAT — ELION)
Ацилирование солей аминов амидами кислот:
нагревание
RNH2.HCl + R'CONHa > RNHCOR'
G0%—колич.)
R = Alk, QH6, CH2CeH5, QH4CH3> CeH4OH, CeH4—СеН„ЫН2
R' = Н, NH2, Alk, CH2CeH6
Аналогично реагирует о-фенилендиамин:
нагревание
(Носн2снгонГ
NH2-HC1 ^/ ^NH-CO
NHCO-(CHj)n—СОН
NH, Н„]
139
NH
NH
<-(СН2)„-
N
См. также Дорнов — Тайдель (№ 257), Шоттен — Бауман (№ 719).
Galat A. Elion G., J. Am. Chem. Soc, 1943, v. 65, p. 1566.
Lane E. S., J. Chem. Soc 1955, p. 1079.
198. ГЕРБЕ (GUERBET)
Получение высших спиртов автоконденсацией алифатических спиртов при
повышенном давлении в присутствии металлических катализаторов:
> 209 °С; 50—60 кгс/см2
2RCHaCH2OH - rRCH2CHO > RCH2CH=C-CHO1 4=fc
I ll J
T—t- RCH2CHj,CHCH2OH
R
R = H, Alk, изо-Alk
* Na, K. Ni-Ренея, MgO + K2CO3 + СиСггО4
Аналогично конденсируются гликоли и непредельные спирты. Реакция при-
применима также для конденсации двух разных спиртов, например, бензилового
спирта с [5-фенилэтиловым или циклогексанола с различными первичными
спиртами:
„ОН
CY + (снзьснснгон
280 °С
он
Побочный процесс: окисление спиртов до соответствующих кислот. Реакция
имеет промышленное значение, в частности для получения 2-этилгексанола.
GuerbetM.,C.r., 1899, v. 128, p. 511; 1912, v. 155, p. 1156.
Machermer H., Angew. Chem., 1952, Bd. 64, S. 213.
Miller R. E., Bennett G. E., Ind. Eng. Chem., 1961, v. 53, p. 33.
Любомилов В. И., Слесарева Л. А., Ж. орг. химии, 1969, т. 5, с. 884.
Wicha J., Chem. Ind., 1973, № 19, p. 954.
Слесарева Л. А., Любомилов В. И., Ж. орг. химии, 1973, т. 9, № 10,
с. 2025—2028.
Высшие жирные спирты. Под ред. С. М. Локтева. М., «Химия», 1970, с. 194.
140
199. ГИБС—ВОЛЬ (GIBBS —WOHL)
Каталитическое окисление нафталина кислородом воздуха с образованием
фталевого ангидрида*:
СО
-400 "С г^^У \
(85-90%)
* Окислы титана, молибдена, алюминия; ванадат олова B70 °С),
ванадовольфрамофосфат аммония
Побочные продукты — бензойная кислота и нафтохннон. Реакция использу-
используется как промышленный способ производства фталевого ангидрида.
Пат. США 1285117 A918); С. А., 1919, v. 13, р. 230.
Англ. пат. 156244 A921); Chem. Zbl., 1921, S. 1065.
PongratzA., Scholtis К., Chem. Ber., 1943, Bd. 76, S. П79.
Encyclopedia of chemical technology. Ed. E. Kirk, E. Othmer. V. 10. New York.
Interscience encycl., 1953, p. 588.
200. ГИЛМЕН —НЕЛСОН (GILMAN — NELSON)
Получение кетонов из хлор ангидридов кислот и кадмийорганическнх соеди-
соединений**:
2RCOC1 + R^
R = Alk, Ar;
2RCOR'
C0-80%)
R' = Alk (первичи.), Ar
Более реакционноспособны хлорангидриды алифатических кислот. При ис-
использовании дналкилкадмия, содержащего вторичные и третичные алкмльные
радикалы, за исключением динзопропилкадмня, выходы кетонов обычно иизки.
В реакцию вступают также хлорангидриды кислот, содержащие функциональ-
функциональные группы, и ангидриды кислот, например:
2С1СН2СОС1 + (я-С4Н9)/М > 2С1СН2СОС4Нв-я
СН2—СО
СН»-СО
:о
2R'COCH2CH2COOH
Побочный процесс—образование третичного спирта вследствие взаимодей-
взаимодействия диалкнлкадмия с образующимся кетоном. Метод имеет преимущества но
сравнению с методом Блэза (см. № 87) вследствие доступности дналкилкадмня
и более высоких выходов кетонов.
Исходные кадмнйорганические соединения получают через реактивы
Гриньяра:
Mg CdC!2
R'Br >¦ R'MgBr >¦ R?Cd
*Называют также реакцией Гибса.
**Называют также реакцией Кейсона (Cason).
141
См. также Оддо (№ 433).
Gilman #., Nelson J. Е., Rec. trav. chim., 1936, v. 55, p. 518.
Cason J., Chem. Rev., 1947, v. 40, p. 15.
Cason J., Schmitz F. F., J. Org. Chem., 1963, v. 28, p. 555.
Shisla R. M., Hammann W. C, J. Org. Chem., 1970, v. 35, p. 3224.
OP, т. 8, с 44.
201. ГЛАЗЕР (GLASER)
Получение диацетиленов окислительной конденсацией ацетиленидов меди под
действием кислорода воздуха в спиртово-аммиачном растворе*:
Си2С12
2RCssCCu
(NH3 + C2H5OH)**
RC=C—CsCR
(-50-60%)
R = Alk, Ar
* K3Fe(CN)e, CuCl2, Си(ОСОСНзJ; ** води. КОН, разб. НС1, QH3N и др.
Реакция проходит успешно и с ацетиленидами, содержащими различные
функциональные группы. Вместо солей меди можно использовать соли серебра
или магнийорганические соединения. Аналогично получают и несимметричные
ацетиленовые соединения, но с меньшими выходами.
Модификация Залкинда (Salkind) — одностадийный процесс с использова-
использованием СигСЬ в водном растворе NH4C1 (выходы до 90%).
Модификация Франке — Майстера — Хея (Franke — Meister — Hay) — ис-
использование каталитических количеств комплекса C112CI2 — амии (пиридин,
М,М,М',М'-тетраметилэтилендиамин и др.) в избытке органического растворителя.
Модификация Эглинтоиа (Eglinton) — использование Си(ОСОСН3)г в C5H5N.
Это позволяет получать линейные и циклические полиины типа:
«НС==С—Y-C=CH
С=С—(С=С—Y—С==С) („_!,—CesC
I у '
Y = алифатический или ароматический радикал, содержащий
функциональные группы
См. также Штраус (№ 729), Кадио — Ходкевич (№ 280), Фрис —Ломан
(№631).
Glaser С, Ann., 1870, Bd. 154, S. 159; 1869, Bd. 2, S. 422.
Eglinton G., Galbreith A., Chem. Ind., 1956, p. 783. "
Gensler W. J., Chem. Rev., 1957, v. 57, p. 215.
Эглинтон Г., Макрае В., Усп. орг. химии, 1966, т. 4, с. 239, 242, 310.
Котляревский И. Л., Шварцберг М. С, Фишер Л. Б. Реакции ацетиленовых
соединений. Новосибирск, «Наука», 1967, с. 173.
¦ Называют также реакцией Глазера — Залкинда.
142
202. ГОГТ (GOGTE)
Получение замещенных а-пиронов С-ацилированием ангидридов Р-арилглу-
таконовых кислот в присутствии пиридина с последующим нагреванием в ва-
вакууме:
R R R
R = Ar; R' = СН3, CeH6> СвН4Вг-л
При нагревании С-ацилированных производных происходит выделение
с одновременной миграцией заместителя R'. Аналогично протекает реакция с
2 моль ацилгалогенида:
R
I
R
2R'COC1
О
R'CO.
HO
COR'
COR'
Исходные ангидриды получают действием ацетилхлорида иа соответствую-
соответствующие кислоты.
См. также Оддо (№ 433).
Gogtc С. R., Proc. Ind. Acad. Sci., 1938, v. 7A, p. 214; С. А., 1938, v. 32,
№ 5389.
Эльдерфильд, т. 1, с. 280.
203. ГОЛЬДШМИДТ (GOLDSCHMIDT)
Получение формиата натрия из окиси углерода и едкого натра*:
NaOH; 120-150 "С; 6-8 кгс/см2
СО •- HCOONa
Реакция проходит с количественным выходом и используется в промышлен-
промышленности для получения муравьиной кислоты.
Klages F., Lehrbuch der organischen Chemie. Bd. 1. Berlin, De Gruyter, 1952.
S. 357, 359.
Encyclopedia of chemical technology. Eds. R. E. Kirk, D. E. Othmer, V. 10, New
York, Interscience encycl., 1966, p. 101.
204. ГОМБЕРГ (GOMBERG)
Получение триарилметильных радикалов дегалогеиироваиием триарилметил-
галогеиидов при действии серебра в атмосфере двуокиси углерода:
Аг3СХ
Ag»; -20 °С
(СвНв)" *
* Hg, Zn-пыль, Си; ** эфир, бензин, CS2, CH3COOH
¦Называют также реакцией Бертло (Berthelot) — Гольдшмидта.
143
Реакцию проводят в темноте. Для дегалогенирования лучше использовать
порошок серебра или ртуть, так как они дают легко удаляемые галогениды.
См. также Арбузов — Арбузов (№ 23).
Gomberg M., J. Am. Chem. Soc, 1900, v. 22, p. 757.
Weingarten H., J. Org. Chem., 1961, v. 26, p. 730.
Bartle M G., Mackie R. K-, Tedder J. M., J. Chem. Comm, 1974, № 7,
p. 271—272.
Уотерс У. Химия свободных радикалов. Пер. с англ. Под ред. Я. К. Сыр-
кина. М., Издатинлит, 1948, с. 48.
205. ГОМБЕРГ — БАХМАН (GOMBERG — BACHMANN)
Восстановление ароматических кетонов бинарной смесью магния и йодисто-
йодистого магния с образованием пинаконов:
Mg + Mgij (RQH4JC-OMgI н2о (RCeH4JC-OH
2(RCeH4JCO — -—*¦ | >- |
,^„„а.^„^„ч 2C-0MgI R(CgH4JC-OH
E0-95%)
(эфир + бензол) (RC,H4JC-OMgI
R
H, CH3, QH,, Cl, N(CH3J
* Mg + MgBr2
Аналогично реагируют кетоны ряда нафталина, флуоренон и ксантон. Кето-
ны ряда пиридина образуют пинаконы только при эквимольном соотношении ке-
тона и иодида магния:
О
II
¦сс,нв
он
он
-С
N
сен5 сен5
C8%)
Gomberg M., Bachmann W. Е., J. Am. Chem. Soc, 1927, v. 49, p. 236.
Bachmann W. E., Shankland R. V., J. Am. Chem., Soc, 1929, v. 51, p. 306.
Fuson R. С e. a., J. Am. Chem. Soc, 1942, v. 64, p. 30.
Fetino E. F., Amstutz E. D., J. Org. Chem., 1963, v. 28, p. 3249.
206. ГОМБЕРГ— БАХМАН — ХЕЙ
(GOMBERG — BACHMANN — HEY)
Получение диарилов конденсацией солей диазония с ароматическими или
гетероциклическими соединениями под действием водной щелочи:
NaOH'
ArN2X + Ar'H -^ Ar-Ar'
B0—70%)
X = Cl, Br, ОН, ОСОСН3
* CH3COONa
Механизм реакции — свободнорадикальный. При наличии заместителей кон-
конденсация всегда идет в орто- или napa-положенне к заместителю. Реакция
144
позволяет получать производные дифенила и терфенилов, арилзамесценные наф-
нафталины, антрахиноны, тиофены, пиридины, ферроцены и т. п.
Аналогичным образом реагируют и N-нитрозоацетиламины:
ArN(NO)COCH3 + Ar'H
-N2
Ar—Ar' + CH3COOH
Реакция имеет большое значение для получения несимметричных диарнлов.
См. также Бамбергер — Хей (№ 42), Меервейн (№ 388), Пшорр (№ 483).
Gomberg M., Bachmann W. E., J. Am. Chem. Soc, 1924, v. 46, p. 2339.
Grieve W. S. M., Hey D. H., J. Chem. Soc, 1934, p. 1797, 1966; 1938, p. 108.
Eliel E. L, Saha I. G., Meyerson S., J. Org. Chem., 1965, v. 30, p. 2451.
Kamigota N. e. a., Bull. Chem. Soc. Japan, 1971, v. 44, p. 3152.
Mann N., Baak W., Mutscler E., Arch. Pharm., 1973, v. 306, № 8, p. 625—631.
Fukata Gouki, Kawazoe Yuichi Taguchi Tanezo, «Tetrahedron Letters» 1973
№ 15, p. 1199—1200.
OP, т. 2, с 244; т. 9, с 529.
207. ГОУЛД —ДЖЕКОБС (GOULD—JACOBS)
Получение 4-оксихинолинов конденсацией ароматических аминов с этиловым
эфиром этоксиметиленмалоновой кислоты, циклизацией продукта конденсации
при нагревании с последующим гидролизом и декарбоксилированием:
С2Н5ООСЧ
С-СООС2Н5
240-250 °С
(минеральное
масло)*
C0-80%)
R = H, СН3, ОСН3, ОСеН5, NO2, Cl, NH2
* Даутерм А
жета-Замещенные анилины образуют главным образом 7-замещенные
4-оксихииолины. В реакцию вступают также амины гетероароматического ряда.
Вместо этоксиметиленмалоната, получаемого конденсацией малонового и
ортомуравьиного эфиров, можно использовать этоксиметиленциануксусный эфир,
но при этом циклизация протекает медленнее н с меньшими выходами.
См. также Комб (№ 315).
Gould R. G., Jacobs W. A., J. Am. Chem. Soc, 1939, v. 61, p. 2890.
Markees D. G., Schwab L. S., Helv. chim. acta, 1972, Bd. 55, № 4, S. 1319—
1326.
Эльдерфильд, т. 4, с. 29; СОП, т. 4, с. 239.
10-684 145
208. ГОФМАН (HOFMANN A. W.)
Термическое расщепление четвертичных аммониевых оснований с образова-
образованием олефинов и третичных аминов (исчерпывающее метилирование):
СН31
->- чгн г n»j:h. i
(Н2О)
I ch3i \ I +
VH_C-NR3 > )CH-C-NR2CH3 Г
| (С2Н5ОН) / |
(CaHsOH)
I + 100—200 CC
)CH_C-NR2CH3 "OH (HaO)>; [pd]».
R2NCH3
Без растворителя;
без катализатора
Реакцию можно проводить и без выделения оснований, нагревая соли ам-
моиия с водными растворами щелочей. Разложение четвертичных аммониевых
оснований проводят также без нагревания в присутствии металлоорганических
соединений (например, C6H5Li) или KNH2 в жидком NH3. Расщеплению под-
подвергаются алифатические, алициклические и гетероциклические аммониевые ос-
основания (за исключением производных пиридина и других азотсодержащих гё-
тероциклов):
(CH3LN "ОН >¦ (CH3KN + CH3OH
-N(CH3K "ОН
(CH3KCHCH2N(CH3K "ОН
/Г
D5%)
N(CH,J
Если атом азота связан с различными заместителями, то олефии образует-
образуется из заместителя с наименьшим числом атомов углерода (правило Гофмана).
Основной побочный процесс — замена R3N-rpynnn на ОН-группу.
Метод «исчерпывающего метилирования» позволяет установить природу
групп, связанных с атомом азота, например:
СН31
100—200 СС ^^S 2- Ag2O rf''^'4! 100—200 °С
(CH3JN+ "ОН
N(CH3J
(CH3JN+ ~OH
Реакция находит применение в синтезе полиенов и при установлении строе-
строения алкалоидов.
Модификация Родионова — использование n-CH3CeH4SO2OCH3 вместо CHsI
для получения четвертичных солей. Это позволяет с высокими выходами прово-
проводить расщепление сложных молекул (наркотина и т. п.).
См. также Браун (№ 110), Внттиг (№ 169), Каур — Гофмаи (№ 286), Коуп
(№ 330), Эмде (№ 738).
Hofmann A. W., Вег., 1881, Bd. 14, S. 494, 659; Ann., 1851, Bd. 78, S. 253;
1951, Bd. 79, S. 11.
Bestmann H. J., Haberlein H., Pits I., «Tetrahedron», 1964, v. 20, p. 2079.
Simon //., Mullhofer G., Chem. Ber., 1964, Bd. 97, S. 2202.
Petrariu I., Stamberg J., Rev. Chim., 1972, v. 23, p. 16.
Smith P. J., Can. J. Chem., 1974, v. 52, p. 365—370.
Фьюзон, с. 269; OP, т. 11, с. 327; OR, v. 18, p. 404.
146
209. ГОФМАН (HOFMANN A. W.)
Получение третичных алифатических аминов алкилированием аммиака ал-
килбромидами под давлением:
NH3; 180 СС, 25-30 кгс/см2 + NH3; REr + NH3: RBr
RBr *¦ RNH3 ВГ »- R2NH2 Br~ >¦ R3N
G5-80%)
R = Alk(C7-C12)
В случае низших алкилбромидов получается сложная смесь продуктов. По-
Побочные процессы: образование первичных и вторичных аминов и четвертичных
солен аммония.
Реакция используется для полупромышленного синтеза высших алифатиче-
алифатических аминов. .
См. также Меншуткин (№ 397).
Hofmann A. W., Ann., 1850, Bd. 73, S. 91; 1861, Bd. 79, S. 16.
Ласкорин Б. Н., Скороваров Д. И., Семенов В. А., ЖПХ, 1966, т. 39,
с. 1049.
210. ГОФМАН (HOFMANN A. W.)
Перегруппировка амидов кислот в первичные амины с потерей одного атома
углерода под действием гипогалогенитов в водном растворе*:
X»; NaOH; 50-80 °С
:
(Н2О)
[RCONHX
RNCO]
v RNH2
F0-80%)
X = С1, Вг
Внутримолекулярный характер перегруппировки подтверждается сохране-
сохранением конфигурации в случае оптически активных амидов. Реакция позволяет
получать алифатические, ароматические, алициклические, гетероциклические
амииы и аминокислоты. Если R = Ar, то наличие электроиодонорных заместите-
заместителей в мета- или яара-иоложениях ускоряет реакцию.
Проведение процесса в спиртовом растворе приводит к образованию урета-
нов. Для увеличения выхода аминов из амидов высших жирных кислот прово-
проводят реакцию в спиртовом растворе, а образовавшиеся уретаны омыляют далее
до аминов:
Br2; CH3ONa
RNHCOOCH3
RCONH23
При избытке брома образуются нитрилы:
RCH2CONH2 » RCH2NH2 v RCH2NX2
RNH2
RC=N
Амиды а-окси- или а,р-непредельиых кислот превращаются в альдегиды,
а амиды пропиоловых кислот — в нитрилы:
RCH=CHCONH2 >- RCH2CHO
RCsCCONH2 * RCH2CN
¦Называют также расщеплением амидов по Гофману.
10*
147
Важным примером использования реакции в промышленности является син-
синтез антраниловой кислоты из фталевого ангидрида:
со
\
со
о
NH3
со
\ NaOCl
NH
ос
соон
(95%)
См. также Курциус (№ 345), Лоссен (№ 369), Шмидт (№ 714).
Hofmann A. W., Вег., 1881, Bd. 14 S. 2725; 1882, Bd. 15, S. 407, 752, 762;
1884, Bd. 17, S. 1406; 1885, Bd. 18, S. 2734.
Ban D. A., Haszeldine R. N.. Chem. Ind., 1956, p. 1050; J. Chem. Soc, 1957,
p. 30.
Patterson J. M. e. a., J. Org. Chem., 1962, v. 27, p. 3148.
Lee Kong Ко е. a., Chem. Pharm. Bull., 1969, v. 17, p. 2540.
Rachon J., Wasielewski C, Sobczak A., Z. Chem., 1974, Bd. 14, № 4, S. 152—
154.
Фьюзон, с. 177; OP, т. З, с. 255.
211. ГОФМАН (HOFMANN A. W.)
Превращение первичных аминов в изоиитрилы под действием хлороформа
в щелочном растворе:
нагревание
[RN=CHC1]
RNC
Реакцию используют для качественного обнаружения аминов. Характерный
интенсивный запах изоиитрила ощущается даже при очень малом количестве
первичного амина.
См. также Ван-Слайк (№ 147).
Hofmann A. W., Ann., 1868, Bd. 146, S. 107; Вег., 1870, Bd. 3, S. 767.
Ugi I. e. a., Angew. Chem., 1965, Bd. 77, S. 494.
Houben-Weyl, Bd. 2, S. 643.
212. ГОФМАН —ЗАНД (HOFMANN К. А. — SAND)
Меркурирование олефииов присоединением солей ртути в щелочном рас-
растворе:
HgX*; NaOH -
RCH=CH2
(Н2О)
RCH=CH2
_ Hg _
R = Alk
* Hg(OCOCH3J> HgNO3,
э
HgSO4
- RCH CHa
OH HgX
При проведении реакции в спирте получаются соответствующие алкоксисо-
единеиия.
148
Обычно происходит граяс-присоедииеиие, однако в случае норборнеиа и дру-
других напряженных систем наблюдается ^ыс-присоедниеиие:
См. также Деииже (№ 243).
Hofmann К. A., Sand. J., Ber., 1900, Bd. 33, S. 1340, 1353.
Chatt J., Chem. Rev., 1951, v. 48, p. 7.
Kitching W., Organomet. Chem. Rev., 1968, v. 3, pt. A, p. 61.
Физер, т. З, с. 182; т. 5, с. 368.
213. ГОФМАН — ЛЕФЛЕР —ФРАЙТАГ
(HOFMANN A. W. - LOFFLER - FREYTAG)
Замыкание пирролидинового кольца при нагревании N-галогеипроизводиых
вторичных алифатических амииов в коицеитрированной сериой кислоте:
CH3(CHa)aCHNR'
а
конц. H2SO4; 95-120 °С
X = Вг, лучше CI
NR'
(-78%)
Аналогично реагируют хлорпроизводиые первичных амииов.
Повышение выходов прн УФ-облучении в 85%-ной H2SO4 при ~20°С под-
подтверждает свободнорадикальиый механизм реакции.
Метод применяется также для синтеза бициклических третичных аминов,
например:
См. таиже Ладенбург (№ 351).
Hofmann A. W., Вег., 1883, Bd. 16, S. 558, 586.
Loffer К., Freytag С, Вег., 1909, Bd. 42, S. 3427.
Wolff M. E., Chem. Rev., 1963, v. 63, p. 55.
Kovacic P., Lowery M. K-, Field K. W., Chem. Rev., 1970, v. 70, p. 661.
Furstoss R., Teissier P., Waegell В., «Tetrahedron Letters», 1970, p. 1263.
Dupeyre R. M., Rassat A., «Tetrahedron Letters», 1973, № 29.
СОП, т. 3, с 29.
149
214. ГОФМАН — МАРЦИУС (HOFMANN A. W. — MARTIUS)
Термическая перегруппировка гидрохлоридов N-алкиланилинов в С-алкил-
анилины:
200—300 СС
CeH5NHR-HX > [C6H5NH2 + R+ + X"]
X=CI, Br
R—CaH4NHa-HX
E0-70%)
В реакцию вступают также ^^диалкиланилины. В основном образуются
пара-изомеры. Миграция первичных алкильных групп происходит при более вы-
высокой температуре, чем вторичных. Если R имеет разветвленную цепь, то в про-
процессе перегруппировки идет также изомеризация радикала, например:
CeH5NH(CH2JCH(CH3)a > я-(СН3KССНа-СеН^На
Побочными продуктами реакции всегда являются RX и олефины.
Модификация Рилли — Хикинботтома (Reilly — Hickinbottom)* — перегруп-
перегруппировка в присутствии галогенидов металлов:
-240 °С
C3H5NHR-HX ¦?—+; R—CeH4NH2-X
* ZnCl2> C.dCI2
Побочные продукты не образуются; изомеризация R не происходит.
См. также Бамбергер (№№ 39, 40), Кляйзен (№ 300), Ладенбург (№ 350),
Фишер — Хепп (№ 615), Фрис (№ 630), Четтэуэй (№ 696).
Hofmann A. W., Martius С. А., Вег., 1871, Bd. 4, S. 742.
Hughes E. D., Ingold С. К-, Quart. Rev., 1952, v. 6, p. 45.
Fischer A., Topson R. D., Vaughan J., J. Org. Chem., 1960, v. 25, p. 463.
Odata Y., Tokagi Katsuhiko, J. Org. Chem., 1970, v. 35, p. 1642.
Ингольд, с. 495.
215. ГРАКАУСКАС (GRAKAUSKAS)
Фторирование щелочных солей полинитроалканов элементарным фтором
в воде с образованием а-фторнитроалканов:
F2: N2; 0-5 сс
:=NO2- M+ ,..„, > RC(NO2JF
(НаО)
NO2
F0-90%)
R = H, Alk, NO2; M = Na, К
В реакцию вступают также нитросоединения с различными функциональны-
функциональными заместителями, например:
CH3OOCCH2CH2-C(NO2J К+ ¦
CO[NHCHaC(NO2)a]2 2K+
СН3ООССНаСНа—C(NOaJF
(88%)
- CO[NHCH2C(NOa)aF]2
C0%)
¦Называют также перегруппировкой Рилли — Хикииботтома.
150
У мононитроалканов фторирование происходит с низкими выходами
E-15%).
См. также Саймоне (№ 534).
Grakauskas V., Baum K-, J. Org. Chem., 1968, v. 33, № 8, p. 3080.
Kamlet M. J., Adolph H. G., J. Org. Chem., 1968, v. 33, p. 3080.
Еременко Л. Г. u др., Изв. АН СССР. ОХН, 1970, с. 2556
Новиков С. С. и др., Химия алифатических и алициклических иитросоеди-
нений. М., «Химия», 1974, с. 117.
216. ГРЕБЕ —УЛЬМАН (GRAEBE — ULLMANN)
Получение карбазолов термическим расщеплением бензотриазолов:
N
,N
N-
R'
-СС
-350 "С
R'
NH
R, R' = Н, Alk, NH2, CI, NO2, CN, COCH3
Реакция проходит с хорошими выходами. Электроноакцепторные заместите-
заместители (R, но не R') затрудняют реакцию. Аналогично из 1-пиридилтриазолов обра-
образуются карболины.
Исходные бензотриазолы получают из о-аминодиариламннов действием
HNO2 или арилированием бензотриазола.
См. также Борше — Дрексель (№ 102), Бухерер (№ 128), Тойбер (№ 571),
Хафнер (№ 644).
Graebe С, Ullmann F., Вег., 1894, Bd. 27, S. 3483; Ann., 1896, Bd. 291, S. 16.
Ashton В. W., Suschitzky H., J. Chem. Sot, 1957, p. 4559.
Nantka-Namirski P., Acta Polon. Pharm., 1966, v. 23, p. 331.
Advances in heterocyclic chemistry. V. 3. Ed. A. R. Katritzky. New York — Lon-
London, Acad. press, 1964, p. 128.
Эльдерфилъд, т. З, с. 235; т. 7, с. 187.
217. ГРЕВЕ (GREWE)
Получение N-метилморфинана и его аналогов из солей тетрагидроизохиноли-
ния и бензилмагиийхлоридов с последующим каталитическим восстановлением
образовавшихся дненамииов и циклизацией под действием фосфорной кислоты:
151
В г
CH2MgCl
NCH3
NCH,
HC1
Грь/Basei]*
R= H,OH
* Pd/C
Аналогично из солей пиридиния и бензилмагнийхлорида получают бенао-
морфаиы:
R
NCH3
+ R
H2MgCl
Г
NCH3
r=h,och3; r'=h,ch3
Продукты реакции обладают обезболивающим действием.
Grewe R., Mondon A., Chem. Ber., 1948, Bd. 81, S. 279.
Schnider O., Frussner A., Helv. chim. acta, 1949, Bd. 32, S. 821.
May E. L, Ager I. H,, J. Org. Chem., 1959, v. 24, p. 1432.
218. ГРЕНАХЕР (GRANACHER)
Конденсация альдегидов с роданином и последующее расщепление продук-
продукта конденсации под действием щелочей с образованием а-тиоксокислот:
RCHO
CH3COONa«
>
ч
NH NaOH; нагревание
>S
S S
R = Alk, Ar
* NH4C1 в NH4OH
В реакцию вступают также гетероциклические альдегиды, например:
сно
-NH
RCH2CCOOH
NH
152
а-Тиоксокислоты могут использоваться для синтеза соединений различных
классов, например а-меркапто-, а-кето-, а-амино- и а-оксиминокислот:
Na/Hg
RCH.CCOOH —
Zn/Hg
(HCI)
NH4OH
RCHjCHCOOH
SH
RCH2CH,COOH
CeH5NHNH2
RCH.CCOOH —
RCH3CCOOH
II
0
Na/Hj?
*- RCHjCCOOH
II
NNHCeH5
nh2oh Zn
>- RCH2CCOOH (СНзСООН)
NOH
RCH2CHCOOH
NH,
а-Оксиминокислоты под действием уксусного ангидрида претерпевают одно-
одновременную дегидратацию и декарбоксилирование, образуя нитрилы:
(СН3СО)гО;
нагревание
RCH2C—СООН »¦ RCH2CN
R
NOH
См. также Кнёвенагель (№ 305), Эрленмейер — Плёхль (№ 740).
Granacher Ck, Helv. chim. acta, 1922, Bd. 5, S. 610; 1923, Bd. 6, S. 458, 467.
Gaudry R., Mclvor R. A., Can. J. Chem., 1951, v. 29, p. 427.
Houben-Weyl, Bd. 9, S. 38.
219. ГРИНЬЯР (GRIGNARD)
Методы синтеза органических соединений на основе присоединения реакти-
реактивов Грииьяра к поляризованным кратным связям* (С = О, C^N, C = S, S = O,
N = 0) (магиийоргаиический синтез), например:
RX —-> RMgX
(эфир • ^
\.
С=О
Н2О
~:c-oh
X-0-MgX
I
R
X = С1, Вг (обычно), I
* Тетрагидрофураи, эфиры гликолей, диоксан, (С3Н7JО, (С4Н9KО и др.
Реактивы Грииьяра — алкил- или арилмагнийгалогениды — получают взаи-
взаимодействием магния с соответствующими галогенпроизводными, активность ио-
торых уменьшается в ряду RI > RBr > RC1. Реакция позволяет получать
¦Реакцию впервые применил Барбье (Barbier), поэтому ее называют также
реакцией Барбье—Гриньяра.
153
соединения различных классов: спирты (I), кетоны (II), альдегиды* (III), кис-
кислоты (IV), р-кетоспирты (V)**:
I н,С CH, + RMgX > RCH2CH2OH
V
R'CHO + RMgX > RR'CHOH
R'COR" + RMgX »- RR'R"C—OH
R'COX + RMgX -
(R'COJO + RMgX >- R2R'C-OH
R'COOR" + RMgX -
II. R'CN + RMgX —
R'COOR" + RMgX -
R'C(OR"K + RMgX —
III. HC(OR'K + RMgX -
HCOOR' + RMgX —
IV. RMgX + CO2 -
V. 2RCOCH3 + CeH5N-MgBr
CH,
RCOR'
-- RCHO
RCOOH
* RC(CHo)CH2CR
I II
ОН О
Реактивы Гриньяра используются также для синтеза элемеитоорганических
соединений, например:
CeH5MgX + SnCl4 v (C6H5LSn
C2H5MgBr + AsCl3 >¦ (C2H5KAs
CHaMgBr + HgBr2 * CHgHgBr
Побочными процессами являются образование углеводородов
RX + RMgX > R—R + MgX2
я олефинов (в случае третичных алкилгалогенидов).
См. также Вагнер (№ 138), Нормаи (№ 428), Иоцич (№ 275), Иванов
(№ 273), Зайцев (№ 259), Реформатский (№ 507), Мальмгрен (№ 373), Шоры-
гии —Ванклин (№718).
Barbier Р., С. г., 1899, v. 128, р. 110.
Grignard V., С. г., 1900, v. 130, р. 1322.
Зелинский Н. Д., ЖРФХО, 1904, т. 36, с. 194.
Ashby Е. С, Smith М. В., J. Am. Chem. Soc, 1964, v. 86, p. 4363.
Максимов Л. Н., ЖОХ, 1973, т. 43, № 5, с. 1198.
Kharasch M. S., Reinmuth О. Grignard reactions of nonmetallic substances.
New York, Prentice-Hall, 1954. 1384 p.
Методы элементоорганической химии. Магний, бериллий, кальцин, стронций,
¦барий. Под ред. А. Н. Несмеянова и К. А. Кочешкова. М., Изд. АН СССР,
1963, 467 с.
Физер, т. 1, с. 227, 232; ОР, т. 8, с. 44.
¦Получение альдегидов из реактивов Грииьяра и муравьиной кислоты
называют также методом Зелинского.
**Называют также реакцией Гриньяра — Колоня (Cologne).
154
220. ГРИСС (GRIESS)
Диазотирование ароматических аминов азотистой кислотой в растворе ми-
минеральной кислоты:
+ HNO2; HCI*; 0—5 СС +
ArNH3 СГ *¦ Ar—N==N СГ
* H2SO4, HBr и др.
В реакции используют NaNO2 и избыток сильной кислоты, которая препят-
препятствует процессу азосочетания. Для получения твердого хлористого арилдиазо-
ния в качестве источника азотистой кислоты применяют смесь органического
нитрита и органической кислоты в эфире; при этом соль диазония, нераствори-
нерастворимая в эфире, выпадает в осадок:
ArNH3 СГ
¦ «-C.H9ONO + CHjCOOH ——»- Ar—N=N СГ + CH3COOC4H9
Наличие электроноакцепторных заместителей в ароматическом ядре способ-
способствует реакции. В среде соляной кислоты скорость диазотироваиия выше, чем
в H2SO4, а в присутствии Вг~ скорость диазотирования особенно высока. По-
Побочные процессы: превращение аминов в оксисоединения и образование диазо-
аминосоедишзний.
Диазотироваиие аминов широко применяют в синтезе многочисленных орга-
органических соединений и, особенно, в производстве красителей.
Модификация Клауса (Claus) — диазотирование в безводной H2SO4. Дей-
Действующим началом является, по-видимому, нитрозилсерная кислота. Метод ис-
используют для диазотирования аминов, плохо растворимых в кислотах, напри-
например, 4-нитро-1-нафтиламина, пикрамида и т. п.
Модификация Киёвенагеля (Knoevenagel)—диазотирование аминов алкил-
нитритами. Метод применяют для аминов, плохо растворимых в воде, а также
для выделения солей диазония. Вместо алкилнитритов иногда используют хло-
хлористый нитрозил.
Модификация Витта (Witt) — использование HNO2, образующейся' «in situ»
из концеитрированной HNO3 и метабисульфита калия:
K2S2O5 + 2HNO, >¦ K2S2O7 + 2HNO2
Метод применяют в случае слабоосновных аминов, плохо растворимых
в кислотах и индифферентных к концентрированной HNO3, например, для
2,4-динитрофениламина, 2,6-дихлор-4-нитрофениламина и т. п.
Griess P., Ann.. 1858, Bd. 106, S. 123; 1862, Bd. 121, S. 257; 1866, Bd. 137,
S. 39.
Белов Б. И., Козлов В. В., Усп. химии, 1963, т. 32, с. 121.
Хвостова В, П. и др., ЖАХ, 1973, т. 28, № 2, с. 328—332.
Саундерс Дж. Ароматические диазосоединения и их техническое применение.
Пер. с англ. Под ред. В. М. Родионова. М., ГОНТИ, 1938, с. 27.
СОП, т. 4, с. 206; Вейганд-Хильгетаг, с. 539.
221. ГРИШКЕВИЧ-ТРОХИМОВСКИЙ - МАК-КОМБИ
(GRYSZKIEWICZ-TROCHIMOWSKI — McCOMBIE)
Замена хлора или брома на фтор в эфирах галогенуксусных кислот при
действии фтористого калия:
KF; 200-220 °С
XCH2COOR *- FCH,COOR
(ДО 80%)
X = Cl, Br; R = Alk, циклогехсил
15S
Реакцию проводят в автоклаве. Использование растворителей (ацетамид,
нитробензол и т. п.) позволяет проводить реакцию при нормальном давлении
и увеличивает выходы. В реакцию вступают также эфиры высших галогенкар-
боновых кислот и галогензамещенные высшие спирты (при ~140°С).
Замена иода на фтор происходит в сложных эфирах фторированных спир-
спиртов (Кнунянц И. Л. с сотр.):
KF; 135 °С
ICH3COOCH2CH2F »- FCH2COOCH2CH2F
См. также Свартс (№ 536).
Gryszkiewicz-Trochimowski E., Sporzynski A., Wnuk J., Rec. trav. chim., 1947,
v. 66, p. 413.
МсСотЫе И., Saunders В. С, Nature, 1947, v. 158, p. 382.
Кнунянц И. Л., Кильдишева О. В., Быховская Э. М., ЖОХ, 1949, т. 19, с. 101.
Bergmann E. L, Blanc I., J. Chem. Soc, 1953, p. 3786.
Успехи химии фтора. Т. 3—5. Пер. с аигл. Под ред. А. П. Сергеева. М.-Л.,
«Химия», 1970, с. 157.
222. ГРОВЕНШТАЙН—ЦИММЕРМАН
(GROVENSTEIN — ZIMMERMAN)
Миграция фенильиой группы к соседнему углеродному атому в металличе-
металлических производных 1,1,1-трифеиилэтана:
(С6Н5KС-СН2С1 ^-^ (С6Н5KСН2 Na+
—> [(С6Н5JС-СН2С6Н5] Na
* К, Mg, Li (и кипящем эфире)
Реакционная способность металлоорганических производных увеличивается
в ряду Mg < Li < К < Na.
Аналогичная миграция происходит в случае металлических производных
2,2-дифенилпропана и 1,1-дифенил-1-п-толилэтана.
В присутствии доноров протонов (NH3, трет-С$НцОН) перегруппировка не
происходит вследствие протежирования промежуточного карбаниона.
См. также Смайлс (№ 553), Фрич — Буттенберг — Вихелль (№ 632).
Grovensiein E. е. a., J. Am. Chem. Soc, 1957, v. 79, p. 4985.
Zimmerman H. E., Smetowski F. J., J. Am. Chem. Soc, 1957, v. 79, p. 5455.
Grovenstein E., Rogers L. C, J. Am. Chem. Soc, 1964, v. 86, p. 854.
De Mayo P., Molecular rearrangements. New York — London, Interscience, 1963,
p. 391.
156
223. ГРУНДМАН (GRUNDMANN)
Получение альдегидов из хлорангидридов кислот через стадии образования
диазокетона, превращения его в ацетоксикетон, восстановления изопропилатом
алюминия и гидролиза до гликоля с последующим расщеплением под действием
тетраацетата свинца:
RCOC1
CH2N3: 0 °С
(эфнр)
С
>- RCOCH=N=N
- СНзСООН; 60-70 °С
N
RCOCH3OCOCH
1. (оэо-СзН70KА1*; нагревание
2. Гидролиз
(оэо-СзН7ОН)
RCHCH3OH
РЬ(ОСОСН8L
(СеНе)"
RCHO
B0-50%)
R = А1к, Аг
* LiAlH4; ** CH3COOH
Метод позволяет получать как алифатические, так и ароматические альде-
альдегиды с тем же числом углеродных атомов, что и в исходном хлорангидриде.
Особая ценность метода — возможность получения непредельных альдегидов.
Однако в случае а,|3-непредельных хлораигидридов вместо альдегидов образуют-
образуются пиразолины вследствие циклоприсоединения диазометана (см. также Бюхнер,
№ 135).
См. также Мак-Фейдиен — Стивене (№ 381), Райссерт (№ 492), Розен-
мунд—Зайцев (№ 524), Стефеи (№ 553), Уолфром — Карабинос (№ 587).
Grundmann Ch., Ann., 1936, Bd. 524, S. 31.
Вейганд-Хильгетаг, с. 811; OP, т. 8, с. 292.
224. ГУАРЕСКИ — ТОРП (GUARESCHI — THORPE)
Образование производных пиридина при циклоконденсации циануксусного
и а-алкилацетоуксусного эфиров с аммиаком:
СН,
CH3COCHCOOR' + NCCH2COOR'
R
ОН
R, R'=Alk
Заместитель R может содержать различные функциональные группы, а так-
также кратные связи. Возможна замена циануксусного эфира амидом ацетоуксус-
ной кислоты. С малоновым эфиром реакция не идет.
См. также Ганч (№ 188).
Guareschi I., Mem. Reale Accad. Sci. Torino, 1896 pt. 11, v. 46, p. 7, 11, 25;
1905, v. 55, p. 19, 287; Chem. Zbl., 1905, Bd. 11, S. 684.
Thorpe J. F. e. a., J. Chem. Soc, 1919, v. 115, p. 686; 1922, v. 121, p. 1756,
1821. . V
McElvain S. M., Lyle R. E., J. Am. Chem. Soc, 1950, v. 72, p. 384.
Lukes R., Kuthan I., Coll. Czech. Chem. Comm., 1960, v. 25, p. 2173.
Brunskill J. S. A., J. Chem. Soc, Perkin Trans., 1972, pt. 1, № 23, p. 2946—
2950.
157
Pyridine and its Derivatives. Ed. E. Klingsber, New York — London, Inter-
science, 1960, pt. 1, p. 361, 382.
Эльдерфильд, т. 1, с. 360.
225. ГУБЕН —ФИШЕР (HOUBEN — FISCHER W.)
Получение ароматических нитрилов конденсацией ароматических соединений
с трихлорацетонитрилом в присутствии хлористого алюминия и последующим
щелочным гидролизом образовавшегося кетимина:
R
НС1
G0-90%)
R = H, Alk, OCH3; R'= Н, ОН, Alk
* ZnCl2
Первая стадия реакции является разновидностью реакции Хеша (см. № 658).
В реакцию вступают также триалкилбензолы. Кислотный гидролиз кетими-
нов приводит к арилтрихлорметилкетонам. Из моно- нли дихлорацетонитрилов
образуются лишь соответствующие арилгалогенкетоны.
См. также Розеимунд—Браун (№ 523), Гаттерман (№ 193).
НоиЬеп ]., Fischer W., J. prakt. Chem., 1929, Bd. 123, S. 313; Ber., 1930,
Bd. 63, S. 2464.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 221.
Houben-Weyl, Bd. 4, T. 2, S. 103.
226. ГУТКНЕХТ (GUTKNECHT)
Получение замещенных пиразинов из оксиминокетонов через стадии вос-
восстановления в а-аминокетоны, циклизации их в дигидропиразииы и последую-
последующего окисления:
2RC—CR'
I! II
О NOH
SnCl*
(НС1)
R'
2RC—CHR'
II I
О NH3 _
-R
СГ
N
2RC—CHR'
I! I
О NH2
N
HgO»
P' 1N R
r-AAr'
R = H, CH3; R' = CH3) CeH5, CH2CeH4
* Zn, Al/Hg; •• O2, CuSO4
158
Превращение дигидропиразинов в пиразииы происходит настолько легко, что
промежуточиое дигидросоедииение ие удается выделить.
Исходные оксиминокетоны получают иитрозироваиием кетонов:
RCCH2R'
II
О
NaNO2
(СН3СООН)
RC—CR'
II II
О NOH
См. также Гастальди (№ 191), Штедель — Рюгхаймер (№ 724).
Gutknecht #., Ber., 1879, Bd. 12, S. 2290; 1880, Bd. 13, S. 1116.
Krems 1. J., Spoerri P. E., Chem. Rev., 1947, v. 40, p. 291.
Эльдерфильд, т. 6, с. 321, 316.
227. ДАНИЛОВ
Изомеризация альдегидов с вторичным или третичным а-углеродными ато-
атомами в кетоны-под действием кислот (альдегидо-кетонная перегруппировка)*:
/С—СНО
I
R"
—ш—о°С
>-
[КОНЦ. H2SO4]*
\ +
.с—сн
R" OH
R
R'
CHR"
ОН
> /CH—C-R"
R'/ II
о
C0-90%)
* Разбавленные минеральные кислоты (~100°С), соли Hg2+(~100°C), ZnCi.
<~350°С), РХ6 в бензоле (~20°С), А1С13 (~0 °С).;
В реакцию вступают альдегиды с алифатическими и ароматическими заме-
заместителями; перегруппировка алициклических альдегидов сопровождаетси расши-
расширением или сужением цикла:
350 °О
(СН3KС-СНО „,,,_,> (СН3JСН-СОСН3
CeH5CH(CH3)-CHO
140 °С
(колич.)
- СвН5СНа-СОСН3
(80%)
*¦ I \-сосн3
D0%)
Перегруппировка родственна пинаколиновой перегруппировке и иаблюдаетси
во многих реакциях, например при дегидратации гликолей, изомеризации
а-окисей, гидролизе оксимов и семикарбазонов альдегидов и т. д.
Данилов С, ЖРХО, 1917, т. 49, с. 282; 1929, т. 61, с. 723.
Bricker С. Е., Vail A. W., J. Am. Chem. Soc, 1951, v. 73, p. 585.
Темникова Т. И. Курс теоретических основ органической химии. Л., «Хи-
«Химии», 1968, с. 743.
РИМИОС, т. 4, с. 210.
¦Называют также реакцией Данилова — Венус-Даниловой.
159
228. ДАРАПСКИЙ (DARAPSKY)
Получение а-аминокислот из алкилциануксусных эфиров через стадии полу-
получения гндразидов, превращения их в азиды и расщепления последних по Кур-
циусу:
RCHCN H2NNH2 RCHCN NaNO2; HC1
СООС2Н5 (НгО) CONHNH2
С2Н5ОН; нагревание
RCHCN - RCHCN
(эфир)
20%-ная НС1"
СО!
IN,
NHCOOC2HS
R = Alk, C6H5
* HCOOH+HC1
RCHCOOH
NHS
D0-50%)
Метод позволяет получать различные аминокислоты, в частности аминокис-
аминокислоты, содержащие тиоалкильные и алкоксильные группы.
Исходные соединения получают алкилированием циануксусного эфира ал-
килгалогенидами или конденсацией циануксусиого эфира с альдегидами и гидри-
гидрированием полученного продукта над Pt/C.
См. также Курциус (№ 345).
Darapsky A., J. prakt. Chem., 1936, Bd. 146, S. 250.
Boivin J. J., Can. J. Res., 1948, v. 26B, p. 503.
OP, т. 3, с 340.
229. ДАРЗАН (DARZENS)
Получение алкилгалогеиидов действием на спирты хлористого или броми-
бромистого тиоиила и третичных аминов (обычно C5H5N):
SOX2; R3N; 0 °
-60 °С
RX
ROH
X = С1, Вг
В реакцию вступают первичные, вторичные, а также ацетиленовые спирты,
третичные спирты претерпевают дегидратацию. Исходные спирты могут содер-
содержать различные заместители (AlkO, C=O, Аг и др.):
HCON(CH3J; SOCI2
HOCH2Cs=CCH2OH : С1СН2С=ССН2С1 (94%)
АгСН2СН2ОН
АгСН2СНгС1
:-СН,ОН
О
:—СН2С1 G5%)
о
Способ ие вызывает изомеризации и успешно применяется для оксисоеди-
неиий, не устойчивых к действию НХ.
160
См. также Райдон (№ 488).
Darzens G., С. г., 1911, V. 152, р. 1314.
Newman M. S., Wotiz J. И., J. Am. Chem. Soc, 1949, v. 71, p. 1292.
Пат. ФРГ 1133716 A962); С. А., 1962, v. 57, p. 16396.
Gerrard W., Hudson H. R., J. Chem. Soc, 1963, p. 1059.
СОП, т. 3, с 374.
230. ДАРЗАН (DARZENS)
Получение тетралинкарбоновых кислот циклизацией замещенных а-бензил-
а-аллилуксусиых кислот под действием серной кислоты:
СН,
[-СООН 80%"ная H2SO4; < 45 °С
СООН
/СН2
сн=сн2 сн3
Аналогично циклизуются соответствующие производные ряда нафталина.
См. также Боджерт —Кук (№ 92), Назаров (№ 415).
Darzens G., С. г., 1926, V. 183, р. 748.
Cook J. W., Hewett С. L, J. Chem. Soc, 1933, p. 1098.
Bergmann E., Chem. Rev., 1941, v. 29, p. 536.
231. ДАРЗАН — ЭРЛЕНМЕЙЕР — КЛЯЙЗЕН
(DARZENS — ERLENMEYER'— CLAISEN)
Получение глицидных эфиров конденсацией альдегидов или кетонов с эфи-
рами а-галогенкарбоновых кислот под действием оснований в атмосфере
азота*:
>+нсС wwit; °;c
/ II I \COOR' (эфир)**
О X
1 |
NaO X
\
я
COOR'
о
B0-70%)
X = С1, Вг, I; R = H, СН„, С2Н5; R' = С2Н5, СН3
* NaNH2, Na, C4H9OK; ** С6Н6, С4Н9ОН
В реакцию вступают алифатические, алициклические, ароматические, жирно-
ароматические и гетероциклические альдегиды и кетоны, а также а,|3-непредель-
ные соединения. Аналогично эфирам а-галогеизамещениых кислот реагируют дру-
другие соединения, содержащие активный атом водорода: а-галогенсульфоны,
а-галогеикетоны, амиды а-галогеикарбоновых кислот н т. п., например:
с2н5ок
с6н5сно + свн6сн2с1 (СаН5ОН> с6н6-нс—сн-свн6
О
¦Называют также реакцией Дарзана и реакцией Дарзана — Кляйзена.
11—684 161
При использовании СНХ2СООС2Н5 илн RCHXCONR2 выходы глицидных
эфиров существенно увелнчиваются:
1. Mg/Hg
Ч 2 Н+ \ G2H5ONa \
,С + CHXjCOOCgHg _ * )С-СНСООСаН5 » ^С CHCOOQH,
/|| (эфир) /\ | /\/
О НО X О
о
D0-98%)
X = С1, Вг
Побочные реакции: автокоидеисация альдегидов н кетонов, перегруппировка
продуктов реакции в эфиры а- или {3-кетокислот, О- или С-алкилнроваиие кар-
карбонильного соединения. Последний процесс особенно характерен для эфиров
а-бром- и а-иодкарбоновых кислот.
Продукты реакции весьма реакционноспособны и находят широкое примене-
применение в органическом синтезе, в частности для удлинения углеродной цепи аль-
альдегидов и кетонов:
COOR'
нагревание Ч
соон
с-с-
II
о
Erlenmeyer E., Ann., 1892, Bd. 271, S. 137; Ber., 1900, Bd. 33, S. 3001.
Darzens G., С. г., 1904, v. 139, p. 1214.
Claisen L, Ber., 1905, Bd. 38, S. 693.
Bachelor F. W., Bansal R. K-, J. Org. Chem., 1969, v. 34, p. 3600.
Sipos G., Schoebel G., Balaspizi L, J. Chem. Soc. Ser. C, 1970, p. 1154.
Deschamps В., Seyden-Penne J., «Tetrahedron», 1971, v. 27, p. 3959.
Takeda Aklra, Tsuboi Sadao, Hongo Tom, Bull. chem. Soc. Japan, 1973, v. 46,
№ 6, p. 1844—1847.
OP, т. 5, с 319.
232. ДАТТ — УОРМОЛЛ (DUTT — WORMALL)
Превращение ароматических аминов в азиды взаимодействием соответст-
соответствующих солей диазония с сульфонамидамн под действием щелочей:
HNO2; HX + HaNSOaR
ArNHj, *¦ ArNssN X~ *
ArN=N—NHSOaR
—RSOaOH
R = Alk, At (обычно n-
ArN=N=sN
(-70%)
Побочная реакция:
ArN2Cl + RSOaOH
ArN=NSOsR
Dutt P. K-, Whitehead H. R., Wormall A., J. Chem. Soc., 1921, v. 119, p. 2088.
Bretschneider H., Rager H., Monatsh., 1950, Bd. 81, S. 970.
Rodd, v. 3, p. 309.
162
233. ДАУ (DOW)
Получение фенола из хлорбензола действием водного раствора щелочи под
давлением*:
10%-ный р-р NaOH; 400 °С, 280 кгс/см2 НС1
С,Н5С1 »- C,H5ONa >¦ CeHeOH
(93%)
В качестве побочных продуктов образуются о- и и-феннлфенолы и дифени-
ловый эфир. Для подавления последней реакции к исходной смеси прибавляют
около 10% дифенилового эфира.
См. также Рашиг (№ 497), Сергеев (№ 537).
Hale W. J., Britton E. С, Ind. Eng. Chem., 1928, v. 20, p. 114.
Roberts J. D., Bottini А. Т., J. Am. Chem. Soc, 1957, v. 79, p. 1458.
Encyclopedia of chemical technology. Eds. E. Kirk, D. E. Othmer. V. 15. New
York, Interscience encycl., 1966, p. 153.
234. ДАФФ (DUFF)
Формилирование фенолов в орто-положение нагреванием с уротропином и
борной кислотой в глицерине с последующим кислотным гидролизом:
; HgBOg; -150 °С
*¦ R
(глицерин)
(-15-20%)
: = Н, Alk, С1
Аналогично реагируют оксипроизводные конденсированных полициклических
углеводородов. Нитрофенолы, а также п- и л-оксибензойные кислоты ие всту-
вступают в реакцию. Из салициловой кислоты образуется смесь 4- н 5-формильных
производных. Диалкиланнлины формнлируются в пара-положение.
Побочные продукты — крезолы и диальдегиды.
Реакция является общим методом синтеза оксиальдегидов, позволяющим
быстро получать продукты, более чистые, чем по методу Раймера — Тимана
(см. № 490).
См. также Соммле (№ 549).
Duff J. С, Bills E. ]., J. Chem. Soc, 1932, p. 1987; 1934, 1305.
Ferguson L. N., Chem. Rev., 1946, v. 38, p. 230.
СОП, т. 4, с 441; OP, т. 8, с. 269.
¦Промышленный способ получения фенола фирмы «Dow Chemical Co».
11»
163
235. ДЕБУ (DEBUS)
Замыкание кольца имидазола при конденсации а-дикарбонильиых соедине-
соединений с альдегидами и аммиаком*:
/.О
RC—CR
II II
О О
2NH,
о°с
—+-
( 2 '
NH
R, R' = Н, Alk, Ar
В реакцию вступают также непредельные альдегиды:
СН3-С-СНО + С6Н5СН=СНСНО + 2NH3 ¦ >¦ СН3-
II
О
NH
Применение аминов вместо NH3 позволяет получать N-замещенные имид-
азолы.
Модификация Вайдеихагеиа (Weidenhagen) — использование ацилоинов в
качестве источника а-дикарбонильиых соединений (дает более высокие выходы
имидазолов):
RCH—CR
II
С
Си(ОСОСНзJ
(NH4OH)
1. R'CHO; NH3
2. H2S
\
О О
Модификация Макэииа (Maquenne):
НО ОН
НООС— С-С-СООН -
НООС—С—С-СООН
NH
(до 60%)
R'CHO; NH3
OaN NO2
НООС
NH
О О
НООС,
~зоо
NH
Этот метод используют для получения одноосновных имидазолкарбоиовых
кислот, которые находят применение в синтезе имидазолов с функциональными
группами в боковой цепи и для количественного определения органических ос-
оснований.
См. также Баллах (№ 144), Воль — Марквальд (№ 174).
Debus И., Ann., 1858, Bd. 107, S. 204.
Radziszewski В., Вег., 1882, Bd. 15, S. 2706.
Weidenhagen R. e. a., Ber., 1935, Bd. 68, S. 1953; 1937, Bd. 70, S. 570.
Hoftnann K. Imidazole and its Derivatives. New York, Interscience, 1953, p. 33,
38, 178.
Эльдерфильд, т. 5, с. 170, 172.
¦Называют также реакцией Радзишевского (Radziszewski).
164
236. ДЕЙВИДСОН (DAVIDSON)
Замыкание кольца оксазола при конденсации О-ацилацилоионов с аммиа-
аммиаком или ацетатом аммония:
RC—CHR
II I
О OCOR'
RC=CR
CH3COONH4
(лед.
HO OCOR'
R = Alk, C6H5; R' = CH3, CeH6
V
Вместо ацилоииов могут быть использованы а-ацетокси- или а-хлорацето-
уксусные эфиры:
CH3-C-CH-COOC2H5
II I
О R
R = OCOCH3, Cl
НА
о
В случае несимметричных ацилоинов типа RCOCH(OH)Ar возможна аци-
лоиновая перегруппировка с образованием оксазолов.
См. также Робинсон—Габриель (№ 517), Япп (№ 753).
Davidson D., Weiss M., Jelling M., J. Org. Chem., 1937, v. 2, p. 328.
Wiley R. H., Chem. Rev., 1945, v. 37, p. 408, 415.
Эльдерфильд, т. 5, с. 250.
237. ДЕЙКИН (DAKIN)
Окисление ароматических о- или л-оксиальдегидов в многоатомные фенолы
действием перекиси водорода в водном растворе щелочи:
Н2О2; 50 °с
[NaOHJ*
о-сно-
А
R = Н, СН3) ОСН3, NH2, Hal, COOCH3
* КОН, [CeH6CH2N(CH3K]+ "ОН, [(CH3LN]+ "ОН
ОН
(да 90%)
Аналогично реагируют о- и л-оксиацетофеноны; ж-оксиальдегиды в реакцию
Не вступают.
Метод находит применение при получении полифенолов из природных окси-
альдегидов, например о-ванилин превращают в 1-монометиловый эфир пирогал-
пирогаллола с выходом 80%.
См. также Бойлэнд —Симе (№ 96), Бои —Шмидт (№ 98), Эльбе (№ 735).
Dakin И. D., Amer. Chem. J., 1909, v. 42, p. 4177.
Никифоров Г. А., Ершов В. В., Изв. АН СССР. ОХН, 1964, с. 176.
165
Lee J. В., Uff В. С, Quart. Rev., 1967, v. 21, p. 453.
СОП, т. 1, с 346; т. 4, с. 340.
238. ДЕЙКИН — УЭСТ (DAKIN — WEST)
Получение а-ациламииокетонов взаимодействием а-аминокислот с ангидри-
ангидридами карбоновых кислот в присутствии основаиий:
RCHCOOH -f (R'CO)aO
-100 °С
RCHCOOH -
NHCOR'
COR'
RC—COOH
NHCOR'
RCHCOR'
NHCOR'
R = Alk, Ar, CHaCeH6; R' = Alk, CeH5
• CH,COONa (безводи.)
N-Алкиламииокислоты (например, саркозии) в более жестких условиях
также могут быть превращены в а-ациламииокетоиы. Продукты реакции легко
претерпевают циклоконденсацию в оксазолы под действием серной кислоты.
См. также Робинсон — Габриель (№ 517), Эрленмейер — Плёхль (№ 740).
Dakin H. D., West R., J. Biol. Chem., 1928, v. 78, p. 91, 745, 757.
Аронова Н. И. и др., Изв. АН СССР. ОХН, 1968, № 11, с. 2571.
Steglich W., Hofte G., Angew. Chem., 1969, Bd. 81, S. 1001.
Knorr R., Huisgen R., Chem. Ber., 1970, Bd. 103, S. 2598.
Hoefle G., Prox A., Steglich W., Chem. Ber., 1972, Bd. 105, № 5, S. 1718— 172S.
РИМИОС, т. 22, с 9.
239. ДЕККЕР —ФОРСТЕР (DECKER — FORSTER)
Получение вторичных аминов конденсацией первичных амииов с альдегида-
альдегидами и алкилированием образовавшихся шиффовых основаиий алкилгалогеиидами
с последующим гидролизом
RNH» + R'CHO
*.
нагревание R"X; нагревание
»- R—N=CHR' — >-
(инертн. растворитель) (абс. растворитель)
+ н2о
R—N=CHR' X~ >- RNHR'
R"
R' = Alk, CeH5 (обычно)
Реакция проходит успешно у алифатических и жирноароматических аминов.
Реакция с ароматическими амииами обычно осложияется побочными процессами.
Легкость алкилироваиия убывает с возрастанием длины цепи алкилгалогеиида.
* Называют также реакцией Деккера ¦— Беккера (Becker P.) и Форстера —
Деккера.
166
Вместо алкилгалогенида можно использовать диметилсульфат, а вместо альде-
альдегида — бензофенон, например:
,. 1. (CH3)aSO4
(С6Н6JСО ^\ 2. Н2О
I II >-
¦(CH2)aNHa
(CHa)aN=CHC,H6
(CHaJNHCH3
G5%)
См. также Баллах (№ 143), Лёйкарт (№ 361), Эшвайлер — Кларк (№ 744).
Forster М. О., J. Chem. Soc, 1899, v. 75, p. 934.
Decker H., Becker P., Ann., 1913, Bd. 395, S. 362.
Houben-Weyl, Bd. 11, pt. I, S. 108, 956; OS, v. 44, p. 75.
240. ДЕЛЕПИН (DELEPINE)
Окисление альдегидов в карбоновые кислоты действием окиси серебра в вод-
водном растворе щелочи:
Ag2O; NaOH*
RCHO >¦ RCOOH
* КОН, Ва(ОНJ
Выходы количественные. Метод особенно удобен для получения иепредель-
яых и высших алифатических кислот.
См. также Байер—Виллигер (№ 35), Пейн — Смит (№ 443).
Delepine M., Bonnet P., Bull. Soc. chim. France, 1909, v. 5, p. 879.
Fiesselmann H., Ber., 1942, Bd. 75, S. 884.
Asinger F., Ber., 1942, Bd. 75, S. 657.
241. ДЕЛЕПИН (DELEPINE)
Получение первичных алифатических аминов кислотным гидролизом четвер-
четвертичных солей алкилгалогенидов с уротропином:
C8H12N4; нагревание + НС1
RCHaX гггг- •¦ (CeH12N4—CHaR) X" ^ „ ,„>. RCHa—NH2• НС1
(CHCI3)
X = CJ, Br, I
(вода. C2H5OH)
Амины выделяют с высокими выходами. Йодистые алкилы реагируют зна-
значительно быстрее, чем хлористые и бромистые, поэтому последние во время
реакции превращают в соответствующие иодиды, добавляя эквимольиые коли-
количества Nal (см. Финкельштайн, № 602).
Метод используют также для синтеза гетероциклических амииов, аминоке-
тоиов и аминокислот.
См. также Габриель (№ 186), Соммле (№ 549).
Delepine M., С. г., 1895, v. 120, р. 501.
Marszak /., Koulkes M., Bull. Soc. chim. France, 1956, p. 93.
Prainov L, Archiv. Pharm., 1970, Bd. 303, № 2, S. 134.
OP, т. 8, с 269.
167
242. ДЕМЬЯНОВ
Расширение (или сужение) алициклов иа один атом углерода при превраще-
превращении первичных амииов в спирты под действием азотистой кислоты:
(СНа)„ (СН2)„
н2с(^ J)
сн2
ей,
. (СН2)„
V
HNOj
(СНе)„
(СН2)„
н с
Н2С
(
/
/
Vй-
\<сн
п = 0 — 5
Перегруппировка всегда сопутствует нормальной реакции и сопровождается
образованием олефинов.
Первым в истории химии примером изомеризации алициклических соедине-
соединений, сопровождающейся увеличением кольца, является следующее превращение:
Аналогичная перегруппировка происходит также у гетероциклических соеди-
соединений:
¦CHtNH2
¦f
HNOa
Z
Z = О, S. NH
Сужение цикла описано лишь для четырех- и шестичленных аминов, на-
например:
(СНг)„ (СН2)„
/ \ HNOs / \
/ \
HgC' \
СН,
lHNH,
Н
СН—СНаОН
1
См. также Тиффено (№ 566), Уайт (№ 578).
Демьянов Н. Я. и др., ЖРФХО, 1903, т. 35, с. 26, 375; Вег., 1908, Bd. 41.
S. 43.
Демьянов Н. Я., Усп. химии, 1934, т. 3, вып. 4, с. 493.
Stetter H., Goebel P., Chem. Вег., 1963, Bd. 96, S. 550.
Diamond J. e. a., J. Org. Chem., 1965, v. 30, p. 1840.
Гудкова А. С, ДАН СССР, 1973, т. 210, № 3, с. 595—597.
168
Темншова Т. И. Курс теоретических основ органической химии. Л, «Хи-
«Химия», 1968, с. 715.
ОР, т. 11, с. 167.
243. ДЕНИЖЕ (DENIGES)
Окисление олефинов в карбонильные соединения солями двухвалентной рту-
ртути в растворе сильной кислоты*:
HgSO|; -80 "С
RCH2-CH=CH2 „о„> RC—СН=СН2
1водн.
О
R = H, Alk
* Hg(NO3J) Hg(ClO4J
В качестве побочных продуктов образуются RCH2CH2CHO и RCH2COCH3.
Так, из пропена получен акролеин с выходом 88%. Олефины, не имеющие терми-
терминальной СН2-группы, превращаются в насыщенные карбонильные соединения,
а окисление циклических олефинов сопровождается сужением цикла, например:
RCH=CHR >¦ RCH2COR
>—СНО
C7%)
Соединения, содержащие фрагмент СвН5—СН=С
гидроксилируются:
С6Н5СН=С(СН3J > С6Н5СН-С(СН3J
ОН ОН
G0%)
Окисление диенов приводит к смеси продуктов, например:
СН2=СН—СН=СН2 * СН3—СО—СН=СН2 +
D7%)
в условиях реакции
О
D6%)
См. также Гофман—"Занд (№ 212), Райли (№ 489), Смидт (№ 545), Этар
(№743).
Deniges G. С. г., 1898, V. 126, р. 868, 1048, 1276.
Katsuhiko Ichikawa e. a., Bull. Inst. Chem. Res. Kyoto Univ., 1964, v. 42, № 4,
p. 221.
Arzoumanian #., Metzger J., «Synthesis», 1971, p. 527.
*Реакцией Дениже называют также способ качественного обнаружения
олефинов или третичных спиртов по желтому осадку, появляющемуся при вне-
внесении вещества в раствор соли Hg2+ в сильной кислоте.
169
244. ДЁБНЕР (DOEBNER)
Получение а,р-иепредельных кислот конденсацией алифатических или аро-
ароматических альдегидов с малоновой кислотой под действием пиридина и после-
последующим декарбоксилированием:
RCHQ+CHt(COOH)t
190 °С
RCH=C(COOH)a
RCH=CH—COOH
* Часто с добавкой пиперидина
Реакция позволяет с высокими выходами получать кислоты, содержащие
несколько двойных связей. Успешно проходит конденсация фурфурола, диметил-
амиио-, окси- и метоксибензальдегидов. Метод является частным случаем реак-
реакции Кнёвенагеля (№ 305).
См. также Перкин (№ 446).
Doebner О., Вег., 1900, Bd. 33, S. 2140; 1902, Bd. 35, S. 1137.
Davis S. J., Elvidge J. A., J. Chem. Soc, 1962, p. 3350.
Gill G. S. e. a., Indian. J. Chem., 1965, v. 3, p. 323.
OP, т. 1, с 286.
245. ДЁБНЕР (DOEBNER)
Получение хинолиикарбоновых кислот конденсацией ароматических аминов
с альдегидами и пировииоградиой кислотой:
+ R'CHO + СН3—С—COOH
NH.
О=С—COOH
СН,
/CHR/
NH
R = H, CH3, OCH3, OH, COOH, Cl, I,
* CH3COOH
R' = Alk
j; R'= Alk, Ar
В реакцию вступают также гетероароматические и коидеисированиые полн-
циклические амины. В качестве альдегидной компоненты могут быть как арома-
ароматические, так и алифатические альдегиды. В случае АгСНО основным продуктом
реакции являются хинолииы, а при AlkCHO — пирролидиидноиы. Проведение
реакции в эфире и использование аналогов пировиноградной кислоты
170
(СвН5СН2СОСООН, С»Н5СОСН2СОСООН, n-O2NC«H4CH2COCOOH) также спо-
способствует образованию пирролидииов. С Р-иафтнламииом во всех случаях обра-
образуется только беизохинолии.
Несмотря на невысокие выходы хинолинов, реакция находит широкое при-
применение вследствие простоты методики и доступности исходных соединений.
См. также Бетти (№ 70), Маниих (№ 384), Скрауп (№ 543).
Doebner О., Ann., 1887, Bd. 242, S. 265; Вег., 1894, Bd. 27, S. 352, 2020.
Gallo N.. Gazz. chim. ital., 1954, v. 84, p. 573.
Эльдерфильд, т. 4, с. 20; т. 6, с. 162, 168.
246. ДЁБНЕР —МИЛЛЕР (DOEBNER — MILLER W.)
Получение 2,3-дизамещеииых хниолииов циклокоиденсацией ароматических
аминов с а,Р-непредельными альдегидами под действием кислот:
коиц. НС1*; иагрепание
2R'CH2CHO •- R'CH2CH=C—СНО
R (Ml
:hsr'
R = Н, Alk, NO2 и др.; R' = H, Alk, Аг
* HSSO4 (конц.), НС1 (конц.) + ZnCl2
Реакция является общей для ароматических аминов, в том числе и произ-
производных конденсированных полициклических углеводородов. Непредельный аль-
альдегид образуется в процессе реакции из двух молекул альдегида. Использование
смеси альдегидов также приводит к 2,3-дизамещеиным хииолииам. Вторичные
ароматические амины образуют соли хииолиния:
-f СН3ШО
^CH
Реакция является одним из основных способов синтеза хниолииов.
Модификация Бейера (Beyer) — использование смеси альдегида с метилке-
тоиом для получения 2,4-дизамещенных хинолинов:
RCOCH3 + R'CHO
на
RCOCH=CHR'
NH2
NH
-R'
171
См. также Скрауп (№ 543).
Doebner О., Miller W., Пет., 1881, № 14, S. 2812- 1883, Bd. 16, S. 2464, 1664;
1884, Bd. 17, S. 1712.
Turner R., J. Chem. Soc, 1927, p. 1832.
Ардашев Б. И., Усп. химии, 1954, т. 23, вып. 1, с. 45—61.
Fiedler И., J. prakt. Chem., 1961, Bd. 13, S. 86.
Пилюгин Г. Т., Гуцуляк Б. М., Усп. химии, 1963, т. 32, с. 389.
Schindler О., Michaelis W., Helv. chim. acta, 1970, Bd. 53, S. 776.
Allinger N. L, Wang G. L, Dewhurst В. В., J. Org. Chem., 1974, № 12,
p. 1730—1735.
Эльдерфильд, т. 4, с. 10; т. 7, с. 162, 168.
247. ДЁРИНГ (DOERING)
Получение алленовых углеводородов из олефинов действием дибромкарбе-
нов (из бромоформа) с последующим расщеплением образовавшихся ге^-ди-
бромциклопропанов магнием*:
=с; +снвг
трет-С4Н9ОК; —20°С
(С5Н12) *"
Mg \
чс—с
/ ч / \ (эфир)
СВгг
С=С=С;
\
A6-35%)
Использование метиллития или бутиллития вместо магния для расщепления
дибромциклопропанов в большинстве случаев позволяет значительно повысить
выходы алленов; более реакциониоспособным является бутиллитий, расщепляю-
расщепляющий даже дихлорциклопропаны:
C4H9Li; -10 °С
СН3(СНгM—НС СС12
\/
СН,
(эфир)
сн3(снаN-сн=е=сн2
C1%)
В реакцию вступают различные ациклические и циклические олефииы и дие-
диены, например:
R—(СН2)„—CR=CHa v CHa=CR— (CH.^—CR=€=CH2
D0-85%)
R = H,CH3; л =1—4
(СН3О)аС=С(ОСНз)а v (СН,О)аС=С=С(ОСН3J
(-60%)
(СНг)„
НС СН
II II
НС СН
>с4
(СНг)„
НС СН
II I!
с с
НС СН
(СНг)„
Достоинством метода являются мягкие условия и отсутствие изомеризации.
Модификация Унча (Untch) — действие на олефины смеси СВг4 и метилли-
метиллития. Выходы алленов увеличиваются вдвое по сравнению с использованием
¦ Называют также реакцией Дёринга — Ля Флямма (La Flamme).
172
СНВгз и бутиллития. Метод применяется в основном для циклических олефинов
и называется также расширением цикла по Унчу:
CH3Li: — 65 °С
(эфир,
F0%)
См. также Фаворский (№ 594).
Doering W. E., Hofmann А. К., J. Am. Chem. Soc, 1954, v. 74, p. 6162.
Doering W. E., La Flamme P. M., «Tetrahedron», 1958, v. 2, p. 75.
Untch K. G., Martin D. J., Castellucii N. Т., J. Org. Chem., 1965, v. 30,
p. 3572.
The chemistry of alkenes. Ed. S. Patai. London — New York — Sydney, Inter-
science publ., 1964, p. 1055.
РИМИОС, т. 21, с 124.
248. ДЖОНС (JONES R. G.)
Получение замещенных оксипиразинов циклоконденсацией а-дикарбонильных
соединений с амидами а-аминокислот под действием едкого иатра:
R—С=О
N
NaOH
NH,
ОН
N
D0-95%)
R, R' = Н, СН3, CeH6; R" = Н, Alk, CeH5, CONHa>
CHaCH2SCH3, n-HOCeH4CH2
• СН3ОН
При R=H, R' и R"=Alk или Аг удается выделить только один из двух
возможных изомеров — 3,5-дизамещенный оксипиразин.
См. также Гастальди (№ 191).
Jones R. G., J. Am. Chem. Soc., 1949, v. 71, p. 78.
Karmas G., J. Am. Chem. Soc, 1952, v. 74, p. 1580.
Эльдерфильд, т. 6, с. 321.
249. ДЖОНС —УИДОН (JONES E. R. Н. — WEEDON)
Получение альдегидов или кетонов, содержащих сопряженный с карбониль-
карбонильной группой фрагмент —С=С—С = С<^ , присоединением ацетиленидов натрия
к C-хлорвинилметилкетонам с последующей перегруппировкой образовавшихся
173
непредельных спиртов под действием кислот:
,С1
RCssCNa -f- СН3—С—СН=С.
II
О
V
H2SO4
он
RC==C—С(СН3)=Ш
О
R'
RC=C—С(СНд)=СНСч
|XR'
он
F0-80%)
R = H, Alk, СН=СНг; R' = H, СН„
Вместо RC = CNa могут быть использованы реактивы Иоцича (см. № 275),
например:
R R
+ СН3—С—СН=СНС1
R R
V
ii
R = Н, СН3
Метод находит применение в химии витамииов и каротиноидов.
См. также Арене —ван Дорп (№ 24), Инхоффен (№ 274), Неф (№ 424).
Jones E. R. Н., Weedon В. С. L, J. Chem. Soc, 1946, p. 937.
Toogood J. В., Weedon В. С. L, J. Chem. Soc, 1949,. p. 3123.
Julia M., Ann. Chim., 1950, v. 5, p. 595.
250. ДЖОНСОН (JOHNSON W. S.)
Аигулярное метилирование бициклических кетонов йодистым метилом с
предварительным блокированием а-метнленовой группы:
НО НО
.СНАг
CH3I;
; 0 °С
Н
н
няс о
няс о
сег
¦СНАг
Н
Аг = С6Н5, фурил
174
Недостатком метода является образование смеси транс- и цне-изомеров в
соотношении 1 : 3. Образования цне-изомера можно избежать, используя в каче-
качестве защитной алкилтиометиленовую группу или применяя в качестве исходных
соединений бициклические кетоиы с двойной связью в положении 6, 7.
Метод ангулярного метилирования часто сочетают с последующим суже-
сужением цикла и широко применяют в синтезе стероидов.
Johnson W. S., i. Am. Chem. Soc, 1943, v. 65, p. 1317.
Johnson W. S. e. a., J. Am. Chem. Soc, 1962, v. 84, p. 2181.
Физер Л., Физер М. Стероиды. Пер. с англ. Под ред. Н. Н. Суворова
и И. В. Торгова. М., «Мнр», 1964, с. 508.
251. ДИКМАН (DIECKMANN)
Внутримолекулярная конденсация сложных эфиров двухосновных карбоно-
вых кислот в присутствии оснований с образованием циклических Р-кетоэфиров:
(СН2)„СООС2Н6
RCH
R'CHCOOC2H6
(СН2)„
rhc; ;c
R"ONa*; нагревание
(СбН6)« *
RHC' С
COOQH,
2н5
(СН2)„
R'/
А
/\
rV
COOCjHj ^1ЛЛ^(П5
* Na, К, ROK, NaH, KH, KNH2, NaNH2; ** абс. С2Н6ОН, эфир
Легкость замыкания цикла зависит от природы а-заместителя и уменьшается
в ряду Н > СН3 > С2Н5 (дальнейшее удлинение цепи не оказывает замет-
заметного влияния на скорость реакции). Как правило, образуются пяти- и шести-
членные циклы, но возможно и получение макроциклов. На направление цикли-
циклизации (размер цикла) влияют заместители в Р-положении (например, метильиая
группа блокирует соседнюю СН2-группу, а СООС2Н6-группа — активирует).
Эфиры, содержащие гетероатом (N, S, О), претерпевают аналогичную кон-
конденсацию:
(СН3)аСН—С—COOC2HS
II
СН—NH—СН2—СООС2Н5
NH
Побочные продукты те же, что и в реакции Кляйзена (№ 301). Следует
отметить также возможность образования ацилоииов, особеиио при использова-
использовании Na и NaH.
Реакция широко применяется для получения полициклических систем.
Синтез Дикмаиа — Компа (Котрра) — конденсация щавелевого эфира с
эфирами глутаровой кислоты или ее аналогов и последующая циклизация с об-
образованием а-дикетонов:
СНаСООС2Н5
СООСаН5 | Na
| + CHR > С2Н5ООС-( >—СООС2Н5
OC2H5
COOC2H5
I
COOC2H6
(ксилол)
.НаСООС2Н5
R = H, Alk, C6H5
* C2H5ONa
:hr
E0-70%)
,.CH2COOC2H
2П5 C2H5ONa
НО, ,ОН
ЧСН2СООС2Н5
(беизол)
C2H5OOC—
/ V
ss
G7%)
-СООС.Н,
Метод Хауза— Бабада (House-Babad)—получение циклических кетонов
циклизацией солей фосфония (реакция, родственная конденсации Дикмана):
СН2СООС2Н5
I
mpem-C4H9OK
СНаР(С,Н5K
См. также Габриель (№ 185).
(СН2)„
Y"
он
, —= 2 4
(СН2)„
;сн,
СО
E0-80%)
Dieckmann W., Ber., 1894, Bd. 27. S. 102, 965; 1900, Bd. 33, S. 595, 2670; Ann
1901, Bd. 317, S. 51, 93.
House H. O., Babad H., J. Org. Chem., 1963, v. 28, p. 90.
Thaoker M. R., Bagavant G., J. Ind. Chem. Soc, 1968, v. 45, p. 885.
Chakravarti R. N.. Dutta N., J. Ind. Chem. Soc, 1974, v. 51, p. 239—255.
OP, т. 1, с 345; OR, v. 15, p. 1.
252. ДИКМАН — МАЙЗЕР (DIECKMANN — MEISER)
Межмолекулярная конденсация эфиров гомофталевой кислоты с алкилфор-
миатами в присутствии натрия и последующая циклизация полученного продук-
продукта с образованием замещенных изокумаринов:
R'v
+ HCOOR'"
,—COOR
нагревание; Н2О
R = CH8, CaHs
R'" = Alk
176
Замена алкилформиата на алкилоксалаты позволяет получить 3-карбокси-
изокумарин с выходом 50%.
Dieckmann W., Meiser W., Ber., 1908, Bd. 41, S. 3253.
Kamal A., Robertson A., Tittensor E. Т., J. Chem. Soc, 1950, p. 3375.
Эльдерфильд, т. 2, с. 170.
253. ДИЛЬС (DIELS)
Дегидрирование кольца циклогексена или циклогексана в полициклических
соединениях действием селена при нагревании с образованием ароматических
соединений:
Se; 300—350 °С
Дегидрирование обычно сопровождается частичной деструкцией.
Преимущество данного метода по сравнению с другими способами дегид-
дегидрирования — меньшее количество побочных продуктов. Реакцию используют при
установлении строения стероидов.
См. также Вестерберг (№ 155).
Diets О., Karstens A., Ann., 1930, Bd. 478, S. 129; Ber., 1936, Bd. 69A,
S. 195.
Новые методы препаративной органической химии. Пер. с англ. Под ред.
Д. Н. Курсанова. М., Издатинлит, 1950, с. 161.
Физер, т. 3, с. 243.
254. ДИЛЬС —АЛЬДЕР (DIELS — ALDER)
1,4-Присоединение соединений с активированной кратной связью (диенофи-
лов) к сопряженным диенам с образованием циклических структур (диеновый
синтез):
С
-С
с
II
C-R
нагревание*
(ннертн. растворитель)*
\
/\
R = СНО, СООН, COOR', NO2 и др.
* Без нагревания; ** без растворителя
ациклические и
В реакцию вступают циклические.
1,3-диены и соединения с фрагментами
С=С—С=О С=С—С=
гетероциклические
С=С—CsC
В качестве диенофилов кроме олефинов могут быть использованы соедине-
соединения, содержащие группировки yC = N—, —N = O, \S = O н др. Реакция
проходит, как правило, с высокими выходами. Наличие электроноакцепторных
12 -684 177
заместителей в диенофиле и электронодонорных в диене облегчает процесс при-
присоединения. Скорость реакции умеиьшается с увеличением числа и объема заме-
заместителей в исходных веществах.
Диеновый синтез протекает по схеме цмс-присоединеиия; компоненты ориен-
ориентируются в соответствии с правилом «накопления ненасыщенности», что приво-
приводит к образованию знйо-изомеров:
Кислоты Льиюса не только ускоряют реакцию, но и вызывают изомериза-
изомеризацию продуктов. Так, при реакции 2-метилбутадиена-1,3 с метилвииилкетоном
в обычных условиях образуется смесь 1,4- и 1,5-дизамещеиных циклогексенов
в соотношении 71 : 29; в присутствии SnCU повышается доля 1,4-изомера (93:7).
сн,—с
СНСОСНз
• II
сн.
СОСН3 Н3С
сосня
Реакция Дильса — Альдера обратима. При нагревании аддукты обычно рас-
распадаются на исходные компоненты или дают новые диен- и диенофил {«ретро-
реакция» Дильса — Альдера или «ретро-диеновое» разложение), например:
С-СООСНз
с-соосн3
"с—соосн3
с—соосн3
400°С;
вакуум
,СООСН3
ООСН3
Взаимодействие несопряжениого диена с диенофилом, в результате которого
три я-связи превращаются в три а-связи с образованием двух новых циклов,
называют «гомо-реакцией» Дильса — Альдера, например:
N— СООСНз
N—СООСНз
СН3ООС— N—N—СООСН„
+
о
II
>
II
о
о
и
\
О
о
178
Диеновый синтез широко применяется во всех областях органической
химии.
См. также Вагнер-Яурегг (№ 141).
Diels О., Alder K-, Ann., 1928, Bd. 460, S. 98; 1929, Bd. 470, S. 62; Ber., 1929,
Bd. 62, S. 2081, 2087.
Martin I. G., Hill R. K, Chem. Rev., 1961, v. 61, p. 537.
Hofmann H. M. R., Angew. Chem., 1969, Bd. 81, S. 597.
McCabe I. R., Eckert Ch. A., Ace. Chem. Res., 1974, v. 7, № 8, p. 251—257.
Онищенко А. С. Диеновый синтез. М., Изд. АН СССР, 1963. 649 с.
Вассерман А. Реакция Дильса — Альдера. Пер. с англ. Под ред. Л. М. Ко-
Когана и О. Н. Темкина. М., «Мир», 1968. 133 с.
Ингольд, с. 568; ОР, т. 4, с. 7, 86; т. 5, с. 93.
255. ДИЛЬС —РЕЗЕ (DIELS —REESE)
Получение азотсодержащих гетероциклических соединений на основе аддук-
тов гидразобензолов с эфирами ацетилендикарбоновых кислот:
R
нагревание
R + R'OOC-GsC-COOR' >
¦NH—NH--
R'OOC CHCOOR"
' ^ "^ ' нагревание
(ксилол)
СНзСООН I C5H5N»; надевание
R
(СН3ОН)
COOR'
V-COOR'
NH
R = Н, СН3, Cl; R' = СН3, С2Н5
Таким способом могут быть получены производные пиразола, хииолнна,
индола.
Аналогично реагируют аддукты, полученные прн действии эфнров ацетилеи-
днкарбоновых кнелот на Ы,Ь1-дибензнлгидразин, трибензилгндразин, N.N-фенил-
бензилгидраэин.
12*
179
Diels 0., Reese J., Ann., 1934, Bd. 511, S. 168; 1935, Bd. 519, S. 147.
Huntress E H., Bornstein J., Hearon W. M., J. Am. Chem. Soc., 1956, v. 78,
p. 2225.
256. ДИМРОТ (DIMROTH)
Изомеризация 1-замещенных 1,2-дигидро-2-иминопиримидинов под действием
оснований в 2-замещенные аминопиримидины (амидиновая перегруппировка):
R'
нагревание; NaOH*
R'
RN
N
NHR
R = Alk, CH2COOC2H5; R' = Alk, Hal, NO2, (CH3JN, CONH2 н др.
* NH4OH
Электроноакцепторные группы в пиримидиновом кольце ускоряют перегруп-
перегруппировку. Скорость реакции увеличивается в следующем ряду заместителей R:
СН3
QH9 < C7Hi5 < СН2СН=СН2 < СН2С6Н5
В неводных средах перегруппировка сильно замедляется. В случае R'=CN
наблюдается аномальное течение реакцни:
NCX
CH3-N
:NH
О'
СН с—NH2
NHCH,
Перегруппировка носит общий характер и наблюдается для ряда гетеро-
гетероциклических систем, в частности для триазинов, тетразолов, тиадиазолов, адени-
нов я др., например:
NHC6HB NHC6H5
N
СН
N-N
:NH
NsN
I J
*С—NH,
NR
HC-N—Co
N*
CH3-N
-> NT V-NHR
NH
HC-N
W \—NHC2HS
S
NHR
X
N N
180
Dimroth 0., Ann., 1909, Bd. 364, S. 183.
Wohren M., Z. Chem., 1969, Bd. 9, № 6—7, S. 241.
Jacquier R., Lopez H., Maury G., J. Heterocyclic. Chem., 1973, v. 10, p. 755—762.
Siddiqui M., Shakil S., Stevens M. F. G., J. Chem. Soc, Perkin Trans. 1, 1974,
№5, p. 609—610.
Brown D. J. In: Mechanism of Molecular Migrations. V. 1. N. Y., Interscience
Publ., 1968, p. 209.
257. ДОРНОВ — ТАЙДЕЛЬ (DORNOW — THEIDEL)
Ацилирование аминов при действии а-кетонитрилов с образованием амидов
карбоновых кислот:
-25 °С
RCOCN + R'NH2 *¦ RCONHR'
(инертн. растворитель)
(-70%)
R = С6Н5> СНС12; R' = Alk, Ar
Так же ацилируются вторичные амины. Аминоспирты даже в присутствии
избытка а-кетонитрила реагируют только по азоту, за несколькими исключения-
исключениями, в частности:
+ C6H5COCN
Преимуществом данного метода является возможность ацилирования ами-
аминов, неустойчивых в водной, кислой и щелочной средах.
См. также Шоттен — Бауман (№ 719), Айнхорн (№ 5), Гейлет — Илион
(№ 197).
Dornow A., Theidel H., Angew. Chem., 1954, Bd. 66, S. 605; Chem. Ber., 1955,
Bd. 88, S. 1267.
Thesing J., Witzel D., Brehm A., Angew. Chem., 1956, Bd. 68, S. 425.
258. ЖЮЛИА —ДЖОНСОН (JULIA — JOHNSON W. S.)
Стереоспецифическое расщепление циклопропилалкилкарбинолов под дейст-
действием бромистоводородной кислоты с образованием 17?акс-C-бромалкеиов:
Н2С СН—CHR
\/ I
сна он
48о/о-ная НВг; 20 «С
/C=Cs
W
(80-85%)
R = Alk
Третичные спирты образуют смесь цис- н траяс-гомоаллилбромидов в соот-
соотношении 3:1:
сня
I
~С—С4Н9
181
Замена НВг смесью РВг3 и LiBr с последующим действием ZnBr2 приводит
к преимущественному образованию транс-томера, например:
1 DD- ' ""-
нет""
сн.
сн3
Реакция используется при синтезе стероидов.
(90%)
Julia M., Julia S., Tchen S. Y., Bull. Soc. chim. France, 1961, p. 1849.
Brady S. F., Ilton M. A., Johnson W. S., J. Am. Chem. Soc, 1968, v. 90,
p. 2882.
Reucrof I., Sammes P. G., Quart. Rev., 1971, v. 1, p. 159.
Taulkner D. J., «Synthesis», 1971, № 4, p. 178.
259. ЗАЙЦЕВ
Получение вторичных и третичных спиртов действием на карбонильные со-
соединения циика и алкилгалогенида:
/\\
о
2п«; нагревание
RZnX
Г
OZnX
**
б
X = I, Вг
Активированный Zn (добавка 12);
: тетрагидрофуран, бензол -f- тетрагидрофуран
В реакцию вступают разнообразные альдегиды и кетоиы, в том числе неко-
некоторые гетероциклические, например:
7СН0 ,СН—СН2СН=СН2
Zn // Л Атт
+ вгсн2сн=сн2 —»- (/ yvn
S S
G8%)
Аналогично реагируют сложные эфиры, нитрилы, хлорангидриды и ангидри-
ангидриды кислот. В настоящее время метод используется, в частности, для получения
ацетиленовых спиртов, например:
С2Н5ООС(СН2JСНО + ВгСН2С==СН > С2Н6ООС(СН2JСН(ОН)СН2С=СН
D4%)
Эта реакция легла в основу реакции Реформатского (см. №' 507).
См. также Бутлеров (№ 125), Вагнер (№ 138), Грииьяр (№ 219), Шоры-
гии—Ванклин (№ 718).
Wagner п., Saytzeff A., Ann., 1875, Bd. 175, S. 363.
Зайцев А. М., Зайцев М. М., ЖРФХО, 1876, т. 8, с. 8.
Методы элементоорганической химии. Цинк, кадмий. Под ред. А. Н. Не-
Несмеянова и К. А. Кочешкова. М., «Наука», 1964, с. 106.
182
260. ЗАНДМЕЙЕР (SANDMEYER)
Получение изатинов циклизацией изонитрозоацетанилидов под действием
серной кислоты:
О
=0
14.
nh"
R = Alk, Ar, Hal, OAlk
При R = NO2, n-CH3O или п-СбНб реакция не идет. Аналогично циклизуются
соответствующие производные полициклических ароматических аминов.
Исходные изонитрозоацетанилиды получают взаимодействием ароматических
аминов с хлоральгидратом и гидроксиламииом в кислой среде:
ArNH2 + С13ССН(ОНJ + NH2OH
ArNHCOCH=NOH
См. также Зандмейер (№ 262), Кляйзен — Шедуэлл (№ 303), Мартиие
(№386).
Sandmeyer Т., Helv. chim. acta., 1919, Bd. 2, S. 234.
Sheidley F. E., McNulty J. S., J. Org. Chem., 1956, v. 21, p. 171.
El-Sebaj A. I., Farghaly A. M., Soliman R., Egypt. J. Pharm. Sci., 1973, v. 14,
№ 1, p. 61—65.
Sumpter W. C, Miller F. M. Heterocyclic Compounds with Indole and Carbazole
Systems. New York — London, Intel science, 1954, p. 111.
СОП, т. 1, с 216.
261. ЗАНДМЕЙЕР (SANDMEYER)
Замена диазогруппы в ароматических или гетероароматнческих соединениях
иа галоген (или псевдогалоген) действием соли одновалентной меди:
НЫОг; НХ
ArNH2 >
Cu2X2; 0-5 °С
X"— тг^~ [ArN24
(водн. НХ)
X = Cl, Br, CN, NO2, SO3H, SCN, SH, N3
нагревание
"CuX2] f ArX
D0-90%)
Предполагается свободнорадикальный механизм распада промежуточного
комплекса. Электроноакцепторные заместители в ароматическом ядре увеличи-
увеличивают скорость реакции.
Побочные процессы: образование азосоединеиий (при наличии электроио-
акцепторных заместителей в ядре солей диазония), образование диарилов
(в случае электроиодонорных заместителей) и фенолов.
Метод обеспечивает введение заместителя в строго определенное положение,
исключая изомеризацию. Реакция находит широкое применение в синтезе про-
промежуточных продуктов и красителей.
Модификация Аиджели (Angeli) — использование соли одновалентной меди
«in situ» (из гипофосфита натрия и сульфата меди).
Модификация Кернера — Контарди (Corner — Contardi)—применение гало-
генидов двухвалентной меди; это приводит к увеличению выходов для соедине-
соединений с электроиоакцепторными заместителями.
Модификация Брэкмена — Смита (Brackman — Smit P. J.)—одностадийное
превращение ароматических аминов в галогеииды под действием ССЬ^НО
в ацетонитриле в атмосфере закиси азота.
183
Марсден (№ 668).
См. также Барт (№ 47), Гаттерман (№ 192), Ходжсон
Швехтен (№ 703), Шиман (№ 708), Лёйкарт (№ 362).
Sandmeyer Т., Бег., 1884, Bd. 17, S. 1633; 1890, Bd. 23, S. 1880.
Angeti A., Gazzetta, 1891, v. 21, p. 258.
Hodgson H. H., Sibbald D. D. R., J. Chem. Soc, 1944, p. 393.
Cowdrey W. A., Davies D. S., Quart. Rev., 1952, v. 6, p. 358.
Pfeil ?., Angew. Chem., 1953, Bd. 65, S. 155.
Dickerman S. C, Weiss K-, Ingberman A. K-, J- Am. Chem Soc, 1958, v. 86,
p. 1904.
Brackman W., Smith P. J., Rec. trav. chim., 1966, v. 85, p. 857.
Wieland Th., Birr Ch., Flekenstein P., Ann. 1972, Bd. 756, S. 14—19.
СОП, т. З, с 467; Мюллер, с. 611.
262. ЗАНДМЕЙЕР (SANDMEYER)
Получение изатина взаимодействием N.N'-дифенилтиомочевины с цианистым
калием, превращением образовавшегося цианоформамидина под действием суль-
сульфида аммония в тиоамид и циклизацией его с последующим гидролизом:
.
HCN или KCN
; (С2н5он>
CN
(NH4)jS
NH
конц. H2SO4; нагревание
О
Изатин можно получить из дифенилтиомочевины, минуя стадию образования
тиоамида:
CN
I
СО
NH
NH
=NHQH5
н2о
Реакция является одним из основных методов синтеза изатина.
См. также Зандмейер (№ 260), Кляйзен — Шедуэлл (№ 303).
Sandmeyer Т., Z. Farb. Textil. Chem., 1903, Bd. 2, S. 129.
Yen Y. Q., Buu-Hoi N. P., Xuong N. D., J. Org. Chem., 1958, v. 23, p. 1858.
Sumpter C. W., Miller F. M. Heterocyclic compounds with indole and carbazole
systems. New York — London, Interscience, 1954, p. 111.
Эльдерфильд, т. З, с. 154.
184
263. ЗЕЛИНСКИЙ
Каталитическое диспропорционирование углеводородов ряда циклогексена с
образованием соответствующих производных бензола н циклогексана (необрати-
(необратимый катализ):
R = Н, Alk, COOAlk
* Pt, Cr2O3/Al2O3 B50 °С)
Из циклогексадиена также получается смесь бензола и циклогексана. Реак-
Реакция происходит и у соединений с экзоциклической кратной связью:
*СН
Диспропорционированию в этом случае предшествует ступенчатое перемеще-
перемещение кратной связи к кольцу. Последнее подтверждается неспособностью к пре-
превращению соединений, содержащих в цепи четвертичный атом углерода.
Необратимый катализ протекает также в случае гетероциклических и няти-
членных алициклических соединений:
450 "С
СООС2Н5
См. также Вестерберг (№ 155).
Зелинский Н. Д., Глинка Н. Л., ЖРФХО, 1911, т. 43, с. 1084.
Зелинский Н. Д., Павлов Г. С, 1924, Bd. 57, S. 1066.
Wibaut J. P., Proost W., Rec. trav. chim., 1933, v. 52, p. 333.
185
Терентьев А. П., Гусева А. #., ДАН СССР, 1946, т. 52, с. 135.
Левина Р. Я- Синтез и контактные превращения непредельных углеводоро-
углеводородов. М., Изд. МГУ, 1949, 254 с.
264. ЗЕЛИНСКИЙ — СТАДНИКОВ
Получение а-амииокислот из альдегидов или кетонов прн действии смеси
цианистого калия с хлористым аммонием с последующим гидролизом образую-
образующихся а-амино нитрилов:
чс=о
KCN
C0-50%)
В реакцию вступают алифатические, алициклические и ароматические аль-
альдегиды и кетоны. Использование RNHj-HCl позволяет получать N-замещенные
а-амннокислоты.
Реакция является усовершенствованием синтеза Штреккера (№ 731).
См. также Бухерер — Берге (№ 129).
Зелинский Н. Д., Ставников Г., ЖРХО, 1906, т. 38, с. 722.
Mowry D. Т., Chera. Rev., 1948, v. 42, p. 237.
Houben-Weyl, Bd. 8, S. 280.
,СОП, т. З, с 58, 63.
265. ЗЕМЛЕР— ВОЛЬФ — ШРЕТЕР
(SEMMLER — WOLFF-— SCHROETER)
Перегруппировка оксимов а,C-иепредельных алициклических кетонов в арома-
fH4ecKne амины под действием бекмановской смеси*:
NOH
(СН3СОJО + СН3СООН; насыщ. НС1; 100 °С
NOCOCH.
NHOCOCH8
R = Н, Alk, пириднл
В реакцию вступают оксимы дизамещенных кетонов, а также кетонов, вхо-
входящих в конденсированные системы (например, а-тетралон, 1-кетотетрагидро-
.фенантрен).
См. также Бекман (№ 58).
¦Называют также реакцией Шрётера илн ароматизацией оксимов по Зем-
леру.
186
Semmler F. W., Ber., 1892, Bd. 25, S. 3352.
Wolff L., Ann., 1902, Bd. 322, S. 351.
Schroeter G., Ber., 1930, Bd. 63, S. 1308.
Ворожцов H. #., Коптюг В. А., Ж. орг. хим., 1968, т. 28, с. 1646.
Davey J., Кеепе В. R. Т., Mannering п., J. Chera. Soc, Ser. С, 1967, p. 120.
Royer R. e. a., Bull. Soc. chira. France, 1970, v. 3, p. 1026.
Nunn A. J., Rowell F. I., J. Chera. Soc, Perkin Trans. I, 1973, № 22, p. 2697—
2703.
266. ЗЕМПЛЕН-КОРИТНИК (ZEMPLEN - KORYTNYK)
Получение ацетилгалогеноз из полностью ацетилированных Сахаров дейст-
действием хлористого алюминия в четыреххлористом углероде:
н—с—ососн,
I
сн3соо—с-н
А1С13
Н—С—С1
6 <сс1*> СН3СОО—С—Н 6
D0-90%)
В реакцию вступают только аиомеры C-ряда. Получаемые хлориды не под-
подвергаются эпимеризации.
См. также Боннер (№ 99), Паску (№ 440).
Zemplen п., Mester L, Eckhart E., Acta Chira. Hungar., 1954, v. 4, p. 73.
Korytnyk W., Mills J. A., J. Chera. Soc, 1959, p. 636.
Korytnyk W., J. Chera. Soc, 1959, p. 650.
Umerzawa S., Kato S., Ito Y., Bull. Chem. Soc. Japan., 1963, v. 36, p. 183.
267. ЗИНИН
Восстановление ароматических - ннтросоединений в амииы действием суль-
сульфида аммония:
(NH4JS
ArNO2 *~ ArNH2
Таким способом впервые были получены анилин, 2-нафтиламин, ж-амино-
бензойиая кислота. Реакция открыла возможность промышленного синтеза аро-
ароматических аминов. В настоящее время метод применяют для получения ами-
аминов ряда антрахинона и частичного восстановления полинитросоединений.
В промышленности для восстановления нитросоединений используют чугунные
стружки в кислой среде (см. Бешаи, № 72).
См. также Байер (№ 33).
Zinin N., J. prakt. Chera., 1842, Bd. 27, S. 140.
Порай-Кошиц А. Е., Усп. химии, 1943, т. 12, с. 94.
Фигуровский Н. А., Соловьев Ю. М. Николай Николаевич Зинин. М., Изд.
АН СССР, 1957. 216 с.
OR., v. 20, р. 455.
187
268. ЗИНОВЬЕВ — СОБОРОВСКИЙ
Получение дихлорангидридов алкилфосфоновых кислот окислительным хлор-
фосфоиированием углеводородов или их производных треххлористым фосфором
и кислородом"""
*.
RH
РС13; О2; —90-г- +70 °С
RPOC12
C0—50%)
В реакцию вступают алифатические, алициклические, непредельные и жирно-
ароматические углеводороды и их производные, содержащие разнообразные
функциональные группы. Циклопропан и его производные реагируют с размы-
размыканием цикла, например:
РС13; О2
Н2С СН2 »- С1СН2—СН2—СН2РОС12
СН2
Реакция всегда приводит к смеси изомеров. В образование С—Р-связи пред-
предпочтительнее вовлекается вторичный или третичный атом углерода. Непредель-
Непредельные соединения реагируют легко, давая, как правило, смесь изомерных про-
продуктов:
СН2=СНС1 >¦ СН2С1—СНС1— РОС12 + СНС12—СН2РОС12
ОД—С=СН >¦ СбН5—СС1=СНРОС12
Окислительное хлорфосфонирование можно проводить также различными
производными трехвалентного фосфора, например арилдихлорфосфинами:
„ /РОС1
, +CeH5POCI2
Побочный процесс: расщепление исходных углеводородов с образованием
продуктов с меньшей молекулярной массой и алкилгалогенидов.
Достоинство метода — доступность исходных веществ и простота аппаратур-
аппаратурного оформления, что позволяет применять его в промышленном масштабе.
Продукты реакции являются ключевыми веществами для получения различных
фосфорорганических соединений.
См. также Клей — Киннер — Перрен (№ 295).
Clayton J., Jensen W., J. Am. Chem. Soc, 1948, v. 70, p. 3880.
Соборовский Л. 3. и др., ДАН СССР, 1949, т. 67, с. 293.
Graf R., Chem. Ber., 1952, Bd. 85, S. 9.
Пурдела Д., Вылчану Р., Химия органических соединений фосфора. Пер.
с англ. Под ред. М. И. Кабачника. М., «Химия», 1972, с. 376.
РИМИОС, т. 21, с. 6.
269. ЗОНН —МЮЛЛЕР (SONN — MULLER E.)
Получение ароматических альдегидов восстановлением имииохлоридов хло-
хлористым оловом с последующим гидролизом образовавшихся анилов:
Ar—С
\„. (эфир)
Ar' = QH5, СвН4СН3-я
E0-60%)
¦Называют также реакцией Клейтона — Енсена (Clayton — Jensen).
188
Метод неприменим для синтеза алифатических альдегидов, так как соответ-
соответствующие иминохлориды очень неустойчивы.
Исходные иминохлориды получают из хлорангидридов ароматических
кислот:
Аг-С
/Р Ar'NH2
" >-
NHAr'
РС15; нагревание
(СвНб)
/NAr'
Модификация Брауиа — Рудольфа (Braun — Rudolph) — использование СгСЬ
вместо SnClj для получения непредельных альдегидов типа RCH = CHCHO
(R=Alk, Ar) из соответствующих иминохлоридов.
См. также Мумм —Хессе (№ 409), Стефен (№ 553).
Sonn A., Muller Е., Вег., 1919, Bd. 52, S. 1929.
Braun J., Rudolph W., Ber., 1934, Bd. 67, S. 269, 1735.
Effenberger F., Gleiter R., Chem. Ber., 1964, Bd. 97, S. 480.
OP, т. 8, с 310.
270. ЗЮКФЮЛЛЬ — ДИТМЕР (SUCKFULL — DITTMER)
I. Получение несимметричных ароматических азосоединений взаимодейст-
взаимодействием солей диазония с диазосульфонатами в водных растворах:
+ 20—55 °С
Ar—N=N + Ar'—N=N—SO^ *" Ar—N=N—Ar'
D0-70%)
Наиболее успешно реакция протекает в тех случаях, когда оба компонента
являются производными ряда нафталина (заместители: SO3Na, NO2, ОН и др.).
При Ar=RC,;H4 реакция идет лишь тогда, когда R — электронодонорный замести-
заместитель; при R = NO2 реакция не идет. Побочная реакция — образование симмет-
симметричных азосоединеиий.
II. Получение несимметричных о-оксиазосоединений взаимодействием солей
диазония с диазотатами в водных растворах:
+ R
N=N-0"
ОН
и Rr= H,SO3Na,OSO2C6H5 и др.;
"= CeH5CONH,NO2,CI,OCH3, SO3Na и др.
В реакцию вступают также диазотаты ряда нафталина и диазотаты типа
NaO3S—СвН4—N=N—С6Н4—N=N—О".
Эти методы позволяют получать азосоединения, недоступные при использо-
использовании других способов синтеза.
Suckfull F., Dittmer H., Chimia, 1961, v. 15, p. 137.
Cheisten M. e. a., Helv. chim. acta., 1966, v. 49, p. 1376.
189
271. ЗЮС (SOS)
Фотохимическая перегруппировка о-хинондиазидов в кетены, сопровождаю-
сопровождающаяся сужением цикла*:
О О"
* СН3СООН, соли Mg или Си;
водный диоксан или спирты
Реакция является удобным методом получения кислот ряда цнклопентадие-
на, поскольку образующиеся неустойчивые кетены легко реагируют с водой.
Перегруппировке подвергаются разнообразные циклические а-диазокетоны
(алициклнческие, гетероциклические, соединения терпенового ряда н т. д.):
NH
E0%)
Побочные реакции: образование кетазинов, димеризацня исходных соеди-
соединений.
Исходные о-хинондиазиды получают обычно диазотированием соответствую-
соответствующих о-аминохинонов.
Sus О., Ann., 1944, Bd. 556, S. 65, 85; 1953, Bd. 579, S. 133.
Smith P. A. S., Berry W. L, I. Org. Chem., 1961, v. 26, p. 27.
Sus 0., Munder I., Steppan H., Angew. Chem., 1962, Bd. 74, S. 985.
Родина Л. Л., Коробицина И. К., Усп. химнн, 1967, т. 36, с. 624.
De Mayo P. Molecular Rearrangements. New York — London, Interscience,
1963, p. 563.
¦Реакция является частным случаем перегруппировкн Вольфа (см. № 176).
190
272. ИБОРН (EABORN)
Получение триалкилиодсиланов действием нода на тетраалкилсиланы в при-
присутствии йодистого алюминия:
12; нагревание
RSiR *&1
R = Alk, C6H5
* А1
Предполагаемый механизм реакции:
R3SiR
[R3Si++(AlI3Rn
R3SiI
[Allsl
Легкость замещения алкильной группы убывает в ряду:
С«Н5 > СН3 > С2Н5 > н- и изо-СдН,
Введение второго атома иода происходит значительно медленнее, а после-
последующее замещение практически невозможно.
См. также Руфф (№ 529), Флуд (№ 618).
ЕаЬогп С, J. Chem. Soc, 1949, p. 2755.
Anderson H. H., Seaton D. L, Rudnicki R. P. Т., J. Am. Chem. Soc, 1951,
v. 73, p. 2145.
Eaborn C, Webster D. E., J. Chem. Soc, 1960, p. 179.
Bott R. W., Eaborn C, Waters J. A., J. Chem. Soc, 1963, p. 681.
273. ИВАНОВ (IVANOFF)
Получение окснкарбоновых кислот взаимодействием альдегидов или кетонов
с магнийгалогенпроизводными солей арнлуксусных кислот (реактивами Ива-
Иова):
\
:с=о
\XOONa MgX
(эфир)
R—С— COONa
-С-OMgX
Н+
" Аг " Аг
R—С—СООН
—С—ОН
I
E0-80%)
Аг = С„Н5, С1СвН4, 2- и 3-тиенил; R = Н, Alk, Ar, ОС„Н5
В реакцию вступают алифатические и ароматические альдегиды и кетоны,
давая смесь эритро- и грео-изомеров.
Реактивы Иванова реагируют с окисями олефинов, лактонамн, алкнлизо-
цианатами и др. по обычной схеме магнииорганического синтеза:
н2с—сна
[CgHeCHCOONalMgX —
RNCO
НОСН2СНаСН(С„Н5)СООН
CeHBCH(COOH)CONHR
R
.-У \=С(С,Нв)СООН
191
Реактивы Иванова получают двумя
M30-C3H7MgCl:
ArRCH—COONa + R'MgX j
ArRCH—COOH + 2R'MgX -
способами, используя обычно
> [ArRC—COONa] MgX
[ArRC—COOMgX] MgX
Подобно реактивам Иванова реагируют магнийгалогенпроизводные, полу-
полученные из фенилацетонитрнла, N-замещеиных фенилацетамидов, солей C,у-непре-
дельных алифатических кислот, фенилметансульфокислот, например:
(С6Н5JСО + CeH5CHSO3Na
MgCl
(QH5JC-CHSO3H
НО CeH5
См. также Гриньяр (№ 219), Реформатский (№ 507), Франкланд—Дуппа
(№ 624).
Ivanoff D., Spassoff A., Bull. Soc. chira. France, 1931, v. 49, p. 19, 371,
375, 377,
Zimmerman H. E., Traxler M. D., J. Am. Chera. Soc, 1957, v. 79, p. 1920.
Blicke F. F., Raines S., J. Org. Chera., 1964, v. 29, p. 204.
Zhdanov Yu. A., Bogdanova G. V., Ryabakhina 0. Yu., Carbohydrate Res., 1973,
v. 29, № 1, 274—275.
274. ИНХОФФЕН (INHOFFEN)
Получение а-замещенных <х,C-непредельных альдегидов из метоксиацетоиа
н реактива Иоцича через стадии частичного восстановления, дегидратации и
кислетиого гидролиза:
ен3сосн2осн3
RC==C—C(CH3)CH2OCH3
[Pd/CaCO3]
он
RCH=CH—C(CH3)—СН2ОСН3
он
НС1
RCH=CH—С(СН3)=СНОСН3 ¦—>- RCH2—СН=
R = к-С4Н9, цикло-Свиа, СбН5
* LiAlH4
В елучае R = цикло-СцНв образуется смесь альдегидов:
2—сн=с—сно ^х.снсн=с—сно
192
Реакция может быть использована для получения триенальдегидов:
СНЯ СНЯ
СН3ОСН2-
он
он
Г
СН3ОСН
Г
2—С=СН—СН=СН—СН=С—
См. также Арене—ван Дорп (№ 24), Джонс — Уидон (№ 249). Неф
(№ 424).
Inhoffen H. H. e. a., Ann., 1950, Bd. 570, S. 54.
InhoffenH. H., Leibner G., Ann., 1951, Bd. 575, S. 105.
Ahmad R., Weedon В. С L, J. Chem. Soc, 1953, p. 2125.
Houben-Weyl, Bd. 7, T. 1, S. 113.
275. ИОЦИЧ
Получение алкинилмагнийгалогенндов (реактивов Иоцича) действием алкил-
или арилмагнийгалогенидов на монозамещенные ацетилены:
RfeCH + R'MgX (^ RCsCMgX
Х=С1, I, Вг(чаще); R = Alk, Ar; R'= CH3, C2H5, CeH5
* (C4H9JO
Электроноакцепторные заместители в ацетиленах способствуют реакции.
В случае ацетилена образуется равновесная смесь
2CH==CMgBr
BrMgC=CMgBr + СН=СН
что позволяет получать моно- или дизамещенные производные.
Реактивы Иоцича вступают во все реакции, характерные для магниноргани-
ческих соединений, но менее активно, чем реактивы Гриньяра:
RC==CMgX + R'X
RCEsCMgX + R2CO —
RCsCMgX + CH(OR'K
—>• RC=CR'
RCsC—C(OH)R2
RC=C—СНО и т. д.
Реактивы Иоцича применяются для получения различных производных аце-
ацетилена (углеводородов, нитрилов, спиртов, альдегидов и т. п.), в синтезе при-
природных соединений.
См. также Гриньяр (№ 219), Шорыгин (№ 717).
Иоцич Ж. И., ЖРФХО, 1902, т. 34, с. 100.
РИМИОС, т. 4, с. 10.
13-684
193
276. ИПАТЬЕВ
Получение производных циклопропана циклокоидеисацней 1,4-днбромолефи-
нов с иатрнймалоновым эфиром:
BrCH—C=C—CHBr + N
BrCH—C=C C(COOCH3K
нагревание
Na+
—CH=C—С С(СООСНзJ
-СН
C0-80%)
Бензол, дноксан
В реакцию вступают алифатические и алициклические дибромолефииы, на-
например:
Вт
Вг
+ NaCH(COOC2H5J
1,1,4,4-Тетразамещенные 1,4-дибромолефииы не образуют цнклопропанового
кольца. Кроме натриймалоиового эфира в реакции используют натриевые про-
производные ииануксусного и бензоилуксусного эфиров, ацетилацетоиа и дез-
оксибеизоииа, например:
BrCH,-~C=CH—CH2Br + NaCH—С,Н5
СН3 СОС,Н5
CH2=C—НС С
СН, СН2
Из дибромолефинов и способных к енолизации циклических C-дикетонов по-
получают пронзводиые дигидрофурана, например:
См. также Симмоис — Смит (№ 540).
Ипатьев В. Н., ЖРФХО, 1901, т. 33, с. 540.
Staudinger H., Muntwyler О., Киреег О., Helv. chim. acta, 1922, Bd. 5, S. 756.
Kierstead R. W., Linstead R. P., Weedon В. С L, J. Chem. Soc, 1952, p. 3610,
3616; 1953, p. 1799, 1803.
Korte F., Scharf D., Bucket К. Н., Ann., 1963, Bd. 664, S. 97.
194
277. ИСБЕЛЛ — ШАФФЕР (ISBELL — SCHAFFER>
Получение высших кетоз альдольиой конденсацией моносахаридов:
R
СНО
А
HOH + R—C—CHR'
II I
нон о он
С=О
C(R'
(R')OH
CHOH
CHOH
* Ba(OHJ и др.
В реакцию вводятся, как правило, алкилиденовые производные альдоз со
свободной альдегидной группой:
О— CHs1*
СНО
ОН СНСНз
сн2о
сн3нс но-
о-
но—
[са(ОНJ]
он
-СН—1
о
:снсн3
сн2о'
См. также Кочетков — Дмитриев (№ 332), Бутлеров (№ 124).
Schaffer R. I., I shell И. S-, J. Am. Chem. Soc, 1959, v. 81, p. 2178.
Кочетков Н. К- и др. Химия углеводов. М., «Химия», 1967, с. 327.
278. ИСЕЙ (ISAY)
Получение птеридинов циклокондеисацией 4,5-диаминопиримидинов с а-дн-
карбоиильными соединениями:
R R
I мч |N
2 О=С— 60—юо °с
R'
R''
= Н, NH2; R' = H,CeH5
С2Н5ОН, водн. С2Н5ОН
N N
C5-70%)
В качестве карбонильной компоненты могут быть использованы глиоксаль,
фенилглиоксаль, метилглиоксаль, альдегидо- и кетокислоты, щавелевая кислота,
ациклические и циклические а-дикетоиы. В случае несимметричных дикарбоинль-
ных соединений получаегся смесь двух изомеров.
13*
195
Isay 0., Ber., 1906, Bd. 39, S. 250.
Albert A., Quart. Rev., 1952, v. 6, p. 225.
Weinstock I. e. a., J. Med. Chem., 1968, v. 11, p. 618.
Strom С. В., Shiman R., Kaufman S., J. Org. Chem., 1971, v. 36, p. 3925.
279. КАБАЧНИК—ФИЛДС (FIELDS)
Получение дналкиловых эфнров а-аминоалкилфосфоновых кислот конденса-
конденсацией карбонильных соединений с диалкилфосфитами н аммиаком или аминами:
+ H—PO(ORJ + R2NH
нагревание
(C»H5OH)
С—PO(ORJ
C0-90%)
R = Alk; R'=H, Alk
В реакцию вступают разнообразные алифатические, ароматические и гетеро-
ароматические карбонильные соединения, например:
г,—\ <85 °С
// \_CHO + НРО(ОСаН5J + (CaH5JNH ^
О О А(С2Н5J
(84%)
Алифатические соединения реагируют с большей легкостью, чем ароматиче-
ароматические. Достоинство метода в том, что он осуществляется в одну стадию и осно-
основывается на легко доступных исходных веществах.
Гидролизом продуктов реакции получают свободные а-амииоалкилфосфоио-
вые кислоты:
)С- PO(OR)a
NR2
HCl; 130 °С; давление
РО(ОНJ
NR2
Реакцию широко используют для получения сложных аминоалкилфосфо-
натов:
<20 °С
2СН2О -f- 2НЮ(ОС4Н9J + CH3NH2 »- [(С4Н9ОJОР-СН2]аМСН3
G5%)
2R2CO + 2HPO(OR'J + HaN(CH2JNH2 >-
>- (R'OJOP—CR2-NH(CH2JNH—CR2-PO(OR'J
Продукты, получаемые при реакции с диаминами, являются ценными комп-
лексообразователями и применяются в аналитической и неорганической химнн,
а также в медицине (например, препарат «фосфнцин»).
См. также Манних (№ 384).
Кабачшк М. И., Медведь Т. Я-, ДАН СССР, 1952, т. 83, с. 689; 1952, т. 84.
с. 717.
Fields Е. K-, J. Am. Chem. Soc, 1952, v. 74, p. 1528.
Медведь Т. Я. и др., Усп. химии, 1968, т. 36, с. 1116.
Медведь Т. Я. и др. Изв. АН СССР, ОХН, 1970, с. 815.
Нифантьев Э. Е. Химия фосфорорганических соединений. М., Изд. МГУ,
971, с. 60.
196
280. КАДИО-ХОДКЕВИЧ (CADIOT - CHODKIEWICZ)
Получение несимметричных диацетиленов конденсацией монозамещенных
ацетиленов с галогенацетнленами в присутствии однохлорнстой меди и осно-
основания:
RC=CH + XCsCR'
NH4OH*; -20-Н-25 "С
[Cu2CI2]; (СН3ОН)«*
> [RG=CCu + XCesCR'] v RC=C-C=CR'
R, R'= Alk, Ar; X = Br (обычно), I
• RNH2(— 10-^-+10°C), C5H5NC0 —40°C);
** C2H5OH, НСОЫН(СНзJ, Н2О, эфир, тетрагидрофураи
Для предотвращения окисления Cu2Cl2 в реакционную смесь добавляют
NH2OH-HC1.
В реакцию вступают соединения с различными функциональными группами.
Реакционная способность RCssCH возрастает с увеличением растворимости его
медного производного н при наличии заместителя (R), увеличивающего подвиж-
подвижность атома водорода при тройной связи. Побочный процесс — образование сим-
симметричного диацетнлена, протекающее легче при повышенной температуре.
Реакция успешно используется для доказательства строения и синтеза при-
природных высоконенасыщенных несимметричных полиацетиленов.
См. также Глазер (№ 201).
Chodkiewicz W., Cadiot Р., С. г., 1955, v. 241, p. 1055.
Behr О. М. е. a., J. Chem. Soc, 1964, p. 1147.
Эглинтон Г., Макрае В., Усп. орг. химии, 1966, т. 4, с. 267.
Мясникова Р. Н. и др., Изв. АН СССР. ОХН, 1970, с. 1906.
Fallis A. G. e. a., J. Chem. Soc, Perkin Trans. 1, 1973, № 7, p. 746—749.
Котляровский И. А. и др. Реакции ацетиленовых соединений. Новосибирск,
«Наука», 1967, с. 315.
281. КАЛУЦА (KALUZA)
Получение изотиоцианатов разложением N-замещенньк карбэтоксидитиокар-
баматов под действием оснований:
КОН* /?S CICOOG2H-,
RNH2 + CS2 >- RNHcf >
кон»; 20 cc
RNH-C-SCOOC2H5 „ > RN=C=S
S
D0%—колич.)
R = Alk, Ar
* (C2H5KN; ** CHCI3
Разложение может протекать и в отсутствие оснований при нагревании до
100 °С.
В реакцию вступают различные ароматические и алифатические амины.
В случае алкениламинов образуются изотноцианаты гра«с-конфигурации. Арома-
Ароматические амины, содержащие NO2- нли CN-группы, в этих условиях не ре-
реагируют.
197
См. также Вернер (№ 152).
Kaluza L, Monatsh., 1912, Bd. 33, S. 964.
Hodgkins J. E., Ettlinger M. G., J. Org. Chem., 1956, v. 21, p. 404.
Garmaise D. L, Schwartz R-, McKay A. F., J. Am. Chem. Soc, 1958, v. 80,
p. 3332.
Hodgkins 1. E., J. Org. Chem., 1964, v. 29, p. 3098.
282. КАЛЬБ— ГРОСС (KALB — GROSS)
Получение ароматических альдегидов из ацилгидразинов действием ферри-
цианида калия в растворе аммиака:
K3Fe(CN)s
Ar_co-NHNH2 -^fr АгСно
E0-65%)
Ar = CeH5, C6H4Br-o, fi-нафтил, 3-пиридил
В качестве побочных продуктов образуются 1,2-диацилгидразины.
См. также Мак-Фейдиен — Стивене (№ 381).
Kalb L, Gross О., Вег., 1926, Bd. 59, S. 727.
Niemann С, Haus J. Т., J. Am. Chem. Soc, 1943, v. 65, p. 482.
Houben-Weyl, Bd. 7, T. 1, S. 297.
283. КАМЛЕ (KAMLET)
Конденсация щелочных солей нитропарафинов с бисульфитными соединения-
соединениями альдегидов в присутствии щелочей с образованием а-нитроспиртов:
,0
+ RCHSO,Na — > RCH— СН—
I JNaOHj* I j
ОН ОН N02
R = Н, А1к, СС13, Аг
* КОН, карбонаты, бикарбонаты, ароматические амины
См. также Анри (№ 17).
Kamlet J., пат. США 2151517 A939).
Mass H. В., Riley E. F., Chem. Rev., I943, v. 32, p. 406.
284. КАННИЦЦАРО (CANNIZZARO)
Окислительно-восстановительное диспропорционирование двух молекул аро-
ароматического альдегида в соответствующие спирт и кислоту под действием ще-
ще2АгСНО
КОН*; -50 °С
ArCOOH + АгСН2ОН
(С2Н5ОН)"
Аг = C6H4Alk, QHOAIk, С„Н4Х, C6H4NO2
* NaOH, Ca(OHJ; ** Н2О, водный диоксан
198
Скорость реакции зависит от природы заместителей в ароматическом кольце
и убывает в ряду:
jk-NO2
я-С1 > Н > n-Alk > n-AlkO > n-Alk2N
В реакцию вступают также гетероциклические и алифатические альдегиды,
не содержащие а-водородных атомов. Главным ограничением протекания реак-
реакции в ароматическом ряду являются стерические препятствия.
Варианты реакций
I. Перекрестная реакция (Родионов В. М., Федорова А. М.) заключается
в использовании двух разных альдегидов, одним из которых обычно является
формальдегид:
АгСНО -f CH2O
ArCH2OH -f HCOOH
Выходы достигают 80—90%. В реакцию вступают моно-, ди- и тризамещен-
ные бензальдегиды, а также производные нафталина. В случае альдегидов,
имеющих а-водородные атомы, реакции предшествует альдольиая конденсация:
RCH2CHO -f HCHO
нсно
RC(CHaOHJ >- RC(CH2OHK
сно
На этой реакции основан один из промышленных способов синтеза пента-
эритрита.
2. Внутримолекулярная реакция, называемая также перегруппировкой Кан-
ниццаро, представляет собой превращение а-кетоальдегидов в а-оксикислоты:
RC—СНО
II
О
RC—CH—О'
II I
О ОН
RCH—
А-
он
-> RCHCOOH
Так, из фенилглиоксаля с количественным выходом образуется миндальная
кислота.
3. Вариант Локка (Lock) — превращение альдегидов в кислоты сплавлением
со щелочами:
КОН; нагревание
АгСНО >¦ ArCOOH
ArCH2OH —
, QHHal, C6]
2АгСООН
Бензиловые спирты, образующиеся в результате диспропорционирования,
в условиях реакции почти количественно переходят в кислоты.
См. также Тищенко (№ 570).
Cannizzaro S., Ann., 1853, Bd. 88, S. 129.
Lock G., Ber., 1930, Bd. 63, S. 855.
Родионов В. М., Федорова А. М., ЖОХ, 1937, т. 7, с. 947.
Lachowicz D. R., Gritter R. J., J. Org. Chem., 1963, v. 28, p. 1061.
Андреева И. В. и др., ЖПХ, 1969, т. 42, с. 1857.
Кизилина И. С, Винник М. И., «Кинетика и катализ», 1973, т. 14,
с. 1134—1138.
Вейганд-Хильгетаг, с. 855; СОП, т. 2, с. 461; Ингольд, с. 563; ОР, т. 2, с. 106.
199
285. КАРБОНИ — ЛИНДСЕЙ (CARBONI — LINDSEY)
Получение замещенных пиридазичов взаимодействием замещенных тетрази-
нов с непредельными соединениями:
R R
нагревание
(ииертн. растворитель)*
N
-*¦ I
R
60-85%)
R = CHFCF.,, С„Нв, СН3СОО и др.
* HCON(CH3J, эфир + пентан
В реакцию вступают диены, ацетилены, алифатические и алициклические оле-
фины и аллены, стиролы, а также простые и сложные эфиры енолов, еиамины
и ацетали кетенов, например:
, + СН2=С(ОС2Н5J
Как правило, алкены типа R'CH = CH2 более реакционноспособны, чем алке-
иы R'CH = CHR'. Реакция облегчается при наличии электроноакцепториых за-
заместителей в тетразинах и электроиодонорных — в непредельных соединениях.
Олефины с несколькими электроноакцепторными заместителями, например ма-
леиновая кислота, тетрацианоэтилеи и т. п., не вступают в реакцию.
Carboni R. A., Lindsey R. V., J. Am. Chem. Soc. ,1959, v. 81, p. 4342.
Sauer J., Heinrichs G., «Tetrahedron letters», 1966, p. 4979.
Эльдерфильд, т. 8, с. 96.
286. КАУР-ГОФМАН (CAHOURS - HOFMANN A. W.)
Расщепление четвертичных гидроокисей фосфония под действием щелочей
с образованием окисей третичных фосфинов и углеводородов:
+ NaOH*; -25 °С
[R4P] "ОН *- [R4P-OH] -—>¦ R3PO -f RH
R = Alk, Ar
* КОН, Са(ОНJ при 60 °C, BaCO3> PbCO3
Легкость элиминирования радикалов убывает в ряду:
СН2=СН-СНг, СеН5СН2 > С6Н5 > СН3 > С0Н5СН2СН2 > С2Н5 > С3Н7
Разложение гидроокисей фосфоиия, содержащих при атоме фосфора оксн-
метильные группы, сопровождается выделением водорода и формальдегида, на-
например:
[изо-С4Н9Р(СН2ОНK] ОН" > «30-C4H9P(CH2OHJ -j- Н2 + СН2О
О
200
В случае оптически активных соединений фосфония процесс протекает сте-
реоспецифичио с обращением конфигурации у атома фосфора.
Реакция успешно применяется для синтеза окисей третичных фосфииов.
См. также Гофман (№ 208).
Cahours A., Hofmann A. W., Ann., 1857, Bd. 104, S. 18, 32.
Grayson M., J. Am. Chem. Soc, 1963, v. 85, p. 79.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. Кабачинка М. И. М., «Химия», 1972, с. 78, 246.
287. КЕЙВ (CAVA)
Получение циклических диазокетонов из а-дикетонов действием п-толуол-
сульфоиилгидразида с последующим омылением образовавшегося тозилгид-
разона:
c=NNHSO2CeH4CH3
=0
/С==О
F0-90%)
Реакцию используют в основном для превращения полициклических дикето-
иов, например аценафтохинона, фенантрохинона, камферхинона и т. п.
См. также Форстер (№ 621), Бэмфорд — Стивене (№ 133).
Cava M. P., Little R. L, Chem. Ind., 1957, р 367.
Cava M. P., Little R. L, Napier D. R., J. Am. Chem. Soc, 1958, v. 80, p. 2257.
Sus O., Steppan H., Rochlitz !., Ann., 1961, Bd. 639, S. 93.
Wiberg К- В., Hess В. Н'., J. Org. Chem., 1966, v. 31, p. 2250.
288. KEPMAH (KEHRMANN)
Межмолекулярная конденсация 2-оксинафтохинонов (или их аналогов) с
о-аминофенолами, приводящая к феноксазонам (или их аналогам):
нагревание
E0-90%)
R = Н, С1, NHCOCH3; R' = Н, СН3> NH2> N(CH3J; Y = О, NH, NCeH5
201
Kehrmann F., Ber., 1895, Bd. 28, S. 353.
Musso H., Dopp D., Kuhls L, Chem. Ber., 1965, Bd. 98, S. 3937.
289. КЕНИГС— KHOPP (KOENIGS — KNORR)
Получение ацилированных О-алкилгликозидов взаимодействием а-ацилгало-
геноз со спиртами или фенолами в присутствии окиси серебра:
Н-С—X
CHOCOR' O + ROH
CHOCOR'
Ag2O*; CaSO4
(ннертн. растворитель)
Х=С1, Вт
* Ag2CO3
Н-С—OR
CHOCOR'
CHOCOR'
Бромиды реагируют лучше, чем хлориды. Для предотвращения гидролиза
продуктов образующуюся воду либо удаляют азеотропной отгоикой, либо связы-
связывают CaSO*. В случае а-ацилгалогеноз реакция стереоспецифично приводит
к Р-.глнкозидам. Для Р-ацилгалогеиоз реакция не является стереоспецифичной
н сопровождается образованием небольшой примеси а-гликозидов.
Модификация Земплена — Хельфериха (Zemplen — Helferich)—применение
Hg(CNJ или Hg(OCOCHsJ. Реакция идет в гомогенной среде; выходы про-
продуктов 40—60%.
Модификация Бредерека (Bredereck) — использование тритиловых эфнров
первичных спиртов в СНзМО2 в присутствии AgC104. Реакция протекает стерео-
специфичио с высокими выходами Р-гликозидов.
Модификация Шредера (Schroeder) — проведение реакции в присутствии
HgO+HgBr. Выходы гликозидов 70—95%-
См. также Фишер (№ 605), Михаэль (№ 405), Хельферих (№ 650).
Koenigs W., Knorr Е., Ber., 1901, Bd. 34, S. 957.
Pliml I., Sorm F., Coll. Czech. Chem. Comm., 1967, v. 32, p. 3060.
Dejter M. e. a., Carbohydrate Res., 1972, v. 23, p. 41.
Wakabayashi Kazumasa, Pigmen W.; Carbohydrate Res., 1974, v. 35, № 1,
p. 3—14.
Кочетков Н. К и др. Химия углеводов. М, «Химия», 1967, с. 215.
290. КИЖНЕР
Замыкание кольца циклопропана при термическом разложении пиразолииов,
образующихся при взаимодействии а,|}-непредельных альдегидов или кетонов и
гидразина:
Н,С—С—
+H2N-NH,
нагревание
(СгН5ОН)
\
XN
\
\
200—230 *С
[КОН* + Pt/SIO2l
\ /
NH
Г Н.С—СН—"
ч s
N
V
сн—
* NaH2PO4, хннолин, триэтаноламии
202
Выходы на стадии разложения пиразолинов достигают 90%, а общие выхо-
выходы замещенных циклопропанов 50—70%- В реакцию вступают карбонильные
соединения с алифатическими, алициклическими, ароматическими и гетероцикли-
гетероциклическими заместителями:
h2nnh2 /г~А
-СН=СНСОСНо >¦ <f 5—НС СН—СН3
о сн2
G5%)
СН3 СН3
H2NNH2 | |
НСCH-C=N—N=C—
Н8С
Н2С CH
СН2
НС-
1С СН.
(СООНJ;
100 °С
Н2С
HN-N
СН—о/ \>-НС
СН2
Н2
сн2
сн3
СН—С СН—НС СН2
i2 vjI~I2 СП2
См. также Бюхнер (№ 135), Кижнер —Вольф (№ 291), Киорр (№ 308),
Кижнер Н. и др., ЖРФХО, 1911, т. 43, с. 1132; 1913, т. 45, с. 949, 957, 987.
Мещеряков А. П., Глуховцев В. Г., Петрова Д., ДАН СССР, 1960, т. 130,
с. 779.
Эльдерфильд, т. 5, с. 61, 83.
291. КИЖНЕР—ВОЛЬФ (WOLFF)
Восстановление карбонильной группы альдегидов или кетонов в метилено-
вую группу нагреванием их гидразонов в присутствии сильных оснований:
\
/
С=О
H2NNH2; нагревание
(ROH)
Т
-N2
КОН»; 200 °С**
• NaOH, C2H5ONa, KOH + Pt, Pd/CaCO3;
\ /Н
хс7
/ \н
(ДО 90%)
** в запаянных трубках
Реакция применима к алифатическим, ароматическим, алициклическим и ге-
гетероциклическим соединениям, терпенам, стероидам, а также к веществам, со-
содержащим различные функциональные группы:
СН2=СН(СН2JСОСН3 ^:;СН2=СН(СН2KСН3
E0%)
СНа(СН2KСН2ОН
C0%)
СН8СО(СН2JСН,ОН
С„Н5СО—СОС,Н5 -
С,Н6СН2СОС,Н5
(колнч.)
203
В случае а,р-непредельных карбонильных соединений образуются пиразоли-
ны (см. Кижнер, № 290).
Вместо гидразонов можно использовать также семикарбазоны и 2,4-динитро-
фенилгидразоны. Применяя трет-С4Н9ОК и в качестве растворителя диметил-
сульфоксид, можно проводить реакцию при комнатной температуре. Замена гид-
гидразина на алкилгидразины приводит лишь к незначительным выходам соответ-
соответствующих углеводородов. Побочные процессы—образование азннов и восста-
восстановление в спирты.
Достоинства метода — возможность восстановления соединений, чувстви-
чувствительных к кислотам, и проведение реакции с большими количествами веществ
(при использовании растворителей).
Модификация Хуанг-Минлона (Huang-Minion)—использование в качестве
растворителя ди- или триэтиленгликоля с одновременной отгонкой воды и избы-
избыточного гидразингидрата. Это позволяет проводить реакцию с большими количе-
количествами веществ и при атмосферном давлении, получая продукту с более высо-
высокими выходами, например:
с„н6о-
-СО(СН2J—СООН
С„Н5О
-(СН2KСООН
Модификация Гарднера (Gardner)—использование триэтаноламина в каче-
качестве растворителя, что облегчает в некоторых случаях выделение продукта реак-
реакции, например:
H2NNH2-2H2O
NaOOC(CH2MCO(CH2)8CO(CH2MCOONa (HOCH2CHgK>N HOOC(CH2J0COOH
G0%)
Модификация Локка (Lock)—использование избытка порошкообразного
КОН для восстановления гидразонов алифатических и ароматических карбо-
карбонильных соединений. Метод позволяет получать углеводороды с выходами
80—90% в открытом сосуде за 1—3 ч.
См. также Клемменсен (№ 296), Уолфром — Карабинос (№ 588), Швенк —
Папа (№702).
Кижнер Я., ЖРФХО, 1911, т. 43, с. 582.
Wolff L, Ann., 1912, Bd. 394, S. 86.
Lock G., Monatsh., 1954, Bd. 85, S. 802.
Cardner P. D., J. Am. Chem. Soc, 1956, v. 78, p. 3425.
Muller E. e. a., Z. Naturforsch., 1963, Bd. 18b, S. 5.
Szmant H. H., Harmuth С M., J. Am. Chem. Soc, 1964, v. 86, p. 2909.
Osman A. M., Younes M. El-Garby, Ata Mts. F. M., Bull. Chem. Soc. Japan,
1974, v. 47, № 8, p. 2056—2058.
РИМИОС, т. 1, с 7; OS, v. 43, p. 34.
292. КИЛИАНИ — ФИШЕР (KILIANI - FISCHER E.)
Удлинение углеродной цепи Сахаров на одно звено присоединением синиль-
синильной кислоты, последующим гидролизом образовавшихся нитрилов до альдоновых
кислот и восстановлением их лактонов в альдозы действием амальгамы натрия:
204
СНО
СГОН
СГОН
NaCN'
CN
снон
(H2O); [Cad2]«V СНОН (водн'
НОН
40-60 °С
СНО
Na/Hg«»«; 5°C СНОН
снон
I
СНОН
(рН 3-3,5)
B5-50%)
* HCN в ДМФА или в C6H6N с катализатором (C2H6KN;
** ВаС12, NH4C1 и др.; *** NaBH4, электролитическое восстановление
на ртутном катоде (в промышленности)
Образующиеся альдоновые кислоты самопроизвольно превращаются в лак-
тоны. Присоединение HCN приводит к смеси эпимеров, разделение которых про-
проводят на стадии альдоновых кислот путем дробной кристаллизации их солей,
лактонов, амидов, бензилиденовых производных или фенилгидразидов. Соотно-
Соотношение эпимеров зависит от природы исходного сахара и условий реакции, в ча-
частности от добавок солей. При использовании жидкой HCN преобладает эпимер
с транс-расположением ОН-групп у С-2 и С-4. В этом случае проводят катали-
каталитическое гидрирование (над Pd) нитрилов в кислой среде до иминов, которые
самопроизвольно гидролизуются в альдозы.
См. также Кочетков — Дмитриев (№ 332), Соуден—Фишер (№ 551), Ульте
(№586), Урех (№590).
Kilianl H., Вег., 1885, Bd. 18, S. 3066; 1886, Bd. 19, S. 221, 767, 1128, 3033.
Fischer E., Ber., 1889, Bd. 22, S. 2204.
Wolfrom M. L, Wood H. В., J. Am. Chem. Soc, 1951, v. 73, p. 2933.
Hudson S. C., Adv. in Carbohydrate Chem., 1945, v. 1, p. 1.
Webber J. M., Adv. in-Carbohydrate Chem., 1962, v. 17, p. 18.
Wang Jy-Shih, Bull. Inst. Chem. Acad. Sinica, 1973, № 19—20, p. 109—115.
Кочетков И. К- " др. Химия углеводов. М., «Химия», 1967, с. 322.
293. КИРСАНОВ
Получение трихлорфосфазосульфонилалкилов (-арилов) из амидов сульфо-
кнслот и пятихлористого фосфора (фосфазо-реакция):
РС15; нагревание*
RSO2NH2 — * RSO2N=PCI3
(u14)
205
R = Alk, Ar
* 100— 170°C в отсутствие растворителя
Реакция проходит с выходами, близкими к количественным, и применима ко
всем соединениям, содержащим H2NSO2-rpynny, например:
(C2H5JNSO2NH2
n-(CH3JNCeH4N=NCeH4SO2NH2
H,NSO,NH, -
¦*¦ (C2H6JNSO2N=PC13
¦> га-(СНзJМСвН4М=МС
C13P=NSO2N=PC13
Скорость реакции уменьшается с возрастанием электроотрицательиости R.
В аналогичную реакцию вступают амиды и тиоамиды различных минераль-
минеральных и органических кислот, амидины, амины, мочевина и ее производные, на-
например:
4NH2
,NSO2C6H4CH3-n
с,н6-с;
о
C2H5OOC—c/
Nsih2
HtN-C—NH2 -
II
О
(CeH5O)P^
¦N=PC13
.NSO
—» с6н5-с
\n=pci3
-*¦ с2н5оос-с^
\n=pci3
C13P=N-C-N=PC18
II
О
Интересным вариантом фосфазо-реакции является получение трихлорфосф-
азоацилов из эфиров иминокарбоновых кислот:
РСЬ
OAlk
,NHPC14
сг
RCO—N=PC13
Подобно РС15 реагируют его фенил- и феноксипроизводные, например:
(СоН30)зРС12; 150 °С
ArSO2NH2 * ArSO2N=P(OC,H6K
По мере замещения атома хлора в РС15 на фенил- или феиоксигруппы ско-
скорость взаимодействия заметно надает.
Реакция сыграла большую роль в развитии химии имидофосфорных соеди-
соединений.
См. также Штаудингер (№ 722).
Кирсанов А. В., Изв. АН СССР. ОХН, 1950, с. 426; ЖОХ, 1952, т. 22,
с. 88, 269.
Деркач Г. И. и др. Фосфазосоединеиия. Под ред. А. В. Кирсанова. Киев,
<Наукова Думка», 1965, с. 16.
Нифантьев Э. К. Химия фосфороргаиических соединений. М., Изд. МГУ,
1971, с. 209.
206
294. КЛАУСОН-КААС (CLAUSON-KAAS)
Превращение 2,5-диалкоксизамещеиных тетрагидрофуранов в N-замещенные
пирролы при действии аммиака (или первичных аминов) в уксусной кислоте:
б " NR"
B5-80%)
R - CH3, C,H6, C3H7; R' = H, uso-C3H7; R" = H, CH3, CH2NHCOCH3;
R" = H, Alk, Ar
Аналогично реагируют эфиры р-аминокарбоиовых кислот:
R
N
s-OR + R'CHCH2COOR —
0 NH2
R'CHCH2COOR
G5-85%)
R = CH3> C2H6; R' = H, CH3, CH2COOCH3
Исходные тетрагидрофураны синтезируют электрохимическим восстановле-
восстановлением фуранов.
См. также Юрьев (№ 745), Байер (№ 31).
Clausen-Kaas N.. Tyle Z., Acta Chem. Scand., 1952, v. 6, p. 667.
Elming N.. Clauson-Kaas N.. Acta Chem. Scand., 1952, v. 6, p. 867.
Терентьев А. П., Яновская Л. А., Усп. химии, 1954, т. 23, с. 697.
Josey A. D., Jenner Е. 1., J. Org. Chem., 1962, v. 27, p. 2466.
Gross #., Chem. Ber., 1962, Bd. 95, S. 2270.
Пономарев А. А. Синтез и реакции фураиовых веществ. Саратов. Изд. Са-
раговск. уи-та, 1960, с. 171.
OS, v. 47, р. 81.
295. КЛЕЙ — КИННЕР— ПЕРРЕН
(CLAY — KINNEAR — PERREN)
Получение дихлорангидридов алкилфосфоновых кислот, взаимодействием
алкилхлоридов и треххлористого фосфора в присутствии хлористого алюминия
с последующим разложением образовавшегося комплекса эквимольиым количе-
количеством воды*:
РС13; < 20 "С + Н2О; 0 "С
RQ [А.С1з]. > fRPC1° А1С'*1 -^Г RP0C1*
R = Alk
* FeCl3) Nil2, AlBr3
Восстановление промежуточного комплекса магнием или алюминием в при-
присутствии хлористого калия приводит к алкйлдихлорфосфинам.
¦Называют также реакцией Клея.
207
Аналогично реагируют алкилбромиды и -фториды, полигалогеииды, алкило-
вые эфиры и их галогенпроизводиые. Вместо РСЬ могут быть использованы
РВгз, PF3 или алкилдихлорфосфиты, например:
BrCH2POBr2
СН3ОСН2С1
СН3ОРС12
[FeClgl '
CH3POF2
СН3ОСН2ГОС12
F8%)
Побочный процесс — изомеризация исходных алкилгалогеиидов, что является
существенным ограничением метода. В настоящее время реакция испрльзуется
редко.
См. также Зиновьев — Соборовский (№ 268).
Clay J. P., J. Org. Chem., I951, v. 16, p. 892.
Kinnear A. M., Perren E. A., J. Chem. Soc, 1952, p. 3437.
Freedman L. D., Doak G. O., Chem. Rev., 1957, v. 57, p. 483.
Pawar R. A., J. prakt. Chem., 1974, Bd. 316, № 3, S. 507—510.
Пурдела Д., Вылчану Р. Химия органических соединений. Пер. с рум. Под
ред. М. И. Кабачника. М., «Химия», 1972, с. 379.
296. КЛЕММЕНСЕН (CLEMMENSEN)
Восстановление карбонильной группы альдегидов или кетонов в метилеиовую
группу при действии амальгамированного цинка и соляной кислоты*:
Zn/Hg*; HC1; нагревание
(Н2О)**
:н0
E0-80%)
* Zn + C2H5OH; ** С2Н5ОН, СН3СООН, инертные растворители
В этих условиях восстанавливаются алифатические, ароматические и жирио-
ароматические карбонильные соединения, содержащие различные функциональ-
функциональные заместители (например, СООН, COOR, ОСНз, ОН). Гидроксильиая группа,
как правило, не восстанавливается, например:
Н<Х ^ ^ОН Н<Х
сосн.
СНоСНо
(97%)
В условиях реакции происходит гидрирование сопряженных с СО-группой
С = С-связей, гетероциклических ядер, а также замена галогена в а-положении
к карбонильной группе на водород. Побочные реакции — образование пииакоиов
и олефинов.
Модификация Мартина (Marthin) — использование кипящего толуола в ка-
качестве разбавителя; выходы продуктов до 90%.
См. также Кижиер — Вольф (№ 291), Уолфром — Карабинос (№ 588),
Швенк —Папа (№702).
* Называют также реакцией Клемменсена — Мартина (Marthin).
208
Clemmensen Е„ Вег., 1913, Bd. 46, S. 1837.
Staschewski D., Angew. Chem., 1959, Bd. 71, S. 726.
Nakabayashi Т., J. Am. Chem. Soc, 1960, v. 82, p. 3900, 3906, 3909.
Schmitt J. e. a., Bull. Soc. chim. France, 1961, p. 340.
Risinger G. E., Thompson J. A., J. Appl. Chem., 1963, v. 13, p. 346.
Woodgate P. D., Quart. Rev., 1969, v. 23, p. 522.
Физер, т. 3, с. 191; т. 4, с. 202; OP, т. 1, с. 194.
297. КЛЕМО (CLEMO)
Получение оксиспартениа циклокоидеисацией метилового эфира а-пиридил-
уксусной кислоты с этилортоформиатом в производное хииолизина с последую-
последующим каталитическим гидрированием и циклизацией:
,CH9COOCH3
+
СООСНз
с
сн(ос2н5K
(СН3СОJО;
нагревание
CHgOOC'
СООСНз
Метод использован для синтеза ряда спартеиновых алкалоидов.
Clemo G. R., Leitch G. С, J. Chem. Soc, 1928, p. 1811.
Galinovsky F., Kainz G., Monatsh., 1947, Bd. 77, S. 137.
BrossiA., Schmider O., Helv. chim. acta, 1962, Bd. 45, S. 1899.
298. КЛЯЙЗЕН (CLAISEN)
О-Алкилирование фенолов алкилгалогенидами в растворе ацетона в присут-
присутствии поташа*:
К2СО3; нагревание
ArOH + RX *¦ ArOR
(ацетон)*
ТУ— Т
= ВГ, 1
* СН3СОС2Н5
"^Метилирование диметилсульфатом в ацетоне в присутствии поташа назы-
называют также метилированием по Робертсону — Робинсону (Robertson — Robin-
Robinson R.).
14-684
209
Вместо RBr можно использовать RC1 с добавкой Nal (см. Финкельштайн,
№ 602). Если Аг содержит группы, легко реагирующие с кетоиами, то в качест-
качестве растворителей используют спирты.
Метод применяют также для алкилирования р-дикарбонильных соединений.
Мягкие условия реакции позволяют использовать чувствительные к щелочам ал-
килирующие агенты, например СН3СОСН2СН2Вг. Образуется смесь продуктов
О- и С-алкилирования, например:
СН3СОСН2СООС2Н5
C4HSCI
СН3СОСНСООС2Н5 -f СН3С=СНСООС2Н5 (9:1)
С4Н9 ОС4Н9
Реакцию особенно часто применяют для синтеза аллнлариловых эфиров.
См. также Уильямсои (№ 582), Тейлор — Мак-Киллоп (№ 561).
Claisen L, Etsleb О., Ann., 1913, Bd. 401, S. 29.
Henecka H., Ber., 1948, Bd. 81, S. 189.
Brieger G., Pelletier W. M., «Tetrahedron Letters», 1965, p. 3555.
Курц А. Л., Белецкая И. П., Изв. АН СССР. ОХН, 1970, с. 831.
Вейганд-Хильгетаг, с. 336; СОП, т. 3, с. 134.
299. КЛЯЙЗЕН (CLAISEN)
Получение эфиров коричных кислот конденсацией ароматических альдегидов
с эфирамн карбоиовых кислот под действием металлического натрия:
Na
ArCH=C-COOR'
ArCHO -f CH,-COOR'
I' i
R = H, Alk, CeH3; R' = CH3 (обычно), С2Н5
В реакцию вступают также гетероциклические альдегиды, например фур-
фурфурол.
См. также Киёвенагель (№ 305), Перкин (№ 446), Кляйзеи — Шмидт
(№ 304).
Claisen L, Ber., 1890, Bd. 23, S. 976.
Thaker К. A., Pathak U. S., Indian J. Chem., 1965, v. 3, p. 416.
Block R., Ann. chim., 1965, v. 10, p. 583.
Howarth T. T. e. a., J. Chem. Soc, Perkin Trans., 1, 1974, № 4, p. 490—501.
Вейганд-Хильгетаг, с. 805; СОП, т. 4, с. 362.
300. КЛЯЙЗЕН (CLAISEN)
Термическая перегруппировка аллнловых эфиров фенолов или еиолов в изо-
изомерные С-аллильиые производные:
OCH,CH=CHR
чн
С6Н5№
О
н
CHR
210
^ CH2
н
II
:hr
• I
R
E0-80%)
R = H. Alk, C6HS
* C6HSN(C2H5J, (C6HsJO, тетралин
Примеры реакции:
R
,OCH2CH=CHR'
сна==сн-о-сн2сн=сн2
а2 >- сн2=снсн2-сн2сно
Эфиры фенолов, не содержащие заместителей в орто-положении, образуют
о-аллилфенолы. Если оба орто-положения заняты, то происходит миграция ал-
лильной группы в геара-положеиие без перемещения двойной связи внутри ал-
лильного радикала; иногда происходит вытеснение орто-заместителя:
OCHs,CH=CHR ОН
осн2сн==снг
Аналогичная перегруппировка наблюдается и у гетероциклов, например:
N N-CH2—CH=CH,
1 \ 2Оо°с
с-осн,сн=сн„
^C=O
Z Z
Z(~\ Q
Реакция находит широкое применение в синтезе природных соединений,
в частности эфирных масел.
Подобно аллиловым эфирам перегруппировываются еиамины, образуя ими-
ны (амино-перегруппировка Кляйзена — amino-Klaisen):
Н,С п Н2С R
/ V*
ЧШа нагревание |( ( ^
Н2С СН
/я
нс^ ^
I
Н2С СН
R = Alk, C6H5
14»
211
Аналогичной перегруппировке подвергаются непредельные тиоэфиры (тио-
перегруппировка Кляйэена — thio-KIaisen):
СН,=СН—S-CH,-CH=CH,
СН,=СН—СН,—СНа—С
CH2=CH-S-CH2-C=CH
СНа=С=С-СН,-С
V
_|
См. также Гофман — Марциус (№214), Коуп (№ 329).
Claisen L., Вег., 1912, Bd. 45, S. 3157.
Marwell Е. N.. Stephenson J. L, Ong I., J. Am. Chem. Soc., 1965, v. 87,
p. 1265.
Jefferson A., Scheinmann F., Quart. Rev, 1968, v 22, p 391
Andrews J. T. S., Angew. Chem., 1970, Bd. 82, S. 779.
Mortensen. J. Z., Hedegaard В., Zawesson S., «Tetrahedron», 1971 v 27
p. 3831.
Jain A. C, Anand S. M., J. Chem. Soc, Perkin Trans. 1, 1974, № 3, p. 329—333
Hartke K., Goelz G., Chem. Ber., 1974, Bd. 107, S. 566—569.
Gilchrist T. L, Storr R. C. Organic Reactions and Orbital Symmetry Cambrid-
Cambridge, Univ. press, 1972, p. 232.
Мюллер, с. 529; Фьюзон, с. 586; Ингольд, с. 480, 498; ОР, т. 2, с. 7.
301. КЛЯЙЗЕН (CLAISEN)
Конденсация сложных эфиров с соединениями, содержащими активирован-
активированную метиленовую группу, в присутствии оснований с образованием новой угле-
углерод-углеродной связи (сложноэфирная конденсация)*:
\
\
—COOR + XCHR'
/
—COOR
\
OR ¦
—С—С
I l\
"О R' _
-С—С'
II |\
О R'
R' = COOAlk, CN, COAlk
*RONa, NaH, NaNH2, (C6H6KCNa, мезитилмагнийбромид и др.;
*»
инертные растворители
В качестве карбонильной компоненты могут быть использованы эфиры ди-
карбоновых кислот, а также эфиры азотной и азотистой кислот (для получения,
соответственно, нитро- и нитрозосоединений). Классическим примером конден-
конденсации является синтез ацетоуксусного эфира:
С2н50№
2СН8СООС2Н5 >- СН3СОСН2СООС2Н5
G5%)
*Называют также реакцией Кляйзена — Гойтера (Geuther) и Кляйзена -
Вислиценуса (Wislicenus).
212
Лучшим конденсирующим агентом при автоконденсации сложных эфиров
является гидрид натрия. Основная побочная реакция — взаимодействие сложных
эфиров с основанием, например аммонолиз сложных эфиров при действии ами-
амида натрия.
Реакция широко используется для синтеза разнообразных р-дикарбонильных
соединений.
См. также Бейкер — Венкатараман (№ 54), Буво —Локкен (№ 120), Дик-
ман (№ 251).
Geuther A., Arch. Pharm., 1863, Bd. 106, S. 97.
Claisen L e. a., Ber., 1887, Bd. 20, S. 655, 2178, 2188; Ann, 1894, Bd. 281,
S. 306.
Львова С. Д., Евстигнеева Р. П., Преображенский Н. А., Ж. орг. хим., 1967,
т 3 с 1573
'Al-Jallo Hikmat N. A., Al-Hajjar F. H., J. Chem. Soc, 1970, p. 2056.
Nelson R. В., Gribble G. W., Org. Prep. Proced. Int., 1973, v. 5, № 2, p. 55—58.
Ponticello J., Furman R. L, J. Polymer Sci., Polymer Chem. Ed., 1974, v. 12,
№ 5, p. 985—992.
Ингольд, с. 632; OP, т. I, с. 345; т. 8, с. 90.
302. КЛЯЙЗЕН — ХААЗЕ (CLAISEN — HAASE)
Перегруппировка эфиров енолов р-дикарбонильных соединений в изомерные
С-ацильиые производные, катализируемая щелочами или кислотами Льюиса:
-С=СН-С- —-> -С-СН-С-
I II [К0Н] II I II
OCOR О О COR О
* C2H6ONa, Na, KNHa> BF8, A1C18, FeCl3
В условиях основного катализа происходит межмолекулярная миграция
ацильной группы, тогда как в присутствии кислот перегруппировка, по-видимо-
по-видимому, является внутримолекулярной.
См. также Фрис (№ 630).
Claisen L, Haase E., Ber., 1900, Bd. 33, S. 3778.
Wheeler Т. S., Chem. Ind., 1947, p. 753.
Gogan F. e. a., «Tetrahedron», 1958, v. 3, p. 140.
Rothman E. S., J. Org. Chem., 1966, v. 31, p. 628.
303. КЛЯЙЗЕН —ШЕДУЭЛЛ (CLAISEN - SHADWELL)
Циклизация о-аминоарилглиоксиловых кислот в изатины под действием
кислот:
н+
•сосоон
R = Н, СООН, СН3, ОСН3
213
При восстановлении фенилгидразоиа о-иитрофеиилглиоксиловой кислоты
можно получить фенилгидразон изатина:
NNHC,H6
С-СООН C=NNHCBH5
fY SnOb fY \
SNO4
CO
Исходные аминоарилглиоксиловые кислоты синтезируют следующим об-
образом:
сосоон
См. также Зандмейер (№№ 260, 262), Мартине (№ 386).
Claisen L, Shadwell /., Вег., 1879, Bd. 12, S. 350.
Эльдерфильд, т. З, с. 153.
304. КЛЯЙЗЕН —ШМИДТ (CLAISEN — SCHMIDT J. G.)
Конденсация ароматических альдегидов с алифатическими или жирноарома-
тическими альдегидами или кетонами в присутствии водной щелочи с образо-
образованием а,Р-непредельных альдегидов или кетонов:
агсно+rwor
АгСНО + R'CHCOR
-ArCH-CH-COR
A- i'
АгСН—СН—COR
ОН R'
ArCH=C-COR
R'
F5-90%)
* КОН или NaOH в спирте.
Аналогично конденсируются гетероциклические альдегиды (например, фур-
фурфурол). Реакция находит применение в синтезе веществ, обладающих фарма-
фармакологической активностью.
Одним из вариантов метода является использование в качестве метилеиовой
компоненты нитроалканов для синтеза нитростиролов:
АгСНО + CH8NO2 э- ArCH=CHNO2
См. также Кляйзен (№ 299), Кнёвенагель (№ 305),
Claisen L, Dlaparede А., Вег., 1881, Bd. 14, S. 2460.
Schmidt J. G., Вег., 1881, Bd. 14, S. 1459.
Davey W., Tivey D. J., J. Chem. Soc, 1958, p. 1230.
Csuros Z. e. a., Acta Chim. Acad. Sci. Hung., 1968, v. 55, p. 411.
Uchida A., Saito S., Matsuda S., Bull. Chem. Soc. Japan, 1969, v. 42, p. 2989.
Wurm G., Lachmann Ch., Arch. Pharm., 1974, Bd. 307, № 9, S. 695—700.
СОП, т. 1, с 77; т. 2, с. 179.
214
305. КНЁВЕНАГЕЛЬ (KNOEVENAGEL)
Конденсация альдегидов или кетонов с соединениими, содержащими активи-
активированную метиленовую группу, в присутствии слабых оснований с образованием
производных этилена:
/ нагревание \ /
/ \
F0-80%)
* RNH2, R4NH, C6H6N, хинолин, пиперидин, RCOONH4, CH3CONH2,
аминокислоты, CsF, RbF, KF; **C6H6, QH5N
В реакцию вступают алифатические, ароматические и гетероциклические
альдегиды. Кетоны реагируют труднее. Метиленовой компонентой чаще всего
служит малоновая кислота и ее производные, а также ацетоуксусный и цианук-
сусный эфиры.
Главным направлением использования реакции является синтез а,|3-непре-
дельных кислот:
Н3О
RCHO + CH2(COOR'J »- RCH=C(COOR'J >-
нагреЕанне
*- RCH=C(COOHJ *- RCH=CHCOOH
Побочный процесс—образование аминосоединений (см. Родионов, № 521).
Модификация Коупа (Соре) — применение в качестве катализатора ацетил-
аминов или ацетата аммония в бензоле с одновременной отгонкой воды; осо-
особенно успешно используется при конденсации циануксусной кислоты или ее
эфира.
См. также Дёбнер (№ 244), Кляйзен (№ 299), Кляйзен — Шмидт (№ 304),
Перкин (№ 446), Штоббе (№ 727).
Knoevenagel E., Вег., 1896, Bd. 29, S. 172; 1898, Bd. 31, S. 735, 2598; 1904,
Bd. 37, S. 4461.
Van der Baan J. L, Bickelhaupt Fr., Chem. Comm., 1970, p. 326.
Danishefsky S., Rovnyak G., J. Org. Chem., 1974, v. 39, № 19, p. 2924—2925.
СОП, т. 3, с 393; т. 12, с. 167; OP, т. I, с. 280; OR, v. 15, p. 204.
306. КНЁВЕНАГЕЛЬ (KNOEVENAGEL)
Замена оксигруппы в диоксинафталинах на ариламиногруппу при нагревании
с ароматическими аминами в присутствии иода:
ОН + 2ArNH2
ArNH
NHAr
(колич.)
Аг = С6НБ, СвН4СНя, С6Н4ОСН3, СвН4ОН
В реакцию вступают также нафтиламины и гетероциклические амины. Ана-
Аналогично реагируют а- и р-нафтолы, резорцин и флороглюцин. В случае о-, п-ди-
фенолов в основном замещается одна оксигруппа:
215
Knoevenagel E., J. prakt. Chem., 1914, Bd. 89, S. I.
Buu-Hoi N. P., J. Chem. Soc, 1952, p. 4346.
Sauerland H. D., Zander M., Franke W. H., «Tetrahedron Letters», 1971, № 5,
p. 455—456.
307. КНООП —ЭСТЕРЛИН (KNOOP — OESTERLIN)
Каталитическое восстановление а-кетокислот в а-аминокислоты в присутст-
присутствии аммиака:
R-C-
II
О
NH3; H2
NH
R-CH—COOH
NH8
(80-» 6%)
R = Alk
* Ni-Ренея
В реакцию вступают также двухосновные кетокислоты.
Knoop F., Oesterlin Н., 1. physiol. Chem., 1925, Bd. 148, S. 294.
Arnstein H. R. V., Bentley R., Quart. Rev., 1950, v. 4, p. 186.
Huffman С W., Skelly W. G., Chem. Rev., 1963, v. 63, p. 632.
308. KHOPP (KNORR)
Получение пиразолов циклоконденсацией р-дикарбонильных соединений
с гидразинами:
R'CH—CR"
RC-CH—CR"
II I II
О R' О
H2NNHR'
* РОС13 при 0 °С, NaOH при нагревании; ** СН3ОН, С2Н5ОН
В реакцию вступают р-дикетоны, Р-кетоальдегиды, эфиры у-кетопиРовино-
градных кислот, ацетали р-диальдегидов, ацетоуксусный эфир, Р-хлорвииилкето-
ны. Замещенные гидразины ((арил- и алкилгидразины, аминогуанидии, семикар-
базид и т. п.) образуют смеси изомерных пиразолов.
Циклоконденсация а,а-диалкильных производных р-дикетонов с гидразином
приводит к пиразоленинам, например:
R
СН3СО—С—COCHS
H2NNH2
R
216
Из а-карбалкокси-р-дикетонов в зависимости от условий реакции образуют-
образуются пиразолы или пиразолоны:
,С3Н,
H2NNH2H2O /
С3Н,СОСНСОСН3—
соосн3
(эфнр)
NH
СН3ООС
H2NNH2CH3COOH
(СНзОН)
См. также Пехман (№ 452).
Knorr L., Вег., 1883, Bd. 16, S. 2597.
Lipp M., Dallacker F., Munnes S., Ann., 1958, Bd. 618, S. 110.
Bianchetti G., Pocar D., Qazz. chim. ital., 1962, v. 92, p. 799.
Грандберг И. И., Кост А. Н. Изв. ТСХА, 1967, с. 210.
Эльдерфильд, т. 5, с. 43.
309. KHOPP (KNORR) •
Получение 2-хинолонов конденсацией Р-кетоэфиров с ариламинами и после-
последующей циклизацией под действием серной кислоты:
R'COCH2COOR" + R
COR'
-^ R
NH,
О
NH
конц. H0S04;
-100—150 °С
R'
ч
NH
R = Н, NH2, ОН и др.; R' = Alk, Ar; R" = Alk
В реакцию могут вступать также 2-аминопиридины и 2-аминохинолииы, но
они циклизуются с участием обоих атомов азота, например:
СН3СОСН2СООС2Н5
сн.
Из 2-аминоиндолов образуются производные а-карболинов:
+ СН3СОСН2СООС2Н5
217
См. также Комб (№ 315), Конрад —Лимпах (№ 319).
Knorr L, Ann., 1886, Bd. 236, S. 69; 1888, Bd. 245, S. 357, 378.
Хитрик С. Я., ЖОХ, 1939, т. 9, с. 1109.
Hodgkinson А. !., Staskun В., J. Org. Chem., 1969, v. 34, p. 1709.
Борисов Н. Н., Сагитуллин Р. С, Каст А. #., «Химия гетероциклических со-
соединений», 1972, № 1, с. 48.
Эльдерфильд, т. 4, с. 25; т. 7, с. 159, 168.
310. КНОРР (KNORR)
Получение пирролов конденсацией а-аминокетоиов с кетонами, содержа-
содержащими активированную метиленовую группу:
RCH-COR' + R"CH2COR'"
NH»
NH
Особенно успешно проходит реакция, если R' и R'" — ацильные или карб-
алкоксильиые группы. При R'"=Alk реакция не идет. Используя N-замещен-
ные а-аминокетоиы, получают соответствующие N-алкил- или N-фенилпирролы.
Побочная реакция—образование пиразинов:
R< N о„
RCH—COR' + H2NCH—COR"'
NH2 R" 1V N
Исходные а-аминокетоны получают восстановлением изонитрозокетонов дей-
действием Na2S2O4 или Zn в СН3СООН:
HNO2
R'CO-CH2R >- R'CO-CR >¦ R'CO-CHR
II I
NOH NH2
Вместо а-аминокетонов успешно используют монофеиилгидразоиы а-дикето-
иов, например:
R\
R—С=О
Zn
CH2R"
I + I
R'_C=NNHC6H5 COR'"
F0-80%)
Аналогично можно получать производиые тетрагидроиндола:
R
сосн3 к х /
NNHCeH,
СН3
NH
См. также Ганч (№ 189), Миллер — Плёхль (№ 399), Пилоти — Робиисон
<№ 459), Хинсберг (№ 667).
218
Knorr L, Вег., 1884, Bd. 17, S. 1635; Ann., 1886, Bd. 236, S. 290.
Treibs A., Schmidt R., Zinsmeister R., Chem. Ber., 1957, Bd. 90, S. 79.
Castro A. J., Giannin D. D., Greenlee W. F., J. Org. Chem., 1970, v 35,
p. 2815.
Терентьев А. П., Яновская Л. А., Усп. химии, 1954, т. 23, с. 697.
Шведов В. И., Алтухова Л. Б., Гринев А. #., «Химия гетероциклических со-
соединений», 1972, № 3, с. 342.
Миронов А. Ф. и др., «Химия гетероциклических соединений», 1973, № 12,
с. 1643—1645.
Эльдерфильд, т. 1, с. 222.
311. КОЛЕР (KOHLER)
Циклизация 1,3-динитроалкаиов в изооксазолии^-оксиды под действием ос-
оснований:
RCH-
j
O2N
СН
R'
CHR
1
NO2
CHsONa»;
нагревание
(СН^ОН)*
R =
*
"Г
I
С,
(С
RCH-C-CHR >
O2N R'
-» R—/ ^N-0
0
F0-90%)
,H5> COOAlk; R' = Ar
2H6JNH в С2Н6ОН
- RC-
II
-O2N
-C=
1
A'
=CHR1
J
Циклизация в отсутствие оснований идет с выходами 20—30%. При R = Alk
реакция не идет.
Аналогичную циклизацию претерпевают З-бром-1-нитроалканы:
O2NCH2—СН—CHR
СНзСООК
I
(СНзОН) \ /
С8Н6 Вг О
R = COOAlk, COAlk, COC0H6
Побочными продуктами в этом случае являются нитроциклопропаны.
Исходные динитроалкаиы получают конденсацией альдегидов или шиффо-
вых оснований с а-нитроэфирами или фенилиитрометаиом, а бромнитроалка-
иы — бромированием иитрокетоиов или эфиров нитрокарбоновых кислот:
R'CHO -f 2OaNCHaR v RCH—CH-CHR
CnH5CH=C—C6H5 -(- CeH5CH2NO2
NO,
O2N R' NO2
—>- CeH3CH—CH—CHCeH5
I I I
O2N CSH5 NO2
Kohler E. P., Barrett G. R., J. Am. Chem. Soc, 1924, v. 46, p. 2105.
Dornow A., Wiehler G., Ann., 1952, Bd. 578, S. 113.
Nielsen А. Т., Archibald T. G., J. Org. Chem., 1969, v. 34, p. 984.
219
312. КОЛЬБЕ (KOLBE)
Превращение алкилгалогенидов в нитрилы под действием цианидов щелоч-
щелочных металлов:
NaCN*; нагревание
RX ГТТ^Г.Г^ RCN
(водн. Q>H5OH)
F0-80%)
* KCN, Cu2(CNJ
Первичные алкилгалогениды реагируют лучше, чем вторичные, а третичные
не вступают в реакцию. Реакционная способность алкилгалогеиидов увеличива-
увеличивается в ряду С1 < Вг < I, что позволяет проводить реакцию избирательно,
например:
С1СН2СН2СН2Вг v C1CH2CH2CH2CN
G0%)
При использовании в качестве растворителя диметилсульфоксида выходы
нитрилов повышаются (в случае первичных алкилгалогенидов — выходы коли-
количественные, для вторичных 70%). Хлорциклогексаиои и я-иитробеизилхло-
рид в реакцию ие вступают.
Побочные продукты — изоиитрилы. С количественными выходами изонитри-
лы могут быть получены реакцией алкнлгалогенидов с цианидом серебра.
См. также Пелуз (№ 445), Розенмунд— Брауи (№ 523), Штреккер (№ 732).
Wohler F., von Liebig J., Ann., 1832, Bd. 3, S. 267.
Friedman M., Shechter H., J. Org. Chem., 1960, v. 25, p. 877.
Gordon M., DePamphilis M. L, Griffin С. E., J. Org. Chem., 1963, v. 28,
p. 698.
Sandier S. R., Kara W. Organic Functional Group Preparations. New York —
London, Acad. press, 1968, p. 459.
Всйганд-Хильгетаг, с. 763.
313. КОЛЬБЕ (KOLBE)
Получение углеводородов электролизом растворов щелочных солей алифа-
алифатических карбоиовых кислот:
20-50 °С
2RCOO- „, _ > [RCOO- > R.J v R-R
E0-90%)
(Н2О)'
R = Alk
* СН3ОН, HCON(CH3J4-(C2HjKN
Использование смеси солей двух разных кислот позволяет получать несим-
несимметричные углеводороды. Наличие функциональных групп, удаленных от карб-
карбоксила, ие препятствует реакции. Разветвление углеродной цепи в а-положеиии
к карбоксильной группе затрудняет реакцию. К а-замещеииым (ОН, CN, X
и т. п.), а также а,|3-иепредельиым кислотам реакция ие применима. В случае
кислот с асимметрическим а-углеродным атомом происходит рацемизация.
Побочные процессы: образование RH, RCOOR, ROH и олефииов.
Реакцию используют, в частности, для получения высших дибромалкаиов:
2Вг(СН2)„СООН > Вг(СН2J„Вг
E5-70%)
! = 5—П
¦220
См. также Брауи — Уокер (№ 112), Хофер—Мест (№ 672).
Kolbe П., Ana, 1849, Bd. 69, S. 257.
Lindsey R. V., Peterson M. L, J. Am. Chem. Soc, 1959, v. 81, p. 2073.
Finkelslein M., Petersen R. C, J. Org. Chem., 1960, v. 25, p. 136.
VudoH Б., Усп. орг. химии, 1963, т. 1, с. 9.
Eberson L, Nyberg K-, Acta Chem. Scand., 1964, v. 18, p. 1567.
Vijh A. K-, Conway B. F., Chem. Rev., 1967, v. 67, p. 623.
Woods R., Electrochim. acta, 1970, v. 15, p. 815.
Beck F., Electrochim. acta, 1973, v. 18, № 5, p. 359—368.
Coleman J. P. e. a., J. Chem. Soc, Perkin Trans., 1974, pt. 2, № 9, p. 1064-
1069.
СОП, т. 12, с. 37.
314. КОЛЬБЕ —ШМИТТ (KOLBE — SCHMITT)
Получение ароматических оксикислот термическим карбоксилироваиием фе-
фенолятов щелочных металлов двуокисью углерода:
соо-
E0-90%)
При использовании феиолятов натрия и лития основным продуктом реакции
является о-оксикислота, а для фенолятов калия — я-оксикислота. Электроиодо-
иориые заместители способствуют реакции, тогда как электроноакцепториые за-
затрудняют процесс. Аналогично реагируют конденсированные полициклические
и гетероциклические оксисоедннеиия.
Реакция применяется как основной способ промышленного синтеза салици-
салициловой, я-амииосалициловой, Р-оксииафтойиой и других кислот.
Модификация Марассе (Marasse) — нагревание смеси фенола с безводным
поташем в атмосфере СО2 A70°С, 90—135 кгс/см2). Поташ может быть заменен
карбоиатами рубидия или цезия.
Kolbe П., Ann., 1860, Bd. 113, S. 125; J. prakt. Chem., 1874, Bd. 10, S. 89.
Schmitt R., Ber., 1887, Bd. 20, S. 2702; J. prakt. Chem., 1885, Bd. 31,
S 397
Marasse R., нем. пат. 78708 A894).
Lindsey A. S., Jeskey H., Chem. Rev., 1957, v. 57, p. 583.
Raecke В., Angew. Chem., 1958, Bd. 70, S. 1.
Bhogwanth M. R. R. e. a., Indian J. Chem., 1969, v. 7, p. 1065.
СОП, т. 2, с 430.
315. КОМБ (COMBES)
Получение замещенных хинолииов конденсацией ароматических аминов
с C-дикетоиами и последующей циклизацией образовавшегося аиила под дейст-
действием серной кислоты:
HO-CR"
нагревание
+ R.C-CH-C-R" ,„ > R
¦NH,
(СгН6ОН)*
о1
о
CR'"
КОНЦ. H2SO4"
нагревание
221
R"
I
N
R'
R"
R=H, Alk, OCH3> Cl, Br; R' = H, CH,
* Без растворителя; ** безводн. HF при -~20 °С; ZnCl2, полифосфорная кислота
В реакцию вступают р-дикетоиы с алифатическими и ароматическими заме-
заместителями, 2-ацилциклогексаноны, а также Р-кетоальдегиды, р-хлорвинилкетоиы,
Р-хлорвииилальдегиды и малоновые диальдегиды, например:
Электронодонорные заместители в лгега-положении к аминогруппе заметно
облегчают, а в яара-положении затрудняют реакцию. Вместо анилинов можно
использовать гетероциклические, а также конденсированные полициклические
амины.
См. также Гоулд — Джекобе (№ 207), Кнорр (№ 309), Конрад—Лимпах
(№ 319), Кэмпс (№ 348), Ниментовский (№ 426), Дёбнер — Миллер (№ 246),
Скрауп (№ 543).
Combes А., С. г., 1887, V. 106, р. 142; Bull. Soc. chim. France, 1888, Ser. 2,
v. 49, p. 89.
Кочетков H. К., Усп. химии, 1955, т. 24, с. 32.
Brown Е. V., J. Org. Chem., 1965, v. 30, p. 1607.
Lloyd D., Gagen J. M. F., J. Chem. Soc, Ser. C, 1970, p. 2488.
Красавин И. А. и др. Труды ИРЕА, 1971, т. 23, с. 94.
Эльдерфильд, т. 4, с. 28; т. 7, с. 160, 164, 168.
316. KOHAHT (CONANT)
Получение а-оксиалкилфосфоновых кислот взаимодействием
треххлористым фосфором и последующим гидролизом*:
1. РС13; <Зб°С
альдегидов с
rcho 2;Zw
он
R = H, Alk, Ar
• (CH3CO)aO
Аналогично РС13 реагируют алкилдихлорфосфины.
При нагревании альдегидов с треххлористым фосфором в запаянных труб-
трубках в результате внутримолекулярной перегруппировки Арбузова (см. № 16)
образуются дихлорангидриды а-хлоралкилфосфоновых кислот:
RCHO
'• РС13: 200 С
*
[(RCHC1OKP >¦ RCHC1-PO(OCHC1RJ]
»- RCHC1—РОС12
¦Называют также реакцией Фоссека-
ge — Conant).
- Пейджа — Конанта (Fossek — Ра-
222
См. также Абрамов (№ 1).
Fossek W., Monatsh., 1884, Bd. 5, S. 121, 627; 1886, Bd. 7, S. 20.
Page H. I., J. Chem. Soc, 1912, p. 101, 423.
Conant J. В., MacDonald A. D., J. Am. Chem. Soc, 1920, v. 42, p. 2337.
Bonnard R. A. B. e. a., Can. J. Chem., 1953, v. 31, p. 976.
Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. Изд. 2-е.
Т. 2. М., «Химия», 1970, с. 395.
317. КОНДАКОВ
Присоединение галогенангидридов карбоновых кислот к олефинам в при-
присутствии кислот Льюиса с образованием Р-галогенкетоиов*:
,0
чх
—КН-+20
lZnCl2]*; (CH2C12)*
RCH2—С—С—С
Х = С1 (обычно), Вг; R = Н, Alk, Hal, CeH6
*SnCl4, A1C13, TiCl4, BF3; **CHC13, CC14, CeH6NO2, CS2
В реакцию вступают ациклические, алициклические и галогензамещенные
олефины, тетраметилэтилен, терпены. Аналогично реагируют фуран и тиофен.
Вместо галогенангидридов могут быть использованы ангидриды кислот.
Р-Галогенкетоны легко отщепляют НХ при повышении температуры или
действии третичных аминов, превращаясь в а,р-непредельные кетоны.
Присоединение галогенангидридов к ацетиленам приводит к Р-галогенди-
винилкетонам, которые в этих условиях не отщепляют НХ:
—С=С- + RCOX
RCO—С=С-Х
Побочные реакции: образование предельных и 3>У~непРеДельнь1х кетонов и
сложных эфиров.
Реакцию часто используют для получения ацилированных олефинов с выхо-
выходами ~35—60%.
См. также Бутлеров — Эльтеков (№ 127), Неницеску (№ 419).
Kondako}} J., J. prakt. Chem., 1893, Bd. 48, S. 467.
Darzens G., С. г., 1910, v. 150, p. 707.
Кочетков Н. K-, Усп. химии, 1955, т. 24, вып. 1, с. 32.
Hanulse J., Smolders R. R., Bull. Soc. chim. France, 1967, p. 2139.
Klein E., Rojahn W., «Tetrahedron Letters», 1971, № 39, p. 3607.
РИМИОС, т. 7, с 255.
318. КОНОВАЛОВ
Нитрование алифатических, алициклических и жириоароматических соеди-
соединений азотной кислотой:
\ 12-20%-ная ШО3; 100-150 °С \
;с—н »- x
/I /I
x-no2
/I
¦Взаимодействие хлораигидридов кислот с алициклическими олефннами в
присутствии А1С1з, приводящее к а,р-иепредельным кетоиам, часто называют
реакцией Дарзана (Darzens) или Дарзана — Крапивина.
223
Нитрование протекает по радикальному механизму. Реакцию, как правило,
проводят под давлением. Обычно образуется смесь первичных, вторичных и тре-
третичных иитросоедииеиий. Легкость замещения атома водорода убывает в ряду:
трет- >его/?- > пере-.
Жириоароматические соединения легко нитруются в а-положеиие боко-
боковой цепи. Галогеипроизводиые нитруются легче, чем соответствующий угле-
углеводород. Спирты и альдегиды в условиях реакций легко окисляются, давай
главным образом кислоты. При замещении у асимметрического атома углерода
оптическая активность соединения сохраняется.
Побочные реакции: окисление, образование нитратов, нитритов, иитрозо-
и полииитросоедииеиий.
Модификация Титова — нитрование азотной кислотой в присутствии кисло-
кислорода; при этом иитросоедииеиия (например, феиилиитрометаи) получаются с бо-
более высокими выходами.
См. также Мейер (№ 391), Тер-Меер (№ 562), Хасс (№ 641).
Коновалов М. И., ЖРХО, 1888, т. 20 B), с. 118.
Топчиев А. В. Нитрование углеводородов и других оргаиических соедииеиий.
М., Изд. АН СССР, 1956, 356 с.
СОП, т. 2, с. 365, 513; РИМИОС, т. 7, с. 133.
319. КОНРАД —ЛИМПАХ (CONRAD — LIMPACH)
Получение 4-оксихииолииов коидеисацией эфиров р-кетокислот с аромати-
ароматическими аминами с последующей циклизацией образовавшихся аиилов р-кето-
эфиров:
COOR"
RCOCHCOOR" + R'"
R'
(ДО 90%)
R = Н, СН3, COOAlk, OAlk; R' = Н, Alk, COCH3
*Кипячеиие с НС1 или H2SO4, нагревание с полифосфориой кислотой
Метод позволяет широко варьировать как амиииую, так и карбонильную
компоненты; в качестве аминов могут быть использованы производные конденси-
конденсированных полициклических систем.
Конденсация при 130—140 °С приводит к аиилидам, при циклизации кото-
которых образуются 2-хииолоиы (см. Киорр, № 309).
Вариант Юста (Just)—конденсация иатриймалоиового или иатрийацетоук-
сусиого эфира с N-замещениыми ароматическими имииохлоридами. Метод ис-
используется для синтеза беизхииолииов:
С1
N=CA
NaCH(COOC2H6J
СН(СООС2Н5J
N=CAr
2 24
См. также Комб (№ 315).
Conrad M., Limpach L, Ber., 1887, Bd. 20, S. 944, 948; 1891, Bd. 24, S. 2990.
Reitsema R. И., Chem. Rev., 1948, v. 43, p. 43.
Moszew /., Przem. Chem., 1965, v. 44, № 10, p. 7.
Heidel N. D., Ohnmacht С J., J. Heterocyclic Chem., 1968, v. 5, p. 869.
Madhav R. e. a., J. Heterocyclic Chem., 1973, v. 10, № 2, p. 225—228.
Эльдерфильд, т. 4, с. 25, 479; т. 7, с. 156, 159, 164, 168.
320. КОРИ (COREY)
а-Карбометоксилирование циклических кетонов действием диметилкарбоната
и гидрида натрия:
\
СН»
¦/
I + (СН3ОJС=О
с=о
NaH; нагревание
».
(диоксан)
—соосна
,С=О
Метод используют для карбометоксилироваиия разнообразных би- и поли-
полициклических кетоиов, например:
СН3 СН3
СН,
(СН3ОJСО СН3"
СООСН,
О
О
¦6%)
Оптическая активность соедииеиий сохраняется. Выходы продуктов значи-
значительно выше, чем при двухстадийиом введеиии карбалкоксигруппы коидеисацией
кетоиов с эфирами щавелевой кислоты и последующим декарбоксилироваиием.
Corey Е. }., Mitra R. В., Udo H., J. Am. Chem. Soc, 1964, v. 86, p. 485.
Eisenbraun E. J. e. a., J. Org. Chem., 1967, v. 32, p. 3010.
321. КОРИ (COREY)
Получение эпоксисоедииеиий из кетоиов действием диметилсульфоииймети-
лида или диметилсульфоксоиийметилида:
\
)С=О + (CH3JS=CH2
-о °с
2
о
*Тетрагидрофураи
F0-8
15-684
225
В реакцию вступают различные ароматические альдегиды и кетоиы, алидик-
лические и а,[$-ненасыщенные кетоны, причем в последнем случае эпоксиды об-
образуются только при реакции с диметилсульфовийметилидом, а действие диме-
тидаульфоксоиийметилида приводит к циклопропилкетонам:
с.н5
С,НвСН=СНСС,Н5—
О
(CH3JS~CH? с,н5сн
=сн—с-
(87%)
\
сн»
-+¦ С,Н5—НС СН—CC,HS
сн2 о
(98%)
От используемого реагента зависит также пространственное расположение
окисиого кольца, например:
О
(CH3JS=CH2
о
(CH3JS=CH2
(80%)
Диметилсульфонийметилид более стабилен, чем диметилсульфоксоииймети-
лид, но менее реакциоиноспособен.
Исходные метилиды получают следующим образом:
. СН3—S=CHa Na+
о-
(CHsJS=CH2 + (CHsJSO
+ NaH
(CHsJS I *¦ (CHsJS=CH2
О
См. также Прилежаев (№ 474).
Corey E J., Chaykovsky M. L, J. Am. Chem. Soc, 1962, v. 84, p. 867, 3782.
Cook С. E., Corley R. С Wall M. E., «Tetrahedron Letters», 1965, p. 891.
Физер, т. 1, с 339; т. 5, с. 139, 141.
226
322. КОРИ —ВИНТЕР (COREY — WINTER R. A. E.)
Получение олефинов взаимодействием гликолей с тиокарбонилдиимидазолом
(Ы,М-диимидазолилтиокетоиом) и последующим десульфироваиием и декарбокси-
лированием циклического тиоикарбоната действием триалкилфосфитов:
II N^ /^
НО ОН
\
Г
О
(ROKP; нагревание \ /
*- V Г
G8-95%)
=s
R=CH3, C2H6,
В реакцию вступают различные алифатические и алициклические 1,2-диолы.
Процесс протекает стереоспецифично и позволяет получать оптически чистые
цис- и гране-олефины, например:
i—СН—СН—С
он
W
(92%)
Метод используют и для получения ненасыщенных производных моносаха-
моносахаридов.
См. также Кун — Винтерштайи (№ 342).
Corey Е. }., Winter R. A. E., J. Am. Chem. Soc, 1963, v. 85, p. 2677.
Horton D., Turner W. N.. «Tetrahedron Letters», 1964, p. 2531.
Corey E. J., Carey F. A., Winter R. A. E., J. Am. Chem. Soc, 1965, v. 87,
p. 934.
Hartmann W. e. a., Chem. Ber., 1973, Bd. 106, № 4, S. 1076—1082.
Физер, т. З, с. 389; т. 5, с. 436.
323. КОРНБЛЮМ (KORNBLUM)
Получение альдегидов превращением первичных алкилгалогеиидов в соот-
соответствующие тозилаты с последующим окислением диметилсульфоксидом:
RCH2X
. . . (CH3JSO; NaHCO3;
0-6 °С 100-159 "С
*¦ RCH2-OS02CeH4CH3 >- RCHO
(CH3CN)
F5-75%)
R = (СН2NСН3, (СНаNСН3, С,Н4Вг-я, С,Н4СН3-п, CeH4NO2-n
X = С1, Вг
Из алкилиодидов альдегиды могут быть получены прямым окислением ди-
диметилсульфоксидом:
R (СНа)„1
(CH3JSO+NaHCO3; H5-150 °С
*¦ R
F0-85%)
CH3, CH=CHa, C=CH; n = 5, 6, 7, Ц
15*
227
Аналогично из яа/кг-замещеииых бромметиларилкетоиов образуются соответ-
соответствующие арилглиоксали:
(CH3)aSO; -25 "С
АгСО—СН2Вг > ArCO—CHO
G0-85%)
Аг = С,Нв> С,Н4—СвНв, CeH4Cl, CeH4Br, CeH4NOa
См. также Соммле (№ 549), Хасс —Беидер (№ 642).
КогпЫат N. е. a., J. Am. Chem. Soc, 1957, v. 79, p. 6562; 1959, v. 81,
p. 4113.
Johnson A. P., Pelter A., J. Chem. Soc, 1964, p. 520.
Физер, т. 1, с. 327.
324. КОРНФОРТ (CORNFORTH J.)
Стереоспецифический синтез цис- или г^акс-олефииов из соответствующих
хлоргидрииов превращением их в эпоксиды, расщеплением эпоксидов иодистово-
дородиой кислотой и последующим восстановлением образовавшихся иодгидри-
нов смесью хлорокиси фосфора и хлористого олова в пиридине:
\
кон \
но ciX
С-
? \ /
/ Х
(-80%)
Эффективное расщепление эпоксида достигается действием Nal+CHsCOONa
в смеси уксусиой и пропиоиовои кислот. Оптическая чистота получаемых олефи-
нов составляет 80—85%.
Исходные хлоргидрины синтезируют из а-хлоркетонов или а-хлоральдеги-
дов и реактива Грииьяра:
\
ХС—CR"
R'/l II
R С1 О
Rv
R'"MgBr
R
./
/R"
V
Cl OH
R, R', R" = H, Alk; R'" = Alk
Метод находит применение для синтеза полиеиов, например сквалеиа.
См. также Коуп (№ 330), Рамберг —Беклунд (№ 494).
Cornforth J. W., Cornforth R. H., Mathew К. К-, J. Chem. Soc, 1959, p. 112.
Brady S. F., Шоп М. A., Johnson W. S., i. Am. Chem. Soc, 1968, v. 90,
p. 2882.
Физер, т. З, с. 29.
325. КОРНФОРТ (CORNFORTH R.)
Окислительное расщепление карбонильных соединений, содержащих активи-
активированную метилеиовую группу, под действием водного раствора периодата иат-
рия с образованием кислот:
NaIO4
RCH2—С—R' ——> RCOOH + R'COOH
и (Н2О)*
О
*СН3ОН (водн.)
228
Для облегчения расщепления кетоны предварительно переводят в а-оксиме-
тиленовые производные, например:
НСООСНз
[CH3ONal
НООС(СН2LСООН
снон
а ,сн„
снон
сн„
но ,сн.
D9%)
См. также Либен (№ 364).
Huebner С. F., Ames S. R., Bull E. С, J. Am. Chem. Soc, 1946, v. 68
p. 1621.
Cornjorth R. H., Cornforth J. W., Popjak Q., «Tetrahedron», 1962, v. 18, p. 1351.
Физер, т. З, с. 85.
326. КОСТАНЕЦКИЙ (KOSTANECKI)
Циклизация о-окси- или о-ацетоксихалкоидибромидов под действием щелочи
с образованием флавонов или 2-бензилиденкумарононов-З:
О Bi Br
II I I л—\
— СН-СН-/ \
NaOH; нагревание
OR"
R' (водн. С2Н5ОН)»
R = Н, ОН; R' = Н, OAlk и др.; R" = Н, СОСН3
*(СН3JСО (водн.)
Направление реакции зависит от природы радикала R', определяющего
реакционную способность атомов брома. В случае R'=H оба атома брома рав-
равноценны, поэтому возможно образование как флавона, так и кумароиона. Если
R' — электронодонорный заместитель, повышается реакционная способность ато-
атома брома в р-положении, что благоприятствует образованию флавоиов. При
проведении реакции в спиртовом растворе KCN или при нагревании выше тем-
температуры плавления образуются только флавоны.
Аналогично реагируют соответствующие производные конденсированных по-
полициклических углеводородов,
229
См. также Алгар — Флинн — Оямада (№ 11).
Kostanecki S., Tambor L, Ber., 1899, Bd. 32, S. 2264.
Fitzgerald D. M., O'Sallivan 1. F., J. Chem. Soc, 1955, p. 860.
Эльдерфильд, т. 2, с. 185.
327. КОСТАНЕЦКИЙ — РОБИНСОН
(KOSTANECKI —ROBINSON R.)
Получение хромоиов ацилированием ароматических о-оксикетонов ангидри-
ангидридами кислот в присутствии солей соответствующих кислот с последующей цик-
циклизацией*!
О
-190-200 "С
О
№2СОз">
R = Alk, OAlk, OCOCH3, ОН, Cl; R'= Н, Alk (до С1в),
Ar, OAlk, OCOCH3; R" = Alk, Ar
*(C2H6KN, (HOCH2CH2KN; "Р2ОВ, НС1 -f CH3COOH,
С2Н5ОН + СНзСООН, (СНаСО)аО
В случае R"=Ar промежуточно образующийся сложный эфир может пере-
перегруппировываться и вступать в реакцию со второй молекулой ангидрида кисло-
кислоты, образуя 3-ароилхромоны:
О
R
OCOAr
КоСОз
О СОАг
II I
.С—CHR'
OCOAr
О СОАг
С—CHR'
ОН
-> R
О
о
(ArCOJO
.СОАг
Аг
При R"=Alk наряду с хромонами образуютси кумарнны (см. Барджеллиии,
№ 44).
¦Реакцию о-оксикетонов с ангидридами ароматических кислот называют
также реакцией Аллана — Робинсона (Allan—Robinson).
230
В реакцию вступают разнообразные ароматические о-оксикетоиы, например:
О О
(СН3СОJО
О
R = СН3, С2Н8, С6Н6
См. также Четтэуэн (№ 695).
Kostanecki S., Вег., 1901, Bd. 34, S. 102, 2942.
Allan J., Robinson R., J. Chem. Soc, 1924, v. 125, p. 2192; 1926, p. 2334.
Cook P., Mclnture I. S., J. Org. Chem., 1968, v. 33, p. 1746.
Szell T. e. a., Helv. chim. acta, 1969, Bd. 52, S. 2636.
Thomas T. S., Sethna S., J. Indian Chem. Soc, 1973, v. 50, p. 326.
OP, т. 8, с 120, 159, 226.
328. КОТИ (KOCHI)
Хлордекарбоксилирование карбоновых кислот действием тетраацетата свин-
свинца и хлористого лития с образованием алкилхлоридов:
РЬ(ОСОСН3L; UC1; 80 °С
RCOOH >¦ RCI
(СвНв)
F0%—колич.)
Предполагают, что реакция протекает по свободнорадикальному механизму.
Наиболее легко реагируют третичные н вторичные алифатические кислоты, ху-
хуже— первичные. Хлордекарбоксилироваиие ароматических кислот проходит с
низкими выходами. Реакция применима также к алициклическнм и гетероцик-
гетероциклическим кислотам, например:
N
соон
:н3
у
С1
сн.
N
-СООН
NH
R = Н, ОСН3, ОСН2С„
Vci
' NH
231
В случае алициклических кислот образуется смесь цис- и транс-изомеров.
Побочный процесс — образование хлористого метила из РЬ(ОСОСНзЬ.
Замена LiCl иа LiBr или Lil позволяет получать соответствующие алкил-
галогениды.
Kochi J. К., J. Org. Chem., 1965, v. 30, p. 3265.
Kochi J. K., J. Am. Chem. Soc, 1965, v. 87, p. 2500.
Trydman B. e. a., J. Org. Chem., 1968, v. 33, p. 3762.
Christol H., Moers D., Pietrasanta Y., Bull. Soc. chim. France, 1969, p. 962.
Stolow R. D., Giants Th. W., J. Am. Chem. Soc, 1971, v. 93, p. 3536.
329. КОУП (COPE)
Термическая изомеризация 1,5-диенов, сопровождающаяся миграцией ал-
лильной группы от С-3 к С-1 и сдвигом двойных связей:
Y
-200 "С *\
/R'
RCH=CH-CH2—С-СН=С
R, R', R" = H, Alk; Y,
чс=сн—с—сн-сн=сн.
L R" R
F5—90%)
: = соос2н5> cn, сен6 и др.
Перегруппировка является внутримолекулярной реакцией, протекающей че-
через циклическое переходное состояние с инверсией аллильной группы. Скорость
реакции зависит от природы заместителей (Y и Z) и уменьшается в ряду:
2CN > CN + СООС2Н6 > 2СООС2Н6
1,5-Диены, не содержащие электроноакцепторных заместителей, реагируют,
как правило, в более жестких условиях (~300°С). Дивинилциклопропан и ди-
винилциклобутан перегруппировываются с расширением цикла, например:
190 °С
-40 °С
В случае соединений типа ArC(YZ)CH2CH = CH2 перегруппировка не про-
происходит.
Синтез кетонов термической изомеризацией 3-окси-1,5-диенов называют
окси-перегруппировкой Коупа (оху-Соре):
R
\
НО
См. также Кляйзен (№ 300).
Соре А. С, Hardy E. M., J. Am. Chem. Soc, 1940, v. 62, p. 441.
232
Doering W. E., Roth W. R., Angew. Chem., 1963, Bd. 75, S. 27.
Berson J. A., Jones M., J. Am. Chem. Soc, 1964, v. 86, p. 5017, 5019.
John E., Kaplan M. S., Chem. Comm., 1969, p. 1354.
Baldwin J. E., Kaplan M. S., J. Am. Chem. Soc, 1971, v. 93, p. 3969=
Takeda K., «Tetrahedron», 1974, v. 30, № 12, p. 1525—1534.
330. КОУП (COPE)
Термическое разложение N-окисей третичных аминов с образованием оле-
финов и Ы,М-дизамещенных гидроксиламинов*:
\ / 80-150 °С* \ /
^СН-С^ > С=С
ОNR
R2NOH
О—NR2
(-90%)
R = СН3> С2Н5, СзН7
•~20 °С в смеси тетрагидрофуран—диметилформамид
Реакцию проводят в токе азота, обычно в вакууме. Как правило, происхо-
происходит ^"оэлиминирование с образованием смеси изомерных олефииов, например:
сн3снаснсн3 —> сн3сн=снсн3 + сн3сн2сн=снг
O~-N(CH3J
C3%)
V
с=снсн3
/
СН/ (93%)
Nc;
сн/
сн3
F7%)
н—сн=сн2
G%)
Н(СН3J
F4%)
C6%)
Побочная реакция — изомеризация N-окисей в О-замещенные гидроксилами-
ны (см. Майзенхаймер, № 376).
Исходные N-окиси аминов получают окислением аминов перекисью водорода
или надкислотами. В случае стерически затрудненных амииов во время окисле-
окисления может произойти самопроизвольное элиминирование гидроксиламина.
Реакцию можно использовать как для получения олефинов, так и для син-
синтеза М,1Ч-дизамещенных гидроксиламинов.
См. также Бэмфорд — Стивене (№ 133), Гофмаи (№ 208), Корифорт
(№ 324), Рамберг — Беклунд (№ 494), Чугаев (№ 700).
Mamlock L, Wolffenstein R., Ber., 1900, Bd. 33, S. 159.
Cope A. C, Foster Т. Т., Towle P. H., J. Am. Chem. Soc, 1949, v. 71, p. 3929.
Ohloff G., Lienhard В., Helv. chim. acta, 1965, Bd. 48, S. 182.
¦Называют также реакцией Коупа — Мамлока — Вольфеиштайна (Соре —
Mamlock — Wolffenstein).
233
Siegl W. О., Johnson С. R., J. Org. Chem., 1970, v. 35, p. 3657.
Zovada J. e. a., Coll. Czech. Chem. Comm., 1973, v. 38, № 7, p. 2102—2120.
Физер, т. 1, с. 621; СОП, т. 11, с. 36; ОР, т. 11, с. 372.
331. КОХ —ХААФ (KOCH —HAAF)
Получение третичных карбоновых кислот карбоксилированием олефинов
смесью муравьиной и концентрированной серной кислот:
\ / НСООН*; H2SO4; 6-40 °С
/С==С\ ~~
\:н—с/
\н-с
с
ос>
.ООН
* СО под давлением; ** без растворителя.
Реакция проходит через стадию образования нона карбоиия, устойчивостью
которого определяются выходы кислот.
Аналогично реагируют спирты, хлористые алкилы, простые эфиры и угле-
углеводороды, содержащие водород при третичном атоме углерода, например:
НООС—С(СН,J
Ж) .СЩСЩ,
НООС СН(СНзJ
(СНз),С—С1
G6%)
(-70%
соон
Реакция часто сопровождается перестройкой углеродного скелета, например:
СН, СН,
СН3(СН2NСН=СН2
—С—С2Н6 + C5HU—С—СН8
соон соон
Реакция ие является стереоспецифнчной; образование того или иного изо-
изомера или их смеси зависит от условий проведения реакции, например:
ОН
НСООН
конц. H2SO4
коиц. H2SO4 + SO3 B0%)
/\/СН3
f L.cooh +
COOH
~- -соон
234
Сравнительное изучение реакций Коха — Хаафа и Риттера (см. № 512)
показало, что окись углерода обладает большей реакционной способностью, чем
нитрилы, особенно в случае соединений, содержащих фенильные группы.
по Риттеру
(С,Н6JС-ОН
СН,
Не реагирует
по Коху—Хаафу
» (С,Н6JС—СООН
СН»
13
A8%)
См. также Ботт (№ 105).
Koch П., Haaf W., Ann., 1958, Bd. 618, S. 251.
Christol П., Solladie G., Bull. Soc. chim. France, 1966, p. 3193.
Peters J. A., Bekkum H., Rec. trav. chim., 1971, v. 90, p. 65.
Kell D. R., McQuillin F. J., J. Chem. Soc., Perkin Trans., 1972, pt. 1, p. 2096.
Godleski S. A. e. a., Chem. Ber, 1974, Bd. 107, № 4, S. 1257—1264.
Физер, т. 2, с. 330.
332. КОЧЕТКОВ —ДМИТРИЕВ
Удлинение углеродной цепи моносахаридов иа два звена превращением их
в г/7аяс-2,3-дегидро-2,3-дидезоксиальдоновые кислоты с последующим гидрокси-
лированием двойной связи действием осмиевого ангидрида в растворе йоднова-
йодноватой кислоты и восстаиовлеиием образовавшихся альдоиовых кислот
сно
нон
COOR COOR
I I
СН СНОН
II I
СН OsO4 СНОН Na/
СНОН (Н1Оз)* СНОН
I I
*НС1О3; **NaBH4
СНО
СНОН
** СНОН
СНОН
Синтез гранс-2,3-дегидро-2,3-дидезоксиальдоиовых кислот может быть осу-
осуществлен конденсацией алкилиденовых производных моносахаридов с малоиовой
кислотой (см. Кнёвенагель, № 305).
RCHO + СН2(СООН)а
[CSH3N]
или реакцией Виттига (см. № 168):
RCHO + (C9H6KP=CHCOOR' —
RCH=CHCOOH
RCH=CHCOOR'
См. также Исбелл — Шаффер (№ 277), Килиани—Фишер (№ 292).
Кочетков Н. К., Дмитриев Б. А., Изв. АН СССР. ОХН, 1962, с. 1262; 1965,
с. 1405.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 325.
[я у:
п. S
Вогеп Н. В. е. a., Acta Chem. Scand.. 1973, v, 27, № 7, p. 2639—2644.
235
333. КОЧЕШКОВ
Диспропорционирование тетраалкил- или тетраарилолова при нагревании
с галогенидами четырехвалентного олова с образованием галогеноловооргани-
ческих соединений:
-200 °С
3R4Sn + SnX4 »- 4R3SnX
-200 °С
R4Sn-f SnX4 >¦ 2R2SnX2
-юо °c
R4Sn + 3SnX4 »- 4RSnX3
X = Cl, Br
Точное соблюдение стехиометрических соотношений реагентов и температуры
реакции позволяет получать продукты нужного состава. При R=Alk выходы
80—90%, а для R = Ar— 60—70%.
В тех случаях, когда образуется смесь продуктов различной степени алкили-
рования, ее превращают в оловоорганическое соединение нужного состава на-
нагреванием с рассчитанным количеством R*Sn или S11X4.
Побочная реакция — разложение конечных продуктов, иапрнмер:
2(C4H9KSnCl v ЗС4Н10 + ЗС4Н8 + Sn -f SnCl2
Кочешков К. А., ЖРФХО, 1929, т. 61, с. 1385.
Методы элемеитоорганической химии. Германий, олово, свинец. Под ред.
А. Н. Несмеянова и К. А.. Кочешкова. М., «Наука», 1968, с. 329.
334. КРАФТ (KRAFFT)
Уменьшение углеродной цепи алифатических карбоиовых кислот на один
атом углерода нагреванием их кальциевых солей с ацетатом кальция и после-
последующим окислением образовавшихся метилкетонов:
СгОз
(RCH2COOJCa -f (СН3СООJСа ¦> RCH2COCH3 >- RGOOH
В реакции можно использовать также бариевые соли.
См. также Барбье — Виланд (№ 43), Галлахер — Холландер (№ 187), Ми-
шер (Jfe 407).
Krafft F., Ber., 1879, Bd. 12, S. 1664.
Whitmore F. С Organic Chemistry. New York, D. Van Nostrand Co., 1951,
p. 255.
Klages F. Lehrbuch der organischen Chemie. Bd. 1. Berlin, De Gruyter, 1952,
S. 262, 266, 368.
335. КРЕЙГ (CRAIG)
Замещение амииогруппы в а-аминопиридинах на бром:
N
¦NH.
Вг2; 0°С
(конц. НВг)
>
NaNO2; 0°C
N
НВг-Вг,
¦NH,
236
N
•N=N Br
NaOH; -20 °С
->¦ R
(Н2О)
N
Br
E0-90%)
R = Н, CH3, Br, Cl
Аналогично реагируют аминопроизводные и другнх азотсодержащих гетеро-
циклов:
N
N
N
G8%)
Метод имеет препаративное значение для получения бромзамещенных гетеро-
гетероциклических соединений, так как в обычных условиях реакции Зандмейера (см.
№ 261) а-аминопиридииы, например, не диазотируются. Для замены аминогруп-
аминогруппы на хлор илн иод метод не пригоден.
Чичибабин А. Е. и др., ЖРФХО, 1915, т. 47, с. 1571; 1918, т. 50, с. 502.
Craig L. С, J. Am. Chem. Soc, 1934, v. 56, p. 231.
Эльдерфильд, т. 1, с. 400, 434; СОП, т. 4, с. 94
336. КРЕЙТОН (CREIGHTON)
Электролитическое восстановление альдоз в соответствующие спирты иа
амальгамированном свинцовом или цинковом электроде в растворе сульфата
натрия:
У Pb(Hg) или Zn(Hg); 18-25 °С ^^
СНОН (води, р-р Na2SO4)* *" СНОН
*K2SO4, Na2CO3, MgSO4, Ca(NO3J
Восстановление глюкозы приводит к сорбиту, побочным продуктом являет-
является маннит. Ксилоза восстанавливается в ксилит, а галактоза — в дульцит.
Метод применяют для промышленного восстановления глюкозы. Общий вы-
выход сорбита и маниита 90%.
Creighton H. }., пат. США 1712951, 1712952 A929); С. А., 1929, v. 23, р. 3172.
Overend W. О. е. a., J. Chem. Soc, 1961, p. 3487.
Рорр F. D., Schultz H. P., Chem. Rev., 1962, v. 62, p. 27.
237
337. КРЕТЬЕН —ЛОНЖИ (CHRETIEN — LONGI)
О-Нитрозирование алифатических спиртов действием смеси нитрита иатрия
и сульфата алюминия:
NaNOs+Al2(SO4K
R0H ^5Г- R0N0
G0-90%)
Фенолы в тех же условиях образуют С-нитрозопроизводные, например:
ОН ОН ОН
N0
(«%) C1%)
См. также Либерман (№ 365).
Chretien A., Longi Y., С. г., 1945, v. 220, р. 746.
Bevillard P., Choucroum J., Bull. Soc. chim. France, 1957, p. 337.
338. KPEHKE (KROHNKE)
Получение альдегидов конденсацией солей N-алкилпиридиния с я-иитрозо-
диметиланилином и последующим гидролизом образовавшегося нитрона:
NaOH
х-
RCH
=N/~v
(Е0ДН,
НС1*
N(CH3J >¦ RCHO
О
G0-80%)
*H8SO4 (разб.)
Мягкие условия реакции позволяют получать ароматические, гетероцикли-
гетероциклические, а,Р-непредельные и а-кетоальдегиды. Наличие электроноакцепторных за-
заместителей облегчает реакцию.
Исходные четвертичные соли получают из RCH^X и C5H5N или по реакции
Ортолева — Кинга (см. № 436)
Метод находит применение в химии терпенов и стероидов.
Модификация Каррера (Karrer) — использование эфиров п-толуолсульфо-
кислоты для получения пиридиниевых солей в тех случаях, когда исходные ал-
килгалогениды труднодоступны:
n-CH3CeHiSO2Cl ~50°C
RCH=CHCH4OH
(C5H5N)
+ RCH=CHCH8—
См. также Соммле (№ 549).
RCH=CHCHO
238
Krohnke F., Borner Е„ Вег., 1936, Bd. 69, S. 2006.
Karrer P. e. a., Helv. chim. acta, 1941, Bd. 24, S. 1044; 1949, Bd. 32, S. 1013.
Krohnke F., Angew. Chem., 1963, Bd. 75, S. 319.
Hamer /., Macaluso A., Chem. Rev., 1964, v, 64, p. 481.
339. КРИГЕ (CRIEGEE)
Получение цис-а-гликолей гидроксилироваиием олефииов действием четы-
рехокиси осмия с последующим гидролизом эфиров осмиевой кислоты*:
OsO4
-ОН
Д tC6H6Ni; (ЗФИР, c_Q/ с_он
/Х /\ /\
(ДО 95%)
•СвНв, циклогексаи, СНС1„ СН3СООС«Н5
В реакцию вступают разнообразные олефины, фенантрен и другие полицик-
полициклические ароматические соединения. Диены дают продукты 1,2тидроксилирова-
иия. Пиридин заметно катализирует реакцию, образуя комплекс с осматами.
По Гофмаиу, гидроксилирование проводят в водных растворах действием
NaClO3+OsO«, что дает особенно хорошие результаты в случае низших алифа-
алифатических олефинов.
Для гидролиза осматов используют раствор ИагБОз в водном спирте, ще-
щелочные растворы маннита нли формальдегида, сероводород.
См. также Вагнер (№ 137), Вудвард (№ 179), Майлас (№ 337), Саретт
(№ 535).
Criegee R., Ann., 1936, Bd. 522, S. 75.
Criegee R., Marchand В., Wannowius H., Ann., 1942, Bd. 550, S. 99.
Ганстон Ф. Д., Усп. орг. химии, т. 1, с. 121.
Физер, т. 3, с. 40; Вейганд-Хильгетаг, с. 275.
340. КРИГЕ (CRIEGEE)
Термическая перегруппировка сложных эфиров 9-гидропероксидекалина в
сложные эфиры 1-окси-1,6-эпоксициклодекаиа:
O—OCOR
О+ "OCOR
нагревание
(СНзОН)*
R= CH3, CCI3, An
*С6Н6, ССЦ, СН3СООН, C5H5N
OCOR
+
О.
OCOR
ОТ
G0-90%)
¦Называют также реакцией Гофмана (Hofmann К- А.) — Криге.
239
Аналогично перегруппировываются эфиры 8-гидропероксигидриидана. При
R = Ar электроноакцепторные заместители в ароматическом кольце ускоряют
перегруппировку, а электронодонорные — замедляют. Эта реакция представляет
собой пример расщепления С—С-связей. Подобная перегруппировка имеет место
в реакции Сергеева (см. № 537).
. Criegee R., Вег., 1944, Bd. 77, S. 722.
Criegee R., Ann., 1948, Bd. 560, S. 127.
Bartlett P. D., Kice 1. L, J. Am. Chem. Soc, 1953, v. 75, p. 5591.
Goering H. L, Olson A. C, J. Am. Chem. Soc, 1953, v. 75, p. 5853.
Denney D. В., Denney D. G., J. Am. Chem. Soc, 1957, v. 79, p. 4806.
341. КРИГЕ (CRIEGEE)
Окислительное расщепление а-гликолей тетраацетатом свинца с образова-
образованием карбонильных соединений:
-С-С-
РЬ(ОСОСН3L
(водн.
но он
2^С=0
(колич.)
*CeHe, CHC1,, C5H6N
Для реакции характерна высокая стереоспецифичность. Быстрее всего рас-
расщепляются а-гликоли, включающие полуацетальный гидроксил (сахара), мед-
медленнее— ациклические гликоли, еще медленнее — циклические. чис"Соединеиия
реагируют быстрее, чем транс-.
Аналогично расщепляются щавелевая кислота, а-дикарбоиильные соедине-
соединения, а-оксиальдегиды, а-оксикетоны, а-оксикислоты.
См. также Малапрейд (№ 382), Руфф — Феитои (№ 530).
Criegee R., Вег., 1931, Bd. 64, S. 260; 1932, Bd. 65, S. 1770.
Новые методы препаративной органической химии. Пер. с англ. Под ред.
Д. Н. Курсанова. М., Издатинлит, 1950, с. 12.
Кочетков Н. К и др. Химия углеводов. М., «Химия», 1967, с. 91.
Физер, т. 3, с. 219.
342. КУН —ВИНТЕРШТАЙН (KUHN — WINTERSTEIN)
Превращение а-гликолей в олефины действием дииодида фосфора:
| |
он он
Реакция применяется для получения различных полиенов или кумулеиов,
например:
CiH,CH=CH~CH—СН-СН=СНСвН5 >- СвН5СН=СН-СН=СН-СН=СНСвНв
он он
(90%)
240
О
сн=с он
о
с=сн
СН
О
о
О
sCH
(С6Н5JС-С=С-С==С-С(СвН6J
ОН ОН
; (QHe)
о
о
О
* (С6Н6JС=С=С=С=С=С(С6Н5),
E8%)
См. также Кори — Винтер (№ 322).
Kuhn R., Winterstein A., Helv. chim. acta, 1928, Bd. 11, S. 106.
lnhoffen H. e. a., Ann., 1965, Bd. 684, S. 24.
Kessler H., Ott W., «Tetrahedron Letters», 1974, № 15, p. 1383—1386.
Физер, т. 4, с. 82.
343. КУН —РОТ (KUHN —ROTH)
Окислительное отщепление С-метильных групп в органических соединениях
действием хромовой и серной кислот с образованием уксусной кислоты:
СН
,-L
CrO3 + H2SO4
+• СН3СООН
Метод применяется для качественного и количественного определения С-ме-
С-метильных групп.
Метод позволяет также определять С-метильные группы в производных
азотсодержащих гетероциклических соединений (пиперидина, пиразина, иидола
и т. д.), кроме производных пиридина. Для определения метильиых групп в выс-
высших жирных кислотах, а также метальных групп, связанных с ароматическим
ядром, метод не применим.
С помощью этого метода возможно проводить определение этокси- и аце-
ацетильных групп. Метоксигруппы в условиях реакции окисляются до СО
Kuhn R., Roth H., Вег, 1933, Bd. 66, S. 1274.
Franck В., Knoke J., Chem. Ber., 1962, Bd. 95, S. 579.
Houben-Weyl, Bd. 2, S. 274.
344. КУРЦЕР (KURZER)
Получение 3,5-диамино-1,2,4-тиадиазолов окислительной циклизацией'амиди-
нотиомочевин:
NHR
N- -/
RNH-C-NH-C-NHR
Зг2*; -25—35 СС
(CHGls)**
*- RNH--
N
NH
S
E0-80%)
R = H, Alk, Ar
*Н20г в разбавленных минеральных кислотах; **водн. С2Н6ОН
16-684
241
Аналогично циклизуются и другие производные тиомочевины, например:
NHCOAr
S
н2о2
H2N-C—NH-C—NH-COAr
II H <HC»
S NH
В качестве окислителя иногда используют арилсульфоиилхлориды в пи-
пиридине.
Побочная реакция: десульфуризенция исходных соединений с образованием
амидииомочевин.
См. также Айнхорн— Бруннер (№ 7), Пеллиццари (№ 444).
Kurzer F., J. Chem. Soc, 1955, p. 1, 2288; 1956, p. 2345, 4524; 1957, p. 2999.
Эльдерфильд, т. 7, с. 430.
345. КУРЦИУС (CURTIUS)
Получение первичных аминов термической перегруппировкой азидов карбо-
иовых кислот в изоцианаты с последующим гидролизом:
RCON,
нагревание
(СвНв)«
R—N=C=O
н2о
RNH2
R = Alk, Аг
•СНС13, инертные растворители
Реакция применима также к гетероциклическим и алициклическим азидам
и азидам, содержащим различные функциональные группы. Азиды а-галогеиза-
мещенных и а,{5-непредельных карбоновых кислот в этих условиях дают альде-
альдегиды или кетоны, например:
Вг
CON,
NCO
О
F0%)
Перегруппировка катализируется сильными кислотами. Превращение опти-
оптически активных азидов происходит с сохранением конфигурации. Вторичные и
третичные амины в этих условиях не образуются.
Метод широко применяется для синтеза изоцианатов, уретаиов и N.N'-диза-
мещенных мочевии:
RCON,
RNCO —
R'OH
R'NHj
RNHCOOR'
RNHCONHR'
См. также Бекман (№ 58), Гофман (№ 210), Дарапский (№ 228), Лоссен
(№369), Шмидт (№714).
Curtius Т., Вег., 1890, Bd. 23, S. 3023.
Fahr E., Neumann L, Angew. Chem., 1965, Bd. 77, S. 591.
Lieber E., Minnis R. L., Rao С N. R., Chem. Rev., 1965, v. 65, p. 381.
Lee Kong Ко e. a., Chem. Pharm. Bull., 1969, v. 17, p. 2540.
242
Степанов Ф. H., Столяров 3. E., Ж. орг. хим., 1970, т. 6, с. 1186.
Кошелев В. И., Плакидин В. JI, Журн. ВХО им. Д. И. Менделеева, 1974,
т. 19, № 3, с. 358—359.
СОП, т. 3, с. 432; Фьюзон, с. 179; ОР, т. 3, с. 322.
346. КУРЦИУС (CURTIUS)
Получение диарилацетиленов из гидразонов а-дикетонов действием окиси
ртути (II):
2H2NNH2
/ (Q)H7OH)
/~\-г_г~
NNH
HgO:
нагревание
—R >-
(СвНв)
F5-75%)
R = H, CH3
Из циклических дикетонов этим методом получают циклоалкины:
(CH3)n-C=NNH2 (СН,)Я-С
СН2 C=NNH2 " СН3 С
B5-35%)
я=5 — 7
Использование вместо HgO смеси CF3COOAg и (C2H6)sN позволяет полу-
получать диарилацетилены с выходами до 85%.
Curtius Т., Thun К., J. prakt. Chem., 1891, Bd. 44, S. 161, 168.
Schlenk W., Bergmann E., Ann., 1928, Bd. 463, S. 76.
Newman M. S., Reid D. E., J. Org. Chem., 1958, v. 23, p. 665.
СОП, т. 6, с 35; РИМИОС, т. 7, с. 47.
347. КУЧЕРОВ
Каталитическая гидратация ацетилена, его гомологов и производных с об-
образованием карбонилсодержащих соединений:
с—с
H2SO4; нагревание
[Н?2+]*; (води. С2Н5ОН)**
-СН=С-
он
50, BF3-H2O; **H2O
—СН2— С—
II
о
Присоединение происходит по правилу Марковиикова. Монозамещениые
ацетилены образуют кетоны, а при наличии сильных электроиоакцепториых за-
заместителей— смесь альдегидов и кетонов, например:
CF,-C=CH
CF3—СН2—СНО + CF3—CO-CH3
16»
243
На направление гидратации дизамещенных ацетиленов сильно влияет при-
присутствие функциональных заместнтелей:
C1C=CR'
)с-<ы*-
R
C1CH2-COR'
—CH2-COR'
,C-C==C-
/I
OCOCH3
= NR2, OH, OAlk
V—СО-СНг—
OCOCH,
Очень легко гидратируются алкоксиацетилены, что позволяет использовать
их в качестве дегидратирующего средства при синтезе пептидов. Возможно про-
проведение селективной гидратации тройной связи в присутствии двойной:
СН2=СН—С=СН у СН2=СН-СО-СН3
Реакцию используют в промышленности для производства ацетальдегнда.
См. также Ньюленд (№ 430).
Кучеров М. Г., ЖРФХО, 1881, т. 13, с. 533, 542.
Kutscheroff M., Вег., 1881, Bd. 14, S. 1540.
Фишер Л. Б., Усп. химии, 1958, т. 27, с. 589.
Дорфман Я. А., Сокольский Д. В., ДАН СССР, 1965, т. 163, с. 103.
Голодова К- Г., Якимович С. И., Ж- орг. хим., 1972, т. 8, № 10,
с. 2015—2019.
Физер, т. 2, с. 65; т. 3, с. 181.
348. КЭМПС (CAMPS)
Циклизация о-ациламиноацетофенонов под действием щелочи с образова-
образованием оксихинолинов:
NaOH*
NHCOCHoR
(водн. С2Н5ОН)
N
*C2H5ONa в спирте
CH2R
Суммарный выход продуктов ~90%. Соотношение изомеров определяется
природой R: при R = H, С6Н5, СОС6Н5 преобладают а-окснхннолины. В реакцию
вступают также разнообразные соединения типа o-RCONHC6H4COR' (R'=C6Hs,
СООН, ОН, Н и др.)- Метод позволяет синтезировать многоядерные гетеро-
гетероциклические соединения:
ОН
С2Н6ООССН2-СО
с,нйоос.
:N
(С;,Н5ОН)
244
-СН2-(СН2J
¦NH—СО—СН
См. также Байер —Древсен (№ 37), Комб (№ 315), Ниментовский
(№ 426), Скрауп (№ 543).
Camps R., Вег., 1899, Bd. 32, S. 3228.
Manske R. H. F., Chem. Rev., 1942, v. 30, p. 127.
Bornstein L, Reid W. I., Torres D. J., J. Am. Chem. Soc, 1954, v. 76, p. 2760.
Эльдерфильд, т. 4, с. 45.
349. КЭРРОЛЛ (CARROLL)
Получение ¦у.о-непредельных кетонов термической конденсацией (З/у-непре-
дельных спиртов с эфирами р-кетокислот*:
ОН
r'c—ch—coor'
II
о
160-190 °С
I r'c-hc
"r'c—CH —COO—C —C=CR —У II
II I III ° Rc;
о I
ноос
I
r'c—сн—с-с=с^
II I
О R
r'c—сн„-с— с=с;
о
R
R = H, А1к ; R'= А1к,Аг
* (мзо-С3Н7K AI, (т/>елг-С4Н9KА1, CHgCOOKa, КОН,
C2H5OK, без катализатора
Выходы, Y.^-непредельных кетоиов составляют 30—80%.
В реакцию вступают алифатические, алициклические и жирноароматические
спирты. В случае первичных алифатических спиртов не происходит перемещеиия
двойной связи, например:
СН3СН=СНСН2ОН + СН3СОСН2СООС2НБ >¦ СН3СОСН2СН2Ш=СНСН3
В общем случае выходы продуктов уменьшаются от третичных к вторич-
вторичным и затем к первичным спиртам, а также при наличии заместителей у С=С-
связи.
* Называют также реакцией Кэрролла — Каймела (Kimel).
245
В реакции используют эфиры различных (J-кетокислот, например:
СН3СНСН=СН2 + СО^НлСООСгНб)^ *г
ОН
>¦ CHSCH=CHCH3CH3COCH3COOC,H5
сн3 q
)гС—СН=СН3 ' ' '
(CHs)i!C=CH(CH2)i!
он
(CHSKC=CH(CH2
"vAo
сн.
2С=СН—CHj—i
6
F8%)
В случае ацетиленовых спиртов образование сопряженных диенонов сопро-
сопровождается циклизацией, например:
СН3
(сн3I!с=сн(сн3)!|с—с==сн + сн„сос:
он
сн,
>¦ (СН^3С=СН(СН2JС-С=СН -
ОСОСН3СОСН3
+ СН-=С-
(CHSKC=CH(CH3I!C= СН— СН
I II
СН, СНСОСН
-сн.
F0%)
C0%)
Вариант Каймела (Kimel) — получение Y.o-иепредельных кетонов пиролизом
непредельных эфиров ацетоуксусиой кислоты. Исходные эфиры синтезируют с
выходами 90—95% из дикетена и соответствующего непредельного спирта:
\ / 0—25 "С
СН3=С-0 + ^С—С=С *
Н8С-С=О НО
>- СН,-С-СН3— СОО-С-С=С/
о
•(C3H5KN, QH6N
\
Вариант Каймела позволяет осуществить реакцию для спиртов с т. кип.
<150°С, а также в том случае, когда исходные вещества и продукты реакции
имеют близкие температуры кипения, что затрудняет выделение последних в ре-
реакции Кэрролла.
См. также Михаэль (№ 406), Торгов (№ 574).
246
Carroll M. F., J. Chem. Soc, 1940, p. 704, 1266; 1941, p. 507.
Wakabayashi N. e. a., «Tetrahedron Letters», 1969, p. 3253.
РИМИОС, т. 12, с 259.
350. ЛАДЕНБУРГ (LADENBURG)
С-Алкилирование пиридина путем термической изомеризации солей N-алкил-
пиридиния с образованием смеси а- и ¦у-алкилпиридинов*:
R
200—300 °С
+NR X-
+NH Х- +NH Х-
Суммарные выходы алкилпиридинов достигают 70—75%. В смеси преобла-
преобладает, как правило, а-изомер. Однохлористая медь и хлористый алюминий ката-
катализируют реакцию. При R=k-C3H7 происходит изомеризация радикала.
В реакцию вступают также производные хинолина, изохинолина и гомологи
пиридина.
См. также Гофман — Марциус (№ 214).
Ladenburg А., Вег., 1883, Bd. 16, S. 1410, 2059.
Claret P. A., Williams G. H., J. Chem. Soc, Ser. C, 1969, p. 146.
Pyridine and Derivatives. Pt. 2. Ed. KJinsberg E. New York — London, Inter-
science, 1961, p. 163.
OP, т. 7, с 177.
351. ЛАДЕНБУРГ (LADENBURG)
Циклизация гидрохлоридов 1,4- или 1,5-диаминов при сухой перегонке с об-
образованием соответственно пирролидина или пиперндина:
нагревание СН2—(СН3)п_л
HCl.H3N(CH2)nNH3-HCI >¦ I |
СН,—NH-HC1
Реакция не имеет практического значения вследствие малой доступности ис-
исходных веществ.
См. также Гофман — Лёфлер— Фрайтаг (№ 213).
Ladenburg А., Вег., 1884, Bd. 17, S. 388, 513; 1885, Bd. 18, S. 3100; 1887,
Bd. 20, S. 442; Ann., 1888, Bd. 247, S. 1.
Эльдерфильд, т. 1, с. 504.
¦Называют также перегруппировкой Ладеибурга.
247
352. ЛАДЕНБУРГ (LADENBURG)
Получение замещенных беизоксазолов циклокоидеисацией о-аминофеиолов
с производными карбоиовых кислот или альдегидами:
О
R = Н, NO3; R' = Alk, Ar; R" = H, Cl, NHNHCeH5
Аналогично реагируют а,|3-амииоиафтолы. Из производных карбоиовых кис-
кислот можно использовать также ангидриды, нитрилы, имииохлориды и амидины.
Ladenburg А., Вег., 1876, Bd. 9, S. 1524.
Эльдерфильд, т. 5, с. 314.
353. ЛЕБЕДЕВ
Получение бутадиена каталитическим пиролизом этилового спирта:
435—445 °С
2сн3сн3он [А1зОз+2пО> сн2=сн-сн=сн3
В качестве побочных продуктов образуются предельные углеводороды, про-
простые эфиры, спирты, альдегиды и кетоиы. Реакция явилась первым в СССР
промышлеииым способом получеиия бутадиена.
См. также Остромыслеиский (№ 438), Реппе (№ 504).
Лебедев С. В., ЖОХ, 1933, т. 3, с. 698.
Egloff G., Hulla G., Chem. Rev., 1945, v. 36, p. 67.
Горин Я. А., ЖОХ, 1950, т. 20, с. 1596.
Houben-Weyl, Bd. 4, Т. II, S. 216.
354. ЛЕМШТЕДТ —ТЭНЭСЕСКУ
(LEHMSTEDT — TANASESCU)
Получение акридоиов конденсацией о-нитробеизальдегидов с ароматически-
ароматическими соединениями под действием серной кислоты с последующими восстановле-
восстановлением и циклизацией:
ОН
СНО
NO2
КОНЦ. H2SO4
¦R' >- R
248
NaNOJ; конц. H2SO4;
~20°С
R, R' = Н, СН3) С1, Вг, F
*HNO3
NH
D0-60%)
Нитробензол, диэтиланилин, бензиловый спирт не вступают в реакцию.
В результате реакции могут образоваться N-оксиды акридонов, например:
О
СНО
Cl
Побочная реакция—образование о-нитробензофеноиов.
См. также Яурдаи — Ульман—Гольдберг (№ 756).
Tanasescu I., Bull. Soc. chim. France, 1927, v. 41, p. 528; 1933, v. 53, p. 381.
Lehmstedt K-, Ber., 1932, Bd. 65, S. 834, 999; 1934, Bd. 67, S. 336.
Spalding D. P. e. a., J. Am. Chem. Soc, 1946, v. 68, p. 1596.
Silberg A., Frenkel L, Rev. Roumaine Chim., 1965, v. 10, p. 1035.
355. ЛЕМЬЁ (LEMIEUX)
Окислительное расщепление олефинов действием водных растворов пермаи-
ганата и периодата*:
KMnO4+NaIO4; K2CO3
RCH=CR3 —— >- RCOOH + R2CO
(Н2О)*
* Водные диоксан, пиридин или трет -С4Н9ОН
В реакции используют каталитические количества КМпО4 и NaIO4. Олефииы
с концевой С^С-связью образуют формальдегид с высоким выходом:
-СН=СН2
-СНО + СН2О
При расщеплении соединений, содержащих концевую изопропилиденовую
группировку, с количественным выходом образуется ацетон:
RCH=C(CH3J > RCOOH + (СН3JСО
а,Р-Дизамещенные олефины образуют смесь кислот, например:
СН3(СН2MСНСН2СН=СН(СН2)БСН2ОН >
ОСОСНз
>- СН3(СН2NСНСН2СООН + НООС(СН2NСН3ОН
ососн,
¦ Называют также реакцией Лемьё—Рудлоффа (Rudloff).
249
Реакция используется прн установлении строения непредельных природных
соединений.
См. также Лемьё — Джонсон (№ 356), Харрнс (№ 640), Хилдич (№ 661).
Lemieux R. V., Rudloff E., Can. J. Chem., 1955, v. 33, p. 1701., 1710.
Meinwald J., Gassman P. G., J. Am. Chem. Soc, 1960, v. 82, p. 2857.
Apstmon J. W. e. a., Can. J. Chem., 1967, v. 45, p. 1439.
Физер, т. З, с. 86.
356. ЛЕМЬЁ —ДЖОНСОН (LEMIEUX — JOHNSON W. S.)
Окислительное расщепление олефинов до карбонильных соединений после-
последовательным действием четырехокисн осмня н пернодата:
/ OsO4; -20 "С
-СН=СХ
(водн. диоксан)*
-НС
С
NaIO4
-сно н- \=о
0sO2 J
*Эфнр + вода, 80%-ная СН3СООН
В реакцию вступают разнообразные олефины, например:
СН3(СН2)9СН=СН2 СН3(СН2)9СНО
F8%)
G5%)
НО^. >—
j| ^>
-сн=снсвн5
\_
сно
(84%)
В случае пространственно затрудненных олефннов реакция идет очень
медленно.
Достоинствами метода являются мягкие условия окисления, а также воз-
возможность регенерации осмиевого ангидрида, используемого в каталитических ко-
количествах. Метод находит применение в химии стероидов.
См. также Лемьё (№ 355), Харрнс (№ 640), Хнлдич (№ 661).
Рарро R., Allen D. S., Lemieux R. U., J. Org. Chem., 1956, v. 21, p. 478.
Baggaley K. //. e. a., «Tetrahedron», 1969, v. 24, p. 3445.
Физер, т. З, с. 88; т. 5, с. 352.
357. ЛЕОНАРД —ДЖОНСОН (LEONARD —JOHNSON С. R.)
Окисление сульфидов в сульфокснды периодатом натрия в водноспиртовом
растворе:
NaIO4; 0 "С
R-S-R' : г—г^г R-S-R'
(водн. СН3ОН)
О
R, R' =
F5%—колич.)!
3, С2Н5, СН2СвН5> С6Н5, СН/ЮОИ, СН8СООСН3
?50
В реакцию вступают также циклические сульфиды типов
^О и
п = 2, 3
R = С1, ОН, OTs
н сульфиды ряда азулена.
Дисульфидиая группа в условиях реакции сохраняется, например:
G1%)
Leonard N. J., Johnson С. R., J. Org. Chem., 1962, v. 27, p. 282.
Replogle L L., Maynard J. R., J. Org. Chem., 1967, v. 32, p. 1909.
Hiskey R. G., Harpold M. H., J. Org. Chem., 1967, v. 32, p. 3191.
DeBoer A., Ellwanger R. E., J. Org. Chem., 1974, v. 39, p. 77—83.
OS, v. 46, p. 78.
358. ЛЕПЕРК (LEPERCQ)
Получение а-окснмнноэфиров из эфиров а-бромкарбоиовых кислот действием
нитрита натрия в этаноле:
NaNO2
RCHCOOC2H5 ,„ „ „>,, rRCH-COOC2H5"I >- RC-COOC2H5
Br
NO2
NOH
G0-8So/0)
а-Окснмнноэфиры используют для синтеза а-амино- н а-кетокислот.
Lepercq G., Bull. Soc. chim. France, 1893, v. 9, p. 630.
Kornblum N., Etcher J. H., J. Am. Chem. Soc, 1956, v. 78, p. 1494.
359. ЛЕСПИО — БУРЖЕЛЬ (LESPIEAU — BOURGEL)
Получение монозамещенных ацетиленов дегндробромированием бромолефн-
у щ
нов действием амида натрия*:
NaNH2; 100—160 °С
RC=CH2
(вазелиновое масло)*
RC=CNa
RC—СН
E0-75%)
R = Alk, Ar
•СвН5СН3, лигроин
В реакцию вступают также галогенпроизводные типов RCHXCH2X,
RCH2CH2X2 и RCX2CH3. Существенное влияние иа выходы алкинов оказывают
чистота н степень нзмельчення амида натрия.
Побочные реакции — перемещение тройной связи, полимеризация и элими-
элиминирование соседних атомов галогена с образованием олефннов (в случае 1,2-дн-
галогенпроизводных).
¦Называют также' реакцией Буржеля.
251
Исходные бромолефины получают действием
2,3-дибромпропен-1:
CH2=CHBr—CH2Br + RMgX >- СН2=СНВг
R = А1к, цикло-к\к
реактивов Гриньяра на
CH2R
См. также Мэттокс—Кендолл (№ 412)
Lespieau M. R., Bull. Soc. chim. France, 1921, v. 21, p. 528.
Bourgel M. M., С. г., 1923, v. 176, p. 751.
OP, т. 5, с 11: СОП, т. 1, с 511.
360. Л ETC (LETTS)
Получение нитрилов нагреванием карболовых кислот нлн их солей с тно-
цианатами металлов:
KSCN*; 200 "С
RCOOH >- RCN
*Pb(SCNJ
При R = Ar выходы достигают 80%, однако нитро-, амино- и оксибензойные
кислоты в этих условиях не реагируют. При R = Alk образуется смесь нитрилов
с амидами. Использование Pb(SCNb позволяет повысить выход нитрилов али-
алифатического ряда. Наилучшие результаты (выходы до 90%) получаются при
нагревании сухих (RCOOJZn с 20%-ным избытком Pb(SCNh. Реакция приме-
применяется также для синтеза ароматических диннтрнлов и нитрилов а,C-непредель-
ных кислот.
Letts E. А., Вег., 1872, Bd. 5, S. 669.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 264.
361. ЛЁЙКАРТ (LEUCKART)
Получение первичных, вторичных нлн третичных аминов восстановительным
аминироваиием альдегидов или кетонов формнатом аммония, формамидом или
их N-замещенными производными*:
,С=О + HCO-NR2
1. 100-230 °С
2. конц. НС1
(НСООН)* / 8
C0—90%)
R = Н, Alk, Ar
*Без растворителя, СН3СООС2Н5, СН3СООН, этилеигликоль, диоксан и т. д.
Хорошие результаты дает использование смеси HCONH2—НСООН. N-Алкил-
н М,М-диалкилформамиды реагируют труднее, а 1Ч,1Ч-диарнлформамиды — легче,
чем формамид. В реакцию вступают алифатические, алнцнклические, жирноаро-
матические и гетероциклические альдегиды н кетоны, например:
190оС / ^/N(CH3J
(НСООН)
G5%)
¦Называют также реакцией Лёйкарта — Валлаха (Wallach).
252
Наиболее гладко проходит реакция в случае ароматических альдегидов и
высококипящих кетонов. Ароматические альдегиды, содержащие функциональные
заместители, обычно обладают пониженной реакционной способностью и реаги-
реагируют только в присутствии каталитических количеств пиридина.
Достоинство метода заключается в том, что в исходных соединениях, как
правило, не затрагиваются функциональные группы, способные к восстановлению,
например:
O,N-
-140 °С
-СОСН3+ HCONH2 > O2N
-Q-CHCH,
NH2
Существенный недостаток метода — жесткие условия проведения реакции.
Применение катализаторов (Ni, Co, Fe, Pt, Pd, Си) позволяет снизить темпе-
температуру на 20—80° и повысить выход.
Побочная реакция — альдольная конденсация карбонильных соединений.
Кроме того, при получении первичных или вторичных аминов в качестве побоч-
побочных продуктов образуются соответственно вторичные или третичные амины.
См. также Баллах (№ 143), Деккер — Форстер (№ 239), Миньонак (№ 401),
Эшвайлер — Кларк (№ 744).
Leuckart R. е. а., Вег., 1885, Bd. 18, S. 2341.
Кост А. Е., Грандберг И. И., ЖОХ, 1955, т. 25, с. 1436.
Bach R. D., J. Org. Chem., 1968, v. 33, p. 1647.
Сое P. F. e. a., J. Chem. Soc, Ser. C, 1968, p. 2265.
Bowman R. E. e. a., J. Chem. Soc, Perkin Trans., 1972, pt. 1, № 15, p. 1926—
1932.
Вейганд-Хильгетаг, с. 485; OR, v. 5, p. 301; РИМИОС, т. З, с. 253.
362. ЛЁЙКАРТ (LEUCKART)
Получение тиофенолов превращением солей дназоння в ксантогеиаты с по-
последующим щелочным гидролизом:
ArN2Cl
KSCSOGaHt*;
70 "С
S КОН;
II нагревание
Ar-S-C-OC2H5 > ArSK
ArN=N—S—С—О С2Н5
н+
(С2Н5ОН)
¦ ArSH
(ДО 80%)
нагревание
ArSC2H5
Аг = CeH4R, где R = СН3, NH2, NO2, ОН, Cl, COOH, Br, OC2H5, SO3H
*KSCSNR2> CS2 + К2СО3, K2S илн полисульфиды, (RNHJCS и др.
Термическим разложением ксантогенатов получают эфиры тиофенолов.
В реакцию вступают также производные ряда нафталина.
См. также Зандмейер (№ 261), Херц (№ 655).
Leuckart R., J. prakt. Chem., 1890, Bd. 41, S. 187.
253
Saunders К. Н. The Aromatic Diazo-Compounds and their Technical Applica-
Application. London, E. Arnold, 1949, p. 325.
Houben-Weyl, Bd. 9, S. 12.
363. ЛЁЙКС (LEUCHS)
Получение оксазолидиндиоиов-2,5 действием на N-карбалкоксипроизводные
а-аминокнслот хлористого тионнла с последующей циклизацией при нагревании
в вакууме*:
Na2CO3 SOGlg
R—CH-COOH + C1COOR' —г-»- R—CH-COOH >-
NH2
NHCOOR'
R—CH-COC1
NHCOOR'
нагревание
NH
О
C5-65%)
R = Alk, Ar; R' = CH3, C6H5
Оксазолидиндноны-2,5 являются исходными веществами для синтеза поли-
полипептидов:
\—NH
°=о=°
Н2О
О
-NHCHCO-
См. также Фукс (№ 636).
Leuchs Н., Вег., 1906, Bd. 39, S. 857.
Woodward R. В., Schramm С. Н., J. Am. Chem. Soc, 1947, v. 69, p. 1551.
Farthing A. C, J. Chem. Soc, 1950, p. 3213.
Petri E. M., Staverman A. J., Rec. trav. chim., 1952, v. 71, p. 385.
Bart left P., Jones R. H., J. Am. Chem. Soc, 1957, v. 79, p. 2153.
364. ЛИБЕН (LIEBEN)
Расщепление метилкетонов с образованием йодоформа и карбоиовых кислот
под действием гипоиодита натрия в щелочной среде (иодоформная реакция):
la; NaOH
R-C—СН3 > R—С—CIS
(Н2О)
NaOH
(Н2О)»
СН13 J- RCOOH
О
О
R = Alk, Ar, H
*Диоксан (водн.)
¦Называют также реакцией Лёйкса — Бергмана (Bergmann).
254
Подобно гипоиодиту действуют гипобромиты и гипохлориты.
Метод применяется для качественного и количественного определения соеди-
соединений, содержащих С-ацетильиую или иодацетильную группу, а также для опре-
деиия веществ, способных в условиях реакции образовывать эти группы, на-
например:
CHsCHOHR »- CH3COR CHI3 + RCOONa
к-С3Н7СН=СНСООС3Н5 »- «-СзН7СНОНСНаСООС3Н5 ¦ ц >
»- СН3СООС3НВ »- СН13 + С3Н6СООН
Положительную иодоформную реакцию дают также амины, C-дикетоны,
оксимы, простые виниловые эфиры, л-беизохиноны и другие соединения.
Иодоформная проба отрицательна в случае пространственно затрудненных
алкилметилкетоиов, а также соединений, неустойчивых в условиях этой реакции,
например:
СН3СО—СН2СООН у СНдСООН
Реакция может быть использована для синтеза некоторых кислот, например:
НООС(СН2KСООН
АгСН=СН—СООН
О
АгСН=СН-СОСН,
См. также Корнфорт (№ 325).
Lieben A., Ann., 1870, Bd. 7, S. 218, 377.
Fuson R. С, Bull В. A., Chem. Rev., 1934, v. 15, p. 275.
Фьюзон, с. 314,
365. ЛИБЕРМАН (LIEBERMANN)
Превращение фенолов в индофенолы действием нитрита калия
кислоте:
KNO2+H2SO.j;
нагревание
серной
R = Н, СН3, ОСН3> С6Н5, С1, Вг
6
Метод является качественной-реакцией иа фенолы со свободным mz/ад-поло-
жеиием, многоатомные фенолы с оксигруппами в жего-положеиии и а- и |3-на-
255
фтолы (окрашивание). Некоторые замещенные фенолы (R=OH, NH2, NOj,
СООН) со свободным па^а-положением в реакцию не вступают. Реакцию ис-
используют также для обнаружения различных ароматических и алифатических
нитрозосоединений и нитрозаминов, которые при действии серной кислоты от-
отщепляют HNO2, вступающую в реакцию с фенолами. Аналогично реагируют
некоторые иитросоединення, способные отщеплять азотистую кислоту, например
CeH5CH2NO2 и C6H5CH = CHNO2.
См. также Кретьен — Лонжи (№ 337).
Liebermann С, Вег., 1874, Bd. 7, S. 248, 1098.
Ванаг Г. Я- Лукович Э. Я., ЖОХ, 1956, т. 26, с. 1400.
Тигпеу Т. A., J. Org. Chem., 1957, v. 22, p. 1692.
366. ЛИПП (LIPP)
Циклизация о-амино-со-хлорстиролов в индолы под действием щелочей:
^СН=СНС1 _ .. _ __ „^ ,
C2H6ONa»; ~130°C
NHR
(СгНБОН)
NR
R = Н, Alk
*30%-ный раствор КОН в спирте
Аналогично образуются дииндолы:
См. также Байер (№ 32), Фулдс — Робинсон (№ 622), Габриель (№ 184),
Фишер (№ 611).
Lipp А., Вег., 1884, Bd. 17, S. 1067, 2507.
Hollins С. Synthesis of Nitrogen Ring Compounds. London, Benn, 1924, p. 121.
Эльдерфильд, т. З, с. 27.
367. ЛИХОШЕРСТОВ
Галогенирование или роданирование ароматических соединений действием
^М'-дихлормочевины и соответствующих солей аммония или солей щелочных
металлов в присутствии минеральных кислот:
CO(NHC1J»; NH4X**; HC1 или H2SO4; ~20°C
АгН * АгХ
(Н2О)"*
X = CI, Вг, I, SCN; Аг = СвНБ, CeH4Alk, C6H4NH2, C6H4NO2
*CH3CONHC1, N-хлорсукцинимид, N-хлоримидоугольные эфиры, дихлорамин Т;
**NaX, KX; ***СН3ОН, СН3СООН, (СН3JСО, эфир и др.
Действующим агентом является соответствующее производное мочевины
CO(NHXJ, образующееся в реакционной смеси. Галогенирование фенолов и
полифенолов происходит легко, роданирование не имеет места. При хлорирова-
256
нии ароматических аминов необходимо защищать аминогруппу. Метод позволяет
получать моно-, ди- и полнзамещенные производные в исключительно мягких
условиях. Реакция применима к конденсированным полициклическим и гетеро-
гетероциклическим соединениям, например:
X
—СН.
-СН3 —
NH " NH
X = Br, I, SCN
Побочный процесс — окисление исходных ароматических соединений.
См. также Биркенбах — Губо — Уотерс (№ 78).
Лихошерстов М. В., ЖРХО, 1929, т. 61, с. 1019.
Buu-Hoi N. P., Demerseman P., J. Org. Chem., 1953, v. 18, p. 649.
РИМИОС, т. 6, с. 42, 44, 63, 64.
368. ЛОБРИ ДЕ БРЮИН —ВАН ЭКЕНШТАЙН
(LOBRY DE BRUYN —VAN EKENSTEIN)
Изомеризация Сахаров под, действием оснований, включающая процессы
эпимеризации альдоз и кетоз, а также их взаимные превращения:
СНО
Н—С—ОН
I
но—с—н
[Са(ОНJ]*
¦ н—с-он"
II
н-с-он
но-с—н
сн2он
с=о
но—с—н
*NaOH, КОН, Ва(ОНJ, C5H6N, хинолин, основные ионообменные смолы, ферменты
Реакция протекает также под влиянием кислот, но значительно медленнее
и с малыми выходами. Все превращения идут одновременно, но с различной
скоростью; обычно самой быстрой является эпимеризация кетоз, наиболее мед-
медленной— превращение альдозаз^кетоза. Реакцию используют для получения
кетоз (выходы 10—50%), а также для получения труднодоступных эпимеров
альдоз, например 2,4,6-три-0-метил-1>-маннозы, ^ацетил-?)-маннозамнна.
Lobry de Bruyn С. A., van Ekenstein W. A., Rec. trav. chim., 1895, v. 14, p. 150,
156, 203; 1899, v. 18, p. 147.
Speck J. C, Adv. in Carbohydrate Chem., 1958, v. 13, p. 63.
17—684
257
Mandicino J. F., J. Am. Chem. Soc, 1960, v. 82, p. 4975.
Tilley В. E. e. a., Carbohydrate Res., 1973, v. 27, № 2, p. 289—296.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 99.
369. ЛОССЕН (LOSSEN)
Перегруппировка гидроксамовых кислот или их производных в изоцианаты
под действием дегидратирующих агентов:
RCO-NH—OR'
R-C-
II
О
*1
н2о
R—N=C=O >- RNH2
R = Alk, Ar; R' = H, COCH3, COCeH4R"
*SOC12, (CH3COJO, нагревание, полифосфорная кислота.
Механизм реакции аналогичен механизму таких родственных анионотроп-
ных перегруппировок, как перегруппировка Гофмаиа (№ 210), Курциуса (№ 345)
и др.
Выходы изоциаиатов или продуктов их гидролиза составляют 60—80%.
Перегруппировка оптически активных соединений протекает с сохранением кон-
конфигурации. Наличие электроиодоиориых заместителей в мигрирующей группе R
ускоряет перегруппировку, тогда как присутствие этих же заместителей в ра-
радикале R' оказывает противоположное действие.
Перегруппировка гидроксамовых кислот, содержащих функциональные груп-
группы (СООН, ОН) и кратные связи, позволяет получать соответственно полиами-
полиамиды, альдегиды, уретаиы:
HOOC(CH2)nCONHOR' >- [—CO(CHa)nNH-]m
RCH-CONHOR' у RCHNCO ¦>¦ RCHNH2 v RCHO
OH OH OH
RCH=CHCONHOR'
RCH=CHNCO-
R"OH
RCH=CHNHCOOR"
См. также Бекмаи (№ 58), Гофман (№ 210), Курциус (№ 345),
{№ 714).
Lossen W., Ann., 1872, Bd. 161, S. 347.
Yale H. L, Chem. Rev., 1943, v. 33, p. 209.
Berndt D. C, Schechter H., J. Org. Chem., 1964, v. 29, p. 916.
Zvilichovsky G., J. Org. Chem., 1969, v. 34, p. 486.
Степанов Ф. Н., Столяров 3. E., Ж. орг. хим., 1970, т. 6, с. 1186.
Swensen J. S. e. a., J. Org. Chem., 1973, v. 38, № 29, p. 3956—3958.
СОП, т. 2, с 87.
258
Шмидт
370. ЛОУРИ (LOWRY)
Мутаротация Сахаров при одновременном кислотно-основном катализе:
сн2осн3
сн2осн3
..н
СН3О
СН2ОСН3
—О. ОН
ОСНЯ
сн3о
+ н+ + в
осн3
Мутаротация тетраметилглюкозы, медленно идущая в абсолютном пириди-
пиридине (слабое основание) или абсолютном крезоле (слабая кислота), значительно
быстрее идет в воде и еще быстрее (в 20 раз по сравнению с водой) в смеси
пиридина с крезолом. Это ускорение обусловлено одновременным действием
основного и кислотного катализаторов.
Особенно эффективными являются бифункциональные катализаторы, напри-
например 2-оксипиридии:
НО
По-видимому, подобным же образом действуют ферменты, обладающие од-
одновременно слабыми нуклеофильными и электрофильиыми центрами.
Lowry Т. М., Richards E. M., J. Chem. Soc, 1925, v. 127, p. 1385.
Swain С. G., Dimilo A. J., Cordner J. P., J. Am. Chem. Soc, 1958, v. 80,
p. 5983.
Pigman W. W. The Carbohydrates. New York, Acad. Press, 1957, p. 56.
371. ЛУКЕШ (LUKES)
Восстановление солей пиридиния муравьиной кислотой с образованием сме-
смеси соответствующих производных пиперидина и тетрагидропиридина:
DHCOOH;
нагревание \S \
+NR' Х- NR' NR'
R = Н, Alk; R' = СН3, СвН5; X = С1, Вг
*(C2H5KN
17*
259
Соотношение продуктов реакции зависит от положения заместителя:
+NCH. Вг-
NCH,
н
+NCH. Вг-
Н3О
NCH,
NCH3
Н.
A:1)
B:1)
NCH.
При восстановлении соответствующих бетаинов происходит декабоксилирова-
ние или образование пиперидинкарбоновых кислот:
соо-
соо-
I
CH3N+
NCH3
СООН
I
NCH,
+NCH3
NCH3
В реакцию вступают также четвертичные соли хинолиния, изохинолиния и
акридииия, например:
R = Н, Alk
Сам пиридин не вступает в реакцию, а в случае хинолина одновременно
с восстановлением происходит N-формилироваиие:
HCOOH
[(C2H5KNJ
N
NCHO
(85%)
См. также Вышнеградский — Ладенбург (№ 180), Бёрч (№ 75).
Lukes R., Coll. Czech. Chem. Comm., 1938, v. 10, p. 66.
Кост А. Н., Юдин Л. Г., ЖОХ, 1955, т. 25, с. 1947.
Cervinka О., Chem. listy, 1965, v. 59, p. 1058.
Ferles M., Pliml J., Adv. in Heterocyclic Chem., 1970, v. 12, p. 71.
372. ЛЬВОВ — ШЕШУКОВ
Хлорирование олефииов в а-положеиие к двойной связи, сопровождающееся
аллильиым сдвигом двойной связи:
\ / С12; 5-20 °С \ /
хсн-с=с; >¦ V=c-q
/ i \ / i ^
260
Несимметрично замещенные олефины образуют смесь изомеров, например:
СН3-С=СН2 »- СН2=С-СН2С1 + СН3СН=С-СН2С1
CjjH5 С2Н6 СН3
Хлорирование терпеновых углеводородов также сопровождается аллильной
перегруппировкой, например:
Побочные реакции: образование хлоралкенов с атомом хлора при С = С-свя-
зи, аллильные перегруппировки продуктов реакции, присоединение НС1 по
С = С-связи. Последний процесс легко подавляется добавкой соды или поташа.
Продукты реакции легко подвергаются гидролизу, давая непредельные
спирты, которые могут быть использованы для синтеза соответствующих карбо-
карбонильных соединений.
См. также Фрич — Клинг (№ 633).
Шешуков М. И., ЖРХО, 1883, т. 15, с. 129, 355.
Львов Д. М., ЖРХО, 1884, т. 16, с. 469, 472.
Тищенко Д. В., ЖОХ, 1950, т. 20, с. 1003.
РИМИОС, т. 4, с. 177.
373. ЛЮТРИНГХАУС (LUTTRINGHAUS)
Перегруппировка днариловых эфиров в о-арилфенолы под действием фенил-
натрия:
C6H5Na:i:
+ C6H5ONa
I
Na
Н2 О
ОН
С6Нэ
D6%)
CeHsK
Побочным продуктом является о-СбН5СбН4ОСбН5 (выход 9%).
Перегруппировка протекает и в случае других ароматических эфиров (на-
(например, а-фенилнафтилового эфира) и является удобным методом синтеза
труднодоступных фенолов.
См. также Виттиг (№ 167).
261
Luttringhaus A., Sauf G., Angew. Chem., 1938, Bd. 51, S. 915; Ann., 1939,
Bd. 542, S. 241.
Hulsgen R, Sauer J., Angew. Chem., 1960, Bd. 72, S. 96.
Schlosser M., Angew. Chem., 1964, Bd. 76, S. 132.
374. МАДЕЛЮНГ (MADELUNG)
Циклизация N-ацил-о-алкиланилинов в 2-алкилиндолы под действием силь-
сильных оснований:
CH2R"
QjHsONa';
250—360 °C
IcHs
NHCOR' / -
I C6H5N,
R
¦CHR"
NCOR'
->¦ R
R
R"
NH
R =-= H, Alk, CeH4OCH3; R' = H, Alk, CeHB) CH2N(CH3J; R" = H, Alk
*C2H5OK, mpem-QH.OK, NaNH2, CH3C6H«NHK, C6H5NHNa, Na в жидком NH3;
** без растворителя
В случае ]^-ацил-2-метил-6-алкиланилинов конденсация идет по метильиой
группе, например:
NHCOCH,
¦СН,
С2Н5
"\ NH
С2Н5
В аналогичную реакцию вступают амидины:
N=CH—N
СН,
,сн3
'С„НЙ
Реакция обычно применяется для получения алкилиндолов. Ограничение
метода — возможность использования лишь таких веществ, которые устойчивы
к действию сильных оснований.
См. также Фишер (№ 611).
Mauthner I, Suida W., Monatsh., 1886, Bd. 7, S. 237.
Madelung W., Ber., 1912, Bd. 45, S. 1128.
Bass К. С Nababsing P., Organic Preparations and Procedures, 1970, v. 2,
P' Augustine R L e. a., J. Org. Chem., 1973, v. 38, № 17, p. 3004—3011.
Sundberg R. J. The Chemistry of Indoles. London — New York, Acad. press,
1970, p. 189.
Эльдерфильд, т. 3, с. 12; СОП, т. 3, с. 258.
262
375. МАЙЗЕНХАЙМЕР (MEISENHEIMER)
Получение хлорхинолинов окислением хинолинов иадкислотами с последую-
последующим хлорированием образовавшихся N-окисей:
1. надкнслота; 15 СС;
2. 5%-ный NH4OH
POCI3*
N
R = Н, ОСН3, Cl, NO2, ОН
*SO2Cla
Хлорирование идет преимущественно в положение 4. Хинолины, замещенные
в положении 8, в реакцию не вступают.
1153.
Meisenheimer J., Ber., 1926, Bd. 59, S. 1848.
Castagnoli N. e. a., «Tetrahedron», 1970, v. 26, p. 4319.
Pokorny D. J., Paudler W. W., J. Heterocycl. Chem., 1972, v. 9,
5, p 1151
Johnstone R. A. W. In: «.Mechanism of Molecular Migrations». Ed. B. S. Thy-
garajan. V. 2. New York, Interscicnce Publ., 1969, p. 249.
376. МАЙЗЕНХАЙМЕР (MEISENHEIMER)
Перегруппировка N-окисеп третичных аминов в О-эфиры дизамсщснных
гидроксиламинов при нагревании со щелочью в атмосфере азота:
R
NN—О
R'
№ОН; 80-165 СС
'Я
\
'N—О- +R'-
R
\
N-O-R'
W
D0-80%)
R = Alk, Ar; R'=CH2Ar, CHAr2, C(C6H5K, CH2CH=CH2) циклоалкенил
*С2Н6ОН, С6Н8, С5Н12
Перегруппировке подвергаются также N-окиси имииов:
(CeH5JC=N-CH(C6H5J ¦ >¦ (CGH5JC=N-OCH(C6H5J
(колич.)
о
Побочные процессы: димеризация промежуточных радикалов, гидратация
окисей аминов (особенно в случае R=Alk), элиминирование по Коупу (см.
№ 330), окислительно-восстановительное расщепление:
(CH3JN-CH2CeH6
О
(CH3JNH -f C6H5CHO
263
Исходные N-окиси аминов легко получают окислением аминов перекисью
водорода или надбензойной кислотой.
Реакция может с успехом использоваться для получения дизамещениых
гидроксиламинов.
Meisenheimer J., Ber., 1919, Bd. 52, S. 1667.
Cope A. C. e. a., J. Am. Chem. Soc, 1949, v. 71, p. 3423.
Castagnoli N. e. a., «Tetrahedron», 1970, v. 26, p. 4319.
Rautenstrauch V., Helv. chim. acta, 1973, Bd. 56, № 7, S. 2492—2508.
377. МАЙЛАС (MILAS)
Каталитическое гидроксилирование олефинов перекисью водорода в присут-
присутствии окислов металлов с образованием гликолей:
V J Н2О2;0«С \ /
/ \ [V2O5]*; (трет-СцЩОН)** / | | \
НО ОН
D0-90%)
*WO3, МоО3, CrO3, SeO2, OsO4, УФ-облучение, без катализатора;
**эфир, ацетон, водн. СН3ОН, СН3СООН
В случае OsO4 происходит цыс-гидроксилироваиие, остальные окислы спо-
способствуют тра«с-гидроксилированию. Вместо Н2О2 может быть применена гидро-
гидроперекись трет-бутила.
Окисление полиолефинов реагентом Майласа (OsO4 в rper-CjHsiOH) часто
происходит избирательно и используется, например, для окисления Р-каротииа
в соответствующий альдегид.
См. также Вагиер (№ 137), Вудвард (№ 179), Криге (№ 339), Бергмаи —
Шотте (№ 63).
Milas N. А. е. a., J. Am. Chem. Soc., 1936, v. 58, p. 1302.
Ганстон Ф. Д. Усп. орг. химии, 1963, т. 1, с. 128.
Gilman L. Organic Chemistry. Ed. 2. V. 4, New York, John Wiley a. Sons Inc.,
1953, p. 1154.
Физер, т. З, с. 83.
378. МАЙО (MAYO)
Фотохимическое присоединение ацетилацетона к циклоолефинам с образова-
образованием дикетонов:
СН,
СН,СО—СН
НО-С +
СНя
НС
/'
СНо
hv
(циклогексан)
сн3сосн
СНдОС-
G0-80%)
п= 1, 2, 4, 8
СН3СО-
но-
(СН2)Я
264
Использование 2-ацетилциклоалкаионов позволяет получать полициклические
кетоны, например:
(СН2)Я
-О
(СН2)„
ОН1
п= 1, 2
Mayo P. e. a., Proc. Chem. Soc, 1962, p. 119.
Mayo P., Takeshita H., Can. J. Chem., 1963, v. 41, p. 440.
Nozaki H. e. a., «Tetrahedron», 1968, v. 24, p. 1821.
379. МАК-ДОНАЛД — ФИШЕР
MacDONALD — FISCHER H. O. L.)
Укорочение углеродной цепи моносахаридов на один атом углерода при
окислении тиоацеталей Сахаров органическими надкислотами с последующим
действием аммиака на образовавшиеся сульфоны:
CH(SRJ CH(SO2RJ
I RCOOOH | NH3 CHO
CHOH >¦ CHOH >¦ I
I | <H*°> CHOH
CHOH CHOH I
E0—70%)
В случае тиоацеталей кетоз происходит уменьшение цепи на два атома
углерода.
См. также Воль (№ 172), Руфф — Фентон (№ 530), Шпеиглер — Пфаннеи-
штиль (№720).
MacDonald D. L, Fischer Н. О. L., 3. Am. Chem. Soc, 1952, v. 74, p. 2087
Hough L, Richardson A. C, J. Chem. Soc, 1961, p. 5561.
Pigman W. W. The Carbohydrates. New York, Acad. Press, 1957, p. 1121.
Кочетков Н. К- и др. Химия углеводов. М., «Химия», 1967, с. 97, 125.
380. МАК-ЛЭФФЕРТИ (McLAFFERTY)
Масс-спектрометрическая перегруппировка молекулярных ионов с миграцией
у-водорода и последующим образованием нового молекулярного иона и оле-
фина:
' Н , •
В \С-
II I
vr
в/
А
н
С
II
с
265
Перегруппировка в общем случае происходит через шестичленное переходное
состояние. Она носит общий характер н охватывает разиообразные классы орга-
органических соединений: карбонильные соединения, амиды, алкилбензолы, алкили-
рованные гетероциклические соединения, ароматические простые эфиры, винило-
виниловые эфиры, олефины.
Наиболее детально этот процесс изучен для карбонильных соединений:
о
А
Н
Р
-1+
?'
RCU
,н
R=Alk, ОЛ1к, Н,ОН
Вторичный атом водорода .мигрирует быстрее, чем первичный. Наличие
двойной связи в а,Р- или р\у-положениях затрудняет перегруппировку. а-Окси-
кетоиы перегруппировываются с трудом. При отсутствии ув°Д0Р°Дн0Г0 атома
перегруппировка затруднена, но возможна, например:
О
Si(CH3
OSi(CH,)8
McLafferty F. W., Anal. Chem., 1956, v. 28, p. 306; 1959, v. 31, p. 82.
Kingston D. G. I., Bursey J. Т., Bursey M. M., Chem. Rev., 1974, v. 74,
p. 215—242.
Budzikiewlcz #., Djerassi С, Williams D. H. Mass Spectrometry of Organic
Compounds. San Francisco Calif., Holden-Day, 1967, p. 155.
Установление структуры органических соединений физическими и химиче-
химическими методами. Под ред. А. Вайсбергера. Кн. I. Пер. с англ. Под ред.
Я. М. Варшавского и И. Ф. Луценко. М., «Химия», 1967, с. 321.
381. МАК-ФЕЙДИЕН — СТИВЕНС (McFADYEN — STEVENS)
Восстановление ароматических карбоновых кислот в альдегиды разложением
их арилсульфонилгидразидов при нагревании с безводным карбонатом натрия:
ArCOOH
H2NNH2 Ar'SO2Cl
ArCOOC2H6 > ArCONHNH, >-
ArCONHNHSO,Ar'
Na2CO3; 150-160 =C
(HOCH2CH2OH)
ArCHO
'60%)
Ar = C6H<1R, где R = H, CH3, OCH3, Hal, CeH6, OQH5, CH2C6H6> NO2;
Ar' = CeH5, CeH4CH3, C6H4C1
* K2CO3
Аналогично образуются гетероциклические альдегиды с выходами 15—45%.
Ароматические альдегиды, содержащие в орто- или пара-положениях электро-
электроотрицательные заместители, а также алифатические, альдегиды не могут быть
266
получены этим методом. Исключение составляют 2,2-диметилпропаналь и фор-
милциклопропан:
(СНз)зС—CONHNHSO2CeH4CH3-«
СН—CONHNHSO2CeH,
(СНзKС—СНО
СН—СНО
н2с-
A6%)
См. также Акабори (№ 9), Вюйтс (№ 181), Грундман (№ 223), Кальб —
Гросс (№ 282), Стефен (№ 553), Сабатье —Мэль (№ 532).
McFadyen J. S., Stevens Т. S., J. Chem. Soc, 1936, p. 584
Newman M. S., Caflisch E., J. Am. Chem. Soc, 1958, v. 80, p. 862
Sprecher M., Feldkimel M., Wilchek M., J. Org. Chem, 1961, v. 26 p 3664
OP, т. 8, с 302.
382. МАЛАПРАД (MALAPRADE)
Расщепление а-гликолей под действием йодной кислоты с образованием двух
молекул альдегидов:
RCH—ОН
R'CH—ОН
НЮ|; рН 3-5
(Н2О)*»
RCH-O.
_R'CH—
ОН
I-OH
RCH=O + R'CH=O
КЮ4> NalO4; ** СН3ОН, диоксан, СН3СООН
При окислении многоатомных спиртов образуются альдегиды (из первичных
ОН-групп) и НСООН (из вторичных ОН-групп). В реакцию вступают также
а-аминоспирты, а-оксиальдегиды, а-оксикетоны и а-дикетоны. Скорость окис-
окисления сильно зависит от структуры и стереохимии исходного соединения; цис-
изомеры окисляются быстрее, чем г/адноизомеры.
Реакция протекает количественно и используется в ряде аналитических ме-
методов, в частности для установления строения моносахаридов и их произ-
производных.
Основной побочной реакцией является «сверхокисление», при котором наблю-
наблюдаемый расход периодата превышает теоретические количества, необходимые для
окисления а-гликольных групп. Наиболее часто причиной сверхокисления слу-
служит образование малонового диальдегида или его производных, которые могут
окисляться далее.
См. также Бэрри (№ 134), Криге (№ 341), Руфф—Фентон (№ 530).
Maiaprade L., Bull. Soc. chira. France, 1928, v. 43, p. 683.
Butst G. J., Bunton С A., Miles J. H., J. Chem. Soc, 1959, p. 743.
Chiitenden G. J. F., Guthiie R. D, J. Chem. Soc, 1965, p. 2271.
Кочетков Н. К- и др. Химия углеводов. М., «Химия», 1967, с. 86.
ОР, т. 2, с. 362.
383. МАЛЬМГРЕН (MALMGREN)
Получение [5-оксикетонов конденсацией а-бромкетонов с карбонильными
соединениями в присутствии магния с последующим гидролизом:
/ Nig; нагревание [ | Н+ \ |
— С-С/ +— С— — >¦ -С-С—С >- ХС-С-С—
II |\ II (^ФиР+бензол) | | , /| | II
О Вг О BrMgO О ОН О
267
В реакцию вступают различные алифатические карбонильные соединения.
В случае алициклических кетонов реакция обычно приводит к непредельным
кетонам:
сна-с-сн—сна
II I
О Вг
=о
СНа—С—С=
II I
о сн
Реакция сходна по типу с реакцией Реформатского (см. № 507).
См. также Гриньяр (№ 219).
Malmgren S., Ber., 1903, Bd. 36, S. 2608.
Colonge J., Grenet S., Bull. Soc. chim. France, 1954, p. 1304.
Du Bois J. E., Maroni P., Ditzler D., С. г., 1955, v. 240, p. 1993.
Методы элементоорганической химии. Магний, бериллий, кальций, стронций,
барий Под ред. А. Н. Несмеянова и К. А. Кочешкова. Изд. АН СССР, 1963,
с. 117.
384. МАННИХ (MANNICH)
Амииометилирование соединений с подвижным атомом водорода действием
формальдегида и аммиака или аминов:
:_н + сн2=о + hnrr'
NC + CH2—NRR'
/I
C-CH2-NRR'
Подобно формальдегиду реагируют другие алифатические и ароматические
альдегиды, а также алифатические, жирноароматические и гетероциклические
кетоиы, р-кетоэфиры, производные малоновой кислоты, нитросоединения, арома-
ароматические и гетероциклические соединения, с подвижным атомом водорода коль-
кольца (пиррол, хинальдин, а-пиколин и др.), производные ацетилена:
нагревание
(СН3JСО + СН2О + (C2H5JNH (СНзШ0^) CH3COCH2CH2N(C2H5J
F5%)
О
Г J
о
сн3
+ (СН2ОK + (CHaJNH >¦
о
щс^Х, сн2м(сн3J
:н3
CH2N(CH3J
D4%)
+ HN(CHaJ
CH2N(CH3J
NH
RGsCH + CH2O ¦
[Fe2+]
NH
(90%)
RC=sC—CH2N(C2H5J
(ДО 80%)
268
В качестве аминной компоненты используют аммиак, алифатические и цик-
циклические амииы, гидразин, гидроксиламин.
Побочные процессы: аминометилирование всех подвижных атомов водорода
в молекуле, а также образование третичных оснований Манниха, например:
4 CH3CH(COOH)s, + CH2O+NH2R > (НООСJС—CH2NHR >•
СН3
> (НООС) 2С—СН2— NR—СН2—С(СООН) 2
сн3 Сн3
В случае спиртов, аминов или тиолов происходит соответственно О-, N- или
S-аминометилирование, например:
С2Н6ОН + СН2О + (C2H5JNH
CeH6SO2NHCH3 + CH2O + HN^ ^
(CH3JCHSH + СН2О + (C2H5KNH
С2Н5О-СН2—N(C2H5J
(95%)
о —> c6h5so2n—ch2-n, ;o
СН3
(94%)
(CHaJCH-S-CH2—N(C2H6J
C7%)
Реакция широко применяется в органическом синтезе, особенно в синтезе
природных веществ и фармакологических препаратов.
См. также Айнхорн (№ 6), Айслеб (№ 8), Бетти (№ 70), Дёбнер (№ 245),
Кабачник — Филдс (№ 279), Петренко-Криченко (№ 450), Пикте — Шпенглер
(№ 456), Родионов (№ 521).
Mannich С, Krosche W., Arch. Pharm., 1912, Bd. 250, S. 647.
Phillips J. P., Chem. Rev., 1956, v. 56, p. 286.
Krdhnke F., Angew. Chem., 1963, Bd. 75, S. 187.
Moehrle H., Spillmann P., «Tetrahedron», 1969, v. 25, p. 5595.
Яхонтов Л. Н. и др., Ж, орг. хим., 1974, т. 10, № 4, с. 868—873.
Hellmann H., Opitz G., a-Aminoalkylierung. Weinheim/Bergstr., «Chemie», 1960,
336 S.
OP, т. 1, с 399.
385. МАРКВАЛЬД (MARCKWALD)
Асимметрический синтез дизамещениых уксусных кислот декарбоксилирова-
нием монобруциновых солей несимметричных диалкилмалоновых кислот:
160-180 °С
;С(СООНJ-Бруцин *¦
НСООН
R'
Таким способом, например, из метилэтилмалоновой кислоты получено 55%
левовращающей и 45% правовращающей метилэтилуксусных кислот.
Marckwald W., Ber., 1904, Bd. 37, S. 349, 1368.
Kenyan J., Ross W. A., J. Chem. Soc, 1951, p. 3407; 1952, p. 2307.
Несмеянов А. #., Несмеянов Н. А. Начала органической химии. Ки. I.
Изд. 2-е. М„ «Химия», 1974, с. 368.
269
386. МАРТИНЕ (MARTINET)
Получение диоксиидолов циклокоиденсацией ароматических аминов с эфи-
рами мезоксалевой кислоты с последующим омылением образующегося эфира
диоксиндол-3-карбоновой кислоты:
R
COOR'
НО COOR'
¦NH2
NH
н2о;
НО"; N2
Аналогично реагируют аминопроизводные конденсированных полицикличе-
полициклических углеводородов, а также аминохинолины:
NH.
-СООС2Н5
N " СООС8Н5 N " N
В присутствии кислорода образуются соответствующие изатииы.
См. также Кляйзен — Шедуэлл (№ 303).
Guyoi A., Martinet J., С. г., 1913, v. 156, р. 1625.
Langenbeck W. e. a., Ann., 1932, Bd. 499, S. 201; 1934, Bd. 512, S. 276.
Sumptcr W. C, Chem. Rev., 1945, v. 37, p. 472.
Эльдерфильд, т. З, с. 177.
387. МАУРЕР — ДРЕФАЛЬ (MAURER — DREFAHL)
Окисление первичных спиртов в карбоновые кислоты действием четырехоки-
си азота*:
RCH2OH
(CHCl:i|
RCH2-ONO
RC—ONO
I!
О
RCOOH
F0-90%)
R = Alk (C7 и выше)
Аналогично окисляются диолы с образованием двухосновных кислот (выхо-
(выходы 80—95%). Реакция применима также для окисления Сахаров, например:
СНО СООН
>- (СНОНL
СООН
Основной побочный процесс —образование альдегидов (особенно в случае
беизиловых спиртов).
(СНОНL
Ш,0Н
¦ Называют также реакцией Маурера
270
Маигег К., Drefahl G., Ber., 1942, Bd. 75, S. 1489.
Lagenbeck W., Richter M., Chem. Ber., 1956, Bd. 89, S. 202.
Физер, т. 1, с. 20.
388. МЕЕРВЕЙН (MEERWEIN)
Арилирование непредельных соединений с активированной двойной связью
конденсацией их с солями диазония*:
RCH=CHR' + ArN2X
рН ~5; 5-40 °С
(водн. СНзСОСНз)'; [СиС12]*
R
\>=CHR' или RCH=C/
C0-80%)
R = H, Alk, Ar'; R' = COOAlk, CN, СНО, COAlk, CeH6;
Ar = CeH5, C,H4C1, CeH4NO2; X = Cl (обычно), Br, SO3H
* CHgCN, C5H5N, H2O; ** Cu2Br2, без катализатора
Реакция может протекать как по ионному, так и по радикальному меха-
механизмам. Очень часто происходит присоединение Аг и X по С=С-связи (галогеи-
арилирование):
RCH=CHR' + ArN2X > RCH—CHR' или RCH-CHR'
X Ar Ar X
Направление арилирования (галогенарилирования) определяется характером
R: при R = Alk происходит Р-арилирование, а при R = Ar' арильный остаток
вступает в а-положение к заместителю R', например:
CH3CH=CHCOOR + ArN2Cl >- CH3CH(Ar)CHClCOOR
CeH5CH=CHCHO + ArN2Cl > CeH5CH=C(Ar)CHO
Арилированию подвергаются сопряженные диены, ацетилен, виниловые эфи-
ры, хиноны и др.:
СН=СН + O2NCeH4N2Cl >- O2NCeHa—CH=CHC1
СН2=СН-СН=СН2 + ClCeH4NsCl v C1C6H4—СН2-СН=СН-СН2С1
Арилироваиие а,[5-непредельных карбоиовых кислот сопровождается декарб-
оксилированием:
СН3СН=СН-СН=СНСООН + CeH5N2Cl >¦ СН3СН==СН-СН=СНС6Н5
Побочные реакции: замена диазогруппы атомом галогена, восстаиовительиое
отщепление азота (дезаминирование), образование ArN = NAr и образование
«диазосмол».
См. также Гомберг —Бахмаи — Хей (№ 206), Эйкман (№ 734).
Meerwein H., Buchner E., van Emster К, J. prakt. Chem 1939, Bd 152,
S. 237.
Домбровский А. В., Усп. химии, 1957, т. 26, с. 695.
Dickennan S. С. е. a., J. Org. Chem., 1969, v. 34, p. 710.
Allard M. e. a., Bull. Soc. chim. France, 1972, № 5, p. 1921.
¦ Называют также реакцией Меервейна — Шустера (Schuster).
271
1897.
Krutosikova A. e. a., Coll. Czech. Chem. Comm., 1974, v. 39, № 7, p. 1892—
OP, т. 11, с 199; РИМИОС, т. 11, с. 285.
389. МЕЕРВЕЙН —ПОННДОРФ—ВЕРЛЕЙ
(MEERWEIN — PONNDORF — VERLEY)
Восстановление карбонильных соединений до спиртов действием алкоголята
алюминия и соответствующего спирта:
^снон
нагревание
1(«Э0-С3Н7ОKА1]*; (СдНв)*«
О
н
н
|
"О
А
'А А
АГ
-СН— + R—С—R'
н
А1
\ _
О
н о
(80-95%)
* (С2Н5ОKА1 или (отреот-С4Н9ОKА1 в соответствующем спирте;
** СвН5СН3, без растворителя
Процесс является обратимым; обратное превращение используется для
окисления спиртов (см. Оппенауэр, № 435).
В реакцию вступают алифатические и ароматические карбонильные соеди-
соединения. Альдегиды обычно восстанавливаются легче, чем кетоны; функциональ-
функциональные группы и кратные связи не затрагиваются, например:
СН3-СН=СН-СН2ОН
СН3-СН=СН-СНО
o-O2N-CeH4-CHO
свн5-с=с-сно
(колич.)
o-02N-CeH4-CH2OH
(92%)
CeH6-C==C—CHSOH
F5%)
Реакция имеет большое препаративное значение. Защищая соответствующие
функциональные группы, можно проводить селективное восстановление, на-
например:
(«зо-СзН70KА1
СЯН6-С-СНО v С6Н6-С-СН(ОСН3J ,„м-г.„.п„> С6Н6-СН-СН(ОСНзJ
он
О
о
См. также Тищенко (№ 570), Хенбест (№ 652).
Meerwein #., Schmidt R., Ann., 1925, Bd. 444, S. 221.
Ponndorf W., Angew. Chem., 1926, Bd. 39, S. 138.
Verley A., Bull. Soc. chim. France, 1925, v. 37, p. 537; 1927, v. 41, p. 788.
Snyder С #., Micklus M. L, J. Org. Chem., 1970, v. 35, p. 264.
272
I ones R. A., Webb Т. С, «Tetrahedron», 1972, v. 28, p. 2877.
Андреева И. В., Турбина А. И., Ж. орг. хим., 1974, т. 10, № 10,
с. 1392—1399.
ОР, т. 2, с. 195.
390. МЕЙЕР (MEYER G.)
Получение алкиларсиновых кислот алкилированием арсенитов щелочных
металлов алкилгалогенидами в водноспиртовых растворах в присутствии ще-
щелочи:
NaOH
Алкилирующими агентами могут служить также галогенпроизводные, содер-
содержащие различные функциональные группы (спирты, кетоны, эфиры, сульфиды
и т. п.), а также диалкилсульфаты. Легкость алкилирования убывает в ряду
I > Вг > С1. Ароматические соединения реагируют с трудом; наличие
в орго- или яара-положениях электроноакцепторных заместителей облегчает
реакцию.
Побочный процесс—отщепление НХ с образованием олефинов. Реакция ис-
используется также для синтеза свииец- и оловоорганических соединений:
Na2Sn02 + RX > RSnOONa
NaHPbO2 + RX > RPbOOH
Модификация Оже (Auger)*—получение диалкиларсиновых кислот алкили-
алкилированием солей алкнларсинистых кислот:
RAs(ONaJ + R'X >¦ RR'AsOONa
См. также Розенмунд (№ 522), Штреккер (№ 732).
Meyer G., Ber., 1883, Bd. 16, S. 1439.
OP, т. 2, с. 415.
391. МЕЙЕР (MEYER V.)
Получение алифатических нитросоединений действием нитрита серебра на
первичные алкилгалогениды:
AgNO2; ~0°С
RX ———->- RNO2
(эфир)*
D0-80%)
X = Вг, I (реже С1)
* СвНв, циклогексан, петролейный эфир, HCON(CH3J, (CH3JSO
В реакцию вступают также алициклические, жирноароматические и некото-
некоторые гетероциклические галогенпронзводные, например:
О О
—СН„Вг
О
О
B7%)
¦Называют также реакцией Оже.
18—684
2 73
Наличие разветвлений в а-положении к углеродному атому, связанному с
галогеном, затрудняет реакцию. а.со-Дигалогеииды дают а,со-дииитропроизвод-
ные. Побочный процесс—образование нитритов.
В случае вторичных RX выходы нитросоединеиий очень малы вследствие
протекания побочных реакций. Из третичных RX образуются в основном соот-
соответствующие нитриты.
Использование NaNCb в диметилформамиде нлн диметилсульфоксиде (Кори-
блюм) позволяет получать вторичные иитросоединения всех типов. Реакция
а-галогеиэфиров с NaNC>2 является единственным общим методом получения
а-ннтроэфиров (выходы 80—90%). Введение иитрогруппы с помощью NaNC>2 —
удобный метод синтеза алифатических и алициклических нитросоединений.
См. также Коновалов (№ 318), Тер-Меер (№ 562), Хасс (№ 641).
Meyer V., Stuber О., Вег., 1872, Bd 5, S. 203.
Edward J. Т., Tremaine P. H., Can. J. Chem., 1971, v. 49, p. 3481, 3489, 3493.
Вейганд-Хильгетаг, с. 442; OP, т. 12, с. 118.
392. МЕЙЕР (MEYER К- Н.)
Бромироваиие енольиых форм [5-дикарбоиильиых соединений с последую-
последующим отщеплением бромистого водорода и образованием а-бромкетонов:
R_C=CH-C-R"
О
Вг
R—С-СН-С—R'
I I II
НО Вг О
—НВг
(Н2О)
R—С—CHg—С—R'-i-KBr+ Is
О
о
Метод используют для определения содержания енольной формы C-дикар-
бонильного соединения (бромометрическое титроваияе). Образовавшийся бром-
кетон легко выделяет иод нз KI; выделившийся иод оттнтровывают тиосуль-
тиосульфатом. „
Метод применим для соединений с небольшим и средним содержанием
енольной формы. У соединений с высокой кислотностью параллельно происходит
прямое замещение водорода бромом, вследствие чего получаются завышенные
результаты. Метод ие надежен и для соединений с малой кислотностью
(рК < Ю-13) (например, для а-алкилацетоуксусных эфиров, у которых ско-
скорость выделения иода из KI соизмерима со скоростью установления таутомерного
равновесия). Для таких соединений разработан модифицированный метод, поз-
позволяющий с достаточной точностью определять малое (до 0,1%) содержание
еиольиой формы (Днкман).
Meyer К. П., Вег., 1911, Bd. 44, S. 2720; 1921, Bd. 54, S. 577.
Dieckmann W., Ber., 1922, Bd. 55, S. 2470.
Schwarzenbach G., Wittwer C, Helv. chim. acta, 1947, Bd. 30, S. 657, 669.
Mauser H., Nickel В., Chem. Ber., 1964, Bd. 97, S. 1745.
Henecka H. Chemie der Beta-Dicarbonylverbindungen. Berlin, Springer, 1950,
S. 43.
274
393. МЕЙЕР-МОР (MEYER E.-MOHR)
Получение замещенных дигидропиридииов циклокоидеисацией альдегидов
или кетоиов с нитрилами неиасыщениых |5-амииокислот*:
— С—.+ 2
II
О
CHCN
II
RCNH2
С
NC-
I!
RC
H2N
C-CN
!!
CR
NH2 _
R = СН3, Ar
Получающиеся дегидропиридины легко окисляются в соответствующие пи-
ридины действием СгОз. . „„ ___
В реакцию вступают разнообразные альдегиды и кетоны алифатического,
алициклического и ароматического рядов, Р-кетоэфиры, арилидеиацетофеиоиы,
например:
свн
C6H5CHO + 2CH3C=CHCN >
NH2
CH3COCH2COOC2H5 + CH3C=CHCN »
NH2
Исходные нитрилы получают димеризацией ацетонитрила или взаимодейст-
взаимодействием его с другими нитрилами под действием оснований:
СН3СХ + RCN
-> RC—CH,CN
II
NH
RC=-CHCN
NH2
См. также Ганч (№ 188).
Meyer E., J. prakt. Chem., 1895, Bd. 52, S. 81.
Mohr E., J. prakt. Chem., 1897, Bd. 56, S. 124.
Meuer E,J prak.t Chem., 1914, Bd. 90, S. 29.
Palii N, J Indian Chem. Soc, 1950, v. 27, p. 71, 667.
Courts A. Petrow V., J. Chem. Soc, 1952, p. 334.
Эльдерфильд, т. 1, с. 362, 483.
•Называют также реакцией Ганча (Hantsch) — Мейера — Мора.
18*
275
394. МЕЙЕР —ШУСТЕР (MEYER К. Н. — SCHUSTER)
Перегруппировка третичных и вторичных а-ацетиленовых спиртов в а,Р-не-
предельные кетоны или альдегиды в присутствии кислых катализаторов:
s
/С—С=С—R"
|
ОН
нагревание
»¦
[H2SO4]«; (CH3COOH)"
/Vj Vj \J t
R''
/C=C=C-R"
H2O
R'-
R'
/C=C=C-R"
R;
/C=CH—C—R"
I!
О
OH
= Alk, Ar; R, R" = H, Alk, Ar
* Дауэкс 50, H2SO4 + HgSO4, HC1, HC1 + HgCl2, H3PO4, P2O5, ZnCl2,
KHSO4> Na2SO4, MgSO4 в вакууме, HCOOH, (CH3COJO, СН3СОС1,
СС13СООН, С1СН2СООН, CeH5OH, n-CH8CeH4SO3H
** Н2О, водн. диоксан, водн. СН3СООН, НСООН, эфир, QH,,
«-С3Н7ОН, («-С4Н9JО, С2Н5ОН
Аналогично перегруппировываются а-ацетиленовые спирты, содержащие не-
несколько кратных связей:
Аг2С(ОН) (С==С)„Аг Ar2C(OH)C=CCH=CHAr ArC=CCH(OH)GsCAr
Побочные процессы: перегруппировки, изомеризация, автоконденсация про-
продуктов реакции. Последний процесс имеет место при R"=H и подавляется при
проведении реакции в газовой фазе.
См. также Рупе (№ 527).
Meyer К. Н„ Schuster К., Вег., 1922, Bd. 55, S. 819.
Newman M. S., J. Am. Chem. Soc, 1953, v. 75, p. 4740.
Ansell M. F., Hancock I. M., Hickinbottom W. J., J. Chem. Soc, 1956, p. 911.
Swaminathan S., Narayanan K. V., Chem. Rev., 1971, v. 71, p. 429.
395. MEHKE (MENKE)
Нитрование ароматических соединений смесью неорганических нитратов и
уксусного ангидрида в среде ледяной уксусной кислоты:
АгН
; 30-80 °С
[(СН8СО)аО]«; (лед. СН3СООнГ ArN°2
C,H4OH, CeH4NH2, CeH4CHO, CeH4COAlk; M = Cu, Fe, Hg, Li, Kg, Co, №
* CH,COC1
276
Наибольшая скорость нитрования наблюдается при применении смеси нитра-
нитратов меди и железа. В реакции образуется смесь трех изомеров с преобладанием
о/?то-изомера, например:
/СН3
3 /С
\_/Ч_МНСОСН,
•СН,
сн3
—NHCOCH.
N0,
(90%)
См. также Фреденхаген (№ 626), Реверден (№ 498).
Menke J. В., Rec. trav. chim., 1925, v. 44, p. 141, 269.
Bacharach G., J. Am. Chem. Soc, 1927, v. 49, p. 1522.
Davey W., Gwilt J. R., J. Chem. Soc, 1950, p. 204, 3348.
396. МЕНЦЕР (MENTZER)
Термическая циклоконденсация многоатомных фенолов с C-кетоэфирами,
приводящая к оксихромонам и оксикумаринам:
О
ч
||
R'0-C
-f
ОН
О
но/
200—300 °С
R'
R
R
НО-
НО^ ^/ ^ \R' НО^ ^/ ~>Г ~^О
R = Н, Alk, цикло-к\к; R' = СН3, Ar; R" = СН3, С2Н5
В реакцию вступают различные полифенолы и C-кетоэфиры, например:
277
б
B5-65%)
Вместо [3-кетоэфиров можно использовать малоновые эфиры, при конденса-
конденсации которых с фенолами образуются только оксикумарины, например:
ОН
СООС2Н3
+ снсн3
)Н СООС2Н5
R = Н, СН3> ОСН3, ОН
См. также Пехман (№ 453), Симонис (№ 542).
Mentzer С, Molho D., Vercier P., Bull. Soc. chim. France, 1949, p. 749.
Pillon D., Bull. Soc. chim. France, 1952, p. 324.
Gowan J. E., MacGollas P., Chem. Ind., 1955, p. 1672.
397. МЕНШУТКИН
Алкилирование третичных аминов алкилгалогенидами с образованием чет-
четвертичных аммониевых солей:
R3N + R'X
R3N-R' X"
(СН3СОСН3)
* Полярные растворители
Скорость реакции сильно зависит от природы R [например, (C6HsKN не
алкилируется], длины н разветвленности цепей R и R' {пере- > втор- >
> трет-), от природы галогена (I > Вг > С1). Из ароматических галоге-
нидов в реакцию вступают лишь 2,4-(О2НJСбНзХ.
Побочные реакции: образование олефинов (прежде всего для третичных
R'X), а также переалкилирование:
R3N
(СН3KСХ
R3N + R'X
R3NH Х
(СН3JС=СН2
R2NR' + RX
См. также Гофман (№ 209), Прелог (J* 473).
Menschutkin N.. Z. phys. Chem., 1890, Bd. 5, S. 589; Bd. 6, S. 41.
Hartmann H., Schmidt A. P., Z. phys. Chem., 1968, Bd. 62, S. 194, 312.
Matsui Takeki, Tokura Niichiro, Bull. Chem. Soc. Japan, 1970, v. 43, p. 1751.
Abraham M. H., Chem. Comm., 1970, p. 293.
Sicsic S., «Tetrahedron», 1974, v. 30, № 2, p. 277—281.
Темникова Т. И. Курс теоретических основ органической химии. М. — Л., «Хи-
«Химия», 1968, с. 318.
398. МЕРРИФИЛД (MERRIFIELD)
Получение пептидов конденсацией N-защищенных аминокислот с аминокис-
аминокислотами или пептидами, связанными ковалентной связью с молекулой полимера
(твердофазный синтез):
нагревание
ZNHCHCOO" +NH(C2H5K + С1СН2—
R
П
(диоксаи)
278
ZNHCHCOO-CH,-
П
НВг
(СН3СООН)
H2NCHCOO-CH2-
П
ZNHCHCO—NHCHCOO—CH2—
R
R'
ZNHCHCOOH; C9Hi1N=C=NC9Hi1
»
(диметилформамид)
НС1'; 25 °С
П
(СН3СООН)
H2NCHCO-NHCHCOO-CH2—] П
R
NaOH"; 25 °С
(С2Н5ОН)
R'
H,NCHCO-NHCHCOOH
I I
R' R
Z = С,Н6СН2ОСО, (СН3KСОСО; j П | = полимер
* НВг, HF + CF3COOH;
(C2H5KN
В качестве полимера обычно применяют хлорметилированиый сополимер
стирола и дивинилбензола, содержащий 1,03 нитрогруппы на бензольное
кольцо.
Метод позволяет получать биологически активные пептиды. Достоинствами
метода являются высокие выходы пептидов, простота, легкость удаления по-
побочных продуктов и избытка реагентов, возможность стандартизации и автома-
автоматизации процесса синтеза.
См. также Бергман— Зервас (№ 62).
Merrifield R. В., J. Am. Chem. Soc, 1963, v. 85, p. 2149; 1964, v. 86, p. 304.
Gutte В., Merrifield R. В., J. Am. Chem. Soc, 1969, v. 91, p. 501.
Margtin A., «Tetrahedron Letters», 1971, p. 3145.
Шредер Э., Любке К- Пептиды. Т. 1. Пер. с англ. Под ред. М. М. Шемя-
Шемякина, Ю. А. Овчинникова. М., «Мир», 1967, с. 398.
Физер, т. 2, с. 68.
Lunkenheimer W., Merrifield-Synthese symmetrischer Cystinpeptide. Koln —
Opladen, Westdeutsch. Verlag, 1970. 74 S.
399. МИЛЛЕР — ПЛЕХЛЬ (MILLER — PLOCHL)
Получение пирролов циклокондеисацией непредельных альдегидов с а-арил-
аминофенилацетонитрилом под. действием щелочи с последующей ароматизацией
образующихся пирролидинов при нагреваиии:
CH=CHR
СНО
- NC—СН—С6Н5
NHAr
КОН
(СН3ОН)'
HC=CHR
ArN
279
—>¦ но-
ArN
R = Н, CH3, С„Н5,
нагревание
NAr
F0-80%)
-п; Аг = С6Н5, С„НйСН3-/г
* сан5он
а-Алкиламиноацетонитрилы образуют пирролы с очень низкими выходами.
См. также Кнорр (№ 310).
Miller /., Plochl ]., Ber., 1898, Bd. 31, S. 2699.
Treibs A., Derra R., Ann., 1954, Bd. 589, S. 176.
Treibs A., Angew. Chem., 1952, Bd. 64, S. 615.
400. МИЛОБЕНДЗКИЙ — ШУЛЬГИН
(MILOBENDZKI - SZULGIN)
Превращение триарилфосфитов в О,О-диарилметилфосфонаты при нагрева-
нагревании с метиловым спиртом:
-215 °С; давление
Р(ОАгK + СН3ОН * [СН3О-Р(ОАгJ] > СН3-РО(ОАгJ + АЮН
Аг = С6Н5, С6Н4СН3
Аналогично реагируют триалкилфосфиты:
Р(ОС2Н5K + СН3ОН > СН3-РО(ОСаН6J
F0%)
При использовании этилового спирта выход фосфонатов уменьшается:
Р(ОС2Н5K + С2Н5ОН >- С2Н5-РО(ОСаН5J
A5%)
В случае высших спиртов основной реакцией является переэтерификация,
например:
Р(ОС6Н5K + h-QH9OH v P(OQH9K + QH6OH
Побочные реакции: образование триалкилфосфатов, диэфиров фосфористой
кислоты, переэтерификация эфиров метилфосфоновой кислоты:
Р(ОС6Н5K + СН3ОН
225 °С
СН3-РО(ОСН3J + С„Н5ОН
Р(ОСаН6K + СН3ОН
215 °С
СН3-РО(ОС2Н3J + НРО(ОС2Н5J + РО(ОС2Н5K
F0%) B5%) A5%)
См. также Арбузов (№ 22).
Milobendzki Т., Szulgin К., Chem. Polski, 1917, v. 15, p. 66; С. А., 1919, v. 13,
p. 2867.
Cason J., Baxter W. N.. J. Org. Chem., 1958, v. 23, p. 1302.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачника. М., «Химия», 1972, с. 387.
280
401. МИНЬОНАК (MIGNONAC)
Восстановительное аминирование карбонильных соединений действием ами-
аминов (или аммиака) и водорода в присутствии катализаторов:
R\ \
ХС=О
XNH
Н2; нагревание
(С2Н5ОН); [№]•
ХСН— К
C0-90%)
К = Н, Alk, Ar; R' = Alk, Аг
* Pt, Pd, PtO
Процесс проводят под давлением. При реакции с аммиаком образуется
смесь первичных и вторичных аминов. Ароматические альдегиды и кетоны более
реакционноспособны, чем алифатические.
См. также Лёйкарт (№ 361), Баллах (№ 143).
Mignonac M. G., С. г., 1921, v. 172, р. 223.
Schwoeg E. L, Adkins H., J. Am. Chem. Soc, 1939, v. 61, p. 3499.
OP, т. 5, с 347; СОП, т. 3, с. 448; Houben-Weyl, Bd. 4/2, S. 51.
402. МИХАЛЬСКИЙ (MICHALSKI)
Перегруппировка тетраалкилдифосфорилсульфидов, образующихся при взаи-
взаимодействии диалкилфосфорилсульфенхлоридов с триалкилфосфитами, в тетраал-
килмонотионпирофосфаты:
(ROJP-SC1 + R'O-P(OR'J
(С6Н6)
О
(ROJP-S-P(OR'J
(ROJP-S-
- (ROJP-O-P(OR'J
О
О
О
R, R' = Alk
Аналогичная перегруппировка происходит и в случае соединений типа
(ROJOP—S—PO(OR')R", где R, R', R" = Alk. Процесс можно рассматривать
как реакцию внутримолекулярного нуклеофильного замещения.
Michalski J. e. a., Roczn. Chem., 1956, v. 30, p. 651.
Michalski J., Patajczak R., Chem. Ind., 1959, p. 539.
Michalski J., Bull. Soc. chim. France, 1963, p. 11.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум. Под ред. М. И. Кабачника. М., «Химия», 1972, с. 478, 555.
403. МИХАЭЛИС (MICHAELIS)
Получение азосоединений из арилизотиоцианатов и N-арилгидроксилами-
нов:
Ar-N=S=O + Ar'NHOH
Ar-N=N-Ar'
(80-90%)
Ar, Ar' = C6H5, C6H4CH3
281
Аналогично реагирует а-нафтилизотиоцианат. При Ar=C6H4NH2-ra образуется
трисазосоединение:
2NHaCeH4NSO + 2Ar'NHOH > Ar'—N=N-CeH«—N=N—CeH4-N=N—Ar'
Michaelis A., Peton K, Ber., 1898, Bd. 31, S. 984.
Fierz-David H. E., Helv. chim. acta, 1951, Bd. 34, S. 846.
404. МИХАЭЛИС —БЕККЕР (MICHAELIS — BECKER T.)
Получение полных эфиров алкилфосфоновых кислот взаимодействием нат-
натриевых или калиевых солей диалкнлфосфитов с алкилгалогенидами:
RCX
>-OM +
-25 °С
R'CK
(С2Н5ОН)*
RO.
R'O'
X
";р-ом
/1
R"
R'O/
P-R"
О
R, R'=Alk, Ar; R" = Alk; X = CI, Br, I; M = Na(обычно), К
* Спирты, тетрагидрофуран, жидкий NH3, инертные растворители
Аналогично реагируют солн алкил (ари.п) фосфинистых кислот, эфиров
алкил (арил) фосфонистых кислот н их тиоаналогов, а также соли полимерных
фосфористых кислот-.
RR'P-OM -f R"X
R(R'O)P-OM -f R"X
ONa
[_O_P-O-(CH2N-Jn
RR'P(O)R"
¦ RR"P(O)OR'
О
¦ лС6Н5СН2С1 —
-O-P-O-(CH2N-
CH2C6H5
Реакционная способность алкилгалогенидов уменьшается от первичных к
вторичным и далее к третичным, а такж$ с увеличением алкильного радикала.
Из третичных алкилгалогенидов лишь триарилметилхлориды гладко дают нор-
нормальные продукты реакции, тогда как из триарилметилбромидов обычно обра-
образуются триарилметильные радикалы (см. Арбузов — Арбузов, № 23). Ацилгалоге-
нпды реагируют подобно алкилгалогенидам.
Реакция может быть использована для получения соединений, содержащих
связь фосфора с различными элементами, например:
(C2H5OJPSNa + C2H5SC1
(C,H5OJP-SC2H6
(ROj2PONa + (R'OKSiCl
(RO),P-Si(OR')8
II
О
Реакция широко применяется в синтезе пестицидов, эфиров непредельных
фосфоновых кислот, лекарственных препаратов и т. п.
Michaelis A.. Becker Т., Вег., 1897, Bd. 30, S. 1, 1003.
Шрейберт А. И., Мудрая Л. М., Мудрый Ф. В. 1969, т. 39, с. 1416.
Vilceanu R., Neamtiu J., Rev. chim. (Bucharest), 1973, v. 24, № 3, p. 153.
282
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер.
с рум Под ред. М. И. Кабачника, М., «Химия», 1972, с. 201.
РИМИОС, т. 15, с. 41.
405. МИХАЭЛЬ (MICHAEL)
Получение ацетилированных О-арилгликозидов взаимодействием а-ацетил-
галогеноз с фенолятом калия:
Н-С—X
дососи.
О + АгОК ~
АгО—С—Н
еодн. ацетон) q
нососн.
Мягкие условия реакции позволяют сохранить ацетильную защиту; как
правило, образуются |3-гликозиды.
См также Кёнигс — Кнорр (№ 289), Уильямсон (№ 582), Хельферих
(№ 650).
Michael A., Am. Chem. J., 1879, v. 1, p. 307; 1885, v. 6, p. 336.
Conchie В J., Levy G. A., Adv. in Carbohydrate Chem., 1957, v. 12, p. 157.
Halasa A. F., Smith G. E. P., J. Org. Chem., 1971, v. 36, p. 636.
406. МИХАЭЛЬ (MICHAEL)
Нуклеофильное присоединение веществ с реакционноспособной метиленовой
группой к активированной С = С-связи в присутствии оснований:
R\ \
R'
[C2H5ONa]*; (C2H5OH)«
СН—C-CR"
н2о
R''
R, R' =CN, COOR, COCH3, CeH6, SO2R и др.;
R" = CHO, COR, COOR, CN и др.
XH-C-CHR"
I I
E0-60%)
* R2NH, RNH2, пиперидин, СаН2, КОН и др.; ** С9Н6, диоксан
Реакция широко используется в органическом синтезе, например:
5 [пнпернднн]
> С6Н5СОСН2СН(С9Н5)СН(СООС2Н5J
(колнч.)
СН3СОСН2СОСН3-f 2CH2=CHCN -[(C^H ^ (CH3COJC(CH2CH2CNJ
G7%)
(ch3Jchno2 + ch2^:hcooch3 -„„ _ mni_,_^r (Ch3Jc(no2)Ch2ch2cooch3
[C6H5CH2N(CH3KOH]
ZCH2COOCH3
[C2H5ONa] Ц
Z = O, S, NCH3
(85%)
CH2COOCH3
>—COOCH,
283
В присутствии избытка катализатора наблюдается «аномальное» течение
реакции:
1 моль C2H5ONa
СН3СН=СНСООС2Н6
+
СН3СН(СООС2Н5J
*¦ СН3СН—СН(СООС2Н6)
СН3СНСООС2Н6
«аномальный» продукт
1/6 моль C2H5ONa
СН3СН-СН2СООС2Н6
СН3С(СООС2Н6J
«нормальный» продукт
«Обратной реакцией Михаэля» (retro-Michael-Addition) называют такое
расщепление молекулы, которое формально можно рассматривать как реакцию,
обратную присоединению по Михаэлю, например:
нонх сн,сн=сн,
(СН3СОJО
>
Н.Сч
СН2ОСОСН3
,)с-сна—с—сн2сн=сн2
Н О/ I
2 сн,ососн,
Модификация Робинсона (Robinson R.) — использование иодметилатов ос-
оснований Манниха в качестве источника <х,р-непредельных кетонов для конден-
конденсации с метиленовыми соединениями:
CH3COCH2CH2N(CH3J
ch3i
CH3COCH2CH2N(CH3K
сн,сосн=сн,
Образующийся кетон обладает высокой реакционной способностью, что
позволяет использовать его in situ для синтеза труднодоступных соединений.
См. также Кэрролл (№ 349), Робинсон — Манних (№ 518), Эйкман
(№734).
Michael A., J. prakt. Chem, 1887, Bd. 35, S. 349; 1891, Bd. 43, S. 390; Ber.,
1908, Bd. 33, S. 3731.
Seebach D., Leitz H. F., Angew. Chem., 1971, Bd. 83, S. 542.
Fohlisch B. e. a., Ann., 1973, Bd. 11, S. 1851—1881.
Buggle K. Michael addition reactions with acetylenic esters and ketones. Dub-
Dublin, Royal Irish Acad., 1971, 256 p.
Фьюзон, с. 442; OP, т. 1, с. 420; т. 10, с. 181; OR, v. 16, p. 47.
407. МИШЕР (MISCHER)
Укорочение углеродной цепи карбоновых кислот расщеплением сложных
эфиров через стадии получения третичного спирта, дегидратации его в производ-
производное дифеиилэтилена, бромирования последнего N-бромсукцинимидом в а-поло-
¦284
жение к двойной связи с последующими дегидробромированием и окислением
хромовым ангидридом до соответствующих кетонов*:
Н3С.
Н3С.
ООСН3
НХ
(эфир)
(С6Н5J (СНзСО)гО; нагревание
ОН
Вг
(СН3СООН)
Н,С,
,„ N-бромсукцинимид;
С6Н5J 50 °С
(СС14)
:(С6Н5J C6H5N(CH3J
~НВг
нх
СОСН,
(С6Н5J СЮ3; 0-3'С
(СС14 + СНзСООН)
Несмотря на сложность и многостадийность синтеза, выход конечного про-
продукта вполне удовлетворителен. Метод успешно применяется в химии стероидов
для укорочения боковой цепи одновременно на три атома углерода.
См. также Барбье — Виланд (№ 43), Галлахер — Холландер (№ 187),
Крафт (№ 334).
Meystre С. е. a., Helv. chim. acta, 1944, Bd. 27, S. 1815.
Zepter В., Ber., 1967, Bd. 100, S. 9.
Физер Л., Физер М. Стероиды. Пер. с англ. Под ред. Н. Н. Суворова и
И. В. Торгова. М., «Мир», 1964, с. 560, 662.
Rodd, v. 2, р. 117, 796, 903.
408. МОРЛЕНД (MORELAND)
Замена галогена в а-галогенкетонах на ацилокси-группу действием триэтил-
аммониевых солей органических кислот:
Аг-С— СН2Х +
II
О
+NH(C2H6K
-20 °С
(СН3СОСН3)
Ar-C-CH2-OCR
= С„Н6, С„Н4С6Н6; R = Ar;
II И
О О
(80-90%)
= C1, Br, I
Аналогично реагируют и другие соединения, содержащие подвижный гало-
галоген, например n-O2NC6H4CH2Cl. Добавление каталитических количеств Nal и на-
нагревание ускоряют реакцию. Метод применяется в химии стероидов.
См. также Байер — Виллигер (№ 35).
¦Называют также реакцией Мейстра (Meystre) — Мишера нли Мишера —
Веттштайна (Wettstein).
285
Moreland W. Т., J. Org. Chem., 1956, v. 21, p. 820.
Rothman E. S., Rerlstein Т., Wall M. E., J. Org. Chem., 1960, v. 25, p. 1966.
Физер, т. З, с. 455.
409. МУММ —XECCE (MUMM — HESSE)
Получение М,1М-диароилаиилинов из ароматических иминохлоридов дейст-
действием солей карбоновых кислот с одновременной внутримолекулярной перегруп-
перегруппировкой образующихся иминоангидридов:
CeH6N=C—Ar + Ar'COOM >¦ C6H6N=C—Ar —
1 OCOAr'
Ar, Ar' =C6H5, C6H4CH3, CSH4NO2> CSH4NH2;
/COAr
c6h6n(
\COAr'
= Na, К
Вместо солей карбоновых кислот можно использовать свободные кислоты и
триэтиламин:
A (C2H5KN /C°R
CeH6N=C/ + R'COOH — > C6H5N^
G0%—колич.)
R = C(CH3K> C6H6; R' = CH3, C(CH3K, CH2C1
Исходные иминохлориды получают действием пятихлористого фосфора на
соответствующие ацетаннлиды.
См. также Зонн — Мюллер (№ 269).
Митт О., Hesse H., Вег., 1910, Bd. 43, S. 2505.
Митт О., Hesse H., Volguartz H., Вег., 1915, Bd. 48, S. 379.
Cramer F., Baer K, Chem. Вег., 1960, Bd. 93, S. 1231.
410. МУРО —МИНЬОНАК (MOUREAU — M1GNONAC)
Каталитическое окисление алифатических спиртов в альдегиды (или кетоны)
нагреванием их в токе кислорода в присутствии порошкообразного серебра:
\ О2; 360-400 "С \
ХСНОН — *- ;с=О
/ [Ag-порошок] /
D0-85%)
В реакцию вступают различные первичные и вторичные спирты.
В некоторых случаях для повышения выхода реакцию проводят в вакууме.
Так, при получении коричного альдегида проведение реакции в вакууме повы-
повышает выход до 90% (вместо 60%).
См. также Адкинс — Питерсои (№ 3), Оппенауэр (№ 435), Пфициер —
Моффэтт (№ 482).
Moureau Ch., Mignonac G., Bull. Soc. chim. France, 1921, v. 29, p. 88.
Moureau H., Chovin P., Brunei M., Bull. Soc-. chim. France, 1948, V. 15,
p. 96.
286
на-Т:
411. МЭНН—ПОУП (MANN —POPE)
Получение сульфилиминов из диалкил- или алкиларилсульфидов и хлорами-
Rx
Rv
— n-CH3C6H,SO2NCl Na+
(Н2О)*
4S=N-SO2C6H4CH3-n
C0-75%)
R, R' = CH3, С2Н5, CH2CH2C1, CH2CeH5, C6H3, CSH4NO2, C6H4OCH3
* C2H5OH (водн.), диоксаи (водн.)
Реакцию проводят, как правило, при охлаждении. Превращение диарил-
сульфидов происходит только при нагревании. Наличие в диарилсульфидах
электронодонорных заместителей облегчает реакцию; (O2NC6H4JS вообще не
реагирует.
Дисульфиды образуют соответствующие бис (соединения), например:
СН
\=/
¦—SO2NC1 Na+ >
~\ S=N-SO2-/r^)-CH3
Mann F. G., Pope W. J., J. Chem. Soc, 1922, v. 121, p. 1052.
Kucsmau A., Kapovits J., Balla M., «Tetrahedron», 1962, v. 18, p. 75.
Kucsmau A., Kapovits J., Tanacs В., «Tetrahedron», 1962, v. 18, p. 79.
412. МЭТТОКС—КЕНДОЛЛ (MATTOX - KENDALL)
Получение а,[3-непредельных кетоиов дегидробромированием а-бромкетонов
действием 2,4-динитрофеиилгидразина и последующей реакцией образовавшегося
динитрофеиилгидразона с пировиноградной кислотой*:
О
ArNHNH2; СН3ЮОЫа
(лед. СН3СООН)
СН3СОСООН*; НВг
NNHAr
(СН3ЮОН + СНС13)
О
Вг
Ar = 2,4-(NO2JCeH3
* Левулиновая кислота
Реакцию проводят в атмосфере азота или двуокиси углерода. Реакция ис-
используется в химии стероидов.
См. также Леспио — Буржель (№ 359).
Mattox V. R-, Kendall Е. С, J. Am. Chem. Soc, 1948, v. 70, p. 882; J. Biol.
Chem., 1951, v. 188, p. 287.
¦Называют также реакцией Кеидолла.
287
г. 71, р. ЮС
Beereboom J. J. e. a., J. Am. Chem. Soc, 1953, v. 75, p. 3500.
Hofmeister H. u. a., Chem. Ber., 1973, Bd. 106, S. 2263—2267.
413. МЮЛЛЕР-КУНРАДИ (MOLLER-CUNRADI)
Конденсация виниловых эфиров с ацеталями в присутствии трехфтористого
бора с образованием а,р-непредельных альдегидов:
CH2=CHOR + R'CH(OR"J
[BF3r
R'CHCH,CH
|
OR"
0R
NDR"
сн3соон
> R'CH=CH
ZnCla
Конденсацию проводят при низкой температуре. При увеличении цепи аль-
альдегида на три атома углерода используют пропениловый эфир. Реакция нашла
широкое применение в синтезе альдегидов ряда каротннондов н витамина А.
Muller-Cunradi M., Pieroh К, пат. США 2165962 A936); Chem Zbl., 1940,
Bd. 1, S. 1423.
Макин С. М., Рожков И. Н., ЖОХ, 1961, 31, с. 3214.
Ислер О., Шудел П., Усп. орг. хим., 1966, т. 4, с. 137.
414. МЮЛЛЕР —РОХОВ (MOLLER R. — ROCHOW)
Получение алкил- н арнлгалогенснланов из алйил- или арилгалогенндов и
кремния в присутствии металлических катализаторов*:
Si; нагревание
RX [Сц]< > R2SiCl2
RSiCL,
R = Alk, Ar; X = Cl, Br
* Ag, Ni, Sn, Sb, Mn
Суммарный выход галогенснланов составляет 50—70%. В качестве катализа-
катализаторов используют также сплавы кремния с медью или другими металлами.
С алкнлгалогенидами процесс ведут при 250—300 °С, а в случае арилгалогенн-
арилгалогенндов — при 400—500 "С. Побочные продукты: R3SiCl, R4Si, SiCl4.
Метод применяется для промышленного получения днметилдихлор- и метил-
трихлорсиланов.
Muller R., Z. Elektrochem., 1941, Bd. 47, S. 327.
Rochow E. G., J. Am. Chem. Soc, 1945, v. 67, p. 963.
Hard D. Т., Rochow E. G., J. Am. Chem. Soc, 1945, v. 67, p. 1057.
Методы элементоорганической химии. Кремний. Под ред. А. Н. Несмеянова
н К- А. Кочешкова. М., «Наука», 1968, с. 100.
*Называют также реакцией Рохова.
288
415. НАЗАРОВ
Циклизация аллилвнннлкетоиов в цнклопентеноны под действием фосфорной
кислоты:
RCH=CR'
СН2
НзРО*; нагревание
СН,-НС
RCH=CR'
± \.
С=О
* HaSO4, HC1, n-CH3CeH4SO3H, НСООН, лед. СН3СООН + H2SO4 и др.
Внннльная группа может содержать алифатические или ароматические за-
заместители. Как внннльная, так н аллильная группа может быть частью цик-
циклической системы:
(-50%)
Аллилвнннлкетон и все замещенные кетоны, внинльная группа которых вхо-
входит в систему пятнчленного цикла, гндратнруются с последующей циклизацией
в тетрагндро-у-пнроны:
О
If О
с
N
Реакция находит применение в синтезе стероидов.
Назаров И. Н. и др., Изв. АН СССР. ОХН, 1946, с. 633; 1947, с. 205.
Назаров И. Н., Усп. химии, 1951, т. 20, с. 71, 309.
Braude E. A., Forbes W. F., J. Chem. Soc, 1953, p. 2208.
Bergelson G., «Tetrahedron», 1959, v. 6, p. 161.
19—684
289
416. НАМЕТКИН
Изомеризация соединений терпенового ряда вследствие миграции одной
из гел-метильных групп к соседнему атому углерода в условиях кислотного ка-
катализа (камфеновая перегруппировка II рода):
ОН
h,so4,' 60 °с
СН3 (лед.СН3СООН)
СН,
сн„
он3
При перегруппировке происходит изомеризация углеродного скелета по типу
ретропииаколиновой перегруппировки:
(CHgKC-CHCH3 ;
ОН
Ан
Оиа сопровождается, в отличие от камфеновой перегруппировки I рода (см.
Вагиер — Меервейи, № 140), изменениями в циклической части молекулы. Про-
десс часто сопутствует перегруппировке Вагнера — Меервейна:
перегруппировк»
1родя
¦С Но
сн,
Вагнер Г., ЖРФХО, 1899, т. 31, с. 680.
Наметкин С. С, Брюсова Л. Я., ЖРФХО, 1924, т. 55, с. 525; 1925, т. 57,
с. 80.
Roberts J. ?>., Vancey J. A., J. Am. Chem. Soc, 1953, v. 75, p. 3165.
Dietrich Bernstein, «Tetrahedron Letters», 1967, p. 2281.
Реутов О. А. Теоретические основы органической химии. М., Изд. МГУ,
1Э64, с. 554.
290
417. НЕБЕР (NEBER)
Перегруппировка сульфонатов кетоксимов в а-аминокетоны под действием
оснований:
ArCHa--C-R + C6H5SO2C1
Й
NOH
АгСН2—С— R
II
NOSO2CeH5
; 0 °С
Аг— НС С—R
\ ¦/
N
ArCH-C—R
I II
NH2O
R = Ar, CH2Ar
* C2H5ONa, CH3OK
Реакцию обычно проводят в атмосфере азота. Последовательное повторе-
повторение реакции приводит к 1,3-диаминокетонам.
Аналогично получают циклические а-аминокетоны:
NOSO2CeH5
ii
R
О
R = Н, СН3; Z = О, S
См. также Баумгартен (№ 51), Бекман (№ 58), Чепмен (№ 694).
Neber.P. W., Friedolsheim A., Ann., 1926, Bd. 449, S. 109.
House H. 0., Berkowitz W. F., J. Org. Chem., 1963, v. 28, p. 307, 2271.
Brien С. О., Chem. Rev., 1964, v. 64, p. 81.
Baumgarten H. E. e. a., J. Org. Chem., 1966, v. 31, p. 3708
Tamura Y. e. a., «Synthesis», 1973, № 4, p. 215—216.
418. НЕБЕР—БОССЕЛЬ (NEBER — BOSSEL)
Получение 3-оксициинолинов диазотированием солей о-аминомиидальных
кислот, восстановлением солей диазония в о-гидразиноминдальные кислоты с
последующей их циклизацией под действием соляной кислоты:
B0-60%)
R = H, OCH,, Cl
19*
291
В случае а-фенил- или а-бензилзамещенных аминоминдальных кислот
3-оксициннолииы образуются с низкими выходами вследствие циклизации соот-
соответствующих диазосоединеиий:
НО
НО R
NNH2
D0-50%)
См. также Видман — Штёрмер (№ 161), Рихтер (№ 514).
Neber P. W. e. a., Ann., 1929, Bd. 471, S. 113, 127.
Alford E. J., Schofield K-, J. Chem. Soc, 1952, p. 2102.
Baumgarten H. E. e. a., J. Am. Chem. Soc, 1960, v. 82, p. 3977, 4634.
419. НЕНИЦЕСКУ (NENITZESCU)
Восстановительное ацилироваиие циклоалкенов хлорангидридами кислот в
присутствии хлористого алюминия:
сн, сна сна
/ \СН 50—70°С / \-CHCl Н2; -70 °С / \СН.
(НаС)„ и +RCOC1 > (НгС)п | »¦ (Н2С)„ |
\ /СН [А1с1з] \ /-CHCOR < /CHCOR
СН2 СН2 СН2
/г = 1, 2
Реакцию проводят в присутствии соответствующего циклоалкана, который
и является источником водорода в результате катализируемой А1С13 автокон-
автоконденсации, например:
2QH,
С12Н2
В случае циклогептена (/г=3) происходит сужение цикла и образование
производного метилциклогексана. Сужение цикла происходит и при ацилирова-
нии циклогексана и метилциклогексана:
+ RCOC1
~20°С
[А1С13]
-сня
R
При ацилироваиии в этих условиях циклопентанов, фенилциклогексана и
конденсированных насыщенных углеводородов размеры циклов не изменяются.
См. также Фридель—Крафтс (№ 627), Кондаков (№ 317).
Nenitzescu С. D., Cantuniari J. P., Ann., 1934, Bd. 510, S. 269.
Hanuise J., Smolders R., Bull. Soc. chim. France, 1967, p. 2139.
Otvos L. e. a., Acta chim. Acad. Sci. Hung., 1972, v. 71, p. 193.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер. с
англ. М., Издатинлит, 1949, с. 749.
292
420. НЕНИЦЕСКУ (NENITZESCU)
Циклоконденсация 1,4-бензохинонов с эфирами N-монозамещенных Р-амино-
кротоновых кислот в эфиры 5-оксиидол-З-карбоновых кислот при нагревании в
ацетоне:
О
СНСООС2Н5
; нагревание
ОН
—сн
С—СООС2Н5
И
С—СН,
B0-75%)
R =Н, СН3, ОСН3, ОН, Cl, CF3, COOCH3; R' = Alk, C6H5, СвН4СН3, СНаС,Н„
Замещенные хиноны дают смесь продуктов, содержащих соответствующие
заместители в положениях 6 н 7. Соединения, замещенные в положении 4, об-
образуются лишь из хиноиов с сильными электроноакцепторными заместителями
(CF3, COOCH3). При взаимодействии бензохиноиов с ^-аминовинилкетонами об-
образуются 5-окси-З-ацилиндолы.
Циклизация 1,4-бензохинонов с эфирами 1\1,М-диалкиламинокротоновых кис-
кислот приводит к производным бензофурана:
COOR
О
CHCOOR
II
CHNR2
НО
-NR2
О
Продукты реакции в условиях кислотного гидролиза легко отщепляют
3-карбэтоксигруппу.
См. также Бишлер — Мёлау (№ 82).
Nenitzescu С. D., Bull. Soc. chim. Romania, 1929, v. 11, p. 37- Chem. Zbl, 1929,
H. 2, S. 2331.
Гринев А. Н., Ермакова В. Н., Терентьев А. П., ЖОХ, 1962, т. 32, с. 1948.
Sundberg R. J. The Chemsitry of Indoles. London — New York Acad press
1970, p. 171. ' V
293
Пакетт А. Основы современной химии гетероциклических соединений. Пер.
с англ. Под ред В. Г. Яшу некого. М., «Мир», 1971, с 145.
OR, v. 20, р. 337.
421. НЕНИЦЕСКУ (NENITZESCU)
Получение индолов восстановлением 2,р-дииитростиролов с одновременной
циклизацией при обработке железными стружками в уксусной кислоте:
СН=С—NOa
А-
Fe
(СН3СООН)
NH
NHOH
R'
NR'
B0-85%)
R =Н, СН3> ОСОСН3, ОСН3, OCH2CeH5, F, Cl, I; R' = Н, СН,
При каталитическом гидрировании дииитростиролов иад Pd/C в смеси эта-
этанол — уксусная кислота индолы получаются с лучшими выходами.
Исходные дииитростиролы обычно получают конденсацией о-иитробеизаль-
дегидов с нитрометаиом или иитроэтаиом в присутствии оснований, а также
нитрованием Р-нитростиролов.
См. также Веермаи (№ 150), Байер (№ 34).
Nenitzescu С. ?>., Вег., 1925, Bd. 58, S. 1063.
Huebner С. F. e. a., J. Am. Chem. Soc, 1953, v. 75, p. 5887.
Eiden F., Kucklaender U., Arch. Pharm., 1973, Bd. 306, № 6, S. 446—449.
Sundberg R. J. The Chemistry of Indoles. Ed. A. Blomquist. London — New
York, Acad. press, 1970, p. 182.
422. НЕСМЕЯНОВ
Получение ароматических металлооргаиических соединений разложением
двойных солей арилдиазоиия и галогеиида металла действием порошка металла
(диазометод):
М'
[ArNaXlm-MXn > ArmMXn-m
[X = Cl (обычно); М = Hg, Sb, Bi, Sn, Pb, Tl, As; M' = Cu, Zn, Bi
В случае ртутьоргаиических соединений, для которых впервые была открыта
эта реакция, при избытке порошка меди образовавшийся первоначально ArHgX
с хорошим выходом превращается в Ar2Hg:
Си Си
[ArN.Xl.HgX, (СН,С0СНз)>. ArHgX —^ AraHg
* СН3СООСаН5, Н2О и др.
По влиянию иа скорость реакции заместители в ароматическом кольце рас-
располагаются в ряд:
no, < а < н < сн„ < с,н5 < ос,нв
Побочные реакции: замещение диазогруппы иа водород или галоген.
294
Модификации метода
1. Разложеиие борфторидов диазоиия металлами, успешно используемое для
синтеза соединений олова, свинца, таллия, например:
ArNLBR,
Pb
Ar4Pb
Аналогично при разложении некоторых двойных солей происходит арилиро-
вание металла, например:
Sb
[ArN2Cl]2-ZnCl2 > Ar,Sba2
2. Разложение солей арилазокарбоиовых кислот, например:
HgClj
ArN=NCOOK
ArHgCl
Этот вариант дает хорошие результаты в случае соединений ртути, сурьмы
и мышьяка.
См. также Хеллерман — Ньюмеи (№ 648).
Несмеянов А. #., ЖРФХО, 1929, т. 61, с. 1393, 1407.
Reutow О. A., Angew. Chem., 1960, Bd. 72, S. 198.
Методы элемеитоорганической химии. Ртуть. Под ред. А. Н. Несмеииова и
К. А. Кочешкова. М., «Наука», 1965, с. 182.
РИМИОС, т. 3, с. 73.
423. НЕФ (NEF)
Получение альдегидов или кетонов действием минеральных кислот на соли
алифатических иитросоедииеиий:
NaOH»
H2SO4 или НС1
\
ОН
ЧОН
/
• кон
:c-n=o
(80-85%)
Метод позволяет получать алифатические н алициклические кетоны и аль-
альдегиды, содержащие различные функциональные группы, например:
HOCH2(CHOHLCH2NO2
(ROOCCH2CH2JCHNO2 -
h-C4H9SO2(CH2JCHCH3 -
NO2
- НОСИ2(СНОНLСНО
(НООССН2СН2JС=О
h-C4H9SO2(CH2JCCH3
II
о
295
Побочные процессы: образование карбоновых кислот, нитрозирование.
Реакция находит широкое применение, в частности в химии Сахаров.
См. также Соуден—Фишер (№ 551).
Коновалов М. И., ЖРФХО, 1892, т. 23, с. 202.
Nef J. U., Ann., 1894, Bd. 280, S. 263.
Noland W. E., Chem. Rev., 1955, v. 55, p. 137.
Shamtna M., Rodriguez H. R., «Tetrahedron», 1968, v. 24, p. 6583.
Deswarte S., Bull. Soc. chim. France, 1969, p. 522.
Perry M. В., Daoust V., Can. J. Chem., 1973, v. 51, № 18, p. 3039—3043.
424. НЕФ (NEF)
Получение ацетиленовых спиртов присоединением ацетиленндов металлов
к кетонам:
Y=O + М—CsCH
(эфнр)*
:-с=сн
(ДО 90%)
M = Li, Na, К. Са
* NH3 (жида.)
В реакцию вступают также а,|}-непредельные кетоны (беизальацетон, фур-
фуральацетон и др.). Следы влаги существенно снижают выход продукта.
См. также Арене—ван Дорп (№ 24), Джойс — Уидон (№ 249), Иихоффен
(№ 274), Реппе (№ 506), Фаворский — Бабаян (№ 595).
Nef J. U., Ann., 1899, Bd. 308, S. 281.
Hurd С. D., McPhee W. D., J. Am. Chem. Soc, 1947, v. 69, p. 239.
Физер, т. 1, с. 79.
425. НИМЕНТОВСКИЙ (NIEMENTOWSKI)
Получение 4-кетохиназолинов циклоконденсацией антраниловых кислот
с амидами при нагревании:
-С00Н
DX.
N
E0-70%)
R = Н, Alk, Ar
* 200 °С (для получения соединений нафталинового ряда)
Прн получении продуктов, замещенных в бензольном ядре, ограничением
метода является возможность декарбоксилирования исходных антраниловых
296
кислот, протекающего при сравнительно низких температурах. В этом случае
используют метиловые эфиры антраниловых кислот.
Существуют разнообразные модификации реакции: использование о-ацил-
аминобензойных кислот, замена амидов амидинами и др., например:
См. также Ниментовский (№ 426), Бншлер (№ 80).
Niementowski S., J. prakt. Chem., 1895, Bd. 51, S. 564.
Endicott M. M. e. a., J. Am. Chem. Soc, 1946, v. 68, p. 1299.
Mehta H. J., Patel B. M., Patel S. R., J. Indian Chem. Soc, 1972, v. 49,
p. 407.
Advances in Heterocyclic Chemistry. Ed. Katritzky A. P. v. 1, New York—Lon-
York—London, Acad. press, 1963, p. 291.
Эльдерфильд, т. 6, с. 273.
426. НИМЕНТОВСКИЙ (NIEMENTOWSKI)
Получение 4-оксихинолинов циклоконденсацией антраниловой кислоты с
карбонильными соединениями, содержащими метиленовую группу:
ОН
соон
+
CH2R' 130-150 °С
I >
COR
N
R'
R
R = H, Ar; R'=H, Alk
Выходы 4-окснхннолинов, как правило, невысоки. При R=H этот процесс
протекает лишь для высших альдегидов, так как низшие альдегиды образуют
8-карбоксихинолины (см. Дёбнер — Миллер, № 246). Антраниловая кислота мо-
может быть успешно заменена ее эфирами, например:
:оос2н5
,-С
+ С,Н,-С(ОС2Н6J
NH2
297
Если в антраниловой кислоте занято opro-положение к NH2-rpynne, то кон-
конденсация с ацетоуксусиым эфиром также приводит к 4-оксихинолинам:
соон СНасоос2н5
СОСН3
СН3О
В случае незамещенной аитраннловой кислоты конденсация с ацетоуксусным
эфиром приводит к производным 2-оксихииолииа (см. Киорр, № 309).
См. также Комб (№ 315), Кэмпс (№ 348), Нимеитовский (№ 426), Пфит-
цингер (№ 481), Скрауп (№ 543), Фридлендер (№ 628).
Niementowski S., Вег., 1894, Bd. 27, S. 1394; 1905, Bd. 38, S. 2044; 1907,
Bd. 40, S. 4285.
Manske R. H., Chem. Rev., 1942, v. 30, p. 127.
Эльдерфильд, т. 4, с. 42; т. 7, с. 169.
427. НИРЕНШТАЙН (NIERENSTEIN)
Получение алифатических или жнриоароматических галогенметилкетонов из
галогенапгидридов кислот и диазометаиа*:
RC-X + CH2=N=N
25 °С
(эфир или беизол)
О
- + +НХ + \
RC— CH-N=N >- RC-CH2№sN X~
A A J
RC—СН2Х
I
О
Прн обратном порядке прибавления реагентов (RCOX к раствору CHjNj)
образуются диазокетоны (см. Аридт— Айстерт, № 25).
Побочный процесс, который может стать основной реакцней в случае мало-
малоактивных RCOX, — образование дигалогендиоксанов:
RCOX + CH2N2 •
т/
о
Clibbens D., Nierenstein M., J. Chem. Soc, 1915, v. 107, p. 1491.
Nierenstein M. e. a., J. Am. Chem. Soc, 1924, v. 46, p. 2551.
Lewis H. H. e. a., J. Am. Chem. Soc, 1925, v. 47, p. 1728.
Кнунянц И. Л. и др. Изв. АН СССР. ОХН, 1956, с. 377.
¦Называют также реакцией Клиббеиса (Clibbens) — Ниреиштайна.
298
428. НОРМАН (NORMANT)
Получение алкен-1-илмагнийгалогеиидов (реактивов Нормана) при действии
магния на алкен-1-илгалогениды в тетрагидрофураие:
Mg; 40-50 °C
(тетрагидрофуран)*
)C=C-MgX
G0-90%)
X = С1, Вг
¦ 2-Метилтетрагидрофуран, тетрагидропираи, (С2Н5ОСН2J, (С4Н9ОСН2J
В случае CHj=CHX выходы достигают 95—98%. Реактивы Нормана ие
уступают по реакционной способности остальным реактивам Гриньяра и широко
используются для получения различных непредельных соединений: диенов, кето-
иов, спиртов, а-аминоспиртов:
CH2=CHMgBr + ВгСН2СН=СН2 ^ СН2=СНСН2СН=СН2
;C=C-MgBr + (RCOJO
CH2=CHMgBr + RCOR'
H2C CH—CH3
0
R'CH=CHMgX -
COR
F0-78%)
CH2=CHC(OH)RR'
F0-85%)
C—CH2CH(OH)CH3
I
F0-76%)
>- (C2H5JNCHCHCH=CHR'
I I I
R R OH
G0-90%)
Вииилирование с помощью реактивов Нормана применяют также для син-
синтеза непредельных альдегидов, тетрагидрофураиов, тетрагидропиранов, акрило-
акриловых кислот, и элемеитоорганических соединений, содержащих Sn, Qe, Si, P,
As, Sb.
См. также Гриньяр (№ 219), Реппе (№ 502), Хершберг (№ 657).
Normant H., С. г., 1954, v. 239, р. 1510.
Иоффе С, Усп. химии, 1958, т. 27, с. 1010.
Норман Г., Усп. орг. химии, 1964, т. 2, с. 5.
429. НОРРИШ (NORRISH)
Фотохимическое расщепление карбонильных соединений с последующим
превращением образовавшихся свободных радикалов по типу I или II.
299
Тип I* (для циклоалканонов в газовой фазе) •— декарбоиилироваиие ацил-
бирадикала и образование циклоалкаиа или алкенов:
(СН2)„
/ ч ftv
GHS >¦ [H2C(CH2)nCH2CO -Z?-
co
H2C CH2
(СН2)„
• [Н2С(СН2)„СН2] -
СН2=СН(СН2)„_3СН3 + СН2=СН2
Тип П** (в жидкой фазе)—переход у-в°Д°Р°Дного атома к кислороду с
образованием 1,4-бирадикала и «фотоэлимииирование», приводящее к олефииу
и еиолу, или циклизация бирадикала в производиое циклобутаиа:
Н
О Сч
II I
R-C СН2
¦R'
/IV
Н
•О
R'
I
R—С
Н2
н
оХ с
R-C I
?
R =
н2
—
Н, Alk, Ar;
OF
[
R-C=CH2 + CH2=
НО
1
R-C-
н2с-
R', R
R'
|
-C-R"
¦
-CH2
" = Alk
\R«
В некоторых случаях, например при фотолизе изовалериаиового альдегида
(в парах), наблюдаются одновременно оба типа превращения:
тин I D7%)
hv
(СН3JСНСН2СНО
)
» (СН3JСНСН3
тип II E3%)
*¦ CHa=CHCHs + CH8CHO
сн4
Norrish R. G. W., Trans. Farad. Soc, 1931, v. 27, p. 378.
Dalton J. С e. a., J. Am. Chem. Soc, 1971, v. 93, № 26, p. 7213—7221.
Lewis F. D., Hillard T. A., J. Am. Chem. Soc, 1972, v. 94, № 11, p. 3852—3858.
¦Называют также «а-распадом» или фрагментацией по Норришу первого
типа.
¦¦Называют также фрагментацией по Норришу второго типа.
300
Bishop R., J. Chem. Soc. Chem. Comm., 1972, № 23, p. 1288—1289.
Kan R. O. Organic photochemistry. New York — London, McGrow-Hill, 1966,
p. 71—93.
430. НЬЮЛЕНД (NIEUWLAND)
Получение а-ацетоксикетоиов ацетилироваиием ацетиленовых спиртов под
действием смеси уксусной кислоты, уксусного ангидрида и эфирата трехфторн-
стого бора в присутствии окиси ртути:
ОСОСН3
СН3СООН; (СН3СОJО '
[BF3; HgO]
ОСОСН3~
XI—С==СН2
ососн3
V
он
'С—С=СН„
СНзСООН
—н2о
Н2О
-СОСН3
•сосн3
Реакция идет и в отсутствие окиси ртути. Благодаря мягким условиям ме-
метод успешно применяют, например, в ряду стероидов для ацетилирования мало-
реакциоииоспособиых оксигрупп.
См. также Кучеров (№ 347).
Nieuwland J. A. e. a., J. Am. Chem. Soc, 1933, v. 55, p. 2858; 1934, v. 56,
p. 1130.
Shoppee С W., Prins D. A., Helv. chim. acta, 1943, Bd. 26, S. 203.
Baer H. H., Kienzle F., Rajabalee F., Can. J. Chem., 1968, v. 46, p. 80.
Топчиев А. В., Завгородний С. В., Паушкин Я. М- Фтористый бор и его со-
соединения как катализаторы в органической химии. М., Изд. АН СССР, 1956,
с 256, 319.
431. НЬЮМЕН —КУОРТ (NEWMAN — KWART)
Термическая перегруппировка О-арилтиокарбаматов в S-арилтнокарбаматы:
-400 °С; N2
ArO-C-NRa
(инертн. растворитель)*
Без растворителя
ArS-C-NR2
II
О
(-70-95%)
Щелочной гидролиз S-арилтиокарбаматов приводит к соответствующим тио-
лам с количественными выходами. Для некоторых арилтиолов это единственный
способ получения.
Реакцию используют как одну из стадий восстановления фенолов, для кото-
которых непригодно прямое гидрирование:
АгОН
COS;
(C5H5N)
ArS—CON(C2H6J
ArO-CSN(C2H5J
КОН; нагревание
~400°C;N2
(C2H5OH)
ArSH
H2
ArH
301
См. также Шёнберг (№ 707).
Newman M S J. Org. Chem., 1966, v. 31, p. 3980.
Kwart H., Evans E. R., J. Org. Chem., 1966, v. 31, p. 410.
Relies Howard M., Pizzoloto Giacomo, J. Org. Chem., 1968, v. 33, p. 2249.
432. ОВЕРБЕРГЕР —ЛОМБАРДИНО
(OVERBERGER— LOMBARDINO)
CeH5CH2-N-CH2CeH5 j
~ r
L
Превращение дибензилнитрозамина в дибензил при действии гидросульфита
натрия:
" CeH5CH2—N—СН2С6Н5
NO L NHOH
> C6H5CHa-N-CHaCeH5'j > С„Н5СН2-С
G7%)
• Li в NH3; ** эфир—диоксан
Аналогично реагирует Ы-нитрозо-2,6-дифенилпиперидин:
N0
E5-60%)
Бензилфенил-, бензилалкил- или диалкилнитрозоамины восстанавливаются в
условних реакции в гидразины, например:
CsH5CH2N(NO)CeH5 > CeH5C
Overberger G. G., Lombardino I. G., Hiskey R. G., J. Am. Chem. Soc, 1957,
v. 79, p. 6430; 1958, v. 80, p. 3009.
Abramovith R. A., Devis B. A., Chem. Rev., 1964, v. 64, p. 149.
Овербергер Ч. Дж., Анселм Ж.-П., Ломбардино Дж. Г. Органические со-
соединения со связями азот-азот. Пер. с англ. Под ред. Б. В. Иоффе. Л., «Химия»,
1970, с. 104.
433. ОДДО (ODDO)
Ацилирование пиррола (или индола) через его галогенмагниевые производ-
производные хлорангидридами кислот:
CH3MgX f~\
(эфир)
COR
N-MgX
NH
E0-80%)
R=CH3> С2Н5, С3Н7, СвН5, СН2СвН5, -\/- ~\/
S О
302
В случае индола ацнльный заместитель вступает в положение 3. Большей
реакционной способностью обладают хлорангидриды ароматических кислот.
Метод довольно широко используетси при синтезе индолнлкетокарбоновых
кислот с последующим восстановлением в нндолилалканкарбоновые кислоты.
См. также Блэз (№ 87), Гнлмен — Нелсон (№ 200), Гогт (№ 202).
Oddo В., Вег., 1910, Bd. 43, S. 1012.
Oddo В., Gazz. chim. ital., 1910, v. 40, Pt. 2, p. 353.
Buu-Hoi N. P., Hoan N., Rec. trav. chim., 1949, v. 68, p. 11.
Кост А. H. и др., ЖОХ, 1964, т. 34, с. 2989.
Методы элементоорганнческой химии. Магний, бериллий, кальций, стронций,
барий. Под ред. А. Н. Несмеянова и К. А. Кочешкова. М., «Наука», 1968, с. 429.
434. ОЛЕ (OHLE)
Расщепление гексоз по связи Сз—С4 путем конденсации нх с о-фениленди-
амином и кипячения образующихся хииоксалинов с избытком фенилгидразина:
СН2ОН
U
N
СНОН H2NC«HiNH2; нагревание
снон
снон
СН2ОН
N ХСНОН
СНОН
СНОН
СНаОН
; нагревание
-ОН
CH=NNHCeH5
+ СНОН
¦CH2-N=NCeH5 lHiQU
* CeH5NH2
Ohle H., Вег., 1934, Bd. 67, S. 155.
О hie H., Hielscher M., Noetzel G., Ber., 1943, Bd. 76, S. 1051.
Morton D., Miller M. J., J. Org. Chem., 1965, v. 30, p. 2457.
Pigtnan W. W. The Carbohydrates. New York, Acad. press, 1957, p. 414.
435. ОППЕНАУЭР (OPPENAUER)
Окисление вторичных спиртов в кетоны действием смеси кетона с алкоголя-
том алюминия:
гг> А1(ОИ')з: нагревание \ ^т.,-.,,
CO »~ С=О + R.CHOH
(CeHe)* /
/
E0-90%)
RaCO = ацетон, циклогексанон, бензохннон, метилэтилкетон;
R' = mpem-CtH9, изо-С3Н7> СвН6
* СвН6СН3,
Реакция обратима; она является процессом, обратным восстановлению по
Меервейну — Понндорфу — Верлею (см. № 389).
Первичные спирты, как правило, не окисляются, но а,|3-непредельные пер-
первичные спирты могут быть превращены в альдегиды через алкоголяты алюминия
с последующим действием коричного альдегида:
RCH=CHCH2OH
С6Н5СН=СНСНО
(RCH=CHCH2OKA1 *- RCH=CHCHO
В случае алициклических спиртов используют анисовый альдегид.
Побочные процессы: альдольная конденсация н перемещение С = С-связи.
Благодаря мягким условиям и селективности реакция широко применяется
для синтеза стероидов, гормонов, алкалоидов, терпенов.
См. также Веттштайн (№ 157), Муро — Миньонак (№ 410), Пфицнер —
Моффэтт (№ 482).
Oppenauer R. V., Rec. trav. chim., 1937, v. 65, p. 137.
Warnhoff E. W., Reynolds-Warnhoff P., J. Org. Chem., 1963, v. 28, p. 1431.
Houben-Weyl, Bd. 4, S. 11, 85, 121.
OP, т. 6, с 235; СОП, т. З, с. 486.
436. ОРТОЛ ЕВА—КИНГ (ORTOLEVA —KING)
N-Кетоалкилирование пиридина действием метилкетонов и иода с образова-
образованием солей пиридиния*:
12; 50—100 °С + // ^
- R-C—СН3 *¦ R—С—СН2—N/7 ^ Г
N
О
О
(колич.)
В реакцию вступают алифатические, ароматические, гетероциклические
и <х,Р-непредельные метилкетоны. Аналогично реагируют соединения, содержа-
содержащие реакционноспособную метиленовую или метальную группы, 2,4-динитрото-
луол и др. Вместо пиридина могут быть использованы пиколин, хинолин, изохи-
нолин, никотинамид и др. Иногда иод может быть заменен бромом (при
20 °С).
Реакция находит широкое применение в органическом синтезе для получе-
получения карбоновых кислот (Крёнке—Кинг) и гетероциклических систем:
RCOCH,
[RCOCH2NC5H5] Г
NaOH
(водн. q>H5OH)
RCOOH
F0-80%)
СН« Is; изохинолин
LiAlH4
н
F5%)
¦Называют также реакцией Кинга (King).
304
См. также Чичибабин (№ 699).
Ortoleva G., Gazz. chim. ital., 1899, v. 29, № 1, p. 503; 1900, v. 30, № 1,
p. 509.
King L. C, J. Am. Chem. Soc, 1944, v. 66, p. 894, 1612.
Krohnke F., Angew. Chem., 1963, Bd. 75, S. 189.
Hamer J., Macaluso A., Chem. Rev., 1964, v. 64, p. 481.
Салдабол Н. О., Зелигман Л. Л., Гиллер С. А., «Химия гетероциклических
соединений», 1971, с. 860.
Yamazaki Motoyoshi e. a., Chem. Pharm., Bull., 1973, v. 23, № 4, p. 712—720.
437. OPTOH (ORTON)
Перегруппировка N-галоген-М-ацилариламинов в о- и я-галогенариламиды
под действием кислот:
X—NCOR'
I
нх
NHCOR'
(лед. СН3СООН)*
NHCOR'
2R
Х2
NHCOR'
i
* Н2О, водн. СНдСООН
В образующейся смеси преобладает «ара-изомер. Перегруппировка идет и
для производных нафталина.
Перегруппировка может протекать в неводных средах под действием
С1СН2СООН, СвН5СН2СООН, о- или ^-O2NCeH4COOH no схеме:
CeH5NXCOR + R'COOH > [CeH5NHCOR + R'COOX] >
> XCeH4NHCOR + R'COOH
См. также Реверден (№ 498).
Orton К- J- P; Jones W. J., J. Chem. Soc, 1909, v. 95, p. 1456.
Scott J. M. W., Can. J. Chem., 1960, v. 38, p. 2441.
Scott J. M. W., Martin J. G., Can. J. Chem., 1966, v. 44, p. 2901.
Ингольд, с. 488.
438. ОСТРОМЫСЛЕНСКИЙ
Каталитическая конденсация ацетальдегида с этиловым спиртом в бута-
бутадиен-1,3:
360—440 °С
СНз-СНО + СН3—СН2ОН r.,.rt_,.> СН2=СН-СН=СН2
C5%)
[А12Оз]«
* Р (красный), BaCi2, ZrO2/C, Ta2O5/C, сульфаниловая кислота
20—684 305
Аиалогичио реагируют другие карбоиильиые соедииеиия и спирты, например:
СНоСНО + С3Н7ОН -
СН3СОСН3 + С2Н5ОН -
СН3-СН=СН—СН=СНа
Реакцию использовали в США для промышленного получения бутадиена из
спирта (катализатор Та2О5/С).
См. также Лебедев (№ 353), Реппе (№ 504).
Остромысленский И., ЖРФХО, 1915, т. 47, с. 1494.
Egloff G., Hulla G., Chem. Rev., 1945, v. 36, p. 73.
Houben-Weyl, Bd. 4, № 2, S. 216.
439. ПААЛЬ— KHOPP (PAAL— KNORR)
Замыкание пнррольиого кольца при конденсации у-Днкарбоиильиых соеди-
соединений с аммиаком или первичными аминами*:
RC—CH2—CH2— CR'
II II
О О
NH2R"
150 °С
R, R' = Alk, ОН, СН2СООН, NH2, NHCeH5
Реакцию проводят в запаянной трубке. Ароматические амииы реагируют в
отсутствие растворителя. Вместо аминов могут быть использованы гидроксил-
амин, гидразин или феинлгндразии с образованием соответственно N-окси-,
N-амино- или N-фениламинопирролов.
См. также Гаич (№ 189), Юрьев (№ 745).
Knorr L, Вег., 1885, Bd. 18, S. 299, 1568.
Paal С, Вег., 1885, Bd. 18, S. 367, 2254.
Терентьев А. П., Яновская Л. А., Усп. химии, 1954, т. 23, с. 697.
Baltazzi E., Krimen L. /., Chem. Rev., 1963, v. 63, p. 513.
Haley I. F., Keehn Ph. M., «Tetrahedron Letters», 1973, № 411 p. 4017—4020.
Эльдерфильд, т. 1, с. 244.
440. ПАСКУ (PASCU)
Получение ацилгалогеиоз из полиостью ацилироваииых Сахаров действием
галогенпда титана (IV) в абсолютном хлороформе:
TiX4: 60 °С Н—С—X
RO-C-H
I
CHOR
О -
(СНС1з)
CHOR
О
TiX4; 40 °С X—С—Н
<енс1з>' CHOR°
I
R = СОСНз, СОСвН5; X = CI, Вг
¦Называют также реакцией Киорра и Киорра — Пааля
306
См. также Боннер (№ 99), Земплен — Коритник (№ 266).
Pascu E., Вег., 1928, Bd. 61, S. 1508.
Ohele H., Marecek W., Bourjan W., Ber., 1929, Bd. 62, S. 833.
Bonner W., J. Am. Chem. Soc, 1958, v. 80, p. 3372.
441. ПАССЕРИНИ (PASSERINI)
Получение аиилидов а-оксикислот взаимодействием альдегидов или кетоиов
с ароматическими нзонитрилами и карбоиовыми кислотами с последующим гид-
гидролизом образовавшихся а-ацилоксиаиилидов:
ч —20 °С
NC=O + ArN=C + RCOOH
~ArN=C О
(ииертн. растворитель)
ArN=C О
V
о-
но
ч.
C-R
/
н^
о
/О
,с- с
Н2О; НО"
\NHAr
-> ,С—(
OCOR
| \NHAr
ОН
(-90%)
В реакцию вступают алифатические, ациклические и ароматические карбо-
карбонильные соедииеиня. Ее используют в химии стероидов, в синтезах пептидов
и т. д., например:
C=N—C-COOC2H5 + R"CH2-COOH
ГСН,—С—O-C—С—NH-C-
СООС2Н5
о
R' О
См. также Уги (№ 581).
Passesrini М, Gazz. chim. ital., 1921, v. 51, p. 126; С. А., 1922, v. 16, p. 555, 556.
Baker R. H., Linn L. E., J. Am. Chem. Soc, 1948, v. 70, p. 3721.
Baker R H., Stanonis D., J. Am. Chem. Soc, 1951, v. 73, p. 699.
Ugi I., Offermann K-, Chem. Ber., 1964, Bd. 97, S. 2276, 2996.
Hagedorn I., Eholzer U., Chem. Ber., 1965, Bd. 98, S. 936.
442. ПАТТЕРНО—БЮХИ (PATERNO — BUCHI)
Фотохимическое цнклопрнсоедннеиие альдегидов или кетоиов к олефииам
с образованием оксетанов:
ftv
чс=о + с=с -
s 'У \ (бензол илн гекеаи)
О—
20"
307
В реакцию вступают алифатические и ароматические альдегиды или кетоиы,
а также хиионы (например, хлораиил). В качестве олефииовой компоненты ис-
используют различные олефииы, содержащие функциональные группы, циклоалке-
ны, ароматические гетероциклы и кетеиимииы, например:
о-
CF3CHO + CF3CF=CFa >
(CeH5)aC=
=0 + О
о
о
"О
~~р с„н5
свн5
о
о
R'
(CH3JC=C=N-C(CH3J + RCR'
сг
I II
N О
R-
CN
R'
С1 С1
CI CI
CI CI
CI
ftv
Аналогично реагируют тиокетоиы, образуя иестойкие тиетаиы:
Av f(CeH5)aC-S 1
(CeH5JC=S + RCH=CHR' *- II *¦
(циклогексан) [ RHC-CHR'J
>¦ RCH=C(CeH5J + R'CH=S
См. также Шёиберг (№ 706).
Paterno E., Chieffi G., Gazz. chim. ital., 1909, v. 39, p. 341.
Buchi G., Inman С G., Lipinski E. S., J. Am. Chem. Soc, 1954, v. 76, p. 4327.
Yang N. C, Loeschen R-, Mitchell D., J. Am. Chem. Soc, 1967, v. 89, p. 5465.
Turro N. J., Wnede P. A., J. Am. Chem. Soc, 1970, v. 92, p. 320.
Arnold D. R. In: Advances in Photochemistry. V. 6. New York — London, In-
terscience publ., 1968, p. 301.
443. ПЕЙН — СМИТ (PAYNE—SMITH С W.)
Окисление циклоалканонов перекисью водорода в циклоалкаикарбоиовые
кислоты, сопровождающееся сужеиием цикла:
(СН2)„
Н2О2
[SeO2]; (mp«m-C4H3OH)
О
0, 1, 2
соон
B3—35%)
308
Аналогично окисляются пергидроиидаиоиы и декалоиы, давая смесь карбо-
иовых кислот с цис- и гракс-коифигурацией:
См. также Делепии (№ 240).
Payne G. P., Smith С. W., J. Org. Chem., 1957, v. 22, p. 1680.
Granger R., Girard J. P., Boussinesg J., С. г., 1966, v. 263, p. 1317; 1967, v. 265,
p. 578.
444. ПЕЛЛИЦЦАРИ (PELLIZZARI)
Получение 1,2,4-триазолов термической циклокоидеисацией гидразидов кис-
кислот с амидами:
/R
200—290 °С '
RCONHNH2 + R'CONH2 >- R'~"\ /"
NH
R, R' = H, Alk, CeHs
В реакцию вступают также замещеииые гидразиды. Возможная миграция
ацильной группы между амидом и гидразидом при температуре выше 210 "С
может привести к смеси изомериых триазолов, например:
/СН,
/СвН5
N
CeH5NHNHCOCH3 + CeH5CONH2
NCeH5
NCeH5
Вместо амидов можно использовать амидииы или хлорангидрид карбамиио-
вой кислоты:
NC—Н2СЧ
\-NCeH5
NCCH2CONHNH2 + C6H5N=CHNHCeH5 > N^ \
N
О
RCONHNHCeHs + HaNCOCl
NCONHa
N
Побочная реакция — дегидратация амидов в нитрилы.
См. также Айихори— Брукнер (№ 7), Курцер (№ 344).
Pellizzari G., Gaz. chim. ital., 1911, v. 41, p. 11, 20.
Atkinson M. R., Polya J. В., J. Chem. Soc, 1952, p. 3419.
Bird С W., Wong С. К-, «Tetrahedron. Letters», 1974, № 14, p. 1251.
Эльдерфильд, т. 7, с. 335.
309
445. ПЕЛУЗ (PELOUZE)
Получение алифатических нитрилов алкилироваиием цианидов щелочных
металлов диалкилсульфатами в водиом растворе:
KCN + (ROJSO2 > RCN
Вместо алкилсульфаюв можно использовать алкилфосфаты.
Реакция является препаративным способом получения низших нитрилов.
При высокой температуре реагируют обе алкильиые группы сульфата. Побочные
продукты — изоиитрилы, которые можно легко удалить кислотным гидро-
См. также Кольбе (№ 312).
лизом.
Pelouze J., Ann., 1834, Bd. 10, S. 249.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 192.
Houben-Weyl, Bd. 8, S. 306.
446. ПЕРКИН (PERKIN)
Получение коричных кислот конденсацией ароматических альдегидов с аи-
гидридами карбоиовых кислот в присутствии осиоваиий:
170—180 °С
ArCHO + (R'CH2COJO [
Ar—CH—CH—COOCOCH2R'"|
ОН R' J
ArCH=C— COOH
J R'
E5-80%)
Ar = CeH4R, где R = Н, Alk, NO2, CI, COOC2H5) CN; R'=H, Alk
• K2CO3, R^N
Реакционная способность кислотной компоненты определяется кислотностью
«-метиленовой группы. В реакцию вступают различные ароматические и гетеро-
гетероциклические альдегиды (фурфурол, 2-тиофенальдегид), коричный альдегид. Вве-
Введение электроиоакцепториого заместителя в молекулу альдегида существенно
облегчает реакцию. При R = Alk выходы незначительны, а при R = NR2 реакция
не идет. Алифатические альдегиды реагируют очеиь плохо.
Модификация Ольялоро (Oglialoro) — использование смеси ArCH2COONa+
+ (СНзСОJО в качестве кислотной компоненты — препаративный способ синтеза
а-арилкоричиых кислот:
(СН3СОJО
АгСНО + Ar'CH2COONa > АгСН=С—СООН
Модификация Габриеля (Gabriel) — использование фталевого ангидрида
вместо альдегида:
RC—СООН
со
\ RCH2COOK
^О + (RCH2COJO »-
СО
\
:0
:о
310
Модификация Фиттига (Fittig) — синтез паракоиовых кислот конденсацией
альдегидов с янтарным ангидридом:
СО СО
R-HC
он н2с
н-соон
I I
о сн2
/
R = Alk, Ar
Паракоиовые кислоты легко превращаются в Рд>-непредельиые кислоты.
См. также Дёбиер (№ 244), Кляйзеи (№ 299), Кнёвеиагель (№ 305), Пшорр
(№ 483).
Perkin W. #., J. Chem. Soc, 1868, v. 21, p. 53, 181.
Leake P. H., Chem. Rev., 1956, v. 56, p. 27.
Ошкая В. П., Ангидридная конденсация. Рига, «Зииатие», 1973, 204 с.
El-Abbady A. M. е. a., Rev. Roum. Chim., 1974, v. 19, p. 79—85.
OP, т. 1, с 267; СОП, т. З, с. 455.
447. ПЕРКИН (PERKIN)
Получение алициклических соединений алкилироваиием |3-дикарбоиильиых
соедииений дигалогеиалкаиами в присутствии алкоголята:
COOR'
R'ONa I
RCOCH2COOR' + ХСН2(СН2)„СН2Х >- RCOCH-CH2(CH2)AtCH2X >¦
COOR'
v RCO-C—CH2 —-*¦ RCO-HC—CH2
, , -co2 ( i
Н2С-(СН2)„ Н,С~(СНа)„
« = 0 — 4; X=C1, Br, I; R = Alk; R' = Alk, OAlk
В реакцию вступают различные дигалогеи- и дикарбонильиые соединения,
а также р-кетоиитрилы, например:
О( +СНг(СООС2Н5J > О'
\сн2сн21 ^—' ncooc2h5
(СНг)„СН(СООС2Н5J
| + Br(CH2)nBr
СН(СООС2Н5J
(НаС)„-СН—СООС2Н»
С2Н5ООС—НС— (СН2)„
См. также Фройид (№ 634).
Perkin W. Н., Вег., 1883, Bd. 16, S. 1793; J. Chem. Soc, 1885, v. 47, p. 801;
1929, p. 1347.
Rice L. .11, Grogan С. Н., J. Org. Chem., 1961, v. 26, p. 54.
311
Henecka H. Chemie der Beta-Dicarbonylverbindungen. Berlin, Springer, 1950,
СОП, т. З, с 490.
448. ПЕРКИН (PERKIN)
Сужение пиранового кольца в кумаринах при последовательном действии
брома и щелочи с образованием соответствующих карбоксипроизводных бенз-
фуранов:
= H, OCH3> OC2H5, O(CH2KOH, C(COOCSH5JC2H5> COOH;
R' = H, OH, OCH3> CH3t NO2
* CH3ONa + CH8OH, Na2CO3; ** H2O
Аналогично реагируют 3-хлор- и 3-метоксикумарины:
СООС2Н5
Н(К ,. 1 XI НО
СН,О'
о
КОН; нагревание
(СН3ОН)
СН,0
СООН
/—СООН
о
При наличии в пирановом кольце аминогруппы реакция не идет.
Продукты реакции легко декарбоксилируются в соответствующие бензфу-
раны:
R R
\-COOH
О
V
/
О
См. также Баллах (№ 146).
Perkin W. Н., J. Chem. Soc., 1870, v. 23, p. 368; 1871, v. 24, p. 37.
Halton G. W., Parker G., Robertson A., J. Chem. Soc, 1949, p. 2049.
Newman M. S., Dalton С. К-, J. Org. Chem., 1965, v. 30, p. 4126.
312
449. ПЕРКОВ (PERKOW)
Образование диалкилвинилфосфатов при конденсации триалкилфосфитов
с а-галогенкарбонильными соединениями (фосфонат-фосфатная перегруппи-
перегруппировка) :
(roJp-op' - -с-с;
О X
о
(roJp-c-cC
r'o ' х
о
(ro),p— о-с=
-10-г + 160 °С
r'x
R,R'=AlK,C6H5,C6H,CH3,CH2CfiH.; X = Cl,Br,I
* Инертные растворители, спирты, СН3СООП, без растворителя
Реакция является общей для соединений трехвалентного фосфора, содержа-
содержащих алкоксигруппу. При R=5^=R' в виде алкилгалогенида отщепляется младший
радикал. Продукты реакции обычно являются смесью цис- и гракс-изомеров.
Реакционная способность эфиров кислот трехвалентного фосфора уменьша-
уменьшается в ряду:
R2POR > (R2NJPOR > RP(ORJ > R2NP(ORJ > (ROKP » (ROJPF
В реакцию вступают разнообразные а-галогенкарбонильные соединения, в
том числе некоторые производные а-галогенкарбоновых кислот и их тиоаналоги,
например:
:hs-
С2Н5-С—СН2—О—Р + СС13СООСН3
ч:но/
150 °С
с2н5—с—сн2—о—р—о—c=cci,
\ II 1
СН2С1 О ОСН3
В случае а-галогенкетонов реакция Перкова сопровождается перегруппи-
перегруппировкой Арбузова (см. № 22). Тенденция к протеканию реакции Перкова усили-
усиливается в ряду I < Вг < С1, а также при увеличении числа а-атомов гало-
галогена, использовании растворителей и снижении температуры проведения ре-
реакции.
Перегруппировка Арбузова не происходит в случае а-галогенальдегидов
и протекает лишь в малой степени при реакциях фосфинитов и фосфонитов.
313
Реакция применяется в промышленности для получения некоторых инсек-
инсектицидов.
См. также Аллеи (№ 12).
Perkow W., Ullerich K-, Meyer F., Naturwiss., 1952, Bd. 39, S. 353.
Lichtenthaler F. W., Chem. Rev., 1961, v. 61, p. 608.
Borowitz I. J. e. a., J. Am. Chem. Soc, 1972, v. 94, p. 1623.
Freiberg J., Seeboth H., J. prakt. Chem., 1974, Bd. 316, № 4, S. 545—549.
Хадсон Р. Структура и механизм реакций фосфороргаиических соединений.
Пер. с аигл. Под ред. Э. Е. Нифаитьева. М., «Мир», 1967, с. 185.
РИМИОС, т. 16, с. 15.
450. ПЕТРЕНКО-КРИЧЕНКО
Замыкание пиперидинового кольца при конденсации аммиака (или аминов)
с двумя молекулами альдегида и эфиром ацетоидикарбоиовой кислоты:
О
RNH2 + 2R'CHO + R"OOCCH2-C—CH2COOR"
R, R' = Alk, Ar
О
R'OOC^Jl/COOR"
K NR K
E0-70%)
В случае СН2О реакция не идет, однако а,о'-диалкилацетоидикарбоиовые
эфиры реагируют с СН2О, давая пиридоиы с хорошими выходами. В качестве
метилеиовой компоненты можно использовать ацетоуксусиый эфир, а также ке-
тоиы (коидеисацию проводят в CHsCOOH).
Реакция послужила основой для синтеза тропииоиа по Робинсону — Шёп-
,фу (см. №520).
См. также Маииих (№ 384).
Petrenko-Kritschenko Р. е. а., Вег., 1906, Bd. 39, S. 1358; 1909 Bd 42,
S. 2020, 3683.
Элъдерфилъд, т. 1, с. 511.
451. ПЕХМАН (PECHMANN)
Получение диазоалкаиов щелочным гидролизом иитрозамииов:
КОН* Г 0-5 °С
RR'CH—N-NO —г———„Т" RR'CHN-NO ч=*
(эфир + вода)*
Н
314
RR'CH—N=NOH >¦ RR'C=N=N
F0-80%)
R, R' =H, Alk, CeH5; R" = COOC2H5> CONH2
* NaOH, C2H5ONa, CH3OK. K2CO,;
*• эфир + «-CSH,OH, эфир + СН3ОН, (СНзJСО
Недостатками метода является неустойчивость N-иитрозоалкилмочевии и ток-
токсичность N-иитрозоалкилуретаиов.
В реакции можно использовать и другие N-иитрозосоедииеиия
[R"=COCH3, COCeH5) SO2CeH4CH3-«, C(CH3JCH2COCHj]. Оии достаточна
устойчивы и нетоксичны, но пока ие получили широкого распространения вслед-
вследствие малой доступности.
Pechmann H., Вег., 189, Bd. 27B, S. 1888.
White Е. Н. е. a., J. Am. Chem., Soc, 1966, v. 88, p. 611.
Дьяконов И. А. Алифатические диазосоедииеиия. Л., Изд. ЛГУ, 1958, с. 9.
СОП, т. 2, с. 174; т. 3, с. 155; т. 4, с. 85; ОР, т. 8, с. 491.
452. ПЕХМАН (PECHMANN)
Циклоприсоедииеиие алифатических диазосоедииеиий к ацетиленам с обра-
образованием пиразолов:
CH=CR + R'CH=N=N
(эфир)
CH=CR
I +
R'CH—№=N
/
R
нагревание // -\
" R' \ /
N NH
(I) (~50%)
R = H, Alk, CHO, COOH, CeH6 и др.; R' = H, Alk, COOCaH6> CeH5
Наличие в ацетиленах электроиоакцепториого заместителя существенно об-
облегчает реакцию. Диацетилеиы могут реагировать как с одной, так и с двумя
молекулами диазосоедииеиия:
CH=C-G=CH + 2CH2N2
HN.
N
NH
N
При R'=5^H превращение пиразолеиииа (I) в пиразолии происходит при тем-
температуре ~80— 160°С.
Соответствующие пиразолы могут быть получены и из дифеиилдиазометаиа,
например:
СН=С-СООСНз + (CSH5JC=N=N >
/СООСН, CeH5X /COOCH,
NH
См. также Бюхиер (№ 135), Киорр (№ 308).
Pechmann H., Вег., 1898, Bd. 31, S. 2950.
Bowden К-, Jones E. R. H., J. Chem. Soc, 1946, p. 953.
Huisgen R., Angew. Chem., 1963, Bd. 75, S. 616.
Грандберг И. И., Кост А. #., Изв. ТСХА, 1967, № 5, с. 210.
Эльдерфильд, т. 5, с. 57.
315
453. ПЕХМАН (PECHMANN)
Получение кумарииов конденсацией фенолов с эфирами р-кетокислот в при-
присутствии кислотных катализаторов*:
•ОН
• CH3—C=C-COOR"
НО R'
*; (C6h5no2)*»
СН3
О
R = Alk, Hal, NO2, ОН и др. R' = Alk, Ar, COOC2H5
* А1С13> ZnCl2, POC13, полифосфорная кислота и др.; ** инертные растворители
В реакцию вступают разнообразные фенолы (гетероциклические, ряда наф-
нафталина, полизамещенные и т. д.). Наличие электронодоиорных заместителей
в жтг-положении существенно облегчает реакцию; opro-заместители, как пра-
правило, затрудняют реакцию; сам фенол мало активен. Кроме различных Р-кето-
эфиров могут быть использованы малеииовая, фумаровая, ацетондикарбоновая
и яблочная кислоты. (Яблочная кислота в условиях реакции разлагается с обра-
образованием формилуксусной кислоты, которая и реагирует далее с фенолом.)
Малоактивные фенолы конденсируются с р-кетоэфирами в присутствии Р2О5
с образованием хромонов (см. Симонис, № 542).
. Модификация Каппе — Циглера (Карре — Ziegler) — использование Р-амино-
кротоиового эфира вместо р-кетоэфиров. Это позволяет получать кумарины с
высокими выходами G0—95%) из соединений, неустойчивых к действию кислот.
Особенно успешно эта модификация используется для синтеза аналогов кумари-
яа, например:
О
HN/'
О CH3
II I
СНСООС2Н5 180 -с HN/N/Ч-
+ II >• ' л
r/^/^noH снз—С—NH2
R'
(I, И)
I. R = CeH5; R' = H
II. R = CH3; R'=COCH3
См. также Аншютц (№ 20), Барджеллини (№ 44), Менцер (№ 396).
Pechmann H., Duisberg С, Вег., 1883, Bd. 16, S. 2119.
Карре Т., Ziegler Е., «Organic Preparations and Procedures», 1969, v. 1,
p. 61.
Зайцев И. А., Шестаева М. М., Загоревский В. А., «Химия гетероцикличе-
гетероциклических соединений», 1970, с. 150.
Kuriakose A. P., Sethna Suresh, J. Indian Chem. Soc, 1972, v. 49, p. 1155—
1159.
Эльдерфильд, т. 2, с. 139; OP, т. 7, с. 7.
316
¦Называют также реакцией Пехмана — Дуйсберга (Duisberg).
454. ПИКТЕ— ГАМС (PICTET — GAMS)
Циклодегидратация р-окси-р-феиилэтиламидов под действием пятиокиси
фосфора с образованием изохинолинов:
СНОН СН
; нагревание
•NH
(С6Н5СН3)
— R
,Ш
ОС
(
R'
Реакция является вариантом синтеза Бишлера — Напиральского (см. № 83).
Диалогично циклизуются соответствующие метоксипроизводные. Классическим
примером этой реакции является синтез папаверина.
При наличии заместителя в а-положении к амидной группе возможна его
миграция и образование Сгзамещенных.
См. также Брукнер (№ 114).
Pictet A., Gams А., Вег., 1909, Bd. 42, S. 2943; 1910, Bd. 43, S. 2384.
Herz W., Tsai L, J. Am. Chem. Soc, 1955, v. 77, p. 3529.
Datta N. L., Wodia M. S., Bindra A. P., J. Indian Chem. Soc, 1971, v. 48,
p. 873.
Эльдерфильд, т. 4, с 274; OP, т. 6, с. 98.
455. ПИКТЕ —ХУБЕРТ (PICTET — HUBERT)
Циклодегидратация о-ациламииобифеиилов под действием хлористого цинка
с образованием фенантридинов:
R' R" R' R"
// \ // \ 250-300 "С; ZnCli fi \ // ^
ROC—NH
?/
(ДО 80%)
R = Alk, Ar
* SnCl2, AICI3 и др.
При R = CHCl2 и СС13 реакция не идет. Скорость реакции зависит от харак-
характера заместителя R': при R'=C1 или NO2 реакция затруднена, a R' =
==NHCOOC2H5 способствует циклизации, что позволят получать разнообразные
фенантридины. Наличие заместителей в кольце, содержащем ациламиногруппу,
не влияет на скорость циклизации.
Модификация Моргана — Уоллса (Morgan — Walls) — использование РОС1з
в C6H5NO2 вместо ZnCl2. Реакция протекает в более мягких условиях и позво-
позволяет получать соединения с функциональными заместителями.
См. также Бишлер — Напиральский (№ 83), Борше—Кеииер (№ 103).
Pictet A., Hubert А., Вег., 1896, Bd. 29, S. 1182.
Morgan G. Т., Walls L. P., J. Chem. Soc, 1931, p. 2447; 1932, p. 2225.
Theobald R. S., Schofield K-, Chem. Rev., 1950, v. 46, p. 175.
Эльдерфильд, т. 4, с 435.
317
456. ПИКТЕ —ШПЕНГЛЕР (PICTET — SPENGLER)
Получение тетрагидроизохинолинов конденсацией альдегидов с E-арилэтил-
а мина ми под действием соляной кислоты:
R"
сн,
HCI; 100 '
NH,
HR
CH
R"
R'
NH
R', R" = ОСН3> ОС2Н5;
R
C0-90%)
R'" = Н, СН3, СООН
В реакции используют главным образом формальдегид, а также ацетальде-
гид, замещенные фенилацетальдегиды, диметилацеталь формальдегида, глиокса-
левую и арилпировиноградные кислоты. В качестве аминной компоненты при-
применяют феннламин, тирозин, амины ряда нафталина, а также аминоалкильные
производные гетероциклических соединений:
NH
Иногда реакцию проводят в условиях, близких к физиологическим (рН 5—6,
25—40 °С), что имеет большое значение для выяснения механизма образования
алкалоидов в растениях.
См. также Манних (№ 384), Бишлер — Напиральский (№ 83), Померанц —
Фрич (№ 469).
Pictet A., Spengler Т., Вег., 1911, Bd. 44, S. 2030.
Szantay С, Kalaus G., Chem. Ber., 1969, Bd. 102, S. 2270.
Kometani Tetsuj, Aoyama Toyohiko, J. Heterocyclic Chem., 1973, v. 10, № 3,
p. 291—295.
Mathison J. W., Solomons W. E., Jones R. #., J. Org. Chem., 1974, v. 39, № 19,
p. 2852—2855.
OP, т. 6, с 177.
457. ПИЛОТИ (PILOTY)
Циклоконденсация замещенных виолуровых кислот с .м-фенилендиамииом
под действием водной щелочи с образованием производных аллоксазина:
О О
N
NaOH; нагревание RN/\^
H.N-^-^^-NRj Or \^ ^Г \^ ^NRi
R = Н, CH3; R' = Н, Alk
318
В случае вторичных и третичных .и-фенилендиаминов образуются производ-
производные изоаллоксазина:
О
R'HN
о
Piloty О., Ann., 1904, Bd. 333, S. 44.
Ganapati К., J. Indian Chem. Soc, 1938, v. 15, p. 77.
King F. E., Acheson R. M., Yorke-Long А. В., J. Chem. Soc, 1948, p. 1926.
458. ПИЛОТИ (PILOTY)
Получение а-хлор- или а-бромнитрозоалканов действием галогенов на окси-
мы альдегидов или кетонов:
Х2; 0—20 °С
(CH3COONa + Н2О)*
/С—N—ОН
к >-
,С—N==0
X = С1, Вг
* НС1 (разб.), C6H6N (водн.), без растворителя
а-Хлорнитрозоалканы легко изомеризуются в хлорангндриды гидроксамовых
кислот, поэтому реакция может служить для получения производных гидрокса-
гидроксамовых кислот, а также а,а-дихлорнитрозоалкаиов:
RCHC1—N=0
RCC1=NOH
С12
RCC18-N=O
Piloty О., Вег., 1898, Bd. 31, S. 454.
Aston J. G., Menard D. F., J. Am. Chem. Soc, 1935, v. 57, p. 1920.
459. ПИЛОТИ —РОБИНСОН (PILOTY — ROBINSON R.)
Внутримолекулярная циклизация азииов в пирролы при нагревании в при-
присутствии кислых катализаторов*:
RCH2 CHaR'"
R'<L ^CR"
~200 °C
N-/
[HCI или ZnCl2]
». О'
// \. D»
\ /
NH
R, R', R", R"' = Alk, CeH6
Процесс идет через стадию образования енгидразииов по схеме, близкой
к схеме реакции Фишера (см. № 611).
Тетрафенилзамещенные азины реагируют с высокими выходами; в случае
алкилзамещеииых азинов выходы низкие вследствие образования пиразолииов.
¦Называют также реакцией Пилоти.
319
Циклизация азина циклогексанона идет легко, например, под действием муравьи-
муравьиной кислоты.
См. также Кнорр (№ 310).
Piloty О., Вег., 1910, Bd. 43, S. 489.
Robinson G. M., Robinson R., J. Chem. Soc., 1918, v. 113, p. 639.
Hollins С The Synthesis of nitrogen ring compounds. London, Benn, 1924,
p. 80.
Robinson R., Chem. Rev., 1963, v. 63, p. 397.
Грандберг И. И., Изв. ТСХА, 1972, № 5, с. 188.
Posvic Н. е. a., J. Org. Chem., 1974, v. 39, № 17, p. 2575—2580.
460. ПИННЕР (PINNER)
Получение амидинов взаимодействием гидрогалогенидов иминоэфиров с ам-
аммиаком или аминами:
ЛЧН-НХ ЛЧН-НХ
RC^ + HNR'R" >- RC^
X = C1, Br; R = Alk,Ar; . R', R" = H, Alk
При избытке первичного амина реакция идет следующим образом:
RC(OR')=NH-HX + 2R"NH2
RC(NHR")=NR'
В реакцию вступают также динитрилы и циангидрины альдегидов и кето-
нов. а-Амииокислоты в этих условиях дают амидинкарбоновые кислоты
R—C( = NH2)NHCHR'COO~. Амидины образуются также при взаимодействии
свободных иминоэфиров с солями аммония.
Исходные гидрогалогениды иминоэфиров получают обычно пропусканием
тока сухого НХ в раствор нитрила в абсолютном спирте (см. Пиннер, № 462).
Pinner A., Klein F., Вег., 1877, Bd. 10, S. 1889; 1878, Bd. 11, S. 4, 1475.
Hunter M. ]., Ludwig M. L, J. Am. Chem. Soc, 1962, v. 84, p. 3491.
Ried W., van der Emden W., Ann., 1963, Bd. 661, S. 76.
СОП, т. 1, с 66; Вейганд-Хильгетаг, с. 462.
461. ПИННЕР (PINNER)
Алкоголиз гидрогалогенидов иминоэфиров с образованием ортоэфиров:
.NH-HX
R-Cf
+ 2ROH
ЧЖ
(абс. ROH)
> R-C(ORK
Аналогично можно получать смешанные ортоэфиры. Продукты находят
применение в синтезе альдегидов по Бодру — Чичибабину (см. № 95).
См. также Пиннер (№ 460, 462).
Pinner А., Вег., 1883, Bd. 16, S. 356.
Roger R., Neilson D. G., Chem. Rev., 1961, v. 61, p. 181.
Gattermann L., Wieland H. Die Praxis des organischen Chemikers. Berlin, Wal-
Walter de Gruyter Co., 1962, p. 127.
Rodd, v. 1, pt. A, p. 614.
320
462. ПИННЕР (PINNER)
Получение гидрогалогеиидов имииоэфиров присоединением спиртов к нитри-
нитрилам под действием галогеноводорода:
НХ;"~0°С ;NH-HX
—C=N + ROH , А > —Cf
(эфир). \QR
Х = С1, Вг; R = Alk, CHgAr
• СНС13, диоксан, CeHe, без растворителя
В случае дииитрилов могут реагировать как одна, так и обе CN-группы, на-
например:
C==NH-HC1
C=NH.HC1
ОС2Н6
В отсутствие растворителя выходы увеличиваются до 75% (исключение со-
составляют ароматические дииитрилы), но сильно возрастает время реакции.
Ацилциаииды и некоторые орто-замещенные ароматические нитрилы в реакцию
не вступают.
Побочные процессы: разложение иминоэфиров при повышении температуры,
образование ортоэфиров при избытке спирта.
Pinner A., Klein F., Вег., 1877, Bd. 10, S. 1889.
Shriner R. L., Neumann F. W., Chem. Rev., 1944, v. 35, p. 354.
Mackenzie C. A. e. a., J. Am. Chem. Soc, 1951, v. 73, p. 4990.
Poupaert J., Bruylants A., Crooy P., «Synthesis», 1972, № 11, p. 622—624.
Rodd.v. 1, pt. A, p. 607.
463. ПИННЕР (PINNER)
Замыкание кольца 1,3,5-триазина при конденсации замещенных беизамиди-
нов с фосгеном:
ОН
,NH ,NH
+ СОС12
АгС
_250„с
( ^С
\NH-C—HN/
II
О
В нафталиновом ряду реакция не идет. Из алифатических амидинов лишь
«рнхлорацетамидии превращается в соответствующий триазии.
21—684
321
Pinner A., Ber., 1890, Bd. 23, S. 2919; 1892, Bd. 25, S. 1414; 1895, Bd. 28,
S. 473.
Rappeport Т., Ber., 1901, Bd. 34, S. 1990.
Schroeder H., Gmndmann C, J. Am. Chem. Soc, 1956, v. 78, p. 2447.
464. ПИРИА (PIRIA)
Восстановительное сульфирование ароматических нитросоединеиий в о- или
n-аминосульфокислоты действием бисульфитов с последующим кислотным гид-
гидролизом:
NO2 NHSO3Na NH2
NaHSOj;
нагревание
(H2O)
Н+; нагревание
>¦ R
SO,H
SO3Na
R = СООН, NO2 и др.
• NH4HSO3
Так же реагируют нитропроизводные конденсированных полициклических
соединений.
Полагают, что восстановление проходит через стадии образования нитрозо-
и оксиаминопроизводных. Наряду с амииосульфокислотами всегда образуется
некоторое количество несульфированного амина:
ArNO2 > ArNHSO3Na ¦ >¦ ArNH2
При наличии в бензольном кольце электроноакцепторных заместителей, а
также в случае конденсированных систем преимущественно образуются сульфо-
кислоты, присутствие СН3-группы способствует образованию несульфированных
аминов. В ряду нафталина и других конденсированных систем возможно ди- и
полисульфирование.
Побочная реакция — образование аминофенолов.
Piria R., Ann., 1851, Bd. 78, S. 31.
Hunter W. H., Sprung M. M., J. Am. Chem. Soc, 1931, v. 53, p. 1432, 1443.
Bunnett J. F., Zahler R. E., Chem. Rev., 1951, v. 49, p. 398.
Vrba Z., Allan Z, Y., Coll. Czech. Chem. Comm., 1968, v. 33, p. 4426.
Джильберт Э. E. Сульфироваиие органических соедииеиий. Пер. с англ. Под
ред. А. И. Гершеиовича. М., «Химия», 1969, с. 158, 364.
465. ПИЩИМУКА
Перегруппировка триалкилтионфосфатов в триалкилтиолфосфаты при на-
нагревании с алкилгалогенидами:
120—180 °С +
(ROKP=S + R'X > [(ROKP-SR'
-RX
(RO)gP— SR'
II
О
R, R' = Alk, QH5
При нагревании выше 130 °C сам тионфосфат может выступать в качестве
алкилирующего средства, вызывая изомеризацию:
140—220 °С
2(ROKP=S
-*¦
2(ROJP-SR
II
О
322
Перегруппировка является общей для всех тионфосфорных соединений, со-
содержащих хотя бы одну алкоксигруппу. Наличие электронодонорных заместите-
заместителей у атома фосфора способствует реакции. В присутствии кислот Льюиса изо-
изомеризация тионфосфатов происходит при ~20°С.
В случае несимметричных триалкилтионфосфатов обычно образуется смесь
изомеров. При перегруппировке диалкиларил- и алкилдиарилтиоифосфатов ми-
мигрирует алкильный остаток:
RO-P
I!
О
/SR
ЧОАг
У диалкилаллилтионфосфатов изомеризация сопровождается аллильной
перегруппировкой:
120—180 °С
(ROJP—O— СН2—CH=CHR >- (ROJP—S—СН—Ш=СН2
II II I
S OR
Pistschimuka P., Ber., 1908, Bd. 41, S. 3854.
Пищимука П., ЖРФХО, 1912, т. 44, с. 1406.
Hilgetag G., Teichmann H., Angew. Chem., 1965, Bd. 77, S. 1001.
Barn A. I., Cadogan I. I., J. Chem. Soc, 1961, p. 5532.
Нифантьев Э. Е. Химия фосфорорганических соединений. М., Изд. МГУ,
1971, с. 172.
466. ПИЩИМУКА
Превращение ароматических аминов в азосоединения под действием селена
(или серы) и меркурацетамида:
Se» + (CH3CONHJHsr
2ArNH* 555^ Ar-N=N-Ar
C5—86%)
= CeH4R, где R = H, CH3, OCH3> NOg> C1,
• S; ** ССЦ, CeH5CH3, циклогексан
Меркурацетамид служит для связывания выделяющегося селеиоводорода
(или сероводорода). Вместо меркурацетамида можно использовать ртутные соли
неорганических или органических кислот, аммиакаты солей ртути и меркурнмиды
различных кислот.
В реакцию легче вступают амины, замещенные в /гара-положеиие; орто-нит-
розамещениые амины не реагируют с селеном и серой. Аминофенолы, а- и
р-нафтиламины, фенилендиамин и бензидин не превращаются в азосоединения,
а в качестве основного продукта реакции дают азины. Использование солей
серебра вместо соединений ртути также приводит к образованию этих продуктов.
Пищимука Р. С. ЖОХ, 1940, т. 10, с. 305, 1951, т. 21, с 1689.
Пищиков И. О., Укр. хим. журн., 1959, т. 25, с. 99.
21'
323
467. ПЛАНШЕ (PLANCHER)
Миграция алкильнои группы в замещениых иидоленинах:
R' R" R' R
N " N
R = Alk, CeH6; R', R" = Н, Alk
Перегруппировка протекает при различных реакциях 2-замещеиных иидо-
лов, например:
•СвН6 + СН31
NH
Н3С СН3 '
>—с„н6
Н3С
HI
-сн.
В случае R'#R" из положения 3 в положение 2 мигрирует низший радикал.
Plancher G., Ber., 1898, Bd. 31, S. 1496; Gazz. chim. ital., 1898, v. 28,
p. 374.
Nakazaki M. e. a.. Bull. Chem. Soc. Japan, 1960, v. 33, p. 466, 472.
Kanaoka Y., Miyashita K., Yonemitsu O., Chem. Comm., 1969, p. 1365.
Эльдерфильд, т. З, с. 76.
468. ПОЛОНОВСКИИ (POLONOWSKI)
Деметилирование арилдиметиламинов обработкой их N-окисей уксусным ан-
ангидридом в спиртовом растворе*!
ArN(CH*>°
ГСН3СОJО*
(сизой)
'
о
ArN(CHs)a
ОСОСН,
Аг.
/N—СН2
Н3С/|
ОСОСН,
—СН2ОСОСН3
-СН2О
Агч
Н2О
—СОСН3 >¦ ArNHCHg
н3с/
* СН3СОС1; ** Н2О
Реакция катализируется основаниями, в роли которых обычно выступает
избыток исходного амина. Побочный процесс — образование о-ацетоксипроиз-
иодиых:
* Названия «реакция Полоновского» и «перегруппировка Полоновского» ис-
используются также в более широком смысле применительно к превращениям
N-окисей под действием аигидридов карбоновых кислот.
324
При проведении реакции в нейтральной среде ацетоксипроизводное полу-
получают в качестве главного продукта.
Реакцию деметилирования особенно успешно используют в ряду гетеро-
гетероциклических аминов.
В случае окисей неароматических аминов наряду с деметилироваиием проис-
происходит окислительное дезаминирование, например:
f\r^\/V(CH3J (сн3соJо
UU4
NCHS
COCHg
+
G0%)
B0%)
При использовании ангидрида трифторуксусной кислоты можно получать
соответствующие кетоны* с выходами 50—60%.
См. также Браун (№ 111), Пуммерер (№ 478).
Polonovski M., Bull. Soc. chim. France, 1927, v. 41, p. 1190.
Huisgen R., Bayerlein F., Heydkamp W., Chem. Ber., 1959, Bd. 92, S. 3223.
Bell S. C, Wei P. H. L., J. Org. Chem., 1965, v. 30, p. 3576.
Cave A. e. a., «Tetrahedron», 1967, v. 23, p. 4681.
Ahond A. e. a., Bull. Soc. chim. France, 1970, p. 2707.
Hayashi Y. e. a., «Tetrahedron Letters», 1974, № 14, p. 1299—1302.
469. ПОМЕРАНЦ— ФРИЧ (POMERANZ — FRITSCH)
Получение изохииолинов конденсацией ароматических альдегидов с амиио-
ацеталем и последующей циклизацией полученных оснований Шиффа под дей-
действием кислот:
+ H2NCH2CH(OC2H5J
сно
СН(ОС2Н5J
I 2 H2SO4; нагревание
R/ -f ^-c^ R'
A0-50%)
R = Н, СН3, ОСН3, ОН, С1, Вг
* H2SO4 + POCI3, полифосфорная кислота + РОС13
Замыкание цикла обычно идет в пара-положение к заместителю в бензоль-
бензольном кольце, однако в некоторых случаях получается смесь 5- и 7-замещенных
изохинолинов. Альдегиды с орто- или пара-заместителями и кетоны образуют
изохинолины с очень низкими выходами или совсем ие вступают в реакцию.
Реакция ие имеет широкого препаративного значения, однако она дает воз-
возможность синтезировать изохинолины с таким расположением заместителей, ко-
которое с трудом достигается другими методами.
Аналогично реагируют альдегиды ряда тиофена и пиррола.
Называют также модификацией реакпии Полоновского.
325
См. также Бишлер — Напиральский (№ 83), Пикте — Шпеиглер (№ 456),
Шлитлер — Мюллер (№712).
Pomeranz С, Monatsh., 1893, Bd. 14, S. 116; 1894, Bd. 15, S. 299; 1897,
Bd. 18, S. 1.
Fritsch P., Ann., 1895, Bd. 286, S. 1; Ber., 1893, Bd. 26, S. 419.
Popp F. ?>., McEwen W. E., Chem. Rev., 1958, v. 58, p. 328.
Wacker O., Fritz #., Helv. chim. acta, 1967, v. 50, p. 2481.
Эльдерфильд, т. 4, с. 279; OP, т. 6, с. 218.
470. ПОНЦИО (PONZIO)
Превращение оксимов ароматических альдегидов или кетонов в арилдинит-
рометаны под действием четырехокиси азота:
N2O4
Ar-O=N0H ——>- Ar—C(NO2J
| (эфир) iv
R R
Ar = CeH4CH,-n, CeH4OCH3-n; R = H, Alk, CeH5, COCH,, СНгОН
Выходы не выше 40% из-за образования побочных продуктов, например:
CeH5CH=N-0 CeHBC=N-O
CeH5CH=NOH >- CeH5CH(NO2J + С„Н5СНО + Г + I I
CeH5CH=N—О CeH5C=N-O
Окснмы алифатических кетонов превращаются в нитрозонитроалканы:
R8C=NOH ¦ *¦ RjC-NO2
NO
Ponzio G., Gazz. chim. ital., 1897, v. 27, p. 171.
Riebsomer J. L, Chem. Rev., 1945, v. 36, p. 183.
Fieser L. F., Doer ing W. E., J. Am. Chem. Soc, 1946, v. 68, p. 2252.
471. ПРЕВО (PREVOST)
траяс-Гидроксилирование олефинов путем присоединения комплекса серебря-
серебряной соли карбоновой кислоты с галогеном (комплекса Симоиинн) и последую-
последующего гидролиза:
\:=С^ + {RCOOAg + Х2}
OCOR
X
нагревание
(инертн. растворитель)
OCOR'
>
ОН
E0-90%)
ОН
/
Х=С1, Br, I; R=C6H5, СН3, «-С3Н7, «-С4Н9
транс-Гидроксилированию подвергаются также ацетилены, диолефины и оле-
фииы, содержащие функциональные группы. В реакции можно использовать
326
серебряные солн дикарбоновых кислот, но наиболее удобен бензоат серебра
вследствие легкости гидролиза дибензоатов в глнколи.
Применение в качестве растворителя ССЦ или СНС1з позволяет остановить
реакцию на стадии образования ацилированного галогенгндрина.
Prevost С, С. г., 1933, v. 196, р. 1129; 1934, v. 197, р. 1661.
Briggs L. И. е. a., J. Chem. Soc, 1962, p. 1850.
Ганстон Ф. Д., Усп. орг. химии, 1963, т. 1, с. 135.
Statesman E. E., Robinson R. A., J. Org. Chem., 1970, v. 35, p. 3532.
Cambe R. С e. a., J. Chem. Soc. Chem. Comm., 1973, № 11, p. 359—360.
OP, т. 9, с 463.
472. ПРЕЙ (PREY)
Образование фенолов при нагревании арилалкнловых эфиров с гидрохлори-
гидрохлоридом пиридина:
C5H5NHC1; 200 °С
ArOR АгОН
G0-90%)
Эфнры многоатомных фенолов также вступают в реакцию. Связь О—Аг не
расщепляется.
Prey V., Ber., 1941, Bd. 74, S. 1219; 1942, Bd. 75, S. 350, 445, 537.
Burwell R. L, Chem. Rev., 1954, v. 54, p. 635.
473. ПРЕЛОГ (PRELOG)
Получение соединении ряда хинуклидина и других азабициклопроизводных
внутримолекулярным алкилнрованием соответствующих галогенаминопроизвод-
ных под действием щелочей:
(CH2)nCH2NH2 (Н2С)„
/ 0,1 н. №ОН /
НС—ГСН,)тВг 777^—*- НС"
(Н2О) \^
СН2
(CH2)m-N
i2
-(CH2)mBr
(СН2)рСН2Вг
C0-80%)
п и р = 2, 3 \тл т. д.: m = 1, 2, 3 и т. д.
Аналогично реагируют иеароматьческие азотсодержащие гетероциклы с ато-
атомом брома в боковой цепи, например:
СН2СН2Вг
NH
NaOH
(эфир)
Азабнциклосоединения могут быть получены также из соответствующих
тригалогенпроизводных и аммиака, но с меньшими выходами.
327
Исходные галогенпроизводные получают из эфиров пнраи-4-карбоиовой кис-
кислоты или бис(этоксиалкил)малоиовых эфиров:
COOCgHB
О
О
СН2ОН
СН2Вг
о
о
ВгСНг-СН[(СНгJВг]г
Вг(СН2)„СНСН2Вг
(СН^Вг
CH-CN
О
CHKCHJ.Brb
о
СгН5О(СН2)„СНСН2ОН
(СН2)тОС2Н5
СгН5О(СН2)„СНСООН
Вг(СН,)„СШН, -
(СН,)тВг
(С
Н2)тОС2Нв
Для превращения СООН-группы в NH2-rpynny используют реакцию Курциу-
са (см. № 345).
См. также Гофман — Лёфлер — Фрайтаг (№ 213), Меншуткии (№ 397).
Clemo G. R., Prelog V., J. Chem. Sot, 1938, p. 400.
Prelog V., Setworth R., Ber., 1939, Bd. 72, S. 1638.
Prelog V., Zalan E., Helv. chim. acta, 1944, v. 27, p. 531.
Эльдерфильд, т. З, с. 311.
474. ПРИЛЕЖАЕВ
Окисление олефинов органическими иадкислотами с образованием а-окисен:
R = СН3, CF3, CeH5, СвН4СООН-о
* СНС13, диоксан, эфир
Алкильные или фенильный заместители при двойной связи значительно об-
облегчают реакцию, наличие сопряженной двойной связи или электроноакцептор-
ных заместителей затрудняют ее.
328
Реакция позволяет получать а-окиси типа
R
НаС C-C=CR'
так как С=С-связь окисляется значительно медленнее, чем связь С=С. При
гидролизе окисей образуются тра«с-а-гликоли. Последние легко могут быть по-
получены также действием НСОООН иа олефины в муравьиной кислоте.
См. также Кори (№321).
Prileschajew N.. Вег., 1909, Bd. 42, S. 4811; ЖРФХО, 1910, т. 42, с. 1387; 1911,
т. 43, с. 609; 1912, т. 44, с. 613.
Payne G. В., J. Org. Chem., 1961, v. 26, p. 250.
Hueckel W., Rotherwoehrer W., Vogt O., Suom. Kemi, 1969, v. 42B, p. 213.
Метелица Д. И., Усп. химии, 1972, т. 41, № 10, с. 1737—1765.
Прилежаева Е. Н. Реакция Прилежаева. Элеитрофильиое окисление. М.,
«Наука», 1974, 332 с.
ОР, т. 7, с. 476.
475. ПРИНС (PRINS)
Присоединение формальдегида к олефинам в присутствии кислых катализа-
катализаторов с образованием 1,3-гликолей и соответствующих циклических ацеталей
формальдегида A,3-диоксанов)* :
Н2О; >70°С
ОН
Н2С-
СН2О; < 70° С \ /
У- -'
СН2
О
* Н3РО4, BF3, ZnCl2
При проведении реакции в соляной или уксусной кислоте образуются соот-
соответственно хлоргидрнны и ацетаты 1,3-гликолей.
Кроме формальдегида могут быть использованы его производные (напри-
(например, диметилацеталь), хлорметиловый эфир, хлорметилалкиловые эфиры, пер-
фторкетоны, хлораль. Другие альдегиды применяют очень редко.
Наиболее легко реагируют третичные и несимметричные олефины (пропилен,
изобутилеи и т. п.), а также диены и стиролы, например:
СвНвСН=СН2 + СН2О
о—
(-88%)
* Называют также реакцией Кривица (Kriewitz) — Прниса.
329
Галогенсодержащие олефины образуют р-оксикислоты:
RCH=CC12 -f СН2О >- НОСН2—CHR—СООН
CFg—CF=CF2 + СН2О > HOCH2-CF(CFS)-COOH
Взаимодействие олефинов с формальдегидом в безводной среде сопровож-
сопровождается аллильной перегруппировкой и приводит к непредельным спиртам:
няс/
С=СН21- СН2О
н3с
¦\
[SnClj]*; (эфир)»*
с—сн,—сн2он
* ZnCl2, SiCl4, AlClg и др.; ** СНС13
Непредельные спирты образуются также в отсутствие катализатора:
200 °С / \\
^=сн., + сн2о —>¦ / ^>—сн2—сн2он
1,3-Диоксаны в условиях реакции могут гидролизоваться, давая 1,3-гликоли,
а последние — дегидратироваться в 1,3-диены. На этом основан один из про-
промышленных способов синтеза бутадиена:
350 °С
СНз—СН=СН2 + СН2О ——*¦ СН3=СН-СН=СН2
[А12О3]
Внутримолекулярную циклизацию ненасыщенных кетонов под действием
кислых катализаторов называют цикла-реакцией Принса (cydo-Prins), например:
.СН.
ОН
RH
ОН
R = OH, OAik, C1 и др.
См. также Риттер (№ 512).
Kriewitz О., Вег., 1899, Bd. 32, S. 57; J. Chem. Soc, 1899, v. 76, p. 298.
Prins H. J., Chem. Weekbl., 1917, Bd. 14, S. 627, 933; 1919, Bd. 16, S. 1072;
J. Chem. Soc, 1918, v. 114, p. 261.
Исагулянц В. И., Усп. химии, 1968, т. 37, с. 17.
Wilkins Ch. L, Marianelli R. S., «Tetrahedron», 1970, v. 26, p. 4131.
Griengl #., Sieber W., Monatsh., 1973, Bd. 104, S. 1008—1026.
Сафаров М. u др.. Ж- орг. хим., 1974, т. 10, № 7, с. 1365—1367.
476. ПУДОВИК
Присоединение неполных эфиров алкил(арил)фосфокистых и фосфористой
кислот к непредельным соединениям с активированной кратной связью в при-
присутствии алкоголятов щелочных металлов:
R0\/°
\
4- /С=СЧ
/
ioo-с
R0
/Р—С—СН—
(ROH); [RONa] R//j| | |
О R"
R = Alk; R' = Alk, Ar, OAlk;
R" = COAlk, COAr, COOAlk, CONH2, СООН, СНО и др.
330
Аналогично реагируют диалкил(диарил) фосфиты и неполные эфиры тиокис-
лот фосфора, например:
С2Н,
\
-h + ch2=c-ch3
P-CH2-CH-CH3
II I
S CN
В качестве непредельных соединений могут быть использованы производные
ацетилена, полиолефины, эфиры алкенилфосфоновых кислот, например:
О
+ СН=С—СООС2Н5 >
[
[(ROJP-]CH-CH2-COOC2H5 + (ROJPCH=CH-COOC.2H5
о
f(ROJP-lC
L о I
2(RO).2P// +CH2=CHSO4CH=CH2
(ROJPCH2-CH2SO2CH2-CH2P(ORJ
!l tl
!l
О
tl
О
+ (СНз)яС=СН-С—СН=СН„ :
\н 0
(CH3JC=CH-C-CH2-CH2-P(ORJ
II Я
о о
J
о
- CH2=CH-CH2-P(ORJ
CH3-CH-CH2-P(ORJ
I II
O==P(ORJ О
Ацетиленовые и этиленовые углеводороды, галогенолефины, непредельные
спирты, виниловые и аллиловые эфиры не реагируют в условиях основного
катализа. Они вступают в реакцию с неполными эфирами кислот фосфора в
присутствии перекисиых соединений или при УФ-облучении.
Побочные реакции: изомеризация и полимеризация исходных олефинов, те-
ломеризация (в условиях радикального процесса), реакции присоединения по
карбонильной группе.
Пудовик А. Н. Усп. химии, 1954, т. 23, с. 54"/*.
Пудовик А- Н., Хайруллин В. К., Усп. химии, 1968, т. 37, с. 745.
Bramley R. К. е. a., «Tetrahedron Letters», 1973, № 34, p. 3207—3208.
РИМИОС, т. 19, с. 30.
* Реакция была открыта в 1947 г. в лаборатории Казанского университета.
331
477. ПУММЕРЕР (PUMMERER)
Получение тетраоксидифенилов из хиионов и двухатомных фенолов (или их
эфиров) в присутствии кислых катализаторов:
ОН OR'
d I
~о°с
OR'
[разб. H2SO4]*; (CH3COOH)"
R = H, CH3, Cl; R'=H, CH3
*А1С13; **CS2
Аналогично реагируют а-нафтохинон, пирокатехин, а-иафтол.
Pummerer R., Huppmann G., Вег., 1927, Bd. 60B, S. 1442.
Pasternak Т. е. a., Helv. chim. acta, 1948, Bd. 31, S. 525.
478. ПУММЕРЕР (PUMMERER)
Перегруппировка сульфоксидов, содержащих в а-положении метилеиовую
группу, в а-ацилоксисульфиды под действием ангидридов карбоновых кислот:
R'-S-CH2R"
И
О
(RCOJO
110-140 °С
RCOO-
R'-S-CH2R"
ОС OR
—RCOOH
R'—S-CHR" <—>- R'—S=CHR"
OCOR OCOR
-> R'-S-CHR"
OCOR
R = Alk, CeH5
Сульфоксиды подвергаются перегруппировке также под действием хлораи-
гидридов карбоиовых кислот, изоцианатов, неорганических галогеиидов (SiCU.
РС1з, SO2C12 и др.), например:
рц с/л f^u 1 /"¦ и /TV! ^ /"Ч-Г с /^и /"ч 1 /"¦ w рлпи
Под действием ангидридов дикарбоиовых кислот (янтарной, малеииовой)
перегруппировка не происходи г
J3 оеакцию вступают сульфоксиды с алифатическими и ароматическими заме-
заместителями, а также р-дисульфоксиды. Реакция заметно облегчается при наличии
Р-кето- или р-карбоксигруппы. В случае несимметричных сульфоксидов ацилокси-
группа присоединяется к наименее замещенному а-углеродиому атому.
:Н—SO—СН3 + (СН3СОJО > (СН3JСН—S—СН2ОСОСН3
F9%)
332
+
Соединения, содержащие семиполяриую связь S—Э, претерпевают перегруп-
перегруппировку такого же типа, например:
+ 130 °С
CeH5-S-CH3 + (СН3СОJО >-
-С(СООСН3J
—S-CH3 + СвН5СОС1
-NCOCH3
СНз-S-CHgCl
См. также Полоиовский (№ 468).
Pummerer R., Вег., 1909, Bd. 42, S. 2282; 1910, Bd. 43, S. 1401.
Оае S. e. a., «Tetrahedron», 1963, v. 19, p. 817, 1783.
Kuszmann J., Sohar P., Horvath G., «Tetrahedron», 1971, v. 27, p. 5055.
Wilson G., Edwin J., Albert R., J. Org. Chem., 1973, v. 38, № 12, p. 2160—2164.
Прохоров Г. М. и др. Ж. орг. хим., 1974, т. 10, № 9, с. 1852—1856.
479. ПУРДИ —ИРВИН (PURDIE — IRVINE)
Метилирование Сахаров кипячением с избытком йодистого метила в присут-
присутствии окиси серебра:
и пи 0Нз1; Asf2°; r и пги
п—им нагревание *-П—LK_J13
сн-он
1-ОСНз
Метод используется только для дометилироваиия частично метилированных
моносахаридов. Недостатки метода: гетерогенность среды вследствие плохой рас-
растворимости моносахарида в Mel, а также необходимость защиты гликозидиого
гидроксила.
Модификация Куна (Kuhn) — использование в качестве растворителей ди-
метилформамида или диметилсульфоксида для создания гомогенности среды, что
приводит к увеличению выходов метилированных Сахаров.
См. также Хейуорт (№ 647).
Purdie Т., Irvine J. С, J. Chem. Soc, 1903, v. 83, p. 1021.
Kuhn R., Trischmann H., Low I., Angew. Chem., 1955, Bd. 67, S. 32.
Wallenfels K. e. a., Angew. Chem., 1963, Bd. 75, S. 1014.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с 437, 494.
480. ПФАУ—ПЛАТНЕР (PFAU — PLATTNER)
Получение азуленов взаимодействием иидаиов с диазоуксусиым эфиром с
последующими гидролизом, дегидрированием и декарбоксилироваиием* :
'+ — 130—160 "С
•R' + N=N-CHCOOR" >¦ R
* Называют также реакцией Платиера.
hCH-COOR*
Н2О; НО""
-СОOR" > R
\^ \ 300 °С
Ъ— СООН _, >
R'
Вместо диазоуксусного эфнра можно использовать другие алифатические
диазосоединения, например дназометан в момент выделения. В случае 5-заме-
щеиных ииданов получается смесь изомерных азулеиов.
См. также Бюхнер (№ 135), Хафнер (№ 644).
Pfau A. S., Plattner P. A., Helv. chim. acta., 1939, Bd. 22, S. 202.
Gordon M., Chem. Rev., 1952, v. 50, p. 141.
Hafner K-, Angew. Chem., 1958, Bd. 70, S. 419.
Небензоидные ароматические соединения. Ред. Д. Гинсбург. Пер. с англ. Под
ред. А. Н. Несмеянова, Издатинлит, 1963, с. 285.
481. ПФИТЦИНГЕР (PFITZINOER)
Получение цинхониновых кислот конденсацией изатина или изатиновой кис-
кислоты с карбонильными соединениями, содержащими а-метиленовую группу*:
О °
II
л
кон-
нагревание <s^ \
ч /~° (н2оГ U
NH
О
у
^у-с-соон
^"^N=C-CH2R'
i
R
II О
X— СООН II
/ + RCCH2R'
^NH2
СООН
/YYR'
kAAR
N К
R = Н, Alk, Аг, ОН, СООН; R' = Н, Alk, OAlk, OAr
*C2H5ONa в С2НДОН
Выходы кислот колеблются в широких пределах. Альдегиды обычно ис-
используют в виде оксимов. Из несимметричных кетонов образуются смеси изо-
изомерных цинхоннновых кислот. У метилкетонов, как правило, в конденсацию
вступает метильная группа. Основной побочный процесс—автокоиденсация кар-
карбонильного соединения. .
Реакцию используют для получения полупродуктов в синтезе лекарственных
препаратов.
Называют также реакцией Пфитцингера — Борше (Borsche).
334
Модификация Вальтера (Walther) — замена карбонильного соединения ими-
нонитрилами:
СООН
ХОСООН ^HzCN ^ ± .CN
Вариант Хальберкана (Halberkann) — образование цинхониновых кислот на-
нагреванием N-ацетилизатинов со щелочами:
О СООН
См. также Ниментовский (№ 426), Фридлендер (№ 628).
Pfitzinger W., J. prakt. Chem., 1886, Bd. 33, S. 100; 1888, Bd. 38, S. 582.
Halberkann !., Ber., 1921, Bd. 54, S. 3090.
Palmer M. H., Mclntyre P. S., J. Chem. Soc. Ser. B, 1969, p. 539.
El-Abbady A. M. e. a., Rev. Roum. Chim., 1973, v. 18, № 5, p. 899—905.
Эльдерфильд, т. 4, с. 36.
482. ПФИЦНЕР —МОФФЭТТ (PFITZNER—MOFFATT)
Окисление первичных (вторичных) спиртов в альдегиды (кетоны) дей-
действием смеси диметилсульфоксида, дициклогексилкарбодиимида и фосфорной
кислоты: ;
НОН
eHuN=C=NCeHu
-20 °С
(СНв)
>
Vhoh
HO-S(CH3J
CeH11N=C-NHCeH11
-H+
(CH8)»S
*H8PO3, NCCH2COOH, C5H5N-CF8COOH, C5H5N-HC1, C5H5N-H8PO4
Метод успешно применяется для окисления спиртовых групп в алифатиче-
алифатических и жирноароматических соединениях, сахарах, стероидах, пептидах, иуклео-
зидах, алкалоидах, например:
F0-70%)
335
Третичные спирты, тиолы, амины в условиях реакции не изменяются, не за-
затрагиваются также разнообразные защитные группы. У фенолов происходит ал-
килирование с образованием о-метилтиометнльных производных,
См. также Болл—Гудвин — Мортон (№ 97), Муро — Мнньонак (№ 410),
Оппенауэр (№ 435), Фентон (№ 598).
Pfitzner К. Е., Moffatt J. G., J. Am. Chem. Soc, 1963, v. 85, p. 3027.
Epstein W. W., Sweat F. W., Chem. Rev., 1967, v. 67, p. 247.
Roberts J. S., Thomson C, J. Chem. Soc, Perkin Trans., 1972, Pt2, № 14,
p. 2129—2140.
Monthgomery J. A., Laseter A. G., Hewson K-, J. Heterocyclic Chem., 1974,
v. 11, № 2, p. 211—218.
Физер, т. 1, с. 328; т. 5, с. 129.
483. ПШОРР (PSCHORR)
Получение производных феиантрена внутримолекулярной циклизацией солей
диазония, синтезируемых конденсацией ароматических о-ннтроальдегидов с арил-
уксусными кислотами с последующим восстановлением нитрогруппы в амино-
аминогруппу и ее диазотированнем:
[Cu-порошок]
соон
В реакцию вступают ароматические о-нитроальдегиды, содержащие заме-
заместители в любом из возможных положений ароматического ядра, а также соот-
соответствующие производные конденсированных полицнклнческих углеводородов.
Наличие амино- или оксигруппы в орто-положении к диазогруппе снижает вы-
выходы фенантренов. Аналогично циклизуется соль диазония, полученная из цис-
аминостильбена (транс-изомер не образует фенантрена):
СН=С
N2C1
(-80%)
Реакция находит широкое применение благодаря возможности варьирова-
варьирования исходных соединений. Так, замена арилуксусных кислот оксиидолом позво-
позволяет проводить конденсацию с жнрноароматическими кетоиами и получать
336
9-алкилфенантрены. Внутримолекулярную циклизацию солей диазоння исполь-
используют для синтеза производных флуорена, карбазола и других гетероциклических
соединений, например:
N С1-
SO.
:СНЧ
N2C1 С2Н5ООС ,СН3
) \ /
N СН,—:f\-COOC2H,
СООС2Н5
NH
NSO2CH3
См. также Гомберг — Бахман — Хей (№ 206), Виттиг (№ 169), Перкин
(№446).
Pschorr R., Ber., 1896, Bd. 29, S. 496; 1900, Bd. 33, S. 176; Ann., 1912, Bd. 391,
S. 40.
Lewin A. H., Cohen Т., J. Org. Chem., 1967, v. 32, p. 3844.
Kametani Tetsuji, Sugahara Tsutomu, Fukumoto Keiichiro, Chem. Pharm. Bull.,
1974, v. 22, № 4, p. 966—969.
Физер Л., Физер М. Хнмня прнродных соединений фенаитренового ряда. Пер.
е англ. Под ред. В. М. Родионова. М.-Л., Госхимиздат, 1953, с. 18, 22.
ОР, т. 9, с. 529.
484. ПШОРР —ХОППЕ (PSCHORR — НОРРЕ)
Образование индола восстановлением о-нитрофенилацетонитрила в соответ-
соответствующее о-аминопроизводное с последующей циклизацией под действием нат-
натрия в спирте:
Na; нагревание
22—684
337
Циклизация о-аминофенилацетонитрила под действием натрия и амилфор-
миата в эфире приводит к нитрилу индол-3-карбоновой кислоты:
Метод из-за низких выходов не находит практического применения. В по-
последние годы реакцию используют для синтеза 2-амииоиидолов, осуществляя
циклизацию о-аминофенилацетоиитрила под действием НС1. При проведении
циклизации в присутствии алкилгалогеиида получают амино-1-алкилиидолы.
См. также Райссерт (№ 491), Байер (№ 33).
Pschorr R., Hoppe G., Вег., 1910, Bd. 43, S. 2543.
Kebrle I., Hoffmann K-, Helv. chim. acta, 1956, Bd. 39, S. 116.
Сагитулин P. С. и др., «Химия гетероциклических соединений», 1970, с. 364.
Эльдерфильд, т. 3, с. 29.
485. РАБЕ (RABE)
Конденсация альдегидов с двумя молекулами Р-дикарбонильного соединения
при нагревании в водном спирте:
нагревание
RCHO + 2R'CO-CH2-COR" ТГТГр^Т rRCH=C
(водн. СгНбОН)* |
L COR"
» R'CO-CH-CH-CH-COR'
R"CO R COR"
R = H, CH3; R' = Aik; R"= Alk, OAlk, NH2, NHAlk, NHAr
*H2O, C2H6OH (абс.)
Аналогично реагируют циклические и гетероциклические Р-дикетоиы, на-
например:
/гл_/"\ _ /~v
RCHO+ 2 <f )=
V мг>'
NH2
H, Alk, C6H5; R'=H, CH3
338
Возможно также присоединение только одной молекулы Р-дикетона, на-
например:
СН3СНО + СН3СОСН2СОСН3 >- СН3СН=С(СОСН3J
Rabe P., Ann., 1904, Bd. 332, S. 1.
Wilson В. D., J. Org. Chem., 1963, v. 28, p. 112, 314.
Pfleiderer W., Sagi F., Grozinger L, Chem. Ber., 1966, Bd. 99, S. 3530.
Langer G., Rofn H. L, Archiv. Pharm., 1969, Bd. 302, S. 75.
486. РАДЗИВАНОВСКИЙ (RADZIEWANOWSKI)
Алкилирование или арилирование ароматических соединений действием со-
соответствующих галогеипроизводиых в присутствии порошка алюминия и газо-
газообразного хлористого водорода:
ArH + RX
-¦> Ar-R
[А1+НСЦ*
D0-70%)
Ar = C6H6, C6H4Alk; R = Alk, Ar; X = C1, Br
*А1 + HgCl2
Этот удобный и экономичный метод, являющийся модификацией реакции
Фриделя — Крафтса (см. № 627), успешно применяют для синтеза дифенилме-
тана, этилбензола, изопропилбензола и т. д.
Radziewanowski С, Вег., 1895, Bd. 28, S. 1135.
Ray J. N.. J. Chem. Soc, 1904, v. 117, p. 1335.
Долгов Б. Н., Бнатов С. А., ЖОХ, 1959, т. 29, с. 582.
487. РАДЗИШЕВСКИЙ (RADZISZEWSKI)
Получение амидов кислот из нитрилов действием перекиси водорода в ще-
щелочной среде:
.О
Н2О3; NaOH; 50-60 °С //
~ =~~ (водн. С2Н5ОН) ~~ \
В реакцию вступают различные алифатические и ароматические нитрилы.
Выходы алифатических амидов составляют обычно 50—60%, а ароматических —
80—90%. Присутствие в молекуле нитрила других функциональных групп и
кратных связей не препятствует реакции, например:
RCOC(CH3JCH2CH2CN >¦ RCOC(CH3JCH2CH2CONH2
R = Alk, C6H5
NCCH=CHCN * H2NCOCH=CHCONH2
В некоторых случаях превращение сопровождается циклизацией, например:
О
•CN
ПС
¦NHCOR
R = H, Alk
22 я
339
См. также Римшнайдер (№ 511), Циглер (№ 686).
Radziszewski В., Вег., 1885, Bd. 18, S. 355.
Siemion I. Z., Wiadom. Chem., 1965, v. 19, № 4, p. 275.
Жданов Ю. А., ЖОХ, 1972, т. 42, № 2, .с. 481.
Фаворская Т. А., Самусик Б. Н., Ж. орг. хим. 1967, т. 3, с. 219.
Физер, т. 3, с. 74.
488. РАЙДОН (RYDON)
Получение алкилгалогенидов действием на спирты алкилтрифеноксифосфо-
нийгалогенидов *:
ROH+[(C6H5OKPR'] х- >- RX
F0-90%)
R = Alk; R' = Alk (обычно СЩ; X = Cl, Br, I
В реакцию вступают также алициклические, алленовые и ацетиленовые спир-
спирты, гликоли, стероидные спирты.
Реакцию можно проводить без предварительного превращения трифенил-
фосфита в фосфониевые соединения:
- (С6Н5ОKР + R
ROH + (C6H5OKP
х2
нх
-v RX + R'PO(OC6H5J + С6Н6ОН
RX + ХРО(ОС6Н5J + С6Н5ОН
ROH + (C6H5OKP >- RX + HPO(OC6H5J + C6H5OH
Непредельные спирты очень гладко превращаются в бромиды при действии
(С6Н5ОKРВг Вг~ в пиридине.
Метод Форсмеиа — Липкина (Forsman — Lipkin) — превращение спиртов в
иодиды взаимодействием с дифенилхлорфосфитом или о-фениленхлорфосфитом и
последующей обработкой иодом:
ROH + (С,Н,ОIРС1
(C5H5N)
(C6H5OJPOR
(CH2C12)
RI
F0-80%)
См. также Арбузов (№ 22), Дарзан (№ 236).
Landauer S. R., Rydon H. N., J. Chem. Soc, 1953, p. 2224.
Forsman I. P., Lipkin D., J. Am. Chem. Soc, 1953, v. 75, p. 3145.
Физер, т. З, с. 416; т. 5. с. 456, 491.
489. РАЙЛИ (RILEY)
Окисление активированной метилеиовой или метальной группы в карбониль-
карбонильную действием двуокиси селена:
SeO2
о
•CHgCOOH, (СН3СОJО, С6Н6> диоксан, Н2О
* Называют также реакцией Ландауэра (Landauer) — Райдона.
340
Метод позволяет получать разнообразные моно- и дикарбонильные соеди-
соединения:
СНз-СНО >- ОНС-СНО
G4%)
СвН5СОСН, >- С6Н6СОСНО
G0%)
X) ^ ^.0
F3%)
сн3
сно
NH
ROOC-CH=CH-COOR
NH
E8%)
ROOC—CO—CO—COOR
а-Метилеиовая группа в олефииах и ацетиленах окисляется в данных усло-
условиях до спиртовой группы:
RCH=CH-CH2R'
RCH=CH-CHOHR'
Реакция проходит особенно гладко, если олефин содержит больше пяти ато-
атомов углерода в цепи.
См. также Дениже (№ 243), Этар (№ 743).
Riley H. L, Morley J. F., Friend N. A., J. Chem. Soc, 1932, p. 1875.
Waitkins G. R., Clark С W., Chem. Rev., 1945, v. 36, p. 235.
Schaefer J. P., J. Am. Chem. Soc, 1962, v. 84, p. 713, 717.
Физер, т. З, с. 246.
490. РАЙМЕР —ТИМАН (REIMER — TIEMANN)
Получение ароматических о-оксиальдегидов взаимодействием фенолов с хло-
хлороформом в щелочном растворе:
-СНО
«50%)
R = Н, Alk, OAlk, Hal
*С2Н6ОН, C5H5N
Количество лсрс-изомеров, как правило, незначительно. Наличие электроно-
акцепторных заместителей дезактивирует молекулу фенола. Вместо СНСЬ можно
использовать СНВг3 и СН13. Аналогично реагируют оксипроизводиые коиденси-
341
рованных полициклических углеводородов и гетероциклических соединений (ин-
(индола, хинолина, тиазола и т. п.):
сно
]
О
N
онс
Ан
N
| N
OH OH
C8%) A0%)
Некоторые о- и n-алкил- или арилфенолы могут образовывать гельпроизвод-
ные (аномальная реакция Раймера — Тимана):
ОН ОН О
ХНО
Несмотря на невысокие выходы реакция находит применение, поскольку
является единственным способом прямого формилирования ароматических со-
соединений в щелочной среде.
См. также Гаттерман (№ 193), Гаттерман — Кох (№ 195), Дафф (№ 234).
Reimer K-, Tiemann F., Ber., 1876, Bd. 9, S. 824, 1285.
Ferguson L. H., Chem. Rev., 1946, v. 38, p. 229.
Wynberg H-, Chem. Rev., 1960, v. 60, p. 169.
Kobayashi Shiguru e. a., Chem. Pharm. Bull., 1969, v. 17, p. 1279.
Thakar K. A., Goswami D. D., J. Indian Chem. Soc, 1972, v. 49, Hi 7, p. 707.
СОП, т. 3, с 365; OP, т. 9, с 61.
491. РАЙССЕРТ (REISSERT)
Получение индолов конденсацией о-нитротолуола с диэтилоксалатом, гидро-
гидролизом образовавшегося эфира о-нитрофенилпировиноградной кислоты, восстанов-
восстановлением кислоты в о-аминофенилпировииоградную кислоту, циклизацией ее в ин-
долил-2-карбоновую кислоту и декарбоксилированием последней при нагре-
нагревании:
<г
СООС2Н5
СООС2Н5
СН2СОСООН
Н2О; Н+
Zn**
NO,
\—СООН
NH
(СНзСООН)
280-250 °С
342
R = Н, СН3, ОСН3, ОСН2С6Н5
*С2Н5ОК, СН3ОК, СаО, Си (порошок), **Zn в присутствии нитратов № и Со;
Zn/Hg в НС1, FeSO4 в NH4OH, Na2S2O4
З-Замещенные индолы получают алкилированием либо на стадии индолил-2-
карбоновой кислоты, либо на стадии эфира о-нитрофенилпировиноградной
кислоты.
См. также Байер (№ 34), Веерман (№ 150), Бишлер —Мёлау (№ 82), Не-
ницеску (№ 421), Пшорр —Хоппе (№ 484), Фишер (№ 611).
Reissert A., Ber., 1897, Bd. 30, S. 1030.
Snyder H. R., Beilfuss H. R., J. Am. Chem. Soc, 1953, v. 75, p. 4921.
Wieland Т., Unger O., Chem. Ber., 1963, Bd. 96, S. 253.
Knabe ]., Frie A., Arch. Pharm., 1973, Bd. 306, № 9, S. 648—658.
Эльдерфильд, т. З, с. 14.
492. РАЙССЕРТ (REISSERT)
Получение альдегидов взаимодействием хлорангидридов карбоновых кислот
с хииолииом и синильной кислотой и последующим кислотным гидролизом
1-ацил-1,2-дигидро-2-цианохинолинов (соединений Райссерта)*:
RCOC1
нагревание
СООН
R = AIk, цикло-Alk, нафтил, С6Н6, C6H4CI, C6H4F, C6H4OAlk, C6H4NO2
*SO3, H2O (для ArCOCt); ** разб. Н3РО4
Соединения Райссерта образуются очень легко. Превращение их в альдеги-
альдегиды происходит с выходами, близкими к количественным. Введение электроно-
акцепторных заместителей в молекулу хлорангидрида или хинолииа снижает
выходы соединений Райссерта. Кроме хинолина используют изохинолин и феиаи-
тридин; 2- и 8-замещенные хинолииы в реакцию не вступают.
Соединения Райссерта широко применяют для получения гетероциклических
* Называют также реакцией Райссерта — Грошейнца — Фишера (Gro-
sheintz — Fischer H. О. L.).
343
карбоновых кислот, спиртов, а также для синтеза алкилированных хинолинов или
изохинолинов (щелочной гидролиз):
1. СеН5Ц
2. RX
Н' 4CN
CRR'
COR
Модификация Пэдбери — Лиидуолла (Padbury — Lindwall) — использование
изохинолинов для получения соединений Райссерта.
См. также Грундман (№ 223), Розенмунд — Зайцев (№ 524).
Reissert А., Вег., 1905, Bd. 38, S. 1610, 3415.
Padbury J. L, Lindwoll H. G., J. Am. Chem. Soc, 1945, v. 67, p. 1268.
Boehme #., Schweitzer R., Chem. Ber., 1969, Bd. 102, S. 3606.
OP, т. 8, с 288.
493. РАЙХЕРТ—НЬЮЛЕНД (REICHERT — NIEUWLAND)
Присоединение ароматических углеводородов к ацетиленам в присутствии
кислых катализаторов с образованием 1,1-диарилэтанов:
R \
10-15 °С
LH2so4+Hgso4]*
сн.
B0-90%)
R = H, Alk, C6HU> Cl, F, OCH3; R'= H, CH3, Cl; R" = H, CH3
*HA1C14, A1C1S
Аналогично реагируют мезитилен, 1,2,3- и 1,2,4-трихлорбензолы. С нафтали-
нафталином реакция не идет. В случае фенилацетилена присоединяется только одна мо-
молекула углеводорода:
С,Н,+СвНвС==СН >. (С6Н5JС=СНа
Reichert J. S., Nieuwland J. A., J. Am. Chem. Soc, 1923, v. 45, p. 3090.
Цукерваник И. П., Юлдашев К. Ю., ЖОХ, 1963, т. 33, с. 3497.
. Hoffenberg D. S., Stolin E. M., Matsuda K-, J. Chem. Eng. Data, 1964, v. 9,
p. 104.
494. РАМБЕРГ—БЕКЛУНД (RAMBERG — BACKLUND)
Получение олефинов из а-галогенсульфонов при действии сильных осно-
оснований:
NaOH»; .
\ / нагревание \— / \ / \ /
*С„Н61Л в бензоле, NaOH в водном диоксане E0 °С),
C2H6ONa в С^ОН B5 °С) и др.
В реакцию вступают алифатические и жирноароматические а-галогенсульфо-
ны. Основным продуктом являются цыс-олефины; с увеличением размеров заме-
заместителей возрастает количество трснс-изомера.
Галогенсульфоны с СООН-группой образуют непредельные кислоты, <х,а'-ди-
галогенсульфоны — диолефины, а <х,а-дигалогенсульфоны — ацетилены:
C6H5CH2SO2C(CH3)BrCOOH
C6H6CH2SO2CBr2R
С6Н5СН=С(СНд)СООН
C6H5C=CR
Тригалогенсульфоны дают в основном винилсульфоновые кислоты.
См. также Фаворский (№ 593), Корнфорт (№ 324), Коуп (№ 330).
Ramberg L, Backlund В., Ark. Kemi., 1940, Bd. A13, № 27, S. 1.
Corey E. J., Block E., J. Org. Chem., 1969, v. 34, p. 1233.
Paguette L. A., Philips J., J. Am. Chem. Soc, 1971, v. 93, p. 4516.
Potter S. E., Sutherland I. O., J. Chem. Soc. Chem. Comm., 1973, № 15, p. 529.
Bordwell F. G., Doomes E., J. Org. Chem., 1974, v. 39, Hi 17, p. 2526—2531.
495. РАП (RAP)
Получение 2-ацилбензофуранов циклоконденсацией салицилового альдегида
с галогенметилкетонами под действием едкого кали*:
«ПС
сно
КОН; нагревание
XCH2COR' .„ ц _ -» R
(С2Н5ОН)
COR'
R = Н, С1, Вг, ОСН3; R' = СН„ С6Н4ОСН3-л, С6Н5; X = Q, Вг
Аналогично реагируют циклические леры-оксикарбонильные соединения, на-
например:
(СН2)„
(СН2)„
COR'
R = H, CH3, ОСН3; п=1, 2, 3
Rap E., Gazzetta, 1895, v. 25, Pt. 2, p. 285.
Stoermer R., Ann., 1900, Bd. 312, S. 331.
Buu-Hoi N. P. e. a., J. Chem. Soc, 1957, p. 2593.
Royer R. e. a., Bull. Soc. chim. France, 1964, p. 2112.
* Называют также реакцией Рапа — Штёрмера (Stoermer).
345
496. РАШИГ (RASCHIG)
Получение N-замещенных гидразинов взаимодействием хлораминов с пер-
первичными аминами:
-20 °с
RNH2 + C1-NH2 >- RNH-NH2
F0-70%)
R = Alk, CH2CH=CH2, C2H4OH, C2H4NH2, циклогексил, морфолил
Реакцию проводят при соотношении RNH2 и NH2C1 8 : 1 в присутствии же-
желатина для дезактивирования металлов, которые могут находиться в реакцион-
реакционной системе. Аналогично реагируют вторичные амины, давая R2NNH2.
См. также Фишер (№ 604).
Raschig F., Ber., 1907, Bd. 40, S. 4587.
Audrieth L. F., Rowe R. A., J. Am. Chem. Soc, 1956, v. 78, p. 563.
Omiethanski G. M. e. a., J. Am. Chem. Soc, 1956, v. 78, p. 3874.
Одрит Л., Огг Б. Химия гидразина. Пер. с англ. Под ред. Я. М. Варшав-
Варшавского. М., Издатннлит, 1954, с. 30.
Вейганд-Хильгетаг, с. 543.
497. РАШИГ (RASCHIG)
Промышленное получение фенола каталитическим хлорированием бензола с
последующим гидролизом хлорбензола водяным паром:
НС1; Ог; -250—270 °С НгО; 400—500 °С
[акт. ~* СвНбС1 ~
*А1С13>
(85-95%)
, Na2CO3> CaCO3> ZnO, SnO2, TiO2) SiO2
Катализатор активируют солями Си (обычно), а также Со, Ni, Ag, Аи или
Pt. Процесс ведут при степени конверсии ~1О°/о на обеих стадиях. При увели-
увеличении степени конверсии сильно возрастает количество дихлорбензола на первой
стадии, а на второй стадии наблюдается уменьшение выхода фенола и сильное
обуглероживание катализатора. Побочными продуктами являются полихлор-
бензолы.
См. также Дау (№ 233).
Raschig F., франц. пат. 698341 A930); Chem. Zbl., 1931, Т. 2, S. 1491.
Marhes W., Angew. Chem., 1939, Bd. 52, S. 591.
Reichle W. Т., J. Catal., 1970, v. 17, p. 297.
498. РЕВЕРДЕН (REVERDIN)
Нитрование орто- или ncpc-галогенфенолов или их эфиров, сопровождаю-
сопровождающееся миграцией галогена*:
= H, Alk
* Называют также перегруппировкой Ревердена.
346
Наиболее легко превращение протекает при Х=1.
См. также Менке (№ 395), Ортон (№ 437), Фредеихаген (№ 626).
Reverdin F., Ber., 1896, Bd. 29, S. 997, 2595; Bull. Soc. chim. France, 1907, v. 1,
p. 618.
Nightingale D. V., Chem. Rev., 1947, v. 40, p. 128.
499. РЕДДЕЛИН (REDDELIEN)
Замыкание кольца пиридина при конденсации ацетофенона с бензиламином
в присутствии следов бромистого водорода:
2Аг— С—СН3 + H2N— CH2— Аг'
II
О
нагревание
[НВг]
Аг, Аг' = С6Н5, С6Н4С1
Строение образующегося продукта доказано встречным синтезом. Побочные
продукты: беизальдегид, дибензиламин, аммиак.
См. также Гаперман — Скита (№ 196).
Reddelien G., Вег., 1920, Bd. 53, S. 334.
Amoros-Marin L, Carlin R. В., J. Am. Chem. Soc, 1959, v. 81, p. 733.
500. РЕЙНДЕРС —РИНГЕР (REINDERS — RINGER)
Замена нитрогруппы на алкоксильную в n-нитробензоннтриле под действием
алкоголята натрия:
\—/
RONa
(ROH>
(колич.)
= CH3, C2H5
Аналогично реагируют нитросоединения, содержащие нитрильную группу в
орто-положении:
NO2
CN
CH3ONa
—осн3
CN
Reinders W., Ringer W. E., Rec. trav. chim., 1899, v. 18, p. 326.
Bradscher Ch. K., Brown F. C, Porfer H. K-, J. Am. Chem. Soc, 1954, v. 76,
p. 2357.
347
501. РЕМФРИ — ХАЛЛ (REMFRY —HULL)
Замыкание кольца пиримидина при конденсации диамида малоиовой кисло-
кислоты с эфирами алифатических карбоиовых кислот под действием этилата натрия:
ОН
RCH(CONH2J + R'COOCj,H6
Q>H5ONa;
нагревание
(С2Н5ОН)
R = Н, Alk, CeH6; R' = Н, Alk
Побочная реакция — автокондеисация диамида:
ОН
2CH2(CONH2)a
N
-CH2CONHa
См. также Биджииелли (№ 77).
Remfry F. G. P., J. Chem. Soc, 1911, v. 99, p. 610.
Hull R., J. Chem. Soc, 1951, p. 2214.
Brown D. J., J. Chem. Soc, 1956, p. 2312.
502. РЕППЕ (REPPE)
Присоединение соединений с подвижным атомом водорода к ацетилену в
Присутствии щелочных катализаторов (вииилироваиие):
RH
150—180 "С; 7—35 кгс/см2
RCH=CH2
(ДО 85%)
R = OR', SR', NRa, OCOR', NHCOR' (где R' = Alk), ОАг
*C2H5ONa, KCN, стеарат калия
Фенолы винилируются легче, чем спирты. Пиррол, индол, имидазол, лакта-
мы и амиды кислот образуют N-винильиые производные. Эфиры оксикислот,
сложные эфиры многоатомных спиртов, соли третичных аминов и Р-дикарбоииль-
иые соединения (типа малонового эфира) гладко винилируются и в присутствии
цинковых или кадмиевых солей органических кислот; фенолы в этих условиях
дают не О-, а С-вииильиые производные:
.ОСН=СН2
[КОН]
ОН
ОС
СН2
См. также Норман (№ 428).
Reppe W., «Experientia», 1949, Bd. 5, S. 93.
Reppe W. e. a., Ann.. 1956, Bd. 601, S. 81.
See}elder M, Ann., 1962, Bd. 652, S. 107.
Houben-Weyl, Bd. 4, T. 2, S. 407.
348
503. РЕППЕ (REPPE)
Получение карбоиовых кислот или их производных путем присоедииения оки-
окиси углерода и веществ с подвижным атомом водорода к ацетиленам или олефи-
иам в присутствии галогеиидов никеля (карбоиилироваиие):
R-H
СО; 150-180 "С; 30 кгс/см2]
СН2=С-С
[№X2]*
CO; 180—200 °C; 200 кгс/сМ2
I Xr
О
-CH=CH2 + R-H
О .0
^ -CH2-CH2—C^ +_СН(СНз)-С^
R \r
A:1)
R = OH, OR', NHR', SH, SR', OCOR' (где R'= Alk)
*CoX2
В случае олефииов или дизамещеииых ацетиленов образуется смесь обоих
возможных изомеров. Каталитическая активность №Х2 падает в ряду: Nil2 >
> NiBr2 >NiCl2.
В аналогичных условиях происходит присоединение окиси углерода к спир-
спиртам, простым эфирам, алкилгалогеиидам:
RCOOH
RCOOR'
HOOC(CH2LCOOH
АгХ >¦ АгСОХ
Фенолы в реакцию ие вступают.
Использование гидридов карбонилов железа или кобальта F0—80°С, 100—
200 кгс/см2) позволяет осуществлять следующие превращеиия:
-сн=сн2
-СН=СН2
СО; Н2О
[Fe(COLH2]
СО; Н2О; RNH2
—СН„—СН»-СН2ОН
2СН^СН
[Fe(CO)jH2]
СО; Н2О
-CH2-CH2-CH2NHR
[Fe(COLH2]
>¦ Н
ОН
Наряду с «каталитическим» карбоиилированием существует «стехиометриче-
ский» вариант: взаимодействие ацетиленов или олефииов в присутствии кислот
или галогенов со стехиометрическим количеством карбоиилов Со или Ni в каче-
качестве источников СО. В случае ацетиленов процесс ведут при 50—60 °С, а в слу-
случае олефииов — при 160—170 °С.
349
См. также Рёлен (№ 508).
Reppe W., «Experientia», 1949, Bd. 5, S. 108.
Reppe W. e. a., Ann., 1953, Bd. 582, S. 1, 38, 72, 87, 116, 133.
Bird С W., Chem. Rev., 1962, v. 62, p. 283.
Falbe L, Korte F., Chem. Ber., 98, 1228 A965), Bd. 98, S. 1228.
Houben-Weyl, Bd. 6, T. 2, S. 664.
504. РЕППЕ (REPPE)
Получение бутадиена присоединением ацетилена к двум молекулам форм-
формальдегида в присутствии ацетилеиида меди, гидрированием полученного про-
продукта в бутандиол и дегидратацией последнего:
СН=СН + 2СН2О
90—120 °С; 5 кгс/см2
uJ; (Н2О)
*- носн2—с=с—сн2он
Н2; 100-120 °С;
325 кгс/см2
>-
[Ni-Cu]; (H2O)
280 "С
280 °С
—> носн2-(сн2J-сн2он [NaHiPQt> сн2=сн-сн=с
[Н3РО4]
Н2С—СН2
Н2С СН2 -
\/
о
Дегидратацию бутандиола в бутадиен проводят в одну или в две стадии с
образованием тетрагидрофурана в качестве промежуточного продукта.
См. также Лебедев (№ 353), Остромысленский (№ 438), Реппе (№ 506).
Reppe W., «Experientia», 1949, Bd. 5, S. 98.
Reppe W. e. a., Ann., 1955, Bd. 596, S. 1.
Copenhaven J. W., Bigelow M. #., Acetylene and Carbon Monoxide Chemistry.
New York, Reinhold, 1949, p. 96.
505. РЕППЕ (REPPE)
Циклополимеризация ацетилена или его производных в арены и циклополи-
олефниы в присутствии никелевых катализаторов:
60 °С; 15 кг.
зсн=сн
*Ni(CNJ, Ni(SCNJ, (o-NH2C6H4OJNi, Ni-производные ацетоуксусного эфира илн
ацетилацетона
Реакция позволяет с выходами, близкими к количественным, получать бен-
бензол и его производные, а также циклооктатетраен:
4СН=СН
80—120 °С; 15—25 кгс/см2
»
!Ni(CNJ]*; (тетрагидрофуран)
G0-90%)
350
Получение циклооктатетраена открывает путь для синтеза пробковой кисло-
кислоты и полиамидов на ее основе.
См. также Бертло (№ 67).
Reppe W. e. a., Ann., 1948, Bd. 560, S. 1, 93, 104.
Meriwether L. S. e. a., J. Org. Chem., 1962, v. 27, p. 3930.
Schrauzer G. N.. Glockner P., Eichler S., Angew. Chem., 1964, Bd. 76, S. 28.
506. РЕППЕ (REPPE)
Конденсация ацетилена или его монозамещенных гомологов с альдегидами
или кетонами (алкииольный синтез), аминами (аминобутиновый синтез) или
оксиаминами (аминопропиновый синтез) в присутствии ацетиленидов тяжелых
металлов с образованием соответствующих ацетиленовых спиртов или аминов
(этинилирование).
а) Алкинольный синтез:
100 "С; 5—20 кгс/см2 RCOR'
СН=СН + RCOR' TTCZTZ " RR'C-Cs=CH >¦
Ан
1- RR'C-C=C-CRR'
OH OH :
*Ацетилениды Hg, Ag, Au
Из высших альдегидов образуются преимущественно алкинолы, из низших —
ацетиленовые гликоли. При реакции с кетонами катализатором является водный
раствор щелочи.
Реакция широко применяется в промышленности для синтеза пропаргило-
вого спирта, бутиидиола, бутадиена и многочисленных полупродуктов для полу-
получения фармацевтических препаратов и полимеров.
б) Аминобутиновый синтез:
CH=CR"
"R
V
—CH=CHR"
R^
CH=CR" \
R
'/ I
C=CR*
Аминобутины легко изомеризуются в 2-аминобута диены,
а) Аминопропииовый синтез:
CH=CR" + \-
25
С; 20 кгс/см2 \
OH
/ I
C=CR"
Прн R"=H возможно образование диаминов. Реакция применяется для по-
получения полупродуктов, используемых в синтезе противомалярийных препаратов.
См. также Неф (№ 424), Реппе (№ 504), Фаворский (№ 595).
Reppe W., «Experientia», 1949, Bd. 5, S. 98.
Reppe W. e. a., Ann., 1955, Bd. 596, S. 1, 12, 25, 38, 80, 158.
Ried W., Fastabend W., Hersek S., Chem. Ber., 1965, Bd. 98, S. 245.
Houben-Weyl, Bd. 4, T. 2, S. 413.
351
507. РЕФОРМАТСКИЙ
Получение эфиров [3-оксикарбоновых кислот взаимодействием альдегидов
или кетонов с эфирами а-галогенкарбоновых кислот под действием металличе-
металлического цинка:
I Zn; нагревание
R'COR" + X-C-COOR ! >¦
(С6Н3)*
R'R"C—C—COOR
I I
XZnO
XZn-C-COOR + R'R"CO
R'R'C—C—COOR
I I
HO
E0-75%)
X = Cl, Br (обычно), I
*C6H5CH3, эфир и т. п.
В реакцию вступают алифатические и ароматические кетоны и альдегиды,
содержащие различные функциональные группы, а также ортоэфиры. Альдегиды,
как правило, более реакционноспособны, чем кетоиы. Активность эфиров гало-
геикарбоиовых кислот убывает в ряду: I > Вг > С1.
Вместо XCH2COOR могут быть использованы их винилоги ХСН2СН =
= CHCOOR, а также соединения, содержащие активированный галоген
(ХСН2С = СН и др.)- В этих случаях в качестве катализатора применяют алю-
алюминий*!
А1; нагревание
(СН3JСО + ВгСН2С==СН >- (СН3JС(ОН)СН2С=СН
G1%)
Побочные процессы: реакция Вюрца у а-галогенэфиров, альдольиая конден-
конденсация исходного карбонильного соединения, дегидратация продуктов в эфиры
а,Р-непредельных кислот.
Реакцию широко используют в препаративных целях не только для синтеза
эфиров р-окси- и <х,Р-непредельных кислот, но и как способ удлинения и раз-
разветвления углеродной цепи.
См. также Блэз (№ 88), Гриньяр (№ 219), Зайцев (№ 259), Иванов
(№ 273), Франклаид (№ 623), Франкланд —Дуппа (№ 624).
Reformatsky S., Вег., 1887, Bd. 20, S. 1210.
Chodkiewicz W., Cadiot P., С. г., 1956, v. 243, p. 2092.
Diaper D. G. M., Kuksis A., Chem. Rev., 1959, v. 59, p. 89.
Rao Y. S., Chem. Rev., 1964, v. 64, p. 360.
Vangham W. R., Knoess H. P., J. Org. Chem., 1970, v. 35, p. 2394.
Dardolze F., Gaudemar M., Bull. Soc. chim. France, 1974, № 5—6, pt. 2,
p. 939—942.
OP, т. 1, с 9.
508. РЁЛЕН (ROELEN)
Гидроформилироваиие олефинов в альдегиды окисью углерода и водородом
в присутствии кобальтовых катализаторов (оксосиитез):
\ / СО; На; -75—200 °С; 1С0—200 кгс/см2 \ /
чс=с7 *¦ хсн—с
\ [СО]* / |\
с
\
НО
•Со2(СОN, Со2(СО)8, ThO2
* Эту реакцию называют также синтезом Годемара (Gaudemar).
352
Олефины с неразветвленной цепью дают смесь изомеров:
RCH=CH2 >¦ RCH—СН3 + RCH2—СН2-СНО
СНО
Стерически затрудненные олефины не вступают в реакцию. В случае не-
несимметричных олефинов СНО-группа присоединяется преимущественно к наи-
наименее замещенному атому углерода, например:
(СНзJС=СН2
(СНдJСН-СН2-СНО
(90-95%)
(СН3KС—СНО
E-10%)
В случае диенов обычно происходит гидроформилирование одной С = С-свя-
зи и гидрирование другой.
Побочные реакции: гидрирование, восстановление альдегидов до спиртов,
конденсация альдегидов, ацетализация, полимеризация, образование кетонов.
Метод широко используется в промышленности для получения спиртов
Сз—С]з. Гидроформилирование и гидрирование можно осуществлять одной и той
же газовой смесью в присутствии одного и того же катализатора, но чаще для
гидрирования альдегидов используют гетерогенный катализ.
См. также Реппе (№ 503), Фишер — Тропш (№ 614).
Roelen О., Angew. Chem., 1948, Bd. 60, S. 62, 213.
Kirch L, Orchin M., J. Am. Chem. Soc, 1958, v. 80, p. 4428; 1959, v. 81,
p. 3597.
Falbe J., Huppes N., Korte F., Chem. Ber., 1964, Bd. 97, S. 863.
Физер, т. 1, с. 286.
509. РИД (REED)
Фотосульфохлорирование алканов при действии сернистого газа н хлора:
_ SO2+C12; hv
RH
RSO2C1
Реакция идет по радикальному механизму. Оптимальные условия сульфо-
хлорирования: i=300—360 нм, 20—25 "С, соотношение C12:SO2=1 : 1,3. В при-
присутствии органических перекисей реакция может идти в темноте. Наиболее глад-
гладко реакция идет для м-алканов и циклоалканов. Вторичный атом водорода с
трудом обменивается на SO2Cl-rpynny, а третичный не обменивается совсем.
У ароматических соединений сульфохлорируется только боковая цепь. Побочным
процессом является хлорирование, в случае парафинов с длинной цепью — обра-
образование полихлорпроизводных.
На основе сульфохлоридов можно получать многие технически важные про-
продукты: сульфоиы и сульфокислоты (гидролиз), олефины (сплавление с щелоча-
щелочами), эфиры сульфокислот (алкоголиз), имиды сульфокислот и сульфамиды (ам-
монолиз), тиолы (восстановление).
Reed С. F., пат. США 2046090 A936); С. А., 1936, v. 30, р. 5593.
Walling С, Pease W. F., J. Org. Chem., 1958, v. 23, p. 478.
Asinger F., Fell В., Scherb H., Chem. Ber., 1963, Bd. 96, S. 2831.
Houben-Weyl, Bd. 9, S. 407.
23—684
353
510. РИМ (RIEHM)
Получение 2,4-дизамещеиных хинолинов циклоконденсацией гидрохлоридов
ароматических аминов с метилкетонами:
200 °С
+2RCOCH,
•NH.-HC1
R = CH3> C6H5; R' = H,CH3
*А1С13, без катализатора
Вместо амина н кетона можно использовать имины:
R
R = СН3, С2Н5) С6Н5
*Р + HI, A1C1,
Образование смеси изомеров и жесткие условия проведения реакции очень
ограничивают область ее применения.
См. также Скрауп (№ 543).
Engler С, Riehm P., Вег., 1885, Bd. 18, S. 2245.
Эльдерфильд, т. 4, с. 14.
511. РИМШНАЙДЕР (RIEMSCHNEIDER)
Гидратация арилтиоцианатов в эфиры тиокарбаминовой кислоты при про-
продолжительном действии серной кислоты с последующим гидролизом водой:
Аг—SCN
1. 95%-ная H2SO4
2. Н2О
Ar-S-CONH2
(-75%)
Ar = C,H4R, где R = H, CH3, Cl, Br, I, CN, NO2> ОН, ОСН3, СООН и др.
При R=o-COOH, o-OCH3 или o-N02 реакция не идет. Аналогично гидрати-
руются первичные и вторичные алкилтиоциаиаты. Реакция может быть исполь-
использована для идентификации ароматических тиоцианатов.
354
См. также Радзишевский (№ 487), Циглер (№ 686).
Riemschneider R., Wojahn F., Orlick G., J. Am. Chem. Soc, 1951, v. 73, p. 5905;
Angew. Chem., 1952, Bd. 64, S. 420.
Riemschneider R., Orlick G., Monatsh., 1953, Bd. 84, S. 316.
Schmidt K-, Kollek-Bbs P., J. Am. Chem. Soc, 1953, v. 75, p. 6067.
512. РИТТЕР (RITTER)
Получение N-замещенных амидов карбоновых кислот присоединением нит-
нитрилов к олефинам в присутствии концентрированной серной кислоты с после-
последующим гидролизом*:
RCN -Ь R'CH=CR"R'"
[H2SO4]; (CH3COOH)
RCN + R'CH2-CR"R'"
RC=N-CR"R"
CH,R'
н2о
>
RC=N-CR"R"'
НО
CH2R' _
RC-NH-CR"R"'
II I
CH2R'
О
R, R' = H, Alk, At; R", R'"=Alk, Ar
Реакция проходит через стадию образования нона карбония. Кроме развет-
разветвленных олефинов, источником ионов карбония могут быть а,р-непредельиые
карбонильные соединения, вторичные и третичные алкилгалогениды и т. д. Со-
Соединения типов 1,1-дифенилэтилена или трифенилкарбинола не вступают в ре-
реакцию.
В качестве нитрильной компоненты используют также динитрилы, непре-
непредельные нитрилы, циангидрнны альдегидов, тиоциаиаты и 5-метилизоксазол, на-
например:
сн3-/^
/
CH3SCN -f (CH3KCOH
- (сн3Jс=снсоос2нв
:h2ch2cn
CH3SCONHC(CH3K
NHCOCH2COCH3
о
/\NH
Н3С СН3
Побочные продукты — соединения, образующиеся в результате перегруппи-
перегруппировок ионов карбония.
Реакция нитрилов с диолами (синтез Тильманса — Риттера) приводит к
разнообразным гетероциклическим соедииениям:
Н3С
(СН3JС-СН2-СНСН3 + CH3CN
ОН ОН
CH3CN
Ан
х>-
* Называют также реакцией Риттера — Графа (Graf).
23*
355
Превращение амидов в олефины называют обратной' реакцией Риттера
(retro-Ritter), например:
,NHCOC6H5
СН3
:асоосн3 сн„соосн3
См. также Ботт (№ 105), Кох — Хааф (№ 331), Принс (№ 475).
Graf P., нем. пат. 870856 A940).
Ritter J. J. e. a., J. Am. Chem. Soc, 1948, v. 70, p. 4045, 4048; 1952, v. 74,
p. 763.
Tillmanns E. J., Ritter J. J., J. Org. Chem., 1957, v. 22, p. 839.
Ryan R. J., Julia S., «Tetrahedron», 1973, v. 29, p. 3649—3654.
Левкоева E. И., Яхонтов Л. Н. Усп. химии, 1972, т. 41, с. 1337.
Зильберман Е. Н. Реакции нитрилов. М., «Химия», 1972, 251.
OR, v. 17, р. 213.
513. РИХЕ (RIECHE)
Формилирование ароматических соединений взаимодействием с дихлорметил-
алкиловыми эфирами в присутствии хлористого алюминия с последующим гидро-
гидролизом:
О
ArH+Cl2CHOR
ГАг-CHORT
[_ Cl J
F0-90%)
R = CH3 (обычно), С4Н9, СН2С1
*TiCl4, SnCl4, ZnCl2; **CS2, C6H5NO2
В реакцию вступают ароматические углеводороды, фенолы и их эфиры, азу-
лены и гетероциклические соединения, например:
С1. С1.
+ СН3ОСНС1„
<0 °G
ШШ; (CS2>
орто-Замещенные фенолы формилируются в иоро-положение. Фенолы дают
смесь орто- и лсрс-изомеров с преобладанием орго-изомера.
Исходные эфиры могут быть получены из соответствующих формиатов и
пятихлористого фосфора, а в промышленном масштабе — хлорированием хлор-
метнлового эфира.
Подобно дихлорметилалкиловым эфирам реагируют дихлорметилсульфиды:
1. <о°с
2. Н2О
E0-95%)
Ar = C6H6, CeH4Alk, С6Н4-СвН6, С6Н4ОН и др.
См. также Вильсмайер (№ 166), Гаттерман (№ 195).
Rieche A., Gross H., Hoft E., Chem. Вег.. 1960, Bd. 93, S. 88.
356
Gross H., Rieche A., Matthey G., Chem. Ber., Bd. 96, S. 308; 1964 Bd 97
S. 2606.
Gross H., Hoeftt E., Z. Chem., 1964, Bd. 4, № 11, S. 401.
Chardonnens L, Noel F., Helv. chim. acta, 1973, Bd. 56, № 1, S. 280—284.
514. РИХТЕР (RICHTER)
Циклизация солей о-алкиииларилдиазония в 4-оксициннолины:
ОН
N
C0-70%)
R = H, СООН, С6Н5; R' = H, СН3, С1, Вг
Исходные соединения получают диазотированием о-аминоарилацетиленов.
См. также Борше—Кёльш (№ 104), Видман — Штёрмер (№ 161) Небеп—
Боссель (№418).
Richter V., Вег., 1883, Bd. 16, S. 677.
Leonard N. J., Chem. Rev., 1945, v. 37, p. 270
Schofield K., Swain Т., J. Chem. Soc, 1949, p. 2393.
Эльдерфильд, т. 6, с. 117, 123.
515. РИХТЕР (RICHTER)
Превращение иара-замещенных нитробензолов в лета-замещенные бензойные
кислоты под действием цианистого калия в спирте {кит-замещение):
NO,
KCN; 150-270 °С
(С2Н5ОН)
O2N
Н2О
СООН
R = Н, Hal, ОСН3, SO3H
R
A0-50%)
Карбоксильная группа всегда входит в орго-положение к отщепляющейся
NO2-rpynne. Если орго-положеине занято, то реакция не идет. Из At-нитробпом-
бензола получается смесь о- и я-бромбеизойных кислот
357
Richter V., Вег., 1871, Bd. 4, S. 21, 459, 553; 1874, Bd. 7, S. 1145; 1875, Bd. 8,
S. 1418.
Bunnett J. F., Quart. Rev., 1958, v. 12, p. 15.
Rosenblum M., J. Am. Chem. Soc, 1960, v. 82, p. 3796.
Cullen E., L'Ecuyer P., Can. J. Chem., 1961, v. 39, p. 862.
СОП, т. 10, с 14.
516. РОБЕВ (ROBEV)
Перегруппировка фенилгидразонов ароматических альдегидов в N-фенил-
амидины под действием амидов щелочных металлов в присутствии окислителей:
ArCH=N-NHC.H
NaNH2*; О2'*;
нагревание
r
(инертн. растворитель)
ArC=NH-f
[ArCH=N- + -NHC6H6
АтС
(ДО 80%)
*KNH2, LiNH2, CeH5Li, AlkMgX; ** органические перекиси
В реакцию вступают также фенилгидразоны некоторых гетероциклических
альдегидов. При использовании в реакции смеси фенилгидразонов получаются
все возможные изомеры.
Робев С, Докл. Болг. АН, 1954, т. 7, с. 37; 1960, т. 13, с. 159.
Робев С, ДАН СССР, 1955, т. 101, с. 277.
Грандберг И. И., Наумов Ю. А., Кост А. Н. Ж- орг. хим, 1, 805 A965).
Наумов Ю. А., Грандберг И. И., Усп. химии, 1966, т. 35, с. 21.
517. РОБИНСОН —ГАБРИЕЛЬ (ROBINSON R. — GABRIEL)
Циклизация а-ациламинокетонов в оксазолы под действием серной кислоты:
RC— CH2
II
О
NH-CR'
II
О
RC=CH-N=CR'
ОН ОН
R-
"\
*РС16, (СН3СОJО (при кипячении), SOC12 (при кипячении)
Аналогично из а-формиламиноацетофеиона получен 5-фенилоксазол. В основ-
основном метод применяют для синтеза 2,5-дизамещеиных. Соединения с алифатиче-
алифатическими заместителями получаются значительно труднее, чем с ароматическими.
См. также Вреде (№ 178), Дейвидсон (№ 236), Дэйкин —Уэст (№ 238),
Фишер (№ 610).
Robinson R., J. Chem. Soc, 1909, v. 95, p. 2167.
Gabriel S., Ber., 1910, Bd. 43, S. 134, 1283.
Wiley R. H., Chem. Rev., 1945, v. 37, p. 403.
Кондратьева Г. Я., Хуан Чжи-Хэн, ЖОХ, 1962, т. 32, с. 2348.
Wasserman H. H., Vinick F. J., J. Org. Chem,. 1973, v. 38, № 13, p. 2407.
Эльдерфильд, т. 5, с. 243.
358
518. РОБИНСОН —МАННИХ (ROBINSON R. — MANNICH)
Получение бициклических непредельных кетонов алкилированием цикличе-
циклических кетонов четвертичными солями {5-амииокетонов (оснований Манниха) под
действием оснований с последующей циклизацией в результате внутримолеку-
внутримолекулярной альдольной конденсации:
О/
О +
+ CH3COCH2CH2-N(C2H6JCHS I
NaNH2
R
ЧСН2СН2СОСН,
R = Alk, CeH6, COOC2H6, OCOCH3
*RONa, mpem-C4H9OK, NaOH
Аналогично реагируют и другие циклоалканоны (С7—Cis). Проведение реак-
реакции облегчается, если предварительно кетон превращают в а-оксиметиленкетон
конденсацией с НСООС2Н5:
j/X-^ НСООС2Н5
(G2H5ONa)
r;C2H5ONa
:О
•СНО
=СНОН
NaOH
;О
При использовании бис-оснований Манииха получают производные мости-
ковых углеводородов:
н2с-
-со
ch3coch[ch2n(ch3K] 21"
н2с-
соос2н5
-со
сосн.
л = 3-4 ^
Бициклические непредельные кетоиы могут быть получены также присоеди-
присоединением по Михаэлю (см. № 406) циклических E-дикетонов к а,р-иепредельным
кетоиам с последующей циклизацией под действием основания*, например:
* Называют также аннелированием по Робинсону.
359
о
CHSCCH=CH2
II
о
кон
(СН3ОН)
О СН3
СН-СН-СОСН,
2 2
пнрролидин
F5%)
См. также Манних (№ 384).
DuFeu Е. С, McQuilin F. L, Robinson R., J. Chem. Soc, 1937, p. 53.
Mannich C, Koch W., Borowsky F., Ber., 1937, Bd. 70, S. 355.
Levine R., Fernelius W. C, Chem. Rev., 1954, v. 54, p. 506.
Johnson W. S. e. a., J. Am. Chem. Soc, 1960, v. 82, p. 614.
Spencer T. A. e. a., J. Am. Chem. Soc, 1963, v. 85, p. 3785.
Balasubramanion K. e. a., «Synthesis», 1974, № 1, p. 51—53.
OP, т. 7, с 156; OS, v. 41, p. 38.
519. РОБИНСОН —РОБИНСОН
(ROBINSON G. M. — ROBINSON R.)
Получение высших алифатических кетокислот путем расщепления ацилалкил-
ацетоуксусных эфиров последовательным действием щелочи и кислоты:
СООС2Н6
R—С—СО(СН2)„СООС2Нй
СОСН3
1. NaOH
2. H2SO4
3. NaOH;
нагревание
(Ht0) >
RCH2-CO(CH2)nCOOH
R = Alk(C8-Cn); я = 2-8
При наличии в алкильиом остатке функциональных групп можно получить
соответствующие замещенные кетокислоты. Побочными продуктами реакции яв-
являются двухосновные кислоты. Метод не находит широкого применения из-за
трудности выделения продуктов и низких выходов.
Исходные ацилалкилацетоуксусиые эфиры получают по схеме:
Na
CHS—С—С—СООС2Н6 + С1СО(СН2)„СООС2Н5-
II I
О R
С—С
II I
О R
СООС2Н6
-СО(СН2)„СООС2Н6
См. также Боумен (№ 107).
Robinson G. M., Robinson R., J. Chem. Soc, 1925, v. 127, p. 175.
Robinson G. M., J. Chem. Soc, 1930, v. 132, p. 745.
Ames D. E., Bowman R. E., Mason R. G., J. Chem. Soc, 1950, p. 174.
360
520. РОБИНСОН —ШЁПФ (ROBINSON R. — SCHOPF)
Получение тропинона или его аналогов при циклоконденсации диальдегидов
с первичными аминами и ацетондикарбоиовой кислотой*!
ОСОСН2
OHC-(CH2)n-CHO + NH2R + Са /
ОСОСН2
NR (СН2)Д
л=1_4; Ц= Alk,CH2CH2OH
Дикетоны не вступают в реакцию, а кетоальдегиды образуют 1-замещенные
соединения. Из ОНС—СН2—Y—CH2CHO (Y=S, Se, NCH3) также могут быть
получены соответствующие аналоги тропиноиа.
См. также Петренко-Кричеико (№ 450).
Robinson R., J. Chem. Soc, 1917, v. Ill, p. 762, 876.
Schopf C, Lehmann G., Ann., 1935, Bd. 518, S. 1.
Battersby A. R., Quart. Rev., 1961, v. 15, p. 259.
Эльминг Н., Усп. орг. химии, 1964, т. 2, с. 76.
Chapman О. L, Fugiel R. A., J. Am. Chem. Soc, 1969, v. 91, p. 215.
521. РОДИОНОВ
Получение E-амииокислот конденсацией альдегидов с малоиовой кислотой и
аммиаком в спиртовом растворе:
-С" +RCH(COOHJ
Нз; нагревание
(С2Н5ОН) *
-СН—С(СООНJ
NH2 R
—СН—ОН + RCH(COOHJ1
NH2 J
> — СН—СНСООН
NH2 R
R = Н, Alk C5-50%)
В реакцию вступают также некоторые гетероциклические альдегиды, на-
например:
-сно + сн2(соонJ - [СбНз(С5н^нГ ( >-снсн2соон
Кроме аммиака применяют первичные амины. В реакции можно использо-
использовать альдимины:
C,H6CH=NCH3 + С2Н6СН(СООНJ
CeH6CH(NHCH3)CH(C2H6)COOH
* Называют также реакцией Робинсона.
361
При замене малоновой кислоты ее эфирами получают эфиры Р-амииокислот
с выходами ~40%.
Побочный процесс—образование а,|3-иепредельных кислот. В ряду произ-
производных индола (см. Кнёвеиагель, № 305) эта реакция становится основной.
Реакция является одним из удобных и распространенных методов синтеза
Р-аминокислот.
Модификация Джонсона (Jonson Т.) — использование раствора CH3COONH4
в спирте. Позволяет вводить в реакцию ароматические альдегиды.
Модификация Кравченко—Родионова—использование смеси CH-sCOONHU
с ледяной СНзСООН для получения Р-аминокислот нафталинового ряда.
См. также Манних (№ 384).
Rodionow W. M., Malewinskaja E. Th., Вег. 1926, Bd. 59, S. 2952.
Johnson Т., Ebans J., J. Am. Chem. Soc, 1930, v. 52, p. 4993.
Вейганд К. Методы эксперимента в органической химии. Ч. 2. Пер. с нем.
Под ред. В. Н. Белова, М., Издатинлит, 1952, с. 665.
Родионов В. М., Избранные труды. М., Изд. АН СССР, 1958, с. 327.
522. РОЗЕНМУНД (ROSENMUND)
Получение ариларсиновых кислот при действии на арилгалогеииды арсени-
та натрия или калия:
АгВг
K3ASO3;
нагревание
-•" Ar—AsO(OKJ
(водн. С2Н5ОН)*
C0—50%)
Ar=CeH4COOH, CeH5, CeH4CGCH3
Без растворителя в запаянной трубке при 150—200 °С
яара-Замещенные бромбензолы менее реакционноспособны, чем орго-заме-
щенные.
См. также Барт (№ 47), Бешан (№ 71), Мейер (№ 390), Шеллер (№ 704).
Rosenmund К. W., Вег., 1921, Bd. 54, S. 438.
OP, т. 2, с. 465.
523. РОЗЕНМУНД—БРАУН (ROSENMUND — BRAUN)
Превращение ароматических бромидов в нитрилы действием цианида меди:
CuCN; 150-250 °С
АгВг
[C-,HUN]*
ArCN
*CuSO4, CH3CeH4CN, хинолии
Выходы высокие. В качестве растворителей можно использовать диметил-
формамид и N-метилпирролидон. В реакцию вступают также винил-, ацил-, окси-
и ct-алкоксигалогениды, причем бромиды реагируют лучше, чем хлориды. Анало-
Аналогично может быть получен нитрил никотиновой кислоты.
См. также Губен — Фишер (№ 225), Кольбе (№ 312).
Rosenmund К. W., Struck E., Вег., 1919, Bd. 52, S. 1749.
Braun ]., Мат О., Ann., 1931, Bd. 488, S. 111.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 207.
Newman M. S., Boden H., J. Org. Chem., 1961, v. 26, p. 2525.
СОП, т. 3, с 344; т. 4, с. 555; Фьюзон, с. 339; Вейганд-Хильгетаг, с. 765.
362
524. РОЗЕНМУНД —ЗАЙЦЕВ (ROSENMUND)
Каталитическое восстановление хлорангидридов кислот в альдегиды*:
,0 .. _ ,Р
-С'
Н2; 80-180 °С
'\ [Pd/BaSO4]*; (C6He)" \
F0-90%)
*Pd/CaCO3> Pd/C, Ni, Pt; ** толуол, тетралин, декалии
Чтобы избежать дальнейшего восстановления СНО-группы, активность ка-
катализатора снижают добавкой контактных ядов (феиилизотиоциаиат, тиомочеви-
на, 2-меркаптотиазол и т. п.). Наиболее эффективной оказалась тетраметилтио-
мочевииа.
Реакция позволяет получать алифатические, ароматические, алициклические
и гетероциклические альдегиды. Как правило, функциональные группы, имею-
имеющиеся в хлор ангидриде, не затрагиваются. Побочные реакции^ восстановление
альдегидов и гидрогеиолиз хлораигидридной группы до метильиой.
См. также Грундман (№ 223), Райссерт (№ 492>, Уолфром — Карабинос
(№ 587).
Saytzeff M., J. prakt. Chem., 1873, Bd. 6, S. 130.
Rosenmund К. W., Ber., 1918, Bd. 51, S. 585.
Affressman S., Thomson S. J., J. Chem. Soc, 1962, p. 2024.
Ayres D. C, Carpenter B. G., Denney R. C, J. Chem. Soc 1965, p. 3578.
СОП, т. 3, с 16; OP, т. 4, с 337.
525. РОУ (ROWE)
Перегруппировка 3-арилфталазонов в 2-арилфталазоны при нагревании с
разбавленной кислотой:
1,2 н. НС1 100 °С
(Н2О) *
ОН
R
1 +
О
N—NHAr
R = Н, СН3
II
О
30-75%
* Называют также реакцией Розеимунда или Розенмунда — Карга (Karg).
363
Введение в Аг электроиодоиориых заместителей, как правило, способствует
перегруппировке; при Аг=СбН6, СбН4МН2 перегруппировка ие идет. При повы-
повышении концентрации кислоты выходы уменьшаются. В случае R=CH3 при тем-
температуре, ие превышающей 150 °С, и концентрации кислоты менее 1 и. образу-
образуются N-ариламино-З-метиленизоиидолоиы-1:
СН3
сн.
0.9 н. HCI: 150 °С
г
N-NHAr
О
Длительным нагреванием при 180 СС полученные продукты могут быть пре-
превращены в 2-арилфталазоиы.
Rome F. M. e. a., J. Chem. Soc, 1926, p. 690.
Vaughan W. R., Chem. Rev., 1948, v. 43, p. 487.
Эльдерфильд, т. 6, с. 206.
526. РУЖИЧКА (RUZICKA)
Получение циклических кетоиов пиролизом солей дикарбоиовых кислот в
вакууме:
(СН3)„ (СН3)„
/ \ 380-400 °С / \
^ ХСН2СОО *¦ Н2с' \Н2
COO" С=О
п = до 31
В реакции могут быть использованы соли Са, Th, Се, V, Zr, Pb и Ва. Вы-
Выходы кетоиов зависят от размера кольца: Сб—Се 80%, С7—Се—10—20%,
С»—С13 — 0,5%, затем выходы несколько повышаются (для Ci7~8%) и далее
снова падают до ~2%. Побочная реакция — образование макроциклических
дикетоиов (до С34) •
Промышленные варианты процесса — нагревание смеси кислот с окислами
указанных металлов при пропускании паров кислоты иад окислом металла.
См. также Блаи (№ 84), Бломквист (№
(№ 680), Циглер (№ 687).
Хэисли — Прелог — Штолль
Ruzicka L., SMI M., Schinz H., Helv. chim. acta, 1926, Bd. 9, S. 249.
Houben-Weyl, Bd. 4, T 2, S. 754.
СОП, т. 1, c. 518.
527. РУПЕ (RUPE)
Перегруппировка ацетиленовых спиртов в а,{5-иепредельиые метилкетоиы
при кипячении с муравьиной кислотой:
ОН
RCH,-C—C=CH
НСООН»;
нагревание
6-н
ss—С С='
R'
СН2
364
RCH=C—C=»CH2 > RCH=C—С—СН3
R' ОН
*Р2О6 в бензоле; Дауэкс 50
Под действием РгО6 перегруппировка, по-видимому, происходит через ста-
стадии дегидратации и гидратации:
,ОН
с=сн Z
о
(-70%)
См. также Мейер — Шустер (№ 394).
Rupe H. e. a., Helv. chim. acta, 1926, Bd. 9, S. 672; 1928, Bd. 11, S. 449; 1931,
Bd. 14, S. 708.
Ckanley J. D., J. Am. Chem. Soc, 1948, v. 70, p. 244.
Hennion G. F., Davis R. В., Maloney D. E., J. Am. Chem. Soc, 1949, v. 71,
p. 2813.
Newman M. S., J. Am. Chem. Soc, 1953, v. 75, p. 4740.
Swaminathan S., Narayana K. V., Chem. Rev., 1971, v. 71, p. 429.
СОП, т. 4, с 82.
528. РУПЕ (RUPE)
Перегруппировка а-цииеиовой кислоты в героиовую под действием серной
кислоты:
конц. H2so4
О ^СООН
Н3С.
н3с/_0/ Vooh
¦ v (СНзJС-(СН2K-С-СН3
I II
соон о
Р-Цииеиовая кислота, (СН3JС=СНСНгСН2(ОН) (СН3)СООН, в этих ус-
условиях также перегруппировывается в героиовую кислоту.
Rupe H., Liechtenhan С, Вег., 1908, Bd. 41, S. 1278.
Dahn H., Reichstein Т., Helv. chim. acta, 1952, Bd. 35, S. 12.
Meinwald J., J. Am. Chem. Soc, 1955, v. 77, p. 1617.
Hasbrouch R. W., Andersen A. D., J. Org. Chem., 1973, v. 38, № 11, p. 2103—
2106.
529. РУФФ (RUFF)
Превращение алкилтрихлорсилаиов в алкилтрииодсиланы действием анили-
анилина с последующей обработкой йодистым водородом:
QsHuNH2 HI
RS1CI3 > R-Si(NHCeHBK i
A-бНб)
R = H, Alk
RSiL
365
Аналогично получают диалкилдииодсилаиы. Триалкилиодсилаиы и алкокси-
трииодсилаиы не удалось получить этим методом.
См. также Иборн (№ 272), Фиикельштайи (№ 602), Флуд (№ 618).
Ruff О., Вег., 1908, Bd. 41, S. 3738.
Anderson Н. И., J. Am. Chem. Soc, 1951, v. 73, p. 2351.
530. РУФФ — ФЕНТОН (RUFF —FENTON)
Укорочение углеродной цепи моносахаридов на одно звено при действии пе-
перекиси водорода на соль альдоновой кислоты в присутствии ионов трехвалент-
трехвалентного железа:
соо-
H-i-
он
снон
I
Н2О2; < 60 °С
?Fe3+]
¦соо-"
с=о
снон
сно
снон
I
C0-50%)
Обычно применяют бариевые или кальциевые соли альдоиовых кислот. Ис-
Использование ионообменных смол для удаления неорганических ионов существен-
существенно облегчает очистку продуктов и повышает их выходы.
См. также Блэз — Герен (№ 90), Веермаи (№ 149), Воль (№ 172), Криге
(№ 341), МакДоиалд—Фишер (№ 379), Малапрад (№ 382), Феитои (№ 598),
Шпеиглер — Пфаиенштиль (№ 720).
Fenton H. J. H., Proc. Chem. Soc, 1893, v. 9, p. 113.
Ruff О., Вег., 1898, v. 31, p. 1573; 1899, v. 32, p. 550, 3672; 1901, v. 34,
p. 1362.
Гахокидзе А. М., ЖОХ, 1950, т. 20, с. 289.
Moody Q. J., Adv. in Carbohydrate Chem., 1964, v. 19, p. 168.
531. РЭПСОН (RAPSON)
Получение трифеииленов взаимодействием циклогексеиилциклогексанона и
арилмагиийбромидов с последующей циклизацией в октагидротрифенилены и де-
дегидрированием последних:
R
R
(cs2)
366
R,R'=H,CH3,OCH3
* SnCl4, HFFe3B.), A12O3, ThO2; ** [Pd/c]
Наилучший результат (выход ~30%) получен при применении в качестве
катализатора на стадии циклизации смеси СаО+АЬОз+ТЬОг. При R=R'=CH3
реакция идет с низким выходом (~2—3%).
Rapson W. S., J. Chem. Soc, 1941, p. 15.
Barker С. С, Emmerson R. G., Periam J. D., J. Chem. Soc, 1955, p. 4482.
Buess С M., Lawson D. D., Chem. Rev., I960, v. 60, p. 315.
532. САБАТЬЕ — МЭЛЬ (SABATIER — MAILHE)
Восстановление алифатических кислот в альдегиды действием муравьиной
кислоты в присутствии окисиых катализаторов:
НСООН; 300-350 °С
RCH2COOH 77П^-Г. ^ RCH2CHO
E0-70%)
[МпО2]*
R = Alk, CeH6) -
*Ti2O8, Na2Ti08
Аналогично восстанавливаются дифеиил- и алкеиилуксусиые кислоты.
См. также Акабори (№ 9), Мак-Фейдиен — Стивеис (№ 381).
Sabatier P., Mailhe А., С. г., 1912, v. 154, р. 561.
Моигеаи И., Chovin Р., Bru.net М„ Bull/ Soc. chim. France, 1948, v. 15, p. 96.
Houben-Weyl, Bd. 7, S. 278.
533. САБАТЬЕ—САНДЕРАН (SABATIER—SENDERENS)
Парофазиое каталитическое гидрирование непредельных соединений в при-
присутствии тоикоизмельчеииого никеля:
V
/ H2; нагревание \ /
^—*" с—с
[№1 7н h4
Ароматические и ацетиленовые соединения также восстанавливаются этим
методом. Аналогичным образом нитрилы алифатических кислот восстанавлива-
восстанавливаются до первичных аминов:
—C=N > —CH2NH2
367
Этот способ дает лучшие результаты, чем восстановление нитрилов цинком
в соляной кислоте, иазываемое реакцией Мендиуса (Mendius).
См. также Брауи (№ 108), Швенк—Папа (№ 702).
Mendius О., Ann., 1862, Bd. 121, p. 129.
Sabatier P., Senderens J. В., С. г., 1899, v. 128, p. 1173; 1907, v. 132, p. 1254;
Ann. chim., 1905, v. 4, p. 344, 355, 367, 415.
Sabatier P., Ber., 1911, Bd. 44, S. 1984.
Новые методы препаративной органической химии. Пер. с аигл. Под ред.
Д. Н. Курсанова. М., Издатинлит, 1950, с. 218.
534. САЙМОНС (SIMONS)
Электрохимическое фторирование органических соедииеиий в безводном фто-
фтористом водороде:
Н-С-
жидк. HF; ~5В; 0,0008—0,02 А/см2; ~0°С
В реакции происходит, как правило, полное замещение атомов водорода
на фтор с образованием перфторсоедииеиий, например:
CH3-SO2F >- CF3-SO2F
(96%)
Н2С—СН2 F2C-CF2
НгС СН2 >¦ F2C CF2
О
Н2С—СН2
о
D2%)
F2C-CF2
< >
Н2С—СН»
<
F2C—CF2
В процессе фторирования обычно затрагиваются некоторые функциональные
группы:
С7Н15СООН v C7H15COF
CS2 > CF3SF6
ROH >¦ Смесь перфторуглеводородов
C8H17SO2C1 >- C8H17SO2F + С8Н18
B5%) B1%)
В случае непредельных соединений происходит присоединение фтора по
кратным связям, например:
CF2
N
F2C
F2C
CF2
Аг.
368
Вследствие малой растворимости в жидком HF углеводороды и алкилгало-
геииды фторируются только в присутствии фторидов щелочных металлов, уве-
увеличивающих электропроводиость растворов.
Преимуществами метода являются простота аппаратуры и сравнительно де-
дешевый источник фтора.
См. также Гракаускас (№ 215).
Simons L, J. Electrochem. Soc, 1949, v. 95, p. 47.
Бердон Дж., Тетлоу Дж. Успехи химии фтора. Т. 1—2, Пер. с аигл. Под ред.
А. П. Сергеева, М., Издатинлит, 1964 г., с. 472.
Рожков И. И., Бухтияров А. В., Кнунянц И. Л. Изв. АН СССР, ОХН, 1972,
с ИЗО.
РИМИОС, т. 6, с. 343.
535. САРЕТТ (SARETT)
Введение 17<х-оксигруппы в молекулу стероида с кето-группой в положении
20 через стадии получения циаигидрииа, дегидратации его в непредельный иит-
рил, гидроксилироваиия четырехокисью осмия с последующим расщеплением
сульфитом натрия:
R
.он
•CN
poci3,c5h5n;
кон
С—CN
2.Na2SO3,
cro3 v
р=сн3,сн2ососн3
(-50%)
Метод является общим для введения 17а-оксигруппы и применяется, в част-
частности, для синтеза кортизона.
Модификация Хеера—Мишера (Неег — Mischer)—использование КМпСч в
ацетоне, содержащем пиперидин, вместо OsCu и Na2SC>3 (выходы ~70%)-
См. также Криге (№ 339).
Sarett L. H., J. Am. Chem. Soc, 1948, v. 70, p. 1454.
Heer J., Miescher K., Helv. chim. acta, 1951, Bd. 34, S. 359.
Физер Л., Физер М. Стероиды. М., «Мир», 1964, с. 660.
536. СВАРТС (SWARTS)
Замена галогена в полигалогензамещениых органических соединениях иа
фтор при действии трехфтористой сурьмы:
\
V у
sbF6
»- ЧС—
)• /
» С
[SbCI5]; (CICH2-CH2C1 )• / ,
Х=С1, Br, I
* Бензотрифторид, этилцеллозольв, без растворителя
24—684
369
Иод и бром обмениваются легче, чем хлор. Легкость обмена уменьшается
в ряду: СС13 > СС1з > СНСЬ- Замена галогена на фтор в группах СНХ,
СН2Х, CRX происходит очень редко. В случае полигалогеипроизводиых полное
перегалогеиироваиие практически невозможно, так как стоящие рядом полига-
логеиалкильиые группировки взаимио затрудияют обмеи:
СС14 > CF2C12 + CFC13
СНС1=СС1-СНС12 v CHC1=CC1-CF3
СС13—CCI2—CCI3 у CFSC1—CC12—CFC12
СС13—СО—CQ3 v CF2C1—CO—CFCI2-fCF2Cl—CO—CF2C1 + CF3—CO—CF2C1
F2%) B9%) D%)
Особенно легко замещается атом хлора, сопряженный с кратной связью, а
также хлор в хдораигидридах кислот.
В промышленности для синтеза фреоиов широко применяется безводный HF
в присутствии соединений сурьмы.
См. также Гришкевич — Трохимовский—Мак-Комбн (№ 221).
Smarts F., Acad. roy. Belg., 1892, v. 24, p. 309.
Гудлицкий М., Химия органических соединений фтора. Пер. с чешек. Под
ред. А. П. Сергеева, М., Госхимиздат, 1961, с. 83.
Шеппард У., Шартс К. Органическая химия фтора. Пер. с англ. Под ред.
И. Л. Кнунянца, «Мир», 1972, стр. 68.
ОР, т. 2, с. 61.
Синтезы фторорганических соединений. Под ред. И. Л. Киуияица и
Г. Г. Якобсона, М., «Химия», 1973, 312 с.
537. СЕРГЕЕВ
Получение фенола и ацетона окислением изопропилбеизола кислородом
воздуха с последующим разложением образовавшейся гидроперекиси изопропил-
изопропилбеизола сериой кислотой*:
СН(СНз)г
О2; 120
3-4 кг
^\/С(
[0,1%-ный р-р СбН3С(СН3JООН] L У ООН
H2SO4; 20-90 °С
он
о
II
СНз-С-СН3
Продукты образуются с количественными выходами. В аналогичную реак-
реакцию вступают углеводороды типа C6H5CH(CH3)R (R = CSH5, w-C3H7> я-С4Н9).
При окислении диалкилбензолов образуются карбинолы, диоксибеизолы, алкил-
феиолы.
Побочные продукты: а-метилстирол, ацетофеиои, диметилфеиилкарбииол.
Реакцию можно использовать для получения различных кислородсодержа-
кислородсодержащих соединений (альдегидов, кетоиов, кислот, спиртов и др.) направленным раз-
разложением гидроперекисей жириоароматических углеводородов.
* Реакция была открыта в 1942 г. Р. Ю. Удрисом в лаборатории П. Г. Сер-
Сергеева. В течение последующих пяти лет был разработан технологический процесс
и выполнен проект промышленной установки, построенной и пущенной в экс-
эксплуатацию в 1949 г. Аналогичный процесс разработали Хок и Лаиг (Hock —
Lang) в 1944 г. (выходы фенола не превышают 90%, а ацетона — 60%).
370
См. также Дау (№ 233).
Hock H., Lang S., Ber., 1944, Bd. 77, S. 257.
Hock H., Kropf H., Angew. Chem., 1957, Bd. 69, S. 319.
Kropf H., Bernert С R., Ann., 1971, Bd. 751, S. 109—126.
Окисление углеводородов в жидкой фазе. Под ред. Эмануэля Н. М. М., Изд.
АН СССР, 1959, с. 197, 207.
Кружалов Б. 3., Голованенко Б. И. Совместное получение фенола и ацетона.
М., Госхимиздат, 1963, 200 с.
538. СЕРИНИ (SERINI)
Превращение моноацетатов гликолей в кетоиы при обработке цинковой
пылью*:
СНОСОСНд
—ОН гп(пыль);
нагревание
(с6н5сн3
Реакция проходит с обращением конфигурации и применяется в химии сте-
стероидов.
См. также Беаль —Соммле (№ 52).
Serini A., Logemann W., Hildebrand W., Ber., 1939, Bd. 72, S. 391.
Shoppee C. W., J. Chem. Soc, 1949, p. 1671.
Goto Т., Kishi K., J. Chem. Soc. Japan, 1962, v. 83, p. 1236.
Ghera Eugene, J. Org. Chem., 1970, v. 35, p. 660.
Физер Л., Физер М. Стероиды. Пер. с англ. Под ред. Н. Н. Суворова и
И. В. Торгова, М., «Мир», 1964, с. 644.
539. СЕРЕНСЕН (SORENSEN)
Получение а-аминокислот алкилироваиием натриевого производного фтал-
имидомалоиового эфира алкилгалогенидами с последующим гидролизом:
СО
N-C(COOC2H6J +
n-C(COOC2H6J
нагревание
RCH—СООН
NH,
I, Вг
* Называют также реакцией Логемаиа (Logemann) — Сериии.
24*
371
Метод представляет собой вариант реакции Габриеля (№ 186) и позволяет
получать разнообразные а-амииокислоты, например:
СО
:N-C(COOC2H6J + С1СН2СООС2Н6
CO Na
^N-C(COOC2H6J -f Br(CH2)8Br
СО Na
¦*- НООС—СН2—СН—СООН
NH2
(-40%)
НОСН2(СН2JСН-СООН
NH,
Sdrensen S. P. L, С. г., 1903, v. 6, р. 1.
Sheehan J. С, Bolhofer W. A., J. Am. Chem. Soc, 1950, v. 72, p. 2786.
Вейганд-Хильгетаг, с. 416; СОП, т. 4, с. 67.
540. СИММОНС — СМИТ (SIMMONS — SMITH R. D.)
Получение циклопропанов из олефинов действием йодистого метилена и
цинк-медной пары:
\ /
;с=с +ch2i
Zn-Cu;
нагревание
*-
(эфнр)
V
ICH2-ZnI
V
-Znl, /\ /~\
CH2
C0-70%)
Из СНгЬ и цинк-медной пары образуется йодистый иодметилцинк (ре-
(реагент Симмонса — Смита), который и присоединяется к олефину. Другие мети-
ленгалогениды в реакцию не вступают.
В реакцию вступают также олефины, содержащие функциональные группы,
жирноароматические и непредельные гетероциклические соединения и циклооле-
фины (Ce—C12), например:
СН8ООС—СН=СН2 >- СН3ООС-
С6Н6СН=СНСН3
C0%)
ч/
E4%)
Ч/
сн„
о
о
F5%)
В случае диенов образуется смесь продуктов, например:
СН2=СН—(СН2J—СН=СН2 *¦ СН
A8%)
"(СН2J-
C6%)
372
Наличие гидроксильной группы в молекуле олефииа приводит к более вы-
высоким выходам соответствующих продуктов:
ОН ОН
D8%)
Замена цинк-медной пары цинк-серебряной парой приводит обычно к суще-
существенному увеличению выхода продуктов. Так, например, в случае метилакрила-
та при замене цинк-медной пары цинк-серебряной парой выход эфира цикло-
пропанкарбоновой кислоты возрастает с 9 до 80%.
См. также Ипатьев (№ 276).
Simmons Н. Е., Smith R. D., J. Am. Chem. Soc, 1958, v. 80, p. 5323; 1959,
v. 81, p. 4256.
Perraud R., Arnaud P., Bull. Soc. chim. France, 1968, p. 1540.
Sawada S. e. a., J. Org. Chem., 1968, v. 33, p. 1767.
Poulier С D., Friedrich E. C, Winstein S., J. Am. Chem. Soc, 1969, v. 91,
p. 6892.
Denis J. M., Girard C, Conia M., «Synthesis», 1972, p. 549.
Yoska J., Fajkos J., Budesinsky M., Coll. Czech. Chem. Comm., 1974, v. 39,
№ 7, p. 1914—1924.
Физер, т. З, с. 286; т. 5, с. 400.
541. СИМОНИНИ (SIMONINI)
Получение сложных эфиров действием иода на серебряные соли карбоно-
вых кислот*:
12; нагревание
RCOOAg ,_,_, >¦ RI
RCOOAg
RCOOR
(эфнр)
A0-80%)
R = Alk, CH2CeH6> C(C,,H6)S) CeH6
Серебряные соли дикарбоновых кислот в этих условиях превращаются в
лактоны:
AgOOC(CH2)nCH(R)COOAg » О=С-(СН2)„-СВД
I
—О-
F0-80%)
R = Н, СН3, изо-С6Ни; п = 2,3
При эквимольиом соотношении RCOOAg и Ь образуются алкилиодиды (см.
Бородин — Хунсдиккер, № 100).
Birnbaum К., Ann., 1869, Bd. 152, S. 111.
* Называют также реакцией Бирнбаума (Birnbaum) — Симонини.
373
Simonini A., Monatsh., 1892, Bd. 13, S. 320; 1893, Bd 14 S 81
ZMZr\y-^ «Tetrahedron», 1971, v. 71.'p.'6323.
OP, т. 9, с 445, 475
542. СИМОНИС (SIMONIS)
Образование хромонов при конденсации фенолов с р-кетоэфирами под дей-
действием пятиокиси фосфора:
R'"OOC
О
нагревание
CR'
о
•R"
R'
A0—30%)
Эта реакция является вариантом конденсации Пехмана (см. № 453), приво-
приводящей к кумаринам. Фенолы, которые с трудом вступают в реакцию Пехмана
(га-крезол, р-нафтол, галогенфенолы и др.) или совсем не вступают в эту реак-
реакцию (нитрофенол, о-крезол, фенолкарбоновые кислоты, гидрохинон и др.), в при-
присутствии РгОб образуют хромоны. Наличие электроноакцепторных заместителей
в ядре фенола, а также а-алкнльных групп в кетоэфирах облегчает образование
хромонов.
См. также Менцер (№ 396).
Simonis H., Lehmann С. В. А., Вег., 1914, Bd. 47, S. 692.
Sethna S. M., Shah N. М., Chem. Rev., 1945, v. 36, p. 14.
Badawi M. M-, Faxer M. В. Е., «Tetrahedron», 1965, v. 21, p. 2925.
Эльдерфильд, т. 2, с. 191, 322.
543. СКРАУП (SKRAUP)
Получение хинолинов нагреванием первичного ароматического амина с гли-
глицерином в присутствии окислителя и дегидратирующего агента, превращающего
глицерин в акролеин:
+ СН2=СН-СНО
60-90%-ная H2SO4*
нагревание
NH,
онс
сн2
-СН2
NH ' "" "N
R = H, Hal, N02, OH, OR', NR?, и др.
*H2SO4 (конц.), Н8РО4; **ArNO2 (соответствующий исходному амину),
AszO6, I2, SnCl4, jm-O2NC6H4SO3H и др.
Замена глицерина готовым акролеином приводит обычно к сильному осмо-
лению продукта. При использовании а-замещенных акролеинов и их производ-
производных образуются 3-алкилхинолины, из винилкетонов — 4-алкилхинолины. мета-За-
мещенные амины дают смесь 5- и 7-замещенных хииолинов, соотношение кото-
374
рых определяется характером заместителя: электронодонорные заместители спо-
способствуют образованию 7-замещенных, а при наличии электроноакцепторных за-
заместителей в смеси преобладают 5-замещенные хинолины. Конденсированные си-
системы, содержащие аминогруппу, а также ароматические диамины легко всту-
вступают в реакцию.
Модификация Иэйла (Jale)—проведение реакции в Н3РО4 при 100 °С с ис-
использованием акролеина или веществ, способных к его образованию.
См. также Бэлли — Шолль (№ 132), Дёбнер (№ 245), Дёбнер — Миллер
(№ 246), Комб (№ 315), Кэмпс (№ 348), Ниментовский (№ 426), Рим (№ 510).
Skraup Z. Н., Вег., 1880, Bd. 13, S. 2086; 1882, Bd. 15, S. 897.
Badger G. M. e. a., Austral. J. Chem., 1963, v. 16, p. 840.
Denton D. A., Suschitzky H., J. Chem. Soc, 1963, p. 4741.
Каневская С. И., Мелентьева Г., ЖОХ, 1953, сб. 1, с. 679.
Каневская С. И. В кн.: «Сборник статей по общей химии». М.-Л., Изд. АН
СССР, 1953, с. 679.
ОР, т. 7, с. 100.
544. СМАЙЛС (SMILES)
Изомеризация замещенных ароматических соединений (диариловых эфиров,
диарилсульфидов, -сульфоксидов, -сульфонов, ариловых эфиров сульфо- и карбо-
новых кислот ароматического ряда и др.) под действием щелочей в результате
внутримолекулярного нуклеофильного замещения:
R'
R = Н, СН8, Hal; R' = Н, NO, NO2, Hal; Y = S, SO, SO2, SO2O, O, COO;
ZH = OH, SH, NHOH, NH2, SO2H, OR", CONHR", SO2NHR", NHR" (где R" = Alk, Ar)
*KOH, NaNH2 в бензоле, К2СО3 в диметилформамиде;
**СН8ОН, С2Н6ОН, (СН3JСО, водн. (СН3JСО или С2Н6ОН
Перегруппировка наблюдается не при всех комбинациях Y и ZH. Реакция
облегчается при возрастании нуклеофильной способности аниона Z~ и при на-
наличии электроноакцепторных R'.
Аналогично перегруппировываются соединения, содержащие вместо одного
из ароматических радикалов конденсированную систему, гетероциклический или
алифатический радикал:
•SCH,
F4%)
375
•N02
ex
CH,CHoOH
N02
O-CH2CH2SOH
Если нуклеофильность анионов Y~ и Ъ~ близка, то перегруппировка может
быть обратимой, например:
НЯС.
Н3С.
.so,—
/
« NO2
Реакция Трюса (Truce) — Смайлса — перегруппировка о-метилдиарилсульфо-
нов под действием я-С4НдЦ:
SO2Ar
K-C4HgLi»
¦SO2H
> R
* mpem-C4Hg0K в (CH^SO
В отличие от перегруппировки Смайлса в этом случае легко происходит ми-
миграция неактивированного ароматического остатка, в частности иафтила.
См. также Гровеиштайи — Циммерман (№ 222), Стивеис (№ 554), Хаяши
(№ 645).
Warren L. A., Smiles S., J. Chem. Soc, 1930, p. 957, 1327.
Bunnett J. F.i Zahler R. E., Chem. Rev., 1951, v. 49, p. 362.
Truce W. E., Ray W. J., J. Am. Chem. Soc, 1959, v. 81, p. 481, 484.
Дрозд В. Н., Трифонова О. И., Ж- орг. химии, 1971, т. 7, с. 1926.
Schneller S. W., Int. J. Sulfur Chem., 1973, v. 8, № 3, p. 485—503.
OR, v. 18, p. 100.
545. СМИДТ (SMIDT)
Окисление алкенов-1 в метилкетоны действием водного раствора хлористого
палладия*:
PdCl2
R-C=CH2 —-*¦ R-C-CH3
| (H2O) ||
H О
R = Н, Alk (до Q)
Для регенерации PdCl2 используют кислород в присутствии СиС12, перекись
водорода или я-бензохинон. В случае высших олефинов окисление проходит бо-
более гладко в водном диметилформамиде (~1О°/о Н2О):
R(CH2)8-CH=CH2 » R(CH2)8-COCH3
(~80%)
R = СН3, СООН
* Окисление этилена в уксусный альдегид в указанных условиях называют
также Уэйкер (Wacker)-процессом.
376
При действии иа олефины спиртовых растворов PdCl2 образуются ацетали
или кетали, например:
CHB=CHCN > (CH3OJCHCH2CN
G0%)
О
(СН3ОН)
PdCI2
(НОСН2СН2ОН)
1,1- и 1,2-Дизамещенные олефины в реакцию ие вступают.
См. также Деииже (№ 243).
Smidt J. e. a., Angew. Chem., 1959, Bd. 71, S. 176.
Clement W. H., Selwitz С. М., J. Org. Chem., 1964, v. 29, p. 241.
Stewart R. Oxidation mechanisms. New York, W. A. Benjamin, Inc., 1964,
p. 86.
546. СМИРНОВ-ЗАМКОВ
Циклодимеризация диметилацетилена с одновременным хлорированием под
действием хлористого сульфурила с образованием замещенного циклобутена:
2СН,-С=С-СН,
SO2GI2
сн„
С1
-сн,
-сн„
A5%)
Использование вместо SO2C12 смеси хлора с эфиратом трехфтористого бора
позволило повысить выход до 45%. Реакция идет по радикальному механизму;
добавка органических перекисей существенно ускоряет процесс. Другие ацети-
ацетилены в данных условиях ие димеризуются.
Побочные реакции: присоединение SO2C12 к диметилацетилену и образова-
образование 2,3-дихлорбутена-2.
Смирнов-Замков И. В., ДАН СССР, 1952, т. 83, с. 869.
Смирнов-Замков И. В., Крстромина Н. А., Укр. хим. ж., 1955, т. 21, с. 233.
Grigee R., Moschel A., Chem. Ber., 1959, Bd. 92, S. 2181.
OP, т. 12, с 22.
547. CMIT (SMITH F.)
Полное расщепление полисахарида периодатиым окислением а-гликольиых
группировок с последующим восстановлением образовавшегося полиоксиальде-
гида боргидридом натрия и кислотным гидролизом ацетальиых связей в получае-
получаемом полиспирте:
377
СН2ОН
СН,О11
сн2он сн2он
' J——о
он
сн2он
4^"
сн2он
сн2он
онс
сн2он
X
онс
сн2он
1
он
сн2он сн2он
¦о. J—-о.
он
|.\аВН4
сн,он
онс \но
он
нон,с
СН2ОН СН2ОН
но-- сно -i-он
+ 1 - I
•••-о— сн2он -•— он
. сн2он сн2он
о-
он
он
СНО
но
сн2он
НО— СНО
+ I +
сн,он
СН2ОН
-о.
но
он
Ч.ОН
'О —
он
В полиальдегиде, образующемся в результате периодатного окисления, аце-
тальные связи гораздо более чувствительны к действию кислот, чем гликозидные.
Это различие открывает возможность избирательного окисления полисахарида
по ацетальным связям с сохранением гликозидных связей моносахаридных звень-
звеньев, не расщепившихся при действии периодата. Неустойчивость полиальдегидов
в кислой среде сильно осложняет картину гидролиза, поэтому их предварительно
восстанавливают до полиспиртов, а затем гидролизуют.
Метод применяется для определения строения олиго- и полисахаридов.
Smith F., J. Am. Chem. Soc, 1952, v. 74, p. 4970.
Aspinall G. 0., Ross K- M., J. Chem. Soc, 1963, p. 1681.
Henrick С A. e. a., Austral. J. Chem., 1970, v. 23, p. 329.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 499.
Fransson L. A., Carlstedt J., Carbohydrate Res., 1974, v. 36, № 2, p. 349—358.
548. СОДИ (SAWDEY)
Перегруппировка 4-арилазооксазолидонов-5 в замещенные 1,2,4-триазолы под
действием оснований:
ArNHN.
0=
N
НООС
кон*
(СН3ОН)
б
Ч
\ N
NAr
378
Ar = C6H6> CeH4CH3, CeH4OCH3, CeH4Br
*NH3) NH2NH2, Na2CO3
В некоторых случаях в этих условиях образуются ациклические соединения,
например C6H5CONHC( = NNHCeHs)COOH. В кислой среде перегруппировка
ие идет.
Sawdey G. №., J. Am. Chem. Soc, 1957, v. 79, p. 1955.
Browne E. J., Polya J. В., J. Chem. Soc, 1962, p. 5149.
549. СОММЛЕ (SOMMELET)
Получение альдегидов действием на алкилгалогениды уротропина с после-
последующим гидролизом:
нагревание
+ х- ^^г-
> [RCH2N=CH2 v RCH=N-CH3] >- RCHO
Х = С1, Br, I; R = Alk, Ar
* 50—80%-ная СН3СООН
Ароматические альдегиды получаются с выходами 50—80%; электроноакцеп-
торные заместители в ядре затрудняют реакцию. Галогенметильные производные
фенолов образуют сложные продукты конденсации. На реакцию существенно
влияют стерические факторы. Так, о,о-дизамещенные бензилгалогениды ие дают
соответствующих альдегидов. Реакция позволяет получать м- и я-диальдегиды,
а также гетероциклические альдегиды (ряда тиофена, пиридина, тиазола), на-
например:
Н3С. Н„
CICH
-СН2С1
сн3
f Va-ш
онс—
СНО
Побочным процессом является образование АгСНгЫНСНз.
Алифатические альдегиды получаются, как правило, с низкими выходами
вследствие легкого протекания дальнейших превращений.
Вариантом этой реакции является получение ароматических, алифатических
и гетероциклических альдегидов из аминов по Ле Энаффу (Le Henaff):
C8Hl2N4
CNH Ь
F0-80%)
См. также Дафф (№ 234), Делепин (№ 241), Корнблюм (№ 323), Крёнке
(№ 338), Хасс —Бендер (№ 642).
Sammelet М., С. г., 1913, v. 157, р. 852; Bull. Soc. chim. France, 1913, v. 13,
p. 1085.
Le Henaff P., Ann. chim., 1962, v. 7, p. 367.
СОП, т. 4, с 474; OP, т. 8, с. 263.
379
550. СОММЛЕ (SOMMELET)
Перегруппировка солей триалкилбензиламмония в третичные амины, содер-
содержащие о-алкилбензильную группу, под действием сильных оснований*-:
R CH2R"
H-NR2
R"
R"
NR2
CH2R
[CeHjjLi]*
+ *NaNHa в жидк. NH3, hv
Многократное повторение перегруппировки позволяет заменить все атомы
водорода бензольного кольца на алкильные группы. С помощью перегруппиров-
перегруппировки могут быть получены гетероциклические системы, например:
Н2С—СН2—СН2
NaNH2 в NH3 (^^^ \
Аналогично реагируют соли сульфония:
Н2С—N—СН2
СН3
:сн2
+S(CH3J
В некоторых случаях одновременно протекает перегруппировка Стивенса
(см. № 554).
Sommelet M., С. г., 1937, v. 205, р. 56.
Hauser С. R. e. a., J. Am. Chem. Soc, 1953, v. 75, p. 2660.
Pine S. H., Sanchez B. L, «Tetrahedron Letters», 1969, p. 1319.
Ингольд, с. 516; OR, v. 18, p. 416.
551. СОУДЕН-ФИШЕР (SOWDEN - FISCHER H. O. L.)
Удлинение углеродной цепи Сахаров на одно звено конденсацией альдоз с
нитрометаном и последующим действием щелочи и кислоты:
СНО CH2NO2
NaOH
СНОН + CH3NO2
(СН3ОН)*
СНОН
I
СНОН
CH=NO2Na
СНОН
СНОН
I
*(CH3JSO, Н2О
СНО
СНОН
СНОН
* Называют также реакцией Соммле — Хаузера (Hauser).
380
Смесь эпимеров, образующаяся при реакции Сахаров с CH3NO2, легко раз-
разделяется дробной кристаллизацией и гладко по реакции Нефа (см. № 423) пре-
превращается в альдозы. D-Глюкоза не конденсируется с CH3NO2. Конденсацией
альдоз с натриевой солью а^и-формы 2-нитроэтанола можно нарастить сразу два
звеиа. Метод во многих случаях предпочтительнее циангидринового (см. Килиа-
ни — Фишер, № 292).
1511.
См. также Анри (№ 17).
Sowden J. С, Fischer Н. О. L., J. Am. Chem. Soc, 1946, v. 68, p. 1
Septon H. H., Richtmyer N. K., J. Org. Chem., 1963, v. 28, p. 1691.
Kovar J., Baer H. H., Can. J. Chem., 1970, v. 48, p. 2377.
Кочетков Н. К. и др. Химия углеводов, М., «Химия», 1967, с. 324, 327.
552. СТЕНХАУЗ (STENHOUSE)
Раскрытие фуранового кольца в 2-фуральдегидах последовательным дейст-
действием ариламина и его гидрохлорида:
R~O~CH0+ArNH2
R
¦/ )>—CH=NAr
О
ArNH2HCl
4-
ArNH=C-CH=CH—C=CH—NHAr
Cl-
R ОН
D0-70%)
R = Н, СН3, NO2; Ar = С6Н5, С„Н4СН3, CeH4OH, CeH4Cl, CeH4Br
Хлор- и бромзамещенные 2-фуральдегиды в этих условиях не расщепляются,
а конденсируются с двумя молекулами амина:
C8H5NH2-HC1 /, ^
»-СНО + CeH5NH2 >- R—<( >-CH(NHCeH5J
R
О
См. также Циике—Кёкиг (№ 691).
Stenhouse J., Ann., 1870. Bd. 156, S. 197.
Zincke Т., Muhlhausen G., Ber., 1905, Bd. 38, S. 3824.
Drisko R. W., McKennis H. jr., J. Am. Chem. Soc, 1952, v. 74, p. 2626.
Foley W. M., Sanford G. E., McKennis H. jr., J. Am. Chem. Soc, 1952, v. 74,
p. 5489.
553. СТЕФЕН (STEPHEN)
Получение альдегидов из нитрилов действием хлористого олова и хлори-
хлористого водорода с последующим гидролизом:
SnCl2; HGI + HS1
—C=N >¦ —C=NH HSnClJ >-
(эфир)»
H2O
(эфир)»
+ 2
*¦ [-CH=NH2]2 SnClg- > —СНО
*HCOOCaH5; СНзСООСаНз, (СН3ОСН2J
381
Реакция позволяет получать ароматические и некоторые гетероциклические
альдегиды (выходы ~60—90%)- 2,6-Дихлор- и 2,6-диметоксибензонитрилы не
реагируют из-за пространственных затруднений. В случае а-иафтоиитрила, о-то-
лунитрила, о-нитробеизонитрила, а также алифатических нитрилов выходы аль-
альдегидов незначительны.
Комплексные соединения нитрилов и хлористого олова используют и для
получения производных альдегидов, например ацеталей и альдимииов:
RCN
[RCH=NH2]2
(C2H5KN
RCH(OC2H6J
RCH=NH
См. также Зонн — Мюллер (№ 269), Грундман (№ 223), Мак-Фейдиен — Сти-
веис (№381).
Stephen H., J. Chem. Soc, 1925, v. 127, p. 1874.
Tolbert Т. L, Houston В., J. Org. Chem., 1963, v. 28, p. 695.
Зильберман Е. Н. Реакции нитрилов. М., «Химия», 1972, с. 319.
СОП, т. 3, с. 331; ОР, т. 8, с. 316.
554. СТИВЕНС (STEVENS)
Внутримолекулярная перегруппировка четвертичных аммониевых солей в
третичные амины под действием оснований:
+ NaOH»
RCH2-N(CH3J Bi
| 3'2 (CHgOH)*
CH,Ar
RCH—N(CH3J
CH2Ar
R = COCH3> CH2C6H6, C6H6 и др.
*C2H6ONa, NaNH2( C6H6Li; ** спирты, эфир
Способность АгСН2-группы к миграции определяется характером заместите-
заместителя в арильном остатке и возрастает в ряду:
СН3О < Н, СН3 < С1, Вг, I
NO2
Мигрирующим остатком кроме АгСН2-группы может быть бензгидрил,
9-флуоренил, E-фенилэтил, аллил, метил. Группой, к которой присоединяется ми-
мигрирующий остаток, может быть также бензгидрильиая, флуореиильиая, аллиль-
иая и др. Возрастание электроноакцепторной способности «принимающей» груп-
группы уменьшает скорость реакции.
Аналогичную перегруппировку претерпевают соли сульфония, арсония, сти-
бония, фосфония.
При действии СбН5Ы кроме указанной перегруппировки часто происходит
перегруппировка Соммле (см. № 550), например:
снас6н5
+ C8H5Li
(C6H5JCH-N(CH3K Br- *-(C6H6JC-N(CHgJ +
сн,
Однако при повышении температуры реакции идет только перегруппировка
Стивенса, например:
382
25 °С
\ + /СН3 C8H5Li
\сн2с6н5
вг
120 °С
N-CH3
•СНз
СН
С6Н6
Перегруппировка Стивенса может быть использована для синтеза производ-
производных фенантрена и других полициклических соединений, например:
Превращение в ряду аминимидов, аналогичное перегруппировке Стивенса,
называют перегруппировкой Вовзонека (Wawzonek):
— + нагревание
СНз-С—Ы-Ы(СНзJ *• СНз-С—N-N(CHsJ
II I II I
OR OR
R = C6H5CH2) CH2-CH=CH2
В реакцию вступают также циклические аминимиды, например:
Н^У-^/СНз ^оо-сНХ. VnCH2C6H5
h^/n/ \сн2с6н5
Н3С
В случае R'=Alk аминимид разлагается с образованием изоцианата и тре-
третичного амина:
RC-N-N(CH3J
О
R'
RN=C=O + (CH3JNR'
См. также Смайлс (№ 544).
Stevens Т. S. e. a., J. Chem. Soc, 1928, p. 3193; 1932, p. 1932.
Wawzonek S., Yeakey E., J. Am. Chem. Soc, 1960, v. 82, p. 5718.
Wadsworth W. S., J. Org. Chem., 1966, v. 31, p. 1704.
Jacobson A. E., Parfitt R. Т., J. Org. Chem., 1967, v. 32, p. 1894.
Adams B. L, Kovacic P., J. Org. Chem., 1974, v. 39, № 21, p. 3090—3094.
De Mayo P. Molecular Rearrangements. New York — London, Interscience, 1963,
p. 378.
Ингольд, с. 422; OP, т. 8, с. 345.
383
555. CTOPK (STORK)
а-Алкилирование и а-ацилирование карбонильных соединений через проме-
промежуточное образование енамннов:
—С—СН2 Ь HNs
II
О
-с=сн
-А-
нагревание
Н2О
R'COX
Н2О
OR'
R = Alk; R' = Alk, Ar
* CH3COOH, Дауэкс 50; ** C6H4(CH3J, C6H5CH3
Для получения енаминов чаще всего используют пиперидин, морфолин, пир-
ролидии. Наиболее активным является пирролидин.
При взаимодействии енаминов с алкилгалогеиндами одновременно с С-ал-
килированием происходит N-алкилирование. В случае электрофнльных галогени-
дов N-алкилирование незначительно. При использовании аллнл-, бензил- и про-
паргилгалогенидов, а-галогензамещенных сложных эфиров, кетонов н нитрилов
выходы продуктов С-алкилирования составляют 50—70%; в основном образуют-
образуются продукты моноалкилирования:
СН3ВГ
ВгСН2СООС2Н5
,СН2СООС2Н5
2,4-(NO2JCeH3Cl
,C6H3(NO2J
о-
Аналогично можно получить а-кетоннтрилы:
=0
D6%)
Енамины легко алкилируются олефинами, содержащими электрофильные
заместители (см. Михаэль, № 406). Выходы продуктов С-алкилировання в этом
случае более высокие F5—85%), чем при алкилированни алкилгалогенидами, так
как идущий параллельно процесс N-алкилировання обратим. В качестве алкилн-
384
рующих реагентов используют а,р"-непредельные нитрилы, сложные эфиры, аль-
альдегиды, кетоны, нитросоединения.
Продукты алкилировання енаминов олефинами в процессе реакции часто
претерпевают циклизацию, например:
аСН2СН2СОСН3
О
v>
Ацилнрованне енамннов протекает, как правило, по углероду. Наиболее
успешно используются производные морфолина. Реакцию проводят в присутст-
присутствии эквимольного количества (С2Н5)зЫ, необходимого для связывания выделяю-
выделяющегося НХ. Для ацилирования применяют хлорангидриды высших карбоновых
кислот (см. Хюниг, № 681), а также разнообразные хлор- и бромангидриды кис-
кислот алифатического, ароматического и гетероциклического рядов:
О
NH
Хорошие результаты дает использование енаминов при формилировании в ус-
условиях реакции Вильсмайера (см. № 166).
Алкилирование и ацилирование карбонильных соединений через енамины
успешно применяется в различных областях органического синтеза, в частности,
для получения циклических структур, в химии стероидов и т. д.
Stork G., Terrell R., Szumskovicz 1., J. Am. Chem. Soc, 1954, v. 76, p. 2029.
Brannock К. С e. a., J. Org. Chem., 1964, v. 29, p. 813, 818.
Шмушкович Дж., Усп. орг. химнн, 1966, т. 4, с. 12, 27.
Физер, т. 3, с. 126.
Devies H. J., Main В. G., J. Chem. Soc, Ser С, 1970, № 2, p. 327.
Enamines: synthesis, structure and reactions. Ed. A. G. Cook. New York — Lon-
London, Marcel Dekker, 1969, 515 p.
556. СТРУКОВ (STRUKOV)
Получение арилдн-B,3-эпокси-н-пропнл) аминов из ариламинов и эпихлор-
гидрина:
~20°С
ArNH2 + 2Н2С СН—СН2С1
12"' (н2оТ
О
25-684
385
ArNrCH2—СН-СНгС1] NaOH или КОН; нагревание ArN["CH2-H
(эфир)
УФ-Облученне ускоряет процесс. В реакцию вступают я-хлораиилии, толуи-
дииы, аннзиднн. Побочный процесс — образование монозамещеиных ариламинов.
Strukov I. Т., Khim. Farm. Prom., 1934, № 2, p. 11; С. А., 1934, v. 28, p. 5421.
Homer R. F., J. Chem. Soc, 1950, p. 3690.
557. СЭНДЖЕР (SANGER)
Избирательное отщепление N-концевых аминокислот полипептндов в виде
дииитрофеиильных производных под действием 2,4-динитрофторбеизола с после-
последующим кислотным гидролизом:
NOa
у ^ _ NaHCO3; -20 °С
COCHNH-COCHNH2 + F-
R'
-NO,
(Н2О)
NO2
COCHNH-COCHNH-f^-NO» ¦—
R
COCHNH2-
R
R'
NO,
HOOC—
R'
Динитрофенильные производные аминокислот образуются с количественны-
количественными выходами; их выделяют нз гндролнзата и идентифицируют колориметрически
или хроматографическн.
Метод успешно применяют в исследованиях строения природных полнпеп-
тидов.
См. также Эдман (№ 733).
Sanger R. R., Biochem. J., 1945, v. 39, p. 507.
Porter R. R., Sanger F., Biochem. J., 1948, v. 42, p. 287.
Кнунянц И. Л., Первова Е. Я., Усп. химии, 1955, с. 661.
Химия биологически активных природных соединений. Под ред. Н. А. Пре-
Преображенского н Р. П. Евстигнеевой. М., «Химия», 1970, с. 72.
558. ТАБУРИ (TABOURY)
Получение селенофенолов действием селена на арнлмагннйбромнды:
Se; нагревание НС1
ArMgBr >- Аг—SeMgBr >
(эфир)
Ar-SeH
D0-60%)
= СвН5, С„Н4А1к, СвН4ОСН3, С6Н4ОС2Н6, CeH4CI, CeH4Br
386
Аналогично получают а-селенонафтол. Побочные реакции—образование
диарнлселенидов и диарнлдиселенндов.
Taboury M. F., Bull. Soc. chim. France, 1906, v. 35, p. 668.
Houben-Weyl, Bd. 9, S. 958; СОП, т. З, с. 386.
559. ТАЙРЕР (TYRER)
Получение бензолсульфокислоты сульфированием бензола серной кислотой:
й^*\. HjSO4; 170-180 "С
(95%)
Побочный продукт — дибензилсульфон B0%). Сульфирование полиалкил-
бензолов проходит с хорошими выходами. На основе этого метода разработан
непрерывный промышленный процесс сульфирования бензола в паровой фазе.
Tyrer D., пат. США 1210725 A917); С. А., 1917, v. 11, р. 689.
Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей.
М, Госхнмиздат, 1955, с. 60.
Houben-Weyl, Bd. 9, S. 452; OP, т. 3, с. 140.
560. ТАФЕЛЬ (TAFEL)
RR'CH—СН2—СН2—СН3
Перегруппировка углеродного скелета при электролитическом восстановлении
fj-кетоэфиров на свинцовом или кадмиевом электродах:
R ~ ОС2Н5 "
СН3-С-С-СООС2Н5 > RR'C=C-CCH3
II I II
OR' _ О .
R = Alk; R' = Н, Alk
Образование углеводородов с тем же числом атомов углерода, что и в угле-
углеродной цепн исходного fj-кетоэфнра, происходит, вероятно, вследствие миграции
ацнльного остатка к углероду карбоэтокснгруппы.
Tafel J., Hahl H., Вег., 1907, Bd. 40, S. 3312.
Stenzl H., Fichter F., Helv. chim. acta, 1934, Bd. 17, S. 669; 1937, Bd. 20,
S. 846.
Teles I., laky M., Acta chim. (Budapest), 1969, v. 59, p. 271.
561. ТЕЙЛОР — МАК-КИЛЛОП (TAYLOR — McKILLOP)
Алкилнроваине и ацилнрованне E-дикарбонильных соединений, ацнлнрование
карбоновых кнелот и фенолов взаимодействием их таллневых солей с алкнл-
или ацилгалогеиидами:
—С—СН2—С—
С2Н5ОТ1
(инерти. растворитель)
О
о
25*
387
-С-СН—С—I- Т1+
RX; нагревание
о о
CaHsOTl V R'COX
н > ус-сг Ti+ -r-t
/ (эфнр)
R = Alk; R' = Alk, Ar
-С—СН—С—
II I II
OR О
V-O-COR'
Продукты алкилирования образуются, как правило, с количественными выхо-
выходами. Алкилироваиие р-дикарбонильных соединений всегда приводит к моно-С-
алкилпроизводиым; наиболее легко реакция идет с йодистыми алкилами. При
ацилироваиии fj-дикарбонильных соединений в зависимости от условий реакции
получают О- или С-производные, например:
СН3СОС1
СНз—С—СН—С—СН3~|- Т1+
О
О
CH3COF
СН,—C=CH—С—СН.
1 II
ОСОСНз О
(СН3СОKСН
Ацилирование фенолов с образованием соответствующих сложных эфиров
легко протекает под действием ацил- или арилсульфоиилгалогеиидов. Из кислот
можно получить как смешанные, так и симметричные аигидриды:
SOCU R'COCl
RC-O-CR -* RCOOT1 >¦ RC-O—CR'
О
О
О
О
Реакция применима также к гетероциклическим соединениям. Алкилирование
пуринов всегда идет в положение 9; алкилирование лактамов идет по атому азо-
азота, а при их ацилировании образуются О-ацилпроизводиые:
См. также Кляйзен (№ 298), Штааб (№ 721), Штеттер (№ 725).
Taylor Е. С, МсКШор А. е. a., J. Am. Chem. Soc, 1968, v. 90, p. 2421, 2422;
J. Org. Chem., 1970, v. 35, p. 1672.
Физер, т. 5, с. 559.
562. ТЕР МЕЕР (TER MEER)
Получение геле-динитроалканов действием на а-галогеииитроалканы нитрита
•калия в щелочной среде:
KNO2 + КОН -
RCHNO2 *- TRC—NO2 + HNO2 4=fc
x 2 [x
388
RC=NO2H f NOa" v RC=NO2H + X~l »- RCH(NO2
X NO2 J
R = CH3, C2H6; X = Br, Cl
* 50%-ный водный С2Н6ОН, боратный буфер
См. также Коновалов (№ 318), Мейер (№ 391), Цинке (№ 689).
ter Meer E., Ann., 1876, Bd. 181, S. 1.
Hawthorne M. F., J. Am. Chem. Soc, 1956, v. 78, p. 4980.
Гидаспов Б. В., Целинский И. В., Базанова А. Г., Ж- орг. хим., 1971, т. 7,
с. 1303.
Новиков С. С. и др. Химия алифатических и алициклических нитросоедине-
ний. М., «Химия», 1974, с. 124.
563. ТИДТКЕ (TIEDTKE)
Конденсация антраниловой кислоты с 2-алкилциклогексанонами, приводящая
к 4-алкил-1,2,3,4-тетрагидроакридонам-9:
E0-80%)
R = Н, Alk (до С8)
Аналогично протекает реакция с 2-этилциклопентаионом:
О
соон
NH2 О
Незамещенный циклопентанон дает аномальный продукт присоединения:
О
NH
Tiedtke Н., Вег., 1909, Bd. 42, S. 621.
Reed R. A., J. Chem. Soc, 1945, p. 186.
Bui-Hoi N. P., Loc Т. В., Dat Xuong N.. Bull. Soc. chim. France, 1958, p. 174.
389
564. ТИЛЕ—ВИНТЕР (THIELE — WINTER E.)
Ацетилирование хинонов, сопровождающееся ароматизацией, при действии
уксусного ангидрида в присутствии кислых катализаторов с образованием аце-
ацетатов соответствующих трехатомных фенолов*:
О О О
-20 °С
[H2SO4]*
О
ОН
+ОН
ососн,
ох
он
ОСОСНз
ОСОСНд
(СН3СОJО
>-
-R у
ОН OCOCHg
R = Н, Alk, Hal, ОСН3, СОСН3, С6Н5
* BF3, HC1 + H2SO4, ZnCl2 + HCl, HC1O4
Наилучшие результаты (выходы 45—55%) получаются при использова-
использовании НСЮ4.
Ацетилирование п- или о-нафтохинонов приводит к 1,2,4-триацетоксинаф-
талину.
См. также Хинсберг (№ 666).
Thiele J., Winter E., Ann., 1900, Bd. 311, S. 341.
Burton H., Praill P. F. G., J. Chem. Soc, 1952, p. 755.
Goodwin S., Witkop В., J. Am. Chem. Soc, 1957, v. 79, p. 179.
Blatchly J. M., McOmie J. F. W., J. Chem. Soc, 1963, p. 5311.
Wilgus H. S., Gaters J. W., Can. J. Chem., 1967, v. 45, p. 1975.
OR, v. 19, p. 199.
565. ТИМАН (TIEMANN)
Перегруппировка амидоксимов карбоновых кислот в производные мочевины
при реакции с бензолсульфохлорндом и последующем гидролизе:
R'
\ C8H5SO2C1
.N-C=NOH
R'N
Tq^nT rv/n-C-N-OSO2C8H5 (рода с^ОН);
R
R'n
> /N-C—NHR
R"/ ||
О
R = C6H5, CH2CaH6
* Диоксан (води.)
* Называют также реакцией Тиле.
390
Скорость перегруппировки зависит от индуктивного эффекта заместителей
R' и R" и уменьшается в ряду:
R = R'=CH3 > R=CH3, R'=C6H5 > R=R'=H
Прн перегруппировке циклических амидоксимов происходит расширение цик-
цикла, например:
,N-OSO2C6H4CH3
б»
О
HN //
NH
(90%)
Амидоксимы легко могут быть получены из нитрилов при действии NH2OH.
См. также Бекмаи (№ 58).
Tiemann F., Вег., 1891, Bd. 24, S. 4162.
De Mayo P. Molecular Rearrangements. New York, Interscience, 1963, p. 564.
OP, т. 3, с 347.
566. ТИФФЕНО (TIFFENEAU)
Превращение 1-аминометилциклоалканолов-! в циклоалканоны, сопровож-
сопровождающееся расширением кольца, при действии азотистой кислоты*:
(СН2)„
(Ш2)" - н2с/Х<°
-CHR
/ОН
HNO2
(Н2О)
Н.С-
Н;
н2с
=0
HR
NH2
По сравнению с реакцией Демьянова (см. № 242), данная реакция проходит
с лучшими выходами и не сопровождается образованием олефинов. Побочные
продукты — гликоли.
При R = Ar, Alk происходит лишь замена аминогруппы на гидроксильную,
например:
/ОН
, ^ОН
/чч:нынг \ /\снон
I I
Реакцию используют обычно для синтеза алициклических кетонов (п=\—5).
Tiffeneau M., Weill P., Tchoubar В., С. г., 1937, v. 205, р. 54.
Favre И., Gravel D., Сап. J. Chem., 1963, v. 41, p. 1435.
Johnson С. R., Cheer С. J., Goldschith D. J., J. Org. Chem., 1964, v. 29,
p. 3320.
Ballantine J. D., Ritchie J. P., Sykes P. J., J. Chem. Soc, Ser. C, 1970, p. 736.
OP, т. 11, с 167.
* Называют также реакцией Тиффено — Демьянова.
391
567. ТИФФЕНО (TIFFENEAU)
Перегруппировка углеродного скелета при дегядроиодированяи иодгидринов
под действием азотнокислого серебра с образованием кетонов (иодгидринная
перегруппировка):
Аг
I I AgNOs j
R_C-C—I ——t R-C-C
-Ar
•H
О
R = H, Alk
* Соли ртути
В процессе дегидроиоднрования мигрирует только арильный заместитель.
У аляциклических иодгидринов перегруппяровка пряводит к сужению цикла, а в
случае гидроароматических соединений образуются альдегиды, например:
н
ОН
СНО
Tiffeneau М. М., С. г., 1907, v. 145, р. 593.
Tiffeneau M. M., Bull. Soc. chim. France, 1931, v. 49, p. 1806.
Schotte L, Bergson G., Svensk. Kem. Tidskr., 1954, v. 66, p. 179; С A., 1955,
v. 49, p. 13891.
568. ТИФФЕНО (TIFFENEAU)
Получение о-метиларилкарбинолов взаямодействнем арнлметнлмагнийгалоге-
иидов с формальдегидом:
.CH2-MgX
+ СН2О
X = Cl, Br; R = Н, Alk, CH2OH, ОСН3
В реакции проясходит перегруппировка типа алляльной с переносом реак-
реакционного центра по системе сопряженных связей.
392
Подобно формальдегиду реагируют бензальдегид, оксираи, этилбензоат,
хлорангидриды и ангидриды кислот. Кроме бензилмагнийгалогенидов аналогич-
аналогичные превращения претерпевают и другие ароматические соединении, содержащяе
фрагмент С = С—CPhMgX, например:
CH2MgBr
.И.С-С
—CHjMgCl + С6Н6СООС2Н6
сн,
СН2СН2ОН
сос6н5
-сн3
Tiffeneau М., С. г., 1903, v. 137, р. 573.
Gilman H., Kirby J. E., J. Am. Chem. Soc, 1932, v. 54, p. 345.
Smith L. I., Spillone L. I., J. Am. Chem. Soc, 1940, v. 62, p. 2639.
Lawesson S. 0., Acta Chem. Scand., 1958, v. 12, p. 1.
Методы элементоорганической химии. Магний, бериллий, кальций, стронций,
барий. Под ред. А. Н. Несмеянова и К. А. Кочешкова. М., Изд. АН СССР, 1963,
с. 362.
569. ТИШЛЕР (TISCHLER)
Получение рибофлавина и его аналогов из ароматяческих 1,2-амнноазосоеди-
неинй и барбитуровой кислоты в присутствия уксусной кислоты:
н.
NH
**¦
„г
нагревание
(СН3СХЮН + дноксан)^
О
NR N О
N
О
B0-70%)
Я = СН3, остатки D-рибита, D-арабита, тетраацетил- и 5-дезокси-0-рнбита;
Аг = С6Н6, С6Н4СН3> С6Н4СООН, С,Н4С1, C,H4NO2
* С4Н9ОН + СН3СООН
Большим преимуществом метода является его простота.
Исходные о-аминоазосоедлнения получают действием солей арилдиазония
на соответствующие амины. При этом образуется смесь 4,5- и 3,4-диметил-1,2-
амииоазосоединений. Последние не вступают в реакцию с барбитуровой кислотой,
393
ио могут быть восстановлены в о-феиилеидиамииы и затем превращены в изо-
рибофлавии или его аналоги реакцией с аллоксаном:
Н3С
NHR
N=NAr
Tischler M. е. a., J. Am. Chem. Soc, 1947, v. 69, p. 1487.
Haley E. E., Lambooy J. P., J. Am. Chem. Soc, 1954, v. 76, p. 2926.
Hemmerich P., Fallab S., Erlenmeyer H., Helv. chim. acta, 1956, Bd. 39, S. 1242.
Korte F., Ludwig G., Ann., 1958, Bd. 615, S. 94.
570. ТИЩЕНКО
Диспропорционироваиие альдегидов с образованием сложных эфиров под
действием алкоголятов алюминия*|
2R*
\„
RC'
(-50%)
R' = Alk
* A1(OR')S + Aids или HgCl2) Mg(OR')a, Zn(OR')a
В реакцию вступают алифатические, ароматические и гетероциклические аль-
альдегиды.
Побочные продукты—результат альдолыгои конденсации RCHO, поэтому
алкоголяты калия или натрия можно использовать лишь в случае ароматических
альдегидов (Кляйзеи), например:
2С,Н6СНО
С,Н6СООСН2СвН6 (90%)
[C2H6ONa]
Перекрестная реакция Тищенко происходит при использовании смеси раз-
различных альдегидов:
RCHO + R'CHO v RCOOCH2R' + R'COOCH2R
Если реакционная способность RCHO существенно выше, чем у R'CHO, то
можно с высокими выходами получить RCOOCH2R'.
См. также Каиниццаро (№ 284), Меервейн — Поидорф — Верлей (№ 389).
Claisen L, Ber., 1887, Bd. 20, S. 646.
Тищенко В. Е., ЖРФХО, 1906, т. 38, с. 355, 482, 540, 547.
Lin /., Day A. R., I Am. Chem. Soc, 1952, v. 74, p. 5133.
* Называют также реакцией Тищенко— Кляйзена.
394
Hawkins E. G. E., Long D. J. G., Major F. W., J. Chem. Soc, 1955, p. 1462.
Ogata I., Kawasaki A., «Tetrahedron», 1967, v. 23, p. 825.
Андреева И. В., Турбина А. И., Ж. орг. хим., 1974, т. 10, № 7, с. 1392—1398.
СОП, т. 1, с. 89.
571. ТОЙБЕР (TAUBER)
Циклизация 2,2'-диаминодифеиилов в карбазолы под действием минеральных
кислот при нагревании:
R R R R
63%-ная H2SO!; -200 °С
H2N NH2
R = Н, Cl, NOa, NH2
* HC1
См. также Гребе — Ульман (№ 216), Ладенбург (№ 351).
Tauber E., Ber., 1890, Bd. 23, S. 3266.
Leditschke H., Chem. Ber., 1953, Bd. 86, S. 522.
Sumpier W. C., Miller F. M. Heterocyclic Compounds with Indole and Carbazo-
le Systems. New York — London, lnterscience publ., 1954, p. 78.
Эльдерфильд, т. З, с. 234.
572. ТОЙБЕР (TEUBER)
Окисление фенолов в хиноны действием иминоксилдисульфоната калия (ра-
(радикала Фреми):
ОН 0 0
Rl D" D И Р"'
^ >Т^ _ХХ\ _ „ I\v. ^\ L\
ON(SO3KJ 6
F0%—КОЛИЧ.)
R, R', R", R'" = H, CH8, C2H6, OCH3, CeH6
* H2O, C2H6OH, НСОЫ(СНзJ
Если в /шра-положении к ОН-группе имеется алкильный или алкоксильный
заместитель, то при окислении получаются о-бензохиноиы с выходами от 20
до 90%.
Реакция применима также для окисления а- и E-нафтолов, ароматических
амниов, хинолинов, индолов и других гетероциклических соединений:
О
(91%)
395
N
:н3
G5%)
Монозамещенные анилины образуют соответствующие производные N-арил-
ы об
о-амино-я-бензохннонмононминов:
NH2
СН„
-NH2 v 0=
См. также Весселн (№ 153).
Teuber H. J., Jellinck С, Chem. Вег., 1952, Bd. 85, S. 92.
Zimmer И., Lankin D. С, Horgan S. №., Chem. Rev., 1971, v. 71, p. 229.
Физер, т. 2, с. 81; т. 5, с. 225.
573. ТОЛЛЕНС (TOLLENS)
Оксиметнлнрование альдегидов нлн кетонов при взаимодействии с формаль-
формальдегидом в присутствии оснований:
_с-сн2- + сн2о [Са(ОНJ];; (H2gr -с-ш-
о о сн2он
Q
II
о
|N:h2oh
В процессе реакции происходит альдольная конденсация карбонильного со-
соединения с двумя молекулами формальдегида и затем, в случае альдегидов, пере-
перекрестная реакция Канниццаро (см. № 284) продукта конденсации с-формальде-
с-формальдегидом:
RC(CH2OHJ + СН2О + Н2О
СНО
RC(CH2OHK + НСООН
В реакцию вступают алифатические и алнциклическне карбонильные соеди-
соединения:
СН3СНО
С(СН2ОНL
E7%)
396
О
ОН
СНгО
НОН.С
(85%)
Применяя эквимольное количество формальдегида, можно остановить реак-
реакцию на стадии альдольной конденсации, например:
CHg-СО—СН2-СН3
сн2о
СН3-СО-СН-СН3
СНаОН
G0%)
Реакция используется в промышленности, в частности для синтеза пента-
эрнтрита.
См. также Бутлеров (№ 124).
Tollens В., Wigand P., Ann., 1891, Bd. 265, S. 316.
Prosser T. J., J. Org. Chem., 1961, v. 26, p. 242.
Bertin D., Fritel H., Nedelec L, Bull. Soc. chim. France, 1962, p. 1068.
OR, v. 16, p. 15.
574. ТОРГОВ
Конденсация а-оксн-а-вннилтетралинов с циклическими 1,3-дикетонамн в
присутствии оснований *;
ноч сн=сн2
RO
""ревание
)п [с6н5сн2Й(сн3Kон]
3
RO
f = h,ch3; r'=h,
*KOH,CH3ONa; **CH3OH, трет -
Выходы продуктов составляют 30—90%.
* Называют также реакцией Торгова — Ананченко.
397
В реакцию вступают также винилциклогексенолы и их аналоги, содержащие
гетероциклы, например:
Н,С
н,с
R= с6н5,ос2н5
Исходные а-окси-а-винилтетралины получают из соответствующих непре-
непредельных кетонов и реактива Нормана (см. № 428), например:
О НО СН=СН2
I + CH2=CHMgBr
R = Н, CHS
Продукты реакции легко циклизуются под действием Р2О5 с образованием
полициклических кетонов, являющихся ключевыми продуктами для синтеза эст-
роиа, его производных и аналогов.
См. также Кэрролл (№ 349).
Ананченко С. Н., Торгов И. В., ДАН СССР, 1959, т. 127, с. 553.
Назаров И. Н., Ананченко С. Н., Торгов И. В., Изв. АН СССР. ОХН, 1959,
с. 103.
Zacharychev А. V., Lagidze D. R., Ananchenko S. N., «Tetrahedron Letters»,
1967,_p. 803.
Weill-Raynal J., Bull. Soc. chim. France, 1969, p. 4561.
575. ТОРП (TORPE)
Димеризация нитрилов с присутствии оснований с образованием имиионит-
рилов;
2RCH*CN [OH.ON4.* Rf H-C-CH2R
CN NH
R = COOR', C6H5 и др.
• C5H6N, (u30-C3H7JNLi, NaH и др.
В случае динитрилов происходит циклизация * :
:h,cn
CN
* Циклизацию динитрилов называют также реакцией Торпа — Циглера.
398
СН2— CH2CN
СН2—CHCN
СООС,Н„
Иминонитрилы широко применяются в синтезах циклических (см. Циглер,
! 687) и гетероциклических кетоиов, например:
NH
ДХ)ОС2Нв
С2Н6ООС—СН,—С—СН—COOCSH6
CN
H2SO4
В процессе некоторых реакций, например алкилироваиия, циклические имино-
интрилы претерпевают размыкание цикла — обратную реакцию Торпа (retro-
Thorpe) :
Н3С СНз
Н„С СНз
47
Н3С
СНз!
Н3С CN
Н3С
С—CN
СНЯ
Baron H., Remfry F. GP., Thorpe J. F., J. Chem. Soc, 1904, v. 85, p. 1726.
Truce W. E., Bannister W. W., Knospe R. H., J. Org. Chem., 1962, v. 27,
p. 2821.
Gordon J. e. a., Chem. Ind., 1966, p. 2012.
Helmers R., Kaiser W., «Tetrahedron letters», 1971, p. 3853.
Helmers R., Ann., 1973, № 2, S. 181—189.
576. ТРАУБЕ (TRAUBE)
Получение мочевой кислоты коидеисацией мочевины с циануксусным эфи-
эфиром, последующей изомеризацией образовавшейся цианацетилмочевины под дей-
действием щелочи в 6-аминоурацил, превращением последнего через нитрозосоедине-
иие в 5,6-диамииоурацил и циклоконденсацией диаминоуранила с хлоругольным
эфиром:
О
NH, COOR
| I C,H6ONa
С=О + СН2
О
NH.
i
:n
О
HN
О=С CN
NHa
О
но-
О
HNO2
NH
NH2
О
N0 (NH4JS
NH
NH 'NH2 ^ NH
• POCI3 (для NCCH2COOH);
cicoochV
(NHj)sCO (сплавление)
X
H NH
399
Метод находит большое применение, так как позволяет получать разнооб-
разнообразные соединения ряда пурина:
NH2 COOR
C=S + СН2
C
NH2
N
NH2 COOR
C=NH + CH2
NH» CN
NH2
C=0
NH,
COOR
¦CH2
CN
HNOa
О
N
NH
>
Использование в качестве конденсирующего средства (CHjCOJO в
СНзСООН при реакции диалкилмочевины с циануксусиой кислотой позволяет
получать разнообразные 1,3-диалкил- и 1,3,8-триалкилксантииы:
О
NHR СООН
С=О + СН2
NHR' C=sN
R-COOH; 140-160 "С
о
RN
N
V
NR' NH
R, R', R" = H, Alk
См. также Беренд— Розен (№ 64), Фишер (№ 613).
Traube W., Ber., 1900, Bd. 33, S. 1371; Ann., 1904, Bd. 332, S. 64.
Speer J. H., Raymond A. L, J. Am. Chem. Soc, 1954, v. 75, p. 114.
Bredereck H., Edenhofer A., Chem. Ber., 1955, Bd. 88, S. 1306.
Kartitzky A. R., Quart. Rev., 1956, v. 10, p. 397.
Gilman H., v. 4, p. 877.
577. ТУИТЧЕЛЛ (TWITCHELL)
Кислотный гидролиз триглицеридов жирных кислот в присутствии эмульга-
эмульгатора с образованием свободных жирных кислот и глицерина:
CH,OCOR CH2OH
I Н2О; 30%-ная H2SO4; 100 °С |
VH»0C0R' [9мульгатор1 " СНОН + RCOOH + R'COOH + R'COOH
CH2OCOR» СН2ОН
400
В качестве эмульгатора используют смесь сульфированных жирных кислот
и нафталина (реактив Туитчелла).
Twitchell Е., J. Am. Chem. Soc, 1900, v. 22, p. 22; 1906, v. 28, p. 196;
Пат. США 601603 A897), 628503 A916); С. А., 1916, v. 10, p. 979.
Schlutius E., J. prakt. Chem., 1935, Bd. 142, S. 49.
Mills V., McClaln H. K., Ind. Eng. Chem., 1949, v. 41, p. 1982.
578. УАЙТ (WHITE)
Превращение первичных алифатических аминов в соответствующие слож-
сложные эфиры ацилированием амина, нитрозированием полученного амида и терми-
термическим разложением образовавшегося N-нитрозамида**
RNH2 + R'COCl
R'C-NHR
II
О
N2O4; CH3COONa; 0 °C
(CH3COOH)*
20-80 °C
/О
(CCI4)
->¦
R'(
4OR
-—v R'C-N-R
II I
О NO
R = Alk, rju/oio-Alk; R' =CH3, CeH5) 3,5-(O2NJC6H3
* СС14, СН2С1а
Реакция протекает с сохранением конфигурации. В случае первичных аминов
общий выход составляет 70—80%, в случае вторичных — 40—60%, для третич-
третичных аминов выходы очень низки. Понижение выхода происходит вследствие кон-
конкурирующей реакции элиминирования азота из N-нитрозамида с образованием
олефинов и карбоновых кислот.
Аналогично протекает превращение лактамов в лактоны, например:
СН3 СН3
Реакция находит широкое применение в химии стероидов.
См. также Ван-Слайк (№ 147), Демьянов (№ 242).
White Е. Н., J. Am. Chem. Soc, 1955, v. 77, p. 6008, 6011, 6014.
Sato Y., Latham H. G., J. Org. Chem., 1957, v. 22, p. 981.
Stevenson R., J. Org. Chem., 1963, v. 28, p. 188.
Физер, т. 1, с. 21; OS, v. 47, p. 44.
579. УАЙТИНГ (WHITING)
Восстановление алкиндиолов в диены алюмогидридом лития:
ОН ОН Н Н
— >¦ .с=с-с=сч
(эфир или R3N) / \
* Называют также дезаминированием по Уайту.
26—684
401
Реакция находит большое применение в синтезе каротиноидов. Так, напри-
например 7,7-дигидро-Р-каротин получен с выходом 80% из соответствующего диола
[60 °С, (CHbNCH]
Whiting М. С. е. a., J. Chem. Soc, 1954, p. 1854, 4006.
Isler O. e. a., Helv. chim. acta, 1956, Bd. 39, S. 454.
Bohlmann F., Mannhardt H. J., Chem. Ber., 1956, Bd. 89, S. 1307.
580. УАРТОН (WHARTON)
Восстановление а,р-эпоксикетонов до аллиловых спиртов действием гидрази-
.на в спиртовом растворе:
"\
\ | | N2H4; нагревание
/С С—C=0 ^rrr^Z—-
\
(QjH5OH)
HO-C-C=C—N=NH
-C-C=N-NH2
—v но
-С-С=СН—
E0-80%)
Реакция стереоспецифнчна, протекает с сохранением конфигурации.
Особенно широко применяется в химии стероидов, например:
ОН
D8%)
О
о
он
Wharton P. S., Bohlen D. Н., J. Org. Chem., 1961, v. 26, p. 3615.
Dierassi С, Williams D. H., Berkor В., J. Org. Chem., 1962, v. 27, p. 2205.
Coffew D. Z., Korzan D. G., J. Org. Chem., 1971, v. 36, p. 390.
Физер, т. 1, с. 203.
581. УГИ (UGI)
Присоединение солей нмония, полученных из соответствующих иминов, к
изонитрилам с дальнейшим превращением продукта присоединения в зависимо-
зависимости от характера аниона:
R,O=NR' + R"B
[R2C=NR'R"]+
R'"NC
R'R"N
/NHR"
Если В = ОН, SeH, S2O3, N3, то дальнейшие превращения затрагивают лишь
углеродную часть молекулы:
I ^он |
R'R"N R'R"N
K2C t-ч *- R2C v, ],
I XN3 I ^/N
R'R"N R'R"N N
Если B = NCO, SCN, OCOR, то происходит внутримолекулярное N-ацили-
рование:
R2C—Сч
R'NH
r2c-c:
R'NH
•OCOR"
,NR"
NCS
-> R2C-CONHR"
R'N—COCH3
R'"N
R V-NH
NR'
Аналогично солям имония реагируют другие электрофильные соединения с
= N-CBH3bK>, например:
RN
FX/
-20-с F3C4 /-0
(FSCJC=N-COR'+ RNC >- V \_R'
N
(90%)
Реакция позволяет в мягких условиях и с высокими выходами получать
производные а-аминокислот, пептидов, р-лактамов, уретанов, тетразолов, гидан-
тоинов и др.
См. также Пассерини (№ 441).
Ugi ]., Steinbruckner С, Angew. Chem., 1960, Bd. 72, S. 267; Chem Ber., 1961
Bd. 94, S. 734, 2802.
lmmer H. e. a., Ann., 1973, № 11, S. 1789—1796.
Полякова А. И. и др., Изв. АН СССР. Сер. хим., 1974, № 7, с. 1597—1599,
582. УИЛЬЯМСОН* (WILLIAMSON)
Получение простых эфиров алкилированием алкоголятов или фенолятов ал-
килгалогенидами:
нагревание
R0M + R'X '
F0-80%)
= Na, К, l/2Mg, Ag; X=C1, Br, I
* Эфир (абс.), диоксан и др.
402
* В русской химической литературе утвердилась транскрипция Вильямсои.
26* 403
Реакционная способность R'X зависит от природы галогена и алкильного
остатка и уменьшается в рядах:
^> dt ^> v_,i и Кщрет ^ Kemop ^ ^перв
Легко реагируют аллил- или бензилгалогениды. Производные сильнокислых
фенолов в реакцию не вступают. В качестве алкилирующих агентов могут быть
использованы галогенпроизводные гетероциклических соединений, а также ал-
килгалогениды, содержащие различные заместители (СНО, COOR", Hal, NH2):
1 моль CH3ONa
Br(CH2NBr ,аА„„ > СН3О(СН2NВг
(80%)
BrCH2CH2COOC2H6
(эфир)
C2H6ONa
(С2Н6ОН)
С2Н5ОСН2СН2СООС2Н5
(88%)
N(CH2CH2C1K-HC1
КОН
(С2Н6ОН)
*¦ N(CH2CH2OC2H5K
Вг
F6%)
ОС2Н5
Вг-
N
2 моль C2H6ONa
>•
(С6Н6)
(89%)
Основные побочные реакции: образование олефинов из R'X и алкилироваиие
в ядро (для фенолов).
Вместо алкилгалогенидов могут быть использованы диалкилсульфаты (как
правило, водные растворы).
Вариантом реакции является метилирование Сахаров по Маскету (Muskat)
действием натрия в жидком аммиаке с последующим метилированием йодистым
метилом. Метод обычно применяют в сочетании с методом Хейуорта (см. № 647)
для дометилирования частично метилированных Сахаров.
См. также Кляйзен (№ 298), Михаэль (№ 405), Ульмаи (Ns 584).
Williamson A. W,, J. Chem. Soc, 1852, v. 4, p. 229.
Muskat J., J. Am. Chem. Soc, 1934, v. 56, p. 693, 2449.
Gay lord N. G. e. a., J. Am. Chem. Soc, 1954, v. 76, p. 59.
СОП, т. 3, с 292; Houben-Weyl, Bd. 63, S. 24.
Фьюзон, с. 254; Ингольд, с. 312.
583. УЛЬМАН (ULLMANN)
Конденсация арилгалогенидов или арилтиоцианатов под действием порошка
меди с образованием диарилов:
100-360 °С
АА>
АГХ [Си];
(ДО 95%)
X = С1, Вг, I, SCN
* HCON(CH3J> C6H5NO2, нафталин, без растворителя
Предполагают, что реакция идет по свободнорадикальиому механизму. Ре-
Реакционная способность арилгалогенидов уменьшается в ряду: Arl > ArBr >
404
>• АгС!. Наличие электроноакцепторных заместителей в орто- или пара-поло-
пара-положениях к атому галогена способствует реакции. Заместители, содержащие под-
подвижный атом водорода, ингибируют реакцию и вызывают побочные процессы.
Использование HCON(CH3J в качестве растворителя существенно поовышает
выход продукта.
Аналогично конденсируются гетероциклические соединения:
.-/Л
и = 1—5
Внутримолекулярная конденсация по Ульману приводит к образованию но-
нового цикла, например:
CHaO
-fVl I-fV-
OCH,
сняо-
.—осн.
G0%)
Вариантом реакции является метод получения фенантридинов по Кондо ¦
Уэё (Kondo — Uyeo):
См. также Вюрц (№ 182), Вюрц—Фиттиг (№ 183), Ульман (№ 584).
Ullmann F., Bielecki J., Ber., 1901, Bd. 34, S. 2174.
Fanta P. E., Chem. Rev., 1946, v. 38, p. 139; 1964, v. 64, p. 613.
Граверов И. П., Казухин Л. Ф., Ж- орг. хим., 1969, с. 5, с. 3.
Tran Dink Tuong, Hida Mitsuhiko, Bull. Chem. Soc. Japan, 1970, v. 43,
p. 1763.
Эльдерфильд, т. 4, 432; СОП, т. 3, с. 216.
Фьюзон, с. 547.
584. УЛЬМАН (ULLMANN)
Конденсация арилгалогенидов с фенолами, ароматическими аминами или
арисульфииовыми кислотами в присутствии меди с образованием, соответственно,
диариловых эфиров, диариламинов или диарилсульфонов:
ArX + Ar'ZH
КОН*; нагревание
Ar-Z-Ar'
* К2СО3;
[Си]»*; (изо-С3Н7ОН)»»*
Z = O, NH, SOj, S; X = C1, Br
** СигС12; ••* С6НиОН, глицерин, (CHsOCH,CHgJO
Электроноакцепторные заместители в АгХ в орто- или яа/?а-положениях к
галогену существенно облегчают реакцию, тогда как электроноакцепторные за-
заместители в Ar'ZH затрудняют ее. Основная побочная реакция — восстанови-
восстановительное дегалогенирование.
Реакция используется для получения диариловых эфиров и производных
N-фенилантраниловой кислоты, применяемых в синтезе 9-хлоракридинов.
Модификация Гольдберга (Goldberg) — конденсация С6Н5Х с N-ацилироваи-
ными ароматическими аминами.
405
См. также Уильямсои (№ 582), Ульман (№ 583).
Uttmann F.. Вег., 1905, Bd. 38, S. 2211; Ann., 1906, Bd. 350, S. 85.
Massie S. P., Kadaba P. K., J. Org. Chem., 1956, v. 21, p. 347.
Weingarten H., J. Org. Chem., 1964, v. 29, p. 977.
Bacon R G. R., Hill A. O., Quart. Rev., 1965, v. 19, p. 122.
Fanta P. E., «Synthesis», 1974, № I, p. 9—21.
OP, т. 14, с 24.
585. УЛЬМАН — ФЕТВАДЯН (ULLMANN — FETVADJIAN)
Получение бензакридинов конденсацией р-нафтола с альдегидами и арома-
ароматическими аминами:
N
A0-90%)
R = Н (обычно), С,Н6, C,H4NOs-«; R' = Н, СН3, CF3, F, л-ОН, *-NHs
В аналогичную конденсацию вступают также аминопроизводные гетероцик-
гетероциклических соединений.
См. также Бернтсен (№ 65).
Uttmann F-, Fetvadjian А., Вег., 1903, Bd. 36, S. 1027.
Buu-Hoi N. P., Royer R., Hubert-Habart M., J. Chem. Soc, 1955, p. 1082.
Thu-Cuc Т., Buu-Hoi N. P., Xuong N. D., J. Chem. Soc, Ser. C, 1966, p. 87.
Acheson R. M. Acridines. New York — London, Interscience pub!., 1956,
p. 324.
586. УЛЬТЕ (ULTEE)
Получение цнангидринов реакцией синильной кислоты с алифатическими
альдегидами или кетонами в присутствии щелочей:
0оС R4 /ОН
* КаСОз. КОН
При перегонке циангидрины стабилизируют добавкой следов A—2%) кис-
кислот (Н3РО4, С1СН2СООН, CH3CSOH, H2SO4).
См. также Кнлиани — Фишер (№ 292), Урех (№ 590).
UНее A. /., Rec trav. chim., 1909, v. 28, p. 1, 248, 257; Ber, 1906, Bd. 39,
S. 1856.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 231.
Hustedt H. H., Pfeii E., Ann., 1960, Bd. 460, S. 15.
Вейганд-Хильгетаг, с 717.
406
587. УОЛФРОМ — КАРАБИНОС (WOLFROM — KARABINOS)
Получение альдегидов восстановительным обессернванием сложных эфиров
тиоловых кислот в присутствии никеля Ренея:
г; нагревание
C
\сг>' lNi-Ренея]; (СН3СОСН3)
R, R' = Alk, Ar
E0-80%)
Альдегиды образуются только при использовании катализатора, частично
дезактивированного кипячением в ацетоне (соотношение катализатора и тноэфи-
ра 10: 1). Применение стандартного никеля Ренея, а также увеличение соот-
соотношения катализатора и тиоэфира (до 20:!), приводит к соответствующим
спиртам.
Тиоэфнры обычно получают взаимодействием тиолов с хлорангидридамн
кислот в присутствии пиридина.
Реакция находит применение в ряду Сахаров и стероидов.
См. также Грундман (№ 223), Розенмунд — Зайцев (№ 524), Уолфром —
Карабинос (№ 588).
Wolfram М. L, Karabinos J. V., J. Am. Chem. Soc, 1946. v. 68, p. 724, 1455.
Spew G. В., Mclntosh A. V., Levin R. H., J. Am. Chem. Soc, 1948, v. 70,
p. 1907.
Mclntosh A. V; Meinzer E. M., Levin R. H., J. Am. Chem. Soc, 1948, v. 70,
p. 2955.
Mclntosh A. V. e. a., J. Am. Chem. Soc, 1949, v. 71, p. 3317.
OP, т. 8, с 297.
588. УОЛФРОМ — КАРАБИНОС (WOLFROM — KARABINOS)
Превращение карбонильной группы в метиленовую гидрогенолнзом соответ-
соответствующих тиоацеталей иад никелем Ренея:
г; нагревание
/C(SC2H6J ^одн сНьОН)'; [NT]
• Н2О, дноксан, абс. С2Н6ОН
Реакция применима к алифатическим, жирноароматическим и ароматическим
альдегидам и кетонам. Благодаря мягким условиям восстановления она успешно
используется в химии стероидов и углеводов.
Тиоацетали получают реакцией карбонильных соединений с тиолами под
действием ZnCb и безводного Na2SO4 при 0 °С.
См. также Кижнер — Вольф (№ 291), Клемменсен (№ 286), Уолфром —
Карабинос (№ 587), Швенк —Папа (№ 702).
Wolfrom M. L, Karabinos J. V-, J. Am. Chem. Soc, 1944, v. 66, p. 909.
Zessis E., Pichtmyer N. K., J. Am. Chem. Soc, 1952, v. 74 p. 4374.
Sato Y., Ikekawa N., J. Org. Chem., 1959, v. 24 p. 1367.
OP, т. 8, с 297.
407
589. УРЕХ (URECH)
Образование гидантоинов при взаимодействии а-аминокислот с цианатом
калия и последующем нагревании с соляной кислотой:
СО
RCH-COOH
NH2
KOCN
RCH—COOK
HN NH2
25%-ная НС1;
нагревание KHL/ \
у- | )
nh
В реакцию можно вводить нитрилы или амиды а-аминокислот, а также тио-
цианаты. При омылении гидантоинов образуются а-аминокислоты, причем с бо-
более высокими выходами, чем при омылении соответствующих а-аминонитрилов.
Реакцию используют для разделения аминокислот при гидролизе протеинов.
См. также Бухерер — Берге (№ 130).
Urech F., Ann., 1873, Bd. 165, S. 99.
Ware E., Chem. Rev., 1950, v. 46, p. 407.
590. УРЕХ (URECH)
Получение циангидринов при действии кислоты на смесь кетона с цианистым
калием в водном растворе:
R\ KCN; HC1* R\ /CN
NC=O *¦ СУ
R'/
(ДО 80%)
R = Alk; R' = Alk, Ar
• CHgCOOH
Выход продукта существенно определяется стерическим эффектом заместите-
заместителей в исходном кетоне. Так, в случае (ызо-С3Н7JСО реакция не идет.
См. также Килиани — Фишер (№ 292), Ульте (№ 590).
Urech F., Ann., 1872, Bd. 164, S. 255.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 231.
Hustedt H. H., Pfeil E., Ann., 1961, Bd. 640, S. 15.
СОП, т. 2, с 566.
591. УРРИ-КАРАШ (URRY-KHARASCH)
Перегруппировка свободных радикалов, полученных из алкилгалогенндов
при действии реактива Гриньяра, в присутствии хлористого кобальта*:
(СН3KСАг
(СНзJС—СН2С1 + RMgX
I
2
I
[Cod,]: (эфир)
Аг
* Называют также реакцией Карата — Гриньяра.
408
> (СНзJС—СН2Аг >¦ (CH3JCHCH2Ar + CH3CCH2Ar+(CH3JC==CHAr
II
сн2
R = Alk, C6H5; Ar = CeH5, C,H4C1, C,H4F, С6Н4СН3, СбН4ОСН3
Перегруппировка проходит на 30—50%.
В случае силанов, содержащих галогеналкильную группу, перегруппировка
образующихся свободных радикалов не происходит, например:
C2H5MgBr
(C,H6KSiCH2Cl > (C,H5KSiCH3 + (C6H5KSiCH2CH2Si(CeH5K
[СоСЗД
B3%)
G2%)
См. также Виланд (№ 162), Вюрц (№ 182).
Kharasch M. S., Fields Е. К- J. Am. Chem. Soc, 1941, v. 63, p. 2316.
Urry W. H., Kharasch M. S., J. Am. Chem. Soc, 1944, v. 66, p. 1438.
Ruechardt C, Trautwein H., Chem. Ber., 1963, Bd. 96, S. 160.
Abraham M. H., Hogarth M., J. Organomet. Chem., 1968, v. 12, p. 497.
Wilt J. W., Kolewe O., Kraemer J. F., J. Am. Chem. Soc, 1969, v. 91, p. 2624.
Allen R. B. e. a., J. Am. Chem. Soc, 1973, v. 95, № 5, p. 1692.
592. УЭНКЕР (WENKER)
Получение азиридинов из {5-аминоспиртов действием серной кислоты с по-
последующей циклизацией образовавшихся {5-аминоалкилсульфатов при нагревании
со щелочами:
КОН или NaOH;
H2SO4; 130 °С нагревание
RCH-CRj- >¦ RCH—СЩ — *¦ RHC CR2
A I I I (нгО) ч /
Н NH2 ~O3SO +NH3 NH
(80-90%)
R = H, C6H5; R'=H, Alk
Аналогично из N-фенилэтаноламина получен N-фенилазиридин с выходом
80%. Метод используют для промышленного получения этиленимина.
См. также Габриель (№ 184).
Weaker H., J. Am. Chem. Soc, 1935, v. 57, p. 2328.
Leighton P. A., Perkins W. A., Renquist M. L, J. Am. Chem. Soc, 1947, v. 69,
p. 1540.
Brois S. J., J. Org. Chem., 1962, v. 27, p. 3532.
Гембицкий П. А., Жук Д. С, Каргин В. А. Химия этилена. М., «Наука»,
1966, с. 16.
593. ФАВОРСКИЙ
Перегруппировка а-галогенкетонов в карбоновые кислоты или их производ-
производные под действием оснований*:
Х
\
;
сн-с
V (эфир)* R
* Называют также реакцией Фаворского — Маркера (Marker).
409
X = C1, Br; Y = OH, AlkO, NH2, NRS; R = Alk, Ar, цикло-Alk;
R' = H, Alk
* спирты
Перегруппировка алициклических кетонов сопровождается сужением цикла,
например:
9 Вг СООН
NaOH
Перегруппировка а,а'- и а,|3-дибромкетонов приводит, соответственно, к про-
производным а,р- и р,у-непредельных кислот:
Rs
4
.С—СОСН2Вг
RCHBr—СВг-СОСНз
сн3
>=сн-с>
н,с/ \-
RCH=C—СН2—Сч]
СН„
Р
/О
Побочные реакции: образование эпоксиэфиров, а-оксиацеталей и а-оксике-
тонов.
Направление реакции существенно зависит от природы основания, на-
например:
XOOR'
R'CT
I/
О
R = СН3; ' R' = mpem-CtH9
Реакция успешно применяется в химии стероидов, при синтезе сильно раз-
разветвленных ациклических карбоновых кислот и гел-замещенных циклоалканкар-
боновых кислот.
См. также Баллах (№ 146), Рамберг — Беклунд (№ 494).
Favorskii А. Е. е. п., J. prakt. Chem., 1895, Bd. 51, S. 533; 1913, Bd. 88,
S. 658.
Deghenghi R. e. a., Can. J. Chem., 1966, v. 44, p. 789.
Udding A. C, Wynberg H., Strating J., «Tetrahedron Letters», 1968, p. 5719.
Bordwell F. G. e. a., J. Am. Chem. Soc, 1969, v. 91, p. 2087.
Ахрем А. А., Устынюк Т. К., Титов Я- А., Усп. химии, 1970, т. 39, с. 732.
ОР, т. 11, с. 267.
594. ФАВОРСКИЙ
Изомеризация ацетиленовых углеводородов под действием щелочей (ацети-
лен-алленоьан перегруппировка):
КОН; 170 °С
RCH2-CsCH ,„ ц „ц> > RCH=C=CH2 » RC=C-CH3
(С2Н5ОН)
R == Н, Alk
410
Превращение является обратимым. Проведение реакции при более низкой
температуре позволяет получать соответствующие аллены, например:
КОН; 150 °С
(CH3JCH-G=CH (CgH5OH) > (СНзJС=С=СН2
Изомеризация существенно облегчается при наличии Аг- или СООН-групп:
40 °С
-*¦ ноос-сн=^с=сн2
НООС—СН2—С=СН
К2СО3
(Н2О)
90 °С
НООС—CseeC-CH,
А1 (актнвир.); 20 °С
ArCH2CsCAr' *¦ АгСН=С=СНАг' >¦ Ar-CsC-CH2Ar'
Обратимую ацетилен-алленовую перегруппировку галогенидов, происходя-
происходящую под действием Си2Х2, называют перегруппировкой Фаворского — Фаворской:
Ч Си2Х2; -80 °С
Л—С=СН >-
/с==с=снх
X
См. также Дёринг (№ 247).
Фаворский А. Е., ЖРФХО, 1887, т. 19, с. 414.
Favorski A., Favorskaya Т., С. г., 1935, v. 200, р. 839.
Bailey W. /., Pfeifer С. R., J. Org. Chem., 1955, v. 20, p. 95.
Wartanjan S. A., Badanjan S. O., Angew. Chem., 1963, Bd. 75. S. 1034.
595. ФАВОРСКИЙ
Присоединение ацетиленов к карбонильным соединениям с образованием
ацетиленовых спиртов:
Г> Т~>
4 КОН»; 0°С; 5—10 кгс/см2 ^ч
(эфир)**;
ОН
R, R' = Alk, Аг; R" = Н, СН=СН2
* NaNH2; *• МН3(жидк.), эфиры гликолей, тетрагидрофуран,
(CH3JSO, ксилол, гексаметапол
Реакция применима также к алициклическим кетонам и некоторым альдеги-
альдегидам, например:
СН3СНО + CHsCH > СН3СН(ОН)С^СН D3%)
При небольшом избытке ацетилена происходит конденсация с участием двух
молекул кетона с образованием ацетиленовых гликолей*:
R\ КОН 20 'С R\ /R
\ КОН; 20 'С
/С=О + СН=СН
С—С=С-
|
ОН
F0—90°/о)
Ч
|\R'
ОН
* Называют реакцией Фаворского — Бабаяна.
411
Проведение процесса в две стадии позволяет синтезировать несимметричные
гликоли. Вместо ацетилена можно использовать карбид кальция.
Реакция имеет большое значение для синтеза виниловых спиртов, диеиов,
различных алициклических и гетероциклических соединений.
См. также Неф (№ 424), Реппе (№ 506).
Фаворский А. Е., ЖРФХО, 1905, т. 37, с. 643.
Бабаян А. и др., ЖОХ, 1939, т. 9, с. 1631.
Назаров И. Н., Котляровсшй И. Л., Рябченко В. Ф., ЖОХ, 1953, т. 23,
с. 1900.
Шостаковский М. Ф. и др., Ж. орг. хим., 1966, т. 2, с. 953.
Михайловский Д. И., Михайловская В., Фаворская Т. А., Ж- орг. хим., 1974,
т. 10, с. 188—191.
596. ФАЙСТ (FEIST)
Замыкание кольца пиррола при конденсации ацилоннов с эфирами Р-амино-
замещенных а,Р-иепредельных карбоиовых кислот под действием хлористого цин-
цинка в спирте:
ZnCll; нагревание
RC-CHR' + R"NH-C=CHCOOC2H6 -*• R
6
ОН
(С2Н5ОН)
:\ ,соос2н6
R'"
NR*
C0-70%)
R, R', R'" = H, CH3, CeH5; R* = H, CH3, CH2CeH5> CeH6> C,H4CH3
* KHSO,
Вместо ацилоинов можно использовать этиловый эфир дикетояитарной
кислоты.
См. также Япп — Мюррей (№ 755).
Feist F., Вег., 1902, Bd. 35, S. 1558.
McKinnon D. M., Can. J. Chem., 1965, v. 43, p. 2628.
Hollins C. Synthesis of Nitrogen Ring Compounds. London, Benn, 1924, p. 76.
597. ФАЙСТ—БЕНАРИ (FEIST—BENARY)
Замыкание кольца фураиа при конденсации а-галогенкетоиов с р-дикарбо-
нильными соединениями:
XOR'
NH3 или C6H5N
RC-CH2C1 + R'C-CH2—CR" »-
h h h '
R, R" = AIk; R' = Alk, OAlk
Выходы замещенных фуранов невысоки. В качестве источника а-галогеике-
тонов можно использовать 1,2-дихлорэфиры, которые в присутствии конденси-
конденсирующего агента образуют монохлоркетоны и моиохлоральдегиды. При примене-
применении аммиака в качестве конденсирующего агента получается смесь фураиов и
пирролов (см. Гаич, № 189).
412
Feist F., Вег., 1902, Bd. 35, S. 1539, 1547.
Benary E., Вег., 1911, Bd. 44, S. 489, 493.
McKinnon D. M., Can. J. Chem., 1965, v. 43, p. 2628.
Эльдерфильд, т. I, с. 104.
598. ФЕНТОН (FENTON)
Окисление ^гидроксильной группы а-оксикислот или а-гликолей в карбониль-
карбонильную группу действием перекиси водорода в присутствии солей закисиого железа
(реактив Фентона):
—СН—R
Н2О2; ~0°С
[FeSO4]
ОН 6
R = СООН, СН2ОН
-C-R
В реакцию вступают различные а-оксикислоты, а-гликоли и полиспирты на-
например:
СН3СН(ОН)СООН
СНоСОСООН
СН2ОН СН2ОН СН2ОН СНО
снон -—>- с=о + с=о + снон
снгон сно сн2он а
:но
Реакция протекает по свободиорадикальиому механизму. Первичные спирты
в условиях реакции не окисляются, сахара подвергаются окислительному рас-
расщеплению, например:
СООН СНО
I
(СНОНL —
| —L
н2он
I
(СНОН).,
|
сн2он
Третичные спирты под действием реактива Феитона, являющегося источни-
источником свободных гидрокснльиых радикалов, димеризуются, например:
НО'
(СНзKС-ОН »- .СН2С(СН3J * (СН3JССН2-СН2С(СН3J
ОН QH ОН
D0%)
См. также Болл — Гудвнн — Мортои (№ 97), Пфициер — Моффэтт (№ 482)
Руфф—Фентон (№ 530). Y ;
Fenton H. I. H., J. Chem. Soc, 1894, v. 65, p. 899.
Уотерс И. Химия свободных радикалов. Пер. с англ. Под ред Я К Сыпки-
на. М., Издатинлит, 1948, с. 270. ^ьф™
Физер, т. 3, с. 78; Gilman, v. 4, p. 1157.
413
RCH-COCHg + CeH6N2Cl >
COOC2H6
на
599. ФЕОФИЛАКТОВ
Получение а-аминокнслот взаимодействием алкилацетоуксусных эфнров с
солями диазония и последующим восстановлением образующихся при этом фе-
нилгидразонов а-кетокислот:
Г N=NCeH6
| КОН
RC-СОСНз >¦ RCH—N=NC,H6
_ СООС2Н6 COOK
Zn; HC1
»- RC=N-NHCeH6 *- RCH-NHa
COOH COOH
(80%—колич.)
R = Alk
Метод позволяет получать а-амииокислоты, содержащие различные замести-
заместители (Hal, ОН, Аг и др.).
Феофилактов В. В., ДАН, 'l939, т. 24, с. 755 A939); Изв. АН СССР, ОХН,
1941, с. 521; ЖОХ, 1940, т. 10, с. 247.
СОП, т. 3, с. 277.
600. ФЕРРАРИО (FERRARIO)
Получение феноксатииа из дифенилового эфира и серы в присутствии хлори-
хлористого алюминия*:
S
к к. ,.
R'
[А1С13]
О
(80—90%)
R, R' = Н, СН3) С1, СОСН3
Реакцию проводят при соотношении эфира, серы и А1СЬ, равном 1,3 : 1 : 0,5.
Ferrario E., Bull. Soc. chim. France, 1911, v. 9, p. 536.
Ackermann F., нем. пат. 234743 A911); Chem. Zbl., 1911, T. 2, S. 1768.
Deasy С L, Chem. Rev., 1943, v. 32, p. 174.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер. с
англ. М., Издатнилит, 1949, с. 664.
Эльдерфильд, т. 6, с. 70.
601. ФИЛЛИПС —ЛАДЕНБУРГ (PHILLIPS — LADENBURG)
Получение бензнмидазолов конденсацией о-фенилеидиамииов с карбоиовыми
кислотами и последующей циклизацией образующихся N-ацильиых производных
под действием минеральных кислот**
f^' 2 N2; нагревание
R Г Т +R'Cooh >-
* Называют также реакцией Феррарио — Аккермана (Ackermann).
** Называют также реакцией Филлипса.
414
NHCOR'
NHCOR'
(Н2О)
NH
R = Н, NO2, OCH3 и др.; R' = Alk, Ar
Диацнльные производные о-феиилеидиамииа реагируют при нагревании в
запаянной трубке A40—200°С). Подобно карбоновым кислотам реагируют их
эфнры, амиды, нитрилы, а также дикарбоновые кислоты.
Получение бензимидазолов из альдоновых кислот используют для иденти-
идентификации альдоз.
Реакция находит применение в синтезе лекарственных веществ, красителей,
пестицидов и др.
См. также Вайдеихаген (№ 142).
Ladenburg А., Вег., 1875, Bd. 8, S. 677; 1877, Bd. 10, S. 1123.
Phillips M. A., J. Chem. Soc, 1928, p. 172, 2393, 3034; 1929, p. 2820.
Cescon L. A., Day A. R., J. Org. Chem., 1962, v. 27, p. 581.
Kamel M. e. a., J. prakt. Chem., 1970, Bd. 312, S. 737.
Эфрос Л. С., Кумаев В. П., Захс Э. Р. «Химия гетероциклических соедине-
соединений», 1967, с. 336.
Эльдерфильд, т. 4, с. 481.
СОП, т. 2,. с. 85.
602. ФИНКЕЛЬШТАЙН (FINKELSTEIN)
Замещение хлора и брома в органических соединениях иа иод при действии
йодистого натрия* I
Nal*
пу >_ р т
(СНзСОСНз)"
X = С1, Вг
* KI, Cal2, A1IS; *• СН3ОН, Н2О
Бромпроизводные реагируют легче, чем хлорпроизводные. Для алкилгалоге-
нидов легкость обмена галогена уменьшается в ряду заместителей: первич-
первичные > вторичные > третичные. Высокой реакционной способностью обла-
обладают соединения, содержащие в а-положении к галогену группы СООН, СО,
С=С, С5Н5. Обмен галогена в ароматическом кольце возможен лишь при нали-
наличии электроноакцепторного заместителя.
1,2-Дигалогенпроизводные в этих условиях превращаются в олефииы.
Основные побочные процессы: обменная реакция RX с растворителем и об-
образование R—R.
См. также Руфф (№ 529).
Finkelstein H., Вег., 1910, Bd. 43, S. 1528.
Treibs W., Hermann J., Zimmermann G-, Chem. Ber., 1960, Bd. 93, S. 2198.
СОП, т. 2, с 443; 4, с. 266.
Фьюзон, с. 226.
* Называют также реакцией Коианта (Conant) — Финкельштайна.
415
603. ФИТТИГ (FITTIG)
Циклоконденсация альдегидов с безводным сукцинатом натрия в уксусной
кислоте с образованием параконовых кислот:
100-120 °С
RC^ + NaOOCCH2CH2COONa
\н
COONa
RCH—CHCH2COONa
Ан
R = Alk, C6H6
Аналогично протекает реакция с солью метилянтарной кислоты, при этом
образуется смесь 2- и 3-метилзамещенных алкилпараконовых кислот.
Fittig R., Ann., 1889, Bd. 255, S. 1.
Houben-Weyl, Bd. 6/2, S. 635.
604. ФИШЕР (FISCHER E.)
Получение арилгидразинов восстановлением солей диазония сульфитами ще-
щелочных металлов в нейтральной или щелочной средах с последующим кислот-
кислотным гидролизом образовавшихся солей арилгидразиндисульфокислот:
+
Ar— N=N X"
(НгО)
0 °С Na2SO3
[Ar—N=N-SO3Na] >-
Ar—N—NHSO.Na
н+
ArNH— NH2
SO3Na
* Zn + CH3COOH, H2SO3
Метод позволяет получать арилгидразины, содержащие в ароматическом яд-
ядре различные заместители (F, NO2, COOH, COOAlk и др.).
Модификация Мейера (Meyer V.) — восстановление солей диазония хлори-
хлористым оловом в кислой среде. Образующиеся комплексные соли олова с гидро-
гидрохлоридами арилгидразинов легко разлагаются щелочами с выделением арилгид-
арилгидразинов. Метод проще, чем метод Фишера, часто применяется в лабораторных
условиях, однако он не пригоден для получения гидразинов антрахинонового ря-
ряда и восстановления хлоридов о-нитрофенилдиазония.
См. также Рашиг (№ 496).
Fischer E., Ber., 1875, Bd. 8, S. 589; Ann., 1878, Bd. 190, S. 79.
Meyer V., Ber., 1883, Bd. 16, S. 2976.
Huisgen R., Lux R., Chem. Ber., 1960, Bd. 93, S. 540.
Саундерс К- Ароматические диазосоединения и их техническое применение.
Пер. с англ. Под ред. В. М. Родионова. М., ГОНТИ, Ред. хим. лит., 1938, с. 157.
Греков А. П. Органическая химия гидразина. Киев «Техника», 1966, 235 с.
416
605. ФИШЕР (FISCHER E.)
Получение О-алкилгликозидов нагреванием моносахаридов со спиртами в
присутствии соляной кислоты:
+ ROH
CHOR
нагревание I
СНОН
СНОН
[НС1]
Процесс состоит из четырех этапов: образование фураиозидов из исходного
моносахарида, аномеризация в равновесную смесь фуранозидов, изомеризация
фуранозидов в пиранозиды и, наконец, аномеризация пиранозидов. В результате
реакции образуется равновесная смесь четырех возможных изомеров. Повыше-
Повышение температуры и увеличение концентрации кислоты способствуют возрастанию
доли пиранозидов.
Реакция пригодна лишь для сиитеза гликозидов низших спиртов.
См. также Кёнигс—Кнорр (№ 289), Фишер (№ 607), Фишер — Шпайер
(№617).
Fischer E., Ber., 1893, Bd. 26, S. 2400; 1895, Bd. 28, S. 1145, 1151.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 213.
606. ФИШЕР (FISCHER E.)
озазонов при нагревании моносахаридов с избытком арилгид-
сно
СНОН + ArNHNH2-HCl
СНОН
HC=NNHAr
CH3COONa; рН^б I
^ШНАг
СНОН
Избыток арилгидразииа действует как окислитель, что приводит к образова-
образованию в молекуле моносахарида новой СО-группы, При этом ArNHNHg восстанав-
восстанавливается до ArNH2 и 1МНз, а образовавшаяся СО-группа вновь реагирует с
ArNHNH2, давая озазон.
В этих условиях кетозы реагируют значительно легче, чем альдозы. Наличие
электроноакцепторных заместителей в бензольном ядре арилгидразинов облегчает
реакцию.
Ранее озазоны широко использовались для установления строения и иденти-
идентификации моносахаридов.
См. также Бэрри (№ 134).
Fischer E., Ber., 1884, Bd. 17, S. 579; 1887, Bd. 20, S. 821.
Percival E. G. V., Adv. in Carbohydrate Chem., 1948, v. 3, p. 23.
Weygand F. e. a., Chem. Ber., 1955, Bd. 88, S. 487; 1958, Bd. 91, S. 1567.
Stroh H. H., Scharnow H. G., Chem. Ber., 1965, Bd. 98, S. 1588.
27—684
417
607. ФИШЕР (FISCHER E.)
Получение ацеталей взаимодействием альдегидов со спиртами в присутст-
присутствии хлористого водорода:
нагревание
r RCH(OR')a
E0-70%)
R = Н, Alk, С6Н6, QH4NO2-n; R' = CH3, C2H5
* NH4C1, CaCl2> ZnCl2, FeCl3
См. также Фншер (№ 605), Хаук —Зауэр (№ 643).
Fischer E., Giebe G., Ber., 1897, Bd. 30, S. 3053.
Helferich В., Fries F. A., Ber., 1925, Bd. 58, S. 1246.
Houben-Weyl, Bd. 7/1, S. 419.
608. ФИШЕР (FISCHER E.)
Получение дипептидов гидролитическим расщеплением 2,5-дикетопипера-
зинов:
ОС—NH
с/ \:h-r
hn-co
НО" +
>¦ H3N—CHCO—NHCHCOO"
i I
Гидролнз неснмметрнчных днкетопнперазннов, как правило, приводит к смеси
двух возможных дипептидов.
Исходные дикетопнперазины легко получают цнклоконденсацией эфиров
аминокислот.
Fischer Е., Fourneau E., Ber., 1901, Bd. 34, S. 2868.
Fischer E., Ber., 1906, Bd. 39, S. 2930.
Шредер Э., Любке К. Пептиды. Т. 1, Пер. с англ. Под ред. М. М. Шемяки-
Шемякина и Ю. А. Овчинникова. М., «Мир», 1967, с. 116.
Кочетков Н. К-, Торгов И. В., Ботвиник М. М. Химия природных соединений.
М., Изд. АН СССР, 1961, с. 490.
609. ФИШЕР (FISCHER E.)
Получение пептидов взаимодействием хлорангидридов а-галогеизамещенных
карбоновых кислот с аминокислотами нлн нх эфнрамн с последующими гидроли-
гидролизом и аммонолизом:
—С—СОС1 + H2N—С-СООСаН5
—С—
X—С—CONH—С—СООС2Н6
Н2О
X—С—CONH—С-СООН
NH3
H2N-C— CONH- С— СООН
Процесс наращивания цепи можно продолжить, если а-галогенациламинокис-
лоту до стадии аммонолиза превратить в хлорангидрид действием PCU и повто-
повторить реакцию с аминокислотой илн пептидом.
Метод в настоящее время представляет в основном лишь исторический ин-
интерес.
418
См. также Бейли (№ 56), Бергман (№ 59).
Fischer E., Ber., 1907, Bd. 40, S. 1754.
Springall H. D., Law H. D., Quart. Rev., 1956, v. 10, p. 230.
Шредер Э., Любке К. Пептиды. Т. 1. Пер. с аигл. Под ред. М. М. Шемяки-
Шемякина и Ю. А. Овчинникова. М., «Мир», 1967, с. 117.
610. ФИШЕР (FISCHER E.)
Получение 2,5-диарнлоксазолов циклоконденсацией ароматических альдеги-
альдегидов с нитрилами а-оксикислот при действии хлористого водорода:
АгСНО + NC-CHAr'
I
он
на N—\
>¦ kr—V \—tW
(эфир)» \ /
о
E0-80%)
• СНС13
Оксазолы, содержащие алифатические заместители, получают циклокоиден-
сацией алифатических альдегидов с амидами а-оксикислот и последующим дей-
действием хлорокиси фосфора:
HN-/
~-\ УR'
о
RCHO + H2NCOCHR'
он о
R=H, Alk; R' = Alk, Ar
См. также Робинсон — Габриель (№ 517).
Fischer E., Ber., 1896, Bd. 29, S. 205.
Wiley R. H., Chem. Rev., 1945, v. 37, p. 410.
Эльдерфильд, т. 5, с. 248.
611. ФИШЕР (FISCHER E.)
Получение индолов внутримолекулярной конденсацией арилгидразонов аль-
альдегидов или кетонов в присутствии кислых агентов:
CHaR
-170 °С
R"
CHR
,NH
NR"
yN [ZnCla]*; (водн. C2H6OH)
NR"
R R'
C=CNH2
NHR"
R, R' =H, Alk, C,HS и др.; R" = H, Alk, COCH8;
tT*
41
R"' = H, Alk, CeH6( OAlk, NO2( Hal, SO3H, COOAlk, CN и др.
* H2SO4, HC1 в СаНбОН, лед. СН3СООН, НзРО4, BF3, CaH2, Си2С1„
полифосфорная кислота
В реакцию вступают арилгидразоны разнообразных альдегидов (кроме
СНзСНО)*, а также алициклических и гетероциклических кетонов, например:
¦NH—N
Подобно арилгидразонам циклизуются соответствующие производные гетеро-
ароматических и конденсированных полициклических соединений, например:
R'
CH2R'
I
NH—N=CR
NH
Наличие в ядре арилгидразона электроноакцепторных заместителей затруд-
затрудняет реакцию.
Циклизация лега-замещенных фенилгидразонов приводит к смеси изомерных
индолов:
R" R' R'
CHaR'
NH-N=CR
NH
R"
\-R
NH
Побочные реакции: образование аминов, гидролиз и алкоголиз гидразоиов,
замыкание колец других типов (например, пиридинового и т. п.). Молекулярные
перегруппировки происходят редко и, в основном, связаны с проведением реак-
реакции в жестких условиях.
Для получения исходных арилгидразоиов используют реакцию Яппа — Клин-
гемана (см. № 753).
Синтез Абрамовича—использование реакции Фишера для получения трипт-
аминов:
NH—
NH [H+]
CH2CHaNH2
\-соон
NH
C0-85%)
* Индолизацию фенилгидразона ацетальдегида удалось осуществить в па-
паровой фазе над А^О
420
См. также Бишлер —Мёлау (№ 82), Борше — Дрексель (№ 102), Липп
{№ 366), Маделюнг (№ 374), Райссерт (№ 491), Фоулдс—Робинсон (№ 622).
Fischer E. е. а., Вег., 1883, Bd. 16, S. 2241.
Abramovitch R. A., Shapiro ?>., J. Chem. Soc, 1956, p. 4589.
Робинсон Б., Усп. химии, 1971, т. 40, с. 1434.
Sundberg R. ]. The Chemistry of Indoles. New York — London, Acad. press,
1970, p. 142, 157.
Грандберг И. #., Усп. химии, 1974, т. 43, с. 266—293.
Китаев Ю. П., Бузыкин Б. И. Гидразоиы. М., «Наука», 1974, с. 235.
612. ФИШЕР (FISCHER E.)
Синтез 2-дезоксисахаров гидратацией гликолей, полученных из ацетилиро-
ванных альдоз бромированием и последующим действием цинка в уксусной
кислоте:
СНОСОСНз
снососн.
НВг
СНВг
СНОСОСНз
I
Zn
(CH3COOH)
Fischer E., Вег., 1914, Bd. 47, S. 196.
Fischer E., Bergmann M., Schotte H., Вег., 1920, Bd. 53, S. 509.
Overend W. G., Stacey M., Adv. in Carbohydrate Chem., 1953, v. 8, p. 45.
Кочетков Н. К. и др. Химия углеводов. М., «Химия», 1967, с. 264.
613. ФИШЕР (FISCHER E.)
Получение мочевой кислоты из псевдомочевой кислоты путем циклодегидра-
тации под действием кислот*:
О
О
0 NH °
•NHCONHR
NH
20%-ная HCl*; нагревание HN
R = Н, Alk, Ar
* (СООНJ
Аналогично циклизуется псевдотиомочевая кислота:
О О
HN
Х
NH NR
NH
¦=s
NH NR
R = Н, СН3
* Называют также реакцией Фишера — Аха (Ach).
421
Исходные псевдомочевые кислоты получают из урамила действием алкил-
или арилизоцианатов.
Метод находит применеиие для сиитеза различных пуринов.
См. также Траубе (№ 576), Беренд — Розеи (№ 64).
Fischer E., Ach L, Ber., 1895, Bd. 28, S. 2473.
Эльдерфильд, т. 8, с. 156.
614. ФИШЕР —ТРОПШ (FISCHER F. — TROPSCH)
Каталитическое гидрирование окнси углерода под давлением с образова-
образованием смеси углеводородов:
Н2; 200—400 °С; 1—10 кгс/см2
(85%)
* Со—Th-Mg, Ni, Ru
Реакция сильно экзотермичиа. Смесь СО н Hj предварительно очищают от
примесей сернистых, азотистых и ароматических соединений. Образующаяся
смесь парафинов (преимущественно с нормальной цепью) содержит небольшое
количество олефииов.
При проведении процесса на железном катализаторе образуются терминаль-
терминальные олефины F0—70%) обычно с одной боковой цепью:
2лСО -f лНа »- С„Н,
Реакцию используют в промышленности для производства искусственного
жидкого топлива (синтии), заменяющего бензин.
См. также Рёлен (№> 508).
Fischer F., Tropsch H., Brennstoff-Chem., 1923, Bd. 4, S. 193; 1932, Bd. 13,
S. 62; 1935, Bd. 16, S. 1.
Kolbel H., Engelhardt F., Angew. Chem., 1952, Bd. 64, S. 54.
Storch H. H., Columbic N., Anderson R. B. The Fischer-Tropsch and Related
Syntheses. New York, John Wiley a. Sons Inc., 1951, c. 138.
Эйду с Я. Т., Усп. химии, 1967, V. 8, р. 824.
Dry М. Е., Schingles Т., Boshoff L. J., J. catalysis, 1972, v. 25, p. 99.
Раппопорт И. Б. Искусственное жидкое топливо. М., Гостоптехиздат, 195S.
546 с.
615. ФИШЕР —ХЕПП (FISCHER О. —НЕРР)
Перегруппировка ароматических N-нитрозаминов в n-ннтрозоанилииы под
действием кислот:
ON-N—R'
НС1 или НВг
(эфир)*
ON—NHR'
NHR'
R = Alk, Hal, COOH; R' = Alk, Ar
* H3O, спирты, СН3СООН
422
Перегруппировке подвергаются также производные нафталина. Так, N-иит-
розо-№алкил-|3-нафтиламины превращаются в а-нитрозо-№алкил-|3-нафтил-
амины.
См. также Бамбергер (№ 39, 40), Гофман — Марциус (№ 214) Фрис
(№ 630), Четтэуэй (№ 696).
Fischer О., Нерр Е., Вег., 1886, Bd. 19, S. 2991; 1887, Bd. 20, S. 1247,
2471.
Steel G., Williams D. L. H., Chem. Comm., 1969, p. 975.
Baliga В. Т., J. Ore. Chem., 1970, v. 35, p. 2031.
Williams D. L, Wilson J. A., J. Chem. Soc, Perkin Trans. 2, 1974, № 1,
p. 13—17.
Химия нитро- и нитрозогрупп. Т. 1. Под ред. Г. Фойера. Пер. с англ. Под
ред. С. С. Новикова. М., «Мир», 1972, с. 163.
616. ФИШЕР—ЦЕРВЕК (FISCHER H. — ZERWECK)
Формилирование пирролов в а-положение действием цианистого водорода н
хлористого водорода с последующим гидролизом:
R\ /R" R\ ,R" R\
HCN + HCP
R—^ J>— CH=NH-HC1
NH
н2о
CHO
\ / (эфир)
NH NH NH
F5-95%)
R = СН3, С6Н6; R' = СН3, СООС2Н5; R" = СН3, С2Н6
• Zn(CNJ + HC1
Если а-положение занято, происходит Р-формилирование. Диальдегиды в
этих условиях не образуются.
См. также Гаттерман (№ 193), Хеш (№ 658).
Fischer И., Zerweck W., Ber., 1923, Bd. 56, S. 519.
McDonald S. F., J. Chem. Soc, 1952, p. 4184.
Houben-Weyl, Bd. 7/1, S. 27; Эльдерфильд, т. 1, с. 239.
617. ФИШЕР—ШПАЙЕР (FISCHER E.-SPEIER)
Получение сложных эфиров взаимодействием карбоновых кислот со спирта-
спиртами в присутствии минеральных кислот:
ОН
RCOOH + R'OH
[HCl]*
+
RC(OHJ
R'OH
OH "
I
R-C-OR
I
+OH2 _
* HaSO4, BF3
R-C-OHR'
ОН
RCOOR'
G0-90%)
423
В реакцию вступают различные алифатические и ароматические кислоты.
Существенное влияние на скорость этерификации оказывает пространствен-
пространственное расположение заместителей около реакционных центров. Так, о,о-дизамещен-
иые бензойные кислоты этерифицируются с трудом, тогда как этерификация
о,о-дизамещенных фенилуксусиых кислот идет легко.
См. также Фишер (№ 605).
Fischer E., Speier А., Вег., 1895, Bd. 28, S. 3252.
Lorette N. В., Brown J. H., J. Org. Chem., 1959, v. 24, p. 261.
Bender M. L., Chem. Rev., 1960, v. 60, p. 53.
Ингольд, с. 617; Физер, т. 1, с. 435.
СОП, т. 1, с. 536; т. 3, с. 504.
618. ФЛУД (FLOOD)
Получение триалкилгалогенсиланов расщеплением гексаалкилдисилоксаиов
под действием серной кислоты и соответствующего галогенида аммония:
конц. H2SO4; NH4X'
R,Si-O—SiR, " R,Si—X
(~80%—колнч.)
X = C1, Br, I;
* NaX
= Alk
Расщепление связи Si—О происходит, по-видимому, как под действием НХ
«in situ» (из NH4X и HfSO4), так и под действием серной кислоты:
H2so4 НХ
R3Si—О—SiR, *- (R,SiJSO4 »- R»Si—X
См. также Ибори (№ 272), Руфф (№ 529).
Flood E. A., J. Am. Chem. Soc, 1933, v. 55, p. 1735.
Whitmore F. С e. a., J. Am. Chem. Soc, 1946, v. 68, p. 156, 1380, 1881; 1948,
v. 70 p. 433, 445.
Post H. W. Silicones and other organic silicon compounds. New York, Rein-
hold publ. corp, 1949, p. 64.
619. ФОГТ (VOIGT)
Амииирование бензоина первичными аминами под действием пятиокиси
фосфора:
Аг—С—СН—Аг' -f H,NR
II I
О ОН
PEOs; 100-200 °С
гАг—С—СН-Аг'
II I
L NROH
; охлаждение
Аг—СН—С—Аг'
I II
NHR О
Аг, Аг' = C,HS, C,H4OCH,; R = Alk, Ar
* НС1; ** без растворителя
424
Ароматические амины реагируют и при отсутствии конденсирующих средств.
Алифатические амины с сильно разветвленной цепью в реакцию не вступают.
Для амииирования могут быть использованы также некоторые гетероциклические
амииы, например:
С,Н6—СН-С—С,Нв
ОН О
кенц. НС1; нагревание
(С6Н5СН3)
N
С,Н
II |
о с,н,
Voigt К., J. prakt. Chem, 1886, Bd. 34, S. 1.
Lutz R. E., Freek J. A., Murphey R. S., J. Am. Chem. Soc, 1948, v. 70,
p. 2016.
Cowper R. M., Stevens T. S., J. Chem. Soc, 1940, p. 347.
Kaye J. A., Pants С L., Burlant W. J., J. Am. Chem. Soc, 1953, v. 75, p. 746.
620. ФОЛЬХАРД — ЭРДМАН (VOLHARD — ERDMANN)
Замыкание кольца тиофена при взаимодействии динатриевых солей янтар-
янтарных кислот с трехсернистым фосфором:
RwR'
RCH—COONa p2s3; ~150°с
R'CH—COONa \
(-30-40%)
R, R' = H, Alk, C6H6, C,H4CH3-n, C,H4OCH3-n
См. также Бауман — Фромм (№ 50), Боджерт — Эррера (№ 93).
Volhard J., Erdmann H., Вег, 1885, Bd. 18, S. 454.
Gronowitz S., Adv. in Heterocyclic Chemistry, 1963, v. 1, p. 24.
OP, т. 6, с 343; СОП, т. 2, с 458; Эльдерфильд, т. 1, с. 167.
621. ФОРСТЕР (FORSTER)
Получение циклических диазокетонов из монооксимов циклических а-дикето-
нов и хлорамина:
;О
NH2C1; 0°C
>-
(водн. NaOH)
:О
—NH2
ОН
B5-40%)
Реакция позволяет получать разнообразные циклические диазокетоны, на-
например диазокамфору, диазоинданон и т. п.
При использовании хлорамина в момент выделения (к смеси щелочного рас-
раствора оксима и NH4OH прибавляют по каплям раствор NaOCl) выходы диазо-
кетоиов повышаются до 60%. Хлорамин может быть заменен гидроксиламино-
сульфоновой кислотой.
425
Оксимы алифатических кетонов реагируют с хлораминами, давая диазосо-
едииения:
NH2C1; О °С
RCH=NONa —* RCHN2
(эфир)
Диазометан образуется с выходом 74%.
См. также Кейва (№ 287).
Forster М. О., J. Chem. Soc, 1915, v. 107, p. 260.
Horner L., Muth K-, Schmelzer G., Chem. Ber., 1959, Bd. 92, S. 2953.
Rundel W., Angew. Chem., 1962, Bd. 74, S. 469.
Anselme Jean P., Koga Nobuko, Chem. Comm., 1970, p. 443.
622. ФОУЛДС— РОБИНСОН (FOULDS — ROBINSON R.)
Получение 2-метилиндолов бромированием М-ацил-2-аллилаиилинов и после-
последующей циклизацией образовавшихся дибромидов -под действием спиртового рас-
раствора щелочи
*.
СН2-СН=СН2
NHCOR
Вг% ^\/СНа-СНВг-СН2Вг 1. КОН или к2соз
(СНС1з) L JL (С2Н5ОН)
V,
¦сн.
NH
R = Alk
Аналогичио превращаются в индол К-ацил-2-винилаиилины:
,СН=СН2
NHCOCH.
>
NH
См. также Фишер (№ 611).
Foulds R. P., Robinson R., J. Chem. Soc, 1914, v. 105, p. 1968.
Taylor T. W. J., Hobson P. M., J. Chem. Soc, 1936, p. 181".
Эльдерфильд, т. З, с. 28.
623. ФРАНКЛАНД (FRANKLAND)
Получение дяалкилцинка диспропорционированнем галогеналкилциика:
Zn*; 25—90 "С
2RX
нагревание
2RZnX > R2Zn
(CHSCOOC2H6 + СвН6СНз)**
X = I, Br
* Zn—Си (сплав, 5% Си), Zn +порошок Си;
** эфир, (изо-С3Н,J0, (изо-С4Н„),О, без растворителя
* Реакцией Фоулдса — Робинсона называют также способ получения хиио-
линов действием хлорокиси фосфора на М-ацил-2-виниланилины.
426
В качестве алкилгалогенидов используют первичные или вторичные иодиды,
смеси иодидов и бромидов. В настоящее время в препаративных синтезах циик
заменяют цинк-медрой парой, а реакцию проводят в этилацетате с добавкой
иода. Вследствие высокой реакционной способности диалкилцинка синтез ведут
в атмосфере азота или двуокиси углерода, в случае высших алкильных произ-
производных — при пониженном давлении.
Реакция имеет большое историческое значение, так как является первым
случаем синтеза истинного металлоорганического соединения.
См. также Реформатский (№ 507).
Frankland Е., Ann., 1849, Bd. 71, S. 171, 213; 1859, Bd. Ill, S. 44.
Nosek J., Coll. Czech. Chem. Comm., 1967, v. 32, p. 2025.
Рохов Ю., Херд Д., Льюис Р. Химия металлооргаиических соединений. М.,
Издатиилит, 1963, с. 118. Пер. с англ. Под ред. И. Л. Кнуняица.
Методы элемеитооргаиической химии. Цинк, кадмий. Под ред. А. Н. Несмея-
Несмеянова и К. А. Кочешкова. М., «Наука», 1964, с. 7.
Вейганд-Хильгетаг, с 647.
624. ФРАНКЛАНД —ДУППА (FRANKLAND— DUPPA)
Получение эфиров а-оксикарбоновых кислот действием иа эфиры щавелевой
кислоты смеси алкилгалогенида и цинка с последующим гидролизом:
Zn; нагревание Н2О
ROOC—COOR+2R'X >- R2C— COOR >- R?C—COOR
OZnR
R, R'=Alk
OH
Циик можно активировать разбавленной НС1 или иодом. Вместо смеси ал-
алкилгалогенида и цинка можно применять цинкорганические соединения.
Метод позволяет ввести две различные алкильные группы в молекулу ис-
исходного эфира, напцимер:
C3H5I
С2Н6ООС—СООСаН6 + СН81
Ан
См. также Реформатский (№ 507), Иванов (№ 273).
Frankland E., Ann., 1863, Bd. 126, S. 109.
Frankland E., Duppa D. F., Ann., 1865, Bd. 135, S. 25.
Krau.se E., Orosse A. V. Die Chemie der metallorganischen Verbindungen Ber-
Berlin, Bornstrager, 1937, S. 115.
427
625. ФРАНШИМОН (FRANCHIMONT)
Получение эфиров алифатических а,|3-дикарбоиовых кислот» взаимодействием
эфиров а-бромкислот с цианистым калием:
2RCH—COOR'
Вг
KCN
•RCH-COOR'-
RC-COOR'
CN
н2о RCH-COOR'
RCH-COOR'
R = Alk, C6H5; R' = Н, Alk
Реакцию используют также для получения циклических дикарбоиовых
кислот:
COOR
СН2СНВг
(СН2)„СНВг
COOR
COOR
CH2CHCN
(СН2)„СНВг
COOR
и = 1, 3
CH-COOR
H2C {,CH—COOR
О
(СН2)„
См. также Браун — Уокер (№ 112).
Franchimont A. P. N., Вег., 1872, Bd. 5, S. 1048.
Henecka И., Chimie der Beta-Dicarbonylverbindungen. Berlin, Springer Verl.,
1950, S. 176.
626. ФРЕДЕНХАГЕН (FREDENHAGEN)
Нитрование ароматических соединений нитратом калия в жидком фтористом
водороде:
KNO3
АгН -> ArNOa
(жндк. HF)
C0-80%)
Аг = С6Н4ОН, С6Н4СН3) С6Н4СНО, CeH4NOa-
В реакцию вступают соединения ряда нафталина, а также антрахинон и хи-
иолин. Нитропиридины этим способом получить не удалось.
См. также Менке (№ 395), Вольфенштайн — Бётерс (№ 177), Реверден
(№ 498).
Fredenhagen K-, нем. пат. 529538 A930); С. А., 1931, v. 25, р. 5175.
Новые методы препаративной органической химии. Пер. с англ. Под ред.
Д. Н. Курсанова. М., Издатиилит, 1950, с. 57.
627. ФРИДЕЛЬ— КРАФТС (FRIEDEL — KRAFTS)
Алкилированне или ацилирование ароматических соединений алкил- или, со-
соответственно, ацилгалогенидами в присутствии хлористого алюминия*!
* Реакцией Фриделя — Крафтса называют иногда реакции алкилироваиия
или ацилирования алифатических соединений в присутствии кислот Льюиса.
428
Алкилирование:
R'
+RX
[АКЗД*
R'
~CLA1C13
6+ 6-
+ R-X.AICI3
R'
R = Alk; R' = H, Hal, OH, OR
* BF3, ZnCl2, FeClj, HF, H2SO4, HgPO^, C1SO3H, полифосфорная кислота
В реакцию вступают также конденсированные полициклические углеводоро-
углеводороды и некоторые гетероциклические соединения (тиофен, фурфурол). Электроно-
акцепторные заместители в ароматическом ядре оказывают иигибирующее дей-
действие. Легкость алкилироваиия определяется поляризуемостью связи С—X ал-
килгалогеиида. В качестве алкилирующих агентов могут быть использованы
также спирты (в присутствии BF3) и олефины.
Побочные процессы: образование полиалкилпроизводных, миграция алкиль-
ных групп в продуктах реакции и изомеризация алкильиого остатка.
Ацилирование:
R'
+ RCOX
RCO + А1С13Х"
COR
1СГ
В качестве ацилирующих агентов могут быть использованы нитрилы и аи-
гидриды кислот, например:
СО
с6н,+
'/о
о
соон
СОС6Н6
(90%)
Ацилнрование подчиняется тем же закономерностям, что и алкилирование.
Электроноакцепторные заместители ингибируют ароматическое ядро, однако при
одновременном присутствии электроноакцепторного и электронодонорного заме-
заместителей возможно введение ацильной группы:
CH3COCI
сн.с
N0,
Ацилироваиие не осложняется ни перегруппировками, ии образованием поли-
ацилпроиз водных.
Модификация Вильсмайера — Хаака (Vilsmeier — Haak) — ацилирование аро-
ароматических соединений анилидами в присутствии хлорокиси фосфора:
АгН + RCONHAr'
ArCOR
Модификации Ненцкого (Nencki) — а) ацилирование фенолов карбоновыми
кислотами в присутствии ZnCb; б) применение вместо А1СЬ безводного FeCl3,
являющегося более мягким катализатором.
429
Модификация Бена (Behn) — использование нитробензола в качестве рас-
растворителя при ацилировании фенолов. Это обеспечивает гомогенность реакци-
реакционной смеси вследствие растворимости каталитического комплекса.
Модификация Перрье (Perrier) — предварительное приготовление комплекса
А1С13 с RCOX и последующее взаимодействие его с ароматическим соединением,
что приводит к увеличению выхода продуктов.
Вариантом реакции Фриделя — Крафтса является метод Фриделя — Крафт-
са — Каррера (Каггег) — получение нитрилов взаимодействием ароматических со-
соединений со свежеприготовленными галогенцианами:
АгН + XCN ¦—-*- ArCN
[AICI3]
X = С1, Вг
См. также Аншютц (№ 19), Бальзон (№ 38), Неницеску (№ 419), Радзи-
вановский (№ 486).
Friedel С, Crafts J. М., С. г., 1877, v. 84, р. 1392, 1450.
Gourmelen С, Gaff Y., Le Tutour В., Bull. Soc. chim. France, 1974, № 7—8,
pt. 2, p. 1715.
OP, т. 2, с 141; т. З, с. 7; т. 5, с. 195.
Friedel —Crafts and Related Reactions, v. 1—4. Ed. Olah G. A. New York—
London, Interscience, 1963—1965.
628. ФРИДЛЕНДЕР (FRIEDLANDER)
Получение замещенных хинолинов конденсацией о-аминоарилкарбонильных
соединений с веществами, содержащими группировку —СНгСО—:
нагревание
(СаНьОН); [КОН?
COR
N=C— CH2R"
i
R, R' = Н, Alk, Аг, ОН, COOH; R" = Н, Alk, Ar, COOH, NO2, CN, SO3H и др.
* KaCO3, NaOH, пиперидин, Дауэкс 2, без катализатора
Из р-дикарбонильных соединений получается смесь изомерных хинолинов:
^СНО
+ CeH6COCH2COOR »
COOR
Диоксиацетофенон, глюкоза, левулиновая кислота в реакцию не вступают.
Основное ограничение метода — малая доступность о-аминокарбонильных соеди-
соединений. Реакцию используют обычно для синтеза хинолинов, замещенных в поло-
положении 3.
Модификация Борше — Рида (Borsche — Ried) — применение шиффовых ос-
оснований вместо о-аминокарбонильных соединений, что особенно удобно для син-
синтеза хинолииов, замещенных в бензольном ядре:
СН3О
CHJ
:h=nc6h4ch3
¦NH,
сн3сосоон
СН3О
CH.0
соон
См. также Ниментовский (№ 426), Пфитцингер (№ 481).
Friedlander Р., Вег., 1882, Bd. 15, S. 2572.
Fergstrom F. W., Chem. Rev., 1944, v. 35, p. 151.
Kempter G., Hirschberg S., Chem. Ber., 1965, Bd. 98, S. 419.
Fehnel E. A., Colin D. E., J. Org. Chem., 1966, v. 31, p. 3852.
Jacquignon P. e. a., Coll. Czech. Chem. Comm., 1973, v. 38, № 12, p. 3862.
Эльдерфильд, т. 4, с. 35; т. 7, с. 171.
629. ФРИДМЕН —ДОК (FREEDMAN —DOAK)
Получение арилфосфоновых кислот взаимодействием борфторидов арилдиазо-
иия с треххлористым фосфором в присутствии медных катализаторов:
РС13; -20 °С
[Ar-feN]+ [BFJ- (диоксаи)..; [Сиа>]..-Г
н2о
>¦ [Ar-N=N-PCl3]+ [BF4]~ >¦ ArPO(OHJ
B0-50%)
Ar = CeH5, CeH4Cl, CeH4SO2NH2, CeH4CH3
* PBrs; *• СН3СООСаН6, CH3COOC4H8, СНзСООСэН^изо; ••• CujBr,, Си
Аналогично могут быть получены диарилфосфиновые кислоты из арилдихлор-
фосфинов и солей диазония:
1. АгРС12
[Аг—N=N]+ [BFJ- — > Аг2РО(ОН)
Doak G. О., Freedman L. ?>., J. Am. Chem. Soc, 1951, v. 73, p. 5658; 1952,
v. 74, p. 753; 1953, v. 75, p. 683.
Kosolapoff G. M., Duncan J. I., J. Am. Chem. Soc, 1955, v. 77, p. 2419.
Freedman L. ?>., Doak G. 0., Chem. Rev., 1957, v. 57, p. 482.
Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. Т. 2. Изд.
2-е. М., «Химия», 1974, с. 395.
630. ФРИС (FRIES)
Перегруппировка сложных эфиров фенолов в о- или «-ацилфенолы в присут-
присутствии хлористого алюминия:
OCOR' ОН ОН
нагревание
>; (C6H6NO2)«
R
COR'
R = Alk; R' = Alk, Ar
* FeCl3, TiCl4, SnCl4 и др.; ** CeH6Cl, C12CHCHC12, CS2, без растворителя
431
Суммарный выход ацилфенолов — 70—90%. Проведение реакции при темпе-
температуре выше 100°С способствует opro-замещенню, при более низких температу-
температурах в основном образуются пара-изомеры:
ОСОСН,
25 °С
[А1С13];
Н:
сосн,
сосн,
(80—85%)
(96%)
При R'=Alk перегруппировка идет легче, чем при R'=Ar. С увеличением
алкильного остатка повышается тенденция к образованию гсара-нзомера. Элек-
троноакцепторные заместители обычно препятствуют реакции. При жестких усло-
условиях возможна миграция или отщепление алкнльных заместителей, связанных с
ароматическим ядром.
Аналогично перегруппировываются эфнры сульфокислот:
OSO2C6H6
С1
SOaCeHB
Перегруппировка имеет большое препаративное значение, поскольку разде-
разделение изомеров не представляет особых трудностей.
См. также Бамбергер (№№ 39, 40), Гофман — Марцнус (№ 214), Фишер —
Хепп (№ 615), Кляйзен — Хаазе (№ 302), Бейкер —Венкатарамаи (№ 54), Чет-
тэуэй (№696).
Fries К., Finck G., Ber, 1908, Bd. 41, S. 4271.
Shah D. N.. Shah N. M., J. Org. Chem., 1954, v. 19, p. 1681.
Dewar M. J. S., Hart L. S., «Tetrahedron», 1970, v. 26, p. 1001.
Le Goff M. Т., Beugelmans R., Bull. Soc. chim. France, 1972, p. 1115.
Kalmus С E., Hercules D. M., J. Am. Chem. Soc, 1974, v. 96, p. 449.
Вейганд-Хильгетаг, с. 862; OP, т. 1, с. 455.
631. ФРИС —ЛОМАН (FRIES—LOHMANN)
Окисление сульфатов а-нафтнламннов перекисью водорода в уксусной кисло-
кислоте с образованием 4,4'-днамино-1,1'-дннафтнлов:
NH2-HaSO4
¦R
Н2О2
(СН3СООН)
432
NH2
B5-40%)
R = Н, Alk, OCH3> C,H6 и др.
Реакция является удобным методом получения 3,3'-днзамещенных 4,4'-ди-
амино-1,1'-дннафтнлов.
См. также Глазер (№ 201).
Fries К, Lohmann W., Ber., 1921, Bd. 54, S. 2912.
Belcher R., Lyle S. J., Stephen W. I., J. Chem. Soc, 1958, p. 3243.
632. ФРИЧ — БУТТЕНБЕРГ— ВИХЕЛЛЬ
(FRITSCH — BUTTENBERG — WIECHELL)
Перегруппировка днарилгалогенэтиленов в днарнлацетилены под действием
сильных щелочей:
Аг.
>
; 200 °С
АгС=САг'
* Калий в mpem-C4HeOH, NaNHa или KNH2 в жидком NH3,
LiAlk в эфире или тетрагидрофуране
Скорость перегруппировки уменьшается в ряду Вг > I >С1. В процессе
перегруппировки не происходит изомеризации Аг'.
Аналогичным образом получен дициклопропнлацетнлен:
Н.С СН-1С=СНС1
(ТГФ)
Н2С СН-С^С-НС СН2
СН2
си,
(83%)
См. также Гровенштайн — Циммерман (№ 222).
Fritsch P., Ann., 1894, Bd. 279, S. 319.
Buttenberg W. P., Ann., 1893, Bd. 279, S. 327.
Wiechell H., Ann., 1894, Bd. 279, S. 337.
Kobrich G., Angew. Chem., 1965, Bd. 77, S. 89.
Kobrich G., Reitz G., Schummacher U., Chem. Ber., 1972, Bd. 105, S. 1674.
Fienemann H., Kobrich G., Chem. Ber., 1974, Bd. 107, № 9, S. 2797—2803.
28-684
433
633. ФРИЧ —КЛИНГ (FRITSCH —KLING)
Хлорирование алифатических метилкетонов хлором в водном растворе кар-
карбоната кальция с образованием а-хлоркетонов:
С12; СаСОз; 40 "С
RCOCH3 — *¦ RCOCH2C1
(-80%)
R = СН3, С2Н6> С3Н7
При хлорировании метилэтилкетона образуется смесь двух изомеров:
сн3снс1соснз и c2h5coch2ci.
Метод имеет ограниченное применение, так как в качестве побочных про-
продуктов образуются дихлорпроизводные, трудно отделимые от моиохлорпроиз-
водных.
См. также Бедукян (№ 53), Львов — Шешуков (№ 372).
Fritsch P., Ann., 1894, Bd. 279, S. 310.
Kling A., Bull. Soc. chim. France, 1905, v. 33, p. 322.
Houben-Weyl, Bd. 5/3, S. 615.
634. ФРОИНД (FREUND)
Циклизация 1,3-дигалогеналканов при действии металлического натрия с об-
образованием циклопропанов:
R'
¦/
с-сн2х
Na
R, R' = H, Alk
Таким же путем могут быть получены и циклы большего размера. Для син-
синтеза циклобутаиа реакция непригодна, так как приводит к трудноразделимой
смеси циклобутана G%) и и-бутана G0%).
Вариант Густавсона—циклизация дигалогеналканов под действием цинковой
пыли.
Побочная реакция — образование олефинов, которой способствует увеличе-
увеличение разветвленное™ цепи и повышение температуры реакции.
Вариант Хасса (Hass) — промышленный способ получения циклопропана
хлорированием природного газа с последующим дегидрохлорированием 1,3-ди-
хлорпропана цинковой пылью в водном спирте или ацетамиде. Выход продук-
продукта -80%.
См. также Перкин (№ 447).
Freund A., Monatsh., 1882, Bd. 3, S. 625.
Gustavson G., J. prakt. Chem., 1887, Bd. 36, S. 300.
Hass H. B. e. a., Ind. Eng. Chem., 1936, v. 28, p. 1178.
Фогель Е., Усп. химии, 1961, v. 30, p. 92.
434
635. ФУДЗИМОТО — БЕЛЛО (FUJIMOTO — BELLEAU)
Получение циклических а,|3-иепредельиых кетонов из б-еиоллактонов и реак-
реактива Гриньяра с последующим гидролизом под действием едкого кали в ме-
метаноле:
HgC -p^L
+ RCH2MgX
N2;o°c
(эфир)
НоС
RHX ОМдХ
н,с
кон
(сн3он)
RH2C ОН
R = А1к, СвН5
Аналогично реагируют б-енаминлактамы:
О
О
О"
н3с
R
E0-70%)
E0%)
Вместо реактива Гриньяра можно использовать алкилиденфосфораны или
фосфонат-аниоиы.
Реакция широко применяется в химии стероидов.
Fujimoto G. I., J. Am. Chem. Soc, 1951, v. 73, p. 1856.
Heard R. D. H., Ziegler P., J. Am. Chem. Soc, 1951, v. 73, p. 4036.
Belleau В., J. Am. Chem. Soc, 1951, v. 73, p. 5441.
Weil-Raynal J., «Synthesis», 1969, v. 1, p. 49.
636. ФУКС (FUCHS)
Получение оксазолидиидионов-2,5 при действии фосгена на а-амииокислоты:
нагревание
RCH-NHa + СОС1а >. 0=
(С8Н6СНз)*
boon о
F0-80%)
R = Н, hso-C4H9, н-С4Н9> СНаСвН5
* Без растворителя
28*
435
По сравнению с методом Лёйкса (см. № 363) данный способ является более
простым и дает лучшие выходы, но требует применения очень чистых амино-
аминокислот.
Fuchs F., Вег., 1922, Bd. 55, S. 2943.
Levy A. L, «Nature», 1950, v. 165, p. 152.
Farthing A. C, J. Chem. Soc, 1950, p. 3213.
Petri E. M., Staverman A. I., Rec. trav. chim., 1952, v. 71, p. 385.
637. ХАЛЛЕР—БАУЭР (HALLER — BAUER)
Расщепление фенилтриалкилметилкетонов под действием амида натрия с об-
образованием амидов триалкилуксусных кислот:
NaNH2; Н2О; нагревание
-C—С„Н5 1^Г, •- R?C-C-NHa
R О
(С6Н6)
R, R' = Alk, цикло-А\к
Я О
Расщеплению подвергаются также алифатические, ароматические и алицик-
лические кетоны, не способные к енолизации:
n-CH3OQH4COC6H6
Н2С—СН2
/ \(СН3J -
со
» n-CH3OC6H4CONH2
(СН3JСН(СН2JС(СН3J
CONH2
Несимметричные алифатические кетоны образуют смесь двух амидов. Али-
Алифатические кетоны с сильно разветвленными заместителями [например,
(СНзЬСНС(СНзJСОС(СНзJСН(СНзJ] в реакцию не вступают.
Препаративное применение метода ограничено из-за трудности синтеза ис-
исходных кетонов, которые получают действием алкилгалогенидов и амида натрия
на фенилалкилкетоны:
RCH2COC6H6
NaNH2
2R'X »- RR2CCOC6H6
См. также Циглер (№ 686).
Haller A., Bauer Е., С. г., 1909, v. 148, р. 70, 127; Ann. chim., 1914, v. 1, p. 5.
Bumgardner С. L., McDaniel K. G., J. Am. Chem. Soc, 1969, v. 91, p. 6821.
Walborsky H. M. e. a., J. Org. Chem., 1971, v. 36, p. 2937.
OP, т. 9, с 7.
638. ХАРД — МОУРИ (HURD —MORI)
Получение 1,2,3-тиадиазолов действием хлористого тионила на N-замещен-
ные гидразоны кетонов, содержащих а-метиленовую группу:
-СН2—C=N-NHR
SOC12; нагревание
^20-60%)
R = COOAlk, COCH3, SO2C,H6 и др.
436
В реакцию вступают гидразоны алифатических, алициклических, жирноаро-
матических, а также некоторых гетероциклических кетонов, например:
NNHCOOC2H6
so,
Hurd С. P., Mori R. I., J. Am. Chem. Soc, 1955, v. 77, p. 5359.
Regitz M., Angew. Chem., 1967, Bd. 79, S. 786.
Эльдерфильд, т. 7, с. 417.
639. ХАРД —СОУДЕН (HURD — SOWDEN)
Получение ацетилированных альдоновых кислот действием на альдозы гидр-
оксиламина с последующим превращением оксимов в нитрилы ацетилирован-
ацетилированных альдоновых кислот, гидролизом нитрилов в амиды и дезаминированием по-
последних азотистым ангидридом:
CH=NOH f С»3<™Н;НВг;
NH2OH | (СНнСОJО; CH3COONa CHOCOCH3 *~
снон о > снон
СНОН
(СгН6ОН)
CONH2 COOH
I N2Os; О °С |
СНОСОСНз ,>. СНОСОСНз
* NOCl, NOBr
Этим методом могут быть получены различные ацетилальдоновые кислоты.
Реакция протекает без эпимеризации. Промежуточные нитрилы получают спо-
способом, используемым в реакции Воля (см. № 172).
Hurd С. D., Sowden J. С, J. Am. Chem. Soc, 1938, v. 60, p. 235.
Robbins G. В., Upson F. IF., J. Am. Chem. Soc, 1938, v. 60, p. 1788; 1940, v. 62,
p. 1074.
Wolfrom M. L., Konigsberg M., Weisblat D. J., J. Am. Chem. Soc, 1939, v. 61,
p. 574.
Rice F. A. H., Johnson A. R., J. Am. Chem. Soc, 1956, v. 78, p. 428.
640. ХАРРИС (HARRIES)
Окислительное расщепление олефинов на два карбонильных соединения пу-
путем озонирования с последующим гидролизом:
II О3 ! I Н2О
RC=CR' *- RC—О—CR' >¦ RC— + R'C—
(инертн. растворитель) ч у II II
0-0 О О
Реакция идет с хорошими выходами. Так, например, превращение циклогек-
сена в адипиновый альдегид проходит с выходом -~65%.
437
Стадию гидролиза в некоторых случаях заменяют восстановительным рас-
расщеплением под действием Zn в СН3СООН или каталитическим гидрированием
иад Pd/СаСОз. Озонирование в метаноле с последующим восстановлением диме-
тилсульфидом позволяет гладко расщеплять олефины, сохраняя имеющиеся
функциональные группы (NO2, COOH и т. п.). По структуре образующихся в
ходе реакции альдегидов или кетонов можно судить о положении С = С-связи
в исходной молекуле.
См. также Лемьё (№ 355), Лемьё — Джонсон (№ 356).
Harries С, Ann., 1905, Bd. 343, S. 311.
Bailey P. S., Chem. Rev., 1958, v. 58, p. 925.
Johnson С D., Bailey P. S., J. Org. Chem., 1964, v. 29, p. 697, 703.
СОП, т. 12, с 59, 61.
641. XACC (HASS)
Парофазное нитрование парафинов азотной кислотой:
\
/
¦С-Н
60%-ная HNO3; 450—500 °С
¦NO»
Этот способ нитрования можно рассматривать как вариант реакции Коно-
Коновалова (см. № 318).
Следы галогена или кислорода ускоряют реакцию. Вместо паров HNO3 мож-
можно применять окислы азота:
NO2; 510 °С
СН3СН2СН3 > CH3CH(NO2)CH3 + CH3CHaCHaNO2 + CH3CH2NOa + CH3NO2
E0%) A5%) A5%) A5%)
Побочные процессы: образование смеси низших нитроалканов в результате
окислительного расщепления высших гомологов.
См. также Мейер (№ 391).
Hass Н. В. е. а., пат. США 1 967 667 A934); С. А., 1934, v. 28, р. 5830.
Hass H. В., Riley E. F., Chem. Rev., 1943, v. 32, p. 373.
Азингер Ф. Химия и технология парафиновых углеводородов. Пер. с нем.
Под ред. В. И. Исагулянна. М., Гостоптехиздат, 1959, с. 265.
642. ХАСС —БЕНДЕР (HASS — BENDER)
Получение ароматических альдегидов из бензилгалогенидов действием нат-
натриевой соли 2-нитропропана:
25—80 °С
АгСНаХ + (CH3JC=NO2' Na+ . . _> ArCH2ON=C(CH3)a » ArCHO
I G0-80%)
О
(абс. С2Н5ОН)
Аг = С,Н6> С6Н4СН3, С,Н4СОСН3, CeH4COOCH3, CeH4CF3, CeH4CN, CeH4Br;
X = Cl, Br (обычно), I
В реакцию вступают также полициклическне соединения:
сш2с
ОНС
СНаС1
СНО
СНО
G0%)
Метод не применим для получения нитробензальдегидов н некоторых поли-
замещенных альдегидов.
См. также Корнблюм (№ 323), Соммле (№ 549).
Hass H. В., Bender M. L., J. Am. Chem. Soc, 1949, v. 71, p. 1767.
Blomquist A. e. a., J. Org. Chem., 1961, v. 26, p. 1687.
Klanderman В. Н., J. Org. Chem., 1966, v. 31, p. 2618.
СОП, т. 4, с 486.
643. ХАУК — ЗАУЭР (HOWK — SAUER)
Получение ацеталей конденсацией монозамещенных ацетиленов с орто-
эфирами:
135-170 °С
RC==CH + R'C(OC2H5K > RCsC-C(OC2H6)
1./.1ИЛ2| I
R' A5-80%)
R=CeH6) C4H9, C6HU, OCaH6, CH2Br, (CH2KBr, (CH2KC1;
R' = H, CH3, C4H9, OC2H6
* Znl2, Zn(NO2J, Cdl2
С низкокнпящими ортоэфирами реакцию проводят под давлением или при
избытке монозамещенного ацетилена.
В случае ацетилена реакция ндет следующим образом:
СН=СН + СЩООДОз г—тг>: (СаН5ОJСН-С=С-СН(ОС2Н6)а +
+ (С2Н6ОJСНСНгСН(ОС2Н6J + СН=С-СН(ОС2Н6J
См. также Фишер (№ 607).
Howk В. W., Sauer J. С, J. Am. Chem. Soc, 1958, v. 80, p. 4607.
Epsztein R., Marszak J., Bull. Soc. chim. France, 1968, p. 313.
Epsztein R., Holand S., Chem. Rev., 1962, v. 255, p. 2778.
СОП, т. 11, с 25.
644. ХАФНЕР (HAFNER)
Получение азуленов конденсацией циклопентадиенов с монометиланилино-
вым производным енольной формы глутаконового альдегида (альдегидом Цин-
Цинке) и последующей циклизацией образовавшихся фульвенов*:
- ОНС—СН=СН—CH=CHNCH3
с„н.
* Называют также реакцией Циглера — Хафнера.
150—200 "С
=СН—СН=СН—CH=CHNCH, > R
с,н5
R=Alk
F0-70%)
Альдегид Цинке получают расщеплением галогенида N-циаио- или М-2,4-ди-
нитрофеиилпиридиния N-метиланилином:
С1
CeH5NHCH,
НС СН—N;
СГ N+
Н3С С6Н5
CH-N
Г
СН3
о
Используя замещенные пиридины, можно синтезировать азулеиы с замести-
заместителями в семичленном цикле.
Вариантами метода являются конденсация солей N-алкилпиридиния с цикло-
пентадиенилнатрием, а также синтез азуленов из циклопентадиенилнатрия и со-
солей пирилия. Последняя реакция проходит в очень мягких условиях и позволяет
получать продукты с высокими выходами (до 95%).
См. также Пфау —Платиер (№ 480), Гребе —Ульман (№ 216).
Ziegler К, Angew. Chetn., 1955, Bd. 67, S. 301.
Haf пег К-, Ann., 1957, Bd. 606, S. 79.
Krohnke F., Angew. Chetn,, 1963, Bd. 75, S. 318.
Hafner K-, Asmus K- D., Ann., 1964, Bd. 671, S. 31.
Небеизондные ароматические соединения. Под ред. Д. Гинсбурга. Пер. с англ.
Под ред. А. Н. Несмеянова. М., Издатинлит, 1963, с. 305.
645. ХАЯШИ (HAYASHI)
Перегруппировка 3-замещенных 2-ароилбензойных кислот в 6-замещенные
2-ароилбензойные кислоты под действием концентрированной серной кислоты:
R
R
Аг
конц. H?SO|
соон
R = СН3, ОСН3) NO,
* PaOt
СОАг
440
Аналогичную перегруппировку претерпевают соответствующие производные
конденсированных ароматических карбоновых кислот и ароилбензойных кислот,,
у которых Аг — гетероароматический остаток:
СОС10Н7 СООН
„соон
При уменьшении кислотности среды изомеризация становится обратимой.
См. также Смайлс (№ 544).
Hayashi M., J. Chetn. Soc, 1927, p. 2516; 1930, p. 1513, 1520, 1524.
Sandin R. B. e. a., J. Am. Chetn. Soc, 1956, v. 78, p. 3817.
Newman M. S., Ihrman K. G., J. Am. Chem. Soc, 1958, v. 80, p. 3652.
Cristol S. I., Caspar M. L, J. Org. Chem., 1968, v. 33, p. 2020.
646. ХЕЙУОРТ (HAWORTH R. D.)
Получение фенантрена циклизацией \>-нафтилмасляных кислот под действием
серной кислоты с последующим восстановлением карбонильной группы цинком в
соляной кислоте и дегидрированием под действием селена:
85%-ная H2SO4; -100 "С ,^\/Ч, Zn; HC1
R, R', R' = Н, СН3> СаНь
* HF, (СН3СОJО в присутствии ZnCl2, SnCl4
Исходные кислоты получают взаимодействием нафталина и ангидрида ян-
янтарной кислоты (см. Фридель — Крафтс, № 627) или реакцией эфиров кетокис-
лот и реактивов Гриньяра с последующим восстановлением по Клемменсену
(см. № 296):
СО
RHC\
+ 1 О
R'HCx /
(CeH6NO,)
О R R' Zn;
II I I
с—сн—снсоон
R R'
Н,—СН—СНСООН
RMgX
C-(CH2J-COOR
=СН—CHXOOR
!—(СН^-СООН
См. также Бардхаи — Сеигупта (№ 46), Боджерт—Кук (№ 92), Виттиг
(№ 169), Хоймаи (№ 669), Яурдаи — Ульмаи — Гольдберг (№ 755).
Haworth R. D., J. Chem. Soc, 1932, p. 1125, 2717.
Haworth R. D. e. a., J. Chem. Soc, 1932, p. 1784, 2248, 2720; 1934, p. 454.
Физер Л., Физер М. Химия природиых соедииеиий феиаитреиового ряда. Пер.
с аигл. Под ред. В. М. Родионова. М.-Л., Госхимиздат, 1953, с. 87.
647. ХЕЙУОРТ (HAWORTH W. Н.)
Метилирование Сахаров диметилсульфатом в водном растворе щелочи:
СНОН I
I I
СНОН О
I
СНОН
(CH3JSO4; N2
C0%-ный водн. р-р NaOH)
СНОСН3
СНОСНз О
сносн,
Достоинство метода — проведение реакции в гомогенной среде благодаря
растворимости моносахаридов и большинства полисахаридов в щелочи и высо-
высокая степень метилирования при однократной обработке диметилсульфатом.
Вследствие плохой растворимости частично метилированных полисахаридов в
воде последующее метилирование проводят в водном ацетоне, диоксане, тетра-
гидрофураие.
Недостаток метода — возможность деструкции Сахаров под действием ще-
.лочи или кислорода воздуха в щелочиой среде.
Вариант метода — метилирование ацетилироваииых Сахаров в ацетоне.
См. также Пурди — Ирвии (№ 479).
Haworth W. H., J. Chem. Soc, 1915, v. 107, p. 13.
Kuhn R., Trischmann H., Chem. Ber., 1963, Bd. 96, S. 284.
Pigman W. W. The Carbohydrates. New York, Acad. press, 1957, p. 369.
Кочетков H. К. и др. Химия углеводов. М., «Химия», 1967, с. 159, 437, 494.
648. ХЕЛЛЕРМАН —НЬЮМЕН (HELLERMAN — NEWMAN)
Получение ртутьоргаиических соедииеиий взаимодействием диазоалкаиов с
.сулемой:
R2CN2
2R2CN2 + HgCl2 j^ fR.C-HgCl] *¦ R2C-Hg-CR2
CI CI
I. A J
R = H, C,HS
.442
Аналогично взаимодействуют с диазоалкаиами арилмеркурхлориды, на-
например:
2CHaN2 + ArHgCl *- [ArHgCH2Cl]
Аг = CgHg, CHjCgHg,
Hg(CH2ClJ
В случае диазоуксусиого эфира реакция проходит следующим'образом:
Г /HgCl
С2Н5ООС—CHN, + HgC!2 ¦ >- Hg —Сч
I ХСООС,Н6
С1
Эта реакция является частным случаем общего метода синтеза элементоор-
гаиических соедииеиий с помощью диазоалкаиов:
mR2CN2 + Э„ХП v (R1CX-)m9«Xn-m
Э = элемент II, III, IV, V и VI ipynn; X = C1, Br, I
См. также Несмеянов (№ 422).
Hellerman L, Newman N.. J. Am. Chem. Soc, 1932, v. 54, p. 2859.
Якубович А. Я-, Гинсбург В. А., Усп. химии, 1951, т. 20, с. 735.
Методы элемеитооргаиической химии. Ртуть. Под ред. А. Н. Несмеянова и
К. А. Кочешкова. М., «Наука», 1965, с. 190, 232.
649. ХЕЛЛЬ — ФОЛЬХАРД — ЗЕЛИНСКИЙ
(HELL-VOLHARD)
а-Галогеиироваиие карбоиовых кислот действием галогена в присутствии
красного фосфора:
Х2~100"С —СН2СООН
—СН2-СООН ——¦> —СН,-СОХ >- -СН-СОХ >¦
X
^ —СН—СООН + —СНа—СОХ
X
(-60%)
X = CI, Br
* РХа
При избытке Хг образуются галогеиаигидриды а-галогеикарбоновых кислот,
которые могут быть легко переведены в кислоты или эфиры действием воды или
спиртов, соответственно.
См. также Бедукяи (№ 53).
Hell С, Вег., 1881, Bd. 14, S. 891.
Volhard J., Ann., 1887, Bd. 242, S. 141.
Зелинский Н. Д., ЖРФХО, 1887, т. 19, с. 585.
СОП, т. 2, с. 89; т. 3, с. 135; Вейганд-Хильгетаг, с. 163.
443
650. ХЕЛЬФЕРИХ (HELFERICH)
Получение О-арнлгликозидов сплавлением полных ацетатов Сахаров с фе-
фенолами в присутствии хлористого иинка (гликозидирование)* :
сношен.
.НОСОСНз О + АгОН
ШОСОСН.
I
СНОАг
нагревание I
[ZnCl2]'
нососн,
I
снососн,
B5-45%)
* /i-CH3C6H4SO3H, HaSO4
В реакцию вступают разнообразные фенолы и нафтолы. Процесс протекает
лтерически неоднозначно; хлористый цинк способствует обычно образованию
а-гликозидов, тогда как я-толуолсульфокислота — образованию Р-гликозидов.
Получение того или иного аномера в значительной мере определяется условия-
условиями выделения продукта реакции из реакционной смеси.
В указанных условиях осуществляется также переацилироваиие, например:
СНОСОСНз
СНОСОСНз 6 + С,Н6СН=СНСООН
СН—i
I
ооссн=снс,н6
снососн,
о
Из-за жестких условий конденсации этот метод мало пригоден для гликози-
дирования лабильных соединений.
См. также Кёнигс—Киорр (№ 289), Михаэль (№ 405).
Helferich В., Schmitz-Hillebrecht Е., Вег., 1933, Bd. 66, S. 378.
Helferich В., Zirner J., Chetn. Ber., 1963, Bd. 96, S. 385.
Soltes E. I., Timell Т. Е., Carbohydrate Res., 1965, v. 1, p. 176.
Кочетков Н. К- и др. Химия углеводов. М, «Химия», 1967, с. 215.
651. ХЕЛЬФЕРИХ (HELFERICH)
Специфическая защита первичной гидроксильной группы в сахарах дейст-
действием трифенилметилхлорида в пиридине (тритилироваиие):
I
СНОН
,он
+ (С6Н6KСС1
СНОН
(C5H6N) сн20-С(СвН
При продолжительном нагревании реагируют также и вторичные ОН-груп-
лы. Исключениями являются D-рибоза и Д-ликсоза, дающие в обычных усло-
условиях ди-О-тритильные производные по вторичным ОН-группам.
Тритнльная защита устойчива к действию основании, но легко снимается под
действием кислот или при каталитическом гидрировании (Pt, Pd).
* Называют также реакцией Хельфериха — Шы-ица-Хиллебрехта
Hillebrecht).
.444
(Schmitz-
См. также Виланд (№ 163).
Helferich В., Moog L, lunger A., Ber., 1925, Bd. 58, S. 872.
Helferich В. Adv. in Carbohydrate Chetn., 1948, v. 3, p. 79.
Кочетков Н. К- и др. Химия углеводов. М., «Химия», 1967, с. 161.
652. ХЕНБЕСТ (HENBEST)
Восстановление циклических кетонов в спирты с аксиальным расположением
оксигруппы смесью водного изопропанола и триметилфосфита в присутствии хлор-
иридиевой кислоты или ее солей:
(СН3ОKР; нагревание
•0
; (водн.г/зо-С3Н7Он)
колич.) ОН
*IrCI,,K2IrCl6,.(NH4) IrCIe
Так восстанавливаются 3,3,5-триметилциклогексаион, 3-трег-бутилциклогек-
санон, холестаион и т. п.
При использовании указанного способа в стероидах восстанавливается толь-
только кетогруппа в положении 3, кетогруппы в любых других положениях остают-
остаются неизмененными.
Достоинствами метода являются его высокая стероспецифичность и исклю-
исключительно высокие выходы спиртов.
См. также Меервейн — Понидорф — Верлей (№ 389).
Haddad J. M. J., Henbest Н. В., Husbands J., Proc. Chetn. Soc, 1964, p. 361.
Browne R. A., Kirk D. N.. J. Chetn. Soc, 1969, C, p. 1653.
Физер, т. 4, с. 133; т. 5, с. 222.
653. ХЕНКЕЛЬ (HENKEL)
Термическая изомеризация солей ароматических 1,2-дикарбоновых кислот
под давлением в атмосфере двуокиси углерода в присутствии катализаторов с
образованием солей 1,4-дикарбоновых кислот:
СООМ СООМ
-СООМ
400 °С; СО2 илн
соом
(-90%)
M = Na, К
*CdCl2, Znl2, ZnClj, CdF2, CdCO3, ZnCO3, без катализатора
Обязательным условием успешного проведения реакции является отсутствие
влаги, кислорода и кислот.
445
Аналогичную перегруппировку претерпевают соли различных дикарбоиовых
кислот ряда нафталина A,3-, 1,6-, 2,3-, 2,7- и 1,8-). Во всех случаях получается
соль 2,6-иафталиндикарбоновой кислоты:
соок
COOK
коос
COOK
(-50%)
Соли моиокарбоиовых кислот ароматического и гетероциклического рядов в
аналогичных условиях подвергаются диспропорциоиироваиию с образованием
солей дикарбоновых кислот:
соок соок
N
N
См. также Якобсен (№ 746).
Raecke В., пат. ФРГ 936036 A952); С. А., 1958, v. 52, р. 20065а.
Ogata У., Tsuchika M., Muramoto A., J. Am. Chem. Soc, 1957, v. 79, p. 6005.
Raecke В., Angew. Chem., 1958, Bd. 70, S. 1.
McNelis E., J. Org. Chem., 1965, v. 30, p. 1209.
Patton J. W., Son M. O., J. Org. Chem., 1965, v. 30, p. 2869
Wimer W. W., Bushick R. D., пат. США 3766257 A973).
654. ХЕРБСТ —ЭНГЕЛЬ (HERBST — ENGEL)
Взаимодействие а-кето- и а-аминокислот при нагревании в водном растворе
с образованием «-аминокислоты и альдегида (переамииироваиие):
RC=O + H2N-CHR'
I I
соон соон
нагревание
RC=N-CHR' ]
I I
СООН COOHJ
н+^
(НгО)
)- RCHNHj + R'CHO
СООН
Переаминированне играет важнейшую роль в процессах обмена азотистых
оснований в тканях животных и растений, будучи основным путем как биосин-
биосинтеза, так и распада аминокислот в биологических системах.
См. также Штреккер (№ 730).
Herbst R. M., Engel L. L., J. Biol. Chem., 1934, v. 107, p. 147.
Herbst R. M., J. Am. Chem. Soc, 1936, v. 58, p. 2239.
Houben-Weyl, Bd. 11/2, S. 325.
446
655. ХЕРЦ (HERZ)
Получение 2-амнио-5-хлортиофенолов из ароматических аминов действием
одиохлористой серы с последующим расщеплением щелочью образовавшихся
хлоридов тиазтиоиия (соединений Херца):
R R
NaOH
R
N
Cl
^S-OH
NaOH*
(водн. C2H5OH)
•Na2CO3, Na2S2O4
В реакции используют разнообразные орто-, мета- и яара-замещениые аро-
ароматические амины в виде гидрохлоридов или ацетильных производных. Если в
исходных аминах яара-положеиие занято заместителями типа NO2, СООН, SO3H,
то происходит их замена на хлор с образованием 2-амино-5-хлортиофенолов. Если
в яара-положеиии находятся заместители типа Br, Alk, OAlk, N(C2H6J, заме-
замещение их на хлор не происходит.
Реакция имеет промышленное значение, так как амииотиофеиолы являются
исходными соединениями для синтеза различных сернистых красителей.
См. также Лёйкарт (№ 362).
Herz R., пат. США 1637 023 A928); С. А., 1928, v. 22, р. 1365; пат. США
1 699 432 A929); С. А., 1929, v. 23, р. 1140.
Warburton W. К., Chem. Rev., 1957, v. 57, p. 1011.
Huestis L. D., Walsh M. L, Hahn N.. J. Org. Chem., 1965, v. 30, p. 2763.
Стрелец Б. К, Эфрос Л. С, «Химия гетероциклических соединений», 1969,
с. 565.
656. ХЕРЦИГ —МЕЙЕР (HERZIG — MEYER H.)
Взаимодействие N-алкиламинов с иодистоводородной кислотой с последую-
последующим термическим разложением до йодистых алкилов:
\ HI; нагревание
ше Г\+ ] 300-360 °С
->- j ;nhr j i- > ri
J
R = Alk
Метод служит для количественного определения N-алкильиых групп по вы-
выделяющемуся йодистому алкилу (весовым или объемным методом) и наиболее
успешно используется для определения N-метильной группы.
Недостатками метода являются большая продолжительность и неполнота
протекания реакции, а также возможность миграции алкильных групп от кисло-
кислорода к азоту при нагревании с иодистоводородиой кислотой.
См. также Цайзель (№ 682).
Herzig I., Meyer H., Ber., 1894, Bd. 27, S. 319; Monatsh., 1894, Bd. 15, S. 613;
1895, Bd. 46, S. 599; 1897, Bd. 18, S. 379.
Houben-Weyl, Bd. 2, S. 667.
447
657. XEPUIBEPr(HERSHBERG)
Получение альдегидов нз алкнлгалогенидов путем образования магннйорга-
ннческнх соединений, взаимодействия их с олефинами с последующим действием
реактива Прево, омыления н окислительного расщепления образовавшегося гли-
гликоля по Криге:
RBr
Mg
CH2=CHCH2Br C6H5COOAg+Ij
н RCH2CH=CHl >
RCH2CH—CH,OCOQHj
СОСвН6
КОН; нагревание
(води. СН3ОН)
РЬ(ОСОСНз)«
RCH2CH-CH2OH ,„ „ . „, _„„>, RCH2-CHO
Ан
(С6Н6+СН3СООН)
= C4H9, CeH6, нафтил-l
(-70%)
Метод представляет собой сочетание хорошо известных реакций гидрокснлн-
рования (см. Прево, № 471) с окислительным расщеплением (см. Криге, № 341)
н позволяет получать альдегиды, содержащие на два атома углерода больше,
чем в исходном бромистом алкнле. Вследствие сложности н многостаднйности
метод не находит широкого применения, но в несколько измененном виде явля-
является ценным для получення нестойкнх альдегидов и |3-окснальдегндов:
RR'C=O + ВгСН2СН=СНа
Mg
RR'C-CH,CH=CH, >-
ОН
>¦ RR'C-CH2CH-CH,OCOCeH6 >- RR'C-CH,-CHO
ОН ОСОС,Н6 ОН
R, R' = Alk
См. также Норман (№ 428).
Hershberg Е. В., Helv. chim. acta, 1934, Bd. 17, S. 351.
OP, т. 8, с 294; Houben-Weyl, Bd. 7/1, S. 106, 353.
658. ХЕШ (HOESCH)
С-Ацилнрованне многоатомных фенолов или их эфиров и нитрилов под
действием хлористого водорода в присутствии катализаторов с последующим
гидролизом образовавшегося гидрохлорида кетимина*:
- OR'
R"CN
HCl*; 0 °С
OR'
[ZnCl2]**; (абс. эфир)***
* Называют также реакцией Хеша — Губеиа (Houben) я Губена — Хеша.
448
OR'
OR'
гидролиз
R'
-R"
I
C-R"
R'
II II
NH-HC1 О
R, R' = H, Alk; R" = Alk, Ar
*HBr; **FeCl3, CoCl2, NiCl2, CdC!2, CuCl2, A1C13;
***CHC13, эфир + хлороформ, ацетон, хлорбензол н др.
В реакцию вступают разнообразные а-замещенные алифатические ннтрнлы,
содержащие группы NH2, Hal, ОН, COOR и СО, жирноароматические нитрилы,
динитрилы. орто-Замещенные ароматические нитрилы обладают пониженной ре-
реакционной способностью.
Подобно фенолам реагируют окснпронзводные гетероароматическнх соеди-
соединений, алкнлнрованные пнрролы н индолы (часто в отсутствие катализатора),
например:
СОСН2С6Н5
V
СН3 + C6H5CH2CN
HCl
NH
—СН.
Метод позволяет получать эфнры тиокислот из алкнл- нли арилтиоцнанатов,
например:
ch3scn
Побочные процессы реакции Хеша — образование нмнноэфнров н днмериза-
ция ннтрнлов.
Ннтрнлы, содержащие |3-заместнтели (С = С, COAlk, CHO, ОН и др.), всту-
вступают в «аномальную» реакцию Хеша с образованием |3-арнлпропионовых кислот,
кумаринов н днгндрокумаринов, например:
Л не. Н0\^^0Н нао
+ CeH6CH=CHCN *- I || >-
^^^CHCHaCN
с„нй
См. также Гаттерман (№ 193), Губеи — Фишер (№ 225), Фишер — Цервек
(№616).
Houben ]., Schmidt E., Ber., 1913, Bd. 46, S. 2447, 3616.
Hoesch К-, Ber., 1915, Bd. 48, S. 1122; 1927, Bd. 60, S. 389, 2537.
Lahey F. N.. Stick R. V., Austr. J. Chem., 1973, v. 26, № 10, p. 2291.
29—684 449
Зильберман Е. Н. Реакции нитрилов. М., «Химия», 1972, с. 195.
Migrdichian V. The Chemistry of organic cyanogen compounds.
New York, Reinhold Publ. Corp., 1947, p. 235.
OP, т. 5, с 284.
659. ХИББЕРТ (HIBBERT)
Дегидратация третичных и вторичных алифатических спиртов с образова-
образованием олефинов при перегонке в присутствии следов иода:
^\ нагревание
C-CH2R' [Irf »
*'Xoh
R'/
3—CH2R'
I-
R
\
VC=CHR'
Rf/
R = Alk; R' = Н, Alk
Метод применяется для дегидратации разнообразных соединений, содержа-
содержащих вторичные и третичные оксигруппы: циклогексанола, пинаконов, кетоспир-
тов и т. п., например:
(СН3JС(ОН)СНаСН3 -
(С6Н6)аС~С(С6Н6J -
(СНз)аС(ОН)СН2СОСН3
(СН3JС=СНСН3
(С6Н6KС-С-СвН6
он
о
>- (СН3JС=СНСОСН3
(~колнч.)
См. также Чугаев (№ 700).
Hibberi H., J. Am. Chem. Soc, 1915, v. 37, p. 1755.
Castro J., J. Am. Chem. Soc, 1950, v. 72, p. 5311.
СОП, т. 1, с 319; Физер, т. 2, с. 66.
660. ХИЛБЕРТ — ДЖОНСОН — РИСТ
(HILBERT — JONSON— RIST)
Получение пиримидиновых иуклеозидов взаимодействием 2,4-диалкоксипири-
мидинов с ацетилгликозилгалогеиидами и последующим гидролизом или аммо-
нолизом*:
OR
[C6H6N]
N
OR ~
N
R1
+NR'
x-
OR
О
NR'
HCl
(CH3OH)
NH3;
(CH3OH)
OH
I
о
N/-
NHa
NR"
О
R = Alk (обычно CaH6); X = Cl, Br; R' = ацетилгликозил; R"
NR"
= ГЛИКОЗИЛ
* Называют также реакцией Хилберта — Джоисоиа.
450
Hubert G. E., Johnson Т. В., J. Am. Chem. Soc, 1930, v. 52, p. 4489.
HUbert G. E., Rist С. Е., J. Biol. Chem., 1937, v. 117, p. 371.
Шабарова З. А., Усп. химии, 1958, т. 28, с. 369.
Ulbricht Т. L. V; Angew. Chem., 1962, Bd. 74, S. 767.
Veda Tohru, Ohtsuka Hiroko, Chem. Pharm. Bull, 1973, v. 21, № 7, p. 1451,
1530.
Химия биологически активных природных соединений. Под ред. Н. А. Пре-
Преображенского и Р. П. Евстигнеевой. М., «Химия», 1970, с. 343.
661. ХИЛДИЧ (HILDITCH)
Окислительное расщепление С = С-связи в эфирах высших непредельных кис-
кислот при действии пермаиганата калия в ацетоне:
КМпОл; нагревание
-СН=СН(СН2)„СООСН3 - ,гнглгн, > -СООН + НООС(СН2)„СООСН3
п > 6
Аналогично расщепляются полиеновые, а также циклические непредельные
кислоты, например:
aCH—(CHa),,COOCaH5
COOH
л =10, 12
Эфирные группы в условиях реакции не изменяются, поэтому метод приме-
применяется для количественного определения содержания непредельных глицеридов
в жирах.
См. также Вагнер (№ 137), Лемьё (№ 355), Лемьё — Джонсон (№ 356).
Hilditch Т. P., Lea С. Н., J. Chem. Soc, 1927, p. 3106.
Stefanovic G., Pejkovic I., С. г., 1954, v. 238, p. 697.
662. ХИЛЛ (HILL)
Фотохимическое восстановление хинонов и других акцепторов электронов в
присутствии изолированных хлоропластов с выделением молекулярного кис-
кислорода:
0=
=О + НаО
[хлоропласт]
HO-
OH +
Предполагают, что подобный процесс происходит при фотосинтезе, и кисло-
кислород выделяется из воды, а ие из СО2.
Hill R., Proc. Roy. Soc. (London), Ser. В, 1939, v. 127, p. 192.
Calvin M., Angew. Chem., 1956, Bd. 68, S. 253.
Сеченска М., Томова Н., печев Г., Докл. Българ. А Н, 1969, т. 22, с. 209.
Harnischferger G., Gaffron H., «Planta», 1970, v. 93, p. 89.
Ku S. В. e. a. Z. Pflanzenphysiol., 1974, v. 72, № 3, p. 320—337.
29*
451
663. ХИНМЕН (HINMAN)
Получение пиразолииов при конденсации кетонов с 1,2-диметилгидразином и
формальдегидом в присутствии соляной кислоты и последующем гидролизе:
RCCHaR' + CH3NH—NHCH3 + CH2O
II
О
*- RCCHaCH2N— NHCH3
II I
О CH3
нагревание
; (абс,
н2о
NCH3
B5-50%)
R = Alk, CeH6; R' = H, CH3> СаН6, СвН5
1-Метил-2-фенилгидразин в реакцию не вступает.
Hinman R. L., Ellefson R. D., Campbell R. D., J. Am. Chem. Soc, 1960, v. 82,
p. 3988.
Aubagnac J.-L., Elguero J., Jacguier R., Bull. Soc. chim. France, 1967, p. 3516;
1969, p. 3300.
664. ХИНСБЕРГ (HINSBERG)
Получение оксиндолов конденсацией вторичных ароматических аминов с би-
сульфитным производным глиоксаля и последующим кислотным гидролизом:
CH(OH)OSO2Na нагревание
•NHR """ CH(OH)OSO2Na <водн-
НС1; 80 °С
—OSO2Na
=0
R = СН3> С2Н6
Диалогично реагируют первичные и вторичные амины ряда нафталина. За-
Замещенные анилины образуют в этих условиях смесь N-арилглицина и ариламино-
ацетаиилида:
CH(OH)OSO2Na
ArNHa+ I
CH(OH)OSOaNa
CHaNHAr CHaNHAr
I + I
COOH CONHAr
Метод ие нашел широкого применения.
См. также Байер (№ 33), Бруннер (№ 115), Штолле (№ 728).
Hinsberg О., Вег., 1888, Bd. 21, S. ПО; 1908, Bd. 41, S. 1367.
Hollins С. Synthesis of Nitrogen Ring Compounds. London, Benn, 1924, p. 112.
Эльдерфильа, т. З, с. 103.
452
665. ХИНСБЕРГ (HINSBERG)
Ацилирование аминов бензолсульфохлоридом в присутствии щелочи:
\ NaOH \
Vh + qh6so2ci* _>. V_s
*n-CH3CeH4SOaCl
Метод используют для разделения смеси первичных, вторичных и третичных
аминов. Третичные амины не реагируют с CeHsSC^Cl и могут быть отделены
перегонкой. Разделение первичных и вторичных аминов основано на различной
растворимости образующихся производных в растворах щелочи.
См. также Шоттен — Бауман (№ 719).
Hinsberg О., Вег., 1890, Bd. 23, S. 2962; 1900, Bd. 33, S. 3526.
Houben-Weyl, Bd. 2, S. 640.
666. ХИНСБЕРГ (HINSBERG)
Присоединение арилсульфиновых кислот к хинонам в водном растворе с
образованием арилсульфонилгидрохинонов:
О
ОН
R
/О
+ ArS'
SO2Ar
О
ОН
R = Н, СН3, С1
Аналогично реагируют хинонимины, а- и р-нафтохиноны.
Реакция используется для синтеза лекарственных веществ.
См. также Тиле — Винтер (№ 564).
Hinsberg О., Вег., 1894, Bd. 27, S. 3259; 1895, Bd. 28, S. 1315.
Walker J., J. Chem. Soc, 1945, p. 630.
Birch A., Crombie D. A., Chem. Ind. (London), 1971, № 6, p. 177.
667. ХИНСБЕРГ (HINSBERG)
Получение замещенных тнофен-2,5-дикарбоновых кислот межмолекулярной
конденсацией а-дикарбонильных соединений с эфирами или нитрилами тиодиук-
сусной кислоты под действием AlkONa с последующим кислотным гидролизом:
R'"ONa; 0—5 °С
R R'
Н2О; Н+ У,—S.
-R" >¦ НООС-/ \-
S
C0-70%)
R, R' = H, Alk, Ar, OC2H3; R" = COOAlk, CN; R'" = CH3, C2H5
453
Использование эфиров имииодиуксусиой кислоты приводит к замещенным
пнрролдикарбоновым кислотам:
R—С—С—R' + C2H6OOCCHa-
ноос—
0 0
R"
= Alk, At, COCH3
Аналогичным методом из фталевого диальдегида можно получать конден-
конденсированные системы, включающие семичлеииые гетероциклы:
COOR
сно
СНО
(ROOC—CH2JZ
B0-30%)
R = Н, СН3, С2Н6; Z = О, S, NCH3
См. также Киорр (№ 310).
Hinsberg О., Вег., 1910. Bd. 43, S. 901; 1912, Bd. 45, S. 2413.
Dimroth К-, Pintschovins U., Ann., 1961, Bd. 639, S. 102.
Wynberg H., Kooreman H. !., J. Am. Chem. Soc, 1965, v. 87, p. 1739.
OP, т. 6, с 368.
668. ХОДЖСОН — МАРСДЕН (HODGSON — MARSDEN)
Обмен дназогруппы в ароматических диазосоедииеииях на иитрогруппу при
разложении кобальтииитритов арилдиазоиия под действием нитрита натрия в
присутствии закиси и сульфата меди:
ктЩ X'
+ V-
Na3[C0(NO2Nl
[ArN2+]3 [Co(NO2)e]=>-
NaNOa; 20 °C
ArNO,
[CuSO4+Cu2O]; (H2O)
(-60%)
X = аиион неорганической кислоты; Ar = CeH4Cl, CeH4NO2, CeH4Alk, CeH4OAlk
Аналогично реагируют кондеисироваииые ароматические диазосоедииеиия.
Основное достоинство метода состоит в том, что ои позволяет в мягких
условиях получать диинтросоедииеиия из моиоинтросоедииеиий.
Ходжсои разработал специальную методику для получения солей диазоиия
слабоосиовиых аминов: раствор амина в уксусной кислоте добавляют при 0°С
к раствору нитрита натрия в концентрированной серной кислоте; образовавшийся
сульфат диазоиия осаждают эфиром при 0 °С.
См. также Заидмейер (№ 261), Шимаи (№ 708).
Hodgson H. H., Marsden E., J. Chem. Soc., 1944, p. 22.
Доналдсон Н. Химия и технология соединений нафталинового ряда. М.,
Госхимиздат, 1963, с. 106.
Физер Л., Физер М. Органическая химия. Т. 2. Пер. с англ. Под ред.
Н. С. Вульфсоиа. М., «Химия», 1970, с. 256, 262.
454
669. ХОЙМАН (HEUMANN)
Получение индиго щелочным плавлением феиилглицина или о-карбоксифе-
нилглицииа и последующим окислением образовавшегося индоксила кислородом
воздуха*:
¦R
NHCH2COOH
NaOH»; 300 °С
>- 2
R = Н, СООН
*NaNH2 при 180—200 °С
Метод применим также для толиламиио- и нафтиламииоуксусиых кислот.
Карбоксифенилглицин получают конденсацией аитраииловой кислоты с хлорук-
сусиой кислотой, феиилглиции — конденсацией анилина с хлоруксусиой кислотой.
В качестве побочных продуктов при окислении образуются иидирубии и ин-
доксиловый красный. Добавка нитратов щелочных металлов препятствует этому
процессу.
Использование NaNH2 (Пфлегер) позволило применить эту реакцию для
промышленного синтеза иидиго.
См. также Байер — Древсен (№ 36), Хейуорт (№ 646), Яурдаи — Ульман —
Гольдберг (№ 755).
Neumann K-, Вег., 1890, Bd. 23, S. 3043, 3431.
Pfleger J., нем. пат. 137 955 A901).
Эльдерфильд, т. 3, с. 189.
670. ХОРЕНШТАЙН — ПЕЛИККЕ
(HORENSTEIN — PAHLICKE)
Получение E-диалкнламииоэтиловых эфиров карбоновых кислот взаимодейст-
взаимодействием карбоиовых кислот с fi-диалкиламиноэтилгалогенидами:
RCOOH + R2NCH2CH2X
нагревание
[R^NHCH2CH2X -OOCR]
(U30-C3H7OH)
>- RCOO-CH2CH2NR2
R' = CH3, C2H6; X==C1, Br
В реакции можно также использовать натриевые или серебряные соли кар-
карбоновых кислот и гидрогалогениды E-диалкиламииоэтилгалогеиидов или галоге-
ниды соответствующих четвертичиых аммоииевых основаиий.
Метод был успешно применен для получения сложных эфиров разнообраз-
разнообразных |3-алкил-а-феиил-|3-оксипропиоиовых кислот, а также ряда желчных кислот.
Horenstein H., Pahlicke H., Вег., 1938, Bd. 71, S. 1644.
Ruzicka L, Plattner P. A., Engel G. В., Helv. chim. acta, 1944, Bd. 27, S. 1553.
Blicke F. F., Cox R. H., J. Am. Soc, 1955, v. 77, p. 5401.
* Называют также реакцией Хоймаиа — Пфлегера (Pfleger).
455
671. XOPHEP (HORNER)
Получение олефинов взаимодействием альдегидов или кетонов с диэтилал-
килфосфонатами в присутствии оснований (олефинирование)*!
\
NC
=O + (С2Н6ОJР—CH2R
Д
№NH2*;
нагревание
>-
(инертн. раст-
воритель)**
ЧС=О + (С2Н6ОJР—CHR
О
4Z—CHR
/I I
-О Р(ОС2Н6J
о
V-CHR
/I I
О-Р(ОС2Н5J
о-
н2о
;C=CHR + (С2Н6ОJР-О-
0
R = H, Alk, Ar, COOAlk, CN, OAlk и др.
*KNH2, mpem-C4H9OK, C6H6K, NaH; ** диоксан, спирты, 1,2-диметоксиэтан,
диметилформамид, тетрагидрофуран
В реакцию вступают разнообразные карбонильные соединения, в том числе
дикетоны, кетены и т. д., например:
СвН6С0ОСН=СН-СН0 + (С2Н60JОР-СН2СООС2Н6 »
. >¦ СвН6СООСН=СН-СН=СНСООС2Н6
G2%)
С6Н6-С-С-С6Н6 + (С2Н5ОJОР-СН2С6Н6
II II
о о
NaH
с6н6
с6н
,-сн=с-с=
=снсвн.
I
с
E0%)
Пространственно затрудненные кетоны в эту реакцию не вступают.
Кроме этиловых эфиров алкилфосфоновых кислот для олефинирования ис-
используют эфиры E-кетофосфоновых кислот, диалкилфосфорилуксусныи эфир, оки-
окиси фосфинов, например:
СС13-СНО+ (С2Н6ОJОР-СН2СООС2Н6
(С6Н5JСО + (С6Н6JР-СН3
О
СС!3-СН=СН-СООС2Н5
E0%)
(С6Н6JС=СН2
* Называют также фосфонатной модификацией реакции Виттига (см.
№ 168) и реакцией Виттига — Хорнера.
456
Для введения двух С = С-связей используют реагенты, содержащие две фос-
форильные группы, например:
С6Н6СН=СНСНО
(С2Н6ОJОРСН2СН=СНСН2РО(ОС2Н6J
> С6Н6-(СН=СНN-С,,Н6
Метод позволяет получать труднодоступные олефины приведенного ниже
типа, которые применяются как светозащитные средства, стабилизаторы поли-
полимеров, оптические отбеливатели высокомолекулярных соединений и т. д.:
ХНО
2 Г II + (С2Н6ОJОР-СН2-/ \-СН2—РО(ОС2Н6J v
N
Метод имеет существенные преимущества перед реакцией Виттига (см.
№ 168): большая реакционная способность олефинирующих реагентов позволяет
вводить в реакцию карбонильные соединения с сильными электронодонорными
заместителями в а-положении; сами реагенты более доступны, так как для их
получения используются хорошо разработанные методы (см. Арбузов, № 22,
Михаэлис — Беккер, № 404), и, наконец, выделение продуктов реакции не тре-
требует специальной методики в отличие от реакции Виттига.
Модификация Эммоиса — использование гидрида натрия в диметоксиэтане
позволяет проводить реакцию в мягких условиях и получать олефины с высо-
высокими выходами.
Homer L. e. a., Chem. Ber., 1958, Bd. 91, S. 61.
Домбровский А. В., Домбровский В. А., Усп. химии, 1966, в. 35, с. 1771.
Deschamps В. е. a., «Tetrahedron», 1972, v. 28, p. 4209.
Boran M. M., Simalty M., Abdelmannan S., «Tetrahedron Letters», 1974, № 22,
p. 1905.
Пурдела Д., Вылчану Р. Химия органических соединений фосфора. Пер. с
рум. Под ред. М. И. Кабачника, М., «Химия», 1972, с. 540.
Физер, т. 1, с. 431; т. 3, с. 321, 464; т. 5, с. 197, 199, 468.
672. ХОФЕР — МЕСТ (HOFER —MOEST)
Образование спиртов при электролизе карбоновых кислот в слабощелочной
среде или в присутствии сильных электролитов:
~он* но-
RC0°- isr IRC0°- ^оГ R>] -^ R0H
(ДО 70%)
R = Alk
*NaHCO3, Na2SO4, NaClO4
Выходы спиртов уменьшаются с ростом длины цепи R. Аналогично получа-
получаются спирты из алициклических и ароматических карбоновых кислот. Побочная
реакция — образование олефииов:
RCH2—СН2+НО-
RCH=CH2 + Н2О
457
В случае замещенных карбоновых кислот (с заместителями, например, ОН,
OAlk, NH2, Hal и т. п.) образующиеся спирты легко претерпевают дальнейшие
превращения: анодное окисление, этерификацию.
См. также Браун — Уокер (№ 112).
Hofer И., Moest M., Ann., 1902, Bd. 323, S. 284.
Weedon В. С. L, Quart. Rev., 1952, v. 6, p. 380.
Fleischmann M., Goodridge F., Discuss. Farad. Soc, 1968, v. 45, p. 254.
Уотерс И. Химия свободных радикалов. Пер. с англ. Под ред. Я. К. Сыр-
кина. М., Издатинлит, 1948, с. 158.
Корниенко А. Г. и др., «Электрохимия», 1974, т. 10, № 2, с. 350.
673. ХОХ— КЭМПБЕЛЛ (НОСН - CAMPBELL)
Замыкание азиридинового кольца при взаимодействии кетоксимов с магний-
органическими соединениями с последующим гидролизом металлоорганического
комплекса:
НС1; ^'
100-140 °С I
С„Н5—С— CH2R + R'MgX —HQ > С„Н5—С CHR
NOH
B0-60%)
R = H, Aik
При R' = Ar гидролиз проводят при 140—150 °С, а в случае R'=Alk — при
температуре ~100°С.
См. также Габриель (№ 184).
Hoch ]., С. г., 1934, v. 198, р. 1865.
Campbell К- N. е. a., J. Org. Chem., 1939, v. 4, p. 198; 1943, v. 8, p. 99, 103;
1944, v. 9, p. 184.
Эльдерфильд, т. 1, с. 52.
647. ХУГЕРСХОФФ (HUGERSHOFF)
Получение N.N'-диарилтиомочевин нагреванием ароматических аминов с се-
сероуглеродом и серой в спирте:
S;
нагревание
2ArNH2 + CS2 > ArNH-C-NHAr
(С2Н5ОН) ||
S
(колич.)
Ar = C,H4R, где R = Н, F, Cl, OH, Alk, OAlk, SCH3, SeCH3
В реакцию вступают также а- и Р-нафтиламины. В случае /г-нитроанилина
реакция не идет.
Ы^'-Диарилтиомочевины применяют, в частности, для синтеза арилизотио-
ционатов (см. Вернер № 152).
Hugershoff А., Вег., 1899, Bd. 32, S. 2245.
Buu-Hoi N. P., Yuong N. D., Nam N. H., J. Chem. Soc, 1955, p. 1573.
458
675. ХУГЕРСХОФФ (HUGERSCHOFF)
Циклизация арилтиомочевин в 2-аминобензотиазолы под действием брома:
S
С оГ2
NH—C-NHR'
(СНС13)'
R
-NHR'
N
R = Н, СН3, ОСН3, Cl, Br, NO2; R' = Н, Alk, Ar
*РОС13 и другие кислоты Льюиса; **С6Н5С1, С1СН2СН2С1
Предполагаемый механизм процесса аналогичен механизму реакции Фише-
Фишера (см. №611).
В реакцию вступают также нафтилтиомочевины. В случае N.N'-диарилтио-
мочевин направление циклизации определяется характером заместителя в аро-
ароматическом ядре, например:
л
N
R = Н, СН3, Вг, С1
S
N
R = NO2
Аналогично циклизуются замещенные тиоамиды и 1,3-фенилендитиомо-
чевииа:
S ^
II
H.NCHN
¦NHC-CHR2
r' = соос2н6, еосн
)>-CHR2
N
A0-70% )
S
¦NHCNH,
H»N
-NH,
N
Использование избытка брома приводит к бромзамещенным бензотиазолам.
См. также Якобсон (№ 748).
Hugerschoff А., Вег., 1901, Bd. 34, S. 3130.
Barnikow U., Kunzek H., J. prakt. Chem., 1965, Bd. 30, S. 13.
Грандберг И. И., Изв. ТСХА, 1972, № 5, с. 201.
Эльдерфильд, т. 5, с. 413, 460; СОП, т. 3, с. 49; т. 4, с. 303.
459
676. ХУКЕР (HOOKER)
Окисление 2-окси-3-алкнлнафтохинонов-1,4 щелочным раствором пермангана-
та, приводящее к отщеплению метиленовой группы боковой цепн:
О
О
н
КМпО4; 0°С
»_
(водн. р-р NaOH)
R = Alk
R
О
Реакция проходит через несколько стадий: образование диоксиннданонкар-
боновой кнслоты, раскрытие цикла и внутримолекулярную альдольную конден^
сацию. В процессе окисления гндроксильная и алкильная группы меняются ме-
местами. Возможно многократное повторение реакции. Если R содержит С = С-
связь, то оиа не затрагивается, например:
О
О
ОН
¦СН2СН=С(СН3J
:н=с(Ш3J
н
о
о
C5%)
Hooker S. С, J. Am. Chem. Soc, 1936, v. 58, p. 1168, 1174.
Fieser L. F., Fleser M., J. Am. Chem. Soc, 1948, v. 70, p. 3215.
Щукина Л. А., ЖОХ, 1956, т. 26, с. 1701.
Физер Л., Физер М. Органическая химия. Пер. с англ. Под ред. Н. С. Вульф-
сона. Т. 2. М., «Химия», 1970, с. 439.
677. ХУНСДИККЕР (HUNSDIECKER)
Получение макроцнклическнх кетонов циклизацией ш-галогеналкнлацетоук-
сусных эфнров в результате внутримолекулярного алкнлирования под действием
поташа с последующнм гидролизом н декарбокснлнрованнем:
(СН2)„
(
СН
КгСО3
Н
2COCH2COOC2H5 (сн3сос2н5) ос.
сн,
-сн-соосан5
кон
ос-
сн2
-сн.
Реакцию проводят при большом разбавлении во избежание межмолекуляр-
иой конденсации. Метод позволяет получать кетоны Си—Ci7 с хорошими вы-
выходами.
См. также Торп (№ 575), Хьюэтт (№ 678), Хэнсли — Прелог — Штолль
(№ 680), Циглер (№ 687), Штолле (№ 728).
Hunsdiecker И., Вег., 1942, Bd. 75, S. 1190, 1197; 1943, Bd. 76, S. 142; 1944,
Bd. 77, S. 185.
Herzig K., Ruchardt C, Chem. Ber., 1972, Bd. 105, S. 363.
460
Henecka H. Die Chemie der Beta-Dicarbonylverbindungen. Berlin, Springer,
1950, p. 172.
Houben-Weyl, Bd. 4/2, S. 754, 770.
678. ХЬЮЭТТ (HEWETT)
Циклизация а-A-бромиафтнл-2)-коричных кислот в 3,4-бензофеиантрен-10-
карбоновые кислоты при нагревании с едкнм кали:
СООН
D0-60%)
При R'=H возможно образование смеси изомеров, например:
:оон
СООН
B1%)
Полученные кнслоты легко декарбоксилнруются прн действии медной бронзы
в кипящем хинолине с образованием 3,4-бензофенантреиов.
Исходные бромкислоты получают нз 1-бром-2-нафтилацетата натрия и соот-
соответствующих альдегидов по реакции Перкнна (см. № 446).
См. также Хунсднккер (№ 677), Штолле (№ 728).
Hewett С. L., J. Chem. Soc, 1938, p. 1286.
Bogaert-Verhoogen D., Martin R. H., «Tetrahedron Letters», 1967, p. 3045.
679. ХЭММИК (HAMMICK)
Получение а-пириднлкарбинолов прн кипячении а-пнколиновой кислоты с
избытком альдегида или кетона:
нагревание
Ч- -С- : »-
N
СООН
—Н+; —СО2
о
N
О
N
о-
н+
N
ОН
К
461
В процессе реакции происходит декарбоксилирование пиколиновой кислоты
с образованием карбаниона, который и реагирует с карбонильным соединением.
Соответствующие карбинолы получают также при декарбокснлировании а-хн-
нальдиновой кислоты.
В качестве карбонильной компоненты используют бензальдегид, ацетофенон,
а также неароматические соединения, например циклогексанон.
Dyson P., Hammick D. L, J. Chem. Soc, 1937, p. 1724.
Beits M. J., Brown B. R., J. Chem. Soc, Ser. C, 1967, p. 1730.
Brown E. V., Shambhu M. В., J. Org. Chem., 1971, v. 36, p. 2002.
Allan Z. J., «Tetrahedron Letters», 1971, p. 4225.
680. ХЭНСЛИ —ПРЕЛОГ—ШТОЛЛЬ
(HANSLEY — PRELOG — STOLL)
Получение макроциклических ацилоинов циклизацией эфнров дикарбоновых
кислот под действием металлического натрия *:
ROOC-(CH2)n—COOR
Na; N2
нагревание
>
(ксилол)
о=с-
NaO—
\
= C-ONa
СНа)„
-СН-ОН
\/
(СН2)„
п = 7, 8 и т. д.
Ацилоины получаются лишь при большом избытке Na D экв), в противном
случае происходит циклизация по Дикману (см. № 251). Выходы продуктов прн
п = 7—11 составляют ~40% и повышаются с увеличением размера цикла, на-
например при я = 19 выход ацилоина 96%.
Метод позволяет получать гетероциклические, а также макроциклическне
ацилоины с я-фениленовыми звеньями, например:
СН2СвН4(СН2)„СООС2Н5
СН2С6Н4(СН2)„СООС2Н5
ДСН^пСООСаНв
RN;
\
(СН2)„-СО
СН,-/ \-(СН2)„-СНОН
7(СН2)т-СО
rn;
\сн2)т-снон
т < 10; R = Alk, Ar
Ацнлоины легко превращаются в кетоны восстановлением цинком в кислоте
или дегидратацией с последующим гидрированием а,Р-непредельного кетона.
См. также Хунсднккер (№ 677), Циглер (№ 687), Буво —Локкеи (№ 120),
Ружнчка (№ 526).
Hansley V. L., пат. США 2229268 A941); С. А., 1941, v. 35, р. 2634.
Prelog V. е. a., Helv. chim. acta, 1947, Bd. 30, S. 1741.
Stoll M. e. a., Helv. chim. acta, 1947, Bd. 30, S. 1815, 1822, 1837; 1948, Bd. 31,
S. 544.
Prey V., Stadler F., Ann., 1962, Bd. 660, S. 155.
СОП, т. 8, с 48; OP, т. 4, с. 215.
* Называют также реакцией Штолля — Прелога.
462
681. ХЮНИГ (HONIG)
Удлинение углеродной цепи алифатической карбоновои кислоты на пять (или
шесть) атомов углерода взаимодействием ее хлорангндрнда с N-циклопентен-Ь
нлморфолином (ацилирование) и последующим щелочным гидролизом, сопро-
сопровождающимся раскрытием цикла и восстановлением кетокнелоты:
,COR
о*
о
нагревание
(СНС13)
\\—
N.
О
NaOH
RC-(CH2L-COOH
II
О
Н2О; Н+
R(CH2MCOOH
D0-60%)
R = Alk (С, и более)
Полученные кетокнелоты легко могут быть восстановлены по Кижнеру —
Вольфу (см. № 291). Прн использовании в качестве енамина Ы-циклогексен-1-
илморфолина возможно удлинение цепи на шесть атомов углерода.
Аналогично протекает реакция с моно- и днхлорангндридами дикарбоновых
кнелот, например:
+
Г\-/~Л>
J: №
О
¦С—(СН2)„СООС2НБ
II
NaOH
С2Н5ООС-(СН2)„-СО-(СН2M-СООН
D0-55)%
С1ОС(СНг)„СОС1 + 2
о
я = 2, 6, 8
2. н+
НООС(СН2MСО-(СН2)„-СО(СН2MСООН
(-40%)
л = 6, 8
Прн использовании дихлорангидридов кислот с числом атомов углерода
меньше семи продукт реакции с енамином претерпевает внутримолекулярное
ацнлнрованне, например:
„О
С1ОССН2СН2СОС1
О
=0
о
463
См. также Сторк (№ 755), Арндт — Айстерт (№ 25), Штеттер (№ 725).
Hunig S. e. a., Chem. Ber., 1957, Bd. 90, S. 2833; 1960, Bd. 93, S. 909, 913.
Nair M. S. R. e. a., «Tetrahedron», 1963, v. 19, p. 905.
Шмушкович Д. Ж-, Усп. орг. хнмнн, 1966, т. 4, с. 57.
Hunig S., Salzwedel M., Chem. Ber., 1966, Bd. 99, S. 823.
Enamines. Synthesis, structure and reacktions. Ed. A. Gilbert Cook. New
York —London, Marcel Dekker, 1969, p. 387.
682. ЦАЙЗЕЛЬ (ZEISEL)
Расщепление метнлалкиловых эфнров ноднстоводородной кислотой:
HI; нагревание
R-O-CH3 ? ROH + CH3I
(H2U)
Реакцию применяют для количественного определения метокснгрупп (по
количеству иода, содержащегося в образовавшемся СН31). Определение нода в
СН31 проводят либо пропусканием его в раствор AgNO3, либо окислением:
СН31
Вг2
IBr + ЗН2О + 2Вг2
HIO3 + 5HI
CH3Br + IBr
НЮ3 + 5НВг
312 + ЗН2О
Второй метод, в отлнчие от первого, допускает определение метокснгруппы
и в соединениях, содержащих серу.
Аналогично может быть определена этокснгруппа. Расщепление простых
эфиров ноднстоводородной кислотой используется также в препаративных целях;
в реакции используют KI н 95%-ную НзРО4:
ROR + 2KI + 2Н3РО4
2RI + 2КНаРО4 + Н2О
См. также Херциг — Мейер (№ 656).
Zeisel S., Monatsh., 1885, Bd. 6, S. 989; 1886, Bd. 7, S. 406.
Stone H., Shechter #., J. Org. Chem., 1950, v. 15, p. 491.
Schole J., Z. analyt. Chem., 1963, Bd. 193, S. 321.
Houben-Weyl, Bd. 2, S. 404.
683. ЦИГЛЕР (ZIEGLER)
Окисление триалкилалюминия кислородом воздуха с образованием алкого-
лята алюминия:
A1R3 *-+¦ [A1(OORK] > A1(ORK
Благодаря доступности алифатических алюминнйорганнческнх соединений
эта реакция имеет большое препаративное значение н широко используется в
промышленности. На ее основе разработан метод получения первичных спиртов
из олефннов:
Н2; A1R3* O2
RCH=CH2 *- RCH2CH2— A1R2 »-
RCH2CH2-O-A1(ORJ
R = H, Alk
*А1НЧ
н2о
RCH2CH2OH
(колич.)
464
Аналогично были получены некоторые спирты терпенового ряда, жнрноаро-
матнческне спирты и фенолы:
c=
сн9
А-ГН-.
СН-СН2ОН
сн„
G8%)
Ziegler K-, Brennstoff-Chem., 1954, Bd. 35, S. 321.
Ziegler К. e. a., Ann., 1960, Bd. 629, S. 121, 144, 241.
Методы элементоорганнческой хнмнн. Под ред. А. Н. Несмеянова и К. А. Ко-
чешкова. Бор, алюминий, галлий, инднй, таллий. М., «Наука», 1964, с. 354.
684. ЦИГЛЕР (ZIEGLER)
Полимеризация этилена при низком давлении на алюмнннйорганнческнх ка-
катализаторах:
50—70 °С; < 1 кгс/см2
яСН2=СН2 с >- (—СН2—СН2— )„
[R3A1*+M]; (бензин) v z z m
М = металлы IV, V и VI групп, Th, U нлн нх галогеннды
*RnAlX3_n
Подбором катализатора удается получить стереоспецнфнческие полимеры с
относительной молекулярной массой от 10 000 до 3 000 000.
Ziegler К. е. a., Angew. Chem., 1955, Bd. 65, S. 426, 541.
Ziegler К., Angew. Chem., 1959, Bd. 71, S. 623; 1960, Bd. 72, S. 829.
Bier G., Angew. Chem., 1961, Bd. 73, S. 186.
Farina M., Peraldo M., Natta C, Angew. Chem., 1965, Bd. 77, S. 149.
Фьюзон, с. 415.
685. ЦИГЛЕР (ZIEGLER)
Получение алкнльных производных алюминия взаимодействием олефннов с
алюминием и водородом или с алюминийалкилами (гидроалюмннированне):
1. Взаимодействие олефннов с алюминием и водородом:
Al; H2;
давление
3(R2C=CH2) -~^-> (R2CHCH2KA1
2. Переалкнлнрованне трналкильных производных алюмнння олефннамн:
(R2CHCH2KA1 + R^C=CH2 ¦ v (R^CHCH2KA1 + R2C=CH2
В случае неустойчивых олефннов реакцию проводят в две стадии:
А1; Н2; ПО—140 °С; 50—200 кгс/см2
R3A1
R2A1H + ЗС„Н2
R,A1H
70-100 °G
(С„Н2„+1KА1
3. Наращивание углерядной цепи в трналкнльных производных алюмнння
присоединением к ним этилена:
90-120 °С
R3A1 + СН2=СН2 >¦
30—684
465
Побочным процессом в данном случае является реакция переалкнлнрования.
Zlegler К, Angew. Chem., 1952, Bd. 64, S. 323.
Zlegler К. e. a., Ann., 1960, Bd. 629, S. 1, 14, 53, 172, 241.
Методы элементоорганнческой химии. Бор, алюминий, галлий, ннднй, тал-
лнй. Под ред. А. Н. Несмеянова н К- А. Кочешкова. М., «Наука», 1964, с. 315.
686. ЦИГЛЕР (ZIEGLER)
Получение триалкилуксусиых кислот алкилированием нитрилов алкнлуксус-
иых кислот, гидролизом образовавшихся триалкилацетоннтрилов и последующим
дезаминированнем соответствующих амидов:
NaNH2» 80%-ная H2SO4
RCH2CN + R'Br >> RR2C—CN *-
NaNO2+H2SO4**
>- RR2CONH2 *- RR2C—COOH
C0-70%)
R = Alk, CeH5; R' = Aik
*LiN(C2H5J; **C4H9ONO + CH3COOH
Метод используется для синтеза триалкнлуксусных кислот, содержащих
высшие алкнльные заместители.
См. также Халлер — Бауэр (№ 637), Буво (№ 118), Радзншевский (№ 487),
Рнмшнайдер (№511).
Ziegler К. е. a., Ann., 1932, Bd. 495, S. 84.
Sperber N., Papa D., Schwenk E., J. Am. Chem. Soc, 1948, v. 70, p. 3091.
Cason ]., Sumrell G., Mitchell R., J. Org. Chem., 1950, v. 15, p. 850.
687. ЦИГЛЕР (ZIEGLER)
Получение макроцнклических кетонов циклизацией диннтрнлов под действием
N-алкнланнлидов натрия с последующими гидролизом и декарбоксилнроваиием*:
н г. н+
Н2°: Н
NaN(CH3)C6H5'; \ ^п
нагревание „./ \„
I >- H2L C=
CH2CN (эфир)** \ /
CHCN
(СН2)„ (СН2)„
/ \ нагревание / \
\:=о > н2с Nc=o
сн—соон сн2
п = 1 — 29
•LiN(C2H6)CeH5> LiN(C2H5J; **(н-С3Н7JО, (изо-С3Н-J0
* Называют также реакцией Цнглера — Торпа (Thorpe).
466
Необходимость большого разбавления (вследствие возможной полимериза-
полимеризации) достигается путем очень медленного добавления раствора дннитрила к рас-
раствору конденсирующего средства. Выходы кетонов зависят от размера кольца:
Выход,, %
С6—Cf . . . колич.
С8 88
С»-Сп. . . 1-2
С14—С2|
Выход, %
8
15
60
Метод позволяет получать также кислородсодержащие макрогетероциклнче-
ские соединения:
о()с=о
(СН2L
О-(СН2)„-С=О
О-(СН2N-Ш2
См. также Ружичка (№ 526), Хунсднккер (№ 677), Хэнсли — Прелог¦
Штолль (№ 680).
Ziegler К. е. a., Ann., 1933, Bd. 504, S. 94; 1934, Bd. 513, S. 43.
Seitz C, Monnighoff H., «Tetrahedron Letters», 1971, p. 4889.
Houben-Weyl, Bd. 4, S. 758; OR, v. 15, p. 28.
688. ЦИНКЕ (ZINCKE)
Получение сульфеннлгалогеиидов действием галогенов на дисульфиды или
тиолы:
R—S-S-R—;
R—SH
Х2; < 0 °С
R-SX
(-80%)
X = Cl, Br; R = Alk, Ar
*СНС13> С2Н4С12 и др.
Хлорирование проходит значительно легче, чем бромированне. Наличие
электроноакцепторных заместителей в ароматическом кольце затрудняет ре-
реакцию.
Побочный процесс — хлорирование алкнльного или арильног о остатка, на-
например:
CH3SSCH3
2; 0 °С
C1CH2SC1
Zincke Т., Вег., 1911, Bd. 44, S. 769.
Kharasch N. е. a., Chem. Rev., 1946, v. 39, p. 283.
Houben-Weyl, Bd. 9, S. 268; СОП, т. 2, с. 560.
30*
467
689. ЦИНКЕ (ZINCKE)
Замещение орто- или яара-галогена на нитрогруппу в полнгалогенфенолах
под действием азотистой кислоты:
ОН ОН
Л\ -^\ /Л
R R
X = Br, I; R = Н, Hal
*NaNO2 + CH3COOH
Обмен фтора или хлора не происходит. В случае дибромидов замещается
лишь одни атом брома с образованием смесн изомеров, например:
ОН ОН ОН
HNO2
См. также Тер-Меер (№ 562).
Zincke Т., J. prakt. Chem., 1900, Bd. 61, S. 561.
Raiforg L. C, Le Rosen A. L, J. Am. Chem. Soc, 1944, v. 66, p. 1872.
690. ЦИНКЕ — ЗУЛЬ (ZINCKE — SUHL)
Превращение фенолов в геж-замещенные цнклогексадиеноны действием че-
тыреххлористого углерода в присутствии хлористого алюминия:
ОН О
СС1,
40—50 °С
[AlClsl;
B0-60%)
R = H, Br, Cl, CHC12
*CS2
Подобно четыреххлорнстому углероду реагирует 1,1,1-трнхлорэтан. Побоч-
Побочный процесс—полимеризация.
Реакция представляет препаративный интерес вследствие высокой реак-
реакционной способности гели-замещенных цнклогексадиенонов.
Zincke Т., Suhl R., Ber., 1906, Bd. 39, S. 4148.
Newman M. S., Pinkus А. С, J. Org. Chem., 1954, v. 19, p. 978, 985.
Ершов В. В., Володькин А. А., Богданов Г. Н., Усп. химии, 1963, т. 32, с. 179.
De Gee A. J. e. a., J. Chem. Soc, Perkin Trans. I, 1974, № 6, p. 676.
468
691. ЦИНКЕ— КЕНИГ (ZINCKE — KONIG)
Расщепление кольца пиридина с образованием солей дианнлов енольной
формы глутаконового альдегида при взаимодействии солей пирнднння с арома-
ароматическими аминами:
R'
R'
e42
0—15 °С
R"CeH4NH—СН=С—C=C-CH=NHCeH4R"
х-
(эфир)*
+NR X-
E0-80%)
R = 2,4-(O2NJCeH3) CN, 4-O2NCeH4 и др.; R' = NH2, OH, NHCOCH3, Alk, Hal,
OCeH5, COCeH5, H и др.; R" = H, Br, OAlk, Alk, NO2 и др.; X=Cl, Br
*CH3COCH3
Легкость расщепления кольца зависит от характера и положения замести-
заместителя, а та^же от основности амина. Электронодонорные заместители стабилизи-
стабилизируют С—N-связи кольца, а ^-заместители делают ядро совершенно устойчивым.
Так, соль Y-ацетиламннопиридиння практически не расщепляется. С увеличением
основности амина легкость расщепления возрастает. В реакции могут быть ис-
использованы гетероциклические (например, 6-амннохннолнн) и алифатические ами-
амины. Последние реагируют труднее, чем ароматические, н образуют смешанные
дианнлы:
R'NH2
+
[R'NH-CH=CH-CH=CH-CH=NHR] X"
+NR X-
Реакция представляет большой препаративный интерес. Образующиеся ди-
анилы легко циклизуются при нагревании, давая соответствующие N-арнлпнрн-
дины. Кроме того, производные глутаконового альдегида могут быть использова-
использованы для введения в молекулу другого соедннення сразу пяти атомов углерода.
Так, продукт расщепления пиридинового кольца метиланнлнном дает при щелоч-
щелочном гидролизе CH3N(C6H5)CH = CH—СН=СН—СНО (альдегид Цннке), исполь-
используемый в синтезе азулена (см. Хафнер, № 644).
См. также Стенхауз (№ 552).
Zincke Т., Ann., 1904, Bd. 330, S. 361; 1905, Bd. 339, S. 193.
Konig W., J. prakt. Chem., 1904, Bd. 69, S. 105; Bd. 70, S. 19.
Kobrich G., Ann, 1961, Bd. 648, S. 114.
Вомпе и др., ЖОХ, 1964, т. 34, с. 1758.
Konig W. e. a., J. prakt. Chem., 1965, Bd. 30, S. 96.
692. ЧАМИЧАН (CIAMICIAN)
Фотоизомеризация ароматических орто-замещенных нитросоединеннй в нит-
розосоединения, содержащие в орто-положении заместитель с а-оксигруппой:
NO2 / NO
Изомеризация происходит как в бензольных растворах, так и в твердом со-
состоянии; мета- и лара-замещенные не изомеризуются. Подобную миграцию кис-
469
лорода от NOj-группы к орто-заместителю претерпевают многие ароматические
ннтросоедннения:
f X
N—0
AsO
Ciamictan G., Silber P., Ber., 1901, Bd. 34, S. 2040.
De Mayo P., Reid S. Т., Quart. Rev., 1961, v. 15, p. 415.
де Майо П., Усп. орг. химии, 1964, т. 2, с. 416.
693. ЧАМИЧАН — ДЕНШТЕДТ (CIAMICIAN - DENNSTEDT)
Расширение пиррольного кольца в пиридиновое под действием дигалогенкар-
бенов:
О
NH
снх„
кон ; 50-so°c
(с2н5он)
+ :сх2
NH
сх„
NH
X
X=CI,Br, I
CH3Li, К-или Na-пирролы
470
В качестве источников карбенов используют также С6Н5СНХ2 и СН2Х2. В ре-
реакцию вступают 2,3- и 2,5-диалкилпирролы, индол, алкил- и алкоксииндолы.
Вследствие малых выходов реакция в большинстве случаев не имеет препара-
препаративного значения.
Ciamician G. L, Dennstedt М., Вег., 1881, Bd. 14, S. 1153.
Vogel E., Angew. Chem., 1960, Bd. 72, S. 8.
Baltazzi E., Krimen L. I., Chem. Rev., 1963, v. 63, p. 525.
Rees С W., Smithen С E., J. Chem. Soc, 1964, p. 928, 938; Adv. in Heterocyc-
lic Chem., 1964, v. 3, p. 66.
694. ЧЕПМЕН (CHAPMAN)
Термическая изомеризация ароматических имииоэфиров в Ы,Ы-диариламнды
ароматических карбоновых кнслот:
-200-300 °С
Ar—C=N—Аг' >- Аг—С—N—Аг'
А
Аг"
II I
О Аг"
G0-90%)
Аг, Аг'=С„Н6) CeH4Cl, CeH4NO2, С6Н4ОСН3, С6Н4СН3;
= CeH4R (где R = Н, F, Cl, Br, NO2, Alk, CH2COOR), нафгил, 8-хинолил н др.
Электроноакцепторные заместители в радикале Аг" облегчают, а электроно-
донорные затрудняют реакцию. Аналогичные заместители в остатке Аг' оказы-
оказывают противоположное действие.
Реакцию используют для получения N-арилантраннловых кнслот и акри-
донов:
О
соосн.
—С=№
I
См. также Бекмаи (№ 58), Небер (№ 417).
Chapman A. W., J. Chem. Soc, 1925, v. 127, p. 1992; 1926, p. 2296; 1927,
p. 1743; 1930, p. 2462.
Relies H. M., J. Org. Chem., 1968, v. 33, p. 2245.
Wheeler O. #., Roman F., Rosado O., J. Org. Chem., 1969, v 34, p. 966.
OP, т. 14, с 7.
471
695. ЧЕТТЭУЭЙ (CHATTAWAY)
Ацетилирование фенолов действием уксусного ангидрида в щелочной среде:
АгОН + (СН3СОJО ^
(юдн
Аг0С0СНз
(80%—колич.)
Аг = CeH4R (где R = NO2, NH2, Br, СООН, СООСН3, СООС6Н5)
Аналогично реагируют а- и р-нафтолы. Многоатомные фенолы в этих усло-
условиях образуют ди- и триацетильные производные. Метод используют также для
ацилирования аминов, например:
ra-H2NCeH4SO3H * n-CHgCONHCeH4SO3Na
См. также Шоттен—Бауман (№ 719), Айнхорн (№ 5), Костаиецкий — Ро-
Робинсон (№ 327).
Chattaway F. D., J. Chem. Soc, 1931, p. 2495.
Marshall E. R., Luck I. A., Elderfield R. C, J. Org. Chem., 1942, v. 7, p. 451.
Israelstam S. S., Simpson I. D., J. S. African Chem. Inst, 1956, v. 9, p. 92.
696. ЧЕТТЭУЭЙ (CHATTAWAY)
Перегруппировка 1Ч,М-диациланклинов в N-ациламиноарилкетоны в присут-
присутствии хлористого цинка:
N(CORJ NHCOR
~ 180 °С
[ZnCl2]
R'
I
COR
(-50%)
R = Alk, CeH5; R' = H, Cl, Br, CH3
napa-Замещенные анилины образуют аминокетоны с выходом 5—15%. N-Me-
тил-Ы-ациланилины не подвергаются перегруппировке.
См. также Гофман — Марциус B14), Бамбергер (№ 39, 40), Фишер — Хепп
(№ 615), Фрис (№630).
Chattaway D. F., J. Chem. Soc, 1904, v. 85, p. 386.
Derick С C, Bornmann J. H., J. Am. Chem. Soc, 1913, v. 35, p. 1269.
Dippy J. F. J., Moss V., J. Chem. Soc, 1952, p. 2205.
697. ЧИЧИБАБИН
«-Аминирование пиридинов под действием амида натрия:
/Н
NaNH2*; 100-150 °С
N
.сн3\
\
сн3;
R
N ЧЧН2
I
Na
N
C0-90%)
R = Alk, СООН
*KNH2, Ba(NH2J; ** ароматические углеводороды, жидкий NH3
472
Реакция применима к широкому кругу ароматических азотсодержащих ге-
гетероциклов. Бензимидазолы, изохинолины, акридины и фенаитридины аминиру-
ются хорошо, хинолины, пиразины, пиримидины и тиазолы — значительно хуже,
2-амино- или 2-амино-8-оксихинолины в этих условиях не реагируют.
Если оба а-положения заняты, аминогруппа вступает в ^-положение. Если в
а-положении находятся группы ОН, SO3Na или CONH2, то происходит обмен за-
заместителя на аминогруппу. Подобный обмен наблюдается и у а^-дизамещенных
хинолинов, например:
CONH2
I
Чичибабин А. Е., Зайде О. А., ЖРФХО, 1914, т. 46, с. 1216.
Adam-W., Grimison A., «Tetrahedron», 1965, v. 21, p. 3417.
Пожарский А. Ф., Симонов А. М. Аминирование гетероциклов по Чичибаби-
ну. Ростов н/Д., Изд. Ростовского ун-та, 1971, с. 133.
Zoltewicz J. A. e. a., J. Org. Chem., 1973, v. 38, № 10, p. 1947.
Эльдерфильд, т. 1, с. 424; OP, т. 1, с. 115.
698. ЧИЧИБАБИН
Получение замещенных пиридииов термической циклоконденсацней альдеги-
альдегидов с аммиаком*!
CH2R
3RCH2—CHO
NH3; 200—250 °С;
давление
(Н2О); [NH4OCOCH3]*
R R
N
R
CH2R
R = Alk, Ar
*А12О3 при 300—400 °С
В реакцию вступают также алифатические и ароматические кетоны, а,|5-не-
предельные альдегиды, кетокислоты, например:
2RCH=CHCHO
NH3
N
СООН
2СН„СОСООН
NH3; 250 °C
N
COOH
* Называют также реакцией Чичибабина — Байера (Bayer).
473
Часто используют смесь различных карбонильных соединенин
NH3
сн2=сн-<:н2-сно + сн3сно —>
N N
АгСНО + 2СН3СОСвН6 ¦ * [АгСН(СН2СОСвН6J]
NH3
Аг
«СН,
+ сн2о
NH3
Недостатком метода являются жесткие условия проведения реакции, что
приводит к образованию значительного количества побочных продуктов.
Реакцию используют в промышленности для синтеза 2-метил-5-этилпиридн-
на — исходного сырья для получения каучуков.
См. также Ганч (№ 188).
Чичибабин А. Е., ЖРФХО, 1906, т. 37, с. 1229; J. prakt. Chem., 1924, Bd. 107,
S. 122.
Ломакин А. Н. и др., ЖОХ, т. 33, с. 204.
Чумаков Ю. И. Пиридиновые основания. Киев. «Техника», 1965, с. 8.
Kametani Т., Nemoto Н., Takano S., Chem. Pharm. Bull., 1968, v. 16, p. 367.
Эльдерфильд, т. 1, с. 352; т. 6, с. 214; т. 7, с. 161.
699. ЧИЧИБАБИН
R
Циклизация четвертичных аммониевых соединений, полученных из а-алкил-
пиридинов и а-галогенкетонов, с образованием замещенных пирроколинов:
R
¦ I
нагревание ^
-г R"-C-CHR'~ -
II I
2R
NaHCO3
N
О X
R'"CH—
COR"
R'
R"
X = C1, Br; R, R', R" = H, CH8; R" = H, CH3, CH2C6H5
Особенно успешно в реакции используются эфиры и нитрилы пиридилук-
сусных кислот.
474
См. также Ортолева — Кинг (№ 436).
Tschitschibabin A. E., Вег., 1927, Bd. 60, S. 1607.
Borrows Е. Т., Holland D. О., Chem. Rev., 1948, v. 42, p. 615.
Holland D. O., Nayler J. H. C, J. Chem. Sot, 1955, p. 1657.
Салдабол Н. О., Зелигман Л. Л., Гиллер С. А., «Химия гетероциклических
соединений», 1971, № 6, с. 860—861.
Эльдерфильд, т. 3, с. 320.
700. ЧУ ГА ЕВ
Дегидратация спиртов в олефины термическим разложением их ксантогена-
тов (ксантогеновая реакция):
. 1. Na*; нагревание
2. CS2; нагревание
-с-с- >¦
н Ан
-С-С-
I I
Н OCSSNa
Ch3i
по—2io°C
(инертн. растворитель)** / \
Н OCSSCH3
*К, КОН, NaNH2, NaH, NaOH; ** без растворителя
Легкость дегидратации спиртов уменьшается в ряду: третичный > вторич-
вторичный > первичный. Как правило, происходит цис-элиминнроваиие.
Разложение ксантогенатов а-гликолей приводит к ацетиленам, например:
СН,—СН—CH2-OCSSCH3 -
сн3—с=сн
CSSCH,
Большим достоинством метода по сравнению с другими способами дегидра-
дегидратации является отсутствие изомеризации углеродного скелета и перемещения
С=С-связи. Недостатки метода — возможные затруднения в получении ксаито-
генатов и загрязнение олефинов примесями, содержащими серу. Реакция успеш-
успешно применяется в химии терпенов и стероидов.
См. также Коуп (№ 330), Хибберт (№ 659).
Tschugaeff L, Вег., 1899, Bd. 32, S. 3332.
Cfombie L, Quart. Rev., 1952, v. 6, p. 132.
DePuy С H., King R. W., Chem. Rev., 1960, v. 60, p. 444.
Rutherford К. С Ottenbrite R. M., Tang В. К-, J. Chem. Soc, Ser. C, 1971,
p. 582.
Chande M. S., Pranjpe S. D., Indian J. Chem., 1973, v. 11, p. 1206.
OP, т. 12, с 71.
701. ЧУГАЕВ—ЦЕРЕВИТИНОВ
Взаимодействие веществ, содержащих подвижный атом водорода, с йоди-
йодистым метилмагннем с образованием метана:
\
/I
;С-ОН + CH3-MgI
*~ СН. + С—OMgl
(инерт. растворитель) / I
Метод используют для определения подвижного водорода в соединениях,
содержащих группы ОН, СООН, SH, NH2 NHR или СН = С. Число эквивален-
475
тов выделившегося СН4 соответствует числу активных атомов водорода. В пер-
первичных аминах реагирует лишь один атом водорода, так как в образующемся
магиийоргаиическом соединении водород лишен подвижиости.
Модификация Терентьева — определение подвижного водорода в атмосфе-
атмосфере СО2, успешно используемое вследствие простоты исполнения.
Tschugaeff L, Вег., 1902, Bd. 35, S. 3912.
Zerewttinoff Т., Вег., 1907, Bd. 40, S. 2023; 1914, Bd. 47, S. 1659, 2417; Z. апа-
lyt. Chem., 1911, Bd. 50, S. 680; 1926, Bd. 68, S. 321.
Иоффе С. Т., Несмеянов А. Н., Справочник по магиийоргаиическим соеди-
соединениям., М.-Л., Изд. АН СССР, 1950, с. 4567.
Тигип С, Erdik E., Comm. Fac. Sci., Ankara, Ser. В, 1973, v. 20, № 1, p. 41.
702. ШВЕНК— ПАПА (SCHWENK — PAPA)
Восстановление органических соединений сплавом никеля и алюминия (сплав
Реиея) в водиощелочиом растворе:
\
?
СН Ni—A1 (сплав); 80—90 °С
D0%-ный р-р NaOH)
(
Этим методом могут быть восстановлены олефииы, кетоны, спирты, оксимы
альдегидов и кетонов, например:
хоон
:н=снсоон
но-/ \_<^Vcoch3
соон
(СН2JСООН
(-90%)
но-/ V/ Vch2ch3
С„Н5СН2-С-СН2С6Н5
II
о
С6Н5СН2ОН
СН2-СН-СС6Н5
I I II -
СН2-СН2 NOH
E0%)
¦ С6Н5СН2-СН-СН2С6Н5
он
G0%)
С6Н5СН3
G0%)
СН2-СН-СНС6Н5
I I I
СН2-СН2 NH2
E7%)
В случае ароматических альдегидов и кетоиов степень восстановления за-
зависит от температуры проведения реакции, например:
476
При восстаиовлеиии ароматических и непредельных соединений, содержащих
функциональные группы, часто происходит замещение последних водородом (де-
сульфирование, дехлорирование и т. п.):
SO3H
ОН
С6Н5(СН2LСООН
(86%)
С„Н5СС1=СС 1—СС1=СС1—СООН
См. также Браун (№ 108), Кижиер — Вольф (№ 291), Клеммеисеи (№ 296),
Сабатье—Саидераи (№ 533), Уолфром — Карабииос (№588).
Papa D., Schwenk E., J. Org. Chem., 1942, v. 7, p. 587.
Papa D., Schwenk E., Whitman В., J. Org. Chem., 1949, v. 14, p. 366.
Cook P. L, J. Org. Chem., 1962, v. 27, p. 3873.
Staskun В., van Es Т., J. Chem. Soc, 1966, Ser. C, p. 531.
Физер, т. 2, с. 434; т. 5, с. 327.
703. ШВЕХТЕН (SCHWECHTEN)
Обмен диазогруппы иа хлор или бром при термическом разложении двойных
солей диазоиия и галогенидов двухвалентной ртути:
нагревание
ArN2X-HgX2 > АгХ
Х = С1, Вг
Реакцию используют обычно для синтеза производных бифеиилена, нафтали-
нафталина, феиантреиа, поскольку другие методы в этих случаях сопровождаются по-
побочными процессами.
См. также Заидмейер (№ 261), Гаттермаи (№ 192), Шимаи (№ 708).
Schwechten H. W., Вег., 1932, Bd. 65, S. 1605.
Dauben W. G., Saegebarth К. A., J. Am. Chem. Soc, 1951, v. 73, p. 1853.
LaBudde J. A., Heidelberger C, J. Am. Chem. Soc, 1958, v. 80, p. 1225.
704. ШЕЛЛЕР (SCHELLER)
Получение арилмышьяковых кислот из ароматических аминов в присутствии
треххлористого мышьяка и следов одиохлористой меди:
О
ArNH,
1. HNO2; AsGl3
2. вода, р-р N
[Gu2Gl2]; (GH3OH или СНзСООН)
ArAs(OHJ
Ar = C6H4NO2, C6H4COCH3> C6H4COOH, C6H4NH2 и др.
Модификация Дока (Doak) — использование Cu2Br2 в С2Н5ОН.
См. также Барт (№ 47), Бешаи (№ 71), Розеимуид (№ 522).
Scheller Е., англ. пат. 261026 A925); С. А., 1927, v. 21, р. 3371
Doak G. О., J. Am. Chem. Soc, 1940, v. 62, p. 167.
Doak G. O., Steinman H. G., J. Am. Chem. Soc, 1946, v. 68, p 1987.
OP, т. 2, с 451.
477
705. ШЕРЛИН — БРАЗ (SCHERLIN — BRAS)
Получение ариларсиноксидов взаимодействием арилгидразинов с мышьяко-
мышьяковой кислотой в присутствии меди*:
H3AsO4
S) Ar"As==0
Аг = CBH5, C6H4CH3-ft
Наряду с ариларсиноксидом образуется триариларсин.
См. также Барт (№ 47).
Seide О. A., Scherlin S. M., Bras G. J., J. prakt. Chem., 1933, Bd. 138, S. 225.
Брукер А. Б., ЖОХ, 1948, т. 18, с. 1297
OP, т. 2, с. 512.
706. ШЁНБЕРГ (SCHONBERG)
Фотохимическое присоединение о-хинонов к олефинам с образованием 1,4-ди-
оксанов:
О
fiv
(CGH6)
О.
О-
О
RCH=CHR'
О
R'
R, R' = Н, -(СН2)„—, Alk, CH2Ar, Аг
Особенно легко реагируют олефины, двойная связь которых сопряжена с
ароматическим кольцом. Активированные о-хиноны (например, тетрахлор-о-бен-
зохинон) реагируют с олефинами в темноте.
См. также Патерно — Бюхи (№ 442).
Schonberg A., Mustafa A., Nature (London), 1944, v. 153, p. 195; J. Chem Soc,
1944, p. 387.
Schenck G. 0., Schmidt-Thomee G. A., Ann., 1953, Bd. 584, S. 201.
Schonberg A., Awad W. 1., Mousa G. A., J. Am. Chem. Soc, 1955 v 77
p. 3850.
707. ШЁНБЕРГ (SCHONBERG)
Термическая перегруппировка диарилтионкарбонатов в диарилтиолкарбонаты:
S
-300 "С*
АЮ—С—ОАг >
/ \
А/ "Х-ОАг
V
Аг—S—С—ОАг
II
О
E0-80%)
* Кипячение в инертном растворителе
Электроноакцепторные заместители в орто- или пара-положениях к атому
кислорода заметно облегчают реакцию.
* Называют также реакцией Зейде — Шерлина — Браза.
478
В случае несимметричных диарилтионкарбонатов перегруппировка обычно
идет в направлении того ароматического кольца, которое имеет более сильные
электроноакцепторные заместители. Побочный процесс — образование симметрич-
симметричных тионкарбонатов и их последующая перегруппировка в симметричные ди-
диарилтиолкарбонаты.
Реакцию используют для получения тиофенолов и восстановления фенолов:
S О
SOC12 II -300 °С II
2АЮН >- АгО—С—ОАг > ArS—С—ОАг
НО"
(С2Н5ОН)
ArSH
н2
[Ni]
АгН
См. также Ньюмен — Куорт (№ 431).
Schonberg A. e. a., Ann., 1930, Bd. 483, S. 107.
Krauch С. И., Farid С, Schenck G. О., Chem. Ber., 1965, Bd. 98, S. 3102.
Kwart H., Evans E. R., J. Org. Chem., 1966, v. 31, p. 410.
Newman M. S., Karnes H. A., J. Org. Chem., 1966, v. 31, p. 3980.
708. ШИМАН (SCHIEMANN)
Получение фторароматических соединений термическим разложением сухих
борфторидов диазония*:
ArNH»
1. HNO2; HC1
2. HBF4 или NaBFj
(Н2О)
*- ArNjj" "BF4
нагревание
> ArF
(-70%)
Вместо борфторидов могут быть использованы гексафторантимонаты и гек-
сафторфосфаты диазония.
В реакцию вступают различные ароматические соединения, в том числе и
производные конденсированных полициклических углеводородов (нафтилина, ан-
антрацена, флуорена и др.), а также ароматические гетероциклы (пиридин, хинолин
и др.):
N2BF4 F
сн
,05 »G
СН3
^
сн.
сн3
G5%)
F4BN2
N
* Называют также реакцией Бальца (Balz) — Шимана.
479
При использовании гексафторфосфатов арилдиазония выходы арилфторидов
повышаются вследствие стабильности и легкости выделения этих солей диа-
зония:
C7%)
N2PFe
N2BF4
Вг
Побочные процессы: замена диазогруппы на водород или гидроксил.
Реакция является одним из основных методов синтеза моно- и дифторзаме-
щенных ароматических соединений.
См. также Зандмейер (№ 261), Гаттерман (№ 192), Ходжсон — Марсден
(№ 668), Швехтен (№ 703).
Balz G., Schiemann G., Ber., 1927, Bd. 60, S. 1186.
Sharts С. М., J. Chem. Educ, 1968, v. 45, p. 185.
Montgomery J. A., Hewson K-, J. Org. Chem., 1969, v. 34, p. 1396.
Сушицкий Н. В кн.: «Успехи химии фтора». Пер. с англ. Под ред. А. П. Сер-
Сергеева. Т. 3—4. М., «Химия», 1970, с. 335.
ОР, т. 5, с. 155.
709. ШИФФ (SCHIFF)
Получение азометииов (оснований Шиффа) из альдегидов и первичных ами-
ноб в присутствии щелочи:
RCH=O + NH.R'
нагревание
[КОН]; (вода или спирт) | i
ОН J
RCH=NR'
Алифатические имины очень неустойчивы, ароматические имииы устойчивы
и могут служить для идентификации как альдегидов, так и аминов.
См. также Деккер — Форстер (№ 239), Эрлих — Закс (№ 742).
Schiff H., Ann. (Suppl.), 1864, Bd. 3, S. 343; 1886, Bd. 140, S. 93; 1881, Bd. 210,
S. 114; Ber., 1892, Bd. 25, S. 1936.
Cordes E. H., Jencks W. P., J. Am. Chem. Soc, 1962, v. 84, p. 832.
Houben-Weyl, Bd. 7, S. 1, 453; Vyas K. N.. J. Anim. Morphol. Physiol., 1972,
v. 19, № 1, p. 77—82.
710. ШИХАН-ФРАНК (SHEEHAN-FRANK)
Получение пептидов конденсацией хлорангидридов N-фталоиламинокислот с
аминокислотами или пептидами с последующим снятием защитной группы:
О + HjjNCHCOOH
СО R
~180°С
СО
\
со
N—CHCOCI
N—СНСООН
R'
H2NCHCOOH;
MgO; 20 °C
(води, диоксаи)
РС15*; 60 °С
*-
(С8н8)**
480
СО
^N-CHCO-NHCHCOOH
СО
!. H»NNH2
2. HG1 (разб.); 20 °C
3. Ионообменная смола
(C2H5OH)
R
R'
>- H2NCHCO—NHCHCOOH
I I
R R'
E0-80%)
*SO2 при —15 °С; **CHC1S, HCON(CH3J, диоксан
В случае аминокислот, дающих легко гидролизующиеся N-фталоилхлоран-
гидриды, последние предварительно превращают в смешанные ангидриды дибен-
зилфосфорной кислоты:
СО
(CeH5CH2OJPOAg »-
II
О
/ I
СО R
CO
./ I II
CO R О
—Р(ОСН2С6Н5J
II
О
Образовавшиеся ангидриды легко конденсируются с аминокислотами.
См. также Бергман — Зервас (№ 62), Виланд (№ 164), Инг —Манске
(№ 186).
Sheehan J. С, Frank V. S., J. Am. Chem. Soa, 1949, v. 71, p. 1856.
King F. E., Clark-Lewis J. W., Vade R., J. Chem. Soc, 1957, p. 873.
Буассона Р. А., Усп. орг. химии, 1966, т. 3, с. 178.
Springall И. D. Structural Chemistry of Proteins. London, Buttenworth, 1954,
p. 45, 46, 50.
711. ШЛАК-КУМПФ (SCHLAK-KUMPF)
Отщепление С-концевой аминокислоты в пептидах действием изотиоцианата
аммония, расщеплением образовавшегося тиогидантоииового производного дей-
действием щелочи и последующим кислотным гидролизом отщепившегося тиогидан-
тоина (тиогидантоииовый метод):
NHCHCO—NHCHCOOH
I I '
R R'
R\ 9
\ I/ NaOH;
/ \ 0-10 °С
•-nhchco-n( }nh —>
1 \ / (Н2О)
R C=S
NH4NCS; (CH3COJO; 100 °С
(Н2О или CH-fCOOH)
R'
• —NHCHCOOH + HN
I
R
NH
I HBr;
I 150 °G
HjNCHCOOH
R'
31—684
481
Выделившуюся свободную аминокислоту идентифицируют хроматографиче-
скими методами. Повторяя процесс, можно отщепить следующую аминокислоту
и т. д. Недостаток метода: определяются не все аминокислоты; так, например,
аспарагиновую и глутаминовую кислоты, а также серии, аргинин и пролин обна-
обнаружить не удается.
Тиогидантоины из пептидов можно получать с количественными выходами,
заменив изотиоцианат аммония дифенилизотиоцианатофосфатом в диметилформ-
амиде:
NHCHCOOH + (С6Н6ОJР—NCS >
I II
R О
s NHCHCONCS + (С,Н5ОJР—ОН
I II
R О
НО"
Rw°
CS
См. также Бергман (№ 61).
Schlack P., Kumpf W., Z. physio!. Chem., 1926, Bd. 154, S. 125.
Waley S. G., Watson L, J. Chem. Soc, 1951, p. 2394.
Rentier G. W., Khorana H. G., Stedman R. I., J. Chem. Soc, 1953, p. 673.
Кнунянц И. Л., Первова Е. Я., Усп. химии, 1955. т. 24, с. 667.
Stark R., «Biochemistry», 1968, v. 7, p. 1796.
712. ШЛИТЛЕР —МЮЛЛЕР (SCHLITTLER —MOLLER J.)
Получение изохинолинов конденсацией бензиламинов с диэтилацеталем гли-
оксаля и последующей циклизацией под действием серной кислоты:
СН(ОС2Н6J
СН
R'
(-40%)
R = Н, ОСН3; R' = Н, Alk
Метод отличается от реакции Померанца — Фрича (№ 469) лишь стадией
синтеза иминоацеталя и используется для получения 1-замещенных изохинолинов.
Schlittler Е., Muller /., Helv. chim. acta, 1948, Bd. 31, S. 914, 119.
Bradsher С. К., Chem. Rev., 1946, v. 38, p. 447.
OP, т. 6, с 223.
482
713. ШМИДЛИН — БЕРГМАН — УИЛСМОР
(SCHMIDLIN — BERGMAN - WILSMORE)
Получение кетена пиролизом ацетона*:
500—750 °С
СНа— СО—СН, »¦
СН2=С=О
(90-95%)
В промышленности пиролиз проводят при 550 °С, а в лаборатории пропуска-
пропускают ток ацетона над нагретой до 700—750 °С проволокой из хромеля А (кетено-
вая лампа). Реакция протекает по свободнорадикальному механизму.
Wilsmore N. Т. М., Stewart A. W., Вег., 1907, Bd. 40, S. 1025.
Schmidlin J., Bergman M., Вег., 1910, Bd. 43, S. 2821.
Quadbeck G., Angew, Chem., 1956, Bd. 68, S. 361.
OP, т. З, с 110.
714. ШМИДТ (SCHMIDT К. F.)
Взаимодействие карбонильных соединений с азотистоводородной кислотой
в присутствии концентрированной серной кислоты с образованием аминов (из
карбоновых кислот), амидов (из кетонов) и смеси нитрилов и амидов (из аль-
альдегидов) :
RCOOH
RC(OHJ
HN3 или NaN3
Г
[коиц. H2SO4]*; (ииерти. растворитель) I
-Н2О
NH-N—N
RC—ОН
N-N=N
-N,
R—N=C—ОН
RNH,
F5-95%)
RCHO > RCN + RNHCHO
RCOR' > RCONHR' + R'CONHR
*НС1, CF3COOH, полифосфорная кислота, 20%-ный олеум, А1С13, ftv
Реакция протекает с сохранением конфигурации. Из несимметричных кето-
кетонов образуется смесь амидов с преобладанием амида, являющегося продуктом
миграции остатка, который находился в анги-положении относительно группы
HN3 'Л +
RCOR' > /C=N\+ * R'C=NR
H2o
R'CONHR
В реакцию вступают алифатические, ароматические, гетероциклические и
жирноароматические карбонильные соединения. Наиболее реакционноспособными
являются алифатические и алициклические альдегиды и кетоны. В случае кето-
кислот возможно выделение продуктов отдельных стадий реакции:
СН3СОСН2СН2СООН v CH3CONHCH2CH2COOH >
> CH3CONHCH2CH2NH2
* Называют также реакцией Уилсмора.
31'
483
а,Р-Непредельные карбоновые кислоты, олефины и ароматические углеводо-
углеводороды в условиях реакции Шмидта претерпевают следующие превращеиия:
RCH=CHCOOH > RCH2CHO
R2C=CHR' »- R2C=NCH2R'
АгН »- ArNH2
При избытке азотистоводородной кислоты из альдегидов и кетонов образу-
образуются тетразолы, например:
N
hn3 / N^ \
N
Недостатками метода являются токсичность HN3 и необходимость проведе-
проведения процесса в сильнокислой среде. Преимущество данного метода по сравне-
сравнению с реакциями Курциуса (№ 345) и Гофмана (№ 210)—возможность син-
синтеза аминов в одну стадию и, часто, более высокие выходы.
См. также Лоссеи (№ 369), Штиглиц (№ 726).
Schmidt К- F., Вег., 1924, Bd. 57, S. 704; Z. Angew. Chem., 1923, Bd. 36,
S. 511.
Conley R. Т., Nowak В. Е., Chem. Ind., 1959, p. 1161; J. Org. Chem., 1961,
v. 26, p. 692.
Sasaki Tadashi, Eguchi Shoji, Toru Takeshi, J. Org. Chem., 1971, v. 36, p. 2454.
Колдобский Г. И. и др., Усп. химии, 1971, т. 40, с. 1790.
Mayo P. Molecular Rearrangements. New York — London, Interscience, 1963,
p. 507.
Misiti D., Rimatori V., Gatta F., J. Heterocyclic Chem., 1973, v. 10, p. 689.
OP, т. 3. с 293.
715. ШМИДТ — РУЦ (SCHMIDT E. — RUTZ)
Превращение ацетатов нитрополиспиртов в соответствующие нитроолефины
под действием слабых оснований:
CH2NO2
CHOH
CHOH
CHi.NO,
NaHCO3;
CHNO,
СНОСОСН, нагревание . СН
[H+] I (эфир или бензол)
СНОСОСНз СНОСОСНд
I I
(90%)
Реакцию используют для получения 2-дезоксиальдоз, подвергая получаемые
иитроолефииы селективному гидрированию с последующей реакцией Нефа
(см. № 423):
CHNO2 CH2NO2
II н I
СН На >
| [Pt или Pd/C] I
СНОСОСН3 СНОСОСН3
сн=о
1. NaOH
2-
I
* СН
2
СНОН
Schmidt E., Rutz G., Вег., 1928, Bd. 61, S. 2142.
Sowden J. С, Adv. in Carbohydrate Chem., 1951, v. 6, p. 313.
Murray D. H., Butler G. G., Can. J. Chem., 1959, v. 37, p. 1776.
Bear H. H., Neilson Т., Can. J. Chem., 1965, v. 43, p. 840, 1829.
484
716. ШОЛЛЬ (SCHOLL)
Дегидроциклизация полициклических диарилкетоиов с образованием конден-
конденсированных циклических систем при нагревании с хлористым алюминием*:
О
II О
С
А1С1з*; О2; в расплаве
*А1С13 + NaCl
В реакцию вступают моно- и поликетоны, имеющие свободное яери-положе-
иие по отношению к карбонильной группе. Присутствие органических осиований
или следов иода облегчает реакцию.
Если nepu-положение занято или в ftapa-положении к СО-группе находятся
группы ОН или OR, образуется пятичленное кольцо:
О
О
С
но-' ^ ^ но'
Аналогично циклизуются полициклические нитрилы, имиды и азосоединения,
например:
,N=N.
См. также Якобсон (Ш 748).
Scholl R., Seer С, Ann., 1912, Bd. 394, S. Ill; Monatsh., 1912, Bd 33, S. 1;
Вег., 1922, Bd. 55, S. 100.
Kranzlein G., Angew. Chem., 1938, Bd. 51, S. 377.
Allen C. F. H., Chem. Rev., 1959, v. 59, p. 987.
Olah G. A., Schilling P., Gross I. M., J. Am. Chem. Soc, 1974, v. 96, p. 876.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер. с
англ. М., Издатинлит, 1949, с. 649.
717. ШОРЫГИН
Металлирование углеводородов алкильными производными щелочных ме-
металлов:
R = Alk; M = Na, К, Li
Реакциониая способность RM убывает в ряду: Na > К > Li. Очень лег-
легко реагируют дифенил- и трифенилметаны, иидеи, флуореи. Бензол и нафталин
¦ Называют также реакцией Шолля — Кренцляйна (Kranzlein).
485
металлируются в ядро, а их алкилзамещенные — в боковую цепь. При наличии
таких заместителей, как ОСН3, ОС6Н5 SC6H5, NR2, метилирование идет в орто-
положение к этим заместителям. При повышении температуры реакции обра-
образуются биметаллические производные, причем второй атом металла вступает в
жега-положение. Гетероциклические соединения (фуран, тиофен) металлируются
в положение 2.
Продукты реакции после обработки двуокисью углерода выделяют в виде
соответствующих карбоновых кислот.
Метод часто дает успешные результаты в тех случаях, когда другие способы
металлирования оказываются непригодными.
См. также Иоцич (№ 275).
Шорыгин П. П. Исследования в области металлоорганических соединений
натрия. 1910, 116 с.
Синтетические методы в области металлоорганических соединений. Под ред.
А. Н. Несмеянова и К- А. Кочешкова. Вып. 1. М.-Л., Изд. АН СССР, 1949, с. 172,
282, 313.
718. ШОРЫГИН —ВАНКЛИН (WANKLYN)
Получение спиртов из кетонов или альдегидов присоединением натрийалки-
лов с последующим гидролизом:
-С- +RNa
1
О
"агревание;
(эфир)'
R-C
I
ONa
R = Alk, CH2C6H5> CeH5
* Инертный растворитель
R-C-
Ан
A5-60%)
В реакцию вступают различные алифатические и ароматические альдегиды
и кетоны. Аналогично идет присоединение к двуокиси углерода:
СО2 + RM > RCOOM
M = Na, Li
Натрийалкилы получают действием натрия на ртутьорганические соеди-
соединения:
Na
R2Hg * 2RNa
См. также Вагнер (№ 138), Гриньяр (№ 219), Зайцев (№ 259).
Wanklyn J. A., Ann., 1858, Bd. 107, S. 125; Bd. 108, S. 67.
Schorigin P., Ber., 1907, Bd. 40, S. 3111; 1908 Bd. 41, S 2711 2717, 2723;
1910, Bd. 43, S. 1931, 1938.
Prey V., Ber., 1943, Bd. 76, S. 156.
Синтетические методы в области металлоорганическрх соединений. Под ред.
А. Н. Несмеянова и К- А. Кочешкова. Вып. 1. М.-Л. Изд. АН СССР, 1949, с. 282,
719. ШОТТЕН-БАУМАН (SCHOTTEN - BAUMANN)
Ацилироваиие спиртов и аминов хлорангидридами кислот в воднощелочном
растворе:
NaOH*
R'OH-r-RCOCl —->- RCOOR'
(Н2О)
NaOH*
R'NH2 + RCOC1 —> RCONHR'
(H2t>)
R = AIk(Ce-C18), CeH5, CeH4NO2-«, C6H3(NO2J-3,5
*Na2CO3, MgO, CaO, BaO, NaHCO3, CH3COONa
Выходы 60—9O°/o- Ацилирование легко гидролизующимися хлораигидридами
(СОСЬ, AlkCOCI) часто проводят в инертных растворителях и при охлаждении.
Реакцию широко используют в промышленных и лабораторных синтезах,
часто применяют для защиты NH2-rpynn в аминокислотах (в частности, при син-
синтезе пептидов).
Бензоилирование имидазола и его производных сопровождается раскрытием
цикла (расщепление по Бамбергеру), например:
НС=С-СН2-СНСООСН3
С6Н5СОС1
NaOH
(Н2О) *
CeH5CONH- СН= С-СН2- СН-СООСН3
C6H5CONH NHCOCeHe
Н
См. также Айнхорн (№ 5), Гейлет — Илион (№ 197), Дорнов — Тайдель
(№ 257), Хинсберг (№ 665), Четтэуэй (№ 695).
Schotten С, Ber., 1884, Bd. 17, S. 2544.
Baumann E., Ber., 1886, Bd. 19, S. 3218.
Sonntag N. O. V., Chem. Rev., 1953, v. 52, p. 272.
Tsuchiga M. e. a., Bull. Chem. Soc. Japan, 1969, v. 42, p. 1756.
Tsuda Minoru e. a., Makromol. Chem., 1973, Bd. 167, S. 183.
Houben-Weyl, Bd. 8, S. 545; Bd. 11/2, S. 478; Фьюзон, с. 289.
720. ШПЕНГЛЕР —ПФАННЕНШТИЛЬ
(SPENGLER— PFANNENSTIEL)
Укорочение цепи Сахаров на одно звеио путем окисления молекулярным
кислородом в щелочном растворе:
СНО
СНОН
о2
j. СООН
| (води. р-р. КОН)" |
СНОН СНОН
I I
*Ва(ОНJ
См. также Веерман (№ 149), Воль (№ 172), Руфф — Фентон (№ 530), Мак-
Доиалд — Фишер (№ 379).
Spengler О., Pfannenstiel А., герм. пат. 618164 A935); Z. Wirtschaftsgruppe
Zuckerindustrie, 1935, Bd. 85, S. 546.
Richtmyer N. К., Hann R. M., Hudson С. S., J. Am. Chem. Soc, 1939, v. 61,
p. 340.
Hardegger E., Kreis K-, Khadem H. E., Helv. chim. acta, 1951, Bd. 34, S. 2343;
1952, Bd. 35, S. 618.
Pigman W. W., The Carbohydrates. New York, Acad. press, 1957, p. 122.
487
721. ШТААБ (STAAB)
Ацилирование соединений, содержащих подвижный атом водорода, дейст-
действием N-ацилимидазолов (имидазолидов), полученных из М,М'-карбонилдиимид-
азола и корбоновых кислот:
О
N
R'OH
С=0 + RCOOH
N
ч
(тетрагидрофураи)*
N
!
COR
RCOOR'
RiNH
R'NHNH2
RCONHNHR'
трет-СЩООИ
4H9-/npe/n
F5-80%)
HCI
RCOC1
*Инертиые растворители
Реакции проходят, как правило, с количественными выходами. Имидазолиды
ароматических кислот менее реакционноспособны, чем производные алифатиче-
алифатических кислот. Подобно карбоновым кислотам реагируют сульфокислоты и произ-
производные фосфорной кислоты.
Ацилироваиие спиртов катализируется соответствующими алкоголятами. Бла-
Благодаря мягким условиям метод успешно используется для ацилирования третич-
третичных спиртов, полиеиовых спиртов и др.
Вместо М,М'-карбоиилдиимидазола могут быть использованы N.N'-тиоиил- и
М,М'-тиокарбонилдиимидазолы, соответствующие производные 1,2,3- и 1,2,4-три-
азола, пиразола, бензимидазола.
Легкость обмена имидазольных остатков на другие группы позволяет ши-
широко использовать Ы,Ы'-карбоиилдиимидазол для получения в очень мягких ус-
условиях уретанов, изоцианатов, замещенных мочевин, а также в синтезе гетеро-
циклов. Метод нашел применение и в синтезе пептидов.
См. также Тейлор — Мак-Киллоп (№ 561).
Staab H. A., Chem. Вег., 1956, Bd. 89 S. 1927
Staab H. A., Rohr W., Graf F., Chem. Вег., 1965, Bd. 98, S. 1122.
Staab H. A., Merdes H., Chem. Вег., 1965, Bd. 98 S. 1134.
Wright W. В., J. Heterocyclic. Chem., 1965, v. 2, p. 41.
Физер, т. 2, с. 119; т. 5, с. 235.
722. ШТАУДИНГЕР (STAUDINGER)
Превращение карбонильной группы в имииогруппу действием иминотрифе-
иилфосфораиов (иминироваиие) *|
х=о + (сен5Kр=1
RN-P(C6H5)
N,
C=NR
* Реакцией Штаудиигера называют также получение имииофосфоранов из
азидов и соответствующих фосфинов.
В реакцию вступают ароматические альдегиды и кетоиы, кетены, изоцианаты,
сероуглерод, двуокись углерода, перфторкетоиы, а-кетокислоты:
(CeH6JC=C=O + (C6H5KP=NC6H5 >¦ (C6H6JC=C=NC6H6
н+
СН3С-СООСН3 + (C6H6KP=NH >¦ СН3С-СООСН3 ^СНзСН-СООСНз
О NH NH2
(CFJ.CO + (C6H6KP=NCOC6H5 >¦ (CFSJC=NCOC6H6
могут быть использованы амидофосфаты и фос-
Вместо (CeHB)sP =
ф азаны:
РС1„
/ \ нагревание
CH3N^ 4jCH3 > [C13P=NCH3
PC13
CeH6N=C=NCeH6
NaH — C8H5CHO
(C2H6OJP-NHCH3 v(C2H6OJP-NCH3 »- C6H6CH=NCH3
О
О
См. также Кирсанов (№ 293).
Staudinger П., Meyer J., Helv. chim. acta, 1919, Bd. 2, S. 635.
Зейфман Ю. В. и др., Изв. АН СССР. ОХН, 1965, с. 450; ЖОХ, 1967, т. 38,
с 2480
Leffer J E. Temple R. D., J. Am. Chem. Soc, 1967, v. 89, p. 5235.
Зейфман Ю. В. и др., ЖОХ, 1967, т. 37, с. 2480.
723. ШТАУДИНГЕР (STAUDINGER)
Получение эписульфоиов (тиираиоксидов) из алифатических диазосоедине-
иий действием сернистого ангидрида*:
\ + - SQs; 40 °С
2 NC=N=N . „ > 2
/ эфир *
R'/
л
4C=SO2
R'/
R
\
-1
TV/ \ / \Р'
к so2 к
B5 80%)
R = H, C2H6, C6H6; R' =Н, СН3, С8Н6, СвН4Вг-«, СвН4ОСН3-«
*с8н14, с6н12, css
В реакции получается смесь цис- и транс-изомеров, причем количество цис-
изомера увеличивается с возрастанием полярности растворителя.
Несимметричные эписульфоны получают при реакции диазоалкаиов с суль-
фохлоридами:
(C2H5KN
RCHN2 + R'CH2SO2C1
RHC-
-CHR'
F0-90%)
R = H, CH3, U30-C3H,, CeH6; R' = H, CeH4Cl, CH2CeH5, CeH4NO2-x(ft)
* Называют также реакцией Штаудингера — Пфеиииигера (Pfenninger).
489
Побочными продуктами реакции являются кетазины или 1,3,4-тиадиазоли-
диндиоксиды-1,1.
Эписульфоиы при нагревании или под действием оснований разлагаются с
образованием олефинов.
Staudinger H., Pfenninger F., Вег., 1916, Bd. 49, S. 1941.
Vargha L. V., Kovacs E., Вег., 1942, Bd. 75, S. 794.
Hesse G., Reichold E., Majunder S., Chem. Ber., 1957, Bd. 90, S. 2106.
Inhoffen H. H. e. a., Ann., 1966, Bd. 694, S. 19.
Fischer N. H., «Synthesis», 1970, v. 8, p. 394.
724. ШТЕДЕЛЬ—РЮГХАЙМЕР (STAEDEL — RUGHEIMER)
Замыкание кольца пиразина при конденсации а-галогенкетонов с аммиаком:
R СНХ NH3; нагревание
=0 RC=0
R'
R'CHNH, R'
N
R
N K
N
N *'
R, R' = H, Alk, Ar
Реакцию проводят под давлением. Получение незамещенного пиразина силь-
сильно осложняется побочными реакциями, например:
СН,Вг
ВгСН,СНО
NH3
BrCH2CH=NH
BrHjjG
NH
См. также Гастальди (№ 191), Гуткнехт (№ 226).
Staedel W., Rugheimer L, Ber., 1876, Bd. 9, S. 563.
Krems I. L, Spoerri P. E., Chem. Rev., 1947, v. 40, p. 295.
725. ШТЕТТЕР (STETTER)
Получение высших карбоновых кислот алкилироваиием дигидрорезорцииа с
последующим раскрытием цикла под действием оснований и восстановлением
кетогруппы образовавшейся б-кетокислоты:
О О
ВаО*
R
нагревание RCH2C(CH2KCOOH
¦О (Н20) ' ^
*КОН, NaOH
R(CH2MCOOH
490
Алкилирование дигидрорезорцина осуществляют тремя путями: действием
алкилиодидов (С2—Ci6) в спиртово-щелочной среде (выходы 30%), альдегидов
в водно-спиртовом растворе (выходы ~70%) и олефинов (выходы 40—60%).
Для восстановления СО-группы б-кетокислот используют либо реакцию
Клемменсеиа (см. № 296) (выходы 50%), либо метод Кижнера — Вольфа (см.
№ 291) (выходы 80—95%).
Аналогично могут быть превращены в кислоты 2,2-диалкил-, 4- и 5-алкил-
дигидрорезорцины. Расщепление алкилдигидрорезорцииа в спиртовом растворе
позволяет получать эфиры б-кетокислот.
Восстановительное расщепление алкилдигидрорезорцина в условиях реакции
Кижнера — Вольфа часто позволяет получать карбоиовую кислоту в одну ста-
стадию, без промежуточного образования кетокислоты:
О О
О
НООС(СН2N
(СН2)„СООН
При помощи реакции Штеттера можно получать окси- и аминокислоты, на-
например:
О
cC'"w
н2
Метод Летре (Lettre) — получение высших дикарбоновых кислот из диме-
тилового эфира резорцина:
ОСН3 ОСН3
GeH5Li
-ОСН3
0CH3 CHSO
HI
Вг(СН2) Вг
ОН НО.
ОСН3 CH.0
он но
> НООС— (СН2)„+10-СООН
C%)
> НООС(СН2)зСОСН2(СН2)„СН2СО(СН2)зСООН —
« = 3 — 6
Восстановление кетокислот проводят по Клемменсену (см. № 296).
См. также Хюниг (№ 681), Тейлор — Мак-Киллоп (№ 561).
Stetter H., Dierichs W., Chem. Ber., 1952, Bd. 85, S. 61, 290, 1061; 1953, Bd. 86,
S. 693.
Stetter H., Bunt gen С, Соепеп М., Chem. Ber., 1955, Bd. 88, S. 77.
491
Stetter H., Engl R., Rauhut H., Chem. Ber., 1958, Bd. 91, S. 2882; 1959, Bd. 92,
S. 1184.
Stetter H., Angew. Chem., 1955, Bd. 67, S. 769.
726. ШТИГЛИЦ (STIEGLITZ)
Перегруппировка триарилметилгидроксиламинов в анилы под действием
пятихлористого фосфора:
ArArJC—NHOH
s; нагревание
(эфир или бензол)
е
>¦ Ar2C=N—Аг + ArAr'C=N—Аг'
л)
Аналогично перегруппировываются хлор- или бромамины под действием ос-
осиований, а также азиды — при нагревании в запаянной трубке.
Наличие электронодонорных заместителей в ароматическом ядре облегчает
перегруппировку. Способность арильного остатка к миграции уменьшается в ряду:
(CH3JNC6H4 > CH3OCeH4 > СН3С6Н4 > CeH5 > ОаНСвН,
Перегруппировка может быть использована в препаративных целях, в том
числе для синтеза гетероциклических систем, например фенаитридииов:
/\_/Л СНзШа
=J \=/ (C5H5N)
OS
w
NHCI
R = CH3, СбН5, а-нафтил
См. также Шмидт (№ 714).
Stieglitz J., Vosburgh I., Ber., 1913, Bd. 46, S. 2151.
Berg S. S., Petrov V., J. Chem. Soc, 1952, p. 3713.
Newman M. S., Hay P. M., J. Am. Chem. Soc, 1953, v. 75, p. 2322.
Saunders W. H., Ware I. C, J. Am. Chem. Soc, 1958, v. 80, p. 3328.
Kovacic P., Lower у К. M., Field К. W., Chem. Rev., 1970, v. 70, p. 664.
Mayo P. Molecular Rearrangements. New York —London, Interscience, 1963,
p. 479.
727. ШТОББЕ (STOBBE)
Конденсация альдегидов или кетоиов с эфирами янтарной кислоты в при-
присутствии осиований с образованием алкилиденянтарных кислот *:
COOR"
I нагревание
:=о + сн2—сн2—coor" >-
2 [C2H6ONa]*; (C2H5OH)
RN
R'/
R
COOR"
^C-CH— CH2— C=O
R'/ I
I—
COOR"
Ba(OHJ*
-o-
R
вания
492
¦Называют реакцией Штоббе — Джонсоиа (Johnson) в случае использо-
i третСНОК
о СООН
\ I
—v т;=с—сн2соон
R'/
R, R'=Alk, Аг, Н
*NaH, mpem-C4H9OK и др.; **NaOH
В реакцию вступают также кетонитрилы, а,Р-непредельные кетоны, кето-
эфиры, бензил; вместо сукцинатов можно использовать
СН2СОСбН5
С6Н5СНО+ |
С Н 2СООС 2 Hg
СбН6СН=С-СОСбН5
С6Н6СОСН3 +
СН2СООС2Н6
СН2РО(ОС2Н6J
сйн,
СН2СООН
(-90%)
^С=С—СООС2Н5
' СН2РО(ОН)ОС2Н6
Проведение реакции при низкой температуре и избытке кетона позволяет
получать диалкилиденянтарные (фульгеновые) кислоты.
Побочные процессы: конденсация Кляйзена (см. № 301), альдольная кон-
конденсация, реакция Канницаро (см. № 284) и восстановление кетонов в кар-
карбинолы.
Реакция широко применяется для синтеза лактонов, инданонов, тетралонов
и полициклических ароматических соединений, родственных стероидам.
См. также Кнёвенагель (№ 305).
Stobbe Н., Вег., 1893, Bd. 26, S. 2312; Ann., 1894, Bd. 282, S. 280.
Martin D. J., Gordon M., Griffin С. Е., «Tetrahedron», 1967, v. 23, p. 1831.
Adel-Wahab S. M., El-Assal L. S., J. Chem. Soc, Ser. C, 1968, Bd. 7, p. 867.
Danion D., Carrie R., «Tetrahedron Letters», 1971, p. 3219.
Martelli J., Danion D., Carrie R., «Tehrahedron», 1974, v. 30, № 17, p. 3063.
Houben-Weyl, Bd. 8, S. 445, 589; OP, т. 6, с. 7.
728. ШТОЛЛЕ (STOLLE)
Циклизация аиилидов а-галогеикарбоновых кислот в присутствии хлористо-
хлористого алюминия с образованием оксиндолов:
¦А_
С=О
нагревание
[А1СЫ; (ииерти. растворитель)
NR'
R = H, Cl, Br, Alk; R'= Н, Alk; X = C1, Br
В реакцию вступают также анилид трихлоруксусиой кислоты и соответствую-
соответствующие производные иафтиламииа.
493
Аналогично циклизуются в изатииы N-замещенные аиилиды, полученные на
основе оксалилхлорида:
О
=0
R = H, Cl, Br, Alk; R'=Alk, Ar
Исходные анилиды получают взаимодействием ароматических амииов с со-
соответствующими хлорангидридами кислот.
См. также Байер (№ 33), Бруинер (№ 115), Хинсберг (№ 664), Хунсдик-
кер (№ 677), Хьюэтт (№ 678).
Stolle R., Ber., 1913, Bd. 46, S. 3915; 1914, Bd. 47, S. 2120.
Baumgarten H. E., Furnas I. L, J. Org. Chem., 1961, v. 26, p. 1536.
Жингиету Г. И. Оксиндол и его производные. Кишинев. «Штиинца»,
1973, с. 45.
Эльдерфильд, т. 3, с. 105, 156.
729. ШТРАУС (STRAUS)
Димеризация монозамещенных ацетиленов с образованием винилацетилеиов
под действием однохлористой меди и кислорода воздуха:
2RCs=CH
Cu3Cl2; Ог
нагревание
2RC=CCu
RCseeC— CH=CHR
D0-75%)
(CH3COOH)
R = CeH6, CH=CHCeH6, (CH2KCOOCH3, COOCH3 и др.
Образуется смесь цис- и гранс-изомеров. В некоторых случаях реакция про-
проходит и в отсутствие кислорода.
Димеризация монозамещенных ацетиленов с образованием продуктов иного
строения идет лишь в присутствии специфического катализатора:
2RCseeCH
30 °С
= Alk
RC=C—C=CH2
R
См. также Глазер (№ 201).
Straus F., Ann., 1905, Bd. 342, S. 201.
Akhtar M., Weedon В. С L, Proc. Chem. Soc, 1958, p. 303.
Hagihasa N., Tamusa M., Yamazaki H., Bull. Chem. Soc. Japan, 1961, v. 34,
p. 892.
Элингтон Г., Макрае В., Усп. орг. химии, 1966, т. 4, с. 254.
730. ШТРЕККЕР (STRECKER)
Превращение а-амннокислот под действием окислителей в альдегиды или ке-
тоны, содержащие иа один атом углерода меньше, чем исходная кислота (окис-
(окислительное дезаминирование):
R
\
окислитель; нагревание
Ш2 О
* Водный глицерин, водный пиридин
494
В качестве окислителей используют как неорганические (О3> Н2О2, Ag2O,
персульфаты и др.), так и органические соединения (аллоксан, кетоны, надкис-
лоты, N-бромсукцииимид, ниигидрин, изатин и др.).
См. также Хербст — Энгель (№ 654), Бичем (№ 79).
Strecker A., Ann., 1862, Bd. 123, S. 363.
Schonberg A., Moubasher R., Chem. Rev., 1951, v. 50, p. 261.
Akerfeldt S., Arch. Chem., 1954, v. 7, p. 75.
Al-Sayyab A. F., Atto А. Т., Sarah F. Y., J. Chem. Soc, 1971, Ser. C, p. 3260.
731. ШТРЕККЕР (STRECKER)
Получение а-аминокислот из альдегидов или кетоиов действием аммиака и
синильной кислоты с последующим гидролизом образовавшихся а-амиионитрилов:
\ NH3 \ HCN \ Н+
;с=° — >-он *& /г™ -^
NH2 NH? ' NH2
(ДО 75%)
/I
соон
В реакцию вступают алифатические, алициклические и ароматические аль-
альдегиды и кетоны. При использовании вместо NH3 аминов получают N-замещеи-
ные а-аминокислоты, а в случае алкилендиаминов—алкилидендиаминтетраук-
сусные кислоты:
4СН2О + NH2(CH2)nNH2 + 4HCN > (HOOCCH2JN(CH2)raN(CH2COOHJ
Реакция широко используется для лабораторного и промышленного синтеза
а-аминокислот.
Модификация Тимана (Tiemann) — изменение порядка прибавления реаген-
реагентов приводит к улучшению выходов:
HCN NH3
RCHO >- RCH—CN >¦ RCH-CN >¦ RCH-COOH
Af
NH2
NHo
См. также Зелинский — Стадииков (№ 264).
Strecker A., Ann., 1850, Bd. 75, S. 27; 1854, Bd. 91, S. 349.
Tiemann F., Ber., 1880, Bd. 13, S. 381.
Mowry D. Т., Chem. Rev., 1948, v. 42, p. 236.
Geipel H. e. a., Chem. Ber., 1965, Bd. 98, S. 1677.
Maki Yoshifumi, Masugi Takashi, Ozeki Koji, Chem. Pharm. Bull., 1973, v. 21,
№ 11, p. 2566.
СОП, т. 3, с 63.
732. ШТРЕККЕР (STRECKER)
Получение солей алифатических сульфокислот алкилированием сульфитов
алкилгалогенидами:
M2SO3
RX Тад RS0*0M
Х=С1, Вг,
= K, Na, NH4
495
Выходы сульфокислот составляют 70—90% прн использовании первичных ал-
килгалогеиидов и 20—25%—для вторичных. Третичные алкилгалогеииды пре-
превращаются в олефины. В реакцию вступают также галогеизамещеииые кислоты,
спирты, кетоны и ароматические соединения, содержащие подвижный галоген.
См. также Кольбе (№ 312), Мейер (№ 390).
Strecker A., Ann., 1868, Bd. 148, S. 90.
Reed R. M., Tartar H. V., J. Am. Chem. Soc, 1935, v. 57, p. 570; 1936, v. 58,
p. 322.
Stewart J. M., Cardts H. P., i. Am. Chem. Soc, 1952, v. 74, p. 5884.
Джильберт Э. Е. Сульфирование органических соединений. Пер. с англ. Под
ред. А. И. Гершеновича. М., «Химия», 1969, с. 129, 135, 136.
733. ЭДМАН (EDMAN)
Действие фенилизотиоциаиата иа пептиды с образованием производиого тио-
мочевины и его последующая циклизация при действии хлористого водорода в
нитрометаие с отщеплением N-концевой аминокислоты в виде фенилтиогидаи-
тонна:
RCH—CONHCHCO + QH,N=C=S
NH2
R'
RCH—CONHCHCO—•
HN NHC6H6
С
на R—HC-
-40 °C
(водн. диоксан);
L(C2H5KN]*
-CO
R'
HN NCeH5
+ H2NCHCO—•
*C6H6N, H2O
Фенилтиогидаитоины сравнительно устойчивы в кислой среде; оии могут
быть выделены и идентифицированы. В некоторых случаях фенилтиогидантоины
обрабатывают Ва(ОНJ и идентифицируют образовавшуюся аминокислоту.
Таким образом можно осуществить многократную последовательную обра-
обработку пептида; в большинстве случаев удается определить последовательно до
13 (а иногда и более) остатков с N-конца.
Метод непрерывно совершенствуется. Удобными способами идентификации
феиилтногидантоинов являются хроматографические методы, масс-спектрометрия.
См. также Бергман (№ 61), Сэиджер (№ 557).
Edman P., Acta chem. scand., 1950, v. 4, p. 283.
Томпсон Е. О., Усп. орг. химии, 1963, т. 1, с. 237.
Birr С. е. a., Ann., 1970, Bd. 736, S. 88.
Waterfield M., Haber E., «Biochemistry», 1970, v. 9, p. 832.
Физер Л., Физер М. Органическая химия. Пер. с англ. Под ред. Н. С. Вульф-
сона. М., «Химия», 1969, с. 8.
Лапин. Я. И., «Химия природных соединений», 1974, т. 10, № 1, с. 121.
496
734. ЭЙКМАН (EIJKMAN)
Присоединение ароматических углеводородов по С = С-связи непредельных
кислот или кетонов в присутствии хлористого алюминия:
\ I Г I I -!<Ц-+Б'С | | | | I
АгН+ ЧС=С- С -С— > Аг-С—С- С -С-
/ [\\n\\ [А1С1з! I I Ш» И
О НО
Ar = C6H4R, где R = H, Cl, F, ОСН3> СООН, ОС6Н4> С6Н6
Присоединение обычно происходит в соответствии с правилом Марковнико-
ва. Наличие электронодонорных заместителей в бензольном кольце облегчает ре-
реакцию. Эфиры непредельных кислот реагируют легче, чем сами кислоты; выходы
и легкость присоединения возрастают по мере удаления двойной связи от карб-
карбоксильной группы. а,р-Непредельные карбонильные соединения реагируют с тру-
трудом. Алифатические а,E-непредельные кислоты обычно претерпевают предвари-
предварительную изомеризацию.
С производными антрацена могут образоваться аномальные продукты при-
присоединения:
+ сно=снсоон
сн2
сн—соон
Реакция олеиновой кислоты с нафталином применяется для получения реак-
реактива Туитчелла (см. № 577), а олеиновой и линолевой кислот с каучуком в
инертном растворителе — для получения пластических материалов.
См. также Бальзон (№ 38), Меервейн (№ 388), Михаэль (№ 406).
Eijkman J. F., Chem. Weekbl., 1908, v. 5, p. 655.
Smith L. I., Chien-Pen Lo, J. Am. Chem. Soc, 1948, v. 70, p. 2215.
Томас Ч. Безводный хлористый алюминий в органической химии. Пер. С
англ. М., Издатинлит, 1949, с. 470.
735. ЭЛЬБС (ELBS)
Окисление едноатомных фенолов в двухатомные действием персульфата ка-
калия в щелочной среде:
R = H, Alk, OAlk, ОН, СНО, СООН, Hal, NO2 и др.
32—684
497
Аналогично окисляются кумарины, флавоны, оксипроизводные конденсиро-
конденсированных ароматических и азотсодержащих гетероциклических соединений. Элек-
тронодонорные заместители способствуют реакции. Если пара-положение занято,
то образуются орго-производные, но с очень низкими выходами.
Окисление двухатомных фенолов сопровождается расщеплением аромати-
ароматического ядра, для предотвращения чего предварительно метилируют одну из
оксигрупп.
См. также Бойлэнд—Симе (№ 96), Бон — Шмидт (№ 98), Дейкин (№ 237).
Elbs К., J. prakt. Chem., 1893, Bd. 48, S 179.
Sethna S. M., Chem. Rev., 1951, v. 49, p. 91.
Boyland E. e. a., J. Chem. Soc, 1953, p. 3623; 1958, p. 4198.
Dernier O. C, Ednison M. Т., Chem. Rev., 1957, v. 57, p. 103.
Behrman E. I., J. Am. Chem. Soc, 1963, v. 85, p. 3478.
Lee J. В., Uff В. С, Quart. Rev., 1967, v. 21, p. 453.
Bader #., Jahngen E. G., пат. США 3652597 A972); С. А., 1972, v. 77,
p. 5175k.
736. ЭЛЬБС (ELBS)
Пиролитнческая циклизация диарнлкетонов, содержащих в орго-положенин
к карбонилу метиленовую пли метильную группы, с образованием конденсирован-
конденсированных ароматических систем:
СО
, 1 400—500 °С
])Я'
R, R' =H, Cl, Alk, C6H5; R" = Alk
В реакции часто используют полиалкилзамещенные бензофеноны н полицик-
лнческие диарилкетоны. При синтезе 1,2-бензантрацена или его производных
выход продукта в заметной степени определяется положением метальной
группы:
Реакцию можно использовать для синтеза конденсированных гетероцикличе-
гетероциклических систем:
н,с ¦'
Побочные процессы:, отщепление R и R', гидрогенизация, дегидрогенизация,
молекулярные перегруппировки.
498
См. также Брэдшср (№ 116).
Elbs К-, Вег., 1884, Bd. 17, S. 2847; J. prakt. Chem., 1886, Bd. 33, S. 180; 1887r
Bd. 35. S. 465; 1890, Bd. 41, S. 1, 121.
Vingiello F. A. e. a., J. Am. Chem. Soc, 1958, v. 80, p. 1714.
Bergmann E. D., Blum J., J. org. Chem., 1960, v. 25, p. 474; 1961, v. 26, p. 3214.
Фыозон, с. 450; OP, т. 1, с. 163.
737. ЭЛЬТЕКОВ
Получение альдегидов или кетонов нагреванием а,|3-днбромалканов с водой
в присутствии окиси свинца*:
\ Н2О;
\:_ен—
-150-С \
^_ V
Вг Вг НО Вг
>¦ \—СН—
/I I
НО ОН ' О
*ZnO, ZnCl2, PbCI2 при 200 °С
Аналогично реагируют дихлоралканы и а-галогенгидрины. Перегруппировка
происходит только в кислой среде. В нейтральной среде образуются а-гликоли
и соответствующие u-окиси. Гидролиз дибромидов, содержащих бром у третич-
третичного атома углерода, можно проводить в более мягких условиях (в отсутствие
РЬО и при температурах около 70 °С).
Побочные реакции: дебромирование и полимеризация с образованием со-
сопряженных диенов и алленов, изомеризация образующихся альдегидов в кетоны
(см. Данилов, № 227).
Реакция является удобным методом получения низших альдегидов и кето-
кетонов (до Cs) из олефинов с выходами до 60%.
Эльтеков А. П., ЖРХО, 1878, т. 10, с. 213.
Evers W. L. e. a., J. Am. Chem. Soc, 1933, v. 55, p. 1136.
Темникова Т. И. Курс теоретических основ органической химии. Изд. 3-е. Л.,
«Хи..шя». 1963, с. 668.
Hnuben-Weijl, Bd. 5/4, S. 162.
738. ЭМДЕ (EMDE)
Восстановительное расщепление четвертичных солей аммония под действием
амальгамы натрия с образованием третичных аминов:
Na Но-
[R:!N-R'] Х- -
TTTf R3N + R'H
нли Н2О)
;ьодн. Сг
* Сплав Ni—A1, К в жидком NH3
Наличие С = С-связи, сопряженной с С—N-связыо, облегчает реакцию.
¦Последнюю стадию этой реакции — превращение а-гликолей в карбониль-
и'.,е соединения — называют перегруппировкой Эльтекова.
32*
499
Продукты реакции, как правило, отличаются от продуктов, получаемых при
расщеплении по Гофману (см. № 208), например:
_(CH2KN(CH3J
Na/Hg
по Гофману
NCH3 +N(CH3J
Реакцию используют для синтеза смешанных третичных амииов:
/сн3
CfiH5CH2-N
,сня
н2сн=сн2 \сн2сн=сн2
а также при установлении строения аминов и алкалоидов.
Em.de Н., Вег., 1909, Bd. 42, S. 2590; Ann., 1912, Bd. 391, S. 88.
Sugasawa С, Ushioda S., «Tetrahedron», 1959, v. 5, p. 48.
hie #., Tsuda Y., Uyeo S., J. Chem. Soc, 1959, p. 1446.
Simanek V'., Klasek A., Santary F., «Tetrahedron Letters», 1973, № 20, p. 1779.
Slocum D. W., Marchal R. D., Jonews W. E., J. Organometal. Chem., 1974,
v. 72, № 2, p. 227.
OP, т. 7, с 183, 340.
739. ЭММЕРТ (EMMERT)
Получение а-пиридилкарбинолов конденсацией пиридина с альдегидами или
кетоиами в присутствии магния и сулемы*:
О
II Mg*; HgCl2
I + r_C-R' »¦
N
N
*А1
I
R'
Процесс идет через стадию образования ион-радикалов. При реакции обра-
образуется также небольшое количество \'-изомера. В реакцию вступают ароматиче-
ароматические и алифатические карбонильные соединения, а также алициклические кетоны
и камфора. Дикетоны и кетоэфиры в этих условиях не реагируют. Вместо кар-
карбонильных соединений могут быть использованы их азотистые аналоги, напри-
например азины. Подобно пиридину реагирует хинолин, например:
Дегидратацией а-пиридилкарбинолов действием H2SO4 в мягких условиях
с последующим каталитическим гидрированием (над PtO2) получают соответст-
соответствующие а-алкилпиридины.
См. также Хзммик (№ 679).
Emmert В., Вег., 1939, Bd. 72, S. 1188.
Lochte H. L, Kruse P. F., Wheeler E. N.. J. Am. Chem. Soc, 1953, v. 75,
p. 4477.
Bachman G. B. e. a., J. Org. Chem., 1957, v. 22, p. 1296.
Bachman G., Kariekoff M., J. Org. Chem., 1959, v. 24, p. 1696.
¦Называют также реакцией Эммерта — Азендорфа (Asendorf).
508
Vinutha Attupakau R., J. Chem. Soc, 1969, Ser. C, p. 2104
Отрощенко О. С, Зияев А. А., Толкачева Г. А. В сб.: «Химия растительных
веществ». Ташкент, Ташкентский ГУ, 1972, с. 120.
740. ЭРЛЕНМЕЙЕР-ПЛЁХЛЬ (ERLENMEYER-PLOCHL)
Получение 4-алкилиденоксазолонов-5 (азлактонов) конденсацией альдегидов
с N-ацилглицинамн под действием уксусного ангидрида:
RCHO
ГН
<снзСОJО;
нагревание
NH-COR' [CH.COONa]*
RCHO
О
-• 1\
N
D0-95%)
R = Alk, Ar; R' =Alk, C6H5 (обычно), СН2С6Н5, С6Н2(ОНK и др.
*Pb(OCOCH3L в тетрагидрофуране (при R = Alk), HCON(CH3J.SO3
(при R=Ar); Cu(OCOCH3J (при R = гетероциклический остаток),
(C2HjKN, K2CO3 или КНСО3 при ~20 °C, H2SO4
В реакцию вступают также гетероциклические и <х,|3-непредельные алифати-
алифатические альдегиды, ацетали, ацетон и циклогексанои, ангидриды кислот, орто-
эфиры и N-замещенные формамиды, например:
(RCOJO-f
снхоон
NHCOC Н ff" или У-Пиколины]
RC=
I
ОН
о
—С6Н5
N
Оч\
R'C(ORK+
СН2СООН
NHCOCeH5
OR N
О:
сн2—соон
C6H5NHCH=NC6H5 + I
NH-COR
.0
N
Побочный процесс: переацилирование N-ацилглицинов с образованием смеси
продуктов, например:
Р
6Н4С
/Р СН2-СООН (СН3СОJО
н
NH—СОС6НБ
о
X
о
FCeH4CH=
N
N
501
Реакция является частным случаем реакции Перкина (№ 446), но проте-
протекает в гораздо более мягких условиях.
Азлактоны используют для синтеза а-аминокислот*, пептидов (см. Бергман,
№ 59), а-кетокислот, а также карбоновых кислот, содержащих на один атом
углерода больше, чем исходный альдегид:
RCH2—СН—СООН
I *
NHCOR'
О
RCH=
О
N
-> RCH2—СН—СООН
NH2
_?_». RCH=C-COOH >¦ RCH2-C-COOH + R'CONH2
NHCOR' О
RCH2— СООН
См. также Бергман (№ 60), Дейкнн — Уэст (№ 238), Гренахер (№ 218),
Эрленмейер—Фрюштюк (№ 741).
Plochl ]., Вег., 1883, Bd. 16, S. 2815; 1884, Bd. 17, S. 1616.
Erlenmeyer E. e. a., Ann., 1893, Bd. 275, S. 1.
OP, т. 3, с 195; РИМИОС, т. 9, с. 163.
741. ЭРЛЕНМЕЙЕР —ФРЮШТЮК
(ERLENMEYER— FROSTOCK)
Получение |3-арилсеринов альдольной конденсацией замещенных бензальде-
гидов с замещенными N-бензнлиденглицинами н последующим гидролизом:
¦ CH2—COO- —
N=CHAr
нагревание
П \"
OH N=CHAr
> Ar—СН—СН—СООН
I I
OH NH2
F0-70%)
r = CeH3, CeH4Alk, CeH4OH, CeH4NO2
H2O; H+
(C8Ho)
При Аг = С6Н4ОН и CeH4NO2 конденсация проходит успешно лишь под дей-
действием окислов щелочноземельных металлов или КОН в спирте. При получении
оксипроизводных используют бензнльную защиту, которую снимают затем ка-
каталитическим гидрированием (H2/Pd).
* Называют также синтезом а-аминокислот по Эрленмейеру.
502
См. также Акабори (№ 10), Эрленмейер — Плёхль (№ 740).
Erlenmeyer E., Frustuck E., Ann., 1895, Bd. 284, S. 36.
Ehrhart'G., Hennig /., Chem. Ber., 1954, Bd. 87, S. 892.
Houben-Weyl, Bd. 11/2, S. 427.
742. ЭРЛИХ —ЗАКС (EHRLICH — SACHS)
Конденсация ароматических нитрозосоединений с веществами, содержащими
активированную метиленовую группу, в присутствии щелочи с образованием ос-
оснований Шиффа:
ArNO
4CH,
Na.CCy
R''
(еодн. С2Н5ОН)*»
R''
;CH-NAr
OH
4,C=NAr
R"
R = COCH3, COOC2H5, Ar; R' = CN, CONH2, COOC2H5
*NaOH, C2H5ONa, K2CO3; **CH3OH (абс.)
В некоторых случаях образукмся окиси нминов RR'C = N(~>O)Ar, вероят-
вероятно, вследствие окисления промежуточного производного гндрокснламнна исход-
исходным ArNO.
См. также Шифф (№ 709).
Ehrlich P., Sachs F., Ber., 1899, Bd. 32 ,S. 2341.
Anderson D. M. W., Bell F., J. Chem. Soc, 1957, p. 516; 1959, p. 3708.
Krohnke F., Steuernagel H. #., Chem. Ber., 1963, Bd. 96, S. 486.
Вейганд-Хильгетаг, с. 412.
743. ЭТАР (ETARD)
Окисление метальной группы в ароматических соединениях в альдегидную
группу под действием хлористого хромила:
СгО2С12; 10-50 °С Н2О
АгСН3 --„ >- |АгСН(ОСгС12ОНJ] >- АгСНО
(CS2)
(-70%)
Ar = CeH5, C6H4CH3, CC)hT4NO2, C6H4OCH3 и др.
*СС14, СИС13, 1,1-С12СвН4
В реакцию вступают также ArCH2Alk. Использование CrO2(OCORJ (где
R = CH3, CeH5, СС13) подавляет побочные процессы (в основном, хлорирование).
Присутствие олефинов катализирует реакцию; это позволяет окислять СНз-груп-
пу в алициклических соединениях, например:
/\ /снз
СгО»С!.>
I J [СН:)СГ12С(СН3)= CH.J I J
B5%)
Циклические олефины в условиях реакции образуют диальдегиды:
CrO2(ORJ
НССН
(СН,)„
503
См. также Деыиже (№ 243), Райли (№ 489}.
Etard А., С. г., 1877, V. 84, р. 127; Вег., 1881, Bd. 14, S. 848.
Tillotson A., Houston В., J. Am. Chem. Soc, 1951, v. 73, p. 221.
Hartford W. H., Darrin M., Chem. Rev., 1958, v. 58, p. 25.
Wieberg К. В., Eisenthal R., «Tetrahedron», 1964, v. 20, p. 1151.
Duff in H. C, Tucker R. В., «Tetrahedron», 1968, v. 24, p. 6999.
Leigh M. I., Strickson J. A., J. Chem. Soc, Perkin Trans. Pt. 2, 1973, № IS,
p. 1476.
744. ЭШВАЙЛЕР—КЛАРК (ESCHWEILER — CLARKE)
Метилирование первичных или вторичных аминов действием формальдегида
и муравьиной кислоты*!
юо °С
R2NH+CH2O +НСООН (водн нюо^ R2N-CH3
(водн
D0—80%)
R = Н, Alk
Выходы часто достигают количественных. В реакцию вступают также ами-
аминокислоты и гетероциклические амины, например:
(СН3JС—СООН + СН2О + НСООН v (СН3JС—СООН
NH,
/ ^NH + CH2O + НСООН
(83%)
(80%)
Ароматические амины метилируются лишь при наличии орто- или пара-за-
пара-заместителей, препятствующих конденсации формальдегида по углеродному атому
ароматического ядра.
См. также Баллах (№ 143), Деккер— Форстер (№ 239).
Eschweiler W., Вег., 1905, Bd. 38, S. 880.
Clarke Н. Т., Gillespie Н. В., Weisshaus S. Z., J. Am. Chem. Soc, 1933, v. 55,
p. 4571.
Nelson W. L, J. Heterocycl. Chem., 1968, v. 5, p. 231.
Pine S. H., J. Chem. Educ, 1958 v. 45, p. 118.
Tichy M., Vasickova S., Coll. Czech. Chem. Comm., 1974, v. 39, p. 555.
OR, v. 5, p. 301.
745. ЮРЬЕВ
Превращение фурана (или его N-алкил- или N-арилзамещенных) в пиррол,
тиофен или селенофен при действии соответственно аммиака (или первичных
аминов), сероводорода или селеноводорода иад окисью алюминия в газовой
фазе:
"НС-СН"
\-
H2Z; -400 "С
о
[А12Оз]
НС СН
_НО ZH.
Z = NR, S, Se
Z
* Реакция является вариантом реакции Лёйкарта (№ 361).
504
Превращение фурана протекает с выходами ~40%, тогда как взаимные
переходы остальиых гетероциклов — с низкими выходами (~2%).
Реакция осуществима также для а-алкилфураиов, шестичленных гетероцик-
гетероциклов, частично и сполна гидрированных пяти- и шесптелеииых гетероциклов с
едиим или двумя гетероатомами, например:
Превращение сполна гидрированных гетероциклов происходит в более мяг-
мягких условиях; выходы до 90%. Реакция позволяет получать труднодоступные
гетероциклические соединения.
См. также Клаусон — Каас (№ 294), Байер (№ 31), Пааль— Кнорр (№ 439).
Юрьев Ю. К., ЖОХ, 1936, т. 6, с. 972, 1669.
Юрьев Ю. К. и др., ЖОХ, 1950, т. 20, с. 171, 1493; 1952, т. 22, с. 513.
Юрьев Ю. К- Ученые записки МГУ. М., Изд. МГУ, 1945, вып. 79, 183 с.
Эльдерфильд, т. 1, с. 130, 164.
746. ЯКОБСЕН (JACOBSEN)
Миграция алкильной группы или галогена в полиалк^лбензолсульфокислотах,
полиалкилгалогенбензолах или полигалогеибензслах под действием серной
кислоты:
R'
R'
W у ^R
R
R = Alk, Cl, Br, I; R' = SO3H, Cl, Br, I
В реакцию вступают лишь тетра- и пентазамещенные бензолы:
SOjH SO3H
н3с
С1
сн3
50%)
Cl
I
A2%)
505
В условиях реакции возможно внутримолекулярное переалкнлирование:
Основной побочный процесс — диспропорционирование, например образова-
образование дигалогенбензолов из моногалогенпроизводных.
См. также Бэддли (№ 131), Хенкель (№ 653).
Jacobsen О., Вег., 1886, Bd. 19, S. 1209; 1887, Bd. 20, S. 901.
Suzuki H., Sugiyama Т., Gotlo R., Bull. Chem. Soc. Japan 1964 v 37 p 1858
Marvell E. N., Graybill В. М., J. Org. Chem., 1965, v. 30 p. 4014
Suzuki H., Bull. Chem. Soc. Japan, 1969, v. 42, p. 2618
OP, т. 1, с 492.
747. ЯКОБСОН (JAKOBSON)
Получение иидазолов из о-толуидина через стадии N-ацилирования, ннтро-
зировання и циклизации при нагревании в бензоле:
R = H, CH3, Cl; R' = CH3, CeH5
В реакцию вступают также нафтиламины и №нитрозодигидрохинолон-2:
'(СН2J— С=0~
Н3С
N
N0
сн,
N=N—О
NH
F5%)
В случае производных и-фенилендиамина происходит образование двух пи-
разольных колец:
NH
СН8
N
\
N
NH
506
Jacobson P., Huber L, Вег., 1908, Bd. 41, S. 660.
Huisgen R., Nakaten H., Ann., 1954, Bd. 586, S. 84.
Gordon D., Fryl L., Sheffer H., Acta chem. Scand., 1969, v. 23, p. 3577.
Эльдерфильд, т. 5, с. 142.
748. ЯКОБСОН (JACOBSON)
Получение бензтиазолов циклизацией замещенных тиоанилндов под дейст-
действием щелочного раствора феррнцианида калия:
S
S j^Y
R
K3Fe(CNN
h_CR' <Е0ДН- P-Р NaOH)
N
B5-75%)
R = H, OCH3, NO2; R' = Alk, CeH5, OAlk, COOH, COOC2H5
Аналогично, и часто с лучшими выходами, реагируют 2-тноацнламннонаф-
талины, не имеющие заместителей в а-положеини. При R'=H илн NH2 циклиза-
циклизация не идет.
См. также Хугерсхофф (№ 675), Штолль (№ 716).
Jacobson P., Вег., 1886, Bd. 19, S. 1067, 1811.
Эльдерфильд, т. 5, с. 412.
749. ЯКОБСОН —БЕРНТСЕН (JACOBSON — BERNTHSEN)
Получение 1,2,3-бензтиадиазолов из о-амииотиофеиолов или нх эфнров в ус-
условиях диазотирования:
N
мн
f^V' НШг; НС1: ~5°с
>
R = H, CH8, Cl, N02, COOH, COOCH3; R' = Н, СН2С„Н5
В реакцию вступают также соответствующие производные нафталина и дру-
другие ароматические и гетероароматические соединения, содержащие в орго-поло-
женни NH2- и SR'-группы, например:
.NH, H2N.
N
SSO3H
N S
(~колнч.)
507
Jacobson P., Ber., 1888, Bd. 21, S. 3104.
Bernthsen A., Ann., 1889, Bd. 251, S. 1.
Hodgson H. H., Dodgson D. P., J. Soc. Dyers a. Golourists,
Эльдерфильд, т. 7, с. 420.
, v. 64, p. 65.
750. ЯНГ —ДЖОНСОН (JANG — JOHNSON T. В.)
Получение замещенных 1,2,4-оксадназолов из бензонлнмидо-О.Б-диалкилтио-
карбонатов действием гидроксиламнна с последующей циклизацией продукта
замещения:
OR
q.H.-C-N=C-OR
О SR'
NH2OH
C,,H5-C-N=C-OR! > CeH6-^ )XN
О NHOH J О
R, R' = CH3, C2HE
Исходные вещества получают алкилированием соответствующих алкил-N-
бензоилтиокарбаматов.
Метод можно использовать для получения E-окси-1,2,4-оксадиазолил-3)-
уретана:
С2Н5ООС—NH—C=NCOOC2H5
SCH,
N /
О
Yang S. Т., Johnson Т. В., J. Am. Chem. Soc, 1932, v 54, p. 2066.
Murray Y., J. Am. Chem. Soc, 1934, v. 56, p. 144.
Эльдерфильд, т. 7, с. 382, 390.
751. ЯНГ —ЭЙР (JOUNG — EYRE)
Циклизация тиосемнкарбазонов альдегидов в 1,3,4-тиадиазолы при действии
хлорного железа:
N-N
^-NHR'
S
R-C=N-NH-C—NHR' •
I I!
R" S
FeCl3»; 70 °С
(Н2О)
R = СН3, СеН5; R' = Н, СН3, SO2CeH4NO2-n; R" = Н, СН2ОН, СН(ОН)С6Н5, СООН
*Ca3[Fe(CN)e]2
В реакцию вступают также тиосемнкарбазоны Сахаров. Аналогично циклн-
зуются N-алкилидентиобензгидразиды, образуя 1,3,4-тнадиазолы:
N-N
R—<
RCH=N-NH-C-CeH5
I! Х/
S S
R = СН3, СН2ОН, полиоксналкнл
508
Joung G., Eyre W., J. Chem. Soc, 1901, r. 79, p. 54.
Holmberg В., Ark. Kemi, 1955, т. 9, p. 65.
Эльдерфильд, т. 6, с. 454.
752. ЯПП (JAPP)
Циклоконденсация бензоина с нитрилами под действием концентрированной
серной кислоты с ебраэованием оксазолов:
СеНц—СНОН конц. H2SO4; ехлаждение
• | ^
сен5-с=о
он
сен5—сон RCN сен5—с
сен5-сон *" сен5-с
NH
II
.C-R
о
О
R = Н, СН3, С2Н5, СеНв
Лучший выход C0%) получен при R = H. Использование формамида вме-
вместо нитрила позволяет получать оксазолы и из алифатических а-окснкетонов:
R'CHOH конц. H2SO4; 100—150 °С
| + HCONH2 *- R—< /
RC=O X^/
C0-70%)
R = Alk, CeHs
См. также Дейвидсон (№ 236), Риттер (№ 512).
Japp F. R., Murray Т. S., J. Chem. Soc. 1893, v. 63, p. 469.
Bredereck H., Gompper R., Chem. Ber., 1954, Bd. 87, S. 726.
Эльдерфильд, т. 5, с. 251.
753. ЯПП —КЛИНГЕМАН (JAPP — KLINGEMANN)
Получение арилгидразонов а-дикарбонильных соединений взаимодействием
|3-дикар6онильных соединений с солями диазония в щелочном растворе:
—С—СН—С— + Ar—N=N Х- ;
~о°с
II I У
О R О
[(водн. р-р NaOH)
»¦ —С—C=NNHAr
II I
О R
= Alk, NO2, CI
N=NAr
I
— С—С—С—
II I II
О R О
509
В случае Р-кетокислот реакция протекает следующим образом:
—С—С
-CeH-,N2Cl > —С—C=NNHCeH3
I! I ' II I
O. R OR
Взаимодействие циклических |3-кетоэфиров с солями диазония сопровож-
сопровождается размыканием цикла:
./О
/СООС2Н5
¦— СООС2Н6 + ArN.Cl > ArNH— N=C
(СН2)8СООН
При реакции с а-алкилацетоуксусными эфирами получаются гидразоны, вос-
восстановление и последующий гидролиз которых приводит к а-аминокислотам.
Продукты реакции успешно используются в синтезе индолов по Фишеру
(см. № 611).
Japp F. R., Klingemann F., Ber., 1887, Bd. 20, S. 2942, 3284, 3398; Ann., 1888,
Bd. 247, S. 190.
Regitz M., Eisterl В., Chem. Ber., 1963, Bd. 96, S. 3120.
Chakraborty D. P., Chowdhury В. К-, J. Org. Chem., 1968. v. 33, p. 1265.
Неплюев В. М. и др., Ж. орг. химии, 1970, т. 6, с. 801; 1974, т. 10 № 10,
с. 2172.
Китаев Ю. П., Бузыкин Б. И. Гидразоны. М., «Наука», 1974. с. 24.
Эльдерфильд, т. 7, с. 396; ОР, т. 10, с. 148.
754. ЯПП- МЕРРЕЙ (JAPP — MURRAY)
Образование замещенных индолов межмолекуляриой конденсацией арома-
ароматических аминов с бензоином в присутствии кислых катализаторов:
R'
I
NH,
НО—СНС6НГ) нагревание
о=сс,н,
R' сйн5
R' Ох
хссвн5
.снс6н5
I
R
С„НВ
NH
NH
R = Н, Cl, COOH; R' = Н, СН3
*НС1 (конц.)
Аналогично реагируют амины ряда нафталина. о-Хлоранилии не вступает
в реакцию.
Реакция не имеет препаративного значения, так как выходы иидолов незна-
незначительны. Метод используется для синтеза 2,3-диарилиидолов. Применение
а-оксикетоиов алифатического нли алициклического рядов дает низкие выходы
соответствующих индолов.
510
См. также Бишлер — Мёлау (№ 82), Файст (№ 596).
Japp F. R., Murray Т. S., J. Chem. Soc, 1894, v. 65, p. 889.
Goldham M. W. G., Lewis J. W., Plant S. G. P., J. Chem. Soc, 1954, p. 4528.
Барони Е. Е., Ковырзина К- А., ЖОХ, т. 29, с. 3815.
755. ЯУРДАН — УЛЬМАН — ГОЛЬДБЕРГ
(JOURDAN — ULLMANN — GOLDBERG)
Получение акридонов внутримолекулярной циклизацией о-дифеииламииокар-
боновых кислот под действием серной кислоты*:
NH NH
H2SO4; 100 °С
R' *- R
C0-90%)
R = H, CH8, NO2; R'=CH8, OCH3, NOa, Cl, Br,F
Побочная реакция — сульфирование.
о-Днфеииламииокарбоновые кислоты получают взаимодействием антраиило-
вых кислот с галогенбеизолами:
•NH2
+
COOH X
R'
К2СО3
[Си]; (C5HUOH)
О
F0%—колн ч.)
Х = С1, Br, I
См. также Лемштедт — Тэнэсеску (№ 354), Хейуорт (№ 646), Хойман
i№ 669).
Jourdan F., Ber., 1885, Bd. 18, S. 1444.
Goldberg I., Ullmann F., нем. пат. 173523 A906); Chem. Zbl., 1906, Bd. 11,
S. 931.
Acheson R. M., Acridines. New York — London, Internscience publ., 1956,
p. 110.
СОП, т. 2, с 18.
* Называют также реакцией Яурдана.
ИМЕННОЙ УКАЗАТЕЛЬ
Цифры соответствуют порядковому номеру реакций
Абрамов 1
Адаме 2, 193
Адкинс 3
Азендорф 739
Азингер 4
Айнхорн (Эйнхорн) 5, 6,
7
Айслеб (Эйслеб) 8
Айстерт 25
Акабори 9, 10
Аккерман 600
Алгар 11
Аллан 327
Аллен 12
Альдер 254
Амадори 13
Ананченко 574
Анджелн 14, 261
Андо 15
Андрусов 16
Анрн (Генри) 17, 18
Аншюц 19, 20
Аппель 21
Арбузов 22, 23
Арене 24, 159
Арндт 25
Атертон 26
Ауверс 27, 28
Ауэ 173
Ах 613
Ахмад 29
Бабад 251
Бабаян 595
Базаров 158
Байер 30, 31, 32, 33, 34,
35, 36, 37, 698
Баллио 74
Бальзон 38
Бальц 708
Бамбергер 39, 40, 41, 42,
719
Барбье 43, 219
Барджеллини 44
Барджер 45
Бардхан 46
Барт 47
Бартон 48
Баудиш 49
Бауман 50, 719
Баумгартен 51
Бауэр 637
Бахман 205, 206
Беаль 52
Бедукян 53
Бейер 188, 246
Бенкер 54, 55
Бейли 56
Бекеланд 57
Беккер 239, 404
Беклунд 494
Бекман 58
Белло 635
Бен 627
Бенари 597
Бен дер 642
Бенкезер 75
Бергман 59, 60, 61, 62,
63, 363, 713
Берге 130
Беренд 64
Беркут 10!
Бернтсен 65, 749
Берти 66
Бертло 67
Бертрам 68
Бертран 69
Бетти 70
Бешан 71, 72
Бёзекен 73, 74
Бёрч 75
Бёснек 76
Бётерс 177
Биджннелли 77
Бил 25
Биркенбах 78
Бирнбаум 541
Бичем 79
Бишлер 80, 81, 82, 83
Блан 84, 85, 119
Бломквист 86
Блэз 87, 88, 89, 90
Боббитт 91
Боджерт 92, 93
Бодру 94, 95
Бойлэнд 96
Болл 97
Бон 98
Боннер 99
Бородин 100
Борше 101, 102, 103,
104, 481, 628
Боссель 418
Ботт 105
Боултон 106
Боумен 107
Браз 705
Браун 108, 109, ПО, 111,
112, 269, 523
Бредерек 289
Брекпот 113
Брукнер 114
Бруннер 7, 115
Брэдшер 116
Брэкмен 261
Буво 117, 118, 119, 120,
121
Буго 122
Бурд 123
Буржель 359
Бутлеров 124, 125, 126,
127
Буттенберг 632
Бухерер 128, 121,
130
Быу-Хой 175
Бэддли 131
Бэлли 132
Бэмфорд 133
Бэрри 134
Бюхи 442
Бюхнер 135, 136
512
Вавзонек 554
Вагнер 137, 138, 139,
140
Вагнер-Яурегг 141
Вайденхаген (Вейденха-
ген) 142, 235
Вакер см. Уэйкер
Баллах 143, 144, 145,
146
Вальбаум 68
Вальтер 481
Ван Дорп 24
Ванклин 718
Ван Слайк 147
Ван Экенштайн 368
Варрентрапп 148
Вартон см. Уартон
Веерман 149, 150
Вейганд 172
Вейденхаген см. Вайден-
Вайденхаген
Вельде 151
Венкатараман 54
Венкер см. Уэнкер
Венус-Данилова 227
Верлей 389
Вернер 58, 152
Вессели 153, 154
Вест 238
Вестерберг 155
Вестфален 156
Веттштайн 157, 407
Вёлер 158
Вибо 159
Видеквист 160
Видман 161
Виланд 43, 162, 163, 164
Виллигер 35
Вильгеродт 165
Вильсмайер 166, 627
Вильямсон см. Уильям-
сон
Винтер 322, 564
Вннтерштайн 342
Вислиценус 301
Витт 183, 220
Виттиг 167, 168, 169,
170, 183, 67!
Вихелль 632
Вихтерле 171
Воль 172, 173, 174, 175,
199
Вольф 176, 265, 29!
Вольфенштайн 177, 330
Вреде 178
Вудвард 179
Вышнеградский 180
Вюйтс 181
Вюрц 182, 183
Габриель 184, 185, 186,
446, 517
Галат см. Гейлет
Галлахер 187
Гаме 454
Ганч 188, 189, 190, 393
Гарднер 291
Гастальди 191
Гаттерман 192, 193, 194,
195, 196
Гейлет 197
Гелль см. Хелль
Генри см. Анри
Гербе 198
Герен 90
Гёш см. Хеш
Гнбс 199
Гилмен 170, 200
Гинсберг см. Хннсберг
Глазер 201
Гогт 202
Годемар 507
Гойтер 301
Гольдберг 584, 755
Гольдшмндт 203
Гомберг 204, 205, 206
Гоулд 207
Гофман 208, 209, 210,
211, 212, 213, 214,
286, 339
Гракаускас 215
Граф 512
Гребе 216
Греве (Грю) 217
Гренахер 218
Гриньяр 182, 219, 591
Грисс 220
Гришкевнч 221
Гровенштайн 222
Гросс 282
Грошейнц 492
Грундман 223
Грю см. Греве
Гуарески (Гуареши) 224
Гуареши см. Гуарески
Губен 182, 225, 658
Губо 78
Гугершофф см. Хугерс-
хофф
Гудвин 97
Густавсон 634
Гуткнехт 226
Дакин см. Дейкин
Данилов 227
Дарапский 228
Дарзан 229, 230, 231,
317
Датт 232
Дау 233
Дафф 234
Дебу 235
Дейвидсон 236
Дейкнн (Дакин, Дэкин)
237, 238
Деккер 239
Делепин 240, 241
Демьянов 242, 566
Дениже 243
Денштедт 693
Дёбнер 244, 245, 246
Дёрннг 247
Джекобе 207
Дженсен см. Енсен
Джонс 248, 249
Джонсон 107, 250, 258,
356, 357, 521, 660, 727,
750
Джордан см. Яурдан
Джулиа см. Жюлиа
Джэпп см. Япп
Дикман 251, 252, 392
Дильс 253, 254, 255
Димрот 256
Дитмер 270
Дмитриев 332
Док 629, 704
Дорнов 257
Древсен 36, 37
Дрексель 102
Дрефаль 387
Дуйсберг 453
Дуппа 624
Дэкин см. Дейкин
Енсен (Дженсен) 268
Жюлиа (Джулиа) 258
Зайцев 259, 524
Закс 742
Залкинд 201
Замков 546
Заид 212
Зандмейер 260, 26!, 262
Зауэр 642
Зейде 705
Зелинский 219, 263, 264,
649
Землер 265
Земплен 172, 266, 289
Зервас 62
Зинии 267
Зиновьев 268
Зонн 269
Зукфюлль 270
Зуль 690
Зюс 271
33—684
.513
Иборн 272
Иванов 273
Илиои 197
Инг 186
Инхоффен 274
Иоцич 275
Ипатьев 276
Ирвин 479
Исбелл 277
Исей 278
Иэйл 543
Кабачиик 279
Кава см. Кейв
Кагур см. Каур
Кадио 280
Каймел 349
Калуца 281
Кальб 282
Камле 283 ¦
Канниццаро 284
Канцлер 194
Каппе 453
Карабинос 587, 588
Караш (Хараш) 127,591
Карбоии 285
Карг 524
Каррер 338, 627
Катрицкий 106
Каур (Кагур) 286
Кейв (Кава) 287
Кейсон 200
Келе 85
Кендолл 412
Кеннер 103
Керман 288
Кельш 104
Кёниг 691
Кёнигс 289
Кернер 261
Кижнер 290, 291
Килиани 292
Кинг 436
Киндлер 165
Киннер 295
Кирсанов 293
Кларк 744
Клаус 220
Клаусон-Каас 294
Клей 295
Клейтон 268
Клемменсен 296
Клемо 297
Клиббенс 427
Клинг 633
Клингеман 753
Кляйзен 231, 298, 299,
300, 301, 302 303
304, 570
514
Кнёвенагель 188, 220
305, 306
Кнооп 307
Кнорр 289, 308, 309, 310,
439
Колер 311
Колонь 219
Кольбе 312, 313, 314
Кольман 185
Комб 315
Компа 251
Конант 316, 602
Кондаков 317
Кондо 583
Коновалов 318
Конрад 319
Контарди 261
Коп см. Коуп
Кори 320, 321, 322
Коритник 266
Корнблюм 323, 391
Корнфорт 324, 325
Костанецкий 326, 327
Коти (Кохи, Кочи, Ко-
ши) 328
Коуп (Коп) 305, 329, 330
Кох 195, 331
Кохи см. Коти
Кочетков 332
Кочешков 333
Кочи см. Коти
Коши см. Коти
Кравченко 521
Крапивин 317
Крафт 334
Крафтс 627
Крейг 335
Крейтон 336
Кренцляйн 716
Кретьен 337
Крёнке 338, 436
Кривиц 475
Криге 339, 340, 341
Кук 92
Крум Браун см. Браун
Кумпф 711 -
Кун 342, 343, 479
Куорт 431
Курцер 344
Курциус 136, 345, 346
Кучеров 347
Кэмпбелл 672
Кэмпс 348
Кэррол 349
Ладенбург 180, 350,351,
352, 601
Ланг 537 „
Ландауэр 488
Лебедев 353
Ледерер 57
Лемштедт 354
Лемьё 355, 356 .
Леонард 357
Леперк 358
Лепти 129
Леспио 359
Ле Сюэр 90
Летре 156, 725
Лете 360
Ле Энафф 549
Лёвенфельд 172
Лёйкарт 143, 361, 362
Лёйкс 363
Лёфлер 213
Ли бен 364
Либерман 365
Лимпах 319
Ли идеей 285
Линдуолл 492
Липкин 488
Липп 366
Литтершайд 18
Лихошерстов 367
Лобри де Брюии 36S
Логеман 538
Локк 284, 291
Локкен 43, 120
Ломан 631
Ломбардино 432
Лонжи 337
Лоссен 369
Лоури 370
Лукеш 371
Львов 126, 372
Лютрингхаус 373
Ля Флямм 247
Маделюнг 374
Майзенхаймер (Мейзен-
геймер) 375, 376
Майзер 252
Майлас (Милас) 377
Майо 378
Майстер 201
Мак-Доналд 379 '
Макенн 235
Мак-Кнллоп 561
Мак-Комби 221
Мак-Лэфферти 380
Мак-Фейдиен 381
Малапрад 382
Мальмгрен 383
Мамлок 330
Манассе 57
Майн см. Мэнн
Манних 384, 518
Манске 186
Марассе 314
Марквальд 174, 184, 385
Маркер 593
Марсден 668
Мартии 296
Мартине 386
Марциус 214
Маскет 582
Маттокс см. Мэттокс
Маурер 387
Меервейн 140, 388, 389
Мейер 390—394, 604, 656
Мейзенгеймер см. Май-
Майзенхаймер
Мейстр 407
Мендиус 533
Менке 395
Менцер 396
Меншуткин 397
Меррей 754
Меррифилд 398
Мёлау 82
Мест 672
Милас см. Майлас
Милобендзкий 400
Миньонак 401, 410
Михальский 402
Михаэлис 22, 403, 404
Михаэль 405, 406
Мишер 407, 535
Мозер 154
Момотани 10
Мор 393
Морган 455
Морленд 408
Мортон 97
Моури 638
Моффэтт 482
Мумм 409
Муро 410
Мэль 532
Мэнн (Ман«) 411
Мэр 87
Мэттокс (Маттокс) 412
Мюллер 269, 414, 712
Мюллер-Кунради 413
Назаров 415
Намёткин 416
Напиральский 83
Небер 417, 418
Нельсон 200
Неницеску 419, 420, 421
Ненки см. Ненцкий
Ненцкий (Ненки) 627
Несмеянов 422
Неф 423, 424
Ннментовский 425, 426
Ниренштайи 427
Норман 428
Норриш 429
Ныоленд 430, 493
Ньюмен 25, 431, 648
Овербергер 432
Оддо 433
Оже 390
Оле 434
Оллис 55
Ольялоро 446
Оппенауэр 157, 435
Ортолева 436
Ортон 437
Остромысленский 438
Оямада 11
Пааль 439
Папа 702
Паску 440
Пассерини 441
Патерно 442
Пейдж 316
Пейн 443
Пелике 670
Пеллиццари 444
Пелуз 445
Перкин 446, 447, 448
Перков 449
Перрен 295
Перрье 627
Петренко-Криченко 450
Петров 156
Пехман 451, 452, 453
Пикте 454, 455, 456
Пилота 457, 458, 459
Пиннер 460—463
Пириа 464
Питерсон 3
Пнщимука 465, 466
Планше 467
Платнер 480
Плёхль 399, 740
Полоновский 468
Померанц 469
Понндорф 389
Понцио 470
Поуп 411
Прево 471
Прей 472
Прелог 473, 680
Преображенский 24
Прилежаев 474
Принс 127, 475
Пудовик 476
Пуммерер 477, 478
Пурди 479
Пфанненштиль 720
Пфау 480
Пфеннингер 723
Пфитцингер 481
Пфицнер 482
Пфлегер 669
Пшорр 483, 484
Пэдбери 492
Рабе 485
Радзивановский" 486
Радзишевский 235, 487
Райдон 488
Райли 489
Раймер 490
Райссерт (Рейссерт) 491,
492
Райхерт 493
Рамберг 494
Pan 495
Рашиг 496, 497
Реверден 498
Редделин 499
Резе 255
Рейндерс 500
Рейссерт см. Райссерт
Ремфри 501
Реппе 502—506
Реформатский 507
Рёлен 508
Рид 509, 628
Рилли 214
Рим 510
Римини 14
Римшнайдер 511
Рингер 500
Рист 660
Риттер 512
Рихе 513
Рихтер 514, 515
Робев 516
Робертсон 298
Робинсон 21, 298, 327,
406, 459, 517, 518,
519, 520, 622
Родионов 208, 284, 521
Розен 64
Розенмунд 522, 523, 524
Рот 343
Роу 525
Рохов 414
Рудлофф 355
Рудольф 269
Ружичка 526
Рупе 527, 528
Руфф 529, 530
Руц 715
Рэпсон 531
Рюгхаймер 724
515
Сабатье 532, 983
Сабба-Рао 109
Саймоис (Симоне) 534
Сандеран 533
Саретт 535
Свартс 536
Сенгупта 46
Сергеев 537
Сериии 538
Сервисен 539
Симмонс 540
Симонини 541
Симонис 542
Симе 96
Скита 196
Симоне см. Саймоис
Скрауп 543
Смайлс 544
Смидт 545
Смирнов-Замков 546
Смит 261, 443, 540, 547
Соборовский 268
Соди 548
Соммле 52, 549, 550
Соудеи 551, 639
Стадинков 264
Старкн 47
Стенхауз 552
Стефен 553
Стивене 133, 381, 554
Сторк (Шторк) 555
Стронг 29
Струков 556
Сэнджер 557
Табури 558
Тайдель 257
Тайрер 559
Тафель 560
Тейбер см. Тойбер
Тейлор 561
Терентьев 701
Тер Меер 562
Тидтке 563
Тиле 564
Тильманс 512
Тиман 490, 565, 731
Титов 318
Тиффено 566, 567, 568
Тишлер 569
Тищеико 570
Тодд 26
Тойбер (Тейбер) 571, 572
Толленс 573
Торгов 574
Торп 224, 575, 687
Траубе 576
Тропш 614
Трохимовский 221
Трус 544
Туитчел 577
Тэнэсеску 354
Уайлдс см. Уилдс
Уайт 578
Уайтинг 579
Уартои 580
Уги 581
Уидои 249
Уилдс (Уайлдс) 25
Уилсмор 713
Уильямсон (Вильямсон)
582
Ульмаи 216, 583, 584,
585, 755
Ульте 586
Уич 247
Уокер 112
Уолс 455
Уолфром 587, 588
Уормолл 232
Уотерс 78
Урех 589, 590
Урри 591
Уэё 583
Уэйкер (Вакер) 545
Уэикер 592
Фаворская 594
Фаворский 593, 594, 595
Файст 596, 597
Феитон 530, 598
Феофилактов 599
Феррарио 600
Фетвадян 585
Фёдорова 284
Филдс 279
Филлнпс 601
Финкельштайн 602
Фиттиг 183, 446, 603
Фишер 225, 292, 379,
492, 551, 604—608,
609—612, 613—617
Флад см. Флуд
Флинн 11
Флуд (Флад) 618
Фогт (Фойгт) 619
Фойгт см. Фогт
Фольхард 620, 649
Фонкеи 107
Форсмеи 488
Форстер 239, 621
Фоссек 316
Фоулдс (Фулдс) 622
Фрайтаг 213
Франк 710
Франке 201
Франкланд 623, 624
Франшимон 625
Фреденхаген 626
Фрейнд см. Фройид
Фридель 627
Фридлендер 628
Фридмеи 629
Фрис 630, 631
Фрич 469, 632, 633
Фройнд (Фрейнд) 634
Фромм 50
Фрюштюк 741
Фудзимото 635
Фукс 636
Фулдс см. Фоулдс
Хаазе 302
Хаак 166, 627
Хааф 331
Хайнс 13
Халл 501
Халлер 637
Хальберкан 481
Хараш см. Караш
Хард 638, 639
Харрис 640
Хасс 634 641, 642
Хауз 251
Хаузер 550
Хаук 643
Хафнер 644
Хаяши (Хаяси) 645
Хеер (Хир) 535
Хей 42, 201, 206
Хейуорт 646, 647
Хеллерман 648
Хелль 649
Хельферих 289, 650, 651
Хенбест 652
Хенкель 653
Хепп 615
Хербст 654
Херц 655
Херциг 656
Хершберг 657
Хессе 409
Хеш (Гёш) 658
Хибберт 659
Хикииботтом 214
Хилберт 660
Хилдич 661
Хилл 662
Хинкель 193
Хинмеи 663
Хинсберг (Гинсберг)
664, 665, 666, 667
Хир см. Хеер
Ходжсон 668
Ходкевич 280
Хойман 669
Хокк 537
Холландер 187
Хоппе 484
Хоренштайн 670
Хориер 176, 671
Хофер 672
Хох 673
Хуанг-Миилон 291
Хуберт 455
Хугерсхофф (Гугер-
шофф) 674, 675
Хукер 676
Хуисдиккер 100, 677
Хьюэтт 678
Хэммик 679
Хэнсли 119, 680
Хюккель 75
Хюниг 681
Цайзель 682
Цервек 616
Церевитинов 701
Циглер 175, 453, 644,
683—687
Циммерман 222
Цинке 688, 689, 690,
691
Чамичаи 692, 693
Чепмен 58, 694
Черняк 6
Четтэуэй 695. 696
Чичибабни 95, 350, 697,
698, 699
Чугаев 700, 701
Шаффер 277
Шах 193
Швенк 165, 702
Швехтен 703
Шедуэлл 303
Шеллер 704
Шерлин 705
Шешуков 372
Шёиберг 706, 707
Шёпф 520
Шиман 708
Шифф 709
Шихан 710
Шлак 711
Шлитлер 712
Шлоттербек 136
Шмндлин 713
Шмидт 47, 98, 304, 714,
715
Шмитт 314
Шмиц-Хиллебрехт 650
Шокииа 24
Шолль 132, 716
Шорыгин 167, 717, 718
Шотте 63
Шоттеи 719
Шпайер 617
Шпенглер 456, 720
Шредер 289
Шрётер 176, 265
Штааб 721
Штаудингер 722, 723
Штедель 724
Штеттер 725
Штёрмер 161, 495
Штиглиц 726
Штоббе 727
Штолле 728
Штоль 680
Шторк см. Сторк
Штраус 729
Штреккер 730, 731, 732
Шустер 388, 394
Эбер 76
Эглинтон 201
Эдман 733
Эйкмаи 734
Эйнхорн см. Айнхори
Эйр 751
Эйслеб см. Айслеб
Эльбе 735, 736
Эльтеков 127, 737
Эмде 738
Эммерлинг 34
Эммерт 739
Эммоис 671
Энгель 654
Эрдман 620
Эрленмейер 231, 740,
741
Эрлих 742
Эррера 93
Эстерлии 307
Этар 743
Эшвайлер 744
Юрьев 745
Юст 319
Якобсен 746
Якобсон 747, 748, 749
Янг 750, 751
Япп (Джэпп) 752—754
Яурдан (Джордан) 755
Ach 613
Ackermann 600
Adams 2, 193
Adkins 3
Ahmad 29
Akabori 9, 18
Alder 254
Algar 11
Allan 327
Allen 12
Amadori 13
Ando 15
Andrussow 16
Angeli 14, 261
Anschiitz 19, 20
Appel 21
Arens 24, 159
Arndt 25
Asendorf 739
Asinger 4
Atherton 26
Aue 173
Auger 390
Auwers 27, 28
Babad 251
Bachmann 205, 206
Baekeland 57
Backlund 494
Baddeley 131
Baeyer 30—37, 698
Bailey 56
Baker 54, 55
Ball 97
Ballio 74
Bally 132
Balsohn 38
Balz 708
Bamberger 39—42, 719
Bamford 133
Barbier 43, 219
Bardhan 46
Bargellini 44
Barger 45
Barry 134
Bart 47
Barton 48
Baudisch 49
Bauer 637
Baumann 50, 719
Baumgarten 51
Beal 25
Bechamp 71, 72
Becker P. 239
Becker T. 404
Beckmann 58
Bedoukian 53
517
Beecham 79
Behal 52
Behn 627
Behrend 64
Belleau 635
Benary 597
Bender 642
Benkeser 75
Bergmann 59, 60, 61, 62
63, 363, 713
Bergs 130
Berkhout 101
Bernthsen 65, 749
Berthelot 67
Berti 66
Bertram 68
Bertrand 69
Betti 70
Beyer 188, 246
Biginelli 77
Birch 75
Birckenbach 78
Birnbaum 541
Bischler 80, 81, 82, 83
Blaise 87, 88, 89, 90
Blanc 84, 85, 119
Blomquist 86
Bobbitt 91
Bodroux 94, 95
Boeseken 73. 74
Boessneck 76
Bogert 92, 93
Bohn 98
Bonner 99
Boord 123
Borsch e 101, 102, 103, 104,
481, 628
Bossei 418
Boters 177
Bott 105
Bougault 122
Boulton 106
Bourgel 359
Bouveault 117, 118, 119,
120, 121
Bowman 107
Boyland 96
Brackman 261
Bradsher 116
Braun 110, 111, 269, 523
Breckpot 113
Bredereck 289
Brown A. C. 112
Brown С. А. 108
Brown H. С 109
Bruckner 114
Brunner 7, 115
Bucherer 128, 129, 130
Buchner 135, 136
Buechi 442
Buttenberg 632
Buu-Hoi 175
Cadiot 280
Cahours 286
Campbell 672
Camps 348
Cannizzaro 284
Cantzler 194
Carboni 285
Carroll 349
Сason 200
Cava 287
Chapman 58, 694
Chattaway 695, 696
Chodkiewicz 280
Chretien 337
Ciamician 692, 693
Claisen 231, 298, 299, 300,
301, 302, 303, 304, 570
Clarke 744
Claus 220
Clauson-Kaas 294
Clay 295
Clayton 268
Clemmensen 296
Clemo 297
Clibbens 427
Colman 185
Cologne 219
Combes 315
Conant 316, 602
Conrad 319
Contardi 261
Cook 92
Cope 305, 329, 330
Corey 320. 321, 322
Corner 261
Cornforth 324, 325
Crafts 627
Craig 335
Creighton 336
Criegee 339, 340, 341
Curtius 136, 345, 346
Dakin 237, 238
Darapsky 228
Darzens 229. 230, 231, 317
Davidson 236
Debus 235
Decker 239
Delepine 240, 241
Deniges 243
Dennstedt 693
Dieckmann 251. 252, 392
Diels 253, 254, 255
Dimroth 256
Dittmer 270
Doak 629, 704
Doebner 244, 245, 246
Doering 247
Dornow 257
Dow 233
Drechsel 102
Drefahl 387
Drewsen 36, 37
Duff 234
Duisberg 453 '
Duppa 624
Dutt 232 '
Eaborn 272
Edman 733
Eglinton 201
Ehrlich 742
Eijkman 734
Einhorn 5, 6, 7
Eisleb 8
Eistert 25
Elbs 735, 736
Elion 197
Emde 738
Emmerling 34
Emmert 739
Emmons 671
Engel 654
Erdmann 620
Erlenmeier 231. 740, 741
Eschweiler 744
Etard 743
Eyre 751
Feist 596, 597
Fenton 530, 598
Ferrario 600
Fetvadjian 585
Fields 279
Finkelstein 602
Fischer E. 292. 604, 605,
606, 607, 608, 609, 610,
611, 612, 613, 617
Fischer F. 614
Fischer H. 616
Fischer H. O. L. 379, 492,
551
Fischer O. 615
Fischer W. 225
Fittig 183, 446, 603
Flood 618
Flynn 11
Fonken 107
Forsman 488
Forster 239, 621
Fossek 316
Foulds 622
Franchimont 625
Frank 710
Franke 201
518
Frankland 623, 624
Fredenhagen 626
Freedman 629
Freund 634
Freytag 213
Friedel 627
Friedlander 628
Fries 630, 631
Fritsch 469, 632, 633
Fromm 50
Frustuck 741
Fuchs 636
Fujimoto 635
Gabriel 184, 185, 186, 446,
517
Galat 197
Gallagher 187
Gams 454
Gardner 291
Gastaldi 191
Gattermann 192, 193, 194,
195, 196
Gaudemar 507
Geuter 301
Gibbs 199
Gilman 170, 200
Glaser 201
Gogte 202
Goldberg 584, 755
Goldschmidt 203
Gomberg 204, 205, 206
Goodwin 97
Goubeau 78
Gould 207
Graebe 216
Graf 512
Grakauskas 215
Granacher 218
Grewe 217
Griess 220
Grignard 182, 219, 591
Grosheintz 492
Gross 282
Grovenstein 222
Grundmann 223
Gryszkiewicz 221
Guareschi 224
Guerbet 198
Guerin 90
Gutknecht 226
Haaf 331
Haak 166. 627
Haase 302
Hafner 644
Halberkann 481
Haller 637
Hammick 679
Hansley 119 680
Hantsch 188, 189, 190, 393
Harries 640
Hass 634, 641, 642
Hauser 550
Haworth 646, 647
Hayashi 645
Hebert 76
Heer 535
Helferich 289, 650, 651
Hell 649
Hellerman 648
Henbest 652
Henkel 653
Henry 17, 18
Hepp 615
Herbst 654
Herrera 93
Hershberg 657
Herz 655
Herzig 656
Hesse 409
Heumann 669
Hewett 678
Hey 42, 201. 206
Heyns 13
Hibbert 659
Hickinbottom 214
Hilbert 660
Hilditch 661
Hill 662
Hinkel 193
Hinman 663
Hinsberg 664, 665. 666.
667
Hoch 673
Hock 537
Hodgson 668
Hoesch 658
Hofer 672
Hofmann A. W. 208, 209,
210, 211, 213, 214, 286
Hofmann K- 212, 339
Hollander 187
Hooker 676
Hoppe 484
Horenstein 670
Horner 176, 671
Houben 182. 225, 658
House 251
Howk 643
Huang-Minion 291
Hubert 455
Hiickel 75
Hugershoff 674, 675
Hull 501
Hiinig 681
Hunsdiecker 100, 677
Hurd 638, 639
Ing 186
Inhoffen 274
Irvine 479
I say 278
Isbell 277
Ivanoff 273
Jacobs 207
Jacobsen 746
Jacobson 747, 748, 749
Japp 752. 753, 754
Jensen 268
Johnson С R. 357
Johnson T. 521
Johnson Т. В. 660, 750
Johnson W. S. 107, 250,
258, 356, 727
Jones E. R. H. 249
Jones R. G. 248
Jourdan 755
Julia 258
Just 319
Kalb 282
Kaluza 281
Kamlet 283
Kappe 453
Karabinos 587, 588
Karg 524
Karrer 338, 627
Katritzki 106
Kehrmann 288
Kendall 412
Kenner 103
Kharasch 127, 591
Kiliani 292
Kimel 349
Kindler 165
King 436
Kinnear 295
KHng 633
Klingemann 753
Knoevenagel 188, 220,
305, 306
Knoop 307
Knorr 289, 308, 309, 310,
439
Koch 195, 331
Kochi 328
Koelsch 104
Koenigs 289
Kohler 311
Kolbe 312, 313, 314
Komppa 251
Kondo 583
Konig 691
Kornblum 323, 391
Korytnyk 266
Kostanecki 326, 327
Krafft 334
Kranzlein 716
Kriewitz 475
Krohnke 338, 436
Kuhn 342, 343, 479
Kumpf 711
Kurzer 344
К wart 431
Ladenburg 180, 350, 351,
352, 601
La Fiamme 247
Landauer 488
Lang 537
Lederer 57
Le Henaff 549
Lehmstedt 354
Lemieux 355, 356
Leonard 357
Lepercq 356, 358
Lepetit 129
Lespieau 359
Le Sueur 90
Lettre 156, 725
Letts 360
Leuchs 363
Leuckart 143, 361, 362
Lieben 364
Liebermann 365
Limpach 319
Lindsey 285
Lindwali 492
Lipkin 488
Lipp 366
Litterscheid 18
Lobry de Bruyn 368
Lock 284, 291
Locquin 43, 120
Loewenfeid 172
Loffler 213
Logemann 538
Lohmann 631
Lombardino 432
Longi 337
Lossen 369
Lowry 370
Lukes 371
Luttringbaus 373
Mac Donaid 379
Madelung 374
Mailhe 532
Maire 87
Malaprade 382
Maimgren 383
Mamlock 330
Manasse 57
Mann 411
Mannich 384, 518
Manske 186
Maquenne 235
Marasse 314
Marckwald 174, 184, 385
Marker 593
Marsden 668
Martin 296
Martinet 386
Martius 214
Mattox 412
Maurer 387
Mayo 378
McCombie 221
McFadyen 381
McKiHop 561
McLafferty 380
Meerwein 140, 388, 389
Meisenheimer 375, 376
Meister 201
Mendius 533
Menke 395
Mentzer 396
Merrifield 398
Meyer E. 393
Meyer G. 390
Meyer H. 656
Meyer К- Н. 392, 394
Meyer V. 391, 604
Meystre 407
Michael 405, 406
Michaelis 22, 403, 404
Michaiski 402
Miescher 405, 535
Mignonac 401, 410
Milas 377
Miller J. 399
Miller W. 246
Miiobendzki 400
Moest 672
Moffatt 482
Mohlau 82
Mohr 393
Momotani 10
Moreland 408
Morgan 455
Mori 638
Morton 97
Moser 154
Moureau 410
Miiller E. 269, 414
Miiller J. 712
Miiller R. 414
Muiier-Cunradi 413
Mumm 409
Murray 754
Muskat 582
Napieralski 83
Neber 417, 418
Nef 423, 424
Nelson 200
Nencki 627
Nenitzescu 419, 420, 421
Newman 25, 431, 648
Niementowski 425, 426
Nierenstein 427
Nieuwland 430, 493
Normant 428
Norrish 429
Oddo 433
Oesterlin 307
Ogiiaioro 446
Ohle 434
Ollis 55
Oppenauer 157, 435
Ortoleva 436
Orton 437
Overberger 432
Oyamada 11
Paal 439
Padbury 492
Page 316
Pahlicke 670
Papa 702
Pascu 440
Passerini 441
Paterno 442
Payne 443
Pechmann 451, 452, 453
Peliizzari 444
Peiouze 445
Perkin 446, 447, 448
Perkow 449
Perren 295
Perrier 627
Peterson 3
Petrow 156
Pfannenstiel 720
Pfau 480
Pfenninger 723
Pfitzinger 481
Pfitzner 482
Pfleger 669
Phillips 601
Pictet 454, 455, 456
Piloty 457. 458, 45Э
Pinner 460, 461, 462, 433
Piria 464
Plancher 467
Plattner 480
P15chl 399, 740
Polonovski 468
Pomeranz 469
Ponndorf 389
Ponzio 470
Pope 411
Prelog 473, 680
Prevost 471
520
Prey 472
Prins 127, 475
Pschorr 483, 484
Pummerer 477, 478
Purdie 479
Quelet 85
Rabe 485
Radziewanowski 486
Radziszewski 235, 487
Ramberg 494
Rap. 495
Rap son 531
Raschig 496, 497
Reddelien 499
Reed 509
Reese 255
Reichert 493
Reilly 214
Reimer 490
Reinders 500
Reissert 491, 492 •
Remfry 501
Reppe 502, 503, 504, 505,
506
Reverdin 498
Richter 514, 515
Rieche 513
Ried G2«
Riehin 510
Riemschneider 511
Riley 489
Rimini 14
Ringer 500
Rist 660
Ritter 512
Robertson 298
Robev 516
Robinson G. M. 519
Robinson R. 21, 298, 327,
406, 459, 517, 518, 519,
520, 622
Rochow 414
Roeien 508
Roosen 64
Rosenmund 522, 523, 524
Roth 343
Rowe 525
Rudloff 355
Rudolph 269
Ruff 529, 530
Rtigbeimer 724
Rupe 527, 528
Rutz 715
Ruzicka 526
Rydon 488
Sabatier 532, 533
Sachs 742
Salkind 201
Sand 212
Sandmeyer 260, 261, 262
S anger 557
Sarett 535
Sauer 642
Sawdey 548
Schaffer 277
Scheller 704
Schiemann 708
Schiff 709
Schlack 711
Schlittler 712
Schlotterbeck 136
Schmidlin 713
Schmidt E. 715
Schmidt H. 47
Schmidt J. G. 304
Schmidt K- F. 714
Schmidt R. E. 98
Schmitt 314
Schmitz-Hillebrecht 650
Scholl 132, 716
Schonberg 706, 707
Schopf 520
Schotte 63
Schotten 719
Schroeder 289
Schroeter 176, 265
Schuster 388, 394
Schwechten 703
Schwenk 165, 702
Semmier 265
Senderens 533
Sengupta 46
Serini 538
Shadwell 303
Shah 193
Sheehan 710
Simmons 540
Simonini 541
Simonis 542
Simons 534
Sims 96
Skita 196
Skraup 543
Smidt 545
Smiles 544
Smit P. J. 261
Smith С W. 443
Smith F. 547
Smith R. D. 540
Sommelet 52, 549, 550
Sonn 269
Sorensen 539
Sowden 551, 639
Speier 617
Spengler 456, 720
Staab 721
Staedel 724
Starkey 47
Staudinger 722, 723
Stenhouse 552
Stephen 553
Stetter 725
Stevens 133, 381, 554
Stieglitz 726
Stobbe 727
Stoermer 161, 495
Stoll 680
Stolle 728
Stork 555
Straus 729
Strecker 730, 731, 732
Strong 29
Strukov 556
Subba-Rao 109
Suckfull 270
Suhl 690
Sus 271
Swarts 536
Szulgin 400
Taboury 558
Tafel 560
Tanasescu 354
Tauber 571, 572
Taylor 561
Ter Meer 562
Theidel 257
Thiele 564
Thorpe 224, 575, 687
Tiedtke 563
Tiemann 490, 565, 731
Tiffeneau 566, 567, 568
Tishler 569
Todd 26
Tollens 573
Trau.be 576
Trochimowski 221
Tropsch 614
Truce 544
Tscherniac 6
Twitchell 577
Tyrer 559
Ugi 581
Ullmann 216, 583, 584,
585, 755
Ultee 586
Untsch 247
Urech 589, 590
Urry 591
Uyeo 583
Van Dorp 24
Van Ekenstein 368
52!
Van Slyke 147
Varrentrapp 148
Venkataraman 54
Verley 389
Vesterberg 155
Villiger 35
Vilsmeier 166 627
Voigt 619
Volhard 620, 649
Wacker 545
Wagner G. H. 139
Wagner-Jauregg 141
Walbaum 68
Walker 112
Wallach 143, 144, 145 146
Walls 455
Walther 481
Wanklyn 718
Waters 78
Wawzonek 554
Weedon 249
Weerman 149, 150
Weidenhagen 142 235
Welde 151
Wenker 592
Werner 58, 152
Wessely 153, 154
West 238
Westphalen 156
Wettstein 157, 407
Weygand 172
Wharton 580
White 578
Whiting 579
Wibaut 159
Wichterle 171
Wideqvist 160
Widman 161
Wiechell 632
Wieland 43, 162, 163 164
Wilds 25
Willgerodt 165
Williamson 582
Wilsmore 713
Winter E. 564
Winter R. A. E. 322
Winterstein 342
Wisiicenus 301
Witt 183, 220
Wittig 167, 168, 169 170
183, 671
Wohl 172, 173, 174, 175
199
Wohler 158
Wolff 176, 265, 291
Wolffenstein 177, 330
Wolfrom 587
Woodward 179
Wormall 232
Wrede 178
Wurtz 182, 183
Wuyts 181
Yale 543
Yang 750
Young 751
Zeisel 682
Zemplen 172, 266, 289
Zervas 62
Zerweck 616
Ziegler 175, 453, 644, 683
684, 685, 686, 687
Zimmerman 222
Zincke 688, 689, 690, 691
УКАЗАТЕЛЬ ТИПОВ РЕАКЦИЙ
Цифры соответствуют порядковому номеру реакций
Автоконденсация
алифатических спиртов 198, 353
аминоцианометплкетонов 191
Алкилироваиие
алкилксантогената натрия 15!
алкоголятов 582
аминов 397, 556
аммиака 209
ароматических соединений 38, 486,
627
арсенитов щелочных металлов 390
восстановительное. 159, 739
диалкилфосфитов 404
карбонильных соединений 555, 561
нитрилов 686
пиридина 436
сульфитов 732
фенолов 298
фенолятов 582
фталимидмалонового эфира 539
цианидов щелочных металлов 445
шиффовых оснований 239
Алкинилирование 24, 595
Алкоголиз иминоэфиров 461
Альдольное присоединение (Конден-
(Конденсация альдольная)
аминокислот 10
бензилиденглицина 741
нптропарафшюв 283
нитроспиртов 17
оксикарбонильных соединений 277
формальдегида 124, 573
Амидирование
алкнларилкетоиов 165
алкилгалогенидов 241
аминов 496
сложных эфиров 94
Амидометилирование 6
Амппнрование
азотсодержащих гетероциклов 697
бензоина 619
восстановительное
— альдегидов 143, 361, 401
— а-кетокислот 307
— кетонов 143, 361, 401
— формальдегида 744
дмоксинафталинов 306
Р-нафтолов 129
Амииоалкилировачие 8, 279, 521
Аыиноацилнрование аминокислот 398
Ампнобензилирование фенолов 70
Амьнолпз
азлактонов 59
Аминолиз
диалкокситетрагидрофуранов 294
нминоэфиров 460
N-карбоксиангидридов 56
Аминометилирование 384
Аммонолиз
диалкокситетрагидрофуранов 294
иминоэфиров 460
окислительный (Аммоксидирова-
ние) 16
Аннелирование 518
Арилирование
аминов ароматических 584
арилсульфиновых кислот 584
кетонов 734
непредельных кислот 734
углеводородов ароматических 206
фенолов 584
Арилсульфонилирование 665, 666
Ароматизация
алициклов 155, 253
оксимов циклоалканонов 265
октагидрофенантренов 46
тетрагидронафталинов 141
хинонов 477, 564
циклогексадиенов 28
Арсенирование 47, 71, 522, 704
Асимметрический синтез 385
Ацетализацня альдегидов 607
Ацетнлированне
ацетиленовых спиртов 430
фенолов 695
хинонов 564
Ацетоксилирование
аминов 164, 197, 238, 257, 609, 719,
721
ароматических соединений 627
карбонильных соединений 555, 561
пиррола 433
спиртов 5, 719, 721
. сульфоксидов 478
фенолов 5, 153, 658, 721
циклоолефинов 419
Бронирование
а-аминопирпдинов 335
C-дикарбонильных соединений 392
олефинов 175
Винилирование 428, 502
Включение 247, 427, 648
Восстановление
алкнндиолов 579
Восстановление
альдегидов 296, 389, 702
альдоз 336
а-амннокнслот 9
гндразонов 291
динитростнролов 421
имидохлорндов 269
карбоновых кислот 381, 532
кетонов 205, 296, 389, 652, 702
Р-кетоэфнров 560
непредельных соединений 108, 533,
702
нитрилов 553
нитросоедннений 33, 34, 37, 72, 150,
267
окнсн углерода 614
окснмов 702
пнрндниа 180
солей диазония 604
— пнрндиння 371
фенолов 690
хннонов 662
хлорангндрндов 524
эпоксикетонов 580
эфнров карбоновых кислот 119
— тиоловых кислот 587
Галогенарнлнрованне 388
Галогенолнз 272, 688
Галогеннрованне
ароматических соединений 78, 192,
261, 367
енолацетатов 53
карбоновых кислот 649
окснмов 458
спиртов 488
Гидратация
ацетилена 347
гликалей 612
окнсн углерода 203
тноцианатов 511
Гидроалюминнрование олефинов 685
Гидроборнрованне 109
Гндрогенолнз 524
Гндрокснлнрованне
арнламинов 96
гликалей 63
непредельных соединений 137, 179,
339, 377, 471, 535
окснантрнхннона 98
фенолов 735
Гндролнз
амидов кислот 118, 487
днбромалканов 737
дикетопнперазинов 608
жнров 577
N-нитрозосоеднненнй 451
фталнмндов 186
хлорбензола 497
Гндросилилирование олефннов 139
Гндроформнлированне 508
Гндроцнанированне 586, 590
Глнкозиднрованне 289, 405, 605, 650
Гомолнтнческое расщепление (Гомо-
лнз)
алкнлгалогенидов 591
карбонильных соединений 429
трнарнлбромметаиа 23
трнарнлметнлгалогенндов 204
Гомологнзацня
карбоновых кислот 25, 43, 187,
334, 407, 681
Сахаров 172, 292, 332, 379, 530,
551
Деалкилнрование 472
Деалкокснлирование 294
Деамннированне 242, 578, 730
Деацилнрованне 538
Дегалогеннрованне 60
Дегидратация
5-а-окснстерондов 156
спиртов 43, 353, 659, 700, 715
Дегидрирование
цнклогексана 253
цнклогексена 155, 253
Дегндрогалогеннрованне
а-бромкетонов 412
бромолефннов 359
галогенацетнлмочевнн 32
дихлорангндрндов 86
Дегидрокснлнрованне 322, 342
Дегидроцнклнзацня с образованием
бензтназолов 675, 748
полициклнческих кетонов 716
тнадиазолов 344
Декарбокснлнрованне 2, 238, 385, 541
Декарбоннлирование 90, 210
Деметнлнрованне амниов 468
Десульфурнзацня 181, 588
Дециклизацня
пиридинового кольца 691
фуранового кольца 552
цнклопропанового кольца 258
Диазотирование 220, 749
Дненовый синтез 141, 254
Днмеризацня
ацетиленов 729
восстановительная 205, 631
нитрилов 575
окислительная 466, 631
фенолов 477
Диспропорцноннрованне
альдегидов 284, 570
тетраалкил(арил)олова 333
циклогексадненов 263
циклогексанов 263
цннкалкнлгалогенидов 623
Замещение
аминогруппы 147, 335
ацетокснгруппы 266
водорода 701
галогена 87, 88, 170, 233, 391,
408, 562, 602, 689
дназогруппы 270, 362, 422, 668
карбоксильной группы 360
карбонильной группы 753
магннйгалогенндов 558
окснгруппы 229
Изомеризация
азоксибензолов 145
N-алкиланнлинов 214
алкнлнндоленинов 467
аллнлвиннлкетонов 415
аллнловых эфнров фенолов 300
4-арнлазооксазолндонов-5 548
арнлгидрокснламннов 40
N-арилгликозиламинов 13
арилнитраминов 39
о-арилтиокарбаматов 431
3-арилфталозонов 525
ароилбензойных кислот 645
ароматических соединений 544,
615, 653, 692, 694
ацетиленовых спиртов 394, 527
а-бензнл-а-аллилуксусных кислот
230
2-бензоилокснарнлметнлкетонов
54
Г\Г-галоген-1М-ациларнламннов 437
дналкилацетофенонов 131
диарнлтнокарбаматов 707
М,Н-днацнланнлннов 696
дигидроиминопирнмидннов 256
диенов 329
дикарбоновых ароматических кис-
кислот 653
имнноэфнров ароматических 694
нитритов 48
нитробензофуроксанов 106
N-ннтрозаминов ароматических 615
нитросоединений ароматических
692
N-окисей третичных аминов 376
окснмов 58
полиалкнлбензолсульфокнслот 746
производных цнклогексадненов 28
солей алкнлпнрнднння 350
— трналкнлбензиламмония 550
тетраалкнлднфосфорнлсульфндов
402
трнарнлметокснльных радикалов
162
трнарнлтнонфосфатов 465
трнфеннлэтана 222
фенилгидразонов 516
Изомеризация
цианата аммония 158
циненовой кислоты 528
эфиров простых 167, 373
— сложных 302, 340, 630
Иминированне
карбонильной группы 709, 722
Карбобензокснлнрованне 62
Карбокснлнрованне
олефннов 331
фенолятов 314
Карбометокснлнрованне кетонов 320
Карбоннлнрованне 503
Кватерннзацня аминов 397
Кине-замещенне 515
Комплексообразованне 73
Конденсация
алкнлгалогенндов 182, 183
альдегидов 30, 57, 299, 438, 446,
485, 740
альдольная см. Альдольное при-
присоединение
аминов ароматических 674
арилгалогенндов 183, 583, 584
ацетиленов 643
ацилоиновая 120, 680
виннлцикленолов 574
дикарбоннльных соединений 485,
574
кротоновая
— ангидридов 446
— N-ацилглицннов 740
— карбонильных соединений 304,
305
-— малоновой кислоты 244
— роданнна 218
— сложных эфнров 299, 727
ортоэфиров 643
сложноэфирная 54, 251, 301
этилового спирта 438
Меркурнрованне о
ароматических соединении Ь
олефннов 212
Металлнрованне 275, 717
Метнленнрованне 136, 321
Метилирование
бнцнклнческих кетонов 250
Сахаров 479, 647
Мутаротацня Сахаров 370
Нитрование
алифатических соединений 318,
641
алнцнклнческих соединений 318
Нитрование
ароматических соединений 177,
395, 626, 498
окислительное 177»
оксимов 470
Нитрозирование
алифатических спиртов 337
ароматических соединений 49, 365
окислительное 49
Озазонирование Сахаров 606
Озонирование 640
Окисление
алкилиодидов 323
З-алкил-2-оксинафтохинонов 676
альдегидов 35, 74, 240
а-гликолей 598
кетонов 35, 443
метильной группы 489, 743
нафталина 199
нафтиламинов 631
оксиальдегидов 237
а-окенкислот 598
оксистероидов 157
олефинов 243, 545, 640
Сахаров 69
спиртов 3, 387, 410, 435, 482
сульфидов 357
тетраметоксикатехина 21
трналкилалюминия 683
фенолов 153, 572, 735
хииолинов 375
Окси метилирование
альдегидов и кетонов 573
бензилмагнийгалогенидов 568
Олефинироваиие 168, 671
Переаминирование 654
Перегалогенирование 221 529, 536,
602
Перетру ппировкя
азидов карбоновых кислот 345
альдегидо-кетонная 227
амидоксимов 565
ацетнлеи-алленовая 594
а-галогеикетонов 593
гпдроксамовых кислот 369
диазокетонов 176
днарилэтиленгалогенидов 632
имидоангидридов 409
иодгидриниая 567
камфеновая 68, 140, 416
карбонильных соединений 714
Р-кетоэфиров 560
молекулярных ионов 380
5-а-оксистероидов 156
Р-окспэфиров 52
сульфоксидов 478
сульфонатов кетоксимов 417
526
Перегруппировка
тион-тиольная 465, 707
триалкилфосфитов 22
триарилметилгидроксиламииов 726
трнарилфосфитов 400
фосфонат-фосфатная 449
четвертичных солей аммония 554
Пиролиз 353, 526, 713
Поликоиденсация 57
Полимеризация этилена 684
Присоединение к
альдегидам 1, 18, 138, 259, 273,
441, 507, 718. См. также
альдольное присоединение.
ацетилену 493
кетонам 1, 259, 273, 383, 441, 507,
718
кратной связи 219
нитрилам 462, 581
олефинам 68, 105, 127, 349, 406.
475, 512
хлорангидридам 125
циклоолефинам 378, 419
Расширение цикла в
алициклах 242
аминометилциклоалканолах 566
замещенных бензолах 480
гетероциклах 27, 185, 693
Расщепление
аминов ПО, 111
«-аминокислот 79
ацнлалкилацетоуксусных эфиров
519
бензотриазолов 216
восстановительное 599'
гексаалкилдисилоксанов 618
карбоновых кислот 148. 334
карбэтоксиднтиокарбаматов 281
кетонов 187, 364, 637
ксантогенатов спиртов 700
окислительное
— ароматических соединений 237,
537
— а-гликолей 341, 356, 382
— карбонильных соединений 325
— олефинов 43, 355, 661
— caxapoR 134, 149. 379, 530, 547
720
пептидов 6!, 557, 711, 733
роданшюв 218
Сахаров 1 72, 434
спиртов 76
фенцлгмдразонов а-кетокислот 599
четвертичиих аммониевых соеди-
Hen.iji 208, 738
эфиров 407, 682
Родапирование 367
Силилирование алкил (арил) галогени-
дов 414
Сужение цикла в
алициклах 242
пиразолинах 290
производных пирана 448
циклоалканонах 146, 443
о-хинондиазидах 271
Сульфирование 464, 559
Сульфуризация
аминов ароматических 655
анилов арилметилкетонов 93
дифенилового эфира 600
коричной кислоты 50
солей диазония 362
— янтарных кислот 620
стирола 50
Тритилирование 163, 651
•Формилирование
ароматических соединений 166,
195, 513
пирролов 616
реактивов Гриньяра 95, 117
фенолов 193, 234, 490
Фосфорилированис 26, 476, 629
Фотохимические реакции 378, 429,
662, 692
Фторирование
полигалогенпроизводных 536
солей полинитроалканов 215
электрохимическое 534
эфиров галогенкарбоновых кислот
221
Хлорирование
алифатических кетоиов 633
ацилпроваиных Сахаров 440
бензола 497
М,М'-диалкиламидов щавелевой
кислоты 144
днметилацетплепа 546
метилендиоксисоединений 45
N-оксидов хииолинов 375
олефинов 372
Хлор метилирование ароматических
соединении 85
Хлорсульфопировапне алкаиов 509
Хлорфосфонированче 263, 295
Цианирование
алкилгалогенидов 312
арилгалогенидов 523
агюматических соединений 225
диалкилсульфатов 445
карбонильных соединений 586, 590
карбоновых кислот 360
Циклизация окислительная 11, 344.
См. также Дегидроциклизация,
Циклодегидратация, Циклодегид-
рогалогенирование, Циклодимери-
зация, Циклоконденсация, Цикло-
присоединение, Циклотримериза-
ция
Циклизация с образованием
азлактонов 60, 740
ацилоинов 680
бензилиденкумарононов 326
бензотриазинов 41
бензотриазолов 216
бензтиазолов 675, 749
изатинов 260
изоксазолин-М-оксндов 311
имидазолов 144
иидаиов 575
индолов 366, 421, 611, 622
карбазолов 571
Р-кетоэфиров 251
Р-лактамов 113
оксадиазолов 750
оксиндолов 115
нирролидинов 351
пирролов 459
тетрагидрокарбазолов 102
тетралинкарбоиовых кислот 230
тиадиазолов 344, 751
тиофенов 620
фенантреиов 483
феноксатинов 600
флавонолов 11
флавонов 326
хпнолпнов 37
циклоалканов 634
цикланопов 84, 86, 415, 526, 687
цнннолииов 104, 161, 514
этнленнмпна 673
•Циклодегидратация
а-амшюалкилсульфатов 592
о-ампностирнлкарбаминовой кис-
кислоты 150
о-амп л офени л гли оке иловых кислот
303
о-ампнофенилуксусных кислот 33
ацпламиноацетофенонов 348
ациламинобифенилов 455
ациламннокетонов 517
.М-гпшл-Р-арилэтнлампиоп 83
N-ацилтолуидинов 374
''-шдроксиламн покор ичцой кпело-
тм 34
чмарилкетонов 116, 736
:?,6-т,икетонов 89
и-дпфенпламинокарбоиовых кис-
кислот 755
fi-окси-Р-фенилэтиламндои 454
лсевдомочевой кислоты 613
феиплэтплциклогексанолоз 46, 92
527
Циклодегидрогалогенирование
аминохлоретиролов 366
1-бромнафтил-2-коричных кислот
678
галогеналкиламинов 184, 473
N-галогенамннов 213
галогенацетилмочевин 32
со-галогенацетоуксусных эфнров
677
Цнклоднмеризация 546
Циклоконденсацня с образованием
азуленов 644
акридинов 65, 499
алнцнклов 447
аллоксазинов 4Ь7
антраценов 19
ацнлбензофуранов 495
бензантронов 132
бензимидазолов 142, 601
бензодиоксанов 101
бензоксазолов 352
бензопиронов 396
бициклических кетинов 171
гндантоннов 589
глнцидных эфиров 231
диарнлтиофенов 50, 93
дигидропиридннов 188, 393
2,5-днметилоксазолов 178
диоксиндолов 386
изокумаринов 252
изохинолииов 91, 456, 469, 712
имидазолов 174, 235
инденов 122
индолов 82, 420, 754
карбазолов 128
кумарииов 44, 453
мочевой кислоты 576
оксазолинднонов 363
оксазолидонов 636
оксазолов 236, 610, 752
окснндолов 664, 728
4-оксихннолннов 207, 319
параконовых кислот 603
пиперидинов 450
пиразинов 191, 226, 248, 724
пиразолинов 663
пнразолов 308
Циклоконденсация
пирндннов 196, 224, 698
пиримндинов 77, 501
пнрроколннов 699
пирролов 189, 310, 399, 439, 596.
птерндннов 278
пуринов 64
рнбофлавинов 569
тетрагидроакридннов 563
тетрагидрофенантрндннов 103
тетрацианоциклопропанов 160
тнадназолов 638
тназолннов 4
тназолов 190
тиофенов 667
трназннов 463
1,2,4-трназолов 7, 444
тропинонов 520
феназинов 173
феноксазонов 288
фуранов 597
хиназолинов 80, 297
хиназолонов 425
хннолинов 246, 309, 315, 426, 481,
510, 543, 628
хромонов 327, 542
циклопропанов 276
цинхоннновых кислот 245
эписульфонов 723
Циклоприсоедннение к
диазосоедннениям 723
диенам 254
карбонильным и непредельным
соединениям 135, 254, 255,
290, 321, 442, 452, 540, 706
Циклотримеризация ацетилена 67, 505
Электрохимические реакции 112, 313,
336, 534, 560
Элиминирование 133, 286, 324, 330,
432, 494, 715
Эпимеризация 368
Эпоксидирование 324, 474
Этерифнкация 617
Этннилнрованне аминов н карбониль-
карбонильных соединений 424, 504, 506
Ксения Вячеславовна Вацуро
Галина Львовна Мищенко
ИМЕННЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ
ХИМИИ
СПРАВОЧНИК