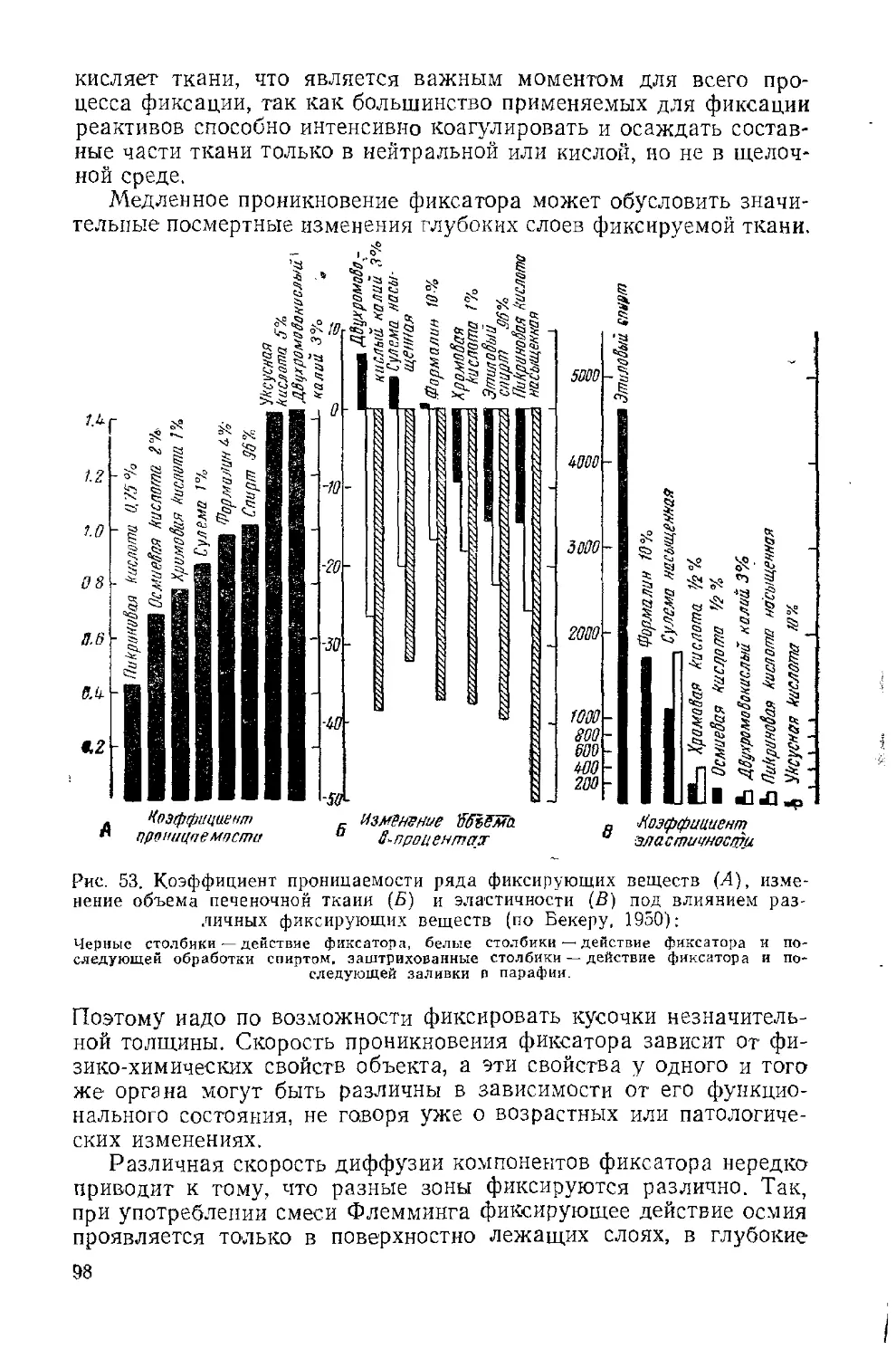
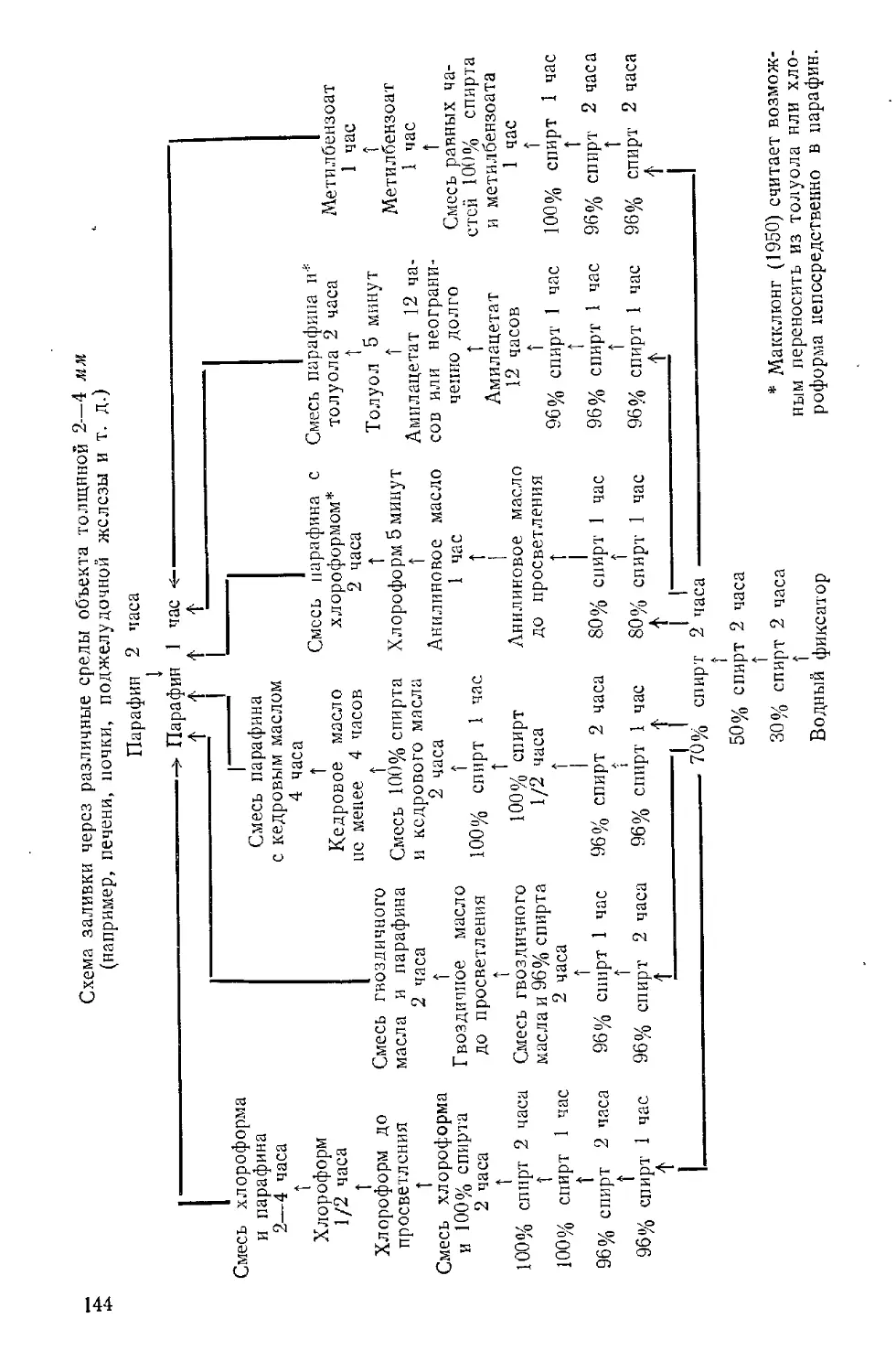
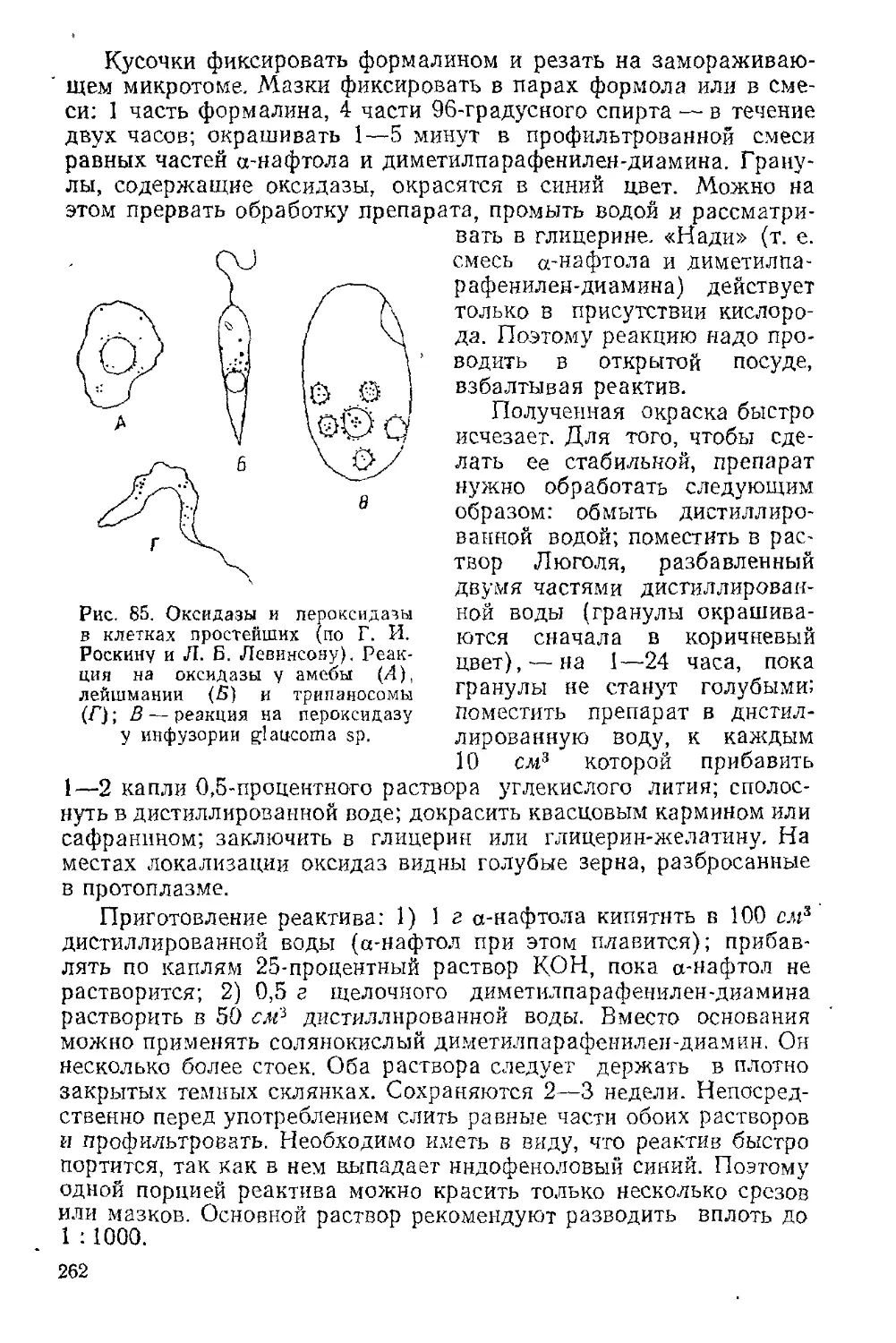
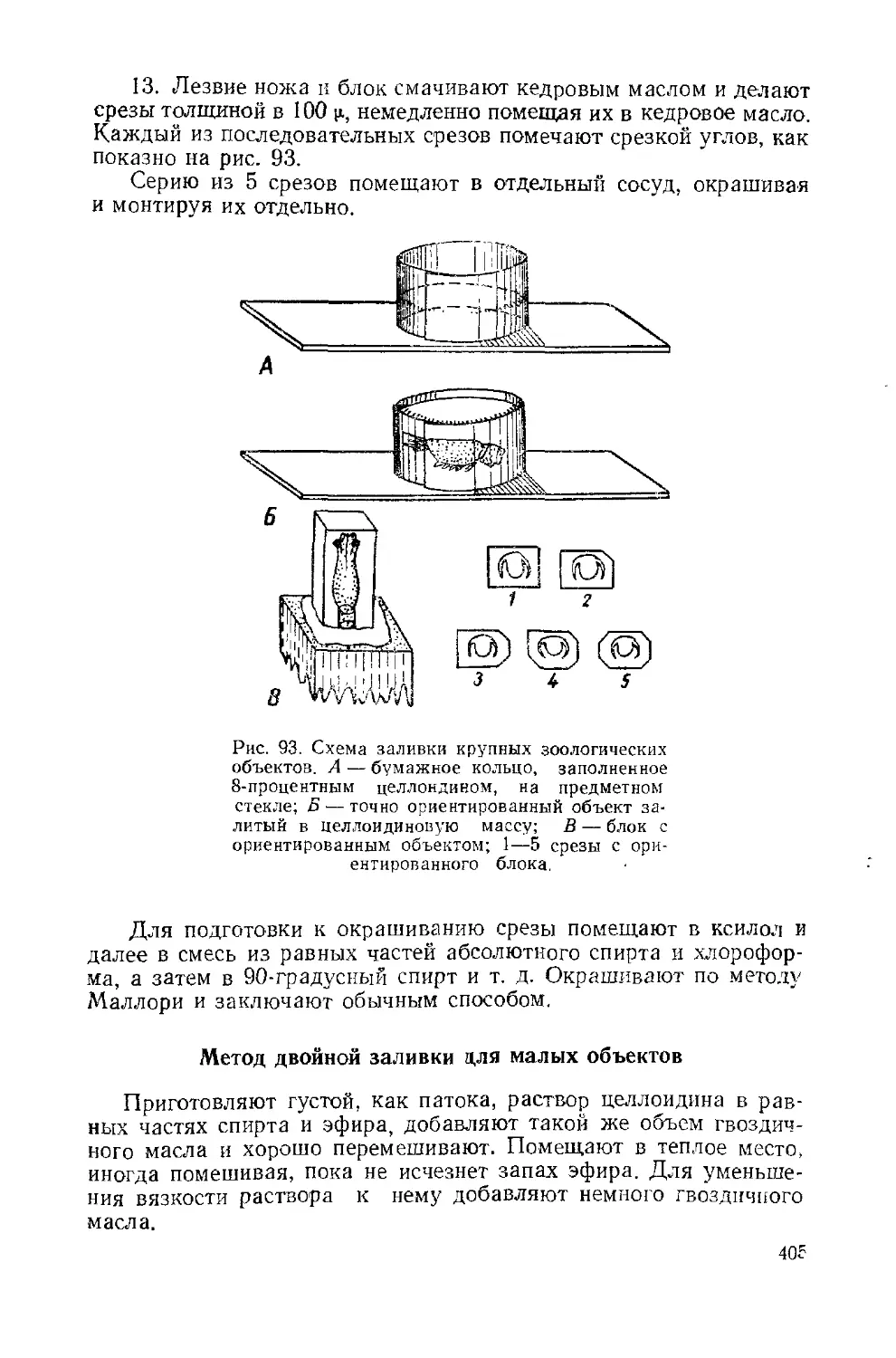
Текст
Г. И. РОСКИИ
OJIEWHCOrf
ИЕРОСЙШЙЧЕЖЯ
Г. И. РОСКИН и Л. Б. ЛЕВИНСОН
МИКРОСКОПИЧЕСКАЯ
ТЕХНИКА
ИЗДАНИЕ ТРЕТЬЕ
Под общей редакцией
проф. Г. И. РОСКИНА
Допущено
Министерством высшего образования СССР
в качестве учебного пособия для высших
учебных заведений
ГОСУДАРСТВЕННОЕ ИЗДАТЕЛЬСТВО
«СОВЕТСКАЯ НАУКА»
Москва — 1957
Как много микроскоп нам тайностей открыл!
М. В. Ломоносов
ПРЕДИСЛОВИЕ
(Предлагаемая читателю книга рассчитана на микроскописта-биолога, рабо-
рщего в области цитологии, эмбриологии и зоологии. Размеры книги не
родили включить в нее специальные методы изучения растительных клеток
раней, но все же многие методы, описанные в общей и цитологической
|ги, могут быть использованы и микроскопистом-ботаником. Ряд полезных
рений, вероятно, найдет в этой книге и врач-исследователь, работающий
масти патогнстологии и гистофизиологии.
Яри построении книги (расположение и соотношение отдельных частей) мы
эдили нз того, что исследования биолога-микроскописта должны основы-
>ся на сочетании прижизненного наблюдения и эксперимента с исчерпыва-
ли использованием классической «препаратной» микроскопической техники
«можно широким применением микрохимических и гистофизиологических
адов.
4адо помнить, что в микроскопической технике нет ничего само собою
иного — о чем нередко забывают, что все нуждается в эксперименталь-
.проверке, подтверждении и критическом анализе, однако эта работа нахо-
дя еще в самом начале. Надо также помнить, что наблюдаемые на препа-
1х картины могут быть в полной мере правильно оценены и истолкованы
!»ко с позиции советской материалистической биологии.
Современная микроскопическая техника не является, как прежде, простым
аанием более или менее удачных эмпирических рецептов фиксаторов или
арок. Напротив, идет большая экспериментальная и критическая работа
|н во всех областях микротехиики. Новые успехи физико-химических наук
ir тому широкие возможности. Очень большие успехи достигнуты за послед-
. годы в области гистохимии. Применение электронных и ультрафиолетовых
' й широко раздвинуло границы микроскопических исследований клеток и
гей.
Успешно разрабатываются теоретические обоснования фиксации и
гски—двух основных разделов классической микроскопической техники.
;шей стране многое сделано в области теоретических вопросов, связанных
облемой прижизненной окраски. Здесь надо особо упомянуть работы совет-
х исследователей Д. Н. Насонова, В. Я- Александрова, А. Л. Шабадаша,
г. Хлопина, А. В. Румянцева, Б. В. Кедровского, П. В. Макарова и др., ко-
по существу продолжают разработку этих кардинальных вопросов
{Ьскопнческой техники, начатую классическими исследованиями Д. Л. Ро-
нского и А. С. Догеля.
Тервые издания нашей книги вызвали многочисленные отклики. Это позво-
’нам в значительной степени учесть тот ценный, но, к сожалению, пока ие-
иточно обобщенный опыт лабораторных микроскопических методов, кото-
одами накапливался в многочисленных лабораториях нашей страны.
'/благодарностью следует отметить существенные указания, полученные
3
нами после первых изданий этой книги от профессоров В. А. ДогсЯ
Д. И. Дейнеки, А. М. Васюточкина, С. Я. Залкинда, Г. В. Ясвоина, Е. С.
нини, К. С. Богоявленского, 3. С. Кацнельсона. i
С особым чувством живейшей признательности мы должны вспомни <1
о проф. Б. И. Лаврентьеве, широко образованном микроскописте и отлич> I
знатоке методов импрегнации, чей опыт и указания нашли свое отраже . I
в ряде страниц этой книги. I
В новое издание книги внесено описание значительного числа новых Mt}
дов микроскопического исследования, опубликованных за последние г< |
в нашей и зарубежной печати. Некоторые разделы руководства напис; 1
заново: теория импрегнации, метахромазия, использование красителей
анализа субмикроскопической плотности клеточных структур, хромо. I
аутогисторадиография, методика изготовления препаратов для электрон |
микроскопии, микроспектрография в ультрафиолетовых лучах, примет *
пластмасс в микроскопической технике, применение детергентов, фикса j
с помощью замораживания — высушивания, новые способы исследовг ’.
углеводов. !
Кроме того, в новое издание книги включено много рисунков новей j
советских и зарубежных приборов, а также рисунков, иллюстрирующих пр:
нение новых методов экспериментальной цитологии и гистохимии.' ~ 1
Глава о методах микроскопического анализа простейших и часть раз!щ
о гистохимических методах изучения клеток н тканей написана Л. Б. Л .'В|,н
соном, которым также добавлено описание отдельных методик в раз! ел
V, VII и IX. I
Размеры книги заставили ограничиться описанием только определечноп
круга вопросов и методов, далеким от попытки дать исчерпывающие сведени
по всем проблемам современной микроскопической техники. Большинство,Гри
веденных в книге методов было испробовано в повседневной лаборатсно:
практике кафедры гистологии Московского государственного универси! ата
Подробности отдельных методов, различных их модификаций, а также <1 ыл
ки на специальную литературу можно иайти в основных руководств:! с 1
обзорах, список которых приводится в конце книги. |
Несмотря на ограниченные размеры книги, автор, проведший всю (зон
долгую жизнь за микроскопом, счел нужным более подробно затронуть разде
лы микроскопической техники, связанные с общетеоретическими вопро?ши
дальнейшая разработка которых ивится задачей нашей растущей нау но!
молодежи.
Г. И. Рсскш
Москва, МГУ, кафедра гИстолсгш
К ИСТОРИИ МИКРОСКОПИЧЕСКИХ ИССЛЕДОВАНИЙ
В РОССИИ
Не подлежит никакому сомнению, что первым русским, уви-
девшим микроскоп и заинтересовавшимся им, был Петр I.
Во время пребывания в Дельфте Петр I пригласил к себе на
яхту Левенгука, который демонстрировал Петру усовершенство-
ванные им микроскопы и показал ряд своих экспериментов. Име-
ются указания, что заботами Петра I микроскопы были приобре-
тены и посланы в Россию. Известно также, что в 30-х годах XVIII
века один из образованнейших и просвещенных людей русского
общества, знаменитый оратор и проповедник, Феофан Прокопович
интересовался микроскопическими исследованиями и обладал дву-
мя микроскопами. В протоколах конференции Академии наук от
1738 года имеется указание, что президент Академии И. Корф не
только демонстрировал Микроскоп, но и поставил вопрос о жела-
тельности дальнейших усовершенствований в его устройстве. Ака-
демия, обладавшая в это время рядом микроскопов различных
систем, приобретенных за границей, организовала их изготовление,
наряду с другими оптическими приборами, в своей мастерской.
Уже в, 20-х годах XVIII века в Петербурге имелись опытные масте-
ра (Беляев, Калмыков), шлифовавшие оптические линзы и изго-
товлявшие микроскопы для нужд Академии и для продажи. Осо-
бого упоминания заслуживает провинциальный нижегородский
часовщик Кулибин, ставший одним из замечательных механиков-
конструкторов. Микроскоп и зеркальный телескоп, построенные
И. П. Кулибиным, были им поднесены в 1768 году Екатерине II,
которая приказала хранить их в Кунсткамере, как «необыкновен-
ные памятники искусства». Кулибин был принят на службу в
Академию наук в качестве механика и руководителя академиче-
ских мастерских, где им было сделано немало простых и сложных
микроскопов и для академиков и для продажи. Спрос на микро-
скопы несомненно был, так как в России, подобно тому, как это
было и на Западе в XVIII веке, микроскоп и телескоп часто мож-
но было найти в богатых и просвещенных домах столицы, а не-
5
редко и в поместьях; это был период «просвещенного любитель-
ства».
А. Т. Болотов, один из культурнейших русских людей своего
времени, рассказывает в автобиографии, как он, приехав в Моск-
ву, в 1768 году «купил в рядах и тот прекрасный микроскоп, кото-
рым в последствии времени мы так много утешались». Свои ми-
кроскопические наблюдения Болотов изложил в четырех статьях,
появившихся в журнале «Экономический магазин» (1787). Эти
статьи содержат не только описание 109 микроскопических объек-
тов, как-то: обитателей воды, мелких насекомых, поперечных сре-
зов различных растений и т. д., но и дают разнообразную методи-
ку приготовления препаратов. Так, например, указывается, каки-
ми номерами объективов следует пользоваться при различных
наблюдениях, в каких случаях надо использовать прямое или бо-
ковое освещение или рассматривать объекты на темном фоне.
Благодаря этим особенностям статьи Болотова следует считать
первым русским руководством по микротехнике. Замечательные
микроскопические исследования над эмбриональным развитием
цыпленка принадлежат академику К. Ф. Вольфу (1759). Большие
работы с микроскопом проводил М. В. Ломоносов, которого по
справедливости считают первым русским ученым, систематически
применявшим микроскоп в своих разнообразных исследованиях.
Само слово «микроскоп» в его русской транскрипции было
впервые применено М. В. Ломоносовым.
В середине XVIII века общий интерес к микроскопическим ис-
следованиям так возрос, что Академия сочла нужным заказать
проф. Гришову специальную книгу о микроскопе, в которой изла-
галась бы техника работы с микроскопом и давалось описание
различных систем микроскопа. Имелись микроскопы и в лабора-
ториях Московского университета, где студентам демонстрирова-
лись методы микроскопического исследования. Эти старинные
микроскопы погибли во время пожара 1812 года.
Нельзя обойти молчанием значительные для своего времени
труды русских микроскопистов второй половины XVIII века, из
которых особо следует отметить А. М. Шумлянского, автора при-
мечательного труда о тонком микроскопическом строении почки.
Успешно развивавшаяся в России в XVIII столетии микроско-
пия к концу века постепенно пришла в упадок. Наступившая в это
время политическая реакция и последовавшая за ней задержка
экономического развития России печально отразились и на столь
успешно начатом отечественном производстве микроскопов. Это
дело заглохло на долгие годы. Несмотря на отдельные интерес-
ные микроскопические исследования русских ученых начала XIX
века, надо все же отметить, что работа с микроскопом долгое вре-
мя не входила в широкую практику естественнонаучных или меди-
цинских лабораторий. Студентам этот прибор демонстрировали
лишь на лекции, а затем запирали в шкаф. Только под влиянием
общего подъема медико-биологических наук в середине XIX века
6
интерес к микроскопическому исследованию захватил широкие
круги ученых. Во второй половине XIX века русские микроскопи-
сты создают ряд первоклассных работ, а русские эмбриологи
становятся на первое место в мире. Большую роль в развитии ми-
кроскопических работ в нашей стране сыграли талантливые иссле-
дования московского гистолога А. И. Бабухина (1827—1891), боль-
шого знатока микроскопической техники, создателя особой моде-
ли штатива для микроскопа.
А. О. Ковалевский (1840—1901) не только заложил идей-
ную основу эволюционной гистологии с ее учением о единстве
развития, строения и функции организма, но и внес ряд усовер-
шенствований в методику изготовления микроскопических препа-
ратов, и еще в 1863 году разработал столь важный для микроско-
пического эксперимента метод, как метод введения в организм
красителей с целью изучения строения и функции различных орга-
нов.
Заслуги И; И. Мечникова (1845—1916) в создании срав-
нительной патологии общеизвестны, однако Мечникова по праву
надо считать также одним из основоположников сравнитель-
ного и экспериментального метода в микроскопической биологии
и, в частности, в цитофизиологии.
М. Д. Лавдовский (1846—1902), наряду с гистологиче-
скими исследованиями, уделял большое внимание развитию мик-
роскопической техники. Им усовершенствован способ приготовле-
ния препаратов из костной ткани, методика выделения отдельных
нервных клеток и, наконец, важнейший метод микроскопической
техники — импрегнация азотнокислым серебром элементов нерв-
ной системы — был введен в исследовательскую практику Лав-
довским ранее, чем это сделал Гольджи.
В связи с развитием во второй половине XIX века микроскопи-
ческих исследований увеличился спрос на микроскопы, которые
нам импортировались из-за границы. Усиление спроса на микро-
скопы послужило стимулом к тому, чтобы наладить их отечествен-
ное производство, но попытка, сделанная в 1883 году, очень быст-
ро заглохла. Такая же судьба постигла одну московскую мастер-
скую, которая в 1916 году начала производство малосовершенных
школьных микроскопов. Серьезным препятствием для успешного
развития производства микроскопов явились незрелость нашей
дореволюционной тонкой механики и оптики и трудность конку-
ренции с иностранными фирмами, захватившими рынок и монопо-
лизировавшими поставки научной аппаратуры.
Массовое изготовление отечественных микроскопов началось
только в Советской России. Завод «Геофизика» стал выпускать
из производства весьма совершенные биологические микроскопы.
Хорошие модели микроскопов стало изготовлять Всесоюзное объ-
единение оптико-механической промышленности (ВООМП).
В настоящее время советское приборостроение достигло тако-
го уровня, когда оно может оснастить микроскопическую лабора-
7
торию наиболее тонкими инструментами для изучения клеток и
тканей, включая приборы для фазовоконтрастной микроскопии,
электронной микроскопии и, наконец, новейшие микроскопы для
ультрафиолетовой микроскопии (сконструированные в Государст-
венном оптическом институте), основанные на совершенно новом
принципе использования ультрафиолетовых лучей.
РАЗДЕЛ ПЕРВЫЙ
УСТРОЙСТВО МИКРОСКОПА И ВСПОМОГАТЕЛЬНЫХ
ПРИБОРОВ
Основные элементы строения микроскопа даны на рис. 1. Важ-
нейшей частью микроскопа является объектив, находящийся
в непосредственной близости от рассматриваемого предмета —
объекта. Объектив состоит из ряда линз, закрепленных в специ-
альной оправе. На оправе имеется резьба, при помощи которой
объектив ввертывают в револьвер, соединенный с цилиндрической
трубой — тубусом. Нормальная длина тубуса равна 160 мм. Для
наводки на фокус служат макрометрический и микро-
метрический винты. При этом микрометрический винт
применяется не только для точной наводки на фокус, но и для
просмотра микроскопического препарата в глубину. Изображение,
даваемое объективом, рассматривают с помощью окуляра, нахо-
дящегося в верхней части тубуса. Окуляр состоит из двух плоско-
выпуклых линз, обращенных своими выпуклыми сторонами к объ-
ективу. Общее увеличение объекта, даваемое микроскопом, равно
произведению увеличений окуляра и объектива. Например, при-
меняя окуляр с обозначением 10 X и объектив 90 X, мы получим
увеличение, равное 900 (при длине тубуса в 160 мм).
Наиболее примитивно устроенные объективы могут страдать
двумя основными дефектами—хроматической и сферической абер-
рацией. Хроматическая аберрация происходит вследствие разло-
жения белого света на цвета, в результате чего появляется окра-
шенность изображения. Сферическая аберрация зависит от того,
что лучи света, упавшие на различные точки линзы, преломляют-
ся различно, и в результате светящаяся точка дает изображение
на экране не в виде точки, а в виде так называемого кружка рас-
сеяния.
В сложных объективах эти недостатки в значительной степени
устранены. Объективы, в которых хроматическая аберрация уст-
ранена в отношении двух наиболее ярких цветов спектра, называ-
9
тотся ахроматами или ахроматическими объективами. Более
совершенными, с точки зрения оптической коррекции, являются
флюоритовые объектив ы, занимающие среднее положе-
ние между ахроматами и сложными, дорого стоящими апохро-
матами, в которых хроматическая аберрация почти полностью
отсутствует. При работе с апо-
хроматами употребляют специ-
альные так называемые ком-
пенсационные окуляры.
Для большинства исследо-
ваний ахроматы вполне при-
годны. Только при наблюдении
цветных объектов иногда появ-
ляется желтый или зеленый фон
вокруг нечеткого контура изо-
бражения.
Апохроматами окраска
объекта передается значительно
правильнее, и цветовые града-
ции отчетливее, а изображение
достаточно резко, даже и в
краевой части поля зрения.
К основной характеристи-
ке объектива относятся фокус-
ное расстояние и разрешающая
способность (апертура).
Фокусное расстояние обыч-
но выражается в миллиметрах
или в дюймах: V12, Vie и т. д.).
Чем короче фокусное расстоя-
ние объектива, тем больше его
увеличение. Самые слабые объ-
ективы имеют фокусное рас-
стояние 50—60 мм, самые
сильные — 1,3 мм. При этом на-
до указать, что работать с такими короткофокусными объектива-
ми весьма затруднительно. Разрешающая способность объекти-
ва, т. е. способность изображать мельчайшие детали препарата,
характеризуется наименьшим расстоянием, при котором, напри-
мер, два тончайших и тесно лежащих штриха изображаются объ-
ективом раздельно. В условиях освещения прозрачного предмета
центральным пучком света это расстояние определяется выраже-
нием е = , где — длина световой волны, А — так называемая
численная апертура. Численной апертурой называется произведе-
ние показателя преломления среды, находящейся между объек-
тивом и предметом, на синус половины угла, который образуется .
двумя крайними лучами, попадающими в объектив: А = п sin а.
1 0
Таким образом, теоретически разрешающая способность объекти-
ва будет максимальной в том случае, если будет использован уз-
кий косой пучок лучей, падающий под наибольшим апертурным
углом; для этого случая е =— .Из этого следует, что разреша-
ющая способность тем больше, чем больше численная апертура
объектива и чем короче длина волны света, применяемого для на-
блюдения. Для испытания разрешающей способности объективов
применяют препараты мелких диатомовых, водорослей, панцыри
которых имеют очень тонкую и сложную решетчатую структуру,
или же пользуются специально изготовленными пластинками Нор-
берта, с нанесенными на них группами тонких параллельных штри-
хов. Чем выше апертура объектива, тем больше приходится счи-
таться с толщиной покровных стекол.
Рис. 2. Схема осветительного устройства микроскопа:
I — осветительное зеркало; 2 — ирисовая диафрагма; «?—кон-
денсор.
Обычно объективы коррегируются для толщины покровного
стекла в 0,17 мм.
Большое значение в микроскопе имеет осветительное
устройство (рис. 2), состоящее у простых моделей из зер-
кала (с одной стороны плоского, с другой — вогнутого), к кото-
рому в более совершенных микроскопах добавлен специальный
конденсор.
Надо помнить, что правильное освещение — одно из важней-
ших условий успешной микроскопической работы. Использование
И
дневного света является давней традицией микроскопистов, одйа-
ко гораздо лучшие результаты достигаются при применении спе-
циальных осветителей, особенно снабженных точечными лампами
(см. стр. 24). В этом случае микроскоп ставят на столе с черной
верхней поверхностью, расположенном в более затемненной части
лаборатории. В этих условиях можно достичь не только лучшего
освещения объекта, но, что также важно, глаза наблюдателя уста-
ют гораздо меньше, чем при работе у ярко освещенного окна.
В микроскопах без конденсора плоское зеркальце микроскопа
применяется при работе со слабыми объективами, имеющими
большое фокусное расстояние. Вогнутым зеркальцем микроскопа
пользуются в тех случаях, когда работают с сильными сухими
(т. е. не иммерсионными) объективами при слабом источнике
света.
Для объективов с фокусным расстоянием 25 мм или менее сле-
дует работать с конденсором и пользоваться плоским зеркальцем
микроскопа, кроме тех редких случаев, когда источник света очень
слаб и, одновременно, расположен очень близко от микроскопа
(Ланжерон, 1949). Поле зрения микроскопа должно быть равно-
мерно освещено. Для этой цели опускают или подымают конден-
сор. При работе со слабыми объективами приходится значительно
опускать конденсор, при работе с иммерсионными объективами —
поднимать почти до предела. Не следует пользоваться конденсо-
ром для регулировки интенсивности освещения. Последнее дости-
гается раскрытием или суживанием ирис-диафрагмы. Теоретиче-
ски ирис-диафрагма — пишет Ланжерон (1949)—должна слу-
жить только для регулировки размеров конуса света, но не для
изменения интенсивности освещения. Практически же эти две опе-
рации совпадают. При детальных микроскопических исследи-' -и-
ях можно с пользой применять для регулировки интенсивности
света синие или зеленые матовые округлые стеклышки, которые
вставляются в держатель фильтров осветительного прибора или
вкладываются в держатель диафрагмы конденсора. Окрашенные
стеклышки одновременно играют роль светофильтров.
Интенсивность освещения при пользовании приборами, снаб-
женными точечными лампами, можно регулировать с помощью
вспомогательного приспособления или реостата. Центрирования
пучка дневного или искусственного света можно достичь, манев-
рируя осветительным зеркальцем микроскопа и одновременно
наблюдая за характером освещения через окуляр микроскопа.
Для этой же цели применяют относительно простой и более точ-
ный способ (Ланжерон, 1949); работая со слабым объективом
(16 мм или 8 мм), поступают следующим образом: 1) если микро-
скоп без конденсора, то окуляр вынимают и, смотря непосредст-
венно через тубус микроскопа, передвигают зеркальце микроско-
па так, чтобы стал четко виден источник света — спираль лампы
или участок окна. Затем в микроскоп вставляют окуляр и присту-
пают к наблюдению; 2) если микроскоп снабжен конденсором/
12
его предварительно максимально поднимают, а затем вынимают
окуляр и устанавливают свет, как сказано выше. После этого
вставляют окуляр и поднимают или опускают тубус микроскопа
до тех пор, пока снова не станет четко видно спираль осветитель-
ной лампы. Затем опускают конденсор настолько, чтобы изобра-
жение лампы исчезло и поле зрения микроскопа было равномерно
освещено. При переходе к работе с сильными объективами снова
сколько возможно поднимают конденсор, не нарушая равномерно-
го освещения поля зрения. Сужение диафрагмы конденсора уст-
раняет избыточные лучи и повышает резкость объектива микро-
скопа. Но при этом следует избегать чрезмерного сужения диаф-
рагмы, так как она может привести к искажению изображения
объекта наблюдения (например, возникают ложные двойные кон-
туры). Обычно диафрагму конденсора сужают наполовину или на
две трети поперечника выходного зрачка объектива. Полезные све-
дения для работы с максимальными увеличениями микроскопа
даны в книге М. А. Пешкова («Цитология бактерий», 1955,
стр. 7—17).
Затем на предметный столик микроскопа кладут препарат и,
глядя сбоку, опускают с помощью макрометрического винта тубус
так. чтобы объектив (малого увеличения) отстоял от покровного
стекла на несколько миллиметров. После этого, смотря в окуляр,
поднимают макрометрическим винтом тубус до момента появле-
ния очертаний изучаемого объекта. Точное наведение на фо-
кус производится микрометрическим винтом. Если необходимо
перейти к наблюдениям с более сильной системой, то, приподняв
немного тубус микроскопа, переставляют барабан револьвера на
объектив иного увеличения и затем производят снова установку
на фокус, как это было описано выше. Чем сильнее увеличение
объектива, тем меньше его фокусное расстояние и тем осторожнее
нужно работать с ним, чтобы не повредить фронтальную линзу
объектива и препарат.
Для работы иммерсионным объективом поступают следующим
образом. При сильной сухой системе исследуемый объект уста-
навливают точно в центре поля зрения, затем поднимают тубус и,
вращая барабан револьвера, заменяют сухой объектив иммерсион-
ным.
После этого на нужное место препарата наносят каплю им-
мерсионного масла. Наблюдая сбоку, тубус опускают до соприко-
сновения объектива с иммерсионным маслом. Затем, глядя в оку-
ляр, осторожно опускают тубус до появления очертаний объекта,
после чего микрометрическим винтом производят точное наведе-
ние на фокус.
Если желательно использовать полную светосилу объектива (с
апертурой больше единицы), то между линзой конденсора и пре-
паратом также помещают каплю иммерсионного масла, которое
должно заполнить все пространство между конденсором и нижней
стороной предметного стекла.
13
Во многих случаях полезно применять водную иммер-
сию, особенно при прижизненных наблюдениях, когда объектив
должен непосредственно соприкасаться с жидкой средой и когда
нежелательно покрывать объект покровным стеклышком. Водной
иммерсией можно также пользоваться при тонкой и детальной
дифференцировке окрашенных препаратов. Если водной иммерси-
ей пользуются, накрыв препарат покровным стеклом, то между
объективом и покровным стеклыш-
ком помещают каплю дистиллиро-
ванной воды.
В Советском Союзе выпускает-
ся много типов микроскопов; основ-
ными из них являются три: первый,
тип — это советский микроскоп М-9,
второй тип — советский микро-
скоп— МБИ-1 и третий — наиболее
совершенная модель — МБИ-2.
Микроскоп М-9 (рис. 3) наи-
более пригоден для текущей лабора-
торной работы и для практических
занятий по гистологии или микроско-
пической зоологии. Общий вид тако-
го учебного микроскопа, распростра-
ненного в наших лабораториях,
имеющего удовлетворительную' осве-
тительную систему и практически
удобный набор окуляров и объекти-
вов, приведен на рис. 3.
Средней моделью современного
биологического микроскопа является
модель МБИ-1 (рис. 4). Штатив это-
го микроскопа снабжен двумя смен-
ными тубусами: наклонным — для
визуальных наблюдений, прямым — для работ, связанных с мик-
рофотографией и применением рисовального аппарата. Микроскоп
снабжен объективами Х8, Х40 и масляной иммерсией Х90, а
также окулярами Гюйгенса 7, 10 и 15, что позволяет работать с
увеличениями от 56 до 1350.
Для исследовательских целей, когда требуется детальное изу-
чение тонких структур, часто лежащих близко к границе разреша-
ющей способности микроскопа, пользуются более совершенно уст-
роенными моделями микроскопов, например, микроскопом МБИ-2.
Микроскоп МБИ-2 (рис. 5 и 6), представляющий собой
большую модель современного биологического микроскопа, явля-
ется дальнейшим развитием и усовершенствованием биологиче-
ского микроскопа.
Основным назначением микроскопа МБИ-2 является исполь-
зование его для медицинских и биологических исследований про-
14
зрачных объектов в проходящем свете как в светлом, так и в тем-
ном поле, с применением соответствующих конденсоров. Кроме
того, с применением эпиконденсора он может быть использован
для исследования непрозрачных объектов в отраженном светлом
поле и в отраженном темном поле, а с применением специальных
поляризационных фильтров
объектов в поляризованном
свете. С помощью насадки
МНФ-1 микроскопом можно
производить микрофотогра-
фии как прозрачных, так и
непрозрачных объектов при
перечисленных выше усло-
виях освещения.
Основные части микро-
скопа М.БИ-2:
1) основание («ножка»)
штатива микроскопа; 2) ко-
робка с микромеханизмом;
3) предметный столик; 4)
тубусодержатель; 5) голов-
ка тубусодержателя; 6) би-
нокулярный тубус (съем-
ный); 7) револьвер на са-
лазках; 8) кронштейн кон-
денсора; 9) панкрэтический
конденсор с револьвером
для трех конденсоров: а)
апланатического, б) с очко-
вой линзой, в) кардиоид-
конденсора темного поля;
10) объективы; 11) парные
окуляры.
Микроскоп укомплекто-
ван компенсационными оку-
можно производить исследования
Рис. 4. Монокулярный микроскоп с косо-
поставлеиным тубусом МБИ-1.
лярами, так как эти оку-
ляры при работе с апохроматическими объективами дают гораздо-
лучшее изображение, чем обыкновенные окуляры. Характеристи-
ка окуляров и общее увеличение микроскопа указаны в табл. 2.
Каждый окуляр обозначен буквой «К» (компенсационный) и
цифрой собственного видимого увеличения.
Микроскоп МБИ-2 имеет следующие особенности:
1. Осветительная система микроскопа вместе с патроном и лам-
пой смонтирована внутри башмака, а шнур выведен наружу.
2. Для включения освещения микроскопа в нормальную сеть с
напряжением 120 вольт к прибору прилагается трансформатор в
8 и 15 ватт.
15
ХАРАКТЕРИСТИКА ОБЪЕКТИВОВ
Таблица 1
Наименование объектива Собственное увеличение объектива Численная апертура Фокусное расстояние в мм Свободное (рабочее) расстояние в мм Видимое поле зрения с окуляром К 10х в лш
10 х 0,30 ЮХ 0,30 16,2 5,0 1,4
20 х 0,65 20 х 0,65 8,3 0,7 0,7
60 х 1,00 60 х 1,00 2,9 0,22 0,25
90 х 1,30 90х 1,30 2,0 0,11 0,15
Таблица 2
ХАРАКТЕРИСТИКА окуляров и общего увеличения микроскопа
Наименование окуляра Видимое увеличение Фокусное расстояние в мм Линейное поле зрения Общее увеличение с объективами
юх | 20Х бох 90х
К 5х 5х 50,0 25,0 75 150 450 675
К 7Х 7х 36,0 18,0 105 210 630 945
К 10х Юх 25,0 14,0 150 300 900 1350
3. Микроскоп МБИ-2 снабжен специальным панкратическим
конденсором, апертуру которого можно менять в соответствии с
апертурой применяемого объектива. На кронштейне панкратиче-
ского конденсора имеется револьвер, в котором смонтированы три
конденсора:
а) апланатический конденсор с апертурой 1,4, который при
совместной работе с панкратическим конденсором обеспечивает
непрерывное изменение апертуры осветительного устройства мик-
роскопа в пределе от 1,4 до 0,16;
б) конденсор с очковой линзой, с большим фокусным расстоя-
нием для наблюдения объектов слабыми объективами;
в) конденсор темного поля системы кардиоид для наблюдения
объектов в темном поле.
4. Тубус микроскопа съемный бинокулярный.
5. Столик вращающийся, центрирующийся при помощи вин-
тов, с возможностью фиксации передвижения верхнего диска сто-
лика по линейным шкалам с точностью до 0,1 мм, в предел^ от
0 до 50 мм по одному направлению и от 50 до 130 мм по другому.
Оптическая схема микроскопа с ходом лучей в нем показана
на рис. 6. Нить лампочки (/) через коллективную линзу (2), пря-
моугольную призму и собирательную линзу (3) проектируется в
плоскость апертурноц, ирисовой диафрагмы (4); далее изображе-
16
Рис. 5. Большой биологический микроскоп, модель
МБИ-2:
I — косопоставленный бинокулярный тубус; 2 — съемное
основание тубуса; 3 — сменный револьвер для четырех
объективов; 4 — подвижный крестообразный столик мик-
роскопа; 5 —основание подвижного столика микроскопа;
6 — часть конденсорного револьвера; 7~ кольцо для уста-
новки апертуры конденсора; 8— апертурная шкала; 9 —
винт тля установки апертурной диафрагмы; 10 — винт
для центрировки светового поля; // — кольцо апертур-
ной диафрагмы; 12 — вращающаяся апертурная диаф-
рагма; 13 — винт для центрировки крестообразного сто-
лика; 14 — винт для движения конденсорного устрой-
ства; 15 — макрометрический винт микроскопа; 16 — мик-
рометрический винт микроскопа; 17 — патрон осветитель-
ной лампочки; 18 — основание («ножка») штатива мик-
роскопа.
Микроскопическая техника
17
ние нити лампочки линзами панкрэтического конденсора (5, 6, 7 и
8) и линзами апланатического конденсора (5) через объектив (10)
микроскопа проектируется в выходной зрачок объектива.
Тубус микроскопа, для излома направления лучей под углом
45° к вертикальной линии, имеет призму (половина пентапризмы)
с двойным отражением лучей. Длина тубуса подобрана так,
7 2
Рис. 6. Оптическая система микроскопа МБИ-2.
Объяснение в тексте.
что (учитывая удлинение хода лучей в призме) соответствует нор-
мальной длине тубуса микроскопа в 160 мм.
6. Конструкция микроскопа предусмотрена для использования
только искусственного освещения, которое точно установлено при
сборке микроскопа, и поэтому регулировка его перед работой от-
падает.
Перед работой необходимо проверить, чтобы ирисовая апер-
турная диафрагма была на оси ее вращения, и для этого винт, сме-
щающий диафрагму, необходимо ввернуть до упора.
Для рационального использования осветительного устройства
надо соблюдать нижеследующие правила.
18
1. Светлое поле для объективов с большим увеличением. Апла-
натический конденсор подводят под объект (предварительно опу-
стив осветительное устройство для избежания удара апланатиче-
ского конденсора о столик микроскопа). Поднимают осветитель
до упора вверх при помощи кремальеры. На столик микроскопа
устанавливают препарат, предметное стекло зажимают между
специальными держателями, подводят нужный объектив, и тубус
фокусируют на резкое изображение объекта. В случае слишком
яркого освещения на ирисовую апертурную диафрагму в специ-
альное гнездо вкладывают светофильтр.
Апертурную шкалу устанавливают на деление, соответствую-
щее апертуре применяемого объектива; это условие необходимо
помнить при смене одного объектива другим.
При помощи специальных центрирующих винтов (см. рис. 5, 9,
10), перемещая собирательную линзу осветительного устройства,
добиваются резко очерченного и круглого поля зрения микро-
скопа.
Наилучшая резкость изображения объекта достигается регули-
ровкой диаметра ирисовой апертурной диафрагмы.
2. Светлое поле для объективов с малым увеличением (5 X).
Очковый конденсор подводят под объект (предварительно опу-
стив весь конденсор, как указано выше) и поднимают его до
упора.
Устанавливают препарат, как указано выше, и подводят нуж-
ный объектив; тубус фокусируют так, чтобы получить резкое изо-
бражение объекта. При слишком ярком освещении необходимо
поставить светофильтр на ирисовую диафрагму. Апертурную
диафрагму открывают до максимального диаметра. Затем сни-
мают окуляр, и наблюдение в тубус ведут глазом, при этом вра-
щают кольцо апертурной шкалы панкратического конденсора до
тех пор, пока поверхность объектива не будет целиком заполнена
светом. После этого вставляют окуляр и рассматривают объект.
3. При работе с темным полем под объектив подводят конден-
сор темного поля, на верхнюю поверхность которого наносят кап-
лю иммерсионного масла. На предметный столик помещают ис-
следуемый объект, и конденсор поднимают в верхнее положение,
пока масло не соприкоснется с предметным стеклом; при этом
должен получиться слой масла в виде кружка. По высоте конден-
сор устанавливают так, чтобы наблюдаемое в микроскоп темное
пятно, находящееся в центре освещаемого поля, исчезло и полу-
чилось бы равномерно освещенное поле. Это поле должно быть по
возможности наименьшим. Если темное кольцо не в центре поля
зрения микроскопа, то его необходимо перенести в центр при по-
мощи центрировочных винтов самого конденсора.
Кольцо апертурной шкалы следует поставить на отсчет 1, 4, а
ирисовую апертурную диафрагму — на максимальный диаметр.
В случае применения иммерсионных объективов необходимо
капельку масла поместить между препаратом и объективом. Объ-
2* 19
ективы должны иметь ирисовую диафрагму для ограничения апер-
туры.
В экспедиционных условиях могут быть полезны дорожные
микроскопы, например, микроскоп МБИ-4, помещающийся в
удобном и портативном футляре.
Среди последних зарубежных моделей микроскопов необходи-
мо отметить остроумную конструкцию исследовательского микро-
скопа, смонтированного вместе с микрофотоаппаратом (рис. 7).
Рис. 7. Большая модель исследовательского микроскопа, смонтированного
вместе с микрофотоаппаратом (модель «Ультрафот» «П» Цейса). Внешний
вид и схема устройства.
Для рассматривания мелких объектов при сравнительно не-
больших увеличениях (от 13,8 до 45) применяют бинокулярную
лупу. Лупа дает прямое, рельефное изображение; расстояние от
объектива до предмета довольно значительное: от 75 до 129 мм.
Объект исследования или препарирования помещают на специаль-
ном столике. Можно работать в проходящем свете или же осве-
щать объект сверху или сбоку.
Микроскоп МБС-2 является моделью стереоскопического
микроскопа, предназначенного для препаровальных работ или
исследования крупных биологических объектов, причем работы
могут вестись как при дневном свете, так и при искусственном ос-
вещении. Микроскоп МБС-2 позволяет применять увеличения от
3,5 до 119. Свободное расстояние микроскопа при всех увеличенн-
ого
ях остается постоянным и равно 64 мм. Столик микроскопа состо-
ит из круглого корпуса, внутри которого вмонтировано осветитель-
ное устройство. Специально сконструированный штатив микроско-
па позволяет широко пользоваться микроскопом при различных
экспериментальных работах. Для удобного положения рук иссле-
дователя при длительных экспериментальных работах при микро-
скопе М.БС-2 имеется пара подлокотников (рис. 8).
Общие замечания по работе с микроскопом
Исследование всякого объекта следует начинать с помощью
наиболее слабого объектива, что позволяет видеть большую пло-
щадь исследуемого объекта и дает возможность выбрать наиболее
Рис. 8. Стереоскопический микроскоп МБС-2.
удачное место объекта для исследования сильным объективом.
Подводя этот участок в центр поля зрения микроскопа, затем пе-
реключают револьвер на более сильный объектив (при этом иссле-
дуемый участок объекта будет оставаться в поле зрения микро-
скопа) и, если в этом будет необходимость, то переводят исследу-
емый участок снова в центр поля зрения и переключают револьвер
на еще более сильный объектив.
Наводка на фокус со слабыми объективами производится мик-
рометрическим винтом.
При сильных объективах точная фокусировка на объект дости-
гается при помощи микрометрического механизма. Так как рабо-
чее расстояние этих объективов очень мало (при точной фокуси-
ровке тубуса на объект расстояние между объективом и препара-
том составляет 0,2 мм), то можно легко раздавить препарат, ко-
21
торый нередко является научно ценным. Поэтому рекомендуется,
глядя сбоку, на уровне предметного стекла, опустить тубус вниз,
оставив минимальный просвет между объективом и препаратом,
а затем, наблюдая в тубус, поднимать его вверх при помощи мик-
рометрического механизма до появления изображения объекта.
При пользовании иммерсионными объективами между объек-
тивом и препаратом, а также между препаратом и конденсором
помещают иммерсионное масло.
Для нахождения определенных мест на препаратах употребля-
ется крестообразный столик. Препарат на крестообраз-
ном столике передвигается по двум перпендикулярным направле-
ниям. Один виит перемещает препарат впе-
ред и назад, другой — влево и вправо. Вели-
чина перемещения с точностью до 0.1 мм от-
считывается на шкалах I и III, снабженных
нониусами. Шкала II дает положение упора.
Таким образом, крестообразный столик поз-
воляет производить отсчетные передвижения
в двух взаимно перпендикулярных направ-
лениях. Положение определенной точки па
препарате дается соответствующими отсче-
тами на шкалах I и III. При повторном на-
хождении определенной точки на препарате
нужно только установить шкалы на ранее
Рис. 9. Схема рисо- установленные числа. Если микроскоп не
зального окуляра. имеет крестообразного столика, то пользу-
ются п р еп а р ато в од и те л ем, который
вставляется своими штифтами в отверстия столика. Препаратово-
дитель снабжен двумя шкалами и нониусом для определения ко-
ординат точек, интересующих наблюдателя. Препарат можно пе-
редвигать в продольном и поперечном направлениях.
Во многих случаях для маркировки определенного места на
препарате можно тушью обводить нужное место на покровном
стекле или, лучше, на обратной стороне предметного стекла.
Для рисования препаратов удобнее всего пользоваться специ-
альным рисовальным окуляром (рис. 9) или рисо-
вальным аппаратом (рис. 10), который надевается на ту-
бус микроскопа, как это показано иа рисунке. На фоне разложен-
ной иа столе бумаги наблюдатель видит в окуляр микроскопа, че-
рез призму рисовального прибора, увеличенное изображение пре-
парата, которое можно легко зарисовать, обводя карандашом ви-
димые контуры изображения. Для установки правильного соотно-
шения освещенности бумаги и препарата служат установленные в
барабане аппарата и секторе сменные светофильтры.
Из дополнительных приспособлений, полезных при работе с
микроскопом, надо указать: окуляр с указательной стрелкой, об-
легчающий демонстрацию препаратов; бинокулярную насадку для
монокулярного микроскопа.
22
Источником света при микроскопировании может служить сол-
нечный свет, но следует предпочитать окна, выходящие на север,
так как непосредственное попадание яркого солнечного света на
зеркало микроскопа сильно мешает работе. При работе с больши-
ми увеличениями лучше всего пользоваться искусственным осве-
щением, которое должно быть достаточно сильным и равномер-
ным. Для обычной работы можно пользоваться матовыми элек-
трическими лампами, примерно 60—100 ватт. Между лампой и
зеркальцем микроскопа помещают так называемый стеклянный
шар сапожников, который полезно заполнить специальным рас-
твором, играющим роль светофильтра.
Рис. 10. Рисовальный аппарат.
Для приготовления фильтров пользуются следующими рецеп-
тами:
Меднокупоросный фильтр: вливают в колбу 40 см3
крепкого аммиака и прибавляют к нему 12 капель раствора
20-процентного бледного купороса, подкисленного 0,5 см3 серной
кислоты. Взбалтывают, пока не растворится выпавший осадок, и
затем наполняют колбу до шейки дистиллированной водой; этот
фильтр применяется при изучении неокрашенных или слегка жел-
товатых объектов. ,
Ахроматический фильтр, употребляющийся при
электрическом освещении: в 400 см3 дистиллированной воды рас-
творяют 0.1 г анилинового синего. Смешивают в колбе 3 см3 этого
раствора с 9 см3 20-процентного медного купороса (подкисленно-
го 0,5 см3 серной кислоты) и наполняют колбу до шейки дистилли-
рованной водой.
М е д и о х р о м о в ы й фильтр: растворяют в 300 см3 воды
5 г сульфата меди и 5 г хромовых квасцов. Этот раствор особенно
пригоден для изучения красно-синих препаратов.
Ланжерон (1949) рекомендует при изучении препаратов, ок-
рашенных синими красителями, для усиления контрастности пре-
парата использовать в качестве светофильтра слабый раствор
оранжа G, а после окраски по Романовскому — слабый раствор
светлого зеленого.
23
Наилучшими осветительными приборами являются так назы-
ваемые осветители с то ч ечными лампами (рис.
И), особенность которых заключается в том, что источником све-
та в них служит маленькая дуга Петрова, образующаяся между
двумя вольфрамовыми шариками, укрепленными на концах нити.
Дута накаливает шарик добел'а и создает очень интенсивно све-
тящуюся точку, и таким образом получается пучок параллельных
лучей, дающих почти идеальное освещение препарата.
Рис. 11. Осветительная лампа для микроскопирова-
ния, модель ОИ-7.
Для измерения величины объектов пользуются измери-
тельными окулярами (обычно 7-кратного увеличения).
На внутреннюю диафрагму такого окуляра помещают стеклян-
ную пластинку с нанесенной на ней шкалой. Пластинку кладут
на диафрагму делениями вниз. Перед применением окулярного
микрометра для абсолютных измерений необходимо определить
значение его делений. Величина этих делений меняется в зависимо-
сти от увеличения взятого объектива и длины тубуса. Для этого
используют о б ъ е к т-м и к р о м е т р, представляющий собой
предметное стекло с точно нанесенной шкалой, каждое деление ко-
торой равно 0,01 мм. Поместив объект-микрометр на столике мик-
роскопа, устанавливают его штрихи параллельно штрихам окуляр-
ного микрометра и совмещают какие-либо два деления того и дру-
гого. После этого отсчитывают, скольким делениям окулярного
микрометра соответствует данное число делений объект-микро-
метра. Если, например, 2 деления объект-микрометра совпали с
12 делениями окуляр-микрометра, то одно деление будет равно
1,66 и-
24
Для длительных наблюдений над клетками и тканями тепло-
кровных животных, для изучения культур тканей in vitro,
а также для различных исследований над влиянием температур-
ного фактора, необходимо пользоваться нагревательным
столиком, легко монтирующимся на предметном столике мик-
роскопа. Весьма удобен нагревательный столик с автоматическим
терморегулятором, дающий температуру в интервале от —20 до
+60° и тем самым позволяющий производить опыты с действием
как охлаждения, так и нагревания (рис. 12).
Рис. 12. Микроскоп с нагревательным столиком, со-
ветская модель.
Сама собой понятна необходимость сохранять микроскоп в
чистоте. В нерабочее время микроскоп лучше всего накрывать
стеклянным колпаком. Пыль вытирать мягкой и чистой тряпкой.
Смазывают микроскоп очень редко. Старое загустевшее и загряз-
ненное масло вытирают тряпочкой, смоченной бензином. Капли
кедрового масла или бальзама, попавшие на микроскоп, удаля-
ют бензином или ксилолом.
Для очистки фронтальных линз объективов от пыли употреб-
ляют очень мягкую и чистую кисточку, предварительно промы-
тую в эфире. Если есть необходимость, то протирают поверхность
линзы батистовой тряпочкой, слегка смоченной в бензине (не
25
пользоваться ксилолом или хлороформом, растворяющими веще-
ства, склеивающие линзы объектива). После работы с иммер-
сией излишнее масло стирают сперва сухой, а затем смоченной
в бензине батистовой тряпочкой. Не следует пользоваться для
очистки линз спиртом.
Разрешающая способность микроскопа при использовании
обычного освещения равна 0,2 г, причем надо помнить, что при
данных условиях форма частиц, меньших 1 ц, искажается тем
больше, чем меньше сама частица, а предельно малые частицы
мы видим шаровидными вне зависимости от их действительной
формы. Повышение разрешающей способности микроскопа мо-
жет быть достигнуто применением для освещения более коротких
лучей. С этой целью могут быть использованы ультрафиолето-
вые лучи, увеличивающие разрешающую способность до 0,11 Н.
Применение темного поля, микрополяризациоипого анализа,
флуоресцентной микроскопии, фазово-контрастного метода и
микроспектрографин в ультрафиолетовых лучах значительно
расширяет пределы обычного микроскопического изучения. Пе-
речисленные методы в комбинации с биофизическими и биохими-
ческими экспериментами позволяют исследователю анализиро-
вать не только новые свойства микроскопических структур, но и
изучать субмнкроскопическое строение клеток и тканей.
Дальнейшее проникновение в мир малых объектов, недоступ-
ное самым совершенным световым микроскопам, стало возмож-
ным лишь при использовании в микроскопии электронных лучей,
обладающих длинами волн, во много раз более короткими, чем
световые лучи. Приборы, в которых с помощью электронных
лучей получают изображения исследуемых объектов, получили
название электронных микроскопов.
ЭЛЕКТРОННЫЙ МИКРОСКОП
Около тридцати лет тому назад математически была доказа-
на глубокая аналогия, существующая между действием симмет-
рического магнитного или электрического поля на электронный
луч и действием стеклянной линзы на световой луч. На основе
этих открытий была разработана новая наука — электронная
оптика. Благодаря использованию преломляющих свойств таких
полей и были построены электронные микроскопы. Электронный
микроскоп и схема его строения даны на рис. 13 и 14. Ход лучей
в таком микроскопе соответствует ходу лучей в обычном микро-
скопе, перевернутом окуляром вниз, но вместо лучей света слу-
жат электронные лучи, «линзами» — электромагнитные поля
(рис. 15). Для получения изображения или фотоснимка иссле-
дуемый объект (бактерии, вирусы, клетки высших организмов,
тонкие срезы и т. д.) переносят на очень тонкую коллоидную
26
пленку, затем пленку коллодия с нанесенным на нее объектом
помещают в тубус электронного микроскопа, представляющий
собой полый металлический цилиндр, в котором с помощью спе-
циальных откачивающих насосов создают условия вакуума.
В отличие от обычного
светового микроскопа, в ко-
тором контрасты изображе-
ния определяются различием
показателей преломления
разных частей объекта, в
электронном микроскопе
контрасты изображения за-
висят от плотности массы
объекта. Поэтому для повы-
шения контрастности можно
пользоваться методами им-
прегнации (например, им-
прегнацией осмием и т. п.).
Слабое проникновение элек-
тронных лучей требует, что-
бы изучаемые объекты были
очень тонки. Надо также
указать, что электронные лу-
чи могут вызывать опреде-
ленные изменения в плазме
объектов и служить причи-
ной образования артефак-
тов.
Применением электрон-
ных лучей удалось чрезвы-
чайно повысить разрешаю-
щую способность микроско-
па (рис. 16).
: <4 И»
Рис 13. Электронный микроскоп
УЭМ-100.
Источником электронов
служит вольфрамовая про-
волока, нагреваемая элек-
трическим током. Электро-
ны, покинувшие нить, под
влиянием электрического по-
ля в 30—50 тысяч вольт при-
обретают большую скорость
благодаря ускоряющему напряжению, приложенному между
нитью и анодом. В центре анода имеется небольшое отверстие,
через которое пролетают электроны, используемые в дальнейшем
для получения изображения. Эта часть микроскопа — источник
электронов — получила название электронной пушки. Вылетев-
шие из «пушки» электроны летят далее по инерции и затем попа-
дают в поле первой конденсорпой линзы, которая изменяет на-
27
Рис. 14. Схематический чертеж маг-
нитного электронного микроскопа
ГОИ:
« — пушка; б — конденсорная лииза; в —
линза объектива: г — проекционная лииза;
д — фотокамера; е — диффузионный мас-
ляный насос; ж — клепанный переключа-
тель вакуума;
/— люк для смены объекта; 2 — окошко
для наблюдения промежуточного изобра-
жения; 5— окошко для наблюдения конеч-
ного изображения; 4—световой микро-
скоп; 5 —люк для смены фотопластинок;
6 — вакуумпровод; 7 — поводки передви-
жения объектива; 8 — ручка управления
пушкой микроскопа; 9 — ручка управления
вакуумной системой микроскопа.
правление их движения таким об-
разом, что они собираются на ис-
следуемом объекте. Длины волн
этих электронных лучей во много
раз короче световых; например,
для электронов, прошедших уско-
ряющее поле в 50 тысяч вольт
(обычное в современных электрон-
ных микроскопах), длины волн
оказываются в 100 тысяч раз бо-
лее короткими, чем длины воля
видимого света.
Рис. 15. Сравнительные оптические схе-
мы электронного и светового микроско-
па. А—электронный микроскоп. Б —
световой микроскоп:
/ — катод — источник электронов; 2 — анодная
диафрагма*. <3 — конденсорная магнитная ка-
тушка; 4 — объект на коллоидной пленке;
$ —объективная магнитная катушка; 6— пло-
скость промежуточного изображения с от-
кидным флуоресцирующим экраном: 7—про-
екционная магнитная катушка; 3—оконча-
тельное изображение: 5 — флуоресцирующий
экран или фотопластинка: / — источник све-
та; //—диафрагма; /// — конденсор /Г —
объект на предметном стекле; V — линзы объ-
ектива; VI — плоскость промежуточного изо-
бражения; V// — фотоокуляр; VIII — оконча-
тельное изображение; IX — фотопластинка.
28
Современные электронные микроскопы дают полезное увели-
чение в 100 и более тысяч раз. Они позволяют видеть и изучать
объекты в 50—100 раз более ,
мелкие, чем наблюдаемые в —
световые микроскопы.
Советские электронные
микроскопы были разрабо-
таны и сконструированы
академиком А. Лебедевым,
В. Верцнером и Н. Занди-
ным в Государственном оп-
тическом институте.
В. Верцнер (1948) дал
следующее описание пер-
вой модели советского элек-
1ОООА ВООА
0,16)4 0,08)4
3
10А
0,0010)4
5
2,2А
0,001)2)4
Рис. 16. Сравнительная таблица вели-
тронного микроскопа.
Электронный микроскоп
имеет форму колонны, высо-
чин, характеризующих разрешающую
способность микроскопов.
Предельная разрешающая способА>сть
светового микроскопа в сиием свете и
тою примерно в метр, диа-
метром 130 мм, в которой
располагаются следующие
основные части (см. рис. 14):
1. Осветительная система
микроскопа, состоящая из
при косом освещении (/), ультрафиоле-
тового микроскопа (2), практически до-
стигнутая разрешающая сила современ-
ного электронного микроскопа (3), сред-
няя величина макромолекул (4), теоре-
тически возможная разрешающая сила
электронного микроскопа (а).
источника электронов —
электронной пушки — с последующей конденсорной линзой (маг-
нитной, как и все остальные), собирающей электроны на иссле-
дуемых объектах.
2. Камера препаратов с предметным столиком, допускаю-
щим перемещение их в двух взаимно перпендикулярных направ-
лениях.
2
3. Объективная линза, служащая первой ступенью увеличе-
ния и дающая увеличенное в 130 раз изображение исследуемых
объектов.
4. Проекционная линза — вторая ступень увеличения; увели-
чение ее может изменяться от 20 до 200 раз и тем самым общее
увеличение микроскопа — от 2600 до 26 000.
5. Фотокамера микроскопа с флуоресцирующим экраном для
наблюдения конечного изображения и устройством для смены
фотопластинок.
6. Вакуумная система, включающая насос предварительного
вакуума, диффузионный масляный насос и специальный распре-
делительный механизм, автоматически осуществляющий во вре-
мя работы микроскопа все необходимые вакуумные переклю-
чения.
Наконец, помимо самого микроскопа, для его работы имеет-
ся специальная установка электрического питания.
29
В передней части колонны микроскопа расположены смот-
ровые окошки, через которые ведется наблюдение изображений,
получаемых в флуоресцирующих экранах. Через окошко над
проекционной линзой рассматривают изображение с увеличе-
нием в 130 раз; это как бы грубый видоискатель, по которому
производится первоначальная установка образцов. Конечное
изображение рассматривают через большое смотровое окно в
нижней части прибора. Размеры смотрового окна позволяют
наблюдать изображение двумя глазами.
Под экраном находится кассета с фотопластинками (четыре
пластинки размером 4,5 X 5,5 см). Экран выполняет одновре-
менно и функции фотозатвора; поднимая экран, производят
съемку; в этом случае электроны падают непосредственно на фо-
точувствительпый слой пластинки.
Установку препаратов па предметном столике, зарядку и
удаление фотопластинок из микроскопа производят через спе-
циальные дверцы, имеющиеся в объективной линзе и фотокаме-
ре микроскопа.
Методика изготовления препаратов для электронной
микроскопии
Электронно-микроскопические исследования производятся
в основном в проходящих электронных лучах. В связи со способ-
ностью материи поглощать электронные лучи толщина объек-
тов не должна превышать 0,1 и.
Казалось, что столь жесткие требования, предъявляемые .к
исследуемым объектам, должны во многом ограничить исполь-
зование электронного микроскопа. Однако к настоящему време-
ни научились приготовлять препараты для изучения самых раз-
нообразных объектов (см. приложение, табл. I) большое число
исследований, уже проделанных, показывает с очевидностью, что
это ограничение преодолимо.
Чаще всего применяется способ нанесения объектов на тон-
кие однородные органические пленки, которые выполняют роль
предметных стекол. Эти пленки обычно приготовляются из 0,5—
1,5-процептного раствора коллодия в амилацетате. Капля этого
раствора выпускается на поверхность воды, находящейся в ши-
роком плоском сосуде, и после испарения амилацетата на ней
остается тончайшая пленка толщиною в 10 5—10"6 мм. Погло-
щение электронных лучей в таких пленках весьма незначи-
тельно.
Коллодиевую пленку обычно вылавливают на специальные
объектодержатели, в качестве которых применяются или метал-
1 Приложение (табл. I—VIII см. в конце книги).
30
лические диски диаметром в 2—4 мм с отверстием в центре в
0,05—0,1 мм, или диски из металлической сетки с большим чис-
лом отверстий (в Государственном оптическом институте при-
меняются сетки, имеющие до 100 отверстий па 1 мм2). Затем
на пленку наносят исследуемый объект в виде взвеси или
тончайших срезов. В первом случае каплю соответствующей
взвеси наносят на пленку при помощи проволочной петли или
пипетки; после испарения жидкости па пленке образуется тон-
чайший слой, подлежащий исследованию. Во втором случае пред-
варительно изготавливают срезы. Это делается следующим
образом.
Кусочки органов толщиной не более 2 мм, которые фиксируют
20—45 минут 1-процентной осмиевой кислотой, разведенной в
ацетатвероналовом растворе (pH—7—7,4), промывают физиоло-
гическим раствором 20—45 минут: обезвоживают последователь-
но в трех стаканчиках (15—20 минут в каждом) с абсолютным
спиртом. Затем объект проводят через 3 сосуда с бутиловым мета-
крилатом, в каждом по 15 минут. Окончательную заливку делают
в желатиновой капсуле, заполненной метакрилатом, куда перено-
сят объект и добавляют пероксид-бензоила (0,1 г на 10 см2 мета-
крилата), который является катализатором процесса полимериза-
ции.
Этот процесс тянется, примерно, 12 часов в зависимости от
качества примененных реактивов. После окончания полимеризации
в теплой воде растворяют желатиновую капсулу. Затем оставляют
пластмассовый блок затвердевать еще в течение 24 часов, после
чего скальпелем придают блоку пирамидальную форму и специ-
альным клеем прикрепляют его к столику микротома. Диаметр
поверхности, направленной к лезвию микротома, не должен пре-
вышать 2—3 мм. Для изготовления срезов служат специальные
микротомы с механическим выдвижением блока или ротацион-
ные микротомы, например, типа Спенсера, у которых выдвижение
блока происходит в силу термического расширения. Ножи изготав-
ливают из витринного стекла толщиной 8 мм. Его разрезают на по-
лосы, шириной в 4 см, которые в свою очередь разрезают на куски
размером, примерно, 2 см, причем разрез проводится в косом на-
правлении под углом в 45°. В качестве микротомного ножа исполь-
зуют край только что разрезанного стекла. Для каждого блока
следует изготавливать новый нож. Когда нож закреплен в ноже-
держателе микротома, пускают ток углекислоты до появления инея
на столике микротома. Сближают вплотную нож с быстро сокра-
тившимся в силу охлаждения блоком. Через несколько секунд,
когда в силу согревания блок снова приблизится к микротомному
ножу, быстрыми резкими движениями ручки колеса микротома
делают срезы. Когда расширение стержня, на котором укреплен
столик микротома, становится более равномерным (спустя не-
сколько минут), срезы делают реже; затем снова охлаждают угле-
кислотой и повторяют процесс изготовления срезов. Полученные
31
срезы кисточкой переносят на какую-либо поверхностно весьма ак-
тивную жидкость, например, на смесь ~ ----- — —
Резитбые
кольца S:
к бакуумой
устаноОке
Рис. 17. Схема прибора для «оттенения» ме-
таллами препаратов для электронной мик-
роскопии.
Объект
Циафраг-
воды и диоксана, где сре-
зы расправляются. Для
электронной микроскопии
отбирают срезы по их спо-
собности окрашиваться в
силу интерференции света
в разные цвета: более тон-
кие — в красный цвет, бо-
лее толстые срезы — в зе-
леный. Срезы переносят в
дистиллированную воду,
где их вылавливают на
специальные сеточки, по-
крытые коллодиевыми
пленками. Затем срезы,
находящиеся на пленке,
высушивают в термоста-
те, метакрилат удаляют
троекратным проведением
через амилацетат
хлороформ, после
срезы
тронном микроскопе.
В последнее время был
предложен метод, позво-
ляющий во многих случа-
ях значительно увеличить
контрастность изображе-
ния и тем самым повы-
или
чего
исследуют в элек-
сить разрешение, давае-
мое электронным микроскопом. Этот метод, названный «методом
теневых покрытий», заключается в том, что на исследуемые объ-
екты, или реплики, наносится испарением в вакууме тонкий слой
металла. Испарение производится под очень малым углом со
спирали, удаленной на сравнительно большое расстояние от об-
разцов, при этом, чем мельче объекты, находящиеся на поверхно-
сти препарата, тем меньше должен быть угол, под которым про-
исходит нанесение металла (рис. 17).
Для теневых покрытий применяют золото и хром.
На неровностях объектов, обращенных к спирали, откладывает-
ся слой металла, который отбрасывает тень на противоположную
сторону объекта. Количество конденсированного металла опреде-
ляется крутизной неровностей. По длине образующихся теней мож-
но судить о величине выступов на поверхности.
При исследовании таких препаратов в электронном микроскопе
получаются изображения с очень высокой контрастностью, что по-
зволяет значительно повысить разрешение.
32
Одним из преимуществ данного метода является также то, что
при таком способе можно наблюдать объекты размером всего
лишь в 10 А, причем такие, которые не могут быть обнаружены
обычным способом, т. е. без «теневых покрытий». Это объясняется
тем обстоятельством, что тень может быть значительно больше
самого объекта, дающего тень.
Таблица 3
СОПОСТАВЛЕНИЕ ПОКАЗАТЕЛЕЙ СВЕТОВОГО И ЭЛЕКТРОНКОЮ
МИКРОСКОПА
Показатели Световой микроскоп Электронный микроскоп
Длина волн Проходимость лучей Вид изображения Возникновение контрастности . Повышение контрастности . . 1. Изменение объекта .... 2. Другие средства Резкость глубины 400—800 ;п р Хорошая Абсорбция Коэффициент пре- ломления Окраска Темное поле Ограниченная 0,005 т р Слабая Абсорбция Плотность Импрегнация метал- лами Электронная апертура объектива Хорошая
Важнейшим условием, определяющим успех электроипо-мик-
роскопического исследования, является необходимая тонина
исследуемых срезов. Для изготовления таких срезов на кафедре
гистологии Московского университета применяется микротом си-
стемы Шестранда. В этом микротоме очень точная подача дости-
гается регулируемым термическим расширением специального
устройства, на котором закреплен объект исследования, а для
резки служат специальные тонкие стальные ножи (рис. 18). С по-
мощью микротома Шестранда можно получить срезы толщиной в
70-300 А
Однако толкование микрофотографий, полученных в электрон-
ном микроскопе, требует большою опыта и критической насторо-
женности, так как необходимо учесть не только изменения, вызван-
ные в протоплазме фиксатором, но и ряд других, связанных со спе-
цификой обработки материала для электронной микроскопии.
К ним относятся: сокращение объекта при заливке в метакрилат,
примерно на !/з—’А, деформация структур при изготовлении сверх-
тонких срезов, изменения, обусловленные полным высушиванием
клеток и, наконец, повреждения, вызванные тепловым эффектом
при бомбардировке протоплазмы потоком электронов.
3 Микроскопическая техника
РАЗДЕЛ ВТОРОЙ
МИКРОСКОПИЯ ЖИВЫХ ОБЪЕКТОВ
НАБЛЮДЕНИЯ НАД МЕЛКИМИ ОРГАНИЗМАМИ
И ИЗОЛИРОВАННЫМИ КЛЕТКАМИ
При исследовании живых объектов мелкие организмы (про-
стейшие, коловратки, водоросли и т. п.) непосредственно из среды,
где они культивируются, переносят на предметное стекло и накры-
вают покровным стеклом. Быстро движущиеся объекты стагГовятся
доступными наблюдению, если на препарат нанести немного гум-
миарабика или вишневого клея. Можно также положить под по-
кровное стекло немного очень тонко расщипанной ваты или не-
сколько более толстых волоконец хлопка; при этом животные, за-
ключенные между соседними волоконцами, имеют ограниченное
пространство для движения. Если изучаемые организмы относи-
тельно крупны, то К углам покровного стекла приделывают «воско-
вые ножки», которые должны быть чуть повыше исследуемых
объектов. Покровное стекло берется двумя пальцами за края и че-
тырьмя углами его осторожно соскабливают с воскового шарика
столько воска, чтобы «ножки» получили надлежащую высоту.
Когда хотят ограничить движения животного, слегка прижимают
«восковые пожки»; при этом объект осторожно зажимается между
предметным и покровным стеклами (удобно для более крупных
Protozoa, Cladocera, Copepoda, маленьких червей и т. п.) Прн
испарении воды тонкие покровные стекла могут слегка проги-
баться, так что лучше прокладывать между предметным и покров-
ным стеклами осколки покровных стекол, тонкие кусочкн стекла,
волосы и т. п. Если организмы потребляют мало кислорода, то
можно окаймить покровное стекло парафином и этим помещать
испарению. Для обрамления употребляют согнутую под прямым
углом проволоку, один конец которой приблизительно равен шири-
не предметного стекла. К другому концу приделывают деревянную
ручку. Парафин слегка согревают до жидкого состояния, погружа-
ют в него согнутый конец проволоки, которым затем проводят меж-
ду предметным и покровным стеклами со всех четырех сторон, по-
ка края не будут вполне замкнуты. Окантовка должна несколько
34
заходить на покровное стекло. При этом лучше, чтобы капля жид-
кости под покровным стеклом не заполняла всего пространства,
а была бы настолько мала, чтобы края покровного стекла остава-
лись свободными. Можно ввести- под покровное стекло зеленые
водоросли, которые выделяют кислород, необходимый для дыха-
ния исследуемого объекта; при этом наблюдаемое животное дли-
тельное время остается живым.
Простейшие животные, образующие в культуре поверхностные
пленки, берутся таким способом: покровное стекло кладут на не-
которое время на пленку и затем снимают; при этом различные
простейшие обычно прилипают к поверхности стекла.
Гораздо труднее исследовать живую клетку из ткани. Ее надо
изолировать, причем всегда приходится считаться с нанесенными
повреждениями. Задача исследователя — сделать эти повреждения
возможно меньшими.
Проще всего проводить наблюдение живых растительных кле-
ток, причем часто можно исследовать целиком маленькие листоч-
ки, корневые волоски или же можно снять неповрежденными плен-
ки эпидермиса. Также относительно легко изучать тонкие живот-
ные покровы, как мезентерий, плавниковые перепонки маленьких
рыб и т. п. Все манипуляции надо производить в средах, соответ-
ствующих данному объекту (см. стр. 77). Объекты всегда должны
быть влажными. Если наблюдение прерывается на короткое время,
препарат кладут во «влажную камеру». Крупные клетки легко
можно поместить под покровным стеклом. Если надо исследовать
клетки массивного органа, то приходится либо делать срезы брит-
венным ножом, либо же расщеплять кусочек ткани в подходящей
среде препаровальными иглами, по возможности под препароваль-
ной лупой. Иногда можно получить изолированные клетки, соскаб-
ливая ножом поверхность увлажненного среза и ополаскивая кли-
нок ножа в соответственной жидкой среде. Если эпителий нельзя
снять,целым пластом, то эпителиальные клетки можно получить
соскабливанием. Само собой разумеется, что при этом клетки
иногда получают серьезные повпеждения. Хрящ можно резать
бритвой (сначала снять чистой полотняной тряпочкой прилежащие
ткани). При наблюдении растительных клеток следует отсосать из
межклеточного пространства воздух водоструйного насоса.
Не всегда легко различить, жива ли еще клетка. В таких случа-
ях лучше всего сравнивать ее с фиксированным препаратом; в
растительных клетках контролируют способность их к плазмолизу.
Во время пребывания растительной клетки в искусственной среде
не должны появляться признаки плазмолиза; точно так же на-
бухание или сморщивание животных клеток указывает на то, что
среда уже не соответствует нормальным условиям.
Появление новых структур в плазме или ядре наблюдаемой
клетки (например, зернистостей, нитей и т. п.) может служить ука-
занием на ее патологическое состояние. В некоторых случаях необ-
ходимо прибегнуть к прижизненному окрашиванию клетки (см.
з* 35
стр. 66) метиленовым синим: как правило, ядро и плазма окраши-
ваются диффузио только в клетках погибающих или погибших.
Следует указать, что даже внутри висячей капли могут возникать
изменения среды. Среду либо разбавляют бидистиллированной во-
дой, либо дают испариться воде, если осмотическое давление среды
понижается. Обычно pH (показатель концентрации водородных
ионов) среды должен быть около 7.
Если под каким-либо соображениям в препарат надо добавить
тушь, ее растирают в подходящей для объекта среде; точно так же
растирают кармин после того, как ои предварительно был вымо-
чен в бидистиллированной воде и затем высушен.
При изучении живых объектов под покровное стекло легко
можно ввести новую жидкость; при этом к одной стороне покров-
ного стекла прикладывают полоску промокательной бумаги, кото-
рая отсасывает из-под него жидкость, а с противоположной сто-
роны пипеткой вводят новую среду: растворы красителей, реак-
тивы и т. п. Эту смену среды можно еще ускорить, если покрыть
обрамляющей массой края покровного стекла, параллельные длин-
ным краям предметного стекла.
Можно также исследовать мелкие организмы и изолированные
клетки в «висячей капле». Для этого употребляют предметные
стекла с круглым отшлифованным углублением. Взамен таких
предметных стекол можно пользоваться обычными предметными
стеклами, на которых при помощи канадского или пихтового баль-
зама укрепляют кольца, вырезанные нз стеклянных трубок. На по-
кровное стеклышко наносится капля среды с находящимся в ней
наблюдаемым объектом. Покровное стекло быстро переворачивают
так, чтобы капля оказалась висящей снизу, н покровное стекло
накладывают на углубление предметного стекла. Чтобы ие проис-
ходило запотевания стенок образовавшейся камеры, необходимо
слегка увлажнить предметное стекло и прежде всего его углуб-
ление. Все эти манипуляции следует производить быстро, чтобы
возможно меньше жидкости испарилось и не наступили изменения
в среде. Этот метод наиболее подходит для тонких наблюдений над
живыми объектами. Чтобы избежать испарения, нужно покровное
стекло окаймить вазелином.
Для исследования клеток или маленьких живых объектов реко-
мендуется употреблять пластинки из сердцевины бузины толщи-
ной в 20—40 р, которые нарезают бритвой из хорошо высушенного
куска и кладут в каплю изучаемой среды под покровное стекло.
Эти пластинки насыщают красящими веществами, которые они
медленно отдают объективам.
Пластинки из сердцевины бузины употребляются также для
«уловления» лейкоцитов: их вводят, например, в спинной лимфа-
тический мешок лягушки, зашивают и оставляют там по крайней
мере на несколько часов, при этом лейкоциты в большом количе-
стве собираются в кусочке бузины. «Уловленные» таким образом
лейкоциты могут служить для наблюдений и экспериментов.
36
ПРИЖИЗНЕННЫЕ НАБЛЮДЕНИЯ С ПОМОЩЬЮ СПЕЦИАЛЬНОЙ
ОПТИЧЕСКОЙ аппаратуры
При микроскопии живых объектов большую пользу приносит
применение «темного поля», основанного на принципах ультрамик-
роскопии, поляризационного микроскопа, флуоресцентного или фа-
зово-контрастного микроскопа, а также различных приборов, по-
зволяющих вести наблюдения в падающем свете.
Все эти приспособления расширяют возможности классической
микроскопии.
Исследование живых клеток и тканей в темном поле
В своем первоначальном виде ультрамикроскоп был для био-
логии мало применим. Лишь в 1903 году был сконструирован над-
Рис. 18. Микротом системы Шестравда для сверхтонких срезов.
лежащий конденсор, который позволил применить принципы
ультрамикроскопии в изучении биологических объектов. Затем
были сконструированы параболоид и кардиоид-копденсор (рис. 19,
20), которые дают большие возможности анализа биологических
объектов в темном поле.
37
Сменный конденсор позволяет по желанию использовать тем-
ное, светлое поле или смешанное освещение объекта (рис. 19).
Рис. 19. Схематический разрез
Параболоид-конденсор Зидентоп-
фа представляет собой одполипзо-
вый конденсор, в котором централь-
ная часть светового пучка, отражае-
мого зеркальцем микроскопа, задер-
живается звездчатой диафрагмой.
Краевые лучи свободно проходят
через кольцевую шель диафрагмы и,
отражаясь от вогнутой параболиче-
ской поверхности линзы, фокусиру-
ются вне ее пределов (см. рис. 19).
Этот конденсор лишен преломляю-
кондснсора темного поля. щих поверхностей, а имеет только
отражательные; он и требует объек-
тивов с диафрагмами. Задача наиболее резкого фокусирования
лучей, выходящих из конденсора, была разрешена при конструи-
ровании кардиоид-конденсора, так как оказалось, что наиболь-
Рис. 20. Схемы устройства параболоид-кондепсора (/) и устройства и хода
лучей в сменном конденсоре (Б):
1—объектив микроскопа; 2— объект; 3—-предметное стекло; 4— линза конденсора;
5 — диафрагма, 6 — эмалированный экран; 7 — зеркальная поверхность.
шая интенсивность освещения достигается при замене парабо-
лоидных отражательных поверхностей кардиоидными. В кар-
диоид-кондепсоре краевые лучи сперва отражаются от выпуклой
поверхности, затем от вогнутой, после чего фокусируются вне кон-
денсора. Этот конденсор применяется только при иммерсии. Фир-
менные указания в отношении толщины предметного стекла дол-
жны соблюдаться еще строже, чем при параболоид-коиденсоре.
38
Точно также еще строже требования к чистоте предметных и по-
кровных стекол. Большое значение имеет толщина слоя исследуе-
мого препарата, находящегося между покровным и предметным
стеклом; она должна быть немного более глубины фокуса объек-
тива.
Хотя кардиоид-конденсор обладает отличными оптическими
свойствами, он все же слишком чувствителен для изменчивой тол-
щины биологического объекта.
Поэтому зтожио рекомендовать в первую очередь параболоид-
конденсор. Параболоид-конденсор вставляется в микроскоп на ме-
сто обычного конденсора, который при этом вынимается.
На рис. 19 дано схематическое изображение направления свето-
вых лучей в параболе щ-конденсоре.
Параболоидное зеркало отражает все параллельно падающие
лучи так, что они концентрируются в фокусе параболоида. Прн
этом конденсор устроен таким образом, что точка пересечения лу-
чей лежит как раз на поверхности исследуемого объекта. Если на-
блюдение ведется с объективом малой нли средней апертуры, то
никакие прямые лучи в объектив не попадают. Поле зрения в ми-
кроскопе представляется темным. Поэтому этот способ освещения
обозначают как освещение темного поля. Если же в точке соеди-
нения пучка световых лучей находятся частички или структуры,
оптически не гомогенные, то свет от них отражается н попадает
через тубус микроскопа в глаз наблюдателя.
Из всего сказанного совершенно1 ясно, что толщина предметно-
го стекла не может быть безразлична для качества изображения.
Поэтому для каждого конденсора темного поля специально указы-
вается толщина предметного стекла.
Иммерсионная среда, предметное стекло и покровное стекло
должны быть совершенно чисты. Рекомендуется мыть стеклянные
предметы спиртом и перед употреблением проводить через пламя
гс-релки.
Как источник света наиболее целесообразно употреблять спе-
циальную дуговую лампу для микроскопирования, дающую пучок
параллельных лучей. Для фильтрации тепловых лучей между
лампой и микроскопом ставят кювету около 6 см ширины с 7-про-
центиым раствором сульфата железа. При освещении темного по-
ля применяется только плоское зеркало микроскопа, так как пучок
световых лучей, поступающий в конденсор, должен быть парал-
лельным.
Из объективов рекомендуют ахроматы 8, 20, 40 н специальную
иммерсию для темного поля. Окуляры можно при темном поле при-
менять очень сильные: компенсационные окуляры до 25-кратного
увеличения.
При установке препарата необходимо обратить внимание на
следующие моменты:
1. Иммерсионная среда ие должна содержать пузырьков воз-
духа.
39
2. Свет следует хорошо центрировать. Плоское зеркало микро-
скопа должно быть полностью и совершенно равномерно освещено.
3. На конденсор наносится капля кедрового масла. Она должна
целиком заполнить пространство между конденсором и предмет-
ным стеклом с препаратом. Мельчайший пузырек воздуха в капле
масла может повредить наблюдению в темном поле.
4. Установка зеркала микроскопа при исследовании препарата
Рис. 21. Схема правильной (3) и
неправильной (/, 2) установки
освещения при работе с темным
полем.
Если смотреть сверху на препарат, по-
ложенный на предметный столик, то
можно определить правильность осве-
щения по световому кольцу или пятну
на препарате. Если видно световое
кольцо, а внутри его у переднего илп
заднего края второе, меньшее кольцо
или пятно (/), — значит зеркальце мик-
роскопа установлено неправильно. Ме-
няя положение зеркальца световое
пятно можно перевести в центр. Вто-
рой тип освещения (2) зависит от не-
правильной установки конденсора или
неподходящей толщины предметного
стекла. В этом случае надо перемещать
конденсор вверх и вниз, пока светлое
кольцо не превратится в едва замет-
ную точку, что является признаком
правильной установки освещения (5).
объективом 3 коррегируется та-
ким образом, чтобы при наилуч-
шем сохранении темного поля
объект изучения имел наиболь-
шую яркость.
5. Если установкой зеркала
этого нельзя достигнуть, осторож-
но поднимают или опускают кон-
денсор до тех пор, пока не будет
достигнута наиболее благоприят-
ная установка зеркала. Обяза-
тельное условие — надлежащая
толщина предметного стекла.
Предметные стекла — не толще
1 —1,1 мм, покровные — 0,2 мм,
иначе объект не будет лежать в
фокусе конденсора. Если пред-
метное стекло очень тонко, то точ-
ка соединения лучей лежит над
объектом. В этом случае следует
слегка опустить конденсор. Если
же предметное стекло слишком
толсто, то точка соединения будет
лежать ниже объекта, находяще-
гося на предметном стекле, и пра-
вильная установка при этом не-
возможна.
6. Толщина слоя между по-
кровным и предметным стеклами
должна быть по возможности
мала.
Верхняя поверхность покровного стекла должна быть сухой
и чистой.
7. Контрастность темного поля сильно снижается, если слон
препарата слишком толст, среда густа или содержит много свето-
преломляющего материала.
8. При использовании для наблюдения в темном поле обычных
объективов следует применять специальные вкладные конусные
диафрагмы, повышающие контрастность, т. е. разницу между не-
освещенным темным полем и освещенными частицами. Схему пра-
40
.вильной и неправильной установки конденсора темного поля см.
на рис. 21.
Наблюдение в темпом поле может оказать большие услуги ис-
следователю при изучении живых клеток. Существенно, что при ис-
пользовании темного поля достаточно даже не-
значительных различий в преломляющей спо-
собности разных клеточных органоидов или плазменных ком-
понентов для того, чтобы получить возможность четко наблюдать
их на темном фоне. Тем самым исследователь получает широкую
возможность наблюдать такие структуры, которые иными метода-
ми в живой клетке мы пока изучать не можем. Микроскопирование
в темпом поле позволяет нам проникнуть также в область ультра-
микронов. Явления, наблюдаемые здесь, аналогичны тем, которые
мы видим, когда солнечный луч, проходящий в темной комнате,
делает заметными для глаза отдельные мельчайшие пылинки, рас-
сеянные в воздухе. При применении специальных установок в тем-
ном поле можно наблюдать в суспензионных коллоидных системах
частицы величиной до 4—6 ту, а в эмульсоидных системах части-
цы до 30 ту. При этих наблюдениях надо помнить, что истинной
формы наблюдаемых частиц мы видеть не можем. Но подобные
исследования позволяют проникнуть в область субмикроскопиче-
ских структур и их изменений в живых клетках как в норме, так
и в условиях эксперимента.
Поэтому применение темного поля в цитологии и микробиоло-
гии очень велико; первые работы принадлежат II. Гайдукову
(1906).
Хорошими объектами изучения в темном поле являются сво-
бодноживущие и паразитические простейшие, особо пригодны не-
которые кровепаразнты (например, трипаносомы), кровяные эле-
менты как позвоночных, так и беспозвоночных, сперматозоиды,
различные изолированные клетки или тончайшие тканевые пленки
и т. п. (рис. 22 и 23).
Из ботанических объектов для изучения в темном поле пригод-
ны некоторые водоросли, например, Spirogyra, бесцветные клетки
гифов грибов, корневые волоски многих растений (например,
Triticum, Sinapis). изолированный эпидермис Allium сера
и т. д.
При изучении физиологии клетки почти невозможно обойтись
без темного поля, особенно при исследовании протоплазмы. Темное
пате позволяет проникнуть в тонкие изменения дисперсности кол-
лоидов плазмы. Прежде всего в темном поле значительно легче и
неоспоримее устанавливаются явления коагуляции, чем в светлом
поле.
Очень рекомендуется попеременно исследовать биологические
объекты в светлом и темном поле. Для этого имеются также спе-
циальные сменные конденсоры.
Применение темного поля дает очень интересные результаты
при изучении действия различных факторов (химических, темпе-
41
Рис. 22. Клетки в темном поле микроскопа: А — нормальный фибро-
бласт; хорошо видна бесструктурность ядра, четко видны митохондрии
и капли липидов; Б — та же клетка после фиксации 2-процентной осмие-
вой кислотой; очень незначительные изменения в форме н структуре;
В — нормальный фибробласт; Г--та же клетка после фиксации суле-
мой, видны значительные изменения, вызванные фиксатором (по
Стренджуэйс и Канти, 1927).
42
Рис. 23. Клетки в темном поле микроскопа: А — живые парамеции в темном поле
микроскопа; ярко выделяются кристаллические включения, молочно-белый микро-
нуклеус и пищевые вакуоли; пульсирующие вакуоли черные, диффузный серый
тон цитоплазмы зависит от присутствия мелких плазматических включений —
«микросом»; Б— живые лимфоциты таракана в темном поле микроскопа. Ядра
оптически пусты; в цитоплазме видны включения; В, Г — живые клетки (фибро-
бласты) из культуры ткани вне организма в темном поле микроскопа. Ядра бес-
структурны, четко видны нитевидные митохондрии; в нижней клетке виден вы-
ход ядерных веществ в цитоплазму (А, Б по Рису, 1938; В, Г по Людфорду, 1935)
43
ратурных и т. п.) на строение цитоплазмы, ядра, а также разнооб-
разных клеточных органоидов.
Характерные изменения протоплазмы можно наблюдать в тем-
ном поле при умирании клеток. Цитоплазма и ядро умерших кле-
ток начинают ярко светиться, в противоположность живой клетке,
у которой обычно цитоплазма кажется оптически пустой, и блестят
лишь более или менее многочисленные гранулы, а клеточное ядро
слабо диффузно светится.
Можно исследовать в темном поле и окрашенные различным
образом препараты. При этом наблюдается яркое свечение окра-
шенных бактерий, трепонем и т. д. Это свечение — эффект Бере-
ка—зависит от селективной дифракции. Для наблюдения поль-
зуются сухими системами объективов. Между конденсором и
предметным стеклом наносят каплю глицерина. На сухие окра-
шенные мазки можно нанести каплю кедрового масла, но без по-
кровного стекла. Метод оказался полезным при изучении многих
бактерий, например, при исследовании палочек Коха в толстых
мазках. Этот метод заслуживает применения и разработки также
и для цитологических исследований.
Фазово-контрастная микроскопия
Светлое поле дает хорошие результаты для окрашенных, а так-
же для контрастных объектов. Чтобы увеличить контрастность
объектов в светлом поле, необходимо сильно закрывать диафраг-
му конденсора. При этом, однако, происходит нежелательное
уменьшение разрешающей способности микроскопа, что, конечно,
неблагоприятно отражается на точности микроскопического изоб-
ражения.
Увеличение контрастности в темном поле имеет также свои
недостатки. Во-первых, в темном поле наблюдается картина, об-
ратная контрастному изображению в светлом поле. Темные места
(позитивные) будут в темпом поле светлыми, а светлые (негатив-
ные) — темными. Во-вторых, наблюдаемое различие в темном по-
ле всегда соответствует истинным различиям в препарате. Поэтому
в темном поле не всегда можно решить вопрос об имеющихся от-
личиях в толщине отдельных мест препарата.
Указанные недочеты, по-видимому, исключаются новым мето-
дом, получившим название фазово-контрастной микроскопии.
Основное достоинство нового, так называемого фазово-конт-
растного метода микроскопирования состоит в том, что он дает
в светлом поле зрения чрезвычайно контрастные изображения жи-
вых неокрашенных клеток и тканей.
Человеческий глаз и фотографическая тластннка реагируют
только па изменения амплитуды световой волны и не в состоянии
воспринять и учесть изменения ее фазы (задержки или ускорения).
44
Рис. 24. Схема фазово-коитрастиого
микроскопа; конденсор (К), снабжен-
ный специальной диафрагмой (Д);
объектив (О), внутри которого нахо-
дится специальная стеклянная пла-
стинка (/7), покрытая снаружи и в
центре веществом, слегка поглощаю-
щим свет и способным вызвать сме-
щение фаз (по Готере, 1949).
«Амплитудные» препараты являются, следовательно, контрастны-
ми, а «фазовые» — малоконтрастными и неудобными для наблюде-
ния. В обычной практике микроскопирования биологических объ-
ектов мы не встречаемся ни с чисто «амплитудными», ни с чисто
«фазовыми» препаратами, а имеем дело с комбинацией тех и дру-
гих при преобладании одного какого-либо типа.
Сущность фазово-контраст-
ного метода заключается в том,
что фазовые смещения световых
волн, образовавшиеся при про-
хождении через фазовые эле-
менты препарата, искусствен-
ным путем превращаются в ко-
лебания с иной амплитудой и
тем самым изображение фазо-
вых элементов препарата стано-
вится таким же контрастным,
как изображение амплитудных
элементов исследуемого объек-
та (рис. 24).
Для фазово-контрастной мик-
роскопии используются следую-
щие приспособления (рис. 25):
1) осветитель;
2) вспомогательный микро-
скоп малого увеличения, встав-
ляемый вместо окуляра;
3) фазовый конденсор с ре-
вольвером и специальными диа-
фрагмами для каждого объек-
тива;
4) специальные объективы
(ахроматы Ф10, Ф20, Ф-40 и
масляная иммерсия ФОИ90);
5) светофильтры (особо
удобен светофильтр, пропуска-
ющий зеленые лучи).
П. А. Генкель (1946) дает
микроскопирование может быть
освещении. Поэтому первой задачей является хорошая освещен-
ность поля зрения, что достигается получением четкого изобра-
жения нитей электролампы на апертурной диафрагме конденсора.
После получения на апертурной диафрагме четкого изображе-
ния нитей или шарика лампы (если лампа точечная) в осветитель
можно вставить матовое стекло. Нить лампы должна быть строго
центрирована по отношению к центру диафрагмы. Этого дости-
гают, перемещая лампу. Затем ставят препарат, закрывают ири-
совую диафрагму осветителя. Конденсор поднимают или опускают
45
следующие указания. Успешное
достигнуто только при хорошем
до тех пор, пока не получится наиболее резкое изображение
препарата, который виден при закрытой ирисовой диафрагме
осветителя.
Если поле зрения слишком ярко освещено, то следует поставить
дополнительный светофильтр. После того, как получено править-
Рис. 25. Приспособления для фазово-контрастной микроско-
пии.
В левом углу сверху — вспомогательный микроскоп; в пра-
вом углу сверху — фазовый конденсор с револьвером;
между ними сверху — меняющийся светофильтр в оправе
с ручкой. В середине — ахроматы 10, 20, 40 и 90 с футля-
рами. Внизу — диафрагма для светлого поля и фазового
контраста и светофильтр и фазовая диафрагма для модели
микроскопа МБИ-2.
ное освещение, центрируют диафрагму при помощи поворота зер-
кала.
Затем открывают ирисовую диафрагму осветителя так, чтобы
освещенным было все поле зрения микроскопа. Более сильно от-
46
крывать диафрагму не рекомендуется. Все указанные операции
производятся при положении диафрагмы фазового конденсора,
совпадающем с цифрой 0. После этого вместо окулятора встав-
ляется вспомогательный микроскоп и движением окуляра вспомо-
гательного микроскопа фокусируется резкое изображение темного
фазового кольца, а затем диск конденсора устанавливается па
цифру, соответствующую увеличению объектива и производится
центрировка обеих пластинок, т. е. диафрагмы конденсора и фа-
зового кольца в объективе. Необходимо их совместить так, чтобы
светлое кольцо диафрагмы тесно соприкасалось своими краями с
темным фазовым кольцом, что достигается смещением револьвера
конденсора при помощи винтов, находящихся с обеих сторон сто-
лика. После того, как кольцо диафрагмы центрировано, вспомога-
тельный микроскоп вынимается, вставляется окуляр, и препарат
рассматривается в фазовом контрасте. Сравнение со светлым по-
лем легко достигается перемещением столика конденсора на цифру
0. Центрировку кольца н диафрагмы при помоши вспомогательного
.микроскопа необходимо производить для каждого объектива в от-
дельности. При соблюдении всех указанных условий в фазово-кои-
грастном микроскопе получается четкое и ясное изображение даже
малокоитрастпых препаратов.
Фазово-контрастные приспособления бывают двух типов: поло-
жительный фазовый контраст, дающий темное изображение на
светлом фоне, и отрицательный фазовый контраст, когда полу-
чается светлое изображение объекта на темном поле.
При фазово-контрастном методе наблюдения можно использо-
вать микроскоп МБИ-2 с паикратическим конденсором. В этом
случае работа производится следующим образом.
1. Ставят в рабочее положение выбранные объектив и окуляр.
2. Кладут исследуемый препарат на столик микроскопа.
3. Включают освещение и устанавливают его па резкость, как
указано выше.
4. Полностью открывают апертурную диафрагму осветителя.
5. Заменяют окуляр на вспомогательный микроскоп 30; фоку-
сируют его на резкость изображения фазовой пластинки.
6. Вкладывают фазово-контрастную диафрагму. Во вспомога-
тельном микроскопе 30 теперь видно, кроме фазовой пластинки
(темное кольцо), эксцентрически расположенное, большего или
меньшего размера изображение кольцевой диафрагмы (светлое
кольцо).
7. Вращением винта апертурной диафрагмы и оправы диафраг-
мы центрируют кольцевую диафрагму с фазовой пластинкой, т. е.
совмещают светлое кольцо с темным.
8. С помощью апертурной шкалы панкрагпческого конденсора
устанавливают равные размеры кольцевой диафрагмы с фазовой
пластинкой.
9. Удаляют вспомогательный микроскоп 30 и заменяют его оку-
ияром.
47
Рис. 26. Фазово-контрастная микроскопия: А— клетка саркомы мыши;
Б — та же клетка во время деления (по Людфорду и Спнлсу, 1952);
в — нервная клетка спинального ганглия; Г—нервная клетка пиявки
(по Л. Б. Левинсону и И. П. Беловой).
10. Рассматривают исследуемый препарат.
Примечание. Необходимо иметь в виду, что при смене объектива
или препарата следует проверить центрировку кольцевой диафрагмы, кото-
рая, однако, не сменяется.
Многие микроскописты применяют с успехом фазово-контраст-
ный микроскоп не только для изучения живых объектов, но и для
исследования фиксированных мазков и срезов.
48
Значительные успехи достигнуты с помощью этого метода при
изучении различных видов живых микробов на разных стадиях
их жизненного цикла. Особо много исследований посвящено как
изучению структуры клеток (хромосомы, ядра, аппарат
Гольджи), так и анализу изменений, наблюдаемых в ней при
действии различных химических агентов и, особенно, фиксаторов.
Некоторые прозрачные ткани также доступны для прижизнен-
ного наблюдения в фазово-контрастном микроскопе. Широко
применяется фазово-контрастный микроскоп в клинических
лабораториях при изучении осадков мочи, вагинальных выделе-
ний, эйякулята, для счета и изучения ретикулоцитов и кровяных
пластинок, исследования простейших животных и их цист, живых
бактерий, процессов агглютинации, вирусов и вирусных телец,
а также для диагностики материала биопсий, особенно костиого
мозга, селезенки и злокачественных опухолей (рис. 26).
*
* А
Новый метод световой микроскопии предложен Вильска
(1953). Нанося на одну из линз объектива кольцевой слой сажи
(аналогичный фазовому кольцу фазово-контрастных объективов)
и установив в конденсоре кольцевидную диафрагму соответ-
ствующей апертуры, Вильска сконструировал микроскоп, дающий
эффект, подобный наблюдаемому при отрицательном фазовом
контрасте.
При этом получается чрезвычайно контрастное изображение
исследуемых микроскопических объектов. Идеи Вильска были
реализованы Рейхертом, выпустившим соответствующие прибо-
ры под названием аноптральных микроскопов.
М. А. Пешков (Москва) дал свою конструкцию аноптраль-
ного микроскопа, показав с его помощью значение этого метода
при исследовании малоконтрастных живых клеток (рис. 27).
Флуоресцентная микроскопия
Разница между обычным световым и флуоресцентным микро-
скопом состоит в том, что в нем препарат рассматривается
в свете, излучаемом самим препаратом во время облучения его
ультрафиолетовыми лучами. В то время как возбуждающие
флуоресценцию ультрафиолетовые лучи невидимы для глаза,
вторично возникающие в объекте лучи имеют более длинную
волну и относятся к видимой части спектра. Поэтому при наблю-
дении в флуоресцентном микроскопе видно на темном поле раз-
нообразное свечение частей объекта. После прекращения
облучения препарат в микроскопе невидим. Препараты, рас-
сматриваемые в флуоресцентный микроскоп, представляются
разнообразно и живописно окрашенными. Отдельные участки
4 Микроскопическая тенхнка 49
препарата, отдельные волокна и клетки в зависимости от их
химического состава флуоресцируют различно. Цвет н интенсив-
ность флуоресценции позволяют отличить друг от друга детали
различной природы. С помощью флуоресцентного микроскопа
удается выявить новые детали структуры, невидимые при обыч-
ном освещении, и дифференцировать элементы тканей различной
природы. В ряде же случаев непосредственно по цвету флуо-
ресценции можно определить природу вещества.
Флуоресцентный микроскоп (рис. 28) по существу представ-
ляет собою обычный микроскоп, к которому прилагается дуговая
лампа, служащая источником ультрафиолетовых лучей. Лампа
Рис. 27. Pleurosigma в аноптральном микроскопе (по
М. А. Пешкову, 1955).
снабжена коллектором и фильтродержателем. Так как часть
ультрафиолетовых лучей, освещающих объект, не абсорбируется
последним и может мешать микроскопии, то для устранения
ГО
этого явления в окуляр вставляется особый фильтр, поглощаю-
щий ультрафиолетовые лучи. В фильтродержатель помещается
«фильтр Вуда» — черное стекло, которое пропускает ультра-
фиолетовые лучи (4000—3200А) и задерживает почти все лучи
видимого спектра, однако пропускает красный цвет с длиной
Рис. 28. Схема установки для флуоресцентной микроскопии:
/ — дуговая лампа. 2—кварцевый коллектор (задняя часть); 3 — кюветка с раство-
ром сернокислой меди; 4 — кварцевый коллектор (передняя часть); 5 — ультрафио-
летовый фильтр; 6—призма; 7 — откидная пластинка из уранового стекла; 8— оку-
лярный фильтр, поглощающий ультрафиолетовые лучи.
волны больше 6500А. Эти лучи имеются в некотором количестве
в спектре излучения ртутной дуги, но их значительно больше
в спектре излучения угольной дуги. Для устранения длинноволно-
вого излучения применяют второй фильтр — 2,5—5-процентный
раствор сернокислой меди.
Объективы и окуляры флуоресцентного микроскопа могут
быть сделаны из обычного оптического стекла, так как здесь
наблюдение ведется уже в видимом свете. Можно пользоваться
сухими и иммерсионными объективами. Работы с микроскопом
ведутся в затемненной комнате с вентилятором для устранения
вредных тазов от источника освещения.
Лампа, применяемая при флуоресцентной микроскопии,
дает сравнительно длинные ультрафиолетовые лучи
(300—400 ту.), которые относительно слабо абсорбируются
стеклом. Это позволяет пользоваться обычным конденсором
и обычными предметными и покровными стеклами, не прибегая
к кварцевому конденсору и кварцевым предметным и покров-
ным стеклам. В качестве среды для заключения препаратов
применяют воду, физиологический раствор поваренной соли,
глицерин, нефлуоресцирующее парафиновое масло.
Для иммерсии следует употреблять нефлуоресцирующее
иммерсионное масло.
4* . 51
С помощью флуоресцентной микроскопии можно исследовать
также объекты, обладающие собственной флуоресценцией, т. е.
излучающие видимые световые лучи под влиянием ультра-
фиолетовых без какой-либо специальной обработки. Такой
собственной флуоресценцией обладает ряд веществ, например,
А и Вг канцерогенные вещества и т. п. Вторичной флуоресцен-
цией называют свечение, возникающее в объекте, обычно
флуоресцирующем только после обработки его веществами,
обладающими интенсивной флуоресценцией, например, особыми
красителям’н (см. табл. 4) •
Таблица 4
ВАЖНЕЙШИЕ ФЛУОРОхРОМЫ
Название флуорохрома Оптимальная концентрация Цвет флуорес- ценции Окрашиваются также
при длительной обработке при кратко- временной обработке
Для окраски ядер: Берберинсульфат 1 :500000 1 : 10 000 Желтый Цитоплазма
Трипафлавин 1 : 5 000 000 1 : 10 000 Желто- бледно-желтая, тучные клетки красные Цитоплазма
Нейтральный красный 1 :20 000 1 : 10 000 зеленый Темно- желто-зеленая Цитоплазма
экстра Экстракт Chelidonium Vio нераз- Неразведеп- красный Золоти- желтая, жир— синеватый Цитоплазма
веденного ный сто- желтая, жир—
Экстракт Rheum экстракта экстракт Желтый синий
Vioo нераз- '/2 ОСН. Желто- Жир золотисто-
веденного раствора зеленый желтый, мыш-
Для окраски цито- плазмы: Триацоловый желтый G экстракта 1 : 100 000 1 : 1 000 Синий цы—светло- зеленые
Для окраски нейт- рального жира: Геранин G 1 : 10 000 1 : 500 Синий
Фосфин 3R 1 : 1 000 000 1 : 10 000 Зеленый
Существует способ наблюдения в микроскопе первичной, или
естественной флуоресценции, когда свежий, ничем не обработан-
ный препарат дает свечение сам по себе, и вторичной флуо-
ресценции после обработки препарата веществами, способными
флуоресцировать.
52
Первичная, или естественная, флуоресценция препарата ме-
нее эффектна, чем вторичная, так как при последнем способе
удается получить большее разнообразие цветов и более резкую
дифференцировку картины объекта.
Собственная флуоресценция
Исследуют срезы или препараты, приготовленные путем рас-
щипывания свежего или фиксированного формалином (1 часть
формалина -}-9 частей воды) материала. Длительное пребывание
материала в формалине иногда вызывает в нем флуоресценцию,
которая раньше не проявлялась (например, у нейтральных жи-
ров). Соли тяжелых металлов, хромовая кислота, пикриновая
кислота способствуют исчезновению флуоресценции.
Особенно рекомендуется фиксировать материал методом высу-
шивания-замораживания (см. стр. 121).
Собственной флуоресценцией не обладают, как правило, ядра,
цитоплазма, эритроциты и нейтральные жиры; синяя и синеватая
флуоресценция наблюдается в коллагеновых и эластических во-
локнах, гиалиновом и эластическом хряще; желтая флуоресцен-
ция — в аргентафинных клетках кишечного тракта, паренхиме пе-
чени, в надпочечнике, гипофизе и в жировых каплях палочек ре-
тины (витамин); красную флуоресценцию дает склера, десцеме-
товая оболочка, а также овариальный гормон.
По данным Хаджиолова (1951) собственная флуоресценция
мышц голубовато-белая, надпочечника—зеленовато-желтая, лег-
ких — голубовато-белая.
Вторичная флуоресценция
Кроме собственной флуоресценции в некоторых составных
частях ткани обработкой определенными реактивами можно выз-
вать вторичную флуоресценцию, красочный эффект которой вы-
является лишь в некоторых частях препарата. При этом электив-
ная окраска получается при употреблении красителей только в
очень сильном разведении: например, ядра клеток при обработке
трипафлавином в концентрации 1 : 1000 не выявляются, в концен-
трации 1:5 000 000 ядра окрашиваются.
Степень окраски можно определить лишь под флуоресцентным
микроскопом.
Список применяемых красителей, а также места их специфи-
ческой локализации даны в табл. 4.
Для флуоресцентного анализа различных органов без наруше-
ния их связи с организмом поступают так, как это описывается
ниже (см. стр. 62 и рис. 34). При таких наблюдениях необходимо
следить, чтобы кровообращение органа не было нарушено. Поверх-
ность органа все время должна увлажняться физиологическим
раствором (для теплокровных животных подогретым до 379С).
53.
Помимо исследования собственной флуоресценции применяют
флуорохромы, которые вводятся в виде водных растворов живот-
ному подкожно, внутривенно или внутрибрюшинно. Для изучения
функций органов используют флуоресцин, избирательно окраши-
вающий цитоплазму, и трипафлавин, дающий прижизненную ок-
раску ядер. Таким образом, например, были проведены очень
ценные исследования по гистофизиологии почек и печени.
Для флуоресцентного анализа тканей изготовляют срезы
(15—20 и) на замораживающем микротоме или применяют, что
лучше, метод замораживания-высушивания. Можно также пред-
варительно фиксировать формалином и затем залить в парафин
по обычной схеме (во избежание флуоресценции случайных при-
месей, реактивы должны быть химически чистыми). На изготов-
ленные срезы — если не ограничиваются изучением собственной
флуоресценции — наносят пипеткой раствор флуорохрома, избы-
ток его отсасывают фильтровальной бумагой, после- чего пипет-
кой накапывают вод> и через 10—15 сек. отсасывают ее фильт-
ровальной бумагой, повторяя эту процедуру до тех пор, пока
фильтровальная бумага не будет оставаться бесцветной. Такие
флуорохромированные срезы заключают в глицерин или, подсу-
шив в парафиновое масло.
Флуоресцентная микроскопия сулит большие возможности для
изучения клетки, бактериологической и патогистологической диаг-
ностики, для изучения распределения ряда веществ в тканях и
органах, анализа проницаемости оболочек и т. д. Таким образом,
перед флуоресцентной микроскопией открываются значительные
перспективы и области физиологии и патофизиологии.
Флуоресцентная микроскопия позволяет обнаружить в клетках
и тканях многие лекарственные вещества. Например, присутствие
красного стрептоцида в срезах органов подопытных животных
можно установить даже при его концентрации 10Х1СГ10 в куб.
микроне; так же можно выявить в клетках и другие лекарствен-
ные вещества — сульфатиазол, сульфапиридин, инсулин, папаве-
рин, пенициллин и другие и тем самым исследовать локализацию
этих веществ, скорость проникновения и выделения и т. д.
Флуорохромироваиие клеток или тканей является сложным физико-хи-
мическим процессом, многие стороны которого изучены совершенно недоста-
точно. Экспериментальными исследованиями было установлено, что в про-
цессе окраски имеют значение: 1) концентрация водородных ионов в среде,
2) концентрация флуорохрома, 3) время окраски и 4) характер окрашивае-
мого материала.
Специфическая окраска клеток или тканей наступает только при опреде-
ленной величине pH среды.
Окрашиваемые элементы клеток имеют, как правило, амфотерный харак-
тер с изоэлектрической точкой, лежащей между pH 3—5. Исходя из э-foro,
катодные флуорохромы, обладающие положительным зарядом, могут окра-
шивать только, если pH > 5. Что же касается анодных красителей (кислых),
то они будут давать эффективную окраску только при значении pH ниже
изоэлектрической точки клеточного белка и опять-такн в пределах диссоции-
рованного состояния. Так, например, аурамии (щелочной флуорохром) в раз-
54
ведении 1 : 10 000 слабо красит при концентрации водородных нонов среды,
равной 2,02 (ниже изоэлектрической точки белка), вследствие того, что ка-
тион краски и белок заряжены одинаково положительно. Окраска аурамииом
дает наилучшие результаты при pH 3,5—9,1; в иной среде способность окра-
шивать резко падает, так как прекращается диссоциированное состояние ау-
рамина, В сильно щелочной среде pH > 11 краситель ие диссоциирован, но
молекулы его в силу липофильности могут накапливаться в липоидных ком-
понентах клетки (не связываясь с белками клетки), окрашивая их в бледно-
зеленый цвет.
Не все флуорохромы могут быть в одинаковой степени использованы при
окраске одного и того же микроорганизма.
Для окраски лептоспир пригодным оказался только примулни, а для
трипаносом, спирохеты возвратного тифа, лейшманий. плазмодия малярии
человека, а также для некоторых вирусов иаилучшне результаты окраски
получены с риванолом. Интересно, что примулин очень интенсивно окраши-
вает капли жира; это заставляет некоторых исследователей предположить,
что гпшмулии является специфическим красителем жиров и липоидов.
Для работы рекомендуется применять свежие растворы флуорохромов,
давностью не свыше 4 дней.
Поляризационная микроскопия
Применение поляризационного микроскопа дает очень цен-
ные результаты при изучении клеток и тканей. Рассматривание в
поляризованном свете позволяет часто различать тонкую струк-
туру препарата, его физико-химические свойства и т. п. По суще-
ству здесь речь идет о том, чтобы однопреломляющие (изотроп-
ные) тела отличать ст двоякопреломляющих (анизотропных).
Микроскоп должен иметь две поляризационные призмы (ни-
коли), из которых одна (анализатор) надевается на окуляр свер-
ху, другая (поляризатор)—на место конденсора под объектом
(рис. 29). Необходимым условием, кроме того, является наличие
в микроскопе подвижной гильзы конденсора и центрирующегося
вращающегося предметного столика. Оба николя (анализатор и
поляризатор) устанавливаются параллельно, поле зрения хорошо
освещается. При повороте анализатора на 90° (перекрещивающие-
ся николи) все поле зрения становится совершенно темным и
светятся только двоякопреломляющие элементы. Если при пере-
крещивающихся николях повернуть предметный столик на 360°,
то двоякопреломляющие объекты освещаются последовательно
четыре раза.
Лучше всего употреблять свежие или живые объекты, так как
при изготовлении постоянных препаратов реактивы изменяют их
преломляющие свойства. Срезы не должны быть слишком тонки-
ми, их необходимо тщательно освобождать от парафина и лучше
оставлять неокрашенными.
Микроскопия в ультрафиолетовых лучах
Многие вещества имеют характерные спектры поглощения
ультрафиолетовых лучей и вследствие этого их можно изучать в
структурах живой клетки или в фиксированной неокрашенной
55
в
Рис. 29. Поляризатор (Л) и анализатор
(5); В— схема поляризационного мик-
роскопа:
I —анализатор; 2— окуляр; 3 — объектив: 4 —
столик микроскопа: 5 — поляризатор; б — кон-
денсор; 7—зеркальце микроскопа.
ткани. Для микроскопии в
ультрафиолетовых лучах в
Государственном оптическом
институте Е. М. Брумберг
(1939) сконструировал* ори-
гинальный прибор МУФ-1.
В настоящее время имеется
несколько моделей МУФ
(ультрафиолетового микро-
' скопа). Основные черты
микроскопа модели МУФ-2
(рис. 30): источник света —
ртутно-кварцевая лампа;
кварцевый коллектор; газо-
вые светофильтры, выделяю-
щие отдельные области ульт-
рафиолетового спектра; мик-
роскоп с кварцевой оптикой;
трехпольная фотокамера.
Объективы МУФ-2 ахромати-
ческие, зеркально-линзовые.
Ахроматизм зеркальных объ-
ективов делает возможным
цветное зрение в ультрафио-
летовых лучах.
Исследуемый участок тка-
ни фотографируют трижды
(на одной и той же пластин-
ке) с помощью светофильт-
ров, выделяющих три различ-
ные области спектра. Подби-
рают те длины волн, которые
поглощаются веществами
клеток. Вещества, видимые
на фотографиях, будут раз-
ными на всех снимках. Три
полученных позитива уста-
навливают в особом прибо-
ре— хромоскопе (рис.
31). Один снимок освеща-
ют синими, другой—зеле-
ными, третий — красными лу-
чами. Три цветных изобра-
жения сводятся оптикой хро-
москопа в одно, где раз-
ными цветами будут выде-
лены различные вещества
клетки.
56
Ультрафиолетовый микроскоп позволяет производить при по-
мощи флуоресцирующего экрана и прямые визуальные наблю-
дения клеток и тканей.
Для микроскопии в ультрафиолетовых лучах материал фик-
сируют формалином или смесью Карнуа, так как эти реактивы
не меняют заметно поглощение ультрафиолетовых лучей элемен-
Рнс. 30. Ультрафиолетовый микроскоп
МУФ-2.
тами ткани. Заливка в парафин: срезы заключают в глицерин.
Покровные и предметные стекла кварцевые.
С помощью МУФ-2 был проведен ряд исследований нуклеино-
вых кислот (Е. М. Брумберг, Е. А. Моисеев, А. А. Ферхмин,
Л. Ф. Ларионов, 1947—1953). В нашей лаборатории (Г. И. Рос-
кин и В. Я. Бродский, 1953; И. М. Лимаренко, 1954) были изуче-
ны нуклеотиды, нуклеозиды и нуклеиновые кислоты (см. прило-
жение, табл. II и III). Микроскопия в ультрафиолетовых лучах
57
позволяет использовать для гистохимического анализа ряд био-
химических реакций, конечные продукты которых бесцветны в
Окуляр
,_ HuUtppDSMO
о СОъектиО
1
видимой области спектра, но сильно поглощают ультрафиолето-
вые лучи (Е. М. Брумберг, М. П. Бухман, В. Е. Козлов, 1952, в
нашей лаборатории В. Я. Бродский
и И. М. Лимаренко, 1954, 1955).
С помощью ультрафиолетового
микроскопа можно количественно
определять поглощение ультра-
фиолетовых лучей веществами
клетки (пропорциональное их кон-
центрации). Метод измерения по-
Рис. 31. Хромоскоп с фотокамерой «Киев» и схема хромоскопа:
/ 2 — зеркала; 3, 4 — полупрозрачные стекла; а, б, в —- цвет-
ные светофильтры: ЛБ— тройной снимок (Брумберг, 1942).
глошения ультрафиолетовых лучей различными компонентами
клеточных структур был разработан шведским ученым Касперссо-
ном (1936, 1940) и впоследствии усовершенствован как самим ав-
тором, так и многими другими исследователями. Ниже в разделе
«Количественное определение веществ в структурах клетки (цито-
фотометрия)» (стр. 291) дано описание этого метода.
58
Прижизненные наблюдения в вертикально падающем свете
Микроскопия живых объектов в падающем свете при слабых
увеличениях не требует особых приспособлений. Необходимо
лишь, чтобы животное, было неподвижно. Широко может быть
использовано освещение косо падающим светом. В практической
медицине относительно давно приведен этот метод. Аппаратура,
употребляемая при так называемой капилляроскопии и в офталь-
Рис. 32 Установка для прижизненного изуче-
ния органов крупных животных.
мологии может быть с успехом применена к исследованию живот-
ных и растений. При косо падающем свете, если исследование не
требует сильных увеличений, можно пользоваться обычным
микроскопом, применяя источник света, лучи которого падают на
лежащий объект приблизительно под углом в 45°. Для изучения
более крупных животных микроскоп прикрепляется к специаль-
ным штативам, позволяющим свободно передвигать его над
объектом (рис. 32). Косо падающий свет может быть использован
при работах с увеличеиениями до 150 раз. Чем сильнее увеличе-
ние, тем труднее осветить объект. Тогда прибегают к вертикаль-
но падающему свету.
Микроскопия в вертикально падающем свете сначала приме-
нялась при исследовании металлов. При перенесении метода
падающего освещения на исследование биологических объектов
обнаружилось, что отражающие поверхности, подобные металли-
ческим, весьма распространены в живых организмах; их оказалось
гораздо больше, чем это вначале можно было бы предполагать.
59
Такие поверхности обычно встречаются в тех объектах, в которых
прозрачный слой ткани лежит на непрозрачном слое, служащем в
качестве рефлектора; так, например, непрозрачная склера яв-
ляется идеальным рефлектором для исследования прозрачной .
коньюнктивы. Но очень часто ткань, лежащая под прозрачным
поверхностным слоем, слабо или совсем не отражает свет. В этих
случаях надо пользоваться специальной оптической аппаратурой.
Для освещения исследуемого объекта может служить сфери-
чески вогнутое полированное зеркало. Рассеянный этим зеркалом
свет ярко освещает помещенный на предметном столике объект.
Применяют обычную оптику для небольших увеличений и обычные
штативы (конденсор микроскопа при этом снимают), источником
света служит сильная лампа накаливания точечного типа или ду-
говая лампа, снабженная коллектором и расположенная примерно
в 40—50 см от микроскопа.
Инструментом для вертикального освещения служит также
опак-иллюминатор, который сконструирован так, что свет попада-
ет в тубус микроскопа сбоку, через особое отверстие, расположен-
ное поверх объектива, отражается перпендикулярно призмой или
стеклянной пластинкой, расположенной под углом в 45°, проходит
через объектив и падает на объект. При сильно рефлектирующих
объектах достаточно применения стеклянной пластинки, при сла-
бо рефлектирующих — необходима призма, дающая больше све-
та. Однако при этом угол падения света будет несколько иной,
чем угол падения от стеклянной пластинки, что иногда мешает
точному исследованию. Стеклянная пластинка дает более равно-
мерное распределение света, но менее яркое освещение объекта.
В щелевом опак-иллюминаторе и призма и стеклянная пластинка
соединены вместе в одном инструменте. Преимущества вертикаль-
ного освещения выявляются при средних и сильных увеличениях.
При исследовании малых животных опак-иллюминатор привинчи-
вается к тубусу обычного микроскопа. Для изучения крупных
объектов прибор подвешивается на специальном штативе. Более
совершенно построен ультраопак (рис. 33), в котором свет,
падающий сбоку, отбрасывается особым зеркалом с отверстием.
Это зеркало расположено под углом в 45° над объективом. Зерка-
ло отбрасывает свет на кольцеобразный конденсор, окружающий
объектив. В дальнейшем пучок света, проходя через конденсор,
падает на объект, причем поле зрения хорошо освещается. Недав-
но появился прибор панопак, в котором вертикальный опак-ил-7
люминатор и ультраопак соединены вместе и могут в некоторых
отношениях дополнять друг друга. Весьма полезно применять
ультраопак при работе с микроманипулятором для целей микро-
инъекции и других микрохирургических операций непосредственно
на живых клетках и тканях и патофизиологических проблем (на-
пример, динамика процессов дегенерации, изменения под влияни-
ем действия различных видов лучистой энергии- и т. д.). Микро-
скопия в падающем свете может оказать услуги при изучении
60
паразитов в живом хозяине: например, наблюдения над живыми
трипаносомами в крови крыс. Приведем некоторые примеры мик-
роскопии в падающем свете, позволяющие судить о ее методиче-
ских возможностях. В течение длительного всемени можно наблю-
дать нервы лягушки (п. peroneus) in situ u in vivo, в условиях нор-
мальной циркуляции крови и питания иерва, а нарушая целость
Рис. 33. Микроскоп с ультраопаком.
нерва — изучать в нем явления дегенерации. Аналогичные наблю-
дения можно проводить над центральной нервной системой, над
строением головного и спинного мозга лягушки и крысы, исследуя
также закономерности циркуляции крови в сосудистых сплетени-
ях мозга и циркуляцию спинномозговой жидкости в желудочках.
При витальной капилляроскопии человеческой кожи, в ногте-
вое ложе можно вводить металлическое зеркальце, служащее
очень сильным рефлектором.
В качестве «рефлектора» применяют также кончик хирургиче-
ской иглы, вводимый под кожу вкось (под очень острым углом),
почти на уровне ее верхней поверхности.
При наблюдениях сосудов кожи дорзальной поверхности луче-
запястного сустава поступают следующим образом: выбривают
61
участок кожи, затем отломанный конец хирургической иглы, слу-
жащий своеобразным рефлектором, втыкают вкось (под очень
Рис. 34. Установка для прижизненного изу-
чения внутренних органов мелких живот-
ных: А — общий вид установки; Б — де-
тали устройства предметного столика мик-
роскопа.
острым углом) на несколь-
ко миллиметров вглубь ко-
жи. Кровь при этом обыч-
но не показывается. Нано-
сят на кожу каплю иммер-
сионного масла; пред-
плечье с кистью укладыва-
ют на особый столик и ук-
репляют особым держате-
лем. Затем участок кожи
над рефлектором изучают
с масляной иммерсией в
вертикально падающем
свете.
При этом можно на-
блюдать детали структу-
ры кожного покрова, на-
пример, двояко контури-
рованные щелевые прост-
ранства между клетками
stratum spinosum с меж-
клеточными мостиками,
ядра клеток эпидермиса
и т. д.
Прижизненные
наблюдения над
внутренними органами
В качестве примера
можно указать на прижиз-
ненные наблюдения над
поджелудочной железой
белой мыши.
Белую мышь закреп-
ляют под микроскопом, в
специально спроектиро-
ванном столике. Приведен-
ный рис. 34 дает представ-
ление об этом приборе. Он
состоит из прочной доски
с большим четырехуголь-
ным отверстием. Справа и
слева от отверстия крепко
привинчены пробковые пластинки, которые служат для закрепле-
ния мыши в растянутом положении. Двумя большими винтами
столик укрепляется на большом крестообразном столике микро-
62
скопа. В обращенном к наблюдателю крае столика имеются спра-
ва и слева квадратные выемки, так что остается свободным до-
ступ рук к винтам для бокового передвигания препарата и столика.
Движение спереди назад производят с помощью крестообраз-
ного столика. Так как винт для его передвижения прикрыт насад-
кой, то здесь предусмотрен легко надеваемый и снимаемый доба-
вочный стержень. Для закрепления предметного стекла служат
два держателя, из которых левый подвижен. Эти держатели при-
креплены к крестообразному столику,' из которого их можно вы-
нимать и вставлять г, новый экспериментальный столик.
Необходимо также несколько изменить осветительный прибор,
так как конденсор не доходит до нижней поверхности лежащего
на экспериментальном столике предметного стекла. Приспособить
осветительную систему можно двояким способом: либо изготовить
особый конденсор с более высокой оправой, либо приспособить
специальное новое кольцо оправы, которое можно сменять.
Сама по себе техника прижизненных наблюдений над подже-
лудочной железой довольно проста. Животное должно находиться
в глубоком наркозе. Для этой цели можно применять в течение
5—6 часов эфирный наркоз, однако он имеет тот недостаток, что
во время наблюдения над объектом необходимо непрерывно сле-
дить также и за наркозом. К тому же при глубоком эфирном нар-
козе не удается сохранить белую мышь живой дольше 5 часов.
Для более длительных наблюдений удобнее применять аметол;
при этом животное очень долго остается в равномерно глубоком
наркозе. Зато с аметолом не всегда легко достигнуть надлежащего
наркоза: животное гибнет чаше, чем при применении эфира. По-
этому для более кратковременных наблюдений (до 5 часов) и для
особо ценных животных применяют эфир; для более длительных
наблюдений — аметол. Наркотизированное животное укрепляют
и растягивают при помощи 4 стеклянных игл на деревянной доске,
покрытой пробковым слоем. Затем левую половину живота мыши
слегка увлажняют водой и чуть-чуть натирают мылом. Животное
поворачивают головой к экспериментатору, натягивают пинцетом
стенку живота как раз у левой боковой складки и с натянутой
таким образом кожи сбривают волосы; затем в области располо-
жения селезенки делают маленький горизонтальный разрез кожи.
Как правило, темная селезенка просвечивает через брюшину:
иногда селезенка смещена и ее приходится специально отыски-
вать. Затем захватывают брюшину пинцетом, слегка оттягивают
ее и в области заднего конца селезенки делают небольшой разрез
брюшины. Величина разреза не должна превышать размеров се-
лезенки. Потом, очень осторожно захватывая селезенку пинцетом,
вытягивают ее так, чтобы задний конец выступал из рапы. Этим
собственно заканчивается операция. После этого стеклянными иг-
лами слегка растягивают животное на экспериментальном столи-
ке, положив мышь на спину так, чтобы она висела над большим
отверстием экспериментального столика и левым боком тела не-
63
сколько заходила на предметное стекло. На стекло наносят не-
сколько капель нагретого физиологического раствора. Затем пра-
вой рукой берут маленький кусочек сухой фильтровальной бумаги,
а левой широкий пинцет. Правой рукой кончиком фильтроваль-
ной бумаги несколько дальше вытягивают селезенку, а левой ру-
кой оттягивают брыжейку селезенки на предметное стекло, не
дотрагиваясь пинцетом до поджелудочной железы. Таким образом
брыжейка с поджелудочной железой растягивается на предметном
стекле в физиологическом растворе.
При более длительных наблюдениях полезно приделать к на-
кладываемому при этом покровному стеклу 4 маленьких ножки из
воска. Особенно надо избегать давления покровным стеклом на
то место, где брыжейка селезенки соединяется с отростком под-
желудочной железы, так как это может сильно ослабить крово-
обращение. Поэтому очень полезно один уголок покровного стекла
отломить или отшлифовать. Покровное стекло должно быть очень
тонким. От времени до времени надо под покровное стекло добав-
лять физиологический раствор.
Поджелудочную железу можно также окрашивать; при этом
краситель либо вводят через кровь, либо наносят па препарат еще
до наложения па него покровного стекла. Можно употреблять два
витальных красителя: нейтральный красный через ток крови и
янусовый зеленый, непосредственно окрашивая железу на пред-
метном стекле. В последнем случае каждые 2 секунды наносят
каплю свежего раствора янусового зеленого и отсасывают его
фильтровальной бумажкой. Через 3—5 минут наступает окраши-
вание клеток. Тогда прибавляют чистый физиологический раствор,
снова накладывают покровное стекло и исследуют при масляной
иммерсии. Окраска янусовым зеленым неравномерна, так как
брыжейка в разных местах различной толщины и в ней имеются
жировые участки, мешающие окраске. Поэтому раствор красителя
проникает на разную глубину.
Надо указать, что этим методом можно исследовать не только
поджелудочную железу. Например, легко удается микроскопиро-
вать в падающем свете почку белой мыши, а также другие орга-
ны, которые легко вытягиваются нз тела без нарушения их связи
с организмом.
Этот метод имеет особенное значение для преподавания в выс-
шей школе: таким образом легко демонстрировать секреторные
процессы, влияние разных раздражителей, прижизненную окра-
ску и т. п.
Большое значение для прижизненных наблюдений имеет ме-
тод «окошечек» Кларка. Метод заключается в введении прозрач-
ной камеры в ухо кролика.
Верхняя и нижняя пластинки камеры делаются из целлулоида.
Верхняя пластинка должна быть тонкой, чтобы можно было поль-
зоваться иммерсионными объективами. Покровная пластинка
имеет размеры 20 мм2, нижняя 18 мм2. Требуемый просвет камеры,
64
равный примерно 350 р.2, достигается применением четырех угло-
вых целлулоидных блоков и двух «столбов» внутри самой камеры.
Камеру вводят следующим образом: с намеченного места, близ
кончика уха сбривают волосы, поле операции тщательно моют во-
дой и мылом, затем стерильной водой и, наконец, 80-градусным
спиртом. Операция, конечно, производится стерильными инстру-
ментами. Место операции обезболивают подкожной инъекцией
кокаина. В наружной поверхности уха вырезают участок кожи,
соответствующий форме камеры, но несколько меньший по разме-
рам. Камера, предварительно наполненная стерильным физиоло-
гическим раствором, вводится в это отверстие так, чтобы край ка-
меры входил в подготовленную щель между кожей и хрящом.
Таким образом, края камеры перекрываются выступами кожи.
Камеру закрепляют шестью швами, причем иглу проводят через
кожу у края камеры, хрящ и кожу внутренней поверхности уха,
затем через всю толщу уха, после чего нитку закрепляют. Затем
в коже внутренней поверхности уха и в хряще делают надрез,
несколько меньший, чем размеры камеры. При этом^амера ста-
новится видна с внутренней и наружной стороны. КЦк*кожи по
линии надреза засыхают через несколько часов после операции,
и камера прочно закрепляется. Наблюдение с камерой можно про-
изводить в течение многих недель.
После операции в камеру Bpag^jgjr новообразующиеся ткани,
при этом можно наблюдать проц^^даврастания капилляров. На
вновь образовавшихся сосудах можно производить не только раз-
личные прижизненные морфологические наблюдения, но и самые
различные физиологические эксперименты. Эта же прозрачная ка-
мера может служить для опытов с трансплантацией в нее различ-
ных органов (селезенки, надпочечника, кости и т. д.). Этот метод
позволяет получить регенерирующие ткани уха кролика или же
ткани, которые можно искусственно пересаживать в камеру. Без
особого труда можно проводить эксперименты с влиянием на эти
ткани температуры, прижизненных красителей, медикаментов,
ядов и т. д. Могут быть поставлены опыты с периферической цир-
куляцией крови и лимфы, наблюдения над живыми нервами или
над функцией артериовенозных анастомозов и т. д.
Источником марковского метода являются работы Максимо-
ва и Циглера по изучению экспериментально вызванных процес-
сов воспаления. Для этой цели в подкожную клетчатку кролика
вводились стеклянные или целлулоидные пластинки, склеенные
таким образом, что между ними имелась щель, куда врастали бы
клетки соединительной ткани и сосуды. По извлечению из орга-
низма содержимое «микрокамер» целиком фиксировалось и ис-
следовалось обычными гистологическими методами. Метод око-
шечек Кларка был усовершенствован Вильямсом (1934). По этому
способу к коже кролика сбоку от лопаток до таза подшивают уз-
кую полоску целлулоида длиной 27 и шириной 6 см. Затем по
краям пластинки с трех сторон, за исключением апикального края,
5 Микроскопическая техника 6S
делают разрез кожи и подкожной клетчатки. Лоскут отсепаровы-
вают от мышц. Целлулоидовую полоску надрезают посредине и
весь лоскут перегибают вдвое таким образом, что каудальный
конец лоскута подшивается к апикальному его концу. Образуется
широкая дубликатура из кожи кролика, где естественная опора
заменена целлулоидовым лубком. Кожа иа теле стягивается клем-
мами, и кожный дефект закрывается. Кожный лоскут с боков за-
шивают тонким шелком и помещают в газовый бандаж, который
прибинтовывают к груди. Через 2—3 недели лоскут готов для
вживления камеры. В лоскуте, как и в ухе, вырезается отверстие
и вводится кларковская камера. Кролика при наблюдениях фик-
сируют на спине. В среднем через 8 дней начинается врастание
сосудов и соединительной ткани в камеру.
В 1917 году В. П. Филатов предложил оригинальный метод
образования круглого стебля для пересадки тканей. Воспользовав-
шись им, Г. В. Плисс (1955) смог разработать сравнительно про-
стой, доступный метод прижизненного микроскопического иссле-
дования тканевых структур в организме в условиях хронического
опыта (см. литературу).
Большого внимание заслуживает метод имплантации
в переднюю камеру глаза кусочков различных тканей.
Этот метод может служить для решения различных проблем экс-
периментальной цитологии и гистофизиологии.
В нашей лаборатории он применялся при изучении желез внут-
ренней секреции и в опытах с гетеротрансплантацией злокачест-
венных опухолей человека и животных.
Обычно, имплантированные кусочки хорошо приживляются,
в них могут врастать сосуды со стороны радужной оболочки. С по-
мощью сильной лупы, а для сильных увеличений — с помощью
ультраопака можно вести постоянные наблюдения над переса-
женной тканью. Техника имплантации весьма проста и легко
удается. Имплантация производится следующим образом. Под*-
опытное животное (чаще всего кролик, но можно морскую свинку
и др. млекопитающих) привязывают к операционному столику
и наркотизируют эфиром или хлороформом. После того как жи-
вотное уснуло, глазным скальпелем делают маленький разрез
между роговицей и склерой. Тонким пинцетом или копьецом осто-
рожно вводят в отверстие очень маленький кусочек ткани. Края
разреза быстро срастаются сами и обычно не требуется каких-
либо мероприятий, чтобы помешать имплантированному кусочку
выпасть наружу. Все манипуляции производятся, конечно, с со-
блюдением обычных правил асептики.
МЕТОДЫ ПРИЖИЗНЕННОГО ОКРАШИВАНИЯ
Общие замечания
Красители, обладающие минимальной токсичностью, так на-
зываемые витальные красители, применяются для выявления раз-
личных органоидов и анализа их изменений в цикле жизни кле-
66
ток, а также для изучения разных физиологических явлений, в пер-
вую очередь явлений проницаемости к лабильности протоплазмы,
и ее изменений под влиянием внешних и внутренних факторов.
Наблюдения над прижизненно окрашенными объектами обыч-
но требуют предварительных ориентировочных опытов, 'так как
для каждого объекта и каждого красителя необходимо подобрать1
оптимальные концентрации и условия, при которых достигается
наилучший эффект.
Кроме того, следует учесть влияние на витальное окрашивание
различных факторов — температуры, лучистой энергии, наркоти-
ков, кислот, щелочей и т. п. Многочисленные примеры такого
рода влияний приведены в работе Насонова и Александрова
(1940).
При окраске мелких водных животных, простейших, водорос-
лей, бактерий краситель можно прибавлять непосредственно к
среде, в которой живут эти организмы. При окраске объектов,
культивируемых in vitro па агар-агаровых средах, краситель мож-
но прибавлять к агар-агару.
Для окраски наземных животных краситель можно примеши-
вать к пище, но в большинстве случаев его необходимо инъициро-
вать. После внутрикожных и подкожных инъекций необходимо
место инъекции подвергнуть легкому массажу, что способствует
лучшему распространению красителя. При внутривенном введении
красителя его доза должна быть меньше, чем при подкожном
введении. Внутривенное введение красителя дает наиболее полное
проникновение его в различные части исследуемого животного.
Прижизненная окраска кислыми красителями и некоторыми
другими веществами
Трипановый синий — один из лучших кислых красите-
лей для витального окрашивания; хорошо сохраняется в ткани
при последующей фиксации объекта.
Для окраски растворяют 0,5 г красителя в 100 ел3 дистилли-
рованной воды или в физиологическом растворе, фильтруют и за-
тем, если необходимо, кипятят 10 минут для стерилизации. Поль-
зуются только свежими растворами, так как давно приготовлен-
ный раствор красителя меняет свои коллоидальные свойства; по-
вышается также его токсичность.
Краситель инъицнруется подкожно, внутрибрюшинно или вну-
тривенно. Лабораторным животным вводят подкожно примерно
следующие дозы: мыши и лягушке — от 0,5 до 1 с.и3, кролику—
от 10 до 15 с.и3 на 1 кг веса.
Окрашивание наступает после первой инъекции и усиливается
после повторных инъекций, которые можно производить с интер-
валами в 3—5 дней. Материал фиксируют через 24 часа после по-
следней инъекции.
Для приготовления срезов на замораживающем микротоме не-
большие кусочки ткани предварительно фиксируют в течение 20—
5* «
.120 минут в 10-процентном формалине (формалин разводится на
физиологическом растворе поваренной соли). Изготовленные сре-
зы можно докрасить кармином или нейтральным красным (к
100 см3 0,1-процентного нейтрального красного прибавляют 2 см3
уксусной кислоты: окрашивают примерно 1 минуту).
Окрашенные срезы ополаскивают дистиллированной водой,
осторожно обсушивают фильтровальной бумагой и переносят не-
посредственно в абсолютный спирт; затем проводят через ксилол
и заключают в бальзам.
Если нужно приготовить парафиновые срезы, то кусочки тка-
ни фиксируют в смесн: формалина 1 часть, насыщенного раствора
сулемы 8,5 частей.
Для выявления митохондрий обрабатывают объект одним из
специальных митохондриальных методов.
Очень хорошо сохраняет трипановый синий смесь «суза» (см.
стр. 120). Кусочек фиксируют обычно от 1 до 24 часов (в зависи-
мости от его толщины) и затем непосредственно переносят в
90-градусный спирт н далее заливают в парафин, как обычно.
Срезы докрашивают кармином или квасцовым гематоксилином;
при гематологических исследованиях срезы можно докрашивать
полихромной метиленовой синькой, по Романовскому, или метило-
вым зеленым — пиронином.
Исследования Ясвоина, Макарова, Глазунова и др. показали,
что частички трипанового синего накопляются в клетках в зоне
нахождения аппарата Гольджи; микротехнические детали даны в
указанных исследованиях.
Для окраски клеток в культурах ткани применяется 0,5-про-
центный трипановый синий, приготовленный на физиологическом
растворе; к культуре ткани прибавляют одну каплю раствора кра-
сителя. Окрашенные культуры фиксируют смесью «суза» 10—
20 минут, а затем докрашивают квасцовым кармином.
Прижизненно окрашенный материал можно подвергнуть, в за-
висимости от целей исследования, обработке по ряду других мето-
дов: декальцинации, импрегнации по Бильшовскому, окраске по
Ван-Гизону и т. д. Таким образом можно изучить нормальный н
патологический материал, пользуясь самыми разносторонними ме-
тодами.
После инъекции любого витального красителя можно отметить
интенсивную окраску близлежащих лимфатических узлов, затем
окрашиваются купферовские клетки печени, эндотелий капилляров
костного мозга, ретикулярные клетки селезенки и лимфатических
узлов, зобной железы н, наконец, при выделении красителя — от-
дельные участки почки. Для усиления эффекта окраски рекомен-
дуется делать повторные инъекции с интервалами в пять дней:
при этом весьма увеличивается окраска гистиоцитов различных от-
делов тела.
Для прижизненной окраски мелких водных животных, голо-
вастиков и водных беспозвоночных трипановым синим, водным
68
синим или витальным красным, рекомендуется помещать этих
животных в аквариумы, куда добавлен краситель. Концентрация
красителя должна быть 1 : 5000. Если раствор обесцвечивается, не-
обходимо снова прибавить краситель. Краситель накапливается
в некоторых отделах почки и почти одновременно появляется в
звездчатых клетках печени; в гистиоцитах соединительной ткани
окрашивание наступает позднее. Первое окрашивание у голова-
стиков наступает через несколько дней, интенсивное обычно через
пару недель. Отдельные кусочки тканей и органов головастика
можно рассматривать в физиологическом растворе. Целых окра-
шенных головастиков фиксируют в насыщенном растворе сулемы,
приготовленном на физиологическом растворе в течение 24 часов.
Затем промывают их в продолжение нескольких часов в дистилли-
рованной воде и, не иодируя, заключают обычно в парафин. Сре-
зы можно докрашивать гематоксилином Гансена с последующей
дифференцировкой пикриновой кислотой. Процессы выделения в
почке и печени можно изучать с помощью прижизненного окраши-
вания трипановым синим.
Литиевый кармин хорошо переносит фиксацию и дей-
ствие спиртов, но несколько более ядовит, чем трипановый синий.
Наилучший способ введения красителя — внутривенный.
Изготовление красителя: 2,5 г кармина растворяют в 100 см3
насыщенного раствора углекислого лития, кипятят на водяной
бане 10—15 минут, после чего фильтруют.
Перед введением красителя животным — из основного раство-
ра приготовляют 20-процентный раствор. Мышам краситель вводят
в хвостовую вену, начиная с дозы 0,2 см3. Обычно необходимы
многократные инъекции. Кроликам вводят Ю-процеитный раствор
по 10 см3. Кусочки окрашенной ткани фиксируют в 10-процентном
формалине (на физиологическом растворе поваренной соли); сре-
зы, изготовляемые на замораживающем микротоме, можно до-
крашивать гематоксилином. Для парафиновых срезов материал
фиксируют в 10-процентном формалине или в смеси 1 части фор-
малина и 8,5 частей насыщенной сулемы. Иодирования следует из-
бегать. Срезы докрашиваются квасцовым гематоксилином или ме-
тиловым зеленым — пиронином. Кусочки ткани, окрашенные ли-
тиевым кармином, можно также обрабатывать различными мето-
дами для выявления митохондрий.
Литиевый кармин употребляется для прижизненной окраски
культур ткани in vitro. К культуре пипеткой прибавляют каплю
20-процентного раствора красителя. Окрашенные культуры тка-
ни можно фиксировать вышеуказанными фиксаторами и докра-
шивать квасцовым* гематоксилином.
Тушь очень часто применяется для изучения явлений фаго-
цитоза. Обычно ее вводят внутривенно. Для этого приготовляют
10—20-процентиый раствор туши на дистиллированной воде, филь-
труют и для стерилизации кипятят 10 минут. Мышам вводят вну-i
69
тривеино 0,4 см3 10-процентного раствора; кроликам—2 см3
20-процентного раствора на 1 кг веса.
Кусочки ткани с частичками туши хорошо переносят фикса-
цию. Хорошим фиксатором служит смесь «суза». Срезы можно
докрашивать кармином.
Раствор туши используют также для изучения фагоцитоза в
культуре тканей.
Ferrum saccharatum (железный сахар) приме-
няется для изучения клеток ретикуло-эидотелиальной системы.
Раствор готовят на дистиллированной воде или на физиологиче-
ском растворе; для стерилизации его можно прокипятить. Раствор
должен быть свежеприготовленным.
Н. Г. Хлопин (1930) вводит лягушкам в лимфатические спин-
ные мешки 0,5 см3 5-процентного раствора железного сахара; че-
рез 24 часа наблюдается интенсивное накопление частиц железа
в купферовских клетках печени. После двухдневного перерыва
можно повторить инъекцию для усиления накопления частиц же-
леза.
В некоторых случаях следует делать 7—10 последовательных
инъекций железного сахара. Мышам вводят внутрибрюшинно
1 см3 4-процентиого раствора железного сахара однократно или
по 0,5—0,7 см3 четыре раза каждый третий день; внутривенно
вводят 0,7—1 см3 однократно; некоторые авторы указывают мень-
шую дозу — 0,3 слг или же рекомендуют вводить 0,5 см3 3-про-
центного раствора.
Кроликам вводят ежедневно в течение ряда дней и даже недель
по 2 см3 50-процеитиого раствора железного сахара (в физиологи-
ческом растворе поваренной соли); можно инъицировать кроликам
ежедневно 1 см3 30-процеитиого раствора в течение 4—6 недель.
Кусочки ткани фиксируют в 20-процеитном формалине. Изго-
товляют срезы на замораживающем микротоме. Железо в клетках
выявляют обычными микрохимическими методами. Срезы можно
затем докрашивать кармином.
Бесцветные карбинолы некоторых кислых красите-
лей, например, кислого фуксина, светлого зеленого, водного сине-
го обладают «элективной гистотропией», в отличие от своей цвет-
ной формы. Для получения элективного окрашивания указанные
красители растворяют в физиологическом растворе и в виде
2,5-процеитного раствора вводят подкожно. В организме краси-
тель переходит в свою бесцветную форму. Через некоторое время
фиксируют органы подопытного животного в формалине с уксус-
ной кислотой и, проведя через спирты и хлороформ, заключают в
парафин. Освобожденные от парафина срезы доводят до воды и
кладут иа несколько часов в 0,1 -процентную соляную кислоту.
Срезы вначале бесцветны, ио затем происходит восстановление
бесцветной, формы красителя в цветную. Этот метод окраски назы-
вают «непрямым витальным окрашиванием».
70
Прижизиеииая окраска основными красителями
Янусовый зеленый употребляют для прижизненной ок-
раски митохондрий в разведениях от 1 : 10 000 до 1 : 500 000 на фи-
зиологическом растворе поваренной соли.
При суправитальном окрашивании маленькие кусочки свеже-
вырезанной ткани кладут в бактериологическую чашку и пипеткой
приливают краситель.
Ткани теплокровных животных помещают в термостат на 10—
20 минут, а затем рассматривают в физиологическом растворе по-
варенной соли. Удобно окрашивать изолированные клетки, клеточ-
ные элементы крови и костного мозга. Для прижизненного окраши-
вания краситель инъицируется подопытному животному в разве-
дениях от 1 : 20 000 до 1 :50 000. Через 10—20 минут после инъек-
ции животное убивают и нужную ткань рассматривают в физио-
логическом растворе поваренной соли. Рекомендуется подержать
кусочек 1—2 минуты на воздухе и лишь затем покрыть его по-
кровным стеклом.
Для окраски клеток культуры ткани к ней добавляют каплю
янусового зеленого (1 : 40 000), помещают на 5—10 минут в тер-
мостат при температуре 37° и затем рассматривают, пользуясь на-
гревательным столиком, под микроскопом.
Нейтральный красный используется для прижизнен-
ной окраски цитоплазмы и ядер, внутриклеточных зернистых обра-
зований, а также в качестве индикатора; в комбинации с зеленым
Янусом для дифференцировки двух родов гранул цитоплазмы. Ме-
тод прижизненной окраски нейтральным красным был широко ис-
пользован рядом советских исследователей (Хлопвн, Насонов,
Александров, Айзенберг, Кедровский и др.) для решения различ-
ных вопросов физиологии клетки. Для суправитальной окраски
употребляют разведения 1 : 20 000—1 : 50 000. Для окраски изоли-
рованных клеток, а также клеток крови и костного мозга приготов-
ляют 1-процентный раствор нейтрального красного на абсолютном
спирте (или смесь равных частей нейтрального красного и янусо-
вого зеленого); раствор фильтруют, пипеткой наносят каплю кра-
сителя на чистое предметное стекло и дают испариться спирту. За-
тем на предметное стекло, предварительно нагретое в термостате
до температуры 37°, наносят маленькую каплю крови или суспен-
зию клеток и тотчас же покрывают теплым покровным стеклом
(температура 37°); края стекла смазывают вазелином, чтобы
предохранить препарат от высыхания: микроскопическое наблю-
дение ведут на нагревательном столике.
Для прижизненной окраски соединительной ткани краситель
инъицируют подкожно в разведении 1 : 50 000 (на физиологиче-
ском растворе поваренной соли) и через 10—20 минут производят
вскрытие животного.
Для интравитальной окраски клеток печени и поджелудоч-
ной железы лабораторных животных нейтральный красный
(1 см3 0,5-процентного раствора) инъицируют внутрибрюшинно.
71
Кролики и морские свинки относительно хорошо переносят дли-
тельные инъекции нейтрального красного. Мыши обычно погибают
в конце недели.
Для окраски in vitro употребляют растворы 1 :50 000—
1 : 100 000 на физиологическом растворе.
Мелких водных животных непосредственно помещают в рас-
твор нейтрального красного (1 : 200 000). Личинок амфибий поме-
щают на несколько дней в раствор нейтрального красного
(1 : 200 000); окрашивание наступает уже через несколько часов,
но интенсивная окраска — через 3—4 дня. Окрашенных животных
затем переносят в чистую воду, причем окраска некоторое время
сохраняется.
Кусочки различных тканей (например, эпидермис) и органов
окрашенных личинок можно изучать в физиологическом растворе
поваренной соли.
Нейтральным красным так же окрашивают прижизненно орга-
ны и ткани, извлеченные из организма.
Объекты сами по себе тонкие и удобные для микроскопирова-
ния (сальник, брыжейка, пленка подкожной клетчатки, мозговые
оболочки, роговица, мелкие косточки, мелкие ганглии) окрашива-
ют тотально.
На ряде органов (почка, селезенка, лимфатический узел, зоб-
ная железа, шитовидная железа, надпочечники, слюнные железы,
кожа, хряши и т. д.) приходится окрашивать поверхность предва-
рительно вырезанного тонкого кусочка органа. Его промывают в
физиологическом растворе и переносят на 15—30 минут в сосуд с
0,005—0,025-процентным раствором нейтрального красного на фи-
зиологическом растворе без соды. Окраска производится в
термостате при 37°. Затем объект споласкивают физиологиче-
ским раствором и перекладывают в чистый физиологический рас-
твор в термостате при той же температуре.
Над объектом следует оставлять минимальный слой красителя
или физиологического раствора и каждые 5—8 минут осторожно
взбалтывать сосуд (для хорошей аэрации жидкости).
Нейтральный красный не глубоко проникает в ткань, и поэтому
толщина слоя окрашенных клеток не превышает нескольких десят-
ков микрон. Неокрашенные клетки, лежащие ниже, не препятст-
вуют изучению препарата и играют роль светофильтра. Поэтому
при микроскопировании в этом случае важно иметь хороший источ-
ник света.
После окраски кусочка с него бритвой делают тонкий срез, па-
раллельно плоскости разреза, сделанного до окраски. Срезанную
пластинку переносят на предметное стекло в каплю физиологиче-
ского раствора окрашенной поверхностью кверху и покрывают по-
кровным стеклом. Под края покровного стекла подкладывают по-
лоску фильтровальной бумаги, чтобы предохранить срез от раздав-
ливания. Нейтральный красный в нормальных клетках отклады-
72
вается в виде зерен, поврежденные или некротические клетки окра-
шиваются диффузно.
Различные факторы физиологического химического и физиче-
ского порядка могут изменять характер нормального гранулярного
окрашивания: сперва диффузно окрашивается цитоплазма, а за-
тем и ядро. Эти стадии окрашивания обратимы, если степень по-
вреждения клеток не переходит известного предела.
Фиксация кусочков ткани, окрашенных нейтральным красным,
представляет значительные трудности. Их можно фиксировать в
течение 24 часов смесью: 43 см3 жидкости Ценкера (без уксусной
кислоты) и 7 см3 формалина, к которому прибавлено 2 капли
1 N NaOH. Маленькие кусочки ткани переносят в свежую смесь на
12—24 часа, промывают их в течение 15 минут водой; затем поме-
щают в 80-градусный спирт на 10 минут; в первый абсолютный
спирт на 1 минуту, во второй абсолютный спирт — на 5 минут два-
жды, в ацетон по 20 минут, дважды в ксилол по 20 минут, дважды
в парафин 56° по 1—2 часа и окончательная заливка.
Полученные срезы можно докрашивать гематоксилином нли
полихромным синим. Некоторые исследователи рекомендуют ок-
раску фиксировать парами иода или, что гораздо лучше, смесью:
60 см3 насыщенного водного раствора пикриновой кислоты, 20 см3
формалина, 20 см3 насыщенного, водного раствора молибденово-
кислого аммония.
Метиленовый синий употребляется для прижизненного
окрашивания Protozoa, изолированных клеток, в культурах ткани,,
изолированных тонких тканевых мембран и пленок; обычное раз-
ведение 1:1000—1:10 000. 10-процентный метиленовый синий
применяют для подкожных инъекций, например, при изучении
лимфатических мешков амфибий.
Для изучения митохондрий в клетках почки в спинные лимфати-
ческие мешки Bufo vulgaris ииъицируют 1-процентный метиле-
новый синий и на следующий день, вскрыв животное, рассматри-
вают под микроскопом маленькие кусочки почечной ткани, слегка
раздавив их покровным стеклом; другие кусочки можно зафикси-
ровать вышеописанной смесью из пикриновой кислоты, формали-
на и молибденовокислого аммония. Затем залить в парафин н до-
красить сафранином.
Для окраски нервной системы низших организмов (гидроидов,
червей, моллюсков, водных рачков) к среде, в которой находятся
животные, прибавляют метиленовый синий. Наилучшне результаты
дают разведения 1 : 1000—1 : 10 000.
Применение метиленового синего для окраски нервной ткани
позвоночных см. стр. 374.
Можно получить окраску митохондрий в клетках культур тка-
ней, применяя метиленовый синий в разведении 1:10 000 (в физио-
логическом растворе); продолжительность окраски 4—8 минут;
для интравитальной окраски животному ииъицируют 0,5-процент-
ный раствор метиленового синего и через 15—30 минут производят
73
вскрытие; для суправитальной окраски помещают кусочки ткани
в 1 : 10 000 раствор красителя (в физиологическом растворе) на
15—30 минут в термостат при температуре 37°. Прижизненно окра-
шенные митохондрии быстро обесцвечиваются. Для прижизненной
окраски митохондрий можно также применить толуидиновый
•синий и яркий крезиловый синий.
Нафтоловый синий рекомендуют для специфической
прижизненной окраски тканей щитовидной и паращитовидной же-
лез, которые он дифференцированно окрашивает в интенсивно си-
ний цвет, а другие ткани — мускульную, слюнные железы и т. д.—
в бледный зеленовато-синий цвет. Краситель разводят 1 ; 40 000 в
•физиологическом растворе поваренной соли. Окрашивание ведется
методом перфузии, причем подопытным крупным лабораторным
животным вводят в кровяное русло 500—1000 см? раствора в тече-
ние 10—30 минут.
Прижизненная окраска гипосульфитными
.лейкобазами (Роскин и Маслова 1935, Роскин и Семенов
1933). Эти лейкобазы приготовляют обработкой основных краси-
телей гипосульфитом. Наблюдения показали, что гипосульфитные
лейкобазы весьма мало токсичны и могут служить как для ви-
тального окрашивания многих Protozoa, так и для различных кле-
ток и тканей Metazoa.
Метод приготовления гипосульфитных лейкобаз следующий: к
100 см? 0,01-процентного красителя прибавляется 1—2,5 см? 0,1 N
раствора гипосульфита и 1—4 с,и3 0,1 N раствора соляной кислоты:
полученную смесь тщательно перемешивают стеклянной палочкой
и ставят в темноту при обычной комнатной температуре. В зави-
симости от красителя и концентрации употребляемых реактивов
происходит быстрое нлн более медленное образование бесцветной
лейкобазы.
В среднем обесцвечивание происходит через 2—3 часа, но ино-
гда тянется до 24 часов.
Растворы гипосульфитных лейкобаз бесцветны, прозрачны и
весьма стойки к окислению, но нх надо сохранять в темноте. ‘
При окраске прибавляют 1—2 капли гипосульфитной лейкоба-
зы к объекту, который может находиться в физиологическом рас-
творе поваренной соли.
Можно изготовить лейкобазы из метиленового синего, азура I,
тионина, а также из толуидинового синего или яркого крезилового
синего.
Для окраски можно употреблять также смеси двух лейкобаз,
.например, метиленового синего и азура I.
Объектами окрашивания могут служить:
1) брыжейка белой мыши или лягушки; 2) кровь лягушки; 3) пленка
.лука; 4) саркомные клетки опухоли крысы; 5) раковые клетки опухоли мо-
лочной железы человека; 6) клетки культуры ткани и т. д.
При окраске брыжейки белой мыши лейкобазой тиоиина хорошо окра-
•шиваются ядра мезотелия, лейкоцитов, соединительнотканных клеток; ядра
тучных клеток интенсивно окрашиваются в сннин цвет, их плазма — в ро-
7-4
зовый, а зернистость — в красный. Через 1—2 часа клетки обесцвечиваются.
Витально окрашенные ядра бесструктуриы.
При окраске культуры ткаии сердца куриного зародыша ленкобазой тио-
нииа можно наблюдать, что уже через 10—15 минут после прибавления кра-
сителя видны отдельные окрашенные клетки: розовая плазма, голубое ядро,
синее ядрышко, фиолетовые зернистые включения в плазме. Раньше всего
появляется синее окрашивание ядрышка, затем окраска плазмы и последним
окрашивается ядро.
Плазма окрашивается неравномерно, интенсивнее всего вокруг ядра.
Только через некоторое время окраска становится равномерной по всей кле-
тке.
Через 25—30 минут клетки вновь обесцвечиваются, и окрашенным оста-
ются только ядрышки. Среди общей массы обесцветившихся клеток видны
отдельные окрашенные клетки, лежащие на самой периферии растущего ку-
сочка.
Сравнивая различные культуры тканей, можно установить, что в зависи-
мости от физиологического состояния клеток, окраска наступает с различной
скоростью; то же относится и к моменту обесцвечивания культуры, могуще-
му наступить через 1—Р/г часа.
Ядра прижизненно окрашенных клеток — в данном случае речь идет о
фибробластах — бесструктуриы. Если рассматривать культуры ткани при ма-
лом увеличении, то при прибавлении лейкобазы тнонина наблюдается сле-
дующее интересное явление: центральная часть эксплантированного кусочка
остается все время неокрашенной, вокруг нее идет узкая кольцевая зона
клеток, окрасившихся в синий цвет, далее—узкая кольцевая зона фиолето-
вых клеток, а затем уже широкая зона полихромно окрашенных клеток,
как это было описано выше.
Проведенные наблюдения показывают, что гипосульфитные лейкобазы
можно широко применять для прижизненного окрашивания ядер и плазмы,
для красочной дифференцировки различных клеток и для цитофизиологиче-
ских наблюдений как над кусочками переживающих тканей, так и над куль-
турами ткани.
Можно предполагать, что гипосульфитные лейкобазы могут быть полез-
ны для прижизненных наблюдений иад окенредукцнонными процессами в
клетках, для решения ряда проблем, связанных с изучением градиента клет-
ки и т. п. Очень интересным является факт гомогенного прижизненного окра-
шивания ядра и отсутствие видимых при этом структур, проявляющихся
только при первых явлениях умирания.
Некоторые специальные методы прижизненного окрашивания
Предложены разнообразные методы и различные красители
для прижизненного окрашивания ядер.
В литературе имеются многочисленные данные о прижизненной
окраске ядер простейших, растительных и животных клеток.
В настоящее время трудно оспаривать возможность окраски
ядер различными красителями, а также их лейкобазами. Дискус-
сионным является только вопрос: в какой мере может окрашивать-
ся совершенно интактное, неповрежденное ядро и не наступает ли
окрашивание только под влиянием тех или иных факторов, вызы-
вающих в той или иной мере повреждение ядра.
Прижизненные красители могут быть применены для анали-
за механизма митоза. Некоторые прижизненные краси-
тели вызывают различные аберрации митоза, так, например, ней-
тральный красный в разведении 1 : 200 000 нарушает митозы в
культурах ткани и вызывает разнообразные патологические изме~
75
нения. Нильский синий, аурамин и яркий крезиловый синий да-
ют аналогичный эффект.
Прижизненное окрашивание развивающих-
ся костей достигается скармливанием краппа (корень Rubia
tinctorum) или же ализарина молодым растущим животным. Наи-
более удачные результаты дают наблюдения над развивающимися
костями щенков или цыплят.
Для тонкого изучения изготовляют шлифы и исследуют их в
свежем состоянии или, быстро обезводив, заключают (минуя кси-
лол) в бальзам.
Развивающуюся кость можно окрашивать, вводя внутривенно
или внутрибрюшинно 1-процентный раствор ализарннсернокислого
натрия (в физиологическом растворе поваренной соли).
Для прижизненной окраски главным обра-
зом эластической, а также к о л л а г е н о в о й ткани,
хряща и кости можно вводить натриевую соль тиенил-хино-
лин-карбоновой кислоты; подкожно или per os — 1 г на 1 кг веса
подопытного животного, внутривенно — по 0,4 г. Опыт хорошо
удается на кроликах. Инъекции можно делать многократно.
Через некоторое время наступает темно-фиолетовое окрашива-
ние эластической ткани; хрящ, кость и коллагеновая ткань окраши-
ваются слабее.
Ализарин, прибавленный к среде, в которой находятся С1а-
docera, специфически окрашивает у них нервную ткань. Окраска
наступает через несколько часов.
Для прижизненной окраски водных живот-
ных (личинки саламандры и тритона, Cladocera) с успехом при-
меняют бисмарк коричневый, метиленовый синий, нейтральный
красный, нейтральный фиолетовый, сульфат нильского синего.
Для определения некробиоза цитоплазмы можно
употреблять смесь равных частей нейтрального красного, метиле-
нового синего и везувина (в разведениях 1 : 10 000}.
По нашим и литературным данным некоторые лекарственные
вещества, как хинин, стрихнин, пилокарпин, вытесняют нейтраль-
ный красный из окрашенных тканей, и таким образом обесцвечи-
вание последних можег служить показателем проникновения ука-
занных веществ в клетки и ткани.
Прижизненная окраска с помощью ионтофореза
Немаловажное значение имеет способ введения прижизненного
красителя: подкожное, внутривенное и т. д. Особые трудности воз-
никают при прижизненном введении красителя внутрь самих кле-
ток. В этом случае можно прибегнуть к микроинъекциям. Однако
этот способ имеет свои существенные недостатки н во многих слу-
чаях вообще технически не осуществим.
Для этой же цели с большим успехом может быть использо-
ван метод ионтофореза, предложенный Г, И. Роскиным и Е. С.
Кирпичниковой.
76
Этот метод основан на введении красящих ионов в живой ор-
ганизм при помощи постоянного тока. Постоянный ток получают
от аккумуляторной батареи (10—12 в, плотность тока 0,25 мв на
1. см2 площади электрода).
Электродами служат станиолевые пластинки, активный элек-
трод несколько меньше индифферентного. Для окрашивания мо-
жет быть использован целый ряд красителей. Так, например, ме-
тиленовый синий, являясь основным красителем, имеет окрашен-
ный положительный ион, который вводится с положительного по-
люса. На прикрепленном неподвижно подопытном животном с
предварительно удаленной шерстью устанавливаются электроды.
Под электродами помещают смоченные марлевые прокладки: под
активным электродом прокладки, смоченные 1—0,5-процентным
раствором метиленового синего, под индифферентным — проклад-
ка, смоченная водой.
Ток пропускают в течение 20—30 минут.
Окрашивание наблюдается после первой электризации и уси-
ливается после ряда последовательных ежедневных сеансов. При
этом методе прижизненно окрашиваются не только клетки кожи,
но и поверхностные слои мыши. Затем животное убивают, смыва-
ют с поверхности кожи краситель и вырезают кусочки ткани, ко-
торые погружают в растворы, закрепляющие метиленовый синий
(стр. 73). Кусочки окрашенных тканей режут на замораживаю-
щем микротоме и затем докрашивают их различными способами.
Тонкие пленки тканей можно изучать непосредственно.
Метод может быть применен для прижизненной окраски нер-
вов.
Среды для прижизненных наблюдений
Физиологический раствор поваренной соли
Для теплокровных употребляют 0,9-процентный раствор, для
лягушек — 0,64-процентный, для саламандры — 0,8-процентный.
Физиологический раствор
(раствор Рингера)
хлористого натрия NaCl 0,85 г (для холоднокровных 0,65 г)
хлористого калия КС1 0,025 г
двууглекислого натрия NaHCO3 0,02 г
хлористого кальция СаС12 0,03 г
бидистиллированной воды 100 см?.
Соли растворяют в указанном порядке. Жидкость не может
долго храниться. Раствор нельзя кипятить.
Раствор Рингера — Локка
для теплокровных
хлористого натрия NaCl 0,85 г
хлористого калия К.С1 0,042 г
двууглекислого натрия NaHCO3 0,02 г
77
хлористого кальция СаС12 0,025 г
дистиллированной воды 100 см3.
Для холоднокровных надо брать хлористого натрия 0,65 г.
Люис рекомендует добавлять декстрозы 0,1—0,25 г. Соли раство-
рять в указанном порядке.
Раствор Тироде для теплокровных
хлористого натрия NaCl 0,8 г
хлористого кальция СаС12 0,02 г
хлористого калия КС1 0,02 г
хлористого магния MgCl2 0,01 г
одноосновного натрия фосфата NaH2PO4 0,005 г
двууглекислого натрия NaHCO3 0,1 г
глюкозы С6Н12О6 0,1 г
дистиллированной воды - 100 см3.
Раствор нельзя кипятить. Для стерилизации фильтровать через
свечу Беркефельда,
Жидкость для клеток наземных и водных
беспозвоночных
хлористого натрия NaCl 1 г
хлористого калия КС1 0,3 г
хлористого кальция СаС12 0,1 г
двууглекислого натрия NaHCO3 1,5 г
двухосновного натрия фосфата Na2HPO4 0.5 г
сернокислого магния MgSO4 0,3 г -
глюкозы C6Hi2O5 1 г
дистиллированной воды 1 000 см3.
Если необходим стерильный раствор, то входящие в его состав
1) NaCl, КС1, СаС12, MgSO4, 2) глюкозу, 3) Na2HPO4 стерилизуют
раздельно, а 4) двууглекислый натрий стерилизуют фильтрацией
через специальную свечу.
Жидкость для клеток насекомых
хлористого натрия NaCl 1,3 г
хлористого калия КС1 0,028 г
хлористого кальция СаС12 0,024 г
двууглекислого натрия NaHCO3 0,002 г
двухосновного натрия фосфата Na2HPO4 0,02 г
дистиллированной воды 200 см3
Жидкость для прижизненных н а б л юде н и й н а д
клетками развивающихся зародышей амфибий
хлористого натрия NaCl 3,5 г
хлористого калия КС1 0,05 г
хлористого кальция СаС12 0,1 г
двууглекислого натрия NaHCO3 0,2 г
дистиллированной воды 1000 см3
78
г
г
г
см3.
Жидкость для клеток морских Crustacea
хлористого натрия NaCl 29,23
хлористого калия КС1 0,75
хлористого кальция CaClj 4,44
дистиллированной воды 1 000
Жидкость для клеток морских моллюсков
хлористого натрия NaCl 23,28 г
хлористого кальция СаСЬ 5,55 г
хлористого магния MgCb 7,62 г
дистиллированной воды 1 000 см3.
Можно указать следующий список сред (расположенных в по-
рядке предпочтения), пригодных для прижизненного наблюдения<
клеток и тканей: 1) плазма крови, 2) сыворотка крови, 3) влага
передней камеры глаза, 4) амниотическая жидкость, 5) жидкость,
плеврального или перитонеального эксудата. Лучшие результаты
получаются, если пользоваться средой, взятой от животного того
же вида, как и исследуемые объекты.
НЕКОТОРЫЕ МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОЙ ЦИТОЛОГИИ
Решение большинства цитологических проблем требует не толь-
ко наблюдения, по и активного вмешательства экспериментатора*
в процессы, протекающие в клетке.
Г
Рис. 35, Микроманипулятор, советская модель.
7»
Большим прогрессом в этой области явилось изобретение при-
боров, известных в настоящее время под названием микроманипу-
ляторов (рис. 35).
Было бы ошибочно думать, что микроэксперимент родился од-
новременно с созданием микроманипулятора. Экспериментирова-
ние с клеткой, особенно с яйцевой, производилось уже много десят-
ков лет назад. Опыты эмбриологов с яйцами различных животных,
(разделение или разрушение
бластомеров) были проведе-
ны «голыми руками» и при
использовании лупных уве-
личений. Но только с того
момента, когда Чемберс и
одновременно с ним Петерфи
в 1923 году сконструировали
свои микроманипуляторы,
микрохирургия (или «мик-
рургия») получила широкое
применение. Микроманипу-
ляторы являются особыми
приборами, соединенными с
микроскопом и позволяющи-
ми благодаря точным меха-
низмам проводить весьма
тонкие манипуляции с клет-
ками и другими микроскопи-
чески малыми объектами. С
помощью микроманипулято-
ра можно проводить на клет-
ке тончайшие операции, под-
Рис. 36. Схема всасывающего и нагне-
тающего насоса, служащего для микро-
инъекций:
1 — «козырек»; 2 — гайки; 3 — коническая
часть; 4— колпачок; 5 — основная часть кра-
на; 6 — цоколь (по Фонбрюну, 1951).
вергать ее действию различных химических и физических фак-
торов.
Работа с микрохирургией может быть дополнена микроииъек-
цией (рис. 36, 37) и экспериментами с микроэлектродами (рис. 38,
39).
Среди новых приборов для микрохирургии надо указать уста-
новки Фонбрюна и Бровей. Пневматический микроманипулятор
Фонбрюпа состоит из манипулятора и приемника; манипулятор
способен пневматически передавать самые тонкие движения руки
экспериментатора 'микрохирургическим инструментам, вставлен-
ным в приемник (рис. 40). Этот прибор очень удобен в работе и по-
зволяет делать тончайшие операции. Значительно более проста
конструкция пантографического микроманипулятора Бровей (см.
указатель литературы).
Полезный прибор — упрощенный микроманипулятор — сконст-
руирован Крюковым и описан им в журнале «Лабораторная прак-
тика» за 1937 год. Необходимые для эксперимента инструменты,
конечно, имеют микроскопические размеры и обычно изготовляют-
80
6 Микроскопическая техника
81
Рис. 40. Пневматический микроманипулятор Фонбрюна.
ся самим экспериментатором. Образцы инструментов, употребляе-
мых в микрохирургии, даны на рис. 41.
Все эти инструменты вставляются з специальные держатели
(рис. 42) и вводятся в поле зрения микроскопа в плоскости препа-
рата, помещаемого на особом препаратном столике. Держатели
инструментов закреплены на особых столиках, находящихся по бо-
кам и обладающих микрометрическими движениями во всех на-
правлениях. Столики стоят на двух металлических колонках неиз-
менно в однажды данном положении. Микроманипулятор соеди-
нен с микроскопом так, что в поле зрения последнего оказываются
кончики микроинструментов. Успешная работа с микроманипуля-
тором требует значительного навыка.
Экспериментатор должен научиться так управлять винтами,
чтобы инструменты в поле зрения производили тончайшие движе-
ния. Объект обычно помещают в специальную влажную камеру
(рис. 43, 44), в которой в висячей капле находится изучаемая
клетка, бактерия и т. п. Если нуждаются в определенной темпера-
туре, то к столику микроскопа прикрепляют миниатюрный термо-
стат, в гнездо которого помещается камера с изучаемым объектом.
82
д
b
Рис. 42. Держатели микроииструментов:
А—двойной держатель; Б — простой дер-
жатель.
Рис.
них
41. Концы разлнч-
инструментов
микрохирургии:
А — игла; Б — игла
разрезов; В— более
стая игла; Г—-микро-
шпатель; Д—микронож;
Е — микропиицет.
для
ДЛЯ
тол-
Рис. 43. Принадлежности
нипулятору: А — влажная камера в
положении с раскрытыми дверцами,
открывающимися для введения опера-
ционных инструментов; Б— микрого-
релка для изготовления тонких инст-
рументов из стекла.
к
микрома-
5
Рис. 44. Схема расположения
микроииструментов во влаж-
ной камере.
6*
83
Приготовление инструментов для микрохирургиче-
ских операций и для работы с микроманипулятором. Все
эти инструменты за редким исключением готовятся из стекла. Каждый иссле-
дователь, работающий с микромаиипулятором или производящий те или иные
микрохирургические эксперименты, должен уметь приготовить для своих це-
лей необходимый набор инструментов. Для их изготовления необходимо
иметь микрогорелку — так называют газовую или спиртовую горелку, даю-
щую пламя высотой в 1—2 мм (см. рис. 43). Подобную горелку легко сде-
лать из тонких стеклянных или металлических трубочек. Пользуясь микро-
горелкой, из тонких стеклянных капилляров изготовляют инструменты, кото-
/----о ' ц 0 а~7мм
«—............- : в
Ь—--15 см-—।
И! О’ 0 а =4 мм
1Д
рые в основном состоят из различных микроигл и микропипеток. Имея мик-
роиглы, можно при известном опыте, который дается относительно легко,
приготовить микроножи, микропинцеты и микрошпатели. Из микропипеток
можно, по желанию, приготовить микроэлектроды и т. п.
Для изготовления микроинструментов лучше всего пользоваться труб-
ками, идущими на изготовление термометров, или трубками из стекла «пи-
рекс». Но наш опыт показал, что при известном навыке можно многие инст-
рументы приготовить из обычных достаточно тонких лабораторных стеклян-
ных трубок, а микроиглы можно изготовить и из стеклянных палочек. Для
микроигл обычно используют трубки с внешним диаметром в 5—7 мм, с тол-
щиной стенок в 2—3 мм; для микропипеток надо брать более тонкостенные
трубки с поперечником в 1—1,5 см, с толщиной стенок в 1—1,5 мм.
Микроиглы изготовляют по следующей схеме (рис. 45). Сперва приго-
товляют ровный капилляр длиной в 15 см, имеющий диаметр примерно в 3—
4 мм. Его осторожно нагревают в одном пункте на пламени специальной го-
релки и затем вне пламени вытягивают очень тонкий, едва видный невоору-
женным глазом, микрокапнлляр. Держа его высоко над пламенем горелкн
и растягивая очень осторожным движением, — получают две мнкронглы
Тончайший кончик микроиглы должен иметь длину 3—30 ц. В зависи
мости от задач эксперимента кончик иглы более или менее загибают, осторож-
но нагревая над микрогорелкой (1—2 см иад пламенем): размягченный нагре-
ванием кончик капилляра можно загибать осторожным надавливанием тон-
кой препаровальной иглы. Прн изготовлении инструмента надо всегда пом-
нить, что высота влажной камеры, в которой нужно будет ими работать»
обычно равна 0,4—1 см, н поэтому отогнутые кончики должны быть воз-
84
Рис. 46. Микрохирургия клетки: Л — микроиглой оттягивается оболочка яйца
морской звезды; Б — две микроиглы вонзаются в делящееся яйцо; В, Г —
микрохирургические операции на глвдких мускульных клетках аводонты (во
Г. И. Роскину и Н. Волжиной).
можно малы. Микропипетки изготовляют, разрезая предварительно растя-
нутые обычным образом тонкие капилляры осторожным «прикосновением»
твк называемого алмазного карандаша (служащего для надписывания иа
стекле). Края микропипетки должны быть ровные (контроль под микроско-
пом). А1икропипеткн служат для отсасывания или для прибавления желаемых
ревктивов к среде, окружающей наблюдаемые клетки, а также для удаления
тех или иных клеток из влажной камеры (см. рис. 43). Для внутриклеточных
инъекций употребляют пнпеткн с выводным отверстием диаметром в 8—15 ц.
Приготовление таких пипеток требует немало опытв и наличия в лабора-
тории подходящих сортов стеклянных трубок.
£5
Различают 2 типа микропипеток: 1) микропипетки с резиновой трубкой
и мундштуком для рта; диаметр выводного отверстия таких пипеток больше
25 pi; 2) тонкие микропипетки с диаметром
таком тонком отверстии требуются особые
выводного отверстия 1—15 ц. При
приспособления для пропускания
через него жидкости. Примером
таких приспособлений является
так называемая электрическая
микропипетка, в которой электри-
ческий ток накаливает тонкую
платиновую проволочку и таким
образом нагревает внутри пипет-
ки воздух, который и выталкива-
ет содержимое пипетки,
Микроинструменты хранят в
пробирках, при этом инструменты
закрепляют в пробках, которыми
затыкают пробирки, так как они
не должны касаться ее
Первоначальное
Рис, 47.
живыми
камеры,
Камера для наблюдения над
клетками. Вверху — общий вид
внизу — схема, поясняющая
принцип действия:
/ — стенки камеры (стеклянные капилляры,
приклеенные к тонкому предметному стеклу;
2—сообщающиеся сосуды; 3— покровное етек-
* парафин; 5 — маленькое покровное
для достижения нужной глу-
Сечение камеры — 50 микрон
В. Я. Бродскому).
ло;
стекло на дне
бины камеры.
(по
к разрезанию
клетки, микроинъекциям и т,
стенок,
обучение
микрохирургии следует начинать
с опытов над каким-либо отно-
сительно легким объектом, на-
пример, над клетками плоского
эпителия, которые просто соскаб-
ливают ногтем со стенки полости
рта, Их помещают во влажную
камеру в висячей капле физиоло-
гического раствора поваренной
соли. Наблюдения начинают при
самых малых увеличениях микро-
скопа, производя для начала самые
простые операции, например, уко-
лы клетки микроиглой. И только
хорошо овладев простейшими ма-
нипуляциями, можно переходить
Д.
Рис, 48. Основные моменты работы с па-
рафиновой камерой (по Коммандоку и
Фонбрюну, 1951).
86
Для успешного витального наблюдения пользуются или куль-
специальной камерой, предложенной В. Я. Брод-
тура ми ткани или
ским (схема камеры дана на
рис. 47). Основное преимуще-
ство этой камеры — непрерыв-
ный ток свежего аэрированно-
го физиологического раствора;
в этих условиях некробиотиче-
ские изменения клеток наступа-
ют через 15—25 часов.
Коммандон и Фонбрюн
предложили очень полезное
приспособление, которое назва-
ли «масляной камерой». Такая
камера представляет собою ви-
сячую каплю жидкого парафи-
на, внутрь которой очень тон-
кой пипеткой вводят капельку
жидкости, содержащей простей-
ших, кровяные клетки или изо-
лированные клетки Metazoa.
При этом жидкий парафин, тон-
чайшей пленкой окружающий
введенную жидкость с клетка-
Рвс. 49. Эксперимент вад живой
клеткой: микроииъекция амебы (по
Фоибрюну, 1951).
ми, предохраняет их от высыхания. Таким образом можно произ-
водить длительные наблюдения над живыми клетками, изучать
Рис. 50. Эксперимент иад живой клет-
кой: микроигла прокалывает эритро-
цит лягушки (по Фоибрюиу, 1951'
влияние на них различных химических веществ и т. п., сменяя
среду или вводя прижизненные красители с помощью пипетки
(рис. 48, 49, 50).
РАЗДЕЛ ТРЕТИЙ
НАРКОЗ
Для наркотизироваиия крупных лабораторных животных наиболее часто
применяется хлороформ нлн эфир. С этой целью крупным млекопитающим
и птицам надевают особую проволочную маску, содержащую вату, пропитан-
ную наркотиком.
Для наркоза собак, кроликов, морских свинок, крыс и мышей лучше
всего пользоваться эфиром.
Кошек и обезьян усыпают хлороформом.
Для получения хорошего наркоза у собак рекомендуется предвари-
тельно за ‘/г—1 час до операции сделать им подкожную инъекцию 3—5 см3
2-процентного раствора солянокислого морфия. (Кошки и обезьяны, наоборот,
очень плохо переносят морфий).
Для наркоза кошек часто пользуются смесью равных частей спирта,
эфира и хлороформа.
Млекопитающих (кроме собак н кошек) усыпляют также подкожными
инъекциями 10-процентного раствора уретана. Наркоз наступает примерно
через 1 час. Доза для кролика — 8—12 см3, морской свинки — 1,5—3 см3,
крысы — 2—3 ел3, мыши — 0,15 ел3.
Мелких животных для усыпления помещают в плотно закрывающуюся
стеклянную банку, в которую кладут кусок ваты, смоченной хлороформом
или эфиром.
Для наркоза водных животных применяют 1—5-процснтлый раствор хло-
ристого магння, прибавляемый к среде, где находится животное. Осторожно
покалывая животное иглой, устанавливают момент усыпления. Гаким же об-
разом пользуются 5-процентиым раствором хлоралгидрата. Хорошие резуль-
таты дает 0,05-процентный раствор хлорэтона (ацетои-хлороформа) или
0,3-процеитный раствор этилуретана.
Для наркотизироваиия многих водных организмов можно использовать
33-процеитный раствор хлористого магния, постепенно (примерно в течение
30 минут) прибавляемый к среде, где находится животное, покуда концен-
трация не достигает 1—2% Для той же цели можно к среде прибавлять
сернокислый магний в виде порошка.
Для наркотизироваиия коловраток, простейших и т. д. можно употреб-
лять пары древесного уксуса.
С этой целью на предметном стекле рядом с каплей, где находятся
организмы, помещают каплю древесного уксуса, или предметное стекло с
висячей каплей, где находятся животные, помещают над горлышком банки
с древесным уксусом на 1—5 минут.
Можно пользоваться следующей таблицей наркотизирующих средств,
применяемых для усыпления различных животных:
88
Таблица 5
СРЕДСТВА, ПРИМЕНЯЕМЫЕ ДЛЯ УСЫПЛЕНИЯ РАЗЛИЧНЫХ ЖИВОТНЫХ
Объект
Protozoa
CnidariB
CtenophorB
Turbellaria
Rotatoria
Nematodes
Nemertini
PolychactB
Oligochaeta
Hirudinea
Gephyrea
Crustacea
Mollusca
Tentaculata
Enteropneusta
Водные личинки
ивсекомых
Chaetognata
Tunicata
Acrania
Pisces
Amphibia
Reptilia
Aves
Mammalia
Наркотизирующее средство
Пары древесного уксуса
Ю-процентный хлористый магний, 10-процентный серно-
кислый магний, 0,25-процентный гидроксиламни
Хлористый магний; спирт, прибавляемый по каплям
0,5-пропентный гидроксиламин (не фиксировать затем
осмиевой кислотой)
Пары древесного уксусв; 1—2-процентный кокаин, при-
бавляемый по каплям
Хлорэтон
1-процентный кокаин; 1-процентный хлоралгидрат
1 -процентный этилуретвн; 1 -процентный хлоралгидрат;
7-процентный хлористый магний; вода, насыщенная
углекислотой
5—10-грвдусный спирт; 0,1-процеитный хлоралгидрат;
1—3-процектный хлорэтон; хлористый мвгний; серно-
кислый магний; хлороформ
Хлорэтон
0,1-процентный хлоралгидрат; по квплям прибавляемый
кокаин
1-процентный этилуретвн; хлорэтон
1-процентный этилуретан; 1—5-процентный кокаин;
0,1—0,5-процеитный хлоралгидрат; 1 -процентный ги-
дроксглвмин; 10-процентный хлористый мвгний или
сернокислый мвгний
Коквин; хлоралгидрат; пвры древесного уксуса; 5—
10-градусный спирт; 10-процентный уретан; хлори-
стый магии
Постепенное прибавление спирта или хлоралгидрата
0,5-процентный этилуретаи
Хлорэтон
0,1-процентный рвствор хлоралгидрата (3—12 часов)
Хлорэтон, прибавляемый по квплям
0,5-процентный этилуретан
Хлорэтон или 0,5-процентный этилуретан (для жвбериых
форм); эфир для неземных форм
Хлороформ; эфир, инъекции уретана
РАЗДЕЛ ЧЕТВЕРТЫЙ
МИКРОФОТОГРАФИЯ
Рис. 51. Камера для микрофо-
тографии МФН-1.
пользовать любые окуляры, ио
Микрофотографическая установка представляет собою фотоаппарат, у
которого удалей объектив н заменен микроскопом; оптическая система по-
следнего выполняет роль объектива (рис. 51, 52) Необходимо отметить, что
соединение микроскопа с фотокамерой должно быть подвижным и в то же
время светонепроницаемым.
В зависимости от того, в каком положении в микрофотографической ус-
тановке но отношению друг к другу находятся микроскоп и фотокамера, раз-
личают установки: 1) вертикальные —
микроскоп и фотокамера расположены вер-
тикально (камера расположена над микро-
скопом) и 2) горизонтальные — микроскоп
и фотокамера расположены горизонтально.
Соединение микроскопа с фотокамерой
может быть жестким (с помощью переход-
ной трубки (рис. 53 и 54) и мягким (фото-
камера типа «фотокора»). Удобна в повсе-
дневной исследовательской работе фотона-
садка МФН-1, приспособленная для работы
с пластинками 6,5X9 см и 9x12 см (см.
рис. 51). Прибор имеет центральный зат-
вор, работающий с двумя скоростями. Пер-
вая—позволяет давать экспозицию любой
длительности, вторая—моментальная (око-
ло '/гз сек.). Кроме фотоиасадок имеются
микрофотографические установки со шта-
тивом, горизонтальные или вертикальные,
однако фотокамеры этого типа в настоя-
щее время находят очень ограниченное
применение.
Для черно-белой микрофотографии при-
годны ахроматические объективы микроско-
па. Для получения цветных микрофотогра-
фий применяются апохроматы. Можно ис-
лучшие результаты дают специальные фото-
графические окуляры. Для получения наиболее контрастного изображения
окрашенного препарата следует применять светофильтры, имеющие цвет,
дополнительный к цвету самого красителя. Фокусировка при работе МФН-1
осуществляется с помощью визуального бокового тубуса, снабженного приз-
мой, которая включена все время, кроме периода экспозиции. В этот момент
при нажиме на спусковой тросик призма автоматически выключается и затем
90
включается после закрытия затвора. Наводка на резкость производится по
сетке визуального тубуса.
Первым условием для получения хорошей микрофотографии является
правильная сборка установки — оптическая ось микроскопа и фотокамеры
должны совпадать.
Для освещения препарата при фотографировании обычно пользуются
искусственным светом, устанавливая его по методу А. Келера (см. Шялла-
бер, 1951).
В качестве источника света лучше всего применять низковольтную про-
екционную лампу — обычные полуваттные лампы мало пригодны, так как
конструкция накаливающейся нити не позволяет полностью использовать
весь световой поток, даваемый лампой. Для производства моментальных
снимков удобно пользоваться дуговыми лампами. Чтобы ослабить вредное
действие тепловых лучей на микроскоп и объект съемки при работе как с ду-
говой лампой, так и с сильными проекционными лампами, между коллек-
торной линзой и микроскопом
следует ставить кювету, с пло-
скопараллельными стенками,
заполненную водой или, лучше,
раствором соли Мора.
Добившись равномерного
освещения объекта, произво-
дят установку и фокусировку
препарата иа матовом стекле
фотокамеры и после этого на-
ходят наиболее выгодное для
данного объекта освещение.
Оно достигается правильным
использованием диафрагмы
осветительного аппарата.
При съемке с иммерсион-
ными системами можно ис-
пользовать полностью раскры-
тую диафрагму. В тех случа-
ях, когда используются сухие
системы с небольшими увели-
чениями. надо несколько умень-
шать величину диафрагмы.
При съемке неокрашенных
препаратов, для увеличения
резкости н контрастности изо-
бражения надо по возможности
больше суживать диафрагму.
Величина диафрагмы имеет
Рис. 52. Приспособление фотоаппарата
типа «ФЭД» для микрофотографии.
Решающее значение для каче-
ства изображения. Однако дать
какие-либо точные указания о
степени диафрагмирования
нельзя, так как в каждом от-
дельном случае она опреде-
ляется характером препарата.
При съемках окрашенных препаратов для получения правильной цвето-
передачи следует пользоваться ортохроматическими и панхроматическими
пластинками и при этом применять светофильтры. Светофильтры могут быть
как жидкими (чаще всего водные растворы красителей, наливаемых в такие
же кюветы, как н тепловые фильтры), так и сухими (твердыми)—стекло,
окрашенное в массе, или бесцветное, иа которое налит слой окрашенной же-
латины.
Светофильтры ставятся на пути светового пучка между источником света
и микроскопом.
91
В тех случаях, когда при съемке надо выявить отдельные участки пре-
парата на окружающем фоне, следует употреблять светофильтры, пропу-
скающие спектральные цвета, дополнительные к цвету, которым окрашены
эти участки препарата. Для выявления деталей препарата, имеющего сплош-
ную окраску, употребляют светофильтры, пропускающие спектральные цвета,
близко стоящие к окраске препарата.
Во многих случаях в качестве светофильтра рекомендуется специальная
смесь. Для ее приготовления в 1000 см3 дистиллированной воды растворяют
115 г сернокислой меди и 11,5 г двухромовокислого калия; к указанному рас-
твору осторожно добавляют 3 см3 серной кислоты, после чего фильтруют.
При съемке с фильтром установку иа резкость и другие манипуляции про-
изводят со включенным фильтром.
В качестве негативного материала из сортов, имеющихся в продаже,
можно указать на ортохроматические и панхроматические пластинки, даю-
щие хорошее покрытие и имеющие довольно мелкое зерно. Для съемок мало-
контрастных объектов можно пользоваться орторепродукционными пластин-
ками. Хороших результатов можно также добиться на противоореольных пла-
стинках или на панхроматической пленке.
Точное определение экспозиции — времени освещения, необходимого для
получения нормального негатива, — очень важно и в то же время наиболее
трудно достижимо при микрофотографировании. Это н понятно, так как экс-
позиция зависит от многих условий: от силы источника света, диаметра
диафрагмы, плотности и окраски самого объекта, увеличения микроскопа и
степени растяжения камеры. Из всего вышесказанного ясно, что ° каждом
отдельном случае экспозиция подбирается опытным путем.
Лучше всего на одну пластинку дать несколько экспозиций, вдвигая
крышку кассеты каждый раз на 1 см. Таким образом, получив на одной пла-
стинке ряд участков с разной экспозицией (например 1, 2, 3, 4, 5 н т. д. се-
кунд), после проявления определяют, какая экспозиция дает лучший резуль-
тат, и производят с ней съемку на целую пластинку.
РАЗДЕЛ ПЯТЫЙ
ФИКСАЦИЯ И ФИКСАТОРЫ
Все методы фиксации преследуют основную цель: убивая объ-
ект, сохранить его прижизненную структуру. Фиксировать — зна-
чит закреплять. Природа и динамика микроструктур не могут быть
с достаточной полнотой и достоверностью изучены на фиксирован-
ном и обычными методами окрашенном препарате. Отсюда поиски
новых методов прижизненного исследования клеток и тканей, по-
зволяющих широко использовать эксперимент, — исследование в
темном поле, флуоресцентная микроскопия, витальные окраски,
микрохирургия, культура тканей и т. д. Все же нужно признать,
что фиксированный препарат по-прежнему является основным
объектом исследования, так как никакой другой метод не выявляет
столь четко структуру, ие дает возможности так детально прово-
дить морфологический анализ клеток и тканей.
Некоторые исследователи пришли к поспешному выводу о том,
что витальная микроскопия отменяет классическую микротехнику с
ее изучением фиксированного препарата. Это неверно. Наоборот,
комбинация этих двух направлений — об этом говорит новейшая
цитологическая и гистологическая литература — сулит новые и
глубокие успехи в деле изучения жизни клеток и тканей. Поэтому
современный биолог-микроскопист работает, как правило, парал-
лельно с фиксированными и с живыми объектами.
Надо также помнить, что методы прижизненного изучения не
могут в настоящее время дать исчерпывающей картины строения
клеток и тканей, так как составляющие их компоненты имеют весь-
ма сходные коэффициенты преломления и в силу этого трудно от-
личимы друг от друга.
Фиксация, вызывая коагуляцию или преципитацию клеточного
содержимого, тем самым изменяет более или менее резко коэф-
фициенты преломления отдельных клеточных элементов. Таким
образом, рационально проведенная фиксация, как правило, уси-
ливает разницу в коэффициенте преломления отдельных частей и
органоидов клетки и тем самым делает их более различимыми друг
от друга.
93
Последующая же окраска еще резче выявляет различные кле-
точные компоненты.
Убить клетку и одновременно сохранить ее, насколько это воз-
можно, в состоянии, в котором она находилась при жизни, — вот
цель фиксации. Хорошая фиксация, как бы остановив процессы,
текущие в клетке, сохраняет все составные части клетки и не вы-
зывает образования новых структур. Быстрое и энергичное дейст-
вие фиксаторов предохраняет объект от посмертных изменений, но
само воздействие примененных реактивов не может не вызвать тех
или иных изменений в клетках. Наилучшие фиксаторы действуют
быстро, вызывают наименьшее изменение в тонких структурах и
не затрудняют проведения последующей элективной окраски.
Фиксация должна, кроме того, «закреплять» ткань, делая ее бо-
лее устойчивой и способной без заметной деформации перенести
ряд последующих операций: обезвоживание, заливку, резку на
микротоме. Большинство применяемых фиксаторов в достаточной,
хотя и в разной степени, закрепляет объекты. Фиксаторы должны
не только сохранять и закреплять клеточные структуры, но и пере-
водить по возможности все компоненты клетки в нерастворимое
состояние, при котором промывка в воде, пребывание в спиртах,
просветляющих средах, красочных растворах не удаляло бы раз-
личных клеточных частей и тем самым не извращало бы коренным
образом картину строения изучаемых тканей. Кроме того, хороший
фиксатор не должен черни :ь структуры, делать их хрупкими л
ломкими, сморщивать ткани, а тем более вредным образом влиять
на последующее окрашивание.
Сопоставление живых клеток с их фиксированными и окра-
шенными препаратами каждый раз приводит исследователя к вы-
воду, что на препаратах при определенной обработке выступают
с совершенной закономерностью определенные структуры, невиди-
мые прн прижизненном наблюдении. Таким образом возникла
проблема соотношения ряда тонких структур препарата к видимой
относительной гомогенности живых клеток и тканей. Первое реше-
ние этой проблемы шло по линии признания всех структур, види-
мых только на фиксированных препаратах, «артефактами». Однако
такое решение было мнимым решением, — вернее неумением про-
анализировать всю проблему в целом, желание попросту «отмах-
нуться» от сложного вопроса, важного для дальнейшего развития
целых разделов цитологии, гистологии, патогистологии.
Исследователь стремится, фиксируя, стабилизировать лабиль-
ную живую систему таким образом, чтобы не произошли сколько-
нибудь значительные изменения, связанные с коллоидальной при-
родой живого вещества. Подвижное равновесие живой системы
должно резко изменяться под влиянием обычно применяемых фик-
сирующих средств, которые производят в первую очередь измене-
ния в ультрамикроскопической структуре. Если возникновение
улыграмикроскопических изменений под влиянием фиксации не-
сомненно, то возникает вопрос: в какой мере эти изменения появ-
94
ляются в области микроскопически видимых структур? Меньше
всего меняются те клеточные и тканевые элементы, которые со-
стоят из твердых веществ или необратимых, малоэластичных ге-
лей. Все остальные компоненты клеток, состоящие из обратимых
гелей и золей, не могут быть стабилизированы (т. е. зафиксирова-
ны) без того, чтобы не произошли явления отмешивания, коагу-
ляции, сжатия, набухания или растворения отдельных фаз, словом,
без далеко идущих изменений их коллоидального состояния и свя-
занных с этим микроскопически учитываемых изменений. С этой
точки зрения можно различать по отношению к фиксаторам ста-
бильные и лабильные структуры клетки. Первые сохраняются при
фиксации в жизнеподобной форме, вторые — гораздо более много-
численные — в зависимости от природы фиксатора в разной степе-
ни меняют свой размер и форму.
Многие структуры выявляются только при фиксации в местах,
которые в прижизненном состоянии казались бесструктурными и
гомогенными. Это могут быть так называемые маскирован-
ные структуры, которые существовали н до фиксации, при-
мерно в той же форме и величине, но были невидимы в обычном
свете. Подобные явления имеют место, когда коэффициенты пре-
ломления определенного клеточного элемента н окружающей его
среды весьма близки. Фиксация в этом случае может увеличить
различие коэффициентов преломления и тем самым сделать дан-
ную структуру видимой на препарате. Наблюдения показывают,
что не только фиксация, но иногда даже небольшая дегидратация
позволяет выявить такие маскированные структуры. Эти структу-
ры, как показывает опыт, при удачном выборе фиксатора закреп-
ляются в весьма жизнеподобной форме. Незаметные переходы
имеются между такими маскированными структурами и так назы-
ваемыми латентными структурами. Последние струк-
туры прижизненно не существуют, но появление их на фиксиро-
ванном препарате строго предопределено специфическими физио-
логическими и ультрамикроскопическими свойствами живого объ-
екта. Эти же латентные структуры могут появляться и в нормаль-
ном цикле жизни клетки или же вызываться экспериментально. Та-
ким образом, латентные структуры, хотя и появляются в результате
микротехнической обработки, не могут быть причислены к арте-
фактам.
Для понимания природы латентных структур и всей проблемы
артефактов в целом очень важны прижизненные наблюдения над
обратимыми структурами. Вполне справедливо рассматривать эти
обратимые структуры как переходные ступени к необратимой фик-
сации. Новая литература дает многочисленные примеры таких
обратимых цитологических структур.
В литературе описана обратимая желатинизация в ядрах кле-
ток культур ткани: при подкислении среды в ядрах появляются
гранулярные структуры, дающие затем сети. Наблюдая ядра эпи-
телия головастиков, можно установить, что в гомогенных ядрах
95
при прибавлении слабой уксусной кислоты возникают сетчатые
структуры, исчезающие при переносе головастиков в водопровод-
ную воду. Любопытно, что такие эксперименты могут быть много-
кратно повторены без видимого вреда для клеток. Аналогичные
наблюдения мы находим в ряде исследований, где описано появ-
ление обратимых структур под влиянием температуры, солевых
растворов, прижизненных красителей. В этом же плане надо рас-
сматривать многие очень поучительные для цитолога наблюдения
Насонова и Александрова. Подобные явления характерны не толь-
ко для ядерных структур. В литературе имеется много наблюде-
ний над обратимостью зернистых или вакуолярных образований
протоплазмы.
Наконец, наряду со стабильными фиксатороустойчивыми и
обратимыми структурами, некоторые микроструктуры возникают
совершенно заново под влиянием фиксаторов в гомогенных частях
клеток и тканей. Их форма также зависит от состояния и ультра-
структур живой массы, но эта зависимость не столь закономерна
и строго специфична, как это имеет место в отношении латентных
структур. Часто весьма сходные фиксаторы вызывают в данном
месте весьма различные образования. Это и есть настоящие а р-
Т е ф а к т ы. Подобные структуры обычно соединяются в сложные
комплексы со структурами вышеописанных категорий. Наличие
артефактов на препаратах давало повод ряду исследователей от-
рицать нацело все наши знания, полученные методами фиксации
и окраски, словом, отрицать всю «микротомную гистологию». Спо-
койное и критическое рассмотрение вопроса вряд ли дает повод
для подобного заключения. Наоборот, повседневный опыт подска-
зывает лишь осторожное и критическое отноше-
ние к микроструктурам препарата и диктует
необходимость параллельных прижизненных
наблюдений для контроля. Все эти соображения имеют
значение только для вопросов тонкой цитологии. В вопросах же
эмбриогенеза, гистотопографии или проблемах гистоархитектони-
ки все эти трудности возникают лишь в исключительных случаях.
Для решения многочисленных и важнейших проблем бывает до-
статочно установить, что появление определенных структур на
препарате обусловливается физиологическими и коллоидно-хими-
ческими свойствами исследуемых клеток, чтобы иметь право рас-
сматривать подобные структуры, как определенные эквиваленты
микроструктур или ультраструктур живой системы.
Прогресс электронной микроскопии, исследования в фазово-
контрастном микроскопе позволили по-новому поставить изучение
изменений, возникающих в живом веществе под влиянием фикса-
торов: речь идет не только о сохранении основных тканевых или
клеточных структур, но и об иммобилизации макромолекулярных
структур. Поэтому понятие о фиксации имеет различный смысл
в зависимости от тех величин, с которыми имеет дело исследова-
тель. В тех случаях, когда исследователь изучает структуры, види-
96
мые в оптический микроскоп (т. е. до предела 0,2—0,1 и), то за-
дачей фиксации, в первую очередь, является перевод в нераство-
римое состояние различных составных частей структур: белков,
липоидов, углеводов. Среди этих веществ одни находятся и в жи-
вой клетке в нераствореином виде (например, склеропротеины,
хитин и т. д.) и задача фиксации сводится только к сохранению
формы этих образований. Сложнее дело обстоит с веществами,
находящимися в растворенном состоянии. При фиксации необхо-
димо их коагулировать или осадить, не вызывая заметных сме-
щений или изменений такого порядка, которые были бы заметны
в оптический микроскоп.
В области же субмикроскопических величин, т. е. в интервале
от 0,1 ц до 50А понятие фиксации имеет другой смысл, так как
здесь идет речь об иммобилизации макромолекул живого вещест-
ва и сохранении их связей между собой, причем надо избежать
как раздвигания, так и слипания макромолекул в кучеобразные
новообразования и появления новых связей между ними. Само
собой разумеется, что задачи фиксации в этой области чрезвычай-
но сложны.
Возвращаясь снова к изменениям, вызываемым фиксатором а
области величин, доступных изучению в обычном микроскопе,
необходимо указать на одно весьма важное обстоятельство, иг-
рающее существенную роль: коагуляты растворенных протеинов
практически (т. е. в условиях обычно изготовленных препаратов)
мало заметны, если только не применена специальная окраска.
Эти коагуляторы могут быть не видны на обычных микроскопи-
ческих препаратах, но они тем не менее существуют, что доказы-
вают наблюдения, проведенные с фазово-контрастным микроско-
пом (Поликар н сотрудники, 1952). При этом уместно напомнить,
что существенным моментом гистологической техники всегда яв-
лялось стремление оставить бесцветным и тем самым и незамет-
ным все, что не входит в задачи примененной микротехнической
методики. В этом смысле примером может служить окрашивание
железным гематоксилином.
При выборе фиксатора и оценке фиксированного препарата
надо учитывать ряд моментов.
Под влиянием фиксаторов происходит изменение объема фик-
сируемого объекта. Наиболее часто оно заключается в сморщи-
вании, реже наблюдается набухание объекта. Эти изменения за-
висят от характера примененных фиксирующих смесей и, в не-
меньшей мере, от физико-химических свойств взятой ткани или
органа. Последующая обработка — проводка через спирты, залив-
ка в парафин изменяет величину объекта до 20—40% от исходной.
В большинстве фиксаторов входят кислоты и, в первую очередь,
уксусная кислота; поэтому pH фиксатора имеет немаловажное
значение. Считают, что pH фиксатора должен быть ниже изоэлек-
трической точки тканевых протеинов, т. е. pH фиксатора, как пра-
вило,<4—4,5. Уксусная кислота не только фиксирует, но и под-
7 Микроскопическая техника 97
кисляет ткани, что является важным моментом для всего про-
цесса фиксации, так как большинство применяемых для фиксации
реактивов способно интенсивно коагулировать и осаждать состав-
ные части ткани только в нейтральной или кислой, но не в щелоч-
ной среде.
Медленное проникновение фиксатора может обусловить значи-
тельные посмертные изменения глубоких слоев фиксируемой ткани.
Рис. 53. Коэффициент проницаемости ряда фиксирующих веществ (Л), изме-
нение объема печеночной ткаии (Б) и эластичности (В) под влиянием раз-
личных фиксирующих веществ (по Бекеру. 1950):
Черные столбики—действие фиксатора, белые столбики — действие фиксатора и по-
следующей обработки спиртом, заштрихованные столбики — действие фиксатора и по-
следующей заливки в парафин.
Поэтому надо по возможности фиксировать кусочки незначитель-
ной толщины. Скорость проникновения фиксатора зависит от фи-
зико-химических свойств объекта, а эти свойства у одного и того
же органа могут быть различны в зависимости от его функцио-
нального состояния, не говоря уже о возрастных или патологиче-
ских изменениях.
Различная скорость диффузии компонентов фиксатора нередко
приводит к тому, что разные зоны фиксируются различно. Так,
при употреблении смеси Флемминга фиксирующее действие осмия
проявляется только в поверхностно лежащих слоях, в глубокие
98
Рис. 54. Схема показывающая ско-
рость проникновения различных фик-
сирующих жидкостей в ткань (кусо-
чек печени) за 4 часа.
Верхний ряд: 1—1-процентная осмиевая
кислота. 0.5—1 мм. 2 — концентрирован-
ная сулема, 1,5—2 /:.и; <3 — 2-процентная
азотная кислота. 3—4 лмц 4—концентриро-
ванный формалин, 4—5 мм. Нижний ряд;
/ — (-процентная осмиевая кислота + 5-про-
иентная кислота; 2 — концентрированная
сулема — 1-процентпая уксусная кислота;
3 — двухромовокислый калий 4- уксусная
кислота; 4 — жидкость Флемминга. На
рисунках заштрихована непрофиксирован-
ная часть объекта.
же слои проникает главным образом уксусная кислота. Подобные
явления наиболее четко сказываются на фиксации тончайших
клеточных структур.
Представление о скорости проникновения фиксаторов в ткань,
об изменении ее объема при фиксации, а также об изменении эла-
стичности ткани при фиксации дают рис. 53, 54 и табл. IV (при-
ложение) .
Для ускорения диффузии фиксатора некоторые исследователи
рекомендуют фиксировать объект первые полчаса при темпера-
туре 37—40° (в термостате).
Однако, наблюдения Тел-
лисницкого не подтвердили
того, что при температуре 35°
фиксация происходит быст-
рее, чем при 20°; в то же вре-
мя мацерация внутренних
слоев фиксируемой ткани
идет при высокой температу-
ре быстрее и, таким образом,
общий результат получается
хуже.
Применение горячих или
кипящих смесей можно реко-
мендовать для фиксации
трудно проницаемых объек-
тов, особенно различных чле-
нистоногих. Но и в этом слу-
чае надо через короткое вре-
мя охладить фиксатор с
лежащим в нем объектом.
Хорошие результаты получаются при фиксации па холоду
(в леднике от 0° до +6°). При этом наблюдается отличная сохран-
ность структур, даже в весьма толстых кусках ткани, что, веро-
ятно, связано с остановкой при этой температуре аутолитических
процессов.
Бо (1952), чтобы избежать артефактов при фиксации, рекомен-
дует сперва подвергнуть объект действию низкой температуры,
затем — фиксатора. Небольшой кусочек органа, взятый от живого
организма, тотчас же замораживают (при температуре— 150°С)
с помощью изопентана. Замороженный объект переносят (шпа-
телем, охлажденным жидким кислородом) в охлажденный (—40,
—50° С) фиксатор, состоящий из абсолютного спирта, к 20 см3 ко-
торого прибавлено 3 капли уксусной кислоты. Пробирка с фиксато-
ром находится в сосуде Дюара (охлаждение достигается смесью
твердой углекислоты и щавелевокислого этила) в течение 24 ча-
сов; за это время лед в клетках постепенно замещается фикса-
тором. Затем объект обрабатывают по желанию.
Продолжительность фиксации зависит от характера фикса-
99
тора и Свойств фиксируемой ткани. Не существует фиксирующих
смесей, в равной мере хорошо сохраняющих все категории клеток
и тканей. Даже в одном и том же органе или ткани различные
клетки в зависимости от своего функционального состояния будут
различно реагировать с фиксатором. Указанные ниже для каж-
дого фиксатора сроки фиксации являются только примерными.
Надрезая острой бритвой толстые куски фиксируемой ткани,
можно по изменению окраски и плотности кусочка легко удосто-
вериться, полностью ли проник фиксатор в глубину ткани. Не
следует передерживать объекты в фиксаторах. Только в 10-про-
це'нтном формалине и смеси Буэна можно сохранять кусочки орга-
нов и тканей неограниченно долгое время.
Для более совершенной фиксации крупных органов или целых
подопытных животных можно ииъицировать фиксатор в кровенос-
ные сосуды, предварительно хорошо промытые физиологическим
раствором. Во избежание спадания сосудов рекомендуется к про-
мывному раствору прибавлять несколько капель амилнитрита; при
этом сосуды расширяются. При промывке физиологическим рас-
твором надо остерегаться попадания пузырьков воздуха в сосуды.
При инъекции сулемовых фиксаторов шприц и капсюли не
должны иметь металлических частей.
При выборе фиксатора следует руководствоваться существую-
щими в специальной литературе указаниями. При отсутствии та-
ковых необходимо испробовать несколько смесей и затем остано-
виться на самой пригодной. Наиболее широкое и, можно сказать,
универсальное применение имеет смесь Буэна, дающая на самом
разнообразном материале вполне удовлетворительные результаты,
если целью является изучение общей картины строения органа
или ткани. Но и смесь Буэна не всегда и везде применима с оди-
наковым успехом: растительные объекты фиксируются ею плохо,
не вполне хорошо фиксируются этой смесью некоторые органы,
например, семенники и почки млекопитающих. Первые хорошо
фиксируются сулемой с уксусной кислотой, а для вторых наиболее
пригодна смесь Карнуа. Широкое применение имеет смесь Цен-
кера, особенно при изготовлении препаратов, дающих общую
топографию органа или ткани. Надо также помнить, что трудно
получить при одном только фиксаторе на препарате одинаково
совершенную фиксацию ядра, плазмы и органоидов клетки, вклю-
чений и т. д.
Широко можно рекомендовать фиксацию 10-процентным фор-
малином, но, как справедливо указывают, после формалиновой
(а также спиртовой) фиксации заливка в парафин не всегда дает
'удовлетворительные результаты. Надо всегда учитывать пригод-
ность взятого фиксатора к последующему методу заливки и окрас-
ки объекта. Так, например, осмиевые фиксаторы затрудняют по-
следующее применение гематоксилина или кармина, в то время
как после них отлично удаются окраски сафранином и рядом
других анилиновых красителей. Пикриновые смеси, напротив, от-
ЮО
лично «подготовляют» объект к гематоксилиновым окраскам.
После сулемы объекты красятся любыми красителями. Для спе-
циальных гистохимических исследований в ряде случаев употреб-
ляют фиксацию чистым абсолютным спиртом, как фиксатором
химически индифферентным. Для этой же цели фиксируют теплом
или подсушиванием, т. е. такими средствами, которые возможно
меньше затрагивают химические свойства изучаемого объекта.
Формалин, смеси с пикриновой кислотой и фиксаторы, содер-
жащие уксусную кислоту, могут растворять известковые соли, так
что в них нельзя сохранить известковые конкременты малого раз-
мера, нежные кристаллы гуанина и т. п. В этих случаях употреб-
ляют нейтральный формалин.
ОБЩИЕ ПРАВИЛА ФИКСАЦИИ
Фиксация должна происходить быстро. Целое животное (ма-
ленькие организмы фиксируют тотально), вырезанный орган или
кусочек органа следует тотчас же опускать в заранее приготовлен-
ную фиксирующую жидкость, так как во многих случаях очень
скоро после умерщвления животного или отрезания органа в них
начинаются значительные изменения. Если требуется более дли-
тельная. препаровка материала, то работу производят в физиоло-
гическом растворе поваренной соли.
Фиксирующая жидкость, количество которой должно в 20—
30 раз превосходить объем объекта, должна иметь комнатную
температуру. В холодильном шкафу фиксация протекает медлен-
нее, зато дает хорошие результаты. Повышенная температура,
как это указывалось выше, ускоряя процесс фиксации, способ-
ствует, однако, процессам распада в участках ткани, не затрону-
тых еще фиксирующей жидкостью, и поэтому фиксация при по-
вышенной температуре применима только к маленьким объек-
там.
Кусочки ткани должны быть по возможности тонкими, чтобы
фиксирующие реактивы быстро проникали в них; кожицы, мезен-
терий и другие пленки и мембраны следует натягивать па деревян-
ные, пробковые или восковые пластинки при помощи игл (при
сулемовой фиксации—деревянных). Эти пластинки опускают
плавать в фиксирующей смеси объектом вниз, так, чтобы ткань
была погружена в фиксирующую жидкость.
Дно посуды, в которой находится фиксатор, надо покрыть
тонким слоем стеклянной ваты, чтобы объект со всех сторон сма-
чивался фиксирующей смесью и чтобы тканевая жидкость могла
свободно диффундировать. Объект не должен касаться дна со-
суда.
Длительность процесса фиксации для различных смесей раз-
лична. Следует избегать излишне долгой фиксации, так как она
портит объекты.
По окончании фиксации объекты промывают — в зависимости
от характера фиксатора—водой или крепким спиртом. Очень
101
удобно промывать фиксированные объекты в маленьких баночках,
отверстие которых завязано марлей. Можно несколько таких
баночек одновременно поместить в большой банке или чашке,
куда вода постепенно поступает по резиновой трубке из водопро-
водного крана. При промывании спиртом необходимо брать жид-
кости по крайней мере в 5—10 раз больше размера объекта, так
как концентрация спирта может значительно снижаться остат-
ками жидкости, диффундирующей из объекта.
ФИКСАТОРЫ
Формалин
Самое распространенное фиксирующее вещество — формол
(иначе формалин): 30—40-процентный водный раствор газооб-
разного' формальдегида. Формалин всегда содержит следы му-
равьиной кислоты, образующейся на свету, которые в общем фик-
сации не мешают. Но при тонких гистологических п особенно цито-
логических исследованиях примесь муравьиной кислоты вредна:
опа вызывает образование осадков в тканях, повреждает слизи-
стые клетки и серьезно нарушает тонкую структуру цитоплазмы.
Поэтому лучше пользоваться нейтральным формалином: -форма-
лин наливают в темную склянку на слой углекислого кальция
или углекислой магнезии толщиной в 1—2 см-, нейтрализовать
надо не менее суток, время от времени взбалтывая.
При продолжительном хранении неразведениого формалина
в нем иногда образуется осадок белого цвета, представляющий
собою продукт полимеризации формальдегида. Для растворения
осадка бутыль с таким формалином надо Поставить в термостат
при 54—56° на 24 часа. Неразведенпый формалин и растворы
его следует сохранять в темном месте. Разводить формол следует
водопроводной водой. Фиксация улучшается, если разводить
формалин физиологическим раствором поваренной соли (0,85%).
При работе с формалином необходима известная осторож-
ность: от длительного воздействия паров формалина у экспери-
ментатора может начаться раздражение слизистых оболочек глаз
и носа («формалинный насморк»).
В литературе имеются указания на то, что формалин дает со-
единения с аминокислотами. Полагают, что формальдегид связы-
вается с молекулами протеина церез лизиновые группы.
Важным эффектом формалиновой фиксации является превра-
щение растворимых в воде (лиофильных) основных групп в лио-
фобные. Это относится и к волокнистым протеинам, так как они
хотя и нс растворены в воде, содержащейся в клетке, но нахо-
дятся в тесной связи с ней через свои лиофильные группы.
Формалиновая фиксация не мешает действию пепсина или
трипсина па протеины кровяной плазмы. Некоторые .исследова-
тели считают, что коллаген, обработанный формалином, пере-
варивается трипсином, другие — отрицают это. Эксперименты по-
102
называют, что все липоиды постепенно уменьшаются в тканях,
фиксированных формалином, так как имеющаяся в клетках ли-
паза не разрушается этим фиксатором.
Формалин не является фиксатором для углеводов, но консер-
вирует протеины таким образом, что гликоген удерживается ими
и не легко растворяется водой.
Формалин не сокращает ткани, но наблюдается последующее
значительное сокращение их в абсолютном алкоголе и парафине.
Поскольку формалин нейтрализует основные группы, он де-
лает протеины более кислыми, чем, например, после фиксации
спиртом; в результате протеины, фиксированные формалином,
имеют особое средство к основным красителям. Одновременно
протеины в значительной мере утрачивают свое сродство к кислот-
ным красителям, хотя все же ие настолько, чтобы перестать окра-
шиваться.
При какой бы температуре и концентрации и как долго не
действовал бы формальдегид, — всегда остаются некоторые сво-
бодные аминогруппы и возможно, что они обеспечивают сохра-
нение известного сродства к кислым красителям.
Не выяснено, почему ткани, фиксированные формалином, пло-
хо окрашиваются кармином. Физико-химические сдвиги, вызывае-
мые формалином, производят известные изменения и в микроско-
пических структурах. Эти изменения были в последнее время
изучены с помощью фазово-контрастного микроскопа (Поликар,
1952). При использовании 5-процентпого формалина наблюдается
начальный короткий период сжатия, после чего происходит снова
увеличение объема клетки и затем вторичное сжатие. 10-процент-
ный формалин вызывает вначале большее сжатие, но последую-
щее набухание бывает незначительным или полностью отсутст-
вует. Под влиянием формалина может происходить образование
особых пузыревидных тел, которые появляются в клетках а затем
могут из них выделяться, создавая картину «загадочных шаро-
видных новообразований», лежащих рядом или на некотором
расстоянии от клеток.
При фиксации формалином изменения ядра протекают, при-
мерно, параллельно изменениям всей клетки. При набухании
нуклеоплазма становится более гомогенной, причем скопления
хроматина (например, в ядрах сперматогопий) сильно набухают
и перестают быть видимыми. При длительной фиксации, когда
наблюдается вторичное сжатие клетки, предсуществовавшие внут-
риядрные сгущения становятся более плотными, а в первона-
чально гомогенных областях ядра появляются новые сгущения.
Кроме того в ядре под влиянием фиксатора могут образовываться
«шаровидные белковые тела», иногда выделяющиеся в цито-
плазму. Формалин также вызывает определенные изменения и
в цитоплазме. Как правило, после длительной фиксации можно
наблюдать появление в гомогенной цитоплазме зернистых и сет-
103
чатых структур. При более концентрированных растворах фор-
малина в ней появляются светлые вакуоли.
Для фиксации наиболее употребительны два разведения фор-
малина: 1 часть формалина и 4 части воды (20-процентиый рас-
твор), либо 1 часть формалина и 9 частей воды (10-процентный
раствор); для низших позвоночных и некоторых беспозвоночных
лучше к последней смеси добавлять 1 часть уксусной кислоты.
Этот способ хорош для получения гистологических препаратов,
имеющих целью дать общую картину строения объекта. После
фиксации объект можно перенести непосредственно в 80-градус-
ный спирт.
Формалин сравнительно быстро проникает в ткань; поэтому
им можно фиксировать как маленькие, так и довольно большие
кусочки (до 0,5 см толщиной). Если толщина кусочков больше,—
лучше их надрезать бритвой для более быстрого проникновения
фиксатора в ткань. Время фиксации формалином зависит от ве-
личины кусочка. Не слишком большие кусочки достаточно фик-
сировать 24 часа.
В формалине фиксированные кусочки можно хранить долго
(месяцами). Обычно материал фиксируют в 20-процентном фор-
малине, а затем переносят в 10-процентный. Фиксированный в
формалине материал после основательной промывки в проточной
воде режут на замораживающем микротоме. После фиксации
в формалине иногда в тканях образуются мелкие бурые зерна.
Для удаления их можно применить метод Девицкого; срезы обра-
батывают несколько минут перекисью водорода; если зерна не
исчезают, повторяют обработку более крепким раствором пере-
киси водорода и несколько удлиняют время обработки.
Формалин часто употребляется для фиксации при изготовле-
нии тотальных препаратов, а также для фиксации планктона.
В последнем случае к улову прибавляют ’/4 или '/в неразведен-
ного формалина; спустя 24 часа раствор разводят таким же ко-
личеством морской или пресной воды, так как иначе объекты
слишком уплотняются.
Формалин часто употребляют для фиксации тканей, содержа-
щих жировые вещества.
Можно рекомендовать 5-процентный формалин (1 часть фор-
малина, 19 частей воды) для фиксации легкого, 10-процентный —
для фиксации мускулатуры; часто указывают, что формалин не-
удовлетворительно фиксирует соединительную ткань, которая при
этом сильно набухает.
Лучшей прописью формалинового фиксатора, по-видимому,
является формол-кальций по Бекеру:
формалин—10 см3, 10-процентный хлористый кальций (без-
водный) — 10 см3, дистиллированная вода —80 см3.
В бутылке с фиксатором должен находиться мел для того,
чтобы смесь имела нейтральную реакцию.
Хлористый кальций действует осмотически, а также предст-
104
вращает потерю липоидов: форма клеток хорошо сохраняется
возможно потому, что липоиды клеточных оболочек не разру-
шаются.
Формалин является фиксатором для митохондрий и аппарата
Гольджи, но редко применяется один при изучении этих состав-
ных частей клеток.
Для успеха некоторых окрасок (смотри методы окраски)
объект, фиксированный формалином, должен быть тщательно
отмыт в воде: 1—24 часа в зависимости от величины объекта.
Спирт и спиртовые смеси
Чистый этиловый спирт. Чистый спирт (от 96 до
100°) фименяется как фиксатор только для специальных целей,
так как он вызывает резкое сморщивание материала.
Было установлено, что альбумин, глобулин и нуклеиновая кис-
лота осаждаются алкоголем, причем первые два дают нераство-
римый, а последняя — растворимый осадок. Берг нашел, что
нуклеиновые осадки иногда растворимы, а иногда — нераство-
римы.
Алкоголь не образует соединения с белком, но отнимает воду
и необратимо денатурирует его. Это действие более похоже на
денатурацию солями тяжелых металлов, чем на тепловую.
Фиксация спиртом не мешает последующему перевариванию
белка пепсином или трипсином.
Большинство липоидов растворимо в холодном алкоголе (хо-
тя цефалин, сфингомиелины и цереброзиды — нерастворимы).
Поэтому, при изучении клеточных липоидов алкоголя следует
избегать. Он не включается в фиксаторы для аппарата Гольджи
и митохондрий, хотя протеины, содержащиеся в последних в.
большом проценте — не растворяются.
Гликоген осаждается, но не фиксируется спиртом, поскольку
он сохраняет свою растворимость в воде. Спирт применяется при
исследовании гликогена, но при его последующей обработке сле-
дует избегать жидкостей, содержащих менее 50% алкоголя.
Алкоголь довольно быстро проникает в ткани, но сокращает
их больше, чем любой другой фиксатор, за исключением пикри-
новой кислоты, причем абсолютный спирт вызывает дальнейшее
уменьшение объема ткани, уже сокращенной 96-процентным спир-
том.
Клетки, фиксированные спиртом, имеют весьма характерный
вид. Диффундируя в ткани, алкоголь сокращает цитоплазму,
осаждая ее, причем преципитат удерживается клеточной оболоч-
кой. Внешняя часть клетки остается пустой. Содержимое ядра
претерпевает примерно такие же изменения. Мочевая кислота,
слизь и другие растворимые в воде вещества при спиртовой фик-
сации сохраняются. Кусочки берутся возможно малые, от 1 до
3 мм толщиной. Фиксация длится не более 1—2 часов, иначе ку-
105.
сочки делаются чересчур твердыми. Берут обильное количество
фиксирующей жидкости, и затем объект заливают в парафин,
целлоидин или желатину и т. д.
Этиловый спирт имеет весьма широкое применение при изго-
товлении микроскопических препаратов, обезвоживании объектов
при их заливке в парафин и т. д. При изготовлении спиртов раз-
личной крепости следует пользоваться табл. 6.
Абсолютный спирт можно получить из 96-градусиого спирта
действием безводного медного купороса. Для получения безвод-
ного медного купороса надо прокалить в фарфоровой чашке обыч-
ный химически чистый кристаллический медный купорос. Про-
каливать надо осторожно, чтобы не произошло восстановление
медного купороса до закиси меди. Прокаленный медный купорос
должен иметь вид бледно-голубого порошка (пожелтение указы-
вает на порчу препарата). Приготовленный безводный медный
купорос всыпают в бутыль с притертой пробкой примерно на чет-
верть ее объема и доливают 96-градусиым спиртом. Безводный
медный купорос следует сменять 2—3 раза через день. Рекомен-
дуется хранить абсолютный спирт в бутыли, иа дно которой на-
сыпан слой безводного медного купороса.
Можно также получить абсолютный спирт перегонкой 96-гра-
дусного спирта с негашеной известью. С этой целью бутыль
(объемом до 2 литров) заполняют мелкими кусочками негашеной
извести и заливают 96-градусным спиртом. Хорошо закрытую
бутыль оставляют на две недели, после чего приступают к пере-
гонке. При этом бутыль помещают в водную баню и соединяют
ее с помощью дефлегматора с холодильником.
В сосуд с абсолютным спиртом рекомендуется класть несколь-
ко кусочков прогретой в термостате желатины, которая погло-
щает следы воды.
Спирт входит в качестве составной части в ряд фиксаторов;
список наиболее употребительных спиртовых фиксаторов приво-
дится ниже.
Смесь Кульчицкого: 96-градусиого спирта 100 частей,
уксусной кислоты 1 часть. Эта смесь лучше проникает, чем чис-
тый спирт. Фиксировать несколько часов, сполоснуть в абсолют-
ном спирте, заливать по обычной схеме в парафин или целлоидин.
СмесьШаффера: 2 части 80-градусиого спирта -)-1 часть
формалина. Фиксировать — 2 дня, иногда дольше, затем перене-
сти в 70—80-градусный алкоголь, где и сохранять до заливки.
Смесь Карну а: 6 частей абсолютного алкоголя, 3 части
хлороформа, 1 часть уксусной кислоты. Смешать перед употреб-
лением. Смесь очень быстро проникает, поэтому применяется
для фиксации труднопроницаемых объектов (насекомые, аскари-
ды).
Длительность фиксации '/а—3 часа; затем объект переносят
в абсолютный алкоголь, после чего, заливают в парафин или цел-
лоидин, или же сохраняют в 70- или 80-градусном спирте.
106
РАЗБАВЛЕНИЕ СПИРТОВ
Таблица 6
Крепость исходного спирта
Крепость разбавленного спирта 85° 90° 85° 80J 75° 70° 65° 60® 55® 50° 45° 40° 35°
90° 6,41
85° 13,33 ' 6,56
80° 20,95 13,79 6,83
75° 29,52 21,89 14,48 7,20
70° 39,18 31,05 23,14 15,35 7,64
65° 50,22 41,53 33,03 24,66 16,37 8,15
60° 63,00 53,65 44,48 35,4 26,47 17,58 8,76
55° 77,99 67,87 57,90 48,07 38,42 28,63 19,02 9,47
50° 95,89 84,71 73',90 63,04 52,43 41,73 31,25 20,47 10,35
45° 117,57 105,34 93,30 81 ,38 69,54 57,78 46,09 34,46 22,90 11,41
40° 144,46 130,80 117,34 104,01 90,76 77,58 64,48 51,43 38,46 25,55 11,7
35° 178,71 163,28 148,01 132,88 117,82 102,84 87,93 73,08 58,31 43,59 27,6 14,4
30° 224,08 206,22 188,57 171,10 153,61 136,04а 118,94 101,71 84,54 67,45 50,6 33,4 17,8
Примечание. В приведенной таблице дано количество воды, которое нужно прибавить к 100 см3 исходного спирта,
чтобы получить спирт желаемой крепости. Например, чтобы получить 70с-градусный ’спирт из 90с-градусного, к 100 см3
последнего надо прибавить 31,05 с,и3 воды.
Жидкость Дитриха:
96-грудусный спирт 30 см3
формалин 10 см3
ледяная уксусная кислота 2 см3
дистиллированная вода 60 см3.
Фиксируют 8—24 часа, переносят в 50-градусный спирт н за-
тем в 70-градусный. Фиксатор дает хорошие результаты при фик-
сации членистоногих.
Спи рт-ф о р м о л: 96-градусного спирта 9 частей, формалина
1 часть. Фиксировать 12—24 часа, затем объекты перенести в
70-градусный спирт, где и сохранять.
Уксусная кислота
Уксусная кислота не употребляется сама по себе в качестве
фиксатора, но входит в состав целого ряда фиксирующих смесей.
Уксусная кислота не фиксирует протеины цитоплазмы, осаж-
дает нуклеиновую кислоту и растворяет гистоны ядра.
Унна считает, что уксусная кислота увеличивает контраст
между ядром и цитоплазмой и повышает эффект последующей
контрастной окраски как кислыми, так и основными красителями.
Уксусная кислота хорошо сохраняет форму хромосом в виде,
сходном с прижизненным. Поэтому ее включают почти во все
фиксаторы для хромосом.
, В покоящемся ядре уксусная кислота осаждает хроматин в
компактные сгустки. Это позволяет выявлять ядра и не приносит
вреда наблюдениям, если исследователь учитывает,
что это явление вызвано реактивом. При высокой
концентрации уксусная кислота разрушает митохондрии и эле-
менты Гольджи и ни при какой концентрации их не фиксирует.
Как правило, уксусную кислоту не следует включать в фикса-
торы для-митохондрий и элементов Гольджи; если использовать
ее, то в очень слабых концентрациях.
Уксусная кислота в концентрациях, обычно применяемых
в фиксаторах, не влияет на жиры, которые в дальнейшем раство-
ряются при обезвоживании, если только не будут приняты спе-
циальные предупредительные меры. Липоиды большей частью
растворимы в чистой уксусной кислоте, но далеко не всегда рас-
творимы в 5-градусных растворах ее. Однако уксусная кислота
не является фиксатором для липоидов и Не консервирует угле-
водов.
Хромовая кислота и двухромовокислый калий
Эти вещества не применяются в качестве фиксаторов, но вхо-
дят в состав очень многих фиксирующих смесей.
Хромовая кислота является сильным окислителем и
легко восстанавливается до Сг2О3. Поэтому ее, как правило, не
следует смешивать с восстановителями, как например, алкоголь
108
и формалин Эксперименты показывают, что она сильно осаж-
дает протеины.
Хромовая кислота дает нерастворимые осадки с альбумином,
глобулином и нуклеиновой кислотой.
По-видимому, при фиксации хромовой кислотой происходит
реакция химического соединения с протеинами, какая именно —
точно не выяснено, но очевидно здесь происходит процесс окис-
ления, связанный с образованием Сг20з, дающего зеленую окрас-
ку ткани.
Хромовая кислота не влияет на жиры. Нет уверенности в том,
что она способствует сохранению липоидов, но она считается
прекрасным фиксатором для митохондрий и элементов Гольджи.
Хромовая кислота является единственным из применяемых в
цитологии веществом, которое действительно фиксирует глико-
ген, т. е. делает его нерастворимым в воде.
Считают, что хромовая кислота проникает в ткани медленно.
Она не сильно сокращает ткани, которые, однако, могут значи-
тельно уменьшиться в объеме при последующей обработке.
Промывка после хромовой кислоты имеет важное значение,
так как если она не проведена достаточно тщательно, то появ-
ляются осадки и ткани будут весьма трудно окрашиваться. Ку-
сочки, обычно используемые в гистологии, достаточно промывать
в течение 12 часов в проточной воде. Если ткани перенести не-
посредственно из хромовой кислоты в алкоголь, то образуется
нерастворимый осадок. После обработки хромовой кислотой ткани
легко окрашиваются основными красителями, ио плохо — кар-
мином.
Ткани, фиксированные хромовой кислотой, не следует подвер-
гать влиянию яркого света, так как это ухудшает результаты
фиксации.
Под действием хромовой кислоты, применяемой в отдельно-
сти, в большинстве случаев, как в ядрах, так и в цитоплазме
образуется обильный плотный осадок. Тем ие менее хромовая
кислота является ценной составной частью фиксирующих смесей.
Она проникает примерно с такой же скоростью, как четырех-
окисный осмий. Хромовая кислота придает тканям лучшую кон-
систенцию для заливки в парафин и обеспечивает лучшее окраши-
вание тканей. В то же время она в смесях допускает консервацию
осмием митохондрий и элементов Гольджи и не мешает доста-
точно гомогенной фиксации цитоплазмы и покоящихся ядер.
Двухромовокислый калий растворим в воде при-
мерно на 12 процентов. Водные растворы его слабо кислотны.
Он является сильно окисляющим агентом, ио все же слабее, чем
хромовая кислота. Его не следует смешивать с алкоголем, в смеси
с формальдегидом он нестоек.
1 Те фиксаторы, в которых применяются одновременно хромовая кислота
и формалин (например, Санфеличе), готовятся непосредственно перед упот-
реблением.
109
Двухромовокислый калий делает альбумин нерастворимым,
но не осаждает его; в этом отношении он напоминает четырех-
окисный осмий. Двухромовокислый калий медленно изменяет
протеины так, что они становятся нерастворимыми в воде и не
дают уже затем плотного губчатого осадка под влиянием алкого-
ля. Гомогенность цитоплазмы сохраняется. Недостатком бихро-
мата калия является то, что он растворяет хроматин, и его не
следует применять для фиксации хромосом (если только он не
подкислен).
Бихромат калия фиксирует двумя совершенно различными
способами в зависимости от того, подкислен он или нет. При pH
ниже, чем 4,6, он фиксирует как хромовая кислота. При мень-
шей кислотности он фиксирует совершенно по-другому (факти-
чески критический pH варьирует между pH 4,2 и 5,2).
При большей кислотности хромосомы сохраняются хорошо,
цитоплазма и хроматин осаждаются в виде сетки, а митохондрии
не сохраняются. Когда кислотность меньше критической циф-
ры, — хромосомы растворяются, хроматиновая сетка нс появ-
ляется, цитоплазма гомогенна и прекрасно сохраняется, а мито-
хондрии хорошо фиксируются.
Одним из наиболее важных для цитологии свойств двухро-
мовокислого калия является его сильное фиксирующее действие
па многие липоиды. Жиры не подвергаются его воздействию, но
липоиды становятся нерастворимыми в липоидных растворите-
лях. Это действие, гораздо более сильное, чем действие формаль-
дегида, делает бихромат калия весьма полезным при изучении
митохондрий. Реакция, по-видимому, не является простым оки-
слением, так как хромовая кислота не сохраняет митохондрий,
хотя она и является сильным окислителем.
Двухромовокислый калий не фиксирует углеводов.
Фиксированный двухромовокислым калием материал следует
отмывать в течение 12 часов в проточной воде. После этого фик-
сатора окрашивание кислыми красителями идет хорошо, но хро-
матин окрашивается только в том случае, если к фиксатору до-
бавляется вещество, осаждающее нуклеиновую кислоту. При этом
бихромат не мешает окрашиванию.
Двухромовокислый калий служит прекрасным фиксатором-
клетки в целом (не считая хроматина), и в особенности — мито-
хондрий. Он сохраняет цитоплазму в состоянии, сходном с при-
жизненным. Ткани часто погружают в него после фиксации с
целью сохранить липоиды, в особенности при изучении митохонд-
рий. Это «последующее хромирование» удобно производить по-
средством насыщенного раствора в термостате при 37° С. Про-
цесс не должен быть слишком длительным (оптимальным сро-
ком считается два дня), так как иначе митохондрии будет трудно
окрасить.
В известной мере К2Сг2О7 предотвращает влияние заливки,
в парафин: объем тканей при этом мало меняется.
Из фиксаторов, содержащих хромовую кислоту, следует от-
метить жидкость Санфеличе: 1-процентной хромовой кислоты —
160 см3, формалина — 80 см3. Фиксировать 24 часа, промывать
в проточной воде 48 часов.
Хорошие результаты при фиксации морских животных дает
смесь С. Г. Навашина: 1-процентной хромовой кислоты 10 см3,
формалина 4 см3, уксусной кислоты 1 см3; фиксировать 12—
24 часа, промывать проточной водой 24 часа.
Хромовая кислота и двухромовокислый калий чаще всего
входят в состав фиксаторов в комбинации с осмиевой кислотой.
Осмий и осмиевые фиксаторы
Из всех фиксаторов, применяемых в цитологии, четырехокис-
ный осмий (так называемая «осмиевая кислота») вызывает наи-
меньшие, в большинстве случаев микроскопически едва замет-
ные изменения в структуре цитоплазмы и ядра. Осмиевая кисло-
та фиксирует, не давая микроскопически видимых преципита-
тов. Четырехокисный осмий является сильным окислителем.
Берг (1927) полагает, что следует различать первичное и вто-
ричное действие осмия. В первое включается соединение целой
молекулы осмия с аминогруппой протеинов. Эта первичная фик-
сация не мешает окрашиванию.
Вторичным действием является окисление образующегося со-
единения, причем часть четырехокисного осмия, не вошедшего
в соединение, восстанавливается до низшей окиси, или гидрооки-
си, делающей ткани коричневыми или черными.
После окисления ткани могут окрашиваться только после
тщательной промывки. Для ускорения вторичного действия до-
бавляется пирогаллол или другие восстановители.
Осмий является единственным фиксатором, фиксирующим как
жиры, так и липоиды. Жиры чернеют, так как все жиры в клет-
ках животных содержат немного олеина, восстанавливающего ос-
мий до темноокрашенной низшей окиси, или гидроокиси.
Жир, по-видимому, становится нерастворимым в большинстве
жировых растворителей, однако остается частично растворимым
в ксилоле, но не в бензоле, и в то же время легко растворяется в
скипидаре, — возможно потому, что последний окисляет осмий
и нарушает фиксацию. Чистые пальмитин н стеарин не чернеют
от осмия.
Липоиды восстанавливают четырехокисный осмий не так
энергично, как жиры, и потому обычно темнеют только в незначи-
тельной степени. В присутствии двухромовокислого калия или
хромовой кислоты они не восстанавливают осмия, а потому
черные капельки, видимые в препаратах после фиксации в сме-
сях Альтмана или Флемминга, обычно представляют собою
жир, а не липоиды. Хотя липоиды не чернеют, они консервиру-
ются смесями хромовой кислоты и четырехокисного осмия. По-
111
скольку первая в отдельности их не сохраняет, ясно, что дей-
ствие осмия не является простым окислением.
Осмий — прекрасный фиксатор для митохондрий. Он фикси-
рует их при гораздо более кислом pH, чем двухромовокислый
калий. Погружение объекта на продолжительное время в раствор
осмия вызывает потемнение элементов Гольджи; четкое выявле-
ние элементов Гольджи зависит от этой реакции.
Четырехокисный осмий не является фиксатором для углево-
дов.
Большим недостатком осмия является неравномерная фикса-
ция. Внешние клетки куска ткани «перефиксируются» и стано-
вятся непрозрачными и трудно окрашиваемыми. Затем идет топ-
кий слой прекрасно окрашиваемых клеток и середина, оста-
ющаяся не фиксированной осмием, но фиксируемая осталь-
ными компонентами смеси, если применялась фиксирующая
смесь.
По общему мнению, четырехокисный осмий является одним из
наиболее медленно проникающих фиксаторов. Имеется основа-
ние полагать, что четырехокисный осмий, выпадая, образует
барьер для собственного проникновения.
Осмий не сокращает клетки при фиксации.
Четырехокисный осмий поступает в продажу в ви-
де желтых кристаллов в запаянных трубках и должен разводить-
ся в безукоризненной дистиллированной воде. Загрязняющие
частицы восстанавливают осмий.
При разведении трубочку очень чисто обмывают эфиром,
подпиливают ближе к тому концу, где находится кусочек осмие-
вой кислоты, и опускают в темную банку с заранее отмеренным
количеством дистиллированной воды. Трубочку разбивают чисто
вымытой стеклянной палочкой внутри банки, которую закрывают
затем плотно притертой стеклянной пробкой. Раствор осмиевой
кислоты следует хранить в темноте. Свет восстанавливает его до
низшей гидроокиси, если только к раствору не добавлено весьма
малое количество сулемы.
Работая с осмиевой кислотой, надо помнить, что она действу-
ет раздражающе на слизистые оболочки носа, горла и т. д.
Заранее приготовленный 2-процентный раствор осмиевой кис-
лоты обычно хранят в банке темного стекла, предварительно без-
укоризненно чисто вымытой. В 1-процептном растворе осмиевой
кислоты материал фиксируют 1—2 дня, затем сутки промывают
в водопроводной воде и сохраняют его в 70—80-процентном спир-
те. Этот фиксатор плохо проникает в ткань, поэтому можно фик-
сировать только маленькие кусочки ткани.
Пары осмиевой кислоты применяются для фикса-
ции простейших, мельчайших многоклеточных животных, тонких
перепонок, изолированных клеток, культур тканей и т. д. С этой
целью объект нужно поместить на покровное стекло и положить
покровное стекло объектом вниз на отверстие широкогорлой
112
стеклянной банки, в которой налита 1—2-процентная осмиевая
кислота. Следует избегать непосредственного соприкосновения с
осмиевой кислотой. Продолжительность фиксации дается опы-
том и зависит от величины объекта (от '/2 минуты до 2 часов).
Объекты не должны подсыхать.
После осмиевых смесей плохо удается окраска по Маллори
и кармином.
Ниже мы приводим наиболее часто употребляемые фиксато-
ры, содержащие осмий.
Смесь Флемминга. Состав: 15 частей 1-процентного
водного раствора хромовой кислоты; 4 части 2-процентной ос-
миевой кислоты; 1 часть ледяной уксусной кислоты. Смесь осо-
бенно пригодна для изучения ядерных структур и хромосом в
процессе деления клетки. Трудность фиксации жидкостью Флем-
минга состоит в том, что отдельные ее составные части неодина-
ково быстро проникают в ткань и более глубокие слои нерав-
номерно фиксируются. Поэтому кусочки не должны быть толще
2—2,5 мм. Срок фиксации от одного до нескольких дней, в зави-
симости от характера материала; фиксировать надо в темноте;
затем не менее 24 часов промывать в водопроводной воде.
Дальнейшая обработка и хранение материала зависит от це-
лей исследования.
Для фиксации мелких особо нежных объектов применяется
так называемая «слабая» смесь Флемминга: хромовой кисло-
ты— 25 см3, 2-процентный осмиевой кислоты — 5 см3, 1-процент-
ной уксусной кислоты — 10 см3, дестиллированной воды — 60 см3
Были предложены различные модификации смеси Флеммин-
га, имеющие широкое применение в цитологических исследова-
ниях.
а) По Бенда: 1-процентной хромовой кислоты — 15 см3, 2-процент-
ной осмиевой кислоты — 4 см3, уксусной кислоты — 2—3 капли.
б) По Мевесу: 0,5-процеитной хромовой кислоты (разведенной в 1 %
NaCl)—по 15 см3, 2-процентной осмиевой кислоты—4 см3, уксусной кислоты—
2—3 капли.
Смесь Мевеса является одним из лучших фиксаторов для самых разнооб-
разных цитологических целей: плазматических структур, митохондрий, внут-
риклеточных фибрилл, мускульных клеток и т. д. Объект должен быть воз-
можно меньшим. Время фиксации 12—24 часа.
Нередко советуют перед употреблением добавлять к смеси Мевеса
0,5-процентной мочевины и затем фиксировать на холоде; при этом особенно
хорошо сохраняются тонкие клеточные структуры.
в) П о Ш а м п и: 1-процентной хромовой кислоты — 7 см3, 3-процентно-
го двухромовокислого калия — 7 см3, 2-процентной осмиевой кислоты —
1 см3. Фиксатор дает отличные результаты при изучении митохондрий и ап-
парата Гольджи, включений, но не ядер.
г) Смесь Альтмана: 5-процентного двухромовокислого калия —
5 см3, 2-процентной осмиевой кислоты — 5 см3. Фиксировать 24 часа.
Фиксатор употребляется при изучении митохондрий и жировых включе-
ний.
д) Смесь Бенсли: 2-процентной осмиевой кислоты — 2 см3, 10-про-
8 Микроскопическая техника 113
центного двухромовокислого калия — 2 см3, дистиллированной воды — 6 см3,
ледяной уксусной кислоты — 1 капля.
Фиксируют 24 часа. Фиксатор дает хорошие результаты при изучении
различных цитоплазматических структур, особенно митохондрий.
е) Смесь Германа является модификацией смеси Флемминга, в ко-
торой хромовая кислота заменена хлорной платиной: 1-процентной хлорной
платины — 15 частей, 2-процеитной осмиевой кислоты — 4 части, уксусной ки-
слоты — 1 часть.
Применение то же, что и для смеси Флемминга. Смесь ие следует долго
хранить.
После фиксации в смеси Флемминга илн Германа, а также и в других
осмиевых фиксаторах, объект можно поместить иа 12—24 часа в древесный
уксус, после чего сполоснуть водой и обычным образом проводить через спир-
ты. При такой обработке объект окрашивается в светло-коричневый тон,
в некоторых случаях позволяющий обойтись без какой-либо добавочной ок-
раски.
ж) Смесь Рос к ин а: 2-процентиой осмиевой кислоты—10 см3,
2,5-процентного двухромовокислого калия — 5 см3.
Перед употреблением прибавить 1 каплю 5-процентной трихлоруксусной
кислоты. Фиксировать 24 часа, промывать проточной водой 24 часа. Можно
после фиксации непосредственно (без промывки) перенести объект в древес-
ный уксус на 12—24 часа, чем достигается окраска тканей в нежный серый
цвет, делающий излишней последующую окраску.
Кацнельсон указывает, что хорошие результаты, особенно для эмбриоло-
гических объектов, дает фиксация в с м е с и Ф о л л я: 1-процентной хромовой
кислоты—25 см3, 1-процентной осмиевой кислоты—2 см3, 2-процентиой ук-
сусной кислоты — 5 см3, дистиллированной воды — 68 см3.
Некоторые авторы подвергают объекты, фиксированные в сме-
сях с осмиевой кислотой, особой обработке для наиболее полного
восстановления осмиевой кислоты. При этом ткани окрашиваются
в темный цвет и таким образом ие нуждаются в применении кра-
сителей при дальнейшем исследовании. Так, например, Герман
обрабатывал объекты, уже уплотненные в спирте, неочищенным
древесным уксусом (12—18 часов).
Колосов с. той же целью употребляет танин и пироталло-
вую кислоту в смеси следующего состава: воды — 450 см3, 85-
процентного спирта — 100 см3, глицерина — 50 см3, танина и пи-
рогалловой кислоты по 30 г.
Этот проявитель, как называет Колосов только что при-
веденную смесь, дает бесспорно прекрасные результаты. Время
необходимое для фиксации, зависит от величины и свойств объ-
екта. Для нежных объектов, например, эпителия серозных по-
кровов, достаточно 5—10 минут. Из проявителя объект еще раз
переносится в водный раствор осмиевой кислоты (’/4%) и затем
уплотняется в алкоголе.
Пикриновая кислота и фиксаторы, содержащие пикриновую
кислоту
Пикриновая кислота представляет собою желтое
кристаллическое твердое вещество. Растворимость ее в воде ко-
леблется от 0,9% до 1,2%, в зависимости от температуры. Она
растворима также в алкоголе, бензоле и ксилоле; горит спокой-
но, но от детонации дает* сильный взрыв. Не растирать сухую
114
пикриновую кислоту в ступке, опасаться взрыва. Во избежание
несчастных случаев ее всегда держат смоченной водой; в этом
состоянии она совершенно безопасна.
Пикриновая кислота дает осадки с альбумином, глобулином,
гистоном и нуклеиновой кислотой; последний растворим в воде,
остальные — нерастворимы.
Считают, что она дает с протеинами химические соединения:
протеино-пикраты.
Фиксация пикриновой кислотой не защищает протеины от пе-
реваривания пепсином или трипсином и, по-видимому, не влияет
на липоиды, но мешает фиксирующему действию бихромата ка-
лия. Она не фиксирует углеводы, однако, очевидно, осаждает
протеины в такой форме, которая противодействует растворению
гликогена в воде.
Существует общее мнение, что пикриновая кислота в ткани
проникает медленно.
Пикриновая кислота не только резко сокращает ткани, ио и
оставляет нх в таком состоянии, что они испытывают дальней-
шее сокращение при последующей обработке. Сокращение, вы-
зываемое пикриновой кислотой, не сопровождается затвердением.
Пикриновую кислоту отмывают в 70—80- или 96-градусном
спирте. Обычно у-тверждают, что пикриновую кислоту ни в коем
случае не следует отмывать водой, но это основано на ошибоч-
ном представлении о растворимости пикрата альбумина.
Вообще особой отмывки пикриновой кислоты не требуется,
так как ее избыток извлекается в процессе обезвоживания объ-
екта и желтый цвет сам по себе не вреден и не мешает после-
дующему окрашиванию объекта. После фиксации пикриновой
кислотой объект легко окрашивается. Количество свободной
пикриновой кислоты, остающейся в тканях, незначительно, по-
скольку она экстрагируется большинством обычно применяемых
растворителей (вода, алкоголь, бензол, ксилол). Для устранения
желтого- окрашивания фиксированного материала рекомендуется
промывка в водном растворе углекислого лития.
Пикриновая кислота, как осаждающая белки, рекомендуется
для использования в смесях с другими фиксаторами, в особенно-
сти, когда необходимо избежать затвердения объекта. При при-
менении в отдельности она слишком сокращает ткани. Кроме тоге,
под влиянием чистой пикриновой кислоты маленькие жировые
капли в клетках сливаются в более крупные капли, вероятно в
связи с изменениями цитоплазмы, нитевидные митохондрии обра-
зуют нечеткие ряды зерен, а в прижизненно гомогенных ядрах мо-
гут возникать губчатые структуры и хроматин выявляется в виде
комочков. Поэтому чистая пикриновая кислота не применяется для
фиксирования, но она входит в состав большого числа фиксирую-
щих смесей.
Смеси с насыщенным водным раствором пикриновой кислоты
применимы в разнообразных случаях и дают прекрасные резуль-
8*
JJ5
тэты. Насыщенный раствор пикриновой кислоты получается при
растворении 25—30 г пикриновой кислоты в 1 л горячей воды.
Выпадающие снова после остывания и оседающие на дно кри-
сталлы этой кислоты следует оставлять в виде осадка на дне со-
суда. После применения пикриновых смесей обычно не удается
заливка в целлоидин. Поэтому лучше для целлоидиновой залив-
ки фиксировать другими смесями.
Смесь Бу эн а. Этот превосходный фиксатор применяется в
гистологической технике для самых разнообразных целей. Состав:
насыщенного водного раствора пикриновой кислоты— 15 частей,
формалина —5 частей, уксусной кислоты —1 часть. Фиксация
длится не менее 2 часов. Большое преимущество этой смеси, осо-
бенно в экскурсиях и экспедициях, состоит в том, что объекты
можно дни и даже месяцы оставлять в этом фиксаторе без замет-
ного для них вреда. Фиксированные объекты промывают в 70—
80-градусном спирте, сменяя его 2—3 раза. Объекты, фиксирован-
ные в смеси Буэна, иногда крошатся после заливки в целлоидин.
Смесь Буэна отлично фиксирует эпителиальные ткани, хорошо
фиксирует различные железы и не всегда удачно — мускульную
ткань.
Дюбоск и Бразиль предложили модификацию смеси
Буэна, пригодную как для фиксации влажных мазков, так и для
фиксации труднопроницаемых объектов (например, членистоно-
гих): пикриновой кислоты— 1 а, 80-градусного спирта— 150 см3.
Непосредственно перед употреблением к этому раствору добав-
ляют 60 см3 формалина и 15 см3 уксусной кислоты. Фиксируют
1—3 дня. Для очень мелких объектов достаточно 30 минут. После
фиксации объект переносят непосредственно в 90-градусный
спирт.
Не раз приходилось отмечать, что прибавление двухромовокис-
лого калия к смеси Буэна — Бразиля улучшает фиксацию плазмы:
12-процентного двухромовокислого калия 1 часть, формалина
нейтрального 1 часть, 95-градусного спирта 2 части, насыщенного'
раствора пикриновой кислоты в 25-процентной уксусной кислоте
1 часть.
Фиксируют в течение 2 дней, затем объект переносят еще на
2 дня в смесь, извлекающую пикриновую кислоту:
70-градусного спирта—100 см3, уксуснокислого аммония —
Юг..
СмесьБуэна — Аллена: насыщенного водного раствора
пикриновой кислоты — 75 см3, формалина (хим. чистого)— 25 см3,
уксусной кислоты — 5 см3. Перед фиксацией смесь нагревают до
38° и при постоянном взбалтывании растворяют в ней 1,5 г кри-
сталлов хромовой кислоты (хим. чистой), а затем добавляют 2 г
кристаллической мочевины. Полученная смесь должна иметь тем-
но-коричневый цвет и быть совершенно прозрачной. Появление
зеленых оттенков показывает, что хромовая кислота недостаточно
чистая, и что фиксатором нельзя пользоваться.
116
Смесь надо готовить непосредственно перед употреблением,
так как она быстро портится. Для фиксации смесь должна быть
нагрета до 37—38’.
Смесь Буэна — Аллена применяется для наркологических ис-
следований и особенно для изучения хромосом. Кусочки семенни-
ков молодых животных (толщиной не более 0,5 см) фиксируют
2—3 часа, после чего дают смеси остыть до комнатной темпера-
туры н переносят материал в 70-градусный спирт.
Смесь в а н-Л е е у в е н а: 1-процентного раствора пикрино-
вой кислоты в абсолютном спирте — 24 см3, хлороформа — 4 с.и3,
формалина — 4 см3.
Перед употреблением добавляют 2 см* ледяной уксусной кис-
лоты. Фиксируют 24 часа, затем промывают в 90-градусном спир-
те. Фиксатор специально рекомендуется для объектов, имеющих
хитиновые покровы.
Модификация Г. И. Роскин а. Насыщенного водного
раствора пикриновой кислоты - 30 частей, формалина — 10 ча-
стей, 1-процентного трихлоруксусной кислоты — 2 части.
Трихлоруксусную кислоту прибавляют непосредственно перед
фиксацией. При этой фиксации особенно хорошо сохраняются
плазматические структуры, внутриклеточные фибриллы, фибрил-
лы мускульных клеток, центросомный аппарат. В некоторых'
объектах хорошо фиксируются и митохондрии. Продолжительность
фиксации 12—24 часа. Затем объект переносят для промывки в
80—90-градусный спирт.
Сулема и сулемовые смеси
Сильное осаждающее действие растворов сулемы на белки по-
казано в многочисленных опытах. Сулема дает осадки с альбуми-
ном, глобулином и нуклеиновой кислотой; все они нерастворимы
в воде. В литературе есть указания, что сулема образует соеди-
нения с аминокислотами, присоединяясь к группе NH2.
Сулема образует дополнительные соединения с некоторыми ли-
поидами, но растворимость этих соединений в жидкостях, приме-
няемых в цитологической технике, слабо изучена, и сулему едва ли
можно назвать фиксатором липоидов. Возможно, что некоторые
липоиды она разрушает. Сулема не фиксирует н не разрушает
углеводы.
Считается, что сулема проникает в ткани со средней или боль-
шой скоростью и сокращает их меньше, чем какое-либо дру-
гое из веществ, осаждающих протеин. Наблюдается значительное
последующее сокращение материала в алкоголе и парафине, но
окончательное уменьшение объема все же меньше, чем при приме-
нении других фиксаторов.
Сулема вызывает значительное затвердение тканей, и в этом
отношении ее превосходят только алкоголь и формальдегид. При
117
последующей обработке объекта алкоголем наблюдается его до-
полнительное затвердевание.
Выдающейся особенностью сулемы как фиксатора является
ее благоприятное влияние на окрашивание. Все красители, вклю-
чая кармин, хорошо окрашивают после нее. Сулема непригодна
для использования в отдельности, ввиду сильного осаждения ею
белков. Под действием сулемы как в ядрах, так и в цитоплазме
образуется грубый осадок, а жировые капельки сливаются в мас-
сы неправильной формы; однако, митохондрии не разрушаются,
и поэтому сулему включают в число фиксаторов для митохондрий
и для элементов Гольджи.
При растворении в воде сулема частично гидролизуется. Насы-
щенный раствор имеет pH = 3,2. В воде растворяется около 7%
сулемы, а в алкоголе примерно в 5 раз больше. Она более раст-
ворима в растворах хлористого натрия, нежели в воде, а именно
в 0,75% хлористого натрия растворяется около 10%.
Насыщенный водный раствор сулемы — главная составная
часть ряда очень употребительных фиксирующих смесей. Для его
приготовления надо вскипятить 1 л дистиллированной воды и рас-
творить в нем 70 г сулемы. Кристаллы, вновь выпадающие после
остывания раствора, оставляют лежать на дне склянки. Прибав-
лением поваренной соли можно повысить концентрацию сулемы
в растворе.
Все металлические инструменты (ножницы, иглы, пинцеты) на-
до беречь от сулемы. Работают поэтому роговыми, стеклянными,
деревянными инструментами или изготовляют из тонкого картона
узкие полоски, которые употребляют как шпатели для переноски
препаратов, и потом выбрасывают.
Для растягивания мембран употребляют вместо металличе-
ских иголок деревянные.
Сулема — сильный яд и при работе с ней надо соблюдать
должную осторожность.
Рекомендуется фиксировать в сулеме не очень большие кусоч-
ки: она не всегда проникает достаточно глубоко. Фиксируют
не дольше, чем это необходимо для полного проникновения фикса-
тора, и затем удаляют сулему сначала в 70-градусном спирте, за-
тем в спиртовом растворе иода (к 60 см3 70-градусного спирта при-
бавляют 1 см3 10-процентной иодной тинктуры и 10 см3 раствора
Люголя), который перестает обесцвечиваться, как только вся су-
лема удалена. При некоторых способах окрашивания присутствие
иода может мешать, поэтому его.отмывают из кусочков, промывая
объект в 70-градусном спирте, или же удаляют из срезов, окуная
предметное стекло со срезами в 0,25-процентный водный раствор
гипосульфита.
Ниже приводятся наиболее часто употребляемые сулемовые
фиксаторы.
Сулема—ледяная уксусная к и с л о т а: к 100 см3
насыщенного водного раствора сулемы прибавляют 5—6 см3 ледя-
118
ной уксусной кислоты. Длительность фиксации от 7? часа до 24
часов; затем 70-градусной иод-алкоголь (см. выше) и т. д.
Сулема — формалин — ледяная уксусная кис-
л от а: смешивают 76 см3 насыщенного водного раствора сулемы,
20 см3 формалина, 4 см3 ледяной уксусной кислоты. Смесь про-
никает относительно быстро даже в крупные объекты. Промыва-
ние, дальнейшая обработка — см. выше.
СмеРь А. М. Васюточкина: насыщенного водного
раствора сулемы — 50 см3, насыщенного водного раствора пикри-
новой кислоты—50 см3, формалина— 10 см3, ледяной уксусной
кислоты — 5 см3.
Формалин и уксусная кислота прибавляются перед употребле-
нием. Дальнейшая обработка обычная. Смесь А. М. Васюточкина
дает хорошие результаты, особенно при фиксации материала, взя-
того от амфибий.
Смесь Ценкера употребляется для самых разнообразных
гистологических целей. Состав: 5 г сулемы, 2,5 г двухромовокис-
лого калия, 1 г сернокислого натра, 100 см3 дистиллированной во-
ды; перед употреблением прибавляют 5 см3 ледяной уксусной кис-
лоты. Продолжительность фиксации от 1 до 24 часов в зависимости
от размеров объекта; после фиксации материал промывают 24 ча-
са в водопроводной воде до обесцвечивания, затем помещают в
спирт с иодом и т. д. Рекомендуется фиксацию производить в
темноте. Смесь Ценкера особенно хорошо фиксирует кожные
покровы.
Максимов рекомендует добавлять к 100 см3 основной сме-
си. Ценкера 10 см? формалина. Фиксировать 1—6 часов. В ряде
случаев следует прибавлять 10 см3 2-процентной осмиевой кисло-
ты; второй смесью фиксировать 24 часа и дольше; в обоих случаях
объекты после фиксации надо промывать в течение 24 часов про-
точной водой.
Смесь Максимова представляет собою универсальный фикса-
тор; дает отличные результаты при изучении цитологических
структур; ее всегда следует применять при изучении клеток сое-
динительной ткани и для фиксации тканевых культур.
Срезы после этой фиксации хорошо окрашиваются различными
методами, особенно азур-эозином, панхромом, методом Романов-
ского и т. д.
Смесь Г е л л и является модификацией смеси Ценкера,
к которой вместо уксусной кислоты прибавляют непосредственно
перед употреблением 5 см3 формалина. Смесь Гелли особо при-
годна для гематологических исследований'(кроветворные органы),
причем следует фиксировать маленькие кусочки (2—5 мм толщи-
ной) и не слишком долго: 1—6 часов. Для гистологических и ци-
тологических целей объекты рекомендуется фиксировать дольше:
24—48 часов; иногда могут хорошо'сохраниться и митохондрии.
Кровяные клетки и их грануляции фиксируются смесью Гелли
лучше, чем смесью Ценкера.
119
Смесь «суза» по Гейденгайну. Состав: сулемы — 4,5 г,
поваренной соли — 0,5 г, дистиллированной воды — 80 сл3, три-
хлоруксуспой кислоты — 2 г, ледяной уксусной кислоты — 4 с .и3,
формалина — 20 см3. Длительность фиксации от 1 до 24 часов,
затем кусочек сразу переносят, в 70-градусный спирт, спирт с ио-
дом и т. д. Прекрасный фиксатор как для общегистологических
целей, так и для выявления различных фибриллярных структур.
В нашей лаборатории для изготовления общегистологических
препаратов, а также для изучения фибриллярных структур мате-
риал фиксируют смесью сулемы и трихлоруксуспой кислоты. Этот
фиксатор дает хорошие результаты при фиксации тканей, богатых
водой, например, личинок амфибий.
Ткани, предварительно витально окрашенные трипановой синь-
кой, хорошо фиксируются следующей смесью:
формалина — 5 сл3, насыщенного раствора сулемы — 25 см3,
5-процентной трихлоруксуспой кислоты —20 см3. Маленькие ку-
сочки фиксируют 1—2 часа, большие—3—24 часа, после чего их
переносят в 80—90-градусный спирт, который надо сменить не-
сколько раз.
Смесь Жильсона: сулемы — 20 г, 60-градусного спир-
та— 100 ел3; азотной кислоты (уд. вес 1,456) — 15 см3, ледяной
уксусной кислоты — 4 см3, дистиллированной воды—880 см3.
Длительность фиксации, в зависимости от величины объекта,
от 15 минут до 6 часов, затем объект переносят в 70-градусный
спирт. Смесь быстро проникает и хорошо фиксирует. Она пригод-
на для многих видов беспозвоночных, особенно членистоногих.
А. П. Римски й-К о р с а к о в предложил следующую моди-
фикацию смеси Жильсона: сулемы (насыщенный раствор) —
100 см3, азотной кислоты (уд. вес 1,456) —3 см3, ледяной уксус-
ной кислоты — 5 см3, 70-градусного спирта — 20 см3.
Смесь Петруикевича: абсолютного спирта — 200 см3,
ледяной уксусной кислоты — 90 см3, дистиллированной воды —
300 см3, азотной кислоты — 10 см3, сулемы — до насыщения (при-
мерно 20 г).
Смесь по своим свойствам и применению близка к смеси
Жильсона.
Смесь Шаудина: насыщенного раствора сулемы — 2 ча-
сти, спирта (96-градусного или абсолютного) — 1 часть. Часто
применяется в подогретом до 50—60° виде. Оъект фиксируют 5—
10 минут, промывают в 70-градусном спирте, иодируют. Смесь
обычно применяется для фиксации простейших и мелких беспо-
звоночных при изготовлении мазков, тотальных препаратов. Фик-
сатор иногда вызывает вакуолизацию плазмы.
Диоксановые фиксаторы
С введением в микротехнику дноксана были предложены фик-
сирующие смеси, в состав которых входит диоксан. Модификация
смеси Буэна, приготовленной на диоксане, дана на стр. 145.
120
Очень хорошие результаты дает следующая модификация сме-
си Петрупкевича: 60-процентного диоксана—100 см3, азотной
кислоты (уд. вес 1,41) — 3 см3, азотнокислой цепи (кристал-
лической)— 2 г, параиитрофенола кристаллического — 5 г.
Смесь оставляют 4га 2—3 дня, время от времени встряхивают
и добавляют 5 см3 эфира. Маленькие кусочки (2—4 мм) фикси-
руют 4—6 часов, большие — 24—48 часов. Затем заливают обыч-
ным образом через диоксаи.
Фиксация с помощью замораживания-высушивания
Стремление избежать воздействия химических реактивов при
фиксации и при дальнейшей заливке в парафин или целлоидин
привело к созданию метода замораживания-высушивания. Осно-
вы этого метода были заложены исследованиями Альтманна
(1894) и Герша (1932). Сущность метода заключается в том, что
кусочки органов, взятые у животного, незамедлительно и быстро
замораживают при температуре жидкого воздуха, затем высуши-
вают в условиях высокого вакуума при температуре —40—65°,
после чего непосредственно переносят в расплавленный парафин.
Срезы с залитого в парафин объекта обрабатывают по различ-
ным гистохимическим методам или окрашивают разными спосо-
бами в зависимости от целей исследования. Доказано, что замо-
раживание-высушивание в высокой мере сохраняет прижизнен-
ные структуры клеток и открывает широкие перспективы для ги-
стохимического и гистоауторадиографического анализа.
Одной из причин, ограничивающих широкое применение мето-
да, являлась сложность и дороговизна необходимых установок
для высушивания. Однако за последние годы предложены ряд
более простых приборов. Один из них (рис. 55) описан А. П. Ды-
бан и В. А. Журавлевым (1954).
Только что извлеченный кусочек ткани (объем его не более
2 мм3) замораживают в изопентане, охлажденном до температуры
жидкого воздуха; можно использовать также легкую фракцию бен-
зина с точкой кипения +26°, -|-34°. Изопентан наливают в метал-
лическую или стеклянную пробирку. Пробирку погружают или в
жидкий воздух, или в жидкий азот, или в жидкий кислород. За-
мораживание непосредственно в жидком воздухе дает менее хоро-
шие результаты. Необходимо соблюдать особую осторожность, так
как при попадании изопентана в жидкий воздух или в жидкий
кислород образуется взрывчатая смесь: заранее проверить каче-
ство пустой пробирки, опустив ее в жидкий воздух. В охлажден-
ный изопентан вносят на кончике стеклянной палочки кусочек
только что извлеченной ткани. Замораживание происходит в пер-
вые же секунды. Полностью замороженный объект вместе со
стеклянной палочкой переносят для дальнейшей транспортиров-
ки в специальную корзиночку (рис. 56), в которой должно быть
достаточное количество твердой углекислоты, так как надо опа-
121
саться оттаивания ткани и действовать быстро. Кусочек ткани от-
деляют от стеклянной палочки. Корзинка укреплена на стеклян-
ной палочке (5) и состоит из двух металлических цилиндров, на-
саженных один на другой. На дно цилиндра (2) помещают замо-
роженные кусочки ткани (3). На дно другого цилиндра (1) кла-
дут твердую углекислоту. Кусочки ткани покрывают сверху так-
Рис. 55. Общий вид прибора для обезвожи-
вания кусочков ткаии при низкой темпе-
ратуре. Объяснение в тексте.
же углекислотой. Отверстия (4) (их несколько) служат для от-
вода испаряющейся углекислоты.
Корзиночку с одним или несколькими замороженными кусоч-
ками ткани помещают в прибор для высушивания (рис. 57) через
вакуумный шлиф (5). В приборе для высушивания под вакуумом
углекислота быстро испаряется. Одно колено (7) прибора шире
другого. В колене (7) находится парафин (3), на поверхности
которого расположен спай термопары (4), служащей для контро-
ля температуры* 1. Колено (7) прибора опускают в сосуд Дюара
(емкостью в 1 л), в котором жидкий воздух занимает несколько
менее половины объема. Колено (2) прибора погружают во вто-
1 До начала высушивания ткаии освобождают парафин, налитый в при-
боре, от газов. Для этой цели, откачивая воздух, создают вакуум и одно-
временно 30—60 минут нагревают парафин до 4-100°. Когда парафин снова
застынет, выключают насос, открывают кран и начинают охлаждение колена
(1) прибора в сосуде Дюара. Как только температура парафина понизилась
до —40°, —45° и ниже, прибор готов для работы.
122
рой сосуд Дюара с жидким воздухом. Вакуум (порядка 10 2 мм
ртутного столба) создают насосом, соединенным с краном (7)
прибора. Насос включают на короткое время в начале обезвожи-
вания до создания необходимого вакуума, затем с помощью кра-
на (7) отключают от прибора. Наличие вакуума контролируют с
Рис. 56. Схема уст-
ройства корзиночки
для переноса кусочков
замороженных тканей
в прибор для обезво-
живания. Объяснение
в тексте.
Рис. 57. Схема установ-
ки для обезвоживания
кусочка ткани при низ-
кой температуре. Объяс-
нение в тексте.
помощью электродов, которые соединены с индуктором. Обезво-
живание кусочков тканей продолжается несколько суток, после
чего колено (1) прибора помещается в парафиновую баню (от
-г52° до +54°). Парафин, находящийся на дне колена (/), пла-
вится, и корзиночка с обезвоженными объектами погружает-
ся в расплавленный парафин. Для полного пропитывания объекта
парафином в условиях вакуума достаточно 10—30 минут. После
этого в прибор впускают воздух, корзиночку с кусочками ткани
вынимают и окончательно заливают в парафин. Парафиновые
срезы из замороженных и высушенных тканей не следует при-
клеивать при помощи воды или смесей, содержащих много воды,
так как при этом срезы разрушаются; рекомендуется пользовать-
ся так называемым сухим способом (см. стр. 153). Многие иссле-
дователи отмечают трудности наклейки срезов после заморажи-
вания-высушивания. Обычным способом депарафинированные
срезы обрабатывают различными методами в зависимости от це-
лей исследования.
123
РАЗДЕЛ ШЕСТОЙ
ПОСТОЯННЫЙ ПРЕПАРАТ
Постоянные препараты приготовляются в виде мазков, срезов
или так называемых тотальных препаратов.
ТОТАЛЬНЫЕ ПРЕПАРАТЫ
Тотальные препараты изготовляются из мелких организмов
(простейшие, черви и т. п.), маленьких органов или их частей,
кусочков тканей, пленок эпителия и т. п. Для изготовления то-
тального препарата поступают следующим образом: материал
фиксируют одним из указанных ранее фиксаторов; особо пригод-
ны для этой цели смесь Буэна или сулемовые смеси, а также
формалин. После соответствующей промывки объект переносят
в 70-градусный спирт на 5—10 минут, после чего помещают в кра-
ситель. Для окрашивания тотальных препаратов особо пригодны
паракармин, борный кармин, квасцовый кармин или квасцовый
гематоксилин (см. стр. 189), без докраски или с докраской одним
из кислых красителей (светлый зеленый, лионский синий, оранж).
Окрашивание лучше всего производить в часовых стеклах или
солонках.
Очень мелкие объекты переносят нз одного реактива в другой
с помощью пипетки, более крупные — шпателем. Под лупой прн
сильном освещении снизу мелкие окрашенные объекты становятся
хорошо видимыми в часовом стекле с красителем.
Можно посоветовать в некоторых случаях краситель разводить
в 2—4 раза (водой или спиртом): при этом процесс окрашивания
несколько замедляется, но зато создается возможность контроли-
ровать его под микроскопом. После окрашивания и соответствую-
щей дифференцировки объект споласкивают в 70-градусном спир-
те и переносят в 96-градусный спирт, сменяют его два раза, пере-
носят объект в абсолютный спирт, где происходит окончательное
обезвоживание объекта.
Простейших в каждом из спиртов можно выдерживать по
124
20 минут; для мелких животных (гидра, мелкие сосалыцики)
необходимо 1,5—2 часа, для более крупных объектов —6—12 ча-
сов. Особо нежные объекты следует проводить через более после-
довательный ряд спиртов, чтобы избежать сморщивания: дистил-
лированная вода — 50—60—70—80—90—96-градусный — абсо-
лютный спирт. Затем спирт сливают или отсасывают пипеткой и,
оставляя на стекле лишь минимальное количество спирта (чтобы
не дать объекту подсохнуть), прибавляют ксилол. Можно также
объект пипеткой перенести в стеклянную чашечку с ксилолом.
Применяются и другие просветляющие средства. Лучшим из них
является гвоздичное масло, в которое объекты переносят из аб-
солютного спирта, выдерживая их в нем до полного просветления.
Хорошие результаты дают кедровое и бергамотовое масла. В ме-
тилбензоат объект можно непосредственно переносить из 96-гра-
дусного спирта, минуя абсолютный. Годится также и терпинеол.
Одну и ту же порцию масла можно употреблять несколько раз.
Если пользоваться ксилолом (толуолом), лучше объекты сначала
перенести в смесь равных частей абсолютного спирта л ксилола
(толуола), а затем уже в чистый ксилол. Нежные объекты (меду-
зы и т. п.) при переносе из абсолютного спирта в масло часто
сморщиваются. Поэтому рекомендуется поместить их сначала в
смесь равных частей масла и абсолютного спирта, затем — в смесь
2 частей масла и 1 части спирта и только тогда — в чистое масло.
Можно использовать и следующий метод: в энтомологическую про-
бирку налить кедрового масла, сверху прилить абсолютного спир-
та, куда и перенести объект; последний будет очень медленно
опускаться в кедровое масло, которое постепенно смешивается со
спиртом. Когда объект опустился на дно, его переносят в чистое
кедровое масло.
После того, как объект просветлился в ксилоле и стал пол-
ностью прозрачным, его переносят (в минимальном количестве
ксилола) на. чистое предметное стекло, на которое предварительно
была нанесена капля канадского бальзама, и покрывают покров-
ным стеклышком. Можно сделать кольцо из бальзама и в центр
его положить объект. Если объект относительно нежный и можно
опасаться, что покровное стеклышко его раздавит, то к покровно-
му стеклышку по его углам приделывают «ножки» из маленьких
кусочков воска или же под него подкладывают тончайшие стек-
лянные капилляры, кусочки волоса и т. д. Покровное стеклышко
не следует накладывать прямо на каплю бальзама с находящим-
ся в пей объектом, лучше сперва покровное стеклышко поставить
на ребро и, постепенно опуская другой край стекла, дать ему
лечь. Тем самым можно избегнуть пузырьков воздуха в препара-
те. Если они все же образовались, то препарат надо положить
в термостат при температуре 37—40°, где обычно пузырьки возду-
ха выходят сами. Если же бальзама оказалось недостаточно и под
покровным стеклом образовались пустоты, то следует нанести
каплю бальзама по краю покровного стекла, и в силу капилляр-
125
ности бальзам войдет постепенно под покровное стекло. Если,
наоборот, бальзама оказалось чрезмерно много, то его, после того
как он подсохнет, можно удалить, соскабливая ножом. Объект
можно заключить также в глицерин или глицерин-желатину.
При изготовлении тотального препарата можно исходить из
следующей схемы:
1) Фиксация (например, формалином) от 10 минут до 24 ча-
сов, в зависимости от величины объекта. 2) Промывка в проточ-
ной воде от 20 минут до 24 часов. 3) Проведение через спирты,
если краситель приготовлен на спирте: 40-градусный 5—10 минут,
70-градусный 5—10 минут. 4) Окраска паракармином, борным
кармином, квасцовым кармином или квасцовым гематоксилином;
если необходимо, то после окраски дифференцируют (детали см.
стр. 191). 5) Постепенное обезвоживание в спиртах: 70-градусном
от 5—10 минут до 2—3 часов, в зависимости от величины объекта,
в 90-градусном от 5 минут до 2—3 часов, в зависимости от вели-
чины объекта, в 100-градусном 5—10 минут (дважды повторить).
6) Ксилол — 5—20 минут до полного просветления. 7) Канадский
бальзам. Вместо 100-градусного спирта объект можно провести
через гвоздичное или бергамотовое масло, в которых объект хоро-
шо просветляется, после чего объект можно непосредственно (ми-
нуя ксилол) заключить в бальзам.
Быстрое обезвоживание (5—10 минут) применяется для очень
мелких объектов (инфузории и т. п.).
МИКРОТРАХИСКОПИЯ
Изучение тотальных объектов является весьма сложной зада-
чей. Для этой цели можно с успехом использовать метод микро-
трахископии, который широко применялся в лаборатории М. А. Ба-
рона.
Метод рассчитан для изучения общей архитектуры органов,
установления взаимосвязи входящих в их состав тканей, опреде-
ления топографии структурных элементов и пр. Трахнскопические
картины чрезвычайно объемны (трехмерны) и соответствуют об-
щеизвестным реконструкциям Брауса с тем лишь отличием, что
1) они гораздо полнее и 2) допускают непосредственное наблю-
дение объекта в натуре, исключая тем самым ошибки, связанные
с графической или пластической реконструкцией.
С наибольшим эффектом метод применим в следующих об-
ластях: гистологии органов, морфологии проводящих путей цент-
ральной нервной системы, патологической анатомии, эмбриологии
позвоночных и человека. Диапазон его охватывает всю область
видения, между тем, что доступное невооруженному глазу (нор-
мальная анатомия), и тем, что может быть рассмотрено лишь при
больших увеличениях (цитология). В трахпскопических препара-
тах, как например, сосочки языка, фолликулы щитовидной же-
лезы, кишечные ворсинки и различного типа волокна, видны кле-
точные ядра и даже ядрышки. Трахископию возможно сочетать с
126
обычными цитологическими методами. В процессе или после изу-
чения трахископического препарата из него выделяется предста-
вившая интерес структурная деталь (например, пачиниево тельце,
потовая или сальная железа, ацинус легкого и т. д.), которая без
перефиксажа заливается в парафин или целлоидин, разлагается
на микротомные срезы и обрабатывается далее обычным спосо-
бом.
Метод предусматривает специальную технику изготовления
препаратов и совершенно особые условия микроскопирования.
Изготовление трахископических препаратов
1. Фиксация. Целые органы (щитовидная железа, гипофиз,
трахея, яичник и пр.), сегменты органов (пищевода, кишки, яйце-
вода и т. п.) или кусочки (печени, кожи, легкого и т. д.) фикси-
руются в 12-процентном нейтральном формалине. Стенки поло-
стных органов, оболочки и т. п. предварительно расправляются иа
восковой пластинке, прикалываются к ней неметаллическими игол-
ками и освобождаются от слизи (отмывание физиологическим
раствором). Объект фиксируется либо сейчас же после извлечения
Рис. 58. Трахископические препараты. А—сечение препарата;
Б — препарат с параллельными сторонами; В — препарат, стороны
которого сходятся под тупым углом (грани); Г — препарат труб-
чатого органа:
/ — пленка целлулоида; 2— слой желатины; 3— пластинка, вырезанная нз
органа.
из трупа, либо до фиксации помещается на 3—5 часов в эксика-
тор, на дне которого находится увлажненная йата, предохраняю-
щая его от высыхания. В последнем случае благодаря неодинако-
вому тургору входящих в состав органа тканей и элементов на
поверхности разрезов искусственно усиливается рельеф. Одни де-
тали выпирают, другие несколько западают (мышечные и сухо-
жильные пучки, мелкие железы, сосуды, трабекулы и т. п.). Объек-
ты, содержащие кость или известь (зуб с альвеолярной ячейкой,
части скелета, эмбриональные закладки костей, окостеневшие хря-
щи) , декальцинируются обычным способом 5-процентной азотной
кислотой, к которой одновременно добавлен формалин указанной
концентрации.
2. Изготовление пластинок. После фиксации, кото-
рая является предварительной и длится около 6—10 часов, объект
споласкивается дистиллированной водой и из него с помощью
хорошо отточенной ручной бритвы вырезаются пластинки
(рис. 58). Оптимальные размеры пластинок 1,5X1,5 см при тол-
127
щине не менее 3—4 мм. В зависимости от объекта они могут варь-
ировать от 5 X 5 см до 1 X 1 мм и достигать толщины 1 см (лег-
кое). Как правило, одна или две грани пластинки должны со-
хранять естественную поверхность органа. Вся манипуляция раз-
резания объекта производится на кусочке зафиксированной пече-
ни, причем, в случае необходимости, объект заключается в насеч-
ку кусочка (поперечные разрезы нерва, мочеточника и пр.). Пос-
ле того как пластинка вырезана, одна из граней скашивается
бритвой под более или менее тупым углом, как это показано на
рис. 58, 3). Такой прием допускает одновременное микроскопи-
рование двух поверхностей, что обеспечивает огромный выигрыш
в трехмерности формы.
3. Дополнительная фиксация. Вырезанные пластин-
ки погружаются на сутки в 12-процентный формалин. В тех слу-
чаях, когда имеется в виду специальный фиксаж (мозговое ве-
щество надпочечника или использованиетрахископического препа-
рата для более топкого анализа), формалин заменяется другими
фиксаторами (жидкости Ценкера, Буэна, Рего, Шафера и пр.).
4. Промывание. Объект тщательно отмывается в много-
кратно сменяемых больших объемах воды: в течение 8 часов в во-
допроводной и 6 часов в дистиллированной. При других фиксажах
производится обычная дополнительная обработка (например, ио-
дирование после сулемовых фиксажей и т. д.).
5. Окраска. Во избежание последующего выцветания пре-
паратов в глицерине наиболее рационально применение гематок-
силина Гансена, орсеина, Судана, спиртового эозина (экстра), ниг-
розина. спиртового анилинового синего и пр. Гематоксилин Ган-
сена имеет большие преимущества перед всеми железными гема-
токсилинами, так как эффективно окрашивает тотальные объекты,
не требует дифференцировки, тонирует детали, отлично сохраняет-
ся и хорошо сочетается в двойной и тройной окраске с перечислен-
ными спиртовыми красителями. Пластинки окрашиваются в силь-
но разведенных растворах, которые готовятся из маточных, обычно
1-процентных. При этом они многократно встряхиваются. Степень
окраски контролируется под микроскопом.
В другой модификации (при заключении пластинок в канад-
ский бальзам) может быть использован обычный набор гистоло-
гических красителей, в том числе и анилиновых. Исключительно
эффективные картины дают полихромные красители: полихром-
ный синий, различные сорта метиленового синего, тионин, толу-
идиновый синий и пр. В этих случаях окраска закрепляется мо-
либденовокислым или пикриновокислым аммонием.
6. Разрезание пластинок. Поскольку для трахископи-
рования обязательна окраска лишь одной стороны пластинок
(другая, обращенная к зеркалу, должна оставаться неокрашен-
ной), пластинка разрезается пополам. Таким образом, в оконча-
тельном виде получаются две пластинки и соответственно этому
толщина их уменьшается вдвое. При разрезании пластинка зажи-
128
мается между двумя пальцами или в насечке кусочка печени и
рассекается на две половины бритвой.
7. Промывание. Как и в первом случае, вначале в водо-
проводной воде не менее 10 часов (изменение цвета триоксигема-
теина), а затем около 2 часов в дистиллированной воде.
8. Наклейка на целлулоидную пленку. Тщатель-
но очищенная рентгенопленка разрезается на части, соответствую-
щие по размерам пластинкам ткани. Один из краев кусочка плен-
ки загибается под прямым углом с тем, чтобы его было удобно
брать пинцетом. Отмытая пластинка вынимается из воды, и ее не-
окрашенная сторона подсушивается фильтровальной бумагой
(противоположная остается все время увлажненной). На заранее
подготовленную пленку целлулоида кисточкой наносится неболь-
шая капля растопленной желатины (25-процентной), профильтро-
ванной и совершенно прозрачной, к которой добавлено несколько
кристаллов тимола. Помещая пленку с каплей па нагретое пред-
метное стекло, размазывают желатину, приклеивают неокрашен-
ную и подсушенную сторону пластинки к целлулоиду и придают
ей желательную ориентировку. Затем окончательно смонтирован-
ный препарат (см. рис. 58) снимается с нагретого стекла, после
чего желатина быстро застывает. Для того, чтобы избежать
последующего растворения и соскальзывания пластинки с целлу-
лоида, она денатурируется опусканием всего препарата на 10 ча-
сов в 20-процентный раствор нейтрального формалина. Затем сле-
дует 2—3-часовое промывание в дистиллированной воде.
9. Просветление. Препараты проводятся через 4 раство-
ра химически чистого нейтрального глицерина постепенно воз-
растающей концентрации: 10-, 20-, 30-, 34-процентный. В первых
двух они остаются по 24 часа, в последних— в течение 2 суток в
каждом.
10. Хранение препаратов. Готовые препараты удобно
сохранять в маленьких бюксах, на, дно которых налит очень тон-
кий слой 24-процентного глицерина. При трахископировании они
переносятся пинцетом на сферическое зеркало *.
1 Кроме этого способа изготовления препаратов, автор предложил еще
два Во втором варианте метода, начиная с 7-го пункта, следует постепен-
ное обезвоживание объекта в спиртах, просветление в бензол-бензонате и ря-
де масел и заключение в канадский бальзам по оригинальному способу на-
растающей капли. Третий вариант, разработанный совместно с химиком
Ластовским, предусматривает заключение трахнскопического препарата в
органическое стекло (плексиглас). В последнем случае пластинка оказы-
вается как бы замурованной внутри идеально прозрачного кристалла.
Однако опнсаиный здесь вариант метода имеет то преимущество, что де-
лает возможным тончайшие манипуляции и мнкропрепаровку под бинокуляр-
ным микроскопом заключенного в жидкую среду трахископическ’ого препарата,
например, извлечение коллоида из отдельных фолликулов щитовидной железы,
выделение яйцеклетки из граафова пузырька, микропрепарирование нервных
пучков и ряда концевых нервных аппаратов и т. Д. Он допускает обесцвечи-
вание и вторичную окраску препарата другими красителями и ие требует
ряда дефицитных в настоящее время реактивов: спирта, масел, канадского
бальзама и т. д.
S Микроскопическая техника
129
Трахископирование
В основе его лежит принцип одновременного освещения препа-
рата в-падающем и боковом проходящем свете и его рассмотрение
в стереоскопическом бинокулярном микроскопе. Соответственно
этому установка включает: 1) вогнутое сферическое зеркало,
2) стереоскопический микроскоп н 3) от 1 до 3 мощных точечных
/
Рис. 59. Установка для микротрахнскопировання. Вид спереди.
Изображен лишь ход лучей падающего света. Фокусы лииз
осветителей не совмещены на центре сферического зеркала.
Третья лампа не нарисована. Обозначения см. на рис. 60.
электроламп. Расположение всех этих частей показано на схеме
(см. рис. 59, 60).
Сферическое зеркало, в простейшем случае рефлектор с како-
го-либо проекционного аппарата, укреплено в кольце резиновой
трубки на столике микроскопа. Вместе с кольцом его можно пере-
мещать и вращать в любую сторону. На зеркало наливается
35-процентный раствор глицерина с таким расчетом, чтобы он
лишь тонким слоем, но целиком покрыл всю окрашенную поверх-
ность расположенного в его центре препарата. Противоположная
неокрашенная сторона обращена к зеркалу. В зависимости от ве-
личины и других особенностей препарата целесообразно исполь-
зовать набор зеркал различной кривизны и размеров.
Существенным моментом при трахископировании является
подбор подходящей модели стереоскопического микроскопа, снаб-
женного большим комплектом перемещающихся на револьвере
двойных объективов вплоть до погружных глицериновых. Положе-
ние трех источников света должно точно соответствовать указан-
ному на рис. 60. Следует применять точечные электролампы, из-
130
готовленные Московским электрозаводом (12 вольт, 100 ватт с
конической нитью накала). Угол наклона ламп от 45 до 60°. Фо-
кусное расстояние собирающей на центр сферического зеркала
линзы 15—20 см.
Ход световых пучков в действительности несколько сложнее,
чем это изображено на схеме. Падающие лучи непосредственно ое-
Рис. 60. Установка для мнкротрахископироваиия. Вид сверху.
Фокусы линз всех трех осветителей совмещены. Микроскоп
не нарисован.
1 _ трахискогтический препарат; вогнутое сферическое зеркало;
3— кольцо из резиновой трубки; 4 — столик микроскопа; 5 — биноку-
лярный стереоскопический микроскоп; 6 — точечная электролампа; 7—
плосковогнутая линза; 3 — цветной фильтр. 9 — падающие лучи; 10—
отраженные от зеркала лучи.
вещают окрашенную поверхность, затем проходят через полупроз-
рачный препарат, желатину, целлулоид и, отражаясь под неодинаг
новыми углами от разных точек вогнутой поверхности зеркала,
вторично освещают препарат проходящим боковым светом. В от-
личие от обычного микроскопирования с помощью укрепленного
под предметным столиком зеркала, лучи, отраженные сферическим
зеркалом, в объектив не проникают. Это и дает совершенно нео-
бычное и чрезвычайно благоприятное сочетание падающего и про-
ходящего света.
Попеременное включение первой, второй и третьей лампы при-
водит к освещению объекта с разных сторон. Это дает различ-
S* 131
ную игру бликов и теней, выпуклых и вогнутых точек рельефа
препарата и еще больше усиливает его трехмерность. Включая
одновременно две или все три лампы, удаляя или приближая их
к зеркалу, совмещая или разводя фокусы линз электроламп, не-
трудно регулировать интенсивность освещения различных участков
препарата. Изменением степени накала ламп, положения зеркала
на столике и препарата в зеркале достигают самых разнообразных
нюансов сочетания падающего и проходящего света, которые еще
больше подчеркивают те или иные структурные детали. Примене-
ние окрашенных фильтров, устанавливаемых в прорезах ламп
впереди линз, дает не менее богатую гамму различных цветовых
оттенков.
ПРИГОТОВЛЕНИЕ МАЗКОВ
Метод мазков применяется при изучении крови, свободножи-
вущих или паразитических простейших, различных тканевых эле-
ментов, бактерий и т. д. Различают сухие и влажные мазки.
Влажные мазки применяются при более тонких цитологических
исследованиях, где необходима возможно лучшая сохранность
клеточных элементов.
При изготовлении влажного мазка из тканевых
элементов кусочек исследуемой ткани, находящийся в физио-
логическом растворе, с возможной осторожностью расщипывают
тонкими иглами на предметном стекле или соскабливают клетки
покровным стеклом, одновременно размазывая клеточные элемен-
ты по предметному стеклу.
Можно также маленький кусочек ткани поместить между двумя
покровными стеклами и затем их осторожно раздвинуть, так что-
бы клетки остались на покровных стеклах. При этом мазок полу-
чается на покровных стеклах, которые и подвергаются дальней-
шей обработке. Совершенно аналогично поступают с каплями
полостной жидкости, каплями различных сред, с простейши-
ми и т. д.
При изготовлении мазка необходимо соблюдать следующие
правила: 1) мазок не должен быть слишком густым, так как это
мешает дальнейшему изучению его, 2) материал следует равно-
мерно распределить по стеклу, 3) мазок необходимо делать бы-
стро, 4) остерегаться раздавливания клеток, 5) по изготовлении
мазков необходимо тотчас же их фиксировать, не дав подсохнуть
клеткам.
При фиксации влажных мазков нужно положить стекло
в фиксирующую смесь, налитую в плоскую стеклянную чашку,
мазком вниз; при этом опасность отлипания клеток меньше, так
как фиксатор как бы «прижимает» клетки к стеклу. Покровные
стекла должны плавать на фиксирующей жидкости; под предмет-
ные стекла предварительно подкладывают кусочки стеклянных ка-
пилляров, чтобы между мазком и дном стеклянной чашки свобод-
но проходила фиксирующая жидкость.
132
Влажные мазки можно также фиксировать парами осмия, для
чего покровное стекло мазком вниз кладут на отверстие широко-
горлой банки с 2-процентной осмиевой кислотой и фиксируют ’/2 —
5 минут или более (избегать подсушивания!) в-зависимости от
объекта и назначения препарата. Если объекты при фиксации пло-
хо приклеиваются к стеклу, то необходимо предварительно стекло
покрыть тончайшим слоем белка куриного яйца или прибавить
его к среде, где находятся подлежащие обработке объекты.
После фиксации мазки обрабатывают так же, как и наклеен-
ные срезы (см. стр. 161). Важным условием получения хороших
Рис. 61. Схема приготовления мазка
крови.
мазков служит безукоризненная чистота покровных и предметных
стекол.
Из кусочка ткани или органа можно приготовить препа-
рат — отпечаток. Кусочек ткани или органа прикладывают
(не размазывая!) к поверхности покровного или предметного
стекла; иногда бывает полезно слегка прижать объект к стеклу.
Затем осторожно убирают кусочек, следя за тем. чтобы не разма-
зать отпечаток, так как при этом клетки, приставшие к стеклу,
сильно повреждаются. Препарату до фиксации нельзя давать
подсохнуть.
Для изготовления сухого мазка из крови, простей-
ших, бактерий поступают так же, как и при изготовлении
133
влажного мазка, но не фиксируя, дают ему высохнуть. Каплю
крови для мазка лучше всего снять с места укола непосредствен-
но предметным стеклом и шлифованным краем другого предмет-
ного стекла или краем покровного стекла быстро и равномерно
распределить ее по большей части предметного стекла. Сущест-
венно, чтобы мазок высыхал возможно быстрее, распределение
клеточных элементов по стеклу было равномерным и материал
для изготовления мазка был взят в должном количестве. Мазок
не должен быть толстым и клетки не должны налегать друг на
друга в два или более слоев. Размазывать каплю нужно не в
слишком медленном и не в слишком быстром темпе: небольшой
практический опыт позволяет исследователю найти необходи-
мый навык в изготовлении мазка. Не следует также слишком на-
жимать краем стекла на размазываемую каплю, чтобы избежать
деформации и раздавливания клеток. При изготовлении мазка
покровное стеклышко (или предметное с шлифованными края-
ми), служащее для размазывания, сближают до соприкосновения
с каплей крови, держа его под углом в 45°, и ведут его по пред-
метному стеклу (рис. 61). При размазывании кровь в силу ка-
пиллярности следует за движением покровного стекла.
Необходимо обратить особое внимание на чистоту стекол: сле-
ды жира на них очень затрудняют получение хороших мазков.
Предназначенные для мазков стекла предварительно моют мылом,
хорошо споласкивают водой и хранят в 90-градусном спирте.
Для многих целей, особенно при изучении кровепаразитов, при-
готовляют так называемые «толстые к а п л и»: на чистое пред-
метное стекло наносят каплю крови; наклоняя стекло, дают ей
немного растечься и затем подсушивают (можно поместить стекло
на 1—2 часа в термостат придемпературе 37°). После этого мазки
промывают дистиллированной водой, гемолизирующей эритроци-
ты, и высушивают.
Высушенные мазки можно затем фиксировать; особенно реко-
мендуется для последующих окрасок по Романовскому фиксиро-
вать метиловым спиртом (3—5 минут) или смесью равных частей
абсолютного спирта и эфира (15—60 минут); мазки после фикса-
ции снова высушивают или же осторожно промокают фильтро-
вальной бумагой.
ЗАЛИВКА И ПРИГОТОВЛЕНИЕ СРЕЗОВ
Общие замечания
Для изготовления срезов необходимо прибегнуть к заморажи-
вающему микротому или заключить объекты в пластическую мас-
су, способную возможно полнее, вплоть до тончайших клеточных
органоидов, пропитать объект и придать ему консистенцию, позво-
ляющую делать тонкие срезы. Для этой цели служит парафин,
целлоидин или желатина. Для заключения объекта в парафин
или целлоидин необходимо его провести через ряд промежуточ-
ных сред.
134
Для заделки фиксированных объектов в па-
рафин или целлоидин объект предварительно подверга-
ется обезвоживанию, для чего используется чаще всего
этиловый спирт (реже ацетон или другие спирты). .Обезво-
женные объекты перед заделкой в парафин проводят через п р о-
межуточные'среды (ксилол, бензол, хлороформ, различные
масла).
Из залитых в парафин или целлоидин блоков изготавливают
срезы, которые окрашивают, обезвоживают, проводят через про-
межуточные среды и заделывают в канадский бальзам
(или его заменители), если в описаниях специальных методов нет
иных указаний. При обезвоживании фиксированных объектов,
а также окрашенных срезов во многих случаях не обязательно
пользоваться абсолютным спиртом, а можно из 96-градусиого
спирта фиксированные объекты или срезы переносить в другие
промежуточные среды: бергамотовое масло,
гвоздичное масло, креозот или карбо л-к с и л о л.
Все эти вещества удаляют остатки воды из срезов и просветляют
препараты. Для очень нежных объектов в качестве про-
межуточной среды рекомендуется испробовать кедровое мас-
ло (не очень густое), куда переносят объект из абсолютного
спирта.
Наиболее часто в качестве промежуточной среды между 96-гра-
дусным спиртом и ксилолом при заделке срезов используют к а р-
бол-ксилол, который быстро просветляет н обезвоживает сре-
зы. Для приготовления карбо л-к с и л о л а банку с кри-
сталлической карболовой кислотой ставят в теплую воду. Когда
карболовая кислота расплавится, то одну часть карболовой кисло-
ты смешивают с тремя частями слегка подогретого (также в теп-
лой воде) ксилола.
Канадский бальзам является особым видом смолы,
хорошо растворимой в ксилоле, бензоле и толуоле. Канадский
бальзам широко применяется для заделки мик-
роскопических срезов по следующим причинам:
1) препараты охраняются в нем, как правило, по нескольку
лет без заметного выцветания;
2) он хорошо просветляет срезы;
3) быстро высыхает;
4) в тонких слоях бальзам совершенно прозрачен и имеет по-
казатель преломления, близкий к показателю преломления стекла.
Раствор канадского бальзама приготовляют, наливая в банку
с сухим и твердым канадским бальзамом, ксилол, и дают ему по-
стоять несколько дней. Если получается густой раствор, то его раз-
бавляют ксилолом до желаемой консистенции: бальзам должен
легко и возможно тонким слоем распределяться между покровным
и предметным стеклом. Иногда рекомендуется при изготовлении
раствора канадского бальзама предварительно тщательно смешать
и растереть в фарфоровой ступке равные части сухого бальзама
135
и двууглекислой соды, после чего долить необходимое количество
ксилола. Через 5 дней раствор бальзама следует профильтровать
и затем, если это нужно, сгустить на водяной бане (осторожно с
пламенем!) до желаемой консистенции.
При отсутствии канадского бальзама его можно заменить пих-
товым, который также растворяют в ксилоле или толуоле.
Еще в середине 80-х годов прошлого столетия профессор Ка-
занского университета Флавнцкий изготовил заменитель канадско-
го бальзама в виде густой профильтрованной живицы сибирской
пихты. Вскоре пихтовый бальзам был испробован и стал употреб-
ляться в гистологической технике.
Учитывая относительную дороговизну пихтового бальзама, ки-
евские исследователи М. К- Даль и А. Ройтман (1949), испытав
ряд заменителей, остановились на идитоле.
Ид и то л, выпускаемый нашими заводами пластмасс, пред-
ставляет собой продукт конденсации формалина с фенолами. Кус-
ковой идитол легко растирается в мелкий порошок, который хоро-
шо растворяется в спирте, лучше при осторожном нагревании до
40°. Растворенный идитол должен иметь консистенцию пихтового
бальзама. Коэффициент преломления идитола—1,5—1,51, что со-
ответствует показателю преломления наиболее распространенных
сортов стекла. Испытание идитола, как заменителя пихтового
бальзама, дало вполне удовлетворительные результаты: в течение
двух месяцев гистологические препараты, окрашенные гематокси-
лип-эозином и по Вап-Гизону, нисколько не изменялись. Высыхает
идитол на препаратах быстро, покровные стекла скоро и плотно
^прикрепляются.
Гумм и-с ироп по Апати применяется для заключения
препаратов, окрашенных метиленовым или толуидиновым синим,
Суданом и многими другими анилиновыми красителями. Среду
Апати можно использовать также для заключения препаратов
после некоторых гистохимических реакций, когда надо избежать
проводки через спирты и ксилол (например, после реакции на
липоиды, жиры, плазмаль и т. д.). Приготовление: 50 г
чистого гуммиарабика и 50 г сахара растворяют в 50 дм3 дистил-
лированной воды (на водяной бане); затем добавляют 0,5 г тимола.
Ср еда для заключения препаратов по Фар-
ранту. 30 г чистого гуммиарабика растворяют на холоду в
30 дистиллированной воды, добавляют 30 см3 глицерина, в
котором растворен 0,1 г мышьяковистой кислоты: к смеси прибав-
ляют немного камфары. Применение то же, что и смеси Апати.
Заливка в парафин является наиболее широко рас-
пространенным методом. Ее преимущества: относительная быст-
рота, возможность приготовлять весьма тонкие срезы (до 1—2 ц)
в виде серии, что особенно важно для гистологических и эмбрио-
логических работ. К недостаткам парафиновой заливки надо отне-
сти некоторое сжатие заливаемого материала (на 8—20%) и необ-
136
ходимость подвергать его действию относительно высокой темпе-
ратуры (56—58°).
Заливка в целлоидин может быть рекомендована для
трудно режущихся объектов или объектов, чрезмерно затвердева-
ющих при парафиновой заливке (декальцинированная кость, ко-
жа, толстые слои гладкой мускулатуры), а также в тех случаях,
когда надо избежать воздействия высокой температуры. Получа-
ющиеся при целлоидиновой заливке срезы можно легко и удобно
по отдельности проводить через различные растворы и красите-
ли. Применение целлоидина может быть рекомендовано в жар-
ком климате, где изготовление хороших парафиновых срезов
весьма затруднительно.
К недостаткам метода надо отнести его длительность, труд-
ность изготовления серийных срезов, относительную трудность на-
клейки срезов и, наконец, большую толщину получаемых срезов
по сравнению с парафиновыми. Следует также подчеркнуть, что
целлоидиновая заливка требует применения полностью безводных
реактивов, а объекты должны быть безукоризненно обезвожены.
Заливку в целлоидин применяют:
1) для объектов, имеющих большие полости или лакуны;
2) для объектов, имеющих слон различной консистенции (на-
пример, членистоногие);
3) для объектов больших размеров, с которых трудно получить
хорошие парафиновые срезы;
4) для изготовления толстых срезов, необходимых для специ-
альных целей.
Преимущества обоих способов — целлоидиновой и парафино-
вой заливки — скомбинированы в целлоидин-парафиновом мето-
де, при котором объект сперва заливается в целлоидин, а затем
заключается в парафин.
Заливка в желатину применяется для рыхлых и легко
распадающихся тканей, подготовляемых для резки на заморажи-
вающем микротоме, а также при изучении жировых и липоидных
включений, не переносящих действия спиртов, ксилола и т. д. При
заливке в желатину происходит минимальное изменение объема
объекта, что особо важно при изучении интерцеллюлярных про-
странств, рыхлой соединительной ткани и т. д.
Заливка в парафин
То, что обычно называют парафином, представляет собой, как
известно, смесь (в различных пропорциях) разных гомологичных
парафиновых углеводородов. Продажные смеси различаются по
их точкам плавления, а химический состав их различен в зависи-
мости от условий получения парафина.
С точки зрения гистологической техники, условия затвердения
парафина при заливке объекта весьма важны. Когда расплавлен-
ный парафин начинает застывать, то в определенный момент на
его поверхности возникает пленка в виде хлопьевидного облака',,
137
а затем начинают образовываться кристаллы, из которых состоит
твердый парафин. Это изменение состояния парафина влечет за
собою уменьшение его объема приблизительно на 5—10%, что
обусловливает константные деформации заделанной в парафин
ткани. Перед исследователями стоит важная задача: получить па-
рафиновые смеси, дающие минимальную деформацию объекта.
Кристаллы парафина имеют форму пластинок или игл более
или менее тонких, в зависимости от охлаждения. Чем охлаждение
медленнее, тем тоньше кристаллы. Кристаллы, выпадающие в
тканевых пространствах при заключении объекта в парафин, не
оказывают деформирующего влияния, поскольку они слишком
малы для этого.
Следующая таблица дает % растворения парафина (при тем-
пературе 50° в граммах на 100 г растворителя):
тслуол . . . :........ 25,0
бензол..................21,5
ксилсл............ .... 20,8
хлороформ...............25,0
кедре все масло......... 3,8
диоксан................. 0,2
бутиловый спирт . . . . 0,2
Когда парафин начинает затвердевать — он непрозрачен, затем
он становится прозрачным, с блестящей поверхностью. В этот мо-
мент сжатие парафина прекращается.
Обычно считают, что чем быстрее охлаждение и затвердение
парафина, тем меньше кристаллы и лучше проходит микротоми-
рование. Однако на самом деле неизвестно, какие кристаллы луч-
ше для микротомирования: мелкие или крупные. Здесь, по-видимо-
му, играет роль связь кристаллов между собою. Если они лежат
в достаточной мере плотно, то парафин становится прозрачным и
гомогенным и легко режется па микротоме.
Весьма важную роль в застывании парафина играет растворен-
ный в нем воздух. При охлаждении определенного объема пара-
фина сперва затвердевает его поверхностный слой. Поскольку
растворимость воздуха в застывающем парафине снижена — в
месте соприкосновения жидкого парафина и затвердевающего слоя
выделяется воздух. Часть этого воздуха снова растворяется в бо-
лее теплой и еще жидкой центральной массе, а другая часть оста-
ется в газообразном состоянии между кристаллами парафина. Та-
ким образом могут создаваться полости, заполненные воздухом.
Это обусловливает зернистый вид в центре блока после его за-
твердевания.
Чтобы избежать подобной грануляции парафина в ходе заделки
объекта, можно применять различные средства. Небольшие ку-
сочки ткани (2—3 мм) можно заделывать на часовом стекле в
малом количестве парафина, который медленно наливают
пипеткой. В таких количествах парафина грануляция не играет
существенной роли. При более крупных объектах хорошие резуль-
таты получаются, если объекты заливать в глубоком и узком со-
суде, так чтобы затвердевание парафина начиналось в глубине и
138
постепенно распространялось бы кверху на жидкую еще поверх-
ность. Освобождающийся при застывании парафина воздух выде-
ляется тогда на поверхности. Пользуясь удлиненными сосудами,
можно заделывать в парафин довольно крупные объекты.
Для заливки в парафин объект необходимо сперва обезводить,
затем провести через промежуточную среду, растворимую как в
парафине, так и в спирте. Таким образом, в процессе заливки объ-
екта в парафин имеется четыре основные этапа: 1) обезвоживание
спиртом; 2) пропитывание промежуточной средой (ксилол, толу-
ол, бензол и т. д.); 3) пропитывание парафином; 4) окончатель-
ное заключение в парафин.
Для обезвоживания объекта после фиксации и промывки его
проводят через ряд спиртов восходящей концентрации. Чем неж-
нее объект и чем больше опасность его сжатия или сморщивания,
тем осторожнее и постепеннее надо повышать концентрацию спир-
та. Обычно приготовляют ряд спиртов: 40-, 70-, 96- и 100-градус-
ный (абсолютный) спирт. Если объект очень нежен и в нем не-
обходимо сохранить тончайшие цитологические детали, то его
последовательно проводят через следующий ряд спиртов: 40-, 50-,
60-, 70-, 80-, 90-, 96- и 100-градусный спирт. Обезвоживание и
пропитывание в промежуточных средах и парафине лучше всего
производить в небольших стеклянных цилиндриках с хорошо при-
тертой пробкой, в которые наливают столько спирта, чтобы его
уровень был выше объекта по крайней мере иа 1—2 см. Спирты
не следует слишком долго употреблять, так как они загрязняются
веществами, извлекаемыми из объектов. Время пребывания в спир-
тах в первую очередь определяется размерами объекта. Для
очень маленьких объектов бывает достаточно пребывание по
25—30 минут в каждом из спиртов. Объекты, толщина которых не
превышает 2 мм, достаточно держать 2—3 часа. Надо, однако,
помнить, что полное обезвоживание объекта — существеннейшее
условие успешной заливки, и не следует спешить и укорачивать
пребывание его в спиртах, если на то пет особых специальных
для данного объекта, указаний. Абсолютный спирт надо дважды
сменять.
Признаком хорошего обезвоживания объекта служит отсут-
ствие каких-либо признаков помутнения ксилола при переносе в
него объекта из абсолютного спирта. Если такая муть появилась,
надо объект снова переложить в абсолютный спирт для полного
обезвоживания. После абсолютного спирта можно перенести объ-
ект в смесь равных частей ксилола и абсолютного спирта, а потом
прямо в чистый ксилол (сменить два-три раза). После ксилола
объект переносят на 2—12 часов в термостат при температуре
37°, в насыщенный раствор парафина в ксилоле, затем объект пе-
реносят в чистый парафин (в термостате при температуре Бо-
бб0), сменяют его дважды, после чего приступают к окончательной
заливке в парафин. При переносе объекта из ксилола в парафин
надо остерегаться заносить в последний остатки ксилола: загряз-
139
пение парафина ксилолом вредно отражается на результатах окон-
чательной заливки и изготовлении срезов. Употребляют парафин
с точкой плавления 54—55°.
Кристаллизаторы с парафином в термостате лучше всегда дер-
жать открытыми, чтобы испарялись даже следы ксилола.
Если парафин плохо режется на микротоме, крошится и т. д.,
то прибавление к нему 5—10% чистого воска обычно улучшает
его ^качества. Для хрупких и крошащихся объектов можно упо-
треблять смесь; парафин 60-градусный — 85 г, стеарин—10 г,
воск пчелиный — 5 г.
Рис. 62. Угольники для приготовления парафинового блока.
Плохо режущийся, крошащийся или неравномерно застываю-
щий парафин можно также улучшить, если его несколько раз под-
ряд расплавить и снова остудить в вытяжном шкафу. Такой пере-
плавленный парафин нужно оставить на несколько недель в вы-
А
Рис. 63. Схема приготовления бумажной коробочки для заливки
в парафин.
тяжпом шкафу для того, чтобы загрязняющие его летучие вещест-
ва могли испариться. Для окончательной заливки парафин нали-
вают в чистое часовое стекло, стенки которого предварительно
смазывают тончайшим слоем чистого глицерина для того, чтобы
застывший парафин можно было легко вынуть из стекла. Затем
в еще жидкий парафин переносят (с помощью осторожно нагрето-
го шпателя) объект, причем парафин должен в достаточной мере
покрывать его. В часовых стеклах заливают относительно неболь-
шие объекты, для более крупных используют особые стеклянные
(или металлические) угольнички, которые располагают на малень-
кой стеклянной пластинке (рис. 62) соответственно размерам за-
ливаемого объекта. Можно также пользоваться бумажными ко-
робочками (рис. 63). Слегка нагретыми иглами располагают объ-
140
ект в нужном положении. Затем необходимо остудить парафин,
учитывая приведенные ранее замечания (см. стр. 140). Для этого
часовое стекло с парафином опускают в холодную воду так, чтобы
вода ие заливала парафин. Как только на поверхности парафина
появляется тонкая твердая пленка, часовое стекло тотчас же по-
гружается на дно сосуда с водой. Через некоторое время, когда па-
рафин полностью затвердеет, его легко вынуть из часового стекла.
Из затвердевшего парафинового диска с заключенным в нем
объектом скальпелем вырезают блок. Блок должен иметь доста-
точно широкое основание, чтобы его легко можно было прикре-
пить к столику микротома. Стенки блока надо очень аккуратно
обрезать так, чтобы грани его были параллельны друг другу. Вы-
резая блок, следует учитывать необходимую ориентировку объекта.
При заливке объектов, имеющих поверхность не более 1 см'!
и толщину не более 3—5 мм, можно пользоваться следующей при-
мерной схемой:
1) 40-градусный спирт — 2—4 часа, 2) 70-градуспый спирт —
4—6 часов (объект можно оставлять неограниченное время),
3) 96-градусный спирт — 6—12 часов, 4) абсолютный спирт —
6—12 часов (дважды сменить), 5) смесь абсолютного спирта и
ксилола (1:1) — 1—2 часа, 6) ксилол — 2—4 часа (дважды сме-
нить),?) ксилол — парафин — 2—12 часов (при температуре 37°),
8) парафин —4—6 часов при температуре 55—56° (дважды сме-
нить), 9) окончательная заливка в парафин.
Более мелкие объекты толщиной менее 1 мм достаточно дер-
жать в парафине 40—60 минут, для больших объектов толщи-
ной до 10 мм необходимо увеличить пребывание в парафине до
10—12 часов.
Все указанные среды должны находиться в небольших стеклян-
ных цилиндрах или небольших широкогорлых стеклянных баноч-
ках (реактивы могут быть использованы многократно). Таким об-
разом, для полной заливки в парафин надо иметь три баночки для
спиртов возрастающей крепости (40°, 70°, 96°), две баночки с абсо-
лютным спиртом (первый и второй абсолютный спирт), баночку
со смесью абсолютного спирта и ксилола, две баночки с ксилолом
(первый и второй ксилол), баночку со смесью ксилола и парафина
и, наконец, две баночки с парафином. Объект переносят из одной
среды в другую пинцетом или шпателем.
При заливке в парафин в качестве промежуточных сред
между спиртом и парафином, кроме ксилола, могут быть исполь-
зованы толуол и бензол, свойства которых для указанных целей
очень близки к ксилолу. При заливке через толуол и бензол мож-
но пользоваться вышеприведенной схемой.
Для нежных объектов или тонких цитологических исследова-
ний в качестве промежуточной среды следует применять хлоро-
форм. Для успешной заливки пригоден хлороформ только без-
водный и не содержащий следов спирта и поэтому обычный про-
141
дажный хлороформ для заливки следует обезвоживать с по-
мощью медного купороса.
Некоторые исследователи рекомендуют в качестве промежу-
точной среды между спиртом и парафином кедровое масло. Оно
дает хорошие результаты, особенно при изучении митохондрий.
Одним из преимуществ кедрового масла является то, что следы
масла, попавшего в парафин, не влияют вредно на качества за-
литого блока.
Для трудно пропитываемых и плохо режущихся на микротоме
объектов, например, для насекомых, может быть с успехом ис-
пользована заливка через бутиловый спирт.
Для заливки в парафин насекомых можно рекомендовать
следующую схему:
1) Материал фиксируют в смеси Жильсона; 2) помещают в
35-градусный этиловый спирт на 30—60 минут; затем проводят
через смеси этилового и бутилового спирта: а) 90 слг3 45-градус-
ного этилового спирта-|-Ю см3 бутилового спирта—1—2 часа;
б) 80 см3 62-градусного этилового спирта + 20 см3 бутилового
спирта — 2 часа; в) 65 см3 77-градусного этилового спирта +
4- 35 см3 бутилового спирта — 4 часа; г) 45 см3 90-градусного
этилового спирта + 55 см3 бутилового спирта — 6—24 часа;
д) 25 см3 90-градусного этилового спирта 4- 75 см3 бутилового
спирта — 6—12 часов; е) переносят в чистый бутиловый спирт
(дважды сменить) — 6 часов; ж) помещают в смесь 2 части па-
рафина и 1 часть бутилового спирта —12—24 часа; з) переносят
в чистый парафин или лучше в смесь парафина и воска.
При некоторых фиксаторах заливка в парафин может произ-
водиться по более упрощенным методам.
Следующая схема пригодна для заливки самого различного
материала, фиксированного смесью Буэна:
1) промыть материал в 90-градусном спирте, 2) обезводить в
абсолютном спирте (трижды сменить) в течение 24 часов, 3) про-
вести через ксилол (трижды сменить) в течение 24 часов, 4) про-
питать в течение 24 часов парафином (дважды сменить) и в
третьем парафине произвести окончательную заливку.
За последние годы многие авторы указывают, что наилуч-
шими промежуточными средами являются метплбензоат и терпи-
неол. Эти вещества имеют то преимущество, что они смешивают-
ся не только со спиртом, но и в некоторой мере с водой. Это по-
зволяет миновать проводку через абсолютный спирт и не требует
особо тщательного обезвоживания объекта, необходимого при
проводке через ксилол, бензол или толуол. При заливке через
метилбензоат или терпинеол последним в возрастающем ряду
спиртов может быть 96—98-градусный спирт. Обычно трудно
режущиеся на микротоме объекты после помещения в терпинеол
прекрасно режутся.
Терпинеол и метилбензоат необходимо предварительно обез-
водить прибавлением к ним хлористого кальция.
142
Для заливки через метилбензоат или терпинеол
можно пользоваться следующей схемой:
1) из 96-градусного спирта перенести объект в смесь 2/з 96-
градусного спирта + '/з метилбензоата (или терпинеола); 2) за-
тем */3 96-градусного спирта + 2/з метилбензоата (или терпинео-
ла); 3) поместить в чистый метилбензоат (или терпинеол), сме-
нить 3 раза; 4) произвести пропитывание и заливку в парафине
по обычной схеме.
Осторожно наливая 96-градусный спирт в цилиндрические со-
судики с метилбеизоатом, можно получить «двуслойный раствор»,
так как спирт легче метилбензоата. Объект, погружаемый в та-
кой «двуслойный раствор», будет по мере пропитывания метил-
бензоатом опускаться на дно цилиндра. Пропитывание заканчи-
вается, когда объект опустится на дно; одновременно объект
просветлится. Тогда пипеткой осторожно отсасывают спирт,
проводят объект через чистый метилбензоат и заливают в.
парафин.
Проводка через диоксан (диэтилендиоксид). За по-
следние годы диоксан находит себе все большее применение при
заливке объектов в парафин. Диоксан имеет то преимущество, что
хорошо смешивается с водой, спиртом и парафином. Все это по-
зволяет во многих случаях переносить объект из воды или фикса-
тора (формалина, смеси Буэна, Кариуа) непосредственно в дио-
ксан (после сулемовых фиксаторов надо предварительно прове-
сти объект через 70-градусный спирт, а после хромовых — хорошо
промыть проточной водой), а из диоксана прямо в смесь пара-
фина и диоксана, затем в чистый парафин.
Объекты после диоксана хорошо красятся и легко режутся
на микротоме.
Хранить диоксан нужно следующим образом: на дно сосудов
с диоксаном насыпают слой хлористого кальция, поверх которого
кладут фарфоровое ситечко или слой стеклянной ваты.
К недостаткам диоксана относится его токсичность. Надо осо-
бенно тщательно избегать вдыхания его паров: сосуды с диокса-
ном должны быть тщательно закупорены. Помещение, где рабо-
тают с ним, должно вентилироваться.
Для проводки через диоксан можно пользоваться следующей
схемой:
1) из формалина или смеси Буэна объект непосредственно
переносят на 12—24 часа в диоксан, после хромовых фиксаторов
объект промывают проточной вод1й (24 часа) и затем кладут
в диоксан на 12 часов; 2) сменяют деоксан и оставляют во вто-
ром диоксане 12*-24 часа; 3) кладут в смесь диоксана—пара-
фина на 1—2 часдг при температуре'56° 4) переносят в чистый па-
рафин на 4—6 wcob; 5) окончател^йб заключают в парафин.
Можно_указЛЕ> следующую упрощенную схему заливки через
диоксан: 1) фгЖация в 10-процентном формалине; 2) 96-градус-
ный спирт — 1 «с; 3) чистый диоксан — 2 часа (сменить 2 раза);
143
Схема заливки через различные среды объекта толщиной 2—4 мм
(например, печени, ночки, поджелудочной железы и т. д.)
Парафин л. 1 2 часа
Смесь хлороформа и парафина 2—4 часа 1 Хлороформ 1/2 часа t Хлороформ до Смесь гн оздичного ф ф 1 1 Смесь парафина с кедровым маслом 4 часа Т Кедровое масло не менее 4 часов ф ф 1 Смесь 1 хлоре 2 арафина с формом* часа t Смесь па толуол Толуол рафика и* а 2 часа 1 5 минут Метилбе 1 ч нзоат 1С
просветления масла и парафина Смесь 100% спирта Хлороформ 5 минут 1 Метилбензоат
t Смесь хлороформа 2 часа t и кедрового масла 2 часа t Анилиновое масло Амилацетат 12 ча- сов или неограни- 1 час t
и 100% спирта 2 часа 1 Гвоздичное масло до просветления 1 1 100% спирт 1 час 1 1 час t 1 чепно долго t Амилацетат Смесь равных ча- стей 100% спирта и метилбензоата
100% спирт 2 часа t Смесь гвоздичного масла и 96% спирта 100% спирт 1/2 часа Анил ино во е маел о до просветления 12 часов t 1 час 1
100% спирт 1 час t 2 часа Г 1 1 1 1 96% спирт 1 час 100% спирт 1 час 1
96% спирт 2 часа t 96% спирт 1 час t 96% спирт 2 часа 80% спирт 1 час t 96% спирт 1 час t 96% спирт 2 часа t
96% спирт 1 час 1 96% спирт 2 часа 1 96% спирт 1 час t 1 1 ——— 70% спир’ 80% спирт 1 час 1 1 1 2 часа ——— 96% спирт 1 час 1 96% спирт 2 часа 1
50% спирт 2 часа
t
30% спирт 2 часа
u t
Водный фиксатор
* Макклюнг (1950) считает возмож-
ным переносить из толуола нли хло-
роформа непосредственно в парафин.
4) диоксан—парафин (1:1) — 1 час; 5) парафин (2 раза сме-
нить) — 1 час; 6) окончательная заливка в парафин.
Для яйцевых клеток, яичников и эмбрионов, находящихся на
ранних стадиях развития, рекомендуют следующий метод фикса-
ции и заливки через диоксан: 1) фиксировать материал в смеси
из двух частей смеси Буэна и 1 части диоксана; 2) промыть в
диоксане; 3) обезводить и просветлить в свежем растворе диок-
сана; 4) перенести в смесь (при температуре 50°): диоксан —
25 слг3, ксилол — 5 слг5, парафин (с температурой плавления 50—
52°) — 20 г; 5) чистый парафин (легкоплавкий); 6) чистый пара-
фин (тугоплавкий); 7) заливка в парафин.
В зарубежной литературе все чаще и чаше предлагаются
новые промежуточные среды как для обезвоживания, так и для
заливки в парафин. Для обезвоживания многие авторы исполь-
зуют бутиловый спирт вместо этилового. Макклюнг (1950) реко-
мендует использовать триэтилфосфат при заливке в парафин,
а также при обезвоживании уже окрашенных срезов и мазков.
Триэтилфосфат (С2Н5О)3РО4, молекулярный вес 182, точка ки-
пения 210—220°. Этот реактив отлично растворим в воде, в спир-
тах, ксилоле, эфире и хлороформе. При заливке через триэтил-
фосфат можно пользоваться следующей схемой (объект толщи-
ной 2—4 мм): из водного фиксатора объект переносят в воду
на 10 минут, затем проводят последовательно через три сосуда
с триэтилфосфатом (в каждом по 8 часов), бензол 15 минут,
бензол 15 минут, парафин 1,5—2 часа, парафин 1,5—2 часа.
Таким образом действие спиртов при этой смене заливки исклю-
чается. Многие зарубежные гистологи и эмбриологи для заливки
в парафин с успехом применяют амилацетат, в котором можно
при желании длительно сохранять фиксированные ткани и раз-
личные эмбриологические объекты, так как они при этом методе
обработки не становятся излишне твердыми и хрупкими (Барон,
1934; Дрери, 1941).
Резка парафинового блока на микротоме
Для разложения залитого объекта на срезы служат микрото-
мы. Два основных типа микротомов—салазочный с подвижным
ножом и микротом с неподвижным ножом (рис. 64 и 65).
Кусочек, залитый в парафин, тщательно обрезают, придавая
ему форму, указанную на стр. 141.
При этом надо помнить, что объект должен быть покрыт со
всех сторон слоем парафина, примерно в 1—2 мм толщиной. Для
того, чтобы прикрепить блок к столику микротома, на последний
наносят слой расплавленного парафина и дают ему застыть.
Затем с помощью нагретого железного шпателя расплавляют
этот парафин и быстро прижимают блок к предметному столику.
Для лучшего закрепления опускают столик с прикрепленным бло-
ком на некоторое время в холодную воду. Важно, чтобы блок
был прочно прикреплен к столику микротома.
?0 Микроскопическая техника
.145
Рис. 64. Салазочный микротом.
Рис. 65. Микротом с неподвижным иожом.
В некоторых микротомах нет предметных столиков, а кусочек,
залитый в парафин, приклеивается на деревянный блок, который
специальными зажимами закрепляется в микротоме.
Затем ориентируют окончательно блок с залитым объектом:
длинная продольная ось объекта должна идти параллельно мик-
ротомному ножу.
После этого скальпелем подравнивают края блока: его проти-
воположные грани должны быть параллельны друг другу, так как
1*6
в противном случае трудно получить серийные срезы. Обычно
микротомный нож устанавливается перпендикулярно к парафино-
вому блоку.
в
Однако при трудно режущихс-.
объектах лезвие ножа должно на-
ходиться под .небольшим углом
Рис. 66, Положение мик-
ротомного ножа при
резке парафинового бло-
ка. А, Б—неправильное
положение ножа; В —
правильное положение
ножа.
Рис. 68. Ножи для микротома
к поверхности блока, который устанавливают эмпирически в зави-
симости от качества заливки и твердости объекта (рис. 66).
Употребляются ножи трех сортов: ножи марки «а» для цел-
лоидиновых срезов, марки «б» для нормальных объектов, заклю-
ченных в парафин, марки «в» для трудно режущихся объектов
или замороженных блоков (рис. 67, 68).
При хорошо проведенной заливке, прочной установке блока
на столике микротома, хорошо отточенном и правильно постав-
10* 147
ленном микротомном ноже из последовательных срезов на лезвии
образуется лента (рис. 69).
Д
Рис. 69. Детали работы с парафиновыми срезами. А — изготовление ленты
сериальных срезов; Б — распределение срезов на предметном стекле;
В — добавление дистиллированной воды, на поверхности которой плавают
срезы; Г — осторожное нагревание предметного стекла для расправления
срезов; Д — заключительная заделка окрашенных срезов ткани — срезы
закрывают покровным стеклом (по Грею, 1954).
148
Обычно приготовляют срезы толщиной 5—6 н; при хорошей
заливке можно изготовить срезы толщиной в 2 н. Если серийные
срезы ие получаются, а отдельные срезы скручиваются, то сле-
дует повысить окружающую температуру, поднеся к микротому
лампочку. Если леита получается ие прямая, надо выправить
неправильно обрезанные края парафинового блока.
Иногда срезы сильно мнутся на иоже и потом плохо расправ-
ляются. Обычно это бывает с очень тонкими срезами. Это может
зависеть от того, что парафин слишком мягок или окружающая
температура слишком высока. В этих случаях надо или охладить
блок холодной водой, или перезаключить объект в парафин с бо-
лее высокой точкой плавления; медленнее вести бритву. Иногда
на срезе образуются царапины, если случайно на бритве имеются
зазубрины. Тогда нужно передвинуть бритву в держателе, чтобы
переменить место бритвы, которым режется блок. В некоторых
случаях объект крошится и выпадает из парафина. Это означает,
что объект плохо пропитался парафином. В этом случае нужно
растворить парафин в ксилоле, довести объект до абсолютного
спирта и вновь залить в парафин.
Очень часто причиной неудачных срезов является плохая за-
ливка и недостаточное пропитывание объекта парафином.
Наклейка срезов
Срезы снимают с микротомной бритвы с помощью мягкой
кисточки и переносят на совершенно чистое и обезжиренное пред-
метное стекло. Для обез- ______
жиривания предметных — у
стекол их моют в горячей Ц
воде с зеленым мылом и Ц
хранят в смеси спирта и z ———
эфира. Массон рекомен- /и'
дует предметные стекла |
обрабатывать смесью 9 я
частей 90-градусиого спир- —•»
та и 1 части соляной или Л
азотиой кислоты, затем ТВ нк.
хорошо промыть и, ие вы- xs*
тирая, применять для на-
клейки Срезов. рис. 70. Нагревательный столик для рас-
Для наклеивания Сре- правления парафиновых срезов,
зов иа стекло, обезжирен-
ное указанным способом, наносят пипеткой немного дистиллиро-
ванной воды (вода должна расплываться). Изолированные срезы
или срезы в виде лент располагают иа предметном стекле пра-
вильными рядами: срезы должны свободно плавать иа поверхно-
сти воды. Затем предметное стекло кладут на особый металличе-
ский столик, который осторожно нагревают (рис. 70, 71). При
этом вода иа стекле должна нагреваться до температуры 30—35°,
149
и тогда парафиновые срезы отлично расправляются (надо остере-
гаться перегревания срезов, — они начинают плавиться и стано-
вятся негодными).
В. А. Захваткин и О. Г. Гольцман предлагают следующий ме-
тод наклейки срезов на предметные стекла. Отдельные срезы
или части ленты серии срезов, при помощи кисточки или препаро-
вальной иглы, если это тонкие срезы, или при помощи пинцета
Рис. 71. Электрический столик для расправления парафиновых
срезов.
при более толстых срезах, переносят на поверхность воды, нагре-
той градусов до 40. Вода наливается в широкий плоский кри-
сталлизатор. Здесь срезы тотчас расправляются, складки сгла-
живаются. Затем берется сухое, чисто вымытое предметное стек-
ло, подводится под срезы и
приподнимается; с ним вместе
приподнимаются и срезы, при-
клеиваясь к предметному стек-
лу. Если наклеивается несколь-
ко срезов или несколько отрез-
ков ленты, то по мере наклеи-
вания срезов стекло постепенно
приподнимают из воды. При
помощи препаровальной нглы
срезы можно правильно распо-
ложить на предметном стекле.
Рис. 72. Проволочная подставка
для сушки расправленных срезов.
Предметные стекла с наклеенными на них срезами оставляются
в наклонном положении до следующего дня, чтобы испарились
остатки воды.
Можно осторожно нагревать стекло со срезами непосредст-
венно на пламени горелки. При этом, конечно, возрастает опас-
ность расплавить срезы. Для расправления срезов стекла можно
поместить на поверхность теплой воды в кристаллизаторе. Как
только срезы полностью расправились, надо осторожно слить (не
смещая срезов) воду с предметного стекла, а предметные стекла
с прилипшими срезами надо поместить на 24 часа для высуши-
вания в термостат при температуре 40° (рис. 72). Надо помнить,
что срезы должны быть хорошо высушены, и поэтому лучше
оставлять их в термостате на большой срок. Такой способ наклей-
ки срезов дистиллированной водой не всегда удается и в неко-
150
торых случаях ие гарантирует от утери срезов при их дальнейшей
обработке.
Для получения хорошего результата необходимо, чтобы сре-
зы полностью расправлялись, а предметные стекла были совеу
шенно чистыми. Удобнее предметные стекла предварительно
смазывать смесью из равных частей чистого свежего куриного
белка и глицерина; смесь фильтруют и добавляют следы камфоры
или тимола, чтобы помешать ее загниванию. Каплю белка-глице-
рииа размазывают как можно более тонким слоем на предмет-
ном стекле и дают высохнуть. Покрытые белком предметные
стекла можно заготовлять заблаговременно. На такие стекла
пипеткой наносят дистиллированную воду, на поверхности кото-
рой располагают парафиновые срезы. Затем поступают так же,
как было указано при способе наклейки с дистиллированной
водой.
Для наклейки срезов, не фиксированных в смесях, содержащих
хромовую кислоту или соли хрома, лучше всего пользоваться
альбуминной водой (Ланжерон, 1949). Белок куриного яйца
выливают в чашку Петри, удаляют все "пленки, взбивают до полу-
чения пены, дают отстояться и затем фильтруют через влажный
фильтр (воронку закрыть от пыли; фильтрация происходит очень
медленно). Отфильтрованный белок сливают в стаканчик, куда
добавляют равное количество глицерина и 1 г салицилового нат-
рия (предварительно растворенного в минимальном количестве
воды). Для расправления и наклейки срезов используют раствор
альбумин-глицерина в дистиллированной воде: к 20 см3 воды при-
бавляют 1 см3 альбумин-глицерина. Когда срезы (при легком
подогревании) расправились, избыток раствора сливают и пред-
метные стекла со срезами высушивают 6—24 часа в термостате
при 37—40° С.
Массон рекомендует срезы (после любых фиксаторов) при-
клеивать желатиной. Для этой цели в 20 см3 дистиллированной
воды, при легком нагревании, растворяют 0,5—1 г желатины.
Полученный раствор служит для расправления и приклейки сре-
зов. Избыток жидкости удаляют и срезы высушивают, как опи-
сано выше. После удаления парафина в ксилоле (или толуоле)
и проводки через спирты, препараты для закрепления желатины
опускают на короткое время в смесь 4 частей спирта и 1 части
формалина, затем моют водой и окрашивают по желанию.
В тех случаях когда возникают трудности с расправлением
и наклейкой срезов, залитых в целлоидин-парафин, Ланжерон
(1949) рекомендует следующую смесь: ацетон — 2 см3, дистил-
лированная вода — 8 см3, метилбензоат — 1 капля, альбумин-гли-
церии — 2—3 капли. Поступают так же, как это описано выше
для способа с альбуминной водой.
Ромейс (1954) рекомендует как падежный и быстрый метод
сухую наклейку срезов. Чисто вымытые предметные
стекла покрывают возможно тонким слоем смеси равных частей
151
куриного белка и глицерина. На этот слой кладут срезы блестя-
щей стороной книзу. Кисточкой осторожно сперва расправляют
срез, а затем прижимают его к стеклу так, чтобы между ним и
стеклом не осталось пузырьков воздуха. После этого препарат
подогревают на слабом пламени горелки, чтобы коагулировать
белковый слой. Срезы, без предварительной просушки, можно
подвергать дальнейшей обработке.
Покрытие срезов коллодием
При некоторых методах обработки срезов, окраски или при
гистохимических реакциях, обычно применяемые методы при-
клейки срезов к предметным стеклам ие достигают цели. В этих
случаях депарафинированные в ксилоле (или бензоле) срезы по-
крывают тончайшим слоем коллодия. Для этой цели
предметное стекло со срезами переносят из 90-градусного спирта
на 1—2 минуты в смесь следующего состава:' раствора коллодия
(officinalis) 20 частей, эфира 40 частей, спирта абсолютного 40
частей. Избыток смеси сливают и, не подсушивая, срезы поме-
щают в 70-градусный спирт, где образуется тончайшая прозрач-
ная пленка, предохраняющая срезы при всех последующих обра-
ботках. После 70-градусиого спирта препарат промывают водой
и далее обрабатывают, как обычно, по любому методу.
Поликар рекомендует покрывать срезы коллодием перед де-
парафинированием, используя для этой цели еще более разве-
денный раствор коллодия и затем обрабатывая срезы как обычно
(ксилол, спирты и т. д.).
Заливка в целлоидин
Для приготовления растворов целлоидина
покупной целлоидин разрезают на небольшие кусочки и полно-
стью высушивают. Затем к 40 г сухого целлоидина прибавляют
250 см3 абсолютного спирта; после набухания целлоидина к нему
добавляют 250 см3 эфира (безводного). Таким образом получа-
ют густой 8-процентный раствор целлоидина, из которого по же-
ланию приготовляют более жидкий, разводя его смесью эфира и
абсолютного спирта.
Можно готовить растворы целлоидина из кинематографиче-
ских лент, для чего с них удаляют желатину в 10-процентном
растворе едкого кали (сутки), хорошо отмывают и тщательно
высушивают, затем кладут на 10 дней в хлороформ для удале-
ния примеси камфоры, протирают и снова кладут в хлороформ
и, наконец, тщательно высушивают.
Схема заливки в целлоидин
1) Объект проводят обычным образом через ряд спиртов воз-
растающей крепости до абсолютного спирта включительно, где
оставляют на 12—24 часа (2 раза сменить); 2) тщательно обез-
воженный объект переносят иа 12 часов в смесь равных частей
абсолютного спирта и эфира (безводного); 3) 2-процентиый цел-
152
лоидии— 1—14 дней; 4) 4-процентный целлоидин— 1—14 дней;
5) 8-процентный целлоидин — 1 —14 дней; 6) уплотнение в цел-
лоидине— 4—12 часов; 7) закрепление блока—1—2 дня в
70-градусном спирте; 8) сохраняют блок в 70-градусном спирте.
Уплотнение в целлоидине (п. 6) производится после того, как
объект полностью пропитался целлоидином, причем необходимо
кусочек, залитый в целлоидин, наклеить на деревянный блок.
Для этого из твердого дерева выпиливают блоки в виде кубиков
или параллелограммов толщиной примерно в 1 см. Такие блоки
предварительно вываривают несколько часов в 2-процеитиом рас-
творе соды, затем выдерживают некоторое время в смеси эфира и
спирта, после чего блок высушивают. Объект, вынутый из 8-про-
центного целлоидина, кладут на деревянный блок, аккуратно об-
ливают его тем же целлоидином и дают постоять па воздухе для
того, чтобы целлоидин немного загустел и покрылся тонкой плен-
кой. Затем блок с приклеенным объектом помещают или под
стеклянный колокол, или в широкогорлую банку с притертой
пробкой, внутри которых помещают маленький открытый сосу-
дик с хлороформом, и рядом ставят блок с наклеенным объектом.
Для полного уплотнения блоки должны находиться в парах хло-
роформа 4—12 часов. Не следует передерживать объекты в па-
рах хлороформа: они становятся хрупкими.
Затем для окончательного уплотнения блоки переносят в
70-градусный спирт на 1—2 дня, после чего объект готов для раз-
ложения на срезы.
Для этой цели деревянный блок с приклеенным залитым объ-
ектом закрепляют в зажим микротома. При резке целлоидино-
вых блоков необходимо соблюдать следующие правила:
1. Для изготовления целлоидиновых срезов употребляется спе-
циальный нож, который устанавливают под острым углом к по-
верхности залитого объекта. Важную роль играет угол наклона
иожа к поверхности кусочка: если нож поставлен под слишком
малым углом, то он может скользить, не захватывая среза, а при
чрезмерном наклоне слишком глубоко врезаться в кусочек.
2. Лезвие ножа должно быть в безукоризненном состоянии,
без малейших зазубрин.
3. Существенное значение для успешного приготовления сре-
зов имеет быстрота и плавность движения микротомного ножа.
В каждом отдельном случае, в зависимости от плотности объ-
екта, остроты ножа и качества целлоидина, приходится эмпири-
чески подбирать необходимый темп движения микротомного но-
жа (медленный и плавный, короткий и отрывистый), легко нахо-
димый при некотором навыке.
4. Нож и поверхность кусочка необходимо во время резки по-
стоянно смачивать 70-градусным спиртом (при помощи кисточки
или пипетки).
Толщина целлоидиновых срезов— 10—15 При правильной
заливке и резке срез должен ровной пластинкой переходить с ку-
153
сочка на поверхность ножа. Если при соблюдении всех вышеука-
занных правил срезы все же получаются неровными или рвутся,
то причина лежит в недостаточном обезвоживании кусочка или не-
достаточном пропитывании объекта целлоидином. В этом случае
объект можно перезалить. Кусочек снимают с деревянного блока
и помещают для извлечения целлоидина в смесь эфира и абсо-
лютного спирта, затем переносят его для обезвоживания на сутки
в абсолютный спирт, после чего снова проводят через спирт-эфир
и растворы целлоидина.
Готовые срезы снимают с микротомного ножа кисточкой и пе-
реносят в плоскую чашку с 70-градусным спиртом, где их можно
хранить некоторое время. Свернувшиеся срезы можно осторожно
расправить кисточкой или иглами. Целлоидиновые срезы можно
наклеивать на предметные стекла или же окрашивать ненакле-
енными, что н делают в большинстве случаев.
Наклеивание целлоидиновых срезов производят по способу
Рубашкина. Для этого на предметное стекло, предварительно
смазанное тонким слоем белка с глицерином (см. стр. 152),
наносят срезы (с минимальным количеством 70-градусного спир-
та), осторожно прижимают их к стеклу фильтровальной бумагой
и затем наливают на стекло терпинеол или чистое гвоздичное мас-
ло, в котором срезы (через 5—20 минут) просветляются. Масле
сливают и предметные стекла со срезами помещают в 96-градус-
ный или абсолютный спирт на 5—10 минут (2 раза сменить),
после чего переносят для окончательного удаления целлоидина
в смесь эфира и абсолютного спирта. Затем следует 70-градусный
спирт, после которого препарат красят и обрабатывают по обыч-
ной схеме так же, как после парафиновой заливки.
Наклейка целлоидиновых срезов не всегда удается и предпоч-
тительно окрашивать целлоидиновые срезы ненаклеенными. Для
этой цели срезы переносят шпателем или кисточкой из 70-градус -
ного спирта в воду и затем красят по обычным схемам. Окраску
и проводку через спирты отдельных целлоидйновых срезов легко
и удобно производить в часовых стеклах или, лучше, в небольших
плотно закрывающихся стеклянных широкогорлых баночках. Уда-
ление целлоидина в большинстве случаев не требуется. Для при-
готовления серийных срезов с целлоидиновых блоков расправ-
ленные срезы плотно накладывают на хорошо смоченные 70-
градусным спиртом ленты из фильтровальной бумаги. Такие бу-
мажные ленты (с соответствующими пометками), с плотно при-
жатыми к ним целлоидиновыми срезами, помещают одну за дру-
гой в хорошо закрывающиеся плоские чашки, достаточно увлаж-
ненные 70-градусным спиртом. Перед окраской такую ленту,
завернута в маленький кусочек марли, промывают в дистиллиро-
ванной воде и затем окрашивают нужными красителями, промы-
вают и т. д.
154
Материал, фиксированный смесью Буэна, перед заливкой в
целлоидин нужно провести через 96-градусный спирт (12—24 ча-
са) и поместить на 24 часа в следующую смесь: кедрового мас-
ла— 10 см3, абсолютного спирта—80 см3, ориганового масла —
20 см3, азотной кислоты— 10 см3.
После этого объект кладут на 24 часа в 96-градусный спирт,
проводят через абсолютный спирт и помещают в смесь равных
частей абсолютного спирта и эфира; далее заливают по обыч-
ной схеме.
Заливка в ц е л л о и д и н-п а р а ф и н используется для
приготовления срезов с хрупких объектов, крошащихся при изго-
товлении обычных парафиновых срезов. При этом, как уже было
сказано, используются выгодные стороны обоих методов.
1. Объект, залитый в целлоидин, переносят на несколько ча-
сов в пары хлороформа.
2. Помещают на 24 часа в смесь из 4 частей хлороформа, 2
частей ориганового масла, 4 частей кедрового масла, 1 части аб-
солютного спирта, 1 части карболовой кислоты кристаллической.
Все вещества, входящие в состав смеси, должны быть безводны-
ми.
3. Проводят через ксилол (или бензол) до просветления (не-
сколько раз сменить); можно также проводить через терпинеол
(12—24 часа).
4. Заливают обычным способом в парафин.
Для заливки легко крошащихся или трудно режущихся
на микротоме объектов в нашей лаборатории применя-
ется следующий метод:
1) фиксация любая; соответствующая промывка;
2) спирт 70° (2—24 часа);
3) спирт 96° (2—6 часов);
4) спирт 100° (2—6 часов);
5) целлоидиновое масло 1—2—3 дня (приготовление целлои-
динового масла: к 100 см3 2-процентиого целлоидина прибавля-
ют 100 см3 касторового масла);
6) хлороформ I — 15—30 минут;
7) хлороформ II — 15—30 минут (до погружения);
8) смесь (парафин + хлороформ 1 :1)—6 часов;
9) парафин I— 15—30 минут;
10) парафин II— 15—30 минут;
11) заливка в парафин.
Приготовление 2-процентного целлоидина: 2 г целлоидина ра-
створяют в 100 см3 спирта с эфиром (1 : 1).
Отличные результаты, особенно для трудно режущихся объ-
ектов, дает метод, при котором объекты из абсолютного спирта
переносятся на 1—2 дня в 1-процентный раствор целлоидина в ме-
тилбензоате (целлоидин медленно растворяется, поэтому нужно
раствор приготовлять за несколько недель). Вместо метилбеизоа-
та можно применять гвоздичное масло. Для этого также готовят
1'55
1-процентный раствор целлоидина (2-процентный раствор цел-
лоидина в смеси равных количеств абсолютного спирта и серно-
го эфира разбавляется' гвоздичным маслом в отношении 1 : 1 по
объему). Объекты должны стать прозрачными. Из раствора
целлоидина в метилбензоате материал переносится на 2—4 часа
в бензол, а из раствора в гвоздичном масле — в хлороформ. За-
тем по обычной схеме заливают в парафин.
Заливка в желатину
Этот способ находит значительное применение при изучении
объектов, легко распадающихся при резке на замораживающем
микротоме, при изготовлении срезов с органов, богатых соедини-
тельной тканью, а также при изучении жировых и липоидных
включений. При этом методе фиксирующие смеси, особенно фор-
мол, должны быть предварительно хорошо отмыты. Полученные
срезы после окраски обычно заключают
в глицерин-желатину (см. стр. 165).
Для успеха метода важно хорошее
качество желатины. Желатину раство-
ряют в тимоловой воде (в которой ее
сперва в течение 20 минут размачи-
вают) , нагревают на водяной бане до
температуры 37° и затем фильтруют.
Таким образом приготовляют 10-про-
центный и 20-процентный растворы же-
латины.
Рис. 73. Зажималка для Для приготовления тимоловой воды
желатиновых срезов. растворяют немного тимола при темпе-
ратуре 50° и фильтруют.
Объекты кладут на 1—24 часа в 10-процентиую желатину (в
термостате при температуре 37°), затем переносят на то же время
в 20-процентную желатину (при температуре 37°). Затем сосу-
дик с желатиной охлаждают проточной водой, предварительно
ориентировав в нем объект иглами. Из застывшей желатины вы-
резают блок желаемой формы. Такой блок можно резать на за-
мораживающем микротоме или же предварительно уплотнить его
в растворе формалина (12—24 часа).
Блок хорошо примораживают к столику замораживающего
микротома. Полученные срезы снимают с ножа увлажненной во-
дой кисточкой и переносят в тимоловую воду, в которой их мож-
но сохранять. Из тимоловой воды срезы переносят стеклянной
палочкой или шпателем в дистиллированную воду. Срезы долж-
ны плавать на поверхности воды, при этом они хорошо расправ-
ляются. Из воды срезы вылавливают на предметные стекла, ко-
торые осторожно подводят под плавающие срезы. Дают стечь
воде, легко прижимают их фильтровальной бумагой к предмет-
ному стеклу (рис. 73) и помещают иа 10—20 минут в термостат
при температуре 37°.
156
Время подсушки срезов в термостате определяют эмпириче-
ски: если недодержать в термостате, то срезы легко отлипают,
если передержать, то срезы сморщиваются. Предметные стекла
можно предварительно покрыть тонким слоем белка с глицери-
ном. Затем наклеенные срезы переносят в воду, нагретую до
температуры 37°; при этом отстает прилипшая фильтровальная
бумага и одновременно удаляется желатина. Далее срезы окра-
шивают и обрабатывают как обычно.
Желатиновые срезы можно также окрашивать, не наклеивая
на предметные стекла, проводя их через красители и реактивы,
налитые в небольшие плоские сосудики.
Желатиновые блоки можно хранить в жидком парафине.
Заливка в желатии-левулезу
При этом методе достигается очень хорошая сохранность
тканей.
1. Объекты, фиксированные формалином, промывают 2—5 ча-
сов в проточной воде. 2. Помещают в 10-процентную желатину
на 2—5 часов при температуре 37°; затем переносят в 15—20-про-
центную желатину на 2—5 часов, чем и заканчивается пропи-
тывание. Сосудик с объектом помещают в холодную воду, где
желатина застывает (15—30 минут). 3. Приготовленный блок
режут на замораживающем микротоме и срезы помещают сперва
в тимоловую воду, а затем стеклянной палочкой переносят в чи-
стую воду, где они расправляются. 4. Расправленные срезы вы-
лавливают на предметные стекла, предварительно обработанные
следующим образом:
Предметные стекла покрывают тонким слоем 3-процентной
желатины, дают ей высохнуть на воздухе и затем помещают на
2 часа в 5-процентный раствор Na2SO4, после чего хорошо про-
мывают проточной и дистиллированной водой и снова высуши-
вают. 5. Предметные стекла покрывают слегка увлажненными
полосками фильтровальной бумаги (размер предметного стекла),
«ладут в виде стопки несколько штук стекол одно на другое, слег-
ка прижимают небольшими гирьками и затем помещают на
10 минут в термостат при температуре 37°. 6. Предметное стекло
с прилипшей фильтровальной бумагой кладут в нагретую воду
t(37—40°), в которой полоски бумаги отстают, а желатина раство-
ряется. 7. Окрашивают срезы разведенными водными раствора-
ми красителей, промывают в воде, тщательно удаляют избыток
воды с предметного стекла и заключают в желатии-левулезу.
Для заключения окрашенных срезов готовят смесь: 26 г кри-
сталлической левулезы растворяют в 15 см3 дистиллированной
воды (на водяной бане при температуре 55°). После охлаждения
к ней добавляют 1,125 г желатины, дают постоять, растворяют
при температуре 50°, добавляют 0,075 г калийных квасцов и
фильтруют. Перед употреблением застывшую массу разжижа-
157
ют, нагревая до температуры 37°, и к 1,25 см? смеси прибавляют
2 капли неразведеииого формалина. В эту свежеприготовлен-
ную смесь и заключают окрашенные срезы. Готовый препарат
помещают иа 10 минут в термостат при температуре 37°.
Приготовление срезов на замораживающем
микротоме
Метод замораживания во многих случаях дает полезные ре-
зультаты. Прежде всего замораживание применимо для диагно-
стических и патолого-анатомических целей, когда необходимо
как можно быстрее получить препарат из определенного органа
или ткани, так как иа изготовление срезов по этому способу
требуется всего несколько минут. Замороженные срезы широко
используются для изучения различных липоидных н жировых
включений, а также для самых разнообразных гистохимических
исследований, если необходимо избежать воздействия фиксато-
ров, спиртов и т. д. Полученные на замораживающем микрото-
ме срезы могут служить для исследования их в поляризованном
свете, а также для микросжигания.
Метод замораживания неприменим к слишком маленьким ку-
сочкам ткани, с которыми трудно манипулировать, а также к
очень рыхлым и нежным тканям, непрочно связанным между со-
бою. Кроме того, иа замораживающем микротоме трудно полу-
чить тонкие срезы; обычно удаются срезы толщиной 10—15—20 щ
Метод замораживания неприменим также в тех случаях, когда
необходимо изготовить непрерывные серии срезов. Изготовление
срезов с нефиксированных кусочков ткани не всегда легко уда-
ется. Гораздо легче режутся кусочки, предварительно зафикси-
рованные 10—20-процентным формалином и затем тщательно
промытые (12—24 часа) в проточной воде. Можно использовать
материал, фиксированный и другими фиксаторами, тщательно от-
мыв его в воде перед замораживанием. Материал, обработанный
сулемовыми смесями, мало пригоден для изготовления заморо-
женных срезов. Объекты, фиксированные спиртом, надо пред-
варительно хорошо промыть в воде или в 4-процентном фор-
малине.
Для изготовления замороженных срезов употребляют спе-
циальные микротомы (рис. 74). Столик, служащий для замора-
живания объекта, присоединен при помощи шланга к баллону с
жидкой углекислотой. Открывая специальный вентиль, пропу-
скают углекислоту через камеру предметного столика. Здесь уг-
лекислота испаряется, значительно охлаждая поверхность сто-
лика; при этом объект, помещенный на столик, замерзает. Сто-
лик с находящимся иа ием кусочком ткани рекомендуется покры-
вать стеклянным толстостенным стаканчиком, при этом замора-
живание идет быстрее и меньше расходуется углекислоты. Баллон
с углекислотой лучше всего держать в специальной металличе-
158
Рис. 74. Замораживающий микротом, советская модель:
/ — станина; 2—механизм микрополачи; 3 — держатель ножа; 4~
ограничитель; 5 — замораживающий столик; б— винт крепления
микротома к столу; 7 — винт-фиксатор для замораживающего сто-
лика, 8—кронштейн; 9—рукоятка держателя ножа; 10— фиксатор
ограничителя; 1!—зажимные винты ножа; 12—гайка-ручка; 13—
винт; /4—пятка; 15 — контргайка: 16 — ручка регулировки подачи
кислоты; 17 — металлический рукав для подачи углекислоты; 18 —
кожух; 19 — контргайка; 20—винт; 21 — винт регулировки хода
мнкровинта; 22 — ручка перемещения микровиита; 23—нож.
159
ской стойке в опрокинутом виде. Перед употреблением привезен-
ного нового баллона с углекислотой следует, открыв кран балло-
на, спустить накопившуюся в нем жидкость, дождаться появления
чистой струи углекислоты и только тогда соединить баллон со
шлангом с помощью специальной шайбы.
Для получения хороших срезов надо эмпирически подобрать
оптимальный наклон микротомного ножа. Объект кладут на сто-
лик микротома в капле воды так, чтобы весь кусочек был покрыт
водой. Степень промораживания объекта регулируют, пропуская
углекислоту небольшими порциями, закрывая и открывая клапан
каждые 1—2 секунды. Как общее правило: сперва объект замо-
раживают несколько сильнее, чем это необходимо для успешной
резки. Если при резке объект крошится, значит он переохлажден.
Тогда немного выжидают и вновь делают пробные срезы, кото-
рые должны правильно ложиться на лезвие ножа. Если кусочек
начал оттаивать, его снова замораживают, пропуская порциями
углекислоту.
При работе на замораживающем микротоме надо соблюдать
два условия: 1) следует брать небольшие, равномерно промерз-
шие кусочки (равномерность промерзания трудно достигается
при замораживании крупных объектов); 2) нужно подбирать не-
обходимую степень замораживания объекта. При соблюдении
этих условий можно добиться получения хороших срезов толщи-
ной в 10—20 ц. Значительно труднее делать более тонкие срезы,
голшиной в 5—7 и.
Полученные срезы кисточкой снимают с ножа и переносят
в физиологический раствор поваренной соли со следами тимола,
где срезы хорошо расправляются. Затем с помощью стеклянной
палочки срезы переносят в нужные красители или реактивы.
Можно также наклеить срезы на предметные стекла. Для это-
го их сначала уплотняют в 50-градусном спирте, затем вылавли-
вают на предметное стекло, предварительно смазанное тонким
слоем белка-глицерина. Дают спирту стечь и опускают предмет-
ное стекло на 30—60 секунд в 96-градусный спирт (для жировой
ткани берут смесь равных частей 50-градусного спирта и 7,5-про-
центного формалина), после чего переносят срезы в 70-градусный
спирт и затем в водные растворы красителей. Или же, выловцв
срезы на чисто вымытое предметное стекло, их осторожно при-
жимают к стеклу фильтровальной бумагой. Эти способы не всегда
удаются, так как срезы отклеиваются, и поэтому лучше красить
замороженные срезы, не наклеивая их на предметные стекла.
Срезы можно также уплотнять в 70-градусном спирте, а за-
тем перенести на предметное стекло, смазанное белком-глицери-
ном, иногда рекомендуют непосредственно из физиологического
раствора поваренной соли выловить их на предметное стекло,
налить на них несколько капель смеси равных частей эфира и
70-градусного спирта; эту операцию повторяют, после чего пред-
метное стекло осторожно окунают в 0,25-процентный раствор цел-
4G0
лоидина. Затем наливают иа предметное стекло 80-градусный
спирт для закрепления целлоидина. Наклеенные таким образом
срезы после окраски не проводят через абсолютный спирт, а непо-
средственно из 96-градусного спирта перекладывают в карбол-
ксилол и затем в чистый ксилол, бальзам.
Качество микротомных срезов в большей мере зависит от со-
хранности лезвия микротомного ножа. Микротомный нож
после употребления каждый раз необходимо
править иа ремне. Для сохранения постоянного уклона,
под которым обточено лезвие, на нож надевают специальный
обух для правки. Микротомный нож проводят несколько раз
спинкой вперед по ремню, на котором тонким слоем нанесена
особая паста. При регулярной правке микротомные ножи долго
не тупятся, но, в конце концов, их все же приходится отдавать
мастеру-специалисту, для точки иа специальном камне. Качество
точки на камне проверяется под слабым объективом микроскопа,
когда ясно выступает малейшая зазубринка.
При точке иа камне также применяют специальные надеваю-
щиеся на бритвы обухи, позволяющие стачивать лезвие ножа
всегда под одним и тем же углом. На камне инструмент под дан-
ным ему углом ведут всегда лезвием вперед, причем используется
вся длина камня. При равномерном движении конец лезвия дол-
жен прийтись к концу камня. После этого поднимают нож и точат
его другую сторону в обратном направлении. Не следует придав-
ливать нож к камню. Камень смазывается костяным или дере-
вянным маслом (предварительно профильтрованным). После
точки на камне бритву надо еще непременно направить на ремне.
ОКРАСКА СРЕЗОВ
Окраска срезов, наклеенных иа предметное стекло
Весь процесс освобождения от парафина и проводки через
промежуточные среды — ксилол, спирты, диоксан и т. д. — удоб-
нее всего производить в стеклянных цилиндрах (в так называе-
мых «биологических стаканчиках»), примерно высотой 8,5—9 см
и диаметром 3,5 см, плотно закрывающихся пробкой или стеклян-
ной крышкой. В стаканчики наливают нужные реактивы и раство-
ры красителей. «Биологические стаканчики» для удобства можно
расположить в ряды (смотри далее схему окраски препарата),
поместив их в особые деревянные стойки (рис. 75). Перенос пред-
метных стекол из одного стаканчика в другой удобно производить
специальным пинцетом (рис. 76).
При замеченном загрязнении или помутнении реактивов их
необходимо заменять новыми. При переносе препаратов из од-
ного реактива в другой надо по возможности избегать заноса и
загрязнения их (не заносить спирта в ксилол и, особенно, воды
в диоксан и диоксана в ксилол). Для этого обратную сторону
предметного стекла, а также края стекла, не- занятые срезами,
11 Микроскопическая техника 161
следует вытирать чистым полотенцем. Необходимо помнить, что
препарат не должен подсыхать во время переноса из одного
реактива в другой. При заключении препарата на него наносят
Рис. 75. Стеклянные цилиндры в деревянных стойках и кюветы для ок-
рашивания препаратов.
каплю (возможно меньшую) канадского бальзама и осторожно
накрывают покровным стеклом. Пока бальзам не высохнет, пре-
парат хранят в горизонтальном положении.
Рис. 76. Пинцет для перекладывания предметных
стекол прн окраске срезов и мазков.
При окраске срезов и мазков можно пользоваться специаль-
ными приспособлениями (рис. 77, 78).
Удобную подставку для окрашиваемых препаратов можно
изготовить из двух параллельно расположенных стеклянных
трубочек, соединенных на концах друг с другом резиновыми
трубками. Такие подставки помещают в плоские стеклянные
или жестяные ванночки.
Изучение способов окраски срезов и приготовления постоян-
ного препарата наиболее удобно начать с одного из важнейших
методов: двойной окраски квасцовым гематоксилином и эозином.
Только хорошо усвоив этот метод, начинающий микроскопист мо-
жет переходить к изучению других способов окраски. Надо пом-
нить, что при других методах окраски срезов в прилагаемой далее
схеме меняются лишь указания для п. 5—8, остальной же порядок
проведения через промежуточные среды, освобождения от пара-
162
фина и заключения в бальзам остается тот же, если нет на то осо-
бых указаний в описаниях метода окраски.
Наиболее распространенным является способ проводки препа-
ратов через спирты и ксилол.
Рис. 77. Вогнутые стеклянные пластинки для окраски
срезов и мазков. Предметные стекла кладутся маз-
ком вниз; под предметные стекла вводятся растворы
красителей.
Рис. 78. Приспособление для окраски срезов и мазков. Кра-
сители наливаются на предметные стекла.
Схема окраски срезов квасцовым гематоксилином—эозином
1) Растворяют парафин в ксилоле 3—5 минут; 2) удаляют
ксилол в абсолютном спирте 2—3 минуты; 3) постепенно проводят
через нисходящий ряд спиртов: 96-градусный 2 минуты, 70-градус-
ный 2 минуты; 40-градусный 2 минуты; 4) дистиллированная вода
1—2 минуты; 5) окрашивают квасцовым гематоксилином 1—5
минут; 6) промывают проточной водой 5—20 минут до посинения
срезов; 7) споласкивают дистиллированной водой; 8) окраши-
вают 0,1-процентным эозином 5—10 минут; 9) споласкивают ди-
11* 1G3
стиллированнон водой; 10) обезвоживают в ряде спиртов восхо-
дящей концентрации; 40-градусном 1 минута, 70-градусном 2 ми-
нуты, 96-градусном 2 минуты, 100-градусном 3—5 минут;
11) окончательно обезвоживают в карбол-ксилоле 2—3 минуты;
12) просветляют в ксилоле 3—5 минут; 13) заключают в бальзам.
Очень важно препарат перед заключением полностью обезво-
дить, в противном случае вода с ксилолом (толуолом, бензолом)
даст муть, избавиться от которой можно только вновь доведя пре-
парат до абсолютного спирта.
Для полного обезвоживания после абсолютного спирта, препа-
рат помещают на 2—3 минуты в карбол-кснлол: 10 частей кри-
сталлической карболовой кислоты растворить в 30 частях ксилола
(толуола, бензола). Препарат можно переносить в карбол-ксилол
даже из 96-процентного спирта. Карболовая кислота очень гигро-
скопична и поглощает остатки воды. Из карбол-ксилола препарат
переносят в чистый ксилол и затем заключают в бальзам.
Приклеенные целлоидиновые срезы после освобождения от
целлоидина так же, как и срезы, освобожденные от парафина,
обрабатываются по вышеприведенной схеме.
Окрашивание ненаклеенных срезов: целлоидиновых
и замороженных
Ненаклеенные замороженные или целлоидиновые срезы обра-
батывают и окрашивают так же, как и наклеенные, ио только про-
межуточные среды наливают в часовые стекла и стеклянные бюк-
сы, причем срезы осторожно переносят из одной среды в дру-
гую стеклянной палочкой или стеклянным шпателем. Заморожен-
ные срезы иногда заключают не в бальзам, а (после окраски и
промывки) в глицерин или глицерин-желатипу, не проводя через
спирты, ксилол и т. д.
Схема окрашивания ненаклеенных целлои-
диновых срезов. 1) Срезы переносят непосредственно в 70-
градусный спирт; 2) дистиллированная вода 2 минуты; 3) окра-
шивание квасцовым гематоксилином 3—5 минут; 4) промывка
в водопроводной воде (несколько раз сменить) 10—20 минут;
5) окрашивание 0,1-процентным эозином 3—5 минут; 6) дистил-
лированная вода 1—2 минуты; 7) 70-градусный спирт 2 минуты;
8) 96-градусный спирт 2—3 минуты; абсолютный спирт, ксилол,
бальзам.
Схема окрашивания замороженных срезов
(окрашивание ядра н жировых включений). 1) Срез с заморажи-
вающего микротома переносят в физиологический раствор (для
нефиксированных объектов) или в воду со следами тимола (для
фиксированных объектов); 2) 50-градусный спирт 1 минута;
3) окрашивание Суданом III 20—30 минут; 4) 50-градусный
спирт 30 секунд; 5) дистиллированная вода 1 минута; 6) окраши-
вание квасцовым гематоксилином 4—.6 минут; 7) промывка водо-
проводной водой 10 минут; 8) заключение в глицерин.
164
Заключение тотальных объектов и срезов в глицерин и глицерин-
желатину
Многие объекты удобнее заключать в глицерин или глицерин-
желатину, минуя при этом действие спиртов и ксилола. Этот спо-
соб особенно пригоден для препаратов, обработанных на жиры
и липоиды, или при заключении очень нежных и легко деформиру-
ющихся объектов, но надо помнить, что некоторые окраски (на-
пример, гематоксилиновые) плохо сохраняются в глицерине и
глицерин-желатнне.
При заключении в глицерин объект из воды или
70-градусного спирта переносят в смесь 10 частей воды и 1 части
глицерина. Предметное (или часовое) стекло с объектами поме-
щают для защиты от пыли в шкаф и дают воде медленно (2—3
дня) испариться, затем отсасывают избыток жидкости фильтро-
вальной бумагой, прибавляют каплю чистого глицерина и накры-
вают объект покровным стеклом. Можно также перенести объект
сначала в смесь равных частей глицерина и воды или спирта, за-
тем в смесь двух частей глицерина и одной части воды или спирта
и, наконец, в чистый глицерин. Глицерин не должен выступать за
края покровного стекла. Для сохранения препарата края покров-
ного стекла заклеивают асфальтовым лаком — особой замазкой,
образующей как бы рамочку вокруг покровного стекла.
Состав замазки для покровных стекол: к 2 частям расплавлен-
ного воска прибавляют 7—9 частей канифоли (осторожно: легко
воспламеняется). Затем дают застыть, перед употреблением осто-
рожно подогревают.
При заключении препарата в глицерин-же-
латину иа него (вынув препарат непосредственно из воды или
из разведенного глицерина) наносят стеклянной палочкой каплю
подогретой глицерин-желатины, покрывают покровным стеклом
и дают застыть. Избыток глицерин-желатины, выступающей нз-
под покровного стекла, снимают ножом.
Приготовление глицерин-желатины: 7 г желатины в течение
2 часов растворяют з 42 см3 дистиллированной воды, затем при-
бавляют 50 г глицерина и 0,5 г карболовой кислоты (кристалли-
ческой), нагревают 10—15 минут на водяной бане и, не дав
остыть, фильтруют через стеклянную вату. Края покровного стек-
ла, закрывающего заключенный в глицерин-желатину объект,
можно покрыть вышеописанной замазкой.
Сухой препарат
Скелеты диатомей, фораминифер, радиолярий и мшанок, кост-
ные шлифы, щетинки, перья, скелетные иглы губок и т. п. можно
заделывать в виде сухих препаратов. С этой целью на предметное
стекло наносят маленькую каплю декстрина (можно использовать
самые разнообразные клеющие вещества, например, синдетикон),
.На иее накладывают объект и дают декстрину подсохнуть. Покры-
165
вают покровным стеклом, приделав к нему соответственные воско-
вые ножкн. Края покровного стекла покрывают специальной за-
мазкой.
Методы быстрого изготовления препаратов
Для диагностических целей иногда требуется очень быстро, ча-
сто в несколько минут, приготовить срезы.
В патологогистологических лабораториях нередко применяют
следующий метод: 1) фиксируют маленькие кусочки кипячением
в формалине (1 часть формола 4- 4 части воды) в реактивном
стаканчике в течение 1—2 минут, 2) промывают в воде 3—4 ми-
нуты, 3) приготовляют замороженные срезы. Дальнейшая обра-
ботка см. стр. 164.
Для парафиновых срезов рекомендуется следующий
способ быстрой заливки материала с проведением через ацетон:
1) маленькие кусочки фиксируют в формалине (1 часть формали-
на -ф- 4 части воды) при температуре 37° в термостате в течение
1 часа; 2) споласкивают водой; 3) помещают в ацетон в хорошо
закрытом сосуде на */2—Р/г часа; 4) переводят через ксилол
(1 час) в парафин (52—56°) на */2—Р/г часа и далее обрабаты-
вают по обычной схеме.
Так как ацетон является в то же время фиксирующим средст-
вом, то обработку препаратов этим способом можно начинать
с пункта 3.
А. В. Смолянников (1947) для обработки биопсий реко-
мендует следующий способ быстрой заливки их в целлоидин.
Кусочки из органов (не толще 0,3—0,4 см) фиксируют в тече-
ние 30 мин. в смеси из 9 частей 96-градусного спирта и 1 части
формалина, переносят на 2—2,5 часа в абсолютный спирт, кото-
рый дважды сменяют, затем помещают на 3 часа в эфир и затем
в густой целлоидин (8-процентный раствор целлоидина), после
чего кусочки наклеивают на деревянные колодки, смоченные эфи-
ром. Приклеенные кусочки подсушивают на воздухе 10—15 минут,
после чего их погружают на 20—25 минут в хлороформ. По изъя-
тии из хлороформа кусочки готовы для резки на микротоме (в
хлороформе они могут находиться и дольше). Дальнейшее хране-
ние блоков обычное (70-градусный спирт).
ПРИМЕНЕНИЕ ПЛАСТМАСС В ГИСТОЛОГИЧЕСКОЙ ТЕХНИКЕ
Синтетические пластмассы, несомненно, займут существенное
место в микроскопической технике. Различные зарубежные иссле-
дователи предлагают использовать изобутиловый метакрилат,
этиловый метакрилат, плексиглас, люцит, виниловый ацетат, раз-
личные полистиролы (например, дистрен-80) и т. д.
Применение пластмасс при заделке срезов и мазков позволяет
отказаться как от канадского бальзама, глицерии-желатины и дру-
166
гих веществ, используемых для названной цели, так и, в целом
ряде случаев, от покровных с.текол, потому что пластмасса, пропи-
тывая срезы, одновременно покрывает их твердым тонким слоем.
Пластмассы, пригодные для заключения срезов, можно разде-
лить па две группы: 1) растворимые в воде (пригодные для за-
ключения объектов, в которых окрашены липиды); 2) раствори-
мые в ксилоле (или бензоле, толуоле). В качестве водораствори-
мой пластмассы Д. С. Саркисов (1951) рекомендует поливинило-
вый спирт. Порошок поливинилового спирта промывают в не-
скольких порциях 96-градусного спирта, затем в эфире (для быст-
рого удаления остатков 96-градусного спирта) и высушивают. Из
порошка приготовляют 20-процентный раствор на дистиллирован-
ной воде. Этот раствор подогревают в течение 20—25 минут в ки-
пящей водяной бане. Получается белый мутноватый раствор кон-
систенции густого меда. Срез вылавливают из воды на предметное
стекло, подсушивают и наносят на него несколько капель приго-
товленного раствора поливинилового спирта. В течение 6—8 часов
препарат сохнет и за это время на предметном стекле образуется
совершенно прозрачная пленка, в которой оказывается заключен-
ным срез. Во время сушки срезы следует по возможности предо-
хранять от пыли.
Для заключения срезов, окрашенных гематоксилнн-эозином и
другими красителями, следует пользоваться пластмассами, раст-
воримыми в ксилоле. Для этой цели Д. С. Саркисов рекомендует
полистирол, который без предварительной обработки растворяют
в ксилоле или толуоле с таким расчетом, чтобы получился
20—30-процентный раствор; затем на каждые 100 с.>г; полученного
раствора добавляют в качестве пластификатора 6 см3 дибутилсо-
бацината. Заключение срезов производится так же, как и в поли-
виниловый спирт, но в отличие от последнего полистироловая
пленка образуется быстро: препарат готов через 30—40 минут.
Пластические массы могут быть использованы в процессе за-
делки объектов для последующего изготовления срезов. Для этих
целей употребляют тот же 20-процентный поливиниловый спирт.
Объект держат в нем 4 суток, один раз сменяя (через 2 суток)
раствор.
После этого объект с избытком пластмассы переносят на обыч-
ный деревянный блок, на котором он остается в течение 2—3 су-
ток. Когда объект достаточно уплотнится, изготовляют срезы на
обычном санном микротоме при максимально косом положении
микротомного ножа (как при резке тканей, залитых в целлоидин).
Срезы с ножа переносят в воду. Если в срезах окрашивают жиры
и липоиды, то заключают их в тот же поливиниловый спирт; если
же применены другие способы окраски, то в полистирол. Такая
заливка не требует предварительной проводки кусочков через
спирты, ксилол и тому подобные жидкости, позволяет окрашивать
полученные срезы любыми способами, в том числе и красителями,
выявляющими жир.
167
Е. Н. Павловский и Д. В. Волжинский (1950) рекомендуют за-
ключать мазки крови или бактерий в раствор метил-метакрилата.
Для этой цели окрашенные и подсушенные препараты опускают
па’1—5 минут в чистый хлороформ, а затем переносят на 1—2 ми-
нуты в 4—5 %-процентный раствор метил-метакрилата в хлоро-
форме. Оборотную сторону препарата вытирают полотенцем.
Препарат оставляют до полного высыхания под стеклянным кол-
паком. Образовавшаяся тонкая, прозрачная пленка заменяет и
бальзам и покровное стекло. Существенно отметить, что в этих
условиях хорошо сохраняется эффект окраски по Романовскому—
Гимза. Окрашенные препараты можно, не подсушивая, обезво-
дить в спиртах и из абсолютного спирта перевести в хлороформ,
затем в метил-метакрилат. Препараты, заключенные таким обра-
зом, могут длительно сохраняться без изменений.
РАЗДЕЛ СЕДЬМОЙ
ОКРАШИВАНИЕ
ТЕОРИИ ГИСТОЛОГИЧЕСКИХ ОКРАСОК
В гистологическом и цитологическом исследовании метод,
окраски занимает очень важное место и, несмотря на значитель-
ный прогресс витальной микроскопии, ультра микроскопии, микро-
хирургии и т. д. остается основой громадного большинства микро-
скопических исследований и пока еще не может быть заменен
другими средствами исследования.
Преимущество наблюдения живого материала неоспоримо,
потому что при этом можно избегнуть многих ошибок и артефак-
тов, но далеко не во всех случаях прижизненная микроскопия при-
менима. Окрашивание показывает структуру клеток и тканей с
ясностью, которой не достигает никакой другой метод.
Методы гистологического окрашивания позволяют различать
разнообразные структуры клеток и тканей. Они также выявляют
образования, которые иначе невозможно увидеть. Употребление
окрасок позволяет приступить к настоящему хроматическо-
му анализу элементов органических структур.
Этот хроматический анализ употребляется не только при морфо-
логическом, чисто статическом изучении ткани, по и является, при
соблюдении определенных условий, методом гистофизиологическо-
го исследования, позволяя судить о функциональных изменениях
клеток и тканей.
Однако необходимо проанализировать значение этого хромати-
ческого метода. Мы видим, что элементы ткани окрашиваются
различно, и из этого заключаем, что они сами различны. Что же
представляют собою эти различия? Разрешение этого вопроса
было бы для цитологии и гистологии существенным прогрессом.
Тогда действительно мы могли бы изучать клетки и ткани, ис-
ходя не только из картин морфологических структур. Мы могли
бы по красочным эффектам заключить об их либо физиологиче-
ских, либо физико-химических и коллоидно-химических свойствах.
Изучение механизма гистологических окрасок, позволяющее-
приступить к разрешению этих проблем, является очень важным
для гистолога, который не удовлетворяется описанием структур,
полученных окраской, а старается дать себе отчет в научных осно-
ваниях техники, которой он воспользовался.
Значение окрасок не уменьшается и в настоящее время, хотя
рядом с чисто описательной гистологией и гистофизиологией соз-
далась новая наука—гистохимия. Гистохимия стремится обосо-
бить и определить химически структурные элементы живого
вещества. Несмотря на успехи этой науки, не следует переоцени-
вать ее возможности: еще долго гистохимия будет очень ограни-
чена в изучении столь многообразны!, тканевых белков.
Некоторые реакции протеиновых веществ, которыми может
пользоваться гистохимия, имеют только относительную ценность,
нередко совершенно второстепенную. Эти реакции, слишком
общие, не всегда позволяют установить отношения между протеи-
нами, столь многообразными в тканях.
Важнейшим свойством, позволяющим нам в данное время
дифференцировать тканевые белки, является их различное срод-
ство к красящим веществам.
Если бы механизм этого сродства был выяснен, то мы облада-
ли бы способом определения белковых веществ и дополнили,
таким образом, недостаточные возможности гистохимии.
Крупнейшие задачи описательной цитологии, нормальной и
патологической гистологии и гематологии были решены с помощью
различных методов окрашивания.
В России большая роль в развитии микроскопической техники,
в частности в разработке новых методов окрашивания и примене-
нии новых красителей принадлежит целому ряду старейших ги-
стологов нашей страны. Особенно надо отметить московскую
школу, основанную Бабухиным, петербургскую во главе с Доге-
лем и харьковскую, где работали большие знатоки микротехники
Кульчицкий и Колосов. Прогресс микротехники теснейшим обра-
зом связан с развитием химии красителей и технологии крашения
волокнистых веществ. Началом эры синтетических красителей
следует считать открытие фуксина русским химиком Натансоном.
Позднее Перкен приготовил мовеии. Эти открытия положили на-
чало приготовлению необозримого ряда разнообразных краси-
телей.
Красители относятся к цветным веществам. Цветные вещества
способны пропускать или отражать видимые лучи падающего
света в тех соотношениях частей спектра, в которых они его полу-
чают. В силу этого каждое цветное вещество имеет свой «спектр
поглощения», обусловливающий характерную видимую окраску
и цвет, дополнительный к поглощаемому.
Следует полагать, что цветность определяется не характером
•составляющих атомов, а их расположением, системой их группи-
ровки. Важным свойством красящих веществ является их способ-
ность при восстановлении переходить в бесцветные основания,
170
.лейкооснования (лейкобазы). Эти лейкооснования кислородом
воздуха могут обратно переводиться в окрашенные вещества. Ана-
лиз показывает, что при восстановлении этих веществ к ним
присоединяются два или более атомов водорода (всегда четное
число), которые удаляются при окислении, когда цветность воз-
вращается. Отсюда заключают, что в некоторых местах молекулы
органического красителя имеют группы атомов, связанных двой-
ными связями. По предложению русского химика О. Н. Витта эти
группы, способные к восстановлению, называют хромофора-
м и, или цветоносными группами.
При соединении углеродистых ядер с хромофорными группами
или при включении последних в кольцевые системы углеводоро-
дов мы получаем окрашенные тела. Так, например, соединением
двух бензольных колец при помощи азогруппы мы получаем азо-
бензол — окрашенное тело.
Таким образом, введение хромофорной группы в углеводород-
ные ядра представляет существенный момент при переходе
бесцветных соединений в окрашенные. В тех случаях, когда полу-
чившиеся окрашенные тела могут дать начало красящим веще-
ствам, они носят название хромогенов.
Кроме хромофоров, в состав красителей входит ряд вспомога-
тельных групп и атомов: алкильные (СН3), амидные (NHz),
гидроксильные (ОН), карбоксильные (СООН), сульфогруппы
(HSO3), галогены и т. д. Эти вспомогательные группы изменяют
свойства цветного вещества. Так, например, амидные группы со-
общают ему основной характер, гидроксил, карбоксил, сульфо-
ксид— кислый характер. Все эти вспомогательные группы носят
название ауксохромов, так как они превращают собственно
цветное вещество в краситель. В основном роль ауксохром-
ных групп троякая: 1) они сильно сдвигают в веществе полосы
поглощения света от фиолетового к красному концу спектра;
2) они усиливают химическую индивидуальность тела; 3) веще-
ство приобретает красящие свойства, которых хромогены
ие имеют. Окрашенное вещество еще не есть краситель: если
имеются хромофоры, но нет ауксохромов, то отсутствует и окраши-
вающая способность. Итак, перемена цвета при восста-
новлении, наличие хромогенов, хромофоров и
ауксохромов является наиболее общей химической ха-
рактеристикой красителя. От каждого хромогена могут
брать начало два ряда красителей: кислые—при введении груп-
пы ОН и основные — под влиянием амидной группы. При введе-
нии в хромоген нескольких однородных ауксохромовых групп
вместе с числом введенных групп увеличивается до определенного
предела интенсивность тона краски.
Например, амидзазобензол — желтый, диамидоазобензол —
оранжевый, триамидоазобензол — коричневый.
Интенсивность тона красителя может увеличиться, помимо ум-
ножения ауксохромных групп, при накоплении атомов углерода.
171
Наконец, изменение цвета может нередко зависеть не только от
введения новых групп в молекулу красителя, но и от простой пе-
рестановки атомов, имеющихся в молекуле.
Особенности, которыми обладают органические красящие
вещества, имеющие сродство к текстильным волокнам или к окра-
шиваемым элементам гистологического среза, стоят в тесной
связи с их химическим строением. Особенности химического стро-
ения обусловливают интенсивность окраски данного вещества.
Необходимые условия, при которых органические вещества
имеют красящую силу, были определены Виттом.
По О. Н. Витту, в хромогене красящий характер в некотором
роде скрыт. Поэтому вещества, включающие в себя хромофор,
являются обычно веществами окрашенными, но не окрашиваю-
щими. Они дают действительную зону поглощения для одного из
цветов спектра, ио они не имеют свойства фиксироваться на тек-
стильных волокнах. Известно около двадцати хромофоров.
Все ауксохромы без исключения переводят хромогены, обык-
новенно нейтральные, в вещества основного или кислотного
характера. Из этого следует, что все красящие вещества являются
электролитами. Каждый раз, когда способность образовывать
соли исчезает, исчезает и ауксохромное свойство.
Витт полагает, что различные степени ауксохромности находят-
ся в прямой зависимости от степени ионизации, т. е. краситель
будет тем ценнее по своей красящей природе, чем большей способ-
ностью к диссоциации он будет обладать. Этот характер электро-
лита, общий всем без исключения красящим веществам, имеет
большое значение для изучения механизма окраски. Всякая разум-
ная теория должна считаться с тем фактом, что потеря красящим
веществом способности к диссоциации влечет за собой тем самым
потерю его красящего свойства.
Современные успехи химии красителей внесли очень мало из-
менений в теорию Витта. Если разница между хромофором и аук-
сохромом несколько потеряла свою ясность, зато идея Витта о не-
обходимости диссоциации красителей осталась нетронутой.
Классификация красителей, обычно применяемая в технологии
крашения, мало применима в гистологии. Для наших целей более
удобна следующая классификация, разделяющая красители на
субстантивные и аджективные; первые могут окра-
шивать текстильные волокна сами, вторые окрашивают только с
помощью протравы.
Таким образом мы различаем:
I. Красители субстантивные (красители основные, кислые, ней-
тральные, индифферентные).
II. Красители аджективные (лаки).
Некоторые исследователи считают, что красители лучше раз-
делять на п р о г р е с с и в и ы е и регрессивные.
Первыми объект окрашивают только до желаемой степени,
172
вторыми же объект сперва окрашивают возможно интенсивнее, а
затем уже ослабляют окраску или, как говорят, дифферен ц’и-
ру ют ее до желаемого тона.
Можно думать, что обе классификации должны быть сохране-
ны, так как они связаны с двумя совершенно различными идеями.
Красители субстантивные так же хорошо, как и аджективные,
могут употребляться н регрессивно, и прогрессивно. Чаще всего
субстантивными красителями окрашивают прогрессивно, аджек-
тивными — регрессивно. Но это дело навыков и не имеет принци-
пиального значения. Так, например, железный лак гематеина ча-
ще всего употребляется по способу регрессивному (железный ге-
матоксилин Гейденгайна), но может употребляться по способу
прогрессивному (гематоксилин Гансена).
По своим химическим свойствам красители разделяются на
основные и кислые. Так как многие красители, как кислые,
так и основные, содержат одновременно основные и кислые ауксо-
хромные группы, то не всегда легко решить вопрос об их кислой
или основной природе. Для решения подобных случаев приходит-
ся прибегать к методу катафореза.
Основные красители представляют собой соли крася-
щих оснований, чаще всего это хлоргидраты. Основные их свойст-
ва зависят от аминогруппы, замещенной или не замещенной, ко-
торую они содержат. Но можно одинаково употреблять и другие
соли, кроме хлоридов. Кислотная природа радикала, соединенного
с основанием красителя, по-видимому не играет никакой роли в
явлениях окрашивания.
Гистологические образования, элективно окрашивающиеся ос-
новными красителями, называются базофильными.
В текстильной технологии основные красители рассматривают-
ся как лучшие красители для различных животных волокон.
Хлопок и целлюлозные волокна (искусственный шелк) основ-
ные красители окрашивают очень плохо, но окраска хлопка
становится возможной после протравы (например, танином).
Под кислыми красителями подразумевают свободные
окрашенные кислоты нли соли этих кислот, обычно соли натрия.
Красители этого класса обнаруживают вообще, и при окрашива-
нии — в частности, свойства кислот: они соединяются с основа-
ниями, образуя растворимые или нерастворимые солеобразные
соединения. Кислоты выделяют из этих солей свободные красите-
ли. Все эти свойства, характерные для кислот, объясняются при-
сутствием в частицах красителей гидроксилов или групп SO2OH,
СООН. Гистологические элементы, красящиеся элективно кислы-
ми красителями, называют оксифильными или ацидо-
фильными.
В нейтральной бане кислые красители не окрашивают ни
шерстяных, ни шелковых, ни хлопчатобумажных волокон, но
дают отличное окрашивание шерсти и шелка в кислой бане; цел-
173
люлозные волокна этими красителями окрашиваются слабо или
не окрашиваются вовсе.
Так называемые нейтральные красители являются
солеобразными соединениями кислых и основных красителей.
Это—соль, анион и катион которой являются красочными ра-
дикалами. В нейтральных красителях базофильные элементы тка-
ни окрашиваются основным компонентом красителя, а ацидофиль-
ные— соответственным кислым компонентом.
Последний класс составляют индифферентные краси-
те л и. Так называют красочные вещества, ие имеющие солеоб-
разиого строения, и их можно только условно назвать красителя-
ми. И действительно, эти вещества ие имеют «сродства» ни к
текстильным волокнам, ни к белковым элементам тканей и клеток.
Это — «окрашенные вещества», но не красители. В микротехнике
оии употребляются для «окраски» жиров. Но это окрашивание
принципиально отлично от обычного окрашивания. Оно объяс-
няется чисто физическим явлением: очень интенсивной раство-
римостью этих веществ в жирах и значительно более слабой
растворимостью в исходном раствврителе. На этом и основано
применение судака III и красного шарлаха для окраски жиров на
гистологических препаратах.
Аджективные красители требуют для окраски при-
менения протравы. Комплекс, образующийся соединением краси-
теля с протравой, носит название лака. Аджективные красители
принадлежат главным образом к антрахиноновым или к так на-
зываемым натуральным красителям (гематоксилин, кармин). В
качестве протрав употребляют окислы металлов, преимуществен-
но трехвалентных. Главнейшими протравами являются соли гли-
нозема, хрома, железа, меди. Особенностью протравного краше-
ния является то, что цвет окраски во многих случаях коренным
образом зависит от протравы. Теория строения и образования ла-
ков еше мало разработана, так же как теория процесса соедине-
ния лака с окрашиваемым субстратом. Также не разработана
достаточно теория дифференцировки окрашенных лаком препара-
тов (например, железным гематоксилином). Надо отметить, что
протрава может производить глубокие изменения в свойствах
красителя; в некоторых случаях протрава превращает некрасящее
вещество в отличный краситель. В микротехнике таким примером
может служить гематоксилин, в чистом виде почти ие обладаю-
щий способностью окрашивать, в то время как его лаки являются
интенсивными красителями. Отметим также, что гематоксилин
имеет кислый характер, а его лаки ведут себя как основные кра-
сители.
Химическая теория гистологической окраски
разрабатывалась и защищалась многими исследователями. Эта
теория (в своей классической форме) утверждает, что окрашива-
ние- сводится к солеобразованию между красителем и субстратом.
Так, например, если взять основной краситель, то его красочный:
174
ион даст с белковым веществом кислого характера «альбуминат
красителя». Белки тканей являются амфотерными веще-
ствами (амфолиты). Они способны вести себя то как кислоты,
то как основания. Это зависит от нахождения в белках основной
группы NH2 и кислотной группы СООН. Эрлих, развивая свою
теорию окраски, ввел понятия базофилии, ацидофи-
лии и нейтрофилии клеточных элементов, основываясь
на сродстве их к основным, кислым или нейтральным красителям.
Но в действительности большинство клеточных элементов способ-
но окрашиваться как основными, так и кислыми красителями, Это
явление с точки зрения химической теории окраски можно объяс-
нить амфотерной природой белковых веществ.
Лишь немногие клеточные элементы способны окрашиваться
только одной категорией красителей. К таким образованиям надо
отнести эозинофильную зернистость лейкоцитов — здесь имеет
место, по терминологии Эрлиха, абсолютная ацидофи-
лия. Также в отношении зерен тучных клеток можно говорить об
абсолютной базофилии. В огромном же большинстве-
случаев мы наблюдаем относительную базофилию или оксифилию,
т. е. имеем дело с амфофильными элементами, с пре-
валирующими основными или кислотными свойств а-
м и.
Аргументы, приводимые в пользу химической теории окраски,
весьма многочисленны. В доказательство ее приводят следующие
соображения, взятые как из области технологии, так и из специ-
альных исследований по теории микротехники.
1. Трифенилметанные красители имеют бесцветные свободные-
основания, но соли их резко окрашены; если органические волок-
на прокипятить в растворе бесцветного розанилинового основа-
ния, то они окрасятся в цвет соответствующего красителя. Этот
феномен до сих пор употребляют в текстильной практике, чтобы
отличать натуральный шелк от искусственного, так как последний,
будучи целлюлозной природы, не ионизируется и тем самым не
дает окрашивания.
2. При окрашивании шерсти и шелка в растворе хлористой со-
ли какого-нибудь основного красителя в баие можно доказать
присутствие НС1 в количестве, соответствующем количеству
фиксированного волокнами красителя.
3. Имеются красители с сильно основными свойствами; они
не окрашивают шерстяные волокна, но если добавить немного
аммиака, то окрашивание происходит.
Шелк, обладающий более резко выраженными кислотными
свойствами, этими красителями (например, метиловым зеленым),
окрашивается непосредственно без добавления аммиака (Нетц-
кий).
4. В растворе пикриновой кислоты шерстяные волокна погло-
щают 13,3% пикриновой кислоты, а в растворе динитронафтола
20,8% красителя, что соответствует как раз молекулярным отно-
175
тениям этих веществ; следовательно, при окрашивании образу-
ются соли.
5. Щелочные соли азокрасителей имеют другой цвет, чем со-
ответствующие свободные кислоты. Но если шерсть погрузить в
раствор свободной кислоты, она примет окраску соли, т. е. и в этом
случае волокна образуют с красителем соль.
6. В литературе приводят следующие интересные эксперимен-
ты. Нафталин С10Н3, неспособный давать солеобразные соедине-
ния, не окрашивается; нафтол С)0Н6(ОН), имеющий кислотный
характер, отлично окрашивается основными красителями н совер-
шенно не окрашивается кислыми; нафтиламин С10Н6 (NH2), име-
ющий основной характер, ведет себя противоположным образом;
наконец, аминонафтол СщБЩОН) (NH=), имеющий амфотер-
ный характер, окрашивается как основными, так и кислыми кра-
сителями.
7. Исследования с белками показали, что растворы альбуми-
на, нуклеиновой кислоты и другие белки дают с бесцветными ос-
нованиями некоторых красителей цветные солеобразные соедине-
ния.
8. Тнмонуклеиновая кислота дает с метиловым синим и мети-
ловым зеленым типичные солеобразиые соединения.
9. Светло-желтый раствор свободной кислоты иодэозина ок-
рашивает базофильные элементы тканей в ярко-красный цвет со-
ли иодэозина. Аналогичные опыты были проведены со свободны-
ми основаниями малахитового зеленого и родамина.
10. Курник и Мирски (1950) установили, что метиловый зеле-
ный, как и некоторые другие красители трифенилметанового ря-
да (например, малахитовый зеленый) дают соединения с высоко-
полимерными нуклеиновыми кислотами (типа дезоксирибонукле-
иновой кислоты), в то время как пироиин дает соединения с
малополимерными нуклеиновыми кислотами (типа рибонукле-
иновой кислоты). Таким образом, если дезоксирибонуклеиновую
кислоту деполимеризовать, то она будет давать соединения с пи-
ронином с той же интенсивностью, как и рибонуклеиновая
кислота.
И. При помощи диффузионного и спектрометрического мето-
дов было установлено, что многие нативные белки способны
связывать красители и что при денатурации белков их сродство
к красителям усиливается (А. Д. Браун, 1948).
Из доводов, приводимых противниками химической теории,
наиболее серьезным является утверждение, что в процессах кра-
шения не имеет места закон кратных отношений.
Многочисленными опытами пытались доказать, что этот закон
приложим к процессам окрашивания, но оказалось, по край-
ней мере для весьма большого числа случаев, что величина мас-
сы волокна, соединяющаяся с грамм-молекулой красителя,
варьирует в зависимости от экспериментальных условии. В силу
этого одни авторы выдвигали гипотезу о том, что здесь имеет ме-
176
сто образование «атипических двойных сОЛей aDvrne авторы го-
ворили о «вариабильных молекулярных комплексах» и т. П. Все
же эта «кардинальная трудность» химической теории окраски
остается не вполне преодоленной и до сегодняшнего дня.
В последнее время снова возрождается химическая теория
крашения. Очень интересные исследования в этой области при-
надлежат А. Порай-Кошицу, по-новому подошедшему к теории
крашения животных волокон (шелка и шерсти). Его соображе-
ния в большой степени касаются сопредельной области гистологи-
ческого крашения: Дело в том, что в последнее время ряду авто-
ров, благодаря применению рентгенографического анализа
при исследовании волокон, удалось весьма точно установить ми-
целлярную структуру кератина шерсти и фиброина шелка. Было
показано, что главная масса шерстяного волокна состоит из
мицелл,' расположенных в направлении длины волокна, примерно
2000 А длиной и 200 А толщиной. В свою очередь каждая ми-
целла состоит из длинных, параллельно расположенных пептид-
ных цепей, связанных между собой солеобразными связями
между NHj-группами одной цепи и СООН-группами другой. Эти
факты подтверждают данные об амфотерной природе животных
волокон, о существовании внутренних солей аминокислот, способ-
ных образовать соли с иными кислотами или основаниями, особен-
но более сильными, чем они сами. Окончательное утверждение
такого положения, пишет Порай-Кошиц, явилось сильной под-
держкой для так называемой химической теории крашения
животных волокон, бывших когда-то господствующей в текстиль-
ной химии, но подвергшейся в начале текущего столетия ожесто-
ченной критике со стороны химиков-коллоидников, не признавав-
ших сначала никакого химизма во. взаимоотношениях шерсти и
шелка с красителями, а сводивших все явления крашения к сорб-
ции. Лишь в последнее время сторонники адсорбционной теории
при объяснении явлений крашения стали говорить о хемосорбции.
С другой стороны, говорит далее Порай-Кошиц, новейшие данные
о строении и о мицеллярной природе вещества и выяснение разме-
ров и строения самих мицелл заставили сторонников химической
теории крашения, т. е. теории солеобразования между амфотер-
ным протеином и кислотой или основанием красителя, пересмот-
реть и принять во внимание, что взаимодействие между твердым
коллоидальным волокном и раствором красителя (тоже часто
обладающим коллоидными свойствами) все же нечто иное, чем
взаимодействие между основанием и кислотой в истинно водных
растворах. Своеобразие происходящих здесь процессов в извест-
ной мере обусловлено тем, что солеобразные связи между NfE-
и СООН-группами полнпептидных цепей протеинов находятся
внутри мицелл, очень тесно связанных Ван-дер-Ваальсовыми си-
лами в пучки; иону кислоты (или основания) красителя надо про-
никнуть в межмицеллярное пространство для того, чтобы образе-
12 Микросквпкческая техника 177
вать соль с протеином волокна. Порай-Кошиц приводит данные, по-
казывающие, что в обычном воздушно-сухом виде шерстяное во-
локно имеет промежутки между мицеллами порядка 6 А, а в силу
этого ни один краситель не способен проникнуть внутрь такого
волокна. Однако при набухании в воде промежутки эти увеличи-
ваются настолько, что становятся способными пропускать слож-
ные молекулы красителей. Это набухание еще увеличивается в
кислой и щелочной среде, причем разрываются и солеобразные
связи между полипептидными цепями. Порай-Кошиц специально
исследовал вопрос о взаимодействии субстантивных красителей с
животными волокнами, чрезвычайно важный и для теории гисто-
логического окрашивания. В качестве рабочей гипотезы было вы-
двинуто предложение, что эти красители будут себя вести так же,
как кислые красители, которые, по-видимому, образуют с протеи-
нами шерсти и шелка соли определенного состава! С другой сто-
роны, можно было предположить, что эти красители, как коллои-
ды, могли адсорбироваться коллоидными животными волокнами
целиком в виде неразложенных солей и коагулировать на них.
Проведенные Порай-Кошицем исследования показали, что краси-
тели химически связываются с протеинами шелка и шерсти с со-
блюдением стехиометрических отношений. Однако при окрашива-
нии разными красителями можно установить два предела насы-
щения. Это явление Порай-Кошиц объясняет тем, что в шерсти
(и шелке) имеются две категории основных групп белка, которые
могут давать соли с кислотами различной силы. Более сильные
кислоты образуют соли с обеими группами, слабые же кислоты
связываются лишь с высокоактивными аминными группами.
Сторонники физик о-х имических теорий краше-
ния полностью отбрасывают идею о том, что при окраске
важнейшее значение имеют химические процессы, и сводят весь
процесс к действию физических или коллоиднохимических
факторов: крашение зависит от физических моментов как со
стороны красителя (величина молекулы, кристаллическое или
коллоидное состояние, степень дисперсности, скорость диффузии),
так и со стороны субстрата окрашивания (величина межмицел-
лярных пространств, сила поверхностного натяжения и адсорб-
ции) .
В литературе нет единой физико-химической теории процесса
крашения.
Одна из старейших физических теорий крашения
связана с именем А. Фишера, который для своих экспериментов
брал различные белки (альбумоза, гемоглобин и т. д.), фиксиро-
ванные разными фиксаторами и затем окрашенные рядом
гистологических красителей. Обрабатывая таким образом пре-
парат гемоглобина, он наблюдал, что при окрашивании желез-
ным гематоксилином и тропеолином крупные зерна, принимают
черный цвет гематоксилина, а мелкие — красный цвет тро-
178
пеолина. Таким образом получалось, что двуцветная окраска
совершенно не связана с химическими свойствами окрашиваемо-
го вещества, так как зерна состоят из одного и того же гемо-
глобина, а определяется величиной зернистостей. При окраске
аналогичного препарата сафранином и генциановым фиолетовым
можно видеть, что крупная зернистость красится в красный
цвет, а мелкая — в фиолетовый. Из ряда подобных опытов был
сделан вывод, что окраски не дают никакого представления
о химизме клеточных элементов; так, например, крупные зерна
окрашиваются медленнее, но и медленнее теряют окраску,
мелкие — быстрее окрашиваются, но и быстрее ее отдают.
В случае окраски смесью красителей существенным является
скорость диффузии красителя; если пользоваться смесью двух
кислых красителей, то крупные зерна окрасятся более быстро
диффундирующим красителем, а мелкие зерна — более медленно
диффундирующим. При использовании смесей основных красите-
лей диффузия имеет меньшее значение, на первое место вы-
ступает относительная концентрация красителей в растворе.
Эти гипотезы подверглись критике, причем указывалось, что
Фишер в своих опытах пользовался только регрессивными мето-
дами окраски и только гомогенными смесями красителей (смесь
двух основных или двух кислых красителей). Если же пользовать-
ся гетерогенными смесями, то распределение происходит по хими-
ческому сродству красителей к определенным элементам ткани,
в то время как при гомогенных смесях распределение зависит от
физических факторов: величины молекулы красителя и размеров
интермицеллярных пространств окрашиваемого субстрата.
Вышеприведенные исследования послужили основой для
работ Меллендорфа и ряда других авторов, которые различают
процессы окрашивания кислыми и основными красителями:
процессы, связанные с последними, протекают значительно
сложнее.
По Меллендорфу процесс окрашивания кислыми красителями
является процессом пропитывания, тесно связанным с диф-
фузионной способностью красителя и плотностью окрашиваемых
структур. Если для окраски взят только один кислый сильно
диффундирующий краситель, то он пропитывает все элементы
ткани, а если краситель коллоидальный, то он проникает только
в наименее «плотные» структуры.
При использовании гомогенной смеси краситель, наиболее
сильно диффундирующий, фиксируется на структурах «рыхлых»,
краситель, слабее диффундирующий, фиксируется на структурах
более «плотных».
Как было выше сказано, сторонники этой теории считают,
что процессы окрашивания основными красителями олее
сложны и устанавливают для них следующие закономерност •
Чем слабее основной краситель диффундирует в желатин ,
179
12*
тем интенсивнее он окрашивает, т. е. здесь имеет место то же
явление, что и для кислых красителей. 11о если исследовать
интенсивность окраски в зависимости от взятой концентрации
красителя, то оказывается, что основные красители распадаются
на две группы. Относимые к первой группе сильно диффундиру-
ющие красители ведут себя так же, как и кислые красители,
у которых интенсивность окраски растет с концентрацией ее
в растворе. Ко второй группе относятся красители, у которых,
начиная с 1/10 000 М при увеличении концентрации происходит
уменьшение интенсивности окрашивания. При крашении гистоло-
гических препаратов основными красителями первой группы
видно, что они окрашивают тс же самые структуры, что и кислые
красители; процесс такого окрашивания течет по типу «про-
питывания» и совершенно не связан с химическими свойствами
красителя. Процесс окрашивания основными красителями второй
группы более сложен. Они также способны давать окрашивание
типа «пропитывания», т. е. ведут себя так же, как и все выше-
описанные красители, и дают такой же эффект окрашивания, как
кислые красители одинаковой с ними интенсивности диффузии.
Но красители второй группы не всегда дают окрашивание типа
«пропитывания»: определенное число тканевых структур
окрашивается совершенно иным образом, — это окрашивание
типа «осаждения».
Характерным моментом окрашивания типа «осаждения»
является то, что оно происходит только на определенных
структурах (хроматин, тучные клетки, эластические тяжи, хрящ)
и только при условии концентрации красителя в растворе выше
1/10 000 М. «Осадочная» окраска имеет более или менее замет-
ный зернистый вид. Но в какой мере явления диффузии в жела-
тине сравнимы с процессами, текущими в водной среде? Ряд
физико-химиков, анализировавших этот процесс, пришел к вы-
воду, что процесс диффузии в желатине имеет свои особенности,
зависящие от ряда условий, нередко трудно определимых. По-
этому метод определения .размеров частиц красителя путем
изучения его диффузии в желатине, как делал Меллепдорф,
теряет свою убедительность и точность.
В целом приходится признать, что все попытки Меллепдорфа
дать общую теорию гистологических окрасок остались незавер-
шенными и весьма односторонними, так как они охватывают
только ограниченный круг явлений, могущий иметь место при
гистологических окрасках.
Сведение всех процессов окрашивания к «пропитыванию»
и «осаждению» вызвало серьезные теоретические и эксперимен-
тальные возражения сторонников химической теории окрашива-
ния.
Поборники физической теории гистологического окрашивания
нередко черпают свои аргументы в технологии крашения тек-
180
стильных волокон, где имеется ряд попыток обосновать
процесс окраски, базируясь на чисто физиче-
ских явлениях адсорбции и роли поверхно-
стных сил. Исследователи исходят из аналогии между
окрашиванием волокон и явлениями сорбции углем красителей
из раствора: как известно издавна, уголь способен обесцвечивать
растворы красителей, причем не наблюдается никаких стехио-
метрических соотношений между количеством адсорбированного
красителя и адсорбентом.
Более подробные количественные исследования показали, что
уголь адсорбирует все неэлектролиты, растворимые в воде, хотя
и в различной степени. Адсорбционная теория утверждает, что
процесс окраски волокон идентичен адсорбции красителей углем,
что химизм субстрата не имеет значения в процессе окрашивания,
и механизм окраски определяется поверхностными силами.
Установленные закономерности адсорбции были использованы
некоторыми авторами для обоснования теории окрасок в техно-
логии крашения, но в гистологии их применение наталкивалось
на ряд серьезных трудностей.
Повседневный опыт доказывает гистологу существование
базофилии и оксифилии клеточных структур. Ему трудно со-
гласиться с тем, что гистологические окраски протекают так же,
как в случае сорбции углем, одинаково адсорбирующим кислые
и основные красители. Гистологи не могли следовать в этом
отношении за технологами. При использовании различных не-
органических порошкообразных веществ было установлено, что
одни из них (каолин, кизельгур) удерживают только основные
красители, в то время как другие (алюминий, гидроокись же-
леза) — только кислые красители. Этот несколько примитивный
и чисто качественный опыт послужил исходным моментом для
подробных и интересных исследований Михаэлиса; исходя из
чисто физической теории крашения, он пришел к построению
такой теории окрасок, в которой химические факторы играют
важную роль. Этот исследователь устанавливает несколько
видов адсорбции в зависимости от ионной характеристики-
адсорбируемого и адсорбирующего вещества.
1. Адсорбирующее вещество индиф- а) адсорбируемое вещество индиффе-
ферентно (т. е. неэлектролит) рентно;
б) адсорбируемое вещество электро-
лит.
2. Адсорбирующее вещество электро- а)Гадсорбируемое вещество индиффе-
лит рентно;
б)'.адсорбируемое вещество электро-
лит.
В случае индифферентного адсорбирующего вещества
процесс протекает так, как было описано выше при адсорбции
красителей углем; адсорбируются одинаковым образом как
электролиты, так и неэлектролиты.
18;
В случае, когда адсорбирующее вещество является электро-
литом, процессы протекают более сложно. Во-первых, индиф-
ферентные вещества адсорбируются электролитами в минималь-
ных, подчас трудно определимых количествах. Во-вторых, при
адсорбции электролитов резко выступает значение химических
факторов: одни вещества адсорбируют только основные кра-
сители, другие — только кислые.
При дальнейшем изучении адсорбции электролитов было
установлено, что здесь имеет место обменная адсорбция,
примером которой может служить адсорбция каолином (силикат
А1 и Са) метиленового синего. При этом происходит процесс,
который упрощенно-схематически можно выразить так: силикат
Са С1 метиленового синего = СаС12 + силикат метиленового
синего.
Дальнейшие наблюдения показали, что для осуществления
адсорбции необходимо, чтобы оба компонента имели «обменные
части», в данном примере Са и С1. Как общий вывод из этих
работ следовало, что основные красители адсорбируются электро-
отрицательными адсорбентами, а кислые красители электрополо-
жительными адсорбентами. Эти положения относятся к таким
веществам, как каолин, кизельгур и т. п. При работе с гистологи-
ческими объектами усложнения проистекают в силу амфотер-
ности составляющих их белков.
Подводя итоги, надо подчеркнуть, что теория обмен-
ной адсорбции позволяет гистологу делать
известные выводы о химическом характере
окрашиваемых веществ, поскольку электрополярность
является ведущим фактором процесса окрашивания. Следует
также отметить, что эта теория подходит по существу очень
близко к химической теории окрашивания.
В настоящее время, наряду с химической и физической тео-
риями, одной из наиболее интересных является э л е к т р о кол-
лоидальная теория окраски. Основной факт, легший в основу
этой теории, — зависимость окончательного эффекта окраски тка-
ней от реакции раствора красителя — был давно известен в тех-
нологии крашения.
В гистологии давно было установлено влияние кислот и ще-
лочей на окрашиваемость животных тканей; так, например, толуи-
диновый синий красит наиболее интенсивно в щелочном растворе,
слабее в кислом растворе, причем уменьшение интенсивности
окраски при возрастающем подкислении раствора отражается не-
одинаково на окрашиваемости разных элементов ткани, и тем са-
мым создается возможность элективной окраски.
Дальнейшие наблюдения показали, что разные элементы клет-
ки окрашиваются при разном pH. Аналогичные идеи мы находим
также в работах, посвященных изучению зависимости окраски
денатурированных белков и мазков от их изоэлектрической точки.
182
Из этих предпосылок родилась идея о зависимости разной ок-
рашиваемости элементов тканей от их изоэлектрических точек.
В ряде экспериментальных работ была показана связь, сущест-
вующая между изоэлектрическим пунктом тканей и интенсивно-
стью красочного эффекта (рис. 79, 80). При этом внимание фик-
сировалось иа двух важнейших факторах: электрическом состоя-
нии протеина и ионной концентрации раствора красителя. Значе-
ние. 79. Схема окраски электро- Рис. 80. Схема окраски электронегатив-
позитивных частиц в смеси кисло- них частиц в смеси кислого и основного
го и основного красителей (по красителей (по П. В. Макарову, 1948J
П. В. Макарову, 1948).
нпе этих двух факторов вытекает уже из идей Михаэлиса, которым
Пишингер дал экспериментальное обоснование на гистологических
объектах. Этот исследователь изучил влияние изменения pH на ад-
сорбцию основного красителя (толуидинового синего) и кислого
красителя (цианола)—яичным белком, желатиной, хрящом и ти-
мусом. Из данных, полученных в этих опытах, вытекало, что для
каждого коллоида или ткани способность давать соединения резко
изменяется при определенном значении pH, причем это уменьше-
ние окраски происходит для цианола в несколько более щелочной
среде, а для толуидинового синего — в несколько более кислой.
Эта точка уменьшения или исчезновения окраски различна
для разных коллоидов или тканей: для свернутого яичного белка
и желатины она лежит около pH, равного 3—4, для тимуса — око-
ло pH, равного 2—3, для хряща — около pH, равного 2. Весьма
интересно, что pH, при котором происходит резкое уменьшение
183
окраски, соответствует изоэлектрическим точкам (коллоидов и
тканей), которые определялись с помощью катафореза.
Найденное совпадение приводит исследователей к выводу, что
резкое падение способности определенного вещества (субстрата)
окрашиваться, адсорбировать краситель, зависит от потери заря-
да исследуемого коллоида; после перезарядки должно происхо-
дить отталкивание соответствующих частиц красителя. На гисто-
логических срезах, фиксированных абсолютным спиртом, можно
наблюдать те же самые явления: резкое падение окрашиваемости
прн определенном значении pH раствора красителя; это ослабле-
ние происходит в кислой стороне для основного красителя — то-
луидинового синего и в щелочной — для кислого красителя —
пианола, причем эта точка уменьшения окраски различна для
различных клеточных элементов. Таким образом, нет принципи-
альной разницы в поведении протеинов типа желатины или кури-
ного белка и протеинов на гистологических срезах.
В целом можно считать, что так как точки уменьшения окра-
шиваемости тканей на срезах совпадают с изоэлектрическими
точками, определенными методом катафореза, то имеется полная
возможность с достаточной уверенностью определять изоэлектри-
ческие точки составных частей клеток и тканей. При этом сле-
дует употреблять высокодисперсные красители, имеющие свойст-
ва чистого электролита и, кроме того, не содержащие в составе
своей молекулы добавочных групп (основных групп для красите-
лей кислых и кислых групп — для красителей основных).
Надо особо подчеркнуть, что электроколлоидальная теория
красочного процесса касается окрасок, проводимых в определен-
ных условиях: фиксация объекта абсолютным спиртом, примене-
ние одного прогрессивно красящего красителя без протрав,
причем применяемый краситель не должен быть коллоидальным.
При этих условиях процесс окрашивания имеет ха-,
рактер адсорбции, тесно связанной с элек-
трическим зарядом тканей, а интенсивность окра-
шивания при данной величине pH раствора (и равном времени
крашения) будет тем выше, чем величина pH будет дальше от
изоэлектрической точки ткани в щелочной стороне для красителей
кислых, в кислой стороне—для красителей основных. Таким об-
разом, старые понятия «базофилия» и «оксифилия»
могут быть определены более точно; базофилия и оксифилия
тесно связаны с электрополярностью клеточных элементов, поэ-
тому можно заменить термины «базофильная ткань» и «ацидо-
фильная ткань» терминами: «ткань, заряженная положительно»
и «ткань, заряженная отрицательно». Эти понятия не абсолютны:
положительный нли отрицательный заряд одного и того же про-
теина, т. е. его базофилия нли ацидофилия зависят от концентра-
ции водородных ионов в среде, в которой находится белок. В ряде
случаев было показано, что окраска в высокой степени зависит от
электрополярности красителя и тканей. Окраска происходит толь-
184
ко тогда, когда заряды частей клетки и красителя имеют противо-
положные знаки. Заряд красителя зависит от его химической при-
роды, заряд ткани обусловлен одновременно изоэлектрической точ-
кой протеина и pH раствора, в котором он находится. Вопрос, в
каком отношении находятся изоэлектрические точки фиксирован-
ных тканей к изоэлектрическим точкам нефиксированных и живых
тканей, по-видимому, решается в том смысле, что такие индиффе-
рентные фиксаторы, как спирт, вряд ли могут вызвать значитель-
ные сдвиги изоэлектрической точки; во всяком случае мало веро-
ятно, что относительное положение изоэлектрических
точек разных тканей должно было бы быть значительно изменено.
Подводя итоги основным современным теориям гистологи-
ческого окрашивания, мы приходим к выводу, что исследователь
не должен стоять перед альтернативой выбора — химической
или физической теории окраски. И то, и другое направление мо-
жет принести свою пользу. Как мы это видели, в защиту каждой
теории имеется достаточное количество серьезных аргументов.
Нам кажется, что каждая из этих теорий, взятая изолированно,
не точна. Гораздо правильнее рассматривать окрашивание как
весьма сложный процесс, в котором играют роль как физические,
так и химические факторы.
Результат окраски зависит
от сочетания свойств красителя
и протоплазмы
Свойства красителя:
Электрический заряд.
Размер частиц красителя.
Присутствие групп, дающих
соединение с белками.
Способность к восстановлению
или окислению.
Поверхностное натяжение.
Вязкость.
Растворимость.
Чувствительность к pH.
Свойства пр ото пл а з-
м ы:
Изоэлектрические точки бел-
ков.
Субмикроскопическая плот-
ность.
Способность образовывать с
красителем лабильные или
более прочные соединения.
Концентрация солей, липидов,
групп СООН, NH2 и т. д.
Способность восстанавливать
или окислять краситель.
Проницаемость.
В каждом конкретном случае (с учетом как особенностей кра-
сителя, так и субстрата) могут превалировать то химические, то
физические факторы. Один из важнейших факторов, определяю-
щих характер процесса окрашивания, — это коллоидные свойства
субстрата и красителей. Исходя из этого положения, можно вы-
двинуть следующую рабочую гипотезу. Все субстраты имеют кол-
185
лоидный характер, но одни из них электролитически инертны
(агар, целлюлоза), другие электролитически активны (желатина,
альбумин, нуклеин и т. д.). Все красители электролитически ак-
тивны, но одни из них находятся в состоянии молекулярного раст-
ворения (метиловый зеленый, трипафлавин, ауранция), другие
же представляют собой коллоидные растворы (пироловый синий
и др.). Таким образом, процесс окрашивания будет зависеть от
комбинации этих двух факторов. Основываясь на этих соображе-
ниях, можно дать следующую таблицу:
I. Субстрат электролитически инактив- а) краситель не коллоидальный—окра-
ный шивание отсутствует;
б) краситель коллоидальный — окра-
шивание «коллоидального типа»;
II. Субстрат электролитически актив- а) краситель не коллоидальный — ок-
ный рашивание «электропсляриого ти-
па»;
б) кра ситель коллоидальный —окра-
шивание «смешанного типа».
Эта схема может служить рабочей гипотезой для дальнейших
исследований по теории гистологического окрашивания.
ОБЩИЕ МЕТОДЫ ОКРАШИВАНИЯ
В микроскопической технике для окрашивания применяют
как различные синтетические красители, так и ряд натуральных
красителей, например, гематоксилин, кармин, орсеин, шафран
и т. д.
В этом разделе приводятся общие методы окрашивания, т. е.
методы, имеющие широкое и разнообразное применение в микро-
скопической технике; более специальные методы окрашивания
даны в соответствующих разделах, посвященных специальным
вопросам зоологии, эмбриологии, цитологии и гистологии.
Приступая к изучению окрасок, надо помнить, что:
1) нет универсальных методов окраски, одинаково пригодных
во всех случаях и для всех объектов;
2) для каждого объекта, с учетом целей и задач исследования,
надо подобрать свой наиболее подходящий метод окраски, если
на то нет специальных указаний в литературе;
3) выбор метода окрашивания должен соответствовать пред-
шествующей обработке объекта (фиксация, заливка и т. д.);
4) удача окраски по тому или иному способу зависит в высо-
кой степени от качества примененных красителей;
5) надо помнить, что свойства одноименных красителей, из-
готовленных на разных заводах, не всегда одинаковы; поэтому
многие очень хорошие методы удаются полностьютоль-
копри условии применения красителей того
же происхождения, как и у автора, описавше-
го метод;
1-86
6) вопрос о стандартизации красителей, применяемых в мик-
ротехнике, к сожалению, остается еще не разрешенным; учиты-
вая все вышеизложенное, каждый микроскопист должен сочетать
в себе умение точно воспроизводить оригинальный метод того или
другого автора и варьировать те или иные детали метода.
Окрашивание кармином
Кармин—один из самых старинных красителей, применяемых
в микроскопии. Он представляет собой экстракт кошенили (пара-
зитических Hemlptera — Coccus cacti) и встречается только в жи-
ровом теле и яичном желтке самок этих насекомых.
Кармин является незаменимым красителем для тотального
окрашивания простейших, мелких многоклеточных организмов,
эмбрионов, а также самых различных объектов, при изучении их
микроскопической анатомии. Дает отличное четкое окрашивание
ядер.
Спиртовый борный кармин Г р е н а х е р а. Один
из лучших красителей для тотальных препаратов. Отличные ре-
зультаты дает при окраске простейших, гидроидов, мелких червей
и т. д. Ядра окрашиваются четко и элективно. После фиксации ос-
миевыми фиксаторами окраска не удается. Для приготовления
красителя 2—3 г кармина растворяют в 100 слг3 4-процентного вод-
ного раствора буры. Раствор осторожно кипятят в течение 30 мин.
(лучше па водяной бане), затем добавляют равный объем 70-гра-
дусного спирта и через 24 часа фильтруют. Объекты красят 1 —
24 часа, затем, не споласкивая, переносят их для дифференциров-
ки в подкисленный 70-градусный спирт (5 капель соляной
кислоты на 100 см? спирта). Дифференцируют до четкого выяв-
ления ярко-красных ядер на фоне бледно-розовой плазмы. Плаз-
му можно докрасить 0,1-процентным раствором лионского синего
или светлым зеленым. Затем объект проводят через спирты и
ксилол и заключают в бальзам.
Спиртовым борным кармином можно красить объекты до за-
ливки в парафин. Продолжительность окраски—1—3 дня, диф-
ференцируют в подкисленном 70-градусном спирте также в тече-
ние 1—3 дней, пока от объекта не перестанут отходить облачки
красителя. Промывают в чистом 70-градусном спирте и заливают
в парафин или целлоидин обычным образом.
После тотальной окраски объекта спиртовым борным кармин-
ном срезы можно красить по методу Маллори, исключив кислый
фуксин.
Желез о-к васцовый кармин Голланда. Метод да-
ет хорошие результаты как при окраске тотальных объектов, так
и при окраске срезов.
Для приготовления красителя в фарфоровую чашку наливают
5 ел3 соляной кислоты, прибавляют 14 г растертого в порошок
187
кармина, размешивают и оставляют иа 24 часа, затем добавляют
250 см3 дистиллированной воды и кипятят 30 минут. После фильт-
рации доливают дистиллированной воды до 180 см3 и прибавляют
75-градусного спирта до 300 см3.
Срезы красят 2—24 часа, быстро споласкивают 30-градусным
спиртом, затем дистиллированной водой н дифференцируют в
3-процентных железных квасцах, в которых срезы быстро черне-
ют. Дифференцировка идет медленно. Объект переносят непосред-
ственно в 70-градусный спирт. Плазму можно докрасить 0,1-про-
центным раствором оранжа G или светлого зеленого (в 70-градус-
ном спирте) и затем срез обычным способом заключают в баль-
зам.
Уксуснокислый к а р м и н см. стр. 308—309.
* Квасцовый кармин Г ренахера. Дает очень электив-
ную окраску ядер, но плохо проникает и пригоден только для не-
больших н легко пропитываемых объектов. Для приготовления
красителя могут быть использованы как калийные, так и хромо-
вые квасцы.
Для приготовления кармина с калийными квасцами 1 г карми-
на и 4 г калийных квасцов растворяют в 100 е.;г! воды, осторожно
кипятят — 20 минут, дают остыть н фильтруют. К раствору добав-
ляют кристаллик тимола. Красят 2—24 часа. Перекрашивания
обычно не наступает, но если нужно, то дифференцируют подкис-
ленным 70-градуспым спиртом. Плазму можно докрасить лион-
ским синим или светлым зеленым. Проведя через спирты, объект
обычным образом заключают в бальзам.
Кармин Фига с хромовыми квасцами. Дает
элективное темно-синее окрашивание ядер. Хорошо применим для
окраски срезов. Обычно перекрашивания не наступает н нет необ-
ходимости в дифференцировке. Для приготовления красителя в
100 см3 горячей дистиллированной воды растворяют 6 г хромовых
квасцов, добавляют 1 г кармина, кипятятД5 минут н’по охлажде-
ния фильтруют. Раствор хорошо сохраняется. Срез^т красят от
получаса до 24 часов, хорошо промывают дистиллнров'анной водой
и обычным образом заключают в бальзам. \
- Окраска кармином по Блажнну.' Применяется для
окраски трематод и цестод н дает исключительно четкие картины
нх анатомического строения на тотальных препаратах. Объект
окрашивают без предварительной фиксации. Трематод н цестод
мацерируют в воде в течение 3—4 дней (меняя воду). Летом, при
высокой температуре, для мацерация достаточно одного дня. Объ-
ект переносят в краситель (0,3 г кармина растворяют в 100 см3
30-процентной молочной кислоты), основательно промывают во-
дой н помещают в раствор полуторахлористого железа (к 100 см'
воды добавляют 3 капли liquor ferri sesquichlcrati н 2 ка .и
1-процентной карболовой кислоты) на 16—24 часа. Окраска ста-
новится коричнево-черной. Промывают в воде. Более мелкие объ-
188
екты обычным способом заключают в бальзам, крупные членики
цестод предварительно высушивают на предметном стекле и затем
заливают бальзамом.
Борный кармин с осмиевой кислотой. Рекомен-
дуется для окраски паренхиматозных животных; особенно хоро-
шие результаты он дает на пиявках. Объекты фиксируют сулемой,
смесью Жильсона и т. п. (не осмиевыми фиксаторами), тотально
•окрашивают спиртовым борным кармином (’/а часа—1 час), диф-
ференцируют подкисленным спиртом и промывают в воде. Затем
объект помещают в темноте на 24 часа в 'h—’/а-процентный ра-
створ осмиевой кислоты, быстро обмывают водой и переносят на
12—24 часа в древесный уксус (в темноте), затем сутки промы-
вают в воде и заливают в парафин обычным образом. Срезы ни-
чем больше не подкрашивают. Получается очень четкая гистологи-
ческая дифференцировка. Ядра красные, соединительнотканные
элементы — буроватые и коричневые.
Окрашивание гематоксилином
Гематоксилин — экстракт кампешевого дерева. Он сам не яв-
ляется красителем, но, легко окисляясь, превращается в сильно
красяший гематеин, который в свою очередь дает различные про-
дукты окисления, не применимые для крашения. Все рецепты при-
готовления гематоксилина для окрашивания препаратов имеют
своей целью превращение гематоксилина в гематеин. Но ни гема-
токсилин, ни гематеин не способны давать окрашивание без про-
трав, с которыми они образуют солеобразные соединения — лаки.
В качестве протрав используют соли алюминия, железа, меди,
хрома, молибдена и ванадия.
Приготовленные растворы гематоксилина должны в течение
некоторого времени (примерно 2—3 недели) «созревать», т. е.
должно произойти окисление гематоксилина в гематеин. Прибав-
ляя к растворам сильные окислители (иодноватокислый калий,
перманганат или перекись водорода и т. п.), можно этот процесс
значительно ускорить.
В повседневной практике гистологических лабораторий исполь-
зуется ряд рецептов приготовления гематоксилина, которые мы
здесь приводим.
• Квасцовый гематоксилин Майера. Краситель
применяется главным образом для окраски целых кусочков ткани,
но может применяться и для окраски срезов.
Приготовляют краситель следующим образом: в литре дистил-
лированной воды растворяют 1 г гематоксилина, 0,2 г иодновато-
кислого натрия (NaJO3) и 50 г калийных квасцов. Затем добавля-
ют 50 г хлоралгидрата и 1 г кристаллической лимонной кислоты.
Раствор годен для немедленного употребления и долгое время
хорошо сохраняется. Кусочки тканей красят в течение 24—48 ча-
189
сов, затем 2—3 часа промывают в проточной воде. Срезы окраши-
вают 5—10 минут, после чего 10 минут промывают в проточной
воде. Ядра и хрящ окрашивают в синий цвет. Другие ткани оста-
ются бесцветными или окрашиваются в бледно-голубой цвет. Если
срезы перекрасились, то их можно дифференцировать несколько
секунд 0,1-процентной соляной кислотой, контролируя под микро-
скопом, после чего хорошо промыть проточной водой.
Этим красителем рекомендуется красить прогрессивно,
т. е. не перекрашивать препарата, а время от времени контролиро-
вать окраску под микроскопом и прерывать окрашивание в нуж-
ный момент.
;Квасцовый гематоксилин по Эрлиху. Для при-
готовления красителя 2 г гематоксилина растворяют в 100 см3
96-градусного спирта и добавляют 100 см3 воды, 100 см3 химиче-
ски чистого глицерина, 3 г калийных квасцов и 10 см3 уксусной
кислоты.
Краситель должен «созревать» примерно 14 дней. Раствор со-
храняет свою красящую силу долгое время. Если вместо гемато-
ксилина взять 0,25—0,5 г гематина, то краситель пригоден к упот-
реблению тотчас же после изготовления. Окрашивание производят
так же, как и гематоксилином Майера. После окрашивания хоро-
шо промывают проточной водой — срезы должны интенсивно по-
синеть. Ядра окрашиваются в темно-синий цвет.
. Квасцовый гематоксилин по Караччи. Гемато-
ксилина — 0,5 г, калийных квасцов — 25 г, йодноватокислого ка-
лия KJO3 — 0,01 г, глицерина—100 см3, дистиллированной во-
ды — 400 см3.
Гематоксилин дает отличное, очень интенсивное окрашивание
ядер на срезах. Способ окрашивания т^т же, что и гематоксили-
ном Майера. Обычно красят прогрессивно, но можно также пере-
крашивать и дифференцировать подкисленным спиртом.
. Квасцовый гематоксилин по Бемеру. 1 г гема-
токсилина растворяют в 10 см3 абсолютного спирта и вливают в
200 см3 10-пропентного раствора калийных квасцов (квасцы раст-
воряют при нагревании, охлаждают и фильтруют). Краситель на
несколько недель оставляют на' свету в широкогорлой открытой
банке для «созревания».
Красят 3—5 минут, в зависимости от зрелости гематоксилина,
промывают водопроводной водой, в которую можно прибавить не-
сколько капель нашатырного спирта. Через несколько минут окра-
ска среза из красно-фиолетовой станет интенсивно синей. В ре-
зультате ядра будут окрашены в синий цвет. Можно дифференци-
ровать 1-процентной соляной кислотой.
- Квасцовый гематоксилин по Делафильду..
Растворяют 4 г гематоксилина в 25 см3 абсолютного или 96-гра-
дусного спирта. Отдельно приготовляют насыщенный (приблизи-
тельно 14-процентный) раствор аммиачных квасцов. Постепенно
вливают гематоксилин в квасцы. Оставляют 3—4 дня стоять на
190
свету в открытой банке (прикрыть марлей от пыли). После этого
фильтруют и добавляют 100 см3 глицерина и 100 см3 метилового
спирта. Через несколько дней вновь фильтруют.
Для окрашивания основной раствор разбавляют дистиллиро-
ванной водой. При разбавлении в 3—4 раза время окраски изме-
ряется несколькими минутами; часто основной раствор разводят
в 20—50 раз и красят 12—24 часа. Если препарат перекрашен,,
можно его дифференцировать в 2-процентном солянокислом 70-
градусном спирте. Можно красить и прогрессивно. Для этого ос-
новной раствор красителя разводят в двести раз. После окраски
и дифференцировки препарат длительно промывают проточной,
водой, в которой краситель синеет.
В результате элективно окрашиваются ядра в синий цвет, во-
лютин (у простейших) —в красно-буро-фиолетовый.
Железный гематоксилин. В литературе приводится
очень много методов окраски с помощью железных лаков гемато-
ксилина. Все эти методы применяются для окраски срезов или
мазков.
При окраске по методу Гейденгайна приготовляют
два раствора.
А. Протрава: приготовляют 3-процентный водный раствор
железных квасцов. Пригодны только светло-фиолетовые кристал-
лы; разложившиеся буровато-желтые крошащиеся кристаллы упо-
треблять не следует. Кристаллы, покрытые буровато-желтым по-
рошком, следует обмыть дистиллированной водой.
Б. Краситель: растворяют 0,5 г гематоксилина в 10 см3
96-градусного спирта и затем добавляют 90 см3 дистиллированной
воды; раствор должен созревать в течение месяца; перед употреб-
лением его разводят пополам дистиллированной водой. Раствор
сохраняет долгое время свои красящие свойства.
Можно пользоваться и свежеприготовленным раствором. Тогда
краситель дает чистые голубовато-серые оттенки. Чем раствор
старее, тем более черные тона он дает, и препарат медленнее диф-
ференцируется. Наконец, наиболее старые и окисленные растворы
вызывают неприятный рыжий топ окраски и практически уже не-
пригодны.
Мо5кно использовать следующий способ быстрого получения
«созревшего» раствора гематоксилина; при кипячении растворяют
1 г гематоксилина в 95 см3 дистиллированной воды, после чего до-
бавляют 5 см3 жидкой карболовой кислоты.
Для тех же целей Г. В. Эпштейн рекомендует к каждым 100 см3
свежеприготовленного красителя прибавлять 1 каплю г'/а-про-
центного раствора квасцов. Раствор долго сохраняет свои крася-
щие свойства. При появлении осадка жидкость следует фильтро-
вать.
Окрашивание препаратов производят по следующей схеме.
1) Срезы протравляют в 3-процентных железных квасцах —
12—24 часа; 2) споласкивают дистиллированной водой, 3) окра-
191
шивают раствором гематоксилина — 12—24 часа; 4) споласкивают
дистиллированной водой; 5) дифференцируют 3-процентными же-
лезными квасцами (или лучше 1-процентным раствором), контро-
лируя под микроскопом; 6) промывают проточной водой — 15—60
минут; 7) обезвоживают в спиртах и, проведя через ксилол, заклю-
чают в бальзам или предварительно докрашивают в течение 3—
10 минут 0,1-процентным водным раствором эозина, кислого фук-
сина или светлого зеленого и затем обезвоживают, как сказало в
п. 7.
Процесс протравления и окраски можно значительно ускорить
(1—2 часа), если проводить его в термостате при температуре
45—50°.
При правильной дифференцировке зерна хроматина, ядрышки,
различные гранулы, центросомы, фибриллы и т. п. окрашиваются
в черный цвет. Так как раскрашивание различных элементов идет
с различной скоростью, то при известном навыке исследователь,
пользуясь этим обстоятельством, может по желанию выявить нуж-
ные структуры. Скорость раскрашивания в значительной мере обу-
словливается толщиной срезов, характером фиксации, физико-хи-
мическими свойствами клеток и т. д.
При изучении препаратов, окрашенных железным гематоксили-
ном, надо помнить, что самые разнородные элементы клеток и тка-
ней могут окрашиваться одинаковым образом.
При должной осторожности и критическом отношении желез-
ный гематоксилин является в руках исследователя одним из основ-
ных методов гистологического и цитологического исследования.
Хорошие результаты этот метод дает также в применении к изу-
чению простейших как на срезах, так и в мазках.
А. Г. Гурвич рекомендует следующий способ быстрой окраски
железным гематоксилином. Срезы, освобожденные от парафина,
доводят до воды, затем на предметное стекло наливают 3—4-про-
центный раствор железоаммиачных квасцов и нагревают над пла-
менем до появления паров, споласкивают в дистиллированной во-
де, наливают на стекло гематоксилин и подогревают до появления
паров (если раствор гематоксилина не старый — сполоснуть ди-
стиллированной водой, вновь налить краску и подогреть), спола-
скивают в дистиллированной воде и, как обычно, дифференцируют
в Р/з—2-процентном растворе железоаммиачных квасцов.
Л. Я. Бляхер указывает, что этим быстрым методом можно по-
лучить такие же результаты, как и оригинальным.
Можно дифференцировать не железными квасцами, а, сполос-
нув окрашенные срезы 96-градусным спиртом, раскрашивать их
следующей смесью: насыщенного раствора пикриновой кислоты в
96-градусном спирте—2 части, спирта 96-градус.ного—1 часть.
Дифференцировка идет медленно. Метод дает хорошие ре-
зультаты на гистологических и патогистологических объектах.
После дифференцировки хорошо промывают водой и затем зак-
лючают в бальзам, как обычно. После окраски объекта железным
192
гематоксилином докрашивать его кислыми красителями не обяза-
тельно, и во многих случаях такая докраска только мешает чет-
кости и ясности препарата. Но если надо особо выявить плазма-
тические или волокнистые структуры, то препарат после промывки
его проточной водой докрашивают в течение 3—5—10 минут 0,1-
процентным водным раствором эозина, кислого фуксина, оранж G
пли светлого зеленого, после чего споласкивают 70-градусным
спиртом и затем обычным образом заключают в бальзам.
В нашей лаборатории широко пользуются железным гемато-
ксилином по методу Г. Ясвоина.
Железный гематоксилин по Ясвоину. Этот
способ отличается простотой и дает в течение нескольких минут
элективную окраску ядер; его особенно следует рекомендовать
для окраски клеток соединительной ткани.
Приготовляют 2 раствора: а) 1 г гематоксилина растворяют в
10 см3 96-градусного спирта, приливают 90 см3 дистиллированной
воды и оставляют до созревания (раствор должен приобрести крас-
ный цвет), б) приготовляют 6-процентный раствор железоаммиач-
ных квасцов. Оба раствора смешивают в часовом стекле в таком
соотношении, чтобы неизбежно образующийся осадок выпадал бы
не раньше, чем через минуты, т. е. через срок, достаточный для
окрашивания препарата. Если осадок выпадает через более дли-
тельный срок, то препарат будет окрашен недостаточно контраст-
но. Примерное соотношение (в зависимости от зрелости гематок-
силина): к 5 каплям квасцов прибавляют (встряхивая) 10—12 ка-
пель гематоксилина'. Следует гематоксилин приливать к квасцам,
а не наоборот. Сделав 2—3 пробы, нетрудно установить правиль-
ное соотношение для раствора гематоксилина данной зрелости.
Приготовленный краситель на несколько секунд наливают на пре-
парат и сразу же после образования осадка (краситель с препа-
рата не сливать, иначе осадок плотно пристанет к срезам) препа-
рат поливают большим количеством проточной воды, продолжая
его промывать в течение 15—30 минут.
Недокрашенный препарат можно докрасить после 10—15-ми-
нутной промывки в дистиллированной воде; перекрашенный —
можно дифференцировать 20-процептпым жслезоаммиачными
квасцами, а затем основательно промыть и обычным образом за-
ключить в бальзам.
Железный гематоксилин по Вейгерту. Этот
метод характеризуется прогрессивным характером окрашивания и
быстротой самого процесса: препарат не перекрашивается и не
нуждается в дифференцировке. Метод дает хорошие результаты
для гистологических целей, по для тонкой цитологии метод Гей-
денгайна лучше.
Приготовляют два раствора.
А. Гематоксилина - 1 г, 96-градусного спирта — 100 см3.
Раствор гематоксилина должен созревать на свету примерно около
месяца.
I? Микроскопическая техника
193
Б. Liquor ferri sesqnichlorati (полуторахлори-
стое железо)—4 см3, соляной кислоты (25%) — 1 см3, дистиллиро-
ванной воды — 95 см3.
Оба раствора смешивают в равных частях непосредственно
перед окрашиванием (смесь скоро портится!). Окрашивают от 2
до 20 минут в зависимости от характера материела, затем промы-
вают проточной водой.
Обычно гематоксилин Вейнерта комбинируют с последующей
докраской по Ван-Гизону.
Железный гематоксилин по Рего. Метод дает
особенно хорошие результаты при изучении митохондрий, по мо-
жет быть применен и для общих гистологических целей. Окраши-
вание получается и после формалиновой фиксации.
1) Срезы протравляют в 5-процентпых железных квасцах 24
часа; 2) промывают дистиллированной водой; 3) красят в течение
24—48 часов в гематоксилине: 10-процентного раствора гематок-
силина в 95-градусном спирте— 10 см3, глицерина— 10 см3, ди-
стиллированной воды — 80 см3; 4) споласкивают дистиллирован-
ной водой; 5) дифференцируют в 1-процентных железных квасцах,
хорошо промывают в проточной воде и обычным образом заклю-
чают в бальзам.
Фосфорновольфрамовый гематоксилин М ал-
ло р и. Этот метод был предложен специально для окраски ней-
роглии, ио может быть с успехом применен для самых различных
целей. Особо надо отметить многоиветность (полихромность) ок-
рашенных по этому методу препаратов.
Наилучшне результаты получаются на материале, фиксирован-
ном смесью Буэна или Гелли.
1) Срезы протравляют 3—24 часа в растворе Луголя; 2) от-
беливают их в 5-процентном 1 ипосульфите и хорошо промывают
водой; 3) красят 24 часа на холоду или 15 минут при 50: в следу-
ющей смеси; гематоксилина — 1 а, 10-процентной фосфорноволь-
фрамовой кислоты — 200 см3, перекиси водорода — 2 см3, дистил-
лированной воды — 900 см3; смесь годна к употреблению уже че-
рез 2—3 дня и может сохраняться несколько месяцев; 4) срезы
быстро промывают дистиллированной водой и, проведя через 96-
градусный, абсолютный спирт и ксилол, заключают в кедровое
масло.
Волокна нейроглии — черио-синие, протоплазма — голубая
или слегка фиолетовая, нервные волокна — розовые, коллаген —
пурпурный.
Триокси гематеин Ганзена часто дает четкое и
прочное окрашивание ядер. Окраска возможна после парафино-
вой и целлоидиновой заливки. Срезы из дистиллированной воды
помещают па 1—10 минут в гематоксилин (контролируя интен-
сивность окраски), споласкивают дистиллированной водой и про-
мывают 30 минут в проточной воде, после чего заключают в баль-
зам. В зависимости от времени окраски на препарате кроме ядер
194
могут окраситься гранулы, клеточные стенки, реснички, волокна и
т. д. При перекрашивании препарата его можно дифференциро-
вать 1-процентной уксусной кислотой.
Если необходима чисто ядериая окраска и протоплазма долж-
на остаться бесцветной, то к раствору гематоксилина прибавляют
серной кислоты (на 8 см? красителя 2 сл3 1-процентной серной
кислоты). Обычно окраску триоксигематеином комбинируют с до-
краской пикрофуксином (см. метод Ван-Гпзона, стр. 201).
Приготовление триокспгематеина. Готовят два раствора: 1) в
150 см? подогретой дистиллированной воды растворяют 10 г фио-
летовых кристаллов железных квасцов и 1,4 г сернокислого аммо-
ния; 2) в 75 см3 подогретой дистиллированной воды растворяют
1,6 г гематоксилина. После охлаждения наливают второй раствор
в фарфоровую чашку и к нему приливают, при непрерывном взбал-
тывании, первый раствор. Смесь сперва имеет коричневый цв^, а
затем — фиолетовый. Ес осторожно нагревают, кипятят 30—60)се-
кунд. осторожно взбалтывая, затем быстро охлаждают, помещая
чашку в холодную воду. Краситель хранят в банке йенского стек-
ла. Перед употреблением фильтруют.
Из новейших модификаций окраски гематоксилином заслужи-
вает внимания способ окраски гематоксили п-.х ромовы-
ми квасцами по Гомори (1941): в 100 см? дистиллиро-
ванной воды растворяют 1,5 г хромовых квасцов и 0,5 г гематокси-
лина, затем добавляют 0,1 слт' серной кислоты и 0,1 г двухромово-
кислого калия; раствор готов к употреблению через 2 дня.
Для получения контрастных и дифференцированных препара-
тов их после гематоксилиновых красителей докрашивают рядом
кислых красителей. Для этого употребляют 0.1—0,5-процентные
водные растворы эозина, кислого фуксина, оранжа G или светлого
зеленого. Продолжительность окрашивания 2—3 минуты. При
перекрашивании избыток красителя можно извлечь промыванием
в воде.
Наиболее часто употребляемый метод двойной окраски: квас-
цовый гематоксилин и эозин. При этом ядра и хрящ окрашиваются
в синий цвет, все остальное — в различные оттеики красного (см.
схему приготовления препарата, стр. 163).
Препарат, хорошо окрашенный гематоксилин-эозином, должен
иметь большое количество оттенков и в нем должны быть диффе-
ренцированно окрашены разные структуры. Ядра, — фиолетово-си-
ние, протоплазма — розово-красная, волокна соединительной тка-
ни, мыищы, промежуточное вещество костной ткани — розово-
красные, промежуточное вещество хряща — фиолетово-синее,
эритроциты—обычно оранжевые, слизь — синевато-фиолетовая.
Патологические включения (амилоид, коллоид, гиалин и т. д.) ок-
рашиваются в разные оттенки розового цвета. Базофильная про-
топлазма некоторых клеток окрашивается в различные оттенки
фиолетово-синего цвета. Однако для выявления базофилии этот
метод не годится.
13*
195
Основные анилиновые красители
Мы приводим здесь несколько наиболее удачных рецептов для
получения контрастных ядерных окрасок с помощью основных
анилиновых красителей1.
Метиловый зеленый дает четкое окрашивание ядерных
элементов. Растворяют 1 г красителя в 100 см3 дистиллированной
воды и добавляют 25 см3 абсолютного спирта. Срезы красят —
10 минут, споласкивают водой, дифференцируют 70-градусным
спиртом (1—2 минуты), проводят через абсолютный спирт (1 ми-
нута), ксилол и заключают в бальзам или кедровое масло.
Метиловый зеленый отлично окрашивает ядра в свежих, не
фиксированных кусочках ткани, в изолированных клетках или у
простейших. Для окраски к капле, где находятся клетки, прибав-
ляют подкисленный раствор метилового зеленого (0,1% метило-
вого зеленого в 1-процентной уксусной кислоте). В зеленый цвет,
кроме ядер, могут также окраситься некоторые включения или
секреты. Препараты не выдерживают проводки через спирты и их
заделывают в глицерин или желатину.
Метиловый зеленый входит в качестве составной части в ряд
полихромных методов окраски.
Сафранин особо пригоден для окраски ядер после фикса-
торов, содержащих хромовую и осмиевую кислоты. Не все марки
сафранина дают хорошее окрашивание.
Растворяют 10 г сафранина G экстра в 155 с/р 95-градусного
спирта и добавляют 145 см3 дистиллированной воды. Для окраски
берут 20 см3 такого основного раствора и смешивают с 80 см3 50-
градусного спирта. Срезы красят 2—24 часа, споласкивают в ди-
стиллированной воде, дифференцируют в абсолютном спирте (слег-
ка подкисленном 0,1% соляной кислоты), споласкивают абсолют-
ным спиртом и, проведя через ксилол, заключают в бальзам. Хро-
матин окрашивается в интенсивно красный цвет.
Можно рекомендовать более стабильный и быстро красящий
раствор сафранина: сафранина — 1 г, 90-градусного спирта —
100 см3. После растворения красителя к раствору добавляют ди-
стиллированной воды 100 см3 и формалина 2 см3.
1 Существует весьма простой способ, чтобы установить кислый или ос-
новной характер водного раствора какого-либо красителя. В качестве ин-
дикатора служит полоска фильтровальной бумаги, как известно, - всегда не-
сущей отрицательный заряд. Ее погружают в раствор красителя, который в
силу капиллярности впитывается бумагой. При этом вода н молекулы кислого
красителя, имеющие также отрицательный заряд, будут отталкиваться от
волокон фильтровальной бумаги и подниматься в полоске бумаги на одну
и ту же высоту. В противоположность этому молекулы основного красителя
(заряженного положительно), пробежав вместе с водой некоторый путь по
капиллярным пространствам между целлюлозными волокнами, притянутся к
ним и вследствие этого отстанут от воды, которая будет продолжать под-
ниматься в полоске фильтровальной бумаги в виде совершенно бесцветной
каемки
196
После окраски сафранином рекомендуется плазму окрашивать
0,5-процентным раствором светлого зеленого в 96-градусном спир-
те, который служит и для дифференцировки сафранина.
Т и о н и н дает элективное окрашивание ядер в синий цвет.
Слизь, основное вещество хряща, зерна тучных клеток и т. д. ок-
рашиваются тионином метахроматически. Для этой окраски луч-
шими фиксаторами являются: сулемовые смеси, смеси Буэна и
Флемминга, абсолютный спирт.
Раствор красителя: 1 часть насыщенного раствора тионина в
60-градусном спирте, 4 части 2-процентной карболовой воды.
Мазки и срезы окрашиваются в течение 5—20 минут. Их диф-
ференцируют слабой 0,1-процентной уксусной или борной кисло-
той и затем обычно заключают в бальзам.
Толуидиновый синий очень близок по своим свойст-
вам к тионину и также дает полихромное окрашивание. Ядра ок-
рашиваются в интенсивный синий цвет. Объект помещают в 1-про-
центный водный раствор красителя на 12—24 часа, но в большин-
стве случаев достаточно 20—30 минут.
Можно употреблять раствор красителя, подкисленный уксус-
ной кислотой (1 : 100).
Для многих целей (тигроидное вещество нервных клеток, клет-
ки крови и т. д.) хорошие результаты дает полихромный
толуидиновый синий: толуидинового синего — 1 г, угле-
кислого лития — 0,5 г, дистиллированной воды — 75 см2. После
растворения добавляют 20 г глицерина и 5 см3 96-градусного спир-
та.
Метиленовый синий употребляют для окраски ядер.
Приготовляют концентрированный водный раствор, к которому
через 1—2 дня добавляют равный объем 96-градусного спирта.
Для окраски 5 см3 красителя разводят в 100 см2 дистиллирован-
ной воды. Объект окрашивают 20—60 минут. Если препарат пе-
рекрашен, его дифференцируют в воде, подкисленной уксусной
кислотой.
Фуксин основной. Для приготовления карболового
фуксина по Ц и л ю смешивают 1 г фуксина основного, 10 см3
96-градусного спирта, 10 см3 5-процентной карболовой кислоты.
Срезы обычно докрашивают светлым зеленым.
Кислые анилиновые красители
Кислые анилиновые красители обычно употребляются для ок-
рашивания протоплазмы клеток. При этом более контрастно выяв-
ляются ядра и другие структуры, окрашенные основными краси-
телями, гематоксилином или кармином. Кислые красители окра-
шивают в большинстве случаев диффузно, создавая как бы фон
препарата. При этом кислый и основной красители подбирают та-
ким образом, чтобы они были достаточно контрастны по цвету
(например красный — зеленый, черный или синий — и розовый и
197
т. д.). Кислые красители можно растворять в воде или спирте.
Наиболее часто употребляются — ауранция, эозин, светлый зеле-
ный, оранж, кислый фуксин, пикриновая кислота и т. д.
Эозин дает диффузную окраску от ярко-красного до золо-
тисто-желтого цветов. Имеются различные марки эозина, несколь-
ко отличающиеся друг от друга по своим свойствам. Некоторые
марки эозина растворяются только в спирте (лучшие в 90-градус-
ном) другие — в воде. Обычно употребляются растворы от 0,1 до
1 %. Окраска срезов (после окраски ядер), в зависимости от кре-
пости раствора, продолжается от одной до нескольких минут. При
дальнейшей обработке препарата, окрашенного спиртовым раство-
ром эозина, надо иметь в виду, что этот краситель извлекается
спиртом, а водный раствор эозина — водой. Водный эозин легко
извлекается нз препарата щелочами, а водопроводная вода обыч-
но имеет слабо щелочную реакцию. Поэтому после окраски эози-
ном не следует промывать срезы водопроводной водой. Красить
эозином можно после всех фиксаторов, но лучше всего окраска
удается после обработки материала в смесях, содержащих хромо-
вые соли.
Ауранция, светлый зеленый, оранж, кислый
фуксин употребляются обычно для докраски препаратов в 0,5—
1-процентных водных растворах. При перекрашивании избыток
красителя легко удалить промывкой препарата в воде. Светлый
зеленый употребляется и в 1-процентном спиртовом (96-градус-
ном) растворе в комбинации с сафранином. Он служит и для диф-
ференцирования сафранина.
Кислый фуксин хорошо закрепляется в препарате абсолютным
спиртом.
Пикриновая кислота окрашивает протоплазму в неж-
ный желтый цвет и употребляется в слабых водных растворах (не-
сколько капель концентрированного водного раствора пикриновой
кислоты на 15—20 см1 дистиллированной воды). При перекраши-
вании препарата пикриновая кислота легко извлекается водопро-
водной водой и спиртом.
Все эти красители входят в сложные многокрасочные методы
окрашивания.
Сложные многокрасочные методы окрашивания
В этом разделе приводится ряд окрасок, имеющих широкое
и разнообразное применение как в гистологии, так и в цитологии.
В большинстве приведенных методов наряду с окраской ядра, до-
стигается не только четкое окрашивание плазмы, но и дифферен-
цировка различных тканей, клеточных включений, волокон и т. д.
Нельзя указать универсальный многокрасочный метод. Один и
тот же метод не дает и не может давать одинаково хороших ре-
зультатов на различных органах и тканях у разнообразных пред-
ставителей позвоночных и беспозвоночных. Приступая к работе
198
с новым объектом, необходимо эмпирически подобрать для него
наилучший метод окраски.
В этих случаях полезно несколько варьировать ранее известные
методы: время окраски и дифференцирования, способ предвари-
тельной обработки, характер фиксатора и т. д.
Метод В а н-Г и з о н а (модификация Гансена)
широко применяется для окраски гистологических препаратов,
имеющих целью общую ориентацию в строении изучаемой ткани
или органа.
1) Срезы из дистиллированной воды переносят в гематоксилин
Гансена, Бемера пли Эрлиха на такое время, чтобы срезы были
перекрашены (3—4 минуты, в зависимости от зрелости гематокси-
лина). или окрашивают 1 час в кармине с хромовытли квасцами.
2) Споласкивают дистиллированной водой и промывают 10 ми-
нут проточной водой, после чего окрашивают 5 минут в растворе
пикрофуксипа. Для приготовления этого красителя к- 100 сж3 на-
сыщенного водного раствора пикриновой кислоты прибавляют
5—7.5 см3 2-процентного раствора кислого фуксина п перед упот-
реблением к 60 см3 этой смеси добавляют 7 капель уксусной кис-
лоты.
4) Помещают препарат на 2—4 секунды в раствор: дистилли-
рованной воды — 60 см3, подкисленного раствора пикрофукецна —
2,5 см3.
Пикриновая кислота дифференцирует гематоксилин, и нужно
подобрать такое соотношение времени пребывания срезов в ге-
матоксилине и пикрофуксине, чтобы препарат был правильно
прокрашен.
5) Быстро осушают от излишней жидкости фильтровальной
бумагой п для извлечения пикриновой кислоты кладут препарат
на 1 минуту в 96-градусный спирт, после чего переносят препарат
в другой сосуд с 96-градусным спиртом также на 1—2 минуты,
затем в абсолютный спирт, ксилол, бальзам.
Результаты окраски: ядра (после гематоксилина) черно-корич-
невые, коллагеновые волокна — ярко-красные, мускулатура —
желтая.
Пикро индигокармин — фуксин по Г. И. Р о с к и-
и у. Метод дает дифференцированную окраску различных тка-
ней и может служить для общей ориентировки в гистологическом
препарате. 1) Срезы, освобожденные от парафина, проводят че-
рез нисходящий ряд спиртов, доводя до воды; 2) окрашивают в
пикронндигокармине (в 100 см3 насыщенного водного раствора
пикриновой кислоты растворяют 0,4 г индигокармина) — 10—30
минут; 3) не споласкивая, наносят на препарат пипеткой насы-
щенный водный раствор основного фуксина и нагревают на пла-
мени горелки до появления паров (срезы должны иметь темно-
красный цвет); 4) дифференцируют абсолютным спиртом до по-
.явления бледно-зеленой окраски срезов (если препарат вышел
199
слишком бледным, можно всю окраску повторить снова); 5) про-
ведя через ксилол, заключают в бальзам.
Ядра, хрящ, слизь имеют ярко-красный цвет, протоплазма —
серовато-зеленая, мышцы — желто-зеленые, эластические волок-
на — красновато-коричневые, коллагеновые волокна — ярко-голу-
бые.
Сафранин — п и к р о и н д и г о к а р м и н по 3. С. Кац-
нельсону. Фиксация хромовоуксусиой смесью (1-процентной
уксусной кислоты — 5 сл3, ледяной уксусной кислоты — 1 см3,
дистиллированной воды — 14 см3). Спиртовой раствор с-афранина
(2 г сафранина растворить в 60 см3 50-градусного спирта), нали-
вают на срезы на 1 минуту, промывают в двух порциях дистил-
лированной воды — 2—3 минуты, окрашивают пикронндигокар-
мнном — 5—10 минут (0,5 г индигокармина растворить в 150 см3
насышенного водного раствора пикриновой .кислоты), 1—2 мину-
ты промывают в дистиллированной воде, быстро (по несколько
секунд) проводят по спиртам, в которых срезы из буроватых дол-
жны стать зелеными.
В результате: ядра — интенсивно красные, мышцы — ярко-
зеленые, соединительная ткань — темно-зеленая с переходом в го-
лубой, эпителий — различных оттенков сине-зеленого цвета. В эти
цвета ткани окрашиваются после фиксации хромово-уксусной
смесью. После других фиксаторов ткани приобретают иные от-
тенки.
Трехцветнын метод Маллори употребляется для
дифференцирования окраски различных тканей, особенно соеди-
нительной ткани. Метод хорошо удается после сулемовых фикса-
торов. Срезы с объектов, зафиксированных формалином, спир-
том, смесью Буэна или Флемминга,— также можно успешно окра-
шивать по Маллори, если их предварительно перед окраской обра-
ботать в течение 15—60 минут смесью Ценкера, хорошо сполос-
нуть и затем красить, как указано ниже.
1) Красить 3 минуты в 0,1-процентном растворе кислого фук-
сШЙ; 2) сполоснуть водой и положить на 3—5 минут в 1-процент-
нук! фосфорномолибденовую кислоту; 4) сполоснуть водой и кра-
сить 2 минуты смесью: анилинового синего — 0,5 г, оранж G —
2 г, щавелевой кислоты — 2 г, дистиллированной воды — 100 елг3;
смесь нагревают до кипения и после охлаждения фильтруют:
4) сполоснуть водой, дифференцировать 90-градусным спиртом
(пока не останутся ярко-синими только коллагеновые волокна),
провести через абсолютный спирт, ксилол н заключить в бальзам.
Коллагеновые и ретикулярные волокна соединительной тка-
ни — темно-синие, слизь — голубая, эритроциты — оранжевые,
мускульная ткань от ярко-желтой до красноватой, нейроглия п
ганглиозные клетки—красно-фиолетовые, ядра — желто-корич-
невые или желто-красные.
Для улучшения эффекта окраски по способу Маллорн кислый
фуксин можно разводить в буферном растворе: кислого фукси-
200
на— 1 г, раствора'цитрата (по Серепсену) —40 ел3, N/10 соля-
ной кислоты — 60 см3, дистиллированной воды — 900 см3. Рас-
твор цитрата: 21 г кристаллической лимонной кислоты + 200 см3
1 N едкого натрия на 1 л раствора.
Метиловый синий — эозин по Манну. Этот метод
дает хорошие результаты при изучении топкой цитологии (отлич-
ная окраска ядрышек), особенно нервной системы, телец Негри,
а также при изучении строения простейших. Его можно использо-
вать в качестве хорошей докраски после окраски квасцовым гема-
токсилином. Применяется как для мазков, так и для срезов после
пикриновых или сулемовых фиксаторов.
1) Срезы доводятся до воды; 2) красить 5—24 часа в следую-
щей смеси: 1-процентного метилового синего — 35 см3, [-процент-
ного водного эозина — 45 см3, дистиллированной воды — 100 см3;
3) сполоснуть водой; обезвоживают в 100-градусном спирте, где
срезы принимают синий цвет; 4) дифференцируют в щелочном
абсолютном спирте, пока срезы не станут красными; 5) отмыва-
ют едкий натр в чистом абсолютном спирте; 6) переносят в под-
кисленную воду (4—5 капель уксусной кислоты па 60 сл3 воды)
на 2—3 минуты, где ядра должны опять принять синий оттенок;
7) проводят через абсолютный спирт, ксилол п заключают в баль-
зам.
Результат; ядрышки — красные, протоплазма — фиолетовая,
секреторные зерна — синие и красные, мышцы и соединительная
ткань — светло-розовые, эритроциты — красные.
Для приготовления щелочного абсолютного спирта смешива-
ют 10 см3 абсолютного спирта с 0,33 см3 30-процентного водного
раствора едкого натра. 10 капель этого раствора прибавляют
к 60 см3 абсолютного спирта.
Хорошие результаты дает следующий способ окраски: срезы
окрашивают смесью Манна в течение 12 часов и затем диффе-
ренцируют их слабым раствором оранжа в 70-градусном спирте,
после чего быстро обезвоживают в 100-градусиом спирте и, про-
ведя через ксилол, заключают в бальзам.
Трехцветный метод Массона. 1) Срезы (после
фиксаторов Ценкера или Буэна) помещают в 5-процентные же-
лезные квасцы на 24 часа (или на 30 минут в термостат при тем-
пературе 50°). 2) Красят в гематоксилине 24 часа (или 30 минут
при нагревании до 50)°. Гематоксилин (по Массону) готовят
следующим образом: гематоксилина — 1г, спирта 96-градусно-
го— 10 см3, глицерина— 10 г, дистиллированной воды — 80 см3.
Гематоксилин растворяют при нагревании в воде и затем прибав-
ляют спирт и глицерин. Гематоксилин должен «зреть» несколько
дней. 3) Споласкивают дистиллированной водой. 4) Дифференци-
руют раствором железных квасцов или лучше пикриновым спир-
том (к 2 частям насыщенного водного раствора пикриновой кисло-
ты прибавляют 1 часть 96-градусного спирта) до,получения элек-
тивной ядерной окраски. 5) Промывают проточной водой. 6) Окра-
201
шивают протоплазму в течение 5 минут в следующей смеси: кис-
лого фуксина — 1 а, уксусной кислоты — 1 с.ч’, дистиллированной
воды — 200 см3. 7) Споласкивают дистиллированной водой.
8) Дифференцируют в 1-процентной фосфориомолибденовой кис-
лоте — о минут. 9) Не споласкивая, красят, наливая насыщенный
в 2,5-процентной уксусной кислоте раствор анилинового синего на
стекло 2 минуты. 10) Споласкивают дистиллированной водой.
11) Дифференцируют в 1-процентпой уксусной кислоте для уда-
ления излишков анилинового синего 5—30 минут. Помещают в аб-
солютный спирт, подкисленный уксусной кислотой 1 : 1000.
12) Проводят через абсолютный спирт, ксилол и заключают в
бальзам.
В результате: ядра — черные, протоплазма — красноватая,
коллагеновые волокна — синие, нейроглиальные волокна — крас-
ные.
Этот метод один из лучших для выявления коллагена, а также
различных протоплазматических структур.
Окраска по Бенда — Икеда. В пашей лаборатории
пользуются следующей прописью: 1
1) Срезы (с объектов, фиксированных смесями Флемминга,
Мевеса, Шампи, а также другими фиксаторами, содержащими
хромовую кислоту) помещают на 6—24 часа в 4-процептные же-
лезные квасцы. 2) Споласкивают дистиллированной водой п пе-
реносят в раствор ализарин-сернокислого натрия (1 см3 насыщен-
ного раствора ализарин-сернокислого натрия в абсолютном
спирте приливают к 80 см3 дистиллированной воды; раствор дол-
жен быть янтарно-желтым) иа 6—24 часа. 3) Тщательно промы-
вают в проточной воде в продолжение 1—2 часов, до ясного по-
краснения срезов. 4) Окрашивают в 0,1-процентном толуидино-
вом синем 24—48 часов. 5) Споласкивают дистиллированной во-
дой. 6) Дифференцируют в 70-градусном спирте с 1-процентной
уксусной кислотой 20—30 секунд. 7) Помещают в 96-градусный
спирт на 5 минут. 8) Дифференцируют в креозоте, контролируя
под микроскопом. 9) Смывают креозот 96-градусным спиртом.
10) Проводят через абсолютный спирт, ксилол и заключают
в бальзам.
Ядра и протоплазма — красновато-коричневые, митохонд-
рии — темно-синие. Метод дает также отличные результаты при
изучении опорных и сократимых фибрилл, плазматических струк-
тур. Интересные результаты получаются, если перед окраской
объект обработать по методу Колачева — Насонова (стр. 323);
тогда на срезах можно наблюдать аппарат Гольджи, митохонд-
рип. а также различные фибриллярные структуры.
Метиловый зеленый — пи ронин по Уина. При-
готовляют смесь: метилового зеленого —0.15 а, пиропииа —
0,25 г, 96-градусиого спирта — 2,5 см3, глицерина — 20 см3. До-
бавляют 0,5% карболовой кислоты до 100 см3.
202
Красят 20 минут, быстро споласкивают водой и дифференци-
руют абсолютным спиртом.
Хроматин — зеленый, все остальные базофильные элементы
окрашиваются в различные оттенки красного.
Окраска по Д о м и и и ч и. 1) Срезы окрашивают 20—
30 минут в смеси: эозина — 0,5 г. оранж G — 0,6 г, дистиллиро-
ванной воды— 100 см3; 2) споласкивают в 60-градусном спирте;
3) красят 1—2 минуты в 0,5-процентном толуидиновом синем;
4) 96-градусный спирт до исчезновения облачков красителя;
5) проводят через абсолютный спирт, ксилол и заключают в баль-
зам.
Метод дает хорошие препараты для общей гистологической
ориентировки, в которых четко выделяются ядерные структуры,
ядрышки. Наилучшими фиксаторами являются смеси Буэна, Цен-
кера, Карну а.
Окраска по Б. В. Кедр о веко му дает элективное
окрашивание гистологических и цитологических объектов.
1) Объект красят 20—30 минут в свежеприготовленной сме-
си: к 15 см 0.6-процентпого эозина прибавляют 0.5—1 см3 1-про-
центной фосфорпомолибденсвой кислоты (прибавлять в кипящий
раствор, затем дать остыть) и 15 см5 1,2-процентного водного
раствора оранж G; 2) споласкивают водой; 3) красят 1-процент-
ным водным раствором толуидинового синего '/г—1 7s минуты;
4) споласкивают водой; 5) дифференцируют, контролируя под
микроскопом в 70-градусном и 96-градусцом спирте; 6) проводят
через абсолютный спирт, ксилол, заключают в бальзам. Для
некоторых марок эозина лучше прибавлять всего несколько ка-
пель фосфорномолибденогой кислоты. Общее правило: кислоту
следует прибавлять до появления стойкого помутнения эозина.
Окраска по Мел л ей дор фу применяется для реше-
ния различных цитологических вопросов, особенно при изучении
ядрышка.
1) Окрасить объект триоксигематеином—5 минут (несколько
перекрасить); 2) сполоснуть в дистиллированной воде и промыть
в проточной; 3) окрасить 1-процентным раствором эозина (на
100 см3 добавляют 10 капель уксусной кислоты)—20 минут;
4) сполоснуть дистиллированной водой; 5) поместить в 2-процент-
ный раствор фосфориомодибденовой кислоты— 10 секунд; 6) спо-
лоснуть дистиллированной водой и окрасить в 1-процентном рас-
творе метилового синего 1—2 минуты; 7) сполоснуть дистилли-
рованной водой и перенести в 96-градусный спирт, где извлекается
избыток красителя, затем провести через 100-градусный спирт,
ксилол и заключить в бальзам.
Паральдегид-фуксин по Го мори (1950) приме-
няется для селективной окраски эластических волокон (окраши-
вание наступает через 5 минут). Кроме того, этим методом изби-
рательно окрашиваются (15—30 минут) р-клетки поджелудочной
железы, p-гранулы питуитарной железы (30—120 минут), зерна
203
тучных клеток (5—10 минут). Фиксируют формалином или жид-
костью Буэна; заливка в парафин. Срезы доводят до воды и
обрабатывают жидкостью Люголя (10—60 минут), удаляют иод
в 5-процентном растворе тиосульфата (1 минута), после чего
окрашивают паральдегид-фуксипом (от 2 до 120 минут, в зави-
симости от целей окраски), промывают в нескольких порциях
70-градусного спирта, докрашивают, по желанию, гематоксилин-
эозшюм по Маллори, или азокармпном по Гейденгайну, заменив в
этих методах анилиновый синий светлым зеленым, обезвоживают
в спиртах, ксилол, бальзам. Приготовление красителя: к 100 мл
0,5-процептпого раствора основного фуксина (на 70-градусном
спирте) добавляют 1 мл концентрированной НС1 и 1 мл параль-
дегида; краситель годен к употреблению, примерно, через 24 ча-
са, когда раствор становится темно-фиолетовым.
Нейтральные красители
В нейтральных красителях основной краситель находится нс
в смеси, а в соединении с кислым красителем. Нейтральные кра-
сители широко применяются в цитологии, гистологии и особенно
в гематологии для дифференцированного выявления базофиль-
ных, оксифильных и нейтрофильных тканевых элементов.
Большое значение в современной микроскопической технике
имеют эозннаты метиленового синего, толуидинового синего, ме-
тилен-азура и метиленового фиолетового. Исходным методом ис-
пользования эозинатов является окраска по Романовскому (смесь
в определенных пропорциях эозинатов метнлен-азура, эозинатов
метиленового фиолетового и метиленового синего); методы Гим-
за, папхром Паппенгейма и папоптический метод Папенгейма и
многие другие являются лишь модификациями этого метода. Ме-
тод Романовского и его модификации находят самое широкое
применение в микроскопической технике. Теория процесса окра-
шивания по методу Романовского была предметом специального
исследования Ш. Д. Мошковского. (Изложение метода Романов-
ского см. стр. 347).
Окраска азур-эозином по Максимову удается
лучше всего после фиксации смесью Максимова, а также по Гел-
ли, Ценкеру или после спирт-формола.
Готовят два основных раствора, которые хорошо сохраняются
в склянках йенского стекла.
Раствор I: 0,1-процентный эозин (растворимый в воде,
желтоватый) в дистиллированной воде.
Раствор II: 0,1 -процентный азур II в дистиллированной
воде.
Непосредственно перед окрашиванием 10 см3 первого раствора
смешивают с 100 см3 дистиллированной воды и затем к нему до-
бавляют, осторожно взбалтывая, 10 см3 второго раствора.
1) Срезы доводят до дистиллированной воды и помещают на
204
6 -24 часа в краситель (он не должен давать осадка); 2) диффе-
ренцируют в 96-градусном спирте до тех пор, пока не наступит
розовое окрашивание эритроцитов и коллагеновых волокон сое-
динительной ткани; 3) обезвоживают в абсолютном спирте 30—
60 секунд и, проведя через карбол-ксилол, заключают в ней-
тральный бальзам или кедровое масло.
Протоплазма — голубая с различными оттенками, хрома-
тин — темно-синий, гемоглобин — светло-красный, оксифильные
гранулы — ярко-красные.
Метод имеет широкое применение для дифференциации окси-
фильных и базофильных элементов различных тканей.
При работе с эозином неизученной марки, указанные отноше-
ния эозина и азура II надо подобрать заново. Для этой цели при-
готовляют ряд смесей; растворов эозина и азура (разведение
0,1 %) • Из каждой смеси опускают по капле па фильтровальную
бумагу: пригодной считают смесь, в центре капли которой обра-
зуется заметный осадок темно-синего азура, а по его краю розо-
вая полоска эозина.
В растворе красителя не должен выпадать осадок сразу же
или вскоре после приготовления. Быстрое появление осадка ука-
зывает на то, что вода неудовлетворительного качества, н такая
смесь непригодна. Если осадок выпадает спустя продолжительное
время, то па успех окраски это не влияет.
Вода для приготовления красителя должна быть нейтральной.
Лучше пользоваться бидистиллированной водой или нейтрализо-
вать воду одной-двумя каплями слабого (1 : 1000) раствора дву-
углекислой соды.
Соотношение между эозином и азуром должно меняться в за-
висимости от фиксации материала, продолжительности и способа
его хранения, оно обычно должно эмпирически устанавливаться
при окраске срезов разных видов животных. Алфеева указывает,
что не все марки азура II обладают одинаковыми красящими
свойствами; лучшие сорта азура II в смеси с эозином дают на
поверхности раствора тонкую пленку и имеют слабый запах чес-
нока.
Окраска п и р и д и н-э о з и н-а з у р о м п о Алфеевой.
Метод Максимова дает превосходные, по непостоянные результаты
препараты при хранении иа свету быстро обесцвечиваются. Раз-
ные сорта эозина и азура надо брать в различных соотношениях.
Алфеева предложила модификацию метода Максимова, дающую
более постоянные результаты и большое разнообразие оттенков.
При фиксации по Максимову, Ценкеру, Гелли (можно при-
менять и формалин) объект следует заливать в целлоидин. Вайль
указывает, что можно заливать и в парафин. Наклеенные на стек-
аю и освобожденные от целлоидина срезы окрашивают следующим
образом; споласкивают дистиллированной водой, помещают в
0,25-процентный марганцевокислый калий на 15 минут, споласки-
вают дистиллированной водой, помещают в 5-процентную щаве-
205
левую кислоту на 5 минут, тщательно промывают дистиллирован-
ной водой, окрашивают в смеси: эозин желтоватый 1 ; 1000_
13 см3, азур II 1 : 1000 — 5 см3, дистиллированная вода—7 см'.
пиридин 6 капель —4—24 часа, быстро споласкивают в воде, диф-
ференцируют в подкисленной воде (1 капля уксусной кислоты
на 30 см3 дистиллированной воды), до появления розоватого от-
тенка срезов, споласкивают дистиллированной водой, помещают
в 96-градусный спирт до прекращения отхода от срезов излиш-
ков азура, быстро проводят через спирт — 96°, дважды сменяют
абсолютный спирт, проводят через чистый ксилол, заключают
в бальзам.
По Алфеевой, «введение пиридина в эозин-азур улучшает
этот метод, дает более верный и точный результат и большое
разнообразие оттенков окраски (розовый, оранжевый, малиновый,
зеленый, синий)», окраска лучше сохраняется.
Нейтральная окраска по Т в о р т у дает полихром-
ное окрашивание мазков и срезов,
«Эта одна из наиболее тонких и чувствительных окрасок», --
лишет Г. В. Эпштейн (1940), большой знаток этого метода —
«ее можно рекомендовать для решения различных цитологиче-
ских, гематологических и протозоологпческих вопросов. Базо-
фильные элементы ядер и хромосомы окрашиваются в интенсив-
но красный цвет. Некоторые базофильные компоненты плазмы
также окрашиваются в красный цвет. Оксифильные элементы
клеток окрашиваются в зеленый цвет. Бактерии в тканях элек-
тивно выявляются, окрашиваясь в ярко-красный цвет».
Для приготовления красителя смешивают равные части
1-процситных водных растворов нейтрального красного и свет-
лого зеленого; правильно составленная смесь должна давать иа
чистой фильтровальной бумаге коричневое пятно, лишенное крас-
ного или зеленого ободка. Это показывает, что нейтральный крас-
ный п светлый зеленый образовали нейтральную соль коричневого
цвета, нерастворимую в воде. Банку с красителем оставляют на
2—3 дня в термостате при температуре 37°, после чего воду сли-
вают, а осадок нейтрального красителя высушивают в термостате.
Мелко растертый порошок нейтрального красителя растворяют
в горячем глицерине (к 50 см3 химически чистого глицерина до-
бавляют 0,1 г красителя, присыпая его мелкими порциями и по-
степенно взбалтывая). При растворении красителя в глицерине
получается темно-фиолетовая жидкость. После охлаждения к ней
прибавляют отдельными порциями 50 см3 чистого метилового
спирта. Полученный раствор красителя может долго храниться.
Перед окрашиванием основной раствор разводят дистиллирован-
ной водой (1 :5). Окрашивают в течение 12 часов. Дифферен-
цируют 96-градусным спиртом и, как обычно, заключают в баль-
зам.
Краситель Творта можно изготовить и другим способом, сме-
206
шивая в равных частях предварительно разведенные вдвое на-
сыщенные водные растворы нейтрального красного и светлого
зеленого (лучше нагреть до температуры 40—50°). Полученный
осадок промывают дистиллированной водой, высушивают в тер-
мостате при температуре 37° и растворяют 1 : 100 в пропиловом
спирте (60-градусном) или в насыщенном водном растворе бути-
лового спирта. Для окрашивания этот раствор разбавляют вдвое
дистиллированной водой. Для усиления эффекта окрашивания
можно добавить на 100 см3 раствора 1 г карболовой кислоты.
Нейтральный г е н ц и а я о в ы й фиолетовый по
Бенсли. Для изготовления красителя смешивают равные ча-
сти насыщенных водных растворов орапжа G и генцианового фио-
летового и оставляют па 24 часа. Осадок отфильтровывают,
промывают дистиллированной водой, высушивают и приготов-
ляют из него насыщенный раствор в метиловом (или этиловом)
спирте. Перед окрашиванием добавляют 1—4 объема дистилли-
рованной воды. Красят 12—24 часа, быстро обезвоживают 96-
градусным и абсолютным спиртом и, проведя через ксилол, за-
ключают в бальзам.
П а н о п т и ч е с к и й метод П а п п е н г е й м а. Метод
представляет собою удачную комбинацию окрасок Романовского
и Май-Грюнвальда и дает красивые и весьма дифференцирован-
ные картины, особенно для изучения нормальной и патологиче-
ской крови и кроветворения.
Существенные условия для получения успешной окраски;
посуда должна быть из выщелоченного стекла и. что особенно
важно, дистиллированная вода должна иметь нейтральную ре-
акцию (pH = 6,8—7); если реакция воды кислая, то воду следу-
ет нейтрализовать, прибавляя по каплям 1-процентный углекис-
лый натрий.
Краситель наливают на предметные стекла, которые для
удобства кладут в соответствующие по размеру бактериологи-
ческие чашки; во время окрашивания чашку прикрывают.
1) На мазок наливают раствор Май-Грюнвальда (см. стр. 350)
и оставляют на 3 минуты. 2) Прибавляют равное количество
дистиллированной воды и оставляют на 1 минуту. 3) Сливают
раствор красителя и, не споласкивая, наливают на препарат
разведенный раствор Романовского (15 капель на 10 см3 дистил-
лированной воды) и оставляют на 15 минут. 4) Споласкивают
дистиллированной водой. 5) Просушивают фильтровальной
бумагой. 6) Заключают в нейтральный бальзам или цедакс.
Цитоплазма лимфоцитов окрашивается в светло-синий, азу-
рофильная зернистость лимфоцитов — в ярко-пурпурный, аци-
дофильная зернистость - - в кирпично-красный цвет, базофиль-
ная зернистость — в коричневый или синевато-розовый цвет,
эритроциты в розовый, полихромные эритроциты — преимуще-
ственно в синеватый, базофильная зернистость эритроцитов —
207
в кобальтово-синий цвет, зерна тучных клеток — в ультрамарино-
вый с фиолетовым оттенком, тельца Жолли — в красно-фиолето-
вый цвет.
В настоящее время все чаще получают применение нижепри-
веденные красители.
Галламиновый синий дает четкую и интенсивную ок-
раску ядер. Растворяют при кипячении 0,1 а галламинового си-
него в 100 см3 5-процентных калийных квасцов, остужают и
фильтруют. Срезы красят 6—24 часа.
Кислый ализариновый синий является, по нашему
мнению, лучшим красителем для гладкой и поперечно-полосатой
мускулатуры; одновременно хорошо окрашиваются ядра.
Растворяют 10 г сернокислого алюминия в 100 елг3 воды; при
кипячении добавляют 0,5 г кислого ализаринового синего и через
5—10 минут остужают и фильтруют.
Срезы окрашивают 5 минут (до диффузной фиолетовой ок-
раски тканей), споласкивают дистиллированной водой и кладут
в 6-процентную фосфорновольфрамовую кислоту на 30 минут,
где срезы краснеют. Затем тщательно промывают дистиллиро-
ванной водой, переносят на 1 минуту в 96-процентный спирт,
абсолютный спирт 3—5 минут, ксилол, бальзам.
Ядра — ярко-красные, плазма — синевато-красная, мус-
кулатура— красная, соединительная ткань — бесцветная.
Если срезы дифференцировать 2—5-процентной фосфорпомо-
либденовой кислотой, то (после формалина и смеси Ценкера)
ядра принимают синий цвет, мускулатура — темно-синий, эритро-
циты — черно-синий цвет.
Соединительную ткаиь можно докрасить в зеленый цвет
0,05-процептным раствором ализарин-виридипа (2—5 минут).
Можно также докрашивать смесью анилинового синего и
оранжа G (по Маллори).
Огромный выбор анилиновых красителей, выпускаемых хими-
ческой промышленностью, уменьшил интерес исследователей-мик-
роскопистов к использованию красителей раститель-
ного происхождения. Однако, по нашим наблюдениям,
многое в этой области может быть с пользой применено для окра-
шивания клеток и тканей. В качестве примера укажем, что хоро-
шую ядерную окраску можно получить с помошью сока ягод чер-
ники (Лавдовский, 1884; Роскин и Федоров, 1946; Меркулов,
1952; Губарев, 1952). Следовало бы детально изучить раститель-
ные красители, издавна используемые в народной практике при
окраске шерсти, например, экстракт свидины южной (Cornus
australis), дающей при протраве железными квасцами черное
окрашивание шерсти, или экстракты душицы обыкновенной
(Origanum vulgare), коры граната, щавеля (Rumex pulcher)
и т. д. В литературе имеется указание, что экстракт ягод крушины
(Sambucus nigra) избирательно окрашивает хроматин.
208
ОКРАШИВАНИЕ КАК МЕТОД ИССЛЕДОВАНИЯ
СУБМИКРОСКОПИЧЕСКОИ ПЛОТНОСТИ РАЗЛИЧНЫХ ТКАНЕВЫХ
СТРУКТУР
Используя смеси красителей, имеющих одинаковый за-
ряд, но отличающихся размерами молекул, можно получить
представление об относительной субмикроскопической плотности
клеточных и тканевых структур (Секи. 1940). Так, например, раз-
личия в структурной плотности некоторых тканевых элементов
коллагеновых волокон, мышц и цитоплазмы эпителиальных кле-
ток выявляются при окрашивании по способам ВанТизона, Мал-
лори или Гейденгайна (азановый метод). Субмикроскопически
относительно пористые коллагеновые волокна окрашиваются
крупно-молекулярными красителями (при способе Ван-Гизона —
кислым фуксином, при способах Маллори и Гейденгайна — ани-
линовым синим). Структурно более плотная мышечная ткань ок-
рашивается красителями, имеющими относительно меньшие мо-
лекулы (по Ван-Гизону — пикриновой кислотой, по Маллори —
орапжем или кислым фуксином, по Гейденгайну — азокармином).
Цитоплазма же при этих методах окрашивается в различные от-
тенки красным или. желтым красителем, в зависимости от ее
структурной плотности. Нередко цвет цитоплазмы определяется
смешением того и другого. Различия в структурной плотности
тканевых элементов нервной системы ясно выявляются на препа-
ратах, которые после фиксации в формалине были окрашены по
Гейденгайну. При этом цитоплазма олигодендроглии становится
сине-фиолетовой, цитоплазма клеток микроглии — голубовато-ли-
ловой, протоплазматическая и волокнистая макроглия — фиоле-
товой, так же, как и нервные клетки, ядра нервных клеток—ли-
лово-красными, мелкие глиальные ядра—красными или оранже-
выми, эритроциты — оранжевыми. Исследуя срезы нервной ткани,
можно установить следующий ряд в соответствии со структурной
плотностью тканевых элементов: коллагеновые волокна < раз-
ветвления аксонов < толстые аксоны < нейрофибриллы < цито-
плазма олигодендроглии, цитоплазма микроглии < цитоплазма
нервных клеток <тельца Ниссля < ядра нервных клеток (без
ядрышек) < малые глиальные ядра < эритроциты. Структурная
плотность ткани может изменяться, что четко выступает при из-
учении возрастных изменений, когда по мере старения происходит
уменьшение дисперсности, обезвоживание и уплотнение тканей.
Так, например, глиальные волокна, окрашенные азановым мето-
дом, могут давать различный эффект окрашивания в зависимости
от возраста организма:
Возраст Цвет глиальных волокон коры большого мота
Собака
20 дней сине-фиолетовые
3 года пурпурно-красные
6 лет оранжево-красные
13 лет оранжевые
14 Микроскопическая техника
209
Возраст Цвет глиальных волокон коры большого мозга
Человек
]5 лет оранжевые с лиловым оттенком
49 лет оранжево-красные
77 лет оранжевые
Конечно, выявление структурной плотности сопряжено с неточно-
стями. При относительно небольших различиях в оттенках окра-
шивания трудно определить, зависят ли эти различия только от
разной структурной плотности гистологических элементов, так
как результаты окрашивания определяются еще и другими усло-
виями, прежде всего электростатическими и Ван-дер-Ваальсовыми
силами, могущими играть немалую роль в сеотношениях частиц
красителя с тканевыми элементами. В недавно опубликованной
работе Б. В. Кедровского и К. П.Трухачевой (1952) весьма широ-
ко поставлен вопрос о необходимости при решении задач
функциональной морфологии изучать с т р у к-
т у п вне плотности гистологических элементов.
Кедровский и Трухачева для анализа относительной плотно-
сти тканевых элементов предложили смесь метилового голубого
(молекулярный вес около 800) и оранжа G (молекулярный вес
452,4). Средний диаметр частицы первого красителя в раз-
бавленных растворах по крайней мере в 5—6 раз больше, чем
у второго. Окрашивают 20—40 минут в смеси: 0,1-процентного
водного раствора метилового голубого—1 часть; 1-процент-
ного водного раствора оранжа G — 10 частей; 80-процентной
уксусной кислоты — 8—10 капель на 100 см3. Дифференцируют
в 96-градусном спирте (контролируя под микроскопом), затем
абсолютный спирт, ксилол, бальзам. Структуры возрастающей
плотности окрашиваются соответственно следующей шкале
цветов: синий — зеленый—желто-зеленый—желтый — оранже-
вый.
МЕТАХРОМАЗИЯ
Многие красители (тионин, толуидиновый синий, яркий кре-
зиловый синий ит. д.) способны окрашивать некоторые элементы
тканей в иной цвет, чем цвет раствора красителя: например, си-
ний тионин дает фиолетово-красное, толуидиновый синий —
синевато-красное, яркий крезиловый синий — синевато-красное
окрашивание. Это явление было названо П. Эрлихом (1873)
метахромазией, а вещества, дающие метахроматическое
окрашивание — хромотропными веществами. Само собою
разумеется, что к явлениям метахромазии нельзя относить
окрашивание, зависящее от тех или иных примесей, которые
могут встречаться у некоторых недостаточно очищенных
красителей. Михаэлис (1926) высказал гипотезу, что метахрома-
тические формы красителя — это его полимеры, однако по-
следующие спектроскопические исследования не смогли
подтвердить это предположение. Согласно исследованиям Лизона
210
(1933, 1935) для основных красителей имеются две возможности
изменения цветности: 1) изменение цветности, зависящее от pH
раствора, названное им «ионным виражем» и 2) изменение
цветности, обусловленное присутствием определенных хро-
мотропных веществ «метахроматическим виражем». Такими
хромотропными веществами являются высокомолекулярные
эстеры серной кислоты (R—OSO3H) и их соли. Иные взгляды
на природу метахромазии развиты в работе Банка и Буигеиберг-
де-Иоига (1939), считающих, что метахроматическое окрашива-
ние зависит не от наличия каких-либо специфических веществ,
а от электрохимических взаимоотношений между катионом
основного красителя и ионами коллоидного субстрата; поэтому
самые различные вещества могут окрашиваться метахроматиче-
ски. По данным Спека (1939, 1940) метахроматическое
окрашивание связано с явлением осаждения образовавшегося
комплекса из хромотропного вещества и метахроматического
основного красителя, причем цвет окрашивания — во всяком
случае в условиях витального окрашивания — зависит от ионной
концентрации, а не от присутствия специфических хромотропиых
веществ. Спор о природе метахромазии не закончен. Тем ие
меиее метахроматическое окрашивание широко используется
в современной гистохимии для обнаружения ряда кислых поли-
сахаридов (см. стр. 247). Кроме мукоидных веществ и хон-
дроитинсерной кислоты хряща к хромотропным веществам
относятся волютин бактерий, дрожжей и протистов, зерна туч-
ных клеток, клеточные оболочки многих протистов •— грегарин,
жгутиковых и инфузорий (Спек и Гиллиссен, 1943). Гольмгрен
(1940) показал, что хромотропиые вещества широко распро-
странены в различных эмбриональных тканях, но затем
постепенно они исчезают, сохраняясь у взрослых животных лишь
в хряще, роговице, склере и стейках кровеносных сосудов.
Хромотропиые вещества найдены в строме злокачественных
опухолей эпителиального и мезенхимального происхождения
(Сильвен, 1938).
К ТЕОРИИ ИМПРЕГНАЦИИ
В микроскопической технике наряду с окрасками нередко
пользуются импрегнацией металлами: золотом, осмием и, наибо-
лее часто, серебром, особенно при изучении нервной и соедини-
тельной ткани.
Методы серебрения столь разнообразны, что не может быть
единой теории импрегнации. Можно лишь дать теоретическое
обоснование отдельным звеньям процесса импрегнации.
Импрегнация может проводиться двумя различными способами.
В первом случае импрегнация зависит от редуцирующего
действия некоторых тканевых компонентов на соли серебра. Так,
например, если обработать свежую или предварительно
фиксированную ткань раствором азотнокислого серебра (слегка
14* 211
подкисленным азотной или уксусной кислотой), то металлическое
серебро может восстанавливаться из солей серебра в виде мел-
ких зерен такими компонентами тканей, как аскорбиновая
кислота, адреналин, креатин, глютатион. С помощью легко
редуцирующегося раствора аммиачного серебра могут черниться
многие элементы, встречающиеся в тканях (причем осадок вы-
падает почти всегда в виде зерен), как, например, меланин,
липофусцин, гранулы ретикуло-эндотелиальных клеток,
эозинофильные гранулы и, наконец, митохондрии. Этот способ
импрегнации не используется при изучении тонкого строения
нервной системы, однако гистолог, применяющий соли серебра
для решения тех или иных морфологических задач, не должен
упускать его из вида, так как он может повлиять иа конечные
результаты импрегнации или же дать повод к несколько по-
спешным заключениям.
Второй способ импрегнации заключается в том, что
ткань предварительно пропитывают солями
серебра, а затем обрабатывают редуциру-
ющими реактивами. Этот способ наиболее распространен
в гистологической технике. Он сводится к тому, что свежую или
фиксированную ткань сперва обрабатывают раствором азотно-
кислого или аммиачного серебра, а затем подвергают действию
редуцирующего реактива, чаще всего формалина; при этом при
определенных условиях можно достигнуть элективного почерне-
ния элементов нервной ткани.
В процессе импрегнации важную роль играют размеры
межмицелляриых пространств тканевых элементов и частиц се-
ребра. Исследованиями Секи (1940) и Липпа (1951) показано
значение структурной плотности тех или иных тканевых элемен-
тов, подвергающихся импрегнации серебром.
Контрастность выявления тех или иных тканевых элементов
при импрегнации достигается тем, что восстанавливающееся из
солей серебра металлическое серебро откладывается в этих
элементах более интенсивно, чем в других. В начале этого про-
цесса образуются мельчайшие участки («зародыши») серебра,
которые затем более или менее быстро увеличиваются за счет
вновь восстановленного серебра. Этим путем получаются
значительные аггрегаты частиц серебра. Такие серебряные
частицы могут образоваться как в микроскопических, так
и в субмикроскопических порах тканевых элементов, и, отклады-
ваясь по их стенкам, чернить их. Если же субмикроскопические
поры слишком узки, то отложение серебра становится невозмож-
ным. Прн слишком широких порах или же тканевых элементах,
богатых защитными коллоидами, также не наступает почерне-
ния, так как азотнокислое или аммиачное серебро будет быстро
удаляться при промывке водой. Различными химическими аген-
тами можно значительно изменить как сродство серебряных
солей к тканевым элементам, так и ширину и коллоидальный
212
состав субмикроскопических пор. Прибавление к формалиновому
фиксатору веществ, вызывающих набухание, т. е. расширение
пор, вызывает смешение оптимальной импрегнации в сторону
более плотных тканевых элементов.
Фиксация кусочков мозга безводными жидкостями сильно
уменьшает пористость тканей и в силу этого существенно меняет
результаты последующей импрегнации серебром. В общем
можно считать, что подходящая микроскопическая
и субмикроскопическая плотность тканевых
элементов и их бедность защитными кол-
лоидами являются важными условиями се-
ребрения.
Для течения процесса импрегнации существенное значение
имеет размер образовавшихся частиц серебра. С увеличением
размеров частиц цвет солей серебра смещается от желтого
к красному, фиолетовому и т. д. Полагают, что размер частиц
серебра на черных посеребренных препаратах больше 120 ти.
Поэтому надо считать, что суб.микроскопические поры тканевых
элементов, в которых откладывается черное серебро, должны,
конечно, иметь не меньшие размеры. Используя различные
реактивы, в первую очередь при фиксации, можно направленно
изменять структурную плотность ткани и тем самым подготовить
ее к элективной импрегнации исследуемых элементов. Поэтому
при серебрении особое значение имеет процесс фиксации и выбор
фиксатора.
В различных методах импрегнации — серебрения особое
значение имеет процесс фиксации и выбор фиксатора.
В различных методах импрегнации серебром рекомендуется
предварительно фиксировать ткань формалином. Под влиянием
формалина в клетках происходят химические и физико-химиче-
ские изменения, которые необходимо учитывать. В литературе
описаны следующие реакции формальдегида с протеинами:
а) реакция с аминогруппами; б) реакция с амидо-, амино-
гидроксильными и сульфогидрильными группами; в) реакция
с ароматическими кольцами тирозина, триптофана, фени-
лаланина и гистидина; г) реакция метиленирования; д) реакции,
связанные с редуцирующими свойствами формальдегида и е) ре-
акции, обусловленные примесями, встречающимися в продажном
формальдегиде; продуктами полимерации формальдегида,
муравьиной кислотой, метиловым спиртом. Существенно от-
метить, что реакции (а) и (г) были изучены в пробирочных
опытах. Предполагают, что формалин способен сетеобразно
объединять пептидные цепи белков.
Поскольку формалин нейтрализует основные группы, он
делает протеины более кислыми, чем это наблюдается, например
после фиксации спиртом. Таким образом формалиновая фикса-
ция приводит к некоторому сдвигу изоэлектрических точек
протеинов в кислую сторону, что не безразлично для последую-
213
щего процесса импрегнации серебром, так как при этом воз-
растает сродство к ионам серебра некоторых элементов нервной
ткани, например, нейрофибрилл. Формалиновая фиксация не
оставляет неизменными липоидные компоненты клеток. Наблюде-
ния показывают, что в тканях, фиксированных формалином,
постепенно, хотя и весьма медленно, уменьшается содержание
липоидов, так как имеющаяся в клетках липаза не разрушается
этим реактивом. Наблюдая фиксированные формалином участки
центральной нервной системы, можно установить, что лецитин
и галакто-липины остаются более или менее неизменными,
а цефалин и сфингомиэлин постепенно исчезают. Эти изменения
в липоидном составе нервной ткани не безразличны для процесса
импрегнации серебром. Некоторые гистологи считают, что удале-
ние липоидов из нервной ткани является весьма желательным
для успеха импрегнации и рекомендуют использовать для этой
цели, например, спиртовую фиксацию. Физико-химические
сдвиги, вызываемые формалином, приводят также к известным
изменениям и в микроскопических структурах.
Промывка проточной или дистиллированной водой после
формалиновой фиксации, эмпирически применяемая в целом
ряде методик, имеет немаловажное значение. Можно считать,
что при фиксации формалином различные гистологические
структуры не одинаково связывают формалин. При последующей
промывке разные гистологические элементы отдают связанный
ими формалин не с одинаковой скоростью и ие в равной мере,
что играет не малую роль в процессах импрегнации серебром.
Кроме того, промывка водой ведет к удалению из фиксированной
ткани подвижных иопов. т. е. действует наподобие диализа. При
промывке водой могут быть удалены из ткани продукты рас-
щепления белков и липоидов. Это в целом обеспечивает успеш-
ный результат последующей импрегнации, так как подвижные
ионы могли бы образовать различные соли с серебром (напри-
мер, хлорид серебра), что повело бы к образованию осад-
ков серебра в самых различных частях препарата. Что же
касается продуктов растепления, то они могли бы заполнить
в той или иной мере межмицеллярные пространства клеточных
структур, в которых, при правильно проведенной импрегнации,
откладываются частицы серебра. Однако чрезмерно длительная
промывка в воде объектов, фиксированных в формалине, вредна.
Опа может привести к набуханию и даже к частичной мацерации
объектов, так как в этом отношении ткани, фиксированные в фор-
малине, недостаточно устойчивы.
Далее следует рассмотреть процессы, происходящие при про-
питывании ткани раствором азотнокислого серебра. Срезы ткани,
перенесенные в раствор азотнокислого серебра, постепенно
желтеют, что связано с образованием в ткани так называемых
«зародышевых» частиц серебра. Для понимания этого процесса
надо учесть, что раствор AgNO3 по крайней мере частично
214
гидролитически расщеплен, и таким образом в нем наряду
с Ag-ионами имеются и частицы AgOH. Кроме того, надо принять
во внимание, что в растворе AgNOs может образовываться не-
большое количество -редуцированного серебра.
Важную роль в процессах серебрения играют электро-
статические явления. Электростатическая адсорбция
тканевыми элементами каких-либо ионов будет тем резче
выражена, чем больше различия между положением изо-
электрической точки субстрата и pH примененного раствора. На
основании этих соображений некоторые исследователи высказали
предположение, что механизм образования в тканях «зародыше-
вых» частиц серебра зависит только от электростатических
явлений. Однако такая гипотеза в применении к механизму
импрегнации некоторых элементов нервной ткани наталкивается
па некоторые трудности. Так, например, изоэлектрическая точка
нейрофибрилл может варьировать в зависимости: 1) от вида
подопытного животного, 2) от рода нерва (так, например, имеет
значение, является ли нерв мякотным или безмякотным), 3) от
характера и длительности предварительной обработки. Однако
появление первичных «зародышевых» отложений серебра нельзя
объяснить образованием только адсорбционных соединений.
В этом случае длительное промывание в воде должно было бы
удалять отложения серебра пли, по крайней мере, резко их
уменьшать. Но каждый гистолог, работавший с методом импрег-
нации нервной ткани, знает, что в действительности этого не
происходит. Поэтому можно думать, что при пропитывании
срезов азотнокислым серебром происходит образование
серебря п о-б е л к о в ы х соединений. Но пока еще трудно
сказать, с какими именно боковыми цепями белковых молекул
соединяется серебро. Можно лишь утверждать, что оно соединя-
ется не только с белковыми молекулами нейрофибрилл, но
и с белками некоторых других тканевых элементов. Несмотря на
то, что альбумипаты серебра бесцветны, препараты, вынутые из
раствора азотнокислого серебра, окрашены в различные оттенки
желтого или коричневого топа. Это явление зависит от способно-
сти составных частей нервной ткани и, в частности, нейро-
фибрилл в некоторой степени редуцировать серебро. Однако
восстановление серебра в тех или иных элементах ткани может
зависеть и от действия формальдегида, который после фиксации
ткани вновь высвобождается из соединений с нею. Это об-
стоятельство также может играть существенную роль.
Одновременно нельзя отрицать значения и окислительно-вос-
становительного потенциала тканевых коллоидов и, возможно,
липоидов. Первичная адсорбция ионов серебра, их химическая
реакция с белками и редукция «образовавшихся соединений—
все эти явления не исчерпывают до конца сложного процесса,
происходящего при первичном пропитывании срезов нервной
ткани раствором азотнокислого серебра.
215
В результате реакции с серебром определенные тканевые
структуры должны изменить свои электростатические свойства.
Если учесть, что в растворе азотнокислого серебра наряду
с ионами серебра имеются также гидроокись серебра и частицы
коллоидального металлического серебра, то можно считать, что
гидроксид серебра может образовывать с отрицательно заряжен-
ными частицами сложные комплексы, 'которые в свою очередь
могут вступать в соединения с ранее образовавшимися соедине-
ниями альбумината серебра. Одновременно с этим процессом
идет процесс редукции серебра. Все эти сложные процессы за-
тихают через некоторое время. Поэтому продление пребывания
кусочков ткани сверх определенного промежутка времени
не усиливает видимого пожелтения элементов нервной ткани.
Как показали исследования Петерса (1955), при пропитыва-
нии азотнокислым серебром (после спиртовой фиксации) про-
исходят, по существу, две различные реакции между ионами
серебра и элементами фиксированной ткани. Значительная
часть серебра соединяется с тканью в невосстановленной форме,
а меньшая часть—восстанавливается, образуя «зародыши»
серебра, па которых могут отлагаться дополнительно новые
частицы серебра. Невосстановленная часть серебра комбиниру-
ется преимущественно с гистидином. Невосстановленное серебро
распределяется однородно (за исключением клеточных ядер) по
всему срезу; количество поступающего в срезы ткани невос-
становленного серебра зависит от концентрации ионов серебра
в растворе. Фракция же восстановленного серебра прогрессивно
увеличивается в зависимости от времени, повышения pH н тем-
пературы пропитывающей ванны. При этом ионы серебра
превращаются в частицы («зародыши») серебра и в дальнейшем
остаются без изменения. Отложение частиц серебра происходит
только после пропитывания объекта при pH от 7,5 до 9.0.
Только в этих условиях впитывается такое количество невос-
становленного серебра, которое достаточно для интенсивного
окрашивания после действия восстановителя (Петерс, 1955).
Следует также указать па коллоидальные изменения, происходя-
щие в тканях при импрегнации. Раствор азотнокислого серебра
вызывает отбухание и сморщивание тканей. Поэтому последую-
щий успех серебрения, определяемый в значительной степени
размером межмицелляриых пространств тканевых элементов,
будет зависеть также от изменений ткани под влиянием раствора
азотнокислого серебра. Время пребывания в нем имеет суще-
ственное значение, тем более, что при излишне длительном
пребывании в растворе азотнокислого серебра начинается
откладывание частиц серебра в различных тканях, а не только
в нервной.
Важную роль играет вторичная обработка срезов формали-
ном. В прописях Б. И. Лаврентьева, а также Гросс-Шульце
рекомендуется срезы, пробывшие некоторое время в растворе
азотнокислого серебра, подвергать обработке формалином. При
этом желто-коричневый тон срезов темнеет, причем в нервной
ткани этот процесс протекает гораздо более интенсивно, чем
в других окружающих тканях. Под влиянием формалина про-
исходит дальнейшее восстановление «зародышевых» частиц
серебра и одновременное присоединение к ним новых ионов-
серебра. В то же время, наряду с потемнением аксонов, может
происходить посветление и даже исчезновение окраски мякот-
ных оболочек. Это показывает, что образовавшиеся «зародыше-
вые» частицы серебра не обязательно остаются связанными
с тканью, а могут вымываться из ткани возникающими диф-
фузионными токами. Чем более рыхло субмикроскопическое
строение ткани, чем шире ее межмицеллярные пространства,
тем интенсивнее идет процесс вымывания уже образовавшихся
солеобразных комплексов серебра — «зародышевых» частиц
серебра.
При импрегнации по Бильшовскому, как известно, после фор-
малиновой фиксации изготавливают срезы на замораживающем
микротоме, пропитывают их в растворе азотнокислого серебра
и затем переносят в раствор аммиачного серебра1, где и за-
канчивается процесс импрегнации. При контакте имеющегося уже
в ткани AgNO3 и аммиачного серебра в плотных и рыхлых ткане-
вых элементах образуется осадок AgjO. Вскоре этот осадок вы-
мывается из рыхлых частей (как, например, коллагеновых тяжей)
и растворяется в растворе аммиачного серебра, так как тот содер-
жит избыток аммиака. При последующем переносе срезов в фор-
малин, в этих рыхлых элементах откладывается металлическое
серебро. Образующийся осадок металлического серебра отклады-
вается и в плотных тканевых элементах, главным образом на осно-
ве ранее образовавшегося осадка Ag»O, но накапливается в них
в очень малых количествах вследствие узости пор и, возможно, в
силу присутствия там защитных коллоидов.
Количество едкого натрия, находящегося в растворе аммиачно-
го серебра, имеет большое значение для возникновения явлений!
мацерации ткани и образования защитных коллоидов из веществ,
входящих в ее состав.
Для успеха импрегнации по Билыповсйому следует учитывать
другие моменты. Так, например, краткое споласкивание водой сре-
за, обработанного аммиачным серебром, необходимо для диффе-
1 При изготовлении аммиачного серебра надо иметь в виду, что добав-
ление избытка аммиака к исходному раствору ведет к образованию комплекс-
ной солн [Ag(NH3)2]N'O3. Константа диссоциации этой соли очень мала и кон-
центрация свободного серебра [Ag+] чрезвычайно низка. Совершенно другой
эффект получается при добавлении к AgNO3 сильной щелочи, как NaOH-
При добавлении NaOH к раствору комплексного аммиачно-серебряного нит-
рата образуется легко диссоциирующийся (Ag(NH3)2ОН]. и концентрация сво-
бодного серебра в растворе повышается. Таким образом, действие избытка
аммиака и NaOH на раствор AgNO3 противоположно. Это позволяет регу-
лировать концентрацию свободного серебра.
217
ренцировки тканевых элементов. Если срезы непосредственно пере-
нести в восстановитель, то специфичность серебрения аксонов и
нейрофибрилл сильно пострадает, так как образуются осадки
серебра на поверхности почти всех элементов ткани. С другой сто-
роны, слишком долгая промывка ведет к сильному ослаблению
импрегнации, получаются бледные, нечеткие препараты.
Существенное значение имеет состав раствора аммиачного се-
ребра. Уменьшение количества добавляемого к аммиачному се-
ребру NaOH вдвое (и соответственное уменьшение аммиака) ве-
дет к ослаблению импрегнации, особенно нейрофибрилл. Если
раствор аммиачного серебра содержит NaOH и аммиака больше,
чем указано в прописи, то тканевые элементы, за исключением
нейрофибрилл, сильно мацерируются и слабее серебрятся, осо-
бенно коллагеновые тяжи, глиальные и нервные клетки; нейро-
фибриллы же, которые при этом не изменяются, особенно интен-
сивно чернятся. Если количество NaOH вдвое больше, чем поло-
жено в прописи Бильшовского, то получается интенсивное почер-
нение всех элементов ткани, так как такой раствор серебра слиш-
ком легко редуцируется. При этом плазматические части клеток
повреждаются и изменяются. Небольшой же избыток аммиака
обусловливает лучшее выявление внутриклеточных нейрофиб-
рилл. При дальнейшем прибавлении аммиака, например при из-
бытке 5 капель аммиака па 20 с.и3 раствора серебра, интенсивно
чернятся глиальные и нервные клетки и их ядра, так как такое
аммиачное серебро легче проникает в плотные тканевые элементы.
По методам Б. И. Лаврентьева и Гросс-Шульце, после обра-
ботки формалином срезы переносят в раствор аммиачного серебра.
При этом срезы ткани могут содержать значительные количества
формалина, который способен восстанавливать аммиачное сереб-
ро. Таким образом, и в самых срезах и непосредственно около них
образуются частицы серебра. Как уже было сказано, количество
образующегося серебра зависит от способа приготовления раство-
ра аммиачного серебра. Частицы вновь образующегося серебра
откладываются на уже ранее образовавшиеся зародышевые части-
цы металла, количество которых тем самым увеличивается. Этот
процесс идет всего интенсивнее в тех местах, где межмнцелляр-
ные пространства являются наиболее подходящими, причем в ней-
рите серебряные частицы располагаются параллельно длинной
оси нейрита. Процесс протекает, таким образом, только до некото-
рой оптимальной точки импрегнации. Если же время импрегнации
удлиняется, то наблюдается беспорядочное отложение частиц се-
ребра, причем не только в межмицеллярных пространствах, но и
на поверхности тяжей и т. д., и таким образом образуются круп-
ные скопления осадков серебра, резко искажающие гистологиче-
скую картину импрегнированных препаратов.
Весьма интересен вопрос о том, в какой мере изменяются раз-
меры импрегнированных элементов тканей, например, фибрилл.
По литературным данным тонкие плазматические нити, имевшие
218
в поперечнике около 100 w, после импрегнации серебром достига-
ли размеров, примерно, 250 ти, т. е. поперечник увеличивался
в 2—2,5 раза, и в силу этого субмикроскопические нити станови-
лись видимыми в обычный микроскоп. Вполне возможно, чго ана-
логичные изменения происходят и при импрегнации нейрофибрилл
по методам Бильшовского или Б. И. Лаврентьева и др. Это обстоя-
тельство следует учитывать при изучении синаптических аппара-
тов, различных концевых разветвлений или ретикулярных образо-
ваний, которые становятся доступными для исследования после
серебрения. Эти наблюдения вносят некоторую ясность в вопрос о
различиях картин, получаемых, с одной стороны, при серебрении
и, с другой стороны, при суправитальном окрашивании метилено-
вым синим; при первом методе, в силу увеличения размеров в ре-
зультате импрегнации частицами серебра, становятся видимыми
очень тонкие структуры, в то время как после метиленового си-
него они остаются недоступными для исследования в световом
микроскопе. Однако было бы неправильно делать из этого вы-
вод, что при суправитальном окрашивании метиленовым синим
вообще не происходит никаких изменений. И при этом методе ок-
рашивания в нервной ткани происходят определенные сдвиги
(физико-химические, субмикроскоппческие и т. д.), но они носят
иной характер, чем при импрегнации.
Трудности построения единой теории импрегнации связаны
не только со сложностью физико-химических процессов, лежащих
в основе процесса импрегнации, но и в равной, если не большей
мере и с многообразием свойств элементов нервной системы, их
изменениями в процессе развития в зависимости от функциональ-
ного состояния и т. д. п т. п. Из приведенных данных следует, что
для научного анализа картин нервной ткани, изучаемых на им-
прегнированных серебром препаратах, далеко не достаточен чи-
сто морфологический подход. Только сочетание морфологических
данных с результатами физиологических, гистохимических, био-
химических, коллоидно-химических и других исследований позво-
нил- достигнуть новых успехов в области нейрогистологип.
РАЗДЕЛ ВОСЬМОЙ
ГИСТОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА КЛЕТОК
И ТКАНЕЙ
Задача гистохимии — изучение химического состава и обмена
веществ микроструктурных элементов организма. В отличие от
микрохимических, гистохимические методы должны не только вы-
являть химические вещества, но и определять их расположение
(топографию) в клетках и тканях.
Поэтому для гистохимической практики пригодны только та-
кие методы, в результате которых те или иные вещества фикси-
руются, осаждаются именно в тех местах, где они располагаются
в живых клетках и тканях. Кроме того, вещества должны осаж-
даться в таком состоянии, чтобы и при дальнейшей обработке они
не растворялись, не выходили из клеток и не изменяли бы своего
положения в клетках.
Гистохимия, своеобразно объединяя методы качественного хи-
мического анализа и технику гистологического изучения микроско-
пического мира, позволяет решать ряд гистологических проблем,
причем динамика превращения веществ изучается ею в неразрыв-
ной связи с клеточными или тканевыми структурами. Методы со-
временной гистохимии обусловливают новые качествен-
ные результаты, содержание которых часто превосходит
простую сумму итогов двух параллельных — химического и мор-
фологического — исследований.
Иногда недооценивают возможностей гистохимического иссле-
дования клеток и тканей. Подобная точка зрения основывается на
недооценке значения границы чувствительности методов, с кото-
рыми оперирует гистохимия. Давно было доказано, что степень
чувствительности аналитических реакций может быть значительно
повышена путем увеличения видимости осадков с помощью мик-
роскопа. В силу этого чувствительность гистохимического анализа,
при использовании ряда общепринятых в аналитической химии
методов, может достигать границ чувствительности спектрального
анализа. Гистохимическое изучение многих веществ могло бы на-
толкнуться на трудности обнаружения столь малых количеств, в
220
которых они встречаются в клетках и тканях. Но здесь исследова-
телю помогает «феномен накопления» многих веществ в виде
«концентратов» только в определенных местах или органоидах
клетки. Надо помнить, что чувствительность химических реакций,
показанная в специальных справочниках, не является масштабом
.для определения тех же веществ в клетках и тканях, так как в
этих условиях вещества, обычно, распределяются не диффузно
и равномерно в протоплазме, а локализованы или связаны с оп-
ределенным участком субстрата. Так, например, для определения
железа граница чувствительности реакции берлинской лазури ле-
жит около 0,002 мг, однако в плазме клеток, в силу указанных
особенностей, возможно определение количеств железа пример-
но в 10 000 раз меньших, т. е. количеств до 2,5 X 10"7. Указанные
соображения имеют особое значение при оценке возможностей
гистохимического анализа.
Вопрос о границах достоверности современной гистохимической
техники имеет большое и принципиальное значение. В настоящее
время можно считать, что основной вопрос о пределах чувстви-
тельности лучших современных гистохимических реакций решается
положительно. «Область микроскопических увеличений и специ-
фика биологического материала создают полноценные предпо-
сылки для обнаружения многих химических составных частей и
метаболитов в клетках и тканях» (А. Л. Шабадаш).
В результате применения гистохимических методов должны
получаться соединения, ясно видимые в микроскоп и хорошо отли-
чимые от других клеточных компонентов. Обычно в результате
достигается окрашивание исследуемых веществ.
Методы гистохимического анализа многообразны. Многие ав-
торы включают сюда и методы гистофизические. Недавно Бекер
(1950) дал следующую классификацию гистохимических методов.
1. Методы, применение которых не связано с нарушением
структур. Анализ объекта основывается на определении следую-
щих свойств объекта.
1) Индекс рефракции.
2) Оптические свойства при исследовании в поляризованном
свете и степень двоякопреломляемости.
3) Число и свойства оптических осей.
4) Кристаллографические свойства.
5) Способность абсорбировать электромагнитные лучи опре-
деленной длины, что выявляется: а) анализом цветности
объекта, б) спектром абсорбции лучей в относительно ши-
роком интервале волн различной длины, в) абсорбцией
лучей одной определенной длины волн.
6) Флуоресценция в ультрафиолетовых лучах (первичная
флуоресценция).
7) Отношение к растворителям или энзимам.
8) Способность сорбировать или растворять определенные
окрашенные реактивы.
221
9) Способность избирательно адсорбировать определенные
красители.
10) Способность растворять или адсорбировать определен-
ные флуорохромы (вторичная флуоресценция).
11) Способность давать цветные химические соединения с
определенными реактивами.
12) Поведение при микросжигании.
13) Реакция энзима с исследуемым субстратом, при которой
образуется окрашенное вещество или вещество, которое
может быть выявлено последующей цветной реакцией.
14) Радиоактивные свойства.
II. Методы, связанные с разрушением структур.
Анализ основывается на определении:
1) Точки плавления.
2) Растворимости: а) под влиянием растворителей; б) под
влиянием энзимов.
3) Эмиссионного спектра.
4) Способности давать кристаллы, подлежащие дальнейшему
определению.
III. Методы extra situm т. е. связанные с выделением клеточ-
ных или тканевых компонентов из исследуемого объекта.
1) С помощью механического отделения.
2) При растворении.
3) При дифференцированном центрифугировании.
4) При микросублимации.
Часть приведенных в таблице Бекера методов не нашла еще
широкого употребления в силу того, что для их осуществления
необходимы сложные приборы, а отчасти и потому, что они еще
недостаточно методически разработаны, чтобы применяться в пов-
седневной лабораторной практике. Но в целом приведенная таб-
лица даст представление о возможностях и перспективах гистоло-
гического анализа клеток и тканей.
Из большого количества методов мы выбрали наиболее досто-
верные и чаще употребляемые в гистологической технике (см.
приложение, табл. V—VIII).
МЕТАЛЛЫ
Калий
Метод Макал л ум а основан на способности кобальто-
азотистокислого натрия CoNa2(NO2)6 образовывать осадок с ка-
лием в виде желто-оранжевых кристаллов. Так как эти кристал-
лы слабо окрашены, то при помощи сернистого аммония превра-
щают кобальт в сернистое соединение черного цвета.
Из свежей ткани приготовляют срезы на замораживающем ми-
кротоме и помещают еще замороженные срезы в реактив, состав-
ленный следующим образом: 20 г азотистокислого кобальта 4-35 г
азотистокислого натрия -|-10 см3 ледяной уксусной кислоты
222
4-65 см3 дистиллированной воды. Через несколько часов фильт-
руют и доливают водой до 100 см3.
Срезы должны находиться в реактиве от получаса до несколь-
ких часов; затем реактив отсасывают и несколько раз промывают
срезы очень холодной водой (со льдом).
Срезы расправляют на предметном стекле и заключают в кап-
лю глицерин-сернистого аммония (50 см'3 50-процентного глице-
рина -J-50 см3 сернистого аммония).
Окрашиваются только зерна калия в черный цвет.
Соли аммония могут дать такой же осадок, как и соли калия,
но аммоний растворяется в холодной воде и удаляется во время
промывки. Из органических веществ, встречающихся у животных,
только креатин подобным же образом осаждает применяемый ре-
актив. Реакция надежна.
Соответствие расположения полученных на препарате зерен с
расположением калия в живой ткани, по-видимому, очень мало,
потому что реактив очень плохо проникает, а скорость диффузии
солей калия чрезвычайно велика.
При помощи метода Марца можно выявить калий, свя-
занный с белками. Растворимый калий удаляется из клетки в про-
цессе приготовления препарата: 1) фиксировать кусочки в 90-гра-
дусном спирте, залить в парафин, довести срезы до дистиллиро-
ванной воды; 2) поместить в свежеприготовленный раствор: азоти-
стокислого кобальта 6,5 г, дистиллированной воды 17,5 см3, ледя-
ной уксусной кислоты — 5 капель — 2 часа; 3) опустить срезы
(очень медленно) в 50-градусный спирт на 30 минут; 4) 3 раза
промыть 50-градусным спиртом для того, чтобы удалить следы
кобальта; 5) поместить в свежеприготовленный 3—5-процентный
раствор сернистого аммония на 5 минут; 6) промыть дистиллиро-
ванной водой; 7) заключить в нейтральный канадский бальзам.
Калий окрашивается в черный цвет.
Для приготовления контрольного препарата срезы обрабаты-
вают как указано выше, за исключением пункта второго.
Карер-Комес предлагает следующий гистохимический метод
выявления калия и одновременно метод избирательной окраски
тканей, богатых калием.
Реакция основана на способности парадипикриламина обра-
зовывать с калием оранжево-красный осадок: 1) фиксируют
ткань нейтральным формалином, заливают в парафин, доводят
срезы до дистиллированной воды; 2) кладут срезы в раствор
парадипикриламина натрия (сиена-орапж.); 3) помещают в
10-процентную соляную кислоту — 3 минуты; 4) дистиллирован-
ная вода (дважды сменить)— 10 минут; 5) осушают препарат
фильтровальной бумагой; 6) заключают в кедровое масло.
Ткани, богатые калием, окрашиваются в оранжевый цвет, ос-
тальные — бледно-желтые или бесцветные.
Препараты можно дополнительно окрашивать. Мускульную
ткань после выполнения п. 3 окрашивают в свежем 0,01-процент-
223
У
пом водном растворе анилинового синего 10—-15 минут, опола-
скивают дистиллированной водой, осушают фильтровальной бу-
магой, проводят быстро через абсолютный спирт, ксилол и заклю-
чают в нейтральный бальзам или кедровое масло. При этом оран-
жевые .мускульные волокна резко выделяются.
Кальций
Реакция кристаллизации. Метод основан на том,
что гипс, кристаллизуясь, образует характерные кристаллы.
Довести срезы до 40-градусного спирта, налить на препарат
каплю З-процептной серной кислоты. При этом очень быстро вы-
падают игольчатые кристаллы гипса, иногда образующие розетки.
Образование лака. Метод основан на образовании ок-
рашенных кальциевых лаков.
Обычно используют совершенно нефиксированный материал
или фиксированный в 96-процентном спирте, приготовляют за-
мороженные или парафиновые срезы, не декальцинируя их; окра-
шивают их в насыщенном спиртовом растворе пурпурина в
70-градусном спирте 5—8 минут; затем помещают в 0,75-процент-
ный раствор поваренной соли 3—4 минуты; споласкивают в 70-
градусном спирте, пока не перестанет отделяться облачко краси-
теля, проводят через абсолютный спирт, ксилол, заключают в ка-
надский бальзам.
Кальций окрашивается в пурпурно-красный цвет, однако не-
значительные количества кальция, находящиеся внутри клеток,
не всегда выявляются.
Метод Кретена чрезвычайно чувствителен. Он позволяет
открыть кальцин даже в клеточных ядрах. Кальций специфически
окрашивается в синий цвет. Другие металлы также дают окра-
шенные лаки, но других оттенков.
Смешать 2 части галловой кислоты и 1 часть триоксиметиле-
на; перед употреблением в 5 см3 кипящей воды растворить 0,26 г
смеси; в кипящей реактив прибавить 0,5 см3 аммиака—смесь
должна принять желтоватый оттеиок. В этот момент она годна
к употреблению. При появлении в пей коричневых или розовых
оттенков применять ее больше нельзя.
Полученный реактив налить на срезы, депарафинированные
ксилолом и промытые хлороформом. Через 10—15 секунд слить
избыток реактива и оставить препарат на воздухе до появления
синего оттенка. Промыть профильтрованным насыщенным вод-
ным раствором СаЭОь окрасить эозином, разведенным на 5-про-
центном аммиаке, сполоснуть 10-процентным формалином; обез-
водить, провести через ксилол, заключить в кедровое масло.
В результате кальций окрашивается в синий цвет, остальная
ткань в розовый или красный.
Метод Косса основан па том, что фосфорнокислый кальций
осаждает серебро в виде фосфорнокислого серебра, которое на
свету восстанавливается до металлического серебра.
224
Фиксировать материал в 96-градусном спирте, приготовить за-
мороженные или парафиновые срезы (не декальцинируя), поме-
стить срезы на '/2—1 час в 1—5-процентный раствор азотнокисло-
го серебра (реакцию проводить при дневном свете, лучше на солн-
це), промыть в дистиллированной воде, обработать 1—2 минуты
в 5-процентном растворе гипосульфита натрия, хорошо промыть в
дистиллированной воде (3 раза сменить). Ядра можно докрасить
квасцовым кармином или сафранином.
В результате фосфорнокислый кальций окрашивается в жел-
тый цвет, быстро переходящий в черный. Реакция недостаточно
специфична, потому что таким же образом окрашиваются и фос-
форнокислые и углекислые соединения меди, железа, свинца
и »г. д„ но практически она может успешно применяться, т. к.
вещества, которые могут дать сходные результаты, обычно не
встречаются одновременно в изучаемых объектах. Кроме того,
можно сделать контрольные препараты, предварительно декаль-
цинировав материал.
Железо
Раньше материал фиксировали абсолютным спиртом, но пос-
ледний, как известно, сильно изменяет ткань. Поэтому пользо-
ваться им 'не следует, так как нельзя с достаточной точностью
установить распределение железа в клетках. Лучше применять
10-процентный формалин или же фиксатор Буэна, потому что ои
не только хорошо сохраняет железо, ио кроме того, что очень
важно, представляет собою хороший цитологический фиксатор.
Кусочки следует резать иа замораживающем микротоме или
же заливать в парафин. При гистохимическом выявлении железа
следует обращать особое внимание на чистоту применяемых реак-
тивов (часто следы железа имеются в дистиллированной воде и
соляной кислоте), потому что примесь железа в них может извра-
тить получаемые картины. Нельзя пользоваться металлическими
инструментами (иглы, шпатели), работать следует только стек-
лянными.
Метод с берлинской лазурью служит для вы-
явления солей окиси железа. Реакция очень чувствительная и
точная. Срезы на 13—30 минут поместить в свежеприготовлен-
ную смесь равных частей 2-процентного раствора желтой кровя-
ной соли и 2-процентной соляной кислоты. Жидкость должна
иметь светло-желтый цвет. Если она принимает зеленый оттенок,
то не годится к употреблению. Промыть дистиллированной во-
дой, докрасить ядра квасцовым кармином и заключить в кедро-
вое масло.
В результате соединения железа окрашиваются в синий цвет.
В препаратах, заключенных в канадский бальзам, берлинская
лазурь постепенно окисляется и бледнеет.
15 Микроскопическая техника 225
Рис. 81 Железосо-
держащие включе-
ния в печеночных
клетках летучей
мыши. Реакция об-
разования турнбу-
левой сини.
Метод с турибулевой синью очень чувствителен и
точен (рис. 81).
Срезы после дистиллированной воды поместить в насыщенный
раствор сернистого аммония на 1—24 часа (раствор должен быть
светло-желтым; сохраняется не больше двух-трех недель), тща-
тельно промыть дистиллированной водой, перенести на 10—20 ми-
нут в свежеприготовленную смесь равных частей 20-процентного
раствора красной кровяной соли (железосинеродистого калия) и
1-процентного раствора соляной кислоты, тщательно промыть
препарат в дистиллированной воде, докра-
сить ядра кармином или сафранином. Заклю-
чить в канадский бальзам. Соли железа
окрашиваются в синий цвет.
Все вышеперечисленные методы выявля-
ют железо, ионизированное или легко иони-
зируемое. Кроме того, в тканях имеется
железо в связанном состоянии («маскирован-
ное»), которое не выявляется изложенными
выше способами. Наиболее надежным мето-
дом выявления связанного железа служит
микросжнгание. При этом железо можно»
узнать по желтовато-красному цвету золы
и, кроме того, оно после сжигания среза вы-
является при помощи методов с берлинской
лазурью и турибулевой синью.
Метод Макаллума позволяет от-
крыть железо в некоторых соединениях, в ко-
торых оно обычными методами часто не
выявляется (хромолипоиды, гемосидерин
и т. д.).
Положить срезы на 1—2 часа при темпе-
ратуре 50—60° (или на 3—10 часов при тем-
пературе 37°) в следующую смесь: 96-градус-
ного спирта — 95 частей и 25-процентной
соляной кислоты — 10 частей. В смеси рас-
творяются соли железа, не связанные с орга-
ническими веществами. Если не нужно дифференцировать связан-
ное и несвязанное железо, эту' операцию можно опустить. Перело-
жить в спирт с серной кислотой (90-градусиого спирта—96 частей,
концентрированной серной кислоты —4 части) на срок от '/г часа
до нескольких часов; сполоснуть в абсолютном спирте; перенести
в дистиллированную воду; положить на 5 минут в свежеприготов-
ленную смесь равных частей 1,5-процентного раствора желтой
кровяной соли и 0,5-процентного раствора соляной кислоты; про-
мыть водой; провести контрастную докраску кармином, заключить
в бальзам обычным способом. Соли железа будут окрашены в си-
ний цвет. После кислого спирта можно также применить для вы-
явления соединений железа метод с турибулевой синью.
226
Медь
Предложена специфическая реакция иа медь, основанная на том, что под
воздействием желтой кровяной соли образуется красная железистосинероди-
стая медь.
Весьма чувствительным и специфическим методом выявления меди являет-
ся реакция с дифеиилкарбазидом. Срезы обрабатывают 10—20 минут смесью
10 сж3 1-процеитиого спиртового раствора дифенилкарбазида и 100 см3 ди-
стиллированной воды. Медь дает нестойкое красио-фиолетовое окрашивание.
Можно пользоваться другим методом; фиксировать 96-градусным спиртом
или 10-процентным формалином при pH = 7; налить иа стекло 6,5-процентиый
раствор гематоксилина (pH = 7). Соединения меди окрасятся в синий или
черно-синий цвет, гемосидерин — в коричневый или черно-коричневый.
Способ не слишком специфичен и его следует контролировать другими
методами.
Цинк
Парафиновые срезы обработать 15 минут при температуре 50° 10-про-
центиым раствором нитропруссида натрия; промыть в проточной воде 15 ми-
нут; накрыть покровным стеклом, под которое ввести каплю 1—5-процеитиого ,
раствора сульфида калия.
В результате цннк будет окрашен в пурпуровый цвет.
Реакция основана на том, что цинк осаждается нитропруссидом, и оса*
док после обработки сульфидом калия становится пурпурным.
Свинец
Ткань фиксируется жидкостью Рего (20 см3 3-процентного двухромово-
кислого калия у 5 см3 формалина). При этом образуется желтый иерастворщ
мый осадок хромата свинца. Препарат можно затем докрасить.
Метод Ивашн. Фиксировать в формалине, поместить срезы в ра-
створ сернистого аммония. В результате образуется сернистый свинец чер-
ного цвета.
Специфичность реакции можно контролировать при помощи перекиси во-
дорода, под воздействием которой PbS должен обесцветиться.
Ртуть
Парафиновые срезы материала, фиксироваиик^го спиртом или формали-
ном, обрабатывают 1-процентным раствором дифенилкарбазида.
В результате образуется осадок фиолетового цвета. Весьма чувствитель-
ный метод.
Предложен также метод для выявления закисной и окисной ртути:
1) из свежезамороженной ткани приготовляют срезы толщиной в 15 щ
2) дают срезам несколько обсохнуть иа предметном стекле; 3) срезы покры-
вают каплей соответствующего реактива (методы приготовления см. ниже),
заклеивают края покровного стекла и препарат через 10 минут рассматривают
в микроскоп.
Металлическая ртуть, образующаяся в ткани, будет иметь вид мельчай-
ших черных шариков. После обработки реактивом для выявления закисной
ртути, кроме черных шариков, через 5 минут появляются характерные жел-
тые кристаллы.
В контрольном реактиве металлическая ртуть образоваться ие должна.
Реактив для закисной ртути: смешивают 1 см3 тиогликолевой кислоты
с 9 см3 глицерина.
Реактив для окисной ртути: смешивают 5 г хлористого олова, 5 г винно-
каменной кислоты и 100 см3 глицерина и нагревают до получения прозрачной
15* 227
жидкости. Прибавляют несколько граммов металлического олова. Раствор
следует хранить в закупоренной бутыли.
Контрольный реактив. Смешивают 5 г вииио-каменной кислоты и 100 см3
глицерина. Оставляют на ночь для растворения.
Мышьяк
Маленькие кусочки ткани следует фиксировать 5 дней в смеси: 10-про-
центного нейтрального формола — 100 см3, CuSCU—2,5 г; промывать в про-
точной воде 24 часа; залить в парафин, разложить на срезы. Можно наблю-
дать без окраски. В местах нахождения мышьяка будут видны зеленые зерна
гидромышьяковистой меди. Можно также покрасить срезы гематоксилином
и эозином, квасцовым кармином или основным фуксином.
Висмут
Для выявления висмута пользуются реакцией, основанной иа образовании
иодовисмутного .хинина, имеющего коричневый цвет и плохо растворимого.
Фиксировать формалином, приготовить замороженные срезы. Обрабатывать
срезы 1 минуту смесью, приготовленной следующим образом: 1) сернокислый
хинин—1 г, воды — 50 см3, азотной кислоты—10 капель; 2) иодистый ка-
лий— 2 г, воды — 50 см3. Непосредственно перед употреблением смешать
равные количества полученных растворов, в смесь прибавить 2 капли офици-
иальиого раствора азотной кислоты и профильтровать.
Быстро промыть срезы в воде, иа каждые 10 см3 которой прибавить
2 капли азотной кислоты. Контрастная окраска геициаиовым фиолетовым
или др.
Висмут выявляется в виде коричневых зерен.
Фосфор
Фосфор имеется в организме либо в ионизированной, либо в «маскиро-
ванной» форме — фосфор, связанный органическими веществами.
Ионизированный фосфор обычно встречается в виде фосфорнокислого
кальция. Методы гистохимического выявления его описаны в разделе, посвя-
щенном кальцию.
Лизои, критически обсуждая различные гистохимические методы обна-
ружения «маскированного» фосфора, указал на высокую специфичность мо-
либденового метода (по Аигели) с применением хлористого олова в качестве
восстановителя.
Аигели обрабатывал срезы растительного материала в течение 20 минут
в смеси; молибденовокислого аммония—3 г, дистиллированной воды—20 см3,
30-процентной соляной кислоты—20 см3, восстанавливал в N/50 хлористого
олова; быстро споласкивал дистиллированной водой и промывал в 2,5-процент-
ном аммиачном растворе. В результате элементы, содержавшие фосфор,
окрашивались в голубовато-зеленый цвет. Реакция весьма специфична.
Серра и Лопес (1945) применяли реакцию молибдата с бензидином, даю-
щую более интенсивную окраску, чем хлористое олово.
«Демаскирование» фосфора производится соляной кислотой в сравни,
тельно небольшой концентрации при низкой температуре, при этом хорошо
сохраняются гистологические структуры.
Модификация молибденового метода Серра и Лопе-
са для фосфора.
Необходимы следующие реактивы:
1) Раствор молибдата. Растворяют 0,5 г молибдата аммония в 20 см3 ди-
стиллированной воды, добавляют 10 см3 30-процентной соляной кислоты и раз-
водят до 50 см3 дистиллированной водой.
2) Раствор уксуснокислого бензидина. Растворяют 25 мг бензидина
в 5 см3 ледяной уксусной кислоты и разводят до 50 см3 дистиллированной
водой.
228
3) Насыщенный раствор уксуснокислого натрия.
Фиксируют ткань в следующей смеси: 96-градусный спирт — 2 части,
формалин — 1 часть; к смеси добавляют несколько капель ледяной уксусной
кислоты. После фиксации материал тщательно промывают водой. Для гидро-
лиза органического фосфора и осаждения свободного фосфора небольшие
кусочки ткани или замороженные срезы обрабатывают указанным выше рас-
твором молибдата, в течение 2—3 недель при температуре 10—12°, а затем
2—3 дня при температуре 20—25°. Для гидролиза требуется длительный
срок, так как кислотность реактива относительно слаба. Покрывают ткань
каплей раствора уксуснокислого бензнднна и через 3 минуты добавляют
2 капли указанного выше раствора уксуснокислого натрия. Заключают в
глицерин, хранившийся с кристаллами уксуснокислого натрия.
Фосфор дает интенсивное синее окрашивание.
Серра и Лопес применяли эту реакцию для выявления фосфора нуклеи-
новых кислот. Идентификация их производилась при помощи иуклеаз.
БЕЛКОВЫЕ ВЕЩЕСТВА
Для гистохимического определения белков применяется целый
ряд методов.
Нингидриновая реакция характерна для продуктов
распада белков и представляет по существу реакцию на «-амино-
кислоты и другие соединения, если в иих входит радикал СООН—
CH—nh2.
Материал фиксировать 10-процентным формолом; промывать
V2—1 час; разложить на срезы на замораживающем микротоме;
срезы кипятить на водяной бане 1 минуту в 2,5 см3 0,2-процептно-
го водного раствора нингидрина, промыть и заключить в глицерин
или в глицерин-желатину. В результате получается синее или фио-
летовое окрашивание в местах нахождения продуктов белкового
распада. Можно также срезы кипятить в смеси равных частей
0,4-процентпого раствора нингидрина в дистиллированной воде и
фосфатного буфера с pH — 6,98.
Краситель, образующийся при нингидриновой реакции, ведет
себя как обычный кислый краситель и может адсорбироваться и
другими клеточными структурами, особенно при длительном на-
гревании объекта или недостаточной фиксации его.
Аллоксановая реакция. 1-процентный спиртовой
раствор аллоксана дает красное или розовое окрашивание с бел-
ковыми веществами.
Замороженные нефиксированные срезы обрабатывают аллок-
саном (длительно — при комнатной температуре или кратковре-
менно при нагревании на водяной бане). С фиксированным ма-
териалом реакция получается слабая. Серра рекомендует вести
обработку при нейтральной реакции, для чего следует употреблять
фосфатный буфер.
К с а итоп ротеинов ая реакция указывает на при-
сутствие в белковой молекуле тирозина, фенилаланина или трип-
тофана. Реакция может получиться и с фенолами, индоловыми
производными, некоторыми алкалоидами и т. д.
Материал фиксируют в смеси из 2 частей 96-градусного спир-
229
та и 1 части формалина. Замороженные срезы в течение несколь-
ких минут обрабатывают концентрированной азотной кислотой;
при этом белки окрашиваются в желтый цвет; промывают дистил-
лированной водой и подвергают воздействию паров аммиака.
Окраска становится оранжевой. Срезы заключают в глицерин.
Диазореакция (см. реакция на гистидин, стр. 235).
Реакция Ромье выявляет в белковых соединениях трип-
тофан. Материал фиксируют формалином, абсолютным спиртом
или жидкостью Буэна; заливают в парафин или лучше в целлои-
дин; наливают па срез каплю концентрированной фосфорной кис-
лоты и накрывают покровным стеклом; затем помещают на не-
сколько минут в термостат при температуре 56° и рассматривают
срез в фосфорной кислоте.
Белковые соединения, содержащие триптофан, принимают вна-
чале красное, затем фиолетовое окрашивание.
Миллон ова реакция (см. реакция на тирозин, стр. 236).
Гистохимические реакции на некоторые ами-
нокислоты. Реакция на аргинин по Серра (1944)
отвечает основным требованиям, которые должны быть предъяв-
лены к гистохимической реакции; 1) она точно локализуется имен-
но в месте нахождения определяемого вещества и не сопровож-
дается диффузной окраской сопредельных зон — это доказывается
рядом убедительных наблюдений; 2) реакция химически специ-
фична, так как она определяется только наличием аргинина, сво-
бодного или входящего в состав сложных белков.
Следует отметить существенное обстоятельство: интенсивность
окрашивания зависит от количества аргинина и, таким образом,
реакция имеет не только качественный, но и в значительной мере
количественный характер, особенно если для определения интен-
сивности окрашивания использовать стандартные цветные табли-
цы, употребляемые, например, в колориметрии. Так как все кле-
точные белки содержат в различных количествах аргинин, то за-
ранее можно предполагать, что все белковые компоненты клеток
будут давать реакцию. Только протеины — с высоким
(15—30% и выше) содержанием аргинина (протамины,
гистоны и некоторые растительные глобулины) дают интенсив-
ную гистохимическую реакцию; все же выводы о ко-
личественном распределении аргинина должны делаться с соблю-
дением должной осторожности.
Гистохимическое исследование (Г. И. Роскин и М. Е. Струве,
1947) показывает, что аргинии содержится в разных тканях в раз-
личных количествах и имеет разную локализацию внутри клеток,
в зависимости от ее физиологического состояния и стадии ее раз-
вития (рис. 82, 83). Примером тканей, богатых аргинином, могут
служить железистый эпителий печени и мускулатура сердца.
В качестве примера клеток, дающих отрицательную реакцию на
аргииии, можно привести эритроциты и глиальные клетки голов-
ного мозга. Аргинин может распределяться относительно равио-
230
Рис. 82. Гистохимическая реакция иа аргииии в различных клетках мле-
копитающих (по Г. И. Роскииу и М. Е. Струве). А—печеночные клетки
мыши; Б — моторные клетки спинного мозга мыши; В — мальпигиевый
клубочек почки мыши; Г —почечный каналец; Д— волокна сердечной
мускулатуры мыши (поперечный разрез); Е— поперечно-полосатая
мускулатура мыши; Ж — гладкая мускулатура тонкой кишки мыши;
3 — кровь крысы.
231
мерно и в ядре и в плазме (печеночные клетки, мускульные волок-
на, моторные клетки спинного мозга, пирамидные клетки коры го-
ловного мозга) или неравномерно, причем главным образом в яд-
ре (эндотелий капилляров, купферовские клетки, ретикулярные
клетки селезенки), или только в ядре (лейкоциты, лимфоциты).
Рис. 83. Схема изменений гистохимических реакций на дезоксирибо-
нуклеиновую и рибонуклеиновую кислоту, аргинин, кальций и магний
в процессе митотического деления (по Г. И. Роскину и М. Е. Струве):
1— аргинин; 2 — дезоксирибонуклеиновая кислота; 3 — рибонуклеиновая кислота;
4 — ионы кальция и магния.
Следует отметить, что во многих тканях ядрышко дает особо
интенсивную реакцию на аргинин (в пирамидных клетках, в мо-
торных клетках спинного мозга, в клетках мочевых канальцев, в
печеночных клетках).
Наиболее пригодным фиксатором служит смесь
следующего состава: 96-градусный спирт — 2 части + 40-процент-
ный формалин — 1 часть; перед употреблением добавляется не-
сколько капель ледяной уксусной кислоты. Продолжительность
фиксации от 12—14 часов, в зависимости от величины кусочков.
После фиксации кусочки тщательно промывают в проточной
воде в течение 12—24 часов и затем прополаскивают в дистилли-
рованной.
Нужно подчеркнуть необходимость тщательной промывки ку-
сочков, так как остаточные следы формалина препятствуют пра-
вильной реакции на аргинин.
232
Второй рекомендуемый фиксатор: спирт — уксус-
ная кислота (3:1) в течение 1—2 часов. Затем обезвоживание в
спирте, после чего кусочки уплотняются в 3-процентном форма-
лине 6—24 часа и тщательно промываются в проточной и дистил-
лированной воде.
Третьим фиксатором может служить 3-процептный
формалин (фиксация 6—18 часов), после фиксации очень тща-
тельная промывка. Можно также пользоваться более крепким ра-
створом формалина, например, 10-процентным формалином.
Для реакции необходимо приготовить следующие реактивы:
1) 1/N раствор NaOH(NaOH должен быть химически чистым).
2) 40-процентный водный раствор мочевины (мочевина должна
быть химически чистой). 3) Слабый раствор «-нафтола.
Для приготовления ела loro раствора «-нафтола берется
1 часть 1-процентного раствора а-нафтола в 96-градусном спирте
+ 10 частей 50-градусного спирта.
4) Водный раствор 2-процентного гипобромида натрия. Для
приготовления водного раствора гипобромида натрия берется
25 см3 5-процентного водного раствора NaOH и добавляется
0,15 см3 брома. Реактивы должны быть свежими (хранить на
холоду, в противном случае реакция на аргинин не удается).
Для проведения гистохимической реакции
нужно изготовить тонкие срезы на замораживающем микротоме.
Срезы помещают в свежеприготовленную смесь: 2 см3 1/N рас-
твора NaOH 4- 2 см3 слабого раствора а-нафтола + 0,8 см3
40-процентного водного раствора мочевины (раствор должен быть
прозрачным). В эту смесь помещают срезы на 10—12 минут. За-
тем к смеси добавляют 0.8 см3 2-процентного раствора гипобро-
мида натрия (при этом смесь окрашивается в оранжевый цвет)
и тщательно взбалтывают в течение 2—3 минут. Затем туда же
добавляется 0,8 см3 40-процентного раствора мочевины и 0,8 см3
2-процентного раствора гипобромида натрия (смесь окрашивается
в оранжево-красный цвет) и тщательно взбалтывают 3—5 минут.
Если смесь окрашена слабо, то следует добавить еще 0,8 см3 ги-
побромида натрия. Цветная реакция появляется и достигает мак-
симума через 5—10 минут.
Рекомендуется реакцию проводить на холоду (в ледяной
бане).
Аргинин дает оранжево-красное окрашивание. Через 10 минут
срезы вынимаются из смеси и заключаются в глицерин. Окраши-
вание (т. е. цветная реакция на аргинин) сохраняется в течение
нескольких недель и затем постепенно бледнеет.
Метод Серра (1944) является приспособлением биохимическо-
го метода Сакагуши к задачам гистохимии.
Бекер (1947) предложил другую модификацик) этого же ме-
тода. Фиксируют смесью Буэна, Ценкера или 10-процентным
формалином. Заливают в парафин. Для реакции можно исполь-
зовать срезы, покрытые коллодием (см. стр. 152). Срезы обычным
233
образом доводят до воды, споласкивают в воде и осушают фильт-
ровальной бумагой. Затем помещают на 15 минут в раствор а-наф-
тола и гипохлорида, осушают фильтровальной бумагой, после че-
го срезы проводят через смесь равных частей хлороформа и пири-
дина; срезы заключают в смеси пиридина и хлороформа или в
в чистом пиридине. Белки, содержащие аргинин, окрашиваются
в различные оттенки оранжево-красного цвета. Раствор а-нафто-
ла и гипохлорида: к 2 см3 10-процентного NaOH добавляют
2 капли 1-процентного раствора а-нафтола в 70-процентном спир-
те и 4 капли раствора гипохлорида (1 г NaOCl и 18 г NaCl в
100 слг3 дистиллированной воды).
Реакция на триптофан Ваузене — Фюрта в
модификации Серра и Кейроз-Лопес (1946). Фик-
сируют 1—3 часа формалином маленькие кусочки ткани; срезы,
изготовленные па замораживающем микротоме, помещают на 3—
5 секунд в водный раствор силиката натрия (плотность 1,1); за-
тем, не промывая, их переводят на 10—15 минут в закрытый фла-
кон со свежеприготовленным реактивом Ваузене (соляная кисло-
та— 10 см3, 2-процентный формалин—1 капля, 0,5-процентпый
раствор азотистокислого натрия (NaNOj— 1 капля), и, не промы-
вая, заключают в глицерин; реакция чувствительная, но быстро
проходящая.
Реакция натриптофан по методу Кедровско-
гоиТрухачевой (1952). Фиксация спиртом, спирт-формолом,
заливка в желатину. Желатиновые блоки, если надо, уплотняют-
ся в слабом растворе формалина. Возможно тонкие срезы обраба-
тывают 5 минут 5-процентным раствором альдегида Эрлиха (па-
радиметиламинобензальдегид) в 10-процентной серной кислоте
(реактив сохраняется 2—3 педели), затем помещают на '/г—1 ми-
нуту в концентрированную серную кислоту (до пожелтения сре-
зов) , после чего переносят в дистиллированную воду или в новую
порцию реактива. Участки ткани, содержащие гистохимически
определимый триптофан — красно-лиловые или фиолетовые. На-
ступающее при реакции на триптофан окрашивание исчезает в
течение, примерно, 5 минут.
М и л ло нов а реакция на тирозин (модификация по
Бенсли и Гершу). Приготовление миллонова реактива: к 400 см3
азотной кислоты (уд. вес 1,42), прибавляют 600 см3 дистиллиро-
ванной воды и оставляют стоять 48 часов. Разбавляют 1 : 9 ди-
стиллированной водой и прибавляют до насыщения кристалличе-
ской азотнокислой ртути, фильтруют и добавляют к 400 см3 фильт-
рата 3 елг3 исходной разведенной азотной кислоты и 1,4 г NaNO3.
Материал фиксируют формалином или 96-градусным спиртом,
заливают в парафин. Парафин из срезов удаляют бензином; спо-
ласкивают безводным ацетоном и дают ему испариться. Срез по-
крывают миллоновым реактивом и оставляют до появления мак-
симального окрашивания, или же срезы, находящиеся в закрытой
бактериологической чашке, помещают в термостат (60° С), где
234
реакция заканчивается в течение 30—60 минут. Споласкивают хо-
лодным или подогретым 2-процентным раствором азотной кисло-
ты (2 см3 азотной кислоты, уд. вес 1,42, добавляют к 98 см3 ди-
стиллированной воды). Быстро обезвоживают в спиртах, ксилол,
бальзам. Протеины, содержащие тирозин, окрашиваются в оран-
жевый или розово-красный цвет; окраска сохраняется без измене-
ния несколько месяцев.
Реакция на гистидин по Брунсвику. Срезы обра-
батывают свежеприготовленной диазобензолсерной кислотой. Бел-
ки окрашиваются в красный или оранжевый цвет. По мнению не-
которых авторов, эта реакция указывает на то, что белок содер-
жит тирозин и гистидин. Если срезы предварительно обрабаты-
вать 33-процентной азотной кислотой, промыть их водой, затем
концентрированным раствором соды и, наконец, диазобензосер-
ной кислотой, то появление красного окрашивания укажет на
присутствие в белке только гистидина. По-видимому, диазореак-
ция выявляет только феноловые соединения.
Приготовление диазобензолсерной кислоты: 2 а сульфанило-
вой кислоты размешивают в 3 см3 дистиллированной воды +2 см3
ледяной уксусной кислоты. К полученной взвеси по каплям при-
бавляют раствор 1 г азотистокислого натрия в 2 см3 дистиллиро-
ванной воды. Жидкость фильтруют, осадок промывают водой на
фильтре, высушивают и растворяют в концентрированном раство-
ре соды. Годится только свежеприготовленный реактив. Осадок
должен быть белым. Пожелтевший осадок или раствор негоден
для употребления.
Фиксатор К ретена и Мао (1946) — это реактив Берг-
манна и Фокса для осаждения аминокислот, примененный для
гистологических целей. К литру 10-процентного раствора хромово-
кислого калия прибавляют по частям (20—30 г) 300 г кристал-
лической щавелевой кислоты. Жидкость становится коричневой,
затем фиолетовой и щавелевая кислота перестает растворяться.
Перед употреблением разводят основной! раствор водой в 4—5 раз
и добавляют 2—3% «метиленов»; можно добавить также и 5%
уксусной или трихлоруксуспой кислоты. Этот фиксатор осаждает
следующие аминокислоты: гликоколь, аланин, валин, лейцин, ци-
стин, цистеин, тирозин, пролин, аспарагин и аргинин. Фиксатор
хорошо сохраняет гистологические структуры и почти не сжимает
ткани. Особенно хорошо фиксируется костная ткань. Фиксации
можно дополнить последующей обработкой хромовой кислотой
или двухромовокислым калием.
«Метиленами» французские авторы называют смесь, которую
во Франции прибавляют к спирту при изготовлении спирта-дена-
турата. «Метилены» — смесь продуктов перегонки дерева, состоя-
щая из различных альдегидов, фурфурола, кетонов, древесно-
го уксуса. Прибавление 2—3% «мителенов» к различным фик-
саторам весьма улучшает результаты фиксации (Ланжерон,
1949).
235
Мочевина
Реакция на мочевину. Реакция основана на том, что
мочевина в тканях под воздействием ксантгидроля образует агре-
гаты игольчатых кристаллов диксантилмочевины.
Небольшие кусочки ткани (реактив плохо проникает) фикси-
руют 6—12 часов в 6-процентном растворе ксантгидроля в ледяной
уксусной кислоте, промывают 48 часов в абсолютном спирте (не-
сколько раз сменить) и через ксилол (не больше часа) заливают в
парафин. Ядра окрашивают гематоксилином. Кристаллы имеют
светло-желтый или светло-зеленый цвет и хорошо видны. Ксант-
гидроль в присутствии воды образует сходные кристаллы, но они
хорошо растворяются в спирте. Раствор ксантгидроля нужно всег-
да приготовлять заново. Нерастворенный ксантгидроль следует
хранить в плотно закрытой банке, завернутой в черную бумагу.
Локализация кристаллов часто не совпадает с расположением
мочевины в живой клетке, поэтому гистохимическое значение
реакции невелико.
Нуклеиновые кислоты
Основные гистохимические методы определения нуклеиновых
кислот базируются на реакциях трех их основных компонентов:
фосфорной кислоты, углеводов и оснований. Для гистохомиче-
ского определения пуриновых и пиримидиновых оснований слу-
жит микроспектрография в ультрафиолетовых лучах (см. стр. 55),
так как эти вещества избирательно абсорбируют ультрафиолето-
вые лучи с длиной волн 260 wa. Реакции нуклеиновых кислот с
рядом основных красителей (метиловым зеленым, пиронипом, ма-
лахитовым зеленым, тионином и т. д.) основаны, как полагают
многие исследователи, на способности этих красителей давать со-
леобразные соединения с отрицательно заряженной группой нук-
леиновых кислот, а именно с фосфорной кислотой. Примером ис-
пользования таких реакций является окраска метиловым зеленым
и пиропином (см. метод Браше, стр. 240). Реакция па углеводы
для определения нуклеиновых кислот использованы в методах
Фельгена, а также Турчини. Представляют интерес новейшие ис-
следования с применением инфракрасных лучей: дезоксирибонук-
леиновая и рибонуклеиновая кислоты дают интенсивные полосы
поглощения в зоне 8,1 и, 9,35 «и 10,3 и, причем дезоксирибонукле-
иновая отличается от рибонуклеиновой кислоты резко выраженной
полосой поглощения в зоне 9,8 и: Исследователи полагают, что
абсорбция нуклеиновыми кислотами инфракрасных лучей опреде-
ляется, повидимому, присутствием сахаров (рибозы и дезоксири-
бозы), а также фосфорной кислоты.
Реакция Фельгена является методом выявления в клет-
ках дезоксирибонуклеиновой (тимопуклеиновой) кислоты. Реак-
ция Фельгена состоит из двух процессов: гидролиза и окрашива-
ния с реактивом Шиффа. Исследования Стесей и его сотрудников
236
(1946, 1949) показали, что дезоксирибоза, входящая в состав ти-
монуклеиновой кислоты, при гидролизе превращается в альдегид,
дающий красное окрашивание с реактивом Шиффа (фуксин-сер-
нистая кислота), который является весьма чувствительным реак-
тивом на альдегиды. Тонкость и специфичность реакции Фельгеиа
на дезоксирибонуклеиновую кислоту подтверждена многочислен-
ными исследователями.
Это, однако, не означает, что метод Фельгена автоматически
может быть применен для выявления тимонуклеиновой (дезокси-
рибонуклеиновой) кислоты в любых цитологических условиях.
К нему применимо общее для любого экспериментального метода
положение: необходимо учитывать наиболее благоприятные усло-
вия осуществления данной реакции. Для реакции Фельгена наибо-
лее существенное значение имеют два обстоятельства. Во-пер-
вых,— это способ фиксации. Так, например, исчезновение реак-
ции Фельгена в процессе созревания ядра яйцеклеток (например,
на стадии «перистых» хромосом) является артефактом, зависящим
от применения неподходящего для данного объекта фиксатора —
сулемы с уксусной кислотой, — вызывающего набухание хромосом
и их растворение в результате гидролиза. Во-вторых, — это кон-
центрация дезоксирибонуклеиновой кислоты. Реакция Фельгена
может быть отрицательной в условиях большой дисперсности и
относительно малых количеств дезоксирибонуклеиновой кислоты.
Так, например, на определенных стадиях развития яйцеклеток
лягушки реакция Фельгена становится отрицательной, однако при
энергичном центрифугировании на центрифужном поле ядра со-
бирается один или несколько комочков, дающих положительную
реакцию Фельгена. Природа протеинов, с которыми связана дезо-
ксирибонуклеиновая кислота в разных клетках и у различных ви-
дов животных, также может оказывать значительное влияние на
течение реакции Фельгена.
В последнее время некоторые авторы критиковали утвержде-
ние о специфичности и строгой локализации реакции Фельгена;
одни утверждали, что при проведении реакции образуется основ-
ной растворимый краситель, который вторично окрашивает базо-
фильный белок «хромосомин», другие предполагали, что окраска,
например, хромосом, определяется не химической реакцией, а ад-
сорбцией красителя на поверхности структур. Экспериментальная
проверка этих утверждений показала их несостоятельность. Важ-
но, что различные методы — гистоспектрография в ультрафиоле-
товых лучах, окрашивание определенными красителями, реакции
Фельгена, Браше и Турчини дают совпадающие результаты по
нахождению и распределению нуклеиновых кислот в клетках и
тканях. Кроме того, доказано, что реакция Фельгена не получается
после обработки препарата ферментом тимонуклеодеполимеразой.
Очень убедителен опыт, в котором биохимически очищенный пре-
парат тимонуклеиновой кислоты обрабатывали фиксатором Цен-
кера, а полученный при этом преципитат заливали в агар и изго-
. 237
товляли срезы: положительную реакцию Фельгена давали только
те участки, где находился преципитат.
Фиксировать материал для реакции Фельгена можно рядом
цитологических фиксаторов (жидкости Шампи, Флемминга без
уксусной кислоты, Ценкера, Буэна — Аллена, Гелли). Реакцию
можно проводить на мазках, срезах и кусочках.
Срезы, вынутые из дистиллированной воды, споласкивают
холодной 1/N соляной кислотой, а затем подвергают гидролизу
при 60° в 1/N соляной кислоте (82,5 см'1 соляной кислоты с удель-
ным весом 1,19 на 1 л дистиллированной воды) в течение 4 —
15 минут, иногда до 25 минут. Время гидролиза зависит от иссле-
дуемого материала и примененной фиксации и определяется опыт-
ным путем. В большинстве случаев оно составляет 4—6 минут.
У низших беспозвоночных обычно больше: 8—12 минут.
Необходимая длительность гидролиза при разных фиксаторах:
Смесь Буэна-Дюбоска 6 минут Смесь Гелли 8 минут
» Еуэ.ча-Аллена 22 » » Петрункевича 3 »
» Карнуа 6 » > Ценкера 5 »
т> Шампи 25 » » Ценкера с добавле-
» Флемминга 16 » » нием формалина 5 »
Гидролиз следует производить в стеклянном стакане на водя-
ной бане при постоянно контролируемой температуре нли в тер-
мостате. Высоту уровня жидкости отмечают на стенке стакана
восковым карандашом, по мере испарения добавляют дистилли-
рованную воду.
Препарат споласкивают в дистиллированной воде, помещают
в фуксин-сернистую кислоту на 1—2 часа, три раза промывают
водой, содержащей SO2 (для того, чтобы удалить из него остатки
реактива Шиффа и свободного фуксина). В каждом сосуде с сер-
'нистой водой держат препарат по 2 минуты. Промывают в проточ-
ной воде 5—10 минут, обезвоживают, проводят через ксилол и
заключают в канадский бальзам. Дезоксирибонуклеино-
вая кислота окрашивается в красно-фиолетовый цвет. Плаз-
му можно докрасить светлым зеленым.
Приготовление фуксин-сернистой кислоты
(реактив Шиффа): 1 г основного фуксина тщательно растереть в
фарфоровой ступке и растворить в 200 с.«3 кипящей воды; осту-
дить до 50° и прибавить 20 см3 1/N соляной кислоты; остудить до
25° и прибавить 1 г сухого бисульфита натрия (NaHSO3). Налить
в склянку с хорошо притертой пробкой, плотно закрыть и хранить
в темноте. Через несколько часов жидкость начнет обесцвечивать-
ся, а через 24 часа она годна к употреблению. Жидкость должна
быть бесцветной или иметь слабо желтый цвет. Когда она окра-
шивается в розовый или красный цвет, употреблять ее больше
нельзя. Приготовление сернистой воды: к 200 см3
дистилливованной воды нужно прибавить 10 ел3 10-процептпого
238
раствора бисульфита натрия и 10 см3 I/N соляной кислоты. Гото-
вить каждый раз перед употреблением.
При проведении реакции каждый раз обязательно следует ста-
вить контроль: часть препаратов без предварительного гидролиза
на 10—15 минут помещают в фуксин-серннстую кислоту. При этом
не должно получаться красно-фиолетового окрашивания.
Многие исследователи советуют готовить реактив Шиффа по
прописи Томази: растворяют 1 г основного фуксина в ?00 см3 ки-
пящей дистиллированной воды. Взбалтывают в течение 5 минут
и затем охлаждают точно до 50°. Фильтруют, после чего добав-
ляют к фильтрату' 20 см3 1/N НС1. Охлаждают до 25° и добав-
ляют 1 г метабисульфита натрия (или калия) (Na2SsO5). Раствор
оставляют в темноте па 14—24 часа. Затем добавляют 2 г акти-
вированного угля и взбалтывают 1 минуту. Фильтруют. Раствор
хранят в темноте при температуре 0—4°. Перед гидролизом полез-
но 24 часа выдержать в 96-градусном спирте для удаления ли-
пидов.
Метод выявления в клетках и тканях рибо-
нуклеиновой кислоты. Основным моментом этого мето-
да, разработанного Браше, является сравнение двух препаратов
(срезы или мазки), один из которых предварительно обрабаты-
вается ферментом рибонуклеазой, растворяющим рибонуклеино-
вую кислоту и не затрагивающим тимонуклеиновую кислоту. Ри-
бонуклеазу можно получить (Роскин и Гинзбург 1944; Роскин и
Харлова, 1944) следующим образом. Свежую бычью поджелудоч-
ную железу оставляют на воздухе в течение 5—6 часов, затем, к*
тщательно размельченной железе добавляют полтора объема 0,1 N
уксусной кислоты и помещают па 24 часа в термостат при темпе-
ратуре 37°, после этого смесь кипятят 10 минут и фильтруют через
бумажный фильтр. Фильтрат нейтрализуют двууглекислым натри-
ем и снова фильтруют. Жидкую часть диализируют в коллодий-
ных или целлофановых мешочках Р/г—2 суток. Затем центрифуги-
руют. Прозрачная жидкость содержит рибонуклеазу. Срезы или
мазки (предварительно зафиксированные смесью Гелли) поме-
щают на 90 минут в раствор рибонуклеазы при температуре
60—65°. Одновременно контрольные препараты на то же время
и при той же температуре помещают в дистиллированную
воду.
Препараты, обработанные рибонуклеазой и дистиллированной
водой, окрашивают метиловым зеленым и пиронином.
По-видимому, пиронин окрашивает специфически клеточные
элементы, содержащие рибонуклеиновую кислоту, исчезающую
после предварительной обработки рибонуклеазой и остающуюся
на препаратах, обработанных только горячей дистиллированной
водой.
Далеко не все марки метилового зеленого и пиронина пригод-
ны. Часто рекомендуют пиронин G или У. Метиловый зеленый мо-
23&
жет содержать примесь метилового фиолетового, поэтому к рас-
твору красителя добавляют хлороформ и, взбалтывая, извлекают
им примеси.
Объект фиксируют смесями Ценкера или Гелли, но предпочти-
тельно фиксировать недолго (4—16 часов) небольшие кусочки
ткани 10-процентиым формалином (pH 7,0 ± 0,2). Заливка в па-
рафин. Срезы окрашивают метиловым зеленым и пиронином по
Унна (см. стр. 204) или же прибегают к более точному методу ок-
раски. Приготовляют два раствора. Раствор А: 5-процентный вод-
ный раствор пиронина—15,5 мл, 2-процентный водный раствор
метилового зеленого (предварительно очищенного хлорофор-
мом) — 10 с.’.Т1, дистиллированной воды 250 см?. Раствор Б: М/5
ацетатный буферный раствор pH 4. 8. Перед употреблением сме-
шивают равные части растворов А и Б; смесь пригодна не более
недели. Срезы окрашивают от 10 минут до 24 часов. Быстро спо-
ласкивают дистиллированной водой и избыток влаги удаляют
фильтровальной бумагой. Быстро обезвоживают в абсолютном
ацетоне. Споласкивают в смеси равных частей ацетона и ксило-
ла, проводят через 10-процентный раствор ацетона в ксилоле, кси-
лол (дважды сменить), нейтральный бальзам. Препараты можно
красить также и по методу Домииичи или азур-эозином Макси-
мову (Роскии и Гинзбург, 1944), соответственно окрашивая кон-
трольные и обработанные рибонуклеазой препараты.
Так как рибонуклеаза содержится в слюне, то препараты мож-
но обрабатывать слюной. В нашей лаборатории поступают сле-
дующим образом: слюну предварительно фильтруют, прогревают
на водяной бане 1 час при температуре 80—85° (при нагревании
разрушаются все ферменты, кроме термостабильной рибонукле-
азы) .
Срезы помещают в обработанную таким образом слюну на 8—
12 часов при температуре 60°. Другую часть препаратов обраба-
тывают дистиллированной водой в течение того же срока и при
той же температуре.
Рибонуклеиновую кислоту можно экстрагировать (по методу
Эриксона, 1949) из срезов обработкой 10-процеитной хлорной
кислотой (12—18 часов при 4° С). Затем нейтрализуют 1-про-
центным раствором углекислого натрия (1—5 минут), промыва-
ют и окрашивают обработанные и контрольные срезы по Унпа или
1-процентным раствором толуидинового синего.
Особо богаты рибонуклеиновой кислотой эмбриональные клет-
ки (Браше, 1940, 1941), клетки регенерирующих тканей и клетки
злокачественных опухолей (Роскин и Харлова, 1944); плазма раз-
личных Protozoa содержит много рибонуклеиновой кислоты (Рос-
кин и Гинзбург, 1944). Ядрышки самых различных клеток также
содержат рибонуклеиновую кислоту.
Метод Т урчи нн для нуклеиновых кислот.
Турчини и его сотрудники (1943—1945) предложили новую цвет-
ную реакцию, позволяющую выявить rf-рибодезозу и d-сибозу.
240
В результате реакции тимонуклеиновая кислота окрашивается
в сине-фиолетовый цвет, а рибонуклеиновая кислота — в жел-
то-розовый цвет.
Для приготовления реактива в 100 сл3 96-градусного спир-
та, содержащего 15 капель концентрированной серной кислоты,
растворяют 80 лг Р-феиил (или метил) —2, 6, 7-тригидрокси—
3-флуорона (С13Н8О2).
Реакция. Ткань фиксируют в жидкости Буэна и обычным
способом приготовляют парафиновые срезы.
При применении м ети л тр иг и д р ок с и-ф л у о р о н а
депарафинированные срезы гидролизируют -в 1/N соляной кис-
лоте при 60° в течение 5 минут, промывают водой, затем спир-
том и обрабатывают 5—10 минут реактивом. Промывают их
несколькими каплями 90-градусного алкоголя и затем 1-про-
центным углекислым натрием, споласкивают водой, заключают в
бальзам.
При использовании ф е н и л т р и г и д р о к с и-ф л у о р о н а
поступают так же, но гидролиз проводят на холоду в 25-процент-
ной соляной кислоте, разведенной в 90-градусном спирте (3—
5 минут).
Серьезного внимания при исследовании нуклеиновых кислот
заслуживает метод окраски по Эйнарсону (1951) галлоциани-
ном с хромовыми квасцами. Для приготовления кра-
сителя растворяют 5 г хромовых квасцов K2SO4 Сг2(5О4)э •
24 Н2О в 100 см3 дистиллированной воды, добавляют 0,15 г
галлоцианина и тщательно размешивают. Затем смесь постепенно
доводят до кипения. Кипятят 5 минут, охлаждают до комнатной
температуры, фильтруют, добавляют дистиллированной воды, что-
бы общий объем раствора красителя был равен 100 см3; pH кра-
сителя 1,64.
Эйнарсон (1951) и Зандриттер (1954) установили, что катио-
ны красителя соединяются с отрицательно заряженными группа-
ми нуклеиновых кислот, давая светло-синие окрашенные комплек-
сы, Зандриттер в опытах in vitro показал количественный харак-
тер реакции этого красителя с нуклеиновыми кислотами. По мне-
нию Зандриттера, галлоциаиии-хромовые квасцы являются един-
ственным красителем, который позволяет делать выводы о количе-
стве обеих нуклеиновых кислот в клетках, а при использовании
рибонуклеазы и о раздельном их количестве. Такое селективное
окрашивание неуклеиновых кислот осуществляется только при
очень низком значении pH (от 0,83 до 1,1). Зандриттер указыва-
ет, что при pH 1,64 также окрашиваются только нуклеиновые
кислоты.
При более высоких значениях pH окрашиваются другие белки
и окрашивание перестает быть селективным для неуклеиновых
кислот. Для получения нужной реакции к 40 см3 раствора краси-
теля добавляют /М НС1 в количестве, указанном в таблице.
16 Микроскопическая техника 241
колич. добавл. 1/M HG1 pH колич. добавл. 1/M HCI рн
10 см1 0,8г 4 гла3 1,14
9 » . 0,9С 3 » 1,18
8 » 0,92 2 » 1,29
7 » 0,94 1 » 1,44
6 » 1,02 0 » 1,64
5 » 1,10
В качестве фиксатора следует пользоваться спиртом или
смесью Карнуа, другие фиксаторы могут быть причиной усиления
неспецифического окрашивания клеточных компонентов. Срезы
или мазки доводят до воды. Красят 48 часов (при комнатной тем-
пературе). Быстро споласкивают водой, обезвоживают в спиртах,
просветляют в ксилоле и заключают в нейтральный бальзам.
Методика фиксации может влиять на количество сохранив-
шихся нуклеиновых кислот. Как показал Моннэ (1955), фиксация
печени морской свинки жидкостью Карнуа (при комнатной тем-
пературе) приводит к потере рибонуклеиновой кислоты в первые
два часа 20%, через 4 часа — 24%, через 20 часов — 59%; дезок-
сирибонуклеиновая кислота в те же сроки теряется в меньшей сте-
пени: 0—3—14%. При фиксации той же жидкостью, но на холоду
(+4° С) через два часа происходит потеря 2% РНК, через 20 ча-
сов— 29%', а ДРНК соответственно 0% и 5%. Метод заморажи-
вания-высушивания не дает потерь РНК и ДРНК- Исследование
базофилии (окрашивание толуидиновым синим, контроль рибону-
клеазой) щитовидной железы при разных методах фиксации по-
казывает, что в замороженном-высушенном материале после об-
работки рибонуклеазой базофилия цитоплазмы практически от-
сутствует, в то время как после фиксаторов Ценкера, Буэна или
Карнуа во многих препаратах наблюдается синее окрашивание
цитоплазмы, что обусловливается неполным удалением РНК-
Глютатион
Гистохимическое исследование глютатиона можно проводить
на свежих или фиксированных объектах. Для нефиксиро-
ванных объектов (мазки, тонкие срезы бритвой, срезы на
замораживающем микротоме) применяют нитропруссид-
ную реакцию, обоснованную Гопкинсом и разработанную
для гистохимических целей Жуайе— Лаверном и Рапкиным. Па-
ниель (1951) рекомендует проводить нитропруссидную реакцию
следующим образом: 1) изготовить на замораживающем микрото-
ме срезы толщиной в 100 и, 2) фиксировать 2—3 часа формали-
ном, 3) возможно быстрее залить в парафин и изготовить срезы
(8—10 !*), 4) обработать в течение 30—60 секунд срезы 5-про-
центным раствором уксуснокислого цинка, 5) налить на пред-
метное стекло каплю 2-процентного раствора нитропруссида нат-
рия, прибавить кристаллик сульфата аммония и каплю концен-
трированного раствора аммиака. Зоны нахождения свободных
242
групп SH (т. е. восстановленного глготатиона) окрашиваются в
красноватый цвет. Специфичность реакции бесспорна. Окислен-
ный глютатион и группы SH, связанные с протеинами, не выяв-
ляются при этой реакции. Для выявления тотального глютатио-
на свежую ткань обрабатывают 5—10 минут 10-процентным рас-
твором KCN. При этом восстановленный глютатион остается почти
без изменения, в то время как окисленный глютатион восстанав-
ливается. После этого можно определить тотальное количество
глютатиона с помощью нитропруссидной реакции или реакции
Шевремона и Фредерика (1943). Сульфгидрильные радикалы,
связанные с протеинами, можно демаскировать с помощью три-
хлоруксусной кислоты. Для этой цели кусочки ткани несколько раз
обрабатывают 10-процентным раствором трихлоруксусной кисло-
ты, каждый раз хорошо промывая водой. Таким образом экстра-
гируют восстановленный и окисленный глютатион, затем исполь-
зуют указанные реакции.
Метод Шевремона и Фредерика (1943) с успехом
применяется в нашей лаборатории для выявления глютатиона как
в свежих, так и фиксированных тканях. Маленькие кусочки ткани
фиксируют в формалине (или в смеси Буэна) несколько часов
(не более 24); быстро заливают в парафин (вся заливка — 4 часа);
срезы очень тщательно моют дистиллированной водой для удале-
ния формалина, затем проводят последовательно через три сосуда
(в каждом по 20—25 минут), содержащих свежеприготовленную
смесь химически чистых реактивов: 0,1-процентного раствора
железосинеродистого калия—1 часть, 1-процеитиого раствора
полуторахлористого железа — 3 части (ие прикасаться металличе-
скими инструментами). Тщательно промывают водой и заключают
обычным образом в бальзам или, без обезвоживания, в сироп
левулезы. Зоны, содержащие SH-группы, синие (мелкозернистый
осадок).
УГЛЕВОДЫ
Для гистохимического анализа углеводов в настоящее время
используют ряд методов, основанных на одном и том же принципе:
с помощью окислителей из полисахаридов получают высокомоле-
кулярные альдегидные соединения, которые выявляют, пользуясь
реактивом Шиффа. Таков метод Бауэра, использующего для окис-
ления хромовую кислоту, метод Каселла, применяющего перман-
ганат калия, метод А. Л. Шабадаша, применившего перйодат ка-
лия и натрия и, наконец, метод Мак Мануса и Готчкисса, исполь-
зующих иодную кислоту. Последний метод (PAS-реакция)
наиболее детально изучен с химической стороны: показано, что
при этом методе из а-гликолевых и а-кетоловых групп, а-амино-
алкоголей и а-алкиламиноалкоголей, а также липидов получаются
альдегиды, дающие затем красное окрашивание с реактивом
Шиффа. PAS-реакция выявляет целую группу веществ: 1) поли-
сахариды, 2) мукополисахариды, 3) мукопротеины и гликопроте-
16* 243
йны, 4) гликолипиды н фосфолипиды, и наконец, нейтральные
жиры. Однако пользуясь рядом вспомогательных приемов, можно
более точно определить природу вещества, давшего положитель-
ную PAS-реакцию. Хотя субстрат окисления при окислении хро-
мовой и иодной кислотой один и тот же, но течение реакции
И темп образования продуктов реакции совершенно различные.
При иодной кислоте (первый этап) реакция завершается очень
быстро и уже через 5 минут наблюдается максимально интенсив-
ная окраска с реактивом Шиффа, второй же этап реакции окисле-
ния— разрушение образовавшихся альдегидных групп — насту-
пает очень медленно и в столь малом количестве, что на гисто-
химической реакции практически не отражается. Иная картина
наблюдается при использовании 10-процентной хромовой кислоты.
В этом случае максимально Интенсивная окраска с реактивом
Шиффа наступает через 30 минут и остается на этом уровне
Около часа, затем наступает второй этап окисления — образова-
ние карбоксиловых групп из альдегидов — и примерно через
1‘Л часа окраска с реактивом Шиффа начинает постепенно осла-
бевать.
Метод Готчкисса (1948). Фиксация формалином, спир-
том, смесью Буэна или другими фиксаторами в зависимости от
цели исследования. Заливка в парафин или срезы на заморажива-
ющем микротоме. Срезы кладут на 5 минут в иодную кислоту,
споласкивают 2—3 раза 70-градусным спиртом и помещают на
1—5 минут в восстановительную баню для удаления из срезов
йодатов и перйодатов, снова споласкивают 70-градусным спиртом
и кладут на 20 минут в реактив Шиффа (см. стр. 239). Затем
промывают 10 минуте проточной воде. Паниель (1951) рекомен-
дует сперва промыть сернистой водой. Докрашивают ядра квас-
цовым гематоксилином или малахитовым зеленым, обезвоживают
и заключают в нейтральный бальзам или пластмассу. Муцин эпи-
телиальных клеток — пурпурно-красный; мукопротеины и ней-
тральные мукополисахариды — темно-пурпурно-красные; глико-
ген— пурпурно-красный; гликопротеины — бледно-красные или
розовые; зерна тучных клеток,— красные; ядра — темно-синие.
Наличие гликогена контролируется обработкой птиалином; липи-
ды— экстрагированием в смеси спирта с эфиром; гиалуроновая
кислота — обработкой гиалуронидазой. Мак Манус и Кесон
(1950) предложили следующий метод контроля: 1) срезы доводят
до воды и одну часть препаратов (А) переносят непосредственно в
реактив Шиффа; 2) две другие части препаратов (В, С) обрабаты-
вают 45 минут в смеси 13 с.и3 уксуснокислого ангидрида и 20 е.и3
пиридина, затем промывают водой; 3) препараты С обрабатыва-
ют 45 минут 0,1N КОН, затем промывают водой, 4) все три груп-
пы препаратов обрабатывают по методу Готчкисса. Положитель-
ная реакция на препаратах А и С и отрицательная на препарате
В подтверждают углеводную природу исследуемого материала.
Иодная кислота; растворяют 0,4 г иодной кислоты
244
(HJO4'2H2O) в 35 см3 этилового спирта, добавляют 5 с.и3 М/5
ацетата натрия (27,2 г в 1 л воды) и 10 см3 дистиллированной во-
ды; в темноте смесь может храниться несколько дней. Восста-
новительная баня: растворяют 1 г йодистого калия и 1 г
тиосульфата натрия (Na2S2O3 5Н2О) в 20 см3 дистиллированной
воды и постепенно прибавляют, все время взбалтывая, 30 слг3 эти-
лового спирта и затем 0,5 см3 2NHC1 (20-процентный раствор
концентрированной НО); осадок должен осесть на дно; реактив
сохраняет годность до 2 недель.
Недавно Лотка (1952) предложил новый метод окисления вис-
мутокислым натрием с последующим применением реактива Шиф-
фа для выявления образующихся альдегидов. Фиксируют 10-про-
центным формалином; срез помещают на 2—3 часа в 1-процент-
ный раствор висмутокислого натрия в 20-процентной фосфорной
кислоте.
В гистологической практике часто встречаются вещества, от-
носящиеся, в широком смысле, к муцинам, например, основное
вещество хряща, сарколемма, базальная мембрана эпителия, кол-
лоид эндокринных желез, слизистые выделения эпителия. С гисто-
химической точки зрения их объединяет присутствие углеводов, в
отдельности или в сочетании с протеинами или липидами. Биохи-
мически эти вещества еще не вполне изучены, но гистохимически
их можно выявить методом иодная ' кислота — реактив Шиффа.
Некоторые виды слизи и сарколемма дают слабую реакцию. Пред-
варительная обработка гистологических срезов слабыми раство-
рами NaOH в некоторых случаях усиливает цветную реакцию.
Этот способ позволяет дифференцировать слабо окрашивающиеся
мукополисахариды, мукопротеины и гликопротеины. У первых
цветная реакция заметно усиливается, у вторых — окраска интен-
сифицируется слабо и непостоянно, у третьих — не изменяется.
Схема реакции по Хэлу (1953): срезы обрабатывают слабым рас-
твором NaOH 15 минут (при 22° С), промывают водой, иодная
кислота—15 минут, промывают водой, реактив Шиффа — 30 ми-
нут, промывают водой, обезвоживают в 90-градусном и 100-гра-
дусном спиртах, просветляют в ксилоле, бальзам.
Герш (1949) предложил для контроля реакции Готчкисса кон-
трольные срезы обрабатывать 1—2 часа в 10-процентном раство-
ре уксусного ангидрида и пиридине (при 22?С), промывать водой
и затем проводить реакцию, как описано выше. После проведен-
ного ацетилирования реакция Готчкисса должна быть отрица-
тельной.
Гиалуроновая кислота
Для выявления кислых полисахаридов типа гиалуроновой кис-
лоты Хэл (1946) применил фиксацию в обезвоживающей среде
(чтобы избежать цх растворения в воде). Реакция основана на
соединении кислых полисахаридов с железом и выявлении желе-
за посредством реакции с турибулевой синью.
245
Железо не соединяется с нейтральными полисахаридами или
протеинами. Для различия между гиалуроновой кислотой и дру-
гими веществами, которые могут давать голубую окраску, Хэл
предлагает обрабатывать один из срезов гиалуронидазой и срав-
нивать с другими срезами.
Метод Хэла для кислых полисахаридов.
1. Фиксируют кусочки ткани толщиной в 3—4 мм жидкостью Кар-
нуа в течение 0,5 часа. 2. Обрабатывают их абсолютным спиртом,
просветляют и заделывают в парафин. 3. Приготовляют срезы и
помещают их на предметные стекла. 4. На депарафинированные
срезы наливают раствор уксуснокислого железа и через 10 минут
хорошо промывают их дистиллированной водой. Для приготовле-
ния раствора уксуснокислого железа смешивают равные объемы
диализированной гидроокиси железа (концентрация не указана)
и 2 М раствора уксусной кислоты. 5. Обрабатывают срезы 10 ми-
нут 0,02 М раствором железосинеродистого калия в 0,14 М раство-
ре соляной кислоты, промывают водой и, по желанию, докрашива-
ют (например, фуксином). 6. Быстро обезвоживают, просветляют
ксилолом и заключают в канадский бальзам.
Кислый полисахарид дает синее окрашивание.
Мукопротеины
Толуидиновый синий окрашивает многие и разнообразные кис-
лые вещества, но метахроматическое окрашивание этим красите-
лем мукоидных соединений, содержащих полисахаридные эфиры
серной кислоты, — специфично для этих соединений (если строго
соблюдается метод Лизона, 1935). «Мнимое» метахроматичное ок-
рашивание может быть устранено быстрой обработкой спиртом,
который обеспечивает «настоящую реакцию» с красной окраской,
характерной и специфичной для полисахаридных эфиров серной
кислоты.
Раствор основного ацетата свинца является лучшим фиксато-
ром для тканей, подвергаемых метахроматичному окрашиванию
толуидиновым синим.
Можно применить смесь этого фиксатора с формалином для
сокращения срока фиксации.
Метод Лизона для выявления полисахарид-
ных эфиров серной к и с л о ты. Объект 12—24 часа фик-
сируют в смеси равных объемов 8-процентиого раствора основного
ацетата свинца и 14—^-процентного формалина. Приготовляют
парафиновые срезы. Окрашивают толуидиновым синим 30 минут,
используя для одних срезов раствор А, для других раствор Б; бы-
стро и хорошо промывают в спирте, заключают в натуральное кед-
ровое масло.
Приготовление растворов красителя: раствор А: 0,1-процент-
ный раствор толуидинового синего в 1-градусном спирте; раствор
Б : 0,1-процентный раствор толуидинового синего в 30-градусном
спирте. Растворы выдерживают несколько дней для созревания.
246
Гликоген
Все попытки выработать гистохимические методы для опреде-
ления в клетках моносахаридов, в частности глюкозы, остались
безрезультатными. Глюкоза чрезвычайно легко растворима в воде,
ее трудно осадить, и поэтому до сих пор не удалось сохранить и
стабилизировать ее при фиксации и дальнейшей обработке мате-
риала.
Другой углевод, часто встречающийся в животных клетках, —
полисахарид гликоген, удается выявить сравнительно легко.
Обычно гликоген фиксировали абсолютным спиртом, потому
что, с одной стороны, он не растворяется в спирте и осаждается им,
а с другой — легко растворяется в воде. Но спирт в концент-
рации ниже 70° почти не подавляет гидролизирующих фермен-
тов. Он медленно проникает в ткань (1 мм в час). Вследствие это-
го, как указывает Шабадаш (1947), создание тормозной 70-гра-
дусной концентрации спирта даже в поверхностном миллиметро-
вом слое произойдет только через 120—150 минут (ткани богаты
водой). К этому времени тканевый гликогенолиз зайдет настолько
далеко, что спирт сможет осадить только часть предсуществовав-
шего гликогена. Следует считаться с тем, что вырезание кусочка
резко усиливает внутритканевый распад гликогена. Кроме того с
гистологической точки зрения спирт плохо фиксирует ткани (пло-
хо проникает, сжимает ткани, делает кусочки слишком твердыми
и т. д.). Другой общеупотребительный фиксатор—жидкость Кар-
нуа (абсолютного спирта 5 см3, хлороформа 3 см3, ледяной уксус-
ной кислоты 1 сл«3) тоже фиксирует не достаточно хорошо.
Абсолютный спирт и жидкость Карнуа не сохраняют всего
гликогена в тканях.
Лизон (1953) считает, что первый фиксатор, предложенный
Карнуа (абсолютного спирта 30 см3, ледяной уксусной кислоты
10 см3), меньше сжимает кусочки ткани и в ряде случаев дает хо-
роший результат. Фиксировать жидкостями Карнуа не больше
1—2 часов.
Гликоген, как коллоид, набухает в воде и неспособен диффун-
дировать сквозь неповрежденную оболочку клеток. Поэтому воз-
можно применять и водные фиксаторы. Хорошие результаты дает
фиксатор Буэна или лучше Буэна — Аллена (насыщенного водно-
го раствора пикриновой кислоты 75 см3, химически чистого форма-
лина 25 см3, ледяной уксусной кислоты 5 см3. Жидкость нагре-
вают в закупоренном сосуде до температуры 38°, а затем прибав-
ляют 1,5 г кристаллической хромовой кислоты и растворяют 2 г
мочевины. Фиксатор готовят перед употреблением).
Фиксируют от 1 до 6 часов при температуре 37°.
Лизон (1953) рекомендует фиксировать жидкостью Жандра:
насыщенного раствора пикриновой кислоты в 90-градусном спир-
те (приблизительно 7-процентная пикриновая кислота) 80 см3;
формалина 15 см3, ледяной уксусной кислоты 5 см3. По мнению
247
Лизона, наилучшие результаты получаются, если фиксировать от
1 до 4 часов при температуре от 0 до —Г.
Основываясь на том, что пикриновая кислота in vitro ие осаж-
дает гликогена, некоторые авторы считают, что в процессе фикса-
ции гликогена пикриновой кислотой происходит не обычное осаж-
дение гликогена, а иммобилизация его на белковом или каком-то
другом субстрате.
В последнее время А. Л. Шабадаш предложил ряд фиксаторов
для гликогена.
Он считает, что фиксатор должен тормозить гликогенолиз, обес-
печить нерастворимость гликогена и хорошо фиксировать ткань.
Для отравления ферментов Шабадаш применяет соли пикриновой
или фосфорновольфрамовой кислот, соли тяжелых металлов, фор-
мальдегид (для амилаз) и флоридзин, ионы меди, цинка, кальция
и слабо кислую реакцию раствора (для фосфоглюкомутазы, чем
достигается торможение фосфоролиза). В целях стабилизации
гликогена А. Л. Шабадаш вводит в свои фиксаторы мало воды.
Смеси А. Л. Шабадаша были проведены в нашей лаборатории.
Наилучшие результаты дал нейтральный фиксатор, который мы и
рекомендуем. Состав: спирт 96-градусный — 100 см3, азотнокислая
медь— 1,8 г, азотнокислый кальций — 0,9 £, формалин— 10 см?.
Фиксировать объекты 3 часа, перенести в раствор: спирта
90-градусного—100 см3, азотнокислого кальция — 2,6 г, форма-
лина — 10 см3 — на 3 часа, промыть в нескольких сменах чистого
спирта — 6—12 часов. Залить в целлоидин или парафин.
Для убыстрения фиксации Шабадаш рекомендует инъициро-
вать фиксирующие смеси в кровеносное русло, предварительно
промытое 1—12-процентным раствором азотнокислого натрия, на
100 см3 которого прибавляется 0,45 г флоридзина.
При выборе фиксатора надо иметь в виду, что гликоген в раз-
ных тканях и у разных животных имеет свои особенности и поэто-
му ни один фиксатор не дает во всех случаях одинаково хороших
результатов. Необходимо, изучая определенный материал, пред-
варительно испробовать несколько фиксаторов.
Парафиновые срезы следует расправлять не иа воде, а на
50-градусном или 70-градусном спирте.
Для выявления гликогена применяют несколько методов. Са-
мый старый из них — это окраска гликогена иодом.
Иодная реакция Клода Бернара. Метод основан
на том, что гликоген под действием иода окрашивается в красно-
бурый или коричневый цвет.
Амилоид и некоторые протеидные гранулы также окрашивают-
ся иодом в коричневый цвет. Поэтому иодную реакцию нужно
всегда контролировать при помощи птиалина. Для этого срезы об-
рабатывают профильтрованной слюной в течение 30 минут при
температуре 37°, — гликоген должен перейти в сахар, раствориться
и иодная реакция даст отрицательный результат. Амилоид, хитин
248
и другие вещества не растворяются птиалином и остаются окра-
шенными.
Иодная реакция, контролируемая обработкой слюной, наиболее
надежная из всех методов выявления гликогена. Ею всегда следует
пользоваться для контроля других методов.
Однако этот метод имеет ряд недостатков: 1) Он не слишком
чувствителен: при содержании гликогена меньше 0,3—0,5 мг отчет-
ливого окрашивания не получается. 2) Не допускает применения
иммерсионных объективов, потому что при больших увеличениях
окраска становится расплывчатой. 3) Препараты недолговечны,
так как окраска быстро выцветает, кроме того, часть гликогена
со временем растворяется и вымывается из срезов.
Иодной реакцией можно пользоваться и на свежем материале
и на срезах. Обрабатывать их нужно раствором Люголя (иода 1 г,
йодистого калия 2 г, дистиллированной воды 300 см3) и рассмат-
ривать в глицерине.
Лизон рекомендует метод Дрейсеяса в своей модификации для
того, чтобы сделать окраску более постоянной.
Метод Дрейсенса. Фиксировать в смесях Дарнуа или
Жандра; заключить в парафин или целлоидин; на срезах окрасить
ядра квасцовым карминам; 96-градусный спирт; 100-градусный
спирт; поместить в смесь, составленную из равных частей раство-
ра Люголя и карбол-ксилола на 3—5 минут (энергично взболтать,
собрать жидкость над водой); промыть в карбол-ксилоле; ксилол;
канадский бальзам.
Раньше гликоген обычно окрашивали кармином по Бесту.
К армии по Б есту. Механизм реакции не ясен; один авторы считают,
что происходит растворение кармииа в гликогене (подобно растворению
Судана III в жире), другие — что при окрашивании происходит какая-то хи-
мическая реакция.
Наконец, возможно, что окраска обусловливается адсорбцией. Кармином,
по Бесту, кроме гликогена окрашиваются некоторые клеточные гранулы, слизь,
кутикулярные каемки эпителия и т. д., так что метод не слишком специфичен
и не может считаться настоящим гистохимическим методом. Поэтому всегда
следует ставить контроль с птиалином слюны.
Ткань фиксировать любым фиксатором, применяемым для выявления гли-
когена, заливать в целлоидин или парафин, срезы расправлять ие на воде,
а на 50-градусном спирте, освободить срезы от парафина и довести по нисхо-
дящим спиртам до воды, окрасить ядра каким-либо гематоксилином, в слу-
чае необходимости дифференцировать спиртом, подкисленным соляной кис-
лотой, тщательно промыть, красить кармином по Бесту (см. ниже) 5 минут,
дифференцировать (ие мыть перед этим водой) в следующей смеси: абсо-
лютного спирта — 30 см3, дистиллированной воды 100 см3. Дифференцировать
обычно нужно 3—5 минут, пока от препарата ие перестанут отходить облач-
ка краски, промыть 80-градусиым спиртом, обезводить, провести через ксилол,
заключить в канадский бальзам.
В результате гликоген окрашивается в ярко-красный цвет, ядра клеток
окрашены гематоксилином.
Кармин по Бесту приготовляется следующим образом: кармииа 2 г, уг-
лекислого калия 1 г, хлористого калия 1 г, растереть в ступке, растворить
в 60 см3 дистиллированной воды, осторожно прокипятить, охладить и добавить.
20 сж3 нашатырного спирта. Краситель следует сохранять в темной склянке
с притертой пробкой; он годен к употреблению 1—2 месяца. Перед употреб-
249
лением разводят основной раствор: кармина 2 части, нашатырного спирта 2
части, метилового спирта 3 части. Следует иметь в виду, что отрицательный
результат после окраски кармином по Бесту не показывает, что в исследуемом
материале нет гликогена, потому что иногда приготовленный раствор не окра
шивает препараты вследствие загрязнения реактивов. Отрицательный резуль-
тат следует всегда проверять, окрашивая препараты при помощи иодной
реакции или по методу Бауэра,
Реакция Бауэра. Метод основан на том, что разведен-
ная хромовая кислота окисляет спиртовые группы гликогена, в ре-
зультате чего образуются альдегиды. Последние с фуксин-серни-
стой кислотой (стр. '239) дают красно-фиолетовое окрашивание.
Реакция Бауэра соединяет специфичность иодной реакции
с четкостью и ясностью морфологических картин, получаемых пос-
ле окраски кармином по Бесту.
По методу Бауэра кроме гликогена окрашиваются и другие
сложные полисахариды: целлюлоза (дает обычно не красно-фи-
олетовое, а красное окрашивание), туницин, галактоген и т. д. (но
не инулин). В животном организме эти вещества очень редко
встречаются совместно, так что практически реакция Бауэра до-
статочно специфична для обнаружения гликогена в животных
тканях.
Окраску, проведенную по этому методу, следует всегда кон-
тролировать при помощи птиалина (после обработки слюной реак-
ция должна быть отрицательной), она также не должна получать-
ся на препаратах, подвергнутых воздействию фуксин-сернистой
кислоты, но не хромированных. Поскольку фуксин-сернистая кис-
лота сама по себе способна при длительном воздействии гидроли-
зировать тимонуклеиновую кислоту, ею нельзя обрабатывать пре-
парат больше 10—45 минут. В противном случае может получиться
реакция Фельгена.
Обработка хромовой кислотой (или перйодатом, см. ниже) мо-
жет вызвать частичное растворение гликогена. Поэтому после ос-
вобождения срезов от целлоидина или парафина их необходимо
покрыть тонкой целлоидиновой пленкой, которая делает гликоген
нерастворимым в воде. Реакция проводится следующим образом:
материал фиксируют соответствующим фиксатором (см. выше);
заливают в парафин; депарафинированные срезы после абсолют-
ного спирта помещают в 1-процентный раствор целлоидина в сме-
си равных частей эфира и абсолютного спирта на 2 минуты; вы-
нимают предметное стекло и дают стечь целлоидину в течение 1
минуты; вытирают нижнюю сторону стекла, уплотняют целлоидин
в 70-градусном спирте 3 минуты, затем промывают водой; поме-
щают срезы в 4-процентную хромовую кислоту на 1 час нли 1-про-
центную на ночь (большая концентрация хромовой кислоты или
большее время воздействия ослабляют реакцию), промываю про-
точной водой 5 минут; помещают в реактив Шиффа (фуксин-сер-
нистую кислоту) на 15—45 минут; промывают 3 раза сернистой
водой (см. стр. 239) по 3 минуты; промывают проточной водой 5
минут; окрашивают ядра любым контрастным ядерным красите-
250
лем; спирт 70-градусный; спирт 90-градусный, растворяют целлои- '
дин в спирт-эфире (1:1) 3 минуты; абсолютный спирт; ксилол;
канадский бальзам.
В результате гликоген окрашивается в красно-фиолетовый цвет.
Л. Л. Шабадаш предложил новый метод выявления
гликогена, химически обоснованный и весьма чувствительный
(рис. 84). Метод основан на том, что перйодат калия (KJO<) или
натрия (NaJO4 ЗН2О) при воздействии на полисахариды изби-
рательно окисляет спиртовые группы второго и третьего углерод-
ных атомов гексозной частицы, превращая их в альдегидные. Сво-
бодные альдегидные группы затем реагируют с фуксин-сернистой
кислотой, давая фиолетово-вишневое окрашивание.
1) Депарафинированные и отмытые дистиллированной водой
срезы поместить на 20—25 минут в 0,01 М раствор перйодата ка-
лия или натрия. Раствор готовится всегда непосредственно перед
употреблением на бидистиллированной воде и употребляется толь-
ко один раз; его следует защищать от яркого дневного света.
2) Сполоснуть срезы в трех сменах дистиллированной воды по
3 минуты. 3) Поместить на 20—25 минут в фуксин-сернистую кис-
лоту. 4) Промыть 3 раза сернистой водой (см. стр. 239). 5) Про-
мыть дистиллированной водой. 6) Докрасить любым контраст-
ным красителем (светлым зеленым, метиленовым синим и т. п.),
заключить в канадский бальзам.
В результате гликоген окрашивается в интенсивный фиолето-
во-вишневый цвет. Кроме гликогена окрашиваются глюкозные
компоненты глюкопротеидных и мукоидных образований и белков
типа коллагена (содержится лактоза) и овальбумина (содержится
глюкозамин). Все эти вещества различаются по цвету. Полисаха-
риды окрашиваются интенсивнее всего, мукоиды — слабее, глюко-
протеиды — совсем слабо.
При взаимодействии перйодата с p-гидроокиси «-аминокисло-
тами образуются формальдегид и ацетальдегид. Вследствие этого
иногда получается нежно-лиловое диффузное окрашивание фона
препарата.
Для того, чтобы избавиться от всех сопутствующих реакций и
получить избирательное окрашивание гликогена, Шабадаш реко-
мендует после получения ориентировочных препаратов для нового
объекта снижать концентрацию перйодата (0,003 М., 0,002 М.,
0,001 М.) и время воздействия—до 7—10 минут.
А. П. Новикова (1949) предлагает для выявления
гл икогена метод фиксации тканей, который состоит
в уплотнении животных тканей в парах формальдегида в закры-
том эксикаторе в течение 36—48 часов.
По окончании фиксации кусочки промываются в проточной воде
и режутся на замораживающем микротоме. Гликоген окрашивает-
ся по методу Бауэра.
Препараты, получаемые при «газовой фиксации», не только не
уступают, но, как указывает Новикова, часто оказываются лучше
251
Рис. 84. Гистохимическая реакция на гликоген А. Л. Шабадаша.
Л—эпителий кишечника аскариды (по Г. И. Роскину); Б — клетки
печени лягушки (по Г. И. Роскниу); В — гладкая мускулатура ки-
шечника эмбриона человека (по М. Е. Струве); Г— мотонейрон
вентрального рога спинного мозга собаки (по А. Л. Шабадашу).
252
фиксированных в спирте или в нейтральном фиксаторе Шабадаша.
Используемый метод фиксации дает возможность одновременно
выявлять в срезах и гликоген и липоиды.
Хитиновое вещество
Фиксация материала в смеси Карнуа. Заливка в целлоидин или
через метилбензоат (или терпентиновое масло) в парафин. Объек-
ты в расплавленном парафине следует оставлять на 1—2 дня. Ес-
ли хитин (это относится и к роговому веществу) очень тверд,
прежде чем заливать, его следует размягчить в диафаноле. В про-
тивном случае получить хорошие срезы невозможно.
1) Материал фиксируют, переводят в 96-процентный спирт;
2) помещают в 65-процентный спирт; 3) переносят в диафанол (со-
хранять в темноте, при комнатной температуре, в банках с притер-
той и смазанной вазелином пробкой), в котором объекты остав-
ляют до полного размягчения; если диафанол теряет свой желтый
цвет, его надо сменить; содержание объекта в диафаноле не дол-
жно превышать необходимого для этого срока, так как диафанол
оказывает на ткань мацерирующее действие; 4) помещают в
65-процентный спирт; 5) затем в 96-процентный спирт и т. д.
Приготовление диафанол а. Диафанол представляет собой дву-
окись хлора (С!О2), растворенную в уксусной кислоте. Раствор мало стоек
и разлагается в течение сравнительно короткого срока. Поэтому рекомендует-
ся приготовлять диафанол самим.
Метод приготовления не сложен. В колбу помещается 150 г щавелевой
кислоты и 40 г бертолетовой соли (КС1О-), затем добавляется 20 см3 дистил-
лированной воды. Колба нагревается на водяной бане до 60°. Через 10—
15 минут начинается выделение желто-зеленого газа, который по трубке от-
водится в 25—50-процеитиую кислоту, охлажденную на льду. Через 30—
40 минут насыщение заканчивается, и жидкость приобретает желтый цвет.
Насыщение надо производить под сильной тягой, так как двуокись хло-
ра очень ядовита.
Хранить диафанол следует в склянке с хорошо притертой пробкой. Диафа-
нол, утративший свою окраску, не годен к употреблению.
После обработки объекта диафанол следует удалять из препа-
рата смесью равных частей 5-процентного азотнокислого натрия
и 2,5-процентного гипосульфита.
Для окраски хитина после обработки его диафанолом
применяют хлорцинкиод. Помещают изучаемый объект на 24—
48 часов в герметически закрытую склянку с диафанолом; склян-
ка должна находиться в темноте; промывают, помещают препарат
в хлорцинкиод. В результате хитин окрасится в фиолетовый цвет.
Иногда окраска наступает только после промывки препарата в
воде.
Приготовление хлорцинкиода: первый раствор — иода 6,1 г,
йодистого калия 10 г, воды 14 см3; второй раствор — хлористого
цинка 60 г, воды 14 см3. Смешать оба раствора и профильтровать
через стеклянную вату. Перед употреблением убедиться в том, что
жидкость окрашивает фильтровальную бумагу в фиолетовый цвет.
253
Можно сначала обработать срез иодом, а затем концентрирован-
ной серной кислотой.
Хитин окрасится в коричневый цвет, целлюлоза и туницин —
в синий.
Меррей предложил еще один метод для размягчения хитина:
фиксировать материал в 10-процентном растворе формалина, в
0,8-процентпом растворе хлористого натра; перенести в смесь
равных объемов абсолютного спирта, хлороформа и ледяной
уксусной кислоты, в которой растворена хлорная ртуть до насы-
щения (приблизительно 4%); поместить на 12—24 часа и дольше
в смесь хлоралгидрата и фенола.
Через ксилол или хлороформ залить в парафин.
Приготовление смеси хлоралгидрата и фенола: смесь равных
весовых количеств хлоралгидрата и фенола подогревают на водя-
ной бане, пока не образуется маслянистая жидкость, которая дол-
жна остаться такой же и при комнатной температуре.
Целлюлоза
На срезы наливают 2—3 капли иодного раствора на 10 секунд,
промакают фильтровальной бумагой и прибавляют каплю раство-
ра хлористого лития, насыщенного при 80° и охлажденного.
Приготовление иодного раствора: 20 см3 2-процентного раство-
ра иода в 5-процентном нодистом калии, 180 см3 воды и 0,5 см3
глицерина.
В результате целлюлоза окрасится в синий, зеленоватый или
желтый цвет.
ВОЛЮТИН
Волютин встречается у простейших и бактерий в виде зерен.
По данным А. Н. Белозерского, главной составной частью волюти-
на (Spirillum volutans) является Дрожжевая нуклеиновая кислота
несколько более сложного состава, чем обычная.
В холодной воде волютин растворяется через 2—3 дня, в горя-
чей воде волютин растворяется в течение нескольких минут. Он
также легко растворяется в щелочах и кислотах: в 5-процентном
растворе соды или 3-процентном растворе едкого кали через 2—
5 минут, в 5-процентной соляной или серной кислоте — через 5—
10 минут. В спирте, хлороформе, эфире волютин нерастворим.
Формалин делает волютин трудно растворимым, абсолютный
спирт также, но в меиьшей степени. Для фиксации применяется
формалин, спирт, сулема, пикриновая кислота, жидкость Кариуа.
Хорошие результаты дает метод окраски, который проводится
следующим образом; фиксировать материал 4—10-процеитиым
формалином или подсушить и красить в следующем растворе: на-
сыщенный раствор метиленового синего в 96-градусном спирте —
1 часть, дистиллированной воды — 10 частей; отсосать краситель
и налить 1-процентную серную кислоту. Весь препарат очень быст-
2М
ро обесцветится, а зерна волютина окрасятся в темно-синий цвет.
Можно также прибавить краситель под покровное стекло.
Если после окраски метиленовым синим срез поместить в жид-
кость Люголя, то протоплазма будет окрашена в коричневый цвет,
волютин — в черный. Слить жидкость Люголя и прибавить 5-про-
центный раствор соды. Обесцветится весь препарат, но волютин
обесцвечивается последним.
ЖИРЫ и липоиды
Изучение жира в клетке следует производить лучше всего на
свежем, нефиксированном материале, либо фиксировать его 10-
процентным или 20-процентным формолом и затем разлагать на
срезы на замораживающем микротоме. Маленькие кусочки или
очень рыхлые органы можно предварительно заключить в желати-
ну. В живой клетке жировые включения имеют вид темных, силь-
но преломляющих свет блестящих капель.
Фиксировать ткань формалином нужно 24—48 часов. Более
продолжительная фиксация изменяет жир: могут образоваться
кристаллы, изменится растворимость, отношение к окраскам и
т. д. В формалине часть жировых веществ, по-видимому, главным
образом фосфатидов, растворяется. Бекер (1944) считает, что
предложенный им фиксатор позволяет этого избежать.
Жидкость Бекера: формалина 10 см3, 10-процентного
хлористого кальция 10 см3; дистиллированной воды 80 см3.
Надежным методом выявления жировых веществ служит окрас-
ка их Суданом III, красным шарлахом и т. д. Все эти красители
растворяются в жирах. При этом краситель из спирта переходит
в жир, в котором растворимость его больше.
Окрашивание Суданом III по Дадд и. Кусочки
фиксируют формалином или формалином с кальцием, из них при-
готовляются замороженные срезы, которые на несколько минут
помещаются в 50-градусный спирт. Затем срезы переносятся в кра-
ситель на 20—25 минут, быстро споласкиваются в 50-градусном
спирте и переносятся в воду.-Перед окраской Суданом (до 50-гра-
дусного спирта) можно окрасить ядра квасцовым гематоксилином
и т. д. Заключаются в глицерин или глицерин-желатину.
В результате жиры окрашиваются в оранжево-желтый цвет.
Ввиду того, что окраска жира сравнительно быстро выцветает,
препарат надо исследовать возможно быстрей после приготовле-
ния.
Краситель приготовляют следующим образом: насыщенный ра-
створ Судана III в 70-градусном спирте в банке с притертой проб-
кой ставят в термостат при температуре 37° на 24—48 часов. Время
от времени его следует взбалтывать. В банке должен быть избы-
ток Судана. Затем раствор профильтровывают и хранят в банке
с притертой пробкой. Окраска красным шарлахом производится
таким же образом.
25Р
Лизон предложил для окраски жира черный Судан Б. Он четко
окрашивает жировые вещества в черно-синий цвет и ие выцветает,
как судан III. Черный судан Б окрашивает и миелин в перифери-
ческих нервах и центральной нервной системе. Бекеру удалось
им окрасить даже митохондрии.
Окрашивание Суданом черным Б. Материал фик-
сируют формалином или формалин-кальцием; приготовляют замо-
роженные срезы; из воды срезы переносят в 70-процентный спирт
на 30 сек., окрашивают в насыщенном растворе Судана черного Б
на 70-процеитном спирту от 5 до 30 минут; промывают 30-процент-
иым спиртом 30 секунд; промывают дистиллированной водой, окра-
шивают ядра и заключают в глицерин или глицерин-желатину.
Обработка осмиевой кислотой. Метод выявления
жира при помощи осмиевой кислоты дает четкие морфологические
картины, но не имеет гистохимической ценности, потому что целый
ряд веществ, кроме жира, редуцирует осмиевую кислоту.
При обработке жира осмиевый ангидрид О^О« восстанавли-
вается, образуя ОзО2; при этом вычериивается часть жировых ве-
ществ, наступает «первичное почернение», другая часть окраши-
вается в коричневые тана.
Если препарат после осмирования обработать спиртом, насту-
пает так называемое «вторичное почернение» и других жировых
веществ.
Жир, вычерненный осмием, почти нерастворим в абсолютном
спирте; довольно хорошо растворяется в ксилоле, бензоле, толуоле,
эфире, креозоте и т. д., лучше всего сохраняется в глицерине,
жидком парафине и кедровом масле. Поэтому при заливке в па-
рафин часть жира теряется. Кусочек лучше резать на заморажи-
вающем микротоме и рассматривать препарат в глицерине.
При заливке в парафин вместо ксилола применяется кедровое
масло.
Свеже взятые очень маленькие кусочки фиксировать 24 часа
в 0,5—1-процентной осмиевой кислоте; промывать 24 часа; резать
на замораживающем микротоме и рассматривать в глицерине.
При этом получается первичное почернение. Если нужно получить
вторичное почернение, кусочек или срезы следует поместить на
1—2 дня в 70-градусный спирт. Хорошо перед осмированием фик-
сировать их 24 часа формалином или жидкостью Флемминга. Ядра
можно докрасить любым контрастным красителем.
Окрашивание сульфатом нильского синего
по Л. С м и с у. Раствор сульфата нильского синего некоторые
жировые вещества окрашивает в розовый цвет, некоторые в си-
ний. Каин (1950) пришел к выводу, что в розовый цвет окрашива-
ются нейтральные жировые вещества (эфиры глицерина и холе-
стерина). Некоторые авторы считают, что розовое окрашивание
указывает на присутствие ненасыщенных жировых соединений
(триолеин). В синий цвет окрашиваются кислые жировые веще-
256
сгва. К ним Каин относит жирные кислоты, в особенности олеино-
вую кислоту, липоиды и хромолипоиды. Отсутствие окраски не го-
ворит об отсутствии жировых веществ. В синий цвет окрашиваются
и некоторые базофильные структуры (напр. ядро). Окраску по
Л. Смису следует всегда проверять каким-либо другим методом.
Материал фиксировать формалином, приготовить срезы на за-
мораживающем микротоме. Можно не фиксировать и делать сре-
зы из свежей ткани. Красить срезы от 10 до 20 минут в концентри-
рованном растворе сульфата нильского синего. Сполоснуть водой,
дифференцировать в 1-процентной уксусной кислоте (10—20 ми-
нут) до получения равномерной окраски срезов чистого топа. Хо-
рошо промыть в воде. Заключить в глицерин или в глицерин-же-
латииу.
Липоиды (жироподобные вещества). Липоида-
ми обычно называют все составные вещества клетки, кроме на-
стоящих жиров (глицеридов простого типа), которые извлекаются
из нее с помощью эфира и других органических растворителей.
При окрашивании липоидов хорошие результаты дает метод
Г ольдмана. Раствор Судана III готовится по следующей про-
писи: 70-градусного спирта— 100 см3, дистиллированной воды —
20 см3, а-нафтола—1,2 г, Судана III — в избытке. Смесь кипятят
в течение 10 минут и фильтруют. Срезы красят 15 минут, затем
дифференцируют 70-градусным спиртом, контролируя под микро-
скопом. Мазки крови фиксируют 3 минуты смесью из 1 части фор-
малина и 4 частей 96-градусного спирта.
Хорошо окрашивается липоидная зернистость белых кровяных
телец.
Для выявления липоидов применяется также метод Чиаччио,
основанный на том, что после продолжительного хромирования ли-
поиды становятся нерастворимыми в обычных растворителях жира.
При заливании объекта в парафин глицериды и жирные кислоты
растворяются, а липоиды затем можно окрасить Суданом III.
Кен и Лизон сомневаются в специфичности реакции, так как,
по их мнению, при заливке в парафин после хромирования не рас-
творяются, кроме липоидов,.и другие жировые вещества.
По методу Чиаччио следует фиксировать маленькие
кусочки в течение 24—48 часов, в смеси: 5-процентного водного
раствора двухромовокислого калия — 80 см3, формалина — 20 см3,
ледяной уксусной кислоты — 5 см3; хромировать 5—8 дней в 3-про-
центном двухромовокислом калин; промывать 24 часа в проточной
воде; провести через восходящие спирты—24 часа, поместить в
абсолютный спирт — 1—2 часа, заключить в парафин через ксилол
или сероуглерод, провести заливку возможно быстрее.
Срезы после 70-градусного спирта окрасить обычным раство-
ром судака III (см. выше) или красителем следующего состава:
спирта 80-градусного — 95 см3, ацетона — 5 см3, Судана III—до
насыщения при температуре 50°. Жидкость охлаждается и фильт-
17 Микроскопическая техника 257
руется. Красить 30 минут — 1 час при температуре 30°; сполоснуть
в 50-градусном спирте, промыть дистиллированной водой. Заклю-
чить в глицерин.
Ядра можно окрасить квасцовым гематоксилином, лучше
до обработки срезов Суданом.
Липоиды окрашиваются в оранжево-желтый цвет.
Метод Смис —Дитриха. Метод основан на том, что липоиды
окисляются двухромовокислым калием. При этом образуется соединение ли-
поидов, главным образом фосфатидов, с хромом. Хром выявляется вторич-
но, образуя лак с гематоксилином.
Ряд авторов подтверждает пригодность этой реакции, но указывает,
что отрицательный результат не исключает наличия липоидов.
Материал фиксировать формалином; приготовленные на замораживаю-
щем микротоме срезы поместить на 1—2 дня в 5-процентный двухромовокис-
лый калий при 375 (иногда рекомендуют хромировать при 60°); сполоснуть
дистиллированной водой, красить 4—5 часов при 37° гематоксилином Кульчиц*
кого (10-процентиого раствора гематоксилина в спирте, приготовленного
не меньше чем за ’/а года, 10 см3, 2-процентной уксусной кислоты 90 см3);
дифференцировать борожелезосинеродистым калием по Вейгерту (буры 2 г,
красной кровяной соли 2,5 г, дистиллированной воды 100 см3), оставив на
ночь; тщательно промыть в воде, заключить в левулезу. Ядра можно окра-
сить квасцовым кармином или сафранином. В результате фосфатиды окра-
шиваются в сине-черный цвет. Серо-синяя окраска не специфична.
Определение холестерина по Вин да у. Виндау
показал, что свободный холестерин со спиртовым раствором диги-
тонина образует характерные двоякопреломляющие игольчатые
кристаллы дигитонин-холестернда.
Капля 0,5-процентного раствора дигитоиина в 85-градусном
спирте вводится на депарафинированный срез между предметным
и покровным стеклом. Сейчас же появляются игольчатые кристал-
лы. Они нерастворимы в воде, ацетоне, эфире, очень мало в холод-
ном 96-градусном спирте, несколько лучше в кипящем. Хорошо
растворимы в уксусной кислоте и особенно в пиридине.
Определение холестерина и хол ест е р и н-э ф и-
ров по Шульцу. Материал фиксировать формалином, резать
на замораживающем микротоме, срезы выставить в разведенном
формоле на яркий свет (по возможности на солнце) на 4 дня;
сполоснуть дистиллированной водой; тщательно просушить срез на
предметном стекле фильтровальной бумагой. Нанести на срез не-
сколько капель смеси равных объемов ледяной уксусной и крепкой
серной кислот (прибавлять серную кислоту к уксусной по каплям,
при охлаждении); покрыть срез покровным стеклом и сейчас же
рассматривать.
Холестерин и холестерин-эфиры окрашиваются в синий или
пурпурный цвет, сейчас же переходящий в зеленый и потом в гряз-
но-бурый. Препарат сохраняется только несколько часов.
Выставление на свет необходимо для того, чтобы холестерин
перешел в оксихолестернн. Действие света можно заменить про-
травой 2,5-процентными железными квасцами прн температуре 37°
в течение 24—48 часов.
258
Метод Ромье. Материал фиксировать формалином или
жидкостью Буэна без уксусной кислоты; срезы, приготовленные
на замораживающем микротоме, высушить на предметном стекле;
налить на препарат крепкой серной кислоты (3—15 секунд);
остановить действие серной кислоты, прибавив 2—3 капли уксусно-
го ангидрида; промыть несколькими каплями этого же реактива;
накрыть покровным стеклом.
Рассматривать немедленно, так как окраска быстро исчезает.
Холестерин и его эфиры окрашиваются в лилово-фиолетовый или
пурпурно-красный цвет, сейчас же переходящий в зеленый. Сле-
дует иметь в виду, что синий, фиолетовый или красный цвет не
характерен; на присутствие холестерина и его эфиров указывает
постепенное, в течение 20—30 минут, появление зеленых оттенков.
Препарат годен 30—60 минут.
ПЛАЗМАЛЬ
В протоплазме ряда животных клеток имеются вещества липо-
идного характера, которые были названы плазмалогеиами. Эти
вещества не растворяются в воде, но растворимы в органических
растворителях (например в спирте). Под воздействием кислот или
раствора сулемы плазмалогеи быстро разлагается, образуя плаз-
маль.
Плазм аль представляет собой смесь высших альдегидов,
соответствующих известным жирным кислотам, и с фуксин-сер-
нистой кислотой дает интенсивно красно-фиолетовое окрашивание.
Оказалось, что плазмалеген — это смесь веществ, относящихся
к группе фосфатидов, состоящих из глицерино-фосфорной кисло-
ты, соединенной по типу ацеталя с высшими альдегидами и по
типу сложного эфира с аминоспиртом.
В разных органах имеется разное количество плазмалегена.
Наиболее интенсивную реакцию дают мышцы, нервная ткаиь,
эпителий толстых кишок. Печень и эпителий тонких кишок дают
слабую реакцию. В жировой ткани взрослых людей, кошек, крыс,
мышей — реакция отрицательная. Время, необходимое для пре-
вращения плазмалегена в плазмаль, различно в зависимости от
от того, происходит ли оно под действием кислоты или сулемы;
при действии одной фуксин-сернистой кислоты замороженные
срезы только через 2—3 часа окрашиваются в фиолетовый цвет.
Если же поместить срезы в 1-процентный раствор сулемы, то до-
статочно нескольких минут для того, чтобы фуксин-сернистая кис-
лота дала с плазмалем фиолетовое окрашивание.
Плазмалевая реакция резко отличается от нуклеальиой тем,
что: 1) альдегидные группы плазмалогена обнаруживаются при
воздействии сулемы и 2) плазмалеген или плазмаль при дейст-
вии спирта извлекается из ткани, в то время как нуклеальные ве-
щества сохраняются. Необходимый для нуклёальной реакции гид-
ролиз соляной кислотой при плазмалевой реакции не требуется.
17' 259
Физиологическое значение плазмалегена пока не ясно. Несом-
ненно лишь, что при его широком распространении, особенно
в растущих клетках, а также з тканях нервной и мышечной, он
должен играть большую роль в процессах обмена. Об этом гово-
рит также наличие в его составе альдегидов — исключительно ре-
акционно способных соединений. Плазмалеген (или подобные ему
Вещества) по-видимому имеет особенное значение в обмене тка-
ней злокачественных опухолей.
Для гистохимического выявления плазмаля мы с успехом при-
меняли метод Кена (1949): 1) маленькие кусочки ткани по-
мещают на 12 минут в смесь равных частей реактива Шиффа
(к которому добавлен равный объем сернистой воды) и насыщен-
ного водного раствора сулемы; одновременно, для контроля, кусо-
чек ткани обрабатывают 15 минут тем же реактивом, но без су-
лемы, которая заменена равным объемом воды; 2) тщательно
промывают в трех сменах сернистой воды (в каждой по 5 минут);
3) затем помещают объект на 2 часа в 10-процентпый раствор
формалина; соединение формальдегид-реактив Шиффа образуется
очень быстро; при этом контрольные кусочки ткани принимают бо-
лее интенсивный фиолетовый цвет, чем ткани, обработанные
смесью, указанной в пункте 1; 4) промывают в проточной воде
24 часа; комплекс формальдегид-реактив Шиффа легко растворим
в воде и поэтому контрольные кусочкн раскрашиваются до очень
бледного тона, в то время как интенсивность окраски ткани, обра-
ботанной смесью с сулемой, не меняется, потому что комплекс
ацетальфосфатид-реактив Шиффа растворим в спирте, но не
в воде; 5) заключают в желатину и для уплотнения блока поме-
щают его в эксикатор с СаС12 (при 37е) на 20—25 часов, после
чего изготовляют срезы и заключают их в глицерин-жела-
тину.
Ацетальфосфатады окрашиваются в темно-фиолетовый цвет.
Если окрашивание красноватое или красное, то к результатам сле-
дует отнестись с осторожностью и провести указанные выше кон-
трольные исследования. Паниель (1951) считает, что метод выяв-
ляет только свободные, но не связанные с протеинами ацеталь-
фосфатиды.
Адреналин и соединения, имеющие феноловые
группы. Кужар (1943) рекомендует фиксировать 24—48 часов
в смеси: 10-процентный нейтральный формалин — 3 части, насы-
щенный водный раствор иодноватокислого калия (KJO3) —
1 часть. Срезы после парафиновой заливки окрашивают железным
гематоксилином по Рего. Метод основан на том, что при действии
альдегидов на фенолы образуются полимерные соединения типа
пластмассы «бакелита». Эта реакция наступает, если фиксируют
ткани, содержащие соединения фенола (медуллярный слой надпо-
чечника, адреналинэргические нервы симпатической нервной
системы). Интенсивность полимеризации зависит от длительности
фиксации, причем окислители (бихроматы, йодаты и др.) ускоряют
260
этот процесс. Образовавшиеся в результате действия реактива
бакелиты способны интенсивно окрашиваться железным гематок-
силином. Кужар предложил для фиксации и другую смесь: 2-про-
центная осмиевря кислота — 1 часть, 3-процентный раствор йоди-
стого калия (KJ) — 3—5 частей. Эта смесь восстанавливает фено-
ловые соединения, в частности адреналин и адреналиноподобные
вещества. Продолжительность фиксации — 24—48 часов.
Гистамин. Реакция Кужара (1947) основана на способно-
сти гистамина восстанавливать нитрат ртути. Таким образом
можно получить элективное окрашивание ауэрбаховского и
мейсснеровского сплетений: гистаминеэргические нервы черные на
бледном фоне. Объект обрабатывают в свежеприготовленной сме-
си, которую можно разбавить на одну треть: насыщенный раствор
азотнокислой ртути 5 частей, дистиллированная вода—1—2 ча-
сти, 2-процентная осмиевая кислота — 1 часть. Объект должен
быть тонким, его можно растянуть на кусочке пробки или на рам-
ке, сделанной из пробковой коры. Обрабатывают смесью 24—
48 часов, затем быстро споласкивают водой, заливают в парафин
и изготовляют срезы.
ФЕРМЕНТЫ
Оксидазы
Для выявления в клетках окислительных ферментов предло-
жен ряд методов. Все они основаны па том, что клетки обрабаты-
ваются определенными бесцветными реактивами или смесями
реактивов, которые при окислении быстро дают на местах локали-
зации оксидаз цветную реакцию (рис. 85). Ферменты чрезвычайно
чувствительны к различным физическим и физико-химическим
воздействиям. Поэтому реакции всегда нужно производить в стро-
го определенных условиях. Для того, чтобы быть уверенным, что
полученные результаты являются следствием действия ферментов,
а не неорганических катализаторов, необходимо ставить контроль.
Большинство окислительных ферментов разрушается после непро-
должительного нагревания до 100° во влажной среде. Даже термо-
стабильные пероксидазы .не выдерживают получасового нагрева-
ния до 120°. «Тепловая проба» представляет собой наиболее на-
дежный контроль. Кроме того, можно пользоваться и другими
способами: разрушение ферментов'при помощи ультрафиолетовых
лучей или обработка препарата 0,1 — 1-процеитным раство-
ром KCN.
Выявление так называемых «стабильных»
оксидаз (м и е л о-н а д и-о кс и д а з н а я реакция). Метод
основан на том, что смесь 1-процентного щелочного раствора
а-нафтола и диметилпарафенилен-диамина с одним атомом кисло-
рода образует лейкобазу. Если клетки обработать лейкобазой, то
на месте локализации оксидаз образуется продукт ее окисления —
индофеноловый синий.
261
Рис. 85. Оксидазы и пероксидазы
в клетках простейших (по Г. И.
Роскиму и Л. Б. Левинсону). Реак-
ция на оксидазы у амебы (/1)
лейшмании (5) и трипаносомы
(Г); В — реакция на пероксидазу
у инфузории glaucoma sp.
Кусочки фиксировать формалином и резать на замораживаю-
щем микротоме. Мазки фиксировать в парах формола или в сме-
си: 1 часть формалина, 4 части 96-градусного спирта — в течение
двух часов; окрашивать 1—5 минут в профильтрованной смеси
равных частей а-нафтола и диметилпарафенилен-диамина. Грану-
лы, содержащие оксидазы, окрасятся в синий цвет. Можно на
этом прервать обработку препарата, промыть водой и рассматри-
вать в глицерине. «Нади» (т. е.
смесь а-нафтола и диметилпа-
рафенилен-диамина) действует
только в присутствии кислоро-
да. Поэтому реакцию надо про-
водить в открытой посуде,
взбалтывая реактив.
Полученная окраска быстро
исчезает. Для того, чтобы сде-
лать ее стабильной, препарат
нужно обработать следующим
образом: обмыть дистиллиро-
ванной водой; поместить в рас-
твор Люголя, разбавленный
двумя частями дистиллирован-
ной воды (гранулы окрашива-
ются сначала в коричневый
цвет), — на 1—24 часа, пока
гранулы не станут голубыми;
поместить препарат в дистил-
лированную воду, к каждым
10 слг1 которой прибавить
1—2 капли 0,5-процентного раствора углекислого лития; сполос-
нуть в дистиллированной воде; докрасить квасцовым кармином или
сафранином; заключить в глицерин или глицерин-желатину. На
местах локализации оксидаз видны голубые зерна, разбросанные
в протоплазме.
Приготовление реактива: 1) 1 а а-нафтола кипятить в 100 cms
дистиллированной воды (а-нафтол при этом плавится); прибав-
лять по каплям 25-процентный раствор КОН, пока а-нафтол не
растворится; 2) 0,5 г щелочного диметилпарафенилен-диамина
растворить в 50 см3 дистиллированной воды. Вместо основания
можно применять солянокислый диметилпарафенилен-диамин. Он
несколько более стоек. Оба раствора следует держать в плотно
закрытых темных склянках. Сохраняются 2—3 недели. Непосред-
ственно перед употреблением слить равные части обоих растворов
и профильтровать. Необходимо иметь в виду, что реактив быстро
портится, так как в нем выпадает нндофеноловый синий. Поэтому
одной порцией реактива можно красить только несколько срезов
или мазков. Основной раствор рекомендуют разводить вплоть до
1 : 1000.
262
Эта реакция часто употребляется в гематологии. Она выявляет
оксидазы во всех миелоидных элементах. Другие кровяные клетки
не дают этой реакции. Кроме того, стабильные оксидазы найдены
в серозных клетках слюнных и слезных желез человека и синци-
тнобластах плаценты.
Выявление «лабильных» оксидаз (тканевая
н а ди-о к с и д а з н а я реакция). Для выявления оксидаз
применяется также смесь а-нафтола и диметилпарафенилен-
диамина без прибавления щелочи; этой смесью обрабатывают
нефиксированный материал. При этом получается оксидазная
реакция почти во всех клетках животных и растений.
Лабильные оксидазы чрезвычайно чувствительны ко всяким
внешним воздействиям. Реакция не получается на фиксированном
материале и при применении щелочных растворов. Для выявления
оксидаз большое значение имеет концентрация водородных ионов
в растворе. Поэтому нужно применять буферные растворы.
Для большинства клеток животных хорошие результаты полу-
чают при pH 7,8, 8,1 и 8,2; для клеток растений — при pH — от
3,4 до 5,9.
Поместить замороженные срезы свежего, нефиксированного
материала или мазки в свежеприготовленную смесь 10-процент-
ного спиртового раствора а-нафтола (перед употреблением раз-
вести 1 : 100) и 1,2 г солянокислого диметнлпарафенилен-диамина
на 100 см3 буферного раствора; через несколько минут срез или
мазок обычно принимает синий цвет; перенести срез на предмет-
ное стекло, оттянуть жидкость фильтровальной бумагой и про-
мыть его физиологическим раствором поваренной соли; окрасить
ядра квасцовым кармином; поместить препарат в раствор уксусно-
кислого калия и накрыть покровным стеклом. Рассматривать его
следует сейчас же после окраски. Приготовить постоянный пре-
парат невозможно.
В результате гранулы, содержащие оксидазы, окрашиваются
в темно-синий цвет. Жир в цитоплазме— в лиловый или фиолето-
вый цвет.
Живые клетки можно красить (например, зародыши морских
беспозвоночных, находящиеся на различных стадиях развития)
смесью 1-процентного щелочного раствора а-нафтола и 1-процент-
ного раствора диметилпарафенилен-диамина. Относительное коли-
чество реактивов надо устанавливать для каждого объекта.
Лизон и Браше показали, что тканевая нади-оксидазная реак-
ция указывает на присутствие в клетках цитохромоксидазы.
При работе со смесями «нади» (а-нафтол-диметилпарафени-
лен-диамин) надо иметь в виду, что в растворе спонтанно выпа-
дает индофеноловый синий, хорошо красящий жиры. При некото-
ром навыке можно отличить в плазме гранулы, содержащие окси-
дазы, от капель жира — по локализации их в клетках и по оттенку
окраски: оксидазы всегда синие, а жиры лиловатые. Нужно упо-
треблять по возможности свежие растворы. Кроме того, необхо-
263
димо ставить контроль с нагреванием объекта, после которого
оксидазная реакция не должна получаться.
Над и-p еакция на цитохромоксидазу (модифи-
кация Му г, 1943). 1. Нефиксированные мазки или срезы све-
жей ткани (100— 150 и) споласкивают раствором Рингера (pH
7,2) и инкубируют 2—5 минут в реактиве нади; контрольные
срезы после промывки в растворах азида натрия и фенилуретана
помешают на 2—5 минут соответственно в растворы нади 4- азид
натрия и нади + фенилуретан. 2. Промывают физиологическим
раствором и докрашивают, если желательно, квасцовым кармином
(30 минут). 3. Заключают в 5-процентный ацетат калия, вокруг
покровного стекла делают парафиновую рамку. Ткани, инкуби5)
рованные в нади или в нади с фенилуретаном, дают синее окра-
шивание в местах расположения цитохромоксидаз; ткани, инку-
бированные в присутствии азида натрия, реакции не дают. Ис-
пользуют только свежеприготовленный раствор нади: смешивают
равные части 0,01 М солянокислого диметил-р-фенилендиамина и
0,01М а-нафтола, растворенных в 1-процентном растворе NaCl
с 0,066 М фосфатного буфера (pH 5,8). Реактивы: 1) азид нат-
рия: 0,005 М раствор NaN3 в физиологическом растворе; 2) нади,
содержащий 0,005 М азида натрия; 3) 0,003 М раствор фенилу-
ретана в физиологическом растворе; 4) раствор нади, содержа-
щий 0,003 М фенилуретана.
Допаоксидаза. Б. Блох считает, что специфический оки-
слительный фермент — допаоксидаза окисляет диоксифенилала-
нин (сокращенно допа) в черный пигмент — допамслаппн, анало-
гичный меланину. Лизон (1953) высказывает мнение, что положи-
тельная допареакция указывает па присутствие не допаоксидазы,
а тирозиназы. Для выявления допаоксидазы необходимо сделать
следующее: нефиксированные кусочки погрузить в- расплавлен-
ный теплый агар; охладить агар до состояния плотного студня;
разложить на замораживающем микротоме на возможно более
тонкие срезы; положить их на 24 часа в 0,1—0,2-процентный ра-
створ диоксифенилаланина в темной, плотно закрытой склянке.
Раствор должен быть прозрачным; если он почернеет, то не годит-
ся к употреблению. Если окраска препарата получается слишком
слабой, проводить реакцию в термостате при 37°. Промыть срезы
дистиллированной водой, заключить в глицерин или канадский
бальзам. Перед заключением их можно окрасить метиловым зе-
леным — пиропином. В результате на месте локализации допаок-
сидазы образуются черные гранулы допамеланина.
Пероксидазы
Реакция с бензидином. Метод Л е л е. Метод осно-
ван иа том, что бензидин в присутствии Н2О2 и пероксидазы пере-
ходит в коричневый оксибензидин. Пероксидазы значительно бо-
лее устойчивы, чем оксидазы. Поэтому можно проводить реак-
цию не только на свежих нефиксированных тканях, но и после
264
фиксации их формолом или спиртом и заливки в желатину или
даже в парафин.
1 г бензидина сильно встряхивают в 200 сж3 дистиллирован-
ной воды; перед употреблением фильтруют; к 50 с.и3 этой жидко-
сти прибавляют 1 см3 0,1-процентной перекиси водорода.
Мазки или замороженные срезы, приготовленные из материа-
ла, предварительно фиксированного формолом, на 3—5 минут по-
мещают в раствор бензидина. На местах локализации пероксидаз
появляются коричневые зерна. Раствор бензидина советуем слег-
ка подкислить уксусной кислотой, тогда пероксидазы красятся
в синий цвет; докрасить ядра; заключить в бальзам обычным
способом.
Для парафиновых срезов применяют следующий ме-
тод.
После фиксации небольших кусочков в 10%-процентном фор-
малине их быстро заливают в парафин: 70-градусный спирт —
I час; ацетон — 30 минут, бензол — 20 минут, парафин — 20 ми-
нут. Тонкие срезы депарафинируют в бензоле — 20 секунд, затем
в ацетоне— 10 секунд.
Срезы обрабатывают смесью (80-градусный спирт—25 см3;
бензидин — 0,1 г; перекись водорода — 2 капли), разведенной
2 частями дистиллированной воды — 5 минут. Помещают в воду —
5 минут; переносят в гематоксилин — 2 минуты, промывают во-
дой— 1 минута; окрашивают 0,1 процентным эозином—20 се-
кунд. Проводят через 96-градусный спирт — 30 секунд; абсолют-
ный спирт—5 секунд, Просветляют ксилолом и заключают в баль-
зам.
а-нафтол — пероксидазная реакция по Леле,
а-нафтол под действием Н2О2 и пероксидазы окисляется в окра-
шенное вещество.
Кусочки фиксировать 10-процентным формолом, резать на
замораживающем микротоме; срезы на несколько минут поме-
стить в следующий реактив; чайную ложку а-иафтола взболтать в
1 л 0,85-процентного раствора поваренной соли; оставить на 3 дня;
перед употреблением 50 см3 профильтровать и прибавить к ним
1 см3 1-процентной перекиси водорода. Затем срезы сполоснуть
и заключить в глицерин. Пероксидазы окрашиваются в темно-
фиолетовый цвет. Выявляемые этим методом ферменты называют
нафтолпероксидазами. Препараты, приготовленные таким спосо-
бом, быстро выцветают. Чтобы сделать их более стойкими, при-
меняют следующий метод: препараты на несколько минут поме-
щают в смесь а-нафтола с генциаиовым фиолетовым (см. ниже);
дифференцируют 50-градусным спиртом, пока пероксидазные зер-
на не будут окрашены в фиолетовый цвет, а весь остальной пре-
парат не станет бесцветным. Заключают в глицерин. Для приго-
товления смеси а-нафтола с генциаиовым фиолетовым чайную
ложку а-нафтола взбалтывают в 1 литре 0,85-процентпого раство-
ра поваренной соли. Полученный раствор а-нафтола отфильтро-
265
вывают и прибавляют по каплям насыщенный спиртовой раствор
генцианового фиолетового до легкого помутнения жидкости; за-
тем прибавляют по каплям 70-градусный спирт, пока жидкость
снова не станет прозрачной. Этот метод основан на том, что зерна,
содержащие фермент, окисляющий а-нафтол, обладают чрезвы-
чайно большой базофилией. Они настолько энергично удерживают
основные красители, что противостоят раскрашивающему дей-
ствию спирта.
Метод Г. В. Эпштейна. Мазок фиксировать в смеси;
96-градусного спирта — 9 частей и формалина — 1 часть; промыть
дистиллированной водой; налить на поверхность мазка на 3 ми-
нуты смесь следующего состава: 40-градусного спирта— 100 см3,
а-нафтола — 1 г, 3-процентиой перекиси водорода — 0,2 см3;
промыть дистиллированной водой; окрашивать от 15 минут до не-
скольких часов следующей смесью: толуидинового синего — 1 г,
лимоннокислого лития — 1 г, дистиллированной воды—100 см3;
быстро сполоснуть дистиллированной водой; быстро (1 секунда)
сполоснуть 1-процентным раствором таннина; высушить фильтро-
вальной бумагой.
Зерна, содержащие пероксидазы, окрашиваются
в ярко-зеленый цвет.
Метод Грехема быстро выявляет пероксидазные гранулы в клет-
ках иа мазках (кровь, простейшие и т. п.).
Влажные или высушенные мазки фиксировать 1—2 минуты в смеси: фор-
малина — 1 часть, 96-градусного спирта — 9 частей; промыть в воде; красить
4—5 минут в 1-процентном растворе, а-нафтола в 40-градусном спирте
(к 100 сл3 этого раствора прибавить 0,2 см3 3-процентной перекиси водорода);
промывать 15 минут в проточной воде; красить 2 минуты в смеси: 0,1 г пи-
ронииа, 4 сл3 анилина н 96 см3 40-градусного спирта; промыть в воде; красить
30—60 секунд в 0.5-процентном водном растворе метиленового синего; про-
мыть в воде, провести через спирты, ксилол, заключить в бальзам.
Зерна нейтрофилов, эозинофилов и базофилов, дающие п е-
р оке ид а з ну ю реакцию, соответственно пурпурно-красные,
светло-красные и пурпурные. Протоплазма и ядра клеток — синие
и голубые, эритроциты —красновато-желтые.
Сукцинод егид р аз а
Сукцинодегидраза широко распространена в животных
и растительных клетках, образуя вместе с цитохромом и цитохро-
моксидазой энзиматическую систему. Этот фермент участвует в
цепи сложных реакций, происходящих при окислении жиров, угле-
водов и белков.
В нашей лаборатории была разработана методика гистохими-
ческого определения сукцинодегидразы в различных тканях. Для
этого из нефиксированного материала изготовляют срезы на замо-
раживающем микротоме. Затем тщательно промывают их дистил-
лированной водой для удаления растворимых веществ, могущих
влиять на восстановление метиленового синего. После этого срезы
окрашивают в смеси: 2 см3 0,05-процентной метиленового синего и
266
2 сл/3 10-процентного янтарнокислого натрия, к которой доливают
фосфатную буферную смесь по Серенсену, с pH 7,6—8,0 — до
10 см3.
Концентрация янтарнокислого натрия может несколько варьи-
ровать. В случае более высокой концентрации янтарнокислого на-
трия реакция обесцвечивания метиленового синего идет быстрее.
Окраска срезов в смеси продолжается 10—15 минут, затем их
переносят на предметное стекло с 1—2 каплями этой смеси и по-
крывают покровным стеклом так, чтобы под ним не осталось пу-
зырька воздуха.
Края покровного стекла тщательно заливают парафином для
достижения анаэробных условий. Таким образом создается анаэ-
робная микрокамера, в которой происходит связанный с окисле-
нием янтарной кислоты процесс перехода метиленового синего в
лейкооснование.
Отмечая скорость обесцвечивания метиле-
нового синего в различных клетках и тканях,
можно установить, в каких элементах тканей
сукцинодегидраза действует активней.
Предварительное нагревание ткани в термостате при темпе-
ратуре 60—80° в течение 5—15 минут полностью уничтожает спо-
собность клеток давать вышеописанную реакцию. Цианистый ка-
лий в концентрациях 0,01 и 0,001 % также совершенно инактиви-
рует сукцинодегидразу. Изменение pH влияет на скорость обесцве-
чивания метиленового синего кусочками ткани; оптимальное pH
равнб 7,6—8,0.
Концентрация янтарнокислого натрия влияет на скорость
реакции: чем меньше концентрация этой соли, тем медленнее идет
процесс.
В большинстве тканей кролика и мыши нельзя отметить разни-
цу между скоростью реакции в ядре и цитоплазме, однако в глад-
кой мускульной ткани желудка такое различие существует.
В некоторых тканях реакция протекает равномерно в различ-
ных участках, в других тканях — эта реакция идет неравномерно,
т. е. отдельные участки обесцвечиваются быстрее других; к таким
тканям относятся, например: 1) печень, где отдельные дольки
обесцвечиваются быстрее, другие медленнее; 2) волокна попереч-
нополосатой мускулатуры.
Весьма интересные результаты дает реакция на сукциноде-
гидразу в клетках крови.
В табл. 7 приведены результаты наблюдения иад клетками
крови человека.
Реакция по Зелигману и Рутенбургу (1951).
Основана на том, что хлористый тритетразолий в присутствии соот-
ветствующего субстрата ведет себя как акцептор водорода, причем
восстанавливается в синий, нерастворимый в воде, диформазан.
Замороженные срезы (штук 10—15) инкубируют в течение 2 ча-
сов (при 37°) в 20 см3 следующего реактива: хлористый тетразолнй
267
Таблица 7
РЕАКЦИЯ НА СУКЦИНОДЕГИДРАЗУ В КЛЕТКАХ КРОВИ ЧЕЛОВЕКА
(по данным Г. И. Роскина и М. Е. Струве)
Название Начало обесцвечивания Конец обесцвечивания Примечание
Нейтрофилы:
Ядра Плазма и зерни- стость Эозинофилы: 1 Ч.— 1 ч. 30 М. Бесцветны 3—4 часа Бесцветны Ядра нейтрофи- лов к концу обес- цвечивания сильно разбухают
Ядра 1 час 3—4 часа Ядра обесцвечи- ваются не полно- стью, остается го- лубая окраска.
Плазма и зерни- Плазма бес- Плазма бес- Зернистость ок-
стость Базофилы: Ядра цветна 1 час, зерни- стость синяя цветна 3 часа, зерни- стость синяя рашивается в жел- товатый цвет
Плазма и зерни- Плазма бес- Плазма бес- Плазма бесцвет-
стость Лимфоциты малые, сред- ние, большие Ядра Моноциты: цветна цветиа ная до и после реакции
1 час Через 5—6 часов ядра почти бес- цветны; на другой день они светло- голубые Ядрышки оста- ются голубыми. Плазма окраши- вается в голубой цвет и остается окрашенной и на следующий день
Ядра 1 час 5—6 часов Плазма окраши- вается в голубой цвет, она остается окрашенной и на следующий день
(1 лгг/сж3) — 1 часть, 0,2 М раствор янтарнокислого натрия— 1
часть, дистиллированная вода— 1 часть, буферный раствор 0,1 М
(pH 7,6)— 1 часть. Срезы споласкивают в 0,85-процентпом рас-
творе NaCl, уплотняют в формалине (30 минут), заключают в гли-
церин. В зонах высокой активности сукцинодегидразы образуется
осадок синего пигмента. Если активность энзима слабая, то про-
исходит частичное восстановление в виде красного моноформазана.
Окраска появляется в первые 5—10 минут и увеличивается во вре-
268
мя инкубации. Толщина срезов играет существенную роль: срезы
не должны быть тоньше 30 ц. Предварительная обработка холод-
ным ацетоном или спиртом значительно подавляет реакцию. Опти-
мум реакции должен быть при pH 7,4—7,8. Для контроля энзим
разрушают нагреванием до 50° С, или подавляют реакцию мало-
натом натрия (3,7 мг/см3) и KCN.
Фосфатазы
Распределение фосфатаз в ядрах и цитоплазме варьирует в за-
висимости от физиологических особенностей клеток (рис. 86, 87).
Рис. 86. Щс-.точиая фосфатаза в моторных (.4)
и чувствительных (Б) нервных клетках (по
Г. И. Роскину и М. В. Шорниковой).
В основе реакции на щелочную фосфатазу (по Гомори) лежит
расщепление глицерофосфата (в условиях щелочной реакции и в
присутствии солей кальция) под влиянием соответствующего эн-
зима. Образующиеся при реакции ионы фосфорной кислоты выпа-
дают в месте фосфатазчон активности в виде трудно растворимого
фосфата кальция. Последний переводится в темную соль кобальта
илн серебра.
269
Метод Г омори (1939, 1951). Свежевыделенная ткань ох-
лаждается 10 минут в рефрижераторе при 4° С и затем фиксирует-
Рис. 87. Кислая фосфатаза в моторных (5) н чувствительных (Л) нерв-
ных клетках (по Г. И. Роскииу и М. Е. Струве).
ся 18—24 часа ацетоном (на льду), обезвоживается 3—6 часов в
двух порциях ацетона, проводится в течение 2 часов через бензол,
заключается (1,5—2 часа) в парафин (дважды сменить): осво-
божденные от парафина срезы доводятся до дистиллированной
270
воды. Затем срезы обрабатывают по одному из вариантов методи-
ки Гомори (А— 1939 г.; Б—-1951 г.).
А. Обрабатывают срезы 1—2 часа (при 37° С) в следующем
растворе: глицерофосфат натрия — 0,5 г Na-веронал —0,5 г, 2-про-
центный раствор хлорида кальция — 5 сл3, 2-процентиый раствор
сульфата магния —2 с.«3, дистиллированная вода— 100 с л3.
Б. Обрабатывают срезы 1—2 часа (при 37° С) в следующем ра,
створе: глицерофосфат натрия — 0,3 г, Na-веронал — 0,5 г, 2-про-
центный раствор хлорида кальция — 25 см3, 10-процентный рас-
твор сульфата магния— 10 капель, долить дистиллированной во-
дой до 50 см3.
После обработки срезов в растворах А или Б их моют водой 1
минуту, помещают на 5 минут в 2-процентный раствор сульфата
кобальта, 1 минуту споласкивают дистиллированной водой и пе-
реводят на 5 минут в слабый раствор сульфида аммония; затем
спирты, ксилол, бальзам.
Выявление щелочных глицерофосфатаз по
Гомори (модификация Бизеле, 1944).
1) Небольшие кусочки ткани фиксируют в абсолютном ацетоне
или 80-градусном спирте (24—48 часов иа холоду). 2) Помещают
в абсолютный спирт (не передерживать). 3) Быстро заливают в
парафин (не перегревать). 4) Изготовляют срезы, толщиной 5—
10 и. Депарафинированные срезы проводят через ксилол, абсолют-
ный спирт, смесь равных частей спирта и эфира. Для укрепления
среза на стекле и предохранения его от осадков, которые могут вы-
пасть в процессе обработки, иа срез наносится капля жидкого ра-
створа коллодия. 5) Излишек коллодия смывают повторным нане-
сением смеси спирта и эфира. Стекло с наклеенными срезами слег-
ка подсушивают иа воздухе, затем для уплотнения коллодия пе-
реносят на 2 минуты в 70-градусный спирт и затем в дистиллиро-
ванную воду. 6) Срезы помещают в реактив следующего состава:
2-процеитный раствор глицерофосфата (рекомендуется а и 3) —
2,5 части: 2-процентный раствор барбитуро-кислого натрия (меди-
нал) —2 части; 2-процентный раствор хлористого кальция—1
часть; М/50 хлористого магния — 6 частей; дистиллированной во-
ды— !/а части. Для контрольных срезов приготовляют раствор,,
в который не добавляют глицерофосфата натрия. В вышеуказан-
ном растворе срезы выдерживаются до суток в термостате при тем-
пературе 38°. 7) Срезы обмывают 1-процентным раствором хлори-
стого кальция (несколько раз). 8) Переносят на 2 минуты в 2-про-
центиый раствор хлористого кобальта. 9) Тщательно промывают
в нескольких сменах дистиллированной воды. 10) Переносят в 1—
2-процентный раствор сульфида натрия (свежеприготовленный).
11) Тщательно промывают, после чего их можно докрашивать
светлым зеленым и другими анилиновыми красителями. 12) За-
ключают в бальзам обычным образом.
Выявление кислых глицерофосфатаз (модифи-
кация Кабата и Неумана).
271
До 6-го параграфа поступают так же, как при выявлении ще-
лочных глицерофосфатаз.
6) Срезы переносят в реактив следующего состава: ацетатного
буфера pH 4,7—12 сл3. 0,1 М раствор азотнокислого свинца —
16 см3. Дистиллированной воды — 74 см3. 3,2-процеитного раство-
ра натрия |3-глицерофосфата — 4 см3 (можно использовать и
смесь а и (J).
Если при добавлении глицерофосфата выпадает осадок, то
раствор реактива надо центрифугировать, В этом реактиве срезы
выдерживают до 24 часов в термостате при температуре 30°. Для
контрольных срезов к реактиву не добавляют глицерофосфата на-
трия. 7) Хорошо споласкивают водой. 8) Переносят в раствор суль-
фида натрия или аммония на 1—2 минуты. 9) Тщательно промы-
вают, докрашивают и заключают обычным образом в бальзам.
Выявление а д е н о з и н-т р и ф о с ф а т а з ы по Гли-
ку и Фишеру.
Поступают так же, как и в первом способе до 6-го параграфа.
6) Для приготовления реактива надо сперва растворить 5 мг
бариевой соли аденозии-трифосфорной кислоты в 0,5 см3 0,1 ЛА
соляной кислоты, добавить 0,1 см3 Na2SO4 (1,11%) до осаждения
избытка бария. Надо испробовать полноту осаждения, после чего
центрифугировать и жидкость нейтрализовать 0,1 М раствором
едкого натрия. Затем приготовить следующий реактив: к 0,75 см3
вышеприведенного раствора добавить 0,5 см3 буферного раствора
pH = 9,0 (9,36 см3 барбитурата натрия +0,64 см3 0,1 М НС1 и
0,05 см3 0,1-процентного раствора СаС12). 7) Промыть препарат
дистиллированной водой. 8) Перенести в 2-процентный раствор
свежеприготовленного сульфида натрия (1—2 минуты). 9) Про-
мыть, докрасить и обычным образом заключить в бальзам.
Определение эстер. аз (по Нахласу и Зелигману, 1949,
модификация Пирса, 1954). 1) Фиксация на холоду (4—6-процен-
тным формалином или ацетоном; срезы иа замораживающем мик-
ротоме (10—15 и) или после заливки в целлоидин-парафин. 2)
Предметное стекло со срезами инкубируют 1—15 минут в следую-
щем реактиве: растворяют 20 мг а-нафтилацетата в 0,25 см3 аце-
тона и добавляют 20 см3 0,1 М фосфатного буфера (pH 7,4);
встряхивают до исчезновения мути и добавляют 20 см3 прочного
синего Б (Fast Blue В), фильтруют и наливают на срезы. 3) 2 ми-
нуты промывают в воде, докрашивают квасцовым гематоксилином,
снова промывают и заключают в глнцерин-желатину. Места на-
хождения эстераз — черные, ядра синие; липаза, ацетилхолин-эс-
тераза и холин-эстераза гидролизуют а-пафталацетат и дают
черное окрашивание.
Оксидоредуказа
Гирш и Бухман и Г. И. Роскин показали, что положительная
окраска клеток или их компонентов с помощью лейкобазы метиле-
272
нового синего зависит от присутствия ферментного фактора, отно-
сящегося к группе ферментов оксидоредуказ.
У различных животных и в разных тканях эта реакция проте-
кает различно, и характер ее меняется в зависимости от функцио-
нального состояния клеток. Особо четко окрашиваются в синий
цвет ядра.
Г. И. Роскин показал, что в отличие от нормальных клеток,
клетки злокачественных опухолей не окрашиваются лейкобазой
метиленового синего, и предложил пользоваться этой реакцией
для цитодиагностических целей при диагностике раковых клеток.
Применяя лейкобазу метиленового синего для сравнительного
изучения цитофизиологических свойств нормальных и злокачест-
венных клеток, нам удалось установить своеобразное явление:
плазма нормальных клеток окрашивается в голубой цвет, а ядра —
в темно-синий, в то время как клетки злокачественных тканей ос-
таются или бесцветными, или принимают нежно-голубой оттенок,
а их ядра, как правило, остаются бесцветными (Роскин, 1932; 1939;
Роскин и Соловьева, 1935).
Это явление, подтвержденное в исследованиях Ватермана
(1934 и 1950) и Войнова (1940), оказалось тем более интересным,
что положительная реакция при окраске лейкобазой метиленового
синего зависит от присутствия в нормальных клетках фермента
(по-видимому, типа оксидоредуказы). Таким образом, речь идет
не о гистологической окраске обычного типа, а о своеобразной
цветной цитофизиологической реакции нормальных и злокачест-
венных клеток.
Доводами в пользу последнего утверждения могут служить
наблюдения, показывающие, что нормальные клетки, дающие чет-
кое окрашивание е лейкобазой метиленового синего, теряют это
свойство после предварительного нагревания их до 80° в течение
30 минут, а также после предварительной обработки их спиртом,
формалином или после воздействия KCN(M/iooo) в течение 40 ми-
нут, и, наконец, после облучения ультрафиолетовыми лучами в те-
чение 30 минут. Легко показать, что все эти факторы не оказы-
вают какого-либо заметного влияния на обычную окраску клеток
метиленовым синим.
Таким образом, отрицательная реакция злокачественных кле-
ток е лейкобазой метиленового синего не только указывает на их
цитофизиологическое своеобразие, но может служить и для диф-
ференциальной цитодиагностики. Этот метод (Г. И. Роскин и
М. Струве, 1946), как. мы полагаем, позволяет быстро получать
дифференцированное окрашивание нормальных и злокачественных
Клеток и тканей. Он может служить не только вспомога-
тельным методом в повседневной патогистологической практи-
ке, особенно при диагностике злокачественных клеток в экссудатах
и пунктатах, но окажется полезным для анализа свойств клеток
при различных формах злокачественных и доброкачественных опу-
холей, при предраковых состояниях и т. д.
18 Микроскопическая техника 273
Интересно отметить, что ядра простейших в отличие от ядер
многоклеточных животных дают отрицательную реакцию с лейко-
базой метиленового синего.
Так же ведут себя некоторые эмбриональные клетки (напри-
мер, клетки эмбриона цыпленка, в отличие от ядер клеток взрос-
лой курицы). У взрослого животного также имеются клетки, ядра
которых едва окрашиваются лейкобазой, например, фибробласты
мыши. В печеночных клетках мыши бледно окрашивается ядро,
а интенсивно — плазма.
Для приготовления гипосульфитной лейко-
базы метиленового синего берут 800 мг гипосульфи-
та, 10 см3 водного раствора 0,1-процентного метиленового синего и
3—4—5 капель соляной кислоты (удельный вес 1,17), разведенной
дистиллированной водой 1 : 3. Лучший результат окраски дает лей-
кобаза с четырьмя каплями соляной кислоты; с меньшим количе-
ством кислоты лейкобаза получается нестойкой, она быстро ста-
новится голубой и непригодной для окраски срезов. Раствор мети-
ленового синего готовят па бидистиллированной воде и перед упо-
треблением тщательно фильтруют.
Гипосульфит применяют химически чистый; обычный же про-
дажный гипосульфит необходимо растворить в дистиллированной
воде, профильтровать и затем перекристаллизовать; такой пере-
кристаллизованный и высушенный гипосульфит надо хранить в
байке с притертой пробкой.
При изготовлении лейкобазы нужно строго соблюдать следую-
щий способ: 800 мг гипосульфита насыпают в чистую колбочку!
(посуда должна быть абсолютно чистой, сухой; предварительно ее
ополаскивают бидистиллированной водой), затем наливают 10 см'
0,1-процентного раствора метиленового синего. После того как ги-
посульфит полностью растворится (несколько раз взбалтывать), в
колбочку добавляют 4 капли указанного раствора соляной кисло-
ты. Колбочку со смесью взбалтывают при осторожном подогрева-
нии на горелке (20—30 секунд) до появления в ней серо-молочно-
го осадка. Затем дают раствору остыть (5—10 минут) и тщательно
фильтруют через двойной фильтр. Воронка, как и вся остальная
посуда, должна быть абсолютно чистой, иа ней не должно быть
следов метиленового синего, иначе профильтрованная лейкобаза
будет голубой и обесцвечивания раствора не наступит. Если про-
фильтрованная лейкобаза примет голубой оттенок, надо поставить
ее иа некоторое время в темноту. Лейкобазу метиленового синего
следует готовить перед употреблением, но ее можно сохранять
10—12 часов в темноте.
Правильно приготовленная лейкобаза бесцветна или имеет
слегка желтоватый тон. Только такая лейкобаза годна для окра-
шивания срезов.
Срезы изготовляются из свежих, нефиксированных
кусочков ткани с помощью замораживающего микротома. Толщи-
274
на срезов 10—15 ц. Кусочки нормальных или патологических тка-
ней можно перед изготовлением срезов хранить в рефрижераторе
(от +2° до —2°) в физиологическом растворе поваренной соли в
течение 1—2 дней.
Изготовленные срезы переносят в бактериологическую чашку
с физиологическим раствором поваренной соли. Затем с помощью
пипетки срез переносят иа предметное стекло (избыток физиологи-
ческого раствора поваренной соли отсасывают фильтровальной бу-
магой), расправляют срез препаровальными иглами и подсушива-
ют при комнатной температуре. Одновременно рядом со срезом
опухолевой или иной патологической ткани таким же образом на-
клеивают срез нормальной ткани (например, почка или сердце
мыши), который служит для контроля эффекта окрашивания. Та-
кие подсушенные срезы готовы для окраски, которую можно про-
водить тотчас же или через 1—2 дня. Подсушенные срезы злока-
чественных опухолей сохраняют свою способность к типичному
окрашиванию лейкобазой в течение двух недель при условии хра-
нения их в сухом и темном месте.
Окрашивание срезов производят следующим образом:
раствор лейкобазы с помощью пипетки наливают на предметное
стекло с наклеенными срезами. Лейкобаза должна быть бесцвет-
ной в течение всего времени окрашивания. Если раствор лейкоба-
зы голубеет, его необходимо сменить. Красить надо до тех пор, по-
ка срез нормальной ткани четко окрасится в синий цвет; срез ра-
ковой ткани должен оставаться бесцветным. Затем надо слить
лейкобазу, промыть срезы большим количеством бидистиллирован-
ной воды, после чего налить на них 0,05-процонтного водного рас-
твора кислого фуксина.
Красить кислым фуксином надо 2—3 минуты, избегая перекра-
шивания срезов. Слив кислый фуксин, дают срезам хорошенько
просохнуть.
Рассматривать их можно в глицерине или заключать в глице-
рин-желатину. Можно также готовить постоянные препараты,
заключая подсушенные срезы в чистое парафиновое масло и об-
рамляя покровное стекло рамкой из соответствующей массы (ас-
фальтовый лак и т. п.). Можно заключить их и в канадский баль-
зам, ио он должен быть нейтральным, иначе срезы раковых тканей
быстро синеют.
Окрашивание лейкобазой метиленового синего требует строго-
го соблюдения световых условий: весь процесс окрашивания необ-
ходимо проводить в затемненном помещении. Яркое освещение
может извратить эффект окрашивания, так как раствор лейкобазы
на свету изменяется. И, наконец, повторяем: окрашивать срезы
можно только бесцветным раствором лейкобазы, в противном
случае результаты окраски будут ошибочными. При правильном
проведении метода различия между злокачественной и нормальной
тканью видны и макроскопически: нормальная ткань синяя, а
срез злокачественной ткани — красный.
18* 275
исследования
химического
на
Рис. 88. Витамин С в клетке; ре-
акция Жиру и Леблона. А — три-
паносома; Б—эндотелий капил-
ляра лягушки; В —поперечный
разрез гладкой мускульной клет-
ки желудка крысы; 1' — клетка
злокачественной опухоли крысы
(опухоль Джоблинга); Д — эпите-
лиальная клетка кишечника двух-
месячного эмбриона человека (по
Г. И. Роскину),
Описанный метод применения лейкобазы метиленового синего
относится не только к срезам, ио и к мазкам или отпечаткам раз-
личных нормальных и патологических тканей.
ВИТАМИНЫ
Витамин С
Реакция Жиру и Леб л он а. Орган, взятый для гисто-
витамин С, прежде всего следует
промыть изотоническим раство-
ром левулезы (вводя его в со-
суды) для того, чтобы удалить
мешающий реакции хлористый
натрий, после чего также в кро-
вяное русло ввести 10-процент-
ный раствор азотнокислого се-
ребра, подкисленный уксусной
кислотой (pH 3—4). Можно
пользоваться следующим реак-
тивом: 8 частей 10-процентного
раствора азотнокислого серебра
и 1 часть 1-процентной уксусной
кислоты. Таким образом, дости-
гается не только выявление ви-
тамина С, но и одновременно
происходит фиксация ткани.
Обычно 15—30 минут бывает
достаточно для реакции, после
чего объект споласкивают ди-
стиллированной водой. Чтобы
избежать последующего выпа-
дения серебра и потемнения
препарата, объект обрабатыва-
ют 3-процентным раствором
гипосульфита в течение 15—30
минут и снова тщательно про-
мывают в воде. Если кусочки
органов невелики, раствор азот-
нокислого серебра можно не
вводить в кровяное русло.
В этом случае маленькие объ-
екты помещают непосредствен-
но в подкисленный раствор се-
ребра и затем поступают, как сказано выше.
Все указанные операции необходимо проводить в темноте или
при слабом темно-красном свете фотографического фонаря.
Кусочки ткани, хорошо отмытые в воде, можно уже на свету
раливать в парафин по обычной схеме, а полученные срезы (тол-
276
щиной в 5—8 ц) следует докрашивать эозином, кислым фуксином
илн квасцовым кармином. При этом черные зерна серебра, выпав-
шие на месте нахождения аскорбиновой кислоты, бывают очень
четко видны на препарате (рис. 88). Специфичность метода Жиру
и Леблона надо признать практически достаточной при условии
точного выполнения всех указанных условий. Лучший объект для
изучения витамина С в клетках — кора надпочечника млекопитаю-
щих. (Подробности о применении методов обнаружения витами-
на С в клетках и тканях даны в работе Г. И. Роскина, 1945 г.).
Недавно Бакхус (1950) предложил следующую модификацию
метода: небольшие кусочки ткани помещают на 45—60 минут в
5-процентный раствор азотнокислого серебра (pH 2—2,5) при тем-
пературе 56° С, затем промывают 1 —15 минут дистиллированной
водой и переносят па 30—45 минут в 5-процентный раствор гипо-
сульфита. Проводка через диоксан, заливка в парафин, срезы до-
красить квасцовым гематоксилином, как обычно, заключить в
бальзам. Черные зерна в тетках— места нахождения аскорби-
новой кислоты.
Витамин А
Для выявления витамина Л служит метод Жуайе — Лаверня.
Фиксация: формалин — 15 частей, физиологический раствор--
85 частей. Кусочек ткани заливают обычным образом в парафин.
Срезы помешают в насыщенный раствор треххлористой сурьмы в
хлороформе на 15—60—120 минут. Витамин А дает синее окраши-
вание. Срезы рассматривают в капле хлороформа или ксилола под
покровным стеклом.
ПИГМЕНТЫ
Каротиноиды
Желтые пли красные пигменты, обычно растворенные в жирах,
образуют вещества, обычно называемые липохромами. Они нера-
створимы в воде, глицерине, формоле, слабых кислотах и щелочах,
растворимы в спирте, хлороформе, ацетоне и т. д.
Особенно хорошо растворяются в сероуглероде. Можно заклю-
чать в парафин, если делать это достаточно быстро.
Обесцвечиваются в 1-процентной хромовой кислоте и дву-
хромовокислом калии. С концентрированной серной кислотой дают
кратковременное синее окрашивание; затем пигмент разрушается.
С иодом (обработать материал раствором Люголя) дают фиоле-
товое окрашивание.
У животных широко распространены пигменты, называемые
хром о протеида ми и представляющие собой комбинацию
каротиноидов и белков. Они образуют в воде коллоидный раствор
и нерастворимы в органических растворителях. Хорошо известен
пигмент панцыря рака (астацин), состоящий из белка и красного
277
каротиноида. Если кипячением или фиксатором осадить белки, —
каротиноид освобождается и, как известно, панцирь окрашивается
в красный цвет.
Зрительный пурпур. Простетической группой зритель-
ного пурпура является каротиноид. Берже и Сегаль (1949 г.)
предложили метод, основанный на том, что зрительный пурпур с
хлористой платиной дает осадок, образующий с некоторыми кра-
сителями соединение, нерастворимое в воде и почти нерастворимое
в спирте.
Реакция Берже и Сегаля. 1) Фиксировать сет-
чатку в темноте в смеси: 2,5-процентной хлористой платины
75 см3 и нейтрального формалина 25 см3; 2) промыть в 90-градус-
ном спирте и заключить обычным методом в парафин; 3) депара-
финированные срезы промыть в чистом 60-градусном спирте, а
затем в 60-градусном спирте, насыщенном газообразным хлором.
Это делается для того, чтобы обесцветить меланин, который может
затемнить картину; 4) промыть в проточной воде 10 минут; 5) ок-
расить метиловым зеленым и пиронином 20 минут; 6) быстро про-
мыть водой и провести через 2 стаканчика с безводным диоксаиом;
7) заключить в кедровое масло. Вместо диоксана можно обезво-
дить и в спирте, но при этом часть красителя растворится.
В результате структуры, содержащие зрительный пурпур, ок-
расятся в небесно-голубой цвет.
Хромолипоиды
Хромолипоиды (липофусцины, коричневый
пигмент изнашивания). Коричневые или желтые пиг-
менты, представляющие собой продукты окисления жиров, широ-
ко распространены в различных клетках позвоночных животных
(нервные клетки, интерстициальные клетки семенника, клетки
коркового слоя надпочечников и т. д.). С возрастом количество
их обычно увеличивается. Они нерастворимы в воде, кислотах
и щелочах; плохо растворимы или совсем не растворимы в орга-
нических растворителях, не дают реакции с иодом. Концентриро-
ванная серная кислота часто красит их в красно-коричневый цвет;
обычно их красят Суданом III и шарлахом красным. Они не реду-
цируют аммиачного серебра и часто дают реакцию на железо. При
помощи реакции Ш.морля можно определить в тканях «пигмент
изнашивания»: поместить срезы на 5 минут в смесь (готовить пе-
ред употреблением) равных частей 1-процеитного хлорного же-
леза и свежеприготовленного {-процентного железосинеродистого
калия. Липофусины окрасятся в синий цвет.
Хромолипоиды можно отличить от каротиноидов благодаря
тому, что они не дают реакции с иодом и серной кислотой и го-
раздо меньше растворяются в органических растворителях. От ме-
ланина они отличаются нерастворимостью в щелочах, окрашивае-
278
мостью Суданом III и красным шарлахом и тем, что не восстанав-
ливают аммиачного серебра.
Метод Хека: окрасить срез сульфатом нильского синего,
затем обработать 3-процентной перекисью водорода в течение
24 часов.
Зерна меланина будут бесцветны, зерна хромолипоида окра-
сятся в синий цвет.
Меланины
Желтые, коричневые, черные, иногда слегка фиолетовые пиг-
менты. Совершенно нерастворимы в неорганических и органиче-
ских растворителях. Обесцвечиваются рядом окислителей (3-про-
центной перекисью водорода — 24—36 часов, сменить ее несколь-
ко раз; диафанолом — 24 часа в темноте, в плотно закрытой
склянке; 0,1-процентным марганцевокислым калием 2—24 часа
хорошо промыть водой; 0,3-процентной щавелевой кислотой — не-
сколько минут, промыть водой). Меланины и их пропигменты об-
ладают очень характерной способностью без применения восста-
новителя непосредственно восстанавливать аммиачное серебро.
Кроме того, они легко импрегнируются серебром при обычных ме-
тодах серебрения. Меланины можно отличить от всех других пиг-
ментов благодаря их нерастворимости в органических растворите-
лях, обесцвечиванию рядом окислителей и способности восстанав-
ливать аммиачное серебро.
Гемоглобин
Гистохимические методы выявления гемоглобина чаще всего
основываются на его пероксидазных свойствах (псевдоперокси-
даза). Это свойство зависит не от присутствия пероксидазы в со-
ответствующих структурах, а от каталитических свойств железа,
содержащегося в гемоглобине и его производных.
В качестве реактива обычно применяют бензидин. На препа-
рате, обработанном бензидином, пероксидазы дают одинаковую
картину с гемоглобином. Их можно различать только благодаря
термостабилыюсти пероксидазных свойств гемоглобина и его про-
изводных: двадцатиминутное нагревание при температуре 180° их
не изменяет, тогда как все другие пероксидазы тканей от этого
воздействия разрушаются.
Гемоглобины не дают реакции на железо. В срезах гемоглобин
может быть выявлен методом Слонимского — Лапинского или бо-
лее простым методом Лепена.
Метод Слонимского — Лапинского. Материал
фиксировать 15—24 часа в смеси: красной кровяной соли —2,5—
4 г, формалина— 10—20 с.’Л, дистиллированной воды— 100 см?
(гемоглобин при этом превращается в метгемоглобин); промыть
24 часа в проточной воде; заключить в целлоидин-парафин или па-
рафин; положить депарафинированные срезы в реактив, приго-
279
товленный следующим образом; 0,1—0,2 г бензидина растворить
в 2—3 см3 96-градусиого спирта, добавить 10 см3 96-градусного
спирта, затем 2 см3 4-процентного пергидроля и 1 см3 раствора
бензидина в ледяной уксусной кислоте; промыть срезы 70-градус-
ным спиртом; окрасить их метиловым зеленым, сафранином (или
любым контрастным красителем); быстро провести через спирты,
ксилол и заключить в бальзам.
В результате гемоглобин окрасится в коричневый цвет.
А4етод Лепена. Положить срезы на 1—5 минут в следую-
щую смесь: 2 см3 0,6-процептпого раствора бензидина в 96-градус -
ном спирте и 0,5 см3 раствора пергидроля в 4,5 см3 70-градусного
спирта; сполоснуть их водой и докрасить контрастным красителем,
заключить в бальзам. В результате гемоглобин окрасится в темно-
коричневый цвет.
Более четкие картины, чем после обработки бензидином, дает
предложенная Лизоном реакция «ц и н к-л е й к о». Ес следует про-
водить следующим образом: фиксировать по Слонимскому —Ла-
пинскому (см. выше) 15—24 часа или по Лизону (нейтрального
формола 10 с.м3, уксуснокислого свинца 2—5 г, дистиллированной
воды 100 см3) — 24 часа; приготовить срезы па замораживающем
микротоме; поместить срезы в раствор лейкофуксина, к которому
перед употреблением па каждые 10 см3 прибавить 1 см3 продаж-
ной перекиси водорода; промыть, докрасить любым контрастным
красителем; заключить обычным способом в канадский бальзам.
Приготовление лейкофуксина: смешивают кислого фуксина 1,5 г,
цинковой пыли 10 г, ледяной уксусной кислоты 2 см3, воды 100 см3.
полученную смесь подогревают, пока она не станет светло-желтого
или коричневато-желтого цвета. После охлаждения прибавляют
еще 2 см3 уксусной кислоты. Лейкофуксин годен несколько дней;
если жидкость вновь окрасится в красный цвет, ее следует проки-
пятить.
Гемосидерин
Желтый пигмент. Обычно располагается внутриклеточно. Не-
растворим в воде, в обычных органических растворителях, в ще-
лочах; растворим в кислотах. Наиболее характерно для гемосиде-
рина то, что он дает реакцию на железо (следует применять реак-
цию на турибулевую синь или метод Макаллума).
Гематоидин
Желто-коричневый или красноватый пигмент. Может распола-
гаться внутри- и внеклеточно в виде зерен, шариков или ромбиче-
ских пластинчатых кристаллов. Нерастворим в воде, спирте, эфи-
ре, разведенных кислотах; растворим в щелочах. Не дает реакции
на железо, дает положительную реакцию Гмелина: под воздейст-
280
вием концентрированной азотной кислоты получается красное
окрашивание, переходящее в фиолетовое, синее и зеленое. Эта
реакция обычно дает хорошие результаты только с кристалличе-
ским гематоидипом. С аморфным гематоидином часто получают-
ся только красноватые оттенки.
Билирубин и биливердин
Эти пигменты, — один красно-коричневый, другой — зеленый —
характеризуются теми же реакциями, что и гемагоидпн.
Малярийный пигмент
Обычно располагается внутриклеточно, в виде мелких черных
или коричневых зерен. Нерастворим в воде, разведенных кислотах
и органических растворителях; растворим в разведенных щелочах
и в спиртовых 5-процентных растворах серной, соляной и азотной
кислот при подогревании до 40—50° в течение 24 часов. Обесцве-
чивается перекисью водорода. Не дает реакции на железо и не
восстанавливает аммиачного серебра. На препарате малярийный
пигмент можно отличить от меланина по его неспособности восста-
навливать аммиачное серебро /г растворимости в разведенных ще-
лочах; ог хромолипоидов — потому, что он не окрашивается кра-
сителями, специфичными для жиров.
При фиксации формалин может образовать в ткаии осадок, ок-
рашенный в коричневый цвет, похожий на малярийный пигмент.
Их можно различить по расположению: осадок формола обнару-
живается как внутри, так и вне клеток самых различных тканей,
малярийный пигмент находится только внутри клеток ретикуло-
эндотелиальной системы и крови.
Аргентафинная и хромафинная реакции
Аргентафинная реакция — реакция восстановления
некоторыми тканевыми элементами металлического серебра из ра-
створа аммиачного серебра, зависит от присутствия редуцирую-
щих веществ (в первую очередь палифеиолов, орто- и пара-амшю-
фенолов). Положительную аргентафиниую реакцию дают некото-
рые меланиновые пигменты и пропигменты, а также гранулы опре-
деленных клеток: например, клетки Кульчицкого в либеркюновых
железах, клетки Чиаччио, базигранулярные клетки Клара и т. д.;
эти гранулы являются одновременно хромафинными и аргента-
финными. Аргентафинная реакция существенно отличается от им-
прегнации серебром, при которой сперва пропитывают ткань се-
ребром, а затем воздействуют на нее (см. теорию импрегнации)
специальными восстановителями. Напротив, при аргентафиниой
281
реакции восстановителем серебра являются редуцирующие веще-
ства самой ткани. Методика реакции (пб Массону 1914, 1932):
фиксируют жидкостью Буэна, депарафинированные срезы тща-
тельно, не менее 2 часов моют дистиллированной водой, затем по-
мещают на 24 часа (в темноте, в закрытом сосуде) в раствор ам-
миачного серебра (0,25-процентный раствор AgNO3 осаждают
раствором аммиака, затем добавляют осторожно по каплям, все
время взбалтывая, аммиак до растворения осадка, после чего при-
бавляют, для удаления избытка аммиака, по каплям, 0,25-процепт-
ный раствор AgKO3 до момента, когда раствор станет слегка опа-
лесцирующим); споласкивают дистиллированной водой; обраба-
тывают несколько минут 0,1-процентным раствором хлорного зо-
лота, затем 5 минут 5-процентным раствором, гипосульфита натрия,
тщательно промывают водой, докрашивают гематоксилин-
эозином или квасцовым кармином; заключают, как обычно, в баль-
зам. Аргентафинные вещества — черные или темно-коричневые.
Хром а фин пая реакция. При действии бихроматов не-
которые элементы тканей окрашиваются в коричневатый цвет. Эта
реакция обусловлена главным образом присутствием в клетках ад-
реналина, который является ортодифенолом, однако и другие ве-
щества (полифенолы, аминофенолы, орто- или иара-полиамины)
также дают хромафинную реакцию. Методика реакции проста:
фиксируют жидкостью Мюллера+формалин или после фиксации
объекта формалином обрабатывают срезы в течение нескольких
часов 3-процентным раствором двухромовокислого калия. Жерар,
Кордие и Лизон показали, что коричневое окрашиваниё’зависит не
от восстановления бихроматов, а является результатом окисления
хромафинной субстанции. Действительно, можно получить такое
же окрашивание и с бесцветным окислителем, например, с иодно-
ватокислым калием. Следует помнить, что в тканях может проис-
ходить псевдохромафинная реакция — результат интенсивной ад-
сорбции солей хрома; в этом случае окрашивания с иодноватокис-
лым калием не наступает.
Хромолиз
Возможности гистохимии, несмотря на ее огромные успехи в
последние годы, все еще остаются ограниченными. Поэтому при
анализе элементов ткани гистохимические методы необходимо со-
четать с методами обработки клеток определенными реактивами.
В качестве примера действия различных реактивов на некоторые
элементы клетки приводим таблицу 8, составленную по данным
монографии Миловидова (1951).
Клетки, обработанные реактивами, следует затем зафиксиро-
вать и окрасить различными красителями; сравнить под микроско-
пом цитологические картины контрольных и обработанных объек-
тов. В этом заключается метод хромолиза, в свое время предло-
женный Унна.
282
Таблица 8
ДЕЙСТВИЕ РЕАКТИВОВ НА ХРОМОСОМЫ И ЯДРЫШКО
Реактив Хромосомы Ядрышко
Дистиллированная вода Медленно растворяют- ся, не набухая Не растворяется, не набухает
Горячая вода 70—-100°С Сильно набухают и растворяются Почти не изменяется, падает интенсивность по- следующей окраски
Концентрированная со- ляная кислота Быстро растворяются Сильно набухает и при длительном действии большая часть раство- ряется
0,1-процентный раствор соляной кислоты Не растворяются Не растворяется, на- бухает
Концентрированная фосфорная кислота Не растворяются Большая часть раство- ряется
Уксусная кислота Не растворяются Не растворяется
Уксуснокислый натрий Хромосомы разных ор- ганизмов ведут себя раз- лично Не растворяется
10-процентный раствор Растворяются раньше Плохо растворяется
КОН или NaOH ядрышка или совсем не раство- ряется
Концентрированный ра- створ Ка2СОз Растворяются Трудно или совсем не растворяется v
10—20-процентный ра- створ NaCl Растворяются Трудно или совсем не растворяется
10-процентный раствор Na2SO4 Растворяются Не растворяется
Пепсин Не растворяются Набухает и частично растворяется
Трипсин Растворяются В разных клетках ве- дет себя различно
Органические раство- рители (эфио, ацетон, хлороформ, бензол) Частично растворяются Не растворяется
ОПРЕДЕЛЕНИЕ ИЗОЭЛЕКТРИЧЕСКИХ ТОЧЕК КЛЕТОК И ТКАНЕЙ
Пишингер следующим образом обосновывает метод определе-
ния изоэлектрических точек элементов ткани. В водной среде бел-
ковые вещества срезов тканей имеют присущие амфолитам элек-
тростатические заряды, зависящие от соотношения диссоциации
основных NH2 и кислых СООН групп. Это соотношение меняется
в зависимости от pH окружающей среды. При определенном pH
диссоциация обеих групп будет одинаковой. Эта величина pH со-
ответствует изоэлектрической точке исследуемого объекта. В этой
области происходит перемена электрического заряда и тем самым
меняется и электростатическая адсорбция. Таким образом можно
определять изоэлектрические точки элементов тканей, устанавли-
вая зону быстрого падения окраски неперезаряжающимися краси-
телями при различных концентрациях водородных ионов.
283
Пишингер для определения изоэлектрической точки ткани при-
меняет водные растворы толуидинового синего и цианола. Концент-
рация растворов красителей составляет 1 : 2000 в N/200 фосфатной
смеси, которая благодаря своему буферному характеру обеспечи-
вает нужную концентрацию водородных ионов растворов красите-
лей. Имеющийся всегда в запасе основной раствор красителя
1 : 1000 разбавляется равным количеством соответствующих N/100
буферных растворов. Применение однозамещенного и двузаме-
щенного фосфата, однако, допускает значение pH в пределах 4,2—
7,85. Более кислые растворы получаются комбинацией НС1 с одно-
замещенным фосфатом.
Взятый для исследования материал фиксируют в абсолютном
спирте, и, проведя через бензол, заливают его в парафин. Срезы
через ксилол п спирт переводят в воду, в течение 10 минут окра-
шивают растворами красителей с различным pH, быстро сполас-
кивают N/200 фосфатными растворами соответствующего pH.
Препараты, окрашенные, толуидиновым сипим, после этого
фиксируют для закрепления красителей в 4-процентном растворе
молибденовокислого аммония, промывают в воде и, проведя через
спирты н ксилол, заключают в бальзам. Препараты, окрашенные
цианолом, обсушивают фильтровальной бумагой, быстро проводят
через смесь ксилола и спирта и через ксилол заключают в бальзам.
Определенное значение pH, при котором происходит резкое
уменьшение окрашиваемости, соответствует изоэлектрической точ-
ке. Оно происходит в кислой стороне для основного красителя то-
луидинового синего и в щелочной — для кислого красителя циа-
нола.
В качестве красителей можно употреблять метиленовый синий
и кислый фуксин (Г. И. Роскин).
Этот метод может иметь самое широкое применение для опре-
деления изоэлектрических точек различных клеток и тканей.
В качестве примера рассмотрим различия изоэлектрических
точек чувствительных и моторных клеток (табл. 9) (Г. И. Роскин
и М. В. Шорникова, 1954).
Приведенные данные показывают, что моторные и чувствитель-
ные нейроны четко различаются по электроколлоидальным свой-
ствам ядра, ядрышка, цитоплазмы и тигроида.
Демпсей и его сотрудники улучшили метод Пишингера, окра-
шивая объект сильно разведенными красителями в течение 24 ча-
сов; в качестве буферного раствора более всего пригоден ацетатно-
вероналовый буфер по Михаэлису (ионная концентрация 0,02),
позволяющий вести определения изоэлектрических точек тканей
в достаточно широком интервале; красители применяются в
М/1000 разведении; в качестве основного красителя — метилено-
вый синий (тетраметилтионинхлорид), в качестве кислого краси-
теля — оранж G (двунатриевая соль бензол-азо-2-иафтол-6,8-ди-
сульфоновой кислоты). При окрашивании используют смесь рав-
ных частей красителя и буферного раствора. В течение 24-часово-
284
Таблица 9
pH ИЗОЭЛЕКТРИЧЕСКИХ ТОЧЕК МО ГОРНИХ И ЧУВСГВИГГЛЕНЛХ КЛЕТОК
Обьекг исследования
Крол и к
Ядро..................
ЯдрЬ’ШКО..............
Цитоплазма............
Тигроид ..............
Крыса
Ядро..................
Ядрышко...............
Цитоплазма............
Тигроид ..............
Мышь
Ядро..................
Ядрышко...............
Цитоплазма............
Тигроид ..............
pH изоэлектри- ческих точек уотор- ных клеток pH чувствительных клеток
4,6 3,4
5,4 5,0
3,2 3.8
3,8 3,0
4,4 5,4
6,0 5,4
5,0 4,6
5,2 4,0
5,1 5,0
4,4 5,3
3,6 3,2
3 4 2 9
го окрашивания раствор механически осторожно взбалтывается
Окрашивание ведется в закрытых сосудах на водяной бане при по-
стоянной температуре 25°±0,ГС. Окрашенные препараты быстро
обезвоживаются проводкой через ряд растворов бутанола возра-
стающей концентрации и затем, как обычно, заделываются в ней-
тральный бальзам. В качестве фиксаторов Демпсей использует
смеси Ценкера и Буэна. Для приготовления ацетат-вероналового
буфера 9,714 г ацетата натрия (МаС2НзО24-ЗН2О) и 14,714 г веро-
налового натрия растворяют в 500 см3 дистиллированной воды
(свободной от СО2). К каждым 5 см3 основного раствора добавля-
ют 2 см3 8,5-процентного раствора NaC), что позволяет поддержи-
вать ионную концентрацию буфера на постоянном уровне, равном
ионной концентрации солевого раствора, изотоничного крови. Из-
менение оН буфера достигается прибавлением 0,1 N раствора НС1
(табл. 10).
Методика Пишингера — окрашивание определенными красите-
лями, растворенными в буферных растворах с различными pH —
позволяет определять не только изоэлектрические точки тканевых
элементов, но и степень базофилии или оксифилии исследуемых
структур. Лишь единичные структуры при всех условиях окраши-
ваются исключительно основными красителями. Столь же редки
тканевые элементы, окрашивающиеся только кислыми красите-
лями. Все же другие структуры можно назвать относительно базо-
фильными, так как при соответствующем pH раствора они будут
также окрашиваться и кислыми красителями. Основным краси-
телем при высоком pH, как правило, окрашиваются все структуры
285
Таблица 10
pH АЦЕТЛТ-ВЕРОНЛЛОВОГО БУФЕРА
Количество прибавля- емого 0, I К раст- вора HCI. см9 pH буфера Количество прибавля- емого 0,1 N раст- вора НС1, см* pH буфера
0 9,64 6,5 6,75
7,0 6,12
0,25 9,16 8,0 5.32
0,5 8,90 9,0 4,93
0,75 8,68 10,0 4,66
1,0 8,55 11,0 4,33
2,0 8,18 12,0 4,13
3,0 7,90 13,0 3,88
4.0 7,66 14,0 3,62
5,0 7,42 15,0 3,20
5.5 7,25 16,0 2,62
6,0 6,99
препарата. При средних значениях pH интенсивно окрашиваются
только некоторые относительно базофильные элементы, а дру-
гие— бледно илн совсем не окрашиваются, так как pH раствора
красителя лежит ниже их НЭТ. При низких значениях pH
(ниже 2) окрашиваются только наиболее базофильные структуры.
Определение степени базофилии структуры может служить указа-
нием для дальнейшего гистохимического ее анализа. Вещества,
базофильные свойства которых достаточно известны: 1) нуклеино-
вые кислоты (нуклеопротеиды), — их базофилия определяется
группами фосфорной кислоты; 2) кислые полисахариды и простые
кислые мукополисахариды, которые несут карбоксиловые группы
уроновых и гексоновых кислот и обладают относительно интен-
сивной базофилией; 3) сложные кислые мукополисахариды, кото-
рые имеют, кроме того, эстерообразно связанные группы O-SO3H
или группы фосфорной кислоты и отличаются исключительно силь-
ной базофилией по сравнению с другими тканевыми элементами;
4) липохромы; их базофилия мало изучена; она зависит, по-види-
мому, от присутствия в молекуле окси- (кето-) кислот; 5) мочевая
кислота; ее производные, часто встречающиеся в тканях беспозво-
ночных, выделяются своей повышенной базофилией. Надо отме-
тить, что обработка препаратов некоторыми реактивами может
быть причиной искусственно вызванной базофилии. Так, например,
в результате длительной обработки хромовой кислотой нейтраль-
ные макромолекулярные полисахариды могут давать эффект базо-
филии.
Повышение базофилии наблюдается также в элементах тканей
с повышенным содержанием серы, если они подвергаются дейст-
вию периодной кислоты, перманганата калия или хромовой кис-
лоты, что вероятно, связано с окислением сульфидных и сульф-
гидрильных групп.
Подробности применения метода определения изоэлектриче-
286
ских точек, а также цитофизиологическое значение этого
метода подробно изложены в работе Г. И. Роскина (1946).
МИКРОСЖИГАНИЕ
Цель метода заключается в изучении распределения раз-
личных неорганических соединений в клетках и тканях, причем
препарат обрабатывается таким образом, что эти вещества
в общем сохраняют то расположение, которое имело место в
живых клетках и тканях. Этот метод состоит в том, что срезы
Рис. 89. Сподограммы тканей. А — гладкая мышечная гкапь кишеч-
ника кошки; Б — сердечная мускулатура кошки; В — поперечно-по-
лосатая мускулатура кошки; Г — хрящ; Д — почечный клубочек кош-
ки; Е — эпителий кишечника.
ткани подвергаются действию температуры 600—700°, и распре-
деление золы на препарате сравнивается с контрольными пре-
паратами, окрашенными обычными гистологическими способами
(рис. 89).
Для микросжигания можно употреблять как замороженные,
так и парафиновые срезы. Парафин при нагревании, если ои до-
статочно очищен, испаряется, не оставляя следов на препара-
те. Ткани, взятые для опыта, могут 'быть свежими или предва-
рительно фиксированными. Весьма важно чтобы все употреб-
287
ляемые реактивы и промежуточные среды были химически
чистыми и не содержали неорганических соединений, способ-
ных загрязнить изучаемую ткань. Фиксаторы, содержащие хро-
мовые соли или сулему, непригодны, так же как фиксаторы, со-
держащие кислоты (например, смесь Буэна), так как они извле-
кают из ткани соли. Лучшими фиксаторами являются спирт,
формалин или формалин, разведенный спиртом (1:10). Заливка
в парафин и наклейка срезов производятся обычным способом.
Рис. 90. Печь для микросжигания.
Замороженным срезам дают подсохнуть на предметных стеклах.
Толщина предметных стекол должна быть около 1 — 1,2 мм. На-
гревание лучше переносят предметные стекла из зеленоватого
стекла. Опытным путем надо подобрать сорт предметных сте-
кол, в которых при нагревании не образуется трещин.
Для микросжигания нет необходимости в особом аппарате,
и нагревание можно производить на любой металлической
пластинке, подогреваемой горелкой Бунзена. Но значительно
удобнее производить сжигание в маленькой электрической печ-
ке, снабженной реостатом (рис. 90). Пластинка, па которую
кладется предметное стекло с препаратом, не должна быть
железной или медной — лучше всего сделать пластинку из пла-
тины, фарфора или плавленного кварца.
Как и всякое химическое сжигание, микросжигание должно
производиться медленно. Препарат надо нагревать до опреде-
ленного температурного минимума, прн котором происходит
полное сжигание его.
В основном нагревание до темно-красного накала, т. е. до
500—600°, вполне достаточно, и температуру не следует под-
нимать выше. К электрической печи для точного измерения
температуры можно приспособить пирометр типа Лешателье,
но для большинства исследований это не является необходимым.
Нагревание должно достигнуть такой степени, чтобы пред-
метное стекло немного размягчилось (не перегреть!) и тогда зер-
288
пышки золы сожженного препарата прилипают к стеклу, что
предохраняет их от смещения. В процессе постепенного нагре-
вания изучаемого препарата наступает фаза «обугливания». Чем
постепеннее и осторожнее производится нагревание, тем меньше
нарушений происходит в объекте особенно на стадии «обугли-
вания».
После сжигания с препаратом надо обращаться с большой
осторожностью. Его покрывают очень тонким покровным стек-
лом, прикрепляемым с краев узким слоем парафина.
Приводим следующие указания Поликара по проведению
микросжигания:
1. Постепенно довести температуру до 200° в продолжение
10 минут.
2. Постепенно повышать температуру до 280° в течение сле-
дующих 5 минут.
3. Постепенно повышать температуру до 385°—5 минут.
4. Постепенно повышать температуру до 480°—5 минут.
5. Постепенно повышать температуру до 580°—5 минут.
6. Постепенно повышать температуру до 650°—3—5 минут.
7. Выключить горелку и охлаждать в течение 5—10 минут.
8. Удалить пластинки из печи и, как только наступит доста-
точное охлаждение среза, наложить на него покровное стекло,
края которого залить смесью из 1 части парафина, 1 части воска
и 1 части смолы. Наличие покровного стекла допускает примене-
ние масляно-иммерсиоиного объектива и предотвращает погло-
щение влаги препаратом. Больше всего нужно заботиться о том,
чтобы во время удаления препарата из печи и заклейки его пок-
ровным стеклом ток воздуха не нарушил расположения пепла на
стекле.
Препарат обязательно изучается в падающем свете. Если его
рассматривают при малом увеличении, то можно предметное
стекло положить на пластинку черного стекла и осветить его силь-
ной лампой сверху. Можно пользоваться также специальными
объективами «ультраопак», сконструированными для рассматри-
вания в падающем свете. Наконец, для тонких цитологических ис-
следований следует пользоваться для темного поля кардиоид-
к о н д е н с о р о м. При изучении топографии золы на препарате
видимые картины необходимо постоянно сравнивать с контроль-
ными препаратами, полученными с обычной гистологической тех-
никой. При этом учитывается количество золы, форма, цвет, ха-
рактер образовавшихся кристалликов и т. д. в различных органо-
идах клетки или различных элементах ткани.
Зола, полученная после микросжигания препарата, может
быть подвергнута дальнейшему микрохимическому и микроспект-
рографическому анализу (см. специальные руководства по микро-
химии и спектральному анализу).
Подробности применения метода микросжигания даны в ра-
боте Н. С. Скадовской (1944).
Ы Макроскопическая техника “89
АУТОГИСТОРАД ИОГРАФИЯ
Для обнаружения радиоактивных изотопов применяют один
из трех приводимых ниже методов.
1. Гистологические срезы в контакте с фо-
топленкой или пластинкой. Г) Ткань фиксируют,
обезвоживают и заделывают обычными гистологическими мето-
дами, с предосторожностями, предотвращающими выщелачива-
ние исследуемого радиоактивного материала. 2) Срезы (5 и)
приклеивают на предметные стекла. Целлоидин или парафин
удаляют и срез просушивают. Затем пред?летные стекла по-
гружают в очень жидкий целлоидин (около 1-процентного,
который служит для защиты ткани при дальнейших операциях;
целлоидиновая пленка не должна быть толще 1—2 и). 3) Когда
целлоидин подсохнет, то срезы иа предметных стеклах накрывают
фотопленкой и помещают в рамку для отпечатывания или скреп-
ляют с пленкой зажимами. 4) Ряд пленок проявляют с различ-
ными интервалами, с тем, чтобы получить фотоснимки с оптималь-
ным почернением. 5) После того как пленка проявлена, срез тка-
ни окрашивают и исследуют соответствующие участки на срезе и
на пленке. Операции 3 и 4 проводят в темной комнате.
11. Гистологические срезы, покрытые фото-
эмульсией. (Метод Беланже и Леблона), пункты 1 и 2, как
указано выше. Следующие операции проводятся в темной ком-
нате. Диапозитивные, средней контрастности пластинки по-
гружают в дистиллированную воду (при комнатной
температуре). Когда желатина набухнет, ее соскабливают
стеклянным ножом в небольшой стаканчик и расплавляют при
35—40° в водяной бане. Пять капель расплавленной желатины
наносят пипеткой на срезы и распределяют равномерно мягкой
кисточкой. Предметные стекла должны быть нагреты до
35—39“ С. Покрытые эмульсией предметные стекла сохраняют
в светонепроницаемом ящике. Важно хранить их раздельно,
чтобы избежать действия радиации одного препарата на
эмульсию другого. Время экспозиции зависит от активности
ткани. После соответствующей экспозиции стекла проявляют,
быстро промывают водой, фиксируют, снова промывают водой
в течение 30 мин. и сушат. Рекомендуется просушивать эмульсию
после каждой операции, чтобы снизить число артефактов и по-
тери срезов, однако сушка некоторых эмульсий вызывает на них
трещины и — отсюда — искаженные изображения. В таких
случаях лучшие результаты получаются при окрашивании
срезов немедленно после проявления и промывки, без сушки
между этими операциями. Окрашивание срезов проводят
в стаканчиках, охлаждаемых текущей водой. Весьма важно,
чтобы температура всех применяемых растворов и воды для
промывки была прохладной, иначе эмульсия размягчится
и испортится. При пользовании метиленовым синим срезы no-
ri 90
мещают в 1-процентный щелочный раствор па 30 мин. и пропо-
ласкивают до тех пор, пока краситель не будет удален из
желатины. При применении гематоксилина срезы окрашивают
слегка, чтобы избежать дифференцировки. Срезы обезвоживают
в спиртах; ксилол, бальзам.
III. Гистологические срезы монтируются прямо на фото-
пластинке. .Метод Эванса. 1) Фиксация, обезвоживание п за-
делка производятся как обычно для гистологических объектов,
однако так, чтобы избежать выщелачивания элементов, под-
лежащих исследованию. 2) Парафиновые срезы помещаются па
поверхность теплой (42° С) дистиллированной воды в чашке Пет-
ря. Воде дают остыть п чашку со срезами опускают в больший
стеклянный сосуд с холодной водой. 3) Следующие этапы про-
водятся в темной комнате. Фотопластинку или пленку подводят
под срез. Угол среза придерживают иглой и пластинку выни-
мают. Препарат просушивают перед электрическим вентилятором
и помещают в светонепроницаемый ящик. Пластинки следует
держать раздельно, чтобы радиация среза на одной пластинке
не действовала на эмульсию другой. 4) После надлежащей
экспозиции парафин удаляют из срезов ксилолом и дают
ксилолу испариться. Перед проявлением пластинки тщательно
промывают, так как следы ксилола вызывают потемнение фото-
эмульсии. 5) Пластинки проявляют, быстро ополаскивают,
фиксируют в кислом фиксаже, промывают не менее 20-30 минут
и просушивают. Весьма важно уточнить время проявления, так
как в результате передержки в проявителе наблюдается вуа-
лирование и зернистость, затрудняющие анализ фотографий. До
окрашивания можно ослабить пластинки (и вуаль) в 0,2-про-
центном растворе перекиси марганца. 6) Препарат окрашивают
гематоксилином и эозином, обезвоживают, осветляют ксилолом
и заключают в бальзам или синтетическую смолу.
* я
Первые работы по ауторадиографии принадлежат русскому
физиологу Е. С. Лондону (1904).
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ВЕЩЕСТВ В СТРУКТУРАХ
КЛЕТКИ (ЦИТОФОТОМЕТРИЯ)
Поглощение световых лучей, падающих на препарат, зависит
от концентрации вещества в препарате и.от толщины слоя веще-
ства.
Если с — концентрация, d — толщина слоя вещества
и D—мера поглощенного света (оптическая плотность), то
О = xcd, откуда концентрация с = —, где х — коэффициент по-
xd
г.тощения — величина постоянная. Таким образом, чтобы найти
концентрацию вещества в структуре, нужно определить
интенсивность поглощения света структурой (оптическую плот-
Ш 291
ность) и толщину структуры. Так как последняя величина
совпадает с толщиной среза, количественный анализ вещества
в клетке сводится к нахождению оптической плотности веще-
ства с помощью фотометрии. При определении оптической
плотности необходимо учитывать иные, помимо поглощения,
причины ослабления света, прошедшего через препарат. Эти так
называемые неспецифические потери света, происходящие
вследствие рассеяния, преломления и отражения света
структурами препарата, должны быть тщательно измерены
и исключены при определении оптической плотности. Фотометрия
клетки может осуществляться фотоэлектрическим методом
(фотометрируется увеличенное в микроскопе изображение
клетки) или фотографическим (фотометрируется негатив, изоб-
ражение клетки на фотоэмульсии). Последний метод исходит
из того, что степень почернения негатива зависит от кон-
центрации вещества, через которое прошли лучи, засветившие
эмульсию.
Метод позволяет определить количество вещества порядка
10-12 г на площади 1р.2 и менее. В настоящее время количествен-
ным методом определяются нуклеиновые кислоты, некоторые
аминокислоты и белки (гистоны), белковые SH-группы, поли-
сахариды, кислая и щелочная фосфатазы. Ошибка метода
± 10%. Основные источники ошибок: неправильное измерение не-
специфических потерь света, ошибка из-за неравномерного
распределения вещества в клетке, неверное определение толщины
среза. Предлагаемая методика сводит к минимуму два первых
источника погрешностей количественной цитохимии. Фотографи-
ческий вариант метода более доступен и не требует уникальной
аппаратуры. Используются приборы: микроскоп, осветитель со
стабилизатором напряжения тока, ступенчатый ослабитель,
регистрирующий микрофотометр, планиметр (В. Я. Бродский,
1955, 1956).
Техника фотометрии клетки
Ультрафиолетовая
микроскопия
1. Фотографирование1 клетки с
исследуемым веществом. На ту
же пластинку снимается ступен-
чатый ослабитель, служащий
стандартом.
2. Фотографирование той же
клетки после удаления исследу-
емого вещества. На ту же пла-
стинку также снимается ослаби-
тель.
Фотометрия ок-
рашенного
препарата
1. Фотографирование1 клетки
до реакции.
2. Фотографирование ' клетки
после реакции.
1 Фотографирование проводится в области максимального поглощения
света веществом или красителем.
292
3. Фотометрия негативов на регистрирующем микрофото-
метре. Измерение почернений структур.
4. Расчет оптической плотности как отношения специфиче-
ского ( с веществом) поглощения к неспецифическому (без ве-
щества).
5. Расчет концентрации вещества, прямо пропорциональной
величине оптической плотности и обратно пропорциональной тол-
щине среза.
6. Определение количества вещества, равного произведению
концентрации вещества в структуре на объем структуры.
ЭМПИРИЧЕСКИЕ МЕТОДЫ ВЫЯВЛЕНИЯ НЕКОТОРЫХ
КОМПОНЕНТОВ ТКАНЕЙ
Далее мы приводим ряд выработанных эмпирических методов
для определения некоторых веществ. Эти методы не дают хими-
ческой характеристики выявляемых структур, н поэтому следует
всегда обращать внимание па морфологию окрашиваемых ве-
ществ (например — нити фибрина, расположение слизи и т. д.).
Желчные кислоты
Метод Форсгрена. Небольшие кусочки ткани обраба-
тывают 3-процентным раствором хлористого бария 6—12 часов;
фиксируют 10-процентным формалином—12—18 часов; быстро
заливают в парафин и разлагают на тонкие срезы, кото-
рые окрашивают по Маллори, проводят через спирт, ксилол, зак-
лючают в бальзам.
В результате зерна желчного секрета в печеночных клетках
окрашиваются в красный цвет. Ядра — в синий или оранжевый,
купферовские клетки, эпителий желчных протоков и соединитель-
ная ткань — в синий, эритроциты — в оранжевый.
Фибрин
Способ Вейгерта. Фиксация спиртом, спирт—формо-
лом, Карнуа; материал можно фиксировать и жидкостями Мак-
симова, Ценкера, Хелли. После фиксации кусочков в жидкостях,
содержащих хром, полученные срезы до окраски следует в
течение 2—3 часов обрабатывать 5-процентной щавелевой кисло-
той, а затем в продолжение Va часа 0,3-процентным раствором
марганцевокислого калия. Срезы окрашивают 5—10 минут в ра-
створе генцианового фиолетового или метилового фиолетового
в анилиновой воде. Краситель сливают и срез промокают фильтро-
вальной бумагой, наливают на 5—10 минут люголевский раствор
(в 300 см3 дистиллированной воды растворяют 2 г йодистого ка^-
лия и затем 1 г кристаллического иода), сливают люголевский
раствор, промокают срез фильтровальной бумагой и дифференци-
293
руют в смеси равных частей анилинового масла и ксилола до тех
пор пока фиолетовый или синий фибрин не выступит на светлом
фоне остальной-ткани. Тщательно отмывают анилиновое масло чи-
стым ксилолом (иначе окраска скоро испортится) и заключают
препарат в бальзам.
Ядра можно предварительно окрасить кармином. Если окра-
шивают целлоидиновые или замороженные срезы, нужно следить
за тем, чтобы они были хорошо расправлены.
Приготовление красителя: в банку с притертой пробкой нали-
вают 100 см3 дистиллированной воды и 5—10 см3 анилинового
масла; смесь несколько минут сильно взбалтывают и затем филь-
труют через влажный фильтр. К 90 см3 анилиновой воды прили-
вают 11 см3 насыщенного спиртового раствора генцианового фио-
летового или метилового фиолетового. Этот краситель быстро
портится. Более стоек раствор метилового фиолетового в карбо-
ловой воде (метилового фиолетового— 1 г, абсолютного спирта —
10 см3, 5-процентной карболовой кислоты—100 см3). Очень
долгое время (годами) могут сохраняться следующие растворы:
1) абсолютного спирта 33 см3, анилинового масла 9 см3, метило-
вого фиолетового — до насыщения; 2) насыщенный водный раст-
вор метилового фиолетового. Для окраски надо смешать 3 см3
первого раствора с 27 см3 второго.
Способ Шуенинова. Материал фиксировать формали-
ном (можно и другими фиксаторами). Перенести срезы на 12—
24 часа в 3-процентный раствор перекиси водорода, красить 15—
20 минут в растворе гематоксилина, приготовленного следующим
образом: гематоксилина—1,75 г, 10-процентного водного раствора
фосфорномолибденовой кислоты — 10 см3, кристаллической кар-
боловой кислоты — 5 г, дистиллированной воды 200 см’. Раствор
должен зреть несколько недель. Затем срезы промывают в воде
и обрабатывают 1—24 часа 5—10-процентным водным раствором
фосфорномолибденовой кислоты.
Промыть водой, провести через спирты, ксилол, заключить в
бальзам.
Вместо фосфорномолибденовой кислоты можно применять
фосфорновольфрамовую.
Слизь
Вайль указывает, что хорошие результаты дает окраска тиони-
ном. Фиксировать материал нужно смесями, содержащими суле-
му, или 96-градусным спиртом (фиксация формалином не реко-
мендуется). В случае фиксации формалином перед окраской сре-
зы переносят на срок от Va минуты до нескольких минут в насы-
щенный или 5-процентный раствор сулемы, промывают водой и
затем 5—15 минут окрашиваютв слабом растворе тионина (2 кап-
ли насыщенного в горячей воде раствора тионина на 5 см3 дистил-
лированной воды), споласкивают в 90—96-градусном спирте, про-
294
ведя через ксилол, заключают в бальзам. Слизь окрашивается
метахроматически в красноватый или красно-фиолетовый цвет,
остальная ткань — в синеватый. Срезы можно рассматривать в
воде или глицерине. При этом особенно ярко выступает метахро-
мазия.-
Слизь растворяется в щелочной воде и не растворяется в ней-
тральной. При добавлении к фиксатору уксусной кислоты обра-
зуется почти нерастворимый осадок. Так же действует и крепкий
спирт.
Вместо тионина можно употреблять толуидиновый синий. Спо-
соб окраски и результаты те же.
Муц и кармин по Мейеру. Нагревают смесь 1 г кар-
мина, 0,5 г хлористого алюминия и 2 ел3 дистиллированной воды'
(подождать около 2 минут до того, как светлая вначале смесь не
поте1Миеет), затем добавляют 100 ел/3 50-градусного спирта, через
24 часа фильтруют. Перед употреблением краситель разводят во-
дой в 10 раз. Разведенный краситель довольно быстро портится.
Красить 5—10 минут. Слизь окрашивается в красный цвет; если
при этом окрашиваются и ядра, значит краситель содержит сво-
бодные кислоты, которые нужно нейтрализовать, прибавляя по
каплям 1-процентный раствор соды. Ядра можно докрасить гема-
токсилином.
Амилоид
Из многочисленных методов окраски амилоида Вайль реко-
мендует следующие: обработка иодом или иодом с
серной кислотой. Фиксация материала абсолютным
спиртом или формолом. Срезы обрабатывают люголевским раст-
вором (разведенным до интенсивного желтого цвета), пока они
не пожелтеют, споласкивают в воде и рассматривают в воде или
глицерине. В результате амилоид окрашивается в различные от-
тенки бурого и буро-красного цвета. В глицерине окраска посте-
пенно исчезает. После обработки люголевским раствором срез в
капле воды можно накрыть покровным стеклом, поместить сбоку
капельку серной кислоты и протянуть ее через препарат, подводя
с другой стороны фильтровальную бумагу. В результате бурая
окраска амилоида постепенно перейдет в синевато-фиолетовую.
Окраска конго красным. Фиксировать материал фор-
малином, спиртом, сулемой. Разложить на парафиновые или за-
мороженные срезы. Депарафинированные срезы красить 15—
20 минут (замороженные срезы — в пределах минуты) в 1-про-
центном водном растворе конго красного, перенести на 15 минут
в 1-процентный водный раствор углекислого лития, дифференциро-
вать в 80-градусном спирте, пока от среза не перестанут отходить
облачка красителя, промыть водой, окрасить гематоксилином,
провести через спирт, ксилол, заключить в бальзам.
В результате амилоид окрашивается в кирпично-красный цвет.
295
Кератогиалин, элеидин и кератин
Фиксировать объект формалином, не промывать водой, приго-
товить замороженные срезы, окрасить ядра квасцовым гемато-
ксилином, промыть водой, красить 5—10 минут в концентрирован-
ном водном растворе конго красного, хорошо сполоснуть водой,
дифференцировать в абсолютном спирте, провести через ксилол,
заключить в бальзам.
В результате: ядра и кератогиалин — синие, кератин — темно-
красный.
Для окраски элеидина Унна рекомендует нефиксированные
замороженные срезы окрашивать следующим образом: поместить
в концентрированный водный раствор пикриновой кислоты —
5 минут; окрасить 1-процентным водным раствором нигрозина —
1 минуту; промыть в воде, заключить в канадский бальзам.
В результате элеидин — черно-синий, роговое вещество — яр-
кожелтое.
РАЗДЕЛ ДЕВЯТЫЙ
СПЕЦИАЛЬНЫЕ МЕТОДЫ ИЗУЧЕНИЯ КЛЕТОК
И ТКАНЕЙ
Из специальных методов исследования в этом отделе описы-
ваются наиболее употребительные.
В отдельных же случаях необходимо пользоваться специаль-
ной литературой, так как не всегда и не всякий рецепт одинаково
пригоден для всех объектов.
Кроме того, необходимо помнить, что даже при получении
вначале плохих результатов можно достигнуть намеченной цели
различными изменениями данного метода. При наличии некото-
рого опыта предлагаемые методы могут быть использованы био-
логом для выполнения всех основных микротехнических задач.
Таким образом, во многих случаях очень ценно самостоятельно
разобраться в ошибках, которые не могут быть учтены оригиналь-
ным рецептом.
При этом предполагается знание приведенных выше общих
методов, и поэтому только в отдельных случаях даются допол-
нительные указания.
ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ
Выбор того или иного метода фиксации и окраски диктуется
в первую очередь той задачей, которая поставлена перед иссле-
дователем. Пример влияния метода обработки на характер цито-
логической картины на препарате дан на рис. 91.
Далеко не безразличен способ умерщвления подопытного жи-
вотного. Надо быть очень осторожным с применением наркоти-
ков, вызывающих в некоторых случаях изменения клеточных
структур. Чем меньше подопытное животное, тем осторожнее надо
быть с применением наркоза. Обезглавливание животного являет-
ся во многих случаях наилучшим способом умерщвления для по-
лучения материала, пригодного для цитологического исследова-
ния. С другой стороны, надо помнить, что некоторые ткани целого
ряда животных способны намного переживать смерть самого жи-
вотного.
297
Для прижизненных цитологических наблюдений очень удобны
различные Protozoa, мелкие многоклеточные животные (Rotatoria,
Cladocera, Nematodes), а также мелкие эмбрионы н личинки, оби-
тающие в пресной и морской воде. Более затруднительны наблю-
дения над изолированными из многоклеточных организмов кро-
вяными и лимфатическими клетками, сперматоцитами и т. Д.
Большую пользу приносит изучение таких тканей, которые можно
Г А
Рис. 91. Цитологическая картина в зависимости от
метода наблюдения н обработки. Сперматоциты вино-
градной улитки. Л—in \ivo; Б— фиксация по Шам-
пи, окраска железным гематоксилином (видны мито-
хондрии и аппарат Гольджи); В — импрегнация по
Аойама; виден аппарат Гольджи; Г — витальная ок-
раска нейтральным красным (видны гранулы); Д —
фиксация сулемой с уксусной кислотой, окраска же-
лезным гематоксилином (видна сетчато-зернистая
структура ядра).
получить в виде прозрачных пленок, например, мезентерии, кончик
хвоста личинки тритона. Особое значение имеет изучение клеток
в культурах ткани, являющихся, во многих отношениях идеальны-
ми объектами для решения ряда цитологических проблем.
Клетки многоклеточных животных необходимо помешать в фи-
зиологический раствор или раствор Тироде. Очень желательно
прибавление к этим средам тканевого сока, гемолимфы, целомной
жидкости и т. п., дающее иногда очень хороший результат. При
изготовлении сред для клеток и тканей надо пользоваться безу-
коризненной дистиллированной водой и тщательно промытыми
стеклянной посудой, покровными и предметными стеклами. При-
меняемые среды должны быть изотоничными, так как изменение
298
•з
осмотического давления существенно влияет па клеточные струк-
туры.
Немалые трудности представляет регулировка оптимального
pH применяемой среды. В большинстве случаев pH должен быть
около 7. Небольшое уклонение в щелочную сторону обычно мень-
ше вредит при цитологических наблюдениях, чем сдвиг в кис-
лую сторону. Наблюдения производят, помещая объект между
покровным и предметным стеклом или в висячей капле, что
имеет ряд преимуществ, так как при этом клетки не подвергаются
сдавливанию, а окружающую их среду можно легко обновлять.
В некоторых случаях полезно подкладывать под покровное стекло
волокна ваты, мельчайшие кусочки стеклянных капилляров и т. д.
для предохранения клеток от сдавливания. При наблюдениях
надо постоянно учитывать возможность изменения клеточных
элементов под влиянием изменения окружающей среды—подсы-
хания, недостатка кислорода. При исследовании клеток тепло-
кровных животных надо пользоваться нагревательным столиком,
прикрепляемым к столику микроскопа. Интенсивность освещения
при наблюдении также может оказать влияние на состояние
клеток; особенно надо избегать действия тепловых лучей. Для
этой цели между источником света и осветительным зеркалом
микроскопа можно помещать так называемый стеклянный шар
сапожников. Очень полезно для решения ряда цитологических
вопросов пользоваться темным полем, а также фазово-контраст-
ным микроскопом.
Цитоплазма
Прижизненное изучение цитоплазмы особенно важно, так как
фиксация структурных особенностей живой протоплазмы принад-
лежит к труднейшим задачам микроскопической техники.
При прижизненном наблюдении объекта нужно помнить о чув-
ствительности цитоплазмы и изменчивости ее структур под влия-
нием внешних воздействий и возможного возникновения в силу
этого артефактов во время самого наблюдения.
Лучшим методом фиксации цитоплазмы простейших, мелких
многоклеточных животных является комбинация предварительной
фиксации их парами осмия с последующей фиксацией смесью
Флемминга Мевеса; кроме того, могут быть использованы сме-
си Гелли, Петрункевича, Буэпа—Дюбоска. Для окраски пользо-
ваться кислым фуксином или светлым зеленым в соответствующих
комбинациях с ядерными красителями.
Объекты, рекомендуемые для прижизненных
наблюдений.
1. Amoeba proteus, различные виды амеб типа Limax, встре-
чающихся в болотах, лужицах.
2. Entamoeba blattae из кишечника таракана. Рассматривать
в содержимом кишечника или прибавлять немного физиологиче-
ского раствора.
299
3. Псевдоподии различных Foraminifera пригодны для наблю-
дений за токами плазмы; рассматривать в морской воде.
4. Плазмодий миксомицетов; особенно пригодны формы, куль-
тивирующиеся на агаре, для наблюдений за явлениями отмеши-
вания в протоплазме.
5. Инфузории (Paramaecium, Stentor, Stylonychia).
6. Spirogyra и Zygnema.
7. Pisum sativum, корневые волоски.
8. Корневые волоски Trianea bogotensis, особо пригодны для
наблюдений за токами плазмы.
9. Tradescantia Virginia особо пригодна для наблюдений за то-
ками плазмы.
10. Интернодиальные клетки Nitella.
11. Клетки Rotatoria, мелких нематод, Cladocera.
12. Сперматоциты бабочек; объек поместить в гемолимфу или
физиологический раствор.
13. Клетки эпидермиса саламандры, тритона или аксолотля; от-
резают кусочки и рассматривают край плавника. Среда: вода или
физиологический раствор.
14. Клетки в культуре ткани.
15. Неоплодотворенные яйца морских ежей, морских звезд, не-
мертин и полихет; среда — морская вода.
16. Яйца нематод; среда — пресная вода.
Объекты для изучения фиксированного ма-
териала. Для этого могут быть использованы все выше пере-
численные объекты.
Изолированные клетки фиксируются парами осмия. Cladocera
Rotatoria фиксируются осмиевыми фиксаторами. Нематод фикси-
руют смесями Гелли, Буэна — Дюбоска или Петрункевича.
Клеточные мостики, плазмодесмы
Прижизненное наблюдение клеточных мостиков в животных
клетках возможно только на немногих объектах. Обычно мате-
риал фиксируют сулемой с уксусной кислотой или смесями Флем-
минга, Буэна или Гелли. Срезы окрашивают железным гематокси-
лином с интенсивной докраской эозином или светлым зеленым.
Можно красить по методу Унна: водный синий — орсеин — эозин
Объектами могут служить.
1. Эпидермис личинок амфибий.
2. Эпителий тонких кишок саламандры или других амфибий.
3. Кость новорожденных млекопитающих (кошка, мышь, кро-
лик) .
4. Хрящ Sepia, Loligo и других Cephalopoda.
5. Эпителий желудка эмбрионов жвачных.
Хорошим объектом для изучения межклеточных мостиков яв-
ляется эпителий твердого нёба хищных или эпителий носового
зеркала жвачных и, особенно, эпителий кондиломатозных разра-
станий (3. С. Кацнельсон).
300
Для изучения замыкающих пластинок могут быть
использованы эпителий тонких кишок кошки, кролика, а также
амфибий и их личинок (фиксация сулемой с уксусной кислотой,
смесь Флемминга) и эпителий кишечника Paracaris equorum.
3, С. Кацнельсон рекомендует в качестве удобного объекта для
изучения замыкающих пластинок эпителий крипт матки жвачных
или свиньи.
Плазмодесмы растительных клеток. Объектами
исследования могут служить семена Phytelephas иасгосагра,
Strychnos nux vomica, Phoenix dactylifera, а также эпидермис
V'isciu-i album. Срезы, сделанные от руки, могут быть сперва изу-
чены прижизненно, а затем обработаны следующим образом:
1) фиксировать срезы смесью Люголя; 2) срезы опустить на 1—
2 минуты в смесь: серной кислоты — 1 часть, воды — 3 части,
иода — до насыщения; 3) красить водным раствором пиоктани-
на—3 минуты; 4) сполоснуть водой; 5) заключить в глицерин.
Ядро
Исследователь, приступающий к изучению ядра, должен при-
нять во внимание не только общие положения о влиянии фикса-
ции на витальное состояние н структуру клетки, но и особо учесть
специфику изучения тонкого строения ядра и возможные ошибки,
возникающие при использовании микротехнических методов без
должной осторожности. В конце XIX в., в период широкого ув-
лечения и некритического использования микроскопической тех-
ники, Бовери и его последователями было развито учение о ядер-
ном остове; они считали, что ядро обладает сложной организа-
цией, имеющей универсальное значение, — в виде системы тон-
чайших переплетающихся и соединяющихся между собою нитей,
на которых располагаются зернышки и глыбки хроматина, интен-
сивно воспринимающего основные красители; промежутки между
петлями сети заполнены ядерным соком, здесь же лежат ядрышки.
Вопрос об истинном строении интеркинетического ядра приоб-
рел особую остроту в последние годы, в связи с современными
построениями морганизма: теоретические представления Моргана
и его последователей настоятельно требуют сохранения хромосом
неизменными в покоящемся .ядре вопреки многочисленным дан-
ным прижизненной микроскопии и экспериментальной цитологии.
Телезницкий (1905) одним из первых высказался с полной оп-
ределенностью в пользу7 бесструктурности покоящегося ядра.
В своей работе он использовал прижизненные наблюдения, а так-
же фиксацию материала четырехокнсью осмия.
К сожалению, данные Телезницкого не привлекли к себе долж-
ного внимания, и только через значительный отрезок времени поя-
вилась целая серия исследований, авторы которых, пользуясь ме-
тодом прижизненного наблюдения, смогли показать отсутствие
в иитеркинетическом ядре постоянной микроскопической структуры
В этой серии исследований значительное место принадлежит
301
использованию .метода ультрамикроскопии. Начиная с русского
ботаника Н. Гайдукова (1910) и кончая новейшими наблюдения-
ми П. Макарова (1948), в этой области были произведены мно-
Рис. 92, Влиянье фиксации
на структуру ядра. Участки
зародышевых пузырьков
Unio. А — при жизни: Б-
после фиксации смесью Гер-
мана; В — после фиксации
флемминговой жидкостью:
Г — после фиксации ценке-
ровской жидкостью (по
Макарове, 1948).
гочисленные исследования на различ-
ных обьектах (растительные пленки,
простейшие, изолированные клетки,
культуры тканей вне организма и т. д.).
Можно считать экспериментально
доказанным, что огромное большинство
интеркинетических ядер самых различ-
ных видов не имеют структурных эле-
ментов кроме ядрышка. К. этому надо
добавить, что опыты с прижизненной
окраской ядер лейкобазами некоторых
безвредных красителей также доказы-
вают, что кариоплазма нормальных
ядер, как правило, бесструктурна
(Г. Роскин). Одпако строение покояще-
гося ядра, так же как и всех других
органоидов клетки, может меняться
в зависимости от физиологического со-
стояния организма, дейс!вия внешних
факторов, или стадии развития самого
ядра; так, например, в стареющих
повреждеппых или начинающих дегеие-
Й шровать ядрах бесструктурная карио-
.тлазма обычно принимает мпогообраз-
но структурированный вид. С этими
фактами должен считаться микроско-
пист при анализе различных вопросов
кариологии.
Весьма важная роль в выяснении
вопроса о прижизненном строении
ядра принадлежит ленинградской шко-
ле экспериментальной цитологии (На-
сонов, Александров и др.) 1 эти исследо-
при действии самых разнообразных
ватели показали, что
повреждающих агентов в гомогенных ядрах появляются зернистые
структуры. Если повреждения обратимы, то вместе с прекращени-
ем раздражения наблюдается исчезновение структур. Многочис-
ленные опыты показывают, что разные фиксаторы, хоз я и в раз-
личной степени влияют на лабильную, легко изменяющуюся
систему ядра, так как под влиянием самых разнообразных фак-
торов, даже в живых, оптически гомогенных ядрах появляются
структуры. Это явление описано на большом числе объектов при
действии па них кислот (Насонов, 1932; Макаров, 1935, 1945),
наркотиков (Макаров, 1934—1938), повышенной температуры
(Иванов п Браун, 1933; Айзенберг, 1934; Макаров, 1945), под
302
влиянием механического повреждения или при удушьп (Насонов,
1930; Александров, 1932; Макаров. 1934).
Влияние различных реактивов иа микроскопическую структуру
ядра показано на рис. 92.
Препарирование и фиксирование материала следует произво-
дить очень быстро и брать возможно меньше кусочки (до 2,5 мм
толщиной). Рекомендуется материал для исследования разрезать
на кусочки или брать большое число объектов для сравнения и
учета возможных артефактов. Само собой разумеется, использу-
емый материал должен быть свеж и взят от здоровых животных.
Существенным условием получения .хорошего цитологического и
особенно наркологического препарата является быстрота взятия
материала для фиксации соответствующей ткани. Наблюдения
показали, что, например, для изучения хромосом материал, по-
лученный через 10—15 минут после смерти, оказался совершенно
не пригодным, так как хромосомы слипались. Срок в 2 минуты
позволяет еще найти одиночные не изменившиеся стадии митоза.
Только материал, зафиксированный через 10—15 секунд после би-
опсии дал хорошие результаты.
Для окраски ядер используют ж е л е з н ы й гемато-
к с и л и н, квасцовый гемато к с и л и н, квасцов ы й
к а р м и н. а также окраску по Манну или по Меллсндорфу; особо
важны для изучения ядер работы Фельгена и Браше. Для ориен-
тировочных наркологических наблюдений полезно пользоваться
уксуснокислым кармином пли смесью метилового зеленого — ук-
сусной кислоты [1 см2 уксусной кислоты + от 0.2 до 1 г метило-
вого зеленого + 100 см'1 воды, прибавлять немного (0,1 до 5 сиг3)
2-процентной осмиевой кислоты]. Для фиксации ядер рекомен-
дуется пользоваться 1—2-процентной осмиевой кислотой, а также
смесями Флемминга, Мевеса, Санфеличе, Максимова. При ка-
риологических исследованиях надо постоянно помнить, что срав-
нение ядерных структур разных тканей или одной и той же тка-
ни, ио на разных этапах развития, возможно только при исголь-
зованлп одного и того же фиксатора.
Необходимо еще раз подчеркнуть важность прижизненных
наблюдений ядерных структур, безусловно необходимых, где толь-
ко это позволяет объект исследования.
В отношении прижизненных наблюдений ядра применимы все
указания, которые были выше приведены для наблюдений над
цитоплазмой. Особо надо избегать надавливаний иа препарат;
помнить о важности осмотических условий среды, так как даже
слабая гипотония или гипертония могут изменить ядерные струк-
туры. Необходимо учитывать и pH среды, в которой находятся
наблюдаемые клетки.
Хорошими объектами для прижизненного изучения ядер, про-
цессов их деления и т. д, являются эпителиальные покровные клет-
ки маленьких личинок амфибий. Личинки можно наркотизиро-
вать хлерэтапом goop — 60(610’ прибавляя его к среде, где находит-
згу
ся личинка, или же пользоваться кураре (5—10 капель следую-
щего раствора: 1 часть кураре растворяют в 100 частях воды и
добавляют 100 частей глицерина); через 30—60 минут личинка
теряет способность к движению. Из других наркотиков рекомен-
дуют 3-градусный спирт или 3-процентный эфир, которые не на-
рушают резко процессов клеточного деления. Но лучше избегать
наркоза.
Прижизненная окраска ядер описана в главе о витальной
окраске.
Объектами для прижизненных наблюдений
ядра могут служить клетки, указанные выше в качестве объектов
для изучения цитоплазмы, кроме Foraminiefra и миксомицетов.
Кроме того:
1. Незрелые яйца Unio, Anodonta, Helix, Planorbis, Limnea;
среда: тканевый сок или физиологический раствор.
2. Euglena sp.
3. Крупные диатомеи.
4. Клетки эпидермиса Allium сера или Campanula trachelium:
наблюдаются в воде или в изотопическом растворе сахара.
5. Фолликулярные клетки яичников саранчи, а также яичников
различных насекомых; среда: физиологический раствор.
6. Ядра вытянутой формы можно наблюдать у Stentor roeseli
и Vorticella.
7. Четковидные ядра — у Stentor coeruleus, Stentor polymor-
phus, а также в клетках Chara или Nitella.
8. Ядра лопастной формы можно наблюдать в клетках эпидер-
миса аксолотля и саламандры; прижизненно и на окрашенных
срезах.
9. Ядра разветвленной формы можно изучать в клетках пау-
тинных желез Bombyx moTi, Lymantria dispar, а также в клетках
желез крупных личинок Phryganida (Limnophilus, Anabolia).
10. Питательные клетки яичника Bombus sp.; прижизненные
наблюдения в висячей капле.
11. Пузыревидные ядра можно наблюдать в незрелых яйцах
моллюсков, морских звезд и морских ежей. Для прижизненных
наблюдений могут служить зрелые ооциты насекомых и Chilopoda
(Lithobius, Geophilus).
Для изучения ядерной оболочки пригодны ядра
Amoeba proteus и Entamoeba blattae; прижизненные наблюдения;
ядра легко изолируются при расщипывании амеб тонкими игла
ми; тотальные препараты после фиксации в смеси Буэна-Дюбоска
или Шаудина. Для той же цели могут служить ядра ооцитов
моллюсков; прижизненные наблюдения и опыты с изоляцией ядер
при помощи тонких иголок.
Для изо ля ции я дер из ткани следует, вырезав возможно
маленькие кусочки ткани, обрабатывать их в 3—4-процентной
лимонной кислоте; срок обработки различен в зависимости от
объекта и каждый раз должен быть определен эмпирически.
304
Для получения большого количества изолированных ядер мож-
но пользоваться нижеследующими указаниями.
Ядра из мышечной ткани. Ткань, очищенную от ви-
димого жира, измельчают в мясорубке как можно тоньше. Поме-
щают 100 г ее в литровую мензурку и заливают 500 мл 5-процент-
ной лимонной кислоты. Изредка помешивают и оставляют на ночь.
Удаляют с поверхности жир, разводят раствор равным объемом
воды, тщательно фильтруют через 8 слоев марли. Пропускают
фильтрат через центрифугу Шарплеса при 26 000 оборотов в ми-
нуту. Цилиндр центрифуги покрывают целлофаном для предотвра-
щения растворяющего действия кислоты иа металл. Материал,
смываемый с листа целлофана, будет содержать около 50% ядер.
Его промывают 4 раза последовательным центрифугированием и
взвешиванием в воде. Этим содержание ядер повышается до 70%.
Остаток обрабатывают (в бутыли центрифуги) смесью: 250 мл
1-процентной соляной кислоты и 250 мл 0,8-процентного раствора
хлористого натрия, содержащего 2—4 мл пепсина (концентрация
1 : 10 000) —в течение 4 часов при температуре 37°. Иногда по-
мешивают, а по окончании этого срока сливают через сифон
поверхностную жидкость с осевших ядер. Промывают дистиллиро-
ванной водой и центрифугируют. Контролируя ядра под микроско-
пом, можно убедиться, что при этом методе ядра не- претерпевают
заметных повреждений.
Ядра из ткани крысиной опухоли. После удале-
ния некротических участков, ткань измельчают в мясорубке, обра-
батывают раствором лимонной кислоты и фильтруют как мышеч-
ную ткань. Добавляют к фильтру 1 объем воды и оставляют сто-
ять 3 часа. Не центрифугируя, поступают далее как с мышечной
тканью.
Ядра из л е й ко ц ит о в. К гною добавляют пять объемов
5-процентной лимонной кислоты.
Ядра быстро осаждаются; затем с осадком поступают так же,
как и с опухолевой тканью.
Хромосомы
Форма хромосом и, отчасти, их размеры, могут значительно
меняться в зависимости от условий изготовления препарата.
В литературе имеются указания иа значение pH фиксатора,
употребляемого для фиксации хромосом.
Из окрасок часто употребляют железный гематоксилин. Пре-
красные результаты дает реакция по Фельгеру. Для хромосом,
главным образом растительных клеток, рекомендуются также ме-
тоды окраски уксуснокислым кармином или генциановым фиоле-
товым по Ньютону.
Хромосомы млекопитающих. Удобным материалом
для изучения хромосом являются семенники взрослых животных,
ткани эмбрионов или амнион; можно использовать пленки плевры
и брюшины, которые можно изучать тотально без заливки и резки.
20 Микроскопическая техника 305
А. Г. Андрес указывает, что в отношении плевральных и пери-
тонеальных серозных листков приходится применять расгципыва-
ние, что может повредить тонкие структуры.
Для кариологических исследований также могут быть исполь-
зованы тканевые культуры. Для этой цели Г. К- Хрущевым, Андре-
сом и Ильиной было предложено использовать культуры белой
крови человек in vitro.
Для фиксации хромосом можно рекомендовать смесь
Флемминга; полезно добавлять к ней 0,5% мочевины и фиксиро-
вать на холоду (4—5°). Некоторые исследователи фиксируют
кусочки семенника человека 1 минуту в смеси Карнуа и затем пе-
реносят кусочки на 24 часа в смесь Флемминга.
Для ряда объектов хорошие результаты дает смесь Буэна —
Аллена (длительность фиксации 2—24 часа). В нашей лаборато-
рии отличные результаты достигались и при фиксации в течение
24 часов смесью Шампи или ее модификацией: 2-процентной ос-
миевой кислоты — 4 части; 1-процентной хромовой кислоты —
8 частей; 3-процентиого двухромовокислого калия — 8 частей.
Андрес советует применять фиксатор Буэна — Аллена, даю-
щий прекрасные результаты для тонких серозных пленок, амнио-
на, а также тканевых культур; фиксировать 24 часа.
Важнейшим методом окраски хромосом является о к-
раска железным гематоксилином. При применении
железного гематоксилина надо учитывать, что лак покрывает хро-
мосомы сплошным слоем и в случае тесного расположения делает
их границы трудно различимыми; кроме того, наблюдается разная
скорость дифференцировки малых и больших хромосом, первые
раскрашиваются быстрее.
П. И. Живаго и Андрес окрашивали кусочки ткани человека
после осмиевых фиксаторов следующим образом:
1) депарафинированные срезы доводятся через ряд спиртов
до воды и затем помещаются для улучшения окраски на сутки
в смесь Чура (смесь равных частей насыщенного водного раство-
ра пикриновой кислоты и ледяной уксусной кислоты); 2) промывка
срезов в проточной воде 1—2 часа; 3) окраска гематоксилином по
Карачи; 4) докраска эозином и обычное заключение в бальзам.
П. И. Живаго рекомендует для кариологических исследований
пользоваться окраской панхро м-т олуидиновым си-
ним (с дополнительной окраской кислым фуксином), дающей
после осмиевых и пикриновых фиксаторов прекрасные результаты.
1) Депарафинированные срезы обычным образом доводят до
воды и затем помещают в следующий краситель: РД-процентный
водный раствор толуидинового синего — 75 см3, углекислый ли-
тий— 0,5 г, глицерин — 20 г, спирт 96-градусный — 5 см3.
Для срезов основной раствор разводится перед употреблением
в 10 раз, для тотальных объектов (амнион) —в 3—4 раза. Про-
должительность окраски 2—20 минут. 2) Быстро споласкивают
водой. 3) Дифференцируют в 35-процентном водном растворе тан-
306
нина до тех пор, пока не станут отчетливо видимыми отдельные
хромосомы. 4) Тщательно промывают в проточной воде (не менее
получаса). 5) Переносят срезы в 70-градусный спирт, к которому
прибавлено несколько капель раствора кислого фуксина в анили-
новой воде. Срезы должны приобрести красный оттенок. 6) Быст-
ро проводят их через 96-градусный и 100-градусный спирт и, как
обычно, заключают в бальзам.
П. И. Живаго и А. Г. Андрес рекомендуют для кариологиче-
ских исследований после осмпйно-платиновых фиксаторов пользо-
ваться следующей модификацией реакции Фельгена,
дающей исключительно чистые и элективные картины.
1. Депарафинированные срезы поместить на сутки в смесь Чу-
ра. 2 Тщательно промыть в проточной воде не менее часа. 3. Вы-
держать 24 часа в 96-градусном спирте (желательно прибавление
1% димедона). 4. Отмыть водой. 5. Сполоснуть в 1/N соляной
кислоте— 1—3 минуты. 6. Гидролизовать в 1/N соляной кислоте
при 60° в течение 4—120 минут. Оптимальный срок гидролиза
должен быть установлен для каждого объекта отдельно. 7. Пере-
нести в холодную соляную кислоту на 0,5 минут. 8. Сполоснуть
водой. 9. Окрасить фуксин сернистой кислотой — 1,5 часа. (При-
готовление реактива, окраска и последующая обработка сернистой
водой производится, как описано на стр. 241). 10. Промыть в про-
точной воде 5—15 минут. 11. Докрасить 0,5-процентным раствором
водного синего в течение 1—2 минуты. 12. Сполоснуть водой.
13. Несколько секунд дифференцировать в насыщенном водном
растворе пикриновой кислоты, затем снова промыть водой и через
ряд восходящих спиртов и ксилол заключить в бальзам.
Для изучения м и т о з о в в клетках крови и кост-
ного мозга А. Г. Андрес советует метод влажных мазков.
Безупречно вымытые сухие предметные стекла обрабатываются
парами осмия в течение 15—20 секунд и на них наносится мазок,
который снова подвергается действию паров, осмия в течение 15—
20 секунд, после чего немедленно во избежание подсыхания фик-
сируется смесью Флемминга (24 часа) или смесью Аллена, Для
окраски мазков кроме указанных выше можно применять -метод
Романовского: окрашивание ведется в воде с применением фос-
фатного буфера (pH = 6,8) в течение 2 часов; препараты спола-
скивают водой и быстро проводят через спирты и ксилол, заклю-
чают в нейтральный бальзам.
Для изучения хромосом птиц применимы те же методы,
что и для хромосом млекопитающих.
Семенники птиц рекомендуется фиксировать 5 часов смесью
Германа, содержащей 1% мочевины, нагретой до 40°, или же
использовать для тех же целей фиксатор Буэна — Аллена с после-
дующей заливкой через анилиновое масло.
Хромосомы рептилий рекомендуется фиксировать
24 часа смесью: 2-процентная осмиевая кислота — 3 части; 1,6-про-
центная хромовая кислота — 6 частей; 6-процентный двухромово-
20* 307
кислый калий — 4 части. Затем промывать 24 часа, быстро про-
вести через ряд спиртов, перевести в кедровое масло, затем через
хлороформ заключить в парафин. Срезы надо отбелить перекисью
водорода (на 50-градусном спирте), поместить на 12—24 часа в
смесь Чура и окрашивать по желанию.
Хромосомы амфибий хорошо фиксируются смесью
Буэна — Аллена или Флемминга. Яйца амфибий с предварительно
снятыми студневидными оболочками можно фиксировать насы-
щенным раствором сулемы, содержащим 1 % уксусной кислоты.
Фиксировать 15 минут, промыть в 70-градусном спирте, обезво-
дить, просветлить в кедровом масле, перевести в смесь равных
частей креозота и толуола, после чего через толуол залить в пара-
фин.
Хромосомы костистых рыб хорошо фиксируются
смесью Шампи или Бенда. Советуют их фиксировать равными
частями 5-процентиой хромовой кислоты и 50-процентного форма-
лина.
Хромосомы беспозвоночных животных обыч-
но хорошо фиксируются смесью Флемминга или Буэна.
Для фиксации яиц, покрытых трудно проницаемыми или хити-
новыми оболочками, употребляют смеси Карнуа, Жильсона или
Петрункевича.
Яйца насекомых рекомендуют фиксировать смесью Буэ-
на — Дюбоска.
Для фиксации семенников Lepidoptera можно пользоваться
смесью Карнуа, а для фиксации яиц — смесью Петрункевича.
Для семенников ракообразных смесь Буэна — Ал-
лена дает хорошие результаты.
С. Л. Фролова применила для изучения яиц Bombyx mori,
имеющих настолько плотный хорион, что он совершенно непрони-
цаем для большинства фиксаторов, смесь Карнуа (а также смесь
Буэна — Дюбоска), нагретую до 48—50°, в которой яйца находи-
лись 3—6 минут, затем при комнатной температуре— 12—24 ча-
са. Яйца заливались через хлороформ или кедровое масло в пара-
фин. Срезы окрашивались железным гематоксилином или обраба-
тывались по Фельгену.
Для изучения хромосом коретры, как и для других Diptera
применяется фиксатор Санфеличе с последующей окраской по
Бенда— Икеда или железным гематоксилином.
Семенники Arachnida хорошо фиксируются смесью Флемминга
или Шампи.
Хромосомы кольчатых червей рекомендуется фик-
сировать смесью Буэна или Буэна — Аллена; также можно поль-
зоваться смесью Навашина или Флемминга.
Для фиксации оогоний, ооцитов и яиц на различных стадиях
оплодотворения у нематод (Parascaris equorum) можно пользо-
ваться смесью Буэна—Дюбоска, Петрункевича, Флемминга.
У к с у с н о-к арминовый метод окраски хромосом.
308
Сущность метода заключается в действии 45-процентной ук-
сусной кислоты, насыщенной кармином, при котором часто до-
стигаются одновременно и фиксация и окраска. Однако достовер-
ность и точность получаемых при этом методе цитологических
картин еще не подвергались необходимому критическому
рассмотрению (это замечание относится и к целому ряду
других, так называемых хромосомных методов).
К насыщенному при температуре кипения раствору лучше
натурального кармина в 45-процентной (по объему) уксусной
кислоте (отстоявшемуся или профильтрованному по охлаждении)
прибавляется на каждые 100 см3 по 1—2 капли раствора уксусно-
кислого железа (избыток осаждает кармин). Цвет раствора при
этом должен стать «темно-винно-красным». Навашин дает сле-
дующие указания о применении этого метода: пыльник кладется
в каплю реактива, помещенную на середину предметного стекла,
и быстро раздавливается скальпелем или, лучше, вторым предмет-
ным стеклом; содержимое его при этом немедленно приходит в
соприкосновение с раствором и подвергается почти мгновенной
фиксации. Клочки стенок пыльника и неразделенные его части
удаляются иголкой, а оставшийся материал равномерно распре-
деляется по стеклу на пространстве, соответствующем применяемо-
му покровному стеклу. Затем все покрывается покровным стеклом,
которое немедленно заклеивается по краям парафином или во-
ском. Препарат после этого должен быть оставлен на несколько
часов и даже дней для того, чтобы кармин мог окрасить объект
как следует.
Чрезвычайно важно, — указывает Навашин, — чтобы выступающий из
пыльника сок не разбавлял реактива, отчего фиксация и окраска могут не
удаться. Для этого рекомендуется сначала взять объект в 1—2 каплях уксус-
ного кармина, а затем удалить последний фильтровальной бумагой и заменить
свежим, в котором уже и произвести раздавливание. Самое раздавливание
надо производить быстро, но так, чтобы не оставлять крупных комплексов кле-
ток, по возможности в то же время не растирая и не повреждая их.
Препараты, приготовленные таким способом, могут сохраняться в темноте
и на холоду (лучше всего в леднике) в течение нескольких недель и даже
месяцев.
Метод окраски хромосом по Ньютону. 1) Кра-
сить 1-процентным генциановым фиолетовым 3—10 минут, затем
сполоснуть водой. 2) Поместить препарат на 30—45 секунд в сле-
дующий раствор: иода—1 г, йодистого калия — 1 г, 80-градусного
спирта — 100 см3. 3) Сполоснуть 2 секунды в 96-градусном спир-
те, затем 2—5 секунд в абсолютном спирте. 4) Дифференцировать
гвоздичным маслом, хорошо отмыть ксилолом и заключить в баль-
зам. Можно обрабатывать иодным спиртом до окраски.
Для окраски хромосом можно использовать еще несколько ни-
жеописанных способов.
1. Материал, трудно красящийся и фиксированный в смесях
Карнуа или Буэна, после окраски генциановым фиолетовым сове-
туют обрабатывать иодным спиртом 2 минуты, сполоснуть 2 секун-
309
ды в абсолютном спирте, затем поместить препарат на 15 секунд
в 1-процентную хромовую кислоту, затем снова на 5 секунд в аб-
солютный спирт, снова на 15 секунд в 1-процентную хромовую
кислоту, на 10—15 секунд в абсолютный спирт, затем дифферен-
цировать гвоздичным маслом, провести через ксилол, заключить
в бальзам.
И. Для окраски хромосом можно использовать уксуснокислый
оранж: растворяют 1 г оранжа в 45 см.3 ледяной уксусной кислоты
и добавляют 45 см3 дистиллированной воды, фильтруют. Окраши-
вают 2—5—10 минут.
ИГ. Можно использовать смесь, которая фиксирует и окраши-
вает хромосомы и одновременно является средой, служащей для
окончательного заключения (заделки) препарата.
Для приготовления смеси смешивают ингредиенты в следую-
щем определенном порядке: пропионовой кислоты — 35 см3; вене-
цианского терпентина — 20 см3; 88-процентиого раствора фено-
ла— 55 см3; ледяной уксусной кислоты — 10—15 см3; дистилли-
рованной воды — 25 см3; Ре(КО3)з ЭН2О — 0,5 г; кармииа — до
насыщения. Взамен кармина можно добавлять 1 г орсеина. Смесь
фильтруют через 12 часов. Небольшой объект кладется в каплю
смеси (находящуюся на предметном стекле), покрывается покров-
ным стеклом — и постоянный препарат готов.
IV. Можно применить для одновременного фиксирования, ок-
раски и заключения объектов еще одну смесь; желатины— 10 г;
сорбитола— 10 сж3; ледяной уксусной кислоты — 50 см3, дистил-
лированной воды — 60 см3; Fe(NO3)3 9Н2О — 0,5 г; кармина —
до насыщения. Взамен кармина можно добавить 1 г орсеина.
V. Для изучения тонкой цитологической структу-
р ы (особенно хромосом) мелкихяиц рекомендуют следующий
метод фиксации и заливки:
1) материал фиксируют смесью: спирта 96-градусного 15 ча-
стей, формалина 6 частей, уксусной кислоты 1 часть, дистиллиро-
ванной воды 30 частей; 2) обезвоживают последовательно в сле-
дующих четырех смесях: а) вода 30 частей + этиловый спирт
50 частей 4- бутиловый спирт 20 частей— 1 час; б) вода И ча-
стей + этиловый спирт 50 частей + бутиловый спирт 35 частей -|-
фенол 4 части — 24 часа; в) вода 5 частей + этиловый спирт 40 ча-
стей -4- бутиловый спирт 55 частей — 1 час; г) этиловый спирт
25 частей + бутиловый спирт 75 частей— 1 час; 3) проводят
через два раствора бутилового спирта, содержащего 4% фенола
(кристаллического), — 1 час; 4) переносят в смесь равных частей
бутилового спирта и парафина — 12—16 часов; 5) затем зали-
вают в парафин по обычным схемам.
Для тонкого анализа структуры хромосом растительных и жи-
вотных клеток (а также ядроподобных образований у бактерий)
можно пользоваться методикой, предложенной Голландом. Фикси-
ровать объект в смеси, приготовленной следующим образом: к
2,5 г уксуснокислой меди прибавляют 100 см3 дистиллированной
ЗЮ
воды и растирают в ступке до растворения; затем постепенно до-
бавляют 4 г пикриновой кислоты и, когда она растворится, при-
ливают 10 см3 нейтрального формалина. После этого добавляют
0,75 г трихлоруксусной кислоты и 0,5 г фосфорновольфрамовой
кислоты; после растворения фильтруют. Фиксировать 6—8 дней,
затем промыть 2 минуты 3-продентным формалином, немного осу-
шить кусочки фильтровальной бумапой и тотчас же положить их
в 3-процентный двухромовокислый калий на 4—6 часов при 37°,
затем промывать в течение 24—28 часов в 3-процентном форма-
лине и провести через возрастающий ряд спиртов, начиная с 10°,
повышая постепенно на 5° (держать в 70°—12 часов, в 96°—24
часа и в 100°— 12 часов), и затем через толуол залить в парафин.
Срезы, освобожденные от парафина, надо продолжительное время
держать в 80-градусном спирте (2—10 дней) и затем, доведя до
воды, промывать в проточной воде 24—48 часов. Окраска желез-
ным гематоксилином или. по способу Манна, с докраской оран-
жем G. Можно фиксировать также вышеуказанной смесью, к
которой на 100 см3 прибавлено 0.1 см3 1-процентного двухромово-
кислого калия; после этого также следует хромировать.
Проведение окраски: срезы кладут на 4—8 дней в смесь Манна,
затем промывают полминуты проточной водой, споласкивают ди-
стиллированной водой и кладут в 0,25-процеитный раствор фос-
форномолибденовой кислоты; споласкивают дистиллированной во-
дой; помещают в подкисленную воду (10 капель уксусной кисло-
ты иа 100 см3 воды); промывают 1 минуту проточной водой; 10—
25 секунд дифференцируют 80-градусным спиртом, насыщенным
Оранжем G; споласкивают 96-градусным спиртом; проводят через
амиловый спирт, ксилол и заключают в нейтральный бальзам.
После действия подкисленной воды и промывки проточной водой
можно окрасить 1-процентным водным раствором полихромного
метиленового синего, сполоснуть дистиллированной водой и диф-
ференцировать, как указано выше, насыщенным спиртовым раст-
вором оранжа G. Полихромный синий может быть заменен 10-ми-
нутной окраской 0,3-процентным раствором светлого зеленого.
Для прижизненных наблюдений митозов мож-
но указать следующие объекты;
1. Сперматоциты Oedipoda, Stenobothrus, Gomphocerus яв-
ляются удобным объектом для демонстрации хромосом: среда —
тканевый сок или физиологический раствор; наблюдение ведется
в висячей капле.
2. Сперматоциты бабочек Vanessa, Limantria; среда — гемо-
лимфа или физиологический раствор; наблюдение в висячей капле.
3. Растущие клетки Tradescantia; среда — 2—3-процентный
тростниковый сахар.
4. Сперматоциты Paludina vivipara; среда — тканевый сок или
физиологический раствор.
5. Дробящиеся яйца мелких нематод.
6. Клетки культур тканей in vitro.
311
7. Эпидермис личинок амфибий; особо пригодны участки жа-
бер или хвостовой край тела; среда — физиологический раствор;
наблюдения в висячей капле.
8. Клетки кончика корешка Allium сера или Hyacinthus; сре-
заются от руки тонкие пластинки; среда — 2—З-процентный трост-
никовый сахар.
9. Молодые листочки Vallisneria spiralis; среда — вода.
10. Делящиеся формы Euglypha.
Изучение митозов на фиксированных препаратах.
1. Меристемные клетки кончика корешка Allium сера или
Hyacinthus; по указанию некоторых авторов, число митозов в те-
чение дня варьирует; особенно много митозов в 13 и 23 часа;
фиксировать в смеси Флемминга, Мевеса или Петрункевича; ок-
раска железным гематоксилином, сафранин — светлым зеленым.
2. Клетки эпидермиса личинок саламандры, тритона, амбли-
стомы; фиксация смесью Флемминга, Мевеса, Гелли; срезы ок-
рашивают железным гематоксилином, сафранин — светлым зеле-
ным или обрабатывать по методу Фельгена.
3. Сперматогояии саламандры и тритона; обработка та же,
что и клеток эпидермиса.
4. Клетки кончика корешка различных видов Ctepis.
5. Клетки бластулы Amblystoma; очень четко видны изменения
центросом; фиксация Гелли, срезы окрашивают железным гема-
токсилином.
6. Амнион ранних стадий эмбрионов мыши, крысы, кролика;
фиксация смесью Флемминга, Мевса, Буэна — Аллена, Гелли;
окраска железным гематоксилином.
С. Я. Залкинд рекомендует эпителий роговицы глаза, как объ-
ект особо удобный для изучения митозов и митотической активно-
сти клеток под влиянием различных факторов. В нашей лаборато-
рии для изучения нормальных и патологических митозов исполь-
зуются очень удобные для этой цели клетки асцитного рака мы-
шей, штамм которого имеется в ряде институтов.
Для изучения амитоза можно использовать эпителий мо-
чевого пузыря мыши; кусочек пузыря осторожно прижимают внут-
ренней стороной к покровному стеклу, тотчас снимают кусочек,
а покровное стекло бросают в фиксатор; необходимо действовать
быстро. Затем можно использовать фолликулярные клетки яични-
ка цикад (Cicada otni) и клопов (Nepa cinerea, Pentatoma). То-
тальные препараты делящихся инфузорий, особенно Colpidium,
Colpoda, Chilodon.
Ядрышко
Для фиксации может быть использовано большинство фикса-
торов, рекомендуемых для кар дологического исследования. Для
того чтобы отличить типичные ядрышки от хроматиновых образо-
ваний, рекомендуется использовать метод Фельгена с последую-
щей докраской светлым зеленым или анилиновым синим.
312
Для окраски ядрышек употребляются следующие основные
методы: а) окраска по Манну; при этом материал рекомендуется
фиксировать сулемой с уксусной кислотой; б) окраска по Меллен-
дорфу; в) окраска по Паппенгейму метиловым зеленым—пиро-
нином; г) окраска сафранином — светлым зеленым; д) желез-
ный гематоксилин (после фиксации смесью Флемминга).
Материалом для изучения ядрышка могут служить следующие
объекты:
1. Типичные ядрышки в меристемиых клетках корней растений,
прижизненные наблюдения; для срезов фиксируют смесью Флем-
минга, Мевеса, Гелли, Буэна. Для этой же цели пригодны различ-
ные клетки, особенно клетки яичников Rotatoria и Cladocera; при-
жизненные наблюдения или фиксация смесью Буэна — Дюбоска,
Флемминга.
2. Для изучения кариосом пригодны амебы Umax или водо-
росль Spil’ogyra; прижизненные наблюдения; тотальные препара-
ты — фиксация смесью Буэна — Дюбоска или Мевеса.
3. Сложного строения ядрышки в ооцитах молюсков или Chi-
lopoda (Lithobius fefrficatus); прижизненные наблюдения или фик-
сация смесью Петрункевича, Буэна — Аллена или Флемминга.
Интересные картины строения ядрышка дают срезы ооцитов ам-
блистомы и рыб.
4. Ядрышки вытянутой формы у Euglypha; прижизненные наб-
людения или тотальные препараты после фиксации смесью Шау-
дина; также срезы с участков роста различных видов Chara, фик-
сация смесью Флемминга, Ценкера или Буэна — Дюбоска.
Центросома
Для фиксации употребляются смеси Буэна, Флемминга и раз-
личные сулемовые смеси.
Центросома, веретено клеточного деления, а также зернистые
и нитчатые структуры цитоплазмы, в зависимости от степени диф-
ференцирования, могут быть выявлены окраской железным гема-
токсилином, с последующей докраской кислым фуксином или
светлым зеленым. Дифференцируют обычно разведенным раство-
ром железных квасцов при постоянном наблюдении под микро-
скопом. Срезы должны быть тонкими.
П. И. Живаго и Л. С. Цешковская разработали модификацию
метода кислородного гидролиза В. Н. Шапошникова для окраски
веретен в делящихся клетках. Фиксация смесями Навашина, Буэ-
на, Санфеличе. Срезы толщиной 7—10 и подвергаются гидролизу
30-процентной серной кислотой, нагретой до 50—60° (температура
подбирается применительно к объекту) в течение 20—60 минут
(также в зависимости от объекта). Окраска железным гематокси-
лином или ализарин — толуидиновым синим.
При этом методе хорошо окрашиваются нити веретена и цен-
тросома, гораздо слабее — хромосомы.
П. И. Живаго и Л. С. Пешковская получили этим методом хо-
313
рошие результаты на яйцах Parascaris equorum, при наблюдении
различных стадий сперматогенеза некоторых прямокрылых и по-
лужесткокрылых.
После фиксации материала в жидкости, содержащей сулему,
окраска центросом лучше всего удается железным гематоксили-
ном, особенно если срезы предварительно окрашиваются 0,2-про-
центным водным раствором бордо красного. Позднее (при диффе-
ренцировании) протоплазма и хромосомы раскрашиваются быст-
рее, чем центросома. Процесс дифференцирования, который целе-
сообразно проводить сильно разведенным раствором железных
квасцов, следует контролировать под микроскопом (лучше всего
с водной иммерсией).
Можно рекомендовать окрашивать центросомы фосфорноволь-
фрамовым гематоксилином.
Объектыд л я изучения центросом. Прижизненные
наблюдения центросомного аппарата можно производить в дробя-
щихся яйцах Parascaris equorum, наиболее пригодна стадия 8—
12 бластомеров.
Для изучения на фиксированном материале пригодны лейкоци-
ты Salamandfa maculosa; сперматогонии и сперматоциты различ-
ных амфибий; кишечный эпителий кролика, кошки, морской свин-
ки; красный костный мозг млекопитающих (мазки и срезы); ооци-
ты кошки и кролика, сперматоциты мыши; амнион зародышей мле-
копитающих (тотальные препараты); яйца Piscicola geometra в
стадии созревания; сперматоциты Helix, Limnea, Dytiscus margi-
nalis, мазки и срезы (палочковидные центросомы очень хорошо
видны); клетки membrana Descemeti кошки. Хорошими объектами
являются яйца морского ежа и аскариды на разных стадиях деле-
ния, делящиеся яйца морских поликлад.
Для наблюдения над строением веретена можно ис-
пользовать деления созревания яиц различных Copepoda: делают
продольные срезы через самку, ие отложившую еще своих яиц
в яйцевые мешки; фиксируют насыщенным спиртовым раствором
сулемы, смесью Буэна — Дюбоска, Буэна — Аллена, Петрункеви-
ча, Флемминга. Другими объектами могут служить стадии дроб-
ления яиц немертии и Cephalopoda (Loligo, Sepia); фиксация су-
лемой с уксусной кислотой, смесью Флемминга; студневидную
оболочку яиц необходимо перед фиксацией удалить.
Базальные зерна и ресннчкн
Для окраски базальных зерен и ресничек лучше всего пользо-
ваться железным гематоксилином; срезы делать по возможности
более тонкие.
В некоторых случаях хорошие результаты дает метод Унна с
окраской: водный синий — орсеии — эозин.
Объектами прижизненного изучения базальных зерен
могут служить различные инфузории (особенно пригодны Chilo-
314
don), клетки нефридия Lumbricus (в физиологическом растворе);
клетки нефридия и кишечного эпителия мелких прозрачных олиго-
хет (Chaetogaster, Nais, Stylaria), где наблюдения можно произво-
дить. не вскрывая животных; жабры маленьких (до 2—3 см) ли-
чинок амфибий.
Для фиксированного материала можно использовать те же объ-
екты, а также кишечный эпителий Anodonta, Unio или Lumbricus,
клетки печеночных протоков Helix, клетки протонефридиев Fas-
ciola hepatica или ленточных червей. Фиксировать смесью Флем-
минга, Буэна — Дюбоска, Гелли.
Для прижизненных наблюдений ресничек могут служить
вышеназванные объекты, а также жаберные клетки Ano'donta.
Жгуты легко наблюдать у Euglena и различных видов Trichomo-
nas (Trichomonas muris мыши. Trichomonas batrachorum из пря-
мой кишки лягушки); средой для трихомонад может служить со-
держимое кишечника, разбавленное физиологическим раствором.
Границы клеток
Суправитальная окраска метиленовым с и-
н и м. Окрашивают тонкую кожицу амфибий, прибавляя к среде,
в которой производят исследование, несколько капель 1-процент-
иого раствора метиленового синего. После окрашивания объект
промывают в той же среде до тех пор, пока не останутся окрашен-
ными только ядра и межклеточные границы. Окрашивание про-
изводится при доступе воздуха (покрывать не надо). Краситель
фиксируется молибденовокислым аммонием.
Метод серебрения по Ранвье. Можно обрабатывать
только покровные ткани. 1. Свежую нефиксированную кожицу ра-
стягивают при помощи неметаллических игол и обмывают в дистил-
лированной воде. 2. Помещают в 0,5-процентный раствор азотно-
кислого серебра и держат в нем до тех пор, пока объекты сделают-
ся непрозрачными — около 5 минут. 3. Переносят их в большую
чашку с дистиллированной водой и держат на свету до потемне-
ния объекта ( до восстановления серебра). 4. Промывают в дистил-
лированной воде. 5. Исследуют в глицерине или обезвоживают,
проводят через ксилол и заключают в бальзам.
Результат: границы клеток — черные.
Водный сини й-о р с е и н-э о з и н для выявления клеточ-
ных границ, мерцательных ресничек и базальной мембраны.
1. Материал фиксируют в формалине или в сулемовой смеси,
приготовляют парафиновые срезы, освобождают от парафина, до-
водят до 96-градусного спирта. 2. Окрашивают в растворе водно-
го синего-орсеин-эозина 10 минут. П е р в ы й р а с т в о р: растворя-
ют 1 г водного синего в 100 см" дистиллированной воды и 1 г ор-
сеина в 50 см3 96-градусного спирта, оба красителя смешивают и
добавляют 20 см3 глицерина и 5 см3 уксусной кислоты. Второй
раствор: 1 г эозина растворяют в 80 см3 абсолютного спирта.
315
Перед употреблением к 10 частям первого раствора прибавляют
3’части второго. 3. Срезы споласкивают в дистиллированной воде.
4. Окрашивают в 1-процентном растворе сафранина 10 минут.
5. Споласкивают в дистиллированной воде. 6. Погружают в 0,5-
процентпый раствор двухромовокислого калия на 10—15 секунд.
7. Промывают в дистиллированной воде. 8. Переносят непосред-
ственно в абсолютный спирт, дифференцируют в нем, контролируя
под микроскопом. 9. Проводят через ксилол, заключают в бальзам.
Митохондрии
На многих объектах прижизненное наблюдение митохондрий
не представляет больших трудностей, но при этом нужно обращать
особое внимание на изотонию среды; часто наличие малейшей
гипотонии ие влияет заметным образом на жизненное состояние
клетки, значительно изменяет форму митохондрий.
О прижизненной окраске митохондрий см. стр. 73. Для при-
жизненного изучения митохондрий следует использовать микроско-
пирование в темном поле и фазов о-к онтрастную
микроскопию.
При изучении митохондрий существенное значение имеет со-
став фиксирующей смеси. Присутствие в фиксаторе таких веществ,
как спирт, эфир, хлороформ, уксусная кислота, разрушающе дей-
ствует на митохондрии. Наиболее пригодны фиксаторы формол-
хромовые или хромово-осмиевые. Нет единого фиксатора для ми-
тохондрий, одинаково пригодного для клеток различных животных.
Нередко метод, дающий хорошие результаты для тканей амфибий,
может быть мало применим для тканей млекопитающих. Для кле-
ток беспозвоночных наиболее пригодны смесь Флемминга (без ук-
сусной кислоты) или Шампи. Смесь Шампи дает хорошие резуль-
таты также и для клеток амфибий. Для тканей млекопитающих
рекомендуют употреблять фиксатор Бенсли. При изучении нового
материала всегда желательно сравнить результаты нескольких
фиксаторов. В некоторых случаях хорошие результаты получают-
ся после фиксации смесями Мевеса или Бенда, являющимися мо-
дификациями смесей Флемминга, но содержащими весьма малое
количество кислоты.
После осмиевых фиксаторов многие исследователи рекоменду-
ют подвергать препараты отбеливанию, чем достигается бо-
лее контрастная дифференцировка митохондрий и аппарата Голь-
джи. Неокрашенные срезы помещают в 1-процентный раствор пер-
манганата на 30—60 секунд, быстро споласкивают дистиллирован-
ной водой и переносят срезы в 5-проп.ентный раствор щавелевой
кислоты на 30—60 секунд, после чего тщательно промывают их
проточной водой.
В некоторых случаях при изготовлении препаратов из мелких
объектов, предназначаемых для исследований митохондрий, мож-
но рекомендовать метод ускоренной заливки в парафин: спирт 15-
316
градусный — 10 минут, спирт 40-градусный— 15 минут, спирт 50-
градусный— 15 минут, спирт 70-градусный — 30 минут, спирт 90-
градусный— 1 час, спирт 100-градусиый — 2 часа (1 раз сменить),
толуол — 2 часа (1 раз сменить), толуол 4-парафин— 2 часа
(1 раз сменить), чистый парафин — 2 часа (1 раз сменить).
Дли фиксации митохондрий хорошие результаты дает следую-
щая смесь: 5-процентный двухромовокислый калий — 6 частей, 2-
процентная осмиевая кислота — 5 частей, 5-процеитная сулема в
физиологическом растворе поваренной солн — 5 частей, 4-процент-
ный азотнокислый уран — 4 части. Фиксировать на холоду (4-6°,
4-8°), 24—48 часов. Затем промывать в воде 12—24 часа. Фикса-
тор сохраняет митохондрии и липоидные вещества.
Методы окраски митохондрий. Рекомендуют фикси-
ровать маленькие кусочки в смеси Флемминга (без уксусной кис-
лоты) 24 часа, промывать 2 часа в проточной воде. Проводить че-
рез спирты, начиная с 30°. Обезвоживать в абсолютном спирте 2—
3 часа, перенести иа короткое время в смесь ксилола и спирта,
затем через ксилол заливать в парафин. Срезы (4—8 в) красить
железным гематоксилином (12 часов в железных квас-
цах и 12 часов в гематоксилине).
Этот метод особо пригоден для половых клеток и тканей бес-
позвоночных.
Хорошие результаты окраски митохондрий дает способ Бен-
да — Икела, описанный ранее.
Метод Альтмана — один из наиболее старых способов
окраски митохондрий. Иногда дает отличные результаты. Следует
брать маленькие кусочки, толщиной не более 2 мм.
1. Фиксация жидкостью Альтмана. 2. Тонкие срезы красить
фуксином Альтмана (20-процентный раствор кислого фуксина в
анилиновой воде), наливая краситель на предметное стекло и на-
гревая на пламени горелки до появления паров; нагревание про-
вести 2 раза, затем остудить краситель и слить его с препарата.
3. Дифференцировать под контролем микроскопа (пока не высту-
пят ярко-красные митохондрии — обычно 1—4 минуты), сначала
в более крепком растворе пикриновой кислоты (10 см3 насыщен-
ного спиртового раствора пикриновой кислоты и 40 см3 20-гра-
дусного спирта), затем в более слабом (10 см3 насыщенного спир-
тового раствора пикриновой кислоты и 70 см3 20-градусного спир-
та). Хорошо промыть в 96-градусном спирте. 4. Провести через аб-
солютный спирт, ксилол, заключить в бальзам.
В результате— митохондрии красные на желтом фоне.
С. С. В а й л ь предлагает следующую модификацию ме-
тода Альтмана: после окраски срезов фуксином, споласки-
вают их в воде и дифференцируют в слабом нашатырном спирте
(под контролем микроскопа). Если дифференцировка идет слиш-
ком медленно, добавляют по каплям нашатырный спирт. Лучше
сильно перекрашивать срезы фуксином и дифференцировать их
в нашатырном спирте средней крепости.
317
Затем споласкивают срезы в воде и докрашивают ядра гемато-
ксилином Эрлиха. Вайль рекомендует окрашивать гематоксили-
ном срезы, слегка перекрашенные фуксином, а гематоксилин диф-
ференцировать соляной кислотой. Тогда при нейтрализации кисло-
ты аммиаком будет извлечен и избыток фуксина. Хорошо докра-
шивать также и насыщенным водным раствором светлого зелено-
го, при этом митохондрии выявляются весьма контрастно.
Метод Волконского является одним из лучших спосо-
бов окраски митохондрий.
1. Материал фиксировать смесью Гелли. 2. Хромировать в на-
сыщенном растворе двухромовокислого калия 24—48 часов при
температуре 37е. 3. Срезы красить фуксином Альтмана. 4. Диффе-
ренцировать ауранцией по Шампи — Кулю. 3. Сполоснуть в ди-
стиллированной воде. 6. Поместить в 1-процентную фосфорномо-
либденовую кислоту на 1 минуту (для закрепления кислого фук-
сина на митохондриях). 7. Красить полихромным синим. 8. Диф-
ференцировать оранж-таннином. 9. Провести через абсолютный
спирт, ксилол, заключить в бальзам.
Метод Бенда. Фиксировать маленькие кусочки в смесях
Бенда, Флемминга или Шампи несколько дней. Промывать сутки
в проточной воде и поместить на сутки в смесь из равных частей
древесного уксуса и 1-процептной хромовой кислоты, затем пере-
нести в 2-процентный двухромовокислый калий иа срок от одного
до трех дней, сполоснуть дистиллированной водой и промывать 24
часа в проточной воде. Быстро залить в парафин. Тонкие срезы
(3—5 и) поместить на 24 часа в 4-процентные железоаммиачные
квасцы. Сполоснуть срезы в дистиллированной воде и поместить
на 24 часа в ализарин-сернокислый натрий (насыщенный водный
раствор его капают в дистиллированную воду, пока она не станет
янтарно-желтой; лучше пользоваться бидистиллированной водой;
раствор следует готовить непосредственно перед употреблением).
Сполоснуть в дистиллированной воде. На срезы налить 3-процент-
ный раствор кристаллического фиолетового в 70-градусном спирте,
смешанного с равным количеством анилиновой воды и нагреть над
пламенем горелки до появления паров (не кипятить!). Оставить
в красителе еще 3—5 минут. Краситель смыть водой и препарат
дифференцировать под контролем микроскопа (обычно 1—5 ми-
нут) 10—30-процентной уксусной кислотой. Промывать 5—10 ми-
нут проточной водой, чтобы удалить уксусную кислоту и прекра-
тить дифференцировку — при этом срезы краснеют. Промокнуть
срезы гладкой фильтровальной бумагой, сполоснуть абсолютным
спиртом, перенести в бергамотовое масло, ксилол, заключить в
бальзам.
Кристаллический фиолетовый легко извлекается спиртом, по-
этому важно соблюдать осторожность в момент обезвоживания
препарата. Если срезы передифференцировать, можно их вновь
окрасить кристаллическим фиолетовым и повторить дальнейшие
манипуляции.
318
В результате ядро и цитоплазма — красно-коричневые, секре-
торные гранулы — сине-фиолетовые, митохондрии — интенсивно
фиолетовые. Волютин у простейших — красно-фиолетовый. Фиб-
риллярные структуры простейших окрашиваются в различные от-
тенки фиолетового цвета. При тщательном выполнении метод Беп-
да дает отличные результаты.
Метод Шампи — К у л я. 1. Материал фиксировать смесью
Шампи — 24 часа (маленькие кусочки ткани). Затем промывать
его в дистиллированной воде полчаса и переложить на 24 часа
в смесь из 1 части древесного уксуса и двух частей 1-процентной
хромовой кислоты. Промывать полчаса в дистиллированной воде
и поместить на 3 дня в 3-процентный двухромовокислый калий,
затем промывать 24 часа в проточной воде, после чего залить в
парафин. 2. Срезы красить фуксином Альтмана (примерно 5—
10 минут), после чего сполоснуть их дистиллированной водой.
3. Красить 0,5-процентным раствором толуидинового синего (или
тиопином) 1—2 минуты. 4. Быстро сполоснуть в дистиллирован-
ной воде. 5 Дифференцировать в 0,5-процентном растворе ауран-
ции в 70-градусном спирте. 6. Быстро обезводить. 7. Провести
через ксилол, заключить в бальзам.
Митохондрии — красные, ядра — спине, плазма — желтая или
зеленоватая.
Препараты сохраняются около года.
После фиксации кусочков смесью Шампи срезы можно также
окрашивать железным гематоксилином, сафранином, светлым зе-
леным или заключить их неокрашенными в бальзам (Г. И. Рос-
кин).
Для ориентировки в препаратах, фиксированных по Шампи,
можно пользоваться табл. 12 (стр. 324).
Окраска по Рего. 1. Фиксируют маленькие кусочки в
смеси Рего (80 см3 З-процентпого раствора двухромовокислого ка-
лия и 20 см3 формалина) в темноте в продолжение 4 дней, еже-
дневно сменяя фиксирующую жидкость. 2. Хромируют их в 3-
процентпом растворе двухромовокислого калия в темноте 8 дней.
3. Промывают в проточной воде 24 часа. 4. Быстро обезвоживают
и, проведя через метилбензоат или лучше через кедровое масло,
заливают в парафин. Содержание в промежуточных средах огра-
ничивается самыми короткими сроками. Толщина срезов 2—3 р-.
5. Протравляют в 5-процентном растворе железных квасцов при
температуре 35° 2—4 часа. 6. Промывают в дистиллированной во-
де 1—3 минуты. 7. Окрашивают в гематоксилине (10-процентнып
раствор в абсолютном спирте— 1 часть, глицерин— 1 часть, ди-
стиллированная вода—8 частей) 24 часа. Можно также красить
железным гематоксилином по Гейденгайну. 8. Дифференцируют
в 5-процентном растворе железных квасцов до получения очень
слабой окраски ядер. 9. Промывают 1—3 часа в проточной воде.
10. Обезвоживают, проводят через ксилол, заключают в бальзам.
319-
Таблица И
окраска КЛЕТОЧНЫХ элементов в зависимости от метода обработки
Метод Митохондрии Жир Желток Аппарат Гольджи
Срезы заклю- чены в бальзам без окраски Желтые Черный От желтого до черного цвета Желтый или не виден
Окраска по Кулю Красные Черный От желтого до черного цвета Обычно не виден в соматических и женских половых клетках; красный в мужских поло- вых клетках
^Железный ге- матоксилин Черные Черный От желтого до черного цвета Обычно не виден в соматических клетках, черный в мужских половых клетках
Окраска по Бенда—Икеда Синие Черный От желтого до черного цвета Обычно не виден в соматических клетках, синий в мужских половых клетках
Митохондрии окрашиваются в черный цвет, выделяясь на жел-
товатом фоне.
Метод Рего так же, как ниже описанный метод Бенсли-Коудри,
наиболее пригоден для тканей позвоночных, особенно млекопита-
ющих.
Метод Бенсли. Фиксируют смесью Бенсли или Рего (формалин дол-
жен быть нейтральным), желательно на холоду, помещая для этого фиксатор
на лед. Срезы обрабатывают 1-процентным перманганатом 3 секунды, затем
3 секунды 5-процентной щавелевой кислотой, хорошо споласкивают дистил-
лированной водой 1 минуту. Окрашивают ’срезы фуксином по Альтману,
а краситель после появления паров оставляют на стекле в течение б минут,
споласкивают препарат дистиллированной водой и наливают на предметное
стекло 1-процентный раствор метилового зеленого на 5—20 секунд. Препа-
рат опускают в 95-процентный спирт на 2 секунды, проводят через абсо-
лютный спирт, толуол и заключают в бальзам.
Вместо метилового зеленого можно пользоваться I-процентным раствором
толуидинового синего или светлого зеленого (равные части 1-процентного
раствора светлого зеленого и 1-процентной уксусной кислоты).
Метод Шридде. Объект фиксируют 2 дня в смеси: формалина 1
часть и мюллеровской жидкости (двухромовокислый калий 2 г, сернокислый
натрий 1 г, дистиллированной воды 100 см3) 9 частей, затем кладут на 2 дня
в 2-проиентпую осмиевую кислоту. Хорошо промывают и заливают в парафин.
Срезы окрашивают железным гематоксилином. Полезно перед окраской срезы
отбелить смесью перекиси водорода (20 частей) н абсолютного спирта (80
частей).
Этот метод успешно применяется при изучении тканей млекопитающих
и птиц.
320
Прижизненные наблюдения митохондрий.
1. Клетки эпидермиса Allium сера поместить в 1-процентный
раствор тростникового сахара, затем их можно зафиксировать и
окрасить иод-осмиевой смесью.
2. Различные виды Carchesium; при сильно затененной диа-
фрагме микроскопа видны крупные митохондрии.
3. Пазуха молодых листочков Elodea canadensis. •
4. Сперматоциты различных насекомых—бабочек, клопов
(Pirrhocoris), жуков (Blaps); средой служит гемолимфа, ткане-
вый сок или физиологический раствор.
5. Клетки культур тканей in vitro.
Материал для наблюдения митохондрий на
фиксированных препаратах. 1. Меристемные клетки
Allium сера, Elodea canadensis, Pelargonium zonale, Tradescantia;
фиксация смесью Мевеса, окраска железным гематоксилином или
по Альтману.
2. Тотальные препараты мелких инфузорий, особенно Glau-
coma scintillans; фиксация смесью Мевеса, окраска железным ге-
матоксилином.
3. Эмбриональные клетки зародыша цыпленка (2—4-днев-
ный); фиксация смесью Мевеса, окраска железным гематоксили-
ном или по Альтману.
4. Пленки эпидермиса личинок амфибий; тотальные препара-
ты, фиксация смесью Мевеса или Рего, окраска железным гема-
токсилином.
5. Поджелудочная железа и печень саламандры или тритона;
фиксация по Шампи, окраска по Бенда, железным гематоксили-
ном, или по Альтману.
6. Амнион эмбрионов млекопитающих; тотальные препараты;
фиксация смесью Мевеса или Шампи, окраска железным гемато-
ксилином.
7. Сперматоциты бабочек, виноградной улитки — мазки или
срезы; фиксация по Шампи или смесью Мевеса; окраска желез-
ным гематоксилином по Альтману, по Кулю, по Бенда.
Аппарат Гольджи
Прижизненное наблюдение аппарата Гольджи возможно с по-
мощью фазово-контрастного микроскопа. При фиксации аппарата
Гольджи следует учитывать, что к уксусной кислоте и спиртам
он еще более чувствителен, чем митохондрии. Также надо пом-
нить. что внешние воздействия могут сильно изменять аппарат
Гольджи.
Импрегнация объекта осмиевой кислотой по
Колачеву — Насонову является наиболее надежным ме-
тодом. Он заключается в следующем:
1. Фиксируют маленькие кусочки, величиной не более 3 мм1
в смеси Шампи, измененной по Насонову (2 части 3-процентного
21 Микроскопическая техника 321
раствора двухромовокислого калия, 2 части 1-процентного рас-
твора хромовой кислоты, I часть 2-процентной осмиевой кислоты),
в темноте 1—4 дня. 2. Промывают в проточной воде 24 часа.
3. Переносят для импрегнации в 1-процентную осмиевую кислоту
при 35° в баночках черного или коричневого цвета на 3—6 суток.
При потемнении жидкости последняя заменяется новой. Чтобы
определить степень осмирования, объект после полного почерне-
ния переносят в дистиллированную воду, отделяют от него иглой
маленький кусочек, который кладут в глицерин и надавливанием
на покровное стекло изолируют клетки. Остальной материал не-
медленно опять помешают в осмиевую кислоту. Если импрегна-
ция осмием достаточна, переходят к п.-4 (Насонов). 4. Промы-
вают в проточной воде 1 час. 5. Быстро обезвоживают и заливают
в парафин. Срезы 2—5 и. толщиной.
Аппарат Гольджи — черный на светлом фоне. Ядра можно до-
красить-сафранином (Г. Роскин).
Насонов рекомендует для одновременного окрашивания на од-
ном препарате аппарата Гольджи и секреторных гранул фиксиро-
вать материал по Шампи, слабо импрегнировать его осмием, кра-
сить кислым фуксином по Альтману и дифференцировать ауран-
цией; в результате получается черный аппарат Гольджи и красные
гранулы на бледно-желтом фоне. Для одновременного же окра-
шивания аппарата Гольджи, хондриосом и секреторных гранул
применяют фиксацию по Шампи, слабую импрегнацию осмием и
окраску по Кулю для хондриосом; в результате — черный аппарат
Гольджи, красные гранулы и фиолетово-красные хондриосомы
видны на желтом фоне.
Для одновременной окраски хондриосом и гранул секрета На-
сонов фиксировал материал своей модификацией смеси Шампи
24 часа, споласкивал дистиллированной водой, помещал кусочек
на 24 часа в смесь из части 1-процентной хромовой кислоты и
двух частей продажного древесного уксуса, быстро проводил по
спиртам и заливал в парафин. Срезы окрашивал по Кулю. В ре-
зультате красные секреторные гранулы и фиолетовые хондриосо-
мы выделяются на желтом фоне.
Для одновременного выявления аппарата Гольджи и капель
жидкого секрета применяется длительное осмирование без после-
дующей окраски. В результате черный аппарат Гольджи и свет-
лые капли секрета видны на сером фоне.
Можно комбинировать метод Колачева с окраской железным
гематоксилином или с докраской по Альтману. При последнем
методе на препаратах одновременно можно видеть красные мито-
хондрии и черный аппарат Гольджи. Аналогичных результатов
можно достигнуть, комбинируя осмирование по Колачеву — На-
сонову с последующей докраской по Бенда (Г. Роскин).
Импрегнация по К а х а л у. Метод с азотнокис-
лым ураном. 3. Совершенно свежие кусочки фиксируют в
смеси, в состав которой входит: азотнокислого урана — 1г, ди-
322
стиллированной воды — 85 см3 и нейтрального формалина______
15 см3. Продолжительность фиксации 10—24 часа. Время от вре-
мени встряхивают. Нервные клетки лучше фиксировать в смеси
из 15—20 см3 формалина, 80 см3 дистиллированной воды, 30 см3
абсолютного этилового спирта и 1 г азотнокислого урана. 2. После
быстрого споласкивания в дистиллированной воде (несколько
секунд) кусочки помещают в 1—1,5-процентный раствор азотно-
кислого серебра, в котором при комнатной температуре оставляют
в зависимости от их величины на 36—48 часов. 3. После быстрого
споласкивания в дистиллированной воде кусочки для восстанов-
ления помещают на 8—24 часа в раствор, содержащий 1—2 г гид-
рохинона, 15 см3 нейтрального формалина, 100 см3 воды и 0,1 —
0,5 г безводного сернистокислого натрия (т. е. такое количество
сернистокислого натрия, которое достаточно, чтобы в ванночке
тотчас же получилось желтоватое окрашивание). Раствор при-
готовляют непосредственно перед употреблением. 4. После про-
мывания в обыкновенной воде материал уплотняют в спиртах и
заливают в парафин или целлоидин.
При удачной импрегнации совершенно черный аппарат Гольд-
жи резко выделяется на светлом желтом фоне. Легче всего импре-
гнация удается на эмбриональном материале различных млеко-
питающих.
Метод с хлористым кадмием. Один из лучших ме-
тодов импрегнации аппарата Гольджи, применимый к тканям по-
звоночных и безпозвоночных, был предложен Аойама.
1. Маленькие кусочки фиксируют в продолжение 3—4 часов
в растворе, состоящем из 1 г хлористого кадмия, 15 см3 нейтраль-
ного формалина и 85 см3 дистиллированной воды. 2. После бы-
строго двукратного споласкивания в дистиллированной воде ку-
сочки помещают в 1,5-процентный раствор азотнокислого серебра
на 10—15 часов при температуре 22°. 3. Снова два раза быстро
споласкивают в дистиллированной воде и помещают на 5—10 ча-
сов для восстановления в раствор гидрохинона, состав которого
дан при описании метода импрегнации азотнокислым ураном по
Кахалу. 4. Основательно промывают в проточной воде. Заливают
в парафин. Указанные концентрации и сроки оптимальны для
большей части тканей теплокровных животных. Для холоднокров-
ных сроки в пп. 1 и 2 должны быть увеличены. Жидкости для
защиты от света помещают под картонный колпак; смену их сле-
дует производить при затемненном свете. 5. Препараты можно
докрашивать метиловым синим — эозином по способу Мапиа.
Метод импрегнации по Д а-Ф а и о. 1. Маленькие
кусочки фиксируют 6—24 часа в смеси: азотнбкислый кобальт —
1 г, формалин — 15 см3, вода — 100 см3. 2. Быстро споласкивают
и кусочки кладут на 24—48 часов в 1,5-процентный раствор азот-
нокислого серебра (в темноте). 3. Снова быстро споласкивают
и, если нужно, разрезают на кусочки толщиной не более 2 мм.
4. Переносят на 5—10 часов в свежеприготовленную смесь: гидро-
21* 323
хинон — 1—2 г, нейтральный формалин — 15 см3, вода — 100 см3,
сернистокислый натрий (безводный)—0,1—0,5 г. Сернистокислый
натрий прибавляют до появления желтой окраски смеси. 5. Хо-
рошо промывают проточной водой и затем заключают в парафин.
Объекты, фиксированные по Аойама или по Да-Фано, могут
быть (одновременно с изучением аппарата Гольджи) использо-
ваны для изучения жировых включений.
Для этого с фиксированных кусочков делают срезы на замо-
раживающем микротоме и затем окрашивают специальными ме-
тодами на жир.
Для дифференциального определения митохондрий и аппарата
Гольджи можно исходить из следующей примерной таблицы.
Таблица 12
ДИФФЕРЕНЦИАЛЬНОЕ ОПРЕДЕЛЕНИЕ МИТОХОНДРИЯ
И АППАРАТА ГОЛЬДЖИ ПРИ РАЗЛИЧНЫХ МЕТОДАХ ОЬРАВОТКИ
Метод обработки Аппарат Гольджи Митохондрии
Метод серебрения Аойама или Да-Фано Черный Желтоватые, очень редко чер- ные
Метод Альтмана Не виден Красные
Железный гематокси- Не окрашивается за исклю- Черные или чер-
ин после фиксации в меси Рего или Шампи чением клеток оогоний или мо- лодых ооцитов, а также муж- ских половых клеток; в других клетках окрашивается очень редко и всегда менее интенсив- но, чем митохондрии но-серые
Прижизненно янусом зеленым 1:10 000 Окрашивается крайне редко; исключение составляют муж- ские половые клетки Зеленые
Метод Бенда Не окрашивается Синие
Осмирование по Кола- чеву — Насонову Черный Не окрашивают- ся; очень редко черные
Метод Шампи — Куля Обычно не виден; как ред- кое исключение красный Красные
Прижизненные наблюдения аппарата Гольд-
ж и в обычном микроскопе весьма трудны. Как указывает Кар-
пова, наиболее пригодным объектом являются сперматоциты Ра-
ludina vivipara. Митохондрии и аппарат Гольджи можно прижиз-
ненно наблюдать в сперматогониальных клетках моллюска Helix
aspersa и насекомых Gryllus или Lepisma; небольшой кусочек
органа помещают в висячей капле физиологического раствора по-
варенной соли.
324
Для наблюдения аппарата Гольджи на фик-
сированных препаратах весьма пригодны следующие
объекты:
1. Клети спинальных ганглиев, простаты и придатков семен-
ников кролика и кошки. Эти же объекты после специальной обра-
ботки могут служить для изучения трофоспонгиев. 2. Клетки под-
желудочной железы, желудка или кишечника амфибий и млеко-
питающих; обработка по Колачеву—Насонову или по Аойама.
3. Тотальные препараты эпидермиса личинок амфибий, обработка
по Колчаеву — Насонову. 4. Сперматоциты легочных моллюсков,
клопов и жуков; обработка по Колачеву—Насонову или по
Аойама.
При цитологическом анализе клеточных органоидов
и включений можно пользоваться следующей примерной схемой как пер-
вой ступенью в исследовании.
1. Материал, фиксированный по Шампи или Альтману, можно обраба-
тывать:
а) по Альтману или железным гематоксилином для выявления митохонд-
рий;
б)’ по Колачеву — Насонову импрегнировать для выявления аппарата
Гольджи;
в) по Чиаччио на липонды, предварительно подвергнув хромированию
(3 дня в 3—5-процентном двухромовокислом калии);
г) хорошо промыв, можно делать срезы на замораживающем микротоме
для дальнейшей окраски на жир.
2. Материал, фиксированный по Буэиу:
а) можно окрашивать различными гистологическими методами для по-
лучения общей картины;
б) обрабатывать специальными методами для выявления ядерных струк-
тур, хроматина, хромосом, ядрышек;
в) обрабатывать по Бауэру или Шабадашу для выявления гликогена.
Вакуом
Образования, в своей совокупности обозначаемые термином «вакуом»,
можно выявить прижизненно или супр-авитально, прибавляя нейтральный
красный к жидкости, в которой производят исследование.
В одних животных клетках нейтральный красный накапливается в пред-
существующих гранулах или вакуолях, в других клетках эти гранулы явля-
ются новообразованиями и, наконец, взаимодействие между красителями и
протоплазмой может вызвать образование (отмешивание) в клетках телец,
которые Н. Г. Хлопин называл «криномом». Следовательно все эти образова-
ния, появляющиеся при окраске нейтральным красным или предсуществовав-
шие в различных растительных и животных клетках, нельзя считать гомоло-
гичными структурами. Волютиновые гранулы, различные метахроматические
гранулы, презимогеновые зерна и т. д. могут также окрашиваться нейтраль-
ным красным.
Трофоспонгии
Для выявления трофоспонгии можно фиксировать мате-
риал 24 часа в 2,5—5-процентной трихлормолочной кислоте и за-
тем залить в парафин. Срезы толщиной 4—5 ц красят 24—48 ча-
сов резорцин-фуксином по Вейгерту и обычным способом заклю-
чают в бальзам. .
325
ГИСТОЛОГИЧЕСКИЕ МЕТОДЫ
Эпителий
Для прижизненного наблюдения можно лезвием безопасной
бритвы срезать тонкие пластинки с органов, выстланных эпите-
лием. Легко удается прижизненное наблюдение биения реснич-
ного эпителия, например, эпителия жаберных пластинок пресно-
водных моллюсков, слизистой оболочки нёба лягушки. Многое
может дать прижизненное наблюдение над культурами эпителия
in vitro.
Прижизненное скрашивание см. стр. 66.
Изучать формы отдельных эпителиальных клеток удобно на
мацерированном материале. Для этой цели нефиксирован-
ные кусочки органов, покрытых эпителием (кишечник, трахея
и т. п.), помещают в мацерирующие жидкости. Наилучшие ре-
зультаты дает спирт в треть (30 см3 90-градусного спирта,
60 см3 воды), где кусочки ткани должны пробыть 12—24 часа,
иногда несколько суток, после чего встряхиванием или осторож-
ным раздиранием кусочка иглами можно изолировать клетки; при
этом методе реснички мерцательного эпителия обычно сохраня-
ются. Хорошая мацерация достигается обработкой разведенной
хромовой кислотой (1 г на 1000 см3 воды), но процесс
идет медленно: 1—5 дней. Ткань можно мацерировать и 0,01-про-
центпой осмиевой кислоте, куда кладут маленькие кусочки
ткани на 24 часа, затем споласкивают водой и осторожно расщи-
пывают в глицерине. Во всех этих случаях количество мацериру-
ющей жидкости должно быть минимальным и превышать объем
мацерируемого кусочка не больше, чем в 2—3 раза. Если получен-
ные при мацерации клетки нужно окрасить и затем обезводить, то
взвесь обработанных тем или иным способом клеток можно после
каждой операции отцентрифугировать и отсосать излишнюю жид-
кость.
Для мацерации можно пользоваться также насыщенным рас-
твором борной кислоты (см. мацерация мускульной ткани)
или сильно разведенной (1 часть на 100 частей воды) жид-
костью Мюллера: двухромовокислый калий — 2,5 з, серно-
кислый натрий— 1 г, дистиллированная вода— 100 см3.
После мацерации кусочек можно осторожно перенести на не-
сколько часов в пикрокармин для окрашивания. Затем шпателем
осторожно проводят по эпителию и стряхивают соскоб в банку
с глицерином, к которому прибавлен кусочек тимола или камфо-
ры (для предохранения от заплесневения). Для приготовления
препарата каплю глицерина с клетками наносят на предметное
стекло, накрывают покровным и обводят края его асфальтовым
лаком или менделеевской замазкой.
Мацерированные клетки в глицерине могут сохраняться очень
долго.
Для изучения клеточных границ эпителия и эндотелия
используют метод серебрения по Ранвье. С этой целью
326
мембраны, мезентерий, кусочки перикарда, вскрытые тонкие сосу-
ды и т. п. споласкивают дистиллированной водой для удаления
крови и кладут в 0,5-процентное азотнокислое серебро примерно
иа 5 минут (кусочек ткани должен стать непрозрачным), затем
переносят в сосуд с достаточным количеством дистиллированной
воды и выставляют на солнце до потемнения ткани, принимающей
коричневый тон (примерно 1—2 дня). После этого кусочки хо-
рошо споласкивают дистиллированной водой и исследуют в гли-
церине, или, проводя, как обычно, через спирты и ксилол (мемб-
раны, во избежание сморщивания, надо растянуть иглами иа кор-
ковой пластинке), заключают в бальзам. При этом методе кле-
точные границы получаются черными на бесцветном фоне. По-
серебренный материал можно докрашивать квасцовым гематок-
силином. При серебрении надо избегать соприкосновения азотно-
кислого серебра с металлическими инструментами.
Для выявления клеточных границ материал можно сперва
фиксировать 24 часа в 0,5-процентисй осмиевой кислоте, а затем
иа сутки поместить его в 2-процентное азотнокислое серебро, пос-
ле чего сполоснуть дистиллированной водой и на солнечном свету
восстанавливать 1-процентным гидрохиноном или пирогалловой
кислотой. Затем промыть водой и, как обычно, заключить в баль-
зам или исследовать в глицерине.
Для окраски фибриллярных структур эпители-
альных клеток можно рекомендовать материал от беспозвоночных
фиксировать 12—24 часа в следующей смеси: фиксатор Ценкера
(вместо уксусной — 5-проиентная муравьиная кислота) — 4 части
и 2-процентной осмиевой кислоты — 1 часть. Материал от позво-
ночных лучше фиксировать в следующей смеси: фиксатор Цен-
кера (без уксусной кислоты)—95 см3, муравьиной кислоты
(85-процеитиой)—2,5 см3, 2-процентиой осмиевой кислоты —
2,5 см3. Провести заливку в парафин, окрасить срезы по методу
Бенсли в геициановом фиолетовом — оранже—24 часа. Для при-
готовления красителя смешивают по 50 см3 насыщенных раство-
ров генцианового фиолетового и оранжа; получившийся при этом
осадок собирают на фильтре, промывают его дистиллированной
водой, высушивают н растворяют в 50 см3 абсолютного спирта;
от этого основного раствора краситель по каплям прибавляют к
20-градусному спирту до тех пор, пока спирт не примет темно-
фиолетовый цвет. Окрашенный препарат осторожно просушивают
фильтровальной бумагой, обезвоживают ацетоном, переносят в
ксилол, дифференцируют смесью: абсолютного спирта — 1 часть,
гвоздичного масла — 2 части. Проведя через ксилол, заключают
в бальзам. Ядра и фибриллы окрашиваются в пурпурно-
фиолетовый цвет, а плазма — в желтый.
Для изучения тонкого строения эпителиальных клеток
с успехом можно применять железный гематоксилин, трехцветный
метод по Массону, метод Бенда или серебрение по Дель-Рио-
Гортега.
327
I
Соединительная ткань
Прижизненные наблюдения над коллагеновой и эластической
тканью
Хорошим объектом для прижизненного наблюдения коллаге-
новой соединительной ткани являются тонкие соединительноткан-
ные пленки, находящиеся между кожным покровом и мускулату-
рой у крыс и мышей. Вырезают ножницами маленький кусочек
такой пленки и, прибавив каплю тканевого сока или физиологи-
ческого раствора поваренной соли, накрывают покровным стек-
лом. При прибавлении 0,1% нейтрального красного (в физиологи-
ческом растворе поваренной соли) очень четко окрашиваются зер-
на тучных клеток. Можно испробовать прижизненную окраску
лейкобазами по Г. И. Роскипу.
Прижизненную окраску трипановым синим см. стр. 67.
Прибавление 1-процентной уксусной кислоты четко выявляет
ядра и одновременно вызывает набухание коллагеновых фибрилл,
которые становятся едва видимыми. Аналогичное действие вызы-
вает разведенный раствор едкого кали, растворяющий коллаге-
новые фибриллы.
Для прижизненного изучения эластической ткани можно ис-
пользовать выйную связку, например, быка; топкие эластические
тяжи можно наблюдать в мезентерии (например, кошки). При-
бавление разведенных растворов уксусной кислоты и едкого кали
заметно не изменяет эластических волокон.
Эластическая ткань, в противоположность коллагеновой, осо-
бенно резистентна по отношению к едкому кали. Этим свойством
пользуются для выявления тончайших эластических волокон.
Например, если кусок ткани легкого подвергать действию раз-
бавленного едкого кали, то через несколько часов коллагеновая
соединительная ткань, кровь и т. д. растворяются и остаются лишь
тончайшие эластические волоконца, оплетающие альвеолы.
Методы искусственного переваривания
Важным методом изучения различных фибрилл соединитель-
ной ткани является метод искусственного переваривания.
Коллагеновые волокна растворяются под действием пепсина,
а эластические волокна — под действием трипсина. Материалом
для исследования служат свежие или фиксированные в 90-гра-
дусном спирте кусочки .ткани. Стеклянные и металлические ин-
струменты следует перед работой стерилизовать.
Переваривание кусочков. 1. Маленькие кусочки
обезжиривают эфиром в продолжение недели (в аппарате Сокс-
лета). 2. Переводят через спирты нисходящей крепости в воду.
3. Промывают водой в течение суток. 4. Помещают в раствор
трипсина или пепсина при температуре 37°. Раствор каждые 2 дня
сменяют, пока ие закончится весь процесс, на что потребуется
около месяца. Раствор пепсина готовят следующим образом:
328
0,1—0,5 г пепсина (Pepsinum siccum) растворяют в 100 cms
0,2-процентной соляной кислоты, к которой добавляют 2—3 см3
толуола. Приготовление раствора трипсина см. ниже.
Переваривание срезов. 1. Кусочки фиксируют спир-
том или смесью Карнуа. Приготовляют парафиновые срезы и на-
клеивают их водой на абсолютно чистые, обезжиренные предмет-
ные стекла. 2. Проводят через ксилол — 3—4 часа. 3. Абсолютный
спирт 5 минут. 4. Бензин — 6—7 дней. 5. Через ряд спиртов
переводят в дистиллированную воду. 6. Переносят в баритовую
воду на 24 часа. 7. Промывают проточной водой. 8. Помещают
в раствор трипсина или пепсина при температуре 37° па 6—24 ча-
са. 9. Быстро споласкивают в дистиллированной воде. 10. Обез-
воживают, заключают в бальзам.
Наклеенные и освобожденные от парафина срезы можно обез-
жирить, помещая их на 1—3 дня в бензин при температуре 37°,
затем провести через спирты, промыть в воде 10—20 минут и по-
сле этого поместить в переваривающую жидкость (к 0,3 г трип-
сина на 100 см3 0,3-процентного раствора углекислой соды при-
бавляют 2—3 cms толуола; панлучшее воздействие при 37—40°),
После этого производят промывку в проточной воде, протравляют
срезы в 0,5-процентном водном растворе Ferridammonium tartari-
cum в течение 1—24 часов, затем снова промывают их водой и
перекладывают на 3—24 часа в 0,5-процентный водный раствор
зрелого гематоксилина; споласкивают водой. Если после спола-
скивания красителя окажется, что перекладины сети все еще не
приобрели черного цвета, то препарат снова кладется на 20—
30 минут в свежеприготовленный раствор протравы.
Пепсином перевар ива ют с я коллагеновые волокна
соединительной ткани, хряща, кости, также ретикулиновая ткань
и роговая субстанция ногтей. Напротив, эластическая ткань доль-
ше противостоит действию пепсина, а нейрокератин, хитин, жир
и углеводы совсем не перевариваются им.
Трипсином переваривается эластическая ткань,
муцин, хондромукоид, а также большинство обычных белковых
тел. Напротив, не изменяются или почти не изменяются (в зави-
симости от времени воздействия) коллагеновые волокна соедини-
тельной ткани, хряща, кости, ретикулиновая ткань, роговая суб-
станция, хитин, жир и углеводы.
Время действия переваривающего фермента может быть раз-
лично в зависимости от изучаемого объекта, размеров кусочка,
возраста животного и т. д. Если процесс переваривания произво-
дится иа срезах, то необходимо время от времени контролировать
его под микроскопом. Надо также помнить, что метод перевари-
вания может найти значительное применение не только при ана-
лизе соединительнотканных элементов, но и при решении
г и с т о ф и з и о л о г и ч е с к и х вопросов, касающихся
самых различных тканей.
Оставшиеся после переваривания ферментами структуры окра-
329
шивают, в зависимости от вида ткани, железным гематоксилином,
молибденовым гематоксилином, гематоксилином с докраской кис-
лым фуксином с пикриновой кислотой, также по методу Маллори
или орсеииом и т. д. в зависимости от целей исследования.
Окрашивание соединительной ткани
Среди методов окрашивания соединительной ткани на первом
месте стоит азанов ый метод Гейденгайна.
Особенно хорошо удается этот метод после фиксации мате-
риала в сулеме с ледяной уксусной кислотой, сулеме с трихлор-
уксусной кислотой, ценкеровской жидкости и ее модификациях,
а также после фиксации в жидкости Буэна. После обыкновенной
формалиновой фиксации также получаются хорошие результаты
окрашивания. Важно отметить, что качество окраски зависит от
хорошей промывки материалов после фиксаторов.
1. Освобожденные от парафина срезы помещают из воды
в азокармин. Окрашивание производится 45—60 минут в термо-
стате, в плотно закрытой стеклянной посуде при температуре
50—60°. Затем срезы 5—10 минут охлаждают при комнатной
температуре. Если раствор красителя предварительно нагреть,
то время окрашивания в термостате можно сократить до 10—
15 минут. 2. Споласкивают в дистиллированной воде. 3. Диффе-
ренцируют в спиртовом растворе анилина (1 см3 анилинового
масла на 1000 сл3 90-градусного спирта). Дифференцируют до
четкого выявления ядер; этот процесс можно ускорить, прибав-
ляя немного дистиллированной воды к анилиновому раствору.
4. Далее производится непродолжительное отмывание анилина
в уксуснокислом спирте (1 см3 ледяной уксусной кислоты на
100 см3 96-градусного спирта) от 0,5 до 1 минуты. Если ткань,
несмотря на произведенную дифференцировку, еще силыю окра-
шена в красный цвет, то препарат снова помещают в спиртовый
раствор анилина. 5. После этого следует протравление в 5-про-
центной фосфорновольфрамовой кислоте (1—3 часа), где соеди-
нительная ткань еще больше обесцвечивается (фосфорноволь-
фрамовая кислота должна быть химически чистой). 6. Затем бы-
стро споласкивают в дистиллированной воде. 7. Окрашивают в
смеси анилинового синего — оранжа G — уксусной кислоты в те-
чение 1—3 часов. 8. Споласкивают в воде, дифференцируют в
90-градусном спирте; затем проводят через абсолютный спирт,
ксилол, заключают в бальзам.
Для выявления очень топких волокон срезы не споласкивают
в воде, а сразу погружают в 96-градусный спирт; затем поме-
щают в абсолютный спирт и т. д.
Коллагеновые и ретикулярные волокна, соединительная ткань
окрашиваются в интенсивно синий свет; хроматин — в красный;
мышечная ткань (в зависимости от фиксации)—в красноватый
с переходами до оранжевого; эритроциты окрашиваются в крас-
ный цвет; нейроглия — в красноватый, слизь — в синий. Зерни-
330
стости клеток, в зависимости от их консистенции, окрашиваются—
в желтый, красный или синий цвет.
Приготовление красящих растворов для
азанового метода. Азокармин имеется в продаже в виде
азокармипа В и G. Первый легко растворяется в воде. Употреб-
ляется он в 0,25—1-процентном водном растворе, на 100 см3 кото-
рого прибавляют 1 см'3 ледяной уксусной кислоты. Обычно реко-
мендуют более трудно растворимый азокармин G. 0,1-процентный
водный раствор последнего кипятят и после охлаждения фильт-
руют через неплотный фильтр.
При этом часть очень мелких частиц красителя проходит
через фильтр в нерастворенном виде и растворяется при дальней-
шем нагревании в термостате. Этот раствор после приготовления
также подкисляется (1 см3 ледяной уксусной кислоты па 100 см3
раствора красителя). Смесь анилинового синего —
о р а и ж a G: 0,5 г анилинового синего и 2г оранжа G растворяют
в 100 см3 дистиллированной воды, к которой прибавляют 8 см?
ледяной уксусной кислоты, кипятят и после охлаждения фильт-
руют. Для окрашивания этот основной раствор разбавляют 1 —
3-кратным количеством дистиллированной воды.
Эта смесь хорошо сохраняется.
Можно использовать модификацию азанового ме-
тода, заменяя азокармин кислым ализариновым синим. После
фиксаторов, содержащих пикриновую кислоту, или после фикса-
ции смесью сулемы с трихлоруксусной кислотой этот метод дает
лучшие результаты, чем азановый метод.
1. Объект красят 5 минут в растворе: сернокислый алюминий
10 г; кислый ализариновый синий — 0,5 г; дистиллированная во-
да— 100 ди3. Раствор кипятят 5—10 минут и после охлаждения
фильтруют. 2. Споласкивают в дистиллированной воде и обраба-
тывают 5-процентной фосфорновольфрамовой кислотой (от не-
скольких минут до часа). 3. Споласкивают дистиллированной во-
дой и красят 2 минуты в неразбавленной смеси: анилиновый си-
ний — оранж (см. стр. 202). 4. Споласкивают дистиллированной
водой, проводят через 96-процентный спирт, абсолютный спирт,
ксилол, заключают в бальзам.
Н. А. О л ь ш в а н г предложил следующий метод
окраски соединительной ткани: 1. Материал фиксировать на-
сыщенным раствором сулемы в физиологическом растворе пова-
ренной соли или смесью Ценкера без Na2SO4 по В. К- Шмидту.
2.. Красить железным гематоксилином по Гейденгайну. 3. Промыть
дистиллированной водой. 4. Красить 3—10 минут следующей
смесью: 2-процентного водного раствора эозина — 3 части и 1-про-
центного водного раствора водного синего — 2 части. 5. Сполос-
нуть в дистиллированной воде. 6. Провести через 96-процентнып
спирт, карбол-ксилол, ксилол, заключить в бальзам.
Цитоплазма-окрашивается в розовый цвет, ядра — в коричне-
вый, коллагеновые волокна — в интенсивно синий. По сравнению
331
с окраской по Маллори метод Н. А. Ольшванга имеет следующие
преимущества: дает черную окраску ядер и не требует протравы
фосфорномолибденовой или фосфорновольфрамовой кислотой.
Метод Маллори (стр. 202) широко применяется при изу-
чении соединительной ткани.
Результаты окраски по Маллори: коллагеновая и ретикуляр-
ная соединительная ткань окрашивается в темно-синий цвет:
слизь — в синий цвет; эритроциты — в оранжево-красный цвет;
мышечная ткань — в ярко-оранжевый или красноватый цвет;
нейроглия, ганглиозные клетки — в красно-фиолетовый цвет;
ядра — в красный цвет с желтоватыми и темноватыми оттенками.
Окрашивание по методу Ван-Гизона (описание метода см,
стр, 201) легко удается и дает отчетливые и контрастные препа-
раты, но коллагеновые фибриллы не так резко видны, как при
азановом методе.
Результаты окраски по Ван-Гизону:
Ядра — темные или темно-синие; коллагеновая ткань — ярко-
красная; мускульная ткань — желтая.
Метод Пачини (модификация Вальтера) дает резкое раз-
граничение между коллагеновыми волокнами и клеточной протоплазмой.
Фиксация сулемовыми смесями Ценкера, Гелли и т. п. Заливка в парафин.
Срезы тонкие э 3—4 ц.
1. Освобожденные от парафина срезы из дистиллированной воды поме-
щают з 25-процентный раствор железных квасцов: срезы, толщиной
в 2—4 и — на 24 часа, для более толстых достаточно 1—2 часа. 2. Споласки-
вают в дважды сменяемой дистиллированной воде. 3. Кладут в смесь Пачи-
ни; срезы толщиной 2—4 ц — на 24 часа, более толстые от 5 минут до 1 ча-
са. 4. Споласкивают в воде, переносят в 96-градусный спирт; в последнем
держат до тех пор, пока от срезов больше не отходят облачка красителя,
и они оказываются в достаточной степени дифференцированными, проводят
через абсолютный спирт, ксилол, заключают в бальзам.
Смесь Пачиви. Раствор А: к 100 см3 1-процентного водного сине-
го прибавляют 50 см3 2-процентного раствора орсеина в 100-градусном спир-
те, к которому добавлено 5 см3 уксусной кислоты и 20 ел? глицерина.
К 30 ел? раствора А прибавляют раствор Б: 30 см3 2-процентного эозина
(на 50-градусном спирте), 4 см3 насыщенного водного раствора кислого
фуксина и 25 ел? глицерина.
Метод Массона. Материал фиксируют смесью Буэна, Ценкера
или другими сулемовыми фиксаторами. Заливают в парафин.
1. Срезы протравливают 24 часа в 5-процентных железных квасцах,
2. Окрашивают гематоксилином по Рего (см. стр. 196) 24 часа. 3. Споласки-
вают дистиллированной водой н дифференцируют железными квасцами нли
пикриновым спиртом (2 части абсолютного спирта, насыщенного пикрино-
вой кислотой,-? 1 часть 95-градусного спирта), дающим лучшую диффе-
ренцировку. Дифференцировку прекращают, когда окрашенными остаются
только ядра. 4. Промывают в проточной воде. 5. Докрашивают 5 минут
в 0,5-процентном кислом фуксине (к 200 см3 прибавить 1 см3 уксусной кис-
лоты). 6. Споласкивают дистиллированной водой. 7. Дифференцируют
в 1-проиентной фосфорномолибденовой кислоте (химически чистой) до обес-
цвечивания соединительной ткани. 8. Не промывая, переносят в насыщенный
раствор анилинового синего (на 100 см3 красителя прибавить 2,5 см3 уксус-
ной кислоты). 9. Споласкивают дистиллированной водой и затем дифферен-
цируют 5—30 минут 1-процентной уксусной кислотой для удаления избытка
анилинового синего. 10. Проводят через подкисленный абсолютный спирт
(0,1 см3 уксусной кислоты на 100 см3 спирта). 11. Затем абсолютный спирт,
ксилол и заключают в бальзам.
332
Результаты окраски: ядра — черные; цитоплазма — красная-
коллагеновые волокна — интенсивно синие. ’
Методы окраски эластических волокон со-
единительной ткани. Окрашивание о р с е и н о м. Харак-
тер фиксатора не имеет особого значения.
1. Приготовляют парафиновые срезы, освобождают их от па-
рафина и доводят до воды. 2. Окрашивают в растворе орсеина
0,5—1 час. Приготовление орсеина: растворяют 1 г орсеина в
100 слР 70-градусного спирта и добавляют 1 см3 соляной кис-
лоты; раствор долго не сохраняется. 3. Срезы споласкивают в ди-
стиллированной воде, помещают в абсолютный спирт и, контро-
лируя под микроскопом, дифференцируют до тех пор, пока ие
будут окрашены исключительно эластические волокна. 4. Прово-
дят через ксилол, заключают в бальзам.
Эластические волокна окрашиваются в красновато-коричневый
цвет.
Перед окраской срезов орсеипом ядра можно окрасить квас-
цовым гематоксилином.
Другим методом может служить комбинированная окраска
о р с е и и ом-к в а с ц о в ы м гематоксилином и пикро-
фуксином. Приготовляют парафиновые срезы, освобождают
их от парафина, переводят в воду и обрабатывают следующим об-
разом:
1. Окрашивают в растворе орсеина — 1 час. 2. Промывают в
дистиллированной воде, два раза сменяя последнюю, — 3 мину
ты. 3. Окрашивают квасцовым гематоксилином. 4. Промывают
в дистиллированной воде — 3 минуты. 5. Промывают в проточ-
ной воде — 3 минуты. 6. Споласкивают в дистиллированной во-
де— 3 минуты. 7. Окрашивают в подкисленном растворе пнкро-
фуксина (к 60 см3 пикрофуксина прибавляют перед употребле-
нием 7 капель уксусной кислоты)— 5 минут. 8. Погружают на
2—3 минуты в дистиллированную воду, к 60 см3 которой предва-
рительно прибавляют 2.5 см3 подкисленного раствора пикрофук-
сина. 9. Обсушивают фильтровальной бумагой. 10. Проводят че-
рез 96-градусный спирт—1 минута. 11. Абсолютный спирт —
3 минуты. 12. Ксилол, заключают в бальзам.
Ядра окрашиваются в темно-коричневый цвет, эластические
волокна — от красновато-коричневого до черного, коллагеновая
соединительная ткань — в красный, мышечная ткань — в желтый
цвет.
Хорошо выявляются эластические волокна после окраски р е-
3 о р ц и н-ф у к с и н о м.
Краситель готовят следующим образом: растворяют 4 г резор-
цина в 100 с,и3 дистиллированной воды и доводят раствор до ки-
пения в фарфоровой чашке; к кипящему раствору приливают
100 см3 2-процентлого основного фуксина и снова доводят смесь
до кипения; добавляют 25 см3 продажного (оффицинального)
раствора полуторахлористого железа (liquor ferri sesquichlorati),
333
кипятят еще несколько минут, все время помешивая; смесь охла-
ждают, фильтруют, фильтрат выливают.
Фильтр с осадком помещают в ту же самую фарфоровую чаш-
ку, в которой кипятилась смесь, и приливают 200 см3 96-градус-
ного спирта.
Осторожно нагревают спирт на водяной или песочной бане
н помещают до растворения осадка. Фильтр удаляют, раствор
охлаждают и доливают столько 96-градусного спирта, чтобы сно-
ва оказалось 200 <7Л13 раствора. Прибавляют 4 см3 2-процентной
соляной кислоты. Для окрашивания срезы помещают в резорцин-
фуксин на 2—24 часа и дифференцируют 96-градусным спиртом
до тех пор, пока не будут отчетливо видны темно-синие эласти-
ческие волокна на светлом фоне. Ядра можно предварительно
окрасить фуксином. При заключении в бальзам не следует при-
менять карбол-ксилол.
Для окраски различных клеточных элементов соеди-
нительной ткани (особенно рыхлой соединительной ткани) можно
рекомендовать окраску гематоксилином по Я св о и ну
и окраску азур-эозином по Максимову. В нашей ла-
боратории при изучении рыхлой соединительной ткани с большим
успехом применяется метод ленинградского гистолога Г. Ясвоииа.
Способ изготовления пленочных препаратов рыхлой
соединительной ткани по Г. Ясвоину
Кожу вместе с подкожной (пли межмышечной) соединитель-
ной тканью быстро отделяют, не допуская ее подсыхания, и фик-
сируют в большом количестве 10-процентного формалина, нейт-
рализованного непосредственно перед разведением (в банку со
100 см3 продажного формалина всыпают 5—6 г углекислой маг-
незии, несколько минут взбалтывают, затем фильтруют).
Препараты можно изготовлять через несколько часов после
фиксации и затем примерно в течение 10—15 дней (материал хра-
нить в том формалине, в котором он был зафиксирован). Рыхлая
соединительная ткань после фиксации должна быть бархатистой
иаощупь. Если ткань жестковата (или становится такой через
10—15 дней), материал непригоден для изготовления пленочных
препаратов. Из этой бархатистой, стекловидной, прозрачной тка-
ни острыми ножницами вырезают узкую полоску (1 мм шириной),
которую иглой кладут на предметное стекло, покрытое тонким
слоем белка с глицерином. Кожу кладут обратно в формалин со-
единительной тканью вниз. Из одного куска кожи можно приго-
товить много препаратов.
Вырезанную полоску передвигают иглой по стеклу 5—8 раз,
описывая при этом во избежание закручивания фигуру восьмерки.
К расправлению надо приступать тогда, когда полоска станет ме-
нее влажной, но не подсохнет. Установив полоску ткани посредине
стекла, можно приступить к ее растягиванию. Растягивание (ие
расщипывание) следует производить двумя иглами. Существенно
334
уловить наиболее благоприятный для этого момент: излишне
влажная полоска ткани будет не растягиваться, а перемещаться
с места на место, и клеточные элементы, в ней заключенные, ока-
жутся при этом деформированными; подсохшая полоска вообще
не будет растягиваться. В результате растягивания, начатого в
подходящий момент, полоска ткани превратится в тончайшую
пленку. Чем тоньше пленка, тем лучше получится препарат. Не
давая пленке окончательно высохнуть, ее помещают на 5 минут
в 96-градусный спирт. Приклеившуюся к стеклу пленку доводят
через нисходящие спирты до дистиллированной воды, в которой
оставляют ее 5—10 минут. Пленка не должна отставать от стекла.
Окрашивать железным гематоксилином по Ясвоину.
Метод прост по выполнению и дает очень хорошие результаты.
Импрегнация соединительной ткани
Импрегнация по Бильшовскому — Марешу. Не-
обходимым условием работы является абсолютная чистота сосу-
дов, пипеток и стеклянных палочек (для каждой жидкости надо
иметь особую пипетку).
1. Фиксируют кусочки в формалине или в смесях Ценкера,
Штиве и Карнуа. 2. Приготовляют парафиновые срезы толщиной
в 5—10 н, наклеивают их на совершенно чистые предметные стек-
ла, освобождают от парафина, переводят в дистиллированную
воду. 3. Помещают срезы в 0,25-процентный раствор марганцево-
кислого калия на 3 минуты. 4. Промывают в дистиллированной
воде. 5. Переносят в 1-процентный раствор щавелевой кислоты иа
5 минут. 6. Промывают в дистиллированной воде, несколько раз
ее сменяя, 1—2 часа. 7. Помещают в 2-процентный раствор азот-
нокислого серебра на 1—2 дня. 8. Быстро, не более 2—5 секунд,
промывают срезы в дистиллированной воде, один раз сменяя ее.
9. Переносят в аммиачное серебро на 5—10 минут (лучше всего
наливать на препарат при помощи пипетки по каплям). Приго-
товление аммиачного серебра: к 10 сж3 10-процентного азотнокис-
лого серебра прибавляют 5 капель 40-процентного едкого натра:
получившийся при этом осадок растворяют, осторожно прибавляя
по каплям аммиак (уд. вес 0,875—0,910; химически чистый); пос-
ле прибавления каждой капли аммиака слегка взбалтывают рас-
твор; остерегаться избытка аммиака, лучше оставить несколько
крупинок осадка нерастворенными. После растворения осадка
долить дистиллированной водой до 20 гж3. 10. Раствор аммиач-
ного серебра сливают и срезы промывают 5—10 секунд в дистил-
лированной воде, сменяя ее один раз. 11. Помещают в нейтраль-
ный формалин (1 часть формалина +9 частей водопроводной
воды) на 10 минут. 12. Промывают в проточной воде 15 минут.
13. Споласкивают в дистиллированной воде (сменяя ее). 14. Пере-
носят в подкисленный раствор хлорного золота (на 10 см3 ди-
стиллированной воды прибавляют 3 капли 1-процентного рас-
335
твора хлорного золота и 2 капли ледяной уксусной кислоты).
15. Промывают в проточной воде 1 минуту. 16. Фиксируют в
5-процентном растворе гипосульфита полминуты. 17. Промывают
основательно в проточной воде 1—2 часа. 18. Обезвоживают и,
проведя через ксилол, заключают в канадский бальзам.
Решетчатые волокна окрашиваются в черный цвет; коллаге-
новые волокна — в темно-коричневый или черный. Иногда окра-
шиваются в черный или коричневый цвет ядра.
Этот метод удается также и на замороженных срезах (начи-
нают обработку с п. 6).
Хорошие результаты дает импрегнация аргентофиль
н ы х волокон по способу Фута.
Фиксация формалином; срезы на замораживающем микрото-
ме (можно использовать и заливку в парафин). Срезы обрабаты-
вают 5 минут 0,25-процентным раствором марганцевокислого ка-
лия. Затем срезы помещают на 30 минут в 5-процентный раствор
щавелевой кислоты, промывают дистиллированной водой и пере-
носят в 20-процентный раствор азотнокислого серебра (48 часов
в темноте). Быстро споласкивают в дистиллированной воде и по-
мещают на 30 минут в аммиачное серебро, промывают дистилли-
рованной водой, обрабатывают 30 минут 5-процентным раствором
формалина, промывают проточной водой, золотят в 1-процентном
растворе гипосульфита, промывают водой, заключают в бальзам.
Рецепт аммиачного серебра: к 10 см3 10-процентного раствора
азотнокислого серебра прибавляют 20 капель 40-процентного рас-
твора едкого натрия, добавляют по каплям аммиак до растворе-
ния осадка и доводят дистиллированной водой общий объем до
80 см3; фильтруют.
Импрегнация по В ал ьгре ну позволяет серебрить
тончайшие соединительнотканные фибриллы.
1. Фиксация материала 5—9 часов в смеси: 1-процентный вод-
ный нитрат-уран — 100 см3, формалин — 20 см3. 2. Сполоснуть в
дистиллированной воде 1—2 минуты и перенести в 1-процентное
азотнокислое серебро на 24—48 часов. 3. Быстро сполоснуть
дистиллированной водой и восстанавливать серебро 12—24 часа
в смеси: пирогалловой кислоты — 1г, формалина 5-процентного—
100 см3. 4. Промыть в дистиллированной воде и через спирты и
хлороформ залить в парафин. Наклеенные и освобожденные от
парафина срезы обработать до исчезновения их коричневой окра-
ски в следующей смеси: перманганата — 0,5 г, концентрированной
серной кислоты—1 см3, дистиллированной воды— 1000 см3.
5. Затем продержать несколько минут в 1-процентной щавелевой
кислоте. Сполоснуть срезы дистиллированной водой, позолотить их
и т. д., как в оригинальном методе Бильшовского. Можно докра-
сить ядра квасцовым кармином.
Метод Снесарева1 на аргентофильные (решет-
1 Методы выявления аргентофильных волокон, так же как и другие ме-
тоды проф. Снесарева, даны согласно оригинальной прописн автора,
336
атые и др.) волокна. 1. Фиксировать в формалине; при
[спользоваиии старого материала, дофиксировать его в
4—20-процентном формалине (лучше в нейтральном). 2. Дли-
-ельно отмывать формалин в проточной воде (от получаса до
;уток). 3. Заключить в 12,5-процентную карболовую желатину, а
через ночь или в тот же день—в 25-процентную желатину1.
4. Вырезать кусочки и дополнительно фиксировать в 5—10-про-
центиом формалине (на этой стадии можно длительно сохранять
кусочки). 5. Быстро промыть в водей резать на замораживаю-
щем микротоме: срезы помещать в дистиллированную воду. 6. По-
местить срезы на 2 суток в 4-процентный раствор железных
квасцов (брать невыветрившиеся кристаллы, жидкость фильтро-
вать). 7. Сполоснуть дважды дистиллированной водой. 8. На сут-
ки поместить в 10-процентный (или 5-процентный) раствор
азотнокислого серебра; работать с химически чистой посудой,
обязательно мыть ее кислотой (технической серной); срезы пере-
нести изогнутой стеклянной палочкой; если нужен шпатель, упот-
реблять только роговой. 9. Далее срез проводить через аммиачное
серебро: быстро промыть дистиллированной водой, поместить в
аммиачное серебро (3—5 минут), быстро промыть в дистиллиро-
ванной воде и поместить в 20-процентный формалин. (Способ
приготовления аммиачного серебра приведен при описании метода
Бильшовского). Затем производят золочение среза по Бильшов-
скому. 10. Золочение срезов: помещают срезы в хлорное золото,
затем в 5-процентный гипосульфит 20—30 секунд (счетом), пере-
носят в воду. 11. Наклеивают срез на предметное стекло, смазан-
ное белком-глицерином, если нужно — предварительно расправ-
ляют срез в аммиачной воде. 12. Проводят через ацетон, ксилол,
заключают в бальзам. Перед ксилолом хорошо провести через
карбол-ксилол; Метод допускает различные дополнительные окра-
ски, например, шарлах, пикрофуксин и т. д.
Метод Снесарева для аргентофильных воло-
кон иа п а р а ф и новых срезах. Если уже имеются гото-
вые парафиновые серии материала, фиксированного формалином,
то только что описанный метод можно применить так:
1. Депарафинируют среды, проводят через спирты, помещают
в воду. 2. Можно подержать срезы в 5—10-процентном формали-
не и затем отмыть его в проточной воде (не обязательно). 3. Тща-
тельно промывают в дистиллированной воде. 4. Стекла со срезами
покрывают слоем карболовой желатины, сначала 12,5-процентной,
потом 25-процентиой, для чего их целиком проводят через жидкую
желатину в термостате. 5. Дают желатине затвердеть ровным
слоем. 6. Помещают в формалин (5—10-процентный). 7. Спола-
1 Карболовую желатину -приготовляют, растворяя 25 г желатины на водя-
ной бане (37°) в 100 сла 1-процентного раствора карболовой кислоты (кар-
боловая вода). Для получения 12,5-процентиой желатины разводят одну
часть основного раствора одной частью карболовой воды.
22 Микроскопическая техника
337
скивают в дистиллированной воде; переносят в железные квасцы и
т. д.; через все реактивы срезы проводят на стеклах.
Метод Ачукарро. 1. Материал фиксируют в формалине
(1 часть формалина и 9 частей воды). Делают замороженные сре-
зы толщиной 10—20 и. Непродолжительно промывают их в ди-
стиллированной воде. Можно также употреблять парафиновые
или целлоидиновые срезы с материала, зафиксированного и в дру-
гих жидкостях. Не годны фиксирующие жидкости, содержащие
хромовые соли. 2. Обрабатывают срезы при 50° насыщенным на
холоду таниновым раствором в течение 15 минут или дольше.
3. После охлаждения обмывают срезы в дистиллированииой воде
до тех пор, пока они снова не станут непрозрачными, затем пере-
кладывают их в 20 см3 дистиллированной воды, к которой прибав-
ляют 8—12 капель раствора аммиачного серебра по Бильшовско-
му. В этом растворе срезы становятся коричневыми. В растворе
серебра необходимо срезы осторожно передвигать стеклянной
палочкой. Степень необходимого окрашивания различна для раз-
личных органов. 4. Затем срезы непосредственно переносят в
раствор формалина 1:9. 5. Промывают их в воде, докрашивают
протоплазму и ядра (фуксином, эозином, метилен-азуром), прово-
дят через восходящий ряд спиртов, ксилол, заключают в бальзам.
При правильном применении этого метода даже тончайшие
волокна окрашиваются в темно-коричневый цвет.
Модификация метода Ачукарро поДель-Ри'о-
Г ортега. Рио-Гортега предложил целый ряд модификаций ме-
тода Ачукарро, благодаря которым метод применим не только
для выявления соединительной ткани, но и раз-
личных других клеточных и тканевых струк-
тур. Методы Гортега дают хорошие результаты при формалино-
вой и при других фиксациях. Окрашивают так замороженные
срезы, так и иеприклеелные целлоидиновые. Иногда удается окра-
сить также приклеенные парафиновые срезы. Очень существен-
но, чтобы раствор танина .подогревался до температуры 50°.
1-я модификация. Импрегнируются: ядра, центросомы,
пластосомы, клеточные зерна, фибриллы эпителия, миофибриллы,
клеточные включения, волокна глии, фибрин, эластические волок-
на. Неокрашенными остаются — коллагеновые и решетчатые
волокна соединительной ткани.
1. Материал фиксируют 10-процентным формалином не менее
10 дней. 2. Срезы, приготовленные на замораживающем микрото-
ме, из дистиллированной воды кладут на 5 минут в 30-процентный
водный раствор танина (50—55°). 3. Затем срезы переносят в на-
полненную дистиллированной водой стеклянную чашечку с тем-
ным дном. К 20 дм3 дистиллированной воды прибавляют 4 см3 ам-
миака. Срезы, находящиеся в этой жидкости, передвигают
стеклянной палочкой, пока они снова не приобретут гибкость и
прозрачность, легко заметную на темном фоне чашечки. 4. После
этого срезы переносят последовательно в три стеклянные чашеч-
338
ки; каждая наполнена 10 см3 дистиллированной воды и 1 см3 ам-
миачного раствора серебра. Как только срезы в первой чашечке
начинают окрашиваться, их переносят во вторую чашечку; когда
они становятся желтыми, их переносят в третью, в которой жел-
тый тон срезов еще больше усиливается. 5. Затем промывают в ди-
стиллированной воде. 6. Золотят в 0,2-процеитном растворе хлор-
ного золота 20—30 минут при температуре 40—45°. 7. Промывают
в дистиллированной воде. 8. Помещают в 5-процентный раствор
гипосульфита на 1 минуту. 9. Промывают в проточной воде, про-
водят через спирты, ксилол, заключают в бальзам.
2-я модификация. Этим методом выявляются в первую
очередь решетчатые волокна, окрашивающиеся в черный цвет;
коллагеновая соединительная ткань окрашивается в слабо-корич-
невый тон.
1. Фиксировать объект в 10-процентном формалине или про-
должительное время в спирте. Приготовить замороженные срезы;
можно также импрегнировать целлоидиновые срезы (лучше рас-
творить целлойдин перед импрегнацией в эфире — спирте.
2. Срезы поместить на 5 минут в 1-процентный раствор танина
в 96-градусном спирте (при температуре 50—55°). 3. Быстро спо-
лоснуть дистиллированной водой. 4. Срезы последовательно про-
вести через 3 чашечки, наполненные каждая 10 см3 дистиллиро-
ванной воды с 1 см3 раствора аммиачного серебра, как при 1-й
модификации. Когда срез окрасится в бледно-желтый цвет, пере-
ложить его в дистиллированную воду, где и оставить лежать, пока
он не примет более'равномерный темный тон. 5. Быстро промыть
в дистиллированной воде (при плохо импрегнируюшихся препара-
тах всего несколько секунд). 6. Поместить в нейтральный 20-про-
центный формалин примерно на 30 секунд. Интенсивность
импрегнации можно регулировать как быстротой предшествовав-
шей промывки, так и временем пребывания в формалине. 7. Осно-
вательно промыть в воде и далее, как в первой модификации.
3-я модификация. Коллагеновые волокна соединительной
ткани окрашиваются в темно-фиолетовый цвет.
1. Фиксируют в формалине или, лучше, продолжительное вре-
мя в спирте. 2. Замороженные срезы переносят из воды на 5 минут
в 1-процентный спиртовый раствор танина при 50—55°. 3. Быстро
промывают в дистиллированной воде (2—3 секунды). Импрегни-
руют в трех последовательных чашечках как при 1-й модифика-
ции, пока срез не становится коричнево-желтым. 5. Тщательно
промывают. 6. Золотят в 0,2-процентном водном растворе хлорно-
го золота 15 минут (при 40—45°), пока срезы, ие приобретут тем-
но-фиолетовый цвет. 7. Фиксируют в 5-процентном гипосульфите.
8. Тщательно промывают в воде и далее, как обычно. Приготов-
ление раствора аммиачного серебра по Дель-Рио-Гортега: к
30 см3 10-процентного раствора азотнокислого серебра прибавля-
ют 40 капель 40-процентного едкого натра. Выпавший осадок
промывают 10—12 раз дистиллированной водой (в общем исполь-
22* 339
зуют 1—1,5 л воды). Промытый осадок размешивают в 50 см3 ди-
стиллированной воды и к раствору осторожно прибавляют по
каплям аммиак до растворения осадка. Затем добавляют дистил-
лированную воду до 150 см3. Раствор можно длительно хранить
в банке из темного стекла.
Гиалиновый хрящ
Для получения свежих препаратов можно использовать хря-
щевую часть epi- или hyposternum или лопатки лягушки, а также
мечевидный отросток мыши, крысы или морской свинки. Мягкие
ткани, окружающие хрящ, соскабливают скальпелем. Исследуют
гиалиновый хрящ в тканевой жидкости или в физиологическом
растворе поваренной соли. Во избежание испарения препарат сле-
дует покрыть стеклом. Из более крупных кусочков хряща (напри-
мер, от головки бедра лягушки) можно сделать бритвой относи-
тельно тонкие срезы. Иногда рекомендуют (наблюдать такие срезы
в 0,5-процентном растворе квасцов.
Фиксация и окраска см. ниже (эластический хрящ).
Эластический хрящ
Для изучения свежих препаратов используют тонкие срезы
(лучше на замораживающем микротоме) надгортанника или хря-
ща ушной раковины. Для изучения хряща на фиксирован-
ных препаратах в качестве фиксатора применяют смесь
Флемминга, дающую отличные результаты, а также смеси Шаф-
фера, Ценкера или сулему с уксусной кислотой.
Некоторые трудности представляют приклеивание срезов к
предметному стеклу. Для этой цели служит смесь из 2 см3 ацетона
с 1 каплей метнлбензоата и 8 см3 воды; добавляют 2—3 капли
белка с глицерином. Срезы хряща легко образуют складки.
Окрашивание квасцовым гематоксилином, целестиновым
синим или галамиповым синим или смесью Доминичи.
«Четверная» окраска по Н. Н. Румянцеву.
1. Окрасить срез гематоксилином Вейгерта (перекрасить). 2. Про-
мыть дистиллированной водой. 3. Поместить в 2-процентный вод-
ный раствор бисмарк-коричиевого на 2—3 минуты. 4. Промыть ди-
стиллированной водой (иногда приходится дифференцировать в
70-градусном спирте). 5. Окрасить пикро-индигокармином —
10 минут. 6. Провести через 70-, 96-градусный спирт (2 раза сме-
нить) , карбол-ксилол, дамарлак. В 70-градусном спирте удаляется
осадок красителя и одновременно вытягивается пикриновая кисло-
та, поэтому время надо определять для каждого объекта особо.
В результате переходная зона основного вещества хряща
окрашивается в голубой цвет, исключая ближайшее окружение
клеток, основное вещество территорий — в коричневый, межтер-
ритории — в сине-зеленоватый.
Окраска эластического хряща орсеином (см.
стр. 333).
340
Фибриллярные структуры выявляют, фиксируя материал в
спиртовом формалине и обрабатывая ненаклеенные срезы в те-
чение 1—3 часов в 0,5-процентном едком кали; затем срезы снова
кладут на несколько часов в спиртовый формалин и, хорошо про-
мыв, окрашивают пикрофуксииом по Ваи-Гизоиу. Фибриллы окра-
шиваются в ярко-красный цвет. Без предварительных обработок
фибриллярные структуры хорошо выявляются при исследовании
в поляризованном свете.
Кость
Исследование нефиксированного материала
Тонкие кости (например, черепные кости личинок тритона)
непосредственно исследуют в физиологическом растворе поварен-
ной соли. На таких свежих препаратах можно также производить
гистохимические реакции на кальций, калий и т. д. Более толстые
кости распиливают на кружки и, непрерывно смачивая физиоло-
гическим раствором поваренной соли, шлифуют иа тонком точиль-
ном камне.
Для шлифовки пластинку кости прикрепляют столярным кле-
ем к деревянному блоку. Отшлифовав одну сторону, пластинку
переворачивают и снова шлифуют до желаемой толщины. Затем
полируют ее иа матовом стекле.
Хорошим объектом для изучения костных пластинок является
тонкая кость жаберной! крышки рыб; ее можно изучать в неокра-
шенном виде.
Для прижизненного окрашивания растущих кос-
тей животным скармливают крап или ализарин и свежие
распиленные и отшлифованные кусочки кости исследуют в физио-
логическом растворе поваренной соли или, быстро обезвоживая,
заключают их в канадский бальзам.
Извлечение извести (декальцинация)
Чтобы из кости можно было приготовить срезы, из нее следует
извлечь известь. При небольших отложениях извести для ее рас-
творения часто достаточно небольшого содержания кислоты в
фиксирующей жидкости (например, в смеси Буэиа). В большин-
стве случаев, однако, приходится употреблять особые декальци-
нирующие жидкости. Предварительно объект должен быть осно-
вательно уплотнен в 80—90-градусиом спирте. После декальцина-
ции рекомендуется приготовлять целлоидиновые или заморожен-
ные срезы.
Декальцинирующие жидкости
Азотная кислота. 1. После фиксации и уплотнения ма-
териал переносят в 5-процеитиый раствор азотной кислоты (иа
100 см3 дистиллированной воды прибавляют, исходя из удельного
341
веса азотной кислоты, 17 см3 продажной, т. е. 7,5 см3 чистой азот-
ной кислоты) на 8—24 часа. Следует брать большое количество
раствора. При этом объект помещают не непосредственно на дно
сосуда, а подкладывают под него вату, чтобы он со всех сторон
был окружен декальцинирующей жидкостью. Последнюю необхо-
димо чаще встряхивать и иногда сменять. 2. Объект помещают
на 24 часа в 5-процентный раствор квасцов, или углекислого ли-
тия, или, наконец, сернокислого натрия, чтобы предотвратить раз-
бухание соединительной ткани. 3. Промывают в проточной воде
1—2 дня. 4. Заключают в целлоидин или парафин или приготов-
ляют замороженные срезы.
Трихлоруксусная кислота. 1. Объекты фиксируют
и уплотняют в 80—90 градусном спирте. 2. Помещают в 5-процен-
Тную трихлоруксусную кислоту +10% формалина на 1—4 дня,
2—3 раза сменяя и помешивая жидкость (дно сосуда покрывают
ватой). 3. Переносят в 90—96-градусный спирт (воды избегать),
дважды сменяя его, на 6—24 часа. 4. Заливают в парафин или
целлоидин.
Пикриновая кислота в насыщенном водном растворе
декальцинирует кость весьма медленно (иногда несколько меся-
цев) и употребляется только для мелких объектов, эмбриональных
костей и т. п.; из пикриновой кислоты объекты переносят прямо в
80-градусный спирт.
Для нежных и очень маленьких косточек можно использовать
фиксатор Флемминга, оставляя в нем объект 8—10 и бо-
лее дней, затем промывая его проточной водой.
Окраска костной ткани
Хорошие препараты костной ткани удается получить при ок-
раске галлеином. 0,1 г галлеина прибавляют к 100 см3 кипящего
5-процентного раствора алюминиум-хлорида и 15 минут кипятят;
после охлаждения добавляют воды до 100 см3, фильтруют и раз-
водят в 5—10 раз. Время окрашивания 12—24 часа. Четко окра-
шиваются остеоциты, ядра, эластические волокна.
Для дифференцировки обызвествленной и
необызвествленной ткани хорошие результаты дает ни-
жеприводимый метод. 1. Объекты в зависимости от их величины
должны пролежать 8—30 дней в следующей смеси: 1000 см3 5-
процентного формалина +250 см3 мюллеровской жидкости. 2. Де-
кальцинируют в 5-процентной азотной кислоте. 3. Нейтрализуют
кислоту в 5-процентном растворе калийных квасцов (24 часа).
4. Промывают в проточной воде 24—48 часов. 5. Обезвоживают
и заключают в целлоидин. 6. Срезы толщиной в 5—10 н красят
12—18 часов в свежем растворе гансеновского гематоксилина:
1 г гематоксилина растворяют в 10 см,3 абсолютного спирта и сме-
шивают с 200 см3 10-процентных калийных квасцов, прибавляют
3 см.3 раствора перманганата (1 г перманганата разводят в 16 см3
воды) и затем кипятят 1 минуту; по охлаждении фильтруют.
342
7. Дифференцируют сильно окрашенные препараты 5—20 минут в
смеси чистого глицерина и ледяной уксусной кислоты (в равных
частях). 8. Промывают 1 час в проточной воде. 9. Окрашивают
в спиртовом эозине (4 : 1000) 5 минут, затем проводят через 96-
градусный спирт, абсолютный спирт, креозот, канадский бальзам
или через воду, заключают в глицерин.
Содержащие известь части ткани окрашиваются в синий цвет;
не содержащая известь ткань—- в красный.
Для окраски костных клеток и костных ка-
нальцев хорошие результаты дает т и о н и н-ф о с ф о р но-
во л ьфрамовый метод. Тонкие костные пластинки фикси-
руют в формалине, уплотняют 5—8 недель в мюллеровской жид-
кости и декальцинируют их в 7,5-процеитной азотной кислоте. За-
мороженные или целлоидиновые срезы выдерживают 1—2—6 ча-
сов в большом количестве формалина и затем окрашивают 3 ми-
нуты в растворе тионина с прибавлением аммиака (раствор тио-
нина: 1 часть насыщенного раствора тионина в 50-градусном спир-
те + 10 частей дистиллированной воды -f- 1—2 капли аммиака).
После споласкивания водой срезы на 1—2 минуты переносят в
70-градусный спирт, затем споласкивают дистиллированной водой
и недолго дифференцируют насыщенным раствором фосфорномо-
либденовой или лучше фосфорновольфрамовой кислоты. Затем
срезы промывают водой, пока они ие приобретут светло-синий
цвет (5—10 минут), фиксируют в формалине, наполовину разбав-
ленном водой, 1—2 часа или же в разбавленном растворе аммиа-
ка (1 : 10) 5 минут и переносят непосредственно в 90-градусный
спирт, который несколько раз сменяют; затем помещают в абсо-
лютный спирт, ксилол, заливают в бальзам.
Если основное вещество окрашено в чрезмерно темный цвет,
то перед тем как перенести в абсолютный спирт, срезы диффе-
ренцируют в 1-процентном солянокислом спирте и основательно
обмывают их водой и затем заключают, как обычно, в бальзам.
Стенки костных телец с разветвлениями ок-
рашиваются в интенсивно темно-синий цвет; протоплазма и
ядра — в светло-синий; основное вещество — от светло-
синего до красноватого и пурпурно-красного; границы костных
пластинок четко выделяются.
Для изучения костной ткани весьма важен метод сереб-
рения костной' ткани по Д. И. Дейнека.
1. Фиксация 1—3 часа следующей смесью: насыщенный рас-
твор HBAsO3 — 30 см3, 20-процентный формйлин — 30 см3, 96-гра-
дусный спирт — 30 см3, или урановой смесью в течение 2—5 ча-
сов; 1-процентный азотнокислый уран — 80 см3, формалин —
15 см3, 96-градусный спирт — 30 см3 или 10-процентным форма-
лином 24 часа. 2. 1—2-процентное азотнокислое серебро — 24 ча-
са. 3. Дистиллированная вода — сполоснуть (2—3 минуты).
4. Восстановление серебра в следующей смеси (24 часа); гидрохи-
нон— 2 г, Na2SOa — 0,5 г, формалин — 5 см3, вода—100 см3.
343
5. Препараты проводят в течение 24 часов через спирты возрастаю-
щей крепости до 100°, а затем через спирты убывающей крепости
в течение 5—6 часов. 6. 1-процентный НС1 1—3 дня. 7. Препара-
ты проводят через спирты возрастающей крепости в течение 24
часов. 8. Спирт-|-эфир 1—2 дня. Заключают в 6-процентный цел-
лоидин; изготовляют срезы толщиной в 10—15 н. 9. Дистиллиро-
ванная вода 20—30 минут. 10. Срезы обрабатывают виражем в те-
чение 3—10 минут: 3% Na2S2O3 — 90 см3, NH4CNS— 3 г, 1 %
АнС12— 10 с.И’1. 11. Дистиллированная вода 30—40 мин. 12. Ос-
тавляют в смеси на 2—10 мин.: КМпО4—1—2 кристалла,
H2SO4— 1—2 капли, дистиллированная вода— 10 см3. 13. 1-про-
центная щавелевая кислота — 1—2 мин. 14. Дистиллированная во-
да: 1 —10 мин. 15. Окраска квасцовым кармином или можно ис-
пользовать различные многоцветные методы. 16. Спирт, ксилол,
бальзам.
Для изучения структуры кости (гаверсовы систе-
мы и т. д.) Ясвоин рекомендует замороженные срезы декальцини-
рованной кости подкрасить слабым раствором пикриновой кисло-
ты, промыть в воде и заключить под покровным стеклом в смеси
из 1 части глицерина и 5 частей 0,5-процентного формалина (гли-
церин слишком сильно просветляет кость). Края покровного стек-
ла обводят асфальтовым лаком или менделеевской замазкой.
Для выявления фибриллярных структур — кость
фиксируют формалином, декальцинируют и затем серебрят по
Бильшовскому. Хорошие результаты дает также азановый метод,
особенно на материале от новорожденных и молодых животных.
Волокна Шарпея можно импрегнировать по Бильшов-
скому или по Ачукарро.
Для изучения развивающейся кости фиксируют
трубчатую кость эмбрионов млекопитающих, например, кролика,
в жидкости Гелли, Буэна или в фиксаторах, содержащих трихлор-
уксусную кислоту. Декальцинируют в азотной или трихлоруксус-
иой кислоте. Для цитологических исследований маленькие кусоч-
ки кости фиксируют в смеси Флемминга. Препараты окрашивают
квасцовым гематоксилином.
Можно окрашивать их железным гематоксилином и дифферен-
цировать 5-процентной фосфорновольфрамовой кислотой, в кото-
рой основное вещество хряща и коллагеновая ткань принимают
красный цвет; затем срезы переносят непосредственно в абсолют-
ный спирт, многократно его сменяя; проводят через ксилол, за-
ключают в бальзам.
Зубы
Для исследования зубов применяются те же методы, что и при
исследовании кости. Можно приготовлять шлифы. Декальцинация
азотной кислотой может продолжаться от одного до нескольких
дней. Заливают в целлоидин, окрашивают обычными методами.
Для изучения различных стадий развития зуба фиксируют
нижнюю челюсть эмбрионов овцы или свиньи в «сузе», в жидко-
344
сти Буэна или Ценкера. После фиксации в «сузе» или в жидкости
Буэна материал декальцинируют в трихлоруксусной кислоте или
в азотной кислоте. Заливают в целлоидин.
Кровь
Для прижизненного наблюдения клеток крови на предметное
стекло наносят капли крови, накрывают покровным стеклом и ос-
торожно замазывают края парафином. Кровь теплокровных над»
рассматривать на нагревательном столике. Из зернистых лейко-
цитов особенно четко видны эозинофилы, благодаря их крупным н
блестящим зернистым включениям. Можно наблюдать движение,
крайне медленное у лимфоцитов и более интенсивное у моноцитов
и зернистых лейкоцитов. Для прижизненного наблюдения полезно
применение темного поля, в Котором можно наблюдать хорошо
видное движение зерен у нейтрофилов. Отлично видны в темном
поле кровепаразиты, трипаносомы и спирохеты. Общие сведения
о прижизненной окраске клеток крови см. ниже.
Для наблюдения живых клеток можно поль-
зоваться следующим методом.
Приготовляют очень тонкие микротомные срезы из высушенной
сердцевины бузины, стерилизуют их кипячением в дистиллирован-
ной воде и затем высушивают. При исследовании кладут такую
пластинку на стерильное покровное стекло, наносят на нее кровь
и каплей вниз кладут иа предметное стекло с углублением, края
которого покрыты вазелином. При этом капля крови надолго пре-
дохраняется от высыхания. В зависимости от целей эксперимента
можно предварительно пропитывать пластинку бузины растворам»
различных реактивов, красителей и т. д. Пластинку с кровью мож-
но фиксировать и заливать в парафин.
Чтобы получить материал для наблюдения псевдоподий
лейкоцитов, в спинной лимфатической мешок лягушки вво-
дят на несколько часов тонкую пластинку сердцевины бузины.
Лейкоциты в большом количестве заполняют эту пластинку. Ее вы-
нимают н производят прижизненные наблюдения клеток или фик-
сируют и заливают в парафин для приготовления срезов. Можно
также вводить в спинной лимфатический мейгок лягушки 0,5 см3
стерильной и относительно густой суспензии угля; через 1—2 дня в
лимфатическом мешке наблюдается большое скопление лейкоци-
тов. В качестве объекта можно использовать также гемолимфу
речного рака.
Для наблюдения псевдоподий лейкоцитов лучше всего пользо-
ваться темным полем.
Прижизненная окраска крови —нейтральным крас-
ным и янусовым зеленым.
Для изучения способности клеток крови накапливать красители
употребляют литиевый кармин, который инъицируют в ве-
ну (в зависимости от величины подопытного животного 5—10 см''
концентрированного раствора красителя) и затем исследуют пери-
345
сферическую кровь и соответствующие органы животного. Изати-
новый синий инъицируют в виде 1-процентного раствора (по
1 см3 на 20 г веса животного); обычно делают повторные инъекции
через 5—6 дней. С фиксированных в формалине органов делают
срезы на замораживающем микротоме и наблюдают накопление
красителя в некоторых мопонуклеарах и ретикуло-эндотелиаль-
ных клетках.
Для суправитальной окраски употребляют яркий
крезиловый синий, метиловый фиолетовый и другие красители.
При окраске ярким крезиловым синим — на подогре-
тое предметное или покровное стекло наносят каплю насыщенного
(в 80-градусном спирте) раствора красителя и быстро ее размазы-
вают другим предметным стеклом так, чтобы получился тонкий и
ровный синеватый слой. Такие стекла с нанесенным красителем
могут длительно сохраняться. Затем на покрытом красителем
стекле делают обычным способом влажный мазок крови и стекло
тотчас же помещают во влажную камеру (например, бактериоло-
гическую чашку, где по окружности положен слой влажной фильт-
ровальной бумаги).
Препарат оставляют во влажной камере 3—5 минут, затем вы-
нимают и дают подсохнуть на воздухе. Препарат изучают с иммер-
сией; зернисто-ниточная субстанция эритроцитов окрашена в си-
ний цвет.
Окраска телец Гейнца метиловым фиолето-
вым. К. капле крови на предметном стекле прибавляют каплю
1-процентного метилового фиолетового (в 0,6-процентном раство-
ре поваренной соли), покрывают покровным стеклом и сохраняют
некоторое время во влажной камере.
Тельца Гейнца бывают видны в виде темно-фиолетовых зерен.
Появление телец Гейнца вызывается отравлением кровяными яда-
ми (нитробензол, бертолетова соль, анилин, мышьяковистый во-
дород) .
Для изучения скелетных нитей эритроцитов амфибий
(саламандра) к свежей капле крови прибавляют немного раство-
ра генцианового фиолетового (0,25 г красителя в 100 см3 физио-
логического раствора поваренной соли.
Фиксация крови
Для изучения клеток крови на срезах органов в качестве фик-
саторов употребляют: смесь Гелли, смесь Ценкера, смесь Макси-
мова, пикриновую кислоту с сулемой (концентрированный раствор
пикриновой кислоты + концентрированный водный раствор суле-
мы 1 : 1).
Изготовление мазков (стр. 132).
Мазки крови фиксируют метиловым спиртом или
смесью абсолютного спирта и эфира 1:1. Можно пользоваться
парами осмиевой кислоты, для чего покровное стеклышко мазком
вниз кладут на 30—60 секунд на горлышко банки с 2-процентиой
.346
осмиевой кислотой. Можно также фиксировать мазки 1—2 минуты
парами смеси равных частей осмиевой кислоты, иода и формалина.
Хорошая фиксация клеток крови получается, если чистое покров-
ное стекло подвергнуть в течение 2 минут предварительному воз-
действию паров осмиевой кислоты, затем тотчас же нанести на не-
го каплю крови и еще влажный мазок снова дофиксировать пара-
ми осмиевой кислоты 30—60 секунд.
Для фиксации очень легко изменяющихся кровяных бля-
шек поступают так: на кожу предварительно наносят каплю
1-процентной осмиевой кислоты и затем производят укол; таким
образом, кровь сразу поступает в осмиевую кислоту, не соприка-
саясь с воздухом. Затем смесь осмиевой кислоты и крови снимают
покровным стеклышком и на нем же делают мазок.
Окраска клеток крови
При окраске методами Романовского, Паппенгейма, Май-
Грюнвальда особое внимание надо обратить на химическую чи-
стоту употребляемых реактивов и красителей, на качество дистил-
лированной воды, на чистоту стеклянной посуды, обязательно
предварительно выщелоченной. Только при соблюдении всех этих
условий можно достигнуть должных красочных эффектов в окрас-
ке различных кровяных клеток и их зернистостей.
Метод Романовского является основным методом пр.и
изучении клеток крови. 1. Фиксируют свежие влажные или подсу-
шенные мазки в метиловом спирте 2—3 минуты или в смеси эфи-
ра и абсолютного спирта 20 минут. 2. Красят 20—30 минут в све-
жеприготовленном растворе красителя (1 капля основного раст-
вора на 1 см3 дистиллированной воды).
Эффективность окраски в высокой мере зависит от pH ди-
стиллированной воды. Оптимальная реакция лежит при pH —
6,8—7,0. Для получения необходимой реакции можно
пользоваться буферными фосфатными растворами, разводя их
в 10—20 раз дистиллированной водой.
Растворы Романовского, как правило, снабжаются указани-
ями оптимальной реакции воды для каждой серии красителя.
Если нет буферных растворов, то пригодность воды можно
проверить при помощи 1-процентного раствора нейтрального
красного, каплю ко'торого прибавляют к 200 см3 испытуемой
воды.
Если вода нейтральная или кислая, она розовеет. Для полу-
чения нужной слабо щелочной реакции прибавляют по каплям
1-процснтиый раствор углекислой соды. После каждой капли
колбочку с водой встряхивают и следят за исчезновением
в ней розового окрашивания. Розовый тон должен совершенно
исчезнуть или же вернуться не ранее 3 мннут после прибавления
последней капли соды. Обычно к 150—200 см3 дистиллированной
воды приходится прибавить 3—4 капли раствора соды. 3. Мазки
споласкивают дистиллированной водой и осушают фильтроваль-
347
ной бумагой. 4. Заключают в нейтральный бальзам или кедровое
масло.
Ядра - фиолетово-красные, нейтрофильные гранулы —
красно-фиолетовые; базофильные зерна — синие или сине-фио-
летовые; эозинофильные зерна — ярко-розовые; протоплазма
лимфоцитов — синяя с пурпурно-красными зернышками; эритро-
циты— бледно-розовые; кровяные пластинки—синие.
Д. Л. Романовский указал, что для успешной окраски по его
методу надо применять только старые водные растворы метиле-
нового синего. Позднее Унна, Нохт, Гимза показали, что харак-
терный эффект окрашивания при методе Д. Л. Романовского
обусловливается продуктами окисления метиленового синего,
образующимися не только при длительном стоянии раствора
этого красителя на воздухе, но и при добавлении к нему не-
большого количества щелочи. Гимза разработал способ
промышленного получения продуктов окисления метиленового
синего, названных им «азур I». В настоящее время краситель по
Романовскому в модификации по Гимза готовится из эозина
и «азура II» (представляющего смесь равных частей «азур I»
и метиленового синего). В результате готовый раствор красителя
по Романовскому-Гимза представляет собой смесь равных частей
эозината «азура I» и метиленового синего, растворенных в смеси
химически чистого глицерина и метилового спирта.
Окраска по Ма й-Г рюнвальду. На подсушенные
свежие мазки крови наливают неразведенный раствор красителя
Май-Грюнвальда (раствор эозината метиленового синего в мети-
ловом спирте — пользуются готовой продажной смесью). Красят
3—5 минут, затем добавляют равное количество дистиллирован-
ной воды и оставляют еще на 5—10 минут (препарат принимает
розовый оттенок), затем сливают краситель, препарат быстро
споласкивают дистиллированной водой и осторожно осушают
фильтровальной бумагой.
Ядра — синие; эозинофильные зерна — кирпично-красные:
базофильные зерна—темно-синие; нейтрофильные — светло- или
пурпурно-красные; кровяные пластинки — бледио-синие; эритро-
циты — светло-красные.
Для окраски мазков крови служит нейтральная смесь (трна-
цид) Эрлиха, состоящая из метилового зеленого, кислого
фуксина и оранжа G. Пользуются покупкой готовой смесью, так
как изготовление ее требует большого опыта и трудно удается.
Окраска триацидом Эрлиха хорошо удается на мазках, фиксиро-
ванных сухим жаром, для чего предметное стекло осторожно
(не перегреть!) проводится три раза над пламенем бунзеновской
или спиртовой горелки. Мазки окрашивают 5—10 минут, наливая
краситель на стекло. Споласкивают их водой, пока не перестанет
отходить краситель; затем осторожно осушивают фильтроваль-
ной бумагой. Заключают в бальзам.
348
Ядра окрашиваются в голубовато-зеленый цвет, нейтрофиль-
ные зерна—в красновато-фиолетовый цвет, эозинофильные
зерна — в ярко-красный; в остальных кровяных тельцах
зернистость не выявляется.
Для окраски влажных мазков, а также окраски кровяных
клеток на срезах и для изучения процессов гистогенеза кровяных
элементов, следует использовать так называемые «в л а ж и ы е
методы» по Романовскому, по Паппенгейму или азурэози-
новый м ето д по Максимову (см. ниже).
Окраска крови и кровепаразитов по Г. Эп-
штейн у. Готовят два раствора.
I. Дистиллированная вода—100 см3, лимоннокислый ли-
тий — 1 г, толуидиновый синий — 1 г. После приготовления
раствор фильтруют.
II. Насыщенный водный раствор пикриновой кислоты.
1. Красят мазки 20—30 минут в I растворе. 2. Споласкивают
в проточной воде. 3. Помещают на 1—2 секунды в насыщенный
водный раствор пикриновой кислоты (II раствор). 4. Споласки-
вают в проточной воде (избегать подогревания). 5. Быстро обсу-
шивают фильтровальной бумагой.
Результаты окраски. Эритроциты — зеленые; ядра лейкоци-
тов — фиолетово-синие; базофильные зерна — вишневые; эози-
нофильные зерна—изумрудно-зеленые; нейтрофильные зерна --
серые.
Кровепаразиты: ядро — красное, цитоплазма — синяя.
Окраска азур-эозином по способу Максимова
(после фиксации в смеси Максимова).
1. Мазки крови или срезки с кроветворныхорганов промывают
в чистой дистиллированной воде. 2. Окрашивают азур-эозином
(следить, чтобы краситель не выпадал) 6—24 часа. 3. Дифферен-
цируют в 96-градусном спирте, пока не достигнут красного окра-
шивания соединительной ткани и эритроцитов. 4. Проводят через
абсолютный спирт Ч?—1 минуту. 5. Ксилол (три раза сменяют),
нейтральный канадский бальзам или цедакс.
Протоплазма кровяных клеток окрашивается в синий цвет; яд-
ро— в синий, иногда с розовыми оксифильными включениями;
гемоглобин — в красный; ацидофильная зернистость — в ярко-
красный; соединительная ткань — в нежно-розовый цвет.
Необходимо следить за качеством дистиллированной воды, со-
ответствующий pH которой поддерживается указанным на
стр. 349 способом.
Окраска мазков или срезов «влажным мето-
дом» по Романовскому. 1. Объект из дистиллированной
воды переносят в свежеприготовленный раствор (1 капля продаж-
ного красителя на 1 см3 дистиллированной воды) 2— 12 часов.
2. Споласкивают в дистиллированной воде. 3. Проводят через
ацетон 95 см3 ксилол 5 см3. 4. Ацетон 70 см,3 4- ксилол 30 см3.
5. Ацетон 30 см3 + ксилол 70 «г. Чистый ксилол. 7. Заключают
349
в кедровое масло, или нейтральный канадский бальзам. Дистилли-
рованная вода и ацетон должны быть чистыми, свободными от
кислот. В ацетоне не должно быть метилового спирта. Результаты
те же, что и после окраски подсушенных мазков. Фиксация смеся-
ми Максимова, Гелли, Ценкера.
В том случае, если материал был фиксирован формалином,
Вайль рекомендует для окраски срезов jio Романовскому предва-
рительно их хромировать и обрабатывать сулемой. 1. Фиксируют
20-процентным формолом 1—2 суток. 2. Изготовляют срезы тол-
щиной 10 и на замораживающем микротоме. 3. Переносят срезы
на 2 сутов в 5-процентный раствор двухромовокислого калия.
4. Промывают в воде и обезжиривают (70-, 96-градусный, абсо-
лютный спирт, хлороформ—10 минут, абсолютный спирт, 96-,
70-градусный, вода). 5. Споласкивают в дистиллированной воде
и кладут на 3 часа в 1-процентный раствор сулемы. 6. Споласки-
вают дистиллированной водой, затем проточной водой, просушива-
ют фильтровальной бумагой. 7. Переносят в раствор красителя
(1 */2 капли на 1 см? дистиллированной воды), в термостате при
37° от одного до нескольких часов. 8. Споласкивают водой и диф-
ференцируют под контролем микроскопа в 70-градусном спирте.
9. Быстро обезвоживают, проводят через ксилол, заключают в
бальзам.
Вайль указывает, что получаются элективно окрашенные пре-
параты, только не всегда .хорошо выявляется зернистость кровя-
ных клеток.
Для окраски клеток костного мозга применяют азур-
эозии, метод Доминичи, влажный метод по Романовскому, метило-
вый зеленый — пиронин по Унна.
Их можно также фиксировать смесью Ценкера с формалином,
окрашивать «триацидом» в течение 5 минут, быстро споласкивать
дистиллированной водой и красить 10 секунд в 0,5-процентном
водном растворе толуидинового синего, затем сполоснуть водой,
поместить в 96-градусный спирт и обычным способом заключить
в бальзам.
Для окраски мегакариоцитов и кровяных бля-
шек пользуются методом Романовского после фиксации материа-
ла в следующей смеси: формалин 10 см3 + насыщенный раствор
сулемы (в 0,9-процентном растворе поваренной соли) 90 см3.
Для окраски тучных клеток пригоден метод Домини-
чи или п о л и х р о м н о г о с и н е го по Унна.
Для окраски плазматических клеток пользуются
окрашиванием метиловым зеленым — пиронином по
Унна.
Для дифференцированной окраски эритоцитов можно исполь-
зовать следующий метод.
1. Материал фиксируют формалином, заливают в парафин.
2. Срезы помещают в 10-процентный раствор фосфорномолибде-
новой кислоты на '/а — 2 минуты. 3. Споласкивают водой и красят
350
1—24 часа в смеси: 100 см3 насыщенного водного раствора ализа-
рин-сернокислого натрия и 30 см3 10-процентной фосфорномолиб-
деновой кислоты. 4. Споласкивают в воде, проводят через спирты,,
ксилол, заключают в бальзам.
Эритроциты — темно-синие.
Окраска фуксинофильной зернистости цитоплазмы
кровяных клеток
1. Влажный мазок крови фиксируют 1—2 часа смесью форма-
лина и мюллеровской жидкости (1 : 9), промывают несколько ми-
нут проточной водой и затем споласкивают дистиллированной во-
дой. 2. Мазок помещают на полчаса (в темноте) в 1-процентную
осмиевую кислоту, после чего быстро промывают водой. 3. На стек-
ло наливают раствор кислого фуксина (20 г кислого фуксина рас-
творяют в 100 см3 насыщенного, на холоду фильтрованного рас-
твора аналина в дистиллированной воде, затем фильтруют) и на-
гревают 5—6 раз над пламенем горелки, каждый раз до появле-
ния паров. 4. Дифференцируют в растворе, состоящем из одной
части насыщенного раствора пикриновой кислоты и семи частей
20-градусного спирта; препарат должен стать желтым. 5. Прово-
дят через абсолютный спирт, ксилол, заключают в бальзам.
Е. И. Фрейфельд модифицировала этот метод, фиксируя
препараты до 1 часа в 1-процентной осмиевой кислоте и применяя
слабое нагревание мазков крови (на покровных стеклах) над не-
большим пламенем спиртовой горелки в течение 15—20 минут,
причем препарат многократно подогревается, но пары не должны
появляться.
При такой технике фуксинофильная зернистость
характера митохондрий обнаруживается в лимфоци-
тах, моноцитах, миэлобластахи очень молодых эри-
троцитах.
Для выявления митохондрий в клетках крови лучше всего поль-
зоваться методами Рего или Бенда — Икеда.
Оксидазная реакция элементов крови
Применяется метод, описанный на стр. 261. Препарат докра-
шивают сильно разведенным фуксином Циля (стр. 197). В интен-
сивно синий цвет окрашиваются гранулы нейтрофильных, эозино-
фильных и псевдо-эозннофильных лейкоцитов крови и костного
мозга.
Лимфоциты, лимфобласты и плазматические клетки, как пра-
вило, не дают синего окрашивания. Поэтому описанный метод мо-
жет служить для дифференциальной диагностики лимфоидных и
миэлоидных клеток.
Пероксидазная реакция элементов крови
Хорошие результаты дает способ Г. В. Эпштейна (см.
стр. 266).
351
При этом зернистость нейтрофилов, эозинофилов и мононукле-
аров, дающая пероксидазную реакцию, окрашивается в ярко-зе-
леный цвет, эритроциты — зеленоватые.
Для выявления пероксидаз в клетках крови приготовляют рас-
твор: спирт — 100 см3; нитропруссид натрия — 0,05 г; бедзидин —
0,05 г; основной фуксин — 0,05 г; перекись водорода — 0,5 см3.
Мазок красят одну минуту, затем раствор разбавляют вдвое
водой и красят еще 3—5 минут, споласкивают водой, дают под-
сохнуть и изучают с иммерсией. Оксидазные гранулы синие.
Окрашивание липоидных включений
Для окраски липоидных включений в клетках крови
используют м ет о д Гольдмана (см. стр. 257).
Окрашивание фибрина
Для этой цепи используют метод Вейгерта (стр. 293).
Мускульная ткань
Прижизненные наблюдения над мускульной тканью
Прижизненное наблюдение гладких мускульных клеток отно-
сительно легко удается на мочевом пузыре лягушки или тритона.
Для прижизненного наблюдения поперечнополосатых мускуль-
ных волокон лезвием безопасной бритвы делают тонкие срезы ку-
сочка скелетной мышцы. Следует помнить, что при длительном со-
держании материала в физиологическом растворе поваренной со-
ли (более часа) поперечнополосатая нсчерченность исчезает. Ее
можно наблюдать только на совершенно свежих препаратах и при
сильном затемнении диафрагмы микроскопа.
Миофибриллы поперечнополосатых мышц можно выде-
лить, осторожно расщипывая иглами мускулатуру крыльев насе-
комых (0,5-процеитный физиологический раствор поваренной со-
ли). Очень хорошим объектом для прижизненного наблюдения яв-
ляется поперечнополосатая мускулатура на отпрепарированных
кусочках Entomostraca или непосредственно мелкие ракообраз-
ные. Здесь можно применить темное поле, фазово-контрастный и
поляризационный микроскопы. Пользуясь последним, можно на-
блюдать изменения изотропного и анизотропного вещества фиб-
рилл во время работы мышц. Хорошим объектом для прижизнен-
ного наблюдения строения и процессов сокращения мускулов яв-
ляются личинки Corethra.
Прижизненное наблюдение фибрилл в гладких мус-
кульных клетках плохо удается, вероятно вследствие то-
го, что разность показателей преломления фибрилл и окружаю-
щей их цитоплазмы относительно невелика. Хорошим объектом
для прижизненного изучения гладких мускульных клеток являют-
ся кусочки замыкательной мышцы Anodonta или Unlo.
352
Для выявления ядер в гладких и поперечнополосатых
свежих кусочках мускульной ткани их помещают в 1-процентную
уксусную кислоту или метиловый зеленый с уксусной кислотой
(стр. 198).
Прижизненная окраска — см. стр. 71.
Суправитальная окраска: на свежий препарат на-
носят 1—2 капли 0,1-процентного раствора крезилового прочного
фиолетового в дистиллированной воде (перед употреблением
фильтруют; при появлении красного окрашивания мышечных во-
локон препарат покрывают покровным стеклом.
Ядра окрашиваются в красный цвет, саркоплазма — в фио-
летовый, промежуточные зерна — в темно-синий цвет. Соедини-
тельная ткань не окрашивается.
Мацерация мускульной ткани
Для гладких мускульных волокон употребляется спирт в треть
(см. стр. 326) (24 часа) или 33-процентный едкий кали (60 —
90 минут). Маленькие кусочки гладкой мускульной ткани можно
мацерировать ПО' методу, предложенному для скелетной мускула-
туры. Фиксируют материал (например, кусок желудка кошки) в
90-градусном спирте, содержащем 2,5% салициловой кислоты. Че-
рез несколько дней материал кипятят в 0,25-процентной салици-
ловой кислоте в течение 1—2 часов, дают остыть и в этом же
растворе сохраняют несколько недель, затем переносят в 10-гра-
дусный спирт, в котором хранят неограниченное время. Малень-
кие кусочки, перенесенные в воду, при встряхивании легко распа-
даются на отдельные клетки, которые затем легко можно докра-
шивать по желанию.
Для мацерации поперечнополосатой му-
скульной ткани маленькие кусочки ткани помещают в 5-
процентный раствор сернистой кислоты на 1—8 дней, промывают в
дистиллированной воде и затем кусочки ткани, находящиеся в ди-
стиллированной воде, раза 3—4 последовательно кипятят и осту-
жают. После этого осторожным встряхиванием изолируют отдель-
ные мускульные тяжи.
Иногда мацерируют маленькие кусочки мускульной ткани 2—
4 недели р 2 .^-процентной салициловой кислоте (в 80-градусном
спирте), г,рДСДвают 24 часа в проточной воде, кипятят 1—2 часа
в воде, помещают в 10-градусный спирт и затем проводят через
спирты и ксилол в бальзам, где осторожно расщипывают ткань.
Для получения изолированных волокон Пуркинье тон-
кие пластинки (0,5 мм) сердца с эндокардом кладут в спирт в
треть на 24 часа, после чего осторожно расщипывают иглами. Изо-
лированные волокна Пуркинье можно докрасить кармином и за-
ключить в глицерин.
Отличные результаты дает мацерация в насыщенном
растворе борной кислоты по Гудричу (1943). Борную
23 Микроскопическая техника
353
кислоту растворяют в 0,75-процентном растворе поваренной соли.
Перед употреблением к 25 сж3 раствора борной кислоты прибав-
ляют по две капли раствора Люголя. Длительность мацерации —
1—3 дня. Затем изолированные клетки можно докрашивать, вводя
под покровное стекло каплю метиленового синего или толуидино-
вого синего.
Метод Гудрича дает отличные результаты и может быть широ-
ко применен для различных тканей как позвоночных, так и бес-
позвоночных животных.
Фиксация мускульной ткани
Лучшие фиксаторы для мускульной ткани: смеси Флемминга,
Мевеса, Шаффера, «Суза».
Некоторые авторы рекомендуют фиксировать мышцы не сразу,
а после препарирования оставить на несколько часов в закрытой
чашке, обернув их тонкой тряпочкой, смоченной физиологическим
раствором поваренной соли. После этого мышцы натягивают при
помощи игл на пробку и фиксируют.
Окрашивание мускульной ткани
Квасцовый гематоксилин-эозин, гематоксилин по Маллори,
железный гематоксилин, метод Ван-Гизона, азановый способ ок-
раски, метод Бенда — Икеда.
Галами новый синий дает хорошую окраску как глад-
ких, так и поперечнополосатых мускульных клеток. Растворяют
0,1 г красителя при кипячении в 100 см3 воды, фильтруют. Не пе-
рекрашивать, контроль под микроскопом.
Кислый ализариновый синий дает очень хорошее
окрашивание гладкой и поперечнополосатой ткани.
Иногда м и о ф и б р п л л ы поперечнополосатой мускулату-
ры полезно окрашивать по следующему методу. Растворяют 6 г
медных квасцов в 100 см3 горячей дистиллированной воды, при-
бавляют 0,5 г кармина и кипятят 15 минут; после охлаждения
фильтруют. Срезы красят прогрессивно 1—12 часов, промывают
30 минут в дистиллированной воде и, как обычно, заключают в
бальзам. —
Для окраски волокон Пуркинье применяют методьгЬян-Гизона
или Пачвни.
Импрегнация. Способ Бильшовского — Мареша; способ
Дель-Рио-Гортега, первая модификация.
Нервная система
Для изучения общего строения нервной ткани фиксируют фор-
малином или жидкостью Буэна, окрашивают квасцовым гемато-
ксилином и эозином.
354
Часто забывают, что прижизненное изучение нерв-
ных клеток вполне доступно на целом ряде объектов, как это
показали Б. В. Кедровский и П. И. Живаго в отношении мелких
прозрачных беспозвоночных (например, Corethra, мелкие ракооб-
разные) или, как это описано Б. И. Лаврентьевым и П. В. Макаро-
вым, в отношении нервных клеток сердца (применение метода Гра-
меницкого); Наконец, целый ряд витальных наблюдений над нерв-
ными клетками можно провести, применяя метод культуры ткани
(Серебряков. Лазаренко, Сутулов, Хлопни).
Центральная нервная система
Для изолирования отдельных нервных кле-
ток употребляют: 1) спирт в треть, в который материал поме-
щают на 1—2 недели, 2) водный раствор хромовой кислоты
(1 : 5000),—-в котором мацерируют 3—7 дней, 3) 0,1-процентный
раствор двухромовокислого калия, в котором мацерируют 2 и бо-
лее недели, 4) 0,1-процентная осмиевая кислота, в которую кладут
материал на 24—48 часов. Обычно для изолирования отдельных
ганглиозных клеток вырезают небольшой кусочек из области пе-
редних рогов спинного мозга (лошадь, кошка), кладут его на ма-
церирующую жидкость и затем, встряхивая и осторожно расщи-
пывая иглами, отделяют ганглиозные клетки. Рассматривают в
воде или глицерине; клетки можно слегка покрасить кислым фук-
сином.
Хорошая мацерация достигается в том случае, если кусочки
нервной ткани положить на 2—3 дня в 0,2-процентный раствор
формалина в физиологическом растворе поваренной соли; изоли-
рованные нервные клетки можно затем докрашивать пикро-
кармином.
Методы импрегнации и окраски нервных клеток
Метод Б. И. Лаврентьева имеет важное значение для
выявления нервных элементов в различных тка-
нях. Для этой цели материал (различные органы, куски мышц,
кишечника, желудка и т. д.) фиксируют в жидкости АФА, состоя-
щей из следующих составных частей: 96-градусный спирт, ней-
тральный формол, насыщенный раствор мышьяковистой кислоты.
Смесь приготовляют из равных частей указанных растворов.
Примечания. 1. Формол нейтрализуют следующим способом. К 40-
процентному формальдегиду (продажный формалин) прибавляют углекислую
магнезию из расчета 20 г на 100 см3 формалина; раствор многократно взбал-
тывают и оставляют для нейтрализации формалина на 1—2 часа, после чего
вновь взбалтывают и фильтруют. 2. Мышьяковистая кислота, как известно,
плохо растворима (на холоду растворяется едва 1% и то медленно), поэтому
необходимо раствор мышьяковистой кислоты приготовлять заблаговременно
(за педелю) или же ставить раствор на 2—3 дня в термостат при 37°.
1. Кусочки органов фиксируют в жидкости АФА в течение 1 ча-
са, после чего без промывки переносят в 20-процеитный нейтраль-
23*
355
At формалин (формалин нейтрализуют так же, как сказано вы-
|®е). В нем они могут лежать от 2 суток до нескольких месяцев.
Сроки хранения кусочков в нейтральном формалине необходимо
устанавливать опытным путем. Оказалось, например, что для ус-
пешной импрегнации чувствительных нервных окончаний в серд-
це и мочевом пузыре сроки фиксации должны быть по возможно-
сти короткими (2—4 дня). Наоборот, для импрегнации нервных
сплетений гладкой мускулатуры полезно пребывание кусочков в
нейтральном формалине в течение 10—20 дней. Пребывание мате-
риала свыше месяца обычно плохо отражается на его импрегна-
ции. В этом отношении фиксация в АФА резко отличается от фик-
сации просто в нейтральном формалине, ибо в последнем случае,
чем дольше находятся ткани в фиксаже, тем лучше идет импрег-
нация. После окончания срока фиксации в жидкости АФА с по-
следующей фиксацией в формалине кусочки переносят в дистилли-
рованную воду и быстро в ней споласкивают.
2. Далее следует резка на замораживающем микротоме. В за-
висимости от задачи исследования срезы варьируют в толщине от
20 до 100 к В тех случаях, когда необходимо прослеживать на
препаратах отростки нервных клеток или отдельные нервные ство-
лики на значительном протяжении, рекомендуется делать толстые
срезы (50—60 и).
3. Срезы с замораживающего микротома поступают в ту же
воду, в которой промывался кусочек (количество промывной жид-
кости равняется приблизительно 150—200 см3 на кусочек в 1 г-н3).
4. Из дистиллированной воды после 1—2-минутного пребыва-
ния в пей срезы поступают в 20-процентиый раствор азотнокислого
серебра. Здесь они остаются в течение 1—30 минут. Время пребы-
вания срезов в азотнокислом серебре во многом зависит от объек-
та и от предварительной его обработки.
Как правило, материал, фиксированный в АФА, требует мень-
шего времени пребывания, нежели материал, фиксированный про-
сто формалином, Каких-либо точных указаний здесь дать невоз-
можно.
Время пребывания в азотнокислом серебре определяется после
нескольких проб. Если при последующих манипуляциях импрегна-
ция наступает чересчур быстро и срезы чернеют даже при прибав-
лении большого количества аммиака, то это указывает на слиш-
ком долгий срок пребывания срезов в азотнокислом серебре. В
этом случае его нужно сократить.
Иногда для импрегнации долго лежавшего или плохо импрег-
нирующего материала приходится удлинять пребывание срезов
в азотнокислом серебре до 1 часа или же (в некоторых случаях)
помещать ванночку в термостат при 37°. Нужное время, как уже
сказано выше, достигается опытом.
5. Из 20-процентного азотнокислого серебра срезы переносятся
в формалиновые ванны. В 4 или 5 небольших баночек или чашек
наливают 20-процентный формол, приготовленный на водопровод-
356
ной воде. Срез при помощи стеклянной иглы вынимают из
20-процентного серебра и быстро проводят через 4—5 формали-
новых ванн. Как правило, в первой же ванне срез дает обильную
муть, во второй — муть, отходящая от среза, делается меньше. Вся
проводка должна идти, таким образом, чтобы в последней ван-
не больше не отходило белых облачков.
Примечание. Так как состав водопроводной воды различен в разных
местностях, то картина отхождения облачков может меняться. Естественно,
что при проводке через воду, содержащую незначительное количество хлори-
дов, облачков будет меньше, и наоборот. В том случае, если хлоридов в воде
так мало, что облачка не отходят, к 20-процентному формалину, разведен-
ному водопроводной водой, рекомендуется прибавлять немного хлористого
натрия. В этом случае берут один маленький кристаллик на 1 л жидкости.
6. После того как последние белые облачка отойдут, срез при
помощи стеклянной иглы переносят в раствор аммиачного серебра,
который готовят следующим способом. К нескольким кубическим
сантиметрам 20-процеитного азотнокислого серебра прибавляют
по каплям 25-процентный аммиак.
Примечание. Аммиак должен быть обязательно крепким. Всякое сни-
жение процентного содержания аммиака отражается самым пагубным обра-
зом на импрегнации и ведет к неудачам.
После прибавления аммиака в растворе серебра появляется
коричнево-бурый осадок. После каждой капли прибавляемого ам-
миака необходимо тщательно взбалтывать или помешивать рас-
твор стеклянной палочкой. Наконец, наступает момент, когда от
одной прибавленной капли весь остаток растворяется. Этот момент
должен быть уловлен. Всякий излишек аммиака недопустим. По-
этому осторожное растворение осадка нужно вести до тех пор,
пока жидкость не будет иметь слегка мутный вид (опалесцирую-
щий), т. е. будет содержать некоторое небольшое количество взве-
шенного осадка. Приготовленный раствор аммиачного серебра
наливают в часовое стекло или в маленькую плоскую стеклянную
чашечку так, чтобы она свободно помещалась на предметном сто-
лике микроскопа. Перед тем как погрузить в часовое стекло или
в чашечку срезы, необходимо добавить 1 —15 капель крепкого (25-
процентного) аммиака. Количество прибавляемого аммиака варь-
ирует в зависимости от состояния материала (времени его фикса-
ции, продолжительности пребывания в ванне с азотнокислым се-
ребром и т. д.). Установить точное количество прибавляемых ка-
пель без предварительного опыта невозможно. Есть, однако, неко-
торая зависимость между временем пребывания в азотнокислом
серебре и количеством прибавляемых капель: чем дольше срез на-
ходится в серебре, тем больше нужно прибавлять аммиака.
7. Дальнейшие манипуляции производятся под контролем мик-
роскопа. Часовое стекло или чашечку с плоским дном, в которых
находятся аммиачное серебро с добавленным аммиаком и срез,
357
ставят на предметный столик микроскопа. Срез рассматривают при
слабом увеличении с поднятым конденсором и полностью откры-
той диафрагмой. При 'этих условиях наступающая импрегнация
делается доступной для наблюдения с необычайной ясностью.
Вначале срез желтеет, приобретая лимонный цвет, затем на
неоднородном фоне начинают появляться нервные волокна, после-
довательно окрашивающиеся в оранжевый, коричневый и черный
цвет. Так же окрашиваются п нервные клетки. Ядра соединитель-
ной ткани, поперечнополосатых и гладких мышц также могут им-
прегнироваться. Однако интенсивность этой окраски должна быть
всегда меньше по сравнению с нервными элементами. Если на сре-
зе в первую очередь выступают ядра клеток различных тканей, то
это является плохим признаком. Через некоторое время срез
быстро почернеет, а нервы не успеют проимпрегнироваться. Это
обстоятельство является ясным признаком того, что в раствор
аммиачного серебра прибавлено мало капель аммиака. Необходи-
мо для следующего среза прибавить на 2—3 капли больше. Таким
опытным путем можно достичь безупречной и элективной импрег-
нации. Так же, как и в отношении предыдущих процедур, —дол-
жные сроки устанавливаются только опытным путем.
8. После того как микроскопическое наблюдение укажет на до-
статочную степень импрегнации среза, последний при помощи
стеклянной иглы переносят в аммиачную воду (1 часть 25-про-
центиого аммиака и 2 части дистиллированной воды). Здесь срез
остается в течение 10—15 минут.
9. Из аммиачной воды срезы переносят в дистиллированную
воду на несколько часов (можно на ночь). Воду рекомендуется
несколько раз сменить.
10. Далее следует золочение срезов обычным способом. Приго-
товляется раствор хлорного золота (1 : 500). В этот раствор по-
мещают срезы и оставляют до окрашивания в серый (стальной)
цвет. Если желательно получить фиолетовые тона, то пребывание
срезов в золотой ванне может быть продлено.
11. После достижения желательного тона срезы на 5—10 ми-
нут переносят без промывки в 5-процентный раствор гипосуль-
фита.
12. Отсюда срезы поступают в дистиллированную воду, где
тщательно промываются (сменить не менее пяти порций в течение
не менее 1—2 часов).
13. Промытые срезы могут быть докрашены различными кра-
сителями (гематоксилин, эозин, конго красный). Возможны, и
сложные окраски, например, по Ван-Гизону, Маллори и т. д. При
окраске по Маллори нужно иметь в виду, что импрегнация ослаб-
ляется. Поэтому для такой дополнительной окраски нужно брать
сильно импрегнированные срезы. После обезвоживания обычным
способом, срезы заключают в канадский бальзам. Можно реко-
мендовать также заключение в желатину-левулезу по Герингу.
358
В этом случае нервные элементы совершенно не подвергаются
сморщиванию.
Обработка нервной ткани по методу Д. И.
Дейне к а; 1. Фиксация кусочков (20—90 минут) в смеси: 96-
градусный или 100-градусный спирт—30 см3, насыщенный рас-
твор мышьяковистой кислоты — 30 см3, нейтральный формалин
20-процентный — 30 см3. 2. Слегка обсушить кусочки фильтроваль-
ной бумагой. 3. 2-процептный AgNO3 (в баночке коричневого стек-
ла) — 18 дней и больше; объекты держать при комнатной темпе-
ратуре. 4. Дистиллированная вода (1—3 минуты). 5. Восстанав-
ливают (24 часа) серебро в смеси: гидрохинон 2 г. Na2SO3 —
0,5 г, нейтральный формалин продажный — 5 см3, дистиллиро-
ванная вода — 95 см3. 6. Промывка в дистиллированной воде
(1—3 минуты). 7. Проводят через спирты возрастающей крепости;
100°— 12 часов, 100° + эфир — 2 часа. 8. Целлоидин 6% — 1—
3 дня (не больше!), густой целлоидин (8%) — 1 час. Заливка в
густой целлоидин прямо на блок. Блок с кусочком положить на
30 минут в 70-градуспый спирт. Затем изготовляют срезы (блоки
хранить нельзя). Срезы собирают в 96-градусном спирте. 9. Ди-
стиллированная вода — 10—15 минут. 10. Вираж (при отсут-
ствии реактивов не обязательно) в следующей смеси: роданистый
аммоний 1,5 г, гипосульфит 1,5 г, дистиллированная вода 50 см3\
на 10 см3 смеси прибавляют 1 см3 1-процентного хлорного золота.
Держать срезы до почернения. 11. Водопроводная вода 2 часа,
дистиллированная вода 15 минут. 12. Дифференцируют 3—10 ми-
нут до просветления: маргаицевокислый калий 2—3 кристалла,
дистиллированная вода 50 см3, крепкая серная кислота 1 капля.
13. Без предварительной промывки переносят в 1-процентную ща-
велевую кислоту на 1—3 минуты. 14. Дистиллированная вода 5—
10 минут. 15. Для подкраски ядер (не обязательно) используют
квасцовый кармин (1 час). 16. 70-градусный спирт 10 минут; 96-
градусный спирт 10 минут; карбол-ксилол 10 минут. 17. Заклю-
чают в канадский бальзам.
Быстрый метод Гольджи (для нервной ткани, эмбри-
онов и очень молодых животных).
1. Кусочки фиксируют (в темной склянке, на дно которой кла-
дут слой стеклянной ваты) в смеси из 40 см3 2,5—3,5-процеитного
раствора двухромовокислого калия и 10 см3 1-процентной ос-
миевой кислоты в течение 3—5 дней (для фиксации берут
кусочки не более 3 мм толщиной). Если материал держать в фик-
саторе 2—3 дня, то окрашиваются клетки глии, если 6—9 дней, то
импрегнируются нервные волокна. 2. Обсушивают объект филь-
тровальной бумагой. Помещают в 0,75-процентиый раствор азот-
нокислого серебра на 1—2 дня. Если раствор делается желтым и
мутным, то его сменяют. 3. Промывают в 40-градусном спирте
(3—4 раза сменить) 1—2 часа. 4. Проводят через 80-градусный
спирт 1—2 часа. 5. 96-градусный спирт —3—4 часа. Затем быстро
заливают в целлоидин или переводят (через 70-, 40-градусный
359
спирт в дистиллированную воду и режут на замораживающем ми-
кротоме. 6. Промывают срезы в 80-градуспом спирте (2 раза сме-
няя его). 7. Проводят через абсолютный спирт. 8. Кедровое мас-
ло. 9. Помещают срезы на покровное стекло, отсасывают филь-
тровальной бумагой остатки масла, наносят каплю канадского
бальзама и, защищая от пыли, дают ей подсохнуть. Затем покров-
ное стекло прикрепляют на предметном стекле, срезом вверх, что-
бы избежать давления стекла, действующего разрушительно на
импрегнацию. Если вместо бальзама употребляют цедакс, то им-
прегнированные срезы могут быть накрыты покровными стеклами.
Ганглиозные клетки и их отростки окрашиваются в совершен-
но черный цвет; фон светлый.
Метод не всегда удается. В таких случаях следует изменять
условия обработки и прежде всего варьировать сроки хромирова-
ния (п. 1). Вообще рекомендуется брать для обработки большое
количество материала и ставить целые серии опытов. Варьируя
при этом концентрацию фиксирующей жидкости, продолжитель-
ность содержания в ней, и применяя различную температуру,
можно опытным путем определить для каждого объекта наиболее
удачный вариант условий для последующей инпрегнации.
Для предотвращения образования на поверхности кусочков
больших осадков серебра рекомендуется перед помещением в
1 -процентное азотнокислое серебро погрузить их несколько раз в
10-процентный раствор желатины, которая образует оболочку,
задерживающую осадки; после импрегнации желатина может
быть удалена промыванием в теплой воде.
Модификация способа Гольджи, предложен-
ная проф. Колосовым. Объекты, выдержанные надлежащее
время (1—7 дней) в смеси двухромовокислого калия и осмиевой
кислоты ('/«-процентный раствор осмиевой кислоты, в котором
растворено 3—5% двухромовокислого калия), переносятя, после
обмывания их дистиллированной водой и легкого обсушивания,
на пропускной бумаге не в слабый (0,75%) раствор азотнокислого
серебра и не в чистый, как это обыкновенно делается, а в 2—3-
процентный и притом содержащий к себе от '/« до ’/а % осмиевой
кислоты. В этом растворе объекты остаются 2—3 дня.
Модификация способа Гольджи, предложен-
ная Т ишуткиным. Тишуткин установил, что для различных
органов нельзя применять шаблонно один и тот же способ. Всегда
следует определить те условия, при которых в данном органе им-
прегнация хромовым серебром идет наиболее успешно. Само
собой разумеется, что это далеко ие легкое дело. При изучении
импрегнации нервов селезенки, Тишуткин получал наилучшне
результаты, применяя для фиксирования смесь 5-процентного рас-
твора двухромовокислого калия и 1-процентного раствора осмие-
вой кислоты (равные объемы или в отношении 15 : 10). Малень-
кие, еще теплые, кусочки органа только что убитого животного
быстро переносились в указанную смесь, подогретую до темпера-
360
туры тела, и в этой смеси оставались от !/2 до 2 часов. Температу-
ра раствора все время поддерживалась на уровне температуры
тела (в термостате). Затем объект переносился в раствор азотно-
кислого серебра (1—2%).
Тишуткин в согласии с Лавдовским и Рубашкиным считает, что
наилучшие результаты получаются при кратковременном фикси-
ровании в хромоосмиевой смеси (ие более 2 часов).
Модификация способа Гольджи, предложен-
ная Кульчицким. Объекты фиксируют 4-процентным раство-
ром формальдегида в течение одного или нескольких дней, смотря
по их величине. Затем переносят в смесь 3 частей двухромовокис-
лого калия, 1 части хлоралгидрата и 100 частей воды, в которой
оставляют также различное время — до 1—2 недель. По истечении
этого срока их переносят в 2-процентный раствор серебра, к кото-
рому также прибавлено некоторое количество хлоралгидрата
(до 1 %), и оставляют в нем до полного восстановления серебра.
Модификация Гольджи — Кокса. 1. Свежие кусоч-
ки нервной ткани помещают в смесь: 5-процентной сулемы —
20 частей, 5-процентного двухромовокислого калия — 20 частей,
5-процентного хромовокислого калия — 16 частей, дистиллирован-
ной воды — 30—40 частей.
Смешивают в указанном порядке, иначе выпадет осадок. Через
сутки фиксатор сменяют. Фиксация длится 1—3 месяца, причем
одновременно происходит фиксация и импрегнация ткани. Режут
на замораживающем микротоме. Срезы помещают на 1—2 часа в
5-процентпый раствор углекислого натрия или насыщенный рас-
твор сульфита натрия, в котором они чернеют (рекомендуется
нагреть до 40° и затем держать срезы в растворе сутки). Промы-
вают в воде, наклеивают и затем заключают в бальзам (без по-
кровного стекла, так же, как при методе Гольджи).
Нервные клетки с отростками—черные на блед-
но-желтом фоне.
Метод Кахаля для импрегнации фибрилл в маленьких и
средних нервных клетках.
I. Свежие кусочки ткани толщиной в 3—4 мм кладут в 0,75 —
3-процентпый раствор азотнокислого серебра на 3 5 дней при
30—35°. 2 . Промывают 1 минуту дистиллированной водой и кла-
дут иа 24 часа в смесь 1—2 г пирогалловой кислоты (или гидро-
хинона), 5 см? формалина и 100 см3 дистиллированной воды. 3.
Промывают 1 минуту дистиллированной водой и заливают в цел-
лоидин или, быстро обезвоживая, в парафин; 0,75-процентный
раствор азотнокислого серебра употребляют для эморионов или
новорожденных животных, 3-процентный раствор для взрослых
животных.
Метод дает черную импрегнацию фибрилл ганглиозных клеток
и нервных тяжей, глиальные клетки не окрашиваются.
361
Метод Кахаля для импрегнации фибрилл аксиальных
цилиндров мякотных нервов и фибрилл крупных ганглиозных
клеток.
1. Материал фиксируют 24 часа в 96-градусном спирте. 2. Ку-
сочки помещают на 4 дня в 1-процентный раствор азотнокислого
серебра при 30—35°. 3. Быстро споласкивают их дистиллированной
водой и кладут на 24 часа в смесь: гидрохинон — 2 г, формалин —
5 ои’, дистиллированная вода— 100 см3 н заливают в целлоидин
или, быстро обезвоживая, — в парафин. Этим методом можно
пользоваться для безмякотных нервов, но кусочки надо фиксиро-
вать спиртом 3 суток.
Метод Кахаля для импрегнации нейрофибрилл больших
нервных клеток и тонких нервных тяжей. 1. Материал фиксиро-
вать в 96-градусном спирте с добавлением аммиака (0,5—1 %; для
больших кусочков тканей — 1,5%) 24—36 часов. 2. Промыть
дистиллированной водой и положить на 3—5 дней в 1,5-процент-
ный раствор азотнокислого серебра при 30—35°. 3. Быстро сполос-
нуть водой и положить на 24 часа в смесь: гидрохинон — 2 г, фор-
малин— 5 см3; дистиллированная вода—100 см3, 4. Промыть
водой и залить в целлоидин или, быстро обезводив, залить
в парафин. ’
Метод может быть использован и для импрегнации нервных
окончаний, при этом берут 3-процентный раствор азотнокислого
серебра.
Метод Кахаля для импрегнации структур мозжечка, а
также моторных окончаний, чувствительных эпителиальных клеток
и т. д. '
1. Материал фиксируют в формалине не менее 3 дней. 2. Сре-
зы, сделанные на замораживающем микротоме, переносят в рас-
твор формалина. 3. Быстро споласкивают водой и переносят на
4—6 часов в следующую смесь: 2-процеитное азотнокислое сереб-
ро— 12 см3, пиридин (7—10 капель), 96-градусный спирт — 5—
6 см3. Срезы должны стать светло-коричневыми. 4. Срезы перено-
сят на 2—4 часа в абсолютный спирт. 5. Восстанавливают 1—3 ми-
нуты в смеси: гидрохинона —0,3 г, формалина —20 см3, дистил-
лированной воды — 70 СЛ43, ацетона — 15 см3. 6. Хорошо споласки-
вают водой и затем золотят обычным способом. 7. Промывают
водой, переносят на предметное стекло, просушивают фильтро-
вальной бумагой; проводят через абсолютный спирт, гвоздичное
масло, ксилол, дамаровый лак.
См. также раздел: Нервные волокна.
Окраска тигроида. Окрашивать тигроид рекомендуется
галлоцианином по Эйнарсону.
Фиксируют спиртом, спирт-формолом, смесью Ценкера и т. д.
Красят 24—48 часов.
Окраска метиленовым синим по Ни селю. Све-
жий материал фиксируют спиртом и заливают в парафин или
целлоидин. Срезы окрашивают в течение суток (в термостате) в
362
следующем растворе красителя Ниссля: метиленового синего —
3,75 г; венецианского мыла— 1,75 г, дистиллированной воды —
1000 см3.
Краситель до употребления должен созревать в течение не-
скольких (до 6) месяцев. Перед употреблением взбалтывать и
фильтровать, Окрашенные срезы дифференцируют анилиновым
спиртом; анилинового масла—10 см3, 96-градусного спирта —
90 см3.
Иногда дифференцировка идет медленно — несколько часов.
Затем срезы проводят через кайепутовое масло, промокают осто-
рожно фильтровальной бумагой, проводят через ксилол и заклю-
чают в бальзам.
Тигроид, ядрышки, базихроматин окрашиваются в синий цвет.
Миэлиновые волокна бесцветны. Если на пробных срезах в белом
веществе встречаются гомогенно окрашенные розоватые шары, то
это свидетельствует о недостаточном обезжиривании материала
перед заключением в парафин. В этом случае необходимо следую-
щие срезы перед окраской снова провести через абсолютный
спирт, хлороформ и снова абсолютный спирт для добавочного
обезжиривании.
Окраска тигронда толуидиновым синим или
тионином. Способ применим для целлоидиновых, парафино-
вых и замороженных срезов: последние предварительно обезжири-
ваются. Срезы окрашивают сутки (в термостате) в 1- или 0,1-про-
центном растворе толуидинового синего или тионина, или подогре-
вают в красителе до появления паров, после чего промывают сутки
в воде. Затем проводят через 70-, 80-, 96-градусный спирт и диф-
ференцируют анилиновым спиртом (см. выше) или 96-градусным
спиртом, подкисленным несколькими каплями соляной кислоты.
Обезвоживают 96-градусным спиртом, осторожно промокают
фильтровальной бумагой, проводят через ксилол (дважды сме-
нить) н заключают в бальзам.
Белецкий указывает, что элективная окраска тигро-
иДа на замороженных срезах получается при следующем способе
обработки. Срезы кладут на 30 минут в раствор: 1-процентного
раствора толуидинового синего — 9 см3, 33-процеитной уксусной
кислоты — 1 см3. После окраски срезы хорошо промывают и за-
ключают в бальзам обычным способом.
Снесарев рекомендует после окраски толуидиновым синим или
тионином докрашивать срезы слабым раствором эозина или эри-
трозина.
Для окраски митохондрий в нервных клетках при-
меняют метод Бенда — Икеда или Куля.
Полезные результаты дает метод Бенсли, при котором тигроид
окрашивается в зеленый или синий цвет, пластосомы — светло-ко-
ричневые, нейрофибриллы — светло-коричневые: нередко выявля-
ются и внутриклеточные каналы.
363
Можно также пользоваться методом Альцгеймера.
Фиксация 24 часа в 10-процентном формоле и затем 8 дней в сме-
си Флемминга (только 1—2 капли кислоты), заливка в парафии.
Срезы красят 1 час (при 58°) в насыщенном водном растворе кис-
лого фуксина, быстро споласкивают водой и кладут на 10—12
секунд в пикриновую кислоту (30 см3 насыщенного спиртового
раствора пикриновой кислоты и 60 см3 дистиллированной воды),
споласкивают водой и помешают на 20—50 минут в насыщенный
водный раствор светлого зеленого (разбавленный пополам водой),
затем быстро споласкивают водой, осторожно промокают фильт-
ровальной бумагой, проводят через абсолютный спирт, ксилол,
заключают в бальзам.
Пластосомы и нейросомы — ярко-красные, тигроид—зеленый,
глиальные и соединительнотканные волокна — красные.
Импрегнация аппарата Гольджи см. стр. 321.
Для выявления нейрокератина объект фиксируют в
96-градусвом спирте (для растворения миэлииа) и затем окра-
шивают квасцовым гематоксилином с докраской кислым фукси-
ном.
Для выявления гликогена применяют метод А. Л. Шаба-
даша или Готчкисса (см. стр. 252).
Трофоспонгии Гольмгрена можно выявить после фиксации
смесью Ценкера и окраски железным гематоксилином или по спо-
собу Маллори.
Суправитальная окраска ганглиозных кле-
ток центральной нервной системы при помощи
метиленового синего. Лягушке в сердечную луковицу
(bulbus cordis) вводят такое количество 2-процентного метилено-
вого синего (в физиологическом растворе поваренной соли), чтобы
все тело лягушки окрасилось в синий цвет. Через 30—60 минут
берут кусочки головного или спинного мозга лягушки и помещают
их во влажную камеру, где примерно через 1—2 часа их окраска
становится более интенсивной. Тогда кусочки помещают па 12—24
часа в 1-процентный молибденовокислый аммоний (для фиксации
окрашивания), затем споласкивают дистиллированной водой, бы-
стро проводят-через спирты и заключают в парафин.
Кроликам краситель вводят внутривенно, в сердце или под
кожу. При внутривенном введении красителя кролика усыпляют
предварительно хлоралгидратом и затем каждые 5 минут ему вво-
дят в vena femoralis 1. см3 метиленового синего, разбавленного
пополам физиологическим раствором поваренной соли н нагретого
до температуры тела. Через час начинают вводить неразбавлен-
ный раствор красителя, продолжая эту операцию до тех пор, пока
животное не погибнет. При подкожном введении кролику инъици-
руют каждые полчаса 10 см3 5-процентного метиленового синего.
Примерно на четвертом или пятом вливании наступает смерть
животного. Тогда вскрывают его грудную полость и в аорту вво-
дят дополнительно 50 сл43 1-процентиого красителя. Через час
364
вынимают кусочки головного или спинного мозга и закрепляют их
окраску молибденовокислым аммонием в продолжение 12—24 ча-
сов (см. стр. 376); затем поступают, как было указано выше.
Окраску нервной ткани по методам А. Л. Шабадаша см. ниже
(стр. 380).
Нервные волокна, нейрофибриллы, периферические нервные
окончания
Для изучения свежего препарата периферического нерва осто-
рожно отпрепаровывают маленький кусочек нерва, например,
п. ischiadicus мыши, помещают его на сухое предметное стекло,
быстро расправляют иглами, прибавляют 1—2 капли 0,5-проп.епт-
ной осмиевой кислоты и накрывают покровным стеклом. При этом
бывает хорошо видна миэлиновая оболочка. Аналогично поступа-
ют и при изучении безмякотного нерва, например, селезеночного
нерва и блуждающего нерва кролика.
При изучении периферических нервных волокон
надо всегда помнить об исключительно большой трудности или
даже о невозможности одновременного выявления их структур:
аксонов и их оболочек. Это достижимо только при параллельном
использовании цитологических и нейрофибриллярных методов.
Применение только одних нейрофибриллярных или цитологиче-
ских методик не дает полного представления о строении нервного
волокна и может привести к неправильным выводам. В качестве
основного метода изучения смешанного и безмякотного нерва
В. В. Порт у галов (1946) избрал метод разволокнения с по-
следующей фиксацией и окраской, описанными ниже. В качестве
фиксаторов можно пользоваться формалином, смесью АФА по
Лаврентьеву с последующей фискацией 12-процентным нейтраль-
ным формалином, жидкостью Германа или смесью Шампи. Пре-
параты окрашивают железным гематоксилином, по Кулю, метиле-
новым синим, пикрокармином, пикроиндигокармином или импрег-
нируют по методу Лаврентьева. В. В. Португалов рекомендует
кусочек свежеизвлеченного нерва (до 0,5 см длиной) расправлять
на предметном стекле. При помощи хорошо отполированных (и
каждый раз новых) игл удаляют периневральную оболочку, а
оголенный нервный стволик осторожными движениями игл распла-
стывают на стекле. Эти манипуляции следует проводить под кон-
тролем лупы. Приготовленный таким образом препарат после
небольшой подсушки на воздухе плотно пристает к стеклу и может
быть фиксирован по вышеуказанным прописям и затем окрашен
сообразно задачам исследования.
Для изучения перехватов Ранвье и миэлиновой оболочки сле-
дует брать тонкий нерв, например, п. ischiadicus лягушки. Нерв
привязывают тонкой ниточкой к обоим концам спички, затем отре-
зают и в таком растянутом состоянии кладут на 12—24 часа в 0,5-
процентный раствор осмиевой кислоты, промывают полчаса в ди-
365
стиллированной воде, проводят через 70- и 96-градуспый спирт
и просветляют в терпинеоле.
Можно также слегка расщипать свежевырезанный нерв и по-
местить его на 15—30 минут в 1-процентный раствор осмиевой
кислоты, тщательно промыть (30 минут) и подкрасить кармином
(1—24 ч.). Промыть, тщательно расщипать на предметном стекле
в капле глицерина, накрыть покровным стеклом, края которого
обвести асфальтовым лаком или менделеевской замазкой.
Для наблюдения концевых разветвлений нервов на
нефиксированном свежем материале можно использовать глазные
мышцы. Небольшой кусочек мышцы осторожно расщипывают иг-
лами в продольном направлении, прибавляют каплю 1-процент-
ной уксусной кислоты и накрывают покровным стеклом, края ко-
торого обмазывают воском. Через пару часов ясно выступают
нервные тяжи. Препарат может сохраняться некоторое время.
Методы импрегнации. Метод Бильшовского
один из основных методов выявления нейрофибрилл в нервных
волокнах, а также в центральной нервной системе.
1. Длительная фиксация материала в нейтральном формалине
(1 часть формалина + 9 частей воды). Снесарев советует объект,
находящийся в нейтральном формалине, перед резкой поместить в
термостат (при 37°) на 24 часа, после чего хорошо промывать
сутки. 2. Срезы, приготовленные на замораживающем микротоме
(5—8 н), помещают па сутки в 2-процентное азотнокислое серебро
(в темноте!). 3. Споласкивают водой и помещают на 5—40 минут
в аммиачное серебро, в котором срезы должны приобрести корич-
невый цвет.
Аммиачное серебро приготовляют следующим образом: к
10 см3 10-процентного азотнокислого серебра прибавляют 5 капель
40-процентного едкого натра, получившийся темно-коричневый
осадок растворяют, прибавляя осторожно и не спеша по каплям
25-процентный аммиак; после каждой капли аммиака раствор на-
до встряхивать. Необходимо избегать избытка аммиака и реко-
мендуется лучше оставлять небольшую часть осадка нераствореи-
пой — раствор должен только слегка пахнуть аммиаком. Получен-
ный таким образом раствор комплексных солей серебра и аммония
необходимо долить дистиллированной водой до 20 см3. 4. Срезы
быстро проводят через воду и кладут в 20-процентный обыкновен-
ный формалин, где они должны почернеть. 5. Хорошо промытые
срезы золотят в растворе хлорного золота: 1-процентного хлорного
золота—'0,5 см3, дистиллированной воды— 10 см3, уксусной кис-
лоты — 2—3 капли. Срезы принимают серовато-фиолетовый цвет.
6. Промывают их в воде и кладут на 20—60 секунд в 5-процент-
ный гипосульфит. 7. Срезы промывают в воде, наклеивают на
стекло, осушают фильтровальной бумагой, обезвоживают ацето-
ном и через ксилол заключают в бальзам.
1 Н е й р о ф и б р и л л ы — черные на сером фоне. Метод осо-
бенно пригоден для нервных волокон.
366
Импрегнация по пиридиново-серебряному
методу Бильшовского.
Особо пригоден для изучения мозга эмбрионов и окончаний
периферических методов. 1. Кусочки фиксируют в нейтральном
формалине (1 часть формола -f- 9 частей дистиллированной воды
или 1 часть формалина + 4 части воды) в течение по крайней ме-
ре одной недели, а затем промывают их в дистиллированной воде
несколько дней. 2. Помещают кусочек объекта, не более 0,5 см
толщины, в чистый пиридин на 3—4 дня (при комнатной темпера-
туре). 3. Промывают в проточной воде 12—24 часа, затем в ди-
стиллированной воде (сменяя ее, пока не исчезнет запах пиридина)
12—24 часа. 4. Переносят его в 3-процентный- раствор азотнокис-
лого серебра на 3—6 дней (в темноте при 37°). 5. Быстро спола-
скивают в дистиллированной воде. 6. Помещают в раствор амми-
ачного серебра (стр. 370) на 24 часа. 7. Промывают в дистилли-
рованной воде (часто сменяя), в зависимости от толщины кусочка,
не более 1—2 часов. 8. Переносят в нейтральный формалин
(1 часть формола -ф- 9 частей воды) для восстановления серебра на
10—12 часов. 9. Промывают в дистиллированной воде. 10. Быстро
проводят через спирты возрастающей крепости и заливают в пара-
фин. После освобождения от парафина срезы переводят в проточ-
ную воду. 11. Помещают в раствор хлорного золота (см. выше) и
оставляют в нем, пока коричневый тон окраски срезов не перей-
дет в серый или в серо-фиолетовый. 12. Фиксируют в 5-процент-
ном растворе гипосульфита 1—2 минуты. 13. Промывают в про-
точной воде 1—2 часа. 14. Проводят через спирты возрастающей
крепости (до 96°); терпинеол, ксилол (возможно быстро) и за-
ключают в бальзам или цедакс.
В некоторых случаях полезно воспользоваться пиридиново-
серебряным методом в модификации Буке, так как он значитель-
но лучше удается (Лаврентьев).
1. Фиксировать в 12-процентном нейтральном формалине.
2. Три часа в пиридине. 3. Промыть в дистиллированной воде 8
часов. 4. Импрегнировать в 3-процентном азотнокислом серебре
при 30—35° 5—6 дней. 5. Обработать разведенным аммиачным
серебром по Бильшовскому — 24 часа. 6. Промывать 2 часа ди-
стиллированной водой. 7. Поместить в нейтральный раствор фор-
малина (20 см3 формалина и 80 см3 дистиллированной воды) на
10—12 часов. 8. Промыть и быстро залить парафин, золочение
проводить на срезах. ,
Модификация метода Бильшовского по
Гросс-Шульце для импрегнации нейрофибриллей и нервных
волокон, а также мультиполярных нервных клеток, межпозвоноч-
ных и симпатических ганглиев, интрамуральных ганглиев и спле-
тения пограничного ствола. Метод дает очень красивые препараты
и довольно легко удается. 1. Фиксация 12-процентным нейтраль-
ным формалином: замороженные срезы кладут на 1—2 часа в 20-
процентное азотнокислое серебро. 2. Срезы переносят в 20-про-
367
центный формалин (на водопроводной воде), в котором срезы ие
должны лежать неподвижно. Когда прекращается выделение бе-
лого облачка из срезов (примерно 10 минут), их переносят в ра-
створ аммиачного серебра. 3. Аммиачное серебро приготовляют,
прибавляя к 5—10 см3 20-процентного азотнокислого серебра по
каплям 25-процентный аммиак до тех пор, пока не растворится
образовавшийся осадок (непрерывно взбалтывать). Этот раствор
наливают в часовое стекло и на каждый 1 см3 раствора прибав-
ляют по одной капле аммиака. Затем в него кладут срезы и кон-
тролируют импрегнацию под микроскопом: нейрофибриллы — чер-
ные на бесцветном фоне. 4. Срезы кладут на 1 минуту в 8 см3
дистиллированной воды + 2 см3 аммиака. 5. Золотят и т. д., как
в основном методе Бильшовского.
Для импрегнации нервных клеток н нервных тяжей человека,
грызунов, птиц и различных беспозвоночных, особенно насекомых,
может быть полезен следующий метод. Свежий материал фикси-
руют в смеси: 80-градусного спирта — 100 см3, пикриновой кис-
лоты— 2 г, уксусной кислоты— 10 см3, формалина—40 см3.
Существенно длительно фиксировать материал (от 2—3 меся-
цев до года).
Перед изготовлением срезов на замораживающем микротоме
кусочки материала помещают на 2—6 часов в аммиачную воду
(30 капель концентрированного аммиака на 100 слг3 дистиллиро-
ванной воды).
1. Затем делают срезы (25 Д на замораживающем микротоме.
2. Помещают срезы на 15 минут в аммиачную воду (52 капли кон-
центрированного NH4OH на 100 см3 дистиллированной воды).
3. Переносят срезы в 20-процентный раствор азотнокислого сереб-
ра (pro analisi), нагретый до 45°; срезы принимают коричневый
топ. 4. К 20 СЛ43 раствора серебра, в котором находятся срезы,
осторожно по каплям прибавляют аммиак до растворения осадка;
раствор надо все время осторожно взбалтывать; избегать избытка
аммиака. 5. Как только осадок растворился и раствор стал опа-
лесцирующим, срезы тотчас же проводят через дистиллированную
воду и помещают в 3-процентный раствор формалина (pro analisi),
в котором срезы должны равномерно потемнеть. 6. Срезы спола-
скивают дистиллированной водой и переносят в 1-процентный ра-
створ хлорного золота, где срезы принимают фиолетовый тон.
7. Срезы переносят в 5-процентный раствор гипосульфита на 10
минут, после чего хорошо промывают водой. 8. Обезвоживают и
как обычно заключают в нейтральный бальзам.
Если из материала нельзя приготовить замороженные срезы,
то его заливают в парафин.
1. Для этого фиксированные кусочки помещают на 24 часа в
аммиачный спирт (90-градусный спирт 50 см3 + 15 капель концен-
трированного аммиака). 2. Переносят в абсолютный спирт на
1 — ] 1/2 часа. 3. Помещают в толуол на 20 минут. 4. Затем перено-
сят кусочки на 6 часов в парафин, содержащий 20% пчелиного
368
воска (в термостате при 58°). 5. Заключают в парафин (с воском).
6. Срезы через ксилол переводят в абсолютный спирт, к которому
постепенно по каплям прибавляют дистиллированную воду и та-
ким образом осторожно доводят срезы до воды, после чего импрег-
нируют их так же, как и замороженные срезы.
Срезы, освобожденные от парафина и проведенные через
спирты до воды, можно импрегпировать и по следующей прописи.
1. Срезы переносят на 10 минут в аммиачную вод}' (26 капель
концентрированного аммиака на 50 см3 дистиллированной воды)..
2. Споласкивают дистиллированной водой и на 10 минут поме-
щают в 10-процептный раствор азотнокислого серебра (при 45°),
где срезы принимают коричневый тон. 3. Срезы переносят в амми-
ачное серебро (заранее приготовленное из 10-процентного азотно-
кислого серебра) па 1—5 минут. 4. Споласкивают дистиллирован-
ной водой и переносят в 3-процснтный формалин. 5. Затем обра-
батывают 1-процентным хлорным золотом, фиксируют 5-процент-
ным гипосульфитом, хорошо промывают проточной водой н
обычным способом заключают в бальзам.
Можно также -пользоваться особой модификацией
Бильшовского, разработанной специально для импрегнации
периферических нервных окончаний. Отличие этого способа за-
ключается в обработке срезов после аммиачного серебра разве-
денной уксусной кислотой.
1. Небольшие кусочки фиксируют в продолжение 24 часов
(лучше 7—14 дней) в 10-процентном формалине. Замороженные
срезы промывают проточной водой, затем дистиллированной 1—3
часа. 2. Срезы кладут иа 2 дня в пиридин и затем тщательно его
отмывают в дистиллированной воде, или же непосредственно, ми-
нуя пиридин, переносят их в 2—З-процентпое азотнокислое сереб-
ро на 24 часа. Как можно быстрее (2—3 секунды) проводят через
дистиллированную воду и кладут в аммиачное серебро (см.
стр 370) на 10—20 минут (срезы становятся коричневыми).
4. Срезы переносят на 1—5 минут в разведенную уксусную кисло-
ту (1—3 капли ледяной уксусной кислоты на 20 см3 воды), где
они желтеют. 5. Помещают в 10-процентпый нейтральный форма-
лин на 10 минут, и далее как в основном методе Бильшовского.
Срезы можно докрашивать гематоксилин-эозином или по
Ван-Гизону.
Аксиальные цилиндры — черные, соединительная ткань — ко-
ричневая.
Одной из лучших модификаций метода Бильшовского является
способ, предложенный Тинелем (1947): 1) фиксировать 8—
10 дней в 20-процентном формалине (слегка подкисленном) или в
жидкости Буэна; объекты хранить в 5-процептном формалине, но
ие в спирте; 2) заливка в парафин, срезы через спирты перевести
в дистиллированную воду, влагу удалить, промокнуть фильтро-
вальной бумагой; 3) импрегпировать в 20-процентном растворе
азотнокислого серебра (24 часа при 37° С); 4) промокнуть фильт-
24 Микроскопическая техника 369
ровальной бумагой, затем покрыть срезы несколькими каплями не-
разведенного формалина (2 секунды); 5) промокнуть фильтроваль-
ной бумагой; 6) поместить в раствор свежеприготовленного амми-
ачного серебра, так же как при методе Гросс — Бильшовского на
20—40 секунд; 7) промыть аммиачной водой, затем водой, подкис-
ленной уксусной кислотой; заключить в бальзам по обычной схеме.
Метод Карея для нервных окончаний в мышцах.
Острыми хирургическими ножницами вырезают из межребер-
ных мышц крысы кусочки толщиной 3—5 мм. Немедленно фикси-
руют их в свежеотфильтрованном лимонном соке в течение 10—15
минут. Сок сливают и, не промывая срезы, наливают на них при-
готовленный предварительно (за 1—2 дня) 1-процентный раствор
хлорного золота.
Держат этот препарат в темноте от 10 минут до 1 часа, пока
ткань не приобретает однородной золотистой окраски; не следует
держать до появления коричневого цвета. Затем ткань без про-
мывки переносят в смесь 1 части муравьиной кислоты с 3 частями
дистиллированной воды и держат в темноте 12 часов. (Если срез
тонкий и имеет равномерную толщину, то в него проникает как
раз нужное количество раствора для окрашивания мышц в красно-
ватый, а нервов — в черный цвет). Споласкивают в водопроводной
воде и кладут в смесь равных частей 50-градусиого спирта и хи-
мически чистого глицерина, затем заделывают в чистом глицерине.
Для импрегнации п е р и ф е р и ч е с к и х нервов и нерв-
ных окончаний с успехом применяют метод Б. А. Фавор-
ского. Материал фиксируют 24 часа в 50—80-градусном спирте,
содержащем от 0,5 до 5 процентов уксусной кислоты, промывают
несколько часов в 50-градуспом спирте, кладут на двое суток в
смесь 100 см3 96-градусного спирта и 1 см? аммиака, затем про-
мывают в несколько раз сменяемой дистиллированной воде. После
этого объект помещают на 1—2 дня в пиридин, промывают 12—24
часа в проточной воде и 2—3 часа в дистиллированной воде, им-
прегнируют 4—10 дней в 2-процентном растворе азотнокислого
серебра (прн 37°С), споласкивают дистиллированной водой и об-
рабатывают 12 часов в смеси: формалин 10 см3, пирогалловая кис-
лота 1—2 г, дистиллированная вода 100 см3. Обезвоживают в
спиртах (в 70-градусном спирте не дольше 1,5 часов, более креп-
кие спирты не вредят) и заливают в парафин или целлоидцн. При
этом методе импрегнпруются нейрофибриллы, осевые цилиндры,
нервные окончания в эпителии, соединительной ткани и мышцах.
Метод Вебера (1947). 1) Фиксатор'- диоксап — 50 c.w3,
изопропиловый спирт — 25 см3, формалин—15 см3, муравьнная
кислота—2 см3, хлоралгидрат—10 г, азотнокислый кобальт —
1 г; перед употреблением добавляют 5% уксусной кислоты: фик-
сируют несколько часов иа холоду (0°) фиксатором, разбавленным
пополам физиологическим раствором, затем объект переносят в
неразбавленный фиксатор на 7 дней (при 55°С). 2) Помещают
объект на 1 час (при 55° С) в раствор: диоксан — 50 см3, изопро-
370
лиловый спирт — 50 см3, дистиллированная вода — 50 см3; ра-
створ сменяют 2—3 раза, затем объект переносят на то же время
в смесь: диоксан — 50 см3, изопропиловый спирт — 25 см3. 3) Если
импрегнируют нервы костной ткани, то декальцинируют 24—48 ча-
сов в смеси: азотная кислота концентрированная — 4 см3, форма-
лин— 5 см3, дистиллированная вода— 100 см3, после чего тща-
тельно промывают дистиллированной водой. 4) Объект помещают
на 24—48 часов в раствор: азотнокислое серебро — 1 г, пиридин—
5 см3, дистиллированная вода — 100 см3. 5) Не промывая, перено-
сят объект на 24—48 часов в аммиачное серебро: к 5 см3 10-про-
центного азотнокислого серебра добавляют по каплям крепкий ра-
створ аммиака до растворения выпавшего осадка, после чего
взбалтывают, добавляют 5 капель 25-процентного раствора едко-
го натрия и снова прибавляют осторожно, по каплям, аммиак до
растворения образовавшегося осадка. Затем доливают дистилли-
рованной воды до 50—100 см3 (чем концентрированнее раствор,
тем темнее будет тон препарата). 6) Не промывая, обрабатывают
2 часа смесью: гидрохинон — 2 г, лимоннокислый натрий—1 г,
дистиллированная вода — 100 см3. 7) Хорошо промывают дистил-
лированной водой и заключают в парафин; срезы (5 и) заклю-
чают в бальзам.
Испанский гистолог Альжибец (1944) предложил легко
удающийся способ импрегнации нейрофибрилл в центральной
нервной системе: 1. Фиксация формалином, срезы (толщиной 15—
20 ц) на замораживающем микротоме, обрабатывают 10—30 минут
смесью подкисленного спирта (содержащего 5% уксусной кисло-
ты) , 1 % соляной кислоты и 1 % муравьиной кислоты, после чего хо-
рошо промывают водой. 2. Срезы помещают на полчаса в протраву
(10-процентный раствор азотнокислого серебра—15 см3, абсо-
лютный спирт — 1 см3, пиридин 4—5 капель; перед употреблением
готовят 10-процентиый раствор этой смеси). 3. Импрегнируют
5—15 минут в аммиачном серебре; (к 10 см3 10-процентного рас-
твора азотнокислого серебра прибавляют аммиак до появления
опалесценции, затем добавляют 10 см3 5-процентпого раствора
кристаллического углекислого натрия, хорошо взбалтывают, рас-
твор просветляют 1—2 каплями аммиака и, прибавляя дистилли-
рованную воду, доводят общий объем до 80—100 см3), быстро
споласкивают дистиллированной водой и обрабатывают смесью:
формалин 1 см3, 1-процентный раствор углекислого натрия 3 см3,
дистиллированная вода 100 см3’- промывают водой и обычным
образом заключают в бальзам.
Протарголовый метод для импрегнации на срезах
нейрофибрилл и безмякотных нервов.
1. Фиксируют 2—12 часов в свежеприготовленной смеси: му-
равьиной кислоты 5 см3, трихлоруксуспой кислоты 5 см3, нормаль-
ного пропилового спирта 25 см3, нормального бутилового спирта
65 см3. 2. Помещают в 96-градус.ный спирт иа 1—2 часа, сменяя
несколько раз, затем заливают в парафин обычным способом.
24* 371
3. Срезы переносят на 1 час в 10-пронентнос азотнокислое серебро
при 58°. 4. Хорошо споласкивают в дистиллированной воде в те-
чение 30 секунд. 5. Переносят на 1 час в 0,2 процентный протар-
гол. 6. Споласкивают водой и кладут на 1 минуту в восстанавли-
вающую смесь.
Раствор А: сернокислого натрия 10 г, дистиллированной воды
90 ди3.
Раствор Б: кислого сернистокислого натрия 5 г, амидола 1 г,
дистиллированной воды 95 см3.
Перед употреблением смешивают 1 часть раствора А с 5 ча-
стями раствора Б.
7. Хорошо промывают в проточной воде, споласкивают дистил-
лированной водой и золотят в 0,1-процентном растворе хлорного
золота. 8. Споласкивают водой и переносят в 1-процентный рас-
твор амидола на 5 секунд. 9. Промывают, обезвоживают и заклю-
чают в бальзам.
Метод Кахаля и Де-Кастро для импрегнации чув-
ствительных и моторных окончаний, особо пригоден для костной
ткани.
1. Кусочки ткани толщиной 4—6 мм фиксируют в смеси рав-
ных частей 96-градусного спирта и воды, в которой растворено
2—4 г хлоралгидрата (или этилуретана, или сомнифепа). К фик-
сатору прибавляют 1—2 см3 40-процентной азотной кислоты, что
усиливает импрегнацию. Для нервных окончаний в железах, арте-
риях, мускулах или коже достаточно 1 см3 кислоты. 2. Кусочки
промывают в проточной воде 6—12 часов и помещают на 8—
12 часов в 50 см3 96-градусного спирта с 2—3 каплями аммиака
(если к фиксатору не была прибавлена азотная кислота, то до-
статочно 1 капли). 3. Быстро споласкивают и кладут на 5—7 дней
в 1,5-процентнос азотнокислое серебро при 37°. 4. Быстро промы-
вают водой и восстанавливают серебро в течение суток в следую-
щей смеси: пирогалловой кислоты 1 г, формалина 5—10 см3, ди-
стиллированной воды 70—100 см3. 5. Проводят через спирты, за-
ливают в парафин; срезы, освобожденные от парафина, заклю-
чают в бальзам. Срезы можно золотить в хлорном золоте 1 ; 500
и докрашивать гематоксилином, кармином или основным фукси-
ном.
Метод Кахаля для импрегнации л аитерманнов-
ских насечек и аппарата Гольджи — Резонико.
1. Кусочки фиксируют 24 часа в смеси: формалина 6 см3. пи-
ридина 10 см3, азотнокислого марганца 0.5 г, дистиллированной
воды 40 см3. 2. Промывают 24 часа в проточной воде и затем кла-
дут на 48 часов в 1,5-процентпое азотнокислое серебро. 3. Пере-
носят на 24 часа в восстанавливающую смесь: гидрохинона 1 г,
формалина 5 см3, дистиллированной воды 80 см3, безводного сер-
нокислого натрия 0,25 г. 4. Затем кусочек осторожно расщипы-
вают п заключают в глицерин.
372
Осмирование и окраска миэлбновых оболочек
Руднев первый подметил, что жир и миэлиновое вещество
нервных волокон окрашивается осмиевой кислотой в черный цвет.
Это явление объясняется тем, что жироподобные вещества, а сле-
довательно и миэлин, быстро восстанавливают металлический
осмий, который и придает этим веществам черную окраску.
Для этой же цели можно пользоваться смесью Колосова: при-
готовляется 0,5-процентный раствор осмиевой кислоты в 2- или
3-процентном растворе азотнокислого урана.
Приготовлеииая таким образом смесь очень легко проникает
даже в довольно большие кусочки органов (например, язык ля-
гушки, разрезанный на 2—3 части). Кроме того смесь, рекомен-
дуемая Колосовым, имеет еще два преимущества, а именно:
1) кусочки органов могут находиться в ней более или менее про
должителыюе время (16, 24, 48 часов — смотря по тому, насколь-
ко интенсивное окрашивание желательно получить) и все-таки не
перекрашиваются и не делаются ломкими; и 2) азотнокислый
уран сам по себе очень легко диффундирует и при том хорошо
фиксирует тканевые элементы.
При употреблении смеси Колосова достигается очень чистое
окрашивание мякотных нервных волокон почти в черный цвет.
Смесь удаляют из кусочков, промывая их в смеси глицерина и
воды (равные объемы), после чего объекты уплотняют по общим
правилам гистологической техники.
Метод Кульчицкого. 1. Фиксируют в 10-процентном
формалине, затем кусочки кладут на 45 дней в мюллеровскую
жидкость или в особую протравляющую смесь (растворяют при
кипячении 2,5 г флуорохрома или хромовых квасцов в 100 см? во-
ды, затем, потушив горелку, прибавляют 5 см? уксусной кислоты и
хорошо размешивая стеклянной палочкой, добавляют 5 а уксус-
нокислой меди. Материал заливают в целлоидин. 2. Срезы окра-
шивают 12—24 часа в гематоксилине Кульчицкого: 10-процент-
ный спиртовой (созревший) раствор гематоксилина— 10 см?, ди-
стиллированная вода — 90 см?, уксусная кислота — 2 см?. 3. Непо-
средственно переносят в смесь из 10 частей концентрированного
раствора углекислого лития и 1 части 1-процентного раствора
красной кровяной соли. В этом растворе происходит дифференци-
ровка срезов, протекающая весьма медленно (3—12 часов). Смесь
надо менять каждый час. 4. Тщательно промывают в проточной во-
де и производят обычное заключение в бальзам.
Мякотные оболочки окрашиваются в черный цвет.
Можно использовать следующую модификацию способа Куль-
чицкого. Пункты 1 и 2, как в методе Кульчицкого, затем срезы
проводят через мюллеровскую жидкость и помещают в 0,25-про-
центный раствор перманганата на 20—30 секунд. Споласкивают
водой и дифференцируют 1—3 минуты в смеси: щавелевой кисло-
373
ты 1 г, сернокислого калия 1 г, дистиллированной воды 200 см3.
После дифференцировки срезы хорошо промывают проточной
водой, по желанию докрашивают квасцовым кармином и обыч-
ным образом заключают в бальзам.
Кроме вышеописанных окрасок мякотных оболочек можно ис-
пользовать также и следующий метод.
1. Фиксация формалином (не менее 3 дней). Замороженные
срезы (25—35 и) помещают на 6 часов в 2,5-процентный раствор
железных квасцов. 2. Споласкивают дистиллированной водой и
переносят на 10 минут в 70-градусный спирт, срезы нужно все
время двигать стеклянной палочкой. 3. Красят их 1—2 часа в
разведенном растворе гематоксилина (5 частей 10-процентного
спиртового созревшего раствора гематоксилина на 100 см3 дистил-
лированной воды). 4. Споласкивают дистиллированной водой и
дифференцируют 2,5-процентиым раствором железных квасцов,
все время контролируя под микроскопом. 5. Промывают в дистил-
лированной воде (несколько раз сменить), 1—2 часа в проточной
воде и затем проводят через спирты, ксилол и заключают в бал-
зам. Мякотные оболочки — черные.
Для изучения эмбриональных стадий развития, а также пери-
ферических мякотных нервов, особенно пригоден следующий спо-
соб. 1. Маленькие кусочки, фиксированные в 1-процентной осми-
евой кислоте, переносят на 24 часа в 1-процентный раствор дву-
хромовокислого калия (трижды сменить), 2. Помещают в 50- гра-
дусный спирт на 24 часа (в темноте). 3. Кусочек кладут на 24—
28 часов в 0,5-процентный созревший раствор гематоксилина в
70-градусном спирте, после чего промывают 1—2 дня в 70-гра-
дусном спирте и заливают в парафин или целлоидин.
Мякотные оболочки, даже 'наиболее тонкие, — четко окраши-
ваются в черный цвет.
Суправитальная окраска нервов метиленовым синим
Мелкцх водных животных окрашивают тотально. У крупных
окрашивают изолированные кусочки или краситель инъицируют
в сосуды.
При применении этих методов окраска через некоторое время
достигает своего максимума и потом опять исчезает. Поэтому
препарат приходится рассматривать тотчас же после окраски и тут
же зарисовывать или фотографировать его или, наконец, немед-
ленно зафиксировать (стр. 376). Следует сначала испробовать все
способы. Окрашивают метиленовым синим или его лейкобазой.
Окрашивание метиленовым синим было подробно разработано в
исследованиях А. С. Догеля.
К числу основных недостатков метода окраски метиленовым
синим А. Догель относит: 1) быстрое исчезновение окраски в нерв-
ных элементах; 2) неодинаковую окрашиваемость нервных элемен-
тов в различных тканях; 3) непрокрашиваемость глубоко лежа-
щих нервных элементов в ряде органов (почки, печень селезенка,
374
лимфатические узлы и т. д.); 4) доступность окрашиванию только
свежих тканей.
Все указанные недостатки побудили исследователей выяснить
их причины. В связи с этим было обращено внимание па физико-
химические свойства тканей, окрашивающих жидкостей, их темпе-
ратуру, приток воздуха и т. д.
Совершенствование методов окраски происходило сообразно
требованиям, которые предъявлялись к ним исследователями.
Первоначальные требования сводились к изготовлению микроско-
пических препаратов с устойчивой окраской, выявляющей тонкую
организацию структурных элементов нервной ткани и взаимоотно-
шение последних с другими тканями. Работая в этом направлении,
Догель и его ученики достигли прекрасных результатов, которые
и по настоящий день не теряют своей ценности. Основываясь на
своих наблюдениях, Догель предложил четыре способа примене-
ния метиленового синего: 1) инъекция в кровеносные сосуды жи-
вотного !Д—'/д-процептных растворов метиленового синего; 2) вве-
дение '/4—'/в-процентных растворов метиленового синего в поло-
сти тела и органов; 3) впрыскивание */е—'/«-процентных раство-
ров красящего вещества под кожу животного или в соединитель-
ную ткань, окружающую органы; 4) непосредственное окрашива-
ние вырезанного органа пли частей его ]/4—Vs—'/«-процентными
растворами метиленового синего.
Эффективность этих способов, как указывал Догель, зависит
от ряда условий: 1) свежесть материала; 2) слабая концентрация
метиленового синего; 3) предварительная промывка сосудов и
возможно лучшее наполнение их тепловыми растворами (36—
37°); 4) свободный доступ атмосферного воздуха к окрашиваемым
органам; 5) умение уловить оптимальный момент окоаски и
зафиксировать ее.
Метиленовый синий. Приготовляют основной 1-про-
центный раствор метиленового синего в соответствующей среде,
употребляемой для исследования (физиологический раствор пова-
ренной соли, морская вода и т. д.).
Тотальное окрашивание. Мелких прозрачных вод-
ных животных окрашивают в растворе метиленового' синего, силь-
но разведенном средой, в которой они находились. Окрашивание
удается только при условии доступа кислорода, поэтому сосуды,
в которых производят окрашивание, не следует закрывать. Кон-
центрация красителя, в зависимости от вида животного, может
быть различна. Лучше всего приготовить сначала серию раство-
ров от светло- до темно-синего цвета и потом опытным путем
найти оптимальное разведение красителя для каждого вида. Сна-
чала проверяют степень окраски каждые 2 минуты, потом каждые
]/4 или '/2 часа.
Нервы окрашиваются в синий цвет и выделяются на почти
бесцветном фоне (о фиксировании окраски метиленовым синим
375
и также лейкобазой метиленового синего и о методе окраски али-
зарином см. на стр. 380).
Окрашивание кусочков. От свежеубитых животных
берут органы или части органов и кладут на стеклянную вату,
предварительно смоченную сильно разведенным раствором мети-
ленового синего (в физиологическом растворе поваренной соли).
Кусочки, а также сделанные бритвой срезы, должны быть по воз-
можности тонкими, так как окрашиваются только их поверхност-
ные слои.
На объект наносят по каплям 1-процентный раствор метилено-
вого синего (разведенный в отношении 1:4 физиологическим
раствором поваренной соли), покрывают его так, чтобы не мешать
доступу воздуха и через некоторое время, во избежание высыха-
ния объекта, прибавляют по каплям еще более слабый раствор
красителя. Если материал взят от теплокровного животного, пре-
парат помещают в термостат при температуре 37°; если от холод-
нокровного, то обрабатывают его при комнатной температуре.
Степень окраски время от времени контролируют. О закреплении
красителей см. ниже.
Инъекция. Убивают животное, вскрывают вены, промыва-
ют кровеносные сосуды физиологическим раствором поваренной
соли, вводя его через аорту, и инъицируют г/4 — или 'Д-процент-
ный раствор метиленового синего (о технике инъицировапия см.
стр. 378), При инъицировании теплокровным животным растворы
подогреваются до температуры тела (37°). Через полчаса живот-
ное вскрывают, вырезают нужный орган и обрабатывают указан-
ным выше для органа или части его способом (приготовляют тон-
кие срезы, наносят по каплям метиленовый синий).
Впрыскивание в серозные полости может применяться и для
окрашивания нервов всего тела, но особенно уместно при изуче-
нии покровов и органов, лежашнх в серозных полостях. Самый
метод весьма прост. В серозную полость животного при помощи
шприца вводят любое количество (разумеется, соразмерное вели-
чине животного) раствора метиленового синего ('А—’/2%), — для
кролика, небольшой собаки или кошки бывает вполне достаточно
40—50 см3. Через 20—30 минут можно уже вырезать подлежащие
исследованию органы. С ними поступают, как указано выше и как
это делают после инъекции в кровеносные сосуды, т. е. вырезан-
ный орган оставляют на воздухе (лучше в термостате при 36—
37° С) некоторое время, а затем фиксируют.
Хотя метод окрашивания метиленовым синим н требует неко-
торого навыка, он все-таки бесспорно принадлежит к числу легко
выполнимых. Окрашивание получается всегда, но спустя некото-
рое время исчезает. Ввиду этого стали прибегать к употреблению
реагентов, которые закрепляли бы окрашивание надолго
(А. С м и р н о в, А. Догель).
Кусочки объекта, предназначенного для закрепления окраски,
переносят в следующую смесь: молибденовокислого аммония 1 г,
376
дистиллированной воды 10 см3, перекиси водорода 1 см3, соляной
кислоты 1 капля.
Только что приведенная закрепляющая смесь должна быть
охлажденной до температуры от +2 до —2°. Если объекты неве-
лики, то для закрепления окраски достаточно 2—3 часов; для
сравнительно больших объектов необходимо и более продолжи-
тельное время (4—5 часов). После закрепления окраски объекты
около получаса промывают в воде, а затем обезвоживают в спир-
те (холодном) и переносят в ксилол для дальнейшей заделки в
парафин (Кульчицкий).
Методы Догеля легли в основу современных макро-микроско-
пических исследований при помощи метиленового синего, методи-
ка которых детально разработана В. П. Воробьевым и его учени-
ками (Н. Кондратьев, А. Шабадаш, А. Журавлев и др.). Эти
исследования явились новым этапом в изучении элемента нерв-
ной системы и в применении метиленового синего (Ф. А. Волын-
ский, 1948).
Ученики В. П. Воробьева разработали ряд методов, которые
характеризуются тем, что нервная ткань окрашивается не чистым
раствором метиленового синего, но в него вводится «посредник»
(катализатор), способствующий более быстрому восприятию мети-
ленового синего нервной тканью, а также и дополнительные кра-
сители, усиливающие полноту окраски. Таким образом, совершен-
ствование первоначальных методов окраски метиленовым синим
связанЬ с усложнением состава окрашивающей жидкости.
Ы. Кондратьев применяет следующий состав красителя: мети-
леновый синий 1,0 а, тионин 0,2 а, железистокислый титан 0,5 а,
кипяченая вода 500 см3. Смесь выпаривается до потери 1/5—1/6
общего количества жидкости. Окраска применяется на свежем и
трупном материале. В последних случаях к ней прибавляют 20—
30 капель насыщенного раствора хлорофилла в спирте и кипятят
до полного исчезновения спирта. Применение этого красителя
дало возможность Н. Кондратьеву и его ученикам выявить тонкие
структуры, вплоть до концевых нервных аппаратов в различных
органах млекопитающих и птиц.
А. Журавлев в раствор метиленового синего вводит Fe2SO4,
а в других случаях — сернокислую магнезию (метиленовый синий
1 г, сернокислая магнезия 10 г, дистиллированная вода 100 см3).
Последний краситель он нередко комбинировал (в равных количе-
ствах) с раствором нейтрального красного (нейтральный красный
1 а, сернокислая магнезия 10 а, дистиллированная вода 1Q0 см3).
Окрашивались свежие ткани человека и животных. Особенно хо-
рошо окрашивались нервные элементы сердца (человека, собаки,
кошки, кролика, теленка), мочеполовых органов (кроме почек),
трахеи и некоторых отделов кишечника.
Ф. Волынский в своих исследованиях применял слабые рас-
творы метиленового синего (1/16—1/8—1/4%), с добавлением пе-
рекиси магния. Раствор составляется различно, в зависимости
377
от свежести материала. Свежий и живой материал окрашивался
в следующей смеси: раствор Рингер-Локка 4000 см3, метиленовый
синий 1 г, перекись магния 5 г. Несвежий материал окрашивается
в другой смеси: физиологический раствор поваренной соли —
4000 см3, метиленовый синий—1 г, перекись магния — 5 г. Все
составные части растворов готовятся отдельно, накануне опыта,
а соединяют их непосредственно перед опытом. Растворы предва-
рительно фильтруют. Метиленовый синий (1 а) растворяют в
100 см? дистиллированной воды при слабом подогревании и филь-
труют; после этого к нему прибавляют 0,5 а перекиси -магния и
взбалтывают. Перед окраской растворы подогревают до темпера-
туры 37—38°, которая поддерживается в течение всего процесса
окрашивания.
Процесс окраски состоит в следующем. Животное хлороформи-
руют до глубокого наркоза. Вскрывают грудную полость (если
необходимо окрасить один из органов брюшной полости; при
окраске органов грудной полости вскрывают брюшную полость)
и вводят в грудную аорту стеклянную канюлю (при окраске
органов грудной полости канюлю вводят в брюшную аорту), сое-
диненную с кружкой Эсмарха (нли аппаратом Боброва), в кото-
рую уже налит один из указанных растворов.
Вслед за этим надрезают нижнюю полую вену у места впаде-
ния ее в правое предсердие (при окраске органов грудной полости
надрезают верхнюю полую вену), что обеспечивает отток крови,
а затем и окрашивающей жидкости. В данном случае необходимо
обеспечить хороший приток и отток окрашивающей жидкости
к органу, не обнажая его до окончания процесса инъекции.
После промывки сосудов, в кружку вливают незначительное коли-
чество раствора метиленового синего, концентрацию которого
постепенно повышают. Первые порции смеси содержат приблизи-
тельно 0,01 %, а остальные 0,025% красителя.
Вводимая жидкость должна протекать медленно и при слабом
давлении с таким расчетом., чтобы в кровеносных сосудах и в ок-
ружающих тканях по возможности сохранилось прижизненное
давление. Эти условия обеспечивают более интенсивную окраску
нервной ткани метиленовым синим; быстрая инъекция и сильное
давление мешают окрашиванию. Для заполнения кровеносных со-
судов крупного животного требуется 1500—2000 см3 окрашиваю-
щей жидкости.
Весь процесс инъекции протекает в течение 15—20 минут.
Последние 150—200 см3 жидкости вводят при перевязанной ниж-
ней полой вене (или другом отводящем сосуде). Признаком доста-
точной наливки является посинение диафрагмы, а также кожных
покровов. Вслед за этим вскрывают брюшную (или грудную)
полость и нужный орган быстро изолируют и вынимают. При этом
рекомендуется как можно меньше его травмировать, не загрязнять,
не охлаждать и предохранять от высыхания. В полых органах
изолируют входные и выходные отверстия, органы промывают при
378
помощи шприца физиологическим раствором поваренной соли и
наполняют слабым теплым раствором окрашивающей жидкости
(температура 37—40°). При этом надо следить, чтобы напряжение
стенок органов не превышало их естественного напряжения.
Уже во время этих манипуляций нервные элементы отчетливо
выступают и могут изучаться невооруженным глазом. Полное их
выявление происходит при последующем докрашивании органа,
которое производится в таком же растворе метиленового синего
(ранее заготовленном и подогретом до 37—40°). Во время докра-
шивания препарат вынимают из жидкости через каждые 5—6 ми-
нут на '/г—1 минуту, чтобы дать доступ к нему кислороду воздуха.
Необходимо помнить, что успех окраски в значительной мере зави-
сит от расправленности стенок препарата и обмывания его окра-
шивающей жидкостью. Складки и места, касающиеся стенок бан-
ки или других препаратов, одновременно окрашиваемых в том же
сосуде, обычно плохо окрашиваются. Это затруднение устраняется
легким растягиванием препарата и подвешиванием его на нитках.
Банки должны быть стеклянными и совершенно чистыми. Процесс
окраски считается законченным, если все нервные стволы интен-
сивно окрашены и не имеют по своему ходу перерывов.
Применение описанного способа окрашивания дало возмож-
ность Ф. Волынскому и его ученикам изучать суправитальную ок-
раску различных органов у ряда млекопитающих (собака, теле-
нок, крыса, кролик) и некоторых — у человека (на нефиксирован-
ном материале). Окраска дает исключительные результаты на
мочеполовых органах (кроме почек), желудочно-кишечном тракте
и сердце. Без особого труда можно выявить как грубые, так и тон-
чайшие нервные стволы, их разветвления, сплетения и узлы,
располагающиеся на поверхности и в глубине тканей. При соот-
ветствующей обработке последних можно при слабых увеличениях
бинокулярной лупы изучать топографию клеток, узлов, их количе-
ство, величину, взаимоотношения с нервными стволами и т. д..
а при больших увеличениях микроскопа доступны исследованию и
цитологические структурные элементы.
Суправитальная окраска нервов лейкобазой метиленового синего
Вместо метиленового синего можно с успехом употреблять его
обесцвеченное основание (стр. 274). В закрытых стеклянных со-
судах готовят серию растворов разной концентрации лейкобазы.
В каждый сосуд кладут по нескольку кусочков, которые остаются
в растворе лейкобазы не менее 10 минут. Затем каждые 5 минут
из раствора красителя вынимают один кусочек и помещают на
предметном стекле (не накрывая покровным) во влажную камеру,
где он, благодаря окислению восстановленного метиленового сине-
го, синеет (контролировать под микроскопом).
После диффузного прокрашивания наступает отчетливая ок-
раска нервов, которая без покровного стекла удерживается
379
приблизительно полчаса и через 2—3 минуты после наложения
покровного стекла опять исчезает.
Закрепление окраски метиленовым синим
и его лейкобазой
1. Объект помещают на 1—24 часа, в зависимости от его вели-
чины, в 5—8-процентный раствор молибденовокислого аммония,
на каждые 20 см3 которого прибавляются 2 капли пикриново-
кислого аммония (концентрированный водный раствор + 1—
3 капли 1-процентной осмиевой кислоты). Вместо этой смеси
можно употреблять 5—8-процентный раствор молибденовокислого
аммония (на 100 см? которого прибавляют 4—6 капель 1-процент-
ной осмиевой кислоты). 2. Тщательно промывают в неоднократно
сменяемой дистиллированной воде 1—6 часов. 3. Проводят через
96-градусный спирт возможно быстрее (спирт вытягивает краску).
4. Терпинеол (сменяют два раза), ксилол, заключают в бальзам.
При окрашивании нервной системы турбелля-
р и й хорошие результаты дает следующий способ, при котором
используется ализарин.
1. Предварительная обработка животных раствором углекис-
лого лития (на 200—600 с.«3 воды, взятой из среды, в которой со-
держатся животные, 1 см3 концентрированного водного раствора
углекислого лития) от 15 минут до нескольких часов (до появле-
ния у животных признаков отравления). 2. Окраска в растворе
ализарина по Рейзингеру.
Окраска нервной ткани метиленовым синим
по методам А. Л. Шабадаша. Эти методы являются усо-
вершенствованием основных положений А. С. Догеля.
Известно, что окраска нервной ткани метиленовым синим
«капризна», причем удача или дефект техники не всегда подда-
ются предварительному рациональному учету. Переменный успех
окраски породил ряд эмпирических модификаций; вследствие не-
редких неудач техники принято готовить избыточное число препа-
ратов и отбирать для изучения удавшиеся объекты.
В противовес представлениям о том, что метиленовый синий
способен выявлять нервные элементы в силу своего «нейротро-
пнзма», Шабадаш показал, что морфологически видимый резуль-
тат окраски зависит от тканевого метаболизма.
Техника окраски по А. Ш а б а д а ш у. Принцип
составления красящего раствора — изотония, изо-
термия и оптимальная концентрация водородных ионов.
А. Шабадаш полагает, что метиленовый синий, окрашивая
нервные элементы, участвует в ферментных реакциях, течение ко-
торых регулируется определенным pH.
Массовая окраска микроструктур осуществляется при pH ниже
7,0, согласно следующей таблице:
380
Таблица 13
ОПТИМАЛЬНАЯ РЕАКЦИЯ РАСТВОРА
ДЛЯ ОКРАСКИ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ НЕРВНОЙ СИСТЕМЫ
Нервные элементы
Оптимальный
pH
Интрамуральные спле1ения дна желудка (кошка)...........
Интрамуральные сплетения кишечной трубки (кошка, собака)
Интрамуральные сплетения тонкой кишки (обезьяна).......
Интрамуральные сплетения подвздошной и толстой кишки
(обезьяна).............................................
Нервные сплетения в паренхиме почки (лягушка)..........
Цереброспинальные нервы и концевые чувствительные аппа-
раты ..................................................
6,98
5,9
6,24
5,7—5,9
4,6—5,1
6,0
Рецептура окрашивающих смесей и добавоч-
ные активаторы окраски. Вводя вместе с красителем до-
полнительные водородные акцепторы, Шабадаш получил значи-
тельное ускорение окраски, у л у ч ш е н и е ее качества и боль-
шее ее территориальное распространение. Доза добавочных
активаторов (резорцин, пирокатехин, параамидофенол и др.) со-
ставляет от 1 : 1000 до 1 : 4000 моля.
Пример окрашивающего раствора: дистиллированной воды
1000 см3, хлористого натрия 7,2 г; резорцина 0.15 г; метиленового
синего 0,2 а.
При инъекции указанного раствора (при pH = 6,2—6,0) кошке
в течение 5—20 минут происходит детальная массовая окраска
всех вегетативных сплетений кишечника, пилорической части же-
лудка, желчных путей и пузырд, семявыносящего протока и т. д.
Шабадаш показал, что усиление углеводного обме-
н а является методом получения удачных окрасок как вегетатив-
ной, так и соматической нервной системы. Пример окрашиваю-
щего раствора: дистиллированной воды 1000 см3; хлористого
натрия 7,2 г; глюкозы 1,5 г; пировинограднокислого натрия 0,32 г;
метиленового синего 0,3 а.
При pH = 5,4—5,6 смесь дает прекрасную окраску подэпите-
лиалытых сплетений мочевых путей, нервов роговицы, слизистых
оболочек и пр. При pH = 6,0 и добавлении бромистого магния
(1,25 г иа литр) осуществляется четкая окраска мякотных воло-
кон, чувствительных и моторных окончаний цереброспинального
происхождения.
Для закрепления окраски употребляют изотоническую смесь,
которую готовят насыщением 0.9—1,12-процсптного водного рас-
твора роданистого аммония оранжевыми кристаллами пикрата
аммония; растворы готовят при 60е и оставляют при этой темпе-
ратуре в термостате па 12—24 часа. Хранить их нужно в банках
темного стекла. Окрашенные объекты помещают в эту смесь иа
2—8 часов (в зависимости от толщины объекта); для органов
теплокровных животных смесь следует нагреть до 27—30°.
381
Препарат после промывки и обычной обработки заключают
в канадский бальзам.
Нейроглия
Глиофибриллярный метод Гольцера. 1. Формали-
новая фиксация. Срезы на замораживающем микротоме. 2. Сте-
клянной палочкой срезы переносят в раствор: '/з-процентной фос-
форномолибденовой кислоты — 1 часть, 96-градусного или абсо-
лютного спирта 2 части. Держат счетом 30—60—90 секунд.
3. Срезы вылавливают на чистое, обезжиренное стекло, дают стечь
жидкости, обтирают кругом среза тряпочкой и прижимают срез
2—3 раза фильтровальной бумагой, смоченной алкоголь-хлоро-
формом (на 2 см3 спирта 8 см3„ хлороформа); срезы должны при-
стать к стеклу. 4. Не давая просохнуть, на влажный срез нали-
вают краситель состава: абсолютного спирта — 2 см3, хлорофор-
ма — 8 см3, кристаллического фиолетового 0,5 г. 5. На покрываю-
щий срез краситель быстро, не давая сгущаться, льют при косом
положении стекла 10-процентный раствор бромистого калия. Кра-
ситель отходит слоями. Стараться удалить бромом зеленоватый
осадок, чтобы срез, освободившись от него, выглядел равномерно
окрашенным, черно-фиолетовым. 6. Хорошенько обтирают краси-
тель кругом среза и один раз промокают фильтровальной бумагой,
смоченной жидкостью следующего состава: анилинового мас-
ла — 4 см3, хлороформа — 6 см3, 1-процентной соляной кислоты —
1 капля. 7. Дифференцируют только что названной жидкостью до
светло-сиреневой окраски среза. 8. Проводят через ксилол,
заключают в бальзам.
МетодСнесарева. Выявление общей картины нейроглии.
1. Фиксация в формалине. 2. После промывания в воде делают
срезы на замораживающем микротоме (для глиофибриллей — как
можно более тонкие). 3. Из дистиллированной воды срез стеклян-
ной палочкой переносят на 30 секунд (счетом) в раствор: 1-про-
центной фосфорномолибденовой кислоты—10 см3, дистиллиро-
ванной воды— 10 см3. По мере надобности прибавляют, как это
определяется пробными срезами, или углекислого калия (1 : 1000)
5—10 капель, или 1-процентной уксусной кислоты 5—10 капель,
или то и другое вместе; обычно употребляют только углекислый
калий. При растворении фосфорномолибденовой кислоты для уда-
ления опалесценции, раствор слегка подогревают над пламенем
горелки и оставляют на сутки в термостате. 4. Объект быстро спо-
ласкивают в дистиллированной воде. 5. В широкой бактериологи-
ческой чашке с дистиллированной водой срез распластывают на
поверхности воды и вылавливают его предметным стеклом, сма-
занным белком с глицерином и слегка подсушенным. 6. Дают
стечь воде, обтирают кругом среза сухой тряпочкой и повторно
раза два промокают сложенной вчетверо фильтровальной бума-
гой, но не сухой, а смоченной в растворе метилового спирта с хло-
382
роформом (в отношении 1 к 2 или 1 к 3 или 4) и далее непродол-
жительное время поливают этим раствором. Требуется, таким об-
разом, укрепить срез на стекле и слегка обезводить его (просвет-
лить), но не давать при этом высыхать. 7. На еще влажный пре-
парат наливают краситель Май-Грюнвальда и красят недолго
(доли минуты)., чтобы избежать перекрашивания ядер. 8. Добав-
ляют 1—2 капли дистиллированной воды и продолжают окраску.
9. Смывают краситель в дистиллированной воде и дифференци-
руют срез уксусной кислотой (1 часть ледяной уксусной кислоты,
2 части воды). Ведут дифференцировку до четкого выявления бе-
лого и серого вещества мозга. 10. Промывают в воде и докраши-
вают эритрозином 3—5 минут (можно с подогреванием): 1 г эри-
трозина на 150 в дистиллированной воды и 2—3 капли ледяной
уксусной кислоты. 11. Хорошо промывают препарат в дистиллиро-
ванной воде. 12. Дают стечь воде, вытирают кругом среза тря-
почкой и повторно просушивают фильтровальной бумагой. 13. Бы-
стро проводят через ацетон, ксилол и заключают в бальзам.
В нервных клетках ядрышко окрашивается в розовый цвет;
тельца Негра—в темно-голубой; аксоны миэлиновых волокон —
в синий; миэлин — в красный цвет; ядра глиальных клеток —
красные; глиофибриллы — сииие; хорошо красятся патологические
зернистости глии.
Неудача окраски чаще всего зависит от передерживания среза
в фосфорномолибденовой кислоте (получается зеленое закраши-
вание). Нужно стремиться к совершенной отчетливости всех
структур, особенно ядер глии.
Можно окраску вести с конца, т. е. сначала диффузно окра-
сить срез эритрозином, потом, после споласкивания в воде, опу-
стить его в фосфорномолибденовую кислоту и далее красить так,
как указано выше.
Этот метод менее элективен, чем метод Гольцера. Но у него
есть свои положительные стороны: он позволяет выявить различ-
ные структурные элементы контрастно и многокрасочно, причем
и такие элементы, которые другими методами или не окрашивают-
ся или окрашиваются только после сложных подготовительных
процедур.
Метод Кахаля выявляет протоплазматическую глию. Наи-
лучшие результаты метод дает при изучении мозга человека и ла-
бораторных животных (собака, кошка и т. д.) как взрослых, так
и эмбрионов.
1. Фиксация кусочков мозга или мозжечка в 14-процентном
формалине 1—2 дня. Более тонкая импрегнация получается, если
к 100 см3 14-процептного формалина прибавить 2 г бромистого
аммония. 2. Срезы на замораживающем микротоме. Срезы поме-
щают непосредственно в 4—6-процентный формалин. 3. Быстро
споласкивают последовательно в двух чашечках с дистиллирован-
ной водой. 4. Кладут срезы на 6—10 часов в следующую смесь:
1-процентного хлорного золота (химически чистого) — 10 см3,
383
дистиллированной воды — 50 см3, 5-процентной сулемы— 10 см?.
Иногда полезно разбавить смесь пополам водой. На 8—10 срезов
нужно взять не менее 30 см3 смеси. 5. Тщательно промывают сре-
зы в дистиллированной воде. 6. Закрепляют в 6-процентном гипо-
сульфите (к 100 см? прибавить 1 г квасцов). Иногда полезно при-
бавить несколько капель насыщенного раствора кислого сернисто-
кислого натрия. 7. Обезвоживают в спиртах, просветляют в ори-
гановом масле и заключают в бальзам.
Олигодендроглия, микроглия
Метод Р ио-Гор тег а для м и к р о г л и и. Метод
требует химически абсолютно чистых реактивов.
1. Маленькие кусочкй фиксируют 1—8 дней (в темноте; в хо-
лодное время года фиксатор с материалом помещают в термостат
—37°) в смеси: формалина—14 см3, бромистого аммония — 2 г,
дистиллированной воды — 86 см3. 2. Перед резкой кусочки в све-
жем фиксаторе помещают на 10 минут в термостат при 50—55°.
3. Резка на замораживающем микротоме; срезы (10—30 и) обра-
батывают аммиачной водой (1 капля на 25 см? дистиллированной
воды), быстро споласкивают водой и переносят па 10 минут
в раствор серебра. Приготовление раствора серебра: к смеси
5 см3 10-процентпого азотнокислого серебра и 20 см3 5-про-
центного углекислого натрия (дающего значительный осадок)
прибавляют по каплям 25-процептный аммиак до полного рас-
творения осадка; затем добавляют 15 см3 дистиллированной
воды. Смесь храпят в темной склянке. 4. После серебра срезы, не
промывая, переносят в 10-процентный нейтральный формалин,
где они принимают темно-коричневый цвет. Процесс восстановле-
ния серебра идет лучше, если срезы приводить в движение стек-
лянной палочкой. 5. Промывают в воде и золотят 10—15 минут
в растворе хлорного золота (7 капель 1-процентного хлорного зо-
лота па 3 см3 дистиллированной воды). Срезы принимают серый
тон, после чего их переносят в 5-процентный раствор гипосульфи-
та на 7г минуты, затем хорошо промывают водой в течение часа.
G. Срезы наклеивают белком, обезвоживают 96-градусиым спир-
том, осторожно просушивают фильтровальной бумагой. Затем
обливают смесью креозота (1 часть) и 10-процентного карболово-
го ксилола (9 частей), промывают фильтровальной бумагой и за-
ключают в канадский бальзам.
Метод Псифильда для олигодендроглии и
м п к р о г л и и является модификацией метода Рио-Гортега.
1. Фиксация формалином или смесью Кахаля. 2. Срезы (20 ч)
на замораживающем микротоме. Срезы промывают 12 часов в
воде, к которой прибавлено 10—15 капель аммиака. 3. Переносят
на 1 час (при 38°) в смесь 5 см3 40-процентной бромоводород-
ной кислоты и 95 см? дистиллированной воды, затем промывают
дистиллированной водой, трижды ее сменяя. 4. Срезы обрабаты-
вают 5-процентным раствором углекислой соды в течение часа,
384
помещают на 3—5 минут в раствор углекислого серебра (по Рио-
Гортега), где они становятся желтовато-серыми. Когда весь срез
становится ровно серым, его переносят в 1-процентный формалин
для восстановления. 5. Промывают водой, золотят и заключают в
бальзам.
Пенфильд предлагает еще одну модификацию. Фиксация от 2
до 48 часов в смеси: формалин — 20 см3, мочевина — 4 г, йоди-
стый калий — 6 г, дистиллированная вода — 80 см3.
Промывают, как в первой модификации, затем п. 2 и п. 3 (1 —
90 минут), проводят через 60-градусный спирт и дальше, как в
п. 4.
Польский гистолог Б аги нс кий (1955) предложил м е т о д
селективной импрегнации нейроглии. 1. Малень-
кие кусочки (3—4 мм) фиксируют 24 часа в смеси: 2-процентный
раствор нитрата бария [Ba(NO3)2] 50 см3, нейтральный формалин
15 см3, дистиллированная вода 100 см3. 2. Промывают 5 минут в
дистиллированной воде. 3. Импрегнируют 48 часов (в темноте)
в 1—1,5-процентном растворе азотнокислого серебра. 4. Споласки-
вают 2—3 минуты дистиллированной водой. 5. Обрабатывают
24 часа смесью: гидрохинон 1,5— 2 г, нейтральный формалин
15 см3, дистиллированная вода 100 см3. 6. Промывают
24 часа в проточной воде. 7. Быстро обезвоживают и заключают в
парафин. Срезы (15—20 и) можно обработать 0,2-процентным
раствором хлорного золота и докрасить ядра'гематоксилином или
другими красителями. Метод дает четкие результаты при условии
использования химически чистых реактивов pro analisi. Селектив-
но серебрятся макроглия, микроглия и олигодендроглия.
МЕТОД КУЛЬТИВИРОВАНИЯ ТКАНЕЙ И ОРГАНОВ
В ОРГАНИЗМЕ ПО Ф. М. ЛАЗАРЕНКО
Метод Ф. М. Лазаренко дает возможность длительно
культивировать в организме ткани различных органов. Удается
получать органотипический рост эпителиальной ткани под-
желудочной, щитовидной и других, желез (Ф. М. Лазаренко),
зобной железы (Ш. Д. Галустян).
Подготовка' опыта заключается в приготовлении измельчен-
ного целлоидина, стерилизации физиологических растворов,
бактериологических чашек и инструментов и, наконец, в под-
готовке животных — донора и реципиента.
Обычно пользуются продажным целлоидином в плитках.
Целлоидин разрезают на кусочки, имеющие форму кубиков при-
близительно в 0,5 мм в поперечнике. Измельченный таким
образом целлоидин кипятят в физиологическом растворе по-
варенной соли (NaCl—0,8%)в течение 1—2 часов для того,
чтобы удалить из него спирт и эфир. Рекомендуется в некоторых
случаях кипятить целлоидин в растворах хлористого натрия
более высоких концентраций до 3 и даже 5%. Установлено, что
25 Микроскопическая техника
385
такой целлоидин обусловливает более резкую воспалительную
реакцию и более полное разрастание новообразующихся органов.
При кипячении кусочки уменьшаются приблизительно в два раза.
Далее кусочки переносят в новую порцию физиологического
раствора поваренной соли и вместе с ней стерилизуют в авто-
клаве.
Заблаговременно также приготовляют и стерилизуют физио-
логический раствор поваренной соли (50—100 см3), необходимый
при операции. Можно пользоваться раствором Тироде, но, как
показали опыты, применение обычного физиологического рас-
твора поваренной соли (NaCl — 0,8%) не изменяет результатов.
Бактериологические чашки стерилизуют обычно в сушильном
шкафу завернутыми в бумагу. Кроме скальпелей, хирургических
пинцетов, пинцетов Кохера и ножниц, при операции требуются
желобоватые и пуговчатые зонды, тонкие изогнутые пинцеты
и тонкие изогнутые ножницы. Все инструменты стерилизуют как
обычно перед всякой операцией.
В большинстве опытов, описываемых ниже, в качестве доно-
ров и реципиентов были использованы кролики различных пород
и возрастов во всевозможных взаимных сочетаниях. Кроме
кроликов пользовались овцами (в качестве доноров брали за-
родышей овец, получаемых на бойне), собаками, морскими
свинками, белыми мышами, курами и их зародышами.
Подготовка животного заключается в удалении у него шер-
стного покрова на операционном поле: у реципиента на брюшной
стенке в 5 см шириной и в 6—7 см длиной, а у донора
в зависимости от органа, который предполагается использовать.
Животное для операции фиксируют на станке и вносят в опе-
рационную закрытым, вместе со станком, стерильными
простынями.
В операционной необходимо, кроме операционного стола,
иметь еще второй столик, на котором происходит обработка
органов, предназначенных для посева. На этом столе приходится
особенно тщательно соблюдать правила асептики.
Перед операцией на посевном столе, застланном стерильной
простыней, расставляют бактериологические чашки. Под ближай-
ший край чашки подкладывают пинцет так, чтобы она оказа-
лась в слегка наклонном положении. В бактериологические
чашки наливают жидкость Тироде, заполняющую только четверть
дна чашки. Далее в сухую часть чашки из физиологического
раствора поваренной соли переносят ложечкой измельченный
целлоидин и складывают небольшой кучкой. После этого чашку
закрывают.
На посевном столике нужны следующие инструменты: же-
лобоватые и пуговчатые зонды, тонкие изогнутые ножницы
и пинцеты. Их сохраняют в положенной на бок простерилизован-
886
ной стеклянной прямоугольной банке так, чтобы важнейшие
части этих инструментов были закрыты от попадания на них
сверху инфекции.
Операция складывается из трех моментов: взятия у донора
посевного органа, обработки посевного материала и собственно
посева этого материала реципиенту.
С соблюдением полной асептики у донора вырезают кусочек
намеченного для опыта органа и переносят в подготовленную,
как только что указывалось, бактериологическую чашку,
в физиологический раствор поваренной соли. Чашку вновь за-
крывают, а донора уносят.
Приготовление посевного материала заключается в следую-
щем. Кусочек органа выдвигают из жидкости на середину чашки
и, поддерживая пинцетом, многократно разрезают и размельчают
изогнутыми ножницами. Из кусочка органа получается бес-
форменная кашица, прилипаюшая к остриям ножниц и пинцету.
Предел измельчения наступает тогда, когда в этой кашице не
остается кусочков больших чем ’/г мм. Полученную липкую
кашицу сдвигают в физиологический раствор поваренной соли
и слегка промывают в нем при помощи пинцета. При этом
слипающиеся кусочки органа должны разойтись друг от друга
и должны быть смочены жидкостью со всех сторон. Промытый
таким образом материал вновь сдвигают на сухую часть чашки
и тщательно перемешивают с заранее подготовленным измельчен-
ным целлоидином. Лучшие результаты получаются, когда
в конгломерат соединяют два объема измельченного целлоидина
и один объем, или еще меньше, частиц подлежащего посеву
органа. Наконец конгломерат опять сдвигают к краю жидкости
и помещают так, чтобы его частицы не расплывались, но в то же
время обильно смачивались и пропитывались жидкостью. После
этого чашку закрывают.
У реципиента на брюшной стороне, тела параллельно белой
линии производят разрез кожи в 2—2,5 см. На середину обоих
краев разреза кожи накладывают пинцеты Кохера. Затем края
кожи слегка растягивают в стороны этими зажимами, опуская
их после этого по боковым сторонам животного. Таким образом,
открывается достаточно большое окно к фасции. Если при этом
появляется кровь, то ее тщательно удаляют марлевыми шари-
ками. Далее двумя хирургическими пинцетами фасцию разры-
вают, при этом появляется доступ в область между ней
и мышцами брюшной стенки. Фасцию разрывают пинцетами,
а не разрезают скальпелем, так как при этом легче избежать
кровоизлияния. Отсутствие крови под фасцией является не-
пременным условием успешности опыта.
Далее каудальный край фасций несколько приподнимают,
под него вводят зонд (также каудально) и образуют пазуху
глубиной в 3 см. На конец желобоватого зонда накладывают
посевной конгломерат, величиной с небольшую горошину, и раз-
25* 387
равннвают его по желобку. Край фасции вновь приподнимают,
и в открытую пазуху до слепого ее конца вводят зонд с посев-
ным конгломератом. Пуговчатым зондом посевной материал
сдвигают с желобка, и оба зонда вынимают из пазухи. Кожный
разрез зашивают. Легким надавливанием пальца на кожу
конгломерату придают плоскую форму.
Только что сказанное относится к операциям, производимым
на кроликах.
При использовании крупных животных, например, овец или
очень мелких, например, мышей или, наконец, птиц, отдельные
приемы приходится несколько изменять.
Применение смачивающих и эмульгирующих агентов и по-
верхностноактивных веществ в микроскопической технике.
В микроскопической технике применение поверхностно
активных веществ (детергентов) может идти, по крайней мере,
двумя путями. Первый — это использование таких веществ для
гистохимического анализа. В качестве примера укажем на
применение сапонина или солей желчной кислоты для анализа
прочности связей рибонуклеиновой кислоты с протеинами цито-
плазмы (Г. Роскин и М. Струве).
Другой путь — это введение поверхностно активных веществ
в рецептуру красителей, что чрезвычайно повышает скорость про-
никновения красителей в субстрат, а также увеличивает интен-
сивность эффекта окрашивания. Диамонд (1945) предложил сле-
дующий быстрый метод окраски гематоксилином после сулемо-
вых фиксаторов: 1. 4-процентный раствор железных квасцов —
5 минут; 2. Сполоснуть дистиллированной водой. 3. Красить
5 минут в свежеприготовленном растворе гематоксилина, к
30—40 см3 которого прибавлена 1 капля тергитоля 7 (готовят
сперва 5-процентный раствор гематоксилина в 96-градусном
Спирте, перед употреблением разводят дистиллированной водой
1 : 10). 4. Сполоснуть дистиллированной водой и дифференциро-
вать 3—5 минут насыщенным водным раствором пикриновой кис-
лоты, сполоснуть дистиллированной водой, затем обработать (до
посинения срезов) проточной водой. 5. Спирты, ксилол, бальзам.
Другим примером может служить метод окраски клеточных
стенок у микроорганизмов по Диару (1947). 1. Мазки фиксируют
сухим жаром. 2. На предметное стекло наливают 3 капли 34-про-
центного раствора хлористого цетилпиридиниума, добавляют
1 каплю насыщенного водного раствора красного конго. 3. Промы-
вают водой, докрашивают метиленовым синим, споласкивают во-
дой; 4. Сухие мазки рассматривают в кедровом масле. Можно вы-
сказать предположение, что использование поверхностно-активных
веществ при окраске таких трудных объектов, как например,
центросомы, жгуты, нейрофибриллы и т. п. позволит с успехом
разрешить задачу селективного окрашивания ряда клеточных
компонентов.
РАЗДЕЛ ДЕСЯТЫЙ
НЕКОТОРЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
БЕСПОЗВОНОЧНЫХ
МЕТОДЫ ИССЛЕДОВАНИЯ ПРОСТЕЙШИХ
Наблюдения в живом состоянии
Одним из основных методов изучения строения, простейших
является наблюдение их в живом состоянии. Весьма важно регу-
лировать при этом освещение. В ярком проходящем свете при от-
крытой диафрагме и поднятом осветителе детали строения про-
зрачных простейших почти неразличимы. Необходимо, регулируя
отверстие диафрагмы и положение осветителя, несколько затем-
нять поле зрения. При достаточном навыке можно рассмотреть
почти все подробности строения простейшего.
Свободиоживущих простейших необходимо рассматривать
в естественной для них среде—пресной или морской воде, или
же в той жидкости, в которой они культивируются; паразитиче-
ских — в тканевой или полостной жидкости хозяина. В случае
необходимости можно пользоваться физиологическим раствором.
При длительном изучении паразитов теплокровных животных
следут применять нагревательный столик.
Простейшее в капле соответствующей жидкости помещается
на предметное стекло и накрывается покровным. При длительном
наблюдении для предотвращения испарения воды и связанного
с этим повышения концентрации солей края покровного стекла
надо обмазывать парафином или вазелином.
Для длительного наблюдения следует пользоваться также
висячей каплей во влажной камере (стр. 36). Для того, чтобы
предохранить объекты от раздавливания покровным стеклом, на
нем часто делают восковые ножки. Для этого углами покровного
стекла осторожно царапают воск, предварительно размягченный
пальцами. Благодаря этому иа углах покровного стекла образу-
389
ются небольшие восковые ножки, препятствующие опусканию
стекла и раздавливанию объекта. Лучше брать не чистый воск, а
приготовленную при нагревании смесь его с терпентином (2,5 г
воска и 1 г терпентина).
Для этой же цели под покровное стекло подкладывают тон-
кие стеклянные нити, волосы и т. п.
Изучение часто затрудняет подвижность простейших, особен-
но инфузорий. Для уменьшения подвижности можно перенести
простейших в каплю не густого раствора вишневого клея или чи-
стого гуммиарабика, но надо иметь в виду, что нередко при этом
происходит деформация тела животного. Хорошие результаты
дает подкладывание под покровное стекло волокон фильтроваль-
ной бумаги, гигроскопической ваты и т. п. Благодаря тигмотакси-
су инфузории останавливаются около волоконец часто на доволь-
но продолжительное время. Наконец, можно осторожно надав-
ливать на простейших покровным стеклом, отсасывая воду филь-
тровальной бумагой. У некоторых инфузорий (стентор, сувойки)
можно добиться тепловой анестезии, очень осторожно нагревая
их до 30—35°. Анестезия при помощи обычных анестезирующих
веществ почти никогда не удается.
Все предметные и покровные стекла, камеры, часовые стекла
и т. п., в которые помещаются простейшие для наблюдения, дол-
жны быть совершенно чистыми и употребляться только для при-
жизненных наблюдений. Мыть стекла нужно сначала мылом, по-
том горячей проточной водой и наконец дистиллированной водой.
Если они были в соприкосновении с фиксаторами, ядами и т. п.,
то их нельзя употреблять для живых простейших. Стекла следует
вытирать платками, употребляемыми ис к л.ю ч ит е л ь н о для
этой цели. Несоблюдение всех этих правил влечет за собой ги-
бель простейших.
Для прижизненного изучения строения простейших следует
широко пользоваться темным полем, в котором ряд деталей их
строения виден значительно лучше, чем при обычном освещении
(жгуты, реснички, мембранеллы, цирры, скелетные нити, различ-
ные зерна и т. д.).
Для изучения токов жидкости, вызванных движением простей-
ших, и процессов образования в них пищеварительных вакуолей
в воду надо добавлять мелкорастертый кармин или тушь (не жид-
кую, натереть с палочки сухой туши!). Цвет взвеси должен быть
серым для туши и светло-розовым для кармина. Через 10—15 ми-
нут в теле инфузорий будут хорошо заметны черные или красные
пищеварительные вакуоли.
Лучшим прижизненным красителем для простейших является
нейтральный красный в разведении 1 : 200 000 и слабее. Более
сильные концентрации его (1 : 10 000— 1 : 50 000) оказывают
уже слабое токсическое действие. При помощи нейтрального крас-
ного можно изучать реакцию пищеварительных вакуолей; в кис-
лой среде ои красный, в щелочной — желтый. Для этой же цели
390
можно применять слабый раствор конго красного. В кислой среде
он синий, в щелочной — красный. Для прижизненного окрашива-
ния можно применять также из основных красителей — нильский
синий в концентрации 1 : 30 000— 1 : 300 000; яркий крезиловый
синий— 1 : 10 000— 1 : 60 000. Из кислых красителей употребля-
ют трипановый синий — 0,5—1 г в 100 ел3 дистиллированной во-
ды или физиологического раствора. Растворять 10 минут при ки-
пячении, профильтровать. Раствор хранить на холоду. .Можно упо-
треблять в течение месяца; затем он становится токсичным. Пе-
ред употреблением разбавлять 1 : 5 000— 1 : 10 000.
В заключение следует еще раз указать, что изучение простей-
ших в живом состоянии совершенно необходимо. Всякая, даже
самая совершенная фиксация влечет за собой свертывание бел-
ков и связанное с этим хотя бы некоторое изменение структур.
Поэтому чрезвычайно желательно во всех случаях сравнивать
фиксированный и живой объект. При наблюдении многоклеточных
это часто очень затруднительно, а во многих случаях и просто
невозможно. Выделение клеток или тканей из организма много-
клеточного животного уже само по себе повреждает клетки н если
исключить наблюдение культуры тканей и некоторых прозрач-
ных животных, то обычно приходится наблюдать не живые, а пе-
реживающие клетки. Простейшие микроскопически малы, про-
зрачны, могут долго жить в условиях, позволяющих вести наблю-
дение под микроскопом и поэтому представляют собой превосход-
ные объекты для изучения в живом состоянии и экспериментиро-
вания. Нужно использовать при этом все возможности, которые
дает современная микроскопия (исследование в проходящем све-
те, темное поле, фазово-контрастная микроскопия, аноптральный
микроскоп, витальное окрашивание и т. д.)'.
Фиксация
К фиксации простейших применимы в общем те же правила,
которые описаны для фиксации клеток и тканей многоклеточных
животных (стр. 95 и сл.). Но подготовка объектов для фиксации
имеет свои особенности, которые зависят от того, имеем ли мы де-
ло со свободноживущими формами, полостными или тканевыми
паразитами.
Для приготовления препаратов из тканевых паразитов фикси-
руют кусочек органа, содержащий простейших, и затем обраба-
тывают его так же, как обычно.
Из полостных и кровяных паразитов приготовляют мазки па
предметных или покровных стеклах (стр. 132). Например, для
приготовления мазка из паразитических кишечных инфузорий,
грегарин и т. д. берут пинцетом кусочек вскрытого зараженного
кишечника, прикладывают к стеклу и слегка размазывают. Часть
простейших в результате этого окажется на стекле. При фикса-
ции белок, имеющийся в среде, окружающей простейших (кровя-
391
ная плазма, содержимое кишечника), коагулирует и они приклеи-
ваются к стеклу, что весьма облегчает их дальнейшую обработку.
Мазок следует фиксировать до того, как он высохнет. Высу-
шивать мазки можно в тех случаях, когда желают только убе-
диться в наличии простейших во взятом материале. В ряде слу-
чаев после высушивания простейших хорошо сохраняются их жгу-
ты, реснички, структуры пелликулы; наконец, объект иногда при-
ходится высушивать для дальнейшего цитохимического исследо-
вания его, потому что при этом сравнительно мало изменяется
химический состав клетки. Во всех остальных случаях нужно
фиксировать влажный мазок.
При изготовлении «сухого» мазка следует делать его как мо-
жно более топким и быстро высушивать. Абсолютно недопустимо
высушивать влажный мазок на какой-либо стадии его дальней-
шей обработки.
Сухие мазки фиксируют абсолютным спиртом или смесью рав-
ных частей спирта и эфира. Затем мазок вновь быстро высуши-
вают, после чего он может долго сохраняться. Стекла, на которых
делают мазки, должны быть совершенно обезжирены, иначе ма-
зок не приклеится.
Влажные мазки лучше делать на покровных стеклах, тогда
для дальнейшей обработки их потребуется меньше реактивов и
красителей и, кроме того, его можно на любой стадии обработки
рассматривать с иммерсионным объективом.
После приготовления мазка его нужно фиксировать как можно
быстрее, но в некоторых случаях для лучшего приклеивания (со-
держимое кишечника и т. п.) приходится мазок несколько под-
сушить (но не высушить!).
Покровное стекло следует бросить мазком вниз на фикси-
рующую жидкость так, чтобы стекло на ней плавало. Фиксатор
лучше наливать в сосуд с выгнутыми стенками (большое часовое
стекло и т. п.), чтобы при опускании стекла в жидкость его мо-
жно было легко вынуть.
Дальнейшую обработку мазка следует вести так же, как это
указано для наклеенных парафиновых срезов. Нужно только
иметь в виду, что простейшие очень тонки и поэтому время про-
мывки может быть сокращено по сравнению со временем, необ-
ходимым для промывки кусочков. При промывке и окраске по-
кровные стекла должны плавать на поверхности жидкости.
Удобно также для обработки мазков различными реактивами
и красителями пользоваться специальной камерой, которую лег-
ко приготовить самому.
На предметное стекло канадским бальзамом приклеивают две
полоски стекла (можно приготовить из другого предметного стек-
ла) на таком расстоянии, чтобы на них могло опереться покровное
стекло. На эти полоски кладут покровное стекло мазком вниз и
образовавшуюся камеру заполняют водой или соответствующим
реактивом. Чтобы стекло не сдвинулось, его прикрепляют кусоч-
392
ками воска. Смену жидкостей можно производить, оттягивая одну
жидкость полоской фильтровальной бумаги и прибавляя другую
пипеткой с противоположной стороны камеры. Верхнюю поверх-
ность покровного стекла надо предварительно насухо вытереть.
В такой камере можно наблюдать за объектом даже при помо-
щи иммерсионного объектива.
В некоторых случаях, когда в ткани имеется много паразити-
ческих простейших, удобно приготовить препарат-отпечаток. Для
этого соответствующий орган разрезают и прижимают поверхно-
стью разреза к покровному стеклу. Дальнейшая обработка ве-
дется. как выше описано для мазков.
Для приготовления препарата из простейших, культивируе-
мых па поверхности агара, покровное стекло накладывают на ага-
ровую пластинку (предварительно убедившись, что в этом месте
есть простейшие), снимают и немедленно бросают в фиксирую-
щую жидкость.
Такой мазок очень быстро сохнет и поэтому стекло после сня-
тия с агара надо как можно быстрее класть на фиксатор. Иногда
между стеклом и агаром остаются капельки воздуха; чтобы изба-
виться от них, надо или класть сначала стекло одним ребром на
агар и при помощи пинцета осторожно его опускать, или же осто-
рожно надавливать на стекло пальцем.
В некоторых случаях хорошие результаты при -приготовлении
препаратов простейших, культивируемых на агаре, дает фиксация
их через агар. Из агаровой пластинки с культурой простейших
вырезается четырехугольный кусочек, по размерам меньший, чем
покровное стекло. Его кладут в плоский сосуд (культурой вверх),
накладывают покровное стекло и осторожно приливают фиксатор
так, чтобы уровень его несколько не доходил до стекла. Фиксатор
диффундирует сквозь агар и фиксирует объекты. При этом спо-
собе фиксации следует опасаться возникновения артефактов. Пос-
ле закончившейся фиксации покровное стекло снимают, или луч-
ше через соответствующее для данного фиксатора время прили-
вают фиксирующую жидкость, и-стекло само всплывает.
Свободноживущих простейших приходится обычно
фиксировать в часовых стеклах или солонках. Предварительно
тонко оттянутой пипеткой из культуры убирают лишнюю воду.
Затем быстро приливают большое количество фиксирующей жид-
кости. Можно также набрать густую взвесь простейших в пипетку
и быстро впрыснуть их в фиксатор. Дальнейшую обработку (про-
мывку, обезвоживание и т. д.) ведут, перенося под лупой пипет-
кой материал из одного часового стекла в другое или (лучше)
всю обработку ведут в одном и том же часовом стекле, оттягивая
реактивы пипеткой и заменяя их другими.
Иногда свободноживущих простейших удается приклеить к по-
кровному стеклу следующим способом: на покровное стекло по-
мещают простейших в капле воды, оттягивают пипеткой возмож-
но большее количество жидкости так, чтобы простейшие не под-
393
сохли, и затем с небольшой высоты бросают покровное стекло
плашмя в фиксатор, простейшими вниз.
Мелких амеб, жгутиковых, инфузорий удобно фиксировать
следующим способом: покровное стекло кладут на поверхность
культуры простейших так, чтобы оно плавало. Через 15—20 ми-
нут на нижней поверхности стекла собираются простейшие. Стек-
ло осторожно вынимают, под лупой или микроскопом убеждаются
в наличии простейших и фиксируют так же, как указано выше.
В большинстве случаев простейшие хорошо приклеиваются, что,
понятно, значительно облегчает их дальнейшую обработку.
При всех методах приготовления мазков из свободно живу-
щих простейших полезно стекло покрыть слоем белка с глицери-
ном (см. стр. 151).
Э. Э. Вегенер разработала хороший способ прочной наклейки
инфузорий, устраняющий потерю материала и пригодный для лю-
бого способа фиксации.
Фиксация материала производится не на предметном стекле,
а в солонках или часовых стеклах. Затем парамеций или других
простейших доводят до 96-градусного спирта. На чистое предмет-
ное стекло, предварительно смазанное белком с глицерином (не-
сколько гуще, чем обычно), наносится маленькая капля спирта с
парамециями. Парамеции непрочно приклеиваются. Не давая вы-
сохнуть спирту, быстро, но осторожно пускают по стеклу струю
смеси абсолютного спирта с эфиром (1 : 1) и наносят на приклеив-
шихся инфузорий каплю очень жидкого целлоидина; все стекло
еще раз заливают спиртом с эфиром, затем подсушивают на воз-
духе 10—20 минут и помещают в 70-градусный спирт для уплот-
нения целлоидина. После такой наклейки препарат можно красить
любыми красителями. Инфузории совершенно не деформируются.
Тончайший слой целлоидина не мешает ни прокрашиванию объ-
екта, ни микроскопированию.
Необходимо соблюдать следующие меры предосторожности:
1) не дышать на стекло во время наклейки; 2) употреблять очень
жидкий целлоидин, 3) давать стеклу хорошо высохнуть перед
опусканием в 70-градусный спирт. Э. Э. Вегенер считает, что этот
метод вполне пригоден для наклейки на стекло не только инфу-
зорий, но и других микроскопических организмов.
Время фиксации должно быть не слишком долгим. Нужно
помнить, что в микроскопической технике указывается время фик-
сации для кусочков органов, а размеры простейших весьма малы.
Поэтому же время отмывки и обработки различными реактивами
может быть короче, чем это обычно указывается. Это относится,
конечно, к изготовлению тотальных препаратов или мазков. При
фиксации кусочков ткани с паразитами следует руководствовать-
ся обычными сроками.
При фиксации простейших в общем можно пользоваться всеми
фиксаторами, употребляемыми в цитологии, или гистохимии как
для сохранения общей структуры клетки, так и для выявления от-
394
дельных ее органоидов (аппарат Гольджи, хондриосомы и т. п.).
Ниже будут приведены фиксаторы, чаще всего применяющие-
ся и дающие лучшие результаты при исследовании простейших.
Пары осмиевой кислоты дают хорошие результаты при фикса-
ции мазков, отпечатков и свободиоживущих простейших (стр. 112). 1-процент-
иый или 2-процентиый водный раствор осмиевой кислоты наливают в низкий
сосуд, диаметр которого несколько меньше диаметра покровного стекла. Верх-
ний край сосуда должен быть плоско отшлифован и смазаи вазелином. Можно
пользоваться также предметным стеклом, к которому канадским бальзамом
приклеено стеклянное кольцо с отшлифованным верхним краем. Расстояние
между поверхностью осмиевой кислоты и объектом, находящимся на покров-
ном стекле, не должно превышать 0,5 см. Фиксировать 1—5 минут. Более дли-
тельная фиксация ведет к импрегнации объектов осмием (почернение) и вредно
действует иа их последующую окраску.
Смесь Флемминга (стр. 113) хорошо фиксирует, но часто Дает артефак-
ты. Лучше в ней несколько уменьшать количество уксусной кислоты (до Я
или даже до '/ю обычного), хотя это несколько ослабляет последующую
окраску. Фиксируют от 10 минут до 12 часов. Обязательна длительная (не
меньше 1 часа) промывка. Хорошие результаты дает и смесь Мевеса.
Смесь Шаудина (стр. 120) фиксировать от 5 минут до 2 часов, затем по-
местить в 70-градусиый спирт с иодом и т. д.
Сулема с уксусной кислотой (5-процентиого водного раствора сулемы
100 см3, уксусной кислоты — 3—5 с.ч3). Фиксировать от 10 минут до 6 часов,
перенести в 30—70-градусиый спирт. Для фиксации морских простейших су-
лему следует разводить в морской воде. В этом случае объект до перенесения
в спирт Vs—2 часа отмывать й дистиллированной воде. Обычно дает такие
же хорошие результаты, как и жидкость Шаудина.
Смеси Ценкера и Гелли (стр. 119). Фиксировать 1—2 часа. Дают
хорошие результаты, ие вредят последующей окраске (иногда только плохо
удаются окраски по Романовскому и по Майну). Плохо приклеивают.
. Смесь Буэна (стр. 116). Очень широко применяется для фиксации про-
стейших. Фиксировать 15 минут — 3 часа, затем хорошо промыть в 70-
градусном спирте. Хорошо приклеивает объекты к покровному стеклу. Со-
вершенно ие вредит окраске.
Смесь Буэна — Дюбоска (стр. 116) применяется для фиксации цист про-
стейших и вообще трудно проницаемого материала. Фиксировать от 10 минут
до 6 часов, затем промывать в 70-градусиом спирте. Очень хорошо приклеи-
вает простейших к стеклу *
Для фиксации цист часто применяется смесь Карнуа (стр. 106), для фик-
сации фибриллярных структур смесь Суза (стр. 120).
Заливка в парафин
Для заливки в парафин простейших, паразитирующих в тка-
нях, заливают обычным способом кусочек ткани или органа, в ко-
торых находятся простейшие. Можно также заливать плотное со-
держимое кишечника, вырезанные кусочки культур на агаре и
т. п. Во всех других случаях, например, свободиоживущих прос-
тейших приходится заливать поодиночке, перенося их пипеткой из
среды в среду, что довольно трудно, или же, чтобы не потерять
материал при заливке, следует пользоваться нижеприведенными
способами.
1. Простейших фиксируют в центрифужной пробирке (ручной
центрифуги) с оттянутым на конце носиком. По истечении вре-
мени, необходимого для фиксации, центрифугу приводят в движе-
ние, вследствие чего простейшие осаждаются на дне пробирки.
395
Фиксатор сливают, наливают воду или спирт для промывки и
вновь центрифугируют. Таким же образом производят обезвожи-
вание спиртами и просветление ксилолом, бензолом или хлоро-
формом. В парафин заливают в часовом стекле. Наливают пара-
фин в стекло, дают ему затвердеть, в застывшем парафине де-
лают ямку, в которую пипеткой переносят простейших из центри-
фужной пробирки вместе с ксилолом-парафином. Стекло ставят
в термостат при 56° на 1—2 часа, чтобы расплавить парафин и
дать испариться растворителю. Затем опускают стекло в холод-
ную воду. Чтобы не растерять простейших, полезно их предвари-
тельно подкрасить эозином или светлым зеленым; тогда они хо-
рошо видны в застывшем парафине. В случае надобности при
дальнейшей обработке эти красители легко отмыть водой,
2. Тонкую стеклянную трубочку, диаметром не меньше 6—
7 мм (иначе будет плохо выливаться жидкость) с одного конца
завязывают планктонной сеткой (мельничным газом). Этот конец
предварительно слегка оплавляют на пламени горелки, чтобы
его края не рвали газ. В трубочку переносят простейших и завя-
занный конец ее опускают в соответствующий реактив, начиная
с 96-градусного спирта, и держат там нужное время. В воде и
спиртах меньшей концентрации простейшие иногда прилипают
к стенкам трубочки. Для заливки, поме того как простейшие
пропитались парафином, верхний конец трубочки зажимают
пальцем, а нижний опускают в холодную воду. Затем материю
снимают, слегда нагревают трубочку и палочкой выталкивают из
нее парафин с залитым в нем материалом.
3. При заливке в целлоидин-парафин (стр. 157) простейших,
находящихся в растворе целлоидина в гвоздичном масле, центри-
фугируют, со дна пробирки набирают их вместе с целлоидином
в пипетки с широким отверстием (2—3 мм) и капают в хлоро-
форм. Раствор целлоидина в хлороформе срезу желатинизирует-
ся и образует маленькие прозрачные шарики с заключенными
в них простейшими. При дальнейшей обработке (хлороформ, па-
рафин) эти шарики переносят из среды в среду.
4. В тех случаях, когда необходима точная ориентировка про-
стейших (и вообще мелких объектов), заливку можно произво-
дить на целлоидиновых пластинках. Пластинки готовят следую-
щим образом: 4—6-процентный раствор целлоидина в смеси аб-
солютного спирта с эфиром наливают в бактериологическую чаш-
ку слоем толщиной 5—7 лиг и дают застыть под стеклянным кол-
паком в парах хлороформа. Через 2—3 дня из целлоидина наре-
зают небольшие кусочки призматической формы, они должны
быть эластичны и легко резаться скальпелем. Пластинки хранят
в банке с терпинеолом.
Перед заливкой пластинкам придают скальпелем форму пря-
моугольной призмы со строго перпендикулярными плоскостями,
удобный размер — длина 3 мм, ширина 2 мм, высота 1,5 мм.
С пластинки фильтровальной бумагой стирают терпинеол и кла-
396
дут ее на предметное стекло широкой поверхностью кверху. Объ-
ект из раствора целлоидина в гвоздичном масле тонкой пипеткой
переносят на пластинку и под лупой или бинокуляром тонкими
иглами ориентируют относительно ее краев, ребер. На одну и
ту же пластинку можно положить несколько объектов. Они дол-
жны быть только смочены целлоидином, а не плавать в нем.
Пластинку с объектами переносят на 15—20 минут в пары хлоро-
форма, где целлоидин желатинизируется, и простейшие плотно
приклеиваются к пластинке. Затем ее переносят па 1—Р/г часа
в хлороформ до полного просветления. Далее заливают в пара-
фин обычным способом. Надо только обратить внимание на то,
чтобы при заливке объекты располагались ближе к стеклу, а не
в толще парафина, тогда при резке объект будет хорошо виден.
Окраска
Для фиксации простейших и одновременной быстрой окраски
их ядер употребляют 0,1-процентный раствор метилового зеленого
в 1-процентной уксусной кислоте. Если нужно получить и хоро-
шую фиксацию протоплазмы, употребляют смесь из 2 см3 1-про-
центной осмиевой кислоты, 3 см3 1-пропентного раствора метило-
вого зеленого и 1 капли 25-процеитного раствора уксусной кисло-
ты. Затем их заключают в глицерин и края покровного стекла об-
водят замазкой. Такие препараты сохраняются несколько меся-
цев.
Для выявления ресничек и жгутов употребляется раствор иода
в иодистом калин (иода 1 г, йодистого калия 2 г, дистиллирован-
ной воды 300 см3). Капельку жидкости, содержащей живых про-
стейших, накрывают покровным стеклом и у края последнего по-
мещают небольшую каплю этого раствора. В одном и том же пре-
парате можно наблюдать различную степень интенсивности окра-
ски жгутов. Для очень чувствительных объектов, легко отбрасы-
вающих жгуты, раствор незадолго до употребления нужно сме-
шать с 1-процентной осмиевой кислотой в соотношении 2: 1.
Для выявления жгутов, мембран и пелликулярных структур
можно смешать небольшую каплю 10-процентного раствора опа-
лового синего с такой же каплей жидкости, содержащей простей-
ших, затем быстро сделать тонкий мазок, дать подсохнуть и за-
ключить в канадский бальзам.
Неокрашенные жгуты, мембраны, выступы пелликулярных
структур четко выявляются на синем фоне.
Количество жидкости не должно быть слишком велико: прос-
тейшие должны несколько выступать из нее.
Негативное изображение формы тела, жгутов и мембран мож-
но получить, применяя тушь. Этот метод годится только для очень
мелких форм. Капли с живыми простейшими смешивают с таким
же количеством взвеси мелко растертой туши, делают тонкий ма-
зок и дают подсохнуть.
397
Заключают в канадский бальзам или прямо рассматривают
с иммерсионным объективом.
Для окраски простейших применяют те же методы, которыми
пользуются в цитологии: сроки воздействия красителей, спиртов
и т. д. вследствие малой величины объектов могут быть меньшими.
Для окраски жгутов и ресничек простейших фиксируют пара-
ми осмия, смесями, содержащими осмий, сулему или пикриновую
кислоту. Красят железным гематоксилином, или по Романовскому.
Хорошие результаты дает метод Геле я. 1. Фиксировать
1 —12 часов в смеси: 10 частей 2-процеитной осмиевой кислоты и
1 части формалина. Смесь составлять непосредственно перед упот-
реблением, фиксировать на холоду. 2. Не промывая, перенести
объекты в следующий раствор: двухромовокислого калия — 2 г,
калиевых квасцов 1 г, дистиллированной воды— 100 см3. 3. Спо-
лоснуть дистиллированной водой. 4. Перенести в 1-процентный
молибденовокислый аммоний—1 —12 часов. 5. Сполоснуть ди-
стиллированной водой. 6. Красить 2—4 минуты в 0,3—1-процент-
ном водном растворе толлуидинового синего при 50—60°, сполос-
нуть, быстро обезводить, провести через ксилол, заключить в баль-
зам.
В результате жгуты, базальные зерна и некоторые пеллику-
лярныс структуры окрашиваются в синий пвет, ядро и протоплаз-
ма — почти бесцветные.
Метод Клейна. Обработка пелликулы азотнокислым се-
ребром выявляет в ней своеобразный сетчатый рисунок. 1. Мазки
подсушивают на воздухе без нагревания, лучше при слабой тяге
воздуха. 2. Переносят в 2-процентный раствор азотнокислого се-
ребра на 6—8 минут. 3. Споласкивают водой. 4. Выставляют в
воде на рассеянный солнечный свет (лучше в фарфоровой чашке).
Необходим постоянный контроль: под микроскопом. Когда в пел-
ликуле ясно выступят темно-коричневые или черные линии на свет-
лом фоне, тщательно промывают дистиллированной водой, под-
сушивают и заключают в чистый канадский бальзам.
Для общей ориентировки в препарате и четкого выявления
ядер обычно применяют окраску гематоксилином Эрлиха или
Делафильда (стр. 192) после фиксации смесями, содержащими
сулему, пикриновую кислоту и двухромовокислый калий. Осмие-
вые фиксаторы дают худшие результаты. Лучше красить не про-
грессивно, а сначала перекрашивать и затем дифференцировать
солянокислым спиртом.
Г. В. Эпштейн предлагает красить простейших гематок-
силином Делафильда с последующей обработкой NH3. Мазки
красят в очень слабом водном растворе гематоксилина Делафиль-
да до 12 часов. Затем, не вынимая препарата из красителя около
открытого стаканчика, где красятся мазки, ставят открытый сосуд
с небольшим количеством NH4OH и прикрывают оба сосуда кол-
паком. Держат до посинения срезов. Промывают водой, прово-
дят через спирт, ксилол, заключают в бальзам. В результате по-
398
лучается хорошая дифференцировка плазмы, окрашивающейся в
синие и красные тона (в тонких частях мазка).
Железный гематоксилин по Гейденгайну в целом ряде слу-
чаев дает очень хорошие результаты после тех же фиксаторов, что
и квасцовые гематоксилины. Ядерные структуры окрашиваются
в различные оттенки черно-синего цвета, протоплазма — в серо-
ватый цвет, опорные фибриллы, реснички, жгуты, базальные зер-
на, центросомы, хроматофоры, пиреноиды, хондриосомы, зерни-
стость — в различные оттенки черного и серого цвета. Недостат-
ком окраски является то, что самые различные структуры красят-
ся примерно в один и тот же цвет, что иногда затрудняет их рас-
познавание.
Борный кармин применяется главным образом для окраски
тотальных препаратов из более крупных простейших, после пик-
риновоуксусных и сулемовых фиксаторов. Протоплазму можно
докрашивать светлым зеленым или анилиновым сипим.
Для тех же целей употребляется и квасцовый кармин, кото-
рый хорош тем, что красит почти исключительно ядра.
Г. В. Эпштейн считает, что одной из наиболее тонких окрасок,
которую можно рекомендовать для большинства простейших, яв-
ляется окрашивание нейтральным красным и светлым зеленым
по Творту (стр. 208). В красный цвет окрашиваются базофиль-
ные элементы ядер и некоторые клеточные включения, в особен-
ности гликопротеиды. В зеленый цвет окрашиваются оксифильные
элементы простейших. Бактерии в тканях окрашиваются в крас-
ный цвет.
Ядра простейших следует фиксировать осмиевыми смесями,
сулемой со спиртом и смесью Гелли. Красить: 1. Покоющееся
ядро —железным гематоксилином, сафранином и светлым зеле-
ным, по Манну, по Романовскому, реакция Фельгена. 2. Митоз —
те же фиксации и окраска. Наиболее контрастные картины дают
железный гематоксилин, сафранин и светлый зеленый, реакция
Фельгена. Ахроматиновое веретено — железный гематоксилин с
интенсивной докраской кислым фуксином или светлым зеленым.
Центросому следует красить железным гематоксилином.
Для окраски митохондрий употребляются обычные цитологи-
ческие методы.
Д. Н. Насонов предложил следующий способ для выявления
стенки сократительной вакуоли — гомолога аппарата Гольджи:
1) фиксация в смеси З-процентпого двухромовокислого калия —
2 части, 1-процентной хромовой кислоты — 2 части, 2-процентной
осмиевой кислоты—1 часть (или 6-процентного двухромовокис-
лого калия— 1 часть, 1-процентной хромовой кислоты—1 часть,
2-процентной осмиевой кислоты— 1 часть) 24 часа; 2) промывка
в проточной воде — 24 часа; 3) импрегнация 2-процентной осмие-
вой кислотой при 35°—3—4 дня (в коричневой банке с притертой
пробкой). Начиная со второго дня, часть простейших просматри-
399
вается для контроля под микроскопом; 4) промывка водой, про-
водка через спирт, ксилол, заключение в бальзам.
Для выявления внутриклеточного скелета простейших, их надо
фиксировать смесями Шаудина, Буэна, Суза, Флемминга. Кра-
сить железным гематоксилином, по Маллори, ализариновосерно-
кислым натрием и толуидиновым синим по Бенда — Икеда. Эти
же методы в общем пригодны и для окраски мионем.
При окраске по Маллори скелетные нити окрашивают-
ся в красный цвет, мионемы — в синий.
Методика сбора материала и культивирования простейших
Свободнодвижущнеся простейшие в большом количестве встре-
чаются главным образом в стоячих непроточных водоемах. При-
брежная зона небольших непроточных прудиков с опавшей лист-
вой, торфяные болотца, пруды большего размера, «цветущие»
весной и летом из-за массового развития в них зеленых жгути-
ковых (такие пруды заселены различными водными растениями,
около которых и надо искать простейших), пересыхающие в жар-
кое время года, и, наконец, прибрежная зона глубоких заводей
рек — таковы те основные водоемы, в которых всегда можно
найти много простейших.
Часть простейших живет в толще воды, их нужно собирать
очень частой планктонной сеткой. Осадок положить в банку и
залить большим количеством воды, взятой из того же места, где
собирался материал. Литоральные формы удобнее всего собирать
в широкогорлые банки, куда следует положить высшие водные
растения, спирогиру и т. д. Между ними и на них живут простей-
шие.
Наконец, для сбора донных простейших вместе с водой нуж-
но зачерпнуть со дна ил. Сборы тут же следует рассмотреть на
свет. Если в банке окажется много циклопов, дафний, личинок
и т. д., лучше собрать новый материал, так как эти животные пое-
дают простейших.
Банки, в которые собирают простейших, должны быть совершен-
но чистыми, никогда не употребляющимися для хранения каких-
либо ядовитых веществ, перед ловом их надо несколько раз спо-
лоснуть водой из того водоема, откуда берут простейших. Напол-
нять банки водой следует ие больше, чем наполовину или на 2/з-
При перевозке проб в лабораторию их надо защищать от перегре-
вания, так как простейшие очень чувствительны к повышению
температуры. Если простейших в пробе мало, приходится прибе-
гать к концентрации материала. Самый простой способ — это
центрифугирование (пробирки должны быть совершенно чисты-
ми!). Часто простейшие сами собираются на различных местах
сосуда, на водорослях, кусочках детрита и т. п. Наконец, из тор-
фа простейших нужно выжать и потом вновь сполоснуть мох
в этой воде.
400
Наконец, очень хорошим методом обогащения материала яв-
ляется постановка так называемых сырых культур. Надо только
иметь в виду, что в них происходит смена форм простейших
и через некоторое время часть видов исчезает.
Культуры простейших
В лаборатории содержимое проб разливают по сосудам мень-
шего размера (банки, стаканы и т. д.), заполняя их не до краев.
В каждую банку прибавляют гниющей листвы, водных растений,
ил, детрит и т. д. Через несколько дней количество простейших
в сырой культуре значительно увеличивается. Нужно просматри-
вать не только поверхностную пленку, но и стенки сосуда и осадок
на дне. В сосуды, в которых простейшие плохо размножаются,
Я. А. Цингер рекомендует прибавлять 1—2 раза в месяц по 5—
10 капель сырого молока или 5—10 см рисового, пшенного, ов-
еянного отвара (50 г крупы кипятят в 1 л воды 15—30 минут).
Культуры какого-либо одного вида простейших удобно разво-
дить в пробирках, конических колбах, кристаллизаторах, больших
конических стаканах. Сырые культуры — в больших прямоуголь-
ных сосудах (аккумуляторных банках и т. п.). Агаровые культуры
свободиоживущих простейших — в бактериологических чашках.
Закрывать культуры нужно стеклянными пластинками или,
в случае необходимости, ватными пробками. Для успеха культи-
вирования большое значение может иметь сорт стекла сосуда.
В химической посуде из некоторых сортов стекла простейшие
иногда гибнут или плохо размножаются. Полезно перед упот-
реблением выщелочить посуду текучим паром.
Как правило, для культивирования простейших нужно упо-
треблять только такую посуду, в которой никогда до этого ие было
ядовитых веществ. Если вести длительные культуры, то сосуды
с простейшими лучше держать в таком помещении, в котором не
работают с ядовитыми фиксирующими смесями (сулема и т. п.).
Мыть посуду нужно следующим образом: па несколько часов
положить ее в закрытый сосуд с 20-процентным раствором чисто-
го К2СГ2О7 в чистой серной кислоте, основательно промыть горя-
чей проточной водой, затем дистиллированной водой и, наконец,
прокипятить. Можно также вымыть мылом, затем горячей проточ-
ной водой, положить на несколько часов в проточную воду, про-
мыть и сполоснуть дистиллированной. Посуду следует сушить,
а не вытирать. Пробки нужно тщательно прокипятить в дистилли-
рованной воде.
Дистиллированную воду для составления синтетических сред
нужно обязательно приготовлять самому, причем перегонку про-
изводить в стеклянном аппарате (лучше применять бпдистилли-
рованную воду). В обычной дистиллированной воде всегда есть
следы тяжелых металлов, которые сразу губят простейших.
Целый ряд инфузорий хорошо культивируется в воде из естест-
26 Микроскопическая техника
401
венных водоемов. Нужно только иметь в виду, что в различных
участках водоема вода может иметь разный состав. Поэтому ре-
комендуется набирать ее из того места, где живут данные простей-
шие. Если точное местообитание их неизвестно, воду надо,наби-
рать в глубине водоема пли на середине реки, где опа чище.
Причиной неудач иногда может служить фильтровальная бу-
мага, употребляемая для фильтрации приготовляемых сред или
обогащения проб, так как в некоторых случаях она обладает ядо-
витыми свойствами. .Лучше брать бумагу, употребляемую при ка-
чественном химическом анализе.
Для вылавливания простейших из культуры, для отбора их,
переноса и т. п. употребляются топко оттянутые стеклянные пи-
петки с резиновыми баллончиками; удобны также, особенно при
работе с более крупными простейшими, стеклянные трубочки с
резиновыми грушами.
С культурами простейших следует работать чистыми стек-
лянными пипетками, палочками и т. п., употребляемыми
только для этой цели. Металлических инструментов лучше не
применять. Совершенно безвредна платина, часто безвредны же-
лезо и сталь, недопустимы медь и латунь.
В некоторых случаях большое значение имеет осмотическое
давление и pH среды. Иногда эти факторы определяют неудачу
культивирования.
Как уже было указано выше, культуры лучше содержать в по-
мещении, в котором не работают с ядовитыми веществами. Наи-
более благоприятная температура 15—18°. Культуры следует обе-
регать от прямого солнечного света, так как при резком повыше-
нии температуры простейшие обычно гибнут. Культуры простей-
ших в темноте развиваются так же хорошо, как и на свету (кро-
ме зеленых простейших) и поэтому их можно держать и в шка-
фах.
При пересеве культур замечено, что они лучше развиваются,
если в свежую среду перенести не слишком мало особей. В слу-
чае необходимости вывести культуру из одной особи, лучше сна-
чала культивировать ее в часовом стекле, а затем размножив-
шихся животных пересеять в пробирку, колбу и т. п.
Для обеспечения учебных занятий и для исследовательской
работы зимой часто необходимо иметь обильный живой материал
по простейшим и по некоторым группам беспозвоночных живот-
ных. Для этого с осени следует заготовлять живые культуры, ко-
торые и поддерживают зимой. Ниже будут описаны методы куль-
тивирования некоторых простейших.
Если с осени культуры не были разведены, то зимой организ-
мы можно вывести из цист и яиц.
М. М. Исакова-Кео разработала ряд удобных и проверенных
методов. (Материалы по методике университетского преподава-
ния. Сборник второй; издание Ленинградского государственного
университета, 1939).
402
Пробы зимой надо брать из различных мест водоема, около бе-
рега, там, где летом имелись заросли элодеи, пузырчатки и других
водных растений. Очень хороши для взятия проб мелкие водоемы.
Прорубают лед па таком расстоянии от берега, чтобы ил не
был замерзшим (3—4 м), и собирают ил скребком со дна вместе
с элодеей.
Материал переносят в большие банки или кристаллизаторы.
Если ил пахнет сероводородом, его вместе с прудовой водой
разливают на большие блюда или кюветки слоем в 3—4 см и ос-
тавляют до исчезновения запаха сероводорода.
Затем на ил, разлитый в чашки или банки слоем в 3—4 см.
наливают настой конского навоза из расчета 2 см3 па литр так.
чтобы чашка или банка была заполнена только до половины. На-
стойка конского навоза: 200 г свежего конского навоза размель-
чают в стеклянной банке и заливают литром кипятка. Жидкости,
все время помешивая, дают остыть до 18—20° и фильтруют через
полотняную тряпку. Сосуды с илом ставят под электрическую
лампу 150—200 в. Температура жидкости должна быть не выше
22—25°, помещения — не ниже 18—20°.
Культуру освещают по 10—12 часов подряд, выключая свет
иа ночь, до тех пор, пока не выведутся нужные организмы.
Через сутки в верхнем слое жидкости с освещенной стороны
обычно появляются жгутиковые: различные виды эвглен, факус,
синура и др. Через три-четыре дня выводятся инфузории, еще
через несколько дней плапарии, малощетинковые черви, коловрат-
ки, циклопы. С этого момента начинается уничтожение культуры.
Организмы, которые нужно развести в культурах, изолируются
сразу же по выходе из цист.
Ил можно заготовлять и с осени в банках или бутылях. Хра-
нить его необходимо при температуре 4—5°. Этот метод имеет то
преимущество, что ил можно брать из таких мест, где заведомо
имеются те или иные организмы и зимой безошибочно получать
нужный материал.
Планктон
Хорошая фиксация пшаийтона достигается разведенной
смесью Флемминга (хромовая кислота 2,5 г, осмиевая кислота
1 г, уксусная кислота 1 см3, дистиллированная вода 100 <?jw3) или
свежеприготовленной смесью равных частей вышеприведенного
фиксатора неразведенного формалина (фиксатор Ло-Бианко).
Метод Франкота позволяет одновременно фиксировать и окра-
шивать микропланктои. Для этой цели каплю планктона смеши-
вают с раствором А, накрывают покровным стеклом, и по мере
высыхания жидкости А ее постепенно заменяют раствором Б (не
снимая покровного стекла). Затем делают рамку вокруг покров-
ного стекла и получают постоянный препарат. Раствор А: спирт
90-градусный — 20 см3, глицерин — 20 см3, формалин неразве-
26* 403
денный— 5 см3, везувин— 0,05 г, малахитовый зеленый — 0,1 г,
вода — 55 см3. Раствор Б: вода — 50 см3, спирт 96-градусный —
20 см3, глицерин — 30 см3.
НЕКОТОРЫЕ СПЕЦИАЛЬНЫЕ МЕТОДЫ ИЗУЧЕНИЯ
МНОГОКЛЕТОЧНЫХ БЕСПОЗВОНОЧНЫХ
При изучении гистологии и цитологии беспозвоночных следуе:
помнить, что большинство ранее описанных методов, как прижиз-
ненной микроскопии, так и методов фиксации, заливки и окраски
могут быть применены и к этим объектам. Поэтому далее приво-
дятся только некоторые специальные указания в отношении от-
дельных систематических групп.
Кроме обычных методов заливки для специальных целей мож-
но использовать два нижеприводимых способа.
Метод заливки для получения толстых срезов
Этот метод особенно подходит для анатомического исследова-
ния организмов длиной 1—2 см, строение которых лучше всего ис-
следовать в срезах толщиной около 100 н.
В этом случае объект заключают в целлоидин, заранее приго-
товляя 2-, 4- и 8-процентный раствор его в равных объемах эфира
и абсолютного спирта.
Объект проводят через:
1. Абсолютный спирт.
2. Равные части абсолютного спирта и эфира.
3. 2-процентный целлоидин в спирте и эфире (несколько дней).
4. 4-процентный » » » » » » »
5. 8-процентпый » » » » » (неделя)
6. Приготовляют кольцо из полоски бумаги, как на рис. 93.
Наполовину наливают его 8-процентным целлоидином.
7. Для затвердевания его помещают в закрытую посуду вместе
с ватой, смоченной хлороформом.
8. Когда целлоидин затвердеет, смягчают его поверхность, сма-
зывая ее слегка смесью спирта с эфиром, заполняют кольцо
доверху 8-процентиым целлоидином, помещают туда объект и
ориентируют его.
9. Кольцо с объектом оставляют затвердевать на ночь или на
более продолжительное время в закрытой посуде с куском ваты,
смоченной хлороформом.
10. Вынимают блок, подсунув под него бритвенное лезвие.
11. Просветляют в течение нескольких часов в кедровом масле
с несколькими каплями абсолютного алкоголя и хлороформа.
12. Блок обрезают, как показано на рис. 93, в. Избыток кедро-
вого масла удаляют и блок прикрепляют к столику микротома
несколькими каплями 8-процентиого целлоидина, который уплот-
няют в парах хлороформа.
404
13. Лезвие ножа и блок смачивают кедровым маслом и делают
срезы толщиной в 100 и, немедленно помещая их в кедровое масло.
Каждый из последовательных срезов помечают срезкой углов, как
показно на рис. 93.
Серию из 5 срезов помещают в отдельный сосуд, окрашивая
и монтируя их отдельно.
Рис. 93. Схема заливки крупных зоологических
объектов. А — бумажное кольцо, заполненное
8-процентным целлоидином, на предметном
стекле; 5 — точно ориентированный объект за-
литый в целлоидиновую массу; В — блок с
ориентированным объектом; 1—5 срезы с ори-
ентированного блока.
Для подготовки к окрашиванию срезы помещают в ксилол и
далее в смесь из равных частей абсолютного спирта и хлорофор-
ма, а затем в 90-градусный спирт и т. д. Окрашивают по метолу
Маллори и заключают обычным способом.
Метод двойной заливки для малых объектов
Приготовляют густой, как патока, раствор целлоидина в рав-
ных частях спирта и эфира, добавляют такой же объем гвоздич-
ного масла и хорошо перемешивают. Помещают в теплое место,
иногда помешивая, пока не исчезнет запах эфира. Для уменьше-
ния вязкости раствора к нему добавляют немного гвоздичного
масла.
405
Рис. 94. Схема
приспособления
для двойной залив-
ки мелких зоологи-
ческих объектов:
/—слой спиртового
раствора эозина с
обьектом; 2 — слой
масла; 3 — слой сме-
си равных и-,четой
масла и целлоидина;
4 — слой густого цел-
лоидина; 5 — корко-
вая подставка.
Чтобы сделать объекты хорошо видимыми, их предварительно
окрашивают эозином в абсолютном спирте. Затем помещают
объект в небольшую закрытую стеклянную пробирку, наполнен-
ную, как показано на рис. 94, слоями промежуточных сред.
Объект, очень медленно опускаясь, постепенно проходит слой
гвоздичного масла, слой смеси гвоздичного масла и целлоидина и
погружается в густой целлоидин. Через несколь-
ко дней пипеткой осторожно удаляют из про-
бирки слои промежуточных сред, а затем объект
в густом целлоидине переносят в кольцо, напол-
ненное целлоидином, и поступают, как было вы-
ше описано для крупных объектов.
Бритвенным лезвием вырезают прямо-
угольный блок целлоидина, вертикальная по-
верхность которого должна быть параллельной
будущей плоскости среза. Чтобы отметить по-
ложение объекта в блоке, обрезают края бло-
ка на конце, противоположном объекту. Блок
заливают (по обычным правилам) в твердый
парафин, обрезают последний параллельно
блоку, ориентируют и делают срезы.
Заключают обычным способом, но вырав-
нивание целлоидина завершают высушиванием
над парами эфира. Высушивают очень медлен-
но, чтобы избежать сморщивания целлоидина.
Наблюдения над живыми объектами
Для изучения живых мелких животных при-
годен способ иммобилизации,
предложенный Г. С. Стрелиным
(1949).
Используют растворы желатины в концентрации от 5 до 15%
в зависимости от разных видов животных и разных целей иссле-
дования. Несомненно, что для некоторых объектов эта концентра-
ция должна быть понижена, для других более пригодной окажется
большая. Во многих случаях бывает достаточно лишь затруднить
движение животного, увеличивая немного вязкость среды.
Замурованное в желатине животное не может изменить сколь-
ко-нибудь значительно свою внешнюю форму и оказывается, та-
ким образом, почти неподвижным. В то же время оно сохраняется
живым в течение значительного срока, не обнаруживая, как пра-
вило, заметных патологических изменений. Для разных объектов
этот срок различен, от нескольких часов до суток и более, в зави-
симости от температуры, концентрации желатины, толщины ее
слоя и пр.
После заливки в желатину объект может быть из нее освобож-
ден или с помощью препаровальных игл, или легким нагреванием
406
препарата, приводящем к полному или частичному разжижению
желатины и не повреждающим животное.
Этот метод Г. Стрелина применяется к кольчатым червям,
турбелляриям, гидре и некоторым другим водным животным.
Для ограничения движений гидры достаточно залить объект в
5—10-процентную желатину.
В условиях относительно медленного застывания желатины
(при комнатной температуре) сократившаяся первоначально гид-
ра обычно успевает вытянуться и расправить щупальцы до мо-
мента затвердевания среды.
Таким образом, для прижизненных наблюдений удается полу-
чить неподвижные объекты, иногда с сильно вытянутыми щупаль-
цами. Это представляет определенное удобство для микроскопи-
рования; добиться такого положения каким-либо другим путем
обычно не удается.
В нашей лаборатории гидры, находившиеся в желатине в тече-
ние 1—2 часов, в дальнейшем после освобождения от нее продол-
жали нормальное существование.
Заливка животного в желатину может быть использована не
только для прижизненных наблюдений и экспериментов над ним,
но и как подготовка к консервированию его тем или другим фик-
сатором.
Разработанная методика иммобилизации животных может
быть применена при изучении весьма разнообразных пресновод-
ных и морских существ. Она дает некоторые дополнительные
возможности для прижизненного наблюдения под большими уве-
личениями микроскопа, зарисовки объектов, в частности с по-
мощью рисовального аппарата, фотографирования, требующего
больших экспозиций, и для цейтраферной съемки движения внут-
ренних органов животных, которой часто мешает общая подвиж-
ность организма.
Описанная методика открывает большие возможности и для
экспериментальной работы: она позволяет воздействовать тем нли
другим внешним фактором, например лучистой энергией, на стро-
го определенные части организма, не затрачивая при этом других
его частей. Опа облегчает в некоторых случаях оперативное вме-
шательство и, может быть, при дальнейшей разработке окажется
полезной при проведении опытов со сращиванием и транспланта-
цией.
Для окраски нервной системы мелких беспозвоночных можно
использовать метод Ромье: небольшое количество бензидина ра-
створяют в нескольких кубических сантиметрах слегка подкислен-
ной дистиллированной воды; через ’/г часа фильтруют; живые
объекты (предварительно ополоснутые дистиллированной водой)
окрашивают в этом растворе 30—60 мин.; затем к раствору до-
бавляют 1—2 капли перекиси водорода; при этом избирательно
в синий цвет окрашивается нервная система (контроль под мик-
роскопом), однако окраска исчезает через 2—3 часа.
407
Губки
Мелкие морские роговые губки. Животное поме-
щают на 5 минут в 1-процентный раствор осмиевой кислоты и
затем переносят его в крепкий спирт, который необходимо дважды
сменить. Обычная заливка в парафин. Срезы можно окрашивать
спиртовым кармином. Молодых Sycon можно фиксировать в абсо-
лютном спирте и окрашивать спиртовым кармином. Личинкам
Spongilla дают осесть на большом покровном стекле и затем фик-
сируют 3 минуты в абсолютном спирте, окрашивают их в спирто-
вом кармине, обезвоживают, просветляют в бергамотовом масле
и заключают в бальзам. Абсолютный спирт особенно рекомен-
дуется для более крупных животных. Спиртовый раствор сулемы
или смесь пикриновой и серной кислоты также дают хо-
роший результат. Известковые губки перед заключением в пара-
фин необходимо декальцинировать в подкисленном спирте.
Кремневые губки следует обрабатывать холодным насы-
щенным раствором фтористого натрия в 40-градусном спирте,
слегка подкисленном несколькими каплями НС1, оставляя их в
этой жидкости иа несколько часов, а в некоторых случаях — дней.
Срезы можно окрашивать железным гематоксилином и кислым
фуксином.
Для изоляции и гл губок применяются два метода, в зави-
симости от того — являются ли спикулы (иглы) известковыми или
кремневыми.
Кремневые спикулы: кусочки животного обрабатывают
слегка разведенной азотной кислотой при нагревании в течение
нескольких минут до разрушения всех органических веществ. Про-
мывают несколько раз путем центрифугирования. Монтируют в
бальзаме.
Известковые спикулы: кусочки животного обрабаты-
вают 10-процентным горячим раствором поташа и затем поступа-
ют, как указано выше.
Паван-де-Секкатти (1955) рекомендует целый ряд методов для
изучения цитологии и гистологии губок. Для одно-
временной декальцинации и фиксации рекомендуется следующая
смесь: к 140 см3 формалина сперва добавляют 40 см3 азотной
кислоты, затем доливают насыщенный водный раствор пикрино-
вой кислоты с тем, чтобы общий объем был равен 1 л. Этот реак-
тив можно использовать после предварительной фиксации объек-
тов в смесях Дюбоска — Бразилия или Шампи. Из методов окрасок
хорошие результаты дает трехцветный способ Массона, железный
гематоксилин с докраской пикрофуксином по Ван-Гизоиу. Паван-
де-Секкатти специально исследовал нервные клетки глубок. Для
избирательной окраски нервных клеток попользовался метод
Фонвиллера (1947—1948), селективно выкрашивающий элементы
нервной системы у самых различных представителей животного
царства. 1. Фиксация нейтральным формалином или смесью Дю-
408
боска — Бразиля. На предметное стекло наливают свежеприго
товленный краситель: 2-процентный раствор трнпанового синего —
80 см', абсолютный спирт—4 см3, 30-процентная уксусная кис-
лота — 2 см3; продолжительность окраски 5—10 минут, после чего
промывают проточной водой 2—5 минут. Окраску закрепляют об-
работкой смесью спирта и формалина (5 минут), затем абсолют-
ный спирт, бутиловый спирт, ксилол, бальзам. Нервные элементы
выделяются своим интенсивно синим цветом. Паван-де-Секкатти
разработал специальный метод импрегнации серебром, который,
возможно, окажется также полезным при анализе нервной систе-
мы некоторых других классов беспозвоночных. 1. Для фиксации
известковых губок—5-процентный нейтральный формалин, для
кремневых губок предпочтительнее пользоваться смесью Шампи;
в тех случаях, когда используются другие фиксаторы помимо
нейтрального формалина, импрегнация теряет свою селективность
в отношении нервной системы, но может служить для решения
вопросов общей гистологии губок. 2. Срезы после промывки в про-
точной воде помещают на 30 минут (при 37° С) в смесь: танин —
5 г, вода дистиллированная—100 см3, бромистый аммоний —
1 г; танин растворяют при нагревании, фильтруют, затем прибав-
ляют бромистый аммоний и добавляют несколько капель форма-
лина. 3. Промывают 5 минут в проточной воде, 5 минут в дистил-
лированной, затем по 5 минут в двух флаконах с аммиачной во-
дой. 4. Серебрят 20—120 минут в смеси следующего состава: ос-
новной раствор аммиачного серебра по Бильшовскому—10 ка-
пель, основной раствор углекислого серебра по Дель-Рио-Горте-
га— 10 капель, пиридин— 10 капель, дистиллированная вода —
50 см3. 5. Быстро, но тщательно промывают дистиллированной
водой. 6. Обрабатывают 15 минут в следующем реактиве; дистил-
лированная вода — 100 см3, формалин — 6 см3, гидрохинон — 2 г,
сульфит натрия—0,75 г. 7. Тщательно промывают дистиллиро-
ванной водой. 8. Обрабатывают 15 минут в 0,5-процентном раство-
ре хлорного золота, промывают в проточной воде, фиксируют
15 минут в 5-процентном растворе гипосульфита натрия, снова
промывают и заключают, как обычно, в бальзам.
Кшиечнополостные
Гидры в природных условиях живут в стоячих водоемах, прудах и озе-
рах. Искать их нужно около берега на элодее, ряске и пузырчатке.1
Собирают гидр (на зиму для разведения в культурах) осенью, в конце
августа нли в начале сентября. Для этого обрывают веточки элодеи, пузыр-
чатки илн же собирают ряску и кладут в небольшие баночки. Через несколько
1 Учитывая интересы как исследователей, так н преподавателей, мы сочли
полезным, кроме микротехнических указаний, дать также известные сведе-
ния по культивированию некоторых беспозвоночных в лабораторных усло-
виях. Все эги указания мы взяли из статьи М. М. Исаковой-Кео (1939). Эти
указания касаются гидры, ресничных червей, пиявок, коловраток, дафний,
анодонты и виноградной улитки.
409
минут сквозь стенку банки при помощи лупы 10-кратного увеличения можно
увидеть гидр, которые довольно быстро начинают расправляться. Можно так-
же просматривать ряску или веточки элодеи в черной фотографической ван-
ночке. На черном фоне гидры очень хорошо.видны.
Содержать гидр необходимо отдельно от других животных.
Сосуд тщательно вымывается. На дно его кладется слой в 1—1,5 см
крупнотолченого угля, затем насыпается слой в 2—3 см хорошо промытого
песка. Банку засаживают элодеей и на 2/3 наливают водой. Гидры широкой
пипеткой опускаются прямо на веточки элодеи так, чтобы они сразу могли
укрепиться. Затем дают гидрам время расправиться и вытянуть шупальцы,
после чего осторожно пипеткой подводят к щупальцам дафний.
Кормят гидр ежедневно. Сначала, пока гидр мало, пускается малое коли-
чество дафний, Также небольшими количествами впускаются парамеции для
корма дафний, которые ие все сразу поедаются гидрами.
Гидпы быстро привыкают к новым условиям, и через несколько дней на
них образуется большое количество почек (3—4—6—8 штук). При желании
получить большее количество почек следует гидр кормить 2—3 газа в день.
При этом необходимо очень тщательно убирать погибших дафний со дна со-
суда при помощи длинной пипетки с грушей на конце,
Волу в байке меняют только в тех случаях, когда она загнивает, т. е.
ст?ночнтся слегка мутной, и на элодее начинают оседать хлопья бактериаль-
ной пленки.
Смену воды производят следующим образом: один конец резиновой трубки
надевают на водопроводный кран, в другой конец этой же трубки вставляют
стеклянную трубку. Стеклянную трубку втыкают в песок до самого дна, от-
крывают кран и медленной струей пускают воду. Так вводится чистая вода.
Для удаления остатков пиши и продуктов распада берут другую резиновую
трубку, наполняют ее водой и оба конца затыкают пальцами. Затем один ко-
ней трубки погружают в банку с гидрами, а другой — в пустой сосуд, кото-
рый ставился несколько ниже первого. Проводя концом второй трубки по по-
верхности песка, собирают все остатки пищи, которые ток воды Уносит в ниж-
ний сосуд.
Вытянувшихся гидр фиксируют, быстро прибавляя к воде, со-
держащей гидр, двойной объем горячей (не кипящей') жидкости
Буэна. Фиксацию продолжают 30 минут в холодном буэновском
растворе, промывают гидр и сохраняют в 70-градусном спирте,
после обезвоживания просветлеют в бергамотовом масле (вместо
ксилола) и заключают в бальзам.
Маленькие медузы и гидроиды. Маленьких и хруп-
ких медуз помещают в бактериологическую чашку, почти полную
морской воды, чтобы они могли свободно плавать. Когда они
вполне расправятся, прибавляют 2 капли 1-процентного раствора
кокаина и затем осторожно мешают стеклянной палочкой. Через
каждые 5 минут повторяют добавление кокаина, пока не прекра-
щается реакция щупалец на прикосновение. Затем прибавляют
10—20 см3 10-процентного продажного формалина, продолжая
двигать палочкой еще несколько минут. Без промедления, чтобы
избежать размягчающего действия кокаина на мезоглею, перено-
сят объект с возможно меньшим количеством воды в 4-процент-
ный раствор формалина, где оставляют его на '/2 часа или больше
и затем хранят в 10-гтроцентном растворе формалина. В некото-
рых случаях следует предпочесть более слабый раствор формалина.
Некоторые виды можно успешно фиксировать без применения
наркотиков, путем постепенного прибавления формалина к мор-
410
ской воде, содержащей животных. На 10 частей морской воды
прибавляют по каплям около 1 части 4-процентного формалина.
Затем обрабатывают как указано выше.
В качестве анестезирующего средства может быть применен
ментол, как это описывается ниже для Actinia. Сохраняют мате-
риал в формалине. Для гистологической работы анестезированных
животных убивают и фиксируют в буэновском растворе или в на-
сыщенном растворе сулемы, отмывая их после этих жидкостей
обычным способом. Последующая обработка производится обыч-
ными гистологическими методами.
Г п др актин и п анестезируют, прибавляя по каплям 10-про-
центный раствор хлорэтона в абсолютном спирте до тех пор, пока
животные не перестают сокращаться. Сохраняют их в 4-процент-
ном растворе формалина, окрашивают железным гематоксилином.
Срезы нужно делать в 7—8 ;j. толщиной.
Некоторые формы можно анестезировать хлоралгидратом или
кокаином, фиксировать в теплой или холодной смеси сулемы и ук-
сусной кислоты, в крепкой смеси Флемминга, или в 1-процентном
растворе осмиевой кислоты. Чтобы лучше сохранить форму жи-
вотного, его убивают в 10-процентном формалине и переносят в
2—3-процентный формалин. Очень постепенно обезвоживают. Ок-
рашивают железным гематоксилином, докрашивая различными
красителями.
Медузы. Фиксируют в слабой смеси Флемминга или некото-
рые виды (Carmarina) — в 6-процентном растворе сулемы в мор-
ской воде или в растворе сулемы (45 частей), формалина (5 ча-
стей) и уксусной кислоты (2 части). Некоторые формы нельзя
фиксировать в сулемовом растворе, так как они не выносят пос-
ледующего воздействия иода. Материал, фиксированный по Флем-
мингу, нужно промывать с большой осторожностью, так как про-
точная вода может разрыхлить эпителий. После обезвоживания
кусочки ткани проводят через несколько ступеней эфира — спир-
та — целлоидина, затем помещают в хлороформ и заключают в
парафин при 56°. Окрашивают срезы железным гематоксилином
или по Маллори.
Лептомедузы. Для работ по систематике, животных фик-
сируют в формалине; для гистологической работы — в флеммин-
говской или германовской жидкости.
М е t г i d i u in. Наркотизируют сернокислой магнезией, фикси-
руют, прибавляя сильно разведенную хромово-уксусную кислоту,
и после продолжительной промывки заключают в парафин. Срезы
окрашивают в квасцовом гематоксилине или борном кармине.
А 1 с у о п i u m и Gorgonia можно наркотизировать мен-
толом в течение 12—24 часов, как описано для Actinia, фиксиро-
вать в горячей сулеме, отмывать в 70-градусном спирте, затем в
спирте с иодом и хранить в 70—80-градусном спирте.
Actinia. Помещают животных в стеклянную чашку с мор-
ской водой, так чтобы вода покрывала их на 2,5 см или больше,
411
и затем в нее бросают кристаллики ментола, которые медленно ра-
створяются. В зависимости от количества воды и размера живот-
ных, наркотизирование продолжается от 12 до 24 часов. Затем,
животных помещают в формалин или в смесь формалина и спирта.
Можно применять также и кокаин, как описано для медуз. После
наркотизации животное может быть зафиксировано в буэповской
жидкости или в сулеме и затем обработано обычным способом.
Черви
Нематоды. Фиксирующую и дегидрирующую жидкость со-
ставляют из абсолютного спирта — 20 сжф хлороформа — 15 еж3;
ледяной уксусной кислоты — 5 еж3; кристаллического фенола сле-
дует прибавить столько, чтобы общий объем смеси увеличился на
10 сж3. Хранят в банке со стеклянной пробкой. Так как жидкость
портится, материал нельзя в ней хранить больше двух недель.
К фиксатору медленно прибавляют кедровое масло или хлоро-
форм, оставляют в этой смеси до просветления, а затем объект
переносят в чистое масло или хлороформ, в котором объект мож-
но держать еще 30—60 минут. К маслу прибавляют стружки па-
рафина, ставят в тепло на 2 часа, после чего переносят в чистый
парафин при 58° и затем заливают. Окрашивают как желательно.
Для монтировки целого животного поступают, как описано выше,
но просветляют его предпочтительно в гвоздичном или бергамото-
вом масле. В этом случае в слегка наклоненное часовое стекло,
в котором находится червь в небольшом количестве масла, наносят
большую каплю чистого канадского бальзама. Нужно дать канад-
скому бальзаму диффундировать в ткани, на что нужно 2—3 часа.
Если.диффузия проходит хорошо, то червь не сжимается н не
сморщивается. Больших червей перед просветлением можно осто-
рожно наколоть препаровальной иглой для проникновения в них
бальзама. Фиксированных и окрашенных червей можо заключать
и в глицерин.
Черви (нематоды, цестоды, трематоды), которые
могут оказаться после фиксации сморщенными, можно затем ре-
ставрировать вымачиванием в 35—50-градусном спирте, к которо-
му прибавлена в равном объеме молочная кислота. После этого
кислоту отмывают, прополаскивая объект в 70-градусном спирте.
Если паразитические нематоды убиты горячей водой или спиртом,
то хотя они и выпрямляются, но окрашиваются с большим трудом.
Важно, чтобы переход объекта из одной жидкости в другую про-
исходил постепенно; нужно, чтобы 6—12 часов уходило иа смену
одной жидкости другой. Объект проводят через слабые спирты до
70-градуспого спирта, затем окрашивают квасцовым гематоксили-
ном в 70-градусном спирте, к которому прибавлено немного уксус-
ной кислоты. Оставляют на педелю в растворе уксуснокислого нат-
рия или калия в 70-градусном спирте, затем переносят в более
крепкий спирт, далее в абсолютный спирт, две или три смеси спир-
412
та с ксилолом, чистый ксилол; затем заливают по обычной схеме
в парафин.
Различных- мелких нематод можно убивать, нагревая их на
предметном стекле с луночкой (в нескольких каплях дистиллиро-
ванной воды). Фиксируют в смеси дистиллированной воды, фор-
малина, 90-градусного спирта и уксусной кислоты (40 : 6 ; 20 : 1).
Переносят в 30-градусный спирт с 2% глицерина, где оставляют
на 6—10 дней, проводят объект через спирты, окрашивают квас-
цовым кармином, дифференцируют окраску, затем проводят че-
рез абсолютный спирт, ксилол, заключают в бальзам.
Нематода Oxyuris. Для тотальных препаратов животное
убивают 70-градусным спиртом, подогревая его до 60°. Оставляют
в спирте на несколько дней, обезвоживают, затем переносят
в кедровое масло-}-спирт (10 : 90). Помещают в эксикатор при 20°.
После трех дней, когда спирт испарится, обновляют кедровое
масло. Для срезов червей фиксируют по Флеммингу, Бенда или
в осмиевой кислоте. Обезвоживают медленно, разрезая животных
на части, и переносят в смесь кедрового масла и абсолютного
спирта (20 : 80), ставят на термостат (56°) и через несколько ча-
сов помещают в чистое масло, затем в смесь равных частей масла
и парафина и, наконец, в парафин на 24 часа. Окрашивают в
квасцовом или железном гематоксилине, докрашивают эозином
или оранжем G.
Gordius. Для прижизненной окраски применяют 0,001-про-
центный раствор метиленового синего. Для срезов нли для тоталь-
ной монтировки — фиксируют в жидкости Германа или Зелинка
(1-процентной хромовой кислоты 35 частей; дистиллированной во-
ды — 45 частей; уксусной кислоты — 1 часть). Для тотальной мон-
тировки переносят прямо в глицерин, для срезов—сначала про-
мывают в проточной воде, медленно обезвоживают и так же мед-
ленно проводят через ксилол до парафина. Эмбрионов режут на
срезы толщиной в 5 и, личинок— 3 ц. Окрашивают в квасцовом
гематоксилине или в анилин-генциановом фиолетовом (5 см3 на-
сыщенного раствора в 96-градусном спирте на 100 см3 анилиновой
воды) в течение 24 часов, затем дифференцируют. Молодых личи-
нок после фиксации в жидкости Германа без отливки и после мед-
ленной проводки монтируют в глицерине.
В лабораторных условиях ресничные черви хорошо сохраняются
в течение зимы.
Dendrocoelum lacteum и Planaria разводят в стеклянных банках емкостью
4—5 л. На дно банки насыпают хорошо промытый песок слоем в 4—5 см,
в который сажают несколько веточек элодеи и кладут несколько камешков.
Затем наливают водопроводной воды до 3/д банки. После этого опускают в
банку турбеллярий и сверху прикрывают от пыли стеклянной пластинкой.
Кормят турбеллярий ежедневно водяными осликами. Для этого осликов
опускают в банку из расчета — один ослик на 3—4 червя.
В случае отсутствия осликов, их можно заменить личинками коретры
Личинки эти предварительно слегка придавливаются.
Можно кормить турбеллярий кровью лягушек. Для этого лучше вынуть
-червей из банки и временно поместить в другой сосуд, в который бросают
413
сгустки лягушиной крови. Через час турбеллярий споласкивают в водопро-
водной воде в 14—15° С и опускают обратно в байку.
Обычно воду меняют через 1—2 дня. Производится это так же, как и у
гидр.
Если желают вывести турбеллярий, то перед тем, как менять воду, про-
сматривают при помощи лупы 10-кратного увеличения стенки банк!!. На ник
можно найти коричневые яйца турбеллярий. Их собирают в отдельный сосуд
и оставляют лежать, пока из них ие вылупятся молодые турбеллярий. Моло-
дых червей кормят мелкими жгутиконосцами и инфузориями.
Пл а н а р ии. Вокруг планарий, вытянувшихся на предметном
стекле, оттягивают пипеткой воду и затем покрывают животных
несколькими каплями 2-процентной азотной кислоты. После
смерти планарий фиксируют 20—30 минут жидкостью Жильсона
или другими смесями, содержащими сулему.
Трематоды. Фиксируют трематод, сплющивая особи меж-
ду предметными стеклами до состояния растяжения, и пропуская
между стеклами горячую смесь Шаудина или жидкости Ценкера,
Буэна. Тотальный препарат червя и срезы можно окрасить бор-
ным кармином или квасцовым гематоксилином.
Кольчатые черви. Разведение и содержание в лабора -
торных условиях. С прибрежной зоны, богатой элодеей и други-
ми водными растениями, берут верхний слой ила вместе с остат-
ками растений. Переносят его в широкую банку и распределяют
ровным слоем в 1—1,5 см.
Доливают водою слоем в 6—8 см и оставляют стоять. От
гниющих листьев элодеи и других растительных остатков иа по-
верхности воды образуется бактериальная пленка, в которой через
10—15 дней и нужно искать червей. Для дальнейшего содержа-
ния их и размножения, червей следует рассадить.
1. Nais и D е г о переносят вместе с илом в старые культуры
зеленых жгутиконосцев Phacus, Euglena, Chlamydomonas и др.
Сюда же вносят бактериальную пленку с навозных культур. Через
определенные промежутки времени (10—12 дней) в жидкость до-
бавляют 2—3 капли бульона на 50—75 см3 культуры.
2. Aeolosoma. Снимают бактериальную пленку с навозных
культур, помещают ее в банку и заливают водою. Сюда же впу-
скают небольшое количество мелких жгутиконосцев. Через 2—3
дня вносят Aeolosoma, которых постепенно подкармливают бак-
териальной пленкой, жгутиконосцами и их цистами.
3. Дождевые черви. С осени на огороде выкапывают
крупных дождевых червей. Хранят их в ящике, который подготов-
ляют следующим образом.
На дно ящика насыпают небольшим слоем огородную землю.
Затем насыпают сухих листьев, опять слой земли, слой листьев
и т. д. до тех пор, пока не будет заполнено 3/4 ящика. Почву слег-
ка поливают водою и кладут червей. Следят, чтобы почва не вы-
сыхала. Время от времени земля слегка обрызгивается водою с
таким расчетом, чтобы она была сырой, но не мокрой. Червей под -
кармливают вареным раздавленным картофелем.
414
Ящик хранят в темном месте при температуре 10—12° С. Его
покрывают крышкой, чтобы черви пе выползли.
Мелкие олигохеты. Тотальные препараты олигохет и
некоторых нематод, могут быть приготовлены следующим обра-
зом: помещают животное на предметное или часовое стекло и
прибавляют солевой раствор до концентрации 1—3%, затем пере-
носят червей в плоскую чашку с водой. Прибавляют понемногу
спирта так, чтобы к концу часа или двух крепость жидкости до-
стигла 10°. После этого червей пз 10-процептного спирта перено-
сят в 1-процентный раствор хромовой кислоты. Через 4 часа ос-
новательно промывают в проточной воде в течение 12 или более
часов. Затем проводят через спирты от 50 до 70°, два или три дня.
в каждом и сохраняют в 70-градусном спирте.
Материал, предназначенный для срезов, помещают в ценке-
ровскую жидкость после предварительной обработки в 10-градус-
ном спирте, как указано выше. После четырех или более часов
фиксации его обрабатывают как обычно.
Дождевых червей (для изучения гистологии) фиксируют
в жидкости Буэна или Шаудина с 3% уксусной кислоты, окраши-
вают в квасцовом гематоксилине и докрашивают эозином или.
пикроиндигокармином. Для изучения железистой секреции после
фиксации в буэновской жидкости применяют окраску тионином
или толуидиновым синим в течение 2—5 минут, можно с пред-
варительной окраской железным гематоксилином. Для выявле-
ния более тонкой структуры желез и глоточного эпителия
маленькие кусочки фиксируют в жидкости Шампи и окрашивают
железным гематоксилином и эозином. В кишечнике дождевых
червей, предназначенных для фиксации, ие должны содержаться
песчинки, которые могут испортить микротомную бритву.
Для цитологического изучения фоторецепторов, земляных
червей фиксируют в крепкой смеси Флемминга и окрашивают
железным гематоксилином. Для изучения общей структуры нерв-
ной системы — фиксируют 24 или более часов в растворе
20-процентного формалина, содержащего 3% ледяной уксусной
кислоты. Импрегнируют 10—18 дней в 2-процентном AgNO3 при
37,5° (в темноте). Проявляют 18—36 часов в 2-процентном
гидрохиноне (в темноте). Обезвоживают в спиртах 70-, 85-,96-
градусном и абсолютном, затем проводят через ксилол,
заливают в бальзам.
Пиявки. Содержат их в стеклянных банках или аквариумах, на
наполненных водою. На дно банки насыпают слой в 4—5 см промытого песка
с примесью крупного толченого угля. Сажают в банку элодею и другие вод-
ные растения. Покрывают банку сверху стеклянной пластинкой; пиявкам воду
меняют, когда в ней появится пленка или буроватая слизь.
1. Ложно-конскую пиявку кормят дождевыми червями.
2. Малых ложно-конских пиявок кормят рачками, мелкими червями и ли-
чинками насекомых.
3. Clepsin а. В банку с Clepsina впускают небольших прудовиков, ка-
тушек и других моллюсков.
415
4, Медицинская пиявка. Сохраняются медицинские пиявки в ши-
рокой банке, наполненной до половины водою. На дно банки насыпают слой
крупного толченого угля, толщиной в 1—1,5 см. затем слон хорошо промытого
песка с примесью угля в 1—2 см и, наконец, слой чистого песка в 0,5—1 см
толщиною. В песок сажают водяной мох.
Нижнюю часть банки обворачнвают черной бумагой, но так, чтобы на
верхушки мха падал свет. Банку сохраняют при температуре 13—14° С, Сверху
ее обвязывают марлей или же покрывают пластинкой стекла.
Пиявки не выносят загрязненной воды; поэтому необходимо следить за
тем, чтобы вода постоянно была чиста. Если появится пленка или бурова-
тая слизь, воду необходимо сменить.
Пиявки могут жить без корма несколько месяцев. Но все же лучше их
время от времени подкармливать. Для этого их сажают в банку с лягушками
После того как они насосались крови, их споласкивают водою и сажают
обратно в ту же банку, откуда они были взяты.
Коловратки
Rotifer относится к организмам, которые очень неприхотливы и при нали-
чии пищи живут в любых условиях. Культивируется на навозных настоях
Культура ставится следующим образом:
Измельчают 500 г конского навоза и заливают литром прудовой воды,
Жидкость оставляют стоять в течение 20—25 дней; за этот срок разовьется
густая культура Rotifer в пленке и на стенках банки под самой пленкой. Эта
культура может стоять годами. Если желают усилить размножение Rotifer,
то вносят питательный материал.
Наркотизируют коловраток в часовом стекле, в воде с раство-
ром кокаина (2-процентный кокаин—3 части; метиловый спирт—
1 часть; вода — 6 частей). Когда движение животных прекра-
щается, оттягивают воду пипеткой и прибавляют каплю ^-про-
центного раствора осмиевой кислоты. Спустя минуту промывают
их в 2,5-проценгиом формалине, сменяя его несколько раз, и со-
храняют в 3—6'процентиом формалине. Если осмиевая кислота
слишком чернит, материал затем отбеливают перекисью водоро-
да. Объекты можно монтировать в стекле с луночкой в 2,5-про-
центном растворе формалина, покрывая края покровного стекла
парафином или воском.
В качестве фиксатора и консервирующей среды для нежных
объектов, например, коловраток, служит жидкость следующего
состава:
Камфорной воды 75 см3
Дистиллированной воды 75 см3
Уксусной кислоты (ледяной) 1 см3
Уксуснокислой меди 0,30 г
Хлористой меди 0,30 г
Мшанки
Анестизируют кокаином так же, как медуз, и затем убиваю г
10-процентпым раствором формалина, проводят известковые фор-
мы через 70-градусный спирт осторожно и быстро.
416
Сохранение пресноводных Bryozoa. Помещают колонию в во-
ду так, чтобы они соприкасались со стенками сосуда. Наркотизи-
руют насыщенным раствором кокаина или хлорэтона, капая его
из пипетки с интервалами в 5 минут. Через полчаса колония мо-
жет быть совершенно наркотизирована. Когда эта стадия достиг-
нута, около 5% всей жидкости можно удалить и заменить ее ко-
каиновым раствором. При прекращении движения ресничек пере-
стают добавлять кокаин. После полной наркотизации (прибли-
зительно через 1 ‘/г часа) следует еще немного подождать и за-
тем прибавить фиксирующей жидкости, приготовленной из 10 ча-
стей тростникового сахара, 90 частей дистиллированной воды и
двух частей формалина. Консервирующую жидкость добавляют
пипеткой до тех пор, пока в смеси не окажется 50% сахарного
раствора.
Объект оставляют в этой смеси на ’/г часа, затем постепенно
увеличивают концентрацию консервирующей жидкости, после че-
го переносят его в неразведенный фиксатор. Спустя неделю или
10 дней объект помещают в свежую фиксирующую жидкость.
Для срезов берут маленькие кусочки и фиксируют их в жид-
кости Буэна несколько часов.
Иглокожие
Этих животных можно фиксировать в обычных жидкостях и
сохранять в 80-градусном спирте. Перед резкой на микротоме
их нужно декальцинировать в 70-градусном спирте, подкислен-
ном соляной или азотной кислотой.
Личинок Auricular! а, а также бипииарий и плутеусов лучше
всего фиксировать в насыщенном водном растворе сулемы (фик-
сировать не больше 4—5 минут); Окрашивать 12—24 часа в
спиртовом кармине, слегка разбавленном 70-градусным спир-
том, обезводить, просветлить в кедровом или гвоздичном масле и
заключить в бальзам. Излишек красителя можно дифференци-
ровать спиртом, подкисленным уксусной кислотой (если экземп-
ляр не имеет тонкого известкового скелета). Голотурий наркоти-
зируют ментолом, как описано для Actinia, затем переносят в 70-
градусный спирт и кроме того в анус инъицируют 90-градусный
спирт. Хранить в 70-градусном спирте.
Моллюски
1. Helix pomatia. Виноградных улиток сохраняют в больших сосу-
дах. Удобны большие стеклянные аквариумы, так как их легко мыть. На
дно аквариума насыпают слой песка в 5—6 см В песок втыкают кочан капусты
корнем вниз. Песок около кочна слегка смачивают водой для того, чтобы
капуста не завяла. В сосуд сажают Helix. Аквариум сверху покрывают сет-
кой или обвязывают марлей.
Уход за Helix состоит в следующем: через 4—5 дней меняют песок и при
этом стенки аквариуму тщательно моют мылом и щеткой — или же хорошенько
протирают песком для удаления слизи. Если улиток небольшое количество, а
27 Микроскопическая техника 417
сосуд большой, то песок меняется значительно реже. Кормят виноградных
улиток, помимо свежей капусты, морковью и традесканцией.
Время от времени улиток просматривают и удаляют погибших.
При хорошем уходе и достаточной пище отхода почти нет.
2. А п о d о п t а. Их запасают в конце августа или в начале сентября,
пока вода еше ие сильно похолодела.
Хранят следующим образом. Необходимо иметь большой аквариум с про-
точной водой. Дио аквариума покрывают слоем песка толщиной в 8—10 см
Песок предварительно хорошо промывают до появления чистой воды. На пе-
сок насыпают огородной земли слоем в 6—8 см. затем наливают слой жидко-
го ила в 2—3 см. Наливается водопроводная вода. По углам аквариума са-
жают пузырчатку, элодею и другие водные растения, В аквариум кладут
Anodonta в один слой, иа расстоянии 2—3 см друг от друга.
Уход за беззубками состоит в следующем.
1. Беззубок необходимо подкармливать. Для этого в аквариум помещают
бактериальную пленку, собранную с поверхности культуры парамеций, вме-
сте со жгутиконосцами. Можно просто вылить в аквариум 1—2 литра куль-
туры разных простейших, выведенных иа бульоне. ’Через некоторое время
они там сильно размножатся.
2. В аквариум необходимо вводить кальций. Ввести его можно в виде
кусков обыкновенного мела.
3. Раз в декаду вода в аквариуме меняется. Для этого спускается вода
и открывается вводной кран.
Как показала практика, содержание беззубок в проточной воде очень вред-
но отражается иа них. Они погибают в большом количестве.
Воду необходимо менять только в том случае, если она мутнеет. При
плохом состоянии воды беззубки зарываются в ил, н сифоны у инх закрыты.
При хорошем состоянии беззубок — сифоны открыты.
Моллюсков можно анестезировать с помощью 70-градусного
спирта, или 2-процентного кокаина в воде, или 0,1—1-процентного
раствора хлоралгидрата. Для этой цели можно также помешать
животных в закрытый сосуд с тепловатой водой, из которой пред-
варительным кипячением был удален кислород. Полезно прибав-
лять хромовую кислоту в таком количестве, чтобы вода слегка
потемнела.
Пищеварительный канал виноградной улитки фиксируют в
жидкости Флемминга или в 7—15-процентном формалине. Окра-
шивают железным гематоксилином и докрашивают кислым фук-
сином, или гематоксилином Делафильда, или сафранином с свет-
лым зеленым.
Мускулатура улиток. Анестезируют улитку в кипяче-
ной воде при температуре 37°. Затем отрезают голову и часть те-
ла и фиксируют их в ценкеровской жидкости. Заключают в цел-
лоидин и изготовляют срезы 8—10 и. и больше толщиной. Окра-
шивают в железном гематоксилине. Для мацерации применяют
Уг-процентную хромовую кислоту, и материал изучают в неокра-
шенном виде в разведенном глицерине нли окрашивают гематок-
силином.
Нервная система улитки. У живой улитки вырезают
часть центральной нервной системы и фиксируют 24—48 часов в
крепком растворе Флемминга. Окрашивают сафранином и свет-
лым зеленым. После фиксации в насыщенном растворе сулемы
(без уксусной кислоты) окрашивают «триацидом» или железным
418
гематоксилином. Ганглии, быстро отпрепарированные из годова-
лого животного, можно окрашивать в растворе метиленового си-
него (1 : 10000 в физиологическом растворе) в течение 24 часов
при комнатной температуре. Затем их нужно перенести в молиб-
деновокислый аммоний на 24 часа, отмыть, заключить в парафин
и резать на 30—40 у. Свежс отпрепарированные ганглии можно
фиксировать 2 часа в 40-процентном формалине с 5-процентным
медным купоросом (1 : 2); отмывать 24 часа и заключать в пара-
фин. Окрашивать 10—15 минут в фосфорномолибденовой гема-
токсилине по Маллори. Дифференцировать в 40-градусном спир-
те и провести через 60-процентный аммиачный спирт.
Половые железы слизня. (Limax). Фиксируют в цен-
керовской или германовской жидкости. Заключают через хлоро-
форм в парафин. Окрашивают железным гематоксилином.
Членистоногие
Дафнии. В лаборатории дафиий разводят следующим образом: в бан-
ку наливают воду, безразлично, прудовую или водопроводную. На дио банки
предварительно насыпают слой в 1 —1,5 см хорошо промытой или же хорошо
прокаленной земли. Затем в нее вносят бактериальную пленку со жгутико-
носцами и парамециями. Через сутки в байку впускают несколько крупных
дафний. Дафнии в банке начинают размножаться. Когда появится довольно
большое количество молодняка, маток вылавливают длинной пипеткой и от-
саживают в другой сосуд.
Дафиий следует постоянно подкармливать. Критерием сытости служит их
темп размножения и внешний вид. Голодные дафнии становятся более про-
зрачными, а сытые имеют слегка розоватый оттенок.
Необходимо следить за тем, чтобы в воде постоянно были парамеции
н жгутиконосцы. А для того, чтобы эти последние не погибли с голоду, необ-
ходимо вводить в культуру бактериальную пленку
Мелких пресноводных членистоногих (Cyclops, Diaptomus и
др.) фиксируют в жидкости Буэна, промывают и окрашивают
кармином, обезвоживают и монтируют в бальзаме или помещают
в жидкий глицерин и затем монтируют в желатнн-глицерине.
Для.мелких членистоногих (клещи и т. п.) хорошим комбини-
рованным фиксатором и консервирующей средой является гум-
ми-хлорал: гумми-арабнка 50 г, хлоралгидрата 100 г, глицерина
32 см3, воды 100 см3.
Выдержать в термостате при 50° в течение нескольких дней.
Для изготовления тотальных препаратов нз насеко-
мых пригоден только свежий материал (высохшие насекомые
все без исключения препарируются очень плохо). Обычно, раз-
личные части насекомого препарируют отдельно, но приводимые
методы можно без особых изменений применять и к целым насе-
комым.
1-й метод. Органы, например, лапки или голову, обрабаты-
вают 10-процентным поташом, чтобы растворить находящиеся
внутри мягкие ткани. Обработка продолжается от нескольких ча-
сов дб нескольких дней, в завнснмости от насекомого. Можно
27* 419
ускорить обработку нагреванием, но это не рекомендуется. Затем
промывают водой и, оставляя объект погруженным в воду, вы-
тесняют из него содержимое легким надавливанием указательно-
го пальца.
Если имеют дело с целым насекомым, то действуют осторож-
но, чтобы не отделить головы и грудной полости от брюшка; если
нужно, слегка расширяют анус; выдавливают содержимое брюш-
ка и выпускают содержимое грудной полости через брюшко. По-
сле чего тщательно промывают в водопроводной воде и затем —
в дистиллированной или подкисленной воде; погружают в 90-гра-
дусный спирт (два раза с часовым 'интервалом), проводят через
абсолютный спирт, ксилол и монтируют в бальзаме.
2-й метод. Обрабатывают целое насекомое или его часть
хлорал-фенолом при нагревании (несколько минут) или на холоду
(несколько часов), сменяя многократно хлорал-фенол.
Помещают объект на предметное стекло и удаляют, возможно
полнее, хлорал-фенол. Затем монтируют в бальзаме. Можно так-
же провести через ксилол, а после того монтировать в бальзаме.
При этом препараты лучше и быстрее высыхают. Хлорал-фенол:
смесь 2 частей хлоралгидрата и 2 частей кристаллической карбо-
ловой кислоты, которую осторожно нагревают до разжижения;
смесь обезвоживает и просветляет объекты и может смешивать-
ся как с водой, так и с бальзамом.
Недостатком 2-го метода является то, что нельзя получить до-
статочно плоские препараты, какие получаются при обработке
поташом.
Крылья многих насекомых не следует подвергать действию по-
таша. Им обрабатывают только крылья полужесткокрылых и
надкрылья жесткокрылых.
Крылья большинства'насекомых можно монтировать, проведя
их через хлорал-фенол, или просто обезвоживая абсолютным
спиртом (в двух сменах) и затем проводя через ксилол.
Сухие крылья насекомых можно монтировать очень просто:
достаточно погрузить их в ксилол, чтобы удалить воздух, и затем
заключить в бальзам.
Чешуйки бабочек препарируют подобным же образом: на
пластинку помещают каплю ксилола и слегка скоблят крыло,
чтобы отделить чешуйки. К ксилолу с чешуйками прибавляют
каплю бальзама и прижимают сверху покровным стеклом. Части
крыла можно также монтировать в бальзаме или сухими — на
черном фоне, для изучения в отраженном свете.
Если невозможно или нецелесообразно удалять хитиновый по-
кров членистоногих, объект должен быть зафиксирован в быстро
проникающих жидкостях. Из таких фиксаторов можно указать
жидкости Петрункевича, Жильсона, Карнуа, Буэна. Во многих
случаях их можно применять в подогретом виде (60—80°), подо-
гревание ускоряет их проникновение. Однако, если можно, стен-
ку тела лучше разрезать или в нескольких местах проколоть.
420
В этом случае для фиксации можно применять обычные фиксато-
ры. О методах обработки хитина см. стр. 253.
Трахейная система. Для инъекции трахей насекомых
помещают в сосуд с ту|шыо, иногда удаляя у них перед этим
крылья. Сосуд соединяют с аспиратором, который соединен с об-
щим водным краном. При протекании воды воздух увлекается из
сосуда через аспиратор, создавая вакуум. При этом воздух, вы-
ходящий из трахей насекомого, замещается тушью.
Мелкие разветвления трахейной системы можно демонстриро-
вать на поверхности proventriculus личинок Dytiscus. Живых ли-
чинок помещают на две недели в большой закрытый сосуд, со-
держащий небольшое количество 2-лроцентного раствора осмие-
вой кислоты. Кусочки стенки proventriculus и жирового тела рас-
пластывают на предметном стекле и заключают в глицерин. Дей-
ствие осмиевой кислоты предупреждает проникновение жидко-
стей тела в трахеолы, и благодаря этому имеющийся в них воз-
дух делает их видимыми. Трахеолы бывают затронуты осмием
гораздо слабее, чем остальные ткани.
В некоторых случаях трахеолы можно демонстрировать путем
применения хромо-серебряного метода Гольджи. Или же после
фиксации в спирте их можно обработать глицерином и отмыть,
затем поместить в ’/^-процентный раствор хлорного золота на
!/2 — 1 час и восстанавливать в ^процентном растворе муравьи-
ной кислоты в течение 10 дней или более; метод капризен.
Нервная система. Тонкие структуры мозга можно вы-
явить с помощью следующего метода. Мозг насекомого средней
величины фиксируют в 10-процентиом формалине 4—20 часов (в
большинстве случаев 6 часов). После обезвоживания просветля-
ют в ксилоле и заключают в парафин. Окрашивают в эозине 20—
30 секунд, затем в квасцевом гематоксилине 30 секунд, отмыва-
ют в воде и переносят в фосфорномолибденовую кислоту (1%)
на 2—3 минуты. Далее следует отмывка в воде, окраска в смеси
Маллори в течение 6 секунд, опять отмывка, обезвоживание, про-
светление и заключение в бальзам. Или же после фиксации в
формалине материал промывают в воде, затем помещают в 5-
процентный раствор медного купороса на 24 часа, промывают,
обезвоживают и заключают в парафин. Срезы красят в'следую-
щей смеси: 10-процептного раствора фосфорномолибденовой кис-
лоты 1 см3; кристаллического гематоксилина 1 г; хлоралгидрата
6—10 г; воды 100 см3.
Для прижизненной окраски живых личинок бабочек или жу-
ков им маленьким шприцем инъицируют различные концентра-
ции метиленового синего (в */2—3/4-процентном растворе пова-
ренной соли). Игла должна пройти через гиподерму и мышцы,
но не через пищеварительный канал, и красителя должно быть
столько, чтобы окрасились все сегменты насекомого. После инъ-
екции животное еще 2—4 часа должно оставаться живым. Вскры-
тие должно обнаружить, что нервы окрасились в синий цвет. Че-
421
рез час или два окраска бледнеет, поэтому в некоторых случаях
метиленовый синий можно закрепить 10-процентным раствором
молибденового аммония.
Яйца и эмбрионы. При подготовке яиц членистоногих
для срезов необходимо прокалывать хорион и вителлиповую
мембрану, препятствующие проникновению обычных фиксирую-
щих веществ. В некоторых случаях яйца лучше фиксировать в
горячем фиксаторе (60—80°). По охлаждении хорион яиц нака-
лывают тонкой иглой и продолжают фиксацию до нужного срока;
сохраняют объект в 75—80-градусном спирте. Перед обезвожи-
ванием и заключением в парафин хорион, если это возможно,
удаляют.
Оболочники
Асцидий помещают в чистую морскую воду, наркотизиру-
ют ментолом (как описано для Actinia) и затем быстро погружа-
ют в раствор 10-процентной уксусной кислоты на 3—10 минут (в
зависимости от их величины), промывают в 50-градусном спирте
и обезвоживают обычным путем. Salpa, Pyrosoma и другие сво-
бодно плавающие оболочники могут быть зафиксированы и со-
хранены в 10-процентном формалине. К раствору формалина
прибавляется небольшое количество 1-процентной хромовой кис-
лоты, чтобы уплотнить слизь.
РАЗДЕЛ ОДИННАДЦАТЫЙ
ИЗМЕРЕНИЕ МИКРОСКОПИЧЕСКИХ ОБЪЕКТОВ
Продольное измерение
Если хотят измерить объект с помощью окуляр-микрометра,
вложенного в специальный измерительный окуляр, то прежде
всего нужно установить, чему соответствует одно деление окуляр-
микрометра (риг 95) при данном увеличении. При этом обьект-
Рис. 95. Микрометрические линейки. А—линейка окуляр-микрометра (5 мм
разделены на 50 частей), Б — линейка объект-микрометра при большом
увеличении (1 мм разделен на 100 частей)..
микрометр помещают под микроскопом и, достигая резкой уста-
новки шкалы (сильно затемняют), отсчитывают, сколько делений
объект-микрометра приходится на известное число делений оку-
ляр-цркрометра, вычисляя таким образом абсолютное значение
одного деления окуляр-микрометра (рис. 96).
423
Пример. 7 делений объект-микромстра покрываются 52 де-
лениями окуляр-микрометра.
1 деление объект-микрометра равно 10 р-, следовательно, 1 де-
ление окуляр-микрометра равно 7%г = 1,3 ц (вычислено при сле-
дующей оптике: масляная иммерсия 712, окуляр 5, тубус установ-
лен на 152).
Эта величина должна быть вычислена для каждого увеличе-
ния, т. е. при определенной уста-
новке окуляра и объектива и оп-
ределенной длине тубуса. Най-
денной величиной можно поль-
зоваться при работе с данным
микроскопом.
При измерении объекта
размер последнего определяют
сначала в делениях окуляр-
микрометра и затем умножают
на абсолютную
го деления.
Пример.
Рис. 9S. Микроскопическая картина
при сравнении делений объект-микро-
метра (толстые линии} и окуляр-
мнкрометра.
величину одно-
Если величина
клеточного ядра равна 12 ХЮ делений, тогда его абсолютная ве-
личина при указанной выше оптике составляет 15,6 X 13
Измеренне площади
Если надо измерить площадь или определить количественное
соотношение между двумя участками ткани, поступают следую-
щим образом: зарисовывают контур всего среза или измеряемого
участка его на бумагу равномерной толщины, вырезают рисунок
и взвешивают его. Кроме того из этой же самой бумаги выреза-
ют кусок определенной площади (1 или 2 см3) и также взвеши-
вают его. Таким способом площадь срезов можно вычислить до-
вольно точно. Если хотят определить соотношение между двумя
тканями (например, промежуточной и генеративной ткани семен-
ников), поступают так же и получают искомое число непосред-
ственно из соотношения весов вырезанных кусочков бумаги.
Определение увеличения рисунка
Увеличение, получаемое при применении рисовального аппа-
рата, определить очень легко. Под микроскопом при соответству-
ющем увеличении помещается объект-микрометр, деления кото-
рого зарисовываются с помощью рисовального аппарата. Так как
абсолютная величина делений известна, то для вычисления увели-
чения рисунка надо разделить число, выражающее измеренную с
помощью линейки длину зарисованных делений, на число, выра-
жающее абсолютную величину этих делений. Вычисленное увели-
чение относится только к дайной микроскопической оптике, длине
тубуса, рисовальному аппарату и высоте рисовального столика.
424
Пример. 4 деления окуляр-микрометра дают на рисунке-
расстояние в 13,1 мм. Абсолютная величина деления 10 и.
13100
= 327,5 х .
40
Увеличение, достигаемое при микрофотографии, можно изме-
рять непосредственно на матовом стекле.
ДОПОЛНЕНИЯ
Мы сочли полезным внести в конце книги ряд методик, почерп-
нутых из новейшей литературы.
В ряде новейших работ для исследований по флуоресцентной
микроскопии используют видимый свет, так как свечение веществ,
флуоресцирующих зеленым, желтым и красным цветом, может
возникать под влиянием не только ультрафиолетовых, но и си-
них и фиолетовых лучей. Для этой цели используют обычный
микроскоп и достаточно сильный источник света (например, низ-
ковольтную лампу для микроскопирования или вольтову дугу);
два фильтра, сиш’-фиолетовый и желтый, должны быть подоб-
раны так, чтобы они, сложенные вместе, не пропускали лучей
видимого спектра.
Сочетание методов флуоресцентной мик-
роскопии с применением конденсатора тем-
ного поля позволяет улучшить и упростить исследование
целого ряда объектов. Источником света служит лампа черно-
фиолетового стекла с микрогорелкой (пары ртути), дающая свет
Вуда (длина волны 350 лш); стенки лампы одновременно явля-
ются единственно нужным светофильтром. Микроскоп обычный
(монокулярный), снабженный темнопольным конденсором. Объ-
ектив 30 X, окуляр 8 X. Наблюдение возможно, когда лампа раз-
горается полностью (через 15 мин.). Между предметным стеклом
и конденсором помещают каплю глицерина. Преимущество ме-
тода: 1) отсутствие фильтров, 2) отсутствие опасности попада-
ния ультрафиолетовых лучей в глаз, 3) возможность изготовле-
ния постояннных препаратов, 4) возможность использования су-
хих объективов и в силу этого значительно более обширное поле
зрения.
Гомори (1950) описал приготовление и использование ново-
го красителя для эластической ткани, получающегося при обработ-
ке спиртового раствора основного фуксина паральдегидом и со-
426
ляной кислотой. В растворе альдегид-фуксин окрашивает изби-
рательно клетки аденогипофиза, продуцирующие тиротропный
гормон, а также нейросекреторную субстанцию в клетках нейро-
гипофиза и гипоталамуса. Приготовление сухого альдегид-фук-
сина: 1) к 100 мл 0,5-процентного раствора (в 70-градусном
спирте) основного фуксина прибавляют 1 мл паральдегида и 1 мл
1концентр1ированной соляной кислоты (смесь стоит три дня при
комнатной температуре); 2) в делительную воронку прибавляют
к 50 мл хлороформа, 100 мл смеси и дополнительно 200 мл дистил-
лирований воды; 3) смесь недолго встряхивают и дают образо-
вавшемуся осадку осесть; 4) фильтруют через бумажный фильтр
(без отсоса); 5) влажный осадок красителя сушат при 50°С;
6) сухой осадок соскабливают с бумажного фильтра и хранят
в герметически закрытой склянке. Для окраски 0,5 г сухого кра-
сителя растворяют в 100 мл 70-градусного спирта и 1 мл концен-
трированной соляной кислоты.
Применение кислых красителей для окрас-
ки бактерий и дрожжей. При исследовании микробов
почти исключительно применяют основные красители, хотя кис-
лые красители имеют целый ряд преимуществ: окраска без нагре-
вания, хорошая сохранность формы бактерий, прозрачность окра-
шенных клеток. Заслуга введения кислых красителей для исследо-
вания бактерий и грибов в значительной мере принадлежит Вино-
градскому (1925). Мансваль (1941) рекомендует следующий ме-
тод: раствор А: 5-процентная карболовая кислота—30 мл, 20-
процентная уксусная кислота — 8—10 мл, 30-процеитное полуто-
рахлористое железо — 4 мл. К раствору А добавляют 1-процент-
ный водный раствор кислого красителя, например, кислого фук-
сина— 1—2 мл или анилинового синего — 2—8 мл или светлого
зеленого — 2—8 мл. Препарат можно окрасить смесью растворов
двух кислых красителей (предварительно обработав мазок раст-
вором А и затем сполоснув водой): кислого фуксина—1 часть,
светлою зеленого’—4 части.
Окрашенные препараты нередко относитель-
но быстро выцветают под влиянием канадского бальза-
ма. Чтобы предохранить препараты, пользуются методом Массона.
Препараты сперва покрывают очень тонким слоем бальзама, ко-
торый окисляется при более или менее длительном контакте с воз-
духом, а затем покрывается добавочно слоем неразведенного ка-
надского бальзама: 1) препарат из ксилола или толуола опуска-
ют на 1—2 мин. в стаканчик с раствором жидкого бальзама
(1 часть бальзама и 6 частей ксилола или толуола), чистым или
насыщенным салициловой кислотой (последняя нужна, если пре-
парат окрашен кислым фуксином, трехцветным способом по Мас-
427
сону и аналогичными методами); 2)' препарат вынимают, дают
стечь избытку бальзама, вытирают изнанку стекла и оставляют
в помещении, защищенном от пыли, покуда ксилол не испарится
и на поверхности срезов не образуется твердая прозрачная пленка
бальзама. Тогда на срезы наносят каплю густого натурального
бальзама, накрывают покровным стеклом и осторожно нагревают
препарат на столике, обычно употребляемом для расплавления
срезов. На покровное стекло кладут маленькую гирьку (20 г). Из-
быток бальзама, выступающий по краям покровного стекла, уда-
ляют обычным способом.
Кретен считает, что и о д я в л я ет ся лучшим декаль-
цинирующим средством: фиксируют 8—10 часов в
смеси равных частей насыщенных растворов сулемы и пикрино-
вой кислот, к которой добавляют 10% формалина; переносят
объект в 25-процентный раствор йодистого калия, добавляют кри-
сталлики иода до насыщения, а затем 10% трихлоруксусной кис-
лоты; этот раствор декальцинируют и одновременно извлекают
сулему; процесс декальцинации протекает длительно, например,
для декальцинации зуба человека требуется 3 месяца.
Гистохимическое выявление кальция г а л-
ламиновым синим (Сток, 1949). Фиксация спиртом или
нейтральным формалином. Заливка в парафин. Срезы (толщи-
ной 10 и) помещают на 10 мин. в раствор галламипового синего.
Этот краситель образует нерастворимый «лак» с кальцием. При-
готовление красителя: растворяют 0,1—0,2 г в 100 см3 кипящей
дистиллированной воды, охлаждают и фильтруют. Кальций ок-
рашивается в синий цвет, ткани бесцветны. Препарат, как обычно,
заключают в бальзам.
Мак-Лиж, Белл, Ла-Кур, Чейен (1957) рекомендуют моди-
фикацию метода выявления аргинина по Сакагу-
ши. Мазки ткани фиксируют 15 мин. смесью Левицкого (равные
объемы 10-процентного формалина и 1-процентного раствора хро-
мовой кислоты), хорошо промывают дистиллированной водой 5
минут, окунают в 1-процентный раствор целлоидина (в равных
объемах спирта и эфира) и высушивают на воздухе. Затем мазки
(или срезы) обрабатывают 6 минут в смеси: 30 мл 1-процентного
раствора NaOH; 0,6 мл 1-процентного раствора 2.4-дихлоро-а-наф-
тола в 70-градусном спирте; 1,2 мл 1-процентного раствора гипо-
хлорита натрия. Красное окрашивание клеток наступает через
1—2 минуты. Затем препарат быстро споласкивают в 5-процент-
ном растворе мочевины и помещают на 5 минут в 1-процентпый
раствор NaOH, и, наконец, монтируют в смеси: 9 частей глицерина
и 1 часть 10-процентного раствора NaOH.
428
При гистохимическом анализе термо лабильных энзи-
мов, например, фосфатаз. Шевремон (1956) рекомендует объек-
ты заливать в маргарин. Маргарин не должен содержать воды.
Продажный маргарин, предварительно нагретый до 303С, фильтру-
ют. Фиксированные объекты проводят, как обычно, через спирты,
ксилол и бензол, и затем помещают на 1 час в жидкий маргарин
(1 раз сменить). Из застывшего маргарина изготовляют блок для
резки на замораживающем микротоме (при температуре—20'С).
Срезы помещают па предметные стекла, с налитой холодной (тем-,
пература тающего льда) водой. По мере нагревания воды до
комнатной температуры срезы постепенно расправляются. После
этого воду удаляют. Срезы прочно прилипают к предметному
стеклу. Если необходимо, то предметные стекла со срезами хра-
нят некоторое время в рефрижераторе.
Для гистохимичесокого выявления рибофлавина Бурн
(1953) рекомендует способ Шевремона и Комера, которые фикси-
руют маленькие (3 мм толщиной) кусочки ткани 5 дней в смеси:
формалин — 25 мл, 30-процснтный раствор уксуснокислого свин-
ца— 33 мл, дистиллированной воды — 100 мл; к смеси добавляют
несколько капель уксусной кислоты. Срезы, изготовленные на за-
мораживающем микротоме, доводят до воды, к которой добавляют
несколько капель уксусной кислоты. Затем срезы помещают в раз-
веденную соляную кислоту7, в которой находится несколько зерны-
шек гранулированного цинка. После этого срезы переносят на 5—
10 минут в воду, содержащую несколько капель перекиси водоро-
да. Затем обезвоживают и заключают в бальзам. Рибофла-
вин обнаруживается в виде розов о-к р а с н ы х
зерен.
Для гистохимического -определения «-аминокислот Иа-
зума и Итикава (1953) предложили использовать нингидрин в
сочетании с реактивом Шиффа. Нингидрин (или аллоксан) вы-
зывает окислительное дезаминирование аминокислот с образова-
нием альдегидных групп, которые затем выявляются реактивом
Шиффа. Этот меотд, приведенный недавно Бурстоном (1955), дает
достаточно точное представление о распределении «-аминокислот
в тканях и клетках. Слабо красно-фиолетовое окрашивание дают
ядра, несколько сильнее выявляются эритроциты, интенсивно ок-
рашиваются эластические и коллагеновые волокна и еще силь-
нее— мышечная ткань; муцин остается бесцветным. Фиксируют
формалином, срезы обрабатывают 20 часов (при 37°) 5-про-
центным нингидрином (или 1-процентным аллоксаном) в абсолют-
ном-спирте. Промывают абсолютным спиртом (сменить 4 раза) и
переносят в воду. Обрабатывают 20 мниут реактивом Шиффа. Спо-
ласкивают 10-процентным раствором бисульфита натрия (5 ми-
429
нут), промывают 30 минут водой, обезвоживают и как обычно’
заключают в бальзам. Для контроля часть срезов: 1) дезамини-
руют— 20 часов в HNO2 (при 0° С), которую приготовляют добав-
лением 10-процентной уксусной кислоты к 5-процентному раство-
ру нитрита натрия (на холоду!) или 2) ацетилируют 1,5 часа
(при 45°С) 30-процентным раствором уксусного ангидрида
(СН3СО)2О в пиридине; кроме того, можно «блокировать» сре-
за ткани 10-процентным водным раствором фенилгидразина
(1 час при 40сС; pH 5) или же 2-процентным раствором анилина
при тех же условиях.
Для выявления аминокислот аланина, валина и лей-
цина Обель и Асселино (1948) предложили использовать гипо-
хлорит натрия, обработка которым ведет к образованию альдегид-
ных групп. Эта реакция была приспособлена Шу и его сотруд-
никами (1953) и затем Бурстоном (1955) для целей гистохимии.
Материал фиксируют ацетоном. Срезы обрабатывают 5 минут
10-процентным раствором гипохлорита натрия (pH 7,5) или 5-про-
центным раствором гипрохлорита кальция. Затем срезы промыва-
ют водой и проводят через слабый раствор тиосульфата натрия
для удаления избытка хлора, снова промывают водой, обрабаты-
вают в течение 30 минут реактивом Шиффа, споласкивают в 10-
процентном растворе бисульфита натрия, промывают и заклю-
чают, как обычно в бальзам. Различные тканевые элементы дают
разное по интенсивности красно-фиолетовое окрашивание. Кон-
трольные срезы обрабатывают также, как и при реакции нингид-
рин—реактив Шиффа.
Демонстрация остеокластов в костной тка-
ни. Берникот (1947) рекомендует тонкую костную пластику, по-
лученную от толького что убитого животного, поместить и
1 : 10000 раствор нейтрального красного (в растворе Рингера) при
37’С (в термостате). Интенсивное окрашивание остеокластов
наступает через 45—60 минут. »
Тинеи и Ундерхилл (1949) советуют для прижизненной
окраски жира инъицировать подопытному животному 0,5 мл
1-процентного водного раствора трифенил-тетразолий-хлорида.
Нейтральный жир окрашивается в оранжево-красный цвет. Таким
образом можно выявлять жировые включения в молочных желе-
зах, мезентерии и печени.
Для окраски моторных нервных окончаний в мус-
кульных волокнах Куто (1947) применяет супровитально раствор
яиуса зеленого (1 : 1000 или 1 : 5000 в физиологическом растворе):
окраску закрепляют обработкой в 10-процентном растворе мо-
либденовокислого аммония, затем фиксируют формалином и за-
ливают в парафин.
430
ПРИЛОЖЕНИЕ
ЛИТЕРАТУРА
Общие руководства и учебники по микроскопической технике:
1. Вайль С. С. Руководство по патолого-анатомической технике, 1947.
2. Наумов Н. А. и Козлов В. Е. Основы ботанической микротехиики,
Москва, 1954.
3. Никифоров М. Н. Микроскопическая техника, 1919.
4. Нем илов А. В. Курс практической гистологии. 1923.
5. Р о м е й с Б. Микроскопическая техника, М., 1953.
6. Cowdry Е. Microscopic Technique in Biology and Medicine, 1943.
7. Gatenby and Painter. The microtomiste Vade-mecum, 1938.
8. Graupser. Mikroskopische Technik, 1934.
9. Krause. Enzyclopedie der mikroskopischen Tcchnik, 1926—27.
10. Langeron. Precis de microscopic, 1950.
11. Me Clung. Handbook of microscopical technique, 1937.
12. Pet erf i. Methodik der wissenschaftlicher Biologic, 1932.
13. Poli card A., Bessis M„ Los quin M. Traite de microscopic,
Paris, 1957.
14. Sch moll. Die pathologisch-histologischen Untersuchungsmethoden, 1932
Методические указания по работе с зоологическими объектами
можно найти в руководствах:
1. Аверинцев С. В. Малый практикум по зоологии беспозвоночных, 1947
2. Иванов А. В., Петрушевский Ю. К., Полянский ГО. И,
Стрелков А. А. Большой практикум по зоологии беспозвоночных,
часть первая, 1941.
3. И в а и о в А. В., М о п ч а д с к и й А. С., П о л я н с к и й Ю. И., С т р е л-
к'ов А. А. Большой практикум по зоологии беспозвоночных, часть вто-
рая, 1946.
4. 'К ю к е н т а л ь. Руповодство по практической зоологии, 1904.
5. Павловский Е. Н. Практикум по зоологии, 1938.
6. Павловский Е. Н. Скорый способ приготовления окрашенных то-
тальных препаратов. «Лабораторная практика», № 5, 1940.
7. Е. Н. Павловский и Д. В. Вол минский. Новая среда для заклю-
чения микропрепаратов. «Зоологич. журнал», том 29, № 5, 1950.
8. Эпштейн Г. В. Практикум по паразитическим простейшим, 1940.
9. Hartmann. Praktikum der Protozoologie, 1928.
10. Mayer. Zoomikrotechnik, 1920.
11. Pan tin C. Notes on Microscopical Technique for Zoologists, 1946.
12. Schuberg. Zoologisches Praktikum. 1910.
28 Микроскопическая техника 433
Специально устройству микроскопа и микроскопических прибо-
ров посвящены книги <и статьи:
1. Алексеев К. С. Самодельный нагревательный столик для микроскопа.
«Лабораторная практика», № 10, 1932.
2. Га иду ков Н. М. Микроскоп и ультрамикроскоп (глава в книге С. Зла-
тогорова «Учение о микроорганизмах», ч. II, 1916).
3. Карпов В. П. Очерк общей теории микроскопа в ее историческом раз-
витии, 1907.
4. Кульчицкий Н. К. Учение о микроскопе, 1909.
5. Клер В. О. Микропроекция для зарисовок. «Лабораторная практика»,
№ 11, 1933. *
6. Мейс ель М. Н. Успехи в развитии микроскопии. «Микробиология»,
№ 9, 1940.
7. Метелкин А. Наша литература о микроскопе. «Лабораторная практи-
ка», 1933.
8. Метелкин А. Простой тип нагревательного столика для микроскопа.
Русск. журн. троп, мед., 8, 1926.
9. Огнев Й. Ф. Микроскоп и первые работы с ним, 1915.
10. Пому с Б. О проекции микропрепаратов. «Лабораторная практика»,
7—8, 1940.
11. Саватеев А. И. Микроскоп. Его устройство и обращение с ним. 1926.
12. Титов. Микроскопы, их принадлежности и применение. НТИ, 1934.
13. Kohler. Das Mikroskop und sein Anwendung, Abderhaldens Handbuch
der biol. Arbeitsmethoden. Abt. 2. Heft 2, Lif. 95, 1923.
14. Meizner-Zimmerman. Das Mikroskop, 1928.
Теориям окрашивания и фиксации посвящены монографиче-
ские работы:
I. Lis on. Les theories des colorations histologique. An Soc. Roy. Sc. Med.
Bruxelles, 1933.
2. Michaelis. Einfilrung in die Farbstoffchemie fur Histologen, 1902.
3. Zeiger. Physikochemische Grundlagen der histologische Methodik, 1938.
Теория окраски по методу Романовского дана в работе Мош-
ковского Ш. Д. К теории и практике окрашивания крови и крове-
паразитов. Архив Русского протистологического общества, т. II,
1923.
Вопросы гистохимии и гистофизиологии подробно и крити-”
чески освещены в работах:
1. Андерс А. Г. и П ер е в о щиков а К- Морфология фосфорного об-
мена в номере и патологии, «Архив патологии», 1947.
2. Глик Д. Методика гисто- и цитохимии, 1950.
3. Граменипкнй М. И. Новые методы физиологического исследования
и пх результаты, 1930.
4. Макаров П. В. Физико-химические свойства клеток и методы их изу-
чения, 1948.
5. П и р с Э. Гистохимия теоретическая и прикладная. 1956.
6. Пор ту г а лов В. В. Очерки гистофизцологни нервных окончаний, 1955.
7. Роскин Г. И. Витамин С в жизни клеток в норме и патологии, «Успехи
соврем, биологии», т. XVIII, № 2, 1944.
8. Роскин Г. И. и Г и н з б у р г А. Зимонуклеиновая кислота протозойной
клетки. «Доклады АН СССР», т. XLII, А? 8, 1944.
9. Роскин Г. И. Распределение рибонуклеиновой кислоты в плазме и яд-
рах различных клеток. «Доклады АН СССР», т. XL1X, № 4, 1945.
10. Роскин Г. И. и Струве М. Е. Гистохимические наблюдения над ар-
гинином нормальных тканей. «Доклады АН СССР», т. LVI1I, № 8, 1947.
434
11. Роскип Г. И. и СтрувеМ. Е. Цитохимические изменения рибонукле-
иновой кислоты и аргинина в процессе деления клетки. «Доклады
АН СССР», 1. LVII, № 9, 1947.
12. Роскин Г. И. К гистофизиологии капилляров. «Доклады АН СССР»,
т. XLV1I, № 9, 1945.
13. Роскин Г. И. Изоэлектрические пункты клеток и их изменения в нор-
ме, развитии и патологии. «Успехи соврем, биологии», т. XXII, № 2, 1946.
14. Роскин Г. И. и Струве М. Е. Новый метод дифференциальной ци-
тофизиологической диагностики раковых и нормальных тканей. «Бюлле-
тень экспериментальной биологии и медицины», т. XX, № 7, 1946.
15. Роскин Г, И., Струве М. Е., Скляр Т. И. Гистохимия-сукииноде-
гидразы эмбриональных клеток и клеток злокачественных опухолей.
«Доклады АН СССР, т. LXXXIV, № 2, 1952.
16. Роскин Г. И., Юлиус А. А. О коллоиднолабильиом состоянии рибо-
нуклеиновой кислоты в развивающихся, интенсивно функционирующих,
а также в злокачественных клетках. «Архив анатомии, гистологии и эмб-
риологии», т. XXXII, № 4, 1955,
17. Роскин Г. И., Бродский В. Я. Нуклеотиды и нуклеиновые кислоты
протозойной клетки. «Доклады АН СССР», т. LXXXIX, № 6, 1953.
18. Шабадаш А. Л. Проблемы гистохимического исследования гликогена
нормальной нервной системы, 1949.
19. Lis on L. Cytochemie et histochemie animate, 1953.
20. Ries. Grundriss der Histophysiologe, 1938.
21. Vo nw ill er P., Lebendige Gewebelehre. Eine Histaphysiologie auf neucr
Grundlage, 1945.
Проблемы витального окрашивания излагаются в следующих
статьях:
1. Кедровский Б. В. О коллоидах развивающихся клеток (анаболитах).
«Биологический журнал», т. VI, 1937,
2. Насонов Д. Н. н Александров В. Я. Реакция живого вещества
иа внешние воздействия. 1940.
3. Gicklhorn, Elektive Vitalfjirbung. Ergebnisse der Biologie, Bd. 7, 1931.
4. M 6 11] e n d 6 r f f, Farbung vitale. Enzyklop. d, mikr. Technik. Krause,
1926—27.
Специально цитологической технике посвящены сводные
работы:
1. Bela г. Die Technik der deskriptiven Cytologie (в книге Peterfi, Met-
hod! k der wiss. Biologic, 1928).
2. Baker J. Cytological Technique, 1945.
Поляризационный микроскоп и его применение в биологии
описаны в работе:
Schmidt. Polarisationsoptische Analyse des submikroskopischen Banes von
Zelleo mid Geweben. Handbuch der biol. Arbeitsmethoden, Abt. V, Teil.
10, 1934.
Вопросам фазово-контрастной микроскопии посвящены работы:
1. Бродский В. Я. Фазово-контрастная микроскопия, ее возможности
и применение в нормальной и патологической гистологии. «Успехи со-
врем. биологии», № 33, 1952.
2. Г а н з е н Г., Ром ингер А., Михель К. Фазово-коитрастная мик-
роскопия в медицине, Москва, 1955.
3. Генкель Б. А. О применении и значении фазово-контрастной микро-
скопии для биологических целей, «Микробиология», 15. 6, 1946.
4. Пешков М. А. Аноптральный микроскоп. Новый оптический прибор
для исследования малоконтрастных объектов. «Успехи соврем, биологии»,
№ 2, 1954.
28’
435
Сведения по работе с микроманипулятором даны в статье
«Микрургия» в Б. медицинской энциклопедии (т. 18, 1931) и в
книге Фопбрюн П. Методы микромапипулянии. 1951.
Методика микросжигания изложена в работах:
I. Скадозская Н. С. Метод микросжига'вия в гистологий, «Успехи со-
врем. биологии», т. 18, 1944.
2. Policard. La methode de la microineration, 1938.
Вопросы прижизненного наблюдения и прижизненного экспери-
мента над клетками и тканями, а также вопросы микрохирургии
освещены в книге Г. К. Хрущева «Физические свойства живой
клетки» (1930), в вышеприведенной книге Me. Clung, >в статье
Чемберса, а также в вышеуказанной книге Peterfi.
По истории микроскопической техники, кроме вышеуказанной
Enzyklopeclie der mikroskopischen Technik под редакцией Krause,
можно указать книгу Кацнельсона «Сто лет учения о клетке»,
1939, где читатель найдет ряд интересных сведений, а также сле-
дующие книги:
1. Рождественский Д. С. Чем овладел и что должен завоевать мик-
роскоп (очерк истории микроскопа), «Природа», 6, 1936.
2. Роскин Г. И. К истории гистологии в Московском университете. Уче-
ные записки Московского государственного университета, вып. 54, 1940.
3. Соболь С. Л. К истории микроскопа в раннем периоде деятельности
Петербургской академии наук, Известия Ак. наук СССР, № 2, 1945.
4. Соболь С. Л. Очерки по истории микроскопа. Диссертация, Ак. наук
СССР (не опубликовано).
5. Соболь С. Л. История микроскопа и микроскопических исследований
в России в XVIII в., 1949.
Вопросы микрофотографии подробно изложены в следующих
руководствах и статьях:
1. Волков Н. А. Краткие основы сГьемки через микроскоп, ВИЭМ, 1935.
2. Давид. Курс фотографии, 1934.
3. Живаго П. И. и Лебедев В. Н. Микрофотография, Большая меди-
цинская энциклопедия, т. XVIII.
4. Цукерман Л. И. Практическое руководство по микрофотографии, 1950.
5. Шиллабер Ч. Микрофотография, 1951.
Методика реконструкции по срезам подробно изложена в сле-
дующих работах:
1. Кащенко. Die graphische Isolierung. Anatomisch. Anzeiger. Bd. 2, 1887.
2. Лебедкин. Zur Technik, der plastischen Rekonstrufction, Zeitschr. wiss
Mikroskopie, Bd. 31, 1914.
3. Лебедкин. Труды Белорусского гос. университета, № 8—10, 1925.
4. Peter К- Die Methoden der Rekonstruktion, 1906.
Методы применения флуоресцентной микроскопии к анализу
клеток и тканей можно найти в следующих работах:
1. Бергольц В. Е. Люминесцентная микроскопия, 1953.
2. Лихачев Н. А. К технике люминесцентной микроскопии гистобиологи-
чсских объектов. «Архив патологии», № 2, 1954.
3. Мей сель М. Н. Флуоресцентная микроскопия и ее применение в мик-
робиологии. «^Микробиология», 1947.
436
4. Петровская О. А. Применение в биологии флуоресцентной микроско-
пии. «Успехи соврем, биологии», 26, 1948.
5. Hat tin ger und Натре г 1. D:e Anwendung der Fluoreszenzmikro-
skops zur Untersuchung tieriseber Gewcbe. Zeitschr. fiir milkr.-anat. For-
schung, 1933.
6A Q u e г n e r. Mikrofluoroskopie und Histulogie, Zeitschr. fiir mikr.-anat. For-
schung, 1933.
Методы прижизненного изучения клеток и тканей изложены
в статьях:
1. Пли сс Г. Б. Новый метод прижизненного микроскопического исследо-
вания тканевых структур. «Успехи соврем, биологии», т. XXXIX, № 3,
1955.
2. Фонви л лер П. Новые исследования школы Е. Р. Кларка по прижиз-
ненной микроскопии. «Архив аиат., гистол. и эмбриол,», т. XVI, № 3
1937.
Подробные данные по теории и практике «электронной микро-
скопии» имеются в книгах и статьях:
1. Бретшнейдер Л. «Электронно-микроскопическое изучение тканевых
срезов. Сборник «Современные проблемы цитологии», 1955.
2. В е р ц н е р В. И. Электронный микроскоп и его применение, 1948.
3. Верцнер В. И. Советский электронный микроскоп. «Заводская лабора-
тория», № 11, 1947.
4. Верцнер В. И. Простой метод теневых покрытий в электронной мик-
роскопии. «Доклады АН СССР», 8, 1031, 1947.
5. Верцнер В. И. и Гольд ии Л. Электронно-микроскопические исследо-
вания гистологических объектов. «Журн. общ. биологии», т IX, № 6,
1948.
6. Зол ко вер А. М. и Тихоненко А. С. Сравнительное электронно-
микроскопическое изучение биологических объектов контрастированных
(подтенеиных) некоторыми металлами. «Известия Академии наук
СССР», серия биологическая, № 2, 1954.
7. Кушнир Ю. Окно в невидимое, 1948.
8. Лебедев А. А. Электронная микроскопия, 1954.
9. С а м о с у д о в а Н. В. Об электронно-микроскопическом исследовании
структуры мышц при помощи ультратонких срезов. ДАН, 103, 1955.
10. Суш кип Н. Г. Электронный микроскоп, 1949.
П. Фр им ер А. и Пу пк о С. Л. Методы исследования в электронной мик-
роскопии. «Заводская лаборатория», № 11, 1947.
12. Ходукин Н. Электронная микроскопия в микробиологии. «Успехи со-
врем. биологии», 26, 1948.
13. Применение электронной микроскопии. Сборник. Москва, 1957.
14. Burton and Kohl. The Electron Microscope, 1946.
15. Gosslett. Electron Microscopy. London, 1951.
Вопросы ауто гисторадиографии освещены в статьях:
1. Мамуль Я. В. Получение микрорадиоавтографов методом погруже-
ния.
«Журн. общ. биологии», № 4, 1952.
2. Bourn G. Autoradiography. Biol. Rew. 27, 1952.
Методы микроскопии и цитофотометрии в ультрафиолетовых
лучах изложены в статьях:
1. Бродский В. Я., Количественные цитохимйческие методы (цитофото-
метрия). «Успехи соврем, биологии», т. 42, в. 1 (4), 1956. 5
29*
437
2. Лимаренко И. М. Ультрафиолетовая микроскопия и се применение
для изучения химического состава клеток и тканей «Успехи соврем, био-
логии», т. 38, вып. 2, 1954.
Методы замораживания'высушивания изложены в работах:
’1 . Белл Л. Применение метода высушивания замороженных объектов в ци-
тологии. Сборник «Современные проблемы цитологии», 1955.
2. Дыбан и Журавлей. О методике замораживания и высушивания
в гистологии «Жури. общ. биологии», 15, № 3, 1954.
3. Применение замораживания-высушивания в биологии. Сборник под ре-
дакцией Харриса. Москва, 1956.
АЛФАВИТНЫЙ УКАЗАТЕЛЬ
(русский)
л
Аберрация сферическая 9
— хроматическая 9
Абсолютный спирт 101, 106
---- ледяная уксусная кислота 247
----щелочной 201
----эфир 346
Абсорбция ультрафиолета 55, 236
Адеяозин-трифосфатазы, метод вы-
явления по Глику н Фишеру 272
Аджективные красители 172, 174
Адреналин 260
Адсорбционная теория крашения 177
Адсорбция инфракрасных лучей 236
Адсорбция красителя 181
Азаиовый метод Гейденгайна 330 —
331
----модификация 331
Азокармик 330
Азотная кислота 234
---- декальцинация 341
Азотнокислое серебро 214, 225, 276
Азур I 74, 348
Азур II 204, 348
Азур-’Эозин 240
----по Максимову 204, 349
Айзенберг 71, 303
Алании 431
Александров 71, 302, 303
Ализарин- 76
— виридин 208
— сернокислый натрий 76, 202
— толуидиновый синий 313
Ализариновый синий кислый 208
Аллоксан 430
Аллоксановая реакция 229
Алфеевой метод окраски 205
Альбумин-глицерин 151
Альбуминовая вода 151
Альдегид-фуксии 427
Альжибеца метод серебрения 371
Алкильные группы 171
Альтмани 121
Альтмана метод окраски митохон-
дрий 317
— фиксатор 113
— фуксии 317
Альцгеймера метод выявления мито-
хондрий 364
Альфа-нафтол (а-иафтол) 233
Аметол 63
Амидные группы 171
Амилацетат 30, 32, 144, 145
Амилоид 295
Аминоксилоты-а, определение 430
— методы выявления 230—235
— осаждение 235
Амитоз 312
Аммиачная вода 384
Аммиачное серебро 217, 218
-----приготовление 335, 336, 339,
357, 366, 368
Аммиачные квасцы 190
Амнион 305, 306, 312, 321
«Амплитудные» препараты 45
Амфотерные вещества 175
Амфофильныс элементы 175
Анализатор 55, 56 * 1
Андрес А. Г. 306, 307
Анизотропные тела 55
Анилин 330
Анилиновая вода 317
Анилиновое масло 144
Анилиновые красители 196, 197. 198
Анилиновый синий 200, 202
Анодные флуорохромы 54
Аиоптральпый микроскоп 49
Аптрахиповые красители 174
Аойама метод выявления аппарата
Гольджи 323
Апатн среда для заключения пре-
паратов 136
Апертура численная 10
Апертурная диафрагма кон'депсора
45
1 Звездочкой обозначены страни-
цы, на которых помещены рисунки.
439
Апертурная шкала 47
Апланатическпй конденсатор 16
Апохроматы 10, 90
Апохроматический объектив 10
Аппарат Гольджи 321—325
— .—, метод выявления азотнокис-
лым ураном 322
----- метод выявления по Аойама
323
— -------по Да-Фаио 323
----------по Кахалу 322
----------по Колакчеву — Насоно-
ву 321
-----хлористым кадмием 323
— — объекты для изучения 324, 325
-----прижизненные наблюдения
321, 324
— Гольджи — Резоиико 372
— рисовальный 424
Аргентафиниая реакция 281
Аргентофильные волокна 336
Аргииии, выявление модифициро-
ванным методом Сакагуши 428
— методы выявления 230—234
— распределение в тканях 230, 231 *
Артефакты 27, 94, 96
Аскарида фиксация 106
Аскорбиновая кислота 276
Асселино 431
Астацин 277
Асфальтовый лак 165
Асцитный рак 312
Ауксохромы 171
Аурамин 55
Аурамия 76
Ауранция 198, 318
Аутогисторадиография 290—291
Ауторадиографический анализ 121
АФА-фиксатор 355
Ахромат 10
Ахроматические объекты 10, 90
Ацетальфосфатиды 260
Ацетат-вероналовый буфер 286
Ацетилхолин-эстераза 272
Ацетон 166
— хлороформ 88
Ацидофилия 175
Ацидофильные элементы 173
Ачукарро метод импрегнации соеди-
нительной ткани 338
Б
Бабухии А. И. 7, 170
Багипского метод выявления нейрог-
лии 385
Базальные зерна 314, 315
Базофилия 175, 184
Базофилы, см. кровь
Базофильные элементы 173
«Бакелит» 260
Бактерии — заключение в метил-ме-
такрилат 168
— окраска кислыми красителями 427
— ядроподобные образования 310
Бакхуса модификация метода Жиру
и Леблона 277
Бальзам канадский 135
— пихтовый 136
Банк 211
Барбитуро-кислый натрий 271
Барой АГ А. 126, 145
Бауэра метод выявления гликогена
250
Безмягкотные волокна, серебрение
371
Бекер 221, 255
Бекера фиксатор 255
— классификация гистохимических
методов 221
Бекера модификация метода Сака-
гуши 233
— формол-кальций 104
Беланже и Леблона метод аутоги-
сторадиографии 291
Белецкого метод окраски тигроида
363
Белковые вещества, методы выяв-
ления 229—235
Белл 428
Белозерский А. Н. 254
Белок-глицерии 151
Бемера квасцовый гематоксилин 190
Бенда метод окраски митохондрий
318
Бенда — Икеда метод окраски 202
— фиксатор 113
Бензидиновая реакция 264
Бензин, удаление парафина 234
Бензол 138, 141
Бенсли метод окраски 207
------- митохондрий 320
— фиксатор 113
— и Гирша модификация миллопо-
вой реакции 234
Берберинсульфат 52
Берг 105, 111
Бергамотовое масло 125
Бергмана и Фокса реактив 235
Берека эффект 44
Берже и Сегаля метод выявления
зрительного пурпура 278
Беспозвоночные, методы исследова-
ния' 389—422
— окраска кармином 187
— — нервной системы по Ромье 407
— прижизненные наблюдения 406
— хромосомы 308
Беспозвоночные, фиксация 120
Беста кармин 249
440
Бесцветные карбинолы 70
Бизеле, модификация метода Гомо-
ри 271
Биливердин 281
Билирубин 281
Бильшовского-Буке метод серебре-
ния 367
— Гросс-Шульце метод серебрения
367
— Мареша метод импрегнации со-
единительной ткани 335
— метод серебрения нервных воло-
кон 366
— пиридиново-серебряпый метод 367
Бинокулярная лупа 20
— насадка 22
Биологические стаканчики 161
Биопсии, обработка 166
Бисмарк коричневый 76
Бисульфит натрия 238
Бихромат калия 109, 110
Блажина метод окраски кармином
188
Блок 145
— деревянный 153
— желатиновый 156, 157
— парафиновый 140
— целлоидиновый, резка 153
Блох Б 264
Бляхер Л. Я. 192
Бо 99
Бовери 301
Болотов А. Т, 6
Борная кислота 326
Борный кармин 124, 399
— •— Гренахера 187
---- с осмиевой кислотой 189
Борожелезосинеродистый калий по
Вейгерту 258
Браун А. Д. 176, 303
Брауса реконструкции 126
Браше 240, 263
Браше метод 239
Бродский В. Я. 57, 58, 292
Бродского камера 86*, 87
Брумберг Е, М. 56, 57, 58
Брунсвика реакция иа гистидин 235
Бумажные коробочки для заливки
“140 *
Буигенберг-де-Ионг 211
Бура 187
Бурн 430
Бурстон 430, 431
Бутиловый метакрилат 31
— спирт 138, 145
Бухман М, П. 58, 272
Буэна фиксатор 100, 116, 124
----модификация Аллена 116, 248
-------Дюбоск — Бразиля 116
— — — Роскина 117
В
Вайль С, С, 205, 294, 295, 317, 350
Вайля модификация метода Альт-
мана 317
Вакуом 325
Вакуумная система 29
Валин 431
Вальгрена метод импрегнации со-
единительной ткани 336
Ваи-Гизона метод окраски (модифи-
кация Гансена) 199
Ваи-Лееувека фиксатор 117
Васюточкина фиксатор 119
Ватерман 273
Ваузепа реактив 234
Ваузена — Фюрта реакция на трип-
тофан 234
Вебера метод серебрения 370
Вегенер Э. Э. 394
Вегенера способ наклейки инфузо-
рий 394
Везувия 76
Вейгерта борожелезосинеродистый
калий 258
— метод выявления фибрина 293
— железный гематоксилин 193
— резорциифуксип 325
Венецианский терпентин 310
Венецианское мыло 363
Веретено клеточного деления 313, 314
Веронал натрия 271
Вертикальное освещение 59—62
Верцнер В. И. 29
Вильска 49
•— метод 49
Вильямс 65
Виндау метод определения холисте-
рина 258
Виннокаменная кислота 227
Виниловый ацетат 166
Виноградная улитка 418
Виноградский 427
Висмут, метод выявления 228
Висмутокислый натрий 245
Висячая капля 36, 82, 389
Витальное окрашивание, см при-
жизненное окрашивание
--- фиксация 364
Витальный красный 69
Витамин А, метод выявления по
Жуайе-Лаверню 277
— С, метод выявления по Жиру и
Леблону 276
Витамины 276—277
Витт О, Н.’171
Вкладные конусные диафрагмы 40
Влажная камера 35, 82, 83*, 389
Влажные мазки 132, 307
441
«влажный метфх^ окраски крови по
Романовскому 349
Вогнутое зеркало 12
Водная иммерсия 14
Водные животные, наркоз 88
----прижизненная окраска 68
Водный синий 68, 70
----орсеин-эознн 300, 314, 315
Водорастворимая пластмасса 167
Водородных ионов концентрация 184
Войнова 273
Волжннский Д. В. 168
Волконского метод окраски мито-
хондрий 318
Вольф К- Ф. 6
Волынский Ф, 377
Волютин 191, 254, 319
Воробьев В. П. 377
Воск 140, 165
Восковые ножки 34, 125, 389
Воспаление 65
Восстановительная баня 246
Вращающийся столик 16
Вспомогательный микроскоп 45, 47
Вторичная флуоресценция 52, 53
«Вторичное почернение» 256
Вуда фильтр 51
Г
Гаверсова система 344
«Газовая фиксация» на гликоген 251
Газовые светофильтры 56
Гайдуков Н. 41, 302
Галактоген 250
Галламнновый синий 208, 354, 428
Галленн 342
Галловая кислота 224
Галлоцнапин 362
— хромовые квасцы 241
Галустян Ш. Д. 385
Ганзена трноксигематеин 194
Гансена гематоксилин 128
— модификация метода Ван-Гизона
199
Гвоздичное масло 125, 154, 155
Гсйдепгайна азановый метод 330—
331
— железный гематоксилин 191, 192,
399
— фиксатор «суза» 120
Гейнца тельца 346
Гелея метод окрашивания простей-
ших 398
Гелли фиксатор 119
Гематеин 189
Гематондин 280
Гематоксилин 100, 189
— Гансена 128
— железный 178
Гематоксилин железный по Вейгерту
193
----по Гейденгайну 191 —192, 399
----по Гурвнчу 192
— — по Рего 194, 260
---- но Ясвоину 193
— квасцовый 163
----по Бемеру 190
— — по Делафильду 190
----по Караччи 190
----по Майеру 189
----по Эрлиху 190
— Кульчицкого 258
— по Гомори 195
— по Массону 201
— фосфорно-вольфрамовый по Мал-
лори 194
Гематокснлнн-эозин 195
Гемоглобин 178, 279
— метод выявления по Лепену 280
— — — по Лизону 280
— ------по Сломннскому—Лапин-
скому 279
Гемосидерин 280
Генкель П. А. 45
Генцнановый фиолетовый 179, 265,
309
Геранин G, флуорохром 52
Герман 114
Германа фиксатор 114
Герш 121, 245
Гиалиновый хрящ 340
Гиалуронидаза 244
Гиалуроновая кислота 245
Гндра 409
Гндрактинии 411
Гидроиды 410
Гидроксильные группы 171
Гидролиз 238
Гиллессен 211
Гнзма 348
Гинзбург 239, 240
Гнпобромид натрия 233
Гипосульфит для лейкобаз 74
Гипосульфитные лейкобазы 74
Гнпохлорид 234 *
Гнрш 272
Гипс 224
Гистамин 261
Гистидин, выявление по Брунсвику
Гнстологнческне методы 326—385
Гистоспектрографня 237
Гистохимические нсследовання 101
— методы 121, 220—296
---- классификация Бекера 221
---- чувствительность 221
Гистохимия, общие замечания 170,
220—222
Глазунова 68
442
Глика и Фишера метод выявления
аденозинтрифосфотазы 272
Гликоген 244, 252
— методы выявления 247—253
--------иодной реакцией 248
--------по Бауэру 250
•-------по Бесту 249
—-------по Дрейсевсу 249
--------по Шабадашу 251, 252 *
— фиксация 247
— «фиксация газовая:» по Новико-
вой 251
Гликопротг'ды 244
Глиофибриллярный метод Гольцера
382
Глицерин 54
Глицерин-желатина, заключение пре-
паратов 165
— заключение препаратов 165
Глицерофосфат натрия 271
Глицерофосфатазы 271
Глия 382—385
Глюкоза 247
Глютатион, методы выявления 242—
243
Гмелина реакция 280
Голланда железо-квасцовый кар-
мин 187
— метод изучения хромосом 310
Голджи аппарат, см. аппарат
Гольджи
— быстрый метод 359
— Кокса метод серебрения 361
Гольмгрен 211
Гольмгрена трофоспонгии 364
Гольдмана метод выявления липои-
дов 257
Гольпсра глиофибриллярный метод
382
Гольцман О. Г. 150
Гомори 427
— гематоксилин 195
— метод выявления фосфатаз 270
--- окраски паральдегид-фукси-
ном 203
-------- эластической ткани 427
Гопкинса реакция на глютатион 243
Гортсга методы импрегнации соеди-
нительной ткани 338—340
Готчкисса метод 244
Граменицкого метод 355
Границы клеток, см. клеточные гра-
ницы
Грехема метод выявления оксидаз
266
Грепахера квасцовый кармин 188
— спиртовый борный кармин 187
Гришов 6
Г росс-Шульце 216
Губарев 208
Губки 408—409
— декальцинация 408
— известковые 408
— кремневые 408
— нервные клетки 408
— роговые 408
— скелетные иглы 165
Гудрича метод 353—354
Гумми-сироп по Апати 136
— хлорал, фиксатор 419
Гурвич А. Г. 192
Гурвича метод окраски железный
гематоксилином 192
Д
Даль М. К- 136
Дамарлак 340
Да-Фано метод выявления аппарата
Гольджи 323
Дафнии 419
Двойной заливки метод 405, 406 *
Двоякопреломляющие тела 55
Двухромовокислый калий 108
---формалин — уксусная кислота
257
Девицкого метод обработки после-
формалина 103
Дегидраза 267
Дезоксирибоза 237
Дезоксирибонуклеиновая кислота,,
выявление 236—239
---методы фиксации 238. 242
Дейнека метод серебрения 359
Декальцинация 127, 341, 428
— губок 408
Декальцинирующие жидкости 341»
342
Декстрин 165
Делафильда квасцовый гематокси-
лин 190
Дель-Рио-Гортега метод серебрения-
327
-------модификация метода Ачу-
карро 338—340
Демсей 284
Депарафинирование бензином 234
— препарата 163
Деревянное масло 161
Деревянные стойки 161, 162 *
Деревянный блок 153
Детергенты 388
Диазобеизолсерпая кислота 235
Диазореакция 235
Диамонд 388
Диара метод окраски микроорганиз-
мов 388
Диатомеи скелет 165
Диатомовые водоросли 11
Диафанол 253
Диафрагма апертурная 45
443’
Диафрагма вкладная конусная 40
ирисовая 12. 45, 46
— кольцевая 47
—• конденсора 13, 44
— осветительного аппарата, прави-
ла пользования 91
— фазового конденсора 46, 47
Дибутилсобацимат 167
Дигитонин 258
Диметилпара финилен-ди амин 261,
263
Диоксан 138, 143
Диоксановый фиксатор по Петрун-
кевичу 121
Диоксифенилалапип (допа) 264
Дистрен— 80, 166
Дитриха жидкость 108
Дифенилкарбазид 227
Диформазон 267
Дифференцировка 258
—• гематоксилина 192
— препаратов 14
— окси- и базофилии 205
Диэтилендиоксид 143
Догель А. С. 170, 374
Дождевые черви 414
Доминичи метод окраски 203, 240
Допаоксидаза 264
Древесный уксус 88, 114
Дрейсенса метод выявления глико-
гена 249
Дрожжевая нуклеиновая кислота 254
Дрожжи, окраска кислыми красите-
лями 427
Дрери 145
Дуговая лампа 60, 91
Дыбаи А. П. 121
Дюбоска — Бразиля фиксатор 116,
408
Ж
Хандра фиксатор 247
Жгутики простейших, окраска 397
Жгуты 315
Желатнн-левулеза заливка объек-
тов 157
'Желатина 151, 156, 406
— карболовая 337
Желатиновые срезы 156, 157
— блоки 156, 157
Железные квасцы 191
Железный гематоксилин, см. гемато-
ксилин железный
’Железный сахар 70
Железоаммиачные квасцы 192
Железо, выявление методом Макал-
лума 226
-------микросжигания 226
-------с берлинской лазурью 225
Железо, выявление методом с турн-
булевой синью 226
— фиксация 225
Железосинеродистый калий 243
Желтая кровяная соль 225
Желтые пигменты 277
Желчные кислоты 293
Жерар 282
Живаго П. И. 306, 307, 313, 355
Жидкая углекислота для заморажи-
вания 158
Жидкие светофильтры 91
Жильсона фиксатор 120
Жир, методы выявления 255—257
— — — осмиевой кислотой 256
— прижизненная окраска 431
— фиксация 255
Жироподобиые вещества 257
Жиру и Леблоиа метод выявления
витамина С 276
Жуайе — Лаверна и Рапкииа реак-
ция на глютатион 242
Журавлев А. 377
Журавлев В. А. 121
Журавлева метод окрашивания ме-
тиленовым синим 377
3
Заделка объектов 135
Заключение в глицерин 165
— — — желатину 165
— в пластмассы мазков и срезов 167,
168
Заливка 134—145
— в желатину 137, 156
Заливка в желатин-левулезу 157
— в маргарин 429
— в метакриалат 31
— в парафин 100, 136, 137—145
------- быстрая 166
— — — мелких объектов 140
— — — схема 144
------- через диоксан 143
— — — — метилбензоат 143
---------- терпинеол 143
----------триэтилфосфат 145
— в пластмассы 167 '
— в целлоидин 137, 152
— — — быстрая 166
------- парафин 155
------- после фиксатора Буэна 155
— для получения толстых срезов
404
— простейших 395—397
— труднорежущихся объектов 142,
155
— хрупких объектов 155
Заливки двойной метод 405, 406 *
Залкинд С. Я. 312
444
Замазка для покровных стекол 165
Замораживанием-высушиванием фик-
сация 121—123
Замораживания метод 158
Замораживающий микротом 156, 158,
159 *
Замороженные срезы 158
Замыкающие пластинки 301
Зандин Н. 29
Зандриттер 241
Захватки» В. А. 150
Зеленый янус 71
Зелигмана и Рутенберга реакция на
сукцинодегидразу 267
Зелнпка жидкость-фиксатор 413
Зеркало 11
— вогнутое 12
— плоское 12
Зеркально-линзовые объективы 56
Зидентопфа параболоид конденсор
38
Злокачественные клетки, цитодиагно-
стика 273
Золочение 358
Зрительный пурпур, метод выявле-
ния по Берже и Сегалю 278
Зубы 344
И
Иванов 303
Иглокожие 417
Идитол 136
Изаминовый синий 346
Известковые спикулы губок 408
Изготовление препаратов быстрое
166
Измерение микроскопических объек-
тов 24. 423—425
площади 424
— продольное 423
Измерительный окуляр 24, 423
Изобутиловый метакрилат 166
Изоляция ядер 304
Изопентан 121
Изотопы радиоактивные, методы об-
наружения 290—291
Изотропные тела 55
Изоэлектрические свойства 185
Изоэлектрическая точка 283—287
Ильина 305
Иммерсионное масло 13, 22
Иммерсионные объективы (системы)
12, 13, 22, 91
Иммерсия водная 14
— масляная 13
Имплантация в переднюю камеру
глаза 66
Импрегнация азотнокислым ураном
322
— металлами, теория 211—221
— осмием 321
Импрегнация серебром, см. серебре-
ние
— хлористым кадмием 323
Индифферентные красители 172, 174
Индофеноловый синий 261
Инструменты для микрохирургии 84
Интеркинетическое ядро 301
Интравитальная окраска 71
Инфракрасных лучей адсорбция 236
Инфузории 300, 314, 321
Инъекция фиксатора в кровеносные
сосуды 100
Иод, выявления амилиода 295
— декальцинация 428
Иода спиртовый раствор 118
Иодная кислота 243, 244
— реакция па гликоген 248
Иодный раствор 254
Йодноватокислый калий 260
— натр 189
«Ионный вираж» 211
Ионтофорез, прижизненное окраши-
вание 76
Ирисовая диафрагма 12, 45, 46
Исакова-Кео М. М. 402, 409
Искусственное переваривание 328
Ишнкава 430
К
Кабата н Неумана метод выявления
фосфатаз 271
Каин 256
Кайепутовое масло 363
Калнй двухромовокислый 109, ПО
Калнй, методы выявления 222—224
-------по Карер-Комеса 223
-------по Макаллуму 222
-------по Марца 223
Калийные квасцы 157, 188, 189, 190
Кальций, выявление галламиновым
сипим по Стоку 428
----по методу Косса 224
----------Кретена 224
---- по образованию лаков 224
---- реакций кристаллизации 224
Камень для точки 161
Камера для прижизненного наблю-
дении 86 *, 87
— масляная 87
Кампешевого дерева* экстракт 189
Камфора 151
Канадский бальзам 135
Канифоль 165
Капилляроскопия 61
Караччи квасцовый гематоксилин 190
Карбинолы бесцветные 70
Карбоксильные группы 171
Карбол-ксилол 164
Карболовая желатина 337
Карболовый фуксин по Цилю 197
Кардиоид конденсор 16, 37, 38, 289
445
Карер-Комеса метод выявления ка-
лия 223
Карея метод выявления нервных
окончаний 370
Кариосомы 313
Кармин 36, 69, 100, 187
— борный 399
--- с осмиевой кислотой 189
— железо-квасцовый, Голланда 187
— квасцовый Гренахера 188
— литиевый 69
— спиртовый борный Гренахера 187
— по Бесту 249
— по Блажину 188
— с калийными квасцами 188
— с хромовыми квасцами Фига 188
Карнуа фиксатор 57, 100, 106
Каротиноиды 277, 278
Каселла метод 243
Касперссон 58
Катодные флуорохромы 54
Кахаля и Де-Кастро метод серебре-
ния 372
— метод выявления аппарата Голь-
джи 322
—------нейроглии 383
— — серебрения 361, 362
Кацнельсон 3. С, 114, 301
Кацнельсона метод окраски пикро-
индигокармин—сафранином 200
Кварцевые стекла 57
Квасцовый гематоксилин, см. гема-
токсилин квасцовый
— кармин 124
Кедровое масло 125, 138, 142, 155
Кедровский Б. В. 71, 210, 355
Кедровского метод окраски 203
Кедровского — Грухачевой реакция
на триптофан 234
Кейроз—Лопеса модификация реак-
ции на триптофан 234
Кен 257
Кона метод выявления плазмаля 260
Кератин 296
Кератогиалин 296
Кесон 245
Кирпичникова Е. С. 76
Кислые анилиновые красители 197.
198
— красители 171, 172, 173
— — окраска микробов 427
— фосфатазы 271
Кислый ализариновый синий 208, 331
— фуксин 70, 198, 200, 202
Кишечнополостные 409—412
Кларка клетки 281
— метод «окошечек» 64, 65
Клейна метод окраски простейших
398
Клеточные границы 315
Клеточные мостики 300
---объекты изучения 300
— органоиды 44
Клод Бернара иодная реакция 248
Кобальтоазотистокислый натрий 222
Ковалевский А. О. 7
Козлов В, Е. 58
Кокаин 410
Колачсва—Насонова метод выявле-
ния аппарата Гольджи 321
Количественное определение веществ-
291—293
Коллаген 200, 202
Коллагеновая ткань 328—335
Коллодиевые пленки 30
Коллодий — покрытие срезов 152
Коловратки 416
Колосов 114, 170
Колосова модификация метода се-
ребрения Гольджи 360
— проявитель после осмиевой фик-
сации 114
— смесь для окраски миэлиновых
оболочек 373
Кольцевая диафрагма 47
Кольцеобразный конденсор 60
Кольчатые черви 414
Коммадон 87
Компенсационный окуляр 10, 15
Конто красный 295, 391
Конденсор 11
— аплапатический 16
— кардиоид 16, 37, 38, 289
— кольцеобразный 60
— панкратическим 16, 47
— параболоид 37, 38 *, 39
— сменный 38, 41
— С очковой линзой 16
— темного поля 16
— фазовый 45
Конденсорная линза 27, 29
Кондратьев Н, 377
Концентрация водородных ионов 184
Кордие 282
Коретра 308
Коричневый пигмент' изнашивания
278
Косса метод выявления фосфорно-
кислого кальция 224
Костная ткань, остекокласты 43Т.
Костные клетки 343
— тельца 343
Костный мозг, окраска 350
Кость 341—344
— методы окраски 342—344
— основное вещество 343
— прижизненное наблюдение 341
—• серебрение по Дейнеке 343
— шлифовка 341
Костяное масло 161
446
Кошенили экстракт 187
Коэффициент проницаемости 98 *
Крапп 76
Красители аджективные 172 174
— анилиновые 196, 197, 198
— индифферентные 172’ 174
— кислые 171, 172, 173
— классификация 172
— нейтральные 172, 174, 204—208
— основные 171, 172, 173
— прогрессивные 172
— растительного происхождения 208
— регрессивные 172
Красители субстантивные 172
— цвет. 171, 172
Краситель, диффузия 179
— определение кислотных и основ-
ных свойств 196
— химическая характеристика 171
Красные пигменты 277
Красный шарлах 255
Крашение, теория Порай-Кошнца 177
Кремневые спикулы губок 408
Креозот 135, 202
Крестообразный столик 22
Кретен 428
Кретеиа н Мао фиксатор 235
Кретена метод выявления кальция
224
«Крином» 325
Кристаллический фиолетовый 382
Кровепаразиты, окрашивание 41,
349
Кровь 345—352
— заключение в ме(илметакрнлат
168
— липоидные включения 351
— мазки 133 *, 134, 346
— мнтозы 307
— окрашивание 347—358
----по Май-Грюнвальду 348
----по Максимову 349’
------- по Паппенгейму 207
— — по Романовскому 347
----по Романовскому (влажный
метод) 349
— — по Фрейфельд (фуксинофиль-
ная зернистость) 351
Кровь, окрашивание по Эпштейну
349
---- по Эрлиху (триацидом) 348
—• — прижизненное 345
---- суправитальное 346
— оксидазная реакция 351
— пероксидазная реакция 266, 351
— прижизненные наблюдения 345
— содержание сукцииодегидразы 268
-- фибрин 351
— фиксация 346
Кровяные бляшки 347. 350
Кровяные пластинки, см. кровяные
бляшки
— элементы 41
Крюков 80
Ксантгидроль 236
Ксантопротенновая реакция 229
Ксилол 138, 141
— карбол 164
— парафин 139, 141
Кулибин И. П. 5
Культивирование простейших 401
— тканей в организме по Лазаренко
385—388
Культура тканей, прижизненное ок-
рашивание 68, 69, 71, 73, 75
Кульчицкий 170
Кульчицкого гематоксилин 258
— клетки 281
— модификация метода серебрения
Гольджи 361
— смесь-фиксатор 106
Куля — Шампи метод окраски мито-
хондрий 319
Кураж 260
Куража метод выявления гистамина
261
— смесь для фиксации адреналина
260, 261
Курник 176
Ку го 431
Л
«Лабильные» оксидазы 263
— структуры 95
Лавдовский М. Д. 7, 208, 361
Лаврентьев Б. И. 216, 355
Лаврентьева метод серебрения 355—
358
Лазаренко Ф. М. 355, 385
Лазаренко метод культивирования
тканей 385—388
Лак асфальтовый 165
Лаки 172, 174, 189
Ла-Кур 428
Лампа накаливания 60
— ртутио-кварцевая 56
Ланжерон 12. 151, 235
Лапгермановские насечки, серебре-
ние 372
Ларионов Л. Ф, 57
Ласговский 129
Латентные структуры 95
Лебедев А. 29
Левицкого фиксатор 428
Левулеза 157, 276
Лейкобаза метиленового синего 273,
274, 379
Лейкобазы 171
Лейкооснования 171
Лейкофуксии 280
Лейкоциты, см. кровь
447
Лейкоциты, изоляция ядер 305
— «уловление» 36
Лейцин 431
Леле метод выявления пероксидаз
264, 265
Лепена метод выявления гемоглоби-
на 280
Лептомедузы 411
Лизои 210, 228, 247, 256, 257, 263,
264, 282
Лизона метод выявления мукопро-
теинов 246
— «цинк-лейко» метод выявления
гемоглобина 280
Лимаренко И. М. 57, 58
Лимонная кислота 304. 305
Лимфоциты, см. кровь
Лионский синий 124
Липаза 272
Липоиды 103
— методы выявления 257
------- по Гольдману 257
-------по Смис-Дитриху 258
-------по Чиаччио 257
— удаление 240
Лиофильные группы 102
Лиофобные группы 102
Липофусцины 278
Липохромы 277
Липп 212
Литиевый кармин 69, 345
Литнй углекислый 69
Ло-Биапко фиксатор 403
Ломоносов М. В. 6
Лондон Е. С. 291
Лопастные ядра 304
Лотка 246
Лупа бинокулярная 20
Люголя раствор 249, 255, 262
Люцит 166
М
Мазки влажные 132
— крови 134
— правила изготовления 132
— простейших 391
— • сухие 133
— фиксация 132
Май-Грюнвальда метод окраски кро-
ви 348
Майера квасцовый гематоксилин 189
Макаллума метод выявления желе-
за 226
------- калия 222
Макаров П. В. 68. 302, 303, 355
Макклюнг 144, 145
Мак-Лиж 428
Мак Манус 244
Мак Мануса и Готчкисса метод 243
Макрометрический винт 9
Максимов 65
Максимова метод окраски азур-эози-
ном 204
------------- крови 349
— фиксатор 119
Маллори метод трехцветной окрас-
ки 200
— фосфорновольфрамовый гемато-
ксилин 194
Малярийный пигмент 281
Маиеваль 427
Манна метод окраски 201, 313
Мариа метод выявления калия 223
Маскированные структуры 95
Масло анилиновое 144
— бергамотовое 125
— гвоздичное 125. 155
— деревянное 161
— иммерсионное 13, 22
— кайепутовое 363
— кедровое 125, 155
— костяное 161
— оригановое 155
— парафиновое 54
— терпентиновое 253
— целлоидиновое 155
Маслова 74
Масляная камера 87
Массон 149, 151, 282
Массона гематоксилин 201
— метод окраски соединительной
ткани 332
--- предохранения препаратов от
выцветания 427
--- трехцветкой окраски 201
Мацерация мускульной ткани 353
— нервной ткани 355
— эпителия 326
Мевеса фиксатор 113
Меди нал 271
Мегакариоциты 350
Медный купорос 106
410, 411
Меды*Чц^шды выявления 227
Межклеточные границы 315
Мейера муцикармии 295
Мел 104
Меланины 279
Меллепдорф 179, 180
Меллендорфа метод окраски 203,313
Ментол 411
Меркулов 208
Меррея метод размягчения хитина
254
Мерски 176
Метакрилат изобутиловый 166
— этиловый 166
Металлические сетки 31
Металлы 222—229
Метахромазия 210—211, 295
«Метахроматический» вираж 211
448
Метахроматичоское окрашивание 197
Метилбензоат 125, 142, 155
Метилметакрилат 168
«Метилены» 235
Метиленовый синий 73, 197, 266
для ионтофореза 77
закрепление окраски 376, 380
инъекция в организм 376
-----лейкобаза 273, 274
-----по Шабадашу 380
прижизненное окрашивание 35
----- суправитальная окраска нер-
вов 374—379
Метиленовый синий, тотальное окра-
шивание 375
Метиловый’ голубой оранж 210
— зеленый 176, 196, 397
----- очистка 239
-----пиронин по Унна 202, 239, 240
— синий — эозин по Маниу 201
ЛТетиловый спирт 134. 346
Метиловый фиолетовый 240. 346
Метилтрит ндроксифлуоран 241
Метод теневых покрытий 32, 33
Мечников И. И. 7
Миелин 256
Миело-нади-оксидазная реакция
261—263
Мнкроглия выявления по Пенфнль-
ду 384
-----лпо Рио-Гортега 384
Микрогорелка 83 *, 84
Микроиглы 84
Микроинъокция _80 *
Микрокамеры 65
Микроманипулятор 79*, 80
— упрощенный 80
— пантографический 80
— пневматический 80, 82 *
Микрометрический винт 9
Микроорганизмы, окраска по Диар\
388
Микропипетка 85
Микроплаиктои 403
Микросжиг.ание 287—289
Микроскоп апоптральный 49
— вспомогательный 45, 47
история 5—8
— М-9 10*. 14*
— МБИ-1 14, 15*
— МБИ-2 14—18, 17*, 18*
— оптическая схема 16, 18*
— правила пользования 18, 19, 21,
25, 26
— поляризационный 55, 56 *
— с микрофотоаппаратом 20 *
— стереоскопический 20, 21 *, 130
— увеличение 9
— ультрафиолетовый 56, 57 *, 58
— устройство 9—33
Микроскоп фазово-контрастный 44—
49, 45 *, 46* , 48 *
— флуоресцентный 49
— электронный 26—30, 27 *, 28 *
— электронный, оптическая схема
27*
Микроскопических объектов измере-
ние 423—425
Микроскопия в ультрафиолетовых
лучах 55—58
— флуоресцентная 426
Микротехника, история развития 170
Микротом замораживающий 156, 158,.
139 *
— с неподвижным ножом 145. 146 *-
— салазочный 145, 146 *
— системы Шестранда 33, 37 *
Микротомирование 138
Микротомные ножи 147*, 161
Микротомный нож, правка 161
Микротрахископия 126—132
Микротрахископирование, установка-
130*, 131 *
Микрофотография 90—92
Микрофотографическис установки 90
Микрохирургии 80, 85 *
Микроэлектроды 80, 81 *
Мнллонова реакция иа тирозин 234
Миловидов 282
Миофибрнллы 352
Митозы в клетках крови и костного
мозга 307
— объекты для прижизненного на-
блюдения 311. 312
— объекты изучения на фиксиро-
ванных препаратах 312
Митохондрии 316—321
— объекты для изучения 321
— окраска по Альтману 317
- - — по Бенда 318
- - — по Бенда—Икеда 202
- - — по Бенсли 320
— — по Волконскому 318
— — по Рего 319
- — по Шампи—Кулю 319
— — по Шридде 320
— прижизненное наблюдение 32?
прижизненное окрашивание 71
— отбеливание 316
— Фиксация 113. 316, 317
Михаэлис 181, 183, 210
Миэлиновая оболочка 365
—• —выявление 373—374
----— по Кульчицкому 373
Многокрасочные методы окрашива-
ния 198—204
Мозжечок, серебрение по Кахалю-
362
Моисеев Е. А. 57
449
Молибденовокислый аммоний 364,
380
Моллюски 417—419
Морган 301
Молочная кислота 412
Моннэ 241
Мора соль 91
Морские животные, фиксация 111
Мочевина, метод выявления 236
Мочевой пузырь 312, 352
Муг реакция нади на цитохромокси-
дазу 264
Мукополисахариды 244
Мукопротеины 244
Мукопротеины, методы выявления
246
Муравьиная кислота_102
Мускульная ткань 352—354
—’ — изоляция ядер 305
— — мацерация 353
-----окрашивание 354
-----кислых ализариновым си-
ним 208
— — прижизненное наблюдение 352
----- серебрение нервных окончаний
по Карею 370
— суправитальная окраска, 3.53
-----фиксация 354
--- — улитки 418
Муцикармин по Мейеру 295
Муцин 244
Мшанки 416
—- скелет 165
Мышьяк, метод выявления 228
Мышьяковистая кислота 355
Мюллера фиксатор 320, 326
Н
Набухание объекта 97
Навашин 309
Навашина смесь 111
Нагревательный столик 25*
«Нади» 262
Нади-оксидазная реакция 263
— реакция на цитохромоксидазу по
.Муг 264
Назума 430
Наклеивание срезов 149—151
-----замороженных 160
----- целлоидиновых 154
Наркоз 88, 89
Наркотизирующие средства 89
Насекомые, заливка 142
— наркоз 88
— нервная система 421
— окрашивание 419
— тотальные препараты 419
— трахейная система 421
- фиксация 106
Насонов Д. Н. 71, 302, 303, 322, 399
Насонова метод выявления стенки
сократительной вакуоли 399
— модификация смеси Шампи 321 •
Натансон 170
Нафтоловый сиций 74
Нафтилацетат 272
Негри тельца 383
---окрашивание по Манну 201
Нейроглия 382—385
— выявление по Багинскому 385
— - - по Гольцеру 382
---по Кахалю 383
------ по Снесареву 382
— окраска гематоксилином по Мал-
лори 194
Нейрокератин 364
Нейросомы 364
Нейрофибриллы 219, 366
Нейтрализация формалина 334, 355
Нейтральная вода 205, 347
Нейтральная окраска по Творту 206
Нейтрального красного отмешивание-
325
Нейтральные красители 172, 174,
204—208
Нейтральный генинановый фиолето-
вый по Бенсли 207
— красный 64, 68, 71, 390
— — светлый зеленый 206
— — фиксация окрашенной ткани 73
— — экстра 52
— фиолетовый 76
Нейтрофилы, см. кровь
Некробиоз цитоплазмы 76
Нематоды 412
Неорганические соединения, метод
изучения 287
Нервная система 354—385
— — беспозвоночных, окраска по
Ромьс 407 *
— — насекомых 421
— — мацерация 355
— - — окрашивание по Шабадашу
380
— прижизненное метиленовым
синим 421
------- суправитальное 364
— — прижизненное наблюдение 355
— — турбелярий 380
— — улиток 418
Нервные волокна 365
— — обработка протарголовым ме-
тодом 371
— — серебрение по Альжибецу 371
— по Бильшовскому 366
—- — — по Бильшовскому—Буке
367
-------по Бильшовскому—Гросс-
Шульце 367
450
Нервные волокна, суправитальная
окраска 365
Нервные клетки, аппарат Гольджн
323
----- гликоген 254
----- губки 408
----- мацерация 355
----- митохондрии 363
-----серебрение по Гольджи 359
---------по Гольджи—Коксу 361
---------по Гольджи модификация
Колосова 360
----- —:-------Кульчицкого 361
-----.---„------Титушкина 360
---------по Дейнека 359
---------? по Кахалю 361, 362
Нервные клетки, серебрение по Лав-
рентьеву 355—358
-----тигроид 362, 363
Нервные окончания в мышцах 431
---------серебрение по Карею 370
-----серебрение по Бильшовскому
(модификация) 369
—'-------Веберу 370
---------Кахалю и де-Кастро
372
---------Тинелю 369
------------Фаворскому 370
Нер;вы безмякотные 371
— суправитальная окраска лейкоба-
зой метиленового синего 379—382
---------метиленовым синим 374—
379
Николи 55
Нильский синий 76, 256, 391
-----сульфат 256
Нингидрин 430
Нингидриновая реакция 229
Ниссля метод окраски тигроида 362
Нитрат, ртути 261
Нитропруссид натрия 227
Нитропруссидная реакция 242
Новикова А. П. 251
Ножи из стекла 31
— микротомные 147*, 161
----- правка 161
Норберта пластинки 11
Нохт 348
Нуклеиновая кислота дрожжевая
254
Нуклеиновые кислоты 57, 176
Нуклеиновые кислоты, адсорбция
инфракрасных лучей 236
-----методы выявления 236—242
-----выявление по Турчнни 240, 241
---------по Эйнарсону 241
Нуклеозиды 57
Нуклеотиды 57
Ньютона метод окрашивания хромо-
сом 309
О
Обезвоживание 124, 135, 139, 141
— препарата после окрашивания
164
Обезжиривание предметных стекол
149
Обменная адсорбция 182
Оболочка ядра 304
Оболочники 422
Обратимые структуры 95
«Обугливания» фаза 289
Обух для правки ножа 161
Объект-микроМетр 24, 423
Объективы 9
— апохроматические 10
— ахроматические 10, 90
— зеркальнолинзовые 56
—4 иммерсионные 12, 13, 22
— сухие 12
— флюоритовые 10
— характеристика 16
Объектодержателн 30, 31
Овель 431
«Окошечек» метод 64, 65
Окрашивание, влияние изоэлектриче-
ских свойств 183
----pH 183
---- кислот и щелочей 182
— замороженных срезов 164
— крони 347—358
— метахроматическое 197
— методы, см. название красителей
и фамилии авторов
— наклеенных срезов 161'
— ненаклеенных срезон 164
— общая схема 163
— общие методы 186
— определяющие факторы 185, 186
— осаждением 180
— полихромное 194, 197
— пропитыванием 180
— простейших 397—400
— сульфатом нильского синего по
Смису 256
— теории 169—186
---адсорбционная 181
---- обменной адсорбции 182
----'физико-химическая 178
----физическая 178
----химическая 174—178
----электроколлоидальная 182—185
— хитина 253
— целлоидиновых срезов 154
— эластической ткани по Гомори
альдегид-фуксином 427
Оксидазы «лабильные» 263
— методы выявления 261—264
— «стабильные», метод выявления
261—263
29*
451
Оксндоредуказа 272
Оксиредукционные процессы 75
Оксифилия 184
Оксифильные элементы 173
Окуляр-микрометр 24, 423
— рисовальный 22 *
— • с указательной стрелкой 22
Окуляры 9
— измерительные 24
— компенсационные 10, 15
— фотографические 90
— характеристика 16
Олигодендроглия, метод выявления
по Пенфкльду 384
Олигохеты 415
Ольшванга метод окраски соедини-
тельной ткани 331
Опак-иллюминатор 60
Опаловый синий 397
Оптическая плотность 292
Определение увеличения рисунка 424
Опухоль, изоляция ядер 305
Оранж G 198, 200
— геициановый фиолетовый 207
Органоиды 44
Оригановое масло 155
Орсеин 310, 333, 340
—- квасцовый гематоксилин-пикро-
фуксин 333
Ортохроматические пластинки 91
Осветители с точечными лампами
24 *
Осветительное устройство 11*
Освещение 11—13, 23, 45
— по Келлеру 91
Освещение, установка 12—13
Освобождение препарата от парафи-
на 163
---—- целлоидина 164
Осмиевая кислота III, 112
— — выявление жира 256
— —- двухромовокислый калий 113,
114
—------• — уксусная кислота ИЗ
— — пары 112, 395
--- фиксация 31
------- митохондрий 113
простейших 395
— — хлорная платина — уксусная
кислота 114
— — хромовая кислота т- двухромо-
вокислый калий ИЗ
----------уксусная кислота ИЗ,
114
— смесь по Альтману 113
-------Бенда ИЗ
-------Бенсли ИЗ
---— Герману 114
— — — Мевесу ИЗ
•------Роскину 114
Осмиевая смесь по Флемингу ИЗ
---_ фоллю 114
---— Шампи 113
Осмий III—114
—- пары 133
Осмиевые фиксаторы 100
Осмирование 373
Основной фуксии по Цилю 197
Основные красители 171, 172. 173
---анилиновые 196—197
Остеокласты 431
Отбеливание 316
Отпечаток-препарат 133, 393
Отрицательный фазовый контраст 47
«Оттенение» металлами 32 *
П
Паван-де-Секатти 408, 409
Павловский Е. Н. 168
Падающее освещение 59
Паниель 243, 245, 260
|Панкратнческий конденсор 16, 47
Панопак 60
Паноптический метод Паппенгейма
207, 313
Пантографический микроманипулятор
Бровей 80
Панхром-толуидиновый синий 306
Панхроматическая пленка 92
Панхроматические пластинки 91
Параболоид конденсор 37, 38 *, 39
Парадиметйламинобензальтид 234
Параднпнкриламин натрия 223
Паразитические простейшие 41
Паракармин 124
Паральдегид-фуксин по Гомори 203
Парафин 137
— быстрая заливка 166
— заливка простейших 395—397
— ксилол 139, 141
Парафин, растворение 138
— точка плавления 140
— удаление из срезов 161
— целлоидин, заливка 155
Парафиновое масло 54
Парафиновый блок 140
PAS-реакция 243
Пачипи метод окраски соединитель-
ной ткани 332
Пелликула 398
Пенфильда модификация метода
Рио-Гортега 384
Пепсин 102, 328, 329
Первичная, естественная, флуорес-
ценция 52, 53
«Первичное почернение» 256
Переваривание кусочков 328
— срезов 329
452
Перехваты Раивье 365
Перйодат 252
Перкен 170
Перманганат 316
Пероксид-бензоила 31
Пероксидазы, методы выявления
264—266
-------для парафиновых срезов
265
-------по Грехему 266
----------Леле 2о4, 265
— .— — — Эпштейну 266
Петерс 216
Петерфи 80
Петрункевича фиксатор 120
Печь для микросжигания 288
Пешков М. А. 13, 49
Пешковская Л. С, 313
Пигменты 277
Пикриновая кислота 114—117
---- декальцинация 342
----окрашивание протоплазмы 198
----отмывка 115
----фиксатор по Буэну 116
—---------Буэн-Аллену 116
— -------вап-Лееувену 117
----------Дюбоск-Бразилю 116
----------Роскину 117
—• — фьрмалин-уксусиая кислота 116
------ формалин-трихлоруксусная кис-
лота 117
— — хлороформ-формалин 117
— сафранин по Кацнельсону 200
Пикроиндигокархмин 340
— фуксин по Г. И. Роскину 199
Пикрофуксии 199
.Пилокарпин 76
Пиоктанин 301
Пиридин 367
— эозин-азур по Алфеевой 205
Пиронин 240
Пирса модификация метода Нахлиса
И Зелигмана на эстеразы 272
Пихтовый бальзам’ 136
Пишингер 183, 283, 284
Пишиигера метод определения изо-
электрической точки 283—287
Пнявкн 415—416
Плазмалевая реакция 259
Плазмалеген 259, 260
Плазмаль 259
— метбд выявления по Кену 260
Плазматические клетки 350
Плазмодесмы 301
Планарин 414
Планктон 403
— фиксация ЮЗ
Пластмассовый блок 31
Пластмассы 166
— для заключения срезов 167
Пластмассы, растворимые в воде 167
---- в ксилоле 167
Пластификатор 167
Пластосомы 364
Плексиглас 166
Пленочные препараты 334
Плисс Г. В. 66
Плоское зеркало 12
Плотность структур 209, 210
Пневматический микроманипулятоЬ
Фонбрюпа 80, 82* и
Поверхностные пленки простейших
35
Поджелудочная железа 203, 321
Показатель концентрации водород-
ных ионов ацетат-вероиалового бу-
фера 286
— ------влияние на окрашива-
ние 183
----------фиксатора 97
Покрытие срезов коллодием 152
---- целлоидиновой пленкой 251
Покровное стекло 11
Поливиниловый спирт 167
Поликар 97, 103, 152, 289
Полисахариды 243—245
Полистеролы 166, 167
Полифенолы 281
Полихромное окрашивание 194, 197
Полихромный толуидиновый сниий
197
Положительный фазовый контраст
47
Полуторахлористое железо 243
Поляризатор 55, 56 *
Поляризационная микроскопия 55
Поляризационные призмы 55
Порай-Кошиц А. 177
Порай-Кошица теория крашения 177
Португалов В. В. 365
Поташ 419
Правка ножей микротомных 161
Предметные стекла, толщина 40
----обезжиривание 149
Препарат для электронной микроско-
пии 30—33, 32 *
— отпечаток 393
— пленочный 334
— . сухой 165
Пцепаратоводитель 22
Прижизненное окрашивание 66—77
----бесцветными карбинолам^ 70
— — водных животных 68, 72, 73,
76
----гипосульфитными лейкобазами
74
----железным сахаром 70
----жира 431
----ионтофорезом 76
----кислыми красителями 67
30 Микроскопическая техника
453
Прижизненное окрашивание колла-
геновой ткани 76
----кости 76, 341
— — крови 71, 345
— — литиевым кармином 69
— — метиленовым синим 35, 73,
421
---------по Волынскому 377
-------------Догелю 374
—------------Журавлеву 377
— —-------— Кондратьеву 377
---- митохондрий 71, 73
— — мускульной ткани 74
----нафтоловым синим 74
----нейтральным красным 71—73
---- непрямое 70
----основными красителями 71
----простейших 390
— — соединительной ткани 71
— •— трипановым синим 67
----хряща 76
---- эластической ткани 76
— — ядер 75
----янусовым зеленым 71
Прижизненные наблюдения аппарата
Гольджи 324
---- беспозвоночных 406
-------в вертикально падающем
свете 59—62
----------поляризационном микро-
скопе 55
—.--------темпом поле 37—44
----------фазово-контрастном мик-
роскопе 44—49, 48*
---- внутренних органов 62—66
— — коллагеновых и эластических
волокон 328
— — крови 345
----нервной системы 355
----объекты 299, 300
---- мускульной ткани 352
----поджелудочной железы 62--
64
----простевших 389—391
----среды для наблюдений 77
----цитоплазмы 299
— — эпителия 326
Приклеивание срезов 340
----из замороженных pi высушен-
ных тканей 123
Примулин 55
Проводка срезов 163
— чЬрез ацетон 166
Прогрессивные красители 172
Проекционная лампа 91
Проекционная лннза 29
Промежуточные среды 135
Проникновение фиксатора 98 *, 99 *
Пропигменты меланина 279
Пропионовая кислота 310
Противоореольные пластинки 92
Протоплазма, окрашивание 197
Просветление объекта 125
Просветляющие средства 125
Простейшие, заливка в парафин
395—397
— культуры 401
— методы исследования 389—404
— окраска 397—400
---- кармином 187
----по методу Гелея 398
Простейшие, окраска по методу
Клейна 398
— приготовление мазков 391
•— прижизненное наблюдение 389—
391
----окрашивание 73, 390
— сбор материала 400
— фиксация 391—395
------- парами осмия 112
Протарголовый метод серебрения
371
Протравы 189, 191
Прочный синий Б 272
Птиалин 248, 250
Птицы хромосомы 307
Пуркинье волокна 353
Пурпурин 224
Р
Радиоавтография 290—291
Радиоактивные изотопы, методы об-
наружения 290—291
Радиолярии скелет 165
Разветвлеивые ядра 304
Разрешающая способность микроско-
па 10, 11, 26, 27, 29 *, 44
Ранвье метод серебрения клеточных
границ 326
— перехваты 365
Расправление парафиновых срезов
149, 150
Рего железный гематоксилин 194т
260
— метод окраски митохондрий 319
— фиксатор 257
Регрессивные красители 172
Резка иа замораживающем микро-
томе 158
— на микротоме 145, 148 * 149
Резка пластмассовых блоков 167
— целлоидиновых блоков 153
Роэорцин-фуксин 333
----по Вейгерту 325
Реплики 32
Рептилии, хромосомы 307
Реснички 314, 315
— простейших окраска 397
454
Ретикулярная соединительная ткань
331
Ретикулярные волокна 330
— клетки 68
Решетчатые волокна 336
Рибонуклеаза 239, 240
Рибонуклеиновая кислота, методы
выявления 239
---фиксация 240, 242
Рибофлавин 430
Риванол 55
Римский-Корсаков, модификация фик-
сатора Жильсона 120
Рднгера раствор 77
Рингера—Локка раствор 77
Рио-Гортега метод выявления мик-
роглии 384
Рисовальный аппарат 22, 23 *. 424
— окуляр 22 *
Роговица глаза 312
Ройтман А. 136
Романовский Д. Л. 348
Романовского «влажный метод» ок-
раски 349
— метод окрашивания крови 347
Ромейс 151
Ромье метод окраски нервной систе-
мы беспозвоночных 407
--- определения холистерина 259
Ромье реакция на триптофан 230
Роскин . Г. И. 57, 74, 76, 208 230,
239, 240, 272, 273, 277, 284, 302, 388
Роскнна' метод окраски пироиндиго-
кармин-фуксином 199
— модификация смеси Буэна 117
фиксатор 114
РТутмо-н^арцевая лампа 56
Ртуть, методы выявления 227
Рубашкин 361
Рубашкина способ наклеивания цел-
L лоидиновых срезов 154
Руднев 373
Жгбы, хромосомы 308
Рмьлая соёднчительная ткань 334
С
. . --ОД 233
салазочный микротом 145, 146*
'Цанфеличе фиксатор 11 ]
Сапонин 388
Саркисов Д. С. 167
Сафранин 100, 179, 200
пикроиндигокдрмин по Кацнель-
сону 200
Светлый зеленый 70, 198
Светофильтры 12, 90, 91
— ахроматические 23
— газовые 56
— жидкие 91
Светофильтры Ланжерона 23
— меднокупоросные 23
— меднохромовые 23
— правила пользования 91—92
— сухие 91
Свинец, выявление по методу Иваши
227
Секи 209, 212
Семенов 74
Семенники птнц 307
— ракообразных 308
Серебрение, выбор фиксатора 213
— кости 343
— лантермановских насечек 372
— нервной ткани 355—362, 365—372
— по Альжибец 371
— — Аойяма 323
— — Ачукарро 338
--------модификация Рио-Гортета
338—339
------- Бильшовскому 366, 369
-------- Буке 367
--------Марешу 335
---Вальгрену 336
•--Веберу 370
— — Гольджи 359
—-------модификация Колосова 360
----------Кульчицкого 361
----------• Титушкииа 360
---Гросс-Шульце 367
- - Да-Фано 323
---Дейнека 343, 359
— -- Карею 370
— — Кахалю 361, 362, 372
--------и Де-Кастро 372
- - по Лаврентьеву 355—358
---Ранвье 315, 236
---Рио-Гортега 384
— — Снесареву 337
— - Фаворскому 370
— футу ззб
— после спиртовой фиксации 216
---формалиновой фиксации 213
— протарголовым методом 371
— соединительной ткани 335—340
— эпителия 326
Серебряков 355
Сернистая вода 239
Сернокислый магний 88
— хинии 228
Серра 229
— реакция на аргинин 230
Сиена-оранж 223
Силикат натрия 234
Сильвен 211
Синдетикон 165
Синтетические пластмассы 166
Скадовская Н. С. 289
Слизь 294—295
30*
455
Слонимского — Лапинского метод
выявления гемоглобина 279'
Сменный конденсор 38, 41
Смис — Дитриха метод выявления
липоидов 258
Смиса метод окрашивания 256
Смолянников А. В. 166
Сморщивание объекта 98
Сиесарев 366
Снесарева метод выявления нейро-
глии 382
--- импрегнации соединительной
ткани 337
Собственная флуоресценция 52, 53
Соединительная ткань 328—340
— — импрегнация, см. серебрение
--- метод искусственного перева-
ривания 328
-------— окрашивания 330—335
— :------азаиовый 33)
—------— ---- орсеином 333
— --------— —квасцовым гематок-
силином— пнкрофуксинс/м 333
---— — по Ван-Гизону 201. 332
— — — — —- Гейдепгайну 330—331
---— клеточных элементов 334
---— -по Максимову 334
Маллори 202, 332
—-------- — Массону 332
— -----— — Ольшвангу 331
-------— __ Оачипи 332
--------- ---- Ясвоипу 193
— — серебрение 335—340
-------по Ачукарро 338
— — — — Бильшовскому — Маре-
шу 335
— •- — — Вальгрену 336
---------- — — Рно-Гортега 338—339
—-------- — Снесареву 337
--------- — Футу 336
— — прижизненное окрашивание 71
— — прижизненные наблюдения 328
Соединительнотканные пленки 334
Сократительная вакуоль 399
Сокслета аппарат 328
Соловьев 273
Сорбитоль ЗЮ
Спек 211
Спепматозоиды 41
Сперматоциты 311. 3X2, 321
Спикулы губок 408
Спирт абсолютный 106
— — получение 106
— бутиловый 145
— в треть 326
— метиловый 134, 346
— обезвоживание 1 Об
— ПОЛИВИНИЛОВЫЙ 167
— разбавление 107*
— уксусная кислота 106, 233
Спирт, формол 108
— формалин (смесь Шаффера) 106
— — уксусная кислота 108, 232
— хлороформ-уксусная кислота 106
— этиловый 105
Спиртовый борный кармин Гренахе-
ра 187
Спирты для обезвоживания 139-
Сподограммы тканей 287 *
Срезы, заключение в пластмассы 167
— замороженные 158
— желатиновые 156, 157
— наклейка 149—151
— приклеивание к стеклу 340
— расплавление 149, 150
~ толщина 149, 153
— целлоидиновые, наклеивание 154
--- окраска 154
Стрелина способ ильмобилизации 406
Струве М. Е. 230, 273, 388
«Стабильные» оксидазы, метод выяв-
ления 261—263
Стабильные структуры 95
Стеарин 140
Стереоскопический микроскоп 20, 21 *,
130
Стесей 236
Сток 428
Столик вращающийся 16
— крестообразный 22
— нагревательный 25*
Субмикроскопические величины 97
Субмикроскопическая плотность
структур 209
Субстантивные красители 172 173
Судан Ш 164, 255, 257
— черный Б 256
«Cvaa» фиксатор по Гейденгайиу 68,
69, 120
Сукпинодегидраза, методы выявле-
ния 266—269
Сулема 101, 117, 259
— ледяная уксусная кислота 118
• — насыщенный водный раствор 118
— пикриновая кислотаформалин—
ледяная уксусная кислота 119
— спирт 120 •
— трихлоруксусная кислота 120
— трнхлоруксуслая кислота — фор-
малин 120
— уксусная кислота 100
— формалин — ледяная уксусная
кислота 119
Сулемовая смесь по Васюточкину
“119
--- по Гелли 119
-------Жильсону 120
— „ — Максимову 119
------- Петрункевичу 120
456
Сулемовая смесь по Римскому-Кор-
сакову 120
-------- Ценкеру 119
-------Шаудину 120
Сулемовые фиксаторы 118—120, 124
Сульфаниловая кислота 235
Сульфат нильского синего 76, 256
Сульфгидрильные группы 242
Суправитальная окраска крови 346
----- мускульной ткани 353
----- нервной ткани 365
----- нервов лейкобазой метиленово-
го синего 379—382
Сульфргруппы 171
Сутулов 355
Сухая'наклейка срезов 151
Сухие мазки 133
— объективы 12
— светофильтры 91
— системы 91
Сухой препарат 165
Сферическая аберрация 9
Т
Творта метод нейтральной окраски
206
Телезницкий 99, 301
Темное поле 19, 37—44
-----объекты изучения 41, 42 *. 43*
Темное иоле, правила пользования
40 *
Теневых покрытий метод 32, 33
Тепловых лучен фильтрация 39
Термолабильные энзимы 429
Терпснтип 390
Терпентиновое масло 253
Терпинеол 142, 154
Тетразолий 429
— хлористый 267
ТетрамёФилтионинхлорид 284
Тигроид, окраска 362—363
- ~ - по Нпссию 362
- • — Эйнарсон\' 362
- тиоиином 363
----- толуидиновым синим 363
Тиенил-хинолин-карбоповая кислота
76
Тимол 151
Тимоловая вода 156
Тимонуклеино'вая кислота 236—239
Тимоиуклеодеполимераза 237
Тииеи 431
Тиогликолевая кислота 227
Тионин 74, 197, 210, 294, 363
— фосфорновольфрамовый метод 342
Тироде раствор 78
Тирозин 229
— выявление 234
Тнтушкина модификация 'метода се-
ребрения Гольджи 360
Толуидиновый синий 74, 197, 210,
246, 284, 398
----полихромный 197
Толуол 138
Толщина замороженных срезов 158,
160
— - предметного стекла 40
— срезов 149
— целлоидиновых срезов 153
Тотальное окрашивание кармином 187
Тотальные препараты 124—126
-----насекомых 419
----- схема изготовления 126
----- фиксация 103
Точечные лампы 12, 130
Трансплантация 65
Трахейная система насекомых 421
Трахископнрование 130*
— установка 130*, 131*
Трахископмческие пластинки 127,
128, 129
— препараты изготовления 127 *
хранение 129
Трахископия, общие замечания 126—
132
— окраска 128
— фиксация 127
Трематоды 412, 414
— окрашивание кармином 188
Трехпольная фотокамера 56
Треххлористая сурьма 277
Трехцветиый метод Маллори 200
-----Массона 201
«Триаиид» Эрлиха 348
Триацоловый желтый 52
Т риокс игематеии 194
Триоксиметилен 224
Тоиолеин 256
Тоипановый синий 67, 391, 409
Трипаносомы 41
Трипафлавин 52, 54
Трипсин 102. 328, 329
Триптофан 229
— реакция Ваузена-Фюрта 234
Келровского—-Трухачевой 234
Тпифенил -тетразоли й-хлорид 431
Трихлоруксуспая кислота 243
----- декальпииапия 342
ТриэтилфосФат 145
Тропеодин 178
ТроФоспонгии 325
— Гольмгрена 364
Труляорежущихся объектов заливка
155
Трухачева К. П, 210
Тубус 9, 14
Турбелярии, окраска нервной систе-
мы 380
Турчини метод выявления нуклеи-
новых кислот 240, 241
457
Тудин 251
Тучные клетки 197» 203
Тушь 69
У
Увеличение микроскопа 9, 16
— рисунка, определение 424
Углеводы, методы выявления 243—
254
Углекислота жидкая для заморажи-
вания 158
— твердая 122
Углекислый литий 69, 115
Уксусная кислота 97, 99, 108
Уксусно-кармяновый метод окраски
хромосом 308
Уксуснокислый оранж 310
«Уловление» лейкоцитов 36
Ультрамикроскоп 37
Ультраопак 60, 61*, 289
Ультрафиолетовый микроскоп 56,
57*, 58
Ультрафиолетовых лучей адсорбция
55, 236
Ундерхилл 431
Унна 108, 282, 296, 348
— метод окраски клеточных мости-
ков 300
-------метиловым зеленым — пи-
ронином 202
Уплотнение в целлоидине 153
— замороженных срезов 160
Упрощенный микроманипулятор 80
Уретан 88
Ф
Фаворского метод серебрения нерв-
ных окончаний 370
Фагоцитоз, инъекция туши 69
Фазовая пластинка 47
Фазово-контрастная диафрагма 47
-----микроскопия 44—49, 45*, 46*.
48*
------- — объекты изучения 49
«Фазовые.» препараты 45
Фазовый конденсор 45
Фарранта среда для заключения пре-
паратов 136
Федоров 208
Фельгена реакция 236
Фенилаланин 229
Фенилтригидроксифлуоран 241
Феноловые группы 260
Ферменты 261—276
Ферхмин А. А. 57
Фибрин 293
Фига кармин с хромовыми квасцами
188
Физиологический раствор 77—79
Фиксаторы, см. обозначение состав-
ных частей и фамилии авторов
Фиксация в термостате 99
— витального окрашивания 364
— влияние на структуру ядра 302*
— выбор фиксатора 97
— для серебрения 213
— кипячением в формалине 166
— мазков 132
— на холоду 99
— общие правила 93, 101
— планктона ио Ло-Бианко 403
— простейших 391—395
— с помощью замораживания-вы-
сушивания 121—123
— скорость проникновения фиксато-
ров 9
— теория 93—101
Филатов В. П. 66
Фильтр Вуда 51
Фишер А. 178 :
Флавицкий 136
Флеминга фиксатор 113, 306
Флеминга фиксатор-декальцинация
342
Флоридзин 248
Флуоресцентная микроскопия 426
Флуоресцентный микроскоп 49
Флуоресценция вторичная; 52, 53
— первичная, естественная 52, 53
Флуоресценция собственная.52, 53
Флуоресцин 54
Флюоритовый объектив 10
Флуорохромы 52, 54, 55
— катодные 54
Фокусировка препарата 13
Фокусное расстояние 10
Фолля фиксатор 114
Фонбрюи 87
Фонбрюна установка 80
Фонвиллер 408
Фопвиллера метод окраски нервных
клеток губок 408
Фораминиферы скелет 165
Формалин 57, 68—70, 100, 102, 124,
127, 158, 233, 411
— время фиксации 103
— действие на липоиды 214
-------протеины 213
------- структуры 103
— кальций по Бекеру 104
— мышьяковистая кислота 355
— нейтрализация 102, 334, 355
— разведение 102, 104
— сулема 68, 69, 119
— уксусная кислота 70 ,
— хлористый кальций 2з5
Формальдегид 102
Формальгегида пары, фиксация 251
Формол, см. формалин
458
Форсгрена метод определения желч-
ных кислот 293
Фосфатазы 269—279
Фосфатазы, метод выявления ио Го-
мори 270
Фосфян 3R 52
Фосфор, выявление по Ангели 228
—------Косса 224
-----— Серра и Лопес 228
— нуклеиновых кислот, выявление
229
Фосфорновольфрамовый гематокси-
лин по Маллори 194
Фосфорномолибденовая кислота 200.
202
Фотографические окуляры 90
Фотокамера электронного микроско-
па 29
Фотометрия 291—293
Фотонасадка МФН-1 90*
Фоторецепторы червей 415
Франкота метод обработки планкто-
на 403
Фрейфельд Е. И. 351
Фролова С. Л. 308
Фуксин кислый 70, 198, 200. 202
— основной 238
-----по Цилю 197
— по Альтману 317
Фуксинсернистая кислота 237, 238.
250. 259
Фуксинофильная зернистость 351
Фуга метод импрегнации соедини-
тельной ткани 336
X
Хаджнолов 53
Хар лов а" 239, 240
Хека метод выявления пигментов 279
Хитин, методы размягчения 253—254
Хитиновое вещество, методы выявле-
ния 253
Хлопни Н. Г. 70, 71, 325, 355
Хлоралгидрат 88
Хлорал-фенол 420
Хлористая платина 278
Хлористое олово 227
Хлористый магний 88
— тетраэолий 267
— цепилпиридинум 388
Хлорное золото 358
Хлороформ 88, 138, 141
Хлорцинкопд 253
Хлорэтон 88, 411
Холестерин, определенно по Вин-
дау 258
-------РоМье 259
-------Шульце 258
Холнн-эстераза 272
Хроматическая аберрация 9
Хроматический анализ 169
Хроыафиниая реакция 282
Хромирование 110, 257
Хромовая кислота 108, 243, 244, 250
----формалин 111
---- уксусная кислота 111
Хромовокислый калий — щавелевая
кислота 235
Хромовоуксусная смось-фиксатор 200
Хромогены 171
Хромолиз 282, 283
Хрсмолипоиды 278
Хромопротеиды 277
Хромоскоп 56, 58 *
Хромосомы 305—312
— амфибий 308, 318
— беспозвоночных 308
— млекопитающих 305—307
— объекты изучения у млекопитаю-
щих 305
— окрашивание 308
— — по Ньютону 309
----уксусно-карминовым методом
308
— птиц 307
— рептилий 307
— рыб 308
- - тонкая структура 310
— фиксация 306, 307, 308
Хромотропные вещества 210
Хромофоры 171
Хрупких объектов заливка 155
Хрущов Г. К. 305
Хрящ гиалиновый. 340
— эластический 340
Хэл 245
Хэла метод выявления кислых поли-
сахаридов 246
— реакция 245
Ц
Цедакс 207
Целлоидин для культивирования
тканей в организме 385
— заливка 152
---- быстрая 166
----после фиксации по Буэну 155
- - парафин, залнвка 155
— приготовление растворов 152
Целлоидиновое масло 155
Целлоидиновые блоки, резка 153
— пластинки 396
— срезы, наклеивание 154
---- окраска 154
Целлюлоза 250, 254
Ценкера фиксатор 119
Центросома, объекты для изучения
314
— фиксация и окраска 313—314
Цестоды 412
— окрашивание кармином 188
Пианол 284
459
Циглер 65
Циля основной фуксин 197
Цингср Я- А. 401
Цинк, метод выявления 227
«Цинк-лейко» метод выявления ге-
моглобина 280
Цитодиагностика злокачественных
клеток 273
Цитологические методы 297—325
Цитоплазма 299—301
— некробиоз 76
Цитофотометрия 291—293
Цитохромоксидазы 263, 264
Ч
Чейен 428
Черники сок ягод для окрашивания
208
Черный судан Б 256
Чемберс 80
Черви 412—416
— дождевые 414
Черви кольчатые 414
— ресничные 413
Четырехокисный омий 111, 112 .
«Четверная» окраска хряща ио Ру-
мянцеву 340
Чиаччио клетки 281
— метод выявления липоидов 257
Численная апертура 10
Членистоногие 419—422
Чура смесь 306, 307
Ш
Шабадаш А. Л. 221, 247, 251
Шабадаша метод выявления глико-
гена 243, 251
— окрашивания нервной ткани 380
— фиксатор гликогена 248
Шампи — Куля метод окраски мито-
хондрий 319
— фиксатор 113
---на митохондри 319
Шапошникова метод кислотного гид-
ролиза 313
Шарлах 255
Шарпея волокна 344
Шарплеса центрифуга 305
Шаудина фиксатор 120, 313
Шаффера смесь 106
Шевремон 429
Шеврсмона и Комера метод выявле-
ния рибофлавина 430
— и Фредерика реакция на глюта-
тиоп 243
Шестранда микротом 33, 37 *
Шиллабер 91
Шнффа реактив 238, 239, 250, 260
Шморля реакция на пигмент изна-
шивания 278
Шорникова 284
Шридде метод окраски митохонд-
рий 320
Шу 431
Шуснинова 1^етод выявления фиб-
рина 294
Шульце метод определения холисте-
Щавелевая кислота 200, 316
Щелевой опак-иллюминатор 60
Щелочиый абсолютный спирт 201
Щелочные фосфатазы 271
Э
Эванса метод аутогисторадиографии
291
Эннарсон 241
Эйнарсона метод выявления нукле-
иновых кислот 241
---- окраски тигроида 362
Экспозиция 92
Эластическая ткань, окрашивание
203, 330, 333
---- переваривание 328
----прижизненные наблюдения 328
Эластический хрящ 340
Эледин 296
Элективная гистотропия 70
Электрическая адсорбция 215
Электронная пушка 2/, 29
Электронный микроскоп 26—30, 27**
28*
Эмбриональные клетки 321
Эозин 163, 198, 204
Эозинаты 204
Эозинат-азур I — метиленовый си-
ний 348
— метиленового синего 348
Эозинофилы, см. кровь
Эпителий 326—327
— мацерация 326
— метод изучения тонкой структу-
ры 327
— окраска фибриллярных структур
327
— прижизненные наблюдения 326
— Серебрение клеточных границ по
Ранвье 326
Эпштейн Г. В. 191, 206, 398, 399
Эпштейна метод выявления перо<
ксидаз 266
---- окраски 349
Эриксона метод экстракции рибону-
клеиновой кислоты 241
Эритрозин 383
Эритроциты, см. кровь
460
Эритроцитов скелетные нити 346
Эрлих П. 175, 210
Эрлиха альдегид 234
— квасцовый гематоксилин 190
— триацнд 348
Эстеразы метод выявления по На»
хлису и Зелигману (модификация
Пирса) 272
Этиловый метакрилат 166
— спнрт-фнксатор 105
Этилуретан 88
Эфир 88
Эфирный наркоз 63
Я
Ядерная оболочка 304
Ядро 301—313
— влияние фиксации 302*
— изоляция 304
— — из лейкоцитов 305
------- опухоли 305
-------мышечной ткани 305
— интеркипетпческое 301
— объекты для прижизненного на-
блюдения 303, 304
— окрашивание 303
Ядро, окрашивание кармином 188
— — метиленовым синим 197
---прижизненное 75
---метиловым зеленым 196
— структура 302
— фиксация 303
Ядроподобныс образования бактерий,
310
Ядрышка объекты изучения 313
— окрашивание 313
---по Доминнче 203
-------Манну 201
-------Меллендорфу 203
— фиксация 312
Яйца амфибий 308
— мелкие 310
— моллюсков 313
— насекомых 308
— нематод 208, 311
Янтарнокислый натрий 266
Янусовый зеленый 64, 71
Яркий крезиловый синий 74, 76, 2I0t
346, 391
Ясвонн Г. В. 68, 334
Ясвоина железргый гематоксилин 193
— метод изготовления пленочных
препаратов 334
АЛФАВИТНЫЙ УКАЗАТЕЛЬ
(латинский)
А
Acrania 89
Actinia 411, 417, 422
Aeolosoma 414
Allium сера 41, 304, 312, 321
Alcyonium 411
Amblystoma 312
Amoeba proteus 298, 304
Amphibia 89, 298, 304
Anabolia 304
Anodonta 304, 315, 352, 418
Arachnida 308
Auricularia 417
Aves 89
В
Blaps 321
Bombus sp 304
Bombyx mori 304, 308
Bryozoa 417
Bufo vulgaris 73
Bulbus cordis 364
C
Campanula trachelium 304
Carchesium 321
Carmarina 411
Cephalopoda 300, 314
Chae*ogaster 315
Chaetognata 89
Chara 304, 313
Chelidonium 52
Chilodon 312, 314
Chilopoda 304, 313
Chlamydomonas 414
Ciadocera 300
Cidaca orni 312
Ciadocera 34, 76, 298, 313
Clepsina 415
Cnidaria 89
Coccus cacti 187
Colpidium 312
Colpoda 312
Copepoda 34, 314
Corethra 352, 355
Cornus australis 208
Crepis 312
Crustacea 79, 89
Ctenophora 89
Cyclops 419
D
Dendrocoelum lacteum 413
Dero 414
Descemeti membrana 314
Diaptomus 419
Diptera 308
Dytiscus marginalis 314, 421
E
Elodea canadensis 321
Entamoeba blattae 298, 304
Enteropneusta 89
Entomostraca 352
Episternum 340
Euglena sp. 304, 315, 414
Euglypha 312, 313
F
Foraminifera 300
G
Geophilus 304
Gephyrea 89
Glaucoma scintillans 321
Gomphocerus 311
Gordius 413
Gorgonia 411
Gryllus 324
H
Helix 304, 314, 315
— pomatia 417
Hemiptera 187
Hirudinea 89
Hyacinthus 312
Hyposternum 340
L
Lepidoptera 308
Lepisma 324
462
Limantria 311
Limax 298, 313, 419
Limnea 304, 314
Limnophilus 304
Lithobius 304
— forficatus 313
Loligo 300, 314
Lumbricus 314
Lumantria dispar 304
M
Mammalia 89
Metazoa 74
Metridium 411
Mollusca 89
N
Nais 315, 414
Nematodes 89, 298
Nemertini 89
Nepa cinerea 312
Nitella 300, 304
О
Oedipoda 311
Oligochaeta 89
Origanum vulgare 208
Oxyuris 413
P
Paludina vivipara, 311, 324
Paramaecium 300
Parascaris equorum 301, 308, 314
Pelargonium zonale 321
Pentatom a 312
Phacus 414
Phoenix dactylifera 301
Phryganida 304
Phytelephas macrocarpa 301
Pices 89
Pirrhocoris 321
Piscicola geometra 314
Pisum sativum 300
Planaria 413
PlanOrbis 304
Polychaeta 89
Protozoa 34, 73, 74, 89, 241, 298
Pyrosoma 422
R
Reptilia 89
Rheum 52
Rotatoria 89, 298, 300, 313
Rotifer 416
Rubia tinctorum 76
S
Salamandra maculosa 314
Salpa 422
Sambucus nigra 208
Sepia 300, 314
Sinapis 41
Spirillum vobetans 254
Spirogyra 41, 300, 313
Spongilla 408
Stenobothrys 311
Stentor 300
— coeru'eus 304
—I polymorphic 304
— roeseli 304
Strychnos nux vomica 301
Stylaria 315
Stylonychia 300
Sycon 408
T
Tentaculata 89
Tracescantia 311, 321
— Virginia 300
Trichomonas batrachorum 315
— muris 315
Triticum 41
Tunicata 89
Turbellaria 89
U r
Unio 304, 315, 352
V
Vallisneria spiralis 312
Vanessa 311
Vena femoralis 364
Vorticella 304
Z
Zygnema 300
оглавление
Предисловие ................................. &
К истории микроскопических исследований
В России ................................ 5
Раздел первый
Устройство микроскопа и вспомогательных приборов ................ 9
Общие замечания по работе с микроскопом .................... 21
Электронный микроскоп ...................................... 26
Методика изготовления препаратов для электронной микроскопии 39
Раздел второй
Микроскопия живых объектов .................................. 34
Наблюдения над мелкими организмами и изолированными клет-
ками .................................................. 34
Прижизненные наблюдения с помощью специальной оптической
аппаратуры ............................................ 37
Исследование живых клеток и тканей в темном поле ....... 37
Фазово-контрастная микроскопия ........................... 44
Флуоресцентная микроскопия ............................... 49*
Поляризационная микроскопия .............................. 55
Микроскопия в ультрафиолетовых лучах ..................... 55
Прижизненные наблюдения в вертикально падающем свете •••• 59
Прижизненные наблюдения над внутренними органами ........ 62-
Методы прижизненного окрашивания . . ..................... 65
Общие замечания ....................................65
Прижизненная окраска кислыми красителями и некоторыми
другими веществами .................................. 67
Прижизненная окраска основными красителями ............. 71
Некоторые специальные методы прижизненного окрашивания.... 75
Прижизненная окраска с помощью ионтофореза ............. 76
Среды для прижизненных наблюдений ...................... 77'
Некоторые методы экспериментальной цитологии ............. 79
Раздел третий
Наркоз .................................................. 85
Раздел четвертый
Микрофотография ........................................... 90
Раздел пятый
Фиксация и фиксаторы ...................................... 95
Общие правила фиксации ................................ 101
464
Фиксаторы ............................................... 102
Формалин ............................................... 102
Спирт и спиртовые смеси ................................ 105
Уксусная кислота ..................................... 108
Хромовая кислота и двухромовокислый калий .............. 108
Осмий и осмиевые фиксаторы ............................. 111
Пикринрвая кислота и фиксаторы, содержащие пикриновую
кисЛоту ............................................. 114
Сулема< и сулемовые смеси ............................... 117
ДиоксаНовые фиксаторы ................................... 120
Фиксация с помощью замораживания-высушивания ........... 121
Раздел шестой
Постоянный 'препарат ............................... 124
Тотальные препараты ........................................ 124
Микротрахископия .......................................... 126
Изготовление трахископических препаратов ................. 127
Трахископирование ......................................... 130
Приготовление мазков ....................................... 132
Заливка и приготовление срезов ........................... 134
Общие замечания .......................................... 134
Заливка в парафин ....................................... 137
Резка парафинового блока на микротоме ................. 145
Наклейка срезов ......................................... 149
Покрытие срезов коллодием ............................... 152
Заливка целлоидин ......................•................ 152
Заливка в желатину ...................................... 156
Заливка в желатин-левулезу .............................. 157
Приготовление срезов иа замораживающем микротоме ........ 158
Окраска срезоа ........................................... 161
Окраска срезов, наклеенных на предметное стекло ......... 161
Окрашивание ненаклеенных срезов; целлоидиновых и заморо-
женных ............................................. 164
Заключение тотальных объектов и срезов в глицерин и гли-
церин-желатину .................................. 165
Сухой препарат ............................................. 165
Методы быстрого изготовления препаратов .................... 166
Применение пластмасс в гистологической технике ............ 166
I
Раздел седьмой
Окрашивание .............................................. 169
Теории гистологических окрасок ............................ 169
Общие методы окрашивания .................................. 136
Окрашивание кармином . . .......’......................... 187
Окрашивание гематоксилином ............................... 189
Основные анилиновые красители ............................ 196
Кислые анилиновые красители ............................. 197
Сложные многокрасочные методы окрашивания ................ 198
Нейтральные красители .................................... 294
Окрашивание как метод исследования субмикроскопической плот-
ности различных тканевых структур ...........................
Метахромазия .................................................
К теории импрегнации-.........................................
465
Раздел восьмой
Гистохимические методы анализа клеток и тканей ............... 220
Металлы ................................................... 222'
Калий ..................................................... 222
Кальций ................................................... 224
Железо . . .............................................. 225
Медь ...................................................... 227
Цинк ...................................................... 227
Свинец .................................................... 227
Ртуть .................................................... 227
Мышьяк .................................................... 228
Висмут ..................................................... 228
Фосфор ................................................... 228
Белковые вещества ......................................... 229
Мочевина ............................................... 236
Нуклеиновые кислоты ...................................... 236
Глютатион ................................................243
Углеводы .................................................. 244
Гиалуроновая кислота ..................................... 246
Мукопротеины ............................................. 247
Гликоген ................................................. 248
Хитиновое вещество ....................................... 253
Целлюлоза ................................................ 254
Волютин ................................................... 254
Жиры и липоиды ............................................ 255
Плазм а ль ................................................ 259’
Ферменты .................................................. 261
Оксидазы ................................................. 261
Пероксидазы .............................................. 264
Сукцинодегидраза ......................................... 266
Фосфатазы ................................................ 269
Ок-спдоредуказа .......................................... 272
Витамины .................................................. 276
Витамин С ................................................* 276
Витамин А ................................................ 277
Пигменты .................................................. 277
Каратиноиды .............................................. 277
Хромолилоиды ............................................. 278-
Меланины ................................................. 279
Гемоглобин ............................................... 279
Гемосидерин .............................................. 280
Гематоидин ............................. ................. 280
Билирубин и биливердин ................................... 281
Малярийный пигмент ...............•....................... 281
Аргентафинная и хромафинная реакции .................... 281
Хромолиз ................................................. 282
Определение изоэлектрических точек клеток и тканей......... 283
Микросжигание . . . ...................................<... 287
Аутогисторадиография .......................................... 290
Количественное определение веществ в структурах клетки
(цитофотометрия) ................................ 291
Техника фотометрии клетки ...........-.................... •• 292
Эмпирические методы выявления некоторых компонентов тканей 293
Желчные кислоты .......................................... 293
Фибрин ................................................... 293
Слизь .................................................... 294
Амилоид .................................................. 295
Кератогиалин, ^леидин и кератин ......................... 296
466
Раздел девятый
Специальные методы изучения клеток и тканей .................. 297
Цитологические методы .................................... 297
Цитоплазма .............................................. 299
Клеточные мостики, плазмодесмы .......................... 300
Ядро .................................................. 301
Хромосомы ............................................... 305
Ядрышко ................................................. 312
Центросома .............................................. 313
Назальные зерна и реснички ............................. 314
Границы клеток .......................................... 315
Митохондрии ............................................ 316
Аппарат Гольджи ......................................... 321
Вакуом ....................'............................. 325
Трофоспонгии .......................................... 325
Гистологические методы ................................... 326
Эпителий ................................................ 326
Соединительная ткань .................................... 328
Гиалиновый хрящ ......................................... 340
Эластический хрящ ....................................... 340
Кость ................................................... 341
Зубы ..............................°..................... 344
Кровь ................................................... 345
Мускульная ткань ........................................ 352
Нервная система ......................................... 354
Метод культивирования тканей и органов в организме по
Ф. М. Лазаренко . . ......................................г 385
Раздел десятый
Некоторые методы исследования беспозвоночных ...................
Методы исследования простейших .............................
Наблюдения в живом состоянии ..............................
Фиксация ..................................................
389
389
389
391
395
397
400
404
Заливка в парафин ..........................................
^Окраска ...................................................
^'Методика сбора материала и культивирования простейших ....
Некоторые специальные методы изучения многоклеточных бссиоз-
I ВОНОЧНЫХ .................................................
Метод заливки для получения толстых срезов ................ 404
, Метод двойной заливки для малых объектов ............... 405
•Наблюдения над живыми объектами ......................... 406
Раздел одиннадцатый
Измерение микроскопических объектов ........................... 423
Продольное измерение .................................. 423
Измерение площади ......................................... 424
Определение увеличения рисунка ........................... 424
Дополнения .................................................. 426
Литература ................................................... 433
Указатель .................................................... 439
Григорий Иосифович Роскин
МИКРОСКОПИЧЕСКАЯ ТЕХНИКА
Редактор Г. М. Игнатьева
Редактор издательства К. Г. Парсаданова
Техн, редактор М. С. Гамзаева
Сдано в набор 12/Ш 1957 г.
Подписано к печати 4/IX 1957 г.
Бумага 60х92'/|б = 29,25 печ. л. 33,5 уч.-изд. л.
Тираж 8500 Т—08070 Издательство «Советская наука»
Заказ 80 Цена 13 руб. 45 коп.
Типография Металлургиздата, Москва, Цветной б., 30
ЗАМЕЧЕННАЯ ОПЕЧАТКА
На стр. 388, строки 12—13 сверху являются заголовком к последующему
тексту.
Зак. 1365