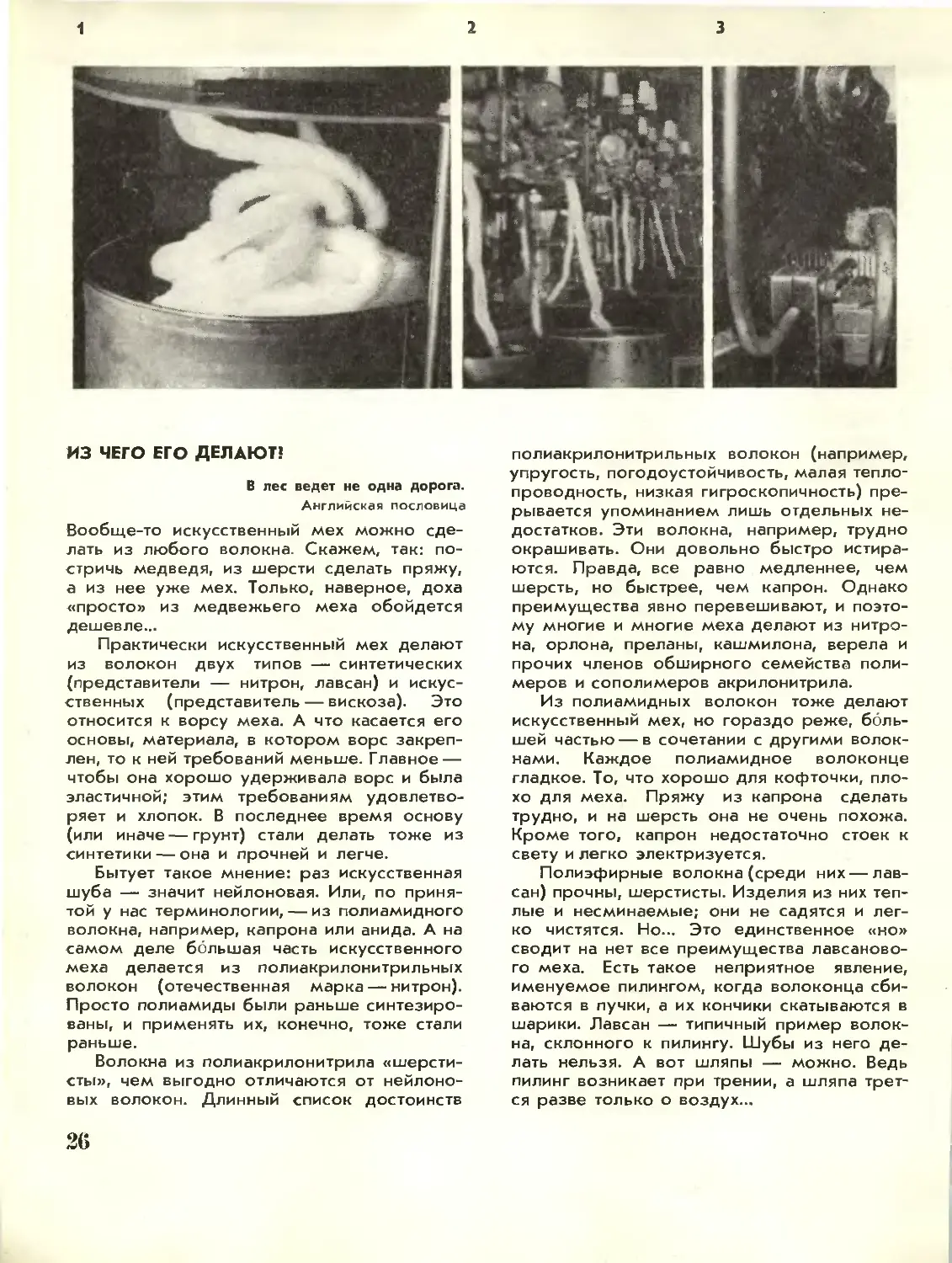
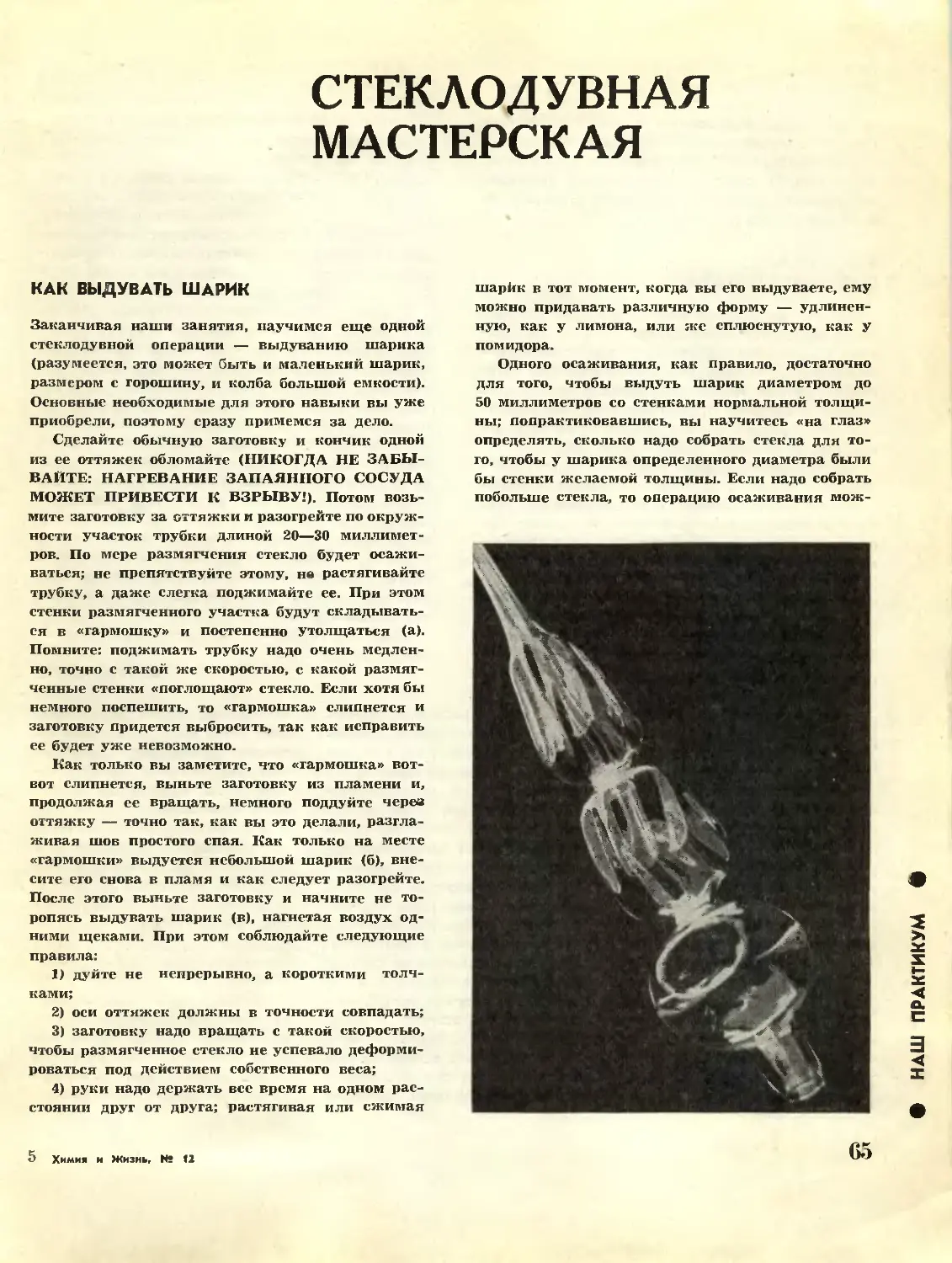
Текст
химия
жизнь
с;
си
I
а
X
■з
3
х
а
ос
5
с
о
с
1
о
I
т
>
ГС
Z
с:
ГС
I
В ЭТОМ НОМЕРЕ:
Элемент № 2: гелий
Уравнение с 1000
неизвестных
Наши консультации
История одной дуэли
Искусственный мех
Страницы истории
Советское шампанское
X
а
ос
с
о
с
1
о
X
7
>
ГС
X
Через несколько
дней после
личной аудиенции
у регента
в гостиницу
был доставлен
открытый лист
с изображением
льва.
Экспедиция
тронулась в путь.
«Утром
до рассвета
отправляем
охрану, которая
начинает стрелять
в воду, разгоняя
крокодилов...
В марте
переправа
нетрудна
и без риска...».
Это строки
из письма главы
экспедиции
Николая
Ивановича
Вавилова
(фото, которое
здесь
воспроизведено,
сделано в 1927
году в Абиссинии).
Очерк об этом
замечательном
ученом читайте
на стр. 16
Шшт jcumuh
^^ ш жизнь
в номере
?ЛЕМЕН^1^2^кТтИ^<андида^сими^
В. Станцо, чем ДЫШАТЬ КОСМОНАВТАМ! 7
В. Б. Кляцкин. БЕРЕГИСЬ АВТОМОБИЛЯ! 10
Ф. Ф. Мачульский. ЗНАТЬ ПРОТИВНИКА! 15
Жизнь замечательных ученых. Г. Григорьев, Л. Мархасев. НИКОЛАЙ
ИВАНОВИЧ ВАВИЛОВ 16
Наши консультации : 23
Как делают вещи и вещества. Инженер О. М. Л и б к и н, ИСКУССТВЕННЫЙ МЕХ 24
Экономика и производство. С. Н. Б лохи на. УРАВНЕНИЕ С 1000 НЕИЗВЕСТНЫХ 31
С. Георгиев. РЕАКЦИИ ВО ЛЬДУ 35
Страницы истории. ПИСЬМА Д. П. КОНОВАЛОВА ИЗ АМЕРИКИ *6
Наш календарь. Доктор химических наук Ю. И. Соловьев. АКАДЕМИК
НИКОЛАЙ СЕМЕНОВИЧ КУРНАКОВ 39
Проблемы и методы современной науки. С. Г. Кара-Мурза. КЛАТРАТЫ:
МОЛЕКУЛЫ В ГОСТЯХ У КРИСТАЛЛОВ 44
ВСПЫШКА ГЕНИЯ . 48
В. Батраков. ИСТОРИЯ ОДНОЙ ДУЭЛИ 50
Химическая кухня. Доктор химических наук П. Н. Федосеев. ТИТРОВАНИЕ
БЕЗ БЮРЕТКИ 54
Рассказы о лекарствах. Л. Солодки н. ХИНИН 58
Кандидат медицинских наук В. М. А ва к умов. ХИНИН И СОВРЕМЕННАЯ
ФАРМАКОЛОГИЯ 61
Наш практикум. СТЕКЛОДУВНАЯ МАСТЕРСКАЯ 64
КАК ПОСЕРЕБРИТЬ И ПОКРАСИТЬ ЕЛОЧНУЮ ИГРУШКУ 66
Из писем в редакцию 67
Обыкновенное вещество. А. Иорданский. СОВЕТСКОЕ ШАМПАНСКОЕ ... 68
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ ЗНАЕТЕ О ШАМПАНСКОМ 74
Л. Гелтон. ОСТОРОЖНЕЕ С ЗАКУСКОЙ 76
Учитесь переводить. АНГЛИЙСКИЙ — ДЛЯ ХИМИКОВ 78
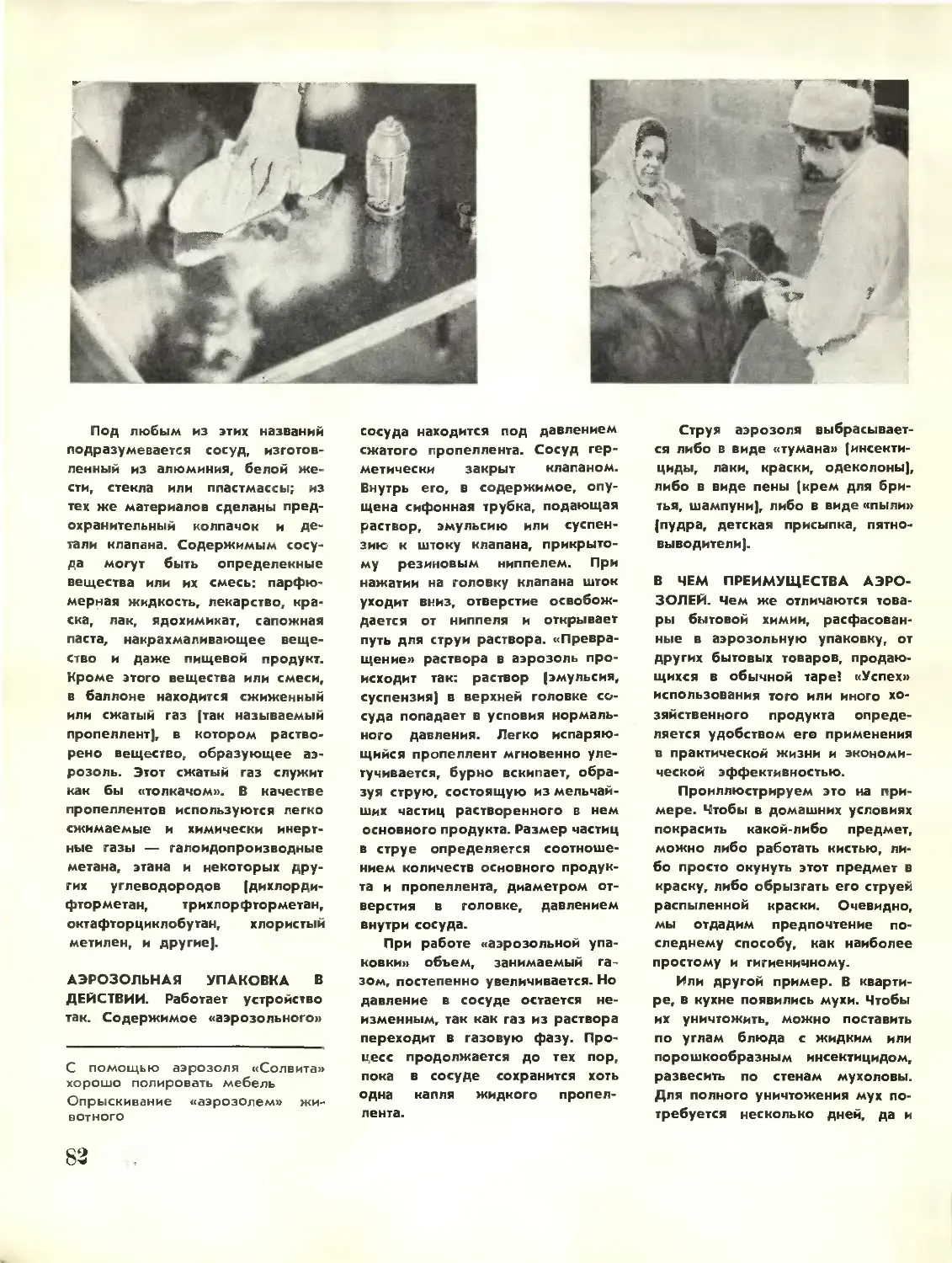
Полезные советы и пояснения к ним дает химик. «АЭРОЗОЛИ» У НАС ДОМА 80
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ ЗНАЕТЕ ОБ АЭРОЗОЛЯХ 83
Клуб Юный химик. ВИКТОРИНА. ОПЫТЫ БЕЗ ВЗРЫВОВ. БИОХИМИЯ — ЗАНЯТИЕ
ПОСЛЕДНЕЕ. УДИВИТЕЛЬНЫЙ КВАДРАТ. ХОТИТЕ ПОДГОТОВИТЬСЯ К
ЭКЗАМЕНАМ ПОЛУЧШЕ! 85
Г. А. Балуева. ХИМИЧЕСКИЕ ТОВАРНЫЕ ЗНАКИ 91
СТАТЬИ, ОПУБЛИКОВАННЫЕ В ЖУРНАЛЕ «ХИМИЯ И ЖИЗНЬ» В 1966 ГОДУ . . 92
НАУЧНО-ПОПУЛЯРНЫЙ «ькабрь \чьъ
ЖУРНАЛ MS 12
АКАДЕМИИ НАУК СССР год издания 2-й
гелии
Кандидат химических наук
Д. Н. ФИНКЕЛЬШТЕЙН
Рисунки А. КОЛМАНКА
4.0026
Щ Гелий — подлинно благородный газ.
Заставить его вступить в какие-либо
химические реакции пока не удалось. Его
молекула — одноатомна.
Щ По легкости гелий уступает только
водороду, он в 7,25 раза легче воздуха
(плотность по воздуху — 0,138).
Н В природе существуют два стабильных
изотопа гелия: Не3 и Не4. Более легкий
изотоп распространен на Земле в 109 раза
меньше тяжелого. Не3—самый редкий из
стабильных изотопов, существующих на
нашей планете.
| Искусственным путем получены три ко-
роткоживущих тяжелых изотопа гелия: Не,
с периодом полураспада 2,4-10~21 сек.
Не6 — 0,85 сек и Не8 — 0,18 сек *.
Щ Гелий почти нерастворим в воде и
других жидкостях.
■ В жидком гелии не растворяется заметно
ни одно вещество.
Щ Твердый гелий нельзя получить при
нормальном давлении, даже если температура
будет ниже 1° абсолютной шкалы.
Щ В истории открытия, исследования и
применения гелия встречаются имена многих
крупных физиков и химиков мира: Ж. Жан-
сена (Франция); Н. Локьера, У. Рамзая,
В. Крукса, Э. Резерфорда (Англия); Б. Паль-
миери (Италия), В. Кеезома и Г. Камерлинг-
Оннеса (Голландия); П. Л. Капицы,
Л.Д.Ландау, А. К. Кикоина и Б. Г. Лазарева
(Советский Союз), Р. Фейнмана и Л. Онсагера
(США) и других.
* Подробнее о Не8 см. «Химия и жизнь», 1966,
№ 5.
ЗЕМНОЙ ГЕЛИИ
Гелий — элемент необычный, и история его
необычна. Он был открыт в атмосфере
Солнца на 21 лет раньше, чем обнаружен на
Земле. Точнее говоря, в спектре солнечной
короны была открыта ярко-желтая линия
D3/ а что за нею скрывалось, стало
достоверно известно лишь после того, как гелий
извлекли из земных минералов,
содержащих альфа-активные элементы.
В земной коре насчитывается 29
изотопов, при радиоактивном распаде которых
образуются альфа-частицы, —
высокоактивные, обладающие большой энергией ядра
атомов гелия.
Гелий на Солнце открыли француз Ж. Жансен,
проводивший свои наблюдения в Индии 19 августа
1868 г., и англичанин Н. Локьер — 20 октября того
же года. Письма обоих ученых пришли в Париж
в один день и были зачитаны на заседании
Парижской Академии 26 октября с интервалом в
несколько минут. Академики, пораженные столь
странным совпадением, приняли постановление выбить в
честь этого события золотую медаль. На ее лицевой
стороне — портреты первооткрывателей. Обратная
сторона медали показана на цветной вклейке.
2
В основном, земной гелий образуется
при радиоактивном распаде урана-238,
урана - 235, тория и нестабильных продуктов
их распада. Несравнимо меньшие
количества гелия дает медленный распад самария-
147 и висмута. Все эти элементы
порождают только тяжелый изотоп гелия — Не1-,
чьи атомы можно рассматривать как
останки альфа-частиц, захороненные в оболочке
из двух спаренных электронов — в
электронном дублете. В ранние геологические
периоды, вероятно, существовали и другие,
уже исчезнувшие с лица Земли естественно
радиоактивные ряды элементов,
насыщавшие планету гелием. Одним из них был
ныне искусственно воссозданный нептуниевый
ряд.
По количеству гелия, замкнутого в
горной породе или минерале, можно судить
об их абсолютном возрасте. В основе этих
измерений лежат законы радиоактивного
распада; так, половина урана-238 за 4,52
миллиарда лет превращается в гелий и
свинец.
Гелий в земной коре накапливается
медленно. Одна тонна гранита, содержащая
2 г урана и 10 г тория, за миллион лет
продуцирует всего 0,09 мг гелия — половину
кубического сантиметра. В очень немногих
богатых ураном и торием минералах
содержание гелия довольно велико — несколько
кубических сантиметров гелия на грамм.
Однако доля этих минералов в
естественном производстве гелия близка к нулю, так
как они очень редки.
Природные соединения, в составе
которых есть альфа-активные изотопы, это
только первоисточник, но не сырье для
промышленного получения гелия. Правда,
некоторые минералы, обладающие плотной
структурой — самородные металлы,
магнетит, гранат, апатит, циркон и другие,—
прочно удерживают заключенный в
них гелий.
Однако большинство минералов с
течением времени подвергается процессам
выветривания, перекристаллизации и т. д., и
гелий из них уходит.
Кривая распространенности элементов в космосе
отражает не только исключительную роль водорода и
гелия в мироздании, но и особое значение гелиевой
группировки в строении атомного ядра. Наибольшую
относительную распространенность имеют те
элементы и те их изотопы, массовое число которых
делится на четыре: О16, Ne20f Mg24 и т. д.
Электронный дублет атома гелия
Высвободившиеся из кристаллических
структур гелиевые пузырьки отправляются
в путешествие по земной коре. Очень
незначительная часть их растворяется в
подземных водах. Для образования более или
менее концентрированных растворов гелия
нужны особые условия, прежде всего,
большие давления. Другая часть кочующего
гелия через поры и трещины минералов
выходит в атмосферу. Остальные молекулы
газа попадают в подземные ловушки, в
которых скапливаются в течение десятков,
сотен миллионов лет. Ловушками служат
пласты рыхлых пород, пустоты которых
заполняются газом. Ложем для таких газовых
коллекторов обычно служат вода или нефть,
d
р I
н
■С г
J ^-Ns
Ш 2fi 30 ДО Ы) 60 70 80 SO
1*
3
а сверху их перекрывают
газонепроницаемые толщи плотных пород.
Так как в земной коре странствуют и
другие газы (главным образом — метан, азот,
углекислота), и притом в гораздо больших
количествах, то чисто гелиевых скоплений
не существует. Гелий в природных газах
присутствует как незначительная примесь.
Содержание его не превышает тысячных,
сотых, редко — десятых долей процента.
Большая A,5—10%) гелиеносность метано-
азотных месторождений — явление крайне
редкое.
Природные газы оказались практически
единственным источником сырья для
промышленного получения гелия. Для
отделения от прочих газов используют
исключительную летучесть гелия, связанную с его
низкой температурой сжижения. После
того, как все прочие компоненты
природного газа сконденсируются при глубоком
охлаждении, газообразный гелий
откачивают. Затем его очищают от примесей.
Чистота заводского гелия достигает
99,995%.
Запасы гелия на Земле оцениваются в
5- 1014 м3; судя же по вычислениям, его
образовалось в земной коре за два
миллиарда лет в десятки раз больше. Такое
расхождение теории с практикой вполне
объяснимо. Гелий — легкий газ, и подобно водороду
(хотя и медленнее), он улетучивается из
атмосферы в мировое пространство.
Вероятно, за время существования Земли гелий
нашей планеты неоднократно
обновлялся— старый улетучивался в космос, а
вместо него в атмосферу поступал свежий —
«выдыхаемый» Землей.
В земной коре гелия приблизительно в
20 миллионов раз больше, чем в
атмосфере; еще больше потенциального гелия
хранится в «утробе» Земли — в альфа-активных
элементах. Но общее содержание этого
элемента в Земле и атмосфере невелико.
Гелий — редкий и рассеянный газ. На
килограмм земного материала приходится всего
0,003 миллиграмма гелия, а содержание его
в воздухе — 0,00052 объемных процента.
ГЕЛИИ
ВО ВСЕЛЕННОЙ
Недра и атмосфера нашей планеты бедны
гелием. Но это не значит, что его мало
повсюду во Вселенной. По современным
подсчетам, 76% космической массы приходится
на водород и 23% на гелий; на все прочие
элементы остается только один процент!
Таким образом, мировую материю можно
назвать водородно-гелиевой. Эти два
элемента главенствуют в звездах, планетарных
туманностях и межзвездном газе.
Вероятно, все планеты солнечной
системы содержат радиогенный —
образовавшийся при альфа-распаде гелий, а
крупные — и реликтовый гелий, из космоса.
Гелий обильно представлен в атмосфере
Юпитера: по одним данным его там 33%,
по другим — 97%. Это открытие легло в
основу сюжета одного из рассказов
известного ученого и писателя-фантаста А.
Азимова. В центре повествования— план
(возможно, осуществимый в будущем)
доставки гелия с Юпитера, а то и заброски на
ближайший спутник этой планеты —
Юпитер V — армады кибернетических машин на
криотронах (о них — ниже). Погрузившись в
жидкий гелий атмосферы Юпитера
(сверхнизкие температуры и сверхпроводимость —
необходимые условия для работы криотро-
нов), эти машины превратят Юпитер V в
мозговой центр солнечной системы...
Происхождение звездного гелия было
объяснено в 1938 году немецкими физиками
Г. Бете и Л. Вейцзекером. Позже их теория
получила экспериментальное
подтверждение и уточнение на ускорителях
элементарных частиц. Суть ее в следующем.
Ядра гелия синтезируются при звездных
температурах из протонов в результате
термоядерных процессов,
высвобождающих 175 миллионов киловатт-часов на
килограмм гелия.
Разные циклы реакций могут привести
к синтезу гелия.
В условиях не очень горячих звезд, таких
как наше Солнце, преобладает,
по-видимому, протонно-протонный цикл. Он
складывается из трех последовательно
сменяющихся превращений. Вначале соединяются
на огромных скоростях два протона с
образованием дейтрона — конструкции из
протона и нейтрона; при этом отделяются
позитрон и нейтрино. Далее соединяются
дейтрон с протоном в легкий гелий с
испусканием гамма-кванта. Наконец, реагируют
два ядра Не3, преобразуясь в
альфа-частицу и два протона. Альфа-частица,
обзаведясь двумя электронами, станет потом
атомом гелия.
1
Часть спектра излучения гелия. Желтая линия
в центре — линия D , ло которой Ж. Жансен
и Н. Локьер открыли гелий на Солнце
ill 'гтап
развилггим
i этап pa3(tw*twn
Ъигум&.+**>
*ХьХ1*€Ы*1
Анрг*о&и*1
Т1лазл*4уи,**д
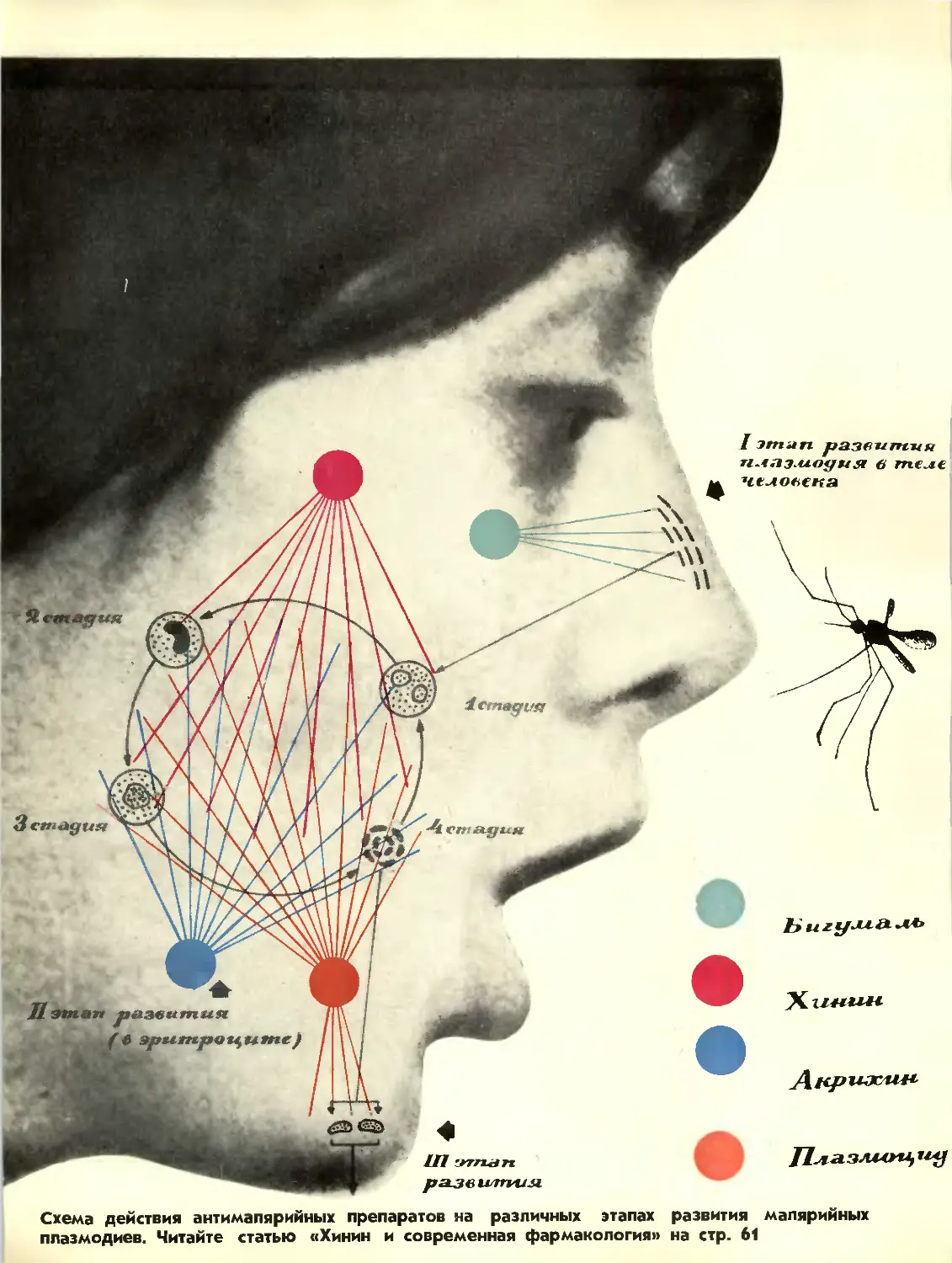
Схема действия антимапярийных препаратов на различных этапах развития малярийных
плазмодиев. Читайте статью «Хинин и современная фармакология» на стр. 61
2A№ + 1№-1D» + e°+1 + v)
2 AD2 + 1H1 -* 2He3 ( 7)
gHe^ -|- 2цез -^ 2Htv* ' 2.Н1
^H1 - 2He4 - 2e" 2 | 20,7 Mob
Тот же конечный результат дает более
быстрый углеродно-азотный цикл, значение
которого в условиях Солнца не очень
велико, но на более горячих, чем Солнце,
звездах роль этого цикла усиливается. Он
складывается из шести ступеней — реакций.
Углерод играет здесь роль катализатора
процесса слияния протонов. Энергия,
выделяемая в ходе этих превращений, такая
же, как и при протонно-протонном цикле —
26,7 Мэв.
Реакция синтеза гелия — основа
энергетической деятельности звезд, их свечения.
Следовательно, синтез гелия можно считать
праотцом всех реакций в природе,
первопричиной жизни, света, тепла и
метеорологических явлений на Земле.
Гелий не всегда бывает конечным
продуктом звездных синтезов. По теории
профессора Д. А. Франк-Каменецкого, при
последовательном слиянии ядер гелия
образуются Be8, С12, О16, Ne20, Mg24, а захват
этими ядрами протонов приводит к
возникновению других ядер. Для синтеза ядер
тяжелых элементов, вплоть до
трансурановых, требуются исключительные
сверхвысокие температуры, которые развиваются на
неустойчивых «новых» и «сверхновых»
звездах.
Известный советский химик А. Ф. Капу-
стинский называл водород и гелий прото-
элементами — элементами первичной
материи. Не в этой ли первичности скрыто
объяснение особого положения водорода и
гелия в периодической системе элементов,
и в частности того факта, что первый период
по существу лишен периодичности,
характерной для прочих периодов?
САМЫЙ, САМЫЙ...
Атом гелия (он же молекула) — прочнейшая
из молекулярных конструкций. Орбиты двух
его электронов совершенно одинаковы и
проходят предельно близко от ядра. Чтобы
оголить ядро гелия, нужно затратить
рекордно большую энергию 54,15 эв .
Отсюда — феноменальная химическая
пассивность гелия.
В последние пять лет химикам удалось
получить химические соединения тяжелых
инертных газов нулевой группы *■ Однако
благородство гелия остается, как и прежде,
вне подозрений.
Вычисления показывают, что если бы и
был найден путь получения, скажем,
фторида или окисла гелия, то при образовании
они поглотили бы так много энергии, что
образовавшиеся молекулы были бы
«взорваны» этой энергией изнутри.
Молекулы гелия неполярны. Силы
межмолекулярного взаимодействия между
ними крайне невелики — меньше, чем в
любом другом веществе. Отсюда — самые
низкие значения критических величин,
наинизшая температура кипения,
наименьшие теплоты испарения и плавления. Что
касается температуры плавления гелия, то
при нормальном давлении ее вообще нет.
Жидкий гелий при сколь угодно близкой к
абсолютному нулю температуре не
затвердевает, если, помимо температуры, на него
не действует давление в 25 или больше
атмосфер. Второго такого вещества в
природе нет.
Нет также другого газа, столь ничтожно
растворимого в жидкостях, в особенности
полярных, и так мало склонного к
адсорбции, как гелий. Это наилучший среди газов
проводник электричества и второй, после
водорода, проводник тепла. Его
теплоемкость очень велика, а вязкость мала.
Поразительно быстро проникает гелий
сквозь тонкие перегородки из некоторых
органических полимеров, фарфора,
кварцевого и боросиликатного стекла. Любопытно,
что сквозь мягкое стекло гелий
диффундирует в сто раз медленнее, чем сквозь боро-
силикатное. Гелий может проникать и через
многие металлы. Полностью непроницаемы
для него лишь железо и металлы
платиновой группы, даже раскаленные.
На принципе избирательной
проницаемости основан новый метод извлечения
чистого гелия из природного газа; варианты
метода уже проходят полупромышленные
испытания. Предпочтение отдается аппаратам
с диффузионными ячейками из тефлоновои
или поливинилперхлориднои пленки, так как
через эти материалы в условиях обычной
* Подробнее о соединениях тяжелых
благородных газов см. «Химия и жизнь», 1965, № 4.
5
температуры и малого перепада давления
гелий проходит в 300—400 раз быстрее, чем
прочие компоненты природного газа.
Исключительный интерес проявляют
ученые к жидкому гелию. Во-первых, это самая
холодная жидкость, в которой к тому же не
растворяется заметно ни одно вещество.
Во-вторых, это самая легкая из жидкостей с
минимальной величиной поверхностного
натяжения.
При температуре 2,186° абсолютной
шкалы происходит скачкообразное изменение
свойств жидкого гелия. Образующаяся
разновидность условно названа гелием II. Гелий
II кипит совсем не так, как прочие жидкости,
он не бурлит при кипении, поверхность его
остается совершенно спокойной. Гелий II
проводит тепло в 300 миллионов раз лучше,
чем обычный жидкий гелий (гелий I).
Вязкость гелия II практически равна нулю, она
в тысячу раз меньше вязкости жидкого
водорода. Поэтому гелий II обладает
сверхтекучестью — способностью вытекать без
трения через капилляры сколь угодно малого
диаметра. Очень интересно, что способность
переходить в состояние с нулевой вязкостью
присуща только одному изотопу — Не4.
Другой изотоп гелия — Не3 в сверхтекучее
состояние не переходит.
ИНЕРТНЫЙ,
НО ОЧЕНЬ НУЖНЫЙ
В конце прошлого века английский журнал
«Панч» поместил карикатуру, на которой
гелий был изображен хитро подмигивающим
человечком — жителем Солнца. Текст под
рисунком гласил: «Наконец-то меня
изловили и на Земле! Это длилось достаточно
долго! Интересно знать, сколько времени
пройдет, пока они догадаются, что делать
со мной?»
Действительно, прошло 34 года со дня
открытия земного гелия (первое
сообщение об этом было опубликовано в 1881 го-
ДУ)/ прежде чем он нашел практическое
применение. Определенную роль здесь
сыграли оригинальные физико-технические,
электрические и, в меньшей мере,
химические свойства гелия, потребовавшие
длительного изучения. Главными же
препятствиями были рассеянность и высокая
стоимость элемента № 2.
Первыми гелий применили немцы.
В 1915 году они стали наполнять им свои
дирижабли, бомбившие Лондон. Вскоре легкий,
но негорючий гелий стал незаменимым
наполнителем воздухоплавательных
аппаратов. Начавшийся в середине 30-х годов
упадок дирижаблестроения повлек некоторый
спад в производстве гелия, но лишь на
короткое время. Этот газ все больше
привлекал к себе внимание химиков, металлургов
и машиностроителей.
Многие технологические процессы и
операции нельзя вести в воздушной среде.
Чтобы избежать взаимодействия
получаемого вещества (или исходного сырья) с
газами воздуха, создают специальные защитные
среды, и нет для этих целей более
подходящего газа, чем гелий.
Инертный, легкий, подвижный, хорошо
проводящий тепло гелий — идеальное
средство для передавливания из одной емкости
в другую легко воспламеняемых жидкостей
и порошков; именно эти функции
выполняет он в ракетах и управляемых снарядах.
Гелием сушат легко взрывающиеся
вещества. В гелиевой защитной среде проходят
отдельные стадии получения ядерного
горючего. В контейнерах, заполненных
гелием, хранят и транспортируют
тепловыделяющие элементы ядерных реакторов. С помо-
6
щью особых течеискателей, действие
которых основано на исключительной
диффузионной способности гелия, выявляют
малейшие возможности утечки в атомных
реакторах и других системах, находящихся
под давлением или под вакуумом.
В научных исследованиях и в технике
широко применяется жидкий гелий.
Сверхнизкие температуры благоприятствуют
углубленному познанию вещества и его
строения — при более высоких температурах
тонкие детали энергетических спектров
маскируются тепловым движением
атомов.
Уже существуют сверхпроводящие
соленоиды из особых сплавов, создающие при
температурах жидкого гелия сильные
магнитные поля (до 300 тысяч эрстед) при
ничтожных затратах энергии.
При температуре жидкого гелия многие
металлы и сплавы становятся
сверхпроводниками. Сверхпроводниковые реле — кри-
отроны все шире применяются в
конструкциях электронно-вычислительных машин.
Они просты, надежны, очень компактны.
Сверхпроводники, а с ними и жидкий гелий,
становятся необходимыми для электроники.
Они входят в конструкции детекторов
инфракрасного излучения, молекулярных
усилителей (мазеров), оптических квантовых
генераторов (лазеров), приборов для
измерения сверхвысоких частот.
Конечно, этими примерами не
исчерпывается роль гелия в современной технике.
Но если бы не ограниченность природных
ресурсов, не крайняя рассеянность гелия,
он нашел бы еще множество применений.
Известно, например, что при
консервировании в среде гелия пищевые продукты
сохраняют свой первоначальный вкус и аромат.
Но «гелиевые» консервы пока
остаются.«вещью в себе», потому что гелия не хватает и
применяют его лишь в самых важных
отраслях промышленности и там, где без него
никак не обойтись. Поэтому особенно
обидно сознавать, что с горючим природным
газом через аппараты химического синтеза,
топки и печи проходят и уходят в
атмосферу намного большие количестве гелия, чем
те, что добываются из гелиеносных
источников.
Сейчас считается выгодным выделять
гелий только в тех случаях, если его
содержание в природном газе не меньше 0,1 %.
Запасы такого газа все время убывают, и не
исключено, что они будут исчерпаны еще до
конца нашего века. Однако проблема
«гелиевой недостаточности» к этому времени
вероятно будет решена — частично за счет
создания новых, более совершенных
методов разделения газов, извлечения из них
наиболее ценных, хотя и незначительных по
объему фракций, а частично — благодаря
управляемому термоядерному синтезу.
Гелий станет важным, хотя и побочным,
продуктом деятельности «искусственных
Солнц».
ЧЕЛ ДЫШАТЬ
КОСМОНАВТАМ?
Вероятно, многим кажется
противоестественной и надуманной
даже сама постановка такого
вопроса. Тем не менее, у космо-
биологов уже давно сложилось
убеждение, что нет и не может
быть газовой среды, которая
была бы в равной степени хороша
для любых условий
космического полета. «Земной» воздух — не
исключение. Его достоинства
самоочевидны, именно они —
причина того, что атмосферы всех
наших «Бостонов» и «Восходов»
состояли из обычного воздуха.
Но в некоторых условиях
обычный и привычный «земной»
воздух может из друга превратиться
во врага или не очень
надежного друга...
Уже лри полете к Луне на
космический корабль будут
реально воздействовать три
источника радиации: излучение ра-
7
диационных поясов Земпиг
галактическое космическое
излучение и корпускулярное излучение
солнечных вспышек.
Предусмотреть интенсивность последнего
практически невозможно. Даже
при надежной защите обычный
воздух в этих условиях может
стать источником вторичной —
наведенной радиации. Точнее,
источником будут атомы азота, из
которого атмосфера корабля состоит
почти на 80%- Из этой ситуации
может быть лишь два выхода:
ипи намного усложнять и
утяжелять средства радиационной
защиты ипи создавать внутри
корабля атмосферу, в которой
невозможно возникновение
наведенной радиации.
В аварийной ситуации может
проявиться и другой «минус»
обычного воздуха. Космический
лопет проходит в условиях
глубокого вакуума. При случайной
непредвиденной
разгерметизации корабля космонавт
подвергнется сразу нескольким
опасностям. От многих из них, в том
числе и от острого кислородного
голодания, его защитит скафандр.
Но будут ли участники длительных
космических полетов постоянно
находиться в скафандрах!! А без
специальной защиты резкое
падение давления смертельно
опасно дпя человека: в тканях и
крови появятся газовые пузырьки,
способные закупорить
кровеносные сосуды мозга и тем самым
вызвать мгновенную смерть.
Наконец, третий недостаток
обычного воздуха как среды
обитания космонавтов состоит в
том, что эта газовая смесь —
далеко не самая легкая.
Собственно, не так тяжеп сам воздух. От
замены его даже водородом
(представим на минуту, что это
возможно) вес корабля заметно
не изменится. Но ведь воздух,
которым дышат космонавты, надо
постоянно регенерировать.
Циркуляция и вентиляция требуют
затрат энергии. Чем легче газ,
тем легче вентиляционные
устройства, тем меньше вес источников
энергии.
Конечно, естественные
достоинства «земного» воздуха с
лихвой перекрывают эти
«минусы», но не считаться с ними
нельзя — вопрос-то гамлетовский:
быть ипи не быть. Поэтому не
прекращаются поиски и
исследования других вариантов
воздушной среды, пригодной для жизни
в космосе. И если от кислорода
никуда не денешься, то азот
воздуха, не играющий в жизненно
важных процессах большой роли,
может быть изъят или заменен.
В отечественной и зарубежной
научной литературе фигурируют
пять реальных вариантов газовой
среды для кабин космических
кораблей. Первый — обычный
воздух: 78% N2, 21% 02, 1% — всё
остальное: водород, инертные
газы, С02 и другие.
Второй, третий и четвертый
варианты предполагают полное
или частичное удаление из
обычного воздуха баластного азота.
Но, как известно, чистым
кислородом долго дышать непьзя.
Чтобы избежать кислородного
отравления, давление в кабине
снижается (человеку в космическом
скафандре это снижение
давления, естественно, ничем не
грозит), так что парциальное
давление кислорода остается таким же,
как в нормальных условиях.
Газовая среда,
освобожденная от азота, позволяет
существенно уменьшить вес кабин.
Именно такие среды использовались в
кабинах американских
космических кораблей «Меркурий» и
«Джемини».
В опытах, поставленных в
нашей стране, были подтверждены
почти все достоинства атмосфер
пониженного давления. Им
действительно не свойственны
недостатки естественной воздушной
среды. Но у них свои минусы.
Во-первых, в сильно разреженной
атмосфере непьзя находиться без
скафандра или с открытым
скафандром. Во-вторых, и при
низком давлении чистый кислород
все-таки раздражает верхние
дыхательные пути. В-третьих, в
атмосфере чистого кислорода, да
еще лри пониженном давлении,
намного увеличивается пожарная
опасность. Вспомните страницы
повести Н. Амосова «Мысли и
сердце» *, рассказывающие о
гибели двух исспедоватепей при
пожаре в кислородной камере.
Прибавлять к многочисленным
опасностям космоса опасность
пожара никак непьзя. Значит, нужно
предусматривать на борту какую-
то технику пожарной
безопасности, а она тоже что-то весит...
И, наконец, пятый вариант —
атмосфера, в которой весь азот
заменен гелием.
Теоретические предпосылки
дпя такой замены были
обнадеживающими. Никто из ученых не
смог получить надежного
подтверждения участия
атмосферного азота в биохимических
реакциях человеческого организма.
Этот факт вместе с
феноменальной химической пассивностью
гелия должен был гарантировать
неизменность направления и
характера таких реакций. Однако
все эти выкладки нужно было
подтвердить опытами. Опыты
были поставлены. Один из них
проходил так.
В камеру, заполненную гелио-
кислородной смесью, поместили
несколько белых мышей.
Животные получали нормальный корм,
воду, необычный воздух
тщательно регенерировался. За мышами
вепи постоянное наблюдение.
Эксперимент длился больше
пятидесяти дней. Никаких
существенных изменений в поведении и
жизнедеятельности животных не
наблюдалось. В ходе опыта не
погибла ни одна мышь, напротив.
* «Наука и жизнь», 1966, № 6—9-
8
у одной из них родипись
мышата и население камеры
увеличилось. После окончания опыта ис-
следовапи ткани и органы
животных, долгое время находившихся
или даже родившихся в гелио-
кислородной среде, но никаких
изменений, причиной которых
мог быть гелий, обнаружено не
было.
Другое важное свойство гелия
как заменителя азота — прочность
и компактность его молекул.
Есть все основания считать, что в
гелио-кислородной среде
опасность наведенной радиации
практически исключена.
Растворимость гелия в крови, моче,
лимфе и особенно жирах намного
меньше, чем азота. Это
уменьшает опасность декомпрессион-
ных расстройств при резких
перепадах давления. Не случайно
гелио-кислородные смеси стали
надежным средством
профилактики кессонной болезни и дали
большой выигрыш во времени
при подъеме водолазов.
И, плюс ко всему, гепий
намного легче азота.
Данные многих опытов на
животных и с участием человека
были за гелиевый воздух. Но все
опыты на людях были кратко-
временны. Как скажется на
человеке действительно долгое
пребывание в гелио-кислородной
среде! Точный ответ на этот
вопрос дали проведенные несколько
лет назад опыты советских
биологов профессора А. Г.
Кузнецова и кандидата медицинских наук
А. Г. Дианова.
Вот что рассказал об этой
работе один из ее участников.
Было проведено два
длительных эксперимента
продолжительностью один — 22, другой —
30 дней. Испытателями были
молодые, абсолютно здоровые
люди. Опыты дали совершенно
аналогичные результаты.
Первые два дня герметическая
камера, в которой находился
испытатель, была заполнена
обыкновенным воздухом. За это время
медики сняли фоновые данные.
На третий день произошла смена
среды обитания. Сначала камеру
провентилировали чистым
медицинским кислородом, который не
только вытеснял азот, но и «вы-
мывап» этот газ из организма
испытателя. Когда концентрация
кислорода в воздухе камеры
достигла 97%, подачу кислорода
прекратили и вместо него
пустили гелий. В этот же день в
камере установилась атмосфера
примерно такого состава: 22,5 % 02,
76% Не и 1,5% N2. Все
остальное — одежда, питание, режим
испытателя — осталось
неизменным.
В первые же часы пребывания
испытателя в гепио-кислородной
среде было зарегистрировано
первое изменение. Испытатель
сообщал о самочувствии.
Сообщал, что все в порядке. Речь его
была вполне разборчивой, но
голос неузнаваемо изменился.
Вместо привычного баритона
слышался высокий, почти мальчишеский
тенорок.
Подобные изменения голоса,
правда не столь резкие,
наблюдались и у водолазов. Объясняется
это различными скоростями
распространения звуковых колебаний
в разных средах. Поэтому
звуковой спектр сместился почти на
целую октаву.
Прошло еще несколько часов.
и испытатель сообщил, что в
камере похолодало. Однако
термометр показывал, что температура
не изменилась. Изменились теп-
поощущения испытателя. Высокая
теплопроводность гелия сдвинула
зону температурного комфорта.
В условиях обычного воздуха эта
зона — от 18 до 24°С. В
«гелиевом» воздухе ■— от 24,5 до 27,5СС
днем, когда испытатель
бодрствует, и 26—29°С ночью.
В дальнейшем опыт проходил
в условиях комфортных
температур. Все дни ни на минуту не
прекращались наблюдения, брались
различные пробы, но никаких
существенных отклонений в
самочувствии, поведении,
работоспособности испытателя, кроме тех
двух, что были замечены в самом
начале опыта, обнаружить не
удалось.
Главным недостатком
«гелиевого» воздуха оказалась все та
же повышенная
теплопроводность. В условиях разогрева
оболочки корабля гелиевый воздух
может не охлаждать, а
перегревать организм (при температуре
среды выше 36—37е С). При
меньших же температурах
вентилировать космический скафандр
гелиевым воздухом технически
выгоднее, чем обыкновенным.
Во время полетов всех
советских космонавтов в их
кораблях поддерживалась «атмосфера
№ 1» — обычный воздух, земное
давление, нормальная влажность.
Но это не значит, что во всех
дальнейших полетах будет
использоваться только такая
атмосфера. У «гелиевого» воздуха есть
хорошие шансы слетать в космос.
В. СТАНЦО
СТАТЬЯ О НОВОМ МЕТОДЕ ИССЛЕДОВАНИЯ МОЛЕКУЛ ПРИ ПОМОЩИ ЭФФЕКТА ШПОЛЬ-
СКОГО — КВАЗИЛИНЕЙЧАТЫХ СПЕКТРАХ ЛЮМИНЕСЦЕНЦИИ, АНОНСИРОВАННАЯ НА № 12,
БУДЕТ НАПЕЧАТАНА В № 1 ЗА 1967 г.
БЕРЕГИСЬ АВТОМОБИЛЯ
Инженер В. Б. КЛЯЦКИН
ГВОЗДЬ В САПОГЕ
Веками люди мечтали о семимильных
сапогах-скороходах: надел их, сделал шаг-
Другой и прибежал в тридевятое царство —
тридесятое государство. К услугам наших
современников целый гардероб
семимильных сапог. Вся наша жизнь неразрывно
связана с этими сапогами или,— если
оставить аллегорию — с автомобилями.
Очередной разговор о «сапоге» мы
повели из-за того, что в нем обнаружен
«гвоздь», да еще такой величины, что
некоторые скептики начали говорить: «А не
лучше ли ходить босиком?»
Лос-анжелосский «смог» (фото из журнала «Курьер
ЮНЕСКО»)
Действительно, автомобили стали очень
сильно влиять на здоровье человечества, и
влиять, мягко говоря, не лучшим образом.
Среднесуточная норма содержания
окиси углерода в атмосферном воздухе,
установленная в СССР санитарными нормами,
имеющими силу закона, составляет 1
миллиграмм на кубический метр. Существует
мнение — его придерживаются, например,
в Смоленском медицинском институте и на
кафедре гигиены Центрального института
усовершенствования врачей,— что и эта
норма должна быть снижена вдвое. В
действительности же концентрация СО в
воздухе наших крупных городов нередко
превышает норму во много раз.
В том, что главная причина этого —
возрастающий поток автомобилей, специа-
ю
листов уже не надо убеждать.
Стандартный двигатель ЗИЛ-164, израсходовав
тонну бензина, выбрасывает в атмосферу
600 кг окиси углерода, а внешне невинный
«Москвич» (двигатель МЗМА-407) — до
850 килограммов окиси углерода на тонну
горючего.
В таких странах, как США и Англия,
воздух загрязнен еще больше. Еще в
1955 году концентрация окиси углерода
в воздухе запруженного автомобилями
Лондона достигала 343 мг/м3.
По английским данным, смертность от
рака в этой стране с 1900 до 1953 года
возросла в 43 раза. Если в 1890 году рак
легких занимал 14-е по распространенности
место среди злокачественных опухолей, а
в 1924 году — 9-е, то к 1930 году он уже
вошел в «лидирующую тройку», а сейчас
передвинулся на 2-е место. Многие медики
уверены, что причина этого —
канцерогенные (вызывающие рак) вещества:
многоядерные ароматические углеводороды, из
которых наибольшей активностью
обладает 3,4-бензпирен. Это соединение
обнаружено в довольно значительных
количествах в отработанных и картерных газах
автомобильных двигателей.
Угарный газ плюс бензпирен... Но этим,
к сожалению, не исчерпывается перечень
«преступлений» автомобиля. (Не убежден,
что слово «преступление» так уж надо
брать в кавычки.) Автомобильные
двигатели выбрасывают в воздух большие
количества чрезвычайно токсичных окислов
азота. Предельно допустимая
концентрация (ПДК) для этих веществ в
атмосферном воздухе в 10 раз меньше, чем для
окиси углерода — всего 0,1 мг/м3. А в
выхлопных газах их содержится до 1%- Это
настолько много, что неоднократно ставился
даже вопрос о промышленном получении
окислов азота с помощью двигателей
внутреннего сгорания.
Но и это еще не все. В выхлопных
газах автомобиля обнаружено более 200
компонентов, из них явно неядовиты только
пять.
Все это говорит о том, что автомобиля
надо опасаться не только перебегая улицу
на красный свет. Плохо то, что
индивидуальных средств защиты от выхлопных
газов практически не может быть. Не станет
же напяливать противогазы все городское
население! Значит бороться с
«автонечистотами» нужно на корню. И борьба эта
ведется, хотя и не всегда успешно.
Проследим этапы этой борьбы.
ТРИШКИН КАФТАН
По способу воспламенения горючей смеси
двигатели делятся на карбюраторные (или,
как их часто называют, бензиновые) и
дизельные. У первых рабочую смесь
зажигает искра электрической свечи, у вторых
смесь воспламеняется сама — от сжатия.
Пути образования вредных веществ в
двигателях двух основных типов не совсем
одинаковы, но некоторые общие
закономерности есть. И в том и в другом случае
количество образующихся вредностей
сильно зависит от весового соотношения
между воздухом и топливом. Если топлива
и воздуха (кислорода) подается ровно
столько, чтобы они могли полностью
прореагировать по известной реакции:
С л Jim Г02->С02 ; Н20,
то такая смесь называется стехиометри-
ческой. Для оценки отклонения состава
смеси от стехиометрического пользуются
коэффициентом избытка воздуха а,
который выражает отношение количества
воздуха, поданного в двигатель, к количеству,
необходимому для полного сгорания
топлива.
Казалось бы, при я = 1 в двигателе не
должны образовываться никакие вредные
вещества — только водяной пар и
углекислый газ. К сожалению, практика не
подтверждает теоретических выкладок.
Только на долю окиси углерода в этих
условиях приходится 1 % от общего объема
выхлопных газов.
Если с<1, то воздуха нехватает. В этом
случае топливо не может сгорать
полностью (даже теоретически), и в выхлопных
газах должны появиться несгоревшие
углеводороды, окись углерода, водород. На
первый взгляд кажется невероятным,
чтобы моторы работали на смеси с а <1: ведь
это приведет лишь к перерасходу топлива
и появлению вредных веществ. Однако на
самом деле все карбюраторные двигатели
значительную часть времени работают
именно в таких режимах... В
частности, смесь всегда обогащается (до а =0,7)
на холостом ходу двигателя. Это
происходит из-за неравномерности распределения
Зависимость мощности двигателя, а также
содержания в отработанных газах окиси углерода и окислов
азота от коэффициента избытка воздуха
компонентов смеси по цилиндрам. Смесь
также переобогащается в моменты запуска
двигателя, при резком открытии
дроссельной заслонки (когда необходимо быстро
набрать скорость, например, при обгоне) и
в моменты, когда двигатель развивает
максимальную мощность. Последнее, как
правило, достигается при «=0,9.
Токсичные вещества попадают в воздух
и по другой причине. В моменты сжатия
горючей смеси в цилиндрах часть газа
прорывается через кольца в картерное
пространство, а оттуда выбрасывается в
атмосферу. Последнее происходит не во
всех автомобилях, но в большинстве.
В конструкциях двигателей ГАЗ-53, «Мос-
квич-403» и «408», М-21 («Волга») отсос
картерных газов и возвращение их в
рабочий цикл не предусмотрены. Так к
токсичности отработанных газов прибавляется
токсичность картерных.
Казалось бы, раз так (и а = 1 и а < 1 —
все плохо) — нужно идти на частичную
потерю мощности и давать избыток воздуха.
Однако при а =1,7 смесь искрой уже не
воспламеняется. Остается только
варьировать в узком диапазоне — от 1 до 1,7.
С увеличением коэффициента избытка
воздуха количество окиси углерода
уменьшается (хотя и не сходит на нуль), а
содержание другого ядовитого компонента —
окислов азота — достигает наибольших
значений при а = 1,15—1,20.
Причина образования окислов азота —
в чрезвычайно высокой температуре газов,
достигающей более 2200° С. В этих
условиях начинают взаимодействовать входящие
в состав воздуха кислород и азот:
N2 -, 02 = 2КО-
Образующаяся окись азота — неустойчивое
соединение, и при снижении температуры
сгорания оно должно разлагаться на
исходные продукты. Однако при расширении
(ход поршня вниз) происходит такое
охлаждение газа, что окислы азота
переходят в сравнительно устойчивое
состояние.
Содержание окислов азота в
отработанных газах растет и с увеличением степени
сжатия в цилиндрах: ведь при этом
повышается температура конца сгорания.
Коэффициент избытка воздуха у
дизелей значительно выше, чем у
карбюраторных двигателей. Количество окиси
углерода и углеводородов в их выхлопе
незначительно, но окислов азота (при равных а )
они продуцируют больше, чем
карбюраторные. Например, двигатель ЯМЗ-236
дает всего 0,08% СО, но 20 мг окислов азота
на каждый литр выхлопных газов.
Общеизвестно, что дизель производит
(и в немалых количествах) еще одно
вещество, сильно загрязняющее воздух,— сажу.
Это она окрашивает в черный цвет
отработанные газы дизелей. Сама по себе сажа
достаточно неприятна, но, кроме того, она
служит носителем 3,4-бензпирена, который
адсорбируется на ее поверхности.
ЗДОРОВЬЕ И ЭКОНОМИКА
Трагизм положения подчеркивается тем,
что мы сами усугубляем, не можем не
усугублять вредное влияние автомобилей на
собственное здоровье. Стремление
сэкономить время — главная причина
увеличения их «поголовья». Мы стремимся
сделать двигатели мощнее и экономичнее
и для этого увеличиваем степень
сжатия горючей смеси. Но так недолга дойти
до детонации. Чтобы избежать ее, в
топливо карбюраторных двигателей вводим
антидетонаторы, чаще всего тетраэтилсви-
нец, а это сильно токсичное вещество,
причем больше 70% его выбрасывается в
атмосферу с отработанными газами.
В том, что варьирование
коэффициентом избытка воздуха—«тришкин кафтан»
(не СО, так окислы азота отравят воз-
12
дух),— мы уже убедились. Правда, при а,
равном 1,3—1,5, содержание в выхлопных
газах и угарного газа и окислов азота
снижается до приемлемых величин, но при
этом теряется половина мощности
двигателя. К тому же в этих условиях
необходимо применять специальные системы
зажигания— обычные надежно не
воспламеняют столь обедненную смесь.
Как же увязать и согласовать
требования экономики и санитарии?
МЕРЫ И ПОЛУМЕРЫ
Нагнетатель. Падение мощности при
обеднении смеси можно компенсировать
повышением степени сжатия, и особенно
наддувом. На двигателе ставят специальный
нагнетатель, увеличивающий давление
воздуха и, следовательно, количество
горючей смеси в цилиндрах. В Лаборатории
нейтрализации и проблем энергетики
автомобилей и тракторов (ЛАНЭ ЦНИТА)
были проведены стендовые испытания
современных автомобильных двигателей ГАЗ-
51, ГАЗ-53 и ЗИЛ-130 с обеднением смеси
и компенсацией мощности наддувом.
Анализ отработанных газов на содержание
ядовитых компонентов дал
удовлетворительные результаты. Но тут неизбежны
технические трудности: характеристики
двигателя и нагнетателя согласуются
неудовлетворительно. В результате
автомобиль становится тяжелее, сложнее, дороже.
В определенной ситуации — это выход
из положения, но не всегда.
Может быть, выручит подача воздуха
в зону выпускных клапанов
карбюраторного двигателя?
Такой эксперимент был поставлен в
университете штата Орегон в Америке.
При подаче дополнительного воздуха
окись углерода, содержащаяся в выхлопе,
соединяется с кислородом воздуха и
превращается в нетоксичную двуокись
углерода:
2С0 -г- 02 = 2С02.
Температура в зоне выпускных
клапанов достаточна для начала этой реакции,
а далее она идет за счет выделяющегося
в процессе тепла. Но вряд ли эта система
может решить проблему обезвреживания
выхлопных газов. Мало того, что и здесь
нужен специальный нагнетатель — растет
Каталитический нейтрализатор для бензиновых
автомобильных двигателей. В разрезе показаны шарики
из керамики, на которые нанесен слой катализатора
количество окислов азота в выхлопе,
кроме того, эта система работоспособна
далеко не на всех режимах работы двигателя.
Каталитические нейтрализаторы.
Нейтрализатор для карбюраторного двигателя
отличается от нейтрализатора дизеля
устройством для дополнительной подачи
воздуха. В остальном они схожи. Действие
нейтрализаторов основано на дожигании
продуктов неполного сгорания топлива,
содержащихся в отработанных газах.
Газы проходят через слой
керамических шариков, на поверхность которых
нанесен платиновый или палладиевый
катализатор, ускоряющий реакцию дожигания
окиси углерода, углеводородов и
альдегидов. Для дизельного двигателя необходи-
Каталитический нейтрализатор для дизеля ЯМЗ-236.
Внутри он устроен так же, как нейтрализатор для
бензиновых двигателей. Вес его 20 кг.
Нейтрализатор улавливает 40—80% СО, 50—80%
углеводородов и 50—100% альдегидов в зависимости от
режима работы двигателя
13
Схема жидкостного нейтрализатора: 1 —
контрольный кран; 2 — успокоитель; 3 — водоотбойный лист;
4 — водоотделительная решетка; 5 — циклон; 6 —
эжекторная трубка; 7 — сливная пробка; 8 —
смотровое окно.
Нейтрализаторы такого типа применимы не столько
для автомобилей, сколько для тепловозов
мости в подаче дополнительного воздуха
нет, так как в его выхлопных газах
достаточно свободного кислорода. (Напомню,
что все дизели работают на обедненных
смесях.)
Каталитические нейтрализаторы —
надежное средство очистки выхлопных
газов от окиси углерода, но они не изменяют
количества окислов азота в выхлопе.
Поэтому они эффективны при работе
двигателя на богатых смесях (а<0,9), когда
окислов азота образуется немного. ЛАНЭ
ЦНИТА спроектированы нейтрализаторы
этого типа для всех марок отечественных
двигателей. Готовится большая
экспериментальная партия таких нейтрализаторов
для всесторонней проверки их в условиях
Москвы. Испытания показали, что эти
нейтрализаторы находятся на уровне
лучших зарубежных образцов.
Однако и каталитические
нейтрализаторы— не средство от всех болезней. При
работе карбюраторного двигателя на
бедных смесях они уже менее эффективны,
а на дизельных двигателях они не только
не нейтрализуют окислы азота, но и не
задерживают сажу. Поэтому приходится
дополнительно усложнять систему очистки.
Жидкостной нейтрализатор. Принцип
работы такой системы предельно прост:
выхлопные газы пропускают через
жидкость определенного химического состава.
Один из возможных вариантов: слабый
водный раствор сульфита натрия или
соды с 0,5% гидрохинона. Сажа
улавливается жидкостью чисто механическим путем,
окислы азота растворяются в воде.
Альдегиды, например формальдегид,
связываются в растворах Na2S03 следующим
образом:
J4a2S03 -} НСПО + Н20 -> NaOH L СН2 (ОН) S03Na.
Подбором компонентов рабочей
жидкости можно нейтрализовать многие вредные
компоненты. Недостатки жидкостных
нейтрализаторов — большие габариты и
большой унос рабочей жидкости
отработанными газами. Поэтому жидкостные
нейтрализаторы пока применяются только на
большегрузных дизельных автомобилях,
тепловозах и тракторах, например, на
отечественном тракторе Д-108,
предназначенном для подземных работ. Но не всякому
автомобилю под силу таскать на себе
нейтрализатор-цистерну.
Этими системами не исчерпываются
возможные способы нейтрализации
отработанных газов. Можно было бы еще
рассказать о пламенных нейтрализаторах, в
которых сажа дожигается пламенем
горелки, работающей на том же топливе, что и
двигатель, о системах на основе цеолитов,
способных поглощать молекулы строго
определенных размеров и, следовательно,-
определенные компоненты выхлопных
газов.
Наряду с решением проблемы
нейтрализации, изучается возможность перевода
автотранспорта на другие виды энергии и
принципиально новые двигатели. Не
случайно головная в нашей стране
организация, занимающаяся проблемами
обезвреживания отработанных газов, называется
Лабораторией нейтрализации и проблем
энергетики автомобилей и тракторов.
и
ЗНАТЬ ПРОТИВНИКА
Инженер Ф. Ф. МАЧУЛЬСКИЙ
С ревом проносится по дороге
грузовик, оставляя за собой
шлейф черного дыма. Черный он
оттого, что в нем содержится
обыкновенная сажа — мельчайшие
частицы углерода. Впрочем, сажа,
выброшенная из дизельного дви-
Такая огромная, хорошо
развитая поверхность легко
поглощает молекулы многих веществ.
А далеко не все вещества,
входящие в состав выхлопных газов,
безвредны для человека.
Достаточно назвать 3,4-бензпирен —
воздуха, необходимо знать раз-»
мер и форму частиц сажи,
характер их поверхности. Поэтому
сажу приходится фотографировать
под электронным микроскопом.
Эти фотографии (с различным
увеличением) и показаны здесь.
гателя, не такая уж
обыкновенная. Ее частицы чрезвычайно
малы, а это означает, что их
суммарная поверхность очень велика.
Если частицы, содержащиеся
всего в одном грамме дизельной
сажи, уложить на плоскости
вплотную друг к другу, они
займут площадь в 70 квадратных
метров!
углеводород, обладающий
канцерогенными свойствами. И как раз
этот углеводород прекрасно
адсорбируется дизельной сажей. Так
с<6езо6идная» сажа становится
носителем опасных для здоровья
веществ.
Инженерам, конструирующим
фильтры, которые
предотвращают загрязнение атмосферного
Как были сделаны эти снимки?
Сажу из выпускного
трубопровода дизеля Я А 3-204 осадили на
специальный фильтр. Затем из
сажи приготовили водную
суспензию, после чего взвешенные в
воде частицы нанесли на колло-
диевые пленки. Эти пленки и
сфотографировали в электронном
микроскопе-
15
НИКОЛАЙ ИВАНОВИЧ
ВАВИЛОВ
Г. ГРИГОРЬЕВ, Л. МАРХАСЕВ
Можно ли счесть звезды на небе?
Можно ли пересчитать зерна на полях всего
света?
Если твердо верить, что зто очень нужно
человеку — можно. Ведь есть же звездные
каталоги.
Николай Иванович Вавилов, один из самых
выдающихся ученых XX века, великий
путешественник — собрал семена всех культурных
растений Земли.
...Ленинград был для него пристанью. Мир —
лабораторией. Он уезжал на другие континенты,
в джунгли, в горы так же часто и так же просто,
как мы с вами уходим утром в школу или на
работу.
Нас обычно спрашивают: «Как дела?». И мы
отвечаем: «Ничего». Его спрашивали: «Куда вы
теперь едете?». И он отвечал: «Вселенную
объезжаем». Он не шутил — он ходил по земле, как
по глобусу. В одном иэ писем он писал:
«Подытоживаю в настоящее время земной шар...
Приведение земного шара в порядок — дело очень
сложное и трудное».
Р егент Эфиопии рас Таффари пристально
смотрел на русского ученого, прибывшего из
загадочной Страны Советов. Рас Таффари привык
иметь дело с европейцами: среди дипломатов он
слыл хладнокровным, непроницаемым
политиком, который умел сочетать вежливость с
недоверием. У него были причины для недоверия:
Эфиопия тогда, в 1927 году, оставалась
единственной независимой страной Африки.
Человека из России не занимали ни
драгоценные «ключи жизни» — истоки Нила, ни
нефть или золото. Только хлеб, пшеница. Только
растения, семена и плоды. Рас Таффари всегда
воздавал должное своей стране. Теперь он
услышал еще одну приятную его слуху вещь:
оказывается, Эфиопия — колыбель пшеницы, один из
самых оригинальных очагов древнего
земледелия. Поэтому советская экспедиция приехала
именно сюда. Она ищет новые сорта, новые
растения, чтобы обновить земледелие в своей
стране. И просит разрешить путешествие по
Эфиопии.
Рас Таффари назначил советскому гостю еще
одну личную аудиенцию. На этот раз они
остались вдвоем, и первым заговорил по-французски
регент. Он просил рассказать, как произошла
Великая Октябрьская социалистическая
революция, как свергли царя и что стало с
императорским двором. Гость отвечал, тоже по-французски,
легко, быстро, бегло.
Опершись тонкими, темными руками о стол,
не отрывая взгляда от рассказчика, рас Таффари
слушал. Потом спросил, какова советская
конституция? Быть может, его высокочтимый гость
пришлет ему на французском языке
описание советской системы управления... Они
расстались.
И через несколько дней в гостиницу был
доставлен открытый лист с изображением льва.
Повелением раса Таффари и императрицы Зау-
дит русский путешественник профессор Николай
Иванович Вавилов объявлялся гостем Эфиопии,
и всем было приказано помогать ему и снабжать
патронами, продовольствием, фуражом и солью
(поскольку соль во многих местах страны еще
заменяла крупные деньги, а красный перец —
мелкие).
Экспедиция тронулась в путь.
Вавилов записывает: «Утром, до рассвета,
отправляем охрану, которая начинает стрелять в
воду, разгоняя крокодилов... Несколько
крокодилов брюхом вверх всплывают на поверхность.
Изредка, для острастки, постреливаем в воду.
В марте переправа нетрудна и без риска».
«Нетрудна и без риска». Мулы срываются в
воду. Проводники падают от усталости и дрожат
от страха, слыша как рядом воют шакалы. А он —
«гость Эфиопии» из далекой холодной страны
спит по нескольку часов, и все собирает растения,
и помечает в записной книжке: «Любопытные,
своеобразные и разнообразные абиссинские
пшеницы в невероятной пестроте форм...
Оригинальные местные абиссинские формы чечевицы, нута,
гороха, чины».
16
Вавилова не отвлекают уже ни рев леопардов,
ни хохот гиен. Удивительно, как оправдались
его предположения: «Между Гондаром и Аксумом
делаем первоклассное открытие: находим на
полях своеобразную, неизвестную в науке безостую
твердую пшеницу. Десятилетия селекционеры
разных стран пытаются выводить безостую
твердую пшеницу путем скрещивания обычных
остистых твердых пшениц с мягкими безостыми
пшеницами. Создание таких пшениц сопряжено с
волны ее тяжело колышутся под застывшим в
небе солнцем Эфиопии. А главное — оправдались
его теоретические предположения.
Вавилов любит повторять: «Жизнь коротка,
надо спешить». Теперь обновление земли
перестанет зависеть от слепого и ленивого случая.
Обновление русской земли. О нем заговорили
вскоре после Великой Октябрьской революции.
Заговорили о нищих, истощенных полях: старые
Николай Иванович Вавилов
в кабинете Всесоюзного института растениеводства
немалыми трудностями ввиду генетической
отдаленности твердых и мягких пшениц. Природа,
однако, сама создала в Абиссинии аналогично
мягким пшеницам безостые формы твердой
пшеницы Хлеб на корню. Собираем тысячи колосьев.
Это, пожалуй, самая интересная находка за все
время путешествия по Абиссинии».
Да, ему повезло. Он увезет с собой 146 форм
твердой пшеницы, в том числе замечательную
«синдитукуру», фиолетовую пшеницу. Черные
сорта пшеницы, ржи, овса скудели, вырождались.
Нужны были новые. Их выписывали из Америки
и Европы, но и они превращались в «сортовой
хлам». Их губила русская зима. Или русское лето.
Они оказывались слишком изнеженными, эти
пришельцы, даже если когда-то сами вышли из
России.
Нет, новые сорта нужно было вновь вести с
самого начала: быть может, поклониться их
«праматери», хранитильнице всех генов, всех
нужных свойств, щедро розданных ею потом
детям и внукам. Но кто сказал, что такая
«праматерь» пшенипы существует, а родина ее — где-то
Я Азии или Африке? Ботаники гадали. А земля
2 Химия и Жизнь, № 12
17
не могла больше ждать. Голод надвигался на
страну. Одно засушливое лето сменялось другим.
Желтая раскаленная пыль стояла над иссохшими
полями Приволжья. Где-то грохотала канонада:
наступал Врангель. В Саратове кончались запасы
хлеба.
Был июнь 1920-го года. В Саратовском
университете Николай Иванович Вавилов на III
Всероссийском съезде по селекции буквально потряс
ученых новой, блистательной идеей.
...Карл Линней, «королевский ботаник и врач
адмиралтейства», как именовали его тогда, ввел
в естествознание понятие вида. Это было
великим открытием, и тогда, 200 лет назад, такое по-
^ нятие казалось вечным. Но два столетия для
науки не прошли даром. За это время она
основательно расшатала систему шведского ученого.
Линнеевские виды дробятся на подвиды,
крошатся на разновидности, распыляются на расы. Там,
где натуралист восемнадцатого века видел
единую группу растений или животных,
современный ученый отмечает десятки, сотни важных
отличий.
Высшие семенные растения сейчас
насчитывают более ста тридцати тысяч видов. Помножьте
эту грандиозную цифру на тысячи подвидов,
разновидностей, рас, и вы получите
астрономическое число. А ботаники открывают,
путешественники выискивают, а селекционеры выводят
все новые и новые формы. Вот почему
современному ученому грозит опасность утонуть в хаосе
растительного разнообразия.
Но взгляните на пшеницы. Они распадаются
на несколько видов: мягкую, твердую,
карликовую, английскую, польскую. Среди мягких
пшениц существуют сорта остистые и безостые,
озимые и яровые, колосья их могут быть
бархатными и голыми, окрашенными в белый, красный,
серый, черный цвет. Теми же признаками
отличаются друг от друга сорта пшениц твердых и
карликовых, английских и польских. И тут есть
формы озимые и яровые, с остями и без остей,
с белыми и красными колосьями... Разновидности
пшениц образуют как бы соответствующие друг
Другу ряды. Эти ряды назовем
«гомологическими». Сорта ржи повторяют пшеницу. Овсы,
ячмени, просо похожи друг на друга составом своих
сортов. Сорта выстраиваются в параллельные
ряды. Тогда появляется ключ к порядку в
щедром, буйном разнообразии царства флоры. Химик
на основании периодической системы элементов
Менделеева может отыскать не открытый еще
элемент. Ботаник теперь тоже не будет искать
вслепую. Если он захочет найти новую форму,
пусть сравнит ряд этого вида с рядом другого,
более полным и известным. И тогда он легка
определит, какими должны быть недостающие
звенья, «что нужно ему искать, какие именно
неизвестные формы должны существовать».
]\1ожно ли пересчитать волны в море или звезды
в небе?
Бывают мгновения, минуты, часы (Стефан
Цвейг называл их «звездными часами
человечества»), когда человек может все. В тот душный
июньский день в голодном Саратове уставших
людей, слушавших Вавилова, вдруг охватило
ликующее чувство приобщения к большому
открытию.
И они отправили в Москву телеграмму:
«Совнарком, Луначарскому. Совнарком, Середе. На-
Всероссийском селекционном съезде выслушан
доклад проф. Н. И. Вавилова исключительного
научного и практического значения с
изложением новых основ теории изменчивости... Теория
эта представляет крупнейшее событие в мировой
биологической науке, соответствуя открытиям
Менделеева в химии».
Да, что искать — теперь можно было узнать
заранее... Но где? Вавилов дал ключ к вратам
зеленых кладов культурных растений мира, но»
прежде чем отправиться в путь, надо было
запастись еще и «ботаническим компасом» и
прочертить маршруты на картах, которых пока пи-
кто не имел.
В марте 1921-го года Николай Иванович
Вавилов был избран заведующим Бюро по
прикладной ботанике и селекции, покинул Саратов и
стал петроградским жителем. Найти наилучшие
сорта с наивысшей урожайностью и отобрать их
для всех зон страны — этим должно заниматься
Бюро. Теперь на вопрос «где» надо было отвечать
немедленно. Если бы знать, откуда «пошли»
пшеница, рожь, ячмень... Если бы найти
сокровищницы, где хранятся самые разные формы
растений, кладовые, где собраны сортовые богатства...
Быть может, они в древних колыбелях
земледелия, в речных долинах? Или там, где до сих
пор находят их диких предков?
И прежде сон Николая Ивановича был
коротким. Теперь по ночам он мысленно отправлялся
в далекие путешествия. Географические карты
покорно ложились к его ногам на полу кабинета,
и ночь напролет, как маяк, горела на
письменном столе лампа. Иногда Вавилов записывал свои
мысли на абажуре лампы. Отрывочные записи
светились, как тайнопись мудреных лоций.
Вавилов снова перечитывал женевского
ботаника де Кандоля, который утверждал, что
18
родина культурных растений там, где они растут
в диком виде.
...Абажур испещрялся знаками вавиловской
тайнописи, письменный стол плыл сквозь
петроградские ночи к неведомым материкам, а карта
мира на полу покрывалась кружками и
точками...
Не правильней ли думать, что колыбель
растения, всех его сортов и рас там, где генетическое
разнообразие наибольшее, где найдено
наибольшее число форм? Но вот (это видно на карте)
кружки в Афганистане. Это все формы мягких
пшениц, а в Эфиопии твердых... Кружки и
точки — условные обозначения пшениц — сбежались
сюда, и получились «ботанические кратеры» (так
метко назвал их А. Роскин, автор замечательной
книги о Н. И. Вавилове «Караваны, дороги,
колосья»). Через эти кратеры изверглось в мир вес
богатство «главного хлеба на Земле».
Кратеров — всего пять: в Юго-Западной Азии,
в Горном Китае, в Эфиопии, в Средиземноморье
и один в Центральной и Южной Америке.
«Ботанические вулканы», давшие все многообразие
культурных растений.
Но как же тогда быть с историками, которые
твердят, что колыбель земледелия — вовсе не
здесь, не в этих местах, затерянных в горах,
отрезанных Андами и Кордильерами, Гималаями
и абиссинской «дегой», осажденных мертвыми
песками и вечными снегами? Историки
ссылаются на археологов. Ведь самые древние орудия
земледелия были найдены в долинах Нила,
Ганга, Тигра и Евфрата. И потом как совместить
одно с другим: Афганистан или Эфиопия — такие
отсталые страны — и вдруг искать истоки
земледелия нужно именно там?
Вавилов уважает авторитет истории. Он
свидетельствует свое уважение и находкам
археологии. Но что же делать, «Платон ему дорог, но
истина дороже». Впрочем, откуда эта уверенность,
что его предположения столь истинны? В конце
концов, кружки и точки на карте не более чем
кружки и точки.
Чтобы доказать свою правоту, не остается
ничего другого, как отправиться в «кратеры
ботанических вулканов». Он сам соберет растения,
как бы огромно ни было их разнообразие, и
привезет сюда, на Исаакиевскую площадь.
Наступает последняя ночь, когда загорается
лампа под абажуром, исписанным рукой
Вавилова. На рассвете лампа надолго погаснет.
Тайнопись перестанет быть тайнописью. Экспедиция
отправится в Афганистан.
Вавилов помнит слова путешественника
Феррье: «Иностранец, которому случится попасть
в Афганистан, будет под особым
покровительством неба, если выйдет оттуда здоровым,
невредимым, с головой на плечах...». А он, прощаясь,
говорит о своем: «Я — фаталист. Мы привезем
из Афганистана замечательные мягкие
пшеницы».
Да, Афганистан оказался «центром генов»
мягких пшениц, как Эфиопия — твердых. Среди
афганских пшениц нашлись скороспелые,
засухоустойчивые, не боящиеся морозов, даже более
выносливые, чем наши северные сибирские
пшеницы. Наверняка, и в эфиопских пшеницах
откроют новые, очень важные для селекционеров,
признаки. Итак, под руками селекционеров
отныне вся «клавиатура» пшениц, они смогут
извлечь любую «музыку», какую только захотят.
Вернувшись в Ленинград, Вавилов с полным
правом скажет: «Жив, вернулся, привез новые гены».
Не только фиолетовой пшеницы, но и багрового
ячменя. И хлебного злака — тэффа. И других
растений, хранящих самые неожиданные
комбинации еще неизвестных генов. Да, догадки
Вавилова блестяще подтвердились. Там, где была
колыбель разных форм растения, там собраны
и все основные признаки растений.
...Тысячи километров прошел Николай
Иванович Вавилов по караванным тропам «Страны
высокостоящего солнца» — Эфиопии. Шесть
тысяч образцов сем ян он увозит с собой. Потом
абиссинские пшеницы и ячмени вырастут в
Детском Селе под Ленинградом и даже в Хибинах,
удивляя своей скороспелостью, крепкой
неполегающей соломой, крупными зернами,
устойчивостью перед болезнями. Но карты иных
континентов будут уже лежать у ног Вавилова.
Впрочем, он никогда не забывает своих
обещаний. Быть может, рас Таффари уже не ждет
книги о загадочной Стране Советов?
Пройдут года. Рас Таффари станет «негусом
негести», «царем царей Эфиопии», и примет имя
Хайле Селассие. Маленькая Эфиопия будет
первой жертвой агрессии фашизма, и Хайле
Селассие возглавит борьбу своего народа. Потом
придет изгнание, и победа, и возвращение в Адис-
Абебу. Страна Советов останется верным
другом «Страны высокостоящего солнца». И может
быть до сих пор в библиотеке «негуса негести»
стоит книга о том, что такое советская власть,
книга, подаренная неустрашимым и мудрым
«охотником за колосьями», первым советским
полпредом в Эфиопии.
<<3емля наша велика и обильна, а порядка в ней
нет». Земля наша велика и обильна, и порядок в
2*
19
ней есть. Но как успеть побывать во всех пяти
колыбелях культурных растений?
«Жизнь коротка — надо спешить». Красный
«молоткастый, серпастый паспорт» Вавилова
покрывается штампами Китая, Марокко, Мексики,
Бразилии... Как будто он не умел уставать и не
научился отдыхать.
Шестьдесят стран знали его, пять
континентов. Он не был только в Австралии — Австралия
его не занимала. Он считал, что Австралия почти
ничего не дала человечеству из культурных
растений. Впоследствии так оно и оказалось.
«Родословные» пшеницы, ржи, ячменя, картофеля
были теперь в распоряжении селекционеров. Из
Перу прислал Вавилов такое письмо:
«Дорогие друзья! Пишу оптом, ибо на этот
раз нет времени для писем, хотя писать можно
без конца. До черта тут замечательного и
интересного!
Пример — картофель. Все, что мы знали о
нем, надо удесятерить... Сортов и разновидностей
ботанических тут миллионы. Невежество наше
и картофель Андов поражающи.
Мы тронули немного картофель. Но я не
сомневаюсь, что если диалектику картофельную
тронуть всерьез в Перу и Боливии, то мы
переделаем картофель, как хотим...
Собираю все.
Худы дела финансовые. Кроме суточных,
сведенных к минимуму, ничего не имею, и покупаю,
и посылаю семена за весьма убогий личный
бюджет. И боюсь, что на полдороге завоплю гласом
великим. Спасайте.
...Отправил 8 посылок по 5 кило. Не могу не
посылать. Но с ужасом помышляю о весе
картошки (а надо каждого сорта по 30 клубней
минимально) и о стоимости каждой пооылки в
в 7—8 рублей золотом, не считая труда.
Беру все, что нужно. Пригодится. Советской
стране все нужно. Она должна знать все, чтобы
мир и себя на дорогу вывести. Выведем».
За экспедициями Вавилова теперь следит весь
мир. Его теоретические труды признаны во
многих странах. О нем начали писать поэмы:
«Победитель Флоры», «Покоритель Зеленого Океана».
Здание на Исаакиевской площади стало
хранилищем всего, что издавна питало человека.
Когда-то селекционеры вздыхали: «Если бы
семена всего мира...». Теперь «если бы» отпало.
Все семена мира здесь, в ящиках, пакетах,
мешочках. Из всех ботанических «вулканов» (их
оказалось не пять, а восемь), из всех
«резервуаров» генов, которые собирала земля с
незапамятных времен.
Еще при жизни Вавилова, благодаря его
мировым коллекциям и на их основе, были выведены
350 сортов зерновых, технических, кормовых»
овощных, бобовых и плодовых культур.
В первые годы советской власти В. И. Ленин
с интересом прочел книгу американца Гарвуда
«Обновленная земля». Через 10 лет Вавилов
скажет: «...мы только закончили первую
пятилетку, а идеал американской обновленной земли
уже совершенно не удовлетворяет нас.
Обновленная советская земля рисуется нам в неизмеримо
более ярких красках». Через 10 лет
американский ботаник профессор Норт будет спешить из
Вашингтона в Ленинград, чтобы потом написать
своему другу:
«Дорогой доктор! Вот мои первые
впечатления: мы недооценили науку Советов. Уже тогда,
в 1924 году, дело шло не только об исследовании
флоры Афганистана ради чистой научной
истины. Вавилов поставил перед институтом, которым
он руководит, ту же задачу, что и наш
департамент земледелия — овладеть культурной флорой
всего мира. Не скрою от вас: мы потерпели уже
серьезное поражение. У нас были деньги, у
них — крылья... В спешке кругосветных
путешествий мы не имели времени как следует
задуматься над нашими маршрутами. Мы
устремлялись в прославленные ботаниками сады и
прошли мимо непривлекательных горных ущелий.
Да, дорогой доктор, мы прошли мимо вавилов-
ских горных очагов, упустили из виду горные
гнезда Азии и Африки. Мы не потрудились
взобраться на эти чердаки. Практическое
значение теории Вавилова огромно. Вскрытые им
мировые центры культурных растений — это
опытные поля селекционных станций, созданные
самой природой и земледельцами древности.
Метод Вавилова кажется — не правда ли? —
ошеломляюще простым. По крайней мере я,
ознакомившись с ним, растерянно осмотрелся
кругом... Вероятно, я был смешон в эту минуту.
Но более подробное знакомство е формулами
Вавилова раскрывает сложный путь его поисков.
Десять лет понадобилось Вавилову на изучение
расового состава мягких пшениц. Десять лет,
чтобы разложить многие тысячи сортов на 67
разновидностей и 166 признаков. Я обратился к
Вавилову с вопросом: какова точность определения
географических координат центров. Он ответил:
«С точностью до 100 километров. Для любого
континента». Это увлекательно, почти
фантастично!»
Император Эфиопии имел длинный, длинный
титул. Но если б он в 30-е годы встретился
с Н. И. Вавиловым, он наверняка был бы подав-
20
лен обилием званий и должностей своего
гостя. Президент Всесоюзной Академии
сельскохозяйственных наук имени Ленина. Президент
Географического общества. Директор Всесоюзного
института растениеводства. Директор Института
генетики Академии наук СССР. Основатель
многих других научных институтов. Член высших
органов Советской власти ЦИК СССР и ВЦИК.
Депутат Ленинградского городского Совета.
Академик трех академий Советского Союза. Член
Агрономического института в Риме, английского
Королевского общества в Лондоне, Шотландской
Академии наук в Эдинбурге, Академии наук в
Галле, Всеиндийской Академии наук,
Американского ботанического общества. Доктор
Софийского университета. Доктор университета в Брно
(Брно — город, где разводил свой горох «отец
генетики» Грегор Мендель). А если еще начать
вспоминать сколько раз избирали Вавилова
президентом и вице-президентом различных
конгрессов, и сколько он получил наград и золотых
медалей во всех концах света!
«Жизнь коротка — надо спешить...» В кабинет,
в отделы и лаборатории, на поля, на
селекционные участки. Дня мало, и ночи тоже. Рукописи и
люди, карты и посевы, страны и мир... И
диссертации молодых: рентгеновские лучи вызвали в
генах пшеницы многообещающие мутации.
Правда, выводы надо обосновать детальнее, но
молодой ученый достоин поддержки. Отзыв Н. И.
Вавилова, как всегда, краток, ясен и
доброжелателен: «Мы полагаем, что углубленная разработка
этого вопроса исключительно важна
принципиально, так как все же основным фактором
эволюции являются мутации, как мелкие, так и
крупные, количественные и качественные.
Одним из самых перспективных направлений в
современной генетической науке является
овладение факторами, вызывающими наследственные
изменения».
...Он не искал ни почестей, ни постов. Высокие
посты и заслуженные почести сами находили его.
Его авторитет был авторитетом огромного дела.
Он никогда не приказывал. Однажды заезжая
комиссия упрекнула Вавилова: очевидно, во
Всесоюзном институте растениеводства слаба
трудовая дисциплина. За все время директор не издал
ни одного приказа, в котором объявил бы
выговор. Николай Иванович резко ответил: «В науке
приказной режим непригоден».
Он никогда не писал: «Предлагаю Вам.*.» И у
других зачеркивал такие слова, сердился: «Вот,
привыкли приказывать». Зачеркнув, надписывал:
«Очень прошу Вас...».
Пожалуй, он был идеальным ученым,
подчинившим все поискам истины. Много людей до сих
пор помнят обаяние Вавилова, его необычайную
энергию, память, требовательность, простоту,
внимание к товарищам. И все всегда вспоминают
его верность правде в науке. В любой критике он
стремился отыскать зерно этой правды. Даже
когда критика была просто критиканством.
«Ничего, — успокаивал своих сотрудников
Вавилов, — те люди, которые занимаются
критиканством... увидят свои ошибки и станут на верный
путь реальной работы и достоверных фактов.
Микроорганизмы и разный мусор зарождаются и
накапливаются в стоячих болотах. Быстрые реки
всегда чисты».
Бывало — его обвиняли: «Вавилов ничего
не дал практике, он мешает улучшению сортов
растений и пород животных». Вавилов отвечал
фактами. Сегодня мы могли бы прибавить к ним
новые. Подсчитано, что только сорок сортов,
привезенных Вавиловым, занимают сейчас десятки
миллионов гектаров наших земель. В Средней
Азии выращивают ячмень, его Николай Иванович
нашел в Марокко, на Украине — ячмень «харь-
ковский-36», его предка Вавилов вывез из
Эфиопии. В прошлом году хлебное море Кубани — два
миллиона гектаров! — было залито волнами
пшеницы «безостая-1» известного селекционера
Лукьяненко. Этот шедевр мировой селекции дает
по 50—60 центнеров зерна с гектара. А получен
он благодаря гибридизации с аргентинскими
пшеницами, завезенными Вавиловым еще в
тридцатых годах.
Когда на одной из генетических дискуссий
кто-то крикнул Вавилову: «Спять вы исходите из
неизменности генов и природы растений»,
Николай Иванович быстро ответил: «Тут хотят
сделать из нас кого-то другого — что же, в
полемике все возможно. Но генетика — это прежде
всего физиологическая наука, и ее основная задача
состоит в том, чтобы переделывать организмы.
Для этого она и существует. Но в ходе
исследований она доказывает, что не так-то просто
изменить наследственную природу... Говорю вам со
всей откровенностью, что верю и настаиваю на
том, что считаю правильным. И не только верю,
потому что вера в науке — это чепуха, но говорю
о том, что я знаю на основании огромного
опыта».
Он погиб 55 лет от роду в расцвете творческих
сил.
«Жизнь коротка — надо спешить...». Короткая
человеческая жизнь — 55 лет — это очень много.
Можно пересчитать все звезды на небе и все
растения на земле. Если спешить, если жить только
ради науки и ради людей.
21
Есть в Абхазии мыс Пицунда. Его омывают
волны Черного моря, и огромные, золотые сосны
бросают тень на прибрежный песок. Дорожки
меж соснами усеяны мягкими красными иглами,
а в зеленых шапках сосен не умолкает эхо
моря... Таких сосновых рощ почти уже не осталось
на земле.
Когда Николай Иванович Вавилов однажды
«Современная биология в своем развитии повторяет
до некоторой степени в своих построениях путь
органической химии. Химия ушла далеко вперед от
биологии. Бесчисленные химические вещества сведены
ныне в стройную систему сочетаний сравнительно
немногих элементов. Однако в последнее
десятилетие генетика быстро идет вперед и до некоторой
степени начинает приближаться к химии, по
крайней мере к химии сложных органических
соединений. Генетика уже разрабатывает лаконический
язык символов для наследственных факторов,
определяющих внешние свойства.
Закономерности в полиморфизме у растений,
установленные путем детального изучения
изменчивости различных родов и семейств, можно условно
до некоторой степени сравнить с гомологическими
рядами органической химии, например,
углеводородами |СН4, С2Н2, СН ...). Ряды этих соединений,
отличаясь друг от друга, все же характеризуются
многими общими свойствами в смысле образования
определенных циклов соединений, определенных
реакций обмена и соединения. Каждый отдельный
углеводород дает серию соединений, сходных с
другими углеводородами.
В общем, роды (Gi, G2, G3) или линнеоны
|L1( L2, L j растений и животных также дают
гомологичные ряды форм, как бы соответствующие
различным гомологичным сериям углеводородов:
попал сюда, он долго смотрел в небо, которое
держали на своих кронах солнечные колонны сосен.
И спутникам его вдруг показалось, что сам он
сродни этим гордым, негнущимся соснам.
В 1926 году были впервые учреждены премии
имени Ленина. Одним из первых лауреатов
Ленинской премии стал академик Николай
Иванович Вавилов.
GjL^a Ь ; с ' ...) G2Li(a Ь ,- с + —)
GiL2 (a ,- b + с -f ...) G2L2(a , b , с -\- ...)
G^ (a -f b -f с -J- ...) G2L3 (а -•- Ь J - с + ...)
Lxa! L^ *-чяз
L2a1 L2a2 L2a3
■^За1 L«3a2 ^За3
Буквы а,г а2, а обозначают признаки, различающие
отдельные формы...
...Закон гомологических рядов показывает
исследователю-селекционеру, что следует искать. Он
намечает правильности в нахождении звеньев,
расширяет кругозор, вскрывает огромную амплитуду
видовой изменчивости»...
«Нас сравнительно очень мало интересует, что
в гробницах фараонов первых династий найдены
пшеница и ячмень. Более близки нам
конструктивные вопросы — вопросы, интересующие инженера.
Гораздо важнее знать, чем отличается египетская
пшеница от пшениц других стран, что в ней ценного
для улучшения нашей пшеницы, понять, как
возникла египетская пшеница, где находятся основные
элементы, «кирпичи», из которых создавались
современные культурные виды и сорта. Это необходимо
для овладения исходным сортовым материалом, для
практической селекции».
Академик Н. И. Вавилов, Избранные труды, том Vf
стр. 142, 217, 219. Изд-во «Наука», М.-Л. 1965 г.
НАШИ КОНСУЛЬТАЦИИ
Как объяснить с точки зрения теории
электролитической диссоциации, что кислоты реагируют с не*
растворимыми солями, а щелочи — не реагируют!
Этот вопрос задает читатель С. Ф. Чуяшов из села
Косика Алтайского края.
На самом деле такой строгой закономерности не
существует. Рассмотрим для примера равновесие
между осадком и раствором хлористого серебра.
Уравнение равновесия может быть записано так:
AgCl ^ AgCl ^ Ag+ -f C1-.
(осадок) (раствор)
По закону действующих масс, между
концентрациями молекул AgCl в растворе и ионов Ag + и С1~
имеется соотношение:
[Ag4-[C1-] _K
[AgCl]
Концентрация молекул в растворе при
постоянных условиях зависит только от растворимости
данного вещества. Поэтому мы приходим к уравнению:
[Ag+]-[Cl-] = const,
где постоянная в правой части называется
произведением растворимости и обозначается ПР. Для AgCl
ПР приблизительно равно 10~10(концентрации берут
в грамм-ионах на литр). Если бы удалось понизить
концентрацию одного иона, то концентрация другого
иона должна возрасти, и часть вещества перейдет
из осадка в раствор. Для этого нужны реагенты,
образующие с одним из ионов молекулу, комплекс
или новый ион, которые либо малодиссоциированы,
либо летучи и легко удаляются из раствора.
Пример образования малодиссоциированных
соединений — растворение солей слабых и летучих
кислот в сильных кислотах. Анион слабой кислоты
соединяется с водородным ионом, образуя
молекулу кислоты, которая слабо диссоциирует.
Концентрация аниона слабой кислоты в растворе
уменьшается, и соль растворяется. Растворение будет
происходить только в том случае, если
произведение растворимости соли не очень мало, а константа
диссоциации кислоты не слишком велика.
У солей сильных кислот анион уже не будет
связываться ионом водорода, поэтому для растворения
таких солей прибегают к комплексообразованию.
Как правило, катионы тяжелых металлов, соли
которых часто бывают нерастворимы, склонны к
комплексообразованию. Многие катионы образуют,
например, комплексы с молекулой аммиака. Соли
таких металлов могут растворяться в типичном
основании— водном растворе аммиака. Пример —
растворение AgCl. При этом происходит реакция:
Ag+ + 2NH3^[Ag(NH3J]+.
Образующийся комплексный ион достаточно
прочен и хорошо растворим в воде.
Как видите, нерастворимые соли могут
растворяться и в кислотах, и в щелочах.
Читатель В. Н. Галахов из Ленинграда пишет: «Прошу
в одном из номеров Вашего журнала сообщить
рецептуру и способ приготовления в домашних
условиях эпоксидного клея — водостойкого,
высыхающего при температуре всего в 18—20С».
Эпоксидный клей, застывающий при комнатной
температуре, приготовляют следующим образом:
тщательно смешивают 100 весовых частей жидкой
эпоксидной смолы (ЭД-5, ЭД-6, Э-40) и 6—10 весовых
частей полиэтиленполиамина. «Жизнеспособность»
такого клея — от 30 минут до 3 часов. Но застывает
он долго. Процесс может продолжаться при
температуре 18—20°С до трех суток. Прочность клеевого
шва удовлетворительна, но ниже, чем у клеев
горячего отверждения. Водостойкость при склеивании
металлов — также удовлетворительная; при
склеивании металла с деревом она значительно меньше.
Эпоксидные клеи, особенно входящий в их состав
полиэтиленполиамин, — токсичны. При работе
с ними необходимо остерегаться, чтобы они не
попали на кожу или слизистые оболочки носа и
полости рта.
Подробнее об эпоксидных клеях можно
прочитать в книге Д. А. Кардашова «Эпоксидные
смолы. Способы получения, свойства и области
применения» (Москва, 1959 г.).
Московский читатель И. В. Стрелков спрашивает:
«Чем можно разбавить клейг применяемый в
обувной промышленности для склеивания резины и кожи,
а также клей марки «88»!».
Большинство резиновых клеев, выпускаемых в
Советском Союзе, можно разбавлять бензином,
который кто-то остроумно назвал «Калоша». Для
склеивания кож чаще всего применяются клеи,
вырабатываемые на основе синтетических смол разного
состава; чтобы подобрать растворитель, надо знать
марку клея.
Клей марки «88» приготовлен на смеси
растворителей — этилацетата и бензина «Калоша»
(соотношение 1:1). Эта же смесь может применяться и для
разбавления клея, если он загустеет.
Однако не всегда загустевший клей удается
разбавить. Если произошло изменение структуры
полимера, никакой растворитель не поможет. Поэтому
если первая порция растворителя не действует,
дальнейшие попытки спасти клей бесполезны.
23
дил m и!&ттмт*тшяве'
ИСКУССТВЕННЫЙ
ЗАЧЕМ ЕГО ДЕЛАЮТ!
Разве может леопард сменить пятна!
Английская пословица
Зверей с пушистыми шкурками на нашей
планете достаточно. Звероводы на фермах и
охотники не страдают от безделья. Спрос
на меховые шубы не уменьшается.
Но звериная шкура (наряду с каменным
топором) была символом каменного века.
Символ нашего века (наряду с ракетами,
синхрофазотронами и т. д. и т. п.) — шуба
из синтетики. Как-никак «нейлоновый век»!
В чем же секрет ее популярности?
Искусственный мех дешев. Не так
дешев, как ситец, но все же дешевле
плохонькой цигейки. И в нем тепло. Не так тепло,
как в натуральном, но все же зимой в
средней полосе не замерзнешь. Этих двух
причин вполне достаточно, чтобы шубы из
синтетики на прилавках не залеживались.
(Можно также предположить, что часть
покупателей — члены общества друзей
животных и убежденные вегетарианцы.
Только вряд ли они диктуют спрос).
Однако достоинства искусственного
меха этим не ограничиваются. Есть еще один
фактор — эстетический.
Вы видели когда-нибудь голубого
медведя? Или леопарда в клеточку? Их просто-
напросто не существует в природе. А ведь
может оказаться, что такие диковинные
меха будут изумительно красивыми. Но
«ошибки» природы исправить трудно.
Текстильщики же сделают вам любой мех — любого
цвета, любого рисунка, любой густоты и
фактуры. Если захотите — леопарда в
клеточку. Правда, это утверждение немного
предвосхищает события. Химические
волокна, из которых делают искусственный мех,
переживают еще пору младенчества. Выбор
их ограничен, а технология находится на
дальних подступах к совершенству. Поэтому
сейчас далеко не всегда удается получить
искусственный мех с наперед заданными
свойствами. Подчеркиваем — сейчас.
Но почему же текстильщики всеми
силами стремятся к точной имитации
натурального меха? Это можно объяснить двумя
причинами. Первая — обыкновенная
инерция. В какой-то мере она оправдана.
Покупатель хочет приобрести искусственную
медвежью шкуру «понатуральнее». Может
быть, он хочет даже ввести всех в
заблуждение и выдать нейлон за медвежью
шерсть. Покупателя (то есть любого из нас,
уважаемый читатель) можно понять:
шкура — вещь хотя и дорогая, но теплая и
прочная; а кто ее знает, эту новомодную
синтетику...
Вторая причина более глубокая.
Сравните два-три десятка лет, в течение которых
делают искусственный мех, с теми
десятками тысячелетий, во время которых
совершенствовался защитный покров животных.
Не забудьте о естественном отборе —
выживали те животные, которым зимой было
тепло; в их потомстве повторялось то же,
и так без конца. Результат такой гигантской
разницы в сроках сказывается на качестве:
овечья шкура в виде цигейки (8700 волосков
на 1 см2) теплее, чем лавсановый мех с
12 000 ворсинок на той же поверхности. Но
текстильные волокна прогрессируют такими
темпами, что нет сомнений — будут
синтетические шубы теплее овчинных тулупов и
красивее горностаевых мантий. Звероводам
и охотникам придется тогда переучиваться
и приобретать менее убийственные
профессии. (Пусть только не отчаиваются
студенты— будущие специалисты по пушнине. На
их век работы хватит.)
25
ИЗ ЧЕГО ЕГО ДЕЛАЮТ!
В лес ведет не одна дорога.
Английская пословица
Вообще-то искусственный мех можно
сделать из любого волокна. Скажем, так:
постричь медведя, из шерсти сделать пряжу,
а из нее уже мех. Только, наверное, доха
«просто» из медвежьего меха обойдется
дешевле...
Практически искусственный мех делают
из волокон двух типов — синтетических
(представители — нитрон, лавсан) и
искусственных (представитель — вискоза). Это
относится к ворсу меха. А что касается его
основы, материала, в котором ворс
закреплен, то к ней требований меньше. Главное —
чтобы она хорошо удерживала ворс и была
эластичной; этим требованиям
удовлетворяет и хлопок. В последнее время основу
(или иначе — грунт) стали делать тоже из
синтетики — она и прочней и легче.
Бытует такое мнение: раз искусственная
шуба — значит нейлоновая. Или, по
принятой у нас терминологии, — из полиамидного
волокна, например, капрона или анида. А на
самом деле большая часть искусственного
меха делается из полиакрилонитрильных
волокон (отечественная марка — нитрон).
Просто полиамиды были раньше
синтезированы, и применять их, конечно, тоже стали
раньше.
Волокна из полиакрилонитрила
«шерстисты», чем выгодно отличаются от
нейлоновых волокон. Длинный список достоинств
полиакрилонитрильных волокон (например,
упругость, погодоустойчивость, малая
теплопроводность, низкая гигроскопичность)
прерывается упоминанием лишь отдельных
недостатков. Эти волокна, например, трудно
окрашивать. Они довольно быстро
истираются. Правда, все равно медленнее, чем
шерсть, но быстрее, чем капрон. Однако
преимущества явно перевешивают, и
поэтому многие и многие меха делают из
нитрона, орлона, преланы, кашмилона, верела и
прочих членов обширного семейства
полимеров и сополимеров акрилонитрила.
Из полиамидных волокон тоже делают
искусственный мех, но гораздо реже,
большей частью — в сочетании с другими
волокнами. Каждое полиамидное волоконце
гладкое. То, что хорошо для кофточки,
плохо для меха. Пряжу из капрона сделать
трудно, и на шерсть она не очень похожа.
Кроме того, капрон недостаточно стоек к
свету и легко электризуется.
Полиэфирные волокна (среди них —
лавсан) прочны, шерстисты. Изделия из них
теплые и несминаемые; они не садятся и
легко чистятся. Но... Это единственное «но»
сводит на нет все преимущества
лавсанового меха. Есть такое неприятное явление,
именуемое пилингом, когда волоконца
сбиваются в пучки, а их кончики скатываются в
шарики. Лавсан — типичный пример
волокна, склонного к пилингу. Шубы из него
делать нельзя. А вот шляпы — можно. Ведь
пилинг возникает при трении, а шляпа
трется разве только о воздух...
26
4
Подкладочные меха тоже можно делать
из лавсана — тут внешний вид не так уж
важен. Идет лавсан и на детские шубки: дети
снашивают и рвут одежду быстрее, чем
сваливаются волоконца.
Искусственные волокна — вискозное и
ацетатное — постепенно вытесняются
синтетикой. Эти волокна легко сминаются и
поглощают слишком много влаги, но сегодня
они дешевле синтетических. Часто идут на
компромисс — смешивают искусственные
волокна с синтетическими. Получается
умеренно дешевый и умеренно практичный
мех.
Натуральные волокна тоже применяют
для искусственного меха, правда, совсем
редко. К ним обращаются лишь тогда, когда
хотят получить очень близкую имитацию
или придать меху особые теплозащитные
свойства. Шерсть, конечно, берут
подешевле — овечью или козью. Как правило, ее
смешивают с синтетикой. Впрочем, дело
идет к тому, что во всех случаях
искусственный мех будет синтетическим, но пока
что слово «синтетический» можно сказать
далеко не о всяком «незверином» мехе.
Мало выбрать материал — нужно
подобрать еще и форму волокна. Для меха
годятся только тонкие и упругие волокна.
Чтобы изделие было пушистым, волокно
должно быть извитым. Это же делает шубу
или шапку более теплыми: между такими
волокнами остается прекрасный теплоизо-
лятор — воздух. Кстати, воздух заманчиво
было бы ввести и в само волокно. Знаете,
почему не мерзнут северные олени? У них
полые волосы. Синтетические полые
волокна — увы — еще слишком дороги. Это не
означает, конечно, что легчайший
(наполовину из воздуха) искусственный мех —
затея бесперспективная. Будущее покажет.
КАК ЕГО ДЕЛАЮТ!
Со временем и при терпении и тутовый лист
превратится в атлас
Английская пословица
Строго говоря, рассказ об изготовлении
искусственного меха следовало бы начать с
получения химических волокон. Но
необъятного, как известно, не объять;
ограничимся на этот раз только ткачеством и
отделкой.
Есть три пути получения искусственного
меха. Начнем с худшего — клеевого.
Таким способом делают, в основном,
искусственный каракуль. Принцип прост: из
пряжи закручивают «каракулевые» завитки
и приклеивают их к ткани (реже —
пришивают). Получается нечто похожее на
каракуль, не очень красивое и не очень
прочное. Этот способ, кажется, отживает свое, и
останавливаться на нем не стоит.
Мех с длинным — до пяти
сантиметров — ворсом делают на трикотажных
машинах. Проследим за ходом одного,
наиболее распространенного процесса
изготовления меха на трикотажной основе.
Волокно поступает в цех в виде
штапеля — рубленых спутанных «шерстинок». Из
27
них готовят так называемую смесовую
постель — укладывают рядами компоненты
будущего ворса. Скажем, ряд лавсана и ряд
нитрона. Каждый слой опрыскивают
антистатическим препаратом. Делается это для
того, чтобы при дальнейших операциях
волокно не наэлектризовалось. Вспомните, как
легко электризуется обыкновенный
гребешок, когда им расчесывают волосы. Если же
наэлектризуются волоконца, то они будут
взаимно отталкиваться, и привести их в
порядок не удастся. Антистатический препарат
(чаще всего это кремнийорганические
соединения) уменьшает трение и
одновременно нейтрализует заряд.
Когда «постель» готова, ее
перемешивают и разрыхляют в щипальной машине, а
затем смесь превращают в круглую
пушистую ленту на чесальной машине. В этой
машине волоконца многократно
расчесываются вращающимися «щетинистыми»
валиками, и распутанное волокно образует
ленту. Этот момент запечатлен на фото 1.
Теперь чесальную ленту подают к
трикотажным машинам, выстроившимся в
шеренгу вдоль цеха (фото 2). Но прежде чем
лента поступит в вязальное устройство, она
пройдет через ряд маленьких чесальных
аппаратов, которые превратят ее в
тоненькую ровную полоску с аккуратно
уложенными волоконцами. Машина вяжет, по
существу, обычный хлопчатобумажный (или
синтетический) трикотаж. Но в каждую
петельку ввязывается пучок синтетических
волокон, которые и образуют пушистый
ворс. Хлопчатобумажная пряжа по длинной
трубке (фото 3, слева) поступает к иглам.
В момент провязки петли под крючок иглы
попадают волоконца, которые поддуваются
воздухом из трубок (фото 3, справа). Не-
провязанные волокна отсасываются
вентилятором и используются вновь.
На такой машине получается меховая
«труба», наподобие огромного чулка. Ее
разрезают и получают полотно меха. Но
какой он неприглядный! Мех теперь
вычесывают валиками с металлическими иглами
(кардами) — такими, как на фото 4. Мех
становится поопрятнее, но до красоты ему
еще далеко.
Впрочем, прежде чем заниматься
эстетическими вопросами, надо позаботиться о
том, чтобы ворс не вылезал из грунта. Для
этого растянутое полотно промазывают с
изнанки латексом (водной дисперсией
каучука) и пропускают через сушильную
камеру. Латекс вулканизуется и накрепко
соединяет ворс с грунтом. Образовавшаяся
пленка заодно придает меху жесткость —
трикотаж, как известно, вещь растяжимая. (Есть
иной, более совершенный метод
закрепления ворса. Достаточно сделать грунт из
волокон, подверженных усадке, и без
всякого латекса пропустить через сушилку.
Нити сожмутся, и ворс будет крепко зажат в
петлях.)
Когда мех выходит из сушилки, он еще
не похож на мех: просто масса хаотично
торчащих ворсинок разной длины. Поэтому
следующая операция — глажка, она же по*
28
10
лировка, она же финиш. Блестящий
нагретый вал с огромной скоростью разглаживает
и полирует мех (фото 5). Он поднимает
ворсинки и придает им блеск — при контакте с
нагретой поверхностью термопластичный
материал ворса слегка размягчается и
полируется.
Теперь волокна предстоит выровнять.
Операция носит прозаическое название
«стрижка». Только ножницы несколько
необычны. Одно их лезвие неподвижно, а
другое— огромный спиральный нож —
непрерывно вращается (фото 6). После стрижки —
снова на полировку, затем опять на
стрижку. Двух-трех проходов достаточно, чтобы
получить такой мех, который не зазорно
отправить на швейную фабрику. Во время
отделки мех вновь опрыскивают кремний-
органическими жидкостями — на этот раз
для придания водоотталкивающих свойств.
Третий способ изготовления меха, не
менее распространенный, чем предыдущий,—
на ткацких станках. Делают тканый мех
точно так же, как плюш. Так как, возможно, не
все знают, как делают плюш, расскажем
вкратце и об этой технологии. Тем более,
что она достаточно оригинальна.
Задумывались ли вы когда-нибудь, как
это на ткацком станке получают ткань с
торчащими вверх ворсинками? Ворсовое
производство древнее, и способов изготовления
накопилось немало. Остановимся лишь на
одном, весьма распространенном. Мех, по
крайней мере, делают именно этим
способом.
Два полотна ткут одно над другим.
Посмотрите на фото 7: в горизонтальном
направлении идут четыре ряда нитей — два
для верхнего полотна, два для нижнего.
А вертикальные нити — это ворсовая
основа. Она как бы пронизывает оба полотна.
Получается «двойная» ткань: у нее две
изнанки и ни одного лица. Но перед выходом
из машины к ткани подходит нож и
разрезает ворс, связывающий полотна, точно
посередине (фото 8). Из одного полотна
получаются два — каждое с торчащим ворсом
(обычно он несколько короче, чем у
трикотажного меха).
Тканый мех тоже отделывают. Так же,
как и при трикотажном способе, его
проклеивают с изнанки (эта операция —
необязательная), расчесывают, подравнивают
спиральными ножами, полируют, обрабатывают
водоотталкивающими препаратами. Кроме
расчесывания и стрижки есть еще одна
операция, заимствованная у парикмахеров —
завивка.
Не каждому меху быть гладким,
некоторым идет укладка. Этой процедурой
занимаются специальные завивочные
машины с вращающимися и двигающимися во
всех направлениях щетками (фото 9). Чтобы
завитки были прочными, мех смачивают
растворами полимеров; рецептура этих
растворов — «фирменная тайна» каждой
фабрики. После завивки (как и положено в
парикмахерских) — окончательное
расчесывание. И после этого — мех готов
(фото 10).
29
КАКИМ ЕГО ДЕЛАЮТ?
Если мы не умеем делать так, как хотим,
надо делать так, как умеем
Английская пословица
Мех делают красивым. По крайней мере,
стараются так делать. Иногда для этого
достаточно описанных выше приемов. Иногда
приходится вводить
дополнительные—скажем, крашение или отбелку. Чтобы
воспроизвести рисунок натурального меха,
прибегают к набивке или вытравке, или иным
хитростям. Это же в полной мере относится
к искусственным мехам, которые не имеют
аналогов в природе.
Вряд ли стоит останавливаться на
крашении или отбелке — это стандартные
операции. Набивку искусственного меха делают
точно так же, как набивку любой ткани из
синтетических волокон. Вытравка несколько
более оригинальна — с кончиков ворсинок
окрашенного меха удаляют краситель.
Получается «переливающийся» мех. Если же
обрабатывают только отдельные участки,
то мех становится пятнистым.
Большая часть «хитростей»
предназначена для тех, кто хочет, чтобы мех был «как
настоящий». У натурального меха, как
известно, есть подпушек (низкие тонкие
волоски) и ость — более толстые длинные
волосы. Ость и подпушек можно имитировать.
Взять, например, смесь двух
волокон—усадочного и безусадочного. Тонкое
усадочное волокно после тепловой обработки
укоротится и образует подпушек.
Можно поступить иначе — для ости взять
прямое волокно, для подпушка — сильно
скрученное, эластичное. Оно расположится
ближе к основанию ткани и создаст
необходимый зрительный эффект.
Вообще смеси волокон дают интересные
зрительные эффекты. Простейший пример:
одно волокно окрашивается неким
красителем, другое — нет. Сотканный мех
пропускают через красильную ванну, и он
получается двухцветным. Или: в массу
одинаковых волоконцев добавляют ворсинки иного
сечения и формы. Это нарушает
однообразие гладкого меха. Цель большинства таких
приемов, как мы уже говорили, —
«подделка» под природу. Даже названия
искусственных мехов говорят об этом:
«горностай», «леопард», «лань», «котик»...
Перечисление всевозможных вариантов
«украшательства» заняло бы слишком
много места. Далеко не все из них уже нашли
применение; многие ждут своего часа.
Может быть, того самого часа, когда
производство искусственного меха выйдет за
тесные рамки имитации; того часа, когда
искусственный мех будет лучше натурального,
и бедняг лисиц и норок отпустят со
звероферм в лес.
Но таких искусственных мехов пока нет.
Поэтому в заключение я прошу
нетерпеливого читателя еще раз прочитать эпиграф
к последней главе.
Инженер О. М. ЛИБКИН
Рисунок В. СКОБЕЛЕВА
ТЕХНОЛОГИ, ВНИМАНИЕ!
ТИТАНОВЫЙ КРЮК
На стальных рамах закреплены
стальные крюки, а на крюках
висят детали — им предстоит
пройти обработку в гальванической
ванне. Но крюки погрузятся в
раствор электролита вместе с
деталями, и если, например, детали
должны быть оцинкованы, то
крюки тоже покроются цинком.
Это приводит к лишнему расходу
цинка и усложнению
технологии — надо протравливать крюки.
Недавно было предложено
делать крюки и подвески из
титана, на котором цинковый слой
не образуется. Хотя титановые
крюки дороже стальных в три
раза, все же применять их
выгодно — срок службы увеличивается
примерно в 10 раз.
(«Product Finishing», 19CG, N1 S)
СМОЛА ПЛЮС МЕТАЛЛ
Можно ли нанести цинковое
покрытие на сталь без помощи
гальваники! Специалисты фирмы
«Коррожн Лимитед» ответили на
этот вопрос утвердительно. Они
предложили защищать
полированную сталь составом, названным
<(ПОлицинк». В него входят
связующее (эпоксидная смола) и
наполнитель (большое количество
цинкового порошка). Такой состав
накрепко пристает к поверхности,
быстро сохнет. Покрытие
получается красивым, а по
антикоррозионной стойкости оно сопоставимо с
обычным, гальваническим.
(«Popular IMaslics», 19CC, № 4)
ТЕХНОЛОГИ, ВНИМАНИЕ!
30
УРАВНЕНИЕ
С 1000 НЕИЗВЕСТНЫХ
С. Н. БЛОХИНА
Рисунки Д. ПЕТРОВА
В распоряжении современного
конструктора — великое множество материалов. На
каком остановиться? Один материал
дешевле, зато другой прочнее, третий лучше
обрабатывается или долговечнее. Нередко
бывают случаи, когда деталь можно сделать
из тысячи разных материалов. Но только
один из них — самый выгодный. Какой же?
МАТЕРИАЛ ВЫБИРАЮТ ТАК
Современное проектирование и подготовка
документации выглядят примерно так, как
показано на схеме. Конструктор
проектирует деталь, расчетчик проверяет, достаточна
ли прочность, и либо визирует чертеж,
либо возвращает его на переделку.
Исправленный чертеж передают технологу,
который решает, как изготовлять деталь.
Технолог выдает также требование на заготовку
в отдел снабжения и в бухгалтерию — для
включения стоимости заготовки в
калькуляцию. Затем документация попадает к
нормировщику, который определяет
трудоемкость изделия; данные о трудоемкости он
сообщает планово-диспетчерскому отделу
для планирования загрузки цехов, и в
бухгалтерию — для калькуляции стоимости из--
делия. Только теперь деталь поступает в
производство.
Схема достаточно проста и на первый
взгляд кажется разумной. Единственный
вопрос — где же здесь экономически
обоснованный выбор материала?
Если приемлемых материалов тысяча, то
нужно проектировать деталь 1000 раз —
для каждого материала отдельно. Сравнив
между собой все варианты проектируемой
детали, можно найти оптимальный. Но
делать тысячу проектов — это немыслимо:
кто же тогда будет делать сами детали?
Можно выбирать материал иначе. Для
изделий, которые производятся уже много
лет, устанавливается свой, традиционный
сортамент материалов. Отобрать нужный
несложно, но ведь при этом за бортом
останутся все новые, прогрессивные материалы.
Этот недостаток в проектировании часто
приводит к тому, что большая часть рацио-
Через множество рук проходит проект новой
детали. Все рассчитывается и учитывается. И в то же
время нет никакой уверенности, что выбран
оптимальный вариант
ш зде
31
нализаторских предложений сводится к
замене одних материалов другими. И при
этом нет гарантии, что такая замена —
наилучшая.
ДАЕШЬ РАСЧЕТ!
Этот подзаголовок — протест против
бездумных кампаний типа «даешь пластмассы!».
Пластики, конечно, хороши, но даже в
одежде мода должна быть прежде всего
целесообразной. Приведем один пример:
«На Рязанском заводе кузнечно-прессового
оборудования с выгодой применяют капрон
вместо бронзы и в то же время заменяют
им дешевый серый чугун, вызывая этим
удорожание изделий. Видимо,
руководители предприятий часто идут на внедрение
полимерных материалов без расчета во имя
моды» («Экономическая газета», 11 января
1964 г.).
Последствия «огульного внедрения»
новых материалов могут оказаться вредными:
огромные средства, затраченные на
освоение производства изделий из «модного»
материала, выбрасываются на ветер —
потому что производство изделий из этого
материала оказывается нерентабельным.
Есть и иной путь. В подтверждение —=
еще один пример. Мытищинский
машиностроительный завод делает вагоны для
метрополитена. Заманчиво делать их из
полимеров? Разумеется! Но прежде чем
заменять металл пластмассой, работники завода
обратились в НИИ ЦСУ —
Научно-исследовательский институт Центрального
статистического управления с просьбой провести
технико-экономический анализ
изготовления вагонов метрополитена из различных
материалов. Через несколько дней они
получили ответ. Машиностроителей
интересовало, из какого материала выгодней
изготовить вагон: из стали, алюминиевого сплава
или стеклопластика СВАМ. Оказалось, что
при замене стали 3 алюминиевым сплавом
АМГ-6 вес вагона снизится в 2,05 раза, при
замене стеклопластиком СВАМ — в 2,19
раза. Это очень важно — чем легче вагон, тем
меньше затраты энергии при эксплуатации.
Но при этом стоимость материала
увеличится в первом случае в 5,78 раза и в 38,8
раза — во втором.
И алюминиевый сплав, и стеклопластик
легче стали. Вопрос в том, какой ценой
будет достигнуто снижение веса. При
переходе от стали 3 к алюминиевому сплаву АМГ-6
уменьшение веса на один килограмм
обошлось бы в 80 копеек, при переходе к
стеклопластику СВАМ — почти в 5 рублей. А при
замене дюраля стеклопластиком снижение
веса на один килограмм стоило бы 60
рублей. Такой перерасход средств на материал
не окупится при эксплуатации вагона.
Проанализировав эти данные,
конструкторы Мытищинского завода решили
отказаться от стеклопластика, а внедрять как
можно шире алюминиевые сплавы. * Это
вовсе не означает, что стеклопластик хуже
алюминия. Просто для данного конкретного
случая — изготовления вагонов метро —
алюминиевые сплавы оказались более
выгодными. В десятках других случаев
пластики оказываются на голову выше многих
металлов.
Каким же образом сотрудникам НИИ
ЦСУ удалось оценить свойства материалов,
не прибегая ни к чертежам, ни к расчетам
на прочность? Помогла созданная ими
методика, позволяющая сравнивать
материалы по их техническим и экономическим
свойствам.
ПРОЧНОСТЬ И ЦЕНА
Цель поиска в «дебрях» материалов —
отыскать один-единственный, наивыгоднейший.
Трудность в том, что в поисках приходится
ориентироваться сразу по множеству
«путеводных звезд», среди которых самые
заметные — прочность, цена и вес. Впрочем,
если ввести показатель удельной прочности
(это отношение прочности к удельному
весу), то одним ориентиром будет меньше.
Поделив же цену материала на удельную
прочность, можно получить обобщенный
показатель — стоимость единицы
прочности. В нем как бы слить! все три величины.
По стоимости единицы прочности можно
сравнивать между собой любые материалы.
На практике удобно иногда сравнивать
два материала по изменению затрат,
необходимых для снижения веса изделия на 1 кг.
Такое сравнение производится по
несложной формуле, в которую входят
упомянутые выше показатели.
Теперь, когда у нас есть сопоставимые
* Высокая стоимость стеклопластика
обусловлена тем, что массовое его производство пока не
механизировано. В недалеком будущем положение,
конечно, изменится. — Ред.
32
величины, нет необходимости заново
проектировать изделие из каждого материала*
Однако объем информации для
экономически обоснованного выбора будет очень
высоким. Материалов-то тысячи! Для
современных условий эксплуатации машин
придется обработать что-то около полутора
миллионов чисел. Поэтому следующая
задача методики — систематизация
материалов.
Удобнее всего группировать сведения
о материалах в таблицы. Но сколько
величин приходится учитывать! И температуру
{скажем, некий пластик при 20°С применять
выгодно, а при 100°С прочность его ни\-
тожно мала), и требуемую долговечность
детали, и вид нагрузок (один и тот же
материал может быть, например, прочным, но
недостаточно жестким). И для каждой
группы сходных материалов — отдельная
таблица. Немудрено, что когда исследователи
занялись этим, то всех таблиц получилось
около 14 000. Впрочем, отыскать нужную,
если известны условия работы детали, —
не так уж сложно.
Вот фрагмент одной такой таблицы.
Сталь, работающая на растяжение
при температуре от 0° до 100 С
Марка
стали
ШХ15
40Х
ЗОХГСА
Х18
40Н
20
10
Удельный вес
7,8
7,85
7,85
7,85
I 7,8
7,85
7,8
Интервал сечения 5—25 мм
предел
прочности,
кг/см2
230
180
180
200
57
42
32
удельная
прочность
29,49
22,93
1 11,93
25,81
7,31 I
5,35 I
4,1
цена
тонны
материала,
руб.
147
106
138
270
96
96
90
цена
единицы
прочности,
РУб.
I 4,98
4,62
6,02
10,5
13,1
17,9
23,4
Естественно, конструктор должен
выбрать материал с низкой ценой единицы
прочности, но с высокой удельной
прочностью. Если же цена единицы прочности
увеличивается, то и удельная прочность
должна увеличиться, иначе материал применять
невыгодно — деталь из него будет дорогой
и тяжелой.
Далеко не все материалы могут
удовлетворить этому требованию. В нашей таблице
выделены жирным шрифтом «избранные»
материалы. Обычно их бывает не более 10%
всех материалов в таблице. Все остальные
материалы, не попавшие в число
«избранных», нецелесообразно применять, но,
разумеется, не вообще, а для данных условий
нагрузки, температуры, требуемой
долговечности, химической стойкости. В числе
«избранных» всегда найдется материал, из
которого можно изготовить деталь более
легкую и с меньшими затратами, чем из
любого материала, не попавшего в
«избранные».
В верхних строчках таблицы находятся
материалы с наиболее высокой удельной
прочностью. Если при проектировании
изделия не предъявляется требований к
снижению веса, то материал нужно взять самый
нижний в группе «избранных» — он самый
дешевый. Если же можно перерасходовать
средства, чтобы снизить вес, то предстоит
выбор по формулам, о которых речь шла
выше. (Кстати, вы обратили внимание, как
неточно слово «дешевый». Самая дешевая
из приведенных сталей — сталь 10
оказывается куда более невыгодной для
данных условий, чем «дорогая» хромистая
сталь.)
Такие расчеты можно считать
окончательными только в том случае, когда
материал не подвергается существенной
переработке. Но такие случаи — большая
редкость в машиностроении.
ОТ ЗАГОТОВКИ К ДЕТАЛИ
При переработке часть материала
неизбежно идет в отходы. Вес детали всегда меньше
веса заготовки, а насколько меньше —
показывает коэффициент использования.
Этот коэффициент неодинаков для
разных групп материалов. Так, для литейных
алюминиевых и магниевых сплавов он
достигает 0,8—0,9%i а Для деформируемых
сталей он может составлять всего 0,3%.
Это тоже надо принять в расчет.
Стоимость обработки зависит от многих
факторов — от химического состава
материала, состояния материала, точности
обработки и т. д. Чтобы учесть стоимость
обработки, в таблицы нужно ввести
коэффициенты, показывающие трудоемкость
различных видов обработки.
Группа «избранных» материалов теперь
несколько пополнится — прибавятся
материалы, которые легко обрабатываются
(хотя стоимость единицы прочности у них
сравнительно высока).
3 Химия и Жизнь, № 12
33
Будем надеяться, что читателю,
убежденному в необходимости экономических
расчетов, формула для сравнения
стоимостей двух материалов не покажется
слишком громоздкой:
п, г^
/ С,нигп+ С2ии, ,,.\
31 ——т Т
кс6р,• чиСр2
Значения букв, входящих в формулу,
таковы:
Л С — изменение расходов на материал при
снижении веса детали на 1 кг;
П — удельная прочность;
Р — нагрузка на деталь;
I — длина детали;
С — цена единицы прочности;
и исп— коэффициент использования;
к обр— коэффициент обрабатываемости.
Как ни скучно заниматься такой
многоэтажной арифметикой, применять эту
формулу необходимо.
ЧТО ИЗМЕНИТСЯ!
Что даст внедрение этой методики в
практику проектирования современных машин?
Экономически обоснованный выбор
материала. Расходы в процессе производства
будут снижены до минимума. Таким образом,
Проектировщик задает машине «общую идею»
детали — в виде чертежа, напоминающего немую
карту. А выбрать правильные размеры и
наивыгоднейший материал, да к тому же посчитать затраты —
это уже дело машины
можно будет получить огромную экономию
средств, величина которой, по-видимому,
достигнет 10—15% всех материальных
затрат производства в стране.
Но это еще не все. При систематизации
материалов сами себя «выдадут» те
металлы и пластики, которые экономически
невыгодны во всех случаях. И такие материалы
нужно снять с производства. В то же время
специалисты по пластмассам и металлам
смогут заранее определить, имеет ли
смысл запускать те или иные новые
материалы в производство.
Имея в руках сравнительные показатели
материалов (и технические, и
экономические — это неразделимо), проектировщик
сможет немедленно определить:
площадь сечения детали — из условий
работы на прочность;
вес детали — исходя из сечения;
вес заготовки — с учетом коэффициента
использования материала;
трудоемкость изготовления детали;
стоимость обработки детали.
Конечно, было бы неверным взвалить
все эти расчеты на конструктора. Но если
использовать для этой цели
счетно-решающую машину средней сложности, то весь
процесс проектирования может
существенно измениться. Как он будет выглядеть,
показано на рисунке, которым мы
заканчиваем эту статью.
Экономическое уравнение, даже с
тысячью неизвестных, имеет один-единственный
ответ. Был бы только способ решения...
Стоимость 2f*an.
#**рузм* - 300т
ш 2Q
34
РЕАКЦИИ
ВО ЛЬДУ
Согласно одному из основных законов химии —
закону Вант-Гоффа — скорость химических реакций
увеличивается примерно в два-три раза при
повышении температуры на 10°С. Известно и другое
правило: растворенные вещества реагируют
гораздо быстрее, чем те же вещества, находящиеся в
твердом состоянии.
Но вот сравнительно недавно выяснилось, что
если раствор заморозить, то в образовавшемся
куске льда многие реакции неожиданно резко
ускоряются *.
Например, было известно, что молекула
пенициллина расщепляется и инактивируется, если в
растворе присутствует несложное гетероциклическое
соединение — имидазол, выполняющий роль
катализатора:
RCONH—СН-СН С ^
ОС—N СН-
СНз
■СНз
-СООН
имидазол
пенициллин
RCONH-CH-CH
НООС HN
/Ч
СНз
V^ch3
-сн-соон
Однако такая реакция протекает довольно
медленно: при 22°С за 65 часов расщепляется всего
два процента растворенного пенициллина, а при
понижении температуры до 0СС (но пока раствор
еще не замерз) распад становится практически
незаметным. Но если этот же раствор заморозить, то
* Это явление известно в химии полимеров под
названием «твердофазная полимеризация» (см.
«Химия и жизнь», 1966 г., № 1). Однако, в отличие от
процессов полимеризации, реакции,
рассматриваемые в настоящей заметке, носят несравненно более
«тонкий» характер. — Ред.
за то же время при температуре минус 18°С. во
льду расщепляется 98,5 процента молекул
пенициллина!
Эти факты привлекли внимание ученых своей
необычностью и положили начало новым
исследованиям молекулярной структуры воды и льда.
Можно полагать, что главная причина увеличения
скорости некоторых реакций при проведении их во
льду состоит в благоприятной ориентации
реагирующих молекул, которые при этом оказываются
связанными в общую «высокомолекулярную»
структуру. Благодаря этому реакции во льду приобретают
некоторое сходство с ферментативными
процессами.
Это предположение было недавно проверено на
примере так называемой реакции гидроксил-
аминолиза:
R-C4
^°
+ NH2OH
NH2 гидроксиламии
-^R-C +NH3
4NHOH
Эта реакция катализируется ионами ОН", но
идет в обычных условиях очень медленно. Поэтому
если при замораж-ивании раствора процесс
действительно приобретает сходство с ферментативным, то,
во-первых, скорость его должна значительно
увеличиться, а, во-вторых, структурные аналоги
реагирующего соединения (субстрата) будут тормозить
реакцию.
Оба эти предположения подтвердились.
В 1965 году американские химики Г. Олбэрн и
Н. Грант нашли, что во льду реакция гидроксил-
аминолиза ускоряется во много раз; позже те же
авторы показали, что эта реакция действительно
тормозится в присутствии структурных аналогов
субстрата. При проведении гидроксиламинолиза в
растворе эффект торможения не наблюдается.
Сейчас известно еще несколько реакций,
которые подтверждают поразительные свойства
замороженных систем; по-видимому, в ближайшем
будущем число их увеличится.
С. ГЕОРГИЕВ
3*
35
ПИСЬМА
Д. П. КОНОВАЛОВА
ИЗ АМЕРИКИ
Выдающийся русский химик
Дмитрий Петрович Коновалов,
многие работы которого вошли
в золотой фонд науки (в
частности, известные «законы
Коновалова», определяющие
условия устойчивого равновесия
между растворами и их
насыщенными парами), был одним
из организаторов нашей
химической промышленности на
рубеже XIX—XX веков.
Коновалов отличался живым умом,
наблюдательностью, интересом ко
всему новому.
В 1893 году он был назначен
русским экспертом на
Всемирную выставку в Чикаго,
организованную американским
правительством в связи с
четырехсотлетней годовщиной
открытия Америки. Поездка в
Соединенные Штаты и работа
вице-президентом экспертной
комиссии мануфактурного
отдела выставки (самого
крупного, где сосредоточивалась
главная масса экспонатов) легли
в основу книги Коновалова
«Промышленность
Соединенных Штатов Северной Америки
и современные приемы
химической технологии», вышедшей
в Петербурге в 1894 году.
Во время поездки по
Америке Коновалов собрал много
интересных сведений о
состоянии науки в Америке того
времени, развитии разных
отраслей химической
промышленности, о взглядах, быте и нравах
американцев. Он использовал
любую возможность увидеть
жизнь — и работу, и быт —
ученых и преподавателей,
заводчиков н рабочих, студентов и
администраторов.
Большой интерес
представляют письма Коновалова жене,
которые он писал во время
американской поездки. В них —
непосредственные, самые яркие
впечатления, острые
сопоставления. Их публикация
подготовлена доктором химических наук
Ю. И. Соловьевым и А. Я. Кип-
нисом.
23 мая 1893 г. из Нью-Йорка:
€<В Америке все имеет успех,
что бьет в глаза. Имеют успех
поэтому и всякие небылицы о
России. Вообще средняя
публика здесь, по-видимому, ничем
серьезным не интересуется.
Газеты, например, не имеют
вовсе иностранного отдела. В
американских газетах мало даже
телеграмм из Европы.
Переполнены они разными мелкими
местными сообщениями, частью
деловыми, и чем сенсационнее
новость, тем крупнее заглавие.
Например, недавно в
Герольде была статья о том, как
недалеко от Чикаго в городе с
30 тыс. жителей на главной
улице среди бела дня толпа
повесила на фонарном столбе
негра за предполагаемое
оскорбление женщины. Затем они
разрезали веревку на кусочки
и разобрали на память. Негр
клялся в невиновности и,
наконец, просил позволения
молиться и пел молитвы до тех
пор, пока его не прервали.
К женщинам внешнее
почтение большое, но жить им
должно быть прескучно, потому
что мужья с утра и до вечера в
погоне за долларом. Погоня за
деньгами здесь вообще вошла
в плоть и кровь и составляет
род спорта. Тип профессора
мне, например, не понравился.
Это знаменитость. Несмотря на
это, по науке уже давно ничего
не делает, но читает 15 лекций
в неделю и, кроме того, состоит
деканом большого факультета,
экспертом торговой палаты и
проч. — все это очень хорошо
оплачивается, так что он
получает большие деньги (говорят,
200 тыс. в год). Ознакомился с
преподаванием в Университете,
Горном институте и разных
прикладных факультетах. Был
на экзаменах по прикладной
химии. Все, что для
практики, — поставлено хорошо,
сведения сообщаются живые,
практические, но чистой науки
здесь мало и она вообще
слабее. Здешние ученые в
некотором роде тоже комиссионеры
науки. Заимствуют из Европы
знания и пускают их в оборот,
как в коммерческом деле, и в
этом направлении они достигли
большого искусства».
Через несколько дней
из Чикаго:
«Выставка привела меня
сначала в полное смущение
своими громадными размерами.
Первые дни я ходил до
изнеможения и в отчаянии
приходил домой, не будучи в состоя-
36
гж«
«Tfcp» >
mr-j£U Ил'лгш
ли. nmw.vi
нкрганжчюж! xjacz.
V
к ^Я^'Ц^^ч^ ^ &2ч?4г^ С+*у*у yicb^y /To-cA.
< «wfj Лг Рим ^ио&щ, Ян/О.
<^ -^о<^«му4сфЧ tc
нии добраться до того, что
нужно. Американцы вообще любят
поражать пифрами и
размерами. Трудно себе представить
эту массу колоссальнейших
зданий, раскинутых по берегу
озера, с бассейнами, каналами,
фонтанами и рощицами между
ними. Все выставочные здания
белые и имеют мраморный вид.
Каждое из зданий в строго
определенном вкусе и стиле,
Д. П. Коновалов отдавал много
сил организации химической и
металлургической промышленности
в России. В 1906 г. он подает в
Совет Санкт-Петербургского
университета прошение об отставке, с
чем и связано публикуемое
письмо (автограф]. С этого момента
вся его деятельность направлена
на развитие химической
технологии и горного дела
Группа русских делегатов на
Всемирной выставке в Чикаго в
1894 г. Слева сидит Д. П.
Коновалов
со множеством статуй, колонн,
барельефов, украшений,
позолоты. Посреди главного
бассейна громадная золотая статуя
Свободы, и мимо нее
постоянно шныряют гондолы. Подумай,
сколько зданий, если для
каждой отрасли промышленности
(мануфактуры, горное, лесное,
сельское хюзяйство, искусства
и проч.) — отдельное громадное
здание и сверх того каждый
штат имеет свое здание (а
штатов 42), разные театры, музей,
рестораны...».
21 июня из Чикаго:
«С американцами нужно, как
я убедился, действовать особым
образом. Они не умеют вовсе
«разговаривать». С ними можно
«говорить», будучи знакомым
с делом. Тогда можно задавать
вопросы и он будет отвечать.
Чем настойчивее ставишь
вопросы, тем охотнее он отвечает.
Вообще здесь в большом
почете настойчивость и энергия.
Хорошо также во время
разговора сесть на стол и сдвинуть
шляпу на затылок: это
показывает, что не намерен скоро
уйти и хочешь добиться своего.
Затем громадную роль здесь
играет реклама. Поэтому к
тому, что читаешь, слышишь и
видишь, нужно относиться с
недоверием и тщательно
проверять. Я не могу без смеха
читать множества объявлений,
которые здесь всюду
попадаются. Изо всех сил стараются
обратить внимание. Вот
образчики объявлений: «Колумб
открыл Америку, а такой-то
открыл порошок для чистки
ножей» или «Современное
состояние полиции введено Робертом
Пилем. Полиция устраивает
мир и спокойствие государства.
Порошок такой-то устраивает
спокойствие желудка»...
37
Чикаго — это бестолковый,
грязный, безобразный город.
Масса двадцатиэтажных домов
отвратительной казарменной
архитектуры. Всюду пыль и
копоть. Здесь яснее всего
недостатки американской жизни.
Здесь нет общества. Здесь
алчная рвущаяся к наживе толпа.
Колоссальный рост города и
полное отсутствие
благоустройства. Превосходный берег озера
они испакостили железной
дорогой и вместо красивой
набережной с прогулками имеют
закопченное полотно железной
дороги, по которому летит со
Звоном бесконечная вереница
поездов. Здесь настолько
поглощены наживой, что,
по-видимому, и не умеют вовсе жить.
В Нью-Йорке все это меньше
заметно. Там масса
иностранцев. Для себя американцы
сделали весьма неудачный выбор,
устроивши выставку в Чикаго,
но для приезжего это очень
хорошо. Здесь яснее оборотная
сторона американского быта.
Мы так привыкли видеть все
дурное у себя, так нам часто
тычут в глаза Америкой, что
очень полезно убедиться, что не
все здесь заслуживает
подражания... Во многом у нас очень
ошибочные сведения об
Америке. Многие отрасли
промышленности стоят у них гораздо
ниже, чем у нас. Вчера я
провел день на громадном
вагонном заводе. Осмотрели с
большим интересом. Но представь
себе, что все полотна, белье,
материи, стекла, зеркала они
получают из Европы. Говорили с
рабочими. Получают в среднем
не менее 100 руб. в месяц. Труд
рабочего здесь очень дорог, а
интеллигентный труд
оплачивается неважно. Богатеют
аферами и рекламой. Поэтому все
произведения промышленности
здесь очень дороги. Дешево
только то, что производится
исключительно машинами.
Изящных, интересных произведений
нет. Машина подавляет
человека. Вообще Америка меня
разочаровала. Посмотреть и
изучить все это было очень
полезно и интересно, но турист не
испытывает здесь наслаждения,
удовольствия, не испытывает
подъема духа,
облагораживающего все... В общем приходишь
к очень приятному сознанию,
что мы идем вперед более
верным, более твердым шагом.
У нас выше наука, выше
искусство, выше человек. Казалось
бы странно в стране свободы!
Писанные права человека здесь
очень велики, но эти права он
должен и лично отстаивать.
Конечно, это развивает
предприимчивость и энергию, но
несомненно понижает уровень
нравственности. Где всем повелевает
доллар, там нет места
общественным идеалам.
Несмотря на неудачный
выбор представителей, комиссаров,
наши отделы понемножку
открываются. Два уже совсем
готовы и открыты:
мануфактурный и художественный. В обоих
толпа. Американцы поражены
выставленными предметами.
Я сам с удовольствием
прошелся по этим отделам. Хотя много
предметов выставлено скверно,
нигде таких скверных витрин
нет, как у нас, а в общем
оригинально, своеобразно и
производит впечатление. Видно,
нисколько не постарались
отличиться...».
22 июня из Чикаго:
«Вчера познакомился со
здешними профессорами... По
умственному уровню профессора
не выше наших ассистентов.
Я окончательно убеждаюсь, что
наука здесь ниже пашей. Среди
здешних профессоров я вообще
чувствую себя козырем, как
среди провинциалов. Но народ
очень милый. Все время меня
угощали... Много совершенно
непонятного и дикого
рассказывали о здешних
университетах. Просто смех. Здесь,
например, в Чикаго новый
университет строился на деньги хозяина
всех керосиновых заводов в
Америке. Он назначил ректора
по своему вкусу. А сам он
разбогатевший приказчик мучной
лавки, миллионер. Ректор
распоряжается, как самодержец.
На время выставки он,
например, велел вынести из
лаборатории все приборы и устроил
номера для приезжаюших за
деньги. Дали мне письмо на
завод керосиновый. Хорошо было
бы проникнуть. Знакомство с
выставкой я кончаю и буду
знакомиться с президентами
отделов, чтобы собрать
подробные сведения, а потом поеду
на заводы. А затем настанет
радостная минута
возвращения».
АКАДЕМИК
НИКОЛАЙ СЕМЕНОВИЧ
КУРНАКОВ
«В настоящее время мы переживаем эпоху
необыкновенно быстрого и мощного подъема
производительных сил нашего отечества... Теперь уже стало
совершенно ясно, что не в одном только добывании
сырья, но и в переработке наших естественных
богатств заключается источник русского
благосостояния и русской экономической самостоятельности.
Чтобы перерабатывать сырые природные материалы,
чтобы уметь их превратить в непосредственные
продукты потребления, необходимо, очевидно, знать
характер и законы превращения вещества...»
Н. С. Курнаков,
1897 г.
В 1906 году группа петербургских химиков,
посетившая кафедру общей химии недавно
созданного Петербургского политехнического
института, была несколько удивлена, когда в химической
лаборатории увидела вместо традиционных
склянок, колб и бюреток механический пресс
Гагарина, мостики сопротивления и другие физические
приборы. На их вопрос: для чего все это в
химической лаборатории? — заведующий кафедрой
профессор Николай Семенович Курнаков ответил,
что посетители видят приборы, с помощью
которых он со своими учениками исследует физико-
химические свойства металлических сплавов.
Химикам в те годы казалось странным: зачем
Курнаков, уже прославившийся работами по
химии комплексных соединений, надумал вдруг
заниматься металлическими сплавами, областью,
казалось бы, далекой от химии. Некоторые
ученые высказывали сожаление, что семья русских
химиков потеряла талантливого,
многообещающего исследователя.
Но прошло всего около десяти лет — и физико-
химический анализ, основанный Кур па новым,
прочно вошел в химию.
НИКОЛАИ СЕМЕНОВИЧ КУРНАКОВ родился
24 ноября 1860 года в Нолинске, бывшей Вятской
губернии. Среднее образование он получил
в нижегородской военной гимназии, высшее —
39
Jt*<
^бсл-с^вЛ^-ср^г^и^^
*4esCc^/fy&&i
71 J^Z I'sjCm- e-^> Ж-я^гя/,
&Ли&<£>
vJbyt^-
*-<rCL*<ILb>
/f' c&e^jfo ??г>$ч.
в Горном институте, в Петербурге. Горный
институт был одним из лучших специальных высших
учебных заведений России. Там были крупные
научные силы, прекрасная научная библиотека,
музей, богато оборудованные лаборатории. Это
был один из немногих институтов, где для
студентов были введены практические занятия по
химии. Студента Курнакова заинтересовала
перспектива практической работы на крупных
металлургических заводах, участия в геологических
экспедициях.
Горный институт окончен в 1882 году.
Приказом по Горному ведомству инженер Н. С. Курна-
ков оставлен при институте для практических
занятий в химической лаборатории.
Начинается самостоятельная работа в науке
и промышленности. Первоначально его интересы
сосредоточены на химико-технических
проблемах: он изучает процессы выплавки металлов
на алтайских заводах. В 1885 году — защита
диссертации на соискание звания адъюнкта по
кафедре металлургии, галургии (соляного дела)
и пробирного искусства. Тема — «Испарительные
системы соляных варниц». Будучи адъюнктом,
Николай Семенович руководит практическими
занятиями студентов по горнозаводскому
техническому анализу, пробирному искусству, читает
лекции по соляному делу, технологии топлива,
общей металлургии.
Но во второй половине 90-х годов он начинает
работать в другой области — химии комплексных
соединений. Изучая обширный класс сложных
оснований, Курнаков не ограничился обычными
в то время методами анализа веществ. Он
исследовал их светопреломление, форму,
растворимость, устойчивость при химических реакциях.
Исследование комплексных соединений (в том
числе открытая им новая реакция изомеров,
двухвалентной платины с тиомочевиной)
послужило материалом для диссертации «О сложных
металлических основаниях», за которую
Н. С. Курнакову в 1894 году присваивается
звание профессора.
КОНЕЦ XIX —НАЧАЛО XX века
ознаменовались крупными техническими достижениями.
В разных уголках мира пролегли тысячи
километров новых железных дорог, с верфей сходят
огромные, первоклассно оснащенные океанские
Письмо профессора Московского университета
И. А. Каблукова, написанное Н. С. Курнакову 10
декабря 1908 г.
40
пароходы, создаются новые машины с большими
скоростями и мощностями. Для этой техники
требуются металлы с новыми качествами —
высокой упругостью, твердостью,
жароупорностью, пластичностью. Электротехника,
зарождающаяся автомобильная и авиационная
промышленность нуждаются в специальных
сплавах. Для анализа этих сплавов не подходят
обычные методы препаративной химии.
Начинаются поиски...
В 1899 году появилась работа Курнакова
«О взаимных соединениях металлов». Начиная
с этого времени, он вместе со своими
многочисленными учениками и сотрудниками всесторонне
изучает различные металлические, солевые и
органические системы. В 1903 году Кур паков создает
новую конструкцию регистрирующего
пирометра — прибора, с помощью которого
определяются термические превращения в
металлических системах. Курнаков приходит к выводу, что
измерение твердости, давления истечения,
электропроводности и термоэлектрических сил дает
возможность количественно, с любой степенью
точности, следить за самыми тонкими
превращениями во время термической и механической
обработки металлов.
Одна из первых буровых вышек в Соликамске,
построенная в 20-х годах под руководством Н. С.
Курнакова
Так выглядит сейчас забой одной из шахт
Соликамского калийного комбината
КУРНАКОВ проводит огромную работу по
обработке опытного материала. В 1912 году он пишет
одному из своих учеников, Н. И. Степанову:
«Электропроводность металлических сплавов»
твердость и другие тесно связанные
механические свойства — это наше научное завоевание,
которое мы должны удержать в своих руках...
Нужна планомерная и систематическая работа
целого ряда работников, сознательных и
самостоятельных. Даже такие ученые, как Тамман,
еще не уяснили себе значения метода
электропроводности для познания природы
металлических сплавов... Я скажу по этому поводу: тем
лучше для нас, мы — впереди».
Авторитетная комиссия, состоящая из
крупных ученых, утверждая Курнакова
руководителем кафедры химии в Петербургской Академии
наук, отмечала, что в области металлографии
ученый «является пионером не только в России,
но и в химическом мире вообще...». 7 декабря
1913 года Академия наук единогласно избирает
Николая Семеновича Курнакова своим
действительным членом.
ЭНЕРГИЯ Н. С. КУРНАКОВА наиболее* полна
проявилась в советское время. Он принимает
активнеиииее участие в работах по изучению
производительных сил страны, создает научно-
исследовательские институты
физико-химического анализа и прикладной химии.
Одна из главных заслуг Курнакова в
социалистическом строительстве — его активное уча*
41
-стие в создании отечественной калийной
промышленности. В дореволюционной России соли
калия не добывались совсем. Россия ежегодно
закупала до 5 миллионов пудов калийных
удобрений за границей. А между тем первые сведения
о содержании калия в районе Соликамска
появились еще в 1896 году и были подтверждены
в 1906 году, когда в Горный институт были
доставлены образцы. Расчет показал: в 20
миллионах пудов маточной соли (ежегодная добыча)
содержится от 2 до 4 миллионов пудов
хлористого калия. В работе «Месторождения
хлористого калия Соликамской соленое ной толщи»,
опубликованной в «Известиях Академии наук»
в 1917 году, Курнаков доказывал, что
калиевые соли Соликамских отложений имеют не
только научное химическое и минералогическое
значение, но важны и в промышленном
отношении.
В 1920 году при ВСНХ была создана
постоянная комиссия по солям калия. В комиссию
избран Н. С. Курнаков. Геологическая разведка,
произведенная в 1925 году, обнаружила в районе
Соликамска мощные калийные месторождения
мирового значения. Прогноз Курнакова
подтвердился полностью. В Соликамске была заложена
первая шахта, выдавшая в 1930 году первую
партию сильвинита. В годы первых пятилеток там
были построены крупные предприятия по добыче
и переработке калийных руд.
Николай Семенович не был только
кабинетным ученым, он участвовал в многочисленных
экспедициях. Его сотрудник М. Г. Валяшко
вспоминает такой случай. В июле 1930 года на озере
Старом была обнаружена обильная садка бишо-
фита (хлористого магния, содержащего шесть
молекул воды). Кристаллизацию бишофита —
минерала весьма гигроскопического — раньше
в течение нескольких часов видели только в Сак-
ских бассейнах. Здесь же кристаллизация
достигла таких размеров, что позволила организовать
промышленную выволочку (добычу). Николай
Семенович заинтересовался этим явлением. Он
решил поехать на озеро. «Дул суховей.
Температура рапы (соляного рассола) достигала почти
40°С при концентрации 39°Ве; рапа представляла
маслянистую густую жидкость, покрывавшую
озеро слоем 25—40 см. На дне, на пласте
поваренной соли — щетка игольчатых кристаллов
бишофита. Н. С, приехав, сразу же пожелал
пойти в озеро. И вот босиком, в обжигающей
ноги рапе, по колючим иголкам бишофита в
течение нескольких часов Н. С. внимательно с
лупой исследовал кристаллы бишофита в местах их
наибольшего скопления. Кожа на ногах Н. С.
сделалась ярко-красной, губы трескались от жары
и иссушающего ветра, но Н. С, как
увлекающийся юноша, никак не хотел уходить из озера, пока
полностью не ознакомился с явлением». В это
время неутомимому ученому было уже 70 лет.
Николай Семенович Курнаков создал свою
школу в неорганической химии. Он был
прирожденным педагогом, всегда принимал близко
к сердцу интересы молодежи. И его
многочисленные ученики и студенты отвечали ему
любовью и уважением.
Скончался Н. С. Курнаков 19 марта 1941 года.
Он похоронен в Ленинграде, на Волковом
кладбище, недалеко от могилы Д. И. Менделеева.
Доктор химических наук
Ю. И. СОЛОВЬЕВ
ученые вспоминают.
Меня всегда восхищала в
Н. С. Курнакове спокойная
мудрость, исключительная широта
его взглядов на науку и жизнь,
его глубочайшее знание
истории науки — не только химии и
физики, но и математики. Он
поражал своих собеседников
детальным знанием биографий и
работ Лагранжа и Кар по,
Ломоносова и Лавуазье, Севергина и
Ловица, Пруста, Бертолле и Гес-
са. Он постоянно интересовался
историей отечественной
металлургии, соляного дела и ряда
отраслей химической
промышленности... В личном общении
он был поразительно приветлив,
внимателен и добр. Будучи уже
маститым ученым с мировым
именем, Николай Семенович
был тем не менее
исключительно прост, доступен для всех, к
нему обращались и студенты, и
молодые научные сотрудники,
и убеленные сединами ученые,
и деятели промышленности. Это
огромное личное благородство и
научный автор итет пр идавал и
его облику величие и красоту.
С. И. ВОЛЬФКОВИЧ
Николай Семенович Курнаков
создал и блестяще разработал
физико-химический анализ —
один из ведущих разделов
общей химии — как метод
изучения химических превращений,
основанный на построении диа-
гр ам мы, вы ражающей завис и -
мость между составом и
физическими свойствами
равновесных систем...
В течение полувека Николай
Семенович изучал сложный
гидрохимический режим
соляных озер Северного Крыма.
Результаты его исследований
42
были положены в основу
бальнеологического и
промышленного использования рассолов и
минеральных грязей озер Саки,
Мойнаки, Старого и других.
А. И. ДЗЕНС-ЛИТОВСКИЙ
Николай Семенович всегда
стремился сочетать научные
интересы с интересами жизни и
техники. Он изучал озера
Нижнего Поволжья как источники
химического сырья. Летом
1931 года Курнаков возглавляет
большую комплексную
экспедицию по изучению соляных
богатств Кулундинской степи.
Это было первое комплексное
исследование целого соляного
района.
М. Г. ВАЛЯШКО
Н. С. Курнаков был
инициатором быстрейшего опробования
новых калийных минералов и
твердых растворов калийно-
фосфорно-аммначных солей на
агрохимическую
эффективность. Была установлена связь
калийной бригады с
сельскохозяйственными научными
учреждениями и опытными
станциями, проводившими
испытания новых видов удобрений.
Николай Семенович до
последних дней своей жизни проявлял
большой интерес к этим
работам и неоднократно посещал
опытные станции.
И. Н. ЛЕПЕШКОВ
Когда, кажется в 1925 году, в
Грозном была пущена
крекинговая установка, Н. С.
Курнаков, будучи председателем
ленинградского отделения
Комитета по цветным металлам,
первый поставил вопрос о
необходимости изучения отходов
этого производства — крекингового
нефтяного кокса — как
возможного сырья для анодов при
электролизе алюминия. В то
время, когда в американской
литературе сообщалось о том,
что отходы эти годны только
для сжигания в топках... Вопрос
этот был изучен и в настоящее
время крекинговый нефтяной
кокс применяется наряду с пи-
ролизньш в производстве
электродов.
Ч. Б. ДУРУНЧА
Николай Семенович не любил
о ком-либо отзываться плохо.
Он предпочитал высказываться
неопределенно. Например,
говорил: «Он, батюшка, всегда
пересаливал». Или: «Не следует это
принимать всерьез». Или:
«Прочитайте об этом лучше там-то».
Но такие замечания доходили
лучше, чем явное неодобрение.
Ему очень нравилось, если в
наших очерках по истории
платины упоминались
малоизвестные или забытые деятели и
ученые. Сам вспомнил о
химике 50-х годов К. Раевском и
просил вставить его имя в
очерк. Мало того, он на память
указал журнал, где напечатаны
статьи К. Раевского, и попросил
достать его из библиотеки.
...В 1934 году был
организован Институт общей и
неорганической химии (ИОНХ), для
чего институты Платиновый,
Физико-химического анализа и
Лаборатория общей химии АН
СССР были слиты воедино.
Николай Семенович возглавил
новый единый институт. Из ярких
воспоминаний этого времени у
меня осталось впечатление от
первого осмотра здания, куда
был переселен ИОНХ. Николай
Семенович целый день ходил
по зданию, заглядывал во все
уголки, интересовался многими
подробностями, которые
другим и в голову не приходили.
К концу осмотра все спутники
его были утомлены до
крайности, он один был доволен и
утомление как будто не
коснулось его. С большой
тщательностью прорабатывал он план
размещения отделов и
лабораторий в новом здании.
Приходилось постоянно отстаивать
покушения различных
академических учреждений-соседей
на помещение института.
Особенно ожесточенные сражения
происходили с заместителем
директора Института горючих
ископаемых. Николай
Семенович о нем говорил с
прибавлением слова «батюшка» и
шаркал ногами. Это было
признаком крайнего недовольства и
неодобрения.
О. Е. ЗВЯГИНЦЕВ
Нельзя сказать, однако, чтобы
Николай Семенович не был
требователен. Наоборот,
несмотря на кажущееся
предоставление полной свободы действий,
каждый из его сотрудников
понимал, что он должен дать
Николаю Семеновичу полный
отчет о своей работе. И хотя этот
отчет не носил официальной
формы, он был страшен тем,
что мог послужить причиной
потери его xopouiero мнения и
уважения.
Широту взглядов он
старался воспитывать в каждом
своем сотруднике и искренне
огорчался, когда видел, что «соле-
вик» мало интересуется
металлическими сплавами, а
«металлист» — химией комплексных
соединений.
Николай Семенович очень не
любил поспешные,
малообоснованные заключения. На
официальных заседаниях он этого
прямо не говорил, но мы всегда
знали его отношение к докладу:
когда он был недоволен, он
снимал и надевал очки.
Неприятное впечатление от чьего-либо
высказывания он старался
загладить какой-нибудь шутливой
репликой.
М. И. РАВИЧ
Из сборника
«Н. С. Курнаков в воспоминаниях
современников и учеников»
(М., Изд. АН СССР, 1961]
КЛАТРАТЫ:
МОЛЕКУЛЫ В ГОСТЯХ
У КРИСТАЛЛОВ
С. Г. КАРА-МУРЗА
Наблюдательные агрономы давно
подметили одно странное явление. Бывало, вместо
ожидаемых заморозков наступало лишь
похолодание до 4—5°С. Оно, видимо, не
должно было представлять для растений
особой опасности — ведь вода замерзает
только при температуре ниже 0°С. Но
растения все же погибали — их ткани
разрушались мелкими кристалликами льда.
А вот еще один не менее удивительный
случай. Лет пятнадцать назад на одном из
газопроводов в США произошла закупорка
труб. Когда трубы, лежащие на
поверхности земли, вскрыли, то оказалось, что они
забиты снегом. Дело было летом, и казалось
непостижимым, что водяные пары (а они
всегда содержатся в газе) могли
сконденсироваться и замерзнуть при 20° тепла.
Когда стали искать объяснение этому
странному явлению, то вспомнили про
всходы, замерзающие выше нуля, затем про
другие похожие случаи и, в конце концов,
установили, что всякий раз виною была
способность воды давать с различными
веществами соединения особого рода — так
называемые клатраты.
Еще в 1886 году немецкий ученый Ф. Ми-
лиус обнаружил, что гидрохинон способен
поглощать многие летучие вещества
(например, сернистый газ SO2), не вступая с
ними, однако, в химическое
взаимодействие *. Образующиеся при этом соединения
* О соединениях подобного типа рассказывалось
также в статье Р. Костяновского «Катенаны —
молекулы соединены без хиллической связи» (с<Химия и
жизнь», 1965, № 2).
Рис. 1. Две клеточные структуры взаимно
проникают друг в друга (условная схема)
Рис. 2. Молекула-«гость» внедряется в пространство
между двумя клеточными структурами
Рис. 3. Если форма молекулы-агостя» не
соответствует форме клетки, то кристаллическая решетка
деформируется
Рис. 3
44
казались ученым не более чем
химическими диковинками, и ими долгое время никто
всерьез не занимался. И только спустя
60 лет англичане Д. Пейлин и Г. Пауэлл
подвергли эти соединения точному
рентгенографическому анализу и установили их
природу и общие закономерности построения.
Примерно в то же время были
обнаружены и многочисленные факты,
свидетельствующие о том» что такие соединения
чрезвычайно широко распространены в природе
и обладают уникальными свойствами,
открывающими фантастические перспективы
для их использования в науке и технике.
Рентгенографические исследования
показали, что клатратные соединения
образуются при внедрении молекул-«гостей» в
межкристаллическое пространство моле-
кул-«хозяев» (термины «гость» и «хозяин»
официально приняты в научной литературе).
Само название «клатратный», предложенное
Пауэллом, означает «включенный», или
«защищенный решеткой».
Любое кристаллическое вещество
образует трехмерную решетку, в узлах которой
находятся ионы или молекулы, связанные
между собой химической связью. Элементы
этой решетки представляют собой как бы
«стенки» клетки, которая для каждого
вещества имеет строго специфические форму и
размер (рис. 1). Когда же кристаллизация
происходит в присутствии посторонних
молекул, то если эти молекулы по своим
размерам и форме способны поместиться в
клетке, кристалл-«хозяин» как бы
приглашает их в гости (рис. 2).
Обычно молекулы с удовольствием
принимают приглашение, так как включение
«гостей» в кристаллы «хозяев» выгодно обо-
+1М. При включении достигается, как говорят,
наиболее плотная упаковка: молекулы-«го-
сти» удобно располагаются в клетках
«хозяина» и вступают в слабое ван-дер-вааль-
сово взаимодействие с узлами решетки.
Хотя силы Ван-дер-Ваальса слабы, в сумме
они приводят к значительной стабилизации
кристалла, так что иногда оказывается даже
выгодной некоторая деформация
кристаллической решетки «хозяина» в соответствии
с формой «гостя» (рис. 3).
Будучи включенными в клетки «хозяина»,
молекулы-«гости» не могут уже так просто
выйти на свободу — им придется
преодолеть теперь силы взаимодействия с узлами
решетки. Чтобы преодолеть эти силы,
необходимо снабдить «гостей» дополнительной
энергией и одновременно расшатать
кристаллическую решетку «хозяина». Для этого
можно, например, нагреть клатрат, а иногда
даже бывает достаточно просто его
размолоть.
Иначе говоря, для разрушения
(например, плавления) клатратного соединения
необходимо затратить больше энергии, чем
для разрушения кристалла самого
«хозяина». Потому-то и не плавился лед в
газопроводе при + 20°С: он был стабилизирован
клатратным соединением метана с водой.
В растениях «гостями» были растворенные в
соке вещества (прежде всего, белки).
Сейчас с каждым годом увеличиваются
два потока работ: исследования свойств и
структуры клатратов, результаты которых
публикуются в научных журналах, и
предложения по практическому применению клат-
ратных соединений в самых различных
областях науки и техники. Подавляющее
большинство таких работ патентуется; о
некоторых из них мы и расскажем в предлагаемых
вниманию читателей коротких заметках.
ОТ МОЛОКА — К НЕФТИ
Случай помог найти кпатратам
одно из наиболее важных
практических применений. В
сороковых годах нашего века немецкий
ученый Ф. Бенген занимался
разработкой нового метода
определения жирности молока. Для
этого он прибавлял к молоку
мочевину, которая способствовала
отделению жира, а для того, чтобы
эмульсия лучше расслаивалась, —•
еще немного нормального (то
есть неразветвленного) октипово-
го спирта СйН!7ОН. Однажды
Бенген заметил, что на поверхности
жидкого слоя плавают кристаллы,
хотя мочевина хорошо
растворима в воде; кристаллы оказались
малорастворимым клатратом
мочевины и октилового спирта.
Это побудило ученого
исследовать другие спирты, а затем и
углеводороды, и оказалось, что
включаться в кристаллы
мочевины могут лишь соединения с лря- '
мой, а не разветвленной цепью!
В результате этих исследований
Бенгену удалось разработать
чрезвычайно эффективный метод
разделения углеводородов (эти
работы оставались в Германии
секретными до конца второй
мировой войны).
Новым методом (он назы-
45
вается «экстрактивной
кристаллизацией») можно разделять
вещества с очень близкими
свойствами. Особенно эффективен он при
разделении нефтяных фракций:
например, в один прием можно
извлечь из бензина ксилол.
Практически для любого
компонента смеси можно подобрать
соединение, дающее с ним клат-
рат; обработав смесь этим
соединением, можно отделить
кристаллы клатрата и выделить затем
из них нужный компонент.
ЗАКОН ГОСТЕПРИИМСТВА
Кристаллическую решетку
«хозяина» можно использовать для
защиты молекул «гостя» от
внешних воздействий. Так можно
хранить неустойчивые вещества,
которые быстро окисляются на
воздухе: это общий метод защиты
таких соединений от окисления.
Предложено, например,
применять не чистый витамин А, а его
клатрат с мочевиной, который в
организме разрушается и
высвобождает свободный витамин.
«ЛЕГИРОВАННЫЙ» ЛЕД
Молекулы-«гости» стабилизируют
кристаллическую решетку
«хозяина», делают ее более
прочной. Может быть в этом и состоит
роль малых добавок при
получении твердых сплавов! Ведь
добавляя легирующие вещества во
время кристаллизации металла,
можно значительно увеличить его
прочность.
Заманчивые перспективы
открывают исследования по
использованию соединений включения
для повышения прочности
самого дешевого строительного
материала — льда и снега.
Кристаллическая структура льда такова,
что в нем есть громадные (по
сравнению с молекулами] лусто-
ты. Если в эти пустоты внедрятся
микроскопические частицы, то
механические свойства льда
улучшатся. В этом случае можно
говорить о «псевдоклатратах», так
как включенные частицы ло
размеру много больше молекул.
И действительно, добавляя в
воду перед замораживанием даже
обыкновенную глину, можно
повысить прочность льда на излом
почти в три раза. А добавив
всего девять процентов стеклянных
волокон, увеличить прочность
почти в семь раз! Это делает лед
уже очень прочным материалом,
пригодным для строительства,
например, шоссе или аэродромов.
Стоит ли говорить о том,
какие возможности раскрываются в
этом случае перед строителями
в арктических районах!
ТОРТ С КЛАТРАТОМ
Иногда применение клатратов
оказывается совершенно
неожиданным. В США, например,
выдан патент на использование
клатрата углекислого газа с
а-декстрином, который можно
использовать вместо дрожжей в
качестве пекарского порошка.
а -Декстрин образуется при
ферментативном гидролизе
крахмала в специальных условиях и
состоит из шести остатков
глюкозы, которые образуют шести-
звенное кольцо. Это кольцо и
представляет собой «клетку», в
которой довольно прочно
удерживается молекула углекислого
газа. Если такой порошок
замесить в тесто, то во время
выпечки, при повышении температуры,
клатратное соединение
разрушается, и выделяющийся углекислый
газ придает тесту пористую
структуру.
САМАЯ ДЕШЕВАЯ ВОДА
Если насыщать морскую воду
каким-нибудь газом (например,
пропаном) под давлением и на
холоду, то газ может дать с водой
свободные от соли
кристаллические клатратные соединения. В
случае пропана образуется
клатрат, в котором на одну молекулу
газа приходится 17 молекул
воды; кристаллы такого соединения
можно выделить и промыть, а
затем, повысив температуру,
разрушить и получить воду,
пригодную для питья. При этом газ
выделится в свободном
состоянии.
Таким образом на установках,
производящих по 38 000 тонн
пресной воды в сутки, можно
получать воду стоимостью 13,2
цента за 1 тонну. А еще в 1960 году
опреснение морской воды по
самому дешевому способу
обходилось более чем в 1 доллар за
тонну.
Американский ученый Джон
Дэй в книге «Вода — зеркало
науки» в связи с этим пишет, что
если удастся найти такой способ
опреснения морской воды, чтобы
цена пресной воды не
превышала ее стоимости при добывании
из естественных источников, то
результаты этого могут оказаться
для человечества еще более
потрясающими, чем, например,
последствия открытия атомной
энергии. По своей дешевизне способ
опреснения морской воды с
помощью клатратов приближается
к этому требованию.
КЛАТРАТЫ
В ОПЕРАЦИОННОЙ
Одна из современных теорий
анестезии рассматривает клатра-
цию как главный механизм
болеутоляющего действия. Например,
известный американский ученый
Лайнус Полинг приводит данные
о том, что в присутствии обычных
анестезирующих агентов
(например, хлороформа, закиси азота]
на белковых цепях образуются
микроскопические «айсберги» —
микрокристаллы льда клатратно-
го типа. Клатраты льда с белками
могут образовываться и без
третьего компонента, но они
неустойчивы при температуре тела.
46
Эти «айсберги» очень малы —
порядка нескольких десятков
ангстрем, однако, обмерзая вокруг
цепи, они нарушают
проводимость импульсов, что и приводит
к анестезии. (Конечно, этот
процесс происходит не только в
мозгу и нервных клетках, а во всех
тканях, куда проникает
анестезирующий агент.] Понятно, что по
мере постеленного удаления
анестезирующего агента из
организма, эти нестойкие «айсберги» тают,
первоначальная структура белков
восстанавливается, и
возобновляется нормальная деятельность
нервных кпеток.
ГАЗ В ЛОВУШКЕ
Дс недавнего времени химиков
удивляла способность инертных
ТЕХНОЛОГИ, ВНИМАНИЕ!
НАЭЛЕКТРИЗУЮЩИЙСЯ
ПОЛИСТИРОЛ
Почти все пластмассы — хорошие
изоляторы и поэтому при трении
легко электризуются и затем
весьма продолжительное время
сохраняют приобретенный заряд.
А заряженные изделия
притягивают пыль, слипаются одно с
другим... С этим явлением боролись,
покрывая поверхность
пластмассовых изделий гидрофильной
пленкой. Большая проводимость
пленки способствовала
«стенанию» заряда; однако пленка
служила очень недолго.
Сейчас для одной из широко
применяемых пластмасс —
полистирола — удалось разработать
новый способ создания токопро-
Бодящей пленки. Для этого
изделие погружают на 10—15 минут в
нагретую концентрированную
серную кислоту или обрабатывают
парами серного ангидрида. При
этом поверхностные спои
полимера сульфируются и
приобретают гидрофильные свойства.
Процесс должен вестись в строго
определенных условиях, так как в
газов — неона, аргона и радона—
давать соединения с водой, так
называемые «газовые гидраты»,
имеющие вполне определенный
состав и напоминающие по своим
свойствам химические
соединения.
Сравнительно недавно удалось
установить, что «газовые
гидраты» — это, по сути дела, те же
соединения включения; были
получены и клатраты инертных
газов с гидрохиноном. Гелий не
дает таких соединений, так как
его атом слишком мал и
свободно выходит из кристаллической
ячейки.
Интересно, что в свободном
состоянии газ, содержащийся в
кпатратах гидрохинона, занимает
обьем в 100 раз больший, чем
объем кристаллов, и поэтому
результате сульфирования может
образоваться продукт, полностью
растворимый в воде.
(«New scientist», 1966, № 501)
УДОБРЕНИЕ... ИЗ ДЫМА
В Токийском технологическом
институте (Ялония) изобретен
новый метод удаления сернистого
клатратные соединения можно
использовать для хранения
инертных газов. Например, клатрат
гидрохинона с Кг85 — один из
наиболее удобных в обращении
источников излучения.
Химические свойства
гидрохинона позволили создать
остроумный прибор, предназначенный для
контроля за чистотой воздуха.
Этот прибор действует по
следующему принципу. Многие
вещества, загрязняющие воздух,
способны разрушать
кристаллические ячейки гидрохинона. При
этом освобождается
радиоактивный криптон, который можно
обнаружить с помощью обычных
детекторов радиации. Так можно
определить наличие в воздухе
ничтожных количеств
загрязняющих примесей.
газа из дыма электростанций и
предприятий. Суть процесса —
окисление сернистого газа до
серного ангидрида над пятиокисью
ванадия при температуре 380—
450°С; затем влага, содержащаяся
в дыме, дает с серным
ангидридом серную кислоту, которая, в
свою очередь, реагирует с
газообразным аммиаком и дает
кристаллический сульфат аммония.
Впервые все стадии очистки
проходят непосредственно в
газовой фазе, причем
улавливается 90 процентов сернистого газа.
Достоинство нового метода
состоит в его дешевизне: затраты на
очистку дыма покрываются за
счет ценного продукта —
сульфата аммония (на электростанции
мощностью 600 тысяч киловатт его
получается 100 тысяч тонн в год).
Предложенный способ очистки
позволит применять в качестве
топлива дешевые угпи с высоким
содержанием серы. Авторы
запатентовали свой метод в Японии,
США и нескольких европейских
странах.
(«Chemical and Engineering News»,
1966, № 26)
■ ТЕХНОЛОГИ, ВНИМАНИЕ!
47
ВСПЫШКА ГЕНИЯ
В девятом и десятом номерах журнала за этот год
были напечатаны отрывки из сборника А.
Гаррета «Вспышка гения», рассказывающие о том, как
делаются открытия, что приводит к решающему эта*
пу научного исследования.
Рассказы принадлежат либо самим ученым-
первооткрывателям, либо свидетелям открытия.
В этом номере печатается еще один отрывок из
сборника «Вспышка гения».
ФРЕОН —Т. МИДЖЛИ и А. ХЕНН
Томас Миджли — молодой инженер-механик
исследовательской лаборатории фирмы «Дженерал
Моторс» — в 1919 году участвовал в открытии
антидетонатора для бензина — тетраэтилсвинца. А десятью
годами позже, в начале 1930 года, он вместе с
Альбертом Хенном открыл фреон, который теперь
используется в большинстве холодипьников. Открытие
молодыми учеными фреона — замечательный
пример роли Периодического закона Менделеева в
повседневной практической работе химика. Вот как
описывает Миджли это открытие.
«Однажды утром в лаборатории я
разговаривал по телефону о чем-то мало
значительном с директором лаборатории
Кеттерингом, который был в это время в
Детройте. Когда мы кончили говорить по делу,
он сказал: «Мидж, вчера вечером я
разговаривал с Лестером Кейлхолтцем, и мы оба
пришли к заключению, что если холодильная
промышленность хочет развиваться, то
нужен новый хладоагент. Я сказал Лестеру, что
позвоню тебе и попрошу тебя
встретиться с ним и обсудить эту проблему
подробнее. Он выезжает в Дайтон сегодня
вечером».
Л. С. Кейлхолтц был ведущим
инженером фирмы «Фрижидэр». Все следующее
утро мы обсуждали у него в конторе эту
проблему. К будущему хладоагенту он
предъявлял два требования. Вещество
должно было быть безвредным и
негорючим. Я сомневался, что нам удастся найти
индивидуальное вещество, которое
отвечало бы этим требованиям. Но, может быть,
можно заменить современные плохие хла-
доагенты смесью негорючего, вредного
вещества с горючим, но безвредным?
Такая смесь, возможно, окажется
практически негорючей и значительно менее
вредной.
С этими мыслями я пошел в
лабораторию. А. Хенн и Р. Нери ждали меня к
завтраку. За завтраком мы обсуждали эту
проблему. Хенн сказал, что его заинтриговало
мое неверие в то, что можно найти
подходящее вещество. Он предложил в
свободное время отправиться втроем в библиотеку
и посмотреть литературу.
Вещество должно было кипеть в
интервале температур от 0° до — 40°С, быть
стойким, безвредным и негорючим. Свойства
некоторых летучих органических
соединений мы нашли в одном из справочников. По
данным этого справочника, температура
кипения четырехфтористого углерода —15° С
(ошибочность этих данных была установлена
гораздо позднее). Поэтому мы стали думать
об этом соединении. Нам пришло в голову,
что могло бы быть полезно еще добавить
соединения хлора. Хенн подвел первые
итоги: соединения, содержащие хлор и фтор,
заслуживают дальнейшего рассмотрения.
Убедившись, что в справочнике
отсутствуют многие данные, я обратился к
периодической системе элементов. В правой части
системы находятся элементы, образующие
достаточно летучие соединения. Но имело
смысл рассматривать только часть из них.
Летучие соединения бора, кремния,
фосфора, мышьяка, сурьмы, висмута, теллура и
йода слишком неустойчивы и вредны.
Инертные газы кипят при очень низких
температурах.
Посмотрим теперь на остальные
элементы. Все хладоагенты, которые применяют
сейчас, представляют собой комбинации из
них. При этом горючесть уменьшается еле-
48
ва направо по таблице, а вредность обычно
падает при переходе от тяжелых элементов
(низ таблицы) к легким (верх таблицы).
Стремление найти соединение
одновременно негорючее и безвредное приводило к
фтору. Это была захватывающая дедукция.
Никто раньше не допускал, что некоторые
соединения фтора могут быть
безвредными. Такое предположение было
неожиданным и для инженеров-холодильщиков. Если
проблему и можно было решить, применяя
какое-нибудь одно вещество, то им должно
было быть соединение фтора. Теплоты
взаимодействия галогенов с углеродом уже
были известны. Они увеличивались от йода
к фтору, что подчеркивало особую
устойчивость фторуглеродных соединений. Все,
казалось, вселяло надежду, кроме старого
опасения, что фтористоводородная
кислота очень вредна. Потом оказалось, что она
менее вредна, чем соляная, но в тот вечер
мы не знали этого.
Затем мы обсудили метод синтеза.
Казалось, что четырехфтористый углерод
слишком сложно получать, может быть, лучше
остановиться на дихлордифторметане? Но
как мог дихлордифторметан кипеть при
—20°С, если четырехфтористый углерод
кипит при —15°С? Понять это было
невозможно. В ход были пущены логарифмические
линейки, миллиметровка, резинка, точилка
для карандаша и многое другое из
арсенала современного ученого-ясновидца. Были
нанесены на график точки кипения,
найдены новые данные, сделаны исправления, и в
конце концов мы решили, что
четырехфтористый углерод должен кипеть около
—136°С, если он не какое-либо
сверхъестественное вещество. (Через некоторое время
в печати появилась статья, посвященная
этому вопросу. Оказалось, что
четырехфтористый углерод кипит при —128°С, а не при
— 15°С.) Мы были почти уверены, что
температура кипения четырехфтористого
углерода указана в справочнике неверно, и
синтезировать его будет трудно. Поэтому
исследования мы решили начать с более
доступного дихлордифторметана.
Я позвонил по телефону в одну из фирм,
снабжавших наши лаборатории
химическими реактивами, и заказал у них пять
28-граммовых бутылочек с трифторидом
сурьмы. Я думаю, что мое требование
исчерпало весь запас трифторида в стране в то
время.
Трифторид сурьмы был получен. Мы
взяли вещество из одной бутылочки и
синтезировали несколько граммов
дихлордифторметана. Затем пустили его под колпак,
где находилась морская свинка. К
большому удивлению физиологов, она не умерла,
у нее даже не началось удушье. Затем опыт
был повторен с реактивом из другой
бутылочки. На этот раз, как и предполагали
специалисты, животное погибло. Перед тем, как
повторить опыт, мы понюхали трифторид
сурьмы, и сразу все стало ясно. В нем
содержался фосген, который и убивал
животное. Простой промывки полученного
препарата в щелочи оказалось достаточно, чтобы
избавиться от отравляющей примеси.
Очищенное вещество было совершенно
безвредно.
Из пяти бутылочек с надписью
«трифторид сурьмы» только одна содержала
действительно чистое вещество. В остальных
вещество было загрязнено двойной солью,
содержащей кристаллизационную воду. Это
приводило к образованию большого
количества фосгена. Мы счастливо наткнулись на
чистое вещество в начале исследования.
Если бы мы начали опыты с трифторидом из
других бутылочек, животное сразу же
погибло бы, как и ожидали все, кроме нас.
Мораль этой маленькой истории проста:
для того, чтобы достигнуть успехов на
поприще прикладной химии и получить медаль
имени Перкина, нужно обязательно быть
удачливым и иметь хороших коллег и
помощников.
Альберт Хенн заслуживает такой же
похвалы, как и я, за разработку хладоагентов
из органических фторидов».
Перевод с английского
Л. СОЛОДКИНА
4 Химия и Жизн», № 12
история
одной дуэли
В. БАТРАКОВ
Рисунок А. КОЛМАНКЛ
■- Дуэли? — спросит удивленный читатель. —
Может быть, действие рассказа происходит где-
нибудь во Франции, в средние века?
Нет, зта дуэль происходила не во Франции, и
не в давние времена, а немного лет тому назад.
Еще точнее — это была всего лишь научная
дискуссия между двумя группами швейцарских
химиков, развернувшаяся на страницах известного
научного журнала «Helvetica Chimica Acta».
И предметом спора была не
прекрасная дама, а «кетолактон» — вещество,
выделенное из эфирного масла жасмина — Jasminum
grandiflorum L.
ЭТА ДИСКУССИЯ имеет маленькую
предысторию. В 1942 году * два химика — И .-Р. Нав и
А. В. Грамполов — выделили из эфирного масла
итальянского жасмина новое вещество
неизвестной структуры, по словам авторов, «светло-
желтую подвижную жидкость со стойким
травянистым запахом». Судя по химическому
поведению, вещество содержало кетонную группу СО и
еще лактонную группировку атомов (систему
циклического сложного зфира СО О); поэтому
авторы назвали его «кетолактоном» (кетон+лактон).
Новое вещество было охарактеризовано соста-
* Helv. Chim. Acta, 25. № 7, 1500 |1942].
вом и константами его производных — семикар-
базона и динитрофенилгидразона; первое
производное плавилось выше 250СС, а второе — при
166—166,5СС. Кроме того, было установлено, что
эти производные не содержат группировок атомов
СН30 или С2Н50. Для самого же «кетолактона»
на основании косвенных данных: анализа был
выведен состав С12Н1603. Вот и все.
Надо признаться, что это были очень скудные
и, более того, просто сомнительные данные. Ведь
индивидуальность самого «кетолактона» не была
установлена, а его строение — практически никак
не изучено. Но по тем временам работа Нава и
Грамполова была вполве заурядной — не
слишком хорошей, но и не слишком плохой: что-то
все-таки они выделили и это «что-то» как-то
охарактеризовали.
Но время шло, и методы исследования
природных органических соединений
совершенствовались. Соответственно менялись и понятия
«плохая» и «хорошая» работа. Химики все шире
стали пользоваться новыми эффективными
методами исследования органических соединений —
хроматографией, спектроскопией. Не
удивительно, что в старых работах, по мере их проверки,
находились подчас грубейшие ошибки: нередко
выяснялось, что авторы, незнакомые с физико-
химическими методами, работали не с
индивидуальными веществами, что структуры этих
«веществ» устанавливались неверно и т. д. Не
удивительно поэтому, что со временем «новая
школа» стала относиться с недоверием (если
даже не с явным пренебрежением) почти ко всем
без исключения старым работам.
СПУСТЯ 20 ЛЕТ три других химика — Э. Демоль,
Э. Ледерер и Д. Мерсье — опубликовали работу,
посвященную изучению эфирного масла
жасмина (правда, в отличие от предыдущих авторов,
они исследовали египетскую разновидность этого
растения) *. К тому времени было уже достоверно
* Helv. Chim. Acta, 45, № 2, 675 11962).
50
установлено, что в эфирном масле жасмина
содержится 26 душистых веществ, однако, хотя эти
вещества в сумме и составляли почти 100
процентов эфирного масла, их смесь все же не имела
характерного запаха природного продукта. Вывод
мог быть одним — жасмин содержит еще какие-
то неизвестные пахучие вещества. Поэтому Де-
моль, Ледерер и Мерсье предприняли попытку
найти зтот неизвестный компонент.
Они выделили из эфирного масла египетского
жасмина новое вещество, представлявшее, по их
описанию, «подвижную бесцветную жидкость с
тонким стойким запахом». Это вещество,
имеющее состав С,3Н2о03, было тщательно очищено,
охарактеризовано, а его строение установлено и
подтверждено встречным синтезом (то есть
вещество, полученное синтетическим путем, оказалось
полностью идентичным природному продукту).
Вещество это было названо «метилжасмонатом»,
так как представляло собой метиловый эфир жас-
м оно вон кислоты (и поэтому, естественно,
содержало меток сильную группу СН30).
Несмотря на тщательные поиски, других
веществ, содержащих карбонильную группу СО, в
зфирном масле египетского жасмина обнаружить
не удалось, и поэтому, комментируя работу
двадцатилетней давности, представители «новой
школы» ехидно заметили:
«Не исключено, что «кетолактон С^Н^Оя»,
выделенный из эфирного масла итальянского
жасмина Навом и Грамполовым в 1942 году,
представляет собой слегка (какова ирония! — В. Б.)
загрязненный образец метилжасмоната».
Перчатка была брошена. Казалось, трудно
оспорить исследование, выполненное
тщательнейшим образом, с привлечением совершеннейшей
методики. Но прошло всего несколько месяцев, и
в том же журнале появляется статья Нава и
Грамполова «По поводу метилжасмоната и кето-
лактона C12H160j из эфирного масла жасмина» *.
Вот резюме этой статьи:
«Кетолактон, полученный 20 лет назад Навом
и Грамполовым из итальянского жасмина,
совершенно отличен от метилжасмоната, описанного
Демолем, Ледерером и Мерсье, а не является
неочищенным препаратом этого зфира, как на том
настаивают авторы».
Было ли у Нава и Грамполова достаточно
оснований для того, чтобы категорически отвергать
предположение своих коллег? Честно говоря —
нет. По сути дела Нав и Грамполов повторили
только то, что писали в 1942 году:
* Helv. Chim. Acta, 45, № 4, 1161 J1962J.
4*
«...Мы вывели формулу С,2Н16Оз иэ данных
анализа двух производных — семикарбазона и
динитрофенилгидразона; вновь сделанные
анализы (то есть анализы образцов, полученных
20 лет назад и сохранившихся каким-то чудом
до сих пор. — В. Б.), подтвердили ранее
опубликованный элементарный состав. Мы еще раз
проверили отсутствие в этих производных меток-
си льной группы (ведь группа СНо0, как уже
подчеркивалось, до л иена была бы содержаться в
соответствующих производных металжасмоната. —
В. Б.)... Динитрофенилгидразон метилжасмоната
плавится при 43—65°С... и уже поэтому отличается
от динитрофенилгидразона кетолактона с
температурой плавления 166—166,5°С, описанного в
1942 году».
Итак, у Нава и Грамполова есть три
доказательства того, что их «кетолактон» — зто
действительно кетолактон, а не метилжасмонат:
1) его состав С12Н|60:, выведенный из анализа
производных и отличающийся от состава
метилжасмоната С13Н2оОз, установленного
непосредственным анализом;
2) отсутствие метоксильной группы СНйО в се-
микарбазоне и динитрофенилгидразоне
«кетолактона»;
3) различие констант дпнитрофенилгидразонов
«кетолактона» и метилжасмоната.
В активе Демоля, Ледерера и Мерсье —
казалось бы убийственные факты:
1) эфирное масло жасмина содержит только
одно неизвестное вещество, содержащее группу
СО — метилжасмонат;
2) строение метилжасмоната установлено с
абсолютной надежностью и, следовательно, с
абсолютной надежностью доказана индивидуальность
зтого вещества.
Вывод? Он кажетсн совершенно очевидным:
Нав и Грамполов ошиблись, никакого особого
«кетолактона» в эфирном масле жасмина нет, зто
всего лишь результат «грязной» работы.
Но возражение все-таки остается возражением,
и на него надо отвечать. И поэтому спустя еще
несколько месяцев в том же журнале появилась
еще одна статья, подписанная на этот раз только
одним автором — Демолем (вопрос с «кетолакто-
ном» казался настолько простым и ясным, что
Ледерер и Мерсье, по-видимому, просто не сочли
нужным участвовать в этой работе). Статья
называлась «О карбонилсодержащих компонентах
• эфирного масла жасмина (Jasminum grandiflo-
rum L.)» *.
* Helv. Chim. Acta, 45, № 6, 1951 J1962J.
51
Работа зта отличалась завидной
обстоятельностью. Чтобы рассеять все сомнения, Демоль
пустил в ход «тяжелую артиллерию» —
масс-спектрометрию, один из наиболее чувствительных и
надежных современных методов исследования
органических соединений.
Но для вящей убедительности Демоль
скрупулезно повторил эксперименты Нава и Грамполо-
ва, выполненные в 1942 году, причем на двух
образцах эфирного масла, полученных из
жасминов египетской и итальянской разновидностей.
Вот что пишет об этом сам Демоль:
«Мы уже высказывали гипотезу о возможной
идентичности этих двух соединений (то есть «ке-
толактона» и метилжасмоната. — В. Б.), но Нав и
Грамполов в своем недавнем возражении
категорически исключили эту возможность. Так как мы
никогда не находили «кетолактона» в ходе
наших собственных исследований, выполняемых,
правда, в другом стиле другими методами, то мы
сочли необходимым повторить часть работы,
выполненной этими авторами, чтобы, наконец,
сопоставить их результаты с нашими».
В заключение Демоль пишет:
«...Мы не смогли подтвердить существования
кетолактона C12Hie03 в эфирном масле жасмина,
даже используя наиболее чувствительные
методы исследования. В этом отношении результаты
масс-спектрометрического исследования особенно
показательны, так как ни один из спектров
различных кетонных фракций, как очищенных, так
и неочищенных, не содержал молекулярного
иона те 208, ожидаемого для этого вещества.
Поэтому можно сделать вывод, что «кетолактон»,
выделенный Навом и Грамполовым,
представляет собой на самом деле, как мы уже
предполагали, слегка загрязненный препарат
метилжасмоната: это соединение неизбежно должно
присутствовать в продукте, полученном зтими авторами».
...КОНЧИВ ЧИТАТЬ статью Демоля и переведя
взгляд на следующий заголовок, трудно было
удержаться от улыбки. Это была... статья Нава и
Грамполова «О карбопил со держащих составных
частях эфирного масла жасмина» *. Начиналась
она так:
«Имеется факт, который не подобает
игнорировать. Семикарбазон и динитрофенплгидразон
кетолактона не содержат метоксильных групп.
Этот факт, установленный еще в 1942 году, был
подтвержден в 1962 году».
Этого Нав и Грамполов сочли (и как мы уви-
* Helv. Chim. Acta, 45, № 6, 1955 |1962).
52
Дим в дальнейшей, вполне обоснованно)
достаточным для того, чтобы начать анализировать...
ошибки Демоля! Может быть, Демоль каким-то
образом «потерял» их вещество? Может быть, зто
вещество разложилось в ходе выделения? Может
быть, наконец, образцы эфирного масла,
изученные Демолем, не содержали «кетолактона» в силу
случайных сезонных изменений?
Одним словом — с больной головы на
здоровую. Только так и можно было расценивать но-
ВБ1Й выпад Нава и Грамполова. Ведь в отличие от
Демоля они не сделали сами ни одного нового
эксперимента, полностью основывая свои
заключения на сомнительных (разумеется, с
современной точки зрения) данных двадцатилетней
давности. Сознавая неловкость своего положения,
авторы в заключение пишут:
«Мы глубоко сожалеем, что выполнение
программы наших насущных исследований лишает
нас возможности немедленно возобновить
изучение эфирного масла жасмина».
Но далее, в резюме, все же декларируют:
«Кетолактон, открытый Навом и
Грамполовым, не является загрязненным препаратом
метилжасмоната, как заявляет Демоль.
Производные кетолактона, а именно, семикарбазон и ди-
нитрофенилгидразон, не содержат метоксильных
групп».
О том, насколько несолидными казались все
эти возражения, свидетельствует хотя бы то, что
тотчас вслед было помещено следующее
примечание:
«Редакция объявляет закрытой дискуссию по
данному вопросу в этом журнале»...
ПРОШЕЛ почти целый год, и история с «кето-
лактоном» постепенно стала забываться. Но что
это? Снова в том же журнале читаем знакомый
заголовок «О карбони л содержащих соединениях
эфирного масла жасмина Jasminum grandiflo-
rum L.» *. Но самое поразительное, зта статья
была подписана Навом, Грамполовым и... Демолем!
Не будем интриговать читателя. Вот резюме
зтой статьи:
«Кетолактон С12Н1603, открытый в 1942 году
Навом и Грамполовым в эфирном масле
итальянского жасмина, был обнаружен при помощи
газожидкостной хроматографии в двух египетских,
итальянской и французской разновидностях
жасмина; он был идентифицирован в виде своего се-
микарбазона и динитрофенилгидразона, а также
с помощью масс-спектров.
* Helv. Chim. Acta, 46, № 3r 1006 |1963].
Как нашел Демоль, основным компонентом
каждой кетонной фракции является метилжас-
монат».
Вот уж воистину: и овцы целы, и волки
сыты... Но что же все-таки произошло? Почему
Демоль не смог ни выделить, ни далее обнаружить
кетолактона?
В какой-то мере этот результат оказался
следствием неожиданного стечения неблагоприятных
(для Демоля, разумеется) обстоятельств.
Во-первых, содержание кетолактона в кетонных
фракциях эфирного масла, исследованного Демолем,
оказалось значительно меньшим, чем во
фракциях, исследованных Навом и Грамполовым
D,2—14,4 процента у Демоля по сравнению с
35 процентами у Нава и Грамполова); это можно
отнести за счет естественных изменений
химического состава растительного сырья. Во-вторых,
выяснилась любопытная особенность этого
вещества: при его масс-спектрометрическом
определении интенсивность пика гп/е 208 (который
пытался обнаружить Демоль в предыдущей работе)
оказалась значительно меньше интенсивностей
пиков жасмона т/е 164 и метилжасмоната т/е
224 при условии, что все эти вещества находились
в смеси в равных концентрациях. Естественно,
что хотя кетолактон и присутствовал в эфирных
маслах, изученных Демолем, обнаружить его
этим методом не удалось.
ТАК НЕОЖИДАННО мирно закончилась эта
своеобразная дуэль. Впрочем, что-то не слышно,
чтобы кто-нибудь из ее участников занялся
изучением структуры злополучного вещества. Так
иногда бывает: после того как соперники
помирились, они могут и забыть о предмете раздора...
И все же в этой, хотя и несколько комической
истории, нашел отражение основной закон
научного исследования: ученый должен уметь не
только отстаивать свою точку зрения, но и
критически относиться к своим выводам, какими
бесспорными они бы ему ни казались. Потому что
научная истина дороже научного авторитета.
Переводы из статей И.-Р. Нава, А. В. Грамполова,
Э. Демоля, Э. Ледерера и Д. Мерсье
подготовил Л. В. БАКИНОВСКИЙ
новости отовсюду
ЛИТОЙ ЧЕМОДАН
Из каких материалов делают
чемоданы! Пожалуй, чаще всего из
фибры. Она легка и дешева, но, к
сожалению, недостаточно прочна,
особенно на сгибах. Поэтому-то
на фибровых чемоданах всегда
ставят металлические уголки.
Чемодан из полипропилена
обладает легкостью фибры, но он
значительно прочнее. Это не
единственное преимущество
полипропилена. Чемодан из него
гораздо легче изготовить — на
питьевой машине. Внутрь формы
вставляют металлические
детали — замки, пряжки — ив форму
впрыскивают расплавленный
пластик. После охлаждения
получается половина чемодана. Вторую
половину делают точно также, и
затем их соединяют. Чемодан
готов. Никакой отделки ему не
требуется — все детали уже на
месте, а красить пластик не надо —
он и без этого достаточно красив.
БЕСШУМНЫЕ АВТОМОБИЛИ
Американские фирмы,
разработавшие электрохимические
источники энергии для космических
кораблей «Джемини», начали
работать над компактным
электродвигателем для автомобиля. Перед
конструкторами стоят две задачи:
уменьшить размеры и увеличить
мощность электрохимических
источников. Если эти задачи будут
решены успешно, то, возможно,
уже в 1970 году появятся
бесшумные и легко управляемые
легковые машины, которым не нужен
бензин. Основное достоинство
таких машин — полное отсутствие
выхлопных газов, загрязняющих
атмосферу городов.
Какие же источники тока
предполагается установить на
автомобилях! Точного ответа на этот
вопрос пока еще нет, но большие
надежды возлагаются на так
называемые элементы воздушной
деполяризации. Энергия в них
вырабатывается в процессе
окисления цинка кислородом воздуха.
НОВОСТИ ОТОВСЮДУ
53
ТИТРОВАНИЕ
БЕЗ БЮРЕТКИ
Доктор химических наук
П. Н. ФЕДОСЕЕВ
Сказать, что титровать можно и
без бюретки, — это все равно что
заявить, например, будто хлеб
можно выпечь без печки.
Действительно, можно ли при
объемном анализе обойтись без
бюреток и других точных
измерительных приборов!
— Нет, — скажет
химик-аналитик.
— Можно, — ответим мы ему.
Объемный метод анализа *
основан на способности веществ
реагировать без остатка в
количествах, прямо пропорциональных их
эквивалентам; при этом
окончание реакции определяется с
помощью так называемых
индикаторов — веществ, резко
изменяющих свои свойства (например,
окраску) в точке
эквивалентности.
При объемном анализе
пользуются нормальными растворами,
концентрация которых выражена
числом грамм-эквивалентов
вещества, содержащихся в литре
раствора. Поэтому растворы
одинаковой нормальности реагируют
друг с другом равными объемами,
объем на объем; если один из
грименяемых растворов окажется
менее или более
концентрированным, то для титрования его
потребуется соответственно больше
или меньше.
Пусть, например, дпя анализа
* Об одной из разновидностей
объемного метода — комплексо-
нометрии — рассказывалось в
майском номере нашего журнала за
этот год. — Ред.
взято 50 миллилитров серной
кислоты неизвестной концентрации и
на ее нейтрализацию пошло 15,5
миллилитров децинормального (то
есть содержащего 0,1
грамм-эквивалента на литр) раствора
щелочи. Спрашивается, какова
концентрация серной кислоты!
Ответить на это вопрос можно очень
просто: в 50 миллилитрах @,05
питра) раствора содержится
столько грамм-эквивалентов
серной кислоты, сколько
грамм-эквивалентов щелочи содержится в
15,5 миллилитрах @,0155 литра) ее
децинормального раствора, то
есть 0,0155 - 0,1 = 0,00155 грамм-
эквивалента; следовательно,
раствор серной кислоты 0,00155:
: 0,05 > 0,03 нормальный.
Для того чтобы провести
объемный анализ, нужно иметь, во-
первых, растворы веществ с
известными концентрациями (а
чтобы их приготовить, требуются, в
свою очередь, весы и точная
мерная посуда) и, во-вторых,
пипетки и бюретки, с помощью которых
определяются объемы взятого на
анализ и пошедшего на титрование
растворов. Полный набор
необходимого для титрования
оборудования изображен на рисунке
слева.
Несмотря на простоту и
доступность, объемный метод обладает
одним существенным недостатком:
он трудно поддается
«индустриализации». Иначе говоря,
промышленность не может взять на себя
всю черновую работу по
приготовлению необходимых растворов,
оставив аналитикам только
наиболее ответственную операцию —
само титрование *. Аналитики
сами готовят себе впрок самые
разнообразные растворы,
устанавливают их концентрации, следят за
их стабильностью. На это уходит
уйма квалифицированного
труда — вспомогательные операции
подобного рода отнимают более
90 процентов рабочего времени.
Метод безбюреточного
титрования появился недавно, он на
сотню с лишним лет моложе
обычного объемного анализа. Однако
это метод сулит такие удобства,
что, надо полагать, в ближайшие
годы он получит повсеместное
распространение.
В чем же особенность этого
метода! Как можно при
объемном анализе обойтись без
бюреток и других точных
измерительных приборов!
Если раствором какого-либо
реагента равномерно пропитать
длинную узкую полоску
фильтровальной бумаги с нанесенными на
нее делениями, затем эту полоску
высушить и определить копичест-
* Надо отметить, что
промышленностью выпускаются так
называемые фиксаналы —
запаянные в ампулы растворы,
содержащие точные навески
веществ. Если содержимое ампулы
перенести в мерную колбу и
разбавить водой до определенного
объема, то получится раствор с
точно известной концентрацией.
Однако фиксаналы не снимают
полностью проблему
«индустриализации» объемного анализа. —
Ред.
54
Слева — аппаратура, необходимая для
объемного титрования: а — весы; б — бутыли
с нормальными растворами; в — бюретки;
г — склянки с индикаторами; д — пипетки;
е — мерные колбы
Справа — аппаратура, необходимая для
безбюреточного титрования: а—
реактивная бумага; б — колба с делениями
во реагента, приходящееся на
одно деление (ведь поскольку
полоска имеет всюду одинаковую
ширину, можно говорить о
количестве реагента, приходящегося
не на единицу площади, а на
единицу длины), то полоску такой
реактивной бумаги можно применять
вместо бюретки с помещенным в
нее стандартным раствором.
Чтобы провести титрование, в этом
случае надо отрезать кусочки
реактивной бумаги и бросать их в
копбу с помещенным в нее
определенным количеством раствора,
концентрацию которого
требуется установить. Точка
эквивалентности определяется любыми из
известных методов (кстати,
реактивная бумага может содержать
и индикатор), а расчет
становится еще проще обычного:
например, если цена одного деления
выражена в грамм-эквивалентах,
то достаточно эту величину
умножить на длину израсходованной
полоски бумаги и разделить на
объем титруемого раствора в
литрах. А если для анализа
берется все время один и тот же
объем раствора, то реактивную
бумагу можно сразу же програ-
дуировать в единицах
нормальности.
Каковы достоинства
безбюреточного метода титрования!
При титровании без бюретки
отпадает необходимость готовить
прозапас большое количество
различных растворов, становятся
излишними многочисленные
подготовительные операции,
отнимающие у работников
аналитических лабораторий так много
драгоценного времени; ненужными
становятся бюретки, пипетки,
мерные колбы, весы и прочее
оборудование; анализы можно
делать не в специально
оборудованных лабораториях, а в любом
месте — у производственного
агрегата, в попе; техника анализа и
методика расчета настолько
упрощаются, что анализы могут
выполнять лаборанты и рабочие, не
имеющие специальной
химической подготовки, причем точность
этого метода подчас не уступает
точности обычного объемного
анализа, а иногда может оказаться и
более высокой.
Реактивная бумага пригодна и
для других целей: с ее помощью
можно быстро (причем, без
весов) готовить растворы любых
концентраций, без взвешивания
дозировать микроудобрения и
даже лекарства.
Титрование без бюретки депает
пишь первые шаги. Но даже
нескольких приведенных примеров
вполне достаточно для того,
чтобы судить о выгодах и удобствах,
которые оно сулит при широком
внедрении в повседневную
химическую практику.
Единственно о чем
приходится сожалеть — это о том, что
широкое производство
реактивной бумаги пока еще не
налажено...
55
«г
ВОДОРОСЛИ
ОЧИЩАЮТ РЕКИ
НОВОСТИ ОТОВСЮДУ
Серьезную опасность дпя всего
населения водоемов представляет
сильно ядовитый феноп,
сбрасываемый в реки со сточными
водами химических предприятий.
Количество фенопа,
попадающего в природные воды, все
возрастает.
В связи с этим большой
интерес вызывает оригинальный
метод борьбы с фенольным
загрязнением, разрабатываемый в ФРГ.
Сотрудница Лимнологической
станции Общества имени Макса
Планка К. Зайдель обнаружила,
что некоторые водоросли
извлекают фенол из воды. Особенным
«аппетитом» к нему отличается
водоросль Schoenoplectus lacus-
fris. Содержание фенопа в ней
наиболее интенсивно возрастает
летом, зимой его поглощение
падает, но не прекращается.
ТКАНЬ-ХАМЕЛЕОН
Широко известны
вещества-индикаторы, меняющие свой цвет в
зависимости от того, в какой
среде — кислой ипи щелочной — они
находятся. Одна американская
фирма, производящая ткани,
использовала подобные красители
для того, чтобы «обойти»
конкурентов. Реклама этой фирмы
может звучать приблизительно так:
«Вам надоел цвет вашей
рубашки! Вы можете мгновенно
перекрасить ее, погрузив в раствор
магического порошка,
прилагаемого к ткани при продаже».
Разумеется, ничего
сверхъестественного в зтом порошке нет — он
содержит в качестве основного
компонента лимонную кислоту.
Под действием кислоты краситель
(в нем-то и весь секрет!)
изменяет свой цвет. Например,
зеленая ткань превращается в
желтую, а коричневая — в
оранжевую.
ПРИТАИВШАЯСЯ
РАДИАЦИЯ
Как сообщает журнал «Popular
science» A966, № 3|, ученые Кор-
непьского университета
обнаружили, что некоторые продукты
питания, консервируемые
облучением, приобретают свойства,
опасные дпя... растений. Дело в
том, что вещества, содержащиеся
в пище, могут превращаться под
действием радиации в такие
химические соединения, которые
хотя сами и не радиоактивны,
оказывают на растительные
клетки такое же воздействие, как и
радиация. Например, клетки
моркови перестают расти в
облученном молоке кокосового ореха,
которое обычно стимулирует их
развитие.
ВОДОРОСЛИ
ГОТОВЫ К СТАРТУ
Идея использовать водоросли для
регенерации воздуха в кабинах
космических кораблей не нова.
Но до сих пор она была
предметом лишь теоретических
исследований. И только сейчас появилась
реальная перспектива ее
практического осуществления. Как
сообщает журнал «Technology Week»,
е США изготовлена действующая
регенерационная установка,
построенная на этом принципе.
Морские водоросли, взвешенные
в воде, циркулируют в ней по
системе труб, освещенных
флуоресцентными лампами. В трубы
подается отработанный воздух с
высоким содержанием
углекислоты. Водоросли в ходе
фотосинтеза усваивают углекислоту и
выделяют кислород, который подается
в кабину. В ближайшее время
предполагается провести
испытания установки
продолжительностью 60 дней с участием двух
экспериментаторов.
СИЛОС —ДЛЯ ЧЕЛОВЕКА!
До сих лор зеленая масса
большинства растений использовалась
только на корм скоту, а человек
оставлял на свою долю то, что
повкуснее: ягоды, семена, клубни.
Но, оказывается, можно и из
листьев изготовлять вполне
съедобную пищу дпя человека. Так,
по крайней мере, утверждают
сотрудники Ротхэмстедской
экспериментальной станции (Англия).
Здесь измельчают листья сахар*
ной свеклы ипи гороха и отжи*
мают из них богатый белками сок*
Этот сок быстро нагревают,
чтобы бепок свернулся, и
полученный экстракт прессуют.
Получаются брикеты концентрата, похожие
на сыр, только темно-зеленого
цвета. 60% веса брикетов
приходится на воду, остальное — белок,
по своей питательности
превосходящий белки пшеницы ипи
ячменя и не уступающий мясному
белку. На вкус концентрат, правда,
довольно своеобразен и
напоминает нечто среднее между
шпинатом и чаем. Но его можно
добавлять в тесто, депать из него
пельмени или котлеты.
Особенно перспективно
применение этого нового вида пищи
в тропиках, где растения быстро
наращивают зеленую массу.
Белковый концентрат, изготовленный
по методу английских ученых, уже
применяют на Ямайке, в Индии и
Израиле.
56
ПРОЗРАЧНАЯ РЕЗИНА
Ко многим достоинствам резины
прибавилось еще одно. В США
взят патент на способ
изготовления прозрачной резины. Чтобы
сделать резиновую смесь
прозрачной, в ее состав в качестве
наполнителя вводится
тонкодисперсная гидроокись кремния и,
кроме того, добавки
азотсодержащих соединений. Испытания
показали, что прозрачные
резины обладают повышенной
прочностью.
КЛУБНИКА
В АЗОТЕ
Океанский корабль доставил в
Лондонский порт клубнику из
Калифорнии. Ягоды были сорваны
уже созревшими, но
двухнедельная прогулка по океану на них
никак не отразилась — казалось,
что их только что сорвали.
Секрет здесь в системе
обработки ягод, получившей название
«окситроль». Суть этой системы в
том, что перед транспортировкой
в контейнер нагнетают азот,
который полностью вытесняет
кислород. Скоропортящиеся продукты
оказываются при этом в полной
безопасности. И только после
вскрытия контейнера вновь
начинают идти биохимические
процессы, приводящие в конечном
счете к порче продуктов.
Конечно, полностью
созревшие ягоды, фрукты и овощи
вкуснее и полезнее недозревших,
которые «доходят до кондиции» во
время транспортировки. И
система «окситроль» дает возможность
морскому и наземному
транспорту конкурировать с авиацией при
перевозках скоропортящихся
грузов.
ОКИСЛИТЕЛЬ — ВОДА
По сообщениям зарубежной
печати, фирма «Юнайтед Текно-
лоджи» разработала портативный
реактивный двигатель размером
с заплечный ранец, который уже
прошел стендовые испытания.
Особенность этого двигателя
состоит в том, что в качестве
окислителя применяемого в кем
твердого топлива служит
впрыскиваемая в камеру сгорания вода.
Горение начинается, как только
вода входит в соприкосновение с
топливом, и прекращается, когда
ее перестают подавать в камеру.
Температура в камере сгорания
достигает 2200С.
ЕЩЕ ОДИН
КОНКУРЕНТ «КОПИРКИ»
Одна из английских фирм начала
выпускать бумагу, позволяющую
получать копии документов, не
пользуясь привычной «копнркой».
Для печатания документа с
копиями используются листы
бумаги трех типов. Первый экземпляр
печатается на листе, обратная
сторона которого покрыта
специальным споем, состоящим из
множества желатиновых
пузырьков, заполненных бесцветной
«проявляющей» жидкостью.
Когда клавиша пишущей машинки
ударяет по листу, желатиновые
пузырьки разрушаются, и
жидкость из них попадает на
лицевую сторону второго листа. Она
покрыта другим составом,
включающим пигмент, который
«проявляется» под действием этой
жидкости. Обратная сторона всех
промежуточных листов (начиная
со второго) тоже покрыта
желатиновыми пузырьками с
«проявителем». Так изображение букв
передается на третий, четвертый,
пятый экземпляры документа.
Последний лист покрыт только
пигментным слоем — в
«проявителе» уже нет необходимости.
Этим способом можно
одновременно получать пять-семь
копий при работе на пишущей
машинке и от трех до шести копий
при письме карандашом или
шариковой ручкой. Полученные
документы можно хранить до
десяти лет, копии получаются
чистыми, без каких-либо пятен и полос.
Что входит в состав
«проявляющей жидкости», какой
применяется пигмент — об этом
французский журнал «Papier, carton
et cellules» A966, № 1—2) не
сообщает. Можно топько
предположить, что используются азо- и
диазосоединения, аналогичные
применяемым при
светокопировании.
Рисунки В. ЗУЙКОВА
43ВЬ
■НОВОСТИ ОТОВСЮДУ •••
57
/
«ДУРНОЙ ВОЗДУХ»
Малярия — одна из самых старых болезней,
известных человечеству. Еще Гиппократ
описывал приступы лихорадки, чередующиеся
.через определенные промежутки времени.
В средние века малярийные эпидемии
опустошали целые области. В царской России
малярия занимала первое место среди
заразных заболеваний. Считается, что и в
наше время половина человечества живет в
условиях, способствующих распространению
этой болезни. До сих пор от малярии
ежегодно гибнет до 2,5 млн. человек.
Слово малярия образовалось от
итальянских слов «mala» и «aria», что в переводе
значит «дурной воздух». В названии
отразилось правильное наблюдение — малярией
страдают обычно жители жарких и влажных
_ стран — тех мест, где дурной, плохой воз-
^ дух, который и считали причиной болезни.
^ Только к концу XIX века были получены
-< достоверные научные сведения о возникно-
ь- вении малярии. В 1880 году французский
о| врач и исследователь А. Лаверан, работав-
■< ший тогда в Алжире, установил, что возбу-
ш дители малярии — паразиты из рода плаз-
^ модий. А через 15 лет в 1895—1897 годах
О английский врач Росс обнаружил в Индии
_ переносчиков малярии — комаров анофе-
И лес.
^ Первым и долгое время единственным в
У арсенале медиков веществом, убивающим
«< малярийных плазмодий, был алкалоид * хи-
о.
* Об алкалоидах подробно рассказано в «Химии
Ф и жизни» № 6 за 1966 г.
58
ХИНИН
л. солодкин
Рисунки Е. СКРЫННИКОВА
ОРУЖИЕ ПРОТИВ МАЛЯРИИ
нин. Хинин C20H24O2N2 — это
кристаллическое вещество с температурой плавления в
безводном состоянии —176°С. Он плохо
растворяется в воде, но хорошо — в спиртах и
эфирах. Обычно хинин кристаллизуется с
несколькими молекулами воды; гидраты
хинина растворимы в воде. В воде
нерастворима только соль хинина (хинине •
H2SO4 ■ 8Н2О — этим свойством ее
пользуются для отделения хинина от других
алкалоидов.
Синтез хинина разработан только в
самое последнее время, он очень сложен и
дорог. Поэтому в основном его добывают
из коры хинного дерева — цинхоны.
Цинхона — это либо вечнозеленые
маловетвистые деревья высотой до 25 метров,
либо крупный кустарник с мелкими
желтыми, белыми, розовыми или малиновыми
цветами, собранными в метелки наподобие
нашей сирени. Они растут по влажному
склону Анд в Южной Америке на высоте
1600—2400 метров над уровнем моря.
Растет цинхона мелкими группами или
поодиночке. Нигде не встречается ни зарослей,
ни тем более больших массивов. Разработка
цинхоны сводилась к вырубке
дикорастущих деревьев и снятии с них коры. И уже к
началу XIX века ее запасы на континенте
катастрофически уменьшились, а
культивировать хинное дерево в Южной Америке
не удавалось.
Совершенно неожиданно цинхона
прижилась совсем в другой части света — на
Яве, на Цейлоне и на склонах Гималаев в
Индии. Ява стала давать до 90 процентов ми-
ровой добычи хинной коры. Причем в
гибридах, выведенных на Яве, содержалось до
26 процентов алкалоидов, тогда как в
южноамериканских сортах их было от 5 до
15 процентов.
Хинин из коры добывают так.
Культурные посадки хинного дерева выращивают
до двадцатилетнего возраста, затем деревья
срубают и даже выкорчевывают пни, в
которых много хинина. Снятую кору сушат в
токе горячего воздуха при температуре
70°С. Недосушенная кора плесневеет и
теряет хинин, при пересушке его также
становится меньше. На фабриках кору
измельчают в муку, а затем обрабатывают
известью и едким натром, чтобы отделить
дубильные кислоты, а оставшиеся в коре
основания извлекают бензолом или
толуолом. Из этих растворов сумма алкалоидов
экстрагируется серной кислотой. При
нейтрализации получившегося раствора
сульфатов в кристаллическом виде остается только
нерастворимый в воде сульфат хинина
(хинин^ • H2S04 • 8Н20, из которого и выделяют
хинин.
По своему действию на живую клетку
хинин — протоплазматический яд. Действуя
на клетку, он вызывает угнетение и паралич
ее протоплазмы. Лекарственное действие
хинина основано на том, что клетки
человека к этому яду устойчивы, а протоплазма
одноклеточных, особенно плазмодий, не
выдерживает даже малых его концентра^
ций.
ОТКРЫТИЕ
К сожалению, история не сохранила имени
благодетеля человечества, открывшего
хинин. Известна только легенда о больном
перуанском индейце, который, сходя с ума
от лихорадки и жажды, бесцельно бродил
по джунглям. Случайно он подошел к луже,
в которой лежало поваленное дерево.
Страдающий индеец бросился к воде и стал
жадно пить. Сн почувствовал, что у воды
горький привкус и решил, что она отравлена
соками поваленного дерева. Это было
дерево хина-хина, считающееся у индейцев
ядовитым. Несмотря на это, индеец продолжал
пить — быстрая смерть казалась ему
желаннее, чем мучения от приступа лихорадки.
И случилось чудо. Вместо смерти вода
принесла исцеление, лихорадка постепенно
проходила. Вскоре он был совершенно здоров...
Болезнь, которой страдал индеец, была
обычна в этом районе, и местные жители,
узнав о чудодейственном излечении от нее,
стали применять кору дерева хина-хина как
лекарство против лихорадки.
Слухи о лекарстве дошли до испанских
завоевателей. Точно установить, когда это
случилось, невозможно. В двух испанских
книгах о медицине инков, изданных в
1 553 году, сведений о коре хинного дерева
еще нет. Но в 1630 году иезуитские
миссионеры в Перу уже знали о лечебном дейст-
59
вии коры, которую они называли
«иезуитской корой». Существовали и другие
названия: «перуанская кора», «порошок
графини», и, конечно, «хинная кора».
Долгое время считалось, что в Европу,
в Испанию, кору завезла жена вице-короля
Перу графиня Цхинхона (ее имя происходит
от названия древнего перуанского племени
Цхинха. В Перу еще и сейчас есть остров и
поселение с таким названием). Но через
300 лет было доказано, что графиня умерла
на корабле, не достигнув берегов
Колумбии. Однако имя ее сохранилось в научном
названии хинного дерева — цинхона.
Впервые его ввел в обиход шведский ботаник
Карл Линней, чтобы увековечить память
человека, впервые, как он думал, одарившего
европейцев хинином. Но Линней ошибся, и
вместо цхинхоны получилось цинхона.
Первое в Европе исторически
достоверное упоминание о хинной коре появилось
в диссертации Германа ван дер Гайдена,
опубликованной в 1643 году в Антверпене.
Хинная кора была в те времена
буквально на вес золота. Иезуиты, которые ввозили
ее в Испанию, меняли кору на равное
количество драгоценного металла. Ловкие
дельцы продавали кору хинного дерева как
панацею от всех болезней.
СТРОЕНИЕ
В хинной коре — более 20 алкалоидов, и до
начала XIX века не было известно, какой из
них обладает ценными целебными
свойствами. В 1820 году французские химики П. Пел-
летье и Ж. Кавенту, оба профессора
фармацевтической школы в Париже, впервые
выделили активное начало хинной коры —
хинин и близкий к нему алкалоид цинхонин.
В середине прошлого века еще не были
известны мощные физические методы
исследования вещества, такие как
инфракрасная спектроскопия, рентгеноструктурный
анализ. Химики вынуждены были идти
длинным и трудным путем чисто химического
анализа. Для установления структуры
хинина потребовалось более шестидесяти лет
кропотливого и изобретательного труда.
Первые сведения о строении
алкалоидов класса хинина принадлежат
французскому химику Жерару. В 1842 году при
плавлении цинхонина с калийной щелочью
он получил смесь продуктов, из которой
выделил известное соединение хинолин:
5 4
8 N
Таким образом, была доказана связь хинина
с хинолином. В дальнейшем из этой смеси
удалось выделить З-этил-4-метилпиридин.
(Тем читателям, которым подобные
названия органических веществ кажутся бес-
GO
смысленным набором букв и цифр, мы
советуем прочесть статью А. Азимова «И вы
можете говорить по-гэльски» в № 9 за
этот год.)
В 1858 году, действуя на цинхонин
кислотными реагентами, аналитики показали,
что в его молекулу входит группа ОН;
через 50 лет стало ясно, что эта группа входит
в состав группировки СНОН.
Еще один шаг к установлению структуры
хинина — при полном окислении хинина и
цинхонина в обоих случаях получается
соединение мерохинен C9H15O2N и кислоты,
которые различаются между собой только
тем, что в случае хинина в положении «6»
хинолинового кольца находится метоксиль-
ная группа, а в случае цинхонина этой
группы нет. Из этих данных прямо следовал
вывод, что раз продукты окисления хинина
отличаются от продуктов окисления
цинхонина только этой метоксильной группой, то
и сами исходные алкалоиды отличаются
друг от друга только такой же группой.
Наконец, суммируя накопленные данные,
П. Рабе в 1908 году предложил структурную
формулу хининовых алкалоидов, которая
вскоре была признана всеми химиками.
Взглянув на эту формулу, вы убедитесь, что
химики не сидели сложа руки.
Н2С,
СНОН — НО
I
N
н
I
./ | Ч.пн — сн =
сн2
I
сн2
СН — СН = СНа
СНо
После установления структурной
формулы хинина можно было приступить к его
синтезу. Этого настоятельно требовала
промышленность — технология производства
хинина из коры, во-первых, очень
трудоемка, а во-вторых, большинство стран
вынуждено работать на привозном сырье: в наше
время хинное дерево культивируют только
на Яве.
Полный синтез хинина, начатый Р. Вуд-
вордом в 1910 году и В. Д. Дерингом в
1917, был завершен только в 1944 году.
Многостадийный синтез хинина включен в
число научных достижений Вудворда, за
которые в 1965 году он был удостоен
Нобелевской премии.
ХИНИН
и современная
фармакология
Кандидат медицинских наук
В. М. АБАКУМОВ
Несмотря на большие успехи медицины, на
земном шаре и сейчас насчитывается до
700 миллионов больных малярией. Эта
болезнь — серьезное препятствие при
освоении обширных районов тропической и
субтропической зон Земли. Поэтому с
огромным размахом ведутся изыскания новых
синтетических противомалярийных
препаратов.
Чтобы понять, почему фармакологов не
совсем удовлетворяет хинин, нужно хорошо
представлять себе ход заболевания
малярией. Дело в том, что ее возбудители
проделывают сложный цикл развития — частично
в организме человека, частично в теле
комара (см. цветную вклейку).
Когда зараженный комар кусает
человека, в кровь проникают одноядерные формы
малярийного паразита. Они разносятся по
кровеносной и лимфатической системам,
проникают в клетки печени, развиваются
там, растут и спустя 6—8 дней (в зависимо-
61
сти от вида паразита) делятся на большое
число мелких одноклеточных форм,
способных проникать в красные кровяные тельца
крови — эритроциты. Это первый этап
развития малярийного плазмодия в теле
человека.
Второй этап протекает внутри
эритроцитов. Там возникшие формы паразита
созревают и вновь делятся. В результате
эритроциты разрушаются, и молодые формы
возбудителя вновь попадают в плазму крови.
В этот момент у человека и начинается
приступ лихорадки.
Часть молодых форм плазмодия вновь
внедряется в эритроциты, и цикл развития
их там повторяется, с чем связаны
повторные приступы лихорадки. Часть же их
видоизменяется и циркулирует в крови (третий
этап развития). При этом они не приносят
ущерба организму человека, но... первый
же комар, укусивший человека, заражается
плазмодиями, и в его теле они в процессе
дальнейшего развития (четвертый этап)
снова превращаются в опасные для человека
формы, а комар — в переносчика болезни.
Один из главных недостатков хинина и
заключается в том, что он действует на
плазмодии только на протяжении второго этапа
их развития, когда они находятся внутри
эритроцитов. На первом и третьем этапах
хинин бессилен.
Поэтому усилия фармакологов были
направлены прежде всего на изыскание
препаратов, способных уничтожать
возбудителей малярии в самые различные моменты их
развития.
В 1925 г. за рубежом в лечебную
практику был введен плазмохин —
производное 8-аминохинолина. Он уступает хинину по
действию на возбудителей, развивающихся
в эритроцитах, но зато уничтожает
видоизмененные формы паразита, которые долгое
время после лечения хинином циркулируют
в крови и способны заражать комаров. Этот
препарат имел огромное значение для
борьбы с распространением тропической
малярии. Подобное же лекарство,
получившее название плазмоцид, было
синтезировано в СССР О. Ю. Магидсоном с
сотрудниками и изучено И. Л. Кричевским.
В 1930 году в Германии был
синтезирован атребин — производное 9-аминоак-
ридина. Этот препарат, как и хинин, не влиял
на те формы возбудителя, которые
погибали от плазмоцида, но в остальных случаях
был гораздо эффективнее хинина. Немецкие
химики хранили в тайне строение атребина,
но в 1933 г. И. Л. Кнунянц и его сотрудники
разработали методику синтеза этого
препарата, получившего в СССР название
акрихин.
В капиталистических странах внедрение
атребина в лечебную практику встречало
значительное сопротивление со стороны
хинных концернов. СССР стал первой
страной в мире, где население было полностью
обеспечено новыми антималярийными
лекарствами.
Дальнейшие работы по синтезу
противомалярийных препаратов в ряду
производных 8-аминохинолина и 9-аминоакридина
привели к созданию новых эффективных
средств. Долгое время для молекулы
противомалярийного препарата считалось
обязательным наличие 6-метоксигруппы, и
предложения синтезировать аналогичные
соединения без нее, но с атомом хлора в
хинолиновом ядре, не встречали сочувствия.
Однако именно такие соединения
впоследствии оказались наиболее ценными из
огромного количества вновь созданных
препаратов. В лечебную практику был введен
сходный по действию с акрихином, но не
окрашивающий в желтый цвет кожу
больных хлорохин; к этой же группе
относится полученный В. И. Ставровской ц и к л о-
хин. Из производных 8-аминохинолина
наибольшее значение приобрел х и н о ц и д,
близкий по строению к плазмоциду. Курс
лечения хиноцидом вслед за обычным
курсом лечения хинином или акрихином
позволяет радикально излечивать малярию.
Так хинин стал родоначальником целой
группы новых синтетических
антималярийных средств.
Однако перечисленные средства были
лечебными, но не профилактическими.
Важно было отыскать и такой препарат,
который уничтожал бы возбудителя малярии и
на первом этапе развития — те его формы,
которые попадают в организм человека при
укусе зараженного комара. Такое лекарство
было синтезировано в 1945 г. и получило в
СССР название бигумаль. Это соединение
нового типа — производное бигуанидина
без гетероциклического ядра:
CI — f 4nH-C-NH-CNH-CH(CH3K
\=/ i| ||
Ш NH
E2
Даже при кратковременном приеме би-
гумаль полностью гарантирует от
заболевания тропической малярией.
Казалось бы, столь разнообразные
синтетические препараты должны были
полностью вытеснить из терапевтической
практики дорогой, трудно синтезируемый хинин,
который к тому же иногда оказывает
вредное побочное действие (вызывает головные
боли, ухудшение слуха). Но этого не
случилось по двум причинам.
Во-первых, известные нам формы
малярии вызываются возбудителями четырех
видов, которые в свою очередь насчитывают
многочисленные географические
разновидности — так называемые штаммы. Они
отличаются друг от друга не только тем, что
дают различную картину болезни, но и тем,
что имеют разную чувствительность к
действию того или иного противомалярийного
препарата. Среди них есть штаммы
(например, индийский или
североамериканский), против которых хинин действует
особенно эффективно. Вот почему он и
сейчас занимает одно из ведущих мест в
лечении малярии.
Во-вторых, хинин известен в лечебной
практике не только как антималярийный
препарат. Он снижает повышенную
температуру тела и оказывает обезболивающее
действие, подобно амидопирину
(пирамидону) или анальгину. Правда, его не
применяют в качестве жаропонижающего или
обезболивающего средства из-за побочных
явлений, о которых мы уже говорили.
Но у хинина были обнаружены и другие
полезные свойства. Например, его
способность вызывать сокращения мышц матки
часто используется в акушерстве. А
особенно пристальное внимание фармакологов
привлекло влияние хинина на ритм
сердечных сокращений. Оказалось, что хинин
понижает возбудимость определенной части
мышечной ткани сердца, что приводит к
уменьшению частоты пульса. При более
детальном изучении алкалоидов коры хинного
дерева был выделен правовращающий
изомер хинина — хинидин, по
фармакологическим свойствам близкий к хинину, но еще
сильнее угнетающий возбудимость
мышечной ткани сердца. Поэтому хинидин, как
получаемый из хинной коры, так и
синтезируемый на основе хинина, применяют при
различных нарушениях ритма сердечной
деятельности.
Так хинин, впервые открытый народной
медициной, в руках ученых стал источником
больших достижений медицины научной.
НОВОСТИ ОТОВСЮДУ
ни боли, ни химии
Уже само слово «болезнь»
говорит о часто сопутствующем ей
неприятном ощущении — боли.
Но, с другой стороны, боль
нужна — она сигнализирует, что
нашему организму грозит какая-то
опасность.
А как быть, если болезнь
неизлечима, а боль не
прекращается ни на минуту! Обычные
обезболивающие препараты помочь в
таких случаях не могут — организм
к ним рано или поздно
привыкает. А операции на головном
мозге, «выключающие»
чувствительность того или иного органа,
сложны и далеко не всегда
эффективны.
Как сообщает журнал «Science
News» A966, № 18), сейчас
ведутся работы с электронным
прибором, который, по-видимому,
сможет в некоторых случаях
избавлять больных от
непрекращающихся страданий. Прибор этот
размером с небольшую монету
будет вживляться в определенный
участок спинного мозга. Здесь
его слабые электрические
импульсы должны блокировать
болевые сигналы, препятствуя их
проходу в головной мозг и,
следовательно, возникновению
чувства боли.
ПРОТИВ ГЕМОФИЛИИ
Гемофилия — заболевание,
заключающееся в плохой
свертываемости крови и связанных с
этим опасных кровотечениях.
Обычно гемофилию печат
переливанием крови или особым
образом обработанной плазмы
крови. Однако вещество,
вызывающее свертывание в
консервированной плазме, сохраняется
недолго.
Недавно, как сообщил журнал
«Chemical Week» A966, № 23),
найден новый метод получения
концентрата этого вещества. В
концентрате оно может
храниться более года. Объем
концентрата в восемь раз меньше объема
плазмы, содержащей ту же дозу
вещества. Кроме того, в нем в
20 раз меньше белка, чем в
плазме, а это уменьшает опасность
аллергических реакций организма.
63
СТЕКЛОДУВНАЯ
МАСТЕРСКАЯ
КАК ВЫДУВАТЬ ШАРИК
Заканчивая наши занятия, научимся еще одной
стеклодувной операции — выдуванию шарика
(разумеется, это может быть и маленький шарик,
размером с горошину, и колба большой емкости).
Основные необходимые для этого навыки вы уже
приобрели, поэтому сразу примемся за дело.
Сделайте обычную заготовку и кончик одной
из ее оттяжек обломайте (НИКОГДА НЕ
ЗАБЫВАЙТЕ: НАГРЕВАНИЕ ЗАПАЯННОГО СОСУДА
МОЖЕТ ПРИВЕСТИ К ВЗРЫВУ!). Потом
возьмите заготовку за оттяжки и разогрейте по
окружности участок трубки длиной 20—30
миллиметров. По мере размягчения стекло будет
осаживаться; не препятствуйте этому, не растягивайте
трубку, а даже слегка поджимайте ее. При этом
стенки размягченного участка будут
складываться в «гармошку» и постепенно утолщаться (а).
Помните: поджимать трубку надо очень
медленно, точно с такой же скоростью, с какой
размягченные стенки «поглощают» стекло. Если хотя бы
немного поспешить, то «гармошка» слипнется и
заготовку придется выбросить, так как исправить
ее будет уже невозможно.
Как только вы заметите, что «гармошка» вот-
вот слипнется, выньте заготовку из пламени и,
продолжая ее вращать, немного поддуйте черев
оттяжку — точно так, как вы это делали,
разглаживая шов простого спая. Как только на месте
«гармошки» выдуется небольшой шарик (б),
внесите его снова в пламя и как следует разогрейте.
После этого выньте заготовку и начните не
торопясь выдувать шарик (в), нагнетая воздух
одними щеками. При этом соблюдайте следующие
правила:
1) дуйте не непрерывно, а короткими
толчками;
2) оси оттяжек должны в точности совпадать;
3) заготовку надо вращать с такой скоростью,
чтобы размягченное стекло не успевало
деформироваться под действием собственного веса;
4) руки надо держать все время на одном
расстоянии друг от друга; растягивая или сжимая
шарик в тот момент, когда вы его выдуваете, ему
можно придавать различную форму —
удлиненную, как у лимона, или же сплюснутую, как у
помидора.
Одного осаживания, как правило, достаточно
для того, чтобы выдуть шарик диаметром до
50 миллиметров со стенками нормальной
толщины; попрактиковавшись, вы научитесь «на глаз»
определять, сколько надо собрать стекла для
того, чтобы у шарика определенного диаметра были
бы стенки желаемой толщины. Если надо собрать
побольше стекла, то операцию осаживания мож-
5 Химия и Жизнь, № И
65
во повторить. Можно поступить и иначе: после
того, как вы разгладили «гармошку» и выдули
небольшой шарик, разогрейте соседний участок
трубки, соберите на этом месте стекло и выдуйте
еще один шарик. Затем разогрейте оба шарика
одновременно, снова дайте стеклу осесть и на их
месте выдуйте один шарик побольше. Повторяя
эту операцию несколько раз, можно собрать в
одном месте очень много стекла.
КАК ДЕЛАТЬ...
ЕЛОЧНЫЕ ИГРУШКИ
Проще всего выдувать гладкие стеклянные
шары (фигурные игрушки, как правило,
выдувают в специальных формах). Для этого надо
сделать небольшую заготовку, всю ее широкую часть
собрать в один небольшой шарик и этот шарик
раздуть в большой шар. После того, как
известным вам приемом вы отпаяете одну из оттяжек,
простейшее елочное украшение готово.
Но стеклодувы, специально занимающиеся
выдуванием елочных игрушек, поступают
несколько иначе. Сделав заготовку, они отпаивают у нее
одну из оттяжек, делают на ее месте круглое дно,
потом разогревают вею заготовку, дают немного
осесть стеклу, поддувают, прижимая дно каким-
либо холодным предметом (можно
воспользоваться кафельной плиткой), снова разогревают
заготовку и затем выдувают шар. После этого
шар серебрят, раскрашивают, оставшуюся
оттяжку отрезают и прикрепляют петельку.
Игрушка готова.
А вот как можно изготовить стеклянную
макушку для елки. Сделайте из трубки диаметром
15—20 миллиметров заготовку длиной 20—25
сантиметров, а затем, отступив от одной из оттяжек
сантиметра на два, выдуйте шарик диаметром
около 50 миллиметров. Это — нижний шарик
макушки. Он будет наряднее, если сделать у него на
боках вмятины — «рефлекторы». Для этого
разогрейте краем пламени бочок шарика размером с
пятак, а когда стекло размягчится, отнимите
шарик от пламени и чуть-чуть потяните через
оттяжку воздух в себя, одновременно вдавив
стекло острым концом напильника (г).
Рядом с этим шариком выдуйте еще один (д).
Этот шарик внесите на одну-две секунды в
пламя, чуточку потяните — и стенки шарика
превратятся в ребристые бока цилиндрической
«коробочки». Рядом с этой «коробочкой» выдуйте
еще один шарик (е), точво так же разогрейте его
и растяните, как и предыдущий, только немного
сильнее, причем чуточку перекрутив винтом.
Вторая «коробочка» получится длиннее, а ее
ребра будут спиральными. Теперь разогрейте
оставшийся участок заготовки (ж) и оттяните «шпиль».
Чтобы он не был очень узким, оттягивая его,
одновременно поддувайте — так, чтобы стенки
оттяжки не опадали. Осталось отпаять нижнюю
оттяжку (э), сделать на ее месте круглое дно,
продуть его, оплавить края отверстия, а затем
отпаять верхнюю оттяжку.
Макушка готова — ее осталось только
посеребрить и раскрасить.
В. ЖВИРБЛИС
КАК ПОСЕРЕБРИТЬ И
РАСКРАСИТЬ
ЕЛОЧНУЮ ИГРУШКУ *
Дпя того чтобы посеребрить
елочную игрушку, нужно
приготовить два раствора.
Раствор № 1
Нитрата серебра .... 1,6 г
Воды . 200 мп
Раствор № 2
Сегнетовой соли .... 1,2 г
Воды 200 мп
* Внутренняя поверхность
игрушки должна быть идеально
чистой. Если вы хотите заново
посеребрить старую игрушку, то ее
надо промыть концентрированной
азотной кислотой, затем щелочью
и, наконец, сполоснуть
дистиллированной водой.
Перед употреблением
растворы смешивают поровну и
наливают полученную смесь в
игрушку, заполняя ее примерно на 1/4
объема. Игрушку сильно
встряхивают и нагревают в кастрюле с
кипящей водой. Через 10—15
секунд внутренняя поверхность
покрывается тонким слоем серебра.
Несколько сложнее серебрить
игрушки с очень узким горпом,
например шарики. Для этого при
выдувании шарика у него
оставляют оттяжку. Шарик на секунду
погружают в кастрюлю с
кипящей водой, а потом быстро
опускают кончик оттяжки в смесь
для серебрения. Через
несколько секунд шарик остынет, и под
действием вакуума в него
втянется немного раствора. Закончив
серебрение, шарик
переворачивают оттяжкой вниз и снова
нагревают (например, коптящим
пламенем горелки). Воздух
расширится и выдавит из шарика
остатки раствора.
Раскрашивают елочные
игрушки нитролаком, разбавляя его
ацетоном и добавляя анилиновые
красители, растворимые в
органических веществах. Примерный
состав краски таков:
Пигмента 5 г
Нитролака 50 г
Ацетона 50 мл
Петельки для подвешивания
игрушек на елку депают обычно
из стальной проволоки; вы
можете заменить их просунутой
внутрь шарика спичкой, к
середине которой привязана ниточка.
66
из писем
в редакцию
■ Хорошо, если бы печатали в
журнале «Тайны химических
иллюзионов», а также описания
небольших научных работ, которые
читатели могли бы сами
проделать. У меня дома целая
химическая лаборатория. Отдельный стол,
на нем — самые нужные книги и
картотека химикатов, которые мне
Удалось собрать. Сами химикаты
лежат в шкафу, я отвел для них
две нижние полки, где потемнее.
Их такое количество, что мне
хватит на много лет: 60
разновидностей солей, 20 разновидностей
металлов, 15 окислов и 15
простых веществ. Кроме того, у меня
хранится 5 индикаторов и 10
концентрированных кислот (конечно,
их я прячу потщательнее).
Хочется еще сказать вам, что,
по моему мнению, читать статьи
о заводах и репортажи с них
скучно, неинтересно. И это — во
всех журналах так. Такого мнения
не только я, но и все мои
товарищи, которые увлекаются химией.
Член клуба Юный химик
А. ДЕВЕККИ,
Ленинград
■ В № 7 вы открыли новый
раздел — «Наш календарь», который
предназначен для подготовки
сообщений и докладов по химии.
Это очень полезно и даже
необходимо, но при этом желательно
чтобы:
1) даты были более полными,
с числом и месяцем, когда это
можно установить;
2) были указаны ссылки на
основную литературу, по которой
можно подготовить более полный
доклад;
3) даты были абсолютно
верными.
К сожалению, в первой же
сводке дат я обнаружил ошибку.
Современный способ
электролитического получения алюминия
был разработан и опубликован
(в виде патента) не в 1866, а в
1886 г. и не одним Чарльзом
Холлом, а также (независимо от него
и в том же году) французским
изобретателем Полем Луи Эру.
Французский патент датирован
23 апреля 1886 г., а
американский — 9 июля... Эти события
описаны в книге П. П. Федотьева
«Электролиз в металлургии»
(Москва, Госхимтехиздат, 1934,
выпуск II, стр. 101).
Профессор В. СТЕНДЕР,
Днепропетровск
■ Хочется сообщить, что я стал
студентом химфака Кишиневского
университета. В подготовке при
поступлении мне оказали
существенную помощь задачи и
вопросы вашей рубрики «Хотите
подготовиться к экзаменам
получше», а также конкурсные
задания Юного химика.
Г. ТОДРАМОВИЧ, Кишинеа
Щ Мы — химики и в силу этого
энтузиасты вашего журнала.
Всякий раз, прочитав очередной
номер, мы с товарищами спорим о
направлении «Химии и жизни»,
достоинствах и недостатках
нового журнала. И нам кажется, что
надо шире открыть дорогу в
журнал творчеству самих читателей,
независимо от того, обладает ли
этот читатель степенью или это
рядовой химик. Есть же в
журнале клуб Юный химик и даж©
страница Садовода и
огородника — так почему бы нэ
организовать Клуб ученых (или что-то в
этом роде)...
Сколько людей хранят в
памяти массу интересных случаев из
жизни, юмористических ситуаций
или полезного опыта. Стоит
заняться разработкой этой
«золотой россыпи». Пусть читатели
придут в этот клуб, попробуют (moi
жет быть, даже в первый раз!)
взяться за перо. И среди этих
написанных «просто так» и «для
себя» страниц наверняка найдутся
интересные, даже
художественные вещи. Редакция журнала
сможет отобрать, обработать их и
кое-что напечатать на страницах
«Клуба». Это будет своего рода
фольклор химиков.
Предлагаем объявить
ежегодный конкурс среди читателей
журнала «Химия и жизнь» на
лучший научно-художественный
рассказ, стихотворение или описание
случая из жизни. Будем
надеяться, что со страниц журнала
забьет мощной струей фонтан
новых, оригинальных идей.
Читатели могут выступить и с
интересными предложениями.
Обсуждение их, всестороннее и
беспристрастное, также будет для
всех интересно.
Аспиранты-химики
Алла и Владимир КУЛИКОВЫ,
Минск
От редакции. Одно из
предложений А. и В. Куликовых уже
реализуется (в № 10 и 11) — это
«научный фольклор», «фольклор
химиков». Приглашаем читателей
присылать нам свои сочинения.
Лучшее будем публиковать.
5*
67
СОВЕТСКОЕ
ШАМПАНСКОЕ
По узкому шоссе, петляющему между
морем и горами, с ревом проносятся огромные
автоцистерны. На них огромными голубыми
буквами выведено: «ВИНО». Это в
маленький крымский поселок Новый Свет везут
сырье для завода шампанских вин. Здесь
оно превратится в самое лучшее «Советское
Шампанское», увенчанное золотыми и
серебряными медалями на международных
конкурсах и выставках в Будапеште,
Брюсселе, Любляне, Тбилиси.
Хотите знать, как это происходит? Тогда
представьте себе, что вы стоите вместе со
мной под жарким крымским солнцем перед
входом в темный туннель, вырубленный в
скале. Оттуда тянет по ногам приятной
прохладой, и сейчас наш гид — микробиолог
заводской лаборатории Людмила
Васильевна Шикина, погремев ключами, распахнет
перед нами тяжелую дверь...
КАНДИДАТЫ В ШАМПАНСКОЕ
Завод шампанских вин «Новый Свет» —
завод вторичного виноделия. Это значит, что
виноград превращается в сок, а потом—в
вино за пределами завода. И в тех
автоцистернах, что едут в Новый Свет, сюда
привозят из крымских винодельческих
совхозов «Судак» и «Золотая Балка» уже в
общем-то готовое белое столовое вино. Но
здесь это — только сырье, «виноматериал»:
до того, чтобы стать благородным
шампанским, ему еще далеко.
Для этого годится далеко не всякое вино.
Поэтому первая «производственная
операция» на заводе — строжайшая приемка.
Прежде всего, вино должно быть сброжено
насухо — все 17—18 процентов сахара,
содержащиеся в винограде, должны быть
полностью переработаны дрожжами в
спирт. Вино проходит и тщательную
микробиологическую проверку: оно может быть
заражено, например, уксуснокислыми или
молочнокислыми бактериями, которые тоже
вызывают брожение, но превращают сахар
не в спирт, а в уксус или молочную кислоту
и этой ложкой дегтя могут перепортить все
бочки шампанского.
Вино, которое получает завод,
изготовлено из разных сортов винограда. Его
нужно рассортировать — собрать сорт к сорту
в огромных, на 1,5—2 тысячи декалитров
резервуарах. Это называется ассамбляж,
в переводе с французского — «сбор,
соединение». (Кстати, большинство терминов,
связанных с производством шампанского,
пришло к нам от его изобретателей —
французов. Есть среди этих терминов и такие, что
для пользования ими нужен немалый опыт:
попробуйте, например, с первого раза
произнести слово «ремюёр» — это название
одной из главных специальностей в
шампанском производстве, о которой речь
впереди)
Молодое вино всегда немного мутно:
в нем еще остались дрожжевые клетки,
высокомолекулярные продукты их
разложения и некоторые другие ненужные
вещества. А насколько должно быть прозрачно
шампанское, знает каждый,— стоит хоть раз
взглянуть на свет сквозь шипящий
пузырьками бокал. Чтобы осветлить вино, в него
добавляют таннин или рыбий клей, которые
осаждают большую часть примесей.
Тут же прибавляют в вино и ЖКС —
желтую кровяную соль, или железистосинеро-
дистый калий. ЖКС выполняет очень
важную задачу — она переводит в осадок
растворенные в вине соли железа:
4FeCl3 4- 3K4[Fe(CNN] =
oki юна л соль ЖКС
железа
= = Fe4[Fe(CN)eb I 12 КС1,
темно-синий осадок
бь
FeCl2 I K4[Fe(CN)e] =
закнсная соль ЖКС
железа
= K2Fe [Fe (CN)G] | } 2KC1.
светло-синий осадок
Если растворенное железо останется в
вине, оно может соединиться с
содержащимися в нем дубильными веществами, и в
бутылке выпадет черный осадок дубильно-
кислой окиси железа. Эта болезнь вина
носит название железный, или черный касс.
А после обработки ЖКС железо
оказывается в осадке, и вино можно «снять с осадка»,
то есть осторожно перекачать в бочки.
Обычно в поступающем на завод вине
содержится 10—20 мг/л железа. Конечно,
лучше всего было бы вообще от него
избавиться, добавляя избыток ЖКС. Но тут
возникает другая, еще более серьезная
опасность: взаимодействуя с кислотами вина,
«лишняя» ЖКС образует сильнейший яд —
синильную кислоту. Чтобы не рисковать,
приходится задавать в вино немного
меньше ЖКС, чем нужно, и оставлять в нем
немного железа. Анализ на содержание
железа — самый ответственный из всех,
какие выпадают на долю заводской
лаборатории.
После осветления вино 20—25 дней
отдыхает. А виноделам отдыхать не
приходится: в сезон вино поступает на завод
непрерывно...
РОЖДЕНИЕ ШАМПАНСКОГО
Каждую зиму, в феврале, на заводе
созывается одно очень важное совещание —
дегустационная комиссия. За столом
собираются и директор, и главный шампанист, и
начальники цехов, и самые старые и
опытные рабочие. На дегустации определяют
купаж — состав шампанского этого года,
устанавливают, в какой пропорции нужно
смешивать поступившие на завод сорта вина.
Каждый год купаж бывает разный: меняется
качество винограда, колеблется урожай того
или иного сорта, — ив условиях этих
непрерывных изменений каждый раз приходится
заново искать самый лучший рецепт
шампанского. Это, конечно, уже искусство.
К дегустации готовят самые разные
варианты. И лишь два-три из них после
пристрастного обсуждения утверждаются и
идут в производство. Вот для примера один
из двух купажей урожая 1965 года:
«рислинг» — 400 декалитров, «сильванер» — 450,
«алиготе» — 200, «каберне» — 70, «пино» —
80, «выдержка» (вино урожая прошлых
лет) — 250.
Для лучшего осветления эту винную
смесь еще раз «оклеивают» —
обрабатывают рыбьим клеем. Потом вино снова
получает месячный отдых в бочках: за это
время формируется букет шампанского,
гармонично сочетающий в себе вкус и
аромат всех вошедших в него сортов.
И наконец, наступает решающий
поворот в судьбе будущего шампанского. Вино
подают на тираж, а попросту — разливают
в бутылки и герметически их закупоривают.
В бутылках и будет происходить процесс
шампанизации — вторичного брожения, при
котором вино насыщается углекислым
газом, придающим ему «игру» *.
Чтобы создать условия для вторичного
брожения, в вино добавляют дрожжи и
пищу для них — сахар в виде ликера (только
не того ликера, что продается в магазинах:
это просто сахар, разведенный в том же
вине, а доза ликера рассчитывается так,
чтобы после полной его переработки
дрожжами содержание спирта в вине достигло
ровно 12 процентов).
Шампанские дрожжи — настоящая элита
среди дрожжей. Их специально отбирают и
выращивают, и даже не на заводе: в Новый
Свет их присылают из подмосковного
Научно-исследовательского института северного
виноградарства и виноделия. Эти дрожжи
не должны бояться спирта, кислот, холода,
должны образовывать как можно больше
ценных побочных продуктов брожения,
придающих вину вкус и букет, и как можно
меньше вредных побочных продуктов, в
частности летучих кислот. Наконец, погибая,
они должны давать осадок зернистой
структуры (зачем это нужно, мы скажем позже).
* Завод «Новый Свет» работает по классической
французской технологии, и шампанизация здесь
происходит в бутылках. На большинстве же заводов
СССР применяется другой, так называемый акрато-
форный метод производства шампанского,
созданный советскими виноделами профессором Г. Г. Ага-
бальянцем и его сотрудниками и отмеченный
Ленинской премией. Там вторичное брожение идет в
больших герметически закрытых резервуарах — акрато-
форах. Новый метод позволяет сократить срок
изготовления шампанского с трех лет до нескольких
месяцев.
69
Сам момент розлива выглядит довольно
прозаично. Под потолком полутемного
туннеля возвышаются днища тиражных бутов —
установленных в лежачем положении бочек
диаметром побольше человеческого роста,
куда подается тиражная смесь. По
транспортеру вереницей подъезжают пустые
бутылки. Работница берет по бутылке в обе руки
и прежде всего... грохает их друг о друга.
Это простой, но (при большом навыке)
верный способ определить прочность бутылки.
Ведь накапливающийся при брожении
углекислый газ создает в ней давление около
5 атмосфер, а рассчитывают бутылки — на
всякий случай! — так, чтобы они могли
выдержать 17 атмосфер. И полного доверия
виноделы удостаивают лишь те из них,
которые не рассыпаются от точно рассчитанного
удара.
Прошедшие это испытание бутылки
загружаются в вертушку-полуавтомат, где их
заполняют тиражной смесью и
закупоривают. Устройство для розлива внушает
почтение: при взгляде на него почему-то
вспоминается первый паровоз Стефенсона.
Эти бутылки, сложенные во дворе завода, пока еще
пусты — они ждут, когда их подадут на тираж
Образцы «Советского Шампанского» хранятся в
нишах, вырубленных в стенах одного из туннелей
завода «Новый Свет» — одного из тех романтических
винных подвалов, с которыми неразрывно связано
наше представление о виноделии. На самом деле
все эти туннели, подвалы и погреба — не просто
дань романтике, а производственная необходимость:
для изготовления хорошего вина нужна постоянная
низкая температура. В туннелях «Нового Света»
температура никогда не бывает ниже + 12° и выше
Ч-14°С
Когда я поделился своими впечатлениями
с главным шампанистом завода Анатолием
Васильевичем Мурашко, выяснилось! что
верх механизации на заводе — повидавшие
виды французские машины довоенного
производства. Механизировать завод трудно,—
пожаловался он: производство
рассредоточено по отдельным туннелям, да и нужных
здесь машин у нас не выпускают. Лишь
недавно обещаны заводу автоматические
линии для тиража и отделки бутылок. Но и это
не решит проблему полностью...
Но вот вино разлито по бутылкам. В них
и разыгрывается главный эпизод биографии
шампанского. В постоянной прохладе
туннелей дрожжи за сорок дней перерабатывают
весь отмеренный им сахар в спирт и
углекислый газ. Теперь вино в бутылках уже
наполовину превратилось в шампанское:
оно насыщено углекислым газом.
Шампанизация сопровождается образованием
сложных эфиров:
с2н5он -.;- н2о -J- со2i_> СоН5осшн -!- н2о
CgH5OH ± CgHjOCOOH ^ (CgH50JCO |- Н20
70
Именно этим процессам и обязано
шампанское своей игрой. Этим оно и отличается
от шипучих вин, искусственно насыщенных
углекислым газом из баллона: как показали
исследования советских виноделов,
углекислота в них содержится лишь в
растворенном, а не в химически связанном виде.
Поэтому шампанское, налитое в бокал,
«играет» и пенится гораздо дольше, чем
шипучее: связанная углекислота выделяется
медленнее, чем растворенная.
ВОСПИТАНИЕ
ШАМПАНСКОГО
Но даже после того, как закончилось
вторичное брожение, вино в бутылках — еще
не готовое шампанское. Еще не
сформировался его букет, еще остались в бутылке
отмершие дрожжевые клетки и продукты
их разложения. Поэтому бутылки остаются
в туннеле, где им предстоит провести в
штабелях три года. Это — годы созревания
шампанского. За это время штабеля
четырежды перекладывают, чтобы извлечь
бутылки, все-таки не выдержавшие давления
углекислоты, а главное — чтобы сделать
более однородным понемногу
накапливающийся осадок.
И вот шампанское готово. Остается
только избавиться от осадка. Но как это
сделать, чтобы сохранить в бутылке
углекислый газ, готовый вырваться на волю, как
только вы приоткроете пробку?
Вековой опыт виноделов подсказал им
остроумный выход из этого, казалось бы,
безвыходного положения. Сначала осадок
собирают в одно место — в горлышко
бутылки («сводят на пробку»). Для этого
каждую бутылку встряхивают, держа ее
горлышком вниз,— и так каждый день на
протяжении двух месяцев. Эта операция
называется «ремюаж» (в переводе с
французского — «переворачивание»), и
занимаются этим опытные мастера-ремюёры. Вот
здесь-то и нужно, чтобы осадок, который
образуют дрожжи, имел зернистую
структуру: иначе он прилипает к стенкам бутылки,
образуя так называемую сетку, от которой
избавиться очень трудно.
На всякий случай виноделы прибегают
еще к одной хитрости. Перед ремюажем
они замораживают бутылку с шампанским
в ледяном рассоле. При встряхивании
образовавшиеся мелкие кристаллики льда, как
щетка, сдирают сетку, даже если она и
появилась.
Проходит два месяца, и если ремюаж
проведен правильно, весь осадок
оказывается в горлышке, на пробке. Наступает
очередь последней операции, которая
называется «дегоржаж» (по-французски —
«прочистка»). Дегоржер берет бутылку,
срывает с пробки надетую три года назад
предохранительную скобу и вынимает
пробку. Происходит то, что и должно произойти,
когда откупоривают шампанское: из
горлышка выплескивается выброшенная
давлением в 5 атмосфер пенная струя, которая
уносит с собой осадок. Молниеносное
движение— и бутылка снова закупорена. На
дегоржаже работают настоящие виртуозы
своего дела: ведь нужно сбросить весь
осадок, но при этом упустить как можно
меньше вина и газа. Опытный дегоржер обычно
теряет из каждой бутылки не больше
30—40 кубических сантиметров вина.
Тут же, при дегоржаже, в шампанское
снова доливают ликер. Ведь весь сахар,
который был в бутылке, уже давно
переработан дрожжами (такое шампанское
называется «брют»). А от количества
добавляемого ликера зависит марка вина, которую
вы можете прочесть на этикетке: «самое
сухое» содержит 0,8—1 % сахара, «сухое» —
3%, «полусухое» — 5% и так далее. Правда,
специалисты считают, что добавка ликера
нарушает создававшуюся годами
гармоничность букета, снижает растворимость
углекислоты, чем портит игру, и вообще чуть ли
не губит шампанское. Но вино выпускается
у нас не только для специалистов, а
большинство покупателей предпочитает
шампанское послаще...
ПУТЕВКА В ЖИЗНЬ
Собственно говоря, шампанское уже готово.
Ему остается провести на заводе последний
месяц. Это контрольная выдержка, уже в
теплом помещении. Здесь вино приучается
к новой жизни, в которую оно вот-вот
вступит, выйдя за ворота завода. Тут же
обнаруживаются бутылки, где не был полностью
сброшен осадок: вино в них мутнеет.
И вот горлышко бутылки оборачивают
фольгой (для чего? — А просто так, по
традиции), наклеивают этикетки,— и она
прощается с заводом.
А куда она попадает дальше?
71
У каждого завода шампанских вин в
нашей стране есть своя «сфера влияния».
«Советское Шампанское» из Нового Света
можно увидеть в магазинах и ресторанах
Крыма. Охотно покупают его и за рубежом:
ведь это лучшая из всех наших марок.
В этом году оно получило на дегустации
8,9 балла, «обойдя» на одну десятую даже
наше знаменитое шампанское «Абрау-
Дюрсо».
Выпуск шампанского заводом «Новый
Свет» растет с каждым годом: с 420 тысяч
бутылок в 1960 году до 600 тысяч в 1966.
Сейчас в подвалах завода находится на
выдержке 2280 тысяч бутылок разных лет
закладки! Прикиньте, на сколько километров
протянутся они, положенные в ряд...
Но пока они тихо лежат штабелями
в туннеле, дверь которого со скрипом
закрывается за нами, и мы из темной
прохлады снова попадаем на солнцепек.
— Вредная наша работа,— жаловались
мне виноделы.— На улице тридцать пять
градусов, а в подвале — двенадцать, туда-
сюда— вот и простудился...
Да, работа нелегкая. Но зато плоды
ее — сверкающие серебром горлышек
бутылки с солнечным, искристым вином —
желанные гости на всяком радостном
празднике, при всяком торжественном случае —
и на свадьбе, и на юбилейном банкете, и за
новогодним столом. И когда часы Спасской
башни отсчитают своим первым ударом
первую секунду 1967 года, по всей стране
прокатится многоорудийным салютом в
честь замечательных советских виноделов
залп из тысяч бутылок «Советского
Шампанского».
А. ИОРДАНСКИЙ,
специальный корреспондент
«Химии и жизни»
СТРАНИЦЫ ИСТОРИИ
СИЯТЕЛЬНЫЙ ВИНОДЕЛ
«Как русский винодел я ничего не
имею против того, чтобы
заграничные вина к нам попали, так как
высокие, хорошие типы нужно
всегда иметь перед собой. Но я
желаю, чтобы главным образом
наши туда пошпи».
Эти слова принадлежат
основателю завода «Новый Свет»
князю Л. С. Голицыну, посвятившему
развитию русского виноделия всю
свою жизнь.
Лев Сергеевич Голицын
родился в 1845 году. Окончив со
званием магистра римского
права Московский университет, он
много лет прожил во Франции.
Там он учился в Сорбонне и
одновременно изучал французское
виноделие. Уже тогда у него
зародилась мысль организовать в
России производство вин, не
уступающих лучшим заграничным.
В 1878 г. он покупает крымское
имение «Новый Свет», чтобы
устроить там серьезное
винодельческое хозяйство. С самого начала
Дело ведется с княжеским
размахом: на 20 гектарах устраивается
коллекционный виноградник с
образцами лучших европейских и
крымских лоз, строятся дома и
дороги, закладывается розарий
на полторы тысячи сортов роз.
Вскоре русские каменщики под
руководством специально
выписанных из Анатолии мастеров-
греков начинают прокладывать в
скалах обширную сеть туннелей —
тех самых, что и теперь служат
заводу. За 10 лет было
проложено 25 туннелей общей
протяженностью почти четыре километра.
И сооружены они киркой и
ломом, на глазок, без всяких
геодезических инструментов...
В одном из туннелей — его и
сейчас называют на заводе
«Образцовым» — хранилась
собранная Голицыным коллекция
бутылочных вин, не имевшая себе
подобной ни в России, ни за
рубежом. Она насчитывала 42 тысячи
бутылок!
Шампанским Голицын начап
заниматься с 1890 г. В 1894 г.
голицы не кое вино подавали к
царскому столу на коронации
Николая II, и с тех пор оно получило
название «Коронационного».
В 1900 г. в Париже, на
Всемирной выставке вин, гопицынсков
шампанское тиража 1899 года
было удостоено Большой премии —
«Гран-лри».
Имение «Новый Свет»
требовало колоссальных расходов. К
тому же Голицын почти не
продавал своего шампанского, но зато
щедро угощал им и своих
светских знакомых, и молодых
русских виноделов, приезжавших в
Новый Свет учиться. Понемногу
7*>
даже его огромное состояние
было исчерпано. Росли долги.
Коллекцию вин пришлось заложить,
м подвал, где она хранилась, был
опечатан. Грандиозному делу
грозила гибель. И тогда Голицын
предпринял последнюю попытку
его спасти. В 1912 г. он подарил
большую часть имения Николаю II.
Это значило, что дело переходит
в руки государства, в ведение
Удельного ведомства,
управлявшего царским имуществом.
Голицын надеялся, что оно продолжит
дело его жизни.
Но Удельное ведомство сочло
крымское шампанское
ординарным и закрыло завод.
Разоренный вконец князь Го-
Князь Л. С. Голицын в Новом
Свете. 1910 год
«Образцовый подвал». Здесь
хранилась знаменитая голицынская
коллекция бутылочных вин
лицын умер в Феодосии в 1915 г.
По его предсмертной просьбе
прах его был перевезен в Новый
Свет и похоронен в склепе на
склоне горы над заводом.
ВТОРАЯ ЖИЗНЬ ЗАВОДА
В 1917 г. имение «Новый Свет»
было национализировано.
Знаменитую коллекцию вин не удалось
вывезти из Крыма, охваченного
гражданской войной, — подвалы
пришлось замуровать.
Только в 1921 г. учреждения
Советской власти приняли
коллекцию в полной сохранности. Два
года спустя она была переведена
в Массандру, где создавался
большой винкомбинат. Там она
хранится м по сей день.
И только в 1936 году завод
был возрожден. В 1937 г. были
заложены на выдержку первые
200 тысяч бутылок, и через три
года в продажу поступила первая
партия «Советского
Шампанского».
А потом в Крым пришла
война. Фашистским оккупантам
удалось захватить завод почти не
поврежденным. Они даже
пытались возобновить производство.
Но рабочие завода и крымские
партизаны непрерывными
диверсиями сорвали их планы.
Гитлеровцы не смогли заложить ни
одного тиража, не смогли и
вывезти хранившееся в подвалах
вино.
После войны производство
шампанского на заводе неуклонно
растет. В 1970 году будет
выпущено 700 тысяч бутылок
шампанского и заложено на выдержку
1 200 тысяч.
По материалам истории
завода «Новый Свет»,
составленной кандидатом
исторических наук Г. ГУБЕНКО
73
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ ЗНАЕТЕ О ШАМПАНСКОМ
ВИНО НАЧИНАЕТ ИГРАТЬ
С игристыми винами были, по
всей вероятности, знакомы еще
римляне: Вергилий в своих
произведениях не раз упоминает о
«пенящейся чаше». А начало
производства шампанского во
Франции относят к середине XVII
века.
Способ его изготовления,
скорее всего, был открыт случайно.
В северных районах виноделия, к
которым принадлежит и
Шампань, белые вина часто дают не-
доброды — дрожжи не успевают
переработать в спирт весь сахар.
Если такие вина осенью разлить в
бутылки, то весной они снова
начинают бродить, и появляется
игра.
Не зная, что вызывает
вторичное брожение, виноделы
приписывали его самым разнообразным
причинам: одни — каким-то
неведомым добавкам, другие —
изготовлению вина из недозрелого
винограда, третьи — даже
действию луны в момент розлива.
МОНАХ-ИЗОБРЕТАТЕЛЬ
Одним из первых, кто заметил, как
«играет» вино, и использовал это
его свойство, был, согласно
легенде, бенедиктинский монах Дом
Периньон. Отвильерское
аббатство, где он с 1670 г. заведовал
виноделием, впервые начало
производить шампанское в больших
масштабах.
Сущности процесса монах,
конечно, не знал, но его выручали
большой опыт и интуиция. Своим
делом он мог заниматься
буквально с закрытыми глазами: к
концу жизни, ослепнув, он без
тРУДа распознавал марки и сорта
вина на вкус и «вслепую»
назначал купажи.
Дом Периньон обогатил
шампанское виноделие
изобретениями, которые используются и До
сих пор. Он, например, первым
стал закупоривать бутылки
пробкой — корой пробкового дуба
(до этого их затыкали
деревяшками или даже промасленной
паклей].
ШАМПАНСКОЕ ТИХОГО
ДОНА
На Дону, в Цимпе, игристые
вина появились еще в начале
XVIII века. Виноград был завезен
сюда из Европы при Петре I.
Мудреные иностранные названия
сортов на Дону скоро забылись,
и виноград был перекрещен
на русский лад — «Плечистик»,
«Красностоп». Один из донских
сортов даже называется «Шам-
панчик». Игристое вино здесь
изготовляли так. Осенью недобро-
дивший виноградный сок
оставляли в подвалах, а в марте разливали
в бутылки и плотно закупоривали.
С наступлением тепла
возобновлялось брожение, насыщавшее
вино газом. Цимлянское игристое
вино попало даже на страницы
«Евгения Онегина»:
«Да вот в бутылке засмоленой.
Между жарким и блан-манже.
Цимлянское несут уже...»
ВЗРЫВЫ
В ПОДВАЛАХ
Пока виноделы не научились
управлять процессом шампанизации,
приготовление шампанского быпо
предприятием крайне
рискованным. Нередко бутылки не
выдерживали давления и взрывались —
потери от боя составляли от 15 до
40 процентов. В 1776 году взрывы
буквально опустошили подвалы
одного из центров шампанского
виноделия — города Эперне. И
даже спустя 65 лет ежегодные
потери от боя составляли два
миллиона бутылок.
ПОДДЕЛЬНОЕ
ШАМПАНСКОЕ
По французским законам,
«Шампанским» имеет право называться
лишь то игристое вино, которое
изготовлено в пределах
Шампани. Однако попытки подделать
эту знаменитую марку начались
еще в XVIII веке. В Америке
после 1860 г. появилось сразу
несколько фирм, производивших
миллионы бутылок в год. Чтобы
обойти законы и получить право
именовать свое вино шампанским,
американские виноделы
окрестили городок в центре своих
впадений Реймсом — по имени центра
французской провинции
Шампань. Больше того, они разыскали
и выписали из Франции женщину,
носившую ту же фамилию, что и
основательница известной
шампанской фирмы uM-me Veuve
Pomrnery» |«Вдова Поммери»), и
стали выпускать шампанское под
ее именем, в точности повторив
французскую отделку.
МУСКАТНОЕ
ШАМПАНСКОЕ
«Драгоценным камнем в
ожерелье итальянского виноделия»
называют итальянцы знаменитое
игристое вино Пьемонта — «Асти
Спуманте» (Асти — название
городка на севере Италии, а
«спуманте» итальянцы называют все
игристые вина). Его изготовляют
из белого мускатного винограда.
Советские виноделы из
института «Магарач» в Крыму сумели
разработать технологию
отечественного вина, не уступающего
пьемонтскому. Оно получило
название кМускатное Шампанское»
и выпускается Киевским заводом
шампанских вин. Нежный
мускатный аромат, «ладанные», слегка
хвойные тона, красивый
золотистый оттенок — вот его отличи-
п
тельные качества. В 1958 г. на
выставке вин в Любляне (Югославия)
это вино получило золотую
медаль.
ШАМПАНСКОЕ ПРИХОДИТ
В РОССИЮ
История производства в
России «настоящего» шампанского
связана с именем известного
русского натуралиста академика
П. С. Палласа. В 1799 г. недалеко
от Нового Света, в Судаке, в его
крымском имении, было
изготовлено первое русское шампанское.
А в 1804 г. по инициативе Палласа
в Судаке было основано казенное
училище виноделия, также
выпускавшее шампанское. Однако
масштабы производства были
ничтожными: за пять лет |1822—
1827] изготовили всего 100 ведер.
Существовали в Крыму и
другие фирмы. В 30-х годах
прошлого века в Судаке изготовлял
шампанское в больших количествах
винодел Крич, представлявший в
России известную французскую
фирму Клико. Шампанское
оказалось настолько хорошим, что
Крич не удержался от соблазна и
начал сбывать его под маркой
Клико. Фирма подала в суд, и
дело пришлось прикрыть.
Хорошее игристое вино «Ай-
Даниль» изготовлял в Алупке, в
своем имении, граф Воронцов —
известный гонитель Пушкина.
Однако до князя Голицына все
это были отдельные, «кустарные»
попытки, не находившие
последователей.
ОТЕЦ «СОВЕТСКОГО
ШАМПАНСКОГО»
Создателем отечественной
технологии производства шампанского
справедливо считается известный
советский винодел профессор
А. М. Фролов-Багреев (это из его
книги «Труды по химии и
технологии вина» почерпнуты многие
приводимые здесь факты]. Ему и
его ученикам мы обязаны тем,
что «Советское Шампанское» в
нашей стране стало напитком для
всех. А начал свои исследования
Фролов-Багреев в 1905 г. в Ма-
гараче. Бутылки для лаборатории
приходилось покупать в одном
ялтинском ресторане, а пробки...
выкрадывать в Абрау-Дюрсо, где
выпускали шампанское бдительно
охранявшие свои секреты
французы.
СТРЕЛЯТЬ
ИЛИ НЕ СТРЕЛЯТЬ!
Многие думают, что при
откупоривании шампанского
обязательно должен прозвучать «выстрел»,
и чем сильнее, тем лучше. Это
неверно: открывать бутылку
нужно, наоборот, медленно,
бесшумно, стараясь ее не взболтать.
После «выстрела» газ выделяется
чересчур бурно, и игра быстро
затухает. С «выстрелом»
шампанское открывают только тогда,
когда нужно проверить степень его
игристости после брожения. Для
этого дают пробке вылететь и
смотрят, сколько вина выльется
вместе с фонтаном лены. Еслн
бутылка опорожняется
наполовину, то игра считается высокой,
если на греть — хорошей, а если
с пеной выбрасывается лишь
четверть бутылки, то игра —
посредственная.
КОГДА ПИТЬ
ШАМПАНСКОЕ?
В нашей стране пользуются
наибольшей популярностью
полусладкое и сладкое шампанское, и
пьют его обычно на десерт, после
еды.
Однако физиологи
утверждают, что это не очень полезно: при
переполненном желудке
углекислый газ вина может вызвать
тошноту. Поэтому правильнее посту*
пают англичане: они пьют
шампанское до еды или за обедом.
Все знают, что шампанское
лучше всего пить охлажденным.
Но при этом нельзя его совсем
замораживать. Самая лучшая
температура для сухого
шампанского — *е ниже +10 С, для
полусухого — не ниже +5°. Более
низкие температуры не позволяют
как следует ощутить аромат и
вкус вина, а при более высоких —
слишком быстро выделяется газ.
ХИМИЧЕСКИЕ
БОЛЕЗНИ
ШАМПАНСКОГО
В очерке о заводе «Новый Свет»
уже говорилось, что при
определенных условиях присутствие в
шампанском железа приводит к
появлению осадка — это болезнь
вина, которая называется
железный, или черный касс. Есть и
другие химические болезни
шампанского. Например, при других
условиях то же железо может вызвать
белый касс, когда в вине
образуется сизоватая муть и белый
осадок. Это выделяется
труднорастворимая фосфорнокислая окись
железа. Муть может появиться
также из-за присутствия в
шампанском меди при выдержке без
доступа воздуха — тогда это
называется медный касс. Наконец,
оксидазный касс — это побуренис
вина в результате перехода
красящих веществ в нерастворимое
состояние под действием
окислительных ферментов.
75
ОСТОРОИШЕЕ С ЗЛКУСШШ!
Л. ГЕЛТОН
Сравнительно недавно умер
прямо во время спектакля актер
А пан Лэдд. Сначала его смерть
объяснили сердечным приступом;
однако, как в конце концов
сообщила одна газета, произошла
«...все чаще случающаяся
трагедия: акт первый — алкоголь, акт
второй — лекарство, акт третий —
смерть».
Очевидно, эта трехактная
трагедия разыгрывается достаточно
часто. Ведь мало кто знает,
насколько рискованно принимать
снотворное в сочетании со
спиртным; распространено мнение, что
оно представляет собой лучшее
средство от бессоницы, а
возможно, и от похмелья. А утром
Рисунок В. ЗУЙКОВА
жертва этого заблуждения может
оказаться мертвой...
Понятнее всего механизм
явления, происходящего при
смешивании алкоголя с
барбитуратами — широко известной группой
снотворных препаратов. В
организме алкоголь обычно
расщепляется ферментами на простые
компоненты — двуокись
углерода и воду. Барбитураты же
блокируют эти реакции; в
результате алкоголь накапливается и
подавляет деятельность дыхательной
системы и системы
кровообращения. Именно поэтому обычная
доза барбитурата в сочетании с
небольшим количеством
алкоголя может привести к смерти.
Надо сказать, что разные
люди имеют различную
сопротивляемость, и поэтому комбинация
алкоголя с лекарством, которая
безвредна для одного, может
убить другого: результат такого
«эксперимента» никогда нельзя
предсказать...
А вот сочетание алкоголя с
транквилизаторами
(успокаивающими препаратами] дает так
называемый синергический
эффект — каждый из компонентов
смеси усиливает действие
другого. Нагляднее всего этот
эффект характеризуется словами
одного из официальных
докладов: «Человек, принявший перед
коктейлями две таблетки тран-
76
квилизатора, еще до начала
вечера имеет два коктейля форы».
Исследователи обнаружили
недавно, что алкоголь часто дает
опасные последствия при
совместном приеме м со многими
другими лекарствами. В
частности, выпивка может привести к
печальному исходу, если до или
после нее принять антибиотик
типа пенициллина; кроме того,
пенициллин быстро инактивируется
алкоголем.
У некоторых людей
неприятный эффект дает сочетание
алкоголя с нитроглицерином —
лекарством, которое принимают
при грудной жабе. Один кино-
лродюссер (у него была грудная
жаба и поэтому он время от
времени принимал нитроглицерин]
решил помочь молодому актеру,
у которого неожиданно появилась
боль в груди, и предложил ему
таблетку этого лекарства. Актер
этот был изрядно «на взводе».
Его знали как всегда очень
кроткого человеке; он становился еще
деликатнее после того, как
выливал. Но приняв таблетку
нитроглицерина, молодой человек
внезапно преобразился: он
бросился на продюссера, сбил его с ног
и пытался выбить ему зубы.
Врач, обследовавший актера,
сказал, что этот человек «один
Этиловый спирт — типичный
наркотик. Всасываясь в кровь,
он действует, прежде всего, на
центральную нервную систему,
вызывая возбуждение, затем
наркоз, а при очень больших
дозах — даже паралич.
В печени спирт окисляется
сначала до уксусного
альдегида, потом до уксусной кислоты
и, наконец, превращается в
углекислый газ и воду
(установлено, что таким путем организм
из тех, у кого алкоголь в
сочетании с нитроглицерином вызывает
тяжелейшую форму
интоксикации и может привести к
временному безумию».
Известно (по крайней мере,
эЗ этом знают врачи), что
алкоголь нельзя мешать с некоторыми
грибами (например, с Corpinus
atramentarius *)■ Эти грибы двют
примерно такую же реакцию, как
и антабус **, причем реакция
обычно наступает только в том
случае, если спиртное
принимается вместе с грибами, или же
сразу после них.
Однажды скорая помощь
доставила в больницу четырех
человек, которые жаловались на
одинаковое недомогание. Каждый из
них выпил по бутылке лива — и
сразу же почувствовал ве рту
металлический привкус, жжение,
покалывание в руках и ногах,
сильное сердцебиение, а также
доходящую до рвоты тошноту.
Озадаченные врачи долго
опрашивали больных и выяснили,
наконец, что накануне вечером все
* Corpinus atramentarius —
съедобный гриб. Русское
название — навозник серый. У нас
употребляется в пищу редко. — Ред.
** Вещество, вызывающее
резкую отрицательную реакцию
на алкоголь. — Ред.
человека способен
«перерабатывать» до Ю миллилитров спирта
в час).
Следует помнить, что
возбуждение, возникшее после
приема алкоголя, быстро
проходит, и поэтому пользоваться
в зтот момент (особенно при
резком отравлении)
успокаивающими средствами опасно:
действие некоторых
барбитуратов и транквилизаторов при
этом резко усиливается. Кроме
четверо ели злополучный гриб,
но при этом чувствовали себя
отлично. На следующий день они
снова поехали за грибами, а по
дороге остановились выпить пива
и тут внезапно заболели. Каким
образом выпитое через 18 часов
пиво дало такую тяжелую
реакцию с грибами — остается тайной.
Впрочем, через два часа все
четверо почувствовали себя
вполне здоровыми...
В наше время много внимания
уделяется холестерину и
сердечным приступам. И вот
выяснилось, что пища, богатая
животными жирами, в смеси с алкоголем
повышает содержание
холестерина в крови. Но есть и
успокаивающие сведения: если пища
богата ненасыщенными жирами (в
основном растительными], можно
не бояться бокала вина и при
высоком содержании холестерина.
Говорят, что ученые нашли
вещество, которое в смеси с
алкоголем дает положительный
эффект; такая смесь помогает
организму выводить алкоголь. Если
это так, то, значит, получено
средство для быстрого отрезвления.
Сокращенный перевод
с английского
Ф. БУШАНСКОГО
[Из журнала «Popular Science»)
того, барбитураты и некоторые
другие лекарственные вещества
тормозят процессы окисления
спирта в организме. Поэтому
при отравлении спиртом
следует принимать не
успокаивающие, а только возбуждающие
средства (например — кофеин,
фенамин, эфедрин).
Впрочем, самое лучшее — не
терять чувства меры и не
злоупотреблять спиртным.
КОММЕНТИРУЕТ
кандидат медицинских
наук В. М. АБАКУМОВ
77
АНГЛИЙСКИЙ—
ДЛЯ ХИМИКОВ
МНОГОЗНАЧНОСТЬ ГЛАГОЛА to be
По сравнению с русским, немецким, французским и
другими европейскими языками, в английском
используется весьма небольшое число грамматических
форм. На первый взгляд кажется, что это должно
значительно упростить изучение языка. Увы, это
только кажущаяся простота...
Дело в том, что чем меньше в языке
грамматических форм, тем большую нагрузку несет каждая
из них. Такое явление называют грамматической
омонимией, многозначностью; эта многозначность и
служит причиной многих ошибок и затруднений при
переводе.
В первую очередь надо знать и уметь различать
семь функций глагола to be. Независимо от того,
в какой форме выступает этот глагол (is, was, will
be, has been, being), его значение зависит от
последующего компонента предложения. Отсюда
вытекает основное правило функционального анализа
to be: чтобы определить функцию
этого глагола, надо выяснить, что стоит
вслед за ним.
I. TO BE + ОБСТОЯТЕЛЬСТВО
Если вслед за глаголом to be стоит
обстоятельство, выраженное существительным с предлогом,
то to be выступает в роли смыслового глагола
«находиться», «быть расположенным».
Например:
The amino group is in the ^-position.
«Аминогруппа находится в |3-положении».
The most direct route to these compounds
appeared to be through the degradation of
carbohydrates.
«По-видимому, простейший путь к этим
соединениям лежал через разложение углеводов».
II. ТО BE + СУЩЕСТВИТЕЛЬНОЕ
ИЛИ ПРИЛАГАТЕЛЬНОЕ
Если за глаголом to be стоит имя
существительное или прилагательное, то to be является глаголом-
связкой, входящим в состав именного сказуемого.
Например:
The Staden acid is a product obtained on
drastic oxidation of cholestanol.
«Кислота Стадена — продукт, получаемый при
окислении холестанола в жестких условиях».
Following regeneration the catalyst is
ready for the next cycle.
«После регенерации катализатор готов для
следующего цикла».
III. TO BE + ИНГОВАЯ ФОРМА
Сочетание to be + инговая форма смыслового
глагола указывает на формы Continuous, не
имеющие грамматических эквивалентов в русском языке.
В научной и технической литературе эти формы
употребляются для грамматического указания на
то, что действие происходит в данное время, или на
то, что один процесс протекает одновременно
с другим. Иначе говоря, упор делается на время,
в которое действие происходит. При переводе на
русский язык Present Continuous необходимо
вставлять слова «сейчас», «в настоящее время».
Например:
Although the method is receiving marked
attention, its possibilities and limitations
have not yet been sufficiently explored.
«Хотя этому методу в настоящее время
уделяется большое внимание, его возможности и
недостатки еще мало изучены».
The spherical joint is becoming more and
more useful in the construction of glass
equipment.
«Сейчас сферические шлифы получают все
большее распространение при изготовлении
стеклянного оборудования».
IY. ТО BE + III ФОРМА
Сочетание to be + III форма смыслового глагола
(Past Participle) указывает на страдательный залог —
пассив. Само название «пассив» говорит о том, что
подлежащее пассивно. При переводе
пассивных конструкций необходимо помнить, что в
русском языке формы страдательного и возвратного
залогов часто совпадают («Маша моется» —
возвратный, а «посуда моется» — страдательный залог).
Например:
Hie temperature rises.
«Температура повышается». Но:
The temperature is raised.
«Температуру повышают».
Во избежание ошибок или неточностей можно
рекомендовать переводить пассивную конструкцию
неопределенно-личной или личной формой глагола
в действительном залоге, помня о том, что подле-
78
жащее в этом случае не должно обозначать
действующее лицо или орудие действия.
Например:
There are polymers wich will be called
linear, whether the chain is opened or closed.
«Имеются полимеры, которые мы будем
называть линейными! независимо от того, будет ли цепь
открытой или закрытой».
This theory was advanced by Euler in the
last century.
«Эту теорию в прошлом веке выдвинул Эйлер».
Значительные трудности вызывает перевод
предложений, в которых одновременно встречаются
страдательный и действительный залоги; о том, как
переводить подобные предложения, мы уже писали
раньше (см. № 9).
V, VI. ТО ВЕ + ТО (ИНФИНИТИВ)
То be + to (инфинитив) выполняет функции или
составного сказуемого, или модального глагола.
В качестве составного сказуемого сочетание
to be 4- to легко выявляется, поскольку оно
встречается в предложениях, подлежащее которых
выражено существительным типа «цель», «назначение»,
«способ», «методика», «долг», «план», «схема»,
«желание», «намерение», «возможность», «трудность»,
«задача», «проблема», «практика». В русском языке
глагол «быть» в качестве глагола-связки в
составном сказуемом в настоящем времени очень часто
отсутствует или передается словом «это». В научной
и технической литературе глагол-связка нередко
заменяется оборотом «заключаться (состоять) в том,
что(бы)».
Например:
The object of Strecker's research was to
find a method for synthesising lactic acid.
с<Цель исследования, предпринятого Штрекером,
заключалась в том, чтобы найти метод синтеза
молочной кислоты».
A simpler method is to render the aqueous
solution more acidic.
«Более простой метод — сделать водный
раствор кислее».
В модальном значении сочетание to be + to
соответствует русским словам «надо», «следует»,
«нужно», «необходимо».
Например:
It is to be pointed out that both series
of derivatives fail to isomerise in acids.
«Необходимо указать, что в кислотах оба ряда
производных не изомеризуются».
This compound is not to be found in
nature.
«В природе это вещество не встречается».
Поскольку долженствование имеет оттенок
действия в будущем (ср. № 2,2), сочетание to be + to
(инфинитив) иногда употребляется также при опи*
сании действия, которое произойдет.
Например:
The method is to be described in more
detail.
«Этот метод будет описан подробнее».
VII- ТО BE + OF + СУЩЕСТВИТЕЛЬНОЕ
В этом сочетании за to be + of обычно следует
существительное типа importance, interest, value, и
глагол to be имеет значение «иметь»,
«представлять».
Например:
It is of interest to consider the
possibility of a reduced potential energy function
of diatomic molecules.
«Интересно рассмотреть возможность
существования приведенной функции потенциальной энергии
двуатомных молекул».
The reaction of hydrogen with carbon
to produce methane is not of great
significance at the moment.
«В настоящее время реакция водорода с
углеродом, приводящая к образованию метана, не имеет
большого значения».
Кандидат филологических наук
А. Л. ПУМПЯНСКИЙ
От редакции. Заканчивая на этом
серию статей о теории и практике перевода
английской научной и технической
литературы, мы предоставляем их автору
возможность назвать здесь свои книги, которые
могут быть полезны читателям,
заинтересовавшимся проблемами научного и технического
перевода:
Введение в практику перевода научной и
технической литературы на английский
язык. Изд. «Наука», Москва, 1965.
Пособие по переводу научной и технической
литературы на английский язык. Изд.
«Наука», Москва, 1965.
Чтение и перевод английской научной и
технической литературы (Фонетика,
Грамматика, Лексика). Изд. АН СССР, Москва,
1962. 2-е переработанное издание — изд.
«Наука», Москва, 1964.
Упражнения по переводу научной и
технической литературы с русского языка на
английский и с английского языка на
русский. Изд. «Наука», Москва (в печати).
Книги, находящиеся в печати, можно
заказать по адресу: Москва К-12, Черкасский
переулок, д. 2/10, «Академкнига» (Книга —
почтой).
79
„АЭРОЗОЛИ"
У НАС
ДОМА
ас
X
<
се
о;
X
ш
X
и
о;
О
С
Q3
О
и
ш
.Q
X
Г)
ш
О
С
В магазинах, продающих товары
бытовой химии, можно купить
препараты, расфасованные в
цилиндрические сосуды с
клапанами-распылителями вверху и
надписями на этикетке: «Аэрозоль».
В такой упаковке рижский
химический завод «Аэрозоль» и
парфюмерные фабрики «Новая заря»
в Москве и «Дзинтарис» в
Риге выпускают инсектициды,
лаки, одеколоны и другую
продукцию.
Разработкой и внедрением в
производство новых препаратов
занимается в Риге Специальное
конструкторское бюро
химизации народного хозяйства. Мы
попросили начальника сектора пар-
фюмерно-косметических и
медицинских аэрозолей этого бюро
Элгара Яновича Грикитыса
рассказать о применении аэрозолей
в быту.
ЧТО ТАКОЕ АЭРОЗОЛЬ!
Аэрозоль — термин химический. В
книгах по коллоидной химии, в
энциклопедиях и справочниках
говорится, что аэрозоли или
аэрозольные системы — это
дисперсные системы с
газообразной средой и с
твердой или жидкой
дисперсной фазой. А проще
говоря, аэрозоль — это тонкое
распределение мельчайших
частиц твердого или жидкого
вещества в газе.
Средой, в которой во
взвешенном состоянии находятся эти
частицы, могут служить любой
газ, смеси газов или просто
воздух. Дисперсной фазой
[так называются взвешенные
частицы] являются пылинки,
кристаллики, мельчайшие капельки
либо пузырьки различных
твердых или жидких веществ.
Размеры этих частиц чрезвычайно
малы: от одного до нескольких
сотен миллимикрон. В зависимости
от среднего диаметра частиц
дисперсной фазы аэрозоли делятся
на высоко-, средне- и
низкодисперсные.
В природе классическими
примерами аэродисперсных систем
могут служить туманы, дымы,
пыль. Даже воздух, которым мы
дышим, никогда не бывает
абсолютно чистым. Он тоже, по
существу, дисперсная система —
ведь в нем содержатся различные
взвешенные частицы. Но они
настолько малы, что человеческий
гпаз их различить не может.
Природные аэрозоли играют
большую роль в жизненных
процессах органического мира, так
как все люди, животные,
растения, по существу, постоянно
дышат аэрозолями. Они бывают
полезными и вредными: капельки
воды, содержащиеся в дождевых
тучах, увлажняют почву.
Испарения, образующиеся в
ингаляционной установке, помогают при
лечении простуды. А пыль на
проселочной дороге засоряет
дыхательные пути. Отравляют воздух
м фабричные дымы, занося на
поверхность альвеол и в поры
кожи мелкие частицы угля, ка*
пельки кислот, щелочей, масел.
Вредны для здоровья человека и
сырые, пронизывающие туманы...
ИСКУССТВЕННЫЕ АЭРОЗОЛИ.
В начале XX века некоторых
ученых заинтересовал вопрос:
эффективно ли использовать
некоторые продукты, вырабатываемые
промышленностью — мази,
порошки, жидкости, в мелко
распыленном виде! Какие при этом
появляются новые свойства,
результаты взаимодействия с
организмом!
Чтобы получить ответы на эти
вопросы, нужно было изготовить
удобное универсальное
приспособление для получения
аэрозольной струи из любого
вещества, в любых условиях и в
достаточном количестве.
Теперь трудно установить, кто
первый придумал баллон для
получения аэрозольной струи.
Американцы утверждают, что это
был Ротхейм. Первый патент на
такой баллон был выдан в
Норвегии. В государственной патент-
80
ной библиотеке в Москве есть
документ, который указывает, что
автор способа и
приспособления для получения аэрозольной
струи — русский химик Михаил
Семенович Цвет [1В72—1919).
Шаг за шагом аэрозольная
упаковка улучшалась. К началу
40-х годов XX века она уже была
в принципе найдена, но еще не
находила практического
применения. Первыми оценили
достоинства аэрозольной упаковки
американцы. В конце второй мировой
войны они начали массовое
производство аэрозолей для борьбы
с насекомыми.
Постепенно область
применения аэрозолей расширялась.
Сейчас практически нет ни одной
страны, где в разных отраслях
промышленности, медицине,
сельском хозяйстве не
использовался бы принцип аэрозольной
упаковки для самых разных
веществ.
БЫТОВЫЕ АЭРОЗОЛИ. Итак,
аэрозоли вошли в нашу жизнь, в
повседневный быт. Употребляемый
при этом термин «аэрозоль» —
неточен; но теперь даже в
специальной научной литературе
«аэрозолем» называют условно
аэрозольную упаковку того или иного
вещества. Часто для обозначения
аэрозольной упаковки
используют другие названия —
«аэрозольные бомбы», «автоматическая
упаковка», «атомизер» и другие.
Устройство прибора, называемого
«аэрозолем»: 1 — сосуд, 2 —
клапан, 3 — содержимое, 4 —
предохранительный колпачок, 5 — струя
аэрозоли
Самая распространенная
конструкция клапана: 1 —сифонная
трубка, 2 — карман, 3 —
пружинка, 4 — шток, 5 —
резинка-ниппель, 6 — основание клапана, 7 —
головка
6 Химия и Жизнь, № 12
81
Под любым из этих названий
подразумевается сосуд,
изготовленный из алюминия, белой
жести, стекла или пластмассы; из
тех же материалов сделаны
предохранительный колпачок и
детали клапана. Содержимым
сосуда могут быть определенные
вещества или их смесь:
парфюмерная жидкость, лекарство,
краска, лак, ядохимикат, сапожная
паста, накрахмаливающее
вещество и даже пищевой продукт.
Кроме этого вещества или смеси,
в баллоне находится сжиженный
или сжатый газ (так называемый
пропеллент], в котором
растворено вещество, образующее
аэрозоль. Этот сжатый газ служит
как бы «толкачом». В качестве
пропеллентов используются легко
сжимаемые и химически
инертные газы — галоидопроизводные
метана, этана и некоторых
других углеводородов [дихлорди-
фторметан, трихлорфторметан,
октафторциклобутан, хлористый
метилен, и другие].
АЭРОЗОЛЬНАЯ УПАКОВКА В
ДЕЙСТВИИ. Работает устройство
так. Содержимое «аэрозольного»
С помощью аэрозоля «Солвита»
хорошо полировать мебель
Опрыскивание «аэрозолем»
животного
сосуда находится под давлением
сжатого пропеллента. Сосуд
герметически закрыт клапаном.
Внутрь его, в содержимое,
опущена сифонная трубка, подающая
раствор, эмульсию или
суспензию к штоку клапана,
прикрытому резиновым ниппелем. При
нажатии на головку клапана шток
уходит вниз, отверстие
освобождается от ниппеля и открывает
путь для струи раствора.
«Превращение» раствора в аэрозоль
происходит так: раствор (эмульсия,
суспензия] в верхней головке
сосуда попадает в условия
нормального давления. Легко
испаряющийся пропеллент мгновенно
улетучивается, бурно вскипает,
образуя струю, состоящую из
мельчайших частиц растворенного в нем
основного продукта. Размер частиц
в струе определяется
соотношением количеств основного
продукта и пропеллента, диаметром
отверстия в головке, давлением
внутри сосуда.
При работе «аэрозольной
упаковки» объем, занимаемый
газом, постепенно увеличивается. Но
давление в сосуде остается
неизменным, так как газ из раствора
переходит в газовую фазу.
Процесс продолжается до тех пор,
пока в сосуде сохранится хоть
одна капля жидкого
пропеллента.
Струя аэрозоля
выбрасывается либо в виде «тумана»
(инсектициды, лаки, краски, одеколоны],
либо в виде пены (крем для
бритья, шампуни], либо в виде «пыли»
(пудра, детская присыпка,
пятновыводители).
В ЧЕМ ПРЕИМУЩЕСТВА
АЭРОЗОЛЕЙ. Чем же отличаются
товары бытовой химии,
расфасованные в аэрозольную упаковку, от
других бытовых товаров,
продающихся в обычной таре! «Успех»
использования того или иного
хозяйственного продукта
определяется удобством его применения
в практической жизни и
экономической эффективностью.
Проиллюстрируем это на
примере. Чтобы в домашних условиях
покрасить какой-либо предмет,
можно либо работать кистью,
либо просто окунуть этот предмет в
краску, либо обрызгать его струей
распыленной краски. Очевидно,
мы отдадим предпочтение
последнему способу, как наиболее
простому и гигиеничному.
Или другой пример. В
квартире, в кухне появились мухи. Чтобы
их уничтожить, можно поставить
по углам блюда с жидким или
порошкообразным инсектицидом,
развесить по стенам мухоловы.
Для полного уничтожения мух
потребуется несколько дней, да и
83
вид этих мушиных «капканов»
особого удовольствия не достав»
ляет. А если всего сотую долю
применяемых инсектицидов
распылить с помощью аэрозольной
упаковки, мухи будут уничтожены
всего за 5—10 минут.
Наконец, третий пример. Для
того чтобы дезинфицировать
комнату старым, «классическим»
способом — с помощью хлорного
раствора и тряпки — необходимо
около 3 литров
дезинфицирующего раствора с 5—10% активного
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ
Щ Наибольшее количество
аэрозольных упаковок для бытовой
химии производится в США.
В 1964 г. там выпускалось
1 365 000 000 штук «аэрозолей» в
год. В ФРГ в то же время
выпускалось ежегодно 151000 000, а в
Японии — 120 000 000 «аэрозолей».
■ В странах социалистического
лагеря выпуск «аэрозолей» для
бытовых нужд начат примерно с
1962 г. В Советском Союзе,
Чехословакии, Польше, ГДР,
Венгрии, Югославии из года в год
выпуск бытовых аэрозолей
неуклонно возрастает. По новому
пятилетнему плану в нашей стране
намечено в несколько раз
увеличить выпуск аэрозолей и
расширить их ассортимент.
■ При использовании бытовых
«аэрозолей» надо иметь в виду,
что некоторые из них —
инсектициды, лаки, удобрения —
содержат ядовитые вещества. Поэтому
перед пользованием ими
рекомендуется надеть перчатки и
марлевую маску. Ни в коем случае
нельзя давать флаконы с такими
«аэрозолями» детям.
■ В настоящее время в магазины,
продающие товары бытовой
химии, поступает продукция
рижского завода «Аэрозоль»:
инсектициды «Универсале» и «Булта»,
вещества и 15—20 минут
времени. А с помощью аэрозолей —
всего 30—50 см3
дезинфицирующего вещества и 1—2 минуты
времени. Эффективность воздействия
при последнем способе
возрастает в 5—7 раз.
Итак, мы убедились, что
аэрозольная упаковка для товаров
бытовой химии целесообразнее
всякой другой. Аэрозоли
постоянно готовы к употреблению, из
герметически закрытых сосудов
невозможны испарение, проливание;
ЗНАЕТЕ ОБ АЭРОЗОЛЯХ -
репеллент «Тайга»,
лак-восстановитель для мебели «Спидумс»,
разных цветов нитролаки,
дезинфицирующий состав «Хлорамин-
Б». Готовится к выпуску средство
для чистки окон, стеклянных и
хрустальных предметов «Солвита».
Щ Парфюмерные фабрики «Новая
заря» в Москве и «Дзинтарис» в
Риге также перешли на
аэрозольную упаковку некоторых видов
своей продукции. Это — одеколон
и духи «Комета», одеколон
«Тайна», одеколоны «Ригас сувенир»,
«Сана», «999», духи «Ригонда»,
«Пикколо», «Варбут», лак для
волос «Элфа», масло для волос
«Аэровита», масло для загара
«Делта», лосьон «Айя»,
антисептическая туалетная жидкость «Аба-
ва», средство от пота «Одоринс»,
профилактическое средство от
простудных заболеваний «Профи-
лакторс» и другие. Готовятся к
выпуску освежитель для
помещений «Дезодоранте», средство от
пота «Боросолс» и другие
аэрозоли.
■ «Аэрозоли» могут широко
использоваться для технических
нужд: огнетушения,
дефектоскопии, чистки и смазки охотничьего
оружия, при запуске двигателей
внутреннего сгорания (поддув
распыленного бензина], для борь-
содержимое в них не портится;
гарантируется его абсолютная
стерильность; все частицы
аэрозольной струи имеют одинаковый
химический состав, размеры
образующихся частиц очень малы.
Аэрозоли не боятся колебаний
температуры, вся «подготовка к
пуску» сводится к отвинчиванию
колпачка на клапане.
Нет сомнения, что за ними —
большое будущее.
Э. Я. ГРИКИТЫС
бы с обледенением окон в
автомашинах, предохранения
поверхности металла от коррозии,
смазки преесформ и штампов,
изоляции контактов, напыления
пластмасс.
Щ Применяются «аэрозоли» и в
пищевой промышленности, при
изготовлении кулинарных и
кондитерских изделий. В некоторых
странах уже изготовляют
аэрозоли различных соков, а также
горчицы, джемов, взбитых сливок,
сыра, меда и других пищевых
продуктов.
■ На базе диэтилфтоламида
рижским заводом «Аэрозоль»
выпускается аэрозоль-репеллент.
Опрыснув себя таким аэрозолем,
человек без спецодежды, в одном
купальнике или трусах может в
течение нескольких часов работать
в самых заболоченных,
насыщенных гнусом и мошкарой районах
тайги или в тундре. Эти аэрозоли
удобны и для охотников,
рыболовов, туристов...
■ Все шире входят в быт
дезинфицирующие «аэрозоли». Они
предназначены для дезинфекции
общественных мест, закрытых
помещений, оказания первой
помощи при ранениях, борьбы с
вредными микроорганизмами и
бактериями, для предохранения от
6*
83
заболеваний заразными
болезнями.
■ В аэрозольной упаковке
начинает выпускать свою продукцию
фармацевтическая
промышленность. Это особенно удобно при
производстве антибиотиков:
решается проблема дозировки
лекарств, в новой расфасовке их
удобнее и проще употреблять.
■ Не менее важны ветеринарные
аэрозоли. Путем ингаляции
определенного количества
мельчайших частиц лекарства можно
эффективно лечить
сердечно-сосудистые и легочные заболевания,
делать местную анестезию, лечить
ожоги, заболевания горла,
кожные раздражения у животных и
птиц.
Щ Большие возможности для
применения в быту имеют лако-кра-
сочные аэрозоли. С их помощью
можно делать мелкие малярные
и декоративные работы, ремонт и
восстановление мебели, чистить
обувь, полировать автомашины.
Ц Выпускаются также «аэрозоли»
для ухода за комнатными
цветами, накрахмаливания белья,
предохранения от запотевания очков,
выведения пятен, чистки ковров и
духовок в газовых плитах. За
рубежом продаются баллоны,
выбрасывающие струю
искусственного снега, уничтожающего в
комнатах запах табачного дыма,
а в кухнях — запах горелой пищи.
НАШИ КОНСУЛЬТАЦИИ
Читательница Семенова спрашивает нас:
«Как определить карбонатную жесткость воды,
если рекомендуемый метод с соляной кислотой дает
в наших условиях более высокий результат, чем при
определении трилонометрическим способом общей
жесткости! В имеющейся у меня литературе на этот
вопрос ответа нет.»
Консультацию дает кандидат технических наук
Е. Ф. Золотова.
Различают следующие основные виды жесткости:
Общую жесткость (Жобщ ), равную суммар-i
ной концентрации находящихся в воде катионов
кальция и магния — Са- и AVg 24 .
Карбонатную жесткость (Ж ), обусловлен-»
ную присутствием в воде бикарбонатов кальция
и магния — Са(НСОз)г и Mg(HC03J- В старых
литературных источниках и анализах карбонатную
жесткость иногда называли «временной»; сейчас этот
термин вышел из употребления.
Некарбонатную жесткость (Жнк)(
определяемую наличием в воде солей сильных кислот
кальция и магния (хлоридов, сульфатов, нитратов
и т. д.). Некарбонатную жесткость иногда называли
«постоянной»; этот термин сейчас также не
употребляется.
В СССР жесткость воды принято выражать
в миллиграмм-эквивалентах на литр (мг-экв/л) или
микрограмм-эквивалентах на литр (мкг-экв/л);
1 мг-экв/л равен 1000 мкг-экв/л.
В случае, если содержание ионов НСОз ~ ,
выраженное в мг-экв/л, меньше содержания ионов Са2+
и A\g2^ величина карбонатной жесткости равна
концентрации НСОз". Но иногда встречаются природные
воды, у которых концентрация ионов НСО~ выше
концентрации ионов магния и кальция, то есть
[НС03~]>[Са 2Л +Mg2H"]; у таких вод карбонатная
жесткость, установленная экспериментально, будет
выше общей, и тогда карбонатную жесткость условно
принимают равной общей жесткости, а
некарбонатную жесткость — равной нулю, причем избыток
ионов НСО~ относят за счет содержащихся в
воде бикарбонатов калия и натрия.
Общая жесткость воды определяется комплеч-
сонометрическим методом — титрованием
раствором дву замещенной натриевой соли эти ленд иамин-
тетрауксусной кислоты (она имеет сокращенное
техническое название «трилон Б»). Этот метод основан
на том, что ионы кальция и магния связываются
трилоном Б в комплексные соединения. В качестве
индикаторов применяются красители хромоген
черный специальный ЕТ-00, кислотный хром синий К,
кислотный хром темно-синий; с ионами магния эти
индикаторы образуют растворимые окрашенные
комплексные соединения. Наиболее четкий переход
окраски дает хромоген черный, поэтому
предпочтительнее применять именно его.
Метод определения карбонатной жесткости
природных вод основан на титровании 0,1 н. соляной
кислотой в присутствии индикатора — метилоранжа.
Теперь, когда известны концентрации Са2+, Mg2+
нсо;
выраженные в миллиграммах на литр
(мг/л), то общую, карбонатную и некарбонатную
жесткости, выраженные в мг-экв/л, можно
рассчитать по следующим формулам:
[Са^] [Mg'-+1.
«1Т£
общ
ж.
20М П
_ [HCCV]
Л6
к 61,02
при [Са*+ + Mg*4 > [НС03"];
ж„ = ж_, = ДСагЧ -f^2+I
к -шщ 200А • 12ЛС
при [Ca^4-Mg^]<[HC03-];
Ж„
Ж,
общ '
ж„
S4
ВИКТОРИНА
Викторина этого, последнего в году, номера «Химии
и жизни» особенная. На ее вопросы легко ответить
только тем, кто внимательно читает журнал. Все
ответы к этой викторине — в статьях, которые
публиковались в журнале в течение 1966 года.
Напоминаем, что в двенадцатом номере журнала
викторина не заканчивается. Последние вопросы
викторины 1966/67 учебного года будут заданы в
майском номере «Химии и жизни».
ЗАБЫТЫЕ ИМЕНА
Один из самых «модных» сейчас металлов
носил в свое время имя менакин. Получали
этот металл из минерала под названием
менаканит.
Что это за металл! И как сегодня
называют менаканит!
ПОРИСТЫЙ СПАСИТЕЛЬ
Иногда при перегонке случается
неприятность — жидкость в колбе мгновенно
вскипает и выбрасывается из колбы. Но
достаточно опустить в сосуд кусочек
какого-нибудь пористого вещества, например пемзы,
и жидкость будет кипеть спокойно. Почему
пемза защищает жидкость от внезапного
бурного вскипания!
КРАСНОЕ
И ЧЕРНОЕ
В середине прошлого века немецкий ученый
Крюгер поставил опыт, озадачивший многих
химиков. Он пропускал хлор через
щелочной раствор, в котором был взвешен
гидрат окиси меди Си(ОН);. Раствор
окрашивался в красный цвет. При добавлении
гидроокиси бария или кальция из раствора
выпадал красный осадок, который быстро
чернел, выделяя пузырьки кислорода.
Почерневший осадок оказался окисью меди. А
каков был состав красного осадка, из
которого окись меди образовалась!
ОПЫТЫ БЕЗ ВЗРЫВОВ
БИОХИМИЯ. ЗАНЯТИЕ ПОСЛЕДНЕЕ
На прошлых занятиях мы имели
возможность убедиться, что ферменты
распространены во всем живом мире. Они ускоряют
течение многих химических реакций, но
делают это избирательно. Ферменты очень
строго «специализированы»; один и тот же
процесс ускоряется иногда несколькими
ферментами. Наше последнее занятие еще
раз подтвердит эти наблюдения.
Рассмотрим ферменты, разрушающие
крахмал с присоединением к его
«осколкам» молекул воды. Такой процесс
называется гидролизом, а ферменты,
ускоряющие его,— гидролитическими. Среди таких
ферментов — амилазы, постепенно гидро-
лизующие крахмал. При этом сначала
образуются декстрины, а затем дисахарид
мальтоза.
85
ОПЫТ 1. Действие на крахмал амилазы
человека и животных.
Самые доступные источники активных
амилаз — это слюна и натуральный
пчелиный мед. За течением реакции гидролиза
крахмала удобно следить по изменению его
окраски с йодом.
Сначала приготовим необходимые для
опыта растворы.
1. Собранную во флакончик спюну
(около 0,5 мл] разбавьте холодной кипяченой
водой в 20 раз и хорошо перемешайте.
2. Из крахмала приготовьте очень
жидкий клейстер. Для этого около четверти
чайной ложки крахмала размешайте с
3—4 ложками холодной воды и влейте
смесь в стакан кипящей воды. Клейстер
охладите до комнатной температуры.
3. Аптечную йодную настойку A—2 мл]
разбавьте водой в 20 раз.
4. Пчелиный мед [2—3 капли] разведите
в 10 раз холодной водой и тщательно
перемешайте.
5. Питьевую соду (половину чайной
ложки] растворите в 10 ложках воды.
Все реактивы и растворы налейте в пе
нициплиновые флакончики с пробками; на
все флакончики наклейте этикетки.
В 9 чистых флакончиков (не забудьте
их пронумеровать] налейте около 5 мл
(примерно полфлакона] клейстера. Во флаконы
1, 4 и 7 прибавьте пипеткой по 5 капель
уксуса, а во флаконы 2, 5 и 8 — по 5 капель
раствора соды. В остальные флаконы добавьте
по 5 капель чистой воды. Содержимое
флаконов тщательно перемешайте и во все
флаконы прибавьте по 10 капель
разбавленной слюны.
Через 10 минут во флаконы 1р 2 и 3
прибавьте по 1—2 каппи разбавленного
раствора йода и перемешайте смесь. Наблюдайте
за изменением окраски. Еще через 15 минут
прибавьте такую же порцию йода во
флаконы 4, 5 и 6, а еще через 10 минут — в
остальные флаконы. Крахмал и декстрины
дают различную окраску с йодом. По мере
разрушения крахмала амилазой цвет из
синего становится фиолетовым, затем
красным, оранжевым и желтым. Таким образом,
по окраске можно судить о ходе распада
крахмала, а по скорости ее изменения —
о том, какая среда (кислая, нейтральная или
щелочная] более благоприятна для этого
процесса. Точно так же ставится опыт и с
раствором пчелиного меда.
Активность амилазы в разных образцах
слюны или меда может сильно колебаться,
поэтому, возможно, время гидролиза
придется увеличить или уменьшить. Например,
в слюне заядлых курильщиков амилазы
содержится очень мало.
ОПЫТ 2. Гидролиз крахмала амилазами
проросшего зерна ячменя (ячменного солода].
Препараты амилаз ячменя готовят так.
Зерна ячменя на несколько часов опустите
в воду, а затем оставьте их прорастать на
блюдце 4—5 дней. Чтобы семена не
высыхали, подливайте каждый день воду в
блюдце. Полученные проростки промойте водой
и тщательно разотрите деревянным
пестиком или ложкой. Приготовленную кашицу
разбавьте двойным количеством
дистиллированной воды и отожмите через плотную
ткань в стакан.
Такой экстракт содержит два фермента:
а. -амилазу и [^амилазу. Дополнительной
обработкой можно разрушить один из них,
чтобы наблюдать действие другого; с<-ами-
лазу разрушают нагреванием. К одной части
экстракта из ячменя прибавьте три части
воды, хорошо перемешайте смесь и
нагревайте ее 20 минут на водяной бане при
температуре 70 С. Баню, конечно, приготовьте
заранее, а раствор амилазы при нагревании
хорошо перемешивайте. С охлажденным
раствором можно ставить опыт.
Раствор з-амилазы можно получить,
разрушив ^-амилазу кислотой. Половину
флакона (около 5 мл) экстракта нужно охладить
в холодильнике или на льду до 2—3°С,
затем прибавить в раствор около 3 мл
(неполную чайную ложку) охлажденного 9/, -ноге
уксуса. Долейте во флакончик почти
доверху холодную воду. Смесь хорошо
перемешайте и оставьте на 15—20 минут. После
этого раствор нейтрализуйте, добавляя
сухой мел (в порошке) до прекращения
выделения углекислого газа. Смесь еще раз
перемешайте и разбавьте в два раза водой.
Дайте осадку отстояться в течение 10—
15 минут и перелейте жидкость над осадком
в чистый пенициллиновый флакон.
Подготовка ко второму опыту окончена.
В десять пенициллиновых флаконов
налейте по 1 мл раствора крахмала и по 9 мл
воды. Затем во флаконы 1—5 добавьте
пипеткой по 10 капель приготовленного
раствора -амилазы, а в остальные 5
флаконов — по 10 капель раствора 3-амилазы.
Содержимое всех флаконов тщательно пе-
80
ремешайте. Через три минуты во флаконы
1 и 6 прибавьте одну каплю раствора йода
и перемешайте. То же проделайте с
флаконами 2 и 7 через 5 минут, с флаконами 3 и
8 — через 10 минут, с флаконами 4 и 9 —
через 20 минут и с флаконами 5 и 10 — через
30 минут.
Выг очевидно, заметите, что в
присутствии '"-амилазы окраска быстро меняется.
При этом образуются крупные осколки
молекул крахмала — декстрины. -амилазы,
напротив, не образуют декстринов, а
«откусывают» небольшие кусочки от молекул
крахмала. Так как декстрины не образуются,
АЛГЕБРА В ПАРИКМАХЕРСКОЙ
В «Занимательной алгебре» Я. И. Перельмана есть
любопытная задача «В парикмахерской» — о том,
как парикмахеры тщетно пытались приготовить
раствор перекиси водорода. У парикмахеров было две
жидкости: одна содержала 3% перекиси, другая —
30 ( . Им же был нужен 12%-ный раствор.
Решение задачи несложно. Пусть требуемое ко-
личество трехпроцентного раствора перекиси равно
х г, а тридцатипроцентного — у г. Очевидно, что
в х г первой жидкости чистой перекиси водорода
содержится 0,03 х г, а в у г второй жидкости 0,3 у г
Н2С. При смешении обеих жидкостей получается
(х 4 у) г смеси. Содержание перекиси водорода
в этой смеси равно 0,03х + 0,3у. Так как готовый
раствор должен содержать 12 % перекиси, то в нем
то окраска с йодом все время остается
синей. Однако по мере распада
крахмала яркость окраски постепенно
уменьшается.
Результаты последнего опыта наглядно
демонстрируют разнообразие свойств даже
близких ферментов. В живых организмах
ферменты обычно действуют совместно.
Происходящие при этом превращения
веществ намного сложнее тех сравнительно
простых реакций, которые мы наблюдали в
пенициллиновых флакончиках. Но познание
простого — это первый шаг к познанию
сложного.
будет (Х+У) - 12, или 0,12 |х + у) г Н202. Итак
получилось уравнение:
0,12 (х + у) = 0,03 х 0,3 у.
Ответ таков: х = 2у. Значит на одну часть первой
жидкости надо взять две части второй.
Подобные задачи встречаются не только в
парикмахерских. Сппошь и рядом приходится составлять
смеси из двух жидкостей различной концентрации.
Например, на фабриках мороженого смешивают
несколько сортов молока, с разной жирностью. А дома!
Скажем, в поваренной книге сказано, что для
маринада нужен уксус крепостью 6%, а в хозяйстве
оказались две бутылки уксуса — одна с 10%-ным
уксусом, другая — с 3%-ным. Сколько же сзять того
и другого!
Как решать такие задачи алгебраически, мы уже
знаем по опыту парикмахерской. Но есть и другое.
УДИВИТЕЛЬНЫЙ КВАДРАТ
87
куда более простое и быстрое решение — с
помощью «квадрата Пирсонам. Это удивительный
квадрат! Ответы он дает почти мгновенно. Убедитесь
в этом.
Пусть у нас две бутыли с серной кислотой; в
одной содержится 921 -ная H2S04, в другой— 10%-ная.
Готовый электролит должен содержать 24% H2SO,.
Решение качнем с того, что нарисуем квадрат и
проведем две диагонали. В точке их пересечения
напишем число, которое означает содержание H2S04
в готовом растворе. А по углам слева напишем
концентрации исходных растворов — в верхнем углу
большую, в нижнем — меньшую. Теперь в каждом
свободном углу запишем разность между
«угловыми» и «центральным» числами (92—24 = 68, 24—10 =
= 14). Полученные цифры и есть ответы. Итак,
92% -ной кислоты надо взять 14 весовых частей, а
10%-ной — 68 весовых частей. Легко проверить, что
в полученном растворе будет содержаться именно
24% HoSO,.
Дпя задачи из «Занимательной алгебры» ответ
будет такой: на 9 частей 30%-ной перекиси водорода
надо взять 18 частей 3%-ной. Или же, сократив на 9,
получим тот же ответ: на одну часть раствора х —
две части раствора у.
Может быть, юные химики, любящие математику,
попытаются раскрыть алгебраический «секрет»
удивительного квадрата!
ХОТИТЕ ПОДГОТОВИТЬСЯ
К ЭКЗАМЕНАМ ПОЛУЧШЕ?
задачи о горении
ЗАДАЧА 1.
При сжигании некоторого газообразного
углеводорода в хлоре расходуется трехкратный объем хлора.
А при сжигании этого же углеводорода в кислороде
расход окислителя по весу уменьшается в 1,48 раза.
Какой это углеводород!
ЗАДАЧА 2.
Смесь углеводородов сожгли и взяли пробу сухих
продуктов сгорания (без учета образовавшейся
воды). Проба при нормальных условиях имела
следующий объемный состав: кислорода — 7,3%.
углекислого газа — 9,9%, остальное — азот.
Определите процентный состав горючего
вещества. (Предполагается, что воздух состоит только из
кислорода и азота).
ЗАДАЧА 3.
30 мл пропан-бутановой смеси, взятой при
комнатной температуре и нормальном давлении, смешали
в эвдиометре с 200 мп кислорода и взорвали. После
приведения условий к исходным объем газов
составил 130 мп.
Какой состав имеет пропан-бутановая смесь
в объемных процентах!
Какой смысл имеет указание на условия опыта!
РЕШЕНИЯ ЗАДАЧ
ЗАДАЧА 1.
При сжигании углеводородов в хпоре углерод
выделяется в свободном виде. Так как в реакции
участвуют два газа, то, согласно закону Авогадро,
уравнение реакции запишется так:
Сх Ну Ч- ЗС12 - хС 6НС1.
Из уравнения следует, что у = 6.
На сжигание 1 моля углеводорода расходуется
3 моля хлора, то есть 213 г.
Расход кислорода на 1 моль углеводорода:
213: 1,48 = 144 г,
или 144 : 32 = 4,5 г-м.
Уравнение горения углеводорода в кислороде (в
расчете на 1 мопь горючего] выглядит так:
Сх Н„ 4,502 = ЗН20 ЗС02.
Из уравнения следует, что х = 3.
Итак, искомый углеводород — С Н, (пропилен или
циклопропан].
ЗАДАЧА 2.
Рассчитаем содержание азота в сухих продуктах
горения (дпя удобства расчет будем вести на 100 л
газов):
100 —G,3 -f 9,9) = «2,8 л.
Теперь определим объем кислорода,
приходящийся в воздухе на 82,8 п азота:
82,*21 = ^ Q л
И)
Здесь 21 и 79 — содержание в воздухе кислорода
и азота в объемных процентах.
Из реакции С-|-©2—> С02 следует, что на
образование углекислого газа израсходовано 9,9 л
кислорода (при нормальных условиях). На образование
воды пошло 22—G,3+9,9) = 4,8 п.
8S
Весовые количества углерода и водорода,
соединившиеся с соответствующими объемами
кислорода, определятся так:
х, 9,9 л
С + 02 -> С0а;
12 г 22,4 л
12-9,9
22,4
к2 4,8 л
5,30 г.
4Н Ь ()о -* 2Н20;
4г 22,4 л
v _ 4-М
22,4
= 0,8G г.
Масса сгоревшего углеводорода составит
5,30+0,86-6,16 г.
Наконец, определим весовой состав горючего:
С~Ш- -l0u% -86%,
о, Jo
Н-^--100% =1496.
D,lb
ЗАДАЧА 3.
Примем объемное содержание бутана в горючей
смеси за х мл. Тогда содержание пропана будет
(ЗС—х) мп.
Запишем уравнения реакций горения бутана
и пропана и с помощью неизвестного выразим
соответствующие объемные количества кислорода
и углекислого газа:
х 6,5х 4х
С4Н10 ^ 6,502 = 4С02 4 5Н20;
30—х 5C0 —х) 3C0 —х)
С3Н8 I 502 = ЗС02 + 4Н20.
Из уравнений реакций видно, что расход
кислорода на сгорание моля бутана выше, чем на
сгорание моля пропана. Предположим, что горючий газ —
это чистый бутан. В таком случае расход кислорода
на сгорание 30 мл газа составит 6,5x30 = 195 мп.
Значит, при любом составе пропан-бутановой смеси
часть взятого объема кислорода окажется непро-
реагировавшей. Обозначим эту часть через у.
Теперь можно составить следующие
алгебраические уравнения:
6,5 х 4 5C0 - х) + у =
= 200 (объем взятого кислорода);
4х 4 3 C0 — х) + у =
= 130 (объем газа после реакции).
После упрощения получаем систему уравнений:
A,5 х + у = 50.
|х у — 40
Решение системы уравнений дает значение х = 20.
Объемный состав газовой смеси:
пропана — — • 100% = 33,3%;
блтана —— 100% =- 6«,7%.
30
Обязательно нужно учитывать условия опыта
(температуру и давление), так как при низкой
температуре и повышенном давлении бутан легко ожижаетсяг
а при высокой температуре и пониженном давлении
в состав газообразных продуктов горения войдут
водяные пары.
Следующие три задачи решите самостоятельно.
Ответы к ним — на стр. 90.
ЗАДАЧА 1.
Существуют ли углеводороды, при сгорании которых
в хлоре и в кислороде расходуются равные объемы
окислителя!
ЗАДАЧА 2.
В замкнутом объеме воздуха сожгли некоторое
количество горючего вещества. Продукты сгорания
имели такой состав: 17,6 г углекислого газа, 10,8 г
воды, 77,0 г азота и 3,8 г кислорода.
Определите количественный состав вещества, если
известно, что азота оно не содержит. [Считайте, что
воздух содержит 23 весовых процента кислорода,
остальное — азот.)
ЗАДАЧА 3.
30 мп пропан-бутановой смеси смешали в
эвдиометре с 200 мп кислорода и взорвали. До взрыва
реакционная смесь имела температуру 127°С и
нормальное давление. После приведения условий к
исходным объем газов в эвдиометре составил 270 мп.
Какой состав в объемных процентах имеет про-
пан-бутановая смесь!
ответы на вопросы
викторины
только
ЛИ АЦЕТИЛЕН!
Если карбид кальция реагирует с водой на холоду
или при умеренном нагреве, то выделяется
ацетилен. Карбид кальция, нагретый до красного каления,
ведет себя иначе. Если над ним пропускать водяной
пар, то вместо ацетипена образуется углекислый газ
и водород. Вот как протекает эта реакция:
СаС2 + 5Н20 -* СаС03 + С03 + 5Н2.
89
КАПРИЗНЫЙ ГАЗ
Окись азота очень медленно разлагается на азот и
кислород:
2NU <. _ N2 ; 02 43 ккал.
Несмотря на то, что в этой реакции выделяется
энергия, даже при 500°С равновесие практически
полностью смещено влево. Поэтому сера
(температура ее пламени около 500°С|, а тем более лучинка
не горит в окиси азота. А температура пламени
фосфора достигает 900°С. При такой высокой
температуре зажженный фосфор продолжает гореть,
отнимая кислород у окиси азота.
ВЕЛИКА ЛИ РАЗНИЦА!
Твердый водород — самое легкое твердое вещество
на Земле. При температуре — 260' С его удельный
вес около 0,076 г см . Самое тяжелое вещество —
осмий (удельный вес 22,48 г/см3). Значит, твердый
водород легче твердого осмия в 296 раз!
ответы к задачам
(СМ СТР. 89)
ЗАДАЧА 1.
Уравнения горения углеводорода в хлоре и в
кислороде в общем виде записываются так:
хС у НС!;
:Ну4-(* . -f)(V
хСО,
J- ILO-
По условиям задачи должно выполняться еле*
дующее равенство:
У
4
Существует единственный углеводород,
отвечающий этому условию: метан — СН-.
ЗАДАЧА 2.
Сначала найдем, сколько кислорода входит в состав
углекислого газа и воды:
17,6 г xt
со2 —
44 г
_ 17,6-32
44
10,8 г
Н20
18 г
_ 10,8-16
20
32 г
- — 12,
х3
— О
16 г
- - П.(
18
Общее содержание кислорода — свободного
и связанного — в продуктах сгорания составит
12,8 9,6 f 3,8 =- 26,2 г.
Из этого количества на долю кислорода воздуха
77,0 23
приходится-
77
= 23 г.
Содержание элементов в составе горючего
вещества таково:
углерода: 17,6 — 12,8 = 4,8 г;
водорода: 10,8 — 9,6 = 1,2 г;
кислорода: 26,2 — 23 — 3,2 г.
Значит, масса сгоревшего вещества будет равна
4,8 -;- 1,2 ; 3,2 = 9,2 г.
Итак, количественный состав горючего:
С- 4'8
н —
9,2
1,2
9,2
•100', о -52,2%;
■100% = 13,0%;
О--|ф-100% = 34,8%.
ЗАДАЧА 3.
Так как температура, при которой измеряются
объемы газов, более 100еС, то в состав газообразных
продуктов реакции входят также и водяные пары.
Запишем уравнения реакций горения бутана и
пропана:
х 6 5 х Ух
С4Н10 -\ б',5 02 ^ ШJ 5Н20;
30 — х 5C0 - х) 7 C0 — х)
С3Н8 4 502 = 3(Ю2 4Н20.
Алгебраические уравнения выглядят так:
6,5 х 5C0 х) у _ 200;
9х ' 7(ЗП -х) f у = 270
(у — объем непрореагировавшего кислорода).
Решение системы уравнений дает значение х = 20.
Состав смеси: пропана—33,3%; бутана — 66,7%.
90
химические
товарные знаки
В девятом номере нашего журнала за 1965 год были
помещены издательские знаки некоторых
крупнейших научных издательств мира. А сейчас мы хотим
познакомить читателей с так называемыми
«товарными знаками» — графическими символами фабрик,
заводов, фирм.
Товарный знак — это сравнительно молодая у нас
область промышленной графики. Чем выше его
художественные достоинства, чем лаконичнее и в то
же время полнее сообщаемые знаком сведения, тем
успешнее выполняет он свои обязанности — быть
«визитной карточкой» товара, рекламировать его,
помогать покупателю в выборе товара.
4 ноября умер наш товарищ — один из старейших
советских полиграфистов Григорий Моисеевич
Павловский.
Григорий Моисеевич прожил большую трудовую
жизнь. В 1918 году шестнадцатилетним юношей он
стал командиром Красной Армии, участвовал в
гражданской войне. Потом был комсомольским
работником, а с 1923 года до последних дней жизни
бессменно трудился в издательствах и типографиях.
В 1928 году он стал членом КПСС.
В двадцатых — тридцатых годах Григорий
Моисеевич работает в издательствах «Московский
рабочий», «Молодая гвардия» и Других. В тяжелые
военные годы Г. М. Павловский возглавляет
крупнейшее полиграфическое предприятие — Первую
образцовую типографию в Москве. В 1948 году он
перешел в Издательство Академии наук СССР (ныне
издательство «Наука»).
Товарный знак — это не просто картинка, как,
например, на конфетной обертке. Он — собственность
предприятия (института, фирмы и т. д.)- Товарные
знаки регистрируются в Комитете по делам
изобретений и открытий при Совете Министров СССР, и ни
одно предприятие, ни у нас, ни за рубежом, не
имеет права изображать чужой знак на своей
продукции.
Число зарегистрированных в нашей стране
товарных знаков приближается к тридцати тысячам.
Среди них немало знаков, связанных с химическим
производством.
(Окончание на стр. 96)
Самоотверженный труд Григория Моисеевича
Павловского был высоко оценен страной — он был
награжден орденом «Знак Почета» и тремя
медалями.
Последние годы, будучи персональным
пенсионером, Григорий Моисеевич Павловский принял
горячее участие в организации выпуска новых научно-
популярных журналов Академии наук. Заведуя
производством нашего журнала, Григорий
Моисеевич с присущей ему напористостью и энергией
помогал редакции, всем своим огромным олытом и
авторитетом поддерживая первые шаги нашего
журнала.
Редколлегия и коллектив редакции глубоко
скорбят о кончине нашего старшего товарища и верного
друга. Память о неустанном труженике Григории
Моисеевиче Павловском мы сохраним навсегда.
ГРИГОРИЙ МОИСЕЕВИЧ ПАВЛОВСКИЙ
а
статьи, опубликованные
в журнале „Химия и жизнь
в 1966 году
ПРОБЛЕМЫ И МЕТОДЫ СОВРЕМЕННОЙ НАУКИ
БАРКАЛОВ И. М. Реакция идет в кристалле —
твердофазная полимеризация. — № 1, стр. 9—14.
ВАСИЛЬЕВ Ю. Б. Топливные элементы. — № 4f стр. 34—
ЗВ.
КАРА-МУРЗА С. Г. Вирус на «крючке». — № 5, стр.
11—15.
КАРА-МУРЗА С. Г. Клатраты: молекулы в гостях у
кристаллов. — № 12, стр. 44—47
ЛЕВИ-ЛЕБЛОН Ж. Погоня за нейтрино. — № 9, стр. 36—
42; ФИЛИППОВ А. Т. Наш комментарий. № 9, стр.
42—43.
МАКАРОВ Е. Ф., МОШКОВСКИЙ Ю. Ш. Локация
молекул. — № В, стр. 17—26; ГОЛЬДАНСКИЙ В. И.
Предисловие к ст. «Локация молекул». № В, стр. 16.
МАНЬКО В. И. Симметрия в микромире. — № 4, стр.
15—24.
ПЕНЬКОВСКИЙ В. В. Электронный глаз химика. — №11,
стр. 6—11.
ПОЖАРСКИЙ А. Ф. Удивительные углеводороды. — № 7,
стр. 13—19.
ПОНОМАРЕВ Л. И. Мезонная химия — возможно ли
это? — № 10, стр. 6—10; Атомы и мезоатомы. № 10,
стр. 11. ГОЛЬДАНСКИЙ В. И. Комментарий к ст.
«Мезонная химия — возможно ли это?». № 10, стр.
11—12.
СТЕНТ Г. С. Новое слово в молекулярной биологии.—
№ 3, стр. 42—44.
СУТОВСКИЙ А. Взрывающиеся проволочки. — № 2, стр.
6—11.
ЭКОНОМИКА И ПРОИЗВОДСТВО
БЕЯОСЕЛЬСКИЙ Б. С. ЭХК —дело близкого
будущего. — № 6, стр. 2—5.
БЛОХИНА С. Н. Уравнение с 1000 неизвестных. — № 12,
стр. 31—34.
Большая химия накануне съезда партии. — № 3, стр.
2—4.
БОРОДЯНСКИЙ Э. И. Что нам даст хозяйственная
реформа.— № 1, стр. 3—6.
ЛЕОНОВ А. Дань моде? Нет, необходимость. — № 3,
стр. 5—10.
МИЛЮКОВ О. Трудно быть первыми. — № 7, стр. 3—
6; № В, стр. 10—12.
ФЕДОРОВИЧ М. М. Приведем в действие резервы! —
№ 5, стр. 2—5.
ЧЕРНЕНКО М. Больше платить — чтобы больше
производить. Больше производить — чтобы больше
платить. — № 9, стр. 2—В; № 10, стр. 2—5.
ЯШУНСКАЯ Ф. И. Счет в пользу капрона. — № В, стр.
13—15.
ЭЛЕМЕНТ №....
Азот.—№ 9, стр. 9; ГИНЗБУРГ П. А. Синтез аммиака.—
№ 9, стр. 10; ЛУНАЧАРСКАЯ И. Как связать азот.
№ 9, стр. 11—14; Что вы знаете и чего не знаете
об азоте и его соединениях. № 9, стр. 14—15.
ВОРОНКОВ М. Г. Третье поколение потомков камня. —-
№ 6, стр. 69—71.
ГУСОВСКИЙ А. А. Железо. —№ 11f стр. 21—27; Что вы
знаете и чего не знаете о железе. № / \, стр. 28—33.
ЖДАНОВ А. А., КРЕНЕВ В. А., ЛОСЕВ В. Б., СТАН-
ЦО В. В., РЫБЧИНСКИЙ Ю. А. Кремний. — № 1, стр.
42—49.
КАЗАКОВ Б. И., ГРУЗИНОВ Е. В. Ванадий. — № 4, стр.
60—65; Только факты. № 4, стр. 65.
КАЗАКОВ Б. И. Золото. — № 6, стр. 10—14; Только
факты. № 6, стр. 14; МОИСЕЕВА Т. Забайкальское
золото ищут снова. № 6, стр. 15—19; СОЛОДКИН Л.
Древние художественные работы по золоту. № 6,
стр. 20—22.
ПЕРЕЛЬМАН Ф. М. Цезий — № 7, стр. 20—24; Еще о
цезии. № 7, стр. 60.
РОЗЕНЦВЕЙГ Я. и ВЕНЕЦКИЙ С. Титан. — № 10, стр.
17—22; Только факты. № 10. стр. 22—23.
РУДЕНКО Е. И., ТАУБЕ П. Р. Золото. — № 5, стр. 40—44;
Разные разности. № 5, стр. 45.
СИНИЦЫН Н. М. Рутений. —№ 3, стр. 36—41.
СТАНЦО В. Курчатовий. — № 8, стр. 2—9.
ТАУБЕ П. Р., РУДЕНКО Е. И. Прометий. — № 2, стр.
54—5В; СТАНИЦЫН В. Богуслав Браунер. «Менделе-
вианский энтузиаст» AВ55—1935). № 2, стр. 58—59.
ФИНКЕЛЬШТЕЙН Д. Н. Гелий. — № 12, стр. 2—6;
СТАНЦО В. Чем дышать космонавтам? № 12, стр. 7—9*
НАУКА О ЖИВОМ
АЙЗАТУЛЛИН Т. А. «Активные поверхности» и жизнь. —
№ 11, стр. 68—69.
ГЕНКЕЛЬ К. П. Вещества-конкуренты. — № 11, стр.
41—43.
ГОЛУБОВСКИЙ М. Д. Та самая дрозофила... — № 4,
стр. 43—44.
ГОЛУБОВСКИЙ М. Д. Человек: генетика и эволюция. —
№ 7, стр. 28—34; Мальчик или девочка. № 7, стр.
36—ЗВ. НИКОЛАЕВ В. Болезни и наследственность.
№ 7, стр. 38—43.
Звериные духи. — № 2, стр. 61—63.
ЗНАМЕНСКИЙ Ю. Морские водоросли. — № 2, стр.
18—21.
ИОРДАНСКИЙ А. Москва, Останкино. — № 3, стр. 12—
22.
КАЙБЫШЕВА Л. Вирусы — сверхпаразиты. — № 6, стр.
39—40.
КАФИАНИ К. А. Автоматическое регулирование в
живой клетке. — № 6, стр. 33—38.
КЛЕЙНЕНБЕРГ С. Е. На вкус и на цвет. —№ 2, стр. 27—
30.
КОРОЧКИН Л. и ПОСПЕЛОВ В. Из единственной
клетки. _ № 2, стр. 42—46.
МОСОЛОВ А. Н. Клетка и вирус— № 3, стр. 26—33.
Новые материалы об озерах Хайыр и Чуандана. — № 1,
стр. 80—87.
Парфюмерия любви у насекомых. — № 2, стр. 60—62.
92
СЕШАДРИ Т. Р. Химия цвета цветов. — № 4, стр. ВО—83;
комментарий А. К. ЧИБИСОВА. № 4, стр. 83.
СОЛОДКИН Л. Краски живого. — № 5, стр. 50—53.
СУХОВЕЕВА М. В. Подводный гербарий. — № 2, стр. 22.
ТИХОМИРОВ Э. А. Еще о красках живого: крылатка —
полосатый тюлень. — N° 5f стр. 96.
ТОНГУР В. С. Эксперимент спрашивающий. — № 5, стр.
46—49.
УОЛД Дж. Происхождение жизни. — № 8, стр. 38—44;
№ 9, стр. 23—27.
УРМАН И. Р. Витамины растений. — № 1, стр. 50—54.
Что вы знаете и чего не знаете о водорослях. — № 2,
стр. 64.
ШУМНЫЙ В. К., РУДЬ В. Д. Вторжение в растительную
клетку. — № 8f стр. 46—53.
ЭЛЬПИНЕР И. Е. Звук созидающий. — № 8, стр. 44—45.
СТРАНИЦА ИНТЕРВЬЮ
Говорит Андрэ Львов. — № 11, стр. 44—45.
Как создавалось «сердце» противогаза. — № 9, стр. 30—*
31.
Лауреат Ленинской премии (А. Н. НЕСМЕЯНОВ). —•
№ 10, стр. 14—16.
Ответы делегата XXIII съезда КПСС Министра
химической промышленности СССР Л. А. Костандова на
вопросы редакции журнала «Химия и жизнь». —
№ 4, стр. 2—3.
НАУКА — ПОЛЯМ. АГРОХИМИЯ.
СТРАНИЦА САДОВОДА И ОГОРОДНИКА.
БОДРОВА Е. М. Теория проверяется опытом. — № 1,
стр. 15—20.
Витаминные сюрпризы. — № 2, стр. 93.
КАЛИТА В. Живые удобрения. — № 8, стр. 53—54.
КАЩЕНКО Ф. П. Доломитовые удобрения. — № 11,
стр. 60—61.
КАЩЕНКО Ф. П. Известкование: когда оно нужно? —
№ 9, стр. 91—92.
КАЩЕНКО Ф. П. Совместимость удобрений. — № В,
стр. 84—85.
НОВОСЕЛОВ А. Гидропоника в вашем доме. — № 4,
стр. 91—93.
НОВОСЕЛОВ А. А. Гидропоника при искусственном
освещении. — № 10, стр. 92.
НОВОСЕЛОВ А. Землянику — к будущему ПервомаюГ—
№ 7, стр. 92—93.
ОВЧАРОВ К. Е.г МУРАШОВА Н. Д. Витамины в жизни
растений. — № 10, стр. 29—32.
ПОЛЯК И. Всего лишь бумага. — № 5f стр. В9; Плюс
несколько шансов. № 5, стр. 88—89.
ПОЛЯК И. «Семерых убивахом». — № 3f стр. 94.
ПОЛЯК И. Скорая помощь садовода. — № 6, стр. 89—
90.
Семена на курорте. — № 2, стр. 92—93.
Фейхоа. — № 2, стр. 93.
ЩЕРБАКОВА В. Еще один южанин на окне. — № 1f стр.
90.
РАССКАЗЫ О ЛЕКАРСТВАХ
АБАКУМОВ В. М. Судьба лекарств. — № 10, стр. 60—65.
КИСИН И. Е. Нитроглицерин. — № 1f стр. ЗВ—41.
МАРТЫНОВ С. Алкалоиды. — № 6f стр. 48—55; Только
факты. № 6, стр. 55—56.
МЕДВЕДЕВА Г.г ПОГЛаЗСВА М. Как проверяют
стерильность будущих лекарств. — № 6, стр. 23.
ПОДОЛЬНЫЙ Р. Точка опоры. — № 5, стр. 65—68.
СОЛОДКИН Л. Хинин. —№ 12f стр. 58—61;
АБАКУМОВ В* М. Хинин и современная фермакология.—
№ 12f стр. 61—63.
ХОДАКОВА И. Древнейшая фармакопея. — № 6, стр. 57.
КАК ДЕЛАЮТ ВЕЩИ И ВЕЩЕСТВА.
ОБЫКНОВЕННОЕ ВЕЩЕСТВО
БАТРАКОВ В. и ДМИТРИЕВ А. Как варят пиво. — № 6,
стр. 58—65; Что вы знаете и чего не знаете о пиве.
№ 6, стр. 66—67; БАЛЕК В. Уравнение чешского
пива. № 6, стр. 67; ПЕНРОУЗ Дж. Добрый напиток
англичан. № 6, стр. 68.
ВОЛЬПЕР И. Кислота в нашей пище. — № 10г стр. 56—58;
МАРШАК М. С. Комментарий к ст. «Кислота в нашей
пище». № 10, стр. 59,
ВОЛЬПЕР И. Хлеб, который мы едим. — № 1, стр. 55—
60; Что вы знаете и чего не знаете о хлебе. № 1,
стр. 57—59; ФЕНЦМЕР Г. Хлеб — белый или черный?
№ 1f стр. 60—61.
ГРУЗИНОВ Е. В. Пиротехника — наука и искусство. —
№ 8, стр. 80—84; Пиротехническая смесь. № 8,
стр. 84.
ГУРЕВИЧ М. А. Содержимое черной коробочки. —
№ 8, стр. 27—32.
ЕЗЕРСКИЙ М. Л. Граммофонная пластинка. — № 9, стр.
66—70.
ИОРДАНСКИЙ А. Советское Шампанское — № 12, стр.
68—72; Что вы знаете и чего не знаете о
шампанском. № 12, стр. 72—75.
КИЗЕВЕТТЕР И. В. Агар. — № 2, стр. 24—25.
КУЗНЕЦОВ Ф. А. Микроэлектроника; от «транзистора»
к карманной вычислительной машине. — № 5f стр.
16—21.
КУРДЮМОВ Г. М. Сверхчистые. — № 10f стр. 45—47, 55.
ЛИБКИН О. М. Галоши шагают по свету. — № 4f стр.
66—69.
ЛИБКИН О. М. Искусственный мех. — № 12f стр. 24—30.
МАРТЫНОВ С. Ионообменная кормилица. — № 2f стр.
47—49.
Мы и кофе. — № 3, стр. 70—71; СМИТ Р. Химия
кофейного зерна. № 3, стр. 72—73; Что вы знаете и чего
не знаете о кофе. № 3, стр. 74—78.
ТАРКОВСКАЯ И. А. Разборчивые иониты. — № 11, стр.
5В—60.
ТУМАНОВСКИЙ Р. Ф. Бумага. — № 8, стр. 64—66;
ПОТАПОВ В. С. Как делают бумагу. № В, стр. 67—
70; Небумажная бумага. № В, стр. 70—71.
ФИНКЕЛЬШТЕЙН Д. Н. Искусственные минералы. —
№ 11, стр. 64—68.
ФРИДМАН Р. А. Искусство парфюмера — № 9, стр. 54—
5В; Просто химический продукт. № 9, стр. 58—59;
ПЕШКОВСКИЙ Я. Ф.г ФЕДОРОВ А. Что вы знаете и
чего не знаете о парфюмерии. № 9, стр. 59—61.
ЦУКЕРМАН В. Будь здоров, дом! — № 10, стр. 49.
ВООРУЖЕННЫМ ГЛАЗОМ. НАУКА НА ЭКРАНЕ
БРЕНДОН Д. Ионный микропроектор — «микроскоп»
для наблюдения одиночных атомов.—*№ 10, стр.
48—50.
Зимний отдых хлоропластов. — № 3, стр. 34—35.
Как образуются ситаллы? — № 9, стр. 65.
МЕДВЕДЕВА Г. Дрожжи под микроскопом. — № 4, стр.
75.
МИТРОФАНОВА Л. На границе жизни. — № 7, стр. 70.
Человек и атом. — № 3, стр. 24—25.
93
И ХИМИЯ — И ЖИЗНЬ!
ГУСЕВ А. Г. Химия и рыба. — № 10, стр. 24—28.
ИОРДАНСКИЙ А. Бумага, кислород и рыба. — № 11,
стр. 2—5.
КЛЯЦКИН В. Б. Берегись автомобиля! — № 12, стр.
10—15.
МАРТЫНОВ С, НИКОЛЬСКАЯ М. Внимание,
ядохимикаты! — № 11, стр. 14—19.
СТАНЦО В. Нужно, как воздух. —№ 7, стр. 9—12.
СТРАНИЦЫ РАЗНЫХ МНЕНИЙ
АНДРИЕВСКИЙ И. И. Существо или вещество? — № 4,
стр. 45—47;
ФАИЗОВА Г. История одного заблуждения. № 4,
стр. 48—50;
НЕЙФАХ А. А. Возможна ли бесструктурная жизнь? № 4,
стр. 50—53.
ЖИРНАУСКАС И. Диалог об алхимии. —№ 4, стр. 54 —
56;
БАТРАКОВ В. Продолжим разговор, № 4, стр. 57—58.
ТОНГУР В. С. Существует ли вещество памяти? — № 9,
стр. 44—48.
КУХТИН В. А. Память, химия и кибернетика. — № 10,
стр. 51—55.
В ЛАБОРАТОРИЯХ ЗАРУБЕЖНЫХ УЧЕНЫХ
БРЕЙК Дж., ТАУЗЕНД Р., СИЛВЕРМЕН Г.
Микроорганизмы— источник электроэнергии. — № 11, стр.
45—47; Комментирует профессор Н. А. КРАСИЛЬ-
НИКОВ. № 11, стр. 48.
НАГАТА Т. Магнитный щит планеты — № 2, стр. 32—37;
Наш комментарий. № 2, стр. ЗВ—40.
ПАРКЕР А. Дж. Сверхрастворители. — № 6, стр. 41—47.
ШАМПАНЬЯ А. Белки из нефти. — № 4, стр. 70—73;
Статью А. Шампенья комментирует
член-корреспондент Академии наук СССР Н. Д.
ИЕРУСАЛИМСКИЙ, № 4, стр. 73.
ИСКУССТВО. КУЛЬТУРА. БЫТ
АЙРАПЕТОВ Дм. ...По которому мы ходим.— № 11,
стр. 80—В2.
«Аэрозоли» у нас дома. — № 12, стр. 80—83; Что вы
знаете и чего не знаете об аэрозолях, № 12,
стр. 83—84.
БАЛУЕВА Г. А. Химические товарные знаки. — № 12,
стр. 91, 96.
ВИКТОРОВ К. Без ниток и гвоздей.— №1, стр. 63—65.
ВИКТОРОВ К. Вакса. — № 3, стр. 79—В1.
ГЕЛТОН Л. Осторожнее с закуской! — № 12, стр. 76—
77; Комментирует кандидат медицинских наук
В. М. АБАКУМОВ. № 12, стр, 77.
ГОШЕВ Г. Газовая гастрономия.— № 7, стр. 57—59.
ДМИТРИЕВ Э. Химия и филателия. — № 1, стр. 71—72;
№ 2, стр. 72—75.
ЖИЛИНА В. Искусство ценинного дела. — № 11, стр.
72—75.
КСЛОМИЙЦЕВА О. Химия и театр. — № 6, стр. 96.
КРИВЕНЦОВ В. И. Краски туркменского ковра. — № 9,
стр. 62—65, 88.
КУПЦОВ И. На первой выставке «Игрушка». — № 1, стр.
В8—89.
НЕВОЛЕ И., ЗАЛЕШ И., БАЛЕК В. Свои секреты
раскрывают кондитеры. — № 4, стр. 95—96.
Нл-/жен лак для паркета. — № 11, стр. 83.
Пластмассовая скульптура.— № 9, стр. 17.
РЫЖАКОВА Н. Рижские моды: товары одеваются
по-новому. — № 11, стр. 90.
САМОЙЛОВ Л. Ковры из синтетики. — № 11, стр. 84.
СТАНИЦЫН В. Спутники зубастых. Четыре рассказа о
зубной пасте. — № 10, стр. 94—96.
ТКАЧЕНКО И. В. Современный витраж.— №8, стр. 58—
59.
ТУМАНОВСКИЙ Р. Ф. Био-экслибрисы. —№ \, стр. 92—
94.
ЦУКЕРМАН В. От Кижей к аэропорту. — № 9, стр. 18—
22.
Что полезно знать о новых чистящих средствах? —
№ 10, стр. 90—91.
ШЕЙНИНА Е. Г. Оживают древние фрески. — № 1, стр.
22—27, 37.
ЖИЗНЬ ЗАМЕЧАТЕЛЬНЫХ УЧЕНЫХ.
НАШ КАЛЕНДАРЬ
АЗЕРНИКОВ В. Первый анализ. — № 7, стр. 53—54.
ВАСИЛЬЕВ Ю. Б. Жизнь для науки. — № 2, стр. 12—14.
ВЛАДИМИРОВ С. Как была открыта радиоактивность. —
№ 9, стр. 34—35.
ВОЛЬПЕР И. Юбилей вкусной кислоты. — № 8, стр. 55—
56.
ГРИГОРЬЕВ Г., МАРХАСЕВ Л. Николай Иванович
Вавилов — № 12, стр. 16—22.
КОСТРИН К. В. Открытия алхимика Бехера. — № 11, стр.
54—57.
МАКАРЕНЯ А. Из переписки Д. И. Менделеева и
К. А. Винклера.— № 7, стр. 55—56.
НАЛБАНДЯН А. Б. и ВЕДЕНЕЕВ В. И. Что такое цепные
разветвленные химические реакции. — № 4, стр.
25—30; ВОЕВОДСКИЙ В. В. О человеке, который
сделал это открытие. № 4, стр. 30—33.
СЕМЕНОВ Н. Н. Будьте первооткрывателями. — № 8,
стр. 34—37.
СЕРГЕЕВ А. Уоллес Карозерс —№ 2, стр. 50—53.
СЕРГЕЕВА И. Юлия Лермонтова. — № 1, стр. 28—30;.
Из писем о Ю. В. Лермонтовой. № 1, стр. 31; Что
читать о Ю. В. Лермонтовой. № 1, стр. 31.
СОЛОВЬЕВ Ю. И. Академик Николай Семенович Кур-
наков. — № 12, стр. 39—42; Ученые вспоминают.
№ 12, стр. 42—43.
Стерлитамаку 200 лет. — № 6, стр. 6—7.
ТОМСОН Дж. П. Пути, ведущие к открытиям. — № 5,
стр. 54—59; № 6, стр. 24—28.
СТРАНИЦЫ ИСТОРИИ. СЛОВАРЬ НАУКИ.
АЗИМОВ А. И вы можете говорить по-гэльски. — № 9,
стр. 49—53.
БАРАШ Б. Первые аптеки. — № 1, стр. 6В—69; Первые
рентгенограммы. № 1, стр. 70; Порошки
флибустьера. № 1, стр. 70.
БОРИСОВ Б., ВЛАДИМИРОВ В. Мы говорим газ. — № 1,
стр. 66—67.
ВЛАДИМИРОВ С. Кто первый решил спор об атомных
весах элементов. — № 3, стр. 23.
В музее истории медицины. — № 3, стр. В4—85.
ВОЗНЕСЕНСКАЯ Г. Секреты древнего металла. — № 6,
стр. 72—75.
ВОЛЬПЕР И. Безжизненный элемент. — № 9, стр. 15—
16.
Вспышка гения. — № 9, стр. 71—73; № 10, стр. 70—71;
№ 12, стр. 48—49.
ГУРОВИЧ Е. И. От ^7 до Н20. — № 9, стр. 32—34.
ЛУКЬЯНОВ П. М. Первые химические лаборатории в
России. — № 10, стр. 33—35.
?
|ПАРИНИ В. П. | Путешествие за жар-птицей. — № 2,
стр. 65—71.
Письма Д. П. Коновалова из Америки.—№ 12f стр. 36—ЗВ.
РИЧ В. Горькая земля. —№ 5, стр. 69—70.
СЕРГЕЕВА И. Николай Щеглов A793—1831). — № 5, стр.
34—37; МАЛЕВАННЫЙ В. Из истории производства
сахара в России. № 5, стр. 37—38.
СОЛОВЕЙЧИК С. Неосторожность, стоившая жизни. —
№ 6, стр. 29—32; КОСТЯНОВСКИЙ Р. Берегите себя
для науки. № 6, стр. 32.
ЮРКЕВИЧ О. П. Менделеевский завод. — № 4, стр. 9—
12.
ЛИТЕРАТУРНЫЕ СТРАНИЦЫ. ФАНТАСТИКА. ШУТКИ
ВЛАДИМИРОВ М. Остров Пуа-Ту-Тахи. — № 3, стр. 50—
64; № 4, стр. 39—41.
КЛАРК А. Техническая ошибка. — № 7, стр. 63—69.
Когда... Однажды... Как-то раз... — № 8, стр. 60—61,
№ 10г стр. 65, № 11, стр. 48.
КОМАЦУ САКЁ. Бумага или волосы? — № 8, стр. 72—
79.
ПОРДЖЕСС А. 1,98. —№ 10, стр. 42—44.
РИЧ В. Горе от ума. — № 11, стр. 62—63.
Сделайте, пожалуйста, анализ... Десять заповедей
химика-органика. — № 10, стр. 77—78.
Совершенно очевидно: шутят не только физики! —
№ 11, стр. 88—В9.
СЦИЛАРД Л. Всем звездам. — № 1, стр. 33—36; ГОЛЬ-
ДАНСКИЙ В. И. Он думал о судьбе
человечества... — № 1, стр. 32.
ШЕКЛИ Р. Специалист. — № 2, стр. 83—89.
ОЧЕРКИ. ОБЗОРЫ. СООБЩЕНИЯ
БАТРАКОВ В. История одной дуэли. — №12, стр. 50—53.
ВОРОБЬЕВ Г. Г. Тектиты — космическое стекло. — № 11,
стр. 39—40.
ГЕОРГИЕВ С. Реакции во льду. — № 12, стр. 35.
ГРУЗИНОВ Е. В. Химическая сварка. — № 5, стр. 26—28.
ГУРЕВИЧ М. А., ЛИТВИНЕНКО В. А. Железные
нервы.— № 10, стр. 36—40.
ГУРЕВИЧ М. A.f ЛИТВИНЕНКО В. А. Схемы без схемы.—
№ 11, стр. 49—53.
ДОРФМАН М. Д. Горючее в камнях. — № 6, стр. 8—9.
ДОРФМАН Я. Г. Магнетохимия, ее настоящее и
будущее. — № 11, стр. 34—38.
КАРАПЕТЬЯНЦ М. X. И мерить, и считать. — № 5, стр.
29—32.
КРЫЛОВ К. Предсказание подтвердилось:
сверхтяжелый гелий. — № 5, стр. 64.
МАКАРЕВИЧ Г. Наша себацинка. — № 5, стр. 7—10.
МЕДВЕДЕВ К. П. Как построен кокс. — № 7, стр. 25—
27.
МОИСЕЕВА Т. Гипсолюбка ищет медь. — № 11, стр.85—
87.
НУРМУХАМЕТОВ Р. Н. Как мы видим. — № 5, стр. 60—
63.
ПАВЛОВ-ВЕРЕВКИН Б. С. Мыльные антипузыри. — № 11,
стр. 12—13.
ПЕТРОВ А. И., АНИСИМОВА Н. Ф. Ленинским
документам — долгую жизнь. — № 4, стр. 4—9.
РОЗОВСКИЙ Г. И. Экзотика валентности. — № 2, стр.
15—17.
ШИШИНА Ю. Человек растет на Земле. — № 5, стр.
22—25.
ШКУРЕНКОВА О. Комплексоны и комплексономет-
рия. — № 5, стр. 38—39-
ПОЛЕЗНЫЕ СОВЕТЫ ХИМИКАМ. НАШ ПРАКТИКУМ
АРТЕМЕНКО А. И. С = ? Н = ? —№ 10, стр. 74—77.
ЖВИРБЛИС В. В гостях у стеклодува. — № 3, стр. 65—
69. № 4, стр. 41—42; № 5, стр. В5—87; № 6, стр.
84—В5; № 7, стр. 84—86; № 8, стр. 95—96; № 9,
стр. 84—В5; № 10, стр. 86—87; № 11, стр. 78—79;
№ 12, стр. 64—66.
ЖДАНОВ А. А., ЛЕВИЦКИЙ М. М. Информация на
спице. — № 5, стр. 71—74.
КОНСТАНТИНОВСКИЙ М. Когда, зачем и как паяют. —
№ 3, стр. 93—94.
КОНСТАНТИНОВСКИЙ М. Позолотите ручку. — № 2,
стр. 94.
ЛЕОНТЬЕВ В. Искусство перегонки. — № 7, стр. 44—49;
Что вы знаете и чего не знаете о перегонке. — № 7,
стр. 50—51.
ПИЛТАКЯН А. М. Пластмассы в массы. Домашняя
фабрика пластмассовых изделий. — № 1, стр. 91—92.
ПУМПЯНСКИЙ А. Л. Английский — для химиков. — № 1,
стр. 61—62; № 2, стр. 79—81; № 3, стр. 81— ВЗ;
№ 4, стр. 77—79; № 5, стр. 75—77; № 6, стр. В6—
88; № 7, стр. 87—89; № 8, стр. 87—89; № 9; стр.
В6—88; № 10, стр. 68—70, № 11, стр. 76—77; № 12,
стр. 78—79.
ФЕДОСЕЕВ П. Н. Титрование без бюретки. — № 12,
стр. 54—55.
УГОЛОК ФОТОЛЮБИТЕЛЯ
ИОФИС Е. А. Проявляющие растворы с фенидоном.—
№ 9, стр. 90—91.
ИОФИС Е. А. Фотография. Близкое и далекое. — № 3,
стр. 45—49.
МИЛЮКОВ О. Амидол. —№ 5, стр. 91—92;
Гипосульфит. № 5, стр. 92—93.
ПЛУЖНИКОВ Б. Ф. Как снять привидение. — № 7, стр.
95—96.
ПЛУЖНИКОВ Б. Соляризация. —№ 10, стр. 88—89.
ПЛУЖНИКОВ Б. Ф. Фотографические эффекты:
крупнозернистая фотография. — № 6, стр. 92—94.
КЛУБ «ЮНЫЙ ХИМИК»
№ 1, стр. 74—7В; № 2, стр. 76—78, 81; № 3, стр.
86—92; № 4, стр. 84—90; № 5, стр. 78—84; № 6,
стр. 76—83; № 7, стр. 71—83; № 8, стр. 90—95; № 9,
стр. 74—83; 95—96; № 10, стр. 79—85; № 11, стр.
91—96; № 12, стр. 85—91.
КНИЖНАЯ ПОЛКА
АЛЕКСЕЕВА И. Выйдут в этом году. — № 1, стр. 95—
96.
АЛЕКСЕЕВА И. Хлеб для всех. — № 5, стр. 93—95.
АНТОНОВ А. С. Атомы, молекулы, жизнь. — № 4, стр.
94.
БАКИНОВСКИЙ Л. Химия углеводов. — № 6, стр. 91.
ГОЛЬДАНСКИЙ В. И. Читатель — соратник
исследователя.— № 9, стр. 89.
ГУБЕРМАН И. Судьба поиска. — № 7, стр. 89—90.
ДМИТРИЕВ А. Белая магия современной науки. — № 3,
стр. 95—96.
ДМИТРИЕВ А. Предвидимые революции. — № 2 стр.
96.
ЛИМОННИК М. Журнал Всесоюзного Химического
Общества им. Д. И. Менделеева. — № 5, стр. 95—96.
ПАРАМОНОВА Л. И. Что мы знаем о светящейся
жизни. — № 6, стр. 90—91.
РАЗГОН Л. Встреча не перекрестке.— № 10, стр. 93.
ЧЕРНЕНКО М. Совсем иной мир... — № 8, стр. 86—87.
1M
ХИМИЧЕСКИЕ ТОВАРНЫЕ ЗНАКИ
(Окончание. Начало на стр. 91)
Из чего образуется товарный знак?
В простейшем случае это инициалы названия
завода. Часто их дополняют, а иногда заменяют
изображениями, указывающими на характер
производства, основное сырье, область применения
продукции. Почему-то наиболее характерным «признаком»
химии художники считают реторту и часто включают
ее в товарный знак, иногда сочетая ее с
заводскими трубами. Следующее место по частоте
употребления принадлежит другим заслуженным
представителям химической посуды — колбам.
Фармацевтические фабрики предпочитают изображение
пробирки или ампулы.
В некоторых случаях монограмма названия
предприятия образует силуэт завода или очертания
химической посуды. Посмотрите, как оригинален
товарный знак Омской галено-фармацевтической
фабрики: буквы образуют воронку и колбу для
фильтрования!
Не забыты в товарных знаках и химические
формулы. Правда, пока ассортимент их не велик, чаще
всего художники довольствуются структурной
формулой бензола.
Быстрыми темпами растет химическая
промышленность, строятся новые заводы, выпускаются
разнообразные химические продукты. И покупая их, вы
легко можете узнать, откуда они родом. Об этом
вам скажет товарный знак.
Г. А. БАЛУЕВА
На третьей странице обложки воспроизведены
двадцать два товарных знака. Их владельцы:
1.ВНИИ монокристаллов; 2. НИИПП, Ленинград; 3. Ке-
дайнский химический комбинат; 4. Новомосковский
химический комбинат; 5. Лесохимический комбинат,
Киев; 6. Завод изделий бытовой химии, Каунас;
7. Омская гапено-фармацевтическая фабрика; 8. Пав-
лоградский завод «Химмаш»; 9. Владимирский
химзавод; 10. ВНИИНЕФТЕХИМ, Ленинград; 11. Данков-
ский химический завод; 12. Техжиркомбинат,
Волгоград; 13. Ухтинский нефтеперерабатывающий завод;
14. Московский витаминный завод; 15. Кучу некий
сульфатный комбинат, пос. Благовещенка,
Алтайский край; 16. Рутченковский коксохимический завод
им. С. М. Кирова, Донецк; 17. Завод «Химэфир»,
Киев; 18. Экспериментальный завод Института
органической химии АН Латвийской ССР, Рига; 19. Ще-
кинский химкомбинат; 20. Завод химических
реактивов, Харьков; 21. Куйбышевский завод
синтетического каучука; 22. Ленинградский завод химреактивов
«Красный химик».
1
5
9
14
18
2
6
10
15
L.
3
7
т—
CN
16
20
Lll
4
8
13
| 17
22
г 1
1 J
На первой странице обложки — рисунок В. Скобелева к статье «Гелий»
Редакционная коллегия:
Главный редактор И. В. Петрянов-Соколов
П. Ф. Баденков, Н. М. Жаворонков, С. В. Кафтанов, Л. И. Мазур,
Б. Д. Мельник, В. И. Рабинович (ответственный секретарь), П. А. Ребиндер,
М. И. Рохлин (зам. главного редактора), С. С. Скороходов, Б. И. Степанов, А. С. Хохлов,
М. Б. Черненко (зам. главного редактора), Н. М. Эмануэль
Рукописи не возвращаются. При перепечатке ссылка на журнал «Химия и Жизнь» обязательна
Оформление С. Верховского Технический редактор Э. Язловская
Адрес редакции: Москва, В-333, Ленинский проспект, 61/1. Телефоны АВ 7-72-64 и АВ 7-66-23
Подписано к печати 25/Xl 1966 г. Т. |4290. Бумага 84 X 1081Ль. Бум. л. 3,0. Печ. л. 6.0. Усл. п. л. 10,08 + 1 вкл. Уч.-иэд. л. 11.2.
Тираж 83 000. Зак. N9 1426. Цена 30 коп. Набор и печать выполнены в Московской типографии № 2 Главполиграфпрома Комитета по
печати при Совете Министров СССР. Москва, Проспект Мира, 105.
Печать обложки и цветной вклейки и брошюровочные работы выполнены во 2-й типографии издательства «Наука».
Москва, Шубинский пер., Ш.
SliMK
to
Ж
7
A
00
J»
X&
Цена 30 коп.
Издательство «Наука»
Индекс 71050