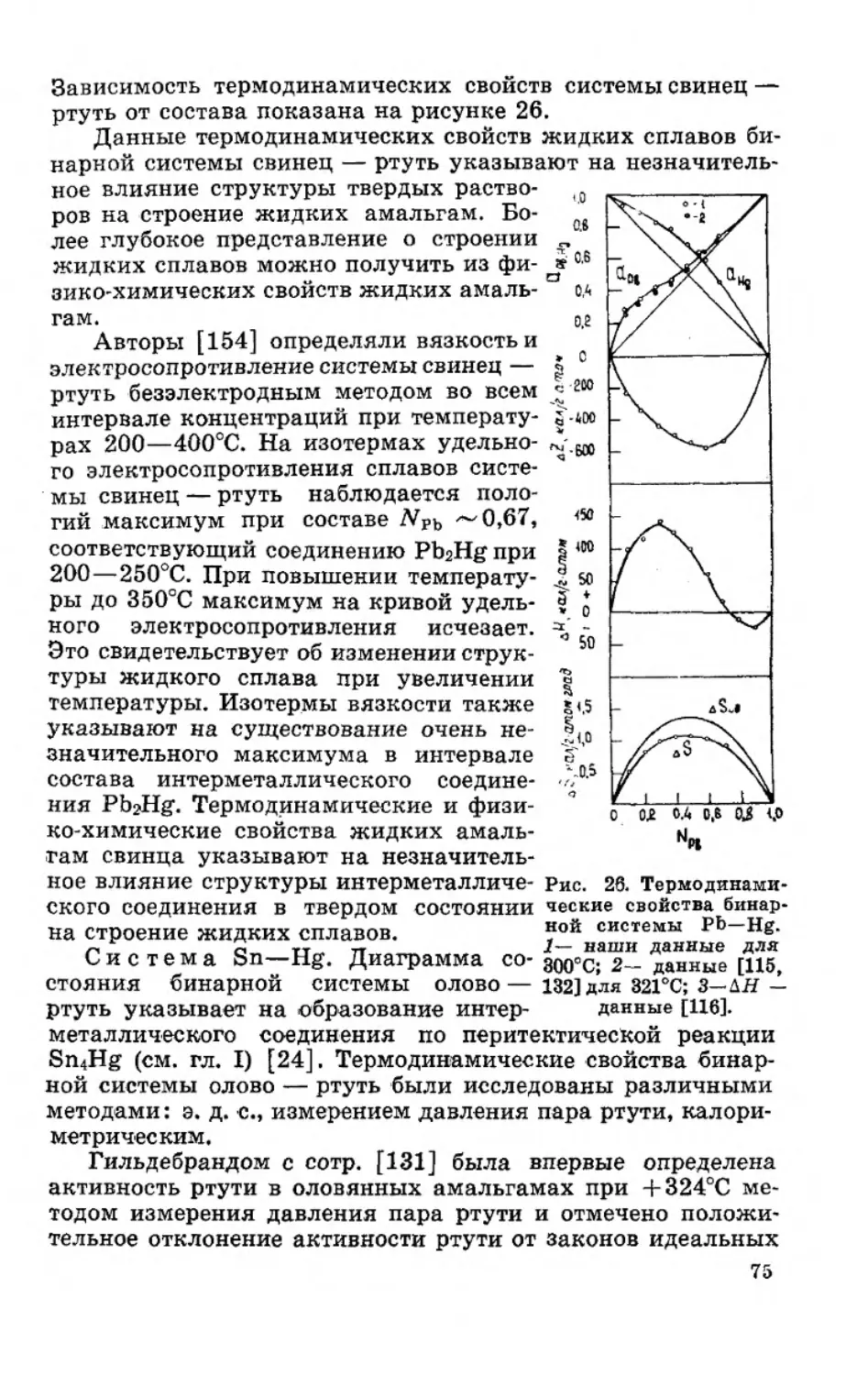
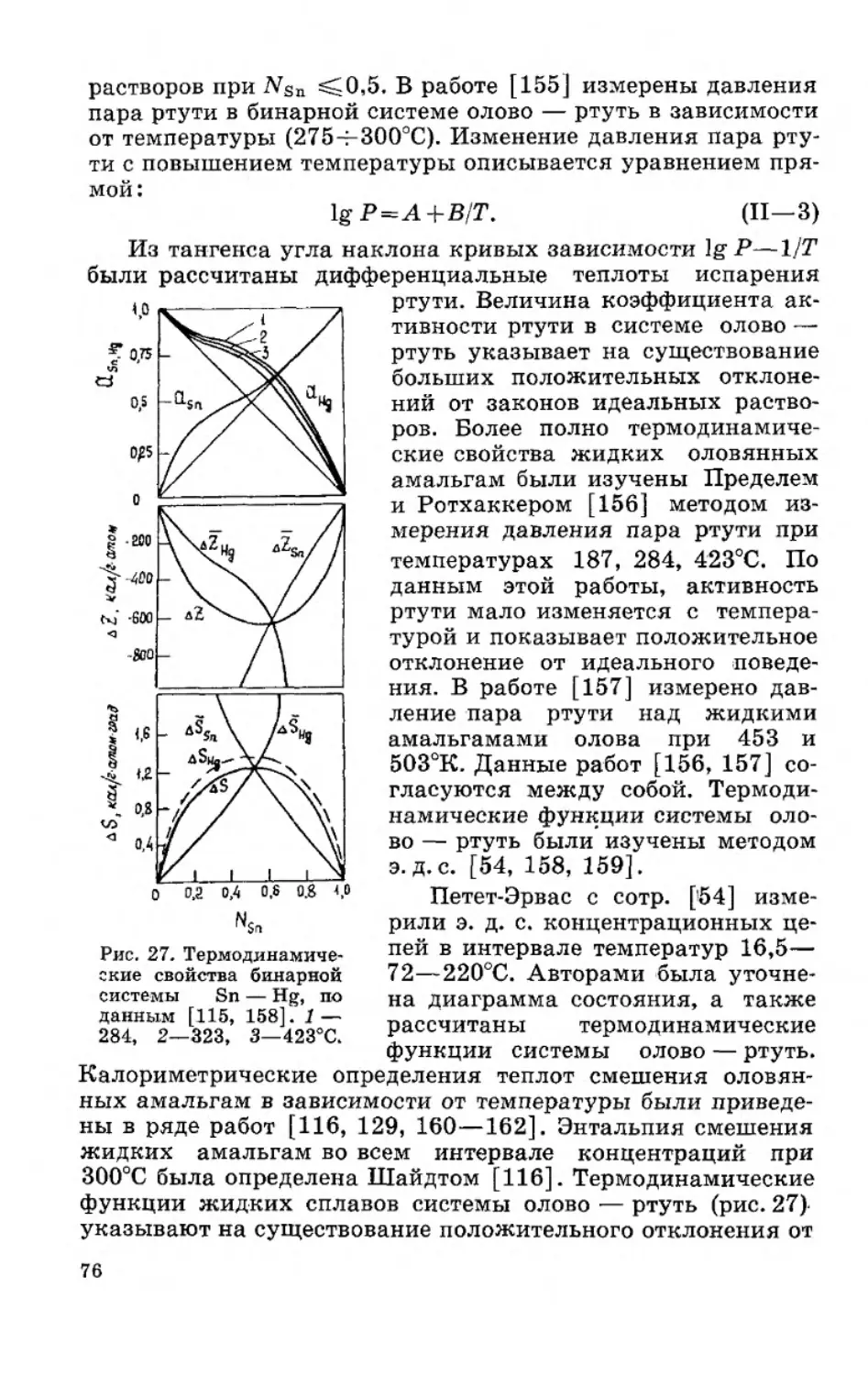
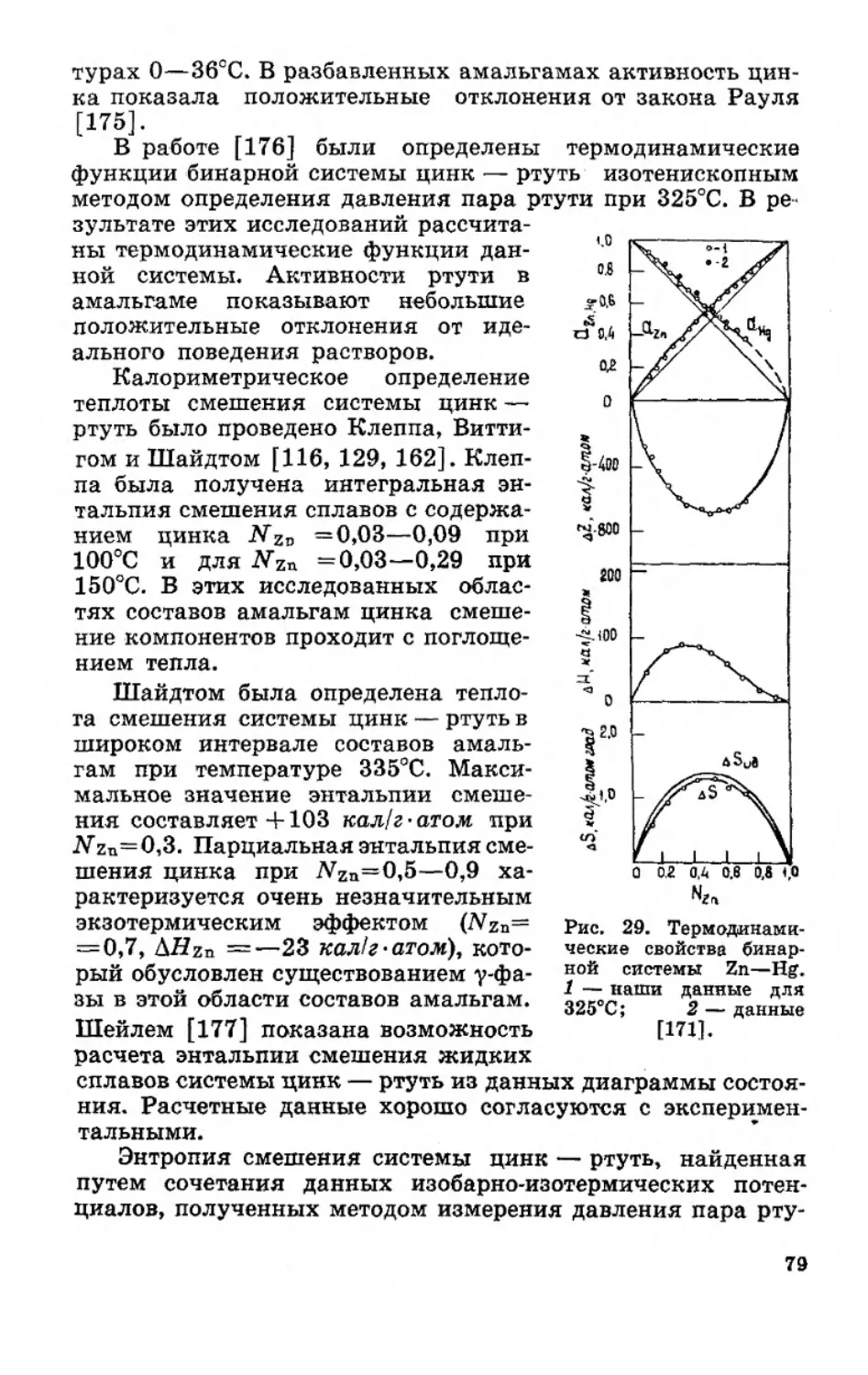
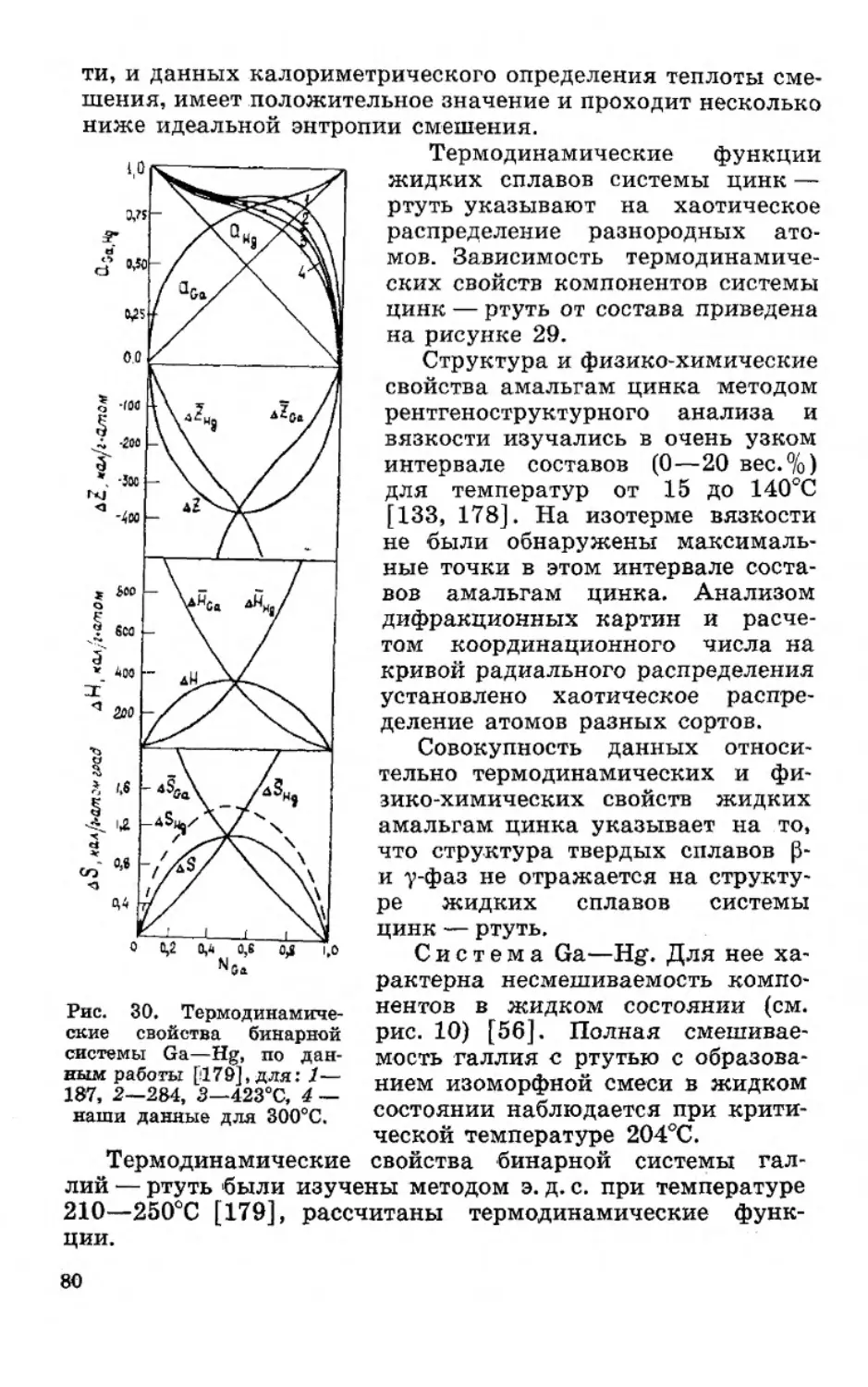
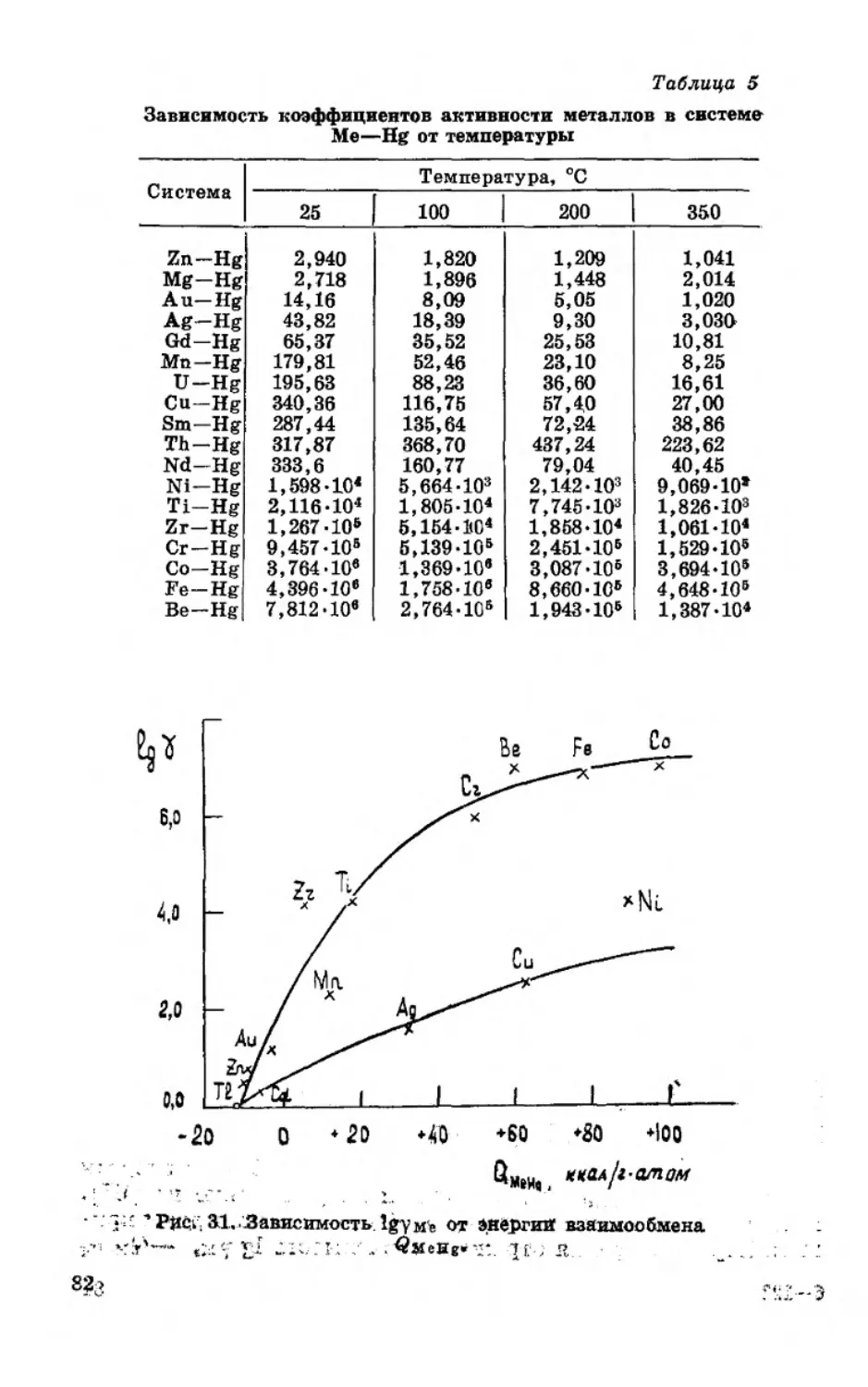
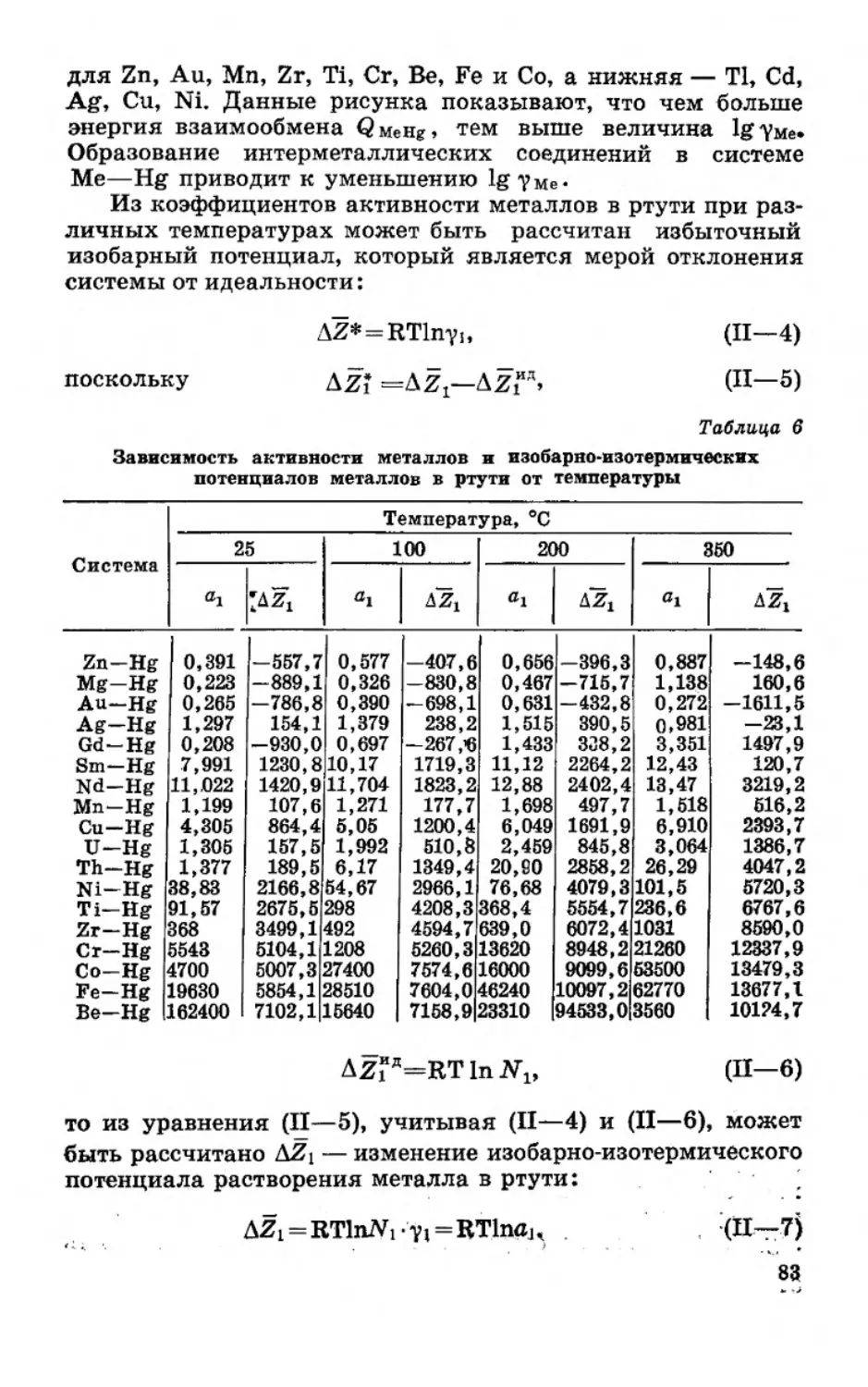
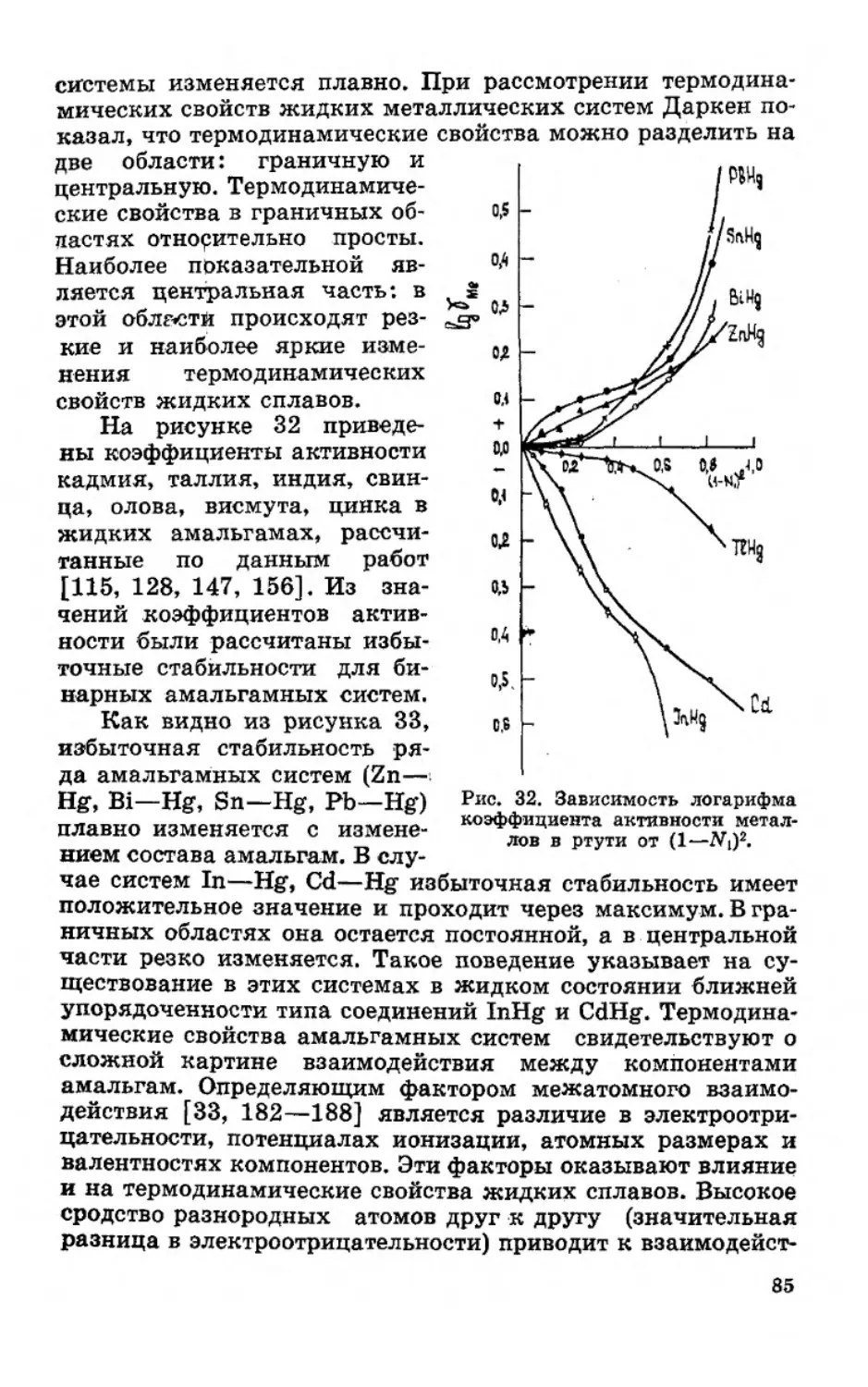
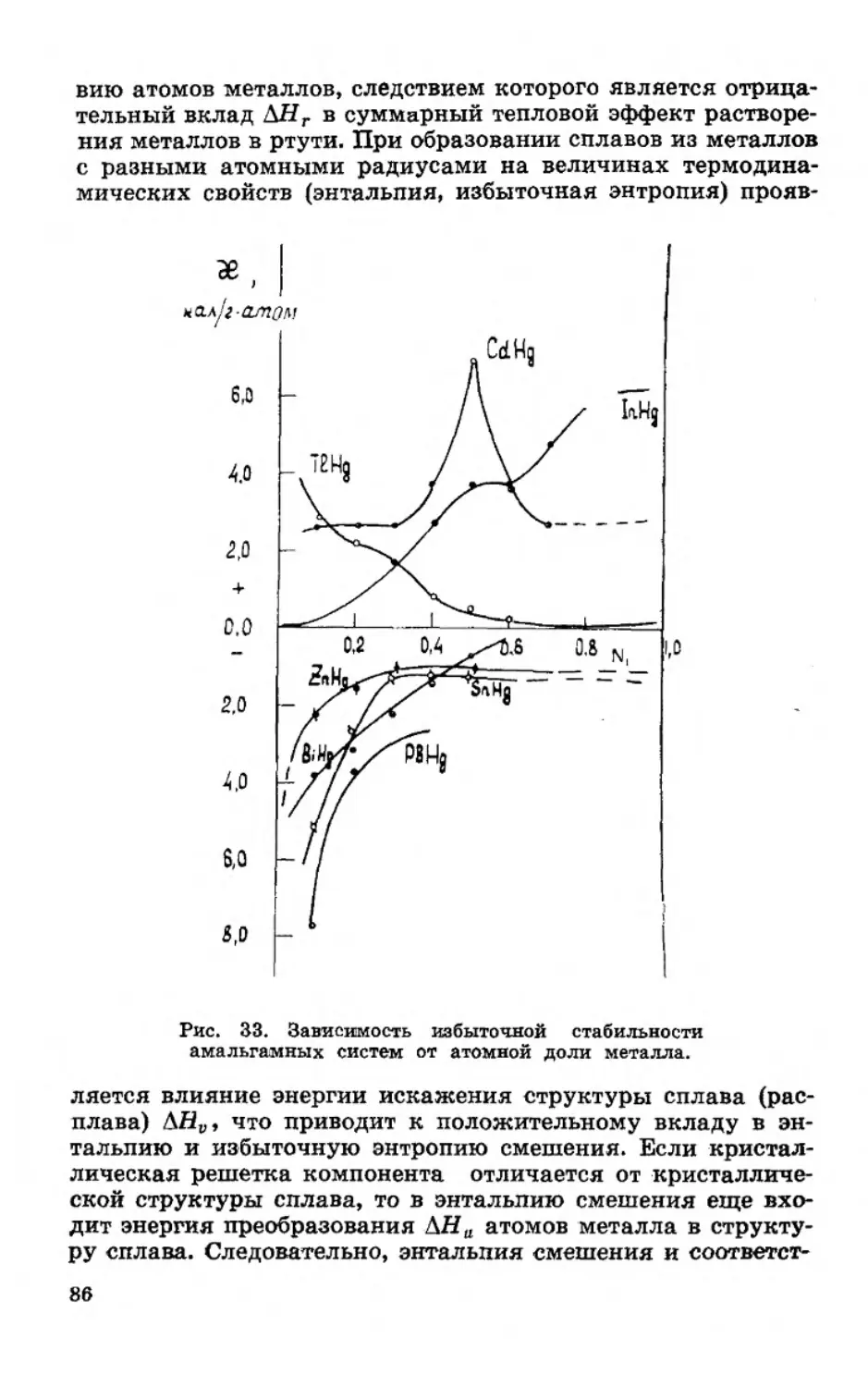
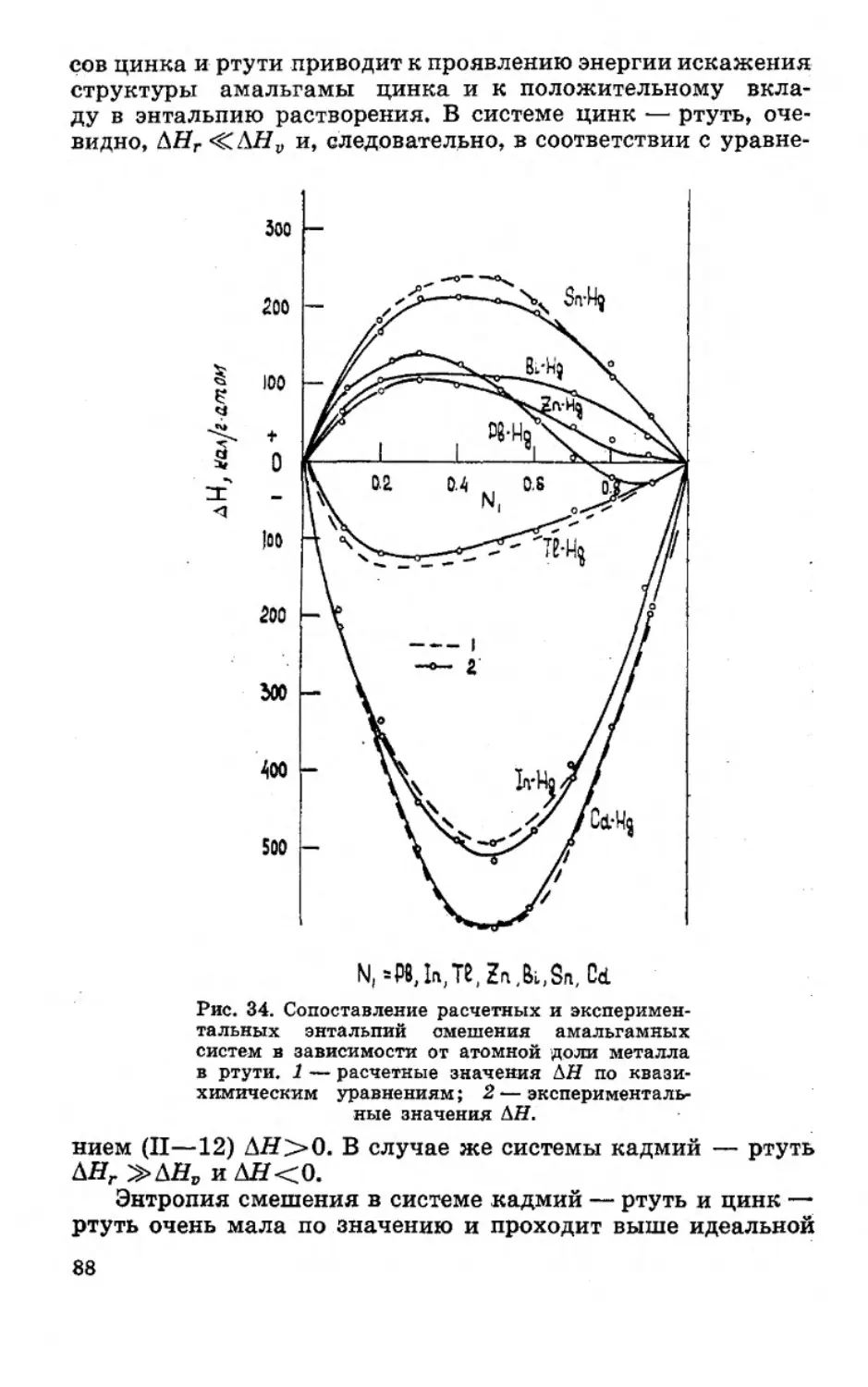
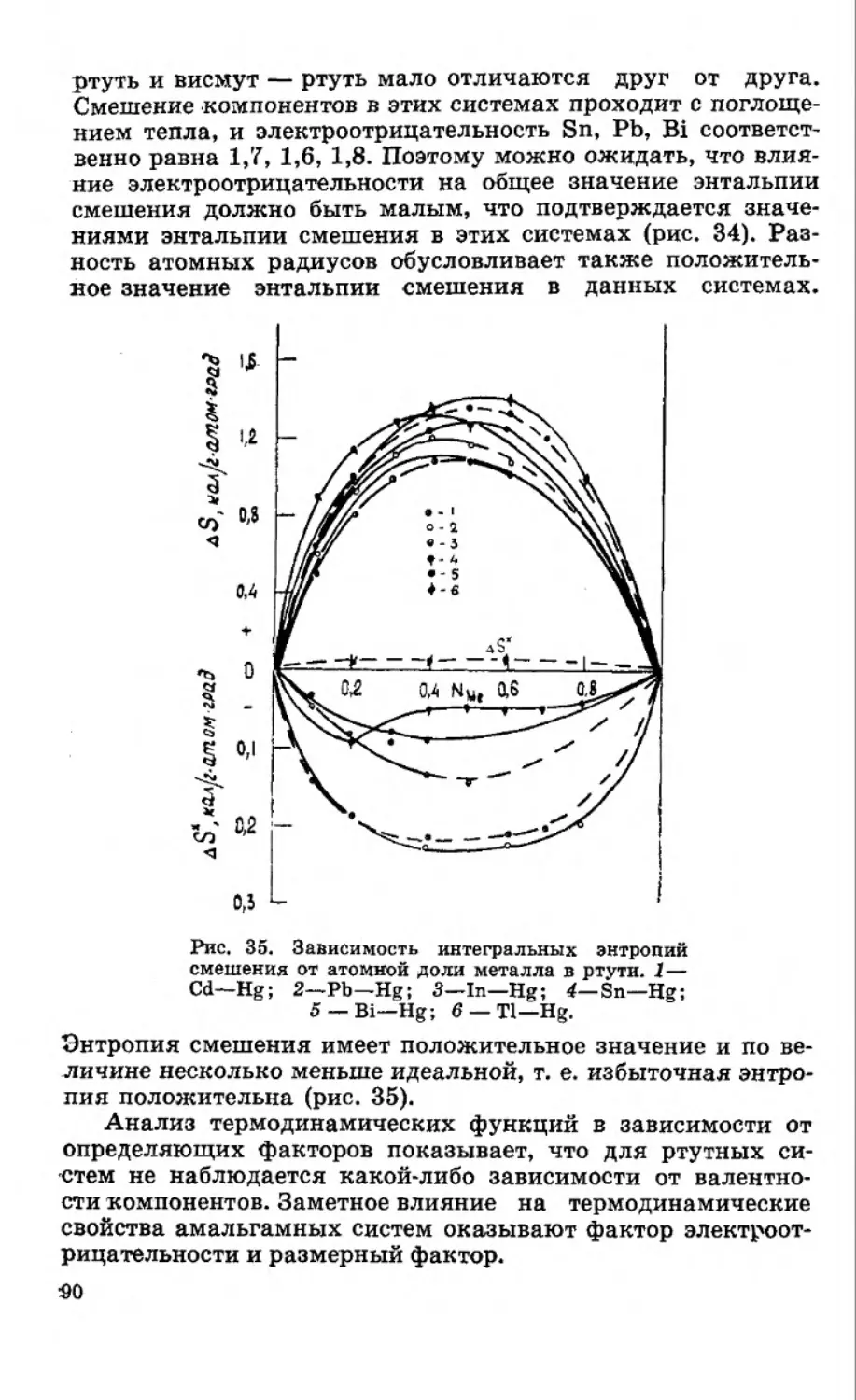
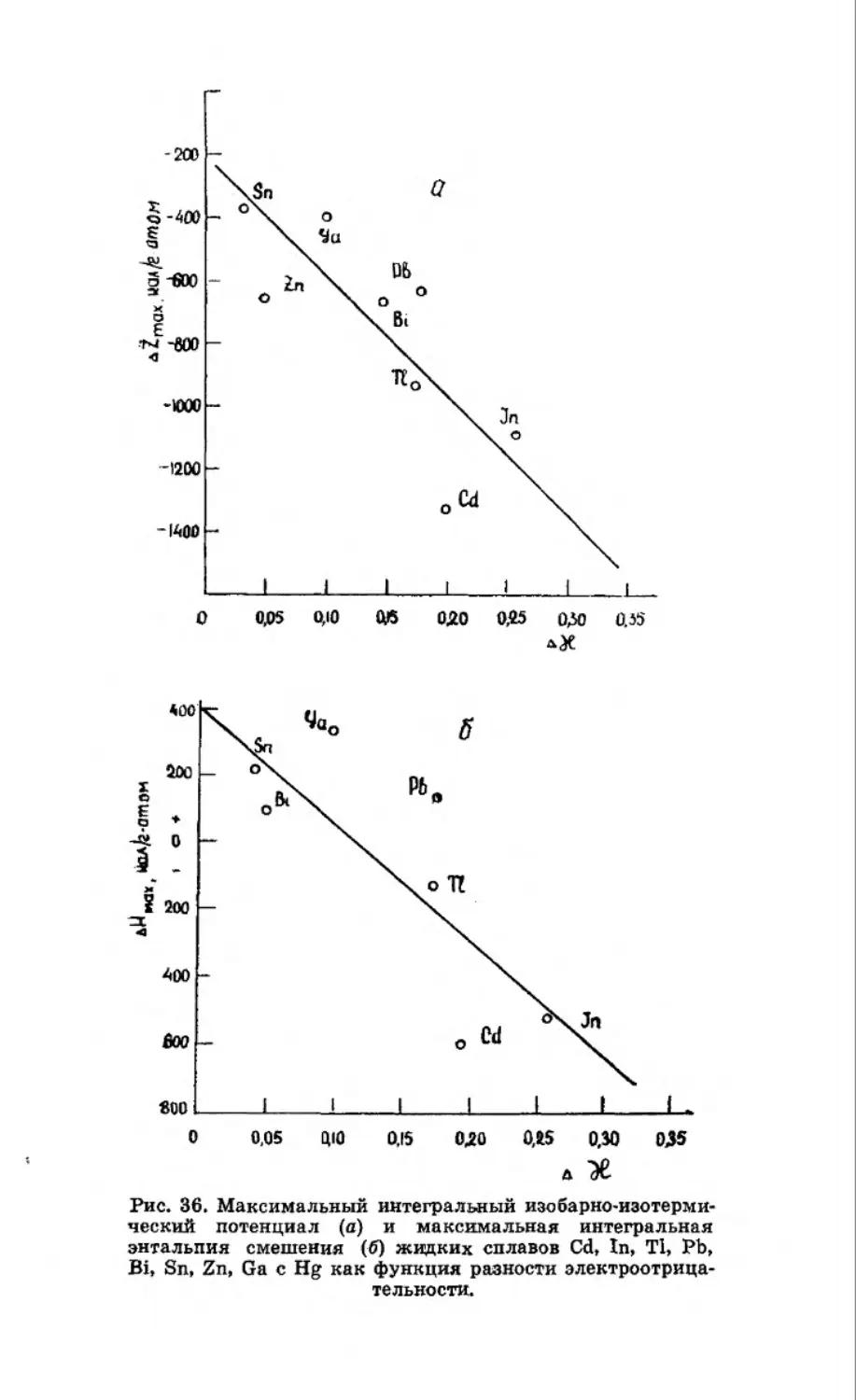
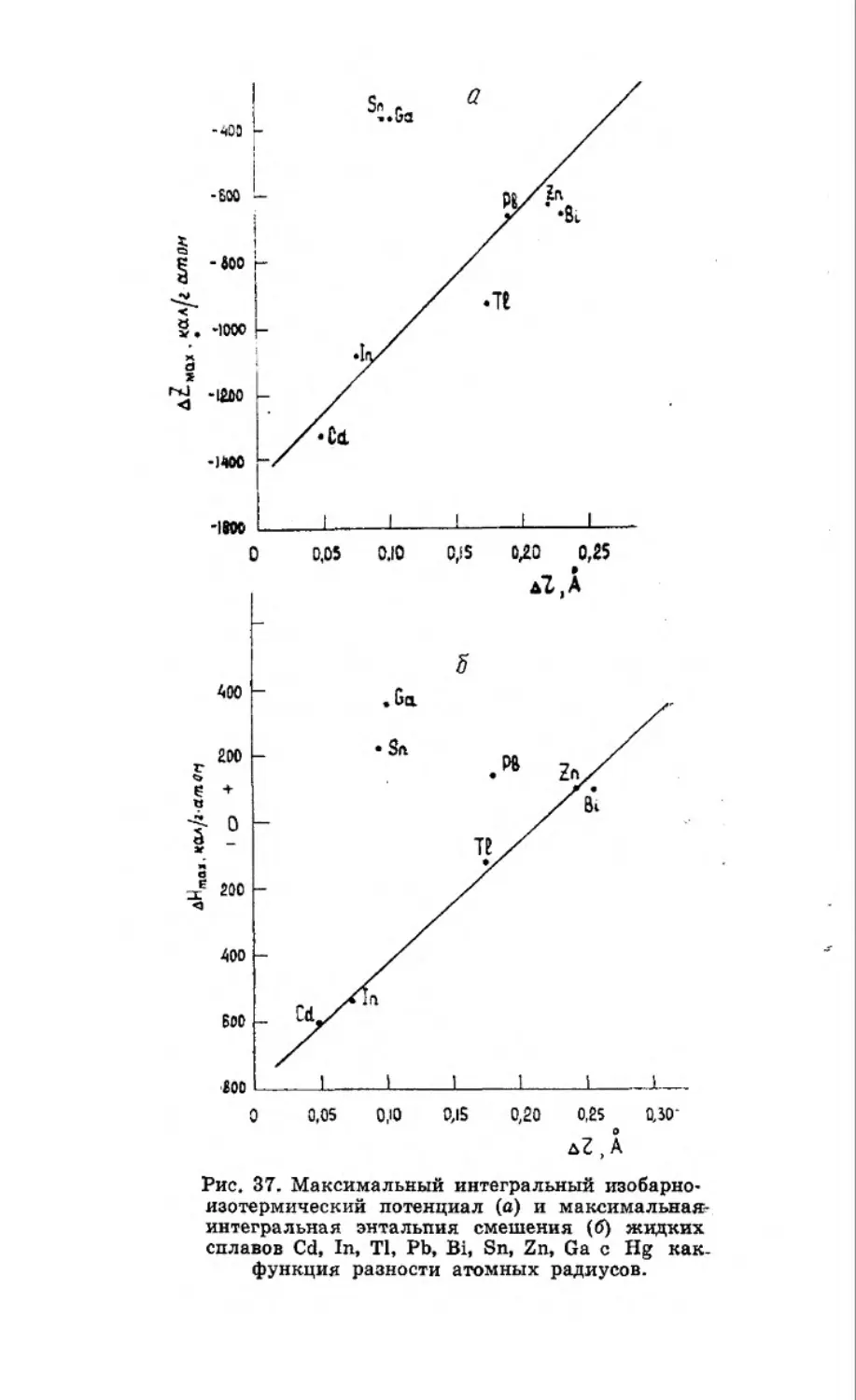
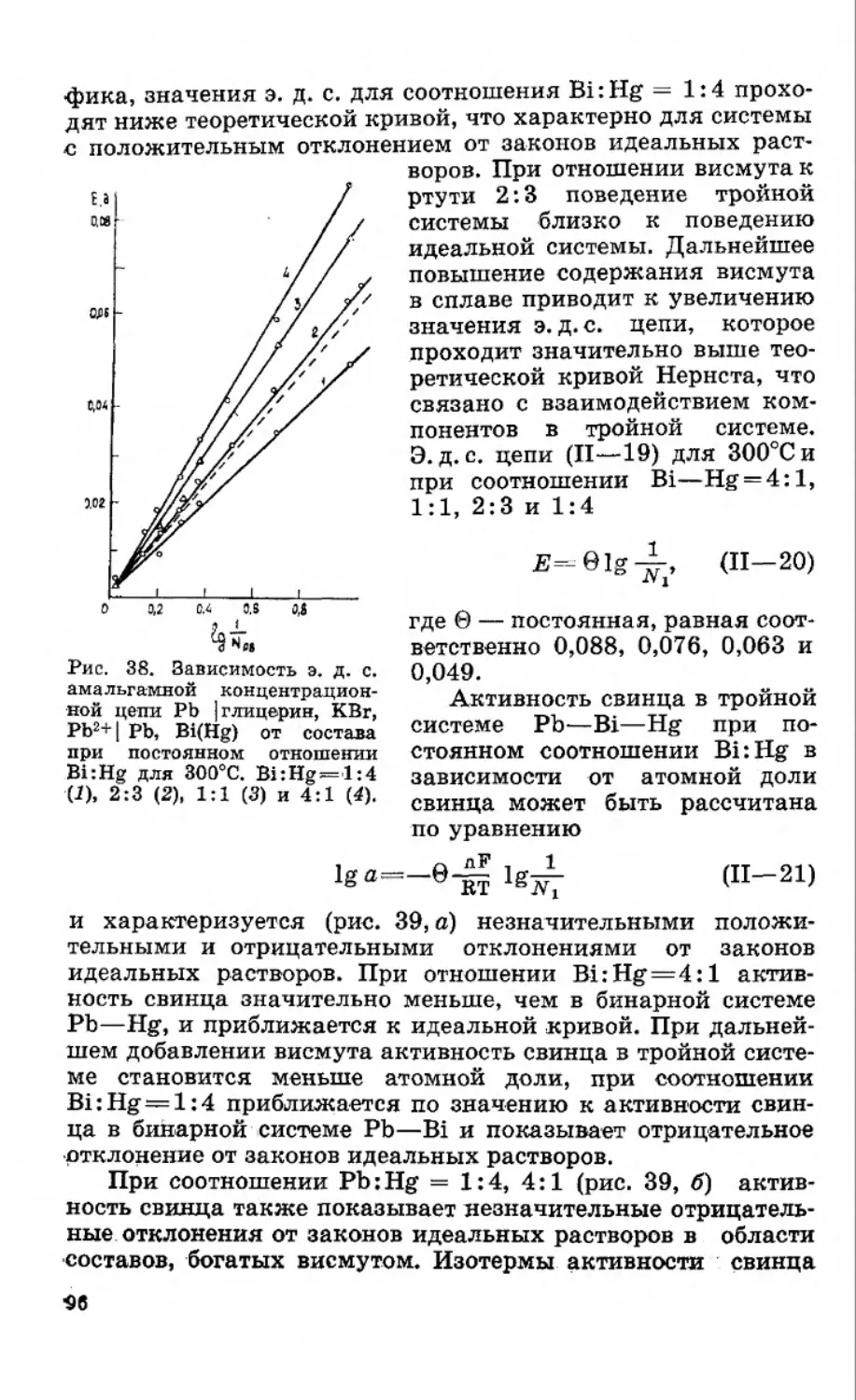
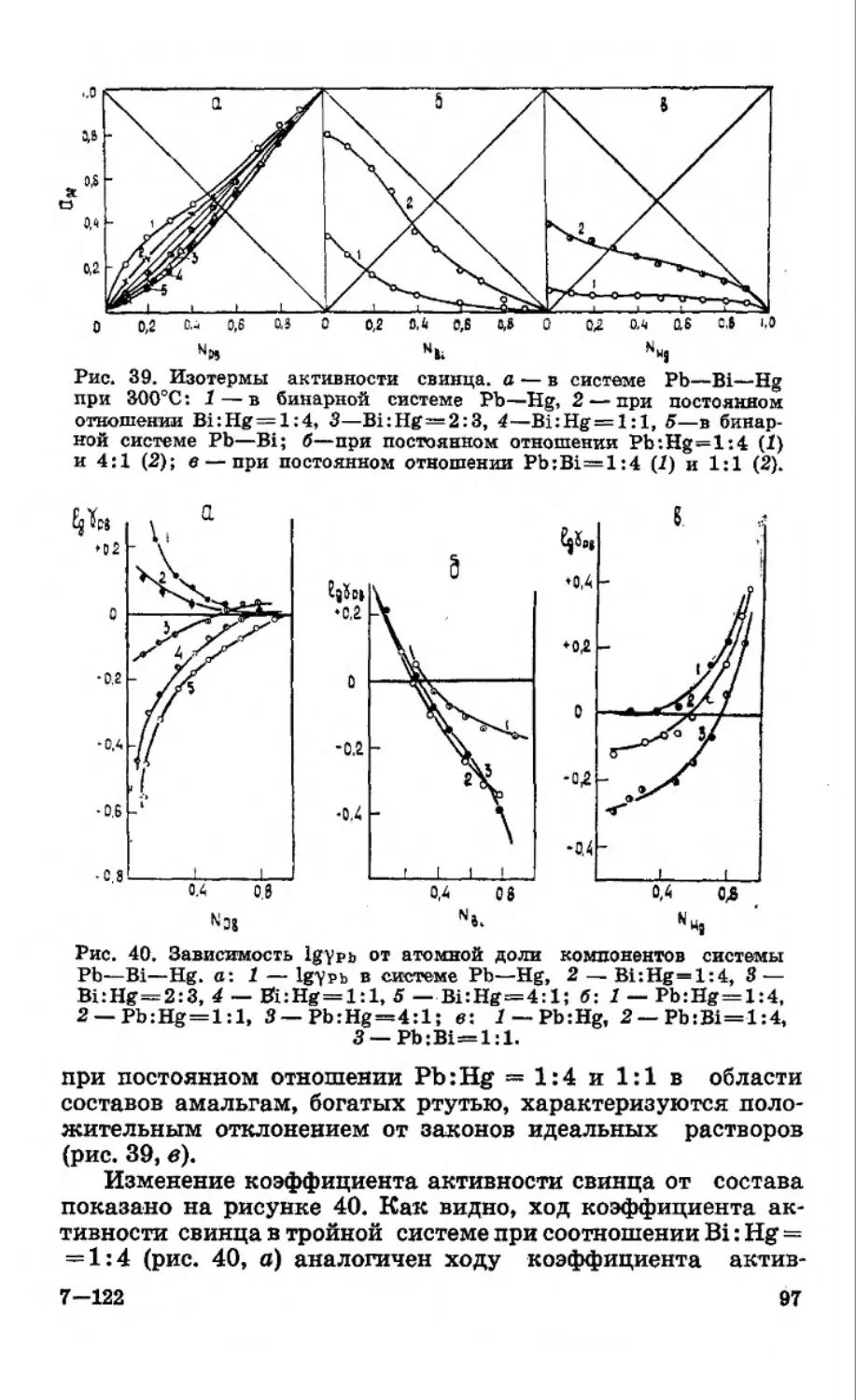
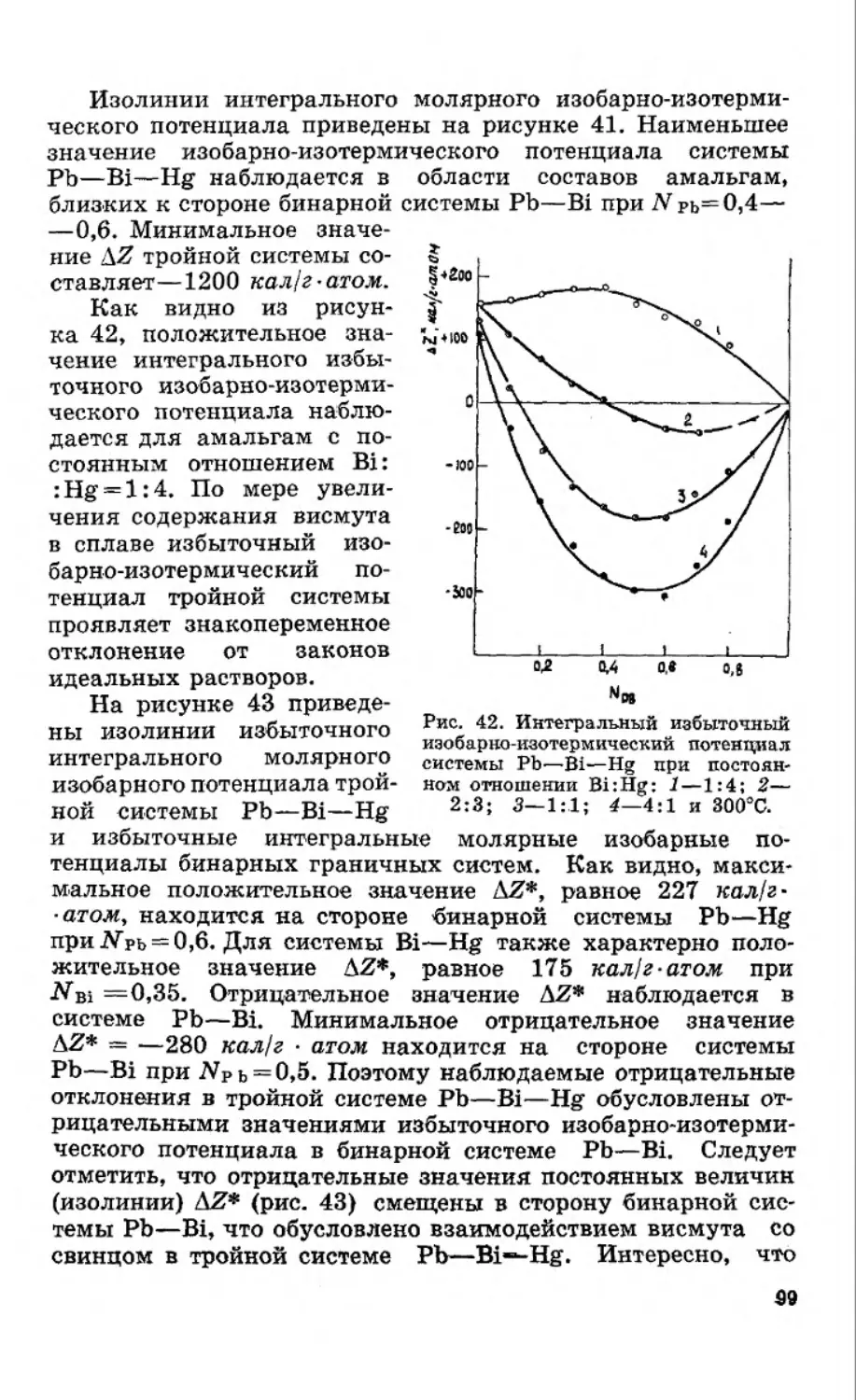
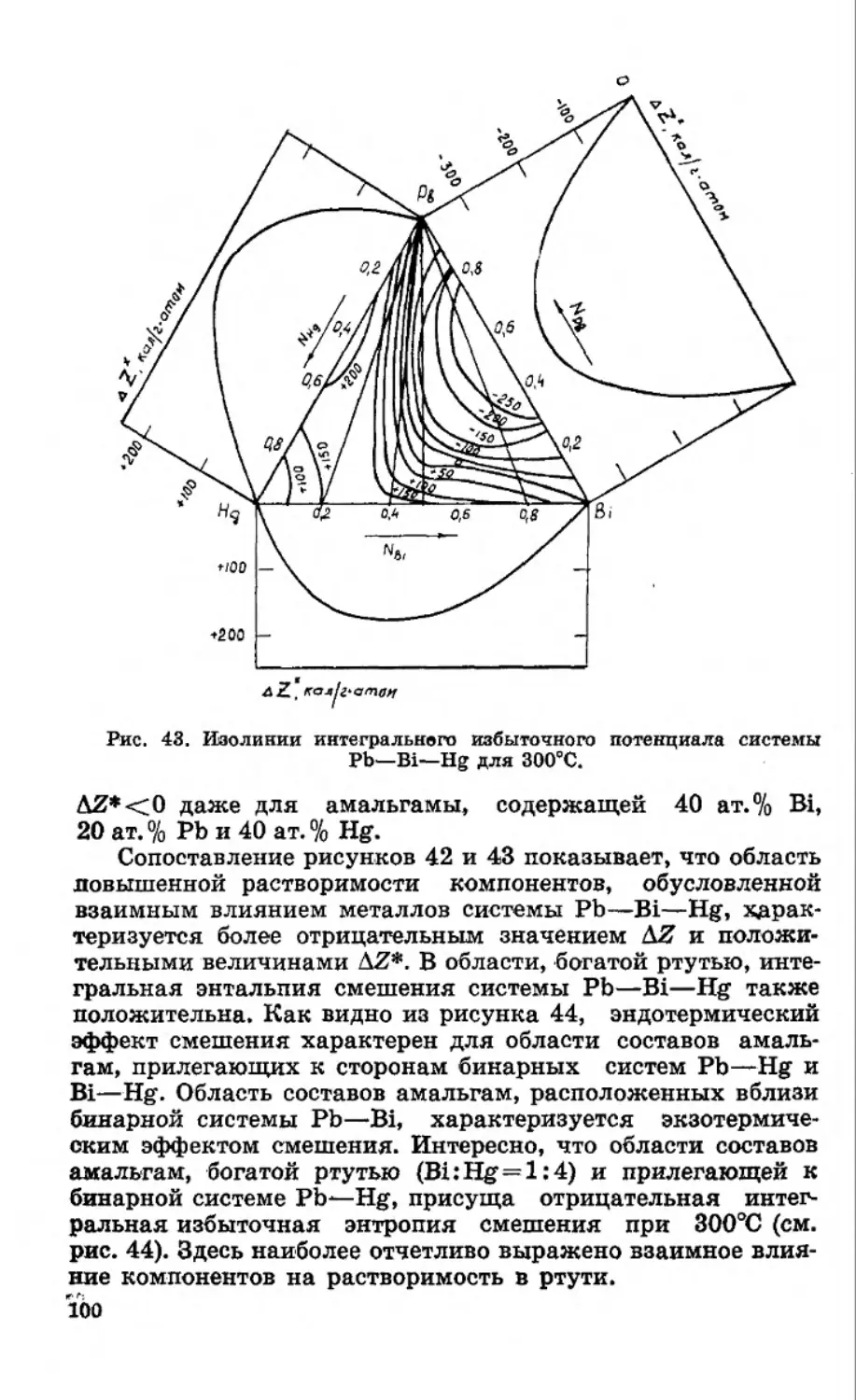
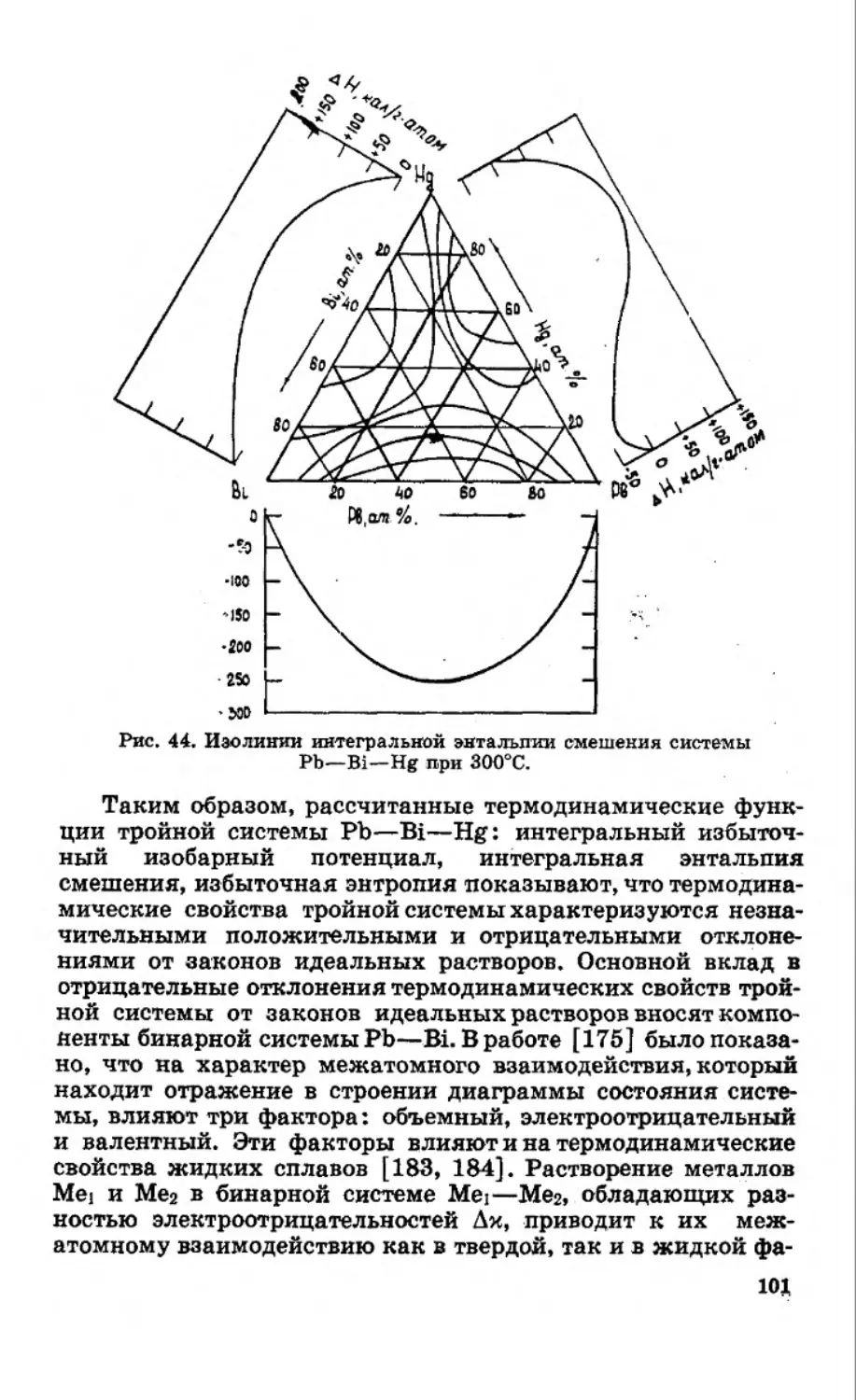
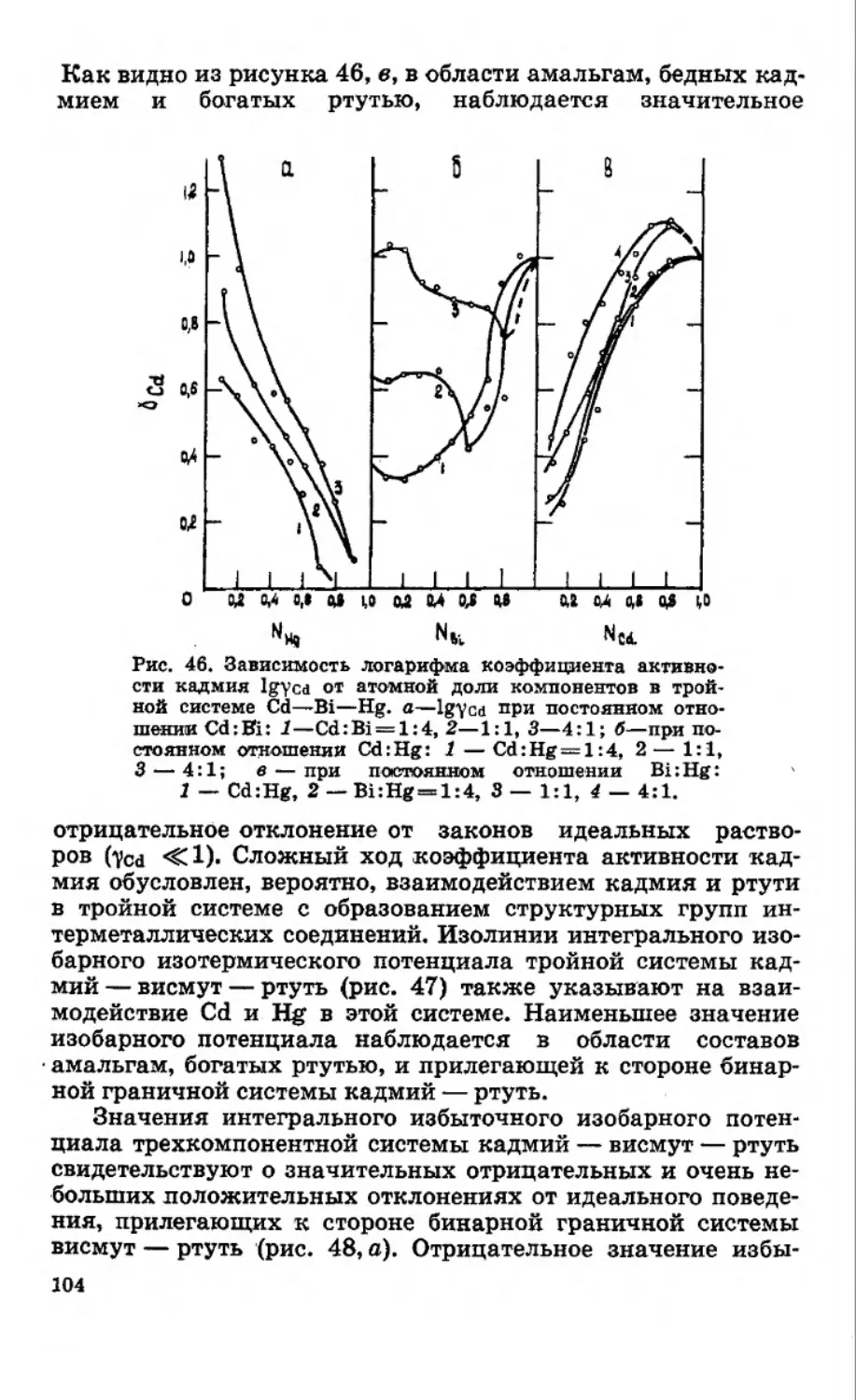
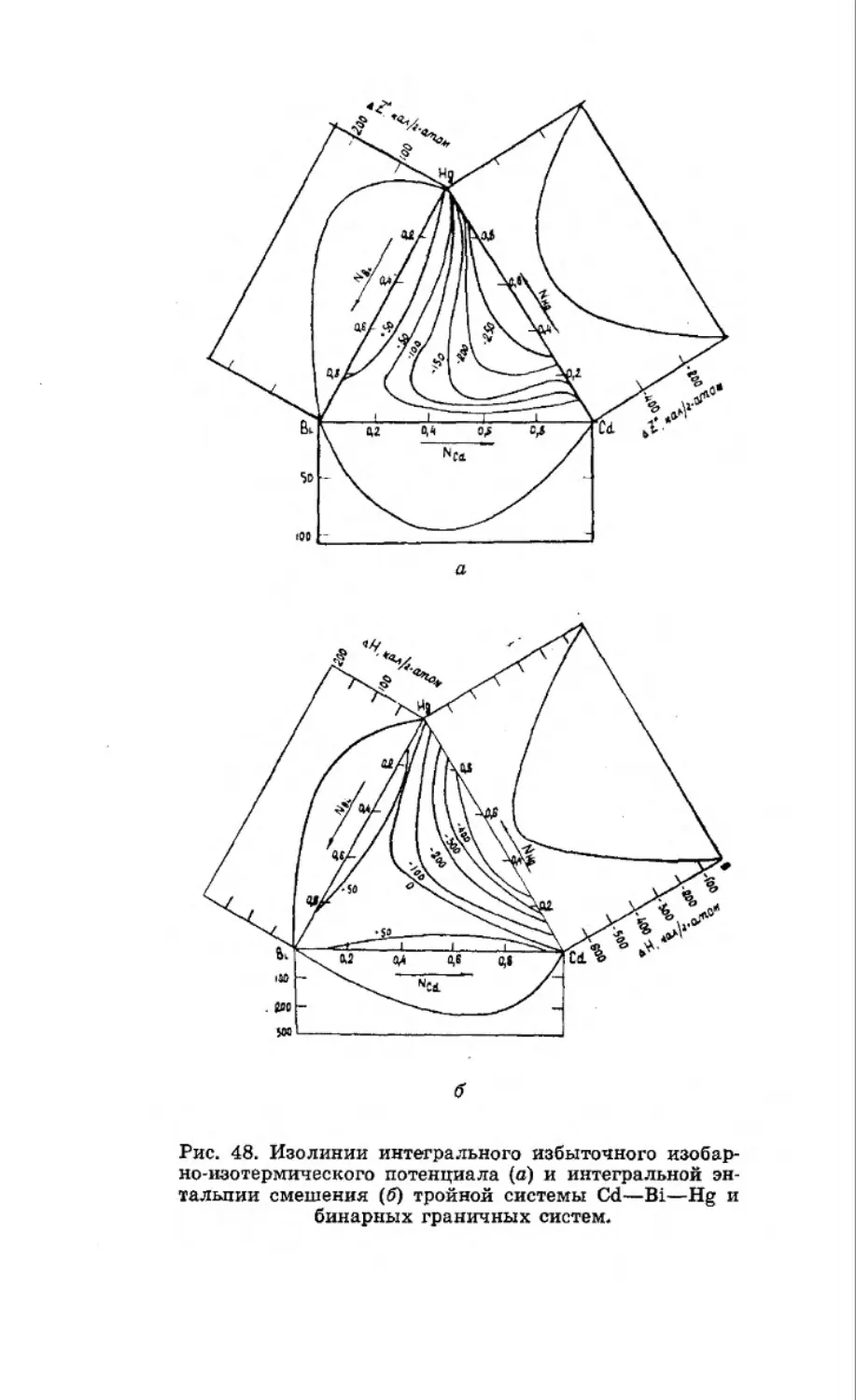
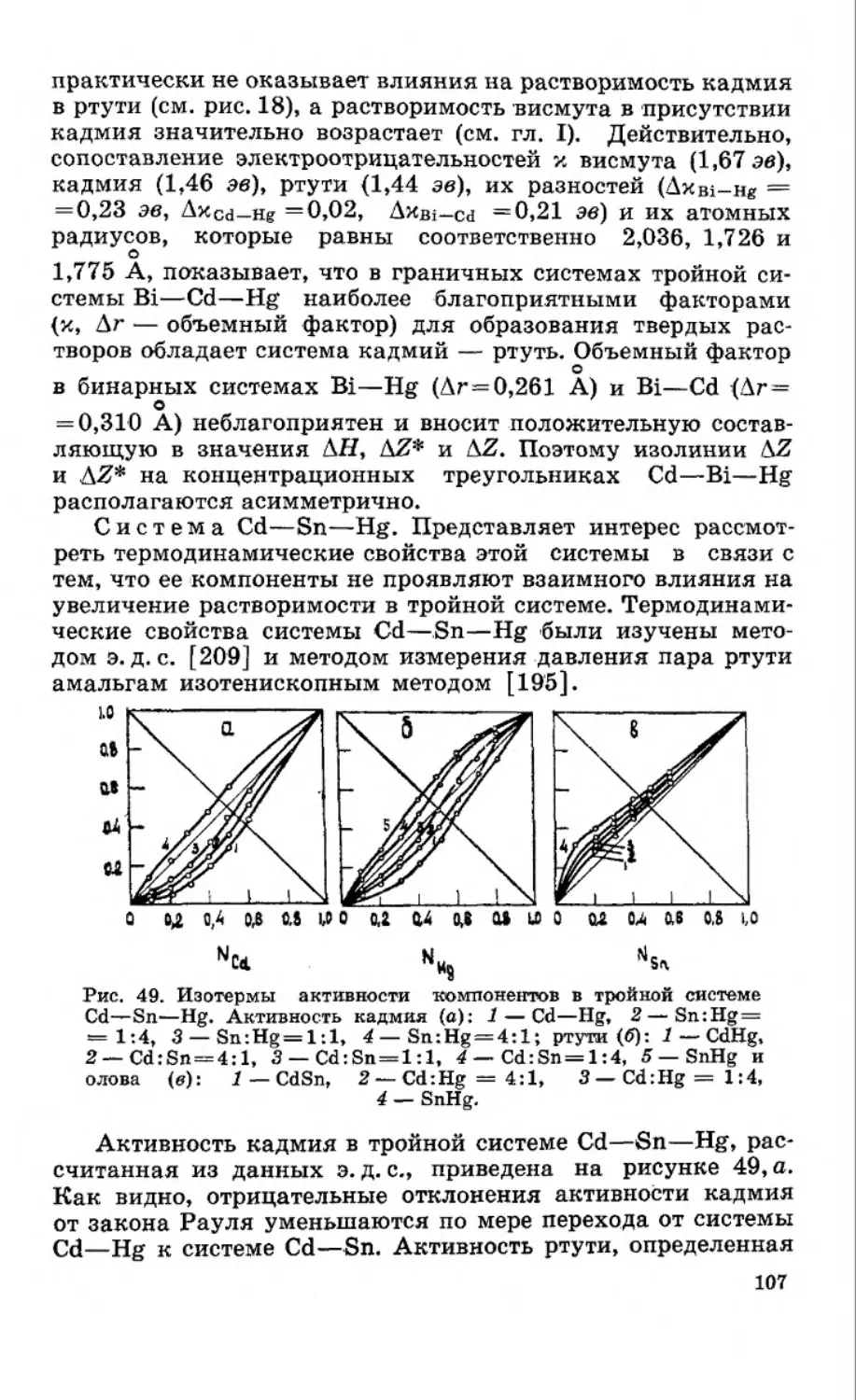
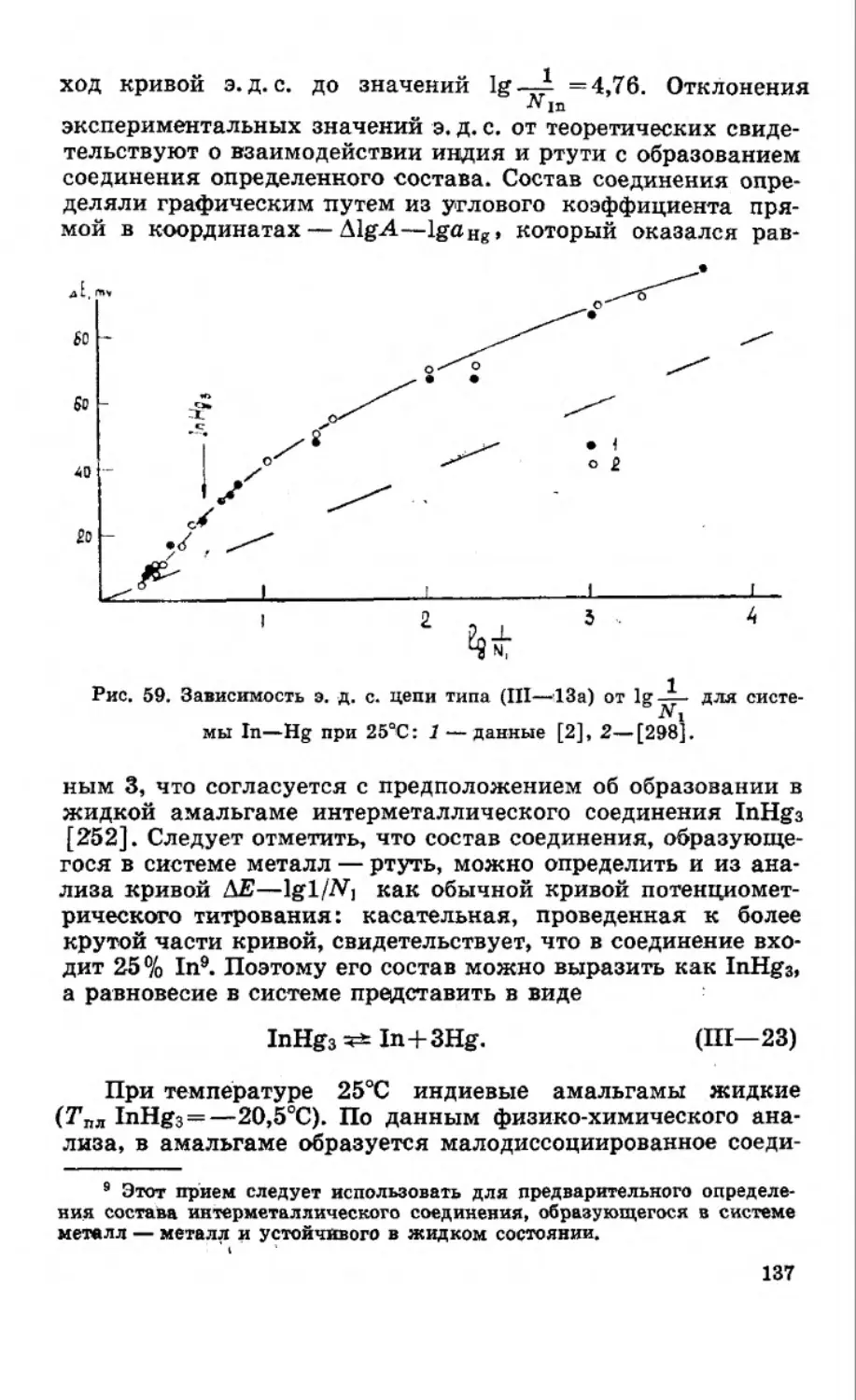
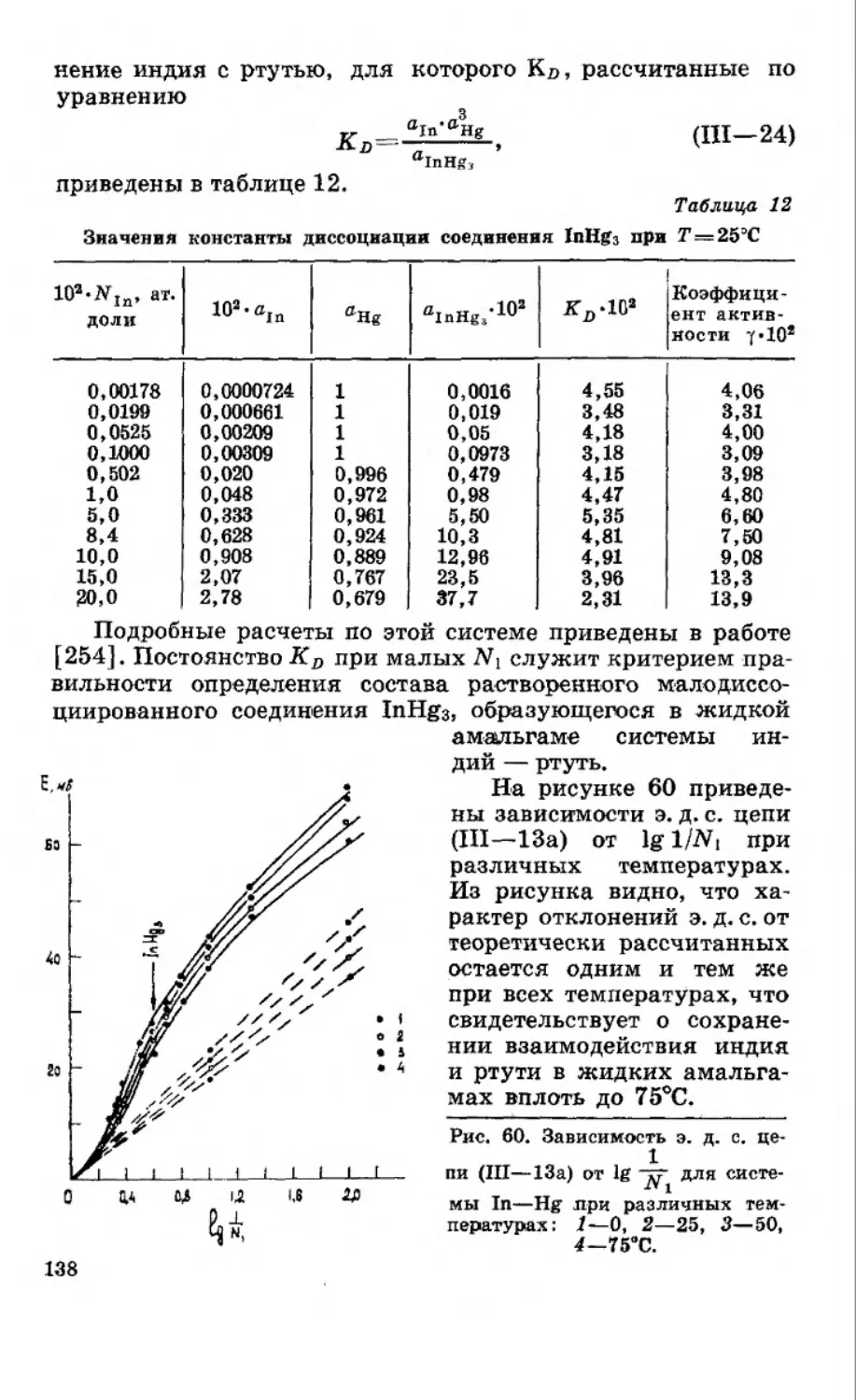
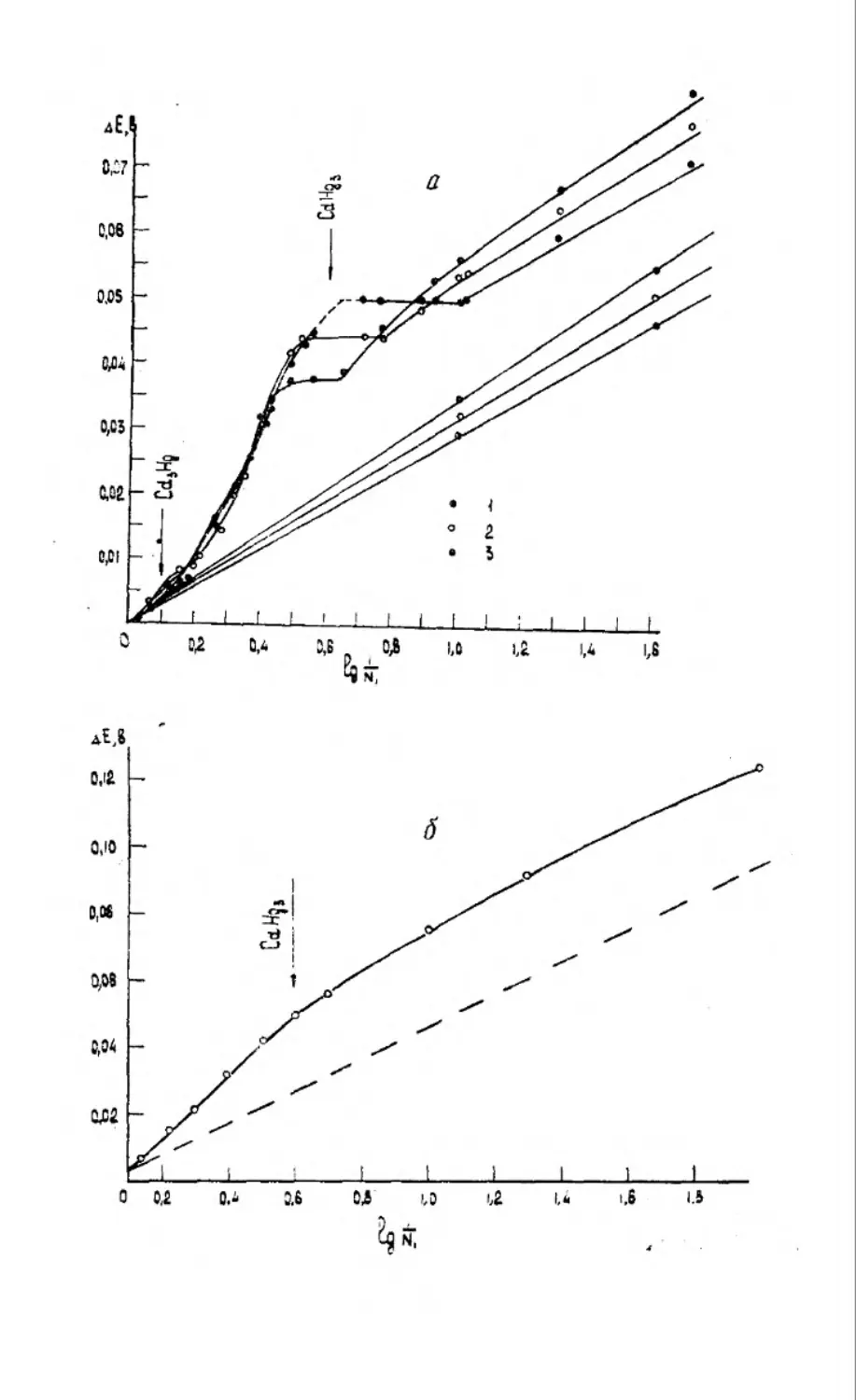
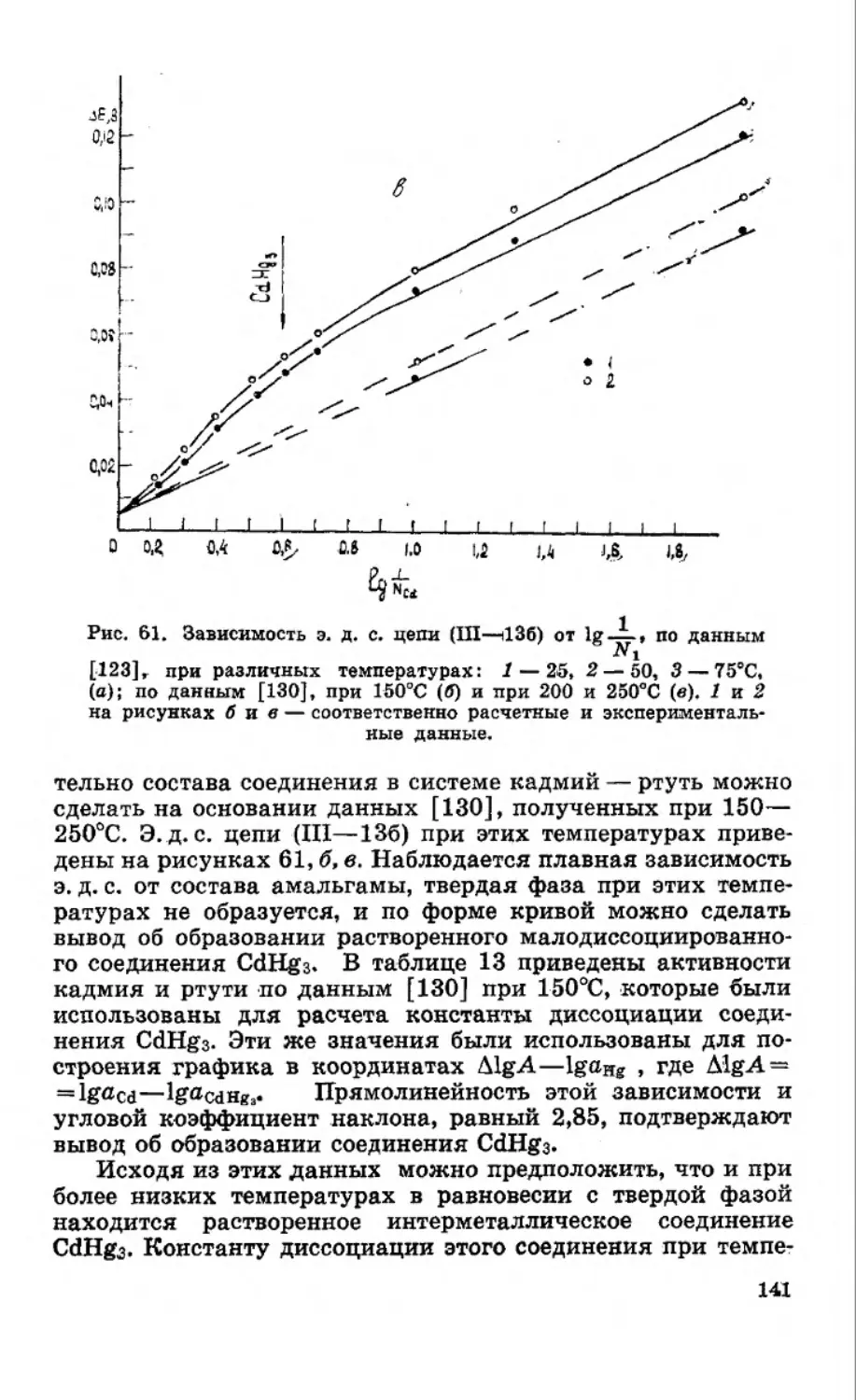
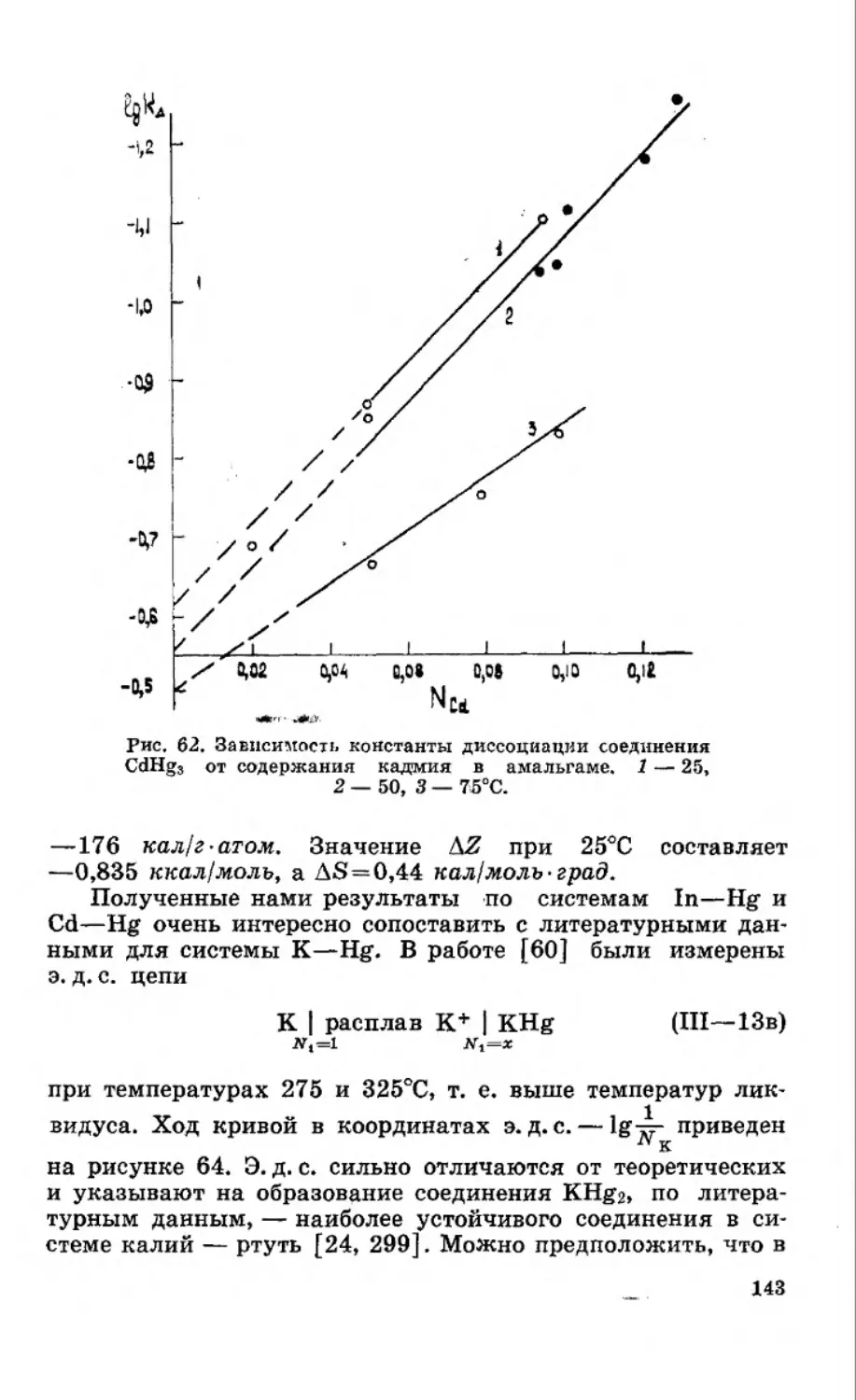
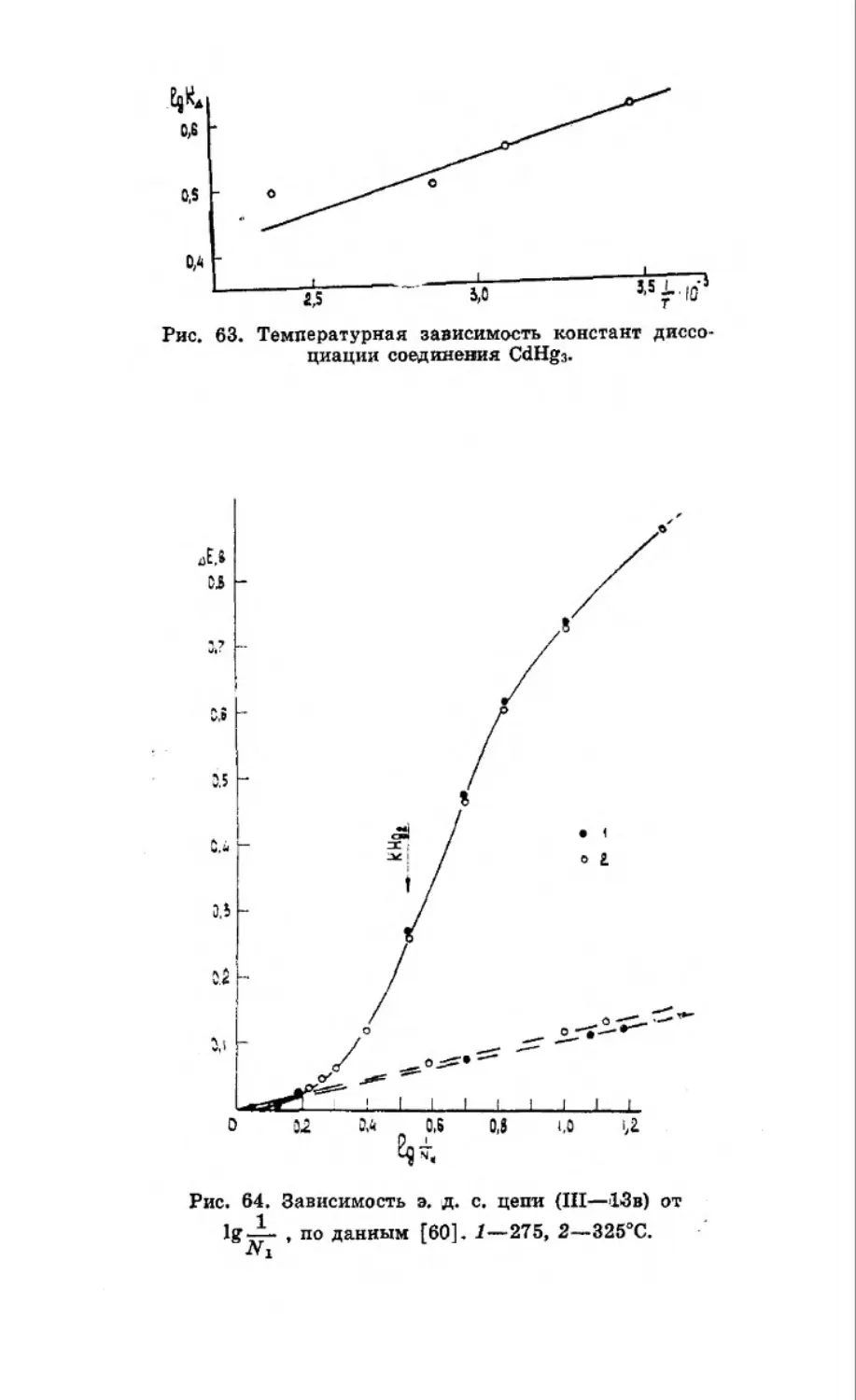
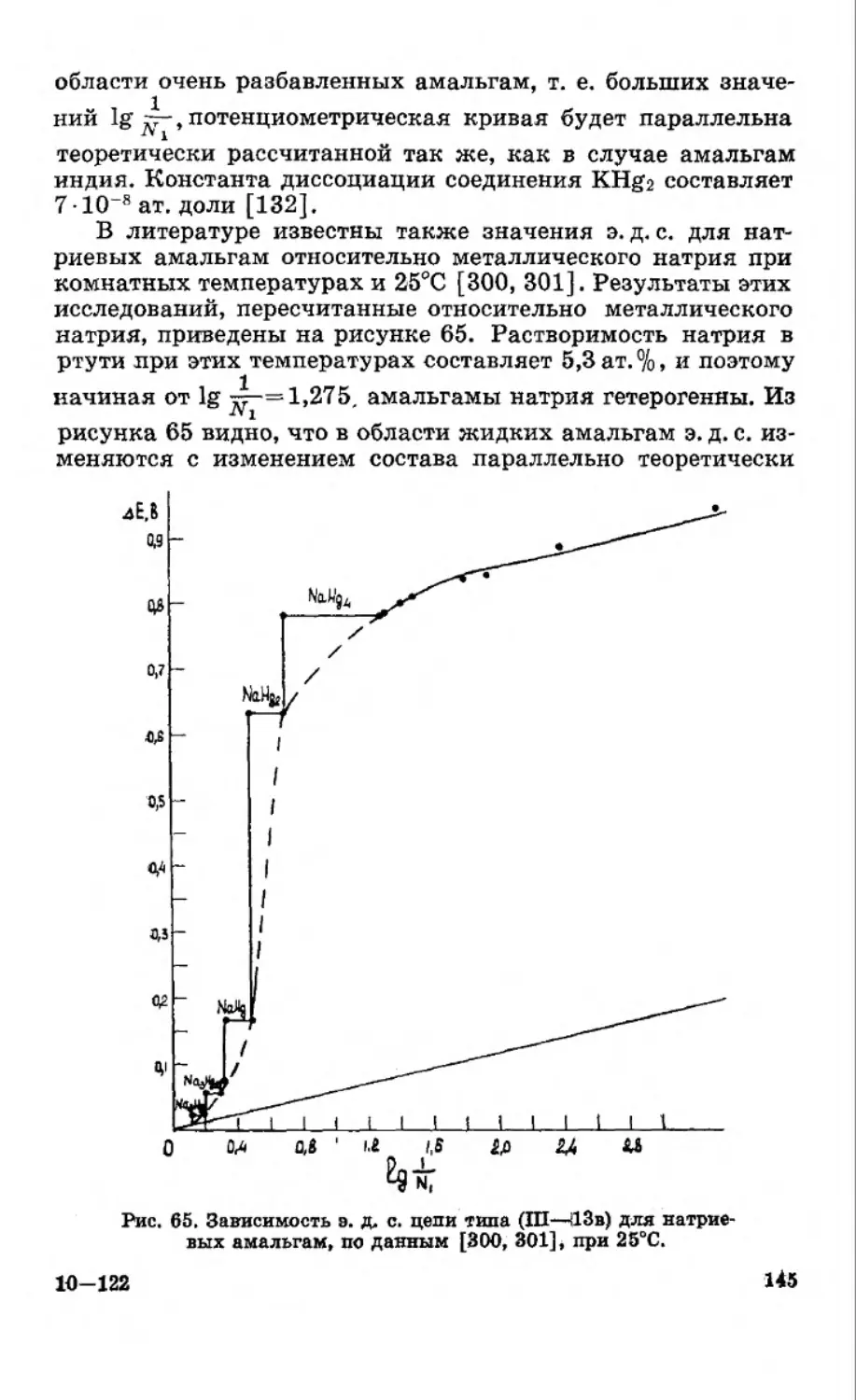
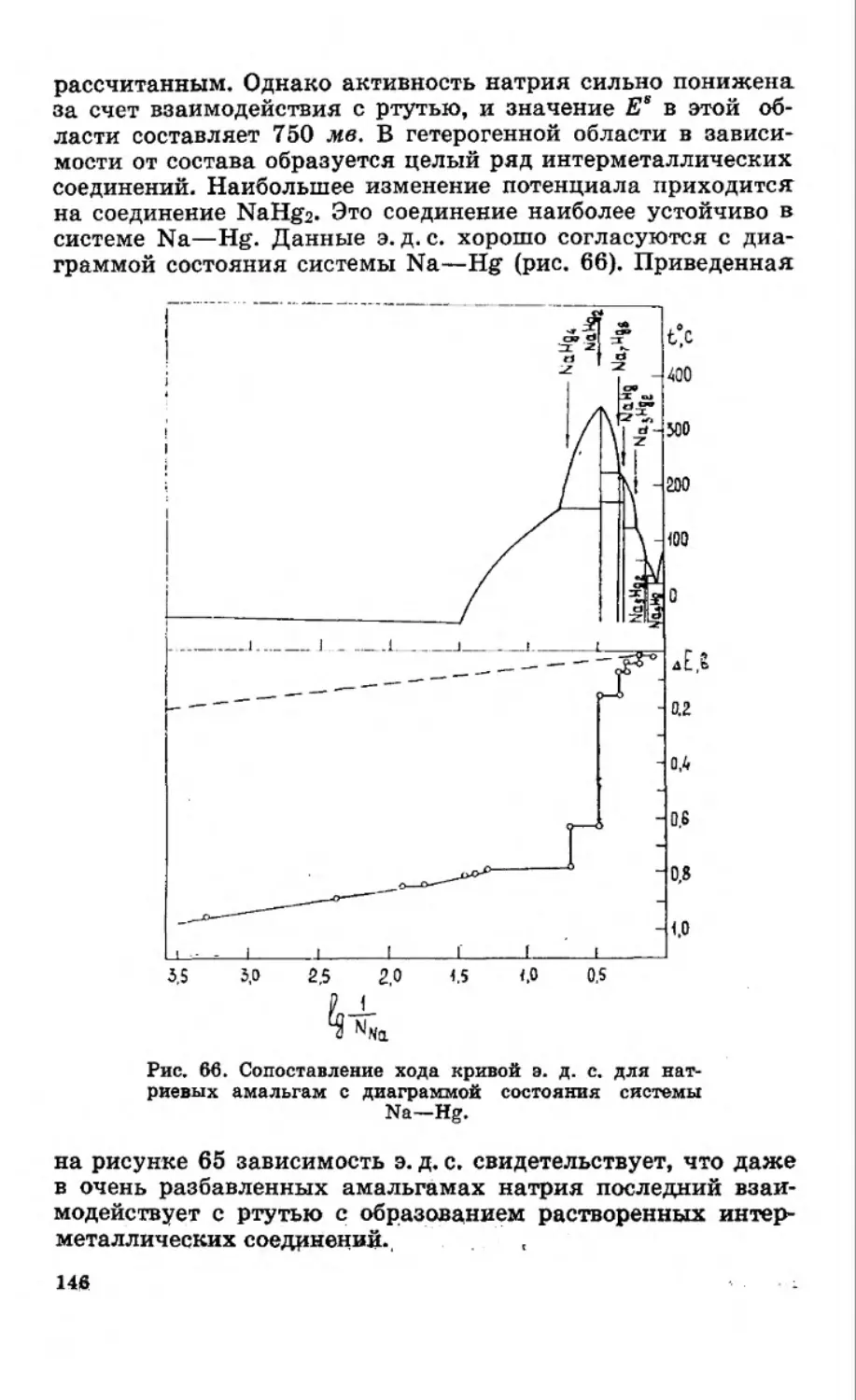
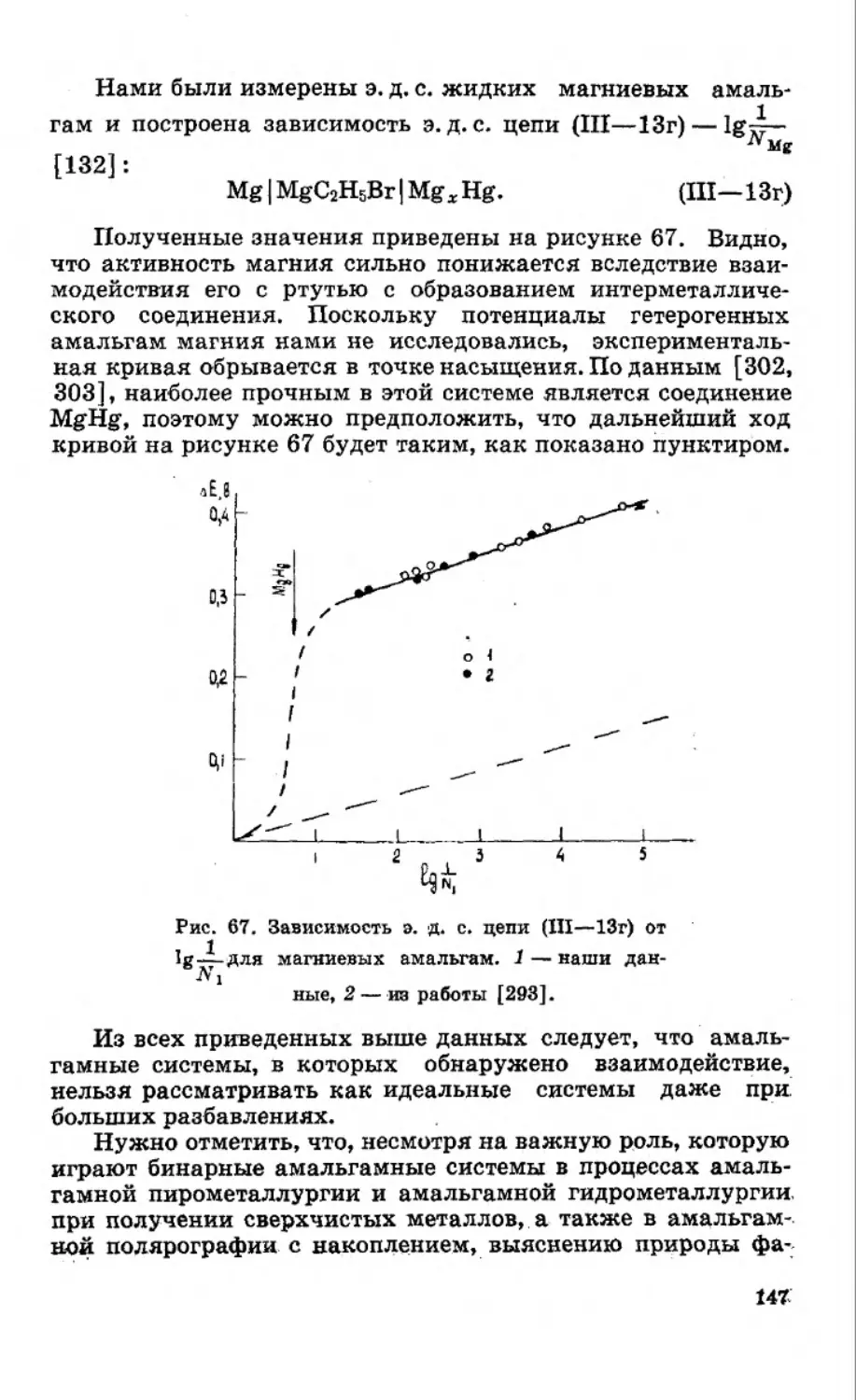
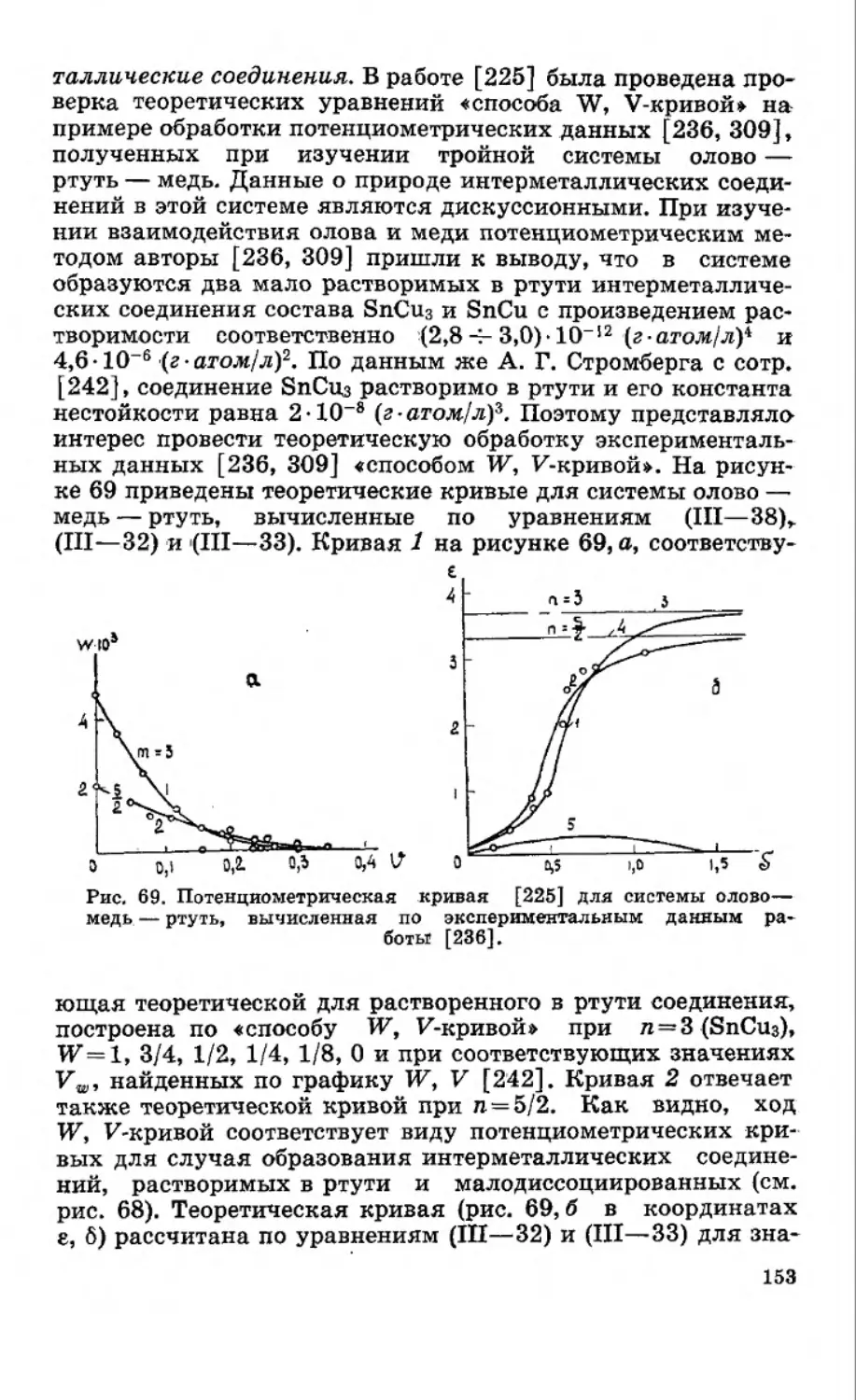
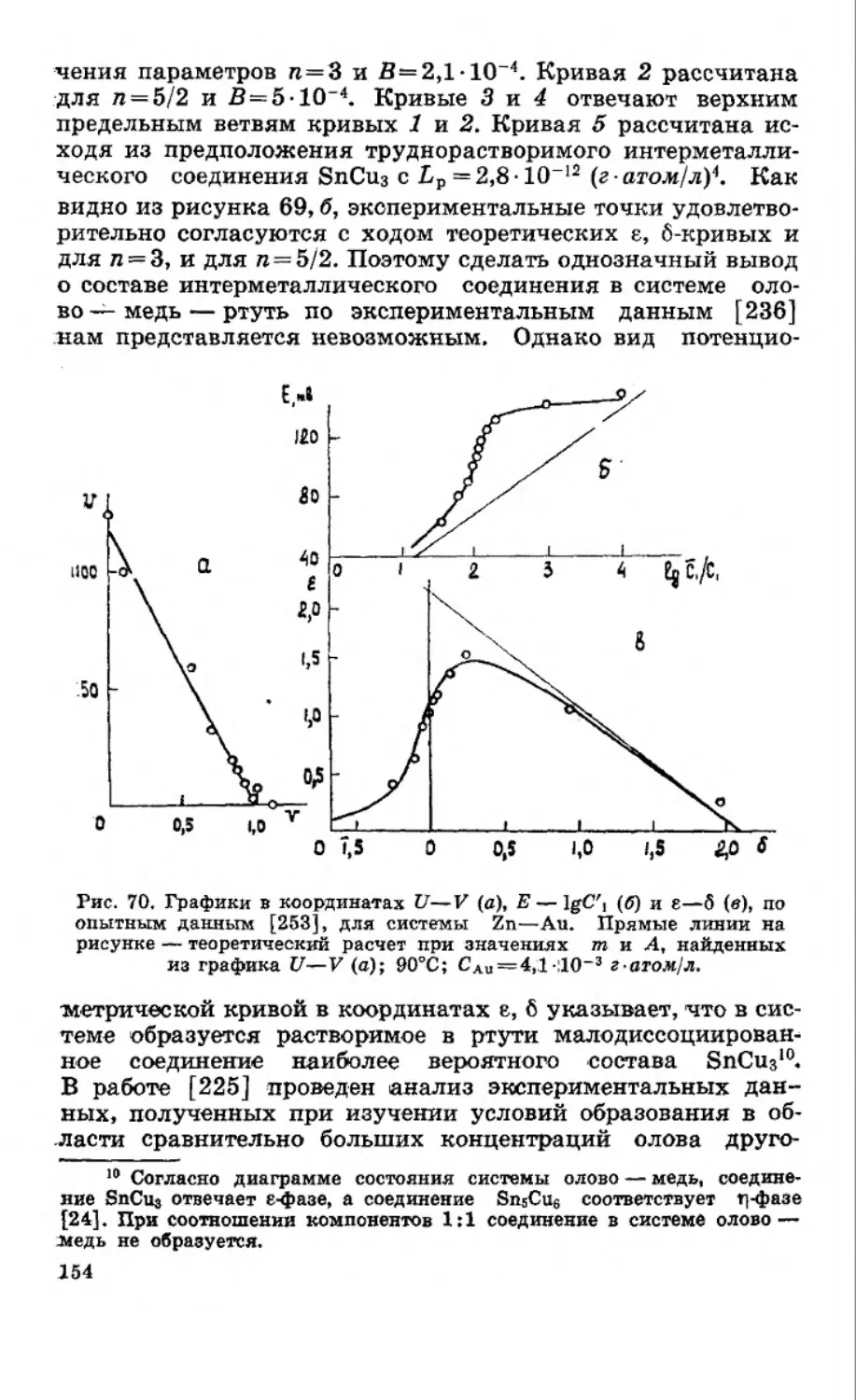
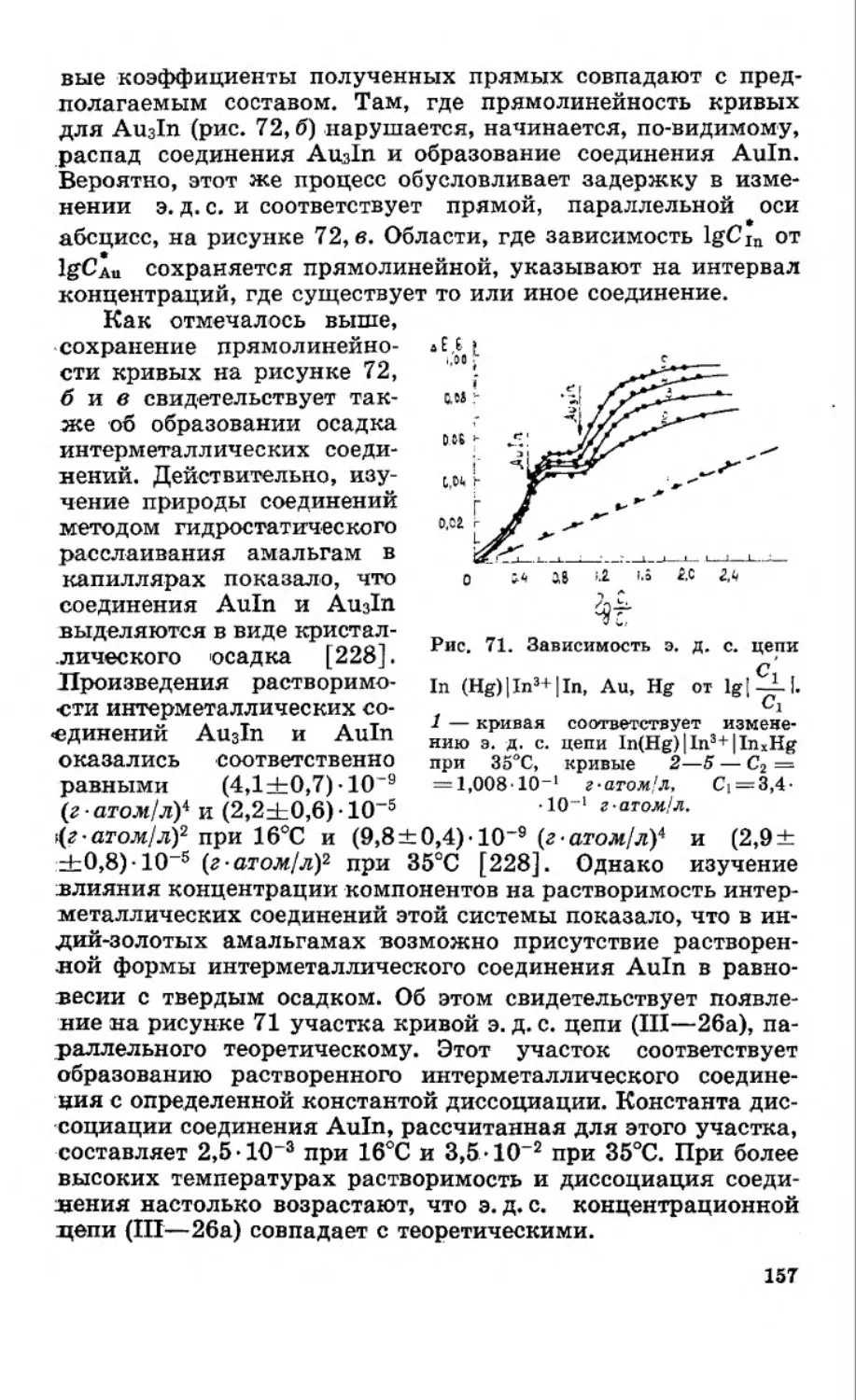
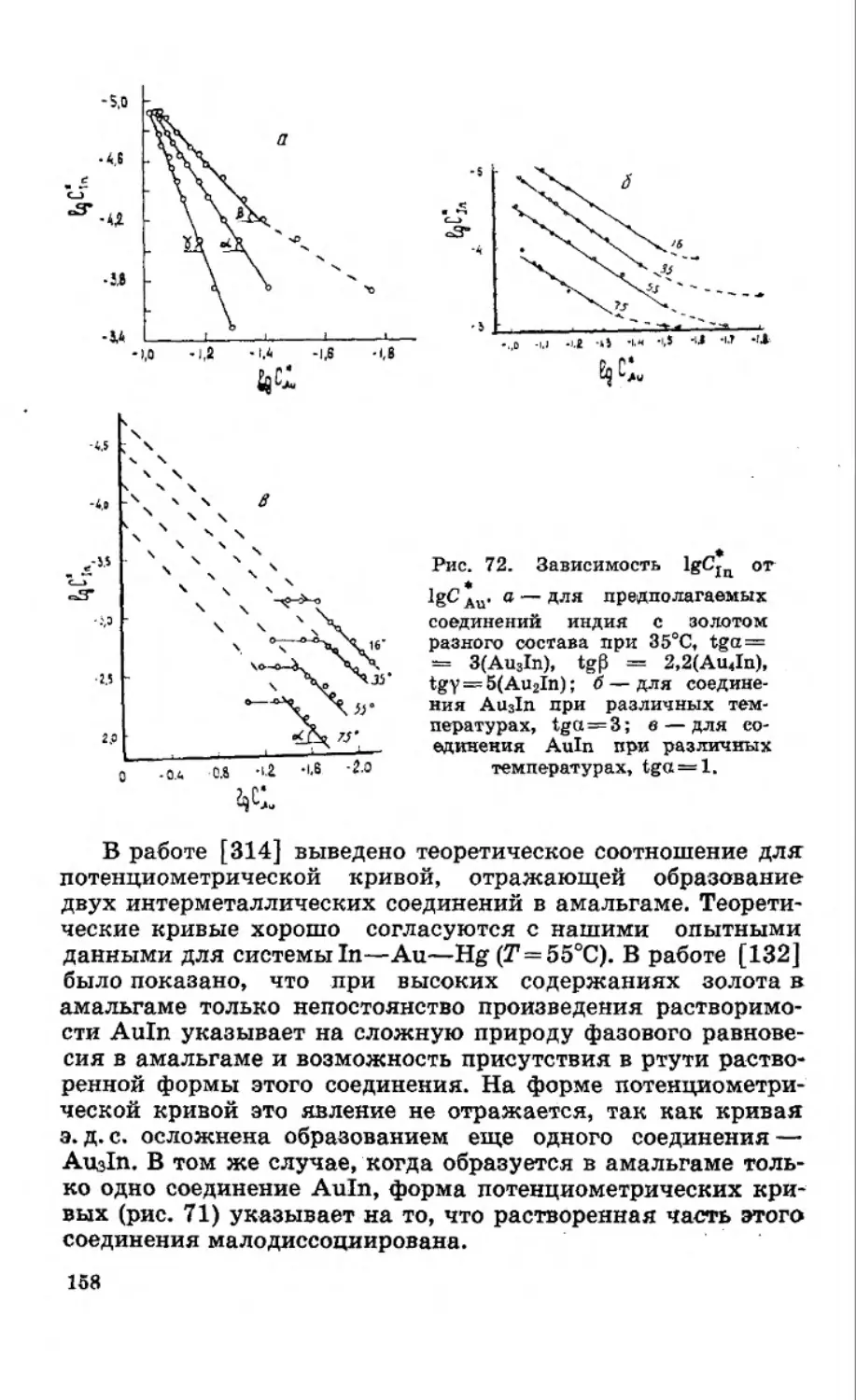
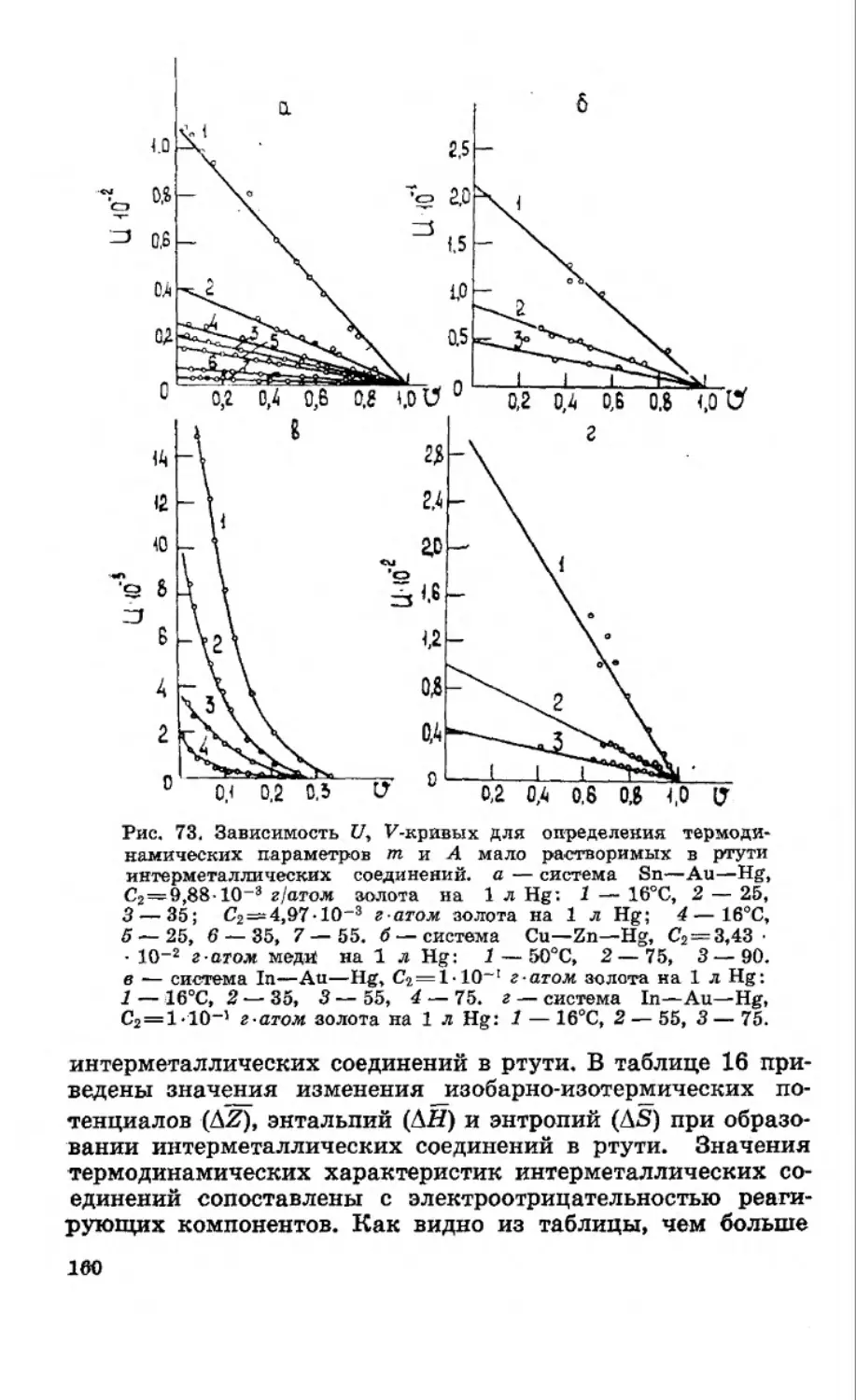
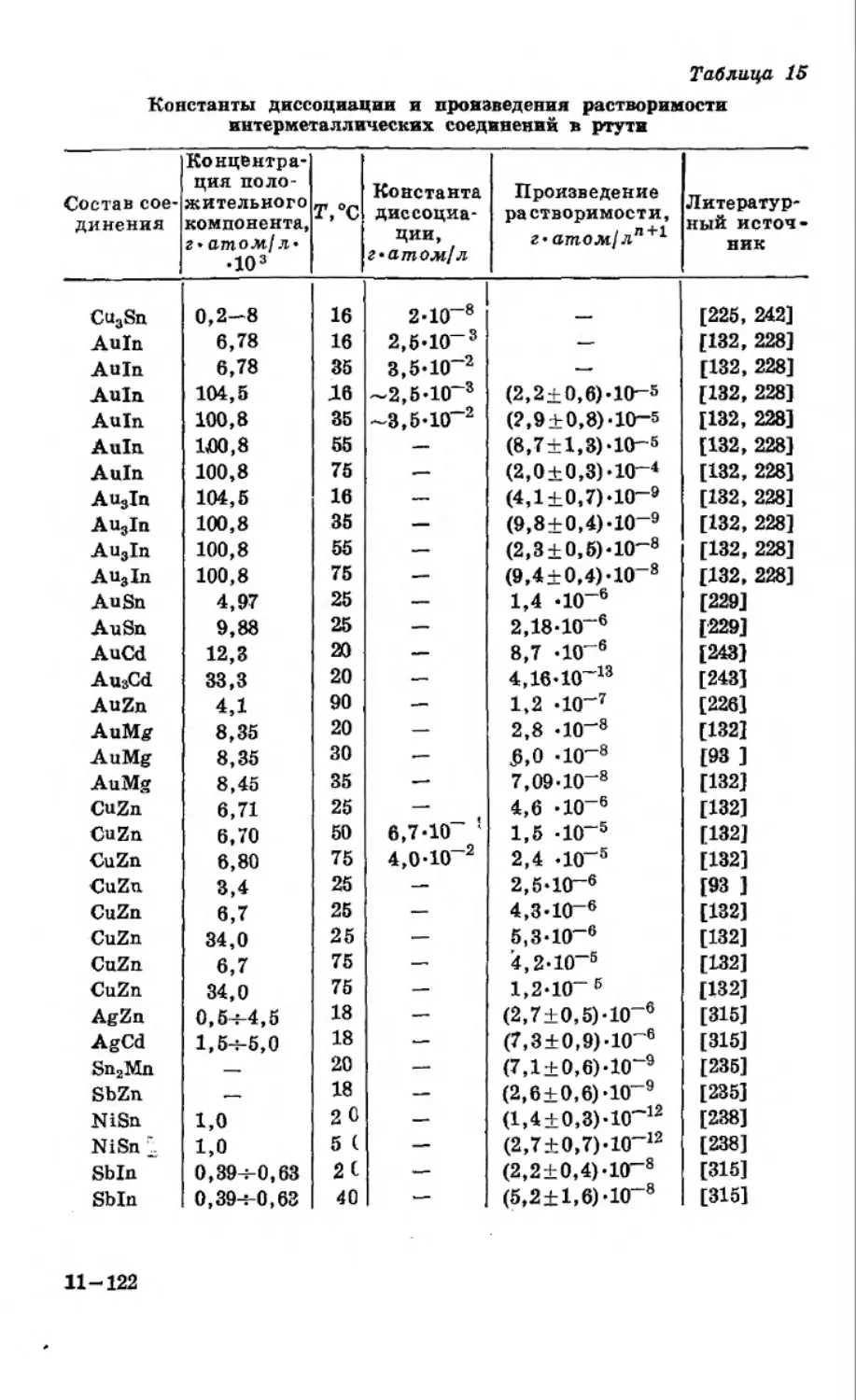
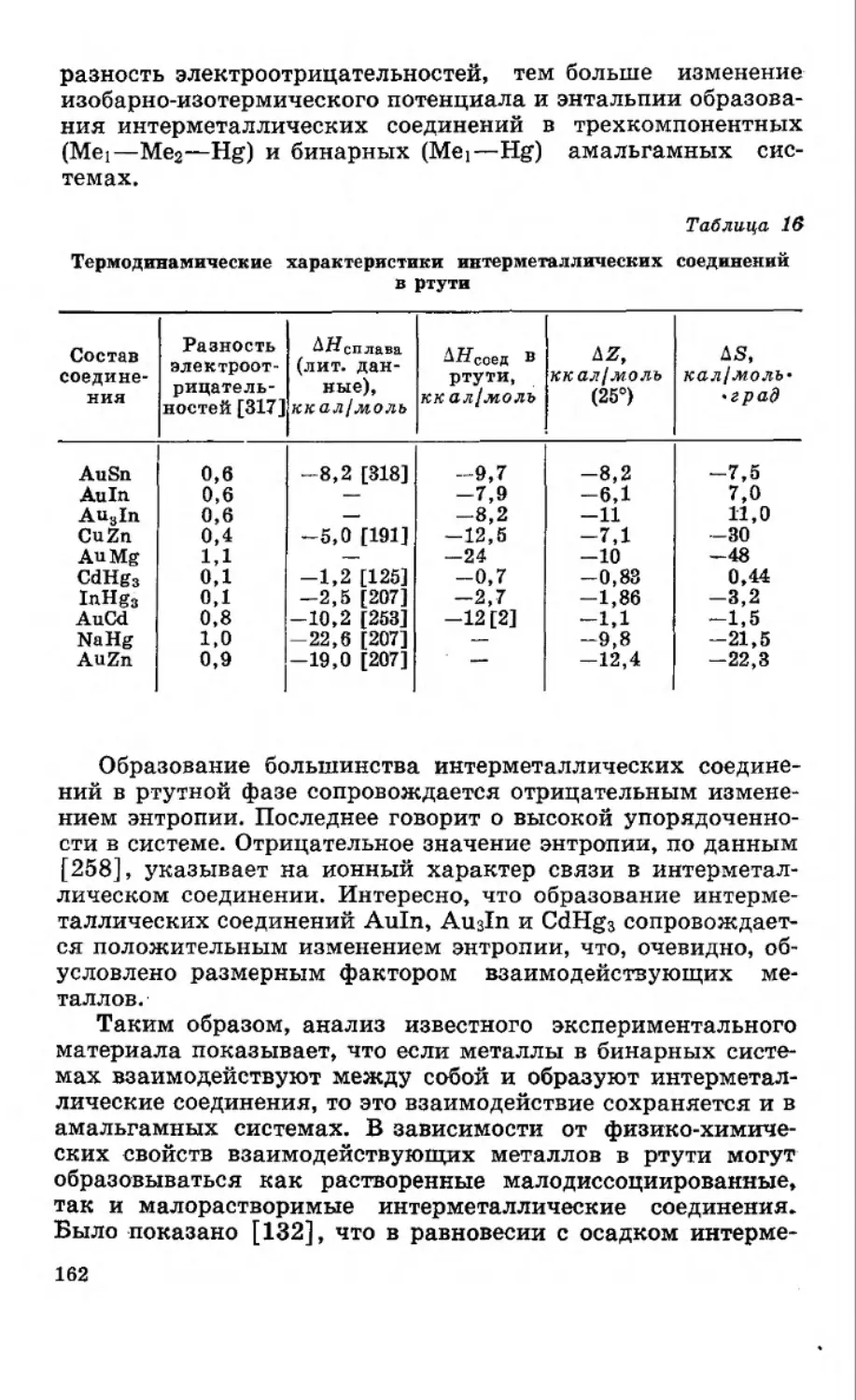
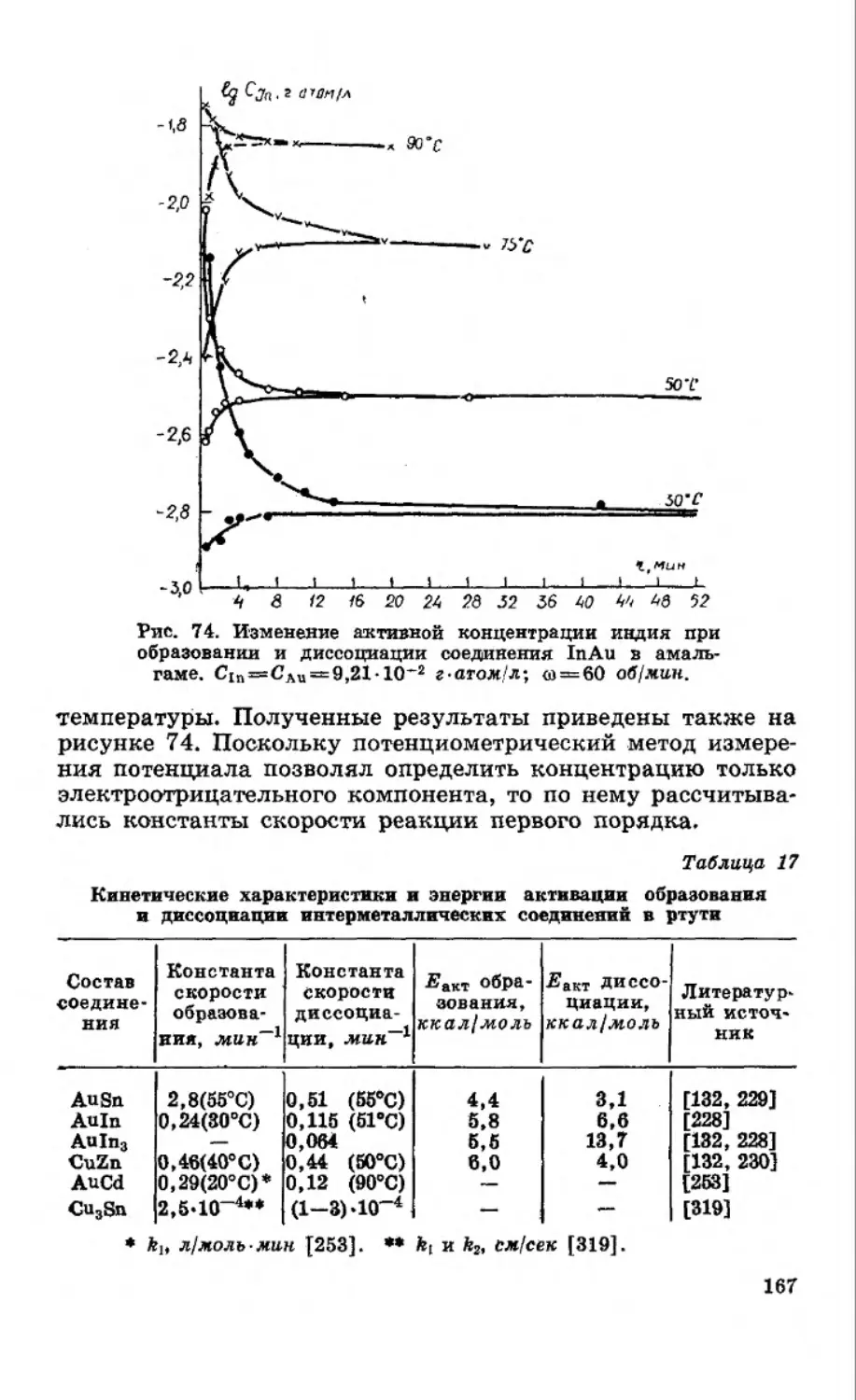
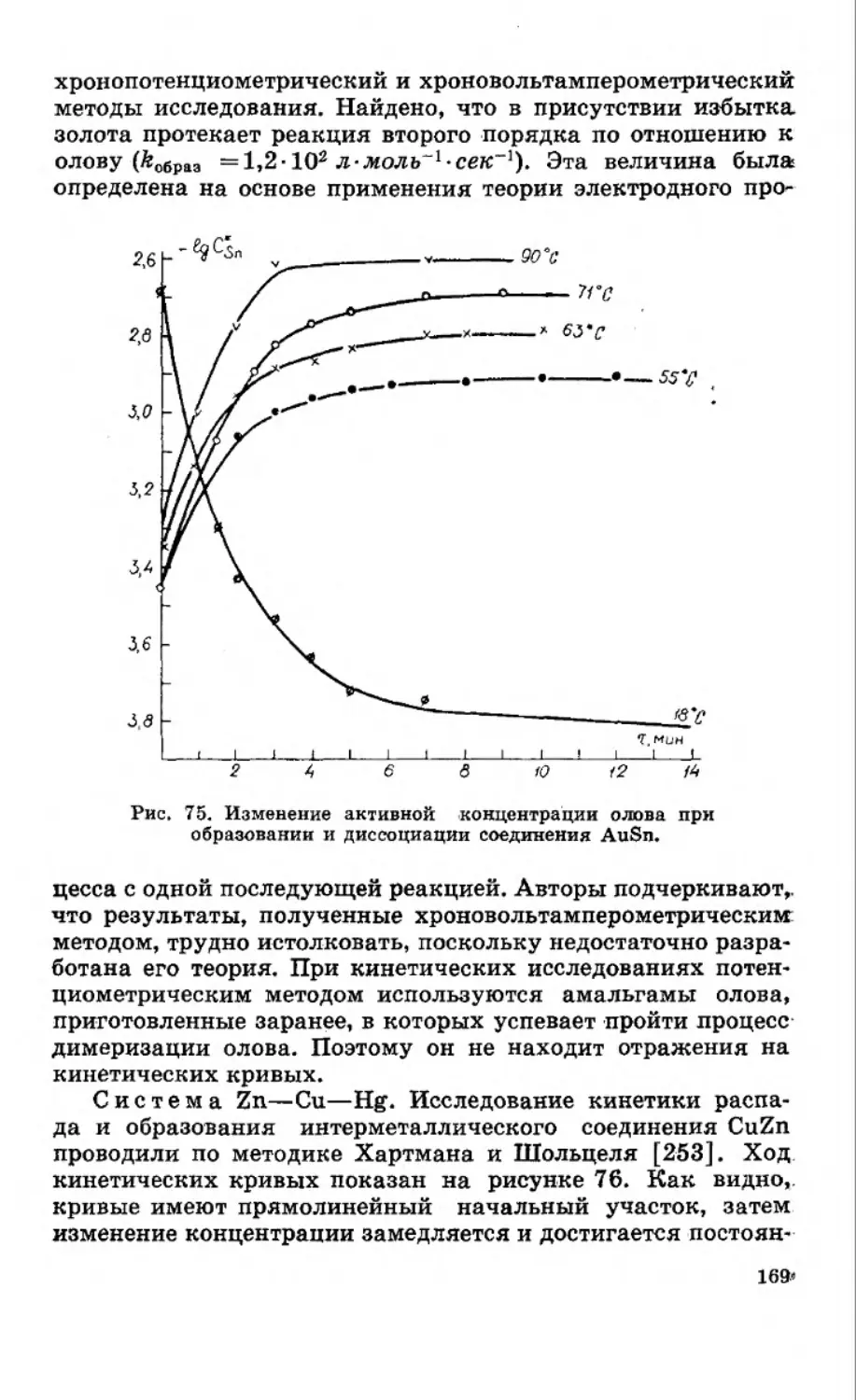
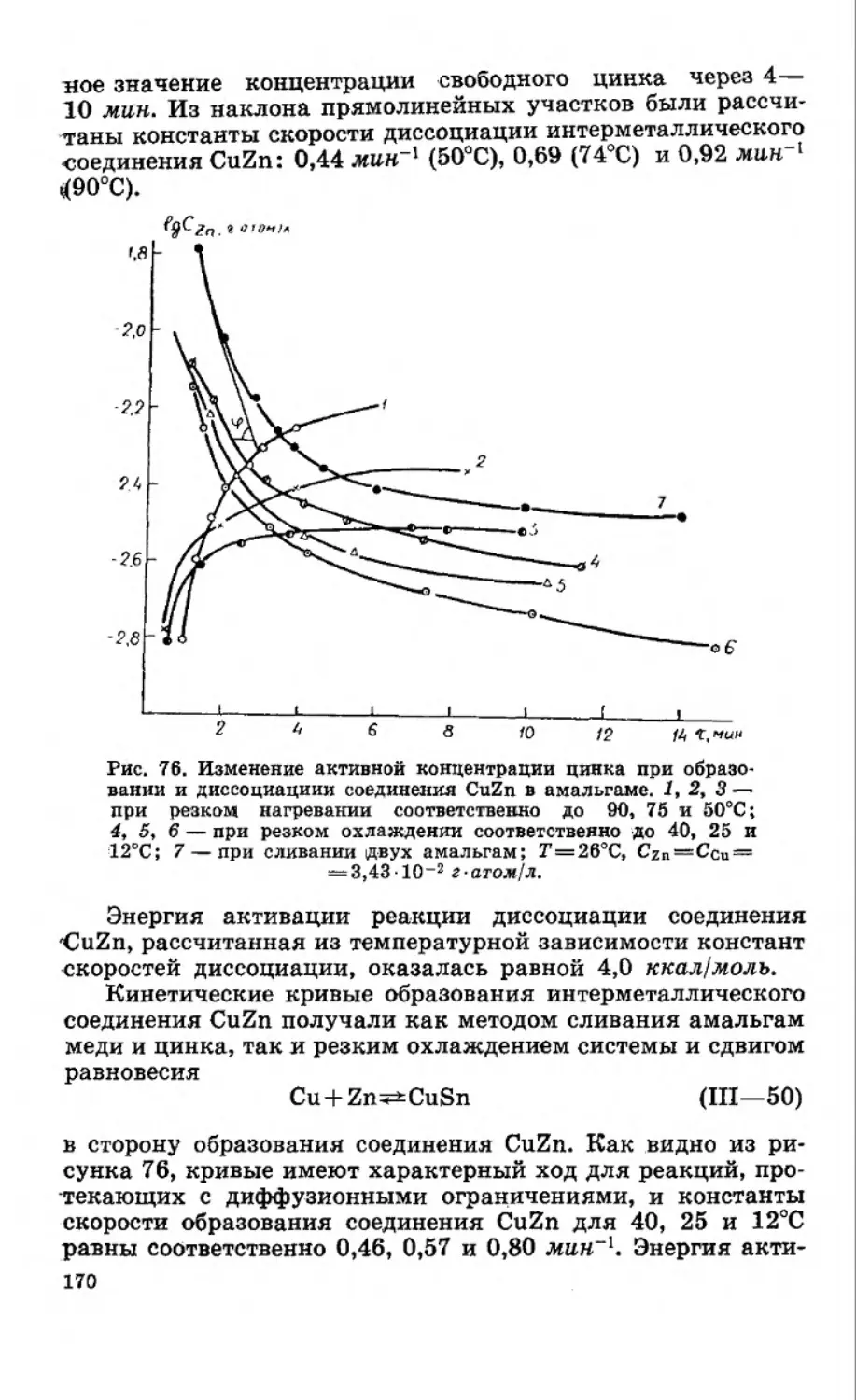
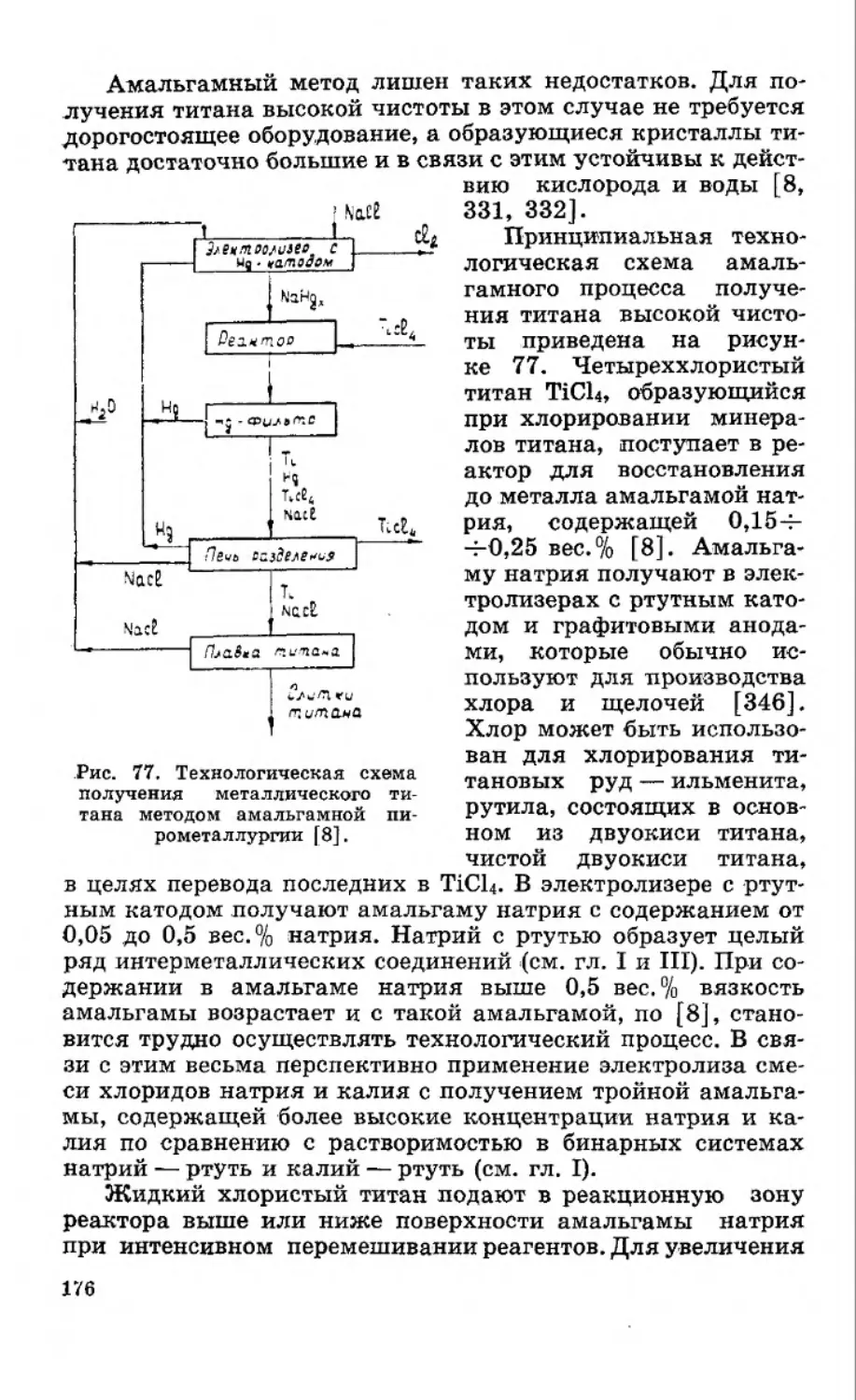
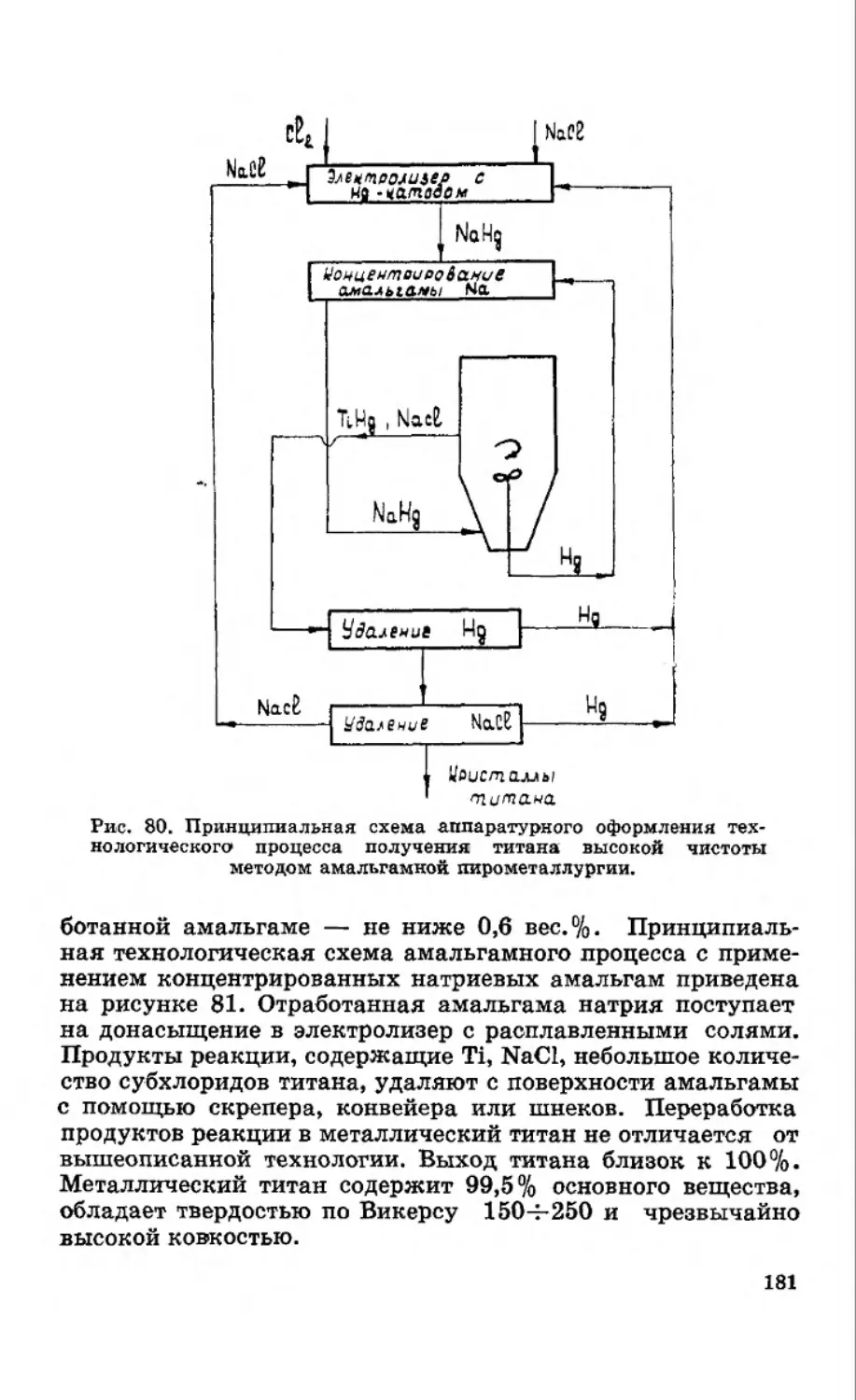
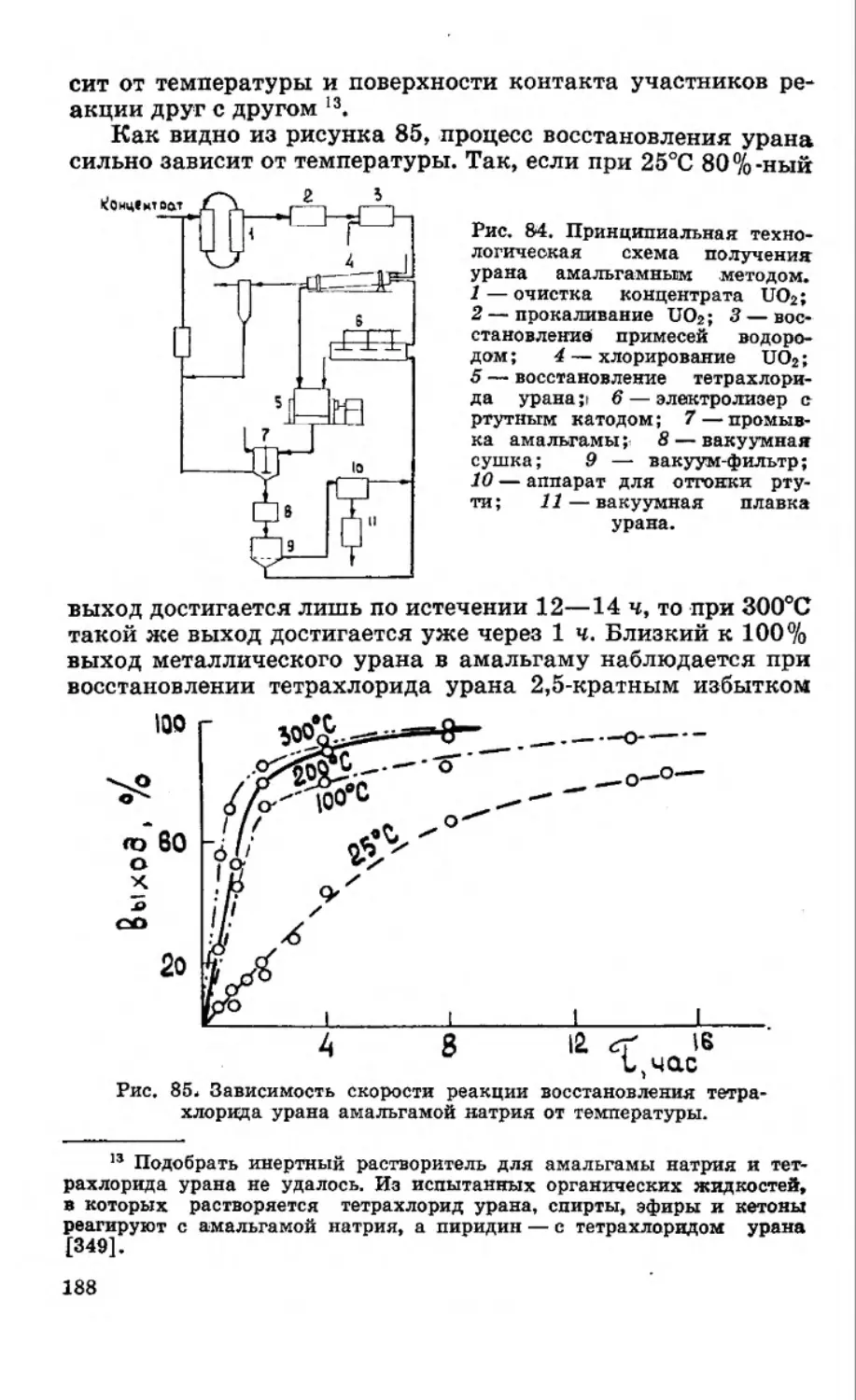
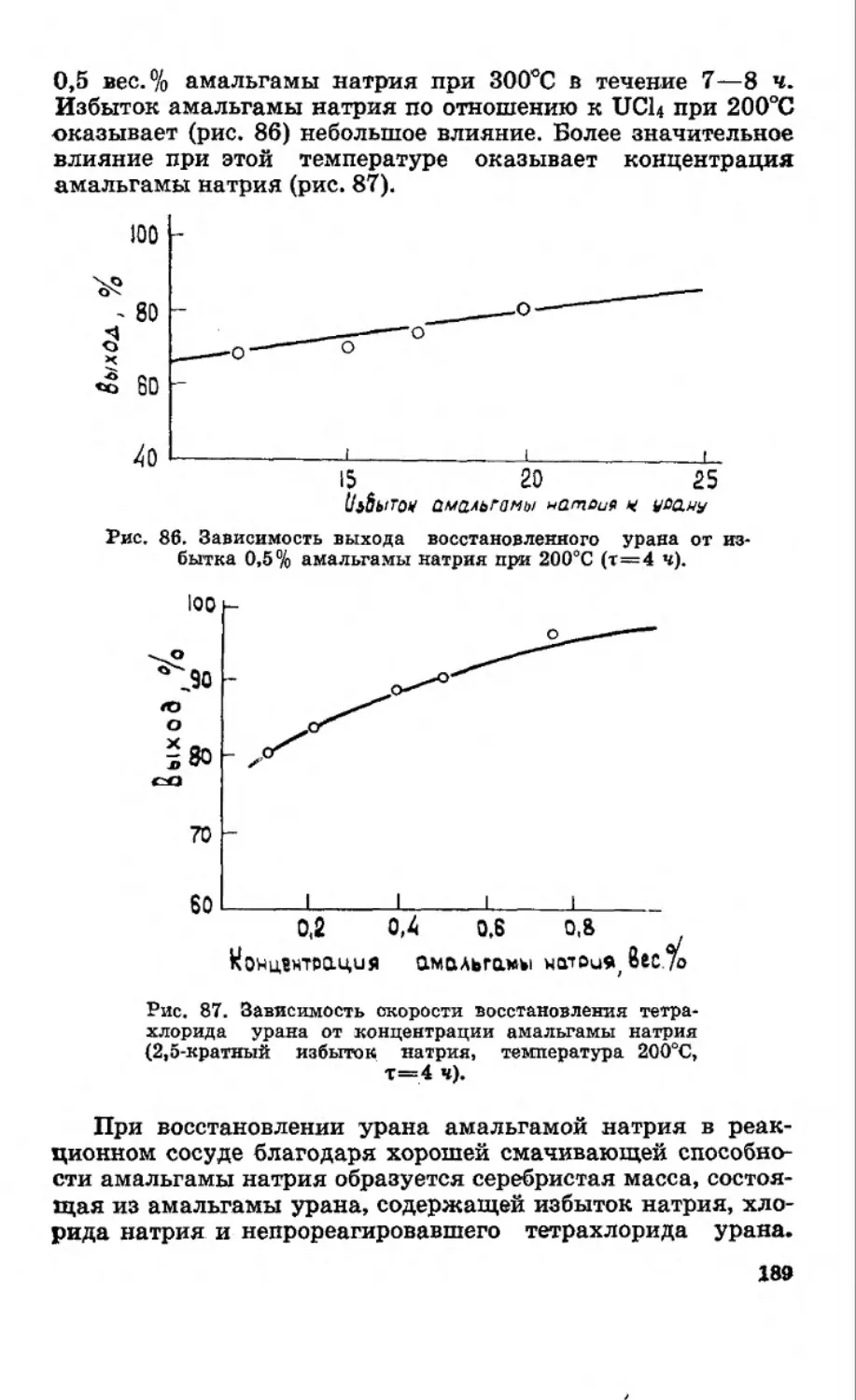
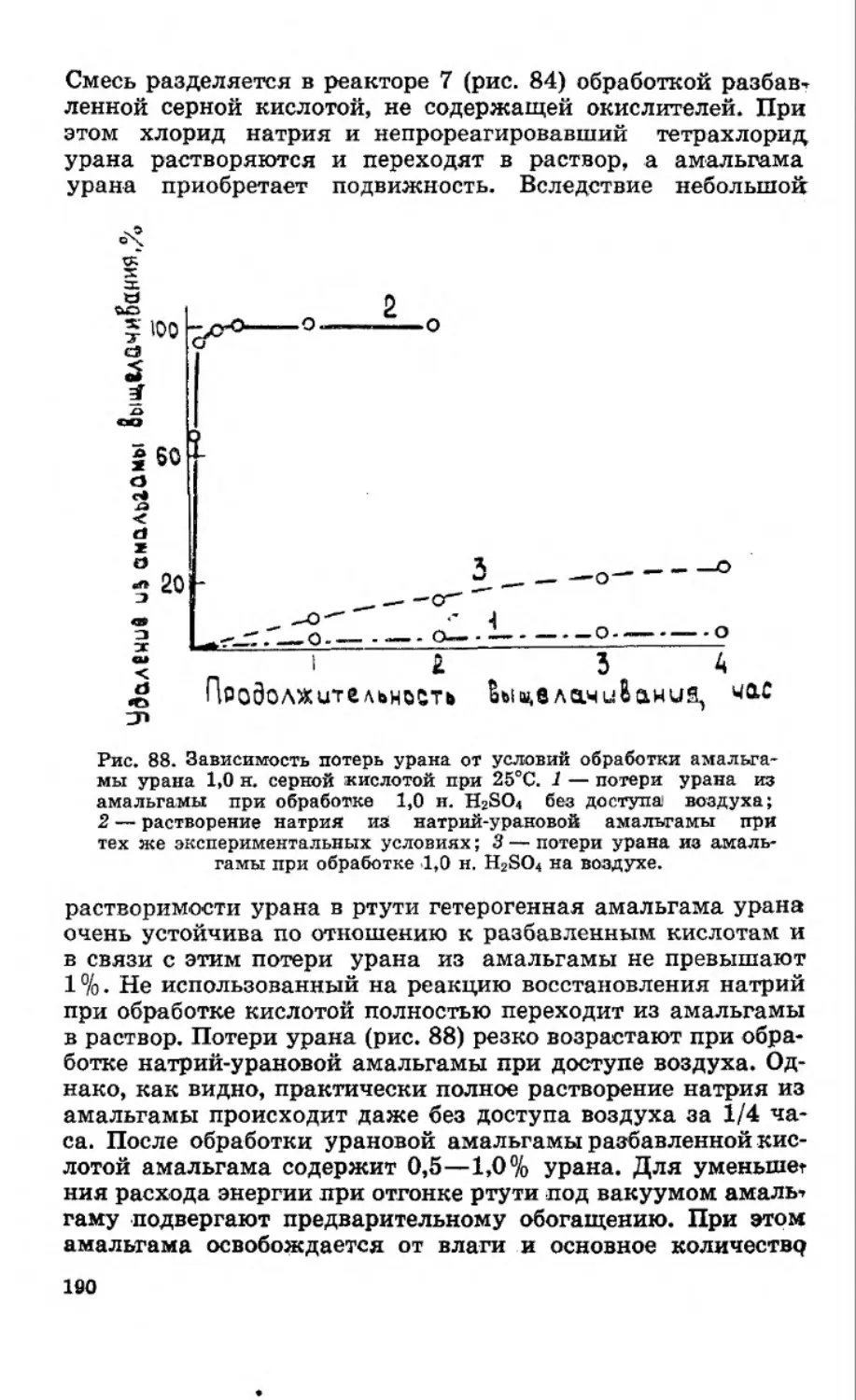
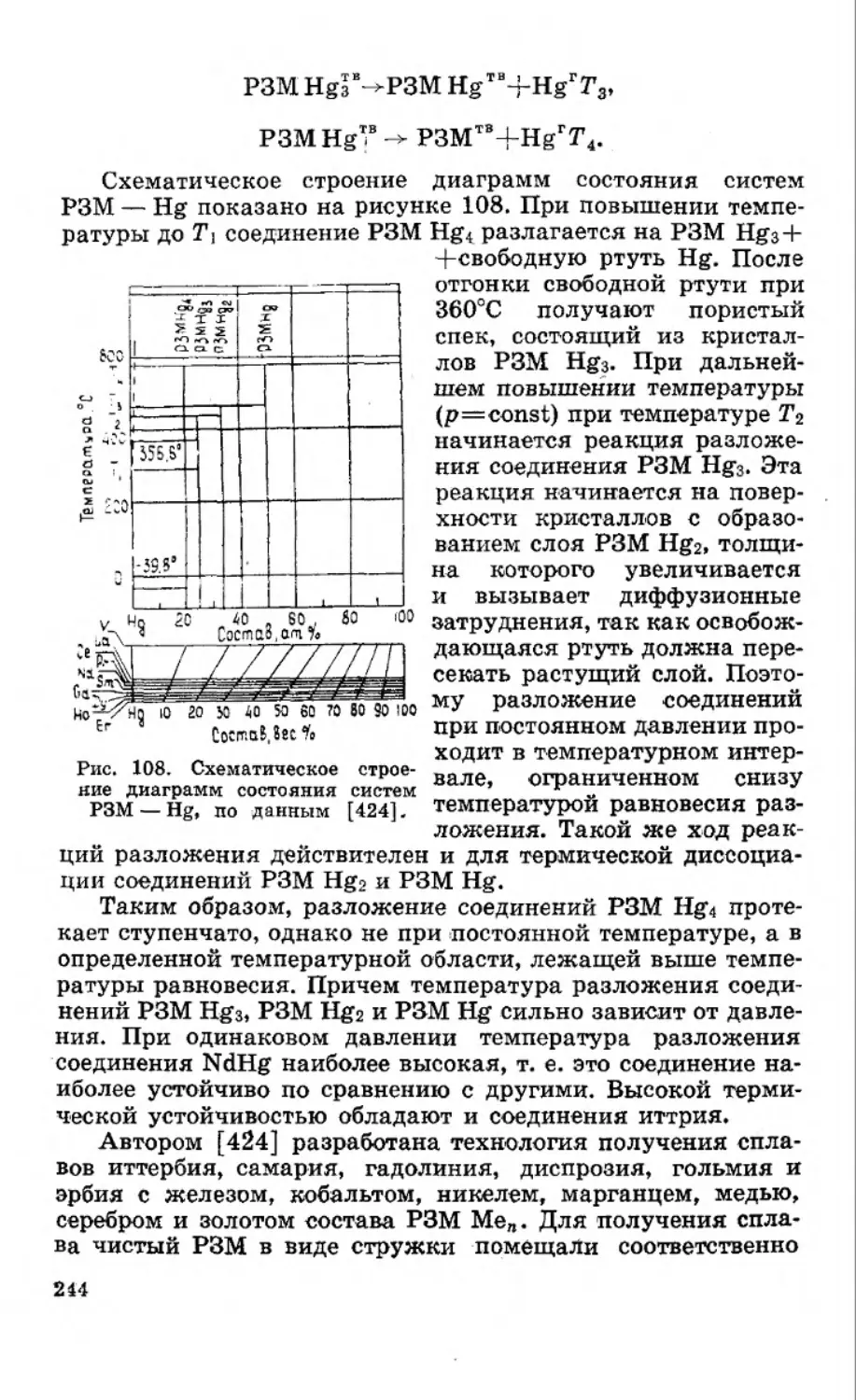
Текст
АКАДЕМИЯ НАУК КАЗАХСКОЙ ССР
ИНСТИТУТ ОРГАНИЧЕСКОГО КАТАЛИЗА И ЭЛЕКТРОХИМИИ
Л. Ф. КОЗИН
АМАЛЬГАМНАЯ
ПИРОМЕТАЛЛУРГИЯ
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
А Л М А - А Т А ♦ 19 7 3
Издательство „НАУКА" Казахской ССР
УДК 669.791.5
Книга отражает основные вопросы амальгамной пирометал-
лургии — новой, интенсивно развивающейся отрасли знаний. Ши-
роко представлены данные по растворимости металлов в ртути.
Рассмотрены условия образования расслаивающихся систем, зако-
номерности образования интерметаллических соединений в амаль-
гамных системах, термодинамические свойства бинарных и неко-
торых тройных амальгамных систем, кинетика растворения ме-
таллов в ртути. Большое внимание уделено технологическим про-
цессам. Описаны гидропиро металлургические и высокотемпера-
турные амальгамные процессы получения тугоплавких электроот-
рицательных металлов путем восстановления их соединений
амальгамами щелочных и щелочноземельных элементов (титан,
цирконий, бериллий, уран, торий, молибден, вольфрам и др.),
сплавов и тонкодисперсных порошков металлов, обладающих за-
данными свойствами. Эти металлы широко применяются в новой
технике, порошковой металлургии — для изготовления деталей
сложной конфигурации и в химической промышленности в каче-
стве высокоэффективных катализаторов. Рассмотрены методы по-
лучения металлов высокой чистоты путем их фракционной пере-
кристаллизации и экстракции из ртутной фазы (алюминий, гал-
лий, уран, торий, переработка отходов ядерных реакторов и др.).
Книга предназначена для научных и инженерно-техрических
работников металлургической и химической промышленности,
преподавателей, аспирантов и студентов старших курсов вузов.
Табл. 20, илл. 108, библ. 424.
Ответственный редактор
академик АН КазССР А. М. КУНАЕВ
К
0254—108
—-----------оо—76
м 405(07)—73
Издательство «НАУКА» Казахской ССР. 1973 г.
ПРЕДИСЛОВИЕ
Амальгамная металлургия — новая, развивающаяся от-
расль знаний — находит широкое применение в различных
областях науки, техники и промышленности. В последние
годы наметилась дифференциация амальгамной металлур-
гии на амальгамную гидрометаллургию и амальгамную
металлургию высоких температур — пирометаллургию. Про-
цессы амальгамной гидрометаллургии используются для из-
влечения металлов из сложных по составу растворов, разде-
ления изотопов, получения и рафинирования металлов до
сверхвысокой чистоты. В основе разработанных и внедрен-
ных в практику необычно эффективных амальгамных гид-
рометаллургических способов получения самых чистых в
мире свинца, висмута, кадмия, индия, цинка и других метал-
лов, содержащих 99,9999—99,999999% основного металла
при анализе на 14—18 сопутствующих примесей, лежат спе-
цифические физико-химические свойства амальгам. Вопро-
сы теории и практики амальгамных гидрометаллургических
методов получения легкоплавких металлов нашли отраже-
ние в ряде монографий и критических обзоров.
Однако современная наука и техника остро нуждаются
в тугоплавких и электроотрицательных металлах высокой
чистоты. Амальгамная пирометаллургия является одним из
3
перспективных методов получения тугоплавких и сверхчис-
тых металлов.
Внедрение амальгамных способов в промышленность
тормозится малой изученностью его физико-химических
основ и слабой осведомленностью о нем как со стороны ис-
следователей, так и практиков, занимающихся разработкой
технологических процессов. Применение процессов амаль-
гамной пирометаллургии дает принципиально новое реше-
ние таких важнейших технических задач, как получение
металлических титана, циркония, гафния, урана, тория и
других исключительно важных металлов; получение спла-
вов металлов как с высокими температурами плавления и
кипения (TiZr, TiW, TiV и др.), так и состоящих из тугоплав-
кого и легкоплавкого металла (TiCd, TiAg, PdCd, Niln, OoZn,
FeZn и др.); получение порошков ферромагнитных метал-
лов, состоящих из однодоменных частиц. Могут также полу-
чить разрешение и многие другие технические проблемы, ко-
торые 15—20 лет назад казались бы фантастическими. При-
менение амальгамной пирометаллургии имеет исключитель-
но важное значение для различных областей новой техники
(ядерная энергетика, самолето- и ракетостроение, радио-
электроника, приборостроение и др.).
Методы амальгамной пирометаллургии оказались конку-
рентоспособными даже в таком крупномасштабном и тех-
нически оснащенном производстве, как получение алюми-
ния, извлечение его из алюминийсодержащего скрапа, пе-
реработке силумина. Поскольку потери ртути могут привести
к нерентабельности процесса, а ядовитость ртути и разма-
зывание ее по продуктам передела могут сделать процесс
опасным с точки зрения производственной санитарии, про-
цессы амальгамной пирометаллургии проводят в герметич-
ной аппаратуре, полностью исключающей попадание ртути
в атмосферу, причем ртуть находится в замкнутом круговом
цикле. Поэтому использование процессов амальгамной пи-
рометаллургии в ряде случаев позволяет по сравнению с
другими производствами значительно уменьшить загрязне-
ние окружающей среды.
Несмотря на высокую эффективность амальгамных пи-
рометаллургических процессов, в настоящее время нет ра-
бот, освещающих состояние, теорию и перспективы этой но-
вой области технологии.
Автор книги является крупным специалистом в области
электрохимии и химии амальгам. Под его руководством и
при его участии разработаны и внедрены в промышленность
новые и оригинальные способы получения ряда редких и
цветных металлов высокой чистоты.
4
В книге приводятся систематизированные и проанализи-
рованные с точки зрения их достоверности сведения из опуб-
ликованной периодической и патентной литературы, а так-
же результаты исследований автора и его учеников по рас-
творимости металлов в ртути, изучению термодинамических
и электрохимических свойств амальгамных систем, диа-
граммам состояния двойных и тройных систем, условиям
образования, составу и поведению интерметаллических со-
единений в ртути, что делает монографию особенно ценной и
для смежных отраслей знаний (амальгамная гидрометаллур-
гия, амальгамная полярография с накоплением). Несомнен-
но, книга Л. Ф. Козина будет способствовать привлечению
внимания исследователей и практических работников к ме-
тоду амальгамной пирометаллургии и более широкому ис-
пользованию его на практике.
Академик АН КазССР
А. М. КУНАЕВ
ВВЕДЕНИЕ
Методы амальгамной пирометаллургии в наши дни ин-
тенсивно развиваются и находят широкое применение в тех-
нологии получения высокоактивных при высоких темпера-
турах тугоплавких металлов (титана, циркония, гафния, ва-
надия, молибдена и др.), радиоактивных (урана, тория, плу-
тония) и легких электроотрицательных (алюминия, берил-
лия, натрия и др.) металлов сверхвысокой чистоты, разнооб-
разных сплавов заданного состава, обладающих уникаль-
ными свойствами, тонкодисперсных порошков металлов и их
многокомпонентных сплавов с особыми физико-химическими
свойствами. Известно использование принципов амальгам-
ной пирометаллургии при разделении изотопов радия, тория,
урана и других металлов. Однако, несмотря на технический
прогресс, достигнутый благодаря амальгамным процессам в
ряде отраслей металлургии, возможности амальгамной пи-
рометаллургии раскрыты далеко не полностью. Это обуслов-
лено тем, что теоретические основы технологических процес-
сов амальгамной пирометаллургии изучены недостаточно.
Методы амальгамной пирометаллургии основаны на про-
цессах получения амальгам фазовым обменом, растворением
металла в ртути, электролизом, перекристаллизацией ме-
таллов из ртутной фазы, получения гетерогенных амальгам
6
электроотрицательных тугоплавких металлов, разделения их
фильтрацией, магнитной сепарацией, отгонкой ртути в опре-
деленных условиях с получением тонкодисперсных порош-
ков металлов или их сплавов с заданными свойствами. При
этом применяются различные технологические приемы,
основанные на физико-химических свойствах амальгам.
Естественно, без знания закономерностей растворимости
металлов в ртути, кинетики и механизма взаимодействия
металлов с образованием интерметаллических соединений в
ртути, их природы, термодинамических свойств бинарных,
тройных и многокомпонентных амальгамных систем и
строения их диаграмм состояния невозможно разработать
эффективный амальгамный пирометаллургический процесс.
Поэтому в книге большое внимание уделено обобщению фи-
зико-химических свойств двойных и тройных амальгамных
систем.
В главе! обсуждаются закономерности растворимости
металлов в ртути. Особое внимание уделяется установлению
обобщений, корреляционных зависимостей между теми фи-
зико-химическими свойствами металлов, которые связаны с
энергиями межатомной связи в металлах и растворимостью
металлов в ртути; рассматриваются закономерности раство-
римости ртути в металлах, а также особенности взаимного
влияния металлов при их совместном присутствии в много-
компонентной амальгаме на растворимость в ртути.
В главе II, написанной совместно с Р. Ш. Нигметовой,
приведены термодинамические свойства бинарных и трой-
ных амальгамных систем, устанавливается зависимость тер-
модинамических свойств амальгамных систем от состава,
электроотрицательности и разности атомных радиусов ме-
талла и ртути, а также показана возможность расчета термо-
динамических свойств тройных систем по опытным данным
для бинарных систем.
В главе III, написанной совместно с М. Б. Дергачевой,
рассматриваются закономерности образования интерметал-
лических соединений в бинарных и сложных амальгамах.
Анализируются методы расчета термодинамических харак-
теристик (константы диссоциации, произведения раствори-
мости) соединений в ртути, обсуждаются дискуссионные во-
просы о природе интерметаллических соединений в амаль-
гамных системах.
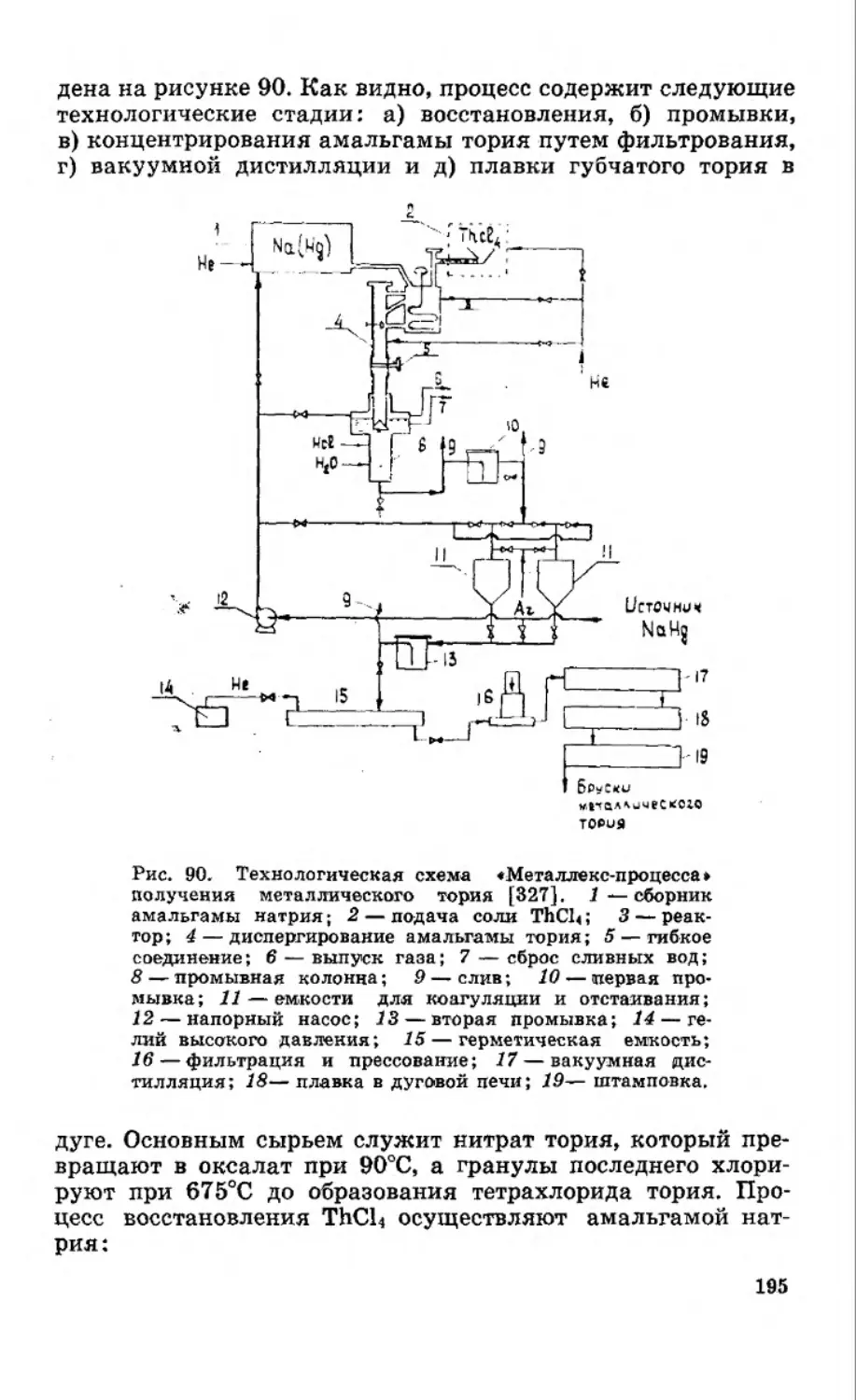
В г л а в е IV рассмотрены амальгамные пирометаллурги-
ческие методы и технологические схемы получения туго-
плавких (вольфрам, титан, цирконий и др.) и электроотрица-
тельных (алюминий, бериллий, натрий и др.) металлов, а
также их соответствующее аппаратурное оформление.
7
Глава V посвящена описанию амальгамных пирометал-
лургических методов получения тонкодисперсных порошков
металлов и их сплавов с заданными свойствами.
В Заключении приведены проблемные вопросы тео-
рии и практики амальгамной пирометаллургии и перспекти-
вы ее развития.
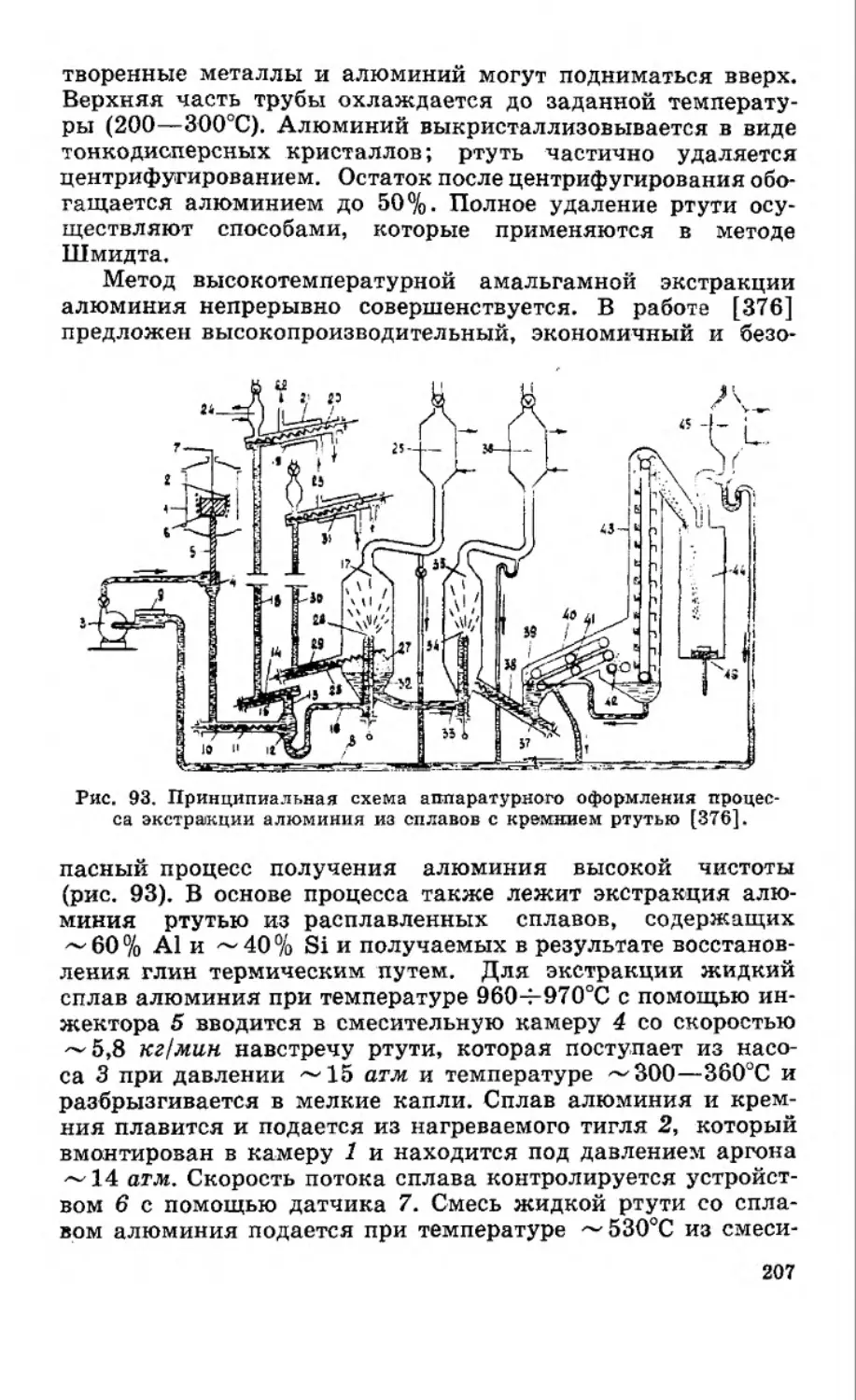
Автор выражает глубокую признательность рецензентам
книги члену-корреспонденту АН УССР профессору И. А. Ше-
ка, доктору химических наук профессору А. Г. Стромбергу,
доктору химических наук профессору С. И. Дракину, док
тору химических наук профессору А. И. Зебревой за ценные
замечания.
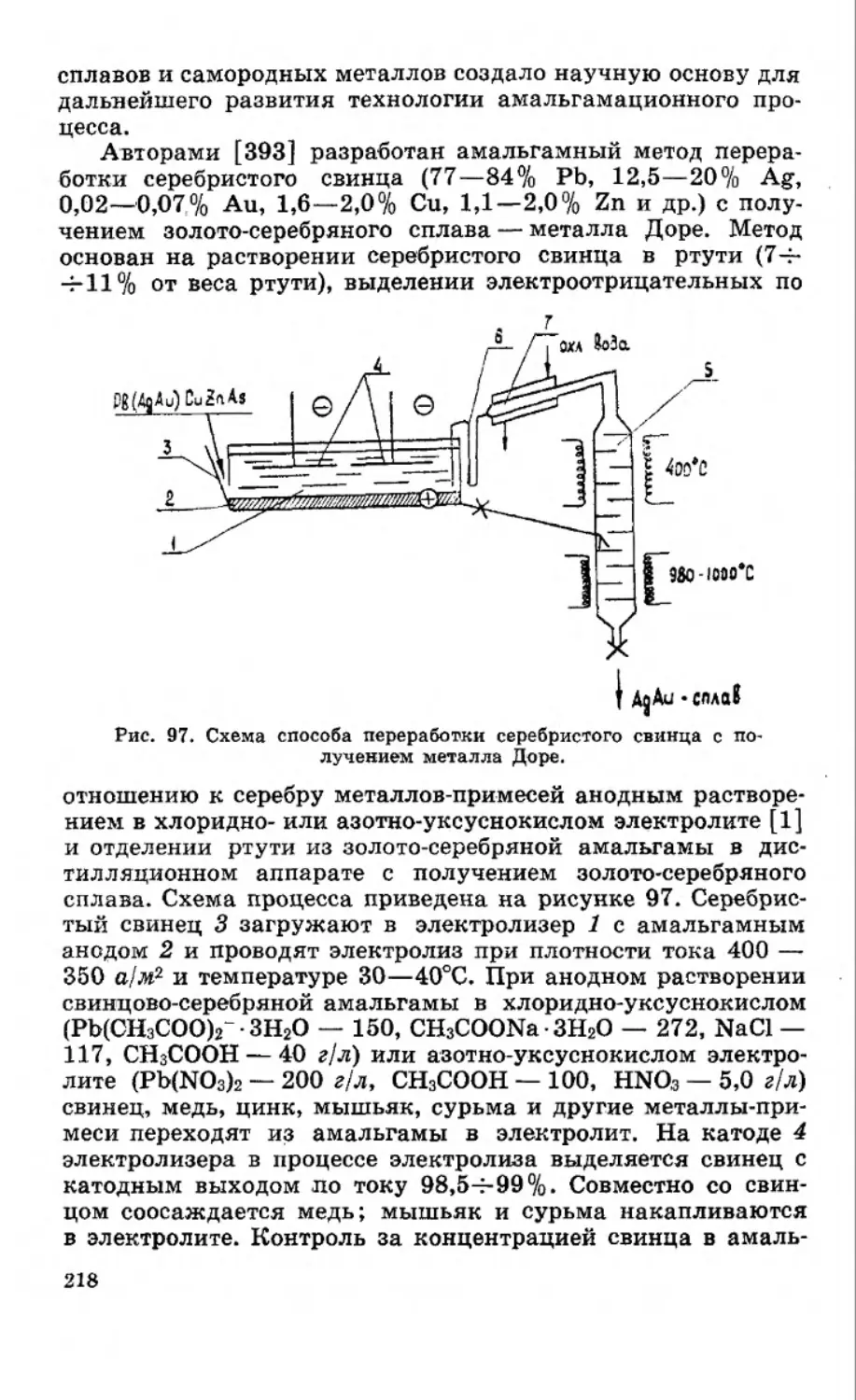
РАСТВОРИМОСТЬ МЕТАЛЛОВ
В РТУТИ
Способность металлов растворяться в ртути используется
в различных технологических процессах амальгамной гидро-
металлургии [1—5], и особенно в амальгамной пирометал-
лургии [6—8]. В процессах пирометаллургии ртуть и ее
сплавы — амальгамы — применяют в качестве реакционной
среды для проведения реакций сплавообразования, носителя
металлов-восстановителей, растворителя продуктов реакции
восстановления соединений металлов, растворителя скрапа
и черновых металлов, ядерного горючего и др. В интенсив-
но развивающихся отраслях новой техники — атомной энер-
гетике, ядерных реакторах, ртутно-водяных энергетических
установках, МГД-генераторах и других — ртуть и амальгамы
служат в качестве теплоносителей, жидких электрических
контактов, источников давления паров ртути и т. п. [9—13].
При использовании ртути и амальгам в высокотемператур-
ных процессах коррозионная устойчивость аппаратов к
действию жидких металлов имеет решающее значение. По-
этому изучению воздействия ртути на твердые металлы и
выявлению закономерностей растворимости металлов в рту-
ти уделяется большое внимание [2, 3, 14—20].
Критический обзор работ, посвященных изучению рас-
творимости металлов в ртути, дан авторами [2, 3, 16, 21].
9
Особое внимание уделено установлению закономерностей и
функциональных зависимостей растворимости металлов в
ртути от физико-химических свойств металлов при 25°С.
Показано, что при оценке отношения металлов к ртути опре-
деляющим является положение их в периодической системе
элементов Д. И. Менделеева. Сродство тяжелых металлов к
ртути возрастает в каждой подгруппе по мере увеличения
металлических свойств и приближения к положению ртути
в периодической системе. Растворение металла в ртути свя-
зано с межатомным взаимодействием атомов ртути и метал-
ла и разрушением вследствие этого кристаллической решет-
ки металла. Поэтому природа и энергия межатомной связи
Емеме в кристаллической решетке металла имеют опреде-
ляющее значение для растворимости металлов в ртути
[2, 16].
Для протекания межатомного взаимодействия атомов
металла и ртути необходимо наличие в металле или элемен-
те ненасыщенной металлической связи со свободными элек-
тронами. Элементы, обладающие только ковалентной, нена-
сыщенной связью, имеют прочносвязанные электроны, по-
этому межатомное взаимодействие атомов растворяемого
элемента и ртути отсутствует — элементы не амальгамиру-
ются [16]. Однако при повышении температуры ковалент-
ные связи частично разрушаются и возникает металличе-
ская связь, которую в кристаллах с ковалентной связью мо-
гут обусловить также сравнительно небольшие количества
примесей посторонних атомов [1]. Эти примеси могут в зна-
чительной степени увеличивать растворимость элементов с
ковалентной связью в ртути и вызывать склонность элемента
к амальгамированию. В случае переходных металлов Ша—
VIII подгрупп также наблюдается высокая энергия связи
Me—Me. Однако вследствие высокой концентрации элек-
тронного газа в кристаллической решетке этих металлов ато-
мы ртути вступают в межатомное взаимодействие с атомами
металла и амальгамируют поверхность, но не могут разру-
шить межатомную связь Me—Me в кристаллической решет-
ке, т. е. оторвать атомы металла с силами межатомного взаи-
модействия Me—Me, превосходящими силы взаимодействия
Me—Hg. Поэтому всегда наблюдается функциональная за-
висимость растворимости металлов в ртути от термодинами-
ческих и физических свойств, которые характеризуют проч-
ность связи Me—Me. Это связано с тем, что термодинамиче-
ские и физические свойства элементов (теплота плавления,
испарения и сублимации, твердость и др.) симбатно зависят
от сил межатомного взаимодействия, которые находятся в
периодической зависимости от порядкового номера [1, 2,
10
16, 22]. В то же время кривые свойство — порядковый но-
мер носят антибатный характер: элементы с высокими зна-
чениями теплот плавления, испарения, сублимации и т. д.
имеют высокую энергию межатомной связи Me—Me и не-
растворимы в ртути, и наоборот. Связь между порядковым
номером, положением металла в периодической системе эле-
ментов Д. И. Менделеева и растворимостью является отчет-
ливо выраженной закономерностью, которая может быть
использована для оценки растворимости металлов в ртути
или исправления малоубедительных экспериментальных дан-
ных [1, 2, 16, 22].
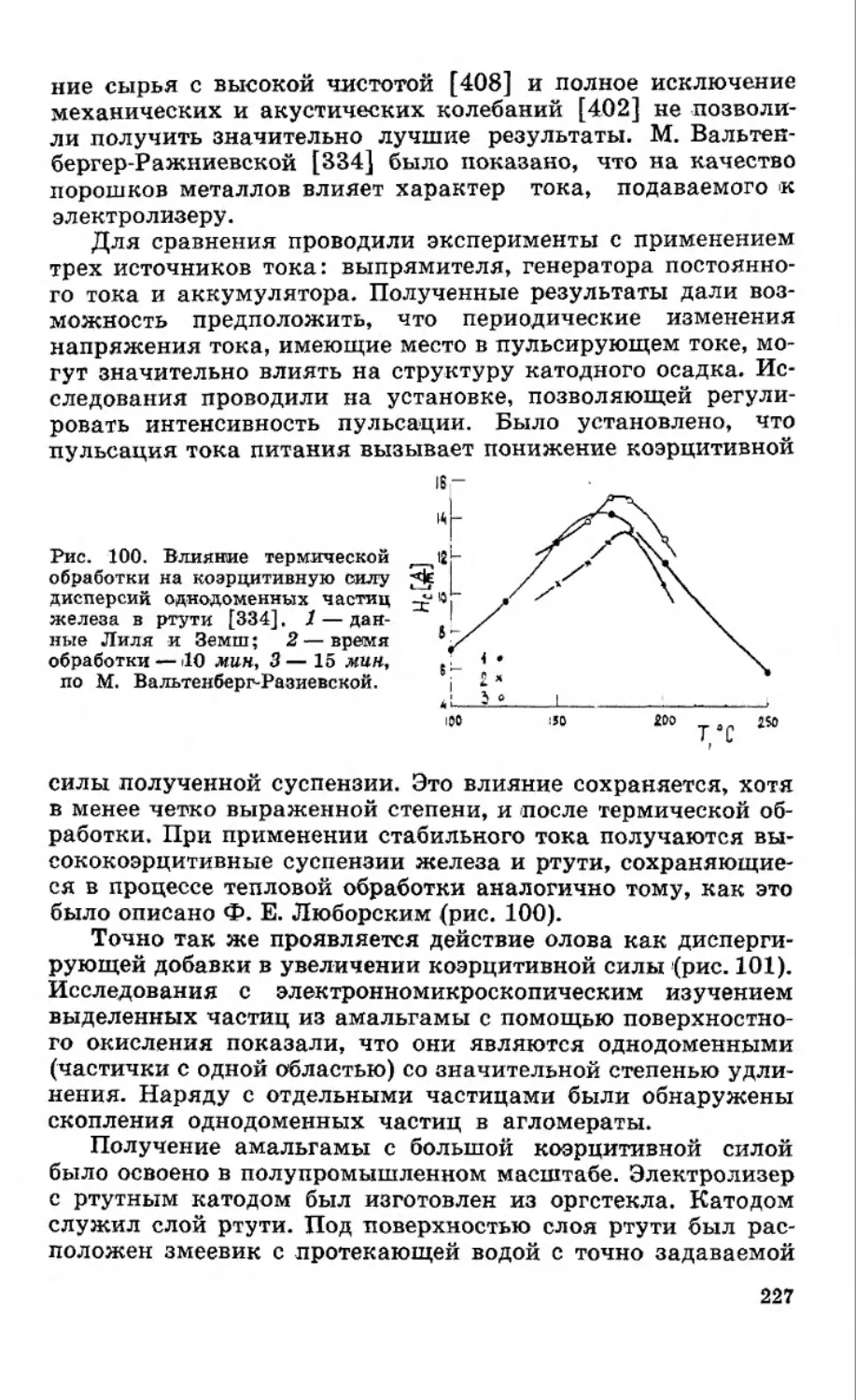
ЗАВИСИМОСТЬ РАСТВОРИМОСТИ МЕТАЛЛОВ
В РТУТИ ОТ ТЕМПЕРАТУРЫ
Для амальгамной металлургии большой практический
интерес представляет возможность оценки растворимости
металлов расчетным путем. Химический потенциал при рас-
творении металла в ртути, в которой он образует идеальный
раствор, отвечает уравнению
Р-ме = H)+RT In Nu (1-1)
где цо — стандартный химический потенциал металла в
ртути; —атомная доля растворенного металла в амаль-
гаме.
Условием термодинамического равновесия является ра-
венство химических потенциалов металлов в насыщенной
амальгаме ц* “ас и твердого металла
1хме= 1хмнеас = t^j+RT In (1-2)
Для чистого твердого металла = Цо. Следовательно,
для идеального раствора значение растворимости металла в
ртути при изменении химического потенциала Др = ц^1"ас—
—ро можно представить уравнением
* нас_
, ^Ме Но Др. /Т
1п^=------------- = ^. (1-3)
Поскольку разность химических потенциалов растворен-
ного твердого металла в ртути с образованием идеального
раствора и чистого твердого металла равна изменению изо-
барно-изотермического потенциала
Дц-Д2, (1—4)
11
которое в соответствии с [20, 23] составляет
&Z— &Нпл. Me ТMe >
d-5)
где ДНпл. ме— теплота плавления металла; Д5ПЛ. ме — энтро-
пия плавления металла.
Принимая во внимание уравнение (I—3) и используя
(I—5), получим
RT
(1-6)
Энтропию плавления металла можно рассчитать из соот-
ношения
^8Пл. Ме
^пл. Ме
Т
л пл. Ме
(1-7)
С учетом уравнений (I—5) и (I—6) уравнение (I—3) пос-
ле некоторых преобразований примет вид
1пЛ\=
А^пл. Ме/ 1
-R \Тпл
(I—6 а)
In N^-
Уравнение (I—6), (I—6а) впервые было получено рус-
ским физико-химиком И. Ф. Шредером и в настоящее время
носит его имя. Из уравнения И. Ф. Шредера следует, что в
случае идеального раствора логарифм растворимости яв-
ляется линейной функцией от обратной температуры, а угло-
вой коэффициент прямой InNj—1/Т равен
Ме
К
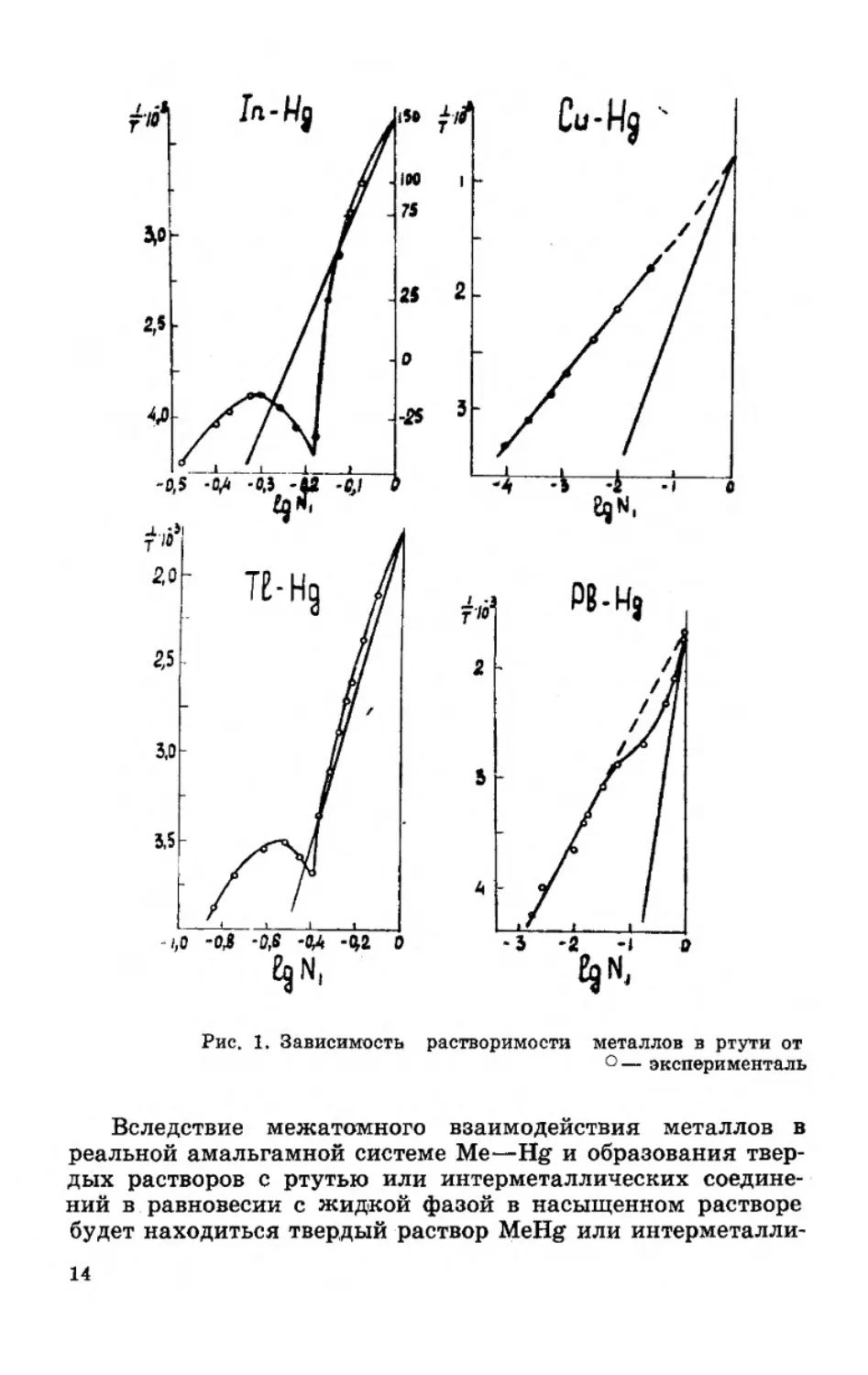
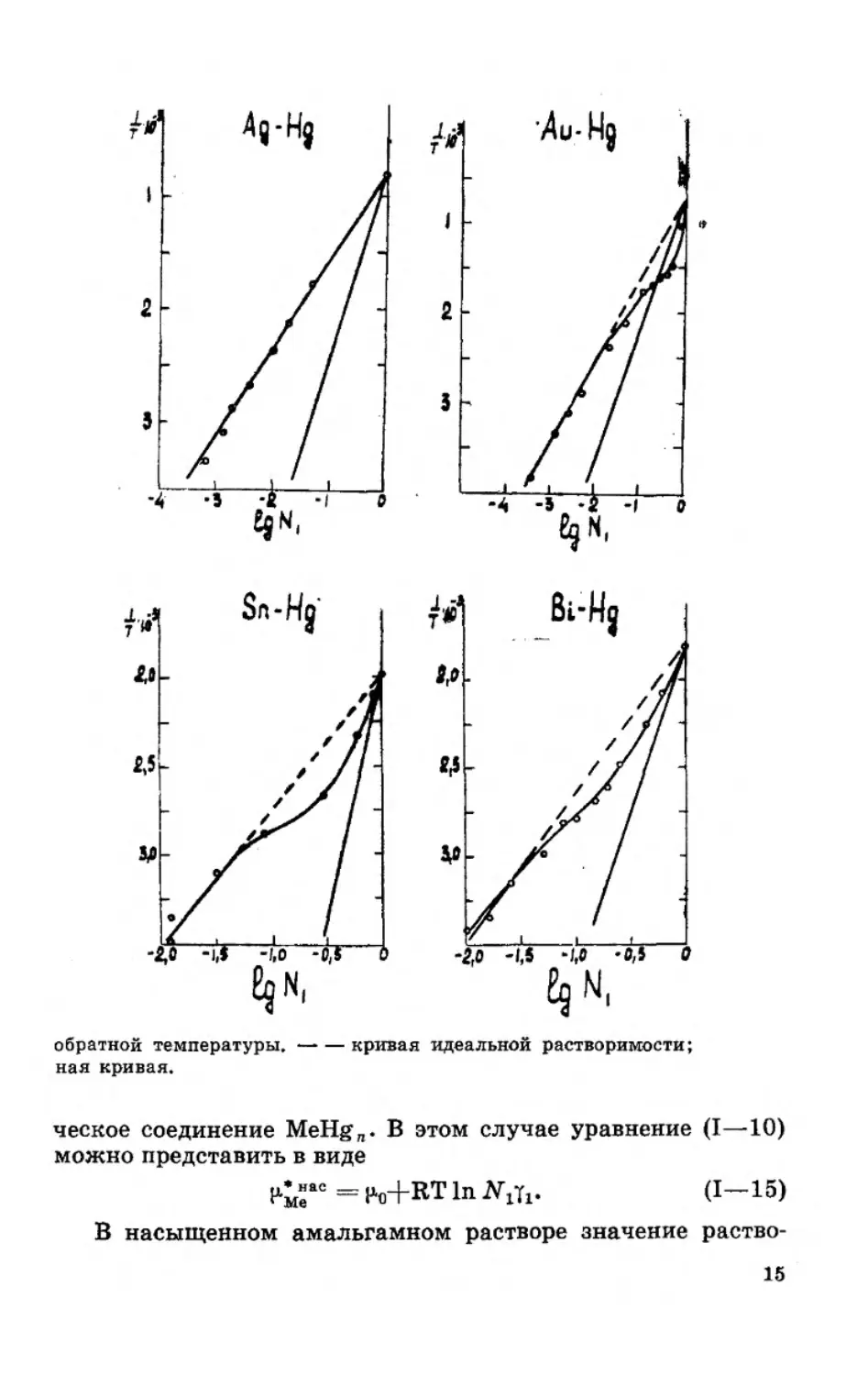
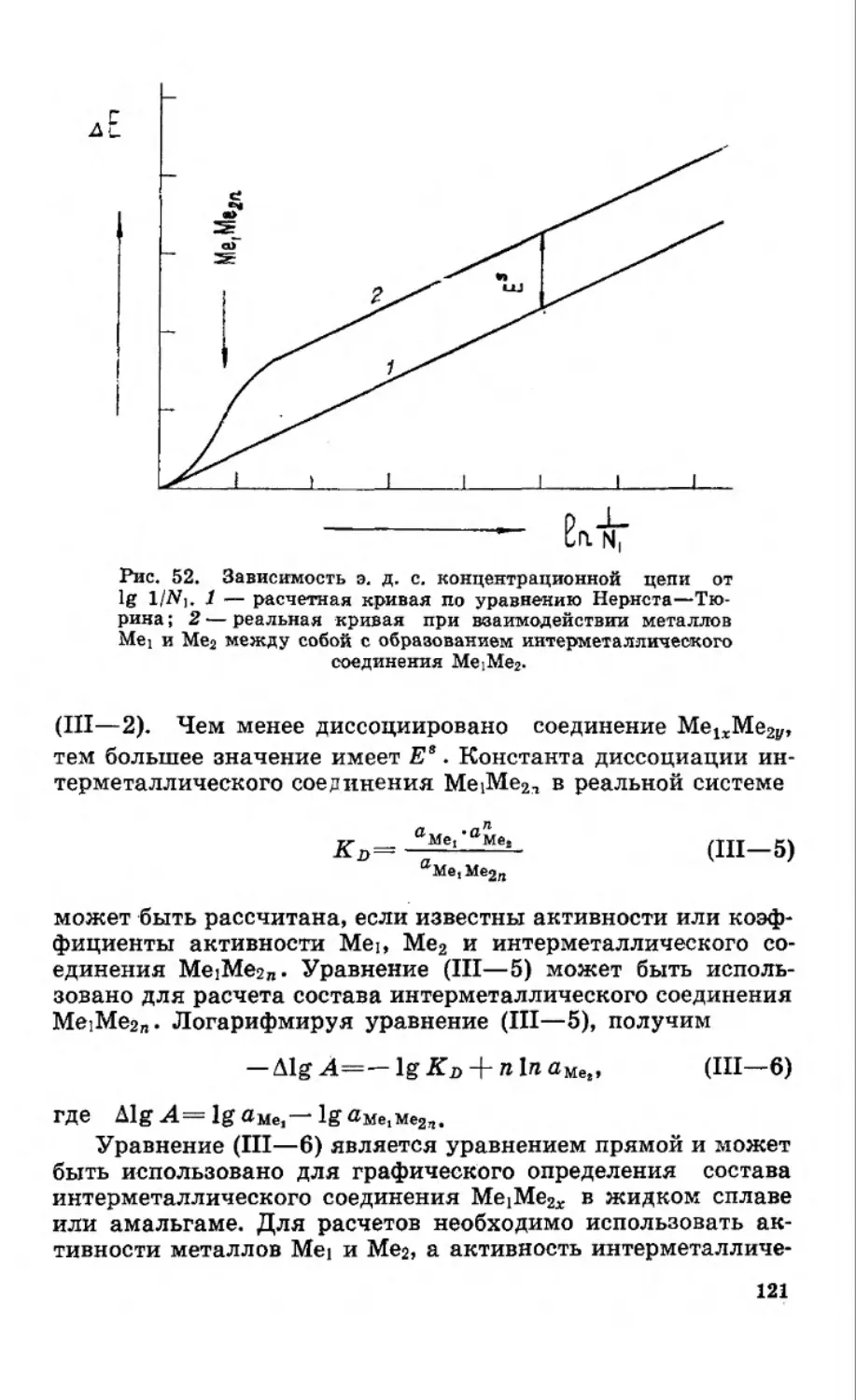
На рисунке 1 приведены кривые идеальной и реальной
растворимости индия, таллия, меди, свинца, олова, висмута,
серебра и золота в ртути в координатах lg • Как вид-
но, в случае индия и таллия в области концентрированных
амальгам наблюдаются небольшие отклонения кривой
реальной растворимости от идеальной. Поэтому уравнением
И. Ф. Шредера можно пользоваться для расчета растворимо-
сти индия и таллия в ртути в интервале температур от 0°С до
температуры плавления этих металлов. При более низких
температурах в системах индий — ртуть и таллий — ртуть
образуются интерметаллические соединения [2, 24, 25], и в
связи с этим наблюдается сильное отклонение кривых рас-
творимости от уравнения И. Ф. Шредера. Для систем медь —
ртуть, свинец — ртуть, серебро — ртуть, золото — ртуть,
висмут — ртуть и олово — ртуть кривые реальной раствори-
12
мости в ртути значительно отклоняются от кривых идеаль-
ной растворимости, рассчитанных по уравнению (I—6а). Сле-
довательно, уравнение (I—6а) не применимо для расчета рас-
творимости металлов в реальных амальгамных системах
Me—Hg.
В реальном растворе химический потенциал растворен-
ного металла отвечает уравнению
Р-ме'^ Но + RT In а19 (1—8)
где — активность металла в амальгаме.
Численное значение активности металла в амальгаме
определяется выбором стандартного состояния [2, 22]. Для
характеристики отклонения амальгамы от идеального пове-
дения в качестве стандартного состояния следует выбирать
чистый металл. Для количественной оценки степени не-
идеальности компонентов амальгамы от значений, отвечаю-
щих идеальному раствору, пользуются коэффициентом ак-
тивности
= X’ С1-9)
или
ai=Njvi, (I—9а)
где у] — коэффициент активности металла в ртути.
Используя выражение (I—9а), из (I—8) получим
име = !1о4-КТ1пЛг111. (1—10)
Сравнивая уравнения (I—10) и (I—1), легко видеть, что
коэффициент активности yi является мерой неидеальности
растворенного металла в амальгамном растворе. Вычитая из
уравнения (I—10) уравнение (I—1), получим
НМе— )«“«= RTfo^. (1—11)
Поскольку коэффициент активности yj связан с удель-
ными избыточными парциальными молярными характери-
стиками — изобарно-изотермическим потенциалом, энтро-
пией и энтальпией следующим соотношением [20, 23]:
"-12’
а
ДЙ*=АЯСМ—TAS*, (1—13)
то, используя (I—12) и (I—13), из (I—11) получим
RTlni!= АНсм—TAS*. (1—14)
13
Рис. 1, Зависимость
растворимости металлов в ртути от
°— эксперимспталь
Вследствие межатомного взаимодействия металлов в
реальной амальгамной системе Me—Hg и образования твер-
дых растворов с ртутью или интерметаллических соедине-
ний в равновесии с жидкой фазой в насыщенном растворе
будет находиться твердый раствор MeHg или интерметалли-
14
обратной температуры, — — кривая идеальной растворимости;
ная кривая.
ческое соединение MeHgn. В этом случае уравнение (1—10)
можно представить в виде
НмГ = Ho+RT In Nfr. (1-15)
В насыщенном амальгамном растворе значение раство-
15
римости металла в ртути при изменении химического потен-
циала Дц=ц^неас—Но можно представить уравнением
ln^= |XMeRT'|X°------In Ъ= -In 11. (1-16)
Принимая во внимание (I—4), (I—5), (I—6) и (I—14), из
(I—16) получим
1п^=
ДНпл-ТД8пл ) _ fAHCM+TASCM*
RT ) \ RT
(1-17)
В соответствии с [20, 23]
AS —ASCM—A Si<a’
d-18)
А5ид=-Я1п^,
(1-19)
где AS0M — энтропия смешения в реальном растворе;
AS ид— идеальная энтропия растворения.
Принимая во внимание (I—18), из (I—17) получаем
In 2VX=
ДЯпл-ТДЗпл- ДЯсм+ТДЯсм- ТД5ИД
RT
(1-20)
Для случая, когда АНСМ = О, a AS0M=AS„4,
In (1-21)
получаем уравнение Шредера. Следовательно, первый член
правой части уравнения (I—17) отвечает растворимости ме-
талла в идеальном растворе (In NТ*), а второй член харак-
теризует отклонение от идеального поведения металла в
ртутном растворе (In yi). Поэтому уравнение (I—20) можно
представить в виде
In In N"’—In Тх (1—22)
или
дтид
ln^=ln-A- (I—22а)
и
№д
^=-2-. (1—23)
71
Следует отметить, что уравнение (I—23) было получено
ранее М. И. Шахпароновым другим путем [23] и является
вполне строгим следствием термодинамики. По уравнению
(I—23) может быть рассчитана растворимость металла в лю-
16
бой системе, если известны коэффициенты активности ком-
понентов. Уравнениями (I—20) и (I—23) описывается раство-
римость металла в ртути независимо от его состояния в жид-
кой фазе (образование интерметаллических соединений или
твердых растворов). Анализ уравнения (I—23) показывает,
что ход кривой реальной растворимости (например, в коор-
динатах 1пА1 = “) зависит от значения коэффициента ак-
тивности Vi. При Vi >1 наблюдается положительное откло-
нение от законов идеальных растворов и растворимость
меньше идеальной. При 71 <1 будут наблюдаться отрица-
тельное отклонение от законов идеальных растворов и рас-
творимость больше идеальной. При 71 = 1 растворимость от-
вечает законам идеальных растворов.
Таким образом, полученные уравнения растворимости
свидетельствуют, что для расчета растворимости металлов в
ртути по уравнениям (I—20) и (I—23) необходимы данные о
термодинамических свойствах металлов в амальгамных си-
стемах Дйпл, Дй'см» ASCM или 71. Анализ уравнения
(I—20) показывает, что тепловой эффект растворения твер-
дого металла в ртути равен сумме энтальпии плавления и из-
быточной энтальпии растворения металла в ртути (АН* =
= ДНСМ) [22]
АНн=ДЯпл+ДЯсм. (1-24)
Аналогичное соотношение справедливо и для энтропии
растворения:
ASSi=ASnjI + AS*.
(1-25)
Учитывая (I—24) и (I—25), уравнение (I—20) можно
представить в следующем виде:
In Л\=-----\т £‘ (1-26)
К1
или
_ ДНЕ1 Д5И
1пЛГ1 RT к •
Следовательно, зависимость растворимости металлов в
ртути в определенном интервале от 1/Т будет отвечать пря-
мым, тангенс угла наклона которых будет равен /R.
Особенно отчетливо видно отклонение реальных кривых
растворимости (кривых ликвидуса) от идеальных растворов
при представлении экспериментальных данных в координа-
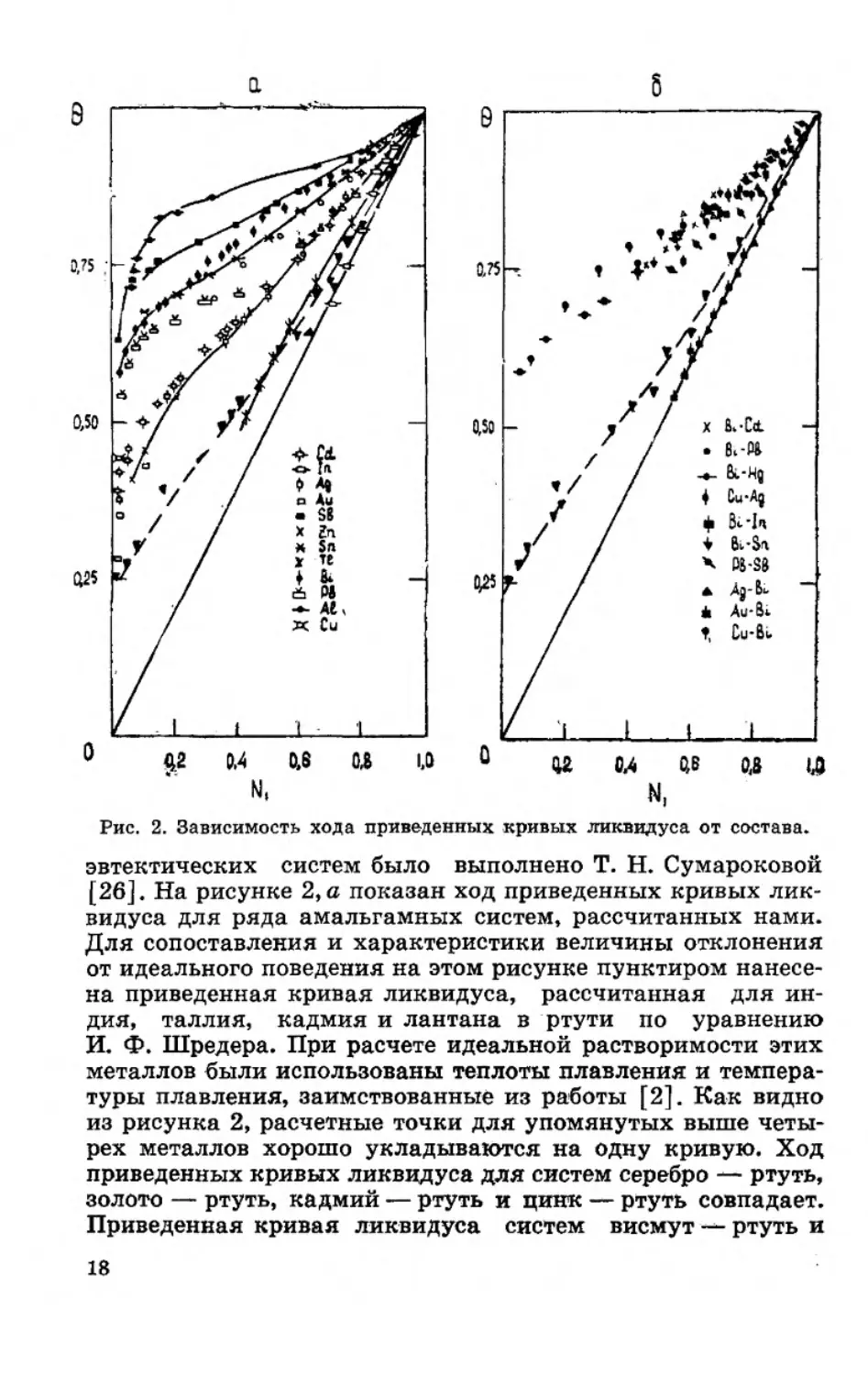
тах ♦ приведенная температура &—Т/Тпл—состав». Впервые
построение приведенных кривых ликвидуса для различных
2-122
Г
I
a
<J2 0.4 0,6 0,8 1,0
N,
6
02 tU 06 0,6 14
N,
Рис. 2. Зависимость хода приведенных кривых ликвидуса от состава.
эвтектических систем было выполнено Т. Н. Сумароковой
[26]. На рисунке 2, а показан ход приведенных кривых лик-
видуса для ряда амальгамных систем, рассчитанных нами.
Для сопоставления и характеристики величины отклонения
от идеального поведения на этом рисунке пунктиром нанесе-
на приведенная кривая ликвидуса, рассчитанная для ин-
дия, таллия, кадмия и лантана в ртути по уравнению
И. Ф. Шредера. При расчете идеальной растворимости этих
металлов были использованы теплоты плавления и темпера-
туры плавления, заимствованные из работы [2]. Как видно
из рисунка 2, расчетные точки для упомянутых выше четы-
рех металлов хорошо укладываются на одну кривую. Ход
приведенных кривых ликвидуса для систем серебро — ртуть,
золото — ртуть, кадмий — ртуть и цинк — ртуть совпадает.
Приведенная кривая ликвидуса систем висмут — ртуть и
18
олово — ртуть располагается несколько выше. Интересно,
что кривая 0—Ni %ля системы свинец — ртуть в области,
богатой свинцом, совпадает с кривой серебро — ртуть, а в об-
ласти, богатой ртутью, — с системой висмут — ртуть. Ход
кривых 0—N] систем сурьма — ртуть и алюминий — ртуть
значительно отклоняется от приведенных выше кривых. На
наш взгляд, такое поведение этих систем связано с измене-
нием природы межатомных связей в их кристаллических
решетках при повышении температуры (уменьшение доли
ковалентной связи и увеличение металлической) [2]. Кроме
того, очевидно, в системах алюминий — ртуть и сурьма —
ртуть проявляется в значительной степени явление ограни-
ченной взаимной растворимости компонентов эвтектических
систем в жидком состоянии, обнаруженное автором [27].
Вследствие достаточно малого межфазового поверхностного
натяжения в эвтектических системах одна из фаз самопро-
извольно диспергируется и образуется термодинамически
устойчивая лиофильная двухфазная дисперсная система.
Поэтому макроскопическое расслоение в области несмеши-
ваемости в этих системах по [27] не наблюдается.
На рисунке 2,6 для сопоставления показан ход кривых
0—для металлических систем эвтектического типа: Bi—
Cd, Bi—Pb, Bi—Hg, Bi—In, Bi—Sn, Pb—Sn, Cu—Ag, Ag—
Bi, Cu—Bi, Au—Bi [24]. Как видно, ход кривых в—2Vi для
различных систем практически совпадает. На наш взгляд,
некоторый разброс экспериментальных значений приведен-
ных кривых ликвидуса, очевидно, обусловлен недостаточно
точно установленным ходом кривых плавкости рассмотрен-
ных систем. Обращает на себя внимание тот факт, что с хо-
дом идеальной приведенной кривой ликвидуса в области вы-
соких концентраций совпадают лишь две из рассмотренных
систем — Ag—Bi и Au—Bi.
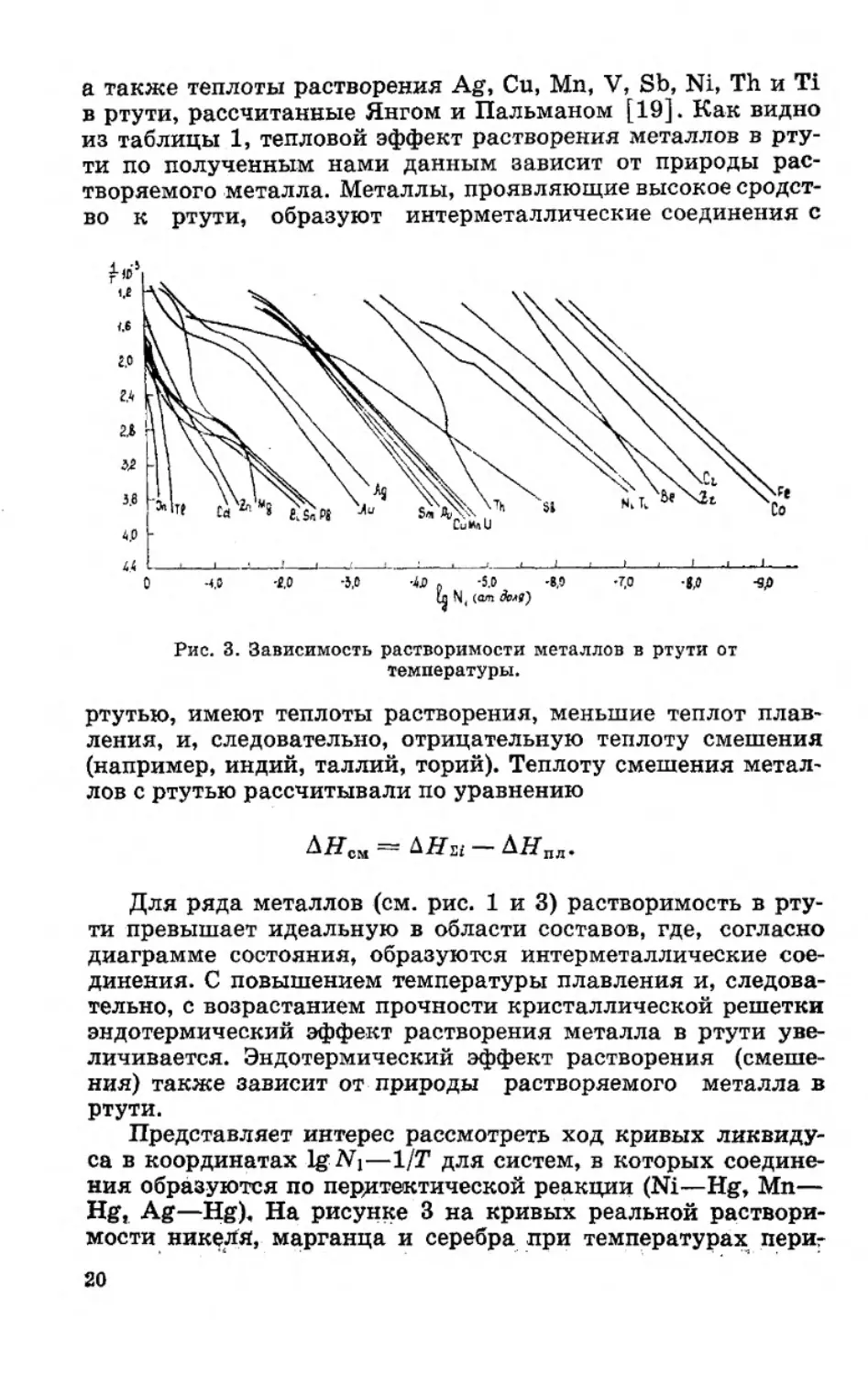
На рисунке 3 в координатах 1g Nj—1/Т приведен ход
кривых ликвидуса всех известных бинарных систем ме-
талл — ртуть (Sn, Al, Sb, U, Sm, Nd, Th, Cd, Zn, Mn, Ti, Mg,
Fe, Co, Pt, Ni), а также данные о растворимости некоторых
металлов в ртути в ограниченном интервале температур (Be,
Zr, Pu [2, 14, 16—20, 24, 25].
Из угловых коэффициентов прямолинейных участков
кривой растворимости в координатах 1g N[—1/Т в соответст-
вии с уравнением (I—126) может быть рассчитан тепловой
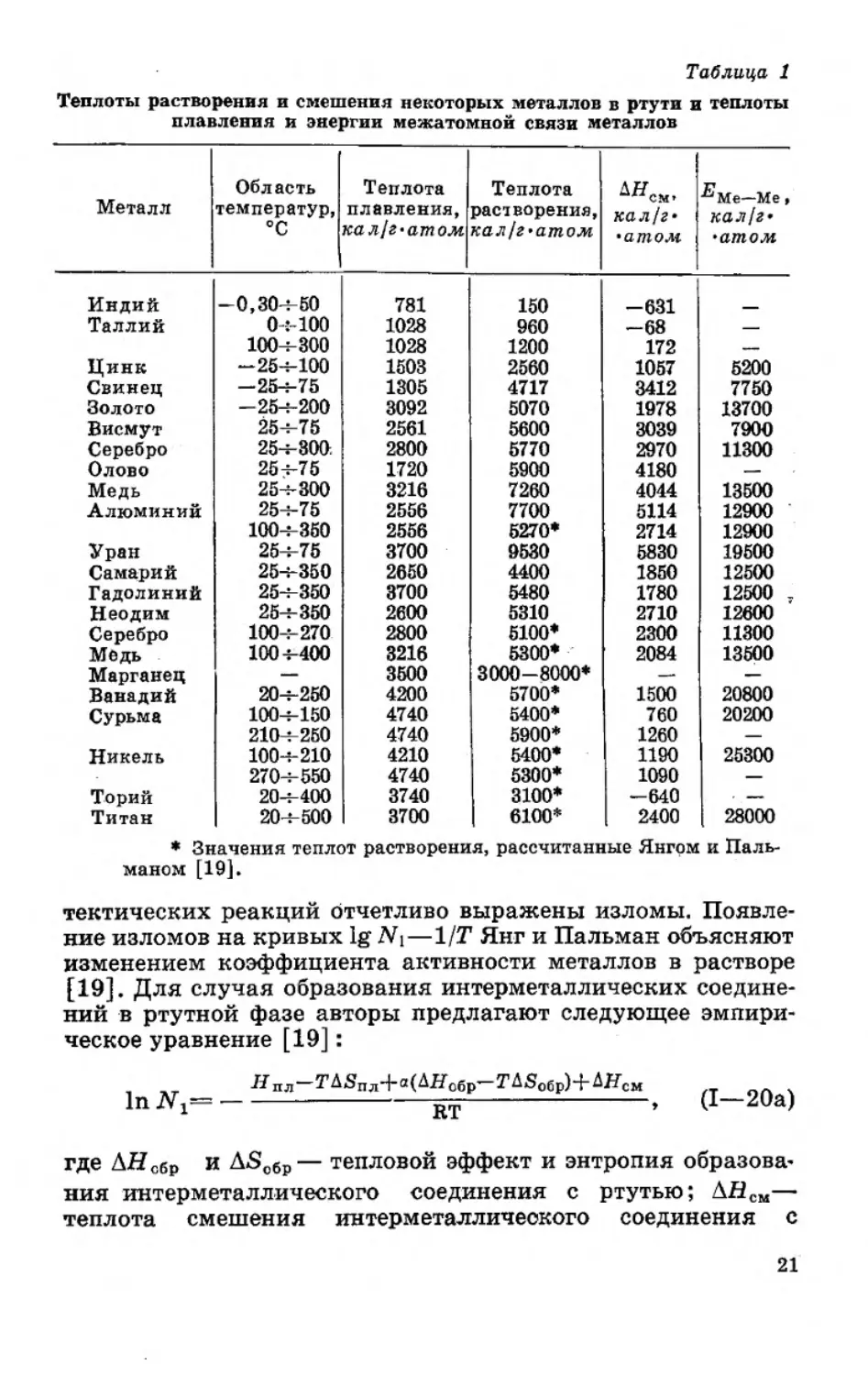
эффект растворения металлов в ртути ЬНм . В таблице 1
приведены рассчитанные нами значения теплот растворе-
ния 1 In, Tl, Zn, Pb, Au, Bi, Ag, Sn, Cu, Al, U, Sm, Gd, Nd,
^Растворимость меди в ртути при температуре 25-4-300°С определе-
на нами [16], а растворимость индия при —- 40-Н15£°С —- в [28].
1В
а также теплоты растворения Ag, Си, Мп, V, Sb, Ni, Th и Ti
в ртути, рассчитанные Янгом и Пальманом [19]. Как видно
из таблицы 1, тепловой эффект растворения металлов в рту-
ти по полученным нами данным зависит от природы рас-
творяемого металла. Металлы, проявляющие высокое сродст-
во к ртути, образуют интерметаллические соединения с
44 --------»------1-----:------------1------:------1-----•-----‘-------------‘-----*------i------«-----<-----!------1-----L-
О 40 -f.O -5,0 4J) . -5.0 -8,0 '7,0 -g.O -Яр
Гл N, (<vn доля')
Рис. 3. Зависимость растворимости металлов в ртути от
температуры.
ртутью, имеют теплоты растворения, меньшие теплот плав-
ления, и, следовательно, отрицательную теплоту смешения
(например, индий, таллий, торий). Теплоту смешения метал-
лов с ртутью рассчитывали по уравнению
Для ряда металлов (см. рис. 1 и 3) растворимость в рту-
ти превышает идеальную в области составов, где, согласно
диаграмме состояния, образуются интерметаллические сое-
динения. С повышением температуры плавления и, следова-
тельно, с возрастанием прочности кристаллической решетки
эндотермический эффект растворения металла в ртути уве-
личивается. Эндотермический эффект растворения (смеше-
ния) также зависит от природы растворяемого металла в
ртути.
Представляет интерес рассмотреть ход кривых ликвиду-
са в координатах lg -N\—1/Т для систем, в которых соедине-
ния образуются по перитектической реакции (Ni—Hg, Мп—
Hg, Ag—Hg). На рисунке 3 на кривых реальной раствори-
мости никеля, марганца и серебра при температурах периг
20
Таблица 1
Теплоты растворения и смешения некоторых металлов в ртути и теплоты
плавления и энергии межатомной связи металлов
Металл Область температур, °C Теплота плавления, кал!г*атом Теплота растворения, кал!г»атом кал/г* •атом Me—Ме , кал!г* •атом
Индий -0,30-4-50 781 150 -631
Таллий 0:100 1028 960 -68
100-4-300 1028 1200 172 —
Цинк —25-4-100 1503 2560 1057 5200
Свинец -25-4-75 1305 4717 3412 7750
Золото -254-200 3092 5070 1978 13700
Висмут 25-4-75 2561 5600 3039 7900
Серебро 25-4-800. 2800 5770 2970 11300
Олово 25-4-75 1720 5900 4180 —
Медь 25-4-300 3216 7260 4044 13500
Алюминий 25-4-75 2556 7700 5114 12900 '
100-4-350 2556 6270* 2714 12900
Уран 25-4-75 3700 9580 5830 19500
Самарий 25-4-350 2650 4400 1850 12500
Гадолиний 25-4-350 3700 5480 1780 12500 7
Неодим 25-4-350 2600 5310 2710 12600
Серебро 100-4-270 2800 5100* 2300 11300
Медь . 1004-400 3216 5300* 2084 13500
Марганец — 3600 3000-8000* — —
Ванадий 20-4-250 4200 5700* 1500 20800
Сурьма 100-4-150 4740 5400* 760 20200
210-4-250 4740 5900* 1260 —
Никель 100-4-210 4210 5400* 1190 25300
270-4-550 4740 5300* 1090 —
Торий 20-4-400 3740 3100* —640
Титан 20-4-500 3700 6100* 2400 28000
♦ Значения теплот растворения, рассчитанные Янгом и Паль-
маном [19].
тектических реакций отчетливо выражены изломы. Появле-
ние изломов на кривых 1g N\—1/Т Янг и Пальман объясняют
изменением коэффициента активности металлов в растворе
[19]. Для случая образования интерметаллических соедине-
ний в ртутной фазе авторы предлагают следующее эмпири-
ческое уравнение [19]:
Н ПЛ — Tсм
]П —
RT
(I—20а)
где ДНсбр и ASo6p— тепловой эффект и энтропия образова-
ния интерметаллического соединения с ртутью; ДНСМ—
теплота смешения интерметаллического соединения с
21
ртутью; а — степень диссоциации интерметаллического
соединения.
Член уравнения (I—20а) а(ДНобР—TAS06p) соответствует
изменению изобарно-изотермического потенциала при обра-
зовании интерметаллического соединения AZo6p . В случае
системы никель — ртуть соединение NiHg4 устойчиво при
низких температурах в ртутной фазе, где оно находится в
виде осадка и растворенного недиссоциированного соедине-
ния. По данным работы [19], ниже перитектической темпе-
ратуры степень диссоциации интерметаллического соедине-
ния NiHg4 изменяется незначительно и в связи с этим
кривая lg Ni—ЦТ представляет прямую линию. Вблизи пери-
тектической температуры вследствие возрастающей диссо-
циации соединения отрицательный член «(АН^р —TAS0$р )
становится все меньше, из-за чего растворимость металла в
ртути по уравнению (I—20а) расчет быстрее, чем если бы оно
возрастало линейно. При температурах намного выше пери-
тектических а становится независимым от температуры и
равным нулю и поэтому соотношение lg —1/Т опять ли-
нейно. В этом случае растворимость должна следовать [19]
уравнению
In Л\= -^л-гупл-д^см . (I—20б)
х К1
Однако в этом уравнении Янг и Пальман не учитывают
избыточную энтропию смешения Авизб, которая равна раз-
ности ASCM и Двид (см. (I—12). Поэтому данное уравнение
применимо только в том случае, когда растворение металла
в ртути сопровождается энтропией смешения ASCM, равной
АЗид, т. е. если система подчиняется законам регулярных
растворов. В этом случае расчетные значения растворимости
металла в ртути по уравнению (I—206) будут согласовывать-
ся с опытными. Однако, как правило, металлические систе-
мы не следуют законам регулярных растворов [29].
В работах [2, 16] нами было показано, что должна су-
ществовать определенная функциональная зависимость меж-
ду величиной растворимости металла в ртути и прочностью
кристаллической решетки металла. Поэтому представляло
интерес найти эту зависимость. Очевидно, мерой прочности
кристаллической решетки металла является энергия меж-
атомной связи -Емеме, которая может быть рассчитана для
всех металлов и элементов периодической системы Д. И.
Менделеева. Расчет энергии межатомной связи атомов ме-
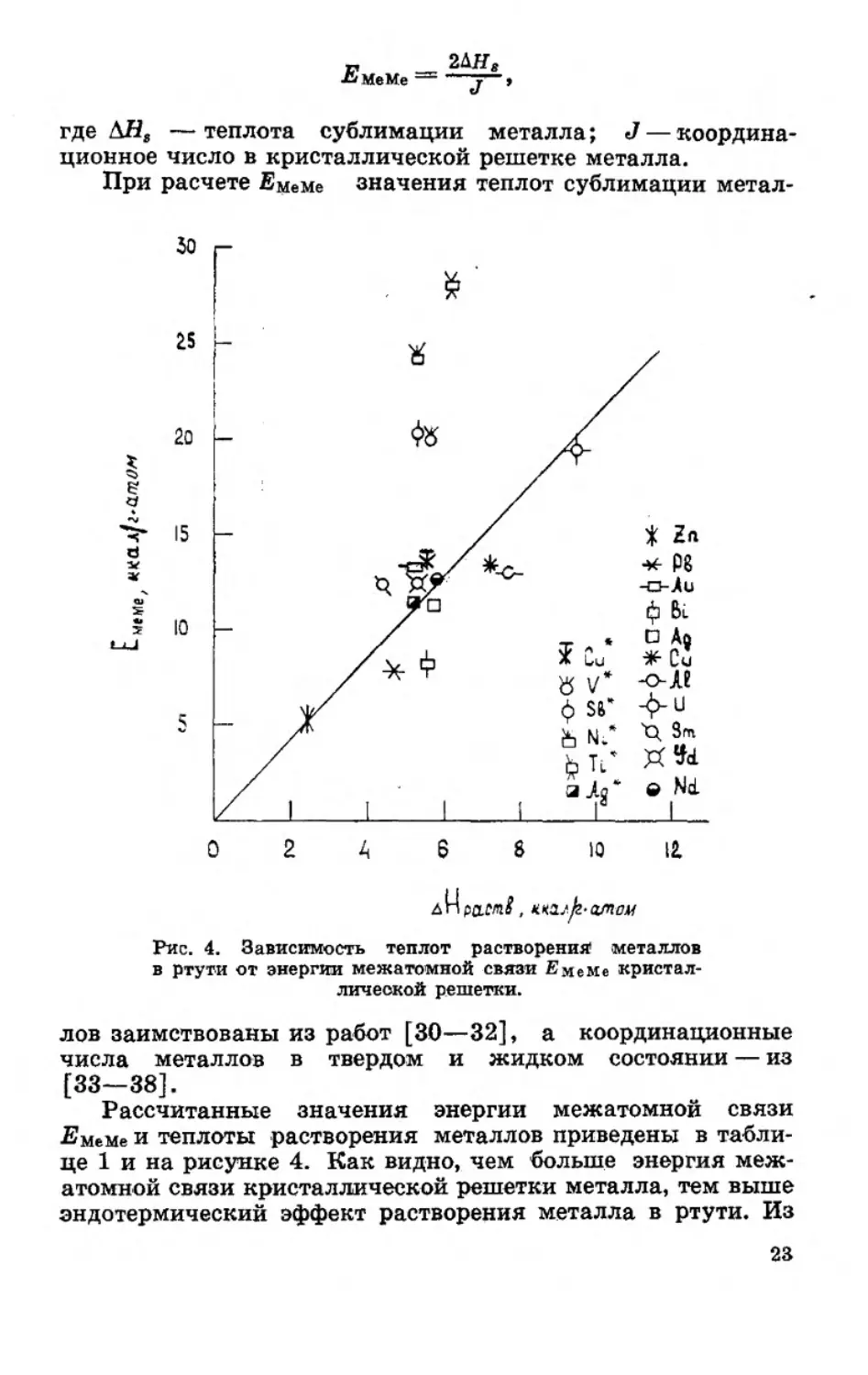
талла в кристаллической решетке проводили по формуле
22
•ЕмеМе —
2ДЯа
где &Н8 —теплота сублимации металла; J — координа-
ционное число в кристаллической решетке металла.
При расчете Емеме значения теплот сублимации метал-
д
Рис. 4. Зависимость теплот растворения* металлов
в ртути от энергии межатомной связи ЕмеМе кристал-
лической решетки.
лов заимствованы из работ [30—32], а координационные
числа металлов в твердом и жидком состоянии — из
[33—38].
Рассчитанные значения энергии межатомной связи
•Емеме и теплоты растворения металлов приведены в табли-
це 1 и на рисунке 4. Как видно, чем больше энергия меж-
атомной связи кристаллической решетки металла, тем выше
эндотермический эффект растворения металла в ртути. Из
23
анализа этих расчетных данных следует, что между величи-
ной теплового эффекта растворения металла в ртути и энер-
гией межатомной связи существует определенная зависи-
мость.
Значения теплот растворения, определенные Янгом и
Пальманом [19] для титана, ванадия, никеля и сурьмы (на
рис. 4 отмечены звездочками), выпадают из хода кривой за-
висимости Емеме —ДНраств. Нам представляется, что рас-
творение ванадия, никеля и титана — металлов с чрезвычай-
но высокой энергией межатомной связи — должно сопро-
вождаться более высоким эндотермическим эффектом рас-
творения. Для сурьмы, очевидно, необходимо уточнить рас-
четную величину энергии межатомной связи.
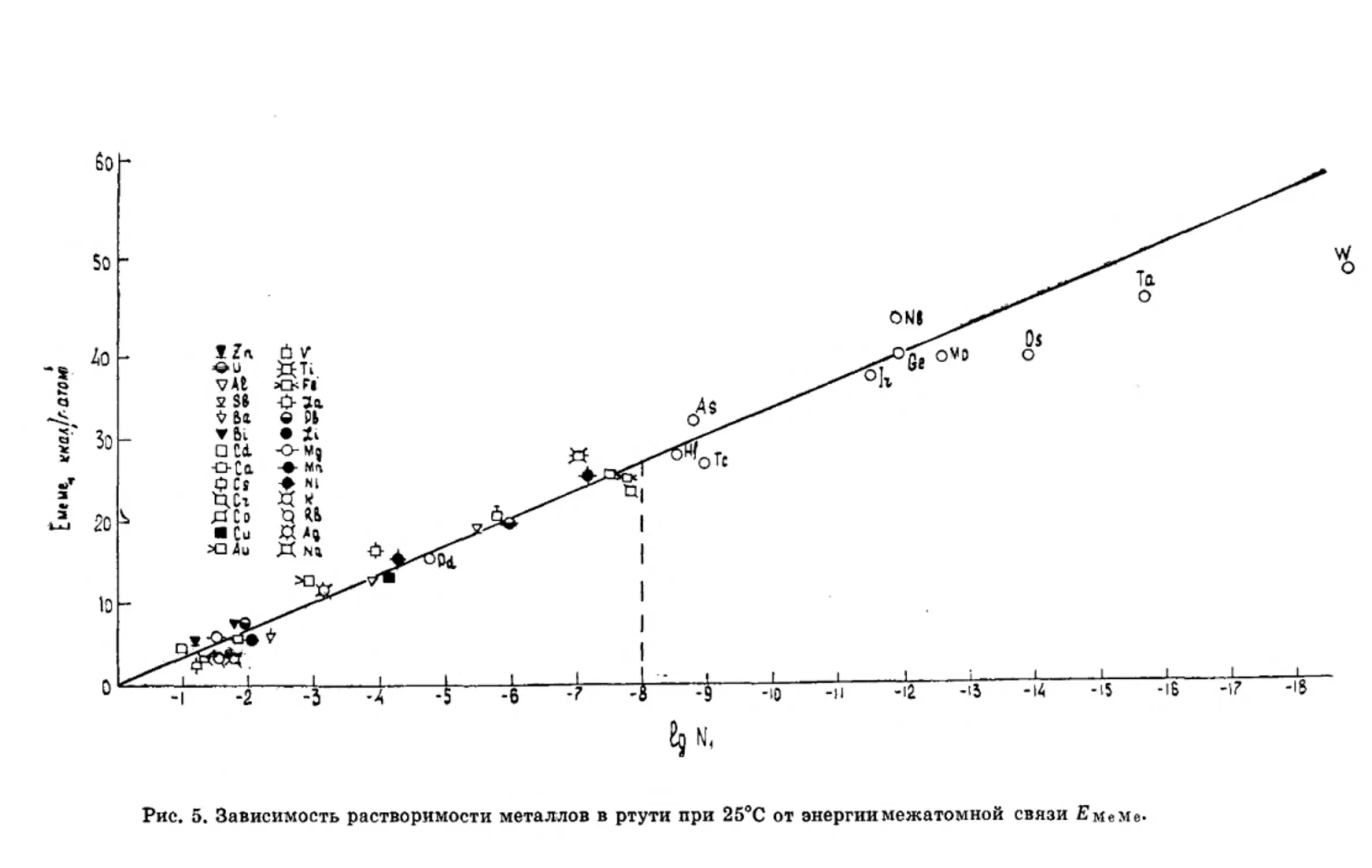
На рисунке 5 приведена зависимость растворимости ме-
таллов в ртути от энергии межатомной связи £меме кри-
сталлической решетки металла. На кривую растворимости
В координатах ЯмеМе —lg до пунктирной линии при
lg Ni = —8 нанесены экспериментальные значения раство-
римости металлов в ртути, которые хорошо соответствуют
прямой. К числу таких металлов относятся Cd, Zn, Bi, Pb,
Cu, Ni, Fe, Ag, Au, Cs, Na, Be, Al, V, Ti и др. Правее пунк-
тирной линии нанесены расчетные значения растворимости
в ртути тех металлов и элементов, экспериментальные зна-
чения которых неизвестны. Расчет проводили по уравнению
In V = — Дв1,39- _ (бпл/Г-бпл/Тп)1’39
1 1,896 1,896 ’
предложенному в работе [2] для определения вероятной
растворимости металлов в ртути с границей доверительных
пределов 0,95. Как видно, расчетные значения растворимо-
сти As, Тс, 1г, Nb, Ge, Mo, Os, Та и W закономерно продол-
жают ход прямой, соответствующей экспериментально опре-
деленным значениям.
Таким образом, наблюдается очень четкая зависимость
растворимости металлов в ртути от величины энергии межа-
томной связи 2?мем© кристаллической решетки металла.
Металлы, имеющие малое значение энергии межатомной
связи £меме и, следовательно, непрочную кристаллическую
решетку, обладают высокой растворимостью в ртути. По ме-
ре увеличения £?Меме атомов кристаллической решетки рас-
творимость металлов в ртути уменьшается. Анализ экспери-
ментальных данных показывает, что растворимость металла
в ртути при 25°С связана с энергией межатомной связи в ме-
талле следующей функциональной зависимостью:
24
. -^МеМе
Ig ^=—X.-——-
f
и
где х — постоянная, равная 0,414.
По этим двум уравнениям можно рассчитать вероят-
ную растворимость металлов в ртути при 25°С. Для расчета
этой величины в широком интервале температур необходимо
учитывать изменение теплоемкости и координационных
чисел металлов при повышении температуры. Поэтому вы-
явление функциональных зависимостей растворимость —
физико-химическое свойство металлов и установление корре-
ляционных уравнений для определения растворимости в рту-
ти расчетным путем всех элементов периодической системы
Д. И. Менделеева является важной йроблемной задачей
амальгамной металлургии [21].
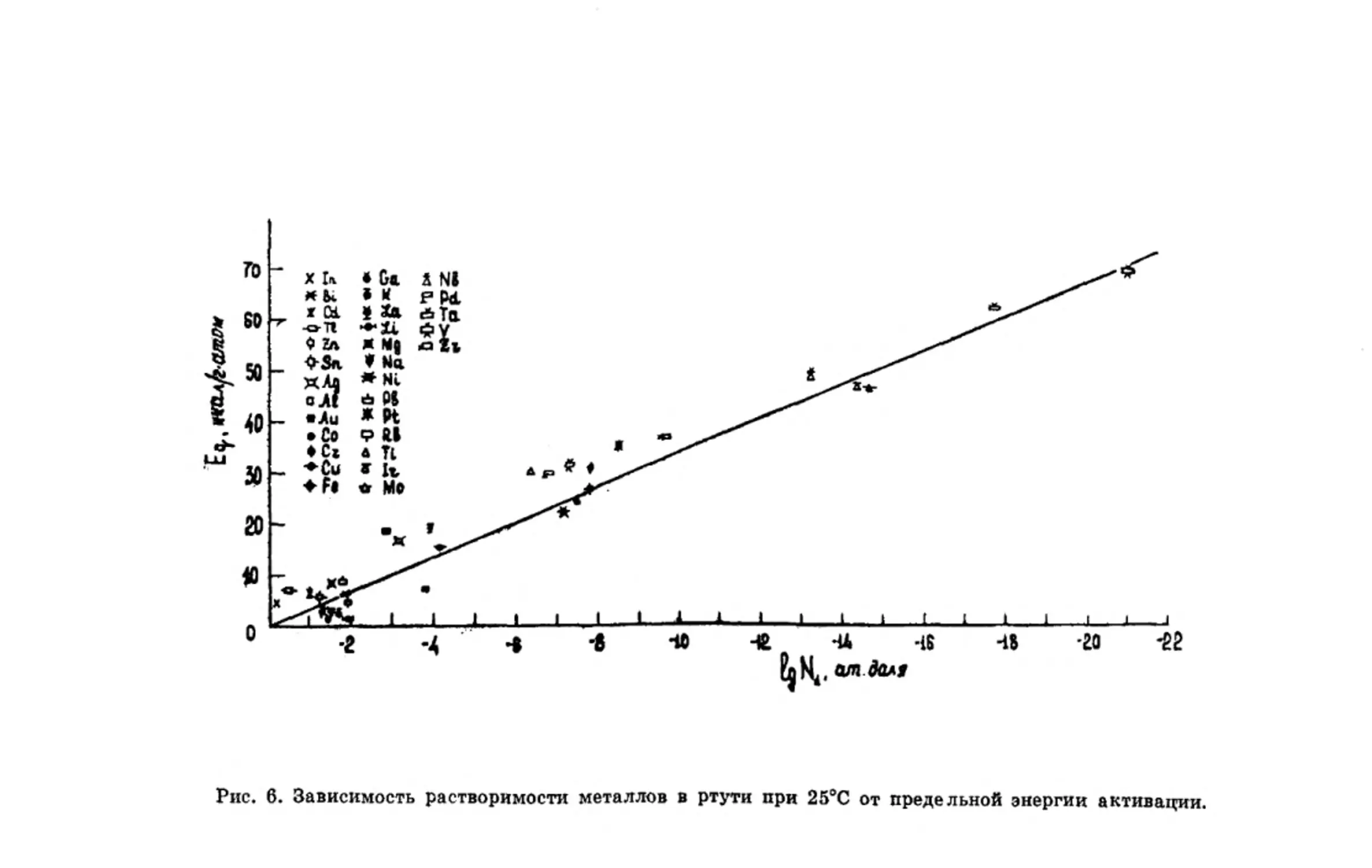
Растворение металлов в ртути связано, как отмечалось
выше, с разрушением кристаллической решетки металла [2].
Для характеристики различных процессов в твердых метал-
лах в работах [38, 39] были развиты представления о пре-
дельных значениях энергии активации Eq. По данным [38,
39], Eq представляет собой предельное состояние устойчи-
вости атомов в кристалле. В частном случае разрушения
кристаллической решетки металла Eq будет характеризо-
вать критическое состояние кристаллической решетки или
переход твердой фазы металла в жидкую. Значение Eq на-
ходится в определенной связи с теплотой активации АН:
АН — nEq,
где п^1 зависит от типа кристаллической решетки металла
и отвечает числу одновременно активируемых атомов в
группе.
При растворении металлов в ртути взаимодействие ком-
понентов протекает на межатомном уровне (п = 1), поэтому
должна существовать определенная зависимость раствори-
мости от величины Eq. Эта зависимость иллюстрируется ри-
сунком 6.
Значения Eq рассматриваемых металлов заимствованы
нами из работ [38, 39]. Как видно из рисунка 6, раствори-
• мость металла в ртути находится в определенной функцио-
нальной зависимости от величины предельной энергии акти-
вации. Чем -больше значение Eq металла, тем он менее рас-
творим в ртути. Анализ рисунка б и данных работ [38, 39]
показывает, что металлы с прочной кристаллической решет-
кой имеют высокие значения Eq. Обращает на себя внима-
25
Ge °v°
Рис. 5. Зависимость растворимости металлов в ртути при 25°С от энергии межатомной связи ЕмеМе>
Рис. 6. Зависимость растворимости металлов в ртути при 25°С
от предельной энергии активации.
ние тот факт, что зависимость Eq —lg Ni подобна зависимо-
сти ЕмеМе—lg N (ср. рис. 5 И 6). СлвДОВаТвЛЬНО, Eq И ЕмеМе^
характеризуют прочность кристаллической решетки метал-
ла, а растворение металла в ртути связано с разрушением
межатомной связи в кристаллической решетке металла
Me—Me. В работе [38] было показано, что значения Eq яв-
ляются периодической функцией атомного номера элемента.
Поэтому установленная нами связь Eq с величиной раство-
римости металлов в ртути закономерна.
Известно, что прочность кристаллической решетки ме-
талла находится в определенной связи и с величиной его по-
верхностной энергии, которая характеризует поверхностную
и объемную плотность когезионных сил сцепления. Пола-
гают, что прочность пропорциональна корню квадратному
из величины поверхностной энергии металла [40]. Посколь-
ку растворение металлов в ртути связано с разрушением ме-
жатомной связи металла Me—Me и преодолением когезион-
ных сил сцепления, то должна существовать определенная
функциональная зависимость между поверхностной энер-
гией металлов о и величиной растворимости их в ртути. Для
построения зависимости lg Nj—о были использованы экспе-
риментальные значения поверхностной энергии, приведен-
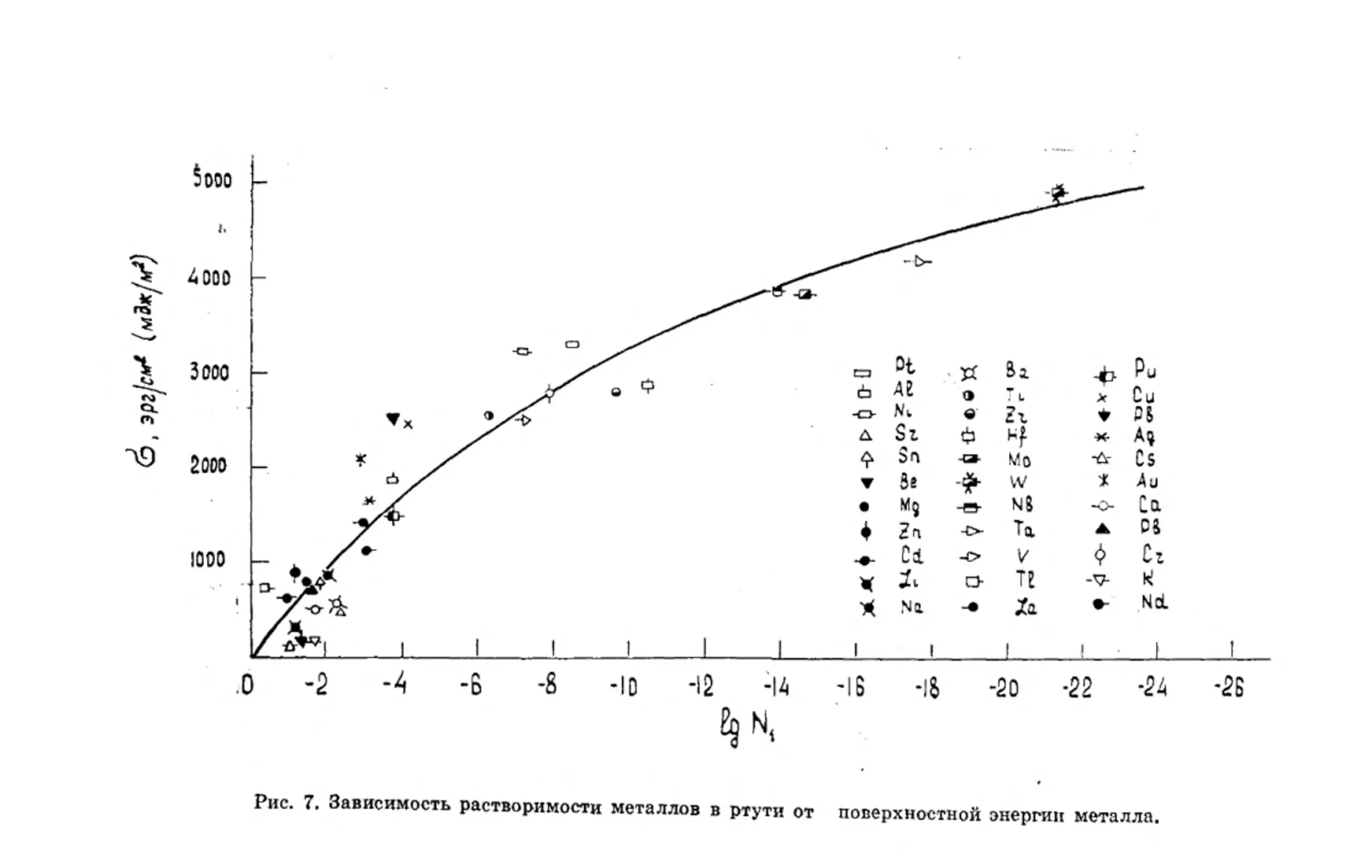
ные в работе [41]. Из рисунка 7 видно, что между величиной
поверхностной энергии металла и его растворимостью в рту-
ти существует отчетливо выраженная зависимость: чем вы-
ше поверхностная энергия ^металла, т. е. чем больше энергия
сил когезионного сцепления, тем меньше растворимость ме-
талла в ртути. И наоборот, металлы с низкой поверхностной
энергией хорошо растворимы в ртути.
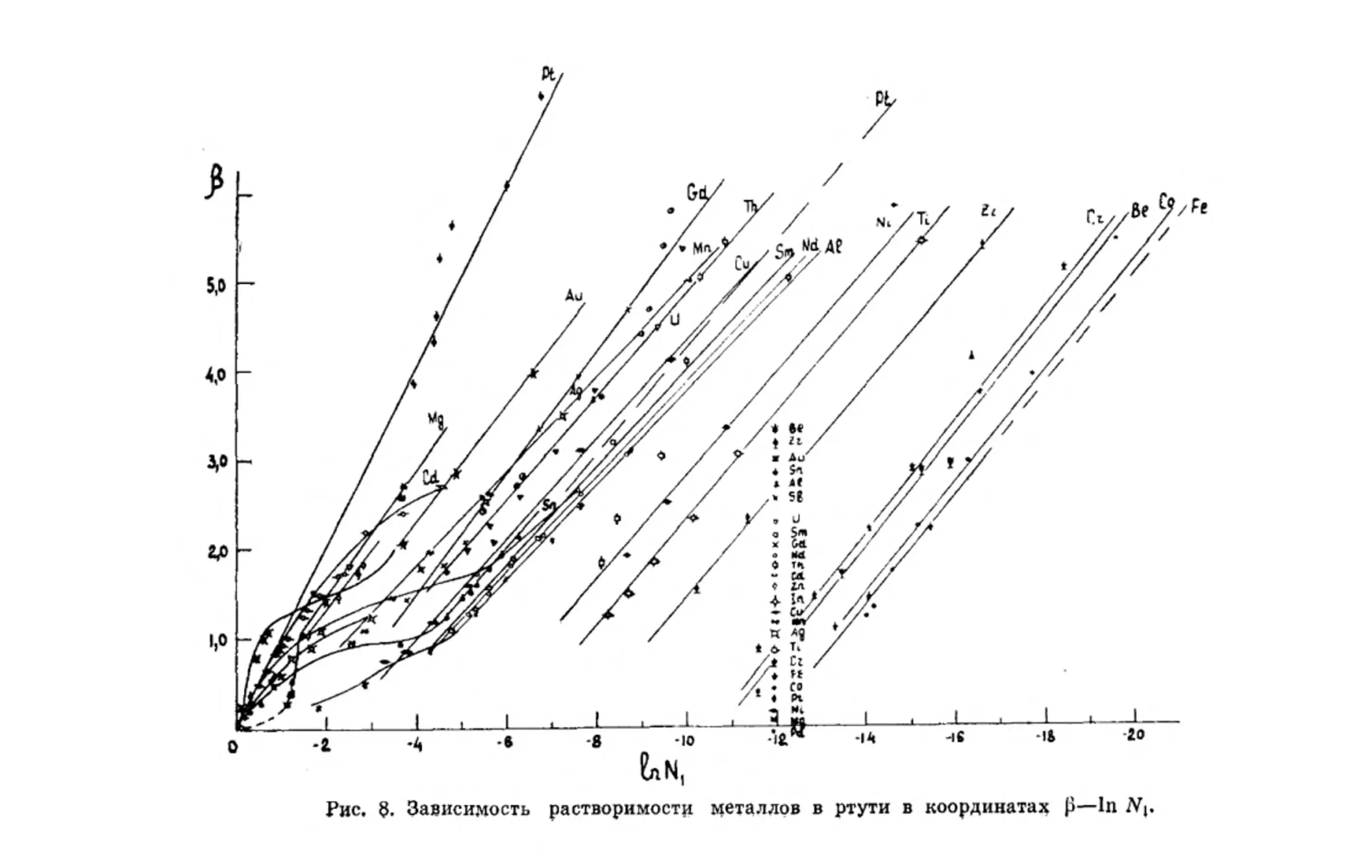
Сопоставим ход кривых реальной растворимости метал-
лов с идеальной кривой, рассчитанной по уравнению
И. Ф. Шредера в координатах (3—In Ni (где р = —
Как видно из рисунка 8, кривые растворимости металлов в
ртути в координатах р—InJVi имеют в области разбавлен-
ных амальгам практически одинаковый наклон и, за исклю-
чением Th, Мп, Gd и Pt, параллельны друг другу. Раствори-
мость платины в ртути близка к идеальной.
По нашему мнению, данные для системы Pt—Hg, удов-
летворяющей уравнению И. Ф. Шредера, ошибочны. В систе-
ме Pt—Hg образуется ряд интерметаллических соединений:
PtHg, PtHg2 и PtHg3 [42, 43].
Следует отметить, что кривые реальной растворимости
не параллельны кривой идеальной растворимости. Разность-
In N** Hg—In Ni уменьшается с повышением температуры-
28
.0 -2 -4 -8 -8 -Ю -12 -14 -16 -IS -20 -22 -24 -26
И
Рис. 7. Зависимость растворимости металлов
в ртути от поверхностной энергии металла.
Рис. Зависимость растворимости металлов в ртути в координатах р—In
Следовательно, в этом случае коэффициенты активности ме-
таллов в ртути уменьшаются (см. уравнение (I—22)). Так,
коэффициент активности железа в амальгаме при 25°С равен
4,4 106 (у! = -ут—), а при 350°С — 4,6 -105, т. е. уменьшается
в 9,5 раза2. Особенно сильное изменение хода кривых р—
In N\ наблюдается в области температур, близких к темпера-
туре плавления металла, когда система приближается к пол-
ной взаимной растворимости компонентов.
Прямолинейность кривых р—InNj в широком интерва-
ле температур, особенно для металлов, трудно растворимых
Таблица 2
Зависимость растворимости металлов в ртути (ат. %)
от температуры
Элемент Температура, °C
26 100 200 350
Индий 70,3 83,7 н/р н/р
Таллий 43,7 56,1 75,9 н/р
Кадмий 10,1 31,9 66,7 н/р
Цинк 6,4 22,0 44,1 81,87
Свинец 1,9 17,9 63,1 н/р
Висмут 1,6 25,0 68,9 н/р
Олово 1,2 29,8 83,8 н/р
Галлий 3,6 6,8 43,5 н/р
Магний 3,0 9,07 22,31 28,08
Золото 0,13 0,60 2,47 26,18
Серебро 0,078 0,41 1,75 10,86
Алюминий 1,5-10" 2 8,9-10" 2 0,50 3,0
Уран 3,10-10"3 2,56-10"2 0,18 1,11
Неодим 9,90-10"3 4,53-10“ 2 0,21 0,82
Гадолиний 4,87-10"3 5,53-10~2 0,22 2,87
Самарий 6,44-10-3 5,53-10"2 0,21 0,82
Марганец 3.71-10-3 4,62-10"2 0,32 2,24
Торий 1,36-Ю-з 4,54-Ю-з 1,09-Ю"2 5,26-10" 2
Медь 7,42-10-3 3,71-Ю"2 0,18 0,94
Никель 1,52-10—6 1,70-10—4 Л 1,23-10"г
Титан 2,05-10-6 9,19-10-5 6,15-Ю"4 7,12-Ю"8
Цирконий 2,27-10-3 1,86-10-5 1,8 5-Ю"4 9,17-Ю"4
Хром 6,19-10—7 4,58-10- -? 2,27-10—5 9,12-10"®
Бериллий 2,67-10-7 2,05-10^-5 6,18-10—5 1,85-Ю"4
Кобальт 1,13-10-7 1,46-Ю-з 1,6 8-10—5 3,93-10"®
Железо 1,03-10-7 9,24-10-7 6,17-10-6 2,91-Ю"5
Платина 3,10-10-7 6,79-10—4 7,48 -10-3 5,53
Примечание. Н/р — неограниченно растворим.
2 Значения коэффициентов активности других металлов, рассчитан-
ные по уравнению (I—19), приведены в главе IIL
31
в ртути, может быть использована для определения точной
растворимости металла в ртути при различных температурах
графическим путем. В таблице 2 приведены наиболее досто-
верные значения растворимости, определенные из экспери-
ментальных данных в координатах р—InJVi для 25, 100,
200 и 350°С. Как видно, наименьшей растворимостью в рту-
ти обладают железо, кобальт, хром, цирконий. Раствори-
мость бериллия в ртути при 25°С составляет 2,67-Ю"7 ат. %.
При определении температурной зависимости растворимости
платины в ртути нами была использована расчетная раство-
римость платины в ртути. На наш взгляд, часто приводимая
в литературных источниках растворимость платины в ртути
(0,102 ат. % при 24°С) завышена и нуждается в проверке.
Растворимость платины в ртути в очень большой степени
зависит от температуры и при 350°С должна составить
5,53 ат.%. Значения растворимости редкоземельных метал-
лов в ртути, по-видимому, несколько занижены по сравне-
нию с экспериментальными данными [44], которые хорошо
согласуются с результатами наших расчетов [2, 21].
Следует отметить, что графический метод определения
растворимость металлов в ртути в координатах £—In Ni
очень надежен. Нами были сопоставлены растворимости ме-
таллов, определенные графически и установленные экспери-
ментально с высокой точностью для меди, золота, марганца,
серебра. Получено очень хорошее совпадение значений рас-
творимости металлов в ртути.
РАСТВОРИМОСТЬ РТУТИ В МЕТАЛЛАХ
Известно, что на взаимную растворимость металлов и
кристаллическую структуру образующихся сплавов решаю-
щее влияние оказывают относительная величина атомов, ва-
лентность и электроотрицательность. В настоящее время
установлено, что все металлы проявляют некоторую раство-
римость в твердом состоянии [45—47]. Величина раствори-
мости металлов друг в друге зависит от их физико-химиче-
ских свойств. Так, при большом различии в атомных разме-
рах, превышающем примерно 14—15%, требуется большая
энергия для внедрения более крупного атома металла в кри-
сталлическую решетку и ее искажения, что приводит к огра-
ниченной растворимости в твердом состоянии. Если же раз-
мерный фактор отличается на ±8%, то он является благо-
приятным для образования непрерывного ряда твердых
растворов. В этом случае размерный фактор имеет уже вто-
ростепенное значение, и общая величина растворимости в
твердом состоянии будет определяться другими факторами.
-32 • •
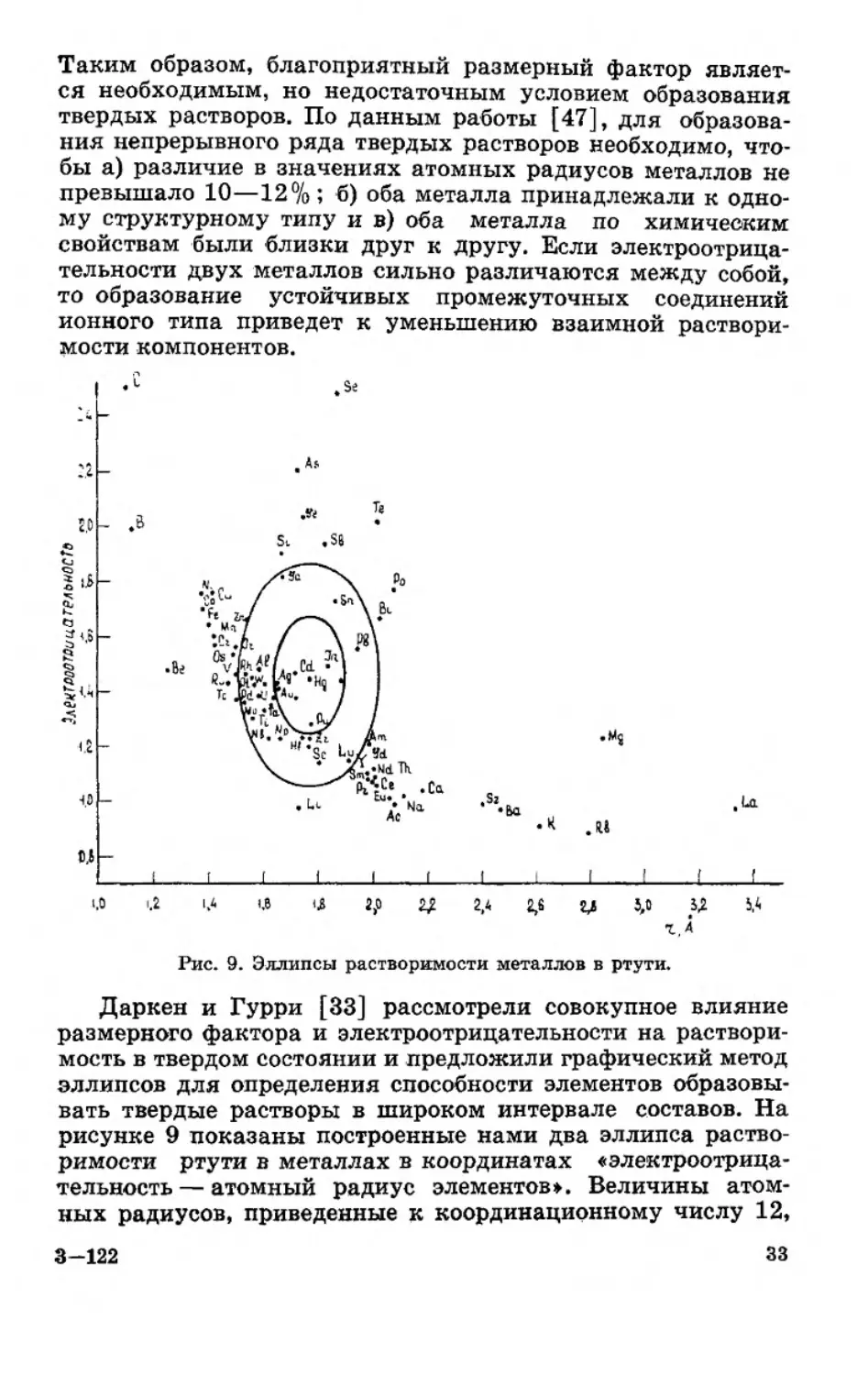
Таким образом, благоприятный размерный фактор являет-
ся необходимым, но недостаточным условием образования
твердых растворов. По данным работы [47], для образова-
ния непрерывного ряда твердых растворов необходимо, что-
бы а) различие в значениях атомных радиусов металлов не
превышало 10—12%; б) оба металла принадлежали к одно-
му структурному типу и в) оба металла по химическим
свойствам были близки друг к другу. Если электроотрица-
тельности двух металлов сильно различаются между собой,
то образование устойчивых промежуточных соединений
ионного типа приведет к уменьшению взаимной раствори-
мости компонентов.
Рис. 9. Эллипсы растворимости металлов в ртути.
Даркен и Гурри [33] рассмотрели совокупное влияние
размерного фактора и электроотрицательности на раствори-
мость в твердом состоянии и предложили графический метод
эллипсов для определения способности элементов образовы-
вать твердые растворы в широком интервале составов. На
рисунке 9 показаны построенные нами два эллипса раство-
римости ртути в металлах в координатах «электроотрица-
тельность— атомный радиус элементов». Величины атом-
ных радиусов, приведенные к координационному числу 12,
3-122
зз
взяты из работы [48], а электроотрицательности по Оллре-
ду— Рохову — из [49]. По Даркену и Гурри, большая ось
внутреннего эллипса равна ±0,2 единицы электроотрица-
тельности, а малая ось этого эллипса соответствует разности
атомных радиусов металлов ±8%. Металлы, попадающие
внутрь эллипса, должны образовывать твердые растворы в
широком интервале составов. Как видно из рисунка 9, в ма-
лый эллипс попали следующие металлы: индий, таллий,
кадмий, серебро, золото и плутоний. Действительно, индий,
таллий, кадмий, серебро и золото образуют в широком ин-
тервале составов твердые растворы ртути (In—12,6, 0-Т1 —
18, Cd—21,5, Ag—36,5, Au—16 ат. % ртути). Растворимость
ртути в плутонии не изучалась. Плутоний образует с ртутью
два интерметаллических соединения: PuHg3 и PuHg4. Боль-
шой эллипс построен для анализа поведения металлов с
неблагоприятными физико-химическими характеристиками
для образования непрерывного ряда твердых растворов.
Большая ось эллипса равна ±0,4 единицы электроотрица-
тельности, а малая ось соответствует разности атомных ра-
диусов ±15%. Металлы, располагающиеся внутри большого
эллипса, должны обладать ограниченной растворимостью
(не более 5 ат.%). В элементах же, располагающихся за пре-
делами большого эллипса, ртуть не растворима. Как видно
из рисунка 9, в большом эллипсе располагаются свинец,
платина и палладий — металлы, обладающие склонностью
образовывать широкие области твердых растворов ртути
(РЬ—23 ат.% [50], Pt-—18,5-^23 [24], Pd—13,8 [51]). Цинк
образует ограниченную область твердых растворов с ртутью
(~3 ат. % Hg) [24]. Ртуть в олове растворима весьма огра-
ниченно (<0,1 ат.%) [24, 52—55]. Галлий в большом
эллипсе располагается на его границе. Следовательно, мож-
но ожидать ограниченную растворимость ртути в твердом
галлии. По данным [56], растворимость ртути в жидком
галлии при 27,7 и 100°С соответственно равна 4,0 и 8,0 ат.%.
Растворимость ртути в уране, по [24], мала. Уран с ртутью
образует ряд интерметаллических соединений: UHg4, UHg3,
UHg2 [24, 57]. Атомный радиус урана, по [58], равен 1,56 А.
Это, очевидно, наиболее достоверная величина. Поскольку
кристаллическая структура урана и ртути одинакова, а соот-
ношение атомных радиусов благоприятно для образования
неограниченного ряда твердых растворов, то остается пред-
положить, что значение электроотрицательности урана нуж-
дается в уточнении3.
3 Если уран в интерметаллических соединениях с ртутью проявляет
валентность 3, то значение электроотрицательности его будет меньше
единицы.
34
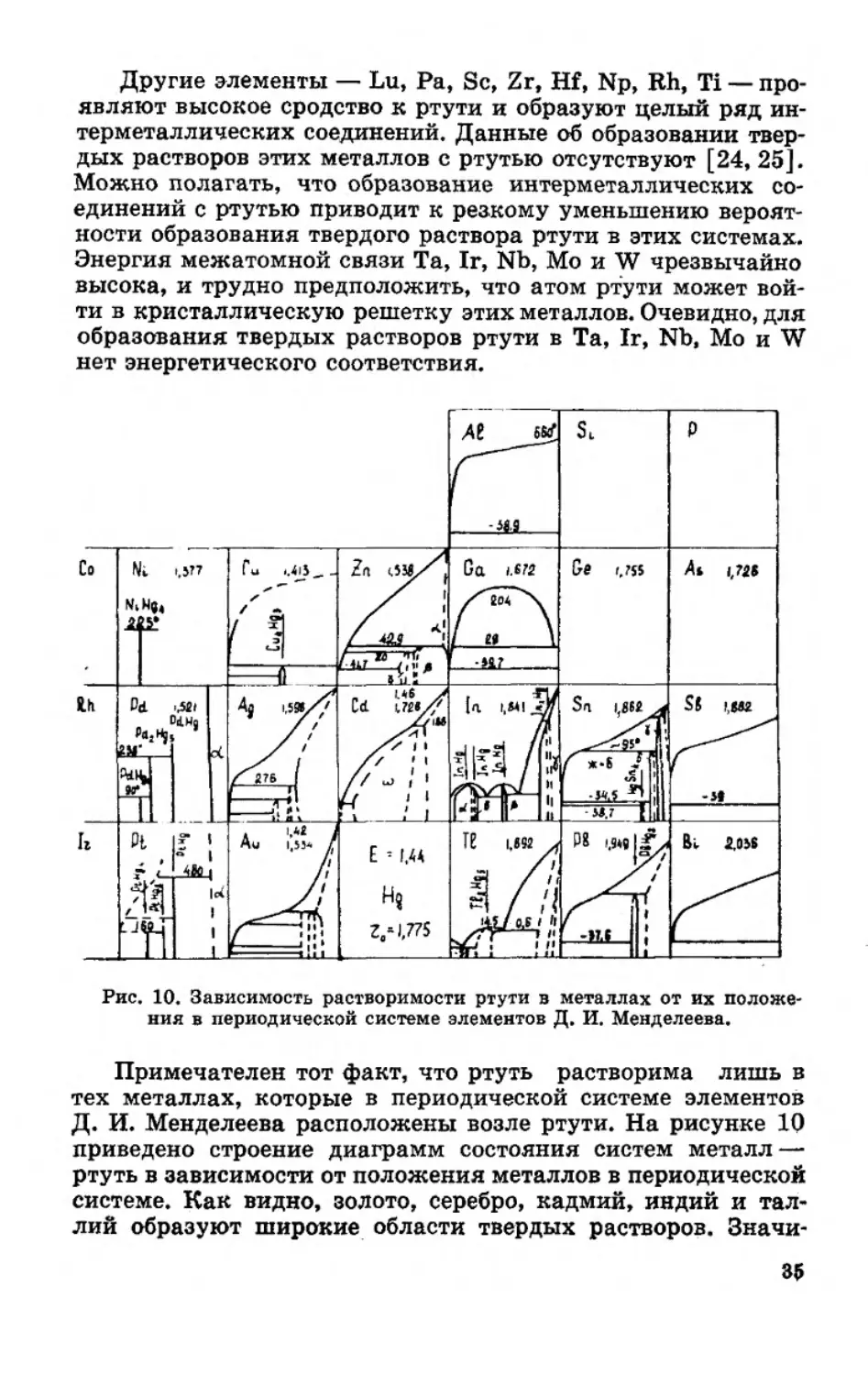
Другие элементы — Lu, Ра, Sc, Zr, Hf, Np, Rh, Ti — про-
являют высокое сродство к ртути и образуют целый ряд ин-
терметаллических соединений. Данные об образовании твер-
дых растворов этих металлов с ртутью отсутствуют [24, 25].
Можно полагать, что образование интерметаллических со-
единений с ртутью приводит к резкому уменьшению вероят-
ности образования твердого раствора ртути в этих системах.
Энергия межатомной связи Та, 1г, Nb, Мо и W чрезвычайно
высока, и трудно предположить, что атом ртути может вой-
ти в кристаллическую решетку этих металлов. Очевидно, для
образования твердых растворов ртути в Та, Ir, Nb, Мо и W
нет энергетического соответствия.
Рис. 10. Зависимость растворимости ртути в металлах от их положе-
ния в периодической системе элементов Д. И. Менделеева.
Примечателен тот факт, что ртуть растворима лишь в
тех металлах, которые в периодической системе элементов
Д. И. Менделеева расположены возле ртути. На рисунке 10
приведено строение диаграмм состояния систем металл —
ртуть в зависимости от положения металлов в периодической
системе. Как видно, золото, серебро, кадмий, индий и тал-
лий образуют широкие области твердых растворов. Значи-
35
тельная растворимость ртути наблюдается в свинце и пла-
тине, заметная — в цинке (3 ат.%) [24] и палладии
(13,8 ат. %) [51]. Растворимость ртути в олове, как отмеча-
лось выше, весьма ограниченна [24, 52—55]. Что касается
растворимости ртути в меди, то исходя из положения в пе-
риодической системе элементов Д. И. Менделеева и ее физи-
ко-химических свойств следует полагать, что ртуть в меди
не растворяется. Данные о растворимости ртути в меди про-
тиворечивы [24]. Расположенные по диагонали по отноше-
нию к ртути германий и никель (на рис. 9 они находятся за
пределами большого эллипса) практически не растворимы в
ртути (меньше 2- 10"бвес.% при 25°С) и не образуют с ней
твердых растворов.
Анализ зависимости растворимости ртути в металлах от
их положения в периодической системе показывает, что
здесь отчетливо проявляется явление вторичной периодич-
ности.
В остальных элементах периодической системы, распо-
ложенных за пределами большого эллипса, ртуть не раство-
рима. Элементы, обладающие электроотрицательностью
^1,9, не только не растворяют ртуть, но вследствие кова-
лентного характера межатомной связи и не амальгамируют-
ся ртутью (Se, С, As, Ge, Те, Si, Sb, В) [1, 2]. Элементы, с
электроотрицательностью 1,25 и неблагоприятными атом-
ными размерами атомных радиусов Дго2^8% (Y, Gd, Sm, Nd,
Pr, Се, Eu ... К, Rb, Mg, La) проявляют высокое сродство к
ртути (электрохимический фактор) и образуют интерметал-
лические соединения ионного типа4. Эти элементы также не
образуют даже ограниченных твердых растворов с ртутью.
На наш взгляд, редкоземельные элементы, расположенные
за пределами большого эллипса, щелочноземельные и ще-
лочные металлы (см. рис. 9) не растворимы в твердой ртути.
Предположение [45] о том, что щелочные, щелочноземель-
ные, редкоземельные металлы и иттрий должны обладать
растворимостью в твердой ртути, близкой к ^0,1 вес.%,
противоречит современной теории твердых растворов и, по
нашему мнению, нуждается в тщательной эксперименталь-
ной проверке другими методами.
4 Соединения ионного типа существуют в очень узких интервалах
состава, обычно соответствующего стехиометрическому отношению реа-
гирующих компонентов. Образование соединений MeHgx ионного типа
сопровождается значительным изменением изобарно-изотермического по-
тенциала и выделением большого количества тепла. Поэтому данные
соединения слабодиссоциированы и находятся в ртутной фазе в виде
структурных групп интерметаллических соединений [59, 60].
36
НЕСМЕШИВАЕМОСТЬ РТУТИ И МЕТАЛЛОВ В
ЖИДКОМ СОСТОЯНИИ
В системах металл — ртуть, как правило, наблюдается
интенсивное межатомное взаимодействие металлов друг с
другом. Лишь несколько металлов не образуют интерме-
таллические соединения с ртутью (железо, кобальт, тантал,
вольфрам, ниобий, алюминий, сурьма, висмут, бор, галлий
и др.). Причем галлий не смешивается с ртутью, даже бу-
дучи расплавленным. Взаимная растворимость наблюдается
лишь при перегреве примерно на 176°С выше температуры
плавления галлия. Возможно, и другие металлы образуют
несмешивающиеся системы с ртутью. По данным [61], пол-
ную смешиваемость жидких металлов нужно ожидать в
том случае, если справедливо неравенство
32)2<2RT, (1-27)
О
где Vi и V2 — атомные объемы соответственно компонентов
Mei и Мег; 61 и 62— параметры растворимости этих компо-
нентов, которые рассчитывают по уравнению
81(2)=
П(2)/ ’
(1-28)
где ДЕ1 — теплота испарения компонента Mei; V\ — его
атомный объем.
Смешивание наблюдается тогда, когда энергия в левой
части уравнения (I—27) (т. е. теплота смешения при образо-
вании идеальных растворов) меньше 2RT. Для амальгам мо-
лярные объемы металлов равны приблизительно 20—25 см3
и, следовательно, 1/2 (ТЛ + Уг)^12. В соответствии с этим
для амальгам, следуя Гильдебранду и Скотту, можно ожи-
дать полную взаимную растворимость при разности пара-
метров растворимости (б i—62) меньшей, чем 10 кал1/2 [смг!2
при 25°С, равной приблизительно 15 кал112 при
350°С. Полная взаимная растворимость наблюдается при
350°С лишь для немногих металлов: индия, таллия, свинца,
олова, висмута, галлия, цинка, кадмия, щелочных и некото-
рых щелочноземельных металлов. Для остальных металлов
разность параметров растворимости превышает эти значения
в десятки раз.
При анализе взаимной растворимости металлов в 529 би-
нарных системах в жидком состоянии Мотт [62] обнаружил,
что с помощью критерия Гильдебранда и Скотта [61] (урав-
нение (I—27)) можно объяснить смешиваемость только в 312
системах (59%). Авторы [61] полагали, что силы сцепления
37
в растворе имеют вандерваальсовский характер и избыточ-
ный изобарно-изотермический потенциал раствора может
быть рассчитан по уравнению
ДНСМ«УСМ(^—В2)2Ф1Ф2. (1—29)
где Vе"* — молярный объем раствора; Ф1 и Ф2 — «объемные
доли» компонентов; Ф,= NiV|+NgV>; &2=
Анализируя обширный экспериментальный материал по
строению диаграмм состояния, Мотт [62] заметил, что если
компоненты в бинарной системе имеют тенденцию к образо-
ванию связей в растворе Mei—Ме2, то при возникновении
нескольких «связей» вероятность несмешиваемости умень-
шалась. Количество возникших связей можно определить с
помощью уравнения
23060(£П1-.Еп/ ’
где Еп, и ЕП1 — электроотрицательности, эв.
Если fe<2, то металлы должны смешиваться в любых
соотношениях, а при k >6 нужно предполагать несмешивае-
мость. Для металлических систем с 2<й<6 смешиваемость
зависит от размерных факторов — величины атомов компо-
нентов Mei и Ме2. При учете значений k из 529 была пра-
вильно предсказана смешиваемость в 443 случаях (80%).
Очевидно, при й = 0, когда межатомные связи не обра-
зуются, смешиваемость будет наблюдаться лишь при высо-
ких температурах. Примером таких систем являются сурь-
ма — ртуть, германий — ртуть, алюминий — ртуть и др.
Ковалентный характер межатомной связи в этих металлах
является причиной их смешиваемости лишь при высоких
температурах, когда наблюдается разрушение ковалентной
насыщенной связи и образование ненасыщенной связи —
металлической. Особенно показательным в этом отношении
является отношение сурьмы к ртути (рис. 10). Относитель-
ная доля металлической связи в сурьме равна 17,7% [1].
Увеличением доли металлической связи в кристаллической
твердой сурьме при повышении температуры и объясняется
значительная растворимость сурьмы в ртути лишь при высо-
ких температурах (при 100, 200, 300 и 400°С — соответст-
венно 1,6 IO-2, 8 10-2, 8,1-10-1 и 15,4 ат.% [63]).
Дальнейшее развитие теория несмешиваемости металлов
в жидком состоянии [61, 62] получила в работах [64—67],
в которых была развита квазихимическая теория, позволяю-
щая определять характер межчастичного взаимодействия
38
Таблица 3
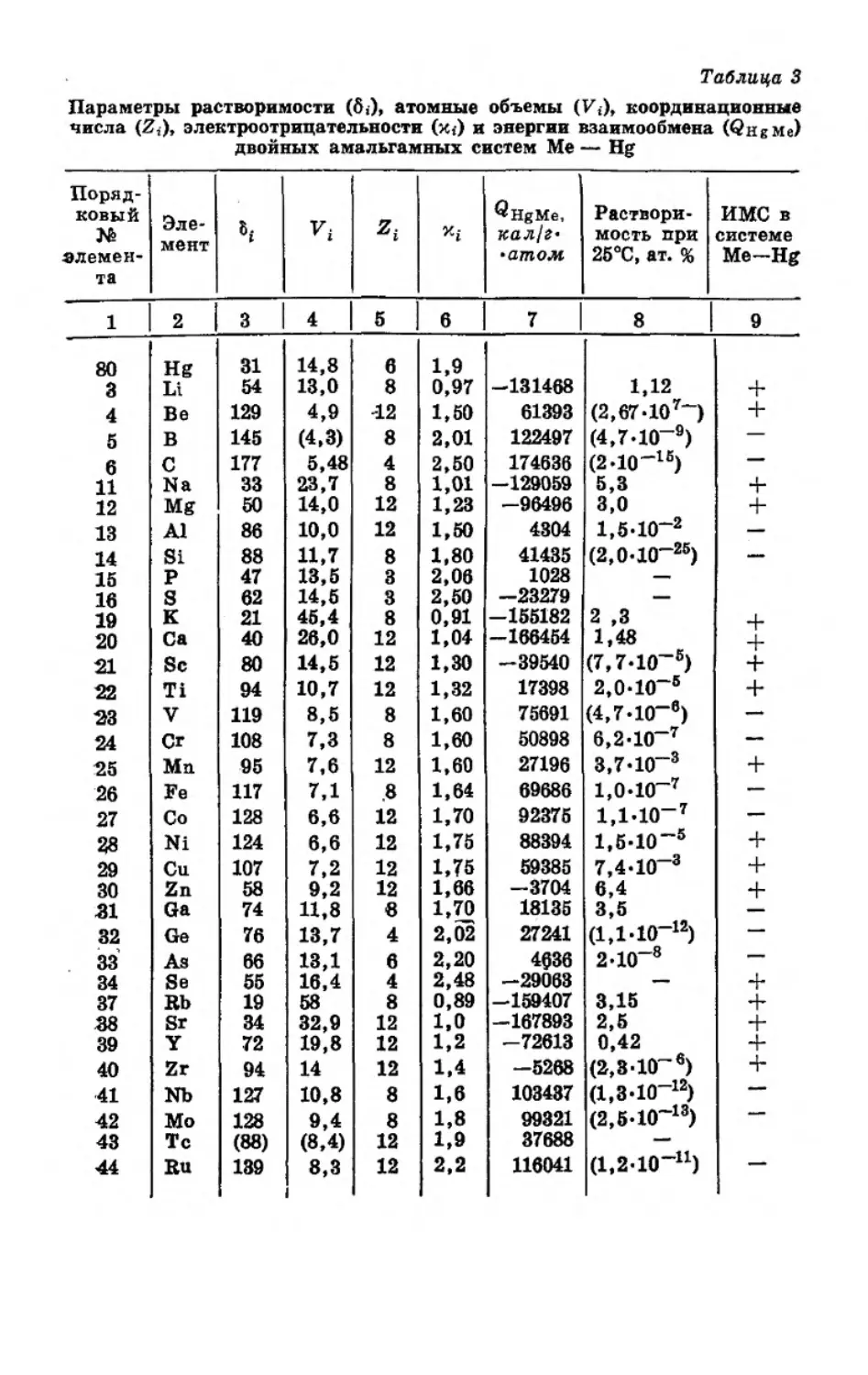
Параметры растворимости (6,), атомные объемы (Vt), координационные
числа (Zi), электроотрицательности (х») и энергии взаимообмена (QngMe)
двойных амальгамных систем Ме — Hg
Поряд- ковый № элемен- та Эле- мент Vi *1 кал[г* •атом Раствори- мость при 25°С, ат. % ИМС в системе Me—Hg
1 2 3 4 5 6 7 8 9
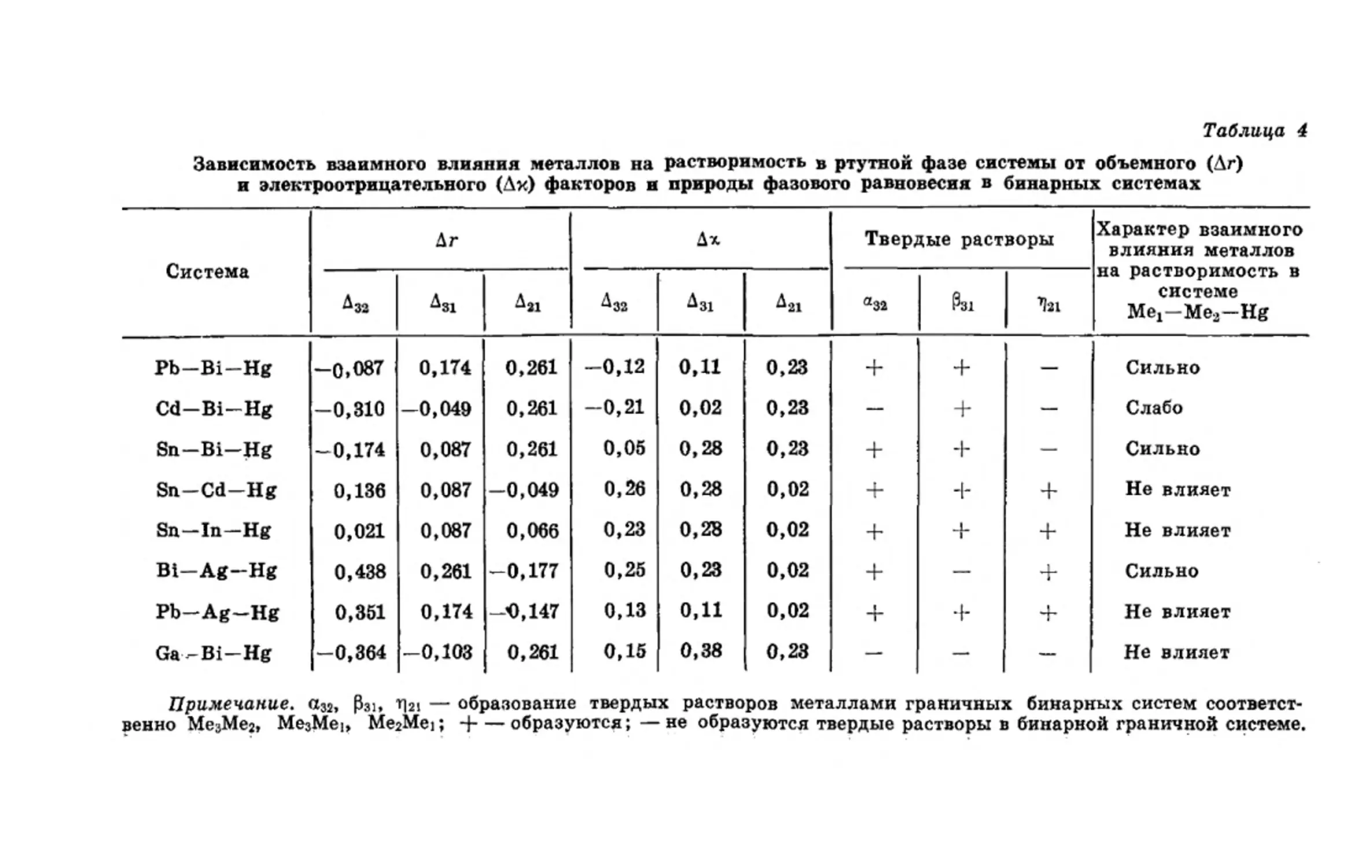
80 8 Hg Li 31 54 14,8 13,0 6 8 1,9 0,97 —131468 1,12 ^1^
4 Be 129 4,9 -12 1,50 61393 (2,67-107“)
5 В 145 (4,3) 8 2,01 122497 (4,7-10“ 9)
6 С 177 5,48 4 2,50 174636 (2-10“1Е)
11 Na 33 23,7 8 1,01 -129059 5,3
12 Mg 50 14,0 12 1,23 -96496 3,0
13 Al 86 10,0 12 1,50 4304 1,5-Ю-2 —
14 Si 88 11,7 8 1,80 41435 (2,0-10-2б)
15 P 47 13,5 3 2,06 1028 —•
16 S 62 14,5 3 2,50 -23279 —
19 К 21 45,4 8 0,91 -155182 2 ,3
20 Ca 40 26,0 12 1,04 -166454 1,48 —1 "
21 Sc 80 14,5 12 1,30 -39540 (7,7-10- Б)
Ti 94 10,7 12 1,32 17398 2,0-10-6
23 V 119 8,5 8 1,60 75691 (4,7-10-®) —*
24 Cr 108 7,3 8 1,60 50898 6,2-10“ 7
25 Mn 95 7,6 12 1,60 27196 3,7-10“3 —
26 Fe 117 7,1 .8 1,64 69686 1,0-10“7 —
27 Co 128 6,6 12 1,70 92375 1,1-10“7 ——
28 Ni 124 6,6 12 1,75 88394 1,б-10“5 ——
29 Cu 107 7,2 12 1,75 59385 7,4-10“3 —1—
30 Zn 58 9,2 12 1,66 -3704 6,4
21 Ga 74 11,8 8 1,70 18135 3,5 —
32 Ge 76 13,7 4 2,02 27241 (1,1-10“12) —
33 As 66 13,1 6 2,20 4636 2-10“8
34 Se 55 16,4 4 2,48 -29063 —
37 Rb 19 58 8 0,89 -159407 3,15
38 Sr 34 32,9 12 1,0 -167893 2,5
39 "Y 72 19,8 12 1,2 -72613 0,42
40 Zr 94 14 12 1.4 -5268 (2,3-10“®)
41 Nb 127 10,8 8 1.6 103437 (1,3-10“х2) —
42 Mo 128 9,4 8 1,8 99321 (2,5-10“13)
43 Tc (88) (8,4) 12 1,9 37688
44 Ru 139 8,3 12 2,2 116041 (1,2-10“11) —
Окончание таблицы 3
1 2 3 4 5 6 7 8 9
45 Rh 129 8,3 12 2,2 92248 (1,0-10-8) 1 1
46 Fd 102 8,9 12 1,8 57660 (1,8-Ю-5)
47 Ag 82 10,3 12 1,9 36642 7,8-Ю- 2
48 Cd 45 13,0 12 1,7 -5577 10,1
49 In 60 15,7 12 1,53 -16330 70,3
50 Sn 65 16,3 6 1,72 13596 1,21 +
51 Sb 59 18,2 6 1,4 12936 (6,0-Ю-5)
52 Те 48 20,0 6 2,1 -506 (5,0-10“ 3)
53 J 14 25,6 6 2,5 -43957 —
55 Cs 16 70 8 0,7 -222904 6,5
56 Ba 33 37 8 0,9 -161317 0,48 —1~»
57 La 66,4 22,5 12 1,1 -109793 1,3-Ю-2
72 Hf 112 13,5 12 1,3 18124 (3,0-Ю-9) —
73 Ta 136 10,8 8 1,5 115293 (1,7-IO-16) »
74 W 145 9,6 8 1,7 152095 (6,8-10" 20)
75 Re 146 8,9 12 1,9 156716 (5,9-Ю-18)
76 Os 144 8,4 12 1,52 119055 (1,1-10-14)
77 Ir 139 8,6 12 1,55 111564 (2,8-Ю-12)
78 Pt 121 9,1 12 1,44 53212 3,1-Ю-7
79 Au 93 10,3 12 1,4 -3643 0,13
81 T1 31 ,14,8 6 1,55 -16603 43,7 •
82 Pb 51 18,3 12 1,8 64125 1,9
‘83 Bl 48 21,3 6 1,9 5216 1,6 —-
Примечание. В скобках приведены значения растворимости, полу-
ченные расчетным путем из приведенных теп лот плавления [2]. Н--об-
разуются интерметаллические соединения (ИМ.С);—не образуются.
компонентов и предсказывать физико-химические свойства
сплавов. Б. П. Бурылевым [67] было предложено уравнение
для расчета энергии взаимообмена в бинарных сплавах:
612= - Чр С5!-^)2- 23060 ~ (хх- у.2),
где z — координационное число сплава.
Для металлических систем с энергией взаимообмена
Qi2^>0 наблюдается расслоение компонентов. Анализ этого
уравнения показывает, что Qi2>0 лишь в случае большо-
го различия в параметрах растворимости металлов, когда в
расплаве происходит взаимное отталкивание частиц. В си-
стемах же с Qi2<0 наблюдается взаимное притяжение раз-
ноименных частиц с образованием ИМС.
В таблице 3 приведены параметры растворимости и энер-
гии взаимообмена металлов в амальгамных двойных систе-
40
мах Me—Hg*. Энергию взаимообмена рассчитывали по урав-
нению [67], используя справочные данные физико-хими-
ческих свойств ртути и приведенных в таблице металлов-
[2, 13, 14, 24, 30, 31, 33, 35—37].
Анализ данных таблицы 3 и сопоставление их с данны-
ми растворимости металлов в ртути при 25°С показывают, что
для двойных систем Me—Hg с отчетливо выраженной склон-
ностью образовывать интерметаллические соединения энер-
гия взаимообмена меньше нуля (QHgMe <0). Бинарные си-
стемы Me—Hg с металлами, обладающими малой раствори-
мостью в ртути, имеют энергию взаимообмена больше ну-
ля (QHgMe > 0). Для систем с большой разницей параметров
растворимости металла и ртути растворимость металла в
ртути очень мала (10“7—10-20%), и металлы не образуют ин-
терметаллических соединений с ртутью. Энергия взаимооб-
мена таких двойных систем Me—Hg QHgMe 0. Так, для
систем Та—Hg, W—Hg, Re—Hg, Os—Hg, Ir—Hg, В—Hg
она равна соответственно 115,3, 152,1, 156,7, 119,0, 111,5 и
122,5 ккал/г-атом. Следует отметить, что положительные
значения QMeHg наблюдаются для восьми двойных систем,
компоненты которых образуют интерметаллические соеди-
нения между собой (Be—Hg, Ti—Hg, Мп—Hg, Ni—Hg, Zr—
Hg, Pd—Hg, Ag—Hg и Pt—Hg). Из рассмотренных 57
амальгамных систем для 49 (86%) можно правильно пред-
сказать отношение металла к ртути.
ВЗАИМНОЕ ВЛИЯНИЕ МЕТАЛЛОВ НА РАСТВОРИМОСТЬ В РТУТИ
При осуществлении процессов амальгамной пирометал-
лургии в ртутную фазу в процессе обмена или растворения
переходят, как правило, несколько металлов. Поэтому пред-
ставляет интерес рассмотреть закономерности взаимного
влияния металлов на их растворимость в ртути. Вопрос о
взаимном влиянии металлов на растворимость в ртути ста-
вился еще в ранних работах Гона [4, 5]. В настоящее вре-
мя известно строение диаграмм состояния многих бинарных
систем Me—Hg [24, 25]. Достаточно подробно изучены диа-
граммы состояния металлов первой группы периодической
системы Д. И. Менделеева5, некоторых щелочноземельных
(магний) и редкоземельных элементов [24, 25, 68, 69], ак-
тиноидов [24, 25, 57, 71, 72] и др. (см. рис. 10). Бинарные
амальгамные системы обладают очень ценными физико-хи-
мическими свойствами и применяются в различных отрас-
5 Исключение составляет система медь — ртуть.
41
.лях науки, новой техники и промышленности. Нередко при
изучении строения тройных амальгамных систем обнаружи-
ваются новые, до сих пор неизвестные особенности и свойст-
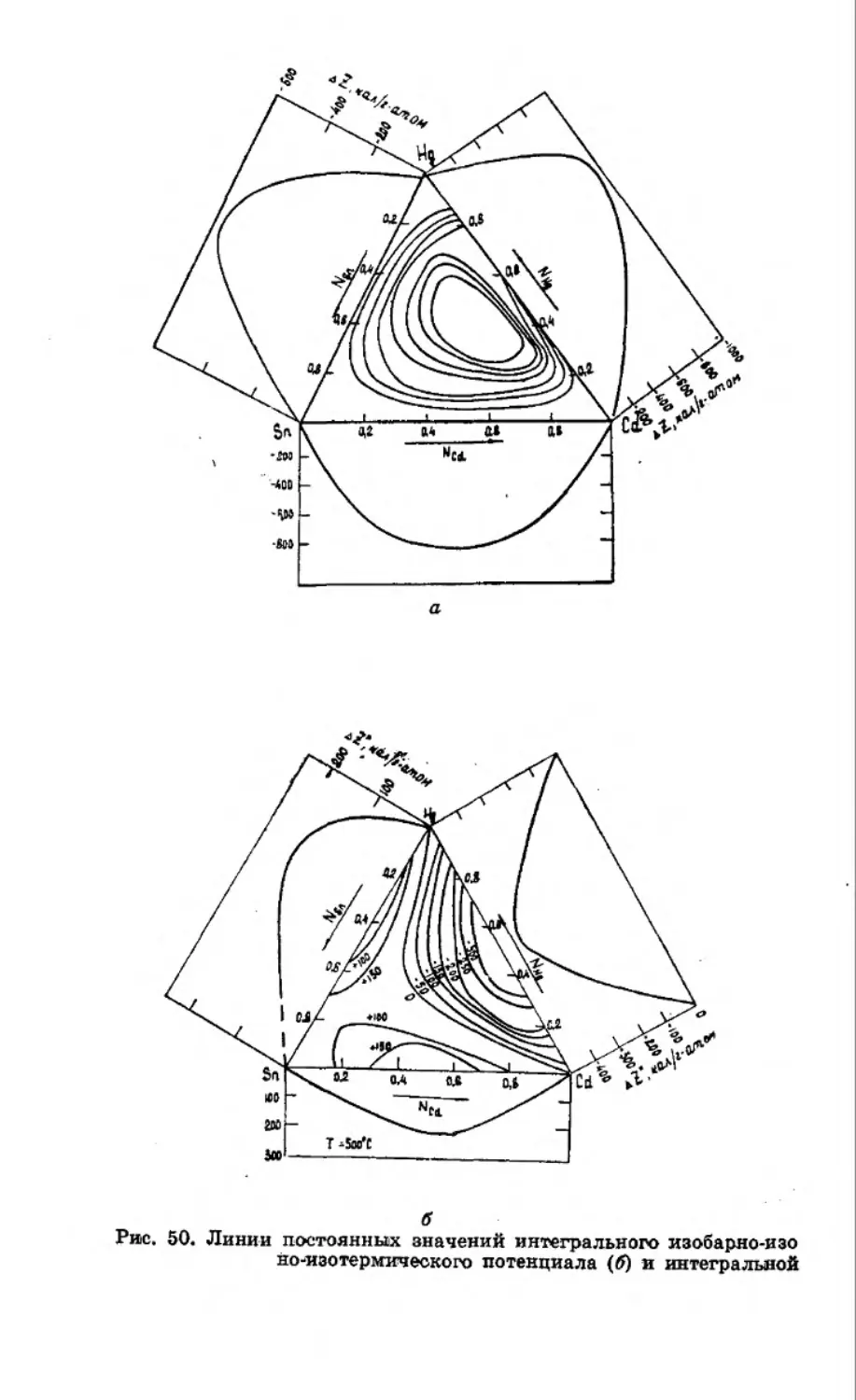
ва таких систем. В настоящее время известно строение лишь
некоторых тройных амальгамных систем [73—82]. Это свя-
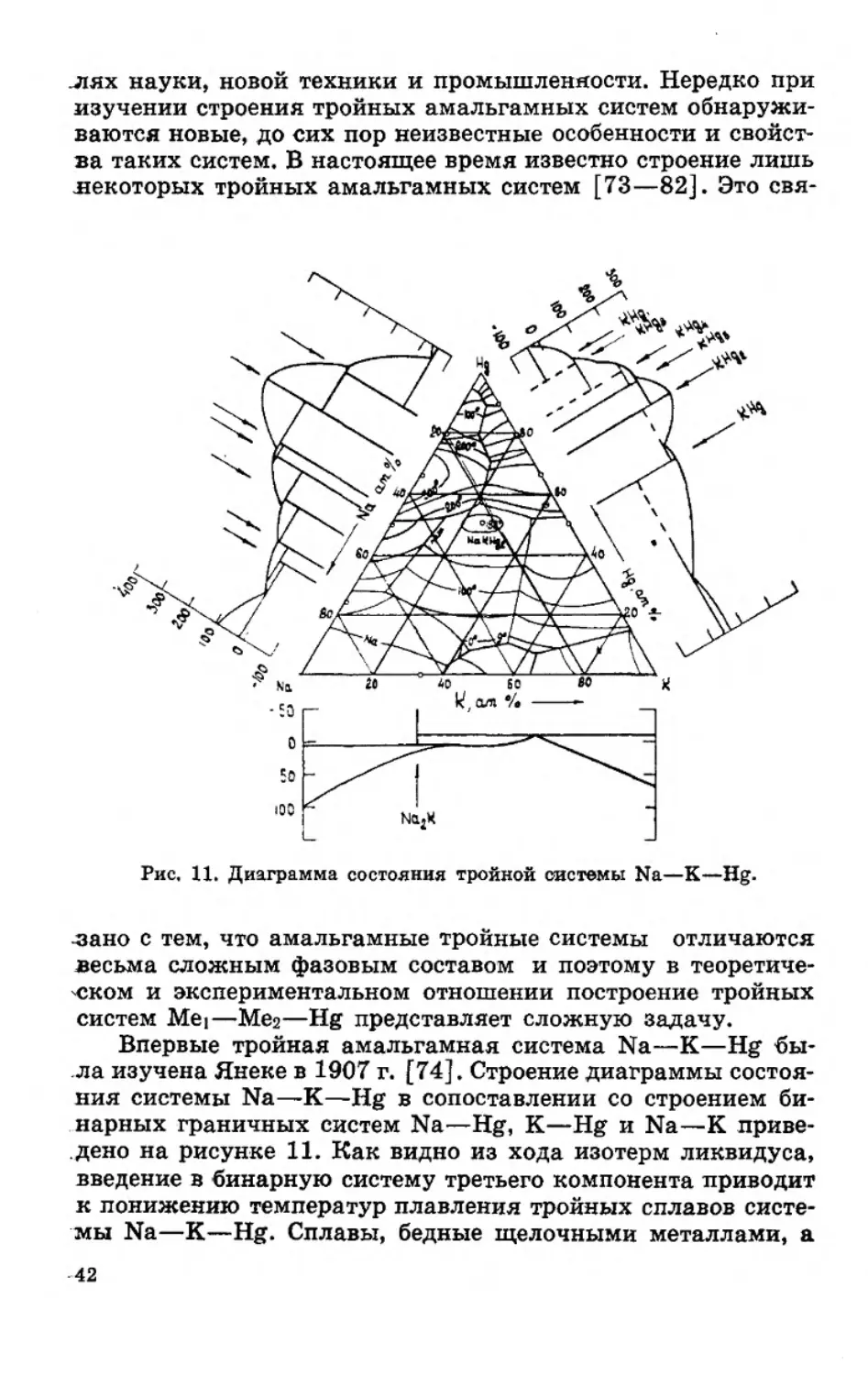
Рис. 11. Диаграмма состояния тройной системы Na—К—Hg.
-зано с тем, что амальгамные тройные системы отличаются
весьма сложным фазовым составом и поэтому в теоретиче-
ском и экспериментальном отношении построение тройных
систем Мв|—Мв2—Hg представляет сложную задачу.
Впервые тройная амальгамная система Na—К—Hg бы-
ла изучена Янеке в 1907 г. [74]. Строение диаграммы состоя-
ния системы Na—К—Hg в сопоставлении со строением би-
нарных граничных систем Na—Hg, К—Hg и Na—К приве-
дено на рисунке 11. Как видно из хода изотерм ликвидуса,
введение в бинарную систему третьего компонента приводит
к понижению температур плавления тройных сплавов систе-
мы Na—К—Hg. Сплавы, бедные щелочными металлами, а
42
-также сплавы, богатые щелочными металлами, при темпера-
-турах 25—30°С жидкие. Особенностью этой системы являет-
ся образование тройного соединения NaKHg2, которое в трой-
ных системах было открыто впервые. Температура плавле-
ния соединения NaKHg2 равна 188°С.
Рис. 12. Диаграмма состояния бинарных граничных систем Bi—
Hg, Pb—Hg, Bi—Pb и изотермы поверхности ликвидуса тройной
системы РЬ—Bi—Hg.
Система Pb—Bi—Hg. Строение тройной системы сви-
нец— висмут — ртуть показано на рисунке 12. Составляю-
щие тройную систему бинарные системы свинец — ртуть и
овинец — висмут образуют с ртутью широкую область твер-
дых растворов. В эвтектической системе же висмут — ртуть
компоненты в твердом состоянии взаимно нерастворимы.
В тройной системе свинец — висмут — ртуть обнаружена
широкая область тройных твердых растворов висмута и рту-
ти в свинце [75]. В области диаграммы состояния, богатой
висмутом, образуется прилегающая к бинарной системе
Bi—Pb ограниченная область твердых растворов свинца и
ртути в висмуте. При отношении свинца к висмуту, равном
1:1, растворимость ртути в сплаве возрастает более чем в
2 раза и составляет около 43 ат. %. В богатой ртутью области
диаграммы состояния наблюдается увеличение взаимной
43
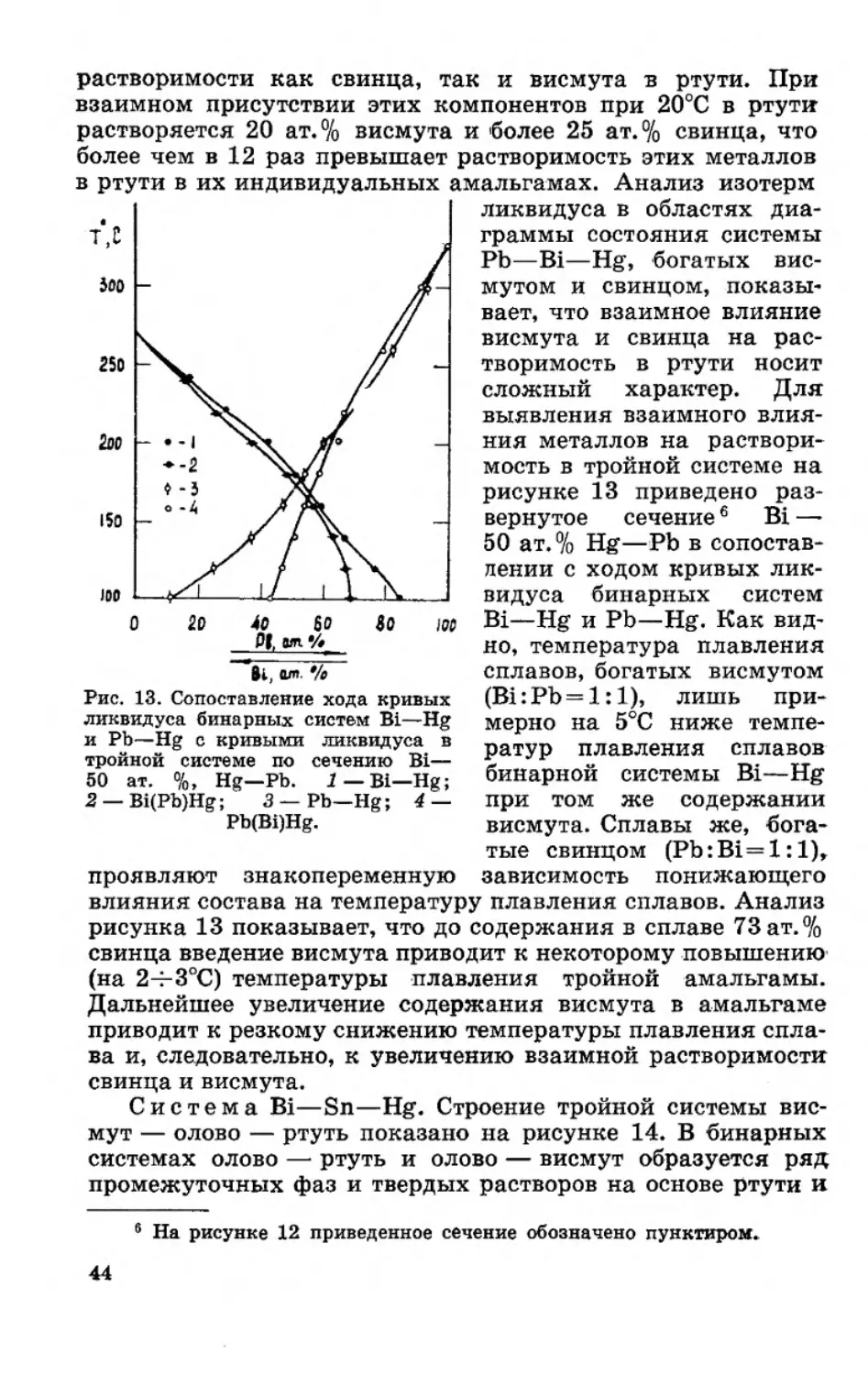
растворимости как свинца, так и висмута в ртути. При
взаимном присутствии этих компонентов при 20°С в ртути
растворяется 20 ат. % висмута и более 25 ат. % свинца, что
более чем в 12 раз превышает растворимость этих металлов
в ртути в их индивидуальных амальгамах. Анализ изотерм
ликвидуса в областях диа-
граммы состояния системы
РЬ—Bi—Hg, богатых вис-
мутом и свинцом, показы-
вает, что взаимное влияние
висмута и свинца на рас-
творимость в ртути носит
сложный характер. Для
выявления взаимного влия-
ния металлов на раствори-
мость в тройной системе на
рисунке 13 приведено раз-
вернутое сечение6 В1 —
50 ат. % Hg—Pb в сопостав-
лении с ходом кривых лик-
видуса бинарных систем
Bi—Hg и Pb—Hg. Как вид-
но, температура плавления
сплавов, богатых висмутом
(Bi:Pb = l:l), лишь при-
мерно на 5°С ниже темпе-
ратур плавления сплавов
бинарной системы Bi—Hg
при том же содержании
висмута. Сплавы же, бога-
тые свинцом (Pb:Bi=l:l),
зависимость понижающего
О 20 40 ЬО So ЮС
ат %
Bl, ат. %
Рис. 13. Сопоставление хода кривых
ликвидуса бинарных систем Bi—Hg
и Pb—Hg с кривыми ликвидуса в
тройной системе по сечению Bi—
50 ат. %, Hg—Pb. 1 — Bi—Hg;
2 — Bi(Pb)Hg; 3 — Pb—Hg; 4 —
Pb(Bi)Hg.
проявляют знакопеременную
влияния состава на температуру плавления сплавов. Анализ
рисунка 13 показывает, что до содержания в сплаве 73 ат. %
свинца введение висмута приводит к некоторому повышению
(на 2-=-3°С) температуры плавления тройной амальгамы.
Дальнейшее увеличение содержания висмута в амальгаме
приводит к резкому снижению температуры плавления спла-
ва и, следовательно, к увеличению взаимной растворимости
свинца и висмута.
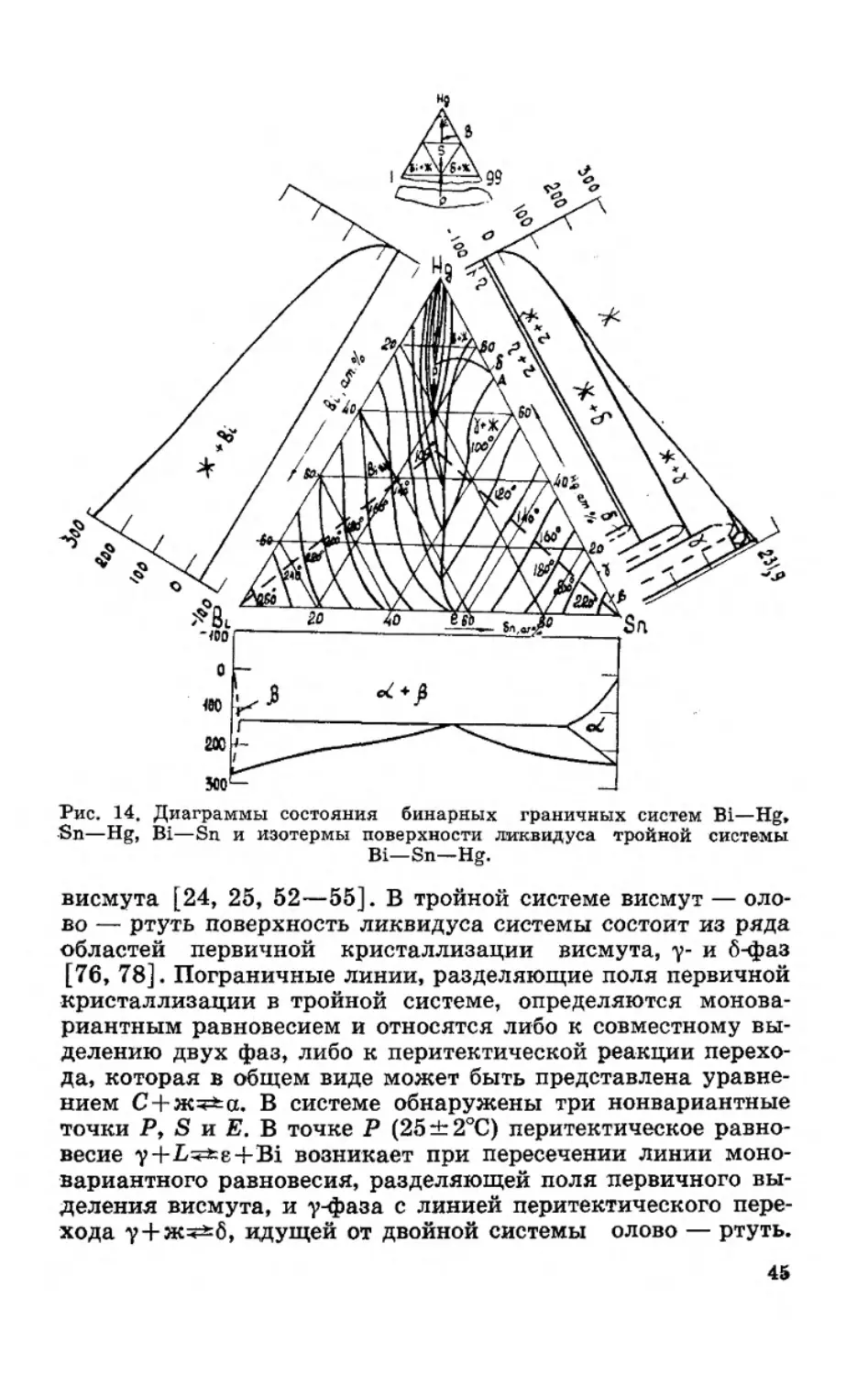
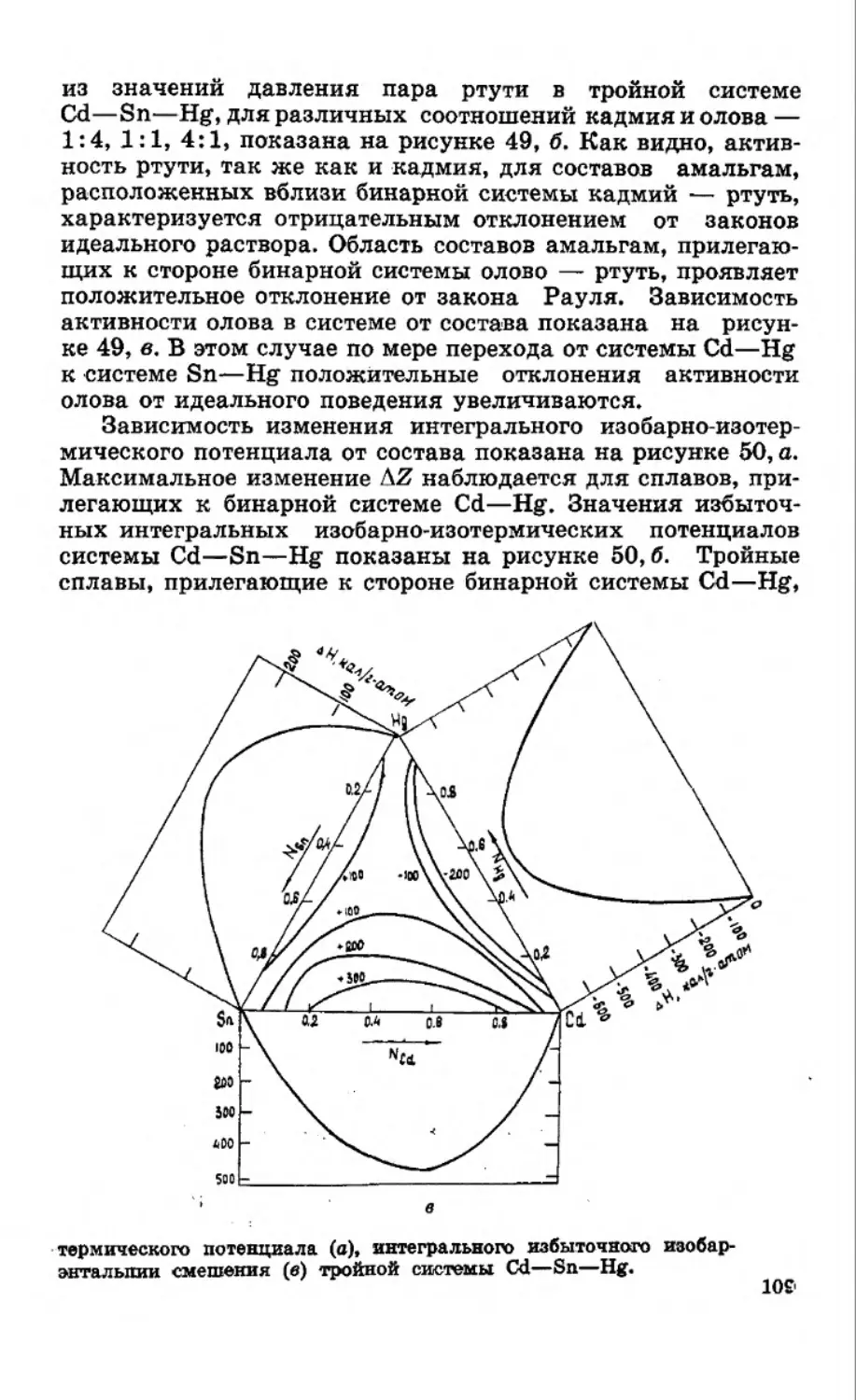
Система Bi—Sn—Hg. Строение тройной системы вис-
мут — олово — ртуть показано на рисунке 14. В бинарных
системах олово — ртуть и олово — висмут образуется ряд
промежуточных фаз и твердых растворов на основе ртути и
6 На рисунке 12 приведенное сечение обозначено пунктиром.
44
Рис. 14. Диаграммы состояния бинарных граничных систем Bi—Hg,
Sn—Hg, Bi—Sn и изотермы поверхности ликвидуса тройной системы
Bi—Sn—Hg.
висмута [24, 25, 52—55]. В тройной системе висмут — оло-
во — ртуть поверхность ликвидуса системы состоит из ряда
областей первичной кристаллизации висмута, у- и 6-фаз
[76, 78]. Пограничные линии, разделяющие поля первичной
кристаллизации в тройной системе, определяются монова-
риантным равновесием и относятся либо к совместному вы-
делению двух фаз, либо к перитектической реакции перехо-
да, которая в общем виде может быть представлена уравне-
нием С + ж^а. В системе обнаружены три нонвариантные
точки Р, S и Е. В точке Р (25±2°С) перитектическое равно-
весие у+Ьч=*8Ч-В1 возникает при пересечении линии моно-
вариантного равновесия, разделяющей поля первичного вы-
деления висмута, и у-фаза с линией перитектического пере-
хода у + ж^6, идущей от двойной системы олово — ртуть.
45
Рис. 15. Сопоставление хода кривых
ликвидуса бинарных систем Bi—Hg
и Sn—Hg с ходом кривых ликвиду-
са в тройной системе по сечению
Bi — 50 ат. % Hg—Sn. I — Bi—Hg;
2 — Bi(Sn)Hg; 3 — Sn—Hg;
4 — Sn(Bi)Hg.
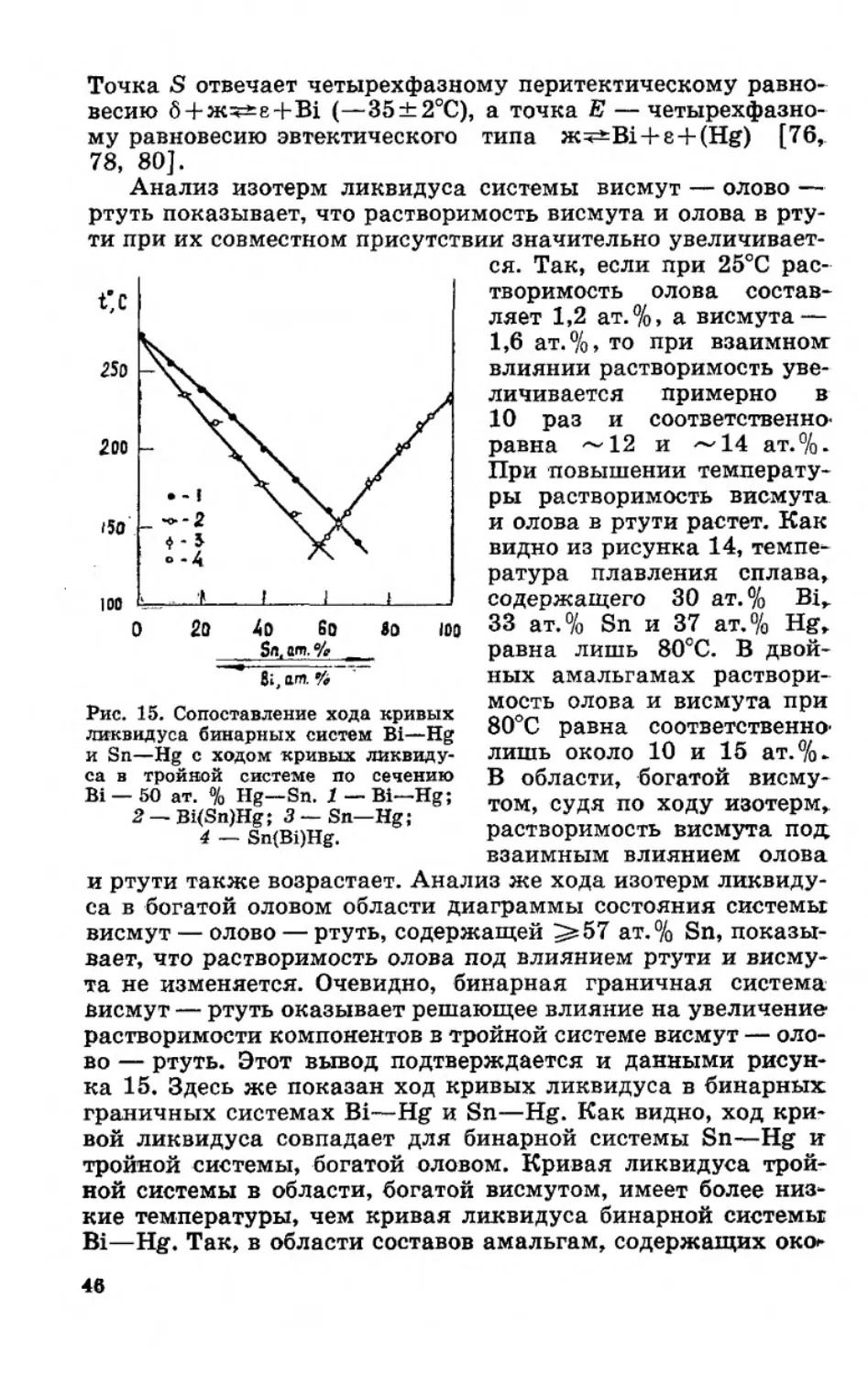
Точка S отвечает четырехфазному перитектическому равно-
весию б + ж^е + Bi (—35±2°С), а точка Е — четырехфазно-
му равновесию эвтектического типа Жч=±В1 + е + (Н£) [76,
78, 80].
Анализ изотерм ликвидуса системы висмут — олово —
ртуть показывает, что растворимость висмута и олова в рту-
ти при их совместном присутствии значительно увеличивает-
ся. Так, если при 25°С рас-
творимость олова состав-
ляет 1,2 ат.%, а висмута —
1,6 ат.%, то при взаимном
влиянии растворимость уве-
личивается примерно в
10 раз и соответственно-
равна ~12 и ~14 ат.%.
При повышении температу-
ры растворимость висмута
и олова в ртути растет. Как
видно из рисунка 14, темпе-
ратура плавления сплава,
содержащего 30 ат. % Bi,.
33 ат. % Sn и 37 ат. % Hg,
равна лишь 80сС. В двой-
ных амальгамах раствори-
мость олова и висмута при
80°С равна соответственно-
лишь около 10 и 15 ат.%.
В области, богатой висму-
том, судя по ходу изотерм,
растворимость висмута под;
взаимным влиянием олова
и ртути также возрастает. Анализ же хода изотерм ликвиду-
са в богатой оловом области диаграммы состояния системы
висмут — олово — ртуть, содержащей ^57 ат. % Sn, показы-
вает, что растворимость олова под влиянием ртути и висму-
та не изменяется. Очевидно, бинарная граничная система
висмут — ртуть оказывает решающее влияние на увеличение
растворимости компонентов в тройной системе висмут — оло-
во — ртуть. Этот вывод подтверждается и данными рисун-
ка 15. Здесь же показан ход кривых ликвидуса в бинарных
граничных системах Bi—Hg и Sn—Hg. Как видно, ход кри-
вой ликвидуса совпадает для бинарной системы Sn—Hg и
тройной системы, богатой оловом. Кривая ликвидуса трой-
ной системы в области, богатой висмутом, имеет более низ-
кие температуры, чем кривая ликвидуса бинарной системы
Bi—Hg. Так, в области составов амальгам, содержащих око**
46
ло 50 ат. % Bi, температура кривой ликвидуса тройной систе-
мы ниже на 25°С по сравнению с бинарной системой Bi—Hg.
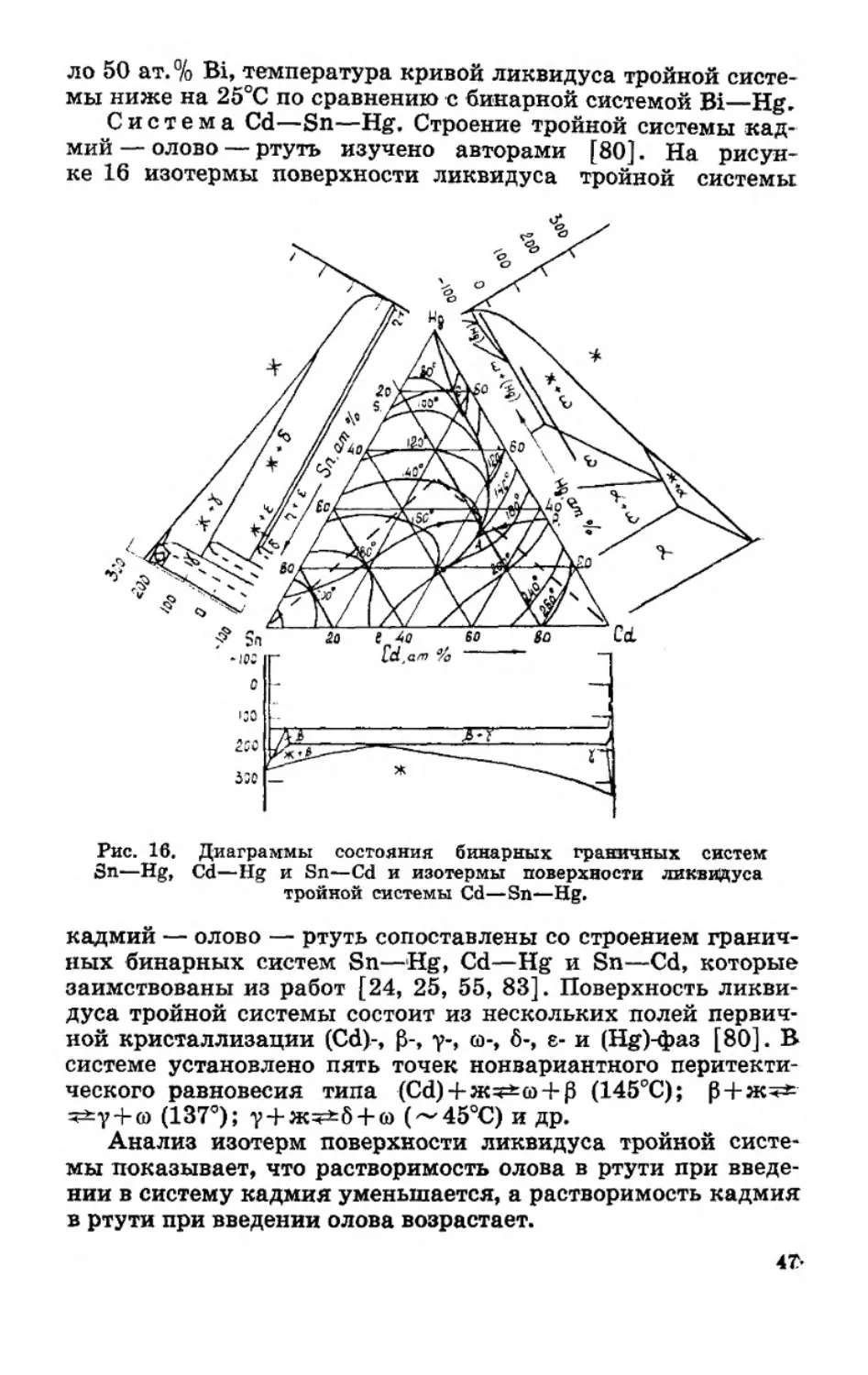
Система Cd—Sn—Hg. Строение тройной системы кад-
мий — олово — ртуть изучено авторами [80]. На рисун-
ке 16 изотермы поверхности ликвидуса тройной системы
Рис. 16. Диаграммы состояния бинарных граничных систем
Sn—Hg, Cd—Hg и Sn—Cd и изотермы поверхности ликвидуса
тройной системы Cd—Sn—Hg.
кадмий — олово — ртуть сопоставлены со строением гранич-
ных бинарных систем Sn—Hg, Cd—Hg и Sn—Cd, которые
заимствованы из работ [24, 25, 55, 83]. Поверхность ликви-
дуса тройной системы состоит из нескольких полей первич-
ной кристаллизации (Cd)-, р-, у-, со-, 6-, е- и (Hg)^a3 [80]. В
системе установлено пять точек нонвариантного перитекти-
ческого равновесия типа (Cd) + nc^co + j3 (145°С); р + ж^
^у + со (137°); у + ж^б + со (~45°С) и др.
Анализ изотерм поверхности ликвидуса тройной систе-
мы показывает, что растворимость олова в ртути при введе-
нии в систему кадмия уменьшается, а растворимость кадмия
в ртути при введении олова возрастает.
47’
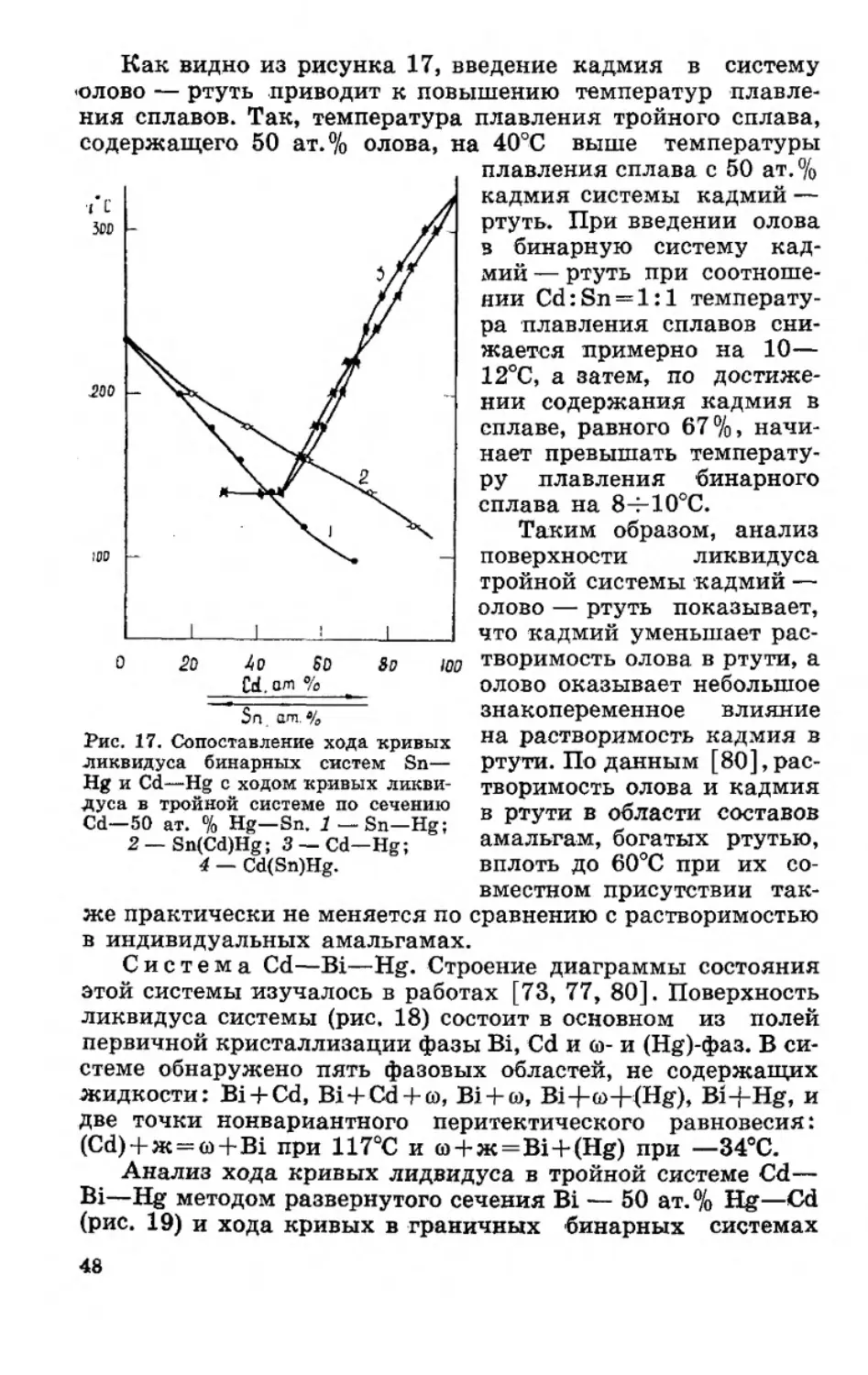
содержащего 50 ат. % олова,
о 2D 4 о 6D 3D 100
Cd. от %
Sn. am.%
Рис. 17. Сопоставление хода кривых
ликвидуса бинарных систем Sn—
Hg и Cd—Hg с ходом кривых ликви-
дуса в тройной системе по сечению
Cd—50 ат. % Hg—Sn. Sn—Hg;
2 —Sn(Cd)Hg; 3 — Cd—Hg;
4 — Cd(Sn)Hg.
Как видно из рисунка 17, введение кадмия в систему
«олово — ртуть приводит к повышению температур плавле-
ния сплавов. Так, температура плавления тройного сплава,
i 40°С выше температуры
плавления сплава с 50 ат. %
кадмия системы кадмий —
ртуть. При введении олова
в бинарную систему кад-
мий — ртуть при соотноше-
нии Cd:Sn = l:l температу-
ра плавления сплавов сни-
жается примерно на 10—
12°С, а затем, по достиже-
нии содержания кадмия в
сплаве, равного 67 % > начи-
нает превышать температу-
ру плавления бинарного
сплава на 8-F10°C.
Таким образом, анализ
поверхности ликвидуса
тройной системы кадмий —
олово — ртуть показывает,
что кадмий уменьшает рас-
творимость олова в ртути, а
олово оказывает небольшое
знакопеременное влияние
на растворимость кадмия в
ртути. По данным [80],рас-
творимость олова и кадмия
в ртути в области составов
амальгам, богатых ртутью,
вплоть до 60°С при их со-
вместном присутствии так-
же практически не меняется по сравнению с растворимостью
в индивидуальных амальгамах.
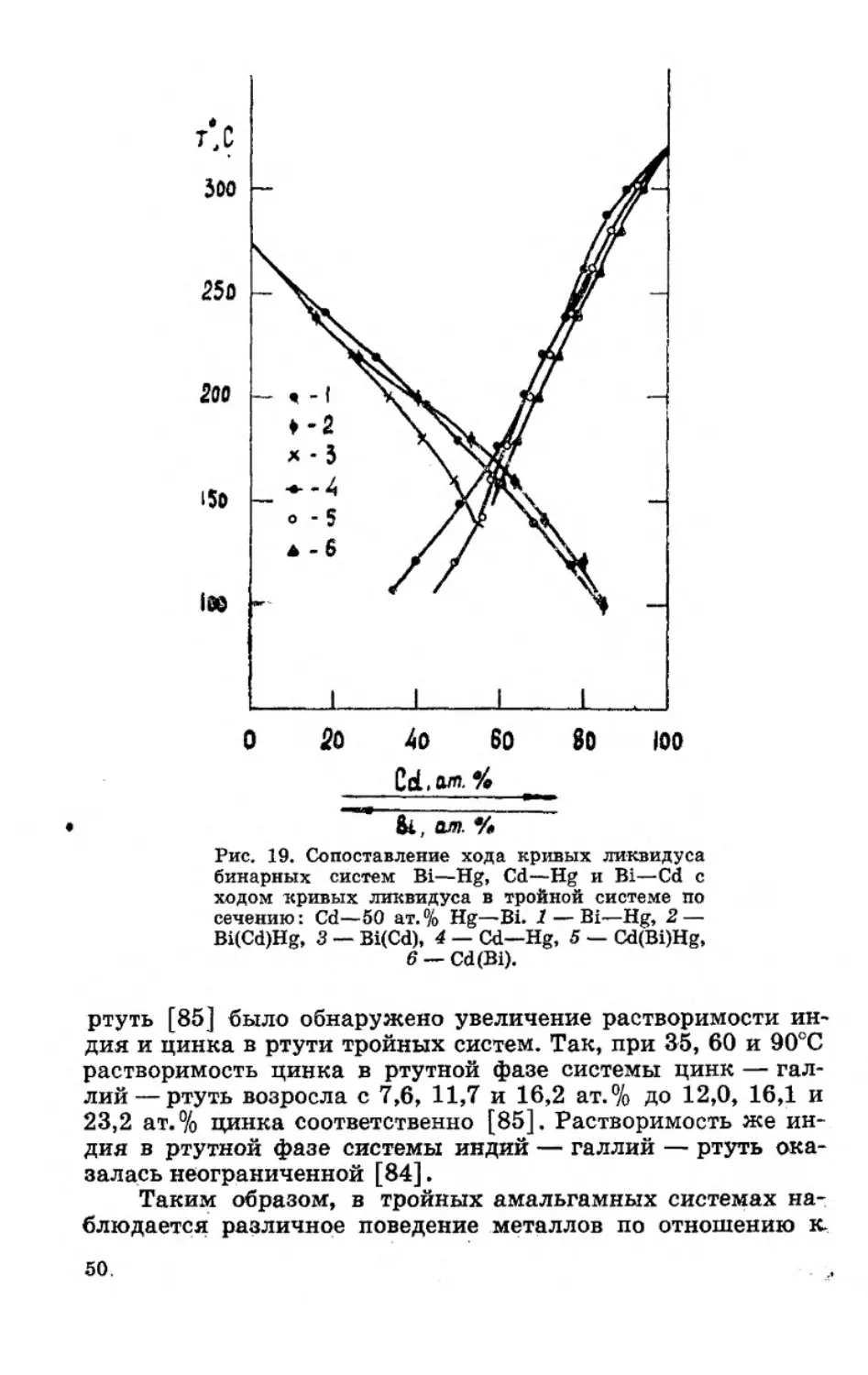
Система Cd—Bi—Hg. Строение диаграммы состояния
этой системы изучалось в работах [73, 77, 80]. Поверхность
ликвидуса системы (рис. 18) состоит в основном из полей
первичной кристаллизации фазы Bi, Cd и (о- и (Н&)-фаз. В си-
стеме обнаружено пять фазовых областей, не содержащих
жидкости: Bi + Cd, Bi + Cd + co, Bi + w, Bi+a>+(Hg), Bi+Hg, и
две точки нонвариантного перитектического равновесия:
(Cd)+ac==<o+Bi при 117°С и <o + ac=Bi+(Hg) при —34°С.
Анализ хода кривых лидвидуса в тройной системе Cd—
Bi—Hg методом развернутого сечения Bi — 50 ат. % Hg—Cd
(рис. 19) и хода кривых в граничных бинарных системах
48
Рис. 18. Диаграммы состояния бинарных граничных систем
Bi—Hg, Cd—Hg и Bi—Cd и изотермы поверхности ликвидуса
тройной системы Cd—Bi—Hg.
Bi—Hg, Cd—Hg и Bi—Cd показывает, что наименьшими
температурами плавления обладают сплавы бинарной систе-
мы Bi—Cd. При введении в сплавы, богатые висмутом, кад-
мия растворимость висмута в интервале температур 270-F
4-200°С возрастает на 2—4 ат.%, а затем уменьшается на
такую же величину. Ход кривых ликвидуса в области диа-
граммы, богатыми кадмием, также мало изменяется при вве-
дении висмута. Различие в ходе кривых ликвидуса в бинар-
ной системе Cd—Hg и тройных амальгам Cd—Bi—Hg прояв-
ляется лишь в области, богатой ртутью. По данным [60],
растворимость висмута в ртути при 20°С в присутствии кад-
мия возрастает с 1,5 до ~6 ат.%, а растворимость кадмия в
присутствии висмута повышается незначительно: с ^9 до
~11 ат. % при 20°С и с ~19 до 24 ат. % при 60°С.
Изучение строения диаграмм состояния систем индий —
олово — ртуть [82] и серебро — свинец — ртуть [81] пока-
зало, что в этих системах не проявляется взаимное влияние
металлов на увеличение растворимости их в ртути. При изу-
чении же констант распределения металлов в двухфазных
системах индий — галлий — ртуть [84] и цинк — галлий —
4-122
49
О to 4о 60 SO 100
Cd. tun#
~ ’ &i, aw. %
Рис. 19. Сопоставление хода кривых ликвидуса
бинарных систем Bi—Hg, Cd—Hg и Bi—Cd c
ходом кривых ликвидуса в тройной системе по
сечению: Cd—50 ат.% Hg—Bi. 1 — Bi—Hg, 2 —
Bi(Cd)Hg, 3 — Bi(Cd), 4 — Cd—Hg, 5 — Cd(Bi)Hg,
6 — Cd (Bi).
ртуть [85] было обнаружено увеличение растворимости ин-
дия и цинка в ртути тройных систем. Так, при 35, 60 и 90сС
растворимость цинка в ртутной фазе системы цинк — гал-
лий— ртуть возросла с 7,6, 11,7 и 16,2 ат. % до 12,0, 16,1 и
23,2 ат. % цинка соответственно [85]. Растворимость же ин-
дия в ртутной фазе системы индий — галлий — ртуть ока-
залась неограниченной [84].
Таким образом, в тройных амальгамных системах на-
блюдается различное поведение металлов по отношению к.
50.
ртути. В одних случаях растворимость металлов в ртути уве-
личивается при их совместном присутствии, а в других —
она не изменяется или даже уменьшается. С чем же связано
взаимное влияние металлов на их растворимость в ртути
тройной системы? Ответ на этот вопрос дает термодинамика
гетерогенных систем, развитая Скрейнемакерсом [86, 87] и
Сторонкиным [88, 89]. Ими проанализировано влияние
третьего компонента на температуру сосуществования фаз в
бинарных эвтектических и перитектических системах. В ра-
боте [88] предложено уравнение, характеризующее влияние
вводимого (первого) компонента на температуру сосущество-
вания фаз бинарной эвтектической системы, состоящей из
второго и третьего компонентов:
dT \
ах1 /^=0; р
^31>(х<3)-х<2’)+*'32> (х^-х'8’)
} ——
*2 *2
(1-30)
(1-31)
Здесь q — молярная теплота кристаллизации бинарного эв-
тектического сплава; Л(81) и Л<182) — предельное значение
коэффициентов распределения первого компонента между
двумя фазами, образованными соответственно третьим и
первым и третьим и вторым компонентами;- х{2\ х\
х{2} — молярная доля второго компонента в соответствую-
щей фазе.
Уравнение (I—30) является предельным, общим и при-
менимым ко всем трем возможным случаям: 1) компонен-
ты бинарной системы не образуют твердых растворов;
2) компоненты ограниченно смешиваются в твердом состоя-
нии; 3) компоненты образуют соединения.
По данным [88], К больше нуля всегда, независимо от
избранного порядка нумерации фаз. Влияние вводимого
компонента на температуру эвтектической кристаллизации
складывается из трех аддитивных эффектов: рь р2 и рав-
ных соответственно
₽i=~<0, (1-32)
>0, (1-33)
4 *2 ~”Х2
51
Drr2 V*1)— *<3)
__^(32) RT2 x2 x2
* x2 *2
(1-34)
Эффект 0! связан с растворением вводимого компонента
в жидкой фазе и, по [88, 89], не зависит от его природы.
Эффект Pi имеет чисто статистико-термодинамический ха-
рактер и может быть вычислен по данным для бинарной
эвтектической системы. В чистом виде эффект проявляет-
ся тогда, когда вводимый (первый) компонент не растворяет-
ся в обеих твердых фазах. Тогда
(1—35)
₽2 = Рз = 0.
В соответствии с [86, 87] справедливо
(1-36)
Знак эффекта Pi определяется знаком молярной теплоты
кристаллизации жидкой фазы бинарной системы qy которая
для эвтектической кристаллизации отрицательна. Поэтому
для эвтектических систем эффект pi всегда отрицателен и,
следовательно, понижает эвтектическую температуру.
Эффекты р2 и рз связаны со способностью вводимого ком-
понента образовывать твердые растворы. Величина эффектов
₽2 и р3, согласно уравнениям (I—33) и (I—34), пропорцио-
нальна коэффициентам распределения вводимого компонен-
та между твердыми и жидкой фазами. Эффекты р2 и Рз за-
висят от природы компонентов бинарной системы (через ве-
личину q и составы фаз), природы вводимого компонента
(через коэффициенты распределения и ).
Природа бинарной системы также сказывается на вели-
чинах коэффициентов распределения. Поэтому для вычис-
ления эффектов р2 и Рз необходимы не только данные для
бинарной системы компонентов (2,3), но и коэффициенты
распределения для вводимого компонента (1). Для эвтекти-
ческих систем эффекты р2 и рз, согласно уравнениям (I—33)
и (I—34), всегда положительны и, по [88], действуют в на-
правлении повышения эвтектической температуры, ослабляя
действие эффекта Рь Если коэффициенты распределения
{31) и kf2} достаточно велики, так, что k>l, то введение
первого (1) компонента в эвтектическую бинарную систему
52
из компонентов (2) и (3) будет вызывать повышение эвтек-
тической температуры. В этом случае, по данным [88], по-
ложительные эффекты Рг и р3 будут перекрывать постоянно
действующий отрицательный эффект
Из вышеизложенного вытекает, по [88, 89], следующее.
1. Если вводимый в бинарную эвтектическую систему
компонент не образует твердых растворов, то при его раство-
рении эвтектическая температура понижается [87].
2. Образование твердых растворов вводимого компонен-
та с компонентами бинарной системы приводит к ослабле-
нию понижающего действия вводимого компонента на эвтек-
тическую температуру; при этом ослабление тем значитель-
нее, чем больше коэффициенты распределения вводимого
компонента между твердыми и жидкими фазами; если
коэффициенты распределения достаточно велики, то эвтек-
тическая температура возрастает.
3. Понижение эвтектической температуры при введении
нового компонента указывает либо на неспособность этого
компонента образовывать твердые растворы с компонента-
ми эвтектики, либо на малые значения коэффициентов рас-
пределения.
4. Повышение эвтектической температуры свидетельст-
вует о том, что вводимый компонент образует твердые рас-
творы; при этом концентрации вводимого компонента в
твердых фазах сравнимы с его концентрацией в жидкой
фазе.
В свете изложенного выше представляет интерес рассмот-
реть диаграммы состояния тройных амальгамных систем с
целью выявления закономерностей взаимного влияния ме-
таллов на увеличение растворимости металлов в ртути. Оче-
видно, понижение эвтектической температуры приводит
и к увеличению растворимости компонентов тройной си-
стемы.
Система РЬ—Bi—Hg. Введение в бинарную эвтекти-
ческую систему РЬ—Bi, компоненты которой образуют меж-
ду собой ограниченные твердые растворы, ртути, образую-
щей очень широкую область твердых растворов со свинцом
и не образующей твердых растворов с висмутом, приводит к
понижению эвтектической температуры и, как следствие, —
примерно к десятикратному увеличению растворимости
свинца и висмута в богатой ртутью области диаграммы трой-
ной системы РЬ—Bi—Hg. В этом случае образование твер-
дых растворов ртути со свинцом бинарной системы РЬ—Bi
не привело к ослаблению понижающего действия ртути на
эвтектическую температуру. Следовательно, в тройной систе-
ме Pb—Bi—Hg (р1)»(₽2)+(Рз)-
53
Система Sn—Bi—Hg. Здесь отчетливо проявляется
взаимное влияние металлов на растворимость в ртути. При
введении в бинарную систему Bi—Sn третьего компонента —
ртути — растворимость олова и висмута возрастает пример-
но в 10 раз. Эта система образована тремя граничными си-
стемами: Bi—Sn, Sn—Hg и Bi—Hg, из которых две системы
также проявляют склонность к образованию ограниченных
твердых растворов. Образование твердого раствора в систе-
ме Sn—Hg не приводит к ослаблению понижающего дейст-
вия ртути на эвтектическую температуру тройной системы.
В системе Sn—Bi—Hg также +
Система Cd—Bi—Hg. Введение в бинарную систему
Cd—Bi, компоненты которой не образуют твердых растворов
между собой, ртути, которая образует лишь твердые раство-
ры с кадмием, приводит к незначительному увеличению
растворимости компонентов в тройной системе Cd—Bi—Hg.
По данным [73], висмут практически не оказывает влияния
на растворимость кадмия в ртути, а в присутствии кадмия
растворимость висмута значительно возрастает и составляет
при NCa =0,1 (31°С) и NCd =0,25 (100°С) соответственно
NBi =0,12 и №1=0,34. По [77, 80], растворимость кадмия
в присутствии висмута возрастает с ~ 9 до 11 ат. % при 25°С
и с ~ 19 до 24 ат. % при 60°С. Растворимость же висмута в
ртути в присутствии кадмия возрастает в 4 раза: с 1,5 до
~6ат.%. Таким образом, в системе Cd—Bi—Hg эвтектиче-
ская температура понижается, однако взаимное влияние ме-
таллов на растворимость в ртути мало. Очевидно, в этой
системе (₽1)^(Р2) + (Рз).
Система Cd—Sn—Hg. В этой системе все компоненты
образуют твердые растворы. Эвтектическая температура при
введении в бинарную систему Sn—Cd третьего компонен-
та — ртути — понижается, однако взаимное влияние метал-
лов на увеличение растворимости в ртути не наблюдается.
Система РЬ—Ag—Hg. Здесь также все компоненты
образуют друг с другом твердые растворы и не отмечено
взаимного влияния металлов на увеличение их растворимо-
сти в ртути [81].
Система In—Sn—Hg. Компоненты этой системы в
бинарных граничных системах образуют широкие области
твердых растворов. Взаимного влияния металлов в системе
не наблюдается [82].
Система Ga—Bi—Hg. Компоненты этой системы не
образуют твердых растворов между собой. Бинарные систе-
мы Ga—Hg и Ga—Bi образуют расслаивающиеся системы.
При изучении коэффициентов распределения в тройной сис-
теме Ga—Bi—Hg, проведенном нами совместно с Л. Худ яко-
54
вой, взаимное влияние компонентов на увеличение раство-
римости металлов в тройной системе не установлено.
Таким образом, если все компоненты в граничных систе-
мах тройной системы Mei—Мв2—Hg образуют твердые раст-
воры или ни в одной из граничных бинарных систем не
образуются твердые растворы, то взаимное влияние компо-
нентов на увеличение их растворимости в тройной системе
Mei—Meg—Hg не проявляется. Анализ строения тройных
металлических систем и бинарных граничных систем, сопо-
ставление значений растворимости металлов в тройных и
бинарных металлических системах показали, что и в метал-
лических системах взаимное влияние металлов на увеличе-
ние растворимости в тройной системе также аналогично за-
висит от строения граничных бинарных систем. Очевидно,
взаимодействие металлов эвтектической граничной системы
без твердых растворов с металлами двух других граничных
систем приводит к образованию тройных твердых растворов
и промежуточных фаз и, как следствие, — к понижению
изобарно-изотермического потенциала системы, что и явля-
ется причиной взаимного влияния на увеличение раствори-
мости компонентов в тройной системе. В случае же, когда в
бинарных граничных системах образуются твердые раство-
ры или компоненты бинарных систем не образуют твердых
растворов, понижение энергии тройной системы вследствие
взаимодействия растворенных компонентов незначительно и
взаимное влияние компонентов на увеличение растворимо-
сти или не проявляется, или проявляется слабо.
Исходя из анализа экспериментального материала по
взаимному влиянию металлов на растворимость их в ртут-
ной фазе тройной системы Mei—Мея—Hg следует заклю-
чить, что вводимый в бинарную эвтектическую систему ком-
понент оказывает влияние на увеличение растворимости ме-
таллов в тройной системе в том случае, если он образует
твердый раствор с одним из компонентов эвтектической сис-
темы. Этот вывод нами проверен специально поставленным
экспериментом. Для проверки гипотезы была выбрана сис-
тема Bi—Ag—Hg. Из анализа строения диаграмм состояния
бинарных граничных систем Bi—Ag, Ag—Hg и Bi—Hg,
составляющих эту тройную систему, можно заключить, что
в этом случае должно проявиться взаимное влияние метал-
лов на увеличение растворимости их в ртутной фазе системы
Bi—Ag—Hg. В граничных системах Bi—Hg и Ag—Hg на-
блюдаются широкие области твердых растворов, а в системе
Bi—Hg твердые растворы не образуются. Действительно, ис-
следование поверхности ликвидуса тройной системы Bi—
Ag—Hg, выполненное совместно с А. А. Требуховым, пока-
55
зало, что растворимость серебра в ртути в присутствии вис-
мута возрастает примерно в 10 раз, В несколько раз увели-
чивается растворимость висмута в ртути.
Для полной характеристики тройной системы следует
учитывать, что на характер межатомного взаимодействия
металлов в системе влияют в основном три фактора: объем-
ный (г), электроотрицательный (х) и валентный [90]. Для
образования непрерывных твердых растворов в бинарной
системе должно быть малое различие этих факторов, особен-
но электроотрицательного и объемного. В таблице 4 приве-
дены разности атомных радиусов (Аг) и электроотрицатель-
ностей (Ах) для составляющих тройные системы граничных
бинарных систем. Как видно, в системе РЬ—Bi—Hg наибо-
лее благоприятные факторы для образования твердых раст-
воров в системах характерны для РЬ—Bi и РЬ—Hg:
° °
Агрь—Bi = 0,087А, ArPb_Hg =0,174 А, Д*хрь—bi = 0,12 эв,
A*pb-Hg =0,11 эв). В этих системах и образуются широкие об-
ласти твердых растворов. Граничная система Bi—Hg облада-
ет наименее благоприятным объемным и электроотрицатель-
о
ными факторами (Агв1-н& =0,261 A, AxBi-Hg = 0,23 эв). В
тройной системе РЬ—Bi—Hg взаимодействие компонентов
системы приводит к значительному снижению энергии сис-
темы и увеличению растворимости в ртутной фазе системы.
Анализ физико-химических свойств систем Sn—Bi—Hg и
Bi—Ag—Hg также показывает, что здесь имеются благо-
приятные условия для образования твердых растворов в
граничных бинарных системах Sn—Bi, Sn—Hg, Bi—Ag,
Ag—Hg и, следовательно, для проявления взаимного влия-
ния в тройной системе Mei—Мег—Hg на растворимость их в
ртутной фазе. В граничных же бинарных системах, состав-
ляющих тройные системы Sn—Cd—Hg, Sn—In—Hg, Pb—
Ag—Hg, образуются твердые растворы, и, очевидно, взаимо-
действие этих металлов в тройных сплавах не приводит к
более глубокому изменению энергетического состояния
систем, вследствие этого не проявляется и взаимное влияние
металлов на их растворимость в ртутной фазе. В бинарных
граничных системах, составляющих тройную систему Ga—
Bi—Hg, твердые растворы не образуются. Смешение этих
металлов в данном случае также не приводит к значитель-
ному изменению энергетического состояния металлов в
тройной амальгаме, и в связи с этим также не наблюдается
взаимное влияние металлов на растворимость в ртути.
В заключение отметим, что изучение взаимного влияния
металлов на их растворимость в ртути, а также изучение
строения диаграмм состояния тройных и четверных систем
56
Таблица 4
Зависимость взаимного влияния металлов на растворимость в ртутной фазе системы от объемного (Аг)
и электроотрицательного (Ах) факторов и природы фазового равновесия в бинарных системах
Дг
Дх
Твердые растворы
Система
32
А 32
21
Характер взаимного
влияния металлов
на растворимость в
системе
Mej—Ме3—Hg
Pb—Bi—Н
Cd—Bi—Hg
Sn—Bi—Hg
Sn—Cd—Hg
Sn—In—Hg
Bi—Ag—Hg
Pb—Ag—Hg
Ga-Bi-Hg
-0,087
-0,310
-0,174
0,136
0,021
0,438
0,351
—0,364
0,174
-0,049
0,087
0,087
0,087
0,261
0,174
-0,103
0,261
0,261
0,261
-0,049
0,066
-0,177
—0,147
0,261
-0,12
-0,21
0,05
0,26
0,23
0,25
0,13
0,15
0,11
0,02
0,28
0,28
0,28
0,23
0,11
0,38
0,23
0,23
0,23
0,02
0,02
0,02
0,02
0,23
Сильно
Слабо
Сильно
He влияет
He влияет
Сильно
Не влияет
Не влияет
Примечание, аза, 0з), т]21 — образование твердых растворов металлами граничных бинарных систем соответст-
венно MejMej, МезМеь MejMei; Н----образуются; — не образуются твердые растворы в бинарной граничной системе.
представляет очень сложную как в теоретическом, так и в
экспериментальном отношении задачу. В связи с этим мно-
гими исследователями предпринимаются попытки разрабо-
тать методы расчета свойств тройных систем на основе дан-
ных о бинарных системах [91—95]. Основываясь на пред-
положении об аддитивности свойств, разработано несколько
методов определения расчетным путем свойств тройных сис-
тем по известным данным для бинарных [91—95]. В работах
[91—94] предложены методы расчета для конденсирован-
ных систем, не образующих эвтектику, а в [95] — для рас-
чета свойств эвтектических тройных систем. По данным [95],
свойство компонентов тройной системы, например, раство-
римость, может быть рассчитано по уравнениям
f\ = (1—№)fl2 + (1 — ЛГ2)./з1— ^/oi,
f2s = (1—Ni)/23 + (1—№)/i2—№/02»
fl = (1-W3I + (1-^>)/23-N3/o3,
где N], Nit N3 — атомные доли компонентов в тройной сис-
теме; /12, /гз» /з1 — соответствующие свойства сплавов бинар-
ной системы (например, температура плавления и др.); /01,
/о2> /оз — соответствующие свойства чистых компонентов.
Используя эти уравнения, можно, зная строение бинарных
амальгамных систем, рассчитать поверхность ликвидуса
тройной амальгамной системы. Нами из данных плавкости
бинарных амальгамных систем Bi—Hg, Pb—Hg и Bi—Pb и
Bi—Hg, Sn—Hg и Bi—Sn была рассчитана поверхность
ликвидуса тройных систем Bi—Pb—Hg и Bi—Sn—Hg и по-
лучено удовлетворительное совпадение с эксперименталь-
ными данными. Естественно, методы, предложенные в [91 —
95], не применимы для систем, в которых образуются кон-
груэнтно плавящиеся интерметаллические соединения.
КИНЕТИКА РАСТВОРЕНИЯ МЕТАЛЛОВ В РТУТИ
Скорость растворения твердых металлов в ртути являет-
ся определяющим фактором при проведении многих процес-
сов амальгамной металлургии. Однако к настоящему време-
ни известно весьма ограниченное число работ по кинетике
растворения металлов в ртути [96—101].
Процесс растворения металла в ртути состоит из трех ста-
дий.
На первой стадии под действием силовых полей поверх-
ности металла и ртути в электронных оболочках взаимодей-
38
ствующих компонентов происходят сильные изменения, при-
водящие к взаимной поляризуемости атомов металла и
ртути и, как следствие, — к амальгамируемости поверхности
металла (смачиваемости ртутью). Амальгамируемость ме-
таллов ртутью [2] тесно связана с природой и энергией
межатомной связи атомов
Ме—Ме в твердом металле
и, следовательно, с величи-
ной силового поля поверх-
ности раздела фаз ме-
талл — ртуть.
На второй стадии проис-
ходит разрыв «однород-
ных» межатомных связей
Ме—Ме, переход атомов в
пограничный слой ртути и
образование новых меж-
атомных связей Ме—Ме. В
Рис. 20. Три стадии процесса раст-
ворения металла в ртути.
зависимости от сродства
металла к ртути могут образовываться различные типы свя-
зи между металлом и ртутью [2].
На третьей стадии растворенные атомы металла диффун-
дируют в объем раствора через пограничный слой жидкой
ртути. Процесс растворения металла в ртути схематически
изображен на рисунке 20.
Скорость процесса растворения будет определяться самой
медленной стадией. Для металлов с ненасыщенной металли-
ческой связью и неокисленной поверхностью смачивание
протекает с высокой скоростью, и поэтому первая стадия не
будет лимитировать переход металла в ртутную фазу. Для
элементов с ковалентным характером межатомной связи и
малой долей металлической насыщенной связи именно пер-
вая стадия может оказаться лимитирующей.
Для металлов скоростьопределяющими стадиями могут
явиться вторая или третья. Рассмотрим основные кинетиче-
ские зависимости растворимости металлов в ртути, которые
применимы и для растворимости твердых металлов в жид-
ких. Если в системе II (рис. 20) кинетика растворения лими-
тирует скорость процесса, то, согласно [15,102,103], резуль-
тирующую скорость dN/dt поступления в ртутную фазу ато-
мов металла можно представить следующим уравнением:
dN/dt = kfi* S—k2CS,
о
(1-37)
где k\, k2 — константы скорости прямой и обратной реакции,
численно равные частоте, с которой атомы растворенного ме-
69
талла поступают в ртутную фазу или выделяются на поверх*
ности раздела фаз; C°s — число атомов на единицу площа-
ди границы твердого металла и ртути; С — концентрация
атомов растворенного металла в ртути; S — поверхность
раздела фаз Me—Hg.
При насыщении раствора металлом C-+Cs скорость по-
ступления атомов металла в раствор
dN/'dt = О
и, следовательно,
*1^8 —
2 ся0’
(1-38)
(1-39)
где Cs — концентрация атомов металла в насыщенном ртут-
ном растворе (амальгаме).
Заменяя N на CV, где V — объем ртути, и используя
уравнение (I—39), получим из (I—37) следующее кинети-
ческое уравнение:
(1—40)
Дифференциальное уравнение (I—40) решаем оператор-
ным методом [104]:
рх=а 1—’
(1-41)
где п=^С° (4 ); х^С; b=C°s *
Решая уравнение (I—41) относительно х, получаем вы-
ражение, называемое в операторном методе изображением
а
(1-42)
которому отвечает оригинал
— е ъ ).
(1—43)
Подставляя в (I—43) значения а и Ь, получим
Г
60
ИЛИ
(1—44)
4
с°
8
(1-45)
После некоторых преобразований получаем уравнение,
удобное для обработки экспериментальных данных:
где k\ — константа скорости реакции растворения металла
в ртути, равная произведению частоты актов отрыва атомов
металла от поверхности твердой фазы (fej) на отношение
атомной плотности этой поверхности к средней равновесной
растворимости металла в ртутной фазе.
Если скорость растворения металла лимитируется ско-
ростью диффузии, то число атомов, перешедших в раствор в
единицу времени, будет равно произведению коэффициента
их диффузии в ртути (D) на площадь границы раздела твер-
дой и жидкой фаз (S) и градиент концентрации растворен-
ного металла в пограничном слое и растворе:
с
dN/dt = DS , (1—47)
где б — толщина пограничного слоя.
В этом случае уравнение для скорости изменения кон-
центрации примет вид
dC _ DSCQs DSC
dt W SF ’
или, после преобразований,
Решая дифференциальное уравнение (I—49)
(1-48)
(1-49)
оператор-
ным методом, получим уравнение
а-50)
61
которое после преобразований примет вид
(1-51>
В случае смешанного контроля скорости растворения ме-
талла в ртути кинетическое уравнение имеет вид
С* D
—— с* 1! (—4
C°s) V I ’
(1-52)
Анализ уравнений (I—46), (I—51) и (I—52) показывает,
что кинетика растворения металла в ртутной фазе носит экс-
поненциальный характер независимо от того, какая стадия
является скоростьопределяющей. Отличие заключается лишь
в одном из сомножителей показателя экспоненты. При кине-
тическом контроле он равен , диффузионном —
C}D / T)C*Yk£\ -В
ZM5 и при смешанном контроле—/ ------^—5-.
Эти сомножители и являются константами скорости раство-
рения металла в ртути или твердого металла в жидкой части
металла [15]. Поэтому кинетическое уравнение растворения
металлов может быть представлено в общем виде:
(I-53)
(J
Следовательно, из линейной зависимости In (1— —)—t
нельзя делать вывод о скоростьопределяющей стадии раство-
рения металла в ртути. Анализ уравнений (I—46), (I—50) и
(I—52) показывает, что скорость растворения металлов в
ртути должна зависеть от величины поверхности раздела
фаз Ме—Hg, объема ртути и физических свойств металлов.
Более того, поскольку k\ обратно пропорциональна числу
связей в твердом металле, разрываемых при переходе по-
верхностного атома в раствор, то, согласно [102], можно
ожидать, что скорость обмена атомами растворяемого метал-
ла между жидкой и твердой фазами, если они находятся й
равновесии, для различных кристаллических плоскостей
будет различна. Поэтому для различных граней монокри-
сталла должна наблюдаться разная скорость растворения
62
металла. Действительно, в работе [96] было показано, что*
скорость растворения монокристалла цинка в ртути по ба-
зисной плоскости, параллельной основному направлению-
кристалла, меньше, чем скорость растворения граней, пер-
пендикулярных к основному направлению. По данным [96],.
это объясняется тем, что в первом случае разрывается де-
вять межатомных связей в твердом цинке, тогда как во вто-
ром случае — семь или восемь связей. Теплота сублимации
для атомов плоскости, параллельной основному направле-
нию роста кристалла, имеет более высокое значение. Оче-
видно, должна существовать корреляция между энергией
кристаллической решетки и скоростью растворения метал-
ла в ртути.
Анизотропия растворения монокристаллов цинка в рту-
ти при диффузионном контроле наблюдалась также автора-
ми [105]. Было обнаружено, что базисная грань цинкового
диска, параллельная подвергаемой растворению торцевой по-
верхности, растворяется в 1,60 ±0,08 раз медленнее, чем
перпендикулярная.
При изучении растворения свинца [97, 98], цинка, сереб-
ра и олова [96] в ртути было установлено, что скорость раст-
ворения свинца, олова и серебра лимитируется диффузион-
ными ограничениями, а скорость растворения цинка в рту-
ти протекает со смешанным контролем. По данным [105],.
растворение цинка в ртути при 30 и 50°С и со ^2100 об/мин
протекает в диффузионном режиме. Процесс растворения
цинка в ртути проходит в кинетической области лишь при
—36°С и со~9000 об/мин. Интересно, что при растворении
цинка в 1,7 вес. % амальгаме базисная грань растворялась в
кинетическом режиме при более высокой температуре (30°) и
меньшей скорости вращения диска (со^бООО об/мин).
В работе [105] получили дальнейшее развитие представ-
ления о механизме растворения цинка в ртути с участием
зародышей растворения.
Интересные данные по кинетике растворения цинка, се-
ребра и олова в ртути при температурах 3-?45°С были полу-
чены Гинзнером и Стевенсоном [96]. Ими показано, что при
растворении образцов цинка, серебра и олова даже со скоро-
стью вращения 4000 об/мин не наблюдается линейная зависи-
мость 1п(1—С/С^8)— f-—-) t и, следовательно, константа ско-
рости растворения уравнения (I—53) fei не является постоян-
ной величиной. На рисунке 21, а приведена зависимость
скорости растворения цинка в ртути при разных скоростях
вращения образцов цинка и температуре 3 и 45°С. Как вид-
63;
по, зависимость ln(l—C/C°)— t не отвечает линейной.
Авторы полагают, что в процессе растворения не достигает-
ся межфазовое равновесие на границе металл — ртуть и,
кроме того, толщина пограничного слоя б не остается посто-
Рис, 21. Зависимость скорости растворения цинка в ртути от скорости
вращения образцов и температуры, а — 1п(1—CjC® _б —
янной и возрастает в процессе растворения металла. С уче-
том изменяющегося значения 6 и инерции пограничного
слоя 6 Гинзнером и Стевенсоном было получено уравнение,
согласующееся с экспериментальными данными (см.
рис. 21, б):
In (1- Ш *4 (1-54)
Показано, что если на вращающийся образец цинка,
олова или серебра воздействовать ультразвуковыми колеба-
ниями, то зависимость 1п(1—С/С°)— также будет ли-
нейной. Очевидно, в этом случае очень быстро устанавлива-
ется равновесие на границе раздела фаз Me—Hg и толщина
пограничного слоя (б) не зависит от времени растворения ме-
талла в ртути.
Интересные результаты получили А. С. Мошкевич и
А. А. Ревдель при изучении скорости растворения свинца в
ртути от температуры с помощью вращающегося свинцового
диска [97]. Скорость растворения вращающегося диска при
.64
диффузионном
нию [106]
контроле должна подчиняться уравне-
J = ?(C°-C)=0,62D2 V1 V 2(Cs- С), (1—55)
где J — скорость растворения, г!см2-сек\ р — коэффициент
массопередачи, см/сек; у — кинематическая вязкость раст-
ворителя, см2) сек \ о) — угловая скорость вращения диска,
сек~}; С и Cs — текущая и насыщенная
воряющегося металла, г/см?.
На рисунке 22 приведена за-
концентрация раст-
висимость скорости растворения
свинца в ртути при различных
температурах от скорости вра-
щения диска. Как видно, ско-
рость растворения свинца в рту-
ти растет с увеличением интен-
сивности перемешивания, что
указывает на протекание процес-
са в диффузионной области. Дан-
ные также показывают, что при
увеличении скорости вращения
(кривые 1 и 2) происходит пере-
ход от прямолинейной зависи-
мости J от У® к криволинейной
с возрастающим углом наклона.
Отклонение от прямолинейной
зависимости начинается при ско-
ростях около 500 об!мин. хотя
ламинарный режим перемешива-
ния в условиях эксперимента ав-
торов должен был смениться на
0 5 W
Рис. 22. Зависимость ско-
рости растворения свинца
в ртути (J-104, г/см3 сек)
от температуры и скорости
вращения диска (
сек-11ч); температура, °C:
1-----36, 2-----15, 3 —
0, 4—15, 5 — 25, 6—50.
турбулентный лишь при 750—800 об) мин.
Рассчитанная из зависимости lg J—1/Т кажущаяся энер-
гия активации оказалась близкой к 500—600 кал!моль, что
также указывает на диффузионный контроль растворения
свинца в ртути.
Интересные данные о значениях энергии активации ра-
створения олова, серебра и цинка в ртути получены в рабо-
те [96]. По данным [96], зависимость скорости растворения
металла в ртути от температуры при постоянном числе
Рейнольдса отвечает следующему уравнению:
In ki'=—b'
(1—56)
где АЕ3=(1—Ь)ДЕ! — ЬДЕ2 — общая энергия активации про-
5-122
65
цесса растворения; Ь' и b — постоянные; Л£7| — энергия ак-
Г УЕ
тивации коэффициента диффузии D = Doexp —
-LV X
Д£2-
/ЛЕ2\
энергия активации вязкости v=vOexpi — •
Следовательно, определив общую энергию активации
Ай3 из данных Infe'i—1/Т и зная величину активации диф-
фузии ДЕ], можно рассчитать энергию активации вязкости
Дй2, и наоборот. В работе [96] с использованием значений
Айз и литературных данных о величине Дй2 были рассчита-
ны значения энергии активации диффузии Ай] для цинка,
олова и серебра в ртути.
В заключение следует отметить, что в настоящее время
известно весьма ограниченное количество данных о кинети-
ческих закономерностях растворимости металлов в ртути.
Определены кинетические характеристики растворения в
ртути свинца, олова, серебра и цинка — металлов, обладаю-
щих относительно слабой кристаллической решеткой и ма-
лой энергией межатомной связи Me—Me. По-видимому, для
выявления систем с кинетическим контролем скорости раст-
ворения металла в ртути необходимо исследовать металлы с
прочной кристаллической решеткой и высокой энергией меж-
атомной связи Me—Me.
♦♦♦
ТЕРМОДИНАМИЧЕСКИЕ
СВОЙСТВА амальгамных систем
БИНАРНЫЕ АМАЛЬГАМНЫЕ СИСТЕМЫ
Для разработки технологии получения редких и туго-
плавких электроотрицательных металлов методами амаль-
гамной металлургии необходимы знания о физико-химиче-
ских и термодинамических свойствах амальгамных систем,
позволяющие судить о характере межчастичного взаимодей-
ствия и состояния металлов в амальгамах. Исследованием тер-
модинамических и физико-химических свойств сплавов и
сопоставлением кривых состав — свойство с диаграммами
состояния установлено существование тесной взаимосвязи
между ними [2, 28, 107—116]. Как правило, если диаграм-
ма состояния указывает на образование компонентами сис-
темы интерметаллических соединений и промежуточных
фаз, то термодинамические свойства таких систем в жидком
состоянии свидетельствуют об отрицательных отклонениях
от законов идеальных растворов. Обычно смешение компо-
нентов таких систем проходит с выделением тепла. Термоди-
намические свойства эвтектических систем обнаруживают
положительные отклонения от идеального поведения, их
образование сопровождается поглощением тепла. Сопостав-
ление термодинамических и физико-химических свойств
жидких и твердых сплавов и амальгам позволяет установить
взаимосвязь между структурами твердого и жидкого состо^-
67
ния [2, 107—109j. Исследованиями многих авторов доказа-
но соответствие структуры жидких и твердых сплавов и
сохранение упорядоченности типа соединения в жидких
сплавах при температурах, значительно превышающих тем-
пературы плавления соединений [108]. Закономерности
образования интерметаллических соединений в амальгамах
и некоторых металлических сплавах будут приведены в гла-
ве III. Здесь рассмотрим термодинамические свойства бинар-
ных и тройных амальгамных систем и их взаимосвязь с
физико-химическими свойствами.
Система In—Hg. Изучению строения диаграммы со-
стояния системы индий — ртуть посвящен ряд работ [28,
110—113]. Результаты исследований разных авторов соста-
ва образующихся соединений в этой системе не совпадают б 7.
В последние годы наиболее достоверные данные о строении
диаграммы состояния системы и состава интерметалличе-
ских соединений получены в работах [28, 113]. Показано,
что в системе индий — ртуть образуются два конгруэнтно
плавящихся соединения: InHge и InHg и два инконгруэнтно
плавящихся соединения: InHg4 и InnHg.
Термодинамические свойства бинарной системы индий—
ртуть исследованы в ряде работ [107, 114—116]. Авторами
[116] термодинамические свойства изучались методом э. д. с.
в интервале температур 0—75°С. Было обнаружено, что ак-
тивности индия и ртути проявляют отрицательные отклоне-
ния от законов идеальных растворов. С повышением темпе-
ратуры активности компонентов очень мало изменяются.
Максимальное значение интегрального изобарно-изотерми-
ческого потенциала системы индий — ртуть наблюдается при
составе 50 ат. % индия и равно AZ = —925 кал!г • атом при
75°С. Избыточный изобарно-изотермический потенциал сис-
темы индий — ртуть показывает отрицательное отклонение
от идеального поведения. В работе [116] были определены
термодинамические свойства бинарной системы индий —
ртуть методом измерения давления пара ртути при темпе-
ратурах 289, 331, 338 и 423°С. Активность ртути в жидких
сплавах индия с ртутью показывает во всем интервале со-
ставов и температур отрицательное отклонение. Активность
индия также проявляет отрицательные отклонения от зако-
нов идеальных растворов.
Методом измерения давления пара были определены тер-
модинамические параметры бинарной системы индий —
ртуть в интервале 150—250°С и рассчитаны активность рту-
б 7 Наиболее полная библиография по этой системе приведена в ра-
v *«
68
ти, интегральный изобарно-изотермический потенциал би-
нарной системы индий — ртуть [114] • Экстремальные зна-
чения термодинамических функций наблюдаются при соста-
ве N in =0,5. Энтропия смешения была рассчитана с учетом
упорядоченности. Все термодинамические функции указы-
вают на существование отрицательного отклонения от зако-
нов идеальных растворов, обусловленное взаимодействием
компонентов в жидком состоянии.
Интегральная энтальпия растворения индия в ртути при
различных температурах (40, 100, 150, 160°С) была опреде-
лена калориметрическим методом Клеппа [115]. Автор по-
казал, что растворение индия в ртути сопровождается выде-
лением тепла и мало зависит от температуры.
Калориметрические исследования жидких амальгам ин-
дия при температуре 200°С были проведены Шайдтом [116]
в интервале составов 0,05—0,95 ТУщ. Максимальное значение
энтальпии смешения наблюдается при iVin =0,5 и составля-
ет 523 кал!г • атом. Сопоставление энтальпии смешения
системы индий — ртуть при 160 и 200°С указывает на неза-
висимость теплоты растворения индия в ртути от температу-
ры. Последний факт свидетельствует о
межатомного взаимодействия в системе
индий — ртуть не изменяется при повы-
шении температуры.
Термодинамические функции жид-
ких сплавов системы индий — ртуть,
представленные на рисунке 23, показы-
вают отрицательное отклонение от
идеального поведения растворов. Обра-
зование интерметаллических соедине-
ний в твердых сплавах отражается и на
термодинамических свойствах жидких
индиевых амальгам — экзотермический
эффект растворения индия в ртути, от-
рицательные отклонения активности от
законов идеальных растворов и др. Оче-
видно, в жидкой индиевой амальгаме
сохраняется межатомное взаимодейст-
вие компонентов с образованием струк-
турных групп интерметаллических со-
Рис. 23. Термодинамические свойства бинарной
системы In.—Hg. 1 — наши данные для 300°С;
2 — данные [115] для 284°С; 3— расчетная
кривая по теории М. И. Усановича; 4 — \Н —
данные [116] для 423°С.
том, что характер
69
единений. Как будет показано в главе III, в жидкой фазе
системы индий — ртуть образуется интерметаллическое со-
единение InHg3 с константой диссоциации KD =5,6-10-2.
Согласно теории растворов М. И. Усановича [107], при учете
химического взаимодействия компонентов для характери-
стики зависимости свойств растворов от состава могут быть
применены законы идеальных растворов. Действительно,
если в системе In—Hg образуется интерметаллическое соеди-
нение InHge, то при учете истинных концентраций индия,
ртути и соединения InHg3 в системе In—Hg мы должны по-
лучить изотермы активности, совпадающие с эксперимен-
тально определенными. Результаты расчетов приведены на
рисунке 23. Как видно, расчетная кривая активности индия
в системе In—Hg очень хорошо совпадает с эксперименталь-
ной.
Физико-химические свойства амальгамы индия были
изучены в ряде работ [117—121]. По данным Брэдли [119],
электросопротивление индиевых амальгам плавно изменяет-
ся с изменением состава амальгам. Такой же характер изо-
термы электросопротивления жидких амальгам индия был
установлен и авторами [120]. В работе [121] определена
температурная зависимость вязкости и электросопротивле-
ния амальгам индия в широком интервале составов. При
измерении вязкости жидких амальгам (7’пл сплайа+50°С) си-
стемы индий — ртуть на кривых состав — свойство обнару-
жено два максимума. Первый максимум соответствует соста-
ву сплава с содержанием индия, близким к 20 ат.%, а вто-
рой — при 60 ат. % индия. Диаграмма состояния системы
индий — ртуть указывает на существование в области, близ-
кой к этим составам (20 и 60 ат. %), интерметаллических
соединений InHg6, InHg4 и InHg. С повышением температу-
ры максимум на кривой вязкость — состав, соответствующий
соединению InHg, несколько сглаживается, а максимум в
области составов, близкой к 20 ат.%, практически не изменя-
ется. Это свидетельствует об образовании прочного интерме-
таллического соединения InHgx , слабо диссоциированного в
жидком состоянии.
При изучении температурной зависимости электросопро-
тивления индиевых амальгам на кривых состав — свойство
не обнаружено ярко выраженных особых точек. Результаты
[121] показывают, что вязкость является более структурно-
чувствительным свойством амальгам, чем электросопротив-
ление.
Система Cd—Hg. Диаграмма состояния данной сис-
темы (см. рис. 10) указывает на существование двух проме-
жуточных фаз — при температурах — 34 и 188°С, образую-
70
щихся в результате перитектических реакций [24, 122]. Тер-
модинамические свойства жидких амальгам кадмия изуча-
лись многими исследователями [123—131], Для изучения
термодинамических свойств системы кадмий — ртуть были
использованы следующие методы: э. д. с., измерение давле-
ния пара ртути и калориметрический [123, 126—131].
Методом э. д. с. система была изучена Билем [123] в
интервале температур 26, 50, 75°С во всем интервале соста-
вов амальгам. Автором установлены границы фазовых пре-
вращений, которые хорошо совпадают с диаграммой состоя-
ния [24]. В работе [1, 130—132] из значений э. д. с. рассчи-
таны термодинамические функции системы кадмий — ртуть
в зависимости от температуры. Характер изменения термо-
динамических свойств твердых амальгам аналогичен тако-
вому для жидких амальгам.
Авторы работ [126—128, 131] определили термодинами-
ческую активность ртути в системе кадмий — ртуть методом
давления пара в интервале температур от 275 до 4003С.
Калориметрические определения теплот смешения были
проведены Клеппа при 100 и 150°С и
Шайдтом для 330°С [116, 129].
Активности кадмия и ртути в жид-
ком состоянии показывают отрицатель-
ные отклонения от закона Рауля. Интег-
ральный избыточный изобарно-изотер-
мический потенциал7а в данной систе-
ме имеет отрицательное значение во
всем интервале составов амальгам, и
максимальное значение AZ* состав-
ляет— 450 кал/г-атом при Ned=ОД По
данным калориметрического определе-
ния [116], смешение кадмия и ртути про-
ходит с выделением тепла. Максималь-
ное значение экзотермического эффекта
при Ncd—0,5 составляет — 600 кал/г-
•атом. Энтропия смешения во всем ин-
тервале составов амальгам имеет поло-
жительное значение и несколько мень-
ше идеальной энтропии.
Рис. 24. Термодинамические свойства бинарной
системы Cd—Hg. 1 —наши данные для 300°С;
2 —данные [132] для 325°С; 3 — данные [115]
для 423°С; ДН — данные [116] (здесь и на
рис. 26, 28 и 29).
7а Звездочка AZ* на рисунках обозначает избыточную термодина-
мическую функцию.
71
Наиболее достоверные термодинамические функции жид-
ких сплавов системы кадмий — ртуть приведены на рисун-
ке 24. Характер изменения термодинамических свойств жид-
ких амальгам кадмия указывает на существование ближней
упорядоченности типа соединения в жидком состоянии.
Данные по электросопротивлению жидких амальгам кад-
мия приведены в работах [134, 135]. На изотерме электросо-
противления наблюдаются аномалии при 25 и 40 и 65 и
75 ат. % Hg. Вязкость жидких амальгам кадмия была опре-
делена в очень узком интервале составов [133].
Система Т1—Hg. В системе таллий — ртуть, согласно
диаграмме состояния, образуется соединение TlgHgs с тем-
пературой плавления 14°С (см. рис. 10) [24, 136, 137]. Тер-
модинамические свойства амальгам таллия изучены рядом
авторов с использованием методов э. д. с., измерения давле-
ния пара ртути и калориметрического [138—147]. Заслу-
живают внимания классические исследования Ричардса и
Дэниэля [141] по определению термодинамических свойств
амальгам таллия методом э. д. с.
Методом измерения э. д. с. концентрационной цепи типа
Т1 | Т1С1О4—0,1М; NaC104—0,9М | TlHgx (И—1)
была определена активность таллия в интервале состава
амальгам от 0,1 до 0,5 A^ti при температурах 20—80°С
[145]. При этих условиях активность таллия проявляет зако-
номерное отклонение от законов идеальных растворов. Тер-
модинамические свойства жидких сплавов системы таллий—
ртуть при 284 и 423°С изучены Пределем и Ротхаккером
[147]. Термодинамические параметры рассчитывали из дан-
ных давления пара ртути амальгам при 284 и 423°С. В этой
системе изотермы активности Т1 и Hg показали незначитель-
ные отрицательные отклонения от законов идеальных раст-
воров. Избыточный изобарно-изотермический потенциал
жидких амальгам таллия имеет отрицательное значение.
Максимальное значение AZ* составляет — 118 кал/г«атом
при ЛГТ1 =0,30. При определении теплоты растворения тал-
лия в ртути в зависимости от температуры было установле-
но, что энтальпия смешения сильно зависит от температуры
в интервале 100—150°С [129]. Смешение компонентов (тал-
лия и ртути) при 332°С проходит с выделением незначитель-
ного количества тепла, максимальное значение наблюдается
при составе Nti =0,2—0,3, ДН=—120 кал/г-атом, т. е. в
области состава амальгам, соответствующей интерметалли-
ческому соединению ThHgs по диаграмме состояния [116].
Зависимость термодинамических характеристик системы
таллий—ртуть от состава приведена на рисунке 25.
72
Значительное изменение термодинамических характерис-
тик системы таллий — ртуть с повышением температуры
обусловлено изменением структуры таллиевых амальгам с
температурой. Анализ рентгенограмм и изотерм вязкости и
электропроводности амальгам системы таллий — ртуть так-
же показывает, что с повышением
температуры структура жидкости
изменяется. Было установлено, что
рентгенограммы ртути и жидкого
таллия почти не различаются меж-
ду собой. Обнаруженное значитель-
ное отличие рентгенограммы интер-
металлического соединения TlsHgs
при температуре, близкой к темпе-
ратуре плавления TlsHgs, и рентге-
нограмм исходных металлов связа-
но с образованием новой структу-
ры жидкости. При повышении тем-
пературы рентгенограмма интерме-
таллического соединения изменяет-
ся и приближается к рентгенограм-
ме ртути и жидкого таллия [148,
149]. Фрост и Смалман также по-
казали, что повышение температу-
ры на 3°С по сравнению с темпера-
турой плавления ThHgs приводит
к полному распаду этого соедине-
ния [18]. Данные по электропро-
водности твердых и жидких амаль-
гам таллия указывают на измене-
ние структуры таллиевых амаль-
гам. На изотерме электропроводно-
сти при температуре ниже точки
плавления интерметаллического
соединения ThHgs наблюдаются
|.от
400
i 600
« -800
’.о
0.8
г ае
<=» а*
о
О 0,2 0.4 0,8 0.8 <0
Nn
Рис. 25. Термодинамиче-
ские свойства бинарной
системы Т1 — Hg. по
данным работы [115].
максимумы при составе, отвечающем этому соединению.
С повышением температуры максимум на изотерме электро-
проводности сглаживается [1, 151]. Термодинамические
свойства амальгам таллия свидетельствуют о незначитель-
ной упорядоченности типа соединений в жидком состоянии.
Система РЬ—Hg. Диаграмма состояния бинарной си-
стемы свинец — ртуть (см. рис. 10) указывает на образова-
ние соединений по перитектической реакции в области соста-
вов, богатых свинцом [24].
Первые исследования по определению активности ртути
в бинарной системе свинец — ртуть статическим методом из-
73
мерения давления пара ртути при 324°С были проведены
Гильдебрандом с сотр. [131]. Авторы рассчитали активность
ртути во всем интервале составов амальгам для 324°С. Изо-
термы активности жидких свинцовых амальгам показывают
положительные отклонения от законов идеальных растворов.
Активность свинца в амальгамах с содержанием свинца
больше 0,6 Л^рь отвечает законам идеальных растворов. Бо-
лее поздние исследования по определению активности ртути
в жидких сплавах системы свинец — ртуть методом измере-
ния давления пара ртути [147, 152] подтвердили результаты
авторов [131]. Методом э. д. с. были изучены термодинами-
ческие свойства твердых и жидких амальгам в зависимости
от температуры (25—250°С) и состава амальгам [153]. При
измерении э. д. с. амальгамных концентрационных цепей в
системе свинец — ртуть
РЬ | РЬ2+, электролит [ Pb(Hg)x (II—2)
наблюдается постоянное значение электродвижущей силы
цепи в интервале составов амальгам 1,9—66,1 ат. % РЬ при
25°С, что находится в хорошем согласии с границами фазо-
вых превращений диаграммы состояния системы свинец —
ртуть. Изотермы активности свинца в твердых амальгамах
при 25, 50, 75°С характеризуются постоянным значением (от
0,02 до 0,5 2Vpb ).
В ряде работ [116, 129] были проведены калориметриче-
ские исследования растворения свинца в ртути при различ-
ных температурах.
Термодинамические функции жидких сплавов системы
свинец — ртуть, рассчитанные из значений э. д. с., давления
пара и калориметрических определений для области амаль-
гам с Nng >0,5, проявляют положительные отклонения от
законов идеальных растворов. Избыточный изобарно-изотер-
мический потенциал жидких свинцовых амальгам имеет
положительное значение во всем интервале составов амаль-
гам. Максимальное значение AZ* — +250 кал!г-атом. На
изотерме активности ртути при NRg =0,2 [152] наблюдает-
ся незначительное отрицательное отклонение. В этой области
на диаграмме состояния происходит образование интерме-
таллического соединения PbsHg. Только в этом интервале
составов амальгам энтальпия смешения характеризуется
очень незначительным экзотермическим эффектом порядка
—7 кал/г-атом [129]. В области амальгам, богатых
ртутью, смешение компонентов проходит с поглощением
тепла. Энтропия смешения имеет положительное значение.
74
Зависимость термодинамических свойств системы свинец —
ртуть от состава показана на рисунке 26.
Данные термодинамических свойств жидких сплавов би-
нарной системы свинец — ртуть указывают на незначитель-
ное влияние структуры твердых раство-
ров на строение жидких амальгам. Бо-
лее глубокое представление о строении
жидких сплавов можно получить из фи-
зико-химических свойств жидких амаль-
гам.
Авторы [154] определяли вязкость и
электросопротивление системы свинец —
ртуть безэлектродным методом во всем
интервале концентраций при температу-
рах 200—400°С. На изотермах удельно-
го электросопротивления сплавов систе-
мы свинец — ртуть наблюдается поло-
гий максимум при составе АРЬ ~0,67,
соответствующий соединению PbsHg при
200—250°С. При повышении температу-
ры до 350сС максимум на кривой удель-
ного электросопротивления исчезает.
Это свидетельствует об изменении струк-
туры жидкого сплава при увеличении
температуры. Изотермы вязкости также
указывают на существование очень не-
значительного максимума в интервале
состава интерметаллического соедине-
ния PbsHg. Термодинамические и физи-
ко-химические свойства жидких амаль-
гам свинца указывают на незначитель-
ное влияние структуры интерметалличе-
ского соединения в твердом состоянии
на строение жидких сплавов.
Система Sn—Hg. Диаграмма со-
стояния бинарной системы олово —
ртуть указывает на образование интер-
0 ОД 0.4 0,6 Cis <.0
%
Рис. 26. Термодинами-
ческие свойства бинар-
ной системы Pb—Hg.
□У— наши данные для
300°С; 2-- данные [115,
132] для 321°С; 3-ДЯ -
данные [116].
металлического соединения по перитектической реакции
Sn4Hg (см. гл. I) [24]. Термодинамические свойства бинар-
ной системы олово — ртуть были исследованы различными
методами: э. д. с., измерением давления пара ртути, калори-
метрическим.
Гильдебрандом с сотр. [131] была впервые определена
активность ртути в оловянных амальгамах при +324°С ме-
тодом измерения давления пара ртути и отмечено положи-
тельное отклонение активности ртути от законов идеальных
75
растворов при Nsn ^0,5. В работе [155] измерены давления
пара ртути в бинарной системе олово — ртуть в зависимости
от температуры (275~300°С). Изменение давления пара рту-
ти с повышением температуры описывается уравнением пря-
мой :
lgP=A+B/T. (II—3)
Из тангенса угла наклона кривых зависимости lg Р—ЦТ
были рассчитаны дифференциальные теплоты испарения
0 0,2 0,4 0.8 0.8 4,0
Рис. 27. Термодинамиче-
ские свойства бинарной
системы Sn — Hg, по
данным [115, 158]. 1 —
284, 2—323, 3—423°С.
ртути. Величина коэффициента ак-
тивности ртути в системе олово —
ртуть указывает на существование
больших положительных отклоне-
ний от законов идеальных раство-
ров. Более полно термодинамиче-
ские свойства жидких оловянных
амальгам были изучены Пределом
и Ротхаккером [156] методом из-
мерения давления пара ртути при
температурах 187, 284, 423°С. По
данным этой работы, активность
ртути мало изменяется с темпера-
турой и показывает положительное
отклонение от идеального поведе-
ния. В работе [157] измерено дав-
ление пара ртути над жидкими
амальгамами олова при 453 и
5ОЗ°К. Данные работ [156, 157] со-
гласуются между собой. Термоди-
намические функции системы оло-
во — ртуть были изучены методом
э.д.с. [54, 158, 159].
Петет-Эрвас с сотр. ['54] изме-
рили э. д. с. концентрационных це-
пей в интервале температур 16,5—
72—220°С. Авторами была уточне-
на диаграмма состояния, а также
рассчитаны термодинамические
функции системы олово — ртуть.
Калориметрические определения теплот смешения оловян-
ных амальгам в зависимости от температуры были приведе-
ны в ряде работ [116, 129, 160—162]. Энтальпия смешения
жидких амальгам во всем интервале концентраций при
300°С была определена Шайдтом [116]. Термодинамические
функции жидких сплавов системы олово — ртуть (рис. 27)
указывают на существование положительного отклонения от
76
законов идеальных растворов. Максимальное значение теп-
лоты смешения составляет +213 кал/г-атом при NSn =0,3.
В области составов амальгам, богатых оловом, смешение
компонентов проходит с поглощением очень незначительно-
го количества тепла ( + 90 кал/г-атом при NSn =0,9). В этом
интервале составов образуется интерметаллическое соедине-
ние в твердом состоянии, но оно, вероятно, в жидком состоя-
нии непрочно и проявляется на термодинамических свойст-
вах амальгам олово — ртуть очень слабо (в виде малого теп-
лового эффекта). Данные физико-химических исследований
(вязкости и электросопротивления) жидких оловянных
амальгам также указывают на существование очень незна-
чительного взаимодействия между компонентами в системе
олово — ртуть [163]. На изотермах вязкости при 250 —300°С
наблюдается очень незначительный максимум в области
сплавов, богатых оловом. С повышением температуры (350—
400°С) максимум на кривой сглаживается. На кривой элект-
росопротивление — состав максимум также наблюдается
при 2Vsn ^0,7—0,78. Существование в твердом состоянии
у-фазы проявляется при температурах 250—300°С. Однако
при дальнейшем повышении температуры структура жидких
амальгам олова представляет собой разупорядоченное рас-
пределение разнородных атомов.
Система Bi—Hg. Данная система относится к простой
эвтектической системе (см. рис. 10). Эвтектика наблюдается
вблизи чистой ртути [24].
Истман и Гильдебранд определили активность ртути при
321°С в системе висмут — ртуть методом измерения давле-
ния пара ртути [164] и показали, что активность ртути при
Nng >0,6 проявляет положительное отклонение от законов
идеальных растворов, а при Nbi >0,4 поведение висмута в
амальгаме следует идеальному раствору. Аналогичные ре-
зультаты были получены и другими авторами [128].
Система висмут — ртуть была исследована методом э. д. с.
в области разбавленных амальгам при температурах 20—
80°С. Изотермы активности висмута показывают положи-
тельное отклонение от идеального поведения. В более широ-
ком интервале составов и температур данная система была
изучена французскими исследователями [165, 166]. В рабо-
те [167] термодинамические свойства амальгам висмута бы-
ли также изучены методом э. д. с. при различных температу-
рах. Активность висмута характеризуется значительными
положительными отклонениями при низких температурах
(25—100°С). С повышением температуры система прибли-
жается к идеальной кривой Рауля. В области, богатой
ртутью, при 420°С наблюдаются незначительные положи-
77
гам висмута были
о ОД ОД ОД ОД 1,0
Рис. 28. Термодинамиче-
ские свойства бинарной
системы Bi—Hg. 1 —
наши данные для 300°С;
2 — данные [164] для
32ГС; 3 — данные
[115] для 423°С.
тельные отклонения, и при Nbi >0,3 амальгама висмута
подчиняется законам идеальных растворов [169]. Калори-
метрические определения теплот смешения жидких амаль-
проведены в работе Клеппа для 100 и
150°С [129] для сплавов, жидких при
этих температурах. Шайдт провел
калориметрическое исследование во
всем интервале составов амальгам
висмута при 330°С [116].
Термодинамические параметры си-
стемы висмут — ртуть (рис. 28): из-
быточный изобарно-изотермический
потенциал, интегральная энтальпия
и энтропия смешения, активности
компонентов свидетельствуют о поло-
жительном отклонении от закона Рау-
ля. Смешение висмута и ртути прохо-
дит с поглощением тепла [116, 169].
Максимальный эндотермический
эффект составляет АН =+112 кал!г-
•атом при ^вi = 0,4 [116]. Избыточ-
ная энтропия смешения системы вис-
мут — ртуть характеризуется незна-
чительным отрицательным отклоне-
нием. Это, вероятно, обусловлено на-
личием разницы в атомных радиусах
компонентов [129].
Система Zn—Hg. В системе
цинк — ртуть (см. рис. 10) образуют-
ся две промежуточные фазы: р-фаза,
устойчивая только при температурах
20сС, и у-фаза (ZnsHga), распадающая-
ся при температуре выше 42,9°С
[24, 170].
Термодинамическая активность
ртути в бинарной системе цинк —
ртуть для 325°С была определена
Гильдебрандом методом измерения
давления пара ртути. Положительное отклонение в системе
цинк — ртуть [171] автор объяснил предположением об
ассоциации атомов цинка по уравнению 2Zn Zn2.
Динамический метод измерения давления пара ртути в
системе цинк — ртуть для сплавов 0,16—0,56 NZn при тем-
пературе 284°С был использован в работе [126].
Ряд авторов проводили исследования методом э. д. с. в
области разбавленных амальгам [172—174] и при темпера-
78
турах 0—36сС. В разбавленных амальгамах активность цин-
ка показала положительные отклонения от закона Рауля
[175].
В работе [176] были определены термодинамические
функции бинарной системы цинк — ртуть изотенископным
методом определения давления пара ртути при 325°С. В ре-
зультате этих исследований рассчита-
ны термодинамические функции дан-
ной системы. Активности ртути в
амальгаме показывают небольшие
положительные отклонения от иде-
ального поведения растворов.
Калориметрическое определение
теплоты смешения системы цинк —
ртуть было проведено Клеппа, Витти-
том и Шайдтом [116, 129, 162]. Клеп-
па была получена интегральная эн-
тальпия смешения сплавов с содержа-
нием цинка -^"zd =0,03—0,09 при
100°С и для 2V*zn =0,03—0,29 при
150°С. В этих исследованных облас-
тях составов амальгам цинка смеше-
ние компонентов проходит с поглоще-
нием тепла.
Шайдтом была определена тепло-
та смешения системы цинк — ртуть в
широком интервале составов амаль-
гам при температуре 335°С. Макси-
мальное значение энтальпии смеше-
ния составляет+103 кал/г-атом при
Nzn=0,3. Парциальная энтальпия сме-
шения цинка при Azn=0,5—0,9 ха-
рактеризуется очень незначительным
экзотермическим эффектом (Azn=
= 0,7, A2?zn =—23 кал/г-атом), кото-
рый обусловлен существованием у-фа-
зы в этой области составов амальгам.
Шейлем [177] показана возможность
Рис. 29. Термодинами-
ческие свойства бинар-
ной системы Zn—Hg.
1 — паши данные для
325°С; 2 — данные
[1711.
расчета энтальпии смешения жидких
сплавов системы цинк — ртуть из данных диаграммы состоя-
ния. Расчетные данные хорошо согласуются с эксперимен-
тальными.
Энтропия смешения системы цинк — ртуть, найденная
путем сочетания данных изобарно-изотермических потен-
циалов, полученных методом измерения давления пара рту-
79
ти, и данных калориметрического определения теплоты сме-
шения, имеет положительное значение и проходит несколько
ниже идеальной энтропии смешения.
Рис. 30. Термодинамиче-
ские свойства бинарной
системы Ga—Hg, по дан-
ным работы [179],для: 1—
187, 2—284, 3—423°С, 4 —
наши данные для 300°С.
Термодинамические
Термодинамические функции
жидких сплавов системы цинк —
ртуть указывают на хаотическое
распределение разнородных ато-
мов. Зависимость термодинамиче-
ских свойств компонентов системы
цинк — ртуть от состава приведена
на рисунке 29.
Структура и физико-химические
свойства амальгам цинка методом
рентгеноструктурного анализа и
вязкости изучались в очень узком
интервале составов (0—20 вес.%)
для температур от 15 до 140°С
[133, 178]. На изотерме вязкости
не были обнаружены максималь-
ные точки в этом интервале соста-
вов амальгам цинка. Анализом
дифракционных картин и расче-
том координационного числа на
кривой радиального распределения
установлено хаотическое распре-
деление атомов разных сортов.
Совокупность данных относи-
тельно термодинамических и фи-
зико-химических свойств жидких
амальгам цинка указывает на то,
что структура твердых сплавов р-
и у-фаз не отражается на структу-
ре жидких сплавов системы
цинк — ртуть.
Система Ga—Hg. Для нее ха-
рактерна несмешиваемость компо-
нентов в жидком состоянии (см.
рис. 10) [56]. Полная смешивае-
мость галлия с ртутью с образова-
нием изоморфной смеси в жидком
состоянии наблюдается при крити-
ческой температуре 204°С.
свойства бинарной системы гал-
лий — ртуть были изучены методом э. д. с. при температуре
210—250°С [179], рассчитаны термодинамические функ-
ции.
80
Предель и Ротхаккер исследовали термодинамические
функции этой системы в зависимости от температуры мето-
дом измерения давления пара ртути над таллиевыми амаль-
гамами [156]. Авторами были получены значения активно-
сти ртути для жидких сплавов ртуть — галлий в широком
интервале составов при 423, 284 и 187°С (рис. 30).
Нами была исследована данная система изотенископным
методом измерения давления пара ртути в интервале 260—
300°С. Активность ртути показывает положительное откло-
нение в интервале составов амальгам от 0,3 до 0,8 NGa
и мало зависит от состава сплава, что согласуется со
строением диаграммы состояния системы галлий —
ртуть.
Калориметрическое определение интегральной энтальпии
смешения данной системы было проведено Пределем и Мо-
зом [180] при температурах 230—240°С в широком интер-
вале составов. Максимальное значение энтальпии смешения
составляет ДН = 350 кал!г • атом. Энтропия смешения компо-
нентов системы галлий — ртуть значительно меньше энтро-
пии смешения идеального раствора, т. е. избыточная энтро-
пия системы отрицательна.
ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ
ХАРАКТЕРИСТИК МЕТАЛЛОВ
ЛО ЗНАЧЕНИЯМ ИХ РАСТВОРИМОСТИ В РТУТИ
Для расчета коэффициентов активности цинка, магния
золота, серебра, гадолиния и других металлов в ртути
(табл. 5) нами было использовано уравнение (I—23). Исход-
ными данными для расчета коэффициентов активности слу-
жили значения растворимости металлов в реальных амаль-
гамных системах и значения идеальной растворимости ме-
таллов в ртути, которые рассчитывали по уравнению
И. Ф. Шредера. Из таблицы 4 видно, что наименьшими зна-
чениями коэффициентов активности обладают магний и
цинк (2,718, 2,940 при 25°С), а наибольшим — хром, цирко-
ний, кобальт, железо и бериллий (9,457 • 1054-7,81 • 106 при
25°С). С повышением температуры коэффициенты активно-
сти уменьшаются. Причем характер изменения коэффициен-
тов с температурой зависит от природы металла системы
Me—Hg. Зависимость 1g уме—— линейна. На рисунке 31
приведена зависимость 1g уме в системе Me—Hg от энергии
взаимообмена QweHg> рассчитанной по уравнению из [67].
Как видно, зависимость Ig^Me от QMeHg отвечает двум кри-
вым. Верхняя кривая отражает зависимость 1g умэ —Фмен$
6—122
Й
Таблица 5
Зависимость коэффициентов активности металлов в системе
Me—Hg от температуры
Система Температура, °C
25 100 200 350
Zn-Hg 2,940 1,820 1,209 1,041
Mg-Hg 2,718 1,896 1,448 2,014
Au—Hg 14,16 8,09 5,05 1,020
Ag—Hg 43,82 18,39 9,30 3,030
Gd-Hg 65,37 35,52 25,53 10,81
Mn- Hg 179,81 52,46 23,10 8,25
u-Hg 195,63 88,23 36,60 16,61
Cu-Hg 340,36 116,75 57,40 27,00
Sm—Hg 287,44 135,64 72,24 38,86
Th-Hg 317,87 368,70 437,24 223,62
Nd—Hg 333,6 160,77 79,04 40,45
Ni—Hg 1,598-10* 5,664-103 2,142-Ю3 9,069-10»
Ti-Hg 2,116-IO4 1,805-IO4 7,745-IO3 l,826-103
Zr—Hg 1,267-Ю6 5,154-1(0* 1,858-104 1,061-IO4
Cr-Hg 9.457-106 5,139-10® 2,451-IO5 1,529-10®
Co—Hg 3,764-10® 1,369-10’ 3,087-IO5 3,694-10®
Fe-Hg 4,396-Ю® 1,758-10® 8,660-10® 4,648-10®
Be—Hg 7,812-10® 2,764-10® 1,943-IO6 1,387-IO4
** PJ1CV; 31..Зависимость IgYMe от энергий взаимообмена
/Л .ЧМеНс**:. 7[;; я..
8?3
для Zn, Au, Mn, Zr, Ti, Cr, Be, Fe и Co, а нижняя — Tl, Cd,
Ag, Cu, Ni. Данные рисунка показывают, что чем больше
энергия взаимообмена QweHg, тем выше величина IgyMe*
Образование интерметаллических соединений в системе
Ме—Hg приводит к уменьшению Ig^Me-
Из коэффициентов активности металлов в ртути при раз-
личных температурах может быть рассчитан избыточный
изобарный потенциал, который является мерой отклонения
системы от идеальности:
AZ* = RTlnyh
(П-4)
поскольку AZ* =Дгг—Д21и\ (II—5)
Таблица 6
Зависимость активности металлов и изобарно-изотермических
потенциалов металлов в ртути от температуры
Температура, °C
Система 25 100 200 350
ai ai <h AZj
Zn-Hg 0,391 -557,7 0,577 -407,6 0,656 -396,3 0,887 —148,6
Mg-Hg 0,223 -889,1 0,326 -830,8 0,467 -715,7 1,138 160,6
Au—Hg 0,265 -786,8 0,390 -698,1 0,631 -432,8 0,272 -1611,5
Ag—Hg 1,297 154,1 1,379 238,2 1,515 390,5 0.981 -23,1
Gd-Hg 0,208 -930,0 0,697 —267,’б 1,433 338,2 3,351 1497,9
Sm—Hg 7,991 1230,8 10,17 1719,3 11,12 2264,2 12,43 120,7
Nd—Hg 11,022 1420,9 11,704 1823,2 12,88 2402,4 13,47 3219,2
Mn-Hg 1,199 107,6 1,271 177,7 1,698 497,7 1,518 516,2
Cu—-Hg 4,305 864,4 5,05 1200,4 6,049 1691,9 6,910 2393,7
U-Hg 1,305 157,5 1,992 510,8 2,459 845,8 3,064 1386,7
Th-Hg 1,377 189,5 6,17 1349,4 20,90 2858,2 26,29 4047,2
Ni-Hg 38,83 2166,8 54,67 2966,1 76,68 4079,3 101,5 5720,3
Ti—Hg 91,57 2675,5 298 4208,3 368,4 5554,7 236,6 6767,6
Zr—Hg 368 3499,1 492 4594,7 639,0 6072,4 1031 8590,0
Cr—Hg 5543 5104,1 1208 5260,3 13620 8948,2 21260 12337,9
Co—Hg 4700 5007,3 27400 7574,6 16000 9099,6 53500 13479,3
Fe—Hg 19630 5854,1 28510 7604,0 46240 10097,2 62770 13677,1
Be—Hg 162400 7102,1 15640 7158,9 23310 94533,0 3560 10124,7
AZi”"=RT In Я,,
(П-6)
то из уравнения (II—5), учитывая (II—4) и (II—6), может
быть рассчитано AZi — изменение изобарно-изотермического
потенциала растворения металла в ртути: ' ' .
AZi=RTln2Viyi=RTlnaj4 . (II—7)
' ' - .... •
83
Для расчета &Z\ были использованы значения уме , при-
веденные в таблице 5, и значения рассчитанные по
уравнению И. Ф. Шредера. Результаты приведены в табли-
це 6. Как видно, растворение цинка, магния и золота сопро-
вождается уменьшением изобарно-изотермического потен-
циала. Значения AZ^ для мало растворимых в ртути метал-
лов — железа, кобальта, хрома, циркония, титана, никеля,
меди — положительны. Следовательно, в такой системе не бу-
дет происходить самопроизвольное растворение металла в
ртути.
В таблице 5 приведены также значения активности ме-
таллов в ртути Nryi = ai при различных температурах. Из
температурной зависимости активности можно рассчитать
энтальпию и энтропию растворения металлов в ртути. По-
скольку
= TASj, (П—8)
то, учитывая зависимость (II—7), получим
ДНг
RT
In а =
R ’
(П-9)
представляющую собой уравнение прямой и позволяющую
графическим путем определить \Н\ и ASj.
Таким образом, рассмотрение термодинамических
свойств бинарных амальгамных систем трудно растворимых
в ртути металлов показывает, что они проявляют сильное
положительное отклонение от законов идеальных растворов.
Для характеристики термодинамических свойств жид-
ких металлических сплавов Даркен ввел функции стабиль-
ности гр и избыточной стабильности х [181]. Функция ста-
бильности гр рассчитывается по уравнению
<?=4,606.RT , (П-10)
а избыточной стабильности х
«—4,«ИМ
(II-11)
Для систем, в которых образуются интерметаллические
соединения, избыточная стабильность проходит через мак-
симум при составе, соответствующем соединению. Избыточ-
ная стабильность в системе магний — висмут, по [181],
имеет резко выраженный максимум при составе соединения
Mg2Bi. В отсутствие Соединений избыточная стабильность
г*
84
своиства можно разделить на
/ РЦ
Рис. 32. Зависимость логарифма
коэффициента активности метал-
лов в ртути от (1—У1)2.
системы изменяется плавно. При рассмотрении термодина-
мических свойств жидких металлических систем Даркен по-
казал, что термодинамические
две области: граничную и
центральную. Термодинамиче-
ские свойства в граничных об-
ластях относительно просты.
Наиболее показательной яв-
ляется центральная часть: в
этой области происходят рез-
кие и наиболее яркие изме-
нения термодинамических
свойств жидких сплавов.
На рисунке 32 приведе-
ны коэффициенты активности
кадмия, таллия, индия, свин-
ца, олова, висмута, цинка в
жидких амальгамах, рассчи-
танные по данным работ
[115, 128, 147, 156]. Из зна-
чений коэффициентов актив-
ности были рассчитаны избы-
точные стабильности для би-
нарных амальгамных систем.
Как видно из рисунка 33,
избыточная стабильность ря-
да амальгамных систем (Zn—
Hg, Bi—Hg, Sn—Hg, Pb—Hg)
плавно изменяется с измене-
нием состава амальгам. В слу-
чае систем In—Hg, Cd—Hg избыточная стабильность имеет
положительное значение и проходит через максимум. В гра-
ничных областях она остается постоянной, а в центральной
части резко изменяется. Такое поведение указывает на су-
ществование в этих системах в жидком состоянии ближней
упорядоченности типа соединений InHg и CdHg. Термодина-
мические свойства амальгамных систем свидетельствуют о
сложной картине взаимодействия между компонентами
амальгам. Определяющим фактором межатомного взаимо-
действия [33, 182—188] является различие в электроотри-
цательности, потенциалах ионизации, атомных размерах и
валентностях компонентов. Эти факторы оказывают влияние
и на термодинамические свойства жидких сплавов. Высокое
сродство разнородных атомов друг к другу (значительная
разница в электроотрицательности) приводит к взаимодейст-
85
вию атомов металлов, следствием которого является отрица-
тельный вклад tsHr
в суммарный тепловой эффект растворе-
ния металлов в ртути. При образовании сплавов из металлов
с разными атомными радиусами на величинах термодина-
мических свойств (энтальпия, избыточная энтропия) прояв-
Рис. 33. Зависимость избыточной стабильности
амальгамных систем от атомной доли металла.
ляется влияние энергии искажения структуры сплава (рас-
плава) ДЯр, что приводит к положительному вкладу в эн-
тальпию и избыточную энтропию смешения. Если кристал-
лическая решетка компонента отличается от кристалличе-
ской структуры сплава, то в энтальпию смешения еще вхо-
дит энергия преобразования ДНЦ атомов металла в структу-
ру сплава. Следовательно, энтальпия смешения и соответст-
86
венно избыточная энтропия являются суммарными трех
приведенных выше вкладов:
ДЯ—ДНг+ЛН&+ДНи,
(П-12)
AS*=-ASr+ASy4-4Su.
(П-13)
Такая зависимость АН и AS* наблюдается и в случае
жидких сплавов. В зависимости от соотношения слагаемых
уравнений (II—12), (П—13) величины ДИ и Д8* могут при-
нимать положительные или отрицательные значения. Так,
если атомные радиусы металлов бинарной системы ме-
талл — ртуть близки или почти равны друг другу и исход-
ные металлы обладают кристаллической решеткой, идентич-
ной структуре сплава, то АН и AS* определяются в основном
значением ДНГ — экзотермическим эффектом химического
взаимодействия компонентов [183, 184]. Если наблюдается
разница в валентности, то это должно привести к асиммет-
рии термодинамических функций. Значительное влияние на
термодинамические свойства сплавов оказывает также и по-
ложение металлов в периодической системе. Анализ термо-
динамических свойств ряда металлических сплавов в зави-
симости от влияния вышеперечисленных факторов был про-
веден Клеппа [129]. Автором была показана значительная
зависимость термодинамических свойств от различия ва-
лентности, размера атомного радиуса и электроотрицатель-
ности. Если размерный и электроотрицательный факторы
малы, то наиболее четко проявляется влияние валентности
на термодинамические свойства жидких сплавов. Рассмот-
рим поведение цинка и кадмия — металлов Ив подгруппы
периодической системы Д. И. Менделеева — в бинарных
системах металл — ртуть.
На рисунке 34 приведены калориметрически определен-
ные значения энтальпии смешения жидких сплавов бинар-
ных амальгамных систем по данным [116]. В системе
цинк — ртуть смешение компонентов проходит с поглоще-
нием тепла и максимум сдвинут в сторону ртути, а для си-
стемы кадмий — ртуть характерен экзотермический эффект.
Электроотрицательности ртути, кадмия и цинка отвечают
соответственно следующим значениям: 1,44, 1,46 и 1,66, а
атомные радиусы — 1,775, 1,726 и 1,538 А. Следовательно,
в системах кадмий — ртуть и цинк — ртуть разность элект-
роотрицательностей равна соответственно Ах = 0,02 и 0,22 эв,
а разность размеров атомных радиусов Аг=0,049 А (2,75%)
о
и 0,237 А (13,4%). Сопоставление этих параметров показы-
вает, что значительное различие в размерах атомных радиу-
8Т
сов цинка и ртути приводит к проявлению энергии искажения
структуры амальгамы цинка и к положительному вкла-
ду в энтальпию растворения. В системе цинк — ртуть, оче-
видно, Д#г <£ДЯУ и, следовательно, в соответствии с уравне-
300 -
Cd
Рис. 34. Сопоставление расчетных и эксперимен-
тальных энтальпий смешения амальгамных
систем в зависимости от атомной доли металла
в ртути. 1 — расчетные значения АН по квази-
химическим уравнениям; 2—эксперименталь-
ные значения АН.
нием (II—12) ДН>0. В случае же системы кадмий — ртуть
ДЯГ »Д2?Р и ДЯ<0.
Энтропия смешения в системе кадмий — ртуть и цинк —
ртуть очень мала по значению и проходит выше идеальной
88
энтропии (рис. 35). Значения энтропии были определены пу-
тем сочетания наших расчетных данных AZ из э. д. с., упру-
гости пара и калориметрических значений ДЯ. Избыточная
энтропия для систем кадмий — ртуть и цинк — ртуть отри-
цательна. Вероятно, это обусловлено различием в атомных
радиусах и структурными изменениями. Поведение метал-
лов Шв подгруппы периодической системы — галлия, индия
и таллия — по отношению к ртути сильно различается между
собой. Так, если галлий не смешивается с ртутью и в жидком
состоянии, то индий обладает наибольшей растворимостью в
ртути из всех металлов (70,3 ат.°/о при 25°С), а таллий также
проявляет значительную, однако несколько меньшую, рас-
творимость в ртути по сравнению с индием (43,7 ат.%). Тер-
модинамические свойства системы галлий — ртуть резко
отличаются от систем In—Hg и Т1—Hg. В системе Ga—Hg
наблюдается эндотермический,
Т1
—Hg — экзотермический э
•ФЕ
а в системах In—Hg и
ект растворения металлов в
ртути. Это обусловлено, вероятно, тем, что системы In—Hg,.
Т1—Hg и Gar—Hg характеризуются различными величина-
ми электроотрицательности и атомных радиусов. Наимень-
шая разность электроотрицательности и наибольшая раз-
ность атомных радиусов наблюдается в * системе Ga—Hg
(Ax —0,20 [189], Аг=0,12 А). Все факторы, благоприятст-
вующие проявлению положительных отклонений от закона
Рауля, присущи этой системе. В системах In—Hg и Т1—Hg
разность электроотрицательностей и атомных радиусов
составляет соответственно Ах = 0,37 и 0,35 и Аг = 0,07 и
0,17 А. !
Следует отметить, что, хотя значения электроотрицатель-
ностей In, TI и Hg близки между собой, термодинамические
характеристики систем In—Hg и Т1—Hg различаются. Так,
если в системе In—Hg наблюдается симметричное изменение
энтальпии смешения в зависимости от состава амальгам, то-
в системе Т1—Hg наблюдается заметная энергетическая
асимметрия. Максимум ЛН в этой системе сдвинут в сторону
образования интерметаллического соединения ThHgs. Зна-
чения энтропии смешения в системах галлий — ртуть, ин-
дий — ртуть и таллий — ртуть невелики и близки между со-
бой. Избыточная энтропия смешения отрицательна для всех
этих систем. В системе галлий — ртуть наблюдается большая
разница в атомных радиусах, и это, вероятно, обусловливает
отрицательное значение энтропии смешения и положитель-
ное значение в энтальпии смешения.
Для металлов IVb и Vb подгрупп —олова, свинца и вис-
мута — характерна малая растворимость в ртути при 25°С.
Термодинамические свойства систем олово—ртуть, свинец—
89
ртуть и висмут — ртуть мало отличаются друг от друга.
Смешение компонентов в этих системах проходит с поглоще-
нием тепла, и электроотрицательность Sn, Pb, Bi соответст-
венно равна 1,7, 1,6, 1,8. Поэтому можно ожидать, что влия-
ние электроотрицательности на общее значение энтальпии
смешения должно быть малым, что подтверждается значе-
ниями энтальпии смешения в этих системах (рис. 34). Раз-
ность атомных радиусов обусловливает также положитель-
ное значение энтальпии смешения в данных системах.
Рис. 35. Зависимость интегральных энтропий
смешения от атомной доли металла в ртути. 1 —
Cd—Hg; 2—Pb—Hg; 3—In—Hg; 4— Sn—Hg;
5 —Bi—Hg; 6 — Tl—Hg.
Энтропия смешения имеет положительное значение и по ве-
личине несколько меньше идеальной, т. е. избыточная энтро-
пия положительна (рис. 35).
Анализ термодинамических функций в зависимости от
определяющих факторов показывает, что для ртутных си-
стем не наблюдается какой-либо зависимости от валентно-
сти компонентов. Заметное влияние на термодинамические
свойства амальгамных систем оказывают фактор электроот-
рицательности и размерный фактор.
яо
Рис. 36. Максимальный интегральный изобарно-изотерми-
ческий потенциал (а) и максимальная интегральная
энтальпия смешения (б) жидких сплавов Cd, In, Ti, Pb,
Bi, Sn, Zn, Ga c Hg как функция разности электроотрица-
тельности.
Рис. 37. Максимальный интегральный изобарно-
изотермический потенциал (а) и максимальная-
интегральная энтальпия смешения (0) жидких
сплавов Cd, In, Tl, Pb, Bi, Sn, Zn, Ga c Hg как.
функция разности атомных радиусов.
При рассмотрении зависимости изобарно-изотермическо-
го потенциала и интегральной энтальпии смешения амаль-
гамных систем Cd—Hg, Tl—Hg, In—Hg, Sn—Hg, Bi—Hg,
Pb—Hg, Zn—Hg и Ga—Hg от разницы электроотрицательно-
стей (рис. 36) можно отметить некоторую закономерность в
изменении термодинамических параметров. В системах
Cd—Hg и In—Hg электроотрицательности компонентов за-
метно отличаются и поэтому здесь наблюдается отрицатель-
ное отклонение от закона Рауля. Эти системы характеризу-
ются наибольшим значением экзотермического эффекта и
наименьшим изобарно-изотермическим потенциалом.
На рисунке 37 представлены зависимость максимального
лзобарно-изотермического потенциала и максимальной ин-
тегральной энтальпии смешения амальгамных систем от раз-
ницы атомных радиусов компонентов. В этом случае наблю-
дается некоторая закономерность в изменении вышеуказан-
ных термодинамических параметров с изменением размера
атомных радиусов компонентов. Наибольший экзотермиче-
ский эффект отмечается для металлов, атомные радиусы ко-
торых близки по величине (Cd, In, Т1). Наибольший эндотер-
мический эффект проявляется в системе Ga—Hg, где разни-
ца атомных объемов компонентов составляет 20%. Как вид-
но из рисунка 37, в изменении изобарно-изотермического
потенциала амальгамный систем обнаруживаются аналогич-
ные закономерности. Таким образом, анализ термодинами-
ческих функций амальгамных систем свидетельствует о
сложном характере взаимодействия между компонентами
амальгам. Факторами, определяющими взаимодействие ме-
таллов с ртутью, по-видимому, являются: 1) сродство метал-
лов к электрону, 2) близость атомных размеров металла и
ртути, 3) положение металлов в периодической системе эле-
ментов Д. И. Менделеева.
ТРОЙНЫЕ АМАЛЬГАМНЫЕ СИСТЕМЫ
Основными методами изучения термодинамических
•свойств тройных амальгамных систем являются метод из-
мерения э.д.с. концентрационных цепей:
Mei | Mei, электролит| Меь Мег, Hg (II—14)
и метод измерения давления пара ртути [190—192]. При ис-
пользовании метода э.д.с. в качестве электролитов приме-
няют твердый электролит с ионной проводимостью [193,
194], глицерин с добавками солей [2, 130, 153, 167] и рас-
плавы солей. Давление пара определяют статическим мето-
дом [195]. Парциальные термодинамические функции по-
93
тенциалопределяющего металла используются для расчета
интегральных термодинамических функций всей системы с
помощью метода Даркена [196]. Интегральные термодина-
мические параметры тройной системы Mei—Ме2—Мез могут
быть рассчитаны по следующему уравнению Даркена:
(1-JV1)2
(II—15)
Для компонента Mei парциальные термодинамические
функции определяются экспериментально. Если известны
термодинамические свойства бинарной граничной системы
Мег—Ме3, то уравнение (II—15) принимает следующий вид:
Д2*=(1-^)
(П-16)
Вагнером [20] был предложен другой метод расчета тер-
модинамических величин тройных систем. Сначала рассчи-
тываются парциальные термодинамические функции ком-
понентов Мег и Мез, а затем на основании парциальных ве-
личин компонентов тройной системы — интегральные термо-
динамические функции:
AZ2(y^1)=AZ2(y12VI=0)+
1 Az‘
(1-.V1)2
д
дУ (1-Xj)2
(II-17)
Д^;(У1Л'1)=Д2з(У1^= 0) +
- i^Az‘(y ^1)’
(П—17а)
94
где у -
\Z*= AZ1^+AZ^2+AZ^3. (П—18)
При расчете термодинамических функций тройных си-
стем в основном используют метод Даркена [197—202].
В ряде работ [203, 204] рассмотрены другие методы об-
работки экспериментальных данных трехкомпонентных си-
стем, однако они не нашли широкого применения при расче-
те термодинамических свойств тройных систем.
При использовании метода э. д. с. или метода измерения
давления пара для изучения термодинамических свойств:
тройных систем экспериментально можно определить только
парциальные термодинамические функции одного потен-
циалопределяющего компонента. Сочетание этих двух мето-
дов дает возможность экспериментальным путем установить
парциальные термодинамические характеристики двух ком-
понентов в тройных системах. В работах Еллинека [205],
Фрауншила и Халла [193, 194] были экспериментально опре-
делены активности двух компонентов в тройных системах.
Система РЬ—Bi—Hg. Термодинамические свойства
этой системы изучались методом э. д.с. [206]. Были изуче-
ны э. д. с. концентрационных цепей тройных сплавов, соот-
ветствующих линиям разрезов при постоянном отношении
висмута к ртути, равном 1:4, 2:3, 1:1, 3:2, 4:1, и линиям
разрезов при постоянном отношении свинца к ртути и свин-
ца к висмуту, равном 1:4, 1:1 и 4:1. Из данных значений
э. д. с. рассчитывали активность свинца, парциальный изо-
барный и парциальный избыточный изобарный потенциалы
свинца в тройной системе. Интегральные термодинамиче-
ские функции тройной системы находили путем графическо-
го интегрирования уравнения (II—16).
Термодинамические функции системы РЬ—Bi—Hg были
рассчитаны для 300°С из значений э. д. с., которые определя-
лись для этой температуры путем экстраполяции графиче-
ской зависимости э. д. с. от температуры.
На рисунке 38 изображена полулогарифмическая зави-
симость значений э. д. с. цепи
РЬ[РЬВг2—0,05М, КВт—Ш, глицерин [Pb(Ni),
Bi<W2), Hg(tf3), (П-19)
где М, АГ2, — атомные доли соответственно свинца, висму-
та, ртути, для 300°С от состава (штриховой линией проведе-
на теоретическая кривая Нернста). Как видно из этого гра-
95
•фика, значения э. д. с. для соотношения Bi:Hg = 1:4 прохо-
дят ниже теоретической кривой, что характерно для системы
<с положительным отклонением от законов идеальных раст-
Рис. 38. Зависимость э. д. с.
амальгамной концентрацион-
ной цепи РЬ | глицерин, КВт,
РЬ2+[ Pb, Bi(Hg) от состава
при постоянном отношении
Bi:Hg для 300°С. Bi;Hg=l:4
(7), 2:3 (2), 1:1 (3) и 4:1 (4).
воров. При отношении висмута к
ртути 2:3 поведение тройной
системы близко к поведению
идеальной системы. Дальнейшее
повышение содержания висмута
в сплаве приводит к увеличению
значения э.д.с. цепи, которое
проходит значительно выше тео-
ретической кривой Нернста, что
связано с взаимодействием ком-
понентов в тройной системе.
Э.д.с. цепи (II—19) для 300°Си
при соотношении Bi—Hg = 4:l,
1:1, 2:3 и 1:4
(П-20)
где б — постоянная, равная соот-
ветственно 0,088, 0,076, 0,063 и
0,049.
Активность свинца в тройной
системе РЬ—Bi—Hg при по-
стоянном соотношении Bi:Hg в
зависимости от атомной доли
свинца может быть рассчитана
по уравнению
lga=-e-g Igj- (II—21)
и характеризуется (рис. 39, а) незначительными положи-
тельными и отрицательными отклонениями от законов
идеальных растворов. При отношении Bi:Hg=4:l актив-
ность свинца значительно меньше, чем в бинарной системе
РЬ—Hg, и приближается к идеальной кривой. При дальней-
шем добавлении висмута активность свинца в тройной систе-
ме становится меньше атомной доли, при соотношении
Bi:Hg=l:4 приближается по значению к активности свин-
ца в бинарной системе РЬ—Bi и показывает отрицательное
отклонение от законов идеальных растворов.
При соотношении Pb:Hg = 1:4, 4:1 (рис. 39, б) актив-
ность свинца также показывает незначительные отрицатель-
ные отклонения от законов идеальных растворов в области
составов, богатых висмутом. Изотермы активности свинца
Рис. 39. Изотермы активности свинца, а — в системе РЬ—Bi—Hg
при 300°С: 1 — в бинарной системе Pb—Hg, 2— при постоянном
отношении Bi:Hg = l:4, 3—Bi:Hg = 2:3, 4—Bi:Hg = l:l, 5—в бинар-
ной системе РЬ—Bi; б—при постоянном отношении Pb:Hg=l:4 (1)
и 4:1 (2); в — при постоянном отношении Pb:Bi=l:4 (1) и 1:1 (2).
Рис. 40, Зависимость igypb от атомной доли компонентов системы
РЬ—Bi—Hg. а: 1 — Ig^pb в системе РЬ—Hg, 2 — Bi:Hg=l:4, 8 —
Bi:Hg=2:3, 4 — Eft:Hg=l:l, 5 — Bi:Hg=4:l; 6: 1 — Pb:Hg=l:4,
2 — Pb:Hg=l:l, 3 —Pb:Hg=4:l; e: 1 —Pb:Hg, 2 —Pb:Bi=l:4,
3 —Pb:Bi=l:l.
при постоянном отношении Pb:Hg = 1:4 и 1:1 в области
составов амальгам, богатых ртутью, характеризуются поло-
жительным отклонением от законов идеальных растворов
(рис. 39, в).
Изменение коэффициента активности свинца от состава
показано на рисунке 40. Как видно, ход коэффициента ак-
тивности свинца в тройной системе при соотношении Bi: Hg =
= 1:4 (рис. 40, а) аналогичен ходу коэффициента актив-
7-122
97
Рис. 41. Изолинии интегрального изобарно-изотермического по-
тенциала системы РЬ—Bi—Hg при 300сС.
ности свинца в бинарной системе РЬ—Hg. Следовательно,
малые концентрации висмута в тройной системе не влияют
на активность свинца. При увеличении содержания висму-
та в системе до соотношений Bi:Hg = 2:3, 1:1 и 4:1 коэф-
фициент активности свинца становится меньше единицы.
Влияние висмута на коэффициент активности свинца пока-
зано на рисунке 40, б. Понижение коэффициента активности
свинца с добавлением висмута обусловлено взаимодействием
свинца и висмута в тройной системе с образованием твердых
растворов и ряда промежуточных фаз (см. гл. II). Следует
отметить, что взаимодействие в бинарной системе РЬ—Bi
сохраняется даже при 900-4-1000°С [207].
Влияние ртути на коэффициент активности свинца при
Nng^0,4 мало. Дальнейшее введение ртути в тройную сис-
тему (рис. 40, в) приводит к уменьшению взаимодействия
свинца и висмута, и в связи с этим коэффициент активности
свинца увеличивается по мере повышения содержания
ртути в сплаве.
98
Рис. 42. Интегральный избыточный
изобарно-изотермический потенциал
системы РЬ—Bi—Hg при постоян-
ном отношении Bi:Hg: 1—1:4; 2—
2:3; 3—1:1; 4—4:1 и 300°С.
Изолинии интегрального молярного изобарно-изотерми-
ческого потенциала приведены на рисунке 41. Наименьшее
значение изобарно-изотермического потенциала системы
РЬ—Bi—Hg наблюдается в области составов амальгам,
близких к стороне бинарной системы РЬ—Bi при Лгрь=0,4—
—0,6. Минимальное значе-
ние AZ тройной системы со-
ставляет—1200 кал(г-атом.
Как видно из рисун-
ка 42, положительное зна-
чение интегрального избы-
точного изобарно-изотерми-
ческого потенциала наблю-
дается для амальгам с по-
стоянным отношением Bi:
:Hg = l:4. По мере увели-
чения содержания висмута
в сплаве избыточный изо-
барно-изотермический по-
тенциал тройной системы
проявляет знакопеременное
отклонение от законов
идеальных растворов.
На рисунке 43 приведе-
ны изолинии избыточного
интегрального молярного
изобарного потенциала трой-
ной системы РЬ—Bi—Hg
и избыточные интегральные молярные изобарные по-
тенциалы бинарных граничных систем. Как видно, макси-
мальное положительное значение AZ*, равное 227 кал/г*
атом, находится на стороне бинарной системы РЬ—Hg
при Npb — 0,6. Для системы Bi—Hg также характерно поло-
жительное значение AZ*, равное 175 кал! г-атом при
Nbi =0,35. Отрицательное значение ДЯ* наблюдается в
системе РЬ—Bi. Минимальное отрицательное значение
Л2* — —280 кал!г - атом находится на стороне системы
РЬ—Bi при NPb = 0,5. Поэтому наблюдаемые отрицательные
отклонения в тройной системе РЬ—Bi—Hg обусловлены от-
рицательными значениями избыточного изобарно-изотерми-
ческого потенциала в бинарной системе РЬ—Bi. Следует
отметить, что отрицательные значения постоянных величин
(изолинии) AZ* (рис. 43) смещены в сторону бинарной сис-
темы РЬ—Bi, что обусловлено взаимодействием висмута со
свинцом в тройной системе РЬ—Bi«-Hg. Интересно, что
99
о
Рис. 43. Изолинии интегрального избыточного потенциала системы
РЬ—Bi—Hg для 300°С.
ДИ*<0 даже для амальгамы, содержащей 40 ат. % Bi,
20 ат. % РЬ и 40 ат. % Hg.
Сопоставление рисунков 42 и 43 показывает, что область
повышенной растворимости компонентов, обусловленной
взаимным влиянием металлов системы РЬ—Bi—Hg, харак-
теризуется более отрицательным значением &Z и положи-
тельными величинами AZ*. В области, богатой ртутью, инте-
гральная энтальпия смешения системы РЬ—Bi—Hg также
положительна. Как видно из рисунка 44, эндотермический
эффект смешения характерен для области составов амаль-
гам, прилегающих к сторонам бинарных систем РЬ—Hg и
Bi—Hg. Область составов амальгам, расположенных вблизи
бинарной системы РЬ—Bi, характеризуется экзотермиче-
ским эффектом смешения. Интересно, что области составов
амальгам, богатой ртутью (Bi:Hg=l:4) и прилегающей к
бинарной системе Pb—Hg, присуща отрицательная интег-
ральная избыточная энтропия смешения при 300°С (см.
рис. 44). Здесь наиболее отчетливо выражено взаимное влия-
ние компонентов на растворимость в ртути.
Г' *4
100
'500 -------------------------------
Рис. 44. Изолинии интегральной энтальпии смешения системы
Pb—Bi—Hg при 300°С.
Таким образом, рассчитанные термодинамические функ-
ции тройной системы РЬ—Bi—Hg: интегральный избыточ-
ный изобарный потенциал, интегральная энтальпия
смешения, избыточная энтропия показывают, что термодина-
мические свойства тройной системы характеризуются незна-
чительными положительными и отрицательными отклоне-
ниями от законов идеальных растворов. Основной вклад в
отрицательные отклонения термодинамических свойств трой-
ной системы от законов идеальных растворов вносят компо-
ненты бинарной системы РЬ—Bi. В работе [175] было показа-
но, что на характер межатомного взаимодействия, который
находит отражение в строении диаграммы состояния систе-
мы, влияют три фактора: объемный, электроотрицательный
и валентный. Эти факторы влияют и на термодинамические
свойства жидких сплавов [183, 184]. Растворение металлов
Mei и Мег в бинарной системе Mei—Мег, обладающих раз-
ностью электроотрицательностей Дх, приводит к их меж-
атомному взаимодействию как в твердой, так и в жидкой фа-
101
зах (к объединению в определенные структурные группы) и,
как следствие, — к отрицательным вкладам в AH, AZ*, AS*.
Различие же в атомных радиусах («объемный фактор») взаи-
модействующих металлов приводит к положительным вкла-
дам, а в эффективных валентностях — к асимметрии термо-
динамических функций. Так, сопоставление и анализ элект-
роотрицательностей х свинца (1,55 эв), висмута (1,67 эв),
ртути (1,44 эв) [49], их разностей в бинарных системах
(Дхрь-в1 = 0,12 эв, Ахрь-Hg =0,11, Axbl—Hg = 0,23 эв) и
атомных радиусов этих компонентов, соответственно равных
о
1,949, 2,036 и 1,775 А [48], показывает, что в тройной систе-
ме РЬ—Bi—Hg объемный фактор и фактор электроотрица-
тельности наиболее благоприятны для образования твердых
растворов в системе РЬ—Bi. Поэтому межатомное взаимо-
действие свинца и висмута в тройной системе РЬ—Bi—Hg
определяет отрицательное отклонение термодинамиче-
ских свойств этой системы от законов идеальных рас-
творов.
Увеличение растворимости свинца и висмута в системе
РЬ—Bi—Hg вследствие взаимного влияния, как отмечалось
в главе I, обусловлено влиянием висмута, который не обра-
зует твердых растворов с ртутью, а образует твердые раство-
ры со свинцом. Образование твердых растворов в тройной
системе и приводит к значительному понижению изобарно-
изотермического потенциала, снижению эвтектической
температуры и увеличению взаимной растворимости ме-
таллов.
Система Cd—Bi—Hg. Термодинамические свойства си-
стемы Cd—Bi—Hg изучали методом э. д. с. [208]. Для изме-
рения э. д. с. применяли концентрационные амальгамные
цепи:
Cd|0,05M CdBr2, 1,0М КВг, глицерин |Cd(Ai)Bi(N2)Hg^3),
где Ai, 2V2, А3— атомные доли соответственно кадмия, вис-
мута и ртути.
Составы тройных амальгамных сплавов в исследуемых
электродах изменяли по линиям разрезов при постоянном
отношении ЛГ2/ЛГ3 = 1:4, 2:3, 1:1, 3:2, 4:1.
Как видно из рисунка 45, активность кадмия в тройной
системе характеризуется знакопеременным отклонением от
законов идеальных растворов. С увеличением содержания
висмута в сплаве активность кадмия в тройной системе кад-
мий — висмут — ртуть по значению приближается к актив-
ности кадмия в бинарной системе кадмий — висмут. Отри-
102
цательное отклонение от идеального поведения в тройной
системе кадмий — висмут — ртуть наблюдается в области
составов, богатых ртутью, которая расположена вблизи би-
нарной системы кадмий — ртуть.
Активность кадмия в системе кадмий — висмут — ртуть
при добавлении висмута незначительно повышается по срав-
нению с активностью кадмия
в бинарной системе кадмий —
ртуть, а коэффициент актив-
ности кадмия резко понижает-
ся при увеличении содержа-
ния ртути в трехкомпонентной
системе кадмий — висмут —
ртуть (рис. 46, а), что может
быть объяснено взаимодейст-
вием кадмия с ртутью с обра-
зованием структурных групп
интерметаллических соедине-
ний (см. гл. III). Влияние вис-
мута на коэффициент актив-
ности кадмия по линиям раз-
резов квазибинарных систем
Bi—Cd—Hg при соотношении
Cd:Bi —1:4, 1:1 и 4:1 показа-
но на рисунке 46,6. Введение
висмута в систему до атомной
Рис. 45. Изотермы активности
кадмия в тройной системе кад-
мий— висмут — ртуть при по-
стоянном соотношении висмута
и ртути при 300°С: 1 — Cd—Hg;
2 —Bi:Hg—1:4; 3 — Bi:Hg=*=
=4:1; 4 — Cd—Bi.
доли, равной 0,4, незначительно изменяет коэффициент ак-
тивности кадмия. Такое поведение висмута в тройной систе-
ме связано, по-видимому, с тем, что энергия взаимодействия
атомов висмута между собой EBiBi значительно больше энер-
гии взаимодействия разнородных атомов висмута и рту-
ти #BiHg.
В связи с этим атомы висмута не могут вытеснить атомы
кадмия из его соединения с ртутью, так как сродство кадмия
к ртути EcdHg значительно выше, чем висмута к ртути.
Дальнейшее добавление висмута в систему при соотношении
Cd:Hg=l:4 вызывает повышение коэффициента активности
кадмия при Nb0,2. Для разрезов Bi—Cd—Hg при соот-
ношении Cd:Hg = l:l и 4:1 характерно незначительное по-
нижение коэффициента активности кадмия по мере увеличе-
ния содержания висмута в амальгаме. Минимум на кривых
зависимости коэффициента активности кадмия от атомной
доли, очевидно, связан с проявлением межатомного взаимо-
действия компонентов тройной системы кадмий — висмут —
ртуть. Взаимодействие кадмия и ртути, наблюдаемое в бинар-
ной системе Cd—Hg, сохраняется и в системе Cd—Bi—Hg.
юз
Как видно из рисунка 46, в, в области амальгам, бедных кад-
мием и богатых ртутью, наблюдается значительное
Рис. 46. Зависимость логарифма коэффициента активно-
сти кадмия Igyca от атомной доли компонентов в трой-
ной системе Cd—Bi—Hg. а—Igycd при постоянном отно-
шении Cd:Bi: 1—Cd:Bi = l:4, 2—1:1, 3—4:1; б—при по-
стоянном отношении Cd:Hg: 1 —Cd:Hg = l:4, 2— 1:1,
3 — 4:1; в — при постоянном отношении Bi: Hg:
1 — Cd:Hg, 2 — Bi:Hg = l:4, S — 1:1, 4 — 4:1.
отрицательное отклонение от законов идеальных раство-
ров (^са 1). Сложный ход коэффициента активности кад-
мия обусловлен, вероятно, взаимодействием кадмия и ртути
в тройной системе с образованием структурных групп ин-
терметаллических соединений. Изолинии интегрального изо-
барного изотермического потенциала тройной системы кад-
мий — висмут — ртуть (рис. 47) также указывают на взаи-
модействие Cd и Hg в этой системе. Наименьшее значение
изобарного потенциала наблюдается в области составов
• амальгам, богатых ртутью, и прилегающей к стороне бинар-
ной граничной системы кадмий — ртуть.
Значения интегрального избыточного изобарного потен-
циала трехкомпонентной системы кадмий — висмут — ртуть
свидетельствуют о значительных отрицательных и очень не-
больших положительных отклонениях от идеального поведе-
ния, прилегающих к стороне бинарной граничной системы
висмут — ртуть (рис. 48, а). Отрицательное значение избы-
104
Рис. 47. Изолинии интегрального изобарно-изотермического по-
тенциала тройной амальгамной системы Cd—Bi—Hg.
точного изобарного потенциала в бинарной системе кад-
мий — ртуть обусловливает значительную область отрица-
тельных отклонений в тройной амальгамной системе кад-
мий — висмут — ртуть.
Растворение компонентов в системе кадмий — висмут —
ртуть в зависимости от состава амальгам сопровождается
отрицательным или положительным значением интеграль-
ной энтальпии смешения (рис. 48,6). Так, область составов
тройных амальгам, прилегающих к бинарной граничной си-
стеме кадмий — ртуть, характеризуется экзотермическим
эффектом, смешение же амальгам, прилегающих к сторонам
бинарных граничных систем висмут — ртуть и кадмий —
висмут, а также содержащих больше 50 ат. % висмута, про-
ходит с поглощением тепла.
Из приведенных термодинамических функций трехком-
понентной системы кадмий — висмут — ртуть следует, что
введение висмута почти не нарушает взаимодействия компо-
нентов в системе кадмий — ртуть. По данным [73], висмут8
8 По данным [79, 80], растворимость кадмия в присутствии висму-
та возрастает с — 9 до 11 ат. % при 25°С и с — 19 до 24 ат. % при 60°С.
105
б
Рис. 48. Изолинии интегрального избыточного и зоба р-
но-изотермического потенциала (а) и интегральной эн-
тальпии смешения (б) тройной системы Cd—Bi—Hg и
бинарных граничных систем.
практически не оказывает влияния на растворимость кадмия
в ртути (см. рис. 18), а растворимость висмута в присутствии
кадмия значительно возрастает (см. гл. I). Действительно,
сопоставление электроотрицательностей х висмута (1,67 эв),
кадмия (1,46 эе), ртути (1,44 эв), их разностей (AxBi-Hg =
= 0,23 эв, Axcd-Hg =0,02, AxBi-Cd =0,21 эв) и их атомных
радиусов, которые равны соответственно 2,036, 1,726 и
1,775 А, показывает, что в граничных системах тройной си-
стемы Bi—Cd—Hg наиболее благоприятными факторами
(х, Аг — объемный фактор) для образования твердых рас-
творов обладает система кадмий — ртуть. Объемный фактор
о
в бинарных системах Bi—Hg (Ar = 0,261 А) и Bi—Cd (Ar =
о
= 0,310 А) неблагоприятен и вносит положительную состав-
ляющую в значения AH, AZ* и AZ. Поэтому изолинии AZ
и AZ* на концентрационных треугольниках Cd—Bi—Hg
располагаются асимметрично.
Система Cd—Sn—Hg. Представляет интерес рассмот-
реть термодинамические свойства этой системы в связи с
тем, что ее компоненты не проявляют взаимного влияния на
увеличение растворимости в тройной системе. Термодинами-
ческие свойства системы Cd—Sn—Hg были изучены мето-
дом э.д.с. [209] и методом измерения давления пара ртути
амальгам изотенископным методом [195].
1.0
al
ав
02
О 0^ 0,4 03 0,8 13 0 0,2 &4 0,8 08 Ю 0 02 0^ 08 0.S Ю
NC4 %
Рис. 49. Изотермы активности компонентов в тройной системе
Cd—Sn—Hg. Активность кадмия (а): 1 — Cd—Hg, 2—Sn:Hg =
— 1:4, 3 — Sn:Hg=l:l, 4—Sn:Hg = 4:l; ртути (б): 1 — CdHg,
2 —Cd:Sn = 4:l, 3 —Cd:Sn=l:l, 4—Cd:Sn = l:4, 5 — SnHg и
олова (в): 1 — CdSn, 2 — Cd:Hg = 4:1, 3—Cd:Hg=l:4,
4 — SnHg.
Активность кадмия в тройной системе Cd—Sn—Hg, рас-
считанная из данных э. д. с., приведена на рисунке 49, а.
Как видно, отрицательные отклонения активности кадмия
от закона Рауля уменьшаются по мере перехода от системы
Cd—Hg к системе Cd—Sn. Активность ртути, определенная
107
б
Рис. 50. Линии постоянных значений интегрального изобарно-изо
но-изотермического потенциала (б) и интегральной
из значений давления пара ртути в тройной системе
Cd—Sn—Hg, для различных соотношений кадмия и олова —
1:4, 1:1, 4:1, показана на рисунке 49, б. Как видно, актив-
ность ртути, так же как и кадмия, для составов амальгам,
расположенных вблизи бинарной системы кадмий — ртуть,
характеризуется отрицательным отклонением от законов
идеального раствора. Область составов амальгам, прилегаю-
щих к стороне бинарной системы олово — ртуть, проявляет
положительное отклонение от закона Рауля. Зависимость
активности олова в системе от состава показана на рисун-
ке 49, в. В этом случае по мере перехода от системы Cd—Hg
к системе Sn—Hg положительные отклонения активности
олова от идеального поведения увеличиваются.
Зависимость изменения интегрального изобарно-изотер-
мического потенциала от состава показана на рисунке 50, а.
Максимальное изменение ЛИ наблюдается для сплавов, при-
легающих к бинарной системе Cd—Hg. Значения избыточ-
ных интегральных изобарно-изотермических потенциалов
системы Cd—Sn—Hg показаны на рисунке 50, б. Тройные
сплавы, прилегающие к стороне бинарной системы Cd—Hg,
в
термического потенциала (а), интегрального избыточного иэобар-
энталыгии смешения (в) тройной системы Cd—Sn—Hg.
IOS
характеризуются отрицательными отклонениями от идеаль-
ного поведения (AZ*<0). Упорядоченность типа соедине-
ния, характерная для жидких сплавов бинарной системы
Cd—Hg, проявляется и в тройных сплавах системы
Cd—Sn—Hg, уменьшаясь по мере добавления олова. Трой-
ные амальгамы, расположенные вблизи
Рис. 51. Интегральная энтропия
смешения тройной системы при
различном соотношении олова и
ртути: 1:4 (7), 1:1 (2), 4:1 (3).
двойной системы
Cd—Hg (рис. 50, в), характе-
ризуются экзотермическим эф-
фектом (AZ7<0).
Интегральная энтропия
смешения данной системы
имеет положительные значе-
ния во всем интервале соста-
вов амальгам (рис. 51). Та-
ким образом, термодинамиче-
ские свойства тройной систе-
мы кадмий — олово — ртуть:
активности компонентов (Sn,
Cd, Hg), избыточный изобар-
но-изотермический потенциал,
интегральная энтальпия сме-
шения — свидетельствуют об
отрицательных и положитель-
ных отклонениях от идеально-
го поведения растворов.
Отрицательные отклонения
термодинамических свойств
тройной системы от законов
идеальных растворов
обуслов-
ливаются главным образом компонентами бинарной системы
кадмий — ртуть. Анализ электроотрицательностей кадмия,
ртути и олова показывает, что они сильно различаются меж-
ду собой. Так, электроотрицательности этих металлов состав-
ляют: xCd —1,46, хнг —1,44, xSn —1,72 эв [49], а разности
электроотрицательностей граничных бинарных систем кад-
мий — ртуть, олово — ртуть и кадмий — олово равны соот-
ветственно Axcd-Hg =0,02, Azsn-Hg =0,28, AxCd-sn =
= 0,26 эв. Следовательно, наибольшая разность электроотри-
цательностей характерна для систем олово — ртуть и кад-
мий — олово. Сопоставление атомных радиусов кадмия, рту-
ти и олова, которые равны соответственно Red —1,726,
Rng—1,775, Rsn —1,862 А [48] и их разностей ABcd_Hg =
= 0,049 A, ARsn-Hg = 0,087 A, ARsn-cd =0,136 А показы-
вает, что объемный фактор в системе кадмий — ртуть наибо-
лее благоприятен и не приводит к возникновению энергии
искажения структуры амальгамы этой системы и, следова-
110
тельно, положительной составляющей в ДН, ДИ*, AS*. В си-
стемах же олово — ртуть и олово — кадмий наблюдается
различие в атомных радиусах, а также в кристаллических
структурах этих элементов [48], которое и приводит к воз-
никновению энергии искажения структуры амальгамы трой-
ной системы кадмий — олово — ртуть, что и вносит положи-
тельный вклад в значения термодинамических функций этой
тройной системы.
Поэтому введение олова в систему кадмий — ртуть при-
водит к изменению отрицательных отклонений от законов
идеальных растворов к положительным.
Выявленная взаимосвязь термодинамических свойств
жидкой тройной системы кадмий — олово — ртуть и физи-
ко-химических свойств металлов в твердом состоянии объяс-
няется тем, что потенциалы взаимодействия металлов при
переходе их из твердого состояния в жидкое изменяются ма-
ло [210]. Очевидно, этим также обусловлено существование
и сохранение наследственной структуры твердых сплавов и
соединений даже при значительном их нагревании — выше
температур плавления [211].
РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ ТРОЙНЫХ
АМАЛЬГАМНЫХ СИСТЕМ НА ОСНОВАНИИ
ДАННЫХ О ДВОЙНЫХ ГРАНИЧНЫХ СИСТЕМАХ
Изучение термодинамических свойств многокомпонент-
ных амальгамных систем из-за резкого увеличения объема
экспериментальных исследований и расчетных работ сопря-
жено с большой затратой труда. В связи с этим в последнее
время в литературе большое внимание уделяется расчетным
методам получения термодинамических данных для много-
компонентных систем на основании экспериментальных дан-
ных термодинамических свойств компонентов граничных
бинарных систем [212—219].
Разработанные различными авторами методы расчета
являются эмпирическими и основаны на различных допу-
щениях относительно свойств тройных систем. Существую-
щие методы можно разделить на две группы. К первой груп-
пе относятся методы расчета, основанные на использовании
уравнения Дюгема — Маргулеса и эмпирических зависимо-
стей избыточного изобарно-изотермического потенциала
(коэффициента активности, изобарного изотермического по-
тенциала, энтальпии смешения и др.) от состава тройных
растворов, К этой группе относятся методы А. Крупковского
[212], Редлиха — Кистера [213], Вооля [94], М. Сусарева,
А. Горбунова [214], Колера [215] и др.
Вторую группу составляют методы, основанные на пред-
111
положении аддитивности свойств компонентов в тройных
системах. К этой группе методов относятся расчетные урав-
нения Я. Нывлта [91—93], Е. Бонье [216], Г. Тупа [217].
Эти методы позволяют рассчитать термодинамические свой-
ства тройной системы путем графической или аналитической
интерполяции соответствующих свойств двойных систем.
Рассмотрим кратко наиболее часто используемые ме-
тоды.
В методе А. Крупковского [212] для расчета термодина-
мических свойств тройных систем предлагается решение
уравнения Гибса — Дюгема с учетом температурной зависи-
мости коэффициента активности для каждой граничной си-
стемы
lg Т1 = (1 - (П-22)
U 7з ~
Для каждой из граничных систем вычисляются постоян-
ные пг и k, которые необходимы при решении уравнений для
тройной системы:
4г‘= •''О”-'-'] +
I1 z (^1—2
<п-2з>
Дя. о
Недостатком метода является необходимость выполнения
расчета ряда постоянных и громоздкость математических
вычислений.
Редлихом и Кистером [213] для двойных систем была
предложена следующая зависимость функции Q от состава:
Qi“2=X21X12[B12-+C12(X12—X21)-H©i2(X12“X2i)2-b...], (П-24)
где Bi2, С12, ©12— постоянные коэффициенты, определяемые
из экспериментальных данных. Для тройных систем урав-
нение Редлиха — Кистера [213] принимает вид
0 = 012+ 023+031+0123, (П—25)
112
где
912 — Х1Х2[В12~\~ ^12(^1 -Х^) 4“ -^12(^1— -Х*2)2...],
©23 = -Х’2Х3[В2з4-СГ2з(Х2——Х’з)2...],
е123-Х1Х2Хз[С-Ы>1(Х2- х3)+ D^x.- Х0+...];
B;i, Cjh Djt —постоянные для двойных систем; С, D jy
Di— для тройных систем.
Метод Редлиха — Кистера [213], предложенный для рас-
чета термодинамических характеристик для тройных сис-
тем, образованных преимущественно органическими соеди-
нениями, был использован А. Г. Морачевским, Л. Н. Гераси-
менко [218] для расчета термодинамических функций
ряда металлических систем: Na—Т1—Pb, Na—Т1—Sn,
Cd—Bi—Sn, Na—Bi—Sn — по уравнению
Q = 012 4~ ©23 + 031- (II—26)
Авторами было показано, что метод Редлиха — Кистера
удовлетворительно согласуется с экспериментальными дан-
ными.
В методе Колера зависимость избыточного изобарно-изо-
термического потенциала в тройной системе от свойств двой-
ных систем дается следующим уравнением [215]:
A2*-A^i2(1-A^3)2+AZ2*3(1-^)2+AZ3i(1-^)2. (II—27)
Термодинамические свойства тройных систем могут быть
рассчитаны по уравнению Вооля [94]:
AZ*^N1N2[^2C21+^2£12]+NiN3L№i2^3i+N3i£i8]+
'Ч*4“^'2^’з[^^2^32"^* -^8-^23Л- (П-28)
Это уравнение отличается от приведенных выше тем, что
содержит тройной член -КЪз. Для расчета термодинамиче-
ских свойств тройной системы по уравнению (II—28) необ-
ходимо определить семь постоянных — по две для каждой
бинарной граничной системы и одну — для тройной.
При расчете термодинамических свойств тройных систем
исходя из данных для двойных граничных систем аддитив-
ными методами [91, 216, 217] свойства тройной системы
уподобляются свойствам двойной по изоконцентрации пер-
вого компонента. Расчетные уравнения интегральных избы-
8-122 ИЗ
точных термодинамических функций на основании данных
о двойных граничных системах имеют следующий вид:
а) уравнение Нывлта [91] :
AZ* = AZ2*3^5-^-(AZ1’3-AZ23)+ JV1AZ1*2+.N2AZ1*2*; (П-29)
б) уравнение Тупа [217]:
AZ* J д^2-1 . J я!
^=(1-W -j— „ v +d-^)2 N ,v ~
KI L KI Jyv!V2 L KI .iNi:-Na
да-*»
в) уравнение Бонье [216]:
A Z*--= AZ^ —41—+Az2’_3^2—+(1-^2)Д z;_3. (11-31)
1’ 1 i jV3 1 1 2
В уравнениях (II—27)—(II—31) избыточный изобарно-
изотермический потенциал для двойной системы i—j с тем
же отношением концентраций компонентов i и j, что и в
тройном растворе.
Метод М. Сусарева и А. Горбунова [214] дает хорошее
согласие с экспериментом для случая тройной системы, в ко-
торой два компонента образуют систему, проявляющую не-
большие по величине отклонения от законов идеальных рас-
творов. В этом случае тройной раствор можно уподобить би-
нарному по линиям, отвечающим постоянству парциального
изобарного потенциала AZ| (линии изопотенциала). Линии
равных значений AZi в таких системах имеют вид прямых.
Экспериментально наблюдаемый факт линейности изопотен-
циалов для одного из компонентов в тройной системе дает
возможность расчета термодинамических свойств тройной
системы на основании данных о граничных двойных систе-
мах. Метод изопотенциалов был применен А. Г. Морачев-
ским с сотр. [218] для расчета термодинамических свойств
тройных систем Na—Pb—Т1 и Na—Sn—TI из данных для
граничных двойных систем. Расчет проводили по уравне-
нию
Д£—(WNa&#На4“^Т1(Л #TI, ,VNa- о) +
+NРь(А^РЬ, ЛЛ1= о+Д^РЪ. ,VNa=o)] ^Na, N’pb/^Ti.
2
Уравнения Колера [215], Тупа [217], Бонье [216],Вооля
[94] были проанализированы в работе О. Кубашевского с
1J4
сотр. [219] на примере десяти тройных металлических си-
стем с различным типом сил взаимодействия в составляю-
щих их граничных бинарных системах. Показано, что ни
одно из этих уравнений не может быть единственным, даю-
щим наилучшее совпадение расчетных и эксперименталь-
ных величин для всех исследованных систем. Для систем с
малым сродством (Cd—Sn—Bi, Cd—Sn—Pb, Cd—Pb—Bi)
расчетные значения термодинамических функций, получен-
ные по уравнениям Колера, Тупа, Вооля, очень близки
друг к другу в пределах 10 кал! г атом для любого выбранно-
го состава. Поэтому любое из этих уравнений может быть
использовано для расчета термодинамических свойств трой-
ных систем с малым сродством металлов.
Для систем с большим сродством значения термодинами-
ческих функций, полученные с использованием уравнений
Колера, Тупа, Вооль — Михайлова, расхождение составляет
50 кал! г-атом. В этом случае лучшее совпадение с экспери-
ментом наблюдается при использовании уравнения Бонье
[214].
Расчет термодинамических свойств тройных металличе-
ских систем по уравнению Бонье был проведен А. Морачев-
ским с сотр. [218а], показавшими, что в тех случаях, когда
одна система близка к идеальной, а в двух других наблю-
даются значительные отклонения от идеального поведения,
эти методы хорошо согласуются с данными, полученными
экспериментальным путем.
Нами были проведены расчеты термодинамических функ-
ций экспериментально изученных (гл. II) тройных амаль-
гамных систем РЬ—Bi—Hg, Cd—Bi—Hg и Cd—Sn—Hg
исходя из свойств двойных граничных систем по уравне-
ниям М. Сусарева — А. Горбунова (С), Бонье (Б) и Коле-
ра (К).
В таблице 7 приведены расчетные значения изобарно-изо-
термического потенциала тройной системы РЬ—Bi—Hg по
уравнениям Бонье (II—31) и Колера (II—27). Сопоставление
расчетных и экспериментальных данных показывает, что
лучшая согласованность термодинамических функций на-
блюдается при использовании уравнения Колера (II—27).
Для амальгам при соотношении Bi:Hg = l:4, 1:1 и 4:1 и
бедных свинцом наблюдаются наименьшие отклонения рас-
четных величин &Z от экспериментальных. При увеличении
атомной доли висмута и свинца в амальгаме различие в рас-
четных и опытных значениях AZ резко возрастает. Расчет-
ные значения Д2? по уравнению Бонье (II—31) примерно на
100 кал! г-атом более отрицательны, чем по уравнению Ко-
лера (II—27).
115
Таблица 7
Сравнение результатов расчета значений изобарно-изотермического
потенциала системы свинец — висмут — ртуть, полученных методами
(Б) и (К) и из экспериментальных данных, кал/г - атом
Bi :Hg=l:4 Bi:Hg=l:l Bi :Hg=4:l
КГ * а S X и _ и IX S'
^vPb IS * IS N £ is ф rq N О « sr ~
<1 <1 W < Й <3 <1 <1 <1 « <J bq <1 <! Й
1 1 “ 1 < 1 ) || 1 1 1 1 1 <
од 586712 126 502)+84 7831009 226 912 —129 690 955 265 785 95
0,2 7221792 70 623’4-99 933 114)220 1050 -117 920 1182 -262 958 38
о,3 776 900 -124 778 -2 109812101121145 -47 1117 1300 -1831164 47
0,4 805 952 147 780 4-25 11281291 1631160 32: 11031396 -290 1300 194
0,5 766 950 -84 770 -4 1097 1250 153 11501 53! 1110 1300 -190-1341 231
0,6 692 916 224 720 -28 905 1189 284.1100)—195 1057 1306 4-249 1300 243
0,7 581 800 -119 650 -69 864 1050'186.1000.-136‘ 971 1220 -2491100 129
0,8 440 650, -210 520 -80 661 850 189! 8OO1—1391 700 1050 -350 920 2£0
Таблица 8
Сравнение значений изобарного изотермического потенциала
систем кадмий — висмут — ртуть и кадмий — олово — ртуть,
рассчитанных методами (С), (Б) и (К) и полученных
из экспериментальных данных, кал!г-атом
2Vcd Bi:Hg(Sn:Hg)—1:4 Bi:Hg(Sn:Hg)-l:l Bi:Hg(Sn:Hg)=4:l
a X ф N <1 1 0 ts <1 1 g <1 f g <1 1 a и . & is <3 1 g N <1 Г g <1 1 g <1 1 a X IS <1 1 0 1 g bJ <1 1 g is о I
0,1 810 790 918 Си 900 гстема 960 Cd— 970 Bi—и 1119 te 1000 760 700 967 900
0,2 1120 1100 1200 1140 1190 1200 1350 1250 970 970 1200 1120
0,3 1280 1280 1390 1280 1340 1390 1517 1350 1060 1180 1373 1240
0,4 1360 1360 1450 1390 1400 1470 1530 1370 1090 1320 1400 1300
0,5 1340 1360 1490 1390 1380 1460 1565 1360 1110 1350 1431 1300
0,6 1250 1300 1370 1300 1280 1390 1500 1300 1040 130,0 1320 1250
0,7 1090 1120 1223 1200 1070 1100 1258 1200 870 1180 1203 1150
0,8 850 900 1050 1020 780 t 720 1150 1050 620 1 10O0 1050 1010
Система Cd—Sn—Hg
0,1 0,2 870 1110 800 1080 705 1070 770i 880 1000 1090 790 1000 811 1050 750 970 580 730 530 800 729 950 OO <55 88
0,3 1290 1210 1196 1160 1210 1180 1197 1100 810 940 10,51 960
0,4 1370 1310 1270 1250 1250 127Б 1230 1150 840 10,00 1080 1020
0,5 1360 1320 1325 1300 1290 1250 1262 1160 «820 980 1095 1030
0,6 1290 1260 1260 1260 1210 1150 1210 1100 760 840 1050 1000
0,7 1200 1130 1106 1100 1100 940 1043 1000 690 720 917 900
0,8 1000 920 950 940 870 750 850 800 550 570 780 700
В таблице 8 приведены изобарно-изотермические потен-
циалы систем Cd—Bi—Hg и Cd—Sn—Hg, рассчитанные из
экспериментальных данных методом Даркена и из значений
ДИ для граничных двойных систем по уравнениям М. Сусаре-
ва — А. Горбунова, Бонье и Колера. Сопоставление данных
показывает, что расчетные значения AZ, полученные при
помощи уравнения М. Сусарева — А. Горбунова и Колера,
очень хорошо согласуются с экспериментальными данными
AZ. Наибольшее расхождение составляет ±50 кал!г-атом,
что находится в пределах ошибки эксперимента при опреде-
лении термодинамических свойств тройных систем. Следует
отметить, что расчетные значения AZ тройной системы
Cd—Bi—Hg, полученные по уравнению Бонье (И—31), зна-
чительно превышают экспериментальные значения AZ на
±200—300 кал!г*атом,
В случае системы Cd—Sn—Hg (см. табл. 8) наблюдается
удовлетворительное совпадение расчетных и эксперимен-
тальных величин AZ. Однако в этом случае наилучшее со-
гласие расчетных и экспериментальных значений AZ наблю-
дается при использовании уравнения М. Сусарева — А. Гор-
бунова.
Расчет по уравнениям Бонье и Колера, особенно для
амальгам, содержащих олово и ртуть при соотношении 4:1,
дал значения AZ, отличающиеся от экспериментальных на
200—250 кал!г-атом.
Таким образом, анализ расчетных и экспериментальных
термодинамических функций тройных амальгамных систем
РЬ—Bi—Hg, Cd—Bi—Hg и Cd—Sn—Hg показывает, что
наибольшее согласие с опытными данными наблюдается при
использовании уравнения М. Сусарева — А. Горбунова. Наи-
большее расхождение получается при расчете изобарно-изо-
термического потенциала по уравнению Бонье (II—31), одна-
ко оно не выходит за пределы ошибки экспериментального
определения AZ (10—15%). Только в области составов амаль-
гам, бедных ртутью, и при соотношении Me:Hg = 4:1 разли-
чие в расчетных и экспериментальных значениях AZ дости-
гает ~ 20 %. Поэтому уравнения М. Сусарева — А. Горбуно-
ва (П—32), Бонье (II—31), Колера (II—27), а также, как
показано нами при расчете термодинамических свойств
тройных амальгамных систем индий — кадмий — ртуть, сви-
нец — индий — ртуть, свинец — олово — ртуть, кадмий —
свинец — ртуть и других, уравнения Нывлта (II—29) [91] и
Тупа (II—30) [217] могут быть использованы для расчета
приближенных значений термодинамических свойств трой-
ных амальгамных систем исходя из свойств двойных гра-
ничных систем.
117
ИНТЕРМЕТАЛЛИЧЕСКИЕ
СОЕДИНЕНИЯ МЕТАЛЛОВ
В АМАЛЬГАМНЫХ СИСТЕМАХ
ПРИРОДА ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
С РТУТЬЮ И В СЛОЖНЫХ АМАЛЬГАМАХ
Для амальгамной металлургии очень важно знать усло-
вия существования интерметаллических соединений в рту-
ти и амальгамах. Однако, несмотря на важность данной про-
блемы, до настоящего времени остаются дискуссионными
[1—3, 146, 220—247] представления о природе фазовых
равновесий в ртути в трехкомпонентных системах Mei —
Мег—Hg, когда металлы Mei и Мег образуют между собой
интерметаллическое соединение состава MeiMe2n, а также в
бинарных системах Mei—Hg, при образовании металлом
(Mei) с ртутью интерметаллического соединения MejHg„.
Ряд авторов считают, что в разбавленных амальгамах интер-
металлические соединения могут существовать лишь в виде
труднорастворимых осадков, растворимая часть которых в
ртути полностью диссоциирована |3, 231—242]. По данным
других авторов [1, 2, 146, 200, 220—230, 243—248], в за-
висимости от физико-химических свойств металлов и их
сродства друг к другу в амальгамах могут образовываться
как хорошо растворимые, малодиссоциированные соедине-
ния, так и плохо растворимые, растворенная часть которых
полностью диссоциирована.
Представления о существовании ближней упорядоченно-
сти типа соединений в амальгамных жидких системах не
118
противоречат закономерностям, установленным для метал-
лических сплавов [108, 211, 249—252]. Из анализа литера-
турных данных следует, что в бинарных амальгамах, так
же как и в металлических сплавах, может сохраняться упо-
рядоченность типа соединения при температурах выше тем-
ператур плавления этих соединений. При плавлении метал-
лических кристаллов, имеющих пространственные решетки
с различными типами связи, образуются жидкости различ-
ного типа. В настоящее время структурные особенности этих
жидкостей все шире исследуются с точки зрения общей тео-
рии жидкого состояния [211, 249—252]. Одним из крайних
случаев структуры расплава интерметаллических соедине-
ний может быть беспорядочное распределение атомов. В дру-
гом крайнем случае интерметаллическое соединение образует
расплав с высокой степенью локального порядка, ана-
логично наблюдаемому в ионных расплавах с многозаряд-
ными ионами. В промежуточных случаях интерметалличе-
ские соединения будут обладать определенной, часто даже
значительной степенью диссоциации.
Известно множество пар металлов, которые образуют
кристаллические соединения и для которых различные тер-
модинамические и физико-химические свойства расплавов
указывают на заметную устойчивость локальной упорядо-
ченности в жидком состоянии [108, 200, 249, 250]. Сохране-
ние структуры ближнего порядка при плавлении характерно
для соединений с сильно различной электроотрицатель-
ностью компонентов. При образовании таких соединений
наблюдается значительное выделение тепла и уменьшение
общего объема, даже если компоненты смешиваются в рас-
плавленном состоянии.
С этой точки зрения можно ожидать существования и
жидких слабодиссоциированных интерметаллических соеди-
нений Mei Мег в ртутной фазе трехкомпонентной системы
Mei—Мег—Hg. Можно полагать, что дискуссионный харак-
тер представлений о природе интерметаллических соедине-
ний в амальгамах обусловлен ограниченным числом экспе-
риментальных фактов о свойствах небольшой группы интер-
металлических соединений, которые были получены с
помощью методов, не позволяющих вскрыть их физико-хими-
ческую природу и характер фазовых равновесий в системе
Mei—Мег—Hg. Поэтому развитию фазовых равновесий в
амальгамных системах будут способствовать накопление но-
вых экспериментальных данных, их анализ и сопоставление
с известными. Для анализа фазового равновесия в сложных
амальгамных системах необходимо использовать различные
методы физико-химического анализа.
119
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
В БИНАРНЫХ СИСТЕМАХ
Количественные характеристики взаимодействия метал-
лов в бинарных металлических системах (состав интерметал-
лических соединений, значения констант диссоциации) мож-
но получить следующим образом. В работе [252] для
определения состава интерметаллического соединения и вы-
числения константы диссоциации предложен потенциомет-
рический метод. Для получения исходных данных измеряют
э. д. с, концентрационных цепей типа
Me | электролит Me.n+ I MeiMe2, (III—1)
^=1 Nt=x
где Me] — более электроотрицательный лотенциалопреде-
ляющий металл; Ме2 — более электроположительный ме-
талл; N] — атомная доля металла Mei в сплаве.
В случае отсутствия взаимодействия между компонента-
ми сплава (идеальные растворы) зависимость э. д. с. цепи
(III—1) от состава должна подчиняться уравнению Нерн-
ста—Тюрина [252]
4В= i
и отвечать прямой в координатах Е—In ~ с угловым коэф-
фициентом RT/nF. Взаимодействие компонентов в бинарной
системе по уравнению (III—3)
Ме1+^Ме2^±: Ме1Ме2л
(Ш-З)
приведет к понижению активности металлов в сплаве и вы-
зовет отклонение э.д. с. от теоретической зависимости по
уравнению на величину Es. В этом случае зависимость э. д. с.
цепи (Ш—1) от состава описывается уравнением
A£=£s + ~ In
1 nF Nj|
(Ш-4)
На рисунке 52 приведен ход теоретической кривой Е—
, 1
In у~ при отсутствии и наличии взаимодействия между ком-
понентами по уравнению (III—3). Как видно, при взаимо-
действии металлов между собой зависимость Е—1п-^- имеет
характерную форму и отвечает линейной зависимости, от-
клоняясь на величину Е8 от расчетной по уравнению
120
Рис. 52. Зависимость э. д. с. концентрационной цепи от
lg 1/N]. 1 — расчетная кривая по уравнению Нернста—Тю-
рина ; 2 •— реальная кривая при взаимодействии металлов
Mei и Мез между собой с образованием интерметаллического
соединения Ме-Мег.
(III—2). Чем менее диссоциировано соединение Ме1хМе2у,
тем большее значение имеет Е8. Константа диссоциации ин-
терметаллического соединения MeiMe2, в реальной системе
ам_ -о"
Aiet Мее
aMetMe2n
(Ш-5)
может быть рассчитана, если известны активности или коэф-
фициенты активности Mei, Ме2 и интерметаллического со-
единения Мв1Ме2Л. Уравнение (III—5) может быть исполь-
зовано для расчета состава интерметаллического соединения
Ме]Ме2л. Логарифмируя уравнение (III—5), получим
— Alg А=— lg KD + п U аМег,
(Ш-6)
где 41g А= 1g аме,— 1g
Уравнение (III—6) является уравнением прямой и может
быть использовано для графического определения состава
интерметаллического соединения MejMe2x в жидком сплаве
или амальгаме. Для расчетов необходимо использовать ак-
тивности металлов Mei и Мез, а активность интерметалличе-
121
ского соединения в расплаве может быть рассчитана по ме-
тоду [253]. Прямолинейной зависимости — AlgA—lgaMe2
будут отвечать лишь данные для соединения MeiMe2n > обра-
зующегося в расплаве.
Второй метод основан на использовании уравнения мате-
риального баланса [254]. В этом случае активность соедине-
ния MelxMeoy может быть рассчитана по уравнению
аМе1жМе2!/
(Ш-7)
/ Д' \
ГДе '^“(Яме, ’ х~\~у_1 " ^Ме(^
Уравнение (III—7) вытекает из уравнения материального
баланса:
• * *
Л2 77о 77^ 71g
(Ш-8)
где п\ и п2 — числа молей компонентов в системе, рассчи-
танные без учета образования интерметаллических соедине-
ний: П1*, 722* и Пз* — количества молей свободных металлов
и интерметаллического соединения в равновесной смеси.
Если предположить, что — стехиометрический коэф-
фициент /-частицы, тогда из (III—8) следует
2 л*=2Яг +
(Ш-9)
и при i = k
'>k= n^nk^N\ ^n^N^-N
откуда
'k~NЧ'*
(III—10)
При (р1 = (рз получим (III—7). Можно оценить N2* по урав-
нению, аналогичному (III—7), либо по разности
(Ш-11)
В уравнениях (III—7) и (III—11) штрихи означают ис-
пользование приближенного равенства Ni^ai при расче-
те 2V|*. Было показано [254], что
у
, (III—12)
Mej^Me2y
122
k„= ДМе,-
л
Me2xMe2F
(Ш—12a)
при -> 0, k' -> k и k" -> k.
Рассмотрим экспериментальные данные о равновесии
межатомного взаимодействия при образовании интерметал-
лических соединений в расплавах и проведем сопоставление
свойств соединений в металлических системах и амальга-
мах. Ряд интерметаллических соединений в расплавах был
обнаружено. А. Есиным с сотр. [255, 256] методом э. д. с.
Установлено, что для жидких сплавов железа с кремнием
и углеродом ход кривой э. д. с. в зависимости от содержания
кремния типичен для кривых потенциометрического титро-
вания, когда образуется малорастворимое или малодиссо-
циированное соединение. При температуре выше кривой
ликвидуса такой ход кривой свидетельствует о существова-
нии в жидком состоянии достаточно прочного соединения.
О сохранении ближнего порядка в жидких сплавах цинка и
кадмия с сурьмой и в жидких растворах таких систем, как
золото — олово, медь — кадмий, магний — висмут и др.,
свидетельствуют данные [257, 258]. Наличие области ближ-
него порядка в жидких Au—Sn- и Au—Pb-сплавах под-
тверждается также в работах [259—261]. Количественная
оценка параметров ближнего порядка соединения AuSn в
жидких растворах была проведена А. Ф. Скрышевским
[260, 261]. Были изучены расплавленные соединения АиЗщ
и AuSn.t. Показано, что интерметаллические соединения си-
стемы Sn—Au в жидком состоянии имеют неодинаковый
ближний порядок в расположении атомов. При изучении
кривой атомной плотности AuSn в жидком состоянии обна-
ружено, что ее первый максимум находится над первой и
второй координационными сферами кристаллической ре-
шетки AuSn. Второй и последующие максимумы также от-
вечают радиусам соответствующих координационных сфер.
Из оценки положений максимумов кривой распределения и
площади первого максимума было показано, что при плав-
лении соединения AuSn существенной перестройки ближне-
го порядка не происходит.
Структура соединения AuSn в расплавленном состоянии
изучалась в работе [262]. Автор наблюдал интересный
факт — раздвоение главного пика при составе, близком и ин-
терметаллическому соединению AuSn, и пришел к заклю-
чению, что в расплавленном соединении AuSn при 440 и
540°С (Тпл Ausn =418сС) часть атомов распределена стати-
стически, а остальные атомы расположены относительно
123
Друг друга, как и в твердом сплаве, т. е. соединение в жид-
ком состоянии частично диссоциировано.
Несмотря на ясность представлений о состоянии интер-
металлических соединений в обычных металлических рас-
плавах, вопрос о природе интерметаллических соединений
в ртутной фазе является остро дискуссионным [1—3, 146,
220—240, 242—248]. По представлениям, развиваемым в
работах [3, 231—240], между разнородными металлами Mei
и Мег в ртутной фазе могут образоваться только слабодис-
социированные труднорастворимые интерметаллические
соединения Ме£Ме2, если они образуются в бинарной системе.
Даже в отношении амальгам щелочных металлов, по мне-
нию [3, 240], «нельзя говорить о наличии... молекул интер-
металлического соединения в жидкой фазе». Авторы [240]
полагают, что в жидких амальгамах щелочных металлов по-
следний связан с большим числом атомов ртути (30—20), ко-
торые образуют сольватную оболочку. В нее входят атомы
ртути не только первой координационной сферы, но также
второй и даже третьей. Причем количество атомов ртути в
сольватной оболочке меняется с изменением концентрации
щелочного металла в амальгаме.
По представлениям многих авторов, в амальгамах ще-
лочных металлов сохраняется упорядоченность типа соеди-
нения в жидкой фазе и даже в парах [2, 200]. В расплаве
Na—Hg каждый атом натрия имеет восемь ближайших со-
о
седей — атомов ртути, расположенных на расстоянии 3,27 А,
и четыре вторых ближайших соседа — атомов натрия на
©
расстоянии 3,45 А. Поэтому трудно представить, следуя
взглядам авторов [240], какие силы могут удержать около
одного атома натрия, калия и т. д. до 30—20 атомов ртути.
По расчетам [3, 240], изменение природы металла амальга-
мы мало влияет на число атомов ртути, окружающих атом
металла в амальгаме. Так, анализ расчетных данных чисел
атомов ртути, связанных с атомами натрия, калия, индия
и таллия в амальгаме, показывает, что независимо от при-
роды металла амальгамы в 2,0 ат. % амальгаме с двумя ато-
мами металла связано 8—10 атомов ртути, а в 4,0 ат. %
амальгаме с четырьмя атомами калия, натрия, индия или
таллия связано 5—6 атомов ртути [3, рис. 42—44].
Физико-химические свойства этих металлов (потенциа-
лы ионизации, электроотрицательности, химические и
электрохимические потенциалы, атомные радиусы, энергии
межатомной связи Me—Me и др.) различаются значитель-
но. Поэтому, по данным работы [241], при взаимодействии
этих металлов с ртутью экзотермический вклад их химиче-
124
ского взаимодействия будет существенно различаться и со-
стояние атомов этих металлов в ртути будет различным.
Изучению структуры жидких амальгамных систем посвяще-
ны работы [149, 263, 264]. Ф. Заурвальд и В. Теске, сопо-
ставляя кривые радиального распределения расплавленных
соединений Tl2Hgo и KHg2, пришли к заключению, что вбли-
зи температуры плавления расположение атомов в расплаве
подобно их расположению в твердом состоянии [249, 263].
Структура интерметаллических соединений щелочных ме-
таллов с ртутью изучалась авторами работы [264]. Для изу-
чения структуры интерметаллических соединений в жидком
состоянии в системах калий — ртуть и натрий — ртуть бы-
ли использованы радиальные функции распределения элек-
тронов [264]. Используя в качестве моделей кристалличе-
ские структуры твердых интерметаллических соединений в
этих системах (KHg, KHg2, KHgs, NaHg, NaHg5), Шуман
установил, что они совместимы с функцией распределения
электронов в этих расплавленных интерметаллических со-
единениях. Было показано, что разрыхленная координация
твердых интерметаллических соединений в системах ка-
лий — ртуть и натрий — ртуть является структурной мо-
делью расплавленных интерметаллических соединений
MeHgx.
Интересные результаты были получены при изучении
температурной зависимости сдвига Найта In115 в жидких
сплавах системы In—Hg с помощью ядерно-магнитного ре-
зонансного дисперсионного спектрометра [265, 266]. Авторы
[265] предположили, что некоторые (остовы) структурные
группы образующихся в твердом состоянии интерметалличе-
ских соединений системы индий — ртуть (InHge, InHgn,
InHg, InnHg) не распадаются и в жидком состоянии около
ликвидусной кривой. Действительно, измерение сдвига Най-
та In115 в жидких сплавах показало отрицательную линей-
ную зависимость резонансной частоты в исследованном тем-
пературном интервале (—70 4-60°С) для всех изученных
сплавов (16, 25, 35, 50 и 65 ат. % индия). Для жидких спла-
вов с 16 и 50 ат. % In, отвечающих интерметаллическим
соединениям InHge и InHg в твердом состоянии, резонансная
частота для In115 продолжала линейно возрастать при умень-
шении температуры, и температура плавления этих соедине-
ний не находила отражения на кривой температурной зави-
симости резонансной частоты. Для других изученных спла-
вов (25, 35 и 65%), не отвечающих составам интерметалли-
ческих соединений, образующихся в системе индий — ртуть,
на кривых температурной зависимости сдвига Найта наблю-
дались изломы, которые соответствовали температурам лик-
125
видуса этих сплавов. Полученные данные показывают, что
в переохлажденных жидких сплавах индий — ртуть, не со-
ответствующих составам соединений в твердом состоянии,
наблюдается изменение атомного распределения и электрон-
ного состояния компонентов в сплаве при переходе через
температуру ликвидуса. В сплавах же, отвечающих соста-
вам интерметаллических соединений в твердом состоянии,
атомное распределение в такой степени устойчиво, что струк-
тура и состав, свойственные для жидкого сплава при темпе-
ратурах выше кривой ликвидуса, сохраняются и в переох-
лажденном состоянии. По мнению [265], такое поведение
сплавов при измерении температурной зависимости сдвига
Найта и временной релаксации In115 в жидких сплавах
In—Hg позволяет предположить образование устойчивого
интерметаллического соединения в этой системе.
Изучению магнитной восприимчивости жидких индие-
вых амальгам (0--60 ат.% индия) посвящена работа [267].
В сплавах с малым содержанием индия (0—6 ат.%) анома-
лии в ходе кривых магнитной восприимчивости не были
обнаружены. При 203С авторы наблюдали максимум магнит-
ной восприимчивости для сплава с 30 ат.% In (12,5 вес.%) и
широкую выпуклость восприимчивости около 49 ат. % In
(~36 вес.%). Эти аномалии объясняются [267] образова-
нием «рыхлых» атомных ассоциатов в жидком сплаве ин-
дий — ртуть.
О взаимодействии компонентов в системах индий — ртуть
и таллий — ртуть в жидком состоянии свидетельствуют ре-
зультаты измерения эффекта Холла в расплавах In—Hg
[118, 268—270] и Т1—Hg [268, 271]. В этих работах откло-
нения от модели свободных электронов были обнаружены
для области составов амальгам, где на диаграмме состояния
наблюдается образование интерметаллических соединений.
Доказательство ближней упорядоченности в амальгамах
щелочных металлов было получено при измерении вязкости
жидких сплавов системы калий — ртуть при 300 и 360°С и
натрий — ртуть при 370 и 390°С [272]. Изотермы вязкости
этих систем характеризуются четким максимумом в облас-
ти существования интерметаллического соединения KHg2 и
NaHg2. Отклонение вязкости от аддитивности при смешении
калия и натрия с ртутью составляет соответственно 250 и
180%.
При измерении вязкости жидких амальгам (Тпл сплава
+ 50°С), как отмечалось в главе II, на кривых состав — свой-
ство были обнаружены [82] два максимума, которые соот-
ветствовали определенным соединениям на диаграмме со-
стояния системы индий — ртуть и не исчезали при повыше-
но
нии температуры. Максимумы на изотермах вязкости
системы индий — ртуть при температурах выше температур
ликвидуса сплавов можно объяснить высоким сродством ин-
дия к ртути и сохранением взаимодействия между индием
и ртутью и в жидком состоянии. Новым методом исследова-
ния металлических расплавов и интерметаллических соеди-
нений, который позволяет делать заключение о наличии или
отсутствии взаимодействия между компонентами, является
метод электродиффузии, успешно развиваемый С. И. Драки-
ным с сотр. [273—281]. В этих работах показано, что обра-
зующиеся в жидких сплавах щелочных металлов интерме-
таллические соединения играют большую роль в процессе
электродиффузии. Установлено, что существует четкая связь
между образованием интерметаллических соединений и ве-
личинами коэффициентов электродиффузии (k) и кажущих-
ся зарядов. Эта связь наглядно представлена в таблице 9, ко-
Таблица 9
Влияние химического взаимодействия на параметры электродиффузии
(К и Z)* в сплавах щелочных металлов, по данным [273, 279—281]
Концент- рация при- меси, мае. % Темпера- тура, °C О г-< а м £ Z Данные об образовании химических соединений
К—Hg 3,0 115 2,92 -25,2 KHg, KHg2
К- -TI 1,0 110 4,50 -40,0 КТ1
К-РЪ 3,0 100 5,20 —44,0 KPb
Na—Hg 0,6 110 4,28 -36,0 NaHg, NasHg2, Na;tHg
Na —Cd 1,0 115 1,72 -15,0 Данные отсутствуют
Na—Pb 1,5 115 6,20 -54,0 Na5Pb4, Na&Pb2, NaPb, NaPb3
Na—In 3,0 115 3,80 -32,0 Данные отсутствуют
Na—Ba 5,0 115 2,20 -36,Э Na12Ba, NaBBa, NaBa
Na-Tl 5,0 115 3,40 -58,0 Na0Tl, Na2Tl, NaTI
Na—Ag 2,5 150 0,6 —► Соединения не обра- зуются
Na-Sr 8,4 115 0,6 —- »
* К — коэффициент электродиффузии; Z—кажущийся заряд.
торая иллюстрирует изменение свойств расплавленных ка-
лия и натрия в амальгамах и других металлических сплавов
при образовании интерметаллических соединений с металла-
ми-добавками. Как видно из таблицы, чем больше в системе
металл — металл образуется интерметаллических соедине-
ний и чем они прочнее, тем большее значение имеют К n Z
127
и, следовательно, интенсивнее диффундирует в процессе
электропереноса растворенный металл к аноду. Влияние тем-
пературы на электродиффузию ртути в системе натрий —
ртуть изучалось в работе [273]. Было показано, что подвиж-
ность ртути в системе при повышении температуры сначала
увеличивается и достигает максимума при 210°С, а затем
падает. Такое поведение ртути обусловлено, по мнению [273,
280], распадом при высокой температуре (т. лл. сплава
~ 80°С) существующих в сплаве частиц интерметаллидов.
Д. К. Белащенко [282—284] также показано влияние
химического взаимодействия в жидких сплавах на величи-
ну кажущегося заряда (Z). Изучая электродиффузию золота
и серебра в металлах-растворителях V (Cd, In, Sn) и VI пе-
риодов (Pb, Bi и Т1), авторы [282—284] нашли, что кажу-
щиеся заряды Ag и Au в первом случае значительно боль-
ше по абсолютной величине, чем во втором. Предполагается,
что это различие связано с образованием интерметалличе-
ских соединений между Ag и Au и металлами V периода,
тогда как с металлами VI периода серебро и золото образуют
эвтектические сплавы.
Методом электродиффузии оказалось возможным изу-
чать межчастичное взаимодействие разбавленных растворов
двух металлов, растворенных в третьем, например в ртути,
олове и других металлах [278, 281].
Из приведенных данных видно, что самые различные ме-
таллические системы на основе ртути или других металлов
при образовании интерметаллических соединений между
компонентами систем, как правило, имеют в расплавах син-
гулярную точку на диаграмме состав — свойство и сохра-
няют в жидком состоянии структуру ближнего порядка,
сходную со структурой твердого интерметаллического соеди-
нения. Рассмотрим некоторые из металлических систем, в
которых наблюдается отчетливо выраженное взаимодейст-
вие в твердом состоянии в соответствии с их диаграммами
состояния.
Для анализа поведения интерметаллических соединений
в расплавах нами был использован метод э. д. с. [227, 252,
254]. Об интенсивности межатомного взаимодействия суди-
ли путем анализа хода кривых ДЕ—lnl/Vi. На рисунке 53
приведена зависимость э. д. с. концентрационных цепей
(III—1) для эвтектической системы галлий — цинк [285].
Данные о значениях э. д. с. были заимствованы из работы
[285]. Как видно, в этой системе ход э. д. с. цепи во всем ин-
тервале концентраций совпадает с теоретическим, что ука-
зывает на отсутствие взаимодействия в системе галлий —
цинк.
128
Рис. 53. Зависимость э. д. с ♦ от 1g тт— для спла-
AZn
bob Ga—Zn, по данным [285]. 1 — расчетные
данные; 2 — экспериментальные (то ясе на рис.
54—58).
Рис. 54. Зависимость э. д. с. цепи типа (Ш—il) от
1g для сплавов Mg—Pb, по данным [286],
при 650*0.
9-122
В случае взаимодействия компонентов и образования в
бинарной системе определенных интерметаллических соеди-
нений ход кривой э.д.с. цепи (III—1) имеет характерную
форму, по которой можно судить об образовании жидких
интерметаллических соединений определенного состава. Как
видно из рисунка 54, экспериментальная кривая э. д. с. силь-
но отличается от теоретической (~100 мв) для области низ-
ких концентраций свинца в системе магний — свинец (пря-
мая параллельна теоретической) [286, 290]. Анализ зависи-
мости — AlgA —}ga Mg показал,
Рис. 55. Зависимость э. д. с. цепи
типа (III—1) от lg -i- для сплавов
Ni
Cd—Sb, по данным [287], при
650°С.
сурьмой [287]. Из рисунка 55
что в этой системе в жид-
ком состоянии образуется
соединение Mg2Pb. Посколь-
ку температура плавления
этого соединения 550°С, а
данные э. д. с. приведены
для 650°С, то, следователь-
но, соединение MggPb на-
ходится в расплавленном
жидком состоянии. Ход
кривой э. д. с. также свиде-
тельствует о сохранении
взаимодействия компонен-
тов сплава и при больших
разбавлениях. Аналогич-
ная зависимость наблюдает-
ся для сплавов кадмия с
видно, что разность э.д.с.,
теоретически рассчитанных по уравнению Нернста и опреде-
ленных в работе [287], составляет 40 мву что связано с обра-
зованием растворенного слабодиссоциированного соединения
CdSb. Из активностей кадмия и сурьмы, приведенных в ра-
боте [287], можно рассчитать активность соединения CdSb
и константу его диссоциации по уравнению
KD=
gCd‘gSb
gCdSb
(III—5а)
Активность соединения CdxSby рассчитывали по урав-
нению (III—7а):
aedsb ♦ (Ш 7а)
где <pi = (аса — —Оса).
В таблице 10 приведены значения константы диссоциа-
130
ции соединения CdSb при Т=650°С, рассчитанные для спла-
вов с содержанием кадмия 2V1 =0,104-0,50.
Из рассмотрения зависимости э. д. с. от lgl/2Vxa (рис. 56)
для сплавов натрия с таллием, построенной по данным
Таблица 10
Константа диссоциации соединения CdSb при Т = 650°С
ATSb, ат. доли Ned, ат. доли asb aCd aCdSb
0,90 0,10 0,900 0,037 0,0672 0,495
0,80 0,20 0,790 0,079 0,137 0,455
0,70 0,30 0,681 0,129 0,206 0,42
0,60 0,40 0,530 0,199 0,251 0,42
0,50 0,50 0,384 0,295 0,257 0,44
[288], следует, что и в этом
случае взаимодействие ком-
понентов сильно влияет на ход
450°С в расплаве существует
наиболее прочное в системе
Na—Т1 соединение состава NaTl
(Тпл =305°С). Значения активно-
сти таллия, определенные по
данным э. д. с., и активности нат-
рия, вычисленные методом гра-
фического интегрирования [2],
приведены в таблице 11. Кон-
станта диссоциации рассчитыва-
лась по уравнению (III—7).
Из сопоставления констант
диссоциации видно, что соеди-
нение NaTl более прочное, его
К d меньше, чем у CdSb.
кривой. При температуре
Рис. 56. Зависимость э. д. с.
цепи типа (III—1) от lg—
для сплавов Na—Т1, по дан-
ным [288], при 450°С.
Таблица 11
Константа диссоциации соединения NaTl при Т’ = 450°С
.vn aNa aTl aNaTl
0,100 0,900 0,00132 0,946 0,109 0,0114
0,159 0,841 0,00317 0,940 0,185 0,0162
0,200 0,800 0,00468 0,801 0,242 0,0150
0,300 0,700 0,0186 0,731 0,391 0,033
Подобные зависимости можно построить и для ряда дру-
гих расплавов бинарных металлических систем. Рассмотрим
некоторые из них.
131
Как видно из рисунка 57, реальная кривая концентра-
ционной цепи (III—1) отклоняется от идеальной кривой
э. д. с., рассчитанной по уравнению (III—2), на величину Е8'
Согласно диаграмме состояния, в системе натрий — олово
образуются два конгруэнтно плавящихся интерметалличе-
Рис. 57. Зависимость э. д. с. цепи типа (Ш—.1) от 1g— для системы
Hi
Na—Sn, по данным [289].
ских соединения: Na?Sn (477°С) и NaSn (576°С) и три ин-
конгруэнтно плавящихся интерметаллических соединения:
Na4Sn (температура разложения 405сС), Na4Sn3 (478°С)
и NaSns (ЗО6°С) [24]. Полагают, что, хотя наиболее тер-
мически прочным соединением является NaSn, в жидком
сплаве натрия с оловом наряду со структурными группами
соединения NaSn существуют и структурные группы соеди-
нения Na^Sn [289]. Анализ зависимости (III—6) показывает,
что в расплаве преобладает соединение NaSn. Константа дис-
социации интерметаллического соединения NaSn при 600°С
равна 3 • 10~6 ат. доли.
На рисунке 58 приведены зависимости АЕ от lgl/N[ для
различных систем [227]. Анализ кривых э. д. с. цепи (III—1)
этих систем в координатах АЕ—igl/Ni показывает, что во
всех случаях образование устойчивых в жидком состоянии
интерметаллических соединений вызывает отклонение э. д. с.
от расчетных значений; появление участка, параллельного
теоретической кривой, свидетельствует о взаимодействии
132
Рис. 58. Зависимость э. д. с._ цепи типа (III—1) от 1g—
' Ni
для системы Na—Pb при 475°С (а), для системы К—РЬ
при 575°С (б) и для системы Mg—Ga, по данным [286],
при 640°С (е).
между компонентами даже при больших разбавлениях, а ве-
личина Es '(разность между теоретическими значениями
э.д. с. и экспериментальными) характеризует прочность об-
разующегося интерметаллического соединения.
Таким образом, измеряя э. д. с. металлических сплавов
относительно чистого электроотрицательного металла, мож-
но оценить глубину взаимодействия компонентов, сделать
вывод об образовании интерметаллических соединений и
рассчитать константу диссоциации.
Взаимодействие металла и ртути в бинарных амальгам-
ных системах можно также изучать путем измерения э. д. с.
концентрационных амальгамных цепей типа
Met | электролит Mef+ 1 MejHg, (Д1—13)
Nt=x
В этом случае для выявления взаимодействия в системе
Mei—Hg путем анализа зависимости ДЕ—lnl/7Vi изучение
цепей (Ш—13) необходимо проводить в широком интервале
концентраций и температур. При изучении электрохимиче-
ских свойств амальгамных систем потенциометрическим
методом часто замеряют э. д. с. концентрационных цепей
типа
MetHg | Ме;+ | MelxHg.
с' ct
(III—14)
Полагают, что признаком отсутствия взаимодействия ме-
таллов в изучаемой системе является прямолинейная зави-
симость э.д.с. концентрационных амальгамных цепей типа
(Ш—14) в зависимости от логарифма отношения концентра-
ций металла в амальгаме электрода сравнения (левый элек-
трод) и в исследуемой амальгаме (правый электрод)
(IgCi'/Ci). При взаимодействии металла с ртутью его актив-
ность понижается и, казалось бы, не должна наблюдаться
прямолинейная зависимость э.д.с. цепи (III—14) от IgC/ZCi.
Однако из-за неправильного выбора электрода сравнения це-
пи (III—14) выявить взаимодействие металла и ртути путем
измерения э.д.с. цепи (III—14) не представляется возмож-
ным. Для измерения э.д.с. цепи (III—14) обычно исполь-
зуют разбавленные амальгамы, и поэтому состояние метал-
ла в электроде сравнения и в исследуемой амальгаме прак-
тически мало различается независимо от того, взаимодейст-
вует металл с ртутью или нет. Угловой коэффициент кривой
ДЕ—lgC//Ci в этом случае обратно пропорционален валент-
ности потенциал определяющего иона, а ход кривой ДЕ—
134
IgCZ/Cj совпадает с ходом кривой, рассчитанной по уравне-
нию Нернста — Тюрина
Rt Ci
(HI—15)
Действительно, прямолинейные зависимости ДЕ—\gC'\!C{
были получены для амальгам индия [229], меди [292], маг-
ния [293J, хотя в этих системах твердо установлено образо-
вание интерметаллических соединений [2, 24]. В работах
[294—297] на основании линейной зависимости э.д. с. цепи
(III—14) от состава были сделаны ошибочные выводы об
идеальности таких амальгамных систем, как индий — ртуть
[294], медь — ртуть [294], висмут — ртуть [296], свинец —
ртуть [297], сурьма — ртуть [294].
Как указывалось выше, величина Es в зависимости от
состава амальгамы может принимать различные значения,
и поэтому при анализе межатомного взаимодействия компо-
нентов амальгамы сопоставление хода экспериментальных
значений э. д. с. и расчетных теоретических необходимо вес-
ти относительно чистого электроотрицательного металла, ак-
тивность которого принимается равной единице. Если же в
качестве электрода сравнения использовать разбавленную
амальгаму, то коэффициенты активности металла в обеих
амальгамах могут оказаться одинаковыми и можно сделать
ошибочный вывод об отсутствии взаимодействия и даже под-
чинении системы идеальным законам.
Действительно, легко показать, что если концентрации
металлов в двух амальгамах (разбавленных) близки между
собой (различаются не более чем на два порядка), то, по-
скольку величина Es (разность между измеренными и тео-
ретически рассчитанными значениями э. д. с.) для них оди-
накова, и коэффициенты активности металла в этих амаль-
гамах будут одинаковыми. Это следует из выражений:
ДЙ=—пЕЕ0, (III—16)
где ДЯ— изменение изобарно-изотермического потенциала,
Eq — расчетное значение э. д.с. цепи (Ш—13);
Д2изб=+ИТ1пт, (III—17)
где у — коэффициент активности металла в амальгаме;
А2изб=—AZ—(—AZ*W), (III—18)
AZM=RTln^=—nFE0, (HI—19)
135
4Z=RTlna = —nFE, (III—20)
где E — э. д. с. концентрационной цепи (III—13).
Подставляя выражения (Ш—19) и (III—20) в (Ш—18)
и учитывая, что Е—Еь—Ев> получим
д 5изб=—nF(E—E^=—nFE&. (HI—21)
Из сопоставления выражений (III—17) и (III—21) сле-
дует, что
. nFE6
RT
(III—22)
Очевидно, что амальгамы, проявляющие постоянное зна-
чение Е* , обладают одинаковыми коэффициентами активно-
сти. В таблице 10 приведены значения коэффициентов ак-
тивности для системы индий — ртуть. Как видно, на участ-
ке экспериментальной кривой, параллельной теоретической,
коэффициенты активности индия постоянны. Следовательно,
при составлении концентрационных цепей типа (III—14) с
концентрациями индия в амальгамах 1 • 10-2 ат. доли
э. д. с. концентрационной цепи будет точно равна рассчитан-
ной по уравнению Нернста — Тюрина. Поэтому для выявле-
ния межатомного взаимодействия металлов с ртутью в амаль-
гамных системах необходимо в качестве электрода сравне-
ния выбирать чистый исследуемый металл [223, 252, 254].
Следует отметить, что литературные данные об э.д.с. кон-
центрационных амальгамных цепей типа (III—14) могут
быть также использованы, если их пересчитать к электроду
сравнения — чистому металлу.
Так, в работах [227, 252, 254] для выявления характера
межатомного взаимодействия металлов в системе индий —
ртуть были использованы данные об э. д. с. цепи типа
(III—13):
In | электролит In3+ ( In(Hg), (III—13а)
а также пересчитаны значения э.д.с. цепи (III—14) к э.д.с.
цепи (III—13а). На рисунке 59 приведены значения э.д.с.
цепи (III—13а) по данным [2, 298]. Здесь же нанесены зна-
чения э.д.с. цепи типа (III—14) при концентрации индия
от 1,8 -10'5 до 2,5* 10'1 ат. доли, определенные с электродом
сравнения, содержащим 5-Ю"3 ат. доли индия и пересчитан-
ные к электроду сравнения Nm=l. Как видно, полученные
значения э.д.с. цепи (III—13а) закономерно продолжают
136
ход кривой э.д. с. до значений 1g—=4,76. Отклонения
экспериментальных значений э. д. с. от теоретических свиде-
тельствуют о взаимодействии индия и ртути с образованием
соединения определенного состава. Состав соединения опре-
деляли графическим путем из углового коэффициента пря-
мой в координатах — AlgA—lgaHg> который оказался рав-
Рис. 59. Зависимость э. д. с. цепи типа (III—13а) от lg-i- для систе-
мы In—Hg при 25°С: 1 — данные [2], 2—[298].
ным 3, что согласуется с предположением об образовании в
жидкой амальгаме интерметаллического соединения InHg3
[252]. Следует отметить, что состав соединения, образующе-
гося в системе металл — ртуть, можно определить и из ана-
лиза кривой ЛЕ—lgl/N\ как обычной кривой потенциомет-
рического титрования: касательная, проведенная к более
крутой части кривой, свидетельствует, что в соединение вхо-
дит 25% In9. Поэтому его состав можно выразить как InHg3,
а равновесие в системе представить в виде
InHg3 In+3Hg.
(1П—23)
При температуре 25°С индиевые амальгамы жидкие
(Тпл InHg3 = —20,5°С). По данным физико-химического ана-
лиза, в амальгаме образуется малодиссоциированное соеди-
9 Этот прием следует использовать для предварительного определе-
ния состава интерметаллического соединения, образующегося в системе
металл — металл и устойчивого в жидком состоянии.
137
некие индия с ртутью, для которого Кр, рассчитанные по
уравнению
Kd^^L^9 (III—24)
aInHg3
приведены в таблице 12.
Таблица 12
Значения константы диссоциации соединения 1пН£з при Т — 25ЭС
ат. доли 10’-“Ш ffHg aInHg3'10’ ^•ic2 Коэффици- ент актив- ности 7*10*
0,00178 0,0000724 1 0,0016 4,55 4,06
0,0199 0,000661 1 0,019 3,48 3,31
0,0525 0,00209 1 0,05 4,18 4,00
0,1000 0,00309 1 0,0973 3,18 3,09
0,502 0,020 0,996 0,479 4,15 3,98
1,0 0,048 0,972 0,98 4,47 4,80
5,0 0,333 0,961 5,50 5,35 6,60
8,4 0,628 0,924 10,3 4,81 7,50
10,0 0,908 0,889 12,96 4,91 9,08
15,0 2,07 0,767 23,5 3,96 13,3
20,0 2,78 0,679 37,7 2,31 13,9
Подробные расчеты по этой системе приведены в работе
[254]. Постоянство KD при малых служит критерием пра-
вильности определения состава растворенного малодиссо-
циированного соединения InHg3, образующегося в жидкой
амальгаме системы ин-
дий — ртуть.
На рисунке 60 приведе-
ны зависимости э. д. с. цепи
(Ш—13а) от lgl/Ni при
различных температурах.
Из рисунка видно, что ха-
рактер отклонений э. д. с. от
теоретически рассчитанных
остается одним и тем же
при всех температурах, что
свидетельствует о сохране-
нии взаимодействия индия
и ртути в жидких амальга-
мах вплоть до 75°С.
Рис. 60. Зависимость э. д. с. це-
пи (1П—13а) от 1g для систе-
мы In—Hg лри различных тем-
пературах: 1—0, 2—25, 3—50,
4—75°С.
138
Значения средних констант диссоциации InHg3, опреде-
ленные для различных температур, соответственно равны:
Т, 9С KD
0 25 50 75 3,2-10~2 4,2-Ю-2 7,07-Ю'2 9,78-10~2
Вывод о наличии в жидких индиевых амальгамах рас-
творенного соединения совпадает с литературными данными
[267]. Исследования по электропроводности [2] показали,
что соединение InHg3 является устойчивым в жидком состоя-
нии и не разлагается при температурах до 80°С. Анализ кри-
вой рисунка 59 показывает, что э. д. с. в широком интервале
составов отклоняются от теоретических на постоянную ве-
личину, которую можно рассматривать как Е8 в функции от
состава (Es = /(AIn )). В области концентраций =10~4—
2,5 10"5 при 25°С Е8 имеет постоянное значение, равное
0,030 в. При дальнейшем увеличении атомной доли индия
в амальгаме значение Е8 плавно уменьшается. В точке, со-
ответствующей соединению InHg3, Е8 =0,012 в, что позво-
ляет подразумевать разницу потенциалов равной
= (Ш-25)
На рисунке 61,о приведена зависимость э.д.с. цепи
(III—136) от состава амальгамы, по данным [289], при 25,
50 и 75°С для кадмиевых амальгам:
Cd | электролит Cd*21 Cdx Hg. (Ill—136)
Как видно, в области гомогенной амальгамы кривая
э.д.с. параллельна теоретической кривой (Е8 = const), что
также указывает на наличие в системе растворимого, слабо-
диссоциированного соединения. Величина Е8 в этой части
кривой определяется константой диссоциации растворенной
части соединения. При достижении предела растворимости
соединение выпадает в осадок (задержка в изменении
э. д. с.). В этой части кривой равновесие можно характеризо-
вать с помощью произведения растворимости. Однако опре-
деление состава соединения в жидкой фазе амальгамы вы-
зывает затруднения, поскольку резкое изменение потенциала
при повышении температуры сдвигается в область соста-
вов, богатых кадмием. Более определенные выводы относи-
139
Рис. 61. Зависимость э. д. с. цепи (III—il36) от 1g —, по данным
№ 1
[123]г при различных температурах: 1 — 25, 2— 50, 3— 75°С,
(а); по данным [130], при 150°С (б) и при 200 и 250°С (в). 1 и 2
на рисунках б и в — соответственно расчетные и эксперименталь-
ные данные.
тельно состава соединения в системе кадмий — ртуть можно
сделать на основании данных [130], полученных при 150—
250°С. Э. д. с. цепи (III—136) при этих температурах приве-
дены на рисунках 61, б, в. Наблюдается плавная зависимость
э. д. с. от состава амальгамы, твердая фаза при этих темпе-
ратурах не образуется, и по форме кривой можно сделать
вывод об образовании растворенного малодиссоциированно-
го соединения CdHg3< В таблице 13 приведены активности
кадмия и ртути по данным [130] при 150°С, которые были
использованы для расчета константы диссоциации соеди-
нения CdHg3. Эти же значения были использованы для по-
строения графика в координатах AlgA—lgaHg , где AlgA =
= Ig’^ca—IgflcdHga- Прямолинейность этой зависимости и
угловой коэффициент наклона, равный 2,85, подтверждают
вывод об образовании соединения CdHg3.
Исходя из этих данных можно предположить, что и при
более низких температурах в равновесии с твердой фазой
находится растворенное интерметаллическое соединение
CdHg3. Константу диссоциации этого соединения при темпе-
141
Таблица 13
Активность компонентов в системе Cd—Hg
и константа диссоциации соединения CdHg3, Т = 15ОЭС
*cd> ат« доли aCd °Hg acdHg3
0,05 0,013 0,997 0,037 3,48 -10~ J
0,1 0,026 0,933 0,074 2,86-XO-
0,2 0,064 0,762 0,136 2,09-10 ;
0,3 0,134 0,623 0,166 1,97-10-1
ратурах 25, 50 и 75°С рассчитали из данных [123] для
участка кривой, параллельного теоретической зависимости.
Из таблицы 14 видно, что KD зависит от концентрации
кадмия, поэтому для нахождения абсолютной величины К &
при Ned =0 построили график в координатах —yVcd
Таблица 14
Константа диссоциации соединения CdHg3,
рассчитанная по данным [123]
T, °c JV'cd- aT- доли aCd*10 2’ ат. доли «Hg-10 KD абс
25 0,0498 0,945 8,3 1,35
0,0947 1,91 6,78 0,785 2,43
50 0,0498 0,977 8,3 1,4
0,0947 2,04 6,82 0,815
0,0983 2,09 6,69 0,812
0,1013 2,14 6,58 0,763 2,76
0,1204 2,76 6,01 0,657
0,1301 3,02 5,69 0,557
75 0,0199 0,399 9,32 2,04
0,0498 1,?8 8,42 2,3
0,0795 2,35 7,52 1,78 3,13
0,0947 2,46 7,95 1,77
0,0983 3,02 6,97 1,48
и экстраполировали полученные прямые на нулевую кон-
центрацию кадмия (рис. 62). Температурная зависимость
констант диссоциации была использована для расчета тер-
модинамических характеристик соединения CdHga. Величи-
на энтальпии образования, определенная из углового коэф-
фициента прямой (рис. 63), составила — 704 кал!моль или
142
—176 кал!г-атом. Значение AZ при 25°С составляет
—0,835 ккал/моль, a AS=0,44 кал/моль-град.
Полученные нами результаты по системам In—Hg и
Cd—Hg очень интересно сопоставить с литературными дан-
ными для системы К—Hg. В работе [60] были измерены
э. д. с. цепи
К | расплав К+ | KHg
(III—13в)
при температурах 275 и 325°С, т. е. выше температур лик-
видуса. Ход кривой в координатах э. д. с. — 1gтг приведен
А к
на рисунке 64. Э. д. с. сильно отличаются от теоретических
и указывают на образование соединения KHg2, по литера-
турным данным, — наиболее устойчивого соединения в си-
стеме калий — ртуть [24, 299]. Можно предположить, что в
143
Рис. 63. Температурная зависимость констант диссо-
циации соединения CdHga.
Рис. 64. Зависимость э. д. с. цепи (III—>13в) от
1g-Д- , по данным [60]. 1—275, 2—325°С.
области очень разбавленных амальгам, т. е. больших значе-
ний 1g , потенциометрическая кривая будет параллельна
теоретически рассчитанной так же, как в случае амальгам
индия. Константа диссоциации соединения KHg2 составляет
7-10-8 ат. доли [132].
В литературе известны также значения э. д. с. для нат-
риевых амальгам относительно металлического натрия при
комнатных температурах и 25°С [300, 301]. Результаты этих
исследований, пересчитанные относительно металлического
натрия, приведены на рисунке 65. Растворимость натрия в
ртути при этих температурах составляет 5,3ат.%, и поэтому
начиная от 1g ^-=1,275, амальгамы натрия гетерогенны. Из
рисунка 65 видно, что в области жидких амальгам э. д. с. из-
меняются с изменением состава параллельно теоретически
Рис. 65. Зависимость э. д> с. цепи типа (Ш—ЛЗв) для натрие-
вых амальгам, по данным [300, 301], при 25°С.
10-122
145
рассчитанным. Однако активность натрия сильно понижена
за счет взаимодействия с ртутью, и значение Es в этой об-
ласти составляет 750 мв. В гетерогенной области в зависи-
мости от состава образуется целый ряд интерметаллических
соединений. Наибольшее изменение потенциала приходится
на соединение NaHg2. Это соединение наиболее устойчиво в
системе Na—Hg. Данные э. д. с. хорошо согласуются с диа-
граммой состояния системы Na—Hg (рис. 66). Приведенная
Рис, 66. Сопоставление хода кривой э. д. с. для нат-
риевых амальгам с диаграммой состояния системы
Na—Hg.
на рисунке 65 зависимость э. д. с. свидетельствует, что даже
в очень разбавленных амальгамах натрия последний взаи-
модействует с ртутью с образованием растворенных интер-
металлических соединений-.
146
Нами были измерены э. д. с. жидких магниевых амаль-
гам и построена зависимость э.д.с. цепи (III—13г) —
[132]:
Mg|MgC2H5Br|MgxHg.
(Ill—13г)
Полученные значения приведены на рисунке 67. Видно,
что активность магния сильно понижается вследствие взаи-
модействия его с ртутью с образованием интерметалличе-
ского соединения. Поскольку потенциалы гетерогенных
амальгам магния нами не исследовались, эксперименталь-
ная кривая обрывается в точке насыщения. По данным [302,
303], наиболее прочным в этой системе является соединение
MgHg, поэтому можно предположить, что дальнейший ход
кривой на рисунке 67 будет таким, как показано пунктиром.
Рис. 67. Зависимость э. д. с. цепи (Ш—13г) от
IgJ-для магниевых амальгам. 1 — наши дан-
ные, 2—из работы [293].
Из всех приведенных выше данных следует, что амаль-
гамные системы, в которых обнаружено взаимодействие,
нельзя рассматривать как идеальные системы даже при
больших разбавлениях.
Нужно отметить, что, несмотря на важную роль, которую
играют бинарные амальгамные системы в процессах амаль-
гамной пирометаллургии и амальгамной гидрометаллургии,
при получении сверхчистых металлов, а также в амальгам-
ной полярографии с накоплением, выяснению природы фа-
147
зовых равновесии в таких амальгамах уделено мало внима-
ния. Из-за отсутствия данных об активности металлов в раз-
бавленных амальгамах иногда полагают, что коэффициент
активности металла в этом случае равен единице. Однако
выше на примере амальгам натрия, калия, магния, индия
и кадмия было показано, что в тех случаях, когда металл
взаимодействует с ртутью с образованием интерметалличе-
ских соединений, это взаимодействие сохраняется и при
очень малых концентрациях металла, приводя к сильному
понижению его активности. Из приведенных данных видно,
что от того, насколько прочными являются интерметалли-
ческие соединения, образующиеся в ртути, зависит величина
отклонения измеряемых э. д. с. от значений, рассчитанных
по уравнению Нернста — Тюрина. Так, в системе калий —
ртуть отклонение измеряемой величины э. д. с. от ее расчет-
ного значения составляет 1001 лге, в системе натрий —
ртуть — 780, магний •— ртуть — 300, кадмий — ртуть — 60,
а в системе индий — ртуть — 30 ме. При повышении темпе-
ратуры характер отклонений э. д. с. изменяется мало, что
свидетельствует о высоком сродстве компонентов друг к дру-
гу и сохранении ближней упорядоченности типа соединений
при температурах, превышающих температуры плавления.
Анализ экспериментального материала показывает, что
взаимодействие в очень разбавленных бинарных амальгамах
и в жидких бинарных сплавах нельзя отождествлять с пове-
дением разбавленных водных растворов солей, поскольку в
случае амальгам атом металла всегда окружен атомами рту-
ти, как бы бесконечно ни была разбавлена амальгама. В вод-
ном же растворе при определенной степени разбавления
можно полностью исключить взаимодействие ионов проти-
воположных знаков. Можно полагать, что между атомами
ртути и растворенного в ней металла в зависимости от
свойств металла возникают различные типы связи (металли-
ческая, ковалентная связь гомополярного типа и ионная
связь, например в амальгамах щелочных металлов [304]).
Необходимо учитывать также, что силы взаимодействия
между атомами могут быть короткодействующими [108].
Образование химической связи определенной природы меж-
ду атомами ртути и металла и понижение химического по-
тенциала атома металла в ртути ведет к образованию раство-
ренной формы интерметаллического соединения, которое по
достижении предела его растворимости выпадает в осадок.
Поэтому в тех случаях, когда металл образует с ртутью
труднорастворимое соединение, растворимость металла в
ртути обусловлена растворимостью соединения. Исследова-
ния ряда авторов свидетельствуют, что в равновесии с осад-
148
ком плохорастворимых соединений CuHg и NiHg4 находится
их жидкая фаза [305—308].
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
В СЛОЖНЫХ АМАЛЬГАМАХ
При изучении межатомного взаимодействия в сложных
амальгамах обычно используются концентрационные цепи
типа
MeJIg | электролит Мер* | MexMe2Hg, (П1____26)
где Mei — более электроотрицательный, потенциалопреде-
ляющий металл; Мег — более электроположительный ме-
талл; 2Vi и No — атомные доли металла Mei и Мег соответст-
венно.
Значение э. д. с. цепи (III—26) определяется активностью
более электроотрицательного металла в амальгаме исследуе-
мого электрода. Если металлы Mei и Ме2 не взаимодействуют
между собой, то э. д. с. цепи (III—26) подчиняется уравне-
нию Нернста — Тюрина
(Ill—15а)
В том случае, когда образуются интерметаллические со-
единения между металлами Mei и Ме2, изменение э. д. с.
цепи (III—26) при изменении концентрации металла Mei в
амальгаме не подчиняется уравнению Нернста — Тюрина.
Чем более прочное интерметаллическое соединение образует-
ся между металлами Mei и Ме2, тем больше различаются
экспериментальные и расчетные значения э. д. с. Поэтому
величина отклонения э. д. с. цепи (III—26) от рассчитанной
по уравнению (III—15а) является мерой межатомного взаи-
модействия металлов в ртутной фазе. В ртутной фазе трех-
компонентной системы Mej-—Ме2—Hg возможны следующие
равновесия при взаимодействии металлов Mei и Ме2.
1. Металлы Mei и Ме2 при взаимодействии
Мег+ п Ме2 (МехМе2п)ж (III—За)
образуют слабодиссоциированное, растворимое в ртути ин-
терметаллическое соединение MeiMe2. В этом случае равно-
весие в ртутной фазе характеризуют с помощью константы
диссоциации [252, 254] (или нестойкости) интерметалличе-
ского соединения [224—226]:
149
(III-27)
где С/, CJ и Сз' — равновесные концентрации в сложной
амальгаме соответственно для Mej, Ме2 и Ме|Мв2п.
2. Металлы Mei и Ме2 образуют при взаимодействии ма-
лорастворимое соединение MeiMe2n> выпадающее в осадок:
Mei+я Ме2 Z (Ме1Ме2/1)тз *; (III—36)
растворенная часть соединения полностью диссоциирована.
Равновесие в ртутной фазе выражают величиной произ-
ведения растворимости:
ЬР^С;.(С2)\ (III—28)
3. Металлы Mei и Ме2 образуют при взаимодействии сла-
бо растворимое в ртути соединение MeiMes» причем раство-
ренная часть соединения малодиссоциирована и находится в
равновесии с осадком интерметаллического соединения:
(w—у)(Ме1Ме2и)тв - (У—ОСМе^ег^ж - i Mej-Нл Ме2. (III—29)
Анализ хода кривых э.д.с. цепи (Ш—26) в координатах
ДЕ—IgCi'/Ci дан в работах [233, 309]. Здесь вопрос о природе
интерметаллических соединений в сложных амальгамах ре-
шается только сопоставлением постоянства величин констан-
ты диссоциации и произведения растворимости. Характери-
зующей равновесие считается та из них, которая меньше
изменяется с изменением концентрации компонентов. Одна-
ко это очень ненадежный метод определения фазовой приро-
ды взаимодействия компонентов сложной амальгамы. Во-
первых, практически во многих случаях эти величины изме-
няются одинаково; во-вторых, в общем случае константы
равновесия неидеально ассоциированных смесей не постоян-
ны при данной температуре, а зависят (более или менее) от
концентрации компонентов [310]; в-третьих, при расчете
константы диссоциации используется дополнительное ариф-
метическое действие (деление на малую величину) в отличие
от расчета произведения растворимости, что вносит допол-
нительную ошибку в определение величины константы дис-
социации; в-четвертых, постоянство величины произведения
растворимости не исключает возможности существования
растворенной формы интерметаллического соединения с не-
большой константой диссоциации. Предложенный автором
[233] метод сравнения хода теоретически рассчитанных по-
150
тенциометрических кривых с экспериментальными для ре-
шения вопроса о фазовой природе интерметаллических со-
единений не всегда оправдан, как это следует из работ [222,
225, 242], Количественная теория потенциометрической
кривой концентрационной цепи (III—26) для изучения при-
роды межатомного взаимодействия металлов в сложной
амальгаме дана А. Г. Стромбергом с сотр. [220—225, 242].
Поскольку вопрос о природе интерметаллических соедине-
ний в сложных амальгамах является дискуссионным [1—3,
146,220—240, 242—248], А. Г. Стромбергом выведены теоре-
тические уравнения потенциометрической кривой сложной
амальгамы и на основе математического анализа их предло-
жены графические способы определения природы интерме-
таллического соединения в ртути (растворимое слабодиссо-
циированное или труднорастворимое соединение) и расчета
термодинамических параметров интерметаллического соеди-
нения (состав, константа нестойкости или произведение рас-
творимости) [220—226]. При выводе уравнений потенцио-
метрической кривой использованы безразмерные перемен-
ные аир, которые связаны с непосредственно определяемыми
из опыта величинами &Е—Е—Е^ Cj, С2 соотношениями
a^CZ/Cj,
(III—30)
Р — С2/С],
—lga=e = (E—Eo)^F/2,3O3 RT,
(III—31)
(1П—32)
(111—33)
W=(l—а)/а,
V=(l—а)/р,
(III—34)
(III—35)
(III—36)
где Ео и E — э. д.с. концентрационной цепи (III—19) при от-
сутствии и наличии в амальгаме второго металла Мег; Ci
я С2 — аналитические (брутто) концентрации металлов Mei
и Ме2 в амальгаме; С/ — активная концентрации металла
Mei в амальгаме; г — число электронов, принимающих
участие в потенциалопределяющей электродной реакции
Mef++Hg-|-ze=Me1Hg.
(III—37)
Уравнение потенциометрической кривой в переменных
151
W и V %ля случая растворимого в ртути интерметаллическо-
го соединения имеет вид [226]:
BW = (1—п V)n,
(III—38)
где В = КН/С2; Кн — константа нестойкости.
При графическом представлении уравнения (III—38) в
координатах W—V при п=Н=1 получаем кривые линии
(рис. 68).
о
О 0,2 0.4 0,® J.0V 0 । 2 3 4V
Рис. 68. Зависимость хода кривых W, V для случая раствори-
мого слабодиссоциированного в ртути интерметаллического
соединения с различным значением п. б—п<1.
Для случая образования малорастворимого соединения в
ртути уравнение потенциометрической кривой в переменных
U и V имеет вид
AU=(1—nVy\ (III—39)
где A = Lp/C2+1; Lp— произведение растворимости.
При графическом представлении уравнения (III—39) в
координатах U—V для л< 1 также получим семейство кри-
вых. Графическую обработку экспериментальных данных
при измерении э. д.с. цепи (III—26) проводят в безразмер-
ных координатах 8 и 6 (см. соотношения (III—30) и
(III—31)). Вид графика в безразмерных координатах е—б, в
отличие от обычного графика потенциометрической кривой
в координатах Е—lgC]'/C[, не зависит от валентности г ионов
металла MeJ+ и от абсолютных величин концентраций Ci,
С2 и С|.
Рассмотрим известные экспериментальные данные.
7. Растворимые в ртути малодиссоциированные интерме-
152
таллические соединения. В работе [225] была проведена про-
верка теоретических уравнений «способа W, V-кривой» на
примере обработки потенциометрических данных [236, 309],
полученных при изучении тройной системы олово —
ртуть — медь. Данные о природе интерметаллических соеди-
нений в этой системе являются дискуссионными. При изуче-
нии взаимодействия олова и меди потенциометрическим ме-
тодом авторы [236, 309] пришли к выводу, что в системе
образуются два мало растворимых в ртути интерметалличе-
ских соединения состава SnCu3 и SnCu с произведением рас-
творимости соответственно (2,8 4- 3,0)-10-12 (г-атом/л)* и
4,6-10“6 (г - атом/л)2. По данным же А. Г. Стромберга с сотр.
[242], соединение ЭпСцз растворимо в ртути и его константа
нестойкости равна 2*10“8 (г - атом/л)3. Поэтому представляло
интерес провести теоретическую обработку эксперименталь-
ных данных [236, 309] «способом W, V-кривой». На рисун-
ке 69 приведены теоретические кривые для системы олово —
медь — ртуть, вычисленные по уравнениям (III—38)г
(III—32) и'(III—33). Кривая 1 на рисунке 69, а, соответствуй
Рис. 69. Потенциометрическая кривая [225] для системы олово—
медь — ртуть, вычисленная по экспериментальным данным ра-
боты [236].
ющая теоретической для растворенного в ртути соединения,
построена по «способу W, У-кривой» при л = 3 (бпСиз),
W=l, 3/4, 1/2, 1/4, 1/8, 0 и при соответствующих значениях
Vw, найденных по графику W, V [242]. Кривая 2 отвечает
также теоретической кривой при п = 5/2. Как видно, ход
W, V-кривой соответствует виду потенциометрических кри-
вых для случая образования интерметаллических соедине-
ний, растворимых в ртути и малодиссоциированных (см.
рис. 68). Теоретическая кривая (рис. 69, б в координатах
е, 6) рассчитана по уравнениям (Ш—32) и (III—33) для зна-
153
чения параметров п = 3 и В=2,1-10~4. Кривая 2 рассчитана
для п = 5/2 и В = 5-10-4. Кривые 3 и 4 отвечают верхним
предельным ветвям кривых 1 и 2. Кривая 5 рассчитана ис-
ходя из предположения труднорастворимого интерметалли-
ческого соединения БпСиз с £р=2,8-10-12 (г-атаи/л)4. Как
видно из рисунка 69, б, экспериментальные точки удовлетво-
рительно согласуются с ходом теоретических е, 6-кривых и
для л = 3, и для 72 = 5/2. Поэтому сделать однозначный вывод
о составе интерметаллического соединения в системе оло-
во—медь— ртуть по экспериментальным данным [236]
нам представляется невозможным. Однако вид потенцио-
Рис. 70. Графики в координатах V—V (а), Е — IgC'j (б) и €—6 (в), по
опытным данным [253], для системы Zn—Au. Прямые линии на
рисунке — теоретический расчет при значениях т и Л, найденных
из графика U—V (а); 90°С; САи—4,1 :10“3 г-атом/л.
метрической кривой в координатах е, 6 указывает, что в сис-
теме образуется растворимое в ртути малодиссоциирован-
ное соединение наиболее вероятного состава ЭпСиз10*
В работе [225] проведен анализ экспериментальных дан-
ных, полученных при изучении условий образования в об-
ласти сравнительно больших концентраций олова друго-
10 Согласно диаграмме состояния системы олово — медь, соедине-
ние SnCug отвечает ефазе, а соединение SnsCu6 соответствует rj-фазе
[24]. При соотношении компонентов 1:1 соединение в системе олово —
-Медь не образуется.
154
то соединения олова с медью — SnCu [236, 309]. Показа-
но, что вследствие большого разброса экспериментальных
данных, ошибок опыта по виду потенциометрической кри-
вой нельзя сделать заключение о существовании второго
интерметаллического соединения состава SnCu. Отклонения
от теоретической кривой W, V связаны с ошибками опы-
та [225], а не с образованием второго интерметаллического
соединения [236, 309]. Следует отметить, что эксперимен-
тальные данные о растворимых в ртути малодиссоцииро-
ванных соединениях в тройных амальгамных системах весь-
ма ограничены.
2. Мало растворимые в ртути интерметаллические соеди-
нения. «Способ U, V-кривой» на примере определения термо-
динамических параметров интерметаллического соединения
ZnAu системы цинк — золото — ртуть был рассмотрен в ра-
боте [226]. В соответствии с уравнением (III—39) для слу-
чая п = 1 экспериментальные точки удовлетворительно рас-
полагались на прямой линии, проходящей через значение
V=VO = 1 на оси абсцисс (рис. 70). Поскольку V0=l, то п =
= 1/Vo = l и, следовательно, в системе цинк — золото —
ртуть образуется интерметаллическое соединение ZnAu, что
согласуется с данными [253]. Вид кривых L7, V указывает,
что соединение ZnAu мало растворимо в ртути. Образование
малорастворимого соединения цинка с золотом подтверж-
дается видом потенциометрической кривой на графике в
безразмерных координатах е, д (см. рис. 70) [226] и в коор-
динатах Д2?, IgCj'/Ci [253]. Следует отметить, что, несмотря
на очевидность образования в системе цинк — золото —
ртуть малорастворимого соединения, авторы [253] полагали,
что соединение ZnAu растворимо в ртути, и рассчитали зна-
чение константы диссоциации этого соединения. Данные ри-
сунка 70 могут быть использованы для расчета произведе-
ния растворимости соединения ZnAu. Из рисунка видно, что
прямая линия пересекает ось ординат при 17=£7° = 120. От-
сюда параметр А = 1/С7°=8,35 -10”3. Используя зависимость
Lp = C£+1, в работе [226] было рассчитано произведение рас-
творимости соединения ZnAu, которое оказалось равным
1,2-10'7 (г • атом/л)2. Там же отмечается высокая точность
предложенного метода расчета термодинамических парамет-
ров интерметаллических соединений в ртути. Как было по-
казано, определение состава интерметаллического соедине-
ния, образующегося в ртутной фазе, затруднительно. Нами
[228] на примере системы индий — золото — ртуть был рас-
смотрен графо-аналитический метод определения состава
интерметаллических соединений в ртути. На рисунке 71
представлено изменение э. д. с. цепи
155
InHg | электролит In3+|In, Au, Hg
(III—26a>
в зависимости от концентрации индия в сложной амальгаме.
Введение первых небольших количеств индия в амальгаму
золота сразу же сильно изменяло э.д.с. цепи (III—26). Пер-
вое резкое изменение э. д. с. на потенциометрической кривой,
указывает на образование в амальгаме соединения Au3In.
Дальнейшее увеличение концентрации индия в амальгаме
не вызывает изменения э. д. с. (прямая, параллельная оси
абсцисс). При достижении соотношения In:Au = l:l проис-
ходит второе резкое изменение э.д.с., связанное с образо-
ванием соединения Auln.
Согласно [24, 311, 312], в системе индий — золото —
ртуть образуются три соединения: Аиз1п, Auln и Аи1п2. По-
следнее является конгруэнтно плавящимся и наиболее проч-
ным, однако оно не находит отражения на потенциометриче-
ской кривой цепи (III—26) [228]. Поэтому в работах [220у
221, 228] был предложен метод определения состава обра-
зующихся соединений в ртути путем построения графика
логарифмической зависимости активностей обоих компонен-
тов [1, 228, 252]. Угловой коэффициент прямой в координа-
тах \ga ме,—lg^Mea должен соответствовать отношению чис-
ла атомов одного компонента к числу атомов другого. Кроме
того, прямолинейность этой зависимости может свидетель-
ствовать об образовании твердого осадка интерметалличе-
ского соединения [313] и характеризовать его произведение
растворимости, что вытекает из следующих уравнений для
соединения MeiMe2a:
^Р““аМе1’аМе3,
lg Lp=lg a^ei-\-n\g аме2,
(III—40)
(III—41)
(III—42)
lg«Me,= lg Lp — nlgaMe|.
Поскольку значения активностей металлов в тройной си-
стеме неизвестны, то для разбавленных амальгам можно
принять, что коэффициенты активностей равны между со-
бой. В этом случае в уравнениях (III—40)—(III—42) можно
использовать значения концентраций. На рисунке 72, а по-
казана логарифмическая зависимость свободных концентра-
ций (С*) индия и золота, рассчитанная для различных соеди-
нений, которые предположительно могут образоваться в об-
ласти первого перегиба на потенциометрической кривой.
Только для соединения Au3In угловой наклон прямой, рав-
ный трем, совпадает с составом. На рисунке 72,6 и в приве-
дены аналогичные зависимости для соединений Auln и
Au3In при различных температурах. Во всех случаях угло-
156
вые коэффициенты полученных прямых совпадают с пред-
полагаемым составом. Там, где прямолинейность кривых
для Аиз1п (рис. 72,6) нарушается, начинается, по-видимому,
распад соединения Аиз1п и образование соединения Auln.
Вероятно, этот же процесс обусловливает задержку в изме-
нении э. д. с. и соответствует прямой, параллельной оси
абсцисс, на рисунке 72, в. Области, где зависимость lgCIn от
I^Cau сохраняется прямолинейной, указывают на интервал
концентраций, где существует то или иное соединение.
Как отмечалось выше,
сохранение прямолинейно-
сти кривых на рисунке 72,
бив свидетельствует так-
же об образовании осадка
интерметаллических соеди-
нений. Действительно, изу-
чение природы соединений
методом гидростатического
расслаивания амальгам в
капиллярах показало, что
соединения Auln и АизГп
выделяются в виде кристал-
лического осадка [228].
Ирой введения раст в ор и мо-
сти интерметаллических со-
единений АизТп и Auln
оказались соответственно
равными (4,1±Ь0,7) • 10-9
Рис. 71. Зависимость э. д. с. цепи
In (Hg)|In3+1 In, Au, Hg от
Ci
1 — кривая соответствует измене-
нию э. д. с. цепи In(Hg)|In3+|InxHg
при Зо°С, кривые 2—5 — С2 =
= 1,008-IO”1 г-атом’л, С| = 3,4«
•10“1 г-атом!л.
и (2,9 ±
изучение
(г • атом/л)4 и (2,2dz0,6) • 10“5
• атом/л)2 при 16°С и (9,8 ± 0,4) • 10~9 (г < атом/л)4
zh0,8)-10“5 (г-атом/л)2 при 35°С [228]. Однако
влияния концентрации компонентов на растворимость интер-
металлических соединений этой системы показало, что в ин-
дий-золотых амальгамах возможно присутствие растворен-
ной формы интерметаллического соединения Auln в равно-
весии с твердым осадком. Об этом свидетельствует появле-
ние на рисунке 71 участка кривой э. д. с. цепи (III—26а), па-
раллельного теоретическому. Этот участок соответствует
образованию растворенного интерметаллического соедине-
ния с определенной константой диссоциации. Константа дис-
социации соединения Auln, рассчитанная для этого участка,
составляет 2,5-10"3 при 16°С и 3,5 Ю~2 при 35°С. При более
высоких температурах растворимость и диссоциация соеди-
нения настолько возрастают, что э. д. с. концентрационной
цепи (1П—26а) совпадает с теоретическими.
15Т
Рис. 72. Зависимость lgC*n от
IgClu- ° — для предполагаемых
соединений индия с золотом
разного состава при 35°С, tga==
— 3(Au3In), tgp = 2,2(Au4In),
tgY = 5(Au2In); 6 — для соедине-
ния Аиз1п при различных тем-
пературах, tga=3; в — для со-
единения Auln при различных
температурах, tga = l.
В работе [314] выведено теоретическое соотношение для
потенциометрической кривой, отражающей образование
двух интерметаллических соединений в амальгаме. Теорети-
ческие кривые хорошо согласуются с нашими опытными
данными для системы In—Au—Hg (Г = 55°С). В работе [132]
было показано, что при высоких содержаниях золота в
амальгаме только непостоянство произведения растворимо-
сти Auln указывает на сложную природу фазового равнове-
сия в амальгаме и возможность присутствия в ртути раство-
ренной формы этого соединения. На форме потенциометри-
ческой кривой это явление не отражается, так как кривая
э. д. с. осложнена образованием еще одного соединения —
Аиз1п. В том же случае, когда образуется в амальгаме толь-
ко одно соединение Auln, форма потенциометрических кри-
вых (рис. 71) указывает на то, что растворенная часть этого
соединения малодиссоциирована.
158
Анализ равновесия в сложных амальгамных системах
In—Au—Hg и Zn—Cu—Hg по «способу £7, V-кривой» пока-
зал, что в случае образования соединений CuZn и AuZn в
амальгаме в равновесии с осадком этих соединений находит-
ся жидкая фаза растворенного малодиссоциированного со-
единения. Проверка аналитическим методом А. Г. Стромбер-
га полностью подтвердила эти выводы.
Нами «способ U9 У-кривой» был проверен при анализе
равновесия в сложных амальгамных системах In—Au—Hg,
Sn—Au—Hg и Zn—Cu—Hg, изученных ранее потенциомет-
рическим методом [228—230] (рис. 73). Значения U и V
были рассчитаны по формулам (III—35) и (III—36). Из ри-
сунка 73, а, б видно, что опытные точки располагаются на
прямых линиях, проходящих через значения V=VO=1. Зна-
чение Vq = 1 соответствует т~1 [226] и свидетельствует об
образовании интерметаллических соединений с соотноше-
нием компонентов 1:1 (AuSn и CuZn). В системе In—Au—Hg
образуются два интерметаллических соединения: Аиз1п
и Auln. Этот факт также находит отражение на U9 V-кри-
вых (рис. 73, в, г). Рассчитанные для области существования
соединения АиДп точки совпадают с теоретически проведен-
ными кривыми при соотношении компонентов 3:1. Для
соединения Auln точки удовлетворительно ложатся на пря-
мую линию. Совпадение соблюдается при всех исследован-
ных температурах. Использованный «способ U9 У^кривых»-
позволяет определить произведение растворимости соедине-
ний по формуле (III—39), используя значения Uo9 отсекае-
мые прямыми при Vo = O. Значения произведений раствори-
мости близки к рассчитанным ранее потенциометрическим
методом. Например, для соединения Auln при 16°С произве-
дения растворимости, рассчитанные по данным рисунка 73'
и потенциометрическим методом, составляют соответственно
2,7-10"5 и 2,2-10~5.
В таблице 15 приведены некоторые наиболее достовер-
ные значения констант диссоциации и произведений раство-
римости интерметаллических соединений в тройных систе-
мах Mei—Ме2—Hg. Как видно, величины констант диссо-
циации и произведений растворимости соединений в ртути
зависят от природы взаимодействующих металлов, концент-
рации реагирующих компонентов (AuSn, CuZn и др.) и тем-
пературы. В таблице 14 температурная зависимость кон-
стант диссоциации и произведений растворимости дана
лишь для некоторых систем. Более полные данные по этому
вопросу можно найти в работах [132, 229, 230, 243]. Из
температурной зависимости констант равновесия (Jfp==l/Lp)
были рассчитаны нами термодинамические характеристики
159*
6
Рис. 73. Зависимость £7, V-кривых для определения термоди-
намических параметров тп и А мало растворимых в ртути
интерметаллических соединений, а — система Sn—Au—Hg,
С2==9,88-10~3 г/атом золота на 1л Hg: 1 — 16°С, 2 — 25,
3— 35; С2=^4,97-10~3 г атом золота на 1 л Hg; 4—16°С,
5— 25, 6 — 35, 7— 55. б — система Си—Zn—Hg, С2 = 3,43 •
• 10“2 г атом медй на 1 л Hg: 1 — 50°С, 2 — 75, 3 — 90.
в •— система In—Au—Hg, С2=1*10~г г-атом золота на 1 л Hg:
1—16°С, 2— 35, 3— 55, 4— 75. г — система In—Au—Hg,
С2 = 1‘10“' г-атом золота на 1 л Hg: 1 — 16°С, 2 — 55, 3— 75.
интерметаллических соединений в ртути. В таблице 16 при-
ведены значения изменения ^изобарно-изотермических по-
тенциалов (AZ), энтальпий (А£Г) и энтропий (AS) при образо-
вании интерметаллических соединений в ртути. Значения
термодинамических характеристик интерметаллических со-
единений сопоставлены с электроотрицательностью реаги-
рующих компонентов. Как видно из таблицы, чем больше
1во
Таблица 15
Константы диссоциации и произведения растворимости
интерметаллических соединений в ртути
Состав сое- динения Концентра- ция поло- жительного компонента, г*атом/л* •103 Г, °C Константа диссоциа- ции, гратом! л Произведение ра створимости, г« атом! лл+1 Литератур- ный источ- ник
Cu3Sn 0,2-8 16 2-Ю-8 1 [225, 242]
Auln 6,78 16 2,6-10“ 8 — [132, 228]
Auln 6,78 35 3,5-10“2 —« [132, 228]
Auln 104,5 16 ~2,5-10“3 (2,2±0,6)-10-5 [132 , 228]
Auln 100,8 35 ~3,б-10“2 (?,9±0,8)-10~5 [132 , 228]
Auln МО,8 55 ’1 (8,7+1,8)40-5 [132, 228]
Auln 100,8 75 (2,0 + 0,3)-10-4 [132 , 228]
Au3In 104,5 16 (4,1±0,7)-10“9 [132 , 228]
Au3ln 100,8 35 — (9,8 + 0,4)-10“ 9 [132, 228]
Au3In 100,8 55 (2,3±0,б)-10“ 8 [132, 228]
Au3In 100,8 75 — (9,4 + 0,4)-10“8 [132, 228]
AuSn 4,97 25 > 1,4 -10“6 [229]
AuSn 9,88 25 2,18-10“® [229]
AuCd 12,8 20 — 8,7 -10“6 [243]
AueCd 33,3 20 — 4,16-10~13 [243]
AuZn 4,1 90 —— 1,2 -10“7 [226]
AuMg 8,35 20 — 2,8 -10“8 [132]
AuMg 8,35 30 S.0 -10“8 [93 ]
AuMg 8,45 35 — • 7,09-10“8 [132]
CuZn 6,71 25 4,6 -10“6 [132]
CuZn 6,70 50 6,7-10 ' 1,6 -10“5 [132]
CuZn 6,80 75 4,0-10“ 2 2,4 ,10“5 [132]
CuZn 3,4 25 2,6-10“® [93 ]
CuZn 6,7 25 — 4,3-10“® [132]
CuZn 34,0 25 —— 6,3-10“® [132]
CuZn 6,7 75 4,2-10“= [132]
CuZn 34,0 75 — 1,2-10“® [132]
AgZn 0,54-4,5 18 (2,7+0,5)-10“® [315]
AgCd l,5+-5,0 18 —— (7,3±0,9)-10~® [315]
Sn2Mn — 20 — (7,1±0,6)-10“9 [235]
SbZn 18 — (2,6 ±0,6) -10“9 [235]
NiSn 1,0 2 0 — (1,4±0,3)-10“12 [238]
NiSn 1 1,0 5 ( —-- (2,7±0,7)-10“12 [238]
Sbln 0,39-г-0,63 2С М (2,2 + 0,4)-10“8 [315]
Sbln 0,394-0,63 40 (5,2±1,6)-10“8 [315]
11-122
разность электроотрицательностей, тем больше изменение
изобарно-изотермического потенциала и энтальпии образова-
ния интерметаллических соединений в трехкомпонентных
(Mei—Ме2—Hg) и бинарных (Mei—Hg) амальгамных сис-
темах.
Таблица 16
Термодинамические характеристики интерметаллических соединений
в ртути
Состав соедине- ния Разность электроот- рицатель- ностей [317] Д-^сплава (лит. дан- ные), ккал [моль ДНсоед в ртути, ккал[молъ ккал [моль (25°) AS, кал[моль* -град
AuSn 0,6 -8,2 [318] --9,7 -8,2 -7,5
Auln 0,6 — -7,9 -6,1 7,0
Au3In 0,6 — —8,2 -11 11,0
CuZn 0,4 —5,0 [191] -12,5 -7,1 -30
Au Mg 1,1 —- -24 -10 -48
CdHg3 0,1 -1,2 125] -0,7 -0,83 0,44
InHg3 0,1 —2,5 Г207 -2,7 -1,86 -3,2
AuCd 0,8 -10,2 [253 -12 [2] -1,1 -1,5
NaHg 1,0 22,6 [207] — -9,8 -21,5
AuZn 0,9 -19,0 [207] —— -12,4 -22,3
Образование большинства интерметаллических соедине-
ний в ртутной фазе сопровождается отрицательным измене-
нием энтропии. Последнее говорит о высокой упорядоченно-
сти в системе. Отрицательное значение энтропии, по данным
[258], указывает на ионный характер связи в интерметал-
лическом соединении. Интересно, что образование интерме-
таллических соединений Auln, Au3In и CdHg3 сопровождает-
ся положительным изменением энтропии, что, очевидно, об-
условлено размерным фактором взаимодействующих ме-
таллов.
Таким образом, анализ известного экспериментального
материала показывает, что если металлы в бинарных систе-
мах взаимодействуют между собой и образуют интерметал-
лические соединения, то это взаимодействие сохраняется и в
амальгамных системах. В зависимости от физико-химиче-
ских свойств взаимодействующих металлов в ртути могут
образовываться как растворенные малодиссоциированные,
так и малорастворимые интерметаллические соединения.
Было показано [132], что в равновесии с осадком интерме-
162
таллического соединения находится растворимая (опреде-
ленное количество соединения Mei— Meg) мало диссоцииро-
ванная форма его в соответствии с уравнением
(т—1/ХМе1Мегл)ть^ (у—ZXMeJWe^)*^ i M^+in Ме2. (Ш—29)
Если концентрация атомов металла Mei и атомов метал-
ла Ме2 в ртутной фазе меньше т или равна у, то осадок ин-
терметаллического соединения не образуется. В этом случае
образуется растворенное интерметаллическое соединение
(У—0 (Ме1Ме2П)ж > которое частично диссоциирует на атомы
iMei и шМе2. Для выявления образования растворенного
слабодиссоциированного интерметаллического соединения
необходимы экспериментальные условия: концентрация
компонентов в ртутной фазе амальгамы должна быть мень-
ше предела растворимости интерметаллического соединения.
Это подтверждается растворимостью в системе Au—In—Hg,
Au—Sn—Hg, Cu—Zn—Hg, Au—Mg—Hg и др. Сопостав-
ление данных работ [222] и [243] показывает, что со-
единение AuCd существует в жидком состоянии до достиже-
ния предела его растворимости в ртути. После выпадения
соединения AuCd в осадок в амальгаме устанавливается рав-
новесие между жидкой и твердой формами интерметалли-
ческого соединения. Чем выше температура, тем большая
концентрация растворимого малодиссоциированного соеди-
нения находится в равновесии с твердой фазой интерметал-
лического соединения. В процессах амальгамной пирометал-
лургии сплавообразования равновесие (III—29) при высоких
температурах играет важную роль.
КИНЕТИКА ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ
ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ В
РТУТНОЙ ФАЗЕ
Данные о кинетических характеристиках интерметалли-
ческих соединений в ртутной фазе или амальгамах весьма
ограничены. В настоящее время известны кинетические па-
раметры взаимодействия металлов лишь в некоторых трой-
ных амальгамных системах: Cd—Au—Hg [243, 253],
In—Au—Hg [228], Sn—Au—Hg [229], Zn—Cu—Hg [132,
230], Sn—Cu—Hg [319].
Для изучения кинетических характеристик используют
два метода: потенциометрический [228—230, 243, 253] и
амальгамную полярографию с накоплением при постоянном
потенциале [319].
В работе [319] показано, что при образовании интерме-
таллического соединения между двумя металлами в ртути
163
*1
Me14-Me<>^=^ MexMe2
(III—43)
зависимость катодного тока от времени при постоянном по-
тенциале выражается уравнением
i^nFS Г*! (с0- у^1'2 Со т^г)].
(Ш—44)
где Bi=^p а=^~ + ’ п — число электронов,
участвующих в реакции; F — число Фарадея; S — поверх-
ность ртутного капельного электрода, ел2; Со — концентра-
ция ионов металла в растворе, г ♦ ион)л; D — коэффициент
диффузии ионов металла; г — радиус ртутной капли, ел;
k\ — константа скорости образования интерметаллического
соединения (сл/сетс), которую определяют из зависимости ка-
тодного тока I от 1/}7 при t = 0 расчетным путем по уравне-
нию
(III—45)
При диссоциации интерметаллического соединения в рту-
ти по реакции, обратной (I—43), зависимость тока электро-
растворения соединения (при условии, что один из компо-
нентов взят в избытке и равновесие реакции (I—43) сдвину-
то вправо) от времени описывается уравнением
i=nFSk2CRe Г ,
(III—46)
где k2 — константа скорости диссоциации интерметалличе-
ского соединения в ртути, см/сек.
В координатах Igz—t это уравнение представляет прямую
линию с тангенсом угла наклона tg 6= , откуда
, _ 2,3r tg 6
з
(III—47)
Система Sn—Си—Hg. В работе [319] были определе-
ны кинетические характеристики образования в этой систе-
ме интерметаллического соединения CusSn, которое раство-
римо и слабодиссоциировано [225,242]. Для определения
константы скорости образования Сизвп снимали кривые за-
висимости катодного тока олова от концентрации меди в
амальгаме при постоянном потенциале, равном —0,5 в (отн.
364
нас. к. э.). Для металла, не взаимодействующего в амальга-
ме, зависимость катодного тока на сферическом электроде
от времени при постоянном потенциале выражается прямой
линией в координатах i—1/t [320]. В случае взаимодейст-
вия металла в ртутной фазе и образования интерметалличе-
ского соединения наблюдается отклонение от линейной за-
висимости i—1/t в сторону увеличения тока. Из полученных
экспериментальных данных при ф = const) в уравне-
ние (III—47) подставляли максимальное отклонение значе-
ния тока от прямой при £ = 0, которое обусловлено образова-
нием интерметаллического соединения. В результате было
получено значение константы скорости образования интер-
металлического соединения Сизвп, равное 2,5 • 10~4 см/сек.
При определении константы диссоциации интерметалли-
ческого соединения в ртути зависимость логарифма тока
электрорастворения соединения СизЭп от времени при по-
стоянном потенциале представляла прямые линии, тангенс
утла наклона которых уменьшался с увеличением соотно-
шения [Cu]/[Sn] по мере связывания олова в амальгаме в
соединение с медью. Достижение постоянного значения угло-
вого коэффициента указывало на то, что все олово прореа-
гировало с медью. Эту постоянную концентрацию олова в
амальгаме, равную 5-Ю'3 г-атом/л, принимали за концент-
рацию интерметаллического соединения, так как концентра-
цию меди в амальгаме по отношению к олову брали в из-
бытке. В уравнение (III—47) подставляли постоянное значе-
ние углового коэффициента прямых в координатах Igf—t.
В результате расчетов было получено значение константы
скорости диссоциации интерметаллического соединения
CuaSn, равное (1—3)10”4 см/сек. Из отношения констант
скоростей диссоциации (&г) и образования (fei) интерметал-
лических соединений была рассчитана константа диссоциа-
ции по уравнению
К= -|ЦСи]3,
равная 10"7 (г-атом/л)3 и находящаяся в удовлетворитель-
ном согласии со значением, определенным потенциометриче-
ским методом 2 10“8 [225, 242].
Для изучения кинетики образования и диссоциации ин-
терметаллических соединений в амальгамных системах вто-
рым методом используется потенциометрический метод
контроля изменения концентрации более электроотрицатель-
ного металла [2, 228—230, 243, 253]. В работе [253] были
предложены уравнения для расчета констант скорости обра-
зования интерметаллического соединения MejMe2
165
Ме1~!-Ме2ч=* Ме^ег
Ct Ci Сц
по реакции второго порядка
(III—43a)
A,t=-------. , In
1 135,06/A2- В
-YA’-B+AtC*,
Va*=b+a+c*2
f-C (III—48)
и диссоциации соединения MeiMe2 по реакции первого по-
рядка
k2t=—1п(С,— Ci*)+C, (III—49)
Г*
где А = —1/2(—Ci + C2 + KD); В——C\KD ; С£* — концентра-
ция свободного соединения или металла в ртути (ат. доля);
С — константа интегрирования; Ci* = C!2*; С12*=С|—С2*.
Авторы [253] предполагали, что образующиеся в ртут-
ной фазе интерметаллические соединения полностью раст-
воримы и слабодиссоциированы.
При изучении скорости образования интерметаллическо-
го соединения MejMe2 амальгаму, содержащую это соедине-
ние в равновесном состоянии, резко охлаждали. При этом
равновесие реакции (III—43) сдвигалось в сторону образова-
ния соединения MejMe2. Если же изучают скорость реакции
диссоциации соединения, то амальгаму, содержащую интер-
металлическое соединение MeiMe2, нагревают — соединение
диссоциирует.
Измеряя э. д. с. цепи (III—26) при охлаждении или при
нагреве, рассчитывали изменение свободной концентрации
более электроотрицательного металла в амальгаме. Из на-
клона кривых логарифм концентрации — время определяли
константы скорости образования распада или диссоциации
интерметаллического соединения Ме|Ме2. Авторы работ
[228—230, 243, 253] изучали кинетику образования интерме-
таллических соединений, сливая амальгамы металлов и
контролируя изменение потенциала образующейся сложной
амальгамы от момента сливания до установления равно-
весия.
Система In—Au—Hg. На рисунке 74 приведен ход ки-
нетических кривых в системе In—Au—Hg при сливании
амальгам индия и золота. По кривым изменения концентра-
ции индия при взаимодействии его с золотом определены
константы скорости образования соединения Auln при раз-
личных температурах. В этих же опытах каждый раз после
сливания амальгам и достижения равновесия амальгамы
охлаждали до 14°С, а затем резко нагревали до заданной
16$
l. Мин
___I_1_!__1__1_I___1_1__1-1--L
4 5/2/6 20 24 2d 52 36 40 44 4$ 52
Рис. 74. Изменение активной концентрации индия при
образовании и диссоциации соединения InAu в амаль-
гаме. CXn ==САи ==9,21 • 10~2 г-атом/л-, <о = 60 об/мин.
температуры. Полученные результаты приведены также на
рисунке 74. Поскольку потенциометрический метод измере-
ния потенциала позволял определить концентрацию только
электроотрицательного компонента, то по нему рассчитыва-
лись константы скорости реакции первого порядка.
Таблица 17
Кинетические характеристики и энергии активации образования
и диссоциации интерметаллических соединений в ртути
Состав соедине- ния Константа скорости образова- ния, мин'1 Константа скорости диссоциа- ции, мин~1 Яакт обра- зования, ккал/молъ Еакт Диссо- циации, ккал/моль Литератур- ный ИСТОЧ' ник
AuSn Auln Auln3 CuZn AuCd Cu3Sn 2,8(55°С) 0,24(30°С) 0,46(40°С) 0,29(20°С)* 2,5*10~4** 0,51 (55°С) 0,115 (51°С) 0,064 0,44 (50°С) 0,12 (90°С) (1-3)-10~4 4,4 5,8 5,5 6,0 3,1 6,6 13,7 4,0 •—• [132, 229] [228] [132 , 228] [132, 230] [253] [319]
♦ kit л/молъ-мин [253]. ** ki и k2t ем/сек [319].
167
Из температурной зависимости констант скоростей были
определены энергии активации образования и диссоциации
соединения Auln, которые оказались равными соответствен-
но 6,6 и 5,8 ккал!моль. Полученные значения энергий акти-
вации характеризуют реакцию образования и диссоциации
соединения Auln как протекающую в области смешанной
кинетики. Изучение скорости образования и диссоциации
интерметаллического соединения Аиз1п показало, что энер-
гия активации образования равна 5,5, а диссоциации —
13,7 ккал!молъ, что указывает на кинетический контроль
скорости реакции. В таблице 17 приведены основные кине-
тические характеристики соединений в системе In—Au—Hg.
Система Sn—Au—Hg. Кинетику диссоциации и обра-
зования интерметаллического соединения AuSn изучали
при резком нагревании или охлаждении системы и из-
меряли э.д.с. цепи (III—26) во времени. Ход кинетических
кривых igCgn—т при различных температурах показан на
рисунке 75. Из рисунка видно, что установление равновесия
в системе достигается быстро. Энергия активации процесса
диссоциации соединения AuSn, вычисленная из температур-
ной зависимости констант скоростей (табл. 16), составила
3,1 ккал/моль. Низкая величина энергии активации указы-
вает на диффузионные ограничения в доставке свободного
олова в жидкую фазу. Очевидно, диффузионные затрудне-
ния связаны с растворением кристаллической формы интер-
металлического соединения AuSn, в равновесии с которой,
как отмечалось выше, находится растворенная слабодиссо-
циированная форма этого соединения.
Константа скорости образования соединения AuSn, опре-
деленная из наклона кривой, приведенной на рисунке 75,
оказалась равной 0,92 леим"1. Эта величина близка к значе-
ниям константы скоростей диссоциации соединения AuSn и,
по-видимому, также характеризует протекание гетерогенной
реакции.
Скорость образования соединения AuSn определялась
методом сливания гомогенных амальгам олова и золота
[132]. В этом случае реакция взаимодействия олова и золо-
та протекала с высокой скоростью и равновесное значение
э.д.с. цепи (III—26) достигалось за 20—30 сек. Константы
скорости образования AuSn в гомогенной золото-оловянной
амальгаме при 25,40 и 55°С соответственно равны 5,2, 3,2 и
2,8 мик~{. Энергия активации реакции образования AuSn
составляет 4,4 ккал/моль.
Кинетика образования интерметаллического соединения
AuSn в ртути исследована в работе [248]. Были применены
168
хронопотенциометрический и хроновольтамперометрический
методы исследования. Найдено, что в присутствии избытка,
золота протекает реакция второго порядка по отношению к
олову (йобраэ = 1,2-102Л‘Моль~[‘Сек~]). Эта величина была
определена на основе применения теории электродного про-
Рис. 75. Изменение активной концентрации олова при
образовании и диссоциации соединения AuSn.
цесса с одной последующей реакцией. Авторы подчеркивают,,
что результаты, полученные хроновольтамперометрическим
методом, трудно истолковать, поскольку недостаточно разра-
ботана его теория. При кинетических исследованиях потен-
циометрическим методом используются амальгамы олова,
приготовленные заранее, в которых успевает пройти процесс
димеризации олова. Поэтому он не находит отражения на
кинетических кривых.
Система Zn—Си—Hg. Исследование кинетики распа-
да и образования интерметаллического соединения CuZn
проводили по методике Хартмана и Шольцеля [253]. Ход
кинетических кривых показан на рисунке 76. Как видно,,
кривые имеют прямолинейный начальный участок, затем
изменение концентрации замедляется и достигается постоян-
169«
ное значение концентрации свободного цинка через 4—
10 мин. Из наклона прямолинейных участков были рассчи-
таны константы скорости диссоциации интерметаллического
соединения CuZn: 0,44 мин~' (50°С), 0,69 (74°С) и 0,92 мин 1
<90°С).
Рис. 76. Изменение активной концентрации цинка при образо-
вании и диссоциациям соединения CuZn в амальгаме. 1, 2, 3—
при резком нагревании соответственно до 90, 75 и 50°С;
4, 5У 6 — при резком охлаждении соответственно до 40, 25 и
12°С; 7 — при сливании двух амальгам; Т=26°С, Czn=Ccu =
— 3,43 10“2 гатом/л.
Энергия активации реакции диссоциации соединения
'CuZn, рассчитанная из температурной зависимости констант
скоростей диссоциации, оказалась равной 4,0 ккал)моль.
Кинетические кривые образования интерметаллического
соединения CuZn получали как методом сливания амальгам
меди и цинка, так и резким охлаждением системы и сдвигом
равновесия
Cu + Zn^CuSn (III—50)
в сторону образования соединения CuZn. Как видно из ри-
сунка 76, кривые имеют характерный ход для реакций, про-
текающих с диффузионными ограничениями, и константы
скорости образования соединения CuZn для 40, 25 и 12°С
равны соответственно 0,46, 0,57 и 0,80 мин~1. Энергия акти-
170
нации процесса образования соединения CuZn составляет
6 ккал-моль.
Система Cd—Au—Hg. Константы скорости образова-
ния и диссоциации соединения AuCd в этой системе опреде-
лялись Хартманом и Шольцелем по вышеописанной методи-
ке [253]. Константа скорости образования соединения AuCd
при 20°С равна 0,29 л/молъ-мин, константа же скорости дис-
социации этого соединения при 90°С — 0,12 мин'1.
Хронопотенциометрические исследования кинетики об-
разования соединения AuCd в ртути были выполнены Галю-
сом [321]. Выяснено, что взаимодействие кадмия с золотом
протекает необратимо, и эта реакция имеет порядок больше
единицы по кадмию. Было замечено, что с увеличением вре-
мени восстановления кадмия, время окисления (ток) умень-
шается, тогда как для реакций второго порядка ток не долж-
но зависеть от времени восстановления. Наблюдаемое откло-
нение от теории электродных -процессов с последующей
химической реакцией указывает, что за электродным процес-
сом следуют две химические реакции. Природа второй хими-
ческой реакции связана с образованием кристаллов интер-
металлического соединения:
Cd2+ + 2e -> Cd, (III—51)
2Cd + 2Au 2AuCd -> AuCd. (Ill—52)
Константа скорости второго порядка для реакции Cd с Au
составляет 28,1 молъ~}-сек~1. Участие в реакции димеров зо-
лота лишь предположительное.
Система Zn—Au—Hg. Хронопотенциометрические ис-
следования кинетики образования соединения AuZn, прове-
денные в работе [322], показали, что эта реакция проходит
намного быстрее реакции образования AuCd, а хронопотен-
циометрические кривые восстановления ионов Zn на золотой
амальгаме проявляют свойства обратимой кривой для элек-
тродного процесса с последующей химической реакцией.
Система Zn—Со—Hg. Кинетика образования соедине-
ния CoZn в ртути была исследована в работе [323] на вися-
чем ртутно-капельном электроде с использованием потенцио-
статического метода. Показано, что интерметаллическое
соединение CoZn существует в равновесии с димерами С02
и Zn2. Константа скорости реакции псевдопервого порядка
по цинку составляет 5,6 сек”1. На возможность участия ди-
меров растворенных в ртути металлов в реакции образования
интерметаллических соединений в ртути указывали Фикер
и Мейтс [324]. Авторы изучали межатомное взаимодействие
171
в системе Zn—Со—Hg хроноамперометрическим методом с
контролем потенциала амальгамного макрокатода.
Анализ кинетических характеристик образования и рас-
пада интерметаллических соединений в тройных амальгам-
ных системах Mei—Мез—Hg показывает, что взаимодейст-
вие компонентов протекает с высокой скоростью. Значения
энергий активации образования соединений показывают,
что скорость реакции лимитируется смешанной кинетикой
(Auln, Auln3, CuZn). Диссоциация интерметаллических со-
единений AuSn и CuZn лимитируется диффузионными огра-
ничениями (Еакт равна соответственно 3,1 и 4,0 ккал/моль).
При диссоциации интерметаллических соединений в системе
In—Au—Hg скоростьопределяющей стадией являются ки-
нетические ограничения.
ПРОЦЕССЫ АМАЛЬГАМНОЙ
ПИРОМЕТАЛЛУРГИИ
АМАЛЬГАМНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ТУГОПЛАВКИХ
ЭЛЕКТРООТРИЦАТЕЛЬНЫХ МЕТАЛЛОВ
В основе процессов амальгамной пирометаллургии туго-
плавких электроотрицательных металлов лежат реакции
восстановления их галогенидов амальгамами щелочных ме-
таллов и электролиз расплавленных солей с ртутным като-
дом [2, 4—8, 325—337]. Эти процессы интенсивно разви-
ваются и находят применение для получения пластичного
титана, тория, циркония, урана, марганца и других метал-
лов высокой чистоты [2, 4—8, 325—334]. Как было показа-
но в первой главе, тугоплавкие электроотрицательные метал-
лы мало растворимы в ртути. Поэтому процессы восстанов-
ления их галогенидов проводят при высоких температурах,
когда металлы легко амальгамируются ртутью и образуют
интерметаллические соединения.
Процесс амальгамно-гидрометаллургического восстанов-
ления галогенидов включает две стадии.
На первой стадии получают амальгаму соответствующе-
го металла любым методом, например электролизом рас-
плавленных солей с ртутным катодом [2, 6, 328—330] или
путем восстановления соединений металла с помощью
амальгам щелочных или щелочноземельных металлов [2,
4—8, 325—327, 331—334].
173
На второй стадии восстановленный металл отделяют от
ртути или амальгамы металла-восстановителя. Обычно при
восстановлении металла получаются амальгамы, содержа-
щие не более одного-двух процентов труднорастворимого
металла, однако чрезвычайно вязкой тестообразной консис-
тенции. Такие амальгамы с целью экономии энергии при от-
гонке ртути подвергают обогащению по крайней мере до
10% по весу металла в амальгаме путем фильтрации, центри-
фугирования, ферромагнитной сепарации и др. [2, 4—8,
325—337]. Для отделения ртути фильтрацией используют
обычные нутч-фильтры и фильтр-прессы, при этом получают
практически свободную от металла ртуть и амальгаму тесто-
образной или маслообразной консистенции, которую подвер-
гают нагреву в вакууме для отгонки ртути. Следует отметить,
что методом фильтрации, центрифугирования или магнит-
ной сепарации не удается обогатить амальгаму выше 10%
даже при применении высоких давлений при фильтрации
или высоких скоростей при центрифугировании. Последнее
объясняется тем, что благодаря сильно развитой поверхно-
сти вследствие высокой дисперсности кристаллов трудно
растворимого металла ртуть удерживается силами межатом-
ного взаимодействия на границе металл — ртуть [2, 6, 334].
Дисперсность порошка и, следовательно, его поверхность
зависят от «возраста» амальгамы и состояния металла в
ртутной фазе. Амальгамы трудно растворимых в ртути ме-
таллов обычно представляют собой суспензированные час-
тицы либо элементарных металлов (железо, кобальт, сурьма
и др.), либо интерметаллических соединений с ртутью (ни-
кель, палладий, цирконий, титан, уран, лантан, марганец,
плутоний, торий, платина и др. [2, 6, 334]. При длительном
стоянии амальгам частицы укрупняются. Скорость укрупне-
ния частиц зависит от температуры [2, 6, 334, 335, 338, 339].
Размер частиц, например железа в амальгаме, полученной
электролизом при комнатной температуре, не превышает 2—
5 ц [339, 340]. При выдерживании амальгамы в течение
21 дня при комнатной температуре величина частиц железа
возрастает до 15ц, в то время как за один час при 300°С
средний диаметр частиц достигает 25ц, а при температуре
выше 400°С частицы быстро увеличиваются до размера бо-
лее 100 ц [339, 340].
Выдерживая амальгаму при определенной температуре»
можно получить желаемую величину частиц железа, что
весьма важно для порошковой металлургии [2, 6, 7, 325,
326, 341—345]. Было найдено, что нагревание амальгамы
трудно растворимого в ртути металла в закрытом сосуде
(без дистилляции) при давлении, превышающем атмосфер-
174
ное, при температуре 360-4-450°С приводит к такому укруп-
нению частиц металла, что при последующем отделении
большей части ртути обычными методами (фильтрация^
центрифугирование) получается высококонцентрированная
амальгама (25-? 50 % металла) [335]. Так, охлаждение и
фильтрация амальгамы железа, содержащей лишь 0,3% же-
леза, после нагрева в течение 5 мин при 550°С и давлении,
равном давлению паров ртути при этой температуре, дает-
в остатке 32%-ную амальгаму железа. При такой же обра-
ботке 4 %-ной амальгамы никеля после фильтрации в остат-
ке содержалось 31% никеля. Обработка этой же амальгамы
при 440°С в течение часа дала возможность получить после
фильтрации лишь 20%-ную амальгаму никеля. Применение
высоких температур в процессе тепловой обработки может
увеличить концентрацию металла в амальгаме после фильт-
рации до 50%. Однако на практике при обработке амальга-
мы в автоклавах температуру нельзя увеличить значительно
выше 600°С, потому что давление паров ртути возрастает в
такой степени, что управление им в промышленных усло-
виях становится затруднительным.
Рассмотрим некоторые технологические схемы получе-
ния тугоплавких электроотрицательных металлов.
Титан. Амальгамные технологические схемы получе-
ния металлического титана являются необычайно эффектив-
ными [1, 2, 4, 5, 7, 8, 331, 332]. Ценные физико-химические
свойства чистого титана — малый удельный вес, высокая
прочность, коррозионная стойкость в агрессивных средах —
позволяют использовать титан как ценный конструкцион-
ный материал в различных отраслях науки, промышленно-
сти и новейшей техники. Однако титан находит небольшое
промышленное применение из-за трудоемкости технологии
извлечения его из руд и восстановления соединений титана
до металла и, следовательно, высокой его стоимости. Сущест-
вующие технологические схемы восстановления галогенидов
титана (T1CI4) металлическим Na, К, Mg и т. д. используют
дорогостоящие реакторы, способные выдержать внутреннее
давление в тысячи атмосфер. Поэтому восстановление соеди-
нений титана с помощью щелочных и щелочноземельных
металлов невыгодно вследствие дорогостоящих операций,
требующих специального прочного оборудования, необходи-
мости применения чистых металлов-восстановителей и труд-
ной обработки получающейся смеси тонкодисперсного тита-
на и соответствующих галогенидов щелочных металлов
вследствие чрезвычайной способности такого титана к окис-
лению кислородом и взаимодействию с азотом, водородом и
другими газами.
175
Амальгамный метод лишен таких недостатков. Для по-
лучения титана высокой чистоты в этом случае не требуется
дорогостоящее оборудование, а образующиеся кристаллы ти-
тана достаточно большие и в связи с этим устойчивы к дейст-
вию кислорода и воды [8,
331, 332].
Принципиальная техно-
амаль-
получе-
I NaC2
Рис. 77. Технологическая схема
получения металлического ти-
тана методом амальгамной пи-
рометаллургии [8].
логическая схема
гамного процесса
ния титана высокой чисто-
ты приведена на рисун-
ке 77. Четыреххлористый
титан TiCU, образующийся
при хлорировании минера-
лов титана, поступает в ре-
актор для восстановления
до металла амальгамой нат-
рия, содержащей 0,154-
4-0,25 вес. % [8]. Амальга-
му натрия получают в элек-
тролизерах с ртутным като-
дом и графитовыми анода-
ми, которые обычно ис-
пользуют для производства
хлора и щелочей [346].
Хлор может быть использо-
ван для хлорирования ти-
тановых
рутила,
ном из
чистой
руд — ильменита,
состоящих в основ-
двуокиси титана,
двуокиси титана,
в целях перевода последних в TiCi4. В электролизере с ртут-
ным катодом получают амальгаму натрия с содержанием от
0,05 до 0,5 вес. % натрия. Натрий с ртутью образует целый
ряд интерметаллических соединений (см. гл. I и III). При со-
держании в амальгаме натрия выше 0,5 вес. % вязкость
амальгамы возрастает и с такой амальгамой, по [8], стано-
вится трудно осуществлять технологический процесс. В свя-
зи с этим весьма перспективно применение электролиза сме-
си хлоридов натрия и калия с получением тройной амальга-
мы, содержащей более высокие концентрации натрия и ка-
лия по сравнению с растворимостью в бинарных системах
натрий — ртуть и калий — ртуть (см. гл. I).
Жидкий хлористый титан подают в реакционную зону
реактора выше или ниже поверхности амальгамы натрия
при интенсивном перемешиванииреагентов. Для увеличения
176
непосредственного контакта жидкий TiCU барботируют через
амальгаму. Восстановление TiCl* амальгамой натрия можно
проводить [8] в широком интервале температур — от 25 до
150°С, предпочтительнее 88-т-104°С, в атмосфере инертного
газа (Не, Ar, Ne). Реакция TiCl4 с амальгамой натрия проте-
кает с высокой скоростью, и восстановление хлористого ти-
тана до металла при наличии избытка натрия в амальгаме 11
заканчивается за короткий промежуток времени. Реакцион-
ный продукт, представляющий собой тонкий черный поро-
Рис, 78. Устройство с ленточным транспортером для
непрерывного разделения амальгам электроотрица-
тельных тугоплавких металлов на металл и
ртуть [337].
шок (средних размеров 0,1Ч-10|1) и всплывающий на по-
верхность амальгамы, отделяется от отработанной амальга-
мы фильтрованием. Этот продукт, который содержит Hg, Na,
NaCl, металлический титан и продукты неполного восстанов-
ления — субхлориды СПС1з, TiCls), переводят в печь и в
вакууме 10-24-10-4 мм рт. ст. или в инертной атмосфере
подвергают термической обработке при температуре от 204
до 370°С для удаления ртути. Отгонку ртути можно осуще-
ствлять периодически в ретортных и муфельных печах, печах
специальной конструкции или непрерывно в инертной атмо-
сфере или в вакууме в печи с ленточным транспортером
[336, 337].
На рисунке 78 схематически показано устройство для
непрерывного разделения амальгам электроотрицательных
металлов [337]. Как видно, ленточный транспортер 8 из
проволочной ткани, состоящий из звеньев, проходит через
туннельную печь Z. Ленточный транспортер 8 и туннельная
печь 7 помещаются в газонепроницаемый корпус 5, стены ко-
торого имеют оболочку для охлаждения 6. Амальгама ме-
талла через ввод 2 и улитку 4 непрерывно подается на лен-
точный транспортер 8. Ленточный транспортер приводится в
11 Концентрация натрия в отработанной амальгаме Должна быть не
менее 0,1 вес. %.
12-122
177
движение мотором 10. При движении ленты транспортера
амальгама медленно проходит через зону нагрева туннель-
ной печи 7, ртуть отгоняется, а чистый металл остается на
ленте транспортера и извлекается с помощью сброса 9 и шлю-
за 13. Пары ртути конденсируются на охлаждаемых стенках
корпуса 5, и ртуть собирается на наклонном дне 14 корпу-
са 5 и стекает через сифон 1.
Оригинальные конструкции печей предложены в работе
[336] для удаления ртути из амальгам трудно растворимых
в ртути тугоплавких металлов, например титана, циркония»
урана, тория и других. На рисунке 79 приведены три ва-
рианта конструкций печей для отгонки ртути. Показано
устройство печи для непрерывной отгонки ртути из амаль-
гам, содержащих суспендированные в ртути металлы, интер-
металлические соединения или сплавы металлов в вакууме, в
восстановительной или инертной атмосфере (рис. 79, а).
Амальгама металлов может иметь различную консистенцию.
Пастообразные амальгамы подаются из сосуда 1 с помощью
шнека 2 в обогреваемую спиралью 3 вертикальную трубу 4.
В процессе движения амальгамы происходит интенсивное
испарение ртути, пары которой конденсируются в водоох-
лаждаемом конденсаторе 6. Амальгама расслаивается, так
как металл, содержащий малое количество ртути, имеет
меньший удельный вес и всплывает на поверхность амальга-
мы. Поскольку высокопористый спек металла или сплава
имеет большую поверхность, скорость испарения ртути
очень высокая. Вследствие существующего градиента темпе-
ратур по длине трубы 4 в верхней части из металла удаля-
ются следы ртути и получаемый тонкодисперсный, не содер-
жащий ртути металлический порошок или губчатый металл
(спек) поступает в сборник 5. Отгоняемая в процессе ртуть
поступает в конденсатор 6, сливается в сборник ртути 7 и
направляется в голову процесса.
На рисунке 79, б показано устройство печи для отгонки
ртути из амальгам пластичных металлов с последующим их
прессованием. В этом случае амальгама поступает по на-
клонной обогреваемой трубе 4. Для достижения более высо-
ких скоростей испарения здесь предусмотрен дополнитель-
ный нагреватель 3. Спек металла или тонкодисперсный по-
рошок, не содержащий ртути, далее прессуется с помощью
поршня 9 л выдавливается через выпускное устройство 10
в виде полуспеченного металла.
„ Высокой производительностью обладает печь, конструк-
ция которой' приведена на рисунке 79, в. В этом случае
амальгама через, устройство 11 вводится в систему обогре-
ваемых труб 12. Далее горячий металл, не содержащий
178 .. -.'*
Рис. 79. Конструкция печей для
непрерывной отгонки ртути из
растворенных или суспендиро-
ванных в ртути металлов и их
сплавов, а — печь для непрерыв-
ной отгонки металлов с получе-
нием высокопористого или по-
рошкообразного металла; б —
печь для отгонки ртути из
амальгамы пластичных материа-
лов с последующим их прессо-
ванием; в — печь для отгонки
ртути из амальгам металлов с
последующей их протяжкой в
ленту.
ртути, поступает через сливное устройство 13 на валки 14
и вытягивается в ленту металла 15. Поскольку процесс
отгонки ртути проводят в вакууме, лента проходит через
шлюз из ртути 16. Если металл смачивается ртутью, то лен-
ту подвергают дополнительной термической обработке.
При обогащении амальгам металлами термическим пу-
тем и удалении ртути из металлов особое внимание уделяет-
ся герметичности лечи, поскольку потери ртути при ее отгон-
ке, с одной стороны, угрожают здоровью рабочих, а с другой
стороны, могут быть причиной нерентабельности производ-
ства. В аппаратах высокотемпературной амальгамной метал-
лургии к сварным швам, соединительным и уплотняющим
фланцам должны предъявляться более жесткие требования,
чем к аппаратуре высокого давления [6]. 3
17ft
После отгонки ртути продукт, содержащий NaCl, метал-
лический титан и субхлориды титана, нагревают в инертной
атмосфере до 8154-1093°С для отделения NaCl от смеси
(ТплЫаС1 805°С),2. При этих температурах субхлориды тита-
на разлагаются, а при пониженном давлении отгоняются. В
вакууме около 10"4 мм рт. ст. при 9824-Ю93°С весь NaCl от-
гоняется и конденсируется на холодных стенках печи. Пос-
ле удаления NaCl получают чистые ковкие кристаллы тита-
на, которые имеют размеры большие, чем размеры частиц»
получающихся в процессе восстановления TiCh. Полагают,
что в процессе отделения NaCl расплавленный хлорид нат-
рия служит в качестве матрицы, промотирующей рост кри-
сталлических агломератов. Кристаллы титана сцепляются
друг с другом с образованием губчатого титана. Такой титан
устойчив по отношению к кислороду и влаге и может быть
переработан в готовые изделия любым способом. Кристал-
лы титана содержат более 99 % основного металла и чрезвы-
чайно ковкие. Чем больше кристалл титана по размеру, тем
он чище (99,9% Ti) и имеет твердость 954-125 по Викерсу.
Такой титан эквивалентен самому чистому и самому ковко-
му металлическому титану, полученному другими методами.
В слитки кристаллы титана переплавляются в вакуумной
высокотемпературной печи. Принципиальная схема аппара-
турного оформления амальгамного технологического про-
цесса получения титана показана на рисунке 80. По данным
[331], для восстановления TiCU до металла более целесооб-
разно применять концентрированные амальгамы натрия,
содержащие 0,54-1,5 вес. % натрия. В этом случае удается
избежать образования субхлоридов титана в процессе восста-
новления TiCh. Для получения концентрированной амальга-
мы натрия амальгаму после электролиза хлоридов натрия
или калия с ртутным катодом подвергают обогащению пу-
тем отгонки ртути или проводят донасыщение амальгамы
электролизом расплавленных солей во втором электролизере.
При применении концентрированных амальгам восстановле-
ние T1CI4 до металла протекает с высокой скоростью. Восста-
новление проводят при температурах 1004-360°С. Концент-
рация натрия в обработанной амальгаме должна быть не ни-
же 0,35 вес. %.
Для восстановления TiCU могут быть использованы и
амальгамы калия. В этом случае концентрация калия в
амальгаме должна быть в пределах 1,34-2,5 вес. %, а в отра-
13 При применении для восстановления T1CI4 смешанной натрий-ка-
Лиевой амальгамы образующаяся в процессе реакции смесь хлоридов
«три соотношении NaCHKCl^l:! будет иметь температуру плавления
около 650°С. 1 . .
180
Рис. 80. Принципиальная схема аппаратурного оформления тех-
нологического процесса получения титана высокой чистоты
методом амальгамной пирометаллургии.
ботанной амальгаме — не ниже 0,6 вес.%. Принципиаль-
ная технологическая схема амальгамного процесса с приме-
нением концентрированных натриевых амальгам приведена
на рисунке 81. Отработанная амальгама натрия поступает
на донасыщение в электролизер с расплавленными солями.
Продукты реакции, содержащие Ti, NaCI, небольшое количе-
ство субхлоридов титана, удаляют с поверхности амальгамы
с помощью скрепера, конвейера или шнеков. Переработка
продуктов реакции в металлический титан не отличается от
вышеописанной технологии. Выход титана близок к 100%.
Металлический титан содержит 99,5% основного вещества,
обладает твердостью по Викерсу 150-?250 и чрезвычайно
высокой ковкостью.
181
В работе [335] восстановление TiCh проводят под давлени-
ем в реакторе, куда подают нагретый до 300°С тетрахлорид
титана и нагретую до 400°С натриевую амальгаму, содержа-
щую около 3% натрия. Температуру в реакторе поддержи-
вают равной 500—700°С. При
этом образуется смесь — кри-
Рис. 81. Схема получения метал-
лического титана по [331]. 1 —
электролизер; 2 — реактор; 3 —
фильтр; 4, 5 — вакуумные печи.
сталлический галогенид нат-
рия и тонкодисперсный ме-
таллический титан, который в
этих условиях образует с
ртутью интерметаллическое
соединение TiHg. Продукты
реакции (TiHg, NaCl) из реак-
тора извлекаются с помощью
шнека. Хлорид натрия раство-
ряется в воде или разбавлен-
ной кислоте и отделяется от
амальгамы титана. Получен-
ная амальгама титана подвер-
гается обогащению путем
фильтрования. Отделение рту-
ти из 5 %-ной обогащенной
амальгамы титана не пред-
ставляет затруднений [335].
Содержание основного вещест-
ва в титане, полученном
амальгамным методом [347], составляет 99,999%.
Процесс восстановления значительно облегчается, если в
качестве восстановителя применять трехкомпонентные амаль-
гамы (Li—Na—Hg, Li—К—Hg, Na—Ca—Hg и др.), кото-
рые содержат металл, образующий низкоплавкую эвтектику
с восстанавливаемым тугоплавким металлом или с хлоридом
металла-восстановителя. Рекомендуется в качестве восстано-
вителя тетрахлорида титана применять амальгаму натрия
или калия с вспомогательным металлом — литием, хлорид
которого образует низкоплавкую эвтектику с хлоридами на-
трия и калия [326, 333, 348]. При непрерывном получении
титана применяют смесь жидких амальгам К: Li при соотно-
шении, равном 4:1 (весовых частей). В этом случае тетрахло-
рид титана взаимодействует с амальгамой уже на холоду при
медленном перемешивании с образованием дихлорида тита-
на. После отделения ртути путем фильтрования от реакцион-
ной смеси вводят новую порцию калий-литиевой амальгамы
и процесс восстановления проводят под давлением при
400°С. В результате кратковременного пребывания в темпе-
ратурной зоне 400°С под давлением дихлорид титана пол-
182
ностью восстанавливается до металлического титана, кото-
рый образует с ртутью интерметаллическое соединение —
TiHg. Образующаяся в процессе восстановления дихлорида
титана калий-литиевой амальгамой смесь хлоридов лития и
калия собирается на поверхности амальгамы в виде свобод-
ного от титана расплава соли. Дальнейшее осуществление
технологического процесса не отличается от описанных вы-
ше. Из обогащенной до 5% амальгамы титана ртуть удаля-
ют при 1200°С. При этом образуется крупнокристаллический
Рис. 82. Технологическая схема и аппаратурное оформление про-
цесса получения металлического титана методом амальгамной
пирометаллургии [332].
титан высокой чистоты, который не пирофорен и может быть
переработан в изделия обычными методами. Более эффек-
тивный непрерывный амальгамный процесс восстановления
соединений титана предложен в работе [332]. Восстановление
TiCl4 проводят амальгамой магния (Na или К) под давлением
и при температуре 360°С. Амальгаму магния получают непо-
средственным растворением металлического магния в ртути.
Схема аппаратурного оформления процесса приведена на
рисунке 82. Металлический магний в гранулах диаметром
12—14 мм с помощью цепочного транспортера загружают в
сосуд 12, Из него гранулы магния захватываются текущей
вниз ртутью и всплывают в реакционную камеру 7 по трубо-
проводу 4, где и растворяются в ртути. Реакционный сосуд 7
183
изготавливают из прочной нержавеющей стали, снабжают
ребрами жесткости, которые служат одновременно теплооб-
менниками, и помещают в нагревательную печь 5. С по-
мощью последней устанавливается температура, необходи-
мая для проведения реакции восстановления. Реакция
TiCl4+2Mg = 2MgCl2 + Ti+121,8 ккал/моль (IV—1)
экзотермична. Поэтому после ее начала не требуется даль-
нейшего подвода тепла. Для восстановления из емкости 1 бе-
рут TiCl4 и с помощью насоса 2 подают по трубопроводу 3 в
реакционную камеру 7. Реакция восстановления протекает с
высокой скоростью. Поэтому количество титана, образую-
щееся в единицу времени, регулируется количеством Т1С14>
подаваемым в реакционную камеру. Продукты реакции вос-
становления — металлический титан и MgCl2 — с помощью
шнекового транспортера 8, приводимого в движение электро-
мотором 6, перемещаются к напорной трубе 9, которая име-
ет высоту 30,5 м, и поднимаются по ней к верхнему уровню
амальгамы 16 в сосуде 17. Для уменьшения захвата магния
с амальгамой поднимающиеся продукты реакции промыва-
ются встречным потоком ртути, подаваемым с помощью на-
соса 11 по трубопроводу 10 и вниз по напорной трубе 9. По-
скольку продукты реакции выдерживаются достаточное
время в высокотемпературной секции аппарата, где при вы-
сокой температуре кристаллы титана укрупняются до раз-
меров, достаточных для быстрого всплывания и более быст-
рого отделения от ртути. Продукты реакции восстановления
из сосуда 17 с помощью шнекового транспортера 18 посту-
пают в сосуд 24, который закрывается с помощью клапана
25. Шнековый транспортер приводится в движение электро-
мотором 19. В сосуде 24 продукты реакции промывают горя-
чим водным раствором, содержащим определенное количе-
ство НС1. При этом MgCl2 растворяется и удаляется с раство-
ром. Остаток промывают соответствующим растворителем
(спирт, ацетон). Далее, сосуд 24 нагревают от 18—25 до
482—538°С. При этом в начале нагревания испаряется раст-
воритель, а затем отгоняется ртуть, захваченная кристалла-
ми титана. Ртуть конденсируется в конденсаторе 21 и возвра-
щается в напорный сосуд 14, из которого она подается с по-
мощью насоса 11 в реакционную камеру 7 по трубопроводу 4
или 10, как описано выше. Если ртутный конденсатор работа-
ет под давлением, то используют вакуумный насос 23 и меж-
ду конденсатором 21 и насосом 23 вводят вспомогательный
холодильник 22, чем предотвращают смешение паров ртути
и масла из вакуумного насоса. Из холодильника 22 сконден-
184
сированную ртуть подают по трубопроводу 20 в сборник
ртути 14. Если восстановление TiCl4 проводят непрерывно,
то в этом случае два сосуда-сборника 24 действуют попере-
менно. Кристаллы титана тонкодисперсны и порошкообраз-
ны, не содержат окислов и перерабатываются в готовые из-
делия по вышеописанным и известным методам.
Особенностью этого процесса является его непрерывность
и то, что ртуть здесь находится в круговом замкнутом цик-
ле в качестве вспомогательного реагента, не расходуемого в
процессе восстановления Т1С14* Отсутствуют также отходы
неполного восстановления TiCI4 до металла из-за высоких
температур и длительного контакта амальгамы магния с
тетрахлоридом титана. Система работает под давлением око-
ло 20 атм. По данным [332], этот процесс может быть ис-
пользован для получения бериллия, ванадия и циркония
восстановлением их галогенидов амальгамами магния, алю-
миния, натрия или калия, а также их сплавов с другими ме-
таллами.
Бериллий. Применение электролиза расплавленных
солей с ртутными электродами не нашло должного освеще-
ния в литературе, хотя при этом и достигнуты интересные*
результаты. Известно применение электролиза расплавлен-
ных солей для получения бериллия [328, 329]. Принципи-
альная схема аппаратурного оборудования для получения
металлического бериллия с малым содержанием кислорода
электролизом эвтектической смеси NaCl—ВеСЬ с ртутным
катодом приведена на рисунке 83 [328, 329]. Амальгаму бе-
риллия получают методом непрерывного электролиза в атмо-
сфере аргона при температуре 300—500°С и силе тока 30—
60 А. В электролизной ванне 1 — цилиндре из нержавеющей
стали, футерованном боросиликатным стеклом 2, в качестве
анода используют угольный электрод 3, а в качестве катода 4
применяют непрерывно циркулирующую в системе ртуть.
Трубка 5 служит для отвода амальгамы, а трубка 6 — для
возврата ртути из циркуляционной системы в электролизер.
Водяная рубашка 7 на отводной трубке 5 служит для охлаж-
дения горячей амальгамы до комнатной температуры при
подаче ее в отделитель 8. Герметичность электролизера до-
стигается при помощи крышки и кольца 9. Электролиз про-
водят при перемешивании ртути и расплавленного электро-
лита мешалкой 10 с ртутным затвором 11. Через отвер-
стие 12, находящееся на крышке, убыль бериллия из распла-
ва при электролизе пополняется добавкой хлористого берил-
лия из специального загрузочного механизма, предохраняю-
щего соприкосновение BeCls с воздухом. Контроль темпера-
туры осуществляется при помощи термопар. Уровень ртути
185.
и электролита контролируется электрозондом, который вста-
вляется в одно из отверстий в крышке (на рис. не показан).
В процессе электролиза разряжающиеся ионы бериллия
переходят в ртутную фазу и образуют склонную к расслоению
амальгаму. Разбавленная амальгама при стоянии расслаи-
Рис. 83. Принципиальная схема установки для получения
металлического бериллия электролизом расплавленных со-
лей с ртутным катодом.
вается, и бериллий обычно концентрируется в верхних слоях.
При содержании 2 вес. % бериллия амальгама представляет
собой пастообразный полутвердый материал. При продавли-
вании разбавленной амальгамы через пористую перегородку
с отверстиями диаметром 0,5 мм удаляется основная масса
чистой ртути и в остатке остается концентрированная амаль-
гама. Это свойство амальгамы используется для концентри-
рования амальгамы бериллия в процессе циркуляции. ртут-
ного катода. Концентрирование амальгамы осуществляют в
отделителе 8, которым служит металлический сосуд с ситом
200 меиг. Такое сито хорошо удерживает амальгаму и про-
пускает избыточную ртуть. В процессе электролиза отдели-
тель 8 наполняется амальгамой за 3—6 ч. При этом лоток
циркулирующей ртути переключается для наполнения вто-
рого отделителя. Концентрирование бериллия в амальгаме
осуществляют путем фильтрования через сито 14 под давле-
нием аргона, который вводится в камеру 13 над отделите-
лем. После удаления избытка ртути отделитель 8 с пастооб-
186
разной амальгамой герметически закрывается с обеих сто-
рон, вынимается из системы и на его место вставляется вто-
рой отделитель. Эту операцию производят, не прерывая
электролиза.
Из полученной пастообразной амальгамы изготовляют
порошок бериллия методом вакуумной дистилляции или
брикеты металлического бериллия методом горячего прес-
сования. При получении брикетов бериллия основное коли-
чество ртути удаляют холодным прессованием пастообраз-
ной амальгамы, а при горячем прессовании в течение 15 мин
под нагрузкой 300 кг/см2 и температуре 900°С оставшаяся
ртуть удаляется до следов.
Содержание кислорода в брикетах бериллия из-за плохо-
го вакуума достигало 0,7—0,8%.
Процесс получения бериллия через амальгаму имеет
ряд преимуществ перед обычным электролизом расплавлен-
ных солей. Основное преимущество заключается в меньшем
числе технологических операций. В процессе электролиза
расплавленных солей катодный бериллий захватывает зна-
чительное количество соли. Эту соль отмывают и в резуль-
тате проведения нескольких технологических операций воз-
вращают в процесс. Бериллий, полученный электролизом
расплавленных солей с твердым катодом, непосредственно
не пригоден для горячего прессования. Металлический бе-
риллий, полученный методом амальгамной пирометаллур-
гии, обладает лучшими физико-химическими свойствами и
в связи с этим пригоден для горячего прессования изготов-
ления деталей сложной конфигурации.
Технологический процесс получения бериллия амальгам-
ным методом может быть автоматизирован, что имеет весь-
ма важное значение в связи с высокой токсичностью этого
металла.
Уран. Значительный практический и теоретический
интерес представляет амальгамный метод получения урана
высокой чистоты [349—351]. Принципиальная технологиче-
ская схема получения урана амальгамным методом приведе-
на на рисунке 84.
С целью получения металлического урана тонкодисперс-
ный кристаллический тетрахлорид урана, который получают
при хлорирующем обжиге UO2 во вращающейся печи при
700°С, подвергают восстановлению амальгамой натрия в
реакционном смесителе (вибрационная мельница с 1600 ко-
леб/мин [349]). Амальгаму натрия получают в обычных
электролизерах с ртутным катодом. Скорость взаимодейст-
вия твердого тетрахлорида урана с амальгамой натрия зави-
187
сит от температуры и поверхности контакта участников ре-
акции друг с другом 13.
Как видно из рисунка 85, процесс восстановления урана
сильно зависит от температуры. Так, если при 25°С 80%-ный
Рис. 84. Принципиальная техно-
логическая схема получения
урана амальгамным методом.
1 — очистка концентрата UO2;
2 — прокаливание UO2; 3 — вос-
становление примесей водоро-
дом; 4— хлорирование UO2;
5 — восстановление тетрахлори-
да урана р 6 — электролизер с
ртутным катодом; 7 — промыв-
ка амальгамы ;• 8 — вакуумная
сушка; 9 — вакуум-фильтр;
10 — аппарат для отгонки рту-
ти; 11 — вакуумная плавка
урана.
выход достигается лишь по истечении 12—14 ч, то при 300°С
такой же выход достигается уже через 1 ч. Близкий к 100%
выход металлического урана в амальгаму наблюдается при
восстановлении тетрахлорида урана 2,5-кратным избытком
Рис. 85- Зависимость скорости реакции восстановления тетра-
хлорида урана амальгамой натрия от температуры.
13 Подобрать инертный растворитель для амальгамы натрия и тет-
рахлорида урана не удалось. Из испытанных органических жидкостей,
в которых растворяется тетрахлорид урана, спирты, эфиры и кетоны
реагируют с амальгамой натрия, а пиридин — с тетрахлоридом урана
[349].
188
0,5 вес. % амальгамы натрия при 300°С в течение 7—8 ч.
Избыток амальгамы натрия по отношению к UCI4 при 200°С
оказывает (рис. 86) небольшое влияние. Более значительное
влияние при этой температуре оказывает концентрация
амальгамы натрия (рис. 87).
Рис. 86. Зависимость выхода восстановленного урана от из-
бытка 0,5% амальгамы натрия при 200°С (т=4 ч).
Рис. 87. Зависимость скорости восстановления тетра-
хлорида урана от концентрации амальгамы натрия
(2,5-кратный избыток натрия, температура 200°С,
т=4 ч).
При восстановлении урана амальгамой натрия в реак-
ционном сосуде благодаря хорошей смачивающей способно-
сти амальгамы натрия образуется серебристая масса, состоя-
щая из амальгамы урана, содержащей избыток натрия, хло-
рида натрия и непрореагировавшего тетрахлорида урана.
189
Смесь разделяется в реакторе 7 (рис. 84) обработкой разбав-г
ленной серной кислотой, не содержащей окислителей. При
этом хлорид натрия и непрореагировавший тетрахлорид
урана растворяются и переходят в раствор, а амальгама
урана приобретает подвижность. Вследствие небольшой
Продолжительность ЬыцвдачиВани^ мае
Рис. 88. Зависимость потерь урана от условий обработки амальга-
мы урана 1,0 н. серной кислотой при 25°С. 1 — потери урана из
амальгамы при обработке 1,0 н. H2SO4 без доступа воздуха;
2 — растворение натрия из натрий-урановой амальгамы при
тех же экспериментальных условиях; 3 — потери урана из амаль-
гамы при обработке 1,0 н. H2SO4 на воздухе.
растворимости урана в ртути гетерогенная амальгама урана
очень устойчива по отношению к разбавленным кислотам и
в связи с этим потери урана из амальгамы не превышают
1%. Не использованный на реакцию восстановления натрий
при обработке кислотой полностью переходит из амальгамы
в раствор. Потери урана (рис. 88) резко возрастают при обра-
ботке натрий-урановой амальгамы при доступе воздуха. Од-
нако, как видно, практически полное растворение натрия из
амальгамы происходит даже без доступа воздуха за 1/4 ча-
са. После обработки урановой амальгамы разбавленной кис-
лотой амальгама содержит 0,5—1,0% урана. Для уменьшат
ния расхода энергии при отгонке ртути под вакуумом амаль-»
гаму подвергают предварительному обогащению. При этом
амальгама освобождается от влаги и основное количестве?
190
ртути удаляется путем фильтрования через пористые пере-
городки в аппарате. При фильтровании урановой амальгаму
под вакуумом получают 5—6%-ную амальгаму урана. Поте-
ри урана с ртутью, которая поступает в голову процесса на
получение натриевой амальгамы, составляют не более
1-10-4%.
Наибольшие трудности при разработке амальгамного
метода получения урана встретились при удалении ртути из
металлического урана и его амальгам. В связи с высоким
сечением захвата нейтронов атомами ртути содержание рту-
ти в уране должно быть снижено до минимальной величины.
Оказалось, что удаление ртути из урана зависит от условий
отгонки. Для глубокого удаления ртути из амальгам урана
и других металлов, образующих с ртутью прочные интерме-
таллические соединения (UHg4, ThHg4, TiHg4, ZrHg4, MnHg,
NiHg4), рекомендуется проводить отгонку при нескольких
температурах [350]. На первом этапе отгонку проводят дли-
тельное время при температуре намного выше температуры
разложения соединения металла с ртутью. Режим отгонки
должен быть таким, чтобы парциальное давление ртути бы-
ло выше давления паров соединения на 10 мм рт. ст., а тем-
пература должна быть приблизительно на 100°С ниже тем-
пературы плавления металла, не содержащего ртути. Интер-
металлические соединения настолько устойчивы, что даже
под вакуумом разлагаются очень медленно. Если ртуть от-
гонять при высоких температурах, то остаток от отгонки
спекается, ртуть «запирается» в металле и не может диф-
фундировать на поверхность или даже образует с металлом
твердые растворы, что также затрудняет удаление ртути из
металла. Если при нагревании интерметаллическое соедине-
ние MeHgx разлагается и образует соединения с различным
соотношением компонентов и температурами разложения,
то в этом случае проводят многоступенчатую отгонку ртути
последовательно при соответствующих температурах. Лишь
после практически полной отгонки металл плавят в слитки.
В работе [3’50] показано, что если из 6 %-ной амальгамы
урана ртуть отгонять при 650°С в течение 3 ч, затем темпера-
туру повысить до 1300°С и металлический уран расплавить,
то содержание ртути в уране составит меньше 5-10“4 ат.%.
Если же эту амальгаму поместить в горячую печь и ртуть
отгонять в течение 1—2 ч при высоких температурах, то пе-
реплавленный металлический уран содержит (0,84-1,2)-
•10"2ат.% ртути.
По данным [349], отгонку ртути из амальгамы урана
проводили под вакуумом (0,1 мм рт. ст.) в печи 10 и
(см. рис. 84) и при одновременном продувании аргоном,
Амальгаму урана вводили в холодную печь и за 60 мин
повышали температуру до 550°С, отгоняли ртуть при этой
температуре в течение 2 ч, затем в течение 3 ч постепенно
повышали температуру вакуумной печи до 1280°С и отгоня-
ли ртуть при этой температуре в течение часа. Содержание
ртути в металлическом переплавленном уране составляло
<44-6) -IO"4 %.
В зависимости от условий отгонки может быть получен
порошкообразный, губчатый или монолитный уран с теоре-
тической плотностью [349].
Технико-экономический анализ эффективности амаль-
гамного метода получения урана показывает, что этот ме-
тод имеет ряд преимуществ перед «классическим» кальций-
или магний-термическим [351]. Поскольку для применения
обоих методов требуются одинаковые помещения и вспомо-
гательные сооружения и аппараты, то они обладают равны-
ми аппаратурными издержками. Основное отличие заклю-
чается в расходе реагентов. В классическом кальций-терми-
ческом методе при производительности 100 г урана в год
расходуется кальция высокой чистоты (210 000 долларов) и
фтористого водорода (40 000 долларов) на сумму 250 000
долларов. При получении урана амальгамным методом рас-
ход на реагенты, энергию и другие вспомогательные средства
составляют лишь 35 000 долларов при равной производи-
тельности установок.
Следует отметить, что амальгамный метод позволяет по-
лучить не только уран высокой чистоты в любом виде (тон-
кодисперсный порошок, губка, монолитный металл), но и
карбиды и нитриды урана, а также чистые гомогенные спла-
вы урана с металлами точно заданного состава [349].
Амальгамный метод нашел применение и для извлечения
урана из обработанных элементов ядерных реакторов. Этот
процесс разработан Дином с сотр. [6, 325, 352] и носит на-
звание «Гермекс-процесса». Обычные химико-металлургиче-
ские методы переработки ядерного горючего весьма трудоем-
ки. После растворения ядерного топлива в кислоте, очистки
растворов от продуктов распада уран и плутоний высажи-
вают из очищенных растворов, а затем перерабатывают в
металл по сложной технологической схеме. Амальгамный
метод позволяет получить эти металлы сразу в металличе-
ском состоянии. На рисунке 89 приведена принципиальная
технологическая схема «Гермекс-процесса» [6, 352]. Здесь
используется принцип дробной перекристаллизации, в осно-
ве которого лежит сильно выраженная зависимость раство-
римости урана в ртути от температуры (см. табл. 2). В
амальгамных технологических процессах элементы ядерных
реакторов и урановые отходы растворяют в кипящей ртути
в аппаратах из нержавеющей стали, после растворения
фильтруют и подвергают дробной кристаллизации [6, 325,
352]. Плутоний, торий и уран образуют с ртутью интерме-
таллические соединения, растворяющиеся в избытке ртути.
Рис. 89. Технологическая схема «Гермекс-процесса» получения
металлического урана [353]. 1 — очистка ртути; 2— растворе-
ние топливных элементов ядерных реакторов; 3 — фильтр с на-
гревом; 4 — кристаллизация; 5 — вакуум-фильтр; 6 — сосуд
для промывки амальгамы; 7 — фильтр-пресс; 8— печь для от-
гонки ртути и плавки урана; 9— зона высокой температуры.
Плутоний с ртутью образует два интерметаллических соеди-
нения: PuHg3 и PuHg4. Растворимость плутония при 300,
305 и 365°С составляет соответственно 0,496, 0,561 и около
1,2 ат.%. Уран с ртутью образует три интерметаллических
соединения: UHg4 по перитектической реакции при 365°С,
UHg3 — при 390°С и UHg2 — при 455°С [36]. Растворимость
урана при 350 (см. табл. 2) и 365°С составляет соответствен-
но 1,11 и 22,5 ат.%.
Торий с ртутью образует два интерметаллических соеди-
нения: ThHg—Гпл 970°С и ThHgs—ТПл 700°С [70]. Раство-
римость тория в ртути при 365°С составляет 9 ат.%. По дан-
ным [353], растворимость урана и тория при совместном
присутствии в ртути взаимопонижается и составляет при
365°С соответственно 1,2 и 0,12 ат.%14. Для отделения
нерастворившихся примесей амальгама фильтруется через
обогреваемый фильтр из спеченной нержавеющей стали.
При этом отделяются молибден, цирконий, палладий, руте-
14 На наш взгляд, эти данные нуждаются в проверке. Уран с торием
не образует интерметаллических соединений, и понижение растворимо-
сти в ртути урана в 18 раз, а тория в 75 раз необъяснимо.
13-122 193
ний, железо и другие металлы, имеющие растворимость
на~5 порядков меньшую, чем уран. Затем приблизительно
0,5%-ную урансодержащую амальгаму охлаждают до 25°С.
При этом уран и торий в виде интерметаллических соедине-
ний выпадают в осадок и отделяются фильтрованием через
фильтры. Остаток после фильтрования содержит около 5%
урана. Поскольку щелочноземельные и редкоземельные ме-
таллы также растворяются в ртути и могут захватываться
осадком урана, его промывают для удаления незначитель-
ного содержания неблагородных металлов несколько раз
1 н. соляной кислотой, затем дистиллированной водой, на-
сыщенной аргоном, и, наконец, метанолом. Последующим
отжатием избытка ртути из амальгамы достигают содержа-
ния урана в продукте 15 % • Фильтраты, содержащие меньше
0,001% урана, возвращают в голову процесса. Из уранового
продукта вакуумной дистилляцией при 800°С или в атмосфе-
ре аргона при 1200°С ртуть удаляют до содержания 0,001%.
Брикеты урана после отгонки ртути переплавляют.
От концентрированной амальгамы отгоняется ртуть в
вакууме при температуре 1200°С с применением жаростой-
ких тиглей из двуокиси циркония. Полученный урановый
спек подвергается индукционной переплавке в атмосфере
аргона непосредственно после отгонки ртути, без прерыва-
ния производственного цикла.
Исследования, проведенные первоначально в небольшом
масштабе, .показали, что этим методом можно устранить
основную массу радиоактивных добавок, содержащихся в
отходах. Коэффициент очистки можно повысить до величи-
ны, превышающей 10. Изотопы с большим периодом полу-
распада легче отделяются от изотопов, отличающихся не-
устойчивостью, в результате чего активность продуктов в
значительной степени уменьшается с течением времени. Че-
рез две недели после завершения процесса «Термекс» актив-
ность уменьшается в двадцать — семьдесят раз [334].
Торий. Это радиоактивный неделящийся материал,
легко превращаемый при поглощении нейтронов с последу-
ющим p-распадом в уран 233, имеющий высокое потенциаль-
ное значение в экономике будущих ядерных реакторов бла-
годаря его ядерным свойствам, лучшим, чем свойства U235, и
более легкой его обработке, чем плутония. В природе торий
распространен так же, как и уран.
Амальгамный метод получения тория разработан Дином
и Эллипсом [327, 354]. Процесс был внедрен в США для
промышленного производства реакторночистого тория и на-
зывается «Металлекс-процессом» [7, 327, 354]. Технологиче-
ская схема непрерывного процесса получения тория приве-
194
дена на рисунке 90. Как видно, процесс содержит следующие
технологические стадии: а) восстановления, б) промывки,
в) концентрирования амальгамы тория путем фильтрования,
г) вакуумной дистилляции и д) плавки губчатого тория в
Рис. 90. Технологическая схема «Металлекс-процесса»
получения металлического тория [327]. 1 — сборник
амальгамы натрия; 2— подача соли ТЬСЦ; 3 — реак-
тор; 4 — диспергирование амальгамы тория; 5 — гибкое
соединение; 6 — выпуск газа; 7 — сброс сливных вод;
8 — промывная колонна; 9—слив; 10 — первая про-
мывка; 11 — емкости для коагуляции и отстаивания;
12— напорный насос; 13 — вторая промывка; 14— ге-
лий высокого давления; 15 — герметическая емкость;
16 — фильтрация и прессование; 17 — вакуумная дис-
тилляция; 18— плавка в дуговой печи; 19— штамповка.
дуге. Основным сырьем служит нитрат тория, который пре-
вращают в оксалат при 90°С, а гранулы последнего хлори-
руют при 675°С до образования тетрахлорида тория. Про-
цесс восстановления ThCl4 осуществляют амальгамой нат-
рия:
195
ThCl4 + 4NaHg4 + 60Hg—ThHg3 +
+ 4NaCl + 73Hg + 20 ккал!М. (IV—2)
Восстановление ThCli проводят в атмосфере гелия или
аргона при температуре 1304-180°С при интенсивном пере-
мешивании реагентов (11004-1410 об/лшн). Процесс восста-
новления протекает с высокой скоростью — за 20 мин дости-
гается 85 %-ное и более (92%) восстановление хлорида
тория до металлического состояния. В присутствии воды и
кислорода процесс восстановления сопровождается побочны-
ми реакциями — образованием окислов тория, гидроокиси
натрия и оксихлорида тория. Интерметаллическое соедине-
ние ThHg3 смачивается и защищается от окисления избытком
ртути, в то время как частично окисленный интерметаллид
ThHg,3 выделяемся из ртутной фазы. Некоторые из восста-
новленных примесей также не смачиваются ртутью. Продукт
восстановления — примерно 1%-ную амальгаму тория, со-
стоящую из суспензии интерметаллического соединения
ThHg3,— промывают 3 н. НС1, растворяющей непрореагиро-
вавший ThCLi, NaCl и избыточный натрий из амальгамы то-
рия, а затем дистиллированной водой. Из промывного аппа-
рата амальгама удаляется в условиях, исключающих воз-
можность уноса воды и растворов, и подвергается обогаще-
нию до содержания 10—15% тория на фильтр-прессе. Все
стадии процесса проводят при низких температурах, что сни-
жает коррозию оборудования. Из обогащенной амальгамы
ртуть отгоняют в стальных ретортах емкостью 60 кг в ва-
кууме при температуре 1100°С. Остаток после отгонки ртути
представляет собой спек с пористостью 154-35%. Получен-
ный таким образом металлический торий содержит 0,54-
4-1,0% окиси тория, следы железа и 0,0014-0,007% ртути
и не содержит практически каких-либо других примесей.
Спек тория может быть переплавлен в электродуговой печи,
прокатан в ленты или переработан любыми другими метода-
ми в готовое изделие.
Стоимость затрат на 1 кг металлического тория состав-
ляет 5 долларов при производительности установки 4 т ме-
таллического тория в день. В затраты входит стоимость при-
готовления амальгамы натрия, реактивов, амортизация обо-
рудования, но не стоимость нитрата тория. Эти данные
показывают, что «Металлекс-процесс» является высоко-
эффективным технологическим процессом получения метал-
лического тория. Ртуть — вспомогательный металл — нахо-
дится в круговом цикле, защищает пирофорный металличе-
ский торий от окисления и, обладая текучестью, позволяет
осуществлять процесс непрерывно.
106
Молибден и вольфрам. Амальгамный пирометал-
лургический процесс восстановления хлоридов молибдена и
вольфрама амальгамой цинка предложен Янгом [355] и
Вильсоном [356]. Для восстановления M0CI5 или WCI5 при-
меняют 14-10 вес. % амальгаму цинка (предпочтительнее
2—5 вес.%), которую берут в избытке 110—200% к теорети-
ческому количеству, необходимому для полного фазового
обмена. Реакцию проводят при нагревании реакционной сме-
си до температуры, близкой или выше температуры плавле-
ния образующегося по реакции хлорида цинка (318°С).
Причем при температуре, несколько меньшей температуры
плавления ZnCh, скорость реакции восстановления хлоридов
молибдена и вольфрама выше. При температурах, более вы-
соких, чем температура плавления ZnCh, скорость реакции
восстановления незначительно уменьшается. После оконча-
ния восстановления M0CI5 или WCI5 температуру реакцион-
ной смеси повышают примерно до 350°С и выдерживают
для укрупнения кристаллов в течение 30 мин. Расплавлен-
ный Z11CI2 при этом полностью выделяется из амальгамы.
После охлаждения хлорид цинка, образовавший твердую
массу в форме плитки, легко отделяется от амальгамы. Из-
быточный цинк из амальгамы и ртуть отгоняют в вакууме
путем постепенного повышения температуры до 800°С. В
остатке получают порошки металлических молибдена и
вольфрама, не содержащие цинка, ртути, кислорода и гало-
генидов.
Марганец обладает ценными физико-химическими
свойствами и находит применение в новых отраслях про-
мышленности, науки и техники. Получение металлическо-
го марганца высокой чистоты гидрометаллургическими ме-
тодами связано со значительными трудностями. В связи с
этим интенсивно разрабатываются амальгамные методы по-
лучения марганца высокой чистоты [4, 5, 357—361]. Иссле-
дования Гоном [4, 5], Р. И. Агладзе с сотрудниками [357 —
359], Янгом [360—361], Г. М. Бацикадзе [362, 363] и А. А.
Ланге [364] электролиза сернокислых растворов марганца с
ртутным катодом показали, что электрохимическое восста-
новление марганца связано с меньшими трудностями. Элек-
троосаждение марганца с выходом почти 100% по току
удается проводить в широком интервале температур (30—
80сС), при высоких плотностях тока (300—3000 А/м2) и из
сравнительно кислых электролитов (pH ^2). Р. И. Агладзе
и Н. С. Федоровой [357] в процессе электролитического
осаждения марганца на неподвижном ртутном катоде из
электролита, содержащего около 75 г/л MnSO4 или 54 г/л
197
МпС12 и 150 г!л (NH4)2SO4, получен выход марганца по току
около 100%.
Анодный процесс при электролизе марганца вызывает
осложнения. Для предупреждения осаждения на аноде боль-
ших количеств окиси марганца нужно применять мембрану.
Американская фирма [365]
получает этим методом амаль-
гаму марганца без примене-
ния диафрагм при pH электро-
лита, равном примерно едини-
це. Кроме того, при низкой
температуре не производится
дозирование сульфата аммо-
ния. При таком ведении элек-
тролиза двуокись марганца на
аноде не образуется. В ван-
нах Гонсберга добиваются вы-
хода по току 90% и расхода
электроэнергии 5,5-г-6,0 кет-
-ч/кг Мп. При этом получают
концентрированную амальга-
му, которую обогащают мар-
ганцем путем фильтрования
через пористые перегородки, а
затем из остатка ртуть отго-
Рис. 91. Принципиальная схема
амальгамного гидрометаллурги-
ческого цикла получения мар-
ганца высокой чистоты: 1 —
электролизер; 2 — фильтрация
Fe(OH)3; 3 — окисление Fe2+ в
Fe3+ и осаждение гидроокиси
железа (Fe(OH)3); 4 — выщела-
чивание (вторая стадия); 5 —
выщелачивание (первая стадия);
6 — регенерация аммиака; 7 —
фильтрация; 8 — осаждение маг-
ния; 9— промывка амальгамы
марганца водой; 10 — сушка
амальгамы под вакуумом; 11 —
концентрирование амальгамы
путем фильтрования; 12—от-
гонка ртути в токе водорода
(швелевание).
няют дистилляцией в токе
инертного газа или вакууме.
Конечный продукт представ-
ляет собой дисперсный поро-
шок марганца высокой чис-
тоты.
Более совершенная техно-
логическая схема амальгам-
ного гидро-пирометаллургиче-
ского цикла получения мар-
ганца высокой чистоты пред-
ложена Янгом [360]. На ри-
сунке 91 приведена принци-
пиальная схема процесса. Ис-
ходным сырьем служат как
сидеритные руды, так и руды,
содержащие пиролюзит. Си-
деритные руды измельчаются, а пиролюзитные подвергают-
ся восстановительному обжигу и выщелачиваются отрабо-
танным кислым электролитом ртутного электролизера. От-
работанный электролит содержит 100 г)л сульфата аммония,
198
154-20 г/л сернокислого марганца и 10 г/л свободной серной
кислоты (pH 1,54-2). Выщелачивание руды проводят в две
стадии. При выщелачивании марганцевой руды кислотность
раствора падает и значение pH раствора после выщелачива-
ния марганцевой руды составляет около 5—6. Кроме боль-
шего количества сульфата марганца и сульфата аммония,
этот раствор содержит выщелоченные сульфаты кальция,
магния и железа (Fe2?). Из этих примесей последующему
электролизу больше всего мешает железо. Обладая более
электроположительным потенциалом по отношению к мар-
ганцу, железо будет соосаждаться с марганцем на ртутном
катоде и загрязнять металлический марганец. Поэтому
электролит очищают от ионов железа путем окисления
ионов Fe2+ в Fe3+ кислородом воздуха при pH 5,5—7,6.
Этот процесс хорошо освоен в свинцово-цинковой промыш-
ленности [366, 367]. Осаждающаяся при пропускании воз-
духа гидроокись трехвалентного железа захватывает также
все взвешенные вещества. После фильтрования раствор по-
ступает на электролиз в горизонтальный электролизер с
циркулирующим ртутным катодом той же конструкции,
которая обычно применяется при электролизе хлоридов ще-
лочных металлов.
В качестве анода используют сплав состава, % • 80 — РЬ,
32 — Sn, 4 — Ag и 4 — Со. На таком аноде практически не
образуется двуокись марганца (0,25%), которая приводит к
шламообразованию и остановке электролизера при исполь-
зовании в качестве анода других сплавов. Электролиз прово-
дят при температуре выше 80°С.
Марганец образует с ртутью соединение Mn2Hgs [368],
которое при 75 °C распадается на MnHg и Hg. При темпера-
турах ниже 75ЭС амальгама марганца уже при содержании
в несколько десятых долей процента настолько вязка, что
циркуляция амальгамы парализуется и из ртути вырастают
дендриты из соединения марганца и ртути, которые могут
явиться причиной коротких замыканий в электролизере.
При температуре выше 80°С содержание марганца в катод-
ной ртути повышается примерно до 0,8% Мп, однако это не
вызывает затруднений в работе. В результате постоянного
вывода части амальгамы из электролизера и замены ее све-
жей ртутью, которая .поступает после фильтрации или отгон-
ки ртути, содержание марганца в ртутном катоде несколько
ниже этого значения. Выход по току марганца выше 80%.
В процессе электролиза в электролите устанавливается pH
около 2,24-2,6. Расход энергии для выделения 1 кг марган-
ца составлял 5,0 квт-ч при плотности тока 500 А/м2 и
6,5 квт ч при 3000 А!м2. Однако эти значения не являются
199
оптимальными и могут быть снижены, например, при умень-
шении межэлектродного расстояния. При полупромышлен-
ных испытаниях расстояние между анодом и катодом для
обеспечения бесперебойной работы выбиралось равным
15 мм. Плотность тока в процессе испытаний была ограни-
чена до 3000 А/лт2, поскольку электролит на поверхности
анода закипал. Если применять охлаждение анодов, то плот-
ность тока может быть увеличена. В связи с этим для гори-
зонтальных ртутных электролизеров не потребуется боль-
шая площадь пола по сравнению с электролизными цехами
с твердыми электродами, работающими при плотности тока
400 А 1м2.
Вытекающая из электролизера амальгама с содержанием
марганца около 0,8% тщательно отмывается от электролита
пропусканием ее через колонку 9, заполненную разбавлен-
ной кислотой, а затем через оросительную колонну с по-
стоянно циркулирующей водой. Промывку проводят очень
тщательно, до полного удаления сульфата, так как в против-
ном случае металлический марганец будет содержать серу.
Исследования показали, что амальгама марганца является
достаточно коррозионноустойчивой и потерь марганца при
обработке амальгамы разбавленной кислотой и водой прак-
тически не происходит. Для предотвращения закупорки
трубопроводов циркуляционной системы MnoHgg амальгаму
промывают при температуре выше 75°С, затем тщательно
сушат при небольшом вакууме в колонне с насадкой 10 и
подвергают обогащению марганцем путем фильтрования че-
рез пористые перегородки 11. При содержании в амальгаме
0,8% марганца для получения 1 кг марганца необходимо
отогнать 125 кг ртути. Поэтому экономичнее подвергать
амальгаму предварительному обогащению. Для достижения
необходимой степени обогащения фильтрование проводят
при температуре выше 75°С. Если процесс проводить при
температуре ниже этой, то из-за образования соединения, бо-
гатого ртутью, — Mn2Hg5 в остатке после фильтрации содер-
жание марганца будет составлять только 2—3%. Если же
фильтрование проводить при 100°С, то будет получена
амальгама с концентрацией марганца 9—10%. При фильт-
ровании амальгамы через пористые перегородки с размером
пор 100 ц вследствие малой растворимости марганца в рту-
ти фильтрат практически не содержит марганца.
В соответствии с данными работы [341] с помощью тер-
мической обработки можно обогатить и амальгаму мар-
ганца. Так, обрабатывая амальгаму с 1,8 вес. % марганца в
течение 30 мин при 560°С и фильтруя ее на холоду, дости-
гают обогащение марганца в осадке до 11 %.Однако, прово-
200
дя фильтрование при 280°С, т. е. при температуре, при кото-
рой ртуть еще не кипит, получают обогащение до 35%
марганца в остатке после фильтрования. Применяя же обра-
ботку при более высоких температурах, достигают обогаще-
ния до 50% металла в осадке после фильтрования.
Для получения металлического марганца ртуть из обога-
щенной-амальгамы отгоняется дистилляцией в атмосфере
водорода, применяемого в качестве защитного газа, при тем-
пературе 600°С. Хотя марганец и образует с ртутью соеди-
нения, из которых наиболее прочным является MnHg [368],
полное выделение ртути из марганца возможно уже при низ-
ких температурах. Интерметаллическое соединение MnHg
распадается при атмосферном давлении уже при 410°С на
металлический марганец и пары ртути; если применяется
вакуум, температура разложения может быть еще больше
понижена [369]. Для отгонки ртути из амальгамы марганца
могут быть использованы печи различных конструкций
[6, 336, 337]. Очень важную роль при обработке амальгамы
марганца играет полное удаление кислорода и паров воды
во время швелевания, так как в противном случае металл
загрязняется окислами. Азот также должен быть удален,
так как он реагирует с марганцевой губкой, в результате че-
го образуется нитрид марганца [362, 363]. В процессе отгон-
ки ртути при 400°С образуется очень мелкий пирофорный
марганцевый порошок, который при контакте с воздухом
спонтанно сгорает с выделением тепла. При 500—600°С ме-
талл начинает спекаться и превращаться в пористый кек,
который уже не способен к самовозгоранию, однако если его
воспламенить, он будет медленно гореть. При повышении
температуры отгонки ртути получается более спеченный ме-
талл, который при 1200°С представляет собой уже компакт-
ный металл с серебристой блестящей поверхностью. Приве-
дем зависимость содержания ртути в металлическом
марганце от температуры отгонки ртути, по данным колори-
метрического метода анализа
Темпеиатура, Содержание
°C ртути, %
400 1,8-Ю^2
600 1,5-10~2
800 0,8-10'3
1000 1»10"“4
1200 Не обн.
Амальгамный метод получения марганца имеет целый
ряд преимуществ перед известным гидрометаллургическим
201
методом электролиза с твердыми катодами. Основными из
них являются: 1) низкий расход электроэнергии; 2) отсутст-
вие тонкой очистки электролита; 3) получение металлическо-
го марганца высокой чистоты, свободного от металлоидов;
4) возможность получения самых разнообразных мар-
ганцевых сплавов высокой чистоты. Единственным недостат-
ком амальгамного метода получения марганца являются
затраты на приготовление амальгамы. Однако при примене-
нии высокопроизводительных электролизеров капитальные
затраты на ртуть будут небольшими. По данным ра-
боты [334], амальгамным пирометаллургическим мето-
дом производит марганец итальянская фирма «Монте Ами-
ата».
Цирконий. Для восстановления тетрахлорида цирко-
ния используют калий-литиевую 0,8%-ную амальгаму, со-
держащую калий и литий в весовой пропорции 4:1 [31]. Вос-
становлению подвергают порошкообразный ZrCl< при темпе-
ратуре 4С0°С небольшим избытком по отношению к цирко-
нию металлов-восстановителей (14-4%). Солевая смесь хло-
ридов калия и лития — побочных продуктов — образует лег-
коплавкий расплав. Процесс осуществляют непрерывно в ко-
лонне с температурой в нижней части 400°С, а верхняя часть
охлаждается водой. Смесь ZrCl4 и калий-литиевой амальга-
мы непрерывно подают в зону нагрева, которая имеет отра-
жательные пластины, обеспечивающие время пребывания
реакционной смеси в течение нескольких минут, в результа-
те достигается 100%-ное восстановление тетрахлорида цир-
кония. Для устранения испарения ртути в реакционной зоне
при 400°С процесс восстановления проводят под давлением
в колонне высотой 1 м.
Реакционная смесь поступает снизу вверх с помощью на-
соса. В холодной части колонны расплав солей затвердевает
и быстро всплывает вверх, в то время как цирконий, будучи
тончайше распределенным в амальгаме, удаляется ниже
слоя ртути. Обогащение амальгамы циркония проводят
обычным методом — фильтрованием через пористые перего-
родки. Остатки неиспользованных металлов-восстановителей
и ртуть из богатой амальгамы циркония удаляют в вакууме
при 1400°С, а затем вместе с очищенной ртутью снова вводят
в реакционную зону с твердым ZrCl4. При этом получают
губчатый цирконий, не содержащий ртути, щелочных метал-
лов и окислов, который переплавляют в слитки или обраба-
тывают любыми другими методами.
202
АМАЛЬГАМНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ
МЕТАЛЛОВ ВЫСОКОЙ ЧИСТОТЫ
ФРАКЦИОННОЙ ПЕРЕКРИСТАЛЛИЗАЦИЕЙ
И ЭКСТРАКЦИЕЙ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ
В последнее время интенсивно развиваются высокотемпе-
ратурные металлургические процессы, в которых в качестве
рабочей среды используют «вспомогательные металлы», и
прежде всего ртуть. Изучение реакций обмена в металличе-
ских средах показало, что свойства таких растворов позво-
ляют в технологических процессах использовать перекри-
сталлизацию, отделение нерастворимых металлических и
неметаллических соединений и отделение «вспомогательно-
го» металла-растворителя путем фильтрации или выпарива-
ния [2, 6, 7, 325, 334—341, 370]. Применение ртути в качест-
ве рабочего реагента в металлургических высокотемператур-
ных процессах может привести к значительному увеличению
эффективности целого ряда производств.
По данным работы [370], методы, основанные на исполь-
зовании расплавленных металлов и ртути в качестве вспо-
могательных веществ, имеют слаборазвитую теоретическую
основу и поэтому не нашли широкого применения. Еще не-
достаточно исследованы свойства и поведение металличе-
ских расплавов и различных металлов и их соединений в
этих жидких металлах. Ртуть является идеальным «вспомо-
гательным металлом» для проведения различных технологи-
ческих процессов, в которых она находится в замкнуто.м
цикле. Ртуть непрерывно участвует в массопереносе и, испа-
ряясь из промежуточных продуктов, легко возвращается в
голову технологического процесса. Особенно эффективно
применение ртути в качестве растворителя при получении
и рафинировании алюминия, галлия, натрия и других ме-
таллов. Рассмотрим некоторые технологические схемы по-
лучения металлов высокой чистоты методами фракционной
перекристаллизации, экстракции и дистилляции.
Алюминий. В настоящее время находит широкое про-
мышленное применение [2, 6, 325] амальгамный пирометал-
лургический метод получения алюминия из алюмоферроси-
лиция (AlFeSi), алюминиевых сплавов, самолетного скрапа
и другого алюминийсодержащего сырья, переработка кото-
рого ни одним из обычных методов не рентабельна и возмож-
на только с большой затратой труда. В основе технологии
лежит метод экстракции алюминия ртутью и дробной фрак-
ционной кристаллизации его в области температур, когда
растворимость алюминия в ртути при снижении температу-
20'3
ры резко изменяется. Так, растворимость алюминия при
500°С равна 3 вес.%, при 600°С — 40, а при 650°С — 80. Алю-
миний и его сплавы покрыты пленкой окислов, и поэтому
растворение алюминиевых сплавов в ртути связано с затруд-
нениями [371]. Предложен ряд методов растворения спла-
вов алюминия в ртути. Для инициирования реакции раство-
рения алюминия в ртути рекомендуется алюминиевый сплав
обрабатывать ртутью в виде пара таким образом, чтобы
ртуть конденсировалась, а затем сплав выдерживался в го-
рячей ртути при заданной температуре. Этот процесс раство-
рения сплава алюминия осуществляют в противотоке. В ра-
боте [371] сплавы алюминия (64% алюминия, 34% кремния,
1,2% железа и 2,8% окиси и карбиды) перед экстракцией
подвергают измельчению между валами вальцевой мельни-
цы под слоем ртути при температуре ^350°С или смеши-
вают жидкий сплав алюминия (94% А1, 4% Си, 2% Pb, Sn
и др.) при 680°С с ртутью при энергичном встряхивании.
В этих условиях образуется тонкодисперсная масса сплава,
смоченного ртутью, обладающая высокой скоростью раство-
рения при повышении температуры экстракции.
При обработке алюминиевого сырья при температуре
530-?650°С алюминий полностью переходит в ртутную фазу,
в то время как Fe, Si, Ti, Cr, W, V и многие другие элементы
и их интерметаллические соединения (Mg2Si, FeSi, FeZn)
вследствие малой растворимости в ртути (см. табл. 2) не пе-
реходят в амальгаму алюминия. Их отделяют горячим
фильтрованием амальгамы алюминия при высоких темпе-
ратурах через металлические шайбы с отверстиями, запол-
ненными волокнистым асбестом, пористые керамические
фильтры или даже тонкую сетку, сложенную в несколько
слоев.
В ртутную фазу совместно с алюминием переходят ще-
лочные, щелочноземельные металлы, цинк, олово, кадмий,
свинец, медь и некоторые другие металлы, обладающие вы-
сокой растворимостью в ртути. Все эти металлы, за исклю-
чением меди, отделяются при дробной кристаллизации алю-
миния из амальгамы и промывке кристаллов алюминия чис-
той ртутью. Затруднения при отделении меди обусловлены
тем, что медь имеет сходный с алюминием ход изменений
растворимости в ртути от температуры. Как видно из табли-
цы 2, растворимость меди и алюминия при 100, 200 и 350°С
близка и соответственно равна, ат. % : 0,0371 и 0,089, 0,18 и
0,50, 0,94 и 3,0. Для отделения меди предложено несколько
технологических приемов. Автор [7] рекомендует фракцион-
ную кристаллизацию алюминия при 450-ь560°С, когда из
ртутной фазы выкристаллизовывается совместно с неболь-
204
шим количеством алюминия практически вся растворенная
медь в виде интерметаллического соединения CuAh [7]. Пос-
ле удаления выпавшего осадка проводят дальнейшее неболь-
шое охлаждение амальгамы для отделения оставшихся ко-
личеств меди. Отделение меди из алюминиевой амальгамы
можно ускорить, если ввести в амальгаму твердый чистый
алюминий в виде стружки или порошка для образования
центров кристаллизации меди [372]. При двухступенчатой
фракционной кристаллизации получают два сорта алюми-
ния. Первый из них содержит от 0,08 до 3—4% меди и мо-
жет быть использован для получения алюминиевых сплавов,
содержащих медь, а второй содержит лишь 0,005% меди
[372]. Экстракцией алюминия ртутью с последующей двух-
ступенчатой кристаллизацией извлекают алюминий из си-
лумина (AlFeSi), алюминийсодержащих шроттов, сырых
алюминиевых сплавов и при получении алюминия прямым
восстановлением из глин или бокситов, содержащих значи-
тельные количества кремния (Si: А1 = 1:2,5). В этом случае
экстракцию проводят при температуре, при которой в сплаве
в соответствии с диаграммой состояния имеется жидкая фа-
за. Например, для сплава AlSi температура экстракции
650°С немного превышает температуру эвтектоидной горизон-
тали при 577°С. При 650°С давление паров ртути достигает
35 ат. При растворении алюминия в ртути и образовании
амальгамы давление паров снижается.
Процесс экстракции проводят в автоклавах в условиях,
полностью исключающих потери ртути, которые недопусти-
мы с гигиенической и экономической сторон. Для обеспече-
ния безопасности работы в устройство вводят ртутно-паро-
вую турбину [373, 374]. Процессы экстракции и кристалли-
зации алюминия осуществляются безупречно. Осадки с
фильтра, образующиеся при растворении алюминия в ртути,
извлекаются после отгонки ртути из аппаратуры и представ-
ляют собой ценные побочные продукты [373].
Для извлечения алюминия из различного сырья и скрапа
методом амальгамной пирометаллургии в Германии был вве-
ден в действие завод с производственной мощностью
10 000 т!год [374]. Экстракцию алюминия ртутью при 600°С
проводили периодически в автоклавах с внутренним диамет-
ром 0,5 л*, высотой 3 м и толщиной стенок 50 мм при весо-
вом отношении Al:Hg = l:20. Полученная амальгама фильт-
ровалась через керамический фильтр, охлаждалась до ком-
натной температуры, алюминий кристаллизовался, и ртуть
удалялась выдавливанием без доступа воздуха. Для полного
удаления ртути алюминиевые брикеты переплавляли в среде
расплавленных солей (NaCl, ВаСЪ) при 700°С и повышенном
205
Рис. 92. Устройство для перера-
ботки алюминиевого скрапа.
давлении. Полученный таким способом алюминий практи-
чески не содержал ртути и имел повышенную коррозион-
ную устойчивость вследствие более высокой чистоты по срав-
нению с обычным алюминием [373, 374].
Для глубокого удаления ртути из алюминиевой амальга-
мы в работе [375] рекомендуется проводить отгонку ртути
в токе инертного газа (водород, аргон) в плавильных печах
с насадкой из графита или пластин с отверстиями. В этом
случае амальгама алюминия постепенно расплавляется,
ртуть отгоняется, а поток
инертного газа, который мо-
жет циркулировать в замкну-
том круге, подается снизу и
отводит пары ртути к конден-
сатору паров, охлаждаемому
водой. Насадка увеличивает
время пребывания амальгамы
алюминия в печи и приводит к
интенсивному воздействию
промывного газа на жидкий
алюминий. В печи устанавли-
вается определенный градиент
температур между верхней и
нижней частями, поэтому не
наблюдается испарения рту-
ти из амальгамы в виде взры-
ва, как в обычных плавильных печах при попадании амаль-
гамы в расплавленный алюминий, что приводит к возникно-
вению ударной волны и распылению амальгамы. Выходя-
щий из печи с насадкой жидкий алюминий имеет температу-
ру 700—705°С и содержит ртути меньше, чем 1-10”6 %.
В Германии также разработано устройство для осуществ-
ления непрерывного технологического процесса [334, 377].
Принципиальная схема устройства приведена на рисунке 92.
Мелкоизмельченный алюминиевый скрап поступает в рабочее
пространство 1 через двойную задвижку 2 и перемещается
при помощи шнека 3, который приводится в движение
редуктором 9. Ртуть циркулирует в противотоке при по-
мощи насоса 4 по напорным трубам 5 и 6. Давление в рабо-
чей камере постоянно (~20 атм). Оно создается высотой рту-
ти и алюминиевой амальгамы в трубах 5 и 6 высотой около
17 м. Температура в рабочей камере 500-—'600°С поддержи-
вается при помощи нагревателя 8. Вход в трубу 5, по кото-
рой поднимается горячая амальгама алюминия, имеет по-
ристую перегородку (фильтр) 7, которая задерживает не
растворившиеся в ртути остатки скрапа, так что только рас-
206
творенные металлы и алюминий могут подниматься вверх.
Верхняя часть трубы охлаждается до заданной температу-
ры (200—300°С). Алюминий выкристаллизовывается в виде
тонкодисперсных кристаллов; ртуть частично удаляется
центрифугированием. Остаток после центрифугирования обо-
гащается алюминием до 50%. Полное удаление ртути осу-
ществляют способами, которые применяются в методе
Шмидта.
Метод высокотемпературной амальгамной экстракции
алюминия непрерывно совершенствуется. В работе [376]
предложен высокопроизводительный, экономичный и безо-
Рис. 93. Принципиальная схема аппаратурного оформления процес-
са экстракции алюминия из сплавов с кремнием ртутью [376].
пасный процесс получения алюминия высокой чистоты
(рис. 93). В основе процесса также лежит экстракция алю-
миния ртутью из расплавленных сплавов, содержащих
— 60 % А1 и — 40 % Si и получаемых в результате восстанов-
ления глин термическим путем. Для экстракции жидкий
сплав алюминия при температуре 960--970оС с помощью ин-
жектора 5 вводится в смесительную камеру 4 со скоростью
— 5,8 кг!мин навстречу ртути, которая поступает из насо-
са 3 при давлении — 15 атм и температуре —300—360°С и
разбрызгивается в мелкие капли. Сплав алюминия и крем-
ния плавится и подается из нагреваемого тигля 2, который
вмонтирован в камеру 1 и находится под давлением аргона
— 14 атм. Скорость потока сплава контролируется устройст-
вом 6 с помощью датчика 7. Смесь жидкой ртути со спла-
вом алюминия подается при температуре — 530°С из смеси-
207
тельной камеры 4 в конвейер 10 и винтовым шнеком 11 — в
экстрактор 12. В конвейере и в термически изолированном
цилиндре основная часть алюминия под давлением ~ 12 атм
растворяется в жидкой ртути с образованием амальгамы.
В экстракторе 12 смесь разделяется, нерастворенный мате-
риал поднимается на поверхность фазы ртуть — алюминий
в устройстве 14 и с помощью шнека 15 подводится к подъем-
нику 18, в котором поддерживается определенное давление.
Всплывающий осадок в подъемнике 18 удаляется с поверх-
ности ртути, нагретой до высокой температуры в наклонном
цилиндре, с помощью оболочки 21 винтовым конвейером 20.
Испаряющаяся ртуть конденсируется в конденсаторе 24 и
возвращается к поверхности ртути в жидком состоянии.
Алюминиевая амальгама с тонко распределенным неот-
делившимся осадком из сепаратора 12 перетекает к соп-
лу 26 в камере 17. С помощью сопла 26 амальгама впрыски-
вается в камеру 17 с расширением до давления 6,5 атм,
которое поддерживается в сосуде путем охлаждения и кон-
денсации паров ртути в конденсаторе 25. После расширения
температура амальгамы, вводимой в камеру 17, падает при-
мерно до 495°С. Снижение температуры приводит к тому,
что алюминиевая амальгама становится пересыщенной и
алюминий выкристаллизовывается. Было установлено, что
падение давления на 1/2 атм и более обеспечивает падение
температуры на ~104-50°С. При проведении процесса спад
давления регулируют таким образом, чтобы температура
снижалась при этом на 20-г-50°С. В этих условиях не более
10% растворенного в ртути алюминия выкристаллизовывает-
ся и захватывает в осадок неотделенные тонковзвешенные
частицы. Твердая фаза осадка металлического алюминия
выше ртуть-алюминиевой фазы образует слой 27, который
выполняет роль фильтра для извлечения твердых частиц из
жидкой алюминиевой амальгамы. Из камеры 17 твердая
фаза с помощью винтового конвейера 29 подается к подъем-
нику 30, где она приводится в контакт с ртутью, которая на-
ходится в непрерывном встречном потоке, а очищенная и
профильтрованная через слой твердых частиц амальгама пу-
тем впрыскивания поступает через сопло 34 в камеру-кри-
сталлизатор 35. При этом давление снижается примерно с 6
до 0,32 атм и до ~300°С или меньше снижается темпера-
тура, при которой растворимость алюминия в ртути (см.
табл. 2) составляет лишь доли процента. Алюминий выкри*
сталлизовывается из амальгамы. Давление в камере-кри-
сталлизаторе 35 регулируется с помощью конденсатора па-
ров ртути 36. Из камеры-кристаллизатора 35 кристаллы
алюминия и жидкая ртуть винтовым конвейером 38 через
208
цилиндр 37 подаются в свободную от воздуха камеру-
бокс 39, не содержащую воздуха при нормальном давлении.
Кристаллы алюминия отделяют автоматически. Жидкая
ртуть поступает в трубопровод 8 «к центробежному насосу 3
для обратного цикла, а паста из алюминиевых кристаллов
и неотд влившейся жидкой ртути ( — 90% ртути и —10%
алюминия) перемещается между звеньями ленточного кон-
вейера 40, где ртуть отжимается и частично отделяется с по-
мощью роликов 41. Рыхлый продукт из пресса, содержащий
около 20% алюминия, поступает в роликовую мельницу 42,
где происходит дальнейшее отделение ртути и содержание
алюминия возрастает до —604-65%. Далее твердый мате-
риал поднимается с помощью ковшового транспортера 43 в
печь для плавки 44, где твердая амальгама алюминия на-
гревается до температуры 700—750°С. При этом ртуть уда-
ляется дистилляцией с потоком аргона при нормальном
давлении, пары ее конденсируются в конденсаторе 45, и жид-
кая ртуть возвращается в систему по трубопроводу 8. Жид-
кий алюминий, свободный от ртути, собирается на дне пе-
чи 44 и выгружается из нее через отверстие 46. Содержание
основного металла в алюминии составляет 99,994-99,999%.
Особенностью этого процесса является не встречное, а па-
раллельное движение потоков ртути и очищаемого продук-
та — алюминия, что дает значительную экономию оборудо-
вания, энергии и ртути. Использование меньшего количест-
ва ртути значительно облегчает конечное разделение раство-
римых и нерастворимых частиц. Кроме того, использование
жидкого сплава рафинируемого алюминия для смешения с
ртутью в виде брызг обоих компонентов позволяет прово-
дить процесс с высокой скоростью и регулировать темпера-
туру парофазного растворения теплом, аккумулированным
в жидком алюминиевом сплаве. Процесс полностью автома-
тизирован.
При разработке процесса рафинирования алюминия бы-
ло обнаружено [376], что алюминий может быть растворен
при значительно меньших температурах и более низком дав-
лении, если вместо чистой ртути использовать ее сплавы.
Следовательно, здесь проявляется взаимное влияние метал-
лов на растворимость в ртути (см. гл. I). Оказалось, что рас-
творимость алюминия возрастает в амальгамах, содержа-
щих несколько весовых процентов легко растворимых в рту-
ти металлов — калия, натрия, цинка, олова и др. Накопле-
ние этих металлов может привести к затруднениям при по-
лучении чистого алюминия.
Для рафинирования алюминия, содержащего металлы-
примеси, в работе [376] предложен оригинальный техноло-
14-122
209
гический процесс. Принципиальная схема аппаратурного
оформления приведена на рисунке 94. В этом случае также
сохранен принцип, использованный автором [61] для пере-
работки сплавов алюминия с кремнием. Ртуть при темпера-
туре ~290°С центробежным насосом 1 со скоростью
Рис. 94. Принципиальная схема процесса получения алюми-
ния высокой чистоты из сплавов алюминия, содержащего
металлические примеси (цинк, свинец, олово и др.) [376].
175 кг!мин подается к соплу 2 камеры 3, заполненной арго-
ном при нормальном давлении. Одновременно жидкий сплав
алюминия при ~700°С подается с помощью датчика 8 под
давлением столба жидкого металла 6, а из печи плавления 7
— к соплу 5 со скоростью 38 кг!мин. Жидкий алюминий
вводится так, что дисперсионный конус потока ртути пере-
секается дисперсионным конусом сплава алюминия, содер-
жащего около 95% алюминия и остальное — примеси меди,
железа, кремния, олова, цинка и других металлов. Колонна
6 имеет 8-метровую высоту и дно камеры 3 на 12 м выше ка-
меры растворения 14. в которую смесь сплава алюминия и
жидкой ртути подается через колонну 11. Камера для гомо-
генизации и «атомизации» сплава 3 связана с емкостью 18,
имеющей объем 5 .г и наполовину заполненной аргоном,
для поддержания постоянного атмосферного давления. Эта
система играет роль демпфера при любом сжатии и расшире-
нии газа в камере 3. Охлаждаемый водой конденсатор для
ртути 9 находится между камерой 3 и емкостью 18 и сводит
210
до минимума поступление горячих ртутных паров в эту
емкость.
Смесь затвердевших тонких частиц алюминиевого спла-
ва, смоченных ртутью, при ~ 360°С перемещается по колон-
не 11 в камеру для растворения 14 с одновременным подогре-
вом с помощью пропускания электрического тока между 10
и 12. Нагретая смесь перемещается через камеру 14 винто-
вым транспортером 13 и впрыскивается в камеру 20 через
сопло под давлением 6,5 атм. После расширения смесь
охлаждается до температуры ~ 495°С и около 10% алюми-
ния выкристаллизовывается, как и в первом случае (см.
стр. 208). Твердые частицы собираются на поверхности амаль-
гамы алюминия, винтовым конвейером 15 непрерывно пе-
ремещаются к подъемнику 16 и отделяются от ртути винто-
вым шнеком 17. Отфильтрованная через слой твердой фазы
алюминиевая амальгама поступает в центральную часть ка-
меры охлаждения 22, в удаленную от стенок массу более
холодной ртути при ~300°С. Температура 300°С в камере
охлаждения поддерживается непрерывным введением через
трубы 23 ртути с температурой 50°С и скоростью подачи
140 кг/мин. При этой температуре до 1% алюминия и менее
выкристаллизовывается из ртути и всплывает. Клапан в ка-
мере охлаждения 23 регулируют таким образом, чтобы уро-
вень амальгамы в конической части камеры 20 оставался
постоянным и был ниже входа в сепаратор 15. Кристаллы
алюминия удаляются с поверхности ртути в камере 22 вин-
товым конвейером 21. Далее переработка кристаллов алю-
миния не отличается от описанной выше. Основная часть рту-
ти после кристаллизации алюминия автоматически возвра-
щается в процесс из камеры 22 к центробежному насосу 1, а
количество, соответствующее 140 кг!мин ртути, поступает
через трубу 25 в теплообменник для охлаждения до 50°С и
возвращается в цикл через трубопровод 23. Во вторичной це-
пи 23 и 25 непрерывно отделяются примеси свинца, олова,
цинка и другие присутствующие в осадке металлы путем
кристаллизации при охлаждении отработанной ртути или
другими методами (например, анодным растворением амаль-
гамы или фазовым обменом с раствором соли ртути).
После плавки в печи алюминий содержит 99,99% основ-
ного вещества и может быть очищен до 99,999% содержа-
ния, если фазу ртуть — алюминий подвергнуть стадии пред-
кристаллизации, при которой удаляется растворенная медь.
Для получения алюминия высокой чистоты интересный
метод предложен в работе [330]. Используется электролиз
расплавленных солей с применением ртутного катода: 80%
А1С1з, 14% NaCl и 6% КС1. Электролиз проводят при темпе-
211
ратурах 120~-150°С с применением подвижного ртутного
катода. В процессе электролиза на катоде образуется высо-
кодисперсная амальгама, которая после удаления из элек-
тролизера подогревается до 450°С в автоклаве для растворе-
ния частичек алюминия в ртути. Затем температуру сни-
жают до 200°С и выдерживают амальгаму при этой
температуре в течение 20 мин. При этом выкристаллизовы-
ваются крупнозернистые частички алюминия, которые
фильтрованием отделяют от ртути, а полное удаление ртути
производят путем дистилляции.
Натрий. Металлический натрий и калий в промыш-
ленности получают преимущественно электролизом расплав-
ленных их хлоридов [378, 379]. Для получения натрия вы-
Рис. 95. Принципиальная технологическая схема
получения натрия экстрагированием из амальгамы
натрия жидким аммиаком.
сокой чистоты применяют электролиз расплавленного едко-
го натра [379]. В связи с применением металлического
натрия в качестве восстановителя галогенидов тугоплавких
электроотрицательных металлов с получением их высокой
степени чистоты требование к чистоте натрия резко возрос-
ло. Значительными потенциальными возможностями удов-
летворения растущего спроса на натрий высокой чистоты
обладает хлорная промышленность. При производстве хлора
и щелочей электролизом хлористого натрия с ртутным като-
дом содержание натрия в амальгаме составляет 0,4-г-
4-0,5 вес.%.
На рисунке 95 приведена принципиальная схема получе-
ния натрия экстрагированием из амальгамы жидким аммиа-
ком. Как видно, амальгама натрия после электролиза с
ртутным катодом 1 с 0,4% Na поступает на обогащение пу-
тем дистилляции ртути до 50%-ного содержания натрия.
Дистилляцию проводят в печи 2 при 55ОсС. Отогнанная
ртуть конденсируется и вновь направляется в электроли-
212
зер 1. После охлаждения обогащенной амальгамы в тепло-
обменнике 3 со свежей амальгамой до 70°С направляется в
экстракционную колонну 7, где проводят экстракцию аммиа-
ком под давлением 35 ат. Аммиачную фазу отделяют и вы-
паривают в испарителе 4 под давлением 62 ат и при темпе-
ратуре выше температуры плавления натрия. Свободный от
аммиака натрий выпускают со дна колонны. Обедненная
натрием амальгама направляется в лечь 2 для обогаще-
ния [6].
Известны также попытки выделить натрий путем дис-
тилляции ртути из амальгамы натрия, получаемой электро-
лизом водных растворов хлористого натрия. Однако вследст-
вие ряда недостатков и неудачного аппаратурного оформле-
ния металлический натрий, получаемый в одноступенчатой
или многоступенчатой колонне фракционирования, содер-
жит более 0,5% ртути ,5< Трудность получения натрия высо-
кой чистоты дистилляционным методом заключается в том,
что натрий с ртутью образует целый ряд весьма прочных
интерметаллических соединений: NaHg4, NaHg, Na3Hg и др.
[2]. Молекулы NaHg и Na3Hg были обнаружены в газовой
фазе [380, 381]. Поэтому освобождение натрия от последних
частей ртути в ректификационной колонне является процес-
сом, связанным с диссоциацией интерметаллических соеди-
нений натрия с ртутью по уравнению
NaxHg{/=Nax-aHgy-t»+a Na 4-5Hg. (IV—3)
На последней ступени ректификационной колонны долж-
на осуществляться реакция
NaxHgy = х Na + у Hg. (IV—4)
Установлено, что лишь при температуре выше 620°С ин-
терметаллические соединения натрия с ртутью диссоци-
ируют полностью [382]. Однако для осуществления процесса
ректификации амальгамы натрия в промышленных усло-
виях с получением натрия высокой чистоты недостаточно
знания физико-химических свойств интерметаллических
соединений натрия с ртутью. В этом случае решающим ока-
залось правильное аппаратурное оформление и учет техно-
логических особенностей процесса. На рисунке 96 приведена
несколько дополненная нами принципиальная технологиче-
ская схема получения натрия высокой чистоты из амальга-
15 При дальнейшей очистке натрия путем перемешивания его с ме-
таллическим кальцием при высокой температуре значительно возрас-
тают издержки производства металлического натрия и процесс становит-
ся нерентабельным.
213
мы натрия. Как видно, амальгаму натрия после электролиза
хлорида натрия с ртутным катодом 1 направляют в испа-
ритель 2 на обогащение натрием с 0,4—0,5% до 5—10 вес.%
натрия. Отгонку ртути при обогащении амальгамы натрия
производят при атмосферном давлении, поскольку пониже-
ние температуры кипения ртути в вакууме может привести
к кристаллизации интерметаллических соединений натрия
с ртутью в испарителе (например, NaHg2 при 353°С) и нару-
Рис. 96. Принципиальная технологическая схема получения
натрия высокой чистоты из разбавленной амальгамы натрия,
шению технологического процесса. Далее обогащенная
амальгама натрия поступает в ректификационную колон-
ну 3, работающую при избыточном давлении более 700 мм
рт. ст. Загрузку обогащенной амальгамы производят не в го-
лове ректификационной колонны, а на одну треть ниже ее
высоты. В этом случае наблюдается тщательное разделение
амальгамы натрия на ее компоненты. При этом на послед-
ней ступени колонны получают металлический натрий с ме-
нее чем 0,01% ртути, который поступает в охладительное
устройство 4, а в голове колонны пары ртути, свободные от
металлического натрия, сжижаются в конденсатор 5. Дис-
стилляцию амальгамы натрия проводят под давлением за-
щитного газа, превышающим упругость пара ртути; на-
пример, при применении азота избыточное давление состав-
ляет 700—800 мм рт. ст. Подвод инертного газа осу-
ществляется через патрубок 6 в сборник ртути 7. Давление
поддерживается постоянным с помощью специального газо-
метра 8. Ртуть из сборника 7 поступает в голову про-
214
цесса для получения амальгамы. Во всей системе с по-
мощью подвода 9 поддерживается одинаковое давление.
Особое внимание в работе [382] уделяется отбору металличе-
ского натрия из ректификационной колонны 3. Натрий из
колонны 3 извлекается при температуре кипения с помощью
сифонного устройства 10, расположенного ниже зеркала
жидкого натрия. Установлено [382], что даже кратковре-
менное падение температуры в трубе ниже температуры ки-
пения приводит к значительному повышению количества
ртути в металлическом натрии, что объясняется сдвигом
равновесия реакции (IV—4) влево. Содержание ртути в ме-
таллическом натрии также повышается, если при извлече-
нии натрия уровень жидкости снижается так, что газообраз-
ная фаза попадает в отводной сифон 10. Отбор металличе-
ского натрия осуществляется через патрубок 11.
Приведенный технологический процесс является высоко-
рентабельным. Тепло, выделяющееся при конденсации па-
ров ртути, может быть использовано не только для подогре-
ва поступающей амальгамы натрия, но и для получения во-
дяного пара и выработки электроэнергии в ртутно-водяных
энергетических установках по известным методам [10, 12].
Значительный интерес представляют работы [6, 383—385],
показывающие принципиальную возможность получения
металлических натрия и калия электролизом с ртутным ка-
тодом. На основе принципов амальгамной металлургии мо-
гут быть развиты простые и экономически эффективные про-
цессы получения чистейших щелочных металлов — натрия,
калия, лития, рубидия и цезия. Методы получения металли-
ческого натрия из амальгамы хлорного производства рас-
смотрены рядом авторов [6, 383—385]. Известен метод по-
лучения натрия из амальгам электролизом при 230°С в элек-
тролите из расплавленной гидроокиси натрия (53%), бро-
мистого натрия (28%) и йодистого натрия (19%) [383].
Металлический натрий из амальгамы получали в электро-
лизере с нагрузкой 1000а. Запроектирована более крупная
установка электролиза с нагрузкой 16 000а. Принципиаль-
ная возможность получения металлических натрия и калия
растворением их амальгам, полученных электролизом вод-
ных растворов хлоридов, в электролитах из расплавленных
гидроокисей щелочных металлов с добавками бромидов и
йодидов показана в работе [385].
Галлий высокой чистоты находит широкое применение
в полупроводниковой технике, энергетике, приборостроении
и других областях новой техники и промышленности [386,
387]. Для очистки галлия от следов примесей используется
амальгамный метод экстракции металлов-примесей [388,
215
389], основанный на том, что многие металлы-примеси, со-
путствующие галлию, проявляют к нему меньшее сродство,
чем к ртути.
Поэтому при смешении расплавленного чернового гал-
лия (т. пл. 29,7°С) с ртутью высокой чистоты примеси из гал-
лия переходят в ртутную фазу. После отделения галлия от
ртути и удаления следов ртути в вакууме получают галлий
высокой чистоты [386, 388—390]. Степень очистки галлия
от примесей зависит от коэффициента распределения их в
системе галлий — ртуть.
Авторами [84, 85] были определены константы распре-
деления (K3=Ng^/N^9 где Ng^ и Nng — атомные доли со-
ответствующего металла в таллиевой и ртутной фазах) цин-
ка и индия в тройной системе галлий — цинк (индий) —
ртуть. Оказалось, что в системе галий — цинк — ртуть
эффективная константа распределения цинка зависит лишь
от температуры и для двухфазной системы при 35, 60 и 90°С
равна соответственно 0,43, 0,51 и 0,53 [85]. С повышением
температуры возрастает.
Эффективная константа распределения в системе гал-
лий — индий — ртуть зависит от концентрации индия в ртут-
ной фазе и изменяется с 0,010 при 1,7 ат. % индия до 0,130
при 84,0 ат. % индия в ртутной фазе [84]. На основании ана-
лиза констант распределения цинка и индия в таллиевой и
ртутной фазах [84, 85] было показано, что галлий от этих
металлов может эффективно рафинироваться экстракцией
ртутью.
Золото. Применение ртути как вспомогательного мате-
риала в методах амальгамации известно со средних веков и
получило широкое развитие в Центральной Америке [4, 6].
Методы основаны на том, что содержащиеся в рудах само-
родные металлы — золото, серебро, платина — легко смачи-
ваются ртутью и образуют амальгамы. Амальгамация золо-
та является наиболее простым и дешевым металлургиче-
ским процессм [391, 392]. В настоящее время его применяют
для извлечения золота из концентратов, получаемых в ре-
зультате гравитационного обогащения, что упрощает и
удешевляет извлечение золота амальгамацией и резко сни-
жает расход ртути. Широко используется процесс амальга-
мации и при извлечении золота из шлихов, продуктов пер-
вичного обогащения песков россыпи, представляющих собой
смесь полезного ископаемого (золота, платины) и минералов
с плотностью свыше 4,2 г!см\ Процесс амальгамации осу-
ществляют двумя способами: а) внутренней амальгамацией,
которую проводят одновременно с измельчением руды в тол-
216
чеях, бегунных чашах, а концентратов — в специальных
аппаратах-амальгаматорах, и б) внешней амальгамацией,
которую проводят на амальгамационных шлюзах или в спе-
циальных амальгаматорах. Амальгамационные шлюзы пред-
ставляют собой деревянные наклонные столы, покрытые
медными амальгамированными листами. При протекании
тонковзмученной пульпы вдоль слегка наклонных сто-
лов с амальгамированными листами частицы золота прили-
пают к ртути, в то время как порода ртутью не смачивается
и беспрепятственно уносится дальше водой. Один раз или
при богатых рудах несколько раз в день слой амальгамы,
содержащий благородные металлы, соскабливают и наносят
свежую ртуть. После отжимки через замшу или плотное сук-
но полученной амальгамы (от 5 до 33% золота) образуется
пластичная амальгама, содержащая от 20 до 50% золота.
Окончательно золото отделяют от ртути путем ее отгонки в
специальных печах при 800-т-850°С. Содержание ртути в
получаемом таким путем черновом золоте составляет не бо-
лее 0,1%. При плавке золота в вакууме содержание ртути
уменьшается до 10”34-10“4%.
Извлечение золота амальгамацией зависит от ряда фак-
торов и составляет для хорошо амальгамирующихся руд
80—85% [391]. По данным [6], при производительности в
3—10 т пропускаемой руды требуется 1 м2 поверхности сто-
ла. Расход ртути достигает 30—50 г на каждую тонну руды
и зависит от содержания золота, величины частиц и часто-
ты соскабливания [4, 6]. Расход ртути при амальгамации
кварцевых золотых руд составляет 3—8 г/г руды [391], а
при обработке богатых сульфидами руд, содержащих медь,
свинец, сурьму и другие примеси, расход ртути достигает
20 г/г и выше.
Таким образом, в процессе амальгамации ртуть является
коллектором, собирающим мельчайшие частицы золота в
амальгаму, или проявляет свойства селективного клеющего
средства — металлического клея, способного приклеивать
металлическую пыль благородных металлов к поверхности
амальгамационных столов, с которых она периодически сни-
мается. Следовательно, амальгамация — быстрый и эффек-
тивный процесс концентрирования золота в небольшом
объеме.
Теоретические основы извлечения благородных металлов
путем амальгамации разработаны И. Н. Плаксиным [392].
Процесс смачивания золота ртутью зависит от многих физи-
ческих и физико-химических факторов: состояния поверхно-
сти золота и ртути, состава золота, ртутной и водной фаз
и др. Выявление закономерностей процесса смачивания
217
сплавов и самородных металлов создало научную основу для
дальнейшего развития технологии амальгамационного про-
цесса.
Авторами [393] разработан амальгамный метод перера-
ботки серебристого свинца (77—84% РЬ, 12,5—20% Ag,
0,02—0,07% Au, 1,6—2,0% Cu, 1,1—2,0% Zn и др.) с полу-
чением золото-серебряного сплава — металла Доре. Метод
основан на растворении серебристого свинца в ртути (74-
4-11% от веса ртути), выделении электроотрицательных по
| AjAu ’СллаВ
Рис. 97. Схема способа переработки серебристого свинца с по-
лучением металла Доре.
отношению к серебру металлов-примесей анодным растворе-
нием в хл ори дно- или азотно-уксуснокислом электролите [1]
и отделении ртути из золото-серебряной амальгамы в дис-
тилляционном аппарате с получением золото-серебряного
сплава. Схема процесса приведена на рисунке 97. Серебрис-
тый свинец 3 загружают в электролизер 1 с амальгамным
анодом 2 и проводят электролиз при плотности тока 400 —
350 а/м2 и температуре 30—40°С. При анодном растворении
свинцово-серебряной амальгамы в хлоридно-уксуснокислом
(РЬ(СНзСОО)г • ЗН2О — 150, CH3COONa • ЗН2О — 272, NaCl —
117, СНзСООН— 40 г/л) или азотно-уксуснокислом электро-
лите (Pb(NO3)2 — 200 г/л, СНзСООН —100, HNO3 — 5,0 г/л)
свинец, медь, цинк, мышьяк, сурьма и другие металлы-при-
меси переходят из амальгамы в электролит. На катоде 4
электролизера в процессе электролиза выделяется свинец с
катодным выходом по току 98,54-99%. Совместно со свин-
цом соосаждается медь; мышьяк и сурьма накапливаются
в электролите. Контроль за концентрацией свинца в амаль-
218
гаме осуществляют потенциометрически [2]. По мере обед-
нения свинцово-серебряной амальгамы свинцом потенциал
амальгамы сдвигается в положительную сторону. При дости-
жении потенциала 4-0,054-0,07 в отн. н. в. э. снова произво-
дят загрузку серебристого свинца. При многократной загруз-
ке свинца и снятии катодного свинца с катодов 4 происходит
накопление серебра и золота в амальгамном аноде до 124-
4-15 % по отношению к весу ртути. Следы свинца, меди, цинка
и других металлов-примесей удаляют следующим образом.
При электролизе обедненной серебряно-золотой амальгамы в
электролит наряду с примесями переходят ионы серебра и
ртути. Электролиз прекращают, и при циркуляции амаль-
гамного анода перешедшие в электролит ионы серебра и рту-
ти цементируются металлами-примесями (медью, цинком,
свинцом и др.) серебряно-золотой амальгамы, которые уда-
ляются до следов. Выделение серебра и золота из богатой
серебряной амальгамы осуществляют путем дистилляции
ртути в аппарате 5, который имеет две зоны нагрева: 400
и 980—1000°С. При 400сС из поступающей в аппарат 12—
15 %-ной серебряной амальгамы удаляется основное коли-
чество ртути, а при 980—1000°С ртуть удаляется из серебря-
но-золотого сплава до содержания 1-10~4%. Ртуть из кон-
денсатора 7 через ртутный затвор 6 возвращается в элект-
ролизер 1.
Содержание других металлов-примесей в серебряно-золо-
том сплаве, получаемом амальгамным методом, следую-
щее, % ’ меди — 0,05, цинка <0,02, свинца — 0,05; мышьяк,
сурьма, кадмий и таллий не обнаружены. Содержание в зо-
лото-серебряном сплаве основных металлов составляло: се-
ребра — 99,6—99,4, золота 0,34-0,5%. Выход золота и сереб-
ра в золото-серебряный сплав — 99,24-99,6%.
Эти данные показывают высокую эффективность амаль-
гамного процесса переработки серебристого свинца. При пе-
реработке серебристого свинца методом купеляции наблю-
даются потери 15—20% серебра и золота и конечный про-
дукт — золото-серебряный сплав имеет высокое содержание
меди, свинца и других примесей. Кроме того, метод купеля-
ции дорогой и весьма трудоемкий [394].
ПРОЦЕССЫ ПОРОШКОВОЙ
АМАЛЬГАМНОЙ ПИРОМЕТАЛЛУРГИИ
АМАЛЬГАМНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ
ТОНКОДИСПЕРСНЫХ ПОРОШКОВ МЕТАЛЛОВ
Тонкодисперсные порошки металлов находят широкое
применение в различных областях новой техники, науки и
промышленности [2, 334, 395—398]. Свойства изделий из
тонкодисперсных порошков зависят от их структуры, фазо-
вого состава, наличия примесей и др. Для получения порош-
ков металлов применяют различные методы порошковой ме-
таллургии [2, 334, 396—398]. Однако амальгамный метод
имеет целый ряд преимуществ перед другими. Основными из
них являются: возможность приготовления порошков с за-
ранее заданными свойствами; получение тонкодисперсных
порошков строго гранулометрического состава; высокая
реакционная способность порошков; приготовление порош-
ков металлов высокой чистоты, не содержащих металлои-
дов; возможность модифицирования порошков путем введе-
ния других металлов, придающих им необходимые свойства;
легкая способность к сплавообразованию при низких темпе-
ратурах.
В зависимости от величины растворимости металла в
ртути и природы взаимодействия его с ртутью, а также ха-
рактера состояния металла в ртутной фазе технологические
процессы получения порошков металлов различаются меж-
220
ду собой. Янг предложил с целью классификации амальгам
по структуре и свойствам разделить металлы по отношению
к ртути на две группы ( 395]. К первой группе относятся ме-
таллы, легко растворимые в ртути при 20°С, — Ag, Au, Cd,
Zn, Sn, Pb, Mg, Ca, Ba, Li, Na, К, а также, очевидно, Bi, Sr,
Tl, In, Ga и др. Амальгамы этих металлов жидкие при ком-
натной температуре. Ко второй группе относятся металлы,
умеренно растворимые в ртути. Металлы второй группы под-
разделяются на подгруппы а), Ь) и с). К подгруппе а) отно-
сятся металлы, которые не образуют интерметаллических
соединений с ртутью, — Al, Со, Cr, Fe, Ge, Sb, Si, As, W
и Mo. К подгруппе b) относятся металлы, образующие соеди-
нения между металлом сплава и ртутью, — Се, Cu, Мп, Ni,
Pt, Th, Ti, U, Zr. К подгруппе с) относятся металлы, сведе-
ния о структуре и свойствах которых неизвестны, — Be, Nb,
Та, V [395]. Амальгамы металлов, легко растворимых в рту-
ти, не имеют практического значения для порошковой метал-
лургии, так как охватывают сплавы ртути с металлами с
низкой температурой плавления. Порошки металлов этой
группы могут быть получены при удалении ртути в глубоком
вакууме при Т<ТПЛ .
Практический интерес для амальгамной пирометаллур-
гии представляют металлы второй группы. Они состоят из
суспензий частиц элементарных металлов или частиц соеди-
нений металл — ртуть в ртути, насыщенной металлом. Гра-
нулометрический состав частиц зависит от условий и време-
ни приготовления амальгам; в процессе стояния частицы в
амальгаме укрупняются и образуют конгломераты.
Наиболее распространенный способ получения амальгам
металлов второй группы — это электролиз растворов их со-
лей с ртутным катодом и восстановлением водных растворов
солей амальгамами щелочных металлов. При этом образуют-
ся тонкодисперсные частицы, которые в начальный период
достигают несколько ангстремов в диаметре и укрупняют-
ся— «растут» при относительно низких температурах [399,
340]. По данным [399], при электроосаждении железа, ни-
келя, кобальта, марганца, меди и других металлов на ртут-
ном катоде получают суспендированные частицы с размера-
ми 2—5 р. Размеры частиц не остаются постоянными и
укрупняются при стоянии даже при комнатной температуре.
Повышение температуры, как отмечалось выше, значительно
ускоряет процесс образования кристаллов в ртутной фазе.
Причем температура влияет лишь на скорость процесса и
очень мало — на размеры частиц. Так, при температуре до
350°С частицы железа с начальными размерами частиц
2—5 ц укрупняются до 20—25 ц. По данным [395, 396, 400],
221
тепловая обработка при температуре ~350°С приводит к
спеканию металлов амальгам. Вследствие низкой температу-
ры кипения ртути тепловую обработку амальгам проводят
под давлением. Даже при кратковременном воздействии вы-
сокой температуры образуются крупные частицы, легко под-
дающиеся обработке, но являющиеся рентгеноаморфными.
Термическая обработка амальгам приводит к снижению
вязкости амальгам и улучшению условий отделения метал-
лов от ртути фильтрованием, центрифугированием и др.
Обычно свежеприготовленная амальгама железа при содер-
жании железа выше 0,5 % является вязкой, при 1,5% амаль-
гама теряет текучесть, при 3% железа она приобретает мас-
лообразную консистенцию и при содержании железа выше
8% — твердая, рассыпчатая, но еще сохраняет пластичность
[400]. После термической обработки амальгамы того же со-
става текучи. Способность амальгам к «разжижению» при
термической обработке используется для концентрирования
амальгам путем фильтрования [401]. Было показано, что
при нагревании амальгамы, содержащей 0,3% железа в те-
чение 5 мин при 550°С под давлением и фильтрации после
охлаждения, осадок содержит 32% железа. При нагревании
в течение 5 мин при 550°С 4 %-ной амальгамы никеля после
охлаждения и фильтрования получают пастообразный оса-
док, содержащий 31% никеля. При обработке 4 %-ной амаль-
гамы никеля в течение часа при 440°С получают осадок с
20% никеля. Подобным же образом могут быть обогащены
и амальгамы других металлов (меди, кобальта, хрома и т. п.).
Путем термической обработки при более высоких темпера-
турах (600°С) достигается обогащение металла в остатке пос-
ле фильтрования до 50% [401].
Нами было показано [1, 2], что способность металлов к
смачиванию ртутью обусловлена межатомным взаимо-
действием в ртутной фазе между атомами растворяемого
элемента и атомами ртути. Для осуществления процесса
амальгамирования необходимо наличие свободных электро-
нов, что имеет место в кристаллах металлов с металлическим
типом связи, которую еще называют ненасыщенной. В кри-
сталлах элементов с ковалентным типом связи (селен, теллур,
бор, мышьяк, германий и др.) связь насыщена и свобод-
ные электроны отсутствуют; такие элементы не амальгами-
руются и не растворимы в ртути. Поэтому если покрыть по-
верхность амальгамированных частиц, находящихся в ртути
или в пастообразной амальгаме, окисной пленкой, то такие
частицы потеряют способность к смачиванию ртутью и вы-
деляются из объема амальгамы на ее поверхности. Именно
окислением поверхности суспендированных в ртути час-
222
тиц железа, никеля, марганца и особенно хрома обусловлено
разложение этих амальгам с выделением серого порошка на
поверхности ртути. В случае амальгам хрома этот процесс
протекал с высокой скоростью, а в случае амальгам железа,
никеля, марганца, меди и др. — в течение длительного вре-
мени. В работе [401] предложен метод ускорения окисли-
тельного разложения амальгам путем введения в состав
амальгамы металла, обладающего высоким сродством к кис-
лороду, например алюминия. Установлено, что количество
добавки электроотрицательного металла мало и для алюми-
ния составляет 10"4-Ь10"2 вес.%, а для марганца—10’3<-
-т-10-1 вес.%. Авторами [401] показано, что при введении
добавки алюминия в 2,5%-ную амальгаму железа и при
10-минутной термической обработке при 550°С в остатке
после фильтрования содержится 85% железа. Оказалось,
что электроотрицательный металл при длительном контакте
с обогащенным металлом из-за взаимодействия с ним, по
данным [401], или, вероятнее, окисления следами кислоро-
да, теряет способность переносить кислород к поверхности
частиц трудно растворимого в ртути металла. Так, после 2-
и 4-часовой термической обработки амальгамы железа при
550°С с добавкой небольшого количества алюминия обога-
щение железа в остатке после фильтрования составляло со-
ответственно лишь 60 и 40%. После 5-часовой обработки
амальгамы обогащение остатка составило лишь 32 вес.%
железа без разложения амальгамы железа на порошок желе-
за и ртуть, не содержащую железа. Поэтому для более
эффективного обогащения амальгам алюминий растворяет-
ся в ртути при высокой температуре (500°С) и амальгама
алюминия смешивается с амальгамой обогащаемого метал-
ла после ее термической обработки под давлением.
Автором [402] также было исследовано влияние неболь-
ших присадок Al, Cd, Mg, Ni, Ag и Sn на рост частиц при
старении амальгам. Однодоменные частицы с лучшими
свойствами были получены при присадке олова. Принцип
окисления поверхности суспендированных в ртути частиц
использован Брейландом с corp, при разработке технологии
получения очень тонкодисперсных порошков железа, нике-
ля и кобальта электролизом с ртутным катодом [403]. В этом
случае для предотвращения укрупнения суспендированных
в ртути частиц металлов их подвергали поверхностному окис-
лению, которое приводило к потере способности частиц к
амальгамируемости (смачиваемости) ртутью и всплыванию
их на поверхность ртути. Благодаря этому приему не нужно
было применять отгонку ртути, которая приводит к укрупне-
нию частиц и делает невозможным получение очень мелких
223
порошков. При получении амальгамы железа его концентра-
ция в амальгаме повышается до 6%, а в результате выдавли-
вания ртути — до 12%. Железо в таком полуфабрикате реа-
гировало с кислородом воздуха и выделялось в виде черных
частиц, не смачиваемых ртутью. Отделение частиц железа
от ртути проводили после перемешивания амальгамы в ша-
ровой мельнице в среде метилового спирта. Полученный
порошок восстанавливали водородом при температуре 350-?-
4-400°С, при этом выделяли остатки ртути и получали очень
тонкодисперсный непирофорный порошок. Исследования с
помощью электронного микроскопа показали, что величина
первичных частиц составляла около 0,05 ц. Наряду с пер-
вичными частицами было установлено также определенное
количество агломератов (вторичных частиц).
Тонкодисперсный порошок никеля высокой частоты по-
лучают также путем ртутного электролиза сульфата и дру-
гих солей никеля [398]. Эта технология требует строгого
поддержания pH раствора и других параметров электролиза.
Она позволяет получить сферические частицы порошка.
Установлено, что плотность тока должна составлять
6500 а!м2 при напряжении 5 в. Ртуть из амальгамы удаляет-
ся путем нагревания в вакуумной печи. Величина частиц
порошка составляла 0,2—1,5 ц. Тонкодисперсные частицы
никеля (1ц) были получены и в работе [397] при электро-
лизе сульфатных растворов никеля с ртутным катодом при
плотности тока 0,1 А/см2.
Калач [334] путем специального подбора параметров
амальгамного электролиза и применяя отгонку ртути в ва-
кууме, получал очень мелкие шаровидные частицы железа.
При отгонке ртути в вакууме при температуре 400°С по исте-
чении 0,5—2 ч были получены порошки железа и никеля с
величиной частиц 1 ц и содержанием металлических при-
месей менее 0,05%. В работе [334] были разработаны также
условия получения высокой чистоты порошков кобальта,
хрома, марганца и безуглех[одистого порошка ферромарган-
ца. Расход электроэнергии на выделение 1 кг порошка со-
ставлял 4,5-?-10 квт-ч. Наиболее тонкодисперсным оказался
порошок марганца. После отгонки ртути был получен рых-
лый, неспеченный порошок с зернами округлой формы,
средняя величина которых была равна примерно 0,6 ц. Ки-
нетические закономерности образования сферических час-
тиц железа и кобальта установлены Ф. Е. Люборским [339,
340, 404, 405]. Измеряя коэрцитивную силу, Ф. Е. Лю-
борский [339] изучал скорость роста кристаллитов в тонко-
дисперсных порошках железа, осажденного из растворов
хлоридов на ртутных катодах. Он показал, что, согласно про-
224
стой диффузионной модели, при предположении наличия
постоянного пересыщения сферические частицы должны рас-
ти по закону г2 =Лз2/)г, где аз — коэффициент роста (функ-
ция концентрации); D — коэффициент диффузии железа в
ртути; г — радиус частиц; т — время (или т ~ г2). Если
учесть зависимость растворимости от размера частиц, то
диффузионное уравнение дает максимальную зависимость
роста сферических частиц в виде соотношения г3. В дейст-
вительности при изучении роста частиц железа от 20 до
о
5000 А в диаметре было обнаружено, что логарифм скорости
роста прямо пропорционален радиусу частиц
r = 0,225 1g т—1430/7—3,56,
где Т — температура.
Этот рост отвечает соотношению т^г4,4 , которое пока-
зывает, что зависимость т—г не согласуется ни с одним при-
ближением, т. е. наблюдается значительно более медленный
рост сферических частиц. Такое замедление роста частиц
обусловлено [339] многими факторами, которые не входят
в уравнение диффузии, — броуновским движением, распре-
делением частиц в ртути, размерами частиц и изменением
межфазной энергии с размером частиц.
При изучении кинетики роста частиц кобальта от 150 до
о
600 А в диаметре был обнаружен еще более медленный рост
частиц [340].
В последние годы проводятся интенсивные исследова-
ния закономерностей роста частиц в ртутной фазе с целью
разработки научно обоснованной технологии получения тон-
кодисперсных порошков для изготовления магнитов, раз лич-
ного рода датчиков и материалов с заранее заданными
свойствами. Значительные успехи достигнуты Ф. Е. Любор-
ским [405, 406]. Если с помощью описанных выше классиче-
ских методов электролиза с ртутным катодом получали по-
рошки металлов более или менее одних размеров и одинако*
вой формы, то метод, разработанный Люборским, позволяет
получать волокна железа в виде дендритов, так называемые
частички ESD (Elongated Singl — Domain Particles) — одно-
доменные, удлиненные частицы с одной областью.
Ф. Е. Люборским разработана технология получения
оптимальной, с точки зрения магнитных свойств, структуры
волокон с диаметром, равным размерам магнитной области
железа, т. е. около 0,015 ц. Метод получения порошка же-
леза заключается в следующем: суспензия частиц железа
осаждается электролитическим способом на ртутном катоде
в насыщенном растворе сульфата железа. Полученная сус-
пензия дендритообразных частиц при температуре до 230сС
15—122
225
подвергается термической обработке, цель которой состоит в
изменении частиц дендритов железа в палочкообразные, бо-
лее всего приближающиеся к теоретической модели частицы
ESD (рис. 98). Затем в амальгаму вводят растворимые в рту-
ти металлы, которые противодействуют агломерации частиц
Рис. 98. Влияние термиче-
ской обработки амальгамы
на форму однодоменных
железных частиц |334].
1 — свежеосажденная ча-
стица ; 2, 3. 4, 5 — измене-
ние формы частиц при
термической обработке со-
ответственно 130, 170, 200
и 250°С.
железа и способствуют дальнейше-
му улучшению магнитных свойств
суспензии. Последним этапом в ла-
бораторном процессе является од-
новременная концентрация и ори-
ентирование суспензии в магнит-
ном поле с напряжением более
50 а/м (рис. 99), при этом получают
механически компактные формы
магнитно-твердого материала. В
промышленном процессе ртуть уда-
ляется полностью путем дистилля-
ции и после соответствующей
очистки возвращается в процесс, а
спеченная масса, полученная после дистилляции, измель-
чается на порошок, отдельные зерна которого содержат мил-
лионы расположенных в порядке частиц с одной областью
в немагнитном основании
(чаще всего — свинце). Ме-
таллическую основу можно
также заменить стеклом,
пластмассой и т. п. Этот по-
рошок прессуется в магнит-
ном поле на готовые формы.
В Польской Народной
Республике проводилась
разработка технологии про-
изводства магнитов ESD
[407, 408]. Были выявлены
факторы, мешающие про-
цессу роста дендритов на
первом этапе технологии.
Известно, что фактором,
мешающим процессу кри-
сталлизации, является на-
личие примесей. Ф. Е. Лю-
борский [404] и Райт [402]
обратили внимание на аку-
стические и механические
колебания, однако примене-
Рис. 99. Технологическая схема по-
лучения однодоменных магнитов
[334]. 1 — электроосаждение на
ртутном катоде частиц Fe(FeCo);
2 — термическая обработка дендри-
тов Fe(FeCo) в суспензии в ртути;
3 — введение диспергирующей ос-
новы ; 4 — концентрирование и
упорядочение в магнитном поле;
5 — вакуумная дистилляция ртути;
6 — измельчение спеченной массы;
7 — окончательное прессование в
магнитном поле.
226
ние сырья с высокой чистотой [408] и полное исключение
механических и акустических колебаний [402] не позволи-
ли получить значительно лучшие результаты. М. Вальтен-
бергер-Ражниевской [334] было показано, что на качество
порошков металлов влияет характер тока, подаваемого к
электролизеру.
Для сравнения проводили эксперименты с применением
трех источников тока: выпрямителя, генератора постоянно-
го тока и аккумулятора. Полученные результаты дали воз-
можность предположить, что периодические изменения
напряжения тока, имеющие место в пульсирующем токе, мо-
гут значительно влиять на структуру катодного осадка. Ис-
следования проводили на установке, позволяющей регули-
ровать интенсивность пульсации. Было установлено, что
пульсация тока питания вызывает понижение коэрцитивной
Рис. 100. Влияние термической
обработки на коэрцитивную силу
дисперсий однодоменных частиц
железа в ртути [334]. 1 — дан-
ные Лиля и Земш; 2—время
обработки —10 мин, 3— 15 мин,
по М. Вальтенберг-Разиевской.
силы полученной суспензии. Это влияние сохраняется, хотя
в менее четко выраженной степени, и после термической об-
работки. При применении стабильного тока получаются вы-
сококоэрцитивные суспензии железа и ртути, сохраняющие-
ся в процессе тепловой обработки аналогично тому, как это
было описано Ф. Е. Люборским (рис. 100).
Точно так же проявляется действие олова как дисперги-
рующей добавки в увеличении коэрцитивной силы (рис. 101).
Исследования с электронномикроскопическим изучением
выделенных частиц из амальгамы с помощью поверхностно-
го окисления показали, что они являются однодоменными
(частички с одной областью) со значительной степенью удли-
нения. Наряду с отдельными частицами были обнаружены
скопления однодоменных частиц в агломераты.
Получение амальгамы с большой коэрцитивной силой
было освоено в полупромышленном масштабе. Электролизер
с ртутным катодом был изготовлен из оргстекла. Катодом
служил слой ртути. Под поверхностью слоя ртути был рас-
положен змеевик с протекающей водой с точно задаваемой
227
температурой, одновременно служивший токоподводом к
ртутному катоду. Анод представлял собой горизонтальную
плиту из железа или сплава Fe—Со. Расстояние между элек-
тродами регулировалось с помощью винта. Все устройство
было установлено на стальной плите, амортизированной тен-
нисными мячиками.
Рис. 101. Влияние термической
обработки на коэрцитивную си-
лу дисперсий однодоменных час-
тиц железа в ртути для образцов
диспергированных оловом [334].
1 — комнатная температура;
2 — 40°С; 3 —60°С; 4 —100°С;
5 — данные после термической
обработки в течение 15 мин и
диспергировании оловом.
Авторами [409] была разработана оригинальная кон-
струкция устройства для одновременного ориентирования
частиц порошка в магнитном поле и прессования из него
магнитов. Устройство представляет собой вид матрицы из
немагнитного материала. Корпус выполнен из аустенитной
стали, а штампы —• из бериллиевой бронзы. Только вклады-
ши, вводящие магнитный поток в углубление пресса, были
изготовлены из магнитно-мягкого материала так, что после
установления смонтированного устройства вместе с полюс-
ной системой на столе гидравлического пресса засыпанный
в прессующее устройство порошок находился в пределах
действия магнитного поля. Нижний штамп был перфориро-
ван, что давало возможность вводить порошок в форме сус-
пензии и выводить жидкость наружу через штамп. Давление
на пробы осуществлялось через дистанционные элементы.
Технология получения тонкодисперсного порошка силь-
но реакционноспособного электроотрицательного металла —
марганца разработана Р. И. Агладзе и М. Г. Бацикадзе
[359]. Амальгаму марганца получали из раствора сульфата
марганца состава: 70—80 г/л MnSO4, 140—150 г)л
(NH^SCli; pH 54-5,5. Анодом служил свинец, который по-
мещали в керамическую диафрагму, а катодом — ртуть. Вы-
ход по току равнялся 100%. В процессе электролиза получа-
ли 0,5%-ную амальгаму марганца. В процессе обогащения
амальгамы на фильтр-прессе специальной конструкции по-
лучали твердую амальгаму с содержанием марганца 9,5%.
При отгонке ртути в атмосфере водорода или в вакууме при
228
350—450°С получали пирофорный порошок марганца. Для
предохранения от возгорания порошок марганца после
охлаждения обрабатывали в вакууме бензолом, ацетоном или
спиртом, после чего он терял пирофорные свойства и не
горел на воздухе. Рентгеноструктурный анализ показал, что
порошок представляет собой а-марганец.
В работе [359] нагреванием амальгамы марганца в ат-
мосфере азота до 6004-800°С получали азотированный мар-
ганец в виде тонкодисперсного порошка. Предложен высо-
копроизводительный процесс получения тонкодисперсных
порошков и коллоидных металлов [410]. Тонкодисперсные
порошки меди, серебра, золота, кобальта, молибдена, хрома,
ванадия, тантала, ниобия, циркония, гафния и других труд-
но растворимых в ртути металлов получают в оригинальном
устройстве, конструкция которого приведена на рисунках
102 и 103. Процесс проводят в водно-органической среде на
вращающемся катоде с пленкой маслянистого растворителя,
нанесенной на его поверхность, содержащую токоподводя-
щие частицы диспергированной ртути. Анодом служит пла-
тина или соответствующий металл. В качестве электролита
используют сернокислые или другие растворы. Плотность
тока на катоде составляет около 21804-4000 А!м\ а на ано-
де — около 980 А/лЛ Напряжение на электролизере око-
ло бе. Электролиз проводят при температуре ~50ч-60сС.
Продолжительность действия электрического тока на катод-
ную поверхность зависит от скорости вращения катода и мо-
жет составлять от 1 мин до 1/300 сек. Для получения частиц
металла большего диаметра катод вращают медленно, и на-
оборот, для получения частиц металла с малым диаметром
катод вращают очень быстро. Поэтому способом, описанным
в работе [410], можно получать тонкодисперсные частицы
металла (от 2,5 -10“3 см до 3,8 10"7 см). Время электролиза
также зависит от глубины погружения вращающегося като-
да 7 в электролит 13 емкости 11 (рис. 102).
Процесс электролитического осаждения тонкодисперс-
ных частиц осуществляют следующим образом. Ртуть и мас-
ло диспергируют до величины 0,01 мм в устройстве 3. Про-
цесс проводят непрерывно. Разделение диспергированных
частиц по фракциям осуществляют в классификаторе 4. Да-
лее тонкодисперсная эмульсия ртути в масле поступает в
агитатор 5, перемешивание в котором пропеллерной мешал-
кой предотвращает расслоение и осаждение токопроводя-
щих частиц ртути. Из агитатора 5 эмульсия поступает в сбор-
ник питателя эмульсии б.
При работе электролизера ртутно-масляная эмульсия на-
носится тонким слоем с помощью валиков 8 на поверхность
229
вращающегося катода 7, которая состоит из изолированных
друг от друга 24 пластин из угля, графита или их смеси. Ко-
личество тонкодисперсных токопроводящих ртутных частиц
на поверхности катода зависит от скорости вращения катода
<
Рис. 102. Схема аппаратурного оформления процесса полу-
чения тонкодисперсных порошков металлов амальгамным
методом.
и изменяется от 220 до 32 г)м2. При вращении катода со ско-
ростью 1/300 об!сек на поверхность катода наносится
32 г/м2 ртутных токопроводящих частиц. При вращении ка-
тода и погружении масляной пленки, содержащей включен-
ные ртутные проводящие частицы, в электролит на части-
цах ртути, включенных в масляную пленку, происходит раз-
ряд ионов металла с образованием амальгамы. Маслянистая
230
пленка с частицами амальгамы выходит из соприкосновения
с раствором электролита 73, и брызги электролита сни-
маются с помощью устройства 14. На поверхность вращаю-
щегося катода шприцем 76 впрыскивается масло, и амаль-
гама с поверхности вращающегося катода снимается с по-
мощью скрепера 75 в смеси с маслом и небольшим количест-
вом электролита. При этом поверхность катода переме-
щается к валикам 8 и снова тонкая масляная пленка,
содержащая токопроводящие частицы ртути, наносится на
вращающийся катод. Смесь же масла и амальгамы металла
поступает в центрифугический сепаратор 77, в котором
амальгама металла отделяется от масла и электролита.
Смесь масла и электролита разделяется в центрифугическом
сепараторе 73, и электролит с помощью насоса 19 поступает
в емкость электролита 77. Отделенное масло центробежным
насосом 20 подается в сборник 7. Отделенная амальгама ме-
талла подаётся в емкость 72, которая заполнена инертным
газом, и далее — в специальной фильтр-пресс 21, где избы-
точная ртуть продавливается через различные слои фильт-
ров. Отфильтрованная ртуть подается с помощью насоса 24
в сборник ртути 2 для повторного использования в процессе.
Отфильтрованную суспензию кристаллов металла или его
интерметаллических соединений с ртутью сжатым инерт-
ным газом перемещают в реторту 22. Отгонку ртути прово-
дят при 427-т-54О°С. Ртуть отгоняется и конденсируется в
конденсаторе 23 и с помощью насоса 24 подается в сборник
ртути 2. После этого реторту 22 разбирают, тонкодисперс-
ный порошок выгружают и используют по назначению. Та-
ким образом получают тонкодисперсные порошки меди, се-
ребра, золота, железа, кобальта, никеля [410]. При изготов-
лении порошков таких металлов, как титан, ванадий, хром,
молибден, ниобий, тантал, цирконий, гафний, олово и др.,
применяют высокие плотности тока, в связи с чем во время
электролиза на катоде, а в некоторых случаях — и на аноде
выделяется большое количество газа. Поэтому получение
этих металлов проводят в электролизере (рис. 103), снабжен-
ном устройством для отделения газов.
Процесс электролиза осуществляют в инертной атмосфе-
ре, которая создается с помощью ряда устройств 1, 2 в газо-
непроницаемом корпусе 4, герметически изолированном с
помощью мягких эластичных прокладок 3 от внешней ат-
мосферы. Анодное пространство 7 отделено от катодного 5
с помощью асбесто-стеклянной диафрагмы 6 и снабжено ря-
дом устройств 8, 9 и 10 для отвода выделяющихся газов 9
(кислорода или хлора, если в качестве электролитов приме-
няются хлоридные растворы), регулировки давления 8 и
231
подвода инертных газов 10. Катодное пространство и газо-
непроницаемый корпус также снабжены устройствами для
отвода газов, регулировки давления внутри корпуса и пода-
чи инертного газа в катодное пространство. В процессе элек-
тролиза кислород и другие газы отводятся из газонепрони-
- г
Рис. 103. Устройство электролизера для получения тонкодисперс-
ных порошков электроотрицательных тугоплавких металллов —
молибдена, ванадия, тантала, циркония, гафния и др.
цаемого корпуса и поэтому тонкодисперсные частицы метал-
лов, образующиеся на вращающемся катоде, не подверга-
ются окислению. В остальном проведение процесса не
отличается от описанного выше.
Следует отметить, что автору [410] удалось достигнуть
значительных успехов при получении тонкодисперсных по-
рошков и коллоидных металлов. Применение ртутно-масля-
ной эмульсии позволило получать тонкодисперсные порошки
электроотрицательных металлов: циркония, тантала, нио-
бия, молибдена, ванадия и других, которые из водных рас-
творов электролитов не выделяются электролитически.
232
АМАЛЬГАМНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ
СПЛАВОВ МЕТАЛЛОВ
Получение сплавов тугоплавких и электроотрицательных
металлов является весьма перспективным направлением
амальгамной пирометаллургии. При больших различиях в
температурах плавления и кипения исходных металлов при
изготовлении из них сплавов точно заданного состава встре-
чаются значительные трудности. Для получения однородно-
го по составу сплава необходимо иногда повышать его тем-
пературу до температуры кипения одного из компонентов,
что приводит к потере металла и нарушению соотношения
компонентов в сплаве |410]. Применение в данном случае
методов порошковой металлургии [396] также приводит к
потерям компонентов сплава, внесению загрязнений из ма-
териала тигля или поглощению металлоидов (азота, углеро-
да и др.). Амальгамные методы получения сплавов лишены
указанных недостатков.
Методами амальгамной порошковой пирометаллургии
при сравнительно низких температурах (200ч-400°С) могут
быть получены сплавы как с высокими температурами плав-
ления и кипения (TiZr, WZr, TiW, TiV и др.), так и состоя-
щие из компонентов, сильно различающихся по температу-
рам плавления и кипения (ZnCo, ZnNi, ZnFe, TiZn, InNi,
AgTi, CdPd, CdTi и др.) [2, 325, 342—345, 355, 395, 398, 411,
412]. Это объясняется тем, что образующиеся в амальгаме
частицы трудно растворимых в ртути металлов полностью
свободны от поверхностных неметаллических загрязнений
(окислов и др.) и при повышении температуры происходит
как бы плавление их в амальгаме (спекание) даже при отно-
сительно низких температурах.
Процесс получения сплавов с применением амальгам
состоит из трех стадий: получения амальгамы необходимо-
го состава; термической обработки амальгамы с целью осу-
ществления реакции сплавообразования в ртутной фазе и
удаления ртути в вакууме при высоких температурах. Кри-
териями возможности применения амальгамного метода для
получения сплавов являются: 1) компоненты сплава долж-
ны образовывать амальгамы или проявлять способность к
амальгамированию [2] и 2) один (или оба) из компонентов
должен или обладать небольшой растворимостью в ртути
или образовывать с ней интерметаллическое соединение16
[343—345, 412].
16 Если компоненты сплава не растворимы в ртути и не образуют
ртутных соединений, однако проявляют склонность к амальгамирова-
нию, то получение сплава возможно только при одновременном электро-
литическом выделении компонентов сплава на ртутном катоде. Приме-
ром такого сплава является сплав Fe—Cr, Fe—Со [344, 345].
233
Получение амальгам металлов (первая стадия) необходи-
мого состава осуществляют электролизом растворов смесей
солей с ртутным катодом [2—5, 334, 395, 397, 398, 414, 415],
реакцией фазового обмена электроотрицательного металла
бинарной амальгамы с водным раствором соли более поло-
жительного металла [1 — 5, 414] или другим методом, вклю-
чая прямое растворение хорошо растворимого компонента
в ртути с последующим введением других составляющих
электролизом и др. Возможно получение сплавов также пу-
тем смешения индивидуальных амальгам металлов, полу-
ченных тем или иным методом. При этом в зависимости от
строения бинарных амальгамных систем наблюдается спла-
вообразование между суспендированным труднораствори-
мым металлом в амальгаме и растворенным металлом или
металлом, атомы которого появляются при термическом рас-
паде ртутного соединения. Скорость реакции сплавообразова-
ния в ртутной фазе возрастает с повышением температуры.
Вследствие высокой реакционной способности частиц ме-
таллов, суспендированных в ртути, по отношению к раство-
ренным металлам или металлам, образующимся при терми-
ческом распаде интерметаллических ртутных соединений,
сплавообразование протекает при сравнительно низких тем-
пературах [343—345, 412, 413]. Реакция сплавообразования
начинается на поверхности суспендированной твердой фазы
частицы металла. Затем процесс перемещается за счет диф-
фузии атомов металла внутрь частицы. Выравнивание кон-
центраций в частицах, суспендированных в ртути, протекает
очень быстро даже при температурах 100—250°С.
При смешивании бинарных амальгам друг с другом во
многих случаях взаимодействие металлов наблюдается уже
при комнатной температуре. Однако сплавообразование при
этом имеет место лишь тогда, когда компоненты сплава об-
ладают растворимостью в ртути, равной десятым долям про-
цента и выше.
В литературе накоплен интересный экспериментальный
материал по реакциям сплавообразования при низких тем-
пературах в трех- и четырехкомпонентных амальгамных си-
стемах [344, 345, 412].
Для получения однородного по составу сплава необходим
2-i- 10-кратный избыток ртути в тестообразной амальгаме.
Это отвечает 3 %-ному и меньше содержанию металлов в
амальгаме.
Таким образом, реакция сплавообразования в ртутной
фазе между металлами, образующими с ртутью интерме-
таллические соединения, также протекает очень быстро
при температурах, превышающих температуры диссоциации
234
соответствующих интерметаллических соединений [344, 345,
412]. Вследствие термической обработки частицы сплава
значительно укрупняются, и после удаления избытка ртути
фильтрованием получают остаток, который всегда содержит
значительно меньше ртути, чем амальгама перед реакцией
сплавообразования. Поэтому технологическая операция ди-
стилляции ртути из сплава (третья стадия) требует меньше
времени, и процесс получения сплава становится более
эффективным. Отгонку ртути из сплава, а также спекание
сплава под давлением с целью получения монолитного слит-
ка проводят в герметически закрытой аппаратуре, чтобы
предотвратить испарение ртути.
При этом могут быть получены как порошки сплава раз-
личной дисперсности, так и монолитный сплав или детали из
него при дистилляции ртути в специальной аппаратуре для
спекания порошков под давлением [410, 416]. Спекшиеся
порошки, полученные амальгамным методом, обладают вы-
сокой плотностью и прочностью, значительно большими, чем
у материалов, полученных методами металлокерамики
[410]. В работах [410, 411] показано, что методы амальгам-
ной порошковой металлургии не имеют себе равных в метал-
локерамике и успешно используются для изготовления кор-
пусов машин сложных конфигураций очень точных деталей,
а также могут найти применение для изготовления матриц
с тончайшим рельефом поверхности из тугоплавких метал-
лов при сравнительно невысоких давлениях и температурах.
Методом амальгамной пирометаллургии могут быть по-
лучены и более сложные безртутные сплавы — тройные, чет-
верные и т. д. В этом случае сплавообразование наблюдается,
даже если в ртутной фазе присутствует лишь один металл,
образующий интерметаллическое соединение, а два других
компонента суспендированы в ртути (например, системы
Со—Ст—Ni, Fe—Со—Ni, Fe—Cr—Ni) [345, 412]. При из-
готовлении сложных по составу сплавов сохраняются все за-
кономерности, установленные для реакции сплавообразова-
ния в бинарных системах MeiHg—MesHg, Здесь также рав-
новесной температурой сплавообразования является темпе-
ратура термического разложения наиболее прочного интер-
металлического соединения.
Лиль и Кирнбауэр [345] сформулировали следующие
условия применимости амальгамного метода для приготов-
ления безртутных сплавов:
1. Компоненты сплава должны образовывать амаль-
гамы.
2. Образование сплава путем смешения бинарных амаль-
гам возможно в том случае, если хотя бы один компонент
235
при комнатной температуре имеет большую раствори-
мость в ртути или образует с ней интерметаллическое соеди-
нение.
3. Интерметаллическое соединение металла с ртутью
должно распадаться с отщеплением всей ртути при темпера-
туре -более низкой, чем температура кипения ртути..
4. Ртуть не может связываться металлами при образова-
нии ими смешанных кристаллов в ртутной фазе. Это следует
из изучения многих систем с кадмием в качестве одного из
компонентов.
5. Реакция сплавообразования должна протекать в ртути.
Поэтому нельзя осуществить реакцию между металлами, от-
делив ртуть отгонкой при высоких температурах. Для проте-
кания реакции сплавообразования необходимо систему вы-
держать во времени до установления равновесия реакции в
ртутной фазе.
6. Если все компоненты сплава не растворимы в ртути и
не образуют интерметаллических соединений с ртутью, то
сплавообразование возможно только при одновременном
электролитическом выделении сплава на ртутном катоде.
Рассмотрим технологические особенности получения
сплавов методами амальгамной пирометаллургии.
Строение двойных амальгам (Me—Hg) имеет решающее
значение для выбора технологических параметров процесса
сплавообразования (температура, время, концентрация ком-
понентов). По данным [344], бинарные амальгамные систе-
мы в зависимости от природы реакций сплавообразования
подразделяются на следующие группы:
1. Амальгамные системы с значительной растворимостью
металла в ртути при комнатных температурах: Cd—Hg (6%
Cd), Zn—Hg (2,5% Zn), Sn—Hg (0,6% Sn), Pb—Hg (2,0%
Pb) и др.
2. Металл амальгамы образует с ртутью соединения, рас-
творимость которых в ртути очень мала, например системы
Cu—Hg, Ni—Hg, Мп—Hg (Cu4Hg3, NiHg4, Mn2Hg5, MnHg).
3. Амальгамы металлов, трудно растворимых в ртути и
не образующих с ртутью интерметаллических соединений
(Fe, Со, Cr, W, V и др.). Для приготовления бинарных спла-
вов металлов из этих амальгам возможны следующие ва-
рианты.
а) Взаимодействие металлов амальгам, обладающих за-
метной растворимостью в ртути (комбинации жидких амаль-
гам цинка, свинца, олова, кадмия и др.); этот случай чрез-
вычайно прост.
б) Взаимодействие металлов амальгамы группы 1 с ме-
таллом группы 2. В этом случае один компонент сплава огра-
236
ниченно растворим (Zn, Pb, Sn, Cd и др.), а второй образует
с ртутью соединение (Cu, Ni, Мп).
в) Взаимодействие металлов амальгамы группы 1 с ме-
таллом амальгамы группы 3. В этом случае металл в амаль-
гаме первой группы растворен и взаимодействует с элемен-
тарным металлом, который находится в виде суспензии.
г) Оба компонента сплава образуют с ртутью интерме-
таллические соединения (амальгамы группы 2).
д) Один компонент сплава образует соединение (амаль-
гама группы 2), а второй компонент практически не раство-
рим в ртути (амальгама группы 3).
е) Оба компонента сплава не растворимы в ртути (амаль-
гамы группы 3).
При приготовлении тройных сплавов металлов из амаль-
гам металлов групп 1, 2 и 3 число вариантов возрастет в со-
ответствии с увеличением числа перестановок.
В случае образования сплава между заметно раствори-
мым в ртути металлом (Zn, Cd, Sn, Pb, Ga, Tl) и медью, ни-
келем или марганцем, образующими интерметаллические
соединения, взаимодействие компонентов протекает с высо-
кой скоростью уже при комнатной температуре и значитель-
но возрастает с повышением температуры. На рисунке 104
показан ход реакции взаимодействия цинка с никелем при
2 и 14°С во времени. Как видно,
уже через 10—20 мин после
сливания амальгам даже при
14°С взаимодействие цинка,
растворенного в ртути, с NiHg4,
приводящее к реакции спла-
вообразования, заканчивается
[344]. При этом образуется 6-фа-
за системы Zn—Ni17. Если тем-
пературу повысить до 100°С, то
сплавообразование заканчивает-
ся за несколько минут.
В системе же Мп—Zn—Hg
взаимодействие интерметалличе-
ского соединения MnsHgs с цин-
Рис, 104. Зависимость взаи-
модействия никелевой амаль-
гамы. с жидкой цинковой
амальгамой от времени. Пре-
дельное содержание цинка в
твердой фазе Ni-f-Zn—90%.
ком протекает чрезвычайно
быстро. Уже через 3 мин в суспендированной твердой фазе
находится теоретическое количество цинка. Однако при этом
возникает тройная фаза Мп—Zn—Hg, которая лишь в ва-
кууме при 200°С распадается с отщеплением ртути и обра-
17 В ртутной фазе наряду с кристаллами d-фазы NiZn находятся
также кристаллы NiHg4, которые, как будет показано выше, могут быть
удалены лишь при нагреве реакционной смеси выше температуры тер-
мического разложения NiHg|.
237
зованием у-фазы MnZn [344]. При взаимодействии амаль-
гамы марганца с амальгамой олова время реакции измеря-
ется уже секундами. При соотношении в смеси Mn:Sn = l:l
реакция сплавообразования заканчивается уже через 30 сек.
В то же время взаимодействие никеля с оловом в ртутной
фазе происходит чрезвычайно медленно (см. рис. 105). В этой
системе при 100°С сплавообразование заканчивается лишь
через 5 ч [344]. По-видимому, скорость взаимодействия ком-
понентов в ртутной фазе зависит от разности нормальных по-
тенциалов и электроотрица-
тельностей.
Гетерогенные сплавы с
высоким содержанием низ-
коплавящихся компонентов
(например, Zn, Cd, Впидр.),
когда они соответствуют
предельному составу, не мо-
гут быть получены взаимо-
действием амальгам Си,
Мп, Ni с жидкими амальга-
мами. Для получения таких
сплавов применяют кон-
центрированные амальга-
мы, например цинка, в ко-
Рис. 105. Зависимость взаимо-
действия никелевой амальгамы
с жидкой оловянной амальга-
мой во времени. Пунктирная
кривая — предельное содержа-
ние олова в сплаве.
торой суспендировано ртутное соединение, распадающееся
уже при комнатной температуре. После отгонки ртути полу-
чают массу равномерно распределенных кристаллитов фаз,
находящихся друг с другом в
Рис. 106. Зависимость скорости
реакции взаимодействия амаль-
гам железа (I, 2) и кобальта
(3, 4) с жидкой цинковой амаль-
гамой при 14(1, 3) и 100°С (2,4).
фаза с низкой температурой
взаимодействия
равновесии.
При взаимодействии за-
метно растворимого в ртути
металла с амальгамой метал-
ла, трудно растворимого в
ртути (элементарным метал-
лом), как правило, образуется
фаза, не содержащая ртути и
богатая низкоплавящимся
компонентом. Исключение со-
амальгам железа и
ставляет только взаимодейст-
вие амальгамы хрома с жид-
кой амальгамой цинка, у ко-
торой, как и в системе Мп—
Zn—Hg, образуется тройная
разложения. Скорость реакции
кобальта с амальгамой
цинка показана на рисунке 106. В случае амальгам же-
леза ни при 14°С (кривая 7), ни при 100°С (кривая 2) даже
238
через 6 ч не достигается предельный состав сплава (пунк-
тирная линия). Скорость реакции взаимодействия амальга-
мы кобальта (кривая 3 при 14СС, кривая 4 при 100°С) с
жидкой цинковой амальгамой выше, особенно в начальный
момент. Примерно через час дальнейший рост концентрации
цинка в твердой фазе замедляется, хотя его предельная кон-
центрация лежит значительно выше. При взаимодействии
компонентов этой группы сплавов реакция начинается на
поверхности кристаллов компонентов сплава, суспендиро-
ванных в ртути. С ростом слоя сплава происходит замедле-
ние реакции взаимодействия, так как доставка цинка в зо-
ну реакции лимитируется скоростью диффузии. В этом слу-
чае после достаточно продолжительного времени и при со-
ответствующей температуре в ртути также образуется фаза,
соответствующая предельной концентрации [345].
Взаимодействие металлов амальгам, образующих интер-
металлические соединения с ртутью, наблюдается лишь при
достижении температуры разложения наиболее термически
стабильного соединения металла с ртутью. Так, при смеше-
нии амальгам меди (Cu4Hg3, Тразл ^98°С [417]) и никеля
(NiHg4, Трагл ~225°С [417]) взаимодействие наблюдалось
лишь при повышении температуры до 225°С. Реакция между
медью и никелем оказалась возможной только на стадии рас-
пада NiHg4.
В промышленных условиях реакцию сплавообразования
проводят при получении медно-никелевого сплава при тем-
пературе выше 205°С [344, 345, 412].
При нагреве 100 кг амальгамы меди (14,4% Си) с 320 кг
амальгамы никеля (4,5% Ni) и 500 кг ртути до 250°С при
перемешивании реакция сплавообразования заканчивается
весьма быстро (вторая стадия) [412]. После двух-пяпйминут-
ного взаимодействия при 250°С реакционную смесь охлаж-
дают до комнатной температуры, жидкую фазу отделяют
прессованием и из остатка отгоняют ртуть в вакууме (третья
стадия). Таким образом получают медно-никелевый сплав с
50% Ni [412]. При смешении амальгамы марганца (MnHg,
Т’разл = 280°С) с амальгамой никеля взаимодействие компо-
нентов с образованием сплавов наблюдалось лишь при тем-
пературе разложения более термически стойкого интерме-
таллического соединения MnHg, которая соответствует
280°С [368]. При получении сплава никель — марганец или
медь — марганец температура при термической обработке
амальгамы для проведения реакции сплавообразования на
второй стадии должна быть не ниже 280°С.
Взаимодействие в амальгамах металлов, образующих ин-
терметаллические соединения, с металлами, суспендирован-
239
ными в ртути, протекает также только при температуре
разложения соединения металла с ртутью [345]. Причем ско-
рость реакции сплавообразования в этом случае значитель-
но меньше, чем скорость взаимодействия металлов, образую-
щих интерметаллические соединения с ртутью. В последнем
случае сплавообразование между металлами происходит
при разложении соединений и выделении одного из метал-
лов, а в идеальном случае — и двух металлов, in statu nas-
cendi на атомном уровне. При взаимодействии же выделив-
шегося металла при разложении интерметаллического соеди-
нения с суспендированным в ртути труднорастворимым
металлом важную роль играют температура и фактор време-
ни [3—5, 344, 345, 412—416]. Сплавы, полученные методом
амальгамной пирометаллургии, и в этом случае, как пока-
зали рентгенографические исследования, также являются
равновесными [345].
Сплавы металлов подгруппы железа. Ав-
тором [418] разработана технология получения порошкооб-
разных железо-никелевых сплавов. Амальгамы металлов по-
лучали электролизом водных растворов железо-никелевых
электролитов. В процессе электролиза в ртутную фазу пере-
ходили железо и никель, который образовывал интерметал-
лическое соединение NiHg4.
Было обнаружено, что при продолжительном хранении
амальгамы соединение NiHg4 под действием железа разла-
гается и возникает однородный железо-никелевый сплав. Во
время проводимой в интервале температур 94—400°С отгон-
ки ртути из амальгамы, в которой отношение количества
железа к никелю составляло 68:32, происходило бурное раз-
ложение соединения NiHg4 и получались однородные порош-
ки железо-никелевого сплава высокой чистоты.
Авторы [419] разработали амальгамную технологию по-
лучения порошков алюминидов никеля, содержащих 68,5-4
4-86% никеля, различного фазового состава, а также с ис-
ключительными технологическими параметрами для пере-
работки методом порошковой металлургии. Технологическая
схема этого процесса представлена на рисунке 107.
В этом случае амальгаму никеля (0,8% Ni) также полу-
чают электролизом на ртутном катоде при применении суль-
фатного электролита. За одну операцию осаждают около
800 г металлического никеля с расходом электроэнергии
3,5 квт^ч/кг никеля. Далее амальгаму сушат химическим
способом или при повышении температуры и вводят в реак-
тор 5, в котором находится ранее полученная 0,5%-ная
240
амальгама алюминия, содержащая около 200 г алюминия.
Температура в процессе смешивания двух амальгам состав-
ляет 600°С, а давление — около 25 атм. В процессе смеши-
вания амальгам, которое продолжает-
ся обычно 20—240 мин, образуется
сплав никеля с алюминием, содержа-
щий кроме свободного никеля также
интерметаллические соединения типа
Ni^Aly. В этом процессе можно при-
менять одно- и двухступенчатое на-
гревание с охлаждением между ступе-
нями. После охлаждения до комнат-
ной температуры около 99% ртути
Рис. 107. Схема процесса получения по-
рошка алюминида никеля методом
амальгамной пирометаллургии. 1 — элек-
тролизер с ртутным катодом; 2 — нике-
левый электролит NiSO* • 7Н20~3800 г
(800 г Ni); 3— ртутный катод (амальга-
ма никеля); 4 — химическая или терми-
ческая сушка амальгамы; 5 — термиче-
ская обработка амальгамы при 25 атм
и 6ОО°С; 6 — фи льтрация (отделение
99% ртути); 7 — дистилляция остаточной
ртути (1% ртути); 8— обработка порош-
ка алюминида бензолом; 9 — возврат
бензола.
OA>0MUHud
нимеля
отделяется от частиц сплава путем фильтрования через
металлические или стеклянные фильтры. Глубокое удале-
ние ртути проводят дистилляцией в реакторе 7 при повы-
шенных температурах. Ртуть возвращается в голову процес-
са. Для получения 1 кг порошка сплава при применении
периодического процесса нужно 100 кг циркулирующей рту-
ти. При этом получаются мелкие порошки, которые содер-
жат свыше 80% массы частиц с диаметром менее 20 р. За-
висимость химического и фазового состава алюминидов ни-
келя от технических параметров сплавообразования в ртут-
ной фазе приведена в таблице 18.
Авторы стремились получить порошки, содержащие
только высокотугоплавкие интерметаллические соединения
никеля с алюминием. Однако во всех случаях образовывался
также твердый раствор алюминия в никеле. Присутствие же
твердого раствора алюминия в никеле, который имеет более
низкую температуру плавления, ухудшает свойства жаро-
прочных сплавов никеля с алюминием.
Для получения высокотемпературных сплавов никеля с
алюминием амальгамы смешиваются таким образом, чтобы
16-122
241
Таблица 18
Технологические параметры одноступенчатого метода получения сплавов А1—Ni, по [419]
Содержа’ ние нике- ля в амаль- гаме, % Время реакции, мин Темпера-.J тура реак- ции, °C Содержа- ние нике- ля в порош-1 KeNi—-А1,%; Фазы, обнаруженные рентге- нографическим методом в сплаве
0,2 0,2 0,4 0,5 0,4 0,4 0,4 0,8 0,8 0,2 0,8 0,8 1,6 1,6 3,0 20 120 240 60 240 1 120 120 240 5 20 240 6 240 60 400 4Q0 400 500 500 600 600 600 600 600 600 600 600 600 600 68,51 68,51 68,51 68,51 68,51 68,51 68,51 68,51 68,51 82,5 82,5 82,5 82,5 88,5 82,5 Ni2Al3, NiAl3 Ni2A.l3, NiAl3 Ni2Al3, NiAl3 Ni2Al3, NiAl3 Ni2Al3> NiAl3 Ni2Al3, NiAl3 Ni2Al3, NiAl3 Ni3Al, NiAl3 Ni3Al, NiAl NiaA.l3, NiAI3 Ni3Al, NiAl, Ni3Ai3 NiAl, Ni2Al3, (Ni3Al) NiAl, Ni2Al3 Ni3Al, NiAl
получить сплавы с 68,51% Ni (что соответствует соединению
NiAl) и 82,5% Ni (что соответствует смеси 50% Ni3A14-50%
NiAl), а также 86% Ni (что соответствует соединению NisAl).
При применении однократного нагревания амальгам никеля
и алюминия в широком интервале времени и температур не
удалось получить сплавы с заданным фазовым составом.
Сплавы содержали смеси химических соединений вместе с
твердым раствором алюминия в никеле (табл. 18). Только
после применения двукратного нагревания амальгам при
температуре 600°С и в интервале 30—120 мин с охлажде-
нием между ступенями были получены сплавы, в которых
содержание твердого раствора алюминия в никеле было не-
значительным или его нельзя было обнаружить методом
рентгеновского анализа. Зависимость состава фаз интерме-
таллических соединений от температуры при двухступенча-
той термической обработке и времени приведена в таб-
лице 19.
В опытах № 1, 4 и 5 наблюдалось образование твердых
растворов алюминия в никеле. Было установлено, что раз-
мер и форма частиц алюминидов никеля зависят от темпе-
ратуры реакции сплавообразования и продолжительности
термической обработки.
Сплавы редкоземельных металлов. Вследст-
вие высокой реакционной способности редкоземельных ме-
242
Таблица 19
Технологические параметры двухступенчатого способа получения
различных сплавов А1—Ni с охлаждением между сплавами, по [419]
№ опыта Содержание ни- келя в амальга- ме, % I термиче- ская обра- ботка II терми- ческая об- работка Содержание ни- келя в порошке Ni-Al, % Фазы, установленные рентгенографическим способом в сплаве
время, мин темпе- ратура, °C время, мин темпе- ратура, °C
1 0,2 60 600 80 400 68,51 Ni, Ni2Al3, NiAI3
2 0,2 60 600 120 400 68,51 Ni3Al, NiAl, Ni2Al3
3 0,2 60 600 30 600 68,51 NiAl
4 0,4 120 600 120 600 68,51 NiAl
5 0,2 60 600 120 500 82,5 (Ni), Ni2Al, NiAl
6 0,2 60 600 120 770 86 (Ni), Ni3Al, NiAl
таллов (РЗМ) получение их сплавов обычными методами свя-
зано с большими затруднениями. Основным из них является
способность РЗМ взаимодействовать при температурах спла-
вообразования со всеми веществами, которые могут быть ис-
пользованы в качестве материалов для тиглей. Сплавы РЗМ
в небольших количествах можно получить плавкой во взве-
шенном состоянии в электромагнитном поле [420—422] и
при плавке электронным лучем в водоохлаждаемом тигле
[423]. Однако здесь также возникают значительные затруд-
нения, если, как отмечалось выше, температуры плавления
и кипения компонентов сплава значительно различаются
между собой.
Методы амальгамной пирометаллургии были использо-
ваны авторами [68, 69, 424] для получения сплавов РЗМ с
рядом металлов. Амальгамы редкоземельных металлов по-
лучали сплавлением их с ртутью в закрытых толстостен-
ных трубках-бомбах из прочного стекла при 450°С. При
охлаждении амальгамы до комнатной температуры получа-
ли соединения РЗМ с ртутью РЗМ Hg или РЗМ Hg3, суспен-
дированные в ртути [68, 69]. Было показано [68, 69], что в
амальгамах иттрия, лантана, церия, празеодима, неодима, са-
мария, гадолиния и эрбия при комнатной температуре су-
ществует соединение РЗМ Hg4. При повышении температуры
соединения этих металлов разлагаются по следующей схеме:
РЗМ Hg?^P3M Hgr+Hg3KTP
РЗМ Hg3B->P3M Hg2TB-|-HgrT2,
243
РЗМ HgF^P3M HgTB4-HgrT3,
P3MHg™-+ P3MT8+HgrT4.
Схематическое строение диаграмм состояния систем
РЗМ — Hg показано на рисунке 108. При повышении темпе-
ратуры до Т\ соединение РЗМ Hg4 разлагается на РЗМ Hg34-
+свободную ртуть Hg. После
Рис. 108. Схематическое строе-
ние диаграмм состояния систем
РЗМ — Hg, по данным [424].
отгонки свободной ртути при
360°С получают пористый
спек, состоящий из кристал-
лов РЗМ Hg3. При дальней-
шем повышении температуры
(р=const) при температуре Т2
начинается реакция разложе-
ния соединения РЗМ Hg3. Эта
реакция начинается на повер-
хности кристаллов с образо-
ванием слоя РЗМ Hg2, толщи-
на которого увеличивается
и вызывает диффузионные
затруднения, так как освобож-
дающаяся ртуть должна пере-
секать растущий слой. Поэто-
му разложение соединений
при постоянном давлении про-
ходит в температурном интер-
вале, ограниченном снизу
температурой равновесия раз-
ложения. Такой же ход реак-
ций разложения действителен и для термической диссоциа-
ции соединений РЗМ Hg2 и РЗМ Hg.
Таким образом, разложение соединений РЗМ Hg4 проте-
кает ступенчато, однако не при постоянной температуре, а в
определенной температурной области, лежащей выше темпе-
ратуры равновесия. Причем температура разложения соеди-
нений РЗМ Hg3, РЗМ Hg2 и РЗМ Hg сильно зависит от давле-
ния. При одинаковом давлении температура разложения
соединения NdHg наиболее высокая, т. е. это соединение на-
иболее устойчиво по сравнению с другими. Высокой терми-
ческой устойчивостью обладают и соединения иттрия.
Автором [424] разработана технология получения спла-
вов иттербия, самария, гадолиния, диспрозия, гольмия и
эрбия с железом, кобальтом, никелем, марганцем, медью,
серебром и золотом состава РЗМ Мея. Для получения спла-
ва чистый РЗМ в виде стружки помещали соответственно
244
с Мп, Cu, Ag или Au в реакционный сосуд с ртутью, запол-
няли аргоном и плавили при 450°С в течение 5—10 ч до об-
разования гомогенной амальгамы. При охлаждении в ртут-
ной фазе образовывались соединения типа РЗМХ Меу Hg2,
которые суспендированы в ртути. Удаление ртути и
сплавообразование проводили при трехступенчатой терми-
ческой обработке. На первой ступени удаляли свободную
несвязанную ртуть в вакууме или при малом давлении арго-
на (5—10 мм рт, ст,) при температурах 200—360°С в тече-
ние 2 ч. Остатки ртути из образовавшихся твердых соедине-
ний РЗМ с ртутью и порошков металлов удаляют повышени-
ем температуры от 700 до 800°С в вакууме в течение 2—3 ч.
Вследствие высокой прочности РЗМ соединений с ртутью
удаление ртути проводят в вакууме при температуре на
100—200°С выше температуры равновесного разложения
соединения с ртутью.
На третьей ступени проводили процесс спекания при
800~-1000°С в атмосфере чистого аргона в течение 10—20 ч.
При получении сплавов РЗМ с никелем, кобальтом и желе-
зом эти металлы вводили в амальгаму электролизом. В
остальном технология получения сплавов не отличалась от
описанной выше. Методами рентгенографического и диффе-
ренциального термического анализа в сплавах установлено
образование таких интерметаллических соединений, как
РЗМ Ме2, РЗМ Ме4, РЗМ Ме5, YFe2, УСо5, УМп12, YNi2,
YCu, YAu.
Таким образом, сплавы редкоземельных металлов мето-
дом амальгамной металлургии получают также отгонкой
ртути (вспомогательного металла) из сложных амальгам пу-
тем разложения соответствующих соединений, составной
частью которых является ртуть. Реакция сплавообразования
протекает при взаимной диффузии металлов, а освобождаю-
щийся из соединения с ртутью редкоземельный металл взаи-
модействует с тонкодисперсным порошком металла с образо-
ванием сплава.
По данным [398], Лиль получил амальгамным методом
сплавы иттербия, гадолиния, самария с марганцем, а также
стойкие интерметаллические соединения состава: YMn,
GdMn, SmMn2, YMn4, GdMn4, SmMn4 и УМщ2 — и показал,
что применение ртути в качестве вспомогательного металла
при получении сплавов и химических соединений редкозе-
мельных металлов позволяет достигать высокой дисперсно-
сти и активности порошков сплавов и химических соедине-
ний типа РЗМ Меп с регулируемым гранулометрическим и
химическим составом, которые могут быть использованы для
переработки методом обычной порошковой металлургии.
ЗАКЛЮЧЕНИЕ
Принципы амальгамной пирометаллургии эффективно
используются для решения различных задач новой техники,
атомной энергетики, при получении редких и рассеянных
элементов. Теоретической основой амальгамной пирометал-
лургии, так же как и амальгамной гидрометаллургии, яв-
ляются закономерности растворимости металлов в ртути в
широком интервале температур и взаимного влияния метал-
лов на растворимость в ртути, термодинамические свойства
и строение диаграмм состояния двойных, тройных и много-
компонентных амальгамных систем, кинетика растворения
металлов в ртути, кинетика и механизм реакций сплавооб-
разования в ртутной фазе и межатомного взаимодействия
металлов с образованием интерметаллических соединений,
выяснение природы межатомных равновесий интерметалли-
ческих соединений и состояния металлов в ртути (природа
амальгам).
Несмотря на то, что благодаря усилиям многих исследо-
вателей знания о физико-химических свойствах амальгам,
закономерностях растворимости металлов в ртути, термоди-
намических свойствах амальгам и их соединений непрерыв-
но расширяются, однако многие из перечисленных вопросов
остаются проблемными и часто носят дискуссионный харак-
246
тер. За последнее десятилетие достигнуты значительные ус-
пехи в области физико-химии амальгам. Если несколько лет
назад можно было лишь предполагать, что в многокомпо-
нентных амальгамных системах Mesi —Hg (где Ме&$ = 2,
3,... , п) в связи с изменением межатомного взаимодействия
и вследствие взаимной поляризации атомов металлов долж-
ны растворяться даже те металлы, которые обычно практи-
чески не растворимы в ртути, то в настоящее время получе-
но экспериментальное подтверждение и теоретическое обос-
нование этого предположения. Так, амальгамная четверная
система РЬ(ЗО)—В1(ЗО)—Cd(10)—Hg (20 ат. %) растворяет
при 87°С 10 ат. % Ni, т. е. растворимость никеля возрастает
примерно в 105 раз. Температура плавления четверной сис-
темы (ат. %): РЬ(40)—Bi(40)—In(10)—Hg(10), содержащей
только 10 ат. % ртути, равна 50°С, а система 1п(64)—
Cd(16)—Bi(10)—Hg(10) имеет температуру плавления лишь
30сС. При увеличении концентрации ртути до 20—25 ат. %
температура плавления амальгам значительно снижается,
при этом особенно часто проявляется взаимное влияние ме-
таллов на растворимость в ртути.
Возможности использования таких многокомпонентных
жидкотекучих амальгам в различных областях новой тех-
ники необычайно велики. Поэтому важнейшей проблемой
физической химии амальгамной пирометаллургии является
изучение строения диаграмм состояния тройных, четверных
и многокомпонентных амальгамных систем, включающих
трудно растворимые в чистой ртути металлы, в том числе
благородные, щелочноземельные и редкоземельные. Повы-
шение растворимости редкоземельных и других металлов в
ртути позволит разработать новые, более высокоэффектив-
ные амальгамные процессы получения, разделения и рафи-
нирования их до сверхвысокой чистоты. Естественно, изуче-
нию строения диаграмм состояния многокомпонентных сис-
тем должно предшествовать детальное изучение строения
диаграмм состояния двойных систем с щелочноземельными,
редкоземельными и другими металлами.
Для практического использования амальгам необходимы
полные сведения о термодинамических свойствах компонен-
тов в амальгамных системах. В настоящее время в этом пла-
не изучены лишь следующие бинарные амальгамные систе-
мы: Na—Hg, К—Hg, Cs—Hg, Rb—Hg, Cd—Hg, In—Hg,
TI—Hg, Pb—Hg, Sn—Hg, Bi—Hg, Zn—Hg. Существенный
практический и теоретический интерес представляет изуче-
ние термодинамических свойств и бинарных амальгамных
систем редкоземельных, щелочноземельных металлов и
247
благородных металлов, обладающих малой растворимостью
в ртути.
Изучены термодинамические свойства следующих сис-
тем: Cd—In—Hg, Cd—Sn—Hg, Cd—Pb—Hg, Cd—Bi—Hg,
Cd—Zn—Hg, Cd—Tl—Hg, In—Pb—Hg, In—Sn—Hg, In—
Bi—Hg, In—Zn—Hg, In—Tl—Hg, Pb—Bi—Hg, Na—Pb—
Hg, Na—Cd—Hg. Показано, что взаимодействие между ком-
понентами тройных систем сохраняется и в жидком состоя-
нии; даже при высоких температурах образуются устойчи-
вые структурные группы интерметаллических соединений.
Поэтому ни одна из изученных двойных и тройных амаль-
гамных систем не следует законам идеальных растворов.
Для установления характера межатомного взаимодействия
необходимо продолжить исследования тройных амальгамных
систем. Особенно перспективным является комплексное ис-
следование тройных амальгамных систем на основе щелоч-
ных, редких, цветных и тяжелых металлов: Met—Ме2—Hg,
(где Mei—К, Na, Ru, Cs; Ме2—Sn, Bi, Zn, In, Tl, Cd, Pb, Ga,
Cu) методом э. д. с., упругости пара ртути, электропроводно-
сти, вязкости и рентгеноструктурным анализом жидких
амальгам. Оно позволило бы получить надежную информа-
цию о взаимосвязи термодинамических и физико-химиче-
ских свойств в амальгамных системах, а также данные о
структуре жидких амальгам сложного состава, встречаю-
щихся на практике.
Сопоставление термодинамических свойств амальгам
тройных систем и металлов, расположенных в различных
группах периодической системы элементов Д. И. Менделее-
ва и обладающих различным сродством к ртути, позволит
выявить особенности межатомного взаимодействия в жидком
состоянии. Это послужит значительным вкладом в развитие
теории металлических растворов. Естественно, важнейшей
задачей является и изучение термодинамических свойств
четверных амальгамных систем (Mei—Ме2—Мез—Hg). Здесь
также представляется возможность выявления чрезвычайно
интересных закономерностей для теории растворов.
Поскольку исследования сложных амальгамных систем
сопряжены со значительными экспериментальными трудно-
стями, то чрезвычайно важно развивать методы расчета фи-
зико-химических свойств сложных амальгам исходя из
свойств индивидуальных компонентов, а также методики
расчета термодинамических свойств многокомпонентных
амальгамных систем на основе минимального числа измере-
ний. Необходимы дальнейшие исследования по расчету тер-
модинамических свойств на основе экспериментальных дан-
ных термодинамических свойств двойных систем Mei—Hg,
248
Мег—Hg и Mei—Мег. Проведенные в этом направлении ис-
следования показывают, что ни один из многочисленных
методов расчета тройных металлических систем не дает
удовлетворительного совпадения расчетных и эксперимен-
тальных значений термодинамических свойств в широком
интервале составов. Поэтому перспективная проблема пред-
сказания термодинамических свойств расчетным путем, к
сожалению, остается открытой.
Дальнейшее развитие теории амальгамных процессов не-
возможно без знания механизма межатомного взаимодейст-
вия металлов в ртути и структуры интерметаллических сое-
динений в амальгамах. В настоящее время отсутствует
модель состояния как растворенного в ртути металла, так и
интерметаллических соединений в ртути, дискуссионными
являются представления о межатомных равновесиях интер-
металлических соединений в ртути и даже о структуре
амальгам щелочных металлов. Так, в некоторых работах
развиваются представления об образовании в амальгамах
ассоциатов определенного состава и даже образований неоп-
ределенного состава, так называемых гидраргатов. Полагает-
ся, что при образовании амальгамы отрицательный дробный
заряд, сообщаемый растворителю щелочным металлом, не
локализуется на одном или двух ионах ртути, а распределя-
ется по всем ближайшим соседям. При этом образуется ассо-
циат, прочность которого определяется энергиями кулонов-
ского взаимодействия и межионной связи в оболочке. В то
же время известно, что жидкая ртуть не ионизирована пол-
ностью и ее эффективная валентность меньше единицы. При
растворении щелочных металлов в ртути и получении раз-
бавленных амальгам щелочных металлов вследствие взаим-
ной поляризации атомов образуются комплексы ионного
типа (хотя жидкая амальгама является ионной не пол-
ностью), состоящие из отрицательно заряженных ионов рту-
ти, сконцентрированных вокруг положительного заряда ио-
нов щелочных металлов Me+Hg~. Таким образом, в частич-
но ионной жидкости — ртути — локально размещаются
структурные группы слабодиссоциированных интерметалли-
ческих соединений ионного типа строго определенного со-
става.
Достоверность этой точки зрения (этих представлений)
экспериментально подтверждается постоянством коэффи-
циента активности щелочного металла в разбавленных
амальгамах. Очевидно, раствор полностью ионного типа
можно получить при соотношении компонентов, соответст-
вующем составу интерметаллического соединения MeHgm, и
при Nmg С высказанными представлениями согла-
249
суются данные физико-химического анализа систем щелоч-
ной металл — ртуть.
Результаты исследования термодинамических и физико-
химических свойств (вязкость, электропроводность, измене-
ние удельного объема, магнитной восприимчивости, рентге-
ноструктурные исследования) амальгамных систем щелоч-
ных металлов показывают, что в сплавах натрия и калия и
других металлов с ртутью образуются устойчивые интерме-
таллические соединения MenHgw с гомеополярным типом
связи, в которых упорядоченность типа соединения сохра-
няется и в жидком состоянии при температуре выше темпе-
ратур ликвидуса. До сих пор остаются дискуссионными
представления о фазовой природе амальгам интерметалли-
ческих соединений в ртути и известно лишь ограниченное
количество данных о кинетических и термодинамических
характеристиках таких соединений. Весьма мало данных о
кинетике растворения металлов и механизме реакций сплаво-
образования в ртути. Исследования в этой области лишь на-
чинают развиваться. Изучение этих проблемных вопросов
представляет большой практический и теоретический инте-
рес для амальгамной пирометаллургии.
Весьма интересные и плодотворные исследования меж-
атомного взаимодействия металлов в тройных системах
Mei—Мв2—Hg методом потенциометрии амальгам прово-
дятся А. Г. Стромбергом и его школой. В настоящее время
развит математический аппарат для описания равновесий в
амальгамных системах с образованием одного или двух ин-
терметаллических соединений металлов (Mei и Мег) в ртут-
ной фазе. Особый интерес представляют методы эксперимен-
тальной проверки представлений, разрабатываемые в лабо-
ратории сверхчистых металлов ИОКЭ АН КазССР, о нахож-
дении в равновесии с осадком малорастворимого интерметал-
лического соединения структурных групп слабодиссоцииро-
ванного интерметаллического соединения того же состава.
На наш взгляд, большой объем информации о кинетике и ме-
ханизме реакций межатомного взаимодействия и состояния
металлов в амальгамах может быть получен методом элект-
ропереноса (электродиффузии), интенсивно развиваемым
С. И. Дракиным с сотрудниками.
Большие задачи стоят перед прикладной амальгамной
пирометаллургией, возможности которой используются да-
леко не полностью. В последние годы в технологии получения
редких, тугоплавких, электроотрицательных металлов, пере-
работке ядерного горючего, рафинирования алюминия, гал-
лия и других металлов, получения тонкодисперсных порош-
ков металлов и их сплавов с заданными свойствами, изготов-
250
ления деталей сложной конфигурации все шире используют
процессы амальгамной пирометаллургии. Физико-химиче-
ские свойства ртути и амальгам (легкая испаряемость ртути,
жидкотекучесть амальгам, избирательная растворимость
металлов в ртути, способность металлов в амальгаме к обра-
зованию интерметаллических соединений и сплавов при
относительно низких температурах и др.) позволяют осуще-
ствлять технологические амальгамные процессы непрерыв-
но. Эти процессы легко поддаются автоматизации и требуют
очень малой затраты ручного труда.
Нами составлена таблица 20, где приведена периодиче-
ская система элементов Д. И. Менделеева. Указано, какие
процессы амальгамной металлургии используются для полу-
чения или рафинирования металлов до сверхвысокой чисто-
ты. При составлении таблицы были использованы литера-
турные данные, результаты исследований автора и его со-
трудников по получению и рафинированию металлов до
сверхвысокой чистоты (99,9999—99,999999% основного ме-
талла), а также физико-химические свойства амальгамных
систем, позволяющие определить перспективность примене-
ния амальгамных процессов для получения тугоплавких
электроотрицательных металлов, их сплавов, тонкодисперс-
ных порошков и др.
Как видно из таблицы 20, амальгамные гидрометаллур-
гические методы используются для получения сверхчистых
металлов: меди, цинка, галлия, кадмия, индия, олова, ртути,
таллия, свинца и висмута, амальгам щелочных, щелочнозе-
мельных и редкоземельных элементов и их соединений.
Амальгамные гидрометаллургические методы используются
и для разделения редкоземельных элементов.
Процессы амальгамной пирометаллургии применяются
для получения высокой чистоты алюминия, бериллия, гал-
лия, титана, циркония, гафния, тория и других металлов,
тонкодисперсных порошков металлов и их сплавов. Качество
металлов и сплавов, полученных амальгамными методами,
значительно выше, чем у полученных другими способами.
Сопоставление распространенности амальгамных гидро- и
пирометаллургических процессов для получения металлов и
их сплавов показывает, что удельный вес амальгамных пи-
рометаллургических процессов значительно превышает тако-
вой амальгамных гидрометаллургических. Амальгамные
гидрометаллургические процессы менее трудоемкие и нашли
более широкое применение в практике промышленных пред-
приятий. Однако с развитием амальгамных пирометаллур-
гических процессов и внедрением их в промышленное произ-
251
Таблица 20
Применение процессов амальгамной пирометаллургия и гидромсталлургжв длд получения сверхчистых
металлов и их сплавов, порошков металлов и элементов периодической системы элементов Д. И. Менделеева
Т рпнсурановые
-------элементы, для которых перспективно применение амальгамных пирометаллургических процессов;
=r;z=:= элементы, для получения которых используются амальгамные пирометаллургические процессы (получе-
ние сплавов, порошков и компактных металлов);
элементы, для получения и рафинирования до сверхвысокой чистоты которых используются процессы
амальгамной гидрометаллургии;
......элементы, электролиз соединений которых используется для получения гидроокисей и амальгам;
элементы, для разделения которых используются амальгамные гидрометаллургические методы.
водство объем производства будет значительно превосходить
амальгамный гидрометаллургический.
В таблице также отмечены элементы, для которых пер-
спективно применение амальгамных пирометаллургических
процессов. Так, учитывая физико-химические свойства двой-
ных систем металл — ртуть, представляется весьма перспек-
тивным разработать амальгамные пирометаллургические
процессы получения сверхчистых металлов и элементов:
сурьмы, германия, серебра, палладия, родия — методом
перекристаллизации в ртути, совершенствовать технологию
получения сверхчистых галлия и алюминия методом ртут-
ной экстракции и др.
Для совершенствования известных амальгамных высоко-
температурных технологических процессов необходимо даль-
нейшее развитие физико-химии амальгам, решение важней-
ших рассмотренных выше проблемных вопросов, исполь-
зование новых принципов транспортировки амальгам,
порошков металлов, а также ртути в замкнутом цикле (маг-
нитная гидродинамика) с максимальной степенью автома-
тизации и минимальным использованием ручного труда.
Использование амальгамных пирометаллургических про-
цессов в практике промышленных предприятий и получение
в больших количествах сверхчистых тугоплавких и электро-
отрицательных металлов и различных сплавов с заданными
свойствами приведет к дальнейшему техническому про-
грессу.
ЛИТЕРАТУРА
1. Козин Л. Ф. Амальгамная металлургия. Киев, «Техника»,
1970.
2. Козин Л. Ф. Физико-химические основы амальгамной метал-
лургии. Алма-Ата, «Наука» КазССР, 1964.
3. Козловский М. Т., Зебрева А. И., Гладышев В. П.
Амальгамы и их применение. Алма-Ата, «Наука» КазССР, 1971.
4. Но h n Н. - «Oster. Chem. Z.», 1948, 49, 15, 60, 102.
5. Н о h n Н. — «Research.», 1950, 3, 16, 407.
6. Янг Г., Бах Г. — В кн.: «Электрометаллургия водных раство-
ров» (под ред. Г. Егера). М., «Металлургия», 1966, стр. 459.
7. J a ngg G.- «Metall.», 1959, 13, 407.
8. Glasser J. Патент США № 2618549 от 18.XI 1952.
9. Бориша некий В. М. и др. Жидкометаллические теплоноси-
тели. М., Атомиэдат, 1967.
10. Ложкин А. И., Канаев А. А. Бинарные установки. Л.,
Машгиз, 1946.
11. Гаррис Л. Магнитогидродинамические течения в каналах.
М., ИЛ, 1963.
12. Гудцов Н. Т., Гавзе М. Н. Воздействие ртути как тепло-
носителя в энергетических установках. М., Изд-во АН СССР, 1956.
13. Гавзе М. Н. Взаимодействие ртути с металлами и сплавами.
М., «Наука», 1966.
14. Гавзе М. Н. Коррозия и смачиваемость металлов ртутью. М.,
♦Наука», 1969.
15. Никитин В. И. Физико-химические явления при воздействии
жидких металлов на твердые. М., Атомиздат, 1967.
16. Козин Л. Ф. — В сб.: «Электрохимия растворов и металличе-
ских систем». Алма-Ата, Изд-во АН КазССР, 1962, стр. 101.
254
17. W e t J. F., Haul R. A. W. — «Z. anorg. allg. Chem,», 1954,
277, 96.
18. Strachan J. F., Harris N. Z. — «J. Inst. Metals.*, 1956—
1957, 85, 17.
19. J a ngg G., Pa Ima n H. — «Z. Metall.», 1963, 54, 364,
20. Вагнер К. Термодинамика сплавов. М., Металлургиздат,
1957.
21, Козин Л. Ф. — «Вести. АН КазССР», 1972, в. 3, 34.
22. Козин Л. Ф. Физико-химические исследования амальгамных
методов получения металлов высокой чистоты. Автореферат дисс. Алма-
Ата, 1964.
23. ШахпароновМ. И. Введение в молекулярную теорию раст-
воров. М., ГИТТЛ, 1956.
24. Хансен М., Андерко К. Структура двойных сплавов,
т. 1, 2. М., Металлургиздат, 1962.
25. Э л л иот Р. П. Структуры двойных сплавов, т. 1, 2. М., Метал-
лургиздат, 1970.
26. Сумарокова Т. Н.— «Изв. АН КазССР, серия хим.», 1957,
№ 1, 3.
27. 3 алкин В. М.— «Ж. физ. хим.», 1972, 46, 8.
28. Козин Л. Ф., Судаков В. А. — «Изв. АН СССР. Металлы»,
1970, Х2 5, 197.
29. Л а м с д е м Дж. Термодинамика сплавов. М., Металлургиздат,
1959.
30. Thermodynamic properties of the elements. Advancies in Chemist-
ry, Seris 18. Waschington, G. D. C., 1956.
31. Славинский M. П. Физико-химические свойства элементов.
M., Металлургиздат, 1952.
324 В е д е н е в В. И., Г у р в и ч Л. В., Кондратьев В. Н., Мед-
ведев В. А., Франкевич Е. Л. Энергии разрыва химических свя-
зей. Потенциалы ионизации и сродство к электрону. Справочник. М.,
Изд-во АН СССР, 1962.
ЗЗй Д а р к е н Л. С., Г у р р и Р. В. Физическая химия металлов.
М., Металлургиздат, 1960.
34. Самойлов О. Я. Структуры водных растворов электролитов
и гидратация ионов. М., Изд-во АН СССР, 1957.
35. Григорович В. К. — «Изв. АН СССР. Металлургия и топли-
во», 1960, № 6, 93.
36. Г р и г о р о в и ч В. К. Периодический закон Менделеева и элект-
ронное строение металлов. М., «Наука», 1966.
37. Коттрелл А. X. Строение металлов и сплавов. М., Метал-
лургиздат, 1961.
38. Осипов К. А. — «Докл. АН СССР», 1958, 121, 637.
39. Осипов К. А.—В сб.: «Исследования по жаропрочным спла-
вам». М., Изд-во АН СССР, 1958.
40. Щукин Е., Сумм Б. — В сб.: «Чувствительность механиче-
ских свойств к действию среды». М., «Мир», 11969.
41. Ощерин Б. Н.—В сб.: «Физическая химия поверхностных
явлений в расплавах». Киев, «Наукова думка», 1971.
42. Плаксин И. Н.» Суворовская Н. А. — «Ж. физ. хим.»,
1941, 15, 978.
43. Bauer Е., Nowotny Н., Stempfl А. — «Monatsh.
Chem.», 1953, 84, 211, 692.
44. Шведов В. П.» Фрол ко в А. 3., Никитин Г. Д. — «Ра-
диохимия», 1971, 13, 252.
45. Александров Б. Н., Ломонос О. И. — «Ж. физ. хим.»,
1971, 45, 3003.
255
46. Массальский Т. Б. — В кн.: «Физическое металловедение»
(под ред. Р. Кана). М., «Мир», 1967.
47. Бок ий Г. Б. Кристаллохимия. М., «Наука», 1971.
48. Кинг X. У. — В кн.: «Физическое металловедение» (под ред.
Р. Кана). М., «Мир», 1967.
49. КотсонФ., Уилкинсон Дж. Современная неорганическая
химия. М., «Мир», 1969.
50. Я н-Ш О'С я н Г. В., Н о с е к М. В., Семибратова Н. М.,
Шаламов А. Е. — В сб.: «Электроды и электролиты». Алма-Ата,
«Наука» КазССР, 1967.
51. Т е г a d а К., С a g 1 е F. W. — «Acta Cryst.», 1961, 14, 1299.
52. Т а у 1 о г D. Е., В u г ns С. L. — «J. Res. Nat. Bur. Standards A.
Phis, and Chem.», 1963, 67A, 1, 55.
53. Mercury-tin system investigated. «Chem. Rundschau», 1964, 17,
12, 323.
54. P e t о t-E rwas G., G a i 11 e t M., Desie P.— «С. r. Acad.
Sci.», 1967, 264, 6, 490.
55. Я н-Ш o-C я н Г. B„ Семибратова H. M., H о с e к M. B. —
В сб.: «Кинетика процессов на окиснометаллических и амальгамных
электродах». Алма-Ата, «Наука» КазССР, 1969, 120.
56. Predel В.— «Z. Physik. Chem.» (Frankfurt), I960, 24, 206.
57. Frost В. R. T. — «J. Inst. Metals.», 1953—1954, 82. 456.
58. Захариасен В. Г. — В кн.: «Плутоний». М., Атомиздат,
1964.
59. Алабышев А. Ф., Л ан тр а то в М. Ф., Морачевский
А. Г. — «Успехи химии», 1958, 27, 921.
60. Лантратов М. Ф., Царенко Е. В.— «Ж. прикл. хим.»,
1960, 33, 1539.
61. Hildebrand J. Н., Scott R. L. The solubility of nonelect-
rolytes, 3 rd ed., Reinhold Publ. Corp. N. J., 1950.
62. M о 11 B. W. — «Phil. Mag.», 1957, 2, 259.
63. J a n g g G., L i h 1 F., Legler E. — «Z. Metall.», 1962,
53, 313.
64. Срыв алии И. T. и др. — «Ж. физ. хим.», 1968, 40, 1789.
65. Срывалин И. Т. и др. — Труды Ин-та металлургии У ФАН,
вып. 18, 3, 1969.
66. Б у р ы л е в Б. А., В а с и л ь е в В. В. — В сб.: «Проблемы сверх-
проводящих сплавов». М., «Наука», 1970.
67. Буры лев Б. П. — «Изв. вузов. Черная металлургия», 1967,
№ 3, 20. ’
68. К i г с h m а у е г Н. R., L u g s с hei der W, — «Z. Metall.»,
1966, 57, 725.
69. Kirchmayer H. R. — «Acta phisica Austriaca», 1964, 18,
193.
70. Domagala R. F., E 11 i о t R. P., Ro stoker W.—
«Trans. Met. Soc. А1МЕ», 1958, 212, 393.
71. BoversoxD. F., Leary A. — «J. Inorg. Nucl. Chem.», 1959,
9, 108.
72. F e г г о R. — «Acta Cryst.», 1958, 11, 737.
73. C a m p b e 1 1 A. N., К a r t s m a r k E. M. — «Canad. J. Chem.»,
1965, 43, 1924.
74. J a n e c ke E. — «Z. phys. Chem.», 1907, 57, 507.
75. Ян-Шо-Сян Г. В., H о с e к M. В., Сем и б р а т о в а Н. М.—
В сб.: «Электрохимия металлов и химия амальгам». Алма-Ата, «Наука»
КазССР, 1969, 129.
76. Но сек М. В., Семибратова Н. М., Ян-Шо-Сян Г. В.—
«Изв. АН СССР. Металлы», 1970, № 1, 178.
256
77. Но се к М. В., Ян-Шо-Сяк Г. В., АтамановаН, М.—
«Изв. АН КазССР, серия хим.», 1970, вып. 1, 30.
78. Но се к М. В., Ян-Шо-Сян Г. В., Атаманова Н. М.—
«Изв. АН КазССР, серия хим.», 1969, вып. 4, 11.
79. Носек М. В., Семибратова (Атаманова) Н. М.,
Ян-Шо-Сяи Г. В. — «Изв. АН СССР. Металлы», 1970, № 4, 194.
80. Атаманова Н. М. Автореферат дисс. Алма-Ата, 1971.
81. Требухов А. А. — Тезисы докладов 6-й республиканской
конференции молодых специалистов-химиков. Алма-Ата, 1971, стр. 102.
82. Судаков В. А. Автореферат дисс. Алма-Ата, 1971.
83. Семибратова Н. М., Я н-Ш о-С я н Г. В., Н о с е к М. В. —
♦Изв. АН КазССР, серия хим.», 1969, № 5, 30.
84. К о з и н Л. Ф., М а л ь ц е в Ю. Т., Степанова О. С. — «Укр.
хим. ж.», 1971, 37, 126.
85. Козин Л. Ф., Мальцев Ю. Т. — «Изв. АН КазССР, серия
хим.», 1969, вып. 5, 38.
86. Скрейнемакерс Ф. А. Нонвариантные, моновариантные и
дивариантные равновесия. М., ИЛ, 1948.
87. Die heterogenen Gleichgwichte vom Standpunkte der Phasenlehre
von Dr H. W. Bakhuis Roozedoom. Drittes Hefte. Die ternaren Gleichge-
wichte., Braunschweig, 1911.
88. С т о p о и к и н А. В. Термодинамика гетерогенных систем.
Изд-во ЛГУ, 1969.
89. С торон к ин А. В., Василькова И. В. — В сб.: «Вопросы
термодинамики гетерогенных систем и теории поверхностных явлении»,
вып. 1. Изд-во ЛГУ, 1971.
£0. Верятин У. Д., МаширевВ. П. и др. Термодинамические
свойства неорганических веществ. М., Атомиздат, 1963.
91. N y'vl t J. — «Chem. Prum.», 1959, 9, 579.
A
92. N y*v 1 t J. — «Chem. Prum.», 1960, 10, 463.
93. N y’v It J., Gottfried J. — «Chem. Prum.», 1964, 14, 376.
94. Wohl K. — «Trans. Am. Inst. Chem. Eng.», 1946, 42, 215.
95. C Ar sky J. — «Chem. Zvestl.», 1971, 25, 266.
96. H in zn er F. W., Stevenson D. A. — «J. Phys. Chem.»,
1963, 67, 2424.
97. M о ni к e в и ч А. С., P e в д e л ь В. А. — «Ж. прикл. хим.»,
1970, 43. 71.
98. Bennet J. A., Lewis J. В.— «Am. Inst. Chem. Engng. J.»,
1958, 4, 418.
99. J ackson J. K., Grace R. E. — «Metallurg. Soc. Conf.»,
1961, 7, 633.
100. Epstein Z. F.— «Chem. Eng. Progr. Sympos. Series.», 1957,
53, 20, 67.
101. FinnistonH. M. — «Austral. Atomic Energy Sympos.». Mel-
bourn, 1958, p. 189.
102. Уикс Д. P., Гурине к и Д. X. —В сб.: «Жидкие металлы
и их затвердевание». М., Металлургиздат, 1962, стр. 126.
103. W а г d A. G., Т а у 1 о г J. W. —- «J. Inst, of Metals.», 1956,
85, 145; 1957, 86, 36.
104. Р о д и г и н Н. М., Родигина Э. Н. Последовательные хи-
мические реакции. М., Изд-во АН СССР, 1960.
105. Ревдель А. А., Мошкевич А. С. — «Ж. прикл. хим.»,
1971, 44, 333.
106. Л е в и ч В. Г. Физико-химическая гидродинамика. М., Физмат-
гиз, 1959.
17-122
257
107. У с а но вич М. И. Исследования в области теории растворов
и теории кислот и оснований. Алма-Ата. «Наука* КазССР, 1970.
108. Евсеев А. М., Воронин Г. Ф. Термодинамика и структу-
ра жидких растворов. М., Изд-во МГУ, 1966.
109. Ре гель А. Р. — В сб.: «Структура и свойства жидких метал-
лов». М.» Изд-во АН СССР, 1959.
110. Ito Н., Ogawa Е., JanagaseT. — «Nippon—Kinzoku—
Gakkay—Schi.», 1961, B15, 382.
111. Козин Л. Ф., T а н а н a e в a H. H. — «Ж. неорг. хим.», 1960,
4, 909.
112. J a n g g J. — «Z. Metallkunde», 1962, 53, 612.
113. С о 1 e s s B. R., Merri am M. F., F i s k Z. — «J. Less—Com-
mon Met.», 1963, 5, 41.
114. Oka ji ma Yusukiro, Schimoji Mitsuo—«Trans.
Jap. Inst. Met.», 1968, 9, 4, 279.
115. HultgrenR., О r r R., Anderson P., Kelley K. Se-
lected Values of Thermodynamic Properties of Metals and Alloys. N. Y„
1963.
116. Scheidt P. Die Mischungwarmen des Quecksilbers mit
Metallen aus den Gruppen II b bis V b Perioden Systems. Diss. Munchen,
1960.
117. Schul z L. G. - «Adv. Phys.», 1957, 6, 102.
118. Cusack N. E., Kendall P., FirlderM. — «Phil. Mag.»,
1964, 10, 871.
119. В r a d 1 e у C. — «Phil. Mag.», 1966, 14, 953.
120. Benkirane M., Robert J. — «Com. R. Acad. Sci.», 1967,
13264, 470.
121. ЯценкоС. П., Кононенко В. И., Судаков В. А.,
Хромцов В. В., Козин Л. Ф.— «Ж. физ. хим.», 1972, 46, 321.
122. С 1 а е s о n Т., Luo Н. L., М е г г i a m М. F. — «Phys. Rev.»,
1966, 141, 412.
123, В i j 1 Н. С. — «Z. phys. Chem.», 1902, 41, 641.
124. Teeter С. E. •—«Z. phys. Chem.», 1931, 53, 3927.
125. Smith F. — «Phil. Mag.», 1910, 19, 250.
126. P e d e r r J., BarratS. — «J. Chem. Soc.», 1933, 55, 537.
127. M e у e r-J u n g n i c k W. — «Z. phys. Chem.», 1957, 13, 184.
128. Predel B., Rotchacker D. — «J. Less-Common Metals»,
1966, 10, 392.
129. Kleppa O. — «Acta Metallurg.», 1960, 8, 435.
130. К о з и н Л. Ф., Нигметова Р. Ш. — В сб.: «Термодинами-
ческие и термохимические константы». М., «Наука», 1970.
131. Hildebrand J. Н., Foster А. М., Bee be С. W.-«J.
Am. Chem. Soc.», 1920, 42, 545.
132. Дергачева M. Б. Автореферат дисс. Томск, 1970.
133. Голик А. 3., Карликов Д. Н.— «Докл. АН УССР»,
1957 3 237
134. R о 11 A., S w a m у N. — «Z. Metall.», 1961, 52, 111.
135. Weber С. L. — «Ann. Phys.», 1887, 31, 243.
136. Курнаков H. С., Путин H. A. — «Ж. рус. физ.-хим. об-
ва», 1901, 33, 5651.
137. Roos G. D. — «Z. anorg. Chem.», 1902, 94, 856.
138. Spenser J. E.— «Z. f. Elektrochem.», 1905, 11, 681.
139. Sucheni A. — «Z. f. Elektrochem.», 1906, 12, 726.
140. OlanderA. — «Z. phys. Chem.», 1934, 171, 425.
141. Richards T. W., Daniels F. — «J. Am. Chem. Soc.»,
1919, 41, 11732.
142. Richards T. W., Smith M. — «J. Am. Chem. Soc.», 1922,
44, 524.
258
143. HildebrandJ. H., E a s t m a n E. — «J. Am. Chem. Soc.»,
1915, 37, 2452.
144. Lewis G., Randall M.— «J. Am. Chem. Soc.», 1921,
43, 233.
145. Козин Л. Ф. — Труды Ин-та хим. наук АН КазОСР, 9,
1962, 71.
146. Ward R. W., Wilson J. R. — «Nature», 1958, 182, 334.
147. Pre d e 1 В., Rotchacker D. — «J. Less-Common Met.»,
1969, 17, 223.
148. Данилов В. И. Рассеяние рентгеновских лучей в жидкостях.
Л.—М.» ОНТИ, 1935.
’14£ . Данилов В. И. — В сб.: «Строение и кристаллизация жид-
кости». Киев, 1956.
150. Smallmann R., Frost В. — «Acta Metallurgies», 1956,
4, 611.
151. Павлович П. — «Ж. рус. физ.-хим. об-ва», 1915, 47, 29.
152. W а 11 w е у J. Е., Т а о L. С. — «J. Chem. Eng. Data», 1965,
10, 234.
153. Козин Л. Ф., Нигметова Р. Ш. — «Изв. АН СССР. Ме-
таллы», 1967, 4, 213.
154. Козин Л. Ф., Т р е б у х о в А. А., Яценко С. П., Коно-
ненко В. И., Нигметова Р. III. — «Изв. АН СССР. Металлы»,
1962, № 5.
455. Suy dan G., Т а о L. — «J. Chem. Eng. Data», 1963, 8, 4.
156. P r e d e 1 В., R о t c h a c k e r D. — «Acta Metallurgica», 1969,
17, 6.
157. Molsberger R., Skaggs R. — «Trans. Metallurg. Soc.
А1МЕ», 1969, 245, 421.
158. Козин Л. Ф., Нигметова P. III.— «Ж. неорг. хим.»,
1963, 8, 2526.
159. Bonnier E., DesreP., Peto t-E r w a s G. — «С. r. Acad.
Sci.», 1962, 19 (5), 2432.
160. TammannG., О hl er E. — «Z. anorg. allg. Chem.», 1924,
135, 118.
161. Kawakami M. — «Sci. Rep. Tohoku Univ.», 1927, 16, 915.
162. W i 11 i g F. E., S cheidt Р,- «Natur.», 1960, 47, 250.
163. Судаков В. А., Козин Л. Ф., Кононенко В. И.,
Яценко С. П. — «Ж. физ. хим.», 1972, 46, 944.
164. Eastman Е. D., Hildebrand J. — «J. Am. Chem. Soc.»,
1914, 36, 2020.
165. Pet о t-Ervas G., Albert M., DesreP., Bonnier E.—
«Bull. Soc. Chem. France», 1969, 5, 1477.
166. Peto t-E rvasG., DesreD., Bonnier E. — «С. r. Acad.
Sci.», 1965, 261, 17.
167. Козин Л. Ф., Нигметова P. Ш.— «Ж. прикл. хим.»,
1967, 40, 1914.
168. Корпачев С. В., К оч е р г и н В. П., И о р д а н Е. Ф.—
«Ж. физ. хим.», 1948, 22, 52.
169. Weibke F., Kubaschewski О. Thermochemie der Le-
gierungen. Berlin, 1943, 167.
170. Schiiz Z.— «Ann. Phys. u. Chemie», 1892, 146, 177.
171. Hildebrand J. H. — «Trans. Am. Electrochem. Soc.», 1912,
22, 319.
172. Richards T. W., Forbes G. — «Z. phys. Chem.», 1907,
56, 683.
173. Richards T. W., G а г г о d-T h о m a s R. N. — «Z. phys.
Chem.», 1910, 72, 165. • -
259
174. Richards T. W., Lewis G. N. — «Z. phys. Chem.»» 1899»
2g j____i2,
175. Crenshau J. L.— «J. Phys. Chem.»» 1910, 14, 158.
176. Козин Л. Ф.» Нигметова P. Ш.» Даирова A. M.—
♦ Ж. физ. хим.», 1971, 45, 8.
177. S c h e i 1 E. — «Z. Elektrochem.», 1943» 49, 242.
178. Го лик A. 3.— «Докл. АН УССР», 1952» 1, 20.
179. Яценко С. П.» Дружинина Б. П., Д а н и л и н К Н. —
♦Ж. прикл. хим.», 1969, 42, 605.
180. Р г е d е 1 В., Mo hs R., RothackerD. — «J. Less-Common
Metals», 1967, 12, 483.
181. Darken L. S. — «Trans. Met. Soc. А1МЕ», 1967, 239, 80.
182. Ю м-P озериВ.» Рейнор Г. Структура металлов и сплавов.
М.» Металлургиздат, 1959.
183. Клеппа О. — В сб.: «Строение металлических растворов».
М., «Металлургия», 1966, стр. 31.1.
184. Heumann Т.» Predel В..— «Archiv Eisenhiittenwesen»,
1968, 10, 783.
185. Predel В., Rothacker D.— «Acta Metallurgies», 1967,
15, 135.
186. Predel B., Em am A.— «Mater. Sci. and. Engng.», 1969,
4, 287.
187. P r a 11 J. N. — «Rev. Inst. Hautes Temper, et Refract.», 1967,
4, 97.
188. Варич H. И., Кравцов И. A. — В сб.: «Диаграммы сос-
тояния металлических систем». М., «Наука», 1971, стр. 213.
189. Laffite М., Claire J., Cast anot R. — «J. Chem. Ther-
modynamics», 1971, 3, 735.
190. Лантратов M. Ф., Морачевский А. Г. — «Изв. Ленин-
градского электрэхим. ин-та им. В. И. Ульянова», 1961, 46, 228.
191. Гейдерих В. А., Никольская А. В., Васильева
И. А. — В сб.: «Соединения переменного состава». Л., «Химия», 1969,
210.
192. К у б а шев с ки й О., Эванс Э. Термохимия в металлургии.
М.» ИЛ» 1954.
193. Frauenschil Н., На tl a F. — «Z. Elektrochem.», 1949,
53, 144.
194. И а 11 a F., Hardy R. — «Z. Elektrochem.», 1952, 56, 213.
195. Даирова А. М., Козин Л. Ф.» Нигметова Р. Ш.—
♦ Изв. АН КазССР, серия хим.», 1972, в. 3, 19.
196. Darken L. S. — «J. Am. Chem. Soc.», 1950, 72, 2909.
197. Elliot J., Chipman J. — «J. Am. Chem. Soc.», 1951, 73,
2682.
198. Алабышев А. Ф., Морачевский А. Г.— «Ж. неорг.
хим.», 1958, 2, 669.
199. Морачевский А. Г.— «Научно-техн, информ, бюлл. ЛИИ»,
1957, № 3, 12.
200. Лантратов М. Ф.— «Ж. неорг. хим.», 1959, 4, 1415, 2043.
201. Лантратов М. Ф.— «Ж. физ. хим.», I960, 34, 782.
202. Лантратов М. Ф. — «Ж. прикл. хим.», <1961, 34, 130.
203. Shuhmann R. J. — «Acta Metallurgies», 1955, 3, 219.
204. G a c k e n M. A. — «J. Phys. Chem.», 1960, 64, 401.
205. J ellinek K., WannowH. — «Z. Elektrochem.», 1949, 53,
144.
206. Нигметова P. Ш., Козин Л. Ф. — «Изв. АН СССР. Ме-
таллы», 1970, № 1, 214.
260
207. С е н ю т а С. Ю., Есютик В. С., Т а з и е в Ж. — Труды Ин-
та металлургии и обогащения АН КазССР, 13, 1965, 22.
208. Козин Л. Ф., Нигметова Р. Ш., Д а и р о в а А. М. —
«Ж. физ. хим.», 1968, 42, 698.
209. Козин Л. Ф., Нигметова Р. Ш., Д а и р о в а А. М. —
♦Изв. АН КазССР, серия хим.», 1971, № 6, 19.
210. Эндер б и Дж., Март Н. Устойчивость фаз в металлах и
сплавах. М., «Мир», 1970.
21L Бертман А. А., Самаркин А. М. Свойства расплавов же-
леза. М., ♦Наука», 1969,
212. Krupkowski А. — «Bull. Acad. Polon. Sci. et Lett. Ser. А»,
1950, 1, 15.
213. RedlichO., KisterA. — «Ind. Eng. Chem.», 1948, 40, 345.
214, С у cape в M., Горбунов A. H.— «Ж. физ. хим.», 1£64,
38, 583.
215. Kohler F., Findenegg G. — «Monatsch. Chem.», 1965,
96, 1226.
216. Bonnier E., CabozR. — «С. r. Acad. Sci.», 1960, 250, 527.
217. To op G. W.— «Trans. Met. Soc. А1МЕ», 1965, 233, 850.
218. Морачевский А. Г., Герасименко Л. H.— «Ж. физ.
хим.», 1971, 45, 1951.
218a. Морачевский А. Г. — «Ж. прикл. хим.», 1963, 36, 329.
219. Spenser Р. J., Hayes F. Н., Kubashewski О.—
♦Rev. Chimie minerale», 1972, 9, 13.
220. Стромберг А. Г., Захаров M. С., Месяц Н. А. — ♦Изв.
Томск, политехи, ин-та», 1967, 164, 165.
221. Захаров М. С., Стромберг А. Г., Месяц Н. А.—
♦Изв. Томск, политехи, ин-та», 1967, 164, 178.
222. Стромберг А. Г., Захаров М. С., Месяц Н. А.—
♦ Электрохимия», 1967, 3, 1440.
223. Месяц Н. А., Стромберг А. Г., Захаров М. С. —
♦ Электрохимия», 1968, 4, 987.
224. Стромберг А. Г., Белоусов Ю. П. — В сб.: ♦Кинетика
и механизм электродных реакций». Алма-Ата, «Наука» КазССР, 1973.
225. Стромберг А. Г., Михеева Н. П.— «Электрохимия»,
1971, 7, 1728.
226. Стромберг А. Г., Месяц Н. А., Михеева Н. П. — «Ж.
физ. хим.», 1971, 45, 1521.
227. Козин Л. Ф., Дергачева М. Б. — В сб.: «Кинетика
электродных реакций на амальгамных и металлических электродах».
Алма-Ата, «Наука» КазССР, 1972.
228. Козин Л. Ф., Дергачева М. Б. — В сб.: «Электродные
процессы». Алма-Ата, «Наука» КазССР, 1971.
229. Козин Л. Ф., Дергачева М. Б. — «Укр. хим. ж.», 1967,
33, 787.
230. Козин Л. Ф., Дергачева М. Б., Абрамова Н. С. —
♦ Изв. АН КазССР, серия хим.», 1970, выл. 3, 19.
231. Зебрева А. И. — «Вести. АН КазССР», 1958, М 11, 88.
232. Зебрева А. И.— «Ж. физ. хим.», 1961, 35, 948.
233. Зебрева А. И. — В сб.: «Электроды и электролиты». Алма-
Ата, «Наука» КазССР, 1967.
234. 3 е б р е в а А. И., Л е в и ц к а я С. А. — «Ж. физ. хим.», 1962,
36, 2799.
235. Зебрева А. И., Козловский М. Т. — В сб.: «Современ-
ные методы анализа». М., «Наука», -1965, 214.
236. Ковалева Л. М., Зебрева А. И. — «Ж. физ. хим.», 1964,
38, 1162.
261
237. Зебрева А. И. — «Ж. физ. хим.», 1962, 36, 1822..
238. Зебрева А. И., Ковалева Л. М. — «Ж. физ. хим.», 1965,
39, 855.
239. Ковалева Л. М., Зебрева А. И. — «Электрохимия», 1965,
1, 1084.
240. Зебрева А. И., Рубан Л. М., ГладышевВ. П.—
♦ Вести. АН КазССР», 1959, вып. 2, 47,
241. PredelB., Rothacker D. — «J. Less-Common Metals»,
1959, 17, 223.
242. Стромберг А. Г., Михеева H. П., Месяц Н .А. — «Ж.
физ. хим.», 1972, 46.
243. Козин Л. Ф., Че р к асо в а Г, Ф., ЕрденбаеваМ. И. —
♦ Изв. АН КазССР, серия хим.», 1969, № 3, 42.
244. F о 1 е у W. Т., R е i d L. Е. — «Canad. J. Chem.», 1963, 41,
1782.
245. Foley W. T., Liu M. T. N. — «Canad. J. Chem.», 1964,
42, 2607.
246. Foley W. T., В a a s a k A. K., Delorey J. R. — «Canad.
J. Chem.», 1964, 42, 2749.
247. Foley W. T., O’S u 1 i v a n K. — «Canad. J. Chem.», 1967,
45, 855.
248. К e м у л я В., Д о в г и р д А., Г а л ю с 3. — «Электрохимия»,
1968, 4, 1058, 1177.
249. Уббелоде А. Плавление и кристаллическая структура. М.,
♦Мир», 1969,
250. Скрышевский А. Ф. Структурный анализ жидкостей. М„
«Высшая школа», 1971.
251. В е р т м а и А. А., Самарин А. М. — Труды Ин-та метал-
лургии АН СССР, 10, 1962, 108.
252. Козин Л. Ф., Дергачева М. Б. — «Ж. физ. хим.», 1969,
43, 249.
253. Hartmann Н., Scholzel К. — «Z. phys. Chem.», 1956,
9, 106.
254. К у мок В. Н., Дергачева М. Б., Козин Л. Ф. — «Ж.
физ. хим.», 1972, 46, 182.
255. Есин О. А., Гаврилов Л. К. — «Изв. АН СССР. ОТН»,
1951, № 8, 1234.
256. Е с и н О. А., В а т о л и и Н. А. — «Изв. АН СССР. ОТН»,
1953, № 8, 1137.
257. F i о г a n i М., Valenti V., Oleari L. — «Gazzetta Chem.
Ital.», 1956, 86, 624.
258. Kubaschewski O., Catteral L. A. Thermochemical
Dates of Alloys, Pergamon Press, 1956.
259. Sacchetto G. А., В о m b i G. G., Flor an у M. — «Вег.
Buns. Phys. Chem.», 1968, 72, 80.
260. Скрышевский А. Ф. — В сб.: «Вопросы физики металлов
и металловедения». Киев, Изд-во АН УССР, 1957.
261. . Скрышевский А. Ф. — «Изв. АН СССР. Металлургия и
топливо», 1960, №6. ,
262. HendusH. — «Z. Naturf.», 1947, 2а, 505.
263. SauerwaldF., Teske W. — «Z. anorg. allg. Chem.», 1933,
210, 247.
264. Schuhmann H.— «Z. anorg. allg. Chem.», 1962, 317, 204;
1962, 317, 204.
265. Seymour E. F. W., S ty les-G. A. — «Proc. Phys. Soc.»,
1966, 87, 473.
266. Kamiy am a T., S u z u k i K. — «J. Phys. Chem. Japan»,
1970, 28, 1371.
262
267. Collings E. W. — «Advan. Phys.», 1967, 16, 459.
268. Menon M. N., Lichter B. D. — «Metallurg. Trans.», 1970,
1 2699.
269. C us a ck N. E., К e n da 11 P. W. ~ «Philos. Mag.», 1963,
8, 157.
270. Halder N. C. — «Phys. Rev.», 1969, 177, 471.
271. Андреев А. А., Регель H. P. — «Физ. тверд, тела», 1965,
7, 2567.
272. D e g e n к о 1 b e J., Sauerwaid F. — «Z. anorg. allg.
Chem.», 1952, 270, 317.
273. Д p а к и н С. И., Б о р и с о в а А. М., С е р г е е в а Т. Н. — «Ж.
физ. хим.», 1968, 42, 1007.
274. ДракинС. И., Аликина И. Б. — «Физика металлов и ме-
талловедение», 1С69, 27, 636.
275. Драк ин С. И., Аликина И. Б. — «Ж. физ. хим.», 1968,
42, 2670.
276. Д р а к и н С. И., Сергеева Т. Н., Русакова В. Н. — «Ж.
физ. хим.», 1961, 35, 1125.
277. Дракин С. И., Сергеева Т. Н., Трепанов А. Н.—
♦ Ж. физ. хим.», 1964, 38, 321.
278. Дракин С. И., Фролова Г. М. — «Ж. физ. хим.», 1963,
37, 1521.
279. Дракин С. И. — В сб.: «Физико-химический анализ». Ново-
сибирск, Изд-во СО АН СССР, 1963.
280. Дракин С. И., Титова Ю. К. — «Ж. физ. хим.», 1967, 41,
635.
281. Дракин С. И. Автореферат дисс. МХТИ им. Д. И. Менделее-
ва, 1968.
282. Белащенко Д. К., Григорьев Г. А. — «Изв. вузов. Чер-
ная металлургия», 1961, 11, 116.
283. Белащенко Д. К. — «Успехи химии», 1965, 34, 530.
284. Белащенко Д. К. Явления переноса в жидких металлах и
полупроводниках. М., Атомиздат, 1970.
285. Svirbely W. J., R е a d S. М. — «J. Phys. Chem.», 1962,
66, 638.
286. N е b е 1 Н. — «Rev. Roum. Chim.», 1970, 15, 59.
287. Герасименко Л. H., Кириченко И. В., Ложкин
Л. Н., Морачевский А. Г. — В сб.: «Защитные металлические и
оксидные покрытия, коррозия металлов и исследования в области элект-
рохимии». М., «Наука», 1965.
288. Морачевский А. Г., Стаценко С. И., Буссе-Мачу-
к а с В. Б. — «Ж. физ. хим.», 1966, 15, 2605.
289. Мор ачевский А. Г., Лантратов М. Ф. — «Ж. прикл.
хим.», 1958, 29, 2109.
290. Морачевский А. Г. — «Ж. прикл. хим.», 1958, 31, 1267.
291. Nappwost А. К.— «Z. phys. Chem.», 1959, 21, 358.
292. Левицкая С. А., Зебре в а А. И. — В сб.: «Электроды и
электролиты». Алма-Ата, «Наука» КазССР, 1967.
293. L е е F. Н., S е n L. R., W a n g A. S. Н. — «Scietia Sinica»,
1960, 9, 664.
294. Левицкая С. А. Автореферат дисс. Алма-Ата, 1966.
295. Нигматуллина А. А. Автореферат дисс. Алма-Ата, 1967.
296. Нигматуллина А. А., Зебрева А. И. — «Изв. АН
КазССР, серия хим.», 1964, вып. 4, 18.
297. Н и г м а т у л л и н а А. А., Зебрева А. И.— «Изв. АН
КазССР, серия хим.», 1965, вып. 2, 20.
298. В u 11 е г J. N. — «J. Phys. Chem.», 1964, 68, 1828.
263
299. Roeder A., Morawietz W. — «Z. Elektrochem.», 1956,
60, 431.
300. Bent H. E., S w if t E. — «J. Am. Chem. Soc.», 1936, 58,
2220.
301. Bent H. E., For zia ti A. F. — «J. Am. Chem. Soc.», 1936,
58, 2216.
302. В r a u e r G., Ru d ol ph R. - «Z. anorg. allg. Chem.», 1941,
248, 405.
303. Muller R., Knaus W. — <Z. anorg. allg. Chem.», 1923,
130, 173.
304. Массальский Г. В. — В кн.: «Теория фаз в сплавах». М.,
Металлургиздат, 196-1.
305. ChaoF., Costa М. — «Bull. Soc. Chim. France», 1968,
2, 549.
306. ChaoF., Costa M. — «Bull. Soc. Chim. France», 1968,
1, 54.
307. Захарова Э. А. Автореферат дисс. Томск, 1965.
308. К e m u 1 a W„ Gaius Z. — «Bull. Acad. Polon. Sci., ser.
chim.», 1959, 7, 729.
309. Зебрева А. И. Автореферат дисс. Алма-Ата, 1967.
310. KehiaianH. — «Bull. Acad. Polon. Sci., ser. chim.», 1964, 12,
311. His cocks S. E. R., Hume-Rothery W. — «Proc. Roy.
Soc.», 1964, A282, 318.
312. Wegst J., Schubert K. — «Z. Metall.», 1958, 49, 533.
313. Schneider A., Stendel. — «Z. anorg. allg. Chem.», 1960,
303, 227.
314. С т p о м б e p г А. Г., Баев В. С. — «Химия и хим. техноло-
гия», 1973, 1, 13.
315. Левицкая С. А., Зебрева А. И. — «Электрохимия», 1966,
2, № 1.
316. Зебрева А. И. — В сб.: «Электрохимия растворов и метал-
лических систем». Алма-Ата, Изд-во АН КазССР, 1962.
317. Б а ц а н о в С. С. Электроотрицательность элементов и химиче-
ская связь. Новосибирск, СО АН СССР, 1962.
318. В i 11 z W., R о h 1 f f s G., V о g e 1 H. U. — «Z. anorg. allg.
Chem.», 1931, 220. 113.
319. Михеева H. П., Назаров Б. Ф., Стромберг А. Г. —
В сб.: «Химия и химическая технология», вып. 1. Изд-во Томского ун-та,
1973.
320. Делахей П. Новые приборы и методы в электрохимии. М.,
ИЛ, 1957.
321, G а 1 u s Z. — «Bull. Acad. Polon. Sci., ser. chim.», 1966, 14, 167.
322. К e m u 1 a W., Gaius 3. — «Bull. Acad. Polon. Sci., ser.
chim.», 1959, 7, 607.
323. Hovsepian В. K., Shain J. — «J. Electroanal. Chem.»,
1967, 14, 1.
324. FickerH., MeitesZ. — «Anal. Chim. Acta», 1962, 26, 172.
325. J a n g g G. — «Chem. Ing. Techn.», 1964, 36, 681.
326. H о h n H. Oster pat. № 196624, 25.03.1958.
327. D e a n О. С., E 11 i s G. K.— «Nucl. Sci. and Enginirg», 1958,
4, 509.
328. К e 11 s M. С., H о 1 d e n R. B., Wh it ma n С. I. — «J. Am.
Chem. Soc.», 1957, 79, 3925.
329. К el 1 s M. С., H о 1 d e n R. B., Whitman С. I. Second Uni-
ted Nations International Conference on the Peaceful Uses of Atomic Ener-
gy. USA, 1958, p. 717.
330. Reynolds Metals Co. Pat. Eng. № 757908, 1956.
264
331. Hampel G. A. Pat. USA № 2618550, 1. 01.1952.
332. Schmidt W. Pat. USA № 2813787, 19.11.1957.
333. HohnH., F i t z e r E., Hofbauer H. — «Berg. Huttenman-
nishe Monatshefte», 1956, 101 (12), 277.
334. Bukowiecki J., Razniewska M. Zarys metalurgii
amalgamatovej, Katowice, Wydawnictwo «Slask», 1970.
335. Siemens and Halske Gesellschaft. Oster, pat. № 814862,
26.07.1957.
336. F i t z e r E. Oster, pat. № 203221, 11.05.1959.
337. Kohler F. Oster, pat. № 198957, 11.08.1958.
338. J a n g g G., F i t z e r E., A 11 h a r t O., HohnH. — «Z. Me-
tall.», 1958, 49, 557.
339. Luborsky F. E.— «J. Phys. Chem.», 1957, 61, 1336.
340. Luborsky F. E. — «J. Phys. Chem.», 1958, 62, 1131.
341. Siemens and Halske Gesellschaft M. В. H. in Wien. Oster, pat.
№ 196134, 25.02.1958.
342. J a n g g G. — «Metall.», 1962, 16, 639.
343. Lihl F. — «Z. Metall.», 1955, 46. 434.
344. LihlF., KirnbauerH. — «Z. Metall.», 1957, 48. 9.
345. Lihl F., К i г n b a u e r H. — «Z. Metall.», 1957, 48. 61.
346. Волков Г. И. Получение хлора и щелочей электролизом с
ртутным катодом. М., «Химия», 1969.
347. As both К. Franz, pat. № 1026455, 05.1953.
348. HohnH. Oster pat. № 194616, 10.01.1958.
349. J ang g G. — «Atompraxis», 1962, 8, 87.
350. Oster pat. № 220378, 26.03.1962.
351. Stall W. — «Atompraxis», 1962, 8, № 3, 93.
352, D e an О. C. a. u. — US At. Energy Commiss. ORNL-—2242
(no |6]).
353. M e s s in g A. F., D e a n О. C. — US At. Energy Commiss.,
ORNL—1960, 21, 2871.
354. Reid R. C. a. u. — «Chem. Eng. Progr.», 1958, 54. 476.
355. Jangg G. Pat. USA № 3480428, 25.11.1969.
356. W i 1 s о n T. Ar. E. Pat. Eng. № 1160411, 6.08.1969.
357. Агладзе P. И., Федорова H. С. — «Ж. прикл. хим.»,
1941, 14, 305.
358. Агладзе P. И., Бацикадзе М. Г. Авт. свид-во СССР
№ 154413 от 30 марта 1962 г.; «Бюлл. изобр.», 1963, № 8.
359. Агладзе Р. И., Бацикадзе М. Г.— «Сообщения АН
ГрузОСР», 1963, 30, 739.
360. Jangg G., Z w е г е n z G., Hohn Н. — «Metall. und Technik-
metalle*, 1959, 13, 31.
361. J a n g g G. — «Metall.», 1965, 19, 728.
362. Бацикадзе M. Г. — В сб.: «Электрохимия марганца». Тби-
лиси, Изд-во АН ГрузССР, 1963.
363. Бацикадзе М. Г. Автореферат дисс. Тбилиси, 1964.
364. Ланге А. А. Автореферат дисс. Алма-Ата, 1969.
365. Pat. Eng. № 597220, 1944.
366. ГецкинЛ. С., Пономарев В. Д. — «Цветные металлы»,
1954, в. 1, 42.
367. Ра к о ч Г. М„ Матвеева С. Ф. — «Цветные металлы»,
К 56, в. 3, 20.
368. Lihl F. — «Monatshefte Chem.», 1955, 86, 186.
369. J a n g g G., Steppan F. — «Z. Metall.», 1965, 56, 172.
370. JanggG.- «Metall.», 1965, 19, 717.
371. Schweiz, pat. № 279968, 1.04.1952.
372. Schweiz, pat. № 281499, 16.06.1952.
265
373. Schmid t W.- «Metall.», 1949, 4, 10.
374. Borchers H. — «Z. Erz. Metall.», 1956, 9, 383.
375. Schweiz, pat. № 279967, 1.04.1952.
376. Messner G. Pat. USA № 3102805, 3.09.1963.
377. S c h m i d t W. Pat. USA № 3243281, 1966.
378. Баймаков Ю, В., В e т ю к о в M. M. Электролиз расплав-
ленных солей. М., «Металлургия*, 1966.
379. Алабышев А. Ф., Грачев К. Я., За редкий С. А.,
Лантратов М. Ф. Натрий, калий. М., Химиздат, 1959.
380. Wartenberg Н. — «Z. Elektrochem. angew. phys. Chem.»,
1914, 20, 443.
381. BarrattS. — «Trans. Faraday Soc.», 1929, 25, 758.
382. К 6 n i g J., К r i e g M. D. B. FDR pat. № 1083059, 5.04.1958.
383. Kakary, Kore, Dzaccu — «Japan Indust. Chem. Soc. J.
Chem. Soc.*, 1965, 68, 1248.
384. Macmullin R. — «Chem. Eng. Progress*, 1950, 46, 440.
385. Кляшторный M. И. — «Изв. вузов. Химия и хим. техноло-
гия», 1960, в. 4, 691.
386. Ш е к а И. А., Я а у с И. С., М и т ю р о в а Т. Т. Галлий. Киев,
Гостехиздат, 1963.
387- Вейсберг Л. Р. — В кн.: «Теория и практика выращивания
кристаллов*. М., «Металлургия», 1968.
388. Pl ust Н. G. FDR pat. № 1025632, 10.03.1956.
389. Р 1 u s t Н. G. FDR pat. № 1022012, 21.04.1956.
390. Еремин Н. И. Галлий. М., «Металлургия», 1964.
391. Масленицкий И. Н., Барышников И. Ф. и др. — В
кн.: «Основы металлургии», т. 5. М., «Металлургия», 1968.
3£2. Плаксин И. Н. Гидрометаллургия. Избранные труды. М.,
«Наука», 1972.
393, Козин Л. Ф., Хобдабергенов Р. Ж., Замулюкин
А. Т., Сапрыкина Т. И. Авторская заявка № 1218348/22—1 от
20.XI 1968.
394. Лакерник М. М. — В кн.: «Основы металлургии», т. 2. М.,
Металлургиздат, 1962.
395- J angg G.— «Powder Metallurgy», 1964, 7, 241.
396. Айзенкольб Ф. Успехи порошковой металлургии. М., «Ме-
таллургия», 1969.
397. EttmayerP., JanggG. — «Mh. Chem.», 1954, 9, 83.
398. К a 1 a c J. — «Hutn. Listy», 1954, 9, 83.
399. JanggG., FitzerE., AdlhartO., HohnH. — «Z. Me-
tall.», 1963, 54, 364.
400. JanggG., S c i z i G., H о h n H. — «Z. Metall.», 1959, 50,
460.
401. Oster, pat. № 196134, 25.02.1958.
402. Wright W. — «Povder Metallurgy», 1959, 2, 79.
403. Branland L„ Loffler I. A., F a 1 d t I.—«Swensk. kemisk.
Tidskrift*, 1956, 68, 380.
404. Luborsky F. E. — «J. Electrochem. Soc.», 1961, 108, 1138.
405. Luborsky F. E. — «J. appl. Phys.», 1961, 3, 171.
406. Luborsky F. E., Paine T. O., MendelsonnL. J. —
«Powder Metallurgy», 1959, 4, 57.
407. Waltenberger-Razniewska M., Starzewski L.,
Waniewski E. — «Ргасе», 1961, 1, 47.
408. W a 11 e n b e r g e r-R a z n i e w s k a M., Starzewski L„
Waniewski E. — «Abhandlugen der Deutschen Academie der Wissensc-
haften zu Berlin, Klasse fur Mathematic, Physik und Technik». Berlin, 1,
1962, 269.
266
409. Waltenberge г-R azniewska M., Razwadowska A.
Materialy Konfer. Metal. Proszkow. Krakow, 19—21.11.1963, Kom. Hutn.
RAN i SITPIH, 170—179.
410. J а г v i s R. H. Pat. USA Xs 3002898, 3.10.1961.
411. Янг Г., Б a x Г. — В кн.: «Справочное руководство по техни-
ческой электрохимии» (под ред. Г. Егера). М., «Металлургия», 1966,
стр. 45£.
412. L i h 1 F., Н о h n Н., К i г n b а и е г Н. Oster, pat. № 199376,
25.08.1958.
413. L i h 1 F.— «Z. Metall.», 1953, 44, 160.
414. К u s s E. — «Angew. Chem.», 1950, 22, 519.
415. Gaumann A. — «Schweiz. Arch, angew. wiss. u. Techn.»,
1955, 21, 337.
416. Jangg G.— «Arch. f. Eisenhuttenwesen», 1962, 33, 339.
417. L i h 1 F., H о w о t n у H. — «Z. Metall.», 1953, 44, 359.
418j Peaver R., Ananthanarayan J. — «Advan. X-ray
Anal.», 1964, 7, 117.
419. FitzerE., GerasimoffP. — «Z. Metall.», 1959, 50, 187.
420. Сажин H. П. Вещества высокой чистоты в науке и технике.
М., «Знание», 1969.
421. Фогель А. А. — «Изв. АН СССР. ОТН. Серия металл, и
топл.», 1959, Ха 2, 24.
422. R о п у Р. R. — «Trans. Vacuum Metallurgy Conf.», N. Y., 1964,
Boston Mass., 1965, 55—135.
423. Грубер Г. Плавка металлов электронным лучом. М„ ИЛ,
1963.
424. KirchmayerH. R. — «Z. Metall.», 1965, 56, 767.
ОГЛАВЛЕНИЕ
Предисловие ....... 3
Введение ........ 6
I. Растворимость металлов в ртути . . 9
Зависимость растворимости метал-
лов в ртути от температуры . . 11
Растворимость ртути в металлах 32
Несмешиваемость ртути и металлов
в жидком состоянии ... 37
Взаимное влияние металлов на ра-
створимость в ртути .... 41
Кинетика растворения металлов в
ртути..............................58
II. Термодинамические свойства амальгамных
систем ....... 67
Бинарные амальгамные системы —
Определение термодинамических
характеристик металлов по значе-
ниям их растворимости в рту-
ти .......................... . 81
Тройные амальгамные системы ... 93
Расчет термодинамических свойств
тройных амальгамных систем на ос-
новании данных о двойных гранич-
ных системах . . . . . * 111
Ш. Интерметаллические соединения металлов
в амальгамных системах .... 118
Природа интерметаллических сое-
динений с ртутью и в сложных
амальгамах ..... —
Интерметаллические соединения в
бинарных системах . . . 120
Интерметаллические соединения в
сложных амальгамах . . . 149
Кинетика образования и диссоциа-
ции интерметаллических соедине-
ний в ртутной фазе .... 163
IV. Процессы амальгамной пирометаллургии ... 173
Амальгамные методы получения
тугоплавких электроотрицательных
металлов ..... —
Амальгамные методы получения
металлов высокой чистоты фракци-
онной перекристаллизацией и экст-
ракцией при высоких температурах 203
V. Процессы порошковой амальгамной пироме-
таллургии ....... 220
Амальгамные методы получения
тонкодисперсных порошков ... —
Амальгамные методы получения
сплавов металлов .... 233
Зак лючение . . . . . . .246
Литература..................................254
Козин Леонид Фомич
АМАЛЬГАМНАЯ ПИРОМЕТАЛЛУРГИЯ
Утверждено к печати Ученым советом
Института органического катализа и электрохимии
Академии паук Казахской ССР
Редактор И» Л. Федорова
Худож. редактор А. Б. Мальцев
Художник Н, М. Кравцов
Техн, редактор В. К. Горячкина
Корректор В. И. Андриасян
♦ ♦ ♦
Сдано в набор 3/VIII 1973 г. Подписано к печати 14/XI 1973 г.
Формат 60X90716. Вумага № 1. Печ. л. 17. Уч.-изд. л. 18.
Тираж 1200. УГ05576. Цена 1 р. 64 к.
* ♦ *
Типография издательства «Наука» Казахской ССР, г. Алма-Ата
ул. Шевченко, 28. Зак. 122.