Текст
А.А. Кишкун
КЛИНИЧЕСКАЯ
ЛАБОРАТОРНАЯ
ДИАГНОСТИКА
УЧЕБНОЕ ПОСОБИЕ ДЛЯ МЕДИЦИНСКИХ СЕСТЕР
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
А. А. Кишкун
КЛИНИЧЕСКАЯ
ЛАБОРАТОРНАЯ
ДИАГНОСТИКА
УЧЕБНОЕ ПОСОБИЕ ДЛЯ МЕДИЦИНСКИХ СЕСТЕР
Москва
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР'Медиа»
2012
УДК 575
ББК 52.5
К26
Кишкун, Алексей Алексеевич.
К26 Клиническая лабораторная диагностика: учебное пособие для медицин¬
ских сестер. — М.: ГЭОТАР-Медиа, 2012. - 720 с.; ил.
15ВК 978-5-9704-1405-7
В учебном пособии представлены основные организационные аспекты
вы1юл1тения лабораторных исследований. Всесторонне рассмотрена роль
медици!тской сестры в процессе лабораторного тестирования. Значитель¬
ное внимание уделено особенностям подготовки пациентов к различным
видам исследований. Подробно описаны методы и способы взятия и сбора
биологического материала. Приведены основные подходы к оценке резуль¬
татов лабораторных анализов, которые ложна использовать медицинская
сестра в своей практике, с учетом кртических величин исследованных по¬
казателей, 'гребующих немедленных действий при оказании медицинской
помощи.
Во второй части учебного пособия подробно рассматриваются лабора¬
торные исследования, которые наиболее часто используются в клиничес¬
кой практике и к выполнению которых чаще всего привлекается средний
медицинский персонал.
Книга предназначена для медицинских работников среднего звена, спе¬
циалистов лаборатории, молодых врачей всех клинических специальнос¬
тей, а также организаторов здравоохранения.
УДК 575
ББК 52.5
Права на данное издание принадлежат ООО Издательская группа ^ГЭОТАР-Медиа».
Воспроизведение и распространение в каком бы то ни было виде части или целого издания не
могут быть осуществлены без писшенного разрешения ООО Издате-зьская группа «ГЭОТАР-
Медиа»
© Кишкущ А.А., 2012
© ООО Издательская группа «ГЭОТАР-Медиа», 2012
© ООО И.здатсльская группа «ГЭОТАР-Медиа»,
15ВЫ 978-5-9704-1405-7 офорлщение, 2012
ОГЛАВЛЕНИЕ
Киедение 14
Глава 1. Основы лабораторного обследования пациентов 18
1.1. Организационные принципы сыпо.тнения лабораторных
исследований 18
1.1.1. Структура и функции клинико-диагностической
лаборатории 21
1.2.1. Основные этапы выполнения лабораторных
исследований 31
1.2. Роль медицинской сестры в обеспечении качественного
.лабораторного обследования пациентов 37
1.2.1. Составление заявки на лабораторные исследования .. 37
1.2.2. Подготовка па[1,иента к лабораторным исследованиям. .45
1.2.2.1. Памятки пациентам по подготовке к лабораторным
исследованиям 49
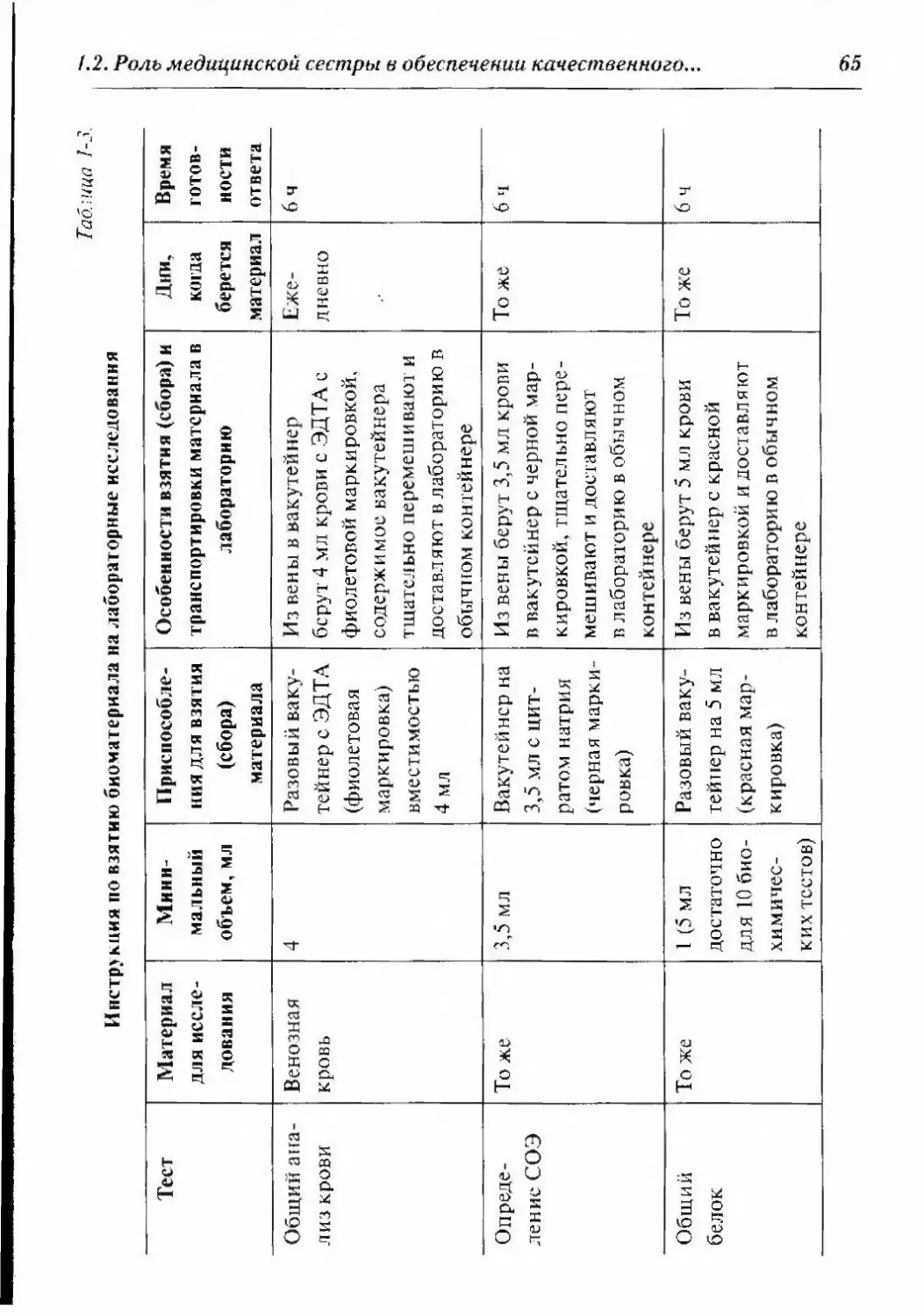
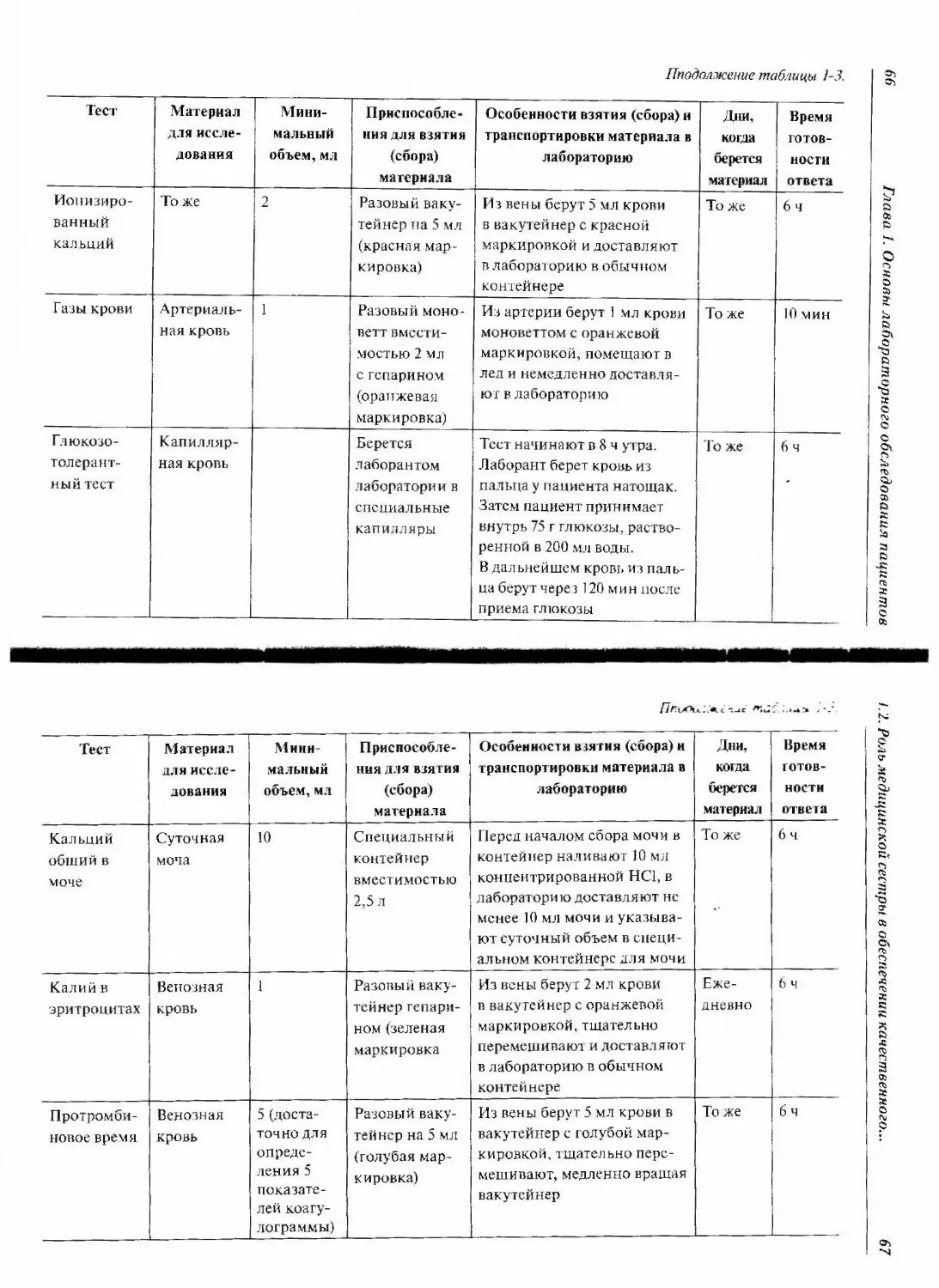
1.2.3. Взятие проб крови на лабораторные исследования.... 51
1.2.3.1. Приспособления, используемые для взятия
проб крови 52
1.2.3.2. Подготовка рабочего места для взятия крови ... .62
1.2.3.3. Выбор процедуры взятия крови 71
1.2.3.4. Процедура взятия крови 71
1.2.3.4.1. Взятие крови из вены 73
1.2.3.4.2. Взятие крови через сосудистый катетер 87
1.2.3.4.3. Взятие капиллярной крови 87
1.2.3.4.4. Методика взятия крови из артерии 90
1.2.3.5. Критерии оценки качества взятых проб крови ... 91
1.2.3.6. Ос,ложнения и возможные затруднения при взятии
крови 94
1.2.3.7. Типичные ошибки при взятии проб крови 95
1.2.4. Сбор других видов биоматериала
Д.ЛЯ лабораторных исследований 101
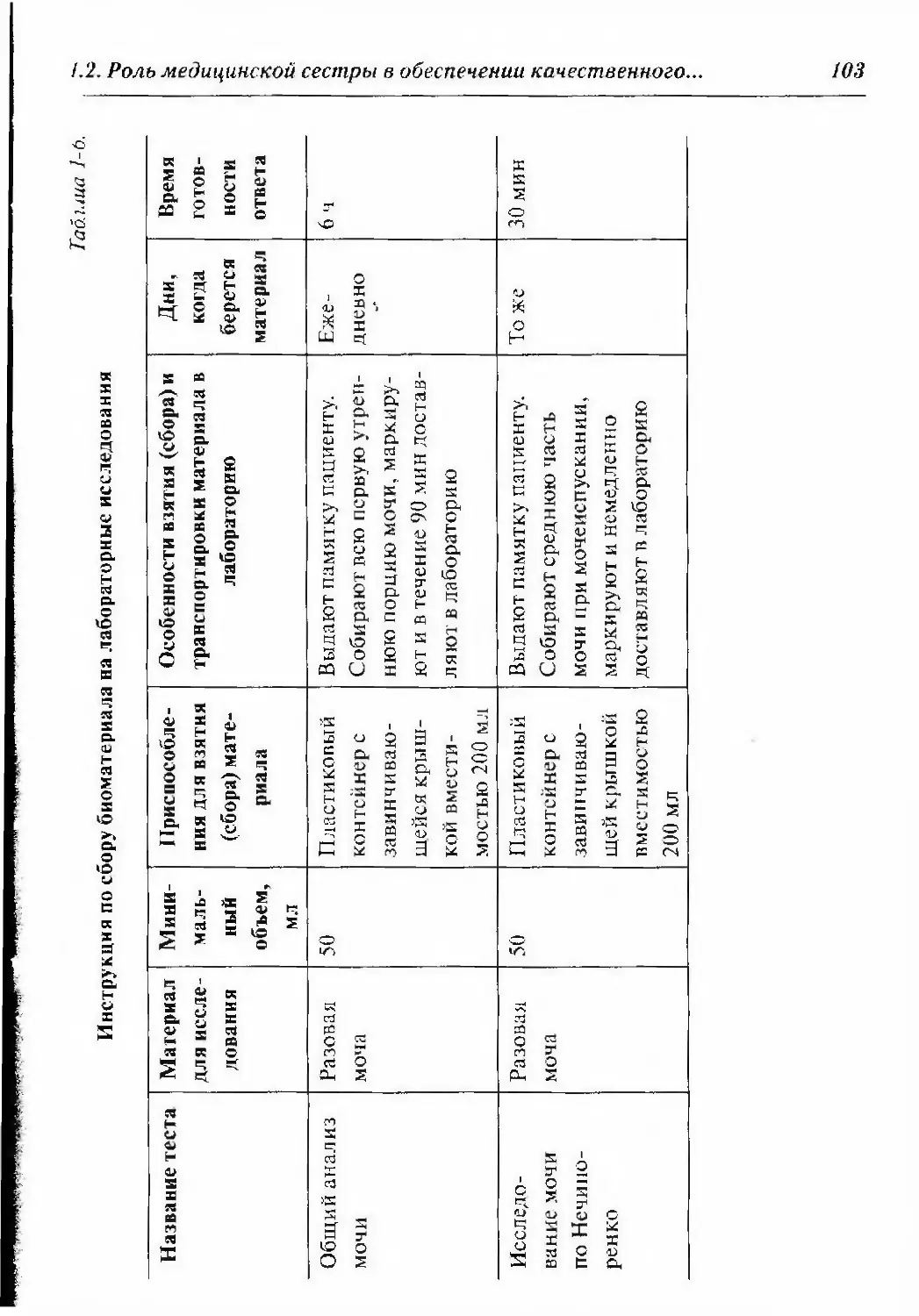
1.2.4.1. Пробы мочи 101
1.2.4.2. Получение спинномозговой жидкости (ликвора) . 115
1.2.4.3. Получение синовиальной жидкости 116
1.2.4.4. Получение плевральной, перикардиальной
и перитонеальной жидкости 117
Оглавление
1.2.4.5. Получение материала из уретры 117
1.2.4.6. Сбор мокроты 118
1.2.4.7. Получение бронхоальвеоляриого смыва 118
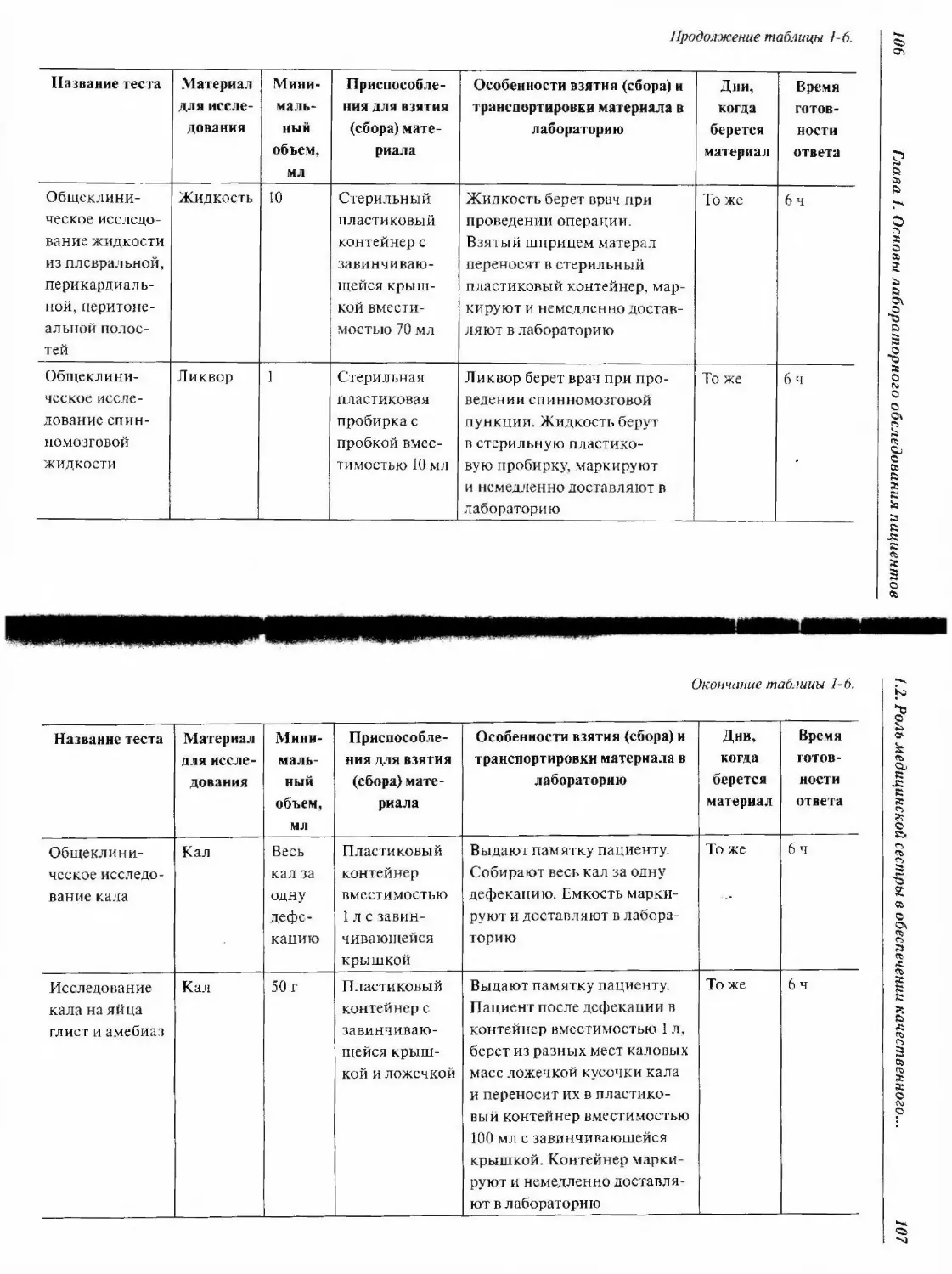
1.2.4.8. Сбор кала 119
1.2.5. Взятие и сбор биоматериала на бактериологические
исследования 120
1.2.6. Организация доставки проб крови и собранного
биологического материала в лабораторию 123
1.2.7. Обеспечение безопасности мри сборе
и транспортировке проб биологического материала 130
1.2.8. Прием проб крови и собранного биологического
материала в лаборатории 131
1.3. Оценка результатов лабораторных исследований 133
1.3.1. Единицы измерения, используемые
в клинико-диагностических лабораториях 134
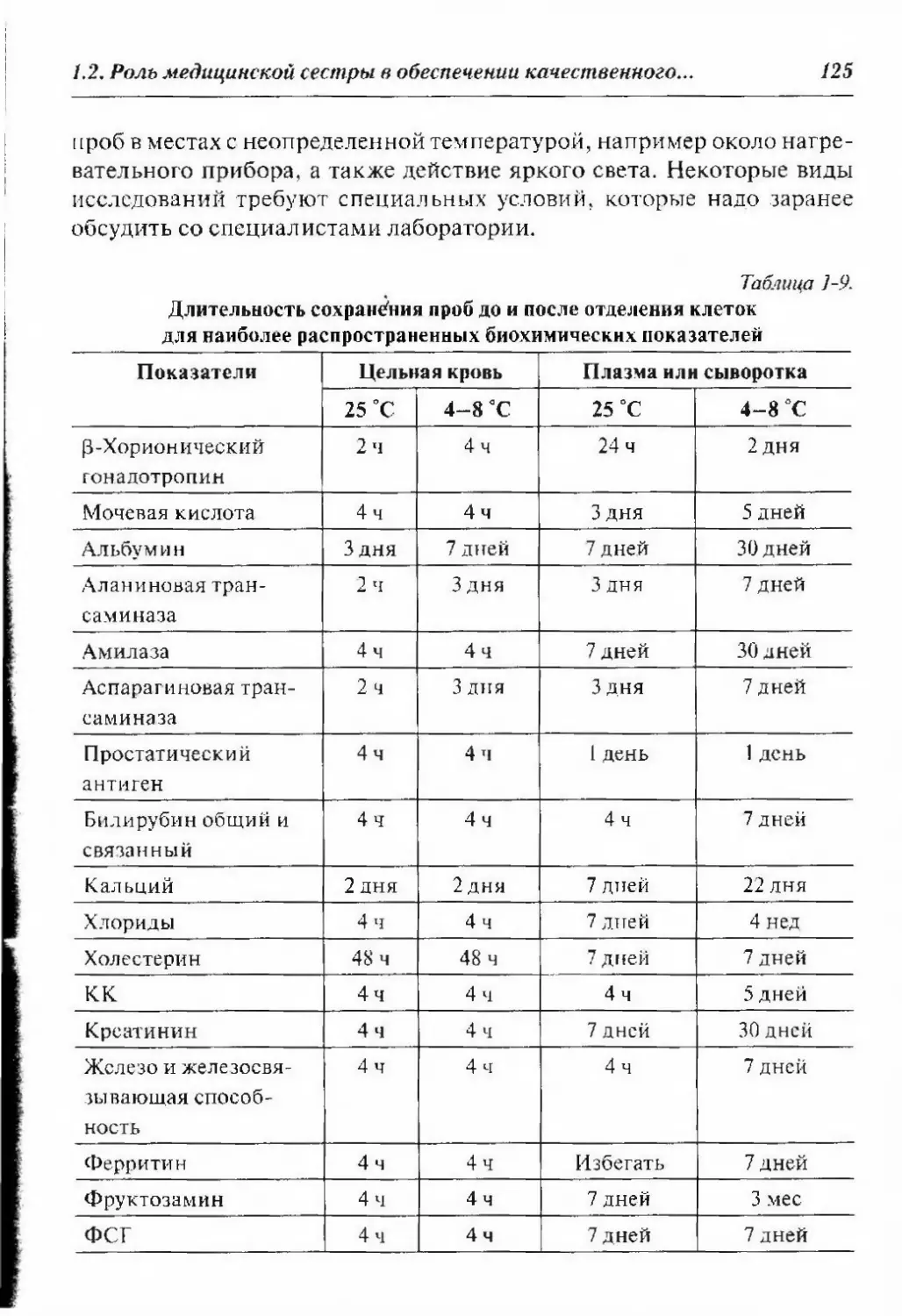
1.3.2. Понятие нормальной и референтной величины 137
1.3.3. Факторы, оказывающие влияние на результаты
лабораторных исследований 142
1.3.4. Результаты лабораторных исследований,
требующие немедленных действий при оказании
медицинской помощи 144
Глава 2. Гематологические исследования 147
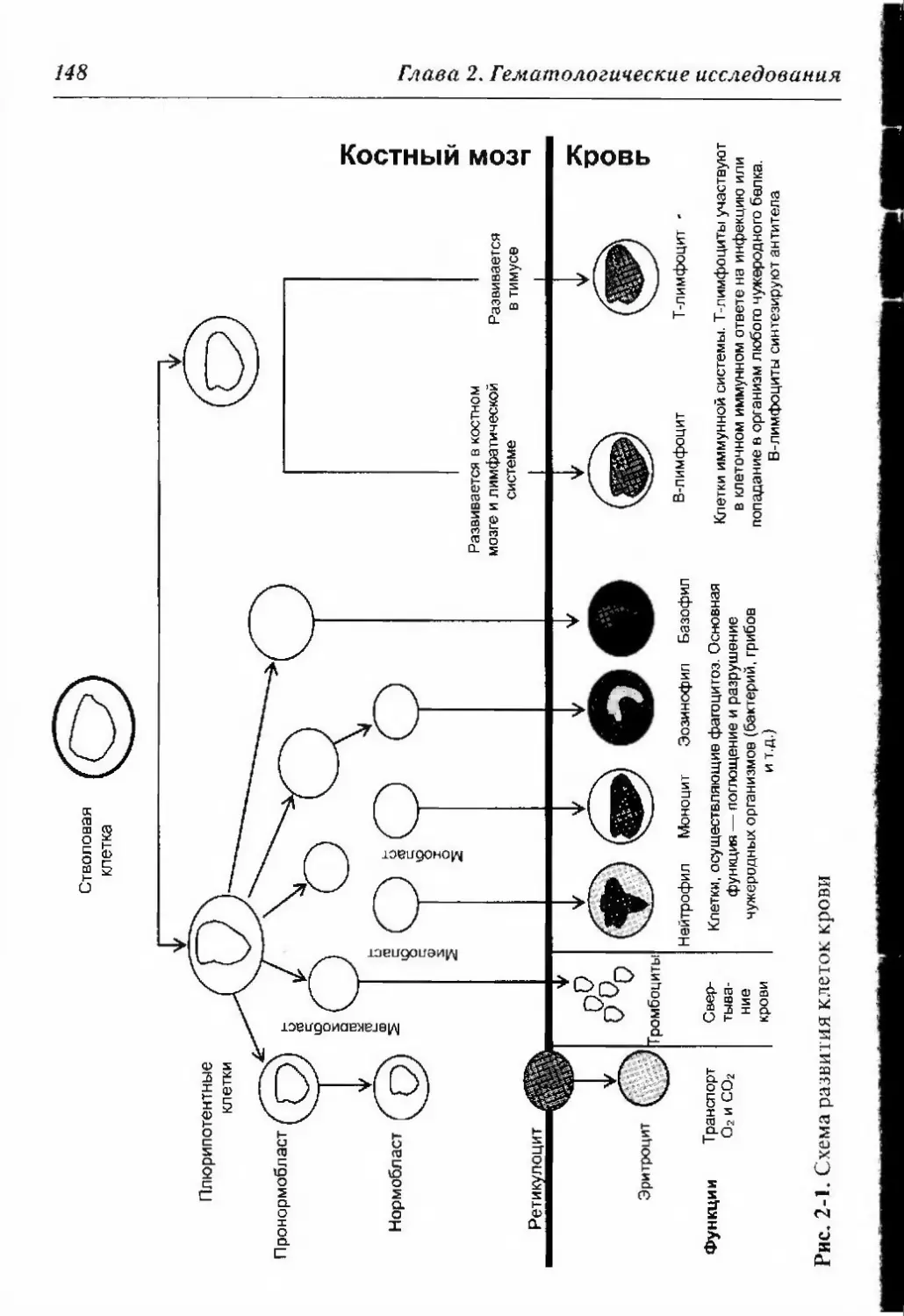
2.1. Основы кроветворения 147
2.2. Общий анализ крови 150
2.2.1. Эритроциты, гемоглобин, гематокрит
и индексы эритроцитов 152
2.2.1.1. Структура и функции эритроцитов 152
2.2.1.2. Структура и функции гемоглобина 153
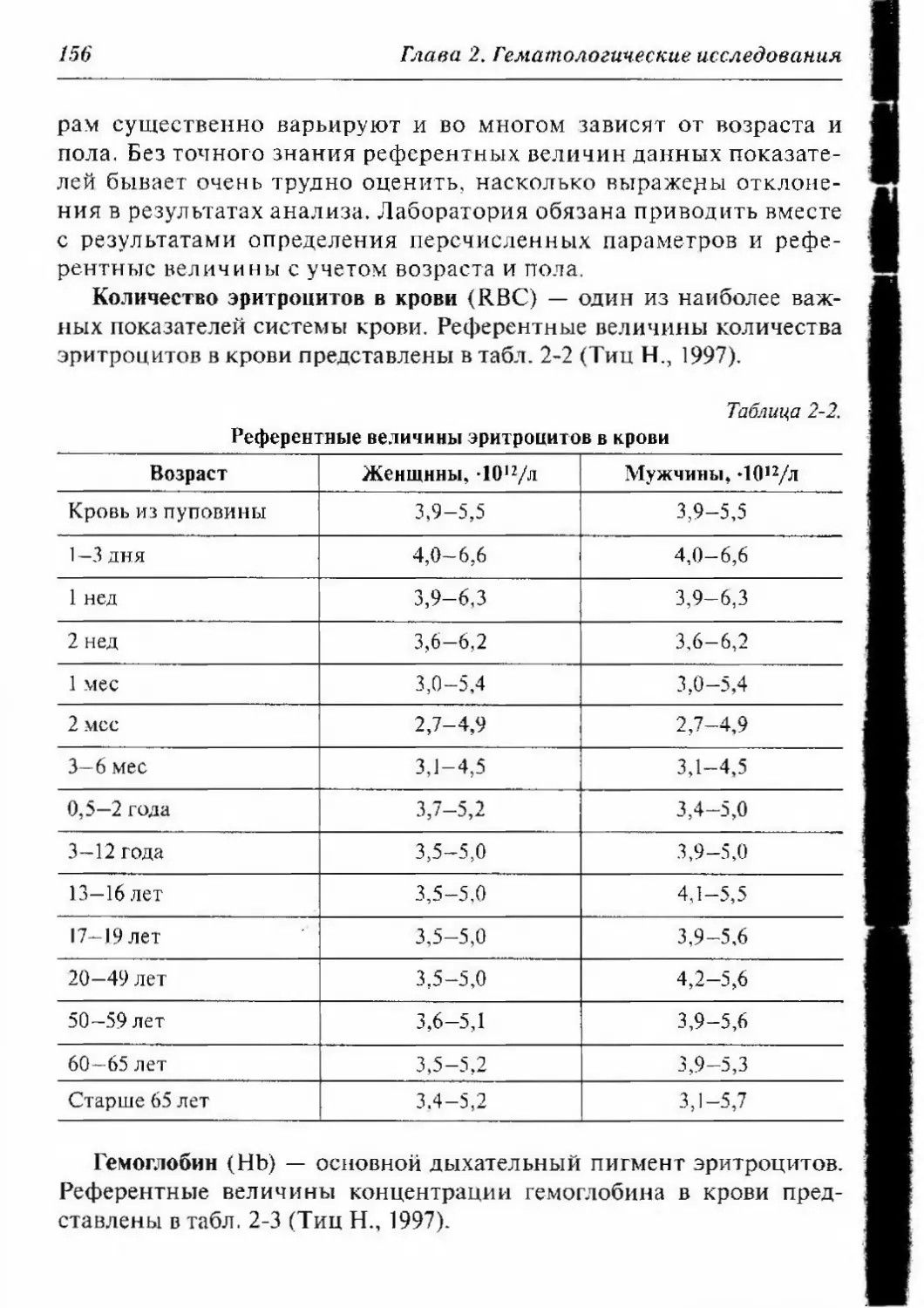
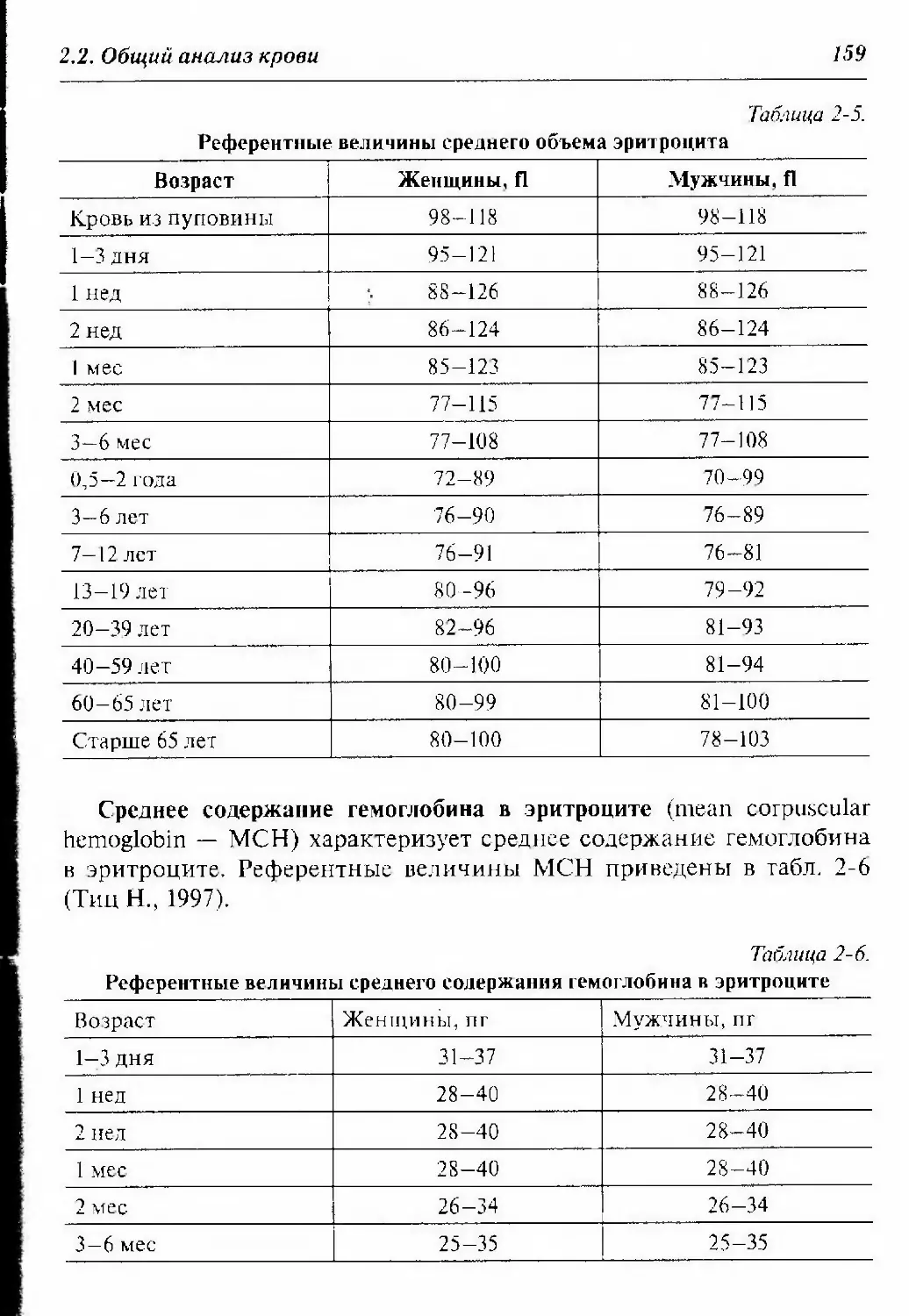
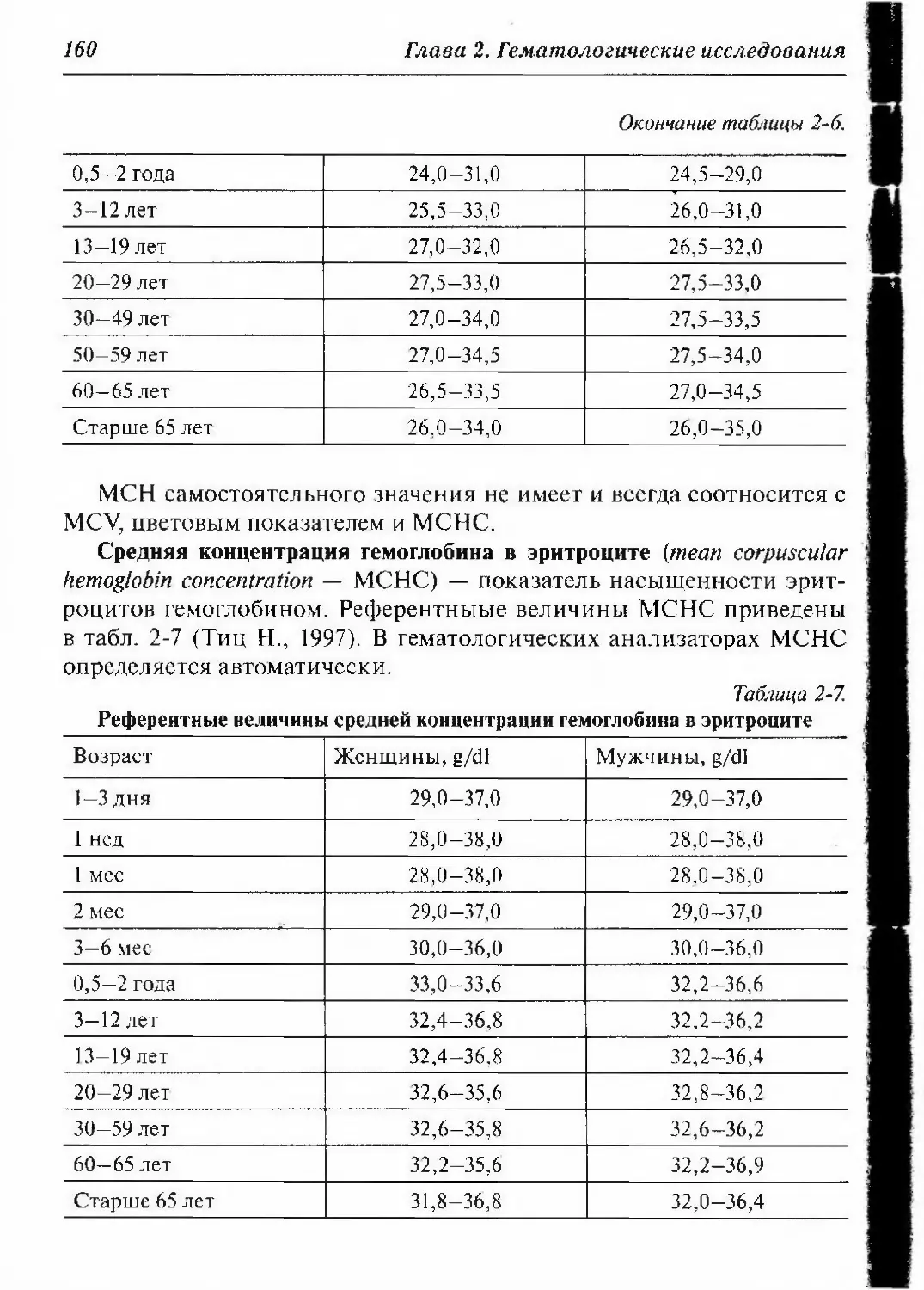
2.2.1.3. Референтные величины количества эритроцитов,
гемоглобина, гематокрита и индексов эритроцитов 155
2.2.1.4. Патологические состояния, связанные
со снижением количества эритроцитов, гемоглобина
и ге.матокрита 161
2.2.1.5. Патологические состояния, связанные
с повышением количества эритроцитов, гемоглобина
и величины гематокрита 166
2.2.1.6. Изменения морфологии эритроцитов 167
2.2.1.7. Гемоглобинопатии 169
Оглаление
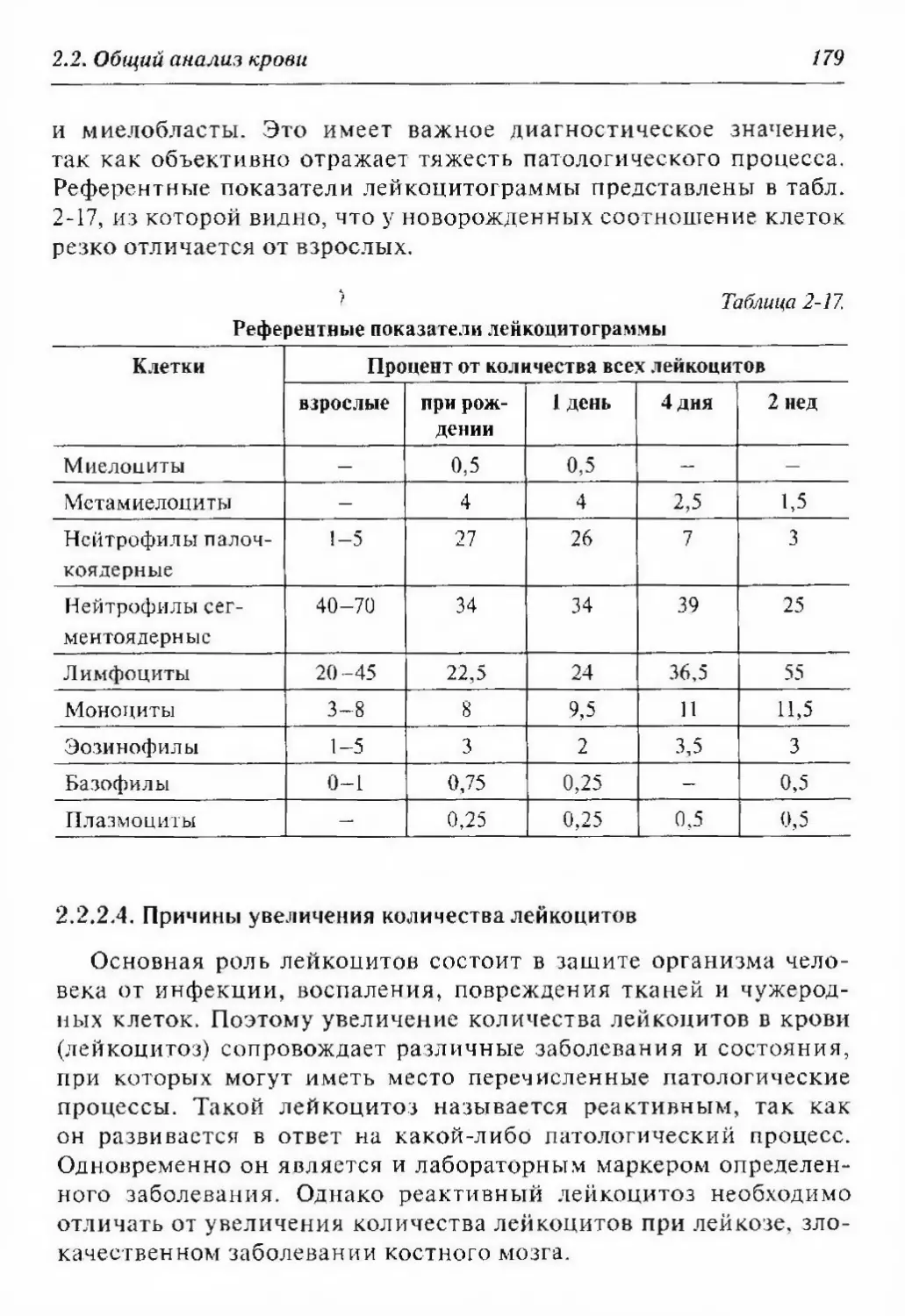
2.2.2. Лейкоциты и лейкоцитарная формула 170
2.2.2.1. Структура и функции лейкоцитов 172
2.2.2.2. Референтные величины количества
лейкоцитов 174
2.2.2.3. Лейкоцитарная формула 178
2.2.2.4. Причины увеличения количества лейкоцитов... 179
2.2.2.5. Причины снижения количества
лейкоцитов 183
2.2.2.6. Изменения лейкоцитарной формулы 185
2.2.2.7. Лейкозы 186
2.2.2.7.1. Острые лейкозы 187
2.2.2.7.2. Хронические лейкозы 188
2.2.3. Скорость оседания эритроцитов 190
2.2.3.1. Факторы, определяющие скорость оседания
эритроцитов 190
2.2.3.2. Причины повышения скорости оседания
эритроцитов 192
2.2.3.3. Причины снижения скорости оседания
эритроцитов 193
2.2.4. Тромбоциты 194
2.2.4.1. Структура и функции тромбоцитов 194
2.2.4.2. Референтные величины количества
тромбоцитов 194
2.2.4.3. Причины снижения количества тромбоцитов... 195
2.2.4.4. Причины повышения количества тромбоцитов — 197
2.3. 1^етикулоциты 197
2.3.1. Референтные величины количества
ретикулоцитов 197
2.3.2. Причины отклонения количества ретикулоцитов
от нормы 198
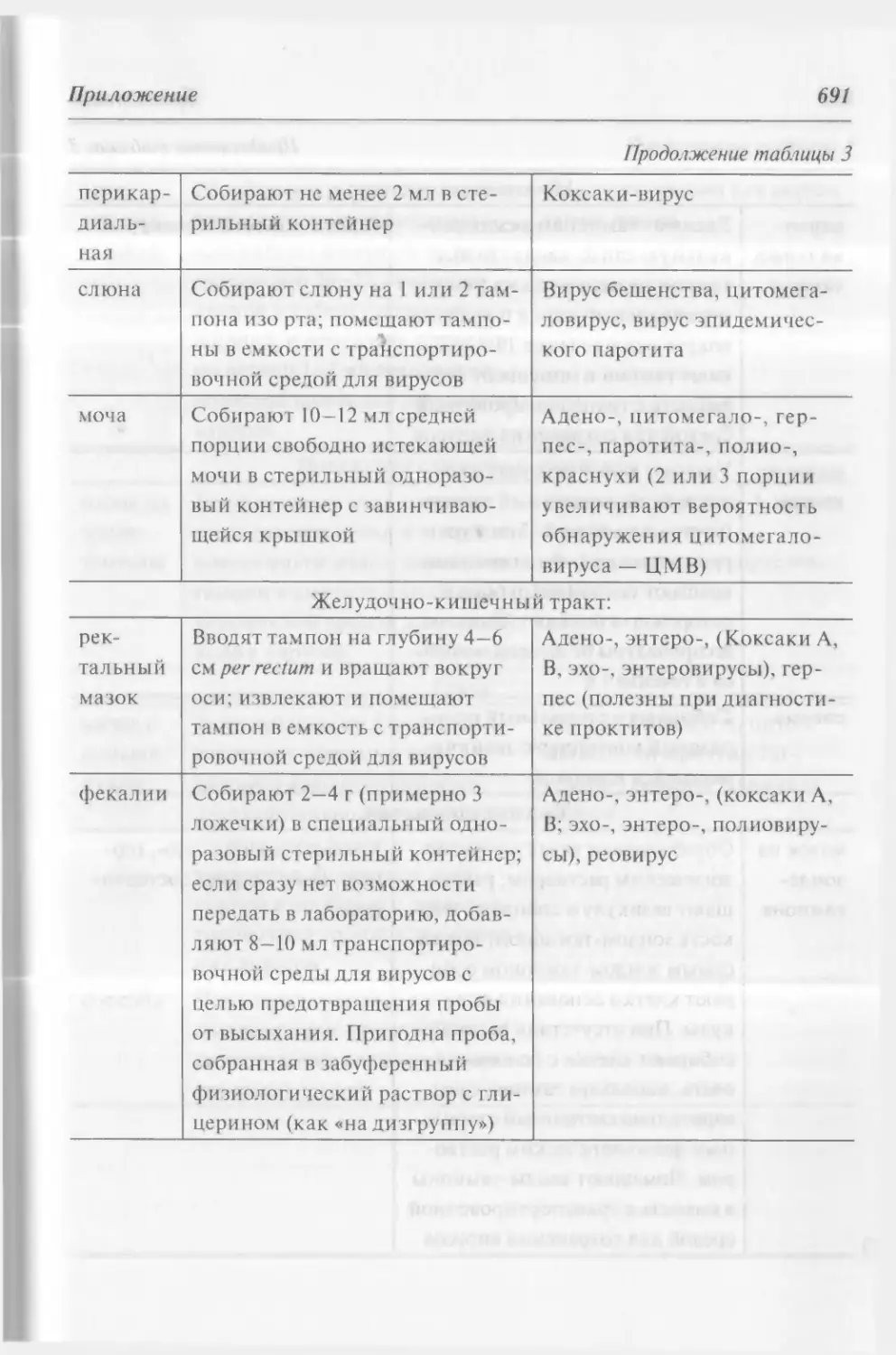
Глава 3. Общеклинические исследования 199
3.1. Исследование мочи 199
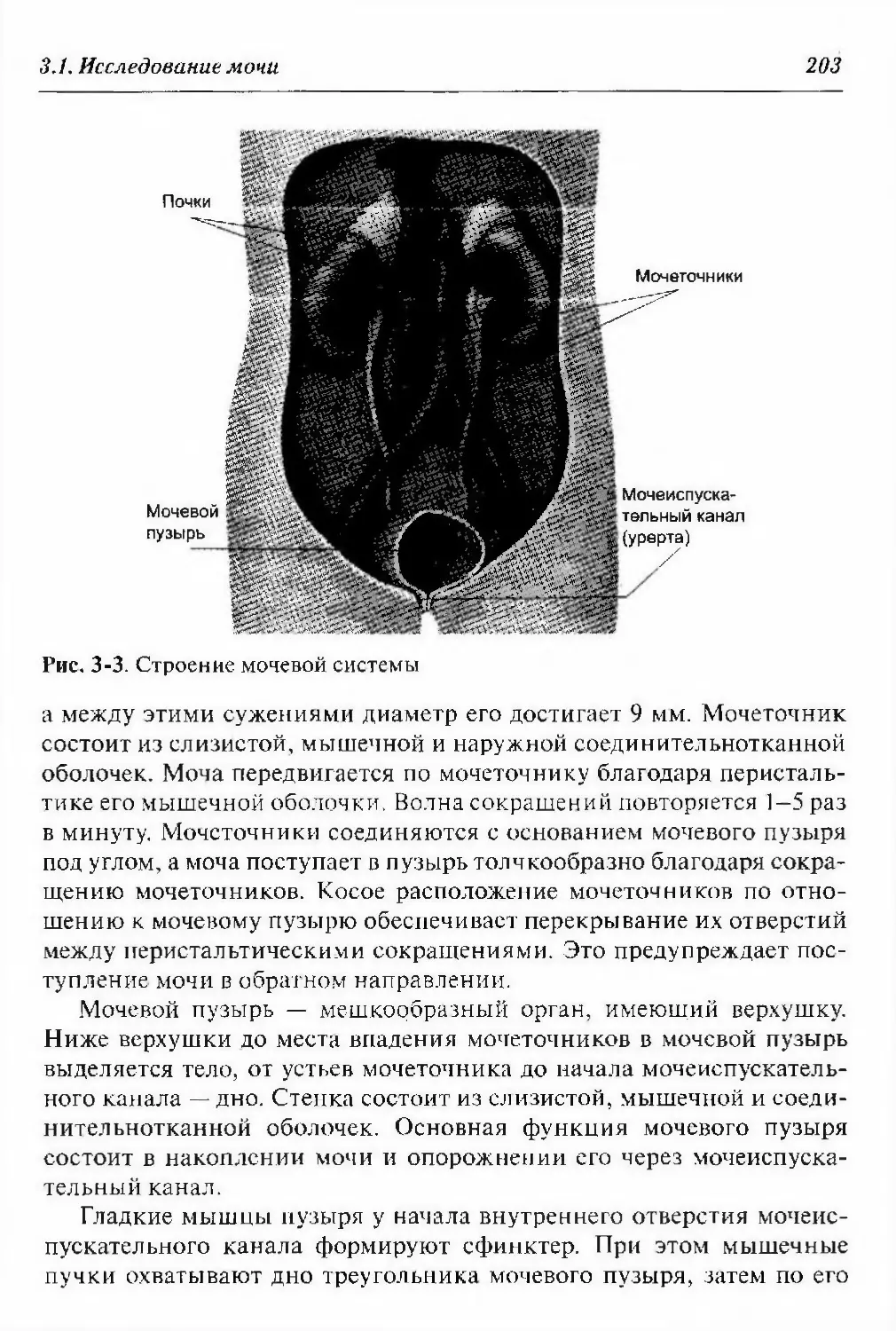
3.1.1. Образование и выведение мочи 200
3.1.2. Общий анализ мочи 205
3.1.3. Анализ мочи по Зимницкому 213
3.1.4. Анализ мочи по Нечипоренко 215
3.1.5. Стаканные пробы мочи 215
Оглавление
3.2. Общеклиническое исследование мокроты 216
3.3. Исследование кала 220
3.3.1. Общеклиническое исследование кала 220
3.3.2. Обнаружение скрытой крони в кале 224
3.4. Общеклиническое исследование отделяемого
из уретры 228
Глава 4. Цитологические исследования 230
4.1. Общие принципы цитологической диагностики опухолей . .230
4.1.1. Особенности взятия биологического материала
для цитологических исследований 232
4.2. Цитологическое исследование мазков из шейки матки... .233
4.2.1. Анатомия и .эпителий шейки матки 233
4.2.2. Рак шейки матки 236
4.2.3. Особенности взятия мазков из шейки матки 237
4.3. Цитологический анализ мокроты 240
4.4. Цитологический анализ мочи 242
Глава 5. Биохимические исследования 244
5.1. Белки и белковые фракции 244
5.1.1. Синтез и метаболизм белков 245
5.1.2. Исследование общего белка 248
5.1.3. Определение белка в суточной моче 250
5.1.4. Белковые фракции сыворотки крови
(электрофорез белков) 251
5.1.5. Специфические белки 256
5.1.6. С-реактивный белок 260
5.2. Показатели азотистого обмена 262
5.2.1. Мочевина и креатинин 264
5.2.2. Регуляция почками уровня мочевины
и креатинина в крови 266
5.2.2.1. Причины изменения концентрации
мочевины 268
5.2.2.2. Причины изменения концентрации
креатинина 272
5.2.3. Клиренс эндогенного креатинина
(проба Реберга—Тареева) 274
5.2.4. Мочевая кислота 280
Оглаление
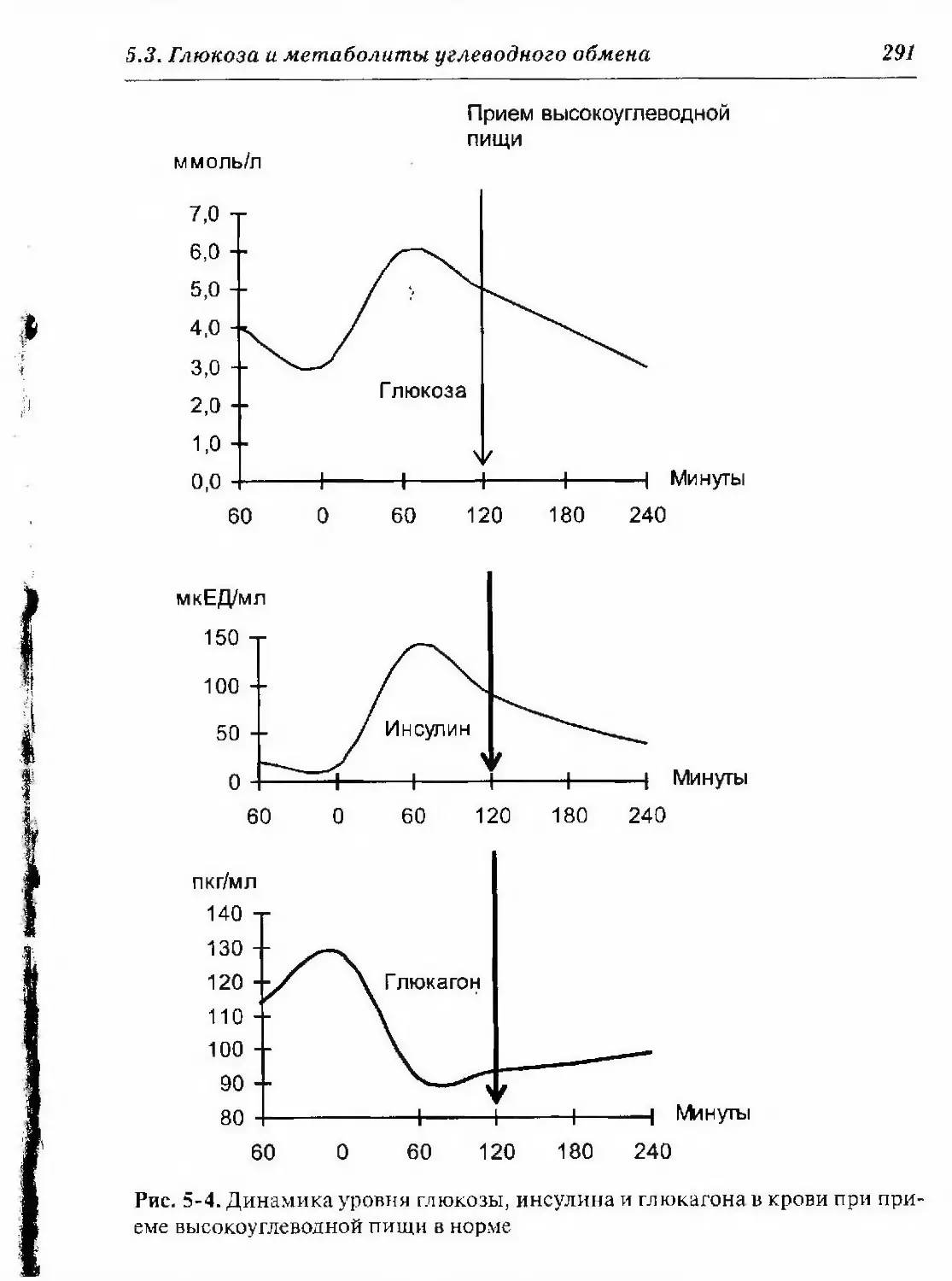
Г».3. Глюкоза и метаболиты углеводного обмена 284
0.3.1. Метаболизм глюкозы 284
5.3.1.1. Основные механизмы поддержания
нормального уровня глюкозы в крови 287
5.3.1.2. Причины патологических изменений
уровня глюкозы в крови 292
5.3.1.2.1. Сахарный диабет 293
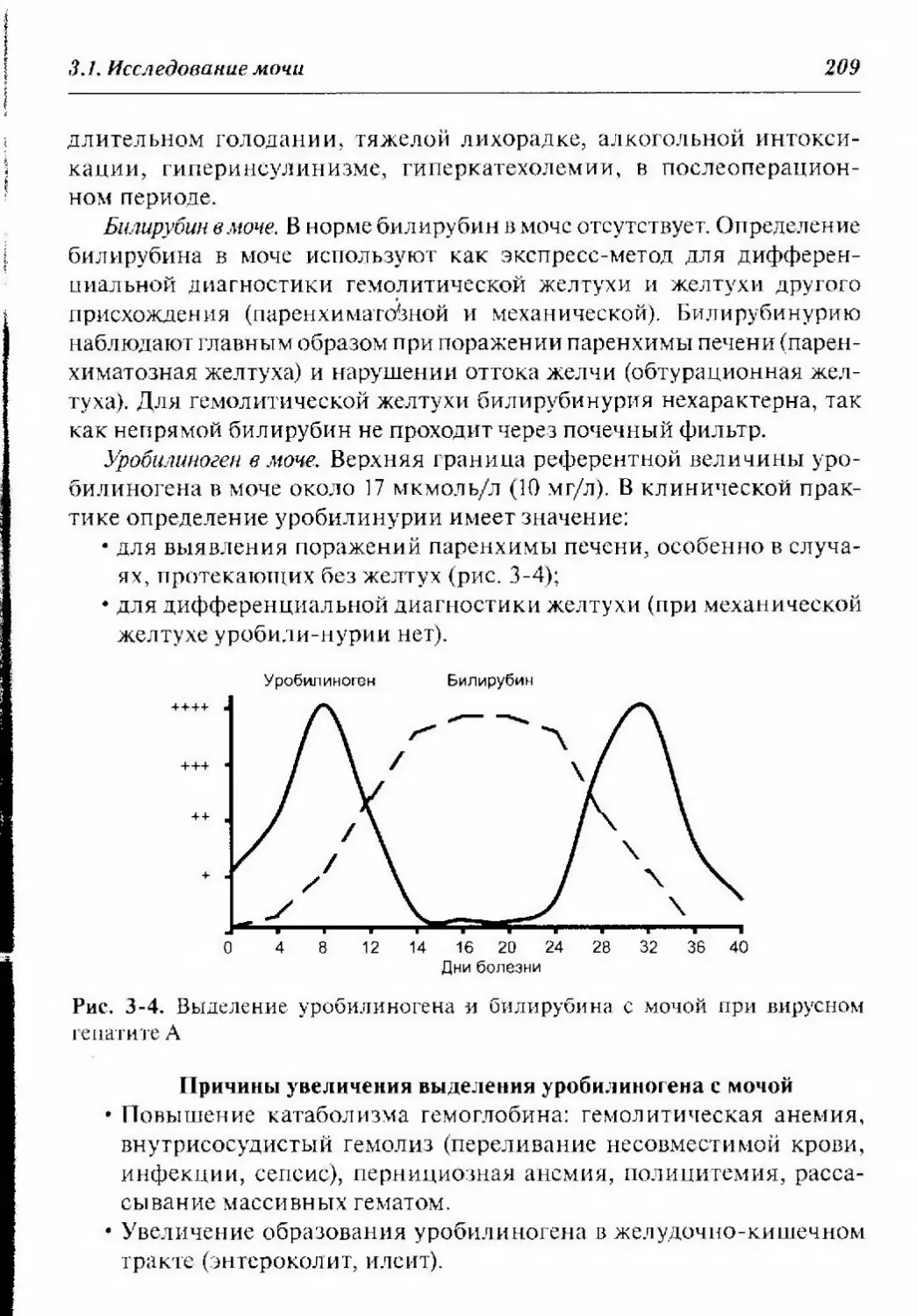
5.3.1.2.2. Диагностика сахарного диабета 295
5.3.1.2.2.1. Исследование глюкозы в крови 296
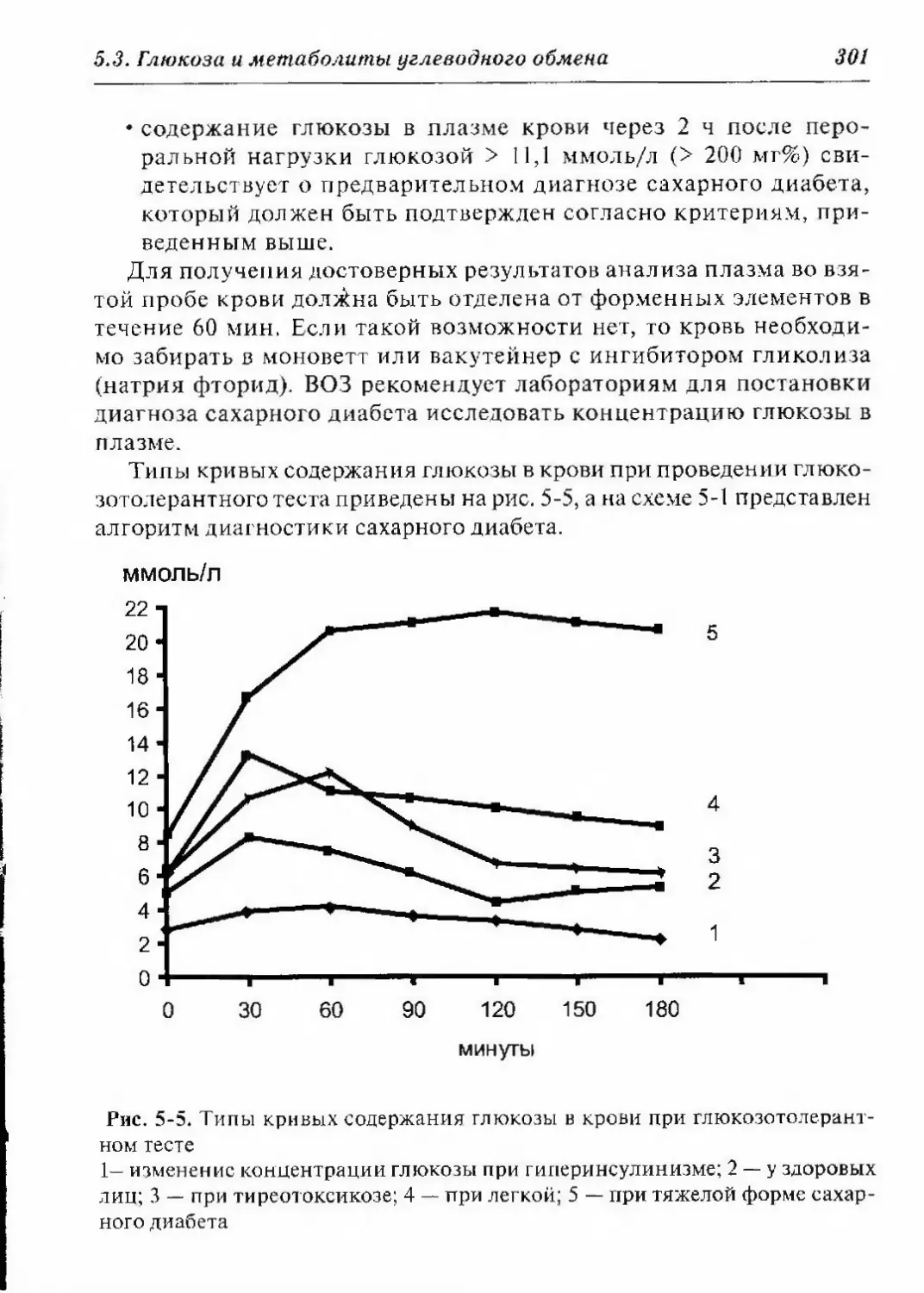
5.3.1.2.2.2. Глюкозотолерантный тест 297
5.3.1.2.2.3. Исследование мочи на глюкозурию .. .297
5.3.1.2.3. Критерии диагностики сахарного диабета— 299
5.3.1.2.3. Гипогликемия 303
5.3.1.2.4. Осложнения сахарного диабета
и их мониторинг 304
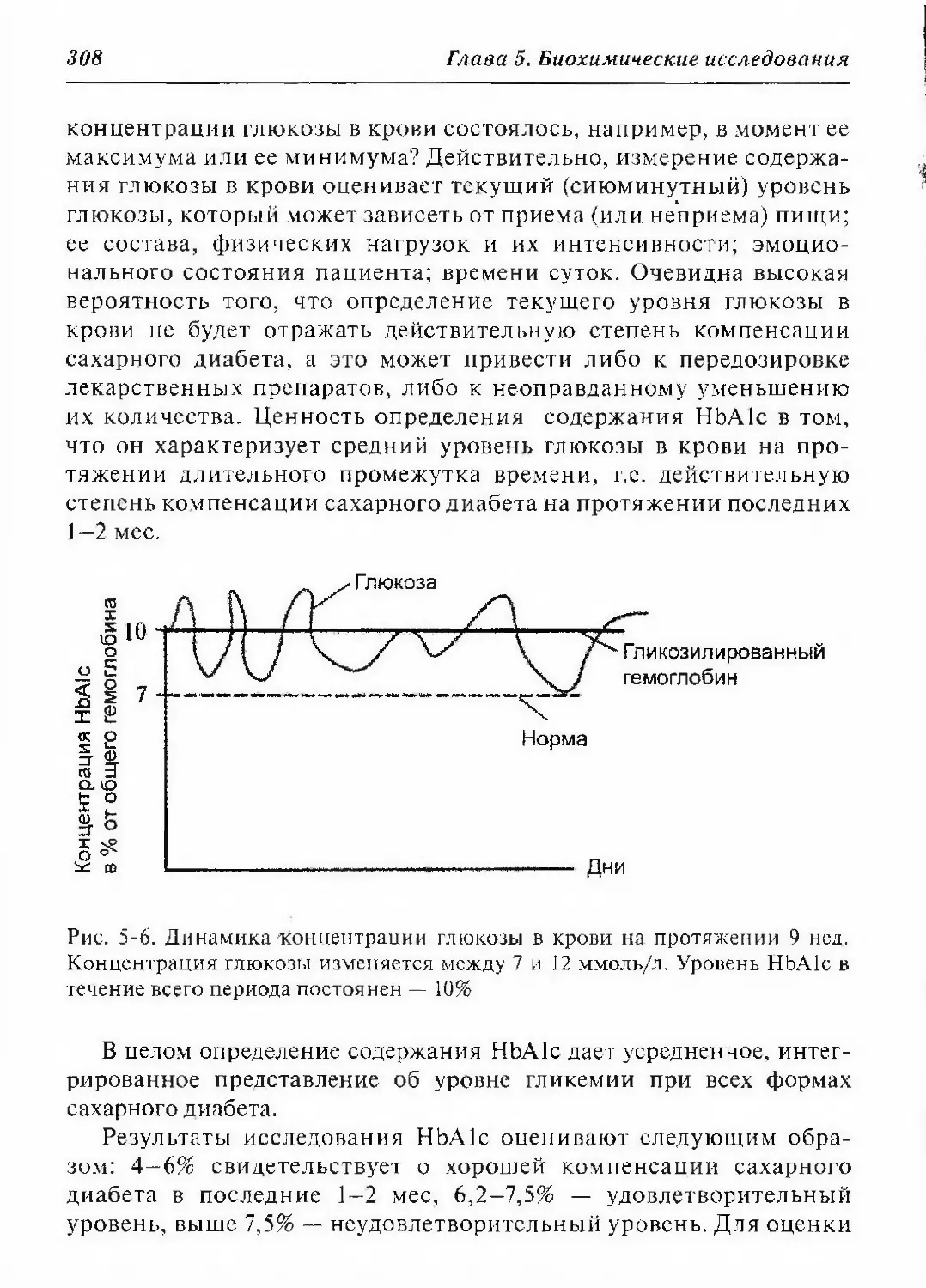
5.3.1.2.4.1. Гликозилированный гемоглобин 307
5.3.1.2.4.2. Кетоновые тела в моче 309
5.3.1.2.4.3. Альбумин в моче
(микроальбуминурия) 309
5.3.1.2.4. Мониторинг уровня глюкозы в крови
самим пациентом 310
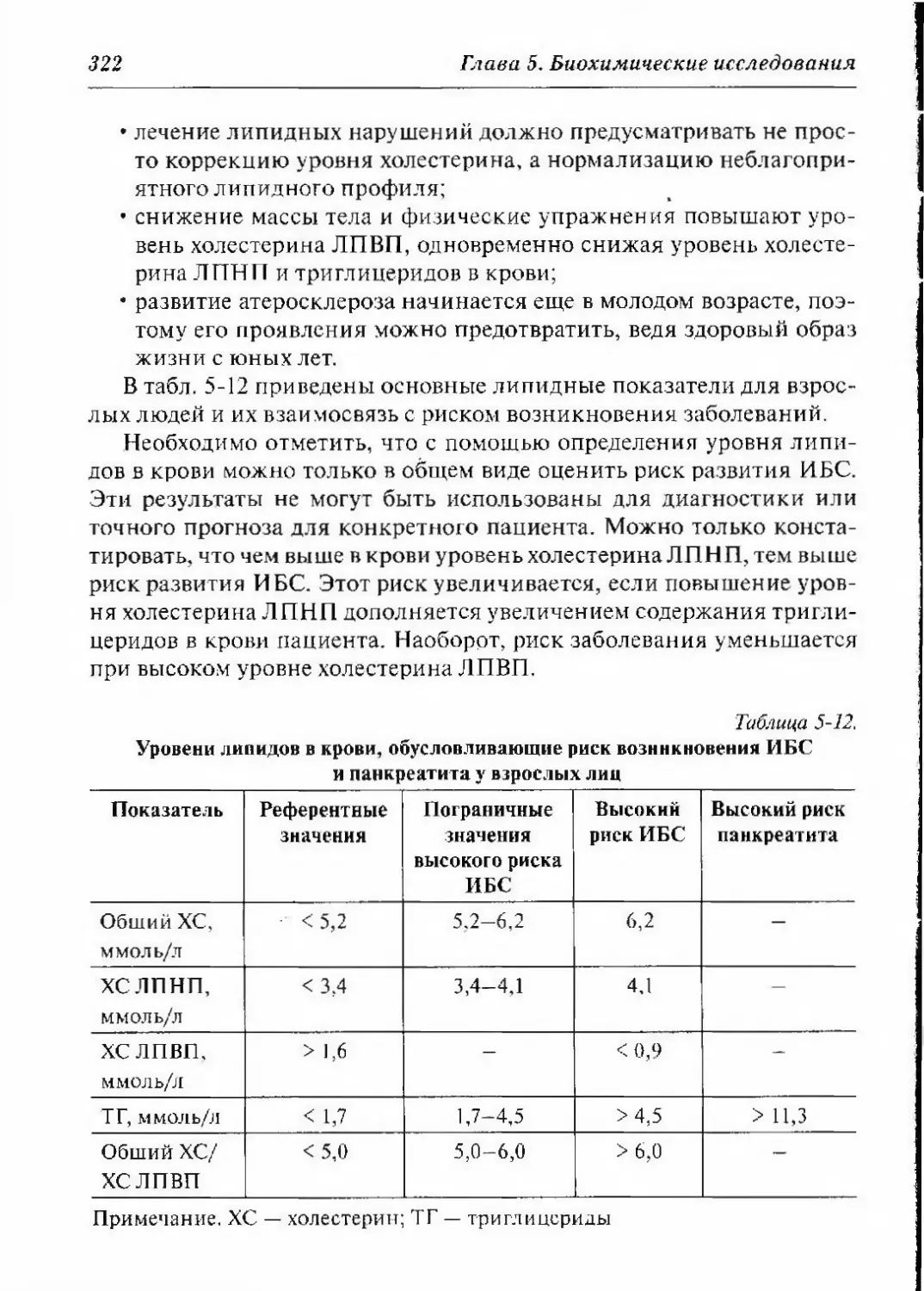
5.-1. Холестерин, триглицериды и липопротеины 312
5.4.1. Функции холестерина, триглицеридов и липопротеинов. .313
5.4.2. Транспорт холестерина и триглицеридов 315
5.4.3. Рекомендуемые величины уровня холестерина
и триглицеридов в крови 317
5.4.4. Последствия повышения уровня холестерина
и/или триглицеридов в крови 319
5.4.5. Причины повышения уровня холестерина
и/или триглицеридов в крови 323
Г).Г), Ферменты 323
5.5.1. Структура и функции ферментов 324
5.5.2. Клиническое значение опреде-пения
активности ферментов 326
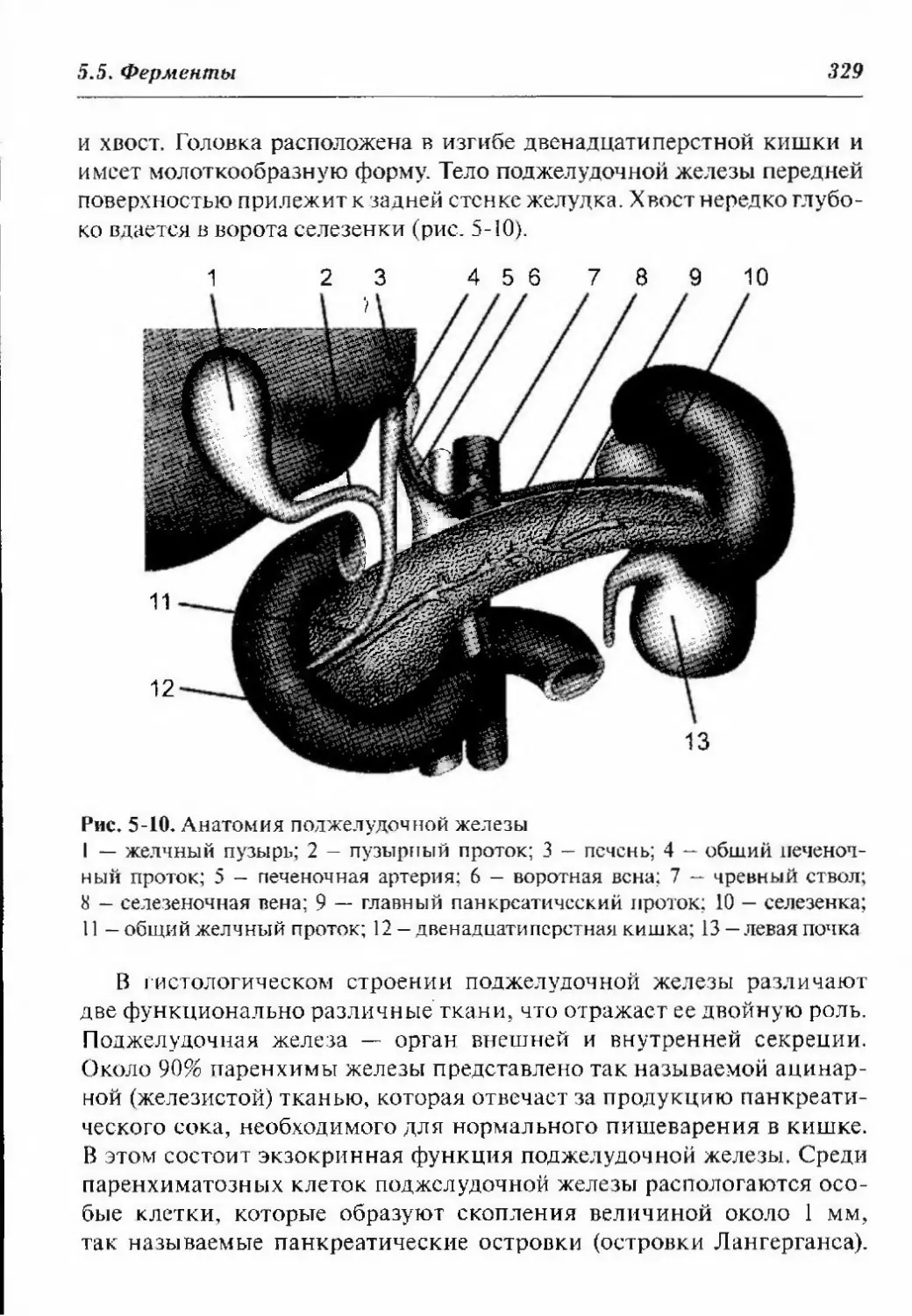
5.5.3. Маркеры повреждения поджелудочной железы 328
5.5.3.1. Структура и функции поджелудочной железы . .328
5.5.3.2. Ферменты поджелудочной железы 332
5.5.3.2.1. а-Амилаза 332
5.5.3.2.2. Липаза 333
Оглавление
5.5.3.3. Причины и клиническое значение повышения
активности ферментов поджелудочной железы 333
5.5.4. Маркеры повреждения миокарда 338
5,5.4.]. Аспартатаминоансфераза 338
5.5.4.2. Креатинкиназа 339
5.5.4.3. Лактатдегидрогеназа 339
5.5.4.4. ,Мио1лобин 340
5.5.4.5. Тропонины 340
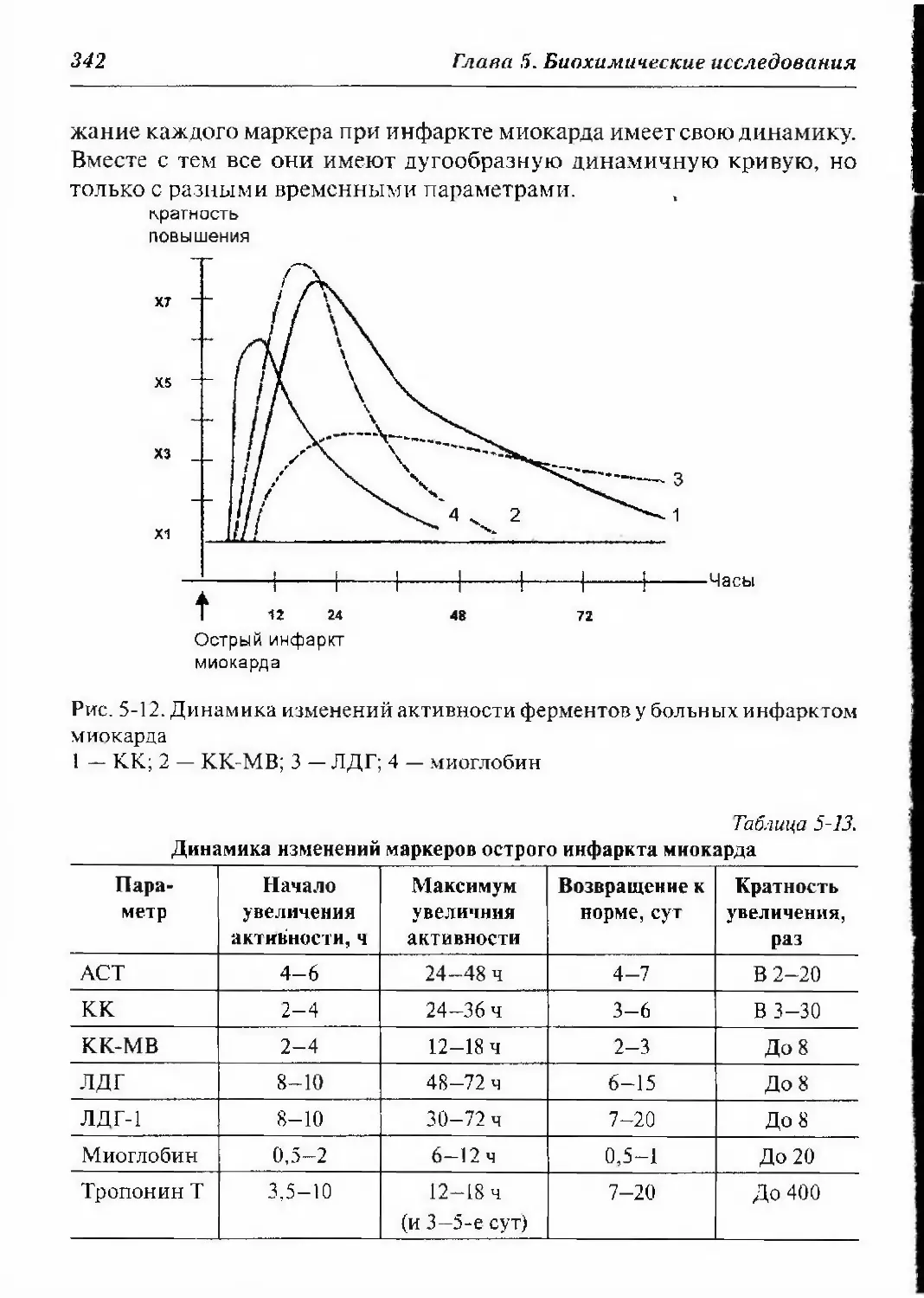
5.5.4.6. Динамика изменений миокардиальных маркеров
при инфаркте миокарда 341
5.5.4.7. Роль миокардиальных маркеров в диагностике
инфаркта миокарда 344
5.5.4.8. Изменение активности ферментов
при других заболеваниях 346
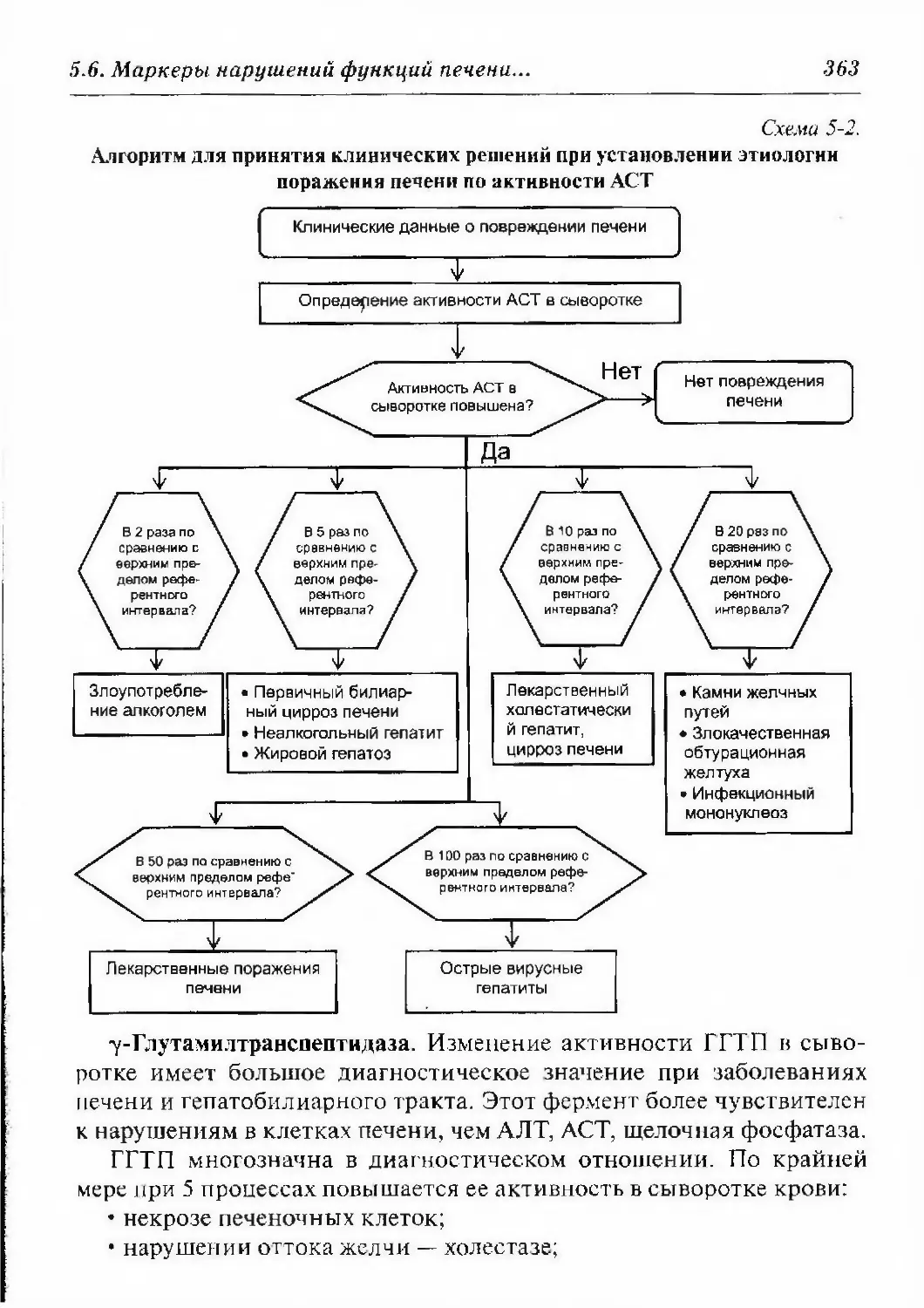
5.6. Маркеры нару{иений функций печени (функциональные
пробы печени) 348
5.6.1. Функции печени 349
5.6.2. Билирубин 351
5.6.3. Альбумин 354
0.6.4. Гамма-глютамилтранспептидаза,
аланинамииотрансфераза и щелочная фоефатаза 355
5.6.5. Причины изменения концентрации
билирубина в крови 357
5.6.6. Причины изменения концентрации
альбумина в крови 360
5.6.7. Причины изменения активности
ферментов в крови 361
5.7. Исследование электролитного баланса 367
5.7.1. Гомеостаз натрия 368
5.7.1.1. Лабораторная оценка состояния водного
и натрисво1'о баланса 371
5.7.1.1.1. Гипонатриемия 372
5.7.1.1.2, Гинернатриемия 375
5.7.2. Гомеостаз калия 376
5.7.2.1. Гипокалиемия 377
5.7.2.2. Гиперкалиемия 379
5.7.3. Гомеостаз кальция 381
5.7.3.1. Гипокальциемия 384
5.7.3.2. Гиперкальциемия 386
Оглаление
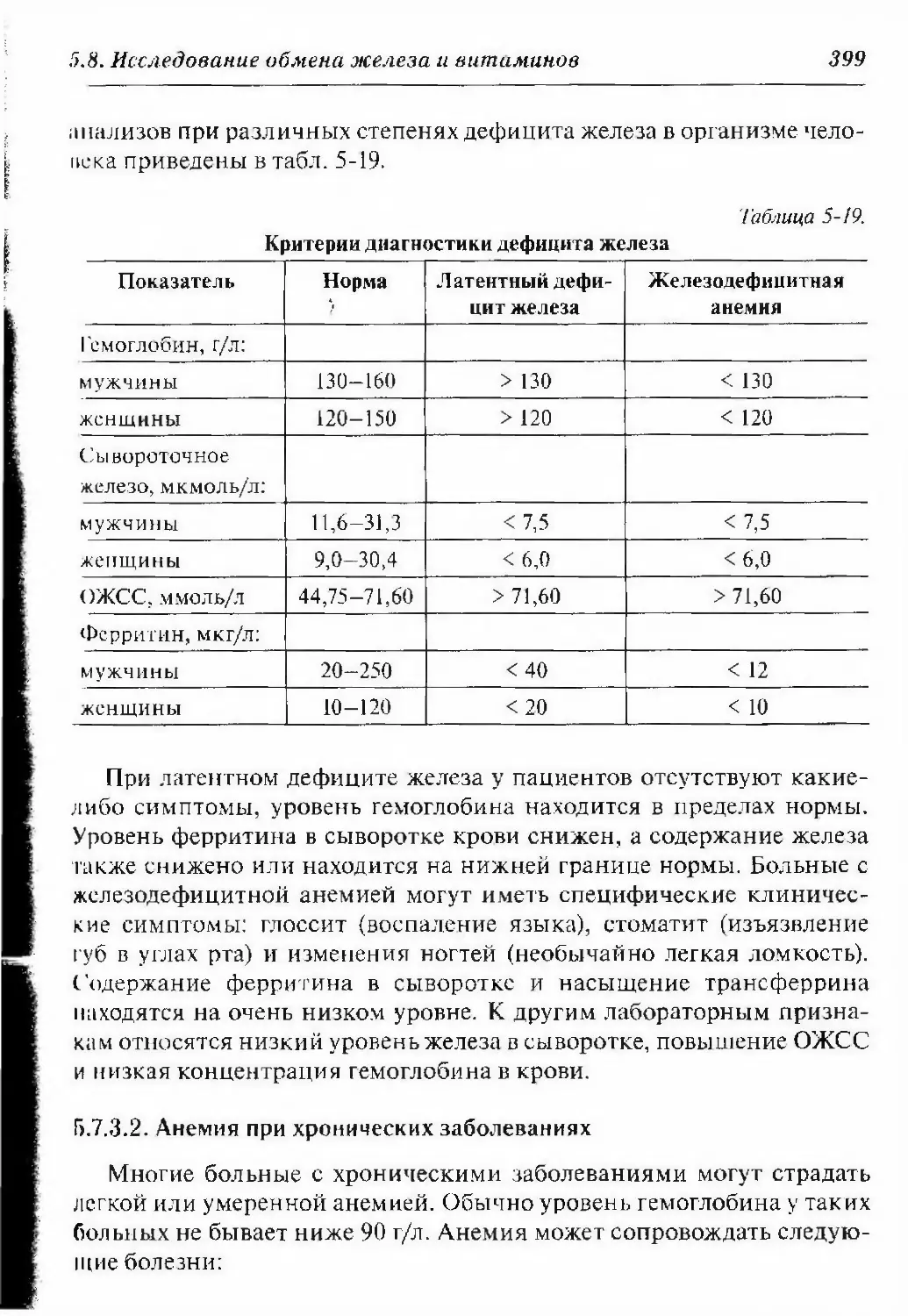
Г1.8. Исследование обмена железа и витаминов 387
5.8.1. Обмен железа 389
5.8.2. Лабораторные показатели, характеризующие
обмен железа 391
5.8.2.1. Концентрация железа в сыворотке крови 392
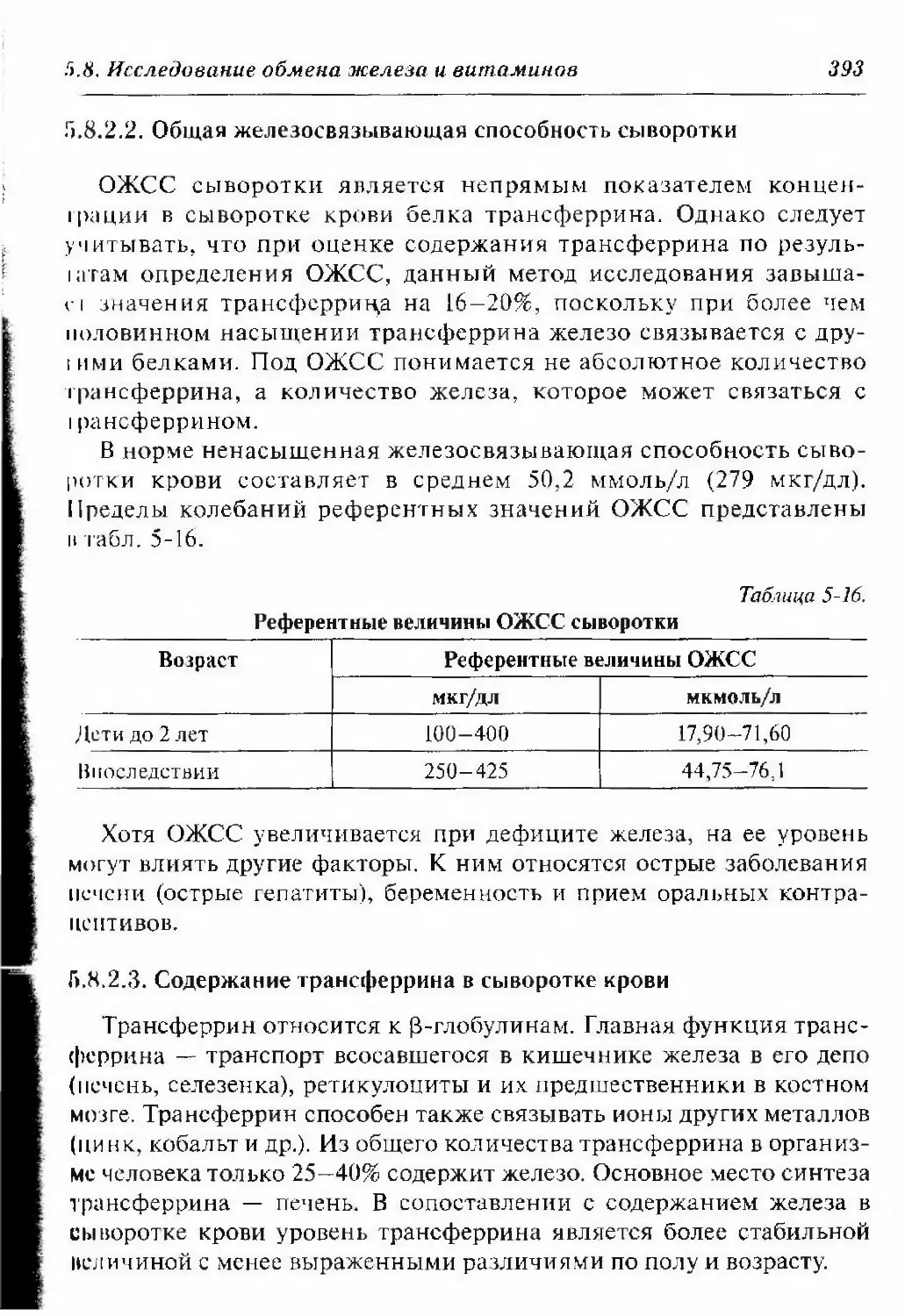
5.8.2.2. Общая железосвязываюшая способность
сыворотки 393
5.8.2.3. Содержание трансферрина в сыворотке крови 393
5.8.2.4. Содержание ферритина в сыворотке крови 395
5.8.3. Состояния, связанные с недостатком и избытком
железа в организме 396
5.8.3.1. Железодефицитная анемия 397
5.8.3.2. Анемия при хронических заболеваниях 399
5.8.3.3. Избыточное накопление железа 400
5.8.4. Функции и метаболизм витамина В,2
и фолиевой кислоты 402
5.8.5. Состояния, связанные с недостаточностью
витамина В12 и фолиевой кислоты в организме 405
5.8.5.1. Мегалобластная анемия 405
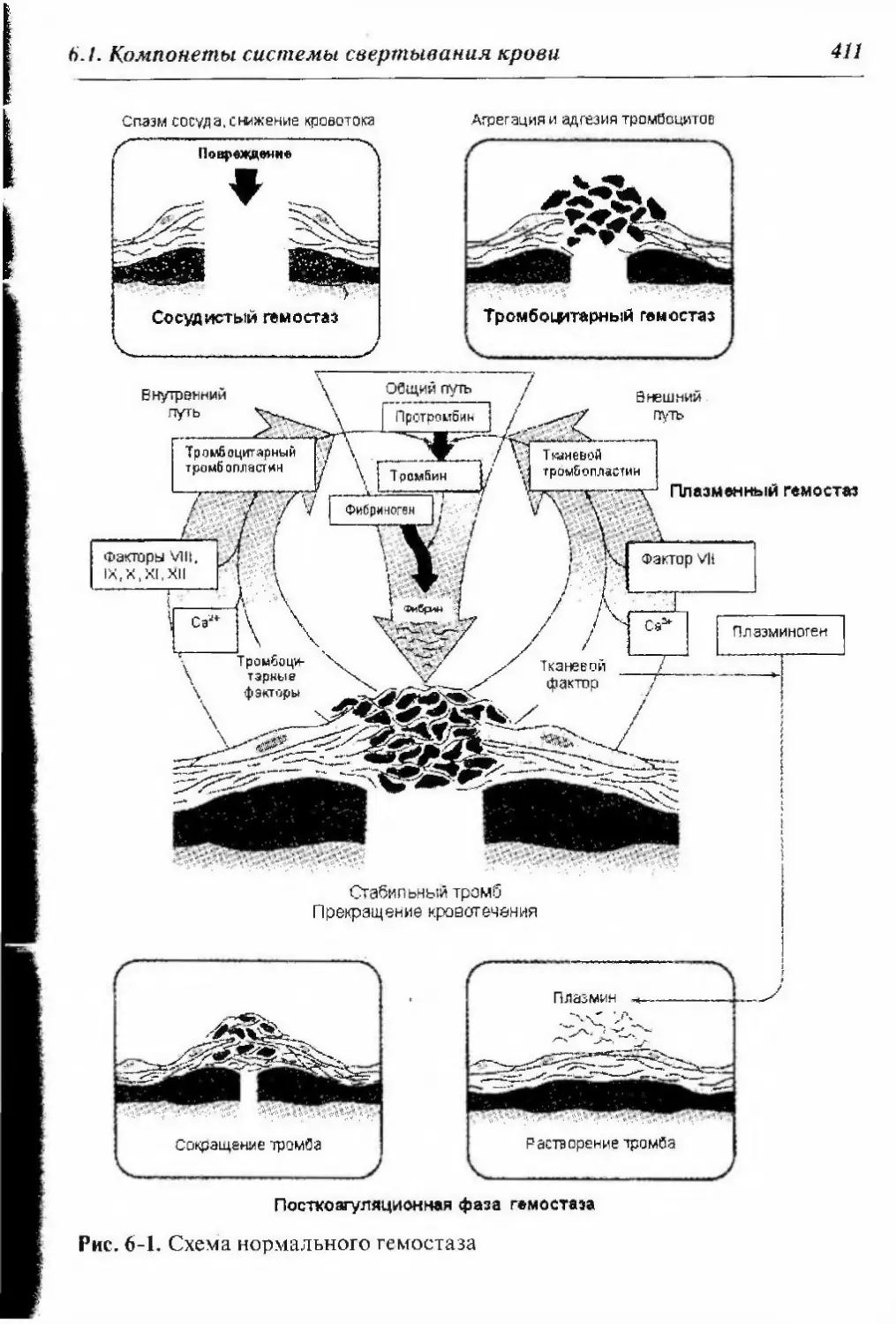
Глниа 6. Исследование свертывающей системы крови 410
6.1. Компоненты системы свертывания крови 410
6.1.1. Сосудисто-тромбоцитарный гемостаз 412
6.1.2. Плазменный (коагуляционный) гемостаз 414
6.2. Лабораторные тесты, используемые для оценки
смортываюшсй системы крови 418
6.2.1. Тесты, характсризуюище сосудистый компонент
1'емостаза 418
6.2.2. Тесты, характеризующие тромбоцитарный компонент
гемостаза 419
().2.3. Тесты, используемые для оценки коагуляционного
гемостаза 421
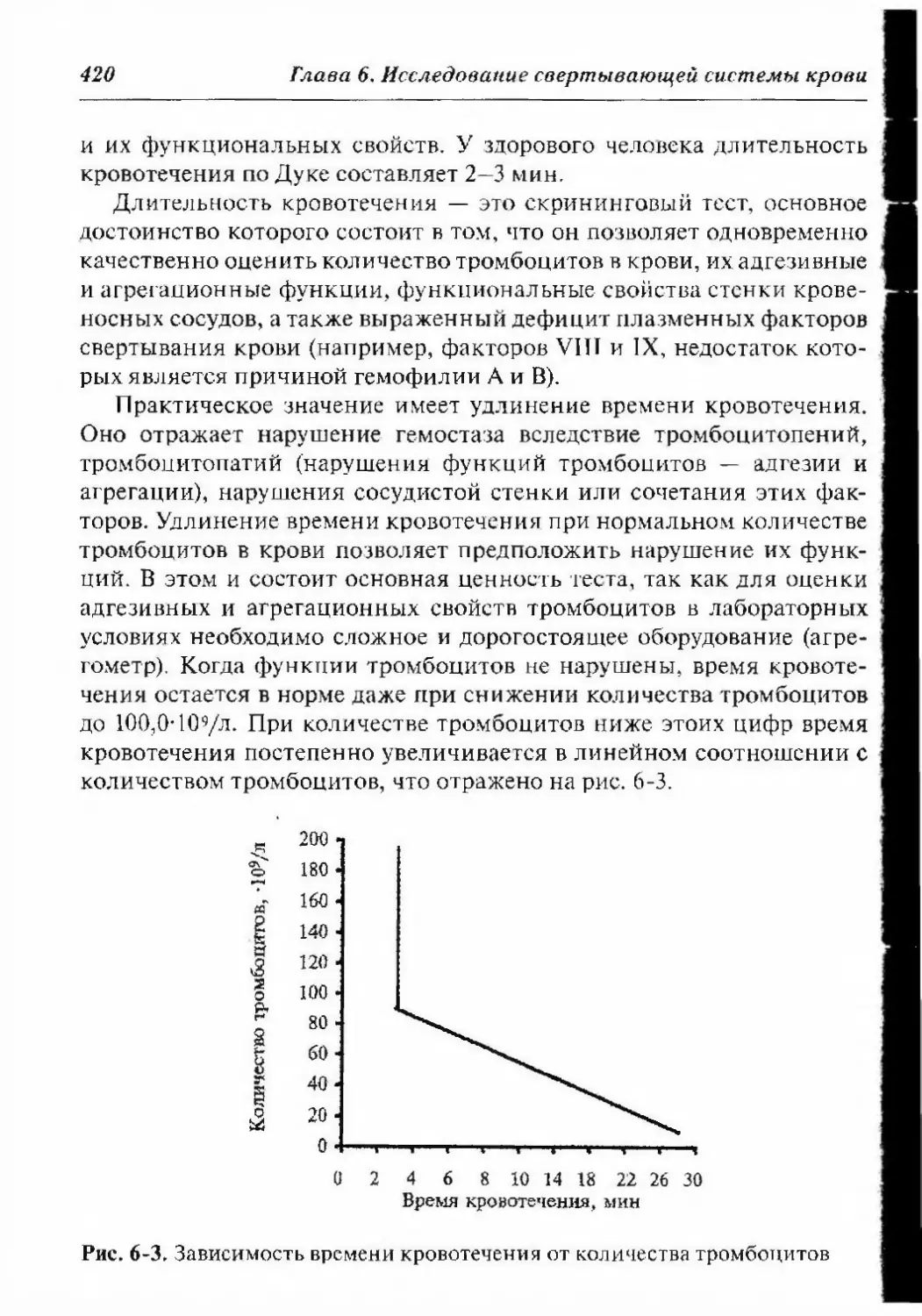
6.2.3.1. Время свертывания крови 422
6.2.3.2. Протромбиновос время 423
6.2.3.3. Активированное частичное тромбопластиновое
время 424
6.2.3.4. Тромбиновое время 426
6.2.3.5. Фибриноген 426
10 Оглавление
6.3. Тесты для диагностики тромбозов глубоких вен
и тромбоэмболии ле('Очной артерии 428
6.3.1. П-димер 429
6.4. Тесты для контроля антикоа1улянтной терапии 429
6.4.1. Прямые антикоагулянты (гепаринотсрапия) 430
6.4.2. Непрямые антикоагулянты, протромбиновое время,
международное нормали.зованиое отношение 431
Глава 7. Иммунологические исследования 433
7.1. Общие представления о структуре и функции
иммунной системы 433
7.1.1. Клеточные факторы иммунитета 437
7.1.2. Гуморальные факторы иммунитета 439
7.1.3. Фагоцитоз и другие механизмы
неспсцифической защиты 441
7.2. Алгоритм иммунного ответа организма 443
7.3. Клиническое значение иммунологических исследований 448
7.3.1. Лабораторные показатели, используемые
для оценки иммунного статуса 449
7.3.1.1, Лабораторные показатели клеточного
иммунитета 449
7.3.1.2, Лабораторные показатели гуморального
иммунитета 452
7.3.1.3, Лабораторные показатели для оценки
неспецифической защиты 457
7.3.2. Оценка результатов исследования иммунного статуса .. 458
7.4. Основные лабораторные исследования, используемые
для диагностики ревматических заболеваний 460
7.4.1. Клетки красной волчанки (1,.Е-клетки) крови 461
7.4.2. Ревматоидный фактор 463
7.4.3. Антистрептолизин-О 464
7.4.5. Антинуклеарный фактор 465
7.5. Исследование опухолевых маркеров 466
7.5.1.а-Фетопротеи н 469
7.5.2. Раково-эмбриональный антиген 470
7.5.3. Раковый антиген СА-125 470
7.5.4. Простатический специфический антиген 472
Оглаление
І'лава 8. Исследования при проведении операции
переливания крови 474
8.1. Антигены эритроцитов и группы крови 475
8.1.1. Группы крови АВО 475
8.1.2. Антигены эритроцитов системы резус
(резус-фактора) 477
8.1.3. Антигены системы Келл 477
8.1.4. Другие, .менее значимые антигены эритроцитов 478
8.2. Антитела к антигенам эритроцитов 479
8.3. Определение группы крови, резус-фактора, титра антител
и совместимости крови донора и реципиента 481
8.4. Осложнения после гемотрансфузий 485
8.4.1. Иммунные гемолитические трансфузионные реакции... 485
8.4.2. Другие трансфузионные реакции 488
8.5. Гемолитическая болезнь новорожденных 489
1'лава 9. Серологические исследования 492
9.1. Диагностика сифилиса 494
9.2. Диагностика ВИЧ-инфекции 498
9.3. Диагностика вирусных гепатитов 501
9.3.1. Вирусный гепатит А 503
9-3.2. Вирусный гепатит В 504
9.3.3. Вирусный гепатит С 509
9.3.4. Вирусный гепатит D 512
9.3.5. Вирусный гепатит Е 513
9.3.6. Вирусный гепатит G 513
9.4. Серологическая диагностика перинатальных инфекций 514
9.5. Полимеразная цепная реакция в диагностике
инфекционных заболеваний 516
9.5.1. Обнаружение вируса гепатита С 517
9.5.2. Обнаружение вируса гепатита В 518
9.5.3. Обнаружение ВИЧ 519
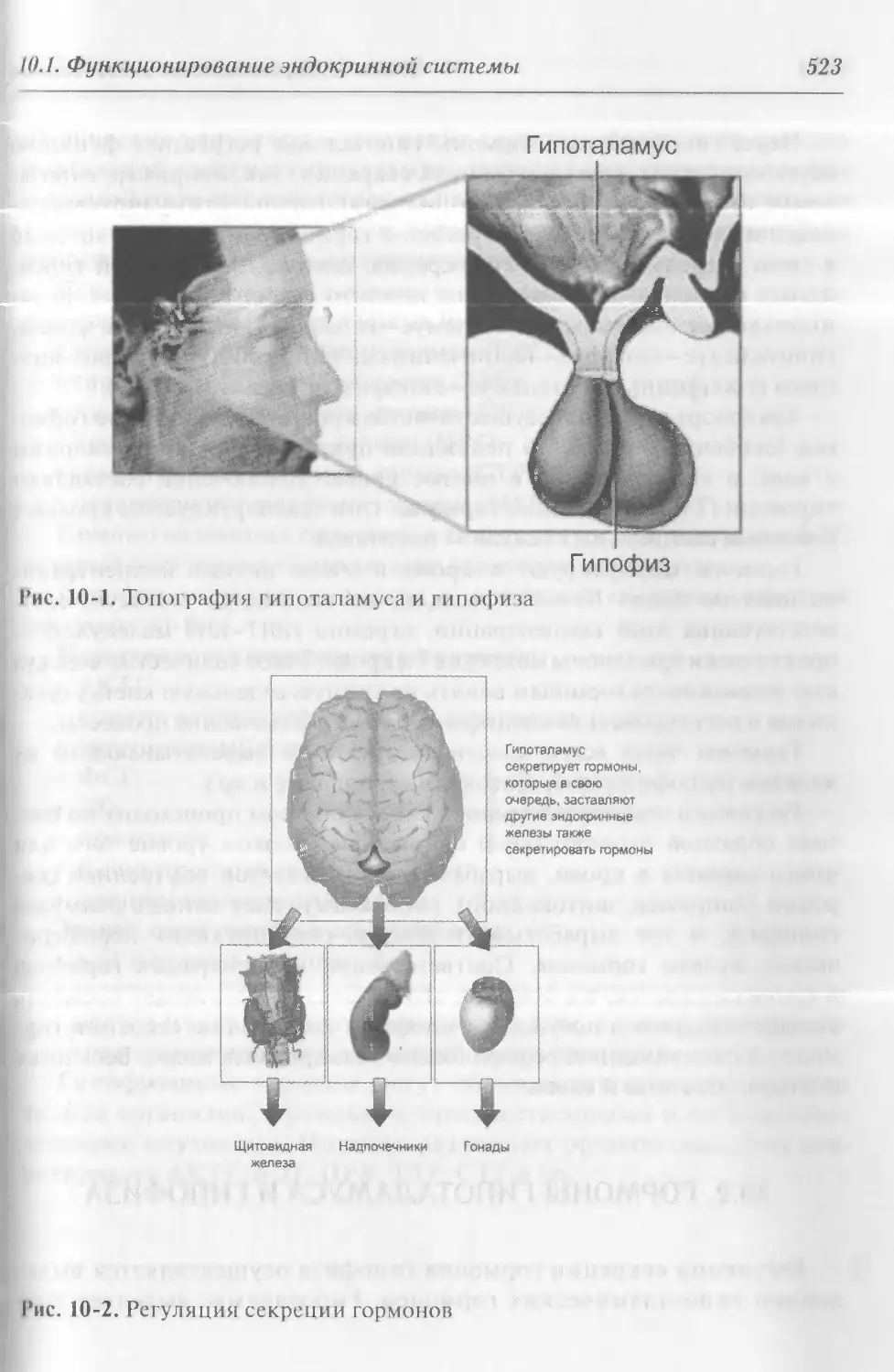
Глава 10. Гормональные исследования 521
10.1. Функционирование эндокринной системы 521
10.2. Гормоны гипоталамуса и гипофиза 524
12 Оглавление
10.3. Нарушение секреции гормонов гипоталамуса
и гипофиза 527
10.4. Функциональное состояние щитовидной железы^ 528
10.4.1. Биосинтез гормонов щитовидной железы 529
10.4.2. Метаболические эффекты гормонов
щитовидной железы 531
10.4.3. Регуляция функции щитовидной железы 531
10.4.4. Причины нарушений функции шитовидной железы 533
10.4.5. Оценка функционального состояния
щитовидной железы 535
10.4.5.1. Эутиреоидный (нетоксический) зоб 535
10.4.5.2.Гипертиреоз (тиреотоксикоз) 536
10.4.5.3. Гипотиреоз 538
10.5. Функциональное состояние надпочечников 541
10.5.1. Биосинтез гормонов надпочечников 542
10.5.2. Метаболические эффекты гормонов надпочечников... 542
10.5.3. Регуляция функции надпочечников 544
10.5.4. Причины нарушений функции надпочечников 545
10.5.4.1. Болезнь Иценко-Кушинга 546
10.5.4.2. Недостаточность коры надпочечников 547
10.5.4.3. Адреногеиитальный синдром 550
10.6. Функциональное состояние репродуктивной системы ... 551
10.6.1. Гормоны репродуктивной системы 531
10.6.1.1. Гонадотропии-рилизинг-гормон
и ]'онадотропины 552
10.6.1.2. Половые стероиды 556
10.6.2. Гормональная регуляция менструального цикла... .562
10.6.3. Гормональная регуляция сперматогенеза 564
10.6.4. Причины нарушения репродуктивной функции
у женщин 564
10.6.5. Климактерический сирідром 569
10.6.6. Причины нарушения репродуктивной функции
у мужчин 570
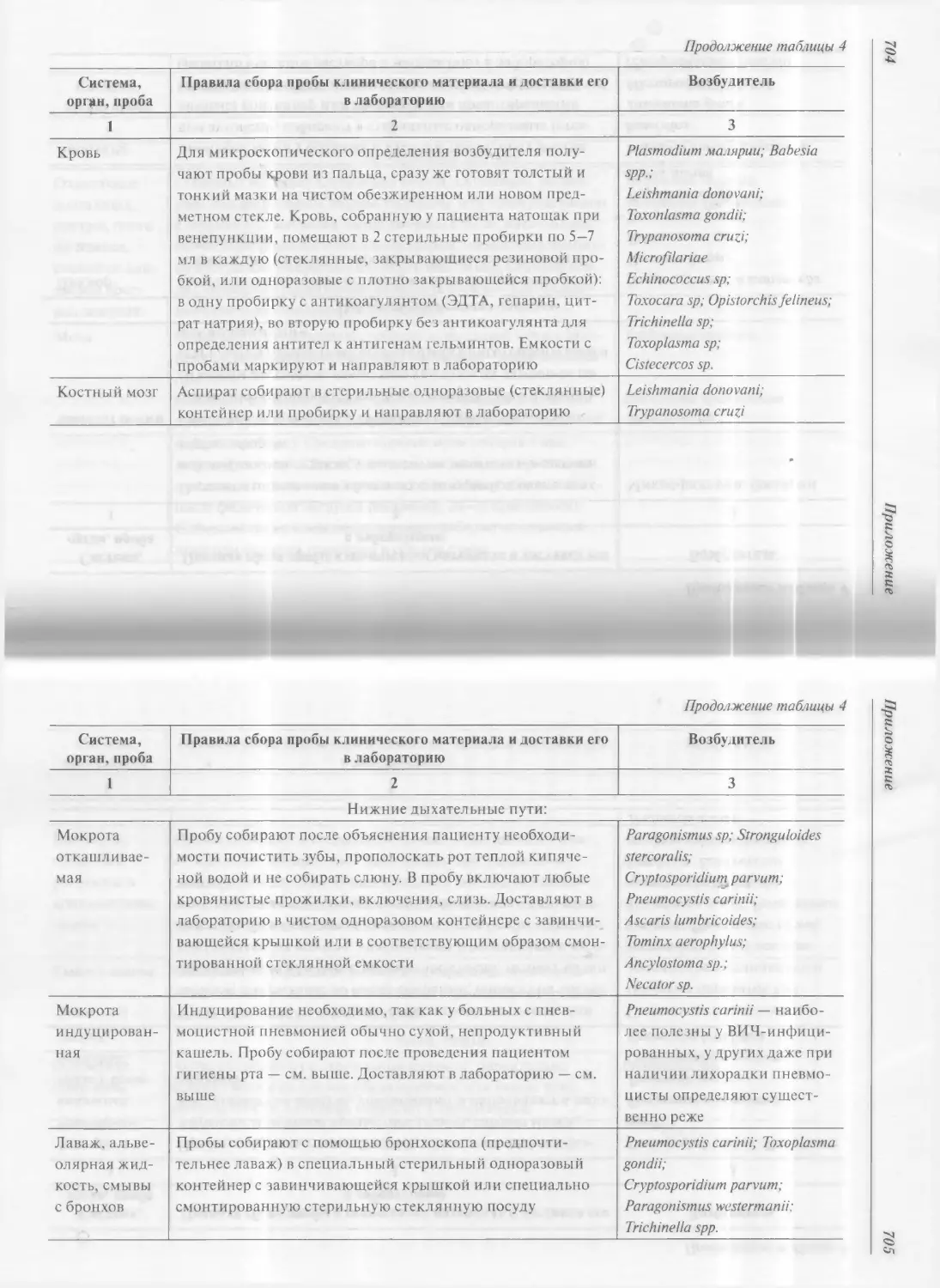
Глава 11. Бактериологические и паразитологические
исследования 573
11.1. Общие сведения о бактериологических методах
исследования 574
Оглаление 13
11.2. Посев крови (гемокультура) 577
11.2.1. Сепсис 578
11.2.1.1. Этиология сепсиса 580
11.2.1.2. Бактериологическая диагностика сепсиса 581
11.2.1.3. Оценка результатов бактериологического
исследования крови 584
11.3. Бактериологическое исследование мочи 585
11.3.1. Строение и функционирование мочевой системы ...585
11.3.2. Инфекции мочевыводящих путей 587
11.3.3. Оценка результатов бактериологического
исследования мочи 589
11.4. Бактериологическое исследование кала при кишечных
инфекциях 592
11.4.1. Сальмонеллезная инфекция 594
11.4.2. Дисбактериоз кишечника 595
11.5. Бактериологическое исследование отделяемого
из женских половых органов 598
1.5.1. Нормальная микрофлора влагалища и шейки матки — 598
11.5.2. Воспалительные заболевания влагалища
и шейки матки 601
11.5.3. Особенности взятия отделяемого из женских половых
органов для бактериологического исследования 604
11.6. Бактериологическое исследование мокроты 606
11.7. Паразитологические исследования 607
11.7.1. Исследование крови на выявление малярии 608
11.7.2. Паразитологические исследования кала 612
11.7.2.1. Исследование кала на яйца гельминтов
(глистов) 612
11.7.2.2. Исследование соскоба
с мерианальных складок на энтеробиоз 614
Приложения 618
Список литературы 718
ВВЕДЕНИЕ
Сестринский персонал играет чрезвычайно важную роль в органи¬
зации и, главное, в оказании медицинской помощи, распространении
информации, консультировании и обучении пациента, наблюдении и
оценке результатов лечения. Правильная организация лабораторного
обследования пациента — обязательная составная часть единого про¬
цесса оказания качественной медицинской помощи. Медицинским
сестрам принадлежит важнейщая роль в обеспечении этого процесса.
Без ее понимания, как и особенностей лабораторного обследования
больного невозможно добиться успехов в лечении пациентов на сов¬
ременном этапе развития медицины.
В настоящее время деятельность клинико-диагностических
лабораторий подвергается большим изменениям, ориентиро¬
ванным на совершенствование качества результатов анализов.
Высокая оснащенность клинико-диагностических лабораторий
первичного звена оказания медицинской помощи современным
оборудованием в рамках национального проекта «Здоровье» —
первый шаг на этом пути. Не менее существенное влияние на рабо¬
ту лечебно-профилактических учреждений оказывает и основное
направление реформирования лабораторной службы — централи¬
зация лабораторных исследований, т.е. создание крупных высо¬
коавтоматизированных лабораторных центров, обслуживающих
многие лечебно-профилактические учреждения и выполняющих
широкий спектр различных анализов.
Несмотря на значительные изменения в деятельности лаборато¬
рий, большинство специалистов среднего звена оказания медицин¬
ской помощи до сих пор рассматривают лабораторию как «черный
ящик», куда они направляют заявки и пробы биоматериала и откуда
выходят результаты анализов. По-прежнему бытует представление,
что медицинские сестры не оказывают никакого влияния на качес¬
тво обследования пациентов и результатов исследований. Вместе с
тем существует ряд факторов (подготовка пациента к исследованиям,
методика взятия проб крови и сбора биоматериала, их правильная
Введение
15
и своевременная доставка в лабораторию), которые могут оказывать
существенное влияние на качество результатов анализов, целиком
находясь в компетенции среднего медицинского персонала. Однако в
силу сложившегося стереотипа мышления сами медицинские сестры
ПС придают большого значения влиянию этих факторов. Вместе с тем
без глубокого понимания их важной роли в обеспечении качества
результатов анализов невозможно улучшить качество диагностики и
лечения больных. >
Получение эффективных результатов лабораторных анализов
больного — это единый процесс, начиная от составления заявки на
анализы, взятия биоматериала, его доставки, проведения исследова¬
ний и заканчивая получением и использованием результатов для ока-
шния пациенту необходимой медицинской помощи. Качество этого
процесса должно обеспечиваться совместными усилиями врачей,
среднего медицинского персонала и специалистов лаборатории.
Для того чтобы повысить качество лабораторных исследований
необходимо улучшить все этапы этого процесса. Именно поэтому
и наиболее развитых странах мира особое внимание стало уделять¬
ся тому, кто, в каких условиях и как осуществляет взятие, хранение
и доставку проб биоматериала в лабораторию и подготовку паци¬
ентов к проведению исследований. Ниже приведены основные
изменения в работе среднего медицинского персонала лечебно¬
профилактических учреждений (ЛПУ) и клинико-диагностичес¬
ких лабораторий за последние десятилетия, которые привели к
тому, что качество взятых проб приобрело чрезвычайно важное
значение, и его влияние на результаты лабораторных исследований
стало поистине решающим.
Факторы, влияющие на качество лабораторных исследований
Раньше
в настоящее время
Пробы брались только в клинике
Пробы берутся и за пределами ЛПУ
Относительно высокая квалифика¬
ция среднего медицинского персо¬
нала
Снижающаяся квалификация сред¬
него медицинского персонала за
счет частой смены кадров
Ограниченное число методов, тес¬
тов и видов анализаторов
Увеличение числа методов, тестов
и видов анализаторов
Чувствительность тестов 10 3
Чувствительность тестов 10—
16
Введение
Лабораторные показатели не мони¬
торировались по времени
Лабораторные показатели монито¬
рируются по времени
Большой объем пробы
Маленький объем пробы
Доставка проб на малые расстояния
в пределах ЛПУ
Доставка проб на большие рассто¬
яния
Эти изменения в лабораторном обследовании больных выводят
на первый план необходимость осознанного активного сотрудни¬
чества врачей-клиницистов, среднего медицинского персонала со
специалистами лаборатории для улучшения качества лабораторного
обследования пациентов. Специалисты лечебных отделений - это не
только простые получатели лабораторной информации, но и заинте¬
ресованные участники единого процесса ее созидания. Их деятель¬
ность по рациональному составлению заявки на анализы, подготовке
пациента к исследованию, правильному взятию и своевременной
доставке биоматериала в лабораторию, практическому использова¬
нию результатов для обоснования диагноза, выбора целей лечения
пациента во многом определяют современное понимание качества
результатов исследований. Без получения действенных результатов
анализов невозможно организовать правильное ведение больных.
Не менее важной задачей практического здравоохранения является
обеспечение безопасности пациента и медицинского персонала. Для
этого необходимо иметь модели процессов, которые могут служить
стандартом, гарантирующим правильное выполнение процедур, а
также использовать в своей работе современные приспособления для
взятия проб крови и сбора биоматериала.
Цель данного руководства состоит в том, чтобы показать специа¬
листам среднего звена оказания медицинской помощи возможности
современной клинической лабораторной диагностики, усовершенс¬
твовать их взаимодействие с лабораторией, а главное, эффективно
использовать результаты лабораторных исследований для повышения
качества ухода за больными и их лечения.
Надеемся, что в представленном руководстве заинтересованный
читатель найдет ответы на вопросы: как правильно подготовить
пациента к лабораторным исследованиям, какие современные при¬
способления необходимо использовать для взятия проб крови и сбора
биоматериала, как правильно забирать кровь на лабораторные анали¬
зы, каковы особенности взятия проб крови и сбора биоматериала для
Введение 17
бактериологических исследований, как правильно и в какие сроки
необходимо доставить пробы с биоматериалом в лабораторию, как
оценивать результаты анализов и как их использовать для оказания
пациенту качественной медицинской помощи, какие результаты
лабораторных исследований требуют немедленных действий по ока¬
занию пациенту неотложной медицинской помощи.
Глава 1
ОСНОВЫ ЛАБОРАТОРНОГО
ОБСЛЕДОВАНИЯ ПАЦИЕНТОВ
в процессе лечения больные подвергаются множеству диагности¬
ческих обследований. Среди них важное место занимают клиничес¬
кие лабораторные исследования. По данным ВОЗ, доля лабораторных
исследований составляет 75-90% общего числа различных видов
исследований, проводимых пациенту в лечебных учреждениях.
Все лабораторные исследования выполняются на биологическом
материале, полученном от больного. Отсутствие пациента в лаборато¬
рии при проведении анализов создает впечатление, что лабораторные
исследования имеют мало общего с сестринским делом и не касаюзся
напрямую медицинских сестер, в отличие от других видов обследо¬
вания (например, электрокардиографии), которые проводятся при
непосредственном участии больного и, как правило, с участием меди¬
цинской сестры. В действительности существует нелый комплекс
причин, по которым среднему медицинскому персоналу необходимо
понимать основы и особенности работы клинико-диагностической
лаборатории (КДЛ),
1.1. ОРГАНИЗАЦИОННЫЕ ПРИНЦИПЫ ВЫПОЛНЕНИЯ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Качество оказания медицинской помощи больному зависит от
слаженной работы разных подразделений ЛПУ, в том числе и лабора¬
тории. Медицинская сестра является важным членом общей коман¬
ды. Главная роль медицинской сестры состоит в том, что она обес¬
печивает взаимодействие между врачом, пациентом и лабораторией.
Правильно организованное взаимодействие между врачом, пациен¬
том, медицинской сестрой и лабораторией помогает с наибольшим
для больно1'о эффектом использовать диагностические возможности
КДЛ. Основные направления участия среднего медицинского персо¬
нала в лабораторных исследованиях представлены на рис. Г1,
20 Глава 1, Основы лабораторного обследования пациентов
Медицинская сестра должна знать, что, согласно законодательству
РФ об охране здоровья граждан, пациент имеет право на;
• выбор врача с учетом его согласия и выбор лечебного учрежде¬
ния;
• проведение по его просьбе консилиума и консультаций других
специалистов;
• сохранение в тайне информации о факте обращения за медицин¬
ской помощью, состоянии здоровья, диагнозе и иных сведений,
полученных при его обследовании и лечении;
• информированное добровольное согласие на медицинское вме¬
шательство;
• получение информации о состоянии своего здоровья, а также на
выбор лиц, которым в интересах пациента может быть передана
информация о состоянии его здоровья.
Знание этих правовых основ поможет медицинской сестре пра¬
вильно построить свои взаи.моотношения с пациентом.
Медицинская сестра — это ключевой специалист, обеспечива¬
ющий подготовку больного к проведению лабораторных исследо¬
ваний. Профессиональные знания об особенностях выполнения
лабораторных исследований и работы КДЛ, а также соблюдение
правил медицинской этики и деонтологии во многом позволяют
медицинской сестре правильно подготовить больного к исследо¬
ваниям и поддерживать необходимый доверительный характер их
взаимоотношений. Большинство лабораторных тестов минимально
инвазивно, тем не менее от пациента все равно должно быть получе¬
но информированное согласие на их проведение. Обычно больные
не проявляют особого внимания к этой проблеме, однако при воз¬
никновении вопросов о целях назначения лабораторных исследова¬
ний и необходимости получения информированного согласия паци¬
ента медицинская сестра должна уметь правильно ответить на них.
Кроме того, информированное согласие должно быть обязательно
получено у пациента при назначении ему исследования на инфици¬
рование вирусом иммунодефицита человека (ВИЧ). Это необходимо
потому, что серологическая реакция выявления ВИЧ-инфекции
считается инвазивным тестом из-за серьезных последствий в отно¬
шении потенциальной дискриминации в области здравоохранения,
трудоустройства и личных взаимоотношений.
Медицинская сестра отвечает за взятие и сбор биологического
материала, правильную и своевременную доставку его в лабораторию.
/./. Организационные принципы выполнения лабораторных... 21
'Знание особенностей сбора биоматериала, высокопрофессиональное
владение методикой взятия крови, а главное, понимание важности
[выполнения этих процедур — важнейшие составляющие получения
качественных результатов анализов для пациента, за которым меди¬
цинская сестра осуществляет уход.
Медицинские сестры нередко участвуют в заполнении заявки на
лабораторные анализы и документировании результатов исследова¬
ний в амбулаторной карте или истории болезни. Очень важно, чтобы
они разбирались в терминологии, сокращениях и способах предостав-
ления результатов исследований, которые использует лаборатория.
Медицинские сестры должны уметь идентифицировать отклонения в
результатах анализов, особенно если они требуют немедленных дейс¬
твий врача по оказанию медицинской помощи.
Традиционно оценку результатов лабораторных исследований про¬
водит врач. Вместе с тем медицинская сестра — специалист, который
постоянно контактирует с больным. Очень важно, чтобы она знала значе¬
ния отклонений в результатах лабораторных анализов, которые требуют
немедленных действий по оказанию медицинской помощи. Кроме того,
ее роль в уходе за пациентом в современных условиях постоянно возрас-
гает, поэтому специалисты среднего звена все чаще привлекаются к этому
процессу; при этом должны владеть основными подходами, используе¬
мыми для интерпретации результатов анализов.
1.1.1. СТРУКТУРА И ФУНКЦИИ
КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ
Современная КДЛ выполняет широкий спектр анализов. Ее струк¬
тура обычно соответствует задачам ЛПУ. В ЛПУ могут быть представ¬
лены клинико-диагностические лаборатории общего типа, которые
обеспечивают выполнение наиболее распространенных лабораторных
исследований, лаборатории экспресс-диагностики, предназначенные
для проведения экстренных анализов, а также специализированные
КДЛ, основной задачей которых является выполнение сложных ана¬
лизов. Наиболее распространенными являются КДЛ общего типа,
которые имеют единую структуру. Однако, несмотря на это, в ней
традиционно существует деление на более мелкие лаборатории или
отделы: клиническая лаборатория (отдел), лаборатория клинической
биохимии (биохимическая), иммунологическая лаборатория, цито¬
22 Глава І. Основы лабораторного обследования пациентов
логическая лаборатория. Бактериологическая (микробиологическая)
лаборатория, как правило, не входит в состав КДЛ и функционирует
как самостоятельное подразделен ие Л П У, т.е. относится к специали¬
зированным лабораториям.
КДЛ является диагностическим подразделением ЛПУ и обладает
всеми правами самостоятельного отделения, как и все другие лечеб¬
ные и диагностические отделения учреждения.
Основные задачи КДЛ:
• организация и выполнение лабораторных исследований: гемато¬
логических, общеклинических, цитологических, биохимических,
коагулологических, иммунологических и бактериологических;
• консультативная помощь врачам лечебных отделений в выборе
наиболее информативных лабораторных тестов для обследования
пациентов и оценки результатов лабораторных анализов.
КДЛ укомплектованы специалистами различного уровня ква¬
лификации, которые отвечают за проведение исследований посту¬
пающих проб биологического материала (схема 1-1). Каждую КДЛ
возглавляет высококвалифицированный врач клинической лабора¬
торной диагностики — заведующий лабораторией, имеющий соот¬
ветствующий опыт работы. В некоторых случаях эту должность зани¬
мает высококвалифицированный специалист-биолог.
В КДЛ работают врачи клинической лабораторной диагностики,
специалисты-биологи. Они выполняют гематологические, цитоло¬
гические, сложные обшеклинические и иммунологические иссле¬
дования, ряд биохимических, коагулологических, гормональных и
серологических анализов. В их обязанности входит контроль за
калибровкой анализаторов и проведением внутрилабораторного кон¬
троля качества. Средний медицинский персонал в лаборатории пред¬
ставлен медицинскими технологами, фельдшсрами-лаборантами,
медицинскими лабораторными техниками, лаборантами, которые
осуществляют прием биологического материала в лаборатории, про¬
водят его подготовку к анализу и выполняют исследования.
Основная задача лаборатории состоит в изучении целого ряда ком¬
понентов, содержащихся в пробах биологического материала обследу¬
емых пациентов. Наиболее часто такими компонентами являются:
• обычные химические вещества (например, глюкоза, билирубин),
абсолютное или относительное увеличение или уменьшение
содержания которых в определенном биоматериале может иметь
диагностическое значение;
1.1. Организационные принципы выполнения лабораторных... 23
Схема 1-1.
Специалисты КДЛ и их обязанности
Заведующий КДЛ
Специалист
с высшим
медицинским
образованием
и стажем работы в
лаборатории
не менее 5 лет
Врач клинической
лабораторной
диагностики
Специалист
с высшим
медицинским
образованием,
прошедший
специализацию
по лабораторной
диагностике
Организует работу КДЛ и выполнение ана¬
лизов
Распределяет обязанности между сотрудни-
>
ками и осуществляет контроль за их выпол¬
нением
Руководит внедрением новых методов иссле¬
дования
Проводит мероприятия по повышению
качества исследований
Выполняет ттаиболее сложные анализы
Организует и проводит занятия по повыше¬
нию квалификации персонала
Консультирует врачей клинических специ¬
альностей по вопросам проводимых лабора¬
торных исследований
Составляет отчетную документацию
Выполняет лабораторные исследования
Руководит работой среднего медицинского
персонала лаборатории
Проводит внутрилабораторный контроль
качества
Контролирует выполнение процедур по
обслуживанию лабораторного оборудования
на своем рабочем месте
Проводит занятия со средним медицинским
персоналом по повышению квалификации
Консультирует врачей клинических специ¬
альностей по вопросам проводимых лабора¬
торных исследований
24
Глава 1. Основы лабораторного обследования пациентов
Продолжение схемы 1-1.
Медицинский
технолог
Специалист со
средним меди¬
цинским обра¬
зованием по
специальности
«Лабораторная
диагностика»
(квалификация
«медицинский
технолог»)
Медицинский
лабораторный
техник
Специалист
со средним
медицинским
образованием
по специальности
«Лабораторная
диагностика»
(квалификация
«медицинский
лабораторный
техник —
фельдшер-лабо¬
рант»
Врлполняют лабораторные исследования
согласно разделам, определенным заведую¬
щим лабораторией
Регистрируют поступающий в лабораторию
биологический материал
Проводят обработку и подготовку биомате¬
риала к исследованиям
Осуществляют взятие крови из пальца на
лабораторные анализы
Осваивают новое оборудование и методы
исследования
Проводят внутрилабораторный контроль
качества лабораторных исследований
Осуществляют мероприятия по повышению
точности и надежности используемых мето¬
дов исследования
Готовят реактивы к методикам исследований
Проводят процедуры по обслуживанию лабо¬
раторного оборудования на своем рабочем
месте
Ведут документацию (протоколы калибро¬
вок, внутрилабораторного контроля качест¬
ва, осуществляют регистрацию результатов
исследований и т.д.)
Осуществляют контроль за хранением реак¬
тивов и биологического материала
Участвуют в составлении заявок по матери¬
ально-техническому обеспечению лаборато¬
рии
Консультирует врачей клинических специ¬
альностей по вопросам проводимых лабора¬
торных исследований
/./. Организационные принципы выполнения лабораторных...
25
• обычные клетки биологических жидкостей (например, крови),
количественное и некоторые качественные изменения которых
важны для диагностики заболеваний;
• необычные клетки и неклеточные образования;
• вирусы, бактерии, грибы, паразитарные микроорганизмы;
■ химический и клеточный состав биологических жидкостей, кото¬
рые не образуются (или образуются в незначительном количес¬
тве) у здорового человека (например, асцитическая жидкость,
плевральный выпот);
• соотношения однородных химических веществ в разных биоло¬
гических жидкостях (например, креатинина в крови и моче при
проведении пробы Реберга—Тареева);
• токсичные вещества и медикаменты, которые могут попасть в
организм пациента.
Деление КДЛ на более мелкие лаборатории или отделы обусловлено
особенностями анализируемого биологического материала, методами
исследований, используемым оборудованием, соответствующей специа¬
лизацией врачей клинической лабораторной диагностики. Медицинская
сестра должна учитывать эти особенности КДЛ в своей работе.
Клиническая лаборатория (отдел) выполняет гематологические
и общеклинические анализы. Гематологический анализ использует¬
ся для диагностики и мониторирования заболеваний, при которых
изменяются количество, размер или структура клеток крови. К ним
относятся красные клетки крови (эритроциты), белые клетки крови
(лейкоциты) и тромбоциты. Общий анализ крови полный подсчет
всех клеток крови с характеристиками их структуры (включая лейко¬
цитарную формулу крови) — наиболее часто назначаемый лаборатор¬
26 Глава I. Основы лабораторного обследования пациентов
ный анализ, характер изменений в котором указывает на наличие у
пациента тех или иных заболеваний. По сути это не один тест, а целый
комплекс тестов, о чем более детально будет сказано в специальных
разделах данного руководства.
В современных КДЛ большую часть гематологических показателей
определяют с помощью автоматических гематологических анализа¬
торов. Использование анализатора существенно уменьшает объем
биопробы для анализа, значительно сокращает время получения
результатов исследования и повышает их точность. Вместе с тем часть
гематологических показателей в лаборатории получают с использо¬
ванием микроскопа. Микроскоп по-прежнему остается основным
инструментом для анализа проб костного мозга.
Гематологические исследования играют важнейшую роль в диа¬
гностике злокачественных заболеваний крови (лейкозы, миеломная
болезнь) и анемий. Не менее важное значение гематологические
показатели имеют для опенки реакции организма на многие инфек¬
ционные и воспалительные заболевания, позволяя определять по
динамике их изменений тяжесть течения и эффективность проводи¬
мого лечения.
Результаты большинства гематологических анализов бывают гото¬
вы в течение 4—6 ч, однако при необходимости некоторые из них
можно выполнить в течение 30 мин — 1 ч в любое вре.мя суток.
Общеклинические исследования включают анализ физико-хими¬
ческих особенностей и клеточного состава других (кроме крови) био¬
логических жидкостей организма больного; мочи, мокроты, жидкости
серозных пространств (например, плевральной), спинномозговой
жидкости (ликвора), кала, отделяемого мочеполовых органов и т.д.
Нередко результаты исследования биологических жидкостей играют
решающую роль в установлении диагноза, например обнаружени-
ибольшого количества лейкоцитов в моче для установления факта
инфицирования мочевыводящих путей. Вместе с тем сбор каждого
вида биоматериала для получения достоверных результатов анализа
имеет свои особенности, которые должна знать медицинская сестра.
Несмотря на ужесточение требований к проведению паразитоло¬
гических исследований со стороны санитарно-противоэпидемиоло-
гических служб (условия проведения паразитологических анализов
должны соответствовать требованиям по работе с микроорганизмами
111—IV группы патогенности), они по-прежнему выполняются кли¬
нической лабораторией. Основным биоматериалом для выявления
1.1. Организационные принципы выполнения лабораторных... 27
паразитарных организмов является кал, реже исследованию подверга¬
ются дуоденальное содержимое, соскобы с перианальных складок.
Цитологические исследования направлены на изучение морфо¬
логических характеристик отдельных клеток. Как правило, клетки
соскабливают с поверхности таких анатомических образований, как
шейка матки, бронхи, слизистая оболочка носа, гортани, желудка.
Клетки на исследование 'можно забрать, используя аспирацию при
помощи тонкой иглы и шприца (например, из плевральной полости,
солидных опухолей молочной железы). Из взвеси клеток в лаборато¬
рии готовят мазки на предметном стекле, их фиксируют, окрашивают
и анализируют под микроскопом. Цитологические исследования
используются в клинической практике в основном для диагности¬
ки предзлокачественных состояний и злокачественных опухолей.
Некоторые цитологические исследования являются обязательной
составной частью скрининговых программ (массовое обследование
населения с использованием наиболее эффективных методов для
выявления распространенного заболевания). Например, анализ цер¬
викальных мазков — обязательное исследование в скрининге женщин
на наличие рака шейки матки.
Лаборатория клинической биохимии (биохимическая) выполняет
широкий спектр анализов, которые необходимы для диагностики и
оценки эффективности лечения многих заболеваний и состояний.
Основными видами биологического материала, которые подвергаются
анализу в биохимической лаборатории, являются кровь и моча. Кровь
состоит из клеток (эритроциты, лейкоциты и тромбоциты) и жидкой
части, которая представляет собой раствор многих неорганических и
органических веществ. Это и есть тот состав, который анализируют в
большинстве биохимических тестов. Поэтому первым этапом после
доставки проб крови в лабораторию для биохимических исследований
является отделение жидкой части крови от клеток путем центрифуги¬
рования проб. Жидкая часть крови, которую получают после центри¬
фугирования, может быть плазмой или сывороткой. Различие между
плазмой и сывороткой определяется типом пробирки или фирменно¬
го приспособления (например, вакутейнер), в которую медицинская
сестра берет кровь. Если для этой цели используют вакутейнер без
всяких добавок, то кровь сворачивается и образуется сыворотка. Если
же в него добавлены антикоагулянты, кровь остается жидкой (не сво¬
рачивается) и получаемая после центрифугирования жидкая часть
называется плазмой. Это важное отличие, которое должна понимать
28 Глава 1. Основы лабораторного обследования пациентов
медицинская сестра при взятии проб крови. Для определения боль¬
шинства биохимических показателей в лаборатории исследуют сыво¬
ротку, однако, например, для определения адренокортикотропного
гормона — АКТГ необходима плазма. Кроме того, для определения
показателей, характеризующих состояние свертывающей системы
крови, необходима только плазма.
У здорового человека концентрация каждого компонента жидкой
части крови находится в определенных пределах, которые отра¬
жают нормальное функционирование основных систем поддержа¬
ния гомеостаза организма, его клеток и тканей. При заболеваниях
нередко происходит нарушение баланса одного или нескольких
биохимических показателей крови, обнаружение которых служит
главным принципом диагностики при проведении биохимических
исследований. Перечень патологических состояний, при которых
биохимическое исследование крови и мочи играет важную роль,
очень широк и включает заболевания сердца, легких, печени, почек,
эндокринной и других систем. Некоторые опухолевые клетки высво¬
бождают в кровь специфические субстанции, так называемые опу¬
холевые маркеры, обнаружение которых биохимическими методами
используется для мониторинга течения опухолевого процесса у
больных.
Биохимическая лаборатория выполняет тесты для оценки состо¬
яния свертывающей системы крови. Данные тесты показаны боль¬
шинству больных, направляемых в ЛПУ для хирургического лечения
и находяпщхся на лечении в отделениях реанимации и интенсивной
терапии. Многие пациенты из группы риска по сердечно-сосудис¬
тым заболеваниям принимают препараты, которые замедляют свер¬
тываемость крови. Антикоагулянтная терапия должна обязательно
сопровождаться мониторированием состояния крови, чтобы вовре¬
мя предупредить такой опасный побочный ее эффект, как кровоте¬
чение.
Большинство биохимических анализов выполняется в КДЛ на
автоанализаторах. Производительность автоанализаторов в разных
лабораториях существенно различается. В небольших лабораториях
автоанализаторы способны тестировать 20-30 проб в 1 ч по 10 биохи¬
мическим параметрам, в крупных — 200—400 проб в I ч. Результаты
большинства биохимических тестов готовы в день поступления проб,
при проведении исследований у больных с неотложными состояния¬
ми — в течение 1 ч.
/./. Организационные принципы выполнения лабораторных... 29
Иммунологическая лаборатория выполняет тесты, результаты
которых необходимы для диагностики различных заболеваний и
состояний, в основе которых лежат иммунные механизмы. К таким
заболеваниям относятся врожденные (первичные) и приобретен¬
ные (вторичные) иммунодефициты, в основе иммунодефицита
лежит недостаточность определенного звена иммунной системы.
Например, недостаточност^ь системы фагоцитоза приводит к частым
рецидивам гнойных инфекций, а клеточного звена иммунитета
(дефицит Т-лимфоцитов-помощников) — к развитию синдрома
приобретенного иммунодефицита (СПИД). Нередко в к.тинической
практике встречаются заболевания, при которых иммунная систе¬
ма организма человека формирует иммунный ответ против собст-
[»енных тканей и клеток. Основное следствие такого нарушения
иммунного ответа — выработка антител. Такие антитела называ¬
ются аутоантителами, а заболевания, которые развиваются вследс¬
твие повреждения ими здоровых клеток организма человека, —
аутоиммунными. Нахождение в крови аутоантител к определенным
клеткам и клеточным структурам играет решающую роль в диагнос-
гике ряда заболеваний щитовидной железы, печени, почек, перни-
циозной и гемолитической анемии.
Наиболее ответственной частью деятельности иммунологической
лаборатории является определение группы крови и резус-фактора у
пациентов. Переливание крови стало настолько обычной процедурой,
что можно легко недооценить его опасность. Вместе с тем необходи¬
мое часто для спасения жизни больного переливание донорской крови
связано со значительным риском для него. Правильное определение
|'руппьт крови и резус-фактора как у донора, так и у пациента в лабо¬
ратории совместно с грамотными действиями медицинской сестры по
идентификации больного, безошибочным заполнением паспортнь[х
данных пациента в бланке-заявке на исследования, в значительной
степени снижают этот риск.
При попадании любой инфекции в организм человека иммунная
система продуцирует антитела к специфическим антигенам (белки)
инфекционного агента (бактерии, вирусы, простейшие, паразиты, гри¬
бы). Повышение уровня специфических антител в крови, которые опреде¬
ли ют серологическими методами, является показателем инфицирования
больного тем или иным микроорганизмом. Наряду со специфическими
антителами серологические методы исследования позволяют обнару¬
живать специфические антигены в крови, что также свидетельствует о
30 Глава 1. Основы лабораторного обследования пациентов
присутствии определенного возбудителя. Тестирование крови на нали¬
чие специфических антигенов и антител является важнейшим методом
диагностики ВИЧ, вирусных гепатитов В и С и сифилиса,
В бактериологической (микробиологической) лаборатории рабо¬
тают врачи-бактериологи и специалисты со средним специальным
образованием — фельдшера-лаборанты, технологи, лаборанты.
Основная задача бактериологической лаборатории состоит в диагнос¬
тике инфекционных заболеваний, вызываемых бактериями (в первую
очередь) и грибами. Сущность работы бактериологической лабора¬
тории заключается в выращивании бактерий на специальных обо¬
гащенных средах и последующем определении (идентификации) их
вида, полученных из различного биологического материала, включая
кровь, мочу, мокроту, спинномозговую жидкость, кал, выделяемое из
органов мочеполовой системы, отделяемое из ран и других инфициро¬
ванных участков организма.
Одна из проблем бактериологического анализа — это то, что
многие виды бактерий являются условно-патогенными (симбио-
тами, которые живут на кожных покровах и слизистых оболочках
человека, не вызывая заболеваний). Задача врача-бактериолога
состоит в том, что он должен дифференцировать патогенные бак¬
терии (вызывающие болезнь) от симбиотических, которые могут
контаминировать (инфицировать) пробу с биологическим мате¬
риалом во время ее получения. Некоторые жидкости организма
человека в норме стерильны. К ним относятся кровь, спинномоз¬
говая и суставная жидкости, а также пунктаты из плевральной и
перикардиальной полостей, в связи с чем бактерии, выделенные из
этого биоматериала, всегда являются патогенными.
После идентификации патогенного вида или штамма микроор¬
ганизма необходимо установить его чувствительность к антибакте¬
риальным средствам. Эта информация поможет назначить наиболее
эффективную терапию, направленную на уничтожение патогена.
Кроме диагностических задач, бактериологические лаборатории
ЛПУ выполняют важную функцию инфекционного контроля и пре¬
дотвращения внутрибольничных инфекций. Не менее значительна
роль лаборатории в контроле за состоянием операционных, перевя¬
зочных, процедурных кабинетов.
Таким образом, КДЛ предоставляет достоверную диагностичес¬
кую информацию о клеточном, биохимическом, иммунном составе
проб биологических материалов, полученных у больного, наличии
1.1. Организационные принципы выполнения лабораторных... 31
в них микроорганизмов и соответствии показателей этого состава с
общепринятой нормой или в сопоставлении их с ранее определявщи-
мися у того же человека аналогичными показателями. Огромна роль
бактериологической лаборатории в реализации принципа безопас¬
ности ЛПУ для пациентов и медицинского персонала.
1.1.2. ОСНОВНЫЕ ЭТАПЫ ВЫПОЛНЕНИЯ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Единый процесс проведения лабораторных исследований принято
делить на три этапа: преаналитический, аналитический и постана-
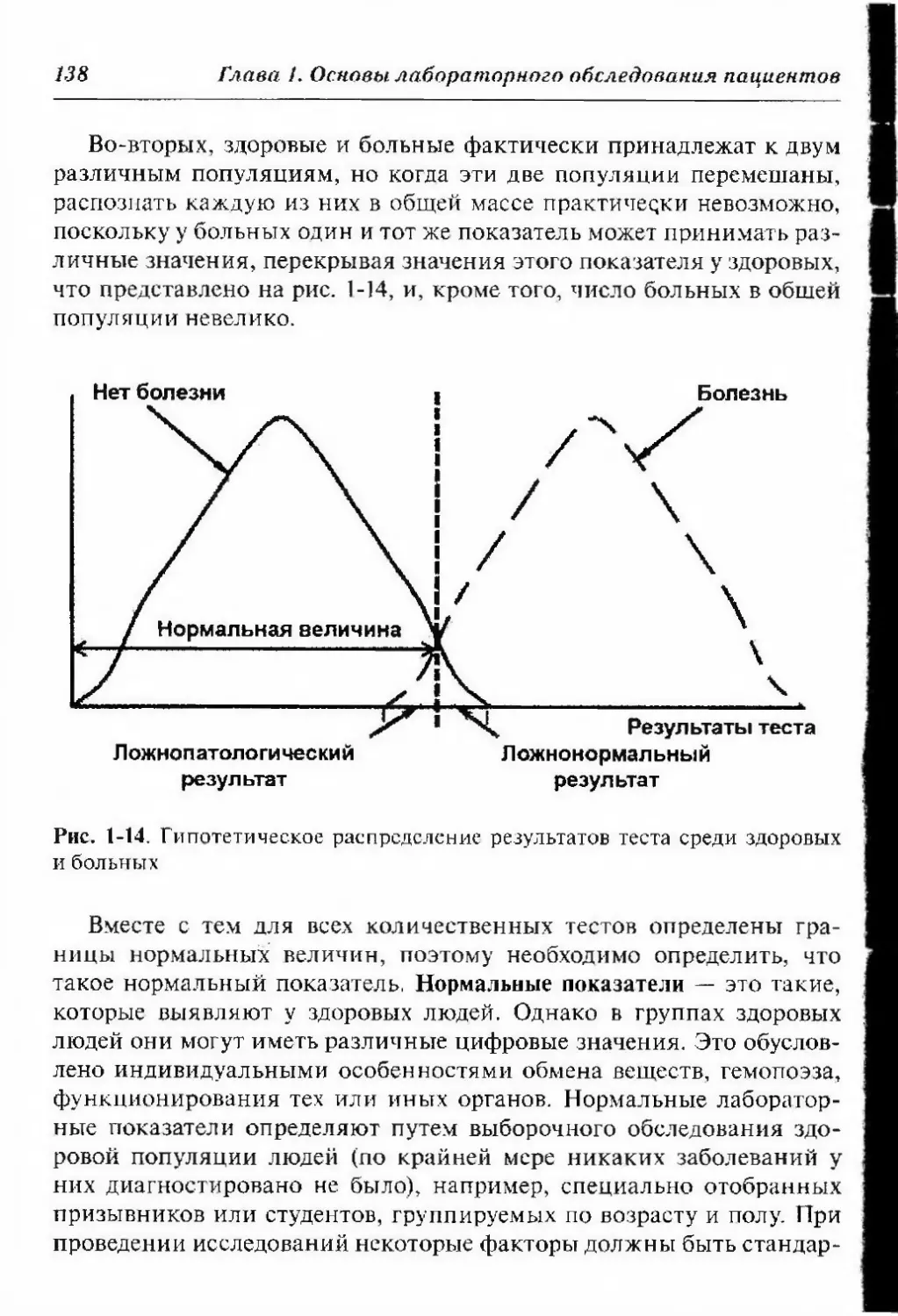
литический (рис. 1-2). Для медицинской сестры важно понимать, что
происходит на каждом этапе, так как они тесно взаимосвязаны, и
л юбые отклонения в их проведении могут вызвать задержку результа-
гов анализов и снижение их качества.
Преаналитический этап частично проводится вне лаборатории и
включает:
• прием пациента врачом и назначение необходимых лабораторных
исследований;
• заполнение бланка-заявки на анализы;
■ получение пациентом инструкций у медицинской сестры об осо¬
бенностях подготовки к сдаче анализов или сбору биологического
материала;
• взятие проб биологического материала у больного в процедурном
кабинете или коечном отделении;
• доставку биоматериала в лаборатори ю.
Это важнейшая часть преаналитического этапа. Она полностью
находится в компетенции врача-клинициста, но в еищ большей сте¬
пени — медицинской сестры, в следующем разделе составляющие
преаналитического этапа, которые осуществляются вне лаборатории,
будут рассмотрены более детально.
Заканчивается преаналитический этап в лаборатории, где в отно¬
шении биоматериала осуществляются следующие процедуры:
• прием;
• регистрация;
• обработка;
• подготовка к проведению исследований.
32
Глава /. Основы лабораторного обследования пациентов
Постаналитический этап
в лаборатории —13,6%
Постаналитический этап
ла^ратории-— 4,0%
Преаналитический этап
вне лаборатории - 20,2%
Аналитический \ Преаналитический этап
этап-20,2% ■■ ' ' ' ‘ ■ ' ■ в лаборатории - 37,1%
Рис. 1-2. Этапы выполнения лабораторных исследований
Аналитический этап проходит непосредственно в лаборатории и
состоит из следующих процедур:
• подготовки анализаторов, реактивов, калибраторов к проведе¬
нию исследований;
• калибровки анализаторов;
• проведения внутрилабораторного контроля качества;
■ проведения различных видов исследований;
• обработки полученных результатов, их регистрания.
Постаналитический этап частично проходит в лаборатории и
включает следующие процедуры:
• написание заключений по результатам исследований;
• доставку результатов исследований в отделения или регистратуру;
• составление статистических отчетов;
• обслуживание и уход за анализаторами.
Вне лаборатории постаналитический этап включает:
• получение бланков результатов анализов медицинской сестрой;
• оценку результатов анализов медицинскими сестрами и врачами;
• документирование результатов анализов;
• эффективное использование результатов анализов в лечении и
уходе за больными.
В общем виде взаимосвязь трех этапов выполнения лаборатор¬
ных исследований и их составляющих представлена на схеме 1-2.
Следствием является лабораторная информация — результаты лабо¬
раторных анализов.
Временные затраты на проведение каждого этапа единого техноло-
1.1. Организационные принципы выполнения лабораторных.
33
34 Глава 1. Основы лабораторного обследования пациентов
гического процесса производства результатов лабораторных анализов
распределяются следующим образом:
• преаналитический — 57,3%, при этом временные затраты вне
лаборатории составляют 20,2%;
• аналитический — 20,2%;
• постаналитический — 17,6%.
Главное требование, предъявляемое врачами-клиницистами к
лабораторной диагностической информации, — объективно и с высо¬
кой надежностью отразить состояние внутренней среды организма
и выявить ее изменение, вызванное определенным патологическим
процессом, т.е. получаемая лабораторная информация должна быть
качественной.
Обеспечение качества результатов анализов базируется на едином
технологическом процессе их производства, начиная от составления
обоснованной заявки врачом-клиницистом, взятия биоматериала,
его доставки, проведения исследований и заканчивая получением
и использованием результатов для оказания пациенту необходимой
медицинской помощи. Качество процесса производства анализов
должно обеспечиваться сов.местны.ми усилиями врачей и среднего
медицинского персонала и специалистов лаборатории.
Если рассмотреть единый процесс проведения лабораторных иссле¬
дований в целом, то легко заметить, что наибольшая его часть прихо¬
дится на преаналитический этап, причем 20,2% времени затрачивается
на различные процедуры вне лаборатории. С.чожность правильной
организации преаналитического этапа в любом ЛПУ во многом обус¬
ловлена тем, что здесь отсутствуют четко установленные стандарты для
различных процедур, преобладает ручной труд, а многочисленный пер¬
сонал, обслуживающий пациента на этом этапе, имеет разнос подчине¬
ние и разное по уровню и содержанию образование. Если врачи-клини-
цисты, медицинские сестры, санитарки работают вне лаборатории, то
врачи клинической лаборатории, технологи, лаборанты, регистраторы
выполняют процедуры внутри лаборатории.
В целом преаналитический этап занимает достаточно много вре¬
мени в едином процессе выполнения лабораторных исследований.
Появление даже незначительных ошибок здесь неизбежно приводит к
искажению качества окончательных результатов лабораторных иссле¬
дований. Как бы хорошо в дальнейшем лаборатория ни выполняла
исследования, ошибки на преаналитическом этапе не позволят полу¬
чить достоверные результаты.
/. /. Организационные принципы выполнения лабораторных... 35
Наиболее частыми причинами неправильного результата лабора-
горных исследований являются ошибки, допущенные на преаналити-
меском этапе: неправильное взятие пробы, ошибочные манипуляции
с полученной пробой и нарушения условий и сроков ее транспорти¬
ровки. По данным многих ЛПУ, иа преаналитический этап приходит¬
ся от 46 до 68% всех лабораторных ошибок.
Лабораторные ошибки ч^юваты потерей времени и средств на проведе-
пие повторных исследований, а их более серьезным последствием может
сіать неправильный диагноз. Исследования многих ЛПУ показывают,
что из-за лабораторных ошибок до 6% пациентов могут полу^іать непра¬
вильное лечение, которое может привести к ухудшению состояния здо¬
ровья, а примерно 19% больным назначаются ненужные дополнительные
исследования, удлиняющие сроки лечения и пребывания в стационаре.
Как было показано выше, преаналитический этап занимает
57,3% времени выполнения исследований и служит самым большим
источником ошибок. Следовательно, чтобы повысить эффективность
результатов лабораторных исследований, в первую очередь необходи¬
мо улучшить качество собираемых проб биологического материала.
Именно поэтому в мировой клинической практике особое внимание
с 1 ал и уделять тому, кто, в каких условиях, какими приспособлениями
и как осуществляет взятие, хранение и доставку проб в лабораторию.
Есть и другие причины, по которым качеству преаналитического
эгапа уделяется так много внимания. Прогресс лабораторных техно¬
логий, оснащение КДЛ современными автоанализаторами позволя-
юг получать существенно более точные результаты анализов. Новые
лптоанализаторы весьма чувствительны к качеству исследуемого био¬
логического материала, и это предъявляет более высокие требования
к условиям взятия, хранения и срокам доставки проб.
Еще одной причиной, обусловливающей повышенные требования к
качеству проб биологического материала, является тот факт, что в послед-
! ІСС время врачи-клиницисты и средний медицинский персонал при при¬
нятии клинических решений все более полагаются на данные лаборатор-
н 1>1х исследований. Следовательно, для постановки правильного диагноза
им необходимы достоверные результаты запрашиваемых тестов.
Существенно изменился и сам процесс лабораторного обследова-
ния пациентов. Если раньше взятие проб биологического материала у
больного и их анализ проводились в одном и том же ЛПУ, то в настоя¬
щее время нередко пробы из разных ЛПУ доставляются в централизо¬
ван ну ю КДЛ, расположенную за много километров. Соответственно
36 Глава /, Основы лабораторного обследования пациентов
значительно удлинились сроки доставки проб и изменились требо¬
вания к их транспортировке. Раньше медидинские сестры постоянно
контактировали с лабораторией, знали особенности е^е работы и тре¬
бования к пробам, в настоящее время этот контакт может быть нару¬
шен. За последние годы значительно расширился спектр тестов, кото¬
рые выполняет лаборатория. Многие тесты требуют особых условий
взятия и доставки проб. Существенно повысилась чувствительность
методов, которые использует лаборатория для анализа биологическо¬
го материала, но при этом объем анализируемого образца уменьш ился
в десятки раз. Это привело к тому, что качество анализируемой пробы
приобрело чрезвычайно важное значение, а влияние преаналитичес¬
кого этапа на результаты лабораторных исследований стало поистине
решающим.
Самый эффективный путь предотвращения ошибок преаналити¬
ческого этапа — разработка стандартов для каждой процедуры данно¬
го этапа. Несмотря на то что в отношении процедур преаналитичес¬
кого этапа у нас в стране не существует установленных стандартов,
отдельно взятые критерии, используемые в КДЛ наиболее развитых
стран мира, могут быть взяты за основу для каждого отдельного ЛПУ.
На уровне ЛПУ ответственность по выработке и внедрению этих
стандартов лежит в первую очередь на главном враче и главной меди¬
цинской сестре ЛПУ. Первым шагом на пути к соверпгенствованию
преаналитического этапа на уровне ЛПУ должны стать создание и
утверждение внутренней инструкции по качественному выполнению
процедур, которой должны будут жестко следовать все специалисты,
участвующие на это\т этапе.
Опыт наиболее развитых стран Западной Европы и США, где
приняты стандарты в отношении различных лроиедур, происходя¬
щих на преаналитическом этапе, таких, как взятие биоматериала и
его доставка в лабораторию, прием биоматериала, подготовка его к
исследованиям, показывает, что качество результатов лабораторных
анализов значительно повышается.
Помимо разработки стандартов, важным шагом на пути к улуч¬
шению качества преаналитического этапа является внедрение в ЛПУ
передовых технологий — использование одноразовых приспособле¬
ний для взятия проб крови и сбора биоматериала. Примером таких
устройств могут служить вакуумные системы для взятия проб крови.
Внедрение современных одноразовых приспособлений для взятия
проб крови и сбора биоматериала требует обучения всего медицин¬
1.2, Роль медицинской сестры в обеспечении качественного... 37
ского персонала, задействованного на преаналитическом этапе, и
в первую очередь медицинских сестер, отвечающих за взятие проб
крови и сбор биоматериала.
1.2. РОЛЬ МЕДИЦИНСКОЙ СЕСТРЫ В ОБЕСПЕЧЕНИИ
КАЧЕСТВЕННОГО ЛАБОРАТОРНОГО ОБСЛЕДОВАНИЯ
ПАЦИЕНТОВ
Преаналитический этап, который проводится вне лаборатории,
включает прием пациента врачом и назначение необходимых лабора¬
торных исследований, заполнение бланка-заявки на анализы, полу¬
чение пациентом инструкций у медицинской сестры об особенностях
подготовки к сдаче анализов или сбору биологического материала,
взятие проб биологического материала у больного в процедурном
кабинете или коечном отделении и доставку биоматериала в лабора¬
торию. Главная роль в обеспечении качественного выполнения пере¬
численных процедур принадлежит медицинской сестре.
Для того чтобы выполнять процедуры преаналитического этапа
правильно, их необходимо строго регламентировать в виде инс¬
трукций или методических рекомендаций, выработать критерии
оценки качества каждой процедуры. Приведенное ниже описание
процедур может служить основой для разработки инструкций в
каждом ЛПУ,
Первоначальной процедурой преаналитического этапа является
составление заявки на лабораторные исследования. Каждая проба
биологического материала должна сопровождаться заполненным
направлением — бланком-заявкой, подписанным врачом-клини¬
цистом или медицинской сестрой.
1.2.1. СОСТАВЛЕНИЕ ЗАЯВКИ НА ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Врач-клиницист является основным заказчиком лабораторных
анализов для лабораторий, а следовательно, и их пользователем. Он
инициирует запрос на лабораторные исследования, составляя заявку
па желаемые анализы в истории болезни или амбулаторной карте.
Эта информация поступает в виде заказа, написанного от руки, или
38 Глава /. Основы лабораторного обследования пациентов
через информационную компьютерную систему медицинской сест¬
ре, которая забирает необходимый для исследований биоматериал у
пациента. В ряде случаев заявка на анализы поступает цлабораторию,
специалисты которой также непосредственно работают с больным,
осуществляя взятие крови на анализы.
От того, насколько правильно и рационально будет составлена
заявка на исследования каждым врачом-клиницистом, во многом
зависит качество результатов лабораторных исследований.
В целях улучшения оформления заявки на анализы, получения
всей необходимой информации о биоматериале и пациенте специа¬
листы лаборатории должны разработать оптимальную форму заяв¬
ки, согласовать ее с врачами-клиницистами и обеспечить бланками
заявок все лечебные подразделения ЛПУ в достаточном количестве.
Если специалисты лаборатории не уделяют этой важной проблеме
достаточно внимания, из клинических подразделенрій будут посту¬
пать неправильно оформленные бланки заявок, что потребует еще
больших затрат времени для выяснения информации, не указанной
в заявках. Примеры бланков-заявок на лабораторные исследования
приведены на рис. 1-3—1-8.
Медицинская сестра играет важную роль в правильном заполнении
бланка-заявки. Ошибки в направлении могут привести к тому, что паци¬
ент с опозданием получит сообщение о важных изменениях в результатах
исследований, или к тому, что анализы вообще не попадут в амбулатор¬
ную карту или историю болезни. Внимание к деталям в сопроводитель¬
ных документах жизненно важно при направлении проб для определения
группы крови и резус-фактора. Большинство случаев трагичнътх транс¬
фузий крови — результат ошибок в сопроводительной документации. Все
бланки-заявки должны включать следующие сведения:
• фамилию, имя, отчество, дату рождения, пол пациента;
• отделение, номер палаты, номер истории болезни или амбулатор¬
ной карты;
• адрес проживания пациента;
• дату и время назначения исследований;
• биологический материал;
• перечень лабораторных тестов;
• дополнительную отметку, если необходимо срочное выполнение
анализа;
• диагноз;
• фамилию, имя, отчество лечащего врача и его подпись;
1.2. Роль медицинской сестры в обеспечении качественного...
39
Дивгностчвсиив панеяи
□ Биологический ВОЄІМСТ
Hj.oStin'
сітсі'блмвс»« АД лл
форе»м>ом»«.<«жел
tir,<ne«»6'TmpeHT>^ftf«rj. 1л»<вв4иа,
soribu^fiutkwM
п М»та^олич»скмй синдром
М і ..... JWMHfe.
Y^Mirnr.oBprfaw. жді^і^нн. їоГійіЛвіжи'ЯпМ,
ГТГ. «^«nryv*.!* ^?WTrs-i' . Kwmsewi,
иигу.'йМ. iflRK«Bi>T'v-.Bpeuf'i«h^ leCT,
•ЛьвуЧЛЙ«» ^»л^Т.МйЧв
О сицдром ожирения
Біс .... _..«r,90tt .CM,
ШЙН,СГТГ ПГ,
.. ж>р»і«00. НМСіГЛИі^
Q іСярдмдлкнийриск
пйкіічіп>Ві>й рпьнн>4С-Г4пн, СЯ5
□ АПО-АІ
Q Апо-8
D Гомоцистеии
о Линогіротеих (а)
□ Тригличариды
□ Холестерин
Q Холвсгврим-РПвП
Q Холеогории-ЛПНП
□ Гастропанвпь
<V;ipKBt9iMk«> Нсір«* 17. n»K»B*qtei* \.
•нтйрвлауц рутжі)
□ Диевотический
Г|Жіцся«.«ф|>Г«.С1Ии<«*. >«ICyT4uf. СчвПГЧЁ.
ВЛкібуїМК »сут<7ім}й *«)U«
Q Остбопоро9
О
□ Дооопмиг«»ьио (моча суточная):
Р Онкологический риск {муж)
(1СА ПСА о».. АФЧ, РОА. СА1 м
□ Омкологичвсхий риск {жвн}
л*ґ:. РЛА. сд ЇМ- СЛ121СА 15^
□ Пренатальний скрииииг
трисомий І1 триместр
баременностм &-13 мгдель)
Аі*,ІХ»іИІ>вВійНУЙ С $»Є«5ТНИГІСИ*1
І іРійШви^й аВЛС.( А 1ИА№-.А). сьобсанір (”
4^ь%\йт-л К0рис»»ч*сгоі о гиий.’іиг рі^'-лл
О Пренаталиаый скрииинг
трисомйй [2 триместр
варвианкаоти 1А-21 модели)
АіВіфвфГ’ог^ЮіЛйн (АФП>,сасво»«лЄ-
сИ^^^\^Ч»*<ЧМ>(*»г«КЖп:№ічи»йОчрів>мім
МПрйОП (1«
□І1робпр>;о с Пробирка с
ЖаЛГОЙ )<р*ЛАИтОм ГОГУЙОи кры шкой
Количество нвзначенных
исследований
Амияаш
Микроатнческвя
П ггш
□ ГлДГ
□ ЛДГ
□ ПДГ-І-Ї
о лчпаз»
D !(р«атии«иназв
□ Кілаїяикиеааа-мв
О Хйлинзстерв«
□ Фссфятаза ще;ючное
АнгаотинзинлревращающиА «'«рритян
ХйльинЯ
искизироаанчыА
D Фосфор
О МагьиЯ
□ Медь
Q Цемк
0$м»н жвтза
□ Же паю
□ Желокивстзьи. ІЛЮСОбн
D Тряноферрии
формант (ЛПФ)
□ Билирубин обмий
D билирубин ПРЯМОЙ
П ЖОЛЧНЬІВ кислоты
Smmim
о Витаїлін ВТ 2
О Фолнеаая <атспста
Зтітоопозз
О Эритропоэтин
Лбхврствениый монитовинг
П Дигоисин
П Обший балок
□ Альбумин
□ Краетинии
Q Мочааина
О Мониаая кяслсла
Р1 Аммиак
П Белкокые Фракции
««годом зпеирофорам
□ Иммуивапвктт>0ф0р«3
о а-1.а>1титрипсин
□ Антистреттголитим о
О 0-1-КИ0ЛЫЙГПИК0ПРО1ИИИ
П Глгттотлобин
Q p-2-Микротловупин
КйТУОИНЫЙ протеин
' зозинофилоа
Q Мифлобим
Р Тропонин!
□ Преальбуыин
о РвематоиАИый фактор
D СЗ компоиент комллем.
D с* комеонат «омлпян
□ СР&
Q СРЬ (ультрачувотвйт)
Q Церулоплазмин
□ 1эА
□ 10«
□ l«C5
О IpE
□□
□ ч П в П п П Я Піл материала (для проиерурного
® и ® Ы « Ы ® кабинета иЛевораторим ХХТ тик.)
o№>9Upwtk3im)t»itt«utbtuP. тшипфмфтттмпит^дч^
ЗАПШШИ ПРШШИ BlfHSMU I» сті^т" О^роиаи (Вьтбрюшт« (ЛФлеВопиш олямуатЗтттеШ)
Рис. 1-3. Бланк-заявка на основные виды лабораторных исследований (лице-
И11Я сторона)
40
Глава 1. Основы лабораторного обследования пациентов
Q ОАщ. яитипюжд. ainKBHOCTb
D тттттш
о
г ормоны
□ Общий тэ
□
□ Общий Т4
П Т4 свсбодиь^й
Q ТТГ (чуь С1 ан гвЛкный)
□ Тир60Г/10буЛУ11
Q Антитела мТГ
□ Антитела к ТПО
Q Тест ПОГГТОЩОНИЯ ТИ|>ООИДНЫА
горнаиоз
ЛГ
ФСГ
Прси.ектутн
Прогестерон
Эстралиол
ЭС70Н0Л свободный
TecTDciapDH
Свободны й твстостерок
Дишдротестостврон
о «апыттонин ^
□ Осгеокапьцин
П Д|93и№ИТЧ4рИДИНапИК
Q (J-OfOWiep*
Q РINP (М-терминальный пропеетмд
прокоплатена 1 типа)
г<тотшт
а стг
□ ИПФР1
О&щеклинические исследов.
о ()ба|ий внапиз мвои.
□
□
□
□
□
О
□
□
□
□
□ Хорионический гонадотропин (ХГЧ)
Q Свободная 0-субьвпинииа ХГЧ
О Лпацвнтарныйлвшстен
г-1 Асооцмироваимыйоборемвнеяоотью
^ плюмвнный беяо«А <РАРР-А)
Q 17ч»хсипрогвсГ«рОм
Q Гпобули-. связывающий
лояоаые гормоны
О Ангиспермалькъю антитела
HadnosewHWfii
□ ШЩ^Ш
□ Кортиаоп
а Андроствндион
□ АГЭА^ОА
□ Апыюстеоон
Гкздяелудтнар железа
d Иткулнн
о с-|мгти
□ Антитела к инсулину
^ Антитела л бе га-клеткам
подасалудочной жвпвзы
Q Анти ra^ia х шугима ^декарбопмгоие
Маркеры опухолевого роста
□ ЛФП
П ПСА общий
□ ПСАсеободный
□ РЭА
О СА13-3
О СА126
О СА19-8
О СА7г-А
□ СуЗга-гт-т
П НеСфонслвкифинескяв енолаза
□ (! г Мифогловутн
Иммунный статус’^
Кл#70ними И туморанькквщ иммунитет,
фа/оцнгм:
ЦИК, иммуноглобулины А.М.ГУ. СЗ СЯ ц.
реастнвиый белок
0 Кл«то<мый иммунитет:
о гуморалкншй иммунитет;
ЦИК. нимуногловулины A.M.G. СЭ, СА. Ц-
(Капмвный бело»
0 »»гоцнтоз:
□ Цириупируютие иммунные «омелотеы (ЦИК)
Коагулопогия
О Время свертывания
Q брвылкровотечень^я
' По прад&аритвлькому сотасовРннюСа^аборатормвЙ {i^i. Эбб-ва-ОЗ)
- Пп<1Лв взятие крони пробирку помесгите 9 омкость со л^дом
1^ исслодонаине производился по поивдольнитм
Биохимия мочи
Газовая nopia« Q
Q Глюкоза
О .Обц(нй бнлЬи . ;
Q АмиТфзз '.
Q Лимгаза лаизреагичвсквя
0 Двшсмшрмдйнапш
Суточный; диурез ] j \ | | мп
о Гоюлз»
□ Общий белог
Q 'Апьбу^^мн
D К^вткыин
о Мсггняайий
О ,Мочвбаяк^(рлд1н
Q Ок^Шы
О Проба Рйбарта
о Кальций
О йодФбр
о Магний
□ ЮМаЗС!
D Кортзол З': - а
СЗ Свовадмыйюргмэол__^
Q (Рг микроглобулнн
О Элект]цфорйа белков
Q б^окомкаолукоубнвя кислоте^
О Мвтенефриим общие (маме) ^
Q МетамеФрин с*ойодны(У^^
О Норметивллриныови»«
О Нормвтанифрнн иврбддиый^
о Ввиилилмищ^ьмай кйрлога ^
о Адрвиали|<^
D Нораярвнал™^
□
О IT-k^HltoCieptKejMOr^C)
Аутоиммунная патология
О Ангннуклеарныв внгнтеоа
Q Агпнгела кгкяшрв.тьнай ДНК
р. Антитела к кврд|лопнлилу 3(зА 1аМ.
нм
LJ Антитела к тнадину fgA. (gG
D Акгитеге к г падкой мускулатуре
СЗ Антнммтокоидриальные антигепа
Изосеоология
■ ■
Рис. 1-4. Бланк-заявка на основные виды лабораторных исследований
(обратная сторона)
1.2. Роль медицинской сестры в обеспечении качественного...
41
ФамилиЯ"
Отчвсі^
W« "
К0#^ЛПУ
■'Врач.
Поізніє'
'Дпа и «р»»ін'«мтиіі'л
КоАОТІІбПеИИЯ,
цим« W” . •—*“ - w,.'-' UJ вфМпц
, ' йа«ві«. Жй«а, '.
ї Д ;■
-іда«йД
Моче
Р Обмий аняпиз мочи
р Акалмз мочи по Змчниикяиу
Р Анялиз мочи по Нечипоренко
о з > стякамнее проба
О Анапи* иомк на миюбачгерии туверкугаиа
Химіггескии «нализ мочваьиг камней
□ Химический анализ мочевого камня (канесгввино)
р ХииичрскиА анализ мочевого камїгя (спеезрескепия,
количесгеегаю)
Определение нархопшкоа в моче
□ КднН4бин0ОДо* 9 моче
□ Кокаик в моч«
С1 ^‘W)тaмфlltaмиN а моче
О Огтиатм в мдчф
□ Зкстаз*1 в моче
О Амфк1Ьми««в0МОЧф
Моярота
□ Исследование мсмроты гЛщил^^ническое
0 Аняпьш иофоты ка микобактерин іуберхупіюо
Транссудаты и мссудаты
0 ИсипедоваийО плевральной жидкости ибшдклииумеокое
Р1 Анапил лоевральчой жидкосш не мичовактерии
тубериумза
О Исследмение оеріеоодиапьной жмаа^січ общоїщинйческоо
0 Аняпиз перигардишіь»юіт жна-состц на микобцкгерии
□
□
□
□
Общеклиничвские исследования
Отбклпмгое мочелопоФьи ореено«
Исслодоеенне отдепиамого мочепогюеых органов
Исчледоевние секрета предо ппельиой (колезы
□ Сеермурамме
Хал
□ Общий анализ кала
Q Паикрелтическея аоартазв.1 е кале
Q Ляподогрзммя капа
О Упшводи а келв
Q Иоспедоеекие кепа чВ скрыгугр крець
Q Исспедования кага не простейшие и яйце сипылитоа
□ у1сРледованпекепе «а знтвровиоз
МсслеЛмАния на грибы
О УТохледование ногтевык пгтасгинок на грибы
р Исспедовение сосковое «окм на ф«6>1
Q Иоспввованиа волос ня грибы
туберкулеза
Слиномомкіейя жидкость
Нсллвіїгвание ониннОмозгсвсй жидкости
Иоследоеение слиниомозгречй жидкости на микобактерии
туберкулезе
Глюкоза в СПИИН0МОЗІРВОЙ жидкости
Хгюрпцы е аіинмомсзгоеоЛ жидкое гн
Суеямвнвя жидкость
] Исглядовачие суставной жидкости
' По птіедеаритегтьному согласованию с паборагориий (гел. 9б5'Г>3'РЗ)
□ ^neQsO 10 Забор материала (ОЛЯ процелуриогс «вбинетв кЛгборатории XXI аек»)
ПЕ<№НЫМХ S№Wf |Ю с»
ЧВьК
йручш) явшаи ели пкташйи чцмдимі
ихдвйоватшз оптмвчаОтеРП)
Иис. 1-5. Бланк-заявка на общеклинические и цитологические исследования
42
Глава 1. Основы лабораторного обследования пациентов
Фамилия
Отчество
•••••.код-
V диагирм
рввупьтлтол • • • я •
Код ЛПУ
Врач
Полис с*рия
кад
контингента
ДЭН! и одвмя взятия
пробы
Код отделения
Дата
ромдвмия
/ / ;
Овч» . - . AMiiftu Г^т- Цмы Мии'/1Ь1.-
Номер чв|ф'
' ■'■ ■. Ж истерии Йопезни ' "■ •
. (аибул. пргы).
Тел.
СтрпЬвяя
вомпяния
Ц Г]
«у*
Г~1 срочная
Заполняется при назначении исследования иа ВИЧ
Адрес TV.»,.
Паотюртвыр
Д»*ны»
KRM
КОГйв
ЙЫ«вК
Серологические
□ CxpuHwe ТО/?С|Н-ун()!1ек«ий
Антител н ктшссля и ||>Л к мп.чАудигел^цм:
токсоплашплв, красиухм, к1Кп:ммг9П0111дгусн:>й
лифвнцин, гвопвсн
□ Скриииг drjf! госпипюпи:1^цип
Леа uToni. к Ое^русу иммунодефицит it чн лммш 1.2 1.2 )
Лк7нтола.)> TreporemapellrcEutn и 1уО)
yWrrurOH BHpyi:e гвРАТктта 6 (Нв»А^>
Ангитепа к вирусу г^пвтигжО (вити-НСЧ') щуммарн.)
Протиаовирусные антитела
ВИЧ инфещия
О А.чтитопв « вирус, имыуяанефицятв чипоеакн 1.2 (ЗИЧ 1,2)
D Аитигела » зирусу иммуиодйфи11итя чепозвко 1.2 (БИЧ 1.2) -г АГ
Гвпетит А
О Аитигела к вирусу .-впагиго А (рМ
Q Амиюпа к вирусу гепатита А tgG Цшпич.)
Леле/пот В
D Аитюен -о» оирусв ™.'.!пита В (HBoAaJ
Q Лодтвержавощий тест на антиген «я» вируса гепатите В (НВеАд)
О Антитепв к антигену и. виоуса гепатита в (ан'иЧЧВвАд)
D Ачтитвга к сардцевиче вируса гепатита В (анти-ИВс) IgM
D Аититепа к сердксвине вируса гепатита 8 (анти-НБс) IgQ
Q Ачтиган <е. вируса гепатита В (ндеАд)
D Аититопо к анпкену те* вируса геиатига й (аиги-КВеАд)
Гу летит С
Q Ачтитега т »ярусу гепатит* С (анги-HCV; сумеарчме
ГГ Аитигепп и вирусу .-«патита С (антя-TlcV) 1дм
Q Подтверждаюгиий тест на антигена к вирусу («гмгита С
исхлтедоеания
Гелвтиш О
С] Антигвпй к вирусу гапвтита .свпьта ]дМ
Ц Антитела )с вирусу гепатита дельта (сумм )
Гепатит В
□ Антитела к вирусу гепатита £ [дРЙ
□ Антитела к вирусу гепатита с 1вС
иитоыиаапоаируонзя ипфепшя
О Анттела « читоиегэлоиирусу |дМ
□ Ангитега в нитомегалрвирусу 1дО
ГергтегттрчесАэя ич1)1>0УЧче
П Антителе в вирусу пррстогп герпес* ' и 2 типа (ко.пи
П Лнтитвпа « вирусу простого герпеса 1з»Л
□ Аптитело»вгфуеу простого герпеса 2-рго типа 1ай
/(рвснуха
П Антитела к еирусу воаснуви 1вМ
О Аитнгела в вирусу краснух« (дО
Корь
О Литигеги к вирусу кори 1дС
Инфокииоппый шнонукпбрз
Антктпля к вдериоыу лнтигену вирус*
ЭпштеДна-Рарр ТдВ (аши.ИА)
Р, Аититепа к капсидиому белку вирусе
ЭпшгейнаЧ5вОД(аи1М-\'СА>1эМ
Опоясывающий топай
О Агяитепа к вирусу ВарицсллоБоствр |дМ
□ Антителе к вирусу Варичеилв-зостер (дС
Кпешавай знй/ефалит
О Антитлла к вирусу плещввоге анцефапит» 1й«
Лигигела к вирусу нледевого зичвграгтиге 1рМ
etmume ЬкШжштт»шартпапопт1япййпиткаячкЛЧВат»^шиГтК><т«М<арни1т1и
Рис. 1-6. Бланк-заявка на серологические исследования
1.2. Роль медицинской сестры в обеспечении качественного...
43
8зааш«а^а^^
Бактермологичаские исспадования
ПрИМВНЯМШ« |-- " ■.■■.»-. .,еы.1
ЙКТИбИОТИКИ I
Моча: 0 сродияя порция, Ц катогвр, 0 другое^
_(уивить)
□ Пия» .на.мифоФлору 1« чурЕяитиЛкИосц.« аи>*<б*'ОТИ(»М'
О По(я«нвСапйави чувствияньмостк и »пммикот ачвс««»« првтф»т»и'
Отдоляомо«: О апагалтца, ^ цервикального канала. [2| агейки шаткн. гкиюсти матки, уретры,
[3 стмрма, □ сеч>вт простаты, □ другое .(угавэгь)
О ;.6аі(Тір'носп;ПйнеетОД.Іихпадааа^
□ -ГЙ<;ёе.)«';Ии«(|бф™ру.нч^*в^^
□ . .И^мдф.аФнйв/ііо Яйиіягоз.твгеіміц», е:вйіібое»сгіцеЙ:Ийяйв-н онгй«йганйі'блеі'ан’^в^^ ;
О Поовача Свікків й чуаоі«н^і»аодть.,»вч™»>«віячво(«Ц:,ірв(мрвтаи
П гІ0сммМ,аогюгіТняае(гойпюі<і:ИчукгвигвіЬй<хгьквиткОйсптим'г
□ Пад»нэ»а(1взр5вныяй»спад1ничуаст*й7«нй«1Еть»я«твв«оти«амг.
□ Ш
Кая[3 О ИШ
□
□
Р
а
а латт
□
о
І а
Отдалмиоа из глаза; □ левый, □ правый (указать)
О Поем нк мйіфИ)ігмву нчуесгентодьногаь ктыгйййвтоквкГ .
О Посей иа Сапбіба я чувсгвитетшаеть«ачГймиючтюииГи првларагвиґ
□ .Посев на Ы\ рдавфовіф (гаяокор!) и ііувотангвпикірл. к:4ит(*&юг*|К«(»-,.
Допшгнительиае услуг»; □ Опредепеим» мувстилепьиосіи ЕЭВ1 шгвииря
аМЯММВ Ивобкйшвв
шритяЛ. гашпрмйимммайручпй ЧЕИИЬМН т Ютстш «р««№
мтииШГПЕЧ№МГеМВШ1лоав4уп|вгсб|дман (Вь;^)»йнь№и№імді]вайияопімм»аюе[^
Рис. 1-7. Бланк-заявка на бактериологические исследования (лицевая сто¬
рона)
44 Глава 1. Основы лабораторного обследования пациентов
Кровь 0 Каптер (вена) □
О Посев нв аяробныв « внвзробныв бвтерш« н чуясгвительность к антибиогйквм*
Огдалями«: []] нос,[|] эав.0 павухн I указать), П другое ( указать)
□ :Б»««р1й»*Х1Нчао(овйкэтздв»РЧ1ввкваи1в«»{ГО^(а^
О №с«а на янкрофйеру и чумтвктельводть к аятибйртнкм*-
□ Посбв иа аназробиыо бакгорлн «.нуаатытгоп-иостъ к аитибиот шам*
□ Пйявиа ечасЛаяий мафиЛлкич! »чувагвлгейЕнимв»витибидаиквке
□ не.С9(Т*4>'Л. чувстаитмкяодть ч:-йнти.й(1к(йу1я*4«ии- ареяврапи*?;'
□ ;Пова9чвА«фТврЙК1
□ ГЬаванв 1ФкПк1ШЧ»)»1итьпрк:»35-гЗЗ:,“1':
□ ■.■■ГЬ5е«*Ф.>Е: ялвй^ кда.губдатумр*Ь(хрвн)»*'ь
Огдапявмое ю укв; Ц пвао«, Ц правое
□ : Яобвв>в МИЦЮфП)^ п иувсткитвяылсть » янтиВиогикаи'. 1
□ ■ ■■ПОД4»ивеайЛааячУ«т«рг*ЛиОДтьк:»йт»Ынк»р«1е1*«м:гф#1«^
Д Мокрота, [3 ДР.. (указать)
□
□ ^
Г*1 Гной, Д ткань, [3 транссудат, [~~] экссудат, [3 отделяемое ран,Г~| инфильтратов, [~~] ввецесеое,
[3 др.... - - ..(указать)
□ :.Б«1Лбри^лц^а>« к^еДвевмйе тЦрбиТ^ яа^.г>
О л<)С^;>^ЯФИ)Рф.11арурчувств)^Ё1;ь^^
□ .П.вйе»(1Йв1*^((йбиь«.вяк1в(Щ^И.чувС''®йгр;^^
О гПоссв'ла »«опстьы отвфИлффкк и‘^сЪ^*Лййрй1к к фстйбар
О <^(ам(Т<а.йей|)1аа;»^^^ .тм
О ;.чуаетК1й1фыф<я.ь^^^^ ,
П Желчь (одна порция)
СЗ .ЙЙ(^*;^;*1Й5!ЯФ5|Р^.Й.Ч^
□ :.П0сР«.йар.ан#бра()9ью.4а1(чриил^
□ пбйонаС^^
О гисае.иа СапеНЗя и музотвитепыф^ к флймикрТнчяским .препарзтеЦ’.
□ ЛЯК.ОР, Пуикционная*ид.ты □ суета«, □ □ ^л,;Т □ «>•
П бектвржоофпнччЕЗоа иглпяцрнавив икодшфк^р д^в >
□ Пос»1««й«р«р1»|ууичу»стшвлькос1ьК»1Т>|5ивту»вМ‘,
СЗ . ПосАви«.Сч;;Фра в чувствительчостък.ккпшикетячеСхиилреларатям'.
О Писвя НКаИйвробаы*'бактерии и чувствитвгьность к антнбиоттфц*.
□ При» «а (Т. дряатЬрва» (гаио«о»*)и ЧувстватяьИасн»« пнтвбиОтттамТ ..
□ Посаа наЫ; тап^ИЛ!* и чуаствитвлвиойть кянтйиотнвям’ {»рамнтц. при *Збг+(17 тр
Грудное молоко: [3 левая | | правая молочные дапезы (указать)
О Лосев на мнкрофлору н.чувствитальиоль к.актиОиотикдмг
□ нэ 90лст^^ (^дф*1Л0>5ай( и sviBGTiaиtбJ^«Ht9CTь х
ЭИ ^•'■МАН И£!: * - иувствлгдльиодГк опредвЛАбТся при обнаружвН)^п 9Г№*ии ич«. « амачи гаиго возбудит апя
&терип>Ш|1т«и’1мслрач£псфт>!а44|Срвлоамли бт«тгильнш< ^ролиош 1ш^пд«»«(4вни1:^4^«милпч2т1вний яfA4t^-•(('C}
■ ■■.••• ■ . СггЛЖйаиычУйнТимчй^ 10П ып (Д':^1«П1А *1»чйМк^ ЧП« йе#йНйЧ1*р п ^tynufi■мuм^*7^^t ‘С)
ВУвВвЯ -2гДр*1Пм<ыа«гзм1«й|к.'(14:ть>в(|цвгдА>|«!г«н:гчв(д4Би^^17 1 г*1ч»ич||. ,'эогчрлл1гс»е тмчьте ЭчясовЭяьатмК'МСЗ'ивсгм'ф/^чо
'’атлыпм^Чшйпим члц тлгкчс фвжг. оеао<; (№СУ«Ый к тФчва'Ле ЗА чдстл |«пи крг]|1«и>*«Ж|Сг4\илм4МУ ''С до24
с*« ;湫м4 «укийнее ка 30 чг (икшаш а тгна«« 2^ часп кгти .'((Мчвмпа « ^^(Чиигакним * ^-»0 *С |
I' ' " 1 Фляйсмн оп* «ро»а (дктпап ■ Т11ч*кн» 3-^ чвем или >ф»1вии» « га^лсгсйгв при • г6-*:17 'С»ЗЛ 'шш»',
Фла*ж с'гоажлоотк») срадюП (дсагаам ■ ггмнм^часм ягмт х1рмиа«га ха1са)и^^мкв »2-40 X ль 3^ •|вйШ)
Количество назначенных
исследований
Забор рмгтернвла (дпя
прОііедурК)іо кабинет
«Лаборвтории ХХІМ«»)
Рис. 1-8. Бланк-заявка на бактериологические исследоваттия
(обратная сторона)
1.2, Роль медицинской сестры в обеспечении качественного... 45
• номер страхового полиса и название страховой компании;
• сведения о принимаемых пациентом лекарственных средствах;
• дату и время взятия (сбора) биоматериала;
• подпись специалиста, проводившего взятие крови или биологи¬
ческого материала.
Обеспечение качества результатов лабораторных исследований
начинается до того, как бу11ет взят биологический материал. Чтобы
получить качественные пробы для исследования, вначале следу-
сг подготовить пациента и приспособления (шприцы, капилляры,
емкости и т.д.) для взятия биоматериала.
1.2.2. ПОДГОТОВКА ПАЦИЕНТА
К ЛАБОРАТОРНЫМ ИССЛЕДОВАНИЯМ
Подготовка пациента к лабораторным исследованиям имеет важ¬
ное значение для получения достоверных результатов анализов.
Медицинская сестра должна знать и понимать значение влияния
целого ряда факторов на многие лабораторные показатели.
Взятие крови у пациента для исследований рекомендуется
производить в ранние утренние часы после 12-часового ночного
юдодания (базовое состояние). Ряд факторов вызывает изменения
в базовом состоянии пациента: диета, физические упражнения,
эмоциональный стресс, суточные колебания некоторых показате-
.1СЙ, положение тела при взятии крови, принимаемые пациентом
лекарственные средства. Они могут оказать существенное вли¬
яние на результаты лабораторных исследований, их необходимо
учитывать при анализе результатов исследований и стремить¬
ся максимально стандартизировать условия взятия проб крови.
Медицинская сестра должна знать особенности подготовки паци¬
ента к лабораторным исследованиям.
Рекомендации по диете. Режим питания, состав принимаемой
пиши, перерывы в ее приеме оказывают существенное влияние на
ряд показателей лабораторных исследований. После 48 ч голодания
может увеличиваться концентрация билирубина в крови. Голодание
и I ечение 72 ч снижает уровень глюкозы в крови у здоровых людей до
2,.5 ммоль/л (45 мг%), увеличивает концентрацию триглицеридов, сво¬
бодных жирных кислот без значительных изменений концентрации
41>лестерина,
46 Глава 1. Основы лабораторного обследования пациентов
Употребление жирной пищи может повысить в крови уровень
калия, триглицеридов и активность щелочной фосфатазы. Последняя
в таких случаях особенно увеличивается у людей с группой крови О
или В. Физиологические изменения после приема жирной пиши в виде
гиперхиломикронемии могут увеличивать мутность сыворотки (плаз¬
мы) и тем самым влиять на величину оптической плотности при изме¬
рении результатов анализов в лаборатории. Липемическая сыворотка
выявляется после приема больным масла, крема или сыра, что приведет
к ложным результатам исследований и потребует повторного анализа.
Охгределенные виды пищи и режимы питания могут оказать вли¬
яние на ряд показателей сыворотки и мочи. Потребление большого
количества мяса, т.е. пищи с высоким содержанием белка, может
увеличить содержание мочевины и аммиака в сыворотке, количество
уратов (солей кальция) в моче. Пища с высоким отношением нена¬
сыщенных жирных кислот к насыщенным может вызвать снижение
холестерина в сыворотке, в то время как пища, содержащая много
мяса, вызывает увеличение концентрации уратов. Бананы, ананасы,
томаты, авокадо богаты серотонином. Если они употребляются в
пищу за 3 дня до исследования в моче 5-оксииндолуксусной кислоты
(продукт метаболизма серотонина, выделяемый с мочой), то в моче
даже здорового человека ее содержание может быть повышенным.
Напитки, богатые кофеином, увеличивают уровень свободных жир¬
ных кислот и вызывают выход в кровь катехоламинов (адреналил,
норадреналин) из надпочечников и мозга. Прием алкоголя увели¬
чивает в крови уровень лактата, мочевой кислоты и триглицеридов.
Повышенное содержание общего холестерина, а-холсстерина, у-глу-
тамилтранспептидаза (ГГТП), мочевой кислоты и увеличение сред¬
него объема эритроцитов (МСУ) может быть связано с хроническим
алкоголизмом.
Длительное голодание (2—4 нед) также способно влиять па изме¬
нение ряда лабораторных показателей. Концентрация общего белка,
холестерина, триглицеридов, мочевины, липопротеинов в крови сни¬
жается. Наоборот, выведение креатинина и мочевой кислоты почками
с мочой повышается. Длительное голодание тесно связано со сниже¬
нием расхода энергии, и, как следствие, в крови снижается концент¬
рация гормонов щитовидной железы — общего тироксина (Т4) и в еще
большей степени трийодтиронина (ТЗ).
Для того, чтобы исключить влияние принимаемой пациентом
пищи, необходимо соблюдать общее правило: двенадцатичасовое
1.2. Роль медицинской сестры в обеспечении качественного... 47
юлодание перед забором крови. Если нужны какие-то ограничения
в питании, то пациент должен быть проинструктирован устно либо
письменно в виде памятки. Например, при взятии крови для исследо¬
вания глюкозы натощак пациента нужно предупредить, что он не дол¬
жен пить чай или кофе, но пить воду. Если запретить пить воду (или
11С сказать о том, что пить можно), l o дисциплинированный пациент
может довести себя до обезвоживания.
Физические упражнения. Физическая нагрузка может оказывать
преходящее влияние или иметь длительное воздействие на различные
параметры гомеостаза. Преходящие изменения включают вначале
снижение, а затем увеличение концентрации свободных жирных
кислот в крови, повышение на 180% содержания аммиака и на 300%
лактата, увеличение активности креатининкиназы (КК), аспартата-
минотрансферазы (ACT), лактатдегидрогеназы (ЛДГ). Физические
упражнения влияют на показатели гемостаза: активируют сверты¬
ваемость крови и функциональную активность тромбоцитов. Эти
изменения связаны с активацией метаболизма, показатели обычно
возвращаются в исходное (до физической нагрузки) состояние вскоре
после прекращения физической деятельности. Однако активность
некоторых ферментов (КК, ACT, ЛДГ) может оставаться повышенной
в чечен ие 24 ч после одночасовой интенсивной физической нагрузки.
Длительная физическая нагрузка увеличивает в крови уровень поло¬
вых гормонов, включая тестостерон, андростендион и лютеинизиру-
101ЦИЙ гормон (Л Г).
Эмоциональный стресс. Степень влияния психического стрес¬
са (страх перед взятием крови, предоперационный стресс и т.д.) на
результаты лабораторных тестов часто медицинскими сестрами недо-
опенивается. Между тем под его влиянием в крови может наблюдаться
преходящее повышение количества лейкоцитов в крови (лейкоцитоз),
снижение уровня железа, увеличение уровня катехоламинов, альдо-
стероиа, кортизола, пролактина, ренина, соматотропного и тиреот-
ропного гормонов и повышение концентрации альбумина, глюкозы,
инсулина, фибриногена и холестерина. Сильное беспокойство, если
оно сопровождается гипервентиляцией, вызывает дисбаланс кис-
jioi HO-ocHOBHoro состояния с увеличением концентрации лактата и
жирных кислот в крови.
Суточные ритмы гомеостаза. При назначении лабораторных иссле¬
дований необходимо учитывать и суточные ритмы колебаний некото¬
рых показателей гомеостаза. Уровень некоторых гормонов в крови в
48 Глава Г Основы лабораторного обследования пациентов
послеобеденные часы снижается, в то время как число эозинофилов
и уровень железа повышаются. Так, концентрация калия ниже после
обеда по сравнению с утренними часами, тогда как концентрация
кортизола возрастает в течение дня и снижается ночью. Ритм сек¬
реции кортизола может быть причиной недостоверных результатов
глюкозотолерантного теста, проводимого во второй половине дня.
В ряде случаев при назначении лабораторных исследований необхо¬
димо учитывать сезонные колебания уровня ряда показателей. Так,
содержание ТЗ на 20% ниже летом, чем зимой.
Достоверно значимые изменения ряда показателей могут быть
вызваны колебаниями уровня гормонов при менструации. Так, кон¬
центрация альдостерона в плазме в 2 раза выше перед овуляцией,
чем в фолликулиновой фазе, а содержание холестерина существенно
снижается при овуляции. Наоборот, уровни фосфатов и железа сни¬
жаются при менструации.
Положение тела пациента при заборе крови также влияет на ряд
показателей. Так, смена пациентом положения «лежа» на положение
«сидя» или «стоя» приводит к гидростатическому проникновению
воды и фильтрующихся веществ из внутрисосудистого пространства
в интерстициальное. Вещества, имеющие большую молекулярную
массу (белки) и клетки крови со связанными с ними веществами, не
проходят в ткани, поэтому их уровень в крови повышается (ферменты,
общий белок, альбумин, железо, билирубин, холестерин, триглице¬
риды, лекарственные средства, связанные с белками, особенно каль¬
ций). Могут увеличиваться концентрация гемоглобина, гематокрит,
количество лейкоцитов.
Влияние лекарственных средств. Некоторые лекарственные средс¬
тва могут оказывать существенное влияние на результаты лабора¬
торных исследований. Например, прием аспиринсодержаших пре¬
паратов при определении времени длительности кровотечения по
Дуке должен быть отменен за 7-10 дней до проведения исследования.
Если этого ие сделать, можно получить неправильный результат
исследования. Если принимаемый пациентом лекарственный пре¬
парат может повлиять на результат анализа, то при невозможности
его отмены врач лаборатории должен об этом знать. Поэтому в заявке
на исследования необходимо сообщить о принимаемых пациентом
лекарственных средствах.
Другие факторы. Среди других факторов, влияющих на результаты
исследований, имеют значение возраст, пол, беременность, географи-
1.2. Роль медицинской сестры в обеспечении качественного... 49
чес кое положение местности, высота над уровнем моря, температура
окружающей среды, курение табака. В связи с этим лабораториям
рекомендуется устанавливать индивидуальные локальные референт¬
ные (нормальные) величины для своей популяции.
У курильщиков может быть повышено содержание карбоксигемо-
1 лобина, катехоламинов в плазме и кортизола в сыворотке. Изменения
концентрации этих гормонЪв часто приводят к снижению количества
эозинофилов, в то время как количество нейтрофилов, моноцитов и
содержание свободных жирных кислот увеличивается. Курение при¬
водит к увеличению концентрации гемоглобина, количества эритро¬
цитов и снижению количества лейкоцитов.
Общим правилом для пациентов, у которых будет взята кровь на
исследования, должно быть воздержание от физических нагрузок,
приема алкоголя и лекарств, изменений в питании в течение 24 ч до
1ЯЯТИЯ крови. Пациент не должен принимать пищу после ужина, ему
необходимо лечь спать накануне в обычное для него время и встать не
позднее чем за I ч до взятия крови.
1.2.2.1. Памятки пациентам по подготовке к лабораторным исследованиям
Для того, чтобы пациент принимал активное участие в подготовке
к проведению лабораторных исследований, очень важно разработать
памятки. Ниже приведены примеры таких памяток для пациента.
Памятка для пациента
Общие положения
Общим правилом для пациента, у которого будет взята кровь на
лабораторные исследования (общий анализ крови, определение груп¬
пы крови и резус-фактора, биохимические анализы, исследование
обертывающей системы крови, гормонов, онкомаркеров, серологичес¬
кие анализы на ВИЧ, сифилис, гепатиты), должно быть воздержание
о г физических нагрузок, приема алкоголя и лекарств (по возможности
в соответствии с рекомендациями лечащего врача), изменений в пита¬
нии в течение 24 ч до взятия крови,
Ва.м необходимо;
• не принимать пищу после ужина;
• лечь спать накануне в обычное для Вас время и встать не позднее
чем за 1 ч до взятия крови;
• утром после подъема воздержаться от курения.
50 Глава 1. Основы лабораторного обследования пациентов
Если Вы испытываете трудности с отменой лекарств, то обязатель¬
но сообщите об этом лечащему врачу. Кровь на анализы сдают утром
до приема лекарственных средств.
Кровь следует сдавать до проведения рентгенологического, эндос¬
копического или ректального исследования или физиотерапевтичес¬
ких процедур.
Непосредственно перед взятием крови на анализы необходимо
исключить физическое напряжение (бег, подъем по лестнице), эмоци¬
ональное возбуждение. Поэтому непосредственно перед процедурой
следует отдохнуть 10—15 мин и успокоиться.
Очень важно, чтобы Вы точно следовали указанным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль¬
таты исследования.
Памятка для пациента
Общий анализ крови
Общий анализ крови назначен Вашим лечащим врачом. Цель
исследования — объективно оценить состояние Вашего здоровья.
Вам нужно подготовить себя к этому исследованию следующи.м
образом: воздержаться оч физических нагрузок, приема алкоголя и
лекарств, изменений в питании в течение 24 ч до взятия крови. Вам не
следует принимать пишу после ужина, лечь спать нужно накануне в
обычное для Вас время и встать не позднее чем за 1 ч до взятия крови.
Утром после подъема воздержитесь от курения.
Если Вы испытываете трудности с отменой лекарств, то обязатель¬
но сообщите об этом лечащему врачу.
Вечером накануне взятия крови подойдите к процедурной меди¬
цинской сестре и уточните, где Вам необходимо находиться утром для
его выполнения.
Очень важно, чтобы Вы точно следовали указанным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль¬
таты исследования.
Памятка для пациента
Глюкозотолерантный тест
Глюкозотолерантный тест назначен Вашим лечащим врачом. Цель
теста — определить у Вас эффективность работы инсулин вы делитель¬
ного .механизма поджелудочной железы и глюкозораспределительной
системы организма.
1.2. Роль медицинской сестры в обеспечении качественного... 51
Вам нужно подготовить себя к этому тесту изменением диеты и режи¬
ма приема лекарств по меньшей мере за 3 дня до проведения теста. Очень
важно, чтобы Вы точно следовали приведенной ниже инструкции, так
как только в этом случае буд>’т получены ценные результаты теста.
Вам необходимо следовать трем главным указаниям:
• количество углеводов в пище должно быть не менее 125 г в сутки
в течение 3 дней перед проведением теста;
• нельзя ничего есть в течение 12 ч, предшествуюших началу теста,
по ни в коем случае голодание не должно быть более 16 ч;
• не позволять себе физической нагрузки в течение 12 ч перед нача¬
лом теста.
Подготовка: медикаменты. Если Вы принимаете лекарства помимо
чех, что назначил лечащий врач, Вы должны сообщить ему об этом,
чак как они могут повлиять на результаты исследования.
Подготовка: диета. Вы принимаете только пищу, выдаваемую
в лечебном отделении. Назначенный Вам лечащим врачом рацион
содержит не менее 125 г углеводов в сутки, поэтому Вам следует возде¬
ржаться от приема дополнительной пищи.
Подготовка: общее состояние. Сообщите врачу о своем самочувствии
перед исследованием, обязательно упомянув при этом об имеющейся
беременности и/или стрессе.
Если Вы испытываете трудности с изменениями диеты или режима
приема лекарств, то обязательно сообщите об этом лечащему врачу.
Накануне вечером перед проведением теста подойдите к процедур¬
ной медицинской сестре и уточните, где Вам необходимо находиться
утром для его выполнения.
Очень важно, чтобы Вы точно следовали указанным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль-
чаты исследования.
1.2.3. ВЗЯТИЕ ПРОБ КРОВИ НА ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Проведение венепункции и взятие проб венозной крови являются
наиболее распространенным методом получения биологического мате¬
риала для лабораторных исследований. Вместе с тем процедура взятия
проб крови является и основным источником низкого качества проб,
результатов лабораторных анализов и лабораторных ошибок. Нарушения
при выполнении процедуры взятия проб крови и манипуляциях с ними
52 Глава 1. Основы лабораторного обследования пациентов
могут служить причиной заболеваний гемоконтактными инфекциями у
пациентов и медицинского персонала. Основным направлением сниже¬
ния количества ошибок являются максимальная стандартизация про¬
цедуры взятия проб крови на лабораторные исследования и обеспечение
выполнения требований противоэпидемического режима, уменьшаю¬
щих риск возникновения гемоконтактных инфекций.
Все медицинские работники лечебного учреждения заинтересо¬
ваны в качественном обслуживании пациента, поэтому необходимо
тщательно планировать объем предполагаемых исследований. Заявки
на анализы должны быть согласованы со всеми врачами-специалис-
тами, участвующими в лечении больного, чтобы при венепункции
взять материал для всех необходимых исследований и не повторять
процедуру. Медицинская сестра должна собрать все заявки на данно¬
го пациента и сделать суммарную заявку на анализы. Если пациент
будет переведен в другое отделение, то она также должна предуп¬
редить лабораторию об этом, чтобы результаты исследований были
направлены в нужное отделение и не утеряны. Сведения, которые
должна содержать заявка, приведены выше.
Указание времени взятия крови имеет важное значение практичес¬
ки для всех видов исследований, но особенно для исследования сис¬
темы гемостаза, лекарственного мониторинга, бактериологических
исследований.
Если пациент принимает лекарственное средство, которое может
оказать влияние на результат исследования, то при невозможности
его отмены в заявке на исследования необходимо сообщить об этом,
чтобы в лаборатории приняли это во внимание. Взятие проб крови
необходимо проводить до выполнения диагностических и лечебных
процедур, так как они могут оказать влияние на результаты лабора¬
торных исследований. Оптимальное время для взятия проб крови на
анализы между 7 и 9 ч утра.
Процедура взятия крови на исследования состоит из нескольких
последовательных действий, включающих выбор приспособления
для взятия крови, подготовку помещения, определение места взятия
крови и саму процедуру взятия крови.
1.2.3.1. приспособления, используемые для взятия проб крови
Одним из важных моментов при взятии проб крови на лаборатор¬
ные исследования является выбор приспособлений для выполнения
этой процедуры.
(.2, Роль медицинской сестры в обеспечении качественного... 53
Широко используемые в настоящее время у нас в стране способы
ыятия проб венозххой крови являются основной и традиционной
причиной их низкого качества, результатов лабораторных анализов и
даже лабораторных ошибок. Они не могут быть стандартизированы и
НС обеспечивают безопасность пациента и медицинского персонала.
При взятии проб венозной крови с использованием иглы и обыч-
мых пробирок высока вероятность попадания крови пациента на руки
медицинского персонала. В этом случае руки медицинской сестры
могут стать источником передачи и распространения возбудителей
гемоконтактных инфекций другому пациенту путем контаминации
кровью инъекционной ранки. Медицинский работник сам может
заразиться от пациента — источника инфекции.
Использование медицинского шприца с иглой для взятия крови
следует избегать из-за его недостаточной безопасности для медицин¬
ского персонала и невозможности исключения гемолиза крови при
переносе пробы под давлением из шприца в пробирку.
Поэтому для взятия проб крови предпочтительнее использовать
одноразовые фирменные приспособления (например, вакуум-содер-
жащие системы). Этот способ имеет ряд преимуществ, основным из
ко горых является то, что кровь попадает непосредственно в закрытую
пробирку, предотвращающую любой контакт медицинского персона¬
ла с кровью пациента.
Испол ьзование фирменных одноразовых приспособлений для взя-
1 ИЯ крови является обязательным стандартом для всех медицинских
учреждений развитых стран мира и должно стать им и в нашей стране.
И X применение значительно упрощает проведение процедуры и повы¬
шает качество результатов лабораторных исследований. Фирменные
приспособления для взятия крови имеют цветную маркировку для
[хазличных видов исследований, содержат антикоагулянт или другие
наполнители, что позволяет соблюдать правильное соотношение
между объемами крови и антикоагулянгов. Использование фир¬
менных приспособлений для взятия крови позволяет максимально
стандартизировать процедуру взятия крови, контролировать качество
[[риспособлений (срок годности, условия хранения).
Проведенные в развитых странах исследования по данной пробле¬
ме показали, что при.менение вакуум-содержаших систем для взятия
крови имеет еще и несопоставимую экономическую выгоду по срав¬
нению с традиционными методами. Важнейшими аргументами в их
пользу являются следующие:
54 Глава 1. Основы лабораторного обследования пациентов
• при заборе крови в обычные пробирки взятый объем крови
у пациента в среднем в 45 раз превышает необходимый для
анализов, при взятии крови в вакуум-содержащие пробирки
только в 7 раз;
• у 47% пациентов, которым требуется переливание крови, отмечается
связанная с проведением лабораторных анализов потеря эритро¬
цитов объемом более 180 мл (равноценно I единице эритроцитной
массы);
• основным приоритетом на ближайшие годы в отношении лабо¬
раторной диагностики является централизация лабораторных
исследований, что предъявляет совершенно другие требования к
сохранности и времени доставки проб крови;
• при времени доставки проб крови, взятых в обычные стеклянные
пробирки на биохимические исследования, превышающем 2 ч,
у 12-25% пациентов в лабораторных анализах ложно повыше¬
ны активность ACT, аланинаминотрансферазы (АЛТ), уровень
билирубина и/или калия (вследствие гемолиза) и ложно снижена
концентрация глюкозы;
• при времени доставки проб крови, взятых в обычные стеклянные
пробирки на биохимические исследования, в течение 1 ч ложно
повышенные активность ACT, АЛТ, уровень билирубина или
калия выявляются у 4—10% пациентов;
• при времени доставки проб крови, взятых в вакуум-содержащие
пробирки на биохимические исследования, в течение 1 ч ложно
повышенные активность ACT, АЛТ, уровень билирубина или
калия выявляются у 0,5—1% пациентов (в 10 раз ниже)
Для получения достоверных показателей у всех пациентов с лож-
ноизмененными результатами анализов необходимы повторное взя¬
тие крови и проведение лабораторных исследований. Доля повторных
исследований из-за «некачественных» проб крови при взятии ее в
стеклянные пробирки в КДЛ составляет до 7,4%. Кроме того, ряду
пациентов по причине избыточного взятия крови и возникновения
вследствие этого анемии показано переливание крови. Все это требует
дополнительных финансовых расходов учреждения.
Часть потерь ЛПУ, связанных с ненадлежащим финансовым обеспе¬
чением, безопасностью пациентов и медицинского персонала, трудно
подсчитать. Например, инфицированность вирусными гепатитами В
и С медицинского персонала вследствие контакта с венозной кровью
пациента как причина профессионального заражения в нашей стране
1.2. Роль медицинской сестры в обеспечении качественного... 55
чрезвычайно высока. В своих исследованиях В.Г. Акимкин и соавт.
(2001) установили, что инфицированность сотрудников гемодиализных
и гематологических отделений составляет 22,7 КДЛ, реанимационных
и хирургических отделений — 14,5%. Работы по оценке финансовых
потерь ЛПУ, связанных с проведением мероприятий по предупрежде¬
нию инфицирования медицинских сестер и сотрудников КДЛ вследс¬
твие укола иглой, порезов п{)и работе со стеклянными пробирками, в
нашей стране отсутствуют. В учреждениях здравоохранения США, где
ведется строгий учет всех случаев заражения медицинского персонала
при случайном уколе иглой сотрудника, затраты медицинского учреж¬
дения на комплекс мер по предупреждению инфицирования составля¬
ют 3000—5000 долларов. При заражении сотрудника ВИЧ, гепатитом В
и другими инфекциями они могут доходить до 1 ООО ООО долларов.
Вакуум-содержащие системы имеют еще ряд преимуществ:
• стандартизация условий взятия крови;
• минимум операций по подготовке образца крови к отправке в
лабораторию;
• возможность прямого использования в качестве первичной про¬
бирки в целом ряде автоматических анализаторов (экономия на
приобретение вторичных пластиковых пробирок);
• герметичная упаковка проб крови и небьющие с я пробирки, что
упрощает и делает безопасным процесс транспортировки и цент¬
рифугирования;
• четкая идентификация пробирок, используемых для различных
типов анализов, за счет цветной кодировки;
• сокращение затрат на приобретение центрифужных пробирок, а
также мойку, дезинфекцию и стерилизацию пробирок;
• простая методика обучения персонала;
• уменьшение риска профессионального инфицирования;
• невозможность повторного применения вакуум-содержаших систем;
• экономия времени на процесс взятия крови;
• простота конструкции вакуум-содержащих систем и ее надежность.
Для взятия крови наиболее часто используют приспособле¬
ния фирм «BECTON DICKINSON» (Vacutainer® — вакутейнеры) и
«САРШТЕДТ» (моноветты). Рассмотрим преимущества использова¬
ния фирменных приспособлений для взятия крови.
Приспособления фирмы «САРШТЕДТ» представляют собой шпри¬
цы-пробирки (моноветты) для венозной крови с антикоагулянтами
(іепарин, цитрат натрия, этилендиаминтстраацитат — ЭДТА) или
56
Глава /. Основы лабораторного обследования пациентов
наполнителями для ускорения свертывания крови и микроветты для
взятия капиллярной крови. Шприцы-пробирки и микропробирки с
капиллярами для взятия крови из пальца (микроветты) изготовлены
из пластического материала, стерильны, на них указан срок годности
изделия, все они предназначены для разового использования.
Система BD Vacutainer®
Одноразовый Стерильная прбирка
держатель для крови BD Vacutainer
с дозированным объемом
вакуума и реактивами-
Стерильная
двусторонняя игла
наполнителями
Одноразовая
стерильная
пробирка
Защи гная крышка
Hcmogard™
7
Этикетка
Дозированный
объем вакуума
Безопасный кла¬
пан для отбора
нескольких проб
'.гг,
■‘'W
Одноразовый
держатель
Стерильная
игла
с защитным
колпачком
/
Стерильные иглы BD Vacutainer®;
• имеют ультратонкие стенки;
» покрыты силиконом для меньшего травмирова¬
ния пациента;
• за счет уникальной V-образной заточки обеспе¬
чивают глад кий и безболезненный ввод в вену.
Рис. 1-9. Система Vacutainer® для взятия крови
/. 2. Роль медицинской сестры в обеспечении качественного... 57
Вакуумная система для взятия крови BD Vacutainer® (рис. 1-9)
состоит из трех основных элементов, соединяющихся между собой в
процессе взятия крови; стерильной одноразовой пробирки с крышкой
и дозированным содержанием вакуума без наполнителей, с антикоа-
I улянтами (гепарин, цитрат натрия, ЭДТА), наполнителями для уско¬
рения свертывания крови или ингибиторами гликолиза (фторид),
стерильной одноразовой двусторонней иглы, закрытой с обеих сторон
защитными колпачками, и одно- или многоразового иглодержателя.
Пробирки BD Vacutainer® производятся из пластика и стекла.
Пластиковые пробирки не бьются, поэтому они предпочтительнее
juiB взятия проб крови, в них также удобнее транспортировать образ¬
цы и их легче утилизировать. Все пробирки BD Vacutainer® стериль¬
ны, предназначены для одноразового использования, выпускаются
разных объемов и размеров. В пробирках используются различные
химические наполнители для проведения разных видов анализов.
В качестве наполнителей используются активаторы свертывания
(тромбин, кремнезем), антикоагулянты (ЭДТА, цитрат натрия, цепа-
рин и т.д.), разделительные гели и др. Выбор антикоагулянта в зависи¬
мости от определяемого лабораторного показателя приведен ниже.
Правильный выбор антикоагулянта для взятия крови на исследова¬
ния и.мсет важное значение, а ошибка в выборе может быть источником
пс|[равильного результата анализа. Оксалат калия может усилить выход
воды из клеток в плазму, тем самым разбавляя ее. Антикоагулянты,
связывающие кальций (цитрат натрия), могут ингибировать некоторые
ферменты плазмы; если перед проведением анализа в плазму не добавить
кальций, это может привести к ошибочным результатам исследования.
Оксалат и цитрат могут ингибировать активность амилазы, ЛДГ, кислой
(|юсфатазы. Оксалат, цитрат и ЭДТА вызывают снижение концентрации
кальция. Если калий или натрий входят в состав антикоагулянта, то в
гакой плазме нельзя определя гь их коицеїгграцию. Поэтому необходимо
правильно выбрать антикоагулянт для определяемого показателя.
При взятии крови на исследования важно не только правильно
выбрать антикоагулянт, но и точно соблюсти пропорцию между ним
и количеством крови. Для обеспечения точного соотношения кровь/
антикоагулянт в пробе в фирменных приспособлениях количество
наполнителей в пробирках строго соответствует заданному объему
крови. Поэтому оптимальным способом избежать отрицательно-
ю влияния антикоагулянга на результаты исследования является
использование фирменных приспособлений.
58
Глава 1. Основы лабораторного обследования пациентов
Выбор анти коагулянта в зависимости от определяемого показателя
Вид исследования
Антикоагулянт
Общеклиническое исследование крови
ЭДТА
Ретикулоциты
То же
Тромбоциты
То же
Глюкоза-6-фосфатдегидрогеназа в эритроцитах
То же
Свободный гемоглобин
ЭДТА или гепарин
Карбоксигемоглобин
Гепарин
Метгсмоглобин
То же
Электрофорез гемоглобина
ЭДТА
Исследование систе.мы гемостаза
Цитрат натрий
Иммунология;
исследование клеточного иммунитета
Гепарин
фагоцитоз
Тоже
раково-эмбриональный антиген
ЭДТА
Биохимия;
Гепарин
аммиак
То же
глюкоза
NaF-oкcaлaт
лактат
То же
Венепункцию проводят с использованием иглы к пробирке
Vacutainer® (моноветту). Верхний колпачок пробирки закодирован
цветом, который свидетельствует о том, какой специфический анти¬
коагулянт имеется в вакутейнере (моноветте) или вакутейнер специ¬
ально предназначен для взятия крови на определенные параметры.
В табл. 1-1 приведены антикоагулянты и цветная кодировка моноветт,
выпускаемых фирмой «САРШТЕДТ», а в табл. 1—2 — вакутейнеры
фирмы «BECTON DICKINSON».
Гепарин в виде литиевой соли — очень эффективный антикоагулянт,
в небольших количествах он практически не влияет на многие показа¬
тели крови и плазмы, поэтому является идеальным универсальным
лекарственным веществом (кроме исследований системы гемостаза).
1,2, Роль медицинской сестры в обеспечении качественного...
59
Таблица 1-1.
Кодированные цветом моноветты с антикоагулянтом
11вет головки шприца
Добавка
Применение
Белый
Ничего не добавлено
Для получения сыворотки
Коричневый
Содержит гель
Для получения сыворотки,
разделяет форменные эле¬
менты крови и сыворотку
Оранжевый
Гепарин
Для получения плазмы и
форменных элементов крови
Красный
ЭДТА
Для получения цельной
крови (связывается кальций)
Фиолетовый
3,13% цитрат натрия
Для определения СОЭ по
Вестергрену
клсный
3,]3% забуференный
цитрат натрия
Для исследования системы
гемостаза
Желтый
Ингибитор гликоли¬
за (фторид)
Для определения глюкозы
1>ссцветный с оран¬
жевым адаптером
Гепарин
Для исследования газов
крови
Таблица 1-2.
Кодированные цветом вакутейнеры с антикоагулянтом
Цвет головки пробирки
Добавка
Применение
красный
Ничего не добавлено
Для получения сыворотки
Желтый
Содержит гель
Для получения сыворотки,
разделяет форменные эле¬
менты крови и сыворотку
'Зеленый
Гепарин
Для получения плазмы и
форменных элементов крови
Фиолетовый
ЭДТА
Для получения цельной
крови (связывается кальций)
Черный
3,13% цитрат натрия
Для определения СОЭ по
Вестергрену
Голубой
3,13% забуфсренный
цитрат натрия
Для исследования системы
гемостаза
60 Глава 1. Основы лабораторного обследования пациентов
Приспособления фирмы «САРШТЕДТ» дают возможность прямо¬
го взятия крови из вены, что экономично, эффективно и позволяет
стандартизировать этот процесс. Соблюдение соотношения между
антикоагулянтом и кровью обеспечивается тем, что кровью должен
быть заполнен весь моноветт, тогда соотношение будет правильным.
Это требование легковыполнимо и может быть проконтролировано.
Моноветты бывают разного объема (2, 5, 7,10 мл) с иглами разового
использования малого, среднего и большого диаметра. Содержащийся
в моноветтах антикоагулянт дает возможность использовать для ана¬
лиза цельную кровь или плазму, которую получают путем иенрифу-
гирования и отделения ее от форменных элементов, к моноветтам
приданы специальные насадки, позволяющие готовить мазки крови,
не снимая верхний колпачок моноветта.
Использование моноветт и вакутейнеров с ингибитором гликоли¬
за (фторидом) позволяет сохранить концентрацию глюкозы в крови.
Гликолиз в обычных условиях взятия крови снижает концентрацию
глюкозы в ней на 5% за 1 ч (вследствие потребления глюкозы клетками
крови при стоянии крови в пробирке).
Моноветты и вакутейнеры с гелем для получения сыворотки
очень эффективны, если взятые пробы необходимо длительно
транспортировать. После взятия крови в такие моноветты ее необ¬
ходимо отдентрифугировать. Специфический удельный вес геля в
моноветтах подобран таким образом (между плотностью формен¬
ных элементов крови и плотностью сыворотки), что при центри¬
фугировании гель всплывает над эритроцитами и располагается
между форменными элементами крови и сывороткой. Гель твер¬
деет, и образуется барьер между форменными элементами крови
и сывороткой. Преимущество таких моноветт и вакутейнеров по
сравнению с обычными:
• простота использования;
• нет необходимости ждать, когда образуется сгусток;
■ выход сыворотки при центрифугировании больше (особенно
важно это в педиатрии);
• центрифугировать надо только один раз;
• после центрифугирования пробу можно транспортировать без
отделения от эритроцитов;
• срок стабильности ферментов, электролитов, ряда субстратов,
гормонов в таких вакутейнерах и моноветтах увеличивается с 2 ч
до 3 и более дней;
1.2. Роль медицинской сестры в обеспечении качественного.., 61
• можно переливать сыворотку в другие пробирки без применения
пипеток.
При центрифугировании моноветт и вакутейнеров с гелем нельзя
пользоваться центрифугами с угловыми роторами, так как часть эрит¬
роцитов может попасть в сыворотку.
Особые требования должны предъявляться к выбору приспособ¬
лений для взятия артериальной крови на исследование газов. Одним
из наиболее часто применяемых устройств для выполнения этой про¬
цедуры является стеклянный шприц, который лучше всего подходит
для взятия крови с высоким р02. Корпус шприца и поршень должны
хорошо подходить друг к другу. Перед взятием артериальной крови в
шприц набирают 1 мл гепарина (1000 или 5000 ЕД/мл в зависимости
(VI объема шприца) и смачивают им поршень. Проверяют подвижность
поршня в шприце. Гепарин выливают, так что в шприце остается
лишь то его количество, которое находится на стенках и в «мертвом»
пространстве шприца. Взятие артериальной крови таким шприцем
дает самые точные результаты исследований. Поршень шприца обыч¬
но сам движется вверх под действием артериального давления (если
игла размером 23 или более). Преимуществом стеклянного шприца
является возможность его многократного использования, а недостат¬
ком — высокая стоимость, необходимость стерилизации (может быть
переносчиком инфекции) и хрупкость.
Пластиковые одноразовые шприцы не нуждаются в стерилизации,
лсшевы, не бьются. Вместе с тем при их использовании возможгха
недостаточная точность результатов исследований, так как газы крови
проходят через пластик, поршень обычно не движется под действием
артериального давления и из него трудно удалить воздушные пузырь¬
ки, если они туда попали. Утечка газов через пластик зависит от типа
л ого материала и парциального давления кислорода и углекислоты в
крови. Чем больше разность между парциальным давлением в крови
и воздухе, тем быстрее вытекает газ. Использование пластиковых
шприцев может исказить результаты исследования р02, поэтому
при их применении исследование должно быть выполнено в течение
15 мин после взятия крови.
Для исследования газов в артериальной крови используют спе¬
циальные гепаринизированные одноразовые моноветты фирмы
«САРШТЕДТ». Д.ля взятия артериальной крови такими моноветтами
применяют специальный адаптер. Следует заметить, что в моноветтах
не бывает утечки газов и аналитические ошибки минимальны.
62 Глава /. Основы лабораторного обследования пациентов
Для взятия капиллярной крови на общеклиническое исследование
пользуются одноразовыми микроветтами с капиллярами, которые
имеют два вида цветном маркировки на пробках к нцм. Красные с
ЭДТА предназначены для определения всех показателей перифе¬
рической крови (гемоглобин, гематокрит, эритроциты, лейкоциты,
тромбоциты), фиолетовые с цитратом натрия для определения СОЭ.
Микроветты снабжены одноразовыми капиллярами, что значительно
упрощает и облегчает процедуру взятия крови. Вся процедура сво¬
дится к заполнению капилляра, переносу крови из него в микроветту
и тщательному перемешиванию, после чего микроветты закрывают
пробками к ним и транспортируют в лабораторию,
1.2.3.2. Подготовка рабочего места для взятия крови
Следующим этапом процедуры взятия крови на исследование явля¬
ется подготовка рабочего места. Для правильного взятия крови необхо¬
димо иметь нижеприведенное оснащение процедурного кабинета.
• Стол для проб крови. Возможно использование передвижного сто¬
лика, бесшумно передвигающегося по любой поверхности.
• Подставки (штативы) для пробирок. Подставки должны быть легки¬
ми, удобными, с достаточным количеством ячеек для пробирок.
• Кресло для венепункции. Для проведения венепункции реко¬
мендуется использовать специальное кресло. Пациент во время
венепункции должен сидеть с максимальным комфортом и безо¬
пасностью для него и быть доступным для медицинского персо¬
нала процедурного кабинета. Оба подлокотника кресла должны
располагаться так, чтобы можно было найти оптимальную для
каждого пациента позицию при венепункции. Подлокотники
служат опорой для рук и не позволяют сгибать локти, что предо¬
твращает спадение вен. Кроме того, кресло должно предохранять
пациентов от падения в случае обморока.
• Кушетка.
• Холодильник.
• Перчатки — одноразовые или многоразовые. Допускается много¬
кратное использование перчаток с обеззараживанием их после
приема каждого пациента двукратным протиранием салфетками
одноразового использования, пропитанными антисептиками,
обладающими вирулицидным действием. При взятии крови из
подключичного катетера перчатки должны быть стерильными,
одноразового использования.
1.2. Роль медицинской сестры в обеспечении качественного.,. 63
• Системы для забора венозной крови.
•Жгуты. Применяются одноразовые и многоразовые резиновые
и латексные жгуты, специально предназначенные для взятия
крови. При попадании крови или других биологических жидкос¬
тей на многоразовый жгут его следует подвергнуть обеззаражива¬
нию, Одноразовые жгуты утилизируются вместе с использован¬
ным расходным материалом.
• Марлевые салфетки. В наличии должны быть стерильные марле¬
вые салфетки (5X5 см или 7,5X7,5 см) или салфетки, пропитанные
антисептиками, в заводской упаковке. Ватные шарики использо¬
вать не рекомендуется.
• Антисептики. Для обработки поверхности инъекционного поля необ¬
ходимо иметь антисептики, разрешенные в установленном порядке.
Антисептики применяются в виде растворов, которые наносятся на
стерильную марлевую салфетку или ватные шарики, либо использу¬
ются салфетки, пропитанные антисептиком, в заводской упаковке.
• Халат. Во всех случаях персонал, проводящий венепункцию, дол¬
жен быть одет в специальную защитную одежду; халат (поверх брюк
или комбинезона), шапочку (косынку), марлевую маску, защитные
очки или щиток, перчатки. Халат нужно менять по мере загряз¬
нения, но не реже двух раз в неделю. Должна быть предусмотрена
немедленная смена спецодежды в случае загрязнения се кровью.
• Стерильный пинцет.
• Подушка для выравнивания локтевого сгиба (при отсутствии спе¬
циального кресла).
• Контейнеры;
— контейнер настольный для игл с упором для безопасного сня¬
тия иглы;
- контейнер с вложенным пластиковым мешком для сбора отхо¬
дов. Необходим прочный контейнер для отходов, куда поме¬
щают использованные иглы (при отсутствии первого кон¬
тейнера), шприцы с иглами и вакуум-содержащие системы,
использованный перевязочный материал.
• Лед или хладоэлемент.
• Бактерицидный лейкопластырь для закрытия места инъекции.
• Согревающие принадлежности. Для усиления тока крови можно
использовать согревающие принадлежности — теплую (около
40 “С) влажную салфетку, приложенную к месту пункции на 5 мин.
• Кожные антисептики для обработки рук и перчаток.
64
Глава 1. Основы лабораторного обследования пациентов
• Дезинфицирующее средство для обеззараживания использованно¬
го материала и рабочих поверхностей.
• Памятка о проводимых манипуляциях.
• Фломастеры для маркировки проб.
Если для взятия крови используются вакуумные пробирки (вакутей¬
неры) или фирменные моноветты, то нужно убедиться в том, что они
не просрочены (срок годности указан на всех упаковочных коробках),
например шприцы с антикоагулянтом; проверяют также иглы для моно¬
ветт и каждый новый лот моноветт (микровеп) или вакуумных пробирок.
Процедурная медицинская сестра, осуществляющая взятие крови, ведет
журнал «Контроль качества вакутейнеров (моноветт) для взятия крови».
^рнал контроля качества вакутейнеров (моноветт) для взятия крови
Дата проверки.
Номер лота
Объем шприца (пробирки).
Цвет шприца.
Срок годности
Кто проверял.
Способ проверки
Результаты проверки
Визуальная проверка:
— механические повреждения
— наличие анти коагулянта
— на месте ли крышка
— нет ли осадка или примесей в вакутейнере
Проверка на стерильность (если нужно)
Проверка в процессе взятия крови:
~ образуются ли сгустки после взятия крови с
а н ти коагул я н том
Проверка при центрифугировании:
— не разрушается ли вакутейнер или пробирка
Проверка на концентрацию натрия, калия и
аммиака в крови, после ес взятия у здорового
человека
Подпись проверяющего.
Перед взятием крови на исследования процедурная медицинская
сестра еще раз должна посмотреть инструкцию для каждого вида
исследований. Пример такой инструкции представлен в табл. 1-3.
1.2. Роль медицинской сестры в обеспечении качественного...
65
о.
о
ю
«
(4
Я
я
Я
X
н
«
т
о
X
2
X
в
5
X
г *■
о
* с
в
я и
X в
^ я
& я
® в
11
X Й I
«32
м в Ь
а в X
в ® л
Я Л О
§ I«
2 I ^
о £
Ед Я
I В
® _
ч н 2
^® « о «
в м я 2
и а а. я
= ч » I
I 8 I;
а к £
>В
ч
3
^ 3
» о
я ^
I ‘й
о
- 5
^ г
Щ Е-
о §,
а СД
« о
и ^
^ и
« &
а *
-I
X
02 г»
В ?*1
с»
Х о
е
о
ь
Сц
я я
2 м
3 % -
02 о ж
I11
«а ® д
" о
? 2 ^
2 в 2
^ 5 2
о й
•е о
н ^1.
о в
о ю
=1 о
«я
а (Т)
СС
;Я о ®
а О. «
Ш 02 Ч
0 Д О
1 « -I 2 ^
е- Н 3 ^ а ж1-
о »
К с
П в
я §
о. 2
В
ч о
о» <1й
я С2.
ео Т
НОЯ
^ о. Э
о. 02 Н
о ж .
Ю «
1^3
* а
в
ё о
2 X
1Й э-
1=: 2
» ю
я о
Ь а
§ 2
X
а 02
а
Си
у н а
« а £
й е- зК
X .2 о
я а
я
а в 3
а н я
0 к р-
з: X Ь
§ О Ж
« ^ Е
1 «
£0 гг, а
41^ ’ ^'
ж 2
®< а
2 §
а- а
СГ)
к 3
э о
о
ж
о зЖ
а о
в ж
3 а
и-2
н и
>1 а
а и
02 Ж
Ю «
3 «
►С Р>ч
о ^
“ я
я а
о с
о с
а
2
ж
а 42
ж §■ «
ж о 4>
в ю н
а я л
я ч о
Зав
>> ^
в *
я >2П
а К]
зж з:
2 а
2 «
я
Си н
2 о . о
р »о 2 ё
я ж,
ё «
I §
:Ж
5
^ ч
ю 5
о (£)
Пподолжение таблицы 1-3.
Тест
Материал
для иссле¬
дования
Мини¬
мальный
объем, мл
Приспособле¬
ния для взятия
(сбора)
материала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Ионизиро¬
ванный
кальций
Тоже
2
Разовый ваку¬
тейнер на 5 мл
(красная мар¬
кировка)
Из вены берут 5 мл крови
в вакутейнер с красной
маркировкой и доставляют
в лабораторию в обычном
контейнере
То же
6 ч
Газы крови
Артериаль¬
ная кровь
1
Разовый моно¬
ветт вмести¬
мостью 2 мл
с гепарином
(оратіжевая
маркировка)
Из артерии берут 1 мл крови
моноветтом с оранжевой
маркировкой, помещают в
лед и немедленно доставля¬
ют в лабораторию
То же
10 мин
Глюкозо-
толерант-
ный тест
Капилляр¬
ная кровь
Берется
лаборантом
лаборатории в
специальные
капилляры
Тест начинают в 8 ч утра.
Лаборант берет кровь из
пальца у пациента натощак.
Затем пациент принимает
внутрь 75 г глюкозы, раство¬
ренной в 200 мл воды.
В дальнейшем кровь из паль¬
ца берут через 120 мин после
приема глюкозы
То же
6 ч
ПпіХКі.:жі-..лг
Тест
Материал
для иссле¬
дования
Мини¬
мальный
объем, мл
Приспособле¬
ния для взятия
(сбора)
материала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Кальций
обший в
моче
Суточная
моча
10
Специальный
контейнер
вместимостью
2,5 л
Перед началом сбора мочи в
контейнер наливают 10 мл
концентрированной НС1, в
лабораторию доставляют не
менее 10 мл мочи и указыва¬
ют суточный объем в специ¬
альном контейнере для мочи
То же
6 4
Калий в
эритроцитах
Ветюзная
кровь
1
Разовый ваку¬
тейнер гепари¬
ном (зеленая
маркировка
Из вены берут 2 мл крови
в вакутейнер с оранжевой
маркировкой, тщательно
перемешивают и доставляют
в лабораторию в обычном
контейнере
Еже¬
дневно
6 Ч
Протромби¬
новое время
Венозная
кровь
5 (доста¬
точно для
опреде¬
ления 5
показате¬
лей коагу-
лограммы)
Разовый ваку¬
тейнер на 5 мл
(голубая мар¬
кировка)
Из вены берут 5 мл крови в
вакутейнер с голубой мар¬
кировкой, тщательно пере¬
мешивают, медленно вращая
вакутейнер
То же
6 ч
Пподолжение таблицы 1-3.
Тест
Материал
для иссле¬
дования
Мини¬
мальный
объем, мл
Приспособле¬
ния для взятия
(сбора)
материала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
6 ч
Активиро¬
ванное
частичное
тромбо¬
пласти¬
новое
время
(АЧТВ)
То же
Фибриноген
То же
Тромби¬
новое время
Тоже
5(доста¬
точно для
опреде¬
ления 5
показате¬
лей коагу-
лограммы)
Разовый ваку¬
тейнер на 5 мл
(голубая мар¬
кировка)
5(доста¬
точно для
опреде¬
ления 5
1(оказате-
лей коагу-
лограммы)
Тоже
5(доста¬
точно для
определе¬
ния 5 фак¬
торов)
То же
Из вены берут 5 мл крови в
вакутейнер с голубой мар¬
кировкой, тщательно пере¬
мешивают, медленно вращая
вакутейнер
То же
На самоклеящейся этикетке
делают вес необходимые
записи, приклеивают ее к
пробирке и как можно быс¬
трее лоставля ют в лаборато¬
рию в обычном контейнере
То же
6 ч
То же
Тоже
6 ч
Ппооо.гжт чиє таб. иы 1-.\
Тест
Материал
для иссле¬
дования
Мини¬
мальный
объем, мл
Приспособле¬
ния для взятия
(сбора)
материала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берегся
материал
Время
готов¬
ности
ответа
Антитром¬
бин ИГ
Тоже
5 (доста¬
точно для
определе¬
ния 5 фак¬
торов)
Тоже
То же
То же
6 ч
Фактор V
То же
То же
То же
То же
6 ч
Фактор VII
Тоже
Тоже
То же
То.же
6ч
Фактор VIII
Тоже
Тоже
То же
То же
6ч
Фактор IX
То же
Тоже
То же
То же
6 ч
Фактор X
Тоже
Тоже
То же
То же
6ч
Исследова¬
ние агрега¬
ции тром¬
боцитов с
аденозин-
дифocфa-
том (АДФ),
коллагеном,
адренали¬
ном, ристо-
цетином
Венозная
кровь
5(доста¬
точно для
исследова¬
ния агре-
[■ации с 1
веществом)
Разовый ваку-
тейтгер на 5 мл
(голубая мар¬
кировка)
То же
То же
6ч
70
Глава 1. Основы лабораторного обследования пациентов
'7)
I
I
«
ч
е4
X
о.
V
н
я
X
£
X
к X о
« М й
а я 2
5 а.®
н и о
Ш в
хо ®
о £
^ * «
« * - 1
2 2 г. I
§ 2 Ю &
о 5 о й
1| *
)К
ч
2 ^
5 Ж
е ^
я на
1 ^
И
я я
2 5
о.
о
н
РО
Н -о
^ « ё
& 2 о
- о ^
Й 3
5 «
о
Й 2
РЧ
Г) я
к 3
2 "Т
I ”
с 1п
я
^ =5
ю 8
Л ^
ЙЗ ^
я 3
л
н
у
§
о
н
2
о.
я
н
2 5
3 Е
я ш
X
2
ас 2:
X §■
I ^
I &
3 ю
« я
я
ч
я
iг
я
а
о
г"1 ^
и (О о
я
я
я «ч
н й
о 3
я я
/.2. Роль медицинской сестры в обеспечении качественного,.. 71
1.2.3.3. Выбор процедуры взятия крови
Для получения крови для клинических лабораторных исследова¬
ний используются три процедуры:
• венепункция;
• взятие капиллярной крови;
• пункция артерии,
Наиболее удобным местом в:зятия крови на анализы является локте¬
вая вена. Венозная кровь — лучший материал не только для определе¬
ния биохимических, гормональ{1ых, серологических, иммунологических
показателей, но и для обшеклинического исследования крови. Это обус¬
ловлено тем, что применяемые в настоящее время гематологические ана-
л и заторы, с помощью которых проводят общеклиническис исследования
крови (подсчет клеток крови, определение гемоглобина, гематокрита и
др.), предназначены для работы с венозной кровью и в большинстве своем
в тех странах, где эти анализаторы производятся, они сертифицированы и
стандартизированы только для работы с венозной кровью. Выпускаемые
(|)ирмами калибровочные и контрольные материалы предназначены для
калибровки гематологических анализаторов по венозной крови. Помимо
>|'ого, при взятии крови из пальца возможен ряд методических особен¬
ностей, которые стандартизировать очень трудно (холодные, цианотич-
иые, отечные пальцы, необходимость в разведении исследуемой крови и
др.), что приводит к значительным разбросам получаемых результатов и
как следствие к необходимости повторных исследований. Для общскли-
ц и чес кого исследования кровь из пальца рекомендуется брать в следую¬
щих случаях:
• при ожогах, занимающих большую площадь поверхности тела
пациента;
• при наличии у пациента очень мелких вен или когда они трудно¬
доступны;
• при выраженном ожирении пациента;
• при установленной склонности к венозному тромбозу;
• у новорожденных.
Пункция артерии для взятия крови на лабораторные исследования
используется редко, в основном для исследования газов крови.
1.2.3.4. Процедура взятия крови
Специалист, осуществляющий забор крови, должен строго выпол¬
нить следующие требования.
72 Глава /. Основы лабораторного обследования пациентов
• Кровь и другие биологические жидкости всех больных изначаль¬
но должны рассматриваться как инфицированные.
• Медицинская сестра или лаборант обязаны раб9тать в перчат¬
ках при соприкосновении с кровью или другими жидкостями
организма, со слизистыми оболочками или интактной кожей
всех пациентов, при работе с загрязненными предметами или
поверхностями, при проведении венепункции или проколе кожи.
Поэтому специалист, осуществляющий забор крови, обязан или
дезинфицировать перчатки, переходя от одного пациента к друго¬
му, или сменять их, если они одноразовые. Все другие предметы
(приспособления), используемые при заборе крови, необходимо
проверять (исправность, срок годности, достаточное количество)
и располагать на рабочем месте так, чтобы их при необходимости
можно было легко взять.
• Специалист, берущий кровь, должен быть эмоционально подго-
тов.лен к процедуре. Его внешний вид, настроение, поведение,
практические навыки, умение общаться с пациентом имеют боль¬
шое значение для установления рабочего контакта с ним.
Техника взятия крови. Процедурная медицинская сестра или
лаборант должны поприветствовать пациента в дружелюбной
профессиональной манере. Если пациент пришел в процедурную,
необходимо спросить: «Как Вас зовут?» или «Как Ваши фамилия,
имя, отчество? Скажите мне дату Вашего рождения» или «Сколько
Вам лет?» Сравните ответ пациента с имеющейся у вас инфор¬
мацией (надпись на заявке, данные на компьютере или на листе
назначения). Если больной находится в палате, постучите в дверь и
войдите. Сравните ваши данные о пациенте с теми, что вы можете
получить у самого больного или с указанными в табличке на его
койке (обычно на табличке указывают паспортные данные и номер
истории болезни). Сообщите пациенту, кто вы и зачем пришли.
Если возникли трудности с идентификацией пациента, позовите
постовую медицинскую сестру и уточните у нее необходимые дан¬
ные. Обратите особое внимание на идентификацию детей, кото¬
рым необходимо взять кровь. Не берите кровь без точной иденти¬
фикации пациента.
Процедурная медицинская сестра или лаборант должны сообщить
пациенту, что венепункция или прокол пальца являются несколько
болезненной процедурой. Никогда не следует говорить пациенту:
«Это совсем небольно». Пациент может бояться самой процедуры
L2. Роль медицинской сестры в обеспечении качественного... 73
ненепункции. Поэтому важно спокойно и доверительно, простыми
словами объяснить ему, как берется кровь и что дискомфорт и болез¬
ненные ощущения обычно исчезают после введения иглы в вену. Если
пациенту когда-либо ранее плохо переносил взятие крови, лучше
предложить ему лечь во время процедуры.
Положение пациента при взятии крови. Луч ше брать кровь в положе-
нии пациента лежа на кушетке или сидя, откинувшись на наклонную
сииику кресла; следует учитывать опасность потери сознания боль¬
ным. Всегда нужно проверить, удобно л и ему.
Положение сидя. Пациент удобно сидит в кресле, положа руку на
подлокотник (или на стол) так, чтобы она была почти прямой от
запястья до плеча и имела хорошую опору. Ее чуть-чуть сгибают в
.30кто. Процедурная сестра должна находиться перед пациентом,
ч I обы в случае обморока поддержать его и не дать ему упасть.
Положение лежа. Пациент удобно располагается на спине. Если
нужна дополнительная опора для руки, под нее подкладывают подуш¬
ку. Рука должна быть почти прямой (чуть согнутой в локте). Пациент
ие должен испытывать никакого физического напряжения при удер¬
жании руки в нужном положении.
Специалист, осуществляющий венепункцию или взятие крови из
пальца, должен подготовить необходимые принадлежности; перчат¬
ки, пробирки, моноветты, иглы, жгут, 70% этиловый (или изопропи-
•повый) спирт, марлевые тампоны, бинты, ватные шарики. Их распо¬
па la ют так, чтобы они были легко доступны специалисту, не мешали
пациенту и он не мог случайно их задеть, уронить, повредить.
(.2.3.4,1. Взятие крови из вены
1. Выберите наиболее доступную вену (самую наполненную).
Проверьте другую руку, возможно, там вены «лучше». Попросите
пациента 3—4 раза сжать и разжать кулак (не более, так как интен¬
сивные и длительные сжимания и разжимания кулака могут гюв-
л и ять на некоторые показатели крови). Указательным пальнем про¬
щупайте вену, определите направление ее хода. Тромбированные
пены неэластичны, похожи на жесткий жгут и очень легко смеща-
кпся. Обычно в первую очередь используют медианную (середин¬
ную) кубитальную вену. Сгиб локтевого сустава является лучшим
местом для венепункции, к cephalica является второй веной, удоб¬
ной для пунктирования. В крайнем случае используют v. basilica.
Пены на кисти, предплечье, на стопе или в районе голеностопного
сусз ава используют, если нет возможности взять кровь из локтевых
74 Глава I. Основы лабораторного обследования пациентов
вен. Если не удается найти подходящую вену, поступайте следую¬
щим образом:
• попробуйте найти вену на другой руке;
• попросите пациента сжать кулак;
• наложите жгут, но помните, что жгут может быть затянут макси¬
мально в течение 2 мин;
• помассируйте руку от запястья к локтю;
• постарайтесь нащупать своим указательным пальцем вену паци¬
ента;
• подогрейте место венепункции, чтобы усилить кровоток, для
этого полотенце или ткань смачивают водой при 42 'С, помешают
в полиэтиленовый пакет и прикладывают к поверхности кожи;
через 3-10 мин развивается гиперемия;
• попросите пациента опустить руку пониже.
Если с первого раза подходящую вену обнаружить не удалось,
необходимо снять жгут и попросить пациента 1—2 мин подвигать
рукой и вновь наложить жгут. Если вены тонкие, используют более
тонкие иглы.
2. Выберите участок вены, из которого будете брать кровь. Нало¬
жите жгут на руку пациента. Обычно используют резиновый жгут
шириной 2,5 см и длиной 50 см. Жгут затягивают туго, но так, чтобы
это не вызывало боль. Лучше всего вместо жгута использовать ман¬
жеты от аппарата для измерения давления. В этом случае давление в
манжете должно быть ниже систолического, но выше диастолическо¬
го. Накладывать жгут можно не более чем на 2 мин, иначе начнется
гемоконпентрапия, что приведет к увеличению концентрации белков
в крови, количества клеток и факторов коагуляции.
3. Продезинфицируйте место пункции, используя тампон (или сал¬
фетку), смоченную спиртом (лучше 70% раствором изопропанола или
1% раствором йода). Протрите им поверхность, двигая тампон от цен¬
тра к периферии по кругу. Обработанная поверхность должна высох¬
нуть. Ничто нестерильное не должно прикасаться к этой поверхности.
Только после дезинфекции перчаток можно начать венепункцию.
4. Проверьте иглы, моноветты, шприцы перед проведением вене¬
пункции. Колпачок с иглы снимают непосредственно перед венепун¬
кцией. Если случайно дотронулись иглой до чего-то нестерильного,
то иглу нужно заменить.
Метод при помощи моноветтов фирмы «САРШТЕДТ». Кровь берут
одноразовым моноветтом соответствующего предназначения: для
1.2. Роль медицинской сестры в обеспечении качественного... 75
обшеклинического исследования крови - моноветт вместимостью
2,7 мл с красной маркировкой (содержит ЭДТА); для СОЭ - моноветт
с (1)иолетовой маркировкой (содержит цитрат); для биохимических,
части гормональных и серологических исследований - с коричневой
маркировкой (содержит гель); для исследований свертывающей сис-
(смы — с зеленой маркировкой (содержит цитрат); для исследования
иммунного статуса — с оранжевой маркировкой (содержит гепарин);
лая исследования глюкозы с желтой маркировкой (содержит фторид).
При взятии венозной крови в моноветты пробы крови с антикоагу-
лянтом берут в последнюю очередь, чтобы избежать попадания анти-
коагулянта в моноветты, где должна быть коагуляция. На моноветт
надевают иглу и снимают с нее колпачок. Одной рукой процедурная
медицинская сестра с помощью большого пальца натягивает кожу
над веной. Моноветт держат так, чтобы игла была расположена срезом
»верх и по отношению к коже под углом 15®. Прокалывают кожу и
СЧ'СНКу вены. Движения должны быть плавными, но быстрыми. Иглу
НС следует погружать глубоко. Когда игла войдет в вену, иглу немно-
!о вытягивают назад и несильно потягивают за поршень моноветта.
Необходимо обратить внимание, не находится ли срез иглы под кожей.
Гели это произошло, то указательным пальцем левой руки определя¬
ют вену и направляют иглу вперед, чтобы вновь войти в вену. Как
юлько кровь начинает поступать в моноветт, иглу не двигают. Если
нсн ы у пациента «хорошие», жгут может быть ослаблен после того, как
кровь начинает поступать в моноветт. Если вены маленькие и/или
сложные для прокола, лучше всего жгут не ослаблять, но не более чем
на 1 мин. Никогда не вынимают иглу из вены при затянутом жгуте.
Далее процедурная сестра одной рукой удерживает моноветт, а
другой медленно тянет поршень моноветта на себя до упора. Моноветт
пол жен наполниться, при этом произойдет смешивание крови с
аитикоагулянтом или консервантом в правильном соотношении.
Нельзя двигать поршень на себя очень быстро — это может вызвать
гемолиз и спадение вены. Если есть необходимость в дополнительном
количестве крови в соответствии с заявкой, то, не вынимая иглу из
вены, отсоединяют первый моноветт и к игле присоединяют другой.
Набирают кровь во второй моноветт и, если крови взято достаточно,
отсоединяют второй моноветт от иглы.
Если кровь поступает плохо, нужно проверить, не слишком ли
сильно вытягивается поршень из моноветта (вена спалась). В случае,
если почему-либо кровь перестает поступать в моноветт, иглу надо
76 Глава I, Основы лабораторного обследования пациентов
подвигать взад-вперед. Обычно это действие улучшает ток крови в
моноветт. Затем иглу следует повернуть наполовину оборота, а жгут,
если он был затянут очень туго, ослабить. Повторный прокол этой же
вены весьма болезнен, поэтому делать это не рекомендуется. Если ни
одна из перечисленных процедур не помогла, то иглу надо вынуть и
искать другое место для венепункции.
Когда две попытки венепункции не удались, необходимо позвать
на помошь более опытных специалистов для взятия крови; в любом
случае обязательно сообщить об этом лечащему врачу и сделать
запись в рабочем журнале.
Как только кровь получена, на место пункции над иглой кладут сте¬
рильный марлевый тампон и осторожно извлекают иглу, слегка нажимая
тампоном на место пункции во время извлечения иглы. На тампон и кожу
наклеивают полоску липкой ленты, и пациент сгибает руку в локте, чтобы
прижать тампон (на Ш мин). Если необходимо, на место пункции накла¬
дывают давящую повязку, чтобы не образовалась гематома.
После взятия крови в моноветт его поршень тянут на себя до щел¬
чка, тем самым «дно» моноветта становится закрытым. Отламывают
шток поршня и выбрасывают его в контейнер для отходов. Моноветт
становится пробиркой с крышкой. Если кровь взята в моноветты с
антикоагулянтом (шприцы с зеленой, красной, фиолетовой и оранже¬
вой маркировкой), для хорошего перемешивания его надо повернуть
несколько раз (5 раз минимум). Перемешивание проводят осторожно
во избежание гемолиза. Никогда нельзя встряхивать моноветт!
Все моноветты снабжаются этикетками, где указаны фамилия,
имя, отчество пациента, номер истории болезни, отделение, палата,
дата и время взятия крови, подпись процедурной сестры. Этикетки с
необходимыми данными о пациенте не следует заполнять заранее, так
как при большом количестве проб их очень легко перепутать.
Использованные для венепункции материалы и предметы разового
пользования помещают в соответствующие контейнеры для отходов.
Взятый материал доставляют в лабораторию. Транспортировку
производят с предосторожностями, чтобы не потерять материал
(иногда взятый с большими трудностями), к тому же он может быть
инфицирован и представлять опасность.
Метод при помощи вакутейнеров фирмы «BECTON DICKINSON»
представлен на Рис. 1-10, а на схеме 1-3 приведена подробная пос¬
ледовательность действий медицинской сестры при взятии проб
венозной крови.
1.2. Роль медицинской сестры в обеспечении качественного...
77
Ш У г si
Р §
Щг
й § I = ^
Ш 5- з: й' ^
Ш Й 2 =
^ а ^ С
Ш I I ? £
- 2 -^. .'к ^ >.
I-!;
ч ^ е; и <^ш Е -“ Й з: О.
^«1|=||=Е|в5г8
|§!1 а|1 ИёИ
ii< й> М ^ >. Си>Тк >.с.2 С 4?
С> е; Си==1нВСссс-(
а
-/л-'лА- ± >ч
%«г«." :. а
1%1ЛЛ\
П.В СХ.в'^ ^02
51|8|1||§г
Н;|Г«|;-г
-л.1о!:222а"с;
: '
ЦЩ1Ш
»1У^52;18
д
’Д
>.
и
я
оа
"=:
с
с
о
К
о
X
о
о.
>i
X
X
н
X
я
Рч
78
Глава 1. Основы лабораторного обследования пациентов
Схема 1-3.
Последовательность действий медицинской сестры
при взятии проб венозной крови
1. Подготовка к процедуре
Вымыть и высушить руки
Необходимое условие для соблюдения инфекционной
безопасности
Надеть защитную одежду: халат (поверх брюк или комби¬
незона), шапочку (косынку)
Каждый пациент рассматривается как потенциально
инфицированный.
Халат меняется по мере загрязнения, но не реже двух раз
в неделю. Должна быть предусмотрена немедленная смена
спецодежды в случае загрязнения ее кровью
Подготовить необходимое оснащение
Пригласить пациента
Зарегистрировать направление на анализ крови
Каждое направление на анализ крови должно быть заре¬
гистрировано для идентификации всех документов и инс¬
трументария, относящихся к одному пациенту. В направ¬
лении на анализ крови должна быть указана следующая
информация: фамилия, имя, отчество пациента, возраст,
дата и время взятия крови, регистрационный номер анали¬
за (указывает лаборатория), номер истории болезни (амбу¬
латорной карты), фамилия лечашего врача, отделение или
подразделение, направившее пациента, другая информа¬
ция (домашний адрес и телефон пациента). Пробирки для
взятия крови и бланки направлений маркируются заранее
одним регистрационным номером
1.2. Роль медицинской сестры в обеспечении качественного...
79
Провести идентификацию пациента
Необходимо убедиться, что взятие крови будет проведено
у пациента, указанного в направлении. Независимо от
подразделения ЛПУ для его идентификации следует пред¬
принять следующее:
• у амбулаторного пациента спросить имя и фамилию,
домашний адрес и/или дату рождения
• сравнить эту информацию с указанной в направле¬
нии
• у стационарного пациента спросить те же данные
(если пациент в сознании), сравнить информацию с
указанной в направлении
• для неизвестных пациентов (пациентов без сознания
или с сумеречным сознанием) в приемном отделении
им должно быть присвоено какое-либо временное, но
четкое обозначение, пока личность не будет выяснена
Объяснить пациенту цель и ход предстоящей процедуры,
убедиться в наличии информированного согласия
Пациент мотивируется к сотрудничеству. Соблюдаются
права пациента на информацию (Основы законодательс¬
тва РФ об охране здоровья граждан, ст. 30—33)
В доступной для пациента форме, учитывая психологи¬
ческие особенности, объясняется цель исследования, что
представляет собой процедура, какие неприятные ощу¬
щения и когда их может испытать пациент. Такой разговор
помогает снять эмоциональное напряжение, создать дове¬
рительную обстановку
При взятии крови у пациента, находящегося в сумеречном
состоянии, необходимо соблюдать особую осторожность,
чтобы предупредить неожиданные движения и вздраги¬
вания в момент введения иглы или нахождения ее в про¬
свете вены. Наготове должна быть марлевая салфетка, при
выпадении или смещении положения иглы жгут нужно
быстро снять. Если неожиданно игла глубоко вошла в
руку, необходимо предупредить врача о возможности пов¬
реждений
80
Глава 1. Основы лабораторного обследования пациентов
Проверить соблюдение пациентом отраничений в диете,
учесть прием назначенных пациенту лекарственных средств
Наиболее важные правила выбора времени для взятия
проб венозной крови;
• по возможности пробы следует брать между 7 и 9 ч
утра
• взятие проб должно выполняться через 12 ч после пос¬
леднего приема пищи и при сниженной физической
активности (например, иа концентрацию холестерина
и триглицеридов в сыворотке влияют состав пищи,
физическая активность, курение, употребление алко¬
голя и кофе)
• взятие проб должно выполняться до проведения диа¬
гностических и лечебных процедур, способных ока¬
зать влияние на результаты
Процедуры обеспечения соблюдения диетических огра¬
ничений оповещения персонала об их отмене после взятия
крови зависят от правил соответствующего уЧрежДС11ИЯ
Вымыть и высушить руки
Необходимое условие для соблюдения инфекционной
безопасности
Надеть защитную одежду: защитные очки или щиток,
перчатки
Каждый пациент рассматривается как потенциально
инфицированный
I Удобно расположить пациента
Расположите руку пациента так, чтобы плечо и предплечье
образовывали прямую линию
/,2. Роль медицинской сестры в обеспечении качественного,..
81
Подобрать и проверить все приспособления, используемые для
взятия крови, и удобно расположить их на рабочем месте
Необходимо проверить исправность, отсутствие внешних
повреждений, срок годности игл, держателей, вакутейне¬
ров, наличие в вакутейнерах реагентов и правильность
выбора вакутейнеров для данных видов исследования
И. Выполнение процедуры
Собрать вакуумную систему для забора венозной крови
Убедитесь в сохранности печати на игле, которая гарантирует
стерильность. Если она повреждена, не используйте иглу
Снимите белый колпачок, чтобы открыть иглу с клапаном
Вверните закрытый резиновым клапаном конец иглы вдержа-
тель (если игла имеет предохранительную розовую оболочку,
отогните ее к держателю)
Выбрать, осмотреть и пропальпировать место предполагаемой
венепункции
Чаще всего венепункция
проводится в области:
• локтевой ямки:
1 — серединная вена локте¬
вого сгиба (К mediana cubiti)
2 — К mediana antebrachii
• предплечья:
3 — Vcephalica
■ тыльной поверхности
кисти:
4 — поверхностная венозная
сеть тыльной стороны кисти
(Rete venosum dorsale manus)
82
Глава /. Основы лабораторного обследования пациентов
Наложить жгут
Жгут накладывается на 7—10 см
выше места венепункции на
рубашку или пеленку
При наложении жгута не исполь¬
зуйте руку на стороне мастэкто-
мии
Необходимо помнить, что дли¬
тельное наложение жгута (более
1 мин) может вызвать измене¬
ния концентрации белков, газов
крови, электролитов, билируби¬
на, показателей коагулограммы
Попросить пациента сжать кулак
Нельзя задавать руке физическую нагрузку (энергичное
сжимание и разжимание кулака), так как это может при¬
вести к изменениям концентрации в крови некоторых
показателей
Для усиления тока крови можно помассировать руку от
запястья к локтю или использовать согревающие при¬
надлежности — теплую (около 40 “С) влажную салфетку,
приложенную к месту пункции на 5 мин.
Если не удается найти вену на данной руке, попробуйте
найти ее на другой
Продезинфицировать место венепункции
Дезинфекция места венепункции проводится марлевой
салфеткой, смоченной антисептиком, круговыми движе¬
ниями от центра к периферии
Подождать до полного высыхания антисептика или просу¬
шить место венепункции стерильным сухим тампоном
Не пальпировать вену после обработки! Если во время
венепункции возникли сложности и вена пальпировалась
повторно, эту область нужно продезинфицировать снова
1.2. Роль медицинской сестры в обеспечении качественного...
83
Снять цветной защитный колпачок
Фиксировать вену
Обхватить левой рукой предплечье пациента так, чтобы
большой палец находился на 3—5 см ниже места венепун¬
кции, натянуть кожу
Медицинская сестра должна находится перед пациентом,
чтобы в случае обморока поддержать его и не дать ему
упасть
Ввести иглу в вену
Игла с держателем вво¬
дится срезом вверх под
углом 15°. При попада¬
нии в вену в индика¬
торной камере появит¬
ся кровь
Кровь в индикаторной камере
Снять (ослабить) жгут
Длительное наложение жгута (более 1 мин) может вызвать
изменения концентрации белков, газов крови, электроли¬
тов, билирубина, показателей коагулограммы
Попросить пациента разжать кулак
84
Глава /. Основы лабораторного обследования пациентов
Вставить пробирку в держатель
Пробирка вставляется в держатель со стороны ее крышки.
Большим пальцем надавите на дно пробирки, удерживая при
этом ободок держателя указательным и средним пальцем
Старайтесь не менять руки, так как это может изменить
положение иглы в вене
Под действием вакуума кровь самостоятельно начнет
набираться в пробирку
Тщательно дозированный объем вакуума обеспечивает
необходимый объем крови и точное соотношение кровь/
реагент в пробирке
При проведении нескольких испытаний пробы крови с
антикоагулянтом берут в последнюю очередь, чтобы избе¬
жать попадания антикоагулянта в другие вакутейнеры
Извлечь пробирку из держателя
Пробирка извлекается после того, как в нее прекратила
поступать кровь. Извлекать пробирку удобнее, упираясь
большихМ пальцем в ободок держателя
Перемешать содержимое наполненной пробирки
Содержимое переме¬
шивается путем пере¬
ворачивания пробир¬
ки несколько раз (не
мснсе 4—5) для полно¬
го смешивания крови
и наполнителя
Не встряхивайте про¬
бирку резко! Это может
привести к разруше¬
нию форменных эле¬
ментов крови
тт
Вставить в держатель следующую пробирку и заполнить
ее, повторить последующие действия
1.2. Роль медицинской сестры в обеспечении качественного...
85
111. Окончание процедуры
У процедурной медицинской сестры на рабочем месте должна быть
краткая инструкция или схема (схема 1-4) проведения венепункции,
» которой отражены основные моменты процедуры и последователь¬
ность действий,
Краткая инструкция для процедурной медицинской сестры при про¬
ведении венепункции:
• идентифицируйте пациента;
• правильно усадите (уложите) пациента;
■ подготовьте и разложите все необходимое для венепункции;
• сверьте направление на исследование с вакуумными пробирками
(моноветтами) для взятия крови;
• выберите место прокола;
86
Глава 1. Основы лабораторного обследования пациентов
I
ВР
о
&•
0
X
1
V
йо
н
а
и
«а
%
и
X
2
т
я
я
сс
н
0
зх
ч
н
X
л
1
«
а
I
ч
и
1.2. Роль медицинской сестры в обеспечении качественного... 87
• наложите жгут;
• продезинфицируйте место пункции;
• произведите венепункцию и заберите кровь;
• снимите жгут;
• выньте иглу;
• забинтуйте руку пациента;
• снабдите этикетками вакуумные пробирки (моноветты);
■ правильно уберите все использованное (в отходы);
• доставьте материал в лабораторию.
1.2.3.4.2. Взятие крови через сосудистый катетер
Если в вене стоит катетер, можно брать кровь через него, чтобы не
производить отдельную венепункцию. Но делать это рекомендуется
НС чаще одного раза в сутки из-за опасности инфицирования катете¬
ра. При взятии крови через катетер первые 5-8 мл крови необходи¬
мо слить, чтобы предотвратить риск смешивания образцов крови с
жидкостями, которые были введены по этому катетеру ранее. Взятие
крови должно производиться очень тщательно из-за возможности
разбавления крови вливаемыми больному растворами, что может
повлечь за собой искажение результатов исследований.
1.2.3.4.3. Взятие капиллярной крови
Прокол кожи является методом выбора при взятии крови в педиат¬
рии, особенно у новорожденных. Большие количества крови, которые
берут при венепункции, могут вызвать анемию у детей, особенно у
новорожденных или недоношенных. Венепункция глубоких вен у
детей может стать причиной (очень редко) остановки сердца, крово¬
течения, тромбоза, сокращения вен, ведущего к гангрене конечности,
повреждению органов или тканей, случайно задетых при венепунк¬
ции, и инфицирования. Более того, доступные вены могут использо¬
ваться для парентеральной терапии. У взрослых прокол кожи делают
при сильном ожирении, тяжелых ожогах, склонности к тромбозу,
многократном взятии крови для исследования содержания глюкозы и
определения газов крови.
В клинической практике прокол кожи используют для взятия
крови из пальца, мочки уха и пятки (у детей). Между объемом получа¬
емой крови и глубиной прокола имеется прямая зависимость. В связи
с этим скарификатор должен выбираться в соответствии с местом про¬
88 Глава 1. Основы лабораторного обследования пациентов
кола и необходимым количеством крови. Пункция пальца не должна
проводиться у младенцев, так как это может привести к повреждению
кости, а прокол подошвенной поверхности пятки ребенка глубже
2,4 мм — к повреждению пяточной кости.
Методика взятия крови из пальца. Взятие крови должно произво¬
диться в следующей последовательности.
• Медицинская сестра или лаборант должны убедиться в том, что
имеются подготовленные перчатки, стерильные ватные шарики
или марлевые тампоны для спирта, стерильные ланцеты, пипет¬
ки, капилляры (капиллярные пробирки), стеклянные пробирки,
разводящие жидкости, фломастеры для надписей, бинты. Он
изучает полученную заявку на исследования.
• Для манипуляции выбирают неохлажденный, нецианотичный,
неотечный палец пациента. Прокол лучше делать у кончика IV
пальца левой руки (у правшей). Можно прокалывать 11 и 111 паль¬
цы. Если руки у пациента холодные, то перед проведением проко¬
ла их нужно обернуть на 10-15 мин горячим полотенцем.
• Чтобы усилить кровоток, нежно массируют палец от основания
к кончику.
• Тампоном, смоченным спиртом, тщательно обрабатывают кон¬
чик пальца и дают поверхности просохнуть.
• Вынимают ланцет из упаковки, не прикасаясь к его острию.
• Одной рукой крепко держат палец пациента, а другой выполня¬
ют прокол на середине расстояния между центром подушечки
пальца и его латеральной поверхностью на глубину, достаточную,
чтобы получить крупную каплю крови.
• Первую каплю удаляют стерильным тампоном.
• Массируя палец от основания к кончику, получают нужное коли¬
чество крови. Нельзя мягь и сжт1ма1Ъ н^ыец — это приводит к лож¬
ным результатам из-за попадания в кровь межтканевой жидкости.
• Набирают нужное количество крови в соответствующие микро¬
ветты или капилляры в соответствии с полученной заявкой.
• Закрывают микроветты с кровью пробками от них,
• Наклеивают на микроветты этикетки с данными пациента, ука¬
зав время и дату взятия крони.
Примечание. На бланке ответа обязательно нужно указывать, что кровь на
исследования бралась из пальна, так как результаты исследований уровня
глюкозы, калия, кальция и некоторы.ч других показателей могут отличаться
от результатов, полученных при работе с венозной кровью.
/,2. Роль медицинской сестры в обеспечении качественного... 89
Методика взятия крови из мочки уха. Кровь для исследования газов
крови может быть взята из пальца, но она не годится для определения
и ней рОз- Хорошим «заменителем» артерии для исследования газов
крови может быть мочка уха, так как она хорошо васкуляризована и
в то же время метаболизм в ней невелик, что позволяет считать эту
кровь близкой по своему газовому составу к артериальной.
Улучшить артериальный кровоток в мочке уха можно, согревая ее
бумажным полотенцем, смоченным водой температурой 39—42 “С, или
щелчками указательного пальца, а также смазав мочку трафурилом.
Мочку уха протирают 70% спиртом и пунктируют ланцетом.
Прокол должен быть таким, чтобы кровь текла свободно. Первую
каплю удаляют стерильным тампоном. Затем два гепаринизирован-
пых капилляра на 100 мкл каждый помешают в центр следующей
капли крови и заполняют их без воздушных пузырьков, которые могут
изменить рОз- Оба конца капилляров, после того как в них помещают
металлические стерженьки для перемешивания крови, закрывают
специальными резиновыми колпачками.
После закупорки обоих концов капилляров кровь в них перемеши¬
вают с помощью магнита. Капилляры с кровью маркируют этикетка¬
ми, на которых указывают сведения о пациенте, а также время и дату
пзятия крови, и немедленно доставляют в лабораторию для исследова¬
ния.
Методика взятия крови из пятки во многом схожа с методикой взя¬
тия крови из пальца. Глубокий укол пятки выполняют у дистального
края пяточной кости, предварительно подогрев стопу в теплой воде
(рис. 1-11). Кровь, взятую из пятки, нельзя использовать д.ля опреде¬
ления газов, так как она отличается от артериальной крови по всем
параметрам, кроме избытка оснований и стандартных бикарбонатов.
Лля исследования газов крови у новорожденных лучше брать кровь
через катетер из пупочной артерии (если ока не
спалась). ...и-л
В качестве меры безопасности не накладывай-
1с лейкопластырь на место прокола у младенцев
и детей, так как он может отклеиться и ребенок
может его проглотить.
Ирнмечание. Если почему-либо при веЕгепункции
или других способах взятия крови получить сс не Места для
удалось, это должно быть документировано с у ка а а- пзятия капилляр-
пи с м п ри ч и н; тюй крови из пятки
90 Глава I. Основы лабораторного обследования пациентов
• пациента нет на месте;
• пацртеит отказался от взятия крови;
• не удалось взять кровь.
1.2.3.4.4. Методика взятия крови из артерии
Артериальную кровь берут для исследования содержания в ней
Оз, СОг и определения pH, Пункция артерии технически более слож¬
на, чем пункция вены. Высокое артериальное давление затрудняет
остановку кровотечения, создает условия для образования гематомы.
Для получения артериальной крови используют пункцию лучевой,
плечевой или бедренной артерии. Место пункции не должно иметь
раздражения кожи, отека, располагаться вдалеке от имеющейся раны,
артериовенозного шунта или фистулы.
Пункция артерии — довольно болезненная процедура. Пациенты
могут жаловаться на значительный дискомфорт: боль, чувство набуха¬
ния или размягчения в области пункции, спазм мышц или судороги.
Предпочитают брать кровь из лучевой или плечевой артерии.
Бедренная артерия больше по диаметру, и ее легче пунктировать, но
нужно помнить, что у пожилых пациентов кровотечение из нее после
пункции бывает дольше и интенсивнее, чем из лучевой или плечевой
артерии. Кроме того, кровотечение из бедренной артерии можно вовре¬
мя не заметить из-за того, что больной накрыт одеялом. Лучевую арте¬
рию пунктировать труднее, но осложнений при этом бывает меньше.
При использовании дл я пункции лучевой артерии надо проверить
способность выбранной конечности к коллатеральному кровообра-
шению. Для этого проводят тест Аллена: пациент поднимает руку
до вертикального положения, врач пережимает лучевую и локтевую
коллатеральную артерии одновременно, т.е. лишает руку кровоснаб¬
жения. Рука бледнеет (белеет), после чего ее опускают и измеряют дав¬
ление на локтевой артерии. Если кровоток достаточен (рука розовеет),
то можно пунктировать радиальную артерию, т.е. если при пункции
затромбируется лучевая артерия, то кровоснабжение конечности
будет обеспечено по локтевой артерии. При отрицательном тесте
Аллена (рука не розовеет) для пункции используют лучевую артерию
на другой руке.
В дальнейшем все действия выполняются в следующей последова¬
тельности.
1. Определяют место пунктируемой артерии по ее пульсации.
Участок прокола кожи обрабатывают 70% водным раствором изопро¬
панола, а затем раствором йода.
1.2. Роль медицинской сестры в обеспечении качественного... 91
1. Можно провести местную анестезию, но обычно этого не тре¬
буется. Пункция артерии без анестезии дает более точные результаты
при определении рСОз и pH.
3. Для пункции используют специальную иглу и гепаринизиро-
аанный моноветт с бесцветной маркировкой и оранжевым колпачком.
Колпачок снимают и на моноветт надевают иглу. Игла должна пройти
иод кожу под углом 45—60® (90° для бедренной артерии) медленно и
осторожно.
4. Как только игла вошла в артерию, кровь начинает пульсовыми
голчка.ми поступать в моноветт, заполняя его целиком(2 мл).
5. После того, как моноветт наполнился, иглу вместе с ним удаля¬
ют, отсоединяют иглу, а на ее место надевают оранжевый колпачок,
ч гобы изолировать кровь от воздуха. Осторожно вращают моноветт
для смешивания крови с гепарином, Моноветт помещают в воду со
льдом, чтобы сократить потребление кислорода лейкоцитами крови.
И глу сбрасывают в контейнер для отходов.
6. На место пункции помещают стерильный тампон, придавливая
его большим пальцем правой руки минимум 2 мин (лучше 5 мин).
7. Взятый материал немедленно доставляют в лабораторию.
1.2.3.5. Критерии оценки качества взятых проб крови
Важным моментом для выявления нарушений в процедуре взятия
крови на лабораторные исследования является определение крите¬
риев оценки качества полученных проб перед их транспортировкой
к лабораторию. Процедурная медицинская сестра должна их знать и
постоянно использовать в своей работе.
1. Пациент правильно подготовлен к взятию крови. Лекарства по
возможности были исключены.
2. Необходимые для исследования пробы взяты у нужного пациента
и правильно промаркированы (этикеткой). Неправильно маркирован-
111>1й или немаркированный материал, доставленный в лабораторию,
ие принимается (выбрасывается). При перепроверке идентификации
пациента возможны новые ошибки, особенно если она проводится
через пациента (т.е. «Брали ли у Вас кровь? На какие анализы? Кто
брал?»). Это недопустимо, так как наносит пациенту психологическую
травму и подрывает его доверие к данному лечебному учреждению.
3. Правильно ли выбран антикоагулянт? Консервант? Достаточно
ли взято крови?
4. Наличие гемолиза, если возможно.
5. Взята ли кровь натощак? Действительно ли она взята натощак?
92
Глава 1. Основы лабораторного обследования пациентов
6. Соблюдены ли временные параметры при взятии проб: вовремя
ли он и взяты; вовремя ли отправлены в лабораторию?
При взятии крови на исследования важно знать »максимальные
нормы крови (особенно у детей), которые можно брать у пациента за
один раз и за все время госпитализации. Незнание таких норм вра¬
чами-клиницистами может в конечном счете (при частых и обшир¬
ных исследованиях) привести к развитию у пациента изменений
в показателях крови (снижение уровня гемоглобина, гематокрита,
количества эритроцитов и др.) без влияния патологического про¬
цесса. Проведенные исследования показали, что при взятии крови
на рутинные исследования в обычные пробирки взятый объем
крови у пациента в среднем в 45 раз превышал необходимый для
анализов, при взятии крови в вакутейнеры — только в 7 раз. У 47%
пациентов, которым требовалось переливание крови, отмечалась
связанная с проведением лабораторных анализов потеря эритро¬
цитов объемом более 180 мл (равноценно 1 единице эритроцитной
массы). Максимальные нормы взятия крови за один раз и за все время
госпитализации у детей до 14 лет приведены в табл. 1-4. У взрослых
рекомендуется брать вдвое больше крови, чем необходимо для выпол¬
нения лабораторных анализов.
Табшца 1-4.
Максимальные нормы взятия крови
за один раз н за все время госпитализации у детей до 14 лет
Масса тела, кг
Максимальная норма
взятия крови за один
раз, мл
Максимальная норма
взятия крови за весь
период госпитализации,
мл
2,7-3,6
2,5
23
3,6-4,5
3,5
30
4,5-6,8
5
40
7,3-9,1
10
60
9,5-11,4
Ш
70
11,8-13,6
10
80
14,1-15,9
10
100
16,4-18,2
10
130
18,6-20,5
20
140
1.2. Роль медицинской сестры в обеспечении качественного...
93
Окончание таблицы 1-4.
20,9-22,7
20
160
23,2-25,0
20
180
25,5-27,3
20
200
27,7-29,5
25
220
30,0-31,8
30
240
32,3-34,1
30
250
34,5-36,4
30
270
36,8-38,6
30
290
39,1-40,9
30
310
41,4-43,2
30
330
43,6-45,5
30
350
Для определения нагрузки процедурных медицинских сестер при
изятии крови на исследования, установления причин снижения
качества лабораторных исследований на этом этапе процедуры важно
жать затраты рабочего времени на взятие крови, чтобы избежать
перегрузки медицинских сестер и лаборантов.
Затраты рабочего времени на взятие крови
(даЕгные Корпорации американских врачей-патологов)
Манипуляция
Затраты времени, мин
Пункция артерии
12
Подготовка к венепункции
1
Иенепункция
4-10
В иЕтие крови из пальца
8-14
Увеличение нагрузки (количества пациентов) на процедурную
медицинскую сестру при взятии крови может привести к сниже¬
нию качества проб и результатов лабораторных исследований,
явиться сигналом к увеличению количества специалистов, рабо¬
тающих на этом этапе процедуры, или времени, необходимого для
приема материала в лаборатории.
94 Глава /. Основы лабораторного обследования пациентов
1,2,3.6. Осложнения и возможные затруднения при взятии крови
Обморок. Чтобы избежать этого осложнения и его последствий,
лучше брать кровь, когда пациент находится в положЬнии лежа.
Гематома. Если начинает появляться гематома, необходимо сразу
снять Ж1'ут и вынуть иглу из вены, после чего наложить давящую
повязку на место пункции.
Петехии. Обычно это следствие нарушения свертывающей сис¬
темы крови, поэтому специалист, производящий венепункцию или
взятие крови из пальца, должен быть готов к тому, что кровотечение
из прокола будет длительным. Таким пациентам обязательно нужно
накладывать давящую повязку.
Отек. Лучше не брать кровь там, где имеются отеки, иначе межтка-
невая жидкость попадет в кровь и результаты исследования будут
искажены.
Ожирение. У людей с ожирением обычно трудно найти вену и
произвести ее пункцию. При заборе крови в нес может попасть много
межтканевой жидкости и активаторов свертывания крови (тканевый
тромбопластин).
Поврежденные и склерозированные вены бывают у пациентов после
многократных венепункций (внутривенное введение лекарств), при
заборе крови на исследования нужно избегать таких век.
Гемолиз. Причинами гемолиза могут быть слишком тонкая игла
для венепункции, очень быстрые движения поршня шприца, неакку¬
ратное (быстрое) переливание крови из одной емкости в другую, очень
интегюивное перемешивание (встряхивание), длительное наложение
жгута (более 2 мин). Необходимо помнить, что одной из причин гемо¬
лиза может быть физиологическая «ненормальность» эритроцитов, о
чем необходимо предупредить лабораторию.
Гемоконцентрация. Причинами этого осложнения являются дли¬
тельное наложение жгута, массаж и сжимание места взятия крови,
склерозированные или окклюзированные вены.
Спавшиеся вены — обычно небольшие вены, из которых хотят
слишком быстро забрать («выкачать») кровь шприцем.
Тромбоз вен носле пункции обычно возникает у пациентов со склон¬
ностью к гиперкоагуляции, он также может появиться при повторных
пункциях в одном и том же месте.
Инфекционные осложнения возникают при нарушении правил
асептики и антисептики.
L2. Роль медицинской сестры в обеспечении качественного... 95
(.2.3.7. Типичные ошибки при взятии проб крови
Наиболее часто встречающиеся ошибки при взятии проб крови
можно разделить на три типа:
• ошибки на этапе подготовки к взятию крови;
• ошибки при проведении процедуры взятия крови;
• ошибки при подготовк'е отобранных проб к отправке в лабора¬
торию, нарушение температурного, светового режим хранения,
условий и времени транспортировки.
Ошибки первого типа могут быть обусловлены факторами, связан¬
ными с пациентом (несоблюдение правил подготовки) и действиями
медицинской сестры. Типичные ошибки, которые допускают меди¬
цинские сестры, связаны с неправильной идентификацией пациента
и неверным выбором приспособлений (пробирок) для взятия проб
крови.
Ошибки при проведении процедуры взятия крови состоят в том,
410 медицинские сестры после наложения жгута нередко просят
пациента поработать кистью рук. Это грубая ошибка, которая может
привести к искажению ряда биохимических показателей у больного.
Переливание крови из шприца в пробирку под давлением поршня
тоже является типичной ошибкой, результатом которой бывает гемо-
лизированная проба.
Гемолиз может оказать существенное в.аияние на качество резуль¬
татов лабораторных анализов. Это высвобождение компонентов кле¬
ток крови в плазму/сыворотку. Наличие гемолиза нередко можно рас¬
познать по появлению красноватого окрашивания плазмы/сыворотки
мосле центрифугирования, связанногос высвобождением гемоглобина
из эритроцитов. Однако отсутствие красной окраски не всегда исклю¬
чает наличие гемолиза, поскольку гемоглобин видим невооруженным
глазом при уровне примерно 0,3 г/л и выше. Кровь состоит из клеток
и плазмы. Многие компоненты, которые определяют при проведении
лабораторных анализов, содержаться в более высокой концентрации
в клетках крови. В связи с этим гемолиз может оказывать существен¬
ное влияние на многие лабораторные показатели (рис. 1-12). Влияние
гемолиза на результаты лабораторных тестов может быть обусловлено
следующими механизмами:
• высвобождением повышенных концентраций внутриклеточных
компонентов в плазму/сыворотку;
• оптической интерференцией, вызванной цветом гемоглобина
(может менять окраску в процессе хранения);
96
Глава }. Основы лабораторного обследования пациентов
• влиянием внутриклеточных компонентов на механизм реакции
проводимого исследования (химическая, биологическая, имму¬
нологическая интерференция; например, высвобождающаяся из
клеток крови аденилаткиназа оказывает влияние на стандартные
методы определения КК).
ЛПВП-ХС — холестерин линонро геинов высокой плотности.
Концентрация гемоглобина, г/л
Рис, 1-12. Влияние гемолиза на уровень и активность различных лаборатор¬
ных показателей в зависимости от концентрации гемоглобина в сыворотке
Для получения достоверных результатов лабораторных исследова¬
ний следует предотвратить возникновение гемолиза. Однако гемолиз
может происходить не только в пробирке (in vitro) при нарушении
процедуры взятия крови, но и в организме пациента {in vivo) вследс¬
твие заболевания. Гемолиз in vivo и in vitro может быть установлен
путем сравнения различных проб одного и того же пациента или
определения чувствительных лабораторных маркеров гемолиза in vivo
(например, гаптоглобина) и анализа клинической информации. При
подозрении на гемолиз ш vivo необходимо проконсультироваться с
1.2. Роль медицинской сестры в обеспечении качественного... 97
лечащим врачом. Гемолиз in vitro можно предотвратить путем стан¬
дартизации и правильного выполнения процедур преаналитического
>гапа (стандартные иглы и фирменные приспособления для взятия
крови, соблюдение техники взятия и времени доставки проб крови,
использование плазмы вместо сыворотки). Источником интерферен¬
ции также может быть лизис тромбоцитов и гранулопитов.
При установлении гемолиза пробы не должны подвергаться иссле¬
дованию, о чем необходимо сообщить лечащему врачу для решения
вопроса о повторном взятии крови. Если новая проба крови не может
(ц.пь получена, врач должен быть проинформирован относительно
возможной степени искажения результатов анализа.
Наиболее существенными причинами нарушения качества проб
крови и другого биоматериала являются:
» метаболизм клеток крови;
■ испарение/сублимация;
* химические реакции;
* обсеменение микроорганизмами;
' осмотические процессы;
' воздействие света;
* диффузия газов.
Мутность проб крови также нередко встречается в клинической
практике. Мутность плазмы и сыворотки в той или иной степени
Сбывает обусловлена, в основном, повышенным содержанием хило-
микронов, липопротеинов очень низкой плотности (ЛПОПП) или тех
II других в крови пациента. Поскольку степень гиперлипидемии может
оказать существенное влияние на результаты опреде.тения липидов и
других лабораторных показателей через механизмы интерференции,
14) мутность необходимо рассматривать как искажающий фактор, вли¬
яние которого следует, насколько это возможно, избегать. Причинами
неправильных результатов анализов мутных проб могут быть:
' негомогенность плазмы и сыворотки (высокая концентрация
липидов в верхнем слое, которая в результате вытеснения воды
может привести к мнимо низкой концентрации электролитов и
метаболитов);
* вытеснение воды липидами до 10% объема (причина более высо¬
кой концентрации натрия и калия при определении на ионосе-
лсктивных анализаторах);
* интерференция за счет мутности (ведет к поглощению света на
всех длинах волн при фотометрировании);
98 Глава 1. Основы лабораторного обследования пациентов
• физико-химическая интерференция (повышенный уровень
липопротеинов снижает доступность для антител, используемых
в различных методах исследования, искажает результаты элект¬
рофоретических и хроматографических методов).
При выраженной мутности ее можно установить невоору¬
женным глазом. При неявно выраженной мутности ее выявляют
путем фотомегрирования при длине волны 660-670 нм. Степень
интерференции по отношению к каждому методу исследования
можно оценить, количественно добавляя материал пробы паци¬
ента с мутностью к прозрачной пробе с последующим определе¬
нием концентрации в каждой пробе отдельно. Если мутная проба
оказывает влияние на результат анализа, се можно устранить с
помощью ультрацентрифугирования. В каждом случае сведения о
степени мутности проб должны быть отражены в бланке резуль¬
тата анализа.
Для нивелирования этих последствий необходимо придерживать¬
ся следующих полезных рекомендаций:
• быстрая доставка проб в лабораторию улучшает достоверность
результатов лабораторных исследований;
■ пробы сохраняются лучше при более низкой температуре хра¬
нения (за некоторым исключением, например цельную кровь не
следует хранить в холодильнике);
• пробы крови всегда должны храниться в закрытом виде даже в
холодильнике (испарение);
■ использование одноразовых фирменных приспособлений сущес¬
твенно снижает воздействие неблагоприятных факторов на качес¬
тво проб;
• разделительные гели позволяют оставлять сыворотку в первич¬
ных пробирках;
• избегать встряхивания проб при транспортировке, так как это
повышает риск гемолиза;
• хранить пробирки е кровью в вертикальном положении (процесс
свертывания ускоряется);
• избегать хранения пробы с цельной кровью;
• гликолиз оказывает влияние на стабильность в пробах глюкозы, лак¬
тата, pH, поэтому необходимо использовать ингибиторы гликолиза;
' избегать воздействия света на пробы (снижается уровень билиру¬
бина, витамина С, порфиринов, КК и фолиевой кислоты);
• использование плазмы для биохимических исследований
/.2. Роль медицинской сестры в обеспечении качественного...
99
имеет ряд преимуществ перед сывороткой: больший выход
материала для исследования, реже возникают гемолиз и тром-
боцитолиз, результаты исследований более точно отражают
состояние in vivo\ однако плазму нельзя подвергать электро¬
форезу, антикоагулянты могут ингибировать активность ряда
ферментов;
* для исследования апоА-1, апоВ определения электрофореза
липопротеинов, сыворотка не должна замораживаться;
• после проведения исследований необходимо хранить пробы в
таких условиях, чтобы в случае необходимости можно было под¬
твердить результаты, проверить идентичность проб или провести
дополнительные тесты.
превышение времени наложения жтуга при взятии проб крови —
1-1 не одна типичная ошибка. Об этом свидетельствуют данные, приведен¬
ные втабл. 1-5 и на рис. 1-13.
Таблица 1-5.
Влияние длительности наложения жгута при венепункции
на результаты анализов
Показатель
время наложения жгута, мин
0
2
4
6
^ Кильций общий,
г ммоль/л
2,38
2,45
2,52
2,58
ІіСЛОК общий, г/л
72
74
77
80
; Альбумин, ]/л
39
40
42
43
S Гемоілобин, і/л
147
148
151
155
Частой ошибкой этого типа является несоблюдение правиль¬
ною соотношения кровь/антикоагулянт в результате неполного
заполнения кровью пробирки с антикоагулянтом. Она становится
критической при определении показателей, используемых для
оценки свертывающей системы крови (например, протромбиновое
ирсмя, АЧТВ). При взятии проб для общего анализа крови увели¬
чение концентрации ЭДТА, обусловленное частичным заполне¬
нием пробирки, приводит к ложным результатам количественных
(заниженные количество эритроцитов, лейкоцитов, гематокрит) и
морфологических (вследствие изменения окраски) характеристик
клеток крови.
100
Глава 1. Основы лабораторного обследования пациентов
г/л
МЕ/Л
Время, мин
Рис. 1-13. Изменение концентрации общего белка и активности ЛДГ в сыво¬
ротке при наложении жгута в течение 15 мин
Нередко грубейшей ошибкой является недостаточно тщатель¬
ное перемешивание проб крови с антикоагулянтом. Последствия
данного нарушения всегда необратимы. Пробы вследствие образо¬
вания сгустка не подлежат исследованию. Однако, помимо невоз¬
можности исследования пробы, в пробирке могут образовываться
микросгустки, которые не видны невооруженным глазом и при
попытке выполнения анализа могут стать причиной выхода из
строя автоанализатора.
Типичные ошибки третьего типа наиболее часто включают превы¬
шение установленного времени доставки проб крови в лабораторию.
1.2. Роль медицинской сестры в обеспечении качественного... 101
Основные временные критерии правильного выполнения этой про¬
цедуры будут рассмотрены ниже.
1.2.4, СБОР ДРУГИХ ВИДОВ БИОМАТЕРИАЛА
ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Медицинским сестрам, помимо взятия проб крови, приходится
учасгвовать в сборе многих других видов биоматериала на лаборатор¬
ные исследования. Многообразие видов биоматериала и особенностей
его сбора требуют от медицинской сестры профессиональных знаний
в этой области, необходимых для того чтобы в простой и ясной форме
объяснить их пациенту. Для получения качественных результатов
исследования должно быть стандартизировано не только взятие крови,
но и сбор других видов биоматериала, изложенных в виде утвержден¬
ных главным врачом ЛПУ инструкций, В табл. 1-6 приведен пример
краткой инструкции по сбору различных видов биоматериала.
1,2.4.1. Пробы мочи
Лабораторное исследование мочи — один из наиболее распростра¬
ненных видов анализа. Несмотря на кажущуюся простоту сбора проб
мочи, эта процедура требует особого внимания со стороны медицин¬
ской сестры.
Сбор и консервирование мочи должны быть строго стандартизова-
IIы в виде утвержденной инструкции, в которой излагаются порядок
и последовательность процедуры. Для сбора мочи используют плас¬
тиковые контейнеры с завинчивающимися крышками и нанесенной
градуировкой, стерильные или нестерильные, вместимостью 200 мл,
2,5 и 4 л, из прозрачного и непрозрачного пластика или стекла.
В клинической практике проводят химическое, микроскопическое
и бактериологическое исследование мочи. Наиболее часто использу¬
ют 5 способов сбора мочи:
• сбор мочи в середине мочеиспускания (разовая моча);
• сбор утренней порции мочи;
• сбор проб мочи за определенный промежуток времени;
• сбор суточной мочи, т.е. объединение всех порций мочи за 24 ч;
' взятие проб мочи при помощи катетера.
Характер назначенного пациенту анализа определяет, какой из
этих способов необходимо использовать.
102 Глава I. Основы лабораторного обследования пациентов
Сбор мочи в середине мочеиспускания — это сбор небольшой
порции мочи (10--15 мл) в любое время суток (случайные пробы).
Его сущность состоит в том, что первую часть мочи при мочеис¬
пускании пациент выливает в унитаз, среднюю порцию собирает
в чистый пластиковый контейнер, а оставшуюся мочу выпускает в
унитаз. В большинстве случаев сбор мочи в середине мочеиспус¬
кания используют для общего анализа мочи, выполнения пробы
Нечипоренко, бактериологического исследования в диагностике
неотложных состояний.
Для исследования осадка мочи особенно важно использовать
свежевыпущенную мочу без консерванта, так как эритроциты и
лейкоциты подвержены быстрому разрушению при хранении при
комнатной температуре и низком осмотическом давлении (удель¬
ный вес менее 1,015). Концентрация билирубина и уробилиногена
снижается под действием света, наличие бактерий в моче снижа¬
ет концентрацию игюкозьт и ацетона, могут меняться мутность и
цвет мочи. Поэтому свежевыпушенная моча для общеклинического
исследования должна быть доставлена в лабораторию в течение 1 ч с
момента ее сбора.
При плановом обследовании больных для получения сравнимых
результатов исследований лучше собирать первую утреннюю порцию
мочи. Она обычно самая концентрированная и расценивается как
лучшая проба для анализа. Для большинства исследований мочи
используют утреннюю порцию (например, общий анализ мочи, бак¬
териологический посев мочи), в ней с большей вероятностью можно
обнаружить вещества, присутствующие в крови в минимальных
количествах. Так, утренняя порция мочи используется для прове¬
дения теста на беременность. Этот тест основан на определении
хорионического гонадотропина человека (ХГЧ) — гормона, который
обычно не присутствует в моче, но появляется в первые несколь¬
ко месяцев беременности в нарастающем количестве. На ранних
сроках беременности концентрация этого гормона столь мала, что
если использовать не утреннюю порцию мочи (концентрированную
мочу), то можно получить ложноотрицательный результат.
Мочу собирают в чистые стеклянные или пластиковые емкости.
Сбор мочи у детей требует особого внимания из-за возможности
загрязнения мочи калом.
1.2. Роль медицинской сестры в обеспечении качественного.
103
1^1
г I
я
X
X
я
а
0
1
о
0
X
2
1
а.
0
в;
«
а
я
4
я
а
а
<и
1
X
ю
ю
и
о
с
к
X
а
X
Ё;
ё
а
5
X ее
=!
л «
о я
ю 5
^ I а
я * £
- “ I
я а я
? II
о I ^
« I
о I
3 I
од о,
од >>
£ 2
я ^
я о.
>. “
С
ё 2
И
Я о
^ О
о. 1Я
^ I
X 2
2! =>
2 о 5
2 ^ -
>1
н л
X н
од о
X £
а
X
X ..
р. О)
X о
2 ю
X сс
Ч О
3 о
со и
вц
« 2
“ I
ье: £
а ^
5 Р
с
н 2
с я
2 р
2 я
ч ю
3 о
са и
2
я
р
о
н
. р
од о
ж ю
4> я
■
ч
I
I §
||
)0
2
Р я
од ш
н 2
я од
Ч 2
од И
« Ж
Ь
2
и од
3
^ 2
Р я
од и
я Я
;Я X
Р X
X §
§ 5?
:Я
О
X
Э
3
р
я
5Я
2
4
н
од
о
5
ё §
од о
ж о
в я а ^
я я ^ ф 5
^ я
2 ^
о
о
1 ^
Р ц
н =
я к
2 §
я
ч
я
я
«
я
3
ю
о
, ® ^
4 8 I
I |£
Л Р
О)
Продолжение таблицы 1-6.
Название теста
Материал
для иссле¬
дования
Мини¬
маль¬
ный
объем,
мл
Приспособле¬
ния для взятия
(сбора) мате¬
риала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Исследова-ние
мочи
на микроальбу¬
минурию
Суточная
моча
5Ü
Контейнер из
темного плас¬
тика вмести¬
мостью 4 л
Выдают памятку пациенту.
Утром пациент первую порцию
мочи выливает в унитаз. Затем
в течение суток мочится в плас¬
тиковый контейнер, включая
порцию мочи утром следую¬
щего дня. в течение всего вре¬
мени сбора мочи она должна
храниться Б холодильнике
(предупредите об этом паци¬
ента). После сбора всей мочи
ее тщательно перемешивают,
в пластиковый контейнер
вместимостью 200 мл отливают
не менее 50 мл мочи, этот кон¬
тейнер маркируют с указанием
суточного диуреза и доставля¬
ют в лабораторию
То же
6 ч
ПроОо.іжение таб.шцы 1-6.
Название теста
Материал
для иссле¬
дования
Мини¬
маль¬
ный
объем,
мл
Приспособле¬
ния для взятия
(сбора) мате¬
риала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Определение
катехолами¬
нов в моче
(адреналин,
норадреналин,
метанефрины,
норметанефри-
ны, ванилил-
миндальная
кислота)
Суточная
моча
Обшеклини-
ческос исследо¬
вание мокроты
Мокрота
50
Вся
соб¬
ранная
мокро¬
та
Контейнер из
темного плас¬
тика вмести¬
мостью 4 л с
30 мл 6 Н. НС1
(получают в
лаборатории)
Выдают памятку пациетыу.
Утром пациент первую пор¬
цию мочи выливает в унитаз.
Затем в течение суток мочит¬
ся в пластиковый контейнер,
включая порцию мочи утром
следующего дня. После сбора
мочи ее тщательно переме¬
шивают, отливают не менее
50 мл мочи, маркируют,
указывая суточный диурез и
доставляют в лабораторию
Поне¬
дельник,
среда
72 ч
Пластиковый
контейнер с
завинчиваю¬
щейся крыш¬
кой вмести¬
мостью 70 мл
Выдают памятку пациенту.
Собирают мокроту, выделяю¬
щуюся при кашле. Емкость с
мокротой маркируют и достав¬
ляют в лабораторию, если
такой возможности нет, мокро¬
ту хранят в холодильнике.
Еже¬
дневно
6 ч
Продолжение таблицы 1-6.
Название теста
Материал
для иссле¬
дования
Мини¬
маль¬
ный
объем,
мл
Приснособле-
ния для взятия
(сбора) мате¬
риала
Особенности взятия (сбора) н
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Общеклини¬
ческое исследо¬
вание жидкости
из плевральной,
перикардиаль¬
ной, перитоне¬
альной полос¬
тей
Жидкость
10
Стерильный
пластиковый
контейнер с
завинчиваю¬
щейся крыш¬
кой вмести¬
мостью 70 мл
Жидкость берет врач при
проведении операции.
Взятый шприцем матерал
переносят в стерильный
пластиковый контейнер, мар¬
кируют и немедленно достав¬
ляют в лабораторию
То же
6 ч
Общеклини¬
ческое иссле¬
дование спин¬
номозговой
жидкости
Ликвор
Стерильная
пластиковая
пробирка с
пробкой вмес¬
тимостью 10 мл
Ликвор берет врач при про¬
ведении спинномозговой
пункции. Жидкость берут
в стерильную пластико¬
вую пробирку, маркируют
и немедленно доставляют в
лабораторию
То же
6 ч
Окончание таблицы 1-6.
Название теста
Материал
для иссле¬
дования
Мини¬
маль¬
ный
объем,
мл
Приспособле¬
ния для взятия
(сбора) мате¬
риала
Особенности взятия (сбора) и
транспортировки материала в
лабораторию
Дни,
когда
берется
материал
Время
готов¬
ности
ответа
Общеклини¬
ческое исследо¬
вание кала
Кал
Весь
кал за
одну
дефе¬
кацию
Пластиковый
контейнер
вместимостью
1 л с завин¬
чивающейся
крышкой
Выдают памятку пациенту.
Собирают весь кал за одну
дефекацию. Емкость марки¬
руют и доставляют в лабора¬
торию
Тоже
6 ч
Исследование
кала на яйца
глист и амебиаз
Кал
50 г
Пластиковый
контейнер с
завинчиваю¬
щейся крыш¬
кой и ложечкой
Выдают памятку пациенту.
Пациент после дефекации в
контей1{ер вместимостью 1 л,
берет из разных мест каловых
масс ложечкой кусочки кала
и переносит их в пластико¬
вый контейнер вместимостью
100 мл с завинчивающейся
крышкой. Контейнер марки¬
руют и немедленно доставля¬
ют в лабораторию
То же
6 ч
108 Глава 1. Основы лабораторного обследования пациентов
Сбор проб мочи за определенный промежуток времени используют
в клинической практике не так часто, в основном при проведении
пробы по Зимницкому, он включает исследования глюкозурическо-
го профиля, а также определение уровня ряда гормонов и их мета¬
болитов (например, адреналина и норадреналина в моче для диа¬
гностики феохромоцитомы как причины гипертонического криза у
больного).
Пробы за определенный промежуток времени собирают, начиная с
ноля часов (например, проба Зи.мницкого). Нулевым временем счита¬
ется окончание первого утреннего мочеиспускания.
Иногда необходимо точно знать, сколько определенного вещества
(например, кальция при остеопорозе) теряется ежедневно с мочой.
Количество теряе.мого вещества можно определить только в том слу¬
чае, если собрать суточную мочу.
При сборе мочи за сутки самая главная проблема - неполный
сбор мочи. В стационаре она решается легче, так как пациенты
находятся под наблюдением медицинских сестер. Амбулаторным
больным надо посоветовать держать мочу в недоступном для детей
месте, особенно если в качестве консерванта используется концен¬
трированная кислота. Для сбора суточной мочи предпочтительнее
использовать пластиковую емкость объемом около 4 л (с добавлени¬
ем при необходимости консерванта). Следует напомнить пациенту,
что первую утреннюю порцию не берут (нулевое время), а собирают
все последующие порции точно до того же времени следующего
дня. По окончании сбора суточной мочи контейнер направляют на
анализ.
При сборе суточной мочи, сборе мочи за определенный отрезок
времени для предупреждения роста бактерий проба должна посто¬
янно находиться в холодильнике или к ней необходимо добавить
консервант. Для некоторых исследований добавление консерванта
небезразлично, в таких случаях предпочтительнее охлаждение.
Консервант добавляют в пустую емкость с предупредительной эти¬
кеткой. Предупреждение необходимо, особенно в том случае, если
в качестве консерванта используют концентрированную кислоту.
Чтобы не разлагались вещества, чувствительные к свету, используют
емкости из непрозрачного пластика.
Консервация проб мочи очень важна для сохранения ее исходных
свойств. Неконсервированная моча легко подвергается микробному
загрязнению и неизбежным химическим изменениям.
1.2. Роль медицинской сестры в обеспечении качественного...
109
Изменения, происходящие в моче при ее разложении
(в отсутствие консерванта)
Изменение
Причина
Изменение цвета
Разрушение или изменение хромогенов
и Других компонентов мочи (гемоглобин,
гомогентизиновая кислота)
Изменение запаха
Рост микроорганизмов, разложение мочи
Увеличивающаяся
мутность
Рост микроорганизмов, образование крис¬
таллов, преципитация аморфных веществ
Ложнонизкое pH
Превращение глюкозы под действием бак¬
терий и дрожжевых грибков в кислоту и
спирты
Ложновысокое pH
Разрушение мочевины микроорганизмами с
образованием аммиака
Л ож ноогрицател ьная
реакция на глюкозу
Потребление глюкозы микроорганизмами
Ложноотрицательная
реакция на ацетон
Улетучивание ацетона, разрушение ацето¬
ацетата бактериями
Л ожноотрицател ьная
реакция на билирубин
Разрушение билирубина солнечным светом.
Окисление билирубина до биливердина
Л ож ноотри цател ьная
реакция на уробилиноген
Разрушение уробилиногена светом
Ложиоположительная
реакция иа нитриты
Продуцирование нитритов бактериями или
грибами
Ложноотрицательная
реакция на нитриты
Превращение нитритов в азот, который уле¬
тучился
Повышенная бактериурия
Размножение бактерий при хранении мочи
Распад клеток осадка
Нестабильная окружающая среда, особенно
когда моча щелочная или гипотоническая
(или то и другое)
Для стандартизации определения специфических показателей в моче
необходимо использовать консерванты (табл. 1-7).
ио
Глава 1, Основы лабораторного обследования пациентов
Габлица 1-7.
Исследуемые показатели мочи, виды консервантов и характер сбора мочи
Показатели
Сбор
мочи, ч
Без
консер¬
ванта
Консервант
Охлаж¬
дение
борная
кислота
(10-15 г)
ледяная
уксусная
кислота
(15 мл)
неї
(15
мл)
Альбумин
24
+
Альдостерон
24
+
Амилаза
2
-1-
Барбитураты
Разовая
+
Белок Бенс-
Джонса
24
+
Кальций
24
+
Катехоламины
24
+
Хлориды
24
+
Хорионический
гонадотропин
24
+
Медь
24
+
Порфирины
24
5 г
N3003
Кортизол
24
+
Креатинин
24
+
(Ь-Аминоле-
пулиновая кис¬
лота
24
+
К, Ыа, С1
24
-ь
Эстриол
24
+
Эстрогены
24
+
ФСГ
24
+
Глюкоза
24
+
17-ОНР
24
+
/.2. Роль медицинской сестры в обеспечении качественного,..
111
5-ГихТрокси-
индолуксусная
кислота
24
Гидрокси-
иролин
24
17-КС
24
17-ОКС
24
Осмолярность
24
Фосфор
24
Белок
24
Мочевая кис¬
лота
24
Ванилил-
миндальная
к ислота
24
Примечание. ФСГ
герои ды; 17-ОКС
— фоллинулостимулирующий гормон; 17-КС — 17-кстос-
17-оксикстостероидьт; 17-ОНР—17-гидроксипрогестерон.
Проблемы, связанные с правильным сбором мочи, можно решить,
давая подробные письменные или устные инструкции пациенту (или
родителям маленьких детей) и предупреждая о том, что в случае
нарушения рекомендаций моча будет непригодна для анализа. Ниже
приведены примеры памяток для пациента.
Памятка для пациента
Общий анализ мочи
Общий анализ мочи назначен Вашим врачом. Цель исследования
но результатам анализа объективно оценить Ваше состояние.
Для получения достоверных результатов Вам необходимо подгото¬
вить себя к этому исследованию: воздержаться от физических нагру¬
зок, приема алкоголя, лечь спать накануне в обычное для Вас время.
Вы должны собрать первую утреннюю порцию мочи, Поэтому утром
после подъема Вы должны получить у медицинской сестры отделения
емкость для сбора мочи. Убедитесь, что на емкости для мочи указа¬
ны Ваши данные: фамилия, имя, отчество, отделение, палата. Перед
сбором мочи Вам необходимо провести тщательный туалет наружных
112 Глава I. Основы лабораторного обследования пациентов
половых органов, промыв их под душем с мылом, чтобы в мочу не
попали выделения из них.
После этой подготовки Вы идете в туалет и полностью собираете
всю мочу в емкость. Завинчиваете емкость крышкой и доставляете
мочу на место, указанное медицинской сестрой.
Очень важно, чтобы Вы точно следовали указанным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль¬
таты исследования.
Памятка для пациента
Исследование мочи по Нечипоренко
Исследование мочи по Нечипоренко назначено Вашим врачом.
Цель исследования — по результатам анализа объективно оценить
Ваше состояние.
Для получения достоверных результатов Вам необходимо подгото¬
вить себя к этому исследованию: воздержаться от физических нагру¬
зок, приема алкоголя, лечь спать накануне в обычное для Вас время.
Вы должны собрать первую утреннюю порцию мочи. Поэтому утром
после подъема Вы должны получить у медицинской сестры отделения
емкость для сбора мочи. Убедитесь, что на емкости для мочи указа¬
ны Ваши данные: фамилия, имя, отчество, отделение, палата. Перед
сбором мочи Вам необходимо провести тщательный туалет наружных
половых органов, промыв их под душем с мылом, чтобы в мочу не
попали выделения из них.
После этой подготовки Вы идете в туалет и собираете среднюю
порцию мочи в емкость (100-120 мл). Завинчиваете емкость крышкой
и доставляете мочу 11а место, указанное медицинской сестрой отделе¬
ния.
Очень важно, чтобы Вы точно следовали ука:1анным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль¬
таты исследования.
Памятка для пациента
Исследование мочи по Зимницкому
Исследование мочи по Зи.мницкому назначено Вашим врачом.
Цель исследования - объективно оценить функцию почек.
Для получения достоверных результатов Вам необходимо подгото¬
вить себя к этому исследованию: воздержаться от физических нагру¬
зок, приема алкоголя, лечь спать накануне в обычное для Вас время.
1.2. Роль медицинской сестры в обеспечении качественного... 113
Вы будете собирать мочу в течение всего следующего дня. Поэтому Вы
должны встать утром в 6 ч, получить у медицинской сестры отделения
емкости для сбора мочи (8 емкостей). Убедитесь, что на емкостях ука¬
заны Ваши данные: фамилия, имя, отчество, отделение, палата.
В 6 ч утра Вы идете в туалет и полностью опорожняете мочевой
пузырь в унитаз. Затем через каждые 3 ч собираете всю мочу, которая
накопилась у Вас за это время, в отдельную емкость. Вы должны соб¬
рать мочу в 9, 12, 15, 18, 21, 24, 3 и 6 ч. Каждую емкость завинчиваете
крышкой и доставляете ее на место, указанное медицинской сестрой
отделения. Для сбора мочи в ночные часы напомните дежурной меди¬
цинской сестре, чтобы она не забыла Вас вовремя разбудить.
Очень важно, чтобы Вы точно следовали указанным рекомендаци¬
ям, так как только в этом случае будут получены правильные резуль¬
таты исследования.
Достоверность результатов, полученных при анализе суточной
чючи, во многом зависит от аккуратности сбора образца. Должна
быть собрана вся моча, выделенная больным за 24 ч. Ниже приведена
последовательность действий медицинской сестры для обеспечения
правильного сбора суточной мочи.
■ Получите из лаборатории специальный контейнер для сбора
суточной мочи. Для сбора мочи на ряд лабораторных анализов
требуется контейнер с консервантом. Убедитесь в правильном
выборе консерванта для данного вида анализа (см. табл. 1-7),
Консервант может обладать агрессивными свойствами (напри¬
мер, соляная кислота), поэтому нужно соблюдать меры предосто¬
рожности и предупредить об этом пациента.
* Наклейте на контейнер этикетку с данными пациента и указани¬
ем времени начала сбора мочи.
• Объясните пациенту, что он должен собрать всю мочу, выделен¬
ную им за 24 ч.
* В любое время (обычно это 8 ч утра) пациент должен опорожнить
мочевой пузырь, выпустив мочу в унитаз.
• Вся моча, выделенная пациентом позже этого времени, должна
быть собрана в контейнер.
• В 8 ч утра следующего дня мочевой пузырь в последний раз снова
полностью опорожняют и добавляют эту порцию мочи в контей¬
нер,
* Собранная моча, предназначенная для анализа, должна быть
отправлена в лабораторию как можно скорее.
114 Глава I. Основы лабораторного обследования пациентов
Памятка для пациента
Исследование суточной мочи
Исслсдопание суточной мочи назначено Ваши-м врачом. Цель
исследования — по результатам анализа объективно оценить Ваше
состояние.
Для получения достоверны.х результатов Вам необходимо подгото¬
вить себя к этому исследованию: воздержаться от физических нагру¬
зок, приема алкоголя, лечь спать накануне в обычное для Вас время.
Вы должны собрать всю выделенную мочу за 24 ч. Емкость для сбора
.мочи (на 3 л) Вы должны получить у медицинской сестры заранее.
Если в емкости содержится жидкость, которую добавляют в качестве
консерванта, уточните у медицинской сестры, какая это жидкость и
как с ней обращаться.
Предварительно напишите на этикетке на емкости для мочи Ваши
данные: фамилию, имя, отчество, дату рождения, дату и время сбора
материала; запись должна быть сделана разборчивым почерком.
Утром Вы идете в туалет. Обязательно зафиксируйте время (нуле¬
вое время). Первую утреннюю порцию не собираете (выпускаете в
унитаз), а собираете все последующие порции точно до того же вре¬
мени следующего дня (за сутки в емкость 3 л). Если в емкость добав¬
лен консервант, то предварительно каждую порцию мочи собираете
в отдельную емкость, а затем переливаете ее в 3-литровую емкость.
В перерывах между сбором мочи емкость храните в закрытом виде.
По окончании сбора суточной мочи завинчиваете емкость крышкой и
доставляете мочу медицинской сестре.
Внимание!
• Держите мочу в недосягаемом для детей месте, так как в качест¬
ве консерванта при сборе суточной мочи может использоваться
концентрированная кислота.
• Недопустимо направлять мочу на исследование в емкостях,
не предназначенных для этих целей, так как остатки содержа¬
щихся в таких емкостях ингредиентов могут существенным
образом исказить результаты Ваших анализов.
Взятие проб мочи при помощи катетера (специальная методика сбора
мочи). Под специальной методикой сбора мочи понимают получение
проб с помощью катетеризации мочевого пузыря. Эта процедура
выполняется урологами. В настоящее время катетеризацию .мочевого
1.2. Роль медицинской сестры в обеспечении качественного... 115
пузыря проводят в том случае, если пациент не может мочиться или
неспособен контролировать мочеотделение.
уретральные катетеры вводят через цистоскоп в соответствующий
мочеточник, Первоначальную мочу выпускают из мочевого пузыря,
затем его промывают и лишь после этого берут пробы мочи. Обычно
такая процедура взятия проб мочи используется для проведения диф¬
ференциальной диагностики инфекции мочевого пузыря и инфекции
почек. Пробы мочи могут быть получены из каждого мочеточника
отдельно.
в прошлом была широко распространена практика взятия проб
мочи на бактериологические исследования путем катетеризации
мочевого пузыря. Однако в настоящее время она упразднена, так
как было установлено, что процедура катетеризации сама по себе
связана с риском инфицирования мочевыводяших путей. Нередко
этот способ получения проб мочи используют у пациентов с пос¬
тоянным катетером. Однако следует соблюдать определенные
правила получения проб мочи через постоянный катетер. Любые
бактерии, присутствующие в моче, будут быстро размножаться,
оставаясь в дренажной сумке. Поэтому мочу для анализа не следу¬
ет брать из дренажной сумки — это приведет к неправильной оцен¬
ке содержания бактерий в мочевом пузыре. Мочу следует собирать
из изолированного рукава дренажной трубки с помощью шприца
и иглы, соблюдая правила асептики.
Моча должна быть собрана в стерильный стеклянный или пласти¬
ковый контейнер. Для анализа достаточно 5—10 мл мочи.
При проведении пункции мочевого пузыря прокол делают иглой
со шприцем в надлобковой области. Игла должна входить в наполнен¬
ный мочевой пузырь, после чего мочу аспирируют шприцем. Обычно
этот метод используется при подозрении на анаэробную инфекцию.
1.2.4.2. Получение спинномозговой жидкости (ликвора)
Для получения спинномозговой жидкости производится люмбаль¬
ная пункция. Прежде чем начать собирать жидкость для лабораторных
исследований, измеряют ее давление. Оно должно быть в пределах
90—180 мм вод.ст. Задержка дыхания, давление на живот, пороки серд¬
ца, воспаление оболочек мозга, закупорка внутричерепных венозных
синусов, повреждение мозга, его отек могут вызывать повышение
внутричерепного давления свыше 180 мм вод.ст. Сначала берут 1—2 мл
спинномозговой жидкости. Заметное снижение давления в этом слу¬
116 Глава 1. Основы лабораторного обследования пациентов
чае говорит о наличии мозжечковых грыж или компрессии спинного
мозга. В таких случаях сбор жидкости прекращают.
Больные с частичным или полным блоком спинномозгового кана¬
ла могут иметь низкое ликворное давление (менее *80 мм вод.ст.),
которое может упасть до нуля при взятии только 1 мл спинномозговой
жидкости, в этом случае ее сбор также прекращают.
Если давление нормальное или заметно не меняется при взятии
1-2 мл жидкости, то ее можно брать еще. Обычно жидкость соби¬
рают в 3 отдельные стерильные пластиковые пробирки с пробками;
для клинического анализа, для биохимических и серологических
исследований, для бактериологического анализа. Для клинического
и биохимического анализа собирают первые 1-2 мл спинномозговой
жидкости. Для бактериологического посева используют следующую
порцию жидкости в количестве 2-5 мл. При подозрении на туберку¬
лезную или грибковую этиологию менингита следует брать не менее
10 мл спинномозговой жидкости, пробирки снабжают этикетками
с данными о больном (фамилия, имя, отчество, отделение, номер
истории болезни, время взятия). Обычно после взятия 10-20 мл
спинномозговой жидкости давление составляет 40—90 мм вод.ст.
Полученные пробы немедленно доставляют в лабораторию. Это осо¬
бенно важно для бактериологического посева, так как один из веду¬
щих возбудителей менингита — N. meningitidis — чрезвычайно чувс¬
твителен к охлаждению.
1.2.4.3. Получение синовиальной жидкости
Синовиальная жидкость образуется путем диализа плазмы
через синовиальную мембрану и секреции гиалуронат-протеино-
вого комплекса. Эту жидкость берут для исследования осторожно,
с соблюдением всех правил асептики. Синовиальную жидкость
не берут при наличии у пациента бактериемии или инфекции в
окружающих сустав мягких тканях. Перед взятием синовиальной
жидкости (артроцентез) пациент должен голодать в течение 6 ч.
Жидкость берут шприцем, содержащим 25 ЕД гепарина на каждый
миллилитр синовиальной жидкости. Обычно удается получить не
более 2 мл. Полученную жидкость переносят в стерильные пласти¬
ковые пробирки с пробками, маркируют и немедленно направляют
на клиническое, бактериологическое, биохимическое и серологи¬
ческое исследования.
/.2. Роль медицинской сестры в обеспечении качественного.., 117
1.2.4.4. Получение плевральной, перикардиальной и перитонеальной
жидкости
Для получения плевральной жидкости выполняют хирургическую
операцию — торакоиентез. Такого же типа операцию производят при
накоплении жидкости в перикарде или брюшной полости. Полученные
с помощью шприца в условиях асептики пробы переносят в сгериль-
ные пластиковые пробирки с пробками (или емкости, если жидкости
много), маркируют и направляют на общеклиническое, биохимичес¬
кое, цитологическое и бактериологическое исследования.
1.2.4.5. Получение материала из уретры
Правильное получение материала из уретры является первым и
самым ответственным этапом при диагностике характера инфекци¬
онного процесса мочеполовой системы. Для установления этиологи¬
ческого агента инфекционного процесса у мужчин материал берут из
уретры, у женщин — из цервикального канала. При это.м необходимо
соблюдать следующие правила:
• пациент не должен мочиться в течение 1 ч до забора материала;
• ввести стерильный маленький капроновый тампон в уретру на
2—4 см, повернуть тампон на 360° и вынуть его;
• сразу же после забора материала поместить тампон на предмет¬
ное стекло и, вращая тампон по кругу, равномерно распределить
материал по поверхности предметного стекла;
• высушить мазок на воздухе и доставить в лабораторию.
• Методика получения материала из цервикального канала с
использование.м цитощеточки;
• удалить ватой или тампоном слизь из устья цервикального канала;
• ввести стерильную шеточку в цервикальный канал и повернуть ее
на 360°, вынуть, не касаясь поверхности влагалища;
• поместить щеточку на предметное стекло и, вращая тампон вдоль
предметного стекла, равномерно распределить материал по его
поверхности;
• высушить мазок на воздухе и доставить в лабораторию.
Методика получения материала с конъюнктивы:
• нанести местный анестетик на поверхность роговицы одного или
обоих глаз;
• используя стерильный малый тампон, осторожно протереть им
внутреннюю поверхность нижнего, а затем верхнего век, при
118 Глава 1, Основы лабораторного обследования пациентов
заборе материала с обоих глаз вначале протирают менее пора¬
женный глаз;
• сразу же после забора материала поместить тампон на предметное
стекло и, вращая тампон вдоль, равномерно распределить матери¬
ал по его поверхности;
• высушить мазок на воздухе и доставить в лабораторию.
1.2.4.6. Сбор мокроты
Этот биологический материал используют для общеклинического
исследования мокроты и наиболее часто для бактериологического
анализа.
Для сбора мокроты испол.ьзуют широкогорлые стерильные плас¬
тиковые контейнеры вместимостью 70 мл с завинчивающейся крыш¬
кой. Мокроту лучше собирать утром до приема нищи. Чтобы предо¬
твратить примешивание к мокроте содержимого полости рта, пациент
перед выделением мокроты, должен тщательно почистить зубы и про¬
полоскать рот и глотку кипяченой водой. Полоскание ротовой полос¬
ти перед сбором мокроты уменьшает риск загрязнения пробы слюной.
Пациента нужно предупредить о том, что собирать следует только
мокроту, отделяющуюся при кашле, а не при отхаркивании. Емкость с
мокротой маркируют и как можно скорее доставляют в лабораторию.
Если получить мокроту не представляется возможным, то исследуют
содержимое бронхиального или бронхоальвеолярного смыва.
1.2.4.7. Получение бронхоальвеолярного смыва
Бронхиальный смыв получают следующим образом. Конец
фибробронхоскопа вводят в устье сегментарного бронха, окклюзиру-
ют его, через биопсийный канал проводят полиэтиленовый катетер
на 1,5—2 см дистальнеє его и через э гот катетер в просвет бронха вводят
50 мл изотонического раствора натрия хлорида, который затем полно¬
стью аспирируют. Для получения бронхоальвеолярного смыва катетер
продвигают на 6—7 см в ілубь сегментарного бронха и дробно вводят
4 порции по 50 мл изотонического раствора натрия хлорида, каждую
порцию которого поочередно полностью аспирируют. Эти смешанные
между собой порции носят название бронхоальвеолярного смыва.
Полученный материал аспирируют в стерильные пластиковые кон¬
тейнеры, которые маркируют и направляют на клиническое, цитологи¬
ческое, бактериологическое или иммунологическое исследования.
1.2. Роль медицинской сестры в обеспечении качественного... 119
1.2.4.8. Сбор кала
Результаты копрологического исследования зависят от правильной
подготовки пациента и правильного сбора, хранения и доставки мате¬
риала на исследования. Перед исследованием больному отменяют
медикаменты, примеси которых мешают микроскопическому иссле¬
дованию и влияют на внещний вид каловых масс, а также усиливают
перистальтику кишечника. К таким препаратам относятся все слаби¬
тельные, ваго- и симпатикотропиые средства, каолин, бария су.тьфат,
препараты висмута, железа и средства, вводим ьте в ректальных свечах,
приготовленных на жировой основе. Если у женщины в назначенное
для сбора кала время имеется менструация, то получение биоматери¬
ала лучше отложить.
Собирают кал за одну дефекацию в чистую сухую пластиковую
банку с завинчивающейся крышкой. Недопустимо направлять кал
на исследование в спичечных или картонных коробках, так как при
это.м меняются свойства и консистенция кала. Кал не должен содер¬
жать посторонних примесей (моча, отделяемое мочеполовых органов).
Нельзя собирать фекалии после клизм. Если необходимо знать точное
количество испражнений, то пустую емкость перед сбором и после
сбора материала взвешивают. Емкость с собранным материалом мар¬
кируют и немедленно направляют в лабораторию.
Если целью исследования является диагностика скрытых крово¬
течений желудочно-кишечного тракта, то в предшествующие анализу
3 дня пациенту запрещают употреблять продукты, в состав которых
входят мясо, рыба и зеленые овощи; он не должен чистить зубы. Для
исследования собирают не весь кал, достаточно 10—15 г, которые берут
в специальные пластиковые пробирки с ложечкой.
Для паразитологических исследований кала специальной подго-
говки не требуется. Собирают ложечкой в специальные пластиковые
пробирки 10—15 г теплого кала, взятого из разных мест, и немедленно
доставляют в лабораторию.
Только добившись строгого и точного выполнения инструкций по
взятию и сбору материала на исследования, можно повысить качество
результатов лабораторных исследований. Любое отступление от инс¬
трукции является нарушением процедуры проведения исследований
и приводит к ошибочным результатам. Главные медицинские сестры
ЛПУ должны постоянно анализировать и выявлять причины нару¬
шений инструкции по взятию и сбору материала на исследования и
разрабатывать меры по их устранению.
(20 Глава /. Основы лабораторного обследования пациентов
В США такие инструкции являются законом, и их нарушения,
приведшие к на несению ущерба пациенту (в том числе морального),
преследуются в судебном порядке.
1.2.5. ВЗЯТИЕ И СБОР БИОМАТЕРИАЛА
НА БАКТЕРИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Правильное взятие и сбор биоматериала на бакп сриологические исследо¬
вания имеет важное значение. Это обусловлено тем, что получение результа¬
тов бакг'сриологического исследования подвержено шшянию .многих факто¬
ров преаналитического этапа. Важнейшими из них являются:
* место взятия биоматериала;
• правильность способа и времени взятия биоматериала;
• используемые системы для транспортировки проб биоматериала;
* продолжительность транспортировки проб биоматериала.
При взятии проб для бактериологических исследований медицин¬
ские сестры должны уделять особое внимание предотвращению кон¬
таминации (попаданию в образец биоматериала бактерий с кожных
покровов и слизистых оболочек). Для этого необходимо выполнять
следующие основные правила.
1. Перед взятием пробы из подкожных очагов кожу следует тщатель¬
но продезинфицировать. Если возможно, образцы гнойного материала
лучше забирать путем аспирации через кожу, так как ее дезинфицировать
легче, че.м слизистые оболочки. Аспираты доставляют в лабораторию в
шприце, предварительно удалив иглу и прочно закупорив канюлю.
2. При взятии образца с открытой раны следует предварительно
механически удалить с помощью стерильного тампона поверхност¬
ный секрет, который содержит вторичные микроорганизмы. Затем с
краев раны собирают материал для исследования.
3. Тампон с образцом следует предохранять от высыхания во время
транспортировки. Для этого тампон помещают в емкость с жидким
бульоном или транспортной средой.
4. При небольшом количестве микроорганизмов объем пробы дол¬
жен быть максимально возможным.
5. При назначении исследования на гемокультуру пробы крови
лучше брать в период повышения температуры тела у больного.
При подозрении на септический эндокардит следует брать не менсс
10 проб крови для гемокультивирования.
L2. Роль медицинской сестры в обеспечении качественного... 121
6. При взятии проб биоматериала на бактериологические иссле¬
дования важное значение имеет правильный выбор контейнера для
сбора и транспортировки образца в лабораторию. Основные требова¬
ния к контейнерам для транспортировки проб для бактериологичес¬
ких исследований:
• стерильность;
• устойчивость к коррозии;
• достаточные размеры;
• прочность закупоривания;
• небьющийся контейнер;
• наличие транспортной или питательной среды для определенных
микроорганизмов.
7. Быстрая транспортировка проб в лабораторию и соблюдение при
лом температурного режима. Эти требования обусловлены целым
рядом особенностей самих микроорганизмов:
• охлаждение и снижение pH биологического материала, а также
воздействие кислорода снижают выживаемость таких бактерий,
как менингококки, гонококки, пневмококки, холерный вибрион,
анаэробные микроорганизмы, гемофильная палочка, сальмонел¬
лы, Helicobacter pylori;
• слишком длительная транспортировка приводит к тому, что жиз¬
неспособность исходных, чувствительных к воздействию окружа¬
ющей среды микроорганизмов в пробе снижается, но при этом в
биоматериале начинают размножаться другие бактерии.
8. Оптимальным для бактериологических исследований является
доставка проб любого биологического материла в течение 1,5 ч после
взятия образца. Если соблюдение этого требования не может быть
обеспечено, рекомендуется использовать различные приспособления
со специальной транспортной средой. Основные требования к транс¬
портировке и хранению проб дли бактериолог ических исследований
приведены втабл. 1-8.
9. Медицинская сестра должна знать, что даже наиболее совершен¬
ная транспортная система (среда) не может заменить быструю достав¬
ку проб биологического материала в лабораторию для получения
достоверных результатов исследования.
10. При назначении исследований по выявлению вирусов в биологи¬
ческом материале (кровь, отделяемое органов) серологическими мето¬
дами решающее значение имеет время взятия проб. Обычно материал
собирают немедленно после выявления симптомов заболевания (если
122
Глава 1. Основы лабораторного обследования пациентов
возможно, в первые 3 дня). Обшим правилом должна быть доставка взято¬
го биоматериала в лабораторию как можно быстрее при температуре 4 °С
в отдельном контейнере, в этих условиях вирусы остаются стабильными
в течение 2-3 дней. Для анализа используются кровь, образцы на тампо¬
нах (глаза, нос, горло, уретра), смывы из носоглотки, везикулярная жид¬
кость при кожных поражениях, кал, моча и спинномозговая жидкость.
Более детальное описание методик сбора биоматериала на бактери¬
ологические анализы приведено в приложении 1 данного руководства.
Таблица 1-1
Условия транспортировки и хранения различных проб биоматериала
для бактериологических исследований
Биоматериал
Условия взятия
и транспортировки
Температура хранения
Кровь
2 флакона(для аэробов
и анаэробов) для гемо¬
культуры
Комнатная температу¬
ра или 37 °С
Гнойный материал
Спинномозговая жид¬
кость
Плевральная, перикар¬
диальная, перитоне¬
альная, синовиальная
жидкость
Быстрая транспорти¬
ровка: оставить обра¬
зец п шприце (закупо¬
ренном) в анаэробных
условиях
Отсроченная транспор¬
тировка: использовать
транспортную среду
Комнатная температу¬
ра, НС инкубировать,
защищать от охлажде¬
ния
Бронхоальвеол ярн ы й
лаваж. Мокрота, дру¬
гие секреты. Кал
Быстрая транспорти¬
ровка (1,5-3 ч)
Охлаждать
Моча
Быстрая транспорти¬
ровка в стерильном
контейнере
Комнатная температу¬
ра или 37 °С
Тампон с образцом из:
глаз, ушей, рта,
гортани, носа, уретры,
шейки матки, прямой
кишки, раневой
поверхности
Тампон в транспортной
среде (время транспор¬
тировки более 4 ч)
Комнатная температу¬
ра, не инкубировать
1.2. Роль медицинской сестры в обеспечении качественного... 123
1.2.6. ОРГАНИЗАЦИЯ ДОСТАВКИ ПРОБ КРОВИ И СОБРАННОГО
БИОЛОГИЧЕСКОГО МАТЕРИАЛА В ЛАБОРАТОРИЮ
Важнейшим моментом в обеспечении качества клинических лабо¬
раторных исследований является транспортировка проб биологи¬
ческого материала в лабораторию. Для того, чтобы быть уверенным
в качестве результатов анализов, этот этап необходимо строго стан¬
дартизовать, т.е. разработать нормы, относящиеся к сбору материала:
манипуляции, сохранению и транспортировке проб, взятых вне стен
лаборатории. Разработанные правила являются общими, они должны
учитываться и выполняться всеми.
При доставке материала в лабораторию всегда необходимо помнить
об особенностях некоторых проб. Например, если взята артериальная
кровь для исследования газов крови, то емкость с кровью должна быть
хорошо закупорена, погружена в ледяную воду и как можно скорее
доставлена в лабораторию, так как гликолиз в эритроцитах и лейкоци¬
тах вызывает снижение pH крови, если проба крови будет находиться
около 20 мин при комнатной температуре. Эти требования необходимо
соблюдать и при исследовании капиллярной крови, которую забирают
в гепаринизированные капилляры. Кровь, взятая для исследования на
АКТГ, ангиотензин I, II, ренин, должна быть сразу после взятия поме¬
шена в лед и как можно быстрее доставлена в лабораторию.
Общим правилом дозгжна быть доставка материала в лабораторию
как можно быстрее. Например, чем раньше сыворотка отделена от
эритроцитов, тем меньше влияние гликолиза (значит, будет меньшим
влияние на содержание глюкозы, фосфора и некоторых ферментов).
Уровень билирубина, например, снижается под воздействием света
(особенно яркого солнечного). Действие света повышает активность
щелочной фосфатазы. Фактор времени является важным и в бак¬
териологии (ряд бактерий гибнет при комнатной температуре). Все
особенности взятия и транспортировки проб необходимо изложить в
инструкции по взятию, сбору и доставке биоматериала в лабораторию
и утвердить у руководителя учреждения.
Если лечебные отделения ЛПУ, где осуществляются взятие и
сбор биологического материала, находятся рядом с лабораторией, то
скорость доставки должна укладываться во временные интервалы,
представленные ниже. Пробирки с кровью помещают в специальные
контейнеры с надписью «Пробы для диагностических исследований»
и хранят вертикально в штативе, избегая встряхивания.
124
Глава 1. Основы лабораторного обследования пациентов
Сроки доставки проб в лабораторию
Исследуемые параметры
Максимально допустимое время
с момента взятия материала, мин
Общий анализ мочи
90
Паразитология:
кал на амебиаз
Немедленно
Общий анализ крови
60
Биохимия:
глюкоза
20
ферменты
30
к, Ка, С1, НСОЗ
30
Коагулограмма
45
Микробиология:
рутинная бактериологическая куль¬
тура
90
тампоны (мазок) со средой
90
тампоны (мазок) без среды
20
жидкие образцы (кровь, моча и т.д.)
40
Нормативы времени доставки должны быть в каждом отделении
ЛПУ. Если эти сроки нарушаются, то пробу берут заново. Проба,
которая поступает в лабораторию слишком поздно, взята напрасно, ее не
будут исследовать!
Время доставки биоматериала в лабораторию должно быть четко
определено и постоянно контролироваться. Длительность сохранения
проб до и после отделения клеток крови для наиболее распространен¬
ных биохимических анализов представлена в табл. 1-9-
Обычно пробы для биохимических исследований могут храниться
при комнатной температуре (22—25 °С) не более 2 ч. Пробирки с кро¬
вью для получения сыворотки с наполнителем (веществом, ускоряю¬
щим образование и ретракцию сгустка) или плазмы с антикоагулян¬
том помешают в маленькие транспортные холодильники. В течение
короткого времени их можно хранить при комнатной температуре, но
лучше сразу поставить в холодильник или даже центрифугировать.
Надо исключить, в том числе при перевозке в автомобиле, хранение
1.2. Роль медицинской сестры в обеспечении качественного...
125
проб в местах с неопределенной температурой, например около нагре¬
вательного прибора, а также действие яркого света. Некоторые виды
исследований требуют специальных условий, которые надо заранее
обсудить со специалистами лаборатории.
Таблица 1-9.
Длительность сохранения проб до и после отделения клеток
для наиболее распространенных биохимических показателей
Показатели
Цельная кровь
Плазма или сыворотка
25 “С
4-8 °С
25 “С
4-8 °С
Э-Хорионический
гонадотропин
2 ч
4ч
24 ч
2 дня
Мочевая кислота
4 ч
4ч
3 дня
5 дней
Альбумин
3 дня
7 дттей
7 дней
30 дней
Аланиновая тран-
саминаза
2 ч
3 дня
3 дня
7 дней
Амилаза
4ч
4 ч
7 дней
30 дней
Аспарагиновая тран-
саминаза
2ч
3 дня
3 дня
7 дней
Простатический
антиген
4ч
4 ч
1 день
1 день
Билирубин общий и
связанный
4 ч
4ч
4ч
7 дней
Кальций
2 дня
2 дня
7 дней
22 дня
Хлориды
4 ч
4ч
7 дтгей
4 нед
Холестерин
48 ч
48 ч
7 дней
7 дней
КК
4ч
4 ч
4ч
5 дней
Креатинин
4 ч
4 ч
7 дней
30 дней
Железо и железосвя¬
зывающая способ¬
ность
4 ч
4 ч
4ч
7 дней
Ферритин
4 ч
4ч
Избегать
7 дней
Фруктозамин
4 ч
4ч
7 дней
3 мес
ФСГ
4 ч
4ч
7 дней
7 дней
126
Глава 1, Основы лабораторного обследования пациентов
Окончание таблицы 1-9.
Гамма-глютамил¬
транспептидаза
4ч
4ч
7 дней
7 дней
Глюкоза
2ч
4 ч
8ч
Здия
Гликозил ирован ный
гемоглобин
4ч
4—7 дней
ЛПВП-ХС
Зч
Избегать
Избегать
4 дня
Лактатдегидрогеназа
2 ч
Избегать
2 дня
Избегать
Л ютеитшзиругощий
гормон
4ч
4 ч
14 дней
14 дней
Эстрадиол
2ч
Избегать
Избегать
Избегать
Щелочная фоефатаза
3 дня
3 дня
4 дня
4 дня
Фосфор неорганичес¬
кий
4ч
4ч
3 дня
7 дней
Калий
Избегать
6 нед
6 нед
Общий белок
4ч
4ч
4ч
Здня
Натрий
2 дня
2 дня
4 дня
7 дней
ТЗ общий
2 дня
2 дня
1 -2 нед
1-2 нед
ТЗ свободный
2 дня
2 дня
1-2 нед
2 нед
Т4 общий и свобод¬
ный
2 дня
2 дня
I -2 нед
1-2 нед
Трансферрин
4ч
7 дней
8ч
Здня
Триглицериды
4ч
4ч
Зяня
7 дней
Мочевина
4ч
4ч
1 день
5 дней
Витамин В12
4 ч
4ч
4ч
3 нед
Если между взятием крови на лабораторные исследования, мате¬
риалом для которых служит сыворотка, и доставкой се в лабораторию
пройдет более 2 ч, то материал следует отцентрифугироватъ в течение
30 мин после взятия крови до транспортировки, а плазма или сыво¬
ротка должны быть перенесены в идентифицированную пробирку
без антикоагулянта или наполнителя. Однако лучше использовать
вакутейнеры или моноветты с гелем.
і.2. Роль медицинской сестры в обеспечении качественного...
127
При отправке проб мочи в лабораторию медицинская сестра, соби¬
рающая материал, должна убедиться, что все собрано правильно, и
проставить на заявке время сбора проб мочи.
Моча является хорошей средой для роста бактерий. Любые бакте¬
рии, находящиеся в моче в момент ее сбора, будут продолжать размно¬
жаться н емкости где она находится, что даст ложноположительный
результат при анализе. Поэ1ому важно, чтобы моча была доставлена
в лабораторию и исследована не позднее, чем через несколько часов
после ее сбора. Если отправка в лабораторию задерживается, мочу
следует хранить в холодильнике, так как низкая температура замед¬
ляет рост бактерий.
Осадок мочи нужно исследовать в течение 2 ч после мочеиспуска¬
ния; пробы должны храниться при комнатной температуре (22—25 °С).
Если в течение 2 ч анализ выполнить невозможно, пробу помешают
в холодильник не более чем на 6 ч и затем проводят исследование.
При этом некоторые компоненты, в частности, клетки, могут быть
разрушены; кроме того, выпадение уратов в осадок может закрыть все
поля зрения при микроскопии. Безусловно, эти факторы повлияют на
качество результата общеклинического исс.тсдования мочи. Сосуды с
мочой должны быть хорошо закрыты и защищены от света.
Длительность сохранения проб мочи для наиболее распространен¬
ных исследований мочи приведена в табл. 1-10.
Таблица 1-10.
Максимально допустимое время сохранения проб мочи
для наиболее распространенных лабораторных исследований
25 *С
4-8 X
Разовые порции мочи:
полное клиническое исследование мочи
2ч
6 ч
микроальбуминурия
4ч
14 дней
проба на беременность
4ч
Здня
Суточная моча:
мочевая кислота
3 дня
Избегать охлаждения
кальций
5 дней
5 нед
креатинин
3 дня
5 дней
фосфор
4 ч
5 дней
128 Глава І. Основы лабораторного обследования пациентов
Окончание таблицы Ї-20.
калии
4 дня
7 дней
белок
4 ч
Здня
натрии
24 ч
7 дней
Образцы кала, собранные в пластиковые контейнеры, перед транс¬
портировкой помещают в полиэтиленовые пакеты и в таком виде
доставляют в лабораторию.
Если срок доставки проб превышает 45 мин после их сбора, то
они должны перевозиться в портативных холодильниках с надписью
«Пробы для диагностических исследований»; внутри холодильника
во все времена года температура должна быть 10-15 °С. Специалисты
лечебного учреждения, обеспечивающего транспортировку, должны
убедиться, что холодильных элементов достаточно, в лаборатории,
принимающей пробы, периодически проверяют температуру в транс¬
портных холодильниках.
При транспортировке инфекционного материала необходимо
использовать дополнительный вторичный контейнер для предотвра¬
щения любого попадания материала во внешнюю среду при каком-
либо механическом повреждении.
При упаковке контейнера с сухим льдом необходимо обеспечить воз¬
можность для выхода углекислого газа наружу. В противном случае он
будет скапливаться внутри упаковки, что может привести к взрыву.
За организацию доставки проб биоматериала в лабораторию отве¬
чает главная медицинская сестра ЛПУ. Непосредственно взятие проб
крови венепункцией, сбор биоматериала и его доставку в лабораторию
осуществляют медицинские сестры лечебных отделений ЛПУ (лучше,
если это будет протіелурная медицинская сестра).
Ниже приведены основные положения инструкции 110 доставке
проб биологического материала, которые могут служить основой для
разработки более детальных инструкций в каждом ЛПУ.
Инструкция по доставке проб биологического материала в лабораторию
Общие положения
Транспортировка проб биологического материала в лабораторию
является важнейшим этаном в обеспечении качества клинических
лабораторных исследований.
1.2. Роль медицинской сестры в обеспечении качественного... 129
1. Обшим правилом должна быть доставка материала в лабораторию
как можно быстрее.
2. Для транспортировки проб крови и другого биоматериала необ¬
ходимо использовать специально предназначенные и промаркиро¬
ванные термоконтейнеры, отдельно для проб крови, мочи и другого
биоматериала, а также бактериологических исследований.
3. Термоконтейнеры до^лжны обеспечивать соответствующий тем¬
пературный режим в зависимости от вида лабораторных исследований.
Если для транспортировки в термоконтейнере необходимо поддержи¬
вать температуру 2-8 °С, то в них должны быть вложены хладогены в
нужном количестве. Для поддержания при транспортировке температу¬
ры 37 °С термоконтейнеры необходимо оборудовать термоэлементами.
Температурный режим в термоконтейнерах должен периодически (раз в
5 дней) контролироваться и поддерживаться на уровне устанавливаемых
в него проб с биологическим материалом; необходимо вести журнал по
контролю за температурным режимом термоконтейнеров.
4. Ответственность за соблюдение правил и условий транспорти¬
ровки проб биологического материала в лабораторию несет медицин¬
ская сестра отделения.
5. Пробирки с кровью на гематологические, биохимические, коа¬
гул ологические, гормональные и серологические анализы помещают
вертикально в штатив, избегая встряхивания, а затем в специальный
контейнеры с надписью «Пробы крови для лабораторных исследова¬
ний». В термоконтейнере должна поддерживаться температура 2—8 °С.
По возможности пробы крови для получения сыворотки должны быть
отцентрифугированы.
6. пробирки с кровью для определения АКТГ, ангиотензина I, II, рени¬
на, альдостерона, гомоцистеина, кальцитонина, остеокальцина должны
быть помещены в специальный контейнер со льдо.м с надписью «Пробы
крови для лабораторных исследований» с температурой внутри 2—8 °С.
7. Пробы мочи и другого биоматериала на общеклинические, био¬
химические, гормональные и цитологические анализы помещают
вертикально в специальный контейнер с надписью «Пробы биомате¬
риала на общеклинические, биохимические, гормональные и цито¬
логические анализы». В термоконтейнере должна поддерживаться
гемпература 10—12 °С.
8. Образцы кала, собранные в пластиковые контейнеры, перед
транспортировкой помещают в полиэтиленовые пакеты и в таком виде
доставляют в лабораторию.
130 Глава 1. Основы лабораторного обследования пациентов
9. Пробы для бактериологическихисследованийпомещаютв допол¬
нительный второй контейнер для предотвращения любого попадания
биоматериала во внешнюю среду при каком-либо механическом
повреждении и только затем в контейнер с надписью «Пробы для
бактериологических исследований». В термоконтейнере должна под¬
держиваться температура 2—8 °С. Пробы крови, чашки Петри с посе¬
вом на коклюш, биоматериал для посева на N. meningitidis помещают в
термоконтейнер с температурой внутри 35—37 °С.
Условия и время транспортировки
1. При транспортировке контейнеры с кровью и другим биомате¬
риалом должны быть плотно закрыты, прочно установлены, чтобы
предотвратить их опрокидывание.
2. Они должны быть защищены от воздействия света (особенно яркого
солнечного) и установлены вдали от нагревательных элементов.
3. Пробы крови и другого биоматериала должны быть как можно
скорее доставлены в лабораторию. Оптимальные сроки доставки проб
биоматериала приведены выше.
4. Доставленный в лабораторию биологический материал должен
быть немедленно передан специалистам лаборатории с указанием в
журнале времени доставки проб.
1.2.7. ОБЕСПЕЧЕНИЕ БЕЗОПАСНОСТИ ПРИ СБОРЕ
И ТРАНСПОРТИРОВКЕ ПРОБ БИОЛОГИЧЕСКОГО МАТЕРИАЛА
Все ЛПУ должны иметь собственные утвержденные правила тех¬
ники безопасности при сборе и транспортировке биологического
материала, основанные на положении, что все собираемые образцы
потенциально опасны для окружающих. Медицинские сестры, участ¬
вующие в этих процедурах, должны знать эти правила.
Среди многих опасностей, которые могут таить пробы биологического
материала, медицинским сестрам особо следует обращать внимание на
ВИЧ и вирусы гепатитов, которые способны передаваться с инфициро¬
ванной кровью. Туберкулезом можно заразиться при контакте с мокротой
больного, инфекцией Helicobacter pylori во время проведения эзофагогаст-
родуоденоскопии, а желудочно-кишечными инфекциями — при контак¬
те с зараженными фекалиями. Ниже приведены обшие положения тех¬
ники безопасности, которые необходимо соблюдать медицинской сестре
при сборе и транспортировке биологического материала.
1.2. Роль медицинской сестры в обеспечении качественного... 131
1. Для снижения риска инфицирования при взятии проб биоло¬
гического материала необходимо строго выполнять все пункты инс¬
трукции по выполнению процедур.
2. Чтобы снизить риск инфицирования при взятии проб биологи¬
ческого материала, следует использовать одноразовые хирургические
перчатки.
3. Необходимо соблюдать все требования по хранению шприцев (ваку-
зейнеров) и игл. Преимущественно через них и контактирует медицинс¬
кая сестра с потенциально инфицированной кровью больного.
4. Большую и часто серьезную опасность представляет нарушение
целостности приспособлений для взятия проб. Ее можно предотвратить,
если использовать одноразовые фирменные приспособления для взятия
(сбора) проб. При отсутствии таких приспособлений в ЛПУ необходимо
выполнять следующие правила: не заполнять пробирку биоматериалом
доверху и использовать надежные колпачки (пробки) для их закрытия.
.5. Если известно, что больной инфицирован ВИЧ или вирусом
гепатита, при взятии проб используют дополнительные меры защиты
(зашитные очки, халаты). Пробы от такого пациента должны быть
четко маркированы несколькими способами (например, штампом на
бланке-заявке «ВИЧ-инфицирован» или надписью красным фломас¬
тером на бланке-заявке и этикетке пробирки).
Медицинская сестра должна понимать, что проблема биологи¬
ческой безопасности, помимо собственной безопасности, имеет еще
одну составляющую — безопасность пациента, являющейся главным
звеном в обеспечении качественной медицинской помощи, В связи с
этим стандартизация и правильное выполнение процедур взятия и
сбора биоматериала, а также соблюдение общих положений техники
безопасности должны быть обязательными.
1.2.8. ПРИЕМ ПРОБ КРОВИ И СОБРАННОГО БИОЛОГИЧЕСКОГО
МАТЕРИАЛА В ЛАБОРАТОРИИ
В КДЛ на приеме проб крови и собранного биоматериала обычно
работает наиболее опытный фельдшер-лаборант или технолог. Эта
процедура в лаборатории стандартизирована в виде утвержденной у
главного врача ЛПУ инструкции.
Специалист лаборатории при приеме материала обращает внимание на
качество доставленных проб и полноту заполнения заявки на исследования.
132 Глава 1. Основы лабораторного обследования пациентов
Если в заявке невозможно разобрать фамилию пациента, не указан диагноз
или отделение, из которого доставлен биоматериал, не перечислены тесты,
которые необходимо выполнить, нет фамилии врача, назначившего анали¬
зы, и медицинской сестры, проводившей взятие крови, и такой биоматериал
принят лабораторией, то в дальнейшем специалисты лаборатории тратят
много времени на выяснение, чья эта кровь, откуда доставлена, что необхо¬
димо выполнить, куда направить результаты. В конечном счете большинс¬
тво таких исследований не выполняется или их результаты теряются.
Основным средством избежать таких осложнений является разра¬
ботка четких критериев отказа в приеме биоматериала на исследования.
Такие критерии должны быть обязательно утверждены у руководителя
лечебного учреждения, изучены на занятиях с врачами-клиницистами,
медицинским сестрами и специалистами лаборатории и обязаны строго
выполняться всеми. Их перечень должен постоянно находиться у специ¬
алиста лаборатории, принимаюшего биоматериал. Медицинские сестры
ЛПУ несут полную ответственность за правильность взятия биоматери¬
ала, его оформление и доставку в лабораторию. Основные критерии для
отказа в принятии лабораторией биоматериала на исследования приве¬
дены ниже. Все медицинские сестры должны хорошо их знать и избегать
направления в лабораторию пробы с биологическим материалом, подпа¬
дающим под действие этих критериев.
Критерии д ля отказа в принятии лабораторией биоматериала на исследования
1. Расхождение между данными заявки и этикетки (инициалы,
дата, время и т.д.).
2. Отсутствие этикетки на шприце или пробирке.
3. Невозможность прочесть на заявке и/или этикетке паспортные
данные пациента, отсутствие названия отделения, номера истории
болезни, фамилии лечашего врача, подписи процедурной сестры, чет¬
кого перечня необходимых исследований.
4. Гемолиз (за исключением исследований, на которые наличие
гемолиза не влияет).
5. Взятый материал находится в несоответствующей емкости, т.е.
материал взят не с тем антикоагулянтом, консервантом и др.).
6. Поврежденный контейнер с биоматериалом.
7. Наличие сгустков в пробирках с антикоагулянтом.
Медицинская сестра должна понимать важность аккуратно запол¬
ненных направлений на анализы, тщательной маркировки образцов
1.3. Оценка результатов лабораторных исследований 133
биоматериала, полученных своевременно, методически правильно и
быстро доставленных в лабораторию. Лечение, основанное на резуль¬
татах анализов, полученных при использовании ошибочно марки¬
рованных или неправильно взятых проб, может принести огромный
вред, особенно если больному оказывается неотложная помощь. Более
того, даже если ошибка будет обнаружена, драгоценное время будет
упущено, тогда как несколько минут внимания и обдумывания в нача¬
ле работы могли бы предотвратить эти нежелательные последствия.
1.3. ОЦЕНКА РЕЗУЛЬТАТОВ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Результаты исследований (информация) — это единственный про¬
дукт, который производит лаборатория. При оценке результатов
анализов необходимо понять, значимы ли обнаруженные отклонения
величин исследуемых параметров от нормальных показателей; имеют
ли эти отклонения физиологический характер (т.е. нет ли оснований
объяснить их какими-либо физиологическими или иными, не связан¬
ными с болезнью причинами) или они являются патологическими.
Медицинские сестры при оценке результатов лабораторных ана¬
лизов должны знать, что они могут быть выражены количественно,
полуколичественно и качественно. Например, результаты биохи¬
мических исследований крови в большинстве случаев выражаются
количественно, исследование кала на скрытую кровь — полуколичес-
I венно: 3 креста (+++)-резкоположительная реакция, 2 креста (++) —
положительная, данные цитологического анализа — качественно
(они представлены в виде описания обнаруженных под микроскопом
клеток). Результаты бактериологического анализа могут быть и качес-
гвснньтми, и полуколичественньтми. в текстовой части заключения
сообщается о выделении конкретного вида патогенных микроор¬
ганизмов, а их чувствительность к антибактериальным препаратам
оценивается полуколичественно (чувствительный, промежуточная
ч у вствительность, резистентный).
Наряду с другими измеряемыми показателями у пациента (напри¬
мер, масса тела, температура, пульс, артериальное давление и др.)
количественные результаты лабораторных анализов выражаются в
определенных единицах измерения.
134
Глава 1. Основы лабораторного обследования пациентов
1.3.L ЕДИНИЦЫ ИЗМЕРЕНИЯ, ИСПОЛЬЗУЕМЫЕ
В КЛИНИКО-ДИАГНОСТИЧЕСКИХ ЛАБОРАТОРИЯХ
В 1960 г. Генеральная конференция по мерам и весам приняла
Международную систему единиц — СИ (Systeme Internationale — SI) как
единую универсальную систему для всех отраслей науки, техники и про¬
изводства. Начиная с 80-х годов XX века в нашей стране все результаты
измерений в практике клинико-диагностических лабораторий стараются,
насколько это возможно, выражать в единицах СИ. В основу СИ (табл. 1-11)
положена метрическая система (в переводе с греческого метрон — мера).
Таблица 1-11.
Основные единицы СИ
Величина
Единица
наимено¬
обозначение
вание
международное
русское
Длина
Метр
m
м
Масса
Килограмм
kg
кг
Время
Секунда
s
с
Сила электрического тока
Ампер
А
А
Термодинамическая температура
Кельвин
К
К
Количество вещества
Моль
mol
моль
Сила света
Кандела
cd
кд
Из 7 основных единиц СИ, приведенных в табл. 1-11, в клиничес¬
кой практике используют только 3:
• метр (м);
• килограмм (кг);
• моль.
Единица длины — метр и единица массы — килограмм широко
используются в клинике и хорошо знакомы большинству медицинс¬
ких работников. Понятие «моль» — требует пояснения.
Моль — это количество вещества, масса которого в граммах экви¬
валентна его молекулярной (атомной) массе. Это удобная единица
измерения, так как 1 моль любого вещества содержит одинаковое
количество частиц — 6,022-102^ (число Авагадро). Рассмотрим на ряде
примеров, как можно определить 1 моль вещества.
l. 3. Оценка результатов лабораторных исследований 135
Чему равен 1 моль калия (К)? Калий представляет собой одно¬
атомный элемент с атомной массой 39 (по таблице Д.И. Менделеева),
следовательно, 1 моль калия равен 39 г.
Чему равен 1 моль натрия хлорида (NaCl)? Молекула натрия хло¬
рида состоит из одного атома натрия и одного атома хлора. Атомная
масса натрия равна 23, хлора — 35,45. Отсюда 1 молъ натрия хлорида =
23 + 35,45 = 58,45. Таким образом, 1 моль натрия хлорида равен 58,45 г.
Чему равен 1 моль глюкозы? Молекула глюкозы состоит из 6 атомов
углерода, 12 атомов водорода и 6 атомов кислорода (молекулярная фор¬
мула глюкозы CfiHijOé). Атомная масса углерода равна 12, водорода — 1,
кислорода — 16. Отсюда 1 моль глюкозы = 6 ■ 12 + 12 • 1 + 6 • 16 + 180. Таким
образом, 1 моль глюкозы равен 180 г.
Приведенные примеры показывают, каким образом знание моле¬
кулярной формулы вещества позволяет использовать моль в качестве
единицы его количества. Однако для некоторых молекулярных комп¬
лексов, присутствующих в крови (например, белков), точная молеку¬
лярная масса не определена. Поэтому для них невозможно использо¬
вать молъ как единицу измерения.
При измерении объема единицы в системе СИ должны базиро¬
ваться на метре, например, метр кубический (мз), сантиметр куби¬
ческий (смЗ), миллиметр кубический (ммЗ). Однако при введении
Международной системы единиц было решено оставить литр в качес¬
тве единицы измерения жидкостей. Литр (л) по сути является основ¬
ной единицей объема в системе СИ. В клинической и лабораторной
практике применяются следующие единицы объема:
• децилитр (дл) — 1/10 (10 -1) литра;
• сантилитр (сл) — 1/100 (10 -2) литра;
• миллилитр (мл) — 1/1000 (10-3) литра.
Ниже приведены наиболее часто используемые для выражения
результатов лабораторных исследований вторичные СИ-единицы
длины, массы (веса) и количества вешества.
Вторичные СИ-единицы длины, массы (веса) и количества вещества
Основная единица длины — метр (м)
Вторичные единицы:
• сантиметр (см) — 1/100 (10-2) метра;
• миллиметр (мм) — 1/1000 (Ю'З) метра;
• микрометр (.мкм) — 1/1 ООО ООО (10-^) метра;
• нанометр (нм) — 1/1 ООО ООО ООО (10-9) метра.
136 Глава I. Основы лабораторного обследования пациентов
Основная единица массы (веса) — килограмм (кг)
Вторичные единицы:
• грамм (г) — 1/1000 (10-3) килограмма; 1000 г = 1 кГ;
• миллиграмм (мг) — 1/1000 (Ю-з) грамма;
• микрограмм (мкг) — 1/1000 (Ю-з) миллиграмма;
■ ыанограмм (нг) — 1/1000 (Ю-з) микрограмма;
• пикограмм (пг) — 1/1000 (Ю-з) нанограмма.
Основная единица количества вещества — моль (моль)
Вторичные единицы:
• миллимоль (моль) — 1/1000 (Ю-з) молей;
• микромоль (мкмоль) — 1/1000 (Ю з) миллимоль;
• наномоль (нмоль) ~ 1/1000 (Ю-з) микромоль;
• пикомоль (пмоль) 1/1000 (Ю-з) наномоль.
В клинической лабораторной диагностике Международную систе¬
му единиц применяют в соответствии со следующими правилами.
1. В качестве единиц объема применяют литр.
2. Концентрация измеряемых веществ указывается как молярная
(моль/л) или как массовая (г/л) концентрация.
3. Молярная концентрация используется для веществ с известной
молекулярной массой.
4. Массовую концентрацию используют для веществ, молекуляр¬
ная масса которых неизвестна.
5. Плотность указывается в г/л, клиренс (от англ. clearance — очи¬
щение; в медицине — скорость очищения крови или других сред и
тканей ор1 ан изма от какого-либо вещества в процессе его химических
превращений, перераспределения в организме и/или выделения из
организ.ма) — в мд/с.
6. Активность ферментов на преформированное количество вещес¬
тва по времени и объему выражается как мольДс • л); мкмольДс • л); как
нмоль/(с • л). Однако в большинстве лабораторий нашей страны для коли¬
чественной оценки активности ферментов используется рекомендованная
Комиссией по ферментам Международного биохимического союза стан¬
дартная международная единица (ME). За единицу активности любого
фермента принимают то его количество, которое в оптимальных условиях
катализирует превращение 1 мкмоля субстрата в 1 мин (мкмоль/мин).
Поясним эти правила. Практически все количественные лабораторные
показатели включают определение концентрации того или иного вещест¬
ва в крови или моче, Концентрацию можно выразить как количество или
1.3. Оценка результатов лабораторных исследований 137
массу (вес) вещества, содержащегося в определенном объеме жидкости.
Единицы концентрации, таким образом, состоят из двух составляющих—
единицы массы (веса) вещества и единицы объема жидкости. Выше
уже было сказано, что если молекулярную массу вещества можно точно
измерить, то концентрацию вещества выражают как моль в единице
объема — литре. Например, концентрация натрия в сыворотке крови 145
ммоль/л. Это означает, что в каждом литре сыворотки крови содержится
145 ммоль натрия. Когда молекулярную массу вещества точно определить
трудно, в этом случае единица массы— это грамм (г), а единица объема —
тот же литр (л). Например, гемоглобин крови 120 г/.т. Это означает, что в
каждом литре крови содержится 120 г гемоглобина.
При выполнении гематологических исследований проводят под¬
счет клеток крови, в данном случае единицей количества является
ч исло клеток, а единицей объема — все тот же литр. Например, в норме
в крови человека содержится от 4 ООО ООО ООО до 8 800 ООО ООО лейкоци¬
тов в каждом литре крови, т.е. от 4,0 * до 8,8 ■ Ю^/л. Нередко при
разговоре можно услышать, что у больного количество лейкоцитов
15,4. Это не значит, что в крови всего 15,4 лейкоцитов, а следует пони¬
мать, что данный показатель равен 15,4 • Юул. Количество эритроци-
гов в крови значительно больше, чем лейкоцитов, поэтому единицы
их подсчета выражаются значениями Юіі/л.
1.3.2. ПОНЯТИЕ НОРМАЛЬНОЙ И РЕФЕРЕНТНОЙ ВЕЛИЧИНЫ
Важнейшим этапом оценки результатов лабораторных исследо¬
ваний является отнесение его к норме или патологии. Это нетруд¬
но сделать при явном отклонении показателей от нормы. Однако
большинство результатов лабораторных анализов, встречающихся в
клинической практике, непросто разделить на норму и патологию,
поскольку эти результаты по природе своей не имеют отчетливых раз¬
рывов или двух различных пиков, из которых один соответствовал бы
только нормальному результату, а другой — только патологическому.
Для этого имеется несколько причин.
Во-первых, разделение биологической популяции людей по мно-
I им лабораторным показателям на больных и здоровых невозможно
даже с теоретической точки зрения. Заболевание может развиваться
незаметно, проявляясь постепенным переходом от небольших откло¬
нений показателя к высоким по мере течения заболевания.
ш
Глава /. Основы лабораторного обследования пациентов
Во-вторых, здоровые и больные фактически принадлежат к двум
различным популяциям, но когда эти две популяции перемешаны,
распознать каждую из них в общей массе практически невозможно,
поскольку у больных один и тот же показатель может принимать раз¬
личные значения, перекрывая значения этого показателя у здоровых,
что представлено на рис. 1-14, и, кроме того, число больных в обшей
популяции невелико.
результат
результат
Рис. 1-14. Гипотетическое распределение результатов теста среди здоровых
и больных
Вместе с тем для всех количественных тестов определены гра¬
ницы нормальных величин, поэтому необходимо определить, что
такое нормальный показатель. Нормальные показатели — это такие,
которые выявляют у здоровых людей. Однако в группах здоровых
людей они могут иметь различные цифровые значения. Это обуслов¬
лено индивидуальными особенностями обмена веществ, гемопоэза,
функционирования тех или иных органов. Нормальные лаборатор¬
ные показатели определяют путем выборочного обследования здо¬
ровой популяции людей (по крайней мере никаких заболеваний у
них диагностировано не было), например, специально отобранных
призывников или студентов, группируемых по возрасту и полу, при
проведении исследований некоторые факторы должны быть стандар¬
1.3. Оценка результатов лабораторных исследований 139
тизованы. Если на исследования берется кровь, то она должна быть
«тошаковой», способ взятия крови и метод определения должны быть
одинаковыми у всех. Математический анализ результатов, получен¬
ных при таких исследованиях, показал, что они подчиняются матема¬
тическому закону распределения Гаусса.
Например, у всех практически здоровых людей определяется
концентрация глюкозы в крови и строится кривая распределения.
Средняя концентрация рассчитывается делением суммы всех резуль¬
татов на их число;
Хср = ^^,
п
где; Хер — средняя всех результатов;
п — число результатов;
XI — величина отдельного результата;
ЕХ1 — сумма всех результатов.
Вариацию результатов средней концентрации какого-либо вещес¬
тва в крови у людей при распределении Гаусса можно выразить сред¬
неквадратическим отклонением — 80, которое рассчитывается с
помощью уравнения:
Е(хі^
V п-1
Результаты распределения популяции здоровых людей в зависи¬
мости от определенной у них концентрации глюкозы крови приве¬
дены на рис. 1-15. Здесь видно, что концентрация глюкозы в крови
у здоровых людей колеблется рт 3,28 до 7,0 ммоль/л. Вероятность
того, что концентрация глюкозы в крови у конкретного пациента
находится в нормальных пределах уменьшается по мере удаления от
среднего показателя в здоровой популяции людей. Крайние значения
«нормального» диапазона могут на самом деле сопутствовать забо¬
леванию (в нашем примере сахарному диабету или гипогликемии).
Чтобы учесть это, область нормальных значений определяют, исклю¬
чая обычно по 2,5% полученных в популяции результатов, лежащих
на границах диапазона. В отношении концентрации глюкозы в крови
исключаются диапазоны от 3,28 до 3,9 и от 6,38 до 6,9 ммоль/л. Таким
ио
Глава 1. Основы лабораторного обследования пациентов
образом, нормальный диапазон для глюкозы крови ограничивается
значениями 3,9-6,38 ммоль/л. В этом интервале лежит более 95%
результатов, полученных у здоровых людей. Однако почти у 5% лиц
здоровой популяции показатель глюкозы выпадет из интервала,
характеризующего ее нормальную величину. Именно поэтому кри¬
терием диагностики сахарного диабета является величина глюкозы
в крови 7,0 ммоль/л и выше, а пациентов с результатами в пределах
6,38—6,9 ммоль/л относят к группе риска по данному заболеванию.
3,28
3,9
4,52
5,14
5,76
6.38
7,0 ммоль/л
Рис. 1-15. Распределение нормальных величин глюкозы крови
Таким образом, при использовании закона гауссова распределения
нормальный лабораторный показатель — это средние значения пока¬
зателей для 95% здоровой популяции. Вместе с тем 5% всех здоровых
людей могут иметь «анормальные» показатели глюкозы крови. Этой
математической закономерности подчиняются результаты значи¬
тельной части лабораторных показателей химического и клеточного
состава крови.
В то же время «нормальные» лабораторные показатели различных
веществ, которые используют при оценке результатов лабораторных
тестов, на самом деле могут в 5% случаев быть патологическими.
Поэтому вместо термина «нормальные лабораторные показатели» в
последние годы стали использовать термин «референтные величины».
Референтные величины определяются на основании измерения того
или иного показателя в большой популяции практически здоровых
людей. Они дают представление о диапазоне, в котором располагают¬
ся нормальные величины. Смысл этого введения состоит в том, что
результаты лабораторного исследования сравнивают с референтными
1.3. Оценка результатов лабораторных исследований 141
величинами, полученными в четко определенных условиях с учетом
отдельных факторов, для того чтобы установить, насколько близко
или далеко эти значения отстоят от референтного диапазона.
При оценке результатов лабораторных исследований необходимо
помнить, что референтные величины являются статистическими
данными 95% популяции и отклонения за пределы диапазона не обя¬
зательно говорят о наличии патологи и.
В стандартном наборе биохимических исследований, применя¬
емых в обычных лечебных учреждениях, имеется минимум 10—12
лабораторных тестов. Вероятность того, что найдется человек, у
которого все 12 показателей окажутся нормальными, невелика.
Данные статистического анализа показывают, что при исследо¬
вании 8 показателей 25% здоровых лиц имеют один «патологи¬
ческий» результат, а когда назначается 20 тестов, то 55% здоровых
будут иметь одно или более отклонений от нормы. Приведенные
данные показывают, насколько важно правильное выполнение
медицинской сестрой процедур преаналитического этапа. Ведь
любое нарушение в подготовке пациента к анализам, более дли¬
тельное (свыше 1 мин) наложение жгута при взятии крови будут
способствовать отклонениям в результатах анализов (в ряде случа¬
ев даже за пределы референтных величин). Например, если проба
венозной крови взята правильно, но доставлена с задержкой в 2 ч,
это может привести к снижению концентрации глюкозы в ней на
0,5 ммоль/л в результате гликолиза. Но если истинная концен¬
трация глюкозы у больного была 7,3 ммоль/л, что указывало бы
на наличие сахарного диабета, то в результате задержки доставки
пробы и гликолиза лаборатория определит величину 6,8 ммоль/л,
а это нормальное значение.
Таким образом, 5% здоровых людей имеют «ненормальные» лабо¬
раторные показатели, поэтому не все значения, выходящие за пре¬
делы нормы, следует расценивать как патологические. И наоборот,
не всегда показатель, лежащий в референтном интервале, говорит о
том, что он непатологический, так как диапазон многих параметров
достаточно широк. Например, в норме гематокрит у мужчин колеб¬
лется от 42 до 52%. Массивная кровопотеря может привести к падению
[ сматокрита от 52 до 42%. Но цифра 42% не вызовет тревоги у врачей,
гак как является «нормальной», хотя для конкретного пациента такое
снижение является значительным. Поэтому важно оценивать дина¬
мику изменения лабораторных показателей, т.е. изменения параметра,
142 Глава 1. Основы лабораторного обследования пациентов
измеренного у пациента повторно (многократно) через определенные
промежутки времени.
1.3.3. ФАКТОРЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА РЕЗУЛЬТАТЫ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Ряд физиологических факторов может оказать влияние на резуль¬
таты лабораторных исследований. Часть из них способна вызывать
реальные отклонения лабораторных результатов от референтных зна¬
чений вне связи с патологическим процессом. К числу таких факторов
относятся:
• возраст пациента;
• его пол;
• беременность;
• время дня, в которое брали пробу.
Так, с возрастом в крови снижается концентрация гормонов над¬
почечников (андростендион), соматотропного гормона и увеличи¬
вается уровень мочевины. Беременность может изменять результаты
определения гормонов щитовидной железы. Концентрация железа в
крови существенно колеблется в течение дня.
профессиональные и бытовые токсичные вещества (этанол, никотин,
наркотики), диагностические и лечебные процедуры, лекарственные средс¬
тва могут также оказывать влияние на результаты лабораторных тестов.
Аналитическая вариация (разброс результатов), зависящая от при¬
меняемых в лаборатории методов и условий их выполнения, расширяет
пределы референтных значений и этим ограничивает возможность по
лабораторным тестам различать здоровье и болезнь. Например, анали¬
тическая вариация метода определения глюкозы крови для диагностики
сахарного диабета не должна превышать 7,8%. Поэтому портативные
глюкометры на тестовых полосках, аналитическая вариация у которых
составляет 15%, не должны использоваться для диагностики сахарного
диабета у пациентов. Ведь если истинная концентрация глюкозы в крови
у пациента составляет 8 ммолъ/л, то глюкометр может показать результат
от 6,8 до 9,2 ммоль/л, но 6,8 ммоль/л — это нормальное значение. Расчет
проводится следующим образом: 8 ммоль/л . 15%/100% = ± 1,2 ммоль/л;
8 ммоль/л ± 1,2 ммоль/л = 6,8-9,2 ммоль/л.
В табл. 1-12 приведены максимально допустимые пределы анали¬
тической вариации (разброса) анализируемых компонентов.
1.3, Оценка результатов лабораторных исследований
143
Таблица 1-12.
Максимально лолустимые пределы аналитической вариации (разброса)
для различных компонентов
Анализируемые
Аналитическая
компоненты
вариация,%
Гематология
Гемоглобин
2
Гематокрит
3
Лейкоциты
10
Эритроциты
10
Клиническая
биохимия
АЛТ
7
Альбумин
3
Альфа-амилаза
Ю
ACT
7
Белок общий
3
Белковые фракции
Билирубин
10
Глюкоза
5
Гамма-ГГТП
10
Железо
5
Калий
2
Кальций
2
Кортизол
7
Креатинин
5
Креатинкиназа
7
ЛДГ
7
Мочевая кислота
7
Мочевина
7
Натрий
2
Триглицериды
7
144 Глава 1. Основы лабораторного обследования пациентов
Окончание таблицы 1-12.
Фосфор
Фоефатаза щелочная
Холестерин
Приведенные в табл. 1-12 значения допустимой аналитической
вариации рассматриваются как средние ориентировочные величины.
Данные вариации, приведенные для лейкоцитов и эритроцитов, отно¬
сятся к подсчету клеточных элементов ручными методами (в камере
Горяева), при использовании гематологических анализаторов коэф¬
фициент аналитической вариации для лейкоцитов составляет 1—3%,
для эритроцитов — 1—2%, тромбоцитов — 2—4%.
Таким образом, при оценке результатов лабораторных исследований
медицинской сестре необходимо учитывать влияние условий взятия,
хранения, транспортировки проб биоматериала, знать аналитическую
надежность лабораторных методов исследования, т.е. быть уверенной в
точности получаемой с их помощью информации о соответствующих
компонентах биоматсриала. Референтные величины служат основой
оценки результатов анализов. При этом чем больше степень отклонения
результата от референтной величины, тем выше достоверность наличия
патологии или того, что имеющаяся патология весьма значительна.
1.3.4. РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ,
ТРЕБУЮЩИЕ НЕМЕДЛЕННЫХ ДЕЙСТВИЙ
ПРИ ОКАЗАНИИ МЕДИЦИНСКОЙ ПОМОЩИ
В случае, если результаты лабораторных исследований выходят за
пределы нормы, медицинская сестра должна знать, при каких значени¬
ях показателя пациенту требуется немедленная медицинская помощь и
в каких случаях нужно немедленно извещать врача. Знание критичес¬
ких величин лабораторных показателей помогает медицинской сестре
принять правильное решение. В табл. 1-13 приведены критические
величины результатов лабораторных исследований, требующие немед¬
ленных действий. Критические значения лабораторных показателей
определяются при патологическом состоянии, которое настолько отли¬
чается от нормального, что является угрожающим жизни больного.
В большей части случаев приведенные в таблице величины отражают
нарушения гомеостаза, опасные для жизни больного.
КЗ. Оценка результатов лабораторных исследований
145
Таблица 1-13.
Критические величины результатов лабораторных исследований, требующие
немедленных действий при оказании медицинской помощи
Показатели
Критическая величина
Гематология
Гематокрит
< 14% или >60%
Лейкоциты
< 2,0 • 109/л у нового пациента или
разница в 1,0 • Ю^/л по сравнению с
предыдущим анализом при уровне
4,0 - 107л
> 50,0 ■ 109/л у нового пациента
Мазок крови
Наличие лейкемических клеток
(програнулоцитов или бластов)
Тромбоциты
< 20,0 • 109/л или > 1000,0 • 109/л
Ретикулоциты
>20%
Протромбиновое время
> 40 с
Микробиология
Культура крови
Положительный результат посева
Окраска по Граму ликвора и других
жидкостей (плевральная, синови¬
альная)
Положительный результат микро¬
скопии
Биохимия
В плазме:
билирубин
> 307,8 мкмоль/л (новорожденный)
тропонин Т
> 0,1 нг/мл
кк-мв
> 6% от активности обшей КК
мочевина
> 28,0 ммоль/л
креатинин
> 400 мкмоль/л
кальций
< 1,5 ммоль/л или > 3,25 ммль/л
глюкоза
<2,22 ммоль/л или > 27,8 ммолъ/л
фосфаты
< 0,323 ммоль/л
калий
< 2,5 ммоль/л или > 6,5 ммоль/л
натрий
< 120 ммоль/л или > 160 ммоль/л
146 Глава 1. Основы лабораторного обследования пациентов
Окончание таблицы 1-13.
бикарбонаты
< 10 ммоль/л или > 40 ммоль/л
П-димер
> 500 мкг/мл
В артериальной или капиллярной крови:
р02
< 40 мм рт.ст.
pH
< 7,2 или > 7,6
рСО^
< 20 мм рт.ст. или > 70 мм рт.ст.
Примечание. КК-МВ — сердечный изофермент КК.
Получив результаты лабораторных анализов, значения которых
соответствует приведенным в табл. 1-13, медицинская сестра долж¬
на немедленно сообщить об этом лечащему врачу, а в его отсутствие
дежурному врачу больницы или поликлиники.
Критические величины результатов лабораторных исследований,
требующие немедленных действий, обязана знать каждая медицинс¬
кая сестра.
Глава 2.
ГЕМАТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Гематологические анализы более 100 лет используются в кли¬
нической практике. Однако, несмотря на такой длительный срок,
многие из них не утратили своего значения и в настоящее время.
Гематологические исследования представляют информацию о
количестве клеток крови и их характеристиках. Оснащение КДЛ
современными гематологическими автоанализаторами, которые
могут предоставлять информацию о более чем 30 параметрах и
характеристиках клеток крови, позволило значительно повысить
клиническую информативность и точность результатов гематоло¬
гических исследований.
Из всех лабораторных исследований наиболее часто в клини¬
ческой практике назначается общий анализ крови. Его результаты
отражают как часто встречающиеся, так и менее распространен¬
ные нарушения здоровья человека, которые могут проявлять¬
ся отклонениями многих параметров общего анализа крови от
нормы. Часто общий анализ крови играет большую роль в поста¬
новке диагноза, а при заболеваниях системы кроветворения ему
отводится ведущая роль.
2.1. ОСНОВЫ КРОВЕТВОРЕНИЯ
Процесс воспроизводства клеток крови происходит в костном
мозге и называется гемопоэзом. В раннем детском возрасте все кости
содержат костный мозг, способный вырабатывать клетки крови. К 18
годам у человека этот процесс ограничен костным мозгом ребер, гру¬
дины, лопаток, костями таза, скул и эпифизами длинных костей бедер
и плеч. Все клетки крови происходят от так называемых плюрипо-
тентных (полипотентных) стволовых клеток костного мозга, которые
затем превращаются в зрелые эритроциты, гранулоциты (нейтрофи-
лы), моноциты, лимфоциты и тромбоциты (рис. 2-1).
148
Глава 2. Гематологические исследования
Костный мозг
15
А
о
о,
о
н
0>
я
О-
«
г
03
X
и
и
2.1. Основы кроветворения 149
Самые незрелые клетки костного мозга, которые затем превращаются в
зрелый эритроцит, — пронормобласт, в зрелый нейтрофил — миелобласт,
в моноцит — монобласт, в лимфоцит — лимфобласт, в тромбоциты —
мегакариобласт. Поэтому все эти клетки называются клетками-пред-
щественниками эритроцитов, нейтрофилов, моноцитов, лимфоцитов и
тромбоцитов.
Все клетки-прсдшественники развиваются путем деления и диф-
ференцировки (специализации), проходя определенные стадии. Так,
эритроцит созревает из пронормобласта, превращаясь сначала в
ретикулоцит и только затем в зрелый эритроцит. Процесс развития от
стволовой клетки до зрелого эритроцита сопровождается следующи¬
ми изменениями:
• постепенным уменьшением размера клетки;
■ потерей ядра и, следовательно, способности к делению;
• потерей внутриклеточных органелл;
• постепенным заполнением клетки гемоглобином.
Стадия созревания ретикулоцита в эритроцит происходит как в
костном мозге, так и в периферической крови. Поэтому обычно 1-2%
циркулирующих в крови эритроцитов являются ретикулоцитами.
Никаких более ранних форм эритроцитов кровь в норме не содержит.
в отличие от эритроцитов, популяция которых является одно¬
родной, лейкоциты представлены 5 типами клеток, различных по
морфологическим и функциональным признакам. Это нсйтрофилы,
эозинофилы, базофильт, моноциты и лимфоциты.
Как и эритроциты, лейкоциты и тромбоциты происходят из ство¬
ловой клетки костного мозга. Часть стволовых клеток внутри кост¬
ного мозга постепенно превращается в мсгакариоциты. Тромбоциты
образуются из цитоплазмы этих клеток в костном мозге, а затем
выходят в кровь. Каждый мегакариоцит дает начало примерно 4000
тромбоцитов.
Образующиеся в костном мозге клетки равномерно поступают по
мере созревания в кровеносное русло. При этом продолжительность
жизни клеток в кровотоке разная. Так, для эритроцитов она составляет
около 120 дней, для тромбоцитов — 10 дней, для нейтрофилов — 10 ч.
Поэтому костный мозг обеспечивает их постоянное воспроизводство.
Для поддержания клеточного состава крови на должном уровне в
организме взрослого человека массой 70 кг ежесуточно должно выра¬
батываться 2 • 10" эритроцитов, 45 • 10^ нейтрофилов и 175 • 10^ тром¬
боцитов. В обычных условиях костный мозг не только покрывает пот¬
150 Глава 2. Гематологические исследования
ребности организма, но и производит довольно большой запас клеток:
зрелых нейтрофилов в костном мозге содержится в 10 раз больше, чем
в кровеносном русле, а ретикулоцитов имеется трехдневный запас.
В среднем у человека за 70 лет жизни вырабатывается 460 кг эритроци¬
тов, 5400 кг гранулоцитов, 275 кг лимфоцитов и 40 кг тромбоцитов.
После выполнения своих функций в течение 120 дней жизни эрит¬
роциты затем удаляются из крови селезенкой и другими клетками
ретикулоэндотелиальной системы.
2.2. ОБЩИИ АНАЛИЗ КРОВИ
Общий анализ крови является одним из важнейших диагностичес¬
ких исследований, который тонко отражает реакцию кроветворных
органов при воздействии на организм различных физиологических и
патологических факторов.
В понятие «общий анализ крови» входят исследования следую¬
щих основных показателей: концентрация гемоглобина, количества
эритроцитов цветового показателя, количества лейкоцитов и тром¬
боцитов, скорости оседания эритроцитов (СОЭ) и лейкоцитарной
формулы крови. В необходимых случаях дополнительно определяют
количество ретикулоцитов.
в настоящее время большинство показателей, входящих в общий
анализ крови, определяют на автоматических гематологических ана¬
лизаторах, которые в состоянии одновременно определять от 5 до 36
параметров. Из них основными являются концентрация гемоглоби¬
на, гематокрит, количество эритроцитов, средний объем эритроцита,
средняя концентрация гемоглобина в эритроците, среднее содержание
гемоглобина в эритроците, полуширина распределения эритроцитов
по размерам, количество тромбоцитов, средний объем тромбоцита,
количество лейкоцитов. Кроме того, многие анализаторы способны
дифференцировать лейкоциты по 3 фракциям (нейтрофилы, лимфо¬
циты, моноциты), а ряд анализаторов — и по 5 фракциям (нейтрофилы,
эозинофилы, базофилы, лимфоциты и моноциты). При этом количест¬
во различных форм клеток, относящихся к лейкоцитам, выражается на
бланке результатов в абсолютных и относительных значениях. Нередко
на бланке результатов анализов все эти показатели приводятся в виде
сокращеных названий или обозначений на русском или английском
2.2. Общий анализ крови
/5/
языке. Медицинская сестра в своей работе постоянно сталкивается с
такими обозначениями и сокращениями, поэтому должна знать, что
означает каждый показатель. В табл. 2-1. приведены основные пока¬
затели, входящие в общий анализ крови и определяемые с помощью
гематологических анализаторов, их английские и русские названия.
Таблица 2-1.
Основные показатели, входящие в общий анализ крови
Показатель
Что отражает
Английское название
Количество эритро¬
цитов
Концентрацию эритро¬
цитов в крови
RBC (red blood cells —
красные кровяные
клетки)
Гемоглобин
Концентрацию гемогло¬
бина в крови
НЬ (hemoglobin)
Гематокрит
Процентную долю эритро¬
цитов в цельной крови
Ht
Средний объем эрит¬
роцита
Средний объем эритро¬
цита
MCV (mean corpuscular
volume)
Среднее содержание
гемоглобина в эритро¬
ците
Среднее содержание
гемоглобина в эритро¬
ците
MCH (mean corpuscular
hemoglobin)
Средняя концентрация
гемоглобина в эритро¬
ците
Среднюю концент¬
рацию гемоглобина в
эритроците
MCHC (mean
corpuscular hemoglobin
concentration)
Показатель распреде¬
ления эритроцитов по
объему
Вариабельность объема
эритроцитов
RDW (red cell
distribution width)
Количество тромбо¬
цитов
Концентрацию тромбо¬
цитов в крови
PLT
Средний объем тром¬
боцитов
Размеры тромбоцитов
(макро- или микро-
тромбоцитопения)
MPV (mean platelet
volume)
Тромбоцитная масса
или тромбокрит
процент количества
тромбоцитов от массы
цельной крови
PCT (platelet crit)
152
Глава 2. Гематологические исследования
Окончание таблицы 2-І
Распределение тромбо¬
цитов 110 размерам
Коэффициент вариации
кривой распределения
тромбоцитов
PDW (platelet
distribiition width)
Количество лейкоци¬
тов
Концентрацию лейко¬
цитов в крови
WBC {white blood cell)
процентное содержа¬
ние !ранулоцитоп
Процентное содержание
гранулоцитов
GRA, %
Абсолютное число гра¬
нулоцитов
Абсолютное число гра¬
нулоцитов
GRA#
Процентное содержа¬
ние лимфоцитов
Процентное содержание
лимфоцитов
LYM, %
Абсолютное число
лимфоцитов
Абсолютное число лим¬
фоцитов
LYM#
Процентное содержа¬
ние моноцитов
Процентное содержание
моноцитов
MONO, %
Абсолютное число
моноцитов
Абсолютное число
монокитов
MONO#
2.2.1. ЭРИТРОЦИТЫ, ГЕМОГЛОБИН, ГЕМАТОКРИТ
И ИНДЕКСЫ ЭРИТРОЦИТОВ
Количество эритроцитов, концентрация гемоглобина, гематокрит,
средний объем эритроцита, средняя концентрация гемоглобина в
эритроцизе, среднее содержание гемоглобина в эритроците, полуши¬
рина распределения эритроцитов по размерам являются важными
составляющими общего анализа крови. Они позволяют оценивать
функции эритроцитов и гемоглобина. Однако наибольшую ценность
приведенные показатели имеют для диагностики и установления
формы анемии (малокровия).
2.2.1.1. Структура и функции эритроцитов
Эритроциты — самые многочисленные клетки крови. Эритроцит —
это маленькая клетка в форме двояковогнутого диска (с утолшенисм по
окружности и углублением в середине). Диаметр его равен 7,5-8,5 мкм.
2.2. Общий анализ крови 153
средняя толщина колеблется в пределах 1,85—2,1 мкм. Эритроциты
большего, чем в норме диаметра, принято называть макроцитами, а
меньшего — микроцитами. Зрелый эритроцит — это единственная
безъядерная клетка. За 120 сут своей жизни эритроцит пробегает по
сосудам путь дли ной почти 150 км. Ему приходится двигаться не только
по цгироким магистралям крупных артерий и вен, но и протискиваться
в капилляры. Диаметр эритроцита в 2 раза больше диаметра капилляра
(4 мкм), через который он должен пройти. Мембрана эритроцита спо¬
собна деформироваться, изменяя форму так, что он может протиснуть¬
ся через капилляры в тканях.
Каждый отдельный эритроцит имеет желтовато-красную окрас¬
ку, но когда они собираются миллионами, то преобладаюшим
цветом становится красный. Такую окраску эритроцитам придает
вещество, которое содержится внутри клеток. Им является кровяной
пигмент — гемоглобин.
Образование гемоглобина в эритроцитах начинается с раннего
созревания в костном мозге и заканчивается после поступления
эритроцитов в кровоток. Каждый зрелый эритроцит содержит
около 640 млн молекул гемоглобина. Для гемоглобина характерна
способность связываться с кислородом воздуха. При этом гемог¬
лобин крови поглощает примерно в 60 раз большее количество
кислорода, чем то, которое может быть физически растворено в
плазме крови человека.
Уникальная струтура зрелого эритроцита хорошо подходит для
выполнения его основной функции — переноса кислорода от легких
к тканям органов и переноса углекислого газа от тканей к легким.
Если «распластать» все имеющиеся в сосудистом русле эритроциты,
разместив их рядом друг с другом, то образуемая ими площадь ока¬
жется в 1500—2000 раз больше поверхности тела взрослого человека.
Это позволяет гемоглобину эритроцитов очень быстро насыщаться
кислородом в капиллярах легких и отдавать его тканям.
2.2.1.2. Структура и функции гемогюбина
Гемоглобин — это пигмент эритроцитов, главная функция
которого состоит в переносе кислорода от легких к тканям, а также
в выведении углекислого газа из организма и регуляции кислотно-
основного состояния. Молекула гемоглобина состоит из 2 частей —
глобина и гема. Глобин — это белок, построенный из 4 сложенных
цепей аминокислот (субъединиц). Гем — железосодержащее орга¬
154 Глава 2. Гематологические исследования
I
I
ническое соединение небелковой природы. Каждая из 4 субъеди¬
ниц глобина имеет присоединенную группу гема, а в центре каж¬
дой группы гема имеется атом железа в форме Ре2+. Тдким образом,
в каждой молекуле гемоглобина содержится 4 группы гема.
Группы гема в молекуле гемоглобина всегда одинаковы, а точ¬
ная последовательность аминокислот в субъединицах глобина
слегка варьирует. Поэтому имеется 4 разновидности глобиновых
цепей: альфа ((х), бета О), гамма (7) и дельта (8). Разновидности
глобиновых цепей определяют и существование в крови человека
различных форм гемоглобина.
В крови взрослого человека имеется несколько типов гемоглобина:
• гемоглобин А1 (НЬА1) — гемоглобин взрослых; состоит из двух
а-идвухЭ-глобиновыхсубьединиц,наегодолюприходится96—98%
всего гемоглобина;
• гемоглобин А2 состоит из двух а- и двух 8-глобиновых цепей, на
его долю приходится 2—4% всего гемоглобина.
У новорожденных преобладает фетальный гемоглобин (НЬГ), кото¬
рый состоит из двух а- и двух 7-глобиновых субъединиц. В первые дни
жизни младенца НЬГ составляет 60-80% всего гемоглобина, к 4—5 мес
жизни количество фетального гемоглобина снижается до 10%.
Понимание строения гемоглобина имеет важное практическое зна¬
чение. Существует большая группа наследуемых нарушений синтеза и
структуры гемоглобина, которые объединены одним общим названи¬
ем «гемоглобинопатии». Имея представление о строении гемоглоби¬
на, легко понять сущность гемоглобинопатий. Большинство из них
встречаются очень редко, но две формы — талассемия и серповидно¬
клеточная анемия — не так редки в клинической практике и заслужи¬
вают пристального внимания (см. ниже).
Свойство гемоглобина связывать кислород определяется наличи¬
ем в центре каждого из 4 гемов 1 атома железа. Молекулы кислорода
как раз и связываются с атомами железа. Насыщенный кислородом
гемоглобин называется оксигемоглобином. Так как в гемоглобине
присутствуют 4 атома железа, то степень насыщения гемоглобина
кислородом определяется количеством атомов же.леза, присоединив¬
ших кислород,
в легких кислород вдыхаемого воздуха (его содержание гораздо выше,
чем в крови) проходит через альвеолы в кровь, и гемоглобин быстро (за
несколько секунд) насыщается кислородом. Наоборот, в тканях содержа¬
ние кислорода низкое, поэтому он быстро вывобождается из гемоглобина
2.2. Общий анализ крови 155
и диффундирует из эритроцитов в клетки тканей, где используется в про¬
цессах клеточного метаболизма.
Однако роль гемоглобина не ограничивается участием в транс¬
порте кислорода. Он к тому же весьма активно освобождает ткани от
избытка углекислого газа, образующегося в процессе обмена веществ,
способствуя выделению из организма до 90% углекислоты. Если
доставка кислорода из легких к тканям почти полностью зависит от
гемоглобина в эритроцитах, то транспорт углекислого газа в обратном
направлении значительно сложнее.
В тканях углекислый газ диффундирует из клеток в крово¬
ток. Часть остается растворенной в плазме, а часть поступает в
эритроциты. Внутри эритроцита часть углекислоты соединяется
с гемоглобином, освободившимся от кислорода, с образованием
карбоксигемоглобина, а часть соединяется с водой в цитоплазме
эритроцита и образует угольную кислоту. Эта реакция протекает с
участием фермента карбоангидразы. В легких эти клеточные реак¬
ции протекают в обратном направлении. В результате углекислый
газ, диффундируя из эритроцитов, проходит вместе с углекислым
газом, растворенным в плазме крови, в альвеолы легких и выделя¬
ется с выдыхаемым воздухом.
Отслужившие свой срок эритроциты разрушаются в ретикуло¬
эндотелиальной системе костного мозга, селезенки и печени. В этих
органах разрушается мембрана эритроцитов. Высвободившийся
гемоглобин расщепляется на свои составные части ~ гем и глобин.
Железо гема используется костным мозгом для воспроизводства
новых эритроцитов, а глобиновые цепи разрушаются до амино¬
кислот, которые поступают в общий пул аминокислот организма.
Оставшаяся часть гема (после удаления железа) превращается в
желчный пигмент билирубин. Билирубин доставляется кровью в
печень где подвергается метаболизму, а затем выделяется, большей
частью с желчью и калом, а оставшаяся часть — с мочой (уробилин
и уробилиноген).
2.2.1.3. Референтные величины количества эритроцитов,
гемоглобина, гематокрита и индексов эритроцитов
Референтные величины количества эритроцитов, гемоглобина,
гематокрита, среднего объема эритроцита, средней концентрации
гемоглобина в эритроците, среднего содержания гемоглобина в
эритроците, полуширины распределения эритроцитов по разме¬
т
Глава 2. Гематологические исследования
рам существенно варьируют и во многом зависят от возраста и
пола. Без точного знания референтных величин данных показате¬
лей бывает очень трудно оценить, насколько выражецы отклоне¬
ния в результатах анализа. Лаборатория обязана приводить вместе
с результатами определения перечисленных параметров и рефе¬
рентные величины с учетом возраста и пола.
Количество эритроцитов в крови (RBC) — один из наиболее важ¬
ных показателей системы крови. Референтные величины количества
эритроцитов в крови представлены в табл. 2-2 (Тип Н., 1997).
Референтные ве.тичины эритроцитов в крови
Таблица 2-2.
Возраст
Женщины,
Мужчины, ЛО^Ул
Кровь из пуповины
3,9-5,5
3,9-5,5
1 -3 дня
4,0-6,6
4,0-6,6
1 нед
3,9-6,3
3,9-6,3
2 нед
3,6-6,2
3,6-6,2
1 мес
3,0-5,4
3,0-5,4
2 мес
2,7-4,9
2,7-4,9
3-6 мес
3,1-4,5
3,1-4,5
0,5—2 года
3,7-5,2
3,4-5,0
3—12 года
3,5-5,0
3,9-5,0
13-16 лет
3,5-5,0
4,1-5,5
17-19 лет
3,5-5,0
3,9-5,6
20-49 лет
3,5-5,0
4,2-5,6
50-59 лет
3,6-5,1
3,9-5,6
60-65 лет
3,5-5,2
3,9-5,3
Старше 65 лет
3,4-5,2
3,1-5,7
Гемоглобин (НЬ) — основной дыхательный пигмент эритроцитов.
Референтные величины концентрации гемоглобина в крови пред¬
ставлены в табл, 2-3 (Тиц Н., 1997).
2.2. Общий анализ крови
157
Таблица 2-3.
Референтные величины концентрации гемоглобина в крови
Возраст
Женщины, г/л
Мужчины, г/л
Кровь из пуповины
135-200
135-200
1—3 дня
145-225
145-225
1 нед
' 135-215
135-215
2 нед
125-205
125-205
1 мес
100-180
100-180
2 мес
90-140
90-140
3—6 мес
95-135
95-135
0,5-2 года
106-148
114-144
3-6 лет
102-142
104-140
7-12 лет
112-146
110-146
13-16 лет
112-152
118-164
17-19 лет
112-148
120-168
20-49 лет
110-152
130-172
50—59 лет
112-152
124-172
60-65 лет
114-154
122-168
Старше 65 лет
110-156
122-168
Гематокрит (Нг) — объемная фракция эритроцитов в цельной крови (дает
представление о соотношении объемов плазмы и эритроцитов). Величиана
гематокрита зависит от количества и объема эритроцитов. В современных
гематологических счетчиках Ш является расчетным (вторичным) парамет¬
ром, выводимым из количества эритроцитов и их объема. Пределы референ¬
тных величин для нг представлены в табл. 2-4 (Тиц Н., 1997).
Таблица 2-4.
Референтные величины Ш
Возраст
Женщины,%
Мужчины,%
Кровь из пуповины
42-60
42-60
1-3 дня
45-67
45-67
158
Глава 2. Гематологические исследования
Окончание таблицы 2-4.
1 нед
42-66
42-66
2 нед
39-63
39-63
1 мес
31-55
31-55
2 мес
28-42
28-42
3—6 мсс
29-41
29-41
0,5-2 года
32,5-41,0
27,5-41,0
3—6 лет
31,0-40,5
31,0-39,5
7-12 лет
32,5-41,5
32,5-41,5
13-19 лет
33,0-43,5
34,5-47,5
20-49 лет
33,0-45,0
38,0-49,0
50-65 лет
34,0-46,0
37,5-49,5
Старше 65 лет
31,5-45,0
30,0-49,5
Понятие «индексы эритроцитов» включает показатели, кото¬
рые определяют современные гематологические анализаторы. Эти
показатели дают дополнительную информацию о форме эритроци¬
тов, содержании в них гемоглобина и используются в клинической
практике для установления причин анемии. К индексам эритро¬
цитов относятся средний объем эритроцита, среднее содержание
гемоглобина в эритроците и средняя концентрация гемоглобина в
эритроците.
средний объем эритроцита {mean corpuscular volume — MCV) — сред¬
ний корпускулярный объем — средняя величина объема эритро¬
цита, измеряемая в фемтолитрах (П) или кубических микрометрах.
В гематологических анализаторах MCV вычисляется делением суммы
клеточных объемов на число эритроцитов.
Значения MCV, находящиеся в пределах 80—100 Л, характеризу¬
ют эритроцит как нормоцит, меньше 80 Л — как микроцит, больше
100 Л — как макроцит. Рефрентные величины MCV приведены в
табл. 2-5 (Тиц Н, 1997).
2.2. Общий анализ крови
159
Таблица 2-5.
Референтные величины среднего объема эритроцита
Возраст
Женщины, fl
Мужчины, fl
Кровь из пуповины
98-118
98-118
1-3 дня
95-121
95-121
1 нед
:• 88-126
88-126
2 нед
86-124
86-124
1 ктес
85-123
85-123
2 мес
77-115
77-115
3-6 мес
77-108
77-108
0,5—2 года
72-89
70-99
3—6 лет
76-90
76-89
7—12 лет
76-91
76-81
13-19 лет
80-96
79-92
20-39 лет
82-96
81-93
40-59 лет
80-100
81-94
60-65 лет
80-99
81-100
Старше 65 лет
80-100
78-103
Среднее содержание гемоглобина в эритроците (mean corpuscular
hemoglobin — MCH) характеризует среднее содержание гемоглобина
в эритроците. Референтные величины мен приведены в табл. 2-6
(Тиц Н., 1997).
Таблица 2-6.
Референтные величины среднего содержания гемоглобина в эритроците
Возраст
Женщины, пг
Мужчины, пг
1-3 дня
31-37
31-37
1 нед
28-40
28-40
2 нед
28-40
28-40
1 мес
28-40
28-40
2 мес
26-34
26-34
3-6 мес
25-35
25-35
160
Глава 2. Гематологические исследования
Окончание таблицы 2-6.
0,5-2 года
24,0-31,0
24,5-29,0
3-12 лет
25,5-33,0
26,0-31,0
13-19 лет
27,0-32,0
26,5-32,0
20—29 лет
27,5-33,0
27,5-33,0
30-49 лет
27,0-34,0
27,5-33,5
50—59 лет
27,0-34,5
27,5-34,0
60—65 лет
26,5-33,5
27,0-34,5
Старше 65 лет
26,0-34,0
26,0-35,0
т
I
мен самостоятельного значения не имеет и всегда соотносится с
MCV, цветовым показателем и МСНС.
Средняя концентрация гемоглобина в эритроците {mean corpuscular
hemoglobin concentration — MCHC) — показатель насыщенности эрит¬
роцитов гемоглобином. Референтныые величины МСНС приведены
в табл. 2-7 (Тиц Н., 1997). В гематологических анализаторах МСНС
определяется автоматически.
Таблица 2-7.
Референтные величины средней концентрации гемоглобина в эритроците
Возраст
Женщины, g/dl
Мужчины, g/dl
1—3 дня
29,0-37,0
29,0-37,0
1 нед
28,0-38,0
28,0-38,0
1 мес
28,0-38,0
28,0-38,0
2 мес
29,0-37,0
29,0-37,0
3—6 мес
30,0-36,0
30,0-36,0
0,5-2 года
33,0-33,6
32,2-36,6
3—12 лет
32,4-36,8
,32,2-36,2
13—19 лет
32,4-36,8
32,2-36,4
20-29 лет
32,6-35,6
32,8-36,2
30-59 лет
32,6-35,8
32,6-36,2
60—65 лет
32,2-35,6
32,2-36,9
Старше 65 лет
31,8-36,8
32,0-36,4
2.2. Общий анализ крови 161
Цветовой показатель (ЦП) длительно применялся в клинической
практике до активного использования гематологических анализа¬
торов. Это расчетный показатель, который отражает относительное
содержание гемоглобина в эритроците. В настоящее время он все
реже используется, так как по своей сути аналогичен МСН и корре¬
лирует с MCV, определяемыми гематологическими анализаторами.
По величине ЦП анемии принято делить на гипохромньте (ЦП < 0,8),
нормохромные (ЦП 0,85-1,05) и гиперхромные (ЦП > 1,1).
2.2.1.4. Патологические состояния, связанные со снижением
количества эритроцитов, гемоглобина и гематокрита
Состояния, которые сопровождаются снижением количества эрит¬
роцитов, концентрации гемоглобина и гематокрита, объединены общим
понятием «анемия». Основные клинические симптомы анемии обуслов¬
лены снижением доставки кислорода к тканям. Существует множество
возможных причин анемии, поэтому она не рассматривается как само¬
стоятельное заболевание, а скорее, бывает проявлением какой-то другой
болезни, которую необходимо выявить для того, чтобы лечение от него и
от анемии было успешным. Другими словами, анемии всегда вторичны,
и, чтобы их успешно лечить, необходимо диагностировать то первичное
заболевание, которое привело к развитию анемии. Независимо от при¬
чины анемия сопровождается снижением содержания гемоглобина в
крови. Поэтому определение концентрации гемоглобина в крови играет
важнейшую роль в диагностике анемий. Пониженное количество эрит¬
роцитов и гематокрита — также признаки анемии. Заключение о нали¬
чии анемии основывается на результатах определения концентрации
гемоглобина и величины гематокрита в крови: для мужчин это снижение
количества гемоглобина ниже 135 г/л и показателя гематокрита ниже
40%, для женщин ниже 115 г/л и ниже 35% соответственно. У детей
уровень гемоглобина в норме ниже, чем у взрослых, поэтому анемию
диагностируют при содержании гемоглобина менее ПО г/л. При анеми¬
ях содержание гемоглобина варьирует в широких пределах и зависит
от степени ее выраженности. Чем ниже результат, тем анемия тяжелее.
Снижение количества эритроцитов и гематокрита зависит не только от
тяжести, но и от причины анемии.
Клинические проявления анемии в основном не зависят от ее при¬
чин и являются результатом снижения оксигенации тканей. Часть из
них отражает попытку организма компенсировать анемию. Наиболее
частыми клиническими признаками анемии являются:
162 Глава 2, Гематологические исследования
• бледность кожных покровов и видимых слизистых оболочек;
• утомляемость и сонливость;
• одышка, особенно при физической нагрузке;
• головокружение, обмороки;
• головные боли;
• учащение пульса, сердцебиение, тахикардия.
Причины анемии. Определение концентрации гемоглобина, вели¬
чины гематокрита и подсчет количества эритроцитов помогают
диагностировать анемию, установить степень ее тяжести, однако
эти показатели не дают существенной информации о ее причинах.
Все виды анемией по причине их развития делятся на три основные
группы:
1. Анемии, обусловленные острой кровопотерей, например после
операции.
2. Анемии, вызванные нарушением кровообразования вследствие:
• дефицита железа (железодефицитная анемия), необходимого для
синтеза гемоглобина, — самая часта причина анемии;
• недоступности железа для эритропоэза, например, при хроничес¬
ких воспалительных заболеваниях, инфекциях, онкологических
процессах; такая анемия называется анемией при хронических
заболеваниях (занимает 2-е место по распространенности после
железодефицитной анемии);
' дефицита витамина В|2 и/или фолиевой кислоты, необходи¬
мых для воспроизводства эритроцитов; такая анемия называется
мегалобластной, или макроцитарной анемией;
• дефицита эритропоэтина, необходимого для стимуляции кост¬
ного мозга к воспроизводству эритроцитов (это главная причина
анемии у больных с хронической почечной недостаточностью);
• злокачественнбго заболевания костного мозга (лейкозы, миелом¬
ная болезнь);
• недостатка костномозговых стволовых клеток (апластическая ане¬
мия), обычно являющаяся результатом действия цитотоксических
препаратов, облучения или радиоизотопного лечения рака,
3. Анемии, связанные с повышенной скоростью разрушения эрит¬
роцитов вследствие:
• генетических дефектов синтеза гемоглобина (серповидно-кле¬
точная анемия, талассемии);
• генетических дефектов структуры мембраны эритроцитов
(болезнь Минковского—Шоффара);
2.2. Общий анализ крови 163
• транс фузи он ных реакций;
• резус-конфликта между матерью и плодом (гемолитическая
болезнь новорожденных);
• действия лекарственных средств.
Существует еще одна причина, при которой концентрация
гемоглобина, гематокрит и количество эритроцитов могут сни¬
жаться и о которой не следует забывать. Дело в том, что перечис¬
ленные параметры являются концентрационными показателями,
поэтому если объем плазмы повышен, например, при избыточной
инфузионной терапии у реанимационных больных (гипергидра¬
тация), то концентрация гемоглобина, величина гематокрита и
количество эритроцитов будут снижены, даже если их абсолютное
содержание в крови остается нормальным. И наоборот, при сниже¬
нии объема плазмы, например, при дегидратации, концентрация
гемоглобина, гематокрита и количество эритроцитов будут повы-
шсньт. Увеличение объема плазмы — обычное физиологическое
явление при беременности. Поэтому беременность сопровождает¬
ся снижением концентрации гемоглобина, величины гематокрита
и количества эритроцитов. В связи с этим беременная женщина
с небольшим снижением концентрации гемоглобина и величины
гематокрита не обязательно страдает анемией.
В установлении причины анемии важное значение имеют индек¬
сы эритроцитов: средний объем эритроцита, среднее содержание
гемоглобина в эритроците и средняя концентрация гемоглобина
в эритроците, а также исследование эритроцитов в мазках крови
под микроскопом. На основании приведенных индексов анемии
могут быть классифицированы (табл. 2-8) по среднему объему
эритроцитов (MCV) на микроцитарные (средний объем эритроци¬
та снижен), нормоцитарные (средний объем эритроцита в норме) и
макроцитарные (средний объем эритроцита увеличен).
В свою очередь на основании средней концентрации гемоглобина в
эритроците (МСНС — показатель насыщенности эритроцитов гемог¬
лобином) анемии можно разделить на нормохромные (нормальная
концентрация гемоглобина в эритроците), гипохромные (концентра¬
ция гемоглобина в эритроците снижена) и гиперхромные (концентра¬
ция гемоглобина в эритроците повышена). Снижение МСНС характер¬
но для гипохромных железодефицитных анемий, а повышение — для
I иперхромных. Снижение МСНС наблюдается и при заболеваниях,
сопровождающихся нарушением синтеза гемоглобина.
ш
Глава 2. Гематологические исследования
Таблица 2-8.
Заболевания и состояния, сопровождающиеся изменением МСУ
Значение МСУ < 80 П
Значение МСУ > 80 и
< 100 Л
Значения МСУ > 100 А
Микроцитарные
анемии:
— железодефицитные
анемии;
— талассемии
— сидеробластические
анемии
Анемии, которые могут
сопровождаться
— микроцитозом:
— гемоглобинопатии
— нарушение синтеза
порфиринов
Нормоцитарные ане¬
мии:
— апластические
- гемолитические
- гемоглобинопатии
— анемии после крово¬
течений
Анемии, которые могут
сопровождаться
нормоцитозом:
-- регенераторная фаза
железодефицитной
анемии
Макроцитарные
и мегалобластные
анемии:
- дефицит витамина
В,2
- дефицит фолиевой
кислоты
Анемии, которые могут
сопровождаться
макроцитозом:
- миелодиспластичес-
кие синдромы
- гемолитические ане¬
мии;
- болезни печени
Отравление свинцом
На основании определения среднего объема эритроцита и средней
концентрации гемоглобина в эритроците основные формы анемии
можно отнести к одной из трех приведенных ниже групп.
1. Микроцитарная гипохромная анемия. К этой группе относится
самая распространенная форма анемии — железодефицитная, а также
талассе.мия.
2. Нормоцитарная нормохромная анемия. В эту группу входят
большинство анемий, связанных с хроническими заболеваниями,
а также анемии вследствие острой кровопотери, повышенного раз¬
рушения эритроцитов (гемолитические анемии), вызванные дефи¬
цитом эритропоэтина (хроническая почечная недостаточность),
повреждением костномозговых стволовых клеток (апластическая
анемия), злокачественным заболеванием костного мозга.
2.2. Общий анализ крови
165
3. Макроцитарная анемия. Для данной формы анемии характерно
образование аномально крупных эритроцитов вследствие дефицита
витамина и/или фолиевой кислоты. Гиперхромия зависит только
от увеличения объема эритроцита, а не от повышенного насыщения
его гемоглобином, поэто.му гиперхромия всегда сочетается с макро¬
цитозом. ^
Изменения показателей красной крови при различных формах
анемий отражены в табл. 2-9.
Дифференциальная диагностика анемий
Таблица 2-9.
Показатели
Анемия
железодефн-
цитная
гемолити¬
ческая
гипопласти-
ческая
в,2-дефи-
цитиая
Гемоглобин
Эритроциты
ц
Цветовой пока¬
затель
Норма
Норма
Средний объем
эритроцита
Норма,t
Норма
444^
Содержание
ге.моглобина
в эритроците
(МСН)
Норма
4^4^
Концентрация
гемоглобина
в эритроците
(МСНС)
Норма
Норма
А
Примечание. Показатель снижен (^), выраженное снижение увели
чен (А), выраженно увеличен (4ФК).
Лабораторные признаки анемии. Снижение количества эритро¬
цитов, содержания гемоглобина и величины гематокрита в крови
является основным лабораторным признаком анемии. Степень
эритроцитопении, снижения уровня гемоглобина и величины
гематокрита широко варьирует при различных формах анемии.
166 Глава 2, Гематологические исследования
При железодефицитной анемии на почве хронических кровопо-
терь количество эритроцитов может быть нормальным или нерез¬
ко сниженным — (3,0—3,6) • 10'2/л, снижение уровня гемоглобина
относительно умеренное (до 85—114 г/л), реже более выраженное
(до 60-84 г/л). При острой кровопотере, В,2-дефицитной ане¬
мии, гипопластической анемии, гемолитических анемиях после
гемолитического криза количество эритроцитов в крови может
снижаться до (1,6—1,0) • Ю^ул, а концентрация гемоглобина — до
50—85 г/л и даже 40—30 г/л, гематокрита до 25—15%, что является
показанием к проведению неотложных лечебных мероприятий.
Минимальное содержание гемоглобина в крови, при котором еще
может продолжаться жизнь человека, составляет 10 г/л.
2.2,1.5. Патологические состояния, связанные с повышением количест-
ва эритроцитов, гемоглобина и величины гематокрита
Повышение количества эритроцитов в крови — эритроцитоз (более
6,0 ■ 10‘Ул у мужчин и более 5,0 - Ю'Ул у женщин) — один из характер¬
ных лабораторных признаков эритремии (полицитемии). Это состо¬
яние противоположное анемии. Эритроцитоз (эритремия) может
быть абсолютным (увеличение массы циркулирующих эритроци¬
тов вследствие усиления эритропоэза) и относительным (вследствие
уменьшения объема плазмы). Основной признак эритремии — повы¬
шение количества эритроцитов, концентрации гемоглобина и гема¬
токрита в крови. Концентрация гемоглобина в крови может повы¬
шаться до 180-220 г/л и выше, гематокрит до 55-65%.
Эритроцитоз может возникнуть как ответ на какое-нибудь
физиологическое или патологическое состояние, при котором
содержание кислорода в крови меньше, чем в норме. В ответ на
низкий уровень кислорода в крови почки начинают усиленно
вырабатывать эритропоэтин, что приводит к усилению воспроиз¬
водства эритроцитов.
Первичная эритремия (истинная полицитемия) представляет
собой опухоль кроветворной ткани костного мозга. В периферичес¬
кой крови отмечается увеличение количества эритроцитов и кон¬
центрации гемоглобина в сочетании с повышенным содержанием
лейкоцитов и тромбоцитов. Содержание гемоглобина в крови обычно
180-220 г/л, а количество эритроцитов 6,8—8,0 * Ю^Ул.
Основные причины увеличения количества эритроцитов в крови
представлены в табл. 2-10.
2.2, Общий анализ крови
167
Таблица 2-10.
Заболевания и состояния,
сопровождающиеся увеличением количества эритроцитов
Основные патогенетические группы
Клинические формы
Абсолютные эритроцитозы, обус¬
ловленные повышенной продук¬
цией эритроцитов:
Первичные
Эритремия (злокачественное забо¬
левание костного мозга)
Симптоматические (вторичные):
- вызванные гипоксией
— связанные с повышенной про¬
дукцией эритропоэтина
~ связанные с избытком адрено-
кортикостероидов или андрогенов
в организме
Заболевания легких, пороки сердца,
наличие аномальных гемоглобинов,
повышенная физическая нагрузка,
пребывание на большой высоте,
ожирение
Рак паренхимы почки, гидронефроз
и поликистоз почек, рак паренхимы
печени, доброкачественный семей¬
ный эритроцитоз
Синдром иценко—Кушинга, фео-
хромоцитома, гиперальдостеронизм
Относительные эритроцитозы
Дегидратация, эмоциональные
стрессы, алкоголизм, курение, арте¬
риальная гипертензия
Смешанный эритроцитоз вследс¬
твие сгущения крови и плацентар¬
ной трансфузии
Физиологический эритроцитоз
новорожденных
2.2.1.6. Изменения морфологии эритроцитов
Изменения морфологии эритроцитов выражаются в уменьшении
размеров, изменении формы эритроцитов, интенсивности и характера
окрашивания. О морфологии эритроцитов судят при исследовании окра¬
шенных мазков крови с помощью иммерсионной системы микроскопа.
168 Глава 2. Гематологические исследования
Изменения размера эритроцитов
Микроцитоз — преобладание в мазках крови эритроцитов диамет¬
ром меньше нормы — наблюдается при железодефицитной анемии,
талассемии.
Макроцитоз — присутствие в мазках крови эритроцитов диаметром
выше нормы — выявляется при макроцитарных анемиях, заболевани¬
ях печени, дефиците витамина В,2 и фолиевой кислоты, при анемии
беременных.
Лпизоцитоз — присутствие в мазках крови эритроцитов, различаю¬
щихся по размеру. Анизоцитоз — ранний признак анемии.
Изменения формы эритроцитов
Пойкилоцитоз — изменения формы эритроцитов различной степени
выраженности, которые отли^шются от дисковидной. Пойкилоцитоз —
важнейший признак патологического изменения эритроцитов. Ряд форм
эритроцитов являются специфичными для конкретной патологии, к ним
относятся микросфероциты — клетки, специфичные для наследственно¬
го микросфероцитоза —- болезни Минковского—Шоффара; серповидные
клетки характерны для серповидно-клеточной анемии.
Изменения окраски эритроцитов
Бледная окраска эритроцитов — гипахрстия эритроцитов, которая обус¬
ловлена низким насыщением эритроцита гемоглобином. Гипохромия
эритроцитов — характерный признак железодефицитных анемий.
Усиленная окраска эритроцитов — гиперхромия — связана с повы¬
шенным насыщением эритроцитов гемоглобином. Она сочетается с
макроцитозом. Эти изменения характерны для больных с дефицитом
витамина В12 и фолиевой кислоты.
Ядросодержащие клетки эритроцитарного ряда в крови
При различных патологических состояниях в периферической
крови можно обнаружить базофилъные, полихроматофильные и окси-
фильные нормобласты (нормопиты). Большое количество нормоблас-
тов характерно для гемолитических анемий. Они могут появляться
в мазках крови при постгеморрагических анемиях, острых лейкозах
(иногда), метастазах новообразований в костный мозг.
2.2Л.7. Гемоглобинопатии
В основе гемоглобинопатий лежат наследуемые (генетические)
нарушения структуры гемоглобина. Наиболее часто в клинической
2.2. Общий анализ крови 169
практике встречаются две формы гемоглобинопатий — талассемия и
серповидно-клеточная анемия.
Серповидно-клеточная анемия обусловлена наследованием специ¬
фического дефекта в гене, который кодирует синтез Э-1лобина. Этот
дефект приводит к продукции аномального гемоглобина 8 (НЬ8),
который состоит из двух нормальных а- и двух аномальных р-цепей.
Если дефектный ген унаследован от обоих родителей, то нормаль¬
ный гемоглобин А1 не синтезируется и практически весь гемоглобин у
больного — это гемоглобин 5. Гемоглобин 8 полимеризуется при низком
напряжении кислорода в крови, вызывая структурные изменения мемб¬
раны эритроцита. В результате эритроциты деформируются в серповид¬
ные (отсюда и название анемии). Деформированные эритроциты плохо
приспособлены (ригидны) для изменения своей формы при прохождении
через мелкие капилляры. Они легко повреждаются (лизируются) с разви¬
тием гемолитической анемии. Поэтому если пациент наследует дефект¬
ный ген от обоих родителей, говорят о серповидно-клеточной анемии.
Клинические проявления серповидно-клеточной анемии сущест¬
венно варьируют, у меньшей части пациентов вообше нет клинических
симптомов болезни, у всех остальных основным признаком заболевания
является хроническая гемолитическая анемия, которая характеризуется
исключительно болезненным кризовым течением. Серповидно-клеточ¬
ный криз связан с повышенным разрушением серповидных эритроци¬
тов в микрососудах различных органов (селезенка, кости, легкие, мозг).
Повышенный выход гемоглобина при разрушении эритроцитов в мик¬
рососуды приводит к их блокированию, нарушая микроциркуляцию
(поэтому кризы очень болезненны), в результате клетки тканей начинают
страдать от недостатка кислорода и питательных веществ и погибают.
Когда происходит закупорка сосудов головного мозга, то развивается
инсульт, при закупорке сосудов сетчатки глаза возникает нарушение
зрения.
Если дефектный ген наследуется от одного из родителей, то
у пациента половина синтезируемого гемоглобина — нормальный
гемоглобин А1, а вторая — гемоглобин 8. Это состояние называют
серповидно-клеточным носительством. Носители не страдают анеми¬
ей. Однако гемолитические кризы могут развиваться при стрессовых
состояниях и других тяжелых заболевания (шок, сепсис, во время
анестезии при неадекватной вентиляции легких),
Талассемии — группа генетических нарушений, характеризующих¬
ся дефектным синтезом а- и р-глобиновых цепей гемоглобина. Эти
170
Глава 2, Гематологические исследования
аномалии приводят к развитию гипохромных микроцитарных анемий
различной тяжести. Генетически дефект синтеза а-глобиновых цепей
гемоглобина вызывает ос-талассемию, (3-цепей — (3-талассемию.
Ген, кодирующий синтез а-цепи гемоглобина, локализован в 16-й
хромосоме. У здоровых людей имеется 4 таких гена — по 2 на каждой
16-й хромосоме. Тяжесть а-талассемических синдромов связана с коли¬
чеством делеций (потерь) этих генов. Носительство а-талассемии —
это легкая бессимптомная форма а-талассемии, вызванная делецией
2 из 4 генов, Для нее характерны микроцитоз эритроцитов (низкий
средний объем эритроцита — MCV) и отсутствие анемии, Делеция
всех 4 генов, контролирующих синтез а-глобиновых цепей, приводит
к несовместимой с жизнью водянке плода. Так как а-цепи необходимы
для синтеза фетального гемоглобина, гемоглобина А1 и гемоглобина
А2, то дефицит гемоглобина слишком значителен, чтобы плод выжил —
смерть наступает внутриутробно. При потере 3 генов развивается мик¬
роцитарная (низкий MCV) гипохромная (низкая средняя концентра¬
ция гемоглобина в эритроците -- МСНС) анемия различной степени
выраженности с содержанием гемоглобина 70-90 г/л.
Ген, кодирующий синтез (3-глобиновых цепей, локализован на 11-й
хромосоме. Если дефектный ген р-глобина унаследован от одного роди¬
теля, то говорят о малой р-талассемии (носительство р-талассемии).
У большинства пациентов клинические проявления заболевания отсутс¬
твуют, тем не менее у многих, несмотря на отсутствие анемии, эритроци¬
ты гипохромны, MCV низкий. Большая р-талассемия ~ это значительно
более тяжелая форма р-талассемии (анемия Кули). Она встречается,
когда дефектные гены унаследованы от обоих родителей. У больных уже
на первом году жизни развивается тяжелая гипохромная микроцитарная
анемия. Избыточное разрушение эритроцитов приводит к увеличению
печени и селезенки. Лечение включает регулярные переливания крови
в сочетании с введением железосвязывающих препаратов или пересадку
костного мозга.
Основным способом выявления патологических форм гемоглоби¬
на является электрофорез.
2.2.2. ЛЕЙКОЦИТЫ И ЛЕЙКОЦИТАРНАЯ ФОРМУЛА
Лейкоциты, так же как и эритроциты, образуются в костном мозге.
Однако, в отличие от однородной популяции эритроцитов, лейкоци-
2.2, Общий анализ крови 171
гы представлены 5 типами клеток, различных по своей форме и фун¬
кциям. Лейкоциты включают нейтрофилы, эозинофилы, базофилы,
моноциты и лимфоциты. Когда мы говорим об общем количестве
лейкоцитов, то имеем в виду суммарное количество всех этих клеток.
Все гематологические анализаторы подсчитывают общее количество
лейкоцитов в крови, в СБОЮ очередь если речь идет о раздельном (диф¬
ференциальном) подсчете лейкоцитов, то под этим следует понимать
количество каждого типа лейкоцитов в отдельности. Раздельный
подсчет лейкоцитов иначе называют лейкоцитарной формулой — это
процентное соотношение разных видов лейкоцитов в мазке крови при
его исследовании под микроскопом. Современные гематологические
анализаторы также способны проводить подсчет каждого типа лей¬
коцитов в отдельности, в этом плане они отличаются только свои¬
ми возможностями. Одни гематологические анализаторы разделяют
общую популяцию лейкоцитов на 3 типа клеток — гранулоциты (ней¬
трофилы, эозинофилы, базофилы суммарно), моноциты и лимфоци¬
ты, другие на 5 популяций — нейтрофилы, эозинофилы, базофилы,
моноциты и лимфоциты.
По своим морфологическим признакам лейкоциты отличаются
от эритроцитов. Они крупнее эритроцитов и содержат ядро. Главной
функцией лейкоцитов является участие в иммунных реакциях защи¬
ты организма человека от всего чужеродного — бактерий, вирусов,
паразитов, грибов, опухолевых клеток, собственных поврежденных
тканей. Большая часть лейкоцитов (нейтрофилы, моноциты) обладает
способностью поглощать и «пожирать» чужеродные микроорганиз¬
мы. Этот процесс называется фагоцитозом. Каждая рана, каждый
фурункул или царапина представляют собой поле для деятельности
лейкоцитов. Гора мертвых лейкоцитов и микробов, смешанных с
обломками разрушенных клеток поврежденной ткани, и составляет
гной, заполняющий рану. Помимо фагоцитоза и переваривания мик¬
роорганизмов, лейкоциты образуют бактерицидные, т.е. уничтожаю¬
щие бактерии, вещества.
Увеличение продукции лейкоцитов в костном мозге — составная
часть нормального (воспалительного) ответа организма на любое
повреждение тканей независимо от его причины. Воспалительный
ответ направлен на ограничение повреждения, удаление потенци¬
ально патогенных факторов (бактерии, вирусы, паразиты, грибы,
опухолевые клетки, собственные поврежденные ткани), стимуляцию
заживления и восстановление поврежденных тканей. Являясь глав¬
172
Глава 2. Гематологические исследования I
ной действующей силой воспалительного ответа, лейкоциты поки¬
дают костный мозг, поступают в большом количестве в кровоток и
доставляются в поврежденные ткани. Поэтому повышение количест¬
ва лейкоцитов в крови — очень частый признак инфекционных забо¬
леваний, воспалительных и злокачественных процессов. Уменьшение
числа лейкоцитов, которое встречается реже, свидетельствует о сни¬
жении иммунитета и высоком риске инфекционных заболеваний.
2.2.2.1. Структура и функции лейкоцитов
Лейкоциты — клетки крови, отличающиеся характерной структурой и
сложным внутриклеточным метаболизмом. Они различаются по форме и
структуре ядра, характеру цитоплазмы, наличию в ней транул.
Основной функцией лейкоцитов является защита организма от
чужеродных агентов. Благодаря их фагоцитарной активности, участию
в клеточном и гуморальном иммунитете, обмене гистамина, гепарина
реализуются антимикробные, антитоксические, антителообразующие
и другие важнейшие компоненты иммунологических реакций.
Нейтрофилы. Нейтрофильные гранулоциты -- самая многочис¬
ленная фракция лейкоцитов. Они характеризуются наличием в
цитоплазме гранул двух типов: азурофильных и специфических,
содержимое которых позволяет этим клеткам выполнять свои фун¬
кции. в азурофильных гранулах содержатся миелопероксидаза,
нейтральные и кислые гидролазы, катионные белки, лизоцим.
Специфические гранулы имеют в своем составе лизоцим, лактофер-
рин, коллагеназу, аминопептидазу. Около 60% общего количества
гранулоцитов находится в костном мозге, составляя костномозговой
резерв, 40% — в других тканях и лишь менее 1% — в периферической
крови. Основная функция нейтрофилов состоит в защите организма
от инфекций, которая осуществляется главным образом с помошью
фагоцитоза. В тканях нейтрофилы окружают и поглощают бактерии.
Ферменты, содержащиеся в гранулах, и образующиеся высокоак¬
тивные свободные радикалы убивают захваченные нейтрофилами
бактерии.
В норме в крови присутствуют сегментоядерные нейтрофилы и
относительно небольшое количество палочкоядерных нейтрофилов
(1-5%). Длительность полупериода циркуляции нейтрофильных гра¬
нулоцитов в крови равна 6,5 ч, затем они мигрируют в ткани. Время
жизни гранулоцитов в тканях зависит от многих причин и может
колебаться от нескольких минут до нескольких дней.
2.2. Общий анализ крови / 73
Эозинофилы. После созревания в костном мозге эозинофилы
несколько часов (около 3-4) находятся в циркулирующей крови, а
затем мигрируют в ткани, где продолжительность их жизни состав¬
ляет 8—12 дней.
Эозинофилы — клетки, фагоцитирующие чужеродный материал,
слишком крупный для нсйтрофи.лов. Например, они обезвреживают
паразитов и вызывают их повреждение, высвобождая ферменты, а затем
фагоцитируют продукты распада. Эозинофилы присутствуют в очагах
воспаления, вызванного аллергическими заболеваниями (бронхиаль¬
ная астма), где они фагоцитируют комплексы антиген-антитело, пред¬
ставленные главным образом иммуноглобулином Е. Высвобождение
биологически активных веществ из эозинофилов — составная часть
патогенеза аллергических реакций.
Базофилы — клетки крови, содержащие в своей цитоплазме грубые
лилово-синие гранулы. Гистамин — основной компонент гранул базо-
филов. Продолжительность жизни базофилов 8—12 сут, время цирку¬
ляции в периферической крови, как и у всех гранулоцитов, короткое —
несколько часов. Базофилы мигрируют из крови в ткани, где созревают
в тучные клетки. Активированные тучные клетки высвобождают боль¬
шое количество медиаторов воспаления, главные из которых гистамин,
который местно расширяет сосуды, что приводит к усилению кровото¬
ка в области поражения, и гепарин — антикоагулянт, необходимый для
начала восстановления поврежденных кровеносных сосудов. Главная
функция базофилов заключается в участии в аллергических реакциях
гиперчувствительности немедленного типа.
Лимфоциты, являясь главными клеточными элементами иммун¬
ной системы, образуются в костном мозге, активно функционируют в
лимфоидной ткани. Главная функция лимфоцитов состоит в узнава¬
нии чужеродного антигена и участии в адекватном иммунном ответе
ор1'анизма (более подробно о функциях лимфоцитов см. гл. 7).
Моноциты образуются в костном мозге из монобластов, относятся
к системе фагоцитирующих мононуклеаров. После выхода из костного
мозга, где, в отличие от гранулоцитов, они не формируют костномоз¬
говой резерв, моноциты циркулируют в крови от 36 до 104 ч, а затем
уходят в ткани. Из крови в ткани за 1 ч уходит 7,0 • 10^ моноцитов.
В тканях моноциты дифференцируются в органе- и тканеспецифичес¬
кие макрофаги. Внссосудистый пул моноцитов в 25 раз превышает цир¬
кулирующий. Макрофагам принадлежит важнейшая роль в процессах
фагоцитоза. Они удаляют из организма отмирающие клетки, остатки
174
Глава 2, Гематологические исследования
разрушенных клеток, денатурированный белок, бактерии и комплексы
антиген-антитело. Макрофаги участвуют в регуляции кроветворения,
иммунном ответе, гемостазе, метаболизме липидов yi железа.
2.2.2.2. Референтные величины количества лейкоцитов
Количество лейкоцитов (WBC) в циркулирующей крови — важ¬
ный диагностический показатель. Увеличение количества лейкоцитов
отражает выраженность защитной реакции организма против повреж¬
дения, инфекции, воспаления. Уменьшение количества лейкоцитов
указывает на снижение защитных возможностей организма и повы¬
шенный риск инфекционных заболеваний. Для оценки результатов
подсчета общего количества лейкоцитов важно знать референтные
величины их содержания в крови, которые приведены в табл, 2-11.
Таблица 2-11.
Референтные величины содержания лейкоцитов в крови
Возраст
Величина, * 109/л
Кровь из пуповины
9,9-27,6
24 ч
9,4-32,2
1 мес
9,2-13,8
12 мес — 3 года
6,0-17,5
4 года
6,1-11,4
6 лет
6,1-11,4
10 лет
6,1-11,4
21 год
4,5-10,0
Взрослые
4,0-8,8
Количество лейкоцитов в крови зависит от скорости притока кле¬
ток из костного мозга и скорости выхода их в ткани. Увеличение коли¬
чества лейкоцитов в периферической крови выше 10,0 • ЮУл называют
лейкоцитозом, уменьшение ниже 4,0 • 109/л — лейкопенией, при этом
увеличение или уменьшение количества лейкоцитов в крови может
быть оценено и в отношении отдельных видов лейкоцитов — нейтро¬
филов, эозинофилов, базофилов, моноцитов и лимфоцитов.
Современные гематологические анализаторы подсчитывают как
общее количество лейкоцитов, так и отдельные виды лейкоцитов и
2.2. Общий анализ крови
175
выражают их в абсолютных и относительный значениях. Если гема¬
тологический анализатор не разъединяет на части отдельные виды
лейкоцитов, то определить абсолютное содержание отдельных видов
лейкоцитов в единице объема крови можно по данным подсчета лей¬
коцитарной формулы с использованием следующего рассчета:
А (%) • общее количество лейкоцитов (- 109/л)
100%
где А — содержание определенного вида лейкоцитов, %.
Например, увеличение процентного содержания лимфоцитов
(60% получают при подсчете лейкоцитарной формулы) при снижен¬
ном общел! количестве лейкоцитов (2,0 • 109/л) означает относитель¬
ный лимфоцитов, так как абсолютное число этих клеток (1,2 • ЮУл) в
пределах нормальных колебаний.
Для лейкоцитоза (лейкопении) нехарактерно пропорциональное
увеличение (уменьшение) числа лейкоцитов всех видов; в большинс¬
тве случаев имеется увеличение (уменьшение) количества какого-
либо одного типа клеток, поэтому применяют термины «нейтрофи-
лез», «нейтропения», «лимфоцитоз», «ли.мфопения», «эозинофилия»,
«эозинопения» и т.д.
Нейтрофилы. Благодаря способности нейтрофилов к фагоцитозу
их принято считать вторым после кожи и слизистых оболочек защит¬
ным барьером организма. Поэтому количество нейтрофилов в крови
является своебразным индикатором, отражающим особенности
состояния организма больного. Референтные величины содержания
нейтрофилов в крови приведены в табл. 2-12 (Тиц Н., 1997).
Таблица 2-/2
Референтные величины содержания нейтрофилов (абсолютное
и относительное — процентное количество) в крови
Возраст
Пределы колебаний,
■Юул
Процент нейтрофилов
12 мес
1,5-8,5
30-50
4 года
1,5-8,5
35-55
10 лет
1,8-8,0
40-60
21 год
1,8-7,7
45-70
Взрослые
1,8-7,7
45-70
176
Глава 2. Гематологические исследования
Иейтрофилез (неитрофилия) — увеличение содержания нейтро¬
филов в крови выше 8,0 • 109/л- Нейтропения — уменьшение содер¬
жания нейтрофилов в крови ниже 1,5 - 109/л.
Эозинофилы. Эозинофилы наряду со способностью к фаго¬
цитозу благодаря наличию в гранулах вещества, обладающего
антигистаминной активностью, выполняют дсзинтоксикацион-
ную функцию в аллергическом процессе. Референтные величины
содержания эозинофенов в крови приведены в табл. 2-13 (Тиц Н.,
1997).
Таблица 2-13.
Референтные величины содержания эозинофилов
(абсолютное и относительное процентное количество) в крови
Возраст
Пределы колебаний,
• ТОУл
Процент эозинофилов
12 мес
0,05-0,7
1-5
4 года
0,02-0,7
1-5
10 лет
0-0,60
1-5
21 год
0-0,45
1-5
Взрослые
0-0,45
1-5
Эозинофилия — повышение содержания эозинофилов в крови
> 0,4 • 109/л у взрослых и 0,7 • ЮУл у детей. Эозинопения — снижение
содержания эозинофилов < 0,05 ■ ЮУл,
Базофилы. Базофилы редко встречаются в крови. Они принимают
участие в воспалительных и аллергических процессах. Референтные
величинысодержаниябазофиловвкровиприведенывтабл,2-14(ТицН.,
1997).
Таблица 2-14.
Референтные величины содержания базофилов (абсолютное
и относительное процентное количество) в крови
Возраст
Пределы колебаний,
Процент базофилов
• ЮУл
12 мес
0-0,2
0,4
4-6 лет
0-0,2
0,6
2.2. Общий анализ крови
177
Окончание таблицы 2-!4.
10 лет
0-0,2
0,6
21 год
0-0,2
0,5
Взрослые
0-0,2
0.5
Базофилия — повышение уровня базофилов в крови > 0,2 • ЮУл.
Базопеиия — снижение уровня базофилов в крови <0,01 •
Моноциты. Моноциты являются ведущими клетками иммунного
ответа, при этом их основные функции состоят в поглощении чуже¬
родного антигена (бактерии, вирусы, паразиты и т.д.), переработке
антигенов и предоставлении их Т-лимфоцитам-помощникам. Это
представление необходимо для запуска реакций специфического кле¬
точного иммунитета. Референтные величины содержания моноцитов
в крови приведены в табл. 2-15 (Тиц Н., 1997).
Таблица 2-15.
Референтные величины содержания моноцитов (абсолютное
и относительное процентное количество) в крови
Возраст
Пределы колебаний,
• ЮУл
Процент моноцитов
12 мес
0,05-1,1
2-7
4 года
0-0,8
2-7
10 лет
0-0,8
1-6
21 год
0-0,8
1-8
Взрослые
0-0,8
1-8
Моноцитоз — увеличение количества моноцитов в крови более
0,8 • ЮУл, Моиоцитопеиия — уменьшение количества моноцитов в
крови ниже 0,09 ■ ЮУл).
Лимфоциты. Под названием «лимфоциты» объединено несколько
групп клеток, имеющих морфологическое сходство, но значительно
отличающихся между собой по своим функциональным особеннос¬
тям (более подробно о лимфоцитах см. гл. 7). Референтные величины
содержания лимфоцитов в крови приведены в табл. 2-16 (Тиц Н.,
1997), У детей до 4—6 лет в общем количестве лейкоцитов преобладают
лимфоциты, т.е. для них характерен абсолютный лимфоцитоз, после
178
Глава 2. Гематологические исследования
6 лет происходит перекрест, и в общем количестве лейкоцитов преоб¬
ладают нейтрофилы.
Таблица 2-16.
Референтные величины содержания лимфоцитов (абсолютное
и относительное — процентное количество) в крови
Возраст
Пределы колебаний,
•109/л
Процент лимфоцитов
12 мес
4,0-10,5
61
4 года
2,0-8,0
50
6 лет
1,5-7,о
42
10 лет
1,5-6,5
38
21 год
1,0-4,8
34
Взрослые
1,0-4,5
34
Лимфоцитоз — увеличение абсолютного количества лимфоци¬
тов в крови более 4,0 • ЮУл у взрослых, более 9,0 • ЮУл — у детей
младшего возраста и более 8,0 • ЮУл у детей старшего возраста.
Лимфопения — уменьшение абсолютного количества лимфоцитов в
крови ниже 1,0 • ЮУл.
2.2.2.3. Лейкоцитарная формула
Лейкоцитарная формула — процентное соотношение разных
видов лейкоцитов в мазке крови. Особенностью подсчета лей¬
коцитарной формулы крови под микроскопом является то, что
такой подсчет в дополнение к дифференцированному подсчету
клеток крови (нейтрофилы, эозинофилы, базофилы, .моноци¬
ты и лимфоциты) на гематологических анализаторах позволяет
выявить различные формы нейтрофилов. В норме нейтрофилы в
мазке крови представлены двумя основными разновидностями:
палочкоядерными клетками (имеют форму ядра в виде палоч¬
ки) и сегментоядерными (имеют форму ядра в виде сегмента).
Палочкоядерные нейтрофилы — это более молодые формы, они
присутствуют в периферической крови в небольшом количестве
(1—6%). При патологических процессах в крови может наблюдаться
увеличение количества палочкоядерных нейтрофилов и появлять¬
ся предшественники палочкоядерных клеток — метамиелоциты
2.2. Общий анализ крови
179
и миелобласты. Это имеет важное диагностическое значение,
так как объективно отражает тяжесть патологического процесса.
Референтные показатели лейкоцитограммьт представлены в табл.
2-17, из которой видно, что у новорожденных соотношение клеток
резко отличается от взрослых.
Таблица 2-17.
Референтные показатели лейкоцитограммы
Клетки
Процент от количества всех лейкоцитов
взрослые
при рож¬
дении
1 день
4 дня
2 нед
Миелоииты
-
0,5
0,5
-
-
Метамиелоциты
-
4
4
2,5
1,5
Нейтрофилы палоч¬
коядерные
1-5
27
26
7
3
Нейтрофилы сег¬
ментоядерные
40-70
34
34
39
25
Лимфоциты
20-45
22,5
24
36,5
55
Моноциты
3-8
8
9,5
11
11,5
Эозинофилы
1-5
3
2
3,5
3
Базофилы
0-1
0,75
0,25
-
0,5
Плазмоциты
-
0,25
0,25
0,5
0,5
2.2.2.4. Причины увеличения количества лейкоцитов
Основная роль лейкоцитов состоит в зашите организма чело¬
века от инфекции, воспаления, повреждения тканей и чужерод¬
ных клеток. Поэтому увеличение количества лейкоцитов в крови
(лейкоцитоз) сопровождает различные заболевания и состояния,
при которых могут иметь место перечисленные патологические
процессы. Такой лейкоцитоз называется реактивным, так как
он развивается в ответ иа какой-либо патологический процесс.
Одновременно он является и лабораторным маркером определен¬
ного заболевания. Однако реактивный лейкоцитоз необходимо
отличать от увеличения количества лейкоцитов при лейкозе, зло¬
качественном заболевании костного мозга.
180 Глава 2. Гематологические исследования
Реактивный лейкоцитоз наиболее часто является следствием ост¬
рых инфекций, особенно если их возбудителями являются кокки
(стафилококк, стрептококк, пневмококк, гонококк) или некоторые
бациллы (кишечная палочка, дифтерийная палочка и др.). При этих
инфекциях количество лейкоцитов обычно составляет (15,0—25,0) • 109,
Сильно выраженный лейкоцитоз (20,0-40,0) • 109 характерен для боль¬
ных пневмококковой пневмонией, скарлатиной, с обширными ожо¬
гами. Лейкоцитоз развивается в течение 1—2 ч после начала острого
кровотечения, особенно интенсивно, если произошло кровоизлияние
в брюшную полость, плевральное пространство, сустав или в непос¬
редственной близости от твердой мозговой оболочки, и менее выражен,
если кровотечение наружное. При прерывании трубной беременности
количество лейкоцитов может повышаться до 22,0 - 109, после разрыва
селезенки оно составляет 31,0 • 109. Лейкоцитоз обычно развивается в
течение острой атаки подагры и может достигать 31,0 • 109. у большинс¬
тва больных острым аппендицитом уже в самом начале заболевания
отмечается повышенное количество лейкоцитов в крови.
Ложное увеличение количества лейкоцитов, подсчитанное с помо¬
щью гематологического анализатора, может наблюдаться при нали¬
чии сгустков или агрегации тромбоцитов в присутствии ядерных
форм клеток красной крови (эритробластов), которые будут подсчи¬
таны как лейкоциты.
При любой природе лейкоцитоза у пациента в его крови преоб¬
ладает один из пяти типов лейкоцитов (нейтрофилы, эозинофилы,
базофилы, моноциты, лимфоциты). Установление преобладающего
типа клеток крови, определяющих лейкоцитоз, также имеет важное
диагностическое значение.
Причины нейтрофилеза. Повышение количества нейтрофилов в
крови (нейтрофилез) встречается наиболее часто по сравнению с уве¬
личением количества других типов лейкоцитов. Также как и лейкоци¬
тоз, нейтрофилез бывает реактивным и злокачественным. Увеличение
количества нейтрофилов в крови может быть признаком:
• Острых бактериальных инфекций:
- локализованных (абсцессы, остеомиелит, острый аппендицит,
острый отит, пневмония, острый пиелонефрит, сальпингит,
гнойный и туберкулезный менингит, ангина, острый холецис¬
тит, тромбофлебит и др.);
— генерализованных (сепсис, перитонит, эмпиема плевры, скар¬
латина, холера и пр.).
2.2. Общий анализ крови
181
• Воспаления или некроза тканей: инфаркта миокарда, обширных
ожогов, гангрены, быстро развивающейся злокачественной опухоли
с распадом, узелкового периартериита, острой атаки ревматизма.
• Экзогенной интоксикации (свинец, змеиный яд, вакцины).
• Эндогенной интоксикации (уремия, диабетический ацидоз,
лола1ра, эклампсия, синдром Кушинга).
• Лекарственных воздействий.
• Миелопролиферативных заболеваний (хронический миелолей-
коз, эритремия).
• Острой геморрагии.
Нейтрофилез является одним из основных объективных диа¬
гностических критериев любого нагноительного процесса, осо¬
бенно сепсиса. Установлено, что чем выше лейкоцитоз, тем более
выражена положительная реакция организма на инфекцию.
Количество лейкоцитов в периферической крови, особенно при
стафилококковом сепсисе, может достигать (60-70) • Ш/д.
Причины эозинофилии. Эозинофилия встречается значитель¬
но реже нейтрофилеза. Наиболее часто сопровождаются эози-
нофилией паразитарные заболевания и атопическая а.ллергия.
Инвазия глистными паразитами является причиной значительной
и длительной эозинофилии; реже эозинофилия вызывается про¬
стейшими. При аллергических состояниях эозинофилия обычно
умеренная — от 0,2 до 1,5 • ЮУл, но в некоторых случаях может
быть и выше, например, при бронхиальной астме или ангионевро-
тическом отеке. Основные причины, приводящие к эозинофилии
в крови, приведены в табл. 2-18.
Таблица 2-18.
Заболевания и состояния, сопровождающиеся эозинофилией
Основные причины
Клинические формы
Аллергические заболевания
Бронхиальная астма, сенная лихорадка,
аллергический дерматит, лекарственная
аллергия
Инвазии паразитов
Аскаридоз, токсокароз, трихинелвзез, эхи-
нококкоз, шистозомоз, филяриоз, строн-
гилоидоз, описторхоз, анкилостомидоз,
лямблиоз
182
Глава 2. Гематологические исследования
Окончание таблицы 2.18
Опухоли
Гемобластозы (острые лейкозы, хроничес¬
кий миелолейкоз, эритремия, лимфомы,
лимфогранулематоз, другие опухоли, осо¬
бенно с метастазами или некрозом)
Иммунодефициты
Синдром Виекотта—Олдрича
Болезни соединительной
ткани
Узелковый псриартериит, ревматоидный
артрит
І
причины базофилии и моноцитоза. Повышение числа базофилов и
моноцитов встречается редко. Заболевания и состояния, при которых
может выявляться базофилия:
• аллергические реакции (на пищу, лекарства, введение чужерод¬
ного белка);
• хронический миелолейкоз, миелофиброз, эритремия;
• лимфогранулематоз;
• хронический язвенный колит;
• гипофункция шитовидной железы;
• лечение эстрогенами.
Моноцитоз при туберкулезе считается доказательством актив¬
ного распространения туберкулезного процесса. При септических
эндокардитах, вялотекущем сепсисе может наблюдаться значи¬
тельный моноцитоз, который нередко встречается в отсутствие
лейкоцитоза. Относительный или абсолютный моноцитоз отмеча¬
ется у 50% больных с системными васкулитами. Кратковременный
моноцитоз может развиваться у больных с острыми инфекциями
в период выздоровления. Основные заболевания и состояния, при
которых возможен монопитоз, приведены в табл. 2-19.
Причины лимфоиитоза. В клинической практике наиболее
частая причина лимфопитоза — инфекционный мононуклеоз.
Это острая инфекция, вызываемая вирусом Эпштейна—Барр.
Инфекционный мононуклеоз возникает чаще у детей и молодых
людей. Клиническая картина проявляется болью в горле, лихо¬
радкой, выраженной утомляемостью, головной болью, увеличе¬
нием лимфатических узлов и печени. Картина крови характери¬
зуется высоким лейкоцитозом за счет лимфоцитов, достигая пика
(10,0—30,0 • ЮУл), который постепенно снижается до нормальных
2.2, Общий анализ крови
183
значений через 1—2 мес. Лимфоциты при инфекционном моно¬
нуклеозе приобретают морфологическое разнообразие. В крови
появляется большое количество атипичных лимфоцитов {моно-
нуклеары), характеризующихся дисплазией ядра, увеличением
цитоплазмы и приобретающих сходство с моноцитами.
Таблица 2-19.
Заболевания и состояния, при которых возможен моноцитоз
Основные причины
Клинические формы
Инфекции
Подострый септический эндокардит, период
выздоровления после острых инфекций; вирусные
(инфекционный мононуклеоз), грибковые, рикке-
теиозные и протозойные (малярия, лейшманиоз,
кала-азар инфекции)
Гранулематозы
Туберкулез, особенно акгивный, сифилис, бруцел¬
лез, саркоидоз, язвенный колит, энтерит
Болезни крови
Острый монобластный и миеломонобластный лей¬
козы; хронические моноцитарный, мисломоноци-
тарный и миелолейкоз, лимфогранулематоз
Коллагенозы
Системная красная волчанка, ревматоидный арт¬
рит, узелковый псриартериит
Остальные причины лимфоцитоза:
• другие, менее частые вирусные инфекции, такие, как цитомега-
ловирусная, ранние стадии ВИЧ-инфекции, вирусный гепатит,
краснуха;
• хронические бактериальные инфекции (туберкулез);
• другие инфекции: коклюш,, токсоплазмоз.
Лимфоцитоз встречается при злокачественных заболеваниях —
хроническом лимфолейкозе, макроглобулинемии Вальдеиетрема.
2.2.2.5. Причины снижения количества лейкоцитов
Снижение количества лейкоцитов (лейкопения) в крови встречает¬
ся реже, чем лейкоцитоз, в большинстве случаев в основе лейкопении
лежит уменьшение количества нейтрофилов или лимфоцитов или тех
и других вместе.
184 Глава 2. Гематологические исследования
Причины нейтропении.
Основными этиологическими факторами, вызывающими нейтро-
пению, являются:
1. Массивные бактериальные инфекции (тиф, паратифы, туляре¬
мия, бруцеллез, подострый бактериальный эндокардит, мил парный
іубсркулез), при коюрых костный мозг вследствие интоксикации и
повышенного потребления нейтрофилов не способен воспроизводить
их с необходимой скоростью.
2. Вирусные инфекции (инфекционный гепатит, грипп, корь,
краснуха) сопровождающиеся легкой нейтроиснией.
3. Токсические влияния на костный мозг и супрессия гранулоци-
топоэза:
• ионизирующая радиация;
■ химические агенты (бензол, анилин, и др.);
• противоопухолевые препараты (цитостатики и иммунодепрес¬
санты);
• недостаточность витамина Віз и фолиевой кислоты;
• острый лейкоз; избыточная пролиферация опухолевых клеток
подавляет продукцию нормальных нейтрофилов;
• апластическая анемия — состояние, связанное с недостатком
стволовых клеток костного мозга, что проявляется угрожающей
жизни тяжелой нейтропенией и недостаточной продукцией всех
типов клеток крови.
4. Иммунные влияния:
• аутоиммунные (системная красная волчанка, ревматоидный арт¬
рит);
• изоиммунные (у новорожденных, пострансфузионный).
5. Перераспределение и секвестрация нейтрофилов в органах:
• анафилактический шок;
• спленомегалия различного происхождения;
6. Наследственные формы нейтропении (циклическая нейтропе¬
ния, семейная доброкачественная хроническая нейтропения, хрони¬
ческая нейтропения у детей):
Агранулоцитоз — резкое уменьшение количества нейтрофилов в
периферической крови вплоть до полного их исчезновения, ведущее
к снижению сопротивляемости организма к инфекции и развитию
бактериальных осложнений.
2.2. Общий анализ крови 185
Причины лимфопении.
Возникновение лимфопении характерно для начальной стадии
инфекциоиио-токсичсского процесса и связано с их миграцией из
сосудов в ткани к очагам воспаления. Основными причинами лимфо¬
пении являются:
• СПИД, который вызывается ВИЧ; этот вирус избирательно пора¬
жает Т-лимфоциты, приводя к тяжелой прогрессирующей лим-
фоцитопении;
• аутоиммунная патология (системная красная волчанка) является
причиной разрушения лимфоцитов и лимфопении;
• острые воспалительные заболевания (аппендицит, острый панк¬
реатит, болезнь Крона) нередко сопровождаются легкой лимфо-
пенией;
• вирусные инфекции (грипп);
■ ожоги, операции, травмы;
• почечная недостаточность;
• первичные (врожденные) и вторичные (приобретенные) иммуно-
дефициты.
2.2.2.6. Изменения лейкоцитарной формулы
Изменения лейкоцитарной формулы крови сопутствуют многим
заболеваниям и в основном являются неспеиифическими. Тем не
менее диагностическое значение этого исследования велико, так как
оно дает представление о тяжести состояния пациента, эффективнос¬
ти проводимого лечения. При лейкозах исследование лейкоцитарной
формулы нередко позволяет уетанови гь диагноз.
При многих тяжелых инфекциях, септических и гнойных про¬
цессах лейкоцитарная формула изменяется за счет увеличения
количества палочкоядерных нейтрофилов, метамиелоцитов и мие¬
лоцитов. Такое изменение лейкограммы с увеличением процентно¬
го содержания молодых форм нейтрофилов носит название «сдвига
влево».
Высокий нейтрофильный лейкоцитоз (до 50 • 109/л) с омоложени¬
ем состава лейкоцитов (сдвиг влево разной степени вплоть до про-
миелоцитов и миелобластов) наиболее часто возникает при острых
бактериальных пневмониях (особенно крупозной) и других тяжелых
инфекциях, остром гемолизе.
Заболевания и состояния, сопровождающиеся сдвигом лейкоци¬
тарной формулы, приведены в табл. 2-20.
т
Глава 2. Гематологические исследования
Таблица 2-20.
Заболевания и состояния, сопровождающиеся сдвигом
лейкоцитарной формулы
Сдвиг влево
(в крови
присутствуют
метамиелоциты,
миелоииты)
Сдвиг влево с омоложени¬
ем (в крови присутствуют
мета-миелоциты, мие¬
лоциты, промиелоциты,
миелобласты
и эритробласты)
Сдвиг вправо (уменьшение
количества палочкоядереых
нсйтрофи.юв в сочетании
с наличием гиперсегменти-
рованных ядер нейтрофилов)
Острые
воспалительные
про цессы
хронические лейкозы
эритролейкоз
Мегалобластная анемия
Гнойные
инфекции
Миелофиброз
Болезни почек и печени
Интоксикации
Метастазы новообразо¬
ваний
Острые
геморрагии
Острые лейкозы
Состояния после перели¬
вания
Ацидоз и кома¬
тозное состояние
Коматозные состояния
крови
Физическое
перенапряжение
2.2.2,7, Лейкозы
Лейкозы — злокачественные заболевания костного мозга, которые
характеризуются нерегулируемой пролиферацией одного вида (клона)
незрелых клеток (сГволовой клетки или клетки-предшественницы
любого направления и уровня дифференцировки) и подавлением
продукции нормальных клеток крови. По клиническому течению
лейкозы подразделяют на острые и хронические. В зависимости от
того, какая клетка костного мозга, миелоидная (предшественница
эритроцитов, гранулоцитов, моноцитов и тромбоцитов) или лимфо¬
идная (предшественница лимфоцитов) дает начало опухолевым клет¬
кам, различают миелолейкоз илимфолейкоз.
Таким образом, выделяют 4 вида лейкоза: острый и хронический мие¬
лолейкоз, острый и хронический лимфолейкоз. Исследование крови и пун-
ктат костного мозга имеют решающее значение для диагностики лейкозов.
2.2. Общий анализ крови 187
2,2,2.7.1. Острые лейкозы
Острые миелолейкоз и лимфолейкоз отличаются не только по кле¬
точному происхождению, но и по ряду клинических особенностей
течения заболевания.
Острый миелолейкоз — наиболее частая форма острого лейкоза.
У взрослых на долю острог«;) миелолейкоза приходится 80%, а у детей —
15% общего количества остркх лейкозов. Острый миелолейкоз не ограни¬
чивается одной формой лейкоза. На основании признаков злокачествен¬
ных (лейкемических) клеток по фрапко-американо-британской (ФАБ)
классификации различают 8 форм острого миелолейкоза.
1. МО — острый миелобластный лейкоз с минимальной миелоид-
ной дифференцировкой.
2. М1 — острый миелобластный лейкоз без созревания.
3. М2 — острый миелобластный лейкоз с созреванием.
4. М3 — острый промиелоцитарный лейкоз.
5. М4 — острый миеломонобластный лейкоз.
6. М5 ~ острый монобластный лейкоз.
7. Мб — острый эритромиелоз.
8. М7 — острый мегакариобластный лейкоз.
К моменту установления диагноза, по данным общего анализа
крови и пунктата костного мозга, клинические проявления заболе¬
вания могут отсутствовать. Обычно пациенты предъявляют неспе¬
цифические жалобы на слабость, сонливость вследствие анемии.
В более поздний период у пациентов часто отмечается лихорадка и
различные инфекции, обусловленные низким количеством полно¬
ценных лейкоцитов в крови. Из-за снижения количества тромбоцитов
нередки гематомы после незначительных травм, имеется повышенная
склонность к кровотечениям. Острый миелолейкоз характеризуется
прогрессирующим клиническим течением и без лечения быстро при¬
водит к смерти.
Острый лимфобластный лейкоз — самая частая форма острого лей¬
коза у детей — 85%, у взрослых на его долю приходится 20%.
На основании ФАБ классификации по морфологическим особен¬
ностям лейкемические клетки при остром лимфобластном лейкозе
подразделяются на три типа: микролимфобласты (Ы), менее диффе¬
ренцированные клетки (Е2), большие клетки, напоминающие имму-
нобласты (ЬЗ).
На момент установления диагноза большинство пациентов имеют
клинические проявления заболевания, которые аналогичны описан-
188 Глава 2. Гематологические исследования
мым для острого миелолейкоза. Заболевание быстро прогрессирует и
без лечения приводит к смерти.
Лабораторные признаки острого лейкоза. При остррм лейкозе всем
элементам кроветворения свойственны глубокие патологические
изменения, в большинстве случаев острого лейкоза развивается
анемия. Анемия носит нормохромный, гиперхромный, реже гипох-
ромный характер и углубляется по мере прогрессирования заболева¬
ния (содержание гемоглобина снижается до 60-20 г/л, а количество
эритроцитов — до 1,5-1,0 • Ю'^/л). Другим характерным признаком
острого лейкоза является тромбоцитопения (часто ниже критичес¬
кого уровня). Общее количество лейкоцитов колеблется в широких
пределах — от уровня лейкопении до 100-300 • Ю^/л (более высокие
показатели фиксируются редко). Лейкоцитоз в момент первичной
диагностики острого лейкоза наблюдается менее чем в 1/3 случаев,
обычно он сопровождается высоким содержанием лейкемических
(бластных) клеток. Значительно чаще при первичном исследовании
крови количество лейкоцитов бывает нормальным или обнаружи¬
вается лейкопения с относительным лимфоцитозом. Обычно среди
лимфоидных элементов можно выявить бластные клетки, однако воз¬
можны случаи, когда типичные бластные клетки в крови отсутствуют.
Лейкопенические формы составляют 40—50% всех случаев острого
лейкоза, при этом количество нейтрофилов может уменьшаться до
катастрофических цифр (0,2—0,3 • ЮУл). Развитие цитопений (грану-
лоцитопения, анемия, тромбоцитопения) при остром лейкозе являет¬
ся следствием присущего этому заболеванию угнетения нормального
кроветворения.
2.2.2.7.2. Хронические лейкозы
Хронический миелолейкоз — опухоль, возникающая из полипотент-
ной стволовой клетки миелоидного ряда, что обусловливает вовле¬
чение в патологический процесс при этом заболевании клеточных
элементов всех рядов гемопоэза (эритроцитарного, гранулоцитарного
и мегакариоцитарного).
На долю хронического миелолейкоза приходится примерно 15—20%
всех случаев лейкозов. Заболевание встречается преимущественно у
пациентов в возрасте 40-60 лет, но могут болеть лица любого возраста.
Клинические проявления заболевания связаны с развитием ане¬
мии. Характерны сильный ночной пот и потеря массы тела. Болезнь
прогрессирует медленно в течение нескольких лет.
2.2. Общий анализ крови 189
Несмотря на поражение всех ростков костного мозга, основным
пролиферирующим ростком, характеризующимся безграничным
ростом при хроническом миелолейкозе, является гранулоцитарный.
Повышенная продукция мегакариоцитов и эритрокариоцитов менее
выражена и встречается реже.
Количество лейкоцитов в периферической крови варьирует от
20,0 до 500,0 • 109/л со сдвигом лейкоцитарной формулы влево до
миелоцитов, промиелоцитов и единичных миелобластов. Важный
гематологический признак, появляющийся уже на ранних этапах
болезни, — увеличение содержания базофилов, а также эозино¬
филов.
Хронический лимфолейкоз — наиболее часто встречающаяся
форма лейкозов. На его долю приходится около 30% всех случаев
лейкоза. Лейкозные клетки при хроническом лимфолейкозе про¬
исходят из одного предшественника (представляют собой моно-
клоновую пролиферацию). Клеточный субстрат болезни состоит
из морфологически зрелых лимфоцитов, в основном В-лимфоци-
тов (около 95%), реже Т-лимфоцитов. Особенностями лимфоцитов
при хроническом лимфолейкозе являются их функциональная
неполноценность, нарушение механизма антителообразования,
что способствует возникновению у больных различных инфекци¬
онных осложнений.
Заболевание встречается почти исключительно у лиц старше
50 лет. Около 25% больных на момент установления диагноза не
предъявляют никаких жалоб. Заболевание обнаруживают случайно
при проведении общего анализа крови у пациента.
В крови количество лейкоцитов может находится в пределах
10,0—150,0 • 109/л. Однако в ряде случаев от начала и до конца болезнь
протекает с лейкопенией (1,5-3,0 • 109/л). При дифференцированном
подсчете лейкоцитов на гематологическом анализаторе (или лейко¬
цитарной формуле) в крови содержание лимфоцитов доходит до 80 и
даже 99% (при более тяжелом течении). Количество эритроцитов и
гемоглобина в начальной стадии заболевания снижается незначитель¬
но, однако с течением времени развивается анемия. Тромбоцитопения
обычно появляется на поздних стадиях заболевания,
Болезнь прогрессирует медленно на протяжении нескольких лет.
Терминальная стадия хронического лимфолейкоза характеризует¬
ся инфекционными осложнениями, истощением, геморрагическим
синдромом и анемией.
190
Глава 2. Гематологические исследования
2.2.3. СКОРОСТЬ ОСЕДАНИЯ ЭРИТРОЦИТОВ
Определение скорости оседания эритроцитов (С‘ОЭ) является
составной частью общего анализа крови. Сущность анализа состоит в
том, что если взять пробу крови в пробирку с антикоагулянтом (чтобы
кровь не свернулась) и оставить ее в покое, то эритроциты начинают
медленно падать (оседать) на дно пробирки, оставляя над собой слой
жидкой плазмы. На этом феномене основано определение СОЭ.
В лаборатории стеклянную капиллярную трубку стандартной
длины заполняют кровью с антикоагулянтом и оставляют в верти¬
кальном положении на определенное время (обычно на 1 ч), В течение
этого времени эритроциты оседают, оставляя над собой столбик про¬
зрачной плазмы. Через 1 ч измеряют расстояние между верхней грани¬
цей плазмы и осевшими эритроцитами. Таким образом, расстояние,
пройденное оседающими эритроцитами за 1 ч, и является скоростью
оседания эритроцитов. Ее величину выражают в миллиметрах в час.
2.2.3.1. Факторы, определяющие скорость оседания эритроцитов
Скорость, с которой оседают эритроциты, представляет собой
феномен, который зависит от целого ряда факторов. Понимание
роли этих факторов имеет прямое отношение к той диагностической
информации, которую представляет определение СОЭ.
Во-первых, эритроциты опускаются на дно капилляра, так как
имеют большую плотность, чем плазма, в которой они взвешены.
Во-вторых, эритроциты несут на своей поверхности отрицательный
заряд, который определяют белки, связанные с ихмебраной. В резуль¬
тате у здоровых людей эритроциты падают вниз каждый сам по себе,
так как отрицательный заряд способствует их взаимному отталкива¬
нию. Если по какой-либо причине эритроциты перестают отталки¬
ваться друг от друга, то происходит их агрегация с формированием
монетных столбиков. Образование монетных столбиков и агрегация
эритроцитов, увеличивая массу оседающих частиц, ускоряют оседа¬
ние. Именно этот феномен встречается при многих патологических
процессах, сопровожающихся ускорением СОЭ.
Основным фактором, влияюшим на образование монетных стол¬
биков из эритроци’юв, является белковый состав плазмы крови. Все
белковые молекулы снижают отрицательный заряд эритроцитов,
способствующий поддержанию их во взвешенном состоянии, но
2.2. Общий анализ крови 191
наибольшее влияние оказывают асимметричные молекулы — фиб¬
риноген, иммуноглобулины, а также гаптоглобин. Повышение кон¬
центрации в плазме крови этих белков способствует повышению
агрегации эритроцитов. Очевидно, что и заболевания, связанные с
увеличением уровня фибриногена, иммуноглобулинов и гаптоглоби¬
на, будут сопровождаться у<^корением СОЭ. На отрицательный заряд
эритроцитов влияют и другйе факторы: pH плазмы (ацидоз снижает
СОЭ, алкалоз повышает), ионный заряд плазмы, липиды, вязкость
крови, наличие антиэритроцитарных антител.
Число, форма и размер эритроцитов также влияют на величину
СОЭ. Эритропения ускоряет оседание, однако при выраженной сер-
повидности, сфероцитозе, анизоцитозе СОЭ может быть низкой (так
как форма клеток препятствует образованию монетных столбиков).
Повышение количества эритроцитов в крови (эритремия) снижает
СОЭ. Референтные величины СОЭ приведены в табл. 2-21 (Тиц Н.,
1997).
Таблица 2-21.
Референтные величины СОЭ
Возрастная группа
СОЭ, мм/ч
Новорожденные
0-2
Младенцы до 6 мес
12-17
Женщины моложе 60 лет
До 12
Женщины старше 60 лет
До 20
Мужчины моложе 60 лет
До 8
Мужчины старше 60 лет
До 15
При определении по Вестергрену
До 20
В последние годы активно используется международный стандарт
определения СОЭ — метод Вестергрена. В этом методе применяют
капилляры длиной 200 мм, что повышает чувствительность.
СОЭ постепенно повышается с возрастом, примерно на 0,8 мм/ч
каждые 5 лет. У беременных СОЭ обычно повышена, начиная с 4-го
месяца беременности, к ес концу она достигает пика — 40-50 мм/ч и
возвращается к норме после родов.
СОЭ не является специфическим показателем для какого-либо
определенного заболевания. Однако нередко при патологии ее изме¬
192 Глава 2. Гематологические исследования
нения имеют диагностическое и прогностическое значение и могут
служить показателем эффективности проводимой терапии.
2.2.З.2. Причины повышения скорости оседания эритроцитов
Наряду с повышением температуры тела и ускорением пульса
возрастание СОЭ встречается при многих заболеваниях. Изменение
состава белков плазмы и их концентрации, которые являются основ¬
ной причиной повышения СОЭ, — признак любого заболевания,
связанного со значительным повреждением тканей, воспалением,
инфекцией или злокачественной опухолью. Несмотря на то что в
ряде случаев СОЭ при этих состояниях может оставаться в пределах
нормы, в целом чем выше СОЭ, тем больше вероятность наличия у
больного повреждения тканей, воспалительного, инфекционного или
онкологического заболевания. Наряду с лейкоцитозом и соответс¬
твующими изменениями лейкоцитарной формулы повышение СОЭ
служит достоверным признаком наличия в организме инфекционных
и воспалительных процессов. В остром периоде при прогрессирова¬
нии инфекционного процесса происходит увеличение СОЭ, в период
выздоровления СОЭ замедляется, но несколько медленнее по сравне¬
нию со скоростью уменьшения лейкоцитарной реакции.
Воспалительные заболевания. Любой воспалительный процесс в
организме сопровождается повышенным синтезом белков плазмы
(белки острой фазы), включая фибриноген, что способствует фор¬
мированию монетных столбиков эритроцитов и ускорению СОЭ.
Поэтому определение СОЭ широко используют в клинической прак¬
тике для подтверждения воспаления при диагностике таких хрони¬
ческих заболеваний, как ревматоидный артрит, болезнь Крона, язвен¬
ный колит. Измерение СОЭ позволяет определить стадию заболевания
(обострение или ремиссия), оценить его активность и эффективность
лечения. Повышение СОЭ указывает на активный воспалительный
процесс у больного и, следовательно, отсутствие реакции на проводи¬
мую терапию. Наоборот, снижение СОЭ свидетельствует о стихании
воспаления в ответ на лечение.
Инфекционные заболевания. При всех инфекционных заболева¬
ниях иммунная система реагирует повышением продукции антител
(иммуноглобулинов). Повышенная концентрация иммуноглобулинов
в крови — одна из причин, увеличивающих склонность эритроци¬
тов к агрегации и образованию монетных столбиков. Поэтому все
инфекционные заболевания могут сопровождаться ускорением СОЭ.
2.2. Общий анализ крови 193
При этом бактериальные инфекции чаще, чем вирусные, сопровож¬
даются повышением СОЭ. Особенно высокая СОЭ наблюдается при
хронических инфекциях (подострый бактериальный эндокардит).
Повторные определения СОЭ позволяют оценить динамику течения
инфекционного процессии эффективность лечения.
Онкологические заболевания. У большинства больных с различ¬
ными формами злокачсствс1^ных опухолей СОЭ повышена. Однако
повышение отмечается не у всех пациентов, поэтому измерение СОЭ
не используют для диагностики онкологических заболеваний. Но в
отсутствие воспалите.льного или инфекционного заболевания значи¬
тельное повышение СОЭ (выше 75 мм/ч) должно вызвать насторожен¬
ность в отношении наличия злокачественной опухоли.
Особенно выраженное ускорение СОЭ (60-80 мм/ч) характерно для
парапротеинемических гемобластозов (миеломная болезнь, болезнь
Вальдеиетрема). Миеломная болезнь — злокачественное заболевание
котного мозга с неконтролируемой пролиферацией плазматических
клеток, вызывающей разрушение костей и боли в костях. Атипичные
плазма! ические клетки синтезируют огромное количество патоло¬
гических иммуноглобулинов (парапротеинов) в ущерб нормальным
антителам. Парапротеины усиливают образование монетных столби¬
ков эритроцитов и повышают СОЭ.
Ускорение СОЭ наблюдается почти у всех больных при злокачест¬
венном заболевании лимфатических узлов — болезни Ходжкина.
Повреждение тканей. Ряд заболеваний, при которых происходит
повреждение тканей, сопровождаются ускорением СОЭ. Например,
инфаркт миокарда вызывает повреждение миокарда. Последующий
воспалительный ответ на это повреждение включает синтез белков
острой фазы (в том числе фибриногена), что усиливает агрегацию
эритроцитов и увеличивает СОЭ. Аналогичная ситуация возникает
при остром деструктивном панкреатите.
2.2.З.З. Причины снижения скорости оседания эритроцитов
Снижение СОЭ встречается в клинической практике значитель¬
но реже и не имеет большого клинического значения. Наиболее часто
снижение СОЭ выявляют при эритремии и реактивных эритропитозах
(вследствие увеличения количества эритроцитов), выраженной недоста¬
точности кровообращения, серповидно-клеточной анемии (форма клеток
препятствует образованию монетных столбиков), механической желтухе
(предположительно связано с накоплением в крови желчных кислот).
194 Глава 2. Гематологические исследования
2.2А. Тромбоциты
Кровь постоянно движется по системе артериальных и венозных
сосудов. Одиако при возникновении повреждения ст’енки сосуда или
ее разрыве кровь может вытечь через возникшее повреждение из раны.
Препятствуют этому присутствующие в крови мелкие клетки — тром¬
боциты. Важнейшая роль тромбоцитов определяется их участием в
свертывании крови, образовании сгустка — тромба, который, подоб¬
но пробке, запирает зияющий просвет поврежденного кровеносного
сосуда. Таким образом, тромбоциты выполняют жизненно важную
функцию в организме человека.
2.2.4.1. Структура и функции тромбоцитов
Воспроизводство тромбоцитов (кровяных пластинок) происходит
в костном мозге из стволовых клеток. Непосредственно тромбоциты
образуются из цитоплазмы мегакариоцитов. Продолжительность их
жизни в периферической крови составляет 10 дней, поэтому костный
мозг постоянно воспроизводит необходимое количество кровяных
пластинок.
Тромбоциты — это безъядерные клетки диаметром 2-4 мкм. Они
выполняют ангиотрофическую, адгезивно-агрегационную функции,
участвуют в процессах свертывания и фибринолиза, обеспечивают
ретракцию кровяного сгустка. Тромбоциты способны переносить на
своей мембране циркулирующие иммунные комплексы, поддержи¬
вать спазм сосудов. Однако главная функция тромбоцитов — форми¬
рование первичного (тромбонитарного) тромба для закрытия отверс¬
тия, появившегося в стенке сосуда в результате его повреждения. Этот
процесс протекает в несколько этапов. На первом этапе происходит
адгезия (прилипайие) тромбоцитов к поврежденной сосудистой стен¬
ке. По мере адгезии тромбоциты выделяют много веществ (АДФ,
тромбоксан А2), которые заставляют их приклеиваться друг к другу и
увеличиваться в размерах. В результате наступает второй этап — агре¬
гация тромбоцитов. Он продолжается до тех пор, пока масса склеив¬
шихся тромбоцитов не станет достаточной, чтобы закрыть дефект в
сосудистой стенке.
2.2.4.2. Референтные величины количества тромбоцитов
В практике клинико-диагностических лабораторий тромбоциты
в крови подсчитывают либо с помошью гематологических анализа¬
2.2. Общий анализ крови /95
торов, либо под микроскопом в мазках крови или камере Горяева.
Подсчет количества тромбоцитов с помощью гематологического ана¬
лизатора отличается большей точностью. Это имеет очень важное зна¬
чение, когда количество тромбоцитов в крови значительно снижено.
Референтные величины содержания тромбоцитов (PLT) в крови:
новорожденные 1—10 дней — (99-421) • ЮУл, старше 10 дней и взрос¬
лые - (180-320) • 109/л. '
Физиологические колебания количества тромбоцитов в крови в
течение суток составляют около 10%. У женщин во время менструации
количество тромбоцитов может уменьшиться на 25—50%.
Снижение количества тромбоцитов в крови менее 180 • Ю^/л назы¬
вается тромбоцитопенией, а увеличение выше 320 * ЮУл — тромбоци¬
тозом.
2.2.4,3. Причины снижения количества тромбоцитов
Снижение количества тромбоцитов в крови — тромбоцитопения —
может быть вызвано либо снижением продукции их в костном мозге, либо
повышенной деструкцией и/или использованием (потреблением) тромбо¬
цитов.
Тромбоцитопении, вызванные снижением образования тромбоцитов
(недостаточность кроветворения). Основными причинами данного
вида тромбоцитопении являются вирусные инфекции, интоксикации
(миелодепрессивные химические вещества и препараты, некоторые
антибиотики, уремия, болезни печени), ионизирующее облучение.
Нередко тромбоцитопения сопровождает злокачественные заболева¬
ния (острый лейкоз, апластическая анемия, метастазы рака и саркомы
в костный мозг). Снижение продукции тромбоцитов в костном мозге
проявляется тяжелой тромбоцитопенией, иногда до значений ниже
50 • 109/л. Мегалобластные анемии (дефицит витамина В,2 и фолиевой
кислоты) также сопровождаются тромбоцитопенией.
Тромбоцитопении, вызванные повышенной деструкцией тромбоци¬
тов. Наиболее частая причина усиленного разрушения тромбоцитов —
иммунная тромбоцитопсни ческая пурпура. Это аутоиммунная патоло¬
гия, связанная с образование аутоантител к собственным тромбоцитам.
Наиболее часто заболевание встречается у женщин молодого и среднего
возраста. Иммунная тромбоцитопеническая пурпура может быть идио-
патической (болезнь Верльгофа), когда причину образования аутоантител
установить не удается, и вторичной — при системной красной волчанке,
хроническом гепатите, хроническом лимфолейкозе, вирусном паротите,
!9в Глава 2. Гематологические исследования
ветряной оспе и других заболеваниях, а также у новорожденных в связи
с проникновением материнских аутоантител во внутреннюю среду орга¬
низма ребенка. Некоторые лекарственные средства также могут способс¬
твовать образованию антитромбоцитарных антител.
Аутоантитела связываются с тромбоцитами, вызывая их преждев¬
ременное разрушение. При этом продолжительность жизни тром¬
боцитов сокращается с 10 дней до нескольких часов. В этих случаях
костный мозг не справляется с воспроизводством тромбоцитов, и
развивается тромбоцитопения.
При спленомегалии (увеличение селезенки) любого происхожде¬
ния и развитии гиперспленизма (увеличенная селезенка усиленно
разрушает тромбоциты) может также наблюдаться тромбоцитопения
(например, при циррозе печени).
Тромбоцитопении, вызванные повышенным потреблением тром¬
боцитов. Наиболее частой причиной повышенного потребления
тромбоцитов является синдром диссеминированного внутрисо¬
судистого свертывания крови (ДВС-синдром). ДВС-синдром —
осложнение многих серьезных заболеваний и патологических
состояний: сепсиса, травм, тяжелых повреждений тканей при
операциях, ожогах, тромбоэмболии. Механические повреждения
тромбоцитов при протезировании клапанов сердца, экстракорпо¬
ральном кровообращении также способствуют повышенному пот¬
реблению тромбоцитов, в результате резко снижается количество
тромбоцитов в крови.
Главная функция тромбоцитов состоит в обеспечении нормаль¬
ного гемостаза, поэтому больные с тромбоцитопенией подвержены
риску кровоточений. Спонтанные кровотечения возникают, если
количество тромбоцитов в крови уменьшается ниже 50 ■ ШУл. Смерть
при кровотечении почти неизбежна, если количество тромбоцитов
снижается до 5 • ЮУл. Поэтому тромбоцитопения — это грозное
осложнение, требующее в ряде случаев немедленной коррекции.
Показанием к неотложной коррекции является следующий уровень
тромбоцитов в крови;
• ниже (10—15) • 109/л при отсутствии других факторов риска кро¬
вотечения;
• ниже 20 - 109/л при наличии других факторов риска кровоте¬
чения;
• ниже 50 • 109/л при хирургических вмешательствах или кровоте¬
чении.
2.3. Ретикулоциты 197
2.2.4.4. Причины повышения количества тромбоцитов
Повышение количества тромбоцитов в крови (тромбоцитов) может
быть первичным, т.е. являться результатом первичной пролиферации
мегакариоцитов (злокачественного заболевания костного мозга) и вто¬
ричным, реактивным, возникающи.м на фоне какого-либо заболевания.
Первичные тромбоцитЬзы. причиной первичного тромбоцитоза
могут быть эссенциальная тромбоцитемия (количество тромбоцитов
может возрастать до 2000—4000 • ЮУл и более), эритремия, хроничес¬
кий миелолейкоз и миелофиброз.
Вторичные тромбоцитозы могут возникать при остром ревматизме,
ревматоидном артрите, туберкулезе, язвенном колите, остеомиелите,
амилоидозе, остром кровотечении, карциноме, лимфогранулематозе,
лимфоме, после спленэктомии (в течение 2 мес и более), остром гемо¬
лизе, после операций (в течение 2 нед).
Тромбоцитоз несет с собой риск развития тромбозов, в клини¬
ческой практике этот риск становится реальным, когда количество
тромбоцитов в крови достигает 1000 • ЮУл.
2.3. РЕТИКУЛОЦИТЫ
Подсчет количества ретикулоцитов не входит в общий анализ крови
и является важным дополнительным исследованием, характеризую¬
щим функциональное состояние эритропоэза. Традиционно количес¬
тво ретикулоцитов подсчитывают в мазке крови и выражают в процен¬
тах к числу эритроцитов. Современные гематологические анализаторы
могут осуществлять отдельный автоматический подсчет рстикулоци-
тов, результат которого выражают в количестве клеток на 1 л крови.
2.3.1. РЕФЕРЕНТНЫЕ ВЕЛИЧИНЫ КОЛИЧЕСТВА РЕТИКУЛОЦИТОВ
Ретикулоциты — молодые формы эритроцитов, содержащие зер¬
нисто-нитчатую субстанцию, выявляемую при помощи специаль¬
ной (суправитальной) окраски. Время созревания ретикулоцитов
4-5 дней, из них в течение 3 дней они созревают в периферической
крови, после чего становятся зрелыми эритроцитами.
198 Глава 2. Гематологические исследования
Референтные величины содержания ретикулоцитов составляют
0,2—1% от всех циркулирующих в крови эритроцитов; с кровью цир¬
кулируют 30—70 ■ ЮУл ретикулоцитов.
Количество ретикулоцитов в крови отражает регенеративные
свойства костного мозга. Увеличение количества ретикулоцитов
наблюдается при усиленной регенерации кроветворения, а сниже¬
ние — при угнетении регенераторной функции костного мозга.
2.3.2. ПРИЧИНЫ ОТКЛОНЕНИЯ КОЛИЧЕСТВА
РЕТИКУЛОЦИТОВ ОТ НОРМЫ
Повышение количества ретикулоцитов в крови обычно свиде¬
тельствует об активации кроветворения (гемопоэза) в костном мозге.
Поэтому повышение количества ретикулоцитов наблюдается после
кровопотери, при гемолитических анемиях, особенно в период криза
(количество ретикулоцитов может повышаться до 20—30% и более), а
также на фоне лечения цианокоба л амином В12-дефицитной анемии
(ретикулоцитарный криз — повышения количества ретикулоцитов
на 5-9-й день лечения). Ретикулоцитарный криз отмечается также на
3-5-й день лечения железодефицитной анемии парентеральным вве¬
дением препаратов железа.
Снижение количества ретикулоцитов в крови отражает угнетение
гемопоэза. Такое происходит при апластической анемии, анемиях,
вызванных недостаточностью железа, витамина В,2 и фолиевой кисло¬
ты, метастазах новообразований в костный мозг и кости, а также при
приеме цитостатических препаратов и ионизирующем облучении.
Глава 3.
ОБЩЕКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Термин «обшеклинические» применяется для тех видов лаборатор¬
ных исследований, которые предоставляют информацию о клеточном
составе и ряде физико-химических свойств анализируемого биоло¬
гического материала. Эта лабораторная информация в большинстве
случаев не указывает на наличие определенного заболевания, но
позволяет существенно сузить диагностический поиск, установить
характер и направленность патологического процесса, а также оце¬
нить эффективность проводимого лечения.
в клинической практике лабораторному общеклиническому ана¬
лизу может быть подвергнут практически любой вид биологического
материала, полученный от пациента. Поэтому общеклинические
исследования могут быть полезны при самом широком спектре забо¬
леваний и состояний, что является еще одной стороной понимания
термина «общеклинические», Данная глава посвящена анализу вкла¬
да общеклинических исследований в диагностику и мониторинг лече¬
ния многих заболеваний.
3.1. ИССЛЕДОВАНИЕ МОЧИ
Моча является конечным продуктом деятельности почек, с мочой из
организма выводятся многочисленные конечные продукты метаболизма
(так называемые шлаки) белков, нуклеиновых кислот. Исследование мочи
широко используется в клинической практике для скрининга и диагнос¬
тики заболеваний почек и мочевых путей. Прежде всего для диагностики
этих заболеваний исследуют клеточный состав мочи. Но во многих слу¬
чаях изменение содержания клеточных э.тементов в моче наступает при
уже далеко зашедшем патологическом процессе, когда, например, прони¬
цаемость почечного фильтра повышается настолько, что крупные клетки
(такие, как эритроциты и лейкоциты) начинают относительно легко
перемещаться из крови в мочу. Несравненно больше сведений о природе,
начальных стадиях и развитии заболевания дает определение отдельных
200
Глава 3. Общеклинические исследования
химических компонетов в моче. Известно, что в основе большого числа
заболеваний лежит нарушение обмена веществ. Поэтому нередко иссле¬
дование мочи необходимо для того, чтобы установить характерные для
болезни отклонения в обмене веществ и на основании этого облегчить
постановку правильного клинического диагноза (например, обнаруже¬
ние глюкозы в моче позволяет заподозрить у больного сахарный диабет).
Выявление и количественное определение в моче отдельных ее компо¬
нентов способствуют распознаванию многих заболеваний.
3.1.1. ОБРАЗОВАНИЕ И ВЫВЕДЕНИЕ МОЧИ
Образование мочи связано с деятельностью почек. Почки выпол¬
няют в организме человека три основные функции;
• выведение отходов жизнедеятельности организма;
• поддержание объема и состава внеклеточной жидкости (объема
циркулирующей крови и межклеточной жидкости);
• синтез гормонов: эритропоэтина для регуляции гемопоэза в костном
мозге, ренина д.гя поддержания артериального давления и кальцит-
риола для поддержания гомеостаза калытия в организме человека.
Для того, чтобы яснее представить работу почек, необходимо озна¬
комиться с их строением, так как функциональная активность органа
тесно связана с его структурны¬
ми особенностями. Почки рас¬
полагаются по обеим сторонам
поясничного отдела позвоноч¬
ника. На внутренней их стороне
имеется углубление, в котором
находятся сосуды и нервы, окру¬
женные соединительной тканью.
Размер почки взрослого человека
около 11*5 см, масса в среднем
200-250 г. На продольном раз¬
резе почки различают два слоя:
корковый темно-красный и моз¬
говой бо.тее светлый (рис. 3-1).
Почки представляют собой
парный орган, функциональ¬
ной единицей которого является
нефрон. Каждый нефрон состо-
Рис. 3-1. Строение почки:
1 — корковый слой; 2 — мозго¬
вой слой; 3 — почечная лоханка;
4 — мочеточник
З.К Исследование мочи
201
ИТ из гломерулярного клубочка
и почечных канальцев (рис. 3-2).
Главной функцией клубочков
является фильтрация воды и вы¬
водимых продуктов метаболиз¬
ма (низкомолекулярных компо¬
нентов крови) с одновремени^ым
удержанием клеток и высоко¬
молекулярных ее компонентов.
Моча — продукт почечной филь¬
трации — представляет собой
водный раствор этих удаляемых
продуктов.
в настоящее время мочеоб-
разование рассматривают как
сложный процесс, состоящий из
двух этапов: фильтрации (уль¬
трафильтрация) и реабсорбции
(обратное всасывание),
В каждой почке содер¬
жится около 1 млн нефронов.
Образование мочи начинается в
гломерулярных клубочках, через
которые кровь проходит со ско¬
ростью 1,25 л/мин. Движущей
силой фильтрации является гид¬
ростатическое давление, кото¬
рое регулируется приносящей и
выносящей артериолами и обес¬
печивается артериальным дав¬
лением. Клубочковый фильтрат
формируется путем п рода влива¬
ния крови через капилляры клубочков, позволяет воде и другим
веществам с низкой или средней молекулярной массой (в том числе
мочевине и креатин и ну) проходить из крови в боуменову капсулу
(капсулу клубочка). Образующийся фильтрат (клубочковый филь¬
трат) представляет собой по сути дела плазму, освобожденную от кле¬
ток крови и белков (белки и клетки крови слишком велики, для того
чтобы пройти через почечный фильтр).
Рис. 3-2. Структура нефрона:
1 — приносящая клубочковая арте-
риола; 2 — выносяшая клубочко¬
вая артериола; 3 — клубочковая
капиллярная сеть; 4 — внутренняя и
наружная части капсулы почечного
клубочка (Шумлянского—Боумена);
5 — просвет капсулы; 6 — прокси-
.мальный каналец; 7 — нисходящая
часть петли Генле; 8 — восходящая
часть петли Генле; 9 — дистальный
каналец; 10 — собирательная трубка
202 Глава 3, Общеклинические исследования
Скорость, с которой образуется этот фильтрат, называется скоро¬
стью клубочковой фильтрации. У здорового человека она составля¬
ет в среднем 125 мл/мин (180 л/сут). Фильтрация ттроисходит через
полупроницаемую стенку капилляров клубочка, которая в основном
непроницаема для белков и крупных молекул. Таким образом, филь¬
трат не содержит белок и клеточные элементов. При прохождении
клубочкового фильтрата через канальцы нефрона его состав и объем
существенно изменяются.
Второй этап образования мочи заключается в том, что первичная
моча проходит по сложной системе канальцев, где последовательно из
фильтрата всасываются нужные для организма вещества и вода. Около
99% профильтрованных клубочками воды и целого ряда веществ
(например, аминокислот, средних и низкомолекулярных полипепти¬
дов, электролитов, глюкозы и др.) реабсорбируется обратно в кровь.
Если бы в почках отсутствовали механизмы реабсорбции продуктов
из клубочкового фильтрата, то за несколько часов организм потерял
бы весь объем крови.
Почки способны также секретировать некоторые вещества непос¬
редственно из крови (минуя механизмы клубочковой фильтрации)
в канальцы в ходе конечного этапа регуляции состава мочи. Точное
количество ре абсорбируемой воды и различных веществ зависит от
метаболических потребностей организма в данный момент.
Моча является конечным продуктом трех процессов: клубочковой
фильтрации, канальцевой реабсорбции и секреции. Она образуется со
скоростью примерно 1 мл/мин или 1,5 л/сут.
Таким образом, за сутки человек выделяет только около 1,5 л мочи,
или менее 1% количества плазмы крови, профильтровавшейся в клу¬
бочках, а 99% реабсорбируется в канальцах почек и возвращается в
кровоток, ВыведЩгис мочи наружу проходит по мочевым путям.
Мочевая система состоит из почек и собственно мочевыводящих
путей — мочеточников, мочевого пузыря и уретры (рис. 3-3).
Окончательная моча изливается в малые чашечки, представля¬
ющие собой выросты лоханки, которые охватывают сосочек почки,
Две-три малые чашечки сливаются в большие, а они в свою очередь
образуют лоханку почки. Лоханка переходит в мочеточник.
Мочеточник — парный трубчатый орган, сообщающий лоханку
почки с мочевым пузырем. Длина мочеточника 30—35 см, диаметр
неравномерный: у места отхождения от лоханки, при входе в малый таз
и при прохождении через стенку мочевого пузыря, он равен 3-4 .мм,
З.К Исследование мочи
203
Мочеточники
Мочеиспуска¬
тельный канал
(урерта)
/
Рис. 3-3. Строение мочевой системы
а между этими сужениями диаметр его достигает 9 мм. Мочеточник
состоит из слизистой, мышечной и наружной соединительнотканной
оболочек. Моча передвигается по мочеточнику благодаря перисталь¬
тике его мышечной оболочки. Волна сокращений повторяется 1—5 раз
в минуту. Мочеточники соединяются е основанием мочевого пузыря
под углом, а моча поступает в пузырь толчкообразно благодаря сокра¬
щению мочеточников. Косое расположение мочеточников по отно¬
шению к мочевому пузырю обеспечивает перекрывание их отверстий
между перистальтическими сокращениями. Это предупреждает пос¬
тупление мочи в обратном направлении.
Мочевой пузырь — мешкообразный орган, имеющий верхушку.
Ниже верхушки до места впадения мочеточников в мочевой пузырь
выделяется тело, от устьев мочеточника до начала мочеиспускатель¬
ного канала — дно. Стенка состоит из слизистой, мышечной и соеди¬
нительнотканной оболочек. Основная функция мочевого пузыря
состоит в накоплении мочи и опорожнении его через мочеиспуска¬
тельный канал.
Гладкие мышцы пузыря у начала внутреннего отверстия мочеис¬
пускательного канала формируют сфинктер. При этом мышечные
пучки охватывают дно треугольника мочевого пузыря, затем по его
204 Глава 3. Обще клинические исследования
боковым сторонам достигают отверстия мочеиспускательного канала
и перекидываются через переднюю стенку канала в виде петли. У жен¬
щин внутренний сфинктер сращен с передней стенкой влагалища,
поэтому разрыв влагалища часто вызывает повреждение сфинктера и
нарушение мочеиспускания. Замыкание мочеиспускательного канала
происходит при сокращении мышечной петли. В эюм случае пере¬
дняя стенка .мочеиспускательного канала прижимается к его задней
стенке, а также к пузырному язычку. Сфинктер сокращается рефлек-
торно без участия сознания человека.
Перед появлением позыва на мочеиспускание в мочевом пузыре
взрослых накапливается 150—400 мл мочи.
Рефлекс мочеиспускания возникает тогда, когда давление в полос¬
ти мочевого пузыря превышает 15 см вод. ст. При этом давлении
происходит раздражение нервных окончаний афферентных волокон,
которые в составе тазовых и подчревных нервов передают импульсы в
крестцовые сегменты спинного мозга. Из спинного мозга направля¬
ются ответные импульсы к мышце стенки мочевого пузыря, вызывая
ее сокращение. После опорожнения мочевого пузыря парасимпати¬
ческий центр угнетается, а симпатический возбуждается. В результате
тонус стенки пузыря ослабевает, а сфинктер сокращается.
Уретра — мочеиспускательный канал,через который мочавыделяет-
ся наружу. Мочеиспускательный канал женщины имеет длину 3-4 см,
диаметр 7—11 мм. Канал слегка изогнут, так как проходит через
мочеполовую диафрагму промежности, располагаясь под симфизом.
В месте прохождения канала через промежность имеется наружный
сфинктер, подчиненный сознанию человека. Мужской мочеиспуска¬
тельный канал имеет длину около 18 см; его большая часть преиму¬
щественно проходит по губчатому телу полового члена. Канал начи¬
нается в мочевом пузыре внутренним отверстием и заканчивается на
головке полового члена.
Лабораторные тесты, которые используются в клинической прак¬
тике для оценки функции почек, делятся на те, которые определяют
скорость клубочковой фильтрации, и те, которые позволяют оцени¬
вать проницаемость мембраны гломерулярного фильтра. Скорость
клубочковой фильтрации обычно оценивают по клиренсу креатини¬
на или пробе Реберга—Тареева (более подробно см. гл. 5). Нарушение
целостности, а соответственно и проницаемости гломерулярного
фильтра клубочка приводит к фильтрации в мочу обычно задержи¬
ваемых почками крупных .молекул — молекул белков, а также клеток
3.1. Исследование мочи 205
крови — эритроцитов и лейкоцитов, проведение общего анализа мочи
позволяет легко обнаружить эти компоненты и выявить нарушение
проницаемости мембран гломерулярного фильтра почек.
Однако прежде чем быть выведенной наружу, моча проходит по
мочевым путям. Если мочевывые пути повреждаются каким-либо
патологическим процессом (например, инфекционным воспалением
или злокачественной опухолью), выведение мочи задерживается, а
элементы патологического процесса (лейкоциты, эритроциты, опухо¬
левые клетки) попадают в мочу. Исследование мочи позволяет выяв¬
лять эти элементы и тем самым способствовать диагностике заболе¬
вания. Самым простым исследованием для общей оценки функции
почек является общий анализ мочи.
3.1.2. ОБЩИЙ АНАЛИЗ МОЧИ
В большинстве случаев общий анализ мочи назначают пациен¬
там как скрининговое исследование для оценки функционального
состояния почек. Однако в ряде клинических ситуаций результаты
общего анализа мочи имеют важное диагностическое значение Его
неоценимое достоинство состоит в том, что он включает определение
физических свойств, химического состава и микроскопическое иссле¬
дование осадка мочи. Тем самым результаты общего анализа мочи
несут информацию об изменениях как клеточного состава мочи, так и
ее химических компонентов.
в настоящее время определение физических свойств и хими¬
ческого состава мочи проводят на анализаторах с использованием
тест-полосок, которые позволяют получить информацию о 8-12
параметрах мочи. Тест-полоски в большинстве случаев предоставля¬
ют достаточно точную информацию о физико-химических свойствах
мочи, необходимую для правильной установки диагноза и оценки
эффективности лечения. Ниже рассматриваются основные парамет¬
ры мочи, которые определяют в лаборатории.
При изучении физических свойств мочи оценивают ее количество,
цвет, прозрачность, плотность.
Количество мочи. У здоровыхлюдей суточное количество мочи состав¬
ляет 0,8—2 л, в среднем около 1500 мл. Увеличение суточного диуреза
наблюдается при схождении отеков, сахарном и несахарном диабете.
Уменьшение суточного диуреза является следствием обильного пото¬
206
Глава 3. Общеклинические исследования
отделения, профузного поноса и рвоты. Наиболее частой причиной
уменьшения суточного диуреза является нарастание отеков вне зави¬
симости от их происхождения. Выраженное снижение диуреза — оли-
гурия (менее 600 мл/сут), отсутствие мочи или ее количество не более
50 мл/сут — анурия. В соответствии с причиной анурии выделяют
следуютиие ее формы. ТТреренальная анурия возникает вследствие вне-
почечных причин: при тяжелых кровопотерях, острой сердечно-сосу¬
дистой недостаточности (шок), неукротимой рвоте, тяжелом поносе.
Ренальная (секреторная) анурия связана с патологическим процессом
в самих почках и может возникнуть при острых нефритах, некронефро-
зах, переливании несовместимой крови, тяжелых хронических заболе¬
ваниях почек. Обтурационная (экскреторная) анурия связана с полной
закупоркой обоих .мочеточников камнями почек или сдавлением их
опухолями, развивающимися вблизи мочеточников (рак матки, при¬
датков, простаты, мочевого пузыря, метастазы из других органов).
Цвет мочи. У здоровых людей цвет мочи соломенно-желтый. Он
обусловлен содержанием в ней мочевого пигмента — урохрома.
Изменение цвета может быть результатом выделения красящих соеди¬
нений, образующихся в ходе органических изменений или под воз¬
действием компонентов рациона питания, принимавшихся лекарств,
контрастных средств.
Красный цвет или цвет .мясных помоев в основном может быть
обусловлен макрогематурией или гемоглобинурией, реже — анемией
в результате свинцовой интоксикации, а также наличием в моче мио-
глобина, порфирина, лекарственных средств или их метаболитов.
Темно-желтый цвет, иногда с зеленым или зеленовато-бурым
оттенком обусловлен выделением с мочой билирубина при паренхи¬
матозной и механической желтухе.
Зеленовато-желтый цвет связан с большим содержанием гноя в моче.
Грязно-коричневый или серый цвет обусловлен пиурией при
щелочной реакции мочи.
Темный, почти черный цвет обусловлен гемоглобинурией при
острой гемолитической анемии или гомогентизиновой кислотой при
алкаптопурии, иногда меланином при меланоме, меланосаркоме.
Беловатый цвет обусловлен наличием в моче большого количес¬
тва фосфатов (фосфатурия) или вследствие липурии — выделения с
мочой жира при инвазии паразита РПаг1а.
Плотность мочи, У здоровых людей колебания плотности мочи в
течение суток составляют 1,008-1,025 г/л и выше. Основные причины,
ЗА. Исследование мочи 207
приводящие к увеличению плотности мочи (выше 1,030 г/л), связаны
с появлением в ней различных веществ, которые в норме отсутству¬
ют. Наиболее часто плотность мочи повышается при наличии в моче
глюкозы (сахарный диабет), белка в значительных количествах (забо¬
левания почек), лекарственных средств и их метаболитов (например,
манитола или декстрана при их внутривенном введении). Постоянно
низкая плотность мочи (ниже 1,015 г/л) — это признак почечного
(несахарного диабета) или хронической почечной недостаточности.
Химическое исследование мочи. Наиболее часто в лаборатории с
помощью тест-полосок определяют pH мочи, наличие белка, глюкозы,
кетоновых тел, билирубина, уробилиногена, нитритов, а также полу¬
количественно оценивают содержание лейкоцитов и эритроцитов.
pH мочи. В норме pH мочи обычно слабокислая, но может иметь
разную реакцию в пределах 4,5—8,0. Снижение pH мочи (pH око¬
ло 5,0) наблюдают при метаболическом и дыхательном ацидозе, гипо-
калиемии, обезвоживании, сахарном диабете. Повышение pH мочи
(pH >7,0) характерно для метаболического и дыхательного алкалоза,
гиперкалиемии, а также отмечается у людей, употребляющих в основ¬
ном растительную пишу.
Белок в моче. У здоровых людей белок в моче отсутствует или его
концентрация составляет менее 0,002 г/л. Появление белка в моче
называется протеи ну рией. Определение белка в моче тест-полосками
служит ориентировочным полуколичественным методом выявления
иротеинурии. При обнаружении белка в моче для установления его
точной концентрации лаборатория использует более точные и сложные
аналитические методы и выражает содержание белка количественно.
Если в моче при проведении общего анализа обычными методами
обнаружены следы белка или концентрация его составляет 0,033 г/л,
необходимо повторить анализ, поскольку даже минимальное коли¬
чество белка должно настораживать в отношении возможного заболе¬
вания почек. В сомнительных случаях следует определять суточную
потерю белка с мочой.
Различают две основные группы протеинурии: физиологическую
и патологическую.
К физиологической протеинурии относятся случаи временного
появления белка в моче, не связанные с заболеваниями. Такая проте-
инурия может встречаться у здоровых людей после приема большого
количества пищи, богатой белками, после сильных физических напря¬
жений, эмоциональных переживаний, эпилептических приступов.
208 Глава 3. Общеклинические исследования
Физиологической является ортостатическая, или юношеская, протеи-
нурия, нередко встречающаяся у детей и подростков, чаще при наличии
у них лордозов, и проходящая с годами.
Патологическая протеи ну рия — это всегда симптом какого-либо
заболевания. По механизму своего развития патологическая протеи¬
ну рия делится на почечную и внепочечную (преренальную и постре-
нальную).
Внепочечная протеинурия обусловлена примесью белка, выделяю¬
щегося мочевыводящими путями и половыми органами; наблюдается
при циститах, пиелитах, простатитах, уретритах, вульвовагинитах.
Величина такой протеинурии редко превышает 1 г/л.
При почечной протеинурии белок попадает в мочу в результате
повреждения структурной единицы паренхимы почки — нефрона.
Почечная протеинурия в большинстве случаев связана с повышенной
проницаемостью гломерул.
Почечная протеинурия наиболее часто встречается при острых и
хронических гломерулонефритах, острых и хронических пиелонефри¬
тах, нефропатии беременных, лихорадочных состояниях, выражен¬
ной хронической сердечной недостаточности, амилоидозе почек,
липоидном нефрозе, туберкулезе почки, геморрагической лихорадке,
геморрагическом васкулите, выраженной анемии, гипертонической
болезни.
Почечная протеинурия, связанная с гемодинамическим стрес¬
сом, может наблюдаться у детей на фоне лихорадки, эмоционального
стресса, застойной сердечной недостаточности или эссенциальной
гипертензии, а также после охлаждения. Несмотря на то, что почеч¬
ная протеинурия не связана напрямую с первичным поражением
почек и обычно исчезает после устранения вызвавшей ее причины,
в период действия патологических факторов в почках выявляются
патологические изменении. Поэтому обнаружение белка в моче у
пациента — это всегда серьезный симптом.
Глюкоза в моче. В норме глюкоза в моче отсутствует (клиническую
оценку обнаружения глюкозы в моче см. в гл 5).
Кетоновые тела в моче. В норме кетоновые тела в моче отсутствуют.
Наиболее частая причина появления кетоновых тел в моче (кетону-
рия) — это выраженная декомпенсация сахарного диабета Т типа.
Резко выраженная кетонурия отмечается при гиперкетонемической
диабетической коме. Помимо сахарного диабета, кетонурия может
выявляться при прекоматозных состояниях, церебральной коме,
3.1. Исследование мочи
209
длительном голодании, тяжелой лихорадке, алкогольной интокси¬
кации, гиперинсулинизме, гиперкатехолемии, в послеоперацион¬
ном периоде.
Билирубин в моче, в норме билирубин в моче отсутствует. Определение
билирубина в моче используют как экспресс-метод для дифферен¬
циальной диагностики гемолитической желтухи и желтухи другого
присхождения (паренхиматс/зной и механической). Билирубинурию
наблюдают главным образом при поражении паренхимы печени (парен¬
химатозная желтуха) и нарушении оттока желчи (обтурационная жел¬
туха). Для гемолитической желтухи билирубинурия нехарактерна, так
как непрямой билирубин не проходит через почечный фильтр.
Уробилиноген в моче. Верхняя граница референтной величины уро¬
билиногена в моче около 17 мкмоль/л (10 мг/л). В клинической прак¬
тике определение уробилинурии имеет значение:
• для выявления поражений паренхимы печени, особенно в случа¬
ях, протекающих без желтух (рис. 3-4);
* для дифференциальной диагностики желтухи (при механической
желтухе уробили-нурии нет).
Уробилиноген Билирубин
Дни болезни
Рис. 3-4. Выделение уробилиногена и билирубина с мочой при вирусном
гепати1'е А
Причины увеличения выделения уробилиногена с мочой
Повышение катаболизма гемоглобина: гемолитическая анемия,
внутрисосудистый гемолиз (переливание несовместимой крови,
инфекции, сепсис), пернициозная анемия, полицитемия, расса¬
сывание массивных гематом.
Увеличение образования уробилиногена в желудочно-кишечном
тракте (энтероколит, илсит).
210 Глава 3. Общеклинические исследования
• Увеличение образования и реабсорбции уробилиногена при
инфекции билиарной системы — холангитах,
• Повышение уробилиногена при нарушении функции печени:
вирусный гепатит (исключая тяжелые формы), хронический гепа¬
тит и цирроз печени, токсическое поражение печени (алкоголь¬
ное, ор1'аничсскими соединениями, токсинами при инфекциях
и сепсисе), другие причины печеночной недостаточности (после
инфаркта миокарда, сердечная и циркуляторная недостаточ¬
ность, опухоли печени).
• Повышение уробилиногена при шунтировании печени: цирроз
печени с портальной гипертензией, тромбоз, обструкция почеч¬
ной вены.
Нитриты в моче. В норме нитриты в моче отсутствуют. Escherichia
соИ, Proteus, Klebsiella, Aerobacter, Citrobacter, Salmonella, некоторые
энтерококки, стафилококки и другие патогенные бактерии восста¬
навливают присутствующие в моче нитраты в нитриты. Поэтому
обнаружение нитритов в моче свидетельствует об инфицировании
мочевого тракта.
Инфицирование мочевого тракта, выявляемое пробой на нитриты,
составляет у женщин 3—8%, у мужчин 0,5—2%, Высокий риск асимпто-
матических инфекций мочевого тракта и хронического пиелонефрита
у девушек и женщин, пожилых (старше 70 лет), больных аденомой
простаты, сахарным диабетом, подагрой, после урологических опера¬
ций или инструментальных процедур на мочевом тракте.
Лейкоциты в моче. В норме лейкоциты в моче при исследовании тест-
полосками отсутствуют. Тест положите.чен, если содержание лейко¬
цитов в моче превышает 10—20клетокв 1 мл (лeйкoцитypия).Лeйкoцитy-
pия — симптом воспаления почек и/или нижних отделов мочевого
тракта. Лейкоцитурил — наиболее характернь(й признакострого и хро¬
нического пиелонефрита, цистита, уретрита, камней в мочеточнике.
Эритроциты в моче. Физиологическая микрогематурия при иссле¬
довании тест-полосками составляет до 3 эритроцитов в 1 мкл мочи
(1—3 эритроцита в поле зрения при микроскопии), Гематурия — содер¬
жание эритроцитов свыше 5 в 1 мкл мочи — считается патологичес¬
ким признаком. Основные причины гематурии ~ почечные или уро¬
логические заболевания и геморрагические диатезы: камни, опухоли,
гломерулонефрит, пиелонефрит, геморрагические диатезы, инфекции
мочевого тракта, травма почек, артериальная гипертензия с вовлече¬
нием почечных сосудов, системная красная волчанка.
I
I
3.1. Исследование мочи 211
Ложноположительные результаты исследования мочи на наличие
крови тест-полосками могут иметь место при употреблении свеклы,
пищевых красителей, больших количеств витамина С, приеме лекарс¬
твенных средств (ибупрофен, сульфаметоксазол, нитрофурантоин,
рифампицин, Ь-допа, хинин, пиридиум), наличии в моче желчных
пигментов, миоглобина, порфиринов, при попадании в мочу крови во
время мснтруации. '
Определение лейкоцитурии, эритроцитурии (гемоглобина) и
бактериурии (нитриты в моче) с помощью тест-полосок, согласно
Рекомендация Европейской ассоциации урологов по лечению инфек¬
ций мочевыводящих путей и инфекций репродуктивной системы у
мужчин, для диагностики и оценки эффективности лечения острого
цистита и пиелонефрита является приемлемым методом.
Гемоглобин в моче. В норме гемоглобин в моче отсутствует. Появление
в моче гемоглобина — гемоглобинурия — наблюдается при тяже¬
лой гемолитической анемии, тяжелых отравлениях, сепсисе, ожо¬
гах, инфаркте миокарда, прогрессирующей миопатии, повреждении
мышц (синдром длительного раздавливания) и тяжелых физических
нагрузках.
Микроскопическое исследование осадка мочи является неотъемле¬
мой и важнейшей частью общего анализа мочи. Различают элементы
организованного и неорганизованного осадков мочи. Основными
элементами организованного осадка являются эритроциты, лейкоци¬
ты, эпителий и цилиндры (слепки почечных канальцев), неорганизо¬
ванного — кристаллические и аморфные соли.
При исследовании мочи здорового человека под микроскопом
обнаруживаются единичные эритроциты, 0-2 лейкоцита, 0-3 эпи¬
телиальные клетки, до 2000 бактерий в 1 мл мочи. Цилиндры отсутс¬
твуют.
Лейкоцитурия — это более 5 лейкоцитов в поле зрения микроскопа.
Выделяют следующие виды лейкРцитурии:
• инфекционная лейкоцитурия (бактериальные воспалительные
процессы мочевого тракта); пиурия соответствует содержанию в
моче 60 и более лейкоцитов в поле зрения;
• асептическая лейкоцитурия имеет место при гломерулонефрите,
амилоидозе, хроническом отторжении почечного трансплантата,
хроническом интерстициальном нефрите.
При обнаружении в моче эритроцитов даже в небольшом количестве всег¬
да требуются дальнейшее наблюдение и повторные исследования мочи.
212 Глава 3. Общеклинические исследования
Причинами гематурии наиболее часто являются острый и хрони¬
ческий гломерулонефрит, пиелит, пиелоцистит, хроническая почечная
недостаточность, травма почек, мочевого пузыря, мочекаменная болезнь,
папилломы, опухоли, туберкулез почек и мочевыводящих путей, передо¬
зировка антикоагулянтов, сульфаниламидов, уротропина.
Наличие цилиндров в моче (цилиндрурия) — первый признак реакции
со стороны почек на общую инфекцию, интоксикацию или измене¬
ния в самих почках.
Гиалиновые цилиндры состоят из белка, попадающего в мочу
вследствие застойных явлений или воспалительного процесса.
Появление гиалиновых цилиндров даже в значительном количестве
может наблюдаться при протеинурии, не связанной с поражением
почек (ортостатическая альбуминурия, застойная, связанная с физи¬
ческой нагрузкой, охлаждением). Часто гиалиновые цилиндры появ¬
ляются при лихорадочных состояниях. Почти постоянно гиалиновые
цилиндры встречаются при различных органических поражениях
почек, как острых, так и хронических.
Эпителиальные цилиндры представляют собой сл ушивающиеся
и склеивающиеся друг с другом эпителиальные клетки канальцев.
Наличие эпителиальных цилиндров указывает на поражение каналь¬
цев почек. Они наблюдаются при нефрозах. Появление этих цилиндров
при нефритах указывает на вовлечение в патологический процесс и
канальцевого аппарата. Появление в моче эпителиальных цилиндров
всегда указывает на патологический процесс в почках.
Зернистые цилиндры состоят из эпителиальных клеток канальцев
и образуются при наличии в эпителиальных клетках выраженной
дегенерации. Клиническое значение их обнаружения такое же, как
эпителиальных цилиндров.
Восковидные цилиндры обнаруживаются при тяжелых поражени¬
ях паренхимы почек. Чаще встречаются при хронических, но могут
быть и при острых поражениях почек.
Эритроцитарные цилиндры образуются из скоплений эритроци¬
тов. Наличие их свидетельствует о почечном происхождении гемату¬
рии (обнаруживают у 50-80% больных острым гломерулонефритом).
Следует иметь в виду, что эритроцитарные цилиндры наблюдаются не
только при воспалительных заболеваниях почек, но и при почечных
паренхиматозных кровотечениях.
Лейкоцитарные цилиндры встречаются довольно редко и почти
исключительно при пиелонефритах.
3.}. Исследование мочи 213
Цилиндроиды представляют собой нити слизи, происходящие из
собирательных трубочек. Нередко встречаются в моче в конце нефри¬
тического процесса, диагностического значения не имеют.
Наличие бактерий в моче (бактериурия) — не абсолютно достоверное
свидетельство воспалительного процесса в мочевыводяшей системе.
Решающее значение имеет их количественное содержание. Наличие
в 1 мл мочи взрослого челбвека 100 тыс. (1 • Ю^) и более микробных тел
можно расценивать как косвенный признак воспалительного процес¬
са в мочевых органах. Определение количества микробных тел выпол¬
няют в бактериологической лаборатории, при исследовании общего
анализа мочи констатируется только сам факт наличия бактериурии
(более подробно см, раздел 11.3).
3.1.3, АНАЛИЗ МОЧИ ПО ЗИМНИЦКОМУ
Анализ мочи по Зимницкому — это проба, которая позволяет
исследовать концентрационную функцию почек. Проведение иссле¬
дования не требует специальной подготовки пациента. Больной
остается на обычном режиме питания, но учитывает количество
выпитой жидкости. Сущность исследования состоит в том, что после
опорожнения мочевого пузыря в 6 ч утра через каждые 3 ч пациент
собирает мочу в отдельные пластиковые или стеклянные емкости в
течение суток, всего 8 порций. Все 8 порций раздельно доставляются
в лабораторию. В лаборатории измеряют количество мочи и ее плот¬
ность в каждой порции, а также рассчитывают суточный, ночной и
дневной диурезы.
Референтные показатели мочи при исследовании по Зимницкому;
• суточный диурез составляет 0,8-2,0 л или 65—80% выпитой жид¬
кости за сутки;
• значительное колебание в течение суток количества мочи в отде¬
льных порциях (40—300 мл) и плотности (1,008—1,025 г/л);
’ дневной диурез преобладает над ночным — 2;1;
• плотность хотя бы в одной порции не ниже 1,020—1,022 г/л.
При исследовании мочи по Зимницкому основным является учет
колебаний плотности в отдельных порциях мочи. Если она остается
на низком уровне, несмотря на перерывы в приеме пиши и жидкости,
то это указывает на нарушение способности почек концентрировать
мочу. Если плотность остается на обычном уровне или ее колебания
214 Глава 3. Общеклинические исследования
не превышают 0,007 г/л после приема жидкости, это говорит об утрате
почками способности к разведению. При различных заболеваниях в
пробе по Зимницкому могут быть выявлены следующие отклонения.
• при сопоставлении суточного диуреза е количеством выпитой
жидкости может оказаться, что в течение суток с мочой выводится
не около 3/4 (65-80%) выпитой жидкости, а значительно большее
или, наоборот, меньшее ее количество. Увеличение диуреза по
сравнению с объемом выпитой жидкости наблюдается при схож¬
дении отеков, уменьшение — при нарастании отеков (вне зависи¬
мости от их причины) и вследствие усиленного потоотделения.
• Дневной диурез и ночной диурез одинаковы или даже ночной
больше дневного (никтурия). Не обусловленное приемом жидкос¬
ти в ночное время увеличение ночного диуреза может возникать
как приспособительная реакция при ограничении концентраци¬
онной функции почек, а также при сердечной недостаточности.
• Плотность мочи во всех порциях может оказаться низкой, а
колебания ее в отдельных порциях в течение суток будут меньше
0,012-0,016, т.е. может быть выявлена изостенурия.
Изостенурия (отсутствие колебаний плотности мочи в течение
суток) является важнейшим признаком почечной недостаточности
и может наблюдаться у больных хроническим гломерулонефритом,
хроническим пиелонефритом, иногда у больных гипертонической
болезнью. Изостенурия может отмечаться при гидронефрозе и выра¬
женном поликистозе почек. Она является более ранним признаком
почечной недостаточности, чем нарастание уровня креатинина и
мочевины крови, и возможна при их нормальном содержании в крови.
Необходимо помнить, что низкая плотность мочи и малые ее коле¬
бания в течение суток могут зависеть от внепочечных факторов. Так,
при наличии отеков колебания плотности могут быть уменьшены.
Плотность мочи в этих случаях (при отсутствии почечной недостаточ¬
ности) бывает высокой; гипостенурия наблюдается только в период
схождения отеков (в частности, при применении мочегонных), при
длительном соблюдении безбелковой и бессолевой диеты плотность
мочи также может оставаться в течение суток низкой.
Низкая плотность мочи с малыми колебаниями (1,000-1,001) с
редкими подъемами до 1,003-1,004 наблюдается при несахарном диа¬
бете и не бывает ни при каких других заболеваниях, в том числе и при
заболеваниях почек, протекающих с недостаточностью их концентра¬
ционной функции.
3.1. Исследование мочи 215
Никтурия (преобладание ночного диуреза над дневным) иногда
является симптомом гипертрофии или рака предстательной железы.
3.1.4. АНАЛИЗ МОЧИ ПО НЕЧИПОРЕНКО
Анализ мочи по Нечипоренко — наиболее широко используемый в
клинической практике метод количественного определения содержа¬
ния в моче лейкоцитов, гзритроцитов и цилиндров. Для исследования
берут разовую среднюю утреннюю порцию мочи.
Сбор разовой утренней средней порции мочи — это сбор неболь¬
шой порции (10-15 мл) в середине .мочеиспускания. Сущность сбора
мочи в середине мочеиспускания состоит в том, что первую часть
мочи при мочеиспускании пациент выливает в унитаз, среднюю пор¬
цию собирает в чистый пластиковый контейнер, а оставшуюся мочу
выпускает в унитаз.
Референтные величины в моче: эритроциты до 1000 в 1 мл мочи
(1 • Юз), лейкоциты до 2000 в 1 мл мочи (2 • 10з), цилиндры до 20 в 1 мл
мочи.
Исследование мочи по Нечипоренко применяется с целью:
• выявления скрытой лейкоцитурии и гематурии и оценки их сте¬
пеней;
• динамического наблюдения за течением заболевания;
• выяснения вопроса о преобладании лейкоцитурии или гематурии.
Выяснение степени преобладания лейкоцитурии или гемату¬
рии имеет важное значение при проведении дифференциальной
диагностики между гломерулонефритом и пиелонефритом, при
хроническом пиелонефрите обычно отмечается значительное уве¬
личение содержания лейкоцитов в суточной моче (до 3—4 • 10' и
более) и преобладание содержания лейкоциюв над эритроцитами.
У больных гломерулонефритом эритроциты в моче преобладают
над лейкоцитами.
3.1.5. СТАКАННЫЕ ПРОБЫ МОЧИ
При проведении стаканных проб исследуют 2 или 3 порции
мочи, полученные последовательно при однократном мочеиспус¬
кании. Перед пробой больной не должен мочиться в течение 3—5 ч.
216 Глава 3. Обще клинические исследования
При двухстаканной пробе больной собирает мочу в 2 сосуда: в 1-м
должно быть 100 мл мочи, во 2-м — остальная часть. При трехста¬
канной пробе мочу собирают в 3 сосуда: в 1-м — начальная порция,
во 2-м — средняя, в 3-м — конечная.
Стаканные пробы широко используются в урологической прак¬
тике, особенно у мужчин. Они оказывают существенную помошь
в установлении локализации патологического процесса. Наличие
патологических примесей (лейкоциты, эритроциты) только в 1-й
порции указывает на то, что их источник — в мочеиспускательном
канале (уретрит, повреждение уретры, опухоль). Патологические
примеси обнаруживаются примерно в одинаковом количестве во
всех порциях мочи при локализации процесса в почке или моче¬
точнике, а также в мочевом пузыре, если они поступают в мочу из
очага поражения постоянно (например, при кровоточащей опу¬
холи мочевого пузыря). Если лейкоциты, гной, слизь или кровь
(эритроциты) обнаружены только в последней порции мочи, есть
основания предполагать локализацию очага в мочевом пузыре или
предстательной железе.
Трехстаканная проба может проводиться с массажем предстатель¬
ной железы и семенных пузырьков. Больной мочится в первые два
сосуда, оставляя часть мочи в мочевом пузыре. После этого делают
массаж предстательной же.тезы, и больной заполняет мочой 3-й сосуд.
Изменения в последней порции мочи (после массажа предстательной
железы или семенных пузырьков) указывает на воспалительный про¬
цесс в этих органах.
3.2. ОБЩЕКЛИНННЕСКОЕ ИССЛЕДОВАНИЕ МОКРОТЫ
Мокрота является патологическим отделяемым легких и дыхатель¬
ных путей — бронхов, трахеи, гортани. Появление мокроты — чаще всего
симптом заболевания легких или бронхов. Характер мокроты обусловлен
патологическим процессом, а встречающиеся в ней микроскопические
структуры нередко указывают на конкретное заболевание.
Для исследования собирают утреннюю мокроту в соответствии с
методикой, описанной в разделе 1.2.4.6. Собранная мокрота должна
быть максимально быстро доставлена в лабораторию. Чем меньше
времени пройдет с моме14та ее получения до момента исследования,
3.2. Общеклиническое исследование мокроты 217
тем ценнее могут быть результаты анализа, так как структурные обра¬
зования мокроты быстро разрушаются бактериями.
Обшеклипическое исследование мокроты включает описание ее
характера, общих свойств и микроскопический анализ.
Общие свойства мокроты. Количество мокроты обычно колеблется
от 10 до 100 мл/сут. Мало мо]фоты отделяется при острых бронхитах,
пневмониях, застойных явлениях в легких, в начале приступа брон¬
хиальной астмы. В конце приступа бронхиальной астмы количество
выделяемой мокроты увеличивается. Большое количество мокроты
(иногда до 0,5 л) может выделяться при отеке легких. Много мокро¬
ты выделяется при нагноительных процессах в легких при условии
сообщения полости с бронхом (при абсцессе, бронхоэктатической
болезни, гангрене легкого, туберкулезном процессе в легком, сопро¬
вождающемся распадом ткани).
Цвет мокроты. В норме мокрота бесцветна. Присоединение гной¬
ного компонента к мокроте придает ей зеленоватый оттенок, что
наблюдается при абсцессе легкого, гангрене легкого, бронхоэктати¬
ческой болезни, актином и козе легкого. При появлении в мокроте
примеси свежей крови мокрота окрашивается в различные оттенки
красного цвета (мокрота при кровохарканье у больных туберкулезом,
актиномикозом, раком легкого, абсцессом легкого, при инфаркте лег¬
кого, сердечной астме и отеке легких).
Мокрота ржавого цвега (при крупозной, очаговой и гриппозной
пневмонии, при туберкулезе легких с творожистым распадом, застое
в легких, отеке легких, легочной форме сибирской язвы) или мокрота
коричневого цвета (при инфаркте легкого) указывает на содержание в
ней не свежей крови, а продуктов ее распада (гематин).
Грязно-зеленый или желто-зеленый цвет может иметь мокрота,
отделяющаяся при различных патологических процессах в легких,
сочетающихся с наличием у больных желтухи.
Желто-канареечный цвет имеет иногда мокрота при эозинофиль¬
ных пневмониях. Отхождение мокроты цвета охры отмечается при
сидерозе легкого.
Черноватая или сероватая мокрота бывает при примеси угольной
пыли и у курильщиков.
Мокроту могут окрашивать некоторые лекарственные препараты,
например, рифампицин окрашивает отделяемое в красный цвет.
Запах. В норме мокрота не имеет запаха. Появлению запаха спо¬
собствует нарушение оттока мокроты. Гнилостный запах она приоб¬
218 Глава 3. Общеклинические исследования
ретает при абсцессе, гангрене легкого, бронхите в результате присо¬
единения гнилостной инфекции, бронхоэктатической болезни, раке
легкого, осложнившимся некрозом. Для вскрывшейся эхинококковой
кисты характерен своеобразный фруктовый запах мокроты.
Реакция. В норме мокрота имеет щелочную или нейтральную реак¬
цию. Разложившаяся мокрота приобретает кислую реакцию.
Характер мокроты. Слизистая мокрота выделяется при остром и
хроническом бронхите, астматическом бронхите, трахеите. Слизисто¬
гнойная мокрота выделяется при абсцессе легкого, гангрене, гной¬
ном бронхите, обострении хронического бронхита, стафилококковой
пневмонии. Гнойно-слизистая мокрота характерна для бронхопнев¬
монии. Гнойная мокрота бывает при бронхоэктазах, стафилококко¬
вой пневмонии, абсцессе, гангрене, актиномикозе легких. Серозная
мокрота встречается при отеке легкого. Серозно-гнойная мокрота
бывает при абсцессе легкого. Кровянистая мокрота выделяется при
инфаркте легких, новообразованиях, пневмонии (иногда), травме
легкого, актиномикозе и сифилисе. Следует отметить, что крово¬
харканье и даже примесь крови к мокроте встречаются не во всех
случаях инфарктов легких (в 12—52%). Нужно помнить, что не всегда
появление обильной примеси крови в мокроте обусловлено легоч¬
ной патологией. Желудочное, носовое кровотечения, кровотечение
из прорвавшегося аневризматического мешка могут симулировать
легочное кровотечение.
Микроскопическое исследование мокроты, при микроскопическом
исследовании мокроты обнаруживают слизь, клеточные элементы,
волокнистые и кристаллические образования, грибы, бактерии и
паразиты.
Альвеолярные макрофаги — клетки ретикулогистиоцитарного проис¬
хождения, Большое количество макрофагов бывает при хронических
процессах и на стадии разрешения острых процессов в бронхолегоч¬
ной системе. Альвеолярные макрофаги, содержащие гемосидерин
(«клетки сердечных пороков»), выявляются при инфаркте легкого,
кровоизлиянии, застое в малом круге кровообращения. Макрофаги с
липидными каплями ~ признак обструктивного процесса в бронхах
и бронхиолах.
Ксантомные клетки (жировые макрофаги) обнаруживаются при абс¬
цессе, актиномикозе, эхинококкозе легких.
Клетки цилиндрического мерцательного эпителия — клетки слизистой
оболочки гортани, трахеи и бронхов; обнаруживаются при бронхитах,
3.2. Общеклиническое исследование мокроты 219
трахеитах, бронхиальной астме, злокачественных новообразованиях
легких.
Плоский эпителий обуслов.лен примесью слюнь[, и его обнаружение
диагностического значения не имеет.
Лейкоциты в небольшом количестве встречаются в каждом образце
мокроты. Большое количество нейтрофилов присутствует в слизисто¬
гнойной и гнойной мокроте. Эозиыофилами богата мокрота при брон¬
хиальной астме, эозинофильной пневмонии, глистных поражениях
легких, инфаркте легкого. Эозинофилы могут встречаться в мокроте
при туберкулезе и раке легкого. Лимфоциты выявляются в большом
количестве при коклюше и, реже, при туберкулезе.
Эритроциты, Обнаружение единичных эритроцитов в мокроте
диагностического значения не имеет. При наличии свежей крови в
мокроте определяются неизмененные эритроциты, если же с мок¬
ротой отходит кровь, задержавшаяся в дыхательных путях в течение
длительного времени, то обнаруживают выщелоченные эритроциты.
Клетки злокачественных опухолей обнаруживаются при злокачест¬
венных новообразованиях.
Эластические волокна появляются при распаде ткани легкого, кото¬
рый сопровождается разрушением эпителиального слоя и освобожде¬
нием эластических волокон, выделяющихся с мокротой при туберку¬
лезе, абсцессе, эхинококкозе, новообразованиях в легких,
Коралловидные волокна выделяются при хронических заболеваниях
легких, таких, как кавернозный туберкулез.
Спирали Куришана образуются при спастическом состоянии брон¬
хов и наличии в них слизи. Во время кашлевого толчка вязкая слизь
выбрасывается в просвет более крупного бронха, закручиваясь спи¬
ралью, Спирали Куршмана появляются при бронхиальной астме,
бронхитах, опухолях легких, сдавливающих бронхи.
Кристаллы Шарко—Лейдена — продукты распада эозинофилов.
Обычно появляются в мокроте, содержащей эозинофилы; характерны
для бронхиальной астмы, аллергических состояний, эозинофильных
инфильтратов в легких, легочной двуустки.
Друзы актиномицета характерны для актиномикоза легких.
Элементы эхинококка появляются при эхинококкозе легких.
Пробки Дитриха — комочки желтовато-серого цвета, имеющие
неприятный запах. Состоят из детрита, бактерий, жирных кислот,
капелек жира. Они характерны для абсцесса легкого и бронхоэктати¬
ческой болезни.
220 Глава 3. Общеклинические исследования |
Элементы, обнаруживаемые в мокроте при бронхиальной астме.
При бронхиальной астме количество слизистой, вязкой мокроты
скудное. Макроскопически можно увидеть спирали Курщмана, осо¬
бенно характерно наличие эозинофилов, цилиндрического эпителия,
встречаются кристаллы Шарко-Лейдена.
3.3. ИССЛЕДОВАНИЕ КАЛА
Общеклиническое исследование состава кала является важным
дополнением к другим методам диагностики заболеваний органов
пищеварения и опенки результатов их лечения. Однако целенаправ¬
ленное исследование кала может быть важнейшей составляющей про¬
грамм скрининга заболеваний желудочно-кишечного тракта (напри¬
мер, исследование кала иа скрытую кровь для раннего выявления
рака толстой кишки).
3.3.1. ОБЩЕКЛИНИЧЕСКОЕ
ИССЛЕДОВАНИЕ КАЛА
Общеклиническое исследование кала — копрограмма — является
важным методом в диагностике заболеваний органов пищеварения и
оценке эффективности их лечения.
Результаты исследования зависят от правильной подготовки больного
и правильного сбора, хранения и доставки материала в лабораторию.
Собирать кал нужно в чистую, сухую стеклянную посуду.
Следует избегать примеси к испражнениям мочи, выделяемого
половых органов и других веществ, в том числе лекарственных.
Если надо знать точко количество испражнений, то посуду, в кото¬
рую их собирают, следует предварительно взвесить.
Подготовка больного. Перед сбором кала надо отменить больному
медикаменты, примеси которых мешают микроскопическому иссле¬
дованию и влияют на внешний вид каловых масс, а также усиливают
перистальтику кишечника. К таким лекарственным препаратам отно¬
сятся все слабительные, ваго- и симпатиктропные средства, каолин,
бария сульфат, препараты висмута, железа и средства, вводимые в
ректальных свечах.
3.3. Исследование кала
221
Копрограмма включает изучение физико-химических свойств
и микроскопическое исследование. Референтные показатели коп-
рограммь! приведены втабл. 3-1.
Таблица 3-1,
Референтные показатели копрограммы
Физико-химические свойства
Характеристика
Количество
100—200 г за одну дефекацию
Консистенция
Плотный, оформ.ленный
Цвет
Коричневый
Запах
Каловый, нерезкий
Реакция
Нейтральная
Билирубин
Отсутствует
Стеркобилин
Присутствует
Растворимый белок
Отсутствует
Микроскопическая характеристика
Мышечные волокна
Небольшое количество или
отсутствуют
Нейтральный жир
Отсутствует
Жирные кислоты
Отсутствуют
Мыла
в небольшом количестве
Перепаримая клетчатка
Отсутствует
Крахмал
Не обнаруживается
Лейкоциты
Отсутствуют
Эритроциты
Отсутствуют
Кристаллы любые
Отсутствуют
Йодофильная флора
Не обнаруживается
Entamoeba coli (кишечная амеба)
Может присутствовать
Endolimax папа (кар.тиковая амеба)
Может присутствовать
Chilomastix mesnill (обитает в толстых отде¬
Может присутствовать
лах кишки)
Jodamoeba butschlii (йодамеба Бючли)
Может присутствовать
Blastocystis hominis (непатогенпый споровик)
Может присутствовать
222 Глава 3. Общеклинические исследования
При различных патологических процессах а желудочно-кишечном
тракте общеклиническое исследование кала позволяет выявить нару-
тиение физико-химических свойств кала.
Количество. Обычно здоровый человек выделяет 100-200 г кала за
одну дефекацию. При запорах — меньше нормы. Больше нормы — при
нарушении поступления желчи, недостаточном переваривании в
тонкой кишке (бродильная и гнилостная диспепсия, воспалительные
процессы), при колите с поносом, колите с изъязвлениями, ускорен¬
ной эвакуации из тонкой и толстой кишки. До 1 кг и более — при
наличии секреторной недостаточности поджелудочной железы.
Консистенция кала. Плотный, оформленный кал, кроме нормы,
бывает при недостаточности желудочного пищеварения; мазе¬
видный — при нарушении секреции поджелудочной железы и
отсутствии поступления желчи; жидкий — при недостаточном
переваривании в тонкой (гнилостная диспепсия или ускоренная
эвакуация) и толстой (колит с изъязвлением или повышенная сек¬
реторная функция) кишке; кашицеобразный — при бродильной
диспепсии, колите с поносом и ускоренной эвакуации из толстой
кишки; пенистый — при бродильной диспепсии; «овечий» — при
колите с запором.
Цвет кала. Черный или дегтеобразный кал бывает при желу¬
дочно-кишечных кровотечениях: темно-коричневый — при недо¬
статочности желудочного пищеварения, гнилостной диспепсии,
колите с запором, колите с изъязвлением, повышенной секреторной
функции толстой кишки, запорах; светло-коричневый —- при уско¬
ренной эвакуации из толстой кишки; красноватый — при колите с
изъязвлениями; желтый — при недостаточности переваривания в
тонкой кишке и бродильной диспепсии; светло-желтый — при недо¬
статочности внешнёсекреторной функции поджелудочной железы;
светло-белый — при непоступлении желчи в кишечник.
Запах. Гнилостный запах кала характерен для недостаточности
желудочного пищеварения, гнилостной диспепсии, колита с запором,
двигательных расстройств кишечника; зловонный — для нарушений
секреции поджелудочной железы, отсутствия поступления желчи,
повышенной секреторной функции толстой кишки; слабый — для
недостаточности переваривания в толстой кишке, запоров, ускорен¬
ной эвакуации из тонкой кишки; нерезкий -- для колита с изъязвле¬
нием; кислый — для бродильной диспепсии; масляной кислоты — для
ускоренной эвакуации из толстой кишки.
3,3. Исследование кала 223
Реакция кала. Слабоосновная реакция кала наблюдается при
недостаточности переваривания в тонкой кишке; основная — при
недостаточности желудочного переваривания, наруитении секреции
поджелудочной железы, колите с запорами, колите с изъязвлени¬
ями, повышенной секреторной функции толстой кишки, запорах;
резкоосновная — при гнилостной диспепсии; резкокислая — при
бродильной диспепсии.
Стеркобилин в ка.ае. Уменьшение содержания стеркобилина в кале
характерно для паренхиматозных гепатитов, холангитов, повыше¬
ние — для гемолитических анемий.
Билирубин в кале обнаруживается при ускоренной перистальтике,
ускоренной эвакуации из кишки, длительном приеме антибиотиков
и сульфаниламидных препаратов (подавление микрофлоры кишеч¬
ника — при дисбактериозах).
Растворимый бе.лок в кале определяется при гнилостной диспепсии,
колите с изъязвлениями, повышенной секреторной функции толстой
кишки, кровотечениях, воспалительных процессах.
Мышечные вшокна в кале обнаруживаются в первую очередь при недо¬
статочности желудочного переваривания, нарушении секреции поджелу¬
дочной железы и процессов всасывания в кишечнике. Наличие мышеч¬
ных волокон в кале сопровождается картиной гнилостной диспепсии.
Соединительная ткань в кале присутствует при недостаточности
желудочного пищеварения и функциональной недостаточности под¬
желудочной железы.
Нейтральный жир в кале обнаруживается в основном при недоста¬
точности секреции поджелудочной железы, а не других отделов желу¬
дочно-кишечного тракта.
Жирные кислоты в кале обнаруживаются при отсутствии поступле¬
ния желчи, недостаточности переваривания в тонкой кишке, ускорен¬
ной эвакуации из тонкой кишки, бродильной диспепсии, при недо¬
статочной секреции поджелудочной железы и ускоренной эвакуации
из толстой кишки.
Мыло в кале присутствует в избыточном количестве при всех состо¬
яниях, перечисленных выше для жирных кислот, но с тенденцией к
запорам.
Крахмал в кале определяется при нарушении секреции поджелу¬
дочной железы, недостаточности переваривания в тонкой кишке,
бродильной диспепсии, ускоренной эвакуации из толстой кишки,
недостаточности желудочного пищеварения.
224 Глава З, Общеклинические исследования
Йодофильная флора в кале обнаруживается при недостаточности
переваривания в тонкой кишке, ускоренной эвакуации из толстой
кишки, бродильной диспепсии, нарушении секреции поджелудочной
железы.
Переваримая клетчатка в кале выявляется при недостаточности желу¬
дочного пищеварения, гнилостной диспепсии, отсутствии поступления
желчи, недостаточности переваривания в тонкой кишке, ускоренной
эвакуации из толстой кишки, бродильной диспепсии, недостаточной
секреции поджелудочной железы, колите с изъязвлениями.
Слизь в кале. Определяется при колите с запорами, изъязвлениями,
бродильной и гнилостной диспепсии, повышенной секреторной фун¬
кцией толстой кишки; отмечается при запорах.
Эритроциты в кале выявляются при колите с изъязвлениями,
дизентерии, геморрое, полипах, трещине прямой кишки; кровь
«скрытая» — при язвенной болезни желудка и двенадцатиперстной
кишки, злокачественных заболеваниях желудка и кишечника.
Лейкоциты в кале обнаруживаются при колите с изъязвлениями.
Появление в кале лейкоцитов при параинтестинальном абсцессе
указывает на его прорыв в кишечник, при наличии опухоли — на ее
распад.
Яйца гельминтов в кале выявляются при различных гельминтозах.
Entamoeba hystolytica (дизентерийная амеба) в кале. Вегетативная
форма и цисты выявляются при амебной дизентерии, обнаруживается
только в свежих фекалиях.
Лямблии в кале. Вегетативные формы и цисты выявляются при
лямблиозе. Обычно вегетативная форма обнаруживается только при
профузных поносах или после действия сильных слабительных.
3.3.2. ОБНАРУЖЕНИЕ СКРЫТОЙ КРОВИ В КАЛЕ
Кровотечение из желудочно-кишечного тракта — проблема, с
которой часто сталкиваются практические врачи. Выраженность кро¬
вотечения значительно варьирует, и наибольшую трудность представ¬
ляет диагностика небольших хронических кровотечений. Чаще всего
такие кровотечения обусловлены раковыми заболеваниями желудоч¬
но-кишечного тракта. Опухоли толстой кишки начинают кровото¬
чить на ранних (бессимптомных) стадиях заболевания, в результате
кровь попадает в просвет кишки.
3.3. Исследование кала 225
Для диагностики кровотечений из желудочно-кишечного тракта
используют различные скрининговые тесты с целью выявления у
внешне здоровых людей бессимптомного течения заболевания, что
позволяет добиться положительного результата лечения.
В норме с калом выделяется 1 мл крови в сутки (или 1 мг гемог¬
лобина на 1 I кала). Это физиологические потери, обусловленные
слущиванием эпителия, травматизацией его грубыми компонента¬
ми пищи. По мере движения по кишечнику кровь распределяется
в каловых массах и подвергается распаду под действием ферментов
пищеварения и бактериальных ферментов. Поэтому при правильной
подготовке больного к исследованию в норме кровь в кале лаборатор¬
ными .методами не обнаруживают.
Скрытой называется кровь в просвете кишечника, не изменя¬
ющая цвет кала и не определяемая макро- и микроскопически.
Для обнаружения скрытой крови в кале в большинстве лаборато¬
рий используют гваяковую пробу (бензидиновая проба запрещена к
использованию). Гваяковая проба основана на способности гваяковой
смоляной кислоты (входящей в состав гвояковой смолы) окисляться
перекисью водорода с образованием озонида, окрашенного в синий
цвет. Катализаторо.м, ускоряющим эту реакцию, является небелковая
составляютцая гемоглобина — гем. Поэтому если в кале содержится
кровь (гемоглобин), гваяковая проба дает положительный результат.
По скорости появления окрашивания и по интенсивности окраски
кала различают слабоположительную (+), положительную (++ и •+-+-!-)
и резкоположительную (++++) реакции. В норме гваяковая проба
отрицательная.
Подготовка больного. Учитывая тот факт, что ряд продуктов питания
содержат вещества, способные ускорять окисление гваяковой смолы, при
назначении данного исследования необходимо соблюдать ряд условий.
При назначении исследования кала на скрытую кровь требуется спе¬
циальная подготовка пациента (иначе исследование может бьпь поло¬
жительным у здорового). Для этого за 3 сут до исследования из рациона
пациента должны быть исключены мясные блюда, некоторые фрукты и
овощи, которые содержат много каталазы и пероксидазы (огурцы, хрен,
цветная капуста), отменены аскорбиновая кислота, препараты железа,
аспирин и другие нестероидные противовоспалительные средства. Для
обнаружения скрыгой крови в кале рекомендуечси исследовать 3 пробы
кала — по одной из 3 последовательных дефекаций, причем каждый раз
берут пробы из двух разных мест каловой массы. При оценке результатов
226 Глава 3. Общеклинические исследования
анализа, даже один результат следует рассматривать как положительный
(и в тех случаях, когда правила подготовки паииента не соблюдались).
Для определения диагностической ценности терта па скрытую
кровь в кале для ранней диагностики рака толстой кишки необ¬
ходимо иметь представление об объеме кровотечения из опухоли,
в среднем кровопотеря из опухолей слепой кишки и восходя¬
щей части поперечной ободочной кишки составляет 9,3 мл/сут (от 2
до 28 мл/сут) (Хендерсон д. м., 1997). При локализации дистальнеепече-
ночного изгиба кишки кровопотеря значительно меньше и составля¬
ет 2 мл/сут. Это различие, возможно, обусловлено большим размером
опухолей проксимальной части толстой кишки. В среднем кровопо¬
теря из аденоматозного полипа составляет 1,3 мл/сут вне зависимости
от его локализации.
Реакции, используемые для выявления скрытой крови в кале, обла¬
дают различной чувствительностью. Реакция с бснзидином выявляет
только кровопотерю, превышающую 15 мл/сут, поэтому дает очень
много ложноположительных результатов и в настоящее время не
используется. Наиболее распространенным тестом для выявления
пероксидазной активности в клинической практике является гваяко¬
вая проба. Обычно при проведении этого теста каловые массы нано¬
сят на фильтровальную бумагу, а затем к ним добавляют гваяковый
реагент, уксусную кислоту и перекись водорода. В такой постановке
метод очень чувствителен для выявления псрексидазной активности,
но плохо стандартизирован и часто дает ложноположительные резуль¬
таты. В связи с этим были разработаны тесты, в которых гваяковый
реагент заранее нанесен на пластмассовую полоску, что позволяет
стандартизировать проведение исследований и диагностировать даже
небольшое кровотечение.
процент положительных результатов 1ваякового теста зависит
от количества крови в кале. Примерно в 50% случаев рака золсгой
кишки опухоль «выделяет» достаточно крови, чтобы выявить ее гвая¬
ковой реакцией, чувствительность которой при колоректальном раке
20—30%. Гваяковый тест помогает также и в диагностике полипов
толстой кишки, но кровопотеря из полипов значительно меньше, поэ¬
тому тест для диагностики этой патологии недостаточно чувствителен
(положителен примерно в 13% случаев) (Wallach J., 1996). Полипы
дистальной части толстой кишки (нисходящая часть поперечно-обо¬
дочной кишки, сигмовидная и прямая кишка) дают положительные
результаты в 54% случаев, проксимальной — в 17%.
3.3. Исследование кала 227
Учитывая недостатки гваяковой пробы, в последние годы разрабо¬
тан совершенно новый метод диагностики кровотечения из желудочно-
кишечного тракта для ранней диагностики рака толстой кишки. Речь
идет об иммунохимических тестах, в которых используются специфи¬
ческие антитела к гемоглобину человека. Они позволяют выявлять в
кале только человеческий гемоглобин, поэтому ие требуюто1раничений
в питании и приеме лекарств. Тесты обладают высокой чувствитель¬
ностью. Они не выявляют кровотечения из верхних отделов желудоч¬
но-кишечного тракта, что позволяет использовать их целенаправленно
для диагностики опухоли толстой кишки. Иммунохимические тесты
положительны в 97% случаев рака толстой кишки при единичном
исследовании и в 60% при наличии аденоматозных полипов.
Исследование кала на скрытую кровь позволяет выявлять рак
толстой кишки на ранних стадиях и снижает смертность от этого
заболевания на 25—33%. Кроме того, этот тест является альтернативой
эндоскопическому (колон оскопи я) методу скрининга рака толстой
кишки. Регулярное скрининговое исследование кала на скрытую
кровь приводит к снижению случаев обнаружения рака толстой
кишки на последней стадии на 50% (Хендерсон Д.М., 1997).
Положительная реакция кала на скрытую кровь может отмечаться
при ряде заболеваний и состояний:
• язвенной болезни желудка и двенадцатиперстной кишки;
• первичных и метастатических опухолях пищевода, желудка
кишечника, большого дуоденального сосочка;
• туберкулезе кишечника, неспецифическом язвенном колите;
• инвазиях гельминтами, травмирующими стенку кишечника;
• расширении вен пищевода при циррозе печени и тромбофлебите
селезеночной вены;
• синдроме Ослера—Рандю при локализации кровоточащих теле-
ангиэкстазий в любом месте слизистой оболочки пищеваритель¬
ного тракта;
• брюшном тифе; у больных брюшным тифом с положительными
результатами реакции на скрытую кровь в кале макроскопичес¬
кие кровотечения встречаются значительно чаше, чем при отри¬
цательных;
• при попадании в пищеварительный тракт крови из полости рта
и гортани, трещинах губ, случайном или умышленном (с целью
симуляции) высасывании крови из полости рта и затекании ее
при носовых кровотечениях;
228 Глава 3. Общеклинические исследования
• при примеси к калу крови из геморроидальных узлов и трещин
заднего прохода;
• при попадании в кал менструальной крови.
3.4. ОБЩЕКЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ
ОТДЕЛЯЕМОГО ИЗ УРЕТРЫ
Отделяемое из уретры исследуют в основном для диагностики
воспалительного процесса при негонококковых уретритах, гонорее,
трихомониазе, хла.мидиозе, сифилисе и др. Кроме этого, исследование
позволяет дифференцировать ряд патологических и физиологических
состояний, характеризующихся наличием выделений из уретры (про-
статорея, сперматорея, уретрорея),
При исследовании отделяемого из уретры число и состав клеточ¬
ных элементов зависят главным образом от остроты и продолжитель¬
ности воспалительного процесса. Информативным материалом для
исследования служат мазки из уретры и/или первая порция мочи.
Проведение двух видов исследований позволяет выявить случаи,
которые могут быть пропущены при использовании только одного
из них. Воспалительное состояние слизистой оболочки мочеиспуска¬
тельного канала (уретрит) выражается наличием не менее 5 лейкоци¬
тов в поле зрения микроскопа. О глубине патологического процесса в
уретре говорит преобладание в мазках-отпечатках цилиндрических и
нарабазальных клеток эпителия. При первичном просмотре препара¬
тов можно сделать следующие практические выводы:
• преобладают лейкоциты (нейтрофилы и лимфоциты) — свежий
уретрит или обострение хронического уретрита; при высоком
содержании эозинофилов (свыше 5—10%) — аллергический урет¬
рит;
• преобладают клетки эпителия при небольшом количестве лейко¬
цитов — хронический уретрит с метаплазией эпителия (дссква-
мативный уретрит) или лейкоплакия уретры;
• значительное количество эритроцитов наряду с лейкоцита.ми и
эпителиальными клетками — травматический уретрит, опухоль
уретры, кристаллу рия, изъязвление слизистой оболочки и др.;
• лейкоциты отсутствуют или имеются только единичные в поле
зрения при большом увеличении микроскопа — простаторея
3.4. Общеклиническое исследование отделяемого из уретры 229
(имеются липоидные зерна); сперматорея (множество сперма¬
тозоидов); уретрорея (преобладает слизь без форменных эле¬
ментов — секрет уретральных желез);
* при небольшом количестве полинуклеарных нейтрофилов
имеются массивные скопления мелких плеоморфных палочек
на клетках эпителия (т,акие эпителиальные клетки получи¬
ли название «ключевые клетки») — уретрит, обусловленный
Corynebacterium vaginale;
• имеются ключевые клетки, в большом количестве разнообразные
бактерии, полинуклеарные единичные нейтрофилы, фагоцитар¬
ная реакция отсутствует — бактериорея.
При более детальном исследовании мазков критериями постанов¬
ки диагноза уретрита согласно Европейскому руководству по уретри¬
там (2001) являются:
* окрашенный по Граму мазок из уретры, содержащий не менее 5
лейкоцитов в поле зрения микроскопа и/или
• обнаружение не менее 10 лейкоцитов в поле зрения микроскопа в
окрашенном по Граму препарате из образца первой порции мочи.
Чувствительность приведенных выше тестов зависит от того, как
долго пациент не мочился перед взятием материала на исследование.
Обычно рекомендуется промежуток 4 ч.
Выявление воспалительного процесса в уретре требует установле¬
ния ei'O этиологического характера. Для этого используют бактерио¬
логические методы исследования (см. гл. 11).
Глава 4,
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Важнейшей задачей клинико-диагностической лаборатории при
проведении цитологических исследований является диагностика,
по возможности ранняя диагностика злокачественных опухолей.
Наиболее широко в клинической практике цитологические исследо¬
вания применяются для диагностики рака шейки матки и злокачест¬
венных опухолей легких.
4.1. ОБЩИЕ ПРИНЦИПЫ ЦИТОЛОГИЧЕСКОЙ
ДИАГНОСТИКИ ОПУХОЛЕЙ
Злокачественная опухоль характеризуется рядом морфологичес¬
ких признаков, выявляемых при гистологическом и цитологическом
исследованиях. К ним относятся:
• тканевый или структурный атипизм опухоли — отклонения в
структурной организации паренхимы и стромы опухоли по срав¬
нению с исходными нормальными тканями, а также нарушения в
расположении клеток;
• клеточный атипизм — неправильное строение опухолевых кле¬
ток, изменения их функции;
• морфологическая анаплазия — недифференцирован ноеть, незре¬
лость опухолевых клеток.
Злокачественная опухоль обладает способностью к инфильтриру¬
ющему, инвазивному росту, т.е. к прорастанию в окружающие ткани,
просвет кровеносных и лимфатических сосудов, создавая предпосыл¬
ки к метастазированию.
Гистологическое исследование биологического материала из опу¬
холи дает возможность оценить все указанные выше морфологические
признаки новообразования. Цитологическое исследование в состоянии
выявлять в основном только признаки атипизма и анаплазми опухоле¬
вых клеток. Однако эти признаки выявляются особенно отчетливо.
4А. Общие принципы цитологической диагностики опухолей 231
В соответствии с принятой методикой проведения цитологичес¬
ких исследований ответ о результатах анализа состоит из описатель¬
ной части и заключения. Заключение должно содержать указание на
тот или иной патологический процесс (новообразование, гиперплас-
тическое состояние, воспаление) по возможности с максимальным
раскрытием его сущности (например, рак из железистого эпителия с
выраженной степенью дифференцировки паренхимы). Заключение
может даваться в уверенной или предположительной форме, иногда с
указанием на необходимость дифференцировать (выбирать) несколь¬
ко патологических процессов. В нем также может быть указано на
невозможность суждения о процессе из-за малого числа клеток, их
дистрофии, повреждений, а также нарушения взятия биологического
материала.
Трудности цитологической диагностики опухолей привели к созда¬
нию типов (классификаций) заключений. Наибольшее распростране¬
ние в мире получила классификация цитологических заключений по
Папаниколау. Она включает 5 групп.
I группа — атипических клеток нет. Нормальная цитологическая
картина, не вызывающая подозрений.
П группа — изменение морфологии клеточных элементов, обус.юв-
ленных воспалением.
III группа — имеются единичные клетки с аномалиями цитоп¬
лазмы и ядер, однако окончательный диагноз установить не удается.
Требуется повторное цитологическое исследование, по рекоменда¬
ции — гистологическое.
IV группа — обнаруживаются отдельные клетки с явными призна¬
ками злокачественности.
V группа — в мазках имеется большое количество типичных раковых
клеток. Диагноз злокачественного процесса не вызывает сомнений.
Оценивая результаты цитологических исследований, следу¬
ет иметь в виду, что термин «атипичная клетка» не обязательно
означает «клетку злокачественной опухоли». Клетки могут приоб¬
ретать признаки атипии, оставаясь доброкачественными, неопу¬
холевыми. Необходимо также понимать, что отсутствие клеток
злокачественной опухоли в исследуемом биологическом матери¬
але не является доказательством отсутствия новообразования у
больного.
Не менее важно знать и сроки выполнения цитологических иссле¬
дований. Общепринятыми сроками получения результатов цитологи¬
232 Глава 4. Цитологические исследования
ческих исследований являются: при срочном исследовании во время
операции — 20—30 мин, при плановом — не позднее 48 ч с момента
поступления биологического материала в лабораторию.
4.1.1. ОСОБЕННОСТИ ВЗЯТИЯ БИОЛОГИЧЕСКОГО МАТЕРИАЛА
ДЛЯ ЦИТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Цитологическому исследованию могут подвергаться соскобы, жид¬
кости (выпоты в полости тела, моча, промывные воды), мокрота,
пунктаты, кусочки ткани и другие виды биологического материала.
В настоящее время в клинической практике наиболее часто использу¬
ют приведенные ниже способы получения биологическою материала.
• Сбор биологического материала, содержащего слущенньте клет¬
ки. Клеточные элементы, в том числе опухолевые, легко сл ушива¬
ются с поверхности слизистых и серозных оболочек, опухолевых
образований. Такие клетки спонтанно попадают в различные
выделения, выпоты, секреты (например, в мокроту, мочу) и ста¬
новятся объектом цитологического исследования. Можно также
получить слущеиные клетки с помошью мазков-отпечатков со
слизистой оболочки шейки матки, бронхов при бронхоскопии, с
изъязвленной поверхности кожи и т.д.
• Пункция тонкой иглой опухолевых узлов, патологических очагов
и кист. Наиболее часто в клинической практике данный метод
взятия биологического материала применяют при наличии пато¬
логических образований в щитовидной и молочных железах.
• Приготовление мазков с поверхности разреза удаленной на опе¬
рации опухоли. Такие мазки получают в виде отпечатков или
путем легкого соскабливания предметным стеклом с поверхности
свежего разреза опухоли.
Биологический материал для цитологического исследования нано¬
сят на чистые обезжиренные предметные стекла, осторожно разма¬
зывая его краем другого предметного (лучше шлифованного) стекла
равномерным тонким слоем. Свежие мазки для сохранности клеток
в образце необходимо немедленно фиксировать. Для этого предмет¬
ные стекла помещают в 90—96° этиловый спирт на 10—15 мин. Стекло
высушивают на воздухе и помещают в пластиковую коробку или
чашку Петри и доставляют в лабораторию.
4.2. Цитологическое исследование мазков из шейки матки 233
4.2. ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
МАЗКОВ ИЗ ШЕЙКИ МАТКИ
Цитологическое исследование мазков из шейки матки представ¬
ляет собой микроскопический анализ клеток, полученных с повер¬
хности шейки матки. Главное достоинство данного анализа состоит
в том, что изменения мффологии клеток поверхностного эпителия
шейки матки происходят иногда за 8-15 лет до развития рака шейки
матки, поэтому регулярное исследование мазков позволяет выявить
заболевание на ранних стадиях и путем проведения лечебных мероп¬
риятий предупредить его развитие. Все женщины должны регулярно
проходить такое исследование.
4.2.1. АНАТОМИЯ И ЭПИТЕЛИЙ ШЕЙКИ МАТКИ
Шейка матки (цервикс, от греч.. cervix шея) — переходное звено
между телом матки и влагалищем (рис. 4-1). Это трубчатая структура
длиной 3-4 см и шириной не более 4 мм, внутри которой проходит цер¬
викальный канал, соединяющий полость матки и влагалище. Шейка
матки состоит из 4 анатомических образований. Самая нижняя часть
шейки матки, которая выступает во влагалище, называется эктоцер-
викс, В пентре эктоцервикса имеется маленькое отверстие, ведущее
в эндоцсрви кал ьный канал, которое называется наружным зевом,
Эндоцерви кал ьный канал — это трубка, которая соединяет внутрен¬
ний зев и влагалище (наружный зев) и является первой частью родо¬
вых путей. У нерожавших женщин наружный зев округлой формы, а
у рожавших в виде поперечной щели. За счет анатомических сужений
(1[аружный и внутренний зев), атакже слизи, заполняющей цервикаль¬
ный канал, ujCHKa матки является барьером между влагалищем, засе¬
ленным множеством микроорганизмов, и стерильной полостью матки.
Поверхность шейки матки покрыта слоем эпителиальных клеток
(эпителия). Они формируют защитный слой шейки матки и служат
основной целью изучения при проведении исследования. Имеется
два типа эпителия: многослойный плоский, который покрывает экто-
цервикс, и призматический, выстилающий эндоцервикальный канал.
В многослойном плоском эпителии различают 4 слоя клеток:
• базальный слой — самый глубокий, состоит из незрелых (базаль¬
ных) эпителиальных клеток, расположенных в один ряд на
234
Глава 4. Цитологические исследования
базальной мембране, которая отделяет многослойный плоский
эпителий от подлежащей соединительной ткани;
• иарабазальный слой, состоит из незрелых (парабазалъных) кле¬
ток, которые располагаются над базальными клетками в 2—3 ряда
и постоянно делятся, чтобы поддерживать целостность эпите¬
лия;
• промежуточный слой, состоит из 6—12 рядов более зрелых кле¬
ток;
• поверхностный слой, состоит из 5—18 рядов эпителиальных кле¬
ток, которые проявляют тенденцию к ороговению и постоянному
обновлению за счет непрерывного слущивания.
Маточная
труба
Яичник
—Цервикальный канал
"•Влагалищная часть шейки
Влагалище
Рис. 4-1. Матка, цервикальный
канал, яичники, влагалище
Процесс, в результате которого клетки поверхностного слоя пос¬
тепенно утрачивают связь друг с другом и слушиваются с поверхнос¬
ти эктоцервикса, называется десквамацией эпителия. Постоянное
обновление клеток базальных слоев многослойного плоского эпите¬
лия обеспечивает замсшснис клеток, слущсиных с поверхности экто¬
цервикса. Большинство клеток, обнаруживаемых в мазках при иссле¬
довании, происходит из промежуточного и поверхностного слоев.
Цикл обновления клеток составляет в среднем 4 дня. Интенсивность
слущивания зависит от фазы менструального цикла — максимальная
к концу первой фазы и в период овуляции. В этот период поверхнос¬
тные клетки преобладают в цитологических мазках из шейки матки.
Клетки парабазального слоя составляют не более 3—6% всех эпите¬
лиальных клеток нормального мазка молодых женщин. У пожилых
женщин в мазках содержится больше парабазалъных клеток, а забо¬
левания шейки матки как раз и проявляются значительным их уве¬
4.2. Цитологическое исследование мазков из шейки матки
235
личением. Базальные клетки в силу того, что расположены в глубине
эпителиального слоя, редко обнаруживаются в мазках.
Слизистая оболочка эндоцервикального канала покрыта высоким
призматическим эпителием. Клетки расположены в один ряд. Часть
клеток секретирует слизь, другие имеют на своей поверхности реснички.
Слизь и реснички облегчают продвижение сперматозоидов через эндо-
цервикальньтй канал в полость матки. Под призматическим эпителием
нередко обнаруживают резервные (комбиалъные) клеточные элементы.
Два вида эпителия — многослойный плоский и призматический —
контактируют в области наружного маточного зева. Область их контак¬
та называется границей (стыком) между ними. Она играет важнейшую
роль в формировании патологических процессов этой локализации,
так как именно в этой зоне они развиваются наиболее часто, в том числе
большинство случаев рака шейки матки. С периода новорожденности
до окончания пубертатного периода у девочек граница между двумя
видами эпителия лежит у наружного зева, но в ответ на гормональ¬
ные изменения, которые происходят в период полового созревания,
призматический эпителий распространяется за пределы наружного
зева, поэтому у взрослых женшин граница проходит по эктопервиксу.
Распространение призматического эпителия из канала на эктоцервикс
называется эктопией. Затем происходит трансформация: плоский эпи¬
телий начинает расти поверх призматического. Участок эктоцервикса,
где наблюдается такое явление называется зоной трансформации.
Трансформированные эпителиальные клетки называются метаплас-
тическими. В период менопаузы у женщин граница между плоским и
призматическим эпителием отступает обратно в цервикальный канал,
становясь недоступной для визуального осмотра.
Рис. 4-2, Расположение
призматического эпителия
и зоны стыка в шейке матки;
1 — многослойный плоский
эпителий; 2 — призмати¬
ческий эпителий; 3 — зона
стыка
236 Глава 4. Цитологические исследования
Знание анатомии расположения границы стыка двух видов эпите¬
лия имеет главное значение для правильного взятия мазков и соот¬
ветственно получения адекватных результатов анализов.
4,2.2. РАК ШЕЙКИ МАТКИ
Рак шейки матки возникает не сразу. В большинстве случаев он
и-меет длительный латентный период. Определенные предраковые
изменения в эпителии происходят в течение 8—15 лет до развития
инвазивного рака. Исследование мазков из шейки матки играет важ¬
нейшую роль в предупреждении развития рака. Основная цель иссле¬
дования — выявление изменений клеток эпителия шейки матки,
которые обычно предшествуют появлению рака. Обнаружение этих
предраковых изменений и их соответствующее лечение позволяют
предотвратить развитие заболевания.
В 80-90% случаев рак шейки матки развивается на границе между
плоским и призматическим эпителием. Однако задолго до его развития
на границе двух типов эпителия наблюдаются микроскопические изме¬
нения плоского эпителия, которые носят название дисплазии. Дисплазия
обычно связана с инфицированием вирусом папилломы человека и явля¬
ется потенциально прогрессирующим состоянием. Она невидна невору-
женным глазом и может определяться только при цитологическом иссле¬
довании мазков из шейки матки как на патологически измененной шейке
матки, так и у здоровых женщин. Если пациентку не начать лечить, то
дисплазия может привести к развитию рака шейки матки.
Различают три степени дисплазии шейки матки (чем глубже про¬
цесс, тем тяжелее дисплазия):
• дисплазия I степени — легкая степень, которая проявляется кле¬
точными изменениями, ограниченными нижней третью эпите¬
лия (базальным и парабазальным слоя.ми);
• дисплазия И степени — у.меренная степень, при которой клеточ¬
ные изменения затрагивают 2/3 слоев эпителия;
• дисплазия 1Г1 степени — тяжелая степень, при которой изменен¬
ные клетки при микроскопии видны по всей толщине эпители¬
ального пласта.
Ус1ановление степени дисплазии имеет важное практическое зна¬
чение. Степень дисплазии определяет риск развития инвазивного рака.
Пациентки с дисплазией I степени подвержены относительно низкому
4.2. Цитологическое исследование мазков из шейки матки 237
риску, у большинства женщин (примерно 50%) дисплазия разреша¬
ется самостоятельно. В остальных случаях дисплазия I степени может
сохраняться (персистировать) без каких-либо проявлений, а у неболь¬
шою числа пациенток — пр01рессировать во 11, а затем и в III степень.
Примерно 30% пациенток с дисплазией 111 степени при отсутствии лече¬
ния заболевают инвазивным раком в течен ие 8-10 лет. Поэтому риск раз¬
вития инвазивного рака наивысший при дисплазии 111 степени. Лечение
дисплазии предупреждает развитие рака почти во всех случаях.
Окончательный диагноз дисплазии устанавливают при проведе¬
нии гистологического исследования. Для этого производят биопсию
и берут кусочек ткани из шейки матки. Поэтому цитологическое
исследование мазков из шейки матки необходимо рассматривать как
скрининговый метод обследования женщин в целях предупреждения
данного заболевания.
4.2.3. ОСОБЕННОСТИ ВЗЯТИЯ МАЗКОВ ИЗ ШЕЙКИ МАТКИ
При взятии мазков из шейки матки необходимо учитывать фазу
менструального цикла у женшин и соблюдать следующие условия:
• желательно брать мазки не ранее, чем на 5-й день менструально¬
го цикла и не позднее, чем за 5 дней до предполагаемого начала
менструации; наилучшее время для взятия мазков — середина
менструального цикла; это помогает избежать загрязнения маз¬
ков менструальной кровью;
• после родов лучше отложить взятие мазков на несколько меся¬
цев;
• нельзя брать мазки в течение 24 ч после полового акта, спринце¬
вания, введения во влагалище медикаментов, свечей, кремов, в
том числе кремов для выполнения ультразвукового исследования
(все это может повлиять на истинную картину строения клеток
шейки матки).
Техника взятия мазка играет очень важную роль в получении пра¬
вильных результатов. Примерно 15—20% мазков берутся неправильно,
поэтому их нужно взять повторно. Навыки правильного взятия маз¬
ков приобретаются путем тренировки и опыта.
Для того чтобы увидеть шейку матки, врач вводит во влагалище
гинекологическое зеркало. После удаления выделений из влагалища
осуществляется забор материала. Эта процедура занимает 5—10 е.
238 Глава 4, Цитологические исследования
Клетки берут с места, где проходит граница между двумя типами
эпителия, так чтобы мазок содержал клетки плоского и эндоцерви¬
кального эпител иев. Так как положение границы с возрастом изменя¬
ется, при взятии мазков необходимо учитывать этот фактор. Обычно
используют несколько инструментов (рис. 4-3). Для взятия клеток
из эндоцервикального канала применяют эндоцервикальную пито-
щеточку. Щеточку вводят в наружный зев шейки матки, осторожно
направляют ее центральную часть по оси цервикального канала.
Далее цитощеточку поворачивают на 360° (желательно до 3-4 раз по
часовой стрелке), достигая тем самым взятия достаточного количест¬
ва клеток с эктоцервикса и зоны трансформации. Инструмент нужно
вводить очень бережно, стараясь не повредить шейку матки. Затем
цитошеточку выводят, и материал распределяют на стекле. Образец
на предметное стекло следует переносить быстро, без подсушивания
и потери прилипших к инструменту слизи и клеток. Материал необ¬
ходимо распределить по предметному стеклу тонким слоем, чтобы
весь он оказался на стекле. Нужно зафиксировать влажный препарат
сразу после его приготовления. Для этого предметные стекла поме¬
щают в 90—96° этиловый спирт на 10—15 мин. Стекло высушивают на
воздухе, помещают в пластиковую коробку и доставляют в лаборато¬
рию.
Для получения клеток из зоны трансформации эктоцервикса
используют шпатель Эйра, который имеет выступающий наконечник
для введения в наружный зев. Полная окружность зоны трансфор¬
мации может быть охвачена при вращении шпателя на 360°, Образец
переносят на маркированное данными пациента предметное стекло
так, чтобы на него попал биологический материал с обеих сторон
шпателя. Если использовали несколько шпателей, материал с каж¬
дого следует перенести на отдельное предметное стекло. Важно,
чтобы клетки в образце были немедленно зафиксированы. Для этого
предметные стекла помещают в 90—96° этиловый спирт на 10—15 мин.
Стекло высушивают на воздухе, помещают в пластиковую коробку и
доставляют в лабораторию.
В настоящее время все большее распространение получает метод
жидкостной цитологии. Главным отличием данного метода от тра¬
диционного является то, что взятый биологический материал не
переносят сразу на предметное стекло, а помещают во флакон со ста¬
билизирующим раствором. Стабилизирующий раствор обеспечивает
сохранность морфологических особенностей клеток, в лаборатории
4.2. Цитологическое исследование мазков из шейки матки
239
из доставленного во флаконе биоматериала с помощью специальных
цитоцентрифуг приготавливают многослойные препараты.
Рис. 4-3. Приспособления для взя¬
тия клеток из эндоцервикального
канала:
а — шпатель Эйра для взятия мате¬
риала с поверхности шейки матки;
б — щеточка для взятия материала из
цервикального канала
В лаборатории мазки окрашивают и исследуют под микроскопом.
Если будет обнаружено, что мазок выполнен ненадлежащим образом,
лаборатория запросит повторную пробу, что создаст определенные
трудности и для медицинской сестры, и для пациента. Поэтому важно
знать, какие причины приводят к неправильному взятию образца.
К наиболее распространенным относятся следующие:
■ в мазках присутствует неадекватное количество эпителиальных
клеток вследствие того, что соскоб с шейки матки был сделай е
недостаточным нажимом или образец был неполностью перене¬
сен на стекло;
• в препарате присутствует большое количество клеток крови
вследствие чрезмерного нажима при взятии биоматериала;
• в мазках ие представлена граница двух типов эпителия (например,
отсутствуют эндопервикальные или метаплазированные клетки);
• материал неравномерно распределен на стекле (мазок слишком
тонкий или слишком толстый);
• клетки плохо зафиксированы вследствие длительного пребыва¬
ния образца на воздухе до фиксации или несоблюдения времени
фиксации;
• образец загрязнен, например, кровью, спермой, смазкой с пре¬
зерватива, гелем для ультразвукового исследования или тальком
(если перед взятием мазков патщентке проведено бимануальное
исследование влагалища).
240 Глава 4. Цитологические исследования
При микроскопическом исследовании в лаборатории примерно в
80-90% правильно взятых мазков не выявляют патологических изме¬
нений. Для таких женщин не требуется проведение дополнительных
диагностических мероприятий. Повторный вызов пациенток для
взятия мазка в этих случаях необходим через 1—3 года (в зависимости
от местных методических указаний). В России у женщин репродук¬
тивного возраста мазки из шейки матки рекомендуется брать для
исследования не реже раза в год. В остальных 10—20% мазков обнару¬
живают изменения строения клеток шейки матки различной степени
выраженности — от доброкачественных до дисплазии и инвазивного
рака. Рак выяв.ляют примерно в 1 случае из 1000 мазков.
Исследование мазков из шейки матки —- это скрининговый тест.
Он позволяет исключить из дальнейшего исследования 80—90% жен¬
щин с отрицательным результатом. В этом заключается его основная
ценность. У остальных 10—20% женщин тяжесть изменений в мазках
определяет последующие шаги. Большинство мазков с патологичес¬
кими изменениями имеют слабую степень дисплазии. Вероятность
того, что эти из-мснения подверг нутся обратному развитию, достаточ¬
но велика, но имеется небольшая доля риска, что со временем разо¬
вьются предраковые изменения. Поэтому таким пациенткам показано
активное наблюдение (например, 1[роходить повторные обследования
через 3 или 6 мес), пока атипия не разрешится. Женщин, в мазках
которых обнаружена дисплазия Пи III степень в двух последователь¬
ных наблюдениях, обычно направляют на колыюскопию (диагнос¬
тическая процедура, во время которой шейку матки исследуют через
специально модифицированный микроскоп) с проведением биопсии
подозрительных участков. Результаты кольпоскопии и биопсии опре¬
деляют лечение, которое может быть проведено пациентке.
4.3. ЦИТОЛОГИЧЕСКИЙ АНАЛИЗ МОКРОТЫ
Рак легких является одним из наиболее распространенных онко¬
логических заболеваний, для которого характерен высокий уровень
смертности. Ежегодно в мире диагностируется около 10 млн новых
случаев рака легких, причем половина пациентов погибает в течение
первого года после установ;[сния диагноза. Высокая смертность объ¬
ясняется тем, что заболевание диагностируется слишком поздно — по
4.3. Цитологический анализ мокроты 241
статистике лишь 25% случаев рака легких выявляют на ранних стади¬
ях. В России рак легких занимает первое место в структуре онколо¬
гической заболеваемости у мужчин. Пятилетняя выживаемость всех
больных раком легкого не превышает 10—15%, а при мелкоклеточном
раке — 1—3%.
Клиническая симптоматика рака легких во многом определяется
локализацией опухоли (Центральный рак, периферический рак) и
стадией заболевания. На ранних стадиях развития новообразования
важное значение имеет клинико-анатомическая форма опухоли.
В целях ранней диагностики рака легких проводят массовые
обследования (цитологическое исследование мокроты и рентгеногра¬
фию грудной клетки) мужчин из группы риска (возраст старше 45 лет,
количество выкуриваемых в день сигарет 40 и более).
Объектами цитологического исследования служат мокрота, биоло¬
гический материал, полученный при бронхоскопии (мазки и соско-
бы слизистой оболочки бронхов, аспираты бронхиального секрета
и промывных вод, кусочки биопсированный ткани). Полученный
биологический материал необходимо немедленно доставить в лабо¬
раторию. Обычно при назначении цитологического исследования
мокроты больной должен собрать 3 порции мокроты в течение 3 дней.
В сомнительных случаях исследование повторяют 4—5 раз. Вероят¬
ность обнаружения клеток злокачественных новообразований повы¬
шается с увеличением числа исследований.
При первичном обследовании рак легких обнаруживают у 4-8
человек из 1000 пациентов, остальных обследуют повторно с интер¬
валом 4 мес. В течение года рак легкого выявляют еще у 4 человек из
1000. При проведении скрининговых обследований диагноз рака лег¬
ких в 72% случаев устанавливают с помошью рентгенографии грудной
клетки, в 20% — с помощью цитологического исследования мокроты
и лишь в 6% — обоими методами. На момент установления диагноза
90% больных обычно не имеют клинических проявлений рака легких
и у примерно 62% опухоль является операбельной. Вместе с тем скри¬
нинговые обследования пациентов на раннее выявление рака легкого
показывают, что они не влияют на пятилетнюю выживаемость боль¬
ных. Причиной низкой выживаемости пациентов служат мелкие,
невыявляемые метастазы рака, которые образуются на самых ранних
стадиях болезни.
Успех цитологической диагностики зависит от правильного соби¬
рания мокроты и ее обработки, а также правильной интерпретации
242 Глава 4. Цитологические исследования
цитологической картины. Для анализа следует брать утреннюю пор¬
цию мокроты, откашливаемую больным натощак. В лабораторию
мокроту доставляют не позднее 1—1,5 ч после откашливания.
Цитологическое исследование мокро гы (пятикратное) позволя¬
ет обнаружить раковые клетки у 50—85% больных центральным и у
30—60% периферическим раком легких.
Особенно ценно исследование мокроты, полученной после брон¬
хоскопии. Ложноположительные заключения на наличие рака отме¬
чаются в 1-6% наблюдений. Отсутствие элементов рака в мокроте не
дает основания отрицать опухоль легкого.
Доступность цитологического метода исследования мокроты поз¬
воляет использовать его при обследовании лиц повышенного риска
по раку легких в различных лечебных учреждениях и амбулаторных
условиях.
4.4. ЦИТОЛОГИЧЕСКИМ АНАЛИЗ МОЧИ
Рак мочевого пузыря — злокачественное заболевание стенки моче¬
вого пузыря. Ежегодно в мире регистрируется более 250 тыс. случаев
рака мочевого пузыря и ежегодно от этого заболевания умирает около
60 тыс. человек. Заболеваемость раком мочевого пузыря в России
составляет 10,9 случая на 100 тыс. населения. Рак мочевого пузыря в
первую очередь поражает мужчин. Наиболее часто это заболевание
встречается в возрасте 60-70 лет. Факторами риска ио заболеванию
раком мочевого пузыря являются потребление никотина и контакт с
определенными химическими веществами (ароматические амины),
использующимися о промышленности как красители.
Примерно 2/3 опухолей мочевого пузыря приходится на поверх¬
ностные их формы. На этой стадии возможно излечение, на более
поздних стадиях терапия неэффективна, и проводится хирурги¬
ческое вмешательство. В большинстве случаев рак развивается из
поверхностного эпителия слизистой оболочки мочевого пузыря,
представленного особыми клетками — уротелием. Поскольку лохан¬
ки, мочеточники и часть уретры также выст.чаны уротелием, то в
любом из вышеназванных отделов мочевого тракта может развиться
злокачественная опухоль (карцинома уротелия). Тем не менее в более
чем 90% всех случаев опухоль обнаруживается в мочевом пузыре.
4,3. Цитологический анализ мочи 243
Достоверных ранних клинических симптомов рак мочевого пузыря
не имеет. В большинстве случаев первым проявлением рака мочевою
пузыря становится макрогематурия (примесь крови к моче). Поэтому
при появлении примеси крови в моче, а также при рецидивирующем
воспалении .мочевого пузыря необходимо как можно раньше обра¬
титься к урологу. Помимо исследования мочи (на наличие клеток
крови, клеток опухоли), ре1пающее значение в диагностике рака имеет
осмотр мочевого пузыря с по.мощью специального инструмента (цис¬
тоскопия). Осмотр мочевого пузыря может быть проведен в большинс¬
тве случаев в поликлинических условиях без применения наркоза.
в настоящее время наилучшим методом диагностики рака мочево¬
го пузыря является цистоскопия, при которой через мочеиспускатель¬
ный канал вводят специальный аппарат с камерой иа конце, позволя¬
ющей осматривать слизистую оболочку органа. Это дорогостоящая
и болезненная процедура. Другим способом диагностики является
цитологическое исследование мочи на наличие раковых клеток,
однако он недостаточно надежен. Эффективность цитологического
исследования мочи составляет 48%.
Приблизительно в 80% случаев после оперативного лечения опухо¬
ли мочевого пузыря рецидивируют. Поэтому необходимо проводить
контрольную цистоскопию 4 раза в течение года после операции.
Глава 5.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Биохимические анализы широко используются в клинической
практике в тех случаях, когда в основе болезни лежат метаболические
нарушения (например, сахарный диабет) или когда биохимические
изменения являются следствием заболевания (например, почечная
недостаточность). В практической медицине биохимические тесты
используются для решения следующих задач:
■ скрининга — выявления болезни на доклинической стадии;
• диагностики — подтверждения или исключения диагноза;
• прогноза — определения величины риска развития заболевания,
особенностей течения заболевания и его исхода;
• мониторинга — наблюдения за течением заболевания или реак¬
ции на лечение.
Современная КДЛ способна многосторонне оценивать динамику
патологического процесса, происходящего у больного. Это достига¬
ется путем использования различных методов исследования, направ¬
ленных на определение концентрации биологически важных хими¬
ческих веществ (белки, углеводы, липиды), различных продуктов их
превращений, активности ферментов, гормонов, медиаторов и других
биологически активных соединений в биологических жидкостях
организма человека.
5.1. БЕЛКИ И БЕЛКОВЫЕ ФРАКЦИИ
Белки представляют собой высокомолекулярные азотсодержа¬
щие полипептиды, состоящие из более чем 20 видов а-аминокислот.
Условной границей между крупными полипептидами и белками
яв.тяется молекулярная масса 8000—10 ООО Д. К белкам относятся
соединения, имеющие молекулярную массу бо.лее 10 ООО. Различают
простые и сложные белки. Простые содержат только аминокислоты, а
сложные — еще и неаминокислотные компоненты: гем, производные
витаминов, липидные или углеводные компоненты. Белки играют
5.1. Белки и белковые фракции 245
центральную роль в процессах жизнедеятельности клеток (например,
ферментов) и формировании клеточных структур.
5.1.1. СИНТЕЗ И МЕТАБОЛИЗМ БЕЛКОВ
Все белки организма непрерывно обновляются. Даже при состо¬
янии внешнего покоя осуществляются два противоположно направ¬
ленных процесса — синтез и распад белка.
Процессы синтеза и распада белков включают ряд сложнейших
химических превращений, регулируемых разнообразными нейроэн¬
докринными факторами, из которых важнейшими являются гормоны
гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофи-
зарно-тиреоидной систем.
Белки в организме человека синтезируются из аминокислот. Они
образуются из бе.тков, поступающих с пищей, белка, возникающе¬
го под действием внутриклеточных протеолитических ферментов
(путем биосинтеза их друг с другом), а также жирных кислот и других
соединений.
Исследования белковой картины крови являются одним из наибо¬
лее распространенных биохимических анализов, позволяющих оце¬
нить состояние пациента. Это во многом обусловлено тем, что белко¬
вые компоненты крови выполняют многобразные ферментативные,
гормональные, иммунные и другие функции в организме человека.
Практически нет ни одного заболевания, которое бы не находило
своего отражения в сдвигах белкового обмена как количественного,
так и качественного характера. В то же время необходимо заметить,
что наблюдаемые сдвиги стандартны (неспецифичны для опреде¬
ленного заболевания) и однотипны, что затрудняет их клиническу
оценку. Однако анализ белков крови позволяет следить за динамикой
патологического процесса у больного и эффективностью лечения, а
также судить о степени выраженности нарушений белкового обмена.
Плазма крови человека содержит более 100 различных видов бел¬
ков, различающихся по происхождению и функциям. Основными
белками плазмы крови являются альбумины, различные фракции
глобулинов, фибриноген, липопротеины, гликопротеины и металло-
протсины. Вместе с неорганическими ионами, глюкозой и другими
низкомолекулярными веществами они образуют специфическую
коллоидную систему с особыми физико-химическими свойствами.
246 Глава 5. Биохимические исследования
Из 9—10% сухого остатка плазмы крови на долю белков приходится
6,5-8,5%. При использовании метода высаливания нейтральными
солями белки плазмы крови можно разделить на три группы: альбу¬
мины “ 4-5%, глобулины — 2-3%, фибриноген — 0,2-0,4'%.
Многие белки крови синтезируются в печени, плазматические
клетки и лимфоциты синтезируют иммуноглобулины, макрофаги —
белки системы комплемента. Пассивная потеря белков с низкой
молекулярной массой происходит через почечные клубочки и стенку
кишечника. Часть этих белков подвергается реабсорбции либо непос¬
редственно через клетки почечных канальцев, либо после перевари¬
вания в кишечнике. Большинство белков плазмы после их захвата
путем пиноцитоза (поглощения) катаболизируется в клетках эндоте¬
лия капилляров или мононуклеарных фагоцитах.
Концентрация белков в плазме крови зависит от соотношения
между скоростью их синтеза и выведения из организма, а также объ¬
ема распределения (т.е. объема циркулирующей крови).
Обычно в лабораторию для исследования доставляют кровь, взятую
без анти коагулянта. После ее центрифугирования получают сыворот¬
ку, которую подвергают анализу. Отличие сыворотки от плазмы состо¬
ит в том, что первая не содержит фибриногена, так как в отсутствие
антикоагулятна в пробирке кровь сворачивается, при этом фибриноген
превращается в фибрин, который служит основой сгустка.
Сыворотка крови содержит альбумин, а-, р- и 7-глобулины.
Альбумин составляет более половины белковых компонентов сыво¬
ротки крови. Он обладает значительным сродством к воде и больше,
чем остальные белки, участвует в поддержании коллоидно-онкоти-
ческого давления. Альбумин регулирует водно-электролитный обмен
также путем фиксации примерно 50% кальция сыворотки крови, что
способствует установлению динамического равновесия между свя¬
занной формой кальция и его ионизированной (свободной) формой.
К а- и |3-глобулинам относятся:
• белки с ферментативными свойствами;
• белки, принимающие участие в свертываемости крови (антиге-
мофильный глобулин, протромбин);
• белки, связывающие металлы, — церулоплазмин, трансферрин;
• белки, связанные с липидами;
• белки, связанные с углеводами.
По с равнению с другими фракциями белка 7-глобулины содер¬
жат наименьшее количество связанных углеводов и липидов. Белки,
5.1. Белки и белковые фракции 247
относящиеся к 7-глобулинам, являются по своей сущности анти¬
телами (агглютинины, антистрептолизины, криоглобулины и др.),
которые составляют основу гуморального иммунитета. В связи с этим
снижение уровня 7-глобулинов в сыворотке крови свидетельствует
о понижении устойчивости организма к различным инфекциям.
Синтез 7-глобулинов оеуиюствляется в лимфоцитах лимфатических
узлов и плазматических клерках.
Физиологическая роль белков крови многогранна. В целом белки
выполняют следующие функции:
• поддерживают коллоидно-онкотическое давление, сохраняя
объем крови, связывая воду и задерживая ее, не позволяя выхо¬
дить из кровеносного русла;
• принимают участие в процессах свертывания крови;
■ поддерживают постоянство pH крови, являясь одной из буферных
систем крови;
• соединяясь с рядом веществ (холестерин, билирубин и др.), а
также с лекарственными средствами, доставляют эти вешества к
тканям;
• поддерживают нормальный уровень катионов в крови путем
образования с ними недиализируемых соединений; например,
значительная часть железа, меди, магния и других микроэлемен¬
тов связана с белками;
• играют важнейшую роль в иммунных процессах;
• служат резервом аминокислот;
• выполняют регулирующую функцию, входя в состав гормонов,
ферментов и других биологически активных веществ.
Распад сывороточных белков осуществляется в самых различ¬
ных тканях и органах. Например, через желудочно-кишечный тракт
теряется в среднем 4 г альбумина в сутки. Потеря белка через кишеч¬
ник является физиологическим процессом, у больных с патологией
кишечника теряемое количество белка увеличивается во много раз.
Знание о распределении белков в организме, их обмене имеет очень
важное значение для обеспечения правильного ухода за больным, в час¬
тности, при применении парантерального питания (дозирование вво¬
димых белковых препаратов и др.), а также использовании ряда лекарс¬
твенных препаратов, влияющих на транспортную функцию белков.
Белки входят в состав всех биологических жидкостей организма
человека, но именно белки плазмы крови исследуют наиболее часто.
Поскольку при многих заболеваниях наблюдаются изменения содер¬
248 Глава 5. Биохимические исследования
жания отдельных белков, исследование их уровня в крови широко
используется в диагностических целях, к важнейшим показателям
белкового обмена, имеющим значение в диагностике многих заболе¬
ваний, относится содержание в сыворотке крови обшегЬ белка, аль¬
бумина (о нем более подробно см. в разделе 5.6.), белковых фракций и
индивидуальных белков.
5.1.2. ИССЛЕДОВАНИЕ ОБЩЕГО БЕЛКА
Синтез белков плазмы крови осуществляется в основном в клетках
печени и ретикулоэндотелиальной системы. Концентрация общего
белка в сыворотке зависит главным образом от синтеза и распада двух
основных белковых фракций — альбумина и глобулинов. На скорость
синтеза белка в организме человека оказывают влияние многие фак¬
торы: характер питания, усвоение пищи, интоксикации, потери белка
в результате кровотечений, с раневым отделяемым, с мочой.
Определение уровня общего белка в сыворотке крови в клиничес¬
кой практике часто используется как важный диагностический тест.
Он характеризует содержание всех видов белков. В норме у здорового
человека концентрация общего белка в сыворотке составляет 65—85 г/л.
Снижение содержания белка в крови по сравнению с нормальными пока¬
зателями принято обозначать термином «гипопротеинемия», а превыше¬
ние — термином «гиперпротеи нем ИЯ».
Гипопротеинемический синдром свидетельствует либо о белковом
голодании вследствие недостаточного поступления аминокислот с
пи шей, либо о значительных потерях белка организмом (например,
через почки при развитии нефротического синдрома), либо об угне¬
тении процессов биосинтеза белков крови при хронических заболе¬
ваниях (например, заболеваниях печени), воспаличсльных процессах,
злокачественных новообразованиях, интоксикации.
Гипопротеинемия возникает вследствие:
* недостаточного поступления белка (при длительном голодании
или продолжительном соблюдении безбелковой диеты);
* повышенной потери белка (при различных заболеваниях почек,
кровопотерях, ожогах, новообразованиях, сахарном диабете,
аспите);
* нарушения образования белка в организме при недостаточности
функции печени (гепатиты, циррозы, токсические повреждения),
5.1. Белки и белковые фракции 249
длительном лечении кортикостероидами, нарушении всасывания
(при энтеритах, энтероколитах, панкреатитах);
* усиления процессов распада белка при лихорадочных состояниях
и интоксикациях;
♦ сочетания перечисленных выше факторов.
Снижение уровня общего белка в сыворотке крови ниже 50 |/л
часто сопровождается гипбпротеинемичсскими отеками тканей.
Гиперпротеинемия встречается сравнительно редко. Кратковре¬
менное повышение концентрации обшего белка в сыворотке крови
обычно развивается как следствие дегидратации в результате поте¬
ри части внутрисосудистой жидкости. Это происходит при тяжелых
травмах, обширных ожогах, холере. При острых инфекциях содер¬
жание обшего белка часто повышается вследствие дегидратации
и одновременного возрастания синтеза белков острой фазы. При
хронических инфекциях содержание общего белка в крови может
нарастать в результате активации иммунного процесса и повышен¬
ного образования иммуноглобулинов. Стойкая, ярко выраженная
гиперпротеинемия наблюдается при появлении в крови 1гарапро-
теинов — патологических белков, вырабатываемых в большом
количестве при миеломной болезни и при болезни Вальдеиетрема.
Концентрация обшего белка в сыворотке при этих заболеваниях
может достигать 120 г/л и выше. Умеренная гиперпротеинемия
встречается иногда в стадии выздоровления от острых вирусных
гепатитов.
Медицинская сестра должна знать и учитывать при взятии проб
крови для исследования обшего белка то, что на величину общей
концентрации белка могут оказывать влияние положение тела,
длительность наложения жгута при взятии крови и физическая
активность. Активная физическая работа и смена положения тела
с горизонтального на вертикальное повышают содержание белка в
сыворотке крови на 10%.
При оценке результатов определения обшего белка в сыво¬
ротке важно понимать, что степень выраженности гипо- и
гиперпротеинемии должна служить не только диагностическим
признаком при определении природы болезни, но прежде всего
показателем тяжести, позволяющим следить за динамикой про¬
цесса, определяющим в ряде случаев тактику лечения, и, в час¬
тности, способы снабжения организма больного необходимым
количеством белка.
250 Глава 5, Биохимические исследования
5.1.3. ОПРЕДЕЛЕНИЕ БЕЛКА В СУТОЧНОЙ МОЧЕ
Обнаружение белка в моче (протсинурия) являет;ся одним из
наиболее важных и практически значимых симптомов поражения
почек и мочевыводящих путей.
Содержание белка в отдельных порциях мочи, собранной в течение
суток, может колебаться в значительных пределах. У большинства
здоровых людей в суточном количестве мочи может определяться
50—100 мг белка, У незначительной части (10—15%) протеинурия
может достигать 150 мг/сут. Если при проведении общего анализа
мочи обычными методами обнаружены следы белка или концентра¬
ция его составляет 0,033 г/л, необходимо повторить анализ, поскольку
даже минимальное количество должно настораживать в отношении
возможного заболевания почек. В сомнительных случаях следует
определять суточную потерю белка с мочой. Днем у больного выде¬
ляется с мочой больше белка, чем ночью. Экскреция белка с мочой,
превышающая 100—120 мг/сут, часто связана с заболеванием почек
и требует проведения дальнейшего обследования папиента.
В моче здоровых людей обнаружено более 200 белков, имеющих
различное происхождение; одни фильтруются из плазмы крови, дру¬
гие имеют почечное происхождение или секретируются эпителием
мочевого тракта. При использовании современных методов исследо¬
вания в норме в моче определяется более 30 белков сыворотки крови.
Конпентрапия белка в суточной моче, превышающая 150 мг/сут,
должна рассматриваться как патологическая протеинурия.
Патологическая протеинурия может быть преренальной, реналь-
ной и посгренальной.
Преренальная протеинурия, или перегрузочная, не связана с пора¬
жением почек, а вознйкас! в результате ряда заболеваний или патологи¬
ческих состояний, сопровождающихся повышенным синтезом низко-
молекулярных белков, циркулирующих в крови, фильтрующихся нор¬
мальными клубочками и не полностью реабсорбирующихся. Наиболее
часто перегрузочная протеинурия наблюдается при миеломной болезни.
Ренальная протеинурия, обусловленная поражением клубочков
и/или канальцев почек, характерна для гломерулонефрита и пиело¬
нефрита.
Постренальная протеинурия обусловлена попаданием воспалитель¬
ного экссудата, богатого белком, в мочу при заболеваниях мочевыво¬
дящих путей (цистит, простатит).
5. г Белки и белковые фракции 251
В зависимости от суточной потери белка выделяют следующие
степени протеинурии:
• слабовы раже иная — экскреция белка 0,15-0,3 г/сут;
• умеренная — 0,5-1 г/сут;
• выраженная — 1-3 г/сут;
•более высокая протеинурия расценивается как проявление
нефротического синдрома.
Определение содержания белка в суточном количестве мочи дает
более правильное представление о заболевании и должно быть обяза¬
тельным при обследовании больных с любой патологией почек. Зная
содержание белка в суточной моче, врач имеет правильное представ¬
ление о потерях белка больным и может целенаправленно корриги¬
ровать эти потери. По уровню потерь белка с мочой можно судить об
активности патологического процесса в почках и оценивать эффек¬
тивность проводимого лечения.
Для определения достоверной величины протеинурии важно пра¬
вильно собрать суточную мочу.
5.1.4. БЕЛКОВЫЕ ФРАКЦИИ СЫВОРОТКИ КРОВИ
(ЭЛЕКТРОФОРЕЗ БЕЛКОВ)
Важное диагностическое значение имеют количественные взаимоот¬
ношения между отдельными белками сыворотки крови. Для разделения
всех белков сыворотки крови на их состовляющие обычно используют
метод электрофореза, основанный на различной подвижности белков
сыворотки в электрическом поле, в сыворотке крови здорового человека
при электрофорезе (фореграмма) можно обнаружить 6 белковых фрак¬
ций: преальбумины, альбумины «рглобулины, «з-глобулины, (3-гло¬
булины и 7-глобулины (табл. 5-1). Это исследование в диагностическом
отношении более информативно, чем определение только обшего белка
или альбумина. При многих заболеваниях часто изменяется процентное
соотношение белковых фракций, хотя общее содержание белка в сыво¬
ротке крови остается в пределах нормы. Анализ фореграмм белков поз¬
воляет установить, за счет какой фракции у больного имеется увеличение
или дефицит белка, а также судить о специфичности изменений, харак¬
терных для данной патологии. Однако исследование белковых фракций
позволяет судить о характерном для какого-либо заболевания избытке
или дефиците белка только в самой общей форме.
252 Глава 5. Биохимические исследования
Таблица 5.1.
Белковые фракции сыворотки крови в норме
Фракции
Содержа ние,%
Преальбумины
2-7
Альбумины
52-65
а,-глобулины
2,5-5
а2-глобулины
7-13
Э-глобулины
8-14
•у-ГЛ0буЛИ1ГЬТ
12-22
При анализе результатов исследования сыворотки крови на белко¬
вые фракции выявляются три типа нарушений:
• диспротеинсмии — изменения в соотношении белковых фракций
по сравнению с нормальными значениями;
• генетические дефекты синтеза белков;
• парапротсинемии — появление в крови аномальных белков
(например, при миеломной болезни).
Диспротеинемия может проявляться различными изменениями
в соотношении основных белков сыворотки крови. Рассмотрим их в
порядке расположения белковых фракций на форсграмме.
Ишенения фракции преальбуминов
Преальбумин, или транстиретин — белок с молекулярной массой
54 980 Д и периодом полураспада 1—2 дня; синтезируется в печени.
Одна из важнейших функций преальбумина — транспорт гормонов
щитовидной железы — тироксина и трийодтиронина — в организме
человека.
Изменения фракции преальбуминов практически всегда прояв¬
ляются снижением их уровня вплоть до полного отсу тствия на форе-
грамме.
Преальбу-мин — очень чувствительный негативный (отрицатель¬
ный) белок острой фазы, и при воспалительных процессах его уровень
может падать ниже 20% средней величины нормы. Его уровень сни¬
жается при недостаточном белково-калорийном питании, циррозе
печени, печеночной недостаточности и хронических заболеваниях
печени. Снижение уровня преальбуминов — ранний и чувствитель¬
ный тест белковой недостаточности в организме больного, При соче¬
тании воспалительного процесса и недостаточного питания уровень
преальбумина в сыворотке крови снижается быстро и значительно.
5.1. Белки и белковые фракции 253
Изменения фракции альбуминов
При исследовании сыворотки крови на белковые фракции обычно
удается выявить количественные изменения содержания альбуминов.
Увеличения абсолютного содержания альбуминов, как правило, не
наблюдается. Гипоальбуминемия — одно из наиболее частых откло¬
нений белкового спектра крови. Основные виды гипоальбуминемий
приведены в разделе 5.6,
Изменения фракции <х^-глобулинов
Основными компонентами данной фракции являются а,-анти-
трипсин, оі-липопротеид, кислый а,-гликопротеид.
Увеличение содержания фракции а і-глобулинов наблюдается при
острых, подоетрых хронических воспалительных процессах, пораже¬
нии печени, всех процессах тканевого распада или клеточной проли¬
ферации.
Снижение содержания фракции а,-глобулинов наблюдается при
дефиците аі-антитрипсина, гипо-а,-липопротеидемии.
Изменения фракции <х2-глобулинов
«з-Фракция содержит аз-макроглобулин, гаптоглобин, аполипоп-
ротеины А, В, С, церулоплазмин.
Увеличение содержания аз-глобулинов наблюдается при всех ост¬
рых воспалительных процессах, особенно с выраженным экссуда¬
тивным и гнойным характером (пневмонии, эмпиема плевры и др.);
заболеваниях, связанных с вовлечением в патологический пропесс
соединительной ткани (коллагенозы, аутоиммунные заболевания,
ревматические заболевания); злокачественных опухолях; в стадии
восстановления после термических ожогов; нефротическом синдро¬
ме; гемолизе крови в пробирке.
Снижение содержания фракции аз-глобулинов наблюдается при
сахарном диабете, панкреатитах (иногда), врожденной механической
желтухе у новорожденных, токсических гепатитах.
К а-глобулинам относится основная масса белков острой фазы.
Увеличение их содержания отражает интенсивность стрессорной
реакции и воспалительных процессов при перечисленной патологии.
Изменения фракции ^-глобулинов
Р-ФракПИЯ содержит трансферрин, гемопекеин, компоненты ком¬
племента, иммуноглобулины и липопротеины.
Увеличение содержания фракции р-глобулинов выявляют при пер¬
вичных и вторичных гиперлипопротеинемиях, заболеваниях печени,
нефротическом синдроме, кровоточащей язве желудка, гипотиреозе.
254 Глава 5. Биохимические исследования
Снижение содержания (3-глобулинов выявляется при гипобетали-
попротеинемии.
Изменения фракции 'у-глобулинов
7-Фракция содержит иммуноглобулины О, А, М, Д, Е. Поэтому
повышение содержания у-глобулинов отмечается при реакции систе¬
мы иммунитета, когда происходит выработка антител и аутоантител:
при вирусных и бактериальных инфекциях, воспалении, коллагенозе,
деструкции тканей и ожогах. Значительная гипергаммаглобулине-
мия, отражая активность воспалительного процесса, характерна для
хронических активных гепатитов и циррозов печени. Повышение
содержания фракции у-глобулинов наблюдается у 88-92% больных
хроническим активным гепатитом, причем значительное повышение
(до 26 г/л и выше) ~ у 60-65% больных. Почти такие же изменения
отмечаются у больных при высокоактивном циррозе печени, далеко
зашедшем циррозе, при этом нередко содержание у-глобулинов пре¬
вышает содержание альбуминов, что является плохим прогностичес¬
ким признаком.
Повышение содержания в крови у-глобулинов, кроме уже назван¬
ных заболеваний, может сопровождать ревматоидный артрит, сис¬
темную красную волчанку, хронический лимфолейкоз, эндотелиомы,
остеосаркомы, кандидомикоз.
Уменьшение содержания у-глобулинов бывает первичным и вто¬
ричным. Различают три основных вида первичных гипогаммаглобу-
линемий; физиологическую (у детей в возрасте 3-5 мес), врожденную
(генетический дефект синтеза антител) и идиопатическую (когда
установить причину не удается). Причинами вторичных гипогамма-
глобулинсмий могут быть многочисленные заболевания и состояния,
приводящие к истощению иммунной системы.
Сопоставление направленности изменений содержания альбу¬
минов и глобулинов с изменениями общего содержания белка дает
основание заключить, что гиперпротеинемия чаще связана с гиперг-
лобулинемиями, в то время как гипопротеинемия — с гипоальбуми-
немией.
Нередко для оценки выраженности диспротеинемии рассчитывают
альбу мин-глобул и новый коэффициент, т.е. отношение величины фрак¬
ции альбуминов к величине фракции глобулинов. В норме этот показа¬
тель составляет 2,5—3,5. У больных хроническими гепатитами и цирроза¬
ми печени он понижается до 1,5 и даже до 1 за счет снижения содержания
альбумина и повышения содержания фракции глобулинов.
5А. Белки и белковые фракции 255
Генетические дефекты синтеза белков. Исследование сыворотки
крови на белковые фракции позволяет выявить генетические заболе¬
вания, передаваемые по наследству. Одним из проявлений наследс¬
твенных дефектов является нарушение синтеза некоторых белков.
К этому типу нарушений белкового спектра относятся:
• отсутствие альбумина при нормальном содержании дру1 их фрак¬
ций белка; клинически этот вид наследственной патологии
характеризуется незначительными отеками в связи со снижением
онкотического давления плазмы крови;
• агаммаглобулинемия — патология, заключающаяся во врож¬
денном дефиците синтеза антител, входящих в 7-глобулино¬
вую фракцию; общее количество белка при этом не изменено.
Больные с такой аномалией обладают повышенной восприимчи¬
востью к бактериальным инфекциям (рецидивирующие пневмо¬
нии, ангины, отиты и др.) при сохраненной сопротивляемости к
вирусным инфекциям;
* гипоглобулинемия — общий недостаток глобулинов в сыворотке
крови, при этом концентрация общего белка в сыворотке снижа¬
ется до 40 г/л, а уровень альбумина остается в норме;
* абетаглобулинемия — отсутствие (3-фракции на фореграмме;
одновременно имеет место недостаток белка трансферрина, осу¬
ществляющего транспорт железа в организме человека.
Парапротеинемией называется появление в крови белков, отли¬
чающихся в физическом, химическом и иммунологическом отно¬
шении от обычных белков сыворотки крови. Такие патологические
белки представляют собой иммуноглобулины или их фрагменты,
однородные по всем физико-химическим и биологическим парамет¬
рам. Поэтому их называют еще моноклональными иммуноглобули¬
нами (иарапротеинами, М-протеинами). Они являются продуктом
секреции одного клона В-лимфопитов или плазматических клеток,
поэтому представляют собой пул структурно гомогенных молекул,
при проведении электрофореза белков сыворотки крови о наличии
парапротеинов свидетельствует появление на электрофорсграм-
ме дополнительной (у здоровых людей отсутствует) узкой и резко
ограниченной фракции белков (ее также называют М-компонент) в
области гаммаглобулинов.
Обнаружение парапротеинов наиболее хараюерно для парапро¬
теинемических гемобластозов (хронических лейкозов) — особой
группы опухолей лимфатической системы, к парапротеинемичес-
256 Глава 5. Биохимические исследования
КИМ гемобластозам относятся миеломная болезнь, макроглобули-
немия Вальденстрема и болезнь тяжелых цепей. Заболевания пред¬
ставляют собой костномозговую опухоль. Клиническая картина в
начале болезни не имеет типичных черт. По мере прогрессирования
процесса появляются боли в позвонках, ребрах, обусловленные
разрутпением костей растущей опухолью. Проведение исследования
на белковые фракции является лучши.м методом ранней диагнос¬
тики заболеваний. Наряду с обнаружением парапротеинов у боль¬
ных резко (до 140—170 г/л) повышена концентрация общего белка
в сыворотке крови за счет увеличения концентрации аномальных
белков. Уровень альбумина в крови при этом не изменен. В ряде
случаев парапротеины, проходя через почечный фильтр, попадают
в мочу, где могут быть обнаружены (получили название белка Бенс-
Джонса). Однако патологические белки могут быть выявлены также
при остром плазмобластном лейкозе, лимфосаркомах, других онко¬
логических заболеваниях, например, раке толстой кишки, молочной
железы, предстательной железы и др.
5,1.5, СПЕЦИФИЧЕСКИЕ БЕЛКИ
Специфические белки крови выполняют разнообразные функции:
осуществляют транспорт различных веществ, участвуют в свертыва¬
нии крови, ингибируют протеолитические ферменты, активно учас¬
твуют в иммунных реакциях. Помимо выполнения специфических
функций, белки крови участвуют в общих реакциях организма на
различные патологические процессы, отражая при этом в определен¬
ной степени состояние органов и тканей, что нашло применение в
клинической практике.
На течение воспалительной реакции оказывают влияние мно¬
гие органы и ткани, главным образом с помощью промежуточных
метаболитов, основным из которых является печень, С началом вос¬
палительного процесса любого характера и локализации в печени
изменяется скорость синтеза, а следовательно, состав и количество
определенных видов белков в крови. Белки, синтез которых неспеци¬
фически увеличивается в ответ на патологические процессы разного
характера (воспаление, повреждение, злокачественные новообразо¬
вания), а также при беременности называются «реактантами острой
фазы воспаления».
5.1, Белки и белковые фракции 257
Повышение уровня реактантов острой фазы воспаления различ¬
но. Содержание С-реактивного белка (СРБ) может возрастать на
1000%, фибриногена, гаптоглобина и «(-антитрипсина — обычно на
200—400%, ферритина на 50%.
Из специфических белков наиболее часто в клинической практике
определяют уровень СРБ, орозомукоида, а,-ан і итрипсина и церуло¬
плазмина.
Кислый «|-гликопротеин (орозомукоид) — белок плазмы крови,
наиболее богатый углеводами. Обладает способностью ингибировать
активность протеолитических ферментов, изменять адгезивность
тромбоцитов, подавлять иммунореактивность, связывать многие
медикаменты (пролранолол) и некоторые гормоны (прогестерон).
Референтные величины содержания кислого а 1-гликопротеина в
сыворотке составляют 13,4—34,1 мкмоль/л (0,55-1,40 г/л).
Орозомукоид относится к белкам острой фазы. Содержание оро¬
зомукоида в крови увеличивается при воспалительных процессах
(инфекции, ревматические заболевания), травма, хирургические вме¬
шательства), опухолях. Исследование этого показателя в динамике
позволяет оценивать протекание воспалительного процесса, а при
опухолях в случае их оперативного лечении диагностировать возник¬
новение рецидива.
Поскольку уровень орозомукоида в крови увеличивается при вос¬
пали тельных процесс ах, он способен связывать повышенное количес¬
тво принимаемого больным лекарственного средства, вследствие чего
может возникать расхождение между фармакологическим эффектом и
уровнем препарата в крови.
Снижение содержания орозомукоида может быть выявлено в ран¬
нем детском возрасте, при беременности (в ранние сроки), тяжелых
поражениях печени, нефротическом синдроме, приеме эстрогенов,
контрацептивов.
а,-Антитрипсин является гликопротеидом, синтезируемым пече¬
нью. функционально он обеспечивает 90% активности, ингибирую¬
щей трипсин в крови. Этот гликопротеид тормозит действие не только
трипсина, но и химотрипсина, эластазы, калликреина, катепсинов и
других протеолитических ферментов, способствуя их расщеплению.
Референтные величины содержания а,-антитрипсина в сыворотке
крови у взрослых до 60 лет 0,78—2,0 г/л, старіле 60 лет — 1,15—2,0 г/л.
«(-Антитрипсин относится к белкам острой фазы, поэтому его
содержание в сыворотке крови повышается при воспалительных
258 Глава 5. Биохимические исследования
процессах: острых, подострых и хронических инфекционных забо¬
леваниях, острых гепатитах и циррозах печени в активной форме,
некротических процессах, состояниях после операций и восстанови¬
тельной фазе термических ожогов, при вакцинации.
Особый интерес представляют снижение содержания а,-анти-
трипсина в сыворотке крови. Выраженный врожденный дефицит а,-
антитрипсина часто сочетается с ювенильной базальной эмфиземой
легких, развитием эмфиземы у людей в возрасте 20—40 лет, муковис-
цидозом. Довольно часто вс1речаются стертые формы врожденной
антитрипсиновой недостаточности. У таких детей обнаруживают раз¬
личные формы поражения печени, включая ранние холестазы. У 1—2%
больных развивается цирроз печени.
Приобретенный дефицит (х^-антитриисина встречается при нефро¬
тическом синдроме, гастроэнтеропатии с потерей белка, острой фазе
термических ожогов. Содержание а,-ангитрипсина в крови может
быть снижено у больных вирусным гепатитом вследствие нарушения
его синтеза в печени. Повышенное расходование этого гликопротеида
при респираторном дистресс-синдроме, остром панкреатите, коагу-
лопатиях также приводит к снижению его содержания в крови.
Церулоплазмин представляет собой белок, обладающий оксидазной
(ферментативной) активностью. Он содержит 8 ионов Си+ и 8 ионов
Сп2+ и катализирует окисление кислородом различных веществ.
Субстратами церулоплазмина в организме человека могут быть аскор¬
биновая кислота, соединения железа, норадреналин, серотонин и
сульфгидрильные соединения. Он также инактивирует активные
формы кислорода, предотвращая перекисное окисление липидов.
Церулоплазмин — главный медьсодержащий белок плазмы, который
относится к 2-глобулина.м; на его долю приходится 3% общего содер¬
жания меди в организме и свыше 95% меди сыворотки. Ему прина¬
длежит ведущая роль в транспорте меди к тканям. Церулоплазмин
синтезируется в печени. Референтные величины содержания церуло¬
плазмина в сыворотке крови у взрослых составляют 180—450 мг/л.
Важнейшую роль определение уровня церулоплазмина в сыво¬
ротке крови играет для диагностики болезни Вильсона—Коновалова
(гепатоцеребральная дегенерация). В основе заболевания лежит
генетический дефект синтеза белка в печени. При недостаточнос¬
ти церулоплазмина ионы меди после их всасывания в желудоч¬
но-кишечном транкте из продуктов питания попадают в общий
кровоток. Однако из-за отсутствия церулоплазмина в плазме ионы
5.1. Белки и белковые фракции 259
меди быстро выходят во внесосудистое пространство (содержание
меди в крови снижается). Они проходят через базальные мемб¬
раны почек в гломерулярный фильтрат и выводятся с мочой или
накапливаются в тканях (например, в роговице глаза). Для про-
ЯВ.1ЄНИЯ клинических признаков заболевания особое значение
имеет степень накопления меди в центральной нервной системе.
Недостаточность ионов меди в крови (вследствие дефицита церу¬
лоплазмина) приводит к повышению их резорбции в кишечнике,
что еще больше способствует ее накоплению в организме с после¬
дующим повреждением органов и тканей. В наибольших количес¬
твах медь откладывается в печени и базальных ганглиях головного
мозга, а также в почечных канальцах. В клинической картине
болезни симптомы поражения печени обычно появляются первы¬
ми. Патологический процесс, развивающийся в печени (гепатит),
приводит через несколько лет к хронической печеночной недоста¬
точности. в ткани мозга появляются полости и дегенеративные
изменения не только в базальных ганглиях, но и в коре головного
мозга, особенно в лобных долях. Неврологические симптомы чаще
всего начинают отмечаться с 6—8-летнего возраста. Появляются
двигательные нарушения и отклонения в психике. Движения рук
напоминают взмахи крыльев птицы. Могут возникнуть психи¬
ческие отклонения, задержка умственного развития. Поражение
почек проявляется развитием почечного канальпиевого ацидоза,
усиленной потерей с мочой аминокислот, неорганического фосфо¬
ра, глюкозы (глюкозурия). Болезнь обычно прогрессирует медлен¬
но. Снижение уровня церулоплазмина в крови выявляется у 97%
пациентов с болезнью Вильсона-Коновалова.
Однако низкие уровни церулоплазмина в сыворотке крови могут
быть выявлены также при нефротическом синдроме (потеря белка
с мочой), заболеваниях желудочно-кишечного тракта (нарушение
всасывания аминокислот), тяжелых заболеваниях печени (в 23% слу¬
чаев) вследствие нарушения его синтеза, заболеваниях центральной
нервной системы (у 15% пациентов).
Церулоплазмин является белком острой фазы (период полураспада
6 сут), поэтому возрастание его уровня наблюдается у больных с ост¬
рыми и хроническими инфекционными заболеваниями, циррозом
печени, гепатитами, инфарктом миокарда, системными заболева¬
ниями, лимфогранулематозом. Повышение уровня церулоплазмина
может быть отмечено у больных шизофренией.
2в0 Глава 5. Биохимические исследования
Содержание церулоплазмина в сыворотке крови увеличивается
при злокачественных новообразованиях различной локализации
(рак легкого, молочной железы, шейки матки, желудочцо-кишечно-
го тракта) в 1,5—2 раза, достигая более значительных величин при
распространенности процесса. Успешное химио- и лучевое лече¬
ние сопровождается снижением уровня церу.юп.чазмина вплоть до
нормального. При неэффективности комбинированной терапии, а
также прогрессировании заболевания содержание церулоплазмина
остается высоким.
5.1.6. С-РЕАКТИВНЫЙ БЕЛОК
СРБ определяется в сыворотке крови при различных воспалитель¬
ных и некротических процессах и является показателем острой фазы
их течения. Свое название он получил из-за способности связывать
С-полисахарид клеточной стенки пневмококка. Синтез СРБ как
белка острой фазы происходит в печени под влиянием питокинов
(белки с небольшой молекулярной массой, продуцируемые ядросо¬
держащими клетками). Основная функция СРБ состоит в актива¬
ции иммунных реакций организма, связывании различных микро¬
организмов и продуктов распада поврежденных тканей. В норме
уровень СРБ в сыворотке крови составляет менее 5 мг/л.
Повышение уровня СРБ в крови, подобно ускорению СОЭ, — при¬
знак любого заболевания, связанного со значительным поврежде¬
нием тканей, воспалением, инфекцией или злокачественной опухо¬
лью, Чем выше уровень СРБ в крови, тем выше вероятность наличия
у больного повреждения тканей, воспалительного, инфекционного
или онкологического заболевания.
Повреждение тканей. Ряд заболеваний, при которых происхо¬
дит повреждение тканей, сопровождается повышением уровня СРБ.
Повышение уровня СРБ в крови начинается в течение первых 4 ч от
момента повреждения, достигает максимума через 24—72 ч и снижает¬
ся в ходе выздоровления.
При инфаркте миокарда (повреждение миокарда) уровень СРБ
повышается через 18—36 ч от начала заболевания, к 18—20-му дню сни¬
жается и к 30—40-му дню становится нормальным. Высокий уровень
СРБ является прогностически неблагоприятным признаком исхода
инфаркта миокарда.
5./. Белки и белковые фракции 261
Для всех форм острого панкреатита (повреждение поджелудоч¬
ной железы) характерно значительное повышение содержания СРБ в
сыворотке крови. Уровень СРБ начинает повышаться приблизительно
через 36 ч от начала заболевания. Установлено, что уровень СРБ выше
150 мг/л свидетельствует о тяжелом (панкреонекроз) или осложнен¬
ном остром панкреатите.
После хирургических вмешательств (хирургическое повреждение)
уровень СРБ повышается в ранний послеоперационный период,
однако начинает быстро снижаться при отсутствии инфекционных
осложнений.
Инфекционные заболевания. Уровень СРБ в сыворотке крови
является самым ранним признаком бактериальной инфекции.
Концентрация СРБ в сыворотке крови выше 80-100 мг/л почти всегда
свидетельствует о бактериальной инфекции. Эффективная антибак¬
териальная терапия сопровождается снижением уровня СРБ в крови.
Воспалительные заболевания. Любой воспалительный процесс в
организме сопровождается повышенным синтезом некоторых бел¬
ков плазмы (белки острой фазы), включая СРБ. Его уровень в крови
отражает интенсивность воспалительного процесса, и контроль за
уровнем СРБ важен для мониторинга течения многих заболеваний.
Уровень СРБ при воспалительном процессе может повышаться в
20 раз и более. При активном ревматическом пропессе повышение
уровни СРБ обнаруживается у большинства больных. Параллельно
со снижением активности ревматического процесса уменьшается и
содержание СРБ. Ревматоидный артрит также сопровождается повы¬
шением уровня СРБ.
Онкологические заболевания. Синтез СРБ усиливается в ответ на
появление в организме злокачественных опухолей различной локали¬
зации. Повышение уровня СРБ отмечается при раке легкого, предста¬
тельной железы, желудка, яичников и других опухолей. Несмотря на
свою неспецифичность, СРБ совместно с другими опухолевыми мар¬
керами может служить тестом для оценки прогрессирования опухоли
и диагностики рецидива заболевания.
Ультрачувствительный (сверхчувствительный) СРБ. Длительное
время считали, что клинически значимым является повышение
уровня СРБ выше 5 мг/л, при содержании СРБ ниже этой величи¬
ны констатировали отсутствие системного воспалительного ответа.
В дальнейшем было показано, что концентрация СРБ, превышающая
3 мг/л, является неблагоприятным прогностическим признаком, свя¬
262 Глава 5. Биохимические исследования
занным с риском сосудистых осложнений у практически здоровых
людей и больных с сердечно-сосудистыми заболеваниями. В связи с
этим были разработаны ультрачувствительныс тест-системы и набо¬
ры реактивов для определения уровня СРБ, Эти методы обладают
примерно в 10 раз большей аналитической чувствительностью по
сравнению с традиционными методами и позволяют регистрировать
минимальные колебания концентрации СРБ в крови. Определение
ультрачувстБительного СРБ имеет важное практическое значение для
установления риска развития тяжелых сердечно-сосудистых заболе¬
ваний и осложнений ~ инфаркта миокарда и инсульта. При уровне
СРБ ниже 1 мг/л риск развития сосудистых осложнений минималь¬
ный, при уровне 1,1-1,9 мг/л — низкий, 2,0-2,9 мг/л — умеренный,
выше 3 мг/л — высокий.
5.2. ПОКАЗАТЕЛИ АЗОТИСТОГО ОБМЕНА
Синтез и распад белков являются единой системой, сбаланси¬
рованной всеми промежуточными реакциями, протекающими на
различных уровнях. Представленные в организме человека, они
настолько многочисленны и разнообразны, что оценить их все с
использованием лабораторных показателей невозможно. Вместе с тем
оценка ключевых звеньев промежуточного обмена белков и азотистых
соединений крайне важна для определения функционального состо¬
яния жизненно важных органов и тканей, таких, как печень, почки,
мышечная система. При этом под промежуточным обменом следует
понимать преврашение компонентов пиши после их переваривания и
всасывания в организме человека. Он включает:
• анаболические процессы — процессы синтеза белков (анабо¬
лизм);
• катаболические процессы — процессы распада белков, образова¬
ния промежуточных и конечных продуктов метаболизма (катабо¬
лизм).
У здорового взрослого человека обновление белков в норме
составляет 1—2% от общего количества белков тела за сутки
и связано преимущественно с деградацией мышечных белков
до аминокислот. При этом примерно 75-80% высвободившихся
аминокислот снова используется в синтезе белков. Оставшаяся
5,2, Показатели азотистого обмена 263
часть метаболизируется до конечных продуктов азотистого обме¬
на (аммиак, мочевина), удаляемых из организма с мочой, а также
превращается в глюкозу. Суточная деградация белка составляет
30-40 г. Для поддержания нормального стапионарного состояния
взрослый человек нуждается в потреблении в среднем 30-40 г
белка или эквивалентного .количества аминокислот.
Белки состоят из аминокислот, обязательно содержащих амино¬
группу, в состав которой входит азот. Поэтому для опенки состояния
белкового обмена в медицинской практике широко используется
термин «азотистый баланс». Баланс азота в организме — это разность
между количеством потребленного и выделенного азота, У здорового
человека скорости анаболизма и катаболизма находятся в равнове¬
сии, поэтому азотистый баланс равен нулю. При травме или стрессе,
например, при ожогах, потребление азота снижается, а потери азота
могут быть больше потребления — тогда у больного развивается отри¬
цательный азотистый баланс. При выздоровлении азотистый баланс
становится положительным вследствие получения белка с пищей.
Исследование азотистого баланса дает более полную информацию о
состоянии пациента, у которого имеются метаболические потребнос¬
ти в азоте.
Общий азот включает все продукты обмена белков, выводимые
с мочой. Его количество сопоставимо с азотом усвоенного белка
и составляет примерно 85% азота, поступившего с белками пищи.
Белки содержат в среднем 16% азота. Точное установление общего
азота важно для последующей оценки состояния азотистого обме¬
на. Однако методы его определения достаточно сложны и не нашли
широкого применения в лабораторной практике.
Помимо азота белков не менее важное значение имеет небелко¬
вый азот. Небелковый азот крови называют также остаточным азо¬
том — это то количество азота, ко горое остается в сыворотке крови
после удаления из нее белков путем осаждения. Небелковый азот
крови включает азот мочевины (50% общего количества небелкового
азота), аминокислот (25%), мочевой кислоты (4%), креатина (5%),
креатинина (2,5%), аммиака и индикаиа (0,5%) и других небелковых
веществ (5%) (полипептиды, нуклеотиды, нуклеозиды, глутатион,
билирубин, холин, гистамин и др.).
Таким образом, в состав небелкового, или остаточною азота крови
входит главным образом азот конечных продуктов обмена простых и
сложных белков.
264 Глава 5. Биохимические исследования
У здорового человека колебания в содержании небелкового азота в
крови незначительны и в основном зависят от количества поступаю¬
щих с пищей белков, при ряде патологическихсостояний«содержангте
небелкового азота в крови повышается. Это повышение носит назва¬
ние азотемии. Она свидетельствует о нарушении нормальных взаимо¬
отношений между образованием и выделение продуктов азотистого
метаболизма из организма.
Различные виды азотемии приводят к неодинаковым изменениям
составляющих остаточного азота в крови и моче. Поэтому для более
детального анализа характера азотемии в клинической практике
целесообразно раздельно определять в крови концентрацию основных
составляющих веществ остаточного азота (мочевина, азот аминокис¬
лот, мочевая кислота, креатинин, аммиак). Так как на долю мочевины
приходится около 50% всего небелкового азота, уровень мочевины в
крови в большинстве случаев наиболее адекватно отражает состояние
всего азотистого обмена в организме человека,
Определение концентрации мочевин ы и креатинина в сыворотке крови
входит практически во все стандарты обследования больных. Оба теста в
основном используются для оценки функции почек. Рассмотрим маркер¬
ную роль и клиническое значение этих метаболитов более детально.
5.2Л. МОЧЕВИНА И КРЕАТИНИН
Конечным продуктом нормального клеточного метаболизма
является аммиак (NHз). Это токсичный продукт, который обра¬
зуется при дезаминировании аминокислот, распаде пуриновых
и пиримидиновых нуклеотидов. Аммиак доставляется кровью в
печень, где обезвреживается, превращаясь в мочевину в процессе
целого ряда фер.ментативных реакций. Этот процесс называется
циклом синтеза мочевины (цикл мочевины). На рис. 5-1 представ¬
лены процессы превращения аммиака и дальнейшая судьба моче¬
вины в организме человека.
Креатинин является конечным продуктом распада креатина,
который играет важную роль в энергетическом обмене мышечной и
других тканей. Креатин синтезируется в основном в печени, отку¬
да он с током крови поступает в мышечную ткань. Здесь креатин,
фосфорилируясь, превращается в креатинфосфат. Креатинфосфат
является макроэргом и участвует в переносе энергии в клетке
5.2. Показатели азотистого обмена
265
Печень
Мочевина выводится из
организма с мочой
В печени аммиак
превращается в
нетоксичную мочевину
Мочевина доставляется
кровью к почкам, где
подвергается клубочковой
Почка
Рис. 5-Т. Образование и выведение мочевины из организма
между митохондриями и миофибрилами. в дальнейшем креатин пре¬
вращается в креатинин, который высвобождается из миоцитов и кро¬
вью доставляется в почки, откуда экекретируется вместе с мочевиной
в составе мочи. Его образование — величина довольно постоянная и
непосредственно зависит от состояния мышечной массы. Креатинин
удаляется почками посредством клубочковой фильтрации, но, в отличие
от мочевины, не реабсорбируется, что делает его хорошим маркером для
оценки скорости клубочковой фильтрации. Концентрация креатинина
в крови зависит от его образования и выведения. Экскреция креатини-
266
Глава 5. Биохимические исследования
на отражает метаболизм мышечного белка. При истощении мышечной
массы наблюдается снижение экскреции креатинина с мочой.
5.2.2. РЕГУЛЯЦИЯ ПОЧКАМИ УРОВНЯ МОЧЕВИНЫ
И КРЕАТИНИНА В КРОВИ
Почки выполняют функцию фильтра для крови, который освобождает
организм от нежелателы1ых продуктов метаболизма (в том числе мочеви¬
ны, креатинина, мочевой кислоты и др.), атакже избыточного количества
электролитов (калий, натрий, кальций, магний, хлор и др.). Моча — про¬
дукт почечной фильтрации — представляет собой водный раствор этих
нежелательных продуктов. Благодаря своей способности изменять объем
и состав мочи почки играют важнейшую роль в поддержании постоянства
плазмы крови и интерстициальной жидкости, окружающей клетки тка¬
ней организма. Такое постоянство внутренней среды (гомеостаз) является
необходимым условием для нормального функционирования клеток.
Напомним, что функциональной единицей почки является нефрон,
который состоит из гломерулярного клубочка и почечных канальцев
(рис. 5-2). В клубочках происходит фильтрация воды и нежелательных
продуктов метаболизма (низкомо¬
лекулярных компонентов крови).
Одновременно клубочки удержи¬
вают клетки и высокомолекуляр¬
ные компоненты (белки) в крови.
Рис. 5-2. Схема строения и кровос¬
набжения нефрона
I — капсула клубочка (Шумлянс¬
кого ■— Боумена); 2 — клубочек
почечного тельца; 3 — просвет кап¬
сулы клубочка; 4 — проксимальная
часть канальца нефрона; 5 — крове¬
носные капилляры; 6 — собиратель¬
ная трубочка; 7 — петля нефрона;
8 — дистальная часть канальца
нефрона; 9 — артерия; 10 — вена;
II — приносящая клубочковая арте¬
риола; 12 — выносяшая клубочковая
артериола
5.2, Показатели азотистого обмена 267
Через почки протекает каждую минуту более 1 л крови (25%
минутного объема кровообращения всего организма). Такая высокая
интенсивность почечного кровотока сопровождается образованием
большого количества фильтрата: за 1 мин о почках образуется 125 мл
фильтрата, за 24 ч — 180 л. Образующийся фильтрат (клубочковый
фильтрат) представляет собой плазму, освобожденную от белков и
клеток крови.
Скорость, с которой образуется этот фильтрат, называется ско¬
ростью клубочковой фильтрации (СКФ). У здорового человека она
составляет в среднем 125 мл/мин (180 л/сут). При прохождении клу¬
бочкового фильтрата через канальцы нефрона его состав и объем
существенно изменяются. В канальцах примерно 99% профильтро¬
ванных клубочками воды и аминокислот, средних и низкомолеку¬
лярных полипептидов, электролитов, глюкозы и других веществ
реабсорбируется обратно в кровь. Помимо реабсорбции, канальцы
секретируют некоторые вещества непосредственно из крови в мочу.
Мочевина и креатинин фильтруются из крови в почечных клубоч¬
ках. Оба продукта являются побочными метаболитами, поэтому реаб-
сорбируются из мочи в небольших количествах. Что касается мочеви¬
ны, то этот процесс активируется, если ее концентрация в фильтрате
слишком высока. Креатинин же и в норме в небольших количествах
может секретироваться из крови почечными канальцами в мочу. Так
как влияние этих эффектов незначительно, то можно сказать, что
количество мочевины и креатинина, экскретируемое с мочой, зависит
в основном от СКФ. Когда СКФ снижается, уменьшается и экскреция
мочевины и креатинина, а значит, повышается их уровень в крови.
СКФ зависит от трех факторов:
• скорости, с которой кровь поступает для фильтрации;
• состояния (проходимости) фильтра (блокирование фильтра,
например, циркулирующими иммунными комплексами при гло¬
мерулонефрите ведет к снижению скорости фильтрации);
• давления с другой стороны фильтра, противодействующего (сни¬
жающего) скорости фильтрации (например, блокирование моче¬
выводящих путей камнем или опухолью).
Таким образо.м, выведение мочевины и креатинина, а соответс¬
твенно и их уровень в крови в основном регулируются почками и
зависят от СКФ. Если способность клубочковой фильтрации, отра¬
жающая функциональное состояние почек, снижается, то уровень
мочевины и креатинина в крови возрастает. Поэтому исследование
268 Глава 5. Биохимические исследования
содержания в крови мочевины и креатинина используют в клиничес¬
кой практике для оценки функционального состояние почек, которое
может нарушаться при ряде заболеваний и состояний.
5.2.2.1. Причины изменения концентрации мочевины
Мочевина является конечным продуктом метаболизма белков в
организме. Она удаляется из организма посредством клубочковой
фильтрации, 40—50% ее реабсорбируется канальцевым эпителием
почек и активно секретируетея тубулярными клетками.
Концентрация мочевины в крови — это отражение баланса между
скоростью ее синтеза в печени и скоростью ее выведения почками с
мочой. Если синтез/продукция увеличивается и/или выведение умень¬
шается, концентрация мочевины в крови повышается. Если же синтез/
продукция снижается и/или экскреция увеличивается, концентрация
мочевины в крови снижается. Референтные величины содержания
мочевины (азота мочевины) в сыворотке крови приведены в табл. 5-2.
Таблица 5.2.
Референтные В6.11ИЧИНЫ содержания мочевины
(азота мочевины) в сыворотке крови
Показатель
Содержание мочевины
ммоль/л
мг/дл
Мочевина
2,5-8,3
15-50
Азот мочевины
2,5-8,3
7,5-25
При патологии сдвиги в уровне мочевины крови зависят от соотно¬
шения процессов образования и выведения мочевины.
Причины снижения концентрации мочевины в сыворотке крови
Ряд физиологических и патологических состояний приводит к
снижению концентрации мочевины в сыворотке крови.
• Диета с низким содержанием белков вызывает снижение уровня
мочевины в крови. Это обусловлено тем, что при сниженном пос¬
туплении белков и аминокислот с пищей в организме образуется
меньше аммиака и соответственно меньше ситезируется мочеви¬
ны, чем при нормальном питании.
• Беременность обычно приводит к увеличению СКФ и, как следс¬
твие, к повышению скорости выведения мочевины. Поэтому у
5.2. Показатели азотистого обмена 269
беременных, как правило, более низкий уровень мочевины в
крови, чем у небеременных.
• Болезни печени — это основная причина патологического сни¬
жения уровня мочевины в крови. Синтез мочевины происходит в
печени, функциональные возможности печени настолько вели¬
ки, что при заболеваниях печени легкой и средней тяжести не
отмечается нарушений синтеза мочевины. Однако для больных
с печеночной недостаточностью характерны снижение синтеза
мочевины и накопление в крови токсичного аммиака.
Причины повышения концентрации мочевины в сыворотке крови
к повышению концентрации мочевины в сыворотке крови могут
привести две основных группы —внепочечные и почечные причины.
Внепочечные причины связаны с повышенным образованием
мочевины в организме при нормальной выделительной функции
почек. Такого рода надпочечную недостаточность называют еще
продукционной. Основными внепочечными причинами повышения
концентрации мочевины в сыворотке крови являются.
• Потребление очень большого количества белковой пиши.
•Длительное голодание, которое сопровождается усилением
катаболизма белков собственных тканей; возросший распад
белков приводит к повышению синтеза мочевины; данная
ситуация может наблюдаться при различных воспалительных
процессах, у тяжелобольных, находящихся в отделении реа¬
нимации.
• Обезвоживание в результате рвоты, поноса; при дегидратации
количество реабсорбированной из почечных канальцев в кровь
мочевины (после клубочковой фильтрации) увеличивается.
■ Желудочно-кишечные кровотечения из язв, опухолей; кровь
попадает в кишечник, в результате всасывание белков (кровь
содержит большое количество белка) увеличивается и, следова¬
тельно, вызывает активацию синтеза мочевины.
Однако при этих состояниях избыток мочевины быстро удаляется из
организма почками, и ее концентрация в крови вскоре приходит в норму.
Уровень мочеви[1ы в крови наиболее часто повышается в результате
нарушения выделительной функции почек. Этот уровень возрастает,
если СКФ снижается.
В соответствии с приведенными выше факторами, способствую¬
щими снижению СКФ, все причины развития почечной недостаточ¬
ности можно разделить {{а три группы:
270 Глава 5. Биохимические исследования
• преренальные (уменьшение потока крови к почкам);
• ренальные (повреждение собственно почечного фильтра);
• постренальные (затруднение оттока мочи).
Патология, лежащая в основе преренальных механизмов почечной
недостаточности, приводит к повышению уровня мочевины в крови
и характеризуется низкой СКФ вследствие уменьшения і ока крови
через почечные клубочки. При этом структура нефрона остается в
норме, но нарушается его функция. Наиболее частыми причинами
преренальной дисфункции почек являются:
• дегидратация и снижение объема циркулирующей крови (шок,
обильные кровотечения, тяжелая диарея, обильная рвота);
• острая или хроническая сердечно-сосудистая недостаточность; сни¬
жение артериального давления или недостаточность сократительной
функции миокарда приводит к снижению СКФ.
Старение ассоциируется со снижением СКФ, поэтому уровень
мочевины в крови с возрастом увеличивается.
Ренальная патология сопровождается низкой СКФ вследствие
блокирования клубочкого фильтра. Структура нефронов нарушена,
и соответственно нарушена их функция. Причинами почечной недо¬
статочности могут быть следующие заболевания:
• острые и хронические гломерулонефриты; при остром гломеру¬
лонефрите уровень мочевины повышается редко и, как правило,
кратковременно; при хроническом гломерулонефрите он может
колебаться, повышаясь при обострении процесса и снижаясь при
его затухании;
• хронические пиелонефриты; повышение уровня мочевины зависит от
выраженности нефросклсроза и воспалительного процесса в почках;
■ нефросклсрозы, вызванные отравление солями ртути, гликоля-
ми, дихлорэтаном, другими токсичными веществами;
• синдром длительного сдавления (размозжен и я); уровень мочеви¬
ны в крови бывает очень высоким, что объясняется сочетанием
задержки выведения мочевины е повышенным распадом белков;
• диабетическая нефропатия;
• гипертоническая болезнь со злокачественным течением;
• подагра;
• гидронефроз, выраженный поликистоз, туберкулез почки;
• амилоидный или амилоидно-липоидный нефроз; повышение
уровня мочевины в крови наблюдается только на поздних стадиях
развития заболевания.
5.2. Показатели азотистого обмена 271
Патология, лежащая в основе постренальных механизмов почечной
недостаточности, проявляется низкой СКФ вследствие блокирования
мочевыводящих путей. Она возникает при задержке выделения мочи из-
за каких-либо препятствий в мочевыводящих путях (камень, опухоль, в
частности, аденома или рак предстательной железы).
Значительное повышение уровня мочевины в крови (выше 10,0
ммоль/л) всегда свидетел|^с1нует о поражении почек, более умеренное
повышение этого показателя (6,5—10,0 ммоль/л) может быть проявле¬
нием другой патологии.
Необходи.мо помнить, что нормальная концентрация мочевины в
крови не исключает раннюю стадию заболевания почек. Увеличение
концентрации мочевины в крови наблюдается только при значитель¬
ном снижении функции почек. Концентрация мочевины в крови не
выходит за пределы нормы до тех пор, пока СКФ не становится ниже
40 мл/мин, т.е. на 50% нормы.
Продолжительное увеличение содержания мочевины в сыворот¬
ке крови выше 10,0 ммоль/л должно расцениваться как проявление
почечной недостаточности.
При развитии острой почечной недостаточности концентрация моче¬
вины в крови нередко бывает очень высокой — 1.3.1,2—149,8 ммоль/л.
В клинической практике увеличение концентрации мочевины в
крови, отмечаемой у больных с выраженным синдромом интоксика¬
ции, называется уре.мией.
Выведение мочевины с мочой пропорционально содержанию белка
в рационе питания, а также скорости метаболизма эндогенных бел¬
ков. Удаляемая с мочой мочевина составляет около 90% всех выводи¬
мых из организма азотистых метаболитов. У взрослых в состоянии
азотистого равновесия выделение 500 ммоль мочевины (или 14 г азота
мочевины) в течение суток соответствует потреблению около 100 г
белка. Рефереп! ные величины содержания мочевины (азота мочеви¬
ны) в моче представлены в табл. 5-3.
Таблица 5-3.
Показатель
Содержание мочевины
ммоль/су г
г/сут
Мочевина
430-710
24-40
Азот мочевины
430-710
12-20
272
Глава 5. Биохимические исследования
Уменьшение выделения мочевины с мочой наблюдается в период
роста, во время беременности, у тех, кто придерживается углеводного
рациона питания с низким содержанием белка.
В клинической практике определение содержания мочевины в
моче используется для контроля за состоянием процессов анаболизма
и катаболизма в организме (для расчета баланса азота в организме)
Это имеет большое значение, особенно у тяжелобольных реанима¬
ционных отделений, получающих энтеральное (зондовое) и паренте¬
ральное питание.
Для оценки азотистого баланса определяют концентрацию моче¬
вины (азота мочевины) в суточной моче, по которой затем рассчиты¬
вают общие потери азота.
5.2.2.2. Причины изменения концентрации креатинина
Содержание креатинина в крови здоровых людей — величина
довольно постоянная и мало зависит от питания и других внеиочеч-
ных факторов. Референтные величины содержания креатинина в
сыворотке представлены в табл. 5-4.
Таблица 5-4.
Референтные величины содержания креатинина в сыворотке крови
Возрастная группа
Содержание креатинина в сыворотке
мкмоль/л
мг/дл
Новорожденные
27-88
0,3-1,0
Дети до 1 года
18-35
0,2-0,4
Дети от 1 года до 12 лет
27-62
0,3-0,7
Подростки
44-88
0,5-1,0
Взрослые; мужчины
62-132
0,7-1,4
Женщины
44-97
0,5-1,1
Ряд физиологических и патоло1'ических состояний может приво¬
дить к отклонению концентрации креатинина в сыворотке крови от
нормальных значений.
Причины снижения уровня креатинина в сыворотке крови
Снижение уровня креатинина в крови не имеет существенного
значения. Тем не менее необходимо знать, что он может снижаться
5.2. Показатели азотистого обмена 273
при беременности в результате увеличения экскреции креатинина
почечными канальцами. Как известно, креатинин синтезируется в
мышцах, поэтому любое заболевание, сопровождающееся существен¬
ным снижением мышечной массы (например, мышечные дистрофии),
может быть причиной патологического снижения уровня креатинина
в сыворотке крови.
Причины повышения уровнй креатинина в сыворотке крови
Уровень креатинина в крови, в отличие от мочевины, не повыша¬
ется при сепсисе, травмах, .тихорадочных состояниях, не зависит от
степени гидратации организма, повышенного потребления белка.
Определение уровня креатинина широко используется в диагнос¬
тике заболеваний почек. Креатинин в меньшей степени, чем мочеви¬
на, зависит от уровня катаболизма, не реабсорбируется в почках, поэ¬
тому в большей мере отражает степень нарушения фильтрационной и
выделительной функций почек.
Повьгшение уровня креатинина в крови в большинстве случаев —
признак почечной недостаточности, которая нередко сопровождает
различные заболевания почек. Причины развития почечной недоста¬
точности аналогичны приведенным для мочевины. Критерями диа¬
гностики острой почечной недостаточности являются:
• уровень креатинина в сыворотке крови 200—500 мкмоль/л
(2-3 мг%);
•увеличение уровня креатинина в сыворотке крови на
45 .мкмоль/л (0,5 мг%) при исходном значении ниже
170 мкмоль/л (менее 2 мг%);
• повышение уровня креатинина по сравнению с исходным
в 2 раза.
При тяжелой острой почечной недостаточности уровень креати¬
нина в сыворотке крови более 500 мкмоль/л (выше 5,5 мг %). Нередко
содержание в крови креагинина может достигать 800—900 мкмоль/л,
а в отдельных случаях — 2650 мкмоль/л и более. Однако увеличение
уровня креатинина и мочевины при острой почечной недостаточнос¬
ти — довольно поздний ее признак. Повышение выявляется, когда
поражено более 50% нефронов.
Показаниями для проведения гемодиализа у больных с острой
почечной недостаточностью являются признаки начинающейся или
выраженной уремической интоксикации — повышение уровня креа¬
тинина в крови до 0,70-0,88 м.моль/л (8-10 мг%), уровня мочевины в
крови до 25 ммоль/л (150 мг %).
274
Глава 5. Биохимические исследования
\
Следует помнить, что такие заболевания, как гипертиреоз, акро¬
мегалия, гигантизм, сахарный диабет, кишечная непроходимость,
мышечная дистрофия, обширные ожоги, также могут сопровождаться
повышением уровня креатинина в крови.
Суточное выделение креати]1ина с мочой относительно постоянно,
эквивалентно суточному образованию и непосредственно зависит
от массы мышц и выделительной способности почек. Насыщенный
животными белками рацион питания способствует повышению
выделения креатинина с мочой. Референтные величины содержания
креатинина в моче представлены в табл. 5-5.
Таблица 5-5.
Референтные величины содержания креатинина в моче
Возрастная группа
Содержание креатинина а моче
МіДкгсут)
мкмольДкг-сут)
Дети до 1 года
8-20
71-177
Дети от 1 года до 12 лет
8-22
71-194
Подростки
8-30
71-265
Взрослые: .мужчины
14-26
124-230
женщины
11-20
97-177
или
м г/сут
м моль/сут
мужчины
800-2000
7,1-17,7
женщины
600-1800
5,3-15,9
Параллельное определение концентрации креатинина в крови и
моче значительно расширяет диагностические возможности оценки
функционального состояния почек. Оно получило название пробы
Реберга-Тареева.
5.2.3. КЛИРЕНС ЭНДОГЕННОГО КРЕАТИНИНА
(ПРОБА РЕБЕРГА-ТАРЕЕВА)
Основополагающим процессом мочеобразования является клу¬
бочковая фильтрация, протекающая в почечном клубочке, состо¬
ящем приблизительно из 50 капилляров, имеющих суммарную
фильтрационную поверхность, приблизительно равную поверхнос¬
ти тела, т.е. около 2 м2, что обеспечивает образование ежесуточно
5.2. Показатели азотистого обмена 275
около 180 л первичной мочи, поступающей в канальцы. Скорость,
с которой образуется первичная моча (фильтрат), называется ско¬
ростью клубочковой фильтрации. На образование первичной мочи
почка практически не потребляет энергии, поскольку фильтрация
происходит под влиянием гидростатического артериального давле¬
ния.
СКФ — чуветвительнЬгй показатель функционального состояния
почек. Концентрация мочевины и креатинина в сыворотке крови
отражает СКФ и влияет на нее, однако не позволяет прямо измерить
СКФ. Это обусловлено тем, что уровни этих метаболитов в крови
не увеличиваются существенно до тех пор, пока почки не теряют
свою функцию (образовывать первичную мочу) на 50%. Поэтому
концентрация мочевины и креатинина в сыворотке крови является
плохим индикатором незначительных нарушений функции почек на
ранних стадиях заболеваний почек. В связи с этим для повышения
информативности оценки СКФ в клинической практике определяют
клиренс креатинина (проба Реберга-Тареева). Определение клирен¬
са креатинина также имеет некоторые недостатки, тем не менее это
достаточно адекватный и доступный метод прямого измерения СКФ
и, следовательно, более чувствительный и специфичный способ диа¬
гностики почечной недостаточности на ранних стадиях, чем оценка
содержания мочевины и креатинина в крови. Клиренс креатинина —
это объем плазмы крови, который очищается от креатинина за 1 мин
при прохождении через почки. Чем эффективнее работают почки по
очищению крови от креатинина и выведению его с мочой, тем выше
клиренс.
в норме клиренс креатинина, или СКФ у здоровых людей колеб¬
лется от 80 до 160 мл/мин, составляя 120±25 мл/мин у мужчин и 95±20
мл/мин у женшин.
При заболеваниях почек величину клиренса креатинина (СКФ)
принято считать достаточно корректным критерием оценки массы
действующих нефронов — параметра, важного в том числе с позиций
клинической фармакологии, поскольку фармакокинетика многих
медикаментов зависит от величины этого показателя.
Общепринятой методикой оценки СКФ является исследование
клиренса креатинина (проба Реберга-Тареева). Измерение СКФ в
пробе Реберга-Тареева основано на изучении клиренса креатинина.
Креатинин, будучи низкомолекулярным веществом, беспрепятствен¬
но приходит из крови в состав первичной мочи в процессе клубочко¬
276 Глава 5. Биохимические исследования
вой фильтрации безбелковой плазмы крови. Таким образом, концен¬
трация креатинина в фильтрате, т.е. первичной моче, соответствует
его плазматической концентрации — концентрации креатинина в
исследуемой сыворотке крови (Ккр). Следовательно, количество кре¬
атинина (ми.члимоль в 1 мин), поступающее в фильтрат, соответствует
произведению концентрации креатинина в фильтрате на минутный
объем фильтрата: Ккр • V.
Порядок проведения пробы Реберга—Тареева
• Не требуется специальной подготовки пациента.
• Пациент в течение суток собирает мочу (всю выделенную мочу за
24 ч). Утром он идет в туалет. Обязательно фиксирует время (нуле¬
вое время). Первую утреннюю порцию не собирает (выпускает в
унитаз), а собирает все последующие порции точно до того же вре¬
мени следующего дня (за сутки в емкость вместимостью 3 л). По
окончании сбора суточной мочи емкость завинчивают крышкой
и доставляют в лабораторию.
■ Утром в день окончания сбора мочи у пациета берут венозную
кровь для определения концентрации креатинина.
• Для получения точных результатов чрезвычайно важно полно¬
стью собрать мочу за 24 ч и указать в направлении на исследова¬
ние, что это суточная моча. Неправильный сбор мочи приведет к
ложным результатам.
В лаборатории определяют концентрацию креатинина в сыворотке
крови (Ккр) и суточной моче (Км) пациента, а также рассчитывают
минутный диурез (Д), исходя из суточного объема мочи, собранного
пациентом. Например, за сутки пациент выделил 1350 мл мочи; это
количествов в миллиметрах необходимо разделить на 24 ч, выражен¬
ные в минутах, — 1440 мин; следовательно, в данном примере минут¬
ный диурез составил 0,94 мл/мин.
Клиренс креатинина рассчитывают но с.тедующей формуле:
Км ^
Клиренс креатинина Д.
К1ф
Проба Реберга—Тареева может выполняться и за более короткие
отрезки времени (например, за 1—2 ч). Однако, проводя исследование
5.2. Показатели азотистого обмена 277
клиренса креатинина в более короткие отрезки времени, необходимо
учитывать возможность значительной ошибки при сборе небольшого
количества мочи из-за неучета остаточной мочи в мочевом пузыре,
низкого диуреза и аналитической вариации метода определения кон¬
центрации креатинина. Для повышения адекватности определения
клиренса креатинина желательно добиваться диуреза у обследуемого
пациента в объеме не менее 1,5 мл/мин, что обеспечивается дополни¬
тельной небольшой нагрузкой 1—2 стаканами воды.
Порядок проведения пробы Реберга—Тареева за более короткий промежу¬
ток времени. Больной утром мочится, выпивает 200 мл воды и затем
натощак в состоянии полного покоя собирает мочу за точно опре¬
деленное непродолжительное время (2 ч). Посередине этого отрезка
времени берут кровь из вены. При направлении проб в лабораторию
для получения правильных результатов определения СКФ в направ¬
лении на исследование очень важно указать, за какой отрезок времени
собрана моча.
В нор-ме величина клубочковой фильтрации наиболее низкая
утром, повышается до максимума в дневные часы и вновь снижается
вечером. У здоровых людей снижение СКФ происходит под влиянием
тяжелой физической нагрузки и отрицательных эмоиий, возрастает
после приема жидкости и высококалорийной пиши.
Так как определение клиренса креатинина является прямым мето¬
дом измерения СКФ, то его величина снижается при уменьшении
СКФ. Уменьшение клиренса креатинина по сравнению с нормальной
свидетельствует о повреждении почек. По уровню снижения клиренса
креатинина можно судить о тяжести их поражения, но не о диагнозе,
так как СКФ уменьшается при заболеваниях почек разной этиологии.
Этот показатель — более чувствительный индикатор ранних стадий
почечной недостаточности.
Снижение СКФ наблюдается при остром и хроническом гломе¬
рулонефрите, нефросклерозе, являясь одним из ранних симптомов
нарушения функции почек.
На СКФ оказывают влияние экстраренальные факторы. Так, СКФ
снижается при сердечно-сосудистой недостаточности, обильном
поносе и рвоте, гипотиреозе, механическом затруднении оттока мочи
(опухоли предстательной железы), поражении печени. В начальной
стадии острого гломерулонефрита снижение СКФ происходит вследс¬
твие не только нарушения проходимости клубочковой мембраны, но
и системных расстройств гемодинамики. При хроническом гломеру-
278
Глава 5. Биохимические исследования
лонефрите снижение СКФ может быть обусловлено азотемической
рвотой и поносом.
Стойкое снижение СКФ до 40 мл/мин при хронической почечной
патологии указывает на выраженную почечную недостаточность,
падение до 15—10—5 мл/мин — на развитие терминальной почечной
недостаточности.
Повышение уровня мочевины в крови выше 35 ммоль/л, креатини¬
на выше 1200 мкмоль/л и снижение клиренса креатинина ниже 10 мл/
мин являются показанием для проведения экстренного гемодиализа.
Клиренс эндогенного креатинина можно быстро рассчитать по
номограмме, приведенной на рис. 5-3, без определения концентрации
креатинина в моче (нет необходимости собирать мочу). Для этого
необходимо знать массу тела больного, возраст и концентрацию креа¬
тинина в сыворотке крови. Первоначально прямой линией соединяют
возраст пациента и его массу тела и отмечают точку на линии А. Затем
отмечают концентрацию креатинина в сыворотке крови на шкале и
соединяют прямой линий с точкой на линии А, продолжая ее до пере¬
сечения со шкалой клиренса креатинина. Точка пересечения прямой
линии со шкалой клиренса эндогенного креатинина и есть СКФ.
Клиренс креатина,
мл/мин
13о1
110-
100-
РП-
<0-
11».
Масса тела,
кг
1Ж-
110-
1Я0-
90-
80
30
Линия А
Концентрация
креатина
в сыворотке,
мкмоль/л
Возраст,
годы
—4*3
м
ж
—354
—Ж
48~
—«в
1$
_вз
_«
_1Я
1«
—и
м
а
—71
-.«2
м
—53
—44
Рис. 5-3. Номограмма рас¬
чета клиренса креатинина
без сбора мочи
5.2. Показатели азотистого обмена 279
Сущность пробы Реберга-Тареева состоит в том, что наряду с опреде¬
лением СКФ (клиренса креатинина) одновременно оценивают и состоя¬
ние канальцевой реабсорбции. Определение канальцевой реабсорбции —
это метод объективной оценки концентрационной функции почек. При
этом никаких дополнительных анализов пациенту не проводят. Все пока¬
затели, которые используются при определении клиренса креатинина,
применяются и для расчета канальцевой рсабсорбции.
Концентрационную функцию почек наиболее часто в клиничес¬
кой практике оценивают по величине составляющего показателя
обшего анализа мочи — относительной плотности мочи (удельный
вес). Если плотность мочи в норме, то концентрационная функция
почек не нарушена. С этой же целью исследуют мочу по Зимницкому.
Тем не менее нередко при назначении исследования клиренса креати¬
нина (СКФ) одновременно определяют и канальцевую реабсорбиию.
Канальцевая реабсорбция (КР) рассчитывается по разнице между
клубочковой фильтрацией и минутным диурезом (Д) и вычисляется в
процентах к клубочковой фильтрации по формуле;
КР = СКФ-Д ^00
СКФ
в норме канальцевая реабсорбция составляет 95—99% клубочково¬
го фильтрата.
Канальцевая реабсорбция может значительно меняться в физиоло¬
гических условиях, снижаясь до 90% при водной нагрузке. Выраженное
снижение реабсорбции происходит при форсированном диурезе,
вызванном мочегонными средствами. Наибольшее снижение каналь¬
цевой реабсорбции наблюдается у больных несахарным диабетом.
При различных заболеваниях почек периоды (время) возникнове¬
ния нарушения (снижения) СКФ и канальцевой рсабсорбции могут
существенно различаться, что используется для оценки динамики
течения заболеваний.
При гломерунефрите, когда первично поражается фильтр почечно¬
го клубочка, канальцевая реабсорбиия снижается позднее, чем СКФ.
Понижение СКФ, как правило, наступает значительно раньше, чем
снижение концентрационной функции почек и накопление в крови
мочевины и креатинина. Кроме того, недостаточность концентраци¬
онной функции почек выявляется достаточно поздно, при снижении
СКФ приблизительно на 40—50%.
280
Глава 5. Биохимические исследования
При пиелонефритах канальцевая реабсорбция снижается раньше
уменьшения СКФ. Это обусловлено тем, что при хроническом пие¬
лонефрите первоначально поражается преимущественно дистальный
отдел канальцев нефрона, а затем — гломерулярный клубочек, поэто¬
му СКФ уменьшается позднее, чем канальцевая реабсорбция.
5.2.4. МОЧЕВАЯ КИСЛОТА
Мочевая кислота является продуктом обмена пуриновых нуклео-
зидов, входящих в состав нуклеиновых кислот (рибонуклеиновая
кислота — РНК и дезоксирибонуклеиновая кислота — ДНК). При
этом мочевая кислота может образовываться из продуктов, поступаю¬
щих с пищей, и в результате распада собственных нуклеиновых кис¬
лот организма. Среди продуктов питания в наибольшем количестве
пуриновые нуклеозиды содержатся в мясе и печени. Пурины пищи
под влиянием пищеварительных ферментов распадаются до мочевой
кислоты уже в желудочно-кишечном тракте, после чего всасываются
в кровоток.
Образовавшаяся мочевая кислота выделяется почка.ми. Во вне¬
клеточной жидкости, в том числе и в плазме крови, мочевая кислота
присутствует в виде соли натрия (ураты) в концентрации, близкой к
насыщению, поэтому существует возможность кристаллизации урата
натрия, если концентрация мочевой кислоты в крови превысит мак¬
симум нормальных значений. Референтные величины содержания
мочевой кислоты в сыворотке крови представлены в табл. 5-6.
Таблица 5-6.
Референтные величины содержания мочевой кислоты в сыворотке крови
Возраст
Содержание мочевой кислоты
ммоль/л
мг/дл
До 60 лет;
— мужчины
0,26-0,45
4,4-7,6
- женщины
0,14-0,39
2,3-6,6
Старше 60 лет;
— мужчины
0,2.5-0,47
4,2-8,0
- женщины
0,21-0,43
3,5-4,2
5.2. Показатели азотистого обмена
281
Мочевая кислота, выводимая с мочой, отражает поступление
пуринов с пишей и распад эндогенных пуриновых нуклеозидов.
Около 70 от% общего количества мочевой кислоты организма выво¬
дится с мочой. Процессы, происходящие с мочевой кислотой в поч¬
ках, сложны. Она фильтруется в клубочках, затем почти полностью
реабсорбируется в проксц.мальном канальце, а в дальнейшем снова
секретируется и реабсорбируется в дистальном канальце. В конечном
счете с мочой выводится около 10% мочевой кислоты от профильтро¬
ванного количества. Референтные величины содержания мочевой
кислоты в моче представлены в табл. 5-7.
Таблица 5-7.
Референтные величины содержания мочевой кислоты в моче
Вид диеты
Содержание мочевой кислоты
мг/сут
ммоль/сут
Обычная диета
250-750
1,48-4,43
Беспуриновая диета:
— мужчины
До 420
До 2,48
- женщины
До 400
До 2,36
Диета с низким содержани¬
ем пуринов:
- мужчины
До 480
До 2,83
— женщины
До 400
До 2,36
Диета с высоким содержа¬
До 1000
До 5,90
нием пуринов
Нарушение пуринового обмена сопровождается либо повышением
(гиперурикемия), либо снижением (гипоурикемия) уровня мочевой
кислоты в крови.
Повышение уровня мочевой кислоты в крови имеет большое зна¬
чение для диагностики подагры. В плазме крови мочевая кислота
находится в виде соли — натрия урата. Эта соль обладает низкой
растворимостью, и при концентрациях чуть выше нормы проис¬
ходит образование кристаллов натрия урата. При подагре соли
мочевой кислоты начинают откладываться в хрящах, синовиальной
оболочке и жидкости суставов, вызывая повреждение кристалла¬
ми суставной поверхности. Клинически это проявляется сильной
282 Глава 5. Биохимические исследования
болью в суставах и их воспалением (острый артрит). Другими прояв¬
лениями подагры являются камни в почках с приступами почечной
колики и образование тофусов (скопление солей мочевой кислоты в
мягких тканях).
Различают первичную подагру, когда накопление мочевой кис¬
лоты в крови и тканях не вызвано каким-либо другим заболева¬
нием, и вторичную, которая может быть следствием нарушения
работы почек, повышенного образования пуринов при гемато¬
логических заболеваниях, когда распадается множество ядерных
клеток (в ядре много РНК и ДНК), после облучения рентгеновс¬
кими лучами, при злокачественных новообразованиях, сердечной
декомпенсации, разрушении тканей при голодании и др. Таким
образом, первичная и вторичная подагры возникают вследствие
нарушения экскреции мочевой кислоты или ее избыточной про¬
дукции.
Первичная подагра — следствие гиперурикемии, развивающейся при
замедленном выведении (90% случаев) либо при избыточном синтезе
(10% случаев) мочевой кислоты. Кристаллы мочевой кислоты (уратов)
могут откладываться в суставах, подкожной клетчатке (тофусы) и
почках.
Определение содержания в крови мочевой кислоты имеет особен¬
но большое значение в диагностике бессимптомной гиперурикемии
(уровень мочевой кислоты в крови у мужчин выше 0,48 ммоль/л, у
женщин выше 0,38 ммоль/л) и скрытого развития подагрической
почки (у 5% мужчин), у 5-10% больных с бессимптомной гиперури-
кемией возникает острый подагрический артрит. Гиперурикемия у
больных подагрой непостоянна, может носить волнообразный харак¬
тер. Периодически содержание мочевой кислоты может снижаться до
нормы, однако часто наблюдаегся его повышение в 3—4 раза по срав¬
нению с нормой.
Критерии постановки диагноза подагры;
* уровень мочевой кислоты в сыворотке крови у мужчин выше
0,48 ммоль/л, у женшин выше 0,38 ммоль/л;
• наличие подагрических узелков (тофусов);
* обнаружение кристаллов уратов в синовиальной жидкости или
тканях;
• наличие в анамнезе острого артрита, сопровождающегося
сильной болью, начавшегося внезапно и стихнувшего в тече¬
ние 1—2 дней.
5.2. Показатели азотистого обмена 283
Диагноз подагры считается достоверным, если обнаруживают по
крайней мере два любых признака.
Вторичная подагра может наблюдаться при лейкозах, В|2-дефи-
цитной анемии, полицитемии, некоторых острых инфекциях
(пневмония, рожистое воспаление, скарлатина, туберкулез), забо¬
леваниях печени и желчных путей, сахарном диабете с ацидозом,
хронической экземе, псориазе, крапивнице, заболеваниях почек,
ацидозе, острой алкогольной интоксикации (вторичная подагра
алкоголика).
Особенности лабораторного исследования больньЕХ подагрой
• Для получения точных данных о содержании мочевой кисло¬
ты в крови, наиболее адекватно отражающих уровень эндо¬
генного образования мочевой кислоты, необходимо в течение
3 дней перед исследованием назначать больным малопурино¬
вую диету.
• Во время острого приступа подагры у 39-42% больных уро¬
вень мочевой кислоты в сыворотке крови снижается до нормы.
Поэтому при нормальном уровне мочевой кислоты таким боль¬
ным необходимо повторить взятие крови на анализы через 3—5 сут
после купирования приступа для получения объективной кон¬
центрации этой кислоты.
Определение содержания мочевой кислоты в моче необходимо
проводить совместно с таковым в крови. Это позволяет во многих
случаях установить патологический механизм, лежащий в основе
подагры у больного (избыточная продукция мочевой кислоты в
организме или нарушение ее выведения). Признако.м гиперпродук¬
ции мочевой кислоты в организме считается ее выведение с мочой
более 800 мг за сутки при проведении исследования без ограниче¬
ния в диете или 600 мг после предварительного применения мало¬
пуриновой диеты, при нарушении выделительной функции почек
высокий уровень мочевой кислоты в крови не сопровождается
увеличением концентрации мочевой кислоты в моче. Определение
механизма развития подагры помогает выбрать правильную схему
лечения больного.
Снижение уровня мочевой кислоты в крови встречается редко, в
основном при врожденных нарушениях метаболизма (генетические
дефекты синтеза ферментов, участвующих в образовании мочевой
кислоты) и дефектах реабсорбпии мочевой кислоты в почечных
канальцах.
284 Глава 5. Биохимические исследования
5.3. ГЛЮКОЗА И МЕТАБОЛИТЫ
УГЛЕВОДНОГО ОБМЕНА
Определение концентрации глюкозы в крови в клинической прак¬
тике имеет важнейшее значение для диагностики и мониторинга
лечения сахарного диабета.
Сахарный диабет по частоте встречаемости среди населения
занимает 3-е место в мире после сердечно-сосудистых и онкологи¬
ческих заболеваний. Распространен ность болезни в нашей стране
сахарным диабетом—3—4% всего населения. Зарегистрированных
больных — примерно 1/2 от фактического количества. По данным
ВОЗ, прогнозируется двукратное увеличение количества больных
сахарным диабетом каждые 15 лет. Частота сахарного диабета среди
мужчин и женщин примерно одинакова.
Большинство больных сахарным диабетом нуждаются в ежеднев¬
ном определении уровня глюкозы в крови. Однако повышение кон¬
центрации глюкозы в крови не всегда означает, что пациент страдает
сахарным диабетом.
5.3.1. МЕТАБОЛИЗМ ГЛЮКОЗЫ
Глюкоза является одним из важнейших компонентов крови; коли¬
чество ее отражает состояние углеводного обмена.
Углеводы — органические соединения, состоящие из углерода,
водорода и кислорода. Общепринято делить углеводы на 4 группы:
• моносахариды — простые сахара (глюкоза, фруктоза, .монноза,
галактоза, ксилоза);
• дисахариды, дающие при расщеплении 2 молекулы моносахарида
(мальтоза, сахароза, лактоза);
• олигосахариды, дающие при расщеплении от 3 до 6 молекул
моносахаридов;
• полисахариды, дающие при расщеплении более 6 молекул моно¬
сахаридов.
Углеводы — важнейший источник энергии в организме человека.
Они поступают в организм в составе пиши. Основными источниками
углеводов в пище являются растительные продукты (хлеб, картофель,
каши). Поступившие с пищей углеводы (главным образом поли¬
сахариды — крахмал, гликоген и дисахариды — сахароза, лактоза)
5.3. Глюкоза и метаболиты углеводного обмена 285
расщепляются ферментами желудочно-кишечного тракта до моно¬
сахаридов, в такой форме всасываются через стенки тонкой кишки
и с кровью воротной вены поступают в печень и ткани организма.
Физиологически наиболее важным углеводом в организме человека
является глюкоза. Основными обменными превращениями, которым
подверіается глюкоза, являются:
• превращение в гликогён;
• окисление с образованием энергии;
• превращение в другие углеводы;
• преврашение в компоненты белков и жиров.
Глюкозе отводится особая роль в системе энергетического обеспе¬
чения организма. Она может функционировать только внутри клеток,
где играет роль источника энергии. Поступившая в клетку глюкоза
при наличии достаточного количества кислорода подвергается мета¬
болическому окислению до углекислого газа и воды. В ходе этого
процесса энергия, аккумулируемая в молекуле глюкозы, используется
для образования макроэргического соединения — аденозиптрифос-
фата (АТФ). В дальнейшем энергия, заключенная в молекуле АТФ,
используется для осуществления многих биохимических реакций
внутри клетки.
При недостатке кислорода в клетке глюкоза может окисляться
в процессе гликолиза с образованием молочной кислоты (лактата).
Накопление молочной кислоты в крови (Jraктaт-aцидoз) — причина
метаболического ацидоза, который сопровождает мноі ие патологи¬
ческие процессы с недостаточным поступлением кислорода (дыха¬
тельная недостаточность) или недостаточным кровоснабжением тка¬
ней.
Большинство тканей (мозг, эритроциты, хрусталик глаза, парен¬
хима почки, работающая мышца) полностью зависят от прямого
поступления глюкозы в клетки и требуют непрерывной подачи
глюкозы каждую секунду, так как в них происходит очень быст¬
рая утилизация АТФ. У взрослого человека потребность в глюкозе
составляет минимум 190 г в день (около 150 г для .мозга и 40 г для
других тканей). Однако, в отличие от других тканей, головной
мозг не способен синтезировать и депонировать глюкозу и потому
всецело зависит от поступления ее из крови для обеспечения энер¬
гетических потребностей. Для нор.мального функционирования
мозга необходимо поддерживать .минимальный уровень глюкозы в
крови около 3 ммоль/л.
286 Глава 5. Биохимические исследования
Глюкоза в качестве источника энергии нужна всем клеткам орга¬
низма человека. Однако потребности клеток в глюкозе могут сущест¬
венно различаться. Например, потребности мышечных клеток (мио¬
цитов) минимальны во время сна и велики при физической работе.
Необходимость в глюкозе не всегда совпадает по времени с приемом
пиши. Поэтому в организме человека существуют механизмы, поз¬
воляющие запасать поступающую с пищей глюкозу впрок и в даль¬
нейшем использовать по мере необходимости. Большинство клеток
организма человека способно запасать глюкозу в ограниченных коли¬
чествах, но три типа клеток служат основными депо глюкозы: пече¬
ночные, мышечные, клетки жировой ткани (адипоциты).
Эти клетки способны захватывать глюкозу из крови и запасать ее
впрок, когда потребность в ней мала, а содержание высокое (после
еды). В ситуации, когда потребность в глюкозе возрастает, а содер¬
жание в крови снижается (в перерывах между приемами пищи), они
способны высвобождать ее из депо и использовать на возникшие
потребности.
Клетки печени и миоциты запасают глюкозу в виде гликогена,
который представляет собой высокомолекулярный полимер глюкозы.
Процесс синтеза гликогена называется гликогенезом. Обратный про¬
цесс превращения гликогена в глюкозу именуется гликогенолизом. Он
стимулируется в ответ на снижение уровня глюкозы в крови. Клетки
жировой ткани — адипоциты — также способны запасать глюкозу. В
процессе липогснеза они превращают ее в глицерин, который затем
включается в состав триглицеридов (форма депонирования жира).
Для обеспечения клеток энергией триглицериды могут мобилизовы¬
ваться из жировых клеток, но только после того, как будут исчерпаны
запасы гликогена. Поэтому в организме человека гликоген выполняет
функцию кратковременного депонирования глюкозы, а жиры дол¬
говременного.
После приема пищи, когда уровни глюкозы и жирных кислот в
крови высоки, печень синтезирует гликоген и триглицериды, .мышеч¬
ные клетки -- гликоген, а адипоциты — триглицериды. Емкость депо
углеводов в организме лимитирована и составляет порядка 70 г в
печени и 120 г в мышцах. Общий запас тканевых и жидких углеводов
у взрослого человека (около 300 ккал) явно недостаточен для обеспече¬
ния энергетических потребностей организма между приемами пищи,
поэтому основным депо и источником энергии в организме человека
являются триглицериды жировой ткани.
5.3. Глюкоза и метаболиты углеводного обмена 287
5.3.1.1. Основные механизмы поддержания нормального
уровня глюкозы в крови
В течение дня поступление и расходование глюкозы в организме
человека значительно колеблются. Тем не менее уровень глюкозы в
крови обычно не поднимается выше 8,0 ммоль/л и не опускается ниже
3,5 ммоль/л. Это обусловлено функционированием целого ряда регу¬
ляторных систем, обеспечивающих поддержание нормального уровня
глюкозы в крови.
в течение короткого периода времени после приема пищи уро¬
вень глюкозы в крови повышается, так как сахара, содержащиеся в
продуктах питания, всасываются из кишечника в кровь. Немедленно
часть глюкозы начинает захватываться клетками органов и тканей и
используется для энергетических потребностей. Одновременно клет¬
ки печени и мышц запасают избыточное количество глюкозы в виде
гликогена. Между приемами пищи, когда содержание глюкозы в крови
снижается, она мобилизуется из депо (гликоген) для поддержания
необходимого уровня в крови. Если возможности депо недостаточны,
глюкоза может быть получена из других источников, например, бел¬
ков (этот процесс называется глюконеогенез) или жиров.
Все эти процессы обеспечивают поддержание необходимого уров¬
ня глюкозы в крови. Вместе с тем как поступление глюкозы в клетку и
ее расходование, так и все ее метаболические превращения (гликоге¬
нез, гликогснолиз) находятся под постоянным контролем.
Наиболее важными регуляторами уровня глюкозы в крови явля¬
ются центральная нервная система и гормоны поджелудочной железы.
В настоящее время установлено, что центральные механизмы регуля¬
ции углеводного обмена находятся в гипоталамусе.
Концентрация глюкозы в крови играет центральную роль в
пищевом поведении. Ее уровень весьма точно отражает энерге¬
тическую потребность организма, а разность сс содержания в
артериальной и венозной крови тесно связана с ощущением голода
или сытости, в латеральном ядре гипоталамуса имеются глюкоре¬
цепторы, которые тормозятся при увеличении уровня глюкозы в
крови и активируются при ее снижении, приводя к возникнове¬
нию чувства голода. Гипоталамические глюкоре цеп торы получают
информацию о содержании глюкозы и в других тканях организма.
Об этом сигнализируют периферические глюкорецепторы, нахо¬
дящиеся в печени, каротидном синусе, стенке желудочно-кишеч¬
ного тракта.
255 Глава 5. Биохимические исследования
Если пища не поступает в орханизм, то в крови снижается содер¬
жание глюкозы и центр голода побуждает человека к еде. В результате
приема пищи в крови увеличивается содержание глюкозы. При дости¬
жении определенной концентрации глюкоза стимулирует центр насы¬
щения, что приводит к возникновению чувства сытости. Параллельно
из центра насыщения идут сигналы, вызывающие торможение актив¬
ности центра голода.
Таким образом, глюкорецепторы гипоталамуса, интегрируя инфор-
мацию, получаемую по нервным и гуморальным путям, участвуют в
контроле за потреблением пищи.
Помимо потребления пищи, в регуляции уровня глюкозы в крови
важнейшую роль играют гормоны поджелудочной железы — инсулин
и глюка гон.
Эндокринная функция поджелудочной железы связана с панкреа¬
тическими островками (островками Лангерганса). У взрослого чело¬
века островки Лангерганса составляют 2—3% общего объема подже¬
лудочной железы. В островке содержится от 80 до 200 клеток, которые
по функциональным, структурным и гистохимическим показателям
разделяют на три типа: а-, (3- и 8-клетки. Большую часть островка
составляют р-кетки — 85%, а-клетки составляют 11%, 8-клетки 3%.
В р-клетках островков Лангерганса—инсулин, а в а-клетках синтези¬
руется и высвобождается глюкагон.
Основная роль эндокринной функции поджелудочной железы
состоит в поддержании нор.мального уровня глюкозы в крови. Эту
роль выполняют инсулин и глюкагон.
Инсулин — основной гормон инкреторного аппарата (т.е, сек-
ретирующего гормоны непосредственно в кровоток) поджелудоч¬
ной железы, представляет собой полипептид, мономерная форма
которого состоиГ из двух цепей; А (из 21 аминокислоты) и В (из 30
аминокислот). Он секретируется -кетками поджелудочной желе¬
зы в ответ на повышение концентрации глюкозы в крови. Свой
эффект инсулин реализует посредством связывания с инсулино¬
выми рецепторами на поверхности мембран инсулинчувствитель-
ных клеток. Инсулин обеспечивает снижение уровня глюкозы в
крови и тем самым:
• способствует транспорту глюкозы из крови в клетки органов и
тканей — инсулинзависимых тканей (поступление глюкозы в
клетки центральной нервной системы и печени не зависит от
инсулина “ инсулиннезависи.мые ткани);
5.3. Глюкоза и метаболиты углеводного обмена 289
■ стимулирует внутриклеточный метаболизм глюкозы до молочной
кислоты (гликолиз);
• активирует образование гликогена из глюкозы в печени и мышцах
(гликогенез);
• усиливает транспорт глюкозы в жировой ткани, повышает ско¬
рость синтеза жирных кислот, угнетает липолиз и способствует
увеличению запасов жира;
• ингибирует образование глюкозы из аминокислот (глюконеогенез).
Инсулин сравнительно быстро (за 5-10 мин) разрушается в печени
(80%) и почках (20%) под действием фермента глутатионинсулинт-
рансгидрогеназы.
Если бы регуляция уровня глюкозы в крови осуществлялась
только инсулином, то этот уровень постоянно колебался бы в пре¬
делах, значительно превышающих физиологические (не выше 8,0
ммоль/л и не ниже 3,5 ммоль/л). В результате инсулиннезависимые
ткани (головной мозг) испытывали бы то недостаток, то избыток
глюкозы. Однако этого удается избежать в результате действия
антагониста инсулина — глюкагона.
Глюкагон — полипетид, состоящий из 29 аминокислотных
остатков. Он продуцируется а-клетками островков Лангерганса и
имеет, также как инсулин, короткий период полураспада (несколь¬
ко минут). В противоположность эффекту инсулина действие глю¬
кагона заключается в повышении уровня глюкозы в крови. Он уси¬
ливает выход глюкозы из печени тремя путями: ингибирует синтез
гликогена, стимулирует гликогенолиз (образование глюкозы из
гликогена) и глюконеогенез (образование глюкозы из аминокис¬
лот). Эти механизмы являются гарантией того, что глюкоза будет
доступна для глюкозозависимых тканей между приемами пищи.
Печень — главный орган-мишень для глюкагона.
Динамика уровня инсулина и глюкагона в крови после приема
пищи в зависимости от уровня глюкозы представлена на рис. 5-4.
Из него видно, что концентрация глюкозы в крови возрастает
после еды в результате всасывания углеводов пищи. Повышенный
уровень глюкозы стимулирует секрецию инсулина поджелудочной
железой. Сигнал, который посылает инсулин клеткам, — «глю¬
коза в избытке», она может использоваться в качестве источника
энергии или депонироваться. Инсулин способствует утилизации
глюкозы в качестве источника энергии, стимулируя ее транспорт
в мышцы и жировую ткань. Он также осуществляет депонирова-
290 Глава 5. Биохимические исследования
ниє глюкозы в виде гликогена в печени и мышцах, в виде триг¬
лицеридов в жировой ткани, способствует захвату аминокислот
мышцами и синтезу белков в них. В результате действия инсулина
уровень глюкозы в крови снижается. Б свою очередь гипогликемия
приводит к индукции секреции глюкагона, который способству¬
ет повышению уровня глюкозы в крови. Глюкагон поддерживает
доступность депонированной глюкозы в отсутствие глюкозы,
поступающей с пищей, стимулируя выход глюкозы из печени (из
гликогена), глюконеогенеза из лактата, глицерина и аминокис¬
лот и в сочетании со сниженным уровнем инсулина стимулируя
мобилизацию жирных кислот из триглицеридов. Сигнал, который
посылает глюкагон, — «глюкозы нет».
Уровни инсулина и глюкагона непрерывно колеблются в соот¬
ветствии с режимом питания, что позволяет поддерживать опти¬
мальную концентрацию глюкозы в крови. Но не только они при¬
нимают участие в этих процессах.
Адреналин, норадреналин, кортизол и соматотропный гормон
(СТГ) также способны повышать уровень глюкозы в крови, т.е.
обладают контринсулярной активностью.
Адреналин и норадреналин синтезируются мозговым вещес¬
твом надпочечников и являются гормонами стресса. В печени,
адипоцитах, скелетных мышцах они оказывают прямое влияние
на мобилизацию глюкозы из депо (из гликогена), способствуя
повышению уровня глюкозы в крови для использования в качес¬
тве источника энергии при стрессовых ситуациях (стресс -Э
адреналин —> гликоген ^ глюкоза). Одновременно они подавляют
секрецию инсулина, т.е. создают почву для того, чтобы глюкоза
продолжала поступать к .месту ее утилизации, пока действуют
стрессовые импульсы.
Глюкокортикоиды (гормоны коры надпочечников, основной
представитель — кортизол) угнетают захват глюкозы многими
тканями. В мышцах глюкокортикоиды стимулируют окисление
жирных кислот, в печени для получения энергии направляют
глицерин и аминокислоты на синтез глюкозы (глюконеогенез),
которая превращается в гликоген и депонируется, т.е. готовятся
легкодоступные запасы глюкозы. При возникновении стрессовой
ситуации и поступлении большого количества адреналина в кровь
эти запасы легко используются.
5.3. Глюкоза и метаболиты углеводного обмена
291
ммоль/л
прием высокоуглеводной
пищи
Рис- 5-4. Динамика уровня глюкозы, инсулина и глюкагона в крови при при¬
еме высокоуглеводной пищи в норме
292 Глава 5. Биохимические исследования
СТГ (гормон роста) угнетает захват и окисление глюкозы в жиро¬
вой ткани, мышцах и печени и тем самым способствует повышению
уровня глюкозы в крови. Помимо этого, он способствует синтезу гли¬
когена в печени из других источников (глюконеогенез).
Таким образом, 4 гормона (глюкагон, адреналин, кортизол, сома¬
тотропный гормон) способствуют повышению уровня глюкозы, не
позволяя ему опускаться слишком низко, и только один инсулин пре¬
дотвращает избыточное увеличение концентрации глюкозы в крови.
Это обстоятельство отражает важность постоянного поддеражния
минимального уровня глюкозы в крови для нормального функциони¬
рования головного мозга.
Вместе с тем это обстоятельство определяет и то, что нормальный
гормональный ответ на повышение уровня глюкозы в крови зависит
от двух факторов:
• секреции в адекватной ситуации количества инсулина, т.е. от нор¬
мального функционирования -клеток поджелудочной железы;
* количества и функциональной активности (чувствительности)
инсулиновых рецепторов на поверхности инсулинчувствитель-
ных клеток.
Если секреция инсулина будет неадекватна (недостаточна) или
функциональная активность инсулиновых рецепторов снизится, кон¬
центрация глюкозы в крови будет повышена, что может перейти в
заболевание — сахарный диабет. В свою очередь избыточная секреция
инсулина (например, при опухоли -клеток поджелудочной железы “
инсулиноме) приведет к развитию тяжелой гипогликемии — состоя¬
нию, угрожающему жизни пациента.
5.3.1.2. Причины патологических изменений уровня глюкозы в крови
При целом ряде состояний содержание глюкозы в крови повыша¬
ется (гипергликемия) или снижается (гипогликемия). Практически
всегда патологические из.менения уровня глюкозы в крови — это
результат недостатка или избытка одного из гормонов, участвующих
в регуляции ее уровня. Поэтому к гипергликемии могут приводить
недостаток инсулина или избыток адреналина, кортизола, СТГ или
глюкагона.
Наиболее часто гипергликемия развивается у больных сахарным
диабетом (недостаток инсулина). Однако повышенный уровень глю¬
козы в крови не обязательно свидетельствует о наличии сахарного
диабета. Кроме сахарного диабета, гипергликемия наблюдается при
5.3. Глюкоза и метаболиты углеводного обмена 293
эпидемическом энцефалите, сифилисе центральной нервной систе¬
мы, повышении гормональной активности щитовидной железы, коры
и мозгового слоя надпочечников, гипофиза, травме и опухолях мозга,
эпилепсии, отравлении окисью углерода, сильном эмоциональном и
психическом возбуждении.
Гипергликемия может быть следствием лекарственной терапии.
Прием глюкокортикоидбв (кортизол), фенитоина, некоторых диуре¬
тиков, а также внутривенное введение глюкозосодержащих растворов
сопровождаются временной гипергликемией.
Гипогликемия у лиц, не болеющих сахарным диабетом, является
следствием опухоли [3-клеток поджелудочной железы — инсулиномы,
которая синтезирует инсулин в повышенном количестве.
Гипогликемию может вызвать дефицит какого-либо из трех гор¬
монов (кортизол, стг, катехоламины), повышающих концентрацию
глюкозы в крови. Например, недостаточность коры надпочечников,
сопровождающаяся дефицитом кортизола, нередко приводит к разви¬
тию эпизодов гипогликемии.
Иногда гипогликемические состояния наблюдаются при заболева¬
ниях центральной нервной системы: распространенных сосудистых
нарушениях, остром пиогенном менингите, туберкулезном .менин¬
гите, криптококковом менингите, энцефалите при эпидемическом
паротите, первичной или метастатической опухоли мягкой мозговой
оболочки, небактериальном менингоэнцефалите, первичном амеб¬
ном менингоэнцефалите.
5.3.1.2.1. Сахарный диабет
Сахарный диабет — заболевание, которое характеризуется гиперг¬
ликемией, возникающей вследствие абсолютной или относительной
инсулиновой недостаточности. В результате недостаточности инсу¬
лина глюкоза накапливается в крови, так как не может проникать в
клетки (за исключением клеток печени и головного мозга).
Выделяют два основных типа сахарного диабета. Сахарный диабет
1 типа (инсулинзависимый) встречается у 10-15% всех больных диабе¬
том. Гипергликемия при сахарном диабете I типа развивается вследс¬
твие инсулиновой недостаточности, обусловленной аутоиммунной
деструкцией (антителами к собственным клеткам) инсулинпроду-
цирующих р-клеток поджелудочной железы. Сахарный диабет 2 типа
встречается значительно чаще, в 85-90% случаев. Гипергликемия при
данном типе обусловлена не недостаточной продукцией инсулина
(у большинства больных концентрация инсулина в крови даже повы¬
294
Глава 5. Биохимические исследования
шена), а неэффективностью его действия на клетки органов и тканей.
Этот феномен называется инсулиновой резистентностью. Рост забо¬
леваемости сахарным диабетом 2 типа наблюдается после 50 лет, в то
время как пик заболеваемости сахарным диабетом 1 типа — отмеча¬
ются в возрасте 3-5 и 11-14 лет. Основные различия между сахарным
диабетом 1 и 2 типов приведены в табл. 5-8.
Таблица 5-8.
Основные различия между сахарным диабетом 1-го и 2-го типа
Сахарный диабет 1 типа
Сахарный диабет 2 типа
Возникает в детстве
Возникает у взрослых людей
Для большинства пациентов харак¬
терно острое начало заболевания
Характерно постенное развитие
заболевания
Пациенты и.меют худошавый вне¬
шний вид
Заболеванию часто сопутствует
ожирение
Уровень инсулина в крови снижен
или не определяется
Уровень инсулина в крови в норме
или повышен
На его долю приходится 10-15%
больных сахарным диабетом
На его долю приходится 85—90%
больных
В возникновении генетические
факторы имеют меньшее значение,
чем при сахарном диабете 2-го типа
Генетическая предрасположен¬
ность очень часто носит семейный
характер
Кетоацидоз (накопление в организ¬
ме продуктов метаболизма жирных
кислот и их токсическое действие на
организм) может быть первы.м про¬
явлением болезни и часто сопро¬
вождает течение заболевания
Кетоацидоз развивается крайне
редко
Больные абсолютно зависимы от
инъекций инсулина
Нет абсолютной зависимости от
инсулина; в большинстве случаев
лечение включает диету и перораль-
ные сахароснижающие препараты
Помимо сахарного диабета 1 и 2 типов, выделяют другие специ¬
фические типы диабета. Сахарный диабет у таких больных является
следствием определенного первичного заболевания (генетического
5.3. Глюкоза и метаболиты углеводного обмена 295
или приобретенного), и такую форму называют вторичным сахарным
диабетом. Основными причинами вторичного сахарного диабета
являются:
• генетические дефекты |3-клеток или действие инсулина;
• акромегалия (гигантизм), обусловленная опухолью гипофи¬
за, которая продуцирует избыточное количество СТГ (гормона
роста); СТГ наруи1ает захват глюкозы жировой и мышечной тка¬
нями путем подавления действия инсулина и способствует разви¬
тию гипергликемии;
• феохромоцитома (как правило, опухоль мозгового вещества над¬
почечников) секретирует избыточное количество катехоламинов
(адреналин, норадреналин); действие катехоламинов направлено
на мобилизацию глюкозы из депо и подавление эффектов инсули¬
на, что приводит к развитию гипергликемии;
• синдром И цен ко—Кушинга (гиперплазия коркового слоя над¬
почечников) сопровождается повышенной секрецией кортизола,
который в свою очередь угнетает захват глюкозы многими тканя¬
ми и способствует развитию гипергликемии;
• хронический панкреатит или операция на поджелудочной железе
вызывают повреждение ткани железы (в том числе и р-клеток),
приводят к снижению секреции инсулина и развитию гипергли¬
кемии;
• токсическое воздействие на поджелудочную железу лекарствен¬
ных или химических средств.
Нормально протекающая беременность сопровождается мно¬
гочисленными гормональными сдвигами, предраспологающими к
гипергликемии и соответственно к развитию сахарного диабета. От
1 до 14% беременных страдают преходящим (транзиторным) сахар¬
ным диабетом. Диагноз сахарного диабета, установленный во время
беременности, называют гестационным диабетом, У большинства
женшин с гестационным сахарным диабетом в конце беременности,
когда гормональные уровни возвращаются к исходным, проявления
болезни исчезают. Тем не менее примерно у 30-50% женщин с геста¬
ционным сахарным диабетом в анамнезе в дальнейшем развивается
сахарный диабет 2 типа.
5.3.1.2.2. Диагностика сахарного диабета
Задачей лабораторного исследования при подозрении на нали¬
чие сахарного диабета является выявление или подтверждение
наличия у пациента абсолютной или относительной недостаточ¬
296 Глава 5. Биохимические исследования
ности инсулина. Основные биохимические признаки недостаточ¬
ности инсулина; гипергликемия натощак или выходящее за пре¬
делы нормы повышение уровня глюкозы после еды, глюкозурия
и кетонурия. при наличии клинических симптомов сахарного
диабета лабораторные исследования необходимы прежде всего для
подтверждения клинического диагноза. В отсу гствис симптомов
результаты лабораторных исследований сами по себе позволяют
установить точный диагноз.
5.3Л.2.2.1. Исследование глюкозы в крови
Исследование концентрации глюкозы в крови является самым
распространенным методом диагностики сахарного диабета. Глюкоза
равномерно распределяется между плазмой и форменными элемен¬
тами крови с некоторым превышением ее концентрации в плазме.
Содержание глюкозы в артериальной крови выше, чем в венозной, что
объясняется непрерывным использованием глюкозы клетками тканей
и органов. Этим же объясняется и преимущество исследования глю¬
козы в плазме или сыворотке венозной крови перед ее определением
в капиллярной крови для диагностики сахарного диабета. Венозная
кровь дополнительно отражает такой важный момент, как использо¬
вание глюкозы клетками тканей и органов. Поэтому для диагностики
сахарного диабета предпочтительно определение глюкозы в венозной
крови. Референтные величины концентрации глюкозы в крови пред¬
ставлены в табл. 5-9.
Таблица 5-9.
Референтные величины концентрации глюкозы в крови
Возрастная групп
Концентрация глюкозы
>■
ммоль/л
мг/дл
Новорожденные
2,8-4,4
50-115
Дети
3,9-5,8
70-105
Взрослые
3,9-6,1
70-110
Методические особенности оаределевия глюкозы в крови
■ Существующие в настоящее время портативные глюкометры
(с использованием тестовых полосок) не могут обеспечить точ¬
ность измерения концентрации глюкозы с достаточной анали¬
тической надежностью, поэтому для диагностики сахарного
5.3. Глюкоза и метаболиты углеводного обмена 297
диабета они не должны применяться. Концентрацию глюкозы
в крови необходимо исследовать в лицензированной КДЛ.
* КДЛ должны использовать для определения концентрации
глюкозы в крови методы, имеющие аналитическую вариацию
не более 3,3% (0,23 ммоль/л от 7,0 ммоль/л), а общую неточ¬
ность — ниже 7,9^.
5.3.1.2.2.2. Глюкозотолерантный тест
Наиболее информативным методом д иагностики сахарного дибета
считается динамика изменения уровня глюкозы в крови пациентов в
ответ на сахарную нагрузку — глюкозотолерантный тест (тест на пере¬
носимость глюкозы).
Глюкозотолерантный тест необходимо проводить больным, если
содержание глюкозы в плазме крови натощак составляет от 6,1 до
7,0 ммолъ/л, атакже лицам с выявленными факторами риска развития
сахарного диабета (сахарный диабет у близких родственников, рожде¬
ние крупного плода, нарушение толерантности к глюкозе в анамнезе,
ожирение, гипертоническая болезнь).
Для проведения теста больной 3 дня должен находиться на диете,
содержащей не менее 125 г углеводов (этому требованию отвечают все
столы больничного питания). Проба проводится утром после 10—14 ч
голодания. Берут исходную пробу крови натощак, больной принимает
75 г глюкозы, растворенной в 200 мл воды, а ребенок — из расчета 1,75 г
глюкозы на 1 кг массы тела, но не более 75 г. Затем повторно берут
кровь через 120 мин и исследуют пробы на содержание глюкозы.
5.3.1.2.2.3. Исследование мочи на глюкозурию
У здоровых людей глюкоза, попадающая в первичную мочу, почти
полностью реабсорбируется в почечных канальцах и в моче общепри¬
нятыми методами не определяется. При превышении концентрации
глюкозы в крови выше почечного поро] а (8,88-9,99 ммоль/л) глюкоза
начинает поступать в мочу и возникает глюкозурия.
Глюкоза может обнаруживаться в моче в двух случаях: при
значительном увеличении гликемии и при снижении почечного
порога для глюкозы — почечном диабете. Очень редко эпизоды
умеренной глюкозурии могут наблюдаться у здоровых людей после
значительной алиментарной нагрузки продуктами с высоким
содержанием углеводов.
Вне зависимости от типа сахарного диабета в отсутствие лече¬
ния у больных сохраняется гипергликемия. При этом если уровень
298 Глава 5. Биохимические исследования
глюкозы в крови превышает почечный порог, глюкоза начинает
выводиться с мочой.
В лаборатории обычно определяют процентное содержание глю¬
козы в моче, что само по себе несет недостаточную информацию,
поскольку величина диуреза и соответственно истинная потеря глю¬
козы с мочой могут широко варьировать. Поэтому необходимо, чтобы
лаборатория выдавала результат с расчетом суточной глюкозурии
(в граммах глюкозы). Для этого в лабораторию необходимо направ¬
лять всю суточную мочу.
У больных сахарным диабетом исследование глюкозурии про¬
водится с целью оценки эффективности проводимого лечения и в
качестве дополнительного критерия компенсации сахарного диабета.
Уменьшение суточной глюкозурии свидетельствует об эффективнос¬
ти лечебных мероприятий.
критерием компенсации сахарного диабета 2 типа (инсули¬
нонезависимый) считается достижение аглюкозурии (отсутствие
глюкозы в моче).
При сахарном диабете 1 типа (инсулинзависимый) допускается
потеря с мочой 20—30 г глюкозы в сутки.
У больных сахарным диабетом глюкозурия обсуловливает раз¬
витие ряда характерных для заболевания клинических симптомов.
Благодаря выраженному осмотическому эффекту глюкозы (глюкоза —
осмотически активное вещество, которое притягиваетводу в сосудис¬
тое русло) вода начинает поступать вслед за ней в мочу, что приводит
к увеличению объема мочи, проявляется полиурией и дегидратацией
(обезвоживание), которая стимулирует центр жажды в гипоталамусе
с последующим увеличением потребления воды. Выраженная гиперг¬
ликемия у больных сахарным диабетом сопровождается 5 классичес¬
кими симптомами:'
• глюкозурией (выведение глюкозы с мочой);
• полиурией (увеличение количества мочи);
• никтурией (опорожнение мочевого пузыря ночью);
• полидипсией (увеличение объема потребляемой жидкости);
• дегидратацией (обезвоживание организма).
Определение глюкозы в моче обычно не используют для диагнос¬
тики сахарного диабета, тем более, что с возрастом почечный порог
для глюкозы увеличивается и у пожилых людей может составлять
выше 16,6 ммоль/л, прежде чем появится глюкозурия. Поэтому у
пожилых людей исследование мочи на глюкозу для диагностики
5.3. Глюкоза и метаболиты углеводного обмена
299
сахарного диабета неэффективно. Однако сахарный диабет 2 типа,
а также вторичный сахарный диабет имеют длительный субклини-
ческий период без проявления симптомов, в связи с этим сахарный
диабет нередко диагностируют по обнаружению глюкозы в моче при
профилактических осмотрах.
5.3.1.2.3. Критерии диагностики сахарного диабета
Диагноз сахарного диабета может быть установлен при наличии
одного из нижеприведенных критериев:
■ клинические симптомы сахарного диабета (полиурия, поли¬
дипсия и необъяснимая потеря массы тела) и случайное повы¬
шение концентрации глюкозы в плазме крови ^ 11,1 ммоль/л
200 мг%) или;
• уровень глюкозы в плазме крови натощак (состояние натощак — это
отсутствие приема любой пищи в течение не менее 8 ч) ^ 7,1 ммолъ/л
(^ 126мг%)или;
• через 2 ч после пероральной нагрузки глюкозой (75 г глюкозы)
уровень 3= 11,1 ммоль/л (3= 200 мт%).
Диагностические критерии сахарного диабета и других кате¬
горий гипергликемии, рекомендованные ВОЗ (Report of WHO
Consultation, 1999), приведены в табл. 5-10. Для эпидемиологи¬
ческих или скрининговых целей достаточно одного значения
уровня глюкозы натощак или 2-часового уровня глюкозы в ходе
перорального теста толерантности к глюкозе. Для клинических
целей диагноз сахарного диабета всегда должен быть подтвержден
повторным тестированием на следующий день, за исключением
случаев несомненной гипергликемии с острой метаболической
декомпенсацией или очевидными симптомами.
Таблица 5-10.
Диагностические критерии сахарного диабета
и других категорий гипергликемин
Категория
Концентрация глюкозы, ммоль/л
цельная кровь
плазма
венозная
капилляр¬
ная
венозная
капилляр¬
ная
Сахарный диабет:
натощак и/или
>6,1
>6,1
>7,0
>7,0
300
Глава 5. Биохимические исследования
Окончание таблицы 5-10.
через 120 мин после при¬
ема глюкозы
> 10,0
> ИД
> 11,1
> 12,2
Нарушение толерант¬
ности к глюкозе:
натошак и
< 6Д
< 6Д
< 7,0
<7,0
через 120 мин после при¬
ема глюкозы
> 6,7 и <
10,0
>7,8 и
< 11,1
>7,8 и
< 11,1
>8,9 и
< 12,2
Нарушенная гликемия:
натощак
> 5,6 и
<6,1
> 5,6 и
<6,1
> 6,1 и
<7,0
> 6,1 и
<7,0
через 120 мин после при¬
ема глюкозы
<6,7
<7,8
<7,8
<8,9
В соответствии с рекомендациями воз диагностическое зна¬
чение имеют следующие уровни глюкозы плазмы венозной крови
натощак (ВОЗ рекомендует для постановки диагноза использовать
только результаты исследования венозной плазмы);
• нормальное содержание глюкозы плазмы крови натощак состав¬
ляет до 6,1 ммоль/л (<110 мг%);
• содержание глюкозы в плазме крови натощак от ^ 6,1 ммоль/л
(^ ПО мг%) до < 7,0 (< 128 мг%) определяется как нарушенная
гликемия натощак;
• уровень гликемии в плазме крови натощак > 7,0 (> 128 мг%)
расценивается как предварительный диагноз сахарного диабе¬
та, который должен быть подтвержден по приведенным выше
критериям.
При проведении глюкозотолсрантного теста важными являются
следующие показатели:
• нормальная толерантность к глюкозе характеризуется содержа¬
нием глюкозы в плазме крови через 2 ч после нагрузки глюкозой
< 7,8 ммоль/л (< 140 мг%);
• повышение концентрации глюкозы в плазме крови через 2 ч
после нагрузки глюкозой > 7,8 ммоль/л (^ 140 мг%), но ниже
11,1 ммоль/л (< 200 мг%) свидетельствует о нарушенной толеран¬
тности к глюкозе;
5.3. Глюкоза и метаболиты углеводного обмена
301
* содержание глюкозы в плазме крови через 2 ч после перо¬
ральной нагрузки глюкозой > 11,1 ммоль/л (> 200 мг%) сви¬
детельствует о предварительном диагнозе сахарного диабета,
который должен быть подтвержден согласно критериям, при¬
веденным выше.
Для получения достоверных результатов анализа плазма во взя¬
той пробе крови долткна быть отделена от форменных элементов в
течение 60 мин. Если такой возможности нет, то кровь необходи¬
мо забирать в моноветт или вакутейнер с ингибитором гликолиза
(натрия фторид). ВОЗ рекомендует лабораториям для постановки
диагноза сахарного диабета исследовать концентрацию глюкозы в
плазме.
Типы кривых содержания глюкозы в крови при проведении глюко¬
зотолерантного теста приведены на рис. 5-5, а на схеме 5-1 представлен
алгоритм диагностики сахарного диабета.
ммоль/л
минуты
Рис. 5-5. Типы кривых содержания глюкозы в крови при глюкозотолерант¬
ном тесте
1— изменение концентрации глюкозы при гиперинсулинизме; 2-у здоровых
лиц; 3 — при тиреотоксикозе; 4 — при легкой; 5 — при тяжелой форме сахар¬
ного диабета
302
Глава 5. Биохимические исследования
Схема 5-1.
Алгоритм диагностики сахарного диабета (венозная кровь)
Определение глюкозы
в плазме крови натощак
£
< Глюкоза <6,1
ммоль/л (< 110
мг%)?
Да|
Диабет маловероятен,
дальнейшие мероприятия
не нужны
Глюкоза < 7,8
ммоль/л
< 140 мг%)?
Нарушенная гликемия
натощак или нарушение
толерантности к
глюкозе
Возможен сахарный
диабет
I
Проведение перорального
глюкозотолерантного теста с
75 г глюкозы и контролем
гликемии через 2 ч
Глюкоза > 7,8
ммоль/л (> 140 мг%).
Глюкоза >11,1
ммоль/л
{>200 мг%)?
▼
\ /9ПП /
Дальнейшие
Сахарный диабет
мероприятия не нужны
V
Г
Наблюдение
Для оценки результатов глюкозотолерантного теста вьписляют два
показателя: гипергликемический и гипогликемический коэффициенты.
• гипергликемический коэффициент — отношение содержания
глюкозы через 30 или 60 мин (берется наибольшая величина) к ее
уровню натощак, В норме он не должен быть выше 1,7;
• гипогликемический коэффициент — отношение содержания
глюкозы через 2 ч к ее уровню натошак, в норме он должен быть
менее 1,3.
Если по изложенным выше критериям воз у больного не выяв¬
ляется нарушений толерантности к глюкозе, но величина одного или
обоих коэффициентов превышает нормальные величины, кривая
нагрузки глюкозой трактуется как сомнительная. Такому пациенту
5.3. Глюкоза и метаболиты углеводного обмена 303
следует рекомендовать воздержаться от злоупотребления углеводами
и повторить тест через 1 год.
5.3.1.2.3, Гипогликемия
Гипогликемия развивается при уровне глюкозы в крови ниже
2,2 ммоль/л, однако у части пациентов ее симптомы могут наблюдать¬
ся и при более высоком уровне.
Глюкоза — основной источник энергии для головного мозга,
поэтому его функционирование зависит главным образом от адек¬
ватного поступления глюкозы. Клинические признаки гипогли¬
кемии являются результатом нарушения функции головного мозга
и влияния катехоламинов (адреналин, норадреналин), которые
выбрасываются в кровь в ответ на понижение концентрации глю¬
козы. К наиболее ярким клиническим проявлениям гипогликемии
относятся:
• чувство голода;
• чувство тревоги;
• заторможенность;
• головная боль;
' спутанность сознания;
• состояние опьянения (неуверенная походка, сбивчивая речь);
• тремор;
• усиленное потоотделение;
• учащенное сердцебиение;
• судороги и потеря сознания.
Причины, вызывающие гипогликемию:
• длительное голодание;
• нарушение всасывания углеводов (заболевания желудка и кишеч¬
ника, демпинг-синдром);
• хронические заболевания печени вследствие нарушения синтеза
гликогена и уменьшения печеночного депо углеводов;
• заболевания, связанные с нарушением секреции контринсуляр-
ных гормонов (гинопитуитаризм, хроническая недостаточность
коры надпочечников, гипотиреоз);
• передозировка или неоправданное назначение инсулина и перо-
ральных противодиабетических препаратов. У больных сахарным
диабетом, получающих инсулин, наиболее тяжелые гипоглике¬
мические состояния вплоть до гипогликемической комы обычно
развиваются при нарушении режима питания — пропуске приема
пищи, а также рвоте после еды;
304 Глава 5. Биохимические исследования
• легкие гипогликемические состояния, которые могут наблюдать¬
ся при заболеваниях, протекающих с так называемой функцио¬
нальной гиперинсулинемией: ожирении, сахарном диабете 2 типа
легкой степени. Для нею характерно чередование эпизодов уме¬
ренной гипергликемии и небольшой гипогликемии через 3—4 ч
после приема пищи, когда действие инсулина, секрстируемого в
ответ на алиментарную нагрузку, максимально;
• наиболее тяжелые гипогликемические состояния (за исключени¬
ем случаев передозировки инсулина), которые набл юдаются при
гиперинсулинизме у пациентов с инсулиномой или гиперплазией
(3-клеток островков поджелудочной железы, в некоторых слу¬
чаях содержание глюкозы в крови больных гиперинсулинизмом
составляет менее 1 ммоль/л;
• спонтанные гипогликемии при саркоидозе.
Самая частая причина гипогликемии — передозировка инсулина.
Она может возникать в отсутствие приема пищи после инъекции
инсулина. Кроме того, физическая нагрузка у больных сахарным
диабетом приводит к понижению уровня глюкозы в крови, поэтому
пациент нуждается в меньшей дозе инсулина. Введение ее в прежней
дозе может приводить к развитию гипогликемии.
Без лечения гипогликемия переходит в кому — состояние, угрожа¬
ющее жизни больного.
5.3.1.2.4. Осложнения сахарного диабета а их мониторинг
Наиболее распространенные осложнения сахарного диабета
сосудистые поражения, получившие название диабетических ангио¬
патий. Они включают поражение крупных артерий (макроангиопатии)
и мелких сосудов: капилляров, венул, артериол (микроангиопатии).
Диабетические ангиопатии являются основной причиной инвалиди-
зации больных диабетом и в большинстве случаев определяют про¬
гноз сахарного диабета. Существуют следующие виды диабетических
ангиопатий:
• ишемическая болезнь сердца (ИБС);
• нарушения мозгового кровообращения;
• облйтерирующий атеросклероз артерий нижних конечностей и
облитерирующие сосудистые поражения другой локализации;
• диабетическая нефропатия;
• диабетическая ретинопатия.
Поражение коронарных, церебральных и периферических
сосудов является основой макрососудистых осложнений сахар¬
5.3. Глюкоза и метаболиты углеводного обмена 305
ного диабета 1 и 2 типа. Диабетические макроангиопатии по
своему механизму развития являются атеросклеротическими.
Атеросклероз у больных сахарным диабетом протекает более
тяжело, имеет большую распространенность и возникает в более
молодом возрасте.
Атеросклероз коронарных сосудов и, как следствие, ИБС, является
ведущей причиной высокой смертности больных сахарным диабетом.
Частота развития ИБС у мужчин, страдающих диабетом, в 2 раза, а у
женщин, больных диабетом, в 3 раза превышает частоту И БС в обшей
популяции. >
Облитерируюший атеросклероз артерий нижних конечностей — вто¬
рое по клинической значимости проявление диабетических макроан-
гиопатий. У больных сахарным диабетом он наблюдается значительно
раньше (с 20 лет) и служит непосредственной причиной смерти у 9,9%
больных.
Атеросклероз мозговых артерий у больных сахарным диабетом
начинается рано и быстро прогрессирует.
Частота развития диабетической нефропатии колеблется от 40 до
50% у больных сахарным диабетом 1 типа и от 15 до 30% у больных
с сахарным диабетом 2 типа. Опасность этого осложнения состоит
в том, что оно развивается медленно и постепенно, поэтому диабе¬
тическое поражение почек долгое время остается незамеченным.
Наиболее ранним признаком развития диабетической нефропатии
(до появления протеинурии) является микроальбуминурия (повы¬
шенный уровень альбумина в моче).
Диабетический кетоацидоз — одно из наиболее острых и тяже¬
лых осложнений сахарного диабета. В основе развития кетоацидоза
и кетоацидотической комы лежит, с одной стороны, нарастающий
дефицит инсулина, а с другой — резкая активация контринсулярных
гормонов: глюкагона, СТГ, кортизола, катехоламинов.
В отсутствие инсулина глюкоза не может проникать в клетки раз¬
личных тканей, кроме мозга и печени, и, следовательно, требуется
другой источник энергии для выживания. Таки.м альтернативным
источником являются жиры (триглицериды), хранящиеся в клетках
жировой ткани. Многие из симптомов кетоацидоза являются резуль¬
татом мобилизации жиров для обеспечения энергетических потреб¬
ностей клеток в отсутствие глюкозы.
в результате расщепления триглицеридов (липолиз) в жировой
ткани образуется много жирных кислот, которые поступают в кровь
306 Глава 5. Биохимические исследования
и транспортируются к органам и тканям. В печени и тканях жирные
кислоты окисляются с получением молекул АТФ, При диабетичес¬
ком кетоацидозе липолиз усиливается настолько, что кровь и печень
буквально заполнены липидами. Вызванное дефицитом инсулина
энергетическое клеточное голодание приводит к повышению актив¬
ности гипоталамо-гипофизарно-надпочечниковой системы (стрессу),
в результате чего увеличивается секреция гормонов (адреналин, кор¬
тизол), обладающих жиромобилизующим свойство.м, что еще больше
увеличивает поступление жирных кислот в кровоток, в результате
окисления жирных кислот в избытке образуются и накапливаются в
крови токсичные продукты, прежде всего ОЗ-гидроксибутират, аце-
тоуксусная кислота, ацетон, которые называются кетоновыми телами.
Все они являются обычными продуктами об.мена жиров, которые в
норме метаболизируются дальше и не оказывают токсического дейс¬
твия на органы и ткани. При диабетическом кетоацидозе, однако,
кетоновые тела накапливаются в избыточном количестве в крови и
выводятся е мочой. Часть избыточного ацетона выводится через лег¬
кие, поэтому его запах может чувствоваться в воздухе, выдыхаемом
больным сахарным диабетом. Накапливающиеся в тканях и крови
кетокислоты (ацетоуксусная кислота), кроме прямого токсического
действия, приводят к изменению pH крови и развитию метаболичес¬
кого ацидоза.
Основным механизмом компенсации метаболического ацидоза
является усиление дыхания (гипервентиляиия) для максимального
удаления углекислого газа (угольная кислота) из крови, что позволя¬
ет поддерживать нормальный pH крови. У больных диабетическим
кетоацидозом гипервентиляция проявляется глубоким дыханием
(дыхание Куссмауля).
Вследствие гипергликемии увеличивается осмотическое давление
во внеклеточной жидкости и развивается внутриклеточная дегидра¬
тация, так как вода и клеточные электролиты (калий, фосфор и др.)
поступают из клеток в межклеточное пространство. Одновременно
с нарушениями кислотно-основного состояния при диабетическом
кетоацидозе развивается водно-электролитный дисбаланс. Когда
гипергликемия превышает почечный порог для глюкозы, наступает
осмотический диурез, в результате чего происходит интенсивная
потеря жидкости и электролитов, что ведет к дегидратаци и и гипово-
лемии с развитием сердечно-сосудистой и почечной недостаточности.
При кетоаиидотической коме содержание глюкозы в крови нередко
5.3. Глюкоза и метаболиты углеводного обмена 307
превышает 30,6 ммоль/л, достигая 55,5 ммоль/л и даже 111 ммоль/л
(2000 мг%). При этом имеется четкая корреляция между уровнем гли¬
кемии и наличием комы. Решающую роль в диагностике кетоацидоза
играет определение концентрации глюкозы в крови и кетоновых тел
в моче.
в заключение необходимо отметить, что, кроме классических
симптомов гиперглике^ии (глюкозурия, полиурия, жажда, поли¬
дипсия и дегидратация), у больных диабетическим кетоацидозом
наблюдаются:
• повышенный уровень кетоновых тел в крови и моче (кетонемия и
кетонурия);
• запах ацетона при дыхании;
• метаболический ацидоз (низкий pH крови);
• гипервентиляция (дыхание Куссмауля);
• гипотензия вследствие существенного нарушения водно-элект¬
ролитного баланса (потеря калия и натрия с мочой) и рвота.
5.З.1.2.4.1. Гликозилированный гемоглобин
Белки, в том числе и гемоглобин, если их долго выдерживать в
растворе, содержащем глюкозу, связываются с ней, и, что важно,
это связывание происходит самопроизвольно, без участия фермен¬
тов. Гликозилированный (или гликированный) гемоглобин (НЬА1с)
образуется в результате такой медленной неферментативной (неэ¬
нзиматической) реакции между гемоглобином А, содержащимся в
эритроцитах, и глюкозой сыворотки крови. Референтные величины
содержания НЬА1с в крови 4,0-5,2% уровня общего гемоглобина.
Степень гликозилирования гемоглобина (а следовательно, его
концентрация) зависит от концентрации глюкозы в крови и длитель¬
ности контакта глюкозы с гемоглобином (срок жизни эритроцита).
Эритроциты, циркулирующие в крови, имеют разный возраст, поэто¬
му для усредненной характеристики уровня связанной с ними глюко¬
зы ориентируются на полупериод жизни эритроцитов — 60 сут. Есть
по крайней мере три варианта гликозилированных гемоглобинов:
НЬА1а, НЬА1Ь, НЬА1с, но только вариант НЬА1с количественно пре¬
обладает и дает более тесную корреляцию со степенью выраженности
сахарного диабета.
Поче.му измерение содержания глюкозы в крови недостаточно для
эффективного мониторинга лечения сахарного диабета?
Ответ на этот вопрос представлен на рис. 5-6. Какой вывод о
реальной компенсации диабета можно сделать, если измерение
308
Глава 5. Биохимические исследования
концентрации глюкозы в крови состоялось, например, в момент ее
максимума или ее минимума? Действительно, измерение содержа¬
ния глюкозы в крови оценивает текущий (сиюминутный) уровень
глюкозы, который может зависеть от приема (или неприема) пищи;
ее состава, физических нагрузок и их интенсивности; эмоцио¬
нального состояния пациента; времени суток. Очевидна высокая
вероятность того, что определение текущего уровня глюкозы в
крови не будет отражать действительную степень компенсации
сахарного диабета, а это может привести либо к передозировке
лекарственных препаратов, либо к неоправданному уменьшению
их количества. Ценность определения содержания НЬА1с в том,
что он характеризует средний уровень глюкозы в крови на про¬
тяжении длительного промежутка времени, т.е. действительную
степень компенсации сахарного диабета на протяжении последних
1 -2 мес.
Рис. 5-6. Динамика концентрации глюкозы в крови на протяжении 9 нед.
Концентрация глюкозы изменяется между 7 и 12 ммоль/л. Уровень НЬА1с в
течение всего периода постоянен — 10%
В целом определение содержания НЬА1с дает усредненное, интег¬
рированное представление об уровне гликемии при всех формах
сахарного диабета.
Результаты исследования НЬА1с оценивают следующим обра¬
зом: 4—6% свидетельствует о хорошей компенсации сахарного
диабета в последние 1—2 мес, 6,2—7,5% — удовлетворительный
уровень, выше 7,5% ~ неудовлетворительный уровень. Для оценки
5.3, Глюкоза и метаболиты углеводного обмена 309
эффективности лечения целесообразно повторить исследование
через 2—3 мес.
Ложное сниженное значение НЬА1с имеет место при уремии, ост¬
рых и хронических геморрагиях, а также при состояниях с уменьше¬
нием длительности жизни эритроцитов (например, при гемолитичес¬
кой анемии).
5.3.1.2.4.2. Кетоновые тела в моче
К кетоновым телам относятся ОЗ-гидроксибутират, ацетоуксусная
кислота и ацетон, которые в избытке образуются при диабетическом
кетоацидозе в крови и выводятся с мочой. В норме кетоновые тела в
моче отсутствуют.
Наиболее частые причины кетонурии — выраженная декомпен¬
сация сахарного диабета 1 типа, а также длительно протекающий
диабет 2 типа при истощении (3-клеток поджелудочной железы и
развитии абсолютной инсулиновой недостаточности. Резко выра¬
женная кетонурия отмечается при гиперкетонемической диабети¬
ческой коме.
У больных сахарным диабетом мониторинг кетонурии использует¬
ся для контроля правильности подбора пищевого режима: если коли¬
чество вводимых жиров не соответствует количеству усваиваемых
углеводов, то кетонурия увеличивается. При уменьшении введения
углеводов (лечение без инсулина) и обычном количестве жиров начи¬
нает выделяться ацетон. При лечении инсулино.м снижение глюкозу¬
рии достигается лучшим усвоением углеводов и не сопровождается
кетонурией.
5.3.1.2.4.3. Альбумин в моче (микроальбуминурия)
Микроальбуминурия — это экскреция альбумина с мочой, пре¬
вышающая допустимые нормальные значения, но не достигающая
степени протеинурии. в норме экскрстируется не более 30 мг аль¬
бумина в сутки, что эквивалентно концентрации альбумина в моче
.менее 20 мг/л при ее разовом анализе. При появлении протеинурии
экскреция альбумина с мочой превышает 300 мг/сут. Поэтому диа¬
пазон колебаний концентрации альбумина в моче при микроаль¬
буминурии составляет от 30 до 300 .мг/сут или от 20 до 200 мкг/мин
(табл. 5-11). Появление у больного сахарным диабетом постоян¬
ной микроальбуминурии свидете.льствует о вероятном развитии
(в течение ближайших 5—7 лет) выраженной стадии диабетической
нефропатии.
310
Глава 5. Биохимические исследования
Классификация видов альбуминурии
Таблица 5-11.
Вид альбуминурии
Экскреция альбумина с мочой
при одноразовом
сборе мочи, мкг/мин
за сутки, мг
Концентрация
' альбумина в
моче, мг/л
Нормоальбуминурия
Менее 20
Менее 30
Менее 20
Микроальбуминурия
20-200
30-300
20-200
Макроальбуминурия
Более 200
Более 300
Более 200
Исследование на микроальбуминурию используют для скрининга
поражения почек и необходимости лечения диабетической нефропа¬
тии. Своевременное начало лечения нефропатии существенно сни¬
жает затраты и улучшает прогноз в отношении развития почечной
недостаточности.
5.3.1.2.4. Мониторинг уровня глюкозы в крови самим пациентом
Важнейшей составляющей адекватного лечения больных инсу¬
линзависимым сахарным диабетом 1 и 2 типов является поддержа¬
ние уровня глюкозы в крови как можно ближе к норме. Основная
трудность в проведении инсулинотерапии связана с вероятностью
развития гипогликемии при необходимости снижения уровня глю¬
козы в крови. Хороший контроль сахарного диабета подразумевает
поддержание уровня глюкозы в крови не ниже 4,4 ммоль/л и не выше
10,0 ммоль/л. Нормализация уровня глюкозы в крови не только пре¬
дупреждает развитие основных симптомов сахарного диабета (дегид¬
ратация, полиурия, жажда, кетоацидоз, эпизоды гипогликемии), но и
сушественно снижает риск развития отдаленных осложнений: заболе¬
вай ий почек (диабетическая нефропатия), расстройств нервной систе¬
мы (диабетическая нейропатия) и нарушений зрения (диабетическая
ретинопатия). В связи с этим больные сахарным диабетом, особенно
те, кому необходима инсулинотерапия, должны регулярно, в том
числе и сами, следить за уровнем глюкозы в крови. Для проведения
регулярного мониторинга уровня глюкозы в крови пациенты исполь¬
зуют диагностические тест-полоски и портативные глюкометры.
Медицинская сестра наиболее часто контактирует с такими боль¬
ными. Нередко у них возникает ряд вопросов, связанных с правиль¬
ным измерением уровня глюкозы в крови и контролем за работой
глюкометров. Приведенная ниже информация будет полезна для
5.3. Глюкоза и метаболиты углеводного обмена 311
медицинской сестры и позволит ей правильно проконсультировать
пациентов по возникшим проблемам,
В настоящее время существует большое количество диагностичес¬
ких тест-полосок и портативных глюкометров. Время исследования
составляет 1—2 мин, и для определения глюкозы достаточно одной
капли капиллярной крови. В основе всех тестов лежит следующий
принцип. Капля крови помещается на реагентную зону тест-полоски,
которая пропитана цветочувствительными реактивами. Изменение
цвета реагентной зоны тест-полоски — результат реакции между глю¬
козой, присутствующей в исследуемой крови, и реактивами, иммоби¬
лизованными на полоске. Степень изменения цвета реагентной зоны
определяется уровнем глюкозы в крови. Результаты можно оценивать
двумя способами. При первом способе сравнивают получившуюся в
результате реакции окраску реагентной зоны с прилагаемой цветной
шкалой и визуально определяют концентрацию глюкозы. При вто¬
ром способе тест-полоску помещают в глюкометр, который измеряет
интенсивность развившейся окраски и определяет, таким образом,
уровень глюкозы в крови. Использование глюкометров позволяет
получить более точные результаты анализа. Выработанный навык
нанесения крови на тест-полоску и правильная работа глюкометра —
необходимые условия получения достоверных результатов.
При использовании глюкометров необходимо соблюдать приве¬
денные ниже правила.
• Кровь на анализ следует брать из сухого чистого пальца или
мочки уха.
• Кровь после прокола должна капать на тест-полоску свободно, так
как при снимании пальца получаются заниженные результаты.
Для стимуляции тока крови палец можно растереть или согреть.
• При нанесении капли крови на реагентную зону тест-полоски
необходимоточно следовать прилагаемой инструкции. Различные
фирмы-производители глюкометров и тест-полосок используют
тонкие модификации метода, поэтому даже нюансы в нанесении
капли крови на полоску могут существенно сказаться на резуль¬
тате измерения.
• Необходимо очень точно соблюдать время реакции, которое
начинается сразу после того, как капля крови соприкасается с
регентной зоной полоски. Если время реакции увеличивается,
могут быть плучены ложновысокие результаты, если уменьшает¬
ся — ложнонизкие.
312 Глава 5. Биохимические исследования
• Реактивы, нанесенные на реагентную зону, могут инактивиро¬
ваться, поэтому их надо хранить в соответствии с прилагающейся
инструкцией. Нельзя использовать тест-полоски с истекшим сро¬
ком годности, который указан на упаковке.
• Портативный глюкометр требует контроля за своей работой.
Главным является правильная калибровка прибора. В зависи¬
мости от его марки это может быть калибровка глюкометра с
использованием раствора глюкозы определенной концентрации
(необходимо следить за его сроком годности). Некоторые глю¬
кометры и.меют внутреннюю калибровку. Тем не менее все виды
глюкометров необходимо регулярно (через определенный проме¬
жуток времени) тестировать, используя внешний стандартный
раствор. Проведение такого тестирования позволяет проверить
качество прибора и обеспечивает получение надежных результа¬
тов определения концентрации глюкозы крови больного. Обычно
тестированием глюкометров занимаются КДЛ.
Медицинская сестра должна знать, что все существующие в насто¬
ящее время глюкометры не могут обеспечить точность измерения
концентрации глюкозы с достаточной аналитической надежностью.
Поэтому для диагностики сахарного диабета у лиц с повышенным
риском развития заболевания концентрацию глюкозы в крови необ¬
ходимо исследовать в лицензированной КДЛ,
Портативные глюкометры с тест-полосками могут применяться для
установления гипергликсмии, тяжелой гипогликемии, а также монито¬
ринга содержания глюкозы в крови у больных сахарным диабетом.
Глюкометры рекомендуется использовать всем больным, полу¬
чающим инсулин. Больные с сахарным диабетом 1 типа должны
измерять концентрацию глюкозы крови по крайней мере Зраза в день.
Эффективность применения глюкометров у больных сахарным диа¬
бетом 2 типа, не получающих инсулин, не установлена.
5.4. ХОЛЕСТЕРИН, ТРИГЛИЦЕРИДЫ И ЛИПОПРОТЕИНЫ
Липиды в плазме крови представлены в основном жирными
кислотами, триглицеридами, холестерином и фосфолипидами.
Они поступают в организм человека в составе мяса и молочных
продуктов. Холестерином особенно богаты куриные яйца. Кроме
5.4. Холестерин, триглицериды и липопротеины 313
того, триглицериды, холестерин и фосфолипиды синтезируются в
организме человека. Холестерин синтезируется преимущественно
в печени, триглицериды — в печен и и жировой ткани. Треть холес¬
терина, который нужен организму человека, он получает с пищей,
две трети синтезируется в печени. Синтез холестерина стимулиру¬
ют насыщенные жиры, и они также содержа гея в мясных и молоч¬
ных продуктов. Поэтому если пища содержит жиры, она не только
поставляет холестерин в организм, но и стимулирует его синтез в
печени и других тканях.
Поскольку липиды нераствормы в воде, они транспортируются
в плазме крови (водно-солевой раствор) в комплексе с белками.
Основным переносчиком свободных жирных кислот является аль¬
бумин, в то время как триглицериды и холестерин циркулируют в
составе белковых комплексов, известных под названием липопро-
теинов,
в клинической практике исследование липидов (триглицеридов и
холестерина) и липопротеинов используют для оценки риска разви¬
тия ИБС. В настоящее время достоверно установлено, что чем выше
в крови уровень триглицеридов и холестерина, тем выше риск ИБС.
Эти тесты имеют также важное значение для определения стратегии
лечения ИБС и оценки его эффективности.
5.4.1. ФУНКЦИИ ХОЛЕСТЕРИНА, ТРИГЛИЦЕРИДОВ
И ЛИПОПРОТЕИНОВ
Важнейшее значение холестерина и триглицеринов в организме
человека состоит в том, что они являются незамени.мы.ми компо¬
нентами клеточных мембран. Холестерин также служит исходным
материалом при биосинтезе стероидных гормонов (кортизола в
надпочечниках, прогестерона в яичниках, тестостерона в яичках).
В коже из модифицированного холестерина образуется витамин О.
В печени холестерин превращается в желчные кислоты и их соли
и экскрстируется из желчного пузыря в желудочно-кишечный
тракт в составе желчи. Желчные кислоты и их соли в составе
желчи необходимы для всасывания жиров, поступающих с пишей.
Триглицериды СОСТОЯ !' из глицерина и 3 молекул жирных кислот.
Они синтезируются в печени и жировой ткани. Главная функция
триглицеридов (вернее, жирных кислот, входящих в состав тригли¬
314 Глава 5. Биохимические исследования
церидов) энергетическая. Триглицериды служат альтернативным
глюкозе источником энергии, используемым при голодании, когда
запасы гликогена и глюкозы истощаются. В условиях относитель¬
ного недостатка глюкозы триглицериды, находящиеся в клетках
жировой ткани (адипоцитах), расщепляются при участии фермен¬
та липазы в процессе липолиза. Освобождающиеся в результате
липолиза свободные жирные кислоты доставляются кровью в дру¬
гие клетки органов и тканей, где окисляются (сжигаются) с выде¬
лением энергии, запасаемой в АТФ. Одновременно другой продукт
липолиза — глицерин — превращается в печени в глюкозу.
Как все липиды, холестерин и триглицериды нерастворимы в
воде, поэтому транспортируются плазмой крови в связанном с рас¬
творимыми белками виде. Эти белки, транспортирующие липиды,
называются апопротеинами, а комплексы липидов (в том числе
холестерина и триглицеридов) с ними — липопротеинами. Каждая
липопротеиновая частица состоит из липидной сердцевины, окру¬
женной растворимым апопротеином. Липопротеины — это частицы
сферической формы, оболочка которых состоит из фосфолипидов,
а внутри содержатся транспортируемый холестерин (точнее, эфир
холестерина) и триглицериды. Апопротеины — белки, которые
расположены на поверхности липопротеинов. Иногда для краткос¬
ти их называют апобелками. Именно апопротеины и определяют,
что будет с холестерином — или он высвободится из упаковки и
будет поглощен клетками, чтобы потом выполнить свои жизненно
важные функции, или, наоборот, излишний холестерин, содер¬
жащийся в организме, будет удален из тканей и крови и упакован
внутрь липопротеиновой частицы, которая затем унесет его в
печень. Апопротеины не только направляют метаболизм липопро¬
теинов путем их связывания со специфическими рецепторами, но
и действуют в качестве кофакторов (активаторов) ферментов, учас¬
твующих в этих процессах. Липопротеиновые рецепторы, которые
присутствуют на плазматических мембранах клеток, контролируют
скорость поглощения клетками и деградацию липопротеиновых
частиц.
Липопротеины, содержащие холестерин, обычно называют холес¬
терином Это определенная условность, так как холестерин в свобод¬
ном виде в плазме крови никогда не присутствует. Это водонерасг-
воримый спирт, поэтому в плазме крови холестерин всегда связан с
липопротеинами.
5.4. Холестерин, триглицериды и липопротеины 315
5.4.2. ТРАНСПОРТ ХОЛЕСТЕРИНА И ТРИГЛИЦЕРИДОВ
В крови циркулирует 4 типа липопротеинов, различающихся
содержанием в них холестерина, триглицеридов и апобелков. Они
имеют разную относительную плотность и размеры. В зависимости от
плотности и размеров различают следующие типы липопротеинов:
• Хиломикроны — представляют собой богатые жиром частицы,
поступающие в кровь из лимфы и транспортирующие пищевые
триглецириды. Они содержат около 2% апобелка, около 5% ХС,
около 3% фосфолипидов и 90% триглицеридов. Хиломикроны
являются самыми крупными липопротеиновыми частицами.
Хиломикроны синтезируются в эпителиальных клетках тонкой
кишки, а их основная функция состоит в транспорте поступивших
с пищей триглицеридов. Триглецириды доставляются в жировую
ткань, где они депонируются, и в мышцы, где используются в качестве
источника энергии.
Плазма крови здоровых людей, не принимавших пищу в течение
12-14 ч, хиломикронов не содержит или содержит ничтожное коли¬
чество.
• ЛПОНП содержат около 10% апобелка, около 15% холестирина,
около 15% фосфолипидов и 60% триглицеридов. ЛПОНП синте¬
зируются в печени, а их основная функция состоит в транспорте
триглицеридов, синтезированных в печени, в жировые и мышеч¬
ные клетки. Они служат предшественниками Л ПНП.
• Липопротеины низкой плотности (ЛПНП) — содержат около
25% апобелка, около 55% холестерина, около 10% фосфолипи¬
дов и 8—10% триглицеридов. ЛПНП — это ЛПОПН после того,
как они доставят триглицериды в жировые и мышечные клетки.
Они являются основными переносчиками синтезированного в
организме холестерина ко всем тканям (рис. 5-7). Основной белок
ЛПНП — апопротеин В (апоВ). Так как ЛПНП поставляют холес¬
терин, синтезированный в печени, в ткани и органы и тем самым
способствуют развитию атеросклероза, то их называют атероген-
ными липопротеинами.
• ЛПВП содержат до 50% апобелка, около 25% фосфолипидов, пример¬
но 20% холестерина и очень немного триглицеридов (3%), По своим
раз.мерам это самые маленькие липопротеиновые частицы. Они
синтезируются в печени и при поступлении в кровоток состоят пре¬
имущественно из апопротеина, но по мере циркуляции в крови обо-
316
Глава 5. Биохимические исследования
гощаются холестерином (рис. 5-8). Основной белок ЛПВП — апоп-
ротеин А (апоА). Основная функция ЛПВП состоит в связывании и
транспортировке излишка холестерина из всех иепеч^номных клеток
обратно в печень для дальнейшего выделения в составе желчи. В
связи со способностью связывать и удалять холестерин ЛПВП назы¬
вают антиатерогснньтми (препятствуютразвитию атеросклероза).
Липопротеины низкой плотности (ЛПНП)
Фосфолипид .Холестериновый
^ эфир
Триглицерид
Неэстерифи-
цированный
холестерин
Апопротеин в
Рис. 5-7, Строение ЛПНП
Апопротеин А
Фосфолипид
Неэстерифи-
цированный
холестерин
Триглицерид
Холестери¬
новый
эфир
Рис. 5-8. Строение ЛПВП
Атерогенность холестерина в первую очередь определяется его
принадлежностью к тому или иному классу липопротеинов. В этой
связи особо следует выделить ЛПНП, которые наиболее атерогенны в
силу следующих причин.
5.4. Холестерин, триглицериды и липопротеины 317
ЛПНП транспортируют около 70% всего холестерина плазмы и
являются частицами, наиболее богатыми холестерином, содержание
которого в них может достигать до 45-50%. Размеры частиц (диаметр
21—25 нм) позволяет ЛПНП наряду с ЛПВП проникать в стенку сосуда
через эндотелиальный барьер, но, в отличие от ЛПВП, которые легко
выводятся из стенки, с|тособствуя выведению избытка холестерина,
ЛПНП задерживаются в ней, поскольку обладают избирательным
сродством к ее структурным компонентам. Последнее объясняется, с
одной стороны, наличием в составе ЛПНП апоВ, а с другой — сущес¬
твованием на поверхности клеток стенки сосуда рецепторов к этому
апопротеину. В силу указанных причин ЛПНП являются основной
транспортной формой холестерина для нужд клеток сосудистой стен¬
ки, а при патологических условиях — источником накопления его в
стенке сосуда. Именно поэтому при гиперлипопротеинемии, характе¬
ризующейся высоким уровнем холестерина ЛПНП, часто наблюдают¬
ся относительно ранний и резко выраженный атеросклероз и ИБС.
При анализе результатов исследования холестерина важно отли¬
чать холестерин, входящий в состав ЛПНП, от холестерина ЛПВП.
5.4.3. РЕКОМЕНДУЕМЫЕ ВЕЛИЧИНЫ УРОВНЯ ХОЛЕСТЕРИНА
И ТРИГЛИЦЕРИДОВ В КРОВИ
В лаборатории при назначении исследования хо.лестсрин-липоп-
ротеинового профиля определяют концентрацию общего холестерина
(т.е. холестерина, входящего в ЛПНП и ЛПВП), холестерина ЛПВП,
холестерина Л ПН П и концентрацию триглицеридов (входящих в состав
ЛПНП, ЛПОНП и ЛПВП) в сыворотке крови, в ряде лабраторий из-за
технической сложности уровень холестерина ЛПНП не определяют, а
рассчитывают по уровню триглицеридов и холестерина ЛПВП,
Нормальные значения концентрации триглицеридов в сыворотке
крови составляют 0,45-2,3 ммоль/л.
В отличие от других лабораторных тестов, концепция нормы не
вполне применима для определения уровня холестерина и холестери¬
на в составе различных фракций липопротеинов в сыворотке крови.
Это обусловлено тем, что при определении референтных значений в
группу практически здоровых людей попадают и те, которые и.меют
повышенный риск развития атеросклероза и ишемической болезни
сердца, но еще не имеют клинических проявлений этих заболеваний.
318 Глава 5. Биохимические исследования
Другими словами, «нормальный» уровень холестерина в сыворотке
крови нельзя четко отождествлять со «здоровыми» людьми. Поэтому
для оценки результатов исследования уровня холестерина в сыворот¬
ке крови используют оптимальные или целевые, а не референтные
значения. Оптимальные холестерин-липопротеиновые показатели в
сыворотке крови следующие:
• общий холестерин — менее 5,2 ммоль/л (200 мг/дл);
• ЛПВП-холестерин — более 1,3 ммолъ/л (50 мг/дл);
• ЛПНП-холестерин — менее 3,4 ммоль/л (130 мг/дл);
• триглицериды — менее 1,7 ммоль/л (150 мг/дл).
У пациентов с ИБС целевой уровень обшего холестерина в крови
должен быть менее 5,0 ммоль/л (190 мг/дл), а целевой уровень холесте¬
рина ЛПНП — менее 3,0 ммоль/л (115 мг/дл).
О гиперхолестеринемии свидетельствует уровень общего холес¬
терина выше 5,2 ммолъ/л, а о гипертриглицеридемии — выше
1,7 ммоль/л. при этом повышение уровня триглицеридов в крови
до 1,7—5,6 ммоль/л расценивается как выраженная гипертриглице-
ридемия, а более — 5,6 ммоль/л как тяжелая гипертриглицериде-
мия.
Особенности взятия проб крови. На концентрацию холестерина и
триглицеридов в крови оказывают влияние многие факторы: диета,
курение, прием алкоголя, инфекции, изменение положения тела при
взятии проб крови. Поэтому важно соблюдать стандартные условия
и минимизировать влияние этих факторов. К особенностям взятия
крови на исследование относятся следующие:
• перед взятием крови пациент должен в течение 2 нед придержи¬
ваться своей обычной диеты;
• вечером накануне взятия крови должен быть исключен прием
алкоголя (это распространенная причина гипертриглицеридемии
даже у голодавших пациентов);
• кровь для исследования липидов следует брать утром натощак
после 12—14-часового ночного голодания;
• если пациент перенес тяжелое заболевание (например, инфаркт
миокарда) или обширное оперативное вмешательство, то взятие
крови необходимо перенести на 3 мес, либо брать ее в течение 24 ч
после эпизода (при заболеваниях средней степени тяжести иссле¬
дование переносят на 2-3 нед);
• пациент должен быть отдохнувшим и должен посидеть 5—10 мин
перед взятием крови;
5.4. Холестерин, триглицериды и липопротеины 319
' наложение жгута при взятии крови не должно превышать 1 мин,
так как более длительное удержание жгута может привести к
искажению результатов.
5.4.4. ПОСЛЕДСТВИЯ ПОВЫШЕНИЯ УРОВНЯ ХОЛЕСТЕРИНА И/ИЛИ
ТРИГЛИЦЕРИДОВ В КРОВИ
В настоящее время общепринятым считается, что повышение
уровня холестерина в плазме крови является главной причиной ате¬
росклероза и его следствия — ИБС. Основной виновник атеросклеро¬
за — так называемый атерогснный холестерин (холестерин ЛПНП),
тот, который поступает из печени в ткани и органы. Но атероген-
ным он становится только при наличии определенных факторов,
которые способствуют развитию атеросклероза и в последующем
ИБС. Атеросклероз представляет собой сложный процесс, который
начинает развиваться за много лет до появления симптомов ИБС.
Первоначально на внутренних стенках артерий образуются жиро¬
вые образования — бляшки. Маленькие бляшки остаются мягкими,
но более старые, большие бляшки имеет тенденцию образовывать
фиброзные шляпки, в которых откладывается кальний и происходит
кальцификация артерий, что приводит к атеросклерозу — сужению
артерий и их затвердеванию, а это может вести к двум последстви¬
ям: кальцинированные и неэластичные артерии становятся узкими
(именно это и называют стенозом), скорость кровотока в них замед¬
ляется, что не дает крови, обогащенной кислородом, поступать к
мышце сердца. Возникает кислородная недостаточность — ишемия,
а зате.м — ишемическая болезнь сердца. Клиническим симптомом
кислородного дефицита является стенокардия — преходяшие при¬
ступы боли за грудиной или дискомфорт в груди в ответ на усиление
сердечной деятельности при физической нагрузке или стрессе. Боль
обычно исчезает, когда увеличенная потребность в кислороде после
отдыха снижается. Однако нестабильные бляшки могут разорваться,
что приводит к образованию тромба на их поверхности. Тромбы могут
закупорить коронарную артерию, и тогда кровь перестает достигать
некоторых участков миокарда. В отсутствие кислорода кардиомиоци-
ты погибают, и развивается инфаркт миокарда. Такое поражение сер¬
дца может стать причиной внезапной смерти. Стенокардия, инфаркт
миокарда и внезапная смерть — три основных проявления ИБС.
320 Глава 5, Биохимические исследования
Липиды крови, прежде всего холестерин, имеют прямое отно¬
шение к ИБС. Это обусловлено их активным участием в патогенезе
атеросклероза.
Атеросклероз начинается с повреждения внутренней оболочки
артерий — эндотелия. Именно повреждение эндотелия является
тем необходимым условием, которое обеспечивает проникновение
в этот слой богатых холестерином ЛПНП, циркулирующих в крови.
Наиболее частыми агентами, вызывающими повреждение эндотелия,
являются различные вирусы (дитомегаловирус, вирус герпеса, гриппа
и др.) и бактерии (хламидии, микоплазмы, Helicobacter pylori и др.).
В результате накопления холестерина ЛПНП в эндотелии к местам
повреждения мигрируют макрофаги, которые захватывают частицы
ЛПНП и аккумулируют их внутри себя. В течение многих лет внутри
повреждений продолжает накапливаться холестерин ЛПНП, что при¬
водит к формиованию мягких бляшек в стенке сосудов. Нормальные
мышечные клетки стенки артерий начинают замещаться белком
соединительной ткани — коллагеном, придающим стенкам сосудов
жесткость. Со временем коллаген откладывается также поверх бля¬
шек, формируя жесткие фиброзные бляшки, которые постепенно
накапливают кальций (кальцифицируются). Эндотелий становится
тонким и ломким. Он легко повреждается (например, при растяжении
артерий вследствие повышения артериального давления) с проникно¬
вением крови внутрь бляшек и формиованием на их основе тромбов,
способных частично или полностью закупорить сосуд (рис. 5-9).
Роль холестерина в процессах атерогенеза состоит в том, что его
накопление в составе Л ПН П в эндотелии является необходимым усло¬
вием для начала атерогенеза. Холестерин ЛПНП, обнаруживаемый в
составе атеросклеротических бляшек, происходит из крови, и чем выше
его уровень в крови, тем выше вероятность развития ИБС. Формирование
атеросклеротических бляшек вызывает именно холестерин ЛПНП.
В настоящее время установлена четкая корреляция между уровнем
обшего холестерина в крови и смертностью от сердечно-сосудис¬
тых заболеваний, т.е. повышение уровня холестерина сопровожда¬
ется ростом смертности среди мужчин и женшин. при содержании
холестерина в крови ниже 5,2 ммоль/л риск развития атероскле¬
роза наименьший. Если уровень холестерина ЛПНП в крови ниже
2,59 ммоль/л, сердечные приступы возникают очень редко.
Неправильное питание, курение и артериальная гипертензия
являются совместно действующими факторами, повышающими риск
5.4. Холестерин, триглицериды и липопротеины
321
развития ИБС. Сочетание одного из этих факторов с любым другим
примерно на 10 лет ускоряет развитие коронарного атеросклероза.
разрыв артериальной
стенки
макрофаг
отложение
холестерина
эритроцит
“пенистая" клетка
макрофага
отложение жира
Рис. 5-9. Строение атеросклеротической бляшки
ЛПВП, напротив, играют защитную роль в отношении развития
ИБС. Чем ниже уровень холестерина ЛПВП, те.м выше риск развития
ИБС. Высокий уровень холестерина ЛПВП в крови ассоциируется с
уменьшением риска развития ИБС. Повышение уровня холестерина
ЛПВП в процессе лечения на 0,03 ммоль/л снижает риск коронарной
патологии па 2-3%.
У лиц с повышенным уровнем в крови холестерина ЛПНП или
пониженным уровнем холестерина ЛПВП, повышенное содержание
григлицсридов увеличивает риск развития ИБС.
Для клинической практики необходимо иметь в виду следующие
моменты:
• снижение уровня холестерина ЛПНП и повышение уровня холес¬
терина ЛПВП способствует уменьшению частоты атеросклероза;
• избыточное питание, ожирение, курение и низкая физическая
активность оказывают неблагоприятное воздействие на липид¬
ный профиль крови;
322
Глава 5. Биохимические исследования
• лечение липидных нарушений должно предусматривать не прос¬
то коррекцию уровня холестерина, а нормализацию неблагопри¬
ятного липидного профиля;
• снижение массы тела и физические упражнения повышают уро¬
вень холестерина ЛПВП, одновременно снижая уровень холесте¬
рина ЛПНП и триглицеридов в крови;
• развитие атеросклероза начинается еще в молодом возрасте, поэ¬
тому его проявления можно предотвратить, ведя здоровый образ
жизни с юных лет.
в табл. 5-12 приведены основные липидные показатели для взрос¬
лых людей и их взаимосвязь с риском возникновения заболеваний.
Необходимо отметить, что с помошью определения уровня липи¬
дов в крови можно только в общем виде оценить риск развития ИБС.
Эти результаты не могут быть использованы для диагностики или
точного прогноза для конкретного пациента. Можно только конста¬
тировать, что чем выше в крови уровень холестерина ЛПНП, тем выше
риск развития ИБС. Этот риск увеличивается, если повышение уров¬
ня холестерина ЛПНП дополняется увеличением содержания тригли¬
церидов в крови пациента. Наоборот, риск заболевания уменьшается
при высоком уровне холестерина ЛПВП.
Таблица 5-12.
Уровени липидов в крови, обусловливающие риск возникновения ИБС
и панкреатита у взрослых лиц
Показатель
Референтные
значения
Пограничные
значения
высокого риска
ИБС
Высокий
риск ИБС
Высокий риск
панкреатита
Обший ХС,
ммоль/л
■ <5,2
5,2-6,2
6,2
—
хслпнп,
ммоль/л
< 3,4
3,4-4,1
4,1
—
ХС ЛПВП,
ммоль/л
> 1,6
-
<0,9
-
ТГ, ммоль/л
<1,7
1,7-4,5
>4,5
> 11,3
Обший ХС/
хслпвп
< 5,0
5,0-6,0
> 6,0
—
Примечание, ХС — холестерин; ТГ — триглицериды
5.5. Ферменты 323
5.4,5. ПРИЧИНЫ ПОВЫШЕНИЯ УРОВНЯ ХОЛЕСТЕРИНА
И/ИЛИ ТРИГЛИЦЕРИДОВ В КРОВИ
Причины, приводящие к повышению уровня липидов в крови,
разделяют на первичные — генетически обусловленные, и вторич¬
ные — проявление другого патологического процесса.
Генетические нарушения обмена липидов могут сопровождаться
повышением в крови уровня холестерина, триглицеридов или обоих
показателей. Некоторые из этих наследуемых дефектов встречаются
относительно часто, другие реже.
Бол ьшиство пациентов с повышенным уровнем холестерина ЛПНП
в крови имеют наследуемый дефект, называемый полигенной гипер-
холестеринемисй. в основе этого состояния лежат нарушения во мно¬
гих генах. При данном нарушении концентрация общего холестерина
в крови увеличивается незначительно, а уровень триглицеридов при
этом обычно в норме. Выраженность гиперхолестеринемии во многом
зависит от диеты.
Семейная гиперхолестеринемия — еще одна форма наследственной
патологии. Это состояние характеризуется высокими концентрация¬
ми общего холестерина (7,8-12 ммоль/л) и холестерина ЛПНП (часто
более 9,0 ммоль/л) в крови, которые наблюдаются с раннего детства и
не зависят от питания.
Вторичные гиперлипидемии являются распространенным
состояние.м. Самая частая причина вторичной гиперлипидемии —
сахарный диабет. Это во многом объясняет повышение риска возник¬
новения ИБС у больных сахарным диабетом. Вторичную гиперлипи-
лемию могут вызывать также заболевания печени, внутри- и внепече-
ночный холестазы, злокачественные опухоли поджелудочной железы,
гломерулонефрит, гипотиреоз, нефротический синдром, хроническая
почечная недостаточность, алкоголизм и ожирение.
5.5. ФЕРМЕНТЫ
Ферменты — специфические белки, выполняющие в организ¬
ме роль биологических катализаторов, т.е. ускорителей химических
реакций. Они содержатся во всех клетках организма, в которых их
концентрация значительно выше, чем в плазме крови. Вместе с тем
324 Глава 5. Биохимические исследования
высокодифференцированные клетки, выполняющие специализиро¬
ванные функции в организме, имеют свой собственный набор фер¬
ментов. Например, клетки миокарда отличаются от клеток печени,
жировой ткани, почек. Практически все метаболические реакции в
организ.ме человека катализируются ферментами. Поэтому в каждой
клетке организма находится от 1000 до 4000 ферментов (в зависимости
от типа ткани). Действие ферментов высокоспецифично: каждый из
них катализирует только одну или ограниченное количество сходных
реакций. Почти все ферменты функционируют внутри тех клеток,
в которых они синтезируются. Но ряд ферментов, например, ренин,
факторы свертывания и комплемента активно секретируются в кровь,
где и выполняют свою физиологическую функцию.
5.5.1. СТРУКТУРА И ФУНКЦИИ ФЕРМЕНТОВ
Все ферменты являются белками, различающимися по размеру и
структуре. Самые простые из них представляют цепочки аминокислот
(полипептиды) с молекулярной массой 10 000-20 ООО Д, а самые слож¬
ные являются комплексами, состоящими из нескольких белковых
субъединиц. Ферменты могут состоять из одной, двух или более иден¬
тичных белковых субъединиц. Каждая субъединица имеет два важных
функциональных участка: связывающий и каталитический центры.
Некоторые ферменты могут существовать в двух или более близких
по свойствам, но несколько отличающихся друг от друга молекуляр¬
ных формах. Эти различные формы фермента получили название
изоферментов. Исследование изоферментов в клинической практике
представляет интерес, когда отдельные изоферменты образуются в
разных тканях (например, в сердце и печени преобладают различные
изоферменты ЛДГ).
Выполняя свою функцию, каждый фермент взаимодействует с
определенны.\1 веществом, которое называется субстратом. В резуль¬
тате ферментативной реакции с субстратом образуется определенный
продукт. Например, субстратом пищеварительного фермента липазы
служат пищевые жиры. Липаза катализирует расщепление жиров, а
продуктом реакции являются монотлицериды и жирные кислоты.
Специфичность (способность связываться е определенным субстра¬
том) любого фермента зависит от строения его связывающего центра,
который полностью соответствует структуре субстрата. При связы¬
5.5. Ферменты 325
вании каталитический центр фермента приближается к субстрату, и
фермент выполняет свою функцию, в результате образуется неста¬
бильный комплекс фермент-продукт, который быстро распадается на
продукт и неизмененный фермент. Фермент может снова реагировать
с молекулами субстрата, высвобождаясь много раз в секунду.
Такие факторы внутриклеточной среды, как pH и температура,
оказывают существенное влияние на активность фер.ментов. Поэтому
нормальный клеточный метаболизм (совокупность клеточных фер¬
ментативных реакций) зависит от поддержания постоянства внутрен¬
ней среды клеток органов и тканей.
Название почти всех ферментов состоит из двух частей: назва¬
ния субстрата и типа катализируемой реакции и заканчивается на
«аза» (липаза, аланинамитрансфераза, у-глутамилтранспептидаза).
Например, субстратом ACT является аспарагиновая кислота. ACT
специфически катализирует перенос аминогруппы с аспарагиновой
кислоты на сх-кетоглутаровую кислоту. Продуктами этой реакции
являются глутаминовая аминокислота и оксалоацетат. Название фер¬
мента отражает его функцию.
Правда, некоторые ферменты открыты задолго до разработки
современной классификации. Поэтому для них сохранены старые
названия. В качестве примеров могут служить ферменты (факторы)
свертывающей системы крови — тромбин, плазмин, а также пищева¬
рительные ферменты — пепсин, трипсин, химотрипсин.
Определение активности ферментов в сыворотке крови служит
чувствительным методом выявления повреждения органов и тканей.
Для количественной оценки их активности Комиссия по ферментам
Международного биохимического союза рекомендовала стандартную
международную единицу (ME). За единицу активности любого фер¬
мента принимают то его количество, которое в оптимальных условиях
катализирует превращение 1 .мкмоль субстрата в 1 мин (мкмоль/мин). Об
активности фермента судят по скорости катализируемой реакции при
определенных температуре, pH среды, концентрации субстрата. Поэтому
при определении активности ферментов в лаборатории строго соблюдают
одни и те же условия, иначе нормальные результаты будут существен¬
но различаться. Кроме того, ферментативная реакция чувствительна к
изменениям температуры. Обычно ферментативную реакцию принято
проводить при температуре 25-40 "С, однако при разной температуре
оптимальные значения pH, концентрации буфера, субстрата и других
параметров различны и соответственно различны значения нормаль¬
326 Глава 5, Биохимические исследования
ных результатов анализа. Максимальная активность большинства фер¬
ментов в организме человека наблюдается при температуре около 37 °С.
Поэтому в целях международной стандартизации температуры измере¬
ния активности ферментов в лаборатории используют температуру 37 °С.
Нормальная активность ферментов приведена ниже для 37 °С.
5.5.2. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ
АКТИВНОСТИ ФЕРМЕНТОВ
Определение активности ферментов применяется в клинической
практике для решения различных задач: установления диагноза,
проведения дифференциальной диагностики заболеваний, оценки
динамики течения болезни, определения эффективности лечения и
степени выздоровления, с прогностической целью.
Наиболее часто в качестве объекта исследования используется
сыворотка крови, ферментный состав которой относительно постоя¬
нен. Нормальная активность ферментов в сыворотке крови отражает
соотношение между биосинтезом и высвобождением ферментов (при
обычном обновлении клеток), а также их удалением из кровотока.
Повышение скорости обновления ферментов, повреждения клеток
или нарушение их выведения обычно приводят к повышению актив¬
ности ферментов, в сыворотке крови выделяют три группы фермен¬
тов: внутриклеточные, секреторные и экскреторные.
Из 4000 ферментов у человека в повседневной клинической прак¬
тике определяют активность около 30. Почти все они являются внут¬
риклеточными, Внутриклеточные ферменты в зависимости от лока¬
лизации в тканях делят на две группы:
• неепецифические, которые катализируют общие для всех тканей
реакции обмена и находятся в большинстве органов и тканей
(например, ACT, АЛТ, ЛДГ, амилаза, липаза и др.);
• органоспецифические, которые присутствуют только в опре¬
деленном типе тканей (например, панкреатическая а-амилаза,
присутствует только в поджелудочной железе).
в сыворотке крови активность клеточных ферментов низкая или
вообще отсутствует. Относительно небольшое количество ферментов,
в норме присутствующих в крови, поступает туда вследствие процес¬
са клеточного обновления (когда клетка погибает, ее содержимое, в
том числе внутриклеточные ферменты, попадают в плазму крови).
5.5. Ферменты 327
Ферменты с низкой молекулярной массой удаляются из организма в
процессе почечной фильтрации, но большинство их разрушается в
клетках ретикулоэндотелиальной системы. При патологических про¬
цессах активность внутриклеточных ферментов в сыворотке крови
зависит от скорости высвобождения из клеток, которая в свою очередь
определяется скоростью^ и степенью повреждения клеток. Любое значи¬
тельное увеличение количества гибнущих клеток (некроз) вследствие
патологического процесса или повреждения проявляется повышенным
высвобождением внутриклеточных ферментов в плазму крови, где их
активность повышается. Усиленное клеточное размножение (напри¬
мер, при росте злокачественной опухоли) также приводит к повыше¬
нию содержания внутриклеточных ферментов в плазме крови.
Большинство внутриклеточных ферментов, которые используются
в клинической практике как маркеры (указатели) повреждения клеток,
являются неспецифическими. Однако хотя они находятся во многих или
по крайней мере в нескольких тканях, их наибольшая концентрация
наблюдается только в одном или нескольких определенных типах тканей.
Поэтому повышение в плазме крови уровня какого-либо определенного
фермента указывает на повреждение клеток той ткани, в которой этот
фермент представлен в наибольшем количестве. Например, больше всего
КК находится в клетках скелетной мускулатуры, сердечной мышцы,
значительно меньше — в мозге, щитовидной железе, матке, легких.
Соответственно при обнаружении повышения акі'ивности КК в сыво¬
ротке крови в первую очередь необходимо предполагать наличие у паци¬
ента повреждения миокарда или скелетной мускулатуры.
Секреторные ферменты (церулоплазмин, псевдохолинэстераза,
ренин) поступают непосредственно в плазму крови и выполняют в
ней специфические функции. Эти ферменты синтезируются в печени
и постоянно высвобождаются в плазму. Их активность в сыворотке
крови выше, чем в клетках или тканях. В клинической практике они
представляют интерес, когда их активность в сыворотке крови стано¬
вится ниже нормы за счет нарушения функции печени.
Экскреторные ферменты образуются органами пищеварительной
системы (поджелудочная железа, слизистая оболочка кишечника,
печень, эндотелии желчных путей), к ним относятся а-амилаза,
липаза, щелочная фоефатаза и др. В норме их активность в сыворотке
крови низка и постоянна. Однако при патологии, когда блокирован
любой из обычных путей экскреции, активность этих ферментов в
сыворотке крови значительно увеличивается.
328 Глава 5. Биохимические исследования
5.5.3. МАРКЕРЫ ПОВРЕЖДЕНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Значительное число среди пациентов, обращающихся за неотложной
медицинской помощью, составляют больные с острой болью в животе.
Острая боль в животе почти всегда является признаком неотложных
хирургических состояний; острого аппендици'га, острого холецистита,
кишечной непроходимости, перфоративной язвы желудка или расслаи¬
вающей аневризмы аорты. Часть пациентов, у которых главны.м си.мп-
томом является боль в животе, могут страдать острым панкреатитом —
воспалительным заболеванием поджелудочной железы, угрожающим
жизни больного. За последние годы частота этого заболевания значитель¬
но увеличилась. Оно занимает теперь 3-е место в структуре острых хирур¬
гических заболеваний органов брюшной полости после острого аппен¬
дицита и острого холецистита, составляя 9—12,5% частоты ургентных
заболеваний (требуюших оказания неотложной медицинской помощи)
органов брюшной полости (от 235 до 331 случая на 1 млн жителей). Острый
послеоперационный панкреатит — также весьма часто встречающееся и
наиболее тяжелое осложнение в хирургии органов пищеварения. Он воз¬
никает, как правило, в раннем послеоперационном периоде в 6,4-12,4%
всех операций на органах брюшной полости.
При остром панкреатите клинические проявления болезни могут
широко варьировать, что не позволяет быстро и точно установить диа¬
гноз. В связи с этим роль лабораторных методов исследования имеет,
а в ряде случаев решающее значение (например, при остром послео¬
перационном панкреатите, когда патологический процесс в поджелу¬
дочной железе прикрыт клиническими проявлениями послеопераци¬
онного периода). Диагностика острого панкреатита сложна, ошибки
на догоспитальном этапе составляют 48,3%, в приемно.м отделении —
21,7% и в стационаре при поступлении — 14,7%. Изменение в лабора¬
торных тестах в виде значительного повышения активности а-амила-
зы и/или липазы в сыворотке крови при острой боли в животе пред¬
полагает наличие острого панкреатита.
5.5.3.1. Структура и функции поджелудочной железы
Поджелудочная железа расположена забрюшинно на уровне I—ТТ
поясничных позвонков, простираясь в поперечном направлении от
двенадцатиперстной кишки до ворот селезенки. Длина ее от 15 до 23
см, ширина от 3 до 9 см, толшина от 2 до 3 см. Масса железы в среднем
составляет 70-90 г. В поджелудочной железе различают головку, тело
5.5. Ферменты
329
и хвост. Головка расположена в изгибе двенадцатиперстной кишки и
имеет молоткообразную форму. Тело поджелудочной железы передней
поверхностью прилежит к задней стенке желудка. Хвост нередко глубо¬
ко вдается в ворота селезенки (рис. 5-10).
Рис. 5-10. Анатомия поджелудочной железы
I — же.лчный пузырь; 2 - пузырный проток; 3 - печень; 4 — обший печеноч¬
ный проток; 5 - печеночная артерия; 6 - воротная вена; 7 — чревный ствол;
8 - селезеночная вена; 9 — главный панкреатический проток; 10 — селезенка;
II - общий желчный проток; 12 - двенадцатиперстная кишка; 13 — левая почка
В гистологическом строении поджелудочной железы различают
две функционально различные ткани, что отражает ее двойную роль.
Поджелудочная железа — орган внешней и внутренней секреции.
Около 90% паренхимы железы представлено так называе.мой ацинар-
ной (железистой) тканью, которая отвечает за продукцию панкреати¬
ческого сока, необходимого для нормального пищеварения в кишке.
В этом состоит экзокринная функция поджелудочной железы, среди
паренхиматозных клеток поджелудочной железы распологаются осо¬
бые клетки, которые образуют скопления величиной около 1 мм,
так называемые панкреатические островки (островки Лангерганса).
330 Глава 5. Биохимические исследования
Панкреатические островки не имеют выводных протоков. Они синте¬
зируют и секретируют непосредственно в кровь гормоны — инсулин
и глюкагон, которые играют важнейшую роль в рег.уляции уровня
глюкозы в крови (см. раздел 5.З.1.1.), Секретируя в кровь инсулин и
глюкагон, поджелудочная железа тем самым выполняет свою эндок¬
ринную функцию.
Экзокринная секреция поджелудочной железы заключается в
выделении пиш,еварительных ферментов и жидкости, богатой элек¬
тролитами. Ацинарные клетки железы отвечают за синтез и сек¬
рецию пищеварительных ферментов, а центроацинарные клетки и
эпителиальные клетки протоков — за секрецию жидкости, которая
транспортирует ферменты в двенадцатиперстную кишку, где они
активируются. Ацинарные клетки располагаются вокруг микроско¬
пических выводных протоков, образуя функциональные единицы —
ацинусы. Ацинарная ткань состоит из миллионов таких функцио¬
нальных единиц. Протоки постепенно сливаются во все большие по
размеру. Они собирают панкреатический сок из всех ацинусов в один
большой главный проток (вирсунгов проток). В головке поджелудоч¬
ной железы главный проток соединяется с общим желчным протоком,
который проходит через головку железы ближе к ее задней повер¬
хности и открывается на вершине большого дуоденального соска
(фатерового соска) в двенадцатиперстную кишку. Панкреатический
сок и желчь поступают в двенадцатиперстную кишку, что регулиру¬
ется сфинктером Одди. Такое анатомическое расположение главного
панкреатического протока имеют около 80% всех пациентов. У зна¬
чительно меньшего числа пациентов имеется отдельный от желчного
проток поджелудочной железы, который впадает в двенадцатиперс¬
тную кишку на 1 см выше фатерова соска.
Внешнесекреторным продуктом ацинарной ткани поджелудоч¬
ной железы является панкреатический сок, который нредсгавляег
собой водянистую жидкость pH около 8,0. Она содержит смесь мно¬
гих пищеварительных ферментов и электролитов (натрий, калий,
хлор, бикарбонат натрия). За сутки поджелудочная железа выделяет
1500—3000 мл панкреатического сока. Его функция состоит в фер¬
ментативном расщеплении пищи в тонкой кишке, которое уже нача¬
лось в ротовой полости, пищеводе и желудке.
Ферменты поджелудочной железы образуются и хранятся в аци-
нарных клетках в зимогенных гранулах. После стимуляции, напри¬
мер, пищей происходит увеличение секреции ферментов поджелу¬
5.5. Ферменты
331
дочной железы. Каждая гранула содержит в различном соотношении
все ферменты поджелудочной железы. Ферменты в гранулах обычно
находятся в уплотненном состоянии и растворяются после их экскре¬
ции из клетки в шелочном секрете поджелудочной железы. Однако
растворение ферментов происходит в неактивной (проферментной)
форме, а переход в актц^вную форму — не ранее, чем они попадут в
двенадцатиперстную кишку. В этом заключается .механизм защиты
поджелудочной железы от самопереваривания.
Поджелудочная железа обладает большой метаболической актив¬
ностью и секретирует различные ферменты. Ферменты поджелудочной
железы можно разделить на три группы в зависимости от субстрата, на
который они действуют. Амилаза расщепляет углеводы, липаза — жиры,
а протеолитические ферменты (протеазы) — белки.
Пищеварительные ферменты поджелудочной железы
Фермент
Мишень
Амилаза
а-1,4-Гликозидные связи крахмала, гликогена
Липаза
Триглицериды (образование моноглицеридов и
жирных кислот)
Фосфолипаза А2
Фосфатидилхолин (образование лизофосфотидил-
холина и жирных кислот)
Карбоксилэстераза
Эфиры холестерина, жирораствори.мых витаминов,
три-, ДИ-, м оно глицериды
Трипсин
Внутренние связи белка (основные аминокислоты)
Химотрипсин
Внутренние связи (ароматические аминокислоты)
Эластаза
Внутренние связи (нейтральные аминокислоты)
протеолитические ферменты выделяются в просвет двенадцати¬
перстной кишки в неактивном состоянии, активация их наступает
под влиянием энтерокиназы — фермента кишечного сока. Липаза
также выделяется в просвет кишечника в неактивном состоянии,
а активатором ее являются желчные кислоты. В присутствии пос¬
ледних липаза расщепляет нейтральные жиры на глицерин и жир¬
ные кислоты. Амилаза, в отличие от других ферментов, выделяется
клетками поджелудочной железы в активном состоянии, расщепляет
крахмал до мальтозы. Последняя под влиянием фермента мальтозы
расщепляется до глюкозы.
332 Глава 5, Биохимические исследования
Регуляция секреции поджелудочной железы осуществляется раз¬
личными воздействиями на рецепторы мембраны ацинарных клеток
различных веществ. Одни из них являются стимуляторами, другие —
ингибиторами панкреатической секреции. К стимуляторам относятся
вазоактивнътй интестинальный пептид, холецистокинин, ацетилхолин,
гастрин-рилизинг-пептид, субстанция Р. Ингибиторы панкреатичес¬
кой секреции представлены панкреатическим пептидом, пептидом УУ,
соматостатином, глюкагоном, панкреастатином (последние два секре¬
тируются клетками островков Лангерганса) и нейропептидами.
5.5.3.2. Ферменты поджелудочной железы
Активация панкреатических ферментов при остром панкреатите
в очагах повреждения поджелудочной железы и нарушение оттока
секрета поджелудочной железы по протоковой системе способствуют
их попаданию в кровь. Исследование активности панкреатических
ферментов в крови больного играет важнейшую роль в диагностике
острого панкреатита.
Изучение ферментов поджелудочной железы в процессе развития
острого панкреатита показало, что наиболее распространенным и
ценным для диагностики этого заболевания является исследование
а-амилазы и липазы. Определение активности а-амилазы и липазы —
весьма чувствительные и ценные лабораторные маркеры для диагнос¬
тики острого панкреатита и контроля за эффективностью лечения.
5.5.3.2.1. а-Амилаза
а-Амилаза относится к группе гидролаз, катализирующих гидро¬
лиз полисахаридов, включая крахмал и гликоген, до простых моно- и
дисахаридов (мальтоза, глюкоза). Наиболее богаты амилазой подже¬
лудочная и слюнные железы. Амилаза секретируетея в кровь главным
образом из этих органов. Плазма крови человека содержит а-амилазы
двух изозимных типов: панкреатическую (тип Р), вырабатываемую
поджелудочной железой, и слюнную (тип 8), продуцируемую слюн¬
ными железами.
в физиологических условиях амилаза сыворотки крови состоит
на 40% из панкреатической амилазы и на 60% из слюнной амилазы.
Референтные величины активности а-амилазы: в сыворотке крови
25-220 МЕ/л; в моче 10-490 МЕ/л.
С мочой выделяется в основном панкреатическая амилаза, что
является одной из причин большей информативности уроамилазы
5.5. Ферменты 333
о функциональном состоянии поджелудочной железы, чем амилазы
сыворотки крови. Полагают, что 65% активности амилазы мочи обус¬
ловлено панкреатической амилазой. Этим объясняется то обстоя¬
тельство, что при остром панкреатите именно ее активность увеличи¬
вается в сыворотке (до 89%) и особенно в моче (до 92%) без изменения
активности амилазы слюнных желез.
Определение активности а-амилазы имеет важное значение в
диагностике заболеваний поджелудочной железы. Повышение актив¬
ности а-амилазы в сыворотке крови в 2 раза и более должно расцени¬
ваться как симптом поражения поджелудочной железы. Небольшая
гиперамилазсмия дает основание заподозрить патологию поджелу¬
дочной железы, но может иногда наблюдаться при заболеваниях дру¬
гих органов,
5.5.3.2.2. Липаза
Липаза — фермент, катализирующий расщепление триглицеридов
на глицерин и высшие жирные кислоты. Этот фермент в организме
человека вырабатывается рядо.м органов и тканей, что позволяет раз¬
личать липазу желудка, поджелудочной железы, легких, кишечного
сока, лейкоцитов и др, Наиболее важной с клинической точки зре¬
ния является липаза поджелудочной железы. Поскольку основным
источником липазы является поджелудочная железа, при ее заболева¬
ниях происходит значительный выброс фермента в циркулирующую
кровь. Референтные величины активности липазы в сыворотке крови
составляют 0—190 МЕ/л.
5.5.3.3. Причины и клиническое значение повышения уровня фермен¬
тов поджелудочной железы
Острый панкреатит — основная причина повышения в крови
активности амилазы и липазы. Это острое заболевание, в основе
которого лежит повреждение ткани поджелудочной железы вследс¬
твие преждевременной активации протеолитических ферментов, в
норме образующихся в поджелудочной железе в неактивной форме.
Активация этих ферлтентов внутри железы ведет к ее самопереварива-
нию и разрушению.
Наиболее частыми причинами острого панкреатита являются вре¬
менное затруднение оттока панкреатического сока камнями желчных
путей (перед впадением в двенадцатиперствую кишку главный про¬
ток поджелудочной железы соединяется с общим желчным протоком)
334 Глава 5. Биохимические исследования
И злоупотребление алкоголем. Примерно 80-90% пациентов с острым
панкреатитом страдают желчнокаменной болезнью или злоупотреб¬
ляют алкоголем. Другие, менее частые причины острого панкреатита,
а их известно более 140, включают травму железы (в том числе и опе¬
рационную), вирусные инфекции (паротит, краснуха, гепатит А и В,
энтеровирусы) и прием некоторых лекарств (цитостатики, аспирин,
тетрациклин, фуросемид и др.).
Основной клинический симптом острого панкреатита — внезапная
резкая боль в верхней части живота, которая нередко иррадиирует в
спину. Довольно часто боль сопровождается рвотой и повышение.м
температуры тела. Течение болезни вариабельно. Острый панкреатит
легкого течения или так называемый интерстициальный (отечный)
острый панкреатит проходит при проведении медикаментозного лече¬
ния через несколько дней или неделю без отдаленных последствий, при
тяжелом течении (его называют некротическим панкреатитом) острый
панкреатит представляет собой состояние, угрожающее жизни боль¬
ного. при этом самопереваривание поджелудочной железы вызывает
распространенные некрозы, воспаление и кровоизлияния не только в
поджелудочной железе, но и в оружающих органах (кишечник, большой
сальник, забрюшинное пространство). У таких больных часто развива¬
ются шок и тяжелая гипотензия. Осложнениями тяжелого панкреатита
являются сердечная и дыхате.льная недостаточность, желтуха, анемия,
гипокалиемия, диссеминированное внутрисосудистое свертывание
крови и сепсис с полиорганной 14едостаточностью. Интерстициальный
панкреатит составляет около 80% всех случаев заболевания, обычно
имеет сравнительно легкое, поддающееся медикаментозному лечению
течение и разрешается без осложнений. Смертность низкая — 1-3%, в
то время как при некротическом панкреатите (20% случаев) смертность
составляет 10-30%, особенно если течение панкрсонекроза осложни¬
лось инфекцией.
Повреждение ацинарных клеток поджелудочной железы, выход из
них ферментов и их местная активация, а также нарушение оттока
панкреатического сока вследствие отека протоков сопровождаются
массивным поступлением панкреатических ферментов в кровоток, в
том числе амилазы и липазы. Поэтому повышение в крови активнос¬
ти амилазы (гиперамилаземия) и липазы (гиперлипаземия) является
маркером повреждения поджелудочной железы.
При остром панкреатите активность амилазы крови и мочи увели¬
чивается в 10-30 раз. Гиперамилаземия наступает в начале заболевания
5.5. Ферменты 335
(уже через 4-6 ч после появления клинических симптомов), достигает
максимума через 12—24 ч, затем быстро снижается и приходит к норме
на 2—6-й день. Зависимости между повышением активности сыворо¬
точной амилазы и тяжестью панкреатита нет. Поэтому высокая актив¬
ность амилазы в сыворотке крови может быть выявлена у больных с
легкой формой панкреатита и, наоборот, низкая — при тяжелой форме
заболевания. Если у пациента с болью в животе активность амилазы
повышена более чем в 5 раз по сравнению с нормой, можно подозревать
у него острый панкреатит. Так как у незначительной части больных ост¬
рым панкреатитом активность фермента повышена менее значительно,
этот диагноз нельзя исключить при повышении активности фермента
в 2—3 раза. Очень редко острые панкреатиты .могут протекать без повы¬
шения активности амилазы (в частности, при панкреонекрозе).
Активность амилазы в моче начинает повышаться (гиперамилазу-
рия) через 6—10 ч после острого приступа панкреатита и возвращается
к норме через 3 сут.
Выявление гиперамилаземии и гиперамилазурии является важ¬
ным, но не специфическим феноменом для острого панкреатита;
кроме того, повышение активности амилазы может быть кратковре¬
менным.
Оценка результатов исследования активности амилазы в крови и
моче затруднен а тем, что фермент содержится в слюнных железах, тол¬
стой кишке, скелетных мышцах, почках, легких, яичниках, маточных
трубах, предстательной железе. Поэтому активность амилазы может
быть повышена при заболеваниях, имеюших сходную клиническую
картину с острым панкреатитом; остром аппендиците, перитоните,
перфоративной язве желудка и двенадцатиперстной кишки, кишеч¬
ной непроходимости, холецистите, тромбозе брыжеечных сосудов, а
также при феохромопитоме, диабетическом ацидозе, после операций
по поводу пороков сердца, после резекции печени. Повышение актив¬
ности амилазы при этих заболеваниях обусловлено рядом причин и
носит в большинстве случаев реактивный характер. Вследствие зна¬
чительных запасов амилазы в ацинарных клетках любое нарушение
их целостности или малейшее затруднение оттока секрета поджелу¬
дочной железы может привести к значительному попаданию амилазы
в кровь. Обычно активность а-амилазы при перечисленных заболева¬
ниях повышается в крови в 3—5 раз.
Хронический панкреатит, в отличие от острого, является дли¬
тельно текущим заболеванием, развивающимся медленно и необра¬
ЗЗв Глава 5. Биохимические исследования
тимо. Наиболее частой причиной хронического панкреатита являет¬
ся длительное злоупотребление алкоголем. Основной клинический
симптом хронического панкреатита — постоянная или периоди¬
ческая боль в животе. Заболевание проявляется нарушением всасы¬
вания пищи вследствие недостатка панкреатических ферментов и
потерей массы тела.
На ранних стадиях хронического панкреатита активность амилазы
в крови и моче повышается (у 10—88 и у 21—70% боль41ых соответствен¬
но) в период обострения процесса. Однако по мере прогрессирования
заболевания, так как продукция ферментов снижается, активность
амилазы в сыворотке крови уменьшается до нормы, а иногда даже
ниже ее. Так как активность амилазы при хроническом панкреатите
у многих пациентов может быть в норме, ее исследование является
малоинформативным для диагностики этого заболевания.
Кроме острого и хронического панкреатита, серьезным заболева¬
нием поджелудочной железы является рак. При раке поджелудочной
железы активность амилазы в крови и моче иногда повышается, в
других случаях она остается в пределах нормы или даже снижена.
Этот тест является малоинформативным для диагностики рака под¬
желудочной железы.
Определение активности липазы в крови является наиболее инфор¬
мативным критерием диагностики острого панкреатита. Существует
ошибочное представление, что при остром панкреатите активность
липазы в крови увеличивается позже, чем амилазы, но остается повы¬
шенной более продолжительное время. На самом деле активность
липазы увеличивается и снижается параллельно повышению и сни¬
жению активности амилазы, но нормализация активности липазы
происходит позже нормализации активности амилазы. Иногда актив¬
ность липазы в крови повышается раньше, чем увеличивается актив¬
ность амилазы, и остается повышенной длительное время.
При остром панкреатите активность липазы в крови увеличива¬
ется в течение нескольких часов после острого приступа, достигая
максимума через 12—24 ч (увеличивается до 200 раз), и остается повы¬
шенной в течение 10-12 дней. Прогноз заболевания является плохим,
если активность липазы в крови повышается в 10 раз и более и не
снижается до 3-кратного превышения нормы в течение ближайших
нескольких дней. Одновременное определение активности а-амилазы
и липазы ~ основа диагностики острого панкреатита. Повышение
активности обоих или одного фермента выявляется у 98% больных
5.5. Ферменты
337
острым панкреатитом. Динамика активности а-а.милазы и липазы в
крови при неосложненном панкреатите представлена на рис. 5-11.
Кратаость
День
Рис. 5-11. Динамика активности а-амилазы и липазы в крови при неослож-
иештом панкреатите
По оси абсцисс ~ кратность повышения активности ферментов; по оси орди-
(?ат ~ день от начала заболевания. 1 — нормальная активность ферментов;
2 — активность а-амилазы; 3 — активность липазы
В отличие от амилазы, активность липазы не повышается при
паротите, внематочной беременности, раке легких, аппендиците.
Активность липазы сыворотки крови обладает высокой чувстви¬
тельностью, особенно в отношении диагностики острого алкоголь¬
ного панкреатита, в то время как для больных с закупоркой желчевы-
водящих путей, большого дуоденального сосочка и панкреатических
протоков характерна высокая активность амилазы. В связи с этим
для установления этиологии острого пакреатита иногда определяют
липазоамилазовый коэффициент — отношение активности липазы
к активности амилазы в сыворотке крови. Величина липазоамила-
зового коэффициента выше 2,0 позволяет диагностировать острый
алкогольный панкреатит. Только у пациентов с острым алкогольным
панкреатитом коэффициент может быть выше 5,0.
338 Глава 5. Биохимические исследования
5.5.4. МАРКЕРЫ ПОВРЕЖДЕНИЯ МИОКАРДА
Инфаркт миокарда — острое заболевание, возникаюшее вследствие
резкого несоответствия между потребностью миокарда в кислороде и
доставкой его по коронарным артериям, заканчивающееся развитием
некроза части сердечной мышцы.
В настоящее время считается доказанным, что причиной раз¬
вивающегося инфаркта миокарда более чем в 80% случаев является
тромбоз коронарной артерии, возникающий, как правило, на месте
имеющейся атеросклеротической бляшки с поврежденной поверх¬
ностью. кровь не может течь через этот сосуд, лишая участок сер¬
дечной мышцы кислорода и питательных веществ. Кардиомиоциты
гибнут. Локализация и протяженность области инфаркта зависят
от того, какая ветвь коронарной артерии закупорена. По мере гибе¬
ли кардиомиоциты высвобождают в кровоток огромное количество
биологически активных веществ, в том числе внутриклеточные фер¬
менты, включая ACT, КК, ЛДГ, а также ряд специфических белков:
миоглобин. тропониныТ и 1, Активность миокардиальных ферментов
и концентрация миокардиальных белков в плазме крови возраста¬
ют. Определение активности некоторых из них в сыворотке крови
используют в клинической практике в качестве маркеров (указателей)
повреждения миокарда — миокардиальных маркеров.
5.5,4,1. Аспартатаминоансфераза
ACT катализирует перенос аминогруппы с аспарагиновой кис¬
лоты (аминокислота) на а-кетоглутаровую кислоту. Продуктами
этой реакции являются глутаминовая аминокислота и оксалоацетат.
Реакция является частью обмена аминокилот и осуществляется во
всех метаболически активных клетках. Поэтому ACT широко рас¬
пространена в тканях человека (сердце, печень, скелетная мускула¬
тура, почки, поджелудочная железа, легкие и др.). Миокард, печень и
скелетные мышцы являются наиболее богатыми источниками ACT.
Референтные величины активности ACT в сыворотке крови состав¬
ляют 10-30 МЕ/л.
Активность ACT в крови повышается при ряде заболеваний, осо¬
бенно при поражении органов и тканей, богатых данным ферментом.
Наиболее резкие изменения в активности ACT наблюдаются при
поражении сердечной мышцы. Активность фермента у 93—98% боль¬
ных инфарктом миокарда повышена.
5.5. Ферменты 339
5.5.4.2. Креатинкиназа
КК (креатинфосфокиназа) — фермент, который катализирует
перенос фосфата с крсатинфосфата на АДФ. Продуктами реакции
являются креатин и АТФ. Наиболее богаты КК скелетная муску¬
латура, сердечная мышца, меньше ее в мозге, щитовидной железе,
матке, легких. КК сосдоит из двух белковых субъединиц М и В, что
позволяет идентифицировать три функционально одинаковых, но
структурно различных изофермента КК: КК-ММ (мышечный), КК-
МВ (сердечный), КК-ВВ (мозговой). При определении активности КК
в сыворотке крови в лаборатории определяют суммарную (общую)
активность всех изоферментов, но могут определить и активность
каждого изофермента в отдельности. Изоферменты КК органоспе¬
цифичны. В сердечной мышце в основном представлен изофермент
КК-МВ, в мышцах — КК-ММ, в головном мозге — КК-ВВ. В клини¬
ческой практике нашли применение только исследования активности
общей КК и МВ-изофермента КК. Они полезны для диагностики
инфаркта миокарда и рассматриваются как миокардиальные фер¬
менты. Повышение активности КК в сыворотке крови наблюдается
из-за выхода фермента из клеток при их повреждении. Общая КК в
сердечной мышце состоит из двух изоферментов: КК-ММ и КК-МВ;
КК-ВВ отсутствует. Так как б льшая часть КК-МВ в сыворотке крови
происходит из миокарда, то определение активности этого изофер¬
мента более специфично для повреждения миокарда, чем определение
уровня общей КК (сумма всех изоферментов). Референтные величи¬
ны активности общей КК в сыворотке крови составляют у мужчин
52-200 МЕ/л, у женщин 35-165 МЕ/л, активность КК-МВ — 6% общей
активности КК, или 0-24 МЕ/л.
При инфаркте миокарда поступление КК и КК-МВ из сердечной
мышцы в сыворотку опережает другие ферменты, поэтому определе¬
ние активности КК нашло наиболее широкое применение в ранней
диагностике инфаркта миокарда.
5.5.4.3, Лактатдегидрогеназа
ЛДГ — фермент, катализирующий отщепление водорода от молеку¬
лы молочной кислоты (лактата). Продуктом реакции является пиро-
виноградная кислота (пируват). Это важнейшая реакция анаэроб¬
ного метаболизма глюкозы, которая происходит во многих клетках,
поэтому ЛДГ широко распространена в тканях организма человека.
340 Глава 5. Биохимические исследования
Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце,
скелетной мускулатуре и печени. ЛДГ содержится не только в сыворот¬
ке, но и в значительном количестве в эритроцитах, поэтому сыворотка
для исследования должна быть без следов гемолиза. Большинство
органов и тканей человека содержит 5 изоферментов ЛДГ. Характер
изоферментного спектра ЛДГ и тип обмена веществ в ткани коррели¬
руют между собой, в тканях с преимущественно аэробным обменом
веществ (сердце, мозг, почки) наибольшей л Д Г-активностью обладают
изоферменты ЛДГ-1 и ЛДГ-2. В тканях с выраженным анаэробным
обменом веществ (печень, скелетная мускулатура) преобладают изо¬
ферменты ЛДГ-4 и ЛДГ-5. В сыворотке крови здорового человека пос¬
тоянно обнаруживаются все пять изоферментов ЛДГ. Имеется зако¬
номерность в отношении активности изоферментов ЛДГ: активность
ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5, Повреждение того или иного
органа из.меняет изоферментный спектр сыворотки крови, причем эти
изменения обус.ловлены спецификой изоферментного состава повреж¬
денного органа. В лаборатории наиболее часто определяют активность
общей ЛДГ (сум.му всех 5 изоферментов), но могут определять более
специфичный для сердечной мышцы изофермент ЛДГ-1. Референтные
величины активности обшей ЛДГ в сыворотке крови составляют
208-378 МЕ/л, а ЛДГ-1 — 15-25% общей активности ЛДГ.
5.5.4.4. Миоглобии
Миоглобин — гемсодержащий белок, транспортирующий кислород
в скелетных мышцах и миокарде. Он содержится в мышечных клетках и
по структуре схож с гемоглобином. Миоглобин с.чабо связывается с бел¬
ками крови. При повреждении миокарда и скелетных мышц миоглобин
легко и быстро попадает в кровь и затем быстро экскретируется с мочой.
Повышение уровня миоглобина в сыворотке крови наблюдается уже
через 2-3 ч после появления боли при инфаркте миокарда и сохраняет¬
ся 2-3 сут. Референтные величины содержания миоглобина в сыворот¬
ке крови составляет у мужчин 2—66 мкг/л, у женщин 1-49 мкг/л.
5.5.4.5. Тропонины
Комплекс тропойина входит в состав сократительной системы
клетки мышц, где функционирует как регуляторный белок при вза¬
имодействии актина и миозина во время мышечного сокращения. Он
образован тремя белками: тропонином Т (молекулярная масса 3700 Д),
5.5. Ферменты 34І
тропонином І (молекулярная масса 26 500 Д) и тропонином С (молеку¬
лярная масса 18 ООО Д),. Около 93% тропонина Т содержится в сократи¬
тельном аппарате миоцитов; эта фракция может быть предптественни-
ком синтеза тропойинового комплекса, и 7% находится в цитоплазме.
Тропонин Т сердечной .мышцы по аминокислотному составу и иммун¬
ным свойствам различается от тропонина Т других мъшттт. Тропонин Т,
как и тропонин Т в сердечной и скелетных мышцах, значительно отли¬
чаются по своей аминокислотной последовательности. Это позволило
создать диагностические наборы для кардиальных изоформ указан¬
ных тропонинов. В норме тропонины Т в сыворотке крови практичес¬
ки не определяются. Референтные величины содержания тропонина
Т составляют 0—0,1 нг/мл, а тропонина I — 0-1,0 нг/мл. Поэтому
повышение их уровня в сыворотке крови выше указанных величин
свидетельствует о повреждении сердечной мышцы.
5.5.4.6. Динамика изменений миокардиальных маркеров при инфаркте
миокарда
Инфаркт миокарда представляет собой динамический процесс,
развитие которого происходит во времени. Повышение активности
миокардиальных ферментов и концентрации миокардиальных белков
в плазме крови при ИМ, является преходящим феноменом и имеет
свои динамические закономерности (рис. 5-12, табл. 5-13).
В первые 4 ч после закупорки коронарной артерии в зоне ишемии
нскрогизируется около 60% кардиомиоцитов, некроз остальных 40%
наступает в течение последующих 20 ч. В результате дефектов, возни¬
кающих в цитоплазматических мембранах миокардиоцитов, белки и
ферменты, локализующиеся в цитоплазме, поступают в кровь больно¬
го инфарктом миокарда со скоростью, зависящей в первую очередь от
раз.мера молекул этих белков и ферментов. Выходя за пределы мемб¬
раны кардиомиоцитов, ферменты и белки попадают в межклеточную
жидкость и оттекают от сердца по лимфатическим сосудам и только
затем попадают в общий кровоток. Это и определяет довольно длитель¬
ный промежуток времени (2—6 ч) от мо.мента гибели кардиомиоцитов
до появления миокардиальных маркеров в крови. Вторая особенность
выхода в кровь маркеров гибели кардиомиоцитов — характерная дина¬
мика нарастания и убывания их концентрации в крови. Они опреде¬
ляются выходом белков из зоны некроза и скоростью их удаления из
кровотока. Небольшие молекулы, например, миоглобин, выводятся
очень быстро, а большие, такие, как ЛДГ, — медленно. Поэтому содер¬
342
Глава 5. Биохимические исследования
жание каждого маркера при инфаркте миокарда имеет свою динамику.
Вместе с тем все они имеют дугообразную динамичную кривую, но
только с разными временными параметрами.
^paтнocть
повышения
миокарда
Рис. 5-12. Динамика изменений активности ферментов у больных инфарктом
миокарда
1 — КК; 2 — КК-МВ; 3 — ЛДГ; 4 — миоглобин
Таблица 5-13.
Динамика изменений маркеров острого инфаркта миокарда
Пара¬
метр
Начало
увеличения
активности, ч
Максимум
увеличния
активности
Возвращение к
норме, сут
Кратность
увеличения,
раз
ACT
4-6
24-48 ч
4-7
В 2-20
КК
2-4
24-36 ч
3-6
В 3-30
КК-МВ
2-4
12-18 4
2-3
До 8
ЛДГ
8-10
48-72 ч
6-15
До 8
ЛДГ-1
8-10
30-72 ч
7-20
До 8
Миоглобин
0,5-2
6-12 ч
0,5-1
До 20
Тропонин г
3,5-Ш
12-18 4
(и 3-5-е сут)
7-20
До 400
5.5. Ферменты 343
При инфаркте миокарда активность ACT повышается в сыворотке
через 6—8 ч, достигает максимума через 24—36 ч, снижается до нормы
к 5—6-му дню. Расширение зоны инфаркта приводит к появлению
второго цикла повышения активности ACT, Степень повышения его
активности является мерой массы миокарда, вовлеченной в патоло¬
гический процесс. Отсутствие снижения активности после 3-4-х сут
заболевания прогностически неблагоприятно. При инфаркте миокар¬
да активность ACT в крови может увеличиваться в 2—20 раз.
Поступление КК из сердечной мышцы в плазму крови при инфар¬
кте миокарда опережает поступление других ферментов, поэтому
определение КК нашло наиболее широкое применение в ранней диа¬
гностике инфаркта миокарда. Активность К К повышается уже через
2-4 ч после острого приступа, достигая максимума через 24-36 ч,
превышая нормальные величины в 5—20 раз. Активность КК сравни¬
тельно быстро возвращается к норме (на 3-6-е сут).
При инфаркте миокарда активность КК-МВ повышается уже через
4-8 ч после острого приступа, достигает максимума через 12-24 ч, на
3-и сут активность изофермента возвращается к норме при неослож¬
ненном течении инфаркта миокарда. При расширении зоны инфаркта
активность КК-МВ повышена дольше, что позволяет диагностировать
инфаркт пролонгированного и рецидивирующего течения. Максимум
активности КК-МВ часто достигается раньше максимума активности
общей КК, Величина повышения активности КК и КК-МВ соответс¬
твует величине пораженной зоны миокарда.
Повышение активности ЛДГ при инфаркте миокарда отмечается
через 8—10 ч после его начала. Спустя 48—72 ч достигается максимум
активности (повышение обычно в 2—4 раза), и она остается увеличен¬
ной в течение 10 сут. Эти сроки могут варьировать в зависимости от
величины участка поврежденной мышцы сердца. Увеличение актив¬
ности общей ЛДГ у больных инфарк гом миокарда идет за счет резкого
повышения активности ЛДГ-1.
Повышение уровня миоглобина в сыворотке крови преходящее,
наблюдается уже через 2-3 ч после появления боли при инфарк¬
те миокарда и сохраняется 2-3 сут. Степень повышения уровня
миоглобина в крови зависит от величины повреждения миокар¬
да. Нормализация уровня миоглобина отмечается на 2—3-и сут.
При развитии осложнений (сердечная недостаточность) уровень
миоглобина повышен более 3 сут. Повторное повышение уровня
миоглобина в крови на фоне уже начавшейся нормализации может
344 Глава 5. Биохимические исследования
свидетельствовать о расширении зоны инфаркта миокарда или
образовании новых некротических очагов.
Динамика изменений уровня тропонинов Т и I р плазме крови при
инфаркте миокарда отличается от динамики изменения активности
ферментов. Уровень тропой и на Т повышается в крови уже через 3—4 ч
после начала болевого приступа, пик его концентрации приходится
на 3—4-е сут, в течение 5—7 дней наблюдается плато, затем уровень
тропонина Т постепенно снижается, однако может оставаться повы¬
шенным до 10—20-х сут. Концентрация тропонина Т увеличивается
после начала инфакрта миокарда значительно больше, чем КК и ЛДГ.
При неосложненном течении ИМ концентрация тропонина Т снижа¬
ется уже к 5—6-х сут, а к 7-м суткам повышенный уровень тропонина Т
выявляется у 60% больных.
Повышение уровня тропонина I в крови отмечается через 4—6 ч
после острого приступа, достигает максимума на 2-е сутки и приходит
к норме между 6-ми и 8-ми.
Тропонины Т и I являются компонентами сократительного аппа¬
рата миокарда, и поэтому структурно связанными белками кард и-
омиоцитов, тогда как растворенные в цитозоле белки (миоглобин)
относительно быстро вымываются из зоны некроза. Деструкция
сократительного аппарата кардиомиоцитов более продолжительна
по времени, поэтому увеличение уровня тропонинов определяется до
8—10 суз и более после начала инфаркта миокарда.
5.5.4.7. Роль миокардиальных маркеров в диагностике инфаркта
миокарда
Среди пациентов с болями в сердЦе только у 10-15% имеется инфаркт
миокарда. Необходимость диагностики инфаркта миокарда в ранние
сроки продиктована те.м, чго тромболитическая терапия (введение боль¬
ному препаратов, растворяющих тромб, закупоривший коронарную арте¬
рию) в первые 2—6 ч снижает раннюю смертность у больных в среднем на
30%, а терапия, начатая через 7-12 ч — лишь на 13% (Ткачук В.А., 2004).
Тромболитическая терапия, начатая через 13-24 ч после возникновения
инфаркта миокарда, не снижает уровня смертности.
В большинстве случаев инфаркт миокарда начинают подозревать
на основании выявления у пациента клинических симптомов (острый
продолжительный приступ интенсивной загрудинной боли, чувство
страха, одышка) и подтверждают наличием характерных изменений
на электрокардиограмме (ЭКГ). Характерные изменения на ЭКГ
5.5, Ферменты 345
включают подъем сегмента ST, инверсию зубца Т и формирование
зубца Q. Однако и при этих условиях определение активности мио¬
кардиальных маркеров в сыворотке крови является обязательным для
подтверждения диагноза.
Вместе с тем в 30% случаев инфаркта миокарда изменения на ЭКГ
могут отсутствовать или они неспецифичньт для установления диа¬
гноза. Именно в этик трудных для диагностики случаях определение
в крови уровня миокардиальных маркеров позволяет или подтвердить
диагноз инфаркта миокарда, если уровень маркеров повьтптен, или
отвергнуть его, если он остается нормальным.
Термин «миокардиальные маркеры» подразумевает, что исполь¬
зуемые для диагностики инфаркта миокарда ферменты и белки
происходят из сердечной мышцы, в действительности это не так.
Практически все так называемые миокардиальные ферменты — ACT,
КК и ЛДГ — содержатся в других тканях, и повышение их активнос¬
ти может быть результатом не только повреждения миокарда. Это
во многом осложняет оценку результатов исследования ферментов,
когда необходимо установить диагноз инфаркта миокарда. Тем не
менее на протяжении многих лет определение активности в сыворот¬
ке крови ACT, КК, ее изофермента MB и ЛДГ использовали в качес¬
тве миокардиальных маркеров для диагностики ИМ. Просто другие
маркеры были недоступны для лабораторий. Однако за последние два
десятилетия были проведены многочисленные клинические исследо¬
вания с целью оценить эффективность и безопасность обследования
и лечения больных инфарктом миокарда. Результаты исследований
были положены в основу международных клинических рекомендаций
по ведению больных инфарктом миокарда.
В клинических рекомендациях указывается, что миокардиальные
белки — тропонины Т и Т — имеют почти абсолю! ную специфичность
для ткани миокарда, а также высокую чувствительность, что позволя¬
ет выявлять даже микроскопические участки повреждения миокарда.
Исследование тропонинов является обязательным для больных с
[шдозрением на инфаркт миокарда. Кардиальные тропонины должны
быть определены при поступлении больного и повторно через 6—12 ч.
Дальнейшие повторные исследования проводят через 12—24 ч, если
результаты предыдущих исследований были отрицательными, а кли¬
ническое подозрение на инфаркт миокарда высоко. В случае рецидива
инфаркта миокарда определение уровня тропонинов возобновляется
через 4—6 ч от начала рецидива и далее повторно через 6—12 ч.
346 Глава 5. Биохимические исследования
Определение уровня миоглобина в сыворотке крови и/или актив¬
ности КК-МВ должны проводиться при недавнем (менее 6 ч от воз¬
никновения острых болей за грудиной) появлении клинических
симптомов (как ранние маркеры инфаркта миокарда) и у больных с
повторной ишемией после недавнего (менее 2 нед) инфаркта миокарда
для выявления рецидива. При рецидиве инфаркта миокарда значение
исследований миоглобина и КК-МВ возрастает, поскольку содержа¬
ние тропонина может еще оставаться повышенным от первоначально¬
го эпизода некроза миокарда.
Пациенты с больто в груди и лабораторными результатами тропо¬
нинов Т (1) выше верхней референтной величины должны рассматри¬
ваться как пациенты с наличием повреждения миокарда. Они должны
быть госпитализированы и интенсивно наблюдаться, чтобы снизить
риск, связанный с этим повреждением.
Клинические рекомегідации однозначно указывают на то, что
исследования активности ACT, ЛДГ и ее изофермектов не должны
использоваться для диагностики инфаркта миокарда.
5.5.4.S. Изменения активности ферментов при других заболеваниях
В клинической практике нашло широкое применение одновре¬
менное определение в сыворотке крови активности ACT и АЛТ
для диагностики заболеваний печени. Активность ACT повышается
при остром гепатите и других тяжелых поражениях гепатоцитов.
Умеренное увеличение наблюдается при механической желтухе, у
больных с метастазами в печень и циррозом.
Повышение активности КК в крови не является специфичным
для инфаркта миокарда. Активность КК возрастает в отдельных
случаях при миокардитах, миокардиодистрофиях различного про¬
исхождения. Но ферментемия у этих больных умеренная и более
длительная и обычно соответствует фазе максимальной активности
процесса. Значительное повышение активности КК в сыворотке
крови наблюдается при травматических повреждениях скелетной
мускулатуры и заболеваниях мышечной системы. Так, при прогрес¬
сирующей мышечной дистрофии (миопатии) активность КК может
увеличиваться в 50 раз и более по сравнению с нормой, что исполь¬
зуется в качестве диагностического теста. Активность КК возрас¬
тает после различных хирургических операций, причем способ и
продолжительность анестезии сказываются на послеоперационной
активности КК.
5.5. Ферменты 347
Высокая активность КК наблюдается при различных наруше¬
ниях центральной нервной системы: шизофрении, маниакально-
депрессивном психозе, синдромах, вызываемых психотропными
лекарствами.
Активность КК повышается при гипотиреозе, в то же время при
тиреотоксикозе наблюдаются необычайно низкая ее активность.
Различные опухоли могут продуцировать КК-МВ, на долю кото¬
рой приходится 60% и более общей активности КК. В этой связи если
КК-МВ составляет более 25% общей КК, необходимо думать о злока¬
чественном новообразовании как причине повышения активности
фермента.
Источником увеличения активности ЛДГ может быть легочная
ткань при эмболии и инфаркте легких. При миопатиях (мышечные
дистрофии, травматические повреждения мышц, воспалительные
процессы, расстройства, связанные с эндокринными и метаболичес¬
кими заболеваниями) отмечается увеличение активности ЛДГ; при
нейрогенных заболеваниях мышц активность ЛДГ не повышается.
При остром вирусном гепатите активность ЛДГ в сыворотке крови
увеличена в первые дни желтушного периода и при легкой и средне-
тяжелой формах заболевания довольно быстро возвращается к норме.
Тяжелые формы вирусного гепатита, особенно развитие печеночной
недостаточности, сопровождаются выраженным и более длительным
повышением активности ЛДГ. В стадии ремиссии при хроническом
гепатите и циррозе печени активность ЛДГ в крови остается в преде¬
лах нормы или слегка повышена. При обострении процесса отмечает¬
ся повышение активности фермента.
При механической желтухе на первых стадиях закупорки желчных
протоков активность ЛДГ в норме, на более поздних стадиях наблю¬
дается повышение активности ЛДГ вследствие вторичных поврежде¬
ний печени.
при карциномах печени или метастазах рака в печень может повы¬
шаться активность ЛДГ.
Повышение активности ЛДГ характерно для мегалобластической и
гемолитической анемии.
Активность ЛДГ повышается при острых и обострении хроничес¬
ких заболеваний почек. Активность ЛДГ при хронических заболева¬
ниях почек, ассоциированных с уремией, может быть нормальной,
но часто возрастает после гемодиализа, что обусловлено удалением
ингибиторов фермента во время этой процедуры.
348 Глава 5. Биохимические исследования
Повышение концентрации миоглобина наблюдается при пов¬
реждении скелетных мышц, так как этот белок присутствует в них в
значительных количествах. Поэтому определение уровня миоглобина
в плазме крови имеет важное значение у больных с синдромом дли¬
тельного сдавления, при обширных травмах мышц, наиболее частым
осложнением которых является острая почечная недос]агочностъ.
Она развивается вследствие массивного отложения миоглобина в
почечных клубочках.
Уровень миоглобина в крови увеличивается при тяжелом элект¬
рошоке, термических ожогах, вторичной токсической миоглобину¬
рии (болезнь Хаффа), повреждении скелетных мышц, артериальной
окклюзии с ишемией мышечной массы.
Некоронарогенные заболевания сердечной мышцы (миокардиты,
травма сердца, кардиоверсия) также могут сопровождаться повы¬
шением уровня тропонина Т в крови, однако динамика изменения,
характерная для инфаркта миокарда, отсутствует.
Содержание тропонинов в сыворотке может быть повышено при
септическом шоке и проведении химиотерапии вследствие токсичес¬
кого повреждения миокарда.
Ложноположительные результаты при определении тропонинов
в сыворотке могут быть получены при наличии гемолиза, у больных
со значительным увеличением концентрации им.муноглобулинов в
крови, острой почечной и особенно хронической почечной недоста¬
точности, а также хронической болезни мышц.
5.6. МАРКЕРЫ НАРУШЕНИЙ ФУНКЦИЙ ПЕЧЕНИ
(ФУНКЦИОНАЛЬНЫЕ ПРОБЫ ПЕЧЕНИ)
Печень играет жизненно важную роль в об.мене веществ, обезвре¬
живании и выведении токсичных продуктов. Повреждения печени
при различных заболеваниях могут не оказывать явного влияния на ее
функциональную активность, поскольку печень обладает значитель¬
ным функциональным резервом, поэтому оценить функцию печени
по какому-то одному показателю не всегда возможно. Традиционно
для оценки функции печени используют комплекс лабораторных
показателей, которые включают определение уровня билирубина,
альбумина, актив110сти АЛТ, ACT, ЛДГ, гамма-глутамилтранспепти-
5.6. Маркеры нарушений функций печени... 349
дазы и щелочной фосфатазы. Часть из этих показателей (аспартага-
минотрансфераза, лактатдегидрогеназа) рассмотрены в предыдущем
разделе, данный раздел посвящен определению 5 веществ, находя¬
щихся в плазме крови: билирубину, альбумину, гамма-глютамил-
транспептидазе, АЛТ и щелочной фосфатазе. Несмотря на то что
они различаются по своей структуре и функциям, их необходимо
рассматривать вместе,Так как все они используются для выявления у
пациентов заболеваний печени или желчевыводящих путей. Каждый
из этих показателей в отдельности характеризует в большей степени
нарушение одной из функций печени, но все вместе они дают доста-
гочно полное представление о состоянии печени в целом, поэтому
традиционно называются функциональными пробами печени. Кроме
того, у пациентов с заболеваниями печени ил и желчевыводящих путей
(в зависимости оттого, каким именно заболеванием он страдает) один
или несколько этих показателей могут оставаться нормальными, но
только в крайне редких случаях все они будут в норме у пациента с
такой патологией.
Таким образом, все 5 показателей, отражающих функциональное
состояние печени, позволяют более надежно выявить заболевание
печени, чем каждый анализ в отдельности. Ни один из них не явля¬
ется специфичным для заболеваний печени, существует много других
болезней, при которых они могут отклоняться от нормы.
5.6.1. ФУНКЦИИ ПЕЧЕНИ
Печень — один из самых больших и важных органов человеческого
организма. Масса печени составляет около 3% массы тела взрослого
человека. Она расположена в правом подреберье и защищена нижней
частью грудной клетки. Верхняя выпуклая часть печени прилежит к
диафрагме. Снизу печень несколько вогнута и обращена к органам
брюшной полости,
Каждую минуту к печени по печеночной артерии и воротной вене
поступает 20% общего объема сердечного выброса. Вещества, образо¬
вавшиеся в результате переваривания пищи в желудочно-кишечном
тракте, поступают в печень с кровью через воротную вену, а кровь,
насыщенная кислородом, — через печеночную артерию. Кровь поки¬
дает печень через печеночные вены, впадающие в нижнюю полую
вену, и возвращается в сердце.
350 Глава 5. Биохимические исследования
Основной структурный элемент печени — печеночная долька. Она
состоит из 15—20 гепатодитов, которые играют центральную роль в
метаболизме, поступивтиих в организм с пищей углеводов, белков и
жиров. Именно поэтому продукты их переваривания поступают в
печень по воротной вене.
Печень выполняет в организме разнообразные функции.
Метаболическая функция печени — это участие в обмене веществ.
В печени происходит синтез основных белков плазмы крови, таких,
как альбумин (12—15 г/сут), до 80% глобулинов, различные факто¬
ры свертывания крови. Главный синтезируемый белок — альбумин.
Распад многих белков, выполнивших свою функцию, также происхо¬
дит в печени. Мочевина, конечный продукт метаболизма аминокис¬
лот, синтезируется в печени, а затем доставляется кровью к почкам,
где фильтруется и выделяется с мочой.
Печень участвует и в обмене углеводов. Она регулирует синтез и
расходование гликогена. Большое количество глюкозы, поступившей
в организм с пищей, хранится в гепатоцитах в виде гликогена, пока в
ней не возникнет потребность. Эти запасы гликогена используются
между приемами пищи, когда поступление глюкозы недостаточно. Во
время голодания, когда запасы гликогена истощены, печень способна
превращать аминокислоты белков, поступивших с пищей, и собс¬
твенных белков организма в глюкозу. Кроме того, в печени инакти¬
вируется инсулин — главный гормон, обеспечивающий поступление
глюкозы из крови в клетки органов и тканей. Благодаря этим меха¬
низмам печень играет важную роль в поддержании концентрации
глюкозы в крови.
Печени принадлежит главная роль в метаболизме жиров (липидов),
поступивших в организ.м с пищей, в печеночных клетках происходит
синтез холестерина, триглицеридов, фосфолипидов, желчных кислот
и липопротеинов, которые необходимы для транспорта липидов, в
том числе триглицеридов и холестерина.
Продукты обмена гемоглобина, многих гормонов и витами¬
нов также распадаются, перерабатываются и выводятся печенью.
Алкоголь, все токсичные и лекарственные вещества подвергаются
метаболическим превращениям в печени.
Барьерная функция печени заключается в удалении из крови
(которая оттекает от кишечника и органов брюшной полости и прохо¬
дит через печень) микробов, их токсинов и продуктов обмена, токсич¬
ных веществ другого происхождения.
5.6. Маркеры нарушений функций печени... 351
Кроме метаболической, синтетической и барьерной функций,
печень осуществляет образование желчи. Желчь представляет собой
волпътй раствор желчных кислот, холестерина, фосфолипидов, били¬
рубина и электролитов, в образовании желчи участвуют гепатоциты
и желчные канальцы. Желчь поступает в двенадцатиперстную кишку
через печеночные протоки, желчный пузырь и общий желчный
проток. За сутки печень выделяет 500—600 мл желчи. Желчные кис¬
лоты необходимы для нормального переваривания жиров пишевых
продуктов в кишечнике, кроме того, в составе желчи из организма
выводятся некоторые вещества (например, билирубин, некоторые
лекарственные средства).
Огромное разнообразие процессов, происходящих в печени, связа¬
но с функционированием многочисленных ферментов. Они обеспе¬
чивают все метаболические процессы. Печень не только синтезирует
подавляющее большинство ферментов, но и обеспечивает их дина¬
мическое постоянство, а также регулирует их распад. Все ферменты
и меют белковую природу. Около 50% аминокислот в печени идет на
синтез ферментов.
Считают, что для проявления биохимических сдвигов необходи¬
мо повреждение примерно половины клеток печени, примерно 1/5
паренхимы печени может обеспечить ее функциональную деятель¬
ность. в здоровом организме, например, используется только 2% воз¬
можностей печени для связывания билирубина (за 18 мин гепатоциты
из крови поглощают 50% экзогенного билирубина).
5.6,2. БИЛИРУБИН
Пациенты с заболеваниями печени часто имеют характерные сим¬
птомы и признаки. Наиболее типична для многих пациентов желтая
окраска кожи, склер и слизистых оболочек. Раньше всего она заметна
на конъюнктиве глаз. Этот клинический признак называется желтухой.
Желтуха наблюдается 11е только при заболеваниях печени, но и других
заболеваниях (например, при гемолитической анемии). Она возникает
из-за высокой концентрации в крови желтого пигмента билирубина.
Билирубин образуется главным образом из кровяного пигмента
эритроцитов гемоглобина. Другим источником билирубина являются
миоглобин (белок мышечных клеток), цитохромы и гемсодержашие
ферменты (рис. 5-13).
352
Глава 5. Биохимические исследования
Эритроцит Погибший эритроцит
Печень
нь
нь
к:
Гемоглобин
Глобин Гем
^ Железо
Билирубин
Ретикулоэндотелиальная
система (селезенка, клетки
Купфера 0 печени и т.д.)
Кровеносные сосуды
Желчевыводящие пути
Некоторая часть конъюгированного
билирубина всасывается в кровь
(уробилиноген)
Небольшая часть ствркпбилиногена
всасывается в кровь и затем
выводится с мочой (уробилин)
Конъюгированны
й билирубин
\ 4
Стеркобилиноган
ф
Выделение с калом
Кишечник
Рис. 5-13. Образование и выведение билирубина
5.6. Маркеры нарушений функций печени... 353
Эритроциты, выполнив свои функции, в конце своего 120-дневно-
го срока жизни удаляются из крови селезенкой и другими клетками
ретикулоэндотелиальной системы. При физиологических условиях в
организме взрослого человека за 1 ч разрушается 1—2 • 10» эритроци¬
тов. Высвободившийся при этом гемоглобин разрушается на белко¬
вую часть — глобин и часть, содержащую железо, — гем. Железо гема
включается в обший оймен железа и снова используется. Свободная
от железа гюрфириновая часть гема подвергается катаболизму. В
основном это происходит в ретикулоэндотелиальных клетках печени
(клетках Купфера), селезенки и костного мозга.
Дальнейший метаболизм билирубина в основном происходит в
печени. Однако билирубин плохо растворим в плазме и воде, поэтому,
чтобы поступить в печень, он специфически связывается с альбуми¬
ном. В соединении с альбумином билирубин доставляется в печень. В
дальнейшем метаболизм билирубина складывается из трех процессов:
• поглощения билирубина паренхиматозными клетками печени
(гепатоцитами);
■ конъюгации (связывания) билирубина с глюкуроновой кислотой
в гепатоцитах;
• секреции билирубина из гепатоцитов в желчь.
В гепатоцитах к билирубину присоединяется глюкуроновая кис¬
лота, и он переходит в водорастворимую форму. Процесс, обеспечива¬
ющий переход билирубина из водонерастворимой в водорастворимую
(|>орму, называется конъюгацией. Сначала происходит образование
билирубинмоноглюкуронида, а затем — диглюкуронида билирубина.
Билирубин секретируетея в желчь преимущественно в виде билиру-
биндиглюкуронида.
в составе желчи конъюгированный (свыше 97%) и неконъюги-
[юванный билирубины поступают в тонкую кишку. После того, как
билирубин достигает области подвздошной и толстой кишки, глю-
курониды гидролизуются специфическими бактериальными фер¬
ментами. Далее кишечная микрофлора восстанавливает пигмент с
последовательным образованием мезобилирубина и мезобилиногена
(уробилиногена). В подвздошной и толстой кишке часть образовав¬
шегося мезобилиногена (уробилиногена) всасывается через кишеч¬
ную стенку, попадает в v. portae и поступает в печень, где полностью
расщепляется, поэтому в норме в общий круг кровообращения и
мочу мезобилиноген (уробилиноген) не попадает. При повреждении
паренхимы печени процесс расщепления мезобилиногена (уробили-
354 Глава 5. Биохимические исследования
ноге на) нарушается, и уробилиноген переходит в кровь, оттуда в мочу,
где может определяться лабораторными методами, В норме большая
часть бесцветных мезобилипогснов, образующихся в толстой кишке,
окисляется в стеркобилиноген, который в нижних отделах толстой
кишки (в основном в прямой кишке) окисляется до стеркобилина и
выделяется с калом. Лишь псболыиая часть стеркобилипогсна (уро¬
билина) всасывается в нижних участках толстой кишки в систему
нижней полой вены и в дальнейшем выводится почками с мочой.
Следовательно, в норме моча человека содержит следы уробилина, но
не уробилиногена. Обнаружение в моче уробилиногена свидетельс¬
твует о нарушении функции печени.
5.6.3. АЛЬБУМИН
Альбумин, находящийся в плазме крови, синтезируется в печени из
аминокислот (примерно 12-15 г/сут). Содержание альбумина в сыво¬
ротке крови составляет около 60% общего белка. Референтные вели¬
чины концентрации альбумина в сыворотке крови равны 35—50 г/л
(3,5-5,0 г/дл). В плазме крови альбумин выполняет следующие основ¬
ные функции: транспортную, регулятора онкотического давления
плазмы крови, белкового резерва организма.
Альбумин транспортирует различные нерастворимые в воде вещес¬
тва, в частности, тиреоидные гормоны, билирубин, свободные жир¬
ные кислоты и многие лекарственные препараты. Примерно половина
кальция, находящегося в плазме крови, связана с альбумином и пере¬
носится им в физиологически неактивной форме.
Альбумин вносит основной вклад в поддержание объема цирку¬
лирующей крови. Поддержание постоянства объема циркулирующей
крови зависит от удержания в сосудистом русле воды. При этом арте¬
риальное давление способствует перемещению жидкости во внесосу-
дистое (межклеточное) пространство, в отсутсвие эффективного про¬
тиводействия этому процессу произошла бы быстрая потеря воды из
сосудистого русла. В отличие от клеточных мембран, стенки капил¬
ляров проницаемы для небольших молекул, поэтому натрий почти
не оказывает осмотического влияния в кровеносных капиллярах.
Наименьшей из молекул, концентрация которых значительна в кро¬
вотоке, но вне кровеносных сосудов низкая, является молекула альбу¬
мина. В норме стенка капилляров для него малопроницаема, поэтому
5.6. Маркеры нарушений функций печени... 355
концентрация альбумина в крови является наиболее важным факто¬
ром, противостоящим общему артериальному (гидростатическому)
давлению. Альбумин присутствует в плазме в больших количествах и
вносит еамый значительный вклад в поддержание ее онкотического
давления. Онкотическое давление препятствует вытеканию жидкос-
I и из капилляров в окружающее интерстициальное (межклеточное)
пространство под действйем давления внутри сосудов. На 65—80%
онкотическое давление плазмы обусловлено альбумином.
При патологии динамическое равновесие и обмен жидкости между
внутри- и внесосудистыми пространствами нарушаются. При умень¬
шении содержания альбумина в крови (острая кровопотеря, высокий
уровень катаболизма, печеночная недостаточность, потери белка с
мочой и др.) онкотическое давление плазмы снижается, жидкость уси¬
ленно покидает сосудистое русло, в связи с чем происходят сгущение
крови, замедление кровотока, а в межклеточном пространстве обра¬
зуется избыток жидкости и развивается отек. Отек, который внешне
выглядит как припухлость, — клинический симптом накопления
жидкости в интерстициальном пространстве.
Своевременное внутривенное введение раствора альбумина поз¬
воляет восстановить объем плазмы крови у пациентов с обширной
гравмой, ожогами или шоком различного происхождения.
5.6.4. ГАММА-ГЛУТАМИЛТРАСПЕПТИДАЗА,
АЛАНИНАМИИОТРАНСФЕРАЗА И ЩЕЛОЧНАЯ ФОСФАТАЗА
Огромное ранообразие процессов, происходящих в печени,
связано с присутствием многочисленных ферментов в отдельных
структурных элементах гепатоцитов. Выраженность повреждения
этих структурных единиц печеночной клетки определяет сущность
обменных нарушений при различных заболеваниях. Различные
этиологические факторы повреждают одни и те же структурные
элементы печени и проявляются похожими отклонениями резуль¬
татов биохимических тестов. Поэтому биохимические анализы не
позволяют определить этиологию конкретного заболевания пече¬
ни, но они представляют информацию для установления степени
тяжести повреждения печени.
ГГТП, АЛТ и щелочная фоефатаза — ферменты, находящиеся в
клетках печени (гепатоцитах) и желчевыводящих путей (билиарный
356 Глава 5. Биохимические исследования
тракт), где каждый из них обеспечивает протекание определенных
метаболических процессов.
ГГТТТ (7-глутамилтранспептидаза) катализцрует перенос
у-глутамила на аминокислоту или пептид. ГГТП является мем-
брано-связанным ферментом. Он расположен преимущественно
в мембранах билиарного полюса гепатоттита, а также в клетках
желчных протоков. В значительных концентраииях ГГТП обна¬
ружена в печени, поджелудочной железе, почках и предстательной
железе (поэтому у мужчин активность ГГТП в сыворотке крови
приблизительно на 50% выше, чем у женщин). В других клетках
тканей ГГТП содержится в небольших количествах. В основном
активность ГГТП присутствует на мембранах клеток, обладающих
высокой секреторной или поглотительной способностью, таких
как эпителиальные клетки желчевыводяших путей, клетки прок¬
симальных канальцев почки, ацинарная ткань поджелудочной
железы и се протоки, шеточная каемка клеток кишечника.
Референтные величины активности ГГТП в сыворотке крови у
мужчин 10,4-33,8 МЕ/л, у женщин, 8—22,0 МЕ/л.
Аланинаминотрансфераза катализирует перенос аминогруппы с
аланина (аминокислота) на а-кетоглутаровую кислоту. АЛТ содер¬
жится в скелетной мускулатуре, печени, сердце. В меньших коли¬
чествах АЛТ обнаружена также в поджелудочной железе, селезенке,
легких. В самых больших концентраций АЛТ содержится в печени.
Референтные величины активности АЛТ в сыворотке 7-40 МЕ/л.
Щелочная фосфатаза широко распространена в тканях чело¬
века, особенно в слизистой оболочке кишечника, клетках кости
(остеобластах), стенках желчных протоков печени, плаценте и
лактирующей молочной железе. Она катализирует отщепление
фосфорной кислоты от ее органических соединений. Свое назва¬
ние фермент получил в связи с тем, что он 1имум pH щелочной
фосфатазы лежит в щелочной среде (pH 8,6-10,1). Фермент распо¬
ложен на клеточной мембране и принимает участие в транспорте
фосфора. Референтные величины активности щелочной фосфата¬
зы представлен в табл. 5-14.
Таблица 5-14.
Референтные величины активности щелочной фосфатазы в сыворотке крови
Возрастная группа
Общая, МЕ/л
Новорожденные
35-106
5.6. Маркеры нарушений функций печени... 357
Окончание таблицы 5,4
мсс
71-213
-3 года
71-142
1 и лет
106-213
До 31 года
39-92
Старше 31 года
39-117
При гибели печеночных клеток (некроз) или нарушении целост¬
ности их мембран, что наблюдается при заболеваниях печени, внут¬
риклеточные ферменты ГГТП, АЛТ и щелочная фоефатаза попадают
и кровь. Они не выполняют в крови своих функций, но их повышенное
количество в плазме служит индикатором повреждения печеночных
клеток. Однако повышение уровня ферментов в крови не всегда отра¬
жает повреждение печеночных клеток. Возможны и другие причины,
га кие, как усиленная клеточная пролиферация при злокачественных
опухолях, нарушение оттока желчи.
Необходимо понимать условность сложившегося общего названия
«печеночные ферменты» в отношении ГГТП, АЛТ и щелочной фосфа-
газы. Печень не является единственным источником этих ферментов,
и повышение их уровня в крови не всегда указывает на повреждение
печени. ГГТП, АЛТ и щелочная фоефатаза присутствуют в клетках
других тканей, и повреждение этих тканей (или наличие заболевания,
затрагивающего их) тоже может сопровождаться высокой концентра¬
цией ГГТП, АЛТ и щелочной фосфатазы в сыворотке крови.
5.6.5. ПРИЧИНЫ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ
БИЛИРУБИНА В КРОВИ
Содержание общего билирубина в сыворотке крови в норме состав¬
ляет 3,4-17,1 мкмоль/л. Возрастание уровня билирубина в сыворотке
крови выше 17,1 мкмоль/л называется гипербилирубинемией. Она
может быть следствием трех основных групп заболеваний:
• болезней, связанных с повышенным образованием билирубина
(в большем количестве, чем то, которое нормальная печень может
экскретировать), при этом печень и желчные пути обычно не
вовлечены в патологический процесс; наиболее частым заболева-
358 Глава 5. Биохимические исследования
ниєм этой группы является гемолитическая анемия, для которой
характерно усиленное разрушение эритроцитов;
• болезней, связанных с повреждением клеток цечени, а следова¬
тельно, с нарушением их способности конъюгировать билирубин
(болезни печени);
• болезней, связанных с нарушением оттока желчи (следовательно,
снижением экскреции билирубина) вследствие закупорки желче¬
выводящих протоков печени (болезни желчевыводящих путей).
Во всех этих случаях билирубин накапливается в крови и по дости¬
жении определенных концентраций диффундирует в ткани, окраши¬
вая их в желтый цвет. Это состояние называется желтухой. Желтушная
окраска кожи появляется тогда, когда содержание билирубина в крови
превышает 30—35 мкмоль/л. Различают легкую форму желтухи — при
концентрации билирубина в крови до 86 мкмоль/л, среднетяжелую —
87-159 мкмоль/л и тяжелую — свыше 160 мкмоль/л.
В соответствии с приведенными группами болезней в клиничес¬
кой практике наиболее широкое распространение получило деление
желтух на гемолитические, паренхиматозные и обтурационные.
Гемолитические анемии — группа болезней, при которых ане¬
мия вызвана усиленным разрушением (гемолизом) эритроцитов. В
результате усиленного гемолиза происходит интенсивное образова¬
ние в ретикулоэндотелиальных клетках билирубина из гемоглобина.
В то же время печень оказывается не способной к связыванию (конъ¬
югации) столь большого количества билирубина, что и приводит к
накоплению свободного билирубина в крови и тканях. Однако даже
при значительном гемолизе гипербилирубинемия обычно незначи¬
тельна (менее 68,4 мкмоль/л) вследствие большой способности печени
к конъюгированию билирубина. Гемолиз также может быть усилен
при В,2-дефицитных анемиях, малярии, массивных кровоизлияни¬
ях в ткани, инфарктах легких, синдроме размозжения мягких тка¬
ней (неконъюгированная гипербилирубинемия). Помимо увеличения
уровня общего билирубина, при гемолитической желтухе выявляется
повышенное выделение уробилиногена с мочой и калом, так как он
образуется в кишечнике в большом количестве.
Наиболее частой формой гемолитической желтухи и гипербилиру-
бинемии является физиологическая желтуха у новорожденных (встре¬
чается у 60% младенцев в первые недели жизни). Причиной ее являют¬
ся ускоренный гемолиз эритроцитов и незрелое состояние печеночной
системы поглощения, конъюгации и секреции билирубина. В связи с
5.6. Маркеры нарушений функций печени... 359
тем, что билирубин, накапливающийся в крови, находится в неконъ-
югированном (свободном) состоянии, когда его концентрация в крови
превышает уровень насыщения альбумина (34,2—42,75 мкмоль/л),
он способен преодолевать гематоэнцефалический барьер. Это может
привести к гипербилирубинемической токсической энцефалопатии.
В первые сутки после рождения уровень билирубина нередко увели¬
чивается до 135 мкмоль/л, у недоношенных детей он может достигнуть
262 мкмоль/л.
Гемолитическими по своему происхождению могут быть желтухи,
вызванные действием лекарственных средств, усиливающих распад
(гемолиз) эритроцитов (например, ацетилсалициловая кислота, тет¬
рациклин и др.).
При паренхиматозной желтухе наступает деструкция гепатоцитов,
нарушается экскреция конъюгированного билирубина в желчные
капилляры, и он попадает непосредственно в кровь, где содержание
его значительно увеличивается. Кроме того, снижается способность
печеночных клеток синтезировать билирубин-глюкурониды, вследс¬
твие чего количество билирубина также увеличивается.
Основными причинами паренхиматозных желтух являются ост¬
рые и хронические вирусные гепатиты, циррозы печени, токсичные
вешества (хлороформ, четыреххлористый углерод, ацетаминофен),
массивное распространение в печени раковой опухоли, альвеолярный
эхинококк и множественные абсцессы печени.
при вирусных гепатитах степень билирубинемии в какой-то мере
коррелирует с тяжестью заболевания. Так, при легкой форме течения
вирусного гепатита В содержание билирубина в сыворотке крови не
выше 90 мкмоль/л (5 мг%), при среднетяжелой — 90—170 мкмоль/л
(5-10 мг%), при тяжелой — выше 170 мкмоль/л (более 10 мг%). При
развитии печеночной комы уровень билирубина может повышаться
до 300 мкмоль/л и выше.
К паренхиматозны м желтухам относятся редко встречающиеся син-
дромьт, в основе которых лежат наследственные дефекты метаболизма
билирубина. Однако один из этих синдромов — болезнь Жильбера —
гютречается довольно часто — почти у 5% всего населения.
Болезнь Жильбера — доброкачественное заболевание, обусловлен¬
ное снижением поглощения билирубина гепатоцитами. Она проявля¬
ется периодическим повышением в крови уровня общего билирубина,
редко превышающего 50 мкмоль/л (17-85 мкмоль/л). Эти повышения
часто бывают связаны с физическим и эмоциональным напряжением
360 Глава 5. Биохимические исследования
и различными сопутствующими заболеваниями. При этом отсутству¬
ют изменения других показателей функции печени, нет клинических
признаков печеночной патологии.
При обтурационной (механической) желтухе нарушается желче-
выведение вследствие закупорки общего желчного протока камнем
или опухолью. Нарастание давления в желчных капиллярах приво¬
дит к увеличению проницаемости или нарушению их целостности
и попаданию билирубина в кровь. В связи с тем, что концентрация
билирубина в желчи в 100 раз выше, чем в крови, при нарушении
оттока желчи уровень билирубина в крови резко повышается и стой¬
ко сохраняется. Механическая желтуха обычно приводит к наиболее
высокому уровню билирубина в крови, который иногда достигает
800—1000 мкмоль/л. В кале резко снижается содержание стеркоби-
линогена, а полная обтурация желчного протока сопровождается
отсутствием желчных пигментов в кале (кал обесцвечивается). Если
концентрация коыьюгированного (прямого) билирубина превышает
почечный порог (13-30 мкмоль/л), то билирубин выделяется с мочой.
5.6.6. ПРИЧИНЫ ИЗМЕНЕНИЯ
КОНЦЕНТРАЦИИ АЛЬБУМИНА В КРОВИ
При лабораторных исследованиях обнаруживают в основном коли¬
чественные нарушения содержания альбуминов в плазме крови. Они
проявляются гипер- (концентрация в сыворотке крови выше 50 г/л) и
гипоальбуминемией (концетрация ниже 35 г/л).
Гипоальбуминемии бывают первичные (у новорожденных в
результате незрелости печеночных клеток) и вторичные, обуслов¬
ленные различными патологическими состояниями. Так как аль¬
бумин синтезируется в печени, можно ожидать, что заболевания
печени всегда связаны со снижением уровня этого белка в плазме
крови. В действительности это не совсем так. Уровень альбумина
снижается только при хронических заболеваниях печени (цирроз
печени) и печеночной недостаточности, но обычно остается нор¬
мальным, если заболевание протекает остро и быстро разрешается
(острый гепатит).
Уровень альбумина может быть низким при заболеваниях и состо¬
яниях, не относящихся к патологии печени. Они практически анало¬
гичны тем, которые вызывают гипопротеинемию (см. раздел 5.1.2).
5.6. Маркеры нарушений функций печени... 361
В понижении концентрации альбуминов может также играть
роль гемодилюция (разведение крови), например, при беременности.
Снижение содержания альбуминов ниже 22—24 г/л сопровождается
отеком легких,
Гиперальбуминемия наблюдается при дегидратации при тяжелых
1'равмах, обширных ожогах, холере.
%
5.6.7. ПРИЧИНЫ ИЗМЕНЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ В КРОВИ
В клинической практике нашло широкое применение одновре¬
менное определение в крови активности ACT и АЛТ. Совместное
определение этих двух ферментов несет гораздо больше клиничес¬
кой информации о глубине поражения, активности патологического
процесса и прогнозе течения заболевания. Повышение активности
грансаминаз (АЛТ и ACT) в сыворотке крови свидетельствует о пов¬
реждении клеток печени. Эти ферменты являются прямыми маркера¬
ми поражения печеночных клеток, которые связаны с выходом внут¬
риклеточных субстанций во внеклеточное пространство (кровь) из-за
повышенной проницаемости мембран гепатоцитов или их гибели.
Степень возрастания активности этих маркеров в крови обычно тесно
коррелирует с тяжестью и распространенностью поражения печеноч¬
ных клеток. Исследование активности АЛТ и ACT в сыворотке крови
имеет исключительно важное значение для диагностики заболеваний
печени. Повышение их активности прямо пропорционално степени
некроза печеночной ткани.
При нарушении оттока желчи (холестазе) повышается активность
щелочной фосфатазы и ГГТП. При тяжелой обструктивной желтухе
активность щелочной фосфатазы в сыворотке крови может превы¬
шать верхний предел нормы в 10 раз и более. Однако в клинической
практике у больных с заболеваниями печени часто возрастает актив¬
ность обоих ферментов, хотя активность одного из них может пре¬
обладать. В свою очередь повышенная активность ГГТП выявляется
как при холестазе, так и при поражении гепатоцитов. Активость этого
(})ермента является очень чувствительным, но не специфическим
показателем заболевания печени.
Таким образом, при различных заболеваниях печени могут выяв¬
ляться различные сочетания повышения активности ферментов в
сыворотке крови. Они не являются специфическими показателями
362 Глава 5. Биохимические исследования
нарушения функции печени, а больше всего отражают активность
течения заболевания печени. Однако определение активности фер¬
ментов в сыворотке крови очень полезно для отслеживания течения
заболевания печени после того, как диагноз установлен. Снижение
активности АЛТ и ACT свидетельствует об уменьшении повреждения
гепатоцитов, а падение активности щелочной фосфатазы предполага¬
ет устранение причины холестаза.
Лланинаминотрансфераза. Активность АЛТ в сыворотке крови в
первую очередь и наиболее значительно изменяется при заболеваниях
печени. Повышение активности АЛТ в 1,5-5 раз по сравнению с вер¬
хней границей нормы рассматривают как умеренную гиперфермен-
темию, в 6—10 раз — как гиперферментемию средней степени и более
чем в 10 раз — как высокую. Степень повышения активности АЛТ
говорит о выраженности некроза печеночных клеток, но не указывает
прямо на глубину нарушений собственно функций печени.
При остром гепатите независимо от его этиологии активность АЛТ
повышается у всех больных, при этом за 10-15 дней до появления
желтухи при вирусном гепатите А и за много недель при вирусном
гепатите В. При типичном течении острого вирусного гепатита актив¬
ность АЛТ достигает максимума на 2-3-й нед заболевания. При бла¬
гоприятном его течении уровень АЛТ нормализуется через 30—40 сут.
Обычно при остром вирусном гепатите активность АЛТ колеблется
от 500 до 3000 МЕ/л. Повторное или прогрессирующее повышение
активности АЛТ свидетельствует о новом некрозе клеток печени или
рецидиве болезни. Удлинение периода повышенной активности АЛТ
часто является неблагоприятным признаком, так как может свиде¬
тельствовать о переходе острого гепатита в хронический.
Для хронического гепатита характерна умеренная и средняя гипер-
ферментемия. При латентных (скрытых) формах цирроза печени
повышения активности АЛТ, как правило, не наблюдается.
Повышение активности АЛТ может быть выявлено и у не имеющих
клинических проявлений носителей поверхностного антигена гепа¬
тита В, что указывает на наличие внешне бессимптомных активных
процессов в печени.
Алгоритм для принятия клинических решений при установлении
этиологии поражения печени по активности ACT представлен на
схеме 5-2.
5.6. Маркеры нарушений функций печени...
363
Схема 5-2.
Алгоритм для принятия клинических решений при установлении этиологии
поражения печени по активности ACT
Клинические данные о повреищении печени
Определение активности ACT в сыворотке
т
Активность ACT в
сыворотке повышена?
/ в 5 раз по \
/ сравнению с \
/ верхним пре- \
\ делом рефе- /
\ рентного /
\ интервала? /
Злоупотребле¬
ние алкоголем
• Первичный билиар¬
ный цирроз печени
• Неалкогопьный гепатит
• Жировой гепатоз
Да
Лекарственный
хопестатически
й гепатит,
цирроз печени
<В 50 раз по сравнению с
верхним пределом рефе"
рентного интервала?
в 100 раз по сравнению С
верхним пределом рефе¬
рентного интервала?
Лекарственные поражения
Острые вирусные
печени
гепатиты
Нет повреждения
печени
В 20 раз по
сравнению с \
верхним пре- \
делом рефе- /
рентного /
интервала?
• Камни желчных
путей
• Злокачественная
обтурационная
желтуха
• Инфекционный
мононуклеоз
7-Глутамилтранспептидаза. Изменение активности ГГТП в сыво¬
ротке имеет большое диагностическое значение при заболеваниях
печени и гепатобилиарного тракта. Этот фермент более чувствителен
к нарушениям в клетках печени, чем АЛТ, ACT, щелочная фоефатаза.
ГГТП многозначна в диагностическом отношении. По крайней
мере при 5 процессах повышается ее активность в сыворотке крови:
• некрозе печеночных клеток;
• нарушении оттока желчи — холестазе;
364 Глава 5. Биохимические исследования
• интоксикации алкоголем;
• опухолевом росте в печени;
• лекарственных повреждений печени.
Такая этиологическая разнородность механизмов повышения
ГГТП требует очень осторожной и тщательной оценки причин гипер-
ферментемии. Обнаружение высокой активности ГГТП заставляет
искать причину этого повышения. Как отсеивающий тест и метод
контроля за течением известного патологического процесса исследо¬
вание ГГТП буквально незаменимо по клиническому значению.
Особенно чувствительна ГГТП к влиянию на печень длительного
потребления алкоголя. У лиц, злоупотребляющих алкоголем, актив¬
ность ГГТП в сыворотке крови коррелирует с количеством принима¬
емого алкоголя. Тест особенно ценен для контроля лечения алкого¬
лизма. Прекращение приема алкоголя снижает активность фермента
приблизительно на 50% в течение 10 дней.
Определение активности ГГТП используется для установления
факта повреждения печеночных клеток, который обычно положите¬
лен в 90% случаев заболеваний печени. У большинства таких больных
в крови повышается активность АЛТ и ГГТП. Изолированное повы¬
шение активности ГГТП наблюдают у 6—20% больных с патологией
гепатобилиарной системы.
При острых гепатитах активность ГГТП повышается раньше, чем
активность АЛТ. На высоте заболевания активность ГГТП ниже
(повышена в 2-5 раз), чем активность АЛТ, и нормализуется значи¬
тельно медленнее. Это позволяет использовать ГГТП при контроле за
выздоровлением больного. Повышение активности ГГТП отмечается
при инфекционном мононуклеозе.
Повышение активности ГГТП более чем в 3 раза вызывают анти-
конвульсантные препараты, жировая дистрофия печени и сердечная
недостаточность.
Наиболее высокую активность ГГТП (в 5-30 раз выше референт¬
ного интервала) наблюдают при внутри- и внепеченочном холестазе.
Несколько ниже активность фермента при первичных опухолях пече¬
ни и метастазах в печень.
Щелочная фосфатаза. Активность щелочной фосфатазы наиболее
часто повышается вследствие повреждения или деструкции гепатоци¬
тов или нарушения оттока желчи (холестаз). Некроз печеночных кле¬
ток как причина повышения активности щелочной фосфатазы играет
ведущую роль при вирусных и аутоиммунных гепатитах, токсических
5.6. Маркеры нарушений функций печени,.. 365
и лекарственных повреждениях печени. Холестаз как причина повы¬
шения активности щелочной фосфатазы в крови развивается при вне-
печеночной обструкции желчных протоков (например, при закупорке
камнем или развитии послеоперационной структуры), сужении внут-
рипеченочных протоков (например, при первичном склерозирующем
холангите), повреждении желчных протоков (например, при первич¬
ном билиарном циррозе пЬчени) или нарушении транспорта желчи
на уровне мелких желчных протоков (при применении некоторых
лекарственных препаратов, например, хлорпромазина). В ряде случа¬
ев активность щелочной фосфатазы повышается при одновременном
действии обоих механизмов повреждения.
Повышение активности щелочной фосфатазы при повреждении
печени происходит вследствие высвобождения ее из гепатоцитов.
в связи с этим активность щелочной фосфатазы, в противополож¬
ность АЛТ, остается нормальной или незначительно увеличивается
(так как увеличения ее синтеза при этом нет, а в кровь попадает только
го небольшое количество щелочной фосфатазы, которая уже имеется
в гепатоцитах) при вирусном гепатите. У 1/3 больных желтухой с цир¬
розом печени выявлено увеличение активности щелочной фосфатазы.
Повышение активности щелочной фосфатазы наблюдается у 90%
больных первичным раком печени и при метастазах в печень. Резко
возрастает активность щелочной фосфатазы при отравлениях алко¬
голем на фоне хронического алкоголизма. Она может повышаться
при приеме лекарственных средств, обладающих гепатотоксическим
свойством (тетрациклин, парацетамол, фенацетин, 6-меркаптопурин,
салииилаты и др.). Приблизительно у половины больных инфекцион¬
ным мононуклеозом на 1-й нед заболевания отмечается повышение
активности щелочной фосфатазы. Примерно у 65% госпитализиро¬
ванных больных высокая активность щелочной фосфатазы обуслов¬
лена заболеваниями печени.
Виепеченочная закупорка желчных протоков сопровождается рез¬
ким увеличением активности этого фермента.
У женшин, принимающих противозачатачные препараты, содер¬
жащие эстроген и прогестерон, может развиться холестатическая
желтуха и повышается активность щелочной фосфатазы. Очень высо¬
кая активность фермента наблюдается у женщин с преэклампсией,
что является следствием новреждения плаценты. Низкая активность
щелочной фосфатазы у беременных говорит о недостаточности разви¬
тия плаценты.
366
Глава 5. Биохимические исследования
Щелочная фосфатаза продуцируется остеобластами костей —
крупными одноядерными клетками, лежащими на поверхности кос¬
тного матрикса в местах интенсивного формирования кости. У детей
активность щелочной фосфатазы повышена до периода полового
созревания. Увеличение активности щелочной фосфатазы сопровож¬
дает рахит любой этиологии, болезнь Педжета, костные изменения,
связанные с гиперпаратиреозом. Быстро растет активность фермента
при остеогенной саркоме, .метастазах рака в кости, миеломной болез¬
ни, поражении костей при лимфогранулематозе.
Алгоритм для принятия клинических решений при установлении
этиологии поражения печени по активности щелочной фосфатазы
представлен на схеме 5-3.
Схема 5-3.
Алгоритм для принятия клинических решений при установлении этиологии
поражения печени по активности щелочной фосфатазы
Клинические данные о повреждении печени
Определение активности щелочной фосфатазы в
сыворотке
Активность щелочной
фосфатазы в сыворотке
повышена?
Нет
т
Нет повреждения
печени
Да
т
в 5 раз по \
сравнению С \
верхним пре- \
делом рефе- }
рентного /
интервала? /
о \
в 10 раз по
сравнению с \
верхним прв \
делом рефе /
рентного /
интервала? /
/ в 20 раз по
/ сравнению с
/ верхним пре-
\ делом рефе-
\ рентного
\ интервала?
• Острый алко¬
гольный гепатит
• Острый вирус¬
ный гепатит
• Инфекционный
мононуклеоз
• Цирроз печени
• Острая жировая
дистрофия печени
• Холедохолитиаэ
• Постнекротйчео
кий цирроз
• Метастазы в печень
или первичный рак
печени
• Первичный билиар¬
ный цирроз печени
• Рак головки подже¬
лудочной железы
• Лекарственный
гепатит
5.7. Исследование электролитного баланса
367
Динамика активности ферментов при остром вирусном гепатите
представлена на рис. 5-14.
Недели после желтухи
Рис. 5-14. Динамика активности ферментов при остром вирусном гепатите
11о оси абсцисс — недели после появления желтухи; по оси ординат — актив¬
ность ферментов, МЕ/л.
ІЦФ — щелочная фоефатаза
5.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОЛИТНОГО БАЛАНСА
Нарушения баланса электролитов, выполняющих важные фун¬
кции в организме человека, вызывают значительные изменения в
«(»ункционировании жизненно важных органов. Электролиты — это
положительно (катионы) или отрицательно (анионы) заряженные
ионы, находящиеся в растворе (плазме крови). В данном разделе будут
368 Глава 5. Биохимические исследования
рассмотрены положительно заряженные (катионы) ионы натрия,
калия и кальция, исследования которых наиболее часто назначаются
пациентам. Снижение или увеличение содержания воды, концентра¬
ции электролитов в организме приводит к развитию* тяжелых состоя¬
ний, перемещению воды из одного водного пространства в другое, что
ставит под угрозу жизнедеятельность клеток органов и тканей.
5.7.1. ГОМЕОСТАЗ НАТРИЯ
В организме здорового человека с массой около 70 кг содержится
порядка 3500 ммоль или 150 г натрия, Около 20% этого количества
сконцентрировано в костях и непосредственного участия в метаболиз¬
ме не принимает. Основная часть натрия почти полностью находится
в жидкости внеклеточного пространства. Натрий является основным
катионом внеклеточной жидкости, где его концентрация в 6—10 раз
выше, чем внутри клеток. Физиологическая роль натрия заключается
в поддержании осмотического давления и pH во внутри- и внеклеточ¬
ных пространствах. Он влияет на процессы нервной деятельности,
состояние мышечной и сердечно-сосудистой системы.
Поддержание натриевого баланса имеет важное значение для нор¬
мального функционирования организма. С пищей взрослый человек
получает ежедневно в среднем 100—200 ммоль натрия (2,3—4,6 г). Это
больше, чем необходимо. Излишек выводится с мочой. Почечная регу¬
ляция выведения натрия позволяет поддерживать его баланс, несмотря
на широкую вариабельность его поступления с пишей. Выведение
натрия почками зависит прежде всего от СКФ (см. раздел 5.2.2). Высокая
СКФ увеличивает выведение натрия, а низкая способствует его задерж¬
ке в организме. Основное количество натрия (96-99%), когорое филь¬
труется в клубочках, активно реабсорбируется при прохождении мочи
через извитые канальцы. Ко времени достижения фильтратом дисталь¬
ных канальцев нефрона в нем остается только 1—5% всего отфильтро¬
ванного в клубочках натрия. Дальнейшая судьба оставшегося натрия
(будет ли он выведен с мочой или реабсорбирован) зависит главным
образом от концентрации в крови альдостерона (гормона, секретиру-
емого надпочечниками). Альдостерон действует на клетки дистальных
канальцев, усиливая реабсорбцию натрия в обмен на ионы калия или
водорода. Поэтому в присутствии высоких концентраций альдостерона
в крови основное количество оставшегося натрия реабсорбируется, а
5.7. Исследование электролитного баланса
369
если концентрация гормона низкая, то натрий не реабсорбируется и
выводится с мочой в относительно больших количествах. Поэтому у
здорового человека выделение натрия почками колеблется в большом
диапазоне — от 1 до 150 ммоль (0,023-3,45 г) за 24 ч.
Секреция альдостерона корой надпочечников находится под конт¬
ролем ренин-ангиотензиновой системы (рис. 5-15). Ренин — фермент,
синтезируемый и секрЬтируемый клетками юкстагломе рул яркого
аппарата почек (группа клеток, расположенных в непосредственной
близости от почечных клубочков) в ответ на снижение кровотока
через почечные клубочки. Так как скорость почечного кровотока (как
и кровотока через любой другой орган) зависит от объема крови и,
следовательно, от концентрации натрия, то ренин секретируется поч¬
ками при относительном снижении уровня натрия в плазме.
I Артериальное давление
370
Глава 5. Биохимические исследования
Выделившийся в кровь ренин воздействует на ангиотензиноген
(см. рис. 5-15, 1) — белок плазмы, относящийся к группе а^-глобули-
нов. Белок ангиотензиноген синтезируется и секретируется печенью.
Ангиотензин I (А-1) не имеет биологической функции, но является
субстратом для ангиотензинпреврашающего фермента (АПФ), кото¬
рый отщепляет от ангиотензина 1 две аминокислоты (см. рис, 5-15,2),
образует ангиотензин II (А-Т1). Ангиотензин И может осуществлять
несколько действий, одно из которых — увеличение синтеза альдосте¬
рона (см. рис. 5-15, 3) и секреции его клетками надпочечников. Другое
действие — сужение сосудов (см. рис. 5-15,4). Б результате увеличения
секреции альдостерона усиливается реабсорбция натрия и воды (см.
рис, 5-15, 5) в дистальных канальцах почек (точно так же в дистальном
отделе толстой кишки, потовых и слюнных железах), что приводит
к увеличению объема циркулирующей крови (вода задерживается в
организме, и ее объем растет). Сужение сосудов способствует повыше¬
нию артериального давления и тем самым восстановлению нормаль¬
ного кровотока через почки.
В ответ на повышение артериального давления и объема крови
клетки предсердия секретируют предсердный (атриальный) натрийу-
ретический пептид (АНП) — гормон, являющийся антагонистом
альдостерона.
Первичной тканью для осу¬
ществления эффектов АНП
являются почки, но он действует
также на периферическое сопро¬
тивление артерий (рис. 5-16).
В почках АНП повышает давле¬
ние в клубочке, т.е. увеличивает
СКФ. Это при водит к увеличению
фи л ьтрации и соответственно
выведения натрия. Увеличению
экскреции натрия дополни¬
тельно способствует подавление
АНП секреции ренина юкстаг-
ломерулярным аппаратом почки.
Наконец, АНП ингибирует сек¬
рецию антидиуретического гор¬
мона (АДГ) из задней доли гипо¬
физа. Основным эффектом АДГ
Рис. 5-16. Действия атриального
натрийуретического пептида
5.7. Исследование электролитного баланса 371
является увеличение резорбции свободной воды из мочи, находящей¬
ся в просвете дистальной части почечных канальцев. Все эти механиз¬
мы в конечном счете направлены на то, чтобы вернуть к норме увели¬
ченное количество натрия и увеличенный объем воды в организме.
Следствием всех этих эффектов является снижение артериального
давления.
Так, в совокупности функция почек, действие ренин-ангиотензин-
альдостероновой системы и АНП обеспечивают тонкую регулировку
баланса натрия в организме человека. Почечный механизм регуля¬
ции натрия — самый важный фактор в поддержании концентрации
натрия в плазме. Многие причины гипонатриемии и/или гипернатри-
смии связаны с нарушением функции почек.
Натрий выводится из оганизма не только почками (с мочой), но и
желудочно-кишечным трактом (с калом) и кожей (с потом). С калом
теряется от 1 до 10 ммоль/сут, а остальное количество реабсорбиру-
стся. Недостаточность реабсорбции натрия в желудочно-кишечном
тракте неизбежно приводит к дефициту натрия, особенно если он
происходит на фоне нарушения функции почек. В целом баланс
натрия в организме зависит главным образом от нормальной функции
почек, адекватной секреции альдостерона корой надпочечников, нор¬
мального функционирования желудочно-кишечного тракта.
Значительное увеличение или уменьшение содержания натрия в
сыворотке крови наступает вследствие непропорциональных потерь
поды и солей. Эти состояния требуют неотложной помощи.
5.7.1 л. Лабораторная оценка состояния водного и натриевого баланса
Концентрация натрия в сыворотке крови зависит от относитель¬
ного содержания в ней натрия и воды. Однако так как основная часть
натрия находится не в плазме крови, а во внеклеточной жидкости,
го, определив концентрацию натрия в крови, мы не можем точно
знать, сколько его содержится во внеклеточной жидкости. Поэтому
и при избытке, и при недостатке натрия во внеклеточной жидкости
концентрация натрия в сыворотке крови может быть повышенной,
нормальной или сниженной в зависимости от количества воды в
межклеточном пространстве. Тем не менее этот анализ совместно с
определением концентрации общего белка в сыворотке крови, натрия
1$ моче (анализ показывает, сколько натрия выводится из организма)
позволяет установить тенденцию изменения содержания натрия и
воды в организме больного.
372 Глава 5. Биохимические исследования
Референтные величины содержания натрия в сыворотке крови
составляют 135—145 ммоль/л (мэкв/л). При концентрации натрия ниже
135 ммоль/л говорят о гипонатриемии, выше 145 ммоль/л — о гиперна¬
трием ии. Концентрацию натрия в клинической практике целесооб¬
разно определять в следующих случаях:
• при обезвоживании организма или избыточной потере жидкости
для выбора соотвествуюшей инфузионной терапии;
• при внутривенном введении жидкости пациентам, находящимся
в реанимационном отделении;
■ пациентам с нарушением сознания, поведения или признаками
чрезмерной возбудимости центральной нервной системы.
5,7.1.1,1. Гипонатриемия
Гипонатриемия — состояние, при котором концентрация натрия в
плазме крови ниже 135 ммоль/л. Как уже упоминалось, обмен натрия
и воды тесно связан. Поэтому концентрация натрия в сыворотке
крови зависит от количества натрия в межклеточной жидкости и объ¬
ема межклеточной жидкости. Гипонатриемия встречается при ряде
заболеваний и может развиваться, если натрий усиленно выводится
из организма (потери натрия) с водой или если объем воды в межкле¬
точной жидкости слишком велик по сравнению с количеством натрия
(т.е. когда происходит разбавление натрия).
Гипонатриемия, обусловленная потерей натрия, разделяется на
два вида: с избыточной потерей натрия с мочой и непочечиой потерей
натрия. Среди основных причин гипонатриемии, связанной с потерей
через почки, выделяют следующие.
1. Форсированный диурез:
• прием диуретиков;
• сахарный диабет с глюкозурией;
•гиперкальциурия;
• внутривенное введение контрастных веществ при рентгенологи¬
ческих исследованиях.
2. Заболевания почек:
• хроническая почечная недостаточность;
• острый и хронический пиелонефрит;
• обтурация мочевыводящих путей;
• поликистоз почек;
• применение антибиотиков группы аминогликозидов (тента¬
ми цин).
3. Недостаточность коры надпочечников (болезнь Аддисона).
5л. Исследование электролитного баланса 373
Выведение натрия с мочой регулируется гормоном надпочечников
альдостероном. При низкой секреции альдостерона (недостаточность
коры надпочечников) вследствие снижения реабсорбции натрия в
канальцах нефрона увеличивается выведение натрия с мочой. Это
приводит к снижению концентрации натрия в крови.
Непочечиая потеря натрия связана с болезнями желудочно-кишеч¬
ного тракта, которые Сопровождаются рвотой или поносом. Потери
натрия могут происходить через фистулу тонкой кишки, илеостому,
билиарную фистулу. Избыточные потери натрия через кожу вклю¬
чают потери при обильном потоотделении, например, при работе в
жарких помещениях, в жарком климате (особенно у неакклиматизи-
рованных людей), при обширных ожогах и их замедленном заживле¬
нии. Влияние этих факторов на концентрацию натрия в сыворотке
крови зависит от того, какова была концентрация этого элемента в
потерянной жидкости. При сильной рвоте, поносе или потоотделении
теряется в основном вода, поэтому концентрация натрия в сыворот¬
ке крови возрастает. Однако если в этих условиях потери жидкости
восполняются внутривенным введением гипотонического раствора,
может развиться гипонатриемия. Именно такая терапия часто явля¬
ется причиной гипонатриемии.
При неконтролируемом сахарном диабете повышается осмоляр¬
ность плазмы крови (вследствие увеличения концентрации глюкозы),
что приводит к переходу воды из клеток во внеклеточную жидкость
(кровь), т.е. к разведению натрия — гипонатриемии. Проблема усу¬
губляется и тем, что глюкоза активно выводится почками, вызывая
осмотический диурез, который усиливает потери натрия с мочой и
увеличивает гинонатриемию.
Избыток воды в организме приводит к гипонатриемии.
Гипонатриемия может развиться остро при избыточном потреблении
воды, но это случается редко. Здоровые почки способны выводить 1 л
воды в 1 ч, поэтому избыток воды и гипонатриемия могут развиваться
только при быстром приеме очень больших количеств жидкости, что
происходит при психозах или большом потреблении, например, пива.
Патогенетические механизмы развития гипонатриемии включают
ощущение жажды во время психоза и соответственно прием большого
количества воды, что приводит к гипонатремии. Чаще всего избыток
воды и гипонатриемия возникают при избыточном внутривенном
введении гипотонической жидкости в сочетании с нарушением выде¬
лительной функции почек у этих больных.
374 Глава 5. Биохимические исследования
Основная причина гипонатриемии разбавления (избытка воды
в организме) — синдром неадекватной секрепии АДГ — состояния,
характеризующиеся постоянным автономным высвобождением АДГ
или усиленной реакцией почек на нормальный уровень АДГ в крови.
Основная функция АДГ состоит в задержке воды в организме. АДГ
стимулирует реабсорбцию воды канальцами почек, что ведет к увели¬
чению объема воды в организме и развитию гипонатриемии.
Гипонатриемия может возникать и в результате патологического
накопления жидкости в межклеточном пространстве, которое обус¬
ловливают застойная сердечная недостаточность, нефротический
синдром, цирроз печени и другие состояния. Общее содержание в
организме воды повышается в большей степени, чем содержание
натрия. В результате развивается гипонатриемия. При избытке воды
и натрия возникают отеки, т.е. жидкость начинает накапливаться в
межклеточном пространстве.
В ряде случаев при получении результатов анализов со сниженной
концентрацией натрия у больного можно предположить наличие так
называемой ложной, или псевдогипонатриемии. Ложная гипонатри¬
емия возможна в том случае, когда концентрация натрия в плазме не
уменьшена, но используемый для анализа лабораторный метод иссле¬
дования дает неправильные результаты. Это .может произойти при
высокой концентрации липидов (гиперлипидемии), белков (уровень
общего белка выше 100 г/л) или глюкозы в крови больного, в таких
ситуациях повышается неводная, не содержащая натрия фракция
плазмы. Такая гипонатриемия коррекции не требует.
Большинство пациентов с содержанием натрия в сыворотке крови
выше 135 ммоль/л не имеют клинических симптомов. При концентра¬
ции натрия 125-130 ммоль/л превалирующими симптомами будут апа¬
тия, потеря апйетита, тошнота, рвота. Нейропсихическис симптомы
превалируют, когда содержание натрия с1ановится ниже 125 ммоль/л,
в основном это происходит из-за отека мозга. Такими симптомами
будут головная боль, сонливость, обратимая атаксия, психоз, судороги,
нарушение рефлексов, кома. Жажды у таких больных, как правило, не
наблюдается. При концентрации натрия в сыворотке крови 115 ммолъ/л
и ниже пациент жалуется на усталость, головную боль, тошноту, рвоту,
анорексию, появляются признаки спутанности сознания. При концен¬
трации 110 ммоль/л проявления нарушения сознания усиливаются, и
пациент впадает в кому. Если это состояние своевременно не корриги¬
руется, то развивается гиповолемический шок и наступает смерть.
5.7. Исследование электролитного баланса 375
5.7.1.1.2. Гипернатриемия
Гипернатриемия встречается значительно реже, чем гипонатри¬
емия. Она может быть следствием избытка натрия в организме, но
чаще возникает в результате потерь жидкости.
Гипернатриемия может развиться, даже если содержание натрия в
организме не выходит за пределы нормы, но при этом потери воды с
мочой, потом, калом и Выдыхаемым воздухом превышают ее поступ¬
ление в организм. Потеря натрия с любой жидкостью тела, за исклю¬
чением кишечного и панкреатического сока (содержание натрия в
)гих жидкостях велико, поэтому при их потере развивается гипона-
1'риемия), приводит к гипернатриемии (общее содержание натрия в
организме снижается). Такую гипернатриемию (концентрация натрия
» сыворотке выше 150 ммоль/л) могут вызвать;
• повышенные потери воды через дыхательные пути во время
отдышки, при лихорадке, трахеостоме, проведении искусствен¬
ной вентиляции легких в условиях недостаточного увлажнения
дыхательной смеси, использовании неувлажнейного кислорода;
• обильное потоотделение без соответствующей водной компен¬
сации;
• открытое лечение ожогов;
• несахарный диабет — нечувствительность рецепторов почек к
АДГ, что приводит к потере большого количества воды с мочой.
При всех этих состояниях принято считать, что повышение кон¬
центрации натрия на каждые 3 ммоль/л натрия в сыворотке крови
сверх 145 ммоль/л означает дефицит 1 л внеклеточной воды в организ¬
ме больного. Гипернатриемия, обусловленная потерей воды, является
серьезным осложнением, которое может привести к шоку.
у большинства пациентов с прогрессирующим хроническим забо¬
леванием почек имеется дефект, заключающийся в прогрессирующей
неспособности почек концентрировать мочу. Хроническая почечная
недостаточность, возникшая по любой причине, может привести к
резистентности (устойчивости) к действию АДГ, что проявляется
выделением мочи с низким содержанием натрия и развитием гилер-
натриемии.
Гипернатриемия может возникнуть в результате избыточного вве¬
дения натрийсодержащих растворов пациентам с недостатком натрия.
Солевая перегрузка организма нередко развивается при кормлении
больных через зонд концентрированными смесями без соответству¬
ющего введения воды при длительном бессознательном состоянии, у
376 Глава 5. Биохимические исследования
пациентов после операций на головном мозге, в связи с обструкцией
пищевода, при питании через гастростому.
Гиперальдостеронизм (избыточная секреция альдостерона аденомой
или опухолью надпочечников) также сопровождается развитием гипер-
натриемии. Почки в ответ на повышенное содержание натрия в крови
выводят меньше воды, что способствует нормализации уровня натрия
в плазме. Однако полной нормализации не наблюдается. Поэтому при
гиперальдостеронизме (синдром Кона), как правило, обнаруживается
незначительное повышение концентрации натрия в сыворотке крови.
Клинические проявления, связанные с гипернатриемией как тако¬
вой, — это жажда, дрожь, раздражительность, атаксия, мышечные
подергивания, спутанность сознания, эпилептические припадки и
кома. Симптомы ярко выражены при резком повышении концентра¬
ции натрия в сыворотке крови.
5.7.2. ГОМЕОСТАЗ КАЛИЯ
Калий играет важную роль в физиологических процессах сокра¬
щения мышц, функциональной деятельности сердца, проведении
нервных импульсов, ферментных процессах и обмене веществ.
в организме здорового человека с массой тела около 70 кг содержит¬
ся 3150 ммоль (45 .ммоль/кг у мужчин и около 35 ммоль/кг у женщин)
или 122,85 г калия. Всего 50-60 ммоль (1,95—2,34 г) калия находится
во внеклеточном пространстве, остальное количество распределено
в клеточном пространстве (внутри клеток). Суточное потребление
калия составляет 60—100 ммоль (2,34-3,9 г). Почти такое же количест¬
во выделяется с мочой и лишь немного (около 2%) выводится с калом.
В норме почка выделяет калий со скоростью до 6 ммоль/(кг/сут). Как
и натрий, калий фильтруется через почечные клубочки, в основном
реабсорбируется в начальной части почечных канальцев. Тонкая
регуляция выведения калия с мочой осуществляется в дистальных
канальцах и собирательных трубках почек. Здесь калий может секре¬
тироваться в обмен на ионы натрия или реабсорбироваться. Натриево¬
калиевый обмен усиливается под действием ренин-ангиотензин-аль-
достероновой системы. Альдостерон активирует реабсорбцию натрия
и выведение калия.
Около 60 ммоль (2,34 г) калия в нормальных условиях секретиру¬
ется в желудочно-кишечный тракт, однако с калом теряется только
5.7. Исследование электролитного баланса 377
10 ммоль (0,39 г). Остальное количество калия подвергается реабсорб¬
ции. Если реабсорбция нарушается, может развиться дефицит калия.
Высокая концентрация калия внутри клеток и низкая в межклеточ¬
ной жидкости и плазме крови поддерживается при помощи натриево¬
калиевого насоса. Усиление или ингибирование (угнетение) этого насоса
сказывается на уровн? калия в плазме крови, гак как изменяется соотно¬
шение его концентрации внутри клеток и во внеклеточной жидкости.
Концентрация калия в сыворотке — показатель его общего
содержания в организме, однако на его распределение между клет¬
ками и внеклеточной жидкостью могут влиять различные факторы
(нарушение кислотно-основного состояния, повышение внекле-
гочной осмолярности, дефицит инсулина). Так, при сдвиге pH
крови на 0,1 следует ожидать изменения содержания калия на
0,1-0,7 ммоль/л в противоположном направлении (т.е. при снижении
pH на 0,1 концентрация калия в сыворотке крови увеличивается на
0,1—0,7 ммоль/л и наоборот). Поэтому увеличение или снижение
уровня калия в плазме крови еще не означает, что имеется дефицит
калия в организме в цело.м. Это может свидетельствовать, например,
о нарушении нормальной пропорции между внутри- и внеклеточ¬
ным содержанием калия.
Поддержание нормального уровня калия в плазме крови зависит от;
• адекватного поступления в организм калия с пишей;
• нормальной функции почек;
• нормального функционирования желудочно-кишечного тракта;
• поддержания кислотно-основного состояния на нормальном
уровне;
• нормальной работы натриево-калиевого насоса.
Референтные величины содержания калия в сыворотке —
.1,5-5,0 ммоль/л (мэкв/л). В оценке состояния электролитного баланса
имеют значение лишь очень низкие и очень высокие показатели калия,
выходящие за рамки нормы. В клинических условиях к гипокалиемии
относят концентрацию калия ниже 3,5 ммоль/л, а к гиперкалиемии —
выше 5,0 ммоль/л. Надежность этих показателей как критериев кали¬
ем и и значительно повышается, если выявляется их многократная
повторяемость.
5.7.2.1. Гипокалиемия
При нормальном pH крови нормальная концентрация калия в
сыворотке крови может скрывать фактически существующий общий
378 Глава 5, Биохимические исследования
дефицит его в организме вплоть до 200 ммоль (7,8 г). Снижение
концентрации калия в сыворотке на каждый 1 ммоль/л соответс¬
твует, как правило, общему дефициту примерно 350 ммоль (13,65 г).
Концентрация калия в сыворотке ниже 2 ммоль/л указывает на общий
его дефицит в организме, превышающий 1000 ммоль (39 г).
Недостаточное поступление калия с пищей редко приводит к гипо¬
калиемии. Наиболее часто гипокалиемия развивается в результате
увеличения потерь калия из организма. В клинической практике к
гипокалиемии приводят:
• потеря желудочно-кишечных жидкостей;
• длительное лечение осмотическими диуретиками или салурети-
ками (маннитол, мочевина, фуросемид), а также диабетическая
глюкозурия;
• стрессовые состояния, сопровождаюшиеся повышенной адрена¬
ловой активностью, болезнь Иценко—Кушинга;
• уменьшение потребления калия в послеоперационном и пост-
травматическом периодах в сочетании с задержкой натрия в
организме (ятрогенная, т.е. вызванная медицинскими мероприя¬
тиями, гипокалиемия);
• продолжительный ацидоз или алкалоз, в результате которых
нарушается функция почек и возникает калийурия;
• предшествующий дефицит калия, вызванный тяжелым хроничес¬
ким заболеванием и усиленный послеоперационным периодом;
• длительное применение стероидных лекарственных средств;
• дилюционная гипокалиемия в фазе регидратации после острой
или хронической дегидратации;
• хроническая почечная недостаточность;
• синдром Бартера;
• гиперальдостеронизм.
В основе всех приведенных причин гипокалиемии лежат 4 основных
механиз.ма: уменьшенное поступление калия в организм, усиленный
переход калия из внеклеточной жидкости внутрь клетки, уменьшен¬
ный выход калия из клетки и увеличенная потеря калия. Основным
механизмом гипокалиемии является повышенная потеря калия.
Существует два главных пути потери калия — через желудочно-
кишечный тракт и почки. Кишечные и желчные свищи, а также
обширные ожоги — два второстепенных канала потерь калия.
Наиболее массивные потери калия происходят при многократной
рвоте (вот почему часто у больных с почечной недостаточностью нет
5.7. Исследование электролитного баланса 379
гипсркалиемии), кишечной непроходимости, а также при всех заболе¬
ваниях, сопровождаюшихся диареей.
Основными причинами усиленного перехода калия из внеклеточ¬
ного пространства внутрь клетки является лечение инсулином или
наличие инсулиномы, тиреотоксикоза, алкалоза.
Гипокалиемия, связанная с алкалозом, обусловлена, во-первых, тем,
ч го калий переходит из внеклеточной жидкости (плазмы) во внутрикле¬
точную в обмен на ионы водорода для снижения pH крови; во-вторых,
происходит усиленная экскреция калия с мочой, при этом кадий теряет¬
ся, а ионы водорода реабсорбируются для борьбы с алкалозом.
Сниженное поступление калия в организм встречается у пациентов
с несбалансированным питанием (алкоголики, пациенты с анорекси¬
ей нервного происхождения), а также при длительном внутривенном
введении безкалиевых растворов.
При недостаточности калия наблюдается тошнота, рвота, мышеч¬
ная слабость (в том числе дыхательной мускулатуры — поверхностное
дыхание), атония кишечника и мочевого пузыря, сердечная слабость.
При концентрации калия в сыворотке крови ниже 3 ммолъ/л на ЭКГ
отмечаются изменения, свидетельствующие об ослаблении возбуди¬
мости и нарушении проводимости в сердечной мышце, в ряде случаев
зависимости между уровнем калия в крови и возникновением таких
серьезных последствий, как нарушение ритма сердца, не обнаружи¬
вается.
5.7.2.2. Гиперкалиемия
К гиперкалиемии могут привести:
• почечная недостаточность вследствие понижения экскреции
калия почками;
• острая дегидратация (обезвоживание);
• обширные травмы, ожоги или крупные операции на фоне пред¬
шествующих тяжелых заболеваний;
• тяжелый метаболический ацидоз и шок;
• хроническая надпочечниковая недостаточность (гипоальдосте-
ронизм);
• быстрая инфузия концентрированного раствора калия, содер¬
жащего более 50 ммоль/л калия (приблизительно 0,4% раствор
хлорида калия);
• олигурия или анурия любого происхождения;
• диабетическая кома до начала инсулинотерапии;
380 Глава 5. Биохимические исследования
• прием калийсберегающих диуретиков, например, триамтерена
(птерофена), спиронолактона (верошпирона).
В основе приведенных причин гиперкалиемии лежат три основных
механизма: усиленное поступление калия в организм, переход калия
из внутриклеточного во внеклеточное пространство и сниженная его
потеря.
Усиленное поступление калия в организм обычно только способс¬
твует развитию гиперкалиемии. Наиболее часто это носит ятроген-
ный характер и встречается у пациентов, получающих внутривенные
вливания растворов с высоким содержанием калия и/или у пациентов
с нарушениями функции почек. К этой группе причин относятся
применение диеты с высоким содержанием калия, бесконтрольное
применение калиевой соли пенициллина в больших дозах, перелива¬
ние длительно хранившейся крови.
Патогенетический механизм, связанный с усиленным переходом
калия из внутриклеточного во внеклеточное пространство, имеет
место при ацидозе, синдроме длительного сдавления, тканевой гипок¬
сии, недостатке инсулина и передозировке препаратов дигиталиса.
Потери калия уменьшаются при почечной недостаточности, гипо-
альдостеронизме, приеме диуретиков, блокирующих секрецию калия
дистальными канальцами, и первичных дефектах тубулярной секреции
калия почками. Гепарин, используемый даже в низких дозах для лечения
и профилактики нарушений свертываемости крови, частично блокируеі
синтез альдостерона и может вызвать гиперкалием и ю (вероятно, вследс¬
твие нарушения чувствительности канальцев к альдостерону).
Особенно высокое содержание калия в сыворотке крови наблюдается
при острой почечной недостаточности, в частности, при некронефрозах,
вызванных отравлениями и синдромом длительного сдавления, что
обусловливается резким снижением (до практически полного прекраще¬
ния) ренальной экскреции калия, ацидозом, усиленным катаболизмом
белка, гемолизом, при синдроме длительного сдавления повреждени¬
ями мышечной ткани. При этом содержание калия может достигать
7,0—9,7 ммоль/л. Важное значение в клинической практике имеет дина¬
мика повышения калия в крови больных с острой сердечной недостаточ¬
ностью. В неосложненных случаях острой сердечной недостаточностью
концентрация калия в плазме крови возрастает на 0,3—0,5 ммоль/л/сут,
после травмы или сложной операции — на 1—2 ммоль/л/сут, однако
может наблюдаться и очень быстрое ее повышение на 1-2 ммоль/л.
Поэтому контроль за динамикой калиемии у больных с острой сердеч¬
5.7. Исследование электролитного баланса 381
ной недостаточностью имеет большое значение и должен проводиться не
реже 1 раза в сут, а в осложненных случаях чаше.
Псевдогиперкалиемия (ложноповышенный уровень калия в сыво-
рогке крови) может быть обусловлена гемолизом при взятии крови
на анализ (наиболее часто вследствие наложения жгута более 1 мин),
1хли кровь берут в стеклянную пробирку, что также способствует
гемолизу, то такие изменения могут быть обнаружены в 20% взятых
образцов крови. При лейкоцитозе (более 50,0'107л) и тромбоцитозе
(1000‘107л) также может наблюдаться псевдогиперкалиемия вследс-
I ние высвобождения калия во время свертывания крови в пробирке.
Гиперкалиемия клинически проявляется парестезиями, сердеч-
ны.ми аритмиями. Угрожающими симптомами калиевой инток¬
сикации являются коллапс, брадикардия, помрачение сознания.
Из.менения на ЭКГ отличаются при концентрации калия выше
7 ммоль/л, а при увеличении концентрации его до 10 ммоль/л насту¬
пает внутри желудочковая блокада с мерцанием желудочков, при кон¬
центрации 13 ммоль/л сердце останавливается в диастоле. По мере
возрастания уровня калия в сыворотке постепенно меняется харак¬
тер ЭКГ. Сначала появляются высокие заостренные зубцы Т. Затем
[)азвиваются депрессия сегмента 8Т, атриовентрикулярная блокада I
степени и расширение комплекса 0Я8. Наконец, дальнейшее расши¬
рение комплекса 0К8 и слияние его с зубцом Т образуют двухфазную
кривую, указывающую на приближающуюся асистолию желудочков.
С корость таких изменений непредсказуема, и от начальных измене¬
ний ЭКГ до опасных нарушений проводимости или арит.мий иногда
проходят считанные минуты.
5.7.3. ГОМЕОСТАЗ КАЛЬЦИЯ
Кальций является самым распространенным элементом в
зеле человека. Организм взрослого человека содержит около 1 кг
(25 ООО ммоль) кальция. Физиологическое значение кальция состоит
в регуляции проницаемости клеточных ме.мбран, участии в пост¬
роении скелета и системе гемостаза, а также в функционировании
нервно-мышечной деятельности. Он обладает способностью накап¬
ливаться в местах, где имеется повреждение тканей различными пато¬
логическими процессами. Примерно 99% кальция находится в костях,
остальное количество — главным образом во внеклеточной жидкости.
382
Глава 5. Биохимические исследования
Внеклеточная жидкость содержит только 22,5 ммоль (0,9 г) кальция,
из которых примерно 9 ммоль (0,36 г) находятся в плазме крови.
Кальций, фиксированный в костной ткани, находится во взаимо¬
действии с ионами плазмы крови. Действуя, как буферная система,
депонированный в кости кальций предотвращает большие колебания
его содержания в плазме.
Кальций поступает в организм человека с пищей. Всасывание его
происходит в тонкой кишке. Всосавшийся кальций поступает в кро¬
воток. В плазме крови кальций представлен тремя формами;
• связанный с белками (в основном с альбумином — около 40%);
• в комплексе с фосфатом и цитратом (около 9%);
• в виде ионизированной (свободной) формы (около 50% кальция
плазмы).
Баланс кальция в организме обеспечивается системой «парати-
реоидный гормон (ПТГ) — кальцитонин -- витамин О». Основная
функция всех этих гормонов — регуляция движения ионов кальция
(Са2+) в организме и поддержание постоянства концентрации Са2+ в
крови (рис. 5-17).
Паращитовидная
железа
Кишка
Рис. 5-17. Регуляция уровня кальция в крови
5.7. Исследование электролитного баланса 383
ПТГ представляет собой поли пептидное вещество, секретируемое
маращитовидными железами. Он повышает концентрацию кальция в
плазме крови, усиливая его вымывание из костей, реабсорбнию в поч¬
ках и стимулируя превращение в них витамина О в активный мета¬
болит калъцитриол. Уровень кальция в крови регулирует секрецию
ИТГ по механизму отрицательной образной связи: гипокальписмия
стимулирует, а гиперк^льциемия подавляет высвобождение ПТГ.
Кальцитонин — физиологический антагонист ПТГ, который синте-
шруется в щитовидной железе. Он стимулирует выведение кальция
почками.
Витамин Оя (холекальциферол) образуется в коже под влиянием
солнечного света ил и поступает в организм с пишей. Синтезированный
и поступивший витамин О, транспортируется кровью в печень, где
и митохондриях превращается в 25-гидроксивитамин [25(ОН)Оз].
Этот промежуточный продукт превращается или в 25(0Н)20з, или в
24,25(0Н)20з. Кальцитриол 1,25(ОН)2Вз, образуется в митохондриях
клеток почек под действием 1-гидроксилазы и является наиболее
активной формой витамина Вз. По своему действию 1,25(ОН)20з явля¬
ется гормоном и прямым антирахитическим фактором. Метаболиты
витамина О стимулируют всасывание кальция в кишечнике.
При метаболическом равновесии суточное выведение кальция
с мочой соответствует количеству всосавшегося в кишечнике
кальция. Выведение кальция с мочой зависит от количества про¬
фильтровавшегося кальция в клубочках и канальцевой реабсорб-
ции. В клубочках почек фильтруются ионизированный кальций
и кальций в комплексе с низкомолекулярными анионами (около
60% сывороточного). Почки реабсорбируют 87—98% профиль¬
трованного кальция. Реабсорбция кальция происходит пассивно
но всех канальцах нефрона. Проксимальные извитые канальцы
реабсорбируют 60%, петля Генле — 30%, дистальная часть каналь¬
цев — около 10%. Реабсорбция кальция в дистальных канальцах
почек стимулируется ПТГ. Выделение кальция почками в норме
колеблется от 2,5 до 7,5 ммоль (0,1-0,3 г) в сутки. Поскольку из
организма кальций выводится также с калом, то минимальные
потребности его поступления с пищей составляют примерно 12,5
ммоль, увеличиваясь в периоды роста, беременности и .лактации.
Кальций, входяший в состав секретов желудочно-кишечного трак¬
та (желудочный сок, сок поджелудочной железы, желчь), частично
реабсорбируется вместе с пищевым кальцием.
384 Глава 5. Биохимические исследования
Внеклеточный кальций, включая кальций плазмы крови, в тече¬
ние суток обновляется приблизительно 33 раза, проходя через почки,
кишечник и кости. Поэтому даже небольшое изменение в любом из
этих потоков оказывает существенное влияние на концентрацию
кальция в плазме крови.
В лаборатории чаще всего определяют содержание общего
кальция в сыворотке крови. Однако при наличии специаль¬
ного прибора — ионоселективного анализатора — лаборатория
может определять и концентрацию ионизированного кальция.
Референтные величины содержания общего кальция в сыворотке
крови составляют 2,15—2,50 ммоль/л, или 8,6—10,0 мг%, ионизи¬
рованного кальция — 1,15—1,27 ммоль/л. Изменение содержания
альбумина в сыворотке, особенно гипоальбуминемия, сказыва¬
ется на общей концентрации кальция, не влияя на клинически
более важный показатель — уровень ионизированного кальция.
Нарушения метаболизма кальция проявляются гиперкальциемией
или гипокальциемией.
Наиболее часто содержание кальция в сыворотке крови изменя¬
ется при дисфункции паращитовидных желез, новообразованиях
различной локализации, особенно при метастазировании в кости,
нарушении функции почек (почечной недостаточности). Нередко
гипо- и гиперкальциемия могут быть первичным проявлением
патологического процесса.
5.7.З.1. Гипокальциемия
Гипокальциемия развивается при недостаточном поступлении
кальция с пищей, нарушении его всасывания в желудочно-кишечном
тракте, повышенном выведении калышя с мочой, а также недоста¬
точности гормональных факторов (ПТГ, витамина П), участвующих в
регуляции баланса кальция в организме.
Недостаточное поступление кальция с пишей наиболее часто
встречается у пожилых людей и приводит к развитию остеопороза.
Остеопороз — метаболическое заболевание скелета, характери¬
зующееся одновременной потерей органического матрикса кости
и минеральных веществ. Основной дефект при остеопорозе —
уменьшение массы кости в единице объема и нарушение микро¬
архитектоники костной ткани (истончение губчатого вещества и
компактного вещества кости), в результате чего кость становится
хрупкой.
5.7. Исследование электролитного баланса 385
У детей основная причина недостатка кальция в организ¬
ме — нарушение его всасывания в желудочно-кишечном тракте
пследствие недостатка витамина О. В результате у детей развивает¬
ся рахит. Рахит — заболевание, при котором происходит недоста-
гочная минерализация в костях и хряще эпифизарных пластинок.
1>олезнь проявляется замедлением роста и рядом деформаций
скелета. Недостаток витамина О и гипокальциемия у взрослых
проявляются остеомаляцией. Остеомаляция — нарушение мине¬
рализации зрелой костной ткани. Легкая и умеренная остеомаля¬
ция часто протекает бессимптомно, при тяжелой остеомаляции
нагрузки вызывают деформации и псевдопереломы костей.
Наиболее распространенная причина снижения уровня общего
кальция в сыворотке крови — гипоальбуминем ия. К развитию гипо-
ил ьбумипеми и приводят хронические заболевания печени, острый
панкреатит, онкологические процессы. Если содержание ионизи¬
рованного кальция при этом находится в пределах нормы, то об.мен
кальция в организме не нарушен. Другие причины снижения кон¬
центрации кальция в сыворотке крови обусловлены заболеваниями
почек, в результате которых нарушается реабсорбция кальция и он
1ПЛВ0ДИТСЯ с мочой.
Гипопаратиреоз — недостаточность функции паращитовидных
желез, характеризующаяся сниженной продукцией ПТГ. Недостаток
ПТГ приводит к гипокальциемии, обусловленной снижением всасы¬
вания кальция в кишечнике, уменьшением его мобилизации из кос-
1СЙ и недостаточной реабсорбцией в почечных канальцах. Наиболее
часто гипопаратиреоз вызван хирургическим повреждением либо
непосредственно паращитовидных желез, либо их кровоснабжения
при частичном или полном удалении щитовидной железы.
Псевдогипопаратиреоз объединяет группу редких наследственных
синдромов, характеризующихся резистентностью кости к действию
ПТГ. При всех этих синдромах на фоне повышенного уровня ПТГ в
крови наблюдается гипокальциемия, так как кальций плохо высво¬
бождается из костной ткани.
Клинические проявления гипокальциемии варьируют в зависи¬
мости от степени и темпа снижения уровня кальция. Наблюдаемая
при гипопаратиреозе повышенная возбудимость нервов и мышц
приводит к парастсзимм и тетании, включая тонические судороги
мышц кистей и стоп. Положительные симптомы Труссо и Хвостека
указывают на латентную тетанию. Тяжелая гипокальциемия вызыва¬
386 Глава 5. Биохимические исследования
ет сонливость, спутанность сознания, редко спазм гортани, судороги
и обратимую сердечную недостаточность. На ЭКГ удлинен интервал
ОТ. Хроническая гипокальциемия может стать причиной катаракты и
кальцификации базальных ганглиев.
5.7.3.2. Гиперкальциемия
Гиперкальциемия — это почти всегда результат повышенного
поступления кальция в кровь из резорбцируемой костной ткани или
из пищи в условиях снижения его выведения почками с мочой. Более
90% случаев гиперкальциемии обусловлены первичным гиперпарати-
реозом и злокачественными новообразованиями.
Первичный гиперпаратиреоз — заболевание, которое проявляется
повышенной функцией паращитовидных желез. Это основная причи¬
на гиперкальциемии у амбулаторных больных. Первичный гиперпа¬
ратиреоз характеризуется повышением секреции ПТГ (в 2—20 раз) и,
как следствие, гиперкальциемией. Это нередкая патология, особенно
у пожилых женщин. Около 85% случаев гиперкальциемии обуслов¬
лены аденомой одной паращитовидной железы, 15% — гиперплазией
всех 4 желез и 1% — карциномой паращитовидной железы. Обычно
гиперкальциемия протекает бессимптомно и обнаруживается слу¬
чайно при диспансерном обследовании.
Злокачественные новообразования — причина большинства слу¬
чаев гиперкальциемии у госпитализированных больных и у лиц
пожилого возраста. При этом действуют два главных механизма ее
возникновения,
• Если первичная опухоль или ее метастазы находятся в кости, то
продукты жизнедеятельности опухолевых клеток стимулируют
локальную резорбцию (рассасывание) кости, что способствует
усиленному поступлению кальция в кровоток; данный механизм
гиперкальциемии имеет место только при обширном поражении
костей опухолью, чаше всего при метастазах рака молочной желе¬
зы, миеломной болезни и лимфоме.
• Если опухоль или метастазы локализованы вне костной ткани,
то опухолевые метаболиты могут оказывать общее гумораль¬
ное действие, стимулируя резорбцию кости и снижая обычно
экскрецию кальция; наиболее часто этот механизм гипер¬
кальциемии наблюдается при плоскоклеточном раке легких,
опухолях головы и шеи, пищевода, карциноме почек, мочевого
пузыря и яичников.
5.8. Исследование обмена железа и витаминов 387
Другие причины гиперкальциемии встречаются редко. Сар-
коидоз, туберкулез, гистоплазмоз могут сопровождается гипер¬
кальцием ией. Гиперкальциемия может быть следствием неадек-
натного лечения рахита витамином О (интоксикация витамином О)
у детей.
Длительная иммобилизация при болезни Педжета или сложных
11среломах сопровождается умеренным остеопорозом и увеличени¬
ем содержания кальция в крови. Стероидиндуцированную гипер-
кальпиемию можно наблюдать при приеме андрогенов, эстрогенов
и глюкокортикоидов. Длительное пребывание пациента в постели
еамо по себе сопровождается гиперкальциемией.
Клинические проявления гиперкальциемии наблюдаются при
уровне кальция в крови выше 3 ммоль/л, причем они более выражены
при быстром развитии гиперкальциемии. К почечным проявлениям
относятся полиурия и мочекаменная болезнь. Желудочно-кишеч¬
ные нарушения включают анорексию, тошноту, рвоту и запор. Из
неврологических симптомов характерны слабость, утомляемость,
спутанность сознания, ступор и кома. На ЭКГ отмечается укоро¬
чение интервала ОТ. Если уровень кальция в сыворотке превышает
1,75 ммолъ/л, возможны почечная недостаточность и отложения
кал ьпия в мягких тканях. Содержание кальция в сыворотке крови до
1 ммоль/л соответствует легкой, а выше 3,38 ммоль/л — тяжелой
гиперкальциемии.
5.8. ИССЛЕДОВАНИЕ ОБМЕНА ЖЕЛЕЗА И ВИТАМИНОВ
Лабораторные исследования обмена железа и витаминов играют
важнейшую роль в установлении причины широко распространен¬
ного состояния — анемии. Гематологические показатели, использу¬
емые для диагностики анемии, включают определение содержания
гемоглобина, подсчет количества эритроцитов в крови и особенно
среднего объема эритроцита и средней концентрации гемоглобина в
эритроците. Роль этих показателей обсуждалась в гл. 2. Напомним,
что анемия — не заболевание, а патологический симптом, который
имеет много причин. Проведение общего анализа крови позволяет
диагностировать анемию и в некоторой степени предположить его
причину. Распознавание причины развития анемии в каждом конк¬
388 Глава 5. Биохимические исследования
ретном случае является конечным этапом диагностического поиска.
От того, насколько правильно будет установлена причина анемии,
зависит успех лечения. Основное значение 6 показателей — концент¬
рации железа, общей железосвязывающей способности (ОЖСС) сыво¬
ротки крови, содержания трансферрина, ферритина, витамина В,, и
фолиевой кислоты, рассматриваемых в данном разделе, состоит в том,
что они позволяют подтвердить предполагаемую причину анемии.
Дефицит железа — наиболее распространенная причина ане¬
мии, от которой страдают в нашей стране более 30% населения.
Железодефицитная анемия — клинико-гематологический синдром,
характеризующийся нарушением синтеза гемоглобина в результате
дефицита железа, развивающегося на фоне различных патологичес¬
ких (физиологических) процессов и проявляющегося признаками
анемии. Определение концентрации железа в сыворотке крови, ОЖСС
сыворотки крови, трансферрина и ферритина позволяют установить
диагноз железодефипитной анемии.
Дефицит в организме витамина В,2 и фолиевой кислоты часто
встречается у пожилых людей и лежит в основе мегалобластной ане¬
мии. Исследование уровня этих витаминов в сыворотке крови позво¬
ляет диагностировать это заболевание.
5.8.1. ОБМЕН ЖЕЛЕЗА
Железо входит в состав гемоглобина (включено в состав молекулы
гема), где выполняет важнейшую функцию связывания и доставки кис¬
лорода клеткам организма человека. Поэтому железо необходимо для
синтеза и функционирования гемоглобина. Общее содержание железа
в организме «стандартного» человека составляет около 4,2 г. Примерно
75—80% его общего количества входит в состав гемоглобина, 20—25%
является резервным, 5—10% входят в состав миоглобина, около 1% содер¬
жится в дыхательных ферментах, катализирующих процессы дыхания в
клетках и тканях. Резервное железо запасается главным образом в печени,
селезенке и костном мозге, где хранится в белках ферритине и гемосиде-
рине. Часть ферритина присутствует в плазме, а его концентрация служит
надежным индикатором состояния запасов железа в организме. Общее
содержание железа в организме человека, входящее в состав гемоглобина,
составляет 3000 мг, в составе миоглобина содержится около 125 мг, печень
содержит около 700 мг, представленного преимущественно ферритином.
5.8. Исследование обмена железа и витаминов 389
()т 3 до 4 мг (0,1% обшего количества железа) циркулирует в плазме крови
в связи с транспортным белком трансферрином.
Железо осуществляет свою биологическую функцию главным
образом в составе других биологически активных соединений (гемог¬
лобин, миоглобин, железосодержащие ферменты), которые выполня¬
ют 4 основные функции;
• транспорт электронов (цитохромы, железосеропротеиды);
• транспорт и депонирование кислорода (гемоглобин, миоглобин);
• участие в формировании активных центров окислительно-вос¬
становительных ферментов (оксидазът, гидроксилазы и др.);
• транспорт и депонирование железа (трансферрин, гемосидерин,
ферритин).
Гомеостаз железа в организме обеспечивается в первую очередь
регуляцией его всасывания в желудочно-кишечном тракте в связи с
ограниченной способностью организма к выделению этого элемента.
Существует выраженная обратная зависимость между обеспечен¬
ностью организма человека железом и его всасыванием в пищевари¬
тельном тракте. Всасывание железа зависит от:
• возраста и обеспеченности организма железом;
■ состояния желудочно-кишечного тракта;
« количества и химических форм поступающего железа с пищей;
• количества и форм прочих компонентов пищи.
Для оптимального всасывания железа необходима нормальная
секреция желудочного сока. Прием соляной кислоты способствует
усвоению железа. Аскорбиновая кислота, восстанавливающая желе¬
зо и образующая с ним хелатные комплексы, повышает доступность
>'юго элемента, так же как и прочие органические кислоты. Другим
компонентом пищи, улучшающим всасывание железа, является фак¬
тор животного белка. Улучшают всасывание железа простые угле¬
воды; лактоза, фруктоза, сорбит, а также такие аминокислоты, как
гистидин, лизин, цистеин, образующие с железом легковсасываемые
хелаты. Всасывание железа снижают такие напитки, как кофе и чай,
полифенольные соединения которых прочно связывают этот элемент.
Поэтому чай применяется для профилактики повышенного усвоения
железа у больных талассемией. Большое влияние на усвоение железа
оказывают различные заболевания. Оно усиливается при недостаточ¬
ности железа, при анемиях (гемолитической, апластической, мега¬
лобластной), гиповитаминозе В^ и гемохроматозе, что объясняется
усилением эритропоэза, истощением запасов железа и гипоксией.
390 Глава 5. Биохимические исследования
Современные представления о всасывании железа в кишечнике
отводят центральную роль двум видам трансферрина — мукозному
и плазменному. Мукозный трансферрин секретируется клетками
слизистой оболочки кишечника — энтероцитами в просвет кишеч¬
ника, где он загружается железом, после чего проникает в энтеро-
цит. В этой клетке трансферрин освобождается от железа, после
чего вступает в новый цикл. Источником мукозного трансферрина
является не сам энтероцит, а печень, из которой этот белок посту¬
пает в кишечник с желчью. Из энтероцита мукозный трансферрин
отдает железо своему плазменному аналогу. Наиболее интенсивное
всасывание железа происходит в проксимальных (начальных) отде¬
лах тонкой кишки (в двенадцатиперстной и тощей) и отсутствует в
подвздошной кишке. Плазменный трансферрин доставляет железо
к тканям, имеющим специфические рецепторы. Количество железа,
поступающего в клетку, прямо пропорционально числу мембранных
рецепторов. Наибольшее количество рецепторов содержат клетки
костного мозга, клетки ретикулоэндотелиальной системы печени и
селезенки, в клетках этих органов происходит высвобождение желе¬
за из трансферрина. Затем плазменный трансферрин возвращается в
циркуляцию. Повышение потребности клеток в железе при их быс¬
тром росте или синтезе гемоглобина ведет к индукции (усилению)
биосинтеза рецепторов трансферрина, и, напротив, при повышении
запасов железа в клетке число рецепторов на ее поверхности сни¬
жается. У взрослого человека в костном мозге железо трансферрина
с помощью специфических рецепторов включается в нормоци-
ты и ретикулоциты, использующие его для синтеза гемоглобина,
в прочие ткани трансферрин доставляет в 4 раза меньшее количест¬
во железа, чем в костный мозг.
В организчте человека хорошо сохраняется железо. После того, как
эритроциты, прожив 120 сут, погибают, железо возвращается в резерв
костного мозга для образования новых эритроцитов. За счет распа¬
да гемоглобина в сутки высвобождается около 21-24 мг железа, что
во много раз превышает поступление железа из пищеварительного
тракта (1—1,5 мг/сут). Более 95% железа поступает в плазму из кле¬
ток ретикулоэндотелиальной системы печени и селезенки, которые
поглощают путем фагоцитоза более 10старых эритроцитов в сутки.
Железо, поступившее в клетки ретикулоэндотелиальной системы,
либо быстро возвращается в циркуляцию в виде ферритина, либо
откладывается про запас. Гемоглобин, поступающий в плазму крови
б.Н. Исследование обмена железа и витаминов 391
11(>и распаде эритроцитов, специфически связывается с гаптоглоби-
(ІОМ, что предупреждает его фильтрацию через почки.
Железо выделяется из организма в основном путем слущивания
1',.1Изистой оболочки кишечника и с желчью. Оно теряется также с
ы)Лосами, ногтями, мочой и потом. Общее количество выделяемого
|;»ким образом железа срставляет у здорового мужчины 0,6—1 мг, а у
ж ей шин репродуктивного возраста — более 1,5 мг в сутки.
Нормальная сбалансированная диета обеспечивает поступление
II желудочно-кишечный тракт око.ло 10—15 мг железа ежедневно.
Основными источниками железа служат мясо, рыба, овощи и крупы.
Железо из животной пищи усваивается в несколько раз лучше, чем из
растительной, в норме из пищи всасывается около 10% содержащего¬
ся в ней железа (І—1,5 мг в день), что вполне достаточно для возмеще¬
ния дневных потерь.
Таким образом, концентрация железа в сыворотке зависит от
резорбции в желудочно-кишечном тракте, накопления в кишечнике,
селезенке и костном мозге, синтеза и распада гемоглобина и его поте¬
ри организмом.
Оптимальным для хорошего здоровья пациента является состоя¬
ние, при котором запасы железа в организме достаточны, но не избы¬
точны.
5.8.2. ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ
ОБМЕН ЖЕЛЕЗА
Определение содержания железа в сыворотке крови может пот¬
ребоваться тогда, когда подозревается дефицит или избыток железа
II организме. Железодефицитное состояние (железодефицитная ане¬
мии) — одно из наиболее распрос граненных заболеваний человека.
Избыток железа в организме встречается значительно реже. Для
подтверждения дефицита или избытка железа необходимо проведе¬
ние комплекса биохимических тестов, характеризующих метаболизм
железа. К таким тестам относятся определение концентрации железа
II сыворотке, ОЖСС сыворотки, содержания трансферрина и фер¬
ритина. Каждый из этих тестов имеет свою цель. Выполненные по
отдельности, они не всегда являются надежными показателями мета¬
болизма железа в организме. При комплексном исследовании этих
показателей их ценность существенно возрастает.
392
Глава 5. Биохимические исследования
5.8.2Л. Концентрация железа в сыворотке крови
Концентрация железа в крови у человека значительно варьиру¬
ет. Она имеет суточный ритм, и ее колебания в сыворотке крови
у здорового человека в течение суток могут составлять 100%.
У женщин существует связь концентрации железа в крови с менс¬
труальным циклом. При беременности содержание железа в орга¬
низме уменьшается, особенно в ее второй половине. Референтные
величины содержания железа в сыворотке приведены в табл. 5-15
(Тиц У, 1997).
Таблица 5-15.
Референтные ве.тичины содержания железа в сыворотке крови
Возрастная группа
Содержание железа
мкг/дл
мкмоль/л
Новорожденные
100-250
17,90-44,75
Дети до 2 лет
40-100
7,16-17,90
Дети 2 лет и старше
50-120
8,95-21,48
Взрослые:
мужчины
65-175
11,6-31,3
женщины
50-170
9,0-30,4
Определение концентрации железа в сыворотке крови дает
представление об уровне транспортируемого железа в плазме
крови, связанного с трансферрином. При недостатке железа в орга¬
низме концентрация железа в сыворотке крови снижается. Однако
она не всегда позволяет надежно оценить выраженность дефицита
железа. Большие вариации содержания железа в сыворотке крови,
возможность его увеличения при некротических процессах в тка¬
нях (например, при некрозе печеночных клеткок), его снижение
при воспалительных процессах (инфекция, травма, хронические
воспалительные заболевания) вследствие перемещения из крови в
депо ограничивают диагностическое значение определения содер¬
жания железа. Измеряя только содержание железа в сыворотке
крови, мы не получим информацию о причинах нарушенного
обмена железа. Для этого необходимо определять в крови общую
железосвязываюшую способность сыворотки или содержание
трансферрина и ферритина.
5.8. Исследование обмена железа и витаминов 393
Г>.8.2.2. Общая железосвязывающая способность сыворотки
ОЖСС сыворотки является непрямым показателем концен¬
трации в сыворотке крови белка трансферрина. Однако следует
учитывать, что при оценке содержания трансферрина по резуль-
кггам определения ОЖСС, данный метод исследования завыша-
с1 значения трансфсррица на 16-20%, поскольку при более чем
половинном насыщении трансферрина железо связывается с дру-
1ИМИ белками. Под ОЖСС понимается не абсолютное количество
трансферрина, а количество железа, которое может связаться с
I рансферрином.
В норме ненасыщенная железосвязывающая способность сыво¬
ротки крови составляет в среднем 50,2 ммоль/л (279 мкг/дл).
Пределы колебаний референтных значений ОЖСС представлены
II табл. 5-16.
Таблица 5-16.
Референтные величины ОЖСС сыворотки
Возраст
Референтные величины ОЖСС
мкг/дл
мкмоль/л
Дети до 2 лет
100-400
17,90-71,60
Впоследствии
250-425
44,75-76,1
Хотя ОЖСС увеличивается при дефиците железа, на ее уровень
могут влиять другие факторы. К ним относятся острые заболевания
печени (острые гепатиты), беременность и прием оральных контра¬
цептивов.
Г),8,2.3. Содержание трансферрина в сыворотке крови
Трансферрин относится к |3-глобулинам. Главная функция транс-
(|)сррина — транспорт всосавшегося в кишечнике железа в его депо
(печень, селезенка), ретикулоциты и их предшественники в костном
мозге. Трансферрин способен также связывать ионы других металлов
(цинк, кобальт и др.). Из общего количества трансферрина в организ¬
ме человека только 25—40% содержит железо. Основное место синтеза
трансферрина — печень. В сопоставлении с содержанием железа в
сыворотке крови уровень трансферрина является более стабильной
величиной с менее выраженными различиями по полу и возрасту.
394 Глава 5. Биохимические исследования
Определение концентрации трансферрина в сыворотке является
наиболее достоверным тестом оценки железодефицитных состояний.
Референтные величины содержания трансферрина представлены в
табл. 5-17.
Таблица 5-17.
Референтные величины содержания трансферрина в сыворотке крови
Возрастная группа
Содержание трансферрина
мг/дл
г/л
Новорожденные
130-275
1,30-2,75
Взрослые
200-320
2,00-3,20
Беременные
305
3,05
При дефиците железа в организме и снижении уровня желе¬
за в сыворотке крови содержание трансферрина повышается.
Такое разнонаправленное изменение этих показателей является
одним из наиболее важных признаков железодефицитной анемии.
Подобные же изменения могут наблюдаться при беременности и у
детей в старшем возрасте, однако они менее выражены. Увеличение
содержания трансферрина в этих случаях связано с усилением его
синтеза для обеспечения повышенных потребностей организма в
железе при беременности и росте детского организма.
В то же время необходимо отметить, что трансферрин является
одним из «отрицательных» белков острой фазы и при различных
воспалительных заболеваниях его концентрация снижается, что
может приводить к ошибкам в диагностике дефицита железа.
Основными причинами сниженного содержания трансферрина в
сыворотке крови являются торможение синтетических процессов
в гепатоцитах при хроническом гепатите, циррозе печени, хро¬
нической нефропатии, голодании, неопластических процессах, а
также значительная потеря белка при нефротическом синдроме
или заболеваниях тонкой кишки.
Снижение содержания трансферрина и повышение концент¬
рации железа в сыворотке обнаруживают при состояниях, харак¬
теризующихся накоплением железа в организме (идиопатический
гемохроматоз), или при гипопластических, гемолитических и
мегалобластических анемиях, что является следствием угнетения
синтеза белка под влиянием высоких концентраций железа.
5.8. Исследование обмена железа и витаминов
395
Г).8.2.4. Содержание ферритина в сыворотке крови
Ферритин является основным белком человека, депонирующим
железо. Он находится в клетках печени, селезенки, костного мозга и
рет икулоцитах. В малых дозах ферритин присутствует в сыворотке
крови, где он выполняет функцию транспорта железа. Хотя в крови
ферритин присутствует в небольших количествах, его концентрация
в сыворотке отражает запасы железа в организме. Референтные вели¬
чины содержания ферритина в сыворотке представлены в табл. 5-18.
Низкое содержание ферритина — это первый показатель уменьшения
ишасов железа в организ.ме. Определение содержания ферритина в
сы воротке крови используется для диагностики и мониторинга дефи¬
цита или избытка железа, дифференциальной диагностики анемий.
Таблица 5-18.
Референтные величины содержания ферритина в сыворотке крови
Возрастная группа
Содержание ферритина, нг/мл (мкг/л)
11о1юрожденные
25-200
1 мес
200-600
2 -5 мес
50-200
(» мес — 15 лет
7-140
взрослые:
мужчины
20-250
женщины
10-120
При желе30дефицитной анемии концентрация ферритина в сыво¬
ротке снижается, указывая на истощение запасов железа в организме.
Однако ферритин относится к белкам острой фазы, и его нормаль¬
ная или повышенная концентрация не обязательно отражает запасы
депонированного железа при воспалительных процессах или злока¬
чественных опухолях. Ферритин высвобождается из печени в кровь
при всех заболеваниях печени, опухолях или метастазах в печень, при
длительном злоупотреблении алкоголем или при приеме оральных
контрацептивов. В этих случаях ценность определения содержания
только одного ферритина для диагностики железодефицитной ане¬
мии невелика.
Повышение содержания ферритина в сыворотке крови может быть
И1,[явлено при избыточном содержании железа (например, при гемохро-
396
Глава 5. Биохимические исследования
матозе уровень ферритина выше 500 мкг/л), при некоторых заболевани¬
ях печени, при воспалительных процессах (легочные инфекции, осте¬
омиелит, артрит, системная красная волчанка, ождги), при некоторых
острых и хронических заболеваниях с поражением печеночных клеток
(алкогольное поражение печени, гепатит), раке молочной железы, ост¬
ром миелобластном и лимфобластном лейкозе, лимфогранулематозе.
5.8.3. СОСТОЯНИЯ, СВЯЗАННЫЕ С НЕДОСТАТКОМ И ИЗБЫТКОМ
ЖЕЛЕЗА В ОРГАНИЗМЕ
По мнению экспертов воз, дефицит железа является широко
распространенным состоянием, связанным с несбалансированным
питанием. Дефицит железа приводит к увеличению заболевае.мости,
снижению работоспособности и качества жизни. Формы клини¬
ческих проявлений железодефицитиых состояний разнообразны и
варьируют от латентно протекающих до тяжелых прогрессирующих
заболеваний, способных привести к типичным органным и ткане¬
вым повреждениям и даже к летальному исходу. Диагностика анемий
включает данные осмотра и физикалъного обследования, а также
лабораторные исследования. В настоящее время общепринято, что
диагноз железодефицитных состояний клиницист обязан установить
до развития полной картины заболевания, т.е. до возникновения
гипохромной анемии. При дефиците железа страдает весь организм, а
гипохромная анемия — это поздняя стадия болезни.
Как правило, железодефицитные состояния встречаются у детей,
молодых женщин и пожилых людей, они также сопровождают раз¬
личные хронические заболевания.
Причины, Цриводящие к развитию дефицита железа, многочис¬
ленны в связи с чем необходи.мо использовать комплекс лабораторных
показателей, позволяющих установить истинную причину железоде¬
фицитных состояний и выработать обоснованную стратегию лече¬
ния, главная цель которого ~ устранение дефицита железа в организ¬
ме больного.
К состояниям, связанным с отклонением показателей обмена
железа в организме, относятся:
• железодефицитная анемия;
• хронические инфекции и воспаления;
• избыток железа в организме.
H.H. Исследование обмена железа и витаминов 397
Клинические проявления зависят от этиологии, выраженности
11 скорости развития анемии. Сопутствующие заболевания, в час¬
тости, болезни сердца и легких, усугубляют тяжесть анемии. Как
правило, при уровне гемоглобина ниже 70 г/л появляются признаки
тканевой гипоксии (утомляемость, головная боль, одышка, головок¬
ружение, стенокардия). При тяжелой анемии отмечаются бледность
II компенсаторная тахикардия. Даже тяжелая анемия может хорошо
переноситься, если она развивается постепенно.
Г».8.3.1. Железодефицитная анемия
Среди различных анемических состояний железодефицитные ане-
мии являются самыми распространенными и составляют около 80%
всех анемий. Железодефицитная анемия развивается при:
• недостаточном поступлении железа с пищей;
• нарушении всасывания железа вследствие заболеваний желудоч¬
но-кишечного тракта;
» кровопотерях;
• состояниях, при которых увеличивается потребление железа
(например, беременность или период роста организма).
Недостаточное поступление железа с пищей — довольно распро¬
страненная причина дефицита железа у нас в стране, зависящая от
низкой доли продуктов животного происхождения в рационе пита¬
ния. В результате в организме человека возникает отрицательный
баланс железа (потери преобладают на поступлением), который, если
он сохраняется в течение длительного времени, приводит к развитию
железодефицитной анемии.
Эритроциты содержат 70% общего количества железа, поэтому
кровотечение (острое и хроническое) является такой же частой причи¬
ной его дефицита, как и недостаточное поступление железа с пищей.
Например, нормальные менструальные кровотечения связаны с поте¬
рей около 15 мг железа каждый месяц, так что здоровая женщина в
это время теряет в среднем 1,5-2 мг железа в день. Для возмещения
могерь и поддержания нормальных запасов железа женщина должна
восполнять их во время менструаций. Если этого не происходит, то
со временем развивается железодефицитная анемия. Хроническая
кровопотеря — самая частая причина железодефицитной анемии у
взрослых (составляет около 80% всех случаев анемии).
Вслед за менструальной кровопотерей вторая ведущая причина
дефицита железа у взрослых — кровопотеря через желудочно-кишеч¬
398
Глава 5. Биохимические исследования
ный тракт. Хроническое кровотечение из желудочно-кишечного трак¬
та — клиническое проявление многих широко распространенных
заболеваний, включая язвенный колит, язвенную болезнь желудка и
двенадцатиперстной кишки, цирроз печени, рак желудка и толстой
кишки. Длительный прием нестероидных противовоспалительных
препаратов (аспирин, волътарен) связан с высоким риском хроничес¬
кой кровопотери через изъязвленную слизистую оболочку желудка.
Трудности своевременной диагностики анемии у таких больных
обусловлены тем, что в большинстве случаев желудочно-кишечного
кровотечения кровь теряется незаметно для пациента, выделяясь
с калом. Гинекологические заболевания, такие, как эндометриоз и
фибромиома матки, сопровождающиеся хроническими кровотечени¬
ями, — довольно распространенная причина анемии у женщин. Пока
запасы железа в тканях сохраняются, дефицит железа не развивается.
Даже единичный случай тяжелой кровопотери не вызовет дефици¬
та железа. Однако продолжительная или регулярная кровопотеря
небольших количеств крови в течение длительного времени медленно
истощает запасы железа в организме.
Беременность сопровождается повышенной физиологической пот¬
ребностью растущего плода в железе, также как и интенсивный рост, кор¬
мление грудью, занятие спортом. При неадекватном поступлении железа
с пищей у таких пациентов может развиться железодефицитная анемия.
Необходимо придерживаться четкого правила: во всех случаях
железодефицитной анемии следует установить ее причину. Это обус¬
ловлено тем, что железодефицитная анемия может быть клиническим
симптомом серьезных заболеваний желудочно-кишечного тракта или
заболеваний органов репродуктивной системы у женщин.
Ранних клинических симптомов дефицита железа не существует,
а симптомы анемии появляются только после истощения запасов
железа в организме. Клинические проявления анемии разнообразны
и варьируют от невыраженных (общая слабость, недомогание, сниже¬
ние работоспособности, извращение вкуса, сухость и пощипывание
языка, нарушение глотания с ошущением инородного тела в горле,
сердцебиение, одышка) до тяжелых прогрессирующих состояний,
способных привести к типичным органным и тканевым повреждени¬
ям и даже к летальному исходу. Диагноз железодефицитных состояний
необходимо уставить до развития полной картины — жслезодефицит-
ной анемии. Лабораторные исследования позволяют практически
решить эту задачу. Типичные изменения в результатах лабораторных
5.8. Исследование обмена железа и витаминов
399
анализов при различных степенях дефицита железа в организме чело¬
века приведены в табл. 5-19.
Таблица 5-19.
Критерии диагностики дефицита железа
Показатель
Норма
Латентный дефи¬
цит железа
Же леэодефииитна я
анемия
Гемоглобин, г/л:
мужчины
130-160
> 130
< 130
женщины
120-150
> 120
< 120
Сывороточное
железо, мкмоль/л;
мужчины
11,6-31,3
<7,5
<7,5
женщины
9,0-30,4
< 6,0
<6,0
ОЖСС, .ммоль/л
44,75 -71,60
>71,60
>71,60
Ферритин, мкг/л:
мужчины
20-250
<40
< 12
женщины
10-120
<20
< 10
При латентном дефиците железа у пациентов отсутствуют какие-
либо симптомы, уровень гемоглобина находится в пределах нормы.
Уровень ферритина в сыворотке крови снижен, а содержание железа
также снижено или находится на нижней границе нормы. Больные с
жслезодефицитной анемией могут иметь специфические клиничес¬
кие симптомы: глоссит (воспаление языка), стоматит (изъязвление
губ в углах рта) и изменения ногтей (необычайно легкая ломкость).
С'«держание ферри гина в сыворотке и насыщение трансферрина
находятся на очень низком уровне. К другим лабораторным призна¬
кам относятся низкий уровень железа в сыворотке, повышение ОЖСС
и низкая концентрация гемоглобина в крови.
5.7,3.2. Анемия при хронических заболеваниях
Многие больные с хроническими заболеваниями могут страдать
легкой или умеренной анемией. Обычно уровень гемоглобина у таких
больных не бывает ниже 90 г/л. Анемия может сопровождать следую¬
щие болезни:
400 Глава 5. Биохимические исследования
• инфекционные (туберкулез, бактериальный эндокардит, пневмо¬
ния);
• воспалительные (ревматоидный артрит, системная красная вол¬
чанка, болезнь Крона);
• онкологические;
• хроническую почечную недостаточность.
Анемия при хронических заболеваниях занимает 2-е место по рас¬
пространенности после железодефицитной анемии и характеризуется
чаше нормальными или увеличенными запасами железа в организме.
Механизм развития анемии при хронических заболеваниях обуслов¬
лен активацией иммунной системы и повышением концентрации
воспалительных цитокиноввкрови. Воспалительные цитокиныдают
ряд эффектов, которые приводят к развитию анемии:
• подавляют синтез эритропоэтина и чувствительность эритроид-
ных клеток-предшественников к его стимулирующему воздейс¬
твию;
• оказывают влияние, противоположное эритропоэтину, на эритро-
ид ные клетки-предшественники;
• стимулируют гибель эригроидных клеток-предшественников.
Уровень железа в сыворотке крови у больных с анемией при хро¬
нических заболеваниях обычно снижен, как и при жслезодефицитной
анемии. Однако ОЖСС сыворотки понижена, а уровень ферритина в
сыворотке крови нормальный или даже повышен. Так как дефицит
железа у пациентов отсутствует, назначение препаратов железа в этих
случаях не оправдано и даже может быть вредно, поскольку повыша¬
ет риск накопления избытка железа. Лечение таких больных должно
быть направлено на устранение основного заболевания. При его
эффективности анемия постепенно исчезает.
5.8.З.З. Избыточное накопление железа
У здорового человека все железо связано с белками. Гемоглобин
связывает железо в эритроцитах, ферритин — в тканях, трансферри-
тин — в плазме крови. В таком состоянии оно нетоксично. Однако
свободное (несвязанное) железо оказывает токсическое и поврежда¬
ющее действие на ткани. Количество белков, связываюших железо и
защищающих ткани в организме человека, ограничено. Как только
они насыщаются железом, любое избыточное поступление железа или
образование его внутри организма приводит к накоплению его в орга¬
нах в свободном (токсическом) состоянии. При хронической пере¬
5.8. Исследование обмена железа и витаминов 401
грузке организма железом возрастает образование высокоактивных
свободных радикалов, которые повреждают нормальные структуры
клетки и нарушают их функции. Кроме того, стимулируются синтез
коллагена и формирование фиброза в органах и тканях. Наиболее
часто повреждаются поджелудочная железа (развитие фиброза и
щтем сахарного диабета), печень (развитие цирроза и печеночной
недостаточности, рака пеЛени), сердце (развитие аритмий, сердечной
недостаточности), гонады (равитие импотенции) и суставы (сильные
суставные боли и развитие артрита).
К синдромам избыточного накопления железа относятся врожден¬
ный гемохроматоз и парентеральный гемохроматоз (парентеральная
перегрузка железом).
Врожденный гемохроматоз представляет собой наследственное
заболевание, характеризующееся увеличением всасывания железа в
кишке и отложением его в паренхиматозных клетках печени, серд¬
ца, поджелудочной железы и других эндокринных желез, у больных
гсмохроматозом из пищи всасывается 3-4 мг железа в день по сравне-
н ИЮ с 1-2 мг у здоровых. У человека не существует механизмов, усили¬
вающих выведение железа из организма, поэтому оно накапливается
со скоростью 0,5-1 г в год. В среднем возрасте, когда обнаруживаются
первые клинические проявления избыточного накопления железа,
сю общее количество может составлять 20—40 г по сравнению с 4—5 г
в норме. Это заболевание обычно плохо диагностируется, поэтому
всех пациентов с заболеваниями печени необходимо обследовать на
1емохроматоз (т.е. исследовать показатели, отражающие величину
запасов железа в организме), если нет другой очевидной причины
заболевания. Также необходимо проводить скрининговое обследова¬
ние на гемохроматоз мужчин, у которых в среднем возрасте развива-
с'гся сахарный диабет. Основным методом лечения наследственного
I смохроматоза являются повторные кровопускания.
Парентеральный гемохроматоз развивается у пациентов, кото¬
рым вводится избыточное количество железа парентерально (при
переливании эритроцитной массы или железа с декстраном). Одна
стандартная единица переливаемой крови содержит око.ю 250 мг
железа в эритроцитах, что более чем в 100 раз перекрывает суточную
потребность. Больные с талассемией и серповидно-клеточной анеми¬
ей, которым долгое время переливают кровь, особенно подвержены
риску перегрузки железом. Пациентам с анемией, которая не является
железодефицитной, могут ошибочно назначать препараты железа. Так
402
Глава 5. Биохимические исследования
как любая анемия независимо от причины сама по себе способству¬
ет повышению всасывания железа в кишечнике, назначение таким
больным препаратов железа может привести к перегрузке организма
железом.
У пациентов с избытком железа результаты анализов крови про¬
тивоположны таковым при его дефиците. В сыворотке крови выяв¬
ляют:
* повышение уровня железа;
* снижение ОЖСС сыворотки;
* повышение уровня ферритина.
5.8.4. ФУНКЦИИ И МЕТАБОЛИЗМ ВИТАМИНА В,<,
И ФОЛИЕВОЙ КИСЛОТЫ
К витаминам относятся различные по химическому строению
вещества с высокой биологической активностью, которые являют¬
ся незаменимыми для организма и в ничтожно малых количествах
играют важнейшую роль в процессах его жизнедеятельности. Они
не могут синтезироваться в организме человека, и единственный
их источник — пища. Большинство витаминов являются составной
частью ферментов, что определяет их активное участие во всех жиз¬
ненных функциях организма.
Из множества витаминов важнейшую роль в развитии одной из
форм анемии (мегалобластной анемии) играет дефицит витамина
В,2 и фолиевой кислоты. Эти витамины необходимы для процессов
нормального созревания эритроцитов. Витамин В,2 (цианокобала-
мин) выполняет функцию кофермента при синтезе нуклеиновых
кислот — ДНК и РНК и метионина из гомоцистеина. Метионин
необходим для превращения фолиевой кислоты в фолиновую, кото¬
рая обеспечивает нормобластичсский тип кроветворения. Кроме
того, витамин Віз обеспечивает синтез липопротеинов в миели-
новой ткани нервной системы. Поэтому дефицит витамина Віз
сопровождается развитием мегалобластической анемии, нейтро-
пснии и неврологических расстройств (фуникулярньтй миелоз).
Иммунодефицит при недостаточности витамина Віз связан с обра¬
зованием гиперсегментированных нейтрофилов, отличающихся
сниженной активностью кислородзависимого механизма бактери-
цидности, который необходим для уничтожения внутриклеточных
бактерий и вирусов.
5.Н. Исследование обмена железа и витаминов 403
Основным источником витамина служат пищевые продукты
животного происхождения: говяжья печень, рыба, морепродукты,
мясо, молоко, сыры, в растениях витамин В12 не встречается, так как
они не способны его синтезировать.
Суточная потребность взрослого человека в витамине В,2 равна
1 мкг, беременных и кррмяших — 4 мкг, детей первого года жизни —
О,.1-2 мкг. Обычно запасов витамина В,2 в печени человека вполне
иоетаточно, чтобы предохранить от развития авитаминоза в течение
I -2 лет. Здоровый организм способен вырабатывать этот витамин
самостоятельно.
Фолиевая кислота относится к водорастворимым витаминам груп¬
пы В. Она необходима для поддержания нормального эритропоэза,
синтеза нуклеопротеинов, размножения клеток, обеспечения сверты¬
ваемости крови, предупреждения атеросклероза. Организм человека
обеспечивается фолиевой кислотой за счет ее эндогенного синтеза
микрофлорой кишечника и потребления с пищей. Этот витамин
всасывается после гидролиза, восстановления и метилирования в
желудочно-кишечном тракте. Среднесуточное потребление фолие¬
вой кислоты составляет 500—700 мкг фолатов. Из этого количества
50-200 мкг фолатов обычно всасывается в желудочно-кишечном
грактс в зависимости от метаболической потребности (у беременных
до 300—400 мкг). В организме фолиевая кислота восстанавливается
л о тетрагидрофол иевой кислоты (для этого необхомо присутствие
витамина В,2), являющейся коферментом, участвующим в различных
метаболических процессах. Обычно от 5 до 20 мг (до 75%) фолатов
накапливается в печени и других тканях. Фолаты выводятся из орга¬
низма с мочой и калом, а также подвергаются метаболизму, поэтому
их уровень в сыворотке крови снижается в течение нескольких дней
мосле прекращения поступления с пишей.
Основными источниками фолатов для человека являются дрожжи,
капуста, морковь, помидоры, грибы, салат, шпинат, лук, печень, почки,
иичный желток, сыр. Суточная потребность взрослого человека в фоли¬
евой кислоте составляет 200 мкг. Она увеличивается при беременности,
и период кормления грудью, при тяжелом физическом труде, недостатке
белка в рационе, приеме больших доз витамина С (2 г и более).
Для ткани костного .мозга характерны постоянное деление
и быстрое обновление клеток. Эти процессы сильно зависят от
нормального синтеза ДНК и, следовательно, от наличия вита¬
мина В(2 и фолиевой кислоты, продукция клеток крови в костном
404 Глава 5. Биохимические исследования
мозге продолжается на протяжении всей жизни, и для постоянного
обеспечения этого процесса необходимо адекватное поступле¬
ние витамина В,2 и фолиевой кислоты в организм человека. Как
указывалось выше, основной источник этих витаминов — пища.
Однако важнейшим этапом поступления витамина Віз и фолиевой
кислоты в организм человека является их всасывание в желудочно-
кишечном тракте. Это достаточно сложный процесс, особенно в
отношении витамина В,2, и его нарушение служит основной при¬
чиной дефицита витаминов в организме человека и развития мега¬
лобластной анемии.
Наличие секреции соляной кислоты слизистой оболочкой
желудка (кислая среда желудка) важно для высвобождения вита¬
мина В,2 из пищи до его всасывания в кишечнике, Всасывание
витамина Віз происходит в дистальных отделах подвздошной
кишки. Однако оно возможно только после связывания витамина
В|2 с внутренним фактором — белком, секретируемым клетка¬
ми слизистой оболочки желудка. Всосавшийся в кровь витамин
доставляется в костный мозг и другие ткани специфическим бел-
ком-переносчиком ~ транскобаламином. Поэтому нормальное
воспроизводство эритроцитов в костном мозге зависит от следую¬
щих факторов:
• достаточного содержания витамина В,2 в пище;
• секреции соляной кислоты и внутреннего фактора в желудке;
• нормального всасывания в тонкой кишке;
• наличия в плазме транскобаламина в достаточном количестве.
Кроме того, необходимо иметь в виду, что витамин В,2 использует¬
ся для роста некоторыми бактериями кишечника, которые препятс¬
твуют всасыванию этого витамина, конкурируя за него с клетками
кишечника. Поэтому на всасывание витамина В,2 может оказывать
влияние и характер микрофлоры кишечника (при дисбактериозе
кишечника всасывание нарушается).
Организм способен сохранять в печени большие запасы витамина
В,2, достаточные для поддержания нормального производства эритро¬
цитов в течение нескольких лет (1—2 года) при отсутствии этого вита¬
мина в пище. Поэтому мегалобластная анемия — это довольно поз¬
днее проявление дефицита витамина В12 в организме. Референтные
величины содержания витамина В,2 в сыворотке крови у новорож¬
денных 160-1300 пг/мл, у взрослых 200-835 пг/мл (средние значения
300-400 пг/мл).
5.8. Исследование обмена железа и витаминов 405
Всасывание фолиевой кислоты происходит в верхних отделах тон¬
кой кишки, и затем она доставляется кровью к костному мозгу и другим
тканям в свободной форме или в связи с альбумином. Следовательно,
и перечень факторов способных повлиять на поступление фолиевой
кислоты в организм, ограничивается содержанием витамина в пище
и состоянием функции тонкой кишки, обеспечивающей его вса¬
сывание. Как и Битами А В],, фолиевая кислота запасается главным
образом в печени. Однако этих запасов хватает только на несколько
месяцев. Референтные величины содержания фолиевой кислоты у
взрослых в сыворотке крови составляют 7—45 нмоль/л (3—20 нг/мл), в
тритроцитах — 376-1450 нмоль/л (166—640 нг/мл).
5.8.5. СОСТОЯНИЯ, СВЯЗАННЫЕ С НЕДОСТАТОЧНОСТЬЮ
ВИТАМИНА В,2 И ФОЛИЕВОЙ КИСЛОТЫ В ОРГАНИЗМЕ
Витамин В,2 и фолиевая кислота участвуют в синтезе гемоглобина
и процессах кроветворения, поддерживают обновление миелина в
I кани нервной системы. Они необходимы для нормального синтеза
ДНК, поэтому незаменимы в тканях и органах с активным обновле¬
нием и делением клеток, таких, как костный мозг и слизистая оболоч¬
ка желудочно-кишечного тракта. Дефицит витамина В,2 и фолиевой
кислоты характеризуется поражением кроветворной ткани, пище¬
варительной и нервной систем. Клинически наиболее ярко все эти
изменения проявляются при заболевании, обусловленном дефицитом
витамина В,2 и фолиевой кислоты, — мегалобластной анемии.
5.8.5.1. Мегалобластная анемия
Термин «мегалобластная анемия» объединяет группу анемий, в
основе которых лежат нарушения синтеза ДНК в клетках костного
мозга. Эти нарушения приводят к образованию крупных эритроб¬
ластов (мегалобластов — предшественников эритроцитов), многие из
которых не созревают и подвергаются разрушению в костном мозге.
Следствием этого являются заметное снижение количества эритроии-
10В в циркулирующей крови и развитие анемии. Эритроциты, которые
псе же созревают и поступают в кровь, крупнее нормальных, поэтому
их часто называют макроцитами. Соответственно нередко в качестве
синонима мегалобластной анемии используют термин «макроцитар-
иая анемия». В действительности, если строго подходить к сущности
406 Глава 5. Биохимические исследования
данных терминов, это не синонимы. Поскольку синтез нуклеиновых
кислот наруишется во всех костномозговых клетках, частыми призна¬
ками болезни являются уменьшение количества тромбоцитов, лейко¬
цитов, увеличение числа сегментов в гранулоцитах. В подавляющем
большинстве случаев (более 90%) причиной мегалобластной анемии
является дефицит вита.мина 8,2 и фолиевой кислоты в организме
человека. Дефицит этих витаминов может быть как раздельным, так
и совместным.
Причинами дефицита витамина В,, и/или фолиевой кислоты
являются:
• недостатоточное поступление витаминов с пишей;
• нарушение всасывания витамина 8,2 вследствие недостаточного
образования внутреннего фактора в слизистой оболочке желуд¬
ка;
• нарушение всасывания витамина 8,2 и/или фолиевой кислоты
при заболеваниях желудочно-кишечного тракта;
• повышенная потребность организма в витамине Віз фолиевой
кислоте во время беременности.
Недостаточное поступление витамина В,2 с пищей встречается
редко, в основном у лиц пожилого возраста и строгих вегетерианцев.
Недостаток фолиевой кислоты в пище — распространенное явление
среди дефицита различных вита.минов. Фолиевая кислота легко раз¬
рушается при термической обработке пищи, в результате ее поступле¬
ние в организм становится минимальным. Сниженное потребление
фолиевой кислоты с пищей часто встречается у больных хроническим
алкоголизмом, а отрицательное влияние алкоголя на ее метаболизм
усугубляет дефицит этого витамина. Недостаточное поступление
фолиевой кислоты с пищей часто встречается у пожилых людей.
Поэтому все пожилые люди должны рассматриваться как группа
риска по дефициту этого витамина.
Самая распространенная причина дефицита витамина Віз в нашей
стране — нарушение его всасывания из-за недостатка внутреннего
фактора. Это особый тип анемии. Раньше, до открытия витамина В12,
эта форма анемии называлась пернициозной (злокачественной), так
как без использования в пишу сырой печени или парентерального
введения витамина Ві, больные не выживали. Лица с пенициозной
анемией не способны синтезировать внутренний фактор вследствие
повреждения клеток слизистой оболочки желудка, вырабатывающих
этот фактор, аутоангителами к ним. Пернициозной анемией чаще
5.8. Исследование обмена железа и витаминов 407
с'градают женщины среднего и пожилого возраста. Таким паииен-
іам витамин следует вводить в виде инъекций, так как принятый
внутрь он не может всосаться. Поступление фолиевой кислоты с
нищей у пациентов с пернициозной анемией не нарушается.
Пернициозная анемия может развиться после тотальной гаст-
рэктомии (когда полностью ликвидируется секреция внутреннего
фактора). Однако клийически она проявляется только через 5-8
ист и более после операции. В течение этого срока больные живут
запасами витамина в печени при минимальном пополнении его за
счет незначительного всасывания в тонкой кишке не соединенного
с внутренним фактором витамина. Одной из причин нарушенного
синтеза внутреннего фактора может быть хроническая алкогольная
интоксикация, когда она сопровождается токсическим поражением
слизистой оболочки желудка.
Тяжелые клинические формы дефицита вита.мина В(2 и фолиевой
кислоты возникают при нарушениях всасывания этих витаминов в
юнкой кишке вследствие осложнений после оперативных вмеша¬
тельств (особенно резекций) на кишечнике, прогрессирующего тече¬
ния энтерита, болезни Крона. Дисбактериоз кишечника как причина
дефицита витамина все чаще встречается в клинической практике.
Весьма редкой причиной дефицита витамина В,2 является нарушение
всасывания витамина в тонкой кишке при инвазии широким ленте-
цом, когда паразит поглошает большое количество витамина В(2-
Относительная недостаточность витамина В,2 и фолиевой кислоты
может возникать при беременности вследствие повышенной потреб¬
ности организма в этих витаминах.
Дефицит фолиевой кислоты наблюдается при гипертиреозе у
детей, цинге, недостатке витамина С, заболеваниях печени, язвенном
колите, злокачественных новообразованиях, миелопролиферативных
заболеваниях, сепсисе, гемолитической анемии, острых воспалитель¬
ных заболеваниях (особенно кожи). Кроме того, недостаток фолиевой
кислоты наблюдается у беременных, у недоношенных детей, при кор¬
млении детей козьим молоком.
Клиническая картина мегалобластной анемии характеризуется
поражением кроветворной ткани, пищеварительной и нервной систем
(дегенеративные изменения спинного мозга). Отмечаются острейшая,
как бы внезапно появившаяся слабость, снижение работоспособ¬
ности, головокружение. Кожа больных иногда слегка желтушна, в
сыворотке крови увеличен уровень непрямого билирубина (за счет
408 Глава 5. Биохимические исследования
повышенной гибели гемоглобинсодержащих мегалобластов костного
мозга). Определяются явления глоссита: «полированный» язык, ощу¬
щение жжения в нем. Желудочная секреция угнетена, часты диспеп¬
сические явления. В связи с повышенным гемолизом увеличиваются
печень и селезенка. Желудочная секреция угнетена, возможна стойкая
ахлоргидрия (отсутствие секреции соляной кислоты). Определяется
небольшое увеличение селезенки, реже печени. Один из характерных
признаков мегалобластной анемии — наличие неврологических сим¬
птомов нейропатии, которые включают:
• парестезии — аномальную чувствительность кожи, наиболее
часто проявляющуюся покалыванием в пальцах рук и ног;
• затруднения при ходьбе;
• повышенную раздражительность;
• потерю памяти.
Эти проявления нейропатии более характерны для больных с
дефицитом витамина В^. При недостаточности фолиевой кислоты
они встречаются значительно реже.
При мегалобластной анемии в анализах крови выявляют сниже¬
ние количества эритроцитов, эритроциты очень крупные (диамет¬
ром более 12 мкм), повышенное содержание гемоглобина в эритро¬
ците — гиперхромию, тромбоцитопению, лейкопению и появление
полисегментированных нейтрофилов при подсчете лейкоцитарной
формулы крови. Степень уменьшения количества клеток крови
может быть различной, редко отмечается одновременное снижение
количества эритроцитов, тромбоцитов и лейкоцитов.
Уровень витамина В,з в сыворотке крови обычно снижен при всех
фор.мах мегалобластной анемии. Нередко в клинической практике
встречаются случаи, когда у пациента имеются только неврологи¬
ческие симптомы дефицита витамина В,2, а другие признаки анемии
отсутствуют. У таких больных уровень витамина В,2 в сыворотке
также снижен. Уровень фолиевой кислоты в сыворотке крови у боль¬
ных с изолированным дефицитом витамина В,2 обычно в норме или
даже повышен. Напротив, в эритроцитах содержание фолиевой кис¬
лоты в норме или снижено.
Поскольку запасы фолатов в организме ограничены, а суточная
потребность высока, то дефицит витамина и мегалобластная анемия
могут развиться через 1—6 мес после прекращения поступления фоли¬
евой кислоты. Уровень фолиевой кислоты в эритроцитах является
лучшим показателем ее запасов в организме, чем содержание в сыво¬
5.8. Исследование обмена железа и витаминов 409
ротке, поскольку не зависит от последнего поступления витамина
с пищей. Для дефицита фолиевой кислоты характерна следующая
последовательность; в течение первых 3 нед от.мечается снижение ее
уровня в сыворотке крови, спустя примерно 11 нед от начала дефипи-
I а при исследовании мазка крови выявляется гиперсегментация ядер
нейтрофилов, базофилов, эозинофилов (гиперсегментация служит
хорошим показателем дефицита), несколько позже обнаруживают
низкий уровень витамина в эритроцитах (17 нед), макроовалоцитоз
эритроцитов (18 нед), металобластный костный мозг (19 нед), раз¬
вернутая клиническая картина мегалобластной ане.мии проявляется
спустя 19—20 нед. Содержание витамина В,2 в сыворотке крови при
мегалобластной анемии, обусловленной изолированным дефицитом
<[)олиевой кислоты, остается в пределах нормы.
Глава 6.
ИССЛЕДОВАНИЕ СВЕРТЫВАЮЩЕЙ
СИСТЕМЫ КРОВИ
Кровь обладает уникальной способностью свертываться.
Свертывание крови — это свойство крови превращаться из жидкости
в эластичный сгусток, способный остановить кровотечение, возник¬
шее при повреждении тканей. Комплекс процессов, который при этом
происходит, называется гемостазом, а все компоненты этого процесса
и сами процессы — системой гемостаза.
Система гемостаза — одна из защитных систем организма человека,
обеспечивающая сохранение крови в жидком состоянии в пределах
кровеносных сосудов и образование тромбов в области повреждения
стенки сосудов, в кровеносных сосудах при отсутствии каких-либо
патологических воздействий жидкое состояние крови является следс¬
твием равновесия факторов, обусловливающих процессы свертывания
и препятствующих их развитию. При нарушениях подобного баланса в
системе свертывания крови или ее элементах могут возникнуть повы¬
шенные кровоточивость или тромбообразование (тромбоз) в сосудах.
И первое, и второе состояния представляют потенциальную угрозу
жизни пациента. Для диагностики подобных нарушений у пациентов,
предупреждения их развития, выбора оптимальных методов лечения и
оценки его эффективности проводят ряд лабораторных тестов, позво¬
ляющих оценить состояние свертывающей системы крови.
6Л. КОМПОНЕТЫ СИСТЕМЫ СВЕРТЫВАНИЯ КРОВИ
Гемостатический процесс включает 5 стадий: локальный спазм
сосуда, формирование тромбоцитарного тромба, стабилизацию его
фибрином, ретракцию (сокращение) тромба и его растворение после
восстановления поврежденной стенки сосуда. Последовательность
событий, которые ведут к формированию стабильного фибринового
сгустка и прекращению кровотечения из поврежденного сосуда, пред¬
ставлена на рис. 6-1.
в. І. Компонеты системы свертывания крови
411
Спззм сосуда.снижение іфовотока
Агрегация и адгезия тромбоцитов
ТромбоиитйрныЙ гемостаз
Общий путь /
Плазменный гемостаз
Посткоягуляционная фаза гемостаза
Рис. 6-1. Схема нормального гемостаза
412
Глава 6, Исследование свертывающей системы крови
Тромбообразование в организме происходит по единым законам с
включением в процесс определенных клеточных элементов, фермен¬
тов и факторов свертывания. В системе свертывай и я, крови различают
два звена: клеточный (сосудисто-тромбоцитарный) и плазменный
(коагуляционный) гемостазы.
Под клеточным гемостазом понимают адгезию клеток (прилипание
тромбоцитов к поврежденной поверхности сосуда), агрегацию (склеива¬
ние одноименных клеток крови между собой), а также высвобождение из
форменных элементов веществ, активирующих плазменный гемостаз.
Плазменный (коагуляционный) гемостаз представляет собой каскад
реакций, в которых участвуют факторы свертывания крови, завершаю¬
щийся процессом фибринообразования. Образовавшийся фибрин под¬
вергается далее разрушению под влиянием плазмина (фибринолиз).
Важно отметить, что деление гемостатических реакций на клеточные
и плазменные является условным. В организме эти звенья свертывающей
системы крови тесно связаны и не могут функционировать раздельно.
Спазм сосудов и снижение кровотока в поврежденном участке
уменьшают величину кровопотери. Повреждение сосуда также вызы¬
вает два важных физиологических эффекта. Первый — адгезия и агре¬
гация тромбоцитов с формированием из них тромбоцитарного тромба,
второй — запуск плазменного (коагуляционного) гемостаза или свер¬
тывающего каскада, который заканчивается образованием фибрина.
Нити фибрина формируются вокруг и между агрегатами тромбоцитов,
придавая устойчивость образовавшемуся тромбоцитарному тромбу.
Нормальный гемостаз в первую очередь зависит от двух факторов:
• адекватного числа нормально функционирующих тромбоцитов;
• нормально функционирующего плазменного (коагуляционного)
гемостаза.
Чтобы понять возникающие нарушения в системе гемостаза, вызван¬
ные заболеваниями, и правильно использовать лаборагорные тесты для
их выявления, необходимо рассмотреть эти факторы более детально.
6.1.1. СОСУДИСТО-ТРОМБОЦИТАРНЫЙ ГЕМОСТАЗ
Важную роль в осуществлении реакций гемостаза играет сосу¬
дистая стенка. Эндотелиальные клетки (эндотелиоциты) сосу¬
дов способны синтезировать различные биологически активные
вещества, формирующие тромбообразование. К ним относятся
6./. Компонеты системы свертывания крови 413
(|л1ктор Виллебранда, простациклин, тромбомодулин, эндотелии,
тканевый фактор (тромбопластин) и др. При отсутствии каких-
пибо повреждений выстилающие сосуд эндотелиальные клетки
обладают тромборезистентными свойствами (свойствами, пре¬
пятствующими образованию тромбов), что способствует подде¬
ржанию жидкого состояния крови.
Нарушение целостности сосудистой стенки и/или изменение
функциональных свойств эндотелиоцитов могут, напротив, спо¬
собствовать развитию протромботических реакций (образование
тромбов). Причины, приводящие к травме сосудов, весьма разно¬
образны и включают как экзогенные (механические повреждения,
лучевое воздействие, гипер- и гипотермия, токсичные вещества, в
I ом числе лекарственные средства и т.п.), так и эндогенные (биоло¬
гически активные вещества — тромбин, ряд цитокинов) факторы.
Такой механизм поражения сосудистой стенки характерен для
многих заболеваний, сопровождающихся склонностью к тромбо-
образованию.
Абсолютно все клеточные элементы крови принимают участие
в образовании тромбов. Но для тромбоцитов (в отличие от эритро¬
цитов и лейкоцитов) эта функция является основной. Тромбоциты
не только являются главными клеточными участниками процесса
тромбообразования в артериях и венах, но и оказывают сущест¬
вен нос влияние на плазменный гемостаз. При повреждении сосу¬
дов происходят активация тромбоцитов и стимуляция процес¬
сов их адгезии и агрегации. Адгезия (прилипание) тромбоцитов
к поврежденной поверхности сосуда обеспечивается фактором
Виллебранда, который высвобождается из разрушенных эндотели-
пльиых клеток. Вслед за адгезией тромбоциты выделяют в плазму
крови много биологически активных веществ (АДФ, тромбоксан,
серотонин, адреналин), влияющих на плазменный гемостаз и сам и
тромбоциты. Эти вещества заставляют тромбоциты приклеивать¬
ся друг к другу и увеличиваться в размерах. Совокупность этих
превращений называется агрегацией. Она продолжается до тех
пор, пока масса склеившихся тромбоцитов не станет достаточной,
чтобы закрыть повреждение в сосудистой стенке. Образования
громбоцитарного тромба обычно бывает достаточно, чтобы оста¬
новить кровотечение из сосуда малого диаметра. При повреждени¬
ях сосудов большего диаметра на помощь сосудисто-тромбоцитар-
цому гемостазу приходит коагуляционный каскад.
414
Глава 6. Исследование свертывающей системы крови
6.1.2. ПЛАЗМЕННЫЙ (КОАГУЛЯЦИОННЫЙ) ГЕМОСТАЗ
Параллельно процессам агрегации тромбоцитов у стенки сосуда
происходит активация плазменного (коагуляционного) гемоста¬
за. Совместно эти два звена обеспечивают образование фибрина.
Свертывание крови происходит в результате реакций, в которых
белки, находящиеся в плаз.ме крови и называемые факторами,
последовательно активируются. Все реакции — ферментативные.
В свое.м неактивном состоянии факторы являются проферментами,
т.е. не могут участвовать в реакциях. Активация их происходит путем
ограниченного протеолиза (изменения белка), в результате кото¬
рого факторы становятся активными ферментами. Каждая реак¬
ция коагуляционного каскада превращает профермент в фермент.
Остальные факторы не являются профермента.ми или ферментами,
а часть из них — простые вешества, которые помогают протеканию
ферментативных реакций (коферменты или кофакторы),
Гемостатичсские реакции, совокупность которых называется плаз-
менны.м (коагуляционным) гемостазом, приводящим в итоге к обра¬
зованию фибрина, обеспечиваются в основном протеинами, носящи¬
ми название плазменных факторов. В табл. 6-1 приведены факторы,
участвующие в свертывании крови.
Таблица 6-І
Факторы свертывания крови
Фактор
Синонимы
Характеристика
1
Фибриноген
Гликопротеин — предшественник
фибрина, синтезируемый в печени
II
Протромбин
профермент, синтезируемый в
печени
ТГІ
Тканевый тромбоплас¬
тин, тканевый фактор
Липопротеин, имеющийся во мно¬
гих тканях; запускает внешний путь
свертывания
IV
Ионы кальция
Неорганическое вещество, кофак¬
тор
V
Проакцелерин,
Ас-глобулин
Белок, кофактор, синтезируемый в
печени
VI
Акнелерин (исключен
из употребления)
(*.І. Компонеты системы свертывания крови
415
Окончание таблица 6-1.
VII
Проконвертин
Профермент, синтезируемый в
печени
VIII
Анти гемофил ьный
глобулин А
Белок, кофактор
IX
Кристмас-фактор,
плазменный тром-
бопластиновый
компонент, антигемо-
фильный фактор В
Профермент, синтезируемый в
печени
X
Фактор Стюарт—
Проуэра
профермент, синтезируемый в
печени
XI
А нти гемофи льнътй
фактор С
профермент
XII
Фактор Хагемана,
фактор котттакта
Профермент
XIII
Фибриназа, фибрин-
стабилизирующи й
фактор
Профермент
Схема свертывающего каскада крови представлена на рис. 6-2. Два
мути взаимодействий могут приводить к запуску каскада — внешний
и внутренний. Внешний путь получил свое название потому, что для
сю запуска необходим тканевый фактор (тромбопластин), который в
норме в крови отсутствует и появляется при повреждении сосудов или
тканей. Внутренний путь, все компоненты которого присутствуют в
крови, активируется при контакте фактора XII с белком коллагеном,
попавшим в кровоток в результате нарушения целостности сосудис¬
той стенки. Оба пути в результате каскада реакций приводят к акти¬
на ции фактора X, Путь от активированного фактора X к образован и ю
фибрина называют общим путем.
Пусковым фактором внутреннего пути является фактор XII, который
НК гивируется либо при контакте крови с чужеродной поверхностью, либо
при контакте крови с коллагеном и другими компонентами соединитель¬
ной ткани при повреждении стенок сосудов; либо фактор XII активирует¬
ся путем его ферментативного расщепления (калликреином, плазмином,
другими протеазами). Активированный фактор ХГІ далее активирует
41в
Глава 6. Исследование свертывающей системы крови
фактор XI, который уже в свою очередь активирует фактор X. Для проте-
кания последней реакции небходимы кофакторы — фактор VIII (антиге-
хюфильный глобулин А) и фактор IV (ионы кальция).
Внешний путь
Тканевый фактор
(фактор III)
Фактор VII > Фактор Vlla-~ ^
Фактор X
Внутренний путь
Контакт
■I'.,.
•4..^
\ Фактор ХМа < Фактор XII
"■■■■'Ч ’
Фактор XI > Фактор XI а
Фактор 1Ха — Фактор IX
/
Фибриноген
^<Сп=|~Фибрин
Рис. 6-2. Плазменный (коагуляционный) каскад
Во внешнем пути основную роль играет тканевый фактор (фак¬
тор III — тромбопластин), который содержится на клеточных повер¬
хностях при повреждении тканей и образует с фактором VII и иона¬
ми кальция комплекс, способный активировать фактор X.
В конце общего пути активированный фактор X активирует фак¬
тор II (протромбин), который превращается в активный тромбин.
Фактор V является кофактором, необходимым для превращения про¬
тромбина в тромбин. Возникший тромбин отщепляет от молекулы
фибриногена 4 пептида и переводит его в фибрин-мономер. Молекулы
последнего полимеризуются сначала в димеры, затем в фибрин-поли¬
меры. Кроме того, тромбин активирует фактор XIII. Последний в
присутствии ионов кальция изменяет фибрин-полимер из легкорас¬
творимой формы в медленно и ограниченно растворимую форму,
составляющую основу кровяного сгустка.
6./. Компонеты системы свертывания крови 417
Большинство факторов плазменного гемостаза, включая фибри¬
ноген, протромбин и факторы V, VII, IX, X, XI, и XII, синтезируются
и печени. Для клинической практики важно знать, что синтез факто¬
ров П, VII, IX и X в первую очередь зависит от наличия в организме
витамина К. Это обусловлено тем, что дефицит витамина в организме
и используемые для лечения больных непрямые антикоагулянты
( реализуют свое действие за счет ослабления всасывания витамина К)
могут приводить к нарушению свертывания крови. Источниками
витамина К в организме человека служат пищевые продукты и обита¬
ющие в толстой кишке бактерии, синтезирующие этот витамин К.
Таким образом, образование фибрина и соответственно форми¬
рование кровяного тромба зависит от адекватной концентрации всех
((»акторов свертывания крови в плазме, что обусловлено:
• нор.мальной функцией печени;
• адекватным поступлением витамина К;
• нормальной микрофлорой толстой кишки;
• нормальным всасыванием витамина К.
В процессе образования гемостатического тромба не происходит
распространения тромбообразования от места повреждения стенки
сосуда по сосудистому руслу, так как этому препятствуют быстро
возрастающий вслед за свертыванием антикоагулянтный потенциал
крови и активация фибринолитической (плазминовой) системы.
После стабилизации фибрина, вместе с форменными элемента.ми
образующего первичный красный тромб, начинаются два основных
процесса посткоагуляционной фазы — спонтанный фибринолиз
(растворение тромба под действем плазмина) и ретракция (сокраще¬
ние), приводящие к формированию гемостатически полноценного
окончательного тромба. В норме эти два процесса идут параллельно,
(физиологический спонтанный фибринолиз (растворение) и ретрак¬
ция (уплотнение) способствуют уплотнению тромба и выполнению
им гемостатических функций. В дальнейшем происходят восстанов¬
ление стенки поврежденного сосуда и растворение тромба под дейс¬
твием плазмина.
Сохранение крови в жидком состоянии и регуляция скоростей
взаимодействия факторов во все фазы коагуляции во многом опре¬
деляются наличием в кровотоке естественных веществ, обладающих
■нтикоагулянтной активностью. Жидкое состояние крови достигается
равновесием между факторами, индуцирующими (стимулирующи¬
ми) свертывание крови, препятствующими его развитию, причем
418
Глава 6. Исследование свертываюи^ей системы крови
последние не выделяются в отдельную функциональную систему, так
как реализация их эффектов чаще всего невозможна без участия фак¬
торов свертывания крови. Вещества, обладающие антикоагулянтной
активностью, постоянно синтезируются в организме и с определен¬
ной скоростью выделяются в кровоток, к ним относятся антитром¬
бин 111, гепарин, протеины С и S.
В клинической практике исследование системы гемостаза прово¬
дится с целью:
• диагностики нарушений в системе гемостаза;
• выяснения допустимости оперативного вмешательства при выяв¬
ленных нарушениях в системе гемостаза;
• контроля за лечением антикоагулянтами прямого и непрямого
действия, а также тромболитической терапией.
6.2. ЛАБОРАТОРНЫЕ ТЕСТЫ, ИСПОЛЬЗУЕМЫЕ
для ОЦЕНКИ СВЕРТЫВАЮЩЕЙ СИСТЕМЫ КРОВИ
В свертывании крови участвуют сосуды, тромбоциты и плазмен¬
ные факторы. Для оценки состояния каждого из них используют раз¬
личные клинические и лабораторные тесты,
6.2.1. ТЕСТЫ, ХАРАКТЕРИЗУЮЩИЕ
СОСУДИСТЫЙ КОМПОНЕНТ ГЕМОСТАЗА
Сосуды активно участвуют в остановке кровотечения. Во мно¬
гом состояние сосудистой стенки определяет риск развития крово¬
течения, Некоторые заболевания (аллергические, эндокринные), а
также дефицит витаминов (например, витамина С) могут вызывать
дистрофические изменения в сосудистой стенке, повышая риск
возникновения кровотечений. Для оценки состояния сосудов
могут быть использованы некоторые пробы, которые выполняет
медицинская сестра.
Проба щипка. Медицинская сестра собирает под ключицей
кожу в складку и делает щипок. У здоровых людей никаких изме¬
нений на коже не наступает ни сразу после щипка, ни спустя 24 ч.
Но если резистентность (стойкость) капилляров нарушена, то
6.2. Лабораторные тесты, используемые для оценки свертывающей... 419
на месте щипка появляются петехии или кровоподтек, особенно
огчетливо видимые через 24 4.
проба жгута. Отступив на 1,5—2 см вниз от ямки локтевой вены,
очерчивают круг диаметром приблизительно 2,5 см. На плечо накла-
аывают манжету тонометра и создают давление 80 мм рт.ст. Давление
поддерживают строго на одном уровне в течение 5 мин, после чего в
очерченном круге подсчитывают все появившиеся петехии.
Оценка результатов исследования. У здоровых лиц петехии не образу-
10 гея или их не более 10 (отрицательная проба жгута). При нарушении
резистентности стенки капилляров число петехий после проведения
11 робы резко возрастает.
6.2.2. ТЕСТЫ, ХАРАКТЕРИЗУЮЩИЕ
ТРОМБОЦИТАРНЫЙ КОМПОНЕНТ ГЕМОСТАЗА
Для оценки тромбоцитарного компонента гемостаза подсчиты¬
вают количество тромбоцитов в крови прямым методом, о чем было
сказано в гл. 2. Напомним, что тромбоциты нужны для осущест¬
вления нормального гемостаза. Больные с тромбоцитопенией под¬
вержены риску кровотечения. Спонтанные кровотечения возни¬
кают, если количество тромбоцитов ниже 50,0-ЮУл. Смертельное
кровотечение почти неизбежно, если количество тромбоцитов
снижается до 5,0107л. Тромбоцитопения имеет тяжелые клини¬
ческие проявления, включая меноррагии, спонтанное образова¬
ние гематом, кровоточивость десен, носовые кровотечения, пете-
хнальные подкожные кровоизлияния в виде сыпи. Повышенное
количество тромбоцитов в крови — тромбоцитоз — приводит к
повышению свертываемости и проявляется тромбозами сосудов,
и клинических ситуациях риск тромбоза становится реальным, если
количество тромбоцитов достигает значений 1000,0-107л и выше,
Однако, помимо подсчета количества тромбоцитов, в России
широко используется тест по определению длительности (времени)
кровотечения.
Время кровотечения определяют в тесте при проколе кожи ска-
ри({)икатором или иглой, фиксируя время, за которое кровотечение
прекратится (время кровотечения по Дуке). Его длительность крово¬
течения зависит от эластичности кровеносных сосудов и их способ¬
ности к сокращению при травме, количества тромбоцитов в крови
420
Глава 6. Исследование свертывающей системы крови
и их функциональных свойств. У здорового человека длительность
кровотечения по Дуке составляет 2—3 мин.
Длительность кровотечения — это скрининговый тест, основное
достоинство которого состоит в том, что он позволяет одновременно
качественно оценить количество тромбоцитов в крови, их адгезивные
и агрегационные функции, функциональные свойства стенки крове¬
носных сосудов, а также выраженный дефицит плазменных факторов
свертывания крови (например, факторов УНТ и IX, недостаток кото¬
рых является причиной гемофилии А и В).
Практическое значение имеет удлинение времени кровотечения.
Оно отражает нарушение гемостаза вследствие тромбоцитопений,
тромбоцитопатий (нарушения функций тромбоцитов — адгезии и
агрегации), нарушения сосудистой стенки или сочетания этих фак¬
торов. Удлинение времени кровотечения при нормальном количестве
тромбоцитов в крови позволяет предположить нарушение их функ¬
ций. в этом и состоит основная ценность теста, так как для оценки
адгезивных и агрегационных свойств тромбоцитов в лабораторных
условиях необходимо сложное и дорогостоящее оборудование (агре-
гометр), Когда функции тромбоцитов не нарушены, время кровоте¬
чения остается в норме даже при снижении количества тромбоцитов
до 100,0-109/Л. При количестве тромбоцитов ниже этоих цифр вре.мя
кровотечения постепенно увеличивается в линейном соотношении с
количеством тромбоцитов, что отражено на рис. 6-3.
200 1
180 -
«г
160«
1
140 •
.3
120 .
1
100 •
г»
80 •
§
60-
40*
1
20*
0-
о 2 4 6 8 10 14 18 22 26 30
Время кровотечения, мин
Рис. 6-3. Зависимость времени кровотечения от количества тромбоцитов
6.2. Лабораторные тесты, используемые для оценки свертывающей... 421
Длительность кровотечения увеличивается при:
• выраженных тромбоцитопениях (см. раздел 2.2.4.3);
• нарушении функций тромбоцитов — тромбоцитопатиях, которые
бывают врожденными (например, синдром Бернара—Сулье) и
приобретенными (пернициозная анемия, острый и хронический
лейкоз, миеломная болезнь, длительный прием аспирина);
• выраженном снижении уровня плазменных факторов свертыва¬
ния крови (например, отсутствие VIII фактора — гемофилия А,
недостаток фактора IX — гемофилия В, выраженная гипофибри¬
ногене ми я);
• нарушении резистентности стенки капилляров (недостаток вита¬
мина С, дефекты сокрашения прекапилляров — микроангиопа¬
тии).
Укорочение времени кровотечения диагностического значения
не имеет и чаше всего бывает следствием технической ошибки при
проведении теста или свидетельствует о повышенной спастической
способности капилляров. Оценить склонность к тромбообразован и ю
110 данным теста длительности кровотечения невозможно.
6.2.3. ТЕСТЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ОЦЕНКИ
КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
Приведенные выше тесты достаточно просты и понятны, труднее
оценивать результаты, которые получают с помощью тестов, харак¬
теризующих состояние коагуляционного гемостаза. Наиболее часто
н клинической практике коагуляционный гемостаз оценивают по
результатам определения времени свертывания крови, протромбино¬
ною времени, АЧТВ, тромбинового времени и фибриногена.
Время свертывания крови представляет собой скрининговый тест,
позволяющий наблюдать за протеканием свертывания крови (коагу¬
ляционного каскада) в пробирке или специальной стеклянной трубке.
1’сзультат теста выражается в минутах и секундах.
Протромбиновое время, АЧТВ и тромбиновое время дают возмож¬
ность оценить способность крови образовывать фибрин в результате
искусственного запуска в пробирке свертывающего каскада. Во всех
этих анализах измеряют время, необходимое для формирования сгус¬
тка фибрина в плазме крови, взятой у больного, после добавления
тою или иного реактива, который запускает свертывающий каскад.
422
Глава 6. Исследование свертывающей системы крови
Результаты выражаются в секундах. При определении протромби-
нового времени в плазму добавляют тромбопластин (фактор III),
который запускает внешний путь свертывания крови. Поэтому опре¬
деление ПВ — это тест для проверки функционального состояния
внешнего и общего пути. Дефицит фактора свертывания любого из
этих двух путей (VII, X и V, протромбина и фибриногена) проявляется
удлинением времени формирования сгустка выше нормы. У такого
пациента в результате анализа, полученного в лаборатории, протром-
биновое время будет удлинено.
Аналогичным образом, добавляя активатор внутреннего пути
свертывания крови к плазме пациента, определяют АЧТВ, АЧТВ поз¬
воляет оценить состояние внутреннего и общего пути свертывания
крови, в этом случае удлинение АЧТВ указывает на дефицит одного
или более факторов внутреннего и/или обшего пути.
При выполнении теста по определению тромбинового времени
в плазму крови пациента добавляют тромбин. Этот тест позволяет
оценить функциональное состояние конечной стадии общего пути —
превращения фибриногена в фибрин. Удлинение указывает на дефи¬
цит фибриногена (фактор 1). Если протромбиновое время, АЧТВ и
тромбиновое время в норме, можно утверждать, что свертывающий
каскад работает нормально. Вместо тромбинового времени можно
непосредственно определить в плазме концентрацию фибриногена
количественно.
6.2.3.1. Время свертывания крови
Методика выполнения теста время свертывания крови по Сухареву.
Кровь берут из пальца в чистый сухой капилляр Панченкова. Первую
каплю крови удаляют тампоном, затем в капилляр набирают столбик
крови высотой 25—30 мм и переводят ее в середину капиллярной труб¬
ки. Включают секундомер и через каждые 30 с наклоняют капилляр
под углом 30-45“. Кровь свободно перемещается внутри капилляра.
С началом свертывания ее движение замедляется. В момент полного
свертывания кровь перестает двигаться. Начало свертывания крови у
здорового человека от 30 с до 2 мин, конец от 3 до 5 мин.
Время свертывания крови является ориентировочным показа¬
телем состояния многоступенчатого коагуляционного каскада, в
результате которого растворимый фибриноген переходит в нераст¬
воримый фибрин. Данный показатель характеризует процесс свер¬
тывания в целом (состояние внутреннего, внешнего и общего путей
h.2. Лабораторные тесты, используемые для оценки свертывающей... 423
гпсртывания крови) и не дает возможности выявить механизмы его
нарушения. Вместе с тем время свертывания крови может укорачи-
пагься только в результате ускорения образования кровяной про-
(ромбиназы, вследствие попадания в кровь тромбопластина (фак-
iDpbi ÏII). Поэтому укорочение времени свертывания крови часто
обусловлено появлением в ^ровяносном русле тканевого тромбоплас-
1ипа при механических повреждениях тканей, ожогах, обширных
операциях, переливании несовместимой крови, сепсисе, васкулите
и др. Укорочение времени свертывания свидетельствует о необходи¬
мости профилактики гиперкоагуляции, которая нередко угрожает
I ромбозом и тромбоэмболией.
Время свертывания крови существенно увеличивается при врож-
iictiHOM или приобретенном дефиците факторов протромбинообразо-
вания (прежде всего VIII, IX и XI), повышении в крови концентрации
ммтикоагулянтов, а также продуктов разрушения фибриногена и
фибрина.
6.2.3.2. Протромбиновое время
Протромбиновое вре.мя характеризует состояния внешнего и обще¬
го путей коагуляционного каскада свертывания крови. Нормальное
протромбиновое время для взрослых составляют 11-15 с, для ново¬
рожденных — 13-18 с.
Увеличение протромбинового времени говорит о наклонности к
I ипокоагуляции, атакже зависит от различных причин.
• Недостаточность одного или нескольких факторов протромбино¬
вого комплекса, которая наблюдается при таких редких наследс¬
твенных коагулопатиях, как гипопроконвертинемия (дефицит
фактора VIT) и гипопротромбинемия (дефицит фактора II);
• Отмечаемое иногда при амилоидозе увеличение протро.мбиново¬
го времени связано с дефицитом фактора X, который поглощается
амилоидом, а при нефротическом синдроме — с дефицитом фак¬
торов VII и V, которые выделяются с мочой.
• Синтез факторов протромбинового комплекса происходит в клет¬
ках печени, при заболеваниях которой количество их снижается
и протромбиновое время в определенной степени может служить
показателем функционального состояния печени. Увеличение
протромбинового времени отмечается при остром и хроническом
гепатите, циррозах печени, при подострой дистрофии печени и
других поражениях паренхимы печени и является плохим про¬
424
Глава 6, Исследование свертывающей системы крови
гностическим признаком. При этом причиной увеличения про-
тромбинового времени может явиться и развивающееся в резуль¬
тате уменьшения поступления желчи в кишечник нарушение
всасывания витамина К, который необходим для синтеза факто¬
ров протромбинового комплекса. Такова же причина увеличения
протромбинового времени и при механической желтухе.
• Энтеропатия и кишечные дисбактериозы, ведущие к недоста¬
точности витамина К, также могут сопровождаться увеличением
протромбинового времени.
• При лечении антагонистами витамина К ~ антикоагулянтами
непрямого действия - нарушается конечный этап синтеза факторов
протромбинового комплекса и протромбиновое время удлиняется.
■ Потребление факторов протромбинового комплекса при остром
ДВС-синдроме приводит к довольно раннему увеличению про¬
тромбинового времени (в 2 раза и более).
• При хроническом панкреатите, раке поджелудочной железы и жел¬
чного пузыря увеличение протромбинового времени может быть
результатом поражения печени и/или развития ДВС-синдрома.
• Афибриногенемия, гипофибриногенемия (снижение содержания
в крови фибриногена до 1 г/л и ниже), а также избыточное содер¬
жание гепарина в крови вызывают увеличение протромбинового
времени.
• Удлинение протромбинового времени выявляется при острых и
хронических лейкозах вследствие развития ДВС-синдрома.
• Повышение уровня антитромбина или антитромбопластина в
крови также приводят к удлинению протромбинового времени;
• Лекарственные средства — ацетогексамид, анаболические сте¬
роиды, антибиотики, ацетилсалициловая кислота (в больших
дозах), слабительные средства, метотрексат, никотиновая кисло¬
та, хинидин, хинин, тиазидные диуретики, толбутамид способны
удлинять протромбиновое время.
Укорочение протромбинового времени говорит о наклонности к
гиперкоагуляции и может быть отмечено в начальных стадиях тром¬
боза глубоких вен нижних конечностей, при полицитемии, в послед¬
ние месяцы беременности.
6.2.З.З. Активированное частичное тромбопластиновое время
АЧТВ — один из наиболее ценных общих тестов, выявляющий
исключительно плазменные дефекты внутренней системы актива-
b.2. Лабораторные тесты, используемые для оценки свертывающей... 425
НИИ фактора X свертывания крови. Нормальные величины АЧТВ
составляют 25-35 с. Удлинение АЧТВ отражает дефицит плазмен¬
ных факторов (кроме VII и Х111) и наблюдается при их значитель¬
ном (ниже 25—10%) снижении в плазме. Удлинение АЧТВ указыва¬
ет на гипокоагуляцию.
Удлинение АЧТВ наблюдается при дефиците факторов VIII, IX, XI,
.\ 11 свертывания в плазме) Дефицит может быть наследственным или
(чаше) приобретенным в результате заболевания. Из наследственных
форм патологии наиболее часто встречается и сопровождается выра¬
женной кровоточивостью дефицит фактора VIII или IX, что характер¬
но для гемофилии.
Развитие гемофилии А обусловлено врожденным недостатком фак¬
тора VIII. Дефект находится в гене, кодирующем синтез фактора VIИ.
Мри этом в крови больных фактора VIII или нет, или он находится в
((»ункционально неполноценной форме, которая не может принимать
участия в свертываемости крови.
Гемофилия А — наследственное заболевание, однако у 20-30%
больных гемофилией семейный анамнез со стороны родствен¬
ников матери никакой информации не дает. При гемофилии
внешний и общий пути свертывающего каскада не страдают,
поэтому протромбиновое время в норме. Однако АЧТВ, харак-
гсризующее состояние внутреннего пути, который зависит от
мзличия в плазме фактора VIII, удлиняется. В связи с этим опре-
11сление АЧТВ имеет большую клиническую ценность для диа¬
гностики гемофилии. При выраженном дефиците фактора VIII
без заместительной терапии больные подвержены риску опасных
для жизни кровотечений, у больных с легкой формой и носителей
гемофилии А клинические проявления заболевания возникают
голько после травм и хирургических вмешательств. Определение
ЛЧТВ играет важнейшую роль в диагностике гемофилии В (дефи¬
цит фактора IX — болезнь Кристмаса). Эта более редко встречаю¬
щаяся форма гемофилии также представляет большую опасность
для больного.
Большинство факторов свертывания синтезируются в печени.
Сих дефицитом связывают большинство кровотечений при заболе¬
ваниях печени (острый и хронический гепатит, цирроз). При тяжелых
заболеваниях печени протромбиновое время и АЧТВ увеличиваются.
Однако протромбиновое время является более чувствительным тес-
гом для оценки поражения печени, чем АЧТВ.
426
Глава 6. Исследование свертывающей системы крови
Все состояния, связанные с дефицитом витамина К, приводят не
только к удлинению протромбинового времени, но и АЧТВ,
Укорочение АЧТВ свидетельствует о преобладании гиперкоагуля¬
ции и отмечается в первой (гиперкоагуляционной) фазе острого ДВС-
синдрома. При развитии фазы гипокоагуляции АЧТВ увеличивается.
Афибриногенемия (отсутствие фибриногена) и гипофибриногенемия,
как врожденные, так и связанные с тяжелыми поражениями печени,
сопровождаются удлинением АЧТВ.
6.2.З.4. Тромбиновое время
Тромбиновое время — время, необходимое д.тя образования
сгустка фибрина в плазме при добавлении к ней тромбина. Оно
зависит только от концентрации фибриногена и активности инги¬
биторов тромбина и оценивает общий путь коагуляционного
каскада — образование фибрина, а также наличие в плазме крови
антикоагулянтов. В норме тромбиновое время в плазме крови
составляют 12-16 с.
В клинической практике определение тромбинового времени чаще
всего преследует следуютцис пели:
• контроль за гепаринотерапией;
* контроль за фибринолитической терапией;
♦ диагностика гиперфибринолитических состояний;
• диагностика афибриногенемии и дисфибриногенемии.
Тромбиновое время, являясь косвенным показателем содержания
фибриногена, удлиняется при наследственных и приобретенных
афибриногенемиях и гипофибриногенемиях (тяжелые поражения
печени, фибринолиз, острый ДВС-синдром). Удлиняется тромбино¬
вое время и при парапротеинемиях.
Определение тромбинового времени является одним из рас¬
пространенных методов контроля за лечением гепарином и фиб-
ринолитиками. В этих случаях тромбиновое время должно увели¬
чиваться в 2—3 раза. При проведении тромболитической терапии
определение тромбинового времени рекомендуется проводить
каждые 4 4.
6.2.3.5. Фибриноген
Фибриноген (фактор I) — белок, синтезирующийся в основном
в печени. В крови он находится в растворенном состоянии, но в
6.2. Лабораторные тесты, используемые для оценки свертывающей... 427
I
результате ферментативного процесса под воздействием тромбина
и фактора ХШа может превращаться в нерастворимый фибрин.
Референтные величины концентрации фибриногена в плазме при¬
ведены в табл. 6-2.
Таблица 6-2.
Референтные в^нчины фибриногена в плазме
Возрастные группы
Новорожденные
Пзрослые
Концентрация фибриногена
М|/ДЛ
125-300
200-400
г/л
1,25-3,00
2,00-4,00
Фибриноген является белком острой фазы, и его уровень в плазме
повышается при инфекции, воспалении, травме и стрессе. Синтез
«фибриногена стимулируется гормонами (инсулин, прогестерон), жир-
ными кислотами и продуктами деградации фибриногена. Уровень
«фибриногена в плазме повышен у курильщиков, больных сахарным
диабетом. С повышением уровня фибриногена увеличивается риск
сердечно-сосудистых заболеваний, У женщин уровень фибриногена
ыяше, чем у мужчин, и у них более заметно его увеличение с возрас-
юм.
Повышение концентрации фибриногена или ее снижение отме¬
чено при следующих состояниях и заболеваниях:
• гиперкоагуляции при различных стадиях тромбоза, инфаркте
миокарда, а также в последние месяцы беременности, после
родов, после хирургических операций;
• воспалительных процессах, в частности, пневмонии; в связи
с этим используют определение концентрации фибриногена
в плазме параллельно с определением СОЭ для контроля за
течением воспалительного процесса;
• неопластических процессах, особенно раке легкого;
• легких формах гепатита (концентрация фибриногена может быть
повышена); тяжелые поражения печени (острый гепатит, цирроз)
сопровождаются снижением концентрации фибриногена;
• наследственных афибриногенемиях и гипофибриногенемиях,
первичном фибринолизе (концентрация фибриногена снижена);
• ДВС-синдроме.
428 Глава 6. Исследование свертывающей системы крови
6.3. ТЕСТЫ ДЛЯ ДИАГНОСТИКИ ТРОМБОЗОВ ГЛУБОКИХ
ВЕН И ТРОМБОЭМБОЛИИ ЛЕГОЧНОЙ АРТЕРИИ
Тромбозы глубоких вен нижних конечностей являются доволь¬
но распространенными заболеваниями и могут приводить к одно¬
му из наиболее опасных для жизни осложнений — тромбоэмболии
легочной артерии (ТЭЛА). Многие пациенты имеют повышенный
риск тромбоза глубоких вен нижних конечностей и соответс¬
твенно ТЭЛА. Повышен риск развития тромбоза глубоких вен у
тучных и пожилых людей, а также у беременных. Нередко тромбоз
глубоких вен развивается у больных после перенесенного инсульта
в период нахождения в палате интенсивной терапии, после обшир¬
ных хирургических вмешательств. Пациенты с сердечно-сосудис¬
тыми заболеваниями также подвержены риску развития тромбоза.
Клинически выраженные тромбоэмболические расстройства раз¬
виваются у 15% пациентов с онкологическими заболеваниями.
ТЭЛА — это окклюзия (закупорка) артериального русла легких
тромбом, первично образовавшимся в глубоких венах нижних
конечностей либо в полостях правого отдела сердца и мигрировав¬
шим в сосуды легких с током крови, в большинстве случаев (около
80—90%) причиной развития ТЭЛА является тромбоз глубоких вен
нижних конечностей.
ТЭЛА —- одно из наиболее распространенных и грозных
осложнений многих заболеваний, послеоперационного и пос¬
леродового периодов, неблагоприятно влияющее на их течение
и исход.
Своевременная диагностика ТЭЛА представляет значительные
трудности в связи с вариабельностью развивающихся клини¬
ческих синдромов, невозможностью использовать в ряде лечеб¬
ных стационаров высокоинформативных методов исследования
(перфузионная спинтиграфия легких, ангиопульмонография),
внезапностью развития и катастрофической быстротой течения
заболевания. При этом летальность среди нелеченых пациентов
достигает 30%, при рано начатой терапии антикоагулянтами она
не превышает 10%.
В настоящее время основным и первоначальным исследованием,
которое должно быть назначено больному при подозрении на наличие
ТЭЛА, является лабораторный тест на определение уровня О-димера
в плазме крови.
6.4, Тесты для контроля антикоагулянтной терапии 429
6.3.1. О-ДИМЕР
О-димеры представляют собой фрагменты, образующиеся в плаз¬
ме крови при расщеплении возникших внутри сосудистого русла
волокон фибрина. Поэтому появление в плазме крови В-димера
свидетельствует о том, что внутри сосудистого русла идут процессы
I ромбообразования. Повышенное содержание фрагмента фибрина —
1)-димера является одним из главных маркеров (указателей) актива¬
ции системы гемостаза, поскольку отражает образование фибрина
в исследуемой крови. В норме содержание О-димера в плазме крови
составляет меньше 0,25 мкг/мл (250 мкг/л).
Определение содержания в плазме В-димера используется для
исключения тромбоза любой локализации и диагностики ДВС-син-
дрома. В настоящее время разработаны тесты для количественного
«)11 ределения В-димера с помощью приборов, а также качественные
экспресс-тесты. Для количественного определения В-димера доста-
I очно нескольких минут, что имеет важное значение для диагностики
I а кого быстро развивающегося состояния, как ТЭЛА. У пациентов с
I ЭЛА тест положителен в 95-98% случаев.
6.4. ТЕСТЫ ДЛЯ КОНТРОЛЯ
АНТИКОАГУЛЯНТНОЙ ТЕРАПИИ
Антикоагулянтная терапия широко используется для лече¬
ния и профилактики различных тромбозов и их осложнений.
ЛI ітикоагулянтьт оказывают выраженное влияние на многие факторы
коагуляционного каскада, увеличивая риск развития кровотечений.
Поэтому контроль за лечением антикоагулянтами имеет жизненно
Н11ЖН0С значение. Регулярное определение протромбинового време¬
ни и АЧТВ — два основных лабораторных теста, которые позволяют
следить за результатами антикоагулянтной терапии,
Антикоагулянты, которые наиболее часто используются в лече¬
нии и профилактике тромбозов, делятся на прямые (гепарин), реа¬
лизующие свой эффект, непосредственно воздействуя на факторы
коагуляционного каскада (ингибируя их активность), и непрямые —
нмтагонисты витамина К, нарушающие синтез факторов с участием
пи гамина К в печени. Непрямые антикоагулянты принимаются через
430
Глава 6. Исследование свертывающей системы крови
рот, поэтому называются оральными антикоагулянтами. В России
применяют оральные антикоагулянты дикумарин, неодикумарин,
синкумар, фенилин, пелентан. В западных странах используется
непрямой антикоагулянт варфарин. АЧТВ определяют для оценки
гепаринотерапии, а протромбиновое время — для контроля за лече¬
нием непрямыми антикоагулянтами.
6.4.1. ПРЯМЫЕ АНТИКОАГУЛЯНТЫ (ГЕПАРИНОТЕРАПИЯ)
Обнаружение по результатам лабораторных исследований призна¬
ков гиперкоагуляции (укорочение времени свертывания крови, про¬
тромбинового времени, АЧТВ) является показанием для назначения
препаратов гепарина.
До введения в широкую клиническую практику гепарина при
тромбозе глубоких вен нижних конечностей лечение включало пос¬
тельный режим, возвыпюнное положение ноги, применение пиявок
и теплых носков. Обычно лечение продолжалось 4—8 нед, в течение
которых тромбоз вен голени распространялся на бедро в 80% случа¬
ев, на другую ногу в 20%; в 28% возникала тромбоэмболия легочной
артерии, каждая 3-я из которых была фатальной. У большинства из
выживших больных развивались осложнения с хроническим отеком,
цианозом, часто обеих ног, приводящие к потере трудоспособности.
Гепарин был открыт в 1918 г. как вещество, ингибирующее коа¬
гуляцию, причем выраженность ингибирующего эффекта прямо
зависела от концентрации этого вещества в крови. Вещество назвали
гепарином, так как его максимальная концентрация была обнаружена
в печени. В настоящее время гепаринотерапия — это наиболее рас¬
пространенный ичасто применяемый в клинической практике метод
лечения больных тромбозами.
Геморрагические осложнения при лечении гепарином встречают¬
ся нечасто, тем не менее они представляют угрозу жизни больного.
Поэтому проведение современной антикоагулянтной терапии невоз¬
можно без надлежащего лабораторного контроля за состоянием сис¬
темы гемостаза. Для контроля за адекватностью проводимой терапии
необходимо 2 раза в сут определять время свертывания крови или
АЧТВ. При исследовании времени свертывания крови доза и введение
гепарина должны подбираться таким образом, чтобы поддерживать
этот показатель в пределах 15—23 мин, а АЧТВ в 2—3 раза выше нормы.
6.4. Тесты для контроля антикоагулянтной терапии 431
6.4.2. НЕПРЯМЫЕ АНТИКОАГУЛЯНТЫ, ПРОТРОМБИНОВОЕ ВРЕМЯ,
МЕЖДУНАРОДНОЕ НОРМАЛИЗОВАННОЕ ОТНОШЕНИЕ
Определению протромбинового времени отводится ведущая роль
в контроле за терапией непрямыми антикоагулянтами. Результаты
исследования традиционно выражаются в секундах. Напомним,
■по при лабораторном ойределснии противотромбинового време¬
ни к плазме пациента добавляют активатор свертывания крови —
громбопластин (фактор III). Поэтому протромбиновое время зави¬
сит от качества (чувствительности) используемого для этих целей
I ромбопластина. Если в лаборатории (или лабораториях) сегодня
используется один тромбопластин, а завтра — другой, то про-
громбиновое время у пациента будет отличаться. Для того, чтобы
исключить влияние тромбопластина на результаты определения
протромбинового времени, применяют показатель — междуна¬
родное нормализованное отношение (МНО). Этот показатель дает
возможность выразить результаты протромбинового времени, при¬
няв во внимание различную активность тромбопластина, который
используется для анализа в разных лабораториях. В результате МНО
обеспечивает возможность сравнения результатов, полученных
в разных лабораториях, и гарантирует более точный контроль за
лечением непрямыми антикоагулянтами. Показатель МНО рассчи¬
тывают путем деления протромбинового времени (ПВ) пациента на
нормальное или контрольное ПВ, затем результат возводят в сте¬
пень, показатель которой равен международному индексу чувстви-
гсльности (МИЧ) тромбопластина, используемого в лаборатории
мри проведении анализа:
МНО пациента =
ПВ пациента (с)
ПВ контроля (с)
Основная задача мониторинга приема непрямых антикоагулян¬
гов — предупреждение кровотечения. Доза антикоагулянта должна
быть подобрана таким образом, чтобы поддерживать МНО на необ¬
ходимом уровне, зависящем от характера заболевания. У большин¬
ства больных МНО необходимо поддерживать на уровне 2,0-3,0.
И некоторых случаях МНО должны быть выше (табл. 6-3).
432
Глава 6. Исследование свертывающей системы крови
Таблица 6-3.
Рекомендуемые уровни антикоагулянтов в МНО при различных заболеваниях
Клиническое состояние
Рекомендуемое МНО
Профилактика тромбоза глубоких вен
2,0-3,0
Лечение тромбоза глубоких вен и легоч¬
ной тромбоэмболии
2,0-3,0
Возвратный тромбоз глубоких вен,
легочная тромбоэмболия
2,0-3,0
Протезы сердечных клапанов из собс¬
твенной ткани
2,0-3,0
Механические протезы сердечных кла¬
панов
2,5-3,5
Сосудистые заболевания, включая
инфаркт миокарда
3,0-4,5
Больным, получающим непрямые антикоагулянты, МНО необхо¬
димо определять каждые 2-3 нед.
Глава 7.
ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
>
Иммунная система — относительно самостоятельная структур¬
но-функциональная система организма, контролирующая клеточ¬
ный и гуморальный состав его биологических жидкостей и тканей.
Основная функция иммунной системы состоит в защите организма
0 [ чужеродных агентов и от измененных потенциально опасных собс-
1 венных компонентов. Термин «иммунный» происходит от латинско¬
го «свободный от».
Иммунные реакции направлены на поддержание постоянства
внутренней среды организма, нарушаемого поступлением в него
микробов, вирусов, а также других чужеродных веществ — животного
II растительного происхождения. Эти реакции носят приспособитель¬
ный характер, но в силу некоторых причин могут нарушаться, вызы-
ввя повреждение собственных структур клеток и, как следствие этого,
аутоиммунные и аллергические заболевания.
7.1, ОБЩИЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ
И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ
Иммунная система представлена совокупностью органов и тканей,
среди которых выделяют центральные, где происходит созревание
лимфоцитов, и периферические, где находятся зрелые лимфоциты.
к центральным органам иммунной системы относятся костный
мозг и тимус (вилочковая железа).
Костный мозг. Все клетки иммунной системы происходят из ство¬
ловых клеток костного мозга, которые разделяются на лимфоциты,
1'ранулоциты, моноциты, эритроциты и метакариоииты, В костном
мозге происходят раннее, антигеннезависимое созревание и диффе-
рснцировка части лимфоцитов. Эти лимфатические клетки, находя¬
щиеся или поступившие в кровь и ткани из костного мозга, относятся
к В-лимфоцитам (В — начальная буква от английского названия кос¬
тного мозга — Ьопе-тагго\у).
434
Глава 7. Иммунологические исследования
Тимус расположен в грудной клетке между грудиной и трахеей. Его
масса у новорожденных составляет 10-15 г, в 9-12 лет масса вилочко-
вой железы достигает максимума — 30-40 г, после чего рост прекра¬
щается, а в 25—27 лет она начинает медленно атрофироваться.
Тимус буквально заполнен лимфоцитами, которые поступают в
него из костного мозга. Из стволовых кроветворных клеток кост¬
ного мозга формируются стволовые лимфоидные клетки — пред¬
шественники Т-лимфоцитов. Последние мигрируют в тимус, где
под влиянием гормонов тимуса (тимозина) и происходит их окон¬
чательная дифференцировка в зрелые Т-лимфоциты. В тимусе
клетки на 90—95% представлены Т-лимфоцитами. Клетки, находя¬
щиеся в самом тимусе или поступившие в кровь и ткани из тимуса,
называются Т-лимфоцитами (Т — начальная буква от английского
названия тимуса — гЬутиз).
Таким образом, в тимусе происходит превращение лимфоцитов
в им му некомпетентные клетки, которые участвуют в иммунном
ответе. Часть лимфоцитов остается в костном мозге, где формируется
популяция клеток, которая в дальнейшем поступает в лимфатические
узлы и селезенку, пейеровы бляшки кишечника, миндалины и другие
лимфоидные органы.
Периферические органы иммунной системы — это периферические
лимфатические узлы, селезенка, лимфатические фолликулы желу¬
дочно-кишечного тракта. Они связаны между собой кровеносными
и лимфатическими сосудами. Перемещаясь по этим сосудам, лимфо¬
циты получают информацию об антигенах (чужих и собственных) и
передают ее во все органы иммунной системы.
Лимфатические узлы — периферические органы иммунной сис¬
темы, расположенные по ходу лимфатических сосудов. Они задер¬
живают антигены (например, бактерии) и предотвращают их
распространение. Морфологически лимфоузлы состоят из стромы
(рыхлая соединительная ткань) и паренхимы, в которой различа¬
ют корковое и мозговое вещество. Корковое вещество содержит
лимфатические фолликулы, состоящие в основном из В-лимфо-
цитов. Т-лимфоциты расположены преимущественно в паракор-
тикальной зоне.
Селезенках задерживает и уничтожает антигены, циркулирующие в
крови. Лимфоидная ткань селезенки представлена островками белой
пульпы, которые, подобно лимфоузлам, имеют фолликулярное стро¬
ение и разделены на В- и Т-зависимые зоны.
7. /. Общие представления о структуре и функции иммунной... 435
Лимфатические фолликулы желудочно-кишечного тракта — это небные
миндалины, собственно лимфатические фолликулы и пейеровы
Ил ЯШКИ кишечника. Лимфатические фолликулы также разделены на
И- и Т-зависимые зоны.
Клетки иммунной системы
Центральной клеткой иммунной системы является лимфонит.
в зависимости от разме}^а лимфоциты делятся на малые, средние
и большие, в периферической крови встречаются преимущественно
малые и, редко, средние лимфоциты. Лимфоциты составляют 30—40%
иссх лейкоцитов крови. Они поистине вездесущи и перемещаются по
псом тканям организма. Большое их количество сосредоточено в сли¬
зистой оболочке зева и кишечника. Перемещаясь из тканей в кровоток
и обратно, лимфоциты осуществляют своеобразный «надзор» за клеточ-
тлм составом периферических органов и тканей. Лимфоциты содержат
рецепторы, позволяющие каждой клетке распознавать отдельный анти-
I си и реагировать на него. Они делятся на Т- и В-лимфоциты, Т-лим-
«фоциты составляют 70—80%, а В-лимфоциты — 10—15% лимфоцитов
крови. Оставшиеся лимфоциты называются нулевыми клетками.
Способность человека противостоять атаке микроорганизмов
(прежде всего бактерий и вирусов) в значительной степени зависит
<1Т выработки антител. Из лимфоцитов под действием определен¬
ных антигенов, могут образовываться плазматические клетки, кото¬
рые в свою очередь служат основным источником синтеза антител.
Антитела — это белки, иммуноглобулины, которые связываются с
бактериями и вирусами и нейтрализуют их. Каждое антитело спец и-
«фично, т.е. оно способно связываться только с одним видом бактерий
или вирусов и не действует на другие. Эта особенность обусловле¬
на природой молекул, находящихся на поверхности каждого вида
бактерий или вирусов. Такие молекулы называются антигенами.
Распознавание лимфоцитами специфических бактериальных или
вирусных антигенов запускает продукцию специфических антител.
С’иособность организма вырабатывать антитела к чужеродным моле¬
кулам не ограничивается антигена.ми, находящимися на поверхности
бактерий и вирусов. Белки и другие вещества на поверхности любых
НС своих клеток рассматриваются как антигены и вызывают продук¬
цию антител. Такой ответ, напри.мер, имеет место при отторжении
пересаженной почки после трансплантации. Таким образом:
• антиген — любое вещество (чаще белок, но может быть и угле¬
вод), вызывающее выработку антител лимфоцитами; антигены
436
Глава 7. Иммунологические исследования
преимущественно (но не обязательно) находятся на поверх¬
ности клеток;
• антитело — это белок (иммуноглобулин), который циркулиру¬
ет в плазме крови и связывается с антигеном, вызвавшим его
образование.
Когда антитело связывается с антигеном, находящимся на повер¬
хности бактерии, вируса или тканевой клетки, это неизбежно приво¬
дит к разрушению такой клетки.
Помимо лимфоцитов, к клеткам иммунной системы относятся
фагоциты.
Фагоциты — это макрофаги, моноциты, гранулоциты, которые
мигрируют в очаг воспаления, проникая в ткани сквозь стенки
капилляров. Они обладают способностью поглощать и переваривать
чужеродные антигены.
Все макрофаги образуются из стволовой клетки костного мозга.
Непосредственными же их предшественниками являются моноци¬
ты периферической крови. Образовавшись в костном мозге, моно¬
циты первоначально устремляются в кровеносное русло, откуда
обычно через 1—2 сут переходят в органы и ткани, где замешают
отслужившие свой срок макрофаги, либо перемешаются в область
воспаления у больного человека. Макрофаги могут стимулировать
другие клетки, например, фибробласты, способные синтезировать
волокнистые структуры соединительной ткани — коллаген, кото¬
рый затягивает раны.
Макрофаги представляют собой большие клетки, играющие важ¬
ную роль в формировании неспецифического иммунитета. Часть мак¬
рофагов постоянно находится в кровеносном русле и лимфатической
системе, но большинство ведет «оседлый образ жизни», сосредоточив¬
шись в селезенке, лимфатических узлах, печени и других тканях.
Основная функция макрофагов — очищение организма от бак¬
терий, вирусных частиц, продуктов распада собственных тканей,
токсинов, остатков эритроцитов, отживающих клеток, аллергенов
белковой природы и т.д. Основной механизм, который используют
макрофаги для реализации своих функций, — поглощение (фаго¬
цитирование) разнообразного материала — от бактерий до молекул
химических красителей. В связи с такой способностью макрофаги
называют также фагоцитами. Для поглощения и переваривания
чужеродных веществ в макрофаге существует специальный аппа¬
рат, состоящий из вакуолей, лизосом, заполненных высокоак-
7.1. Общие представления о структуре и функции иммунной... 437
1ИВНЫМИ ферментами, расщепляющими белки, жиры, углеводы
и нуклеиновые кислоты, т.е. те компоненты, из которых состоят
чужеродные антигены (бактерии, вирусы и др.).
Иммунные функции выполняют и многие другие клетки крови.
Гак, моноциты и нейтрофилы фагоцитируют и выводят из организма
чужеродные клетки и вещества, эозинофилы играют важную роль
И зашите от гельминтов ^ простейших, базофилы и тучные клетки
участвуют в организации очага воспаления. Клетки кожного и ели-
1ИСТ0Г0 покрова создают механический и иммунологический барьер
на пути проникновения болезнетворных агентов.
В иммунных реакциях участвуют многие гуморальные факторы
ыщиты, такие, как система комплемента, ферменты — лизоцим,
муцин, белки острой фазы (С-реактивный белок) и др.
И ммунные механизмы отражают действие взаимосвязанных между
собой клеток, тканей и органов, совокупность которых и называется
иммунной системой. Оптимальный иммунный ответ реализуется
[олько при взаимодействии клеточного, гуморального и неспецифи-
чоских звеньев иммунитета.
КЛЕТОЧНЫЕ ФАКТОРЫ ИММУНИТЕТА
Клеточный иммунитет представлен различны.ми популяциями
Г- и В-лимфоцитов, соотношение которых играет важную роль в оцен¬
ке состояния этого звена иммунитета. Их родоначальником являются
стволовые лимфоидные клетки, в последующем дифференцирующи¬
еся (превращающиеся) в тимусе в Т-лимфоциты, а в костном мозге —
в В-лимфоциты (в этих органах происходит созревание лимфоцитов).
В-клетки называют костномозговыми, так как стволовые клетки
костного мозга, взаимодействуя с клеточным микроокружением,
трансформируются в В-лимфоциты непосредственно в костном мозге.
С'огласно современным представлениям, развитие В-лимфоцитов
проходит стадийно от стволовой клетки к ранним и поздним пред¬
шественникам и, наконец, к зрелой клетке. В-лимфоциты участвуют
в выработке антител.
В состав Т-лимфоцитов входят клетки, выполняющие различные
(функции в иммунном ответе. Одни Т-лимфоциты помогают опре¬
деленным В-лимфоцитам вырабатывать специфические антитела к
цмтигенам. Они получили название Т-лимфоцитов-помощников или
438
Глава 7. Иммунологические исследования
хелиеров (от англ, help — помощь). Другие лимфоциты принимают
активное участие в развитии аллергических реакций — Т-лимфоци-
ты-эффекторы. Наконец, третья группа лимфоцитов — Т-лимфоци¬
ты-супрессоры, участвует в подавлении иммунных реакций. В насто¬
ящее время известны и многие другие популяции Т-лимфоцитов.
Т-лимфоциты несут на своей поверхности маркеры — антиге¬
ны. Антигены клеточной поверхности лимфоцитов, выявляемые в
лаборатории с помощью моноклональных антител к ним, принято
называть кластерами дифференцировки и обозначать латинскими
буквами CD. CD нумеруются по мере их выявления (открытия).
Поэтому нередко вместо названия клона Т-лимфоцитов лабора¬
тория в бланке результата анализа указывает их условное обоз¬
начение. Например, Т-лимфоциты-хелперы обозначаются CD4,
Т-лимфоциты-супрессоры — CD8. Т-лимфоциты выступают в
роли первичных стимуляторов В-лимфоцитов и моноцитов крови,
тканей. Это достигается либо посредством выделения ими гумо¬
ральных факторов (интерлейкинов и лимфокинов), либо путем
прямого контакта с В-клетками.
Таким образом, популяция Т-лимфоцитов подразделяется на три
основных подкласса: хелперы (помощники), супрессоры (подавители)
и эффекторы, оказывающие цитотоксическое действие на чужерод¬
ные клетки, зрелые Т-лимфоциты отвечают за реакции клеточного
иммунитета и осуществляют иммунологический надзор за антиген¬
ным гомеостазом в организме,
В-лимфоциты, в отличие от Т-лимфоцитов, служат основными
клетками, обеспечивающими формирование гуморального иммуни¬
тета. В процессе иммунного ответа они дифференцируются в плаз¬
матические клетки, способные синтезировать антитела — иммуног¬
лобулины. В-лимфоцитьт ведут «оседлый образ жизни», в основном в
периферических лимфоидных органах-
Зрелъте Т-лимфоииты мигрируют с кровотоком во вторичные
лимфоидные органы, лимфатические узлы. В лимфатических узлах
в ответ на контакт с любым антигенным стимулом (например, бак¬
териями) происходят активация и пролиферация Т-лимфопитов с
преимущественным размножением определенного клона клеток,
имеющего рецепторы к внедрившимся антигенам. Резкое увеличе¬
ние специфического клона Т-лимфоцитов отмечается на 7—9-е сут
при первичном иммунном контакте с чужеродным антигеном или на
4-5-е сут при вторичном иммунном контакте.
7. /. Общие представления о структуре и функции иммунной... 439
Т-лимфоциты выполнягот в организме две важные функции:
иффекторную и регуляторную. Эффекторная функция Т-лимфоцитов
состоит в уничтожении специфических чужеродных клеток и антиге¬
нов. Главными исполнителями этой функции являются цитотокси-
ческие Т-лимфоциты (Т-супрессоры). Регуляторная функция (систе¬
ма Т-хелпсрьт—Т-супрессоры) состоит в контроле за интенсивностью
ра звития специфической рЬакции иммунной системы на чужеродные
антигены. Т-хелперы усиливают, а Т-супрессоры угнетают иммунный
ответ. Поэтому для оценки выраженности иммунного ответа рассчи-
імвают индекс Т-хелперы/Т-супрессоры.
Зрелые В-лимфоциты мигрируют из костного мозга в перифе¬
рические лимфоидные органы и ткани, где под влиянием антигена
(бактерии, вирусы) и при помощи Т-лимфоцитов и макрофагов пре¬
вращаются в зрелые плазматические клетки. Каждая из них участвует
ІІ синтезе иммуноглобулинов (антител), специфичных для данного
им гигена. При первичном контакте с определенным антигеном синтез
иммуноглобулинов начинается через 3 сут, при повторном — к концу
1-х сут. Антитела нейтрализуют токсины, продуцируемые чужерод¬
ными клетками.
Часть специфичных для данного антигена В-лимфоцитов сохраня-
С1 свою особенность многие годы. Это так называемые клетки памя¬
ти. Они могут длительно сохраняться в селезенке, лимфатических
узлах, аппендиксе, миндалинах. Однако любой повторный контакт со
знакомым ранее антигеном приводит к быстрой активации специфи¬
ческого клона В-.лимфоцитов и синтезу необходимых антител (уже к
концу 1-х сут) для уничтожения чужеродного антигена. На этих осо¬
бенностях формирования иммунного ответа основана вакцинация
против наиболее распространенных инфекционных заболеваний.
Таким образом, основной функцией В-лимфоцитов является про¬
дукция антител. Известно 5 классов иммуноглобулинов (Із; от англ.—
ltnmunoglobцИn): 1§М, 1еО, lgA, ^gD и 1§Е.
7.1.2. ГУМОРАЛЬНЫЕ ФАКТОРЫ ИММУНИТЕТА
Стимуляция В-лимфоцитов антигеном, реагирующим с повер¬
хностными рецепторами клеток и Т-лимфоцитами, приводит к
их превращению в плазматические клетки, которые продуцируют
цнтитела — иммуноглобулины.
440
Глава 7. Иммунологические исследования
Иммуноглобулины — это факторы гуморального иммунитета,
которые представляют собой сложные белки, различающиеся по
молекулярной массе, электрофоретической подвижности, содержа¬
нию углеводов и иммунологической активности.
Вес иммуноглобулины построены по общему типу. Их молеку¬
лы состоят из двух тяжелых (Н-цепи) и двух легких (Ь-цепи) цепей,
соединенных между собой. Известно 5 разных классов Н-цепей (каж¬
дый со своими особыми свойствами), соответственно имеется 5 клас¬
сов иммуноглобулинов (см.выше).
Иммуноглобулины класса О — основной вид иммуноглобулинов
в крови человека. Они составляют 75% всех им.муноглобулинов сыво¬
ротки крови, с ними связан процесс гуморальной защиты организма
человека от воздействия многих бактерий и вирусов, а также их ток¬
синов. Иммуноглобулины класса О имеют небольшую молекулярную
массу — 150 ООО Д, что обеспечивает им возможность проникать через
плаценту от матери к плоду. Определение таких специфических анти¬
тел к возбудителям инфекционных заболеваний у новорожденного'
(например, антител igG к цитомегаловирусу) создает значительные
трудности для исключения внутриутробного инфицирования.
Усиленная продукция антител плазматическими клетками
начинается лишь после повторного взаимодействия с антигеном..
У детей значительное увеличение концентрации иммуноглобули-;.
нов в крови наступает к 1,5—2 годам. При контакте с инфекцион-;
ным агентом специфические антитела 1§С начинают повышаться
в крови к концу 1-й нед, достигают пика ко 2-3-му мес и могут
сохраняться многие годы.
Иммуноглобулины класса А включают два вида специфических;!
белков; сывороточный и секреторный. Сывороточный 1зА входит |
в фракцию ЭАлобулинов и составляет до 15% иммуноглобули¬
нов сыворотки крови. Секреторный IgA содержится в секретах,,
(молоко, слюна, слезная жидкость, секреты кишечного и респира-,
торного тракта). Антитела класса 1вА синтезируются в основном
лимфоцитами слизистых оболочек в ответ на местное воздействие
антигена, осуществляют защиту слизистых оболочек от патоген¬
ных микроорганизмов, потенциальных аллергенов и аутоанти¬
генов. Связываясь с микроорганизмами, IgA-aнтитeлa тормозят
их прилипание к поверхносги клеток эпителия и препятствуют
проникновению во внутреннюю среду организма, предупрежда}
тем самым развитие хронических местных воспалительных про-Л
7. /, Общие представления о структуре и функции иммунной... 441
цессов. Локальный синтез IgA обусловливает местный иммунитет.
11роникая во внутреннюю среду организма, IgA инактивирует бак-
к-рии и вирусы, активирует систему комплемента.
Иммуноглобулины М относятся к 7-глобул и новой фракции сыво¬
ротки крови и составляют в ней около 5%. Эволюционно это самый
егарый класс иммуногдрбулинов, поэтому они первыми выраба-
гываются в ответ на острую инфекцию, осуществляя антибактери-
ильный иммунитет, к ним относятся изогемагглютинины, анти-
«юктериальные, гетерофильные антитела, ревматоидный фактор.
Иммуноглобулины М имеют большую молекулярную массу (около
900 ООО Д) и не проникают через плаценту в кровь плода. В связи с
ним обнаружение специфических антител класса IgM к определен¬
ному агенту (например, бледной спирохете) будет свидетельствовать
об инфицировании новорожденного.
Иммуноглобулины класса D выявляются в плазме крови здо¬
ровых людей в низких концентрациях. Об их функциях известно
немного. Они принимают участие в процессах дифференцировки
лимфоцитов — способны блокировать активность иммуноглобу-
л и нов других классов.
На долю иммуноглобулинов класса Е приходится около 0,2% от
иссх сывороточных иммуноглобулинов. IgE накапливается преиму¬
щественно в тканях слизистых оболочек и кожных покровов, где
сорбируются (оседают) на поверхности гучных клеток, базофилов и
эозинофилов. в результате взаимодействия IgE со специфическим
антигеном на поверхности этих клеток происходят их дегрануляция
(и1.1брос) и попадание в кровь таких биологически активных веществ,
как гистамин, серотонин, что и лежит в основе возникновения мно-
1'их аллергических состояний.
7.1.3. ФАГОЦИТОЗ И ДРУГИЕ МЕХАНИЗМЫ
НЕСПЕЦИФИЧЕСКОЙ ЗАЩИТЫ
На всякое изменение внутренней среды организма реагирует сис¬
тема фагоцитоза.
Фагоцитоз — поглощение клеткой крупных частиц, видимых в
микроскоп (например, микроорганизмов, крупных вирусов, пов¬
режденных тел клеток и т.д.) с образованием вакуоли — фагосомы.
Процесс фагоцитоза делится на две фазы. В первой частицы, под¬
442
Глава 7. Иммунологические исследования
лежащие удалению, связываются на поверхности мембраны клеток.
Во второй происходят собственно поглощение частицы клеткой и
ее дальнейшее разрушение внутри клетки. Различают две основ¬
ные группы клеток-фагоиитов: дмононуклеарные и полинуклеарные.
Полинуклеарные нейтрофилы составляют первую линию защиты
от проникновения в организм разнообразных бактерий, грибов и
простейших. Они уничтожают поврежденные и погибшие клетки,
участвуют в процессе удаления старых эритроцитов и очистке ране¬
вой поверхности. Мононуклеарные фагоциты участвуют как в разру¬
шении, так и в инициации (запуске) и стимуляции фибропластичес¬
ких процессов. Они способствуют синтезу биологически активных
вешеств и формированию иммунного ответа (путем модификации
антигенов и представления их лимфоцитам). Таким образом, клет¬
ки мононуклеарно-фагоцитарной системы играют важную роль в
инициации иммунного ответа посредством захвата антигена, пред¬
ставления его Т-лимфоцитам и секреции интерлейкина-1 (основного
активатора Т-лимфоцитов).
Показатели фагоцитоза имеют значение при комплексном анализе
и диагностике иммунодефицитных состояний: часто рецидивирую¬
щих гнойно-воспалительных процессах, длительно не заживающих
ранах, склонности кпослеоперационным осложнениям. Исследование
системы фагоцитоза помогает в диагностике вторичных иммуноде*
фицитных состояний, вызванных лекарственной терапией. В связи'
с тем, что фагоциты участвуют в элиминации (удалении) иммунных;
комплексов и активность фагоцитоза тесно связана с активностью
компонентов системы комплемента, концентрацией lgG-aнтитeл,
наличием других факторов, исследование активности фагоцитоза]
играет важную роль в диагностике, оценке эффективности терапии I
при ревматических заболеваниях, коллагснозах.
Система комплемента состоит из 9 последовательно активиру-1
ющихся компонентов (белков) и 3 ингибиторов (угнетающих ком-:
понентов). Она играет важную роль в зашите организма от всего)
чужеродного: разрушает бактериальные и инфицированные вирусами |
собственные клетки организма. Кроме того, система комплемента
имеет большое значение в усилении фагоцитоза, нейтрализации]
вирусов, а также в иммунной адгезии (прилипании), за счет которой
к некоторым клеткам, включая и В-лимфоциты, прикрепляются!
комплексы антиген-антитело. Определенные компоненты компле-?!
мента участвуют в высвобождении гистамина из тучных клеток. Эта!
7.2. Алгоритм иммунного ответа организма 443
система играет важную роль, особенно при воспалении и в развитии
усюйчивости организма к инфекционным агентам. Дефекты в сис-
1сме комплемента сопровождаются снижением антиинфекционной
резистентности организма.
Проникновение антигена в организм человека обычно вызывает
характерные реакции со ст;,ороны клеточных и гуморальных факторов
иммунной защиты. Рассмотрим основные закономерности развития
иммунного ответа организма.
7.2. АЛГОРИТМ ИММУННОГО ОТВЕТА ОРГАНИЗМА
Каждый человек отличается индивидуальной реактивностью своей
иммунной системы в отношении различных возбудителей инфекци¬
онных заболеваний. Однако несмотря на это, формируемый иммун¬
ный ответ в отношении инфекционных агентов имеет общие для всех
людей закономерности.
Иммунные факторы защиты разделяют на две категории: антиген-
исспецифические (врожденные) и антигенспецифические (приобре¬
тенные, адаптивные). Врожденные факторы зашиты неспецифичны,
действуют без участия механизмов распознавания и запоминания
С1 роения патогена (чужеродного антигена), поэтому отвечают одними
и 1ЄМИ же реакции на любой стимул при инвазии или повреждении.
Приобретенные факторы способны распознавать и запоминать осо¬
бенности молекулярной структуры патогена (чужеродного антигена), в
связи с чем при повторных контактах с ними защитный эффект может
б1>1ТЬ более быстрым и эффективным, в процессе иммунной защиты
организма от патогена антигеннеспецифические и антигенспецифичес¬
кие факторы тесно взаимосвязаны и взаимодействуют друг с другом.
К антигеннеспецифическим иммунным факторам защиты
относятся:
• клетки пограничных тканей (кожа, слизистые оболочки дыха¬
тельных путей, пищеварительного и урогенитального тракта);
• макрофаги различных органов и тканей;
• клетки крови;
• эндотелиоциты и интима артерий;
• циркулирующие и выделяемые с секретами водорастворимые
молекулы — антигеннеспецифические гуморальные факторы.
444
Глава 7. Иммунологические исследования
Неспецифический иммунитет обеспечивает однотипные и про¬
стые реакции на любые чужеродные антигены. Иначе говоря, неспе¬
цифический иммунитет — это неспецифические «антимикробные
системы, наличие которых не зависит от предварительного контакта с
антигеном. Главные клеточные компоненты неспецифического имму¬
нитета — фагоциты, а главные неклеточные — система комплемента,
цитокины, интерлейкины, С-реактивный белок и другие белковые
комплексы. Основная задача фагоцитов — захватывать и переваривать
микроорганизмы. К фагоцитам относятся нейтрофилы и моноциты,
которые присутствуют в крови, и макрофаги, которые содержатся в
тканях. Система комплемента состоит из группы сывороточных гло¬
булинов, которые, взаимодействуя в строго определенной последова¬
тельности (каскадом), разрушают как стенки микроорганизмов, так и
стенки клеток собственного организма.
Одним из составляющих компонентов антигеннеспецифичеко-
го механизма иммунной защиты от возбудителей инфекционных
заболеваний является фагоцитарная система крови, которая пред-»
ставлена в основном гранулоцитами (нейтрофильные, эозинофиль¬
ные и в меньшей степени базофильные лейкоциты) и макрофагами.
Нейтрофильные лейкоциты способны захватывать, убивать и пере¬
варивать разнообразные внеклеточио размножаюшиеся инфекцион-;
ные агенты. Для выполнения этих функций лейкоциты генерируют!
активные формы кис.торода (супероксид-анион-радикал, пероксид!
водорода, гидроксильный радикал, синглентный кислород и др.) я]
множество дезинфектантов, образующихся в фагоцитах при низком і
pH в присутствии хлора и йода с участием мислопероксидазы (хлорної
ватистая кислота, надйодная кислота, хлорамин и др.). Выброс актив«]
ных форм кислорода убивает бактериальные клетки. В целом обра«
зование активных форм кислорода — эволюционно древний защит-]
ный механизм, лежащий в основе неспецифического иммунитета*
Базофильные лейкоциты продуцируют гистамин и несут на своей]
поверхности рецепторы к IgE, поэтому вместе с тучными клетками]
играют важнейшую роль в развитии аллергического воспаления.
Среди антигеннеспецифических гуморальных факторов и.ммун-]
ной защиты большее значение имеет система комплемента, состо¬
ящая из 25—30 сывороточных и мембранных белков, которые^
участвуют в каскадной реакции (аналогичной механизму коагуляцион¬
ного каскада), приводящей к различным биологическим результатам.1
В обычном состоянии участвующие в каскаде протеины неактивнЫг!
7.2. Алгоритм иммунного ответа организма 445
Для их активации необходим какой-либо стимул после воздействия
которого в реакциях каскада продукт одной реакции выполняет роль
кятзлизатора для осуществления следующей. Активация системы
комплемента происходит при взаимодействии с продуктами инфек¬
ционных агентов, С-реактивным белком и иммунными комплексами.
Конечные белки активированной системы комплемента образуют
мультимолекулярные комплексы, которые выполняют три основных
(|)ункции: стимуляции острых воспалительных реакций; видоизме¬
нения поверхностей антигена для увеличения эффективности про¬
цесса фагоцитоза; модификации (изменения) клеточных мембран
инфекционного агента, ведущей к лизису (разрушению) микроорга¬
низма (формируют в мембране клеток, содержащих инфекционные
агенты, водные каналы, благодаря этому в клетку поступает вода и
ПИИ подвергаются лизису). Эти реакции предназначены для борьбы с
проникшими извне бактериями, обеспечивают защиту от вирусных
инфекций, удаляют белковые комплексы и активируют развитие
иммунных процессов.
функциональное состояние нейтрофильных лейкоцитов играет
|>с[иаюшую роль в уничтожении внеклеточно размножающихся мик¬
роорганизмов, в особенности при остром воспалительном процессе.
Антигенспецифическими компонентами иммунной системы
ииляются Т- и В-лимфоциты и антитела. Из всех клеток иммун¬
ной системы только лимфоциты способны распознавать антиген,
нтаимодействовать с ним и обеспечивать формирование иммун¬
ной памяти. Для обеспечения своих специфических функций Т- и
В лимфоциты содержат антигенраспознающие рецепторы, которые
имеют внеклеточный, трансмембранный и цитоплазматический
участки. Каждый лимфоцит имеет множество антигенраспознающих
рецепторов. Взаимодействие антигенраспознающих рецепторов Т- и
Н-лимфоцитов с инфекционными агентами является первым сигна¬
лом ДЛЯ активации лимфоцитов и последующей их пролиферации
и/или дифференцировки. в дальнейшем сигналы для реализации
Иммунного ответа на антиген подаются посредством цитокинов и
прямым взаимодействием антигенов с рецепторами. В результате
янтигенной активации в организме человека накапливаются лим¬
фоциты антигенреактивного клона (сообщества), которые и обеспе-
М и иают защиту от данного вида инфекционн ых агентов.
Популяция Т-лимфоцитов представлена различными типами клеток.
Наибольшее значение в формировании алгоритма иммунного ответа
446
Глава 7. Иммунологические исследования
организма на инфекционные агенты имеют Т-хелперы (CD4) и Т-суп¬
рессоры (цитотоксические лимфоциты — CD8). Т-супрессоры имеют
рецепторы к антигенам и способны B3aHM0AeiicTi30Bai^> с ними. Такое вза¬
имодействие стимулирует Т-супрессоры, обеспечивая их пролиферацию
и дифференцировку. Активированные Т-супрессоры выделяют в сторону
клетки, содержащей антиген, перфорины и гранзимы, что приводит к
ее гибели. В основном Т-супрессоры уничтожают собственные клетки,
несущие чужие антигены (например, содержащие внутриклеточные
микроорганизмы, вирус гриппа, гепатита, токсоклазмы, листерии), но
могут непосредственно убивать клетки паразитов и грибов. Для образо¬
вания достаточного количества Т-супрессоров в ответ на инфицирование
требуется некоторое время, поэтому данный компонент иммунной защи- !
ты включается позднее антигеннеспецифических факторов.
Этапы развития иммунного ответа
1. Причиной развития иммунного ответа служит проникновение!
чужеродного антигена (например, бактерий, вирусов) во внутреннюю!
среду организма. Наиболее часто это происходит при травмированиш
кожи или слизистых оболочек человека. В ответ на повреждение окру-|
жающие клетки начинают выделять биологически активные вещест!
(цитокины, белки теплового шока) — медиаторы (посредники) доиму!
му иного воспаления. Действие медиаторов направлено на то, чтобь
не пропустить антиген глубже покровных тканей. Они вызыва!
местное расширение сосудов, способствуют выпоту из сосудов в ткаш
плазмы и попаданию в очаг лейкоцитов (фагоцитов). Локальный отс1
препятствует всасыванию антигена в системную циркуляцию (попг
Данию в кровоток). ij
2. Проникший через поврежденные покровы в ткани антиге!
захватывается и поглощается местными дендритными (отростчаты-
ми) клетками и макрофагами. И те и другие являются aHTHreHnpe4fj
ставляющими клетками, т.е. обладают особой способностью вступац
во взаимодействие с Т-лимфоцитами. Однако только дендритныц
клетки могут мигрировать из локального очага в региональные ЛИ1
фатические узлы, где в Т-зависимых зонах и представляют антиге!
Т-лимфоцитам. Не перехваченный клетками пограничных ткане!
антиген попадает в системный кровоток, где, если он опасен для оргг
низма, сразу начнет приносить вред. Тем не менее иммунный отве{
на него может развиться, поскольку дендритные клетки и макрофап
присутствуют в синусоидах селезенки, через которую во время цирку^^
ляции проходит весь объем крови.
1.2. Алгоритм иммунного ответа организма 447
3. В Т-зависимых зонах лимфатических улов дендритные клетки
представляют антиген для «рассмотрения» интенсивно мигрирую¬
щим Т-лимфоцитам. Среди Т-лимфоцитов (Т-лимфоциты-хслпсры
(I типа — ТЬ—0) рано или поздно найдутся те, которые имеют ренеп-
юры к данному антигену. Если при этом состоится правильное и
лл.екватнос взаимодейств1^е с антигеи-представляюшей клеткой, то
I лимфоцит получит активный сигнал, и с этого момента начнется
собственно иммунный — лимфоцитарный — ответ.
4. Распознавший антиген Т-лимфоцит начинает пролиферировать
и дифференцироваться. В результате образуется клон антигенспеии-
<1тчиых дифференцированных Т-лимфоцитов хелперов.
5. В Т-зависимых зонах периферических лимфатических узлов
происходит взаимодействие активированных антигеном Т-лимфоци-
гов-хслперов с В-лимфоцитами.
6. Освободившийся от связи с Т-лимфонитами В-лимфонит мигрирует
к юну фолликула лимфатических узлов, где пролиферирует и дифферен¬
цируется в плазматическую клетку. Первые плазматические клетки оста¬
ются в лимфатическом узле рядом с очагом повреждения. Секретируемые
Ими антитела активно связывают антиген и в таком виде на протяжении
днительного времени способны удерживать его в лимфатическом узле,
Остальные плазматические клетки мигрируют из лимфатического узла
Ире имущественно в костный мозг или слизистые оболочки, где осущест-
пляют массовую продукцию иммуноглобулинов (антител). Эти антитела
попадают в кровоток и осуществляют гуморальную защиту организма от
аи'1'игсна, попавшего в кровь, или доставляются в очаг повреждения.
7. Другая часть Т-лимфоцитов-хелперов (взаимодействававшая с
йитигеном Т-лимфоцитов) выходит из региональных лимфатических
узлов, попадает в кровоток, а оттуда - в очаг воспаления.
К. Если Т-лимфоциты-хелперы в очаге воспаления находят и сия-
ц.ишют свои антигены, то они начинают усиленно синтезировать и
декретировать клеточные токсины, которые убивают клетку носителя
чужеродного антигена (бактерии, вирусы, паразиты). Т-лимфоциты-
Хслперы могут выполнить свою задачу и другим путем. Для этого они
•нанимают» те или иные лейкоциты (макрофаги, нейтрофилы, эози-
' ИО(|)илы, тучные клетки).
9. В результате всех этих суммарных воздействий антиген подвер¬
гнется фагоцитозу и разрушению гидролитическими ферментами,
|СИслородными радикалами до мелких метаболитов, которые выво-
[Дйтся через почки с мочой.
44В
Глава 7. Иммунологические исследованш
10. Организм санирован от патогена/антигена — результат достиг-]
нут. После этого в норме происходит остановка (супрессия) иммун¬
ного ответа. Иногда в силу нарушения взаимодействия клеточных и’
гуморальных механизмов супрессии иммунного ответа не происхо*]
дит, и это является одной из причин развития аутоиммунной патолоИ
ГИИ. При отсутствии первоначального патогена иммунные механизмы;
продолжают активно функционировать, что приводит к повреждению]
собственных клеток и тканей и синтезу антител к ним.
7.3. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
ИММУНОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Основные задачи иммунологических исследований состоят
в диагностике, определении прогноза и оценке эффективност!
лечения заболеваний человека, в том числе сопровождающихс!
различными дефектами иммунной системы. При оценке состоя-?
ния различных звеньев иммунной системы должны учитываться
как количественные, так и качественные изменения показателе!
иммунитета. Иммунологические исследования позволяют решат!
следующие задачи:
• выявлять врожденные и приобретенные иммунодефициты;
• диагностировать аутоагрессию против нормальных компоч
нентов организма (аутоиммунные заболевания) и избыточш
накопление иммунных комплексов (болезни иммунных комп¬
лексов);
• выявлять дисфункции, при которых в том или ином звене имму]
нитета развивается признаки гиперфункция в ущерб функцио¬
нированию других звеньев (гиперга.ммаглобулинемия, болезщ
тяжелых цепей, миелома и др.);
• осуществлять контроль за эффективностью иммуносупресси!
ной или иммуностимулирующей терапии;
• проводить типирование и подбор доноров при пересадке органе
и контроль за проведением иммуносупрессивной терапии пр|
трансплантации органов;
• проводить фенотип ирован ие гемобластозов;
• диагностировать генетическую предрасположенность к сомат!
ческим заболеваниям.
Клиническое значение иммунологических исследований 449
7.3.1. ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ,
ИСПОЛЬЗУЕМЫЕ ДЛЯ ОЦЕНКИ ИММУННОГО СТАТУСА
В настоящее время наиболее часто применяется двухэтапный
принцип оценки иммунного статуса. На первом этапе выявляются
пйобшенные характеристики или грубые дефекты в системе гумо¬
рального и клеточного иммунитета и системе фагоцитоза с помошью
наиболее простых, так называемых ориентировочных методов. Этим
требованиям отвечают следующие иммунологические тесты.
Основные тесты, используемые для оценки иммунного статуса.
1. Количество лейкоцитов (абсолютное число).
2. Количество лимфоцитов (абсолютное и относительное число).
7). Количество Т-лимфоцитов (СОЗ; абсолютное и относительное
число).
4. Количество Т-хслперов (С04; абсолютное и относительное
число).
5. Количество Т-супрессоров (СОЗ; абсолютное и относительное
число).
6. Индекс соотношения С04/С08.
7. Количество В-лимфоцитов (СО20; абсолютное и относитель¬
ное число).
8. Количество иммуноглобулинов А.
9. Количество иммуноглобулинов М.
10. Количество иммуноглобулинов с.
11. Уровень СЗ-компонента комплемента.
12. Уровень С4-компонента комплемента.
13. Фагоцитарная активность нейтрофилов в крови (фагоцитарное
число, фагоцитарный показатель, индекс завершенности фагоцитоза,
«(кп'оцитарная емкость крови, количество активных фагоцитов).
14. Циркулирующие иммунные комплексы в сыворотке.
Более детальный анализ иммунного статуса целесообразно про¬
водить на втором этапе, если имеются отклонения в ориентирующих
тестах или при наличии специальных показаний.
7.3.1.1. Лабораторные показатели клеточного иммунитета
Для оценки Т-клеточного звена иммунитета наиболее часто опре¬
деляют общее количество лимфоцитов, количество Т-лимфоцитов,
Т-хелперов, Т-супрессоров.
450
Глава 7. Иммунологические исследования
Определение общего количества лимфоцитов в крови является
обязательной составной частью общего анализа крови (см. гл. 2).
Общее количество Т-лимфоцитов в крови у в;зрослых в норме
составляет 58-76%, абсолютное количество — 1,1-1,7‘107л.
В основе многих заболеваний лежит патология в Т-зависимом
звене иммунной системы, которая в одних случаях непосредствен¬
но связана с поражение.м Т-лимфоцитов, а в других опосредована
нарушением иммуноретуллции. Снижение абсолютного количества
Т-лимфопитов в крови свидетельствует о недостаточности клеточно¬
го иммунитета, повышение — о гиперактивноеги иммунитета и/или
наличии иммунопролиферативных заболеваний.
Развитие любого воспалительного процесса сопровождается прак¬
тически на всем его протяжении снижением количества Т-лимфо¬
цитов. Это наблюдается при воспалениях самой разной этиологии:
различных инфекциях, неспецифических воспалительных процес¬
сах, при разрушении поврежденных тканей и клеток после операции,.
травмах, ожогах, инфарктах, разрушении клеток злокачественных
опухолей, трофических разрушениях и т.д. Снижение количества
Т-лимфоцитов определяется интенсивностью идущего воспалитель¬
ного процесса, однако такая закономерность наблюдается не всегда.
Т-лимфоциты наиболее быстро из всех иммунокомпетентных кле¬
ток реагируют на начало воспалительного процесса. Эта реакция!
проявляется еще до развития клинической картины заболевания.
Повышение количества Т-лимфоцитов в течение воспалительного
процесса является благоприятным признаком, а высокое количество
Т-лимфоцитов при резко выраженных клинических проявлениях]
процесса, напротив, — неблагоприятный признак, указывающий на
вялое течении воспалительного процесса с тенденцией к хронизации.
Полное завершение воспалительного процесса сопровождается нор¬
мализацией количества Т-лимфоцитов.
Количество Т-лимфоцитов-хелперов в крови у взрослых в норме
составляет 36-55%, абсолютное количество — 0,4-1,М09/л.
Т-лимфоциты-помощники (СП4) — индукторы иммунного ответа,
клетки, регулирующие силу иммунного ответа организма на чуже-*
родный антиген, контролирующие постоянство внутренней среды-
организма (антигенный гомеостаз) и обусловливающие повышенную]
выработку антител. Увеличение количества Т-лимфоцитов-хелпе-]
ров свидетельствует о гиперактивности иммунитета, снижение —V
об иммунологической недостаточности.
7л. Клиническое значение иммунологических исследований 451
Количество Т-лимфоцитов-супрессоров в крови у взрослых в норме
1ч>ставляет 17—37%, абсолютное количество — 0,3—0,7Т09/л.
Т-лимфоциты-супрессоры (CD8) — клетки-индукторы, тормозя¬
щие иммунный ответ организма. Т-супрессоры тормозят выработку
антител (различных классов) вследствие задержки пролиферации
II дифференцировки В-лимфоцитов. При нормальном иммунном
HI ветс на попадание в организм чужеродного антигена максимальная
акгивация Т-супрессоров отмечается спустя 3—4 нед, Т-супрессоры
оказывают свое влияние при воспалительных процессах, вирусной
инфекции и онкологических заболеваниях. Увеличение количества
(1)8 в крови свидетельствует о недостаточности иммунитета, сниже¬
ние — о гиперактивности иммунной системы.
Ведущее значение в оценке состояния иммунной системы имеет
соотношение Т-хелперов и Т-супрессоров в периферической крови,
III к как от этого зависит интенсивность иммунного ответа. В норме
должно вырабатываться столько цитотоксических клеток и анти-
1СЛ, сколько их необходимо для выведения того или иного антигена.
Недостаточная активность Т-супрессоров ведет к преобладанию вли¬
яния Т-хелперов, что способствует более сильному иммунному отве¬
чу (выраженной антителопродукции и/или длительной активации
Т-зффскторов), Избыточная активность Т-супрессоров, напротив,
приводит к быстрому подавлению и обрыву течения иммунного
(п вета и даже иммунной толерантности (иммунный ответ на антиген
КС развивается). При сильном иммунном ответе возможно развитие
аутоиммунных и аллергических процессов. Высокая функциональная
активность Т-супрсссоров притакой реакции не позволяет развиться
адекватному иммунному ответу, в связи с чем в клинической картине
иммунодефицитов преобладают инфекции и предрасположенность к
икжачественномуросту. Соотношение CD4/CD81,5—2,5 соответствует
нормальному иммунному ответу, более 2,5 — избыточному, менее 1 —
иммунодефициту, при тяжелом течении воспалительного процесса
соотношение CD4/CD8 может быть менее 1, Принципиальное значе¬
ние это соотношение имеет в оценке иммунной системы у больных
С ПИДом. При СПИДе ВИЧ избирательно поражает и разрушает
С'П4-лимфоциты, в результате чего соотношение CD4/CD8 понижа-
ггся до значений, гораздо меньших 1.
Повышение соотношения CD4/CD8 (до 3) нередко отмечается в острой
(|>азе различных воспалительных заболеваний за счет повышения коли¬
чества Т-хелперов и снижения Т-супрессоров. В середине воспалительно¬
452
Глава 7. Иммунологические исследования
го заболевания наблюдается медленное снижение количества Т-хелперов
и повышение количества Т-супрессоров. При стихании воспалительного
процесса эти показатели и их соотнотпение нормализуются. Повышение
соотношения CD4/CD8 характерно практически для всех аутоиммунных
заболеваний: гемолитической анемии, иммунной тромбоцитопении,
тиреоидита Хашимото, пернициозной анемии, системной красной вол¬
чанки, ревматоидного артрита. Увеличение соотношения CD4/CD8 за
счет снижения количества CD8 при перечисленных заболеваниях выяв¬
ляется обычно в разгаре обострения при большой активности процесса.
Снижение соотношения CD4/CD8 из-за повышения количества CD8
характерно для ряда злокачественных опухолей.
Общее количество В-лимфоцитов (CD20) в крови у взрослых в норме
составляет 8-19%, абсолютное значение — 0,19-0,38-107л.
CD20 — клетки гуморального иммунитета, ответственные за син¬
тез антител. Количество В-лимфоцитов в периферической крови —
достаточно стойкий показатель гомеостаза, мало изменяющийся при
различных воздействиях, поэтому отклонение его от нормы может
служить одним из важных признаков иммунной патологии.
Недостаточность В-клеток ведет к тяжелым иммунодефицитным
состояниям, их избыточная активность — к развитию аутоиммунной
патологии.
Ряд острых и хронических лейкозов характеризуется именно
патологическим увеличением количества в крови В-лимфоцитов.
Инфицирование В-лимфоцитов вирусом Эпштейна-Барр вызывает
инфекционный мононуклеоз.
7.3.1.2. Лабораторные показатели гуморального иммунитета
Для опенки гунорального иммунитета используются исследова¬
ния, которые характеризуют функциональную активность В-лимфо¬
цитов и включают определение концентрации иммуноглобулинов,
уровня антител после профилактической иммунизации, выявление
циркулирующих иммунных комплексов.
Иммуноглобулины представляют собой специфический продукт секг ]
реции В-лимфоцитов на конечной стадии их дифференцировки, т.е.]
плазматических клеток. Концентрация иммуноглобулинов в сыворотке,!
является результатом установившегося равновесия между их синтезом и]
распадом. Дефекты, связанные с нарушением метаболизма иммуноглобу-.|
линов, наблюдаются при многих заболеваниях. Уменьшение содержания,^
иммуноглобулинов в сыворотке крови может наблюдаться в результате:
л-7. Клиническое значение иммунологических исследований
453
* нарушения синтеза одного, нескольких или всех классов имму¬
ноглобулинов;
* повышенного разрушения иммуноглобулинов;
* значительных потерь иммуноглобулинов (например, при нефро¬
тическом синдроме).
Следствием этих процессов является дефицит иммуноглобулинов,
и гем самым и антител.
Увеличение количества иммуноглобулинов может быть обуслов¬
лено усилением их синтеза или уменьшение.м интенсивности их рас¬
пада. Повышенная выработка иммуноглобулинов является причиной
гипергаммаглобулинемии.
Референтные величины содержания IgA, IgM и IgG в сыворотке
представлены в табл. 7-1—7.3 (Тиц Н, 1997).
Таблица 7-1.
Референтные величины содержания IgA в сыворотке крови
Возрастная группа
Содержание IgA, г/л
Дети:
1 7 мсс
0,06-0,58
4 -6 мес
0,1-0.96
7 -12 мсс
0,36-1,65
2 -Злет
0,45-1,35
4 -5 лет
0,52-2,2
() -7 лет
0,65-2,4
10-11 лет
0,91-2,55
12-13 лет
1,08-3,25
1) »рослые
0,9-4,5
Таблица 7-2.
Референтные величины содержания IgM в сыворотке крови
Возрастная группа
Содержание IgM, г/л
Дети:
1 -3 мес
0,12-0,87
4-6 мес
0,25-1,2
2-3 лет
0,46-1,90
454
Глава 7. Иммунологические исследования
Окончание таблицы 7-2.
4-5 лет
0,40-2,00
6-7 лет
0,55-2,1
10-11 лет
0,66-1,55
12-13 лет
0,70-1,50
Взрослые: мужчины
0,50-3,20
женщины:
0,60-3,70
Таблица 7-3.
Референтные величины содержания lgG в сыворотке крови
Возрастная группа
Содержание IgG, г/л
Дети
1-3 мес
2,7-7,8
4-6 мес
1,9-8,6
7-12 мес
3,5-11,8
2-3 лет
5,2-13,6
4-5 лет
5,4-14,2
6-7 лет
5,7-14,1
10-11 лет
7,3-13,3
12-13 лет
7,7-15,1
Взрослые
8,0-17,0
Иммуноглобулин Е ответствен за аллергические реакции немед-1
ленного типа — наиболее распространенный тип. Помимо участия в
аллергических реакциях, 1§Е также принимает участие в защитном]
противогельминтном иммунитете. Референтные величины содержа-]
ния общего IgE в сыворотке приведены в табл. 7-4.
Таблица 7-4,1
Референтные величины содержанияобщего IgE в сыворотке крови
Возрастная группа
Содержание lgE, кЕ/л
-
1-3 мес
0-2 \
3—6 мес
3-10 1
7.,?. Клиническое значение иммунологических исследований
455
Окончание таблицы 7-4.
1 1’ОД
8-20
5 лет
10-50
15 лет
15-60
взрослые
20-100
Определение содержания общего IgE в сыворотке применяется
чля диагностики аллергических заболеваний. В табл. 7-5 приведены
примерные диапазоны содержания общего IgE в сыворотке крови у
взрослых при некоторых патологических состояниях.
Таблица 7-5.
Содержание общего IgE в сыворотке крови при некоторых
патологических состояниях
Пато.110гическое состояние
Содержание IgE, кЕ/л
Аллергический ринит
120-1000
Атопическая бронхиальная астма
120-1200
Атопический дерматит
80-14 ООО
Аллергический бронхопульмональ-
мый аспергиллез:
[»емиссия
80-1000
пбострение
1000-8000
IgE миелома
15 ООО и выше
Моноклональная иммуноглобулинопатия (парапротеине.мия) пред-
сгавляет собой синдром, выражающийся в накоплении в сыворотке
крови и/или моче больных однородных по всем физико-химическим
и биологическим параметрам иммуноглобулинов или их фрагментов.
Моноклональные иммуноглобулины (парапротеины, М-протеины)
ииляются продуктом секреции одного клона В-лимфоцитов или
плазматических клеток, поэтому представляют собой пул (собрание)
структурно-гомогенных молекул, имеющих тяжелые цепи одного
класса (субкласса), легкие цепи одного типа и вариабельные области
одинакового строения. Моноклональные иммуноглобулинопатии
принято разделять на доброкачественные и злокачественные. При
доброкачественных формах моноклональных гаммапатиях проли¬
456
Глава 7. Иммунологические исследования
ферация плазматических клеток контролируется таким образом, что
клинические симптомы отсутствуют, при злокачественных формах
происходит бесконтрольная пролиферация лимфоидных или плаз¬
матических клеток, которая и обусловливает клиническую картину
заболевания — миеломную болезнь. Класс и тип секретируемых
миеломой патологических иммуноглобулинов (Pig) определяет имму-
нохимический вариант заболевания (если синтезируются IgG —
G-миелома, IgA — А-миелома и т.д.). В сыворотке крови больных;
выявляют повышенные концентрации патологических иммуноглобу¬
линов: IgG — бо.лее 35 г/л или IgA — более 20 г/л. Содержание общего
белка резко повышено — до 100 г/л, а на электрофореграмме белков
сыворотки крови выявляется дополнительная узкая и резко ограни¬
ченная фракция белков (М-компонент).
Циркулирующие иммунные комплексы — совокупности, состоящие
из антигена, антител и связанных с ними компонентов комплемента
СЗ, С4, Clq. В норме иммунные комплексы, образовавшиеся в кро¬
вотоке, фагоцитируются и разрушаются как фагоцитами, так и клет¬
ками печени. Однако при увеличении их размера комплексы могут
откладываться в периваскулярном (вокруг сосудов) пространстве и
корковом слое почек, вызывая активацию комплемента и воспали¬
тельные процессы. Патологические реакции на иммунные комплексы ,
могут быть обусловлены превышением скорости их образования над I
скоростью элиминации (удаления), дефицитом одного или несколь¬
ких компонентов комплемента или функциональными дефектами
фагоцитарной системы. Определение уровня иммунных комплексов;
в сыворотке крови имеет важное значение в диагностике острых вос¬
палительных процессов и аллергических реакций 12 типа, при кото¬
рых уровень циркулирующих иммунных комплексов повышается, а!
также в оценке эффективности проводимого .течения. Содержание
циркулирующих иммунных комплексов в сыворотке крови в норме]
составляет 30-90 МЕ/мл.
При различных аутоиммунных заболеваниях реагирующие;
с тканями аутоантитела оказывают цитотоксическое действие, но!
несравненно большее повреждающее действие оказывают иммунные]
комплексы. Вследствие этого заболевания, в патогенезе которых ayxo-j
иммунные процессы играют важную роль, нередко называют болез-|
нями иммунных комплексов. Описано более 100 болезней, первопри-]
чиной которых является депонирование в различных органах, тканях|
или системах циркулирующих иммунных комплексов.
7.5. Клиническое значение иммунологических исследований 457
Повышение уровня циркулирующих иммунных комплексов в
крови характерно для:
• острых бактериальных, грибковых, паразитарных и вирусных
инфекций;
• аутоиммунных заболеваний, коллагенозов, ревматизма, гломе¬
рулонефрита, аллергических альвеолитов, васкулитов, феномена
Артюса; -
• иммунокомплексных заболеваний, сывороточной болезни;
• аллергических реакций 12 типа.
7.8.1.3. Лабораторные показатели для оценки неспецифической защиты
Наиболее часто в клинической практике для оценки антиген-
нсспецифического звена иммунной системы исследуют показатели
<|»агоцитоза.
Показатели, характеризующие состояние фагоцитоза
Фагоцитарное число — среднее количество микробов, поглощенных
олиим нейтрофилом крови. Этот показатель характеризует поглотитель¬
ную способность нейтрофилов. в норме фагоцитарное число составляет
5-10 поглощенных микробных частиц одним нейтрофилом крови.
Фагоцитарная емкость крови — количество микробов, которое могут
поглотить нейтрофилы 1 л крови, в норме она составляет 12,5—25 • 10“^
поглощенных микроорганизмов на 1 л крови.
Фагоцитарный показатель — процент нейтрофилов, участвующих
II (фагоцитозе, в норме фагоцитарный показатель составляет 65—95%
нейтрофилов.
Индекс завершенности фагоцитоза характеризует внутриклеточное
переваривание микроорганизмов фагоцитами. В норме индекс завер¬
шенности фагоцитоза должен быть более 1,0.
Фагоцитарная активность нейтрофилов обычно повышается в
начале воспалительного процесса. Ее снижение ведет к хронизации
иосиалительного и поддержанию аутоиммунного процесса, так как
при этом нарушается функция разрушения и выведения иммунных
комплексов из организма.
Снижение показателей фагоцитоза выявляют при врожденных
дссфектах фагоцитарной системы.
Параметры, характеризующие состояние системы комплемента.
Одновременное определение 3 показателей — СЗ-, С4-компонентов
комлемента и титра комплементной активности сыворотки крови —
позволяет оценить состояние системы комплемента.
458
Глава 7. Иммунологические исследования
Любой воспалительный процесс при адекватном иммунном ответе
сопровождается повышением титра комплемента. Снижение титра
свидетельствует о недостаточности комплемента и приводит к ослаб¬
лению его цитотоксичности, что способствует накоплению иммун¬
ных комплексов и ведет к хронизации воспалительного процесса.
Увеличение активности комплемента характерно для аллергических
и аутоаллергических процессов.
Снижение уровня СЗ- и С4-компонентов комплемента в крови
приводит к ослаблению ее опсонизирующей функции (процесс, в ходе
которого бактерии становятся более восприимчивыми к действию
фагоцитов), а также фагоцитоза, цитолиза и может быть связано с
нарушением их синтеза или усилением катаболизма (распада), его
адсорбцией на иммунных комплексах при аутоиммунных заболева¬
ниях. Увеличение уровня СЗ и С4 в сыворотке характерно для острого
периода инфекции (белки острой фазы). В период выздоровления
уровень СЗ и С4 в крови нормализуется.
7.3.2. ОЦЕНКА РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
ИММУННОГО СТАТУСА
Основным принципом оценки результатов комплексного иссле¬
дования иммунного статуса у больного являются количественная и
функциональная оценка всех его звеньев антигеннеспецифических
и антигенспецифических факторов — и их сравнение с нормальными
величинами. Под нормальным состоянием иммунного статуса под¬
разумеваются показатели иммунной системы, определяемые у прак¬
тически здоровых лиц разного возраста. Определение параметров
иммунной системы при различных патологических состояниях дает
возможность разделить последние на 3 главные группы:
• без существенных изменений в иммунном статусе;
• с недостаточностью иммунной системы (иммунодефициты);
• с гиперактивацией иммунокомпетентных клеток (аутоиммуни¬
тет, аллергия).
Используя методы клинической иммунологии, необходимо
выявить у больного характер и уровень нарушений, а затем осущест¬
влять контроль за восстановлением иммунного статуса организма
в процессе лечения. Наиболее часто встречающимся нарушением
состояния иммунной системы у человека являются иммунодефи-
Л5, Клиническое значение иммунологических исследований 459
питы. Термином «иммунодефициты» обозначают нарушения нор¬
мального иммунного статуса, обусловленные дефектом одного или
нескольких механизмов иммунного ответа. Различают первичные и
шоричные иммунодефициты. При первичных нарушение иммунных
механизмов (продукция иммуноглобулинов и/или Т-лимфоцитов)
часто связано с генетическим наследованием определенных дефектов
н различных звеньях иммуннсій системы, в зависимости от локализа¬
ции дефекта различают следующие иммунодефициты:
• с преобладанием дефектов в системе гуморального иммунитета
(дефект синтеза иммуноглобулинов);
• обусловленные дефектами неспецифической системы резистент¬
ности (в частности, системы фагоцитоза, системы комплемента);
• обусловленные дефектами клеточного звена иммунитета;
• комбинированные иммунодефицитные состояния.
Недостаточность гуморального иммунитета может проявлять¬
ся в форме общей гипогаммаглобулинемии как дефекта синтеза
иммуноглобулинов, недостаточности антител вследствие обшей
потери белка (при нефротическом синдроме, экссудативных про¬
цессах) и усиления процессов распада иммуноглобулинов. Редко
может встречаться избирательный (селективный) дефицит различ¬
ных иммуноглобулинов. Например, при селективных дефицитах
1^0 отмечают рецидивирующие инфекции верхних дыхательных
мутей, среди первичных иммунодефицитов наиболее часто встре¬
чи ются комбинированные формы. При нарушении Т-клеточного
іиена иммунной системы больные подвергаются особой опасности
поражения вирусными и грибковыми инфекциями. Нередко пер¬
выми признаками иммунодефицита являются кандидоз, осложне¬
ния после вакцинации БЦЖ, тяжелые формы инфекций, обуслов¬
ленных вирусом герпеса и ветряной оспы. При клеточных формах
иммунодефицита часто выявляется снижение количества и функ¬
циональной активности лимфоцитов периферической крови.
Количество В-лимфоцитов может быть несколько увеличено, а
Т-лимфоцитов — снижено.
Вторичные иммунодефициты характеризуются приобретенным
дефектом иммунной системы, выражающимся в неспособности
организма осуществлять реакции клеточного и/или гумораль¬
ного иммунитета. Дефекты иммунной системы при вторичных
иммунодефицитах могут возникать в различных звеньях: Т- и
В-лимфоцитарном, макрофагальном, гранулоцитарном, компле-
460
Глава 7. Иммунологические исследования
ментном. Общий механизм возникновения вторичных иммуно¬
дефицитов заключается в нарушении естественно существующих
взаимодействий между рецепторами клеток и циркулирующими
иммуноглобулинами под влиянием различных стрессовых и пато¬
генных агентов и воздействий.
Многие заболевания, химиотерапевтические, физические и другие
методы лечения, иные воздействия вызывают изменения иммуноре¬
активности. Вторичные иммунодефициты наиболее часто выявляют¬
ся при инфекциях, СПИДе, тяжелых ожогах, уремии, злокачествен¬
ных новообразованиях, проведении иммуносупрессивной и лучевой
терапии.
7.4. ОСНОВНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ,
ИСПОЛЬЗУЕМЫЕ ДЛЯ ДИАГНОСТИКИ
РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ
В настоящее время к ревматическим относят заболевания, в основе
которых лежит системное или локальное поражение соединительной
ткани, а наиболее ярким клиническим проявлением служит пораже¬
ние суставов. К ревматическим относятся следующие заболевания:
ревматизм (ревматическая лихорадка); диффузные болезни соеди¬
нительной ткани (основные формы — системная красная волчанка,
системная склеродермия, диффузный фасцит, дерматомиозит/поли¬
миозит, болезнь Шегрена, смешанные заболевания соединительной
ткани и др.); системные васкулиты (узелковый полиартериит, грану¬
лематозные артерииты, гиперергические ангииты, облитерирующий
тромбангиит, синдром Бехчета); ревматоидный артрит; ювенильный
артрит; анкилозирующий спондилоартрит (болезнь Бехтерева); арт¬
риты, сочетающиеся со спондилитом; артриты, связанные с инфек¬
цией; микрокристаллические артриты; остеоартроз; другие болезни
суставов; артропатии при неревматических заболеваниях; болезни
внесуставных мягких тканей; болезни костей, хряща и остеохондро¬
патии.
Для лабораторной диагностики ревматических заболеваний
применяется комплекс показателей (общий анализ крови, СОЭ,
общий анализ мочи, исследование суставной жидкости, биохими¬
ческие показатели, исследование иммуноглобулинов, циркулиру¬
7.4. Основные лабораторные исследования, используемые для... 461
ющих иммунных комплексов, показатели системы комплемента
и др.). В данном разделе приведено диагностическое значение
показателей, характеризующих аутоиммунный компонент ревма-
іических заболеваний. Аутоиммунные механизмы играют важ¬
ную роль в развитии многих ревматических заболеваний. Суть
) |'их механизмов состоит в том, что в результате предшествующих
повреждений клеток oprarfoB и тканей вирусами или бактериями
многие структурные компоненты клеток изменяют свои антиген¬
ные свойства и иммунная система начинает воспринимать их как
чужие. В ответ на эти изменения В-лимфоцитьт синтезируют анти¬
тела к антигенам собственных клеточных структур (аутоантитела).
Выявление этих аутоантител имеет важное практическое значение,
1!1К как при различных ревматических заболеваниях образуются
разные виды аутоантител. Лабораторные исследования позволяют
иыявлять эти виды, характерные для определенного заболевания,
и тем самым помогают правильно поставить диагноз. Часть этих
аутоантител неспецифичны и присутствует при многих ревмати¬
ческих болезнях. Поэтому их определение в крови используют для
скрининга на ревматические заболевания или оценки активности
аутоиммунного процесса. К лабораторным показателям, которые
наиболее часто исследуются у больных с ревматическими забо¬
леваниями, относятся клетки красной волчанки, ревматоидный
(фактор, антистрептолизин-0, С-реактивный белок и антинукле-
арный фактор. Результаты приведенных анализов необходимы для
подтверждения диагноза, характеристики активности процесса,
опенки эффективности терапии, прогнозирования исходов избо-
лсвания.
7.4.1. КЛЕТКИ КРАСНОЙ ВОЛЧАНКИ (ЕЕ-КЛЕТКИ) КРОВИ
Волчаночные клетки являются морфологическим (клеточным)
проявлением иммунного феномена, характерного для системной
красной волчанки {lupus erythematosus — LE , отсюда и сокра¬
щенное название — LE-клетки). Они образуются в результате
фагоцитоза нейтрофильными лейкоцитами (реже моноцитами)
остатков ядер собственных погибших клеток тканей (в том числе
и самих лейкоцитов). Этот ядерный материал, поглошенный дру¬
гими лейкоцитами, можно выявить после окраски под микро¬
462
Глава 7. Иммунологические исследования
скопом. Соответственно лейкоциты, которые содержат остатки
ядерного материала, являются LE-клетками. При системной крас¬
ной волчанке клетки тканей гибнут в результате их повреждения
аутоантителами. Из погибших клеток ядра попадают в кровоток,
где фагоцитируются лейкоцитами. Обнаружение ЕЕ-клеток —
специфический симптом системной красной волчанки. В норме
LE-клєтки в крови отсутствуют.
Системная красная волчанка — аутоиммунное заболевание,
при котором наблюдается развитие иммунной реакции в отно¬
шении неизмененных компонентов собственных клеток (ядер¬
ных и цитоплазматических). Свое название болезнь получила по
характерному покраснению кожи, напоминающему, как говорили
когда-то, полосы красноты на коже после волчьих укусов илй
красноватые волчьи щеки (латинское название заболевания lupus
erythematosus происходит от lupus — волк, erythema — покрасне¬
ние). Для заболевания характерно поражение суставов, серозных
оболочек, кожи, внутренних органов и центральной нервной
системы. Болезнь чаще начинается с рецидивирующего артрита,
недомогания, повышения температуры тела, кожных высыпаний,
быстрого похудания, реже с высокой лихорадки, острого артрита
и выраженного характерного кожного синдрома. В последующем
развивается прогрессирующая патология со стороны различных
органов.
Обнаружение в крови ЕЕ-клеток является важным диагности¬
ческим признаком системной красной волчанки. Исследование на
наличие ЕЕ-клеток у пациента необходимо проводить до начала
кортикостероидной терапии. Для анализа берут пробу венозной
крови (2—3 мл) в пробирку или вакутейнер с антикоагулянтом
(ЭДТА). LE-клетки обнаруживаются в раннем периоде болезни,
а также при выраженном нефротическом синдроме и потере с
мочой большого количества белка. Чаще LE-клетки обнаружива¬
ют в крови при обострении заболевания. Появление их в большом
количестве - прогностически неблагоприятный признак. Прй
улучшении состояния больного в процессе лечения количество
ЕЕ-клеток уменьшается, а иногда они и совсем исчезают. Частота’
обнаружения ЕЕ-клеток у больных острой системной красной вол-|
чанкой колеблется от 40 до 95%.
Отрицательный результат исследования не исключает наличие]
системной красной волчанки.
7.4. Основные лабораторные исследования, используемые для... 463
7.4.2. РЕВМАТОИДНЫЙ ФАКТОР
Ревматоидный фактор (РФ) — это антитела (аутоантитела) к собс-
I пенным иммуноглобулинам, которые часто присутствуют в крови
Iвольных ревматоидным артрито.м.
Аутоантитела (ревматоидный фактор) могут образовывать
иммунные комплексы’; соединяясь как с белками системы комп¬
лемента, так и с другими белками. Иммунные комплексы, попа-
апя в синовиальную жидкость, фагоцитируются нейтрофилами
и в процессе фагоцитоза разрушаются. В результате выделяются
различные медиаторы воспаления, которые оказывают поврежда¬
ющее действие на ткани сустава и способствуют формированию у
них ревматоидных узелков. Кроме того, в результате взаимодейс¬
твия иммуноглобулинов и ревматоидного фактора (аутоантител)
образуются крупные белковые комплексы, которые не фагоцити¬
руются, а откладываются в межклеточном пространстве вокруг
сосудов, что приводит к возникновению воспаления (васкулита).
Большинство внесуставных (системных) проявлений ревматоид¬
ного артрита связано с развитием васкулита, а также с непосредс¬
твенным повреждением различных тканей аутоантителами.
Ревматоидный артрит — системное аутоиммунное воспалительное
заболевание соединительной ткани с преимущественным поражени¬
ем суставов по типу хронического прогрессирующего полиартрита.
Ио статистике, от этого заболевания страдает каждый 100-й житель
земли, преимущественно женщины среднего и пожилого возраста.
Обнаружение в крови ревматоидного фактора имеет важное зна¬
чение в диагнстике ранних форм ревматоидного артрита. У здоровых
людей уровень ревматоидного фактора в сыворотке крови составляет
менее 14 МЕ/мл. Повышение этого уровня характерно для ревматоид¬
ного артрита и может определяться почти у 90% больных. Оно выяв¬
ляется не ранее, чем через 6-8 нед после начала клинических прояв¬
лений заболевания, Наличие ревматоидного фактора в крови больных
указывает на тяжелую форму заболевания (протекает с выраженным
воспалительным процессом в суставах, зачастую с их деструкцией).
Отрицательны й результат исследования не всегда позволяет отверг¬
нуть диагноз. Незначительный уровень ревматоидного фактора может
б|,1ть обнаружен в низких значениях при инфекционном мононуклео-
1с, острых воспалительных процессах, системной красной волчанке с
поражением суставов, аутоиммунном гепатите.
464
Глава 7. Иммунологические исследования
7.4.3. АНТИСТРЕПТОЛИЗИН-0
Инфекции, обусловленные стрептококком группы А, всегда
вызывают специфический иммунный ответ — значительное повы¬
шение титра антител к одному из внеклеточных стрептококковых
антигенов — стреп голизину О. Поэтому антитела к стрептокок¬
ковому гемолизину-0 (АСЛО) — маркер острой стрептококковой
инфекции. У здоровых людей в норме референтные величины анти-
стрептолизина-0 в сыворотке крови составляют у взрослых менее
200 МЕ/мл, у детей - до 150 МЕ/мл.
В клинической практике исследование АСЛО назначают паци¬
ентам с подозрением на стрептококковую инфекцию, которая
является основной причиной ревматизма и гломерулонефрита.
Стрептококки при ревматизме вызывают повреждения тканей сер¬
дца, а при гломерулонефрите — клеток почечных клубочков (гло-'
мерул). в результате повреждения клетки тканей изменяют свои
антигенные свойства, и В-лимфоциты начинают вырабатывать
к ним антитела (аутоантитела), так как принимают их за чужих.
Образующиеся аутоантитела усугубляют повреждение тканей и
поддерживают воспалительный процесс.
Исследование АСЛО назначают пациенту для подтверждения или
исключения участия стрептококковой инфекции в развитии заболе¬
ваний, в основном ревматизма и гломерулонефрита.
Уровень АСЛО в крови повышается в острый период инфекции
(7-14-й день) и снижается в период ее стихания и выздоровления.
В клинической практике определение АСЛО используют для наблю¬
дения за динамикой ревматического процесса. Титр АСЛО повышает¬
ся у 80—85% больных с ревматической лихорадкой. К 3-й нед заболе¬
вания уровень АСЛО значительно повышается, достигая максимума к
6—7-й нед. При благоприятном течении процесса к 4—8-му мес актив¬
ность АСЛО снижается до нормы. Под влиянием проводимой терапии
эти сроки могут сократиться. Отсутствие снижения активности АСЛО
к 6-му месяцу заболевания позволяет предположить возможность
рецидива. Стойкое и длительное повышение активности после анги-^
ны может быть предвестником ревматического процесса. В 10—15%
случаев ревматизма повышения активности АСЛО не наблюдается.
Увеличение уровня АСЛО обнаруживается у половины больных
острым гломерулонефритом, развивающимся после стрептококковой
инфекции.
7.4. Основные лабораторные исследования, используемые для... 465
7.4.4. АНТИНУКЛЕАРНЫЙ ФАКТОР
Антинуклеарный фактор — это группа аутоантител, вступающих в
реакцию с нуклеиновыми кислотами и связанными с ними белками —
компонентами ядра клеток органов и тканей. Особенностью этих
путоантитсл является их способность повреждать клетки соедини¬
тельной ткани. Поэтому определение антинуклеарного фактора — это
lecT на системные заболевания соединительной ткани. Одним из
наиболее распространенных системных заболеваний соединительной
1кани является системная красная волчанка. При этом заболевании
пнтинуклеарный фактор появляется в сыворотке крови у 95% боль¬
ных в течение 3 мес после его начала, ß связи с этим основная цель
исследования антинуклеарного фактора — исключить наличие у
больного системной красной волчанки.
У здоровых людей титр антинуклеарного фактора в сыворотке
крови составляет 1:40—1:80. Клинически значимым обычно считают
1итр >1:160.
Антитела к нуклеарным антигенам высокоспецифичны для
системной красной волчанки. Их титр увеличивается при актив¬
ной форме заболевания до 1:1000 и выше. Сохранение высокого
уровня антител в течение длительного времени является неблаго¬
приятным признаком. Снижение уровня предвещает ремиссию.
Определение антинуклеарного фактора имеет большое значение
для диагностики других форм системных заболеваний соединительной
гкани. При узелковом периартериитс титр может увеличиваться до 1:100,
при дерматомиозите — до 1:500. При склеродермии частота выявления
ынител к нуклеарным антигенам составляет 60—80%, однако титр их
ниже, чем при системной красной волчанке. При ревматоидном артрите
Д(»вольно часто выявляются антитела к нуклеарным антигенам.
Кроме ревматических заболеваний, антитела к ядерным антигенам
и крови обнаруживают при хроническом активном гепатите (в 30—50%),
их титр иногда достигает 1:1000. Аутоантитела к нуклеарным антигенам
могут выявляться в крови при инфекционном мононуклеозе, ост¬
рых и хронических лейкозах, приобретенной гемолитической анемии,
болезни Вальдеиетрема, циррозе печени, билиарном циррозе печени,
гепатитах, малярии, лепре, хронической почечной недостаточности,
тромбоцитопениях, лимфопролиферативных заболеваниях.
Почти в 10% случаев антинуклеарный фактор обнаруживается у
здоровых людей, однако титр у них не превышает 1:50.
466 Глава 7. Иммунологические исследования
7.5. ИССЛЕДОВАНИЕ ОПУХОЛЕВЫХ МАРКЕРОВ
Онкологические заболевания по распространенности занимают
2-е место среди всех заболеваний населения. Однако рассчитывать
на успех лечения заболеваний раком можно лишь при выявлении
злокачественных опухолей на ранней стадии их развития. За пос¬
ледние годы значительно расширились возможности медицины по
раннему выявлению опухолей в связи с использованием в клиничес¬
кой практике современных инструментальных методов диагностики.
К таким методам относятся компьютерная и рентгеновская томогра¬
фия, ультразвуковое исследование, радиоизотопная диагностика и др,
Сушественно увеличились и возможности лабораторной диагности¬
ки. Это связано с внедрением в клиническую практику определения
опухолевых маркеров, которые стали широко использоваться для
выявления первичной опухоли и ее метастазов.
Опухолевые маркеры (онкомаркеры) — это вещества, наличие кото¬
рых в организме пациента связано с присутствием или прогрессировани¬
ем злокачественной опухоли, К маркерам злокачественного роста отно¬
сятся вещества разной природы: гормоны, ферменты, гликопротеины,
липиды, белки, метаболиты. Синтез маркеров обусловлен особеннос¬
тями метабо.тизма раковых клеток. Основным механизмом продукции
маркеров опухолевыми клетками являются патологические изменения в
генах (участках молекулы ДНК) такой клетки. В результате этого опухо¬
левые клетки начинают синтезировать эмбриональные и плацентарные
белки, ферменты, метаболиты, липиды и гормоны, которые в норме
не продуцируются или продуцируются в крайне малых количествах.
Поэтому появление таких веществ в крови пациента или резкое увели¬
чение их концентрации может свидетельствовать о наличии в организме
больного злокачественного новообразования. Известен широкий спектр
маркеров для различных форм и локализаций рака. Однако почти все
они имеют недостатки в отношении выявления ранних форм рака.
Сложности обусловлены многообразием требований, предъявляемых
к идеальному маркеру. Идеальный опухолевый маркер должен проду¬
цироваться опухолевыми клетками в достаточном количестве, чтобы
его можно было определить с помощью современных лабораторных
анализов, он не до.чжен присутствовать в крови у здоровых людей и при
доброкачественных опухолях. Маркер должен выявляться в крови на
ранних стадиях опухолевого процесса, его концентрация в крови долж¬
на соответствовать объему опухоли, этот маркер должен определяться в
7.5. Исследование опухолевых маркеров 467
крови еще до клинических проявлений опухоли, уровень в крови должен
огражать результаты противоопухолевого лечения.
в клинической практике используется ряд достаточно полезных
опухолевых маркеров, которые, однако, не всегда соответствуют всем
приведенным выше требованиям в полной мере. Поэтому большин-
1Г1Ю маркеров непригодно для скринингового обследования населения
при отсутствии клинических симптомов заболевания. Исключение
составляет простатический специфический антиген, который широ¬
ко используется для раннего выявления рака предстательной железы
у мужчин старше 40 лет. В большинстве других ситуаций определение
уровня опухолевых маркеров является дополнительным методом
диагностики онкологических заболеваний в комбинации с другими
методами исследований. Однако в целом ряде клинических ситуаций
По з определения опухолевых маркеров трудно обойтись.
В первую очередь определение уровня опухолевого маркера в крови
пациента используют для оценки эффективности противоопухоле¬
ного лечения. Снижение концентрации опухолевого маркера в крови
уже на ранних этапах лечения будет свидетельствовать об его эффек¬
тивности и, наоборот, повышение его уровня — о необходимости кор¬
рекции химиотерапии.
Во-вторых, исследование опухолевого маркера имеет важное зна¬
чение для наблюдения за течением онкологического заболевания.
Повышение уровня опухолевого маркера в крови по сравнению с
исходным нередко позволяет заподозрить и обнаружить метастазы
и/или рецидив опухоли на 3—5 мес и более раньше клинических про-
ивлений болезни, у некоторых пациентов определение уровня опу¬
холевого маркера после хирургического удаления первичного очага
«>пухоли является более чувствительным методом мониторинга, чем
эндоскопия или компьютерная томография.
В-трстьих, определение уровня опухолевого маркера в крови паци¬
ента весьма эффективно для выявления остатков опухолевой ткани
в организме больного после ее хирургического удаления, а также
раннего обнаружения рецидивов опухоли. Незначительное снижение
уровня опухолевого маркера в крови или его полное отсутствие свиде¬
тельствует о частичном удалении опухоли или наличии множествен¬
ных опухолей (метастазов).
В-четвертых, определение концентрации опухолевого маркера в
крови позволяет прогнозировать течение опухолевого процесса, что
имеет важное значение для выбора методов лечения больного.
468
Глава 7. Иммунологические исследования
Не менее важно для правильного использования результатов
исследования опухолевого маркера придерживаться следующей
последовательности назначения анализов больному (рекоменда¬
ции ВОЗ):
1) определить уровень опухолевого маркера перед лечением и в
дальнейшем исслсдонать только те онкомаркеры, уровни которых
были повышены;
2) после курса лечения (операции) исследовать опухолевый маркер
через 2—10 дней с целью установления исходного уровня для дальней¬
шего мониторинга;
3) для оценки эффективности проведенного лечения (операции)
провести исследование опухолевого маркера спустя 1 мес;
4) дальнейшее исследование уровня опухолевого маркера в крови
проводить 1 раз в месяц в течение 1 года после лечения, 1 раз в 2 мес в
течение 2 года после лечения, 1 раз в 3 мес в течение 3-5 лет;
5) проводить исследование опухолевого маркера перед любым
изменением лечения;
6) определять уровень опухолевого маркера при подозрении на
рецидив и метастазирование;
7) определять уровень опухолевого маркера через 3-4 нед после
первого выявления повышенной концентрации.
Для исследования крови на ОМ берут кровь в пробирку или ваку¬
тейнер без всяких добавок. К полученным проба.м крови предъявля¬
ются следующие требования;
• если кровь после ее взятия и образования сгустка в пробирке
нельзя отдентрифугировать на месте, то пробы должны быть)
доставлены в лабораторию в течение 30-40 мин;
• гемолизированные пробы крови не подлежат исследованию (гемо-1
лиз повышает уровень ряда опухолевых маркеров);
• контаминация (инфицирование) проб крови недопустима (повы¬
шает уровень ряда опухолевых маркеров);
• прием лекарственных препаратов, вызывающих повышение уров-;
ИЯ опухолевых маркеров в крови, должен быть по возможности]
ограничен (эстрадиол, ионы 2- и 3-валентных металлов, аналоги]
гуанидина, нитраты, митамицин).
Наиболее часто в клинической практике назначают исследова¬
ние а-фетопротеина (АФП), раково-эмбрионального антигена (РЭА),
ракового антигена СА125 и простатического специфического антиге¬
на (ПСА).
7.5. Исследование опухолевых маркеров 469
7.5.1. а-ФЕТОПРОТЕИН
АФП представляет собой белок, связанный с углеводом. Он син¬
тезируется в желточном мешке, а также печени и кишечнике плода.
У плода он является основным белком плазмы крови. После рождения
основным белков плазмы крови становится альбумин, а продукция
ЛФП подавляется. Поэтк»му у взрослых нормальная концентрация
ЛФП в сыворотке крови не превышает 10 МЕ/мл (в небольших коли¬
чествах он синтезируется печенью). Повышение концентрации АФП в
крови в норме наблюдается при беременности.
В клинической практике АФП как опухолевый маркер использу¬
ется, во-первых, для выявления и мониторинга гепатоцеллюлярной
карциномы (рака печени), которая возникает, как правило, в цирро-
гической печени, во-вторых, для выявления тератобластомы яичка
(рака яичка) и, в-третьих, для оценки эффективности терапии этих
заболеваний.
АФП является основным опухолевым маркером в диагностике
рака печени, уровень АФП может повышаться при опухоли неболь¬
шого размера, что способствует увеличению послеоперационной
пыживаемости у этих больных. Первичный рак печени встречается
редко, поэтому исследование АФП не используют для скринин-
га населения. Однако больные циррозом печени, хроническими
вирусными гепатитами В и С, гемохроматозом имеют высокий
риск развития этой формы рака, и проведение скрининга с опреде¬
лением уровня АФП у них имеет большое практическое значение.
Уровень АФП более 15,0 МЕ/мл выявляют в 95% случаев первич¬
ного рака печени.
Содержание АФП в сыворотке крови хорошо отражает эффект
химиотерапевтического лечения рака печени. Значительное сни¬
жение уровня АФП свидетельствует об эффективности лечения.
Хирургическое удаление опухоли сопровождается резким уменьше¬
нием содержания АФП в крови, его увеличение говорит о нерадикаль-
ности хирургического лечения.
у пациентов с раком яичка определение концентрации АФП в
сыворотке крови используется для оценки прогноза, определения
стадии заболевания и мониторинга лечения.
Исследование уровня АФП в сыворотке крови у беременных жен¬
щин применяют для ранней диагностики врожденных пороков разви¬
тия нервного канала и синдрома Дауна у плода.
470
Глава 7. Иммунологические исследования
7.5.2. РАКОВО-ЭМБРИОНАЛЬНЫИ АНТИГЕН
РЭА — гликопротеин, синтезируемый в желудочно-кишечном
тракте плода. У взрослых в норме РЭА в сыворотке крови практичес¬
ки отсутствует, его концентрации составляют 0-5 нг/мл. На уровень
РЭА влияют курение и в меньшей степени прием алкоголя (повышают
уровень маркера).
Этот опухолевый маркер определяется в повышенных концентра¬
циях в сыворотке крови у 60% больных раком толстой кишки. Однако
повышение концентрации РЭА наблюдается и у больных с незлока¬
чественными заболеваниями, такими, как заболевания печени (гепа¬
тит), панкреатит, воспалительные заболевания кишечника (язвенный
колит, болезнь Крона), хронические заболевания легких, аутоим«
мунные заболевания. Поэтому РЭА не является достаточно чувстви¬
тельным маркиром для скрининга на наличие рака толстой кишки*
Уровень РчЭА в сыворотке крови больных раком толстой кишки кор¬
релирует со стадией заболевания и служит показателем эффектив¬
ности оперативного лечения, химио- и лучевой терапии. РЭА может^ |
использоваться в качестве раннего маркера рецидивов и метастазов]
опухолей толстой кишки. При нелеченых злокачественных опухолях!
уровень РЭА постоянно увеличивается, причем в начальной стадии]
его повышение имеет выраженный характер.
Уровень РЭА может повышаться при других формах злокачественных!
заболеваний, таких как рак печени, молочной железы, желудка, легких*
поджелудочной железы, поэтому совместно с другими опухолевыми мар-!
керами используется для .мониторирования течения этих заболеваний.
7.5.3. РАКОВЫЙ АНТИГЕН СА-125
Злокачественные новообразования органов репродуктивной системі
у женщин составляют 15% всех опухолей. Среди злокачественных опухо¬
лей рак яичников занимает 2-е место по распространенности после рг
матки и 1-е место в структуре смертности. Наилучшим маркером налип|
чия рака яичников у пациента является раковый антиген СА-125.
Раковый антиген СА-125 — гликопротеин, синтезируемый серо¬
зными оболочками внутренних полостей организма и некоторым!
тканями. У женщин детородного возраста основным источникої
СА-125 является эндометрий, с чем связано циклическое изменен!
7Л. Исследование опухолевых маркеров 471
по уровня в крови в зависимости от фазы менструального цикла,
и период менструации концентрация СА-125 в крови повышается.
При беременности СА-125 выявляется в сыворотке крови беременной
(I I риместр) и амниотической жидкости (16-20 нед). У здоровых жен¬
шин на уровень СА-125 в крови оказывает влияние синтез этого мар¬
кера в мезотелии брюшной и плевральной полостях, перикарде, эпи-
1СЛИИ бронхов, маточных труб, яичников, а у мужчин (в дополнение к
гсрозным полостям) — в эпителии семенников. Нормальный уровень
(’Л-125 у женщин в сыворотке крови составляет до 35 МЕ/мл, при бере¬
менности сроком 1—2 нед — до 100 МЕ/мл, у мужчин — до 10 МЕ/мл.
Исследование СА-125 в крови применяют главным образом для
мониторинга серозного рака яичников и диагностики его рецидивов.
Установлено, что для серозного рака яичников повышение уровня
( А-125 в сыворотке крови тесно связано со стадией процесса, т.е. уро¬
вень маркера тем выше, чем выше стадия заболевания. У 83% больных
раком яичника уровень СА-125 в сыворотке крови составляет в сред¬
нем 124-164 МЕ/мл.
Регрессия опухоли при эффективном химиотерапевтическом,
химиолучевом лечении или удаление ее хирургическим путем сопро¬
вождается уменьшением содержания СА-125 в крови. Повышение
уровня СА-125 в крови связано с прогрессированием опухолевого про¬
цесса. Для оценки эффективности химиотерапии необходимо иссле-
л<ншть уровень СА-125 в крови перед началом каждого курса лечения,
II после его завершения с периодичностью 1—2 мес. В большинстве
случаев начало повышения уровня СА-125 в крови опережает клини¬
ческие проявления рецидива заболевания на 4—6 мес (в отдельных
случаях на 9-10 мес).
В отличие от серозного рака яичников, когда повышенный уровень
СЛ-125 в сыворотке крови выявляют у 60-81% пациенток, при других
гистологических типах рака яичников его содержание повышается в
25-30% случаев.
СА-125 является полезным маркером для оценки эффективности
лечения и раннего обнаружения рецидивов эндометриоза, который
шни.мает 2-е место после рака яичников по числу больных с повы¬
шенным содержанием СА-125 в крови. Повышение уровня СА-125 в
Крови коррелирует со стадией эндометриоза.
Концентрация СА-125 в крови повышается при различных
Иеопухолевых заболеваниях при вовлечении в процесс серозных
оболочек — перитоните, перикардите, плеврите разной этиологии.
472
Глава 7. Иммунологические исследования
Более значительное увеличение уровня СА-125 в крови наблюда¬
ется иногда при различных доброкачественных опухолях органов
женской репродуктивной системы (киста яичников), а также при
воспалительных процессах, вовлекающих придатки матки, и доб¬
рокачественной гиперплазии эндометрия. Однако в большинстве!
таких случаев концентрация СА-125 в сыворотке крови не превы¬
шает 100 МЕ/мл.
7.5.4. ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ АНТИГЕН
Простатический специфический антиген (ПСА) — гликoпpoтe-^
ин, синтезируемый клетками эпителия канальцев предстательной]
железы, В связи с тем, что ПСА синтезируется в парауретральны»!
железах, у женщин его малые количества могут обнаруживаться
крови. Нормальный уровень ПСА в сыворотке крови у мужчин д<
40 лет составляют до 2,5 нг/мл, после 40 лет — до 4 нг/мл. и
Исследование ПСА применяют для диагностики и мониторинга]
лечения рака предстательной железы, при котором его концент-'
рапия увеличивается, а также для мониторинга состояния паци«
ентов с гипертрофией предстательной железы в целях как можш
более раннего выявления рака этого органа. Уровень ПСА вьн
4 нг/мл обнаруживается примерно у 80—90% больных раком и
20% больных аденомой предстательной железы.
Пальцевое ректальное исследование, цистоскопия, колоноско-
ПИЯ, трансуретральная биопсия, лазерная терапия, задержка мочі
также могут вызвать повышение уровня ПСА. Влияние этих про¬
цедур на уровень ПСА максимально выражено на следующий ден1
после их проведения, причем наиболее значительно у больных
гипертрофией предстательной железы. Исследование ПСА в сыво,-^
ротке крови в таких случаях следует проводить не ранее чем чере^
7 дней после проведения перечисленных процедур.
Значительное повышение уровня ПСА в сыворотке иног;
обнаруживается при гипертрофии предстательной железы, а так:
при ее воспалительных заболеваниях.
При оценке уровня ПСА в крови необходимо ориентироватьс!
на следующие показатели:
• 0—4 нг/мл — норма;
• 4—10 нг/мл — подозрение на рак предстательной железы;
7,5. Исследование опухолевых маркеров
473
• 10—20 нг/мл — высокий риск рака предстательной железы;
• 20—50 нг/мл — риск диссеминированного рака предстательной
железы;
• 50—100 нг/мл — высокий риск метастазов в лимфатические узлы
и отдаленные органы;
• более 100 нг/мл всегда метастатический рак предстательной
железы.
Мониторинг концентрации ПСА обеспечивает более раннее
«»бнаружение рецидива и метастазирования рака предстательной
железы, чем прочие методы. При этом изменения даже в преде¬
лах границ нормы являются информативными. После тотального
удаления предстательной железы ПСА не должен выявляться, его
обнаружение свидетельствует об остаточной опухолевой ткани,
региональных или отдаленных метастазах. После операции уро¬
вень ПСА определяют не ранее чем через 60—90 дней в связи с воз¬
можными ложноположительными результатами.
При эффективной лучевой и гормональной терапии уровень
ПСА снижается. Контроль за уровнем ПСА у больных с леченым
раком предстательной железы следует проводить каждые 3 мес, что
позволяет своевременно выявить отсутствие эффекта от проводи¬
мой терапии.
Глава 8.
ИССЛЕДОВАНИЯ ПРИ ПРОВЕДЕНИИ
ОПЕРАЦИИ ПЕРЕЛИВАНИЯ КРОВИ
Переливание донорской крови — обычная процедура в клиничес¬
кой практике. В большинстве случаев она выполняется для спасения
жизни больного. Вместе с тем переливание донорской крови связано
со значительным потенциальным риском для пациента (реципиента).
Имеется два наиболее серьезных осложнения этой процедуры: зара¬
жение пациента инфекционной болезнью и опасная для его жизни
гемолитическая трансфузионная реакция, которая имеет место при
переливании несовместимой крови.
Для исключения заражения пациента инфекционной болезнью
все доноры крови подвергаются тщательному отбору, а вся донорская
кровь строго проверяется на наличие инфекции. Все стандартные
единицы донорской крови проверяются на наличие:
• антител к возбудителю сифилиса {Treponemapallidum)',
• поверхностного антигена вируса гепатита В (Hbs-антиген);
• суммарных антител к вирусу гепатита С;
• антител к ВИЧ '/г и антигена ВИЧ р24.
Ответственность за мероприятия, которые гарантируют поступ¬
ление безопасной донорской крови в отделения переливания крови
местных больниц, несут станции переливания крови.
Для предупреждения второй большой опасности — переливания
пациенту несовместимой крови — выполняется целый комплекс
анализов. Эти анализы производят в лечебном отделении больницы,
а также КДЛ. Первостепенное значение имеют три анализа: опреде¬
ление группы крови, определение антител, выполнение теста на сов¬
местимость крови донора и реципиента. Для понимания возможных
последствий переливания несовместимой крови и роли перечислен¬
ных анализов необходимо вспомнить некоторые знания основ имму¬
нологии (см. гл. 7).
Антитела — это белки, иммуноглобулины, которые связываются с
чужеродными белками и нейтрализуют их. Каждое антитело специ¬
фично, т.е. оно способно связываться только с одним видом антигена.
Эта особенность обусловлена природой молекул, находящихся на
Н.1. Антигены эритроцитов и группы крови 475
поверхности каждой клетки. Такие молекулы называются антигена¬
ми. Распознавание лимфоцитами специфических антигенов запускает
продукцию специфических антител. Способность организма выраба¬
тывать антитела к чужеродным молекулам лежит в основе иммунных
реакций. Белки и другие вещества на поверхности любых не своих
клеток рассматриваются как антигены и вызывают продукцию анти¬
тел. Таким образом, по]1 антигеном следует понимать любое вещество
(чаще белок), вызывающее выработку антител лимфоцитами, а анти¬
тело — это белок (иммуноглобулин), который циркулирует в плазме
крови и связывается с антигеном, вызвавшим его образование.
Понимание этих основ иммунологии имеет важное практическое
значение при определении группы крови, резус-фактора и антител к
эритроцитам при переливании донорской крови.
8.1. АНТИГЕНЫ ЭРИТРОЦИТОВ И ГРУППЫ КРОВИ
Эритроциты, как и другие клетки крови и тканей, несут на
своей поверхности антигены (белки, гликопротеины, гликолипиды).
Антигены эритроцитов наследуются от родителей. Они или их отсутс¬
твие определяют группу крови у каждого человека. Антигены эритро¬
цитов обладают способностью взаимодействовать с соответствую¬
щими антителами и образовывать комплексы антиген-антитело. При
попадании в организм антигена, отсутствующего у данного человека,
создаются предпосылки для выработки антител к нему. Выявлено
около 236 эритроцитарных антигенов (большинство из них встречает¬
ся редко), которые распределены по 29 системам групп крови. Однако
юлько небольшое число из них имеет практическое значение. К ним
относятся антигены системы АВО и системы резус-фактора.
8.1.1. ГРУППЫ КРОВИ АВО
Одной из основных систем антигенов эритроцитов является систе¬
ма АВО. У людей известны 4 группы крови по системе АВО (рис. 8-1),
которые определяются наследованием или ненаследованием двух
іритроцитарньїх антигенов — А и В, Если индивидуум не унаследовал
пи А-, ни В-антигенов, то у него группа крови О . У лиц с наследова-
476
Глава 8. Исследования при проведении операции переливания крови
нием А- или В-антигенов группа крови А или В соответственно. У тех,
кто унаследовал оба антигена, группа крови АВ. Ї
Антигены системы АВО формируются на эритрдцитах еще до рож- '
дения ребенка. Однако окончательное созревание антигенов происхо¬
дит только через несколько месяцев после рождения. I
А- и В-антигены
отсутствуют,
группа крови о
Имеется
А-антиген, группа
крови А
Имеется
В^антиген, группа
крови В
Имеются А- и В-
антигены, группа
крови АВ
Рис. 8-1. Группы крови ПО системе АВО
Характерной особенностью, отличающей систему антигенов эрит¬
роцитов АВО от других систем антигенов, является врожденное пос¬
тоянное присутствие в сыворотке крови людей (кроме лиц с группой
крови АВ) антител, направленных к антигенам А и В. Антитела к
антигенам эритроцитов других систем не являются врожденными и
вырабатываются в ответ на попадание этих антигенов в организм при
переливании крови или во время беременности. По наличию на эрит¬
роцитах антигенов А и В, а также присутствию в сыворотках крови
анти-А- и анти-В-антител различают 4 группы крови, характеристика
которых приведена в табл. 8-1.
Таблица 8-1,
Группы крови по системе АВО
Характеристика
Группа крови
0
А
В
АВ
Антигены
на эритроцитах
нет
А
В
А+В
Антитела
в сыворотке
Анти-А
Анти-В
Анти-В
Анти-А
Нет
Н./. Антигены эритроцитов и группы крови 477
8.1.2. АНТИГЕНЫ ЭРИТРОЦИТОВ СИСТЕМЫ РЕЗУС
(РЕЗУС-ФАКТОРА)
Система резус-фактора названа так потому, что впервые была
иы явлена у макак-резусов (Rh). Ее определение также имеет важное
імачение для успешного переливания крови. В системе резус выде¬
ляют 5 основных антигенс^в: С, с, D, Е и е. Однако только D-антиген
имеет сушественное практическое значение. Около 85% населения
России имеет D-антиген на эритроцитах. В этих случаях говорят, что
человек резус-положительный (RhD+). Около 15% людей не имеют
1)-антигена и являются резус-отрицательными (RhD-).
Обладая выраженными иммуногенными свойствами, антиген D
и 95% случаев является причиной гемолитической болезни новорож-
лснных при несовместимости матери и плода, а также частой причи¬
ной тяжелых посттрансфузионных осложнений.
Антитела к антигенам эритроцитов системы резус могут появиться
II крови человека в результате переливания ему эритроцитов доноров,
содержащих антигены, отсутствующие у реципиента (лимфоциты в
(пвет на попадание чужеродного антигена синтезируют антитела), а
также у матери в ответ на ее иммунизацию эритроцитами плода.
8.1.3. АНТИГЕНЫ СИСТЕМЫ КЕЛЛ
Система антигенов эритроцитов Келл (KELL) была открыта и
1946 г. R Кумбсом при исследовании причин гемолитической болез¬
ни новорожденных, в настоящее время насчитывается 24 антигена
•ритроцитов системы Келл. Наибольшее клиническое значение при
ірансфузиях имеет антиген К из-за его высокой иммуногенности.
Частота встречаемости антигена составляет в России 7—10%. Поэтому
почти каждая 10-я гемотрансфузия — это гемотрансфузия Келл-поло-
жительной крови Келл-отрицательному реципиенту, а каждая 10-я
Переменность — это беременность Келл-отринательной женщины
Келл-положительным плодом.
в сыворотке крови присутствуют антитела к анти гену к (анти-К).
)ти антитела могут вырабатываться после гемотрансфузий или
|||Ж гемолитической болезни новорожденных. Однако встречаются
.ІІІТИ-К антитела, которые выработались у индивидов без наличия
и анамнезе этих состояний. Появление этих антител связывают с
478 Глава 8. Исследования при проведении операции переливания крови
широким распространением в природе микроорганизмов, в кле¬
точной стенке которых содержатся белковые молекулы, близкие по
своей структуре с антигеном К человека.
Трансфузионные реакции, вызванные анти-К антителами,
могут привести к смертельному исходу. Антигены системы Келл
выявляются на эритроцитах плода в ранние сроки беременности.
При наличии в крови матери анти-К антител, они могут проник¬
нуть в кровь плода и вызвать гемолитическую болезнь новорож¬
денных. При этом анти-К антитела вызывают наиболее тяжелые
формы болезни с внутриутробной смертью и мертворождением.
Частота встречаемости гемолитической болезни новорожденных,
обусловленной анти-К антителами, составляет 1 случай на 10 000-
20 ООО родов. Учитывая тяжелые последствия заболевания, у
нас в стране проводится обязательное обследование доноров и
беременных на наличие антигенов эритроцитов системы Келл
(К-антигена). При его выявлении дополнительно определяю!
анти-К антитела.
8.1.4. ДРУГИЕ МЕНЕЕ ЗНАЧИМЫЕ АНТИГЕНЫ ЭРИТРОЦИТОВ
При переливании крови обычно исследуют наличие антиге¬
нов системы АВО и резус. Из остальных 236 антигенов, которые
могут находиться, а могут и отсутствовать на поверхности эритро¬
цитов, некоторые имеют практическое значение при переливании
крови. Среди антигенов эритроцитов это антигены системы Даффи
(Duffy — антиген Fy), Кидд (Kidd — антиген Jk), MNS (антиген MNS)
и Левис (Lewis — антиген Le). Эти антигены редко вызывают трансфу¬
зионные реакции, так как встречаются у людей нечасто, к тому же они
относительно слабоиммуногенны. В системе резус, помимо антигена
D, могут встречаться антигены С, с, Е и е.
Безусловно, в идеальном варианте при решении вопроса о
переливании пациенту крови было бы целесообразно опреде¬
лять максимально возможное число антигенов эритроцитов. Это
позволило бы осушествлять индивидуальный подбор крови для
каждого реципиента. Однако на практике реализовать это очень
трудно, да и не нужно, так как не все антигены эритроцитов обла¬
дают выраженной иммуногенностью, а некоторые из них встреча¬
ются очень редко.
Н.2. Антитела к антигенам эритроцитов 479
8.2. АНТИТЕЛА К АНТИГЕНАМ ЭРИТРОЦИТОВ
Наличие различных систем антигенов на эритроцитах имеет важ¬
ное практическое значение при переливании крови. Это обусловлено
ГСМ, что в плазме крови реципиента могут присутствовать антитела
к ним. Реакция на переливание несовместимой крови происходит в
ЮМ случае, если антител'а реципиента связываются с соответствую¬
щими антигенами эритроцитов донора. Это связывание антигенов с
пнтителами приводит к разрушению эритроцитов донора и называ-
сгся гемолизом. Гораздо реже гемолиз наступает в результате разру¬
шения эритроцитов реципиента антителами донора. Этот процесс
может наблюдаться при трансфузиях донорской плазмы, содержащей
пнтитела к антигенам эритроцитов реципиента. Для описания такого
(»сложнения переливания крови или плазмы используют термины
-гемолитическая трансфузионная реакция» или «посттрансфузион-
ное гемолитическое осложнение».
Если плазма реципиента не содержит антител к антигенам эритро¬
цитов донора, их кровь называется совместимой и донорскую кронь
можно безопасно переливать.
Для понимания основ развития гемолитической трансфузионной
реакции важнейшим является механизм образования антител к анти-
1еиам эритроцитов в организме реципиента. Откуда появляются эти
пнтитела и при каких ситуациях?
Из основ иммунологии хорошо известно, что антитела образуются
юлько после контакта лимфоцитов с соответствующим чужеродным
интигеном. Для клинической практики важно понимать, что сущес-
щуетдва случая, когда лимфоциты реципиента могут вступать в кон-
111КТ с чужеродными антигенами эритроцитов. Первый из них — это
переливание донорской крови, а второй — беременность. В первом
емучае антиген непосредственно поступает в организм с эритроцита¬
ми донора, и иммунная система реципиента отвечает на них синтезом
I иепифических антител. Во время беременности эритроциты плода
могут проникать в кровоток матери. Если они содержат на сноей
Поиерхности антигены, унаследованные от отца, а эритроциты матери
Щ' имеют этих антигенов, то иммунная система матери рассматривает
шкие клетки как чужие и начинает синтезировать антитела к ним.
Напомним, что при первичном контакте с чужеродным антигеном
иммунная система продуцирует небольшое количество антител. Поэтому
мри первом переливании крови или беременности они не оказывают
480 Глава 8. Исследования при проведении операции переливания крови
выраженного повреждающего действия. Однако в результате первичного
контакта с чужеродным антигеном формируются В-лимфоциты памяти,
которые хранят информацию об антигене. При првторном контакте с
чужими эритроцитарными антигенами они синтезируют большое коли¬
чество антител, способных разрушать эритроциты донора. Такие антите¬
ла называются антиэритроцитарными антителами.
Наибольшее практическое значение такой механизм появле¬
ния антител имеет в отношении антител к эритроцитам, несущим
RhD-антиген (антиген системы резус-фактора). Безусловно, только
те люди, которые не имеют RhD-антигена (15% населения, резус-
отринательные), могут быть иммунизированы и вырабатывать анти-
D-антитела. Примерно 1% населения имеют такие антитела в резуль¬
тате предыдущего переливания крови или беременности. Если таким
лицам переливают резус-положительную кровь, антитела, имеющие¬
ся в их плазме, связываются с антигенами на поверхности донорских
эритроцитов, что вызывает их гемолиз.
Однако проблема гемолитическихтрансфузионных реакций состо¬
ит в том, что иммунные антиэритроцитарные антитела не единствен¬
ные, представленные в плазме реципиента. Поэтому не только лица,
имеющие в анамнезе переливание крови и беременность, подверженi.i
риску получения несовместимой крови.
Напомним, что клиническое значение групп крови системы АВО
состоит в том, что антитела к антигенам эритроцитов присутствуют и
плазме крови изначально (являются врожденными), а не появляются
в результате предшествующей иммунизации чужеродными эритро¬
цитами. Лица с группой крови О (на эритроцитах нет антигенов А и
В), имеют в сыворотке крови антитела к обоим антигенам (анти-А
и анти-В). У людей с группой крови А (А-антиген на эритроцитах)
есть антитела к В-антигену (анти-В). Лица с группой крови В имею! ,
анти-А-антитела. Примерно 3—4% населения имеют группу крови АН *
(на эритроцитах присутствуют А- и В-антигены) и, следовательно, мс
содержат антител в сыворотке крови.
Широкая распространенность и потенциальная опасность наличия
анти-А- и анти-В-антител имеют первостепенное клиническое значение
при определении группы крови по системе АВО у донора и реципиента.
Все остальные антитела, имеющие значение для клиническоИ
практики, появляются подобно анти-П-антителам, в результаю
иммунизации и отсутствуют в сыворотке крови, если в анамнезе
пациента не было переливания крови или беременности.
г
Н.З. Определение группы крови, резус-фактора, титра антител... 481
Таким образом, важнейшее клиническое значение имеют только
тиачально существующие в организме человека антитела — анти-А
и анти-В. Поэтому если обеспечена совместимость донора и реципи¬
ента по системе АВО, переливание крови на 97% иммунологически
Нсзопасно.
8.3. ОПРЕДЕЛЕНИЕ ГРУППЫ КРОВИ, РЕЗУС-ФАКТОРА,
ТИТРА АНТИТЕЛ И СОВМЕСТИМОСТИ КРОВИ ДОНОРА
И РЕЦИПИЕНТА
Предупреждение переливания пациенту несовместимой крови
предусматривает выполнение комплекса мероприятий и анализов
II отношении крови реципиента и донора. Частично эти анализы
выполняют в лечебном отделении ЛПУ, но в основном — в КДЛ.
Для определения группы крови, резус-фактора и титра антител
достаточно взять у пациента 6—8 мл крови в обычную пробирку (ваку-
юйнер) без каких-либо добавок. Допускается хранение проб крови до
I сут при температуре 4—8 'С.
Переливание донорской крови может представлять потенциаль¬
ную опасность для пациента. В первую очередь необходимо исклю¬
чить возможность переливания донорской крови не тому пациенту.
Для этого чрезвычайно важное значение имеют точная идентифика¬
ция пациента и скрупулезность при оформлении сопроводительной
.'кжументации, когда производят взятие крови для определения ее
I руппы и резус-фактора. Перед взятием крови необходимо убедиться,
4 10 перед вами именно тот пациент, которому назначены анализы,
I просив его фамилию, имя и отчество и проверив, совпадают ли они с
памными бланка-заявки.
На этикетке пробирки и бланке-заявке должна быть отражена сле-
аующая информация:
• фамилия, имя и отчество пациента;
• пол и дата рождения;
• номер истории болезни (амбулаторной карты);
• отделение и палата;
• данные врача, назначившего анализы;
• дата и время взятия крови;
• фамилия и инициалы лица, берущего кровь.
482 Глава 8. Исследования при проведении операции переливания крови
Прежде чем приступить к переливанию крови, необходимо провести
ряд исследований по предупреждению несовместимости при перелива¬
нии крови. Согласно существующим в России руководящим докумен¬
там, перед отправкой крови пациента для исследования в лабораторию
необходимо определить группу крови в процедурном кабинете. Это
исследование должен выполнить врач-клиницист. Однако на практике
определение группы крови проводит медицинская сестра, а врач оце¬
нивает результаты теста. Поэтому медицинская сестра должна знаті,
методику проведения исследования. Она аналогична той, что выпол¬
няется в лаборатории с моноклональными антителами (цоликлонами)
и приведена ниже. Результат определения группы крови в процедурном
кабинете вносится в направление, подписывается врачом-клиницис
том и вместе с пробой крови доставляется в лабораторию.
Первый анализ, который проводят в лаборатории, — определение
группы крови пациента. Одновременно определяют резус-фактор.
Для определения группы крови используют различные методы.
В нашей стране определение группы крови АВО проводят по антиге
нам, содержащимся на исследуемых эритроцитах, либо по антигенам
эритроцитов и антителам, содержащимся в исследуемой сыворотке.
В первом случае для исследования используют стандартные изогемаї -
глютинирующие сыворотки или моноклональные антитела (цоли
клоны), во втором — стандартные изогемагглютинирующие сьіворої -
ки или моноклональные антитела, а также стандартные эритроциты
групп крови А, В и О (перекрестный метод). Наибольшее распростра¬
нение получил метод с использованием моноклональных антител
(цоликлонов) и стандартных эритроцитов (перекрестный метод).
Определение группы крови. Группу крови по системе АВО определя¬
ют простым смешиванием на плоскости планшета эритроцитов паци¬
ента с тремя сыворотками; одна из них содержит анти-А-, другая
анти-В-, а третья — анти-А+В-антитела (цоликлоны). Связывание
антител с соответствующими антигенами проявляется агглютинаци¬
ей эритроцитов. Этот феномен отражает другое название для эритро¬
цитарных антигенов и антител. Антитела к эритроцитам называются
агглютининами, а антигены — агглютиногенами. При добавлении
сывороток к антигенам эритроцитов эритроциты либо агглютини¬
руют, либо остаются во взвешенном состоянии. Оценка результатов
проводится в соответствии с данными, приведенными в табл. 8-2.
Медицинская сестра в процедурном кабинете при определении груп¬
пы крови выполняет только эту часть методики.
Н.З. Определение группы крови, резус-фактора, титра антител...
483
В лаборатории же проводят еще и дополнительный проверочный
ICCT, при котором сыворотку крови пациента добавляют к стандарт¬
ным эритроцитам группы крови О, А и В,
Учет реакции производят путем сопоставления результатов, полу¬
ченных при помощи стандартных сывороток и стандартных эритро¬
цитов. Результаты обеих реакций должны совпадать, т.е. указывать
IUI содержание агглю^иногенов и агглютининов, соответствующих
одной и той же группе крови.
Таблица 8-2.
Оценка результатов реакции агглютинации эритроцитов
с моноклональными антителами
Результат реакции исследуемых
эритроцитов с антителами
анти-А
анти-В
анти -АВ
Исследуемая кровь
принадлежит к группе
АВ
Определение резус-фактора. Резус-фактор определяют смешива¬
нием эритроцитов пациента с раствором моноклональных анти-О-
нитител. Агглютинация указывает на присутствие В-антигена на
•ритроцитах. Такая кровь является резус-положительной. Отсутствие
агглютинации указывает, что кровь резус-отрицательная.
Определение антител. Определение группы крови по системе АВО
цошоляет установить, какие антитела (агглютинины) к эритроцитам
имеются в крови пациента. Плазма крови может содержать либо анти-
А . либо анти-В-антитела, либо те и другие, либо их вовсе не содер-
Ж!ггь. Примерно в 97% случаев другие антитела в сыворотке крови
у пациента отсутствуют. В подавляющем большинстве случаев все
Опальные антитела к эритроцитам, включая антитела к резус-факто-
||5у (анти-О антитела), появляются в сыворотке крови пациента только
Iрезультате предшествующей иммунизации при гемотрансфузии или
беременности. Вместе с тем необходимо понимать, что присутствие
Тнких нетипичных антиэритроцитарных антител в крови пациен-
|ти способно вызвать гемолитическую реакцию, если переливаемые
»ритроциты несут соответствующий антиген. Поэтому в сыворотке
484 Глава 8. Исследования при проведении операции переливания крови
крови всех пациентов, которым назначено переливание крови, прово¬
дится поиск нетипичных антиэритроцитарных антител.
Тест проводят путем добавления капли сыворртки крови пациента
к набору образцов разных эритроцитов группы О, каждый из которых
несет известную комбинацию антигенов, способных вызвать иммун¬
ную реакцию.
В основе теста лежит иммунологическая особенность эритроцитои
группы О —они не несут на себе ни А-, ни В-антигенов. Поэтому любая
агглютинация при добавлении к ним сыворотки пациента будет обус¬
ловлена присутствием в ней нетипичных антител. Отсутствие агглю¬
тинации указывает на их отсутствие.
При положительной реакции на наличие антител их идентифика¬
цию проводят таким же методом с использованием панели эритроци¬
тов, содержащих 12—15 образцов с различными антигенами.
В практической медицине антитела к эритроцитам определяют и
следующих случаях:
• у доноров перед сдачей крови, чтобы быть уверенным, что заго¬
товленная кровь (или гемотрансфузионная среда — тромбовз-
весь, плазма, эритроконцентрат) не содержит антител, способных
вызвать гемолиз эритроцитов реципиентов;
• у реципиентов перед переливанием крови, чтобы предотвра¬
тить гемотрансфузию, несовместимую по антигенам эритроцитои
донора с антителами реципиента;
• у беременных для выявления возможного иммунного конфликта
с плодом по антигенам эритроцитов (для предупреждения гемо¬
литической болезни новорожденных).
Исследование донорской крови. После определения группы крови,
резус-фактора и антител к эритроцитам у пациента необходимо
подобрать подходящую донорскую кровь. Подбирают кровь, эритро¬
циты которой не несут антигенов, реагирующих с антителами в сыво¬
ротке реципиента. Пациентам, у которых не обнаружено дополни¬
тельных антител, достаточно подобрать кровь, совместимую по АВО и
резус-фактору. В большинстве случаев это означает подбор крови той
же группы АВО и резус-принадлежности, что и у пациента.
Пациентам, у которых обнаружены нетипичные антитела, необ¬
ходимы дальнейшие мероприятия по подбору донорской крови.
Первоначально отбирают кровь, соответствующую по системе АВО
и резус-фактору, как описано выше. В дальнейшем эритроциты это!!
донорской крови проверяют на присутствие антигенов, антитела к
Н.4. Осложнения после гемотрансфузий 485
которым обнаружены в сыворотке крови пациента. Если такие анти-
1СНЫ отсутствуют, эту кровь можно переливать, если нет - подбирают
яругую донорскую кровь.
Определение совместимости крови донора и реципиента. Проведя
подбор донорской крови, эритроциты которой не несут антиге¬
нов, реагирующих с антителами в плазме реципиента, осуществля¬
ют последнюю проверк;^, чтобы гарантировать совместимость. Для
ного выполняют анализ, который моделирует переливание крови,
по проводят его в пробирке. Сущность анализа состоит в том, что
•ритроциты донора смешивают с образцом сыворотки крови паци¬
ента (реципиента) и наблюдают за появлением агглютинации. Если
игглютинации не происходит, то это указывает на отсутствие реакции
интиген—антитело, а значит, на совместимость эритроцитов донора с
плазмой пациента и безопасность предстоящего переливания крови.
8.4. ОСЛОЖНЕНИЯ ПОСЛЕ ГЕМОТРАНСФУЗИИ
Термин «посттрансфузионные реакции и осложнения» использу-
сгся для обозначения всех нежелательных последствий, возникающих
у реципиента после переливания крови. При проведении гемотранс¬
фузий у реципиентов возможны иммунные и неиммунные реакции и
осложнения. Осложнения иммунного типа обусловлены иммунологи¬
ческим конфликтом между компонентами крови донора и реципиен-
т, в основе которых лежит реакция антиген—антитело. Осложнения
псиммунного типа обусловлены многими причинами: трансфузиями
1смолизированных эритроцитов, переливаниями инфицированной
ипрусами и бактериями крови, метаболическими нарушениями в
результате трансфузии, нарушениями техники трансфузии.
8.4.1. ИММУННЫЕ ГЕМОЛИТИЧЕСКИЕ
ТРАНСФУЗИОННЫЕ РЕАКЦИИ
Гемолитические реакции и осложнения обусловлены разрушением
эритроцитов доноров антителами реципиентов. Гораздо реже гемоли-
шческие реакции и осложнения наступают в результате разрушения
эритроцитов реципиента антителами доноров (наблюдаются при
486 Глава 8. Исследования при проведении операции переливания крови
трансфузиях плазмы, содержащих антитела к антигенам эритроци¬
тов реципиента). Частота иммунных гемолитических осложнении
составляет от 0,002 до 0,2% количества всех гемохрансфузий.
Самой частой причиной иммунных гемолитических трансфу-
зионных реакций являются переливания крови, несовместимой
по антигенам эритроцитов АВО. Анти-А-, анти-В-антитела, при¬
сутствующие в плазме крови у лиц, не имеющих соответственно¬
го антигена А или В на эритроцитах, реагируют с эритроцитами
донора, несущими этот несовместимый антиген. Такая реакция
может начаться уже после введения нескольких миллилитров крови.
Рассмотрим закономерности развития гемолитической реакции нл
примере донора с группой крови В, кровь которого перелили паци¬
енту с группой крови А (рис. 8-2).
В этом случае анти-В антитела в плазме пациента (реципиента)
связываются с антигеном В на поверхности эритроцитов донора.
Происходят реакция антиген—антитело и агглютинация эритроци
тов. Образовавшийся комплекс антиген—антитело активирует систе¬
му комплемента (см. гл. 7). Белки системы комплемента ответственны
за многие проявления гемолитической трансфузионной реакции,
Они принимают участие в разрушении эритроцитов (гемолиз) путем
образования в клеточной мембране эритроцитов отверстий, через
которые в эритроцит из плазмы крови поступает вода. Эритроциты
содержат много белка (гемоглобина), поэтому притягивают воду.
В результате они набухают, и их мембраны разрываются, а содержимое
(гемоглобин) попадает в плазму. Интенсивность разрушения эрит¬
роцитов в основном зависит от уровня антител в плазме пациента.
В наиболее тяжелых случаях АВО-несовместимости могут разрушить¬
ся все донорские эритроциты. Кроме того, белки системы компле¬
мента запускают воспалительный ответ, который включает высво
бождение биологически высокоактивных веществ из активированных
тучных клеток (гистамин, брадикинин), что приводит к ознобу, лихо¬
радке и резкому снижению артериального давления, которое вызыва¬
ет развитие шока и снижает кровоснабжение почек, а, следовательно,
и скорость клубочковой фильтрации. В наиболее тяжелых случаях
развивается острая почечная недостаточность. Другие осложнения
тяжелой гемолитической трансфузионной реакции включают диссс
минированное внутрисосудистое свертывание крови и желтуху, так
как гемоглобин, вышедший из разрушенных эритроцитов, превраща¬
ется в билирубин.
Н,4. Осложнения после гемотрансфузий
487
Кровь донора
«УЧ.
•“0- ^
Плазма
пациента
+
Ч -ч
ч
V \
Группа крови В
Эритроциты несут на
поверхности В-
антиген
'В-антиген
Группа крови А
Анти-В-антитела
находятся в плазме
Анти-В
Гис. 8-2. Реакция на переливание несовместимой крови
488 Глава 8. Исследования при проведении операции переливания крови
Если донорская кровь совместима с кровью реципиента по системе
АВО, то остается риск гемолитической трансфузионной реакции при
наличии в плазме пациента других антиэритроцитарных антител. R
большинстве случаев эти антитела приобретаются на протяжении
жизни в результате перенесенных переливаний крови или беременнос¬
ти. Наиболее значимы из них анти-О-антитела (антитела к резус-фаю
тору). Гемолитические реакции и осложнения, обусловленные анти-D
антителами, занимают 2-е место среди всех таких осложнений после
несовместимости по антигенам эритроцитов АВО. Значительно реже
гемолитические трансфузионные реакции связаны с наличием антител
к другим антигенам системы резус, таких как анти-С-, анти-с-, анти
Е- и анти-е-антитела. Еще реже гемолитические реакции связаны с
наличием антител к другим антигенам эритроцитов: анти-К (к группе
антигенов Kell), анти-Fy (к группе антигенов Duffy) и др. Клинические
проявления гемолитической трансфузионной реакции, которая разви
вается из-за присутствия этих антител, менее тяжелы, чем при несов
местимости по группе АВО. Довольно часто они могут носить отсро
ценный характер (до 10 дней). В результате разрушения эритроцитои
развиваются гемолитическая анемия и умеренная желтуха.
При развитии тяжелой гемолитической реакции необходимо пои
торно направить в лабораторию пробу донорской крови и свежий
образец крови пациента для выяснения причины реакции. В обеих
пробах крови лаборатория повторно определяет группу крови, резус
фактор, нетипичные антитела в плазме крови пациента и совмести
мость крови донора и реципиента.
8.4.2. ДРУГИЕ ТРАНСФУЗИОННЫЕ РЕАКЦИИ
Помимо гемолитических, существуют и другие реакции, которые
могут происходить во время переливания крови, чаще всего негемолити
ческие иммунные реакции. Они происходят при участии иммунной сис^
темы реципиента, но не сопровождаются гемолизом. Антитела, вызыва
ющие негемолитические реакции, направлены к антигенам лейкоцитов и
тромбоцитов донора. Чаще всего клиническое течение негемолитических
осложнений менее тяжелое, смертельные исходы редки.
Фебрильные негемолитические реакции клинически проявляются
повышением температуры тела реципиента в течение 8—24 ч после
трансфузии. Сопровождаются ознобом, иногда головной болью и
Н.5. Гемолитическая болезнь новорожденных 489
(к)лью в спине. Негемолитические реакции обусловлены взаимодейс-
іиием между антителами, присутствующими в плазме реципиента,
и антигенами, находящимися на перелитых реципиенту лимфоци-
іах, гранулоцитах и тромбоцитах донора. Они неопасны для жизни
пациента и встречаются в 1 случае на 130—140 трансфузий крови или
и 20% при трансфузиях тромбоцитной массы. Такие реакции чаще
наблюдаются у реципи^тов, имеющих в анамнезе множественные
ірансфузии или многократные беременности.
Аллергические реакции — крапивница — обусловлены аллергией к
одному или нескольким белкам плазмы переливаемой крови. Реакция
характеризуется сыпью, кожным зудом, обычно без повышения тем¬
пературы тела. Она проявляется через 15—20 мин после трансфузии.
Очень редко аллергия может проявляться тяжелым анафилактичес¬
ким шоком — неотложным состоянием, характеризующимся сниже¬
нием артериального давления, болью в груди и одышкой.
Бактериальная инфекция. Очень редко в клинической практике
могут встречаться факты переливания крови, загрязненной бактери-
ими. В таких ситуациях клинические симптомы у пациента в связи с
(ыктериемией могут варьировать и зависят от вида и количества бак¬
терий, попавших в кровь реципиента. В наиболее тяжелых случаях
возможно развитие сепсиса.
8.5. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ
Гемолитическая болезнь новорожденного и плода развивается при
наличии в крови у матери антител к антигенам эритроцитов плода,
способных проходить через плаценту в кровоток ребенка и взаимо-
асйствовать с его эритроцитами, вызывая их гемолиз.
Наиболее частой причиной гемолитической болезни новорожден¬
ных являются антитела к антигенам резус-системы. Если ребенок
унаследовал от отца эритроцитарные антигены, с которыми реаги¬
руют материнские антитела, происходит гемолитическая реакция и
эритроциты плода разрушаются.
В наибольшей степени риск развития гемолитической болезни
иыражен при беременности, когда мать принадлежит к группе ORhD-,
и отец ORhD+. Согласно законам наследования, имеется один шанс
И1 четырех, что ребенок будет резус-положительным. Если это про¬
490 Глава 8. Исследования при проведении операции переливания крови
исходит, то эритроциты плода, несущие О-антиген, проходя через
плаценту в кровь матери, распознаются лимфоцитами матери как
чужеродные антигены. В ответ на поступление ^^yжepoдныx анти¬
генов В-лимфоциты продуцируют анти-О антитела. При первой
беременности количество синтезированных антител недостаточно
для того чтобы вызвать иммунную реакцию и массовый гемолиз
эритроцитов плода. Однако в крови матери образуются В-лимфоци¬
ты памяти, которые хранят информацию о чужеродном О-антигенс
и могут ответить массивной продукцией антител при повторном пос¬
туплении антигена. Поэтому при последующих беременностях резус-
положительным плодом в организме женщины образуется большое
количество анти-О антител. Они поступают из крови матери в кровь
плода и связываются с антигеном на его эритроцитах, вызывая их
массивный гемолиз.
Гемолиз эритроцитов влечет повышенное образование билирубина
и гипербилирубинемию, так как печень плода еще функционально
незрела и не может осуществлять его связывание с глюкуроновой кис¬
лотой (в печени отсутствует фермент, обеспечивающий связывание
свободного билирубина с глюкуроновой кислотой). Поэтому во время
внутриутробного развития билирубин в крови плода находится в несвя¬
занном (свободном) состоянии. Он может проходить через плаценту И
кровь матери и подвергаться связыванию и удалению ее печенью. Этоз
процесс приводит к снижению уровня гипербилирубинемии у плода.
Однако в наиболее тяжелых случаях развивающаяся гемолитическая
анемия может привести к внутриутробной гибели плода.
После рождения в связи с функциональной недостаточностью пече¬
ни новорожденного превращение свободного билирубина в связанный
(коньюгированный) в печеночных клетках идет замедленно. Поэтому
концентрация свободного билирубина в крови, который не можеі
выделяться почками, начинает быстро возрастать. В результате разви¬
вается гипербилирубинемия, что клинически выражается в желтуш¬
ном окрашивании кожных покровов и слизистых оболочек новорож¬
денного. Повышение концентрации свободного билирубина в крови
плода оказывает токсическое действие на все ткани новорожденного.
Так как свободный билирубин хорошо растворим в жирах, то при
высокой концентрации происходит его накопление в богатых липида¬
ми нервных клетках. Под действием гипербилирубинемии поражают¬
ся преимущественно подкорковые и стволовые ядра головного мозга, и
результате развивается билирубиновая энцефалопатия.
I
Н.5. Гемолитическая болезнь новорожденных 491
Ребенок с гемолитической желтухой нуждается в обменном перели¬
вании крови, при котором резус-положительная кровь (новорожден¬
ного), содержащая повреждающие антитела, замещается резус-отри-
нательной (донора), эритроциты которой из-за отсутствия антигенов
НС могут быть разрушены.
В целях предотвращения развития гемолитической болезни ново¬
рожденных, вызванной резус-несовместимостью, всем резус-отри-
нательным женщинам, впервые беременным резус-положительным
плодом, показано введение (в виде инъекции) иммуноглобулина
анти-О (анти-В антитела). Иммуноглобулин анти-О должен быть
введен до того, как началась иммунизации или при любом сроке бере¬
менности, если имеется подозрение, что эритроциты плода проникли
в кровь матери. Введенные анти-О антитела разрушают эритроциты
плода в крови матери, прежде чем они вызовут иммунный ответ, и тем
самым предупреждают продукцию собственных антител, которые
могут осложнить последующие беременности.
Другие антитела, которые принадлежат к системе резус-факто¬
ра (анти-С, анти-Е и анти-е), также могут вызвать гемолитическую
Оолезнь. Однако такие варианты заболевания встречаются редко.
Как причина гемолитической болезни новорожденных несовмес-
шмость по системе группы крови АВО встречается крайне редко. Это
обусловлено тем, что анти-А- и анти-В-антитела не могут проникать
через плаценту и вступать в контакт с эритроцитами плода. В редких
с лучаях при осложненном течении беременности возможно развитие
1смолитической болезни новорожденных, обусловленной АВО-несов-
мсстимостью. Однако клинически она протекает легко.
Учитывая серьезные последствия, которые могут оказывать нети¬
пичные антиэритроцитарные антитела на плод, необходимо обследо-
илгь женщин на наличие таких антител в ранние сроки беременности.
Глава 9.
СЕРОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
организм человека защищается от возбудителей инфекционных
заболеваний с помощью механизмов иммунитета. В основе имму¬
нитета лежат антиген неспецифические (врожденные) и антигеп-
специфические (приобретенные, адаптивные) факторы защиты,
Реализация антигенспецифических механизмов иммунитета явля¬
ется функцией высокоспециализированных клеток иммунной сис¬
темы—лимфоцитов. Антигенспецифические механизмы иммунного
ответа формируются только после контакта с конкретным микроор
ганизмом, возбудителем инфекционного заболевания. Белки, вхо
дящие в состав структур микроорганизмов, являются чужеродными
веществами для организма человека и называются антигенами.
Основная защитная функция лимфоцититов состоит в распознава¬
нии и удалении чужеродных антигенов (бактерий). Механизмами
практической реализации защитной функции являются синтез и
секреция специфических антител к конкретному антигену (возбуди¬
телю), которые способны связывать чужеродные антигены бактериіі
и удалять их из организма. Закономерности практической реали¬
зации антигенспецифических механизмов иммунной защиты поз¬
волили разработать и использовать в клинической практике серо
логические методы исследования для диагностики инфекционных
заболеваний. Серологические методы дают возможность выявлять и
крови больных или антитела, специфичные для определенного воз¬
будителя инфекционного заболевания, или антигены (в большинс
тве случаев белки) самих микроорганизмов. В любом случае в основе
всех серологических реакций лежит взаимодействие антигена и
антитела. Таким образом, серологические реакции используются в
двух направлениях.
Обнаружение с диагностической целью антител, специфичных к
определенному возбудителю инфекционного заболевания в сыво¬
ротке крови обследуемого, в этом случае из двух компонентов реак¬
ции (антитело—антиген) неизвестным является сыворотка (анти¬
тела) крови, так как реакция проводится с заведомо известными
антигенами, т.е. к сыворотке крови больного добавляется антигеи
Серологические исследования 493
определенного микроорганизма. Положительный результат реак¬
ции свидетельствует о наличии в крови антител, специфичных к
применяемому антигену; отрицательный результат указывает на
огсутствие таковых. Диагностическое значение имеет или высокий
уровень (титр) антител уже в первом исследовании, или нарастание
уровня (титра) антител в 4 раза и более при исследовании парных
1'ывороток крови больногб, взятой в начале заболевания (3—7-й день)
и через 10—12 дней.
В качестве антигенов при диагностике бактериальных инфек¬
ций применяют взвеси живых или убитых микрорганизмов, их
»кстракты или отдельные фракции экстрактов.
При диагностике вирусных инфекций в качестве антигенов
используют аллантоисную, амниотическую жидкость, суспензии
пллантоисных оболочек и желточных мешков куриных эмбрионов,
жидкую фракцию и экстракт клеток тканевых культур или гомоге-
иаты органов животных, зараженных определенными вирусами.
С внедрением в практику лабораторий метода иммунофермент-
иого анализа (ИФА) стало возможным определять в крови больных
пнтитела, относящиеся к различным классам иммуноглобулинов
|lgM и IgG), что существенно повысило информативность сероло-
шческих методов диагностики. При первичном иммунном ответе,
ю есть когда иммунная система человека взаимодействует с инфек¬
ционным агентом в первый раз, синтезируются преимущественно
пнтитела, относящиеся к иммуноглобулинам класса М. Лишь поз-
лмее, на 8—12-й день после попадания антигена в организм в крови,
начинают накапливаться антитела иммуноглобулинов класса С,
При повторном контакте с антигеном уже с первых часов развития
иммунного ответа количество сывороточных антител IgG к данному
позбудителю инфекционного заболевания превышает количество
питител IgM. Поэтому количественное определение в крови паци¬
ента антител IgG и IgM к соответствующему антигену позволяет не
только судить о наличии заболевания, но и оценить, первичное это
инфицирование или вторичное. При иммунном ответе на инфекци¬
онные агенты вырабатываются также и антитела класса IgA, кото¬
рые играют важную роль в защите от инфекционных агентов кожи и
слизистых оболочек.
Определение с диагностической целью родовой и видовой при¬
надлежности микроба или вируса, которые могут присутствовать
п сыворотке крови больного, в этом случае неизвестным компо¬
494 Глава 9. Серологические исследования
нентом реакции является антиген (микроб или вирус), к которому
добавляют иммунную сыворотку с антителами к заведомо извест¬
ному возбудителю инфекционного заболевания.
Серологические исследования, выполняемые для обнаружения
специфических антител и антигена возбудителя при инфекционных
заболеваниях, — более доступные методы лабораторной диагностики,
чем бактериологическое выявление возбудителя. В ряде случаев серо¬
логические исследования являются единственным методом диагнос¬
тики инфекционных заболеваний.
Наиболее часто серологические методы исследования применяют
в клинической практике для диагностики сифилиса, вирусных гепа¬
титов и инфицирования ВИЧ (ВИЧ-инфекции).
Серологические исследования не обладают 100% чувствительнос¬
тью и специфичностью в отношении диагностики инфекционных
заболеваний, могут давать перекрестные реакции с антителами,
направленными к антигенам других возбудителей. В связи с этим оце¬
нивать результаты серологических исследований необходимо с боль
шой осторожностью и учетом клинической картины заболевании.
Именно этим обусловлены использование для диагностики одной
инфекции множества тестов, а также применение дополнительных
методов для подтверждения результатов скрининговых тестов.
9.1. ДИАГНОСТИКА СИФИЛИСА
Сифилис — заболевание, передающееся половым путем, которое
вызывает бледная спирохета {Treponema pallidum). Заболевание начи¬
нается с появления безболезненной язвы (твердого шанкра) в Mecie
внедрения возбудителя и регионарного лимфаденита. Через некото¬
рое время инфекция становится генерализованной: развивается вто
ричный, а затем третичный сифилис.
Классификация сифилиса
1. Первичный — развивается спустя 10—90 сут (в среднем 21 cyi)
после заражения.
2. Вторичный — развивается спустя 2—6 мес после заражения или
2—10 нед после появления твердого шанкра.
3. Латентный (скрытый) — стадия болезни, при которой серо¬
логические реакции положительны, а какие-либо признаки пора¬
V./. Диагностика сифилиса 495
жения кожи, слизистых оболочек и внутренних органов отсутс-
I вуют:
• ранний латентный — менее 2 лет с начала заболевания;
• поздний латентный — более 2 лет с начала заболевания;
• неуточненный латентный.
4. Третичный — развивается через 3—7 лет после начала заболева¬
ния (от 2 до 60 лет), гуммь! появляются через 15 лет.
5. Врожденный.
Для диагностики сифилиса наиболее широко используются
серологические методы, позволяющие обнаруживать иммунные
сдвиги (появление противосифилитических антител) в организ¬
ме больного в ответ на размножение в нем возбудителя болез¬
ни. Сифилитические антитела могут быть неспецифическими
(реагины) и специфическими (противотрепонемными). Реагины
направлены против липидных антигенов бледной трепонемы
н аутоантигенов, возникающих вследствие разрушения клеток
больного. Уровень реагинов может повышаться при различных
|1)Изиологических и патологических состояниях, поэтому реагины
могут стать причиной ложноположительных серологических реак¬
ций на сифилис. Специфические противотрепонемные антитела
направлены против бледной трепонемы, поэтому позволяют более
надежно подтвердить факт заражения.
Возникновение противосифилитических антител при
(аболевании происходит в соответствии с общими зако¬
номерностями иммунного ответа: вначале вырабатывают¬
ся антитела 1вМ, по мере развития болезни начинает преоб-
падать синтез антител класса 1вО. Антитела 1§М появляются
на 2-4-ю нед после заражения и исчезают у нелеченых боль¬
ных примерно через 18 мес, при лечении раннего сифилиса —
через 3—6 мес; позднего — через 1 год. Антитела 1§С появляются
обычно на 4-й нед после заражения и достигают более высоких
штров, чем 1яМ. Они могут длительно сохраняться даже после
клинического излечения больного.
Серологические реакции в зависимости от выявляемых ими анти¬
тел подразделяются на две группы:
• Реакция микропреципитации (РМП) с плазмой крови или инак¬
тивированной сывороткой крови— экспресс-метод диагностики
сифилиса, который позволяет выявлять реагиновые (неспецифи¬
ческие) антитела;
496 Глава 9. Серологические исследования
• Видоспецифические трепонемные реакции (выявляют специфи¬
ческие трепонемные антитела в сыворотке крови):
- реакция пассивной гемагглютинации (РПГА\бледных трепонем;
— метод ИФА, который позволяет выявлять антитела lgM и ^gG;
- реакция иммобилизации бледных трепонем (РИТ);
— реакция иммунофлюоресценции (РИФ).
Многообразие серологических реакций для диагностики сифи¬
лиса вызывает ненужные затруднения. В целях упорядочения при¬
менения серологических реакций для диагностики сифилиса были
разработаны Методические указания «Постановка отборочных
и диагностических тестов на сифилис» (Приложение 1, утверж¬
дено приказом Минздрава России от 26.03.2001 № 87). В связи с
тем, что использование тестов для диагностики сифилиса строго
регламентировано, ниже приведены основные положения данных
рекомендаций.
Для серо- и ликвородиагностики сифилиса применяются следую¬
щие методы.
• РМП с кардиолипиновым антигеном, которая является отбороч¬
ным тестом при обследовании населения на сифилис. Постановки
РМП осуществляется с плазмой или инактивированной сыворот¬
кой крови пациента. Зарубежные тесты ВДРЛ (УОКЕ), РПР(ВРК)
и другие аналогичны РМП как по принципу постановки реакции,
так и по чувствительности и специфичности.
• ИФА с антигеном из культуральных или патогенных бледных
трепонем.
• РПГА с антигеном из культуральных или патогенных бледных
трепонем.
• РИФ с антигеном патогенной бледной трепонемы штамма
Никольса.
• РИТ, в которой в качестве антигена используют патогенные блед¬
ные трепонемы штамма Никольса.
РИТ, РИФ, ИФА и РПГА являются высокочувствительными и
высокоспецифичными реакциями на сифилис. Они относятся к диа¬
гностическим подтверждающим тестам. При этом в связи с простотой
постановки и наличием коммерческих тест-систем ИФА и РПГА могу г
быть и высокоэффективными отборочными тестами.
Ввиду различной чувствительности при разных формах сифилиса,
специфичности и сложности постановки каждая из указанных реак¬
ций имеет свое предназначение.
9.1. Диагностика сифилиса 497
Профилактическое обследование населения на сифилис можно
проводить с помощью РМП, ИФА и РПГА.
При получении положительного результата в РМП пациент дол¬
жен обследоваться дерматовенерологом с повторным исследованием
крови в любом диагностическом тесте на сифилис.
При профилактическом обследовании на сифилис больных
1лазных, психоневрологических, кардиологических стационаров,
беременных, в частности, направляемых на искусственное преры¬
вание беременности, должны использоваться ИФА или РПГА.
При обследовании доноров необходимо применять ИФА или
РПГА, но обязательно в сочетании с РМП. Постановка двух реакций
одновременно обусловлена высокой ответственностью данного иссле¬
дования.
РМП в количественном варианте с экономической точки зрения необ¬
ходимо использовать в качестве контроля эффективности лечения.
Вышеуказанные специфические тесты служат для диагностики
всех форм сифилиса, в частности, скрытого, а также для распозна¬
вания ложноположительных результатов, полученных в РМП. При
диагностике скрытого сифилиса целесообразна постановка двух спе¬
цифических тестов одновременно.
Таким образом, порядок обследования пациентов на сифилис
представляется следующим образом.
• При первичном обследовании проводятся отборочная (скринин¬
говая) РМП или ее модификации (RPR — РПР, TRUST — ТРАСТ,
VDRL — ВДРЛ) в количественном и качественном вариантах и
в случае положительного результата любой специфический под¬
тверждающий трепонемный тест (РПГА, ИФА, РИФ, РИТ).
• После окончания терапии ставится РМП или ее модификация и
по снижению титра судят о динамике инфекционного процес¬
са и эффективности терапии; подтверждением эффективности
проведенной терапии считается снижение титра в 4 раза и более
в течение 1 года.
• По окончании этого срока проводится та же специфическая
реакция, что и при первичном обследовании. Следует учитывать,
что специфические трепонемные тесты могут оставаться положи¬
тельными (не становятся отрицательными) в течение ряда лет, а в
отдельных случаях остаются положительными на всю жизнь.
Характеристики трепонемных и нетрепонемных методов диагнос¬
тики сифилиса приведены в табл. 9-1.
498
Глава 9. Серологические исследования
Таблица 9-І.
Характеристики трепонемных и нетрепонемных методов диагностики сифилиса
Нетрепонемные тесты
Трепонемные тесты
Антигенами в этих тестах являются
кардиолипин, холестерин и лецитин
•
Антигеном в этих тестах является
Т. pallidum
Положительны у 80-86% больных
первичным сифилисом
Положительны у 90-95% больных
первичным сифилисом
Положительны почти у всех боль¬
ных вторичным и ранним латент¬
ным сифилисом
Положительны почти у всех боль¬
ных вторичным и ранним латент¬
ным сифилисом
Положительны у 70-75% больных
поздним латентным сифилисом
Положительны у 94-96% больных
поздним латентным сифилисом
Могут быть использованы для оцен¬
ки эффективности антибиотикоте-
рапии и диагностики реинфекции
Не могут быть использованы для
оценки эффективности антибиоти-
котерапии и диагностики реинфек¬
ции (обычно тесты положительны
всю жизнь)
9.2. ДИАГНОСТИКА ВИЧ-ИНФЕКЦИИ
ВИЧ-инфекция — заболевание, вызываемое ВИЧ, длительное
время персистирующего в лимфоцитах, макрофагах, клетках нервной
ткани, в результате чего развивается медленно прогрессирующее
поражение иммунной и нервной систем организма, проявляющееся
вторичными инфекциями, опухолями, подострым энцефалитом и
другими патологическими изменениями.
Возбудители — ВИЧ I и II типов — ВИЧ-1, ВИЧ-П, (HIV-I,
HIV-II, Human Immunodeficiency Virus, types\, И) — относятся к семейс¬
тву ретровирусов, подсемейству медленных вирусов. Вирионы
являются сферическими частицами диаметром 100—140 нм.
Вирусная частица имеет наружную фосфолипидную оболочку,
включающую гликопротеины (структурные белки) с определенной
молекулярной массой, измеряемой в килодальтонах. У ВИЧ-1 —
это gp 160, gp 120, gp 41. Внутренняя оболочка вируса, покрываю¬
щая ядро, также представлена белками с известной молекулярной
массой — р17, р24, р55 (ВИЧ-И содержит gpl40, gpl05, gp36, р16, р25,
р55).
9.2. Диагностика ВИЧ-инфекции
499
В организме человека основной мишенью ВИЧ являются
Г-лимфоциты, несущие на поверхности наибольшее количество
С04-рецепторов. После проникновения ВИЧ в клетку вирус синте¬
зирует ДНК, которая встраивается в генетический аппарат клетки-
хозяина (С04-лимфоциты) и остается там пожизненно в состоянии
ировируса. Помимо Т-ли^^зфоцитов-хелперов, поражаются макрофа¬
ги, В-лимфоциты, клетки нейроглии, слизистой оболочки кишеч¬
ника и некоторые другие клетки, в результате нарушения функции
иммунной системы, особенно при снижении количества Т-лимфо¬
цитов (С04) до 400 и менее в 1 мкл крови, возникают условия для
неконтролируемой репликации (размножения) ВИЧ со значительным
увеличением количества вирионов в различных средах организма.
В результате поражения многих звеньев иммунной системы человек,
зараженный ВИЧ, становится беззащитным перед возбудителями
различных инфекций. На фоне нарастающей иммунодепрессии раз¬
виваются тяжелые прогрессирующие болезни, которые не встречают¬
ся у человека с нормально функционирующей иммунной системой.
Это болезни воз определила как СПИД-маркерные (индикаторные).
Они подразделяются на две группы. Первая группа — заболевания,
которые присущи только тяжелому иммунодефициту (количество
С04 ниже 200 в 1 мкл крови). Клинический диагноз ставится при
отсутствии анти-ВИЧ-антител или ВИЧ-антигенов. Вторая группа —
заболевания, которые могут развиваться как на фоне тяжелого имму¬
нодефицита, так и, в ряде случаев, без него. Поэтому в этих ситуациях
необходимо лабораторное подтверждение диагноза.
СПИД-индикаторные болезни
Первая группа:
• кандидоз пищевода, трахеи, бронхов;
• внелегочный криптококкоз;
• криптоспоридиоз с диареей более 1 мес;
• цитомегаловирусные поражения различных органов, помимо
печени, селезенки или лимфатических узлов, у больного стар¬
ше 1 мес;
• инфекция, обусловленная вирусом простого герпеса, проявляю¬
щаяся язвами на коже и слизистых оболочках, которые персисти-
руют (сохраняются) более 1 мес, а также бронхитом, пневмонией
или эзофагитом любой продолжительности, поражающими боль¬
ного в возрасте старше 1 мес;
• генерализованная саркома Капоши у больных моложе 60 лет;
500 Глава 9. Серологические исследования
• лимфома головного мозга (первичная) у больных моложе 60 лет;
• лимфоцитарная интерстициальная пневмония и/или легочная
лимфоидная дисплазия у детей в возрасте до 12 лет;
• диссеминированная инфекция, вызванная атипичными мико¬
бактериями (микобактерии комплекса М. аушт-ШгасеИи1аге) с
внелегочной локализацией или локализацией (дополнительно к
легким) в коже, шейных лимфатических узлах, лимфатических
узлах корней легких;
• пневмоцистная пневмония;
• прогрессирующая многоочаговая лейкоэнцефалопатия;
• токсоплазмоз головного мозга у больного старше 1 мес.
Вторая группа:
• бактериальные инфекции, сочетанные или рецидивирующие у
детей до 13 лет (более 2 случаев за 2 года наблюдения): сепсис,
пневмония, менингит, поражение костей или суставов, абсцессы,
обусловленные гемофильными палочками, стрептококками;
• кокцидиоидомикоз диссеминированный (внелегочная локали¬
зация);
• ВИЧ-энцефалопатия (ВИЧ—деменция, СПИД—деменция);
• гистоплазмоз с диареей, персистирующей более 1 мес;
• изоспороз с диареей, персистирующей более 1 мес;
• саркома Капоши в любом возрасте;
• лимфома головного мозга (первичная) у лиц любого возраста;
•другие В-клеточные лимфомы (за исключением болезни
Ходжкина) или лимфомы неизвестного иммунофенотипа:
— мелкоклеточные лимфомы (типа лимфомы Беркитта и др.);
— иммунобластные саркомы (лимфомы иммунобластные, круп¬
ноклеточные, диффузные гистиоцитарные, диффузные недиф¬
ференцированные);
• микобактериоз диссеминированный (не туберкулез) с поражени¬
ем, помимо легких, кожи, шейных или прикорневых лимфатичес¬
ких узлов;
• туберкулез внелегочный (с поражением внутренних органов,
помимо легких);
• сальмонеллезная септицемия рецидивирующая;
• ВИЧ-дистрофия (истощение, резкое похудание).
Определение антител к ВИЧ является основным методом лабо¬
раторной диагностики ВИЧ-инфекции. В основе метода лежит ИФА
(чувствительность более 99,5%, специфичность более 99,8%). Антитела
9.3. Диагностика вирусных гепатитов 501
К ВИЧ появляются у 90-95% инфицированных в течение 3 мес после
тражения, у 5—9% через 6 мес и у 0,5—1% в более поздние сроки. В ста-
,чии СПИДа количество антител может снижаться вплоть до полного
исчезновения. При получении положительного ответа-выявлении
антител к ВИЧ — во избежание ложноположительных результатов ана-
'I из должен быть повторен еще один или два раза, желательно с исполь-
юванием диагностикума другой серии. Положительным результатом
считается, если из двух в обоих или из трех в двух анализах отчетливо
иыявлены антитела.
Метод ИФА по определению антител к ВИЧ является скрининго-
иым. При получении положительного результата для подтверждения
сгоспецифичности используется метод иммуноблотинга Western-blot —
негречная преципитация в геле антител в сыворотке крови больно-
ю с различными вирусными белками, подвергнутыми разделению
110 молекулярной массе с помощью электрофореза и нанесенными
иа нитроцеллюлозу. Определяются антитела к вирусным белкам
gp41, gpl20, gpl60, р24, р18, р17 и др. Обнаружение антител к одному
m гликопротеинов — gp41, gpl20, gpl60 — следует считать положи-
юльным результатом. При обнаружении антител к другим белкам
иируса результат считается сомнительным, и такого человека следует
обследовать еще дважды: через 3 и 6 мес. Отсутствие антител к специ-
(|)ическим белкам ВИЧ означает, что иммуноферментный метод дал
.южноположительный результат.
Алгоритм диагностики ВИЧ-инфекции приведен на схеме 9-1.
9.3. ДИАГНОСТИКА ВИРУСНЫХ ГЕПАТИТОВ
Вирусные гепатиты — инфекционные заболевания, характеризую¬
щиеся поражением печени. Они имеют сходную клиническую симп¬
томатику, но различаются по этиологии, патогенезу и исходам.
В настоящее время выделяют следующие формы вирусных гепати¬
тов: гепатит А, гепатит В, гепатит С, гепатит О и гепатит Е. По меха¬
низму инфицирования вирусные гепатиты делятся на энтеральные
(А и Е) и парентеральные (все остальные). Для диагностики каждой
|ы перечисленных форм вирусных гепатитов используется определен¬
ный перечень лабораторных маркеров.
502
Глава 9. Серологические исследования
Схема 9-1.
Алгоритм диагностики ВИЧ-инфекции
Скрининговый тест на антитела к ВИЧ-1
/ВИЧ-П в сыворотке
Антитела
обнаружены?
Да|
Отрицательный
результат
исследования
Определение антител к ВИЧ-1/ВИЧ-И в
сыворотке на 2 тест-системах
(желательно разных фирм)
Антитела
обнаружены?
Да
Отрицательный
результат серо¬
логического
исследования
Исследование сыворотки методом
иммуноблотинга ВИЧ-1 — \Л/в5(егп-Ыо1
Антитела к протеинам
др41. др120, др160
(положительный ре¬
зультат УУв81егп-Ыо1)?
Даф
Положительный результат
серологического исследования
Неопреде-
/ ленный
\ результат
\Л/е81ет-Ыо1?
Исследование
сыворотки ме¬
тодом иммуно¬
блотинга ВИЧ-Н -
У^е51егп-Ыо1
Положительный
результат
серологического
исследования
Отрицательный
результат
серологичес¬
кого исследо¬
вания
Дополнитель¬
ные методы
диагностики
ВИЧ-инфекции
(ПЦР)
Положительный
результат?
Нет
Повторное исследование
через 1—2 мес
ВИЧ-М инфекция
I
Примечание. ПЦР — полимеразная ценная реакция.
9.3. Диагностика вирусных гепатитов 503
9.3.1. ВИРУСНЫЙ ГЕПАТИТА
Гепатит А (Hepatitis А) — острая энтеровирусная инфекция,
характеризующаяся симптомами интоксикации, быстропроходя-
1ИИМИ нарушениями функции печени и доброкачественностью
гечения. Возбудитель—вирус гепатита А (ВГА, HAV) — энтеровирус
1ипа 72. Геном вируса представлен однонитчатой РНК. ВГА содер¬
жит единственный антиген (HA-Ag). Заболеваемость гепатитом А
II суммарной заболеваемости вирусными гепатитами составляет
70-80%. В структуре заболеваемости гепатитом А дети составляют
;ю 80%, причем в основном это дошкольники и школьники началь¬
ных классов.
Диагноз гепатита А достоверно подтверждается серологически¬
ми методами — обнаружением нарастания уровня специфических
антител (анти-HAV), принадлежащих к иммуноглобулинам класса М
(анти-HAV IgM). При гепатите А нарастание уровня антител, отно¬
сящихся к IgM, начинается еще в инкубационном периоде, за 5—10
дней до появления первых симптомов болезни, и быстро прогрес¬
сирует. к моменту первичного обращения больного к врачу уровень
анти-HAV IgM повышается настолько, что выявляется методом ИФА.
Общепринято, что анти-HAV IgM у больных появляются в начале
клинических проявлений заболевания и сохраняются до 6 мес после
перенесенной инфекции. Спустя год после перенесенной инфекции
апти-HAV IgM в крови не обнаруживаются.
Определение анти-HAV IgM - основной тест специфической диа-
июстики гепатита А. Нарастание анти-HAV IgG происходит в более
поздние сроки, в фазу реконвалесценции, и поэтому не может слу¬
жить критерием ранней диагностики гепатита А. Выявление анти-
IIAV IgG у здоровых людей (возможно у 30—60% здорового населе¬
ния) свидетельствует о предыдущей инфекции и иммунитете (рет¬
роспективная диагностика). Вместе с тем отстутсвие анти-HAV IgG
II период разгара гепатита позволяет исключить его связь с ВГА.
Количественное определение анти-HAV IgG в сыворотке крови может
быть использовано для оценки динамики поствакцинального иммун¬
ного ответа при вакцинировании против гепатита А. Динамика мар¬
керов вирусного гепатита А представлена на рис. 9-1.
504
Глава 9. Серологические исследования
Инкубаци- Острая
онный инфекция
Выздоровление
Месяцы после инфицирования
Рис 9-1. Динамика маркеров вирусного гепатита А
9.3.2. ВИРУСНЫЙ ГЕПАТИТ В
Вирусный гепатит В — острое или хроническое поражение печени.
Хронический вирусный гепатит В характеризуется медленным разви¬
тием, длительным течением и частым формированием цирроза пече¬
ни и гепатокарциномы. Возбудитель заболевания — вирус гепатита В
(ВГВ, HBV) — относится к семейству гепаднавирусов, ДНК-содер-
жащих вирусов, поражающих клетки печени. Вирионы ВГВ имеюі
наружную липоцротеидную оболочку и нуклеокапсид, содержащий
двунитчатую циркулярную ДНК и ДНК-зависимую ДНК-полимера-
зу. На рис. 9-2 представлена антигенная структура вириона и маркеры
вирусного гепатита В.
В структуре ВГВ выделяют следующие антигенные системы:
• поверхностный («австралийский») антиген, HBsAg, находящий¬
ся в составе липопротеидной оболочки ВГВ, является маркером
ВГВ, указывая на инфицированность вирусом;
• ядерный (соте), HbcAg обнаруживается в нуклеокапсиде вирио-
нов, свидетельствует об активной репродукции вируса;
• HbeAg — входит в состав ядра ВГВ, указывая на активность вируса
и, кроме того, на его высокую вирулентность и инфекционность;
9.3. Диагностика вирусных гепатитов
505
• HBxAg расположен вблизи оболочки вириона, его роль в генезе
инфекции изучается.
Свыше 5% населения инфицировано ВГВ, а частота безжелтушных
((юрм ВГВ составляет, по данным разных авторов, от 60 до 82%.
1'ис 9-2. Антигенная структура вириона вирусного гепатита В
I — наружная оболочка — поверхностный антиген (HBsAg); 2 — антиген с
(НВсАе) — коровий, или ядерный антиген; 3 — антиген е (НВеА§); 4 — ДМ К-
полимераза, ДНК вируса гепатита В
В диагностике вирусного гепатита В ведущее значение имеет опре-
пеление комплекса маркеров гепатита.
Поверхностный антиген гепатита В в сыворотке крови. Обнаружение
поверхностного антигена (НВзАв) гепатита В подтверждает острое
или хроническое инфицирование вирусом гепатита В.
При остром заболевании HBsAg выявляется в сыворотке крови
м последние 1—2 нед инкубационного периода и в первые 2—3 нед
к цинического периода. Циркуляция HBsAg в крови может ограни¬
506 Глава 9. Серологические исследования
чиваться несколькими днями, поэтому следует стремиться к раннему
первичному обследованию больных. Частота выявления HBsAg зави¬
сит от чувствительности используемого метода иccлeдqвaния. Метод
ИФА позволяет выявить HBsAg более чем у 90% больных. Почти у 5%
больных самые чувствительные методы исследования не обнаружива¬
ют HBsAg, в таких случаях этиология вирусного гепатита В подтверж¬
дается наличием анти-HBcAg IgM.
При остром течении гепатита В концентрация HBsAg в крови пос¬
тепенно снижается вплоть до полного исчезновения антигена. HBsAg
исчезает у большинства больных в течение 3 мес от начала острой инфек¬
ции. Снижение концентрации HBsAg более чем на 50% к концу 3-й нед
острого периода, как правило, свидетельствует о близком завершении
инфекционного процесса. Обычно у больных с высокой концентрацией
Н BsAg в разгар болезни он обнаруживается в крови в течение нескольких
месяцев. У больных с низкой концентрацией HBsAg исчезает значительно
раньше (иногда через несколько дней после начала заболевания). В целом
срок обнаружения HBsAg колеблется от нескольких дней до 4—5 мес.
Максимальный срок обнаружения HBsAg при гладком течении острого
гепатита В не превышает 6 мес от начала заболевания.
HBsAg может быть обнаружен у практически здоровых людей,
как правило, при профилактических или случайных исследованиях.
В таких случаях исследуют другие маркеры вирусного гепатита В-
анти-HBcAg IgM, анти-НВс IgG, анти-HBeAg и изучают функцию
печени. При отрицательных результатах необходимы повторные
исследования на HBsAg. Если повторные исследования крови в тече¬
ние более 3 мес выявляют HBsAg, такого человека относят к хрони¬
ческим носителям поверхностного антигена. Носительство HBsAg -
довольно распространенное явление. В мире насчитывается более 300
млн носителей, у нас в стране — около 10 млн. Прекращение цирку
ляции HbsAg с последующей сероконверсией (появление антител к
HbsAg) всегда свидетельствует о санации организма.
Антитела к HBsAg (анти-HBsAg) гепатита В в сыворотке крови.
Антитела к поверхностному антигену гепатита В — анти-HBsAg
обнаруживаются в конце острого вирусного гепатита В или, чаще всего,
через 3 мес от начала инфекции, изредка позже (до года) и сохраняю г-
ся долго, в среднем 5 лет. Анти-HBsAg обнаруживаются не сразу после
исчезновения HBsAg. Продолжительность фазы окна варьирует oi
нескольких недель до нескольких месяцев. Антитела к поверхностному
антигену гепатита В нейтрализуют вирус и рассматриваются как при
9.3. Диагностика вирусных гепатитов 507
знак иммунитета. Они относятся к 1§С. Определение aнти-HBsAg —
I надежный критерий развития постинфекционного иммунитета и
выздоровления. Выявление aнти-HBsAg может служить критерием
ретроспективной диагностики гепатита ранее не уточненной этиоло-
I I ии. Aнти-HBsAg свидетельствуют о ранее перенесенной инфекции.
Выявление антител к HBs^g играет важную роль в определении
контингента для вакцинации против гепатита В. Согласно рекомен-
I дациям ВОЗ, если уровень aнти-HBsAg составляет менее 10 мМЕ/л,
то таким лицам показана вакцинация против гепатита В, при уровне
. 10—100 мМЕ/л вакцинация должна быть отложена на 1 год, при уровне
■ более 100 мМЕ/л вакцинация показана через 5—7 лет.
Общие антитела к ядерному антигену гепатита В (анти-НВсА§) в
сыворотке крови. Антиген Н BcAg обнаруживается только в ядрах гепа-
гоцитов. В крови в свободном виде HBcAg не выявляется. Антитела
к ядерному антигену гепатита В появляются первыми среди других
антител, связанных с гепатитом В в сыворотке крови больных острым
11 хроническим вирусным гепатитом В, а также у реконвалесцентон
(выздоравливающих). Общиеантителакядерному антигену гепатита В
состоят из иммуноглобулинов классов М и О. Определение общих
антител к ядерному антигену гепатита В может использоваться толь¬
ко для ретроспективной диагностики гепатита В, так как у 5—10%
больных исследования на НВбАе дают отрицательный результат. Для
того, чтобы установить, в какой стадии развития находится гепатит В,
необходимо дополнительное определение антител IgM. Антитела
lgM — маркер активной репликации вируса, т.е. острой инфекции, а
антитела IgG — перенесенной инфекции.
Антитела 1§М к ядерному антигену гепатита В (анти-НВсА§ IgM)
и сыворотке крови. Анти-НВсА§ IgM обнаруживаются уже в начале
острой фазы болезни, еще до появления или в первые дни желтухи,
иногда даже в конце инкубации. Выявление aнти-HBcAg Ig]VI явля¬
ется убедительным критерием диагностики гепатита В, особенно при
отрицательных результатах исследования на HBsAg. Aнти-HBcAg lgM
циркулируют в крови больных в течение нескольких месяцев (2—5 мес)
ао периода реконвалесценции, а затем исчезают, что рассматривается
как признак очищения организма от вируса гепатита В.
Антитела IgG к ядерному антигену гепатита В (aнти-HBcAg-IgG)
и сыворотке крови, у больных aнти-HBcAg-IgG появляются в острый
период вирусного гепатита В и сохраняются на протяжении всей жизни.
Лllти-HBcAg-IgG — ведущий маркер перенесенного гепатита В.
508
Глава 9. Серологические исследования
НВе-антиген (НВеА§) гепатита В в сыворотке крови. НВеА§ можно
обнаружить в сыворотке крови большинства больных острым вирус¬
ным гепатитом В. Он обычно исчезает из крови раньше НВ8-антигена.
Высокий уровень НВеА§ в первые недели заболевания или обнару¬
жение его на протяжении более 8 нед дает основание заподозрить
хроническую инфекцию. Этот антиген часто обнаруживается при
хроническом активном гепатите вирусной этиологии. Наличие HBeAg
в крови свидетельствует о присутствии в организме обследуемого
активной инфекции гепатита В и обнаруживается только в случае
присутствия в крови НВ5-антигена. Наличие НВе антигена свиде¬
тельствует о продолжающейся репликации вируса и инфекциозности
больного. НВеА£-антиген—маркер острой фазы и репликации ВГВ.
Антитела к HBeAg гепатита В (aнти-HBeAg) в сыворотке крови.
Появление анти-НВеА§ антител указывает обычно на интенсив¬
ное выведение из организма ВГВ и незначительное инфицирование
больного. Эти антитела появляются в острый период заболевания и
сохраняются до 5 лет после перенесенной инфекции. При хроничес¬
ком персистирующем гепатите aнти-HBeAg обнаруживаются в крови
больного вместе с НВ8А§.
Подробная динамика основных маркеров вирусного гепатита В
в первые недели после инфицирования представлена на рис. 9-3.—9-4.
Недели после инфицирования
Рис 9-3. Динамика маркеров вирусного гепатита В в первые недели после
инфицирования
9.3. Диагностика вирусных гепатитов
509
Продромальная фаза Острая инфекция Выздоровление
1‘ис 9-4. Динамика маркеров в крови при остром вирусном гепатите В
Периоды обнаружения в крови маркеров вирусного гепатита В при
остром процессе:
• поверхностный HBs-антиген обнаруживается с инкубационного
периода до периода ранней реконвалесценции (5,5-6 мес);
• антиген НЬе обнаруживается в инкубационный и продромаль¬
ный периоды (до 3,5 мес); его обнаружение свидетельствует о
репликации вируса;
• антитела к НЬе-антигену появляются в острый период заболева¬
ния (3-4-й мес) и сохраняются до нескольких лет;
• антитела IgM к ядерному антигену (анти-HbcAg-IgM) появляют¬
ся в продромальном периоде и сохраняются до периода реконва¬
лесценции (со 2-го по 6-й мес заболевания);
• антитела IgG к ядерному антигену (анти-HbcAg-IgG) появляются
в продромальном периоде и сохраняются на протяжении всей
жизни (ведущий маркер вирусного гепатита В);
• антитела к поверхностному Hbs-антигену (анти-Н BsAg) появляются в
стадии поздней реконвалесценции (6-й мес) и сохраняются до 5 лет.
9.3.3. ВИРУСНЫЙ ГЕПАТИТ С
Гепатит С (Hepatitis С) — вирусное заболевание, наиболее часто
протекающее в виде посттрансфузионного гепатита с преобладанием
бсзжелтушных форм и склонное к хронизации. Возбудитель — вирус
юпатита С (ВГС) — имеет сходство с флавовирусами, содержит РНК.
510 Глава 9. Серологические исследования
Примерно 90% всех случаев посттрансфузионных гепатитов свя¬
зано с ВГС. Среди доноров антитела к вирусу гепатита С (анти-ВГС)
обнаруживают в 0,2—5% случаев. У 40—75% больных регистрируется
бессимптомная форма болезни, у 50—75% больных острым вирусным
гепатитом С формируется хронический гепатит, у 20% из них разви¬
вается цирроз печени. Важная роль вирусному гепатиту С отводится п
в этиологии гепатоклеточной карциномы.
Геном ВГС представлен одноцепочечной положительно заряжен¬
ной РНК, которая кодирует 3 структурных (нуклеокапсидный белок
core и нуклепротеины оболочки Е1-Е2) и 5 структурных (NS1, NS2,
NS3, NS4, NS5) белков. К каждому из этих белков вырабатываются
антитела, обнаруживаемые в крови больных гепатитом С.
Отличительной чертой вирусного гепатита С является волнообразное
течение, в котором разграничивают 3 фазы: острую, латентную и фазу
реактивации. Для острой фазы характерны повышение активности пече¬
ночных ферментов в сыворотке крови, уровня антител IgM и IgG к ВГС
с нарастанием титров, а также присутствие РНК ВГС в крови. Латентная
фаза характеризуется отсутствием клинических проявлений, наличием
в крови антител класса IgG к ВГС в высоких титрах, отсутсвием антител
IgM и РНК ВГС в крови либо их присутствием в низких концентрациях
на фоне незначительного повышения активности печеночных ферментов
в периоды обострения. Для фазы реактивации характерны появление
клинических признаков, повышение активности печеночных ферментов,
наличие антител IgG в высоких титрах, присутствие РНК ВГС и нараста¬
ние титров антител IgM к ВГС в динамике.
Антитела к ВГС в сыворотке крови. Диагностика гепатита С основа¬
на на обнаружении суммарных антител к ВГС методом ИФА, которые
появляются в первые 2 нед заболевания и свидетельствуют о воз¬
можной инфицированности вирусом или перенесенной инфекции.
Анти-ВГС-антитела могут сохраняться в крови реконвалесцентов на
протяжении 8—10 лет с постепенным снижением их концентрации.
Возможно позднее обнаружение антител спустя год и более после
инфицирования. При хроническом гепатите С антитела определяют¬
ся постоянно и в более высоких титрах. Большинство используемых и
настоящее время тест-систем для диагностики вирусного гепатита С
снованы на определении антител класса IgG. Тест-системы, способ¬
ные определять антитела IgM, позволяют верифицировать активную
инфекцию. Антитела IgM могут выявляться не только при остром, но
и при хроническом вирусном гепатите С. Снижение их уровня в про¬
9.3. Диагностика вирусных гепатитов
511
цессе лечения больных хроническим гепатитом с может свидетельс¬
твовать об эффективности лекарственной терапии.
Обнаружение суммарных антител IgG к ВГС методом ИФА недо¬
статочно для постановки диагноза вирусного гепатита С и требует
подтверждения способом иммуноблотинга для исключения ложно-
ноложительного результата исследования. Необходимо полное обсле¬
дование пациента на антитела IgG к различным белкам ВГС (к белку
core и белкам NS) и антитела IgM к ВГС в динамике. Результаты серо-
иогических исследований совместно с клинико-эпидемиологически¬
ми данными позволяют установить диагноз и стадию заболевания.
Иммуноблотинг на антитела к белкам ВГС в сыворотке крови. Метод
ИФА, применяемый для определения антител к ВГС, является скринин-
ювым. При получении положительного результата для подтверждения
сю специфичности используют метод иммуноблотинга Western-blot —
встречную преципитацию в геле антител в сыворотке крови больного с
различными вирусными белками, подвергнутыми разделению по моле¬
кулярной массе с помощью электрофореза и нанесенными на нитро¬
целлюлозу. Исследование считается положительным, если выявляются
антитела к 2 или более белкам ВГС интенсивностью +1. Специфичными
для ВГС являются антитела к белкам core, NS1, NS2, NS3, NS4, NS5.
Иммуноблотинг на ВГС служит подтверждающим тестом специ-
(|)Ичности результата определения антител методом ИФА.
Динамика маркеров вирусного гепатита С представлена на рис. 9-5.
Недели после инфицирования
Рис 9-5. Динамика маркеров при остром вирусном гепатите С
5/2 Глава 9. Серологические исследования
У больных хроническим вирусным гепатитом С для определение
стратегии лечения, помимо установления этиологического диагноза
серологическими методами, необходимо определить генотип ВГС и
вирусную нагрузку (уровень вирусных частиц в 1 мл крови). Для этих
целей используется метод ПЦП.
9.3.4. ВИРУСНЫЙ ГЕПАТИТ D
Гепатит D — вирусная инфекция (дельта-инфекции), протекаю
щая вследствие биологических особенностей вируса исключительно
в присутствии ВГВ и характеризующаяся тяжелым течением, часто с
неблагоприятным исходом.
Возбудитель — вирус гепатита D (ВГО), по своим биологическим
свойствам приближается к вироидам — обнаженным молекулам
нуклеиновых кислот. Печень человека — единственное место реп
ликации (размножения) ВГО. Инфицированный ВГО встречается
у 5—15% больных гепатитом В. Сочетание вирусных гепатитов В и
D сопровождается развитием более тяжелых форм заболевания, что
определяется главным образом действием ВГО. Летальность дости
гает 5—20%,
Для диагностики вирусного гепатита D используют обнаружение
РНК вируса в сыворотке крови или плазме методом молекулярноіі
гибридизации или выявления антител класса IgM и IgG к ВГО.
Антитела IgM к ВГВ в сыворотке крови. Антитела ВГО IgM (анти
ВГО IgM) появляются в острый период дельта-инфекции (со 2-й нед).
По мере выздоровления при вирусном гепатите О происходят эли
минация (удаление) вируса из печени и исчезновение анти-ВГО IgM
(через 2 мес с начала периода разгара). При хронизации процесса
наблюдается персистирование ВГО в ткани печени и анти-ВГО IgM и
высокой концентрации в крови. Антитела ВГО IgM говорят об актин
ной репликации вируса.
Антитела IgG к ВГВ в сыворотке крови. Антитела ВГО IgG (анти
ВГО IgG) появляются в период реконвалесценции (3—8 нед от начала
заболевания), и их концентрация постепенно снижается в течение
нескольких месяцев (могут обнаруживаться в течение 1—2 лет в низких
концентрациях). Определение анти-ВГО IgG может служить критс
рием ретроспективной (отдаленной) диагностики гепатита ранее ие
уточненной этиологии.
\мг
9.3. Диагностика вирусных гепатитов 513
9.3.5. ВИРУСНЫЙ ГЕПАТИТ Е
Возбудителем вирусного гепатита Е (ВГЕ) является РНК-вирус.
Для заболевания характерен фекально-оральный путь передачи,
преимущественно водный. Инкубационный период болезни— около
15 сут. Клиническое течение острого вирусного гепатита Е (ВГЕ)
похоже на течение вирусного гепатита А. Существенно тяжелее забо¬
левание протекает у беременных, особенно в III триместре. РНК
иируса гепатита Е появляется в крови через 2—3 нед после заражения.
Иирусемия свидетельствует о факте заражения и длится в среднем
1 мес, а в ряде случаев до 6 мес.
Для специфической диагностики вирусного гепатита Е используют
метод ИФА, основанный на выявлении антител IgM (анти-ВГЕ IgM),
которые появляются в крови через 3—4 нед после заражения (10—12 день
о| начала клинических проявлений). Обнаружение в крови повышенного
уровня анти-ВГЕ IgM служит лабораторным подтверждением диагноза.
Они выявляются у 90% больных острой инфекцией в течение 1-4 нед от
начала заболевания. Анти-ВГЕ IgM исчезают из крови в течение несколь¬
ких месяцев. Антитела IgG при вирусном гепатите Е обнаруживают в
крови в разгар заболевания; в период выздоровления их уровень достигает
иаивысших значений (обнаруживаюту 93—95% больных). Наличие только
ПН1 ител IgG не является подтверждением диагноза вирусного гепатита Е.
1)1Я подтверждения положительного результата определения антител
1цМ и IgG используют метод иммуноблотинга Western-blot — встречную
преципитацию в геле антител в сыворотке крови больного с антигенами
ИГЕ, подвергнутыми разделению по молекулярной массе с помощью
ыектрофореза и нанесенными на нитроцеллюлозу.
При вирусном гепатите Е в ранние стадии вирусная РНК методом
ПЦР может быть выявлена у 75% больных в сыворотке крови. Нередко
I’ll К обнаруживают даже в инкубационный период инфекции.
Динамика маркеров вирусного гепатита Е представлена на рис. 9-6.
9.3.6. ВИРУСНЫЙ ГЕПАТИТ G
В настоящее время вирусный гепатит G является официально
признанным инфекционным заболеванием с парентеральным меха¬
низмом заражения (в основном при гемотрансфузиях). Вирус гепатита
< i (BEG) относится к семейству Flaviviridae. Геном вируса представлен
514
Глава 9. Серологические исследования
одноцепочечной РНК. В настоящее время предполагается наличие ис
менее 3 генотипов и нескольких субтипов ВГС, которые распределены
в соответствии с их географическим происхождением. Вирус содержит
липидную оболочку, которая служит препятствием для образования
иммунных комплексов антиген—антитело во время персистенции
вируса в организме человека. В России ВГС встречается у 3—11% доно
ров крови, у 16-24% больных вирусным гепатитом С. Клинические
проявления заболевания по сравнению с другими формами вирусных
гепатитов менее выражены. Только у 30—50% инфицированных ВГС
отмечается повышение активности трансаминаз в сыворотке крови.
Основным лабораторным маркером ВГС служит обнаружение и
крови РНК вируса методом ПЦР. Для ретроспективной диагностики
вирусного гепатита G можно использовать выявление специфических
антител IgG к белку оболочки Е2 ВГС в сыворотке крови.
Желтуха
Недели после инфицирования
Рис. 9-6. Динамика маркеров вирусного гепатита Е
9.4. СЕРОЛОГИЧЕСКАЯ ДИАГНОСТИКА
ПЕРИНАТАЛЬНЫХ ИНФЕКЦИЙ
Заражение плода в организме матери может привести к различ¬
ным инфекционным заболеваниям, которые объединены общим
названием «внутриутробная инфекция». Ребенок может заразиться
9.4. Серологическая диагностика перинатальных инфекций 515
различными возбудителями инфекционных заболеваний во время
родов (при прохождении по инфицированным родовым путям) или
мосле рождения (через материнское молоко и другие биологические
жидкости). Инфекционные заболевания, развившиеся вследствие
них причин, получили название неонатальных инфекций (интра- и
иостнатальные). У многих новорожденных, заразившихся во время
или после родов, инфекцйя может протекать бессимптомно. Однако
V некоторых из них, особенно у недоношенных, развиваются выра¬
женные клинические проявления заболевания с тяжелым течением.
Перинатальные инфекции — это инфекционные заболевания, воз¬
никшие вследствие инфицирования плода в процессе внутриутроб¬
ного развития, во время или после рождения.
В последние годы отмечается значительное увеличение частоты
ирожденных инфекций, причем преимущественно вирусной этио¬
логии. в настоящее время очевидна роль этих инфекций в форми¬
ровании заболеваемости младенцев, инвалидности и смертности.
( огласно последним данным, более 10% новорожденных инфициру-
кнся внутриутробно различными вирусами и микроорганизмами.
Вирусные инфекции вызывают до 80% врожденных пороков раз¬
вития у детей, среди которых ведущее место занимают поражения
центральной нервной системы, а также врожденные пороки сердца
и почек. Многочисленные научные данные свидетельствуют об эти¬
ологической связи врожденных пороков развития у детей с вирус¬
ными инфекциями, перенесенными во время беременности, или с
іранспланцентарной передачей вирусов от матерей с персистентной
формой инфекции.
к наиболее распространенным перинатальным инфекциям отно¬
сился герпетическая, цитомегаловирусная, парвовирусная, токсо-
плазменная инфекции, краснуха и хламидиоз.
Лабораторное обследование позволяет диагностировать вирусную
инфекцию у подавляющего большинства (до 98%) новорожденных
И беременных. Нередко у беременных и новорожденных выявляют
смешанную инфекцию, представленную не менее чем 3 вирусами,
способными вызывать развитие врожденных пороков.
Ранняя и своевременная диагностика вирусной инфекции у бере¬
менных и врожденной инфекции у детей позволяет выработать опти¬
мальную терапевтическую тактику ведения беременности и родов,
рационально применять противовирусные препараты с целью сниже¬
ния вероятности возникновения у детей пороков развития.
516 Глава 9. Серологические исследования
При подозрении на внутриутробную инфекцию чаще всего прово¬
дят обследование беременных женщин на наличие маркеров герпети¬
ческой, цитомегаловирусной, парвовирусной, хламидийной и токсо-
плазменной инфекций, а также краснухи. Отрицательные результаты
исследований матери во время беременности на данные инфекции и
большинстве случаев позволяет исключить возможность инфициро¬
вания плода. При подозрении на интра- и постнатальную инфекцию
необходимо проводить параллельное исследование крови матери и
ребенка.
Лабораторное обследование беременных и ребенка при подозре
НИИ на перинатальные инфекции включает определение в сыворотке
крови:
• антител IgM и IgG к цитомегаловирусу:
• антител IgM и IgG к вирусу простого герпеса типа I и II:
• антител IgM и IgG к парвовирусу:
• антител IgM и IgG к вирусу краснухи:
• антител IgM и IgG к токсоплазме:
• антител IgM, IgA и IgG к Chlamidia trachomatis.
9.5. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ
В ДИАГНОСТИКЕ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
ПЦР, являющаяся одним из методов ДНК-диагностики, позволяс!
увеличить число копий детектируемого (изучаемого) участка генома
(ДНК) бактерий или вирусов в миллионы раз. Тестируемый специ
фический для данного генома отрезок нуклеиновой кислоты много¬
кратно умножается (амплифицируется), что позволяет его иденти
фицировать (точно определить). Для диагностики достаточно одной
молекулы ДНК, т.е. одной бактерии или вирусной частицы. Введение
в реакцию дополнительного этапа — синтеза ДНК на молекуле РНК
при помощи фермента обратной транскриптазы — позволило тести¬
ровать и РНК-вирусы, например ВГС. ПЦР — это трехступенчатый
процесс, повторяющийся циклично. Синтезированное количество
ДНК идентифицируют методом ИФА или электрофореза.
В ПЦР может быть использован различный биологический материал;
сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или
спинномозговая жидкость и др. В первую очередь ЦПР применяют для
9.5. Полимеразная цепная реакция в диагностике инфекционных... 517
/тагностики инфекционных болезней: вирусных гепатитов В, С, О, цито-
мсгаловирусной инфекции, инфекционных заболеваний, заболеваний,
ы'редающихся половым путем (гонорея, хламидийная, микоплазменная,
урсаплазменная инфекции), туберкулеза, ВИЧ-инфекция и т.д.
Преимущества ПЦР в диагностике инфекционных заболеваний
перед другими методами исследований:
• возможность обнаружения возбудителя инфекции в любой био¬
логической среде организма, в том числе в материале, полученном
при биопсии;
• возможность диагностики инфекционных болезней на самых
ранних стадиях заболевания;
• возможность количественной оценки результатов исследований
(сколько вирусов или бактерий содержится в исследуемом мате¬
риале);
• высокая чувствительность метода (для обнаружения бактерий
или вирусов достаточно всего 4—5 патогенов).
9.5.1. ОБНАРУЖЕНИЕ ВИРУСА ГЕПАТИТА С
В отличие от серологических методов диагностики вирусного гепа-
I и га С, где с их помощью обнаруживают антитела к ВГС, ПЦР позволя-
44 выявить наличие непосредственно РНК ВГС и количественно выра-
ип ь его концентрацию в исследуемом материале. Тест имеет видовую
гисцифичность и высокую чувствительность — 10 молекул РНК ВГС
И исследуемом материале достаточно для его выявления. Обнаружение
йитител к вирусу гепатита С подтверждает лишь факт инфицирования
Пациента, но не позволяет судить об активности инфекционного про¬
цесса (о репликации вируса) и прогнозе заболевания. Кроме того, анти-
1гла к ВГС обнаруживают как в крови больных острым и хроническим
Гепатитом, так и у тех пациентов, которые болели и выздоровели, а
нередко антитела в крови появляются только спустя несколько месяцев
После появления клинической картины заболевания, что затрудняет
цюсвременную диагностику. Обнаружение ВГС в крови с использова¬
нием ПЦР — более информативный метод диагностики. Выявление с
помощью ПЦР РНК ВГС свидетельствует о виремии, позволяет судить
и репликации вируса в организме и является одним из критериев
эффективности противовирусной терапии. Обнаружение РНК ВГС
(' помощью ПЦР на ранних этапах развития вирусной инфекции на
518 Глава 9. Серологические исследования
фоне полного отсутствия каких-либо серологических маркеров можеі
служить самым ранним свидетельством инфицирования. Однако изо
лированное выявление РНК ВГС на фоне полного отсутствия каких-
либо других серологических маркеров не может полностью ИСКЛЮЧИЇІ.
ложноположительный результат ПЦР. В таких случаях требуется всес
торонняя оценка результатов клинических, биохимических и морфо
логических исследований и повторное неоднократное подтверждение
наличия инфекции методом ПЦР.
Важное значение имеет применение метода ПЦР у больных хроии
ческим вирусным гепатитом С, так как у большинства из них отсутс¬
твует корреляция (соответствие) между наличием вирусной реплика
ции и активностью печеночных ферментов, в таких случаях только
ПЦР позволяет судить о наличии вирусной репликации, особенно
если конечный результат выражается количественно. В большинстве
случаев исчезновение из сыворотки крови РНК ВГС наблюдается
позже нормализации активности печеночных ферментов, поэтому
нормализация активности ферментов не может служить основанием
для прекращения противовирусного лечения.
Обнаружение РНК ВГС в материале с помощью ПЦР используется
в целях:
• разрешения сомнительных результатов серологических исследо¬
ваний;
• дифференцировки гепатита С от других форм гепатита;
• выявления острой стадии заболевания по сравнению с ранее
перенесенной инфекцией или контактом; определения стадии
инфицированности новорожденных от серопозитивных по ВГС
матерей;
• контроля эффективности противовирусного лечения.
9.5.2. ОБНАРУЖЕНИЕ ВИРУСА ГЕПАТИТА В
Примерно 5—10% случаев цирроза и других хронических забо
леваний печени обусловлены хроническим носительством ВГВ.
Маркерами активности этих заболеваний являются НВеА§ и ДНК
ВГВ в сыворотке крови.
ПЦР позволяет определять в исследуемом материале (кровь,
пунктат печени) ДНК ВГВ как качественно, так и количественно.
Качественное определение ВГВ в материале позволяет подтвердит».
9.5. Полимеразная цепная реакция в диагностике инфекционных... 519
наличие вируса в организме больного и тем самым установить при¬
чину заболевания. Количественный метод определения содержания
Л,НК ВГВ дает важную информацию об интенсивности развития
ыболевания, эффективности лечения и развитии резистентности
(устойчивости) к противовирусным препаратам. Проведение ПЦР
мри ВГВ необходимо для суждения о вирусной репликации. Вирусную
ЛНК в сыворотке крови обнаруживают у 50% больных при отсутс-
1ИИИ НВеА£. Материалом для выявления ДНК ВГВ могут служить
сыворотка крови, лимфоциты, гепатобиоптаты. Оценка результатов
исследования на ДНК вирусного гепатита В во многом аналогична
описанному для гепатита С.
Обнаружение ДНК ВГВ в материале с помощью ПЦР необходи¬
мо для:
• разрешения сомнительных результатов серологических исследо¬
ваний;
• выявления острой стадии заболевания для дифференцировки от
ранее перенесенной инфекции или контакта;
• контроля эффективности противовирусного лечения.
9.5.3. ОБНАРУЖЕНИЕ ВИЧ
Метод ПЦР для обнаружения РНК ВИЧ может быть качественным и
количественным. Качественное обнаружение РНК ВИЧ используют для:
• неонатального скрининга;
• подтверждения результатов скринингового серологического
исследования;
• скрининга пациентов с высоким риском наличия ВИЧ-инфекции;
• разрешения сомнительных результатов по иммуноблотинговому
исследованию;
• контроля эффективности противовирусного лечения;
• определения стадии заболевания СПИД (переход инфицирован-
ности в заболевание).
Прямое количественное определение РНК ВИЧ с помощью ПЦР
позволяет более точно, чем определение количества С04-лимфоци-
10В, предсказать скорость развития СПИДа улиц, инфицированных
ИИЧ, следовательно, более точно оценить их выживаемость. Высокое
содержание вирусных частиц обычно коррелирует с выраженным
нарушением иммунного статуса и низким количеством С04-лимфо-
520
Глава 9. Серологические исследованиЛ]
цитов. Низкое содержание вирусных частиц обычно коррелирует с'
более благополучным иммунным статусом и более высоким количес¬
твом С04-лимфоцитов. При инфекции ВИЧ прогноз непосредствен-.-
но определяется уровнем виремии. Снижение уровня виремии прн|
лечении улучшает прогноз заболевания.
Глава 10.
ГОРМОНАЛЬНЫЕ ИССЛЕДОВАНИЯ
>
Данная глава посвящена лабораторным исследованиям, исполь-
»усмым в клинической эндокринологии, — разделе практической
медицины, который занимается лечением пациентов с заболевани¬
ями органов или их частей, отвечающих за продукцию и секрецию
юрмонов.
Организм человека находится в очень тесных взаимоотношениях
г внешним миром. Физические условия среды, степень ее загряз¬
нения, стрессорные воздействия — главные факторы, с которыми
неразрывно связана жизнедеятельность организма. Однако организм
человека может существовать только при условии, если внутренние
параметры обмена веществ поддерживаются в определенных, обычно
довольно узких пределах. Это положение было сформулировано вели¬
ким французским физиологом К. Бернаром еще в XIX веке и полу¬
чило название закона постоянства внутренней среды организма —
необходимого условия жизни организма. Выполнение закона посто¬
янства внутренней среды организма обеспечивается деятельностью
эндокринной системы (от греч. епдоп —внутри и кппо — отделять,
иыделять). Эндокринная система включает железы внутренней сек¬
реции. Они называются так потому, что свои гормоны (биологически
цктивные вещества) выделяют непосредственно в кровь.
10.1. ФУНКЦИОНИРОВАНИЕ ЭНДОКРИННОМ СИСТЕМЫ
Гормоны — биологически активные вещества, которые выде¬
ляются железами внутренней секреции непосредственно в кровь
или в тканевую жидкость и с током крови разносятся по всему
организму. Гормоны оказывают физиологическое воздействие на
клетки органов и тканей (органы-мишени), нередко находящие¬
ся на значительном отдалении от места их образования. Главные
||>ункции гормонов — регуляция обмена веществ и других про¬
цессов жизнедеятельности в основном путем их воздействия на
522 Глава 10. Гормональные исследовани и
активность ферментов, обмен витаминов, рост тканей и всей»
организма, активность генов, формирование пола и размножение,
приспособленность к среде обитания, поддержание постоянстмн
внутренней среды организма.
Гормоны различаются по своей химической структуре и физи
ко-химическим свойствам. В организме человека функпионируе і
более 100 гормонов. Их общим свойством является то, что после
выделения из клеток, в которых они образуются, они достигаюI
клеток других органов и вызывают в них более или менее специ
фические изменения метаболизма. После инактивации гормоны
выводятся из организма. Скорость образования гормонов, ич
действия и разрушения регулируются потребностями макроорга
низма.
Эндокринная система состоит из центральных и периферії
ческих органов. Центральными органами эндокринной системі.і
являются гипоталамус и гипофиз (рис. 10-1). Синтез и секреция
гормонов регулируются гипоталамусом. Гипоталамус — облаем,
головного мозга, являющаяся центром эндокринной системы.
Здесь происходит выработка веществ, регулирующих деятельное 11.
гипофиза. Гипоталамус — типичная эндокринная железа, синтс
зирующая и выделяющая специальные гормоны. В ней образуются
гормоны пептидной природы, называемые либеринами (рили-
зинг-гормонами), или пусковыми факторами, которые в неболь
ших количествах через систему портального кровообращения
гипофиза приносятся к клеткам гипофиза.
Гипоталамус чутко реагирует на изменение уровня гормонов м
крови и сразу же «дает приказания» гипофизу, который регулирусі
периферические органы эндокринной системы, — половые железы,
щитовидную железу, надпчочечники.
Гипофиз — придаток головного мозга, состоящий из клеток, син¬
тезирующих гормоны, регулирующих деятельность периферических
эндокринных органов. В клетках передней доли гипофиза синтези¬
руются различные гормоны. Попадая в кровоток, эти гормоны транс¬
портируются к клеткам периферических желез внутренней секреции,
в которых вызывают синтез и высвобождение гормонов, оказываю¬
щих прямое биологическое действие. Под строгим контролем гипо¬
таламуса и гипофиза находятся периферические железы внутреннеіі
секреции: щитовидная железа, половые железы (у мужчин яички, у
женщин яичники), надпочечники (рис. 10-2).
ЮА. Функционирование эндокринной системы
523
Гипоталамус
Гипофиз
1’ис. 10-1. Топография гипоталамуса и гипофиза
Гипоталамус
секретирует гормоны,
которые 8 свою
очередь, заставляют
другие эндокринные
железы также
секретироаать гормоны
Щитовидная Надпочечники Гонады
железа
1*ис. 10-2. Регуляция секреции гормонов
524 Глава 10. Гормональные исследования
Через гипофизарные гормоны гипоталамус регулирует функцию
периферических желез внутренней секреции. Так, например, гипота
ламус, секретируя тиреотропин-рилизинг-гормон, стимулирует обри
зование и выделение тиреотропного гормона гипофизом, которі.іИ
в свою очередь стимулирует секрецию щитовидной железой тирсо
идных гормонов, в связи с этим принято говорить о единых функ
циональных системах: гипоталамус—гипофиз—щитовидная железа,
гипоталамус—гипофиз—надпочечники, гипоталамус-гипофиз-яич
ники (у женщин), гипоталамус—гипофиз—яички (у мужчин).
Транспорт гормонов осуществляется кровью. Большинство гормо
нов (особенно белковой и пептидной природы) хорошо растворимы
в воде, а следовательно, в плазме крови. Исключение составляюі
тироксин (Т4) и стероидные гормоны. Они траспортируются кровью г
помощью специальных белков — носителей.
Гормоны циркулируют в крови в очень низких концентраті
ЯХ (обычно около Ю-б—10-9 моль/л), но количество молекул, СООІ
ветствующих этой концентрации, огромно (1017-1014 молекул/л)
практически триллионы молекул в 1 л крови. Такое количество молекуи
дает возможность гормонам влиять на каждую отдельную клетку орга
низма и регулировать ее специфические метаболические процессы.
Гормоны чаще всего классифицируют по вырабатывающим их
железам (гипофизарные, щитовидные, половые и др.).
Регуляция секреции гормонов гипоталамусом происходит по сис
теме обратной отрицательной связи. При высоком уровне того или
иного гормона в крови, вырабатываемого железой внутренней сек
реции (например, щитовидной), гипоталамус дает меньше стимулоп
гипофизу, и тот вырабатывает меньше регулирующих периферії
ческие железы гормонов. Соответственно концентрация гормоном
в крови снижается, а в ответ на это гипоталамус начинает посылам,
больше стимулов и побуждает гипофиз к повышению секреции ГО))
МОНОВ и стимуляции переферических эндокринных желез. Весь цикл
повторяется снова и снова.
10.2. ГОРМОНЫ ГИПОТАЛАМУСА И ГИПОФИЗА
Регуляция секреции гормонов гипофиза осуществляется выдс
лением гипоталамических гормонов. Гипоталамус выделяет сне-
10.2. Гормоны гипоталамуса и гипофиза 525
пифические медиаторы — рилизинг-гормоны, которые по сосудам
портальной системы гипоталамус—гипофиз поступают в гипофиз
и, воздействуя непосредственно на его клетки, стимулируют или
юрмозят секрецию гормонов. Гормоны гипоталамуса и гипофиза
относятся к белковым и полипептидным веществам.
Стимуляцию секреции гормонов гипофиза осуществляют следую¬
щие гормоны гипоталамуса (дхема 10-1):
• кортикотропин-рилизинг-гормон (КРГ);
• тиреотропин-рилизинг-гормон (ТРГ);
• гонадотропин-рилизинг-гормон (ГРГ);
• пролактин-рилизинг-гормон (ПРГ);
• соматотропин-рилизинг-гормон (СТРГ);
• меланотропин-рилизинг- гормон (МРГ).
Помимо названных гормонов, в гипоталамусе синтезируется АДГ,
который поступает в тканевые депо задней доли гипофиза.
Гипофиз выделяет гормоны с широким спектром действия
(см. схему 10-1).
Передней долей гипофиза секретируются:
• АКТГ;
• соматотропный гормон (СТГ), или гормон роста;
• тиреотропный гормон (ТТГ);
• ФСГ;
• ЛГ;
• пролактин;
• р-липотропный гормон (Р-ЛТГ);
• пропиомеланокортин (ПМК).
Задней долей гипофиза секретируются:
• АДГ (аргинин-вазопрессин);
• окситоцин (ОКТ) — гормон, который регулирует выделение
молока из лактирующей молочной железы, а также может участ¬
вовать в инициации сокращений матки при родах.
Гипофизарные гормоны могут образовываться также в других
гканях организма, в основном злокачественными и доброкачест¬
венными опухолями. Опухоли различных органов способны сек¬
рети ровать АКТГ, АДГ, ПРЛ, ТТГ, СТГ и др.
526
Глава 10. Гормональные исследования
I
■и<
X
о
X
т
X
я
л
X
■&
о
с
X
1
г
о
§
>
X
ш"
8
1
к
—>
С
5
—
1
£
с
Оч
С
о
а
а
£
и
я
-0-
зХ
3
X
ю
о
§
с
0
д
X
и
X
X
1
о.
е
с
X
X
X
н
X
я
§
а
с
X
X
я
X
од
ж
X
а
С
10.3. Нарушение секреции гормонов гипоталамуса и гипофиза 527
10.3. НАРУШЕНИЕ СЕКРЕЦИИ ГОРМОНОВ
ГИПОТАЛАМУСА И ГИПОФИЗА
Секреция гормонов гипофиза регулируется механизмом, работа¬
ющим по принципу отрицательной обратной связи, который функ¬
ционирует следующим образом. Гипоталамус секретирует повышен¬
ное количество определенного рилизинг-гормона, например ТРГ,
который заставляет гипофйз вырабатывать ТТГ. Этот гормон с током
крови доставляется к щитовидной железе, где стимулирует синтез и
секрецию тироксина и трийодтиронина. Соответственно их концен¬
трация в крови увеличивается и тормозит секрецию — гипоталаму¬
сом ТРГ, а гипофизом— ТТГ. Как только концентрация тироксина и
трийодтиронина в крови снижается, снимается их тормозящее влия¬
ние на гипоталамус, который снова начинает секретировать ТРГ, и все
события повторяются. Аналогичным образом регулируется секреция
половых гормонов и гормонов надпочечников.
Повреждение любого из компонентов гормональной регуляции
нарушает единую цепь регуляции функций организма и приводит к
развитию различных патологических состояний.
Причинами эндокринных заболеваний могут быть:
• генетически обусловленные дефекты синтеза различных гормо¬
нов;
• повреждение эндокринных желез (центральных и периферичес¬
ких) в результате воспалительных, аутоиммунных и опухолевых
заболеваний, травм, нарушения кровоснабжения;
• нарушение чувствительности самих эндокринных желез, а также
периферических тканей (органов-мишеней) к гормонам;
• неадекватное поступление в организм веществ, необходимых для
синтеза гормонов.
В основе заболевания эндокринной системы лежат гиперфункция,
I ипофункция или дисфункция желез внутренней секреции.
Нарушение взаимосвязи гипоталамуса, гипофиза и периферичес¬
ких желез внутренней секреции — основа большинства эндокринных
ыболеваний. Для выбора эффективных методов лечения необходимо
установить, на каком уровне произошел сбой взаимосвязи в системе
гормональной регуляции. Лабораторные тесты помогают выявить
нарушения механизма обратной связи и тем самым установить при¬
чину болезни.
Эндокринные заболевания наиболее часто проявляются симп-
юмами снижения или повышения функции гипофиза (табл. 10-1)
528
Глава 10. Гормональные исследования
и могут развиваться в результате как нарушения функционального .
состояния самого гипофиза, так и первичного поражения перифери
ческих желез внутренней секреции. '
Таблица 10-1.
Последствия первичного нарушения секреции гормонов
передней доли гипофиза
Гормон
Избыток
Недостаточность
СТГ
Акромегалия
Наносомия (карликовость)
Чрезмерный рост
:•
Пролактин
Аменорея
Отсутствие лактации
Бесплодие
Галакторея
АКТГ
Болезнь Иценко-
Кушинга
Вторичная гипофункция коры
надпочечников
ТТГ
Гипертиреоз (очень
редко)
Вторичный гипотиреоз
ЛГ/ФСГ
Преждевременная
половая зрелость
Вторичная гипофункция
половых желез
Бесплодие
Для оценки функционального состояния эндокринной системы
используется определение в крови целого комплекса гормонов, обеспе¬
чивающего всю линию функциональной связи: гипоталамус -> гипо¬
физ периферическая железа внутренней секреции -> гипоталамус.
Например, если исследуется состояние гипоталамо-гипофизарно-тире-
оидной системы, то проводятся исследования ТРГ -> ТТГ -> свободны||
тироксин (сТ4). Более подробно изменения лабораторных показателей
при нарушениях в различных отделах гипоталамо-гипофизарной сис¬
темы будут рассмотрены в соответствующих разделах данной главы.
10.4. ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Заболевания щитовидной железы по распространенности занима¬
ют 2-е место среди эндокринных заболеваний после сахарного диабе¬
Ю.4. Функциональное состояние щитовидной железы
529
та. Они развиваются в результате изменений биосинтеза тиреоидных
гормонов, нарушений механизмов регуляции функции щитовидной
железы или нарушений действия гормонов на ткани. Лабораторные
исследования, которые включают определение концентрации тире¬
оидных гормонов, играют важную роль в диагностике, мониторинге
(отслеживании) эффективности лечения заболеваний щитовидной
железы. Нарушениями функции щитовидной железы страдает около
5% взрослого населения, поэтому исследование уровня тиреоидных
гормонов в крови наиболее широко используется в клинической
практике.
10.4.1. БИОСИНТЕЗ ГОРМОНОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Щитовидная железа состоит из двух долей и перешейка (рис. 10.3).
У '/з людей имеется добавочная пирамидальная долька, отходящая от
перешейка. Располагается щитовидная железа на передней поверх¬
ности шеи в нижней ее трети и имеет бабочкообразную или подково¬
образную (реже) форму. Она охватывает спереди трахею (дыхательное
горло) и хрящи гортани, располагаясь чуть ниже щитовидного хряща,
который, как щит, закрывает гортань. Из-за этого соседства железа
и получила свое название «щитовидная». Масса щитовидной железы
нзрослого человека в среднем 15—30 г. Щитовидная железа снабжается
кровью, причем интенсивность кровообращения в ней значительно
Гис. 10.3. Топография щитовидной железы
530 Глава 10. Гормональные исследования
превосходит таковую во всех других органах и тканях. За 1 мин череэ
железу прокачивается около 300 мл крови. Таким образом, практичес¬
ки вся кровь, которая циркулирует в нашем организме, проходит через
щитовидную железу примерно за 17 мин. Доли жеЛезы покрываю»
крупные сосуды (общую сонную артерию, яремную вену), нервы (воз¬
вратные), околощитовидные железы и примыкают сзади к пищеводу.
Увеличение щитовидной железы получило название «зоб» (по ана
логии с зобом у птиц) — признак многих нарушений ее функции. Его
можно легко обнаружить при осмотре больного в виде припухлости
шеи или пропальпировать при физикальном обследовании.
Щитовидная железа содержит 3 типа клеток, синтезирующих гор
МОНЫ и гормонально-активные вещества:
• А-клетки — фолликулярные клетки, вырабатывают два вида
тиреоидных гормонов — ТЗ и Т4;
• В-клетки, синтезируют серотонин и обладают высокой метаболи
ческой активностью;
• С-клетки — парафолликулярные клетки, синтезируют кальци
отонин — гормон, необходимый для нормального обмена каль
ПИЯ,
Для образования тиреоидных гормонов необходимы неорганичес
кий йод и аминокислота тирозин. Около 95% йода, содержащегося »»
организме человека, находится в щитовидной железе. Йод поступає»
в организм с пищей и водой, всасывается в тонкой кишке и с кровью
доставляется в щитовидную железу, где используется для синтеза ТЗ
и Т4. Баланс йода в организме подвержен значительным колебаниям.
Избыточное количество йода из организма выделяется с мочой (98%)
и желчью (2%).
Синтез гормонов щитовидной железы происходит в фолликулярных
клетках из аминокислоты тирозина. Йод включается в молекулу тиро
зина, образуя моно- и дийодтирозин. Соединение двух молекул дийод-
тирозина приводит к образованию Т4, а молекул моно- и дийодтиро-
зина—к образованию ТЗ. Синтезированные гормоны секретируются
фолликулярными клетками в кровь. Однако около 80% ТЗ образуется
не в щитовидной железе, а в периферических тканях (печень, почки)
путем отщепления молекулы йода от Т4.
Тиреоидные гормоны Т4 и ТЗ в крови обратимо связаны со спс
пифическим белком — тироксинсвязывающим глобулином. Когда
содержание тиреоидных гормонов повышается, избыток связывается
с другими белками — преальбумином и альбумином. Только 0,05%
Ю.4. Функциональное состояние щитовидной железы 531
общего количества ТЗ и Т4 находятся в крови в свободной форме.
Свободные гормоны отвечают за метаболический эффект (обла¬
чают метаболической активностью). В крови создается равновесие
связанных гормонов и небольших количеств свободных гормонов.
Белковосвязанные гормоны представляют своего рода депо гормонов,
освобождающихся по мере необходимости.
>
10.4.2. МЕТАБОЛИЧЕСКИЕ ЭФФЕКТЫ ГОРМОНОВ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Тиреоидные гормоны влияют на различные метаболические про¬
цессы в организме. ТЗ и Т4 играют важную роль в водно-электролит-
иом и газовом обмене, стимулируя прежде всего поглощение кисло¬
рода и выделение углекислого газа. Непосредственное отношение они
имеют и к белковому обмену. При недостаточном поступлении белков
ТЗ и Т4 стимулируют их синтез, а при насыщении усиливают распад.
От состояния функции щитовидной железы зависят такие важные
биологические процессы, как рост, развитие и дифференцировка тка¬
ней. ТЗ и Т4 (при адекватном уровне) стимулируют рост, оказывают
положительное действие на регенеративные процессы, участвуют в
регуляции жирового и углеводного обмена. Они увеличивают всасы¬
вание углеводов (глюкозы и галактозы) в кишечнике и утилизацию их
в клетках, стимулируют распад гликогена, уменьшая его содержание
в печени, снижают уровень холестерина в крови.
Тиреоидные гормоны оказывают влияние на работу сердца и цен¬
тральной нервной системы. Неадекватная продукция гормонов щито¬
видной железы приводит к нарушению роста и психического развития
у детей.
10.4.3. РЕГУЛЯЦИЯ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Концентрация тиреоидных гормонов в крови должна поддержи¬
ваться в нормальных границах. Регулирование синтеза и секреции
гормонов щитовидной железой осуществляется гипоталамусом и
гипофизом. Гипоталамус вырабатывает ТРГ, или тиролиберин.
Функция щитовидной железы находится под контролем тиролибе-
рина, секрстируемого гипоталамусом. ТРГ относится к группе гипо-
532
Глава 10. Гормональные исследования
таламических гипофизотропных рилизинг-гормонов (образуется и
серобугорных ядрах гипоталамуса), стимулирует синтез и высвобож¬
дение ТТГ гипофизом (рис. 10-4). ТТГ — гликопротеин, выделяемый
гипофизом. Он действует на щитовидную железу, стимулируя синтез
Т4 и ТЗ и выделение их в кровь. Референтные величины содержания
ТТГ в сыворотке крови у новорожденных составляют 1—39 мМЕ/л, у
взрослых — 0,4—4,2 мМЕ/л.
В свою очередь высвобождение ТРГ и ТТГ гипоталамусом и гипо¬
физом контролируется концентрацией в крови ТЗ и Т4. Как только ома
снижается, секреция ТРГ и ТТГ возрастает, стимулируя щитовидную
железу к синтезу и секреции тиреоидных гормонов, в свою очередь
как только концентрация ТЗ и Т4 в крови повышается, секреция ТРГ
и ТТГ снижается и соответственно уменьшается секреция тиреоид¬
ных гормонов. Этот постоянно действующий механизм, получивший
название отрицательной обратной связи, поддерживает концентра¬
цию тиреоидных гормонов в крови в нормальных границах.
Референтные величины тиреоидных гормонов в сыворотке крови:
• ТЗ — 1,08-3,14 нмоль/л;
• свободный ТЗ (сТЗ) — 4,0—7,4 пмоль/л;
• Т4 — 60-150 нмоль/л;
• сТ4 — 9—26 пмоль/л.
Рис. 10.4. Регуляция секреции гормонов шитовидной железы
ї
10.4. Функциональное состояние щитовидной железы 533
10.4.4. ПРИЧИНЫ НАРУШЕНИЙ ФУНКЦИИ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Нормальная секреция тиреоидных гормонов и, следовательно, их
нормальная концентрация в крови зависят от следующих причин:
• адекватного поступления с пищей йода, который необходим для
синтеза тиреоидных Г(ірмонов;
• нормального функционирования щитовидной железы;
• адекватной секреции ТТГ — нормально функционирующего
гипофиза;
• адекватного количества ТРГ — нормально функционирующего
гипоталамуса.
Недостаточное или чрезмерное поступление йода может быть
причиной заболевания щитовидной железы. Здоровый человек
нуждается в ежедневном поступлении примерно 150 мкг йода.
Недостаток его в пищевых продуктах является основной причиной
возникновения зоба. При недостатке йода снижается синтез Т4
щитовидной железой, что повышает содержание в крови ТТГ по оси
отрицательной обратной связи и приводит к развитию гиперпла¬
зии щитовидной железы и образованию зоба. Гиперплазированная
щитовидная железа образует больше ТЗ, что клинически проявля¬
ется эутиреозом (отсутствием признаков заболевания) при низком
уровне Т4 в крови. Помимо абсолютной недостаточности, не мень¬
шую роль в генезе тиреоидной патологии играют факторы, приво¬
дящие к возникновению относительной йодной недостаточности.
Такая патология возникает при поражении печени и желудочно-
кишечного тракта, при поступлении в организм йода в форме,
затрудняющей его всасывание.
В большинстве случаев дефицит йода дает о себе знать повышенной
утомляемостью, ухудшением памяти и способности сосредоточиться,
повышенной тревожностью, чрезмерной температурной чувствитель¬
ностью, снижением умственной и физической работоспособности,
сонливостью, постоянными запорами, подверженностью просту¬
дам, нарушением сердечного ритма, выпадением и истончением
волос, ломкостью ногтей, ожирением, снижением количества грудно¬
го молока и быстрым прекращением лактации у кормящих женщин.
Болезни, связанные с дефицитом йода, в первую очередь угрожают
тем, кто много работает и мало отдыхает, часто подвергается стрессам,
неправильно и нерегулярно питается.
534 Глава 10. Гормональные исследования
Чрезмерное употребление пищи с высоким содержанием йода
и введение фармакологических доз йодидов в виде препаратов для
лечения хронических легочных заболеваний в составе рентгено
контрастных веществ могут приводить к развитию зоба, появ
лению симптомов недостаточности или повышенной функции
щитовидной железы.
Для оценки функции щитовидной железы используется ряд тер
минов, значение которых медицинская сестра должна понимать и
использовать в своей работе:
• эутиреоз (эутиреоидизм) — нормальная активность щитовидной
железы;
• гипертиреоз (гипертиреоидизм) — повышенная активность щито
видной железы;
• гипотиреоз (гипотиреоидизм) — пониженная активность щито
видной железы;
• зоб — увеличение щитовидной железы; в зависимости от функ
ции щитовидной железы зоб может быть эутиреоидным, гипоти
реоидным или гипертиреоидным;
•тиреотоксикоз — клинический синдром (совокупность кли
нических признаков), который развивается при гипертиреозе
(нередко используется как синоним гипертиреоза);
• микседема — клинический синдром (совокупность клиничес
ких признаков), который развивается при выраженном гипо
тиреозе.
Повышенная функциональная активность щитовидной железы
называется гипертиреозом. При данном состоянии секреция ТЗ п
Т4 и соответственно их концентрация в крови повышены, а уро
вень ТТГ снижен. Гипертиреоз может быть вызван болезнью самой
железы. В таком случае говорят о первичном гипотиреозе. Если
повышенная функциональная активность щитовидной железы свя¬
зана с высокой секрецией ТТГ гипофизом, то говорят о вторичном
гипотиреозе, а если с избыточной секрецией ТРГ гипоталамусом
о третичном гипотиреозе. Аналогичным образом сниженная функ¬
циональная активность щитовидной железы — гипотиреоз — может
быть обусловлен повреждением самой железы (первичный гипоти¬
реоз), снижением секреции ТТГ гипофизом (вторичный гипотиреоз)
или секреции ТРГ гипоталамусом (третичный гипотиреоз). При
гипотиреозе продукция тиреотропных гормонов снижена, а уровень
ТТГ повышен.
Ш.4. Функциональное состояние щитовидной железы 535
10.4.5. ОЦЕНКА ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Оценка гормонального статуса щитовидной железы позволяет
выявить три ее функциональных состояния; гиперфункцию, гипо-
(бункцию и эутиреоидное состояние. Определение в сыворотке крови
концентрации ТТГ совмес^тно с уровнем сТ4 является одними из
ведущих стратегических маркеров при оценке гормонального статуса
щитовидной железы.
Уровень ТТГ в сыворотке крови является наиболее чувствитель¬
ным индикатором функции щитовидной железы. Увеличение содер¬
жания ТТГ в сыворотке крови является маркером при первичном
гипотиреозе. Снижение его уровня или полное отсутствие ТТГ —
наиболее существенный индикатор первичного гипертиреоза.
Совместное определение уровня ТТГ и сТ4 имеет важное значение
для подбора адекватной терапии выявленных нарушений функции
щитовидной железы. Доза препаратов тиреоидных гормонов, которые
используются в лечении гипотиреоза, подбирается соответственно
уровню ТТГ. Адекватное лечение сопровождается нормализацией его
уровня. Определение уровня сТ4 особенно важно для мониторинга
терапии гипертиреоза, поскольку может потребоваться 4—6 мес для
восстановления функции гипофиза. На этой стадии выздоровления
уровень ТТГ может быть снижен, несмотря на то, что содержание сТ4
нормальное или понижено и лечение гипертиреоза адекватно.
10.4.5.1. Эутиреоидный (нетоксический) зоб
Зобом называют любое увеличение щитовидной железы. Простой
юб является результатом попытки организма компенсировать сни¬
женное образование тиреоидных гормонов. Если содержание сТ4 в
крови снижается, секреция ТТГ по механизму отрицательной обрат¬
ной связи возрастает. Это стимулирует синтез Т4 и ТЗ, поддерживая
адекватный уровень гормона в крови. В результате увеличивается
щитовидная железа (зоб), но гипотиреоз не развивается. Причинами
1ИКИХ изменений могут быть нарушение синтеза тиреоидных гор¬
монов (снижение активности ферментов, катализирующих реакции
синтеза гормона), недостаточность йода в организме (эндемический
«об), прием парааминосалициловой кислоты, кордарона, солей
пития (медикаментозный зоб), поступление с пищей зобогенных
пешеств — тиоцинатов и тиооксизолидов (содержатся в отдельных
536 Глава 10. Гормональные исследования
видах овощей). Довольно часто зоб развивается при длительном
лечении гипотиреоза. Сочетание зоба и врожденной глухоты полу¬
чило название синдрома Пендреда.
Простой зоб со временем становится многоузловым и имеет тен
денпию к автономности функции, которая проявляется независимой
от ТТГ продукцией и секрецией тиреоидных гормонов. Некоторые
узлы могут стать гиперфункционирующими, сопровождаясь гипер¬
тиреозом.
у больных с узловым или диффузным увеличением щитовидной
железы без нарушения ее функции концентрация ТТГ в крови нор
мальная, иногда незначительно повышена. Уровни Т4, ТЗ не изменя
ются. Однако содержание ТЗ и сТЗ может быть заметно снижено при
нормальном или высоком уровне сТ4. Исследованию уровня гормонои
щитовидной железы в крови у больных с эутиреоидным зобом отво
дится важная роль в наблюдении за течением заболевания и эффек
тивностью проводимого лечения.
10.4.5.2. Гипертиреоз (тиреотоксикоз)
Гипертиреоз, или тиреотоксикоз, развивается при избыточном
образовании гормонов щитовидной железы (ТЗ и Т4). Он бывает
первичным (при повреждении самой щитовидной железы), а также
вторичным (при заболеваниях гипофиза) или третичным (при заболе¬
ваниях гипоталамуса). Наиболее частой формой гипертиреоза являет
ся первичный гипертиреоз. Выделяют три формы первичного гипер
тиреоза: диффузный токсический зоб (болезнь Грейвса, базедова
болезнь), токсический узловой зоб и автономную аденому щитовид¬
ной железы.
Диффузный токсический зоб — аутоиммунное заболевание,
которое встречается у 1—2% взрослого населения, чаще у женщин.
Щитовидная железа при диффузном токсическом зобе диффузно
увеличена и функционально гиперактивна, что проявляется новы
шенной секрецией тиреоидных гормонов (ТЗ и Т4 и соответственно
их свободных форм), в основе заболевания лежит постоянное обра-^
зование иммунной системой патологических антител (аутоантител),
которые действуют на щитовидную железу так же, как ТТГ. В резуль¬
тате уровень ТЗ и Т4 в крови повышается. Однако, в отличие от ТТГ,
когда высокий уровень тиреоидных гормонов в крови по механизму
отрицательной обратной связи угнетает его секрецию и функция
щитовидной железы приходит в норму, аутоантитела никуда не исчс-
Ю.4. Функциональное состояние щитовидной железы 537
зают и непрерывно стимулируют железу. Поэтому концентрация ТЗ и
Т4 в крови постоянно повышена.
При диффузном токсическом зобе у больных в лабораторных
анализах крови повышено содержание Т4, сТ4, ТЗ и снижена концен¬
трация ТТГ. Лучшим тестом диагностики тиреотоксикоза является
совместное определение в 1^ови уровней ТТГ, сТ4 и сТЗ, позволяющие
диагностировать тиреотоксикоз почти в 100% случаев.
Определение уровня сТ4 и ТТГ является важным для контроля за
лечением заболевания. Целью терапии являются снижение уровня
тиреоидных гормонов в крови до нормы и ликвидация, таким обра¬
зом, клинических проявлений заболевания, т.е. достижение состоя¬
ния клинического эутиреоза.
Для лечения больных диффузным токсическим зобом применяют
з ри подхода. Большинство больных получает антитиреоидные препа¬
раты. При правильном подборе дозировки антитиреоидных средств
концентрация сТ4 в крови должна поддерживаться на нормальном
уровне. Чрезмерная блокада синтеза тиреоидных гормонов (уровень
сТ4 в крови ниже нормы) может привести к выбросу ТТГ. Повышение
уровня ТТГ в крови более 6 мМЕ/л свидетельствует о передозировке
препарата и приводит к увеличению зоба. При проведении лечения
определение концентрации сТ4 и ТТГ в крови необходимо выполнять
регулярно каждые 4-6 нед до достижения эутиреоидного состояния.
Достижение эутиреоидного состояния и уменьшение симптомов
зиреотоксикоза служат показаниями для перехода на поддержива¬
ющие дозы антитиреоидных препаратов. Стойкое сохранение эути¬
реоидного состояния и клинической ремиссии в течение 4—6 мес
служит показанием для отмены антитиреоидных препаратов. Обычно
ежедневный прием антитиреоидных препаратов в течение 12—18 мес
приводит к излечению почти 50% больных. У остальных 50% проводят
лечение радиоактивным йодом или осуществляют частичное хирур-
I ическое удаление тканей шитовидной железы.
Наиболее часто в лечении диффузного токсического зоба исполь¬
зуется радиоактивный 1311, который, как и обычный йод, накаплива¬
ется в щитовидной железе и вызывает разрушение ее ткани (в течение
2-3 мес). Исследование уровня ТТГ, сТ4 в крови является важным
для выбора терапевтической дозы, оценки эффективности лечения
1311 и дальнейшего наблюдения за функцией щитовидной железы.
Нормализация уровня сТ4 в крови через 2-3 нед служит показате-
■зсм эффективности проведенного лечения. Увеличение уровня ТТГ
538 Глава 10. Гормональные исследования
в крови после проведенной терапии радиоактивным 1311 в 2 раза и
более (вне зависимости от клинической картины) служит основанием
к назначению заместительной терапии Ь-тироксинрм для профилак¬
тики развития одного из частых осложнений этого лечения — гипоти
реоза, который наблюдается в 1—10% случаев.
Менее часто первичный гипертиреоз встречается при узловом ток¬
сическом зобе и аденоме щитовидной железы. Почти у всех больных
с выраженной клинической картиной заболевания в крови вьіявляюі
повышение уровня сТ4 и снижение уровня ТТГ.
Вторичный и третичный гипертиреоз — очень редкие состояния,
при которых повышенная секреция тиреоидных гормонов вызвана
неконтролируемой секрецией ТТГ (гипофиз) и ТРГ (гипоталамус).
В большинстве случаев эти формы гипертиреоза обусловлены опу¬
холью гипофиза или гипоталамуса. Щитовидная железа нормально
реагирует на повышенную стимуляцию ТТГ — избыточной секрецией
ТЗ и Т4, Однако при опухолях гипофиза или гипоталамуса высокая
концентрация ТЗ и Т4 в крови не может подавить продукцию ТТГ
или ТРГ опухолью. Типичные изменения в результатах лабораторных
анализов при вторичном и третичном гипертиреозе — повышенная
концентрация ТТГ, Т4, сТ4 и ТЗ в сыворотке крови.
Клинически гипертиреоз проявляется следующими симптомами;
• повышенной потливостью;
• потерей массы тела;
• повышением аппетита;
• тахикардией;
• сердцебиением;
• нервозностью;
• тремором рук;
• невозможностью сконцентрировать внимание;
• нарушениями менструального цикла;
• экзофтальмом (пучеглазием).
10.4.5.3. Гипотиреоз
Гипотиреоз может быть связан с первичным поражением непос¬
редственно щитовидной железы (первичный гипотиреоз), наруше¬
нием регуляции ее функции гипоталамо-гипофизарной системой
(третичный и вторичный гипотиреоз), в подавляющем большинстве
случаев (90—95%) гипотиреоз обусловлен патологическим процессом
в щитовидной железе, снижающим уровень продукции гормонов
Ю.4. Функциональное состояние щитовидной железы 539
(первичный гипотиреоз). Первичный гипотиреоз встречается сравни¬
тельно часто, примерно у 2—3% всего населения, и обусловлен умень¬
шением содержания в циркулирующей крови одного или обоих гор¬
монов щитовидной железы. Это состояние характерно для женщин,
особенно старше 45 лет. Дефицит сТЗ или сТ4 приводит к развитию
клинической картины заболевания.
Наиболее частая причина первичного гипотероза — хронический
аутоиммунный тиреоидит (тиреоидит Хашимото) — заболевание,
обусловленное генетическим дефектом иммунных клеток, приводя¬
щее к инфильтрации щитовидной железы макрофагами, лимфоци¬
тами, плазматическими клетками, в результате чего в щитовидной
железе происходит образование антител к антигенам ткани железы.
Взаимодействие антител с антигенами вызывает деструктивные изме¬
нения в фолликулярных клетках и ведет к снижению функции щито-
иидной железы, вследствие чего синтез и секреция тиреоидных гор¬
монов снижаются, в процессе развития хронического аутоиммунного
тиреоидита функция щитовидной железы претерпевает стадийные
изменения с практически обязательным исходом в гипотиреоз.
Среди аутоиммуннных тиреоидитов преобладают субклинические
(|юрмы заболевания, при которых показатели функции щитовидной
железы (уровень ТТГ и сТ4) обычно нормальные, но даже при кли¬
ническом эутиреоидите уровень ТТГ может быть слегка или умерен¬
но повышен. По мере прогрессирования недостаточности функции
железы снижается концентрация в крови Т4, а затем и ТЗ, а уровень
ГТГ постепенно нарастает. В дальнейшем развивается клиника гипо¬
тиреоза с характерными лабораторными проявлениями — низким
уровнем сТ4 (Т4, ТЗ) и повышенным ТТГ в крови.
Функциональное состояние щитовидной железы при аутоиммун¬
ном тиреоидите оценивается по уровню ТТГ и сТ4 в крови. Если уро-
кень ТТГ находится в пределах 0,2—5 мМЕ/л, то это расценивается как
эутиреоидное состояние. Повышение уровня ТТГ свыше 5 мМЕ/л при
нормальной концентрации сТ4 расценивается как субклинический
гипотиреоз, а повышение уровня ТТГ при снижении уровня сТ4 — как
манифестный гипотиреоз.
Клинически гипотиреоз проявляется следующими симптомами:
• сухостью кожных покровов;
• увеличением массы тела;
• снижением аппетита;
• сонливостью;
540 Глава 10. Гормональные исследования
• заторможенностью;
• непереносимостью холода;
• одутловатостью лица;
• брадикардией (редкие сердечные сокращения).
При первичном гипотиреозе в лабораторных анализах могут быть
выявлены следующие изменения:
• концентрация ТТГ в сыворотке крови повышена;
• концентрация Т4 в сыворотке крови снижена (может быть на
нижней границе нормы на ранних стадиях болезни);
• концентрация сТ4 в сыворотке крови снижена (может быть на
нижней границе нормы на ранних стадиях болезни).
Вторичный и третичный гипотиреоз развивается вследствие пора¬
жения гипофиза (травма, кровоизлияние в гипофиз, оперативное или
лучевое лечение по поводу аденомы гипофиза) или гипоталамуса.
Недостаточная секреция ТТГ гипофизом или ТРГ гипоталамусом
приводит к низкой стимуляции щитовидной железы и снижению
уровня тиреоидных гормонов в крови. Характерная особенность вто¬
ричного и третичного гипотиреоза — низкий уровень в сыворотке
крови ТТГ на фоне сниженных концентраций сТ4, Т4 и ТЗ.
Основной и единственный способ лечения первичного гипоти¬
реоза — заместительная терапия препаратами щитовидной железы
(тироксин). Таблетки необходимо принимать ежедневно и обыч¬
но всю жизнь. Целью лечения является повышение уровня ТЗ и
Т4 в крови до нормального. Это приводит к нормализации кон¬
центрации ТТГ в крови и ликвидации клинических проявлений
гипотиреоза. Доза тироксина для каждого пациента различна. Ее
подбирают путем постепенного повышения с учетом результатов
определения уровня ТТГ и сТ4 в крови. Эффективной считается
терапия, при которой нормализуются уровни ТТГ и сТ4 в крови.
Динамический контроль за уровнем ТТГ и сТ4 в крови позволя¬
ет подходить к подбору дозы заместительного препарата инди¬
видуально. Уровень ТТГ, как правило, нормализуется медленно,
особенно при длительно существующем гипотиреозе. После под¬
бора оптимальной дозы гормонального препарата у больного необ¬
ходимо ежегодно определять уровень ТТГ в крови. С возрастом
потребность в гормонах щитовидной железы снижается, и дозу
Е-тироксина уменьшают в соответствии с уровнем ТТГ в крови. При
выборе лечения рекомендуется поддерживать уровень ТТГ в крови в
пределах 0,5-1,5 мМЕ/л.
10.5. Функциональное состояние надпочечников 541
10.5. ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
НАДПОЧЕЧНИКОВ
Гипоталамус, передняя доля гипофиза и кора надпочечников фун¬
кционально объединены в гипоталамо-гипофизарно-надпочечнико-
мую систему.
Надпочечники представляют собой парный внебрюшинный орган,
располагающийся на уровне XI—XII грудных позвонков. Правый над¬
почечник лежит несколько ниже левого. Задней поверхностью правый
надпочечник прилегает к поясничной части диафрагмы, передней
соприкасается с поверхностью печени и двенадцатиперстной киш¬
кой, а нижней-вогнутой с верхним полюсом правой почки. Левый
надпочечник передней поверхностью прилегает к хвосту поджелу¬
дочной железы, к желудку, задняя его поверхность соприкасается с
диафрагмой, а нижняя — с верхним полюсом левой почки. В среднем
длина надпочечника 45 мм, ширина 25—30 мм, толщина 6—10 мм.
Суммарная масса обоих надпочечников 10-12 г. Правый надпочечник
имеет пирамидальную форму, левая железа более сглажена и, как пра-
иило, принимает вид полумесяца.
Каждый надпочечник состоит из коры и мозговой части, выпол¬
няющих различные функции. Гистологически в коре надпочечников
и }рослого человека различают три слоя. На долю коркового слоя при¬
ходится около 90% ткани надпочечника. Этот слой состоит из трех зон:
наружной — клубочковой, средней — пучковой и внутренней (окру¬
жающей мозговой слой) — сетчатой. Располагаясь непосредственно
под фиброзной капсулой, клубочковая зона занимает примерно 15%
объема коркового слоя; ее клетки содержат сравнительно небольшое
количество цитоплазмы и липидов, вырабатывают гормон альдосте¬
рон. На долю пучковой зоны приходится 75% всего коркового вещест-
на; ее клетки богаты холестерином и эфирами холестерина, вырабаты-
нают в основном кортизол. Клётки сетчатой зоны также продуцируют
кортизол и половые гормоны — андрогены и эстрогены.
В корковом слое надпочечников вырабатывается более 50 различ¬
ных стероидных соединений. Он служит единственным источником
гдюко- и минералокортикоидов в организме, важнейшим источником
андрогенов у женщин и играет незначительную роль в продукции
ктрогенов и прогестинов. Основным глюкокортикоидом у человека
имляется кортизол. Избыток или недостаток этого стероида сопро-
иождается существенными нарушениями всех видов обмена веществ.
542 Глава 10. Гормональные исследования
Основным минералокортикоидом у человека является альдостерон.
Избыток минералокортикоидов обусловливает артериальную гипер
тензию и гипокалиемию, а недостаток— гиперкалиемию, которые
могут оказаться несовместимы с жизнью.
Мозговой слой надпочечников продуцирует соединения, по своей
структуре далекие от стероидов, — катехоламины, к которым относят
адреналин, норадреналин и дофамин.
10.5.1. БИОСИНТЕЗ ГОРМОНОВ НАДПОЧЕЧНИКОВ
Кора надпочечников — источник трех важнейших классов гормо
нов: глюкокортикоидов, минералокортикоидов и половых гормонои.
Основным представителем глюкокортикоидов в организме человека
является кортизол (80% всех глюкокортикоидов), минералокортико
и лов — альдостерон.
Синтез стероидных гормонов в надпочечниках происходит из холес
терина (схема 10-2). В пучковой зоне коры надпочечников прегненолоп,
синтезированный из холестерина, преобразуется в 17а-оксипрегненолон,
служащий предшественником кортизола, андрогенов и эстрогенов. На
пути синтеза кортизола из 17а-оксипрегненолона образуется 17а-окси-
прогестерон, который последовательно гидроксилируется в кортизол.
к продуктам секреции коры надпочечников относятся гормо
ны, обладающие андрогенной активностью: дегидроэпиандростерои
(ДГЭА), дегидроэпиандростерон-сульфат (ДГЭА-С), андростенедиом
(и его пр-аналог) и тестостерон. Все они образуются из 17а-оксип
регненолона. В количественном отношении главными андрогенами
надпочечников являются ДГЭА и ДГЭА-С. Андрогенная активность
надпочечниковых стероидов в основном обусловлена их способностью
преобразовываться в тестостерон. В самих надпочечниках его образу¬
ется очень мало, равно как и эстрогенов (эстрона и эстрадиола).
10.5.2. МЕТАБОЛИЧЕСКИЕ ЭФФЕКТЫ
ГОРМОНОВ НАДПОЧЕЧНИКОВ
Глюкокортикоиды оказывают разнообразное действие на орга¬
низм. Наиболее значительным следует считать влияние кортизола
на углеводный обмен, в связи с чем и возникло наименование «тлю-
10.5. Функциональное состояние надпочечников
543
Схема 10-2.
Биосинтез половых стероидов в надпочечниках
кокортикоид», т.е. глюкозокортикоид. Глюкокортикоидные гормоны
стимулируют образование глюкозы в печени через процесс глюконе-
огенеза. в скелетных мышцах глюкокортикоиды ингибируют (тормо-
1ят) синтез гликогена и активируют его распад. Суммарное влияние
1Люкокортикоидов на углеводный обмен выражается в повышении
концентрации глюкозы в крови.
Под влиянием кортизола снижается синтез белков в мышцах и
соединительной ткани, усиливаются протеолиз белков и поступление
аминокислот в кровь. В соединительной и костной ткани глюкокор-
I икоиды тормозят биосинтез коллагена и фибронектика, что является
одной из причин сморщивания кожи и усиления резорбции (расса¬
сывания) костной ткани с развитием остеопороза. Глюкокортикоиды
утетают синтез иммуноглобулинов плазматическими клетками, что
приводит к снижению гуморального иммунитета.
Глюкокортикоиды оказывают своеобразное влияние на обмен
липидов. Они усиливают липолиз (распад триглицеридов) в тканях
конечностей человека и липогенез (синтез триглицеридов) в других
•ыстях тела (туловище и лицо). Такая разнонаправленность обменных
процессов в различных частях тела организма человека придает харак¬
терный вид больным с избыточной секрецией глюкокортикоидов.
544 Глава 10. Гормональные исследования
Основная функция минералокортикоидов — поддержание баланса
электролитов и жидкостей в организме человека. Альдостерон увс
личивает реабсорбцию натрия из первичной мочи ц одновременна
экскрецию ионов калия. Задержка натрия приводит к увеличению
содержания воды в организме и повышению артериального давления,
а потеря калия — к развитию гипокалиемии.
Гормоны коры надпочечников играют важную роль в поддержании
постоянства внутренней среды, регуляции обменных процессов и фуи
кционального состояния различных органов и систем, а также обеспс
чении адаптационных механизмов и защитных реакций организма.
10.5.3. РЕГУЛЯЦИЯ ФУНКЦИИ НАДПОЧЕЧНИКОВ
Продукция надпочечниковых глюкокортикоидов регулируется
гипоталамо-гипофизарной системой. В гипоталамусе вырабатывается
КРГ, попадающий через портальные сосуды в переднюю долю гипофн
за, где он стимулирует продукцию АКТГ. АКТГ вызывает в корковом
слое надпочечников быстрые и резкие сдвиги. В коре надпочечников
АКТГ повышает скорость синтеза кортизола в надпочечниках. Эти гор
МОНЫ (КРГ ^ АКТГ -> свободный кортизол) связаны между собой клас¬
сической петлей отрицательной обратной связи. Повышение уровни
свободного кортизола в крови тормозит секрецию КРГ. Снижение
уровня свободного кортизола в крови ниже нормы активирует систему,
стимулируя высвобождение КРГ гипоталамусом.
АКТГ — гормон, выделяемый передней долей гипофиза под вли
янием тропных факторов гипоталамуса, представляет собой пептид,
состоящий из 39 аминокислотных остатков с молекулярной массой
около 4500 Д. Секреция АКТГ в кровь подвержена суточным ритмам,
концентрация максимальна в 6 ч утра, а минимальна около 22 ч.
Сильным стимулятором его выделения является стресс. АКТГ
важнейший стимулятор коры надпочечников. Референтные вели
чины содержания АКТГ в сыворотке крови составляют в 8 ч менее
26 пмоль/л, в 22 ч менее 19 пмоль/л.
Кортизол — стероидный гормон, выделяемый корой надпочечни¬
ков. Он составляет 75-90% всех глюкокортикоидов, циркулирующих
в крови. Основная часть кортизола в плазме крови связана с корти-
костероидсвязывающим глобулином, и только незначительная часіь
находится в свободной форме. Кортизол фильтруется в почечных клу¬
10.5. Функциональное состояние надпочечников 545
бочках и удаляется с мочой. Референтные величины содержания кор¬
тизола в сыворотке крови в 8 ч 200—700 нмоль/л (70—250 нг/мл), в 20 ч
55-250 нмоль/л (20—90 нг/мл); разница между утренней и вечерней
концентрацией более 100 нмоль/л. При беременности концентрация
кортизола повышается и нарушается суточный ритм его выделения.
Одновременное определение содержания АКТГ и кортизола в
крови играет важнейшую рол1> в диагностике заболеваний коры над¬
почечников,
17а-гидроксипрогестерон (17-ОНР) является стероидом, предшест-
ненником кортизола, обладающим натрийуретическими свойствами,
(ормон вырабатывается в основном в надпочечниках. 17-ОНР в резуль¬
тате гидроксилирования превращается в кортизол. Референтные
пеличины содержания 17-ОНР в сыворотке приведены в табл. 10-2.
Таблица 10-2.
Референтные величины содержания 17-ОНР в сыворотке крови
Возрастная группа
17-ОНР, нмол/л
Дети, пубертатный возраст:
мальчики
0,1-2,7
девочки
0,1-2,5
Женщины:
фолликулиновая фаза
0,4-2,1
лютеиновая фаза
1,0-8,7
постменопауза
Менее 2,1
Определение 17-ОНР в крови играет ведущую роль в диагностике
пдреногенитального синдрома, который сопровождается гиперпро-
;1укцией коры надпочечников гормонов одной группы и снижением
секреции—другой.
10.5.4. ПРИЧИНЫ НАРУШЕНИЙ ФУНКЦИИ НАДПОЧЕЧНИКОВ
Основной причиной нарушений функции надпочечников явля¬
ются заболевания коры надпочечников. Они могут протекать или с
Iиперфункцией при повышении секреции гормонов (гиперкорти-
иизм), или с гипофункцией при снижении секреции (гипокорти-
546 Глава 10. Гормональные исследования
цизм). Патология, при которой определяется повышение секреции
одних гормонов и снижение — других, относится к группе дисфумк
ций коры надпочечников.
При заболеваниях коры надпочечников выделяют следующие сии
дромы.
• Гиперкортицизм:
— болезнь Иценко—Кушинга — гипоталамо-гипофизарное забо
левание (наиболее часто доброкачественная опухоль гипофиза);
— синдром Иценко—Кушинга — кортикостерома (доброкачсс
твенная или злокачественная опухоль коры надпочечников)
или двусторонняя мелкоузелковая дисплазия коры надпочсч
ников;
• Гипокортицизм (недостаточность коры надпочечников):
— первичный;
— вторичный;
— третичный.
• Дисфункция коры надпочечников:
— адреногенитальный синдром.
Для оценки функционального состояния гипоталамо-гипофп-
зарно-надпочечниковой системы определяют уровень АКТГ и кор
тизола в плазме, а для выявления адреногенитального синдрома
содержание 17-ОНР в плазме крови.
10.5.4.1. Болезнь Иценко—Кушинга
Болезнь Иценко—Кушинга — одно из наиболее тяжелых и слож
ных эндокринных заболеваний гипоталамо-гипофизарного проис¬
хождения. В основе большинства случаев болезни Иценко-Кушиша
лежит доброкачественная аденома гипофиза. Аденома продуцирует
большое количество АКТГ, что приводит к избыточной стимулянт)
коры надпочечников, синтезу повышенного количества кортизола и
связанному с ним нарушению всех видов обмена. Высокая концентра
ПИЯ кортизола в крови не в состоянии подавить избыточную продук
циюАКТ опухолью гипофиза. Отрицательная обратная связь в функ¬
циональной системе гипоталамус -Э гипофиз -> кора надпочечникой
(КРГ -> АКТГ ^ кортизол) перестает работать, и развивается гипер
плазия клеток (кортикотрофов) коры надпочечников.
Для болезни Иценко-Кушинга характерно одновременное уве¬
личение содержания в крови АКТГ и кортизола, что выявляется при
проведении лабораторных исследований.
10.5. Функциональное состояние надпочечников 547
Синдром Иценко—Кушинга — заболевание, обусловленное добро¬
качественной или злокачественной опухолью коры надпочечников,
пли двусторонней мелкоузелковой дисплазией коры надпочечников.
Мри этом заболевании кора надпочечников секретирует избыточное
количество кортизола. Однако функционирование в системе КРГ ->
АКТГ -> кортизол не нарушенр, поэтому высокий уровень кортизола в
крови подавляет секрецию К1^Г и АКТГ. В крови больных с синдром
Иценко—Кушинга определяется низкая концентрация АКТГ и высо¬
кая— кортизола.
Основным методом лечения болезни Иценко-Кушинга являет¬
ся оперативное удаление аденомы гипофиза. Об эффективности
ючения свидетельствует нормализация уровня АКТГ в крови. При
неэффективности операции концентрация АКТГ в крови остается
повышенной. Это служит показанием к повторной операции вплоть
110 тотальной гипофизэктомии.
Хирургическое вмешательство с целью удаления гиперплазиро-
паных надпочечников (двусторонняя адреналэктомия) для лече¬
ния болезни Иценко—Кушинга в настоящее время применяется
реже. После операции патологические последствия избыточной
секреции глюкокортикоидов во многом подвергаются обратному
развитию. Однако секреция АКТГ опухолью гипофиза после уда¬
ления надпочечников остается высокой. Больным с удаленными
надпочечниками показаны заместительная терапия препаратами
глюкокортикоидов и регулярный контроль за уровнем АКТГ и
кортизола в крови, что позволяет индивидуально регулировать
позу принимаемого препарата.
10.5.4.2. Недостаточность коры надпочечников
Недостаточность коры надпочечников, или гипокортицизм может
()1.1ть следствием повреждения патологическим процессом самих над¬
почечников (первичная недостаточность), гипофиза (вторичная недо¬
статочность) или гипоталамуса (третичная недостаточность).
Первичная недостаточность коры надпочечников (болезнь
Аддисона) наиболее часто встречается в клинической практике.
( реди причин, приводящих к развитию первичной надпочечниковой
недостаточности, различают:
• аутоиммунное поражение надпочечников (нередко сочетающееся
с аутоиммунным поражением других эндокринных желез — щито¬
видной, паращитовидных, поджелудочной, яичников и кожи);
548 Глава 10. Гормональные исследовани и
• удаление надпочечников по поводу болезни Иценко—Кушинга и
других заболеваний;
• бактериальные и грибковые инфекции (туберкулез, бластомиоз,
гистоплазмоз, менингококковая инфекция, сепсис);
• амилоидоз;
• гемохроматоз;
• метастазы рака (чаще рака бронхов, молочной железы);
• осложнения при использовании различных лекарственных пре
паратов (антикоагулянты, блокаторы стероидогенеза в надпочеч
никах — аминоглутетимид, хлодитан, кетоконазол; барбитураты,
спиронолактон, рифампин).
При первичной надпочечниковой недостаточности в результаю
деструктивных процессов в коре надпочечников снижается продук
ция глюкокортикоидов, минералокортикоидов и андрогенов. Низкая
концентрация кортизола в крови не оказывает тормозящего влияния
на гипоталамус и гипофиз, в результате секреция КРГ и АКТГ повы
шается. Однако повышенная секреция АКТГ вследствие повреждения
надпочечников не способна обеспечить синтез адекватного количес
тва кортизола и других гормонов, что приводит к нарушению всех
видов обмена в организме.
Наиболее грозные симптомы болезни Аддисона обусловлены недо
статочностью минералокортикоидов (альдостерона). Недостаточное I ь
альдостерона приводит к повышенной потере натрия и хлоридов с
мочой. Первоначально выведение натрия сопровождается адекватны
ми потерями воды, поэтому концентрация натрия в крови остаезси
в пределах нормы. В дальнейшем уменьшение объема циркулирую
щей крови вызывает стимуляцию секреции АДГ, в результате чси)
реабсорбция воды увеличивается в большей степени, чем натрия, что
приводит к развитию гипонатриемии. Длительное течение заболева
ния вызывает дегидратацию и гипотонию. Среди других нарушений
водно-электролитного баланса выявляют повышение уровня калии и
крови и метаболический ацидоз.
Недостаточность глюкокортикоидов усугубляет водно-электро
литные сдвиги и гипотонию, происходят глубокие изменения уГЛС'
водного обмена: повышается чувствительность к инсулину, ослабс
вают процессы глюконеогенеза, в результате появляется тенденция
к гипогликемии; угнетается синтез белка, снижается активное 1Ь
ферментов, тормозится эритро- и лейкопоэз (количество лимфоцитои
увеличено).
10.5. Функциональное состояние надпочечников 549
Снижение продукции половых гормонов приводит к ослабле¬
нию анаболических процессов, особенно в мышцах (гипоплазия
II атрофия), нарушению половых функций (импотенция), наруше¬
нию менструального цикла.
При выраженной декомпенсации состояния больных с хрони¬
ческой надпочечниковой^ недостаточностью (в результате стресса,
острой инфекции, хирургического вмешательства) может возник¬
нуть острая надпочечниковая недостаточность — аддисонический
криз. Он развивается в течение нескольких суток или даже часов.
Наиболее частыми лабораторными признаками первичной над¬
почечниковой недостаточности являются гипонатриемия и гипер¬
калиемия. У больных может также развиваться нормоцитарная
нормохромная анемия, а в мазках периферической крови обнару¬
живают эозинофилию и лимфоцитоз.
Гормональная диагностика первичной надпочечниковой недо¬
статочности основана на определении в крови гормонов гипота-
мамо-гипофизарно-надпочечниковой оси. При первичной недо¬
статочности коры надпочечников уровень АКТГ в крови повышен
II 2—3 раза и более, а уровень кортизола снижен. Для первичной
надпочечниковой недостаточности характерно и снижение кон¬
центрации альдостерона в крови.
Вторичная и третичная надпочечниковая недостаточность воз¬
никают в результате поражения гипоталамуса или гипофиза
с последующим снижением продукции АКТГ. Так как АКТГ
секретируется слабо, надпочечники не получают адекватного
количества стимулов и перестают синтезировать глюкокортико-
нды. Постепенно развивается гипоплазия или атрофия коры над¬
почечников. Обычно вторичная надпочечниковая недостаточ¬
ность бывает врожденного или аутоиммунного происхождения.
Наиболее частой причиной третичной недостаточности надпо¬
чечников является длительное использование подавляющих доз
мюкокортикоидов в лечении воспалительных или ревматичес¬
ких заболеваний. Вторичная и третичная надпочечниковая недо¬
статочность часто сочетается с гипотиреозом, гипогонадизмом, а
у молодых лиц — с отставанием в росте (следствие недостаточной
секреции гормона роста).
Содержание АКТГ в крови при вторичной надпочечниковой
недостаточности снижено в отличие от первичной. Одновременно
определяются низкие концентрации кортизола в крови.
550 Глава 10. Гормональные исследовани и
10.5.4.3. Адреногеиитальный синдром
В основе адреногенитального синдрома лежит наследственный
дефицит различных ферментов, участвующих в биосинтезе стеро
идных гормонов. Различают несколько форм адреногенитальнот
синдрома, клинические проявления которых зависят от дефицит
конкретного фермента: 21-гидроксилазы, 1 lß-гидроксилазы, 3ß-0Kcii
дегидрогеназы, P450SCC (20,22-десполаза), 17-гидроксилазы (см. схе¬
му 10.2). Общим для всех форм адреногенитального синдрома являє i
ся нарушение синтеза кортизола, регулирующего секрецию АКТГ ік»
принципу механизма отрицательной обратной связи.
Снижение содержания кортизола в крови способствует усиленно
му выделению передней долей гипофиза АКТГ, что ведет к гиперфуп
кции надпочечников, их гиперплазии и увеличению секреции сто
роидных предшественников, из которых синтезируются андрогены
Однако большое количество андрогенов не в состоянии по принципу
обратной связи уменьшить выделение гипофизом АКТГ. В результаю
в коре надпочечников накапливается избыточное количество 17-ОПГ,
как из-за недостаточного его превращения в кортизол, так и велело
твие усиленного его образования.
Наиболее часто (80-95% случаев) обнаруживается недостаточное 11.
21-гидроксилазы, которая необходима для превращения 17-ОНР м
11-дезоксикортизол и далее в кортизол. У каждой 3-й больной с этим
типом энзимного дефекта наблюдаются грубые нарушения синтези
кортизола и недостаточный синтез альдостерона. Клинически это
выражается в синдроме потери соли. Организм не способен удержи
вать натрий, в результате чего наступают потеря его с мочой, дегил
ратация, коллапс. Смерть больных детей обычно наступает в первые
недели жизни.
Пренатальная диагностика основана на определении уровня
17-ОНР в амниотической жидкости, так как надпочечники плоли
начинают функционировать на 3-м месяце внутриутробного разви
тия. Постнатальная диагностика основана на определении содор
жания 17-ОНР в крови новорожденного. Высокий уровень 17-011Р
в крови или амниотической жидкости свидетельствует о наличии у
больного АГС.
Менее тяжелая форма недостаточности 21-гидроксилазы (неклао
сическая форма адреногенитального синдрома) имеет более поздние
клинические проявления — в период полового созревания или по і
днее. При этой клинической форме заболевания повышение уровня
I
10.6. функциональное состояние репродуктивной системы 551
17-ОНР в крови не столь выражено, как при классической форме, а
иногда вообще отсутствует.
10.6. ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
РЕПРОДУКТИВНОЙ СИСТЕМЫ
Репродуктивная система характеризуется только ей присущей
(функцией — обеспечением репродуктивного процесса (вынашива¬
ние и рождение ребенка). Она состоит из конкретных структурных
»лементов: определенных структур гипоталамуса и гипофиза, гонад
(яичников у женщин и яичек у мужчин), органов-мишеней (маточ¬
ные трубы, матка и др.). Элементы репродуктивной системы связаны
между собой гормональной регуляцией, что позволяет ей функциони¬
ровать как единое целое.
Гормональные механизмы регуляции репродуктивной системы
сложны. Они включают гипоталамус, синтезирующий и секретирую-
1НИЙ ГРГ, который стимулирует продукцию двух гормонов гипофиза —
л г и ФСГ, оказывающих стимулирующее воздействие на гонады.
Гонады в ответ вырабатывают половые гормоны, которые оказывают
юрмозящее влияние на секрецию гонадотропных гормонов. Таким
образом, гормональные механизмы регуляции репродуктивной сис¬
темы обеспечивают состояние физиологического равновесия между
юнадотропинами плазмы и половыми стероидами.
10.6.1. ГОРМОНЫ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Важнейшая роль в регуляции репродуктивной системы отводится
юрмонам. Гормоны репродуктивной системы классифицируются по
их химическому строению и месту секреции. Точное определение
концентрации этих гормонов в биологических жидкостях человека
имеет важное значение для оценки функционального состояния
I ормональных систем регуляции репродуктивной системы и диагнос-
1ИКИ заболеваний, вызывающих их нарушения. Определение содер¬
жания гормонов широко используется для установления причин как
женского, так и мужского бесплодия, при которых во многих случаях
на первом месте стоит нарушение гормональной регуляции.
552 Глава 10. Гормональные исследована м
Классификация гормонов репродуктивной системы по месту синте иі
Гипоталамус: ГРГ, ПРГ, гонадотропин-рилизинг-ингибирую
щий гормон (ГРИГ), пролактин-рилизинг-ингибнрующий гормон
(ПРИГ).
Гипофиз: ЛГ (лютропин), ФСГ (фоллитропин), пролактин.
Яичники: эстрогены, гестагены, андрогены.
Плацента: эстрогены, гестагены, хорионический гонадотропин
(ХГ), пролактин.
Семенники: андрогены.
Кора надпочечников: андрогены, эстрогены.
Рассмотрим отдельные группы гормонов по их происхождению,
химической природе и физиологическим функциям.
10.6.1.1. Гонадотропин-рилизинг-гормон и гонадотропины
Гонадотропин-рилизинг гормон, называемый также гонадолибери
ном, представляет собой полипептид, который синтезируется в клеї
ках гипоталамуса. В передней доле гипофиза ГРГ стимулирует син го»
и освобождение Л Г и ФСГ. Органом-мишенью ГРГ является передняя
доля гипофиза.
Гонадотропины — ФСГ и ЛГ — являются гликопротеинами, секро
тируемыми клетками передней доли гипофиза под действием гипо
таламического рилизинг-фактора. Органами-мишенями являются
гонады (яичники у женщин и яички у мужчин). Регуляция секреции
ФСГ и ЛГ осуществляется по типу отрицательной обратной связи. У
мужчин высокий уровень тестостерона в крови угнетаетсекрецию л I,
Регуляция секреции гонадотропинов у женщин гораздо сложнее (см.
раздел 10.6.2). В течение менструального цикла у женщин концентра
ция гормонов в крови изменяется. Менструальный цикл продолжает
ся 28±4дня и имеет три фазы;
фолликул и новую (фолликулярную), которая включает все ста
дии созревания фолликула; фазу овуляции; лютеиновую, т.е. стадию
цикла, продолжающуюся от овуляции до момента децидуации эндо
метрия и таким образом отражающую полный период жизни желтою
тела. Началом менструального цикла считается первый день менстру
ального кровотечения.
Фолликулостимулирующий гормон является пептидным гормоном,
выделяемым передней долей гипофиза, у женщин ФСГ контролируем
рост фолликулов до наступления их зрелости и готовности к овуля
ции. Совместное действие ФСГ иЛГстимулирует синтез гранулезны¬
10.6. функциональное состояние репродуктивной системы
553
ми клетками фолликулов эстрадиола. У мужчин ФСГ контролирует
рост и функцию семенных канальцев, в особенности сперматогенез
и клетках Сертоли. Референтные величины содержания ФСГ в сыво¬
ротке крови в норме представлено в табл. 10-3.
Таблица 10-3.
Референтные величины содержания ФСГ в сыворотке крови
Обследованные
Содержание ФСГ, МЕд/л
Дети младше 11 лет
0,3-6,7
Женщины:
фолликулиновая фаза
1,37-10
(|)аза овуляции
6,17-17,2
лютеиновая фаза
1,09-9,2
период менопаузы
19,3-100,6
Мужчины
1,42-15,4
Ед/л
День менструального цикла
Рис. 10-5. Изменение концентрации ФСГ в течении нормального менстру¬
ального цикла.
Изменение концентрации ФСГ в течении нормального менструально-
10 цикла приведено на рис. 10-5. В начале менструального цикла уровень
ФСГ выше, чем в заключительных стадиях. Пик концентрации гормона
наблюдается в середине цикла одновременно с овуляторным пиком Л Г.
IІОСЛЄ овуляции уровень ФСГ падает и вновь достигает значений, наблю¬
даемых в ранних стадиях фолликулиновой фазы к концу цикла.
554
Глава 10. Гормональные исследования
Лютеинизирующий гормон — пептидный гормон передней доли
гипофиза. Мишенями ЛГ у женшин являются клетки оболочки яич
ника и желтое тело. ЛГ стимулирует овуляцию и активирует в клетках
яичников синтез эстрогенов и прогестерона. Он активирует синтс і
тестостерона в клетках Лейдига семенников у мужчин. Референтиі.іс
величины содержания ЛГ в крови приведены втабл. 10-4.
Таблица 10-4
Референтные величины содержания ЛГ в крови
Возрастная группа
Содержание ЛГ, МЕд/л
Дети младше 11 лет
0,03-3,9
Женщины:
фолликулиновая фаза
1,68-15
фаза овуляции
21,9-56,6
лютеиновая фаза
0,61-16,3
период менопаузы
14,2-52,3
Мужчины
1,24-7,8
Ед/л
День менструального цикла
Рис. 10-6. Изменение концентрации ЛГ в течении нормального менструаль
ного цикла
Изменение концентрации Л Г в течении нормального менструальною
цикла приведено на рис. 10-6. Здесь уровень Л Г остается низким, за исключс*
нием его подъема в середине цикла. Овуляция происходит примерно 12—20 ч
спустя после достижения максимальной концентрации Л Г.
10.6. функциональное состояние репродуктивной системы
555
Пролактин — гормон передней доли гипофиза. Его синтез и высво¬
бождение находятся под стимуляционно-ингибиторным влиянием
гипоталамуса. Гормон секретируется эпизодически. Органом-мише¬
нью для пролактина является молочная железа, развитие и дифферен¬
циация которой стимулируются этим гормоном. Во время беременнос¬
ти концентрация пролактина повышается под влиянием усиленного
образования эстрогена и прогестерона. Стимулирующее воздействие
пролактина на молочную железу приводит к послеродовой лактации.
Концентрация пролактина в крови увеличивается во время сна, физи¬
ческих упражнений, гипогликемии, лактации, беременности.
Высокие концентрации пролактина оказывают ингибирующее
действие на синтез половых гормонов в яичниках, образование и
секрецию ФСГ и ЛГ гипофизом. У мужчин функция его неизвестна.
Референтные величины концентрации пролактина в сыворотке крови
представлены в табл. 10-5.
Таблица 10-5.
Референтные величины концентрации пролактина в сыворотке крови
Возрастная группа
Концентрация пролактина, мМЕ/л
Дети до 10 лет
91-526
Женщины
61-512
Беременные:
12 нед
500-2000
12-28 нед
2000-6000
29-40 нед
4000-10 000
Мужчины
58-475
Повышение концентрации пролактина (гиперпролактинемия) в
крови (у мужчин и женщин) является главной причиной нарушений
репродуктивной функции. Исследование пролактина используют в кли¬
нической практике при нерегулярных менструальных циклах, гиперпро-
лактинемической аменорее (отсутствии менструаций), гинекомастии и
шооспермии (полное отсутствие сперматозоидов в семенной жидкости).
Пролактин определяют также при подозрении на опухоли гипофиза.
При определении концентрации пролактина следует помнить, что она
чависит от времени взятия крови, так как секреция пролактина происхо¬
дит эпизодически и подчиняется 24-часовому циклу. Выделение пролак-
556
Глава 10. Гормональные исследования
тина физиологически стимулируется грудным кормлением и стрессом.
Кроме того, повышение концентрации пролактина в сыворотке вызыва¬
ют дибензодиазепины, фенотиазин, ТРГ и эстрогены. Секрецию пролак¬
тина подавляют производные дофамина, Ь-ДОФ и эрготамина.
10.6.1.2. Половые стероиды
По биологическому действию, атакже последовательности и коли
честву углеродных атомов (18, 19, 21) в молекулах половые стероиды
делятся на три основные группы:
• С13 — эстрогены с основным представителем — эстрадиолом;
• С|9 — андрогены с основным представителем — тестостероном;
• С21 — гестагены с основным представителем — прогестероном.
У женщин местом синтеза наиболее важных половых стероидов
(т.е. эстрогенов, гестагенов и андрогенов) являются яичники и корв
надпочечников, а во время беременности — плацента. Половые сто
роиды у мужчин — это андрогены, которые синтезируются в яичках
и в небольшом количестве в коре надпочечников. Биосинтез половых
стероидов в яичниках и яичках представлен на схеме 10-3.
Схема Ю-З
Биосинтез половых стероидов
10.6. функциональное состояние репродуктивной системы
557
Все половые стероиды и гормоны коры надпочечников являются
производными холестерина. Стероиды липофильны, что означает
их низкую способность растворяться в воде, поэтому в крови 95%
стероидных гормонов находится в связанном состоянии со специфи¬
ческими транспортными белками. С помощью транспортных белков
юрмоны переносятся к своим органам-мишеням. Только свободные,
не связанные с белком стероиды являются биологически активными.
Стероидсвязывающий глобулин специфично связывает эстрадиол и
андрогены, в то время как кортикостероидсвязываюший глобулин
соединяет прогестерон и глюкокортикоиды. Помимо своей транспорт¬
ной функции, гормонсвязывающие белки защищают стероиды от мета-
Гюлической инактивации по пути от секретирующей железы к органу-
мишени. Рассмотрим три основные группы половых стероидов.
Эстрогены. Главным представителем эстрогенов является эст¬
радиол, который обладает наивысшей биологической активностью.
Эстрадиол продуцируются в основном гранулезными клетками яич¬
ника. Секреция эстрогенов усиливается в ответ на выход ФСГ из
1ипофиза. В гипоталамусе и гонадотрофах передней доли гипофиза
иозросший уровень эстрадиола в крови подавляет секрецию ГРГ и
<1)СГ. Определение концентрации эстрадиола необходимо для оценки
(|>ункции яичников. Референтные величины концентрации эстрадио¬
ла в крови приведены в табл. 10-6.
Таблица 10.6.
Референтные величины концентрации эстрадиола в сыворотке крови
Возрастная группа
Концентрация эстрадиола, пг/мл
Дети младше 11 лет
Менее 15
Женщины:
(|)олликулиновая фаза
20-350
(1>аза овуляции
150-750
лютеиновая фаза
30-450
период менопаузы
Менее 20
Мужчины
10-50
Достоверных подтверждений наличия секреции эстрогенов у муж¬
чин не обнаружено, обычно они образуются из тестостерона.
Органами-мишенями эстрогенов у женщин являются матка, вла¬
галище, вульва, фаллопиевы трубы и молочные железы. Эстрогены
558
Глава 10. Гормональные исследования
отвечают за развитие вторичных половых признаков и определи
ют характерные физические и психические особенности женщин
Эстрогены вызывают закрытие эпифизарных точек роста.
Изменение концентрации эстрадиола в течении нормального менстру¬
ального цикла приведено на рис. 10-7. Уровень эстрадиола остается ни »
КИМ в начале и середине фолликул и новой фазы менструального цикла.
За 3—5 дней до пика Л Г уровень эстрадиола начинает расти и достигаем
максимальных значений примерно за 12 ч до пика Л Г. После резкою
падения до наименьших значений, наблюдаемых спустя 48 ч после пики
Л Г, уровень эстрадиола начинает снова подниматься. Максимальная
концентрация гормона достигается на 9-й день после овуляции и затем, к
концу цикла, вновь падает по мере атрезии желтого тела.
пг/мл
День менструального цикла
Рис. 10-7. Изменение концентрации эстрадиола в течении нормального мене
труального цикла
При заболеваниях уровень эстрадиола в крови может быть снижен,
повышен или неизменен. Низкий уровень эстрадиола наблюдается
при заболеваниях гипоталамуса или гипофиза, высокий — при эстро-
генсекретирующих опухолях или фолликулярных кистах яичникои
в таких случаях избыток эстрадиола подавляет секрецию Л Г и ФСГ,
приводя к ановуляции.
Гестагены. Гестагены продуцируются в яичниках, яичках, коре нал
почечников, а во время беременности — в плаценте. Действие гестагеном
направлено на осуществление нормальной репродуктивной функции
организма. Основным представителем гестагенов является прогестерон.
10.6. функциональное состояние репродуктивной системы
559
Прогестерон — женский стероидный гормон, который способс¬
твует пролиферации слизистой оболочки матки, облегчает имп¬
лантацию оплодотворенного яйца. Синтезируется желтым телом.
После оплодотворения главным его источником становится плацента.
Концентрацию прогестерона в крови измеряют с целью подтверж¬
дения или исключения овуляции во время менструального цикла.
Референтные величины концентрации прогестерона в сыворотке
представлены втабл. 10-7.
Таблица 10-7
Референтные величины концентрации прогестерона в сыворотке крови
Обследованные
Концентрация прогестерон, нмоль/л
Женщины:
фолликулиновая фаза
0,5-2,2
фаза овуляции
3,1-7,1
лютеиновая фаза
6,4-79,5
период менопаузы
0,06-1,3
Беременные:
9-16 нед
32,6-139,9
16-18 нед
62,0-262,4
28-30 нед
206,7-728,2
предродовой период
485,8-1104
Мужчины
0,4-3,1
Главным органом-мишенью прогестерона является матка. Гормон
вызывает секреторную трансформацию пролиферативно утолщенно¬
го эндометрия, тем самым обеспечивая его готовность к имплантации
оплодотворенной яйцеклетки. Более того, прогестерон выполняет
важную контрольную функцию в системе гонадотропины—гонадные
стероиды и вызывает стимуляцию теплового центра. Это сопровож¬
дается повышением температуры тела на 0,5 °С в лютей новую фазу
менструального цикла после овуляции.
Изменение концентрации прогестерона в течении нормального
менструального цикла представлено на рис. 10-8. До момента окон¬
чания пика ЛГ концентрация прогестерона остается крайне низкой.
Параллельно с эстрадиолом уровень прогестерона начинает подни¬
маться во второй половине цикла. Это означает, что лютеинизация
560
Глава 10. Гормональные исследования
завершена. К концу цикла концентрация прогестерона снова падаеч
и достигает значений первой, фолликул и новой, фазы, в которой воз¬
действие желтого тела практически отсутствует. Данное резкое падение
концентрации прогестерона вызывает менструальное кровотечение.
мкг/л
День менструального цикла
Рис. 10-8. Изменение концентрации прогестерона в течение нормального
менструального цикла
Андрогены. Главными представителями андрогенов в женском орга
низме являются тестостерон, андростендион и ДГЭС-С. Андрогены
стимулируют рост волос на лобке и в подмышечных впадинах, повы¬
шают либидо (половое влечение) и оказывают влияние на размер кли¬
тора и больших половых губ.
У мужчин главными представителями андрогенов являются тес-^
тостером и д и гидротестостерон (ДГТ). Большая часть тестостерона
в сыворотке связана стероидсвязывающим глобулином (около 60%).
Доля свободного тестостерона составляет 1-3%, а доля тестостерона,
связанного с альбумином, — около 40%, В органы-мишени (простата,
семенные пузырьки и кожа) может проникать только свободный тес¬
тостерон и тестостерон, связанный с альбумином. Достигнув орга
на-мишени и проникнув внутрь клеток, тестостерон превращается
в ДГТ (основное количество образуется в предстательной железе), и
только после этого ДГТ оказывает биологическое действие. В других
органах-мишенях, таких как мышцы и почки, андрогены действую!
напрямую.
10.6. функциональное состояние репродуктивной системы
561
Тестостерон — андрогенный гормон, ответственный за вторичные
половые признаки у мужчин. Важнейшим источником тестостерона
являются клетки Лейдига семенников. Тестостерон поддерживает
сперматогенез, стимулирует рост и функционирование добавочных
половых желез, а также развитие полового члена и мошонки. Гормон
оказывает анаболическое действие, главным образом на кости и
мышцы. За счет непосредственного воздействия на костный мозг, а
также путем активации синтеза эритропоэтина в почках тестостерон
стимулирует эритропоэз. Гормон также необходим для поддержания
либидо и потенции. Синтез тестостерона контролируется ЛГ передней
доли гипофиза. У мужчин это главный андроген, обусловливающий
достижение половой зрелости. Концентрация гормона в крови увели¬
чивается после физической нагрузки. Референтные величины концен¬
трации тестостерона в сыворотке крови приведены в табл. 10-8.
Таблица /0.8.
Референтные величины концентрации тестостерона в сыворотке
Возрастная группа
Пол
Концентрация
тестостерона
нг/дл
нмоль/л
Новорожденные
м.
75-400
2,6-13,9
Ж.
20-64
0,69-2,22
Препубертатный возраст:
1-5 мес
М.
1-177
0,03-6,14
Ж.
1-5
0,03-0,17
6-11 мес
М.
2-7
0,07-0,24
Ж.
2-5
0,07-0,17
1-5 лет
м.
2-25
0,07-0,87
ж.
2-10
0,07-0,35
6-9 лет
м.
3-30
0,10-1,04
ж.
2-20
0,07-0,69
Пубертатный возраст:
1-я возрастная группа
м.
2-23
0,07-0,80
ж.
2-10
0,07-0,35
2-я возрастная группа
м.
5-70
0,17-2,43
562
Глава 10. Гормональные исследования
Окончание таблицы 10.8
Ж.
5-30
0,17-1,04
3-я возрастная группа
М.
15-280 •
0,52-9,72
Ж.
10-30
0,35-1,04
4-я возрастная группа
М.
105-545
3,64-18,91
Ж.
15-40
0,52-1,39
5-я возрастная группа
М.
265-800
9,19-27,76
Ж.
10-40
0,35-1,39
Взрослые:
М.
280-1100
8,72-38,17
Ж.
15-70
0,52-2,43
Беременные
3-4-кратный уровень взрослых
Постменопауза
8-35
0,28-1,22
10.6.2. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ МЕНСТРУАЛЬНОГО ЦИКЛА
Менструальный цикл — это повторяющееся выражение деятель
ности системы гипоталамус—гипофиз—яичники, которое вызывас!
структурные и функциональные изменения репродуктивного тракта:
матки, маточных труб, эндометрия, влагалища. Каждый цикл закап
чивается менструальным кровотечением, 1-й день которого считается
началом цикла.
Во время первой, фолликулиновой, фазы менструального цикла ФСІ.
секретируемый передней долей гипофиза, стимулирует продукцию эст
радиола гранулезными клетками яичника. ФСГ и эстрадиол вызываю!
пролиферацию этих клеток, и секреция эстрадиола увеличивается. Эти
гормоны стимулируют Л Г-рецепторы. Эстрадиол действует на зндоме ї
рий матки, вызывая его утолщение и васкуляризацию, тем самым готови і
его к имплантации яйцеклетки. По мере созревания фолликулов в них и в
крови увеличивается уровень ингибина, который оказывает селективно
ингибирующее действие на секрецию ФСГ.
П ик эстрадиола, приходящийся на середину менструального цикла
(14-й день), запускает волну выброса Л Г из гипофиза. Л Г стимул иру
ет овуляцию (выход зрелой яйцеклетки из фолликула). Оставшиеся
клетки в постовуляторном фолликуле формируют желтое тело, кото
рое начинает секретировать прогестерон и эстрадиол.
10.6. функциональное состояние репродуктивной системы
563
Во время лютеиновой фазы прогестерон совместно с эстрадиолом
заставляет эндометрий еще больше утолщаться. Происходят усилен¬
ная васкуляризация клеток эндометрия и их дифференцировка, клет¬
ки становятся секреторными.
Приблизительно через неделю с момента образования желтое
тело начинает обратное развитие и секретирует меньше эстрадиола
и прогестерона. К 28-му днЬ менструального цикла уровень яични¬
ковых стероидов становится неадекватным для поддержания жизни
утолщенного эндометрия, он «сползает» в полость матки и выводится
наружу. Этот выход крови из влагалища называется менструацией.
Кровотечение длится 3—5 дней. Низкие уровни эстрадиола и прогес¬
терона в конце цикла снимают (по принципу отрицательной обратной
связи) ингибирование секреции гипоталамусом ГРГ. Уровень ГРГ в
гипоталамусе повышается, стимулирует секрецию ФСГ и Л Г гипофи¬
зом, и менструальный цикл начинается вновь. Гормональная регуля¬
ция менструального цикла приведена на рис. 10-9.
Овуляция
Рис. 10-9. Гормональная регуляция менструального цикла
564 Глава 10. Гормональные исследования
10.6.3. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ СПЕРМАТОГЕНЕЗА
У мужских половых желез (яички, семенники) есть две главные
функции: синтез и секреция мужских половых гор'монов (андроге¬
нов); сперматогенез, т.е. образование и развитие сперматозоидов.
Андрогены необходимы не только для сперматогенеза и созревания
спермы, но и для контроля роста и функции семенных везикул и про¬
статы. При этом достаточный уровень тестостерона — необходимое
условие нормальных либидо и половой потенции мужчины.
ГРГ секретируется эпизодически в течение дня клетками гипота¬
ламуса. Он стимулирует переднюю долю гипофиза, которая в отвеч
секретирует ЛГ и ФСГ. Л Г действует на клетки Лейдига в яичках,
стимулируя в них продукцию и секрецию тестостерона. Тестостерон
проходит в клетки Сертоли яичек, где способствует сперматогенезу и
сперматогониях.
у половозрелых мужчин ФСГ способствует началу сперматогенеза.
Гормон присоединяется к рецепторам плазматической мембраны кле¬
ток Сертоли, которые находятся на базальной мембране семявынося-
щих канальцев яичек. Клетки Сертоли отвечают на стимуляцию ФС1
продукцией белков, которые ускоряют созревание сперматогоний в
канальцах. Если процесс сперматогенеза запущен, то для его подде¬
ржания достаточно одного тестостерона.
10.6.4. ПРИЧИНЫ НАРУШЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ
У ЖЕНЩИН
Аменорея является одной из основных причин нарушения репро¬
дуктивной функции у женщин. Аменорея — полная утрата менстру¬
аций. Она занимает одно из первых мест в структуре многообразных
нарушений менструального цикла. Частота ее высока — 3,3% от числа
всех женщин репродуктивного возраста. Аменорея является наиболее
тяжелой формой патологии менструального цикла.
Аменорею принято делить на первичную и вторичную. К первич¬
ной аменорее относят те случаи, когда у женщин репродуктивного
возраста никогда не было самостоятельных менструаций. Отсутствие
менструаций у девушек после 15 лет следует расценивать как пер¬
вичную аменорею. Первичная аменорея встречается сравнительно
редко и вызвана недоразвитостью или анатомическими врожденны¬
10.6. функциональное состояние репродуктивной системы 565
ми дефектами половых органов, сниженной функцией гипофиза или
щитовидной железы, гиперплазией надпочечников (адреногениталь-
иый синдром).
Под термином «вторичная аменорея» понимается отсутствие у жен¬
щины менструации в течение 6 мес и более, ВТО время как до развития
данного состояния они были более или менее регулярными. Прежде
нсего в таких случаях должны быть исключены физиологические
причины аменореи — беременность, постменопауза. Патологическая
пторичная аменорея в большинстве случаев имеет функциональную
природу.
Причинами первичной аменореи могут быть анатомические дефек¬
ты развития яичников и органов репродуктивного тракта: матки,
маточных труб, эндометрия, влагалища. В зависимости от типа
анатомического дефекта развития страдает и секрекция гормонов
гипоталамусом, гипофизом и яичниками. Если произошла остановка
развития яичников в период внутриутробного развития или возникло
их повреждение вследствие лучевой терапии, химиотерапии, хирур¬
гических операций в детском возрасте, то уровень эстрадиола в крови
резко снижен или вообще не определяется. Одновременно отмечается
аысокий уровень ФСГ, Л Г (отсутствует тормозящее влияние эстра¬
диола на их продукцию). При опухолях яичников аменорея развива¬
ется вследствие повышенной секреции опухолью половых гормонов
(чаще всего андрогенов). Данная форма первичной аменореи характе¬
ризуется повышенным уровнем тестостерона в крови.
Причиной первичной аменореи может быть задержка полового
развития. О ней следует говорить при отсутствии признаков полового
созревания (формирование молочных желез, рост волос на лобке и в
подмышечных впадинах) до 14-летнего возраста. Причиной данно¬
го состояния являются особенности конституциального развития
(позднее развитие), хронические нарушения питания, а также редко
истречающиеся заболевания центральной нервной системы. У таких
пациенток при лабораторном обследовании выявляют сниженный
уровень ФСГ иЛГ в крови.
Первичная яичниковая недостаточность может быть следствием
хромосомных заболеваний. Наиболее часто встречается синдром
Шерешевского—Тернера — врожденное заболевание, обусловленное
отсутствием одной Х-хромосомы. Для больных характерны низ-
корослость, вторичные половые признаки у них не развиваются, в
некоторых случаях отмечается рост грудных желез и даже появление
566
Глава 10. Гормональные исследования
менструаций. Яичники неразвиты, содержат только соединитель
ную ткань; изредка обнаруживают отдельные половые клетки, что
объясняет частичное половое созревание. Уровень гонадотропинов и
крови, особенно ФСГ, обычно выше, чем у сверстников, даже в ран
нем возрасте. При подозрении на синдром Шерешевского—Тернера
обязательно следует провести анализ хромосом.
Причины вторичной аменореи классифицируют по 4 уровням
(рис. 10-10):
• уровень I — выводящий тракт (матка, шейка матки, влагалище);
• уровень II — яичники (развитие фолликула);
• уровень III — передняя доля гипофиза (продукция гонадотропн
нов, пролактина, ТТГ и их секреция);
• уровень IV — центральная нервная система и гипоталамус (про¬
дукция и секреция ГРГ).
Уровень IV
Центральная
нервная система
Г ипоталамус
ГРГ
ТРГ
Стресс
Изменения массы тела
Психологические
проблемы
Физическая нагрузка
Уровень I
Передняя доля
гипофиза
т
ТТГ. ФСГ. ЛГ
Пролактин
1
Опухоль гипофиза
Недостаточность гипофиза
Синдром Шихена
Г ипотиреоз
Уровень I
Яичники
Эстрогены
Прогестерон
Андрогены
Перименопаузальные
женщины
Синдром поликистозных
яичников
Повреждение яичников
(недостаточность яичников)
Опухоли яичников
Сахарный диабет
Уровень 1
Выво/:
тра
матка,
матки, вг
t
1ЯЩИЙ
1кт;
шейка
іагалище
Аномалии мюллеровых
желез
Деструкция эндометрия при
синдроме Ашермана
Синдром Ашермана
Рис. 10-10. Классификация этиологических факторов аменореи по уровням
10.6. функциональное состояние репродуктивной системы 567
Основной причиной вторичной аменореи являются нарушения на
1’ипоталамическом уровне. В основе таких нарушений лежит изменение
частоты и амплитуды импульсов высвобождения ГРГ, что влечет за собой
недостаточность или полное отсутствие пиков ЛГ. Гипоталамический
уровень поражения при вторичной аменорее может быть обусловлен
ирожденной гипоплазией или дефектом гипоталамуса, следствием пере¬
несенных нейроинфекций, тфавм головы, кровоизлияний.
Ведущее место среди гипофизарных причин вторичной аменореи
занимает аменорея, обусловленная повышенной продукцией пролак-
гина (гиперпролактинемическая аменорея). Под гиперпролактине-
мией понимают состояние, при котором уровень пролактина в сыво¬
ротке крови превышает 512 мМЕ/л. Аменорея отмечается у 30—70%
больных с гиперпролактинемией. Кроме нарушений менструального
цикла любой степени выраженности, включая аменорею, гиперпро-
лактинемия в 30-60% случаев сопровождается лактореей (выделение
молочной жидкости из грудных желез).
Хроническая гиперпролактинемия нарушает циклическое выде¬
ление ГРГ, а следовательно, и гонадотропинов (ФСГ и Л Г), уменьшает
частоту и амплитуду секреторных пиков Л Г, ингибирует действие гона¬
дотропинов на яичники, что способствует формированию синдрома
гипогонадизма. В результате гипофункции яичников развиваются
аменорея и бесплодие.
Основным в диагностике синдрома гиперпролактинемии является
определение уровня пролактина в крови. Для синдрома гиперпролакти¬
немии характерно повышение уровня пролактина в крови. Даже неболь¬
шое его возрастание (450-750 мМЕ/л) может быть причиной недостаточ¬
ности яичников, ановуляторных циклов и бесплодия. Повышение уровня
пролактина до 3000 мМЕ/л вызывается преимущественно функцио¬
нальными причинами и чаще характерно для гиперпролактинемии при
синдроме «пустого турецкого седла», гормонально-неактивной опухоли
гипофиза. Уровень выше 3000 мМЕ/л характерен для гиперпролактине¬
мии, обусловленной опухолью гипофиза (пролактинома).
В диагностике гиперпролактинемии при уровне пролактина в
крови более 3000 мМЕ/л информативно даже однократное его опреде¬
ление, при меньшем уровне (до 1000 мМЕ/л) рекомендуется 3-5-крат-
мое исследование.
Недостаточность гипофиза, ведущая к аменорее, может быть следс¬
твием повреждения соседних с гипофизом тканей аневризмой сонной
артерии, закупоркой сильвиева водопровода или ишемией, как это
568 Глава 10. Гормональные исследовани и
бывает при синдроме Шихена. Синдром Шихена является следствием
послеродового сосудистого инфаркта гипофиза.
Такие эндокринные заболевания и состояния, как гипотиреоз,
сахарный диабет, выраженный избыток или недостаток массы тела
нередко приводят к развитию вторичной аменореи.
Синдром поликистозных яичников (синдром Штейна—Левен
таля) — еще одна причина вторичной аменореи. Синдром обнаружн
вается у 3—5% женщин репродуктивного возраста. В основе синдрома
поликистозных яичников лежит первичный, генетически обусловлен
ный дефицит ферментов яичников. Чаще всего имеется генетически!!
дефект фермента 19-гидроксилазы. Недостаточность этого фермета
блокирует превращение андрогенных предшественников в эстрогены
В результате в яичниках накапливается тестостерон, а продукция эсч
рогенов резко снижается. Низкая концентрация эстрадиола влечет за
собой увеличение высвобождения Л Г в гипоталамусе, а высвобожден НС
ФСГ блокируется высокой концентрацией тестостерона. Вследствие
снижения уровня секреции ФСГ клетки фолликулов яичников полу
чают слабую стимуляцию, что ведет к недостаточности эстрадиола
в сочетании со стимуляцией продукции андрогенов клетками внуI
ренней оболочки стенки фолликула, обусловленной относительным
повышением уровня л г. Данный дисбаланс эстрадиола и андрогенов м
пользу андрогенов тормозит рост фолликулов. Повышенный уровеш.
андрогенов провоцирует развитие прогрессивного фиброза капсулы
яичников, что приводит к поликистозу. в крови выявляется увели
чение уровня тестостерона и Л Г. Концентрация эстрадиола в крови
больных с синдромом поликистозных яичников снижена.
Дисфункция яичников возникает у перименопаузальных женщин
и характеризуется повышенным уровнем гонадотропинов в крови.
Обычно у женщин перед наступлением менопаузы в крови повышен
уровень ФСГ при нормальном— Л Г. Повышенный уровень ФСГ необ
ходим для стимуляции немногих оставшихся фолликулов, у которых
снизилась эстрогенпродуцирующая способность. Дисфункция яич¬
ников почти всегда необратима. В редких случаях терапия эстрогена
ми позволяет восстановить активность яичников.
Недостаточность яичников при редком синдроме резистентных
яичников обусловлена нечувствительностью рецепторов на клетках
яичников к гонадотропным гормонам. В основе синдрома лежат гене
тические дефекты рецепторов ЛГ и ФСГ либо появление аутоантител,
блокирующих рецепторы, в крови выявляют высокие концетрацин
10.6. функциональное состояние репродуктивной системы 569
юнадотропинов, которые необходимы для того, чтобы вызвать рост
(|юлликулов.
Преждевременная недостаточность яичников возникает как пос¬
ледствие инфекции, облучения, химиотерапии или наличия аутоан-
гител к антигенам стероидных клеток яичников.
10.6.5. КЛИМАКТЕРИЧЕСКИЙ СИНДРОМ
Менопауза — это период жизни, когда вслед за утратой функции
яичников полностью прекращаются менструации. Перименопауза
представляет собой период непосредственно до и после наступления
менопаузы. Климактерий — это более широкое понятие, обозначаю¬
щее период, в течение которого женщина утрачивает свою репродук¬
тивную способность и вступает в период постменопаузы, когда пре¬
кращают функционировать яичники. Средний возраст наступления
менопаузы у женшин 50-52 года.
После утраты регулярности менструальных циклов в конце непол¬
ноценной лютеиновой фазы или после пика эстрадиола в крови появ¬
ляются вагинальные кровотечения, однако при этом не происходит
овуляции и формирования желтого тела. Наступление менопаузы
свидетельствует об отсутствии фолликулов в яичниках. Уровень ФСГ
при этом повышается в 10-20 раз, ЛГ — в 3 раза, достигая максимума
через 1—3 года после наступления менопаузы. В дальнейшем содер¬
жание обоих гонадотропинов начинает постепенно, но неуклонно
снижаться. Повышение уровня ФСГ и ЛГ в сыворотке крови после
наступления менопаузы свидетельствует о неспособности яичников
синтезировать адекватное количество половых гормонов. Уровень
эстрадиола в крови после наступления менопаузы снижен. В конеч¬
ном счете это приводит к тому, что из-за недостатка эстрогенов утра¬
чиваются вторичные половые признаки.
Понимание закономерностей изменения секреции половых гормо¬
нов имеет важное практическое значение в плане подбора адекватной
юрмонотерапии для устранения негативных последствий гормональ¬
ной недостаточности.
Наиболее ярким проявлением происходящих в организме женщи¬
ны гормональных изменений является климактерический синдром.
Климактерический синдром — это своеобразный клинический
симптомокомплекс, осложняющий течение климактерического пери¬
570 Глава 10. Гормональные исследования
ода и проявляющийся нервнопсихическими, обменно-эндокринны
ми и вегетативными нарушениями.
Исследование гормонального статуса у пациенток с климактерн
ческим сидромом играет важную роль, так как специфическими для
них становятся проблемы, включающие надежную контрацепцию
и борьбу с остеопорозом, возникновение которого обусловливается
эстрогенной недостаточностью (встречается примерно у 30% женщин
в возрасте старше 60 лет), а также нарушениями липидного обмена,
проявляющимися снижением уровня холестерина ЛПВП и повыше
нием уровня холестерина ЛПНП, что способно ускорить развитие ате
росклероза, увеличивающего риск возникновения инфаркта миокар
да и инсульта. Критический уровень эстрадиола в сыворотке крови,
необходимый для поддержания нормального состояния костной
ткани, равен 40—50 пг/мл (146—184 фмоль/л). Благодаря своевремен
ному назначению эстрогенов число переломов лучевой и бедренной
костей можно снизить на 50—60%.
При назначении заместительной терапии эстрогенами необходим
мониторинг уровня эстрадиола. При правильно подобранной док’
лекарственного средства уровень эстрадиола в сыворотке крови дол¬
жен быть в пределах 40—100 пг/мл (150—370 пмоль/л). Уровень ФСГ я
крови не может служить ориентиром при мониторинге доз эстрогена.
10.6.6. ПРИЧИНЫ НАРУШЕНИЯ РЕПРОДУКТИВНОЙ
ФУНКЦИИ у МУЖЧИН
На долю эндокринных нарушений, которые возникают на различ¬
ных уровнях гормональной системы, регулирующей сперматогенез,
приходится 15—30% случаев мужского бесплодия. Следствием эндок¬
ринных нарушений является мужской гипогонадизм, или тестику¬
лярная недостаточность, которая обусловлена снижением уровня анд¬
рогенов в крови с одновременным в большинстве случаев нарушением
сперматогенеза. Клинически гипогонадизм может проявляться недо¬
развитием внутренних или наружных половых органов и вторичных
половых признаков, а также нарушением фертильности (способности
к деторождению) различной степени выраженности или бесплодием.
В зависимости от того, на каком уровне нарушается функциониро¬
вание оси гипоталамус—гипофиз—гонады, выделяют первичный и
вторичный мужской гипогонадизм.
10.6. функциональное состояние репродуктивной системы 571
Первичный гипогонадизм — первичное поражение гонад (яичек),
сопровождается снижением секреции тестостерона и повышением
уровня ФСГ и ЛГ в крови.
Вторичный гипогонадизм — первичное повреждение гипотала¬
мо-гипофизарной системы со снижением секреции ФСГ и ЛГ и, как
следствие, нарушением продук.ции андрогенов и сперматогенеза.
Первичный и вторичный гипогонадизм по своему происхождению
может быть врожденным или приобретенным.
Первичный врожденный гипогонадизм чаще всего обусловлен ана¬
томическими нарушениями развития семенных канальцев, отсутс¬
твием или недоразвитием яичек, аплазией семявыводящих протоков,
нарушением дифференцировки половых органов (мужской псевдо-
термафродизм), а также врожденной недостаточностью ферментов,
обеспечивающих синтез андрогенов (тестостерона).
Вторичный врожденный гипогонадизм встречается редко и обус¬
ловлен анатомическим недоразвитием гипоталамической области
мозга. Такие анамалии сопровождаются нарушением секреции ЛГ и
ФСГ и, как следствие, отсутствием их стимулирующего влияния на
яички и развитием вторичного гипогонадизма.
Первичный приобретенный гипогонадизм связан с повреждением
яичек бактериальными и вирусными инфекциями (наиболее частая
причина — орхит после эпидемического паротита). Травма, облучение
яичек — также нередкая причина развития их недостаточности.
Воспалительные процессы в центральной нервной системе, трав¬
мы с переломом основания черепа, сосудистые аневризмы, синдром
гиперпролактинемии — наиболее частые причины вторичной приоб¬
ретенной недостаточности яичек. В ее основе лежит нарушение сек¬
реции гипоталамусом и гипофизом гонадотропных гормонов (ФСГ
и Л Г). Низкая концентрация в крови ФСГ и Л Г не в состоянии обес¬
печить адекватную стимуляцию синтеза андрогенов (тестостерона)
яичками, что в большинстве случаев приводит к нарушению сперма-
гогенеза.
Гиперпролактинемия занимает одно из важных мест при половых
расстройствах у мужчин. Частота встречаемости гиперпролактине¬
мии у мужчин с нарушением половых функций (снижение либидо
и потенции) составляет от 16 до 40%, при бесплодии — от 1 до 30%.
Это обусловлено тем, что пролактин является гормоном широкого
действия, в том числе и регулятором половой функции у мужчин.
Однако механизм действия и патогенез симптомов при гиперпролак-
572 Глава 10. Гормональные исследования
тинемии у мужчин до сих пор неизвестны. Первое место среди при
чин гиперпролактинемии у мужчин занимают пролактиномы, затем
следуют различные опухоли, которые деформируют ыожку гипофиза
и вызывают функциональную гиперпролактинемию (так называемы 1)
эффект пересеченной ножки гипофиза), — псевдопролактиномы.
Третье место занимает идиопатическая (неустановленного характера)
гиперпролактинемия.
Вторичный приобретенный гипогонадизм может развиться у паци¬
ентов с хроническими системными заболеваниями и интоксикация
ми (уремическая интоксикация).
Гормональные исследования у мужчин при подозрении на нару¬
шение репродуктивных функций назначают обычно только после
получения патологической спермограммы. Целью гормональных
исследований является дифференциальная диагностика между гипо¬
гонадизмом, который обусловлен гипоталамо-гипофизарной недоста
точностью, и гипогонадизмом, связанным с недостаточностью яичек.
Базовая гормональная диагностика включает определение ФСГ, ЛГ,
пролактина и тестостерона.
Глава 11.
БАКТЕРИОЛОГИЧЕСКИЕ
И ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Бактериологические исследования наиболее часто проводят при
подозрении на гнойно-воспалительные заболевания. Основной целью
этих исследований являются установление этиологии (вида возбудите¬
ля) заболевания и определение чувствительности возбудителей к анти¬
бактериальным препаратам. Результаты бактериологических анализов
способствуют выбору наиболее эффективного лекарственного средства
для антибактериальной терапии, своевременному проведению мероп¬
риятий по профилактике внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются
истинно патогенные бактерии, но чаще — условно-патогенные микро¬
организмы, входящие в состав естественной микрофлоры человека или
попадающие в организм извне. Большинство истинно патогенных бак¬
терий способствуют развитию инфекционного заболевания у любого
здорового человека. Условно-патогенные микроорганизмы вызывают
заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызванных
истинно патогенными микроорганизмами, направлены на поиск
определенного возбудителя. Если заболевание вызывается услов¬
но-патогенными микроорганизмами, то целью бактериологических
исследований является выделение всех микроорганизмов, находя¬
щихся в патологическом материале.
Для получения адекватных результатов бактериологического
исследования при гнойно-воспалительных заболеваниях особенно
важно соблюдать ряд требований к взятию биоматериала для анали¬
за, его транспортировке в лабораторию, проведению исследования и
оценке его результатов. Основные требования к взятию различных
видов биоматериала на бактериологические анализы и его доставке
обсуждены в гл.1 и подробно приведены в Приложении 1.
в клинической практике медицинские сестры чаще всего осущест¬
вляют сбор (взятие) биологического материала для бактериологичес¬
кого исследования крови на гемокультуру, посева мокроты, мочи,
кала и отделяемого мочеполовых органов.
574 Глава 11. Бактериологические и паразитологические исследования
11.1. ОБЩИЕ СВЕДЕНИЯ О БАКТЕРИОЛОГИЧЕСКИХ
МЕТОДАХ ИССЛЕДОВАНИЯ
•
Для идентификации вида возбудителя гнойно-воспалительных
заболеваний и определения чувствительности к антибактериальным
препаратам бактериологические лаборатории используют комплекс
методов. Они включают микроскопическое исследование мазка (бак
териоскопия) из доставленного биоматериала, выращивание куль
туры микроорганизмов (культивирование), идентификацию бакте
рий, определение чувствительности к антимикробным препаратам и
оценку результатов исследования. Медицинская сестра должна име і ь
представление о тех процедурах, которые проводятся с биологичес
КИМ материалом в бактериологической лаборатории. Это позволит
ей правильно собирать биоматериал и своевременно доставлять его и
лабораторию для получения объективных результатов анализа.
Биоматериал первоначально подвергается микроскопическому
исследованию.
Микроскопическое исследование мазка (бактериоскопия). Для
исследования берут мазки мокроты, гноя, отделяемого из ран, слизис¬
тых оболочек (мазок из цервикального канала, зева, носа, глаза и т.д.),
окрашенные по Граму (или другими красителями). Результаты мик¬
роскопии позволяют предположительно судить о характере микро¬
флоры, ее количественном содержании и соотношении различні.іч
видов микроорганизмов в биологическом материале. Иногда мик¬
роскопия позволяет выявить микроорганизмы, плохо растущие на
питательных средах. Данные микроскопии позволяют правильно
выбрать питательные среды для выращивания микробов, обнару¬
женных в мазке. На рис. 11-1 представлен вид некоторых бактерий
при окраске по Граму при бактериоскопии.
Культивирование микроорганизмов. Для выделения чистых культур
микроорганизмов, установления их вида и определения чувствитель¬
ности к антибактериальным препаратам проводят посев исследуемого
биоматериала на питательные среды. Для целей используют различ¬
ные питательные среды, позволяющие выделить наибольшее количес¬
тво видов микроорганизмов. Оптимальными являются питательные
среды, содержащие кровь животного или человека, а также сахарный
бульон, среды для анаэробов. Одновременно производят посев на ди(|»-
ференциально-диагностические и селективные (предназначенные для
определенного вида микроорганизмов) среды. Посев осуществляют пн
11.1. Общие сведения о бактериологических методах исследования
575
1’ис. 11-1. Бактериоскопическая картина мазков, окрашенных по Граму.
I — стрептококки; 2 — стафилококки; 3 — диплобактерии Фридлендера;
4 — пневмококки
стерильные чашки Петри, в которые предварительно заливают сте¬
рильную питательную среду для роста микроорганизмов.
Чашки Петри с посевами инкубируют в термостате при определен¬
ных температурных, а для ряда микроорганизмов в специальных газо¬
вых (например, для выращивания анаэробов создают условия с низ¬
ким содержанием кислорода) режимах в течение 18—24 ч. Затем чашки
Петри просматривают. Количественную обсемененность доставлен¬
ного биоматериала микрофлорой определяют по числу колониеобра-
»уюших единиц (КОЕ) в 1 мл или I мг исследуемого образца. При про¬
смотре чашек Петри выявляют особенности изменения цвета среды,
се просветления в процессе роста культуры. Многие группы бактерий
образуют характерные формы колоний, выделяют пигменты, которые
окрашивают колонии или среду вокруг них. Из каждой колонии дела¬
ют мазки, окрашивают по Граму и микроскопируютс целью изучения
особенностей строения бактерий (форма, размер, наличие спор или
.576 Глава 11. Бактериологические и паразитологические исследования
других включений, капсулы, расположение бактерий) и отношения к
окраске по Граму. Эта информация служит важнейшей составляющей
для выбора сред и получения в дальнейшем чистой.культуры каждого
микроорганизма.
Для отсева выращенных колоний используют плотные, жидкие,
полужидкие питательные среды, оптимальные для культивирования
определенного вида бактерий. В итоге выделяют чистые культуры
микроорганизмов, которые в дальнейшем изучают с использованием
диагностических тестов. Тесты основаны на морфологических, фер
ментативных, биологических свойствах и антигенных особенностях,
характеризующих бактерии соответствующего вида или варианта.
Идентификация — это комплекс бактериологических методов изу
чения бактерий, позволяющий определить вид микроорганизма.
Для подтверждения этиологической значимости выделенных бак
терий для данного заболевания определение рода и вида, к которому
они относятся, является обязательным для бактериологической лабо
ратории. Оно (или его род) должно быть отражено на бланке резуль
тата исследования в виде наименования микроорганизма, например.
Streptococcus pneumoniae (пневмококк) или Eschrichia coli (кишечная
палочка).
Определение чувствительности к антибактериальным препаратам.
Чувствительность к антимикробным препаратам изучают у выде
ленных чистых культур микроорганизмов, имеющих этиологичсс
кое значение для данного заболевания. Поэтому в направлении на
бактериологические анализы необходимо указать диагноз больно! н
Определение чувствительности бактерий к спектру антибиотик«)!!
помогает лечащему врачу правильно выбрать средство для леченi!и
больного.
Оценка результатов исследования. Если из исследуемого биоматери
ала больного в лаборатории выделяют чистую культуру истинно-па!ч)
генных бактерий, то оценка результата анализа не вызывает сложное i и.
Установленный вид микроорганизма является возбудителем заболс
вания у пациента. Однако при выделении из биоматериала условно
патогенных микроорганизмов возникает ряд трудностей при оценке их
этиологической роли в развитии гнойно-воспалительных заболевании,
Условно-патогенные микроорганизмы могут представлять нормал!.-
ную микрофлору исследуемых жидкостей и тканей или контаминиро
вать (инфицировать) их из окружающей среды. Однако если исследу¬
емый биоматериал в норме стерилен, как, например, спинномозговая
11.2. Посев крови (гемокультура) 577
жидкость, экссудаты, все выделенные из него микроорганизмы могут
считаться возбудителями заболевания. В отношении других биома-
гериалов для правильной оценки результатов бактериологических
исследований необходимо знать состав естественной микрофлоры
изучаемого образца. Отделяемое влагалища, кал, мокрота, имеют собс¬
твенную микрофлору, поэтому необходимо учитывать изменения ее
качественного и количественного состава, появление несвойственных
ему видов бактерий, количественную обсемененность биоматериала.
Так, например, при бактериологическом исследовании мочи степень
Оактериурии (число бактерий в 1 мл мочи), равная 105 и выше свиде¬
тельствует об инфекции мочевых путей, у здоровых людей может быть
иыявлена более низкая степень бактериурии, которая является следс-
I вием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофло¬
ры помогают также нарастание количества и повторность выделения
бактерий одного вида от больного в процессе заболевания.
Медицинская сестра должна знать, что положительный результат
бактериологического исследования в отношении биологического мате¬
риала, полученного из стерильного в норме очага (кровь, плевральная
жидкость, спинномозговая жидкость, пунктат органа или ткани) —
всегда тревожный результат, о котором необходимо немедленно сооб¬
щить лечащему врачу, а в его отсутствие — дежурному врачу.
11.2. ПОСЕВ КРОВИ (ГЕМОКУЛЬТУРА)
Посев крови с целью выделения гемокультуры микроорганизмов
используют в клинической практике, чтобы подтвердить или исклю¬
чить наличие в крови бактерий (бактериемии). Посев крови полезен в
грех клинических ситуациях.
• При подозрении на наличие у пациента сепсиса.
• Для диагностики некоторых инфекционных заболеваний, при
которых возбудители (микроорганизмы) болезни распространя¬
ются с током крови; к таким заболеваниям относятся бактери¬
альный эндокардит (инфекция клапанов сердца), остеомиелит
(инфекция костей) и инфекционный артрит (инфекция суставов);
кроме того, посев проб крови показан пациентам с пневмонией
средней и тяжелой степени.
578 Глава II. Бактериологические и паразитологические исследования
• У лиц с лихорадкой неясного генеза, которая проявляется пові.і-
шением температуры тела в течение более 10 дней без видимой
причины. .
В норме кровь человека стерильна (не содержит бактерий). Однако
повседневная жизнь связана с постоянным риском контакта цирку
лирующей крови с бактериями, и даже у здорового человека время
от времени может возникать преходящая бактериемия. Повреждения
кожи или слизистых оболочек облегчают доступ в кровоток бактери іі,
колонизирующих эти покровы. Полость рта содержит большое КОЛИ
чество микроорганизмов, которые почти всегда попадают в кровоток
во время или после стоматологических манипуляций. Многие хирур
гические вмешательства, несмотря на асептическую технику, сопро
вождаются попаданием в кровь небольшого количества бактерий i
кожных покровов или кишечника при операции на нем. В кровоток
бактерии могут попасть при ряде заболеваний и переливании крови
Врожденные и приобретенные механизмы иммунной защиты подле
рживают стерильность крови и предупреждают переход транзитор
ной (преходящей) бактериемии в сепсис, который развивается у ряля
больных.
11.2.1. СЕПСИС
Длительное время сепсис рассматривался как генерализованный
инфекционный процесс, развивающийся на фоне сниженного имму
нитета, основополагающим признаком которого считалось присутс
твие бактерий в крови. Сейчас установлено, что инфекция сама по
себе не является непосредственной причиной многочисленных паю
логических сдвигов, характерных для сепсиса. Скорее всего они воі
никают как результат ответной реакции иммунной системы организ¬
ма на инфекцию. Поэтому в настоящее время сепсис рассматриваеіся
как результат неконтролируемого генерализованного (системною)
воспалительного ответа на присутствие инфекции. При сепсисе реї у-
лирующие системы организма больного не способны контролироваїь
иммунные реакции, в результате чего начинают доминировать пом
реждающие эффекты медиаторов воспаления этой системы, что спо
собствует нарушению проницаемости и функций эндотелия сосудоц.
формированию отдаленных очагов генерализованного воспаления,
развитию моно- и полиорганной недостаточности.
11.2. Посев крови (гемокультура) 579
Бактериемия всегда вызывает генерализованный воспалительный
ответ, при котором включаются ответные иммунные реакции орга¬
низма. Однако если при нормальном течении инфекционного процес¬
са подобные реакции можно расценивать как реакции приспособле¬
ния или адаптации, то при сепсисе в силу ряда причин их активность
носит избыточный и повреждающий характер в отношении многих
органов и систем организма больного.
Современное представление о сепсисе требует понимания новой
стандартизованной терминологии, характеризующей течение септи¬
ческого процесса. В настоящее время используется приведенная ниже
терминология.
Клинические понятия, использующиеся при характеристике сеп¬
тических состояний:
• Колонизация — микробиологическое событие (МБС).
• Инфекция — микробиологическое событие + местная воспали¬
тельная реакция (МВР).
• Сепсис — микробиологическое событие + генерализованная вос¬
палительная реакция (ГВР).
• Тяжелый сепсис — микробиологическое событие + генерализо¬
ванная воспалительная реакция + синдром полиорганной недо¬
статочности (С ПОН).
• Септический шок — микробиологическое событие + генерализо¬
ванная воспалительная реакция + синдром полиорганной недо¬
статочности + гипотензия (снижение артериального давления).
В свою очередь микробиологическое событие характеризуют:
- рост микрофлоры из крови или нормально стерильных локусов
(мест) или очагов;
- клинические признаки проникновения инфекции в нормаль¬
но стерильные среды организма;
- лабораторные и инструментальные признаки инфекционного
заболевания (лейкоциты в стерильной жидкости, рентгеногра¬
фические признаки пневмонии).
О наличии генерализованной воспалительной реакции у больного
свидетельствуют:
- температура тела выше 38 °С или ниже 36 °С;
- число сердечных сокращений (пульс) более 90 в мин;
- число дыханий более 20 в мин или проведение больному искус¬
ственной вентиляции легких;
- лейкоцитоз в крови выше 12,Ох ЮУл или ниже 4,0х 109/л;
580 Глава 11. Бактериологические и паразитологические исследовани и
— наличие в лейкоцитарной формуле крови более 10% незрелых
форм нейтрофилов (миелоциты, метамиелоциты).
Критериями синдрома полиорганной недостатсМности при тяже
лом сепсисе являются:
— нарушение сознания;
— лабораторные признаки гипоксемии — парциальное давление
кислорода (р02) в артериальной крови ниже 75 мм рт. ст.;
— наличие метаболического ацидоза — pH артериальной крови
ниже 7,3;
— снижение диуреза (олигурия) мочи менее 30 мл/ч;
— лабораторные признаки нарушения свертывания крови: сни
жение количества тромбоцитов на 50% от нижней границы
нормы, увеличение протромбинового времени или АЧТВ Mil
20% и уровень D-димера более 500 нг/мл.
Диагноз сепсиса не вызывает сомнений при наличии:
— инфекционного очага (микробиологическое событие), опредо
ляюшего природу патологического процесса;
— признаков генерализованной воспалительной реакции;
— признаков организменной дисфункции — синдрома полиор
ганной недостаточности.
Этот алгоритм должен служить основой для постановки диагноза
«сепсис» в повседневной практике.
Несмотря на то, что выделение бактерий из крови не является обя
зательным критерием диагностики сепсиса, установление возбудите
ля и его чувствительности к антибиотикам, по-прежнему являются
важнейшим моментом в определении прогноза и эффективности
лечения больного.
11.2.1.1. Этиология сепсиса
Возбудителями сепсиса могут быть почти все сушествующие паго-
генные и условно-патогенные бактерии. Наиболее распространенны¬
ми возбудителями считаются стафилококки, стрептококки, синегной
ная палочка, протейные бактерии, анаэробная флора и бактероиды.
Грамположительные бактерии составляют около 50% всех микро
организмов, выделяемых из крови больных сепсисом. На долю стафи ¬
лококков приходится около 55% в общей структуре возбудителей сеп¬
сиса. Среди стафилококков наиболее часто выделяют Staphylococcus
aureus. Staphylococcus aureus — грамположительный кокк, обычно
присутствующий в носовой полости у 20—30% и на коже у 5—10% здо-
11.2. Посев крови (гемокультура) 581
ровых людей. Он часто является причиной хирургической и раневой
инфекций, может вызывать инфекционные заболевания кожи —
(|)урункулы и карбункулы. Очагами инфекции при сепсисе чаще всего
являются инфицированные раны и внутривенные катетеры.
Escherichia coii, Kiebsieiia, Enterobacter cioacae являются грамотри-
цательными палочками, которые в норме обитают в кишечнике и
служат наиболее частой причиной инфекции мочевыводящих путей.
Первичный очаг инфекции в случае, когда возбудителем является
один из этих микроорганизмов, находится обычно в мочевом тракте
или причиной служит инфицированный мочевой катетер.
В каждом конкретном случае сепсиса возбудителем является
единственный вид бактерий. Очень редко (менее чем в 8% случаев)
обнаруживают более одного вида микроорганизмов.
11.2.1.2. Бактериологическая диагностика сепсиса
Диагностика сепсиса включает выявление этиологического фак-
гора — определение возбудителя и изучение его чувствительности к
антибактериальным препаратам, так как именно использование соот-
иетствующих антибиотиков является при прочих равных условиях
шлогом окончательного излечения больного.
Как только врач при осмотре больного заподозрит сепсис, необ¬
ходимо принять все меры для немедленного бактериологического
исследования и посева крови, мочи и отделяемого первичного очага.
При взятии проб крови для бактериологического исследования
иажно соблюдать технику взятия и определенные правила.
Техника взятия проб крови
Необходимо придерживаться асептической техники, чтобы исклю¬
чить бактериальное загрязнение культуры. При правильном взятии
проб в культуре крови присутствует только тот микроорганизм, кото¬
рый находится в крови пациента.
• Кровь следует брать из периферической вены. Нельзя использо¬
вать для этого постоянный катетер, который может быть загряз¬
нен бактериями.
• Кровь следует брать в стерильных перчатках. Место венепунк¬
ции обрабатывают 2% раствором йода или другим антисептиком.
Через 1-2 мин йод удаляют 70% этиловым спиртом. Необходимо
убедиться, что кожа сухая. Крышку флаконов с культуральной
средой, куда вносится образец крови, тоже необходимо продезин¬
фицировать 70% этиловым спиртом.
582 Глава 11. Бактериологические и паразитологические исследовани и
• Кровь следует брать стерильным шприцем и иглой, стараясь мг
прикасаться руками к месту венепункции.
• Необходимо сменить иглу на шприце перед Ьведением взятой
пробы крови из шприца во флакон с культуральной средой черг і
закрывающую его резиновую пробку. Это предупреждает про
никновение в культуру бактерий, которые могли попасть на иглу
с кожи пациента. Нельзя снимать пробку с флакона с культурал і.
ной средой, так как это может привести к ее загрязнению бак гг
риями из окружающей среды.
• Флаконы с культурой крови должны быть снабжены этикеткой
с данными о пациенте и вместе с бланком-заявкой немедленмо
отправлены в лабораторию. Если лаборатория к тому времени
уже закончила работу, флаконы следует поместить в термоснії
при температуре 37 °С, чтобы мог начаться рост бактерий. И
бланке-заявке на бактериологическое исследование крови важмо
привести клинические данные о пациенте (диагноз) и сведения о
терапии антибиотиками.
Помимо техники, для успешного обнаружения специфическом»
возбудителя сепсиса важно соблюдать определенные правила взятмя
проб крови для получения гемокультуры:
• Многократный в течение суток бактериологический посев крови
(обычно не менее 3—5 раз в сут, кровь берут на фоне повышения
температуры тела у пациента за 2—3 ч до ее максимального поді.
ема в 2 флакона — для аэробов и анаэробов); при однократном
посеве крови на гемокультуру удается получить 80% положителі.
ных результатов, при двукратном — 90% и трехкратном — 99%.
• Большинство методов, используемых в бактериологическмч
лабораториях, дает положительный результат исследования
гемокультуры при количестве бактерий от 10 до 15 в 1 мл кроим,
увеличение количества крови, взятой для исследования ми
гемокультуру с 2 до 20 мл, повышает вероятность получения
положительного результата с 30 до 50% (за исключением нови
рожденных).
• У детей с сепсисом количество бактерий в 1 мл крови выше, чгм
у взрослых. Количество взятой крови рассчитывают следующим
образом: у детей до 10 лет — 1 мл крови на каждый год жизни,
старше 10 лет — 20 мл.
• Оптимальное соотношение между количеством взятой крови дли
исследования и культуральной средой должно составлять 1:10.
11.2. Посев крови (гемокультура) 583
• Не следует откладывать начало лечения антибиотиками для того,
чтобы получить несколько проб крови в течение большого про¬
межутка времени (с целью повысить вероятность положительного
результата исследования гемокультуры).
Обнаружить источник-сепсиса непростая задача. Септический
очаг может быть связан с предшествующим хирургическим вмеша¬
тельством и последующими осложнениями в месте операции, а может
иметь ятрогенное происхождение, например, как следствие постинъ-
скционного абсцесса.
В ряде случаев септическим очагом могут быть пневмония, легоч¬
ное нагноение или эмпиема плевральной полости, гнойники кожи.
Около 60% больных заболевают сепсисом, находясь в больнице, —
1ЯЖСЛЫЙ вариант внутрибольничной инфекции. Это обусловлено тем,
что все шире при лечении неотложных состояний применяются инва-
«ивные методы интенсивной терапии: длительная интубация трахеи,
трахеостомия, при которых трахея неизбежно превращается в гной¬
ную рану и может стать местом локализации септического очага.
Нередко развитие сепсиса связано с очагом инфекции в подкожной
клетчатке или других соединительнотканных образованиях (костный
мозг, суставы, забрюшинная клетчатка при панкреонекрозе и др.).
Вмешательство на мочевых путях, их постоянная катетеризация
или мочевые свищи могут стать источником сепсиса, который обычно
протекаете выраженной клинической картиной.
Очень часто септическим очагом становится брюшина при лока¬
лизованном (внутрибрюшной абсцесс) или разлитом гнойном пери¬
тоните. Следует помнить, что септическим очагом могут являться
желче вы водящие пути. Развитие сепсиса в таких случаях обусловлено
бактериальным ангиохолитом и нарушением оттока инфицирован¬
ной желчи. Кишечная микрофлора при любом сепсисе играет важную
роль в формировании синдрома генерализованной воспалительной
реакции, но не следует забывать, что развитие сепсиса может исходно
определяться наличием тяжелого дисбактериоза и антибиотико-ассо-
циированного псевдомембранозного колита.
В последние годы септический очаг инфекции все чаще локали¬
зуется в различных отделах сердечно-сосудистой системы. Наиболее
частой причиной такой формы сепсиса в настоящее время являются
ие столько гнойные тромбофлебиты, сколько установка внутрисо-
судистых катетеров для длительной инфузионной терапии (один из
вариантов такой ятрогении назван катетерным сепсисом).
584 Глава 11. Бактериологические и паразитологические исследования
Отсутствие видимого источника инфекции или задержка ранено
го отделяемого при наличии катетера в крупных венозных сосуллч
требует тщательного осмотра места его введения. При сомнениях н
асептичности и отсутствии других предполагаемых входных воро!
обязательны удаление катетера с отсечением и посевом его кончика, и
при необходимости введение катетера для продолжения инфузионноИ
терапии в другой сосуд.
У 25% больных сепсисом не удается обнаружить источник инфск
ции; в этой ситуации показано назначение антибиотиков широкою
спектра действия против как грамположительных, так и грамотриин
тельных бактерий.
11.2.1.3. Оценка результатов бактериологического исследования кропи
При посеве крови на гемокультуру бактериологическая лабо
ратория обычно ежедневно выдает промежуточные заключения о
наличии или отсутствии роста бактерий на питательных средах
Окончательный ответ включает идентифицированный вид бактерии,
выделенных из культуры, вместе со сведениями о чувствительное III
или устойчивости этого вида к антибиотикам.
Результаты посева крови распределяются на следующие группы:
• нет роста бактерий;
• рост монокультуры (единственного вида бактерий) или чисюй
культуры;
• смешанный рост (выделено более одного вида бактерий).
• Отсутствие роста бактерий может быть достоверным резулыа
том в том случае, если кровь пациента действительно стерильна
Окончательный отрицательный результат лаборатория выдаш,
если через 10 дней после посева крови роста бактерий на кулы V
ральных средах не обнаружено. Однако следует учесть возмож
ность того, что такой результат является ложноотрицательным,
т.е. у пациента есть бактериемия, но ее не удалось выявим.
Причинами ложноотрицательного результата могут быть:
• содержание микроорганизмов в крови низкое, и взятое количссч
во крови недостаточно для получения роста культуры;
•до взятия крови больному было начато лечение антибиотиками
(антибиотики, содержащиеся в крови взятой пробы, угнетаки
рост бактерий);
• время, в течение которого проводилось исследование, недостаточ МО
для получения роста редких медленно растущих видов бактери!!
11.3. Бактериологическое исследование мочи 585
При получении монокультуры или смешанного роста оценка
результата зависит от вида выделенных микроорганизмов и массив¬
ности роста.
Выделение патогенных видов бактерий с несомненностью свиде¬
тельствует об их этиологической роли в заболевании. В том случае,
когда из крови выделены условно-патогенные микроорганизмы, иног¬
да трудно решить, является лй полученный вид бактерий результатом
бактериального загрязнения (ложноположительный результат) или
отражает наличие сепсиса (положительный результат). Выделение
одного вида микроорганизмов в чистой культуре из крови более веро¬
ятно отражает наличие бактериемии, чем бактериальное загрязнение
пробы, если:
• у больного из какого-либо другого очага инфекции был выделен
тот же вид бактерий;
• при повторном взятии пробы крови был выделен тот же вид бак¬
терий.
Смешанный рост указывает на то, что из культуры крови было
выделено более одного вида бактерий. При сепсисе такой результат
встречается редко, поэтому в большинстве случаев он свидетельствует
о загрязнении культуральной среды, особенно, если выделенные бак¬
терии являются частью нормальной микрофлоры кожи.
Вместе с тем при оценке результатов бактериологических исследо¬
ваний необходимо понимать, что рост микрофлоры в крови — важный
диагностический признак сепсиса, но только при наличии соответс¬
твующей клинической картины заболевания.
11.3. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ МОЧИ
Бактериологический посев мочи — один из наиболее востребо¬
ванных видов исследования. Обычно его назначают для того, чтобы
подтвердить или исключить диагноз инфекции мочевых путей.
11.3.1. СТРОЕНИЕ И ФУНКЦИОНИРОВАНИЕ МОЧЕВОЙ СИСТЕМЫ
Мочевая система состоит из почек и собственно мочевыводяших
путей — мочеточников, мочевого пузыря и уретры (рис. 11-2).
586
Глава 11. Бактериологические и паразитологические исследована
Напомним, что моча образуется в структурной единице почки — не<|и
роне (см. гл. 3). Кровь поступает в почку по почечной артерии и фильтр)
ется в клубочке каждого нефрона. В результате процессов фильтраищ
образуется ультрафильтрат. В канальцевой системе нёфрона благодаря
реабсорбции и секреции объем и состав ультрафильтрата меняются
При выходе из нефрона в нем остаются ненужные продукты обмен]
веществ, растворенные в небольшом количестве воды, — это моча.
Выведение мочи наружу проходит по мочевым путям. Мочевая сш
тема состоит из почек и собственно мочевыводяших путей — мочеточ]
ников, мочевого пузыря и уретры. Окончательная моча изливается
малые чашечки, представляющие выросты лоханки, которые охвать
вают сосочек почки. Две-три малые чашечки сливаются в большие,!
те в свою очередь образуют лоханку почки. Лоханка переходит в моч(
точник. Мочеточники соединяются с основанием мочевого пузыр>
основная функция которого состоит в накоплении мочи и выводе о1
при мочеиспускании через мочеиспускательный канал (уретру) и|
организма.
Нижняя полная вена,
ведущая к сердцу
Почечная лоханка -
полость для скопле¬
ния мочи
Правая почка
Мочеточник
Корковое и
ш
мозговое ве¬
щества. содер-.-
жащие около
1 млн нефро¬
нов в каждой
почке
Тазовый
пояс
Мочевой^
пузырь
Мочеиспуска¬
тельный канал
Рис. 11-2. Строение мочевыделительной системы
П.З. Бактериологическое исследование мочи 587
В норме мочевыводящие пути от почек до последней трети уретры
не содержат бактерий, поэтому моча в мочевом пузыре у здоровых
людей стерильна. Однако на коже промежности и в кале присутствуют
бактерии, которые могут легко попадать в уретру. В связи с этим они
почти всегда присутствуют в нижней трети уретры, не вызывая каких-
либо симптомов и заболеваний. Это обусловлено наличием ряда меха¬
низмов (иммунные и неиммунные), контролирующих бактериальное
загрязнение уретры. ОсновнЬй из неиммунных механизмов — это
механический очищающий эффект стерильной мочи, проходящей
через уретру при мочеиспускании. Поэтому в норме моча стерильна
или содержит очень малое количество бактерий.
П.3.2. ИНФЕКЦИИ МОЧЕВЫВОДЯЩИХ ПУТЕЙ
Инфекция мочевыводяших путей является одним из наиболее
распространенных инфекционных заболеваний как у амбулаторных,
так и у госпитализированных пациентов. Инфицирование мочевыво¬
дящих путей и развитие в дальнейшем воспалительного заболевания
чаще всего являются результатом проникновения в нее бактерий,
в норме присутствующих в кишечнике или на коже. Выделяясь с
калом при дефекации, бактерии кишечника попадают на кожу про¬
межности, а с нее в уретру и в мочевой пузырь. Помимо этого, кожа
промежности и сама по себе содержит бактерии, которые проникают в
мочевыводящие пути. Бактерии женских половых путей (влагалища)
также инфицируют мочевой тракт, но значительно реже.
Термин «инфекция мочевыводящих путей» обозначает инфек¬
цию во всем мочевом тракте человека. Однако всегда необходимо
стремиться более точно установить локализацию инфекции, от чего
будут зависеть вид лечения и прогноз заболевания. Поэтому по лока¬
лизации принято подразделять эти инфекции на инфекции верхних
и нижних мочевыводящих путей. Инфицирование, а затем развитие
воспалительного процесса в мочевом пузыре называется циститом
(инфекция нижних мочевыводящих путей). Это наиболее частая
инфекция мочевых путей, в случае восходящего распространения
инфекции далее по мочевым путям (мочеточникам) в воспалитель¬
ный процесс могут быть вовлечены лоханки и почечная паренхима.
Воспаление лоханок и почек называется пиелонефритом (инфекция
верхних мочевыводящих путей). Он встречается реже (в 30% случаев
588 Глава II. Бактериологические и паразитологические исследовани и
всех инфекций мочевого тракта), но представляет для больного боль
шую опасность, чем цистит. В ряде случаев пиелонефрит может стаи,
источником проникновения бактерий в кровь и развития сепсиса
Хронический пиелонефрит при длительном течении Люжет привесш
к почечной недостаточности.
Восходящий путь инфицирования мочевых путей в клинической
практике встречается наиболее часто. Однако в ряде случаев баки-
рии, присутствующие в крови, могут вызвать нисходящую инфекцию
мочевого тракта, поражая сначала почки, а затем мочевые пути.
Инфицированию мочевого тракта способствуют:
• пол; женщины болеют чаще мужчин; это обусловлено особен
ностями строения уретры: у женщин она короткая и широкая и
расположена близко к влагалищу и прямой кишке;
• нарушение оттока мочи из мочевого пузыря (застой мочи) вслелі
твие закупорки мочевыводящих путей камнем, опухолью, при
заболеваниях предстательной железы (отсутствует очищающий
эффект стерильной мочи);
• госпитализация; около 1/3 внутрибольничных инфекций
инфекции мочевыводяших путей;
• беременность; пиелонефрит — нередкое заболевание у беремен
ных, поэтому всех беременных необходимо обследовать на нал и
чиє инфекции мочевыводяших путей;
• роды;
• у женщин связь инфекции с половой жизнью (соблюдение ГИІ и
ены половой жизни и опорожнение мочевого пузыря до и после
полового акта уменьшают вероятность инфицирования);
• сахарный диабет; больные сахарным диабетом более подвержены
инфекциям вследствие глюкозурии (моча, содержащая глюкзу,
хорошая средщдля роста), а также снижения иммунитета; перио
дическое бактериологическое исследование мочи показано болі,
ным с сахарным диабетом;
• пузырно-мочеточниковый рефлюкс — патологическое состояние,
при котором инфицированная моча забрасывается из мочевой»
пузыря в мочеточники; наиболее часто встречается у маленьких
детей и представляет для них серьезную опасность; постояти»
присутствующий пузырно-мочеточниковый рефлюкс способе
твует проникновению инфекции в почки, развитию пиелонефрн
та, а в дальнейшем — сморщиванию почки;
• воспаление половых органов при урогенитальных инфекциях;
11.3. Бактериологическое исследование мочи 589
• охлаждение, запор, употребление веществ, раздражающихслизис-
тую оболочку мочевого пузыря [гексаметилентетрамин (уротро¬
пин)], облучение мочевого пузыря при лучевой терапии опухолей
органов малого таза.
Этиология. Наиболее частыми возбудителями воспалительных
заболеваний мочевого тракта являются грамотрицательные бактерии;
Escherichia coii, Proteus, Enterok^acter, Kiebsieiia, Pseudomonas aeruginosa,
Streptococuss группы D. Возбудителями также могут быть Staphylococcus
aureus, Staphylococcus epidermidis, Candida albicans, Mycoplasma и другие
микроорганизмы. Наиболее частым возбудителем воспалительных
заболеваний мочевого тракта является Escherichia соИ, которая во всем
мире выделяется более чем у 80% амбулаторных больных.
Клинические проявления воспалительных заболеваний верхнего и
нижнего отделов мочевого тракта существенно различаются.
Клинические симптомы цистита:
• частые позывы на мочеиспускание, даже при наличии небольшо¬
го количества мочи в мочевом пузыре;
• жгучая боль в процессе и сразу после мочеиспускания;
• иногда лихорадка.
При инфекции верхнего отдела мочевого тракта (пиелонефрит)
больные чувствуют себя значительно хуже, чем при цистите. Основные
клинические проявления пиелонефрита:
• лихорадка и озноб;
• общее недомогание, иногда с тошнотой;
• боль в спине;
• иногда симптомы цистита.
Для диагностики инфекций мочевого тракта проводят общий ана¬
лиз мочи, стаканные пробы и бактериологический посев мочи.
11.3.3. ОЦЕНКА РЕЗУЛЬТАТОВ БАКТЕРИОЛОГИЧЕСКОГО
ИССЛЕДОВАНИЯ МОЧИ
Бактериоскопическое исследование мочи (исследование осадка
из пробы мочи под микроскопом) дает минимальную клиническую
информацию для диагностики инфекций мочевыводящих путей,
поэтому в клинической практике не используется.
Гарантированное подтверждение наличия или отсутствия бакте¬
рий и их идентификация возможны только при бактериологическом
590 Глава 11. Бактериологические и паразитологические исследования
исследовании мочи (посев и выделение культуры). Однако моча и
норме может содержать небольшое количество бактерий, происхо
дяших из нижней трети уретры, поэтому только установления факт;|
(рост колоний при посеве мочи на специальных бредах) присутс
твия бактерий (бактериурий) недостаточно для постановки диагнозл
инфекции мочевыводящих путей.
Достоинство бактериологического исследования состоит и
том, что оно, помимо установления вида микроорганизма, поз¬
воляет определить и количество бактерий. Рост любых бактерий
на культуральной среде в чашке Петри проявляется образова¬
нием колоний на поверхности среды. Каждая колония содержит
тысячи микроорганизмов, произошедших от одной-единственной
бактерии, находившейся в моче. Число колоний прямо отражаем
количество бактерий в моче. Подсчитав число колоний (колоние¬
образующих единиц — КОЕ), выросших при посеве известного
объема мочи, можно определить начальную концентрацию бакте¬
рий в исследуемой моче. Если моча стерильна, то колоний можеа
не быть.
Основная задача при интерпретации полученных результатом
бактериологического исследования заключается в доказательстве
этиологической роли микроорганизмов, выделенных из мочи, в забо¬
левании. При этом должны учитываться следующие факторы:
• степень бактериурии;
• вид выделенного микроорганизма;
• повторность его выделения в процессе заболевания;
• присутствие в моче монокультуры или ассоциации микроорга¬
низмов.
Рост более 100 ООО КОЕ в 1 мл (более 1-105 КОЕ/мл) свежевыде¬
ленной моче позволяет поставить диагноз инфекции мочевыводяших
путей. Правда, в настоящее время доказано, что инфекция мочевы¬
водящей системы может возникать и при количестве бактерий даже
менее 1 • 105 КОЕ/мл, все же значение более 1 • 105 КОЕ/мл остается
главным ориентиром в диагностике инфекций.
Клинически значимой бактериурией (т.е. бактериурией, которая
свидетельствует об инфекции мочевого тракта) у взрослых считают:
• ^105 бактерий в 1 мл средней порции мочи у женщин с острым
циститом;
• >104 бактерий в 1 мл средней порции мочи у женщин с острым
пиелонефритом;
П.З. Бактериологическое исследование мочи 591
• >105 бактерий в I мл средней порции мочи у женщин или >10'*
уропатогенов в 1 мл средней порции мочи у мужчин (или в моче,
полученной с помощью катетера у женщин) с осложненной инфек¬
цией мочевыводящих путей (острый цистит и пиелонефрит);
• любое количество бактерий в моче, полученной путем надлобко¬
вой пункции мочевого пузыря.
Асимптоматической бактериурией (т.е. бактериурией, которая
выявляется у лиц, не предъявляющих каких-либо жалоб) считается
обнаружение > 105 одного и того же вида бактерий в 1 мл мочи в 2 пос¬
ледовательных анализах, взятых с интервалом более 24 ч. Выделение
данной формы бактериурии важно с практической точки зрения.
Большинство исследователей не рекомендуют лечение асимптомати¬
ческой бактериурии.
У детей диагноз инфекции мочевыводяших путей устанавливают
на основании следующих критериев бактериологического исследова¬
ния мочи:
• при посеве мочи из мочеприемника значимым считается только
отрицательный результат;
• обнаружение любого количества бактерий в моче, полученной с
помощью надлобковой пункции мочевого пузыря;
• обнаружение в моче коагулазонегативных стафилококков в кон¬
центрации >300 КОЕ/мл;
• обнаружение в моче, полученной с помощью катетера, бактерий в
концентрации 10'*-5 КОЕ/мл;
• при исследовании средней порции мочи: обнаружение бактерий в
концентрации Ю'* КОЕ/мл с симпто.мами инфекции мочевыводя¬
щих путей или 105 КОЕ/мл в 2 образцах мочи, взятых с интерва¬
лом более 24 ч у детей без симптомов инфекции мочевыводяших
путей;
• значимая пиурия; обнаружение 10 лейкоцитов в 1 мл в сочетании
с концентрацией бактерий 104-5 КОЕ/мл, полученной с помощью
катетера, у детей с лихорадкой позволяют провести диффе¬
ренциальную диагностику между инфекцией и контаминацией
(обсеменением); между пиелонефритом и асимптоматической
бактериурией.
Особенности бактериологического обследования разных категорий
больных. Бактериологическое исследование мочи не является обяза¬
тельным методом исследования у женщин с циститом. Оно показано
при сохранении у женщин симптомов цистита или их рецидивах в
592 Глава П. Бактериологические и паразитологические исследовани и
течение 2 нед. Бактериологическое исследование мочи необходимо
выполнять всем больным с острым пиелонефритом.
Бактериологическая диагностика инфекций мочевыводящих путей
у беременных имеет свои особенности, у большинства женщин бак
териурия возникает еще до беременности, у 20—40% женщин с асим
птоматической бактериурией (>105 бактерий одного и того же вида
в 1 мл средней порции мочи в 2 последовательных анализах, взятых
с интервалом 24 ч) во время беременности развивается острый пис
лонефрит. Частота ложноположительных результатов однократною
культурального исследования средней порции мочи может достига! I.
40%. В связи с этим всем женщинам с положительным результатом
бактериологического исследования необходимо проводить повторный
посев мочи через 1—2 нед, уделив особое внимание туалету наружных
половых органов перед мочеиспусканием. После завершения лечения
бактериологическое исследование мочи проводят спустя 1—4 нел.
а также повторно перед родами.
11.4. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ КАЛА
ПРИ КИШЕЧНЫХ ИНФЕКЦИЯХ
Возбудители, которые выделяют при воспалительных процессах и
кишечнике, могут быть истинно патогенными (возбудители дизенте
рии — палочки рода Shigella, возбудители брюшного тифа, паратифоі»
и токсикоинфекций — бактерии рода Salmonella), но в основном явля
ются представителями нормальной микрофлоры кишечника.
Бактериологическое исследование кала на наличие возбудителеіі
кишечных инфекций проводят с целью:
• установления этиологии заболевания;
• контроля перед выпиской из лечебного учреждения для выявлс
ния бактериовыделителей среди выздоравливающих;
• обследования лиц, подозрительных на хроническое заболевание;
• обследования лиц, подозрительных как источник инфекции при
вспышках заболевания;
• обследования работников объектов питания, лечебных и детских
учреждений;
• обследования здоровых лиц в окружении больного с кишечной
инфекцией.
ПА. Бактериологическое исследование кала... 593
Среди кишечных инфекций можно выделить основные группы,
которые имеют наибольшее значение для клинической практики:
• 1. Группа кишечных инфекций сальмонеллезной этиологии, к
которой относятся брюшной тиф, паратифы А и В, токсикоин-
фекции
• 2. Дизентерия, вызываемая бактериями рода Shigella
• 3. Колиэнтериты, вызываемые кишечной палочкой (£. соИ).
Не все виды микроорганизмов рода Salmonella играют активную
роль в возникновении заболевания. Поэтому для клинической прак¬
тики очень важно определение вида сальмонелл. Бактериологическое
исследование является единственным методом установления вида
сальмонелл и, соответственно, этиологии заболевания.
В отношении дизентерии задачи диагностики несколько проще.
В настоящее время общепризнано, что дизентерия вызывается бак¬
териями рода шигелл {Shigella), поэтому выделение в чистой культуре
из кала палочек рода Shigella будет свидетельствовать именно об этой
этиологии заболевания.
Среди кишечных палочек (£. соИ) встречаются такие, которые
способны вызывать энтериты и колиты, клинически проявляющи¬
еся от у мерен ной диареи до тяжелого холероподобного заболевай и я.
В основном заболевания возникают у маленьких детей (1—2 лет).
Однако эти бактерии способны вызывать заболевания также у детей
старшего возраста и взрослых. Иногда эти заболевания клиничес¬
ки протекают как дизентерия. Поэтому при обследовании больных
с кишечными инфекциями, помимо поиска сальмонелл и шигелл,
нужно исследовать биоматериал (кал) на кишечную палочку. При
этом бактериологическая лаборатория должна установить штамм
Е. соИ, который позволит отнести его к энтеропатогенным (напри¬
мер, штамм 0124), т.е. считать этиологическим фактором заболе¬
вания.
В кишечнике обитает большое количество бактерий, которые
являются нормальной микрофлорой, участвующей в переваривании
пищи, синтезе ряда витаминов. У них существуют установившие¬
ся качественные и количественные соотношения. Однако при ряде
ситуаций, например, длительном приеме антибиотиков для лечения
инфекции мочевых путей, эти соотношения между микроорганизма¬
ми могут существенно изменяться, что приводит к возникновению
различных кишечных расстройств, — кишечному дисбактериозу. Для
установления этиологии возникших нарушений в соотношении мик¬
594 Глава II. Бактериологические и паразитологические исследования
роорганизмов при этих расстройствах проводят бактериологическое
исследование кала на дисбактериоз.
Методические особенности сбора биоматериала для бактериологи
ческой диагностики кишечных инфекций приведены в Приложении 1,
п.4.1. САЛЬМОНЕЛЛЕЗНАЯ ИНФЕКЦИЯ
Обнаружение возбудителей брюшного тифа, паратифов А и В и
токсикоинфекции занимает в клинической практике значительное
место. Это имеет не только диагностическое, но и большое эпидемио
логическое значение. Своевременно установленный диагноз брюшно
го тифа позволяет быстро госпитализировать больного, что уменьши
ет тяжесть и длительность заболевания, и провести все необходимые
противоэпидемические мероприятия. Тщательный контроль персл
выпиской больного обеспечивает выявление бактерионосителе!!,
которые в дальнейшем требуют наблюдения и бактериологическою
контроля в профилактических целях.
Бактериологическое исследование является единственным мето
дом определения вида салмонелл. Еще большую роль бактериологи¬
ческие исследования играют при стертых и неясных формах заболс
вания.
Для этиологической диагностики сальмонеллезной инфекции
важно не упустить возможность обнаружения у больных тифозных
и паратифозных бактерий. Для этого прежде всего необходимо и
каждый период течения заболевания исследовать соответствующи(1
биологический материал.
Учитывая закономерности развития сальмонеллезной инфекции
для повышения вероятности обнаружения сальмонелл, необходимо
придерживаться следующих правил исследования биоматериала:
• из крови легче всего выделить бактерии на 1—2-й нед заболевании
(бактериемия);
• из кала — начиная со 2-3-й нед заболевания, а также у бактери¬
оносителей; при пищевом отравлении (токсикоинфекция) бакте¬
рии можно выделить из кала в первые дни заболевания;
• из мочи — с конца 2-й нед заболевания, а также у некоторых бак¬
терионосителей;
• из желчи (дуоденальное содержимое) — в течение всего заболева¬
ния, а также у бактерионосителей.
И.4. Бактериологическое исследование кала... 595
11.4.2. ДИСБАКТЕРИОЗ КИШЕЧНИКА
Организм человека и его микрофлора являются единой эколо¬
гической системой, находящейся в состоянии динамического рав¬
новесия. Состав микрофлоры здоровых людей относительно пос¬
тоянен, несмотря на влияние различных факторов внешней среды.
Микрофлора кишечника представляет собой высокочувствительную
индикаторную систему, которая реагирует количественными и качес¬
твенными сдвигами на изменения состояния здоровья организма, с
другой стороны, но она способна влиять на состояние здоровья чело¬
века.
Под дисбактериозом следует понимать качественное и количест¬
венное изменение под влиянием ряда экзогенных и эндогенных фак¬
торов нормальной микрофлоры кишечника, нарушение ее функций
и биологических свойств. Кроме того, может наблюдаться размно¬
жение различных условно-патогенных бактерий, которые в норме
совсем отсутствуют или составляют незначительную часть мик¬
рофлоры. Необходимо учитывать, что дисбактериоз кишечника —
это не самостоятельное заболевание, а нарушение равновесия в
качественном и количественном составе микрофлоры кишечника,
В тех случаях, когда изменение микрофлоры кишечника приводит
к нарушению ее основных функций, развивается клиническая сим¬
птоматика дисбактериоза, которая, однако, не имеет специфичес¬
ких проявлений. Основными функциями нормальной микрофлоры
кишечника являются:
• защитная — создание иммунологического барьера для патогенных
микроорганизмов;
• участие в процессе пищеварения (окончательное переваривание
пиши);
• синтез витаминов и ферментов;
• участие в регуляции моторики желудочно-кишечного тракта;
• поддержание постоянства биохимической среды желудочно-
кишечного тракта;
• иммуномодулирующая функция.
Изменение этих функций определяет клинические проявления
кишечного дисбактериоза. Нарушения, возникающие при количест¬
венных или качественных изменениях состава микрофлоры кишеч¬
ника, чаще проявляются неустойчивым аппетитом, снижением
массы тела, избыточным газообразованием, изменением частоты и
596 Глава И. Бактериологические и паразитологические исследования
характера стула, развитием железо- и витаминодефицитной анемии.
Тяжелые формы дисбактериоза кишечника приводят к нарушен и к»
иммунного статуса и развитию инфекционных осложнений, в том
числе сепсиса.
Несмотря на то, что патогенетическое значение дисбактериоз;!
кишечника в развитии кишечных расстройств у человека известно
давно, дисбактериозу стали уделять серьезное внимание лишь и
последние десятилетия. Это объясняется тем, что в КЛИНИЧеСКО!!
практике все шире применяются антибиотики и химиопрепара
ты и накапливается все больше данных, свидетельствующих об
отрицательном влиянии их на микрофлору кишечника, а значиз,
что дисбактериоз кишечника становится все более частой патоло
гией.
Бактериологическая диагностика кишечного дисбактериоза осно¬
вана на количественной и качественной оценке содержания различ
ных видов бактерий, которые обитают в кишечнике. При дисбактери¬
озе резко нарушается равновесие в составе микрофлоры. Для оценки
нарушений качественного и количественного состава микрофлор!.!
кишечника необходимо располагать сведениями о составе микрофло¬
ры здоровых людей. Нормальное содержание основных видов бактс
рий в кале приведено в табл. 11-1.
Основным показателем нормальной микрофлоры кишечника
являются преобладание кишечной палочки и особенно бифидобак¬
терий и лактобактерий.
У здоровых грудных детей микрофлора кишечника отличаез-
ся однообразием, ее основой являются бифидобактерии, которые
составляют до 98% всей микрофлоры и обнаруживаются в кале и
количестве до 10»-'2.
Патологические отклонения в составе микрофлоры кишечник;!
могут существенно варьировать. В большом проценте случаев выя!»
ляют атипичные разновидности кишечной палочки, которые облада¬
ют выраженной гемолитической активностью, нередко обнаружива
ют гнилостные микроорганизмы рода Proteus (протей), а также гриб!.!
Candida, увеличение числа кокковых форм, в том числе пиогенно!«»
гемолизирующего стафилококка.
Количественное содержание бактерий, нехарактерных для нор¬
мальной микрофлоры кишечника, при дисбактериозе значительно
повышается. Это особенно касается бифидобактерий. Более чем в 80%
случаев при дисбактериозе бифидобактерии отсутствуют, в остальны .ч
11.4. Бактериологическое исследование кала...
597
случаях их количество не превышает 10^. Резкое снижение количества
бифидобактерий, даже при отсутствии других сдвигов, следует всегда
расценивать как проявление дисбактериоза. В значительно меньшем
числе случаев дисбактериоз характеризуется резким снижением коли¬
чества кишечной палочки.
Таблица 11-1.
Нормальное содержание основных видов бактерий в кале
Вид бактерий
Нормальное значение
Общее количество бактерий Е. соИ
(кишечная палочка)
Из них:
107-8
ферментирующие лактозу
90% и более
лактозонегативные
До 5%
с гемолитической активностью
Нет
Бактерии рода Proteus
Менее 102
Другие условно-патогенные энтеро¬
бактерии
Менее 104
Неферментирующие бактерии
104
Бактерии Enterobacter (энтерококк)
105-8
Стафилококки гемолитические
(5. aureus и др.)
Нет
Стафилококки (Staphilicoccus
epidermidis и др.)
104
Бифидобактерии
109-10
Лактобактерии
107-8
Бактероиды
107
Клостридии
Не более 105
Дрожжевые грибы
Менее 105
Вместе с тем необходимо придерживаться следующего правила:
для констатации состояния дисбактериоза кишечника важно повтор¬
ное его выявление, т.е. необходимо в течение 10-14 дней повторить
исследование.
598 Глава 11. Бактериологические и паразитологические исследования
11.5. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
ОТДЕЛЯЕМОГО ИЗ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ
Воспалительные заболевания женских половых о^зганов занимают
1-е место (55-70%) в структуре гинекологической заболеваемости.
Значительная доля их приходится на инфекции влагалища и шейки
матки. У женщин репродуктивного возраста вагиниты (воспаление
влагалища) обусловлены наличием бактериального инфицирования
(40—50%), развитием кандидоза (20—25%) и трихомониаза (10—15%).
Бактериологическое исследование отделяемого из влагалища игра¬
ет важную роль в диагностике воспалительных заболеваний нижнего
отдела половых органов. Главное достоинство метода состоит в том,
что он позволяет не только выявить общие признаки воспалительного
процесса (наличие в отделяемом из влагалища лейкоцитов и макро¬
фагов), но и установить инфекционный агент, вызвавший воспали¬
тельный процесс.
Наиболее часто для диагностики характера воспалительного про¬
цесса во влагалище в клинической практике проводят бактериоско¬
пию мазков, полученных из влагалища и цервикального канала, и
лишь в отдельных случаях бактериологический посев отделяемого.
11.5.1. НОРМАЛЬНАЯ МИКРОФЛОРА
ВЛАГАЛИЩА И ШЕЙКИ МАТКИ
В диагностике воспалительных процессов половых путей жен¬
щины важнейшую роль играет изучение микрофлоры отделяемого.
Влагалище и шейка матки рассматриваются как экологические ниши
микроорганизмов. Условия обитания микроорганизмов во влага¬
лище и шейке матки отличаются особенностями pH среды и свойс
твами эпителия, выстилающего поверхность этих анатомических
образований. При рождении влагалище стерильно, но уже на первой
неделе жизни оно заселяется микроорганизмами, преимущественно
грамположительной флорой, состоящей из анаэробных бактерий,
стафилококков, стрептококков, дифтероидов, а pH среды влагалища
составляет 7,0. В период полового созревания эпителий утолщается, м
нем возрастает уровень гликогена, и микрофлора начинает меняться
с преобладанием лактобацилл, а реакция влагалищного отделяемого
становится кислой (pH 4,4).
11.5. Бактериологическое исследование отделяемого...
599
Лактобациллы (влагалищные палочки, палочки Дедерлейна) явля¬
ются нормальными обитателями влагалища у женщин детородного
возраста. Для влагалища женщины репродуктивного возраста в норме
характерны (табл. 11-2):
• небольшое число микроорганизмов, 95% которых составляют
лактобациллы;
• концентрация лактобацилл Ю^—10^ КОЕ/мл;
• низкая концентрация других микроорганизмов (условно-пато¬
генная флора).
Таблица 11-2.
Видовой состав нормальной микрофлоры влагалища
Микроорганизмы
Содержание, частота
обнаружения
Общее количество микроорганизмов
105-107/мл
Факультативные (облигатные) лактобацил¬
лы
Более 90%
Другие микроорганизмы.
Из них:
Менее 10%
Staphylococcus epidermidis
36,6%
бифидобактери и
50%
Candida albicans
25% (у беременных до 40%)
Gardnerella vaginalis
40-50%
Ureaplasma horn inis
У 70%
КИщечная палочка
В небольшом количестве
стафилококки и стрептококки
То же
анаэробная микрофлора (бактероиды, пеп-
тострептококки, клостридии)
То же
В состав нормальной микрофлоры входят также единичные
кокки и мелкие палочки. В небольшом количестве в норме может
присутствовать условно-патогенная микрофлора: Gardnerella
vaginalis, кишечная палочка, Ureaplasma hominis. Mycoplasma hominis.
стафилококки и стрептококки, бактероиды, клостридии и другие
бактерии. Микрофлора у каждой женщины индивидуальна, срав¬
нительно постоянна, она несколько изменяется в разные периоды
менструального цикла. Сочетания микроорганизмов могут быть
600 Глава И. Бактериологические и паразитологические исследования
самыми разнообразными. Состав бактериальной флоры зависиі
от гормональных факторов, приема медикаментов и сексуальных
контактов.
У женщин в постменопаузе лактобациллы постепенно уступаюі
место коккам, грамположительным диплококкам, мелким палочкам.
Бактериальная флора в постменопаузе обычно бывает скудной.
Содержимое цервикального канала в норме стерильно. Лишь у
наружного зева матки в слизистой пробке могут быть обнаружені.і
микроорганизмы (преимущественно лактобациллы) как результаї
контаминации (загрязнения) микрофлорой влагалища.
Микроорганизмы, составляющие нормальную микрофлору вла
галиша, находятся между собой в разнообразных взаимоотношениях
(нейтралитет, конкуренция, синергизм, паразитизм и др.). На фоне
преобладания кислотопродуцирующих микроорганизмов (лактоба¬
цилл) создается оптимально кислая среда в шейке матки и влагалище,
что и обусловливает равновесие между различными видами бактерий,
колонизирующих женские половые пути. Нормальная бактериальная
флора выполняет защитную роль, препятствуя инвазии патогенных
микроорганизмов, а любая инвазия в здоровый эпителий почти всегдії
сопровождается изменениями микрофлоры влагалища. Изменение
количества того или иного вида микроорганизмов или появление пе
свойственных данному месту обитания бактерий является одной и і
важных причин развития воспалительных заболеваний влагалища и
шейки матки.
Для оценки состояния микрофлоры влагалища в клинической
практике длительное время использовалась бактериологическая
классификация, в которой выделялись 4 степени чистоты с учетом
количества лактобацилл, наличия условно-патогенных бактерий,
лейкоцитов, эпителиальных клеток.
Первая степень. В мазках эпителиальные клетки и чистая кулі,
тура лактобацилл, реакция влагалищного содержимого кислая
(pH 4,0-4,5).
Вторая степень. Небольшое количество лейкоцитов, лактобацилл
меньше, имеются другие сапрофиты, преимущественно грампо
ложительные диплококки, реакция содержимого остается кислоіі
(pH 5,0-5,5).
Третья степень. Большое количество клеток эпителия, лейкоциты,
лактобациллы в незначительном количестве, разнообразная кокковая
флора; реакция содержимого слабокислая или основная (pH 6,0—7,2).
11.5. Бактериологическое исследование отделяемого... 601
Четвертая степень. Клетки эпителия, много лейкоцитов, разнооб¬
разная гноеродная флора при полном отсутствии влагалищной палоч¬
ки; реакция основная (pH выше 7,2).
В настоящее время очевидны условность данной классификации
и недостаточная ее информативность. В ней не учитываются мно¬
гообразие видов нормальной микрофлоры, их взаимоотношения, а
также возможное присутствие патогенных возбудителей, таких, как
гонококки, трихомонады, грибы, хламидии и др. Поэтому данная
классификация утратила свое практическое значение.
11.5.2. ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
ВЛАГАЛИЩА И ШЕЙКИ МАТКИ
Нарушение соотношения количества различных видов микроорга¬
низмов или видового состава ассоциаций бактерий влагалища приво¬
дит к возникновению в нем воспалительных процессов.
Все воспалительные процессы гениталий делят на неспецифичес¬
кие и специфические, вызванные инфекцией, передающейся половым
путем.
Неспецифические воспалительные процессы вызываются условно-
патогенной флорой и имеют две клинические формы — неспецифи¬
ческие вагиниты и бактериальный вагиноз.
Неспецифические вагиниты — инфекционно-воспалительные забо¬
левания влагалища, обусловленные действием условно-патогенных
микроорганизмов (кишечная палочка, стрепто-, стафилококки и др.).
При неспецифических вагинитах в мазках обнаруживается большое
количество лейкоцитов (от 30 до 60 и более в поле зрения), ключевые
клетки отсутствуют, но наблюдается достаточно много клеток слу-
щенного эпителия влагалища. Как правило, обнаруживают несколько
видов микроорганизмов. В целом микроскопическая картина харак¬
терна для воспалительного экссудата.
Бактериальный вагиноз — неспецифический (похожий на воспали¬
тельный) процесс, при котором во влалищном отделяемом не обнару¬
живаются патогенные возбудители (на его долю приходится 40—50%
всех инфекционных вагинитов). В настоящее время бактериальный
вагиноз рассматривается как дисбактериоз влагалища, в основе кото¬
рого лежит нарушение соотношения количества уровня различных
видов микроорганизмов или их видового состава.
602 Глава //. Бактериологические и паразитологические исследования
Наиболее информативным лабораторным методом диагностики
бактериального вагиноза является обнаружение в мазках, окрашен
ных по Граму, ключевых клеток (слущенных клеток влагалища, пок
рытых большим количеством мелких грамотринательных бактерий).
Эти клетки выявляются у 94,2% пациенток, в то время как у здоровых
женщин они не определяются. Кроме ключевых клеток, в пользу бак¬
териального вагиноза при бактериоскопии свидетельствует наличие
мелких бактерий при отсутствии лактобацилл.
Концентрация различных факультативных {Gardnerella vaginalis)
и анаэробных (бактероиды) бактерий при бактериальном вагинозе
выше, чем у здоровых женщин. Фактически общая концентрация
бактерий во влагалище возрастает до 1011 КОЕ/мл. Высокая кои
центрация этих бактерий влечет изменение состояния влагалища.
Уменьшение количества лактобацилл приводит к снижению образо
вания молочной кислоты и повышению pH. У больных бактериаль
ным вагинозом pH влагалища равен 5,0—7,5.
Gardnerella vaginalis (выявляется у 71—92% больных и составляс!
более 5% всех представителей микрофлоры) и другие анаэробы спо
собствуют интенсификации процессов отторжения эпителиальных
клеток, особенно в условиях алкалоза, что приводит к образованию
патогномоничных (характерных для данной патологии) ключевых
клеток.
Вследствие увеличения количества факультативных анаэробои
при бактериальном вагинозе возрастает продукция аномальных ами
нов (продукты метаболизма бактерий, содержащие азот). Амины при
повышении вагинального pH становятся летучими, обусловливая
типичный рыбный запах влагалищного отделяемого. Для его выяв¬
ления проводится аминотест. При добавлении 10% раствора КОН к
капле влагалищного секрета появляется этот специфический запах
(тест положительный).
Наличие большого количества лейкоцитов (признак воспалении)
в мазках из влагалища не является характерным для бактериального
вагиноза.
Критерии постановки диагноза бактериального вагиноза:
• клинические симптомы: жалобы на выделения из влагалища,
часто с неприятным запахом, усиливающиеся после менструации
и полового контакта, зуд, жжение в области гениталий;
• положительный аминотест;
• pH вагинального отделяемого более 4,5;
11.5. Бактериологическое исследование отделяемого... 603
• ключевые клетки в мазках, окрашенных по Граму;
• отсутствие в мазках лактобацилл;
• отсутствие в мазках признаков воспаления (нет или мало лейко¬
цитов).
Для установления диагноза необходимо наличие не менее двух из
перечисленных критериев.
Специфические воспалительные процессы гениталий вызываются
патогенными микроорганизмами. Наиболее часто специфические
(инфекционные) вагиниты обусловлены хламидиями, гонококками,
трихомонадами и грибами рода Candida.
Хламидиоз. Вохбудители хламидиоза — хламидии — облигатные
внутриклеточные паразиты (т.е. присутствуют только в клетках тка¬
ней), Их можно рассматривать как грамотрицательные бактерии,
которые утратили способность синтезировать АТФ и ряд других фер¬
ментов, иными словами, утрат вырабатывать метаболическую энер¬
гию. Этот дефект обусловливает их внутриклеточный рост, благодаря
которому они имеют доступ к богатым энергией промежуточным
продуктам метаболизма клеток хозяина.
У женщин хламидии вызывают цервициты, сальпингиты, воспа¬
лительные заболевания органов малого таза, уретрит, перигепатит.
В результате может развиваться бесплодие. Считается, что около 80%
трубного бесплодия вызвано хламидиями. При любой локализации
инфекции может развиваться соответствующая симптоматика забо¬
левания. В то же время болезнь может протекать бессимптомно (при¬
мерно у 50% женщин), но передаваться половым путем партнерам.
В настоящее время диагностика хламидийных инфекций основа¬
на на выделении возбудителя в культуре клеток (золотой стандарт).
Бактериологический метод является одним из наиболее чувствитель¬
ных и специфичных для диагностики хламидиоза. Однако он требует
специальной методики (выращивание на культуре ткани), которая
не всем доступна, поэтому используют методы, позволяющие обна¬
ружить антиген Chlamidia trachomatis в исследуемом материале (метод
флюоресцирующих антител, ИФА, ПЦР),
Гонорея. Возбудитель гонореи — гонококк. При исследовании вла¬
галищных мазков для гонореи характерны внутриклеточное располо¬
жение гонококков (в лейкоцитах), их бобовидная форма и отрицатель¬
ная окраска по Граму. Для окончательного подтверждения диагноза
проводят бактериологический посев отделяемого влагалища, выде¬
ление гонококков в чистой культуре и их идентификацию. Однако
604 Глава 11. Бактериологические и паразитологические исследования
выделить культуру гонококков довольно трудно. Это обусловлено их
слабой природной жизнеспособностью, которая не позволяет широ¬
ко использовать бактериологический метод (дaet положительные
результаты в 20—30% случаев). Поэтому применяют методы обнаруже¬
ния антигена гонококков (ИФА, ПЦР).
Трихомониаз относится к специфическим воспалительным
заболеваниям женских половых органов (на его долю приходится
15—20% всех инфекционных вагинитов). Заболевание вызывается
Trichomonas vaginalis — микроорганизмом, относящимся к простей¬
шим. Трихомонады способны давать выраженную воспалительную
реакцию с некрозом слизистой оболочки шейки матки и образова¬
нием эрозий. Диагностика трихомониаза основана на бактериоско-
пическом обнаружении влагалищных трихомонад. Следует отметить,
что не всегда при микроскопическом исследовании сразу удается
выявить трихомонады (только в 40—80%). Поэтому необходимо браті,
материал для исследования повторно.
Диспансерное наблюдение с исследованием мочи и отделяемого и »
влагалища у женщин, перенесших трихомониаз, должно проводиться
в течение не менее двух менструальных циклов.
Кандидоз гениталий вызывается дрожжеподобными грибами рода
Candida (на его долю приходится 20-25% всех инфекционных вагини¬
тов). Для диагностики кандидоза проводят микроскопическое иссле¬
дование взятого из очага поражения материала (результаты исследо¬
вания положительны в 40-60% случаев). В остром периоде кандидоза
гениталий лактобациллы в отделяемом из влагалища обнаруживаются
в незначительном количестве или отсутствуют (в среднем составляю!
16,6% всей микрофлоры), у 75% больных pH влагалища равен 5,0—5,5,
что является весьма информативным для диагностики кандидоза.
Присутствие мицелия и спор во влажных мазках, обработанных 10%
раствором КОН, подтверждает диагноз.
11.5.3. ОСОБЕННОСТИ ВЗЯТИЯ ОТДЕЛЯЕМОГО
ИЗ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ
ДЛЯ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Взятие биологического материала для бактериоскопического и
бактериологического (посев) исследований из влагалища и шейки
матки проводит врач-гинеколог. Медицинская сестра оказьіваеі
11.5. Бактериологическое исследование отделяемого... 605
врачу помощь при выполнении этой процедуры и должна знать осо¬
бенности взятия и приготовления биоматериала к исследованию.
После введения зеркала и подъемника во влагалище биоматери¬
ал для исследования берут стерильным ватным тампоном из зад¬
него свода или с патологически измененных участков слизистой
оболочки влагалища. Тампон погружают в стерильную пробирку
и закрывают стерильной пробкой. Биоматериал для бактериоло¬
гического посева должен быть взят до проведения мануального
обследования.
После обнажения шейки матки в зеркалах влагалищную часть ее
обрабатывают стерильным ватным тампоном, смоченным стериль¬
ным раствором 0,9% хлорида натрия или водой, после этого тонким
ватным тампоном (стерильным), осторожно введенным в шеечный
канал (не касаясь стенок влагалища), берут материал для исследо¬
вания. Тампон погружают в стерильную пробирку и закрывают сте¬
рильной пробкой.
Параллельно с взятием биологического материала на посев
следует приготовить мазки на стекле (не менее двух) для бакте¬
риоскопии. Биоматериал для мазков берут другим ватным тампо¬
ном (стерильным) и переносят на чистое предметное стекло. При
приготовлении необходимо равномерно распределить материал по
предметному стеклу мягкими движениями, не применяя грубого
втирания и резких штриховых движений тампоном. Такая техника
выполнения мазка позволяет клеткам распределяться слоями, не
повреждая их, сохраняя истинное распределение и количествен¬
ное соотношение компонентов взятого биоматериала, дает воз¬
можность наблюдать под микроскопом внутриклеточное располо¬
жение бактерий (например, гонококков). После высушивания при
комнатной температуре мазки покрывают чистым предметным
стеклом (или помещают в чашку Петри), четко маркируют с указа¬
нием данных пациента и места взятия биоматериала и отправляют
в лабораторию. Хранение влажного мазка, сдавленного между
двумя предметными стеклами, недопустимо.
Взятый биологический материал должен быть доставлен в лабора¬
торию в ближайшие 1—2 ч. При невозможности выполнить эти тре¬
бования тампоны с биоматериалом для бактериологического посева
необходимо поместить в специальную транспортную среду (обеспе¬
чивает сохранность биоматериала в течение 24 ч). Хранить взятые
пробы нужно в холодильнике.
606 Глава 11. Бактериологические и паразитологические исследования
11.6. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
МОКРОТЫ
«
Сбор мокроты для бактериологического исследования применяю!
в клинической практике для установления этиологии гнойно-вос
палительных заболеваний нижних дыхательных путей (пневмония,
бронхит, плеврит, бронхоэктатическая болезнь, абсцесс легкого и др.).
Своевременная идентификация инфекционного возбудителя очет.
важна и для правильного выбора антибактериального препарата для
лечения больного.
Возбудителями гнойно-воспалительных процессов нижних дыха
тельных путей могут быть бактерии, микоплазмы, риккетсии, грибм
и простейшие. Наиболее частыми возбудителями среди бактерий
являются Staphylococcus pneumoniae. Staphylococcus aureus, Klebsiella
pneumoniae и др.
Для бактериологического исследования мокроту следует собира! i.
до начала антибактериальной терапии или после введения препара
та через определенный промежуток времени, необходимый для еи)
выведения из организма больного (перед введением очередной доаы
препарата). Собирают утреннюю порцию мокроты и немедленно
отправляют в лабораторию. Можно хранить мокроту до отправки и
лабораторию в холодильнике при 4 °С не более 2—3 ч.
Бактериологическое исследование мокроты включает приготои
ление и бактериоскопию мазка мокроты и бактериологический поссм
для получения чистой культуры.
Окраска мазка мокроты по Граму — наиболее распространенный
метод окраски всех видов материала, полученного от больного с
заболеванием нижних дыхательных путей (мокрота, бронхоальвео
лярный смыв и др.), для быстрого и ориентировочного установленИ1
инфекционного агента. С помощью бактериоскопии мазка мокроты,
окрашенного по Граму, проводят предварительную оценку возможно
го этиологического агента. Мазок мокроты исследуют до посева ее па
питательные среды также и с целью оценки пригодности для культи ин
рования и идентификации вероятного возбудителя. Мокроту считаю!
пригодной, если в мазке, окрашенном по Граму, при малом увеличс
НИИ микроскопа обнаруживают более 25 лейкоцитов и менее 10 эни
телиальных клеток в поле зрения. Признаками качественного образна
мокроты, который можно использовать для культивирования, явля
ются преобладание в ней лейкоцитов над эпителиальными клетками.
11.7. Паразитологические исследования 607
а также наличие бактерий одного вида, которые располагаются внут¬
ри лейкоцитов или вокруг них. Грамположительные бактерии в пре¬
парате имеют темно-синюю окраску, грамотрицательные — розовую.
Возбудители атипичных пневмоний (микоплазмы, легионеллы, рик-
кетсии и хламидии) не окрашиваются по Граму, поэтому для их выяв¬
ления в основном используются серологические методы.
Посев мокроты производят^на питательные среды, которые инку¬
бируют при 37 °С в течение 18—24 ч. Из выросших колоний выделяют
чистую культуру, идентифицируют бактерии и определяют чувстви¬
тельность к антибактериальным препаратам.
Окраску мазков мокроты по Цилю-Нильсену используют для
идентификации кислотоустойчивых бацилл, в первую очередь мико¬
бактерий туберкулеза. Препарат готовят из гнойных частиц мокроты,
которые выбирают из 4—6 разных мест. Отобранные частицы тща¬
тельно растирают между 2 предметными стеклами до гомогенной
массы. Высушивают на воздухе, фиксируют над пламенем горел¬
ки. Микобактерии туберкулеза окрашиваются в красный цвет, все
остальные элементы мокроты и бактерии — в синий. Микобактерии
туберкулеза имеют вид тонких, слегка изогнутых палочек различной
длины, с утолщениями на концах или посередине, расположенных
группами и поодиночке. Обнаружение микобактерий туберкуле¬
за является наиболее достоверным признаком туберкулеза легких.
Метод окраски мазков по Цилю—Нильсену при активных формах
туберкулеза легких обладает чувствительностью 50% и специфичнос¬
тью 80-85%.
Бактериологический посев мокроты на микобактерии туберкулеза
используют для подтверждения этиологии заболевания легких. Это
достаточно длительное исследование, так как микобактерии растут
медленно, поэтому окончательный результат бактериологического
исследования лаборатория выдает примерно через 45 дней.
11.7. ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Паразитологические исследования назначаются больным не так
часто. Однако есть ряд анализов, с которыми медицинская сестра пос¬
тоянно сталкивается в своей работе. К таким лабораторным тестам
относится исследование крови на выявление малярии и кала на нали-
608 Глава 11. Бактериологические и паразитологические исследования
чиє яиц гельминтов. Каждое исследование имеет свои особенности,
которые необходимо знать медицинской сестре и использовать для
правильной подготовки пациента к обследованию. .
11.7.1. ИССЛЕДОВАНИЕ КРОВИ НА ВЫЯВЛЕНИЕ МАЛЯРИИ
Малярия — острое заболевание, которое вызывают малярийные
плазмодии (кровепаразиты-простейшие). Оно характеризуется лихо
радочными приступами, анемией, увеличением печени и селезенки.
Малярийные плазмодии — наиболее распространенные предста
вители простейших кровепаразитов. Они поочередно паразитируюі
в 2 хозяевах: в организме самки комара рода Anopheles, в котором осу¬
ществляется половое размножение (спорогония), и в организме чело¬
века, где происходит бесполое размножение (шизогония). Начальная
фаза размножения паразитов в организме человека происходит в кле i -
ках печени — гепатоцитах (экстраэритроцитарная шизогония), после
дующая — в эритроцитах (эритроцитарная шизогония). Развиваясь и
эритроцитах, плазмодии питаются гемоглобином и разрушают пора¬
женные эритроциты. Все патологические проявления малярии (при¬
ступы лихорадки, анемия, спленомегалия, поражение центральной
нервной системы при тропической форме малярии) целиком связаны
с массовым разрушением эритроцитов.
Паразитологическая диагностика малярии основана на обнаруже¬
нии бесполых и половых форм возбудителя при микроскопическом
исследовании крови, что возможно только в период его развития и
эритроците. Для обнаружения плазмодиев и определения их вила
используют препараты крови, приготовленные методом тонкого мазка
и толстой капли, окрашенные по Романовскому—Гимзе. Оба метода,
имеющие свои преимущества и недостатки, являются взаимодополня¬
ющими. Обнаружение в мазке крови или толстой капле любых стадий
плазмодиев (даже 1 паразита), развивающихся в эритроцитах, явля¬
ется единственным бесспорным доказательством наличия малярии.
Следует иметь в виду, что объем исследуемой крови в толстой капле и
20—40 раз больше, чем в тонком мазке, поэтому положительный отисг
можно дать даже после исследования мазка, а отрицательный — толь¬
ко после исследования толстой капли с иммерсионным объективом и
течение минимум 5 мин с просмотром не менее 100 полей зрения (стан¬
дарт ВОЗ). Если при подозрении на малярию при однократном исслело-
I
//. 7. Паразитологические исследования 609
вании плазмодиев в крови обнаружить не удается, иногда необходимо
проведение многократных исследований (при Malaria tropica мазки
крови следует брать каждые 6 ч на протяжении всего приступа).
Взятие проб крови для исследования на выявление малярии
• Кровь для паразитологического исследования берут из пальца
руки (у взрослых — из безымянного, у детей — из большого, у
новорожденных — из бол1ьшого пальца ноги, но не мочки уха).
• Периферическую кровь для исследования берут вне зависимости
от температуры тела и клинических проявлений.
• Для прокола кожи пальца используют стерильные одноразовые
скарификаторы или специальные стерильные иглы разового
использования.
• В целях безопасности пациента взятие крови на малярию произ¬
водят на стерильные предметные стекла, так как во время взятия
крови возможно их касание с местом прокола.
• Перед проколом кожу пальца тщательно протирают ватным тампо¬
ном, смоченным 70% спиртом, чем достигается не только предуп¬
реждение инфицирования места прокола, но и попадание с кожи
пальца бактерий, различных посторонних частиц на препарат
крови, которые могут затруднить диагностику при микроскопии.
• Первую каплю крови, выступившую после прокола, вытирают
сухим стерильным ватным тампоном, чтобы избежать фиксации
эритроцитов остатками спирта, которым дезинфицировали кожу,
• Последующие капли (выступающие самостоятельно или при
надавливании на палец массирующими движениями) использу¬
ют для приготовления препаратов крови. При этом кровь заби¬
рают в стерильный сухой гематологический капилляр, из кото¬
рого быстро переносят на предметное стекло, либо выступившую
кровь непосредственно из прокола пальца наносят на предметные
стекла. Если кровь набирают в капилляр, то можно использовать
нестерильные предметные стекла.
• От одного пациента готовят не менее 2—3 стекол с толстыми
каплями и 2—3 тонких мазка крови. Рекомендуется первоначаль¬
но окрасить по одному стеклу с тем, чтобы иметь возможность
исправить дефекты окраски.
Метод толстой капли
• На предметное стекло наносят каплю крови диаметром около
5 мм, кровь распределяют в равномерный диск или прямоуголь¬
ник размером 1-1,5 см. На краю стекла делают мазок в виде
610 Глава 11. Бактериологические и паразитологические исследования
полоски крови для маркировки препарата, при массовых обслс
дованиях делают две полоски, где наносят маркировку.
• Все препараты высушивают на воздухе. Для ускорения высыхания
толстых капель можно использовать обычный комнатный венти
лятор. Высушивание на солнце, огне или любом другом источим
ке тепла исключается, так как препарат становится непригодным
для исследования.
Метод тонкого мазка
• На край предметного стекла, отступив 0,5-1 см, наносят неболь
шую каплю крови (объемом в 5-10 раз меньше, чем для препарат
с толстой каплей). Предметное стекло с нанесенной каплей кла
дут на горизонтальную поверхность стола, при этом край стекла с
каплей крови должен быть справа.
• Двумя пальцами левой руки предметное стекло за боковые пове|і
хности фиксируют на столе.
• Край шлифованного стекла (фиксированного в правой руке) ста
вят под углом 45° к предметному стеклу, прикасаясь к левому краіо
капли крови.
• После того, как капля растекается по касательной линии в мест
соприкосновения обоих стекол, шлифованное стекло быстрым
движением продвигают справа налево к противоположному кран»
предметного стекла, постепенно ослабляя давление на предметное
стекло, что позволяет закончить тонкий мазок бахромчатой час
тью, где наиболее четко видны специфические особенности мор
фологии паразитов и изменения пораженных эритроцитов. Мазок
крови должен быть тонким, равномерным, не доходить до конца и
краев предметного стекла, заканчиваться бахромчатым краем.
• Если угол наклона шлифованного стекла увеличить, то мазок
получится коротким и толстым с расположением эритроцитоп
в несколько слоев (это маскирует некоторых паразитов, а также
приводит к их деформации); если уменьшить угол наклона, ю
трудно создать бахромчатую часть мазка. Качество тонкого мазкя
зависит также от правильной подготовки предметного стекла п
равномерности края шлифованного стекла.
Маркировка препаратов крови
• Высохшие препараты крови маркируют простым карандашом (он
не смывается во время фиксации и окрашивания).
• Маркировка включает фамилию и инициалы пациента или номер
истории болезни (можно номер страхового полиса), или порядки
11.7. Паразитологические исследования 611
вый номер по списку обследуемого и обязательно дату взятия
крови.
• Препарат с толстой каплей, приготовленный непосредственно на
предметном стекле, маркируют на полоске крови.
• Тонкий мазок маркируют в толстой части (не следует делать над¬
пись вдоль всего мазка).
При исследовании препараГов крови в лаборатории у больных
могут быть выявлены следующие виды плазмодиев:
• Р. falciparum — Malaria tropica — возбудитель тропической лихорадки,
наиболее опасной формы малярии, требующей срочного лечения;
• Р. vivax — Malaria tertiana — возбудитель трехдневной лихорадки;
• Р. malariae — Malaria quartana — возбудитель четырехдневной лихо¬
радки;
• Р. ovale — типа Malaria tertiana — вызывает трехдневную лихорадку.
Цикл размножения паразитов в эритроцитах (эритроцитарная
шизогония) повторяется у Р. falciparum, Р. vivax и Р. ovale каждые 48 ч,
у Р. malariae — 72 ч. Малярийные приступы развиваются на той фазе
цикла эритроцитарной шизогонии, когда основная масса поражен¬
ных эритроцитов разрушается и вышедшие из них дочерние особи
плазмодиев инвазируют интактные эритроциты.
При острых приступах малярии имеется определенная закономер¬
ность изменений крови. Во время озноба появляется нейтрофиль-
ный лейкоцитоз со сдвигом влево, в период лихорадки количество
лейкоцитов несколько уменьшается. При появлении пота и сниже¬
нии температуры тела нарастает моноцитоз. В дальнейшем после
2—4 приступов появляется анемия, которая особенно рано и быстро
развивается при тропической лихорадке. Анемия носит в основном
гемолитический характер и сопровождается повышением содержания
ретикулоцитов. При присоединении угнетения костного мозга коли¬
чество ретикулоцитов уменьшается. СОЭ при малярии значительно
повышается.
В межприступном (безлихорадочном) периоде в крови при всех фор¬
мах малярии постоянно присутствуют те или иные стадии плазмодиев.
В связи с этим нет необходимости брать кровь на исследование только на
высоте малярийного приступа, а можно исследовать ее в любое время.
Интенсивность паразитемии оценивают методом толстой капли в
расчете на 1 мкл крови.
Контроль за эффективностью лечения проводят методом толстой
капли крови с подсчетом паразитов в 1 мкл крови. Исследование необ-
612 Глава 11. Бактериологические и паразитологические исследования
ходимо выполнять ежедневно с 1-го по 7-й день от начала химиотера
ПИИ. При исчезновении паразитов в течение этого периода дальнейшее
исследование крови проводят на 14, 21 и 28-й дни от начала лечения.
При выявлении резистентности возбудителя малярии к лекарствен
ным средствам (оценивают по уровню паразитемии) и соответственно
неэффективности лечения противомалярийный препарат заменяюі
препаратом другой группы и исследование крови проводят по той же
схеме (рекомендации ВОЗ, 1994).
За больными, перенесшими тропическую малярию, устанавли
вают диспансерное наблюдение в течение 1-2 мес, при этом с интер
валом 1—2 нед проводят паразитологическое исследование крони
Диспансеризацию больных, перенесших малярию, вызванную
Р. vivax, Р. ovale и Р. malariae, следует проводить в течение 2 лет. Любо«'
повышение температуры тела у этих лиц требует лабораторного иссле
дования крови с целью обнаружения малярийных плазмодиев.
П.7.2. ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ КАЛА
Паразитологические исследования кала широко используются кяк
для целенаправленной диагностики гельминтозов и оценки эффек
тивности их лечения, так и в качестве скрининговых исследований
для массового обследования населения. Они включают анализ кала
на наличие яиц гельминтов (глистов) и обнаружение яиц острим
(целенаправленное исследование на энтеробиоз).
11.7.2.1. Исследование кала на яйца гельминтов (глистов)
Гельминтрзами называются болезни, вызываемые паразитически
ми червями, или гельминтами. Гельминты (более распространеншп'
название — «глисты») используют в качестве среды обитания орга
низм человека.
Человек, в кишечнике которого паразитируют самки и самцы
гельминтов, является единственным источником заражения для дру
тих людей. Зрелая самка способна отложить до 250 ООО яиц в сутки,
причем откладываться могут как оплодотворенные, так и неоплодо ї
воренные яйца. Неоплодотворенные яйца не могут вызвать инвазию
Во внешнюю среду с калом выделяются незрелые яйца гельминтом,
которые созревают только при благоприятной для развития темпера
туре и влажности.
ti.7. Паразитологические исследования 613
Заражение происходит при проглатывании зрелых яиц. Основное
значение имеют овощи, на поверхности которых имеются частицы
почвы. В настоящее время большую опасность для распространения
гельминтозов имеют садово-огородные участки, где используются не
обезвреженные фекалии человека для удобрения почвы.
Паразитирующие у человека черви принадлежат к одному из двух
подтипов — круглым илй плоским. Последние в свою очередь делятся
на ленточных червей и сосальщиков.
Наиболее часто обнаруживают яйца следующих гельминтов;
• круглых червей: аскарида {Ascaris lumbricoides), власоглава
{Trichocephalus trichiurus), том и икса {Thominx aerofdus), кривоголов-
ки двенадцатиперстной {Ancylostoma duodenale), некатора {Necaîor
americanus), трихостронгилиды {Trichostrongylidea);
• сосальщики: двуустки печеночной {Fasciola hepatica), дву¬
устки кошачьей {Opisthorchis felineus), двуустки ланцетовид¬
ной {Dicrocoelium lanceatum), шистосомы {Schistosoma mansoni и
japonicum)’,
• ленточных червей: цепня невооруженного {Taeniarhynchus
saginatus), цепня вооруженного {Taenia solium), лентеца широкого
{Diphyllobothrium latum), лентеца малого {Diphyllobothrium minus).
Действие гельминтов на организм человека многообразно. Они
могут вызывать токсические и токсико-аллергические реакции (аска¬
риды, трихинеллы), оказывать механическое воздействие, травмируя
стенку кишечника; паразиты (например, анкилостомы) могут вызы¬
вать кровотечения, приводящие к анемии, а также способствовать
проникновению патогенных микробов из содержимого кишечника
в кровь; они могут закрывать просвет как кишок, так и выводных
протоков печени и поджелудочной железы (аскариды), приводить к
различным нарушениям обмена веществ и авитаминозу (авитаминоз
Bi2 при инвазии широким лентецом).
Наиболее общие клинические признаки гельминтоза — явления
длительной интоксикации: слабость, вялость, снижение работос¬
пособности, аппетита, утрата радости жизни, похудание, анемия.
Периодически отмечается небольшое (не выше 38° С) повышение тем¬
пературы тела, могут наблюдаться расстройства стула, неприятные
ощущения, тяжесть в правом подреберье, непереносимость каких-
либо пищевых продуктов.
Особенности сбора кала. Фекалии для исследования необходимо
собирать в чистую стеклянную или пластиковую посуду и доставлять
614 Глава //. Бактериологические и паразитологические исследования
в лабораторию свежими (желательно в теплом виде). В настоящее
время имеется различные одноразовые фирменные пластиковые ком
тегінерьі с ложечкой и завинчивающейся крышкой, которые позволя
ют легко собирать пробы кала. Объем фекалий должен быть не менее
•Д пластикового контейнера, так как небольшие порции испраж
нений быстро высыхают и яйца гельминтов в них деформируются.
Лаборатория должна исследовать кал в день доставки пробы.
При необходимости длительного хранения проб кала, а также е
целью исключения влияния неблагоприятных условий при транс
портировке, которые могут привести к деформации яиц гельмим
тов, рекомендуется использовать химикаты для их консервации
Хорошими консервирующими свойствами обладают 1-1,5% растворы
стиральных порошков. Растворы стиральных порошков и проб кал:і
необходимо использовать в соотношении 1:5.
Микроскопическое исследование кала является прямым методом
обнаружения гельминтов, их фрагментов, яиц и личинок гельминтов.
При наличии яиц гельминтов в кале по их морфологическим
особенностям устанавливают вид гельминтов. При однократном
исследовании процент выявления в кале гельминтоносителсй
яиц сравнительно невысок. Поэтому отрицательный результаї
однократного исследования кала на яйца гельминтов еще не сви
детельствует о действительном отсутствии гельминтоношения,
Отрицательные результаты даже повторных исследований кала
на яйца гельминтов не могут категорически исключить наличие
гельминтной инвазии.
Для контроля эффективности лечения гельминтозов кишечника
кал исследуют через 1 мес после окончания лечения. При первом
отрицательном результате исследования фекалий пробы отбираюі
еще 2 раза с интервалом 2—4 дня, после чего выдают окончательный
результат лабораторного анализа.
11.7.2.2. Исследование соскоба с перианальных складок на энтеробиоз
Энтеробиоз {enterobius vermicularis от греч. enteron — кишечник.
bios — жизнь, vermicularis от лат. vermis — червь) — самый распростри
ненный гельминтоз не только в России, но и во многих странах мира
с умеренным и холодным климатом.
Дети составляют основную группу зараженных энтеробиозом
чаще всего заражение происходит в возрасте от 3 до 10—14 леї.
Максимальная пораженность отмечается у детей в возрасте 4-6 лет.
//. 7. Паразитологические исследования 615
Основные клинические симптомы энтеробиоза:
• боли в животе;
• частая тошнота, рвота;
• утомляемость, раздражительность, тревожный сон, скрип во сне
зубами;
• аллергические состояния;
• перианальный зуд; '
• вульвовагинит — воспаление слизистой оболочки влагалища;
• инфекции мочевыводящих путей;
• отставание в росте, массе тела.
Исследование соскоба с перианальных складок на энтеро¬
биоз — целенаправленное исследование на обнаружение яиц остриц
{Enterobius vermicular is).
Яйца остриц в кале находят редко. Зрелые самки остриц отклады¬
вают яйца не в кале, а выползают (что сопровождается кожным зудом)
для кладки яиц в складки вокруг заднего прохода. Поэтому яйца этого
паразита легче обнаружить в соскобе со складок вокруг заднего про¬
хода или в ректальной слизи. Взятие биологического материала для
исследования на энтеробиоз осуществляет медицинская сестра.
Особенности сбора биологического материала. Для получения био¬
логического материала используют различные методы.
Соскоб с перианальных складок можно получить с помощью дере¬
вянного шпателя. Его производят утром до дефекации. У детей соскоб
лучше производить вечером, через 2—3 ч после того как ребенок лег
спать. Шпатель перед соскабливанием смачивают 50% раствором
глицерина или 1% раствором гидрокарбоната натрия. Полученный
материал вместе со шпателем помещают в чистую стеклянную или
пластиковую емкость и доставляют в лабораторию.
Материал с перианальных складок можно собрать, используя
ватный тампон на палочке, смоченной 50% раствором глицерина.
Условия сбора биоматериала аналогичны приведенным выше. Сбор
биоматериала осуществляется тампоном с поверхности перианальных
складок у ануса и из нижних отделов прямой кишки. Палочку с там¬
поном помещают в пробирку и доставляют в лабораторию.
Взятие биоматериала может быть осуществлено с использованием спе¬
циальной липкой ленты. Ленту клейкой поверхностью наносят на кожу
перианальных складок у ануса, а затем снимают и переносят (наклеивают)
на предметное стекло (лучше брать несколько проб). Предметное стекло
помещают в специальный контейнер и доставляют в лабораторию.
616 Глава //. Бактериологические и паразитологические исследования
Согласно существующим в настоящее время руководящим доку¬
ментам (санитарно-эпидемиологические правила «Профилактика
энтеробиоза. СП 3.2.1317—03», утвержденные Главным государствен
ным санитарным врачом Российской Федерации 24 апреля 2003 г.),
обследованию на энтеробиоз подлежат:
• дети дошкольных образовательных учреждений;
• персонал дошкольных образовательных учреждений;
• школьники младших классов;
• дети, подростки, декретированные контингенты при диспансс
ризации и профилактических осмотрах;
• дети, подростки по эпидемиологическим показаниям (часто
болеющие острыми кишечными инфекциями, проживающие II
антисанитарных условиях и социально неблагополучных семьях
и т.п.);
• дети и подростки, оформляющиеся в дошкольные образовател 1.
ные учреждения (организации), приюты, дома ребенка, детские
дома, школы-интернаты, на санаторно-курортное лечение, и
оздоровительные лагеря, в детские отделения лечебно-профилак
тических организаций;
• дети всех возрастов учреждений закрытого типа и круглосуточно
го пребывания;
• амбулаторные и стационарные больные детских поликлиник и
больниц;
• дети дошкольного и младшего школьного возраста, посещающие
плавательные бассейны, в соответствии с нормативными доку
ментами;
• декретированные и приравненные к ним контингенты;
• лица, контактные с больным (паразитоносителем) энтеробиозом.
Обследование амбулаторных больных проводят при их обращении к
врачу по поводу клинических проявления энтеробиоза. При поступлении
в стационар обследованию на энтеробиоз подлежат все дети дошкольного
и младшего школьного возраста вне зависимости от клинических прояи
лений и профиля лечебно-профилактической организации.
Всем пациентам, у которых выявлены яйца остриц, проводят лече¬
ние. После его окончания осуществляют контроль эффективности
лечения. Контрольное обследование больных с выраженной клини¬
ческой симптоматикой проводят троекратно с интервалом 1-2 дня.
Первое контрольное обследование назначают через 6—7 дней после
окончания курса лечения.
11.7. Паразитологические исследования 617
Контроль эффективности лечения после плановых профилак¬
тических обследований проводят выборочно и однократно через
6-7 дней после окончания лечения. Лиц, контактных с больным энте¬
робиозом в семейных очагах, обследуют на энтеробиоз или им прово¬
дят химиопрофилактику без обследования.
ПРИЛОЖЕНИЕ
ПРИЛОЖЕНИЕ 1
УТВЕРЖДАЮ
Руководитель Федеральной
службы по надзору в сфере
защиты прав потребителей
и благополучия человека,
Главный государственный
санитарный врач
Российской Федерации
ГГ. ОНИЩЕНКО
23 декабря 2005 і.
Дата введения:
I июля 2006 I.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
ТЕХНИКА СБОРА И ТРАНСПОРТИРОВАНИЯ БИОМАТЕРИАЛОВ
В МИКРОБИОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ МУ 4.2.2039-05
1. Разработаны: МОНИКИ им. М.Ф. Владимирского (К.И. Савиц¬
кая, Е.Е. Круглов); главным бактериологом Министерства здравоохра¬
нения и социального развития Российской Федерации (В.В.Кутырен);
Центральным научно-исследовательским институтом эпидемиоло¬
гии (Н.А.Семина, В.В. Галкин); ФГУЗ «Федеральный центр гигиенм
Приложение 619
и эпидемиологии» Роспотребнадзора (Е.Н. Беляев, И.В. Брагина,
H.С. Кривопалова); Научно-исследовательским институтом антимик¬
робной химиотерапии Смоленской государственной медицинской
академии (Л.С. Страчунский, P.C. Козлов); Научно-исследователь¬
ским институтом вирусологии им. Д.И.Ивановского (Л.В. Урываев);
Институтом медицинской паразитологии и тропической медицины
им. Е.И. Марциновского ММА им. И.М. Сеченова (В.П. Сергиев,
М.Н. Лебедева); Федеральной службой по надзору в сфере защиты
прав потребителей и благополучия человека (З.С. Середа).
2. Рекомендованы к утверждению Комиссией по государственному
санитарно-гигиеническому нормированию при Федеральной службе
по надзору в сфере защиты прав потребителей и благополучия челове¬
ка 6 октября 2005 г. (протокол N 3).
3. Утверждены и введены в действие руководителем Федеральной
службы по надзору в сфере защиты прав потребителей и благополучия
человека, главным государственным санитарным врачом Российской
Федерации Г.Г. Онищенко 23 декабря 2005 г.
4. Введены в действие с 1 июля 2006 г.
5. Введены впервые.
I. Область применения
1.1. В методических указаниях изложены правила сбора и транс¬
портирования биологических материалов в микробиологические
лаборатории в целях повышения качества результатов лабораторных
исследований и организации противоэпидемических и профилак¬
тических мероприятий, а также профилактики внутрибольничных
инфекций у медицинского персонала и пациентов.
1.2. Методические указания предназначены для использования
органами и организациями Федеральной службы по надзору в сфере
защиты прав потребителей и благополучия человека, а также могут
использоваться органами и организациями здравоохранения.
2. Общие положения
2.1, Получение достоверных данных о выявлении источников зара¬
жения необходимо для своевременной и эффективной организации
противоэпидемических и профилактических мероприятий, оценки
уровня пораженности населения при проведении эпидемиологичес¬
кого надзора.
620 Приложение
2.2. Разработанная техника сбора и транспортирования биологи
ческих материалов в микробиологические лаборатории позволит спи
зить уровень преаналитической ошибки и повысит^ качество работы
лабораторий по объективизации результатов.
2.3. Методические указания определяют правила предохранении
медицинского персонала и пациентов от инфицирования при сборе
и доставке в лаборатории проб биоматериалов, которые могут бы 11.
обсеменены бактериями, грибами, вирусами, паразитами.
2.4. Методические указания могут применяться при проведении
эпидемиологического надзора за антимикробной резистентностью
выделенных и идентифицированных в лаборатории возбудителей
инфекции, оптимизации применения антимикробных препаратов и
мероприятий в области профилактики, контроля и сдерживания резис-
тентности на локальном, региональном и национальном уровнях.
3. Общие требования к сбору проб биологического материала
для микробиологического исследования
3.1. Для предохранения от инфицирования медицинского пер
сонала и пациентов при сборе проб биоматериалов и доставке его и
лабораторию необходимо:
— не загрязнять наружную поверхность посуды при сборе и
доставке проб;
— не загрязнять сопроводительные документы (направления);
— свести к минимуму непосредственный контакт пробы биома
териала с руками медицинского работника, собирающего и
доставляющего его в лабораторию;
— использовать стерильные одноразовые или разрешенные к
применению для этих целей в установленном порядке контей
неры (емкости) для сбора, хранения и доставки проб;
— транспортировать пробы в переносках или укладках с раздел!,
ными гнездами;
— соблюдать асептические условия для предотвращения инфи
цирования пациента в процессе выполнения инвазивных
мероприятий;
— собирать пробы в стерильную одноразовую или стекляннук»
посуду (не загрязненную биоматериалом, не испорченную трс
шинами, отколотыми краями и другими дефектами).
3.2. Пробы биоматериала необходимо собирать следующим
образом:
Приложение 621
— до начала антибактериальной терапии, при отсутствии такой
возможности — непосредственно перед повторным введением
(приемом) препаратов;
— в количестве (вес, объем), необходимом для выполнения ана¬
лиза, т.к. недостаточное для исследования количество биома¬
териала приводит к получению ложных результатов;
— с минимальным зaVpязнeниeм материала нормальной мик¬
рофлорой, т.к. ее наличие приводит к ошибочной трактовке
результатов, полученных, например, при исследовании мокро¬
ты, проб из носа, глотки (зева), гениталий и др.
3.3. При сборе пробы следят за тем, чтобы в лаборатории при
вскрытии емкости с биоматериалом не образовывался аэрозоль:
пробы крови и других жидкостей организма аккуратно, без образова¬
ния пены переносят из шприца в сухую и/или наполненную средой
(антикоагулянтом) посуду.
3.4. В направлении на исследование указывают: фамилию, имя,
отчество больного; год рождения; отделение, в котором он находится;
номер истории болезни (амбулаторной карты); диагноз; материал,
посылаемый на исследование, и задачи исследования; дату и время
взятия материала (часы); антибактериальные (иммунные) препараты,
если проба сдается на фоне антибиотико- и/или иммунотерапии;
фамилию, имя, отчество лечащего врача (консультанта), направляю¬
щего пробу на исследование. При направлении биоматериалов, полу¬
ченных при вскрытии, указывают также отделение, в котором умер
больной,
3.5. Перед сбором пробы, особенно при применении инвазивных
методов, учитываются вероятность риска для пациента и пользы,
а также значимость именно данного вида биоматериала для целей
объективизации клинического диагноза и оценки проводимых или
планируемых лечебных мероприятий.
4. Общие требования к доставке проб биоматериала в микробиологи¬
ческую лабораторию
4.1. Все собранные пробы отправляют в микробиологическую
лабораторию немедленно после получения, за исключением случаев
использования емкостей с транспортировочными средами, разре¬
шенными к применению для этих целей в Российской Федерации в
установленном порядке.
622 Приложение
Это необходимо для:
— сохранения жизнеспособности возбудителей и возможное
ти выделения микроорганизмов, требующих рсобых условий
культивирования {Haemophilus и др.);
— предотвращения избыточного роста быстрорастущих и актив
ных микроорганизмов;
— поддержания соотношения исходных концентраций изолятов
при наличии в пробе микробных ассоциаций;
— сокращения времени контакта пробы с некоторыми антисеи
тиками, используемыми местно, которые могут обладать анти
бактериальной активностью;
— объективизации клинического диагноза инфекционно-воспа
лительного заболевания и оценки результатов терапии.
4.2. Допускается использование альтернативных методов для уве
личения сроков доставки биоматериала в лабораторию.
Пробы хранят в холодильнике при температуре 2—8 °С, за исключе
нием нижеперечисленных случаев.
4.2.1. Когда пробу хранят в специализированной транспорти
ровочной емкости (транспортировочная система), разрешенноп
к применению в установленном порядке, представляющей собой
стерильную одноразовую пробирку с агаризованной или жидкой
транспортировочной средой и зондом-тампоном, вмонтированным
в пробку и стерильно упакованным вместе с пробиркой. В таки.ч
емкостях пробы хранят при комнатной температуре (18—20 °С).
Транспортировочные среды, специальные плотные с активирован¬
ным углем и без него, позволяют обеспечить сохранение жизнеспо
собности микроорганизмов, требующих особых условий культиви¬
рования, в течение 48-72 ч.
Для проб на анаэробы и для фекальной флоры используют специ
альные емкости с транспортировочной средой, пробирки со средами
для выделения кампилобактерий и хеликобактера, разрешенные к
применению в установленном порядке. Такие среды создают анабио
тическую атмосферу для микроорганизмов, что способствует снижс
нию их метаболизма, сдерживанию роста, препятствует их высыха
нию и накоплению продуктов жизнедеятельности.
Каждую пробу, собранную в жидкую среду, тщательно перемеши
вают со средой.
4.2.2. Когда кровь культивируют в бульоне, тогда после получения
пробу хранят в термостате при температуре 35—37 °С.
Приложение 623
Если пробы собирают в специальные емкости для последующего
исследования с двухфазной средой, их следует хранить при комнатной
температуре (18—20 °С).
4.2.3. Когда при возможном наличии температурозависимых мик¬
роорганизмов {Neisseria sp.) пробы оставляют при комнатной темпера¬
туре (18-20 °С).
4.2.4. Когда пробу храня"^ в емкостях с соответствующими пита¬
тельными средами, подготовленных в лаборатории или разрешенных
к применению в установленном порядке при проведении:
— бактериологических исследований — в пробирках с вмонтиро¬
ванными зондами-тампонами или без них со средой, состоящей
из забуференного физиологического раствора с глицерином
для определения энтеробактерий семейства Кишечных («на
дизгруппу») и аэромонад. При работе с тампонами, вмонти¬
рованными в ватно-марлевую пробку, следят за тем, чтобы не
замочить (не загрязнить) пробку средой и/или собранным мате¬
риалом. Собранную пробу тщательно перемешивают со средой.
Используют также готовые пробирки со специальной плотной
средой, разрешенные к применению в установленном порядке;
— вирусологических исследований — в специальных емкостях с
жидкой средой, разрешенных к применению в уст-ном порядке;
— паразитологических исследований — пробу тщательно смеши¬
вают с консервантом.
Пробы ликвора хранят при комнатной температуре (18—20 °С), а
при проведении в лаборатории вирусологических исследований — в
термостате при 35—37 °С.
4.3. Для транспортирования проб, исследуемых на наличие аэро¬
бов и факультативных анаэробов, используют:
— одноразовые стерильные сухие пробирки с вмонтированным
зондом-тампоном (тубсеры) или емкости с транспортиро¬
вочной средой, разрешенные к применению для этих целей в
Российской Федерации в установленном порядке; допускается
использование стерильных стеклянных пробирок, укупорен¬
ных газопроницаемой пробкой с вмонтированным зондом-
тампоном, приготовленных в лаборатории;
— одноразовые стерильные емкости с завинчивающейся крыш¬
кой (допускаются стеклянные с газопроницаемой пробкой) —
для сбора проб мочи, мокроты, фекалий, бронхоальвеолярного
лаважа, биопсийного (кусочки ткани) материала;
624 Приложение
- стерильные одноразовые с завинчивающейся пробкой или
стеклянные пробирки — для сбора стерильных жидкостей,
бронхоальвеолярного лаважа, отделяемого рз дренажей или
соскобов;
- стерильные чащки Петри — для сбора проб волос или для
транспортирования соскобов с маркировкой дна чашки;
- специальные стерильные носоглоточные и урогенитальные
зонды-тампоны с осью из алюминия (диаметр оси 0,9 мм) и
маленьким тампоном из хлопка или вискозы на кончике (диа¬
метр тампона 2,5 мм), вмонтированным в пробку, укупорива¬
ющую стерильную одноразовую стеклянную пробирку — для
проб из носоглотки на В. pertussis и из уретры у мужчин.
4.4. Для транспортирования проб, исследуемых на наличие анаэ¬
робов, используют емкости со специальными транспортировочными
средами и пробирки с тиогликолевой средой; пробирки со средами
для выделения кампилобактерий и хеликобактера, разрешенные к
применению для этих целей в Российской Федерации в установленном
порядке, пробу, собранную в жидкую среду, тщательно с ней переме¬
шивают. Для получения проб рекомендуются следующие приемы:
- отделяемое дренажей, используемых для активной аспира¬
ции полостей, отсасывают стерильным шприцем с плотным
поршнем в объеме 2—4 мл; на заполненный шприц надеваю!
стерильную иглу, закрытую стерильным ватным тампоном,
удаляют из шприца избыток воздуха; ватный тампон сбрасы¬
вают в дезинфицирующий раствор; конец иглы вкалывают и
стерильную резиновую пробку и в таком виде шприц с матери¬
алом доставляют в лабораторию;
- содержимое очагов инфекции и полостей, получаемое путем
их пунктйрования, собирают в объеме 2—4 мл с помощью 2-.
5-,10-миллилитровых шприцев с плотным поршнем; из шпри¬
ца удаляют избыток воздуха, закрыв иглу стерильным ватным
тампоном, который затем сбрасывают в дезинфицирующи!)
раствор; иглу дезинфицируют протиранием тампоном, смо¬
ченным 70% этиловым спиртом; для герметизации конец игл!.1
вкалывают в стерильную резиновую пробку и в таком виде
шприц с материалом доставляют в лабораторию.
При сборе большого объема материала (3 мл и более) анаэробные
бактерии могут оставаться жизнеспособными в течение 24 ч при ком¬
натной температуре (18-20 °С).
Приложение
625
Если отделяемого всего несколько капель, его переносят из шпри¬
ца в небольшую емкость или пробирку с транспортировочной средой
немедленно после получения (емкости с транспортировочными сре¬
дами накануне получают в лаборатории).
Кусочки тканей (биопсийный материал) при подозрении на ана¬
эробную инфекцию собирают в стерильные одноразовые емкости с
завинчивающейся крышкбй (допускается — в стеклянную посуду с
притертой крышкой) и доставляют в лабораторию немедленно.
4.5. Для транспортирования проб, исследуемых на наличие виру¬
сов, используют специальные емкости с жидкой средой для сохране¬
ния вирусов.
5. Пробы различных видов биоматериала и среды, окружающей боль¬
ного
Таблица I
Посуда, используемая для доставки проб в лабораторию
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Кровь
Специальные транспортировочные емкости
со средой, с нейтрализаторами антибиотиков
и реагентами, разрушающими форменные
элементы крови, или без них, разрешенные
к применению для этих целей в Российской
Федерации в установленном порядке; двух¬
фазная среда во флаконах
Центральная нервная система
Ликвор
Стерильные одноразовые пробирки с завин¬
чивающейся пробкой; стерильные стеклян¬
ные пробирки с целлюлозной или ватно-мар¬
левой пробкой
Материал при абсцессах
мозга и биопсийный мате¬
риал при воспалительных
процессах в центральной
нервной системе
Шприц с иглой, воткнутой в стерильную
резиновую пробку; пробирка с тиогликолевой
средой, закрытая стерильной резиновой про¬
бкой; транспортировочные емкости со средой
для сохранения анаэробов
626
Приложение
Продолжение таблицы /
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Нижние дыхательные пути
Биопсийный материал
легких и трахеи; мокрота,
естественно откашлива¬
емая и индуцированная;
соскоб с бронхов
Стерильная одноразовая емкость с завин-
чиваюшейся крышкой (для сбора мокроты);
подготовленная в лаборатории стерильная
стеклянная емкость
Аспират трахеи, бронхо¬
альвеолярный лаваж,
смывы с бронхов
Стерильная одноразовая емкость для сбора
мокроты с завинчивающейся крышкой; плот¬
но закрывающаяся стерильная стеклянная
пробирка
Аспират транстрахеаль¬
ный и легких
Специальные транспортировочные емкости
со средой для анаэробов; шприц с иглой,
воткнутой в стерильную резиновую пробку;
емкость с тиогликолевой средой; стерильная
одноразовая пластиковая емкость с завинчи¬
вающейся крышкой; плотно закрывающаяся
пробирка
Верхние дыхательные пути
Мазки из носа, зева,
носоглотки, наружного
уха
Стерильный одноразовый зонд-тампон,
вмонтированный в стерильную сухую про¬
бирку (тубсер), или транспортировочная
емкость с соответствующей средой; транс¬
портировочный сосуд для вирусов; стериль¬
ная стеклянная посуда, смонтированная в
лаборатории
Назальный смыв, назофа-
гальный аспират
Стерильная одноразовая емкость с завинчи¬
вающейся крышкой; транспортировочный
сосуд для вирусов
Приложение
627
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Жидкость, получаемая
при тимпанопентезе,
аспират синуса, получа¬
емые при аспирации иглой
Шприц с иглой, обеззараженной после про¬
ведения манипуляции с помощью тампона,
сплоченного 70% этиловым спиртом, и вот¬
кнутой в стерильную резиновую пробку;
можно перенести материал из шприца в сте¬
рильную одноразовую или стеклянную про¬
бирку или специальный сосуд со средой для
транспортирования анаэробов
Ткань, получаемая во
время операции носа,
глотки, уха
Стерильный одноразовый контейнер с завин¬
чивающейся крышкой; пробирка с тиогли¬
колевой или другой транспортировочной
средой, плотно закрытая стерильной рези¬
новой пробкой; плотно закрытая стерильная
одноразовая пластиковая или стеклянная
пробирка
Глаза
Соскобы с конъюнктивы
уголка глаза
Мазки на стерильных обезжиренных пред¬
метных стеклах; материал, который отбирают
в специальный транспортировочный контей¬
нер со средой или засевают в питательную
среду
Интраокулярная жид¬
кость
Мазки на стерильных обезжиренных пред¬
метных стеклах; материал, который отбирают
в специальный транспортировочный кон¬
тейнер со средой для анаэробов или шприц с
предварительно обеззараженной 70% этило¬
вым спиртом иглой, воткнутой в стерильную
резиновую пробку
628
Приложение
Продолжение таблицы I
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
Отделяемое, взятое сте¬
рильной стеклянной
палочкой или стерильным
ватным зондом-тампоном
со слизистой оболоч¬
ки нижней переходной
складки, с края век, при
язве — с роговицы (после
обезболивания), при угол¬
ковом конъюнктивите с
уголков век
Стерильная одноразовая или стеклянная
пробирка с сахарным бульоном, в которую
вмонтирован зонд-тампон, или стерильная
стеклянная палочка, используемые для взя¬
тия пробы; специальный транспортировоч¬
ный контейнер со средой для вирусов
Секрет из слезного мешка
Одноразовый стерильный зонд-тампон,
вмонтированный в стерильную сухую про¬
бирку (тубсер) или стеклянную пробирку
Мочеполовая система
Моча
Средняя порция свобод¬
но истекающей мочи;
из канала подвздошной
кишки, использованного
для создания искусствен¬
ного мочевого пузыря; из
катетера у реанимацион¬
ных больных. Смыв из
мочевого пузыря - проба,
полученная при била¬
теральной уретральной
катетеризации
Стерильная одноразовая емкость для сбора
мочи с завинчивающейся крышкой; или сте¬
рильная одноразовая пробирка с крышкой;
или специальная одноразовая пробирка для
сбора мочи. При использовании стериль¬
ной стеклянной пробирки с целлюлозной
или ватно-марлевой пробкой следят за тем,
чтобы не замочить пробку материалом (объем
пробы 10-20 мл)
Приложение
629
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Проба, полученная при
проведении надлобковой
аспирации '>
Стерильный шприц без иглы, закрытый
стерильной резиновой пробкой; стерильный
шприц с иглой, предварительно обеззаражен¬
ной 70% этиловым спиртом и воткнутой в
резиновую пробку
Материал из женских половых органов
Жидкости: амниотичес¬
кая, фаллопиевых труб,
бартолиновая
Специальная транспортировочная емкость
со средой для анаэробов; шприц без иглы,
закрытый стерильной резиновой пробкой;
шприц с иглой, обработанной 70% спиртом и
воткнутой в стерильную резиновую пробку
(объем пробы 1—2 мл)
Пробы из цервикального
канала, уретры, влагали¬
ща
Одноразовый стерильный зонд-тампон,
вмонтированный в стерильную сухую про¬
бирку (тубсер) или емкость транспортиро¬
вочная со специальной средой; зонд-тампон,
вмонтированный в целлюлозную или ватно¬
марлевую пробку стерильной стеклянной
пробирки. Предметное стекло с приготов¬
ленным мазком для исследования бактери¬
альных инфекций, передаваемых половым
путем, и вирусов. Пробирка с транспортиро¬
вочной средой с активированным углем для
сохранения гонококков в течение 48 ч и более
Пробы материала из эндо¬
метрия
Стерильная одноразовая емкость с завин¬
чивающейся крышкой или пробирка, или
емкость транспортировочная со средой для
анаэробов; стерильная стеклянная посуда
630
Приложение
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2 *
Материал наружных поло¬
вых органов
Стерильный шприц без иглы, закрытый
стерильной резиновой пробкой; предметное
стекло с мазком, закрытым покровным стек¬
лом для определения т. pallidum; зонд-тампон,
вмонтированный в стерильную одноразовую
(тубсер) или стеклянную пробирку; специ¬
альная транспортировочная пробирка со сре¬
дой с активированным углем для сохранения
гонококков и транспортировочные емкости
для вирусов и хламидий; мазки на предмет¬
ных стеклах для обнаружения других возбу¬
дителей инфекций, передаваемых половым
путем
Материал из мужских половых органов
Мазки из уретры
Зонд-тампон на алюминиевой оси (урет¬
ральный зонд-тампон), вмонтированный
в стерильную одноразовую (тубсер) или
стеклянную пробирку; специальная транс¬
портировочная пробирка со средой с активи¬
рованным углем для сохранения гонококков
и транспортировочные сосуды для вирусов и
хламидий; мазки на предметных стеклах для
обнаружения других возбудителей инфекций,
передаваемых половым путем
Эякулят, сперма
Стерильная одноразовая емкость с завинчи¬
вающейся крышкой; стерильные пробирки
или тубсер одноразовые или стеклянные
Материал придатков
яичка при эпидидимите
Специальный транспортировочный контей¬
нер со средой для анаэробов или емкость с
тиогликолевой средой; стерильная однора¬
зовая емкость с завинчивающейся крышкой
или стерильная стеклянная пробирка с цел¬
люлозной или ватно-марлевой пробкой
Приложение
631
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Поражение пениса
Шприц без иглы, закрытый стерильной рези¬
новой пробкой; предметное стекло с мазком
на Т. pallidum, покрытое покровным стеклом;
зонд-тампон, вмонтированный в стерильную
одноразовую (тубсер) или стеклянную про¬
бирку; транспортировочные контейнеры для
вирусов и хламидий; мазки для обнаружения
других возбудителей инфекций, передавае¬
мых половым путем
Материал при подозрении на наличие гонореи
Мазки из ануса, церви¬
кального канала, уретры,
влагалища
Зонд-тампон, вмонтированный в стериль¬
ную одноразовую (тубсер) или стеклянную
пробирку;специальная транспортировочная
пробирка со средой с активированным углем
для сохранения гонококков в течение 48 ч и
более
Желудочно-кишечный тракт
Полость рта
Зонд-тампон, вмонтированный в стериль¬
ную одноразовую (тубсер) или стеклянную
пробирку; стерильная одноразовая или стек¬
лянная емкость для сбора смыва из ротовой
полости
Желудочный лаваж или
промывная жидкость;
дуоденальный аспират;
проба, получаемая при
ректороманоскопии;
ректальный биопсийный
материал
Стерильная одноразовая емкость с завин¬
чивающейся крышкой; специальный сте¬
рильный контейнер для сбора мокроты;
стерильная стеклянная емкость; аспират в
стерильном шприце с иглой, предварительно
обеззараженной и воткнутой в стерильную
резиновую пробку
632
Приложение
Продолжение таблицы I
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
Ректальный мазок
Одноразовый стерильный зонд-тампон,
вмонтированный в стерильную сухую про¬
бирку (тубсер); или стерильная пробирка со
специальной транспортировочной средой;
зонд-тампон из нержавеющего материала,
вмонтированный в целлюлозную или ватно¬
марлевую пробку стерильной стеклянной
пробирки
Фекалии на наличие
кишечных инфекций («на
дизгруппу»), хеликобакте¬
ра, кампилобактера
Стерильная пробирка с тампоном в физиоло¬
гическом растворе с глицерином; контейнер
транспортировочный со средой для анаэробов
в фекальных образцах, со специальными сре¬
дами с активированным углем и без него для
выделения Campylobactersp. и Helicobactersp.;
зонд-тампон в сухой стерильной одноразовой
пробирке (тубсер); стерильная стеклянная
пробирка, смонтированная с зондом-тампо¬
ном на металлической проволоке из титана,
стали, алюминия. Не допускается использо¬
вание тампона с деревянной осью
Фекалии на наличие дис¬
бактериоза по родовому и
видовому составу микро¬
бов («на флору»)
Специальный транспортировочный контей¬
нер со средой для анаэробов в фекальных
образцах, со специальными средами с акти¬
вированным углем и без него для выделения
Campylobacter sp. и Helicobacter sp., разрешенные
к применению для этих целей в Российской
Федерации в установленном порядке; зонд-
тампон в пробирке с физиологическим рас¬
твором с глицерином в стерильной одноразо¬
вой или стеклянной пробирке; специальный
одноразовый стерильный контейнер с завин¬
чивающейся крышкой; стеклянная, смонти¬
рованная в лаборатории емкость
Приложение
633
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Фекалии на наличие дис¬
бактериоза с количествен¬
ным учетом выделенных
и идентифицированных
микробов («на дисбакте¬
риоз»)
Специальные стерильные одноразовые
контейнеры с завинчивающейся крышкой
и лопаточкой для сбора материала и отбора
пробы для посева, имеющие стандартный
вес; смонтированная в лаборатории специ¬
альная стерильная стеклянная емкость
Кожа и подкожные ткани
Язвы, узелки (узелковые
утолщения), неглубокие,
поверхностные раны
(гнойные, ожоги); глубо¬
кие раны или абсцессы,
кости
Специальные стерильные одноразовые кон¬
тейнеры с завинчивающейся крышкой; сте¬
рильные пробирки с пробками одноразовые
или стеклянные объемом 5 мл; емкости со
специальными средами для анаэробов
Экссудат подкожной и
мягких тканей; аспират
мягких тканей
Стерильный шприц без иглы, закрытый
стерильной резиновой пробкой; шприц с
иглой, предварительно обеззараженной 70%
этиловым спиртом и воткнутой в резиновую
пробку
Стерильные жидкости
организма, за исключени¬
ем крови, ликвора, мочи
(см. выше)
Жидкости
Плевральная, перитоне¬
альная, асцитическая, сус¬
тавная, синовиальная
Стерильная одноразовая емкость с завинчи¬
вающейся крышкой; закрытый шприц без
иглы или с иглой, предварительно обеззара¬
женной 70% этиловым спиртом и воткнутой в
стерильную резиновую пробку
634
Приложение
Продолжение таблицы I
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Биоматериал для ПЦР-диагностики
Кровь; другие жидкости
организма
Стерильные одноразовые пробирки с про¬
бкой объемом 1,5 мл с антикоагулянтом.
Пробирку переворачивают 3—5 раз для сме¬
шивания пробы с антикоагулянтом. Доставка
в лабораторию в штативе из материалов, под¬
лежащих стерилизации в автоклаве
Биопсийный материал;
соскобы; мокрота и другие
виды биоматериала
Стерильные сухие одноразовые пробирки
типа «Эппендорф» и другие аналогичные.
Доставка в лабораторию — в специальном
штативе из материалов, подлежащих стери¬
лизации в автоклаве
Пробы среды, окружающей больного
Воздух
Стерильные чашки Петри одноразовые
(диаметр 90 мм) или стеклянные (диаметр
100 мм) с плотными питательными средами.
Доставка в лабораторию в специальных кон¬
тейнерах-переносках
Смывы с объектов среды,
окружающей больного
Стерильные зонды-тампоны, вмонтирован¬
ные в прозрачные пробирки с прозрачной
бесцветной жидкой средой. Пробы доставля¬
ют в лабораторию в штативах из материалов,
подлежащих стерилизации в автоклаве
Пробы для определения стерильности
Кровь и компоненты
крови из отделения, зани¬
мающегося их заготовкой
Емкости с заготовленным материалом
доставляют в лабораторию в специальных
контейнерах-переносках
Приложение
635
Продолжение таблицы 1
Источник и вид клиничес¬
кого материала
Изделия, используемые для доставки пробы
1
2
Смывы с медицинского
инструментария, шлангов
аппаратуры, используе¬
мой в реанимационных и
анестезиологических отде¬
лениях, а также в операци¬
онных; с рук медицинско¬
го персонала; белья
Стерильные зонды-тампоны, вмонтирован¬
ные в прозрачные пробирки с прозрачной
бесцветной жидкой средой. Пробы доставля¬
ют в лабораторию в штативах из материалов,
подлежащих стерилизации в автоклаве
Хирургический матери¬
ал; тампоны, салфетки,
турунды, ватные тампоны
на деревянной оси
Стерильные прозрачные пробирки с пробка¬
ми с прозрачной бесцветной жидкой средой с
3-5 стерильными стеклянными бусинками.
Пробы доставляют в лабораторию в штативах
из материалов, подлежащих стерилизации в
автоклаве
Шовный материал: кетгут,
хранящийся в операцион¬
ной в спиртовом растворе
йода
Стерильная пробирка (флакон с пробкой)
с раствором нейтрализатора (гипосульфит
натрия)
Шелк, капрон, мономер¬
ные синтетические нити,
хранящиеся в операцион¬
ной в спиртовом растворе
Стерильная пробирка с пробкой со стериль¬
ной дистиллированной водой в качестве
смывной жидкости. Пробы шовного матери¬
ала доставляют в лабораторию в штативах,
подлежащих стерилизации в автоклаве
Смывы с операционного
поля больного
До обработки поля; прозрачные пробирки,
наполненные прозрачной жидкой питатель¬
ной средой. После обработки поля: стериль¬
ная пробирка (флакон с пробкой) с раство¬
ром нейтрализатора (гипосульфит натрия).
Доставку материала в лабораторию осущест¬
вляют в штативах, подлежащих стерилизации
в автоклаве
636
Приложение
Продолжение таблицы 1
Источник и вид клиничес¬
Изделия, используемые для доставки пробы
кого материала
1
2 •
Пробы для определения иммунологических факторов системы анти-
инфекционной защиты (система антиинфекпионной резистентности
организма — САПР)
Кровь и другие жидкости
организма для определе¬
ния гуморальных факто¬
ров защиты
Одноразовые шприцы-пробирки (вакутей¬
неры); стерильные одноразовые пробирки с
завинчивающейся пробкой; стерильные стек¬
лянные пробирки со стерильными резино¬
выми, целлюлозными или ватно-марлевыми
пробками. Пробы доставляют в лабораторию
в специальном штативе из материалов, под¬
лежащих стерилизации в автоклаве. При
использовании стеклянных пробирок с
ватно-марлевыми пробками — не замочить
их при транспортировании
Кровь и другие жидкости
организма для определе¬
ния клеточных факторов
защиты
Стерильные одноразовые пробирки с завин¬
чивающейся пробкой; стерильные стеклян¬
ные пробирки,плотно закрытые стерильной
резиновой пробкой. Пробирки одноразовые с
антикоагулянтом, подлежащие центрифуги¬
рованию. Доставку в лабораторию осущест¬
вляют в специальном штативе из материалов,
подлежащих стерилизации в автоклаве
Мазки для определения
бактериальных и вирус¬
ных антигенов (например,
при подозрении на нали¬
чие инфекций, передаю¬
щихся половым путем)
Стерильное обезжиренное предметное
стекло; для Т. pallidum — предметное стекло
должно быть покрыто покровным стеклом.
Доставку в лабораторию осуществляют в
одноразовом контейнере или стерильных
одноразовых или стеклянных чашках Петри
в специальных контейнерах
Примечание. Пробы гноя, жидкости и тканей следует доставлять в лабора
торию в специальных стерильных одноразовых контейнерах с завинчиваю
щимися крышками. Зонды-тампоны — сухими в стерильных одноразовых
пробирках (тубсерах) или в емкостях с транспортировочной средой, если
материал нельзя доставить в лабораторию немедленно после взятия пробы
Приложение 637
Окончание таблицы I
Для этих целей можно использовать транспортировочные среды, в т.ч. в
одноразовых пробирках, упакованных вместе со стерильным зондом-тампо¬
ном, разрешенные к применению в Российской Федерации в установленном
порядке. Зонды-тампоны выпускают (готовят) с использованием ряда мате¬
риалов: для самого тампона (ватно-марлевый, хлопковый, вискозный, дак-
роновый), для оси зонда-тампона (дерево, пластик, нержавеющий металл —
титан, сталь, алюминий) и с плотными агаризованными средами: углем и без
него для анаэробов. •.
Многие клинически значимые анаэробы, например, Clostridium
perfringens, BacteroidesfragilispoQTai04\\o толерантны к наличию кисло¬
рода и хорошо сохраняются в большом количестве гноя, пробах жид¬
костей и тканях организма, а также на зонде-тампоне в специальной
транспортировочной или тиогликолевой среде.
Более чувствительные к кислороду (например, фузобактерии)
также хорошо сохраняются в пробе биологического материала, и если
материал посеять в течение 2—3 ч от момента его сбора, то не требуется
особого внимания к способу доставки. Анаэробы, требующие особых
условий культивирования, не сохраняют жизнеспособность на зонде-
тампоне в транспортировочной емкости со средой, не предназначен¬
ной для доставки анаэробов, за исключением емкостей со специаль¬
ными транспортировочными средами или тиогликолевой.
Вместе с тем эти микроорганизмы растут на 5—7 сут дольше вре¬
мени, в течение которого большинство практических лабораторий
инкубирует чашки, засеянные материалом для выделения и иденти¬
фикации аэробов и факультативных анаэробов. По этой причине в
обычных практических лабораториях представляется нецелесообраз¬
ным рутинное исследование на наличие анаэробов с использованием
специальных транспортировочных анаэробных емкостей со средами
и можно ограничиться пробирками с тиогликолевой средой.
Для сбора и транспортирования проб используют среды, емкости,
инструменты и материалы, разрешенные к применению в Российской
Федерации в установленном порядке,
6. Правила и техника получения проб различных видов биологического
материала для микробиологического исследования
Получение у пациента любой пробы, требующей использования
инвазивных методов, рекомендуется производить врачом (исключе¬
ние — проба крови, которую может собирать процедурная медицин¬
ская сестра).
638 Приложение
При необходимости сбора материала при помощи зонда-тампона
на открытой операционной поверхности или в случае иного инва¬
зивного вмешательства допустимо использование готовых зондов-
тампонов с международным уровнем безопасности не ниже Class ПА.
разрешенных к применению для этих целей в Российской Федерации
в установленном порядке.
6.1. Пробы крови
Пробы для определения наличия в крови биологических агентов
(бактериемия, виремия и др.) получают венепункцией периферичес¬
ких вен (чаще вены локтевого сгиба), артерий или из пятки у ново¬
рожденных.
Сбор пробы из постоянного внутривенного или внутриартериаль-
ного катетера допускается только в случаях подозрения на наличие
катетерассоциированной инфекции или отсутствия возможности се
получения венепункцией.
6.1.1. При остром сепсисе, менингите, остеомиелите, артрите, ост¬
рых нелеченых бактериальных пневмониях и пиелонефрите собираю i
2 пробы из двух сосудов или двух участков кровеносного сосуда перел
началом антибактериальной терапии.
6.1.2. При подозрениях на наличие эндокардита и вялотекущего
сепсиса с маленькой (10—30 КОЕ/мл) концентрацией возбудителя и
циркуляции:
— при наличии острого процесса собирают 2 пробы из двух участком
сосудов (различных сосудов) в течение первых 1—2 ч подъема тем¬
пературы тела (не на пике температуры!) и до начала терапии;
— при подостром или вялотекущем течении собирают в нервыil
день 3 пробы с интервалом 15 мин и более. Если все пробы
отрицательны, на вторые сутки после посева собирают еще 3;
— у пациентов с эндокардитами, получающими антибиотики,
собирают по 2 отдельные пробы в каждый из 3 дней с положи¬
тельной клинической динамикой терапии;
— для подтверждения клинического диагноза «инфекцион¬
ный эндокардит» при невозможности получения у пациента
необходимого количества проб крови для микробиологичес¬
кого анализа или при отрицательных результатах посевом
пробы крови посылают на исследование иммунологических
факторов системы защиты организма (системы антиинфек-
ционной резистентности — САИР); доставку в лабораторию
осуществляют в стерильных стеклянных или одноразовых
Приложение 639
пробирках с крышкой (пробкой), полученных накануне в
лаборатории;
— если больной страдает врожденным пороком сердца (ВПС),
следует помнить, что ВПС — продром инфекционного эндо¬
кардита и в алгоритм обследования такого пациента включают
определение иммунологических факторов САИР.
6.1.3. У больных, в комплщф терапии которых включены антибиоти¬
ки, собирают 6 проб в течение 48 ч; пробы необходимо собирать непос¬
редственно перед введением (приемом) следующей дозы препарата.
6.1.4. При наличии у больного лихорадки неясного генеза перво¬
начально собирают 2 пробы из разных кровеносных сосудов (двух
участков сосуда), затем через 24-36 ч еще 2 пробы на фоне повышения
температуры тела (не на пике температуры!).
6.1.5. Техника получения пробы крови. Сбор проб крови для посева
производят 2 человека у постели больного или в процедурной.
Для получения пробы необходимо выполнить следующее:
— участок кожи над выбранным для пункции сосудом проде¬
зинфицировать: обработать кожу тампоном, смоченным 70%
этиловым спиртом, затем другим тампоном, смоченным 1—2%
раствором йода или другим дезинфектантом, разрешенным к
применению для этих целей в установленном порядке, круго¬
выми движениями, начиная от центра, в течение 30 с;
— подождать, пока высохнет обработанный участок. Не допускается
пальпировать сосуд после обработки кожи перед введением иглы;
— при работе с флаконами с двойной средой: стерильным шпри¬
цем собрать у взрослых 10 мл крови, у детей 5 мл; над пламе¬
нем спиртовки открыть флакон; внести кровь во флакон из
шприца, предварительно сняв иглу; обжечь горлышко и про¬
бку флакона в пламени спиртовки, закрыть флакон пробкой;
осторожно, чтобы не замочить пробку флакона, перемешать
его содержимое круговыми движениями.
При использовании готовых флаконов со средой и реагентами,
нейтрализующими антибиотики и разрушающими форменные эле¬
менты крови, или без них, разрешенными к применению для этих
целей в Российской Федерации в установленном порядке, у взрослых
получают 10—30 мл крови, у детей 0,5—3,0 мл.
При этом:
— параллельно с дезинфекцией участка кожи для пунктирования
обрабатывают пробки флаконов 70% этиловым спиртом (рас¬
640 Приложение
твор йода не допускается использовать для обработки пробок
при работе с бутылочками, например Bactec, Vital и другими
аналогичными, разрешенными к применению для этих целей
в Российской Федерации в установленном*порядке);
— кровь, получаемую от взрослых, в равных объемах, проколов
при этом пробку емкости, вносят в «аэробную» и «анаэроб
ную» емкости; кровь, полученную от детей, — в специальную
«детскую» бутылочку, проколов при этом пробку емкости.
6.1.6. После венепункции и посева крови в емкости со средой дли
предотвращения возможного раздражения (ожога) с участка кожи
пациента стирают остатки йода с помощью тампона, смоченного 70%
этиловым спиртом.
6.2. Пробы при инфекционно-воспалительных процессах
центральной нервной системы (ЦНС)
6.2.1. Ликвор. В микробиологическую лабораторию на исследова¬
ние отправляют 4,0—5,5 мл ликвора, полученного при люмбально!!
пункции из субарахноидального пространства между позвонками
Lijj—Ljv, Ljv—Ly или Ly—S|, a также при пунктировании боковых
желудочков мозга.
Сбор проб проводят медленным заполнением трех пробирок тремя
порциями материала для исследования в лабораториях. Использую!
стерильные пробирки с плотно закрывающимися крышками (однора
зовые с пробкой или стеклянные со стерильной резиновой пробкой).
Из трех пробирок с материалом, полученным при люмбальной
пункции, всегда отправляют пробирку с самым мутным содержи
мым, как правило, это вторая пробирка в процессе сбора пробы.
При получении материала пункцией боковых желудочков мозш
свежевзятый ликвор из шприца, предварительно сняв иглу, вносят !»
стерильную пробирку над пламенем спиртовки, обжигают горлышко
пробирки и пробку в пламени спиртовки (при работе со стеклянно!!
пробиркой, заделанной ватно-марлевой или резиновой пробками),
закрывают пробирку пробкой.
Во всех случаях, подозрительных на менингит, помимо спинно¬
мозговой жидкости, собирают материал из предполагаемых очаго!»
инфекции: мазки из носоглотки, среднего уха, пробы крови, и вместе
с ликвором отправляют в лабораторию. Хорошим способом длитель¬
ного (до 48 ч) сохранения менингококка являются взятие материала
мазком зондом-тампоном и помещение его в пробирку с транспорти¬
ровочной средой с активированным углем или без него.
Приложение 641
Ликвор для микробиологического исследования немедленно
отправляют в лабораторию на грелке для сохранения температуры
35—37 °С. При отсутствии такой возможности ликвор собирают в
емкость с транспортировочной средой и оставляют в холодильнике
(при температуре 4—8 °С) до утра, а затем доставляют в лабораторию.
При необходимости проведения вирусологических исследований
пробы ликвора помещаЬт в холодильник при температуре 2-8 °С
или замораживают, или сохраняют их при комнатной температуре с
использованием емкостей со специальной жидкой средой.
6.2.2. Материал из абсцессов мозга. Учитывая, что в 90% случаев в
пробе растут анаэробы, аспирируют материал из очага и отправляют в
лабораторию в емкости с анаэробной средой, разрешенной к примене¬
нию для этих целей в Российской Федерации в установленном поряд¬
ке, или в шприце, которым собирали пробу, предварительно сняв иглу
и закрыв шприц стерильной резиновой пробкой.
Пробу доставляют немедленно после получения.
6.2.3. Биопсийный материал. Получают пробы во время операции,
помещают в емкость с анаэробной средой или в стерильную пробирку
с тиогликолевой средой, закрытую стерильной резиновой пробкой.
Материал отправляют в лабораторию немедленно.
6.3. Пробы при инфекционно-воспалительных процессах глаз
Большинство проб, получаемых из глаза, собирает врач-офтальмо¬
лог. Эти пробы следует сеять на питательные среды у постели больного
или в процедурном кабинете, или в кабинете врача во время приема и
засеянный материал передавать в лабораторию для культивирования,
выделения, идентификации и определения антибиотикочувствитель-
ности возбудителей. Пробы, взятые при использовании инвазивных и
других агрессивных методов, собирают параллельно с мазком с конъ¬
юнктивы, который в таких случаях служит контролем.
Накануне за 6—8 ч (ночь) отменяют все медикаменты и процедуры.
При наличии специфических клинических проявлений инфекци¬
онно-воспалительного процесса или подозрений, имеющихся у врача,
обязательно до анестезии готовят мазки для определения хламидий
и вирусов и отправляют препараты в лабораторию. Для сохранения
хламидий и вирусов собирают материал в емкости с транспортиро¬
вочными средами.
Отделяемое собирают стерильной стеклянной палочкой или сте¬
рильным зондом-тампоном: двумя-тремя движениями проводят по
слизистой оболочке нижней переходной складки, с края век, при
642 Приложение
язве — с роговицы (после обезболивания), при уголковом конъюнк
тивите — с уголков век.
Секрет из слезного мешка собирают стерильн1^1М зондом-тампоном
после осторожного массажа.
Материал, взятый палочкой и/или зондом-тампоном, помещают и
емкость с транспортировочной средой или в стерильную стеклянную
пробирку с жидкой средой и доставляют в лабораторию, внимательно
следя за тем, чтобы не замочить целлюлозную или ватно-марлевую
пробку пробирки.
При использовании зондов-тампонов предпочтительнее пользо
ваться одноразовыми емкостями с транспортировочной средой или
стерильными стеклянными пробирками с ватно-марлевыми пробка
ми, наполненными стерильной средой.
Наиболее корректную информацию о возбудителе воспалитель
ного процесса можно получить при микробиологическом аналик-
соскобов,
6.3.1. Конъюнктивит и блефароконъюнктивит. Накануне за 6—8 ч
(ночь) у больных в стационаре отменяют все медикаменты и пропс
дуры.
Пробы с конъюнктивы собирают с помощью стерильного, пред
варительно увлажненного вискозного или из алгината кальция зонд
тампона, находящегося в одноразовом стерильном тубсере или стек
лянной пробирке. Пробы из каждого глаза собирают отдельными
тампонами двумя-тремя круговыми движениями по слизистой.
Тубсеры с мазками из каждого глаза маркируют соответственно
«правый» и «левый» и немедленно отправляют в лабораторию.
Перед получением соскоба вводят 1-2 капли анестетика, напри
мер, пропаракаина гидрохлорида или другого, имеющегося и разрс
шенного к пркменению для этих целей в установленном порядке,
Двумя-тремя короткими резкими движениями в одном направлении
с помощью специального стерильного шпателя собирают соскобы с
конъюнктивы. При проведении манипуляции глаз должен бытьоткрьп.
Внимательно следят за тем, чтобы при сборе пробы не касаться
ресниц.
Готовят по меньшей мере по 2 мазка из каждого глаза, нанося мате¬
риал на чистое обезжиренное предметное стекло круговыми движе¬
ниями на площадь диаметром 1 см.
Фиксируют мазки в течение 5 мин в 95% метиловом спирте, нахо
дящемся в специальной плотно закрывающейся емкости.
Приложение 643
Немедленно передают в лабораторию пробирки с зондами-тампо¬
нами и стекла с мазками.
6.3.2. Бактериальный кератит. Накануне за 6—8 ч (ночь) у больных
в стационаре отменяют все медикаменты и процедуры.
Получают 2 пробы с конъюнктивы, как описано в п. 6,3.1, т.к.
результаты их посева могут быть полезны для определения источника
контаминации роговиць! (одну пробу используют при подозрении на
наличие грибковой инфекции).
При подозрении на наличие вирусной инфекции конъюнктиваль¬
ный экссудат и материал, полученный соскобом, помещают в специ¬
альную транспортировочную среду для вирусов.
Проводят обезболивание, как указано в п. 6.3.1.
Собирают 3—5 соскобов методом, описанным в п. 6.3.1.
Помещают собранный материал в маленькую (5 мл) стерильную
одноразовую пробирку с завинчивающейся пробкой или стерильную
стеклянную с резиновой пробкой, наполненную средой.
Готовят 2-3 мазка на предметном стекле и после высыхания фик¬
сируют их, как описано в п. 6.3.1.
Немедленно передают весь материал в лабораторию.
6.3.3. Бактериальный эндоофтальмит. Пробу жидкости стекло¬
видного тела (1—2 мл) собирают путем тонкоигольной аспирации и
получают образец при проведении витректомии.
Далее выполняют следующее:
— из шприца, удалив иглу, содержимое помещают в одноразовый
стерильный контейнер с завинчивающейся крышкой или про¬
бирку, плотно закрытую резиновой пробкой;
— пробу материала можно оставить в шприце, убрав воздух и уда¬
лив иглу, закрывают шприц стерильной резиновой пробкой;
— собирают пробус конъюнктивы, как описано в п. 6.З.1.;
— весь материал немедленно отправляют в лабораторию.
6.3.4. Пресептальный целлюлит. Обрабатывают кожу 70% этило¬
вым спиртом и 1—2% раствором йода или йодоформом, или другим
имеющимся дезинфектантом, разрешенным к применению в установ¬
ленном порядке.
При отсутствии открытой раны для сбора материала прокалывают
верхнее или нижнее веко.
При наличии открытой раны собирают пробу гнойного материала
шприцем с иглой.
Готовят мазки на предметном стекле, как описано в п. 6,3.1.
644 Приложение
Переносят собранный материал в транспортировочную ємкості,
со средами для анаэробов или, оставив в шприце, который, удалив и і
него воздух и сняв иглу, закрывают пробкой.
Собранный материал и мазки немедленно отправляют в лаборато
рию.
6.3.5. Орбитальный целлюлит. Собирают аспират из зоны по мето
дике, изложенной ранее в п. 6.3.2.
Собирают пробу с конъюнктивы и готовят мазки на предметном
стекле, как в п. 6.3.1.
Для доставки в лабораторию используют материалы, описанные и
п. 6.3.3.
Собирают у пациента пробы крови по методике, изложенной в п. 6.1
Пробы крови, весь собранный материал передают в лабораторию.
6.3.6. Воспаление слезной железы (дакриоаденит).
Собирают гнойное содержимое, используя зонд-тампон, как в п. 6.3.1.
Не пользуются методом аспирации иглой, чтобы не нарушим,
целостность слезной железы.
Зонд-тампон и предметные стекла с мазками передают в лабора
торию.
6.3.7. Воспаление слезного мешка (дакриоцистит). Получают пробу
с конъюнктивы, как в п. 6.3.1.
Массируют и надавливают на слезный мешок, чтобы получим,
пробу экссудата для посева и приготовления мазков или, используя
другой метод, собирают экссудат шприцем с иглой.
Помешают собранную пробу экссудата в транспортировочні.к*
емкости, как это описано ранее, и доставляют в лабораторию.
6.3.8. Каналикулит. Прижимают внутреннюю часть века, чтобы
получить гной.
Далее проводят работу по методикам, изложенным ранее в этом
разделе.
При наличии в лечебно-профилактической организации специ
ализированного отделения (клиники) все посевы производят у пос¬
тели больного на питательные среды, полученные в лаборатории.
Засеянный материал вместе с приготовленными мазками передают и
лабораторию.
6.4. Пробы при инфекционно-воспалительных процессах уха
6.4.1. При поражении наружного уха производят обработку ко
жи 70% спиртом с последующим промыванием стерильным физио¬
логическим раствором. Отделяемое из очага собирают на стерильный
Приложение 645
одноразовый зонд-тампон тубсера или пробирки с транспортировоч¬
ной средой или на тампон, вмонтированный в стерильную стеклян¬
ную пробирку, закрытую пробкой, со специальной средой или без нее.
Тампон помещают в пробирку и доставляют в лабораторию.
6.4.2. При поражении среднего и внутреннего уха собирают пун¬
ктаты и другой материал, полученный во время операции. Пунктаты
доставляют в лабораторию в закрытом шприце с предварительно уда¬
ленным воздухом. Образцы ткани — в транспортировочной емкости
со средой для анаэробов, разрешенной к применению для этих целей
в Российской Федерации в установленном порядке, или в стерильном
одноразовом контейнере с завинчивающейся крышкой. Возможно
использование стерильной стеклянной пробирки, закрытой стериль¬
ной резиновой пробкой.
6.4.3. Тимпаноцентез барабанной перепонки производят для мик¬
робиологической диагностики инфекций среднего уха только в слу¬
чаях, если больной не отвечает на проводимую ранее терапию или при
торпидном течении катарального среднего отита даже при визуальном
отсутствии экссудата в выступающей крови (высевы из носоглотки
положительны менее чем в 90% случаев).
Для получения пробы очищают наружный канал с помощью там¬
пона, смоченного 70% этиловым спиртом, с последующей обработкой
стерильным физиологическим раствором.
С помощью шприца собирают жидкость из барабанной полости.
В лабораторию пробу доставляют в стерильном одноразовом контей¬
нере с завинчивающейся крышкой или в закрытом шприце с предва¬
рительно удаленным воздухом.
Если барабанная перепонка повреждена, материал собирают зон¬
дом-тампоном с помощью зеркала. Тампон помещают в стерильную
одноразовую пробирку (тубсер) или емкость с транспортировочной
средой (допускается использование стерильной стеклянной пробир¬
ки со средой или без нее) и в таком виде доставляют в лабораторию.
6.5. Пробы при инфекционно-воспалительных процессах дыха¬
тельных путей
6.5.1. Верхние дыхательные пути. При подозрении на наличие у
больного дифтерии, коклюша, хламидиоза, микоплазмоза, легионел¬
леза, гонореи до доставки пробы информируют работников лаборато¬
рии, чтобы они подготовились к анализу такого вида материала.
6.5.1.1. Пробу со слизистых передних отделов полости носа соби¬
рают одним стерильным зондом-тампоном, вмонтированным в сте¬
646 Приложение
рильную одноразовую пробирку (тубсер) или специально вмонтиро
ванным в стерильную стеклянную пробирку:
— извлекают тампон из пробирки, вводят в правукх ноздрю и вра-'
щательными движениями собирают материал с крыльев носа и
верхнего угла носового отверстия;
— повторяют манипуляцию для левой ноздри;
— помещают тампон в пробирку и доставляют в лабораторию.
Пробы, полученные таким способом, полезны для определения
носительства золотистого стафилококка у медицинских работни
ков, наличия возбудителей внутрибольничной инфекции, а также
для характеристики дисбиотических нарушений слизистых верхних
дыхательных путей при комплексном клинико-иммуномикробиоло-
гическом обследовании пациентов, проводимом в научно-практичес
ких лабораториях.
При наличии в полости носа очагов воспалений или изъязвлени!)
отдельным тампоном собирают материал из очага (очагов),
6.5.1.2. Аспираты из носоглотки собирают для определения носи
тельства стрептококка пиогенного, менингококка, возбудителей ди(|)-
терии и коклюша, а также при проведении эпидемиологических иссле¬
дований антимикробной резистентности S. pneumoniae и Я. influenzae:
— отсасывают материал из носоглотки;
— переносят материал в стерильный одноразовый контейнер
с завинчивающейся пробкой или специальную стерильную
пробирку с газопроницаемой целлюлозной или ватно-марле¬
вой пробкой, внимательно следя за тем, чтобы не замочить ее
пробой клинический материал.
6.5.1.3. Мазок из носоглотки. Материал собирают для определения
носительства менингококка и диагностики коклюша.
Осторожно вращательными движениями по нижнему носовому
ходу поочередно в обе ноздри вводят в носоглотку зонд-тампон хлоп¬
ковый, вискозный или с алгинатом кальция. Одновременно крылья
носа прижимают к тампону и носовой перегородке для более плотно¬
го его контакта со слизистой оболочкой.
Помещают тампон в стерильную пробирку и доставляют в лабора¬
торию.
6.5.1.4. Назальный смыв используют для определения наличия не
только бактериальной, но и преимущественно вирусной инфекции.
Предупреждают пациента, чтобы он не глотал при проведении
процедуры.
Приложение 647
Помещают голову пациента в положение вверх-назад под углом
приблизительно 70°, вводят в каждую ноздрю по 5 мл стерильного
физиологического раствора; пациент должен находиться в таком
положении 3—5 с.
Для сбора материала опускают голову пациента вперед, чтобы
жидкость вылилась из ноздрей в стерильный одноразовый контейнер
или аспирируют жидкость введением резинового дренажа в каждую
ноздрю.
Помещают равный объем смыва в емкость с транспортировочной
средой для вирусов или доставляют эту порцию в стерильном однора¬
зовом контейнере.
6.5.1.5. Пунктат пазухи. Используя методику аспирации шприцем,
специально подготовленный опытный врач или отоларинголог полу¬
чает материал из верхнечелюстной фронтальной или других пазух.
Содержимое шприца помещают в емкость с транспортировочной
средой для анаэробов или в стерильную пробирку с тиогликолевой
средой. Можно оставить материал в шприце и, закрыв его стерильной
резиновой пробкой, доставить в лабораторию.
6.5.1.6. Получение пробы со слизистой глотки (зева).
Не допускается собирать материал из глотки (зева) при воспален¬
ном надгортаннике, так как проведение процедуры может привести к
серьезной респираторной обструкции.
При взятии пробы со слизистой зева (глотки) не касаются тампо¬
ном слизистых щек, языка, десен, губ, а также не собирают слюну,
так как этот материал характеризует слизистые ротовой полости, т.е.
верхний отдел желудочно-кишечного тракта.
Мазок из зева (глотки) собирают натощак или через 3—4 ч после
приема пищи. Перед взятием пробы больной должен прополоскать
рот теплой кипяченой водой.
Для получения пробы используют стерильный шпатель или
тампон: извлекают вискозный тампон из стерильной одноразовой
пробирки (тубсера) или используют приготовленный в лаборато¬
рии тампон, вмонтированный в стерильную стеклянную пробирку.
Использование зонда-тампона с вискозной головкой предпочтитель¬
нее, т.к. вискоза адсорбирует меньше жидкости и больше клеточного
материала.
Одной рукой прижимают язык больного стерильным шпателем.
Другой рукой собирают материал, поочередно обрабатывая тампоном
правую миндалину, правую нёбную дугу, левую миндалину, левую
648 Приложение
нёбную дугу, язычок, на уровне язычка касаются тампоном задней
стенки глотки.
Пробы, полученные таким способом, полезны ддя определения
наличия возбудителя внутрибольничной инфекции, а также для
характеристики дисбиотических нарушений слизистых верхних
дыхательных путей при комплексном клинико-иммуномикробиоло-
тическом обследовании пациентов, проводимом в научно-практичес
ких лабораториях.
При наличии очагов воспалений или изъязвлений на слизистоіі
относятся к сбору пробы особенно внимательно и собирают отдс
льным тампоном дополнительно материал из очага (очагов).
Помещают тампон в стерильную одноразовую или стеклянную
пробирку и доставляют в лабораторию.
6.5.1.7. При подозрении на дифтерию информируют работником
лаборатории, указав диагноз в направлении.
В случаях наличия респираторного патологического процесса
одновременно собирают материал со слизистых носоглотки и глотки
по методикам, представленным ранее.
Если подозревают кожную форму дифтерии, собирают материал
с кожи, а также со слизистых зева (глотки) и носоглотки и все пробм
доставляют в лабораторию.
6.5.2. Нижние дыхательные пути. Микробиологическая диагнос
тика воспалительных процессов в нижних дыхательных путях пред¬
ставляет серьезные трудности, т.к. в процессе сбора проба можсі
быть контаминирована микроорганизмами, обсеменяющими верх¬
ние дыхательные пути. Эта экологическая ниша достаточно обиль¬
но обсеменена условно-патогенными микробами, особенно при
наличии дисбактериоза (качественного — видовой состав и/или
количественного — концентрация присутствующих видов в КОЕ/мл
у ослабленного и/или иммунокомпрометированного контингент
обследуемых).
По этой причине пробы материала из нижних дыхательных путей
собирают особенно тщательно для получения корректной информа
ции об этиологическом агенте (агентах). При использовании инва¬
зивных методов для сбора пробы (если это происходит не во время
операции) применяемые инструменты проходят через верхние дыха¬
тельные пути и появляется реальная возможность обсеменения более
глубоких локусов микроорганизмами — обитателями верхних дыха¬
тельных путей.
Приложение 649
6.5.2.1. Мокрота.
Свободно отделяемая (отхаркиваемая) мокрота — предпочтителен
утренний сбор.
Перед сбором пробы пациент, если это возможно, должен почис¬
тить зубы и сполоснуть рот и горло теплой кипяченой водой, если
пациент не в состоянии сделать это сам, то туалет его ротовой полости
осуществляют медицинские работники.
Предупреждают больного, чтобы он не собирал в контейнер слюну
или носоглоточное отделяемое.
пробу мокроты, полученную в результате глубокого кашля, соби¬
рают в специальный стерильный одноразовый контейнер с завин¬
чивающейся крышкой или в специальным образом подготовленную
стерильную стеклянную банку.
Пробу мокроты передают в лабораторию.
Индуцированная мокрота (рекомендуется преимущественно при
подозрении на Mycobacterium tuberculosis и Pneumocystisyiroveci) — пред¬
почтителен утренний сбор.
Перед сбором пробы пациент, если это возможно, должен почис¬
тить зубы и сполоснуть рот и горло теплой кипяченой водой; если
пациент не в состоянии сделать это сам, то туалет его ротовой полости
осуществляет медицинский персонал.
До проведения процедуры смачивают чистую зубную щетку теп¬
лой кипяченой водой и проводят ею по слизистой обеих щек, языку
и деснам.
Активно споласкивают рот пациента теплой кипяченой водой.
Используя ингалятор, дают больному проглотить 20—30 мл 3—10%
стерильного физиологического раствора.
Собирают индуцированную мокроту в специальный стерильный
одноразовый контейнер с завинчивающейся крышкой или в стериль¬
ную стеклянную банку, подготовленную соответствующим образом.
Передают пробу в лабораторию;
Одновременно с пробой мокроты в лабораторию следует отправить
пробу из глотки (зева), собранную после проведенного туалета полос¬
ти рта и непосредственно перед сбором мокроты, свободно отделяе¬
мой (отхаркиваемой) или индуцированной.
6.5.2.2. Аспираты из трахеостомы и эндотрахеальные. Трахеостома
колонизируется микроорганизмами уже через 24 ч после интубации
пациента, вследствие чего результаты культурального исследования
имеют низкую клиническую значимость. Учитывая изложенное,
650 Приложение
результаты посевов, полученные у интубированных больных, необ
ходимо постоянно сравнивать с клиническими данными (например,
лихорадка или появление инфильтратов на рентгене)..
Пробы смыва с бронхов или бронхоальвеолярного лаважа собира
ют, если это возможно, до получения проб соскобов или биопсийною
материала. Правило продиктовано необходимостью избежать избытка
крови в получаемой жидкости, т.к. кровь может изменить концентра
цию клеточных и неклеточных компонентов пробы и оказать влияние
на результат микробиологического анализа.
Пробу-аспират собирают в стерильный одноразовый контейнер «
завинчивающейся крышкой или в стерильную стеклянную емкосп..
смонтированную соответствующим образом, или в стерильную одно
разовую стеклянную пробирку с пробкой, или доставляют в лабора
торию в закрытом шприце с удаленным воздухом.
6.5.2.3. Пробы, полученные с использованием бронхоскопа,
Бронхоальвеолярный лаваж (образец выбора), смыв с бронхов (низ
кая чувствительность при диагностике пневмоний), соскоб с бром
хов (более значим, чем смыв), образцы транстрахеальной биопсии
получают введением бронхоскопа трансназально или трансоралыю
неинтубированному больному или через эндотрахеальную трубку у
интубированного.
Для получения пробы смыва с бронхов или бронхоальвеолярною
лаважа:
— вводят шприцем через биопсийный канал бронхоскопа отде¬
льными порциями стерильный небактериостатический (офи
цинальный) физиологический раствор (общий объем от 5—20
до 100 мл);
— перед введением следующей порции физиологического раство¬
ра осторожйо отсасывают введенной частью шприца в стерил I.
ный одноразовый контейнер с завинчивающейся крышкой
или в стерильную одноразовую или стеклянную пробирку е
пробкой, или оставляют в закрытом шприце, предварительно
удалив из него воздух (как правило, 50-70% введенного физио¬
логического раствора находится в лаваже);
— каждую отсасываемую порцию собирают в отдельную посуду;
— по окончании процедуры соединяют пробы, полученные и I
одного и того же участка. Пробы из разных участков (например,
правая верхняя доля легкого и правая нижняя доля) следусз
соединять вместе только после консультации с лечащим врачом;
Приложение 651
— в направлении указывают общий объем введенного физиоло¬
гического раствора.
Для получения пробы соскоба с бронхов:
— через биопсийный канал бронхоскопа вводят телескопический
двойной катетер с обработанным полиэтилен гликолем (или
другим соответствующим реактивом) дистальным концом для
предотвращения контЬминации пробы;
— собирают материал в стерильный одноразовый контейнер
с завинчивающейся крышкой или в транспортировочную
емкость со средой для анаэробов, или в стерильную пробирку
с тиогликолевой средой, плотно закрытую стерильной резино¬
вой пробкой;
— доставляют материал в лабораторию.
Для получения трансбронхиального биоптата собирают пробу
через биопсийный канал бронхоскопа и, поместив ее в стерильный
одноразовый контейнер с завинчивающейся крышкой с неболь¬
шим количеством (1—2 мл) небактериостатического (офипиналь-
ного) физиологического раствора или в пробирку с тиогликолевой
средой, плотно закрытую резиновой пробкой, передают в лабора¬
торию.
6.5.2.4. Пробы аспирата легких. Для сбора пробы иглу через гру¬
дину вводят в инфильтрат легкого под контролем сканера ком¬
пьютерного томографа. Материал аспирируют из очага воспаления.
Если имеется большой инфильтрат или их несколько, необходимо
получить несколько проб из соответствующих очагов или несколько
проб из одного большого очага. В лабораторию материал передают в
транспортировочном контейнере со средой для анаэробов или в стек¬
лянной пробирке с тиогликолевой средой, или в завинчивающемся
одноразовом контейнере.
6.5.2.5. Пробы биоптатовлегких. Если возможно, получают кусоч¬
ки ткани величиной 1—3 см^. Если очаг большой или их несколь¬
ко, собирают несколько проб. Помещают пробу в стерильный
одноразовый контейнер с завинчивающейся пробкой или в транс¬
портировочную емкость со средой для анаэробов, или в емкость
(пробирку) с тиогликолевой средой, закрытую стерильной резино¬
вой пробкой.
6.6. Пробы при инфекционно-воспалительных процессах
мочеполовой системы
6.6.1. Пробы мочи.
652 Приложение
6.6.1.1. Общие правила сбора проб:
— не допускается собирать мочу с постельного белья или и I
мочеприемника;
— для анализа мочи при естественном мочеиспускании исполь
зуют среднюю утреннюю порцию;
— перед сбором пробы необходимо тщательно промыть наружные
половые органы и область заднего прохода теплой кипяченоИ
водой; особое внимание при этом следует уделять обработке
отверстия мочеиспускательного канала у мужчин (преддверию
влагалища — у женщин) для уверенности, что при проведении
процедуры проба не будет дополнительно контаминирована
микробами;
— для проведения обработки не допускается использовать дезин
фектанты, т.к. при попадании в пробу они могут ингибирован,
рост микроорганизмов;
— пробу передают в лабораторию не позднее 2 ч с момента сбора;
— для сбора и доставки проб в лабораторию используют сто
рильные одноразовые контейнеры с завинчивающейся крыш¬
кой или пробирки (возможно использование стерильных
специально смонтированных стеклянных пробирок с газон
роницаемой целлюлозной или ватно-марлевой пробкой, но
при этом особое внимание уделяют тому, чтобы не замочи 11.
пробку);
— доставку в лабораторию проб аспиратов, полученных с исполь¬
зованием техники надлобковой пункции мочевого пузыря,
осуществляют в транспортировочной емкости со специально!)
средой для анаэробов или в закрытом шприце без иглы;
— пробы при подозрении на наличие вирусной инфекции достав¬
ляют в лабораторию в стерильном одноразовом контейнере,
помещенном на подтаявший лед (сухой лед использовать не
допускается!);
— любую процедуру получения пробы с использованием катетера
(особенно у женщин) проводят с тщательным соблюдением
правил асептики для предотвращения дополнительной конта¬
минации пациента в процессе введения катетера;
— для микробиологического исследования не допускается
использовать пробу из суточной мочи.
6.6.1.2. Сбор пробы мочи у женщин при естественном мочеиспус¬
кании.
Приложение 653
Используют среднюю порцию, т.к. первый пассаж мочи должен
удалить комменсалов, возможно находящихся в уретре. Проба, соб¬
ранная при следующих пассажах, должна быть свободна от загряз¬
нения. Достоверность положительных результатов такого материала
составляет 80% при сборе одной пробы, 90% — при двух последова¬
тельных и 100% — при трех, если все пробы дают одинаковые резуль¬
таты. >
Медицинский работник, собирающий пробу, должен вымыть
руки с мылом, сполоснуть водой, высушить. Если пробу собирает сам
пациент, ему подробно объясняют, как это делают, с учетом изложен¬
ной выше подготовки, и предупреждают о том, что может произойти,
если он нарушит правила:
— следует тщательно промыть отверстие мочеиспускательного
канала и область преддверия влагалища, а также промежность
и область заднего прохода мыльной водой или жидким мылом,
сполоснуть теплой кипяченой водой, высушить стерильной
марлевой салфеткой;
— отверстие влагалища необходимо закрыть стерильным ватным
тампоном;
— наружные половые губы держите на расстоянии друг от друга в
процессе мочеиспускания;
— спустите небольшое количество мочи в специальную посуду
для утилизации, не прекращая при этом мочеиспускание;
— соберите среднюю порцию мочи (10-20 мл) в специальный
одноразовый контейнер с завинчивающейся крышкой или
специально смонтированную в лаборатории стерильную стек¬
лянную емкость.
6.6,1.3. Сбор пробы мочи у мужчин при естественном мочеиспус¬
кании.
у мужчин для микробиологического исследования требуется одна
порция мочи, т.к. вероятность контаминации у них существенно
меньше, чем у женщин.
Собирающий пробу должен вымыть руки с мылом, сполоснуть водой,
высушить. Если пробы собирает сам пациент, ему необходимо детально
объяснить, как это делают, с учетом изложенной ниже подготовки и
предупредить о том, что может произойти при нарушении правил:
— следует тщательно вымыть теплой мыльной водой (водой с
мылом) пенис и оттянутую крайнюю плоть (при ее наличии и
отсутствии в ней проблем, требующих микробиологического
654 Приложение
исследования), а также промежность и область заднего прохода
и сполоснуть теплой кипяченой водой, высушить стерильной
марлевой салфеткой;
— при мочеиспускании держите крайнюю плоть оттянутой для
предотвращения контаминации пробы мочи микроорганиз¬
мами кожи;
— спустите небольшое количество мочи в специальную посуду
для утилизации, не прекращая мочеиспускания;
— соберите среднюю порцию мочи (10-20 мл) в специальны!)
одноразовый контейнер с завинчивающейся крышкой или
специально смонтированную в лаборатории стеклянные банку
или пробирку.
6.6.1.4. Сбор пробы мочи у новорожденных и маленьких детей пр!!
естественном мочеиспускании.
Медицинский работник, собирающий пробу, должен вымыть руки
с мылом, сполоснуть водой, высушить. Если пробу собирает мам;|
(родственники), ей необходимо подробно объяснить, как это делают, с
учетом изложенной ниже подготовки и предупредить о том, что МОЖС !
произойти, если будут нарушены правила:
— дайте ребенку попить воды или другой жидкости, пригодной
для питья;
— у девочек тщательно промойте отверстие мочеиспускательного
канала, а также промежность и область заднего прохода теплой
мыльной водой или жидким мылом, сполосните теплой кипя¬
ченой водой, высушите стерильной марлевой салфеткой;
— усадите ребенка на колени мамы или медицинской сестры, ил !1
дежурного по палате;
— держите наружные половые губы на расстоянии друг от друга и
процессег мочеиспускания;
— спустите небольшое количество мочи в специальную посуду
для утилизации;
— соберите среднюю порцию мочи (10—15 мл) в специальный
одноразовый контейнер с завинчивающейся крышкой;
— доставьте материал в лабораторию;
— у мальчиков 2 первых этапа подготовки выполняются так же,
как описано выше для девочек, затем:
— пенис и оттянутую крайнюю плоть (при ее наличии и
отсутствии в ней проблем, требующих микробиологическо¬
го исследования), а также область заднего прохода вымойзс
Приложение 655
теплой мыльной водой (водой с мылом) и сполосните теплой
кипяченой водой, высушите стерильной марлевой салфет¬
кой;
— усадите ребенка на колени мамы, или медицинской сестры,
или дежурного по палате;
— при мочеиспускании держите крайнюю плоть оттянутой для
предотвращения кбнтаминации пробы мочи микроорганизма¬
ми с кожи.
Дальнейшие этапы сбора пробы проведите так же, как описано
ранее для девочек.
6.6.1.5. Сбор пробы из участка подвздошной кишки, использован¬
ной для создания искусственного пузыря, выполняют только при
необходимости для назначения соответствующей терапии, например
при гипертермии или органическом недомогании:
— уберите устройство (прибор) и вылейте из него мочу;
— мягким тампонированием очистите отверстие 70% этиловым
спиртом, а затем 1—2% раствором йода или другого имеюще¬
гося дезинфектанта, разрешенного к применению для этих
целей в установленном порядке, удалите избыток йода 70%
этиловым спиртом для предохранения пациента от возмож¬
ного ожога;
— катетеризируйте обработанный участок;
— соберите мочу из катетера (8—10 мл) в стерильный одноразо¬
вый контейнер с завинчивающейся крышкой или стерильные
специально смонтированные стеклянные емкости (банки,
пробирки с ватно-марлевыми пробками, обращая особое вни¬
мание, чтобы не замочить материалом пробку);
— передайте материал в лабораторию.
6.6.1.6. Сбор пробы катетером у женщин допускается только в
крайнем случае, т.к. очень велика возможность инфицирования
пациентки, а также пробы в процессе введения катетера. Этот способ
получения мочи у мужчин и женщин допускается:
— в условиях реанимации при отсутствии возможности ее
получения естественным путем;
— при большой вариабельности получаемых результатов,
необходимых для объективизации диагноза;
— у пациентов, слабо контролирующих освобождение мочево¬
го пузыря, т.е. у пожилых и с нейрогенным мочевым пузы¬
рем.
656 Приложение
Перед катетеризацией, если мочевой пузырь заполнен, пациет
должен, насколько возможно, его освободить, т.к. жидкость СНИЗИ1
концентрацию микробов в пробе.
Далее проводят обработку наружных половых органов, а также
область промежности и заднего прохода, как это указано ранее.
Вводят стерильный катетер в мочевой пузырь.
Собирают вначале из катетера 15—30 мл мочи в специальную посу¬
ду для утилизации.
Собирают среднюю или последнюю порции мочи в специальны!)
стерильный одноразовый контейнер или специально смонтирован
ную стерильную стеклянную посуду и доставляют пробу в лаборато
рию, внимательно следя за тем, чтобы не замочить газопроницаемые
целлюлозные или ватно-марлевые пробки.
Следует иметь в виду, что катетер Фоля не подвергают исследоиа
нию, т.к. обнаруженный в этих случаях рост характеризует микрофло
ру дистальной области уретры.
6.6.1.7. Сбор пробы надлобковой пункцией мочевого пузыря про¬
водят при отсутствии эффекта терапии инфекции мочевых путей,
при подозрении на наличие инфекции у взрослых с вариабельными
результатами в рутинных исследованиях, а также у пациентов, по
контролирующих мочеотделение (пожилые, новорожденные и дети
младшего возраста).
Перед пункцией пациент, если это возможно, должен освободит),
пузырь, т.к. имеющаяся в нем жидкость снижает количество микро¬
организмов.
Следует побрить и продезинфицировать кожу над лобком или тща¬
тельно продезинфицировать без бритья.
Через разрез в эпидермисе шприцем с иглой аспирируют мочу
(10-15 мл) из пузЪфя и передают в лабораторию в закрытом шприце
без иглы или в транспортировочном контейнере со средой для сохра¬
нения анаэробов или в тиогликолевой среде.
6.6.1.8. Сбор пробы с использованием цистоскопа — билатеральная
катетеризация мочеточника — полезен для определения очага инфек¬
ции в мочевыводящих путях.
Перед проведением цистоскопии пациент должен освободит),
заполненный мочевой пузырь.
Обрабатывают наружные половые органы, области промежности и
заднего прохода, как указано ранее.
1
Приложение 657
Вводят цистоскоп в мочевой пузырь и собирают 5—10 мл мочи в
специальный стерильный одноразовый контейнер или стерильную
стеклянную посуду.
Маркируют контейнер или посуду символом КМП — катетерная
моча пузыря, затем орошают пузырь небактериостатическим физио¬
логическим (официнальным) раствором.
После орошения пузыр^я и введения катетера собирают истекаю¬
щую жидкость, держа концы обоих катетеров над открытым стериль¬
ным одноразовым контейнером или специальными стерильными
стеклянными емкостями.
Маркируют емкости символом ПЖП — промывная жидкость
пузыря.
Проводят мочеточниковые катетеры к среднему отделу каждого
мочеточника или почечных лоханок без дополнительного введения
жидкости; открывают цистоскоп, чтобы освободить мочевой пузырь.
Не используют для анализа первые 5—10 мл мочи из каждого кате¬
тера в мочеточнике.
Собирают 4 последующих пары проб (5-10 мл каждая) прямо в сте¬
рильный одноразовый контейнер или соответствующие стерильные
специальные емкости.
Маркируют емкости с материалом символами ПП—1 — правая почка,
Л П—1 — левая почка и т.д. Все пробы передают в лабораторию на посев.
6.6.2. Пробы при воспалительных процессах мочеполовых орга¬
нов у женщин. На ценность результатов микробиологического ана¬
лиза проб из гениталий в плане выявления этиологического агента
воспалительного процесса основное влияние оказывают детали,
обнаруженные гинекологом при осмотре пациентки; отдел моче¬
половой системы, из которого получена проба; качество собранной
пробы. Это обусловлено наличием нормальной микрофлоры гени¬
талий и изменениями в ее составе, происходящими в течение жизни
женщины.
Для получения полноценного материала из шейки матки реко¬
мендуется использовать одноразовый стерильный инструментарий,
например шпатель Айре и специальную щеточку — cervix brush; для
беременных — accelon combi и cervisoft; для женщин в менопаузе и
после конизации шейки матки — cytobrash plus cell collector или скри-
нет, представляющие собой щеточки с множественными щетинками,
расположенными по спирали.
658 Приложение
Для получения проб со слизистых уретры, влагалища (заднего
свода), цервикального канала также рекомендуется использован,
одноразовый стерильный инструментарий, например: уретральный
зонд — пропиленовый зонд с синтетическим ворсом (вискоза или лак
рон), а также специальные щеточки — cervix brush и vola brush.
6.6.2.1. Сбор проб из влагалища. Для объективизации наличия вое
палительного процесса во влагалище и выявления этиологического
агента не допускается посылать в лабораторию материал, собранный
из его переднего свода, т.к. эта проба, как правило, отражает только
обсемененность промежности.
Материал для анализа получают до проведения мануального иссле¬
дования.
Для сбора пробы используют 2 стерильных зонда-тампона или
тубсера.
После введения зеркала пробу собирают одним стерильным зон¬
дом-тампоном или тубсером (стерильным зондом-тампоном, вмонти
рованным в пробку стерильной одноразовой пробирки), допускается
также использование зондов-тампонов, вмонтированных в стериль¬
ную стеклянную или завинчивающуюся одноразовую пробирку;
материал собирают со слизистой заднего свода или с ее патологически
измененных участков. Зонд-тампон помещают в стерильную пробир¬
ку (тубсер) для доставки в лабораторию. Вторым стерильным зон¬
дом-тампоном (тубсером) собирают пробу и готовят мазки на чистом
обезжиренном стекле для исключения или подтверждения наличия
бактериального вагинита.
Более информативны пробы вагинального секрета, полученные с
помошью стерильной одноразовой калиброванной петли или пипет¬
ки, материал из которых переносят в стерильную одноразовую или
стеклянную гфобирку для доставки в лабораторию.
Мазки высушивают на воздухе и, поместив в стерильные чашки
Петри, доставляют в лабораторию.
6.6.2.2. Сбор проб из цервикального канала. Следует иметь и
виду, что из проб цервикального канала, как правило, выделяется
существенно меньший спектр микроорганизмов, чем из влагалища,
что является следствием различий в составе эпителия и pH этих эко¬
ниш.
После обнажения шейки матки в зеркалах тщательно очищаю!
шейку от секретов вагины и слизи с помощью ватного тампона, смо¬
ченного стерильным физиологическим раствором или стерильной
Приложение 659
водой. После этого щеточку (стерильный зонд-тампон, зонд-тампон
тубсера или зонд-тампон транспортного коллектора со средой) осто¬
рожно вводят в цервикальный канал на глубину 1,0-1,5 см, не касаясь
стенок влагалища. Вращая любой из перечисленных выше инстру¬
ментов несколько раз вокруг оси, захватывают материал — клетки,
экссудат — по периметру цервикального канала. Переносят материал
в стерильную одноразЬвую или стеклянную пробирку и доставляют в
лабораторию.
Для определения наличия гонококков необходимо собрать матери¬
ал на 3 тампона: из цервикального канала, уретры, ануса. Наилучшие
условия для сохранения гонококков с целью их последующего высе¬
ва обеспечивает использование специальных транспортировочных
пробирок со средами с активированным углем (обеспечивают пере¬
живание гонококков до 48 ч и более). Отдельную пробу собирают
для определения наличия хламидий: готовят мазки на предметном
стекле; материал, собранный зондом-тампоном, помешают в емкости
с транспортировочной средой для хламидий.
6.6.2.3. Сбор проб из полости матки. Правильное взятие матери¬
ала из матки может быть выполнено только при использовании спе¬
циальных инструментов типа шприца-аспиратора с покрытием на
зонде. После прохождения зондом цервикального канала в полости
матки раскрывают наружную оболочку зонда и набирают отделяемое
в шприц. Закрывают наружную оболочку и выводят зонд из матки.
Материал из шприца переносят в стерильный одноразовый контейнер
с завинчивающейся крышкой или стерильную пробирку (одноразо¬
вую или стеклянную) и доставляют в лабораторию.
6.6.2.4. Сбор пробы из уретры. Собирают материал через 1 или 2 ч
после освобождения мочевого пузыря — мочеиспускания.
Стимулируют образование отделяемого легким массажем уретры
через влагалище.
Собирают образовавшееся отделяемое стерильным зондом-там¬
поном.
Помещают зонд-тампон в тубсер или стерильную одноразовую
пробирку с завинчивающейся пробкой или в стеклянную — с газоп¬
роницаемой пробкой и передают материал в лабораторию.
Если описанным выше способом не удалось получить отделяемое,
промывают наружную уретру бактерицидным мылом, споласкивают
теплой кипяченой водой, вводят стерильный зонд-тампон на 2-4 см
в эндоуретру, осторожно поворачивают его несколько раз вокруг оси
660 Приложение
и оставляют в уретре на 1-2 с, извлекают тампон, помещают в сте¬
рильную емкость (см. выше) и доставляют материал в лабораторию.
6.6.2.5. Сбор пробы с наружных половых органов. Очищают повер¬
хность очага воспаления стерильным физиологическим раствором;
если на ране образовалась корочка, удаляют ее.
Производят выскабливание повреждения до появления серозной
жидкости.
Удаляют жидкость и остатки ткани стерильной марлевой салфет¬
кой, стараясь избежать кровотечения.
Прижимают основание раны до тех пор, пока не появится прозрач¬
ная жидкость.
Аспирируют жидкость шприцем с иглой № 26—27. Прикасаются
к жидкости в ране стерильным предметным стеклом, готовят мазок,
фиксируют, закрывают покровным стеклом (для определения нали¬
чия Treponema pallidum).
Вскрывают везикулу и собирают жидкость стерильным зондом-
тампоном из транспортировочной емкости со средой для вирусов.
с помощью стерильного скальпеля соскребают основание откры¬
той везикулы, а затем энергично протирают его стерильным тампо¬
ном из транспортировочной емкости со средой для вирусов.
Аспират в закрытом шприце с удаленной иглой, предметные стек¬
ла и материал в емкостях для вирусов передают в лабораторию.
6.6.2.6. Сбор проб фекалий с помощью ректального тампона.
Пробу, собранную с помошью ректального тампона, используюі
преимущественно для объективизации диагноза и выделения возбу¬
дителя гонореи, герпеса, дизентерии и анального носительства пио-
генного стрептококка.
Вводят кончик стерильного зонда-тампона на 2,5—3,0 см за аналь¬
ный сфинктер.
Осторожно вращая тампон вокруг оси, собирают материал с крит
ануса и так же осторожно извлекают тампон.
Помещают тампон в стерильную одноразовую пробирку (тубсер)
или в транспортировочную емкость с агаризованной средой без угля,
или в стерильную стеклянную пробирку; используют транспортиро¬
вочные емкости со средами для сохранения вирусов или стерильную
пробирку с забуференным физиологическим раствором с глицерином.
Передают материал в лабораторию.
Следует иметь в виду, что ректальные мазки для получения необ¬
ходимой информации — материал существенно худший по сравнению
Приложение 661
с пробой фекалий, даже в случае наличия трудности сбора материала
у маленьких детей и стариков.
6.6.2.7. Сбор пробы фекалий после дефекации. Фекалии после
дефекации собирают из предварительно продезинфицированных,
тщательно промытых (особое внимание следует уделять удалению
дезинфектантов, оказывающих ингибирующее действие на микро¬
флору фекалий и существенно искажающих результаты исследова¬
ния), ополоснутых заварным кипятком и охлажденных до комнатной
температуры судна или горшка сразу после дефекации в стерильный
одноразовый контейнер при помощи вмонтированного в его крышку
стерильного шпателя-ложечки. В экстремальных ситуациях (реани¬
мационные больные, маленькие дети) материал собирают в такой же
контейнер с ложечкой или ректальным тампоном; возможен также
сбор материала со стерильной сухой пеленки, не касаясь ткани.
Пробы можно также собирать с помощью специальных стериль¬
ных палочки или проволочной петли, приготовленных из нержавею¬
щего металла (алюминий, сталь, титан).
При наличии в испражнениях патологических примесей — слизи,
крови, хлопьев, гноя — включают их в отбираемую пробу.
Наиболее подходящей емкостью для сбора фекалий является спе¬
циальный стерильный одноразовый контейнер с широким горлом и
завинчивающейся крышкой, содержащий одноразовую ложечку-шпа¬
тель, вмонтированную в крышку контейнера. Если фекалии жидкие,
контейнер заполняют не более чем на 1/3 объема для предохранения
от разбрызгивания материала при вскрытии емкости в лаборатории.
Если фекалии оформленные, плотные — помещают в контейнер 3-4
ложечки (1,5-2,0 г). Материал, собранный с несвежего постельного
белья, искажает результат, а заполненный до верха контейнер анализу
не подлежит.
В случае отсутствия в лаборатории одноразовой посуды порцию
фекалий помещают в специально смонтированную стерильную стек¬
лянную посуду.
6.6.2.8. Пробы амниотической жидкости получают с помощью
катетера при проведении кесарева сечения или при пункции плодно¬
го пузыря.
Материал собирают в специальный одноразовый контейнер с
завинчивающейся крышкой, а полученный пункцией материал
оставляют в шприце, сняв иглу и закрыв его стерильной резиновой
пробкой. Контейнер и шприц доставляют в лабораторию.
662 Приложение
6.6.2.9. При получении проб из воспаленной бартолиновой железы
обеззараживают кожу и аспирируют материал из бартолинова прото¬
ка; снимают иглу, плотно закрывают шприц стерильной резиновой
пробкой и отправляют в лабораторию.
6.6.2.10. Пробы из фаллопиевых труб. Получают аспират из абсцес¬
са в процессе хирургической операции.
В закрытом шприце со снятой иглой, закрытым стерильной рези¬
новой пробкой, доставляют материал в лабораторию.
Если экссудат не выделяется, используют цитологические щеточ¬
ки, переносят материал в стерильную одноразовую или стеклянную
пробирку и доставляют в лабораторию.
Для исследования можно использовать материал, взятый на сте¬
рильный зонд-тампон, или пунктат, полученный при пункции пря¬
мокишечного углубления.
6.6.3. Пробы при воспалительных процессах мочеполовых органон
у мужчин.
6.6.3.1. Пенис. Очаги воспаления чаще исследуют для диагности¬
ки инфекций, передающихся половым путем (гонорея, хламидиоз
герпетические поражения, кандидоз и др.), сифилиса, а также для
определения возбудителей — представителей условно-патогенной
микрофлоры.
Тщательно моют наружные половые органы, промежность и
область заднего прохода теплой кипяченой водой с мылом; сполас¬
кивают теплой кипяченой водой; просушивают стерильной марлевой
салфеткой (необходимо для предотвращения дополнительной конта¬
минации).
Очищают поверхность очага воспаления стерильным физиологи¬
ческим раствором, если есть корочка, удаляют ее.
Соскребают рану, пока не появится серозная жидкость.
Промокают жидкость и убирают остатки ткани стерильной марле¬
вой салфеткой, стараясь избежать кровотечения.
Надавливают основание раны, пока не появится чистая жидкость.
Аспирируют жидкость шприцем с иглой № 26—27.
Прикасаются к жидкости в ране стерильным предметным стеклом
и закрывают покровным стеклом для определения наличия Treponema
pallidum.
Вскрывают везикулу и собирают жидкость стерильным зондом-
тампоном для определения вирусов, а также в шприц.
Приложение 663
С помощью стерильного скальпеля соскребают основание откры¬
той везикулы, а затем энергично протирают его стерильным зондом-
тампоном из транспортировочной емкости со средой для вирусов.
Аспират в закрытом шприце с удаленной иглой, предметные стекла
и материал в транспортировочной емкости передают в лабораторию.
6.6.3.2. Сбор пробы из уретры. Тщательно моют наружные половые
органы, промежность и область заднего прохода теплой кипяченой
водой с мылом, споласкивают теплой кипяченой водой; просушивают
стерильной марлевой салфеткой (необходимо для предотвращения
дополнительной контаминации).
Собирают пробу не ранее чем через 2 ч после мочеиспускания.
Вводят специальный стерильный уретрогенитальный зонд-там¬
пон на оси из тонкой алюминиевой проволоки (предпочтительно с
алгинатом кальция, но допускается использование тампона из хлоп¬
ка, вискозы или дакрона), а также тампон из транспортировочной
емкости со средами с активированным углем или без него на 3—4 см в
дистальный отдел уретры.
Осторожно вращая тампон вокруг оси, оставляют его в уретре на
2-3 с.
Извлекают тампон и помещают его в пробирку, доставляют в лабо¬
раторию.
6.6.3.3. Сбор пробы секрета предстательной железы (неинвазивный
метод). Для микробиологической объективизации диагноза «проста¬
тит», острого или хронического в лабораторию направляют 3 вида
материала от каждого пациента: 2 пробы мочи и 1 пробу эякулята.
Тщательно моют наружные половые органы, промежность и область
заднего прохода теплой кипяченой водой с мылом, споласкивают теп¬
лой кипяченой водой и просушивают стерильной марлевой салфеткой
(необходимо для предотвращения дополнительной контаминации).
Собирают первую пробу мочи до массажа предстательной железы:
для получения материала первую порцию мочи при естественном
мочеиспускании собирают в специальную банку для утилизации;
не прекращая мочеиспускания, держат стерильный одноразовый
контейнер с завинчивающейся крышкой (стерильную стеклянную
пробирку) против струи мочи и собирают в нее 8-10 мл; закрывают
контейнер крышкой (или пробирку — газопроницаемой целлюлозной
или ватно-марлевой пробкой), дезинфицируют наружную поверх¬
ность емкости.
664 Приложение
В стерильной перчатке производят пальцевый массаж простаты
через прямую кишку (врач-уролог).
Собирают образовавшийся эякулят в стерильньщ одноразовый
контейнер с завинчивающейся крышкой или в стерильную пробирку
(одноразовую с завинчивающейся пробкой или стеклянную, специ¬
ально смонтированную с газопроницаемой целлюлозной или ватно¬
марлевой пробкой), закрывают емкость (если материала мало, соби¬
рают пробу на зонд-тампон или, предпочтительно, на специальный с
алгинатом кальция).
После массажа пациент должен помочиться в стерильный однора¬
зовый контейнер с завинчивающейся крышкой или стеклянную про¬
бирку с ватно-марлевой пробкой — вторая проба мочи; дезинфицируют
наружную поверхность емкости с пробой, если на нее попала моча.
Пробы клинического материала доставляют в лабораторию; при
использовании пробирки с ватно-марлевой пробкой — не замочив
пробку, чтобы не исказить результаты исследования.
Для дифференциальной диагностики воспалительных процессов
мочеполовой сферы у мужчин в лабораторию направляют 5 видов
материала от каждого пациента: 4 пробы мочи и 1 пробу эякулята.
В отличие от ранее указанных правил сбора проб для диагности¬
ки простатита, первую порцию мочи не утилизируют, а собирают;
собирают также пробу мочи, полученной через 40-45 мин после
массажа. Все собранные в стерильные емкости пробы одновременно
доставляют в лабораторию. Наиболее удобны для сбора указанных
материалов стерильные одноразовые контейнеры с завинчивающи¬
мися крышками.
6.6.3.4. Сбор пробы из предстательной железы инвазивными мето¬
дами (трансуретральная резекция — ТУР, тонкоигольная биопсия,
полостная операций и др.). Получение эякулята, ткани аденомы и
других новообразований производят в транспортировочный кон¬
тейнер со средой для анаэробов, жидкость — в шприц. Доставляют в
лабораторию в емкостях, а также в шприце со снятой иглой, закрытом
стерильной резиновой пробкой.
6.6.3.5. Сбор пробы из яичка, его придатков и паховых лимфоузлов.
Производят для микробиологической диагностики неспецифичес¬
ких бактериальных эпидидимитов и эпидидимитов, возникающих
в результате сексуальных контактов. Следует иметь в виду, что воз¬
будителями бактериальных эпидидимитов являются представители
условно-патогенной микрофлоры, они встречаются чаще у мужчин
Приложение 665
старше 35 лет, но в настоящее время патология существенно помоло¬
дела. Инфекции, вызванные микобактериями туберкулеза, встреча¬
ются в основном среди пациентов, перенесших ранее простатит и/или
воспаление семенных пузырьков, а также эпидидимиты как результат
сексуальных контактов, чаще являются следствием недиагностиро-
ванных и/или неадекватно леченных гонореи, хламидиоза и других
инфекций, передающихся половым путем.
При наличии указанных выше подозрений, со всеми приготовле¬
ниями, соответствующими инвазивным методам, шприцем с иглой
аспирируют материал из яичка, придатков, паховых лимфоузлов.
Пробы доставляют в лабораторию в шприце со снятой иглой,
закрытом стерильной резиновой пробкой.
6.6.4. Пробы фекалий с помощью ректального тампона. Пробу,
собранную с помощью ректального тампона, используют преиму¬
щественно для объективизации диагноза и выделения возбудителя
гонореи, герпеса, дизентерии и анального носительства пиогенного
стрептококка.
Вводят кончик стерильного ректального зонда-тампона на 2,5—3,0
см за анальный сфинктер.
Осторожно вращая тампон вокруг оси, собирают материал с крипт
ануса и также осторожно извлекают тампон.
Помещают зонд-тампон в транспортировочную пробирку с агари-
зованной средой с активированным углем или без него; стерильную
одноразовую (тубсер) или стеклянную пробирку; в пробирку с забу-
ференным физиологическим раствором с глицерином; в зависимости
от клинической симптоматики используют также емкости с транс¬
портировочной средой для сохранения вирусов.
Передают материал в лабораторию.
Следует иметь в виду, что ректальные мазки для получения необхо¬
димой информации — материал худший по сравнению с пробой фека¬
лий, даже в случае наличия трудностей сбора материала у маленьких
детей и стариков.
6.6.4.1. Сбор пробы фекалий после дефекации. Фекалии после
дефекации собирают из предварительно продезинфицированных,
тщательно промытых и ополоснутых заварным кипятком, а затем
охлажденных на воздухе судна или горшка сразу после дефекации.
Особое внимание следует обращать на удаление с посуды дезинфек¬
тантов, оказывающих ингибирующее действие на микрофлору фека¬
лий и сушественно искажающих результаты исследования.
666 Приложение
Для сбора проб фекалий не допускается использовать туалетную
бумагу, т.к. она может быть пропитана солями бария, ингибирующи¬
ми рост некоторых фекальных патогенов.
Не допускается контаминировать пробу фекалий мочой, т.к. это
искажает результаты исследования.
В экстремальных ситуациях (реанимационные больные, малень¬
кие дети) собирают материал стерильным ректальным зондом-там¬
поном или петлей из нержавеющего материала (алюминий, сталь,
титан); можно собирать пробу со стерильной сухой пеленки, не каса¬
ясь ткани.
При наличии в испражнениях патологических примесей — слизи,
крови, хлопьев, гноя — следует включать их в отбираемую пробу.
Предпочтительной емкостью для сбора фекалий является стериль¬
ный одноразовый контейнер с широким горлом и завинчивающейся
крышкой, содержащий ложечку-шпатель, вмонтированную в крышку
контейнера. Если фекалии жидкие, заполняют контейнер не более
чем на 1/3 объема для предохранения от разбрызгивания материала
при вскрытии емкости в лаборатории. Если фекалии оформленные,
плотные, помещают в контейнер 3—4 ложечки (1,5— 2,0 г). Материал,
собранный с несвежего постельного белья, искажает результаты иссле¬
дования, а заполненный до верха контейнер анализу не подлежит.
В случае отсутствия в лаборатории одноразовой посуды порцию
фекалий помещают в специально смонтированную стерильную стек¬
лянную емкость.
6.7. Пробы диализата у больных, находящихся на постоянном
амбулаторном диализе
Основным осложнением гемодиализа является перитонит. Он
характеризуется мутным истекающим диализатом с более чем 100
лейкоцитами в 1 мл независимо от наличия клинических симптомов:
лихорадка и/или абдоминальных болей, а также наличием микро¬
организмов в жидкости.
В лабораторию на исследование направляют пробу (10-15 мл) мут¬
ного истекающего диализата или прозрачную пробу, полученную у
пациента с абдоминальными болями.
Пробу собирают в стерильный одноразовый контейнер с завин¬
чивающейся крышкой или стерильную одноразовую пробирку с
завинчивающейся крышкой, или стерильную стеклянную пробирку с
газопроницаемой пробкой. Следят за тем, чтобы не контаминировать
диализатом пробирки снаружи. Если это произошло, емкость с мате¬
Приложение 667
риалом дезинфицируют с помощью тампона (салфетки), смоченного
70% спиртом. При доставке в лабораторию пробы, собранной в стек¬
лянную пробирку с газопроницаемой пробкой, следят за тем, чтобы
не замочить пробку, т.к. это искажает результаты исследования.
При получении проб истекающего диализата у больных с острой
почечной недостаточностьЮу находящихся на прерывистом перитоне¬
альном диализе, соблюдают правила, изложенные выше.
Для получения информации о возможном наличии анаэробов в
обоих случаях пробы собирают шприцем и отправляют в лаборато¬
рию в шприце с удаленной иглой, закрытом стерильной резиновой
пробкой.
6.8. Пробы при инфекционно-воспалительных процессах желу¬
дочно-кишечного тракта и желчевыводящих путей
Перечень микроорганизмов, являющихся этиологическими аген¬
тами инфекций у человека, постоянно расширяется по мере усовер¬
шенствования методов выделения и идентификации, используемых в
лабораториях, увеличения удельного веса иммунокомпрометирован-
ных больных, а также тяжести и сложности клинических проявлений
заболевания.
Желудочно-кишечный тракт — наиболее обсемененная экологи¬
ческая ниша, которая является резервуаром огромного количества
видов микробов, способных к перемещению (транслокации) в другие
органы и ткани пациента при наличии нарушений в физиологичес¬
ком и микробиологическом аспектах системы антиинфекционной
резистентности организма, а также являющихся причиной появления
внутрибольничной инфекции.
в перечень возбудителей инфекции включены сальмонеллы,
шигеллы, иерсинии, кампилобактеры, аэромонады, плезиомонады,
клостридии {difficile), энтеропатоген ные, токсигенные и геморрагичес¬
кие кишечные палочки, а также золотистый стафилококк, дрожжепо¬
добные грибы (грибы плесневые и др.), синегнойная палочка.
Необходимость включения аэромонад {Aeromonas spp.) в короткий
список возбудителей обусловлена тем, что этот микроорганизм —
причина водянистой диареи, вызванной употреблением некипяченой
воды, особенно в слаборазвитых и развивающихся странах; плези¬
омонады {Plesiomonas spp.) — причина гастроэнтерита, вызванного
также употреблением некипяченой воды и недостаточно тщательно
приготовленных морепродуктов; клостридии (С/, difficile) — причина
токсинассоциированной диареи, обусловленной применением анти¬
668 Приложение
биотиков (псевдомембранозный колит). При этом следует иметь и
виду, что точный диагноз такого колита может быть поставлен при
эндоскопическом исследовании (наличие псевдомембран или микро¬
абсцессов у больных с диареей, получавших антибиотики).
В пробах фекалий и рвотных масс с диагнозом «пищевые отравле¬
ния» (не обязательно микробного происхождения) часто выделяются
С/, perfringens, S. aureus. При этом кишечные интоксикации вызыва¬
ются токсинами, а не самими микроорганизмами. Такая патология
может быть обусловлена наличием, например, нитратов в овощах и
фруктах, что, однако, не является препятствием для направления
собранной пробы на исследование микробиологам.
Во многих лабораториях все пробы фекалий, а также аспираты
12-перстной кишки, биопсии ректальные и тонкой кишки иссле¬
дуют на наличие Giardia lamblia, Cryptosporidium sp., Microsporidium sp..
Entamoeba histolytica, Balantidium coli и личинок Strongyloides stercoralis и
Ascaris lumbricoides, т.е. представителей простейших.
В связи с возрастанием роли вирусов в патологии человека в спе¬
циализированных отделах или лабораториях пробы из пищевода,
ректальные биопсии и содержимое слизистых исследуют на наличие
вирусов. При этом материал посылают в термостатированном контей¬
нере на чуть подтаявшем льду (сухой лед не применять!). При исполь¬
зовании транспортировочных емкостей со средами для сохранения
вирусов пробы не охлаждают.
6.8.1. Не допускается посылать в лабораторию пробы:
— фекалий без транспортировочной среды, собранных позднее
чем через 2 ч после дефекации;
— высохшие ректальные тампоны или пробы биопсии;
— несколько проб, полученных у больного в один и тот же день;
— наполненные до верха материалом контейнеры или пробирки.
6.8.2. Пробы, собранные с помощью ректального тампона. Пробу
используют преимущественно для объективизации диагноза и
выделения возбудителей сальмонеллеза, дизентерии, иерсиниоза,
гонореи, вирусных инфекций, энтеропатогенных и токсигенных
эшерихий, а также анального носительства пиогенного стрепто¬
кокка.
Вводят кончик стерильного зонда-тампона на 2,5—3,0 см за аналь¬
ный сфинктер.
Осторожно вращая тампон вокруг оси, собирают материал с крипт
ануса и также осторожно извлекают тампон.
Приложение 669
Помещают зонд-тампон в транспортировочную емкость с агари¬
зованными средами с активированным углем и без него или в пустую
стерильную одноразовую пробирку с зондом-тампоном (тубсер), или
стерильную стеклянную пробирку с забуференным физиологическим
раствором с глицерином; в зависимости от клинической симптома¬
тики используют такж^ емкости с транспортировочной средой для
сохранения вирусов.
Передают материал в лабораторию.
Более полную информацию получают при исследовании проб
фекалий.
6.8.3. Пробы, собранные после дефекации. Фекалии собирают
сразу после дефекации из предварительно продезинфицированных,
тщательно промытых и ополоснутых заварным кипятком, а затем
охлажденных на воздухе судна или горшка. Особое внимание сле¬
дует уделять удалению дезинфектантов, оказывающих ингибирую¬
щее действие на микрофлору фекалий и существенно искажающих
результаты исследования.
Для сбора проб фекалий не используют туалетную бумагу, т.к. она
может быть пропитана солями бария, ингибирующими рост некото¬
рых фекальных патогенов.
Пробы не контаминируют мочой, т.к. это искажает результаты
исследования. В экстремальных ситуациях (реанимационные боль¬
ные, маленькие дети и др.) собирают материал у пациента стерильным
ректальным зондом-тампоном или петлей из нержавеющего матери¬
ала, подлежащего стерилизации (алюминий, сталь, титан); можно
собирать пробу фекалий со стерильной сухой пеленки, не касаясь
ткани.
При наличии в испражнениях патологических примесей — слизи,
крови, хлопьев, гноя — их следует включить в отбираемую пробу.
Рекомендуемой емкостью для сбора фекалий является стериль¬
ный одноразовый контейнер с широким горлом и завинчивающейся
крышкой, содержащий ложечку-шпатель, вмонтированную в крышку
контейнера. Если фекалии жидкие (например, профузная диарея), их
собирают с помощью стерильного катетера со стерильным наконеч¬
ником с одной стороны и грушей, предварительно простерилизован-
ной или обработанной 70% этиловым спиртом и тщательно ополосну¬
той стерильным физиологическим раствором — с другой. Жидкими
фекалиями контейнер заполняют не более чем на 1/3 объема для
предохранения от разбрызгивания материала при вскрытии емкости
670 Приложение
в лаборатории. Если фекалии оформленные, плотные, то в контейнер
помещают 3-4 ложечки (1,5-2,0 г). Материал, собранный с несвежего
белья, и заполненный до верха контейнер анализу не под;тежат, т.к. в
первом случае гарантированы некорректные результаты, а во втором —
материал не исследуется.
В случае отсутствия в лаборатории одноразовой посуды порцию
фекалий помещают в специально смонтированную стерильную стек¬
лянную емкость.
6.8.4. Содержимое двенадцатиперстной и подвздошной кишки,
как и содержимое толстой кишки (фекалии), собирают в специаль¬
ный контейнер (флакон), в котором доставляют в лабораторию (см.
выше) не позднее 2 ч после дефекации и сбора пробы. При отсутствии
такой возможности пробы хранят в холодильнике (при температуре
4—8 °С), за исключением пробы фекалий для определения Cl. difficile,
которые замораживают при температуре —20 °С.
Пробы фекалий, в зависимости от наличия клинических симпто¬
мов направляют в лабораторию на одно из исследований, перечислен¬
ных ниже.
6.8.4.1. «На облигатные кишечные патогены» («на дизгруппу») —
проводят с целью обнаружения общепринятых патогенов: сальмо¬
нелл, шигелл, иерсиний, энтеропатогенных, токсигенных и геморра¬
гических Е. coll. При этом материал собирают и направляют в лабора¬
торию на тампоне, вмонтированном в стерильную одноразовую или
стеклянную пробирку с забуференным физиологическим раствором
с глицерином, или на тубсерах, помещенных в специальные среды с
активированным углем или без него.
6.8.4.2. «На флору» — проводят с целью выделения как патогенных,
так и условно-патогенных микроорганизмов, включая бифидо- и лак¬
тобактерии, качественным методом. При этом материал собирают и
доставляют в лабораторию в специальных одноразовых стерильных
контейнерах с ложечкой или специально смонтированных стериль¬
ных стеклянных емкостях.
6.8.4.3. «На дисбактериоз» — предусматривает количественное
определение патогенных и условно-патогенных микроорганизмов.
Материал собирают и доставляют в лабораторию в специальных одно¬
разовых стерильных контейнерах с ложечкой или специально смонти¬
рованных стерильных стеклянных емкостях.
6.8.4.4. «На простейшие» — проводят с целью выявления цист
и вегетативных форм простейших, способных вызвать поражение
Приложение 671
слизистых желудочно-кишечного тракта {Giardia lamblia. Entamoeba
histolytica, Criptosporidium parvum, Balantidium coll, lodamoeba butschlii,
Cyclospra spp.).
6.8.4.5. «Ha вирусы» — предусматривает определение энтеропато¬
ген ных вирусов (ротавирусы, энтеровирусы, коронавирусы).
При исследовании на распространенность дисбактериоза следу¬
ет параллельно анализировал^ обсемененность слизистых ротовой
полости.
6.8.5. Сбор проб со слизистой ротовой полости проводят утром
натощак до приема пищи после утреннего туалета, при котором
необходимо почистить зубы пастой без бактерицидных или бактери-
остатических добавок (фтор, дезинфицирующий набор трав), затем
прополоскать рот теплой кипяченой водой.
Пробу собирают одним из следующих методов.
6.8.5.1. Сухим стерильным зондом-тампоном (из хлопка, вискозы
или с алгинатом кальция), извлеченным из стерильной одноразовой
(тубсера) или стеклянной пробирки, тщательно и достаточно жест¬
ко обтирают слизистые щек, языка, основания языка, десен, зонд-
тампон помещают в пробирку и отправляют в лабораторию. Можно
использовать зонд-тампон из транспортировочных емкостей со сре¬
дами с активированным углем или без него, особенно если нельзя
срочно доставить пробу в лабораторию.
6.8.5.2. Набирают в рот 10—15 мл стерильного изотонического
физиологического раствора, не запрокидывая головы, в течение
30—60 с тщательно прополаскивают рот, выливают жидкость в сте¬
рильный одноразовый контейнер с завинчивающейся крышкой или
специально смонтированную стерильную стеклянную емкость, плот¬
но закрывают посуду с материалом, доставляют в лабораторию, указав
при этом в направлении точный объем физиологического раствора,
использованного для полоскания.
6.8.6. Пробы аспиратов желудка. Пациент должен быть голодным
перед проведением каждой из перечисленных ниже процедур (послед¬
ний прием пищи — не позднее 19 ч накануне).
6.8.6.1. Желудочный лаваж используют для определения
М Tuberculosis у RQTeii, когда невозможно получить качественную мок¬
роту. Пробу собирают после пробуждения пациента утром, т.к. загла¬
тываемая во сне мокрота еще находится в желудке. Пробы собирают
также для исследования распространенности дисбактериоза. В этом
случае материал получают у пациента (обследуемого) не ранее чем
672 Приложение
через 4-5 ч после пробуждения, когда носоглоточная слизь и, возмож¬
но, мокрота уже не будут находиться в желудке.
Вводят смазанный зонд через рот или нос в ^желудок пациента и
собирают лаваж.
Перед удалением зонда производят отсос и зажим для предотвра¬
щения травмы слизистой и/или дополнительной аспирации при уда¬
лении зонда.
Удаляют зонд.
Материал из зонда с соблюдением правил асептики переносят и
стерильные одноразовый контейнер с завинчивающейся крышкой
или в пробирку с завинчивающейся пробкой, или в специально смон¬
тированную стеклянную пробирку с газопроницаемой пробкой. При
использовании специально смонтированных стерильных стеклянных
пробирок с пробками не замочите пробку.
Доставляют пробу в лабораторию.
6.8.6.2. Пробы аспирата 12-перстной кишки направляют в лабора¬
торию для определения наличия Giardia lamblia и личинок Strongyloides
stercoralis, Ascarls lumbricoides, a также они могут быть использованы для
микробиологического исследования распространенности дисбакте¬
риоза желудочно-кишечного тракта.
Вводят зонд через рот пациента в двенадцатиперстную кишку.
Для аспирации пробы на гиардиаз зонд вводят, по меньшей мере, в
третью часть 12-перстной кишки.
Материал с соблюдением правил асептики переносят в соответс¬
твующие емкости (см. выше) и доставляют в лабораторию.
6.8.7. Биоптаты, соскобы, смывы. Пациент перед проведением
исследования должен быть голодным (последний прием пищи в 19 ч
накануне).
6.8.7.1. Пробы из пищевода, желудка, 12-перстной кишки. Пробы
из пищевода используют для определения количества Candida spp. и
вирусов (в основном у пациентов с иммунодефицитными состояни¬
ями); пробы из желудка и двенадцатиперстной кишки — Helicobacter
pylori; пробы из 12-перстной кишки — также для определения Giardia
lamblia и личинок S. stercoralis и А. lumbricoides.
Вводят эндоскоп через рот обследуемого.
Получают пробы через канал эндоскопа одним из следующих
методов:
— используя биопсийные щипцы, получают пробы из пищевода,
желудка, луковицы 12-перстной кишки;
Приложение 673
— используя щеточки, несколько раз скребут подозрительные
места на слизистых пищевода, желудка, 12-перстной кишки
(для Я pylori) для получения достаточного количества клеточ¬
ного материала;
— производят смывы, вводя 25-30 мл стерильного небактериос-
татического изотонического физиологического раствора через
биопсийный канал в поражение; собирают пробу аспирацией
жидкости через эндоскоп в стерильную емкость, которая при¬
соединена к отсасывающему зонду (если видна язва желудка,
собирают пробы с основания слизистой желудка, окружающей
язву, и каждого из четырех квадрантов краев язвы); при достав¬
ке материала в лабораторию в случае необходимости получе¬
ния данных о количественном составе выделяемых микро¬
организмов указывают объем жидкости, использованной для
получения аспирата;
— переносят материал в специальные емкости и доставляют в
лабораторию.
Пробу содержимого двенадцатиперстной кишки собирают мето¬
дом менее инвазивным, чем аспирационный, — с помощью Entero-Test
Capsula — String Test (стринг-тест, струнный тест). Пробы дуоденаль¬
ного содержимого, полученные таким методом, используют для опре¬
деления наличия паразитов: гельминтов и простейших {Strongyloides,
Giardia, Cryptosporidium и Isospora). Перед исследованием больного
готовят по правилам, предусмотренным для проведения инвазивных
мероприятий:
— извлекают капсулу из упаковки;
— конец струны закрепляют на шее пациента;
— дают пациенту проглотить капсулу, запив небольшим количес¬
твом воды;
— предупреждают лабораторию о времени проглатывания кап¬
сулы;
— после заглатывания капсулы дают пациенту отдохнуть в тече¬
ние 4 ч;
— держась за струну, осторожно извлекают приспособление;
— помещают струну с адгезированным на ней биоматериалом в
небольшой (для сбора мочи) одноразовый стерильный контей¬
нер с плотно завинчивающейся крышкой;
— немедленно доставляют в лабораторию в полиэтиленовом
мешке.
674 Приложение
При невозможности немедленного транспортирования пробы и
лабораторию добавляют в контейнер ~ 1 мл физиологического раство
ра, чтобы сохранить струну с материалом влажной*.
6.8.7.2. Ректальную биопсию производят для определения наличия
Entamoeba histolytica, Balantidium coii и вирусов. Если повреждение не
очевидно, получают пробу слизистой на расстоянии 7—10 см от аналь¬
ного отверстия.
6.8.7.3. Биопсию тонкой кишки производят для определения Giardia,
Cryptosporidium и Microsporidium. Биопсия тонкой кишки дает инфор
мацию очень высокой степени точности для наличия Microsporidia spp.
Материал из других отделов желудочно-кишечного тракта (желудок,
толстая кишка) в сравнении с тонкой кишкой гораздо менее информа¬
тивен. Пробы биопсии очага получают в процессе операции.
Материал помещают в стерильный одноразовый контейнер с
завинчивающейся крышкой или в стерильные пробирки одноразовые
или стеклянные.
6.8.7.4. Пробы, получаемые с использованием ректороманоскопа,
используют преимущественно для определения наличия Entamoeba
histolytica и Micobacterium spp., а также для С/, difficile и S. aureus (при
подозрении на псевдомембранозный колит процедура противопока¬
зана, так как может привести к перфорации кишечника):
- производят ректороманоскопию, используя гибкий или ригид¬
ный ректороманоскоп;
- получают биопсийный материал любого видимого пораже¬
ния;
— дополнительно аспирируют жидкость из воспаленной кишки с
помощью пипетки, введенной через ректороманоскоп;
— переносят пробы в стерильные одноразовые контейнеры с
завинчивающейся крышкой или другие емкости с притертой
пробкой;
- если проба биоптата очень мала, добавляют в емкость, в кото¬
рую ее перенесли, небольшое количество стерильного небакте¬
риостатического физиологического (официнального) раствора
для предотвращения ее от высыхания;
— доставляют материал в лабораторию.
6.8.8. Пробы при инфекционно-воспалительных процессах в жел¬
чевыводящих путях. Пробы желчи собирают при острых холангитах,
острых холециститах, эмпиеме желчного пузыря и инфекциях, ассо¬
циированных с наружным дренированием желчевыводящих путей.
Приложение 675
При острых холангитах вместе с пробой желчи направляют в
лабораторию пробы крови для определения наличия бактериемии.
При острых холангитах проба крови может быть единственным
материалом, направляемым на микробиологическое исследова¬
ние для получения необходимой информации. Материал из очага
воспаления направляют^ в лабораторию в емкости с транспортиро¬
вочной средой для анаэробов. Пробы крови — см. раздел «Пробы
крови».
Не допускается собирать пробу желчи из дренажного мешка.
При наличии у больного дренажа собирают из него пробу с помо¬
щью шприца, предварительно тщательно обработав участок, который
будет подвергаться пунктированию.
Материалом для микробиологического исследования с целью
получения результатов об этиологическом агенте (агентах) и его (их)
антибиотикочувствительности являются пробы, полученные в про¬
цессе полостной операции или при проведении лапароскопии (лапа-
ротомии). Таким материалом являются пробы желчи, гноя, аспирата
из печеночных абсцессов.
Пробы собирают шприцем с иглой или без нее и, закрыв шприц
стерильной резиновой пробкой, направляют в лабораторию. Материал
из шприца с соблюдением правил асептики можно немедленно пере¬
нести в стерильные одноразовые контейнер или пробирку с завинчи¬
вающейся крышкой, или в специально смонтированную стерильную
стеклянную пробирку со стерильной резиновой пробкой.
При проведении амбулаторного обследования пациента с инфек¬
цией в желчевыводящих путях пациента готовят к нему с соблюдени¬
ем всех необходимых правил для его проведения;
- пробы желчи — среднюю порцию — собирают при зондирова¬
нии в процедурном кабинете;
- над пламенем спиртовки открывают пробирку для сбора мате¬
риала; полученную желчь (10-12 мл) помещают в одноразо¬
вую стерильную пробирку с завинчивающейся пробкой; при
использовании стерильной стеклянной пробирки, закрытой
газопроницаемой пробкой, после наполнения емкости обжи¬
гают горлышко и пробку в пламени спиртовки, закрывают
пробирку;
- при использовании пробирки с газопроницаемой пробкой
пробу доставляют в лабораторию в строго вертикальном поло¬
жении, чтобы не замочить пробку желчью.
676 Приложение
6.9. Пробы у пациентов, получающих в качестве медицинской
помощи перитонеальный диализ
Главным осложнением перитонеального диализа является перито¬
нит, при котором наиболее типичные проявления — мутный истека¬
ющий диализат и абдоминальные боли. Реже наблюдаются лихорадка
и лейкоцитоз.
Мутность диализата в этой ситуации может быть обусловлена
также наличием фибрина или хелатов, что не является препятствием
для направления пробы на исследование.
В лабораторию на исследование доставляют пробу, собранную сле¬
дующим образом:
— дезинфицируют часть стенки мешка стерильной салфеткой,
смоченной 70% этиловым спиртом и ждут не менее 2 мин, чтобы
спирт высох и проявил свой дезинфицирующий эффект;
— собирают не менее 30 мл жидкости, введя шприц с иглой в
продезинфицированный участок стенки, не касаясь руками
продезинфицированных участков, чтобы не вызвать дополни¬
тельную контаминацию;
— переносят жидкость в стерильные одноразовые контейнеры
с завинчивающейся крышкой, при их отсутствии оставляют
материал в шприце с удаленной иглой, плотно закрытом сте¬
рильной резиновой пробкой;
— пробы в контейнерах (шприцах) немедленно доставляют в
лабораторию;
— если нет возможности немедленно доставить материал в лабо¬
раторию, помещают его в холодильник при 2—8 °С.
6.10. Пробы стерильных жидкостей тела (кроме крови, ликвора, мочи)
Перед проведением чрескожной аспирации тщательно очищают
выбранный участок кожи 70% этиловым спиртом; затем дезинфициру¬
ют его 1-2% раствором йода или другим дезинфектантом, разрешенным
к применению для этих целей в установленном порядке, для предотвра¬
щения внесения инфекции; избыток йода удаляют марлевой салфет¬
кой, смоченной 70% спиртом во избежание ожога кожи пациента.
Соблюдая правила асептики, выполняют чрескожную аспирацию
для получения проб плевральной, перикардиальной, перитонеальной
или синовиальной жидкостей.
Удаляют любые пузырьки воздуха из шприца и немедленно пере¬
носят пробу в емкость с транспортировочной средой для анаэробов
или в пробирку с тиогликолевой средой или посылают пробу в лабора¬
приложение 677
торию в шприце с удаленной иглой, закрытом стерильной резиновой
пробкой.
Минимальный объем жидкости, который необходимо напра¬
вить в лабораторию для идентификации аэробных, факультатив¬
но-анаэробных и анаэробных микроорганизмов, включая грибы и
микобактерии, составляет 10—12 мл. При этом, следует иметь в виду,
что больший объем пробы увеличивает возможность обнаружения
патогена.
Если подозревают гонококковый артрит, для сбора пробы исполь¬
зуют пробирку с транспортировочной средой с активированным
углем для сохранения гонококков и готовят для посева соответствую¬
щие среды (заранее предупреждают лабораторию).
В случае серозного характера любой пробы полученной жидкос¬
ти задача лаборатории — исключить нежелательную возможность
инфекции, а не подтвердить подозреваемый сепсис. Если перечислен¬
ные выше полости очевидно инфицированы, то любая проба, посыла¬
емая в лабораторию, — это всегда гной из исследуемой полости.
6.11. Пробы при инфекциях кожи и подкожной клетчатки
6.11.1. Ожоговые раны. Поверхность ожоговой раны всегда обсеме¬
няется или микрофлорой пациента, или микроорганизмами среды,
окружающей больного. В случае большой концентрации микроорга¬
низмов в очаге происходит инфицирование подстилающих тканей и
возникает реальная угроза бактериемии. Следовательно, сбор проб
только с обожженной поверхности недостаточно информативен. По
этой причине часто показано получение материала из более глубоких
слоев. Более того, микроорганизмы не всегда равномерно обсеменяют
ожоговую поверхность, что требует сбора проб из нескольких участков
очага воспаления:
- дезинфицируют поверхность ожога 70% этиловым спиртом,
затем 1—2% раствором йода или другим дезинфектантом, раз¬
решенным к применению для этих целей в установленном
порядке; во избежание ожога пациента убирают избыток йода
салфеткой, смоченной 70% этиловым спиртом;
- дают высохнуть дезинфектантам в течение 2 мин;
— с помощью дерматома иссекают небольшие (3—4 мм) кусочки
ткани для количественного определения обсеменен ности очага;
— иссеченные кусочки ткани немедленно помещают в неболь¬
шой стерильный одноразовый контейнер (например, для сбора
мокроты) с завинчивающейся крышкой;
678 Приложение
— для предотвращения высыхания пробы добавляют в контей¬
нер 1—3 капли стерильного изотонического физиологического
раствора;
— немедленно передают материал в лабораторию.
У ожоговых больных необходимо проводить постоянный монито¬
ринг обсемененности крови.
6.11.2. Поверхностные раны бактериальные (варикоз, ишемичес¬
кие и диабетические язвы, пролежни).
Мазок с поверхности раны существенно менее информативен, чем
проба, аспирированная шприцем.
Материал получают следующим образом:
— очищают поверхность раны 70% этиловым спиртом, затем
1—2% раствором йода или 1% свободным йодом, или другим
дезинфектантом, разрешенным к применению для этих целей в
установленном порядке, удаляют избыток йода салфеткой, смо¬
ченной 70% этиловым спиртом во избежание ожога пациента;
— дают высохнуть дезинфектантам в течение 2 мин;
— используя 3-5-миллилитровый шприц с иглой № 22—23, аспи¬
рируют самую глубокую область очага;
— при наличии везикул одним шприцем собирают жидкость и
клетки с основания очага;
— удаляют иглу, плотно закрывают шприц стерильной резиновой
пробкой и передают в лабораторию.
В случае, если при первичном проведении процедуры аспирации
не удалось получить материал:
— вводят подкожно стерильный небактериостатический физио¬
логический раствор;
— повторяют попытку аспирации (см. выше).
В случае, еслп вновь не удалось получить материал:
— промывают использованную иглу и шприц 1—3 мл стерильного
питательного бульона, полученного накануне в лаборатории,
пропуская бульон через иглу в шприц;
— удаляют иглу, плотно закрывают шприц стерильной резиновой
пробкой и передают в лабораторию, указав, какой объем буль¬
она был использован, при желании получить количественную
характеристику обсемененности раны.
6.11.3. Поверхностные раны грибковые (варикоз, ишемические и
диабетические язвы, пролежни).
Приложение 679
Мазок с поверхности раны существенно менее информативен, чем
проба, аспирированная шприцем.
Материал получают следующим образом:
— очищают поверхность раны стерильной салфеткой, смоченной
стерильной дистиллированной водой;
— используя лезвие скальпеля, получают соскоб с периферичес¬
кой границы раны; ^
— помещают материал в стерильный одноразовый контейнер с
завинчивающейся крышкой или специально смонтированную
стерильную стеклянную емкость;
— для предохранения пробы от высыхания добавляют в емкость
1—3 капли дистиллированной воды;
— передают пробу в лабораторию.
В случае наличия раны на поверхности с волосяным покровом после
предварительной обработки (см. выше) соскребают с помощью лезвия
скальпеля материал с волосами (10-12 волосинок) и помещают его в отде¬
льную емкость (стерильные одноразовые контейнер или чашку Петри
диаметром 55 мм).
В случае поражения ногтя после его обработки марлевым (не
ватным!) тампоном, смоченным 70% этиловым спиртом, получают
соскобы или материал ниже ногтевой пластины и передают пробы в
лабораторию в стерильных одноразовых контейнере или маленькой
(диаметром 55 мм) чашке Петри.
6.11.4. Язвы и узелковые утолщения.
6.11.4.1. Материал получают следующим образом:
— очищают поверхность язвы 70% этиловым спиртом, затем
дезинфицируют 1—2% раствором йода или другим дезинфек¬
тантом, разрешенным к применению для этих целей в уста¬
новленном порядке; раствор йода удаляют после проведения
процедуры стерильной салфеткой, смоченной 70% этиловым
спиртом, чтобы избежать ожога пациента;
— сухой стерильной салфеткой удаляют некротические массы,
детрит, гной;
— кюретажной ложкой выскабливают основание язвы или узел¬
кового утолщения;
— помещают материал в стерильные одноразовые контейнер с
завинчивающейся крышкой или пробирку с крышкой, или
стерильную стеклянную пробирку;
— передают материал в лабораторию.
680 Приложение
6.11.4.2. При наличии экссудата в язве или узелке;
— собирают пробу с помощью шприца или, что менее информа¬
тивно, с помощью зонда-тампона;
— закрывают шприц стерильной резиновой пробкой; зонд-там¬
пон помещают в стерильную сухую одноразовую пробирку
(тубсер), а лучше в транспортировочную емкость со средами с
активированным углем или без него;
— передают материал в лабораторию.
Следует иметь в виду, что присутствие анаэробов в ожоговых
ранах, язвах, узелках, поверхностных ранах маловероятно. Эти мик¬
роорганизмы обнаруживают в ранах, являющихся следствием укусов
человека, животных, насекомых, а также следствием травмы.
6.11.5. Сбор проб из раны с помощью зонда-тампона позволяс!
получать результаты микробиологических исследований менее зна¬
чимые, чем с помощью методов, представленных выше. Вместе с тем
в большинстве лечебно-профилактических организаций пользуются
именно зондом-тампоном.
Правила и техника сбора проб с помощью зонда-тампона:
— для сбора проб и транспортирования материала в лабораторию
используют два стерильных тампона (из хлопка, вискозы или
с алгинатом кальция), извлеченных из стерильных одноразо¬
вых (тубсеры) или стеклянных пробирок; используют емкости
(пробирки) с транспортировочными средами с активирован¬
ным углем или без него;
— перед взятием материала кожу вокруг раны предварительно обра¬
батывают 70% этиловым спиртом или другим антисептиком;
— сухой стерильной салфеткой удаляют с поверхности раны
некротические массы, детрит, гной;
— после обработки раны одновременно двумя стерильными зон¬
дами-тампонами производят взятие материала круговыми вра¬
щательными движениями от центра к периферии, плотно
прижимая тампоны к поверхности раны, при этом стараясь
добиться максимальной нагрузки тампонов материалом впло ! ь
до полного их насыщения;
— нагруженные материалом тампоны помещают в пробирки, и \
которых они были извлечены;
— передают материал в лабораторию.
6.11.6. Сбор пробы из очага без отделяемого (целлюлиты, абсцес¬
сы в стадии формирования) представляет очень большую проблему.
Приложение 681
Необходимо очень внимательно искать место, через которое можно
войти в очаг. Если место найдено, рану тампонируют и передают
пробу в лабораторию. Иногда показаны пункционная биопсия или
использование кюретки. Для детей пригодна аспирационная биопсия
очень тонкой иглой.
Пункционная биопсия показана только при крайней необходимос¬
ти в выделении возбудителя^ и определения его чувствительности к
антибиотикам (например, при неэффективности стартовой терапии).
Это связано с низкой чувствительностью методики вследствие возмож¬
ности развития осложнений и технической сложности манипуляций.
Для получения пробы:
— очищают поверхность очага стерильной марлевой салфеткой,
смоченной 70% этиловым спиртом, дают высохнуть;
— набирают в шприц небольшое количество (0,5—1,0 мл) физио¬
логического раствора, вводят его в место предполагаемого
очага инфекции, затем сразу аспирируют;
— переносят материал в стерильную одноразовую пробирку с
плотно закрывающейся пробкой или стеклянную пробирку с
плотно закрывающейся стерильной резиновой пробкой;
— пробирку с материалом направляют в лабораторию, указав при
этом объем использованного физиологического раствора.
6.12. Пробы из инфицированных глубоких ран, абсцессов,
мягких тканей
6.12.1. Раны как следствие укуса. Пробы из свежеукушенных ран не
рекомендуется сдавать на микробиологическое исследование, так как
наиболее вероятно получение отрицательного результата (роста нет).
При появлении нагноения в ране:
— с помощью шприца с иглой или без нее аспирируют из раны
гной;
— закрывают шприц стерильной резиновой пробкой или втыка¬
ют иглу в стерильную резиновую пробку;
— направляют материал в лабораторию.
Если гной очень густой, соскабливают его и собирают в стериль¬
ный одноразовый контейнер или с помощью стерильного зонда-
тампона (хлопок, вискоза, альгинат) помещают в сухую стерильную
одноразовую пробирку или емкость с транспортировочной средой,
доставляют в лабораторию.
6.12.2. Глубокие раны и абсцесс. Материал получают следующим
образом:
682 Приложение
— дезинфицируют поверхность 70% этиловым спиртом, затем
1—2% раствором йода или другого дезинфектанта, разрешенно¬
го к применению для этих целей в установленном порядке;
— раствор йода удаляют марлевой салфеткой, ‘смоченной 70%
этиловым спиртом во избежание ожога пациента;
— аспирируют самую глубокую область очага, старательно избе¬
гая загрязнения микрофлорой раневой поверхности.
При сборе пробы в процессе операции направляют в лабораторию
часть стенки абсцесса в отдельной емкости.
6.12.3. Аспират инфицированных мягких тканей. Материал полу¬
чают следующим образом:
— дезинфицируют поверхность 70% этиловым спиртом, затем
1—2% раствором йода или другого дезинфектанта, разрешенно¬
го к применению для этих целей в установленном порядке;
— удаляют раствор йода салфеткой, смоченной 70% этиловым
спиртом, чтобы избежать ожога пациента;
— аспирируют самую глубокую область очага, уделяя особое
внимание тому, чтобы не загрязнить пробу поверхностной
микрофлорой;
— аспирированную жидкость направляют в лабораторию в шпри¬
це, плотно закрытом стерильной резиновой пробкой.
При сборе пробы в процессе операции кусочки ткани (3-5 смз)
помещают в стерильные контейнер или стеклянную емкость, добавив
3—5 мл небактериостатического (официнального) физиологического
раствора для предохранения материала от высыхания.
6.13. Пробы при инфекциях в стоматологии (десны,
периодонтальные, перианикальные и стоматиты Винсента)
Материал получают следующим образом:
— очищают десны и десневые карманы и полностью поверхность
зуба;
— используя специальный крючок (скалер), собирают инфициро¬
ванный субгингивальный материал;
— переносят пробу в емкость с транспортировочной средой для
анаэробов или в емкость с редуцированной тиогликолевой
средой, плотно закрытую стерильной резиновой пробкой, и
направляют материал в лабораторию;
— параллельно готовят мазки на чистом обезжиренном предмет¬
ном стекле. Пробу для мазка собирают, как было указано выше.
Направляют в лабораторию.
Приложение 683
6.14. Пробы при инфекционно-воспалительных процессах костей
и суставов
6.14.1. Острый остеомиелит. В процессе операции собирают
2 пробы из очага воспаления: одну пробу инфицированной кости
(1—5 см^) непосредственно из очага, вторую — на самой границе очага,
т.е. из области, до которой удаляется очаг воспаления.
Собранные пробы (каждую отдельно) помещают в стерильный
одноразовый контейнер с завинчивающейся крышкой или плотно
укупоренные пробирки (одноразовые или стерильные).
в емкости с пробкой для предотвращения высыхания можно доба¬
вить несколько капель стерильного физиологического раствора.
Емкости с пробами доставляют в лабораторию немедленно.
Для определения наличия анаэробов используют специальные
емкости с транспортировочными средами.
При наличии в ране дренажей для активной аспирации собирают
пробу из предварительно продезинфицированного участка дренажа с
помощью шприца с иглой и, убрав из шприца пузырьки воздуха, сняв
иглу и закрыв шприц стерильной резиновой пробкой, доставляют
материал в лабораторию.
Можно собрать гной на зонд-тампон, извлеченный из стерильной
одноразовой (со средами или без них) или пустой стерильной стек¬
лянной пробирки. Тампон в пробирке доставляют в лабораторию.
Параллельно с пробами из очага воспаления обязательно направ¬
ляют в лабораторию пробы крови больного для определения наличия
бактериемии.
6.14.2. Хронический остеомиелит. В лабораторию направляют
пробу из раны, собранную зондом-тампоном из пораженной полости
над областью остеомиелита.
Следует учитывать, что наиболее информативный результат может
быть получен при доставке в лабораторию проб грануляционной
ткани или гноя непосредственно из очага — области инфицированной
кости; или секвестров (при их наличии), при посеве которых можно
получить данные об этиологическом агенте воспаления и качестве
проведенной операции.
Каждую пробу собирают в отдельную стерильную емкость однора¬
зовую или стеклянную и доставляют в лабораторию.
Для определения наличия анаэробов используют специальные
емкости или системы со средами, разрешенные к применению для
этих целей в установленном порядке.
684 Приложение
6.14.3. Инфекции суставов. В лабораторию направляют зонд-там¬
пон, нагруженный материалом из вновь открытого инфицированного
сустава.
Следует принять во внимание, что наиболее инфор'мативный мате¬
риал — грануляционная ткань, собранная из очага, и суставная жид¬
кость. Ткань собирают в стерильный одноразовый контейнер, жидкость
направляют в лабораторию в шприце, закрытом стерильной резиновой
пробкой, и в специальной емкости или системе со средами, разрешен¬
ными к применению для этих целей в установленном порядке.
6.14.4. Кости. Пробу инфицированной кости (1—5 см^) собирают в
процессе операции, помещают в стерильные одноразовые контейнер
с завинчивающейся крышкой или в стеклянную пробирку; в емкость
с пробой можно добавить стерильный физиологический раствор для
предотвращения от высыхания.
6.15. Пробы для определения обсемененности сосудистого катетера
при подозрении на катетерассоциированную инфекцию
Материал собирают следующим образом:
— очищают кожу вокруг катетера стерильной марлевой салфет¬
кой, смоченной 70% этиловым спиртом;
— с соблюдением правил асептики удаляют катетер;
— стерильными ножницами отрезают около 5 см от дистального
конца катетера;
— помещают отрезанный кусок в сухие стерильные одноразовую
пробирку с пробкой или стеклянную пробирку, или стериль¬
ный одноразовый контейнер с завинчивающейся крышкой
(для сбора мокроты);
— немедленно передают материал в лабораторию; для предохра¬
нения от высыхания можно добавить несколько капель сте¬
рильного физиологического раствора.
6.16. Пробы материала при аутопсии
Основным условием для получения достоверных результатов и их
правильной интерпретации является взятие материала не позднее 12 ч
после смерти больного, даже при хранении трупа при пониженной
температуре.
6.16.1. Пробы крови получают из левого желудочка сердца стериль¬
ным шприцем. Пункцию производят после обработки выбранною
участка стерильной салфеткой, смоченной 3% раствором перекиси
водорода, и последующим удалением антисептика стерильной сал¬
феткой, смоченной стерильным физиологическим раствором.
приложение 685
Дезинфекцию выбранного для пункции участка сердца можно
выполнить методом прижигания ткани шпателем. Для получения
пробы из левого желудочка сердца стерильным шприцем необходимо
отсосать не менее 10 мл крови. Сразу после взятия материал переносят
в стерильный стеклянный флакон с двойной средой, закрытый ватно¬
марлевой пробкой. Край^лакона и пробку обжигают над пламенем
спиртовки. При наличии в лечебно-профилактических организациях
специальных флаконов со средами для определения наличия бак¬
териемии или соответствующего оборудования полученные пробы
вносят в 2 бутылки: для аэробного и анаэробного культивирования по
10 мл в каждую емкость,
6.16.2. Пробы (кусочки) органов и/или тканей величиной не
менее 3—5 смЗ (обязательны пробы из селезенки, регионарных и
отдаленных лимфоузлов, очагов воспаления) помещают каждый в
отдельную стерильную емкость (одноразовые стерильные контей¬
неры с завинчивающейся крышкой или чашки Петри (б = 55 мм).
Используют также специальные емкости с транспортировочными
средами, разрешенными к применению для этих целей в установлен¬
ном порядке. Маркируют емкости с материалом с указанием пробы
органа и/или ткани.
6.16.3. Гной из вскрытых полостей, спинномозговую и другие жид¬
кости отсасывают стерильным шприцем в объеме не менее 7-10 мл
и помещают в стерильные одноразовые пробирки или оставляют
в шприцах, закрытых стерильными резиновыми пробками, или в
транспортировочных емкостях. Маркируют пробы.
6.16.4. Материал от трупа больного с гнойно-воспалительной пато¬
логией доставляют в лабораторию в течение 1 ч после взятия.
В сопроводительном документе (направлении) дополнительно
указывают дату и время смерти, а также отделение, в котором умер
больной, дату и время вскрытия.
7. Пробы биоматериалов для определения наличия анаэробов, вирусов,
простейших
7.1. Пробы биоматериала для определения наличия анаэробов
Клинические признаки анаэробной инфекции:
— неприятный гнилостный запах отделяемого;
— гнилостный характер очага воспаления: некроз тканей, фор¬
мирование глубоких абсцессов;
686
Приложение
- близость очага воспаления к органам естественного обита¬
ния анаэробов; пищеварительному тракту, половым органам,
дыхательным путям;
- развитие инфекции на фоне лечения больного антибиотиками
из группы аминогликозидов;
- наличие газа в тканях или клинической картины газовой ган¬
грены;
- черное окрашивание экссудата;
- наличие септического тромбофлебита.
Таблица 2
Возможная локализация анаэробной инфекции и биоматериалы,
посылаемые на исследование
Возможная локализа¬
ция инфекции
Пробы биоматериала
1
2
Голова и шея
Аспираты абсцессов, полученные шприцем с
иглой после деконтаминации поверхности; био¬
птат, полученный при операции; мазки, полу¬
ченные во время операции, при невозможности
получения биоптата
Легкие
Транстрахеальный аспират; материал, получен¬
ный из легкого при чрескожной пункции; био-
птаты, полученные во время операции; пробы
при проведении бронхоскопии, полученные
защищенной щеткой; пробы, полученные при
проведении торакотомии; мазки, полученные во
время операции, при невозможности получения
биоптата
Центральная нервная
система
Аспираты абсцессов, полученные шприцем с
иглой; биоптаты, полученные во время опера¬
ции; мазки, полученные во время операции, при
невозможности получения биоптата
Приложение
687
Продолжение таблицы 2
Брюшная полость
Перитонеальная жидкость, полученная шпри¬
цем с иглой; аспираты абсцессов, полученные
шприцем с иглой; желчь, полученная шприцем
с иглой при чрескожной аспирации, а также
полА^ченная во время операции; биоптаты,
полученные во время операции; мазки, полу¬
ченные во время операции, при невозможности
получения биоптата
Урогенитальный
тракт:
— моча
— женские половые
органы
— мужские половые
органы
Проба, полученная надлобковой аспирацией
Пробы, полученные кульдоскопом; аспираты
эндометрия, полученные отсосом или специаль¬
ным защишенным медицинским инструментом;
аспираты абсцессов, полученные шприцем с
иглой; биоптат, полученный шприцем с иглой;
мазки, полученные во время операции, при
невозможности получения биоптата
Аспират придатков яичка; биоптат аденомы пред¬
стательной железы, полученный при проведении
трансуретральной резекции (ТУР) или во время
полостной операции; биоптат новообразований;
эякулят; аспират яичка, полученный шприцем
с иглой; мазки, полученные во время операции,
при невозможности получения биоптата
Кости и суставы
Гной, полученный прямой аспирацией во время
операции; грануляционная ткань или гной из
инфицированной кости; биоптат, полученный
во время операции; секвестры, полученные во
время операции; аспираты, полученные шприцем
с иглой; мазки, полученные во время операции,
при невозможности получения биоптата
688
Приложение
Окончание таблицы 2
Мягкие ткани
Аспираты, полученные шприцем и иглой; биоп¬
таты, полученные во время операции; аспират из
синусов любой локализации, полученный иглой
и малым одноразовым катетером; глубокие аспи¬
раты краев открытой раны, полученные чрес¬
кожной аспирацией предварительно очищенной
кожи; глубокие аспираты поверхностных изъ¬
язвлений, полученные чрескожной аспирацией
предварительно очищенной кожи
Желудок, 12-перст¬
ная кишка, тонкий
кишечник
Биоптаты желудка и 12-перстной кишки или
из тела и antrum желудка для определения
Helicobacter pylori', биоптаты из всех полостей толь¬
ко при наличии проблем петли слепой кишки
или синдроме мальабсорбции
Толстая кишка
Только для культивирования и определе¬
ния наличия токсина при подозрении на
С/, difficile или Cl.botulinum, Anaerobio-spirillum
succiniciproduceus и другие этиологические агенты
Для доставки проб в лабораторию используют следующие транс¬
портировочные емкости:
- флаконы или пробирки с анаэробной атмосферой и агаровой
основой с индикатором для ее контроля, в которых доставляют
аспирационный материал;
- специальные мешки или система пробирок, из которых уда¬
ляется молекулярный кислород; в них доставляют ткани, био¬
псийный материал, пробы, полученные при выскабливании
кюреткой;
- емкости с транспортировочной агаризованной средой для ана¬
эробов, разрешенные к применению в установленном порядке,
со стерильным зондом-тампоном для сбора материала;
- для доставки материала, собранного тампоном, используют
пробирки с анаэробной атмосферой и агаровой основой с
индикатором для ее контроля; пробирки с катализатором,
генерирующим анаэробную атмосферу после введения тампо¬
на в пробирку, пробирки с анаэробной атмосферой и редуци¬
рованной средой.
Приложение 689
При наличии специальных емкостей и сред с реагентами аспираты
доставляют в лабораторию во флаконах или пробирках с анаэробной
атмосферой и агаровой основой, в которую добавляют индикатор
анаэробиоза; кусочки ткани, биопсийный или собранный кюреткой
материал — в мешке или системе пробирок, действие которых состоит
в удален и и молекулярного кислорода; пробы, собранные тампоном, —
в пробирке с анаэробной Атмосферой и агаровой основой с индикато¬
ром анаэробиоза; в пробирке с каталитической системой для генера¬
ции анаэробной атмосферы после того, как в нее помещают тампон; в
пробирке с анаэробной атмосферой и редуцированной транспортной
специальной средой.
В отсутствие специальных емкостей и сред с реагентами допустимо
использование пробирки и другой емкости с редуцированными тиог¬
ликолевой средой, с тиоловым бульоном, а также со средами с добав¬
лением гемина и менадиола. Пробирку со средой плотно закрывают
стерильной резиновой пробкой.
7.2. Пробы биоматериала для определения наличия вирусов
По мере появления новых клинических симптомов заболевания,
а также развития и совершенствования методов лабораторной диа¬
гностики перечень возбудителей и биоматериал может претерпевать
изменения.
Сбор проб необходимо производить как можно раньше, после
появления клинической симптоматики: вероятность обнаружения
вируса максимальна в течение первых трех суток и резко снижается
по прошествии пяти суток. Сбор материала при аутопсии произ¬
водят по возможности в самые ранние сроки после смерти паци¬
ента. Все пробы получают с соблюдением асептических условий;
каждый образец помещают в отдельный стерильный одноразовый
контейнер; собирают анамнез больного, обращая внимание на
контакты и поездки в страны (регионы), эндемичные по опреде¬
ленным заболеваниям. Пробы отправляют в лабораторию в емкос¬
ти с транспортировочной жидкой средой для сохранения вирусов
немедленно; при невозможности выполнить это пробы хранят в
холодильнике или на подтаявшем льду.
Пробы собирают в стерильные контейнеры с завинчивающейся
крышкой, можно использовать стерильные конические центрифуж¬
ные пробирки (15—50 мл) с плотно закрывающимися пробками, а
также маленькие (4 мл), в которые можно внести 1-2 мл вирусной
транспортировочной среды.
690
Приложение
Для сбора пробы зондом-тампоном используют стерильные там¬
поны (из вискозы или дакроновые) на пластиковом или алюминиевом
основании, пригодны также маленькие тампоны на легком алюмини¬
евом основании (уретральные зонды-тампоны).
Не допускается применять тампоны с алгинатом кальция и с дере¬
вянной осью.
Для аспирации жидкости везикул используют туберкулиновые
шприцы, в каждую емкость с зондом-тампоном при сборе пробы
вносят по 3—4 стерильные стеклянные бусинки (сі = 5 мм) для снятия
материала с тампона.
Кровь собирают в стерильные одноразовые или стеклянные про¬
бирки с антикоагулянтом (гепарин, ЭДТА, цитрат натрия).
Таблица 3
Сбор проб для кльтивирования вирусов
Проба
Способ получения
Вирусы-возбудители
1
2
3
Кровь
Собирают 8-10 мл в емкость с
антикоагулянтом
Арбо-, адено-, ЦИТО-, мега-
ЛО-, герпес симплекс-,
иммунодефицита человека
тип 1 и другие ретровирусы
(персис-тируюшие и диссе¬
минированные инфекции у
иммунокомпрометирован-
ных индивидуумов и ново¬
рожденных)
Костный
мозг
Собирают не менее 2 мл в
емкость с антикоагулянтом
Цитомегаловирус
Жидкости:
ликвор
Собирают 2—5 мл в стерильный
контейнер
Энтеровирусы (Коксаки А, В,
эхо-, энтеровирусы); герпес,
лимфоцитарного хориоме-
нингита, эпидемического
паротита, бешенства (может
быть полезным для некото¬
рых арбовирусных инфек¬
ций)
Приложение
691
Продолжение таблицы 3
перикар¬
диаль¬
ная
Собирают не менее 2 мл в сте¬
рильный контейнер
Коксаки-вирус
слюна
Собирают слюну на 1 или 2 там¬
пона изо рта; помещают тампо¬
ны в емкости с тра^4спортиро-
вочной средой для вирусов
Вирус бешенства, цитомега-
ловирус, вирус эпидемичес¬
кого паротита
моча
Собирают 10-12 мл средней
порции свободно истекающей
мочи в стерильный одноразо¬
вый контейнер с завинчиваю¬
щейся крышкой
Адено-, цитомегало-, гер¬
пес-, паротита-, полно-,
краснухи (2 или 3 порции
увеличивают вероятность
обнаружения цитомегало-
вируса — ЦМВ)
Желудочно-кишечный тракт:
рек¬
тальный
мазок
Вводят тампон на глубину 4—6
см per rectum и вращают вокруг
оси; извлекают и помещают
тампон в емкость с транспорти¬
ровочной средой для вирусов
Адено-, энтеро-, (Коксаки А,
В, эхо-, энтеровирусы), гер¬
пес (полезны при диагности¬
ке проктитов)
фекалии
Собирают 2—4 г (примерно 3
ложечки) в специальный одно¬
разовый стерильный контейнер;
если сразу нет возможности
передать в лабораторию, добав¬
ляют 8—10 мл транспортиро¬
вочной среды для вирусов с
целью предотвращения пробы
от высыхания. Пригодна проба,
собранная в забуфсренный
физиологический раствор с гли¬
церином (как «на дизгруппу»)
Адено-, энтеро-, (коксаки А,
В; эхо-, энтеро-, полиовиру-
сы), реовирус
692
Приложение
Продолжение таблицы 3
Мочеполовая система:
церви¬
кальный
тампон
Удаляют тампоном экзоперви-
кальную слизь; вводят новый
тампон не менее чем на 1 см в
цервикальный канал и врашают
вокруг оси в течение 10 с; извле¬
кают тампон и помешают его в
емкость с транспортировочной
средой для сохранения вирусов
Герпес-, цитомегаловирусы
мазок из
уретры
Удаляют любой экссудат; вво¬
дят легкий, подвижный тампон
(уретральный) на 2—3 см в урет¬
ру; осторожно 2-3 движениями
врашают тампон вокруг оси и
осторожно извлекают. Пациент
до процедуры не должен мочить¬
ся в течение 1 ч
сперма
Собирают в стерильный одно¬
разовый контейнер с завинчи¬
вающейся крышкой
Кожные поражения:
I
мазок на
зонде-
тампоне
Обрабатывают везикулу физио¬
логическим раствором; разру¬
шают везикулу и собирают жид¬
кость зондом-тампоном; тем же
самым збндом-тампоном соби¬
рают клетки основания вези¬
кулы. При отсутствии везикул
собирают клетки с основания
очага, используя тампон, пред¬
варительно смоченный стериль¬
ным физиологическим раство¬
ром. Помешают зонды-тампоны
в емкость с транспортировочной
средой для сохранения вирусов
Коксаки А-вирус, эхо-, гер¬
пес-, ПОКС-, герпес зостерви-
русы
Приложение
693
Продолжение таблицы 3
аспи¬
раты из
везикул
Обрабатывают очаг стерильным
физиологическим раствором;
аспирируют жидкость из вези¬
кулы иглой 26—27, присоеди¬
ненной к туберк3|^л и новому
шприцу, и немедлено промыва¬
ют шприц 1—2 мл транспорти¬
ровочной среды для сохранения
вирусов
Предпочтительно для вируса
герпес зостер
Поражения слизистых оболочек:
мазок на
1 зонде-
тампоне
Тампонируют очаг, двигая
зонд-тампон назад и вперед по
поверхности очага; помешают
тампон в емкость с транспор¬
тировочной средой для сохра¬
нения вирусов
Оральные: Коксаки А, вирус
герпеса
Аногенитальные: вирус гер¬
песа
] Глаза:
мазок с
конъюн-
1 ктивы
Тампонируют нижнюю конъ¬
юнктиву с помощью под¬
вижного изящного тампона,
предварительно смоченного
стерильным физиологическим
раствором. Помещают зонд-
тампон в пробирку с транспор¬
тировочной средой для сохране¬
ния вирусов
Адено-, Коксаки А, цито-
мегало-, энтеро (тип 70)-,
герпес-, болезни Ньюкасла
вирусы
соскобы
Помещают соскобы, получен¬
ные тампоном-щеточкой, в
емкость с вирусной транспорти¬
ровочной средой
694
Приложение
Продолжение таблицы 3
Дыхательные пути:
мазки со
слизис¬
той носа
Вводят изящный подвижный
зонд-тампон в ноздрю, вращают
тампон и оставляют его в ноздре в
покое на несколько секунд, чтобы
абсорбировать секреты; помеща¬
ют тампон в емкость с вирусной
транспортировочной средой. Для
каждой ноздри используют раз¬
ные тампоны. Оба тампона поме¬
щают в одну емкость со средой
Адено-, цитомегало-, энте¬
ро-, герпес-, грипп-, кори-,
парагрипп-, бешенства-,
риносинцитиальный-, крас¬
нухи-, герпес зостер-вирусы
Особенно полезны для обна¬
ружения риновирусов
мазки
со сли¬
зистой
носог¬
лотки
Вводят тонкий подвижный там¬
пон через ноздрю в носоглотку
и вращают его вокруг оси очень
мягко несколько раз. Помещают
тампон в емкость с транспорти¬
ровочной средой для вирусов
мазки
со сли¬
зистой
ротог¬
лотки
Используют стерильный шпа¬
тель, чтобы прижать язык и не
контаминировать зонд-тампон
слюной. Собирают материал,
поочередно обрабатывая там¬
поном правую и левую минда¬
лины и заднюю стенку глотки.
Помещают тампон в емкость с
транспортировочной средой для
сохранения вирусов
Мазки из ротоглотки исполь¬
зуют преимущественно для
обнаружения вирусов грип¬
па, парагриппа, риносинци-
тиального, а также адено-,
цитомегало-, энтеро-, кори-,
бешенства, краснухи-, герпес
зостер-вирусов
Жидкости:
бронхо¬
Собирают 8-10 мл в стериль¬
Перечисленные выше
альвео¬
ный одноразовый контейнер с
лярный
завинчивающейся крышкой
лаваж
приложение
695
Продолжение таблицы 3
носогло¬
точный
аспират
Используют приспособления
для сбора слизи (отсосы), вводят
через нос в носоглотку катетер
соответствующего размера;
отсасывают материал во время
удаления катетера. Разводят
аспират 5-8 мл среды для
сохранения вирусов и переносят
материал в стерильную пробир¬
ку (одноразовую или стеклян¬
ную)
плев¬
ральная
Собирают не менее 2 мл жидкос¬
ти в стерильный одноразовый
контейнер или стерильную стек¬
лянную пробирку
Вирус Коксаки В
Ткани:
Помещают маленькие пробы
(легочный биоптат, например)
в емкость с вирусной транспор¬
тировочной средой для сохране¬
ния вирусов и предотвращения
пробы от высыхания. Помещают
большие пробы (1—2 г, напри¬
мер, при аутопсии) в стериль¬
ный одноразовый контейнер,
в который добавляют 8-10 мл
транспортировочной среды для
сохранения вирусов при высы¬
хании пробы
Из тканей могут быть выде¬
лены практически все пере¬
численные ранее виды пато¬
генных для человека вирусов
Мозг:
Арбовирусы, бешенства
и другие вирусы, которые
могут вызывать энцефалиты,
включая вирус герпеса. Все
вирусы, перечисленные ранее
696
Приложение
Окончание таблицы 3
Другой материал:
Для определения необходимы
полные клинические дан¬
ные, анамнез, оформленная
история болезни, из которой
можно получить необходимую
информацию
7.3. Пробы биоматериала для определения наличия простейших
7.3.1. Общие положения. Пробы биоматериала для проведения
паразитологических исследований направляют в лабораторию:
— при наличии клинических показаний (аллергические прояв¬
ления, инфекционно-воспалительное заболевание неясной
этиологии), подтвержденных в ряде случаев высокой эозино¬
филией в общем анализе крови;
— при обследовании декретированных контингентов (работники
общепита, детских образовательных учреждений, плаватель¬
ных бассейнов и др.);
— при плановом обследовании населения.
Для лабораторного подтверждения (постановки) диагнозов «гельминтоз»,
«протозооз» служат различные виды проб биологического материала, полу¬
чаемые от обследуемого из желудочно-кишечного тракта, мочеполовой и цен¬
тральной нервной систем, крови, нижних дыхательных путей, глаз, кожи.
Необходима дифференциальная диагностика паразитарных инфек¬
ций и патологических процессов другой этиологии из-за частого отсутс¬
твия у больного специфической симптоматики, широкого распростране¬
ния паразитов по организму, особенно у иммунокомпрометированных
больных, тяжести течения заболевания и вероятностью летального исхо¬
да при отсутствии четкой диагностики.
Указанное требует от медицинских работников знания и владения
правилами и техникой получения пробы (подготовка обследуемого;
время отбора и доставки пробы в лабораторию; емкости, используемые
для сбора и транспортирования пробы; использование консервантов и
маркировка проб биоматериалов).
7.3.2. Биологический материал и встречающиеся в нем гельминты
и простейшие — возбудители воспалительных процессов в различных
органах и тканях организма.
Приложение
697
II
* «
*!
е; ее
ее
2
ю
о
о.
в
я
о.
о
ю
и
«
=:
в
ев
я
я
^ ю
я о
5 о-
<и в
н ^
Продолжение таблицы 4
<»)
оо
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
Посуду для сбора пробы получают в лаборатории. Это чис¬
тая (прокипяченная) сухая стеклянная банка или однора¬
зовая с широким горлом и плотно закрывающимися крыш¬
ками. Стерил1)Ная посуда требуется для исследования на
амебиаз. Фекалии — утреннюю порцию — после дефекации
собирают в посуду из разных участков в объеме от чайной
до столовой ложки (не менее 50 г). Избегают контаминации
пробы мочой и/или водой. Пробы доставляют в лабора¬
торию в полиэтиленовом мешке не позднее 1-2 ч после
дефекации. При отсутствии возможности доставки пробы в
лабораторию в указанные сроки или ее исследования в день
дефекации получают посуду с консервантом, в которую
собирают пробу. Материал хранят при температуре 4-8 ”С
Tominx aerophilus;
Trichostrongylidae spp.;
Balantidium coii;
Cryptosporidium parvum;
Entamoeba coii, hartmanni,
histolytica;
Isospora spp.;
Lamblia intestinalis
Продолжение таблицы 4
R
О
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
Перианальная
область
В подготовку обследуемого включают инструктаж (если
обследуют ребенка, то инструктируют родителей) по
правилам сбора материала и доставке его в лабораторию,
предупреждение о необходимости сбора проб рано утром,
когда пациент только проснулся, до дефекации и душа
(обследуемому не следует подмываться или принимать душ
и вечером накануне отбора пробы — соскоба с перианаль¬
ных складок), т.к. паразиты откладывают яйца на коже в
течение ночи. Посуду накануне получают в лаборатории:
одноразовую пробирку с тампоном (тубсером) или чистую
специально смонтированную стеклянную пробирку с ват¬
ным тампоном, смоченным в глицерине; или тампоном на
шпателе, смоченным в глицерине; или другую специально
подготовленную чистую стеклянную посуду; или (особен¬
но при массовых обследованиях населения, в основном
детского) чистые предметные стекла с липкой лентой.
Enterobios vermicularis;
Entamoeba histolytica — в
соскобах с язв перианальной
области
Продолжение таблицы 4
2
Система,
орган,проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
При невозможности транспортировать материал в лабора¬
торию в контейнер добавляют около 1 мл физиологического
раствора для предотвращения пробы от высыхания
Аспират из
12-перстной
кишки
Собирают при наличии эзофагоскопа или Entero-Test
Capsule (String Test — струнный тест), немедлено направ¬
ляют в лабораторию в плотно закрытом завинчивающейся
крышкой одноразовом контейнере (для сбора мочи) или
одноразовой плотно закрытой центрифужной пробирке,
или определенным образом смонтированной стеклянной
емкости. Емкости с материалом помещают в пластиковый
пакет
Strongyloides stercoralis, Giardia
lamblia;
Cryptosporidium parvum;
Isospora belli;
в редких случаях — Clonorchis
sinensis
Слизь, слизис¬
тая, фекалии
и/или ком¬
бинация всех
трех образцов;
язвы сигмо¬
видной и обо¬
дочной кишки
Собирают в процессе проведения ректороманоскопии у
постели больного (в процедурном кабинете) для немедлен¬
ного просмотра (влажный мазок на чистом обезжиренном
или новом предметном стекле). Если пробу доставляют
в лабораторию, ее помещают в одноразовую емкость или
специально смонтированную стеклянную с добавлением
0,5—1,0 мл физиологического раствора для предотвращения
от высыхания
Вышеперечисленные воз¬
будители, преимуществен¬
но Entamoeba histolytica, a
также Shistostoma mansoni;
Balantidium coli;
Trichomonas hominis;
Trichinella spp.
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
Ткани — био¬
птаты реко¬
мендуется
использовать
для диагнос¬
тики тканевых
паразитов
Пробы тонкой кишки
пробы тощей кишки
Толстая кишка
Пробы 12-перстной кишки
Биоптат прямой кишки
Cryptosporidium parvum;
Enterocytozoon bieneusi;
Entamoeba histolytica;
Shistostoma mansoni и spp.;
Giardia lamblia;
Entamoeba histolytica;
Balantidium coli;
Cryptosporidium parvum
Печень, селе¬
зенка
Аспираты и биоптаты органов собирают в 4 (от каждого
органа) отдельных одноразовых стерильных контейнера
или другие стерильные емкости с герметично закрываю¬
щимися крышками, в которых доставляют в лабораторию.
Пробы аспирата печени собирают с краев абсцесса, а не из
некротического центра
Echinococcus spp.; Clonorchis
spp.,
Opisthorchis spp.;
Toxoplasma gondii;
Leishmania donovani;
Cryptosporidium parvum;
Pneumocystis carinii;
Entamoeba histolytica;
Fasciola hepatica
с
i
%
I
I
Ä
R
<t>
Продолжение таблицы 4
§
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
Мочеполовая система:
Отделяемое
влагалища,
уретры, очага
на пенисе,
соскоб со сли¬
зистой урет¬
ры, эякулят
Собирают материал платиновой петлей, хлопковым, вискоз¬
ным или дакроновым зондом-тампоном, или непосредственно
с зеркала; готовят мазок на предметном стекле, зонд-тампон,
смоченный физиологическим раствором, помещают в пробир¬
ку пустую или со средами без угля (типа Эймса, Стюарта или
др.), отдельные высушенные на воздухе мазки — для исследо¬
вания методом иммунофлуоресценции
Trichmonas vaginalis;
Shistostoma haemotobium
Моча
Собирают первую порцию свободно истекающей мочи в одно¬
разовые контейнер или пробирку, у мужчин — после массажа
простаты.
Собирают среднюю порцию свободно истекающей мочи или
пробу из суточной мочи, собранной в одноразовые контей¬
нер или пробирку. Среднюю порцию мочи собирают при
мочеиспускании с 12 до 15 ч дня, т.к. на это время приходится
пик выделения личинок паразита, желательно собрать мочу
после физической нагрузки (например, 20—30 приседаний).
Собирают также последнюю порцию свободно истекающей
мочи при наличии гематурии и обилии слизи
Trichmonas vaginalis;
Shistostoma haemotobium
R
0
1
%
R
Я
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
Паразиты определяют у больных с хилурией, с очень тяже¬
лой инфекцией, а также у пациентов, лечившихся диэтил-
карбамазином
Микрофилярии, филярии
Биоптат почки
Пробу ткани собирают в стерильную одноразовую емкость
с помощью стерильного тампона, пропитанного физиоло¬
гическим раствором, после того как этим же тампоном на
стерильных предметных стеклах были приготовлены мазки
для исследования
Microsporidia
-•*
I
0
1
а
R
Центральная нервная система:
Ликвор
Пробы ликвора собирают в стерильные одноразовые кон¬
тейнер или стеклянную пробирку. Передают материал в
лабораторию
Naegleria fowleri; Acanthamoeba
Hartmanella spp.;
Eshinococcus sp;
Toxoplasma gondii;
Trypanosoma spp.;
Tienia soleum
Биоптаты
Биоптаты мозга у больных и кусочки ткани, полученные
при аутопсии, собирают в стерильные одноразовые (стек¬
лянные) контейнер или пробирку, для предотвращения
от высыхания добавляют несколько капель стерильного
физиологического раствора и направляют в лабораторию
Naegleria fowleri; Entamoeba
histolytica;
Toxoplasma gondii;
Microsporidia;
(Encephalitazoon cuniculi)
g
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лаборатории)
Возбудитель
1
2
3
Кровь
Для микроскопического определения возбудителя полу¬
чают пробы крови из пальца, сразу же готовят толстый и
тонкий мазки на чистом обезжиренном или новом пред¬
метном стекле. Кровь, собранную у пациента натощак при
венепункции, помещают в 2 стерильные пробирки по 5-7
мл в каждую (стеклянные, закрывающиеся резиновой про¬
бкой, или одноразовые с плотно закрывающейся пробкой):
в одну пробирку с антикоагулянтом (ЭДТА, гепарин, цит¬
рат натрия), во вторую пробирку без антикоагулянта для
определения антител к антигенам гельминтов. Емкости с
пробами маркируют и направляют в лабораторию
Plasmodium малярии; Babesia
spp.;
Leishmania donovani;
Toxonlasma gondii;
Trypanosoma cruzi;
Microfilariae
Echinococcus sp;
Toxocara sp; Opistorchis felineus;
Trichinella sp;
Toxoplasma sp;
Cistecercos sp.
Костный мозг
Аспират собирают в стерильные одноразовые (стеклянные)
контейнер или пробирку и направляют в лабораторию
Leishmania donovani;
Trypanosoma cruzi
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
Нижние дыхательные пути:
Мокрота
откашливае¬
мая
Пробу собирают после объяснения пациенту необходи¬
мости почистить зубы, прополоскать рот теплой кипяче¬
ной водой и не собирать слюну. В пробу включают любые
кровянистые прожилки, включения, слизь. Доставляют в
лабораторию в чистом одноразовом контейнере с завинчи¬
вающейся крышкой или в соответствующим образом смон¬
тированной стеклянной емкости
Paragonismus sp; Stronguloides
stercoralis;
Cryptosporidia^ parvum;
Pneumocystis carinii;
Ascaris lumbricoides;
Tominx aerophylus;
Ancylostoma sp.;
Necator sp.
Мокрота
индуцирован¬
ная
Индуцирование необходимо, так как у больных с пнев-
моцистной пневмонией обычно сухой, непродуктивный
кашель. Пробу собирают после проведения пациентом
гигиены рта — см. выше. Доставляют в лабораторию — см.
выше
Pneumocystis carinii — наибо¬
лее полезны у ВИЧ-инфици¬
рованных, у других даже при
наличии лихорадки пневмо¬
цисты определяют сушест¬
венно реже
Лаваж, альве¬
олярная жид¬
кость, смывы
с бронхов
Пробы собирают с помошью бронхоскопа (предпочти¬
тельнее лаваж) в специальный стерильный одноразовый
контейнер с завинчивающейся крышкой или специально
смонтированную стерильную стеклянную посуду
Pneumocystis carinii; Toxoplasma
gondii;
Cryptosporidium parvum;
Paragonismus westermanii;
Trichinella spp.
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
Аспираты
трансброн¬
хиальные,
трахео-брон-
хиальные,
легких
Пробы, собранные тонкой иглой, наносят на чистое обез¬
жиренное или новое предметное стекло, готовят мазки,
высушивают^на воздухе, упаковывают и направляют в лабо¬
раторию
Pneumocystis carinii; Toxoplasma
gondii;
Paragonismus westermanii;
Trichinella spp.;
Cryptosporidium parvum;
Entamoeba histolytica
Биоптаты
Пробы бронхов, полученные специальной щеточкой, или
легкого, полученные во время операции, наносят на чистое
обезжиренное или новое предметное стекло, готовят мазки,
высушивают на воздухе, упаковывают и доставляют в лабо¬
раторию. Для культивирования паразитов пробы собирают
в специальные контейнеры (консультируйтесь с паразито¬
логом!)
Полезны для диагностики
тканевых паразитов как
дополнение к стандартным
гистологическим исследо¬
ваниям: Pneumocystis carinii;
Toxoplasma gondii; Paragonismus
westermanii; Entamoeba
histolytica; Echinococcus
sp.; Strongoloides stercoralis;
Trichinella spiralis
§
R
Ь
0
1
%
R
Продолжение таблицы 4
Система,
орган, проба
Правила сбора пробы клинического материала и доставки его
в лабораторию
Возбудитель
1
2
3
с
ti
о
Глаза:
Биоптаты,
соскобы с
роговицы и
конъюнктивы;
линзы
Пробы собирают в стерильные емкости одноразовые или
стеклянные, специально смонтированные, герметично
закрывающиеся. Для предотвращения высыхания добав¬
ляют несколько капель стерильного физиологического рас¬
твора. Доставляют в лабораторию
Acanthamoeba spp.; Naegleria
fowleri;
Microsporidium spp.;
Филярии; ^
Toxoplasma gondii;
Nosema sp.
Смыве линзы
Собирают в стерильные емкости одноразовые или специ¬
ально смонтированные стеклянные, герметично закрываю¬
щиеся. Доставляют в лабораторию
Кожа, ткани:
Основание
(дно) язвы
Аспират собирают в стерильные емкости; параллельно
готовят мазки на чистом обезжиренном или новом пред¬
метном стекле; материал передают в лабораторию
Leishmania spp.
708
Приложение
Приложение 709
8. Пробы биоматериала и иммуносерологические методы
определения возбудителей инфекционно-воспалительных процессов
8.1. Общие положения
Проведение иммуносерологических исследований основано на
применении технологических приемов (методик), позволяющих
определять специфические антигены возбудителей инфекционных
и инфекционно-воспалйтельных заболеваний, и/или вводимых при
вакцинации, и ответной реакции на них организма образованием
антител. Это необходимо для объективизации клинического диагно¬
за, результатов терапии, оценки качества вакцинации, своевременной
организации и проведения противоэпидемических мероприятий.
Тест-системы, предназначенные для определения специфических
антигенов, используются для идентификации конкретного микроор¬
ганизма в пробе клинического материала или выращенного in vitro.
С помошью методов, предназначенных для определения антител,
дается характеристика ответа организма (человека) на конкретный
антиген без учета или с учетом специфического класса иммуногло¬
булинов (Ig), в котором они находятся. IgM-ранние антитела (4—7 сут
от первичного инфицирования микроорганизмами), IgG-поздние
антитела, которые (в зависимости от антигена) могут находиться в
организме от 5—7 сут до 3-4 нед (период реконвалесценции) и даже
всю жизнь. Сывороточные IgA при всей их вариабельности по сро¬
кам образования (11—15 сут) и персистенции в организме (до 30 сут)
отражают не столько реакцию на конкретный бактериальный анти¬
ген, сколько на деструкцию органа, обусловленную воспалительным
процессом микробной этиологии. Уровень секреторного IgA — про¬
гностический признак вероятности развития инфекции на слизистых
оболочках при нарушениях микроэкологии, т.е. микробиологичес¬
кого аспекта системы антиинфекпионной резистентности (САИР),
а также вероятности проникновения (транслокации) возбудителя в
другие органы и ткани. Уровень IgE-антител увеличивается в ответ
на паразитарные инфекции, но специфическая реакция на другие
инфекционные агенты в этом классе Ig отсутствует.
Возникновение инфекционного и инфекционно-воспалительного
заболевания, течение патологического процесса и эффективность тера¬
пии в большой степени зависят от состояния защитных сил организма,
т.е. от факторов системы антиинфекпионной резистентности, в част¬
ности, в ее иммунологическом аспекте. Нарушения в синтезе и фун кци-
ональной активности терминальных компонентов каскада комплемен¬
710 Приложение
та (мембран-атакующего комплекса) — фактор, предрасполагающий
к развитию рецидивирующих нейссериальных {N. gonorrhoeae) инфек¬
ций. Мутация в рецепторе гамма-интерферона — основа тяжелей¬
шей диссеминированной микобактериальной инфекции и фатального
исхода от Mycobacterium bovis — основы противотуберкулезной вакцины
Кальмет-Гсрсна. Полиморфизм генов человека — основа устойчивос¬
ти к малярии, а врожденное отсутствие некоторых эритроцитарных
антигенов среди определенной человеческой субпопуляции опреде¬
ляет их абсолютную устойчивость к парвовирусам. Недостаточность
или нарушения в функционировании бактерицидных систем в клетке
нейтрофила и/или в целом в процессе фагоцитоза — основа развития
воспалительного процесса, вызванного условно-патогенными микро¬
организмами. В настоящее время имеется возможность определения и
подсчета количества В-лимфоцитов, активирующих плазменные клет¬
ки, образующие антитела, с паралллельным определением специфи¬
ческих антигенов. Для этого используют пробу периферической крови,
в которой также определяют вирусы лихорадки Денге, гриппа, респи¬
раторно-синцитиального, вируса иммунодефицита человека (ВИЧ).
Учитывая важность иммунологического и микробиологического
аспектов системы антиинфекпионной резистентности организма в
развитии и течении инфекционно-воспалительных процессов, в т.ч.
внутрибольничной природы, в научно-практических лабораториях
рекомендуется проводить комплексные клинико-микробиологичес¬
кие и иммуносерологические обследования,
8.2. Иммуносерологическое обследование
Иммуносерологическое обследование включает определение;
— антител к эндо- и экзотоксинам, клеточной стенке и ее компо¬
нентам микробов-возбудителей воспалительных процессов;
— С-реактивного белка (СРБ) и других белков острой фазы как
показателей наличия и активности воспаления инфекционной
природы;
— бактерицидной активности сыворотки (БАС) и/или других
жидкостей тела с аутоштаммами пациента; этот тест до назна¬
чения антибактериальной терапии свидетельствует о состоя¬
нии комплекса гуморальных факторов защиты организма, при
наличии антибактериальной терапии позволяет проводить
мониторинг ее активности;
— иммуноглобулинов М-, G-, А-классов в сыворотке крови и дру¬
гих жидкостях организма как показателя остроты и длитель¬
Приложение 711
ности инфекционно-воспалительного процесса, способности
обследованного реагировать на возбудитель, а также как необ¬
ходимых компонентов, участвующих в фагоцитозе нейтро¬
филов в качестве опсонинов (IgM, IgG) и показателя наличия
деструкции органа (IgA) в результате воспаления;
— активности комплемента и его компонентов в качестве суб¬
станции, приводящей к лизису клетки микроорганизма, если
комплекс антиген—антитело находится на ее поверхности, и
как инициатора выброса нейтрофилов, если комплекс нахо¬
дится в тканях, а также как опсонина;
— лизоцима как показателя состояния лейкоцитов, способности
организма к лизису грамположительных кокков и в крови —
Е. coir,
— фагоцитарной функции нейтрофилов в незавершенном и
завершенном вариантах с контрольными и аутоштаммами,
выделенными из очага воспаления;
— В-лимфоцитов, учитывая их способность к дифференциации
в плазменные клетки и образованию специфических антител в
различных классах иммуноглобулинов;
— Т-лимфоцитов и их субпопуляций как контролирующих актив¬
ность В-лимфоцитов и реагирующих с клетками с более низ¬
кой степенью специфичности, чем те, с которыми реагируют
цитотоксические Т-лимфоциты.
Стерильную посуду для сбора проб и их транспортирования (кровь
и другие жидкости организма обследованных) накануне получают в
лаборатории.
Иммуносерологические исследования проводят параллельно с
микробиологическими, анализирующими материал из очага воспа¬
ления, обсемененность слизистой верхних дыхательных путей (нос,
зев), гениталий и содержимого кишечника.
Все пробы готовят в один и тот же день; при поступлении, нака¬
нуне операции или с операционного стола (до операции), на 3—4-е
сут после операции (2—3-е сутки после госпитализации у терапевти¬
ческих больных), на 14—16-е сут после операции (после госпитализа¬
ции терапевтических больных), перед выпиской из стационара или в
сроки, оговоренные клиницистами.
Комплексные исследования с анализом проводят с целью изучения
патогенеза воспалительного процесса определенной локализации,
вызванного условно-патогенной микрофлорой, которые позволяют
712 Приложение
установить нарушения в системе антиинфекционной резистентнос¬
ти организма, определить возможность развития внутрибольничной
инфекции и реакцию на нес конкретного больного, а т^кже способ¬
ность пациента реагировать на определенный возбудитель (возбуди¬
тели), проводить мониторинг эффективности антибактериальной и
специфической иммунотерапии и других лечебных мероприятий.
8.3. Методы исследования, применяемые в иммуносерологии
Выбор оптимального метода определения антигенов и антител
зависит от соответствия собранной пробы целям и задачам исследо¬
вания (сроки от начала заболевания, отсутствие гемолиза и липолиза
пробы, контаминации посторонней микрофлорой) и требований к
спектру исследований, которые могут быть выполнены в конкретной
лаборатории.
Используют следующие методы исследования;
Реакция агглютинации — используют для подтверждения наличия
инфекции, вызванной определенным бактериальным антигеном.
Непрямая (пассивная) гемагглютинация (РПГА) с латексными
частицами или эритроцитами барана — используют для определения
наличия антител к возбудителям кишечных инфекций, в модифи¬
кации с использованием латексных частиц (диагностикумов) — для
диагностики бактериальных менингитов, определения антигенов
Candida, гонококков, гемофильной палочки.
Ингибиция гемагглютинации — модифицированная РПГА,
используют для определения антител к вирусам краснухи, гриппа,
парагриппа, респираторно-синцитиального.
Преципитация — реакция между растворимыми антигенами и
антителами, используют метод диффузии в геле.
Радиальная иммунодиффузия — определение антигенов или анти¬
тел в моноспецифической системе с чувствительностью 1—10 мг/л,
используют для сравнения антигенов (чувствительность — несколько
наннограмм/мл).
Электроиммунодиффузия — подобна радиальной, но миграция
реагентов направляется электрическим полем, и ее чувствительность
в 5—10 раз выше, чем в радиальной иммунодиффузии.
Быстрые методы определения антигена и антител (15—20 мин) —
основаны на использовании коллоидных, меченных золотом анти¬
тел. Определяют антитела к ВИЧ и антиген хламидии трахоматис.
Диагностику лихорадки Денге осуществляют с помощью иммунохро-
матографического определения сывороточных IgM и IgG.
Приложение 713
Методы с меченными антителами — специфичные высокочувс¬
твительные методы для определения антигенов в клетках и тканях;
прямая (ПИФ) и непрямая (НИФ) иммупофлуореспеиция, а также
антигенов микроорганизмов. Используют для определения кластеров
дифференциации и антигенов на поверхности лимфоцитов. Можно
определять антигены в м^зке материала (инфекции, передающиеся
половым путем). С использованием прямой иммунофлуоресценции
определяют антиген в количестве не менее 5—10 микробных тел.
Непрямая иммунофлюоресценция в 5—10 раз чувствительнее, чем
прямая.
Радиоиммунологические (метка — 1251) исследования (РИА)
и ELISA-ИФА (метка-фермент; пероксидаза хрена) — каждый из
методов используют для количественного определения конкретного
антигена в растворе даже при наличии смеси антигенов. Применяют
для идентификации вирусов (герпес симплекс, ЦМВ, герпес зос-
тер), возбудителей коклюша {Bordetella pertussis), бруцеллеза {Brucella
abortus) в мазке материала — пневмонии {Legionella рпеиторИуИае,
Mycoplasma pneumoniae), болезни Лайма {Borrelia burgdoferi), сифилиса
{Т. pallidum), ИППП {Chlamidia spp., Ureaplasma spp.), кишечных инфек¬
ций {Salmonella spp., Shigella spp.). Streptococcus группы. A, Toxoplasma
gondii, Helicobacter pylori — в крови. Чувствительность методов —
1—2 нг/мл. Альтернативный метод — иммуноблоттинг, использу¬
емый для мониторирования инфекций, вызванных ВИЧ, виру¬
сами гепатита, Т. pallidum, Borrelia burgdoferi (чувствительность —
1—2 нг/мл) и других.
Мечеными конъюгатами определяют и мониторируют ответ (выра¬
ботка антител) на антигены вирусов (ВИЧ, ЦМВ, герпес симплекс,
герпес зостер), Т. pallidum, В. burgdoferi.
Полимеразная цепная реакция (ПЦР) и различные модификации
на ее основе (методы гибридизации Д Н К и PH К) — основана на заме¬
не биологической амплификации (накопление клеток микроорганиз¬
ма при культивировании in vitro) ферментативной (энзиматической)
амплификацией специфических последовательностей нуклеиновых
кислот возбудителя. Гибридизация нуклеиновых кислот возбудителя
позволяет определять гены, ответственные за антибиотикорезистент-
ность, наличие в биопробе медленно растущих и требующих особых
условий культивирования микроорганизмов (например, легионеллы
и микобактерии), тех, которые невозможно культивировать in vitro
(возбудитель болезни Уипла — Tropheryma whippelii и др.).
714 Приложение
8.4. Сбор и хранение образцов для ПЦР-диагностики
Материалом для исследования служат: соскоб из уретры, церви¬
кального канала, заднего свода влагалища, секрет лредстательной
железы, сперма, моча, мазки с конъюнктивы.
8.4.1. Сбор материала (соскоб из урогенитального тракта) у женщин.
Соскобы производят из трех различных точек; цервикального канала,
уретры, заднего свода влагалища. При необходимости материал для
исследования берут из эрозивно-язвенных поражений. Сбор материа¬
ла производят отдельными одноразовыми стерильными зондами.
8.4.1.1. Сбор материала из цервикального канала. Удаляют слизь
с поверхности шейки матки тампоном, вводят зонд в цервикаль¬
ный канал на 1,0—1,5 см и вращают его в течение 3—5 с. Извлекают
зонд, избегая касания стенок влагалища, и помещают его в стериль¬
ную одноразовую пробирку с транспортировочной средой (0,3 мл).
Погрузив рабочую часть зонда в транспортировочную среду, вращают
зонд в течение 10—15 с, избегая разбрызгивания раствора. Вынимают
зонд из раствора, прижимая его к стенке пробирки и, отжав избыток
жидкости, удаляют зонд и закрывают пробирку.
8.4.1.2. Сбор материала из уретры. Перед забором соскоба из уретры
необходимо обработать ее наружное отверстие тампоном, смоченным
стерильным физиологическим раствором. Производят массаж урет¬
ры пальцем со стороны влагалища, прижимая ее к лобковой кости.
Вводят зонд в уретру на глубину 1,0—1,5 см и аккуратно, не поранив
слизистую, несколькими вращательными движениями производят
соскоб эпителиальных клеток и переносят зонд в пробирку с транс¬
портировочной средой (0,3 мл). Погрузив рабочую часть зонда в
транспортировочную среду, вращают зонд в течение 10—15 с, избегая
разбрызгивания раствора. Вынимают зонд из раствора, прижимая
его к стенке пробирки и, отжав избыток жидкости, удаляют зонд и
закрывают пробирку.
8.4.1.3. Сбор материала из заднего свода влагалища. В случае
избытка слизи и обильных выделений их удаляют стерильным ват¬
ным тампоном. Проводят зондом по поверхности слизистой в области
заднего свода влагалища и эктоцервикса и переносят зонд в пробирку
с транспортировочной средой (0,3 мл). Погрузив рабочую часть зонда
в транспортировочную среду, вращают зонд в течение 10-15 с, избегая
разбрызгивания раствора. Вынимают зонд из раствора, прижимая
его к стенке пробирки и, отжав избыток жидкости, удаляют зонд и
закрывают пробирку.
Приложение 715
8.4.2. Сбор материала (соскоб из урогенитального тракта) у муж¬
чин.
8.4.2.1. Сбор материала из уретры. Перед сбором соскоба из уретры
необходимо обработать головку полового члена в области наружного
отверстия уретры тампоном, смоченным стерильным физиологичес¬
ким раствором. Производят массаж уретры. При наличии свободно
стекающих из уретры выделений удаляют их сухим тампоном. Вводят
зонд в уретру на глубину 3-4 см. Несколькими вращательными дви¬
жениями производят соскоб эпителиальных клеток и переносят зонд
в пробирку с транспортировочной средой. Погрузив рабочую часть
зонда в транспортировочную среду, вращают зонд в течение 10-15 с,
избегая разбрызгивания раствора. Вынимают зонд из раствора, при¬
жимая его к стенке пробирки и, отжав избыток жидкости, удаляют
зонд и закрывают пробирку.
8.4.2.2. Сбор секрета предстательной железы может быть осущест¬
влен двумя способами:
— первый — после окончания массажа предстательной железы ее
секрет в количестве 0,5—1,0 мл собирают в одноразовую сте¬
рильную пробирку объемом 1,5 мл;
- второй — при невозможности получить секрет сразу после
массажа собирают первую порцию мочи (в которой содержится
секрет предстательной железы) в количестве 10 мл (см. правила
забора мочи).
8.4.2.3. Сбор спермы осуществляют в стерильные одноразовые
флаконы или пробирки.
8.4.3. Сбор проб мочи. Для анализа отбирают первую порцию
утренней мочи в количестве не меньше 20—40 мл в специальный сухой
стерильный флакон или сухую стерильную пробирку.
8.4.4. Сбор проб с конъюнктивы. Сбор пробы осуществляют
сухими стерильными ватными тампонами под местной анастезией
(2 капли раствора дикаина или инокаина). Оттянув нижнее веко,
вращающими движениями провести зонд 4—5 раз по конъюнктиве,
захватывая внешний и внутренний углы глаза. После забора мате¬
риала тампон (рабочую часть зонда с ватным тампоном) помещают
в стерильную одноразовую пробирку с транспортировочной средой.
Погрузив рабочую часть зонда в транспортировочную среду, вращают
зонд в течение 10—15 с, избегая разбрызгивания раствора. Вынимают
зонд из раствора, прижимая его к стенке пробирки и, отжав избыток
жидкости, удаляют зонд и закрывают пробирку.
716 Приложение
8.5. Сбор проб для диагностики сифилиса
8.5.1. Влажные поражения: удаляют корочку с очага, далее необхо¬
димо промокнуть любой экссудат вторичной инфекции стерильной
марлевой салфеткой, придавливают основание очага для накопления
тканевой жидкости на его поверхности, прикладывают обезжиренное
или новое предметное стекло к экссудату или собирают жидкость
стерильной бактериологической (одноразовой или металлической,
обожженной в пламени спиртовки и остуженной на воздухе) петлей и
переносят жидкость на стекло, готовят мазки.
8.5.2. Сухие поражения кожи: осторожно удаляют поверхностный
слой кожи с помощью стерильных скальпеля, кончика иглы или про¬
водят механическую экскориацию, прижимают очаг, если это необ¬
ходимо, и собирают экссудат (см. выше). Материал можно собрать,
введя в основание очага небольшое количество стерильного небакте-
риостатического физиологического раствора, отсасывают жидкость
шприцем с тонкой иглой, готовят мазок (см. выше).
8.5.3. Цервикально-вагинальные очаги: пробу собирают, используя
зеркало для определения локализации очага, удаляют любое отделя¬
емое из вагины и цервикального канала с помощью стерильного там¬
пона, используя стерильную бактериологическую петлю (см. выше),
собирают серозный экссудат. При необходимости прижимают очаг
(поражение) специальным зажимом для получения серозного экссу¬
дата, готовят мазки.
8.5.4. Сифилитические пятна на слизистых оболочках: собирают
материал со слизистых носа, глотки, полости рта или кишечника с
помошью стерильной бактериологической петли (см. выше) и готовят
мазки.
8.5.5. Лимфоузлы: если сифилитические очаги лечили местным
применением антибиотиков, то трепонемы могут быть разрушены.
В этих случаях проба из лимфоузла — единственный материл для полу¬
чения корректного результата исследования. Необходимо обработать
кожу над узлом, тампонируя 70% этиловым спиртом, а затем 1—2%
раствором йода или другого дезинфектанта. Крепко держат узел и
вводят в него стерильную иглу, присоединенную к шприцу, содержа¬
щему не более 0,2 мл небактериостатического физиологического рас¬
твора. Вводят раствор в лимфоузел и осторожно поводят в нем иглой в
разных направлениях для разрыхления ткани. Отсасывают шприцем
жидкость и отделяемое и переносят его на стекло для немедленного
исследования.
Приложение 717
8.5.6. Жидкости тела, экссудаты поражений, суспензии мацери-
рованной ткани и другой материал: тщательно перемешивают эти
жидкости и суспензии стерильной пипеткой с резиновой грушей для
уверенности в равномерном распределении материала.
При приготовлении мазков необходимо на чистое обезжиренное
или новое предметное сте)<ло нанести материал на площадь диамет¬
ром 1 см. Мазки высушивают на воздухе. Если возможно, необходимо
из каждой пробы приготовить по 4 мазка. До передачи в лабораторию
мазки следует зафиксировать в ацетоне в течение 10 мин или легким
нагреванием над пламенем спиртовки. Стекло каждого пациента
независимо от используемого метода, фиксируют отдельно.
8.5.7. Биопсии тканей и материал, полученный при аутопсии, ана¬
лизируют в отделе патоморфологии параллельно с гистологическим
исследованием.
8.5.8. Пробы для серологических специфических и неспецифичес¬
ких для т. pallidum тестов: кровь собирают венепункцией.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Гудер В.Г., Нарайана С., Вислер Г., Цавта Б. Пробы: от пациента
до лаборатории. Влияние факторов преаналитического этапа на
качество результатов лабораторных исследований / Пер. с англ. GIT
VERLAG, 2003. - 105 с.
Долгов В.В., Мошкин A.B. Обеспечение качества в клиничес¬
кой лабораторной диагностике: Практ. руковод. — М.: «Медиздат»,
2004. -216 с.
Кишкун A.A. Современные технологии повышения качества
и эффективности клинической лабораторной диагностики. — М.:
РАМЛД. - 2005. - 528 с.
Меньшиков В.В. (ред.) Клинический диагноз — лабораторные осно¬
вы. — М.: Лабинформ, 1997. — 301 с.
Меньшиков В.В. (ред.). Обеспечение качества лабораторных
исследований: Преаналит. этап: Справ, пособие. — М.: Лабинформ,
1999.-315 с.
Методические указания ГУЗМО РФ от 28.10.97 «Правила и техника
получения проб клинического материала для исследования в лабора¬
тории клинической микробиологии».
«Методические рекомендации по взятию, транспортировке, хране¬
нию и пробоподготовке биологического материала для ПЦР-диагнос¬
тики», ЦНИИЭ М3 РФ, 2003.
МУК 4.2.735-99 «Паразитологические методы лабораторной диа¬
гностики гельминтозов и протозоозов».
Пустовалова Л.М. Основы биохимии для медицинских колледжей
(2-е изд.)/Серия «Медицина для вас». — Ростов на Дону: Феникс,
2004. - 448 с.
Тиц Н. Клиническое руководство по лабораторным тестам. — М.:
Юнимед-пресс, 1997.
ГДЕ И КАК КУПИТЬ КНИГИ
Оптовые продажи
Руководитель отдела — Горячева Ирина Емельяновна
Тел./факс: (495) 921-39-07, (499) 246-39-47, моб.: 8-916-876-90-59
E-mail: iragor@geotar.ru, www.geotar.ru
Розничные продажи
Руководитель отдела — Жернова Юлия Аркадьевна
Тел.: (495) 921-39-07, 228-09-74,
8-800-555-999-2 (для регионов — бесплатно), факс: (499) 246-39-47
► Интернет-магазин www.medknigaservis.ru ► Служба «Книга - почтой»
Доставка по РФ — почтой или транспортной компанией,
по Москве и ближнему Подмосковью — курьерская доставка.
Фирменные магазины в г. Москве
м. «фрунзенская»
(выход из метро налево).
Комсомольский просп., д. 28.
(Московский дворец молодежи)
вход со стороны Детского парка.
Ежедневно с 10.00 до 20.00.
Тел.; 8-916-877-06-84,
(499) 685-12-47.
http://www.medknigaservis.ru
м. «Коньково» (авт. 712, 295),
м. «Юго-Западная» (авт. 66, 718),
ул. Островитянова, д. 1
(РГМУ, главный корпус,
студенческий вход, налево).
Пн.-пт. с 10.00 до 18.00.
Тел.; (495) 434-55-29.
E-mail: rgmu@geotar.ru,
http://www.medknigaservis.ru
м. «Новокузнецкая»
Выставка-продажа
ул. Садовническая, д. 9, стр. 4
Пн.-пт. с 10.00 до 18.00.
Тел.: (495) 228-09-74,
(495) 921-39-07 (доб. 139)
httpV/www.medkn igaservis.ru
Республика Казахстан:
010000, Астана, ул. Бейбитшилик, д. 54,
кв. 3; тел./факс: -I-7 (7172) 39-82-62,
+7 (702) 361-85-85 (моб.).
E-mail: geotarmedia_kz@mail.ru
ТОО «ГЭОТАР-КазМедиа»
Представители в СНГ
Республика Узбекистан:
700060, Ташкент, ул. Маштабиб, д. 3/16;
тел.: (998-71) 233-07-97, (998-71) 255-09-93,
8(10998) 983-000-93-52 (моб.).
E-mail: ooo_anyuta@mail.ru
Представительство ИГ «ГЭОТАР-Медиа»
в Узбекистане
НОВЫЙ АДРЕС ИГ «ГЭОТАР-Медиа»:
115035, Москва, ул. Садовническая, д. 9, стр. 4 (м. «Новокузнецкая»)
в учебном пособии представлены основные организаци¬
онные аспекты выполнения лабораторных исследований. Все¬
сторонне рассмотрена роль медицинской сестры в процессе
лабораторного тестирования. Значительное внимание уделено
особенностям подготовки пациентов к различным видам иссле¬
дований. Подробно описаны методы и способы взятия и сбора
биологического материала. Приведены основные подходы к
оценке результатов лабораторных анализов, которые должна
использовать медицинская сестра в своей практике, с учетом
критических величин исследованных показателей, требующих
немедленных действий при оказании медицинской помощи.
Во второй части учебного пособия подробно рассматривают¬
ся лабораторные исследования, которые наиболее часто исполь¬
зуются в клинической практике и к выполнению которых чаще
всего привлекается средний медицинский персонал.
www.geotar.ш
\у\уш.тебкп1§а5ег\'1$.ги
1SBN 978-5-9704-1405-7
9 Тв5970 414057