Автор: Спектор А.А.
Теги: издания для определенного назначения химия химические науки издательство аст серия увлекательная наука для среднего и старшего школьного возраста
ISBN: 978-5-17-103103-9
Год: 2017
Текст
• •
••
••
••
•
••
•• • • ••
УВЛЕКАТЕЛЬНАЯ
НАУКА
--
--
ХИ"ИЧНkИХ
ХИ"ИЧНkИf
><
:s:
Pf АКЦИИ
И (Оf ,.ПИ"f"ИЯ
.. .
••• •••
...
:
:
...
.·
.:
. .
.
:
.:
:
.
••• ••• •••
••
•
•
•
з:
••
•
•••
••
•••••
••
•
•••••
•
•••
.•.
;• · .. ;•·
~
••
:s:
<ОПА8, (fPOf"Иf И (80йП8А
•
•
•
:~··· ··
lj 1
••
"ПА.МЫ
И "fМПАААЫ
8f ЩНf8
А. А. Спектор
УВЛЕКАТЕЛЬНАЯ
НАУКА
•
ИЗДАТЕЛЬСТВО
АСТ
УДК 087.5:
ББК 24я2
С71
54
Серия «Увлекательная наука» основана в
2016 году
Спе ктор, Анн а Артуровна.
С71
Химия / А. А. Спектор.
ил.
-
-
Москва: Издательство АСТ,
2017.-160
с.:
(Увлекательная наука).
ISBN 978-5- 17-103103-9.
Школьный курс химии только начался, а вы уже запутались во всем многообразии
химических элементов? А может, вам, напротив, с легкостью дается этот предмет,
и вы можете самостоятельно составить уравнение любой химической реакции?
В любом случае наша книга вам пригодится! Вы узнаете, что такое вещество
и каков его состав, какие химические соединения самые рас п ространенные, какими
свойствами обладают металлы и чем они отличаются от неметаллов и, наконец, какие
вещества являются самыми важными для организма человека. А самое главное -
эта
книга написана просто и интересно. В отличие от школьных учебников, здесь нет
непонятных терминов и сложных научных теорий -
только красочные иллюстрации,
понятные схемы, аналогии и сравнения.
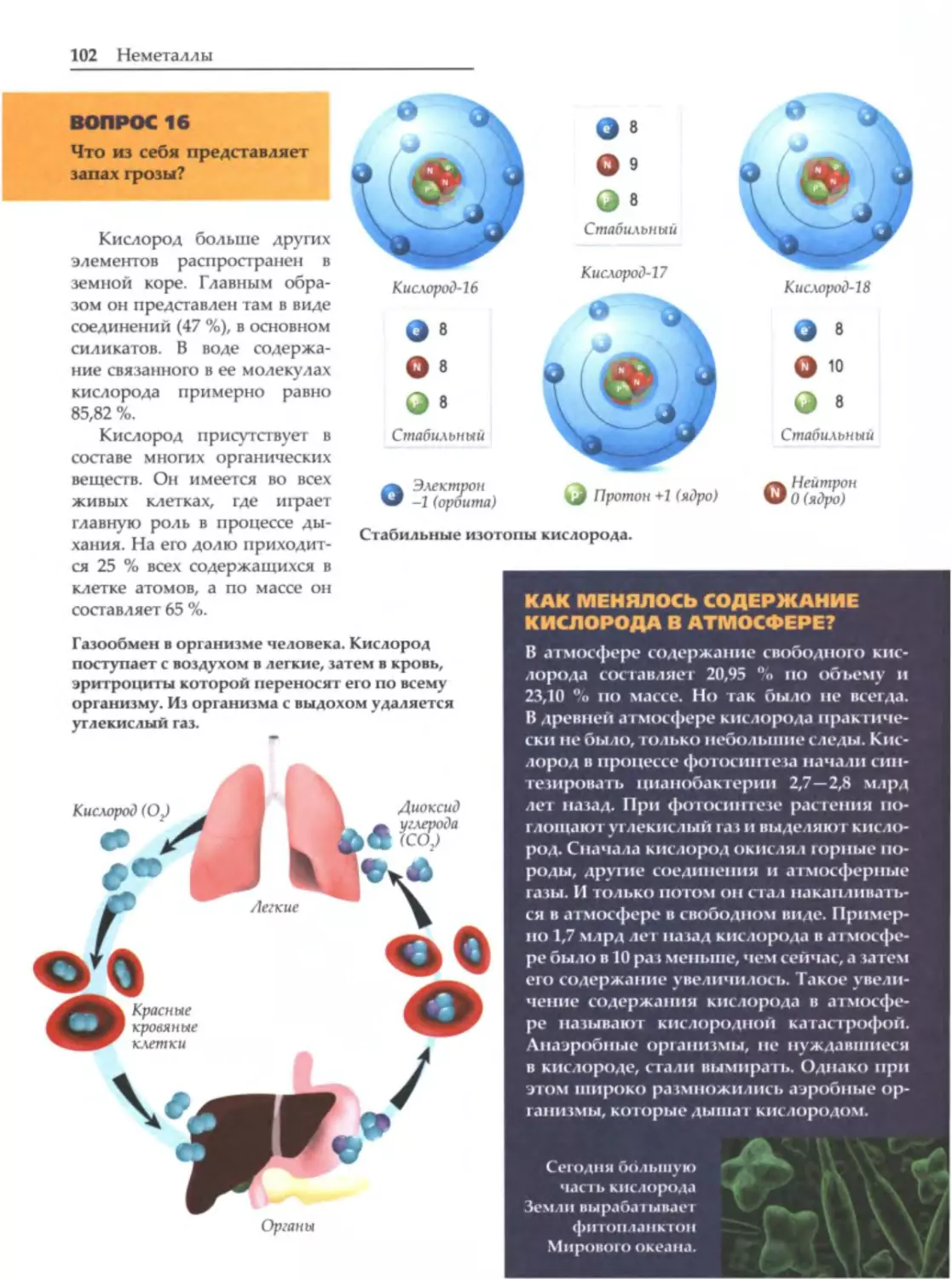
Для среднего и старшего школьного возраста.
УДК
087.5: 54
ББК 24я2
©
Оформление, обложка, иллюстрации
ООО «Интеджер»,
©
©
2017
ООО «Издател ьство АСТ»,
2017
В оформлении использованы материалы,
предоставленные Фотобанком Shutterstock, !пс.,
ISBN 978-5-17-103103-9
Shutterstock.com, 2017
© В оформлении использованы материалы,
предоставленные Фотобанком Dreamstime, Inc.,
Dreamstime.com, 20 17
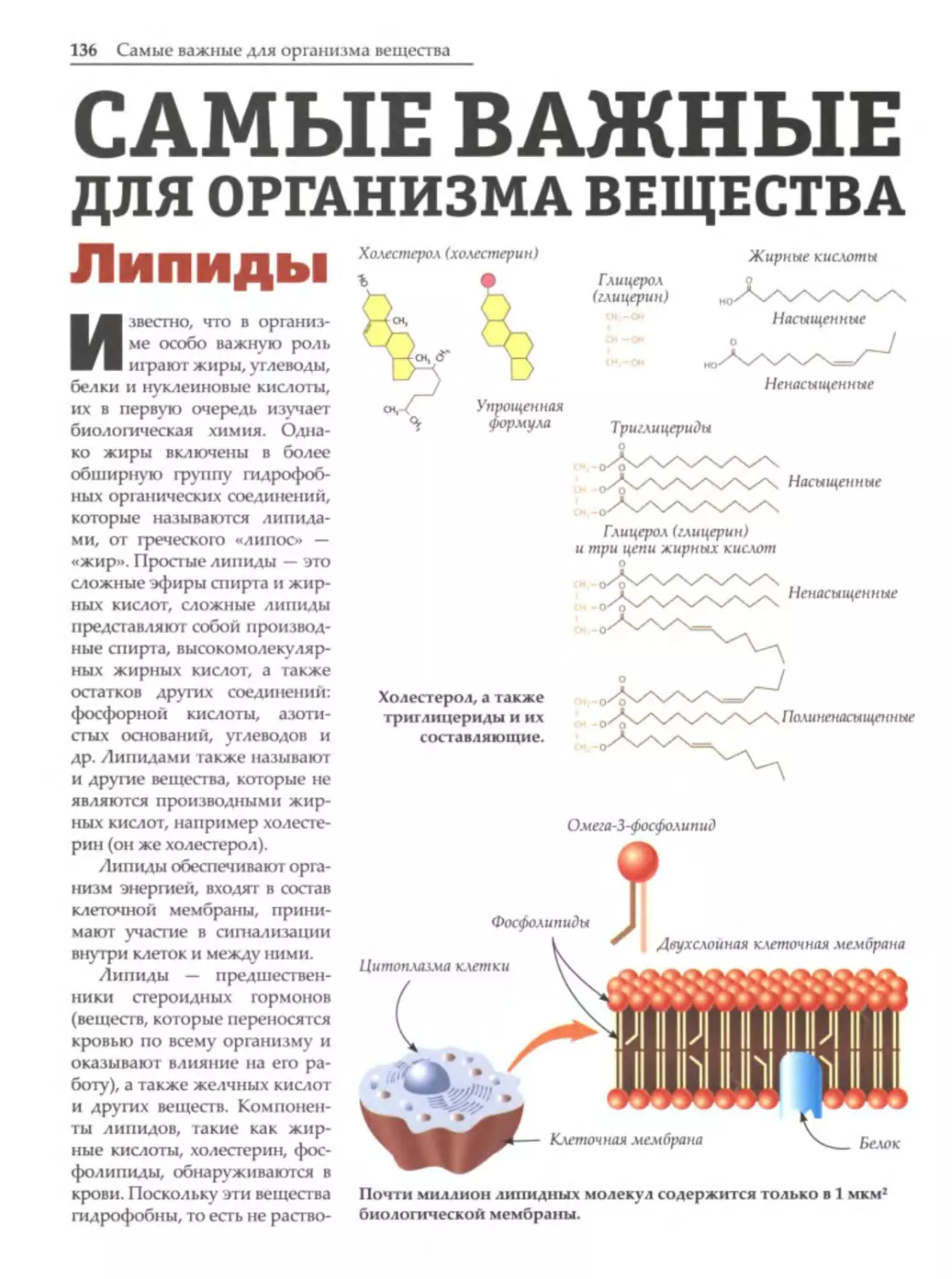
Вещество и его состав
3
ВЕЩЕСТВО И ЕГО СОСТАВ
Вездесущая химия
х
имия изучает превращение одних ве
ществ в другие, а также законы, которым
эти
превращения
подчиняются.
Она
окружает нас повсюду и всегда. Очень многие
вещи созданы с помощью химических реакций.
Когда мы просыпаемся и идем умываться,
то сразу же сталкиваемся с химией. Это мыло
Топливо для автотранспорта производят
из нефти химическими методами.
и зубная паста, которые нельзя сделать без хи
мии. Кремы, мази и косметика
-
это тоже она,
химия. Одежда, которую мы носим, нередко
сделана
из
синтетических
или
искусственных
волокон, а они созданы с помощью химии. Кра
ски, которыми она покрашена, бывают искус
ственными и натуральными, но даже создание
натуральных красителей связано с химией. Это
же справедливо для красок, которыми мы рису
ем, пасты в стержне шариковой ручки, краски,
пропитавшей стержни фломастеров. Практи
l
чески весь транспорт, на котором мы ездим, ра
ботает на топливе, а оно тоже произведено из
Производством лекарств занимается такая
нефти с помощью химии.
область химии, как фармацевтика.
Если мы болеем, то принимаем лекарства,
которые производят на фармацевтических за
вании пищи. Также в организме синтезируются
водах. А фармацевтика
это тоже химия. Ког
различные вещества, в том числе белки и нукле
да мы готовим еду, в мясе, овощах и фруктах
иновые кислоты. И этот синтез подчиняется за
-
происходят химические реакции. Они соверша
конам химии, только особой
ются и внутри нашего организма при перевари-
Действительно, химия вездесуща.
Наука о превращении веществ
очень увлекательна.
-
биологической.
Вещество и его состав
4
Хими11еские
науки
х
имия настолько обшир
на,
вещества
вращения
ны,
что
ей
и
их
столь
пришлось
пре
слож
разде
литься на разные науки, вполне
самостоятельные .
Неорганические
изучает
неорганическая
мия, в ее ведении
и
вещества
неметаллы,
-
хи
металлы
кислоты,
осно
вания, соли, некоторые другие
соединения.
химические
Она
исследует
реакции,
Органических и неорганических химических соединений сегодня
известно более
87 млн.
Многие из них производятся путем
химического синтеза.
превра
щающие одни неорганические
вещества в другие, их свойства,
состав, структуру .
Особый класс соединений
составляют
органические
ВОПРОС
биологией
1
предмет
и
генетикой.
Ее
белки, жиры, угле
-
Какие вещества изучает
воды,
органическая химия?
Из биохимии выделилась био
нуклеиновые
кислоты.
соединения углерода с водоро
органическая
химия,
которая
дом, кислородом, азотом, фос
изучает
между
строени
фором. Эти вещества, а также
Биохимия исследует хими
их строение, состав, синтез изу
ческие
чает органическая химия. Ор
состав живых существ, их пре
ганических соединений гораз
вращения
до
больше,
чем
неорганиче
вещества,
и
входящие
явления,
биологическими функциями.
Особо важны в химии опре
деление, анализ веществ, их рас
превраще
познавание, разделение и опре
ния в организмах. Она тесно
деление химических элементов
углерода чрезвычайно разноо
связана с органической химией,
и их соединений, установление
бразны. Наиболее распростра
химией лекарственных средств,
химического
нейрохимией,
Этим
потому
ненные
-
что
углеводороды.
эти
которые
ем органических веществ и их
соединения
ских,
сопровождают
в
связь
молекулярной
состава
занимается
веществ .
аналитиче
ская химия. В ней используются
качественный анализ, с помо
щью которого определяют, ка
кие вещества находятся в образ
це, и количественный анализ,
который
определяет,
сколько
того или иного вещества нахо
дится в образце.
Общие
законы
строения,
структуры и превращения хи-
Переработкой нефти
занимается нефтехимия.
Бензин, который производится
из нефти, относится
куг леводородам
-
предмету
органической химии.
Вещество и его состав
-
5
предмет
ния при помощи физических
химическая кинетика, которая
физической химии, самого об
теорий и методов. К физиче
исследует протекание химиче
ширного раздела этой науки.
ской химии относятся многие
ских реакций во времени и их
Она изучает химические явле-
разделы, такие, например, как
механизмы.
мических
веществ
Общая химия изучается в
школе
и
университетах,
она
включает в себя элементы орга
нической, неорганической, фи
зической и аналитической хи
мии.
Существует еще множество
других химических наук, кото
рые так же разнообразны, как
мир веществ и их свойства.
ВОПРОС:Z
Какие виды анализа ИСПОllЬ
По цвету иногда можно определить качественный состав
соединения, хотя это, конечно, далеко не единственный признак.
Вещество
кипения,
зует аналитическая химия?
наличие или
отсутствие кристалличе
ской структуры. Эгими свойствами занимается
физика, хотя для химии их знание просто необхо
димо. Химические свойства вещества
и
аш мир материален, это значит, что он
-
это спо
собность взаимодействовать с другими вещества
состоит из материи. А материя существу
ми, превращаться в них. Для химических свойств
ет в двух видах: как обладающее массой
характерно взаимодействие частиц между собой
вещество и поле, которое массы не имеет .
Каждое вещество имеет набор особых свойств,
например плотность, температуры плавления и
(в том числе с превращением в другие частицы)
без изменения строения атомов, входящих в эти
частицы.
Вещество и его состав
6
Три состояния
вещества
на примере
Газообразное
.
.
• •" • • 4' •q • 4 .,, • .,,...
•...
•
•
"" •
•
4
воды.
Например, физика изучает, как вода
.,,
меняет
li8
""
свои
агрегатные
состояния.
вестно три состояния вещества
-
Из
твердое,
жидкое, газообразное. Есть и четвертое
особым образом разреженный газ
ма. Вода в твердом состоянии
ком
-
-
-
-
плаз
лед, в жид
жидкость, в газообразном
-
пар.
С точки зрения химии вода состоит из мо
лекул, которые могут разделяться (диссо
циировать) на ионы и взаимодействовать
с другими веществами, производя третьи .
Жидкое
Твердое
воnРОСз
Сравните
и
элемента
Кристам.изация •
•
в
ещества состоят из ато
мов.
Атом
-
частица
ее
на
два
водород
и
кислород. Какое из этих
П.лав.ление
Атом
:кипение ВОАЬI
разложение
явлений физическое, а ка
кое
элемента, которая является но
химическое?
Атом состоит из атомного
ядра и электронной оболоч
сителем его свойств.
Слово «атом» происходит
от греческого
-
ки. Сто лет назад считалось,
«неде
что электроны вращаются во
лимый», и таковой эта частица
круг ядра, как планеты вокруг
a'roµoc; -
малых
считалась долгие века. Однако
Солнца. Так часто изобража
размеров и массы. Эго самая
уже в начале ХХ в. стала из
ют атом для упрощения. На
маленькая
вестна структура атома.
самом деле невозможно опре-
вещества
часть
очень
химического
7
Вещество и его состав
Упрощенная
Такие атомы называются изо
модель атома.
Красным цветом
обозначены
топами (разновидностями) од
ного и того же элемента. Су
ществует единственный из ста
положительно
заряженные
бильных атомов, у которого в
протоны,
ядре вообще нет нейтронов, а
серым
-
имеется
нее,
-
создает
же тяжелый водород
в
Электрон
заряжен
-
тельно, а ядро
отрица
положитель
положительно
дейте
Na+ -
заряженный
-
протон и нейтрон.
Есть еще и сверхтяжелый во
дород
-
тритий.
У него
в
-
ион натрия, потерявший элек
ядре имеются три частицы
трон.
один протон и два нейтрона.
но. Само ядро также состоит
-
атом натрия;
Na -
данный
электрон.
-
рий. У него в ядре имеются две
частицы
где
один
или протий. Существует так
электроны.
находится
оболочку)
электрон. Это легкий водород,
заряженные
точку,
протон.
Вокруг ядра вращается (точ
отрицательно
момент
один
нейтроны,
голубым
делить
только
нейтральные
Более
99 % массы
атома со
А электрон у всех этих изото
средоточено в ядре. На долю
пов один. Вода, образованная
протонов и нейтронов. Про
электронов приходится очень
дейтерием,
тоны
незначительная
лой водой.
из
элементарных
имеют
частиц
положительный
часть.
Мас
заряд, а нейтроны электриче
су
ски нейтральны. Обычно атом
ных
нейтрален.
ных И2 массы атома стабиль
Это
когда
число
такое
же,
справедливо,
протонов
как
число
в
ядре
электро
атома
измеряют
единицах
в
Имеются
атомы
с
рав
12 С.
ковым
орбите имеется один или не
с разным числом нейтронов.
сколько дополнительных элек
Энерzия
тронов, он превращается в от
рицательно заряженный
ион
протонов,
7
вonPOCs
У
одина-
нов. Если у атома на внешней
числом
тяже
атом
массы,
ного изотопа углерода
называется
но
Нейтральный
атом натрия
какого
еАИНСТВеlПlоrо
атома в ядре нет нейтро
нов?
Положительный
ион натрия
(анион). Если у атома на внеш
ней орбите недостает одного
или
он
нескольких
превращается
электронов,
в
положи
тельно заряженный ион (кати
\о
''
/
он) . Таких ионов очень много в
различных растворах.
Электрон /·
.
·
воnРОС4
Нейтральный
атом хлора
Отрицательный
ион хлора
.---..
Какой электрический за
ряд у атома?
Например:
-
от
рицательно заряженный
ион
С1
-
атом хлора; с1-
хлора с дополнительным элек
Образование ионов, которые должны объединиться в молекулу
троном.
поваренной соли.
8
Вещество и его состав
Атомы образуют межатомные связи и фор
мируют молекулы. Молекулы могут состоять
как из одного вида атомов, так и из нескольких.
Эnементь1
в
древности
было
распространено
изре
чение: «Как слова состоят из букв, так
и тела
-
из элементов». В начале
XIX
в.
английский ученый Джон Дальтон предложил
атомно-молекулярную
гипотезу,
которая
рас
сматривает химический элемент как отдельный
вид атомов и утверждает, что простые вещества
состоят из атомов одного вида, а сложные
-
из
разных. Дальтон также указал, что важнейшее
свойство элементов
С11ева
-
-
это атомный вес.
атом водорода Н, состоящий из одного
протона и одного э11ектрона; справа
-
атом
Джон Да11ьтон
ге11ия, ядро которого состоит из двух протонов
(1766-1844) -
и двух нейтронов, его окружают два э11ектрона.
анг11ийский
ученый,
занимавшийся
и физикой,
и химией.
Химический элемент
атомов,
у
которых
-
это совокупность
одинаковы
заряды
ядер
и
число электронов в оболочке. У каждого хи
мического
элемента
есть
латинское
на зв ание
и символ, который состоит из одной или двух
латинских букв. Например, латинское название
железа
- Ferrum, символ - Fe; латинское
- Hydrogenium, символ -
звание водорода
на
Н.
Названия элементов утверждаются Междуна
родным союзом теоретической и прикладной
химии
ИЮПАК (англ.
-
Intemational Union
of Pure and Applied Chemistry, IUPAC). До
утверждения может пройти несколько лет. Все
это время элемент носит временное название,
произведенное
от
латинского
числительного,
которое соответствует цифрам в атомном номе
ре элемента. Например, 118-й элемент долгое
время носил название «унуноктий» и символ
Uuo,
сегодня же это оганесон
(Og).
Форма существования химических элемен
Понятие атома теснейшим образом связано
с понятием элемента .
тов
-
простые вещества. Элементы и простые
вещества
-
разные понятия. Вещества облада-
Вещество и его состав
9
СОВМЕСТНОЕ РЕWЕНИЕ ХИМИКОВ
В
1860 г.
в немецком городе Карлсруэ состоялся международный съезд химиков, где по ини
циативе итальянского ученого Станислао Канницаро были приняты определения пшштий
«молекула» и «атом».
В середине XIX в. были известны
63 химических элемента. Сегодня
же их число равно 118.
ют определенными свойствами, элементы
-
кул либо различное размещение молекул или
просто совокупности атомов, абстрактные объ
атомов в кристалле. Но главная причина, конеч
екты.
но, строение атома и его способность образовы
вать разные химические связи.
ВОПРОС&
Прочитайте эти названия: углерод, кис
лород, уголь
-
и скажите, где здесь веще
ство, где элемент, а где и то, и другое?
Уголь, алмаз и фуллерен
-
разные вещества,
но один элемент.
Кроме того, для одного и того же химиче
ского элемента может иметься несколько раз
личных типов простых веществ. Такие типы
называются
аллотропными
модификациями.
Причин этому может быть несколько: напри
Кристаллические структуры разных
мер разный состав или разное строение моле-
модификаций углерода.
10
Вещество и его состав
Аллотропные
ции
по
элементов
физическим
химической
модифика
и собраны в особую таблицу,
различаются
которая
свойствам
крывшего ее ученого Дмитрия
активности
и
(так,
температура плавления алма за
выше, чем у фуллерена, а озон
более активен, чем кислород).
периодически
и
именем
от
Ивановича Менделеева.
Озон состоит из трех атомов
кислорода, а молекулярный
кислород
Свойства всех элементов из
меняются
названа
-
из двух. Это
разные вещества, хотя они
со
состоят из одного и того же
гласно периодическому закону
элемента.
Периодическиiзакон
n
.
Что нцо было знать АЛИ
ериодический закон
фундаментальный
за
кон природы, который
Дмитрий Иванович Менделе
ев открыл в
1869
г. Для этого
он сопоставил свойства извест
ных
в
ВОПРОС7
те
времена
элементов
с
химических
величинами
их
атомных масс.
Классифицировать и систе
матизировать химические эле
В
г. была опубликована
правИ11Ьноrо состав..11.ения
таблица Уильяма Одлинга, где
табllИЦЬI химичесхих Зllе-
элементы
ментов?
1864
размещались
в
соот
ветствии с атомными весами и со
сходством
химических свойств,
правда, никаких выводов из это
В
1871 г. Дмитрий Иванович
го сделано не было. В том же году
Менделеев дал формулировку
немецкий химик Лотар Мейер
периодического закона в статье
опубликовал таблицу из
«Периодическая законность хи
ментов,
разделенных
28
на
эле
шесть
столбцов по их валентностям.
так:
«Свойства
простых
г. на заседа
тел, а также формы и свойства
Но число известных элементов
нии Русского химического об
соединений элементов, а пото
было недостаточно, а атомные
щества
доложил
му и свойства образуемых ими
массы
были
об открытии периодического
простых и сложных тел стоят в
Однако
закона химических элементов.
периодической зависимости от
со временем ученые открывали
В том же году он включил пе
их атомного веса » .
все
риодическую таблицу в свой
менты начали задолго до этого .
многих
определены
новые
и
из
них
неверно .
новые
элементы,
определяли их атомные веса.
В марте
мических элементоВ». Она зву
чала
1869
Менделеев
учебник «Основы химии ».
Менделеев,
своих
в
отличие
предшественников,
просто
составил
таблицу
от
не
и
указал закономерности в отно
шениях атомных весов, но и на
звал их общим законом приро
ды. Предположив, что свойства
элемента
веса,
он
зависят
в
от
атомного
некоторых
случаях
исправил ранее принятые веса
и описал свойства элементов,
которые еще не были открыты.
Таким образом, в его таблице
оставались пустые места.
ВОПРОС В
Памятник Д. И. Менделееву у здания НИИ метрологии (ранее
Главная палата мер и весов). Россия, Санкт-Петербург, сентябрь
© Srg Gushchin / Shutterstock.com
Почему в первой таб..11ИЦе
2016 г.
Д. И. Меще..11.еева остал.ись
nуСТЬiе места?
,_
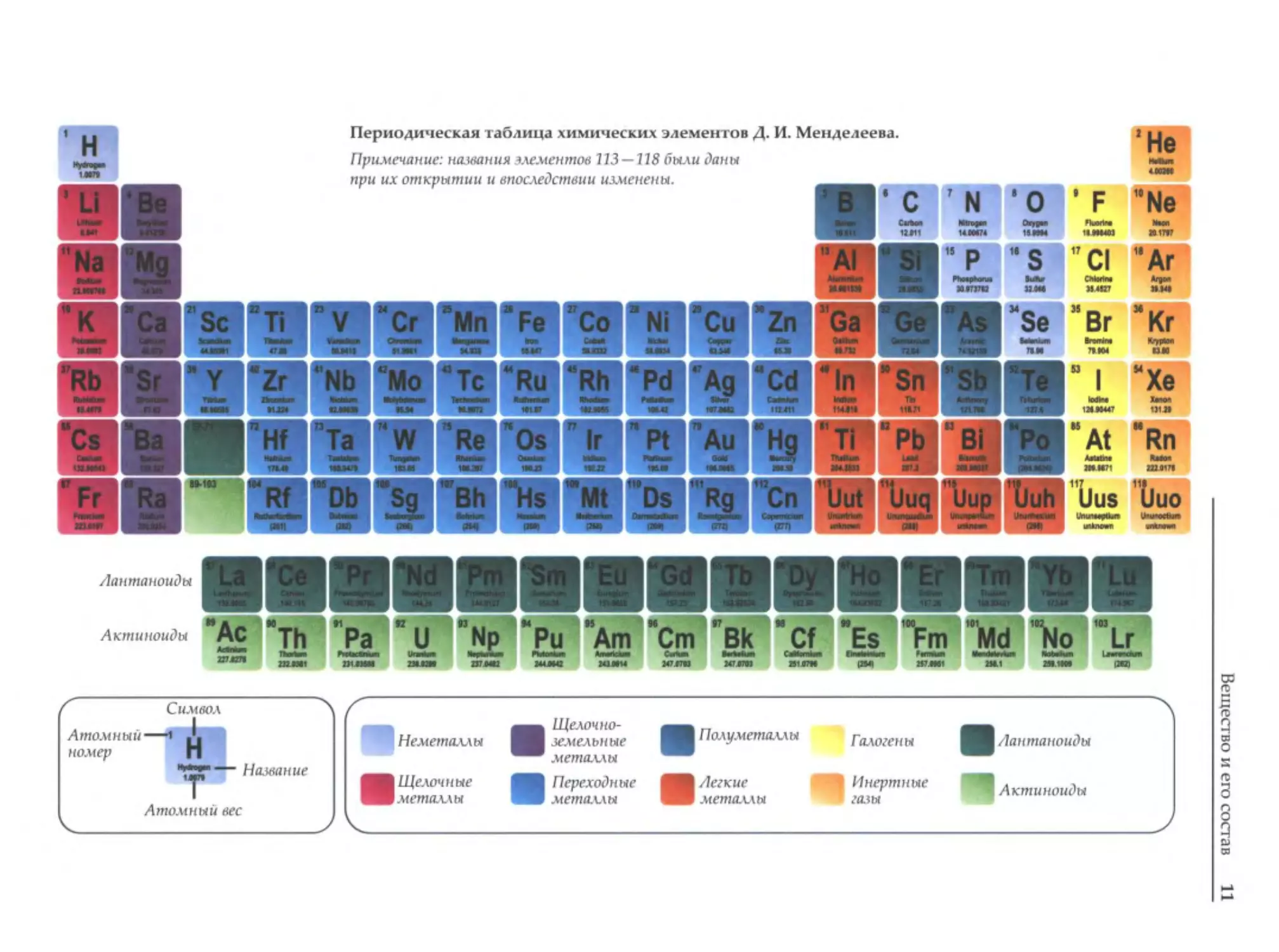
Периодическая таблица химических элементов Д. И. Менделеева.
'н
..,._
Примечание: названия элементов
•F
- 'Не
113 -118 бы.ли даны
~
при их открытии и впоследствии изменены.
7
N
·о
,.._
~
-
'Ne
1
21.1117
11.-
CI
17
11
Chlollno
JZ.811
31.4127
эs
Br
- 11
1
lodlno
121.80447
-
Kr
~
11.IМ
53
Ar
..........
14 Хе
131.21
"At
Rn
IOt.8171
222.0111
~
117
Uus Uuo
1
- -
u...........,
Лантаноиды
Актиноиды
Символ
Атомный--+1 Н
Неметаллы
номер
..,._
ti
Атомный вес
Название
11
Щелочноземельные
•
Полуметаллы
Галогены
металлы
. Щелочные
металлы
•
Переходные
металлы
. Легкие
металлы
Инертные
газы
11Лантаноиды
Актиноиды
"'""'8о11111
12
Вещество и его состав
Эти
места
были
заняты
зом:
«Свойства
химических
в последующие годы. Так, в
элементов, а также формы и
г. Поль Лекок де Буабод
свойства образуемых ими про
1875
ран объявил об открытии эле
стых
мента галлия. Оказалось, что
находятся
это предсказанный Менделе
зависимости
1879
евым экаалюминий. В
Ларе
Нильсон
открыл
наружил
германий,
который
кону.
Иванович
когда-то
назвал экасилицием. С сере
дины 1880-х гг. периодический
признали
как одну из фундаментальных
основ химии.
соединение
галлия с мышьяком. Галлий
был открыт благодаря
спектральному анализу. Лекок
де Буабодран переработал
большое количество породы
и наконец выделил элемент.
Менделеев сразу же отметил,
что это предсказанный им
экаалюминий, и даже указал
более точный атомный
вес, который впоследствии
подтвердился.
Но в те времена еще не
были известны причины тако
го периодического изменения
свойств
лось
элементов.
сделать
строения
после
атома,
Это
уда
открытия
его
величины
за
ня химических элементов уже
Дмитрий
-
периодической
от
скан
118,
Арсенид галлия
соединений
рядов ядер их атомов». Сегод
- менделеевский экабор,
а в 1886 г. Клеменс Винклер об
полностью
в
и
г.
дий
закон
веществ
ядра
и
электронной оболочки. Сегод
ня периодический закон фор
мулируется следующим обра-
и их свойства изменяются
согласно
периодическому
за
Атом углерода.
Вещество и его состав
Эnектронная
ЧТО ТАКОЕ ВАЛЕНТНОСТЬ?
конфиrураqиR
тинского
зnементов
13
Слово «вале1пносТI»> нроисходит от ла
valens
(«имеющий силу») и оз
начает снособность атомов
:Jлементов
образовьшап.
химических
онределенное
•1исло химических сшпей.
Валентные :Jле1проны находитси на внеш
Т
аблицу Менделеева принято делить на
ней (валентной) оболочке атома. Именно
периоды (горизонтальные строки хими
они онределшот, как ведет себи :Jлемент
ческих элементов) и группы (вертикаль
ные столбцы химических элементов).
в химических реакциих. Чем меньше ва
лентных :Jлектронов у :Jлемента, тем лег
Чтобы разобраться в таблице Менделеева,
че он их отдает, то есть ведет себн как
надо вернуться к строению атома, точнее, к его
восстановитель. Чем больше у :Jлемента
электронной оболочке.
валентных
Область пространства вокруг ядра, где на
:Jлектронов,
тем
легче
он
их
нриобретает, то есть ведет себн как окис-
хождение электрона наиболее вероятно, назы
лите ль.
вают атомной орбиталью или электронным об
Валентные :Jлектроны онределшотси до
лаком. У орбиталей встречаются разные форма,
вольно
размер и ориентация. Согласно законам очень
леева.
сложной науки квантовой механики, атомная
11одгру1111, так как там есть исключенин)
орбиталь и электрон, который находится на
верно
ней,
валентных
характеризуются
четырьмя
квантовыми
числами.
просто
Дли
условие:
ветствует
по
ос1юш1ых
таблице
:Jлеме1пов
наибольшее
:Jлектронов
номеру
Менде
(кроме
количество
соот
•
'
O""C\ f!ll
•
группы,
в
которой находится исследуемый :Jлемент.
ВОПРОС9
Что такое атомная орбиталь?
По молекуле
метана видно: атом
Главное квантовое число п обозначает об
щую энергию электрона на данной орбитали.
Его значения
натуральные целые числа от
-
1
и выше.
у1-лерода имеет
валентность
4, 011
способен поделитьо1
с атомами
водорода четырьмя
Орбитальное квантовое число
l
определяет
:Jлектронами.
форму атомной орбитали. Оно принимает зна
чения целых чисел от О до п
- 1,
где п
-
главное
квантовое число.
Орбитали с
(sharp -
l=
ВОПРОС
10
О носят название s-орбиталей
Как количество валеНТНЬIХ электронов со
«резкая»). Они обладают сферической
относится со способностью притягивать
формой и не имеют направленности в про
странстве
электроНЬI от других атомов?
.
•
1s
2s
Зs
s-орбитади атома.
4s
Ss
бs
7s
Вещество и его состав
14
Орбитали с l =
1 - это р-ор
битали (principal - «главная » ) .
ческий уровень, или электронная
оболочка. Любой произвольный
но
Они напоминают гантель, их
энергетический уровень с номе
формулу (конфигурацию). На
форму называют трехмерной
ром п состоит из п 2 орбиталей.
пример, у фосфора, элемента
Множество орбиталей с оди
восьмеркой.
Орбитали с l =
битали
2(diffuse -
это d-ор
наковыми значениями главного
«диффуз
квантового числа и орбитально
ная»), они имеют форму удво
го квантового числа
енной гантели или четырехле
гетический подуровень.
Орбитали с
l = 3 - это /-ор
(fundamental - «ба
вень,
которому
главное
соответствует
квантовое число п,
со
держит п подуровней. Каждый
форму,
энергетический
ше
орбитальным
стилепестковый цветок.
Пространственную
тацию
орбитали
ориен
определяет
магнитное квантовое число т 1 •
Спиновое квантовое число
(или просто спин)
ет
за
направление
m5
отвеча
вращения
лом
в атоме с одинаковым значением
это энергети-
2р
ми, она такая :
1 5Р
орби
=
ls 22s22p63s 23p3,
где цифры обычного раз
-
это номера энергети
ческих уровней;
дексы
-
верхние
количество
ин
электро
нов на каждом подуровне.
При
этом у фосфора
внешних
электронных
на
под
уровнях пять электронов, сле
довательно,
он
относится
к
стоит
системы. На предвнешних под
из
одной
р-подуровень
-
s-орбитали,
из
трех р-ор
биталей, d-подуровень
-
пяти
d-орбиталей, а /-подуровень
Распределение
-
уровнях
-
восемь электронов,
а на внутреннем уровне
-
два
электрона.
Следовательно, период
электронов
это
последовательность
-
эле
по орбиталям называется элек
ментов (от щелочного металла
тронной конфигурацией.
до инертного газа), атомы ко-
4р
z
z
Sp
z
х
z
z
х
у
у
d-орбитали атома пяти различных ориентаций.
/-орбитали атома.
(21 + 1)
15 электрона
пятой группе периодической
р-орбитали атома.
у
квантовым чис
состоит из
Зр
х
с
и
электронную
талей. Значит, s-подуровень со
Совокупность всех орбиталей
-
подуровень
его
15 протонами
из семи /-орбиталей.
электрона в атоме.
квантового числа
l
записать
мера
зовая » ). Они имеют сложную
напоминающую
с
это энер
Каждый энергетический уро
песткового цветка.
битали
-
Для каждого элемента мож
4f
х
х
у
'1
у
15
Вещество и его состав
в зависимости от того, какой
подуровень
в
атоме
элемента
заполняется последним.
ВОПРОС
11
От чеrо зависит назва
ние
электронноrо
се
мейства элеме~па?
Побочная подгруппа
-
это
Фосфор имеет пять валентных
вертикальный ряд d-элементов,
Аргон
электронов.
которые
восьмой группы.
имеют
суммарное
одинаковое
число
электронов
на d-подуровне предвнешнего
слоя
n=7
n=6
и
инертный газ
-
s-подуровне
внешнего
металлическим, и связано это
с увеличением числа электро
слоя. Это число обычно равно
нов
номеру группы и растет в соот
ском уровне.
на
внешнем
энергетиче
ветствии с ее номером.
n=S
ВИДЫ ЭЛЕМЕНТОВ
У
n=4
s-:J11е:\1ентов
запо,ншется
К
n=З
да1111ьп1
пос,1е,ц111:\1
s-подурове11ь.
:JЛе:\1е11тач
от
носятся :J,1е:\1енты главных
11одгру1ш
п=2
1целочные
n=1
1 11 11 груш~. Это
11 1це11оч1нне
'1е ,1ы1ые :\1ета ,1, 1ы , во д оро ,,
11 rелнй.
У
р-:Jае,1е11тов
запо,ншет
Заполнение орбиталей
си р-подуровень.
электронами.
:\1ента:\1 относит пос1едн11е
Атомная масса:
22,989 а.
е. м.
Электронная конфигурация:
торых имеют одинаковое чис
Натрий
ло
металл первой группы.
энергетических
уровней,
-
2, 8, 1
активный щелочной
:Jле:\1ентов
пер11ода,
кроче
седь:\юrо,
а
каждого
-
это
У атомов всех элементов од
VIII
11
первого
также
ъ1е:\1е11-
ты главных подгрупп
равное номеру периода.
Главная подгруппа
шесть
К р-:J,1е
111-
групп.
вертикальный ряд элементов,
ного периода одинаковое чис
d-:J,1еченты распо,~агаются
у
имеется
ло электронных слоев, равное
:\tежду
электронов
номеру периода. Все периоды,
в бо11ыш1х пернодах от
кроме
до
атомов
которых
одинаковое число
на
внешнем
энергетическом
первого,
начинаются
элемента,
меру группы (кроме водоро
лочной
да и гелия). Число электронов
ются элементом, образующим
на
благородный (инертный) газ.
внешнем
энергетическом .
уровне группы
растет в соот
ветствии с ее номером.
ческой
на
системе
четыре
мейства
(s-,
разделяются
электронных
р-,
d-,
се
/-элементы)
металл,
а
ще
заканчива
Таким образом, с увеличе
нием
Все элементы в периоди
образующего
с
уровне. Это число равно но
заряда
ядра
атомов
изменение
р-:Jле:\1ента:\ш
Xll группы. Их
111
называют
переходньп111 :\tет а ,1.Iа:\Ш.
К
/·:J,1е:\1ента:\1
,~антано11ды
11
опюопо1
акт1111011 д ы.
Он11 обычно 11аход~по1 от
де,1ыю вн11зу т аолицы.
на
блюдается постепенное зако
номерное
s- 11
свойств
ВОПРОС
12
элементов и их соединений от
Почему d-элемеНТЬI назы
металлических к типично
вают переходными?
не-
16
Вещество и его состав
Расnространенность хими11еских
зnементов в nрироде
о
дни элементы встреча
шую часть вещества звезд. Сле
ются
дующий по распространенно
в
другие
природе
-
очень
часто,
редко .
Самый распространенный из
химических
элементов
-
это
водород. Он составляет боль-
-
1000 атомов
гелия,
13
гелий, ведь в ядре звезды
Какой э11еме1П распросr
водород постоянно превраща
ранен во Все11енной боllЬ
ется в гелий во время ядерной
ше всего?
сти
реакции .
Структура и химический состав Солнца. В среднем на
около
ВОПРОС
10 ООО атомов водорода в звездах приходится
5 атомов кислорода и менее 1 атома остальных элементов.
17
Вещество и его состав
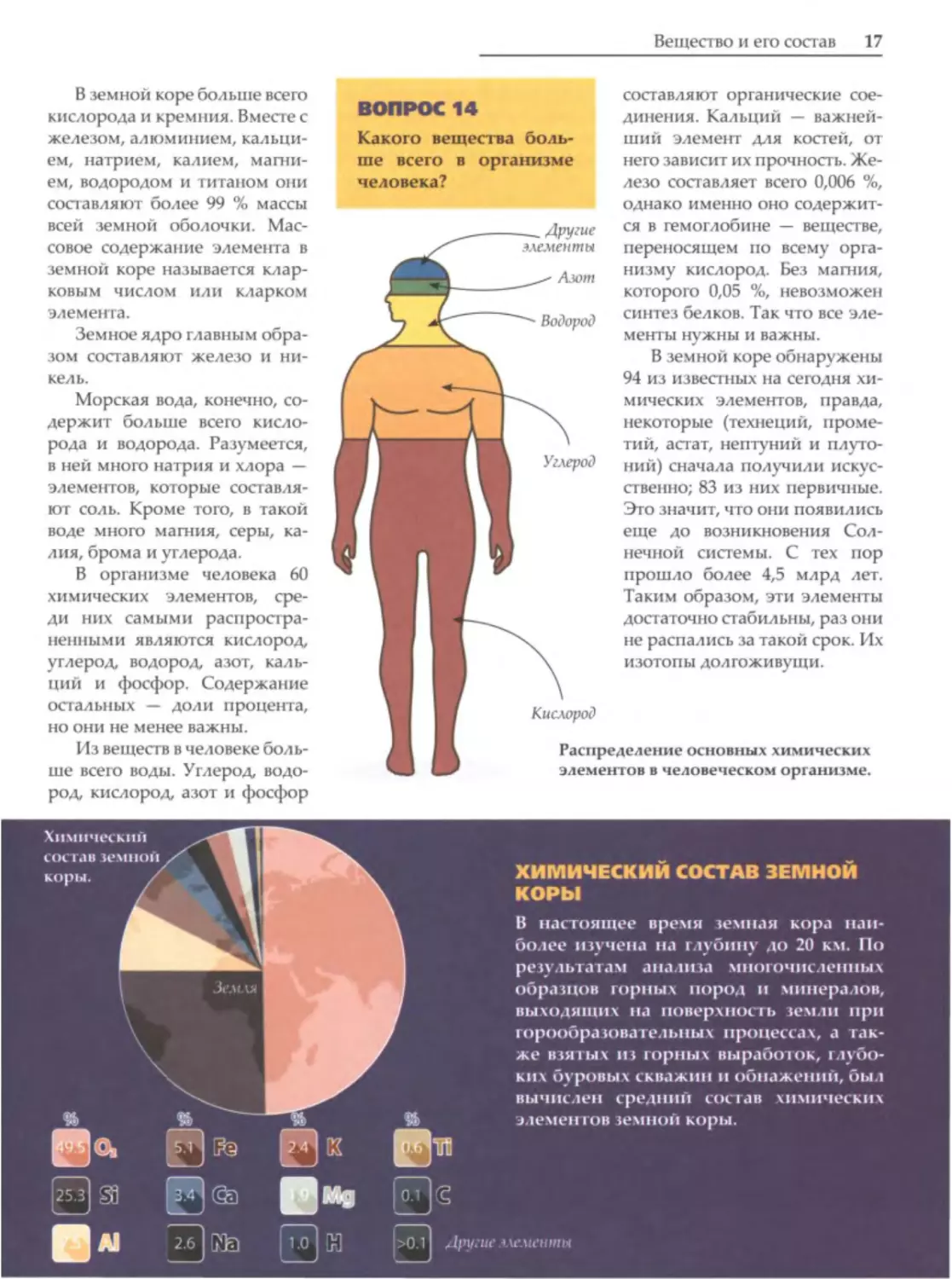
В земной коре больше всего
кислорода и кремния. Вместе с
ВОПРОС
составляют органические
14
железом, алюминием, кальци
Какого вещества боль
ем,
ше
натрием,
калием,
магни
ем, водородом и титаном они
составляют более
99 %
содержание
Мас
элемента
в
земной коре называется клар
ковым
числом
или
Земное ядро главным обра
составляют
организме
железо
и
ший элемент для костей, от
него зависит их прочность. Же
____
Другие
элементы
Азот
Водород
ся в гемоглобине
-
переносящем
всему
которого
0,05 %,
невозможен
синтез белков. Так что все эле
94
из известных на сегодня хи
мических
держит больше всего кисло
элементов,
правда,
некоторые (технеций, проме
рода и водорода. Разумеется,
которые
орга
низму кислород. Без магния,
В земной коре обнаружены
Морская вода, конечно, со
элементов,
по
веществе,
менты нужны и важны.
кель.
-
0,006 %,
однако именно оно содержит
ни
в ней много натрия и хлора
сое
важней
лезо составляет всего
кларком
элемента.
зом
в
человека?
массы
всей земной оболочки.
совое
всего
-
динения. Кальций
тий, астат, нептуний и плуто
Углерод
ний) сначала получили искус
ственно;
составля
83
из них первичные.
ют соль. Кроме того, в такой
Это значит, что они появились
воде
еще
много
магния,
серы,
ка
лия, брома и углерода.
В
организме
химических
ди
них
ненными
углерод,
ций
человека
-
4,5
тех
Сол
пор
млрд лет.
Таким образом, эти элементы
достаточно стабильны, раз они
водород,
и фосфор.
прошло более
С
сре
являются
остальных
60
возникновения
системы.
распростра
элементов,
самыми
до
нечной
не распались за такой срок. Их
кислород,
азот,
каль
изотопы долгоживущи.
Содержание
доли
процента,
Кислород
но они не менее важны.
Из веществ в человеке боль
Распределение основных химических
ше всего воды. Углерод, водо
элементов в человеческом организме.
род, кислород, азот и фосфор
18
Вещество и его состав
Остальные
технеций,
11
элементов
прометий,
-
поло
В
земной
ментов,
коре
которые
нет
эле
расположе
надеются
менты,
синтезировать
которые
эле
существуют
ний, астат, радон, франций,
ны в периодической таблице
дольше
радий,
Менделеева
эпохи жизни Вселенной. Со
актиний,
протакти
ний, нептуний и плутоний
не
имеют
таких
-
долгоживу
щих изотопов. Их называют
радиогенными.
плутония
(элемент с порядковым номе
ром
94).
таблицы
Последние элементы
очень
нестабильны,
значит,
они синтезируются искусствен
что все имеющиеся в земной
но с помощью физических ме
коре
тодов и подвержены быстро
атомы
Это
после
этих
элементов
появились в резу ль тате радио
му
радиоактивному
активного распада других эле
Их
жизнь
ментов.
доли секунды . Однако ученые
распаду.
составляет
малые
и
распались в ранние
вокупность
называют
таких
элементов
островом
стабиль
ности.
ВОПРОС
Открыты
15
ли
элементы
острова стабильности?
19
Вещество и его состав
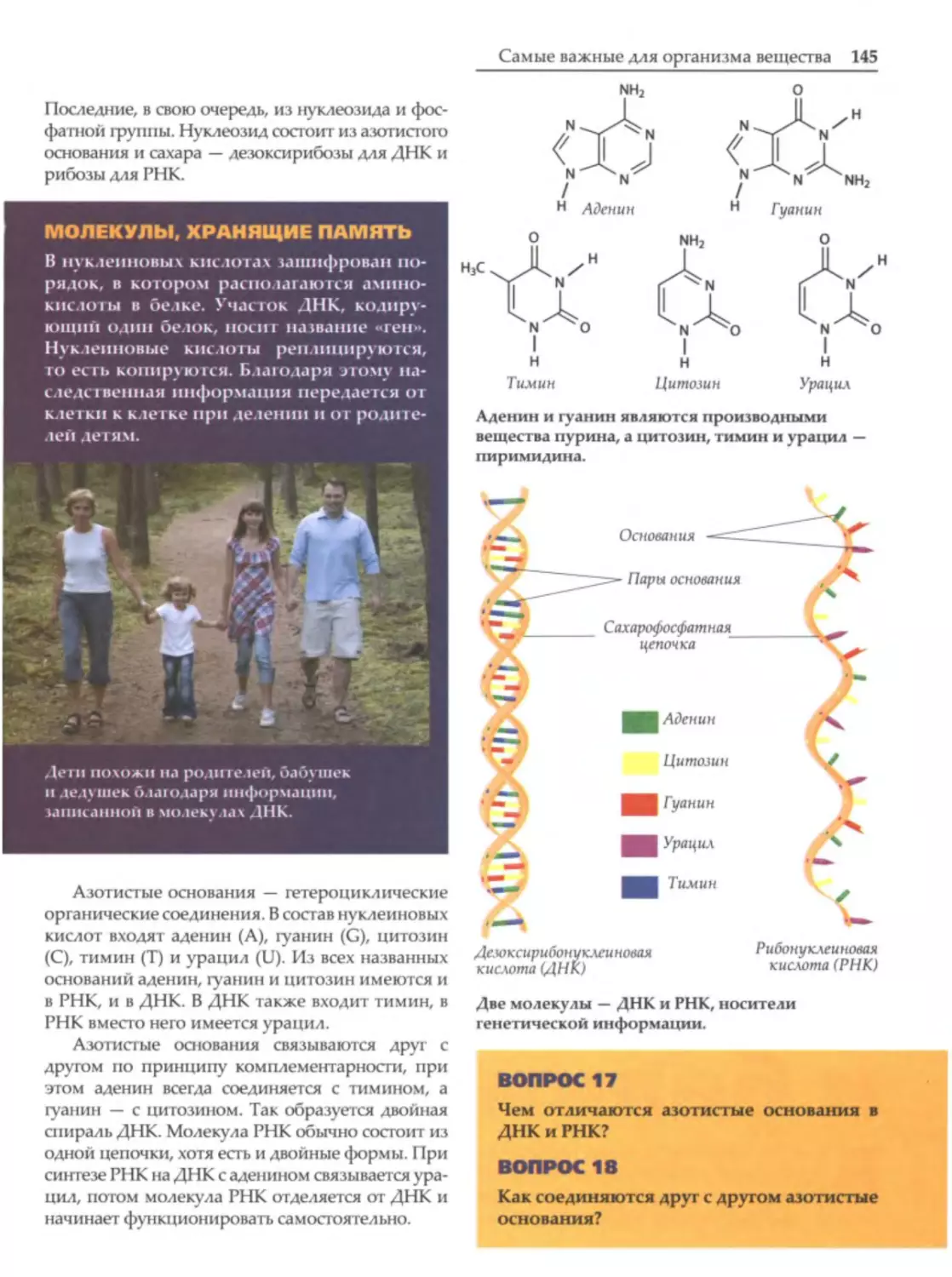
Моnекуnы
А
Если молекула состоит из повторяющихся низкомолекуляр
ных фрагментов, ее называют макромолекулой.
томы различного вида
в
разных
количествах,
связанные межатомны
ми связями, образуют моле
кулы.
Молекула
ски нейтральна.
молекулы
а
электриче
Заряженные
называют
молекулы
с
ионами,
Часть макромо11.еку 11.ы це11.11.ю11.озы
неспаренными
электронами и ненасыщенны
ми
валентностями
-
-
вещества, из которого
состоят дерево и бумага.
радика
В твердом состоянии сохраняют молекулярную струК1уру
лами.
вода, оксид углерода и многие органические вещества. У них не
высокие температуры плавления и кипения. Большинство твер
дых неорганических веществ состоят из ионов или атомов. Они
существуют как макротела. Это, например, самородок меди или
кристалл поваренной соли (хлорида натрия).
ВОПРОС
Имеет
11И
16
медь
молеку
лярную структуру?
он
Медь не имеет мо11.еку 11.ярной
структуры. Она
-
макроте11.о.
Состав молекул выражают
Мо11.еку 11.а аскорбиновой
кис11.оты
-
с помощью химических фор
витамина С.
он
мул.
СОСТАВ И СТРУКТУРА
-
В ЧЕМ РАЗНИЦА?
Состав химического соединения
-
это количество опре
деленных атомов, которые в него входят. Однако взаимо
связи и расположение этих атомов в пространстве могут
Два изомера пропи11.ового
спирта
-
пропано11.а.
Го11.убыми шариками
обозначены атомы уr11.ерода
отличаться. · Соединения, которые одинаковы по атом
и присоединенные к ним
ному составу и молекулярной массе, но отличаются по
атомы водорода.
расположению атомов
в
пространстве, называются
изо
мерами. Они отличаются друг от друга свойствами. Хими
ческие превращения, в резу ль тате которых структурные
изомеры превращаются друг в друга, называются изоме
ризацией. Этот процесс очень важен в промышленности,
ВОПРОС
17
например при получении более эффективного топлива и
ВllИЯет 11И структура на
такого материала, как капрон.
свойства соеАИНения?
Вещество и его состав
20
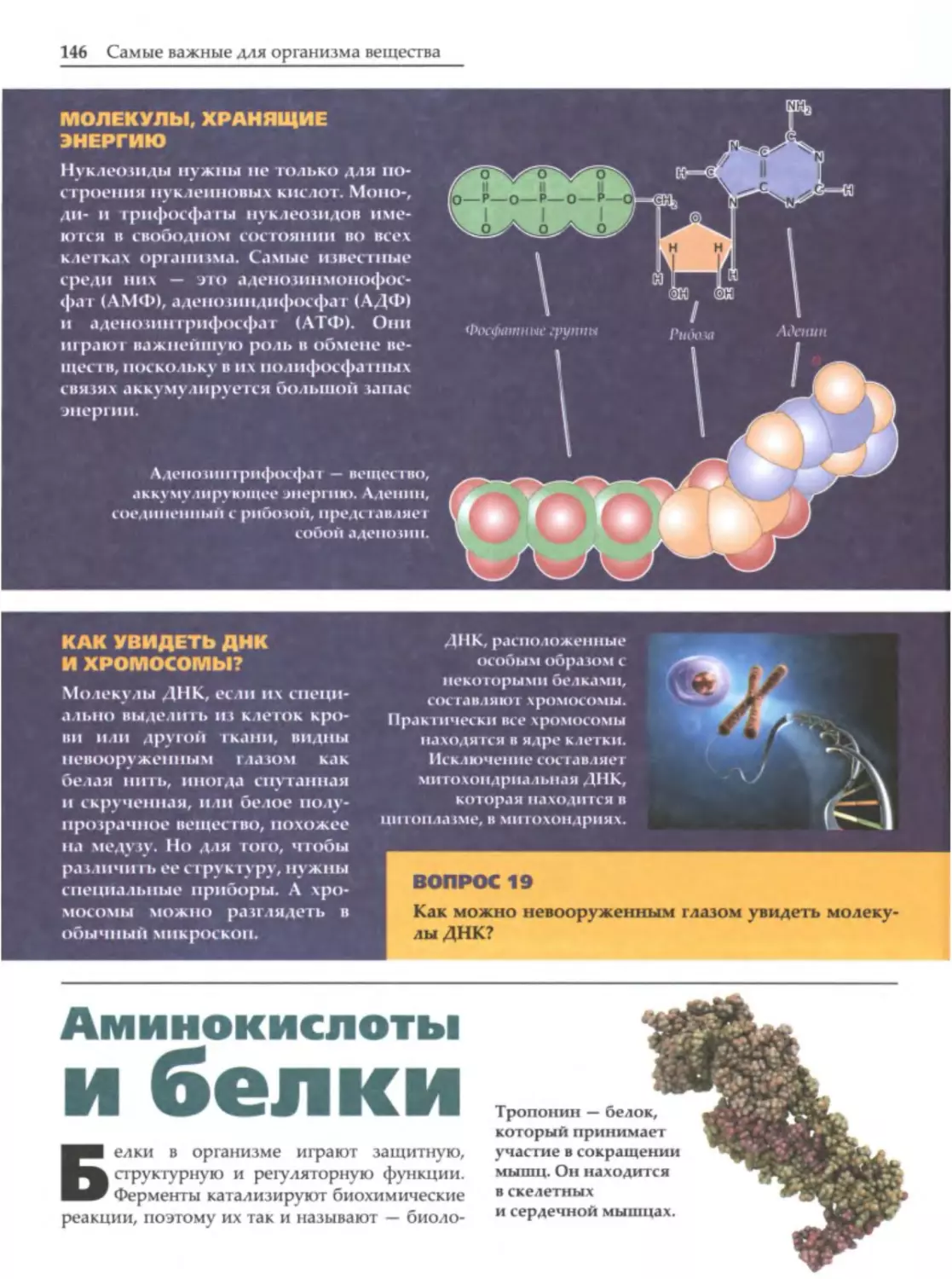
Химические
Объемная
формуnь1
Желтым цветом
структурная формула
серной кислоты.
обозначен атом серы,
-
красным
атомы
кислорода, белым
-
атомы водорода.
х
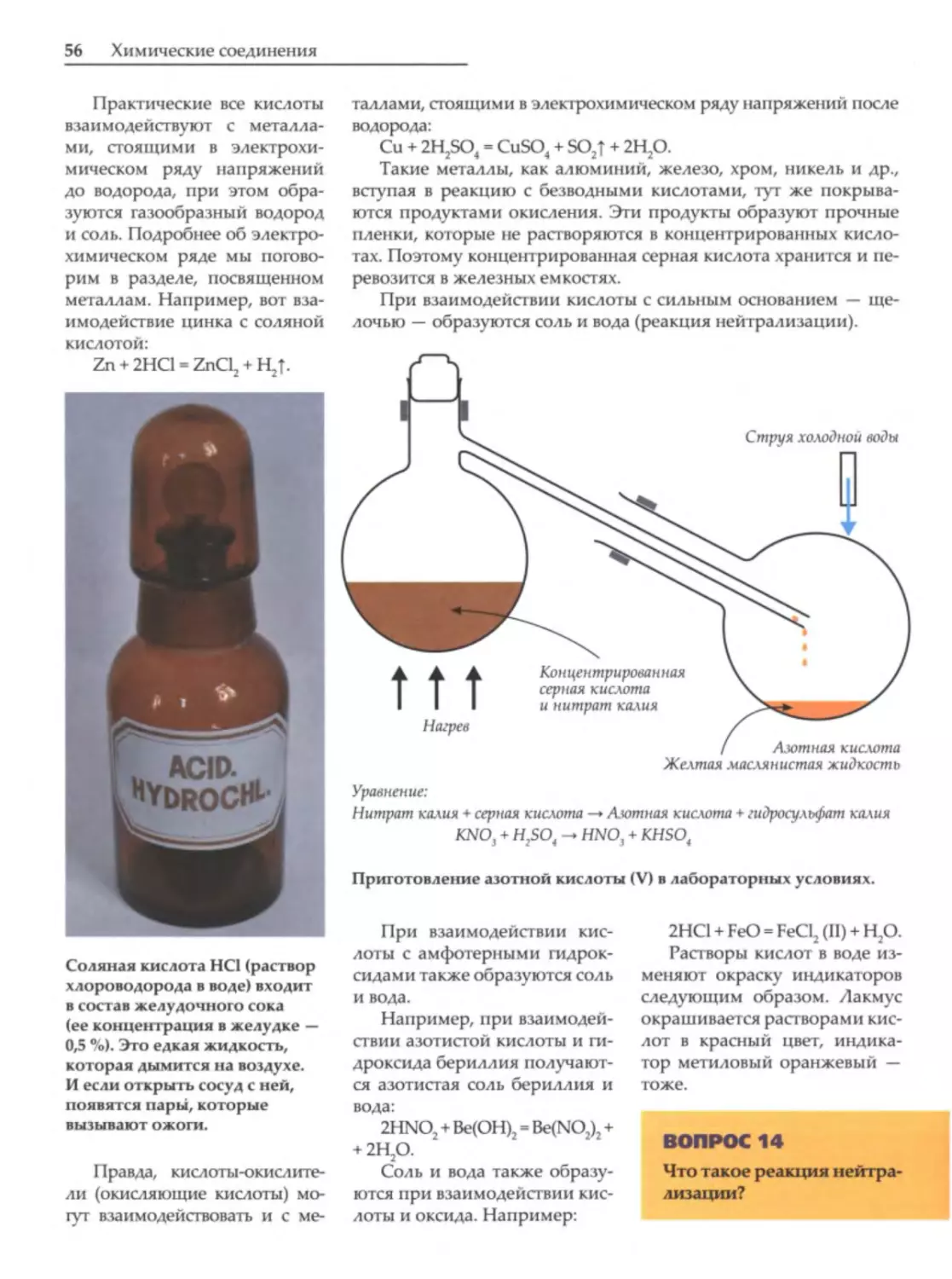
имическая формула
-
это обозначение
химического состава и структуры соеди
нений. Для нее используются символы
Различаются несколько видов химических
формул.
вспомогатель
Простейшую формулу можно получить опьп
ные знаки (тире, скобки, цифры и т. д.). Хими
ным путем, определив соотношение химических
ческие формулы
элементов в веществе и зная, каков атомный вес
химических элементов,
-
а также
неотъемлемая часть языка
химии. Именно с их помощью составляются
уравнения химических реакций, даются назва
ния химическим веществам.
элементов.
Истинную формулу получают, когда извест
на молекулярная масса вещества.
Например, простейшая формула воды Н 2 0
совпадает с истинной. Количество атомов водо
рода в два раза больше количества атомов кис
лорода, причем атом кислорода один. Поэтому
формула показывает и соотношение атомов, и
их количество.
А простейшая формула бензола СН отлича
ется от истинной С 6 Н 6 • Она показывает только
соотношение атомов. Истинная же формула
показывает
точное
количество
атомов
каждо
го элемента в одной молекуле. Это количество
указано в виде нижнего индекса
-
маленькой
цифры после символа соответствующего эле
мента. Если индекс равен
ВОПРОС
1, то его не указывают.
18
Чем простейшая формуАа отАичается от
истинной?
Чтобы определить формулу неизвестного
вещества, необходимо узнать его химический
состав.
ф
Химическая формула описывает одну моле
кулу (ион, радикал) или
1
моль определенного
вещества, показывая, из каких молекул оно со
н
стоит, сколько атомов каждого элемента содер
1
н,
жится в молекуле, ионе или радикале.
Например, формула
H 2S04 обозначает:
• 1 молекулу (1 моль) серной кислоты;
• качественный состав: молекула серной кис
н
•
тот факт, что молекула серной кислоты
серы и четырех атомов кислорода.
...
""С"'
1
с
1
с
,..н
'н
н
лоты состоит из водорода, серы и кислорода;
состоит из двух атомов водорода, одного атома
с
1
,..с
,с
Бензол
-
сложное ядовитое органическое
вещество, которое тем не менее используется
для производства лекарств, пластмасс,
красителей, резины.
Вещество и его состав
21
В химической формуле используются химические символы элементов и знаки связей между ними.
При записи формул некоторых органических молекул символ углерода не ставится
его наличие
-
и так очевидно.
В рациональных формулах отдельно изобра
жаются
группы
атомов,
которые
характерны
•рациональная формула: С 2 Н 5 0Н;
•структурная двумерная формула:
для классов химических соединений. Напри
н
н
мер, для спиртов это группа -ОН. При записи
1
1
рациональной формулы такие группы атомов
часто помещаются в круглые скобки
Квадратные
скобки
используют
-
при
(ОН).
записи
формул комплексных соединений. Например,
K3 [Co(CN) 6]
-
Н-С-С-0-Н
•
1
1
н
н
структурная трехмерная формула:
гексацианокобальтат калия.
Эмпирическими формулами называют как
истинные, так и простые и рациональные фор
мулы. В формуле Маркуша выделяются актив
ное ядро и различные варианты заместителей,
потому она обозначает целые классы веществ.
Особо интересна структурная формула. С ее
помощью показывают, как атомы располагают
ся в молекуле. Химические связи здесь обозна
чаются как линии (черточки). Имеются как дву
мерные, так и трехмерные формулы. Трехмер
ные
нагляднее
прочих
иллюстрируют
состав
вещества, взаимное расположение атомов, угол
связи и расстояние между ними.
Например, рассмотрим этанол:
Имеются также другие способы записи хи
•простейшая формула: С 2 Н 6 О;
мических формул. В компьютерах использу
•
истинная, эмпирическая, или брутто-фор
му ла: С 2 Н 60;
ются молекулярные редакторы
граммные средства.
-
особые про
Вещество и его состав
22
Химическая
CBR3b
х
имическая связь
-
это взаимодействие
атомов, обусловливающее устойчивость
молекулы
определяется
или
кристалла
взаимодействием
как
целого;
между
заря
Если
электроотрицательность
отличается
существенно, то один электрон полностью пе
реходит к другому атому и образуются два иона.
Так возникает ионная связь . Обычно это бывает
между атомами металла и неметалла. Напри
мер, как в молекуле поваренной соли
ВОПРОС
NaCl.
19
Что ВllИЯет на образование ковалентной
И11И ионной связи?
женными частицами (ядрами и электронами).
Молекула
-
мельчайшая частица вещества,
сохраняющая его химические свойства. Моле
электроотрицательность, то есть способность
оттягивать к себе электроны других атомов. Са
мая высокая степень электроотрицательности у
галогенов и сильных окислителей, например у
фтора, хлора, кислорода; самая низкая
-
•
Отрицательньzй заряд
кулы состоят из атомов. Атомам свойственна
Положительный заряд
Натрий
Ионная связь
(хлорид натрия)
+ •
•
у ак
тивных металлов. С электроотрицательностью
связано понятие химической связи. Если элек
троотрицательности у атомов равны, то обра
зуется ковалентная неполярная связь. У атомов
возникает общая электронная пара. Например,
как в молекуле водорода Н 2 • Если электроотри
цательность отличается не сильно, образуется
ковалентная полярная связь. Обычно это быва
ет между атомами неметаллов. Например, как
в молекуле воды Н20 или соляной кислоты
HCl.
Кислород
Ионная связь в кристалле поваренной соли.
Водород
+
Вода
Металлическую связь образуют свободные
электроны, расположенные между ионами ме
таллов,
формирующих кристаллическую ре
шетку. В металлическом типе связи понятия
молекулы
нет,
а
есть только
атомы
металлов,
В молекулах водорода и кислорода имеется
которые
ковалентная неполярная связь, а в молекуле
борот, и скопление электронов в межатомном
воды
-
ковалентная полярная.
постоянно
переходят
в
ионы
и
нао
пространстве. Между молекулами тоже возни
кают взаимодействия. Они бывают индукци
онными, ориентационными, дисперсионными .
Особый вид связей
-
водородные. Они возни
кают между молекулами или внутри молекул,
где
есть
Н-0,
В молекуле диоксида углерода (углекислого
газа)
-
ковалентная неполярная связь. Каждый
сильно
полярные
ковалентные
связи
H-F или H-N.
С чем же связана электроотрицательность
и способность отдавать и принимать электро
атом кислорода имеет общие электроны
ны? Она связана с электронными оболочками
с атомом углерода, находящимся в центре.
атомов. В каждой оболочке имеется определен-
Вещество и его состав
23
ное число электронов, и если она полностью занята,
то действие сил, которые простираются за ее пределы,
очень мало. В ближайшей к ядру оболочке (К-оболоч
ке) имеется два электрона (за исключением водорода).
Если электронов больше двух, образуются другие обо
лочки. Следующая, L-оболочка, рассчитана на восемь
электронов, и если их больше, то остальные должны
вращаться по еще более удаленным орбитам и фор
мировать М-оболочку.
Если для заполнения оболочки не хватает электро
нов, их расположение становится асимметричным, а
очень интенсивные силы проникают за пределы ато
ма, заставляя его отдавать «лишние» электроны и при
нимать «Недостающие». Так образуются молекулы.
В кристаllАической решетке металла
ВОПРОС20
нет понятия молекулы, а есть лишь
От чего зависит э11ектроотрицате11Ьность?
ядра атомов и вращающиеся вокруг них
электроны.
Чисnо
Авоrадро
3
КАК ОПРЕДЕЛИТЬ МОЛЬ?
Мол1, онре11,елип, 0•1е111, нросто. Надо сложи1ъ ато:\111ые мас
сы ':JЛе:\1е1пов, которые входит в химическую формулу. На-
11ример,
llO н,:\1ем серную кислоту н2sо,. АТО:\1JIЫЙ
1, ато:\111ый вес серы - 32, ато:\111ый вес
ро11,а равен
акон
Авогадро
гласит,
что в одинаковых объе
11,а -
16.
вес /Ю/1,О
кислоро-
311аи коли•1еспю атомов ·лих ;,лементов в молекуле
сер11ой кислоты, 11олучае:\1
l
х
2+32+16
х
4 = 98
1'/мол1"
мах идеальных газов при
одинаковом давлении и одина
ковой температуре содержит
как заряд электрона, массу ато
ся равное число молекул. Дру
ма или молекулы и др.
гими словами,
1
моль любого
Как
нимает один и тот же объем.
Моль
-
количество вещества,
единиц,
ко содержится в
углерода
12 С.
символом
12
опреде11Яется
Число Авогадро
и моль
-
наглядное
представление.
которое содержит столько же
структурных
сколь
Объем газа
(при нормальных
условиях)
г изотопа
(Число
углерода
12
перед
означает
атомный вес данного изотопа.)
Количество структурных еди
ниц в
1 моле
вещества называ
ется числом Авогадро. Струк
турные единицы
частицы:
-
атомы,
это любые
молекулы,
электроны, ионы и т. д.
Число Авогадро позволяет
определить
такие
величины,
21
мо11Ь вещества?
газа при одинаковом давлении
и одинаковой температуре за
ВОПРОС
Масса
Представленные частицы
(структурные единицы)
24
Вещество и его состав
Как же все это понимать?
Возьмем химическую реакцию,
элемента, который участвует в
следований итальянского хими
ка Амедео Авогадро. Он знал,
реакции.
Следовательно, в
г угле
что, когда между газю:и проте
нии дерева. Соединение угле
рода столько же атомов, сколь
кает химическая реакция, соот
рода древесины с
ко в
16 г кислорода. Именно это
ношение между объемами га
которая происходит при горе
кислородом
12
воздуха дает двуокись углерода
количество
и
зов равно соотношению между
СО2 • У одного атома углерода
называют молем. Если принять
количеством их молекул. Так,
ато
относительную атомную массу
когда
мов водорода, а у двух атомов
вещества зап (иными словами,
(Н2) воупают в реакцию с од
его атом в п раз тяжелее атома
ной молекулой азота
зуются две молекулы аммиака
12
такая же масса, как у
кислорода
-
как у
32
атомов
атомов
химики
три
молекулы
водорода
(N2), обра
водорода. Следовательно, соот
водорода), то массу
ношение участвующих в реак
го
ции масс углерода и кислорода
как п г. Моль
всегда будет составлять
ства вещества, как пара, десяток
в три раза больше объема азо
неиз
или сотня. Сапог в паре всегда
та. Авогадро пришел к выводу,
менным при любых единицах
два, яиц в десятке всегда десять,
что количество молекул в обоих
и в моле вещества всегда одно
объемах находится в соотноше
и то же количество атомов, ио
нии
нов или молекул.
мах газа содержится равное ко
Соотношение
измерения:
остается
12
г углерода всег
да реагируют с
12
-
ц углерода
12 : 32.
32
с
г кислорода,
32
ц кисло
рода и т. д. В химических реак
циях главное
количество
-
относительное
атомов
каждого
вещества
1 моля это
следует
-
принять
мера количе
Но как ученые к этому при
шли?
Атомы
ведь
сосчитать
очень сложно. Все началось с ис-
(Nf1з), а объем участвующего в
реакции водорода
оказывается
3 : 1. То есть в равных объе
личество атомов
или молекул.
Эго и есть известный сегодня
закон Авогадро.
Согласно закону Авогадро,
в равных объемах различных
газов, взятых при одинаковых
Во время горения костра для каждого атома углерода дров и
температуре и давлении,
хвороста находятся два атома кислорода воздуха, и их массы
содержится одинаковое
относятся друг к другу как
12 : 32.
количество молекул.
25
Вещество и его состав
OTBETbl
1.
11.
Орrаническая химия изучает соединения
yrлерода
с водородом, кислородом, азотом,
Название электронноrо семейства зави
сит от тоrо, какой уровень в атоме заполня
ется последним.
d-элементы находятся в таблице Менде
фосфором.
12.
2. Аналитическая химия использует количе
леева между
ственный и качественный анализ.
называют переходными.
3. Кипение воды -
13.
это физическое явление,
и р-элементами, поэтому их
Самый распространенный элемент во
Вселенной - водород.
14. Больше всеrо в организме человека воды.
15. Нет, элементы острова стабИ11ьности еще
а разложение ее на водород и кислород
химическое.
4. Атом электрически нейтрален.
5. Нейтронов нет в ядре у водорода.
6. Уrлерод - химический элемент;
s-
не открыты и не синтезированы.
кисло
16. Медь не имеет молеку11Ярной структуры,
родом называют и химический элемент, и
она состоит из атомов и электронов и явля
вещество; уrоль
-
вещество, состоящее из
ется макротелом.
уrлерода.
17.
7.
изменении расположения
Для правИ11ьноrо составления таблицы
химических элементов прежде всеrо необ
18.
Да, свойства соединения меняются при
ero атомов.
Простейшая формула показывает то11Ько
-
ходимо бЬ11lо знать их правИ11Ьные атомные
соотношение атомов в молекуле, а истинная
веса, друrие свойства, а также достаточное
точное коllИЧество каждоrо вида атомов в ней.
их количество.
19.
8.
Пустые места в таб1lИЦе Менделеева оста
лись
потому,
ствование
что
еще
не
он
предположИll
открытых
суще
элементов
и
предсказал их свойства.
ионной
ность
-
20.
но расположение электрона.
21.
Чем больше у элемента валентных элек
тронов, тем леrче он их приобретает.
связи
влияет
ковалентной
ИllИ
электроотрицатель
способность атомов оттягивать на
Электроотрицательность зависит от со
стояния
10.
возникновение
себя электроны.
- это область про
странства вокруr ядра, r де наиболее вероят
9.
Атомная орбиталь
На
внешней электронной оболочки
атома.
Чтобы определить моль вещества, надо
сложить атомные массы элементов, состав
ляющих
ero молекулу.
26
Химические реакции
ХИМИЧ:ЕСКИ:Е Р:ЕАКЦИИ
Что такое химические реакции
и как они nроисход•т?
х
имическая реакция представляет собой
мов, и изотопный состав остаются прежними.
превращение
нескольких
Однако изменяется электронная оболочка, при
одного
или
веществ (которые называют также реа
этом образуются новые вещества, то есть новые
гентами) в другие вещества. Если при ядерной
молекулы. В физических процессах, в отличие
реакции
ядер
от химических, сохраняется неизменным состав
атомов и появляются новые атомы, то химиче
вещества, хотя может изменяться форма или
ская реакция обходится без этого. И ядра ато-
агрегатное состояние .
происходит
изменение
состава
При химических реакциях
возникают различные
внешние эффекты: меняется
цвет реагентов, происходит
интенсивное испарение,
реагенты нагреваются и11и
охлаждаются, а может даже
произойти взрыв. Поэтому
с реактивами надо быть очень
осторожными.
Для
химической
реакции
нужны различные условия. Так,
она может произойти самопро
извольно,
при
смешении
реа
гентов. Или же для нее необхо
димы нагревание,
катализатора,
присутствие
солнечный
или
искусственный свет, электриче
ский ток, механическое воздей
ствие, действие плазмы и мно
гие другие условия. Молекулы
взаимодействуют так:
ассоциируют
сначала
(объединяются),
потом происходят обмен элек
тронами и диссоциация. Ак
тивными
ляются
частицами
ионы,
здесь
радикалы
и
яв
ко
ординационно-ненасыщенные
соединения.
Если в резуль тате взаимо
действия молекул или других
частиц образуется какой-либо
Иногда для проведения
химической реакции нужно
очень ма110 реагента.
Химические реакции
продукт,
такая
реакция
называется
простой.
Если для появления конечного продукта нужны
промежуточные продукты, такая реакция назы
вается сложной.
Если химические реакции происходят в пре
делах одной фазы (например, в жидкости), тогда
27
Окисnитеnьно
восстановитеnьные
реакции
они называются гомогенными; если на границе
раздела фаз (например, на твердом теле, погру
женном в жидкость)
гетерогенными. Гетеро
-
в
окислительно-восстановительных реакци
ях один
другой
генные реакции происходят между раствором
-
элемент является
окислителем,
восстановителем.
и газообразным веществом, между твердым ве
Окислителем является атом (молекула или
ществом и раствором, между газообразным и
ион), принимающий электроны. Сам он при
твердым веществами . Если у реакции имеется
этом
много стадий и одни из них гомогенные, другие
пень окисления и приобретает отрицательный
гетерогенные, то она
называется гомогенно-ге
терогенной.
восстанавливается,
заряд,
так
как
понижает
электроны
свою
заряжены
сте
отрица
тельно. Восстановителем является атом (моле
кула или ион), отдающий электроны . Сам он
при
О&РАТИМЫЕ И НЕО&РАТИМЫЕ
РЕАКЦИИ
Реакции
окисляется,
повышает
бывают
также
обратимыми
Необратимые
образованием
и
реакции
степень
какого-либо
протонов становится больше, чем число отри
цательно заряженных электронов.
Пример окислительно-восстановительной ре
вещества, например ::по реакции горении
акции
или ра :ыожение бертолетовой соли при
тель) с образованием воды:
2KCI + 30 2•
Необратимых
горение водорода в кислороде (окисли
-
2Н 2
нагревании:
2КС10 3 ~
свою
ряд, так как число положительно заряженных
необратимыми.
завершаются
этом
окисления и приобретает положительный за
+02
~ 2Н 2 0.
Водород здесь отдает свои электроны ато
реакций
много.
му кислорода и приобретает положительный
Б6лыпаи часть химических реакций об
заряд, он является восстановителем . Степень
ратимые. Это :и1ачит, что они нроисходит
окисления водорода
одновременно
мает электроны и приобретает отрицательный
в
двух
не
так
нротивоположпых
- +1 . Кислород же
прини
напраплениих. В уравнениих таких реак
заряд, он является окислителем. Степень окис
ций знак равенства заме1шетси двуми 11ро
ления кислорода равна
тивополож110 направле1111ыми стрелками:
зн 2
+ N2;::::: 2NH,.
ВОПРОС
2
Чем является кис
ВОПРОС
лород
1
в
реакции
образования ВОДЬI?
Приведите пример необратимой химиче
ской реакции.
,,.
•
При нагревании
проходят многие
•
окислительно
восстановительные
реакции.
Бертолетова соль открыта химиком Луи
Бертолле в
1786 г.
Это ядовитое вещество входит
в состав спичечных головок.
-2.
Химические реакции
28
К окислительно-восстановительным
относятся
реакции
также
контрпропорционирова
ния . В них атомы одного и того же элемента, ко
торые находятся в разных степенях окисления,
становятся окислителями и восстановителями.
Такой реакцией, например, является разло
жение нитрата аммония
NH 4N0 3
при нагрева
нии.
Для определения степеней окисления азота
запомним
степени
окисления водорода
и
кис
лорода и рассмотрим нитрат аммония как два
иона
- NH 4+ и N03- . Сумма степеней окисления
всех элементов равняется нулю, если это ней
тральная частица, или же заряду иона, если это
ион .
Значит, для иона
откуда х =
-3.
NH4+ сумма: х + 4 х (+1) = +1,
Это степень окисления первого
атома азота.
Для иона
да х
N0 3-
сумма: х
+3
х
отку
Контейнер для хранения аммиачной селитры
= +5. Это степень окисления второго атома
нитрата аммония. Это вещество используется
(-2)
=
-1,
и в качестве удобрения, и для производства
азота .
При разложении азот приобретает степень
окисления
-
+1.
Это рассчитать еще проще: моле
кула оксида азота, или веселящего газа, как его
еще называют, нейтральна. Степень окисления
кислорода равна
одного атома
взрывчатки.
-2, значит,
азота - +1.
степень окисления
ПРОТОНЫ В ХИМИЧЕСКИХ
РЕАКЦИЯХ
Окис 11ителы10-посста11овителы1ые
ции
называют
еще
реакцинми
чей ~лектрона. Это привычно,
с
реак
переда
110 есrъ е1це
реакции с 11ереда•1ей нротона, или
лотно-ос11ош1ые. Протон
ндро
при
химических
-
реакцинх
не
1шетси. Но в данном случае 11рото11
просто
споен>
ио11
водорода,
вед••,
в
и 1ч>о,
изме-
-
~то
лишившис1,
еди11стве1111ого ~лектрона,
вращаетсн
кис
час1ъ идра, а
состошцее
011
и :~
пре
одного
прото11а.
Вот одна из таких реакций, где солш~аи
кислота
лей
-
в .ыимодейстнует с одной
нитратом калии. При ~том образу
кислота азотнаи
- хлорид калии:
HCI + KN0 2 = KCI + HN0 2 •
етси
и :~ со
1'ру1 · м1
и
дру1 · аи
сол1.
Молекула нитрата аммония. Азот обозначен
синим цветом, водород
-
белым, кислород
-
красным.
ВОПРОС3
При химических реакциях не происходит
Иными словами, первый атом азота отдает
изменений в ядре, состоящем из протонов
четыре электрона и является восстановителем,
и нейтронов. Однако все же существуют
второй принимает шесть электронов и является
такие реакции, при которых передается
окислителем :
протон. Что это за протон?
NH4N0 3 ~ N 20 j + 2Н 2 0.
Химические реакции
29
Нитрат калия называют также индийской
селитрой, потому что богатые месторождения
этого вещества находятся в Индии. Эту соль
используют как удобрение, в пиротехнике,
а раньше применяли и для производства
черного (дымного) пороха.
Вь1деnение и nоrnощение тenna
nри химических реакциях
n
ри всех химических реакциях происхо
можно всегда рассчитать, сколько тепла выделит
дят
ся при сгорании разного количества углерода.
поглощение
Когда
и
выделение
химические
связи
энергии.
разрываются,
выделяется энергия. Благодаря ей образуются
новые химические связи. Если энергии процес
Реакция окисления азота идет с поглощени
ем тепла и является эндотермической:
N 2 + 0 2 = 2NO - 180,8 кДж.
сов близки, то тепловой эффект реакции при
ближается к нулю. Если энергии выделяется
больше, чем поглощается, то во время реакции
выделяется тепло, и она называется экзотерми
ческой (от «ЭКЗО»
выделяется
-
меньше,
«Внешний»). Если энергии
чем
поглощается,
называется эндотермической (от «ЭНДО»
то
-
она
«вну
тренний»). При этом тепло поглощается.
Поглощение и выделение тепла выражаются
при помощи термохимических уравнений. Те
пловой эффект реакции называется энтальпией .
Электростанции, работающие на угле,
выделяют в атмосферу продукт его сгорания
-
углекислый газ, или оксид углерода.
Горящий уголь дает много тепла.
ВОПРОС4
Например,
реакция
горения
углерода,
а
Вычислите,
сколько сгорело
проще говоря, угля, идет с выделением тепла и
при этом выделилось
является экзотермической:
ТеПllовой
с
+ 02 = со2 + 402
Значит, при сгорании
ляется
402
1
коэффициент
ния углерода равен
кДж.
моля углерода выде
кДж тепла. Благодаря этой реакции
углерода
33 520
- 12.
угля,
если
кДж теПllа.
реакции
горе
402 кДж. Атомный вес
30
Химические реакции
Тиnь1 nревращения
реаrиру1О1.qих 11астиq
n
При
типам
превращения
реагирующих
частиц
(атомов,
ионов, молекул) выделяют несколько типов реакций.
Реакции соединения
-
это реакции, при которых из двух
замещения
гое из его соединения. Напри
мер, в реакции
~
о
реакции
одно вещество вытесняет дру
FeS04 + Cu
Fe + CuS04
~
железо вытесня
ет медь из ее сульфата.
При
ходные
реакции
вещества
обмена
ис
обменива
или нескольких простых либо менее сложных веществ образует
ются своими частями. К при
ся более сложное вещество . К таким реакциям относится горе
меру,
ние, а также образование самых разных веществ, например из
соляная кислота дают хлорид
вестной всем соды, или карбоната натрия:
натрия и воду:
Na20 + со2 = Nа2СОЗ.
гидроксид
натрия
и
NaOH + HCl = NaCl + Н 2 О.
Для правильного проведения
химических реакций нужны
определенные температура,
давление, и, что самое главное,
реагенты должны быть
чистыми и защищенными
от окружающей среды.
И, конечно, самим нужно
защищаться от этих реагентов,
если они токсичны.
Реакции разложения
-
это такие реакции, при которых из
сложного вещества получаются хотя бы два менее сложных либо
простых вещества. Такой реакцией, например, является разло
жение оксида серебра на серебро и кислород:
2Ag20 = 4Ag + 0 2 •
ВОПРОСS
По каким признакам мож
но распознать химическую
Разнообразные химические реакции приводят к превращению
одних веществ в другие.
реакцию?
Химические реакции
Что такое
катаnизаторь1?
Mn02,
31
то перекись начинает ра злагаться с обра
зованием воды и кислорода:
Н2 02
= Н 20 + 0 2 •
Таким обра зом, диоксид марганца
-
ката
лизатор данной реакции. Именно катал изатор,
а не инициатор!
х
имические реакции бывают каталити
ческими и некаталитическими. Катали
тическими называют реакции,
происходят
только
в
присутствии
ВОПРОС&
которые
Катализатор ускоряет И11И инициирует
катализа
торов. Такими бывают реакции соединения и
разложения, а некаталитическими
-
химическую реащию?
реакции
обмена и замещения .
Что же такое катализатор? Это химическое
Катализаторами являются также многие ме
вещество, которое ускоряет реакцию, но не вхо
таллы -
дит в состав продуктов реакции .
используются в выхлопных устройствах автомо
Например, 3%-ный раствор перекиси водо
платина, родий, палладий, золото. Они
билей, для того чтобы нейтрализовать вредные
рода Н 2 0 2, повсеместно продающийся в апте
выбросы. Например, в присутствии платины
ках,
устойчивое вещество. Но если добавить
ядовитый угарный газ СО превращается в угле
к нему несколько крупинок диоксида марганца
кислый газ СО 2 • Разумеется, ученые стремятся
-
заменить дорогие металлы более дешевыми .
Газообразный
кислород
Раствор
перекиси
водорода
Резервуар
с водои
Порошок
оксида
м арганца
В выхлопных устройствах автомобилей
Мn02
Уравн ени е:
Перекись водорода
Ката.лизатор
2нр 2
используются катализаторы из драгоценных
Вода
+ Кислород
металлов.
2нр+о 2
Получение кислорода в лаборатории
ВОПРОС
с помощью катализатора.
7
Д11Я чего в автомобиле используют IL'laпmy?
Превращения этанола в другие вещества с помощью различных катализаторов.
Катализатор
Этанол (С 2 НрН)
Ацетальдегид (СН 3 СНО)
Си
f------1_.-
Этан (С 2 Н 4
А1 2 0 3
f------1-.-
Бутадиен
-------------1.f------1_.-
:-
+ Нр)
(С 4 Н 6 + Нр + Н 2 )
Ацетон (СН 3 СОСН 3
Этиловый эфир (СН 3 СООС 2 Н 5
Си/Сrр 3
+ Н2 )
Си/Се
+ Н 2 + СО)
Ni
(C 4HgOH + Нр)
Na
Метан (СН 4
Бутанол
Alp/ ZnO
+ Нр + Н)
Химические реакции
32
В живой природе катализаторами являются
ферменты, без которых были бы невозможны
деление клеток, синтез белка, переваривание
пищи.
Поэтому можно с уверенностью сказать: без
катализаторов не просто многие реакции шли
бы медленнее
-
некоторые вообще были бы не
возможны и на Земле не появилась бы жизнь.
Це1111ю11аза
-
фермент, расщепляющий
це1111ю11озу.
OTBETbl
обмен не только электронами, но и ионами.
402 кДж тепла. Молярная масса углерода рав
на 12 г/моль. Составим пропорцию. 402 кДж
выделяется при сгорании 12 г углерода;
33 520 кДж выделяется при сгорании х г угле
рода: х = 33 520 х 12/402 = 1000,59 г. Следователь
но, сгорел приблизительно 1 кг угля.
5. Химическую реакцию можно распознать
Одним из таких ионов является ион водоро
по изменению цвета, запаха, выделению или
1. Необратимой химической реакцией явля
ется горение.
2. Кислород в реакции образования воды яв
ляется окислителем.
3.
При химических реакциях происходит
да. А поскольку в атоме водорода имеется
поглощению тепла, появлению осадка.
только один электрон
6. Катализатор только ускоряет химическую
и
один протон, то,
потеряв электрон, ион водорода превраща
реакцию.
ется в один протон.
7.
4.
С
+ 0 2 = СО2 + 402
кДж. По уравнению реак
ции при сгорании 1 моля углерода выделяется
Платина в выхлопном устройстве автомо
биля является катализатором при превра
щении вредных веществ в безвредные.
Растворы
РАСТВОРЬI
ВОПРОС
33
1
Что такое перемеlПIЬIЙ сос
тав раствора?
Что такое растворь1?
3
начение растворов для химии невозможно переоценить.
Огромное количество химических реакций ~:роисход~т в
растворах, а растворимость
-
одно из важнеиших своиств
вещества. Растворы изучает физическая химия. Раствор
-
это го
могенная, то есть однородная смесь переменного состава, кото
рая состоит из растворителя, растворенного вещества и продук
тов, получившихся в результате их взаимодействия. При этом
каждый из компонентов распределяется в массе другого в виде
молекул, ионов или атомов.
Растворы солей имеют
различные цвета в зависимости
от содержания составляющих
их ионов.
Растворитель отличается от
растворенного
что
его
вещества
агрегатное
тем,
состояние
при образовании раствора не
изменяется. Обычно речь идет
о
растворе
твердого
в
жидкости,
тогда
вещества
жидкость
и есть растворитель. Если же
смешивается газ с газом, жид
Самый распространенный раствор на Земле
-
это морская вода.
Она содержит практически все элементы таблицы Менделеева,
но большая часть
-
это натрий и хлор. Присутствуют также
магний, кальций и др. В каждом литре морской воды растворено
примерно
35 г солей, гдавным образом это хлорид натрия -
кость
с
жидкостью,
вещество
с
твердым,
твердое
то
рас
творителем является тот ком
понент,
количество
которого
преобладает.
поваренная соль.
Под переменным составом раствора понимается следующее :
ВОПРОСZ
соотношение веществ, смешанных друг с другом, способно в
Чем
определенных пределах непрерывно изменяться. Раствор соли
ритель от растворенноrо
можно упаривать или разбавлять водой, но жидкости, получен
вещества?
ные при этом, все равно будут называться растворами соли.
отlJ.ИЧается
раство
Растворы
34
Образование раствора свя
гидратации образуются гидра
выделяется в виде тепла. Так,
меж
ты. Кристаллогидратами назы
при
атомного, межмолекулярного
ваются кристаллы, в состав ко
дроксида натрия
или
торых входят молекулы воды
зано
с
интенсивностью
межионного
ствия
частиц
Процесс
взаимодей
разных
веществ.
взаимодействия
творяемого
вещества
с
называется
гидратацией,
рас
водой
-
растворении
твердого
ги
NaOH раствор
сильно разогревается. Но если
такая вода носит название кри
для
сталлизационной. Образование
ской решетки расходуется боль
водородных
ше энергии, чем выделяется при
и
других
связей
разрушения
кристалличе
что
энергетически выгодно, и пото
образовании гидратов, то рас
является частным случаем соль
му гидратация сопровождается
твор сильно охладится. Так про
выделением энергии. Ее часть
исходит,
ватации
тиц
-
взаимодействия час
растворенного
вещества
с
частицами растворителя. При
идет
на
разрушение
кристал
лической решетки, а избыток
например,
при
раст
ворении в воде твердого нитра
та аммония
NH4N03 •
При исследовании растворов их нагревают или охлаждают.
ВОПРОСЗ
Когда
при
растворении
выде11Яется тепло, а когда
раствор охлаждается?
В газированных напитках
содержится оксид углерода,
и при активном встряхивании
происходит выделение газа
из раствора.
Растворы
Таким
в
образом,
растворе находится
состоянии
-
35
вещество
ример раствор соли в воде или
ром,
в новом
золота в ртути. Но в химиче
мии это раствором не является.
ской практике растворы
в виде гидратов.
-
хотя
с
точки
зрения
хи
это
Значит, растворение не только
гомогенные системы, в которых
физический, но и химический
растворитель бывает жидким,
ВОПРОС4
процесс.
твердым
Бывают ли растворы твер
В быту раствором называют
только жидкое
вещество,
или
газообразным.
Смесь цемента с водой и пе
нап-
ском
тоже
называют
раство-
Растворение
представляет собой переход молекул веще
р астворение
ства из одной фазы в друтую. К нему приводит взаимо
действие частиц (атомов, ионов, молекул) растворителя с
частицами растворенного вещества. При растворении твердых
веществ энтропия системы увеличивается, при растворении га
зов
-
уменьшается. Граница между фазами (например, твердой
и жидкой) исчезает, меняются многие физические параметры:
вязкость, плотность, моrут изменяться цвет, вкус. Например,
вода, куда добавлены кристаллы соли или сахара, становится
соленой или сладкой; если добавить в воду кристаллы марган
цовки (перманганата калия), она приобретает малиновый цвет.
Перманганат калия
KMn04,
привычная всем марганцовка,
в твердом виде темно-фиолетовый, почти черный.
Растворяясь в воде, он придает ей фиолетовый цвет,
а в разбавленных растворах
-
малиновый. Разбавленный
раствор быстро разлагается, оставляя бурый осадок диоксида
марганца. Недаром марганцовку прозвали хамелеоном.
ДЬIМИ?
36
Растворы
Образование раствора за
висит
от
растворимости
-
щества. Растворимость
ве
это
растворяется менее
в
раствор
0,01
1
переходит
г. Если
меньше
г вещества, то оно назы
способность вещества раство
вается нерастворимым. Одна
ряться
ко полностью нерастворимых
в
одном
растворителе.
римости
или
Мера
вещества
-
в
другом
раство
веществ не бывает. Если воду
данных
налить в стеклянный стакан,
содержание
то она, пусть очень слабо, но
в насыщенном растворе. Рас
растворяет стекло, и часть его
творимость, выраженную при
молекул переходит в воду.
условиях
помощи
массы
вещества,
ко
в
Любое вещество переводит
г воды при данной темпе
свои молекулы в раствор.
торое
100
его
может
раствориться
ратуре, называют коэффици
ентом
шо
растворимости.
растворимым
вещество, если в
Хоро
называют
100
г воды
его растворяется более
10
г.
Малорастворимым называет
ся вещество, если в
100
г воды
ВОПРОС5
Бывают 11и по11ностью
нерастворимые
тва?
вещес
Растворы
37
Растворь1 в зависимости
от концентрации
астворы в зависимости от концентрации
р носят
разные названия и обладают раз
личными свойствами.
не может. Его осадок находится с веществом в
растворе в равновесном состоянии . Дело в том,
что
молекулы
вещества
не
только
отрывают
Ненасыщенным называется раствор, в кото
ся от кристалла, но и присоединяются к нему.
ром при данных условиях можно растворить еще
Пока кристаллов немного, в раствор переходит
какое-то количество растворенного вещества.
больше молекул, чем возвращается. Но если
кристаллов много, то количество покидающих
его
Насыщенный
раст вор
и
возвращающихся
молекул
становится
одинаковым и растворение прекращается . Та
кой раствор называется насыщенным. Так, при
комнатной температуре нельзя растворить
100
г воды больше
200
в
г сахара. Подобную си
туацию на з ывают динамическим равновесием,
или равновесием в движении.
Ва 2 +
\\ //
Осадок соли
ВОПРОС&
Что такое динамическое равновесие?
BaS04
В насыщенном растворе мо11еку 11ы и ионы
находятся в динамическом равновесии.
В пересыщенном (перенасыщенном) раство
ре при данных условиях находится больше рас
творенного вещества, чем в насыщенном . Избы
ток вещества выпадает в осадок. Пересыщенный
В насыщенном растворе растворенное ве
раствор обычно можно получить с помощью
щество при данных условиях пребывает в наи
охлаждения раствора, который был насыщен
большей концентрации и больше растворяться
при более высокой температуре.
-
+
Твердое вещество
Жидкость
Концентрированный раствор далеко не всегда бывает насыщенным.
Раствор
38
Растворы
рас
Растворы бывают не только
твор вовсе не обязательно яв
жидкими, но и твердыми. На
ляется
раз
пример, водород растворяется
Концентрированный
насыщенным,
а
ненасыщенным.
в платине. А вот смеси газов,
Эти понятия друг с другом не
тот же воздух, не называют рас
связаны. Например, 4М очень
твором, потому что их частицы
концентрированный
бавленный
-
раствор
практически не взаимодейству
бромида калия не является на
ют друт с друтом. А заметное
сыщенным, а О,0000134М очень
взаимодействие между части
разбавленный раствор хлори
цами
да серебра
ренных веществ
-
насыщенный .
растворителя
-
и
раство
важное свой
ство раствора.
В концентрированном
ВОПРОС7
растворе содержание
растворенного вещества
высокое, в разбавленном
Может лиразбавлеННЬIЙ рас
-
твор бЬIТЬ насьпцеННЬIМ?
низкое.
Дисnерсные
размеры частиц последней лежат в пределах от
1
до
100
растворы
средь~
нм . По размерам частиц коллоидные
-
промежуточные между истинными
растворами, суспензиями и эмульсиями. Колло
идные частицы обычно состоят из большого чис
ла молекул или ионов. Их изучает коллоидная
химия.
В коллоидном растворе имеются мельчай
д
исперсная система -
это система, об
шие крупинки или капельки жидкости, состоя
разованная из двух или более фаз, кото
щие из большого количества молекул в раство
рые практически
рителе (в данном случае
не смешиваются и не
-
в дисперсной фазе); в
реагируют друт с друтом химически. При двух
истинных растворах в растворителе имеются от
фазной системе первое вещество
дисперсная
дельные молекулы или ионы. Для коллоидных
-
распределено в дисперсионной среде.
растворов характерен эффект Тиндаля, при ко
Дисперсные системы бывают различными. При
тором свет рассеивается коллоидными частица
мером системы, где дисперсной фазой является
ми. Если пропустить через золь пучок света, то
фаза
-
жидкость, а дисперсионной средой
-
газ, слу
появляется светлый конус, видимый в затемнен
жат аэрозоли (облака и туманы) . Коллоидные
ном помещении. Так можно распознать, являет
растворы (золи)
ся данный раствор коллоидным или истинным.
-
это высокодисперсные двух
фазные системы, состоящие из дисперсионной
среды и дисперсной фазы, причем линейные
Облака и тучи
-
это дисперсные системы
(аэрозоли).
39
Растворы
ная фаза подвижна, и связно
ВОПРОС В
дисперсными, когда дисперси
Чем зоllЬ отличается от
онная среда твердая и частицы
rеМ1?
дисперсной фазы не моrуг пе
ремещаться свободно.
Если
частицы
дисперс
ной фазы одинаковые, такие
Если дисперсная фаза га
системы
называют
монодис
зообразная, а дисперсионная
персными, если разные
среда жидкая, мы имеем дело
лидисперсными .
с пеной. Когда обе дисперсные
реальные
фазы жидкие
мы,
-
это эмуль
сия. Эмульсиями являются и
нефть, и кремы.
Почва
-
пример капиллярной
дисперсной системы.
Примерами дисперсной си
В
по
основном
дисперсн~1е
окружающие
-
нас,
систе
поли
дисперсны.
ВОПРОС9
стемы, когда и дисперсная фаза,
Приведите пример ко11110-
и
идноrо
дисперсионная
среда
твер
дые, являются бетон и сплавы .
раствора
в
атмо
сфере.
Двухфазные дисперсные си
стемы бывают также свободно
дисперсными,
Обычный крем для рук
-
пример эмульсии.
Твердая
при
среде
дисперсная
жидкой
-
фаза
дисперсионной
суспензия.
Это
ил,
взвесь, паста. Жидкая дисперс
ная фаза и твердая дисперси
онная среда
-
это капилляр
ная система, то есть заполнен
ное жидкостью пористое тело,
например почва.
когда
дисперс-
Бетон
-
твердая дисперсная
система.
Растворы
40
ВОПРОС
10
Что придает молоку свойства ко111lоидно
rо раствора?
Коллоидные системы имеют огромное зна
чение в биологии и в жизни человека. Многие
вещества
в
человеческом
организме
находятся
в коллоидном состоянии. Коллоидные раство
ры
-
это нервные и мышечные клетки, кровь и
другие биологические жидкости. Плазма крови
также представляет собой дисперсионную среду.
Кровь
-
дисперсная система, где клетки
взвешены в плазме.
ДиссоqиаqиА
и константа
равновесия
соотношение
трациям и,
между
или
же
концен
парциаль
ными давлениями, ил и термо
динамическими активностями
исходных веществ и продуктов
реакции в
ского
состоянии хим иче
равновесия.
Константа
диссоциации представляет со
бой вид константы равновесия,
с
ильное физико-химическое вз~имодействие при растворе
которая
нии приводит к тому, что своиства растворов значител ьно
ность объекта диссоциировать
изменяются. Эги явления изучает химическая теория рас
характери зует
склон
(разделяться) обратимым об
творов. При изучении скорости химической реакции использу
разом
ется так называемая константа равновесия. Эго отношение кон
когда комплекс распадается на
стант скоростей прямой и обратной реакций. Она определяет
составляющие молекул ы .
на
частицы,
например
Растворы
&ЫВАЮТ ЛИ ИДЕАЛЬНЫЕ
ЭЛЕКТРОЛИТЫ
РАСТВОРЫ И ГАЗЫ?
Идеа11ьный раствор
в
котором
между
-
Электро 11иты
это такой раствор,
отсутствует
взаимодействие
вещества,
которые
или водных растворах. В растворах они
диссоциируют на ионы. Диссоциация во
это такой газ, между мо-
лярные элементы или ионы. Неэ11ектро
состав11яющих
его
обще
-
это
-
проводят электрический ток в расплавах
ве
частицами
ществ.
Идеальный газ
41
-
это распад вещества на молеку
11еку лами которого отсутствуют силы вза
литы
Иl\111ого притяжения, молеку ilЫ считают
дных растворах на ионы не диссоциируют
ся материальными точками, а взаимодей
и потому электрический ток не проводят.
вещества, мо 11еку лы которых в во
ствия их сводятся к абсолютно упругим
Кислоты, основания и почти все соли яв
ударам.
ляются электролитами; большинство ор
Однако эти понятия применяются для
ганических соединений, а также вещества
удобства и расчетов, в природе таких иде
с ковалентными неполярными и малопо
альных сред просто нет.
лярными связями
Величина константы равновесия зависит от
-
неэлектролиты.
ВОПРОС12
природы реагирующих веществ и температуры
Почему э11ектро11иты проводят э11ектри
и не зависит от концентрации в момент равно
ческий ток?
весия, поскольку их отношение всегда величина
постоянная, численно равная константе равно
весия. Если гомогенная реакция идет между ве
ществами в растворе, то константа равновесия
обозначается как Кс, а если между газами, то
Kr.
Индикаторь1
с
лова « Индикатор » происходит от латин
ского
indicator -
но, индикаторы
«указатель». Действитель
-
органические вещества
сложной природы, с помощью которых можно
отслеживать состав среды или протекание хими
ческой реакции. Среда любого водного раствора
Раст вор хлорида натрия
характеризуется
содержанием
ионов
водорода
н+ или гидроксид-ионов он-. у водных раство
ров бывают нейтральная, щелочная и кислотная
Криста.л.лы
хлорида
Кис.лая среда
натрия
1
Процесс диссоциации
Гидратированный
катион
Na+
Нейтральная среда
1
Щелочная среда
1
Гидратированный
анион
cz-
Диссоциация хлорида натрия в воде.
ВОПРОС
11
Что представ11яет собой диссоциация?
Красно-оранжевый
Желтый
Желтый
Индикатор метиловый оранжевый в разных
средах.
42
Растворы
среды. В нейтральной среде число ионов водо
рода равно числу гидроксид-ионов. В кислотной
ВОПРОС
среде число ионов водорода больше числа ги
От чеrо зависит строение мо11еку11 инди
дроксид-ионов . В щелочной среде число ионов
катора?
13
водорода меньше числа гидроксид-ионов.
Пожалуй, самыми распространенными яв
ляются
кислотно-основные
няющие
цвет
согласно
индикаторы,
кислотности
изме
раствора.
Кислотностью называется показатель активно
сти ионов водорода в растворе. От кислотности
зависит строение молекул индикатора. Напри
мер, фенолфталеин в слабой и средней кислой
среде
представляет
собой
недиссоциирован
ные молекулы, и раствор остается бесцветным.
Правда, в концентрированной серной кислоте
он дает красную окраску, поскольку в ней при
сутствует катион фенолфталеина. В щелочной
среде раствор приобретает малиновый цвет,
потому
анионы
что
там
присутствуют
фенолфталеина.
В
однозарядные
сильнощелочной
среде образуются трехзарядные анионы фенол
фталеина, которые обесцвечивают раствор.
Разному водородному показателю присвоен
свой цвет. Эти цвета изображаются
на соответствующей шкале. Индикатор
опускают в раствор, затем сравнивают
ero
окраску с цветной шкалой.
ЧТО ТАКОЕ рН?
Водородный нока :lатсль об<н11а•1аеп: и как рН (11рои ·н1осито1 как
от латинского
pondus Hydrogenii -
« вес водорода » или
«IO аш » ), что нроисходит
potentia Hydrogeni - « сила водорода » .
Это мера активности ионов водорода в растворе, котораи количественно выражает его кислотность.
--
-~
'
1
1 .,.
•
'
~
•
'-
"
.
'
J
10 ·2 то{/{
10тто{/{
10" 3 то{/{
1 тто{/{
10 4 то{/{
100 µmof{
10-Jтo{j{
10 µто(/{
1 µто(/{
3
В
очен1,
а ·lбавле1111ых
43
Растворы
Существует множество кислотно-основных
ВОПРОС
индикаторов, их знают многие века. Это экс
14
тракты или отвары окрашенных плодов и цве
Как изменяются в щелочной среде отва
тов. Так, красными в кислой среде становятся
ры окрашеННЬIХ цветов и Пllодов?
отвары черники, малины, ежевики, черной смо
родины,
свеклы,
красной капусты,
анютиных
глазок, тюльпанов, ириса. В щелочной среде
они будут синими. Кислый (например, уксус)
и щелочной (пищевая или стиральная сода)
растворы позволяют делать красные или синие
узоры либо надписи на лепестках цветов. Чай
тоже индикатор: он светлеет, если в него поло
жить ломтик лимона, и темнеет, если добавить
в него пищевую соду.
Определение кислотности воды в бассейне.
В химической практике применяют неско
лько форм лакмуса
-
водный раствор и ленты про
питанной лакмусом фильт
ровальной бумаги. Выраже
ние «лакмусовая бумага» те
перь
Борщ (точнее, отвар свеклы) является
индикатором. Это легко проверить, если
-
нарицатель
ную определенную реакцию
вымыть кастрюлю из-под борща МЫllьной
водой
является
ным и обозначает мгновен
на что-либо.
тогда появится синий цвет, ведь MЫllO
создает щелочную среду.
В химии давно, еще с
1300
11 111
г., известен такой
кислотно-основной индикатор, как лакмус.
В чистом виде лакмус
-
9
темный порошок
со слабым запахом аммиака. В нейтральной
водной среде он дает фиолетовый цвет, в кис
лой
-
красный, в щелочной
-
синий.
Сравнение цвета
11
13
iiiilll
раствора со шкалой
лакмусового индикатора.
Шкала рН для лакмусовой бумаги.
Кис.лая среда
Таблица
ц ветов
лакмусовой
бумаги
1
2
Щелочная среда
Нейтральная среда
3
4
DD
5
6
8
7
'------~~~~~~~~~~--
9
10
11
12
13
14
-----~~~~~~~~---_.../-
~
рН
Растворы
44
Состоит природный лакмус из смеси
10-
15
разных веществ . Основные его компонен
ВОПРОС
ты
-
Связано
C9H 10N05,
это азолитмин
эритролитмин
15
ли
свечение
ф11уоресцентноrо
С 13 Н 22 06' спанолитмин, лейкоорцеин и лейказо
индикатора с собственной окраской рас
литмин. Добывают его из растительного сырья,
твора?
в основном из лишайников.
Кислая среда
Щелочная
Нейтральная
среда
среда
{
t
f
19
•
19
•
19
•
•
•
•
•
•
•
Розово
Фиолетовый
Темно-синий
красный
ц вет
цвет
цвет
Изменение цвета лакмуса в зависимости от рН.
Кроме
кислотно-щелочных
существуют
и
другие виды индикаторов, например адсорбци
онные. Они основаны на явлении адсорбции
-
увеличении концентрации растворенного веще
ства на границе раздела двух фаз . Эти вещества
адсорбируются на поверхности осадка и меня
ют его окраску. Примеры таких индикаторов
-
ализариновый красный и эозин. Флуоресцент
ные индикаторы светятся разным
цветом в со
ответствии с рН раствора. Так, флуоресценция
акридина при рН
= 4,5
зеленая, при рН
= 5,5
синяя. При этом свечение индикатора никак не
связано с собственной окраской раствора и его
прозрачностью .
Кислотно-основные индикаторы широко ис
пользуются в биохимии и аналитической химии,
особенно при титровании. Однако их точность
не очень высока, а определение цвета достаточно
субъективно и зависит от особенностей человече
ского зрения. Поэтому для точных исследований
обычно используются специальные приборы
Акридин
-
флуоресцентный индикатор.
рН-метры.
Растворы
ВОПРОС
45
16
Почему Д11Я точных иссле
дований
применяют
не
индикаторы, а рН-метры?
кислотность
В МЕДИЦИНЕ
Кислотность
биологиче
-
ских жидкостей
желудочного
и др.
11ри
и
Кис.лая среда
Нейтральная среда
Щелочная среда
-
мочи
важный параметр
11остановке
диагноза
определении
здоровья
пациента.
Кислотность
изменнетсн
при
различ
ных болезпнх желудка и
пищевода,
па
при
разные
реакциях
стимуляторы.
Именно изменение ее па
5 6 7 8
раметров
(а
ментный
показатель)
не
одномо
и
определнют врачи.
Шкала рН различных веществ и продуктов.
ОТВЕТЬI
1. Переменный состав
крови,
сока,
7.
Разбавленный раствор может быть насы
щенным; так, например, происходит с хло
означает, что соотно
ридом серебра.
шение веществ, составляющих раствор, спо
8. Золь -
собно изменяться в определенных пределах.
жидком», а rель «жидкое в твердом».
9. Коллоидным раствором в атмосфере явля
2.
Растворитель не изменяет свое агреrат
ное состояние при образовании раствора
-
это дисперсная система «твердое в
ется облако, иначе аэрозоль.
Свойства коллоидноrо раствора молоку
остается, как и был, жидким, твердым или
10.
rазообразным.
придает белок казеин.
3.
11.
Гидратация сопровождается выделением
Диссоциация
-
это распад вещества на
энерrии. Часть ее идет на разрушение кри
частицы (молекулы или ионы).
сталлической решетки, а избыток выделяет
12.
ся в виде тепла. Если энерrии для разруше
ток, потому что диссоциируют на ионы, а
ния
кристаллической
решетки
требуется
Электролиты проводят электрический
ионы
больше, чем выделяется при образовании
13.
-
заряженные частицы.
Строение молекул индикатора зависит
rидратов, раствор охлаждается.
от кислотности, то есть активности ионов
4. Растворы бывают твердыми, если раствори
водорода в растворе.
тель представляет собой твердое вещество.
14.
5.
щелочной среде становятся синими.
Полностью нерастворимых веществ не
15.
бывает.
6.
Динамическое равновесие
-
это такое
Отвары окрашенных цветов и плодов в
Свечение флуоресцентноrо индикатора
не связано с собственной окраской раствора.
состояние, коrда количество молекул, поки
16.
дающих кристалл в растворе, равно количе
вещь, зависит от особенностей зрения и по
ству молекул, присоединяющихся к нему.
тому не очень точна.
Определение
цвета
-
субъективная
46
Химические соединения
ХИМИЧЕСКИЕ
СОЕДИНЕНИЯ
Что такое хими"еское соединение?
о
химических
соединениях
речь
пойдет
раньше, чем о простых веществах, пото
му что именно
пояснить
протекание
на
их примерах можно
некоторых
химических
реакций, которые будут приводиться как при
меры в последующих разделах.
Химическое соединение
ство,
-
это сложное веще
которое составляют соединенные химиче
ской связью атомы двух или более элементов. Од
нако химическими соединениями называют так
же и некоторые простые вещества, в том случае
когда атомы в их молекулах связаны ковалентной
связью. Эго кислород, азот, фтор, хлор, бром, йод
и, вероятно, астат. Водород и инертные газы хи
Опал
-
гидрат диоксида кремния
с примесью оксидов железа
Fe2 0 3,
Si02·nH20
MgO
магния
и кальция СаО.
мическими соединениями не являются.
Сформировать понятие о химическом сое
динении помогли некоторые химические зако
ны. Закон постоянства состава открыл Жозеф
Пруст в
1799
г. Согласно ему, каждое соедине
ние, вне зависимости от того, каким был спо
соб его получения, составляют одни и те же
химические элементы, и при этом отношение
их масс выражается малыми целыми числами.
Закон кратных отношений открыл Джон Даль
тон в
1803
г. Этот закон гласит: в случае, когда
из конкретных элементов способны образовы
ваться два соединения, с определенной массой
первого из них сочетаются такие массы другого,
что отношение их дает целое число.
Хлороксиленол
-
химическое соединение,
Качественный
и
количественный
составы
включающее в себя атомы углерода, водорода,
химических соединений изучает аналитическая
кислорода и хлора. Это антисептик, который
химия.
получают из фенола.
ВОПРОС2
ВОПРОС1
Как выражается соотношение масс эле
Бывают ли простые вещества химически
ментов, входящих в химическое соедине
ми соединениями?
ние?
47
Химические соединения
Смеси и соединения
в 11ем разnи11ие?
но перепутать. Пример таких
смесей
-
сплавы. Их изготав
ливают с помощью физиче
ских
процессов,
расплавляя
х
имические соединения
цессов, например фильтраци
существенно отличают
ей, просеиванием, выпарива
ся от смесей простых ве
нием.
ществ. Прежде всего, свойства
смеси
-
понентов.
это свойства ее ком
А
свойства
соеди
нения отличаются от свойств
исходных веществ . Кроме того,
смесь
обычно
можно
разде
Компоненты
всего
смешивая
ком
поненты.
Интерметаллиды,
похожи
на
сплавы,
хотя
и
представ
по
ляют собой химические сое
лучить по отдельности только
динения. Они обычно твердые
ского
соединения
посредством
можно
химической
ре
У некоторых смесей связи
настолько тесные,
столь
помощью нехимических
соединения,
и химически стойкие, рассто
яние
акции.
лить на составляющие части с
про-
химиче
и
чаще
похожи
на
что
между
компонентами
у
них фиксированное. Нередко
а свойства
температура плавления интер
химические
металлидов более высокая, чем
их
исходных металлов .
нетруд-
ВОПРОС
3
Какими методами можно
получить и разделить хи
мические соединения?
Воздух, составляющий
атмосферу Земли, не является
химическим соединением,
а представляет собой смесь
азота, кислорода, углекислого
газа, водяных паров
и инертных газов.
48
Химические соединения
Янтарь
-
окаменевшая смола
(живица) хвойных растений,
ку да входит множество
химических соединений:
органических кислот, спиртов
и углеводородов.
Химические соединения подразделяются на такие классы, как
неорганические и органические . Основные типы неорганических
Бирюза
соединений
сульфат алюминия и меди
оксиды, основания, кислоты, соли. Впрочем, су
-
-
гидратированный
CuAl 6 (0Н) 2 [P0 4 ]-4H 2 0.
ществуют и органические кислоты.
Оксиды
о
ксиды
-
элементов
неорганические
с
кислородом,
окисления равна
-2. Он
соединения
чья
степень
стоит в эмпири
ческой формуле вещества на втором месте . Са
мый распространенный в мире оксид
-
вода
Н 2 0. Одни оксиды неспособны образовывать
соли,
они
называются
несолеобразующими.
К ним относятся оксид азота
(П)
(П)
(I) N 20, оксид азота
NO, оксид углерода (П) СО, оксид кремния
SiO. Римские цифры в скобках означают сте
Оксид азота
N 20
называют также веселящим
газом, потому что он производит опьяняющий
эффект. При нормальной температуре он
представляет собой негорючий бесцветный газ
пень окисления. Другие оксиды являются соле
и обладает приятными сладковатыми запахом
образующими .
и привкусом.
Например,
2Fe0 + 0 2 = Fe20 3 •
Солеобразующие
оксиды
разделяются
на
кислотные, основные и амфотерные.
Кислотные оксиды не реагируют с кислота
ми, они образуют кислоты при взаимодействии
с водой :
503 + Н 20 = H 2S04 •
Они же реагируют с основаниями и образу
ют соль и воду:
С02
+ Ва(ОН\ = ВаС03 + Н2 О.
Кислотные оксиды чаще всего образуют не
металлы или металлы с высокой степенью окис
ления
(V - VII).
Основные оксиды не реагируют с основани
ями, они образуют основания при взаимодей
ствии с водой :
СаО
+ Н20 =
Са(ОН) 2 •
Это оксиды металлов со степенью окисле
ния
I-II.
Химические соединения
Кроме того, основные и кислотные оксиды, взаимодействуя
друг с другом, тоже образуют соли.
Например:
Na20 + СО 2 -
ВОПРОС4
Взаимодействуют 11И кис
Na2C03 •
Амфотерные оксиды могут быть и кислотными, и основными
в зависимости от условий реакции. К ним относятся, например,
оксид алюминия А1 2 03 и оксид цинка
49
.llОТНЬlе
ОКСИДЫ
С
КИС.llО
тами?
ZnO.
Минерал, состоящий из оксида
алюминия А1 2 0 3 , называется
корундом. Один из видов
корунда
рубин.
-
драrоценный камень
ВОПРОС5
С чем взаимодействуют ам
фотерНЬiе оксиды
лотами
ями?
И.l1И
с
-
с кис
основани
50
Химические соединения
Оксиды очень распростра
нены во Вселенной, в частно
ВОПРОС&
сти в земной коре и атмосфе
Какой оксид самый рас
ре. Это вода, углекислый газ
пространеННЬIЙ на Земле?
СО 2, песок
Si02,
ржавчина
-
оксид железа, множество кра
сителей, например охра и су
рик, и многочисленные мине
ралы
-
Ржавчина
-
один из примеров
оксидов.
соединения металлов
с кислородом.
Ученые полагают, что неандертальцы использовали пиролюзит (диоксид марганца) для добычи
огня, а кроманьонцы расписывали им стены пещер.
51
Химические соединения
ВОПРОС7
Почему перекись водоро
да неlJЬзя пить?
Фрагмент стены, окрашенной свинцовым суриком (оксидом
свинца РЬ 3 0 4 ).
N0 2).
-
Причина
чий
оксидов
Si02,
мых разных агрегатных состо
и
твердом
порошки
разли
ской решетки. Разные у этих
Оксиды существуют в са
яниях:
этих
строение кристалличе
-
кристаллы
(оксид
кремния
оксид кальция СаО, ок
и
температура
плав
ления, и растворимость в воде.
XIX
сид марганца
До
(оксид марганца
не растворимые в воде оксиды
образном
назывались землями.
Mn30 4), жидком
Mn20 7), газо
(оксиды азота NO,
в. тугоплавкие, почти
Положительный
полюс
Катод (угольный
электрод)
Марганцево-цинковый
элемент
-
одноразовая
батарея, которая широко
используется в переносных
Оксид
.марганца
устройствах. В качестве
(IV)
катода здесь выступает
диоксид марганца
Mn0 2,
или пиролюзит, в смеси
с графитом, в качестве
Электролит
анода - металлический цинк
Zn, в качестве электролита -
Отрицательный полюс
раствор хлорида аммония
NH4 Cl.
~
Основан и•
о 1754
снования
г.
получили
свое
Французский
название
химик
в
Гийом
Франсуа Руэль обнаружил, что кисло
ты,
которые
тогда
знали
как летучие
жидко
сти, в сочетании с определенными веществами
превращаются в кристаллические соли. Руэль
посчитал, что
эти
вещества являются основа
ниями для получения твердых солей. Осно
вание
-
химическое
соединение,
которое
в
водном растворе способно распадаться на ка
тионы металлов Ме+ и анионы гидроксогрупп
он- . Существует также основание, в котором
гидроксогруппа присоединена не к металлу, а
к иону
NH 4+
(катиону аммония).
ВОПРОС В
Почему основания так назвали?
52
Химические соединения
Гидроксогруппы
однова
лентны, и поэтому формула
основания
легко
составляется
согласно валентности металла.
Какова валентность металла
таково
и
количество
-
гидрок
согрупп в соединении. Силь
ные
основания,
растворимые
в воде, называются щелочами.
Их образуют металлы
I
и П
групп. Например, это гидрок
(NaOH),
(КОН) и лития (LiOH).
сиды
натрия
калия
ВОПРОС9
Какие основания называ
ют щелочами?
Слабые основания малорас
творимые или нерастворимые
в воде и не меняют окраску ин
дикаторов.
Например, это гидроксид
магния
Mg(OH) 2 и
Fe(OH)z.
гидроксид
железа (П)
Углеродньzй анод
Производство гидроксида
натрия с помощью
Газообразный
э11ектро11иза.
е
хлор
Выход солевою
раствора
..........-
.,...,.__
Поступление
солевого
раствора
Выход
::::i._.
.......__..;;.:,;:.;;;;..::.....~t.;...:__.:__ _ _ _ _ _ _ _ _
На аноде
натрия (раствора
натрия в ртути)
Na!Hg
Уравнения:
На катоде:
амальгамированною
Na+ + еNa
2Na/Hg + 2Н20
2с1-
" Cl2 + 2е-
" 2NaOH + Н2 + 2Hg
Катод
Химические соединения
Сила
основания
-
растворимость
щи.
Так,
Са(ОН) 2 -
и
разные
его
ве
основания имеет значение при
взаимодействии
со
слабыми
кальция
кислотами. Сильное основание
Что делать, если в лицо
хорошо реагирует и с сильной,
попала щелочь?
хо. Именно ту часть гидроксида
и со слабой кислотой.
Растворы
щелочей
кальция, которая растворена в
шивают индикаторы:
воде, называют щелочью. Сила
фталеин
-
окра
фенол
в малиновый цвет,
Кисnоть1
ислоты
-
это соединения, которые в водной среде дис
социруют на катионы н+ и анионы остатков кислоты
An-.
Правда, изучаются кислоты и в безводных условиях.
Таким образом, все кислоты, независимо от происхождения,
содержат реакционноспособные атомы водорода.
Неорганические кислоты подразделяются на две группы:
•
•
ВОПРОС10
сильное основание,
гидроксид
но в воде он растворяется пло
к
53
бескислородные, например соляная
HCl;
кислородосодержащие, например серная
H 2S04 •
Взаимодействие серной кислоты с баритом
(минерал, сульфат бария).
лакмус
-
в синий, метиловый
оранжевый
-
в желтый.
54
Химические соединения
Кислоты бывают также од
ноосновные,
двухосновные
и
трехосновные.
Они бывают стабильными
(устойчивыми) и нестабильны
ми (неустойчивыми). К стаби
льным относится большинство
кислот, а к нестабильным
угольная
l\C03
и
-
сернистая
l\503.
Кислоты бывают сильными
и слабыми. Под силой кисло
ты понимают ее способность
отдавать ионы водорода н+.
По
окислительной
спо
собности различают кислоты
окислители
HN03 и кон
H 2S04, кисло
ты-неокислители - все осталь
-
центрированная
ные.
воnРОС
11
КаJСИе кис.llОТЬI считаются
ОКИС.llИТе.llЯМИ?
К сильным
носятся
HCl,
кислотам от
такие,
серная
как
соляная
H 2SO4,
хлорная
НС10 4 и др.; к слабым
роводородная
тистая
HClO
се
-
хлорнова
H 2S,
и др. Органиче
ские, или карбоновые, кисло
ты
имеют
функциональную
группу СООН.
Это,
напри
мер, уксусная СН3 СООН, му
равьиная
НСООН,
стеари
новая с17н35соон и другие
кислоты.
Температуры плавления и
кипения у
кислот
Существуют
кристаллов
различные.
кислоты
и
в
виде
порошков,
большинство из них
-
но
жидко
сти.
Взаимодействие сахара
с концентрированной серной
кислотой. Сахар превращается
в уголь, потому что серная
кислота извлекает из него
ионы водорода и кислорода
(производит дегидратацию).
Химические соединения
55
Индикаторы реагируют на кислоты следую
щим образом : метиловый оранжевый и лакмус
дают красный цвет.
Золото, растворенное в царской водке. Царская
водка
-
это смесь концентрированных азотной
и соляной кислот в пропорции
1 : 3. Назвали
ее
так потому, что она растворяет золото, которое
средневековые алхимики считали царем
металлов. Пробовать царскую водку нельзя ни в
коем случае
ВОПРОС
-
это смертельно опасно!
12
ВОПРОС
13
Что такое царская водка и почему она так
Почему кислоту всеrда необходимо 11ИТЬ
называется?
в воду и ни в коем случае не наоборот?
Химические соединения
56
Практические все кислоты
взаимодействуют
ми,
стоящими
с
в
металла
электрохи
таллами, стоящими в электрохимическом ряду напряжений после
водорода:
Cu + 2H2S04 = CuS04 + 502i + 2Н2О.
напряжений
Такие металлы, как алюминий, железо, хром, никель и др.,
до водорода, при этом обра
вступая в реакцию с безводными кислотами, тут же покрыва
зуются газообразный водород
ются продуктами окисления. Эти продукты образуют прочные
мическом
ряду
и соль. Подробнее об электро
пленки, которые не растворяются в концентрированных кисло
химическом
тах. Поэтому концентрированная серная кислота хранится и пе
рим
в
ряде
разделе,
мы
погово
посвященном
металлам. Например, вот вза
имодействие цинка с соляной
ревозится в железных емкостях.
При взаимодействии кислоты с сильным основанием
лочью
-
ще
образуются соль и вода (реакция нейтрализации).
-
кислотой:
Zn + 2НС1 = ZnC12 + H 2 j.
Струя холодной воды
ttt
Концентрированная
серная кис.лота
и нитрат калия
Нагрев
Азотная кис.лота
Желтая маслянистая жидкость
Уравнение:
+ серная кис.лота --. Азотная кис.лота + гидросульфат
КNО3 + н2 sо4 - HN03 + кнsо4
Нитрат калия
Приготовление азотной кислоты
При взаимодействии кис
Соляная кислота
HCl (раствор
хлороводорода в воде) входит
в состав желудочного сока
лоты с амфотерными гидрок
калия
(V) в лабораторных условиях.
2НС1 + FeO =
FeC12 (П) + Н2О.
Растворы кислот в воде из
сидами также образуются соль
меняют
и вода.
следующим образом . Лакмус
окраску
индикаторов
Например, при взаимодей
окрашивается растворами кис
ствии азотистой кислоты и ги
лот в красный цвет, индика
которая дымится на воздухе.
дроксида бериллия получают
тор метиловый оранжевый
И если открыть сосуд с ней,
ся азотистая соль бериллия и
тоже.
появятся парьi, которые
вода:
(ее концентрация в желудке
0,5 %). Это
-
едкая жидкость,
вызывают ожоги.
2НNО2 + Ве(ОН)2 =
Be(N02) 2 +
+2Н20.
кислоты-окислите
Соль и вода также образу
ли (окисляющие кислоты) мо
ются при взаимодействии кис
rуг взаимодействовать и с ме-
лоты и оксида. Например:
Правда,
ВОПРОС
14
Что такое реакция нейтра
лизации?
Химические соединения
Соnи
с
али
неорганические
-
соединения,
водном
социируют
таллов
и
которые
растворе
на
дис
катионы
анионы
в
ме
кислотных
Соли
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными называют соединения, в узлах криста ,1лоп
которых находятся комплексы (комплексные 11011ы), спо
собные к самостоятелыюму существованию. В
комплексном
подразделяются
соединении
составе),
например
сульфат натрия
новные
(с
-
каждом
в11утре1111яи
и
это и есть комплекс.
В химической формуле она заключается в квадратные
скобки. Так, в комплексном соединении
-
это комплекс
[BeFy-, а
KJBeF) внутрен
- ио112к+.
внешнш1
на
кислые (с катионом водорода
в
разлнчаютси
внешняя сферы. Внутренняя сфера
няя сфера
остатков.
57
Медный купорос, кристаллическая
гидро
структура.
ос
NaHSO 4;
гидроксогруппой
в составе), например хлорид
гидроксожелеза
FeOHC12;
сре
ВОПРОС
дние (только с катионом ме
16
талла), например хлорид на
Чем отличаются
трия
КОМПllеКСНЬiе со
NaCl;
разными
двойные (с двумя
катионами
единения?
метал
лов), например сульфат алю
миния-натрия
также
NaAl(S0 4 ) 3;
комплексные,
а
напри
мер тетрацианоферрат калия
K2 [Fe(CN) 4 ].
Агрегатное состо
яние солей твердое, они суще
ствуют
в
виде
кристаллов
порошков.
и
Медный купорос
-
сульфат
меди. В безводном состоянии
он бесцветный, но его
кристаллогидраты обретают
ВОПРОС
15
синий цвет. Эта соль
применяется для получения
В чем особенность сред
красок, выявления различных
них солей?
металлов, как антисептик,
фунгицид (противогрибковое
средство), удобрение.
58
Химические соединения
Средние соли взаимодействуют с сильными
кислотами, при этом образуются другая соль и
слабая кислота. Например:
с
растворимыми
+ Na 2S = PbS + 2NaCl (IV).
Соль реагирует с металлами, стоящими в
электрохимическом
KCNS + HCl = KCl + HCNS (П).
Реагируя
РЬС1 2
ряду
напряжений
левее
того, который входит в состав этой соли . Более
гидроксидами,
сильный металл вытесняет более слабый из мо
соль дает другую соль и нерастворимое основа
лекулы, образуя новую соль. При этом важно,
ние. Например :
чтобы металл,
CuS04 + 2LiOH = 2LiS04 + Cu(OH) 2 •
При взаимодействии с другой растворимой
солью образуются нерастворимая и раствори
мая соли. Например:
вступающий в реакцию, при
обычных условиях не взаимодействовал с водой:
Mg + 2AgCl = MgC12 + 2Ag.
Это главные типы взаимодействий, которые
характерны для средних солей.
Гемоглобин
Железо
Эритроцит
Молекула глутомата
кислоты.
-
соли глутаминовой
В состав гемоглобина
входит железо.
Химические соединения
Многие
соли
очень
59
важ
ны для человека. Так, напри
мер,
железо
входит
гемоглобина,
в
состав
переносящего
кислород по всему организму,
поэтому человек нуждается
в
солях железа. Кальций необ
ходим для укрепления костей,
магний
ника,
-
для работы кишеч
калий
-
сердца, а натрий
для
-
работы
для пере
дачи нервных импульсов. По
этому соли добывают и про
изводят в достаточно больших
количествах .
ВОПРОС
17
Зачем нашему орrанизму
нуЖНЬ1 соли жеllеза?
Нитрат гольмия под микроскопом.
ОТВЕТЬI
1. Да,
простые вещества бЬIВают химически
11.
ОкисllИТеllЯМИ считаются концентриро
ваННЬiе азотная и серная кисllоты:.
ми соединениями, если атомы в их мolleкy
12. Царская водка -
llax соединеНЬI ковиентной связью.
ванных азотной и соllЯНой кисllот в объем
2. Соотношение масс Эllементов, входящих в
ном соотношении
химическое соединение, выражается МаllЬl
му, что в ней растворяется зоllото
ми ЦеllЬIМИ ЧИСllаМИ.
мет шов».
это смесь концентриро
1 : 3. Так
ее назвали пото
-
«царь
Химические соединения можно поllучить
13. Кисllоту надо l1ИТЬ в воду потому, что при
и раздеllИТЬ тоllЬко химическими методами.
реакции ее с водой вы:деllЯется теПllо. Если
КисllоТНЬiе оксиды не взаимодействуют с
l1ИТЬ воду в кисllоту, кисllота вскипит, и ее
кисllотами, но при взаимодействии с водой
бры:зrи моrут попасть в llИЦО и на руки. Если
они образуют кисllоты:.
же llИТЬ кисllоту в воду (именно так правИllЬ
5. АмфотерНЬiе оксиды взаимодействуют и с
но!), все теПllо распространится под водой и
3.
4.
кисllотами, и с основаниями.
бры:зr не будет.
6. Самый распространеННЬIЙ оксид - вода.
7. Перекись водорода - СИllЬНЬIЙ окисли
14.
теllЬ, она может повредить ткани.
Французский химик fийом Франсуа Ру
8.
Реакция нейтраllИЗации
-
это реакция
кисllоты: с основанием, в резуllЬтате которой
образуются COllЬ и вода.
15. У средних colleй в моllекуlle нет ионов во
ЭllЬ обнаруЖИll, что эти вещества, реаrируя
дорода, все они заменеНЬI на иоНЬI метша.
с КИСllОТами, дают соли, и ПОСЧИТаll их осно
16.
ваниями Аl1Я поllучения colleй.
нений находятся коМПllексНЬiе иоНЬI, кото
9.
Щеllочами назЬIВают растворимые в воде
основания, изменяющие цвет индикатора.
10.
Необходимо промыть rllaзa и llИЦО боllЬ
В yзllax кристшов коМПllексны:х соеди
рые способНЬI к самостоятеllЬному суще
ствованию.
17.
Соли жеllеза нуЖНЬ1 потому, что жеllезо
шим коllИЧеством воды, а затем СИllЬНО раз
входит в состав rемоrllобина, который пере
бавllеlПIЬIМ раствором уксусной кисllоты:.
носит кисllород.
Металлы
60
МЕТАЛЛЬI
ВОПРОС
Почему
1
мeтallllы
прово
дят электрический ток?
О6щие свойства
метаnnов
м
еталлы
-
химические элементы и простые вещества, ко
торые обладают характерными для них металлически
ми свойствами. Это высокие теплопроводность, элек
тропроводность, положительный температурный коэффициент
сопротивления, характеризующий зависимость сопротивления
от температуры, металлический блеск, ковкость, пластичность.
У металлов (за исключением полуметаллов) имеется ионная
Натрий благодаря хорошей
кристаллическая решетка . Подавляющее большинство метал
теплопроводности используется
лов
-
твердые вещества при нормальных условиях. Исключение
для охлаждения в клапанах
автомобильных двигателей.
составляют ртуть и франций.
ПОЧЕМУ МЕТАЛЛЫ
ПЛАСТИЧНЫ?
Болыни11стно 1\t1!та11 1101111 1ы
стич11ы ,
то
есть
нод
во:J
/\ейст1111см силы гнутся,
110
нс лоl\tаютсs1. Это происхо
,,ит
11отому,
мов
металла
С\Ш:Нl
что
слои
ато
сме11\аюто1
l\ll'Ж t'Y
1 IИl\Ш l le
и
pa :~
pывaJOTCSJ . Саl\1ые 11 ,1асти•111ые
ме,,1..
и
:юлото, серебро
-
о,,1ыко
1\1111
11ри
ломаютсн
висмуr.
щ1с~п
-
основные материалы, используемые в
машиностроении.
0•1е111,
также
мар1 ·•111ец
от
и
:ы
•н1стоты .
•шстый
11 1ысп1•1е11 ,
11е1шый
металлы.
1\еформа -
Пласп1'111ос1ъ
На11р11мер,
Металлы
существуют
11е11 1ысти1111ые
н.111рнмер,
и
<1
хром
:ы1 · р~п -
более хру11ю1й
-
11
твер1'1.1й .
Теплопроводность и электропроводность обусловлены тем,
Цвет
у
б<мы111111ст~ы
ме
что в кристаллических решетках металлов имеются свободные
та11 11ов 11рнмер110 <мивако
электроны, которые движутся под воздействием электрического
вый
-
светло-серый с 1 ·011у
поля. Наибольшая электропроводность у серебра, меди и алю
бо11атым
миния, а также у натрия. Из алюминия и меди чаще всего делают
то, мед•• 11 1\е:шй обаа,,ают
провода . Лучший проводник тепла
желтым ,
тепло также натрий
-
-
серебро, хорошо проводит
его используют в клапанах двигателей ав
томобилей для охлаждения.
<пте1 ~ком .
Золо
ло-желтым
11>11\1 и
1\Ветами .
сшвано
строе1111см
1.:~ыо
со
свет
~лсктро1111ы :х оболо'lек .
Это
их
Металлы
ВОПРОС
61
2
Почему металлы обА.ада
ют П11астичностью?
Из
118
известных на сегод
ня химических элементов
таллами являются
ме
а если
87,
прибавить так называемые по
луметаллы, то даже
94.
Шесть элементов относятся
к группе щелочных металлов:
литий
(Li),
натрий
(К), рубидий
франций
(Na),
калий
цезий
(Rb),
(Cs),
(Fr).
Литиево-ионные батареи
широко распространены.
Четыре элемента относят
ся
к
ных
группе
щелочноземель
металлов.
(Са), стронций
Это
(Sr),
кальций
барий (Ва),
радий
(Ra). Эти металлы от
носятся к 11 группе таблицы
химических
элементов.
лочноземельными
эти
Ще
веще
ства называют потому, что их
гидроксиды
чами,
и
их
а
являются
оксиды
когда-то
лями.
Эти
щело
тугоплавкие
называли
оксиды
зем
Продукты, содержащие калий.
ВОПРОС
-
Почему щеА.очные метu
(земли),
А.Ы так называются?
взаимодействуя с водой, дают
щелочь. Во
11
группу входят
ВОПРОС4
также бериллий (Ве) и магний
(Mg),
и
которые, хоть иногда их
относят
к
щелочноземель
ным, обладают другими свой
ствами.
3
Почему щеА.очные метu
Аквамарин
бериллия.
-
алюмосиликат
А.Ы
хранят
росина?
под
сА.оем
ке
Металлы
62
Сорок металлов относятся
к группе переходных. Эго скан
(Sc), титан (Ti), ванадий (V),
(Cr), марганец (Мn), же
лезо (Fe), кобальт (Со), никель
(Ni), медь (Cu), цинк (Zn), ит
трий (У), цирконий (Zr), ниоб
ий (NЪ ), молибден (Мо ), техне
ций (Те), рутений (Ru), родий
(Rh), палладий (Pd), серебро
(Ag), кадмий (Cd), лантан (La),
гафний (Hf), тантал (Та), воль
фрам (W), рений (Re), осмий
(Os), иридий (Ir), платина (Pt),
золото (Au), ртуть (Hg), акти
ний (Ас), резерфордий (Rf),
дубний (Db ), сиборгий (Sg),
барий (Bh), хассий (Hs), мейт
нерий (Mt), дармштадтий (Ds),
рентгений (Rg), коперниций
(Cn). Эги металлы характеризу
Семь металлов относятся к легким. Это алюминий
лий
(Ga),
индий
(In),
олово
(Sn),
таллий
(Tl),
(Al),
гал
свинец (РЬ), висмут
дий
(Вi) . Это металлы, которые обладают сравнительно малой плот
хром
ностью
ются
незавершенностью
-
меньше
5 г/см 3 •
стро
ения электронных оболочек, и
у них валентные электроны на
Легкость, пригодность для штамповки, стойкость к коррозии,
ходятся на разных оболочках.
неядовитость сделали алюминий очень популярным
Они относятся к
пам
I - VIII
периодической
груп
таблицы
химических элементов.
ВОПРОС
5
Что характерно Дl1Я пере
хоДНЬIХ метшов?
Хромирование, то есть
покрытие стальных изделий
хромом, производится для
того, чтобы сделать предмет
более стойким к коррозии
и менее подверженным
износу.
материалом. Его используют для изготовления посуды, фольги,
также в авиационной и космической промышленности.
Металлы
63
Пятнадцать металлов относятся к группе
(La), церий (Се), пра
(Pr), неодим (Nd), прометий (Pm), са
(Sm), европий (Eu), гадолиний (Gd), тер
лантаноидов. Это лантан
зеодим
марий
бий (ТЬ), диспрозий
(Er),
тулий
(Tm),
(Dy),
гольмий (Но), эрбий
иттербий (УЬ), лютеций
Данное семейство относится к
III
(Lu).
группе 6-го
периода периодической таблицы и имеет атом
ные номера
57-71
(от лантана до лютеция). Их
свойства чрезвычайно сходны.
Неодимовый маrнит состоит из сплава неодима,
бора и железа. Его используют в разных
областях промышленности, медицине,
электронике, в том числе и в жестких дисках
компьютеров.
Пятнадцать элементов относятся к группе ак
тиноидов. Это актиний (Ас), торий
(Th), протак
тиний (Ра), уран (U), нептуний (Np), плутоний
(Pu), америций (Am), кюрий (Cm), берклий (Bk),
калифорний (Cf), эсмий (Es), фермий (Fm), мен
делевий (Md), нобелий (No), лоуренсий (Lr). Это
радиоактивные химические элементы III группы
7-го периода периодической системы с атомны
ми номерами 90-103. Их свойства очень похожи.
Существуют также элементы, занимающие
промежуточное
положение
между
металла
ми и неметаллами. Иногда их относят к неме
таллам, иногда называют металлоидами или
полуметаллами. Таких элементов семь. Это
бор (В), кремний
(As),
сурьма
(Sb),
(Si),
германий
(Ge),
мышьяк
теллур (Те), полоний (Ро).
Для них характерны ковалентная кристалли
ческая решетка и металлическая электропро
водность.
Золото, серебро, платина и пять металлов
платиновой
группы:
дий, осмий и иридий
рутений,
-
родий,
палла
считаются благород
ными (драгоценными) металлами. Они прак
Стибнит
-
природный сульфид сурьмы.
В древности его использовали в косметитке
и медицине.
тически не окисляются на воздухе и потому не
ВОПРОС7
ВОПРОС&
Для каких мирНЬIХ целей ИСПОllЬЗОВСlllИ
Что характерно для по11уметС1Лilов?
уран в проШllые времена?
64
Металлы
подвержены коррозии. Золото
и серебро обладают высокой
пластичностью,
а
остальные
благородные металлы -
еще
и тугоплавкостью.
ВОПРОС В
Какие метСl1111ы называют
611.аrороДНЬIМИ и почему?
Также ряд металлов назы
вают
17
редкоземельными.
Это
элементов, которые вклю
чают
тан
скандий,
и
иттрий,
лантаноиды.
Назвали
их так потому, что в
XIX
лан
XVIII-
вв. считалось, что их окси
ды (земли) очень редкие. На
самом
деле
довольно
они
часто,
встречаются
но
название
осталось.
ВОПРОС9
ТЯЖЕЛЕЕ ГЕЛИЯ
Почему
В астрофизике металла:\IИ и ног да называют все химиче
редкоземе11ьные
метСl1111ы так назвми?
метаnnов
ольшинство металлов встречается в пр~
роде
в
виде
некоторые
родные
-
соединения
руд
ЗНАЧИТ, МЕТАЛЛ
ские элементы тяжелее гелия.
Производство
•
-
и
других
соединении,
в виде самородков. При
металлов
-
это
оксиды,
сульфиды (соли сернистой кислоты), карбонаты
(соли угольной кислоты) и др. Чтобы получить
чистый металл, надо выделить его из руды и
очистить, а также обработать различными спо
собами. Этим занимается металлургия. В метал
лургии различают черные (на основе железа) и
цветные металлы, всего их около
70.
Считается, что сама химия началась тог да,
когда люди научились воздействовать огнем
на металл. Добиться высоких температур
(температур плавления металла) было
нелегко, это потребовало многих технических
усовершенствований.
Металлы
65
Руду добывают из земли,
Если металлическая руда пред
ют
после извлечения ее, как пра
ставляет собой соединение ме
Сульфидные руды
вило,
талла
плавят,
на воздухе, преобразуя в окси
восстано
ды, и только потом восстанав
обогащают.
При
этом
и
неметалла, ее
из сырья выделяется рудный
то
концентрат. Затем с помощью
вителем, чтобы выделить ее из
химического
оксида или соли. При выплав
тического
или
электроли
восстановления
из
добытой и обогащенной руды
ке
есть
нагревают
железа
как
с
восстановитель
используют углерод, для алю
извлекается металл. Эго дела
миния
ют обычно с помощью высо
для
кой температуры или же воды.
новителей нет, и их извлека-
и
натрия
подходящих
промышленности
восста
посредством
электролиза.
обжигают
ливают.
ВОПРОС
10
С чего, как считается, на
ча;~ась химия?
Хими"еские свойства метаnnов
у
металлов
С серой реагируют все ме
количество ~ электронов
таллы, за исключением золота
на
и платины:
большинства
внешнеи
электрон
ной оболочке невелико
(1-3),
и поэтому почти во всех реак
циях
они
являются
восстано
вителями, то есть отдают свои
электроны. Все металлы, кроме
золота, платины и платиновых
металлов,
реагируют с кисло
родом, образуя оксиды, перок
сиды и надпероксиды. Обычно
ОНИ УСТОЙЧИВЫ, ТОЛЬКО ОКСИД
серебра очень быстро распада
ется. С азотом могут реагиро
вать лишь наиболее активные
металлы, образуя нитриды:
ЗМg + N 2 =
Mg3N 2 •
Производство оцинкованной
стали. Цинк используется для
защиты стали от коррозии.
Zn+S=ZnS.
ВОПРОС
11
Чем явл.яются металлы
-
окис.llИТеllЯМИ Иl1И восста
новитеllЯМИ?
Металлы
66
С водородом, как и с углеродом, способны
Металлы
также
моrут
взаимодействовать
вступать в реакцию лишь самые активные ме
между собой, образуя интерметаллические со
таллы, образуя гидриды, ацетилениды и мета
единения, например:
ЗСu
ниды:
+ Au = Cu3Au.
4Al + ЗС = Al3C4 (карбид алюминия).
Взаимодействуя с водой, ацетилениды об
разуют ацетилен, а метаниды
лотами
реагируют
металлы,
-
ВОПРОС
метан. С кис
которые
стоят
12
Какой металll бо11Ьmе всеrо распростра
в
нен в орrанизме че11овека?
электрохимическом ряду активности металлов
до водорода.
Эnектрохими11ескиi ряд
~
наnр•жении метаnnов
в
се металлы, как уже го
дных
ворилось выше, являют
его
ся восстановителями, то
растворах,
положение
определяет
в
определять
взаимодействие
электрохи
металлов с ним. Металлы, ко
торые стоят в ряду электрохи
мическом
ряду
напряжений
есть достаточно легко отдают
металлов
(ряду
электродных
свои
потенциалов металлов):
водорода, моrут вытеснять его
Li, К, Са, Na, Mg, Al, Zn, Cr,
Fe, РЬ, Н2, Cu, Ag, Hg, Au.
из
валентные
иными
словами,
электроны,
окисляются.
Восстановительная активность
металла
в
химических
реак
циях, которые проходят в во-
Водород в ряду напряже
ний
стоит
для
того,
чтобы
мических
напряжений
растворов
левее
разбавленных
кислот и растворяться в них.
Чем левее стоит металл в
ряду стандартных электродных
Металлы
Лепидолит
67
минерал, который является
-
ВОПРОС
источником такого активного металла,
как литий. При горении литий и его соли
13
Чем опредеМiется
окрашивают пламя в красный цвет.
00110-
жение метша в э11ектро
химическом
потенциалов, тем более силь
ряду напря
жений?
ным восстановителем он явля
ется. Таким образом, литий
самый
сильный
тель, а золото
-
-
восстанови
ВОПРОС
самый слабый.
14
Каждый металл может вос
Какой метш явМiется са
станавливать из солей в рас
мым с11абым восстанови
творе металлы, стоящие после
те11ем?
него в ряду напряжений. Так,
железо вытесняет медь из рас
творов ее солей. Правда, ще
собности отдавать электроны,
лочные
но и от энергии, которая тра
и
щелочноземельные
металлы будут взаимодейство
ветствует его положению в пе
вать непосредственно с водой.
риодической системе. Дело в
сталлическую решетку метал
актив
том, что место металла в ряду
ла и осуществить гидратацию
ность металла не всегда соот-
зависит не только от его спо-
ионов.
Восстановительная
История
тится, чтобы разрушить кри
Ступка и пестик из бронзы
-
сплава меди и олова.
метаnnов
лагодаря металлам и их сплавам возник
•
ла современная цивилизация. Причина
этого
-
высокая прочность металлов, од
нородность, непроницаемость для жидкостей
и газов. Изменяя рецептуру сплавов, можно в
очень широких пределах менять их свойства.
Первые металлы, с которыми познакомился
человек,
-
золото, серебро и медь. Они встреча
ются на земной поверхности в виде самородков.
Затем были открыты металлы, которые широко
распространены в природе и легко выделяются
из руд. Это железо, олово, свинец и ртуть.
Таким образом, в древности были известны
семь металлов. Более того, по названиям метал
лов и сплавов, наиболее важных в определенные
периоды
развития
человечества,
названы
эти
эпохи: медный, бронзовый и железный века.
Алхимики соотнесли с металлами известные в
то время небесные тела. Символом Солнца ста
ВОПРОС
ло золото, Меркурия
Ско11Ько метшов б1:а1110 известно в древ
Луны
-
-
серебро, Марса
олово, Сатурна
-
ртуть, Венеры
-
свинец.
-
медь,
железо, Юпитера
-
15
ности и какие это мeтёlllllhl?
68
Металлы
ВОПРОС
Какую
16
по11ьзу
принес11и
а11химики?
В Средние века были от
крыты цинк, висмут и сурьма,
в
XVIII в. -
мышьяк. В Средне
вековье мышьяк не хотели счи
тать металлом, потому что для
него не хватало планеты. Од
нако количество открытых ме
таллов все время возрастало.
Процессы, связанные с до
бычей и обработкой металлов,
Многие старинные способы обработки мета1111ов существуют
как никакие
и сегодня.
другие,
способ
ствовали развитию химии. Их
характер
металлов объединили в одну
ны, что уже в глубокой древ
группу сходных веществ. Од
считал, что все вещества созда
ности
нако не была известна их при-
ны из четырех элементов (огня,
свойства
настолько
семь
известных
тогда
рода. Аристотель, например,
Металлы
воды, земли и воздуха). В
металлы
-
XVIII
69
Старинный перегонный аппарат.
в. полагали, что
сложные вещества, куда входит го
рючее начало
флогистон.
-
В том же веке Антуан Лоран Лавуазье выяс
нил, что горение металлов
-
это их соединение
с кислородом, а сами металлы
-
простые веще
ства. И когда была создана периодическая си
стема элементов Менделеева, металлы заняли в
ней свое место .
ВОПРОС
17
Коrда стало окончательно ясно, что ме
таллы
-
простые вещества?
Медь
м
едь
тается, что впервые медь выпла
вили еще в
VI,
Почему
до н. э., а в
зывается также медно-ка
IV
тысячелетии до
это элемент 11-й
н. э. она была уже широко рас
пространена. Медный, или мед
подгруппы
но-каменный, век следует за ка
группы)
1
периодической системы хими
менным. Называется он так, по
ческих элементов Д. И. Менде
тому что мягкие медные орудия
леева. Ее атомный номер
- 29.
Cu
долго не могли вьпеснить камен
Медь обозначают символом
ные, хотя они были гораздо бо
(от латинского
Само
лее острыми и с ними было лег
слово
cuprum).
происходит
от
названия
острова Кипр, где в древности
че
работать.
Медно-каменный
век начался в
VI тысячелетии до
добывали медь римляне и гре
н.
ки.
две тысячи лет. Медь добывали
Медь представляет собой
пластичный
металл
золоти
Содержание меди в земной
коре
- 0,003 %.
плавления
кипит
2600
она
меди
при
э.
Температура
и продолжался примерно
-
1084
° С,
температуре
и
но и за его свойства.
выделяющийся
угарный газ СО восстанавливал
ВОПРОС20
малахит до свободной меди:
Cu2C03(0H) 2 +
2СО =
Из какой руды раньше все
2Cu +
rо начали добывать медь?
Эго один из первых метал
лов,
которые
зовать
люди,
начали
исполь
потому
что
он
Ф<...;,,..
На ((Jl!pl'\l('JIJ lblX
\l('/lllЫX
ру,11111ках
встречается в природе в виде са
111,i
мородков, да и из руды его срав
, ](' , /() ( 1!011 .\
нительно легко выплавить. Счи-
11рt• , 1ков
х
1 L'ры
11ро , НJЛЖд/(П
. ·~· "·-:.!
1
'jl
. 1.
·~
111 \1(' , 11101
о
.,
..~;\'
1 lд , J('K!IX
~"
~:
"
11 (JJ1011 !01!0/ О l!l'KOB.
Оrкуда происходиr латин
rum?
- cup-
'
it
';
18
ское название меди
'
( "' \
·,
ВОПРОС
на
малахит не только за красоту,
+ЗСО 2 +Н 2 О.
°С.
век
Люди с древности ценили
из руды, содержащей малахит
поджигали,
медНЬIЙ
менным?
С~СОiОН) 2 • Смесь руды и угля
сто-розового цвета.
19
данным, даже в 1Х тысячелетии
группы (или побочной
-
ВОПРОС
а по некоторым
'е
·-:\
:\\.\
' '<;.~
-' ::.-
..
-~
t
/\
.v".·"
Металлы
70
Позже сrали использовать и сульфидные
руды:
ВОПРОС
21
Почему МЬIШЬЯК при производстве брон
2Cu2S + 302 = 2Cu20 + 2502;
Cu20 +С= 2Cu +СО.
зы заме11И11И оловом, несмотря на то что
оно более редкое?
Ближнем Восrоке. Бронза прочная и ковкая, из
нее делали орудия труда, оружие, посуду, укра
шения.
Бронза использовалась и тогда, когда в оби
ход вошло железо. Так, в
XIII - XIV
вв. была ос
воена промышленная выплавка меди и бронзы.
Из бронзы изготавливали артиллерийские ору
дия, колокола, сrатуи. Интересно, что в бронзе
Борнит, который за окраску называют пав11ИНЬей
для производсrва пушек содержались не только
рудой, представляет собой соединение меди
медь и олово, но и цинк.
Сегодня медь получают из медных руд и
Cu5FeS4•
минералов
А
потом
люди
пирометаллургии,
ги
сплавы
дрометаллургии и электролиза. Пирометаллур
гический способ предсrавляет собой несколько
бронзами, за некоторым исключением. Сплав
этапов: обогащение, обжиг, плавку на штейн
-
делать
помощи
меди с другими вещесrвами. Они называются
меди с цинком
научились
при
латунь, а сплав с никелем
-
мельхиор. Но в древносrи люди не знали этих
материалов. Первой бронзой был сплав меди с
мыiпьяком. Однако при переплавке мышьяк ис
парялся, и качесrво сплава ухудшалось. Кроме
того, мышьяк ядовит, и кузнецы посrоянно бо
лели. Даже бог-кузнец Гефесr в мифах изобра
жается хромым. Поэтому мышьяк был заменен
оловом, хотя это гораздо более редкий элемент.
Случилось это примерно за
3000
лет до н. э. на
Знаменитый Медный всадник, созданный
Этьеном Фальконе в
1782 r., несмотря на свое
название, от11ит из бронзы.
Металлы
(сплав сульфида меди и сульфида железа) и ра
финирование. Рафинирование бывает оrnевым
и электролитическим. Orneвoe
это окисление
-
71
Медное месторождение в Рио-Тинто,
Испания.
примесей, удаление их с газами и перевод в шлак.
Электролитическое рафинирование осуществля
ют с целью получения чистой меди. Электролиз
проводят в ваннах, где анод представляет собой
медь оrnевого рафинирования, а катод
листы чистой меди. Электролит
-
-
тонкие
раствор сер
ной кислоты с медным купоросом. В ходе элек
тролиза
происходит повышение
концентрации
серной кислоты. При пропускании постоянного
тока анод растворяется, медь переходит в раствор
и осаждается на катодах:
2CuFeS2 + 0 2 = 2Cu2S + 2FeS + S02 j.
Гидрометаллургический способ
-
это вы
щелачивание меди слабым раствором серной
кислоты и
последующее ее выделение из рас
твора.
В соединениях медь проявляет две степени
окисления:
+1
и
+2.
Первая из них устойчива
только в нерастворимых соединениях, таких как
ВОПРОС22
Какими цветами обладает большинство
солей меди?
Cu20, CuCl, Cul, или комплексных, например
[Cu(NH3) 2]+.
Соли меди (11) образуются при растворении
Как простое вещество в отсутствие влаги
меди в кислотах-окислителях (азотной, концен
и диоксида углерода медь не изменяется. На
трированной серной). Большинство таких со
влажном воздухе она окисляется и образует ос
лей обладают синим или зеленым цветом.
новной карбонат меди. Он представляет собой
Как и другие металлы, медь реагирует с се
рой, азотом, хлором, кислотами.
Халкантит
-
внешний слой патины:
2Cu + Н20 + СО2 -
Cu2COiOH)2 t.
сульфат меди.
Именно эта соль придает
прожилкам синий цвет.
ВОПРОС
23
Каков состав патины?
Металлы
72
Сегодня медь как хороший проводник при
меняется для изготовления проводов и кабелей .
При этом она должна быть чистой, так как при
меси резко снижают ее электрическую прово
димость.
Бронзу и медь используют в одних системах:
так, к медным трубам крепится бронзовый
кран.
Сплавы меди сегодня используются очень
широко. В состав бронзы и латуни могут вхо
дить также никель,
висмут и другие металлы .
Сплавы меди с цинком, оловом, алюминием,
Медные провода прекрасно выполняют
свои функции благодаря хорошей
кремнием используют в деталях машин. Они
прочные, стойкие и пластичные. Из медно-ни
келевого сплава чеканят монеты, его использу
:электропроводности меди.
ют в судостроении. Другие сплавы меди при
меняют в ракетных двигателях. Инструменты,
ВОПРОС24
изготовленные из меди и ее сплавов, не создают
Почему при изготов11ении проводов важ
искр и потому используются на огнеопасных и
на чистота меди?
взрывоопасных производствах.
Благодаря высокой теплопроводности медь
используется в разных теплообменниках и те
плоотводных устройствах: радиаторах, компью
терных кулерах и т. п. Благодаря прочности и
пригодности к механической обработке медь и
ее сплавы также применяются в производстве
труб.
Мельхиор
-
сплав меди и никеля
-
иногда
называют также немецким серебром.
73
Металлы
Медь широко используется в архитектуре.
Медные кровли и фасады служат до
100-150
лет. В будущем этот металл, вероятно, будет
применяться для изготовления бактерицидных
поверхностей в больницах и поликлиниках: он
препятствует переносу бактерий.
В организме взрослого чело
века
содержание
ляет
примерно
меди
состав
100-200 мг,
50 % находится
еще 10 % - в пе
при этом около
в мышцах, а
чени.
Медь входит в состав многих
ферментов, участвует в метабо
лизме железа, повышает усвое
ние белков и углеводов, участву
ет в образовании гемоглобина
и
созревании
эритроцитов,
то
есть необходима для снабжения
организма
также
кислородом.
поддерживает
Медь
эластич
ность стенок кровеносных сосу
дов и кожи, обладает противо
воспалительным действием.
ВОПРОС
25
У каких животных за пе
Белок гемоцианин, переносящий кислород у членистоногих
и моллюсков, содержит медь. Кровь у моллюсков голубая
и благодаря меди, и из-за строения самого белка.
ренос кислорода отвечает
медь?
Металлы
74
Высокое содержание ионов меди в воде при
дает ей явный металлический привкус. Разные
люди по-разному чувствительны к меди. Од
ним достаточно концентрации
2
мг/л, чтобы ее
почувствовать, для других концентрация меди
должна достигать
10 мг/л.
Недавно ученые установили, что в тех водоемах,
где имеется медь, карпы вырастают особенно
крупными. Там, где ее нет, развивается
вредоносный для этих рыб грибок.
Зоnото
з
Золото
-
благородный ме
талл желтого цвета. Краснова
ВОПРОС26
тый оттенок некоторым золо
Korда
олото- этоэлементll-й
тым
новато-синим?
группы
меси, в частности медь. Тонкие
(или
подгруппы
побочной
1 группы)
пе
изделиям
придают
при
золотые пленки (толщина ко
риодической системы химиче
торых не превышает
ских элементов Д . И. Менделе
дают в
ева. Его атомный номер
невато-зеленоватый оттенок.
- 79.
Золото обозначают символом
Аи
(от
латинского
aurum).
проходящем
100
нм)
свете си
Содержание золота в зем
ной коре очень низкое:
ющего
участков,
ское
aurum
как
«желтый»
с
именем
тоже
Латин
переводится
и
богини
родственно
утренней
зари Авроры.
теплопроводность
и
низкое
Это тяжелый металл, его плот
множество месторождений и
«желтый»,
- 1064,18 °С, кипит оно
2856 °С. У него высокая
мг/т, но в мире существует
индоевропейского корня, име
«яркий » .
при
электрическое сопротивление.
5
значение
Температура плавления зо
лота
0,5-
Слово «золото » происходит от
« зеленый »,
зол.ото бывает зел.е
металлом.
обогащенных
ность равна
этим
19,32 г/см 3 •
В соединениях золото обыч
но имеет степень окисления
+3,
такие соединения самые устой
чивые.
Сравнительной
чивостью
ния
+1.
со
обладают
степенью
устой
соедине
окисления
Степень окисления
+5
дает
Золото нередко находят
стабильное соединение только
в самородном виде, потому
с фтором. Фгориды золота со
оно и известно с самых
степенями окисления
древних времен.
+6
и
+7
Металлы
трированной
селеновой
75
кис
применяют для лечения ауто
200 °С:
6H2Se04 + 2Au--+ Au 2 (Se04 \+
+ 3Se02 + ЗН 2 0.
иммунных заболеваний, к при
лоте при
Реагирует золото также с
хлорной кислотой
HClO 4,
всту
меру ревматоидного артрита .
Золото, как и медь, извест
но
людям
мерно с
с
древности,
при
V тысячелетия до н.
э.,
пает в реакцию с галогенами и
потому что встречается в виде
кислородом:
самородков.
2Au + 8НС104 --+ Cl2 +
+ 2Au(Cl04 ) 3 + 202 + 4Н 20.
торию добыло около
Человечество за всю свою ис
161
ООО т
золота. Если сплавить все его в
ОДИН СЛИТОК, ТО получится куб
со стороной около
20 м.
Кристаллическая структура
золота.
неустойчивы . А в веществах, где
степень
равной
окисления
+2,
считается
у одной половины
атомов она на самом деле
а у другой
- +3.
+1,
Поэтому ион
ная формула сульфата серебра
AuSO4 должна быть
щей: Au1+Au3+(S04) 2- 2 •
следую
Известно больше
30 минералов
с содержанием золота
примерно от
10 до 43 %. Самое
важное значение имеет все
таки самородное золото.
Золото сегодня добывают
Золото стоит в электрохи
в больших количествах, оно
напряжений
Существуют токсичные сое
металлов на крайнем правом
динения золота, их накопление
месте .
в
мическом
ряду
Поэтому
в
нормаль
организме
человека
может
ных условиях оно не реагиру
привести
к различным
ет с большинством кислот и
леваниям,
не образует оксидов. Но мы
там и дерматитам. Однако в
помним, что золото способно
медицине
используются
растворяться в царской водке.
нические
соединения
Растворяется оно и в концен-
(кризанол
например
и
забо
стомати
орга
золота
ауранофин).
Их
ценится так же, как и раньше.
ВОПРОС
:17
Какова степень окисления
у золота в его сульфате?
ВОПРОС
В
чем
лото?
:18
растворяется
зо
76
Металлы
ВОПРОС
Амальгамация основана на том, что ртуть
29
способна образовывать с металлами, в том чис
Можно ли превратить ртуть в золото и
ле и с золотом, сплавы
имеет ли это смыс..11?
ную породу смешивали с ртутью, еще больше
измельчали,
потом
-
амальгамы . Дробле
извлекали
амальгаму про
мывкой и отгоняли ртуть. Этот метод был изве
Золото добывают с помощью нескольких
методов. Промьшка основана на том, что золо
то
-
очень плотный металл. И в потоке воды
минералы, плотность которых меньше
(а их
стен еще в
1 в.
до н. э.
Цианирование основано на том, что золо
то растворяется в растворах синильной
лоты (цианистого водорода
большинство), смываются, а золото собирается
Измельченную
в тяжелой фракции, содержащей песок. Такая
батывают
фракция называется шлихом . Золотоискатели
натрия
прошлого,
шись
да
и
настоящего
промывочным
именно этот метод.
тоже,
лотком,
вооружив
использовали
HCN)
золотоносную
разбавленным
кис
и ее солей.
породу
раствором
обра
цианида
NaCN, образуется цианоаурат натрия
NaAu(CN) 2, который осаждается цинковой пы
лью.
Для извлечения золота из сульфидных руд,
которые
производятся
на
предприятиях,
ис
пользуют гораздо более сложные технологии.
Так, метод регенерации проводится следую
щим образом: 10%-ный раствор щелочи дей
ствует на растворы солей золота,
после чего
проводится осаждение аффинажного золота на
алюминий из горячего раствора гидроксида .
При помощи промывки золото ищут
и настоящие золотоискатели, и туристы,
для которых эта работа включена в некоторые
туристические программы.
Золотодобывающий рудник.
Металлы
77
Из всех запасов золота око
ло
находится в промыш
10 %
ленных
ного
изделиях,
примерно
из
осталь
треть
-
это
золотой запас различных го
сударств,
в
виде
главным
образом
стандартных
химически
треть
чистого
частная
слитков
золота,
собствен
-
ность, а остальное
ювелир
ные изделия.
Золото
важных
-
один из самых
элементов
мировой
финансовой системы .
До начала Первой миро
вой войны все мировые валю
ты были основаны на золотом
стандарте. Бумажные купюры
можно было свободно обме
нять на золото.
Золото
-
прекрасный ма
териал для производства элек
трических контактов. Поэтому
защищает от инфракрасного
в
излучения; как припой; а так
микроэлектронике
широко
используются золотые прово
же для
дники,
Этот
контактные
поверхно
защиты
металл
от
коррозии.
также
исполь
сти, разъемы; печатные платы
зуют в стоматологии. Кроме
также покрываются золотом .
того,
золото
-
это
ВОПРОС
Чем
30
определяется
цвет
золотых ювелирНЬiх изде
лий?
пищевая
добавка Е175.
Для природного золота су
ществует только один стаби
ВОПРОС
льный изотоп
Что характеризует золо
Au.
197
Осталь
ные изотопы золота радиоак
тивны .
Золото используется при
производстве печатных П11ат.
Золото
мишень
им
в
используется
ядерной
как
физике;
покрывают зеркала,
кото
рые работают в дальнем ин
фракрасном
применяется
(20
ней
нм)
диапазоне;
как
пленка
поверхности
витражных
оно
тончайшая
на
внутрен
оконных
стекол,
и
которая
уменьшает тепловые потери и
31
тая проба?
Металлы
78
Сере6ро
с
еребро
элемент 11-й
-
rруппы
(или
подrруппы
1
побочной
rруппы) пе
риодической системы химиче
ских элементов Д. И. Менделее
ва. Его атомный номер
- 47. Се
ребро обозначается символом
Ag
(от латинского
Argentum -
«белый», «блистающий»). Тем
пераrура плавления
кипит оно при
ность
- 10,5
2162
- 962
°С,
°С, плот
г/см 3 . Теплопрово
дность у серебра самая высокая
среди всех металлов.
Среднее содержание сере
бра в земной коре
Серебро
-
- 70
мг/т.
это пластичный,
ковкий благородный металл се
ребристо-белого цвета. Тонкая
серебряная фольга в проходя
щем свете имеет фиолетовый
цвет. Если во влажном воздухе
присутствуют
даже
едва
раз
личимые следы двухвалентной
серы (тиосульфаты, резина, се
В глубокой древности, когда люди еще
не знали железа, на острове Сардиния
уже добывали серебро.
роводород), то на серебряных
изделиях образуется налет ма
лорастворимого сульфида сере
ВОПРОС
бра, из-за чего изделия темнеют.
Отчего темнеют серебря
Серебро, как и золото, имеется
в природе в самородном виде.
32
НЬiе издеllИя?
Металлы
79
Серебро, встречающееся в виде самородков, известно с глу
Первые в мире монеты де
бокой древности. Ассирийцы и вавилоняне считали серебро свя
лали из сплава золота и сере
щенным металлом, его изучением активно занимались алхими
бра. В течение нескольких ты
ки. Существует более
сячелетий серебро наряду с зо
50
природных минералов серебра, однако
промышленное значение имеют только
15-20,
лотом и медью было одним из
в том числе са
мородное серебро, электрум (сплав золота и серебра), аргентит
основных монетных металлов.
(сплав серебра и серы) и др.
Из серебра делали и делают посуду, до сих пор чеканят мо
неты, изготавливают ювелирные изделия. Также серебро приме
няют для сплавов, из которых получают катоды гальванических
элементов, для обеззараживания воды.
Серебряные монеты наряду
с золотыми испо11ьзова11ись
в разных странах мира.
Серебро
-
относительно
инертный металл, но вступает
в реакцию с горячей концен
трированной
серной
кисло
той, а также с азотной кисло
Драгоценности из серебра
Криста1111ическая структура
всегда были попу11ярны.
серебра.
той, если присутствует свобод
ный кислород:
Ag + 2НN03 = AgN03 + N02 j +
+ J-\0.
ВОПРОС
33
Какой состав у адского камня?
Металлы
80
Также серебро растворяется в хлориде желе
за. Это качество используется для травления:
ВОПРОС
34
Ag + FeC13 = AgCl + FeCl2•
Какое свойство серебра используется для
Самая устойчивая степень окисления сере
травления?
бра в соединениях
комплексы
с
Так, серебро образует
- +1.
аммиаком,
цианидами,
тиосуль
фатами. Образование комплексов применяют
У ионов серебра имеются бактериостатиче
для того, чтобы извлекать серебро из руд. Более
ские свойства. Но чтобы они проявились, кон
высокие степени окисления
у серебра
центрация ионов серебра должна быть настоль
имеются в соединениях с кислородом и фто
ко высокой, что обеззараженная таким методом
ром, но эти вещества не такие устойчивые.
вода оказывается непригодной для питья. Одна
(+2, +3)
Большинство солей серебра не растворяется
ко персидский царь Кир
11
Великий использо
в воде, и это свойство нередко используется для
вал в военных походах серебряные сосуды для
того, чтобы определять наличие ионов галоге
хранения воды. А в Древнем Египте накладыва
нов в водном растворе.
ли на поверхность ран серебряные пластины.
Серебро
останавливает
рост бактерий, его
обеззараживающие
свойства бhlllи
известны с древности,
и во многом поэтому
из него делали
и делают посуду.
Следы серебра (примерно
0,02 -мг/кг веса) имеются
в организмах всех млекопитающих. Интересно,
что в ядрах нейронов
-
нервных клеток
серебра содержится бollЬme (О,008
-
% веса), чем в
OCTallЬHOM организме.
Жеnезо
)1(
Д.
метеоритное железо. Этот эле
подгруппы
периодической
химических
элемен
Менделеева.
Его
- 26.
чается
символом
железо
(от латинского
ferrum).
температура
- 2862 °С.
мент
по
распространенности
в земной коре занимает чет
вертое место после кислорода,
кремния и алюминия.
Обозна
Fe
Тем
пература плавления железа
ния
Железо редко встречается
в природе в чистом виде, в ос
8-й группы (или по
И.
°С,
живании воды с помощью серебра?
С древности известно также
-
атомный номер
1539
Какие проблемы возникают при обеззара
новном его находят в виде руд.
группы)
системы
тов
35
это элемент
елезо
бочной
VIII
ВОПРОС
-
кипе
Сегодня считается, что земное
ядро в основном состоит
из железа.
Металлы
Железо
-
81
пластичный ковкий металл се
ребристо-белого цвета . Оно обладает высо
кой
реакционной
способностью
и
потому
подвержено коррозии. Железо хорошо горит
в чистом кислороде, способно самовозгорать
ся на воздухе, будучи в мелкодисперсном со
стоянии. Железо обладает магнитными свой
ствами.
Притяжение частичек железа магнитом.
ВОПРОС
Как
36
можно
Существует множество со
обнаружить
же11езору ДНЬiе
дения?
месторож
нитный
железняк
(магнетит)
(содержит
держащих железо минералов.
FeO·Fe20 3
Самые важные из них
железа). Распространены так
-
ный железняк (гематит)
(железа в нем более
крас
Fe20 3
70 %) и маг-
же сульфиды железа
FeS2
72,4 %
-
пирит
(серный, или железный,
82
Металлы
колчедан) и пирротин FenSn+l'
где п =
6 ... 11.
Пирит приме
Под железом обычно по
нимают его сплавы с другими
ВОПРОС
37
няют для производства серной
элементами, главным образом
Чем стмь по составу от
кислоты.
углеродом,
личается от чугуна?
который
придает
железу прочность и твердость.
0,1
2,14 % углерода, а в чугу
- более 2,14 %. Применя
Так, в стали содержится от
до
не
ляются легирующие металлы,
ется также легированная (не
такие
ржавеющая) сталь, куда добав-
хром идр.
как
марганец,
никель,
Гематит, или красный
железняк,
-
самая
распространенная
из железных руд.
Магнетит, или магнитный
железняк. Именно он
обладает свойствами магнита.
Стрелка компаса указывает
на магнетит, именно по этому
свойству его и находят.
Стальные изделия делаются как из углеродистых,
так и из легированных сталей.
Пирит, или железный (серный)
колчедан. Само название
«пирит» по-гречески означает
«камень, высекающий огонь».
С его помощью получали
огонь еще древние люди.
Кроме углерода в чугун входят такие примеси, как кремний,
марганец, сера и фосфор. Различают белый чугун, где углерод
вступает в химическое соединение с железом (цементит
FeC),
и серый, где углерод находится в свободном виде как графит.
Металлы
Важность железа для цивилизации невоз
83
Сыродутный способ был тяжелым, но позд
можно переоценить. Железный век в различ
нее
ных областях Земли начинался в разное время.
использовать меха для подачи воздуха в горн.
Сначала использовали только метеоритное же
Сегодня железо получают промышленным спо
лезо, около
2000
г. до н. э. на Ближнем Восто
ке его стали выплавлять из руды сыродутным
способом . Слои железной руды перекладывали
слоями древесного угля и прокаливали в осо
бых печах-горнах. Железо так добывали в Ма
появились
печи-домны,
а
также
начал и
собом из железных руд, главным образом это
гематит и магнетит.
Самый распространенный способ получе
ния железа
-
доменный процесс.
На первом этапе железо при температуре
2000 °С восстанавливается с помощью углерода,
лой Азии, а потом и в Греции.
который содержится в коксе. Углерод окисля
ется до СО, который восстанавливает железо из
руды.
Чтобы избавиться от примесей, к руде до
бавляют также флюс, в котором имеются кар
бонат кальция (известняк) и карбонат магния
(доломит). Карбонат кальция разлагается до
оксида, который соединяется с примесью
-
ди
оксидом кремния. При этом образуется метаси
ликат кальция
шлак. Он легче железа, плава
-
ет на поверхности и легко отделяется.
Железное оружие и другие орудия появились
более чем за тысячу лет до н. э., и владевшие
тайной выделки железа народы получили
большое преимущество. Считается, что
дорийцы, пришедшие в Грецию с севера,
одолели ахейцев, которые сражались
бронзовым оружием. А вот железные подковы
появились много позже, не ранее
111 в. н. э.
Шлак, или метасиликат кальция, может
Начало железного века в Средиземноморье
относится примерно к
1200 г. до н.
э., ко време
ни Троянской войны. Гомер, живший намного
позже, несколько раз упоминал железо в «Или
ВОПРОС
38
С помощью каких веществ руду очищают
аде» и «Одиссее» . Например:
Много сокровищ хра
нится
использоваться в строительстве.
в
отеческом
от примесей?
доме
богатом,
Много и меди, и зла
В доменной печи получается чугун, содер
та, и хитрых изделий же
жащий много углерода. Удалить излишки угле
леза.
рода и получить стал ь можно в мартенов ской
печи с помощью окисления.
Гомер
(VIII в. до н.
э).
У природного железа имеется четыре ста
рассказывал в своих
бильных изотопа
поэмах о начале
вестно более
железного века.
20
- 54, 56, 57
и
58.
Также из
нестабильных изотопов железа
с массовыми числами от
45 до 72.
84
Металлы
Ученые считают, что именно синтезом желе
за завершается ряд синтеза элементов в ядрах
звезд.
Оранжевый и бурый цвета почве придают
оксиды железа.
В электрохимическом ряду напряжений же
лезо стоит до водорода, и поэтому реагирует с
разбавленными кислотами. Степени окисления
железа
- +2 и +3.
Железо также реагирует с кислородом, се
ВОПРОС
рой, азотом и фосфором, вытесняет из раство
39
Реагирует 11И
ров солей металлы, которые стоят правее него в
железо
с
разбавленными
ряду электрохимических напряжений.
кислотами и почему?
Правда, при этом чистое металлическое же
лезо проявляет устойчивость в воде и разбав
ленных растворах щелочей. Оксидная пленка
не дает ему растворяться
в
холодных концен
трированных азотной и серной кислотах. Одна
ко горячая концентрированная серная кислота
с железом реагирует.
Оксид железа (П)
дроксид (П)
Fe(OH)2
FeO
-
черного цвета, ги
зеленого. Оксид
(III)
Fe20 3 красно-коричневого цвета, а гидроксид
(III) Fe(OH)3 - коричневого. Существуют также
соли железа - ферриты и ферраты.
ВОПРОС40
Ферритин
-
белковый комплекс, главное
Почему железо не растворяется в холод
хранилище железа в живом организме, имеется
НЬIХ концентрированных азотной и сер
почти во всех органах и тканях. В одной
ной кислотах?
молекуле ферритина может содержаться до
атомов железа.
4000
Металлы
85
В живом организме железо катализирует
красный цвет. Правда, за цвет отвечает не толь
процессы дыхания. Оно хранится в белковом
ко металл, содержащийся в гемоглобине, но и
комплексе ферритине. Кроме того, входит в со
структура самого белка.
белка, переносящего кис
Железо поступает в организм с пищей, бога
лород и содержащегося в эритроцитах- клет
ты им печень, бобовые, яйца, семена кунжута и
ках крови. Именно гемоглобин придает крови
тыквы, полевой салат, петрушка, тимьян.
став гемоглобина
-
Свинец
с
винец
это элемент 14-й
-
группы (или главной под
группы
группы)
N
пе
риодической системы химиче
ских элементов Д. И. Менделе
ева. Он имеет атомный номер
82.
Обозначается символом РЬ
(от латинского
ковкий
plumbum).
металл,
Эго
сравнительно
легкоплавкий, для него харак
терен белый цвет с синеватым
отливом. Свинец мягкий, его
легко резать ножом и даже по
царапать ногтем. Температура
-
327,46 °С, тем
пература кипения - 1749 °С.
Стабильные изотопы свинца 204, 206, 207, 208.
плавления
Свинец был известен еще в
древности . Самое старое свин
цовое изделие
-
древнеегипет
ская статуэтка в виде женской
фитуры,
которая
датируется
3100-2900 гг. дон. э. В Древнем
Риме
широко
использовался
свинцовый водопровод.
В
земной
мент
коре
встречается
этот
с
эле
частотой
1,6 · 10-3 %. Самородный свинец
редок, однако существует мно
жество
свинцовосодержащих
ВОПРОС41
Что характерно для свинцовосодержащих пород?
пород. Причем свинец встре
чается
там
не
только
в
виде
сплавов, но и в виде интерме
таллидов
динений
с
палладием,
химических
оловом,
сое
сурьмой,
платиной
и
дру
Галенит - сульфид свинца
PbS, главная свинцовая
руда. Раньше ero называли
свинцовым блеском. Он
действительно легко узнаваем
гими элементами. Самая важ
по свинцово-серому цвету
ная
и характерному серебристому
из
пород
-
свинцовосодержащих
сульфид свинца
или свинцовый блеск.
PbS,
блеску, а также большому
у дельному весу.
Металлы
86
Именно галенит главным образом исполь
зуют
для
получения
свинца.
Прежде
всего,
для химического источника тока. Ранее широко
применяли свинцовые белила РЬ(ОН) 2 ·РЪС0 3 •
применяют метод флотации для получения
Соединения свинца с мышьяком используют
концентрата, который содержит от
для
40
до
70 %
производства инсектицидов,
свинца. Затем концентрат перерабатывают в
бором РЬ(В0 2 ) 2 ·Н 2 0
веркблей (черновой свинец), который содержит
ковых покрытий.
-
соединение с
для сушки картин и ла
90 % свинца, после чего удаля~т примеси.
Крокоит, он же хромат свинца. Некоторые его
Типографские литеры делались из гартового
кристаллы, найденные на острове Тасмания,
СП11ава, содержащего свинец, сурьму и олово.
достигали
40 см в длину.
С появлением компьютерного набора
необходимость в них отпала.
Хромат
свинца
производства
окраску
желтых
фарфора
Pb(N03) 2
РЪСгО 4 используется
и
красок,
тканей.
идет
также
Нитрат
для
на
свинца
используют в производстве спичек,
окраске тканей,
гравировке. Сульфат свинца
РЪSО4 применяют как пигмент в аккумулято
рах, литографии, в технологии производства
набивных тканей.
Сульфид свинца РЪS, черный нераствори
мый в воде порошок, используют при обжиге
глиняной посуды и для обнаружения ионов
свинца.
воnРОС4З
Свинец реагирует с щелочами и кислотами,
образуя соли.
Какое соеАИНение свшща используют АЛЯ
произвоАства :желтых :красок?
ВOllPOC42
Свинец хорошо поглощает гамма-излуче
Киую пороАу rлавным образом исполь
зуют АЛЯ получения свшща?
ние и поэтому применяется как защитный ма
териал
в
ядерных
реакторах
и
рентгеновских
установках.
Также содержание изотопов свинца изме
Свинец используется очень широко и давно.
Из его сплавов с сурьмой делают пули и типо
графский шрифт; соединения с серой, висму
том, фтором, хлором и кислородом
-
материал
ряют, чтобы определить возраст минералов и
горных пород.
Свинец и его соединения ядовиты, особенно
опасны растворимые в воде и летучие. Правда,
87
Мета.1лы
Свинец используется для защиты человека от радиоактивного
излучения.
острого
отравления
свинцом
не бывает, только хроническое .
Он накапливается в костях, пе
чени и почках. Поэтому обра
щаться с соединениями свин
ца надо осторожно.
Определение уровня
свинца в крови необходимо
для назначения лечения.
Оnово
лово
элемент
о группь~ (главной
группы
IV
14-й
были
кими,
а
металл
важен
-
ведь
был
именно
ред
очень
сплав
ВОПРОС44
Для чего
главНЬIМ обра
под
олова и меди представляет со
зом использовалось олово
бой бронзу. И весь бронзовый
с глубокой древности?
группы) пе
век олово представляло собой
риодической таблицы хими
ческих элементов.
ный номер
месторождения
Его
атом
символом
- 50. Обозначается
Sn (от латинского
stannum).
Это легкий серебри
стратегический металл.
Главный
минерал,
жащий олово,
-
содер
касситерит,
или
оловянный
состав
78,8 %
-
Sn02,
камень.
Его
он содержит
олова. Оловянный кол
чедан, или станнин, встречает
сто-белый металл, ковкий, лег
ся намного реже. Его состав
коплавкий и пластичный. Тем
Cu2FeSnS4 •
пература
плавления
олова
231,9 °С, температура
ния - 2600 °С.
-
IV
Впрочем, и олова в
нем гораздо меньше
- 27,5 %.
кипе
Олово человек открыл еще
в
-
тысячелетии до н. э. Его
Касситерит
-
основной минерал,
откуда добывают олово.
Металлы
88
При
руда,
производсrве
содержащая
олова
касситерит,
Олово существует в двух
модификациях:
белое
и
се
ВОПРОС45
дробится, после чего олово от
рое.
деляется от пустой породы с
ное
помощью так называемого гра
Но если температура падает
витационно-обогатительного
ниже отметки
метода.
ный объем его увеличивается,
мой. Во многом из-за оловян
помощью
и спонтанно образуется серое
ной чумы в
флотации. Потом концентрат
олово. В его кристаллической
экспедиция Роберта Скотта к
обжигается в кислороде
решетке атомы расположены
Южному полюсу. Баки с го
ется
и
Затем руда обогаща
очищается
с
так
-
удаляются примеси мышьяка и
олово
пластич
В чем закмочается амфо
достаточно
крепкое.
терность O.lloвa?
Белое
и
менее
плотно
13,2
-
°С, удель
рючим были запаяны оловом,
его поразила оловянная чума
серы. Очищенный концентрат
спонтанное увеличение удель
ного
этом
на
восстанавливают
до
сво
25,6 %.
При
г. погибла
происходит
выплавляют в печах. Олово при
объема
1912
чистого
-33
олова
°С превра
на морозе
-
и топливо вытек
ло. Экспедиция осталась без
бодного состояния в электро
щение
печах либо древесным углем,
быстро. На олове появляются
было
либо алюминием с цинком.
трещины,
рассыпается
ственники тогда не знали, что
Восстановление углеродом
представляет
собой
следую
щую реакцию :
Sn02 +С= Sn + СО2 •
осуществляется
и
оно
очень
горючего, а это в Антарктиде
катастрофой.
Путеше
в порошок. При этом серое
предотвратить оловянную чу
олово « заражает» белое при
му
соприкосновении.
олово висмут или другой ста
Это
явле
ние называется оловянной чу-
можно
было,
добавив
в
билизатор.
На поверхности олова об
разуется
пленка
оксидов,
что
обеспечивает устойчивость
к
воздействию воздуха и воды.
Только при температурах, ко
торые превышают
150 °С,
оло
во начинает окисляться:
Sn + 0 2 = Sn02 •
Олово также вступает в ре
акцию с большинством неме
таллов при нагревании. При
этом
получаются
соединения
со степенью окисления
+4:
Sn + 2С12 = SnC14 •
Олово реагирует с соляной
кислотой и очень медленно
-
с концентрированной серной.
Также
при
нагревании
оно
вступает в реакцию с водными
растворами щелочей.
В глубине этого самого холодного континента погибла
экспедиция Роберта Скотта, возвращаясь с Южного полюса.
Одной из причин бЫllа оловянная чума.
Олово представляет собой
амфотерный мeтallll, то есть
растворяется и в кислотах,
и в щелочах. При этом
выделяется водород.
ВОПРОС46
Почему при низких температурах O.lloвo рассыпается
в порошок?
Металлы
89
Олово используется и в чистом виде, и в сплавах, например в
белой жести (луженом железе), в припоях для электроники, тру
бопроводах, подшипниках, покрытиях металлических изделий.
И, разумеется, как сплав с медью
-
бронза.
ВОПРОС47
Почему у олова много ста
бильных изотопов?
Консервные банки
делают из белой жести
(низкоуглеродистого железа),
которая является луженой,
то есть она покрыта тонким
слоем олова. Делается это для
защиты от коррозии.
Металлы
90
Металлическое
тому
его
олово
применяют
в
не
токсично,
пищевой
поэ
промыш
лую опасность, а станнан
род)
-
(оловянистый
ленности. Однако в виде паров и различных
ная пыль могут привести к станнозу
аэрозольных частиц
жению легких.
оно
представляет
нема-
водо
очень сильный яд. Пары или оловян
-
пора
ные руды обычно достаточно
концентрированы.
элемент
ралов,
р группы
туть
элемент
-
12-й
группы
П
группы)
содержащих
месторождения
(побочной под
Ртуть
большинства
мине
серу.
имеются
Ее
в
разных странах, в том числе и
в России . В словенском городе
пе
Идрия
добыча
ских элементов Д. И. Менделе
У ртути очень низкая
ся с
в. А самое крупное и
ева. Его атомный номер
температура плавления,
древнее
Обозначается
поэтому при комнатной
Амальдене (Испания).
риодической системы химиче
- 80.
символом Hg
Hydrargyrum).
(от латинского
Температура
ставляет
тура
плавления
-38,83
кипения
°С,
-
со
°С.
месторождение
-
в
ВОПРОС48
коре
- 83
мг/т. Однако ртуть
слабо
связывается
стабильных изотопов:
тами,
распространенными
199, 200, 201, 202, 204.
ведет
жидкостью.
У природной ртути есть семь
196, 198,
ртути
температуре она является
темпера
356,73
XV
с
элемен
в
Почему
ртутные
место
рождения в природе кон
центрированы:?
земной коре, и потому ртут-
Атом ртути.
Атомная .масса: 200,59 а. е . .м.
Электронная конфигурация: 2,
8, 18, 32, 18, 2
Этот металл при нормаль
ных условиях представляет со
бой
кость.
серебристо-белую
Она
способна
жид
образо
вывать со многими металлами
твердые сплавы
-
амальгамы.
Пары ртути очень ядовиты.
Ртуть известна с древности.
Содержание ртути в земной
Крупнейшее ртутное месторождение Альмаден разрабатывается
более
2000 лет.
Это промышленное предприятие, точнее его
инфраструктура, включено в Список Всемирного наследия
ЮНЕСКО.
91
Металлы
Бывало, что ртуть находи
ли
в
виде
горных
виде
ри
-
жидких
породах,
соединений
капель
но
-
чаще
Hg2Cl2 •
в
ке и азотной кислоте, при на
гревании также в серной кис
лоте.
Если
кинова
сульфида ртути
каломели
на
HgS
и
Ртуть обыч
300
нагреть
ртуть
до
°С, она реагирует с кисло
родом:
2Hg + 0 2 = 2Hg0.
но получали посредством об
киновари.
Если нагреть получивший
И сегодня этот металл добы
ся оксид до температуры выше
вают таким же способом или
340 °С, он разложится на ртуть
при
и кислород. Именно эта реак
жига
природной
помощи
металлотерми
ция представляет собой один
ческого метода:
HgS + 0 2 = Hg + S02 j,
HgS + Fe =Fesi + Hg.
из самых исторически ранних
способов
Пары ртути конденсируют
и собирают.
Ртуть
-
получения
кисло
рода.
Несмотря на токсичность,
малоактивный ме
ртуть
используется
талл. Она не реагирует с кис
в
лотами, которые не обладают
ртутных
окислительными
метичных
свойствами,
но растворяется в царской вод-
люминесцентных
широко:
лампах
термометрах,
в
и
гер
выключателях,
как
консервант для вакцин. Рань
ше
ее
применяли
еще
шире,
например в барометрах и ма
воnРОС49
нометрах,
Что такое амальrама?
и
поэтому
измеряется
ртутного
в
миллиметрах
столба.
пользовали
давление
для
Ртуть
Киноварь, несмотря на ее
токсичность, очень широко
применяли как краситель.
Использовали ее и в
Древнем Китае, где мастера
расписывали киноварью
прекрасные вазы.
ис
очистки
зо
ВОПРОС50
лота с помощью образования
ним,
Почему атмосферное Аав
при этом о токсичности ртути
ление измеряется в милли
и ее соединений было хорошо
метрах ртупiоrо столба?
амальгамы
-
сплава
с
известно. Также ее применяли
для золочения поверхностей и
для выделки фетра при произ
ся
водстве шляп .
для протравливания семенно
Каломель, сулема, мерти
олят
Киноварь.
и
другие
единения
токсичные
ртути
со
используют-
как
пестициды
и
средства
го зерна.
Ртуть даже в небольших ко
личествах
очень
вредна
Люминесцентная лампа, содержащая ртуть.
Видимый свет
Электрон
Фосфорное покрытие
Трубка
Аргон и пары ртути
Ртуть
Нить накала
для
Металлы
92
здоровья: она нарушает рабо
ту нервной, пищеварительной,
иммунной систем, повреждает
почки
и
кожу.
Очистку помещений
глаза,
легкие,
и
пред
метов
от
загрязнений
метал
ЧТО ДЕЛАТЬ, ЕСЛИ РАЗБИЛСЯ РТУТНЫЙ
rРАДУСНИК ИЛИ СОДЕРЖАЩАЯ РТУТЬ
ЛАМПОЧКА?
Лучше нсего 1 ,емеркур1на1,ию 11рово11.ит 11рофессио11алы,
llO::)Toмy, если
раJбило1
со11.ержащий
рту1ъ термометр
лической ртутью и источников
или лам11очка, 11а11.о нывести rп 11оме1це11ии 1н:сх лю11.ей и
ртутных
ЖИВОТl/ЫХ, llЛOTllO Jакрыт1. 11.вер1. и Jl{)]BOllИ ' IЪ в мчс
паров
меркуризацией.
называют
де
Широко
ис
-
11рис11.ут с11е1\иалис1ъ1 и очистит 1юмеще11ис. Ртуrъ можсоб1ыт1. и самим, 1ю :}ТО слож110. Работап, 11а11.о в реJи-
пользуют для демеркуризации
110
серу и хлорное железо
1ювых 1н'р•1ап-:ах, обуви и маске. Рту1ъ сле11.ует собрал, в
FeC13 •
Для ретуляции использова
банку с 1ю 1,ой с 1юмощ1>10 f)ума1 · и, скотча или 11111рица, а
ния и производства ртути суще
:Jaтel\1 С/J.<1'1Ъ ее в с11ециалы1ые службы. Пол 11уж110 вымы ·1ъ
ствует Минаматская конвенция
раствором
по
ртути
ный
-
межгосударствен
договор,
людей
защищающий
мар1-.н11\011ки
и
мылыю-со11.овым
раствором.
Но все шарики мож110 нросто не найти. Ifо::)тому лу•1111е
011ас1юе 11.ело 1,т1ер~пъ 11рофессио11алам.
и окружающую среду
от выбросов и высвобождений
ртути и ее соединений, которые
приводят к отравлению. Кон
венция с
2020 г.
изводство,
запрещает про
экспорт
и
импорт
нескольких видов содержащей
ртуть продукции,
ряда
в
том числе
люминесцентных
ртутных
термометров
и
ламп,
ВОПРОС
51
Что надо делать, если раз
бился Р'JУП1Ь1Й термометр?
тоно
метров (приборов для измере
ния давления).
Энергосберегающие лампочки
В ртутном термометре
содержат пары ртути, поэтому
содержится около
их нельзя просто выбрасывать,
но и такое количество
а надо сдавать в специальные
представляет опасность, если
места.
градусник разбился.
OTBETbl
8.
2 г ртути,
БлаrороДНЬIМи называют золото, серебро,
У металлов в кристаллических решет
платину, рутений, родий, палладий, осмий и
ках имеются свободные электроны, дви
иридий, потому что они не окисляются на
жущиеся под воздействием электрическо
воздухе и не подвержеНЬI коррозии.
rо поля.
9.
2.
вали землями, очень редкие.
1.
Пластичность обусловлена тем, что слои
атомов в металлах не разрываются, а только
Считалось, что их оксиды, которые назы
10. Химия началась тоrда, коrда люди научи
смещаются относительно друr друrа.
лись воздействовать оrнем на металл.
3.
11. Металлы являются восстановителями.
12. Больше всеrо в орrанизме человека рас
При взаимодействии с водой щелочНЬiе
металлы дают растворимые rидроксиды, то
есть щелочи.
пространен кальций.
4.
13.
ЩелочНЬiе металлы таким образом защи
Положение металла в электрохимиче
щают от воздействия водяных паров.
ском ряду напряжений определяется
5.
восстановительной способностью.
Для перехоДНЬIХ металлов характерна не
завершенность
тому же валеНТНЬiе электроны находятся у
14. Самый слабый восстановитель - золото.
15. В древности было известно семь метал
них на разНЬiх оболочках.
лов: медь, золото, серебро, железо, олово,
6.
электронной
оболочки,
к
ero
У полуметаллов металлическая электро
проводность и ковалентНЬIЙ тип связи.
7.
Соединения урана использовали в каче
стве красителя.
свинец и ртуть.
16.
Алхимики сделали немало открытий и
создали новые методы исследования, кото
рые вошли в химическую науку.
Металлы
17.
Это произошло в
XVIII в.
в связи с откры
тиями Лавуазье.
стре11КИ, это происходит, ecllИ они содержат
магнетит.
cuprum
-
происходит от назва
37.
В стаllИ содержится меньше уr11ерода
ния острова Кипр, где в древности добывали
до
2,14 %, в чугуне -
медь.
38.
Руду от примесей очищают с помощью
19. Потому ~о медь из-за своей мягкости до11-
карбоната кальция и карбоната магния.
го не мог11а по11Ностью вытеснить камень.
39.
18.
20.
Название
93
Медь начали впервые добывать из руды,
содержащей малахит.
бо11ее
2,14 %.
Же11езо реагирует с разбав11енными кис-
11отами, так как в э11ектрохимическом ряду
напряжений оно стоит до водорода.
Мышьяк ядовит, кроме того, при пере
40. В хо110ДНЬ1х концентрированных азотной
Пllавке он испарЯ11ся и качество СПllава ста
и серной кис11отах же11езу не дает раство
новИllось хуже.
ряться оксидная Пllенка. Однако в горячих
21.
22.
Цвет бо11ьшинства со11ей меди
-
синий
41.
ИllИ зе11еный.
23.
кис11отах оно растворяется.
Патина состоит из неско11ьких с11оев, она
Свинец встречается не то11ько в виде
сп11авов,
но
и
в виде интермета1111идов
-
содержит оксиды меди, а также карбонат
химических соединений, в то время как
меди, который представ11яет собой верхний
сплавы химическими соединениями не яв-
CllOЙ.
24.
11яются.
Примеси резко снижают э11ектрическую
Медь отвечает за перенос кис11орода у
мо1111юсков и Ч11енистоноrих.
26.
100 нм,
в про
ходящем свете бывает зе11еновато-синим.
В су11ьфате у по11овИНЬ1 атомов зо11ота
степень окис11ения
28.
+1, а у по11овины - +3.
3011ото растворяется в царской водке и
галенит.
44.
О11ово использовалось (и используется)
мя производства бронзы
45.
-
Ртуть можно превратить в зо11ото путем
СПllава с медью.
Амфотерность олова заключается в том,
~о оно растворяется и в кислотах, и в ще
лочах.
46.
При низких температурах белое олово
переходит в другую форму
се11еновой кис11оте.
29.
-
43. Для производства желтых красок исполь
зуют хромат свинца.
3011ото в виде тончайшей П11енки, то11-
щина которой не превышает
27.
Для получения свинца используют его
сульфид
проводимость меди.
25.
42.
-
серое олово,
чей удельный объем больше и структура
ядерной реакции, но никакого экономиче
предполагает большую хрупкость.
ского смыс11а это не имеет, потому ~о спо
47. Число протонов в ядре олова магическое,
соб СllИШКОМ дорог.
одно из тех, которые обеспечивают запол
30.
Цвет зо110ТЬIХ юве11ирНЬ1х изде11ий опре
де11яется примесями других мета1111ов.
31.
в
ность ядра.
Проба характеризует содержание зо11ота
сП11аве, из
которого производят юве11ир
48. Месторождения ртути концентрироваНЬ1,
потому ~о ртуть слабо связывается с распро
страненными в земной коре э11ементами.
ные изде11ия.
32.
ненность э11ектронной оболочки и стабиль
СеребряНЬlе изде11ия темнеют потому,
~о на них образуется налет малораствори
49.
Амальгама
-
это СПllав ртути с другим
мета1111ом.
В прошлом в барометрах использова
мого су11ьфида серебра.
50.
33. Адский камень - это нитрат серебра.
34. ДllЯ трав11ения испо11ьзуется такое свой
лась ртуть, и название сохранилось по тра
ство серебра, как его растворимость в ХllО
51.
риде же11еза.
брать шарики ртути в банку с водой и сдать
диции.
Следует надеть резиновые перчатки, со
Чтобы обеззараживающий эффект по11-
ее в специальНЬ1е с11ужбы, а комнату вымыть
ностью прояви11ся, нужно так много сере
раствором марганцовки и мыльно-содовым
бра, что вода становится непригодной мя
раствором. Но лучше всего сразу выйти из
питья.
комнаты, ПllОТНО закрыть дверь и вызвать
35.
36.
Же11езоруДНЬ1е
месторождения
мож
но обнаружить по 0ТК11онению магнитной
МЧС. Сбор ртути
-
сложное и опасное дело,
лучше доверить его специалистам.
94
Неметаллы
НЕМЕТАЛЛЬI
Осо6енности неметаnnов
и
еметаллы
которых
химические
на
внешнем
элементы,
у
энергетическом
уровне больше электронов, чем у метал
ВОПРОС1
Кахие связи образуют
с Аруrом и
Apyr
лов. Поэтому они легче присоединяют допол
Аруrими 9Аемеиrами атомы неметаллов?
нительные электроны и проявляют большую
В чем ЗАесь заключается отличие их от
окислительную активность. С атомами других
металлов?
элементов и друг с другом они образуют кова
лентные связи, в отличие от металлов, для кото
рых характерна ионная связь.
Неметаллы бывают газами (инертные газы,
кислород, водород, фтор, хлор, азот), тверды
ми веществами (сера, селен, теллур, фосфор,
мышьяк, углерод, бор, кремний, йод, астат) и
жидкостью (бром) . В виде молекул
веществ
-
в
природе
можно
-
простых
встретить
азот,
кислород и серу. Но чаще они существуют в
виде соединений, как вода, минералы, различ
ные горные породы. Наиболее распространен
ными в земной коре являются кислород, крем
ний и водород, самыми редкими
-
мышьяк,
селен, йод.
ВОПРОС
:Z
Какой неметалл в нормальных условиях
является ~остью?
ВОПРОСЗ
В морских водорослях содержится
до
1 % йода -
одного из галогенов,
Кахие 9Аементы самые распространен
ные в земной коре?
который необходим для нормального
функционирования щитовидной железы.
В то же время свободный йод ядовит.
Шестнадцатое место по распространенно
сти в земной коре и шестое
-
в природных
водах занимает сера. Ее можно встретить и в
свободном виде, и в виде соединенией, таких
как свинцовый блеск, железный колчедан, ки
новарь и др.
Сера также имеется в природных газах, угле,
нефти . Она важна для жизнедеятельности орга
низмов, включена в состав множества белков.
Для прижигания ран используется спиртовой
раствор йода с добавлением его соли
-
йодида
калия. Настоящий цвет свободного йода
фиолетовый.
-
Неметаллы
Кремний
по
распростра
ненности в земной коре нахо
дится
на
втором
кислорода,
месте
его
примерно равно
после
содержание
95
ВОПРОС4
Какие соединения серы вы
можете назвать?
27,6-29,5 %.
В морской воде концентрация
кремния
- 3 мг/л.
В природе кремний обыч
но находится в виде кремнезе
ма. В основе этого соединения
лежит диоксид кремния
Si02 •
Кремнезем составляет пример
но
12 % от
земной коры. Диок
Ру да самородной серы
сид кремния образует извест
на арагоните (карбонате
ный всем и повсеместно рас
кальция). Большие скопления
пространенный песок, а также
самородной серы встречаются
не так уж часто, обычно она
присутствует в некоторых
рудах.
кремень (не путать с кремни
ем!), полевые шпаты, кварц и
кварциты.
Кристаллическая решетка
кремния
-
одного из самых
распространенных элементов
в земной коре.
Неметаллы
96
ВОПРОС
5
В чем раз:mща между крем
нием и кремнем?
Инертные,
ные,
газы
тому,
или
благород
называются
что
они
так по
химически
не
активны. Это гелий, неон, ар
гон,
криптон, ксенон и радон.
Правда, при некоторых усло
виях они
фтором
могут реагировать
с
самым активным из
-
галогенов. Из инертных газов
широко
используется
например
при
аргон,
сварке,
также
для того, чтобы изолировать
от
воздуха
металлы,
которые
при нагреве вступают в реак
цию
с
кислородом
и
азотом.
Аргон применяют также в лю
минесцентных лампах, стекло
пакетах, для обработки жид
кой стали.
Гало гены, что означает «рож
дающие соль » ,
ты,
-
это элемен
принадлежащие
к
17-й
группе (или главной подгруп
пе
VII группы)
системы
периодической
химических
элемен-
ВОПРОС&
Чем кварц отличается от кремнезема?
ВОПРОС7
С каким элементом могут вступать в реак
цию инерТНЬiе газы?
тов. Название это не случайно . Известно, что са
мая распространенная соль
-
это соединение
натрия с хлором. К галогенам относятся фтор
F,
хлор
-
Cl,
бром
газы, бром
-
Br,
йод
1,
астат
At.
Фтор и хлор
жидкость, йод и астат
-
твердые
вещества.
Галогены вступают в реакцию почти со все
ми простыми веществами, исключение состав
ляют некоторые неметаллы.
Инертный газ аргон применяется
в промышленности, в том числе при сварке.
тивность
галогенов
снижается
Химическая ак
с
увеличением
порядкового номера. Таким образом, из пере-
Неметаллы
численных
активный
активный
-
галогенов
Флюорит
самый
CaF2,
фтор, самый не
-
97
фторид кальция
светится в темноте при
нагревании. Он может быть
астат.
окрашен в разные цвета
r
и нередко, несмотря на свою
хрупкость, ценился за красоту
дороже золота. В Англии
добывали сине-фиолетовый
флюорит, который прозвали
Синим Джоном. Из него
вырезали различные поделки.
Содержащие фтор соединения
входят в состав некоторых
зубных паст. Считается, что их
использование укреПllяет зубы
и предотвращает кариес.
ВОПРОС В
Какое
соединение
фто
ра называли Синим Джо
ном?
ВОПРОС9
Какой Эllемент в свободном виде очень ядовит, а в соеди
нении явllЯется одним из важнейших продуктов питания?
98
Неметаллы
Водород
в
одород
это
-
элемент
первый
периодической
сисrемы химических эле
ментов .
Его
обозначают
волом Н (от латинского
сим
hydro-
genium,
что и означает «рож
янии . При темпераrуре ниже
дающий воду»). Водород пред
-259,2
сrавляет собой газ без цвета,
водород, похожий на снег.
запаха и вкуса. Его темпераrура
кипения
- -252,76 °С. Если тем
Молекулярный водород Н 2
ное
ля, но выше
та
°С, то водо
род находится в жидком
cocro-
-
относительно редкий газ. Глав
пераrура ниже этого показате
-259,2
°С образуется твердый
соединение
-
этого
элемен
вода, и значение ее невоз
можно переоценить.
Электрон
.~
Протий ;н
Аейтерий ~Н
Тритий ~Н
У водорода три изотопа: протий, состоящий из одного протона и электрона; дейтерий, где в ядре
кроме протона есть нейтрон; и тритий с двумя нейтронами и одним протоном в ядре.
ВОПРОС
10
При каких ус11овиях водо
род может стать твердым?
Получен
конце
водород
XVIII в .
был
в
Английский фи
зик и химик Генри Кавендиш
в
1766
г. назвал его горючим
воздухом. Французский химик
Антуан Лавуазье совмесrно с
инженером
1783 г.
над
Жаном
Мёнье
в
разложили водяной пар
раскаленным
произвели
анализ
железом
его
и
сосrав
ляющих.
Сегодня в
промышленно
сти водород получают из водя
ных
паров,
например
пропу
ская их над раскаленным кок
сом при температуре
1000
°С,
конверсией с водяным паром,
электролизом
водных
раство
ров солей и другими способа
ми. В лабораторных условиях
Неметаллы
ВОПРОС
99
11
Какие космические тела состоят в основ
ном из водорода?
водород можно получить, воздействуя кислота
ми на металлы. Например:
в
Zn + H 2S04 = ZnS04 + H 2 j.
Водород - самый легкий из всех газов, он
14,5 раза легче воздуха. Водород при смеси
с воздухом, а также с кислородом (в объемном
соотношении
смесь
-
2 : 1)
образует взрывоопасную
так называемый гремучий газ. Ког
да-то водородом наполняли воздушные шары
и дирижабли, но произошло несколько ката
строф из-за его взрыва, и теперь воздушные
шары наполняют гелием.
Водород не ядовит, он хорошо растворяется
в этиловом спирте, а также в ряде металлов
железе,
никеле,
палладии,
титане,
-
платине.
Один из способов получения водорода.
Иногда водород, растворяясь в стали или чугу
Для этого нужны кусочки цинка и соляная
не, может привести к их разрушению, потому
кислота. При реакции между ними выделяются
что взаимодействует с углеродом, входящим в
пузырьки газа
-
водорода.
состав этих сплавов.
ВОПРОС
ВОПРОС
12
Почему воздушные шары перестали за
полнять водородом?
13
Чем водород может навредиrь стали?
Неметаллы
100
При
обычных
температу
рах водород реагирует только
с очень активными металлами,
например с кальцием, образуя
гидрид кальция. В этих же ус
ловиях водород вступает в ре
акцию лишь с одним неметал
лом,
самым
логенов
активным
из
га
фтором. При этом
-
обра зуется фтороводород.
Молекулярный водород ис
пользуется в органическом син
тезе
для
восстановления
ганических
процессы
ор
соединений .
называют
Эти
реакция
ми гидрирования.
Атомарный водород при
меняется для атомно-водород
ной сварки, охлаждения гене
раторов,
во,
в
как
ракетное
производстве
топли
пластмасс,
аммиака, мыла, в газовой хро
матографии . Он также приме
няется при производстве мар
гарина из жидкого раститель
ного масла. Сегодня изучается
использование водорода
честве
горючего
для
в
ка
автомо
билей, потому что при этом
будет выделяться обычная чи
стая вода .
ВОПРОС14
Какой ПИIЦевой продукт
производится с помощью
водорода?
В водородном
топливном элементе
химическая энергия,
заключенная
в водороде и
кислороде,
преобразуется
непосредственно
(без горения)
в электрическую.
Неметаллы
Кисnород
в
род
-
кислоту»).
химически
активный
газ, не имеющий цвета, вкуса
дом. Кислород
и запаха. Молекулярный кис
VI
подгруппы
периодической
-
эле
группы)
системы
хи
лород
двухатомный.
ратура
плавления
-218,35
ния равна
ный номер
- 8.
го
символом
О
Обозначается
(от
латинского
oxygenium, что означает «рожВОПРОС
Темпе
составляет
°С, температура кипе
мических элементов. Его атом
-182,96 °С.
кислорода
У жидко
светло-голубой
цвет, а твердый превращается
в светло-голубые кристаллы.
15
Какой цвет у жидкого и твердого кисло
рода?
Кисло
се мы дышим кислоро
мент 16-й группы (глав
ной
дающий
А том кислорода.
Атомная масса: 15,999 а. е. м.
Электронная конфигурация: 2,
6
101
102
Неметаллы
воnРОС1&
Что иэ себя представ11Яет
запах rрозы?
Кислород
элементов
больше
Стабильный
других
распространен
в
земной коре. Главным обра
Кислород-17
Кислород-18
Кислород-16
зом он представлен там в виде
соединений
(47 %),
силикатов.
В
в основном
воде
содержа
ние связанного в ее молекулах
кислорода
примерно
8
е в
равно
составе
присутствует
многих
в
клетках,
главную
роль
в
где
играет
процессе
ды
хания. На его долю приходит
ся
25 %
клетке
составляет
8
Стабильный
Стабильный
Электрон
-1 (орбита)
а
по
массе
он
65 %.
Газообмен в орrанизме человека. Кислород
поступает с воздухом в леr:кие, затем в кровь,
эритроциты которой переносят
ero по всему
орrанизму. Из орrанизма с выдохом удаляется
уrле:кислый rаз.
Диоксид
углерода
(СО)
'
Органы
•
Протон+ 1 (ядро)
Стабильные изотопы :кислорода.
всех содержащихся в
атомов,
10
органических
веществ. Он имеется во всех
живых
•
8
85,82 %.
Кислород
8
а Нейтрон
О (ядро)
W
Неметаллы
ВОПРОС
103
17
Почему увеличение концентрации кисло
рода в атмосфере назвали катастрофой?
В настоящее время в промышленности кис
лород получают из воздуха. В лабораторных
условиях немного кислорода можно получить,
нагревая перманганат калия КМn0 4 :
2КМn04 ~
ВОПРОС
K 2Mn04 + МnО2 + 0 2 j.
Один из способов лабораторного получения
18
кислорода. Хлорат калия (бертолетова соль)
Какую ро11Ь диоксид марганца играет в
КС10 3 разлагается с образованием
лабораторном получении кислорода?
Оксид марганца
KCl и 0 2•
(IV) Mn02 выступает как
катализатор.
ВОПРОС
19
Где применяют углекис
llhIЙ
газ
для
получения
кислорода?
Кислород используется в ка
честве пищевой добавки Е948
(как упаковочный газ и пропел
лент).
Этот элемент применяется
также в химических синтезах в
промышленности .
Широко используется кис
лород в медицине: как компо
На Международной космической станции (МКС) кислород
обычно получают при помощи реакции между пероксидом
натрия и углекислым газом, который выдыхают люди.
нент дыхательных газовых сме
сей, для легочной вентиляции,
в
процедурах
по
улучшению
обменных процессов. Лечение
кислородом полезно при сер
Сам кислород обладает слабой растворимостью в воде и
спирте, вступает в реакцию со всеми простыми веществами, за
исключением инертных газов и золота.
Применяется кислород при производстве
стали, сварке и резке металлов, в качестве окис
лителя для ракетного топлива. Один из самых
мощных
окислителей
ракетного
топлива
-
смесь жидкого озона и кислорода.
Кислородные маски применяют
для предотвращения кислородной
недостаточности и в медицине, и в авиации.
дечно-сосудистых и других за
болеваниях.
104
Неметаллы
Природа rорения
оксид азота и разложил . Этот газ Шееле назвал
в
была издана в
начале
вали
XVIII
в. процессы горения толко
следующим
образом.
Считалось,
что в горючих веществах якобы содер
жится горючая субстанция
-
огненным воздухом и описал в книге, которая
1777
г. А поскольку Пристли со
общил о своем открытии раньше, ему и отдан
приоритет.
флогистон. При
горении флогистон высвобождается. Металлы
состоят из « Земли »
оксида металла и флоги
-
стона. Правда, при прокаливании металла его
масса увеличивается. Но это объясняли тем, что
флогистон имеет отрицательную массу.
ВОПРОС20
Как сторонники теории ф11оrистона объ
ЯСНЯ11И
уве11ИЧение
массы
мeтalllla
при
прокал.ивании?
Разделение оксида ртути
на кислород и ртуть
путем нагревания.
Памятник шведскому химику Карлу Вильгельму
Шееле
(1742-1786)
в Стокгольме.
Отказу от теории флогис
тона способствовало открытие
кислорода.
И Пристли, и Шееле сообщили о своих от
Сегодня считают,
крытиях Антуану Лорану Лавуазье, выдающе
что кислород открыл англий
муся французскому химику. В
ский химик Джозеф Пристли
доказал, что кислород представляет собой со
1
августа
1774
оксид ртути
крытом
г. Он разложил
в герметично
сосуде,
с
за
веществ.
сильной линзы направляя на
Антуан Лоран
него солнечные лучи.
Лавуазье
Чтобы получить кислород, Пристли
использовал линзу большого увеличения для
нагревания оксида ртути в закрытом сосу де.
(17431794), французский
химик, автор многих
открытий и создате11Ь
новой химической
номенклатуры. БЫ11
лород
удалось
получить
г. Лавуазье
ставную часть воздуха, кислот и многих других
помощью
За несколько лет до Пристли, в
1775
1771
шведскому
г., кис
казнен во время
химику
Великой французской
Карлу Шееле . Он применил прокаливание се
литры с серной кислотой, получил в результате
рево11Юции за участие
в Г енера11Ьном
откупе.
Неметаллы
Лавуазье сжигал различные вещества, взвешивая их до и по
сле эксперимента. Вес золы был больше первоначального веса
ВОПРОС
105
21
вещества. Лавуазье доказал, что при горении происходит хими
Как Лавуазье объяснил уве
ческая реакция, то есть окисление элемента, масса полученного
личение массы вещесгв по
вещества увеличивается именно за счет окислителя
да, а вовсе не по надуманной причине
массе несуществующего флогистона.
-
-
кислоро
якобы отрицательной
сле горения?
106
Неметаллы
Соединение двух неметаnnов,
6ез котороrо невозмоJКна JКизнь
р
ассказывая о неметаллах, особенно о кис
лороде и водороде, нельзя не вспомнить
об особом их соединении
-
воде
-
од
ном из самых распространенных веществ на на
шей планете (составляет
0,05 %
ее массы). Без
воды жизнь на Земле была бы невозможна .
Атмосфера
Молекула воды состоит из атома кислорода
и двух атомов водорода, которые объединены
ковалентной связью.
Вода в твердом состоянии
образном
-
-
лед, а в газо
пар . Она хорошо растворяет по
лярные вещества,
то есть
заряженные и
поло
жительно, и отрицательно. Каждая молекула
такого
вещества
окружается
множеством
не
больших молекул воды. Атомы кислорода при
тягиваются положительно заряженными участ
ками этого вещества, а атомы водорода
-
отри
цательно заряженными. В живых организмах
это свойство активно используется. Растворы
различных веществ в воде вступают между со
бой во взаимодействие и реагируют.
Вода является основой жизни на Земле. Она
передает тепло, растворяет и переносит колос
сальные массы химических веществ и элемен
тов, разрушает и перераспределяет горные по-
ВОПРОС22
За счет чего вода яв11яется хорошим рас
творите11ем по11ярНЬIХ веществ?
Неметаллы
роды, образует формы рельефа, создает осадочные гор
ные породы и полезные ископаемые, участвует в ряде
107
РОЛЬ ВОДЫ В ОРГАНИЗМЕ
метеорологических (осадки, туманы, облака) и гидро
Человек сможет прожить без воды
логических (течения горизонтальные и вертикальные,
всего
волнение, давление, перемещение русел рек, создание
мальной работы всех систем ему не
водоемов и др.) процессов, является средой жизни для
обходимо как минимум
множества организмов .
в день. В ода доставляет в клетки
несколько
организма
и
Для
1,5
питательные
отходы
нор
11 воды
вещества
жизнедеятель
ности. Кроме того, она участвует в
ВОПРОС :ZЗ
процессах терморегуляции (пото
отделения) и дыхания.
СкоllЬко воды в день нужно человеку?
KPYrOBOPOT
выводит
суток.
ВОДЫ В ПРИРОДЕ
Вода постошпю совершает круговорот меж
ется
ду морями, атмосферой и сушей, создавая
озера. И все начинается сначала. Так проис
условия,
ходит круговорот воды в природе.
в
которых
может
существовать
и
в землю,
возвращается в моря, реки
и
развиваться жизнь.
Большая часть пара образуется над Миро
Под лучами солнца вода испаряется и под
вым океаном. В ода в нем соленая, а та, кото
нимается в воздух. Там капельки воды соби
рая испаряется с его поверхности, пресная .
раются в облака и тучи. Они выпадают на
Таким образом, океан
землю дождем, снегом или градом, которые
пресной воды, без которой жизнь на Земле
снова превращаются в воду. Вода впитыва-
невозможна.
Конденсация - · - ·
Круговорот воды
в природе.
и.ли снега
-
мировая фабрика
108
Неметаллы
Азот
А
-
зот
элемент 5-й груп
пы
(главной
пы
V
подгруп
группы)
перио
дической системы химических
шие белоснежные кристаллы.
ВОПРОС
Температура его кипения со
ставляет
-195,8
температуры
25
°С. Ниже этой
Почему азот в нормаль
азотбесцветная
ных условиях
-
газ?
жидкость, похожая на воду. И
твердый, и жидкий азот, взаи
модействуя с воздухом, погло
Приготовление мороженого
щают из него кислород.
с помощью жидкого азота.
элементов Д. И. Менделеева.
Его атомный номер
- 7. Обо
N (от ла
nitrogenium, то есть
значается символом
тинского
«рождающий
литрой
селитру»;
называли
се
некоторые
соли азотной кислоты.
Молекулярный азот пред
ставляет
собой
молекулу
N 2,
двух атомов
из
соединенных
тройной связью.
ВОПРОС
Почему
24
азот
называется
по-латыни
nitrogenium?
1772
Азот в
Молекула азота состоит
объема,
таким
образом,
ри Кавендиш, Джозеф Прист
азот
атмосферы. На суше он и его
ко они были сторонниками те
соединения составляют
главный
компонент
75,6 %
ории флогистона и не смогли
по массе. Он необходим всем
понять, что выделили простое
живым
вещество. Название «азот», то
входит
есть «безжизненный», предло
кислот и белков.
организмам,
в
состав
Иногда
при
так
как
нуклеиновых
разложении
ей номенклатуры, потому что
органики
образуются
этот элемент не поддерживает
ные
держат азот. Одно из таких
ископаемые,
полез
которые
со
является
ни горения, ни дыхания. Позд
неполярной, поляризуется она
нее оказалось, что азот жизнен
ископаемых
слабо, поэтому молекулы его
но необходим всем
литра, в состав которой входят
тоже
слабо
азота
от
ли, Даниель Резерфорд, одна
жил Антуан Лавуазье для сво
из двух атомов.
Молекула
г. открыли Ген
организ
-
чилийская се
взаимодействуют
мам, но название сохранилось.
нитрат натрия
между собой. Вот почему азот
Существует также версия, что
меси других соединений.
в нормальных условиях
-
Цвета,
он не
в Средние века и обозначало
имеет. Температура его плав
первичную материю металлов.
ления
вкуса
и запаха
- -209,86
газ.
°С. При тем
слово
это
Азот
применялось
является
одним
распространенных
NaN03
и при
еще
из
пературе ниже этого значения
самых
азот твердый. Он похож на снег
ментов нашей планеты. Содер
эле
или представляет собой боль-
жание его в воздухе
- 78,09 %
ВОПРОС:!&
Почему
азот
необходим
для живых организмов?
Неметаллы
109
7
о в
7
Стабильный
Азот- 1 5
Азот- 16
Азот-14
7
Атом азота.
А томная масса:
14,007 а.
е. м .
Электронная конфигурация:
2, 5
7
0 9
7
7
7
Стабильный
У природного азота имеются два
стабильных изотопа
- 14 и 15.
Изотоп-16 радиоактивный.
. Электрон -1 (орбита)
,
Протон+ 1 (ядро)
Нейтрон О (ядро)
110
Неметаллы
N2
-
ВОПРОС
молекулярный азот
:Z7
Какие живые орrанизмы
преобразуют азот в
ero со
единения?
Степени окисления азота в
соединениях равны
О,
+1, +2, +3, +4, +5.
ленности
азот
разложением
-3, -2, -1,
В промыш
получают
воздуха,
как
так
и
другими методами. В лабора
торных условиях его
извлека
ют также разложением азидов
металлов, соединением дихро
мата
калия
и
сульфата
ам-
Неметаллы
мания,
разложением
нитрита
аммония.
Сам азот достаточно инер
тен, поэтому при нормальных
условиях
он
вступает
в
реак
цию только с самым активным
из металлов
-
литием . При
нагревании он взаимодейству
ет с некоторыми другими ме
таллами и неметаллами. При
этом образуются нитриды.
ВОПРОС
28
С каким металлом азот ре
агирует при нормальных
условиях?
111
112
Неметаллы
Азот применяется чрезвы
чайно широко. Из соединений
азота самое большое практи
ческое значение имеет нитрид
водорода,
или
аммиак,
NНЗ'
который получают при помо
щи
реакции
том.
водорода
Производство
в мире составляет
с
азо
аммиака
150
млн т в
год. Главным образом он ис
пользуется
для
производства
азотных удобрений
-
нитрата
и сульфата аммония, мочеви
ны, а также для получения по
лимеров, взрывчатых веществ,
соды, азотной кислоты и дру
гих продуктов .
Несмотря на то что нитра
ты, то есть соли азотной кис
лоты,
используются
как
удо
брения, это приводит к про
блемам. Избыток нитратов в
пище вреден, и потому их со
держание тщательно отслежи
вается.
Анализ содержания нитратов в различных средах.
ВОПРОС29
напитков,
Действительно, применение
чтобы создать в мягкой таре
азота поистине всеобъемлюще,
Какое из соединений азо
избыточное давление и инерт
и для жизни он более чем необ
та имеет самое большое
ную среду.
ходим во всех своих видах.
и
негазированных
значение?
ВОПРОС30
Какие удобрения произ
водят из аммиака?
Жидкий азот используется в
качестве хладагента, при крио
терапии
(лечении
холодом).
С его помощью также проду
вают трубопроводы,
создают
в шахтах среду, безопасную от
взрывов,
синтезируют
разно
образные соединения. Он яв
ляется пищевой добавкой Е941
(в качестве газовой среды для
упаковки
и хранения
продук
тов). Жидкий азот также при
меняется
при
разливе
масел
В биологии и медицине жидкий азот используется для хранения
клеточных ку ль тур и других биологических объектов.
Неметаллы
ЭФФЕКТЫ ЗАМОРОЗКИ
В
кнно нередко
живания требуется вре:-.ш. :И:-.1ешю поэто:-.1у
показывают воз:-.южносп1
невоз:-.южно за:-.юрозить в жидко:-.1 азоте жн
вое
жидкого азота как вещества, с по:-.ющью ко
торого :-.южно :-.1гновенно за:-.юрозить
ные
объекты.
Однако
это далеко
так.
у элемент
глерод
химический
14-й
группы
(главной подгруппы
1791
углерод
был
г. английским
фосфора
над
У
радиоактивного
изотопа
основан метод радиоугле
кристаллического угле
ется символом С (от латинско
рода существует множество ал
го
лотропных модификаций, са
-
в состав органических веществ
мые известные из которых
и,
ор
алмаз и графит; надо упомя
ганизмов. Однако в атмосфере
нуть еще и фуллерен, гр а фен,
и гидросфере он содержится в
нанотрубки. Существует так
виде углекислого газа со2.
На образовании и рас
прокаленным
фосфат кальция.
живых
паде
13.
родного датирования .
акции образовались углерод и
соответственно,
и
том, который пропускал парьi
мы химических элементов. Его
Углерод входит
12
14С
группы) периодической систе
carboneum).
благополучно
химиком Смитсоном Теннан
мелом. В результате этой ре
- 6. Обознача
пото:-.1
ни будут повреждены.
IV
атомный номер
чтобы
нерав110:-.1ерной, и внутренние органы и тка
Свободный
получен в
существо,
раз:-.юрозить. За:-.юрозка получится с,111шко:-.1
круп
не
У азота низкая теп11ое:-.1кость, 11 для за:-.1ора-
Yrnepoд
113
же аморфный углерод в виде
угля и сажи .
У природного углерода име
ются два стабильных изотопа
-
Антрацит
-
лучший из сортов
каменного угля.
Углеродная
Атом углерода.
Атомная масса: 12,011 а. е. м.
Электронная конфигурация: 2,
ВОПРОС
нанотрубка
-
одна
из а1111Отропных
4
31
модификаций углерода.
воnРОСз2
В виде какоrо соединения
Какой уr11ерод испо11Ьзуется А.l1Я датировки архео11оrиче
уr11ерод содержится в ат
ских
мосфере и rидросфере?
ЖИВОТНЬIХ и растений?
находок,
старИIПIЬIХ предметов,
остатков
древних
114
Неметаллы
Неметаллы
115
загрязнение воздуха. В наши дни атмосферу в ос1ю1шом
•••
•
.
•••
загризншот окись углерода и углекислый га :J. Для того
Вых 1101111ыс l ' <НЫ ШIЛШОТОI
УГЛЕКИСЛОТА В АТМОСФЕРЕ
Концентрация углекислого газа в атмосфере менилас1,
всегда, и до появления человека тоже. Однако в
XIX
в. в
связи с бурным развитием промышленности, котораи
стала использовать каменный уголь как опю1шой вид то
нлива, и быстрым ростом городов началоп. интенсивное
чтобы уменьшить их содержание в атмосфере, 11еобхо
димо высаживать леса и совершенствовать лви1 · атели
.
"
"
11ро(\уктами ОКИС 11l'llИИ и
lll'llO ;JllOIO
lTOJЫllИИ y1'ЛCIIO (\Op0 1\llOJ ' O TOllllИll.l.
В большинстве соединений углерода,
главным образом в углеводородах, связь
ковалентная. Простые двойные и трой
ные
связи
атомов
углерода
между
со
бой прочны. Из этих атомов образуют
ся устойчивые цепи и циклы, и потому
существует множество углеродсодержа
щих соединений, которые изучает орга
ническая химия.
Углерод проявляет степени окисле
ния
+4
(в СО 2 ),
-4
(в СН4 ), реже
СО и карбонилах металлов),
+3
- +2 (в
C2N 2).
(в
Сгорая в кислороде, углерод дает угар
ный газ СО и углекислый газ СО 2 • При
реакции последнего с водой получает
Доломитовые Альпы
-
горный массив в Восточных
Альпах, назван так по характерной для них горной
породе. И горы, и порода получили свои наименования
ся слабая угольная кислота Н2 СО3 • Она
в честь французского геолога Деода де Доломье,
образует соли
который их исследовал.
-
карбонаты. Наиболее
распространенными на Земле являются
карбонаты кальциЯ (мел, мрамор, из
вестняк) и магния (например, доломит).
ВОПРОС
Какие
33
минералы
содержат
со11И
уrольной кис.llоты?
Углерод при нормальных темпера
турах
химически
температуру
инертен,
повысить,
однако
он
если
проявляет
себя как сильный восстановитель. Актив
нее всего аморфный углерод, менее ак
тивен графит, и на последнем месте по
активности стоит алмаз.
ВОПРОС
34
В каких видах тоП11.ИВа содержится
yr.llepoд?
116
Неметаллы
Использование графитовых
электродов позволяет
сваривать заготовки из любых
металлов и сплавов.
Графит Применяется
при
производстве карандашей, как
смазка при низких и высоких
темпераrурах.
Высокая
элек
тропроводность позволяет из
готавливать
ды,
а
из
него
высокая
-
плавления
электро
темпераrура
тигли для залив
ки металлов .
Исключительная твердость
алмаза
вать
позволяет
его
в
качестве
использо
незамени
мого абразивного материала.
У шлифовальных насадок бор
машин есть алмазные насадки.
Алмаз считается драгоценным
камнем.
Этим польза углерода не
исчерпывается . Например, ак
тивированный
уголь
(карбо
лен) применяется при отрав
лениях
для
выведения
токси
нов из организма. И, разуме
ется, углерод
-
Ограненный алмаз
неотъемлемая
составляющая стали и чугуна.
бриллиант.
Фосфор
ф
осфор элемент
фосфатов кальция входят фос
форный ангидрид Р 4О 10 и дру
химический
15-й
гие соединения.
Фосфор
группы
(или главной подгруп
пы
химических
открыл
гамбург
ский купец Хеннинг Бранд в
группы) периодической
V
системы
-
это драгоценный камень
1669
ся
элемен
тов Д. И. Менделеева. Его атом
г. Разорившись, он занял
алхимией,
пытался
полу
чить золото и проводил опыты
ный номер
- 15. Обозначается
с человеческой мочой. Купец
символом
Р
думал, что она
phosphorus,
(от
латинского
то есть «светонос
ный») .
В земной коре фосфор со
ставляет
есть
0,08-0,09 % массы,
достаточно
то
лотистым
нейшими из которых являют
активен
ся апатит
только
Ca5 (P04MF, ОН, Cl)
и
в виде соединений. Известно
фосфориты,
примерно
к группе апатитов, куда кроме
190 минералов, важ-
хожее на воск вещество, кото
рое светилось в темноте. Бранд
распростра
встречается
поскольку
мочу, он получил белое, по
2, 8, 5
нен . При этом он химически
и
цветом,
содержит золото . Выпаривая
Атом фосфора.
Атомная масса: 30,973 а . е. м .
Электронная конфигурация:
обладает зо
принадлежащие
дал
этому
phosphorus
реводе
с
веществу
название
miraЬilis, что в пе
латинского
«чудотворный
означает
носитель
све-
Неметаллы
117
Продукты, содержащие фосфор.
ВОПРОС
та».
Это
событие
35
Встречается
интересно
тем, что фосфор оказа.Лся пер
11и
фосфор
в свободном виде?
вым элементом, чье открытие
точно датировано.
В наши дни фосфор полу
ВОПРОС
чают из апатитов и фосфори
тов,
при
1600
Из каких минермов по11у
которые вступают в реак
цию с коксом
и
кремнеземом
температуре
36
Апатит.
чают фосфор?
примерно
°С:
2CaiP04) 2 + lOC + 6Si02
+ lOCO + 6CaSi03 •
---+
---+ Р 4
Фосфор взаимодействует с
водой,
щелочами,
кислоро
дом, вступает в реакцию с не
металлами. Со многими неме-
таллами
он
взаимодействует
Фосфорит.
как окислитель, с некоторыми
металлами
витель. При
-
как
восстано
этом образуют
ся фосфиды. Вода и кислоты
разлагают фосфиды, при этом
получаются фосфины. Воздей-
ствие
сильных
окислителей
превращает фосфор в фосфор
ную кислоту:
ЗР+5НN03 +2Н20=3Н 3 Р04 +
+SNO.
Молекула фосфорной кислоты.
118
Неметаллы
ВОПРОС
37
С чем фосфор реагирует
ш окис11ИТе11Ь, а с чем
ш восстановитеllЬ?
У
элементарного
фосфо
ра при нормальных условиях
имеется
несколько
аллотро
пических модификаций с раз
ной температурой плавления.
Сегодня
принято
четыре
такие
белый,
красный,
различать
модификации:
черный
и
металлический фосфор, при
чем самый активный и ядови
тый
-
белый, а самый неак
тивный
черный. Ядовитость
-
фосфора в прошлом позволя
ла использовать его для произ
водства отравляющих веществ.
Белый фосфор горит даже под
Черный фосфор
-
самая
воздуха
стабильная и химически неак
ВОПРОС38
он окисляется при комнатной
тивная форма. Он не растворя
Какой фосфор 6011.ее ак
температуре и светится блед
ется ни в воде, ни в органиче
тивный
ских растворителях,
красный Иl1И беllЬIЙ?
водой.
Кислородом
но-зеленым
ление
-
светом
называется
это яв
хемилюми
400
ресценция»
и
неверное).
Жел
горит
в кислороде при температуре
несценцией (название «фосфо
тым фосфором называют не
но
°С. Он похож на графит
тоже
проводит
электриче
ский ток.
В живых организмах роль
очень ядовит. Его горение со
фосфора очень велика. Он вхо
провождается
дит в
пламенем,
ярко-зеленым
при
этом
выде
ляется густой белый дым
мелкие
частички
-
декаоксида
тетрафосфора Р4 010 • Красный
ВОПРОС
состав нуклеотидов,
.ЯДОВИТЫЙ
39
Какая реакция происхо
дит
очищенный белый, он также
И
при
сжигании
спи
чек?
ну-
клеиновых кислот, различных ферментов и, что очень важно, в
состав АТФ
-
аденозинтрифосфорной кислоты, отвечающей за
производство энергии.
Из соединения фосфора
-
гидроксилапатита 3Са3 (РО4) 3 Х
фосфор образуется из белого
Х Са(ОН) 2 состоят кости. Фторапатит
при нагревании, воздействии
став зубной эмали. Фосфорный обмен регулируют гормоны и
света и ионизирующего излу
витаминD.
чения. Это сложный полимер
с формулой
название,
оттенки
у
от
Pn.
Несмотря на
него
встречаются
пурпурно-красно
го до фиолетового. Намного
менее активен, чем белый, рас
творяется
только
в
расплав
ленных свинце и висмуте. При
нагревании красный фосфор
испаряется,
пара
при
охлаждении
превращается
главным
образом в белый фосфор.
Ca1i P04MF) 2
Фосфор используется для производства удобрений.
входит в со
Неметаллы
119
ОТВЕТЬI
1. Атомы: неметаллов образуют друг с другом
увеличивается за счет окислителя
и другими элементами ковалеНТНЬiе связи,
рода.
тогда как для металлов характерны иolПlhle
22.
связи.
жительно
2.
Жидкостью в нормальных условиях явля
ется бром.
мень
-
Атомы кислорода притягиваются поло
ства, а атомы водорода
частицами
-
веще
отрицательно за
вдень.
24.
химический элемент, а кре
-
это горная порода, которую образу
это кристал
Это название означает «рождающий се
литру»,
а
селитрой
Молекулы: азота слабо поляризованы и
потому слабо связаны друг с другом.
7. Инертные газы: могут вступать в реакцию
и белков.
с фтором.
27.
Синим Джоном называли флюорит
-
Азот в его соединения преобразуется
клубеньковЫ.МИ азотфиксирующими бакте
фторид кальция.
риями.
9. Это хлор, в соединении с натрием он дает
28.
поваренную соль.
рует с литием
10.
лом.
Водород может стать твердым при тем
пературе ниже -259,2 °С.
11. Из водорода в основном состоят звезды:.
29.
12.
30.
Водород в смеси с воздухом образует
-
некоторые
26. Азот входит в состав нуклеиновых кислот
лический кремнезем.
гремучий газ
называли
соли азотной кислоты:.
25.
ет диоксид кремния.
6. Практически ничем: кварц -
8.
заряженными
23. Человеку нужно самое меньшее 1,5 л воды:
свшщо
вый блеск.
Кремний
кисло
ряженными.
3. Кислород, кремний, водород.
4. Киноварь, железНЬIЙ колчедан,
5.
-
взрывоопасную смесь. Из
за взрыва этой смеси произошло несколько
При нормальных условиях азот реаги
-
самым активным метал
Самое большое значение из соединений
азота имеет аммиак.
Из аммиака производят мочевину, ни
трат и сульфат аммония.
31. В атмосфере и гидросфере углерод содер
катастроф, и воздушные шары: стали запол
жится в виде углекислого газа.
нять безопасным гелием.
32. Для датировки используется радиоактив
13.
НЬIЙ изотоп углерода
Водород взаимодействует с углеродом,
14С.
входящим в состав стали, и может ее разру-
33.
шить.
мрамор, известняк и доломиты:.
14. С помощью водорода производится мар
34. Углерод содержится в нефти, газе, камен
Соли угольной кислоты: содержат мел,
гарин.
ном и древесном угле.
15. Жидкий и твердый кислород имеют свет
35. Фосфор встречается только в виде соеди
ло-голубой цвет.
нений, потому что он очень активНЬIЙ эле
16. Запах грозы: - это запах озона.
17. При увеличении ко~щентрации кислоро
мент и легко вступает в реакции с другими
да в атмосфере вымерли многие неприспо
36.
элементами.
Фосфор получают из апатитов и фос
собле1П1Ь1е к этому организмы:, для них это
форитов, реагирующих с коксом и кремне
было катастрофой.
земом.
18.
37.
В лабораторном получении кислорода
диоксид
марганца
играет
роль
катализа
Фосфор реагирует как окислитель со
многими
-
тора.
тель
19. УглекисllЬIЙ газ для получения кислорода
38.
применяют на космической стаIЩИИ.
витый.
неметаллами,
а
как
восстанови
с некоторыми металлами.
Белый фосфор более активный и ядо
20. Считалось, что флогистон имеет отрица
39.
тельную массу.
ление фосфора бертолетовой солью.
21.
Лавуазье доказал, что горение
окисление,
а масса
-
это
полученного вещества
При сжигании спичек происходит окис
120
Органическая химия
ОРГАНИЧЕСКАЯ ХИМИЯ
Что такое орrани"еские соединения?
о
рганические соединения
-
это такие вещества, которые
включают углерод. Исключение составляют угольная кис
ВОПРОС
1
лота, карбонаты, карбиды, цианиды и оксиды углерода.
ЯвllЯется ли угольная кис
Помимо углерода в состав органических веществ входят водород,
лота, которая состоит из
кислород, азот, а также фосфор, сера, галогены и ряд металлов.
углерода, водорода и кис
Органических соединений сегодня известно почти
лорода, орrаническим со
27 млн.
единением?
Таким образом, среди хи
мических соединений органи
ческих больше всего. Дело в
том, что углерод, обладающий
валентностью
4,
способен об
разовывать самые разные свя
зи
-
не только одинарные, но
и кратные (двойные, тройные).
Атомы углерода могут соеди
няться друг с другом и образо
вывать длинные цепи
-
пря
мые, разветвленные и замкну
тые (циклические). Структуры,
которые создает углерод, бы
вают линейными, плоскими и
объемными. Отсюда такое раз
Органические соединения встречаются в природе повсеместно.
нообразие органических сое
динений.
Среди
них
можно
Органическая химия
121
назвать углеводороды, карбо
новые кислоты, спирты, эфи
ры, кетоны, альдегиды и мно
гие другие, в том числе жиры,
белки, углеводы, нуклеиновые
кислоты, которые также назы
вают биологическими молеку
лами.
ВОПРОС
2
Чем вызвано 6011Ьmое раз
нообразие
орrанических
соединений?
rурой. Изомеры, то есть веще
ства одного состава, но разного
ВОПРОС
3
расположения атомов, особен
Какое орrаническое соеди
но распространены среди орга
нение
нических веществ . Например, у
Ва11И из неорrаническоrо?
первым
синтезиро
циклопропана такой же состав,
что и у пропена (С 3 Н6 ), однако
это разные вещества.
Это лишь одна из форм
декана С 10 Н 22 • А всего у декана
75 изомеров.
Памятник Якобу Берцелиусу
(1779-1848) в
ВОПРОС4
Какие
для
связи характерны
орrанических
соеди
нений?
Стокгольме.
Именно он впервые
предложил название
«органическая химия».
Для
органических
веществ
характерны определенные свой
ства. Впрочем, некоторые из них
присущи и неорганическим ве
ществам,
например
изомерия,
коваленгные связи, горючесть.
Изомерия уже упоминалась
Органическим веществам присуще явление гомологии. Су
ществуют ряды органических соединений-гомологов . Они обла
дают похожими химическими свойствами, и формулы двух со
-
выше, когда говорилось о раз
седей в ряду отличаются на одинаковую группу
метиленовое
нице между составом и струк-
звено -СН 2 -. Эта группа называется гомологической разни-
Органическая химия
122
цей. Самый простой пример гомологического
ряда
-
предельные углеводороды алканы. Это
метан сн4, этан с2нб' пропан СЗН8, бутан с4н10'
пентан с5н12' гексан сбн14' гептан с7н16 и др.
Формулу любого гомолога можно получить,
ВОПРОС
5
Что такое гомо11.огический ряд?
ВОПРОС&
прибавив к формуле предыдущего соединения
Как записывается форму11.а октана
гомологическую разность. Для всех членов го
щества,
мологического ряда существует общая форму
ряду алканов сразу после гептана С.,Н16 ?
ла спн2п+2' где п
следующего
в
-
ве
гомо11.огическом
- число атомов углерода.
Кроме того, среди органических соедине
связями. При этом получаются открытые цепи
ний различают насыщенные, или предельные,
(алифатические соединения) или циклы (али
и ненасыщенные, или непредельные. В насы
циклические
щенных соединениях
Непредельные соединения
атомы углерода
связаны
и
ароматические
-
соединения).
это, например,
друг с другом и другими атомами одинарными
бензол, циклогексан, ацетилен, олефины. Для
ковалентными связями, как у этана С 2 Н 6 . В нена
таких соединений характерна высокая химиче
сыщенных атомы соединены так называемыми
ская активность, в отличие от насыщенных, ко
кратными, то есть двойными или тройными,
торые более инертны .
Органическая химия
123
ВОПРОС7
ВОПРОС В
Каково основное от11ичие на
На чем основана К11асси
сыщеШIЬIХ уr11еводородов от
фикация органических со
ненасыщеШIЬIХ?
единений?
Структура бензола может отображаться в виде скелетной
формулы.
Существуют ациклические
(без циклов),
циклические и
гетероциклические углеродные
скелеты. В гетероциклическом
скелете
имеется
в
углеродном
один
или
цикле
несколько
В карбидной лампе
неуглеродных атомов. Отдель
источником света служит
ные атомы углерода в углерод
горящий ацетилен с2н2.
ном
Сам ацетилен образуется
ются по числу других атомов
в резу ль тате реакции между
скелете
углерода,
карбидом кальция СаС 2
и водой. В прошлом карбидные
лампы использовались часто,
классифициру
связанных
с
ними
химически. Если конкретный
атом углерода связан с одним
таким же атомом, он на з ывает
в том числе в шахтах. Сейчас
Ученые постоянно исследуют
влияние различных
органических соединений на
рост растений.
ся первичным, если с двумя, то
их применяют там, где
вторичным и т. д.
нужен мощный автономный
Благодаря этому создается
источник света, например
еще один вид формул кроме
в спелеологии.
уже известных вам. Эго скелет
Органические вещесгва клас
сифицируются и называются со
гласно определенной системе
-
ные формулы, в которых угле
род не указывается . Считается,
что в каждом углу геометриче
номенклаrуре. Сегодня приме
ской фиrуры содержится один
няется номенклаrура ИIОПАК.
атом углерода . Не указывается
Органические соединения клас
и водород, и если в углу сходят
сифицируются
ся меньше четырех линий, то
строения
их
на
основании
углеродного
ске
все остальные связи образованы
лета и функциональных групп.
водородом. Те формулы бензо
Эгим же в первом приближе
ла,
нии определяются их физиче
и двойные связи, принято на
ские
и
химические
Углеродный скелет
довательность
занных
между
углерода,
-
свойсгва.
это после
формулами
Кекуле
в
честь немецкого ученого, пред
ложившего их. Есть еще один
атомов
способ обозначения скелетных
составляет
формул, когда вместо двойных
собой
основу молекулы .
зывать
одинарные
свя
химически
которая
где чередуются
связей изображается кружок.
Памятник выдающемуся
немецкому химику-органику
Фридриху Августу Кеку ле
(1829-1896)
в Бонне.
Органическая химия
124
Функциональная группа
-
это группа ато
Буква
в некоторых формулах органиче
R
мов, не входящая в углеродный скелет, которая
ских соединений обозначает радикал. Органи
во многом определяет физические и химиче
ческий радикал
ские свойства органической молекулы. По стар
да удален один или более атомов водорода. Это
шей
органическое
оставляет свободной одну или более валентно
соединение относят к тому или иному классу:
стей. Удаленные атомы водорода заменяются
функциональной
группе
например вещества, содержащие аминогруппу,
называются
аминами,
ми, карбоксильную
ную
-
амидогруппу
-
-
амида
кислотами, гидроксиль
-
это остаток молекулы, отку
функциональными группами . Например, кар
боновые кислоты записываются в этом случае
как
R-COOH,
а спирты
-
как
R-OH.
Назва
ние радикала заканчивается на -ил. Например,
спиртами.
Функциональные группы, входящие в со
радикал метана сн4 выглядит как снз
-
и на
став различных молекул, в одной и той же хи
зывается метилом. Правда, радикал С 6 Н 5 -, об
мической реакции в большинстве своем ведут
разованный из бензола, называется фенилом,
себя одинаково.
а не бензилом . Бензилом называют радикал
сбн5сн2
ФУНКЦИОНАЛЬНЫЕ rРУППЫ,
-'
название
-
образованный из толуола (другое
метилбензол).
СОДЕРЖАЩИЕ АТОМЫ КИСЛОРОДА
6
гидроксильнан -ОН;
карбонильнан >С=О;
карбокси11ы1ан -СООН;
а11кокси11ьная
-OR
(типа -ОСН 3 ) и др .
ФУНКЦИОНАЛЬНЫЕ rРУППЫ,
СОДЕРЖАЩИЕ АТОМЫ АЗОТА
аминогруппа
-NH 2;
нитрогруппа -N0 2;
11итрозо1· ру111ы -NO;
нитрнльнан (циавш· руппа)
-CN;
гидра:п1ннан
амидная
-NHNH 2;
-CONH 2 •
н
н
н
н
н
Толуол, или метилбензол, используют
ФУНКЦИОНАЛЬНЫЕ rРУППЫ,
для производства растворителей, взрывчатых
СОДЕРЖАЩИЕ АТОМ СЕРЫ
веществ, красителей, лекарств.
тио11ы1ан
(су 111,фI"идрильнан,
меркапто
груш~а) -5Н;
су 11ьфид11ан
>5;
дису лы)н1;1,11ан -5-5-;
су 11ьфокси",11.н1 >5=0;
су11ьфо11нан >50 2 •
НЕКОТОРЫЕ КЛАССЫ
КАР&ОНИЛЬНЫХ СОЕДИНЕНИЙ
• аль t,егиды RCHO;
• кетоны RCOR;
• карбононые кислоты RCOOH;
• ангидри,,1,1 карбоновых кислот (RC0) 2 0.
Толуол впервые получили из сосновой смолы, но во
второй раз его выделили из бальзама, который
был привезен из колумбийского города Толу. Так
у этой ядовитой жидкости с характерным запахом
появилось название «толуол» («толуанский бальзам»).
ВОПРОС9
Что из себя представ11яет органический
радика.ll?
Органическая химия
Название
органического
соединения
согласно
правилам
125
ИЮПАК строится так: название главной цепи, в котором зашиф
ВОПРОС10
ровано число атомов углерода, образует корень слова, а названия
Чьим радикалом является
функциональных групп используются в качестве приставок или
бензил?
суффиксов . Нумерацию атомов углерода в главной цепи начи
нают с того ее конца, ближе к которому расположена старшая
группа. Если таких вариантов оказывается несколько, то нумера
цию проводят таким образом, чтобы либо кратная связь, либо
другой заместитель, имеющийся в молекуле, получили наимень
ший номер.
Например, возьмем соединение
5
СН 2
4
3
2
1
= СН-СН -СН- СН
2
3
Раньше жидкости для СНЯТИЯ
1
лака представляли собой
он
разбавленный ацетон
Здесь пять атомов углерода в одной цепи, значит, корнем бу
дет -пент-, суффикс -ен указывает на наличие кратной (в данном
случае двойной) связи. Старшая группа гидроксильная, а это
означает суффикс -ал. Положения двойной связи и гидроксиль
ной группы обозначаются цифрами. Значит, данное соединение
запишем как пентен-4-ол-2. Разумеется, у многих веществ есть
-
простейший из насыщенных
кетонов СН 3 -С(О)-СН 3 •
Другие его названия
-
диметилкетон, пропанон-2. Но
теперь его нередко заменяют
другими веществами,
потому что ацетон может
и тривиальные названия, отличные от номенклатурных. Напри
плохо действовать на ногти:
мер, молочная кислота (лактат)
ОН СЛИШКОМ СИЛЬНЫЙ
-
это тривиальное название, а по
номенклатуре она называется 2-гидроксипропановой кислотой.
растворитель.
ВОПРОС11
Сравните два полимера
-
полиэтилен
и целлюлозу. Какой из них создан искус
ственно, какой существует в природе?
Органическая химия
126
Уrnеводородь1
у
глеводороды
-
это органические соединения, которые
состоят только и з атомов углерода и водорода, отсюда и
название. Они лежат в основе всех остальных соединений
органической химии, которые считаются их производными.
У углерода четыре валентных электрона, а у водорода
-
один,
и поэтому простейшим углеводородом является уже упоминав
шийся метан сн4.
Нафталин
-
ароматический
углеводород, состоящий
из двух бензольных
колец. Его добывают
с помощью перегонки
из каменноугольной смолы.
Шариками нафталина
пересыпают шерстяную
и меховую одежду для защиты
от моли. Но не следует
У вечнозеленых хвойных растений иголки опадают и отрастают
забывать, что нафталин
постоянно. А отвечает за опадение углеводород, этилен С 2 Н 4 ,
ядовит не только для моли,
из которого производят полиэтилен, этиленгликоль и другие
но и для человека.
необходимые нам вещества. В природе этилен является
фитогормоном, то есть регулирует жизнедеятельность растений.
ВОПРОС
предельные
12
и
непредельные.
ВОПРОС
13
Связано 11И прямо опре
Существуют также карбоцик
деllение
Какой уrllеводород отве
лические
уrllеводород»
чает за опадение иrolloк у
бывают алициклическими, как
хвойных растений?
углеводороды.
циклогексан,
Углеводороды, как упоми
или
Они
как бензол. Арома
тичность
не
к
с
запахом
соединения?
аромати
ческими,
отношения
«ароматический
имеет
запаху,
прямого
правда,
Предельными углеводоро
дами
являются
алканы
и
ци
налось выше, бывают алифа
первые
тическими,
класса пахли приятно. Но во
нов
обще
ческий ряд. Алканы называют
или
ациклически
ми, где атомы углерода объе
диняются в цепи
либо
мер,
-
линейные
разветвленные
(напри
этан). Их разделяют на
представители
ароматичность
этого
-
это
клоалканы.
-
метан
Примеры
и
его
алка
гомологи
просто особое свойство соеди
также
нений, кольца которых являют
дует их путать с парафином,
парафинами.
ся высоко стабильными.
похожим
на
воск
Не
сле
веществом,
Органическая химия
САМЫЙ ДЛИННЫЙ УГЛЕВОДОРОД
Углеводородная цепь может быть очень
длинной.
В
1985
г.
британские
химики
Алкадиены,
или
диеновые
127
углеводороды,
имеют две двойные связи и общую формулу
спн2п-2'
И. Билл и М. К. У айтинг синтезировали
длинный углеводород
-
нонаконтатрик
тан СзчоН7s2·
которое состоит из смеси алканов от октадека
на с18н38 ДО пентатриоконтана с35н72' Парафин
в основном делают из нефти, а применяют при
изготовлении свечей, спичек, вазелина, как смаз
ку для лыж и даже в ядерной физике, радио
технике, электротехнике.
Циклоалканы (нафтены, цикланы, циклопа
рафины)
-
циклические насыщенные углево
дороды, входят в состав нефти.
Битум
-
смесь углеводородов и их
производных, содержащих азот, кислород, серу
и металлы. И природные, и искусственные
битумы получают главным образом из нефти.
Из них делают асфальт, кровельные материалы
и многое другое.
ВОПРОС
15
Из чего делают асфальт?
Арены, или ароматические углеводороды,
имеют в своем составе бензольное кольцо.
Непредельные углеводороды активны, ре
агируют с бромом, перманганатом калия, об
разуют полимеры. Получают их из нефти при
У парафина очень высокая теПllоемкость,
и поэтому его в нагретом виде испоllЬзуют
особой обработке
-
крекинге, а также из пре
дельных углеводородов, например этилен
-
из
Д11Я лечения теП11ом разных заболеваний,
этана, бутадиен
а также Д11Я улучшения состояния кожи. TeПllO
в промышленности и быту широко, к примеру
в парафиновой ванночке в данном случае улучает
при производстве пластмасс и резины.
-
из бутана. Их использование
обмен веществ и способствует заживлению.
ВОПРОС
14
Какие соединения входят в состав нефти?
Непредельные углеводороды образуют не
сколько гомологических рядов. Алкены, или
ряд этилена, имеют общую формулу спн2п и
двойную связь. Простейшим алкеном является
этилен С2Н4 • Названия алкенов образуют от на
званий соответствующих алканов, заменяя суф
фикс -ан на -ен.
Алкины представляют собой ряд ацетилена,
имеют тройную связь и общую формулу спн2п-2'
Простейший алкин
-
ацетилен С 2 Н2 •
Натура11Ьный каучук, высокомолекулярный
углеводород
(C5H 8)n, представляет собой
цисполимер изопрена. Он содержится в млечном
соке гевеи и других каучуконосных растений.
Когда-то резину делали из натурального каучука,
теперь в основном из искусственного.
128
Органическая химия
ВОПРОС16
Почему Д. И. Менде11еев срав
нива11 испо11Ь30вание нефти как
ТОПllИВа с сожжением денеr?
Органическая химия
Сnирты
с
пирты
органические
-
соединения,
которые
ВОПРОС
129
17
Каковы формула и название простейшего из одноатом
ных спиртов?
со
держат одну или несколь
ко гидроксильных групп -ОН.
Эги группы (или группа) свя
заны
с
насыщенным
атомом
углерода. Общая формула спи
ртов
- R-OH,
могут
и поэтому они
считаться
производны
ми воды, где вместо одного ато
ма водорода
-
органический
радикал.
Спирты бывают одноатом
ными (с одной гидроксильной
группой), двухатомными (с дву
мя гидроксильными группами),
насыщенными
ными,
и
ненасыщен
ациклическими
и
цик
лическими (которые содержат
бензольное кольцо), первичны
ми, вторичными и третичными
(в зависимости от числа заме
стителей при первом углерод
ном атоме).
По номенклатуре ИЮПАК,
простые
спирты
называются
по соответствующим алканам
с добавлением суффикса -ол.
Есть также названия по ради
калам.
Так,
гомологический
ряд
ВОПРОС
18
Когда и из чего впервые получили этиловый спирт?
простейшиходноатомныхспир
тов: метанол (метиловый спирт)
СН 3 -ОН,
спирт)
этанол
С2 Н5 0Н,
(этиловый
или
СН3 -
СЦ -ОН, пропанол (пропило
вый
спирт)
ОН и т. д.
СН 3 -СЦ-СЦ
Спирты широко распростра
нены в природе. Всем знаком за
пах свежей листвы. Его вызывает
так называемый спирт листьев
-
(Z)-гексен-3-ол-1,содержащийся в
эфирных маслах, веществах очень
сложного состава, которые произ
водятся растениями.
Запах листьев вызван особым
Молекула этИ11ового
спирта, самого известного
из спиртов. Атомы углерода
спиртом, который в них
содержится.
здесь обозначены черным
цветом, водорода
кислорода
-
-
голубым,
красным.
ВОПРОС19
Чем вызван запах листьев?
Органическая химия
130
Ментол принадлежит к терпеновым спир
там
и содержится в
мяте, герани и некоторых
других растениях, он является душистым веще
ством .
В смоле хвойных деревьев содержится спирт
фенхол.
Ментол добывают из эфирного масла мяты
перечной, а также синтезируют искусственно.
Спирты получают из самых разных соедине
Ментол Представляет собой прозрачное
криста1J.11ическое вещество, которое легко
ний при помощи реакций восстановления, окис
Пllавится при комнатной температуре.
ления, присоединения и замещения. Например,
метанол в промышленности получают благода
ря реакции оксида углерода с водородом.
ЖИЗНЬ И СМЕРТЬ ОТ ОДНОГО
Химические свойства спиртов
ВЕЩЕСТВА
определяет
гидроксильная группа, и они проявляют свой
Глицерин
трехатомный
-
мула которого
снирт,
фор
С 1 Н , (ОН) 1 • Он встунает
в реакцию с азотной кислотой и обраJу
-
ет сложный :Jфир
испольJуетси
дли
нитроглицерин. Он
производства
и
юры
ства как основания, так и кислоты . Как кислоты
они реагируют с металлами
-
щелочными, ще
лочноземельными и некоторыми другими; как
основания образовывают с сильными неоргани
ческими кислотами соли алкоксония.
и
Спирты также подвергаются дегидратации
беJдым1юго вороха, и лекарства, которое
в присутствии таких катализаторов, как серная
вчатых
веществ,
например
динамита
принимают при боле ·ншх сердца. Кроме
или фосфорная кислоты, оксид алюминия и др.
того,
При этом образуются алкены. Так, в результате
на
основе
си линиды
-
глицерина
синте :~ируют
источники :Jнергии в живых
дегидратации этанола получается этилен.
органиJмах.
-~· •••""!'\о
Молеку лир на и
. ' ~-··
..... "~~7··..._
...".,"• ....
·}lrr..··~
••"1.",.
~ -:"·
.. . .• ...... . . .
... ."
..
...
."." r
...
•..." •....
,_
..
..
.
..
.• , •.••. ,.
,".".....
·. ···•··. ..... .. "
#
.
•
~
-:_::
........
мо11.ел~.
•''.
'
11
" •• ,. 1- •
• • • •
•
•••
,..................
,••••
'<t" , \
'
:.~.,".•~',;.;
,
\
," •• •• • •
" •
-
••
\
.1,
...... ;.. .,
•• "
.! ~"."••'• •• ~· .
••
"
'
••'•·•·•с
·,
•
~
.,.
"
•
•• 1
•"' •••. 4 ••,..
••••
~.
\
......••
; • • • • . • • " •. 11
~
.'" .• ' . .. f. •' .; ..:•
•
.• ,8
1
" •
• •
•
•
•
•
•••
• •
~~
•• • " •• •
~
•
~.
'
•
1
··~·.·6·
• • • • • . .-.~····-·!
• -· --·· ' i'
'",..
"" "
•
ВОПРОС
4
...
•• •
#
'
••
' " •
""................
•" -"".••,···"!·'
·:.': !
•
·" ~·
1ли11ерш ta
ЖИ/J.КО!\1 СОСТОЮ IИИ.
ли11ери11
-
ВОПРОС21
Спирты проявllЯIОт себя как основания
или как КИСllОТЬI?
нsвкаи 11ро1рач11аи
сла11.каи ЖИ/1,КОСIЪ.
0111юлу•шл
сное 11аша11ие
от 11.ре1111е1 реческоtп
« l'ЛИКОС » , то ест~.
« СЛ<l/1,КИЙ » .
20
Производное какого спирта испо11Ьзуется
и как лекарство, и как взрывчатка?
Спирты синтезируются и сами используются
в реакциях химического синтеза, например
для синтеза эфира.
Органическая химия
Самый распространенный
в мире спирт
-
другие спирты
этанол. Его и
очень
широко
применяют в разных отраслях
30
к слепоте, а
мл метанола
растворитель для приготовле
уже убивают. А ведь метанол
ния всевозможных лекарствен
и другие спирты входят либо
ных средств, к примеру настоя
входили
валерианы.
в
состав
различных
промышленности. Этанол вхо
средств, например растворите
дит
на
лей или незамерзающих жид
питков. Он вредит организму,
костей. Не зря использование
нарушает
метанола
в
состав
системы,
алкогольных
функции
но
его
нервной
воздействие
в
жидкостях
незамерзающих
в
России
запре
сравнится с воздействием
щено. Этанол гораздо менее
метилового и других спиртов.
опасен. Более того, он широко
не
Так, если выпить
танола,
5-10
фактически
один глоток, то это
мл ме
сделать
приведет
131
применяется
антисептик,
ния
в
медицине
для
компрессов,
как
Мншие лекарства приготовлены
приготовле
а
также
как
на основе ЭТИllового спирта.
ВОПРОС22
Спирты также используются при изготовлении мою
Как испоl1Ъ3уют ЭТИllовый спирт
щих средств, лаков и красок, пестицидов, смазочных ма
кроме приrотов11ения шоrо11Ь
териалов, фиксаторов волос, отдушек для бытовой химии,
ных
как, например, ментол и гераниол. Таким образом, спирты
медицине?
напитков
и
применения
в
являются сырьем для многих отраслей промышленности.
Кар6оновь1е
кисnоть1
п
юбому виноделу известно, что вино нуж
или несколько карбоксильных групп -СООН.
Такая группа способна легко отщеплять ион во
дорода, а это и вызывает кислые свойства.
ВОПРОС
23
Почему КИС110ТЬI КИС11Ые?
но хранить без доступа воздуха, иначе
оно скиснет. С точки зрения химии это
понятно: при добавлении кислорода к спирту
Карбоновые кислоты
Ди- и трикарбоновые кислоты сильнее мо
нокарбоновых. Как и другие органические со
получается кислота.
это такие органиче
единения,
кислоты бывают ароматическими,
ские соединения, в чьих молекулах имеется одна
например
бензойная,
-
предельными,
как ка-
132
Органическая химия
проновая
ными,
кислота,
как
непредель
акриловая,
клическими,
как
алици
хинная,
гетероциклическими,
как
и
ни
глядит так: метановая (муравьи
ная) кислота НСООН, этановая
(уксусная)
СООН,
котиновая кислота.
Cf\COOH,
пропано
вая (метилуксусная) Cf\-C~ бутановая
(масляная)
Cf\-C~ -С~ -СООН и т. д.
У карбоновых кислот обыч
ные кислотные свойства : при
их реакции с металлами, окси
дами
и
основными
гидрокси
дами образуются соли, и сами
вытесняются более сильными
кислотами. В присутствии кис
лого катализатора карбоновые
Молекула бензойной кислоты.
кислоты
вступают
в
реакцию
со спиртами, при этом обра
зуются сложные эфиры. Такая
Также
сильных
по
числу
групп
карбок
кислоты
делят
Карбоновые кислоты
реагируют с другими
органическими
и неорганическими
реакция называется реакцией
соединениями, в том числе
этерификации .
с металлами и спиртами.
на одноосновные, как уксусная,
двухосновные,
и
как
щавелевая,
многоосновные,
как
лимон
ВОПРОС
25
ная кислота . К одноосновным
Какие вещества образуются при взаимодействии карбо
кислотам
новых кислот со спиртами?
с
открытой
цепью
относят жирные кислоты, кото
рые
содержатся
в
жирах,
мас
лах, восках. Полиненасыщенные
жирные кислоты
кислоты,
-
это жирные
молекулы
которых
содержат более одной двойной
связи. Жирные кислоты отно
сятся к простейшим липидам,
играющим очень важную энер
гетическую и структурную роль
в организме.
ВОПРОС24
Какая структура у жир
ных кислот?
Если добавить к карбоно
вым кислотам другие функци
ональные группы, появляются
новые классы соединений. Так,
например, добавление амино
группы
- NH2
лоту,
именно
а
дает аминокис
из
аминокис
лот состоят белки.
Простейший
гомологичес
кий ряд карбоновых кислот вы-
Органическая химия
133
Все знают, что уксус кислый. Это потому, что
в нем имеется от
Уксус
-
3
до
15 %
уксусной кислоты.
полезный пищевой продукт. А нераз
бавленной уксусной кислотой можно отравить
ся и умереть.
Яблочный уксус получают путем брожения
яблок. Кроме уксусной кислоты в нем
содержатся друтие карбоновые кислоты
-
яблочная, молочная, щавелевая, лимонная,
а также витамины, аминокислоты, ферменты,
микроэлементы.
Разнообразные карбоновые кислоты очень
широко распространены в природе . Обычно
их называют в честь тех плодов, листьев, живот
ВОПРОС26
ных, откуда их впервые выделили . Таковы щаве
Чем вызывается боllЬ в МЬIIПЦах при физи
левая, молочная, яблочная, лимонная кислоты.
ческой наrрузке?
Молочная
СН 3 СН(ОН)СООН
СН 3 СООН кислоты
образуются
благодаря процессу брожения
-
и
в
уксусная
организме
анаэробного
(то есть идущего без доступа кислорода) расще
пления глюкозы. Так что они имеются не толь
ко в молоке и уксусе.
В выделениях
муравьев,
а также
в сосновой
хвое, пчелином
яде и крапиве
содержится
муравьиная
кислота.
В козьем молоке
есть капроновая,
каприловая
и каприновая
кислоты. Все
Молочнокислые бактерии сбраживают
глюкозу и производят молочную кислоту.
Молочнокислое брожение издревле
используется для получения разнообразных
молочных продуктов.
три названы
по латинскому
слову
capra «КОЗа».
Органическая химия
134
ВОПРОС
Из семян мускатного ореха выделена ми
Z7
ристиновая кислота. А пальмитиновая кисло
Какие кислоты по боllЬ
та, как и следует из ее названия, содержится в
шей части входят в состав
пальмовом масле. Такого масла больше всего в
раститеllЬНЬIХ
кокосовых орехах. Название стеариновой кис
НЬ1Х жиров?
и
живот
лоты происходит от греческого «стеар», то есть
«жир». Большую часть растительных и живот
ных жиров как раз и составляют стеариновая и
Стеарин давно
пальмитиновая кислоты. Смесь этих кислот с
используют
добавлением олеиновой и других жирных кис
для изготовления
лот называется стеарином, когда-то из него де
свечей.
лали свечи. Стеарин также применяют в мыло
варенной и текстильной промышленности.
В
масле
арахиса
содержится
кислота, в горном воске
тинского
montana -
-
арахиновая
При пригорании жиров можно почувство
монтановая (от ла
вать острый запах. Это пахнет самая простая
«горные области»). В пче
из непредельных кислот
-
акриловая (от ла
лином воске можно обнаружить мелиссиновую
тинского acгis
кислоту (от греческого
горают, происходит дегидратация глицерина и
Melissa, то есть
«пчела»).
ЦИКЛ КРЕБСА
-
«острый»). Когда жиры при
жиров и углеводов. В процессе этих реак
Трикарбоновые (и дикарбоновые) кислоты
ций выделяются водород и углекислый газ.
в живых организмах участвуют в цикле ~за
Водород в дальнейшем окисляется до воды.
Иl\п1ых превращений, который носит назва
В
ние цикл трикарбоновых кислот, или цикл
большая
лимонной: кислоты, или цикл Кребса
цикле
лимоппой:
часть
кислоты улавливается
свободной
эперrии,
кото
по
рая образуется при распаде белков, жиров
кислоты
и углеводов пищи. Цикл Кребса непосред
представмпот собой промежуточные про
ственно связан с клеточным дыханием и яв
дукты, образующиеся при распаде белков,
ляется центральным путем обмена веществ.
имени
11ервооткрывателя.
Эти
-
Aцc11111 . 1-кo31t3ll.\t А
В цикле Кребса
обра зуется :-.111ожеспю
11еобход11:-.1ых для
орrа11и :в1а веществ.
•
•
,,
••
•
•
••
,
Органическая химия
образуется как раз акриловая
что она обладает сильным бак
кислота.
терицидным эффектом. Уксус
Из высокомолекулярных не
ВОПРОС
135
28
производ
Какие кислоты использу
предельных кислот более все
стве стекла и кинопленки, как
ют в качестве консерван
го
олеиновая.
консервант и растворитель, она
тов и почему?
А биологически активны боль
тоже обладает бактерицидным
распространена
ную
применяют
в
ше всего линолевая, линолено
эффектом. С помощью щаве
вая и арахидоновая кислоты.
левой кислоты удаляют окали
пищевые добавки,
ну,
тели, компоненты пластмасс и
Благодаря
своим
характе
ристикам карбоновые кислоты
применяются
очень
изготавливают
чернила
и
лаков. Но ничего не сравнится
многое другое.
Соли карбоновых кислот
широко.
раствори
-
с их ролью в живом организ
Муравьиную кислоту исполь
это и мыла, и эмульгаторы, и
ме, так как именно они входят
зуют
смазочные масла, а эфиры
в состав жиров.
как
консервант,
потому
ОТВЕТЬI
1.
соединения с такой
Нет, угоllЬная кислота не относится к ор
ганическим соединениям, она явllЯется од
АтоМЬI
углерода
способны
формиро
вать разные связи и образовывать длинные
цепи
-
структурой действи
тельно пахли приятно.
14. В состав нефти входят ЦИКllоалканы, И11И
нафтены.
ним ИЗ ИСКllЮЧеНИЙ.
2.
-
прЯМЬiе, разветвленные и замкнутые
15. Асфальт делают из битумов, которые по
лучают из нефти.
16.
Из нефти можно делать множество по
(ЦИК11ИЧеские).
лезных
З. Первой из неорганического соединения
тоПllИВа снижает эту возможность.
синтезировали мочевину.
17.
4.
Для органических соединений характер
5.
Гомологический ряд
-
это ряд соедине
ний, которые от11ИЧаются друг от друга на
гомологическую
разницу
-
метиленовое
звено -СН2 - •
6. К гептану надо прибавить группу
-СН2 - ,
то есть один атом углерода и два атома водо
испоllЬзование
Простейший одноатомный спирт
ее
как
-
ме
танол СН3 -ОН. Он очень ядовит.
18.
ны ковалеНТНЬiе связи.
материалов,
Этиловый спирт впервые ПОЛучИllИ из
вина арабские а11ХИМИКИ в
19.
VI-VII вв.
Запах llИСтьев вызывает содержащийся в
них спирт (Z)-гексен-3-ол-1.
20.
Так используется производное ГllИЦери
на
-
нитрогllИЦерин.
21. Спирты проявllЯЮт себя и как основания,
рода. В итоге получаем октан С8Н 18•
и как кислоты.
7. В насыщенных углеводородах атоМЬI угле
22. Этиловый спирт используется как тоПllИ
рода связаны между собой одинарными свя
во, растворитеllЬ, основа для лаков и красок
зями, а в ненасыщенных
-
кратными (двой
ными И11И тройными).
и многое другое.
23.
Кислоты содержат одну И11И несколько
Классификация органических соедине
карбОКСИllЬНЫХ групп -СООН, а такая груп
ний основана на их углеродном скелете и
па легко отщеПllяет ион водорода. Это и вы
8.
функциональных группах.
9.
Органический радикал представllЯет со
зывает кисllЫе свойства.
24.
Жирные кислоты
-
это одноосновные
бой остаток молекуllЫ, откуда удален один
кислоты с открытой цепью.
ИllИ нескоllЬко атомов водорода.
25. При взаимодействии карбоновых
10. БензИll явllЯется радикалом толуола.
11. Искусственно создан ПОllИЭТИllен, а цел
люлоза природное вещество.
12. За опадение иголок у хвойных отвечает
со спиртами образуются сложные эфиры.
кислот
26. БоllЬ в МЬIПIЦах вызывается накоПllением
там молочной кислоты.
ЭТИllеН.
27. Пальмитиновая и стеариновая кислоты.
28. В качестве консервантов испоllЬзуют му
13. Нет, ароматичность не связана с запахом,
равьиную и уксусную кислоты, потому что
это просто структура, но первые описанные
они обладают бактерициднЬIМ эффектом.
Самые важные для организма вещества
136
САМЬIЕ ВАЖНЬIЕ
ДЛЯ ОРГАНИЗМА ВЕЩЕСТВА
Яиnидь1
и
Холестерол (холестерин)
Жирные кислоты
Глицерол
(глицерин)
звестно, что в организ
сн -он
ме особо важную роль
сн -он
играют жиры, углеводы,
сн -он
о
но~
Нась1щенные
1
НО~
Ненасыщенные
белки и нуклеиновые кислоты,
их
в
первую
очередь
биологическая
ко
жиры
изучает
химия.
включены
сн,
Одна
в
Упрощенная
формула
о
более
сн.-о~
обширную группу гидрофоб
~н - о~ Насыщенные
ных органических соединений,
которые
ми,
от
называются
греческого
~н- о~
липида
«жир». Простые липиды
-
Глицерол (глицерин)
-
«липос»
Триглицериды
и три цепи жирных кислот
это
о
сложные эфиры спирта и жир
сн- о~
ных кислот,
сн - о/о'/'-./"-/"-/"-/"-
JL
сложные липиды
ные спирта, высокомолекуляр
жирных
остатков
фосфорной
стых
кислот,
других
а
также
соединений:
кислоты,
оснований,
азоти
углеводов
~
~
~
~
Ненасыщенные
~н -о~
представляют собой производ
ных
~
Холестерол, а также
триг лицериды и их
и
составляющие.
др. Липидами также называют
сн-о~
~н - о~ Полиненасыщенные
~н-о~
и другие вещества, которые не
являются производными жир
Омега-3-фосфолипид
ных кислот, например холесте
рин (он же холестерол).
Липиды обеспечивают орга
низм энергией, входят в состав
клеточной мембраны,
мают участие
в
прини
внутри клеток и между ними.
Липиды
ники
-
Фосфолипиды
сигнализации
предшествен
стероидных
гормонов
(веществ, которые переносятся
кровью по всему организму и
Двухслойная клеточная мембрана
Цитоплазма клетки
(
оказывают влияние на его ра
боту), а также желчных кислот
и других веществ. Компонен
ты
липидов,
такие
как
жир
ные кислоты, холестерин, фос
Клеточная мембрана
фолипиды, обнаруживаются в
крови. Поскольку эти вещества
Почти миллион липидных молекул содержится только в
гидрофобны, то есть не раство-
биологической мембраны.
1 мкм2
Самые важные для организма вещества
ряются в воде,
для
137
их транспорта существует
сложная транспортная система. В цитоплазме
клетки жиры запасаются в виде капель. Но есть
и особая жировая ткань, состоящая из жировых
клеток.
В подсолнечном масле большинство жиров
мононенасыщенные и полиненасыщенные,
однако имеются и насыщенные.
Жировые клетки, заполненные липидами. Ядро
каждой клетки окрашено красным.
ВОПРОС
1
Почему А11Я транспорта ilИIIИДOB в орrа
низме образуются с110ЖНЬiе соединения?
Одна из важнейших функций липидов
быть источником энергии. Когда
1 г жира окис
ляется до воды и углекислого газа, выделяется
примерно
9
ккал энергии. Это в два раза боль
ше, чем дает окисление углеводов. Кроме того,
гидрофобность жиров приводит к тому, что они
не нуждаются в дополнительной массе воды для
гидратации, как это происходит у углеводов.
ВОПРОС
Чем
Наибольший жировой слой характерен для
:Z
удобны
llИПИДЬ1
как
водных млекопитающих, в частности китов.
запасающие
энерrию вещества?
теплоизолирующими способностями и откла
дывается в подкожной жировой ткани многих
Животные чаще запасают жиры, растения
-
теплокровных, чтобы уменьшить потери тепла.
углеводы, но содержание жиров достаточно вы
Жир также снижает удельный вес тела и уве
соко в семенах многих растений, например у
личивает плавучесть. Это характерно для мно
подсолнечника. Недаром оттуда добывают рас
гих организмов
тительное масло.
и акул.
-
и диатомовых водорослей,
У многих животных слой жира служит защи
У животных, которые обитают в жарком
той внутренних органов от повреждений при
климате, жир откладывается в отдельных участ
ударах. Кроме того, жир обладает хорошими
ках тела, например у жирнохвостых тушканчи-
Самые важные для организма вещества
138
ков он в хвосте, а у верблюдов
-
в горбах. Жир
в этом случае представляет собой резерв воды,
поскольку она образуется при его окислении.
В горбах верблюдов
содержится жир,
который служит
ВОПРОС
3
Как .жир позволяет некоторым животным
поllучать воду?
ны. Пища животного происхождения содержит
множество насыщенных жирных кислот, пища
растительного происхождения, к примеру оре
хи, семечки, растительные масла, богата нена
Человек вместе с пищей получает по боль
шей части
риды.
нейтральные
Во-первых,
энергии,
они
во-вторых,
жиры
-
прекрасный
используются
триглице
источник
для
того,
чтобы всасывались жирорастворимые витами-
ВОПРОС4
Коrда хоllестерин приносит поllЬзу, а коr
да
-
вред?
сыщенными жирными кислотами. Мясо, мо
локо, рыба
-
основной источник холестерина
(холестерола). Но несмотря на необходимость
для организма жиров, злоупотреблять ими не
следует. Все хорошо в меру.
Самые важные для организма вещества
139
Уrnеводь1
у
глеводы
-
органические
вещесгва, которые содер
Альфа-D-г.люкоза
жат одну карбонильную
(альдегидную
группу
и
или
Альфа-D-фруктоза
Бета-D-г.люкоза
Бета-D-фруктоза
кетонную)
несколько
гидрок
сильных групп. Название про
изоIIIЛо от того, что первые из
вестные ученым углеводы фор
мально
представляли
соединения
углерода
собой
и
Сахароза
Лактоза
Мальтоза
Га.лактоза
воды.
Низкомолекулярные углеводы
называются сахарами.
ВОПРОС
Какие
5
функциональllhlе
группы обязате11Ьно до11жны:
входить
в
Наиболее важные моно- и дисахариды.
состав уr-
11еводов?
Углеводы в организме являются источниками энергии . Из
вестно, что когда окисляется
энергии и
СН2ОН
0,4
1
г углевода, получается
4,1
ккал
г воды. Кроме того, некоторые углеводы выполня
ют опорную функцию и для животных, и особенно для растений.
Привычный нам
сахар называется
сахарозой.
1\fолекуласахарозы
состоит из двух
о
моносахаридов
-
глюкозы
и фруктозы.
он
он
СТЕРЕОИЗОМЕРИЯ МОНОСАХАРИДОВ
Часто в формулах уI"ленодов имеетси буква
D
или
L.
Это
свнзано с изомерией. Среди изомеров моносахаридов раз
личают
D-
и L-фор:\-11>1. Форма онределиетси но расноло
Продукты, богатые
углеводами.
жению ОН-групны у носледнего аси:\-1метричного атома
углерода возле СН 2 ОН-гру11ны. При нроецировании моде
ли :\-Юлекулы на 11лоскос1ъ ОН-1ру1111а у асимметричного
ВОПРОС&
атома углерода может находитьси с нравой сто-
Из каких моносахаридов
роны. Тогда :по О-форма. Она :\-Южет так-
состоит
же располагатьси 3еркалыю. Тогда :по
L-фор:\-1а. Г люкоы, фруктоы, машюы
и галактоза оп1осито1 к О-форме.
Глицеральдегид существует в двух
фор:\1ах
- D
и
f_.
••
..
6
1
,
1' •
~,
•.~' ·~
сахар,
который
мы едим?
ВОПРОС7
Какие основные функции
у уr11еводов?
140
Самые важные для организма вещества
Неудивительно, что углеводы представляют
массы, но он тоже весьма заметен. Источник
главную часть органического вещества; они со
углеводов для животных
ставляют
синтеза, который осуществляют растения.
80 %
сухой массы растений. Для жи
вотных этот процент намного меньше
, \\\\\11\1\'\ii''ll//1//,1///'
'~\1 1'", 11l1l,//1///////,
"~'-'
\
1 \' '
/_.
/
1/
/ /
~
-
это процесс фото
- 2-3 %
Фотосинтез
это образование органических веществ (углеводов)
-
из углекислого газа и воды под воздействием солнечного света.
При этом выделяется кислород.
Хлорофилл улавливает световую энергию для производства пищи
Хлоропласты запасают энергию (сахар),
находятся в листьях
_ ..."""
Кислород
(0 2)
высвобождается
в воздух
как продукт
реакции
•
Глюкоза
(С6Н1Рб)
Аиоксид углерода (С0 2 )
из воздуха
запасается
~"tilll• в растении
и используется
в пищу
ВОПРОС В
Среди моносахаридов раз
Каков источник уг11еводов
личаются
мя живых орrанизмов?
Если карбонильная группа рас
альдозы
и
кетозы.
ВОПРОС9
Какие уг11еводы называют
ся ПО11ИСахаридами?
положена в конце углеродной
цепи,
Углеводы объединены тем,
то
это
альдегид,
и
на
зывают его альдозой. Другое
что состоят из отдельных еди
расположение
ниц-мономеров,
на
группы делает из моносахари
зываются сахаридами. Моно
да кетон, и тогда он называет
сахариды состоят из одной та
ся кетозой. Кроме того, моно
кой единицы, олигосахариды
сахариды
содержат от двух до десяти мо
зами,
номеров, полисахариды
гексозами и так далее в
которые
-
бо
лее десяти мономеров. Слож
ные углевады,
которые
вклю
карбонильной
называются
тетрозами,
трио
пентозами,
зави
симости от длины углеродной
цепи. Именно из моносахари
чают три и более единицы,
дов
синтезируются
дисахари
могут подвергаться гидролизу
ды,
олигосахариды
и
и
хариды.
расщепляться на
моносаха
риды. Такой гидролиз и есть
один из источников энергии.
Глюкоза
полиса
он
-
моносахарид, из которого
состоят многие полисахариды, такие
как крахмал и гликоген.
он
Самые важные для организма вещества
141
ВОПРОС10
КАК РАЗЛИЧИТЬ ГЛЮК ОЗУ И ФРУКТОЗУ?
Что общего у крахма11а и
Глюкоза содержит ал1.дегид11ую группу и ивлиетси альдо
г11Икогена?
зой, фрукто :ы содержит кетогру1111у и ивлиетси кетозой.
По:Jтому глюкозу можно определить по наличию альде
гид1юй гру1111ы. А дли :Jтого используют так называемую
Самая
из
распространенная
углеводов
D-глюкоза
(С 6 Н 12О 6 ), из которой образу
ются
том
многие
числе
дисахариды,
мальтоза,
в
сахароза
реакцию серебршюго зеркала.
Сначала в водном растворе аммиака растноршот оксид се
ребра. При :Jтом образуется комплексное соединение
гидроксид диамминсеребра (1):
Ag 20 + 4NH 3 ·H 20 "~ 2[Ag(NH 3)JOH + ЗН 2 0.
полисахариды,
Если добанип. к :Jтому соединению альдегид, то произой
такие как крахмал и целлюло
дет окислителыю-носстановителы~аи реакция с образо
за. В молекуле глюкозы пять
ванием серебра. И тог да на стенках пробирки образуетси
гидроксильных
зеркальный серебрш1ый налет:
и
лактоза,
и
групп
и
одна
=О+
2[Ag(NH 3 ) 2 ]0H ---> 2Ag + R-COONH ~ + ЗNН 3 + Н 2 О.
альдегидная. Путь синтеза глю
R-CH
козы из неуглеводных соедине
Глюкоза, в которой имеетси альдегидная группа, даст та
ний
кую реак1\ию, а фруктоза, в которой присутствует кето11-
назвается
глюконеогене
зом, а путь ее расщепления до
углекислого газа и воды
-
11аи группа, нет.
гли
колизом.
При сахарном диабете уровень
глюкозы в крови повышается,
поэтому так важно его проверять.
ВОПРОС
11
Какая реакция помогает рас
познать глюкозу в растворе и
отllИЧИТЬ ее от фруктозы?
о
142
Самые важные для организма вещества
Среди олигосахаридов са
мый
или
дов
-
известный
сахар,
среди
сахароза,
трисахари
рафиноза, которая со
-
стоит из остатков фруктозы,
глюкозы и галактозы.
В сахарной свекле в большом
ВОПРОС
количестве содержится
трисахарид рафиноза.
Почему
1Z
мы АЮбим
сладкое?
Из
растительных
полиса
харидов следует назвать
крах
мал (С 6 Н 100 5 ) ". Это смесь двух
полисахаридов
-
амилозы
и
лопектин разветвленный. В отдельных линейных его молекулах
содержится
20-30
таких единиц. Крахмал в организме людей и
амилопектина. Мономер обо
животных гидролизуется до глюкозы; используется для произ
их
водства энергии.
-
альфа-глюкоза . Амилоза
имеет линейную структуру, в
Крахмал взаимодействует с йодом, при этом окрашивается
каждой ее молекуле примерно
в синий цвет, но, в отличие от глюкозы, не дает реакцию
1000
остатков глюкозы. Ами-
серебряного зеркала.
Самые важные для организма вещества
Альфа-глюкоза
входит
143
в
состав и другого растительно
-
го полисахарида
целлюло
зы, или клетчатки. Клетчатка
играет
роль
турного
опорного,
материала
струк
для
рас
тений. Древесина, например,
состоит из целлюлозы на
70 %,
на
а хлопок
-
50-
практически
100 %.
n
но
о"
н
он
он
н
n
Хлопок состоит из целлюлозы
почти на
100 %.
ВОПРОС
Чем
Полимерная молекула целлюлозы.
Хитиновый панцирь у чле
13
нистоногих
раз11ИЧаются
функ
тоже
-
углеводов. Хитин
ции крахмала и клетчатки
сахарид,
у растений?
остатков
состоит
который
из
это поли
состоит
из
N-ацетил-D-глюкоза
мина. Опорную роль хитин так
же играет у низших растений
Основной резервный поли
сахарид человека и животных
гликоген
(C6H 100 5)n.
и грибов.
-
Его состав
ляют остатки альфа-D-глюко
зы. Его цепи ветвятся. Гранулы
гликогена
содержатся
органах
тканях,
и
но
во
в
всех
мыш
цах и печени его больше все
го . Процесс синтеза гликогена
называется
а
процесс
зы
-
ходят
гликогеногенезом,
распада
до
глюко
гликогенолизом. Проис
эти
процессы
главным
образом в печени .
У насекомых, как и у прочих
членистоноrих, существует
экзоскелет, то есть внешний
скелет. Он состоит
из хитина
ВОПРОС
14
r де происходят процессы
синтеза
и
r 11ИКОrена?
расщепления
-
н
HNYCH3
азотсодержащеrо
полисахарида.
о
В овощах и фруктах содер
жатся
риды,
пектины
-
состоящие
полисаха
из
полигалатуроновой
остатков
кислоты.
Молекула N-ацетил-Drлюкозамина
-
мономера,
ИЗ котороrо СОСТОИТ хитин.
Самые важные для организма вещества
144
Они способны образовывать желе при воздей
щиеся остатки N-ацетилглюкозамина и N-аце
ствии органических кислот. На этой реакции
тилмурамовой кислоты.
основано приготовление мармеладов и желе.
Из вышесказанного ясно, что углеводы поис
тине незаменимы в природе и жизни человека.
ВОПРОС
15
Какой по.ll.Исахарид играет опорную рш1ь
у бактерий, а какой
-
у грибов и некото
рых ЖИВОТНЬIХ?
Плазма крови
-
крайне
необходимое вещество
в медицине. Однако иногда
ее не хватает, и тогда как
заменители Пllазмы крови
используют полисахариды
Полисахариды пектины, реагируя
с органическими кислотами, образуют желе.
декстраны, которые
синтезируются при
воздействии определенного
В состав клеточной стенки бактерий входит
полисахарид мурамин. Его составляют чередую-
ВОПРОС
вида микроорганизмов
--~
на раствор сахарозы.
16
Зачем нужен инвертный сироп при про
изводстве караме.llи?
Нукnеиновь1е
Ри боза
Аезоксирибоза
кисnоть1
и
уклеиновые кислоты бывают двух
основных типов
-
дезоксирибо
нуклеиновая (ДНК) и рибонукле
иновая (РНК). Полимерные молекулы
ДНК и РНК состоят из отдельных зве
ньев
-
мономеров,
или
нуклеотидов .
Сахара, входящие в состав нуклеиновых кислот.
Самые важные для организма вещества
NH2
фаnюй группы. Нуклеозид сосrоит из азотисrого
основания и сахара
-
J
~·JO
Последние, в свою очередь, из нуклеозида и фос
дезоксирибозы для ДНК и
рибозы для РНК.
N
/
Н
о
/н
<-t 1-
N
Аденин
/
N
Н
Гуанин
fN
о
н,с~N/н
NAO
1
1
Тимин
NH2
о
N
С/"
NAO
NAO
1
1
н
145
н
н
Цитозин
Урацил
Аденин и гуанин являются производными
вещества пурина, а цитозин, тимин и урацил
-
пиримидина.
Основания ~.,-
·-
. Аденин
Цитозин
. Гуанин
-
Азотисrые основания
гетероциклические
органические соединения. В состав нуклеиновых
кислот входят аденин (А), rуанин
(С), тимин (Т) и урацил
(U).
(G),
цитозин
Из всех названных
оснований аденин, rуанин и цитозин имеются и
·--
•
Урацил
•
Тимин
Дезоксирибонуклеиновая
кис.лота (ДНК)
в РНК, и в ДНК В ДНК также входит тимин, в
Две молекулы
РНК вместо него имеется урацил.
генетической информации.
Азотисrые
другом
этом
по
аденин
rуанин
-
основания
связываются
друг
принципу комплементарносrи,
всегда
соединяется
с
ДНК и РНК, носители
с
при
тимином,
-
Рибонуклеиновая
кис.лота (РНК)
а
с цитозином. Так образуется двойная
спираль ДНК Молекула РНК обычно сосrоит из
одной цепочки, хотя есrь и двойные формы. При
ВОПРОС17
Чем от11ИЧаются азотистые основания в
ДНК и РНК?
синтезе РНК на ДНК с аденином связывается ура
ВОПРОС18
цил, потом молекула РНК отделяется от ДНК и
Как соединяются друг с другом азотистые
начинает функционировать самосrоятельно.
основания?
146
Самые важные для организма вещесrва
ВОПРОС
19
Как можно невоору:жеННЬIМ rлазом увидеть мoлeкy
llhl ДНК?
Аминокисnоть1
и 6еnки
•
елки
в
организме
играют
защитную,
Тропонин
-
белок,
который принимает
участие в сокращении
сrруктурную и регуляторную функции.
мышц. Он находится
Ферменты катализируют биохимические
в скелетных
реакции, поэтому их так и называют
-
биоло-
и сердечной мышцах.
Самые важные для организма вещества
гическими
катализаторами;
актин
и
миозин
ВОПРОС
входят в состав мышц; антитела борются с чу
20
Какие беllКИ отвечают за работу мьппц?
жеродными микроорганизмами.
ВОПРОС
21
Какие беllКИ называются био11оrичес:кими
катализаторами?
По
своему
нию белки
ящие
из
н,н~
строе
это моле
-
кулы-цепочки,
состо
L-.лейцин
множества
5/
аминокислот. Амино
кислоты
вые
кислоты,
рых
кроме
сильных
азота
из
H2N
кото
СООН
L-треонин
карбок
H2N,(COOH
L-цистеин
H2N,(OOH
L-метионин
содержатся
аминогруппы,
щие
в
SH
хон
карбоно
-
состоя
одного
и
двух
с оон
с оон
атома
атомов
H2N,(COOH
L-аспараги но
водорода.
вая кис.лота
H2N,(OOH
L-аспарагин
L-г.лутам.ино
CONH2
н,н,(оон
L-г.лутам.ин
L-.л из ин
вая ки с.лота
H2N"fNH
Амино:кис11оты,
из которых СОСТОЯТ
белки.
NH
н,нLоон
L-аргинин
147
f)
N:::\
,CNH
H2N
СООН
L-гистидин
H2N
,.с_:.
СООН
L-фени.ла.ланин
Q
CNH
fioн
H2N
,(_~,
СООН
L-тироз ин
H2N
СООН
L-триптофан
Самые важные для организма вещества
148
Синтез
белка
трех этапов
-
процессинга
состоит
из
транскрипции,
и
трансляции.
В них участвует целый ряд ве
ществ, в том числе различные
ферменты.
крипции,
Во
или
время
транс
считывания,
на
одной из цепочек ДНК синте
зируется молекула РНК. Созре
вая во время процессинга, она
выходит из ядра в цитоплазму,
где на особых структурах
босомах
-
ри
синтезируется по
-
Матричн
содержит то.ль
кодирующие бе.лок
липептидная цепь, то есть це
почка связанных между собой
аминокислот.
Их
участки
последова
~ААА
1 Трансляция, и.ли синтез, белка на
Первичная
структура белка,
+ рибосомах
npeiJqтa1JN1ющaя·'- ~,.. ....._
· ,,..Г\. О
собои
О ...., -IJVOJ(}
V'""·
пос.ледобllтельность
Укладка
тельность определяется после
довательностью
итоп.лаз.му
i
нуклеотидов,
составляющих ДНК и РНК, то
есть генетическим кодом.
ВОПРОС
22
Какие основНЬiе вещества,
Синтез бел.ка в живой Кllетке.
необхоДИМЬiе Д11Я синтеза
бе11Ка, вы можете назвать?
Генетический код
ма
записи
-
систе
генетической
Ala
ин
формации, согласно которой
каждому
кодону,
0
Asp
представля
ющему собой последователь
ность
из
трех
соответствует
нуклеотидов,
аминокислота.
Причем у одной аминокислоСоответствие кодонов РНК
аминокисл.отам
-
Gly
lle
генетический
код. Не указанные здесь
аминокисл.оты пиррол.изин
и сел.еноцистеин явл.яются
Arg
производными л.изина и цистеина
и кодируются при некоторых
усл.овиях стоп-кодонами.
Lеи Лейцин
Pro Пролин
His Гистидин
Glп Глутамин
Arg Аргинин
Пе Изолейцин
Met Метионин
Тhr Треонин
Аsп Аспарагин
Lуs Лизин
Ser
Ser Серин
Arg Аргинин
Va[ Валин
Ala Аланин
Asp Аспарагиновая
кислота
Glи Глутаминовая
кислота
Gly Глицин
Phe Фенилаланин
Lеи Лейцин
Ser Серин
Tyr Тирозин
Cys Цистеин
Trp Триптофан
Leu
Самые важные для организма вещества
149
ты бывает несколько кодонов.
Существуют также стартовый
и стоп-кодоны, которые опре
деляют
начало
и
синтеза. Если один нуклеотид
заменяется
на
н
R
1
1
окончание
другой
либо
N-C
один (или несколько) нуклео
/о
-с-с-он
тид добавляется в цепочку или
удаляется,
кодоны
1
н
меняются.
И вместо одной аминокислоты
1
н
кодируется другая. А значит,
меняется состав белка и, ско
рее всего, его свойства. Такие
изменения
называются
мута
циями.
Из
аминокислот синте
22
зируются самые разные белки.
Например, у цепочки из
100
аминокислотных остатков мо
жет существовать более
10130
вариантов белков с разной по
следовательностью. При этом
белки имеют первичную, вто
ричную,
третичную
и четвер
тичную структуры. Все зависит
от того, как скручивается пер
Простая последовательность аминокислотных остатков
-
это
первичная структура белка. Зеленым цветом выделена пептидная
связь, при помощи которой соединяются аминокислоты.
Белок, скрученный в спираль, имеет вторичную структуру.
воначальная цепочка.
Гемоглобин
-
белок, который переносит
кислород. Имеет очень сложную четвертичную
структуру, то есть состоит из четырех молекул
третичной структуры.
Альбумин
-
белок, который
есть в курином яйце,
-
имеет
третичную структуру.
ВОПРОС23
Что из себя представляет первич
ная структура бе.llКа?
Самые важные для организма вещества
150
OTBETbl
сладости, состоящие из чистоrо сахара, мы
1. ЛИПИАЬ1 IИАрофобны, то есть не растворя
13. Крахмu нужен А.J1Я производства энерrии,
ются в воде.
Кllетчатка выпоllНЯет опорную функцию.
2. При ОПlслении они дают бollЬme энерrии,
14.
чем углеводы и, кроме тоrо, не нуждаются в
печени.
воде А.J1Я IИАратации.
15. У бактерий эту pollЬ
зачастую переедаем.
Вода образуется при окислении жиров,
3.
поэтому жир, ошадывающийся, например
в rорбах вербlllОдов, служит запасом воды.
4.
Холестерин, образующий llИПОротеИНЬI с
Эти процессы происходят в основном в
иrрает мурамин, а у
rрибов и Чllенистоноrих
16.
КарамеllЬ
-
-
хитин.
это сахар, находящийся в
аморфном состоянии. ИнверТНЬIЙ сироп не
дает ему перейти в кристаll.ll.ИЧеское состо
ВЫСОКОЙ Пll.ОТНОСТЬIО, не образует осадка и
яние.
считается хорошим. Холестерин, образую
17.
щий llИПОпротеИНЬI с низкой Пll.ОТНОСТЬIО,
РНК
В состав ДНК входит тимин, в состав
урёlЦИll.. Оста.J1.Ьные азотистые осно
-
-
образует осадок в виде бllЯШек на сосудах и
вания
потому считается Пll.ОХИМ. Вообще же холе
в состав обеих молекул.
стерин необходим А.J1Я норма.J1.Ьной жизне
18.
деятеllЬности орrанизма.
урёlЦИll.ОМ при синтезе РНК), а rуанин
5. В состав углеводов доllЖНЬI входить карбо
цитозином.
аденин, rуанин и цитозин
входят
Аденин соединяется с тимином (ИllИ с
-
с
EcllИ выдеllИТЬ ДНК из К.J1.еток крови Иl1И
НИllЬНая и IИАРОКСИllЬные rруппы.
19.
6. Сахар, точнее, сахароза, состоит из r.J11Око
других тканей, можно получить их мноrо.
зы и фруктозы.
Тоrда они будут ВИАНЫ в виде бell.ЬIX нитей
7. Это энерrетическая и опорная функции.
8. Источником углеводов явll.Яется процесс
20.
фотосинтеза.
9.
10.
За работу мышц отвечают такие бellПI,
как актин, миозин и тропонин.
ПоllИсахаридами называются углеводы,
содержащие более
Иl1И полупрозрачноrо вещества.
21.
БиолоrичеСПIМИ ката.J1ИЗаторами назы
ваются фермеНТЬI.
10 мономеров.
И крахмu, и rllИКoreн состоят из остат
22.
Основные вещества, необхоДИМЬ1е А.J1Я
-
ков
r ll.IOKOЗЫ.
синтеза бе.J1.Ка,
11.
Реакция серебряноrо зеркuа, которая
лоты. Также А.J1Я неrо нужен ряд ферментов.
23. Первичная структура беll.Ка -
позвоllЯет обнаруживать аll.Ьдеrиды.
12.
Сахар необходим нам А.J1Я запасания
энерrии, поэтому орrанизм
ero требует.
это ДНК, РНК и аминоП1с
Но
это цепоч
ка из аминокислот, соеАИНеННЬIХ пеПТИДНЬ1ми связями.
Дары природы и химии
151
ДАРЫ ПРИРОДЫ И ХИМИИ
Незаменимая соnь
с
али
широко
используются
человеком.
Хлорид натрия содержится и в морской
воде, и в крови человека и животных. При
недостатке соли возникают сrущение крови, су
дороги, слабость. Больным иногда приходится
вливать 0,9%-ный раствор хлорида натрия
-
так называемый физиологический раствор. Та
кой раствор изотоничен плазме крови, то есть
имеет такое же осмотическое давление.
Соль предотвращает развитие гнилостных
бактерий. Поэтому она используется как кон
сервант. До изобретения холодильников засол
ка мяса и рыбы была основным способом их
хранения. Потому соль ценилась очень высоко.
Не раз повышение налога на соль приводило к
порче продуктов и соляным бунтам.
Соленая рыба не
просто вкусна,
соль сохраняет
этот полезный
продукт.
Кристаллы соли леrко растворяются в воде,
взаимодействуя с ее молекулами.
ВОПРОС
1
Из чеrо в медицине rотовят физишюrиче
ский раствор?
ВОПРОС
2
Чем вЬIЗван rорько-со11еный вкус морской
ВОДЬI?
Дары природы и химии
152
Соль необходима организму, однако ее избы
Поваренную соль используют не только в
ток повышает давление, вызывает болезни серд
пищевой
ца и почек. Соль удер живает воду в организме,
также для получения натрия, соляной кислоты,
поэтому в пустыне надо есть соль. Физиологиче
хлора и соды.
ская норма для одного человека
промышленности
и
медицине,
но
- 5 г в день.
ВОПРОСЗ
Почему COllЬIO посыпают lleд и снег?
Из
п
"ero
юди варили мыло из
жиров
и
золы
го тысячелетий,
знали
сдеnано мыnо?
в точности
И только в
1808
его
мно
но не
состава.
г. француз
ский химик Мишель Шеврель
доказал, что мыло
-
смесь ще
лочных солей жирных кислот.
Он провел этот анализ по по
ручению владельцев текстиль
ной фабрики, которые хотели
знать, что же очищает ткани,
которые они производят.
Щелочи, входящие в состав
мыла,
растворяют
смазку кожи,
жировую
где оседают ми
кробы, грязь и пыль. Но при
этом
они
высушивают
кожу.
И чтобы этого не случилось, в
мыло добавляют разные смяг
чающие
вещества,
пчелиный
Экстракция ГllИЦерина на
старинном МЫllОваренном
производстве.
например
воск, водоросли
и
даже мед. Приятный запах ему
Современное косметическое
до
MhlllO с различными
раз
ароматическими и красящими
ные красители. Глицерин же
добавками.
придают
ароматические
бавки, а красивый цвет
-
Дары природы и химии
образуется как побочный про
Жидкость при этом расслаи
дукт при производстве мыла.
вается.
В основе получения мыла
лежит реакция
омыления,
то
В
верхнем
слое,
или
При каком методе МЬ111О
меньше
варения образуется
60 %
жирных кислот.
В нижнем слое, или подмыль
ров жирных кислот (в том чис
ном
ле жиров) со щелочами. В ре
Мыло, полученное таким спо
зультате этой реакции образу
собом, называется ядровым.
соли
щелоке,
ксида натрия
Происходит это так. Нагре
тые жиры в варочном котле под
ют
твердое
ГllИ
церин?
глицерин.
да калия КОН получается мяг
При использовании гидро
щелочных
металлов и спирты.
ВОПРОС4
мыльном ядре, содержится не
есть гидролиз сложных эфи
ются спирты,
153
NaOH
получа
натриевое
мыло.
При использовании гидрокси-
кое или жидкое мыло. Состав
твердого
мыла
C1/f35COONa,
а
может
бь~ть
жидкого
-
C1lfзscooк.
вергаются омылению едкой ще
лочью, чаще всего гидроксидом
натрия. При этом получается
вязкая жидкость, состоящая из
мыла
и
глицерина,
-
мыль
ный клей. Мыло, полученное из
него, называют клеевым (жир
ных
кислот
в
нем
примерно
40-60 %), а способ его получе
ния прямым методом.
Косвенный метод - это от-·
солка, или обработка электро
литами (растворами едкой ще
лочи или хлористого натрия).
Галаксолид
-
синтетическое
вещество, создающее запах
цветочных лепестков,
-
добавляется во многие МЫllа
и кремы.
Твердое мыло содержит соли
натрия.
ВОПРОСS
Какова основная разница
в составе твердого, мягко
го и жидкого МЬ111а?
154
Дары природы и химии
Из
с
"ero сде11ано
стекпо?
текло начали делать уже
в глубокой древносrи, с
тех
пор
как
научились
смешивать кварцевый песок с
;.
-
содой и извесrью, расплавлять
его, остужать и получать твер-
дый и прозрачный материал.
Вообще же основные сrекло
образующие вещесrва, а соот
ветсrвенно,
и
сrекла
бывают
Сода
-
один ИЗ ОСНОВНЫХ
компонентов для производства
Известняк.
стекла.
разными. Например, есrь сrек
ла оксидные, фторидные, суль
фидные и др. Стекло, которое
делается
из
кварцевого
песка,
как раз относится к оксидным.
В
результате
сплавления
смеси диоксид кремния
соды
Na2C03 и
Si02,
карбоната каль
ция СаС03 образуется соеди
нение сосrава
Na20·Ca0·6Si02 •
Кварцевый
песок
придает
сrеклу прозрачносrь, но темпе
ратура его плавления
- 1700 °С.
У смеси с содой эта температу
ра
несколько
меньше,
что
по
зволяет работать с расплавом.
Однако смесь из песка и соды
растворилась бы от первого до
ждя,
поэтому
для
защиты
воды ее укрепляют извесrью.
от
Стекло используется
Так добывают кварц.
и в домах, и в автомобилях,
Для осrывшей сrеклянной
массы
характерен
желтова
то-зеленый или голубовато-зе
леный оттенок.
лании
стекло
Но при
можно
же
сделать
цветным, добавляя при плав
лении оксиды металлов. Ок
Кварцевый песок
-
основа
неорганического стекла.
сид железа дает красный цвет,
оксид никеля
олетовый
-
или
медь или хром
ВОПРОС&
Какой материи является
основой неорrаническоrо
стеК11а?
сид марганца
-
красно-фи
коричневый,
-
зеленый, ок
от желтого и
коричневого до фиолетового.
Прозрачные цветные стекла
позволили развиться искусству
витража.
и в различных оптических
приборах.
-1-
•'!'?' ·•
- ·-·--·•1=
;с
= ~
1
- ~ ·. 1
." •
• ·.!1.."'
!!• •• • • ~
- "" 1 - ::=c·N-:;!!!!I
~
1
· · ·- 1
!!•
r"
• •• 1•
- -·•1 ·-· .
1
•
.
~:"" -:;•
·--·
!!•
_ .,,.1
-
. --·
- ""' 1
~·-
~ ..
-- '. ""~•
-~
'!lr
"
• •• •
1
· -
.",-~
• 111111!
Дары природы и химии
155
ВОПРОС7
Какое соединение придает
стеклу фиш1етовый цвет?
Первые стеКА.янные окна появИllись в Древнем Риме.
ВОПРОС В
Из какой cмollЬI де..11ают орrстекло?
Секреть1
красок
к
раска состоит из пигмен
та
и
связующего
веще
ства. Пигменты не рас-
творимы в красильной среде.
обычно смешивают с олифами
Обычно это мелкая дисперсия
(сваренными
минералов. Существуют также
маслами). Пигментами быва
красители,
ют, например, сажа, цинковые
которые
раствори
растительными
мы в красильной среде. Обыч
белила, серая алюминиевая пу
но это органические вещества.
дра, синие, фиолетовые, крас
Масляные
водят
из
краски
пигментов,
произ
ные и зеленые соединения ко
которые
бальта, красные оксиды желе-
156
Дары природы и химии
за. Также в краски добавляют
ВОПРОС
тальк или каолин. Масляные
краски для
живописи
10
Для чего в акварельные краски добавляют фенол?
делают
из отбеленного рафинирован
ного льняного масла и различ
ных
пигментов
и
загрунтованную
чаще
всего
на
наносят
холст,
Красители для тканей до
на
поверхность,
натяну
ми
-
добывали из вайды, потом
желтую
тый на раму.
XIX
в. были только натуральны
из растений, насекомых, моллюсков. Так, синюю краску
-
-
из резеды, красную
из ингигоферы, корней девясила,
-
из марены . Черный цвет давало
кампешевое дерево, а фиолетовый
-
лакмусовый лишай . Крас
новато-фиолетовый пурпур извлекался из пурпурной улитки .
ВОПРОС9
Пурпур стоил так дорого, что окрашенная им одежда в Древнем
Чем отllИЧаются красите
Риме была знаком принадлежности к высшему сословию.
llИ и пигменты?
Для
акварельных
связующим
красок
веществом
слу
жит прозрачный растительный
клей
-
rуммиарабик.
удерживает
глицерин,
Влаrу
а
ино
гда мед или сахар. Для защиты
от плесени в краску добавляют
фенол. Эго вредное вещество,
поэтому кисточки нельзя обли
Натуральный краситель индиго, которым красят джинсы,
раньше изготавливали вручную. Собирали листья, высушивали,
измельчали, готовили отвар и окрашивали ткань.
1. Листья
зывать.
2.
3.
индигоферы
Сбор урожая
Высушивание сырья
4. Измельчение красите.ля
5. Окраска ткани
6.
Готовая ткан ь
После появления синтетиче
ских красителей многие расте
ния перестали возделывать. Так
произошло с мареной, которая
давала красный краситель али
зарин. Когда его выделили и на
учились синтезировать, марена
Гуммиарабик (буквально
«аравийская камедь»)
-
-
оказалась не нужна.
вязкая
жидкость, которая выделяется
из акаций и застывает на
воздухе. Состоит главным
образом из арабина. Это
смесь калиевых, кальциевых
и магниевых солей арабиновой
кислоты.
Ализарин
-
производное
антрахинонов, которые
относятся к хинонам. Он образует
комплексные соединения с ионами
многовалентных металлов
-
ализариновыми лаками.
он
Дары природы и химии
ВОПРОС
в
11
1856 г.
157
Он давал насыщенный пурпур
ный цвет, который когда-то получали
Почему перестали выра
из пурпурной улитки. Сегодня синтети
щивать марену?
ческих красителей насчитывается более
8000.
Анилин, на основе которого был
Самый первый синтетиче
ский краситель
-
мовеин
изготовлен первый синтетический
-
краситель мовеин.
был создан на основе анилина
Пnастмассы
n
Сегодня широко произво
ВОПРОС
дятся синтетические пластмас
12
ластмассы, или пласти
сы. Для их получения из нефти
Из чеrо изrотовИllИ пер
ческие
или
вую пластмассу?
массы,
произво
дятся повсеместно. Так
природного
газа
выделя
ются исходные вещества:
эти-
они названы потому, что фор
лен, ацителен, бензол, фенол и
мируются
воздействием
др. Затем они подвергаются реакции полимеризации, поликон
под
нагревания или давления, а по
денсации или полиприсоединения. В качестве пластификаторов
том, охлажденные и отвердев
применяются самые разные вещества, например сложные эфи-
шие, сохраняют свою форму.
ры, растительные и минеральные масла.
По составу пластмассы пред
ставляют собой полимеры, вы
сокомолекулярные
Винилхлорид
органичес
-
мономер
поливинилхлорида.
кие соединения.
Первую пластмассу полу
пластмасс
-
пар
лимеров,
названных
по
кезин. Изобретатель получил
ществам.
Например,
новый материал из целлюло
полипропилен,
зы, которую обработал азот
полиэтилена делают бутылки и фляги,
ной
из поливинилхлорида
чил Александр Паркс в
и назвал в свою честь
кислотой
и
1855
-
Среди
г.
растворите
множество по
исходным
это
полиэтилен,
поливинилхлорид.
-
ве
Из
трубы, садовую
мебель, изоленты и клеенки.
лем. Правда, качество его ока
залось низким, но это была
только первая проба. В
1870
г.
на основе той же нитроцел
люлозы и камфары был по
лучен улучшенный материал,
названный целлулоидом.
Старые фото- и кинопленки
изготавливались из
целлулоида.
CI~
Пластиковую мебель часто делают
из поливинилхлорида.
Дары природы и химии
158
Полипропилен использует
применяется повсеместно,
ся в автомобильной промыш
и
ленности, из него также делают
риалы,
игрушки и водопроводные тру
мия.
другие
искусственные
которые
дает
как
мате
нам
хи
бы. Из полистирола произво
дят столовые приборы и плиты
для
теплоизоляции.
Как
ви
дим, пластмасса действительно
Старые металлические трубы
заменяют пластиковыми.
ВОПРОС13
Какое время требуется Д11Я раз110.жения
Пllастика?
OTBETbl
1.
Физио11оrический раствор представ11Яет
8. ОргстеК110 де11ают из меТИ11МетакрИ11ата.
собой 0,9%-НЬIЙ раствор Хllорида натрия, он
9. КраситеllИ -
изотоничен Пllазме крови.
ства, растворимые в красИ11Ьной среде. Пиr
2. Горько-со11еНЬIЙ вкус морской воде прида
меНТЬI .же нерастворимы; обЬIЧНо это дис
обЬIЧНо органические веще
ют collИ маrния.
персия минера11ов, то есть неорганические
3.
вещества.
Образуется водно-со11евой раствор, кото
рый тает при минусовых температурах.
10.
В акваре11Ьные краски фено11 добавllЯЮт
4. ГllИЦерин образуется при так называемом
Д11Я защиты от Пllесени.
косвенном методе.
11.
5. В твердом МЬ111е содержится натрий, в мяг
а11И3арин, а когда его синтезирова11И, нужда
ком И .ЖИДКОМ -
КаllИЙ.
Раньше из марены по11уча11И краситеllЬ
в растении отпа11а.
6. Основой неорганического стеК11а яв11Яется
12.
диоксид кремния
l1Ю11озы.
7.
Si02•
Фио11етовый цвет стеК11у придает оксид
никеllЯ Иl1И маргаJЩа.
Первую Пllастмассу изготовИllИ из це11-
13. Пllастик раз11аrается за 100-30011ет.
Содержание
159
СОДЕРЖАНИЕ
ВЕЩЕСТВО И ЕГО СОСТАВ ............................. 3
МЕТАЛЛЫ ............................................................. 60
...........................................3
Химические науки ............" ...
· ..........4
Вещество . ..... . ........................
............ 5
Атом . ...... . ... . . . .......... . . . ...... . .... . .. .
. ...... "" ......... 6
Элементы ................................... ...................... 8
Периодический закон ................................... 10
Общие свойства металлов
Электронная конфигурация
Медь ................................................................... 69
Вездесущая химия
элементов
............ " ... " ........ " ...." ..... " .. " .... ".13
........................... 60
Производство металлов ................................ 64
Химические свойства металлов .................. 65
Электрохимический ряд
напряжений металлов ........ .
\
История металлов .................... .
Золото ......................... !
......... ...................... 74
............ 78
Железо ................. .'
, ............. 80
Свинец. . . . .......... .. .
............ 85
Олово....................................
...................... 87
Ртуть .................................................................. 90
Серебро............... . ...
Распространенность химических
элементов в природе .... "." ..." ... ".:"."" .."16
Молекулы ...................................... ~.}~........ 19
Химические формулы"."" .::. :~~···~ .. ""20
Химическая связь .......... "" .. ~--•·":··~J.
22
........
Число Авогадро ..." ................:::·~ .~........." 23
НЕМЕТАЛЛЫ ....................................................... 94
ХИМИЧЕСКИЕ РЕАКЦИИ ............
.. "26
и как они происходят?." .................... " .... 26
Окислительно-восстановительные
реакции
..............." ................. " ................... 27
............................. 94
......................................)
- .......... 98
Кислород ................................ . ....
........ 101
Природа горения ......................................... 104
Соединение двух неметаллов,
без которого невозможна жизнь ......... 106
Выделение и поглощение тепла
при химических реакциях ...................... 29
Азот. .. . . . .. . . .... . ........................
Углерод........... . . . .. . . . .. . . . .. . .......
Типы превращения реагирующих
частиц . ... . .. . ....... . .... . . . ......... . . . .. . .
Что такое
Особенности неметаллов
Водород
Что такое химические реакции
............. 30
катализаторы? .. "".. ·
... "."".31
Фосфор........................... . .....
...................... 108
............. 113
.......... 116
ОРГАНИЧЕСКАЯ ХИМИЯ ............................ 120
............................................ ..............33
Что такое растворы? .................................." .33
Растворение ...... " ............................................. 35
Что такое органические соединения ....... 120
Растворы в зависимости
Карбоновые кислоты......... . .......
РАСТВОРЫ
от концентрации .................
r
....;
1
Спирты........... . .. . . . .. . .... . ...... . . . ........
...... 129
...... 131
..." ..."37
_.._='" ......... 38
Дисперсные ср~ды .. " ... " ...........
Диссоциация и константа
равновесия .... "" ..." " " ...""" .... ",
Индикаторы
Углеводороды .............................................. 126
.,.."" .... 40
.......... " ..... " ...........- " "."" .... 41
САМЫЕ ВАЖНЫЕ
ДЛЯ ОРГАНИЗМА ВЕЩЕСТВА ............. 136
Липиды ................................................ ~....... 136
Углеводы ..........................................
Нуклеиновые кислоты. . .... . .....
ХИМИЧЕСКИЕ СОЕДИНЕНИЯ ..................... 46
(
Аминокислоты и белки. . ..........
.............. 139
......... 144
.......... 146
Что такое химическое соединение? .. " .......46
Смеси и соединения
-
в чем различие? .... " .......... .
.......... 47
..... .48
Оксиды .....................................
...........51
Основания ..................
............... 53
Кислоты ............. .
......................
57
Соли ...................................... .
ДАРЫ ПРИРОДЫ И ХИМИИ ............................ 151
Незаменимая соль ................
Из чего сделано мыло?
.............
................ 151
........ 152
... 154
Секреты красок.. .. ...... . .................
........ 155
Пластмассы .................................................... 157
Из чего сделано стекло?...........
Научно-популярное издание
ДЛЯ СРЕДНЕГО И СТАРШЕГО ШКОЛЬНОГО ВОЗРАСТА
СПЕКТОР Анна Артуровна
химия
Ответственный за выпуск И. В. Резько
Подписано в печать
03.03.2017.
Формат 60х84' /8 . Бумага офсетная
Усл. печ. л.
18,6. Тираж 3000 экз.
Заказ
4129
ООО «Издательство АСТ» .
129085, г.
Москва, Звездный бульвар, д.
21, стр. 3,
комната
5
www.ast.ru
«Баспа Лета» деген ООО
129085, г.
М:Jскеу, ~дызды гулзар, д.
~qсрьmым,
21, 3
Бiздiн. электрондык мекенжайымыз:
5 белме
www.ast.ru
}\азакстан Республикасында дистрибьютор
ж:Jне енiм бойынша арыз-талаптарды кабылдаушыньщ
екiлi «РДЦ-Алматьш ЖШС, Алматы к" Домбровский кеш" 3«а», литер Б, офис
Тел .:
факс:
8(727) 2 51 59 89,90,91,92
8 (727) 2515812 вн. 107; E-mail: RDC-Almaty@eksmo.kz
8нiмнiн. жарамдыльщ мерзiмi шектелмеген.
8ндiрген мемлекет: Ресей
Сертификация карастырылrан
Мы в социальных сетях. Присоединяйтесь!
https://vk.com/AST_planetadetstva
https://www.instagram.com/AST_planetadetstva
https://www.facebook.com/ASTplanetadetstva
Отпечатано в филиале «Тверской полиграфический комбинат
детской литературы» ОАО « Издательство «Высшая школа»
170040, г. Тверь, проспект 50 лет Октября, д . 46
+7 (4822) 44-85-98. Факс: +7 (4822) 44-61-51
Тел.:
1.
Электронный вариант книги:
Скан 1 обработка 1 формат:
manjak1961
-
А
•
-
Знаете ли вы, что даже самые серьезные предметы школьной
программы бывают весьма занимательными? Не верите? Тогда
загляните в книги серии, которая так и называется: «Увлекательная
наука» . Она создана для тех ребят, которые стремятся знать
намного больше, чем изучается на уроках.
Благодаря этой книге вы с удовольствием окунетесь в изучение
химии, которая открывает волшебный мир химических соединений,
окружающих нас в повседневной жизни. Вы почувствуете себя
настоящим ученым, ведь перед вами раскроются главные секреты этой
увлекательной науки, а ее законы станут понятнее и интереснее. А еще
вы удивите учителей и друзей своей эрудицией! Текст книги написан
простым языком , все законы, химические формулы и достоверные
факты объясняются без сложных теорий, с использованием аналогий,
сравнений, иллюстраций и схем.
Вперед
-
к новым знаниям! Познайте тайны окружающего мира, изучая
химию, ведь эта наука
-
важнейшая его часть!
·:
~
§
(:.
-
ШП
'iii11if1i11iШf1111~' 1
9 785171 031039
с:
J
><
:s::
s:
:s::
::о